Автор: Цоглин Л.Н. Пронина Н.А.
Теги: систематика растений микробиология ботаника водоросли
ISBN: 978-5-91522-325-6
Год: 2012
Текст
Л.Н. Цоглин, Н.А. Пронина
БИОТЕХНОЛОГИЯ
МИКРОВОДОРОСЛЕЙ
Москва
Научный мир
2012
УДК 582
ББК 28.4; 30.16
Ц76
Цоглин Л.Н., Пронина Н.А.
Биотехнология микроводорослей. - М.: Научный мир, 2012. -184 с.: ил.
ISBN 978-5-91522-325-6
В книге обобщены многолетние достижения и уникальный опыт Института
физиологии растений им. К.А. Тимирязева РАН в области выращивания микроводо-
рослей и цианобактерий. Последовательно рассмотрены пути оптимизации продук-
тивности культур, закономерности роста и особенности развития популяций. При-
водятся расчеты потенциальной и реально достижимой продуктивности. Показаны
методы управления биосинтезом культур, изложены биотехнологические приемы,
обеспечивающие высокие скорости роста и получение целевых продуктов. Описан
ряд фотореакторов для интенсивного культивирования микроводорослей с высоким
КПД использования световой энергии.
Книга предназначена для специалистов в области экологии, фундаментальной
биологии, а также для исследователей и инженеров, работающих в области промыш-
ленной биотехнологии.
Tsogiin L.N., Pronina N.A.
Biotechnology of microaigae. - M.: Scientific World, 2012. -184 p.: il.
The book summarizes long-term achievements and unique experience of the Timiryazev
Institute of Plant Physiology RAS in the cultivation of unicellular microalgae and cya-
nobacteria. The interplay the pathways for optimization of culture productivity, the regu-
larities of miproalgal population growth and development are considered. Calculations of
potential and actually achievable productivity algae are given. The methods for controlling
the biosyntheses in cultures, the main principle of algal cultivation and biotechnological
approaches providing for the high growth rates and accumulation of desired products are
stated. Some photoreactors for intense cultivation of microalgae and cyanobacteria with the
high efficiency of light energy usage are described.
The book is intended for those who are working in ecology, basic biology, as well as
for researchers and engineers in the field of industrial biotechnology
Издание осуществлено при финансовой поддержке Российского фонда
фундаментальных исследований по проекту .Vs 12-04-07019д
ISBN 978-5-91522-325-6
[ин Л.Н., Пронина H.A., 2012
1ный мир, 2012
ОГЛАВЛЕНИЕ
Предисловие............................................5
1. Потенциальная фотосинтетическая продуктивность
микроводорослей..........................................7
2. Параметры культивирования микроводорослей.............9
3. Энергия света и светораспределение в суспензиях.......19
4. Источники света и спектральный состав света...........24
5. Закономерности роста культур..........................28
6. Основные принципы культивирования.....................31
7. Причины потери продуктивности культур и эффективности
использования световой энергии...........................37
8. Управление биосинтезом микроводорослей................44
9. Метод двухфазного культивирования.....................59
10. Биосинтез меченых соединений.........................63
11. Обогащение биомассы микроэлементами..................72
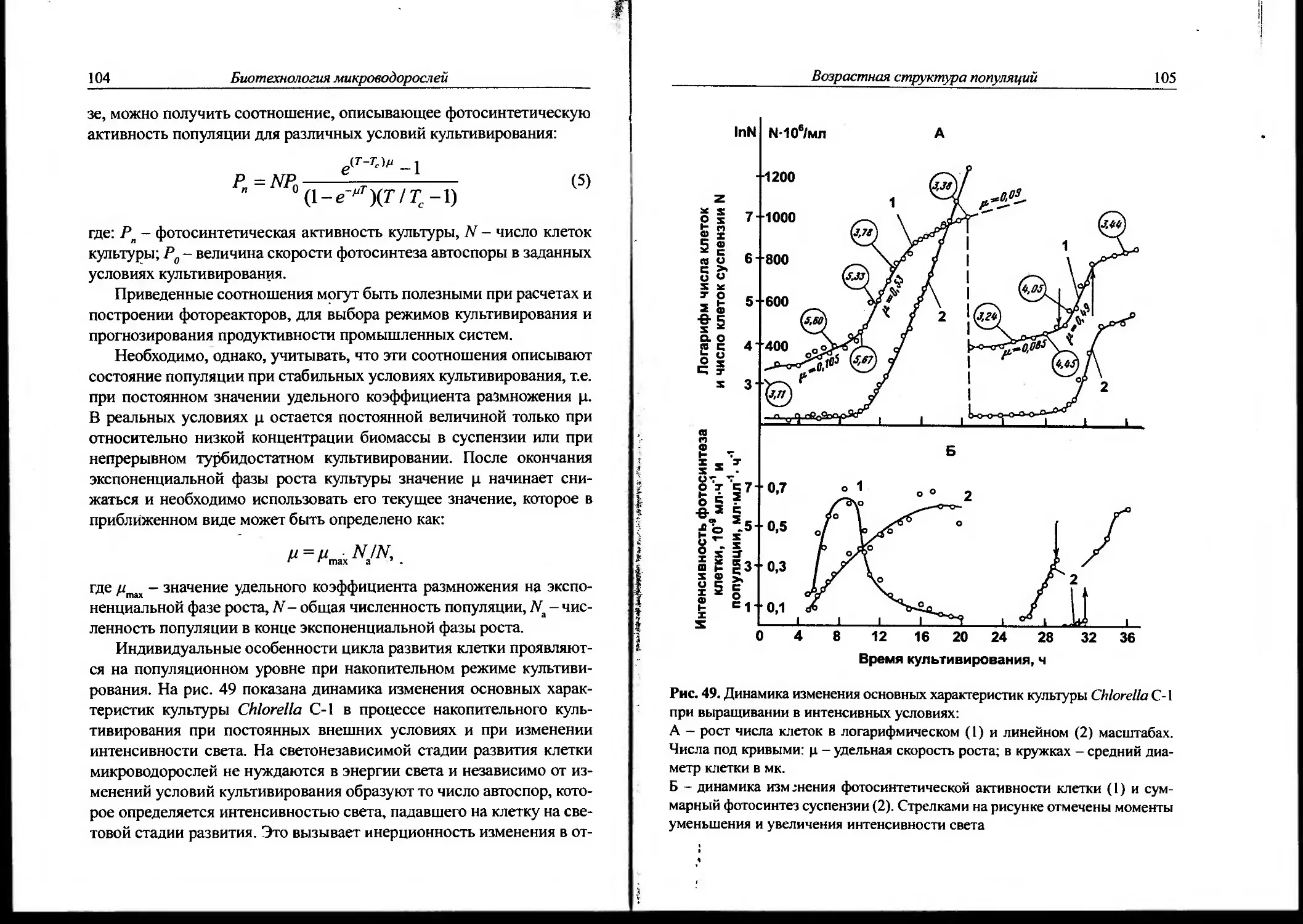
12. Биологические особенности популяций микроводорослей..85
13. Возрастная структура популяций.......................101
14. Автоселекционные процессы в популяциях...............113
15. Реально достижимая продуктивность микроводорослей....123
16. Экологические аспекты промышленного применения
микроводорослей..........................................127
17. Фотореакторы для интенсивного культивирования
микроводорослей..........................................132
18. Структура биотехнологического производства
биомассы микроводорослей.................................153
19. Ошибки и несостоявшиеся идеи.........................156
Публикации лаборатории в области биотехнологии
микроводорослей.......................................160
Авторские свидетельства и патенты РФ по вопросам
биотехнологии микроводорослей, полученные ИФР РАН.....180
TABLE OF CONTENTS
Preface.............................................................5
1. Potential photosynthetic productivity of microalgae...............7
2. Parameters of cultivation.........................................9
3. Light energy and its distribution in suspension...................19
4. Light sources and spectral composition............................24
5. Regularities of culture growth....................................28
6. Basic principles of cultivation...................................31
7. Reasons for the loss of culture productivity and efficiency
of light energy usage..................................................37
8. Controlling biosyntheses in microalga culture.....................44
9. Method of biphasic cultivation....................................59
10. Biosynthesis of labeled compounds................................63
11. Biomass enrichment with micronitrients...........................72
12. Biological characteristics of microalgal populations.............85
13. Age structure of populations.....................................101
14. Autoselection processes in populations...........................113
15. Actually achievable microalga productivity.......................123
16. Ecological aspects of microalga industrial application...........127
17. Photoreactors for microalga intense cultivation..................132
18. Structure of biotechnological production of microalgal biomass...153
19. Errors and unfulfilled ideas.....................................156
Publications of the laboratory in biotechnology of microalgae.....160
Copyright certificates and the patents of the Russian Federation
received by IFR RAS concerning biotechnology of microalgas.........180
ПРЕДИСЛОВИЕ
Одноклеточные фотосинтезирующие организмы играют ведущую
роль в образовании органических соединений и кислорода на Земле и
имеют важное экологическое значение. Практический интерес к микро-
водорослям связан с уникальными потенциальными возможностями их
использования как продуцентов ценных метаболитов, витаминов и ряда
других органических соединений, необходимых для многих сфер дея-
тельности человека.
Кроме того, одноклеточные фотосинтезирующие организмы рас-
сматриваются как некоторая альтернатива традиционному сельскому
хозяйству благодаря высокой фотосинтетической продуктивности, воз-
можности ведения процесса фотосинтеза в индустриальных условиях с
существенно меньшей зависимостью от сезонности и погодных условий,
с использованием земель и регионов, не пригодных для выращивания
высших растений.
В отличие от гетеротрофных микроорганизмов, нуждающихся для
роста в различных органических соединениях, фототрофные микроводо-
росли синтезируют биомассу из полностью окисленных неорганических
веществ (углекислый газ, вода) и минеральных элементов за счет све-
товой энергии, преобразуемой в процессе фотосинтеза. Технологии ин-
дустриального производства биомассы микроводорослей не загрязняют
окружающую среду и расходуют относительно небольшое количество
воды. Достигнутые в настоящее время производительности культур ми-
кроводорослей превосходят продуктивность посевов высших растений.
Тем не менее они еще очень далеки от потенциальных фотосинтетиче-
ских возможностей микроводорослей.
Постановка лк бой задачи с применением микроводорослей требует
в первую очередь решения далеко не простого вопроса их культивиро-
вания в заданных масштабах с высокой и достаточно стабильной про-
дуктивностью.
6
Биотехнология микроводорослей
Именно этим вопросам посвящена значительная часть исследований
группы управляемого фотосинтеза, созданной в 1958 году чл.-корр. АН
СССР Анатолием Александровичем Ничипоровичем (1899-1995) в Ин-
ституте физиологии растений (ИФР) им. К.А. Тимирязева АН СССР, ко-
торая в дальнейшем была преобразована в Лабораторию молекулярных
основ внутриклеточной регуляции и биотехнологии.
Основной задачей лаборатории в первые десятилетия после ее орга-
низации была разработка принципов создания замкнутых экологических
систем жизнеобеспечения на основе фотосинтеза микроводорослей. Ла-
бораторию возглавил аспирант А.А. Ничипоровича Виктор Ефимович
Семененко (1932-1998), который оставался ее бессменным руководите-
лем более 40 лет и был признанным лидером в исследованиях регуляции
фотосинтеза и биотехнологии фотоавтотрофных биосинтезов в Совет-
ском Союзе и за рубежом.
В данной работе обобщена та часть исследований лаборатории
В.Е. Семененко, которая имеет непосредственное отношение к вопросам
культивирования и биотехнологии микроводорослей. Почти в тезисном
изложении приводятся только конечные результаты многолетних иссле-
дований коллектива. Подробности проведения экспериментов, поиски
путей решения конкретных задач при желании можно изучить по списку
публикаций лаборатории, приведенному в конце работы. В публикациях
можно найти ссылки и на работы других исследователей, посвященные
изучению микроводорослей.
Многие исследования были проведены уже почти полвека назад, тем
не менее они не потеряли актуальность до сих пор. Результаты работ
опубликованы в научных журналах, сборниках, докладах всевозмож-
ных конференций. В ходе проведения исследований было проверено и
много ошибочных идей, о которых, естественно, нигде не сообщалось.
Ошибочные идеи, как правило, выглядят очень привлекательно. Вслед за
лабораторией В.Е. Семененко многие ошибки повторяли другие иссле-
дователи и часто повторяют сейчас, особенно при разработке различного
типа фотореакторов для культивирования микроводорослей. Поэтому в
данной работе ошибкам также будет уделено определенное внимание.
Большой вклад в исследование различных аспектов жизнедеятель-
ности микроводорослей и развитие биотехнологии внесли сотрудники
лаборатории - к.б.н. М.Г. Владимирова, к.б.н. Г.Л. Клячко-Гурвич, к.б.н.
М.И. Таутс, д.б.н., проф. Д.А. Лось, к.б.н. Е.С. Купцова, А.Г. Маркелова,
Б.В. Габель и многие другие сотрудники, которые фактически являются
соавторами данной работы.
1. ПОТЕНЦИАЛЬНАЯ ФОТОСИНТЕТИЧЕСКАЯ
ПРОДУКТИВНОСТЬ МИКРОВОДОРОСЛЕЙ
Потенциальная фотосинтетическая продуктивность представляет
собой чисто теоретическую величину, своего рода дальний ориентир
для сверки направления при достижении конкретной цели.
Для расчета возьмем сначала более простой случай с искусствен-
ным (ламповым) круглосуточным освещением суспензии микрово-
дорослей с интенсивностью фотосинтетически активной радиации
(ФАР) 400 Вт/м2 (95 кал м'2-с ’). Теоретический КПД фотосинтеза
оценивается в 0,25, но учитывая, что при преобразовании первичных
продуктов фотосинтеза в более сложные соединения и компоненты
клеток имеются определенные энергетические потери (Белл, 1980),
примем общий КПД фотосинтеза за 0,2. Суточный приход световой
энергии составит 8200 ккал, а энергия, запасенная в образовавшей-
ся в результате фотосинтеза биомассе, - 1642 ккал. Энергетическая
емкость одноклеточных водорослей находится в пределах от 3,5 до
6,0 ккал на 1 г сухой биомассы и зависит от множества параметров,
включая условия культивирования. Возьмем наиболее часто встреча-
ющуюся величину для Chlorella - 4,0 ккал на 1 г сухой биомассы и по-
лучим потенциальную продуктивность порядка 400 г сухой биомассы
с 1 м2 в сутки.
Рассчитаем потенциальную продуктивность микроводорослей
другим путем. Известно (Цоглин, Владимирова, 1973; Цоглин, Кляч-
ко-Гурвич, 1980), что клетки некоторых штаммов Chlorella имеют
длительность цикла развития порядка 10-11 ч и за этот период спо-
собны сформировать 32 автоспоры и разделиться, т.е. увеличить свою
8
Биотехнология микроводорослей
биомассу в 32 раза. Расположим на площади в 1 м; 5 г массы клеток,
обеспечивая таким образом практически не лимитированные свето-
вые условия для каждой клетки. За сутки произойдет более 2-х ци-
клов деления клеток, и продуктивность с 1 м2 составит порядка 380 г.
Для условий с естественным (солнечным) освещением возьмем
11-12-часовой световой период со средней за день интенсивностью
света ФАР - 300 Вт/м2 (71 кал-м’2-с') и, повторив энергетический рас-
чет, получим потенциальную продуктивность в 150 г сухой биомассы
с 1 м2 в сутки. За световой период мы вправе рассчитывать только
на один цикл развития клеток и, соответственно, на увеличение био-
массы в 32 раза. Потенциальная продуктивность по числу автоспор
составит 160 г биомассы с 1 м2 в сутки.
Впечатляющие цифры. Реальная продуктивность фотобиореак-
торов (далее фотореактор) выглядит значительно скромнее. При ис-
пользовании пока еще бесплатного солнечного света нас интересует
максимальная продуктивность микроводорослей, а при искусствен-
ном освещении фотореактора ведущее значение приобретает энерге-
тический КПД.
Каковы же пути хотя бы частичного приближения продуктивно-
сти при промышленном культивирования микроводорослей к потен-
циальным возможностям, и каковы пути повышения энергетического
КПД? Это - одни из главных вопросов, попытки решения которых
будут рассмотрены ниже.
2. ПАРАМЕТРЫ КУЛЬТИВИРОВАНИЯ
МИКРОВОДОРОСЛЕЙ
Для фототрофного роста микроводорослей необходимы мине-
ральная питательная среда с определенной температурой, источник
углерода - СО2 и энергия света в области ФАР. Как и для высших рас-
тений, для одноклеточных водорослей нет и не может быть стандарт-
ных режимов культивирования. Разнообразие форм микроводорослей
значительно богаче, чем высших растений, и каждая из форм требует
своих условий выращивания.
Как правило, рост популяций простейших организмов ограничи-
вается одним, главным в конкретный момент, лимитирующим фак-
тором. При культивировании микроводорослей в естественных усло-
виях лимитирование роста может возникать за счет недостаточности
минерального питания на средах, приготовленных на основе местных
источников, за счет низкой температуры суспензии и за счет светово-
го ограничения в пасмурные дни.
При выращивании микроводорослей в контролируемых условиях
нетрудно обеспечить нелимитированное минеральное питание, опти-
мальную температуру. Главным лимитирующим фактором в условиях
плотных интенсивно растущих культур обычно является недостаточ-
ное обеспечение клеток энергией света.
Кроме того, между параметрами культивирования существует
взаимосвязь, и от слонение от оптимального значения одного из них
требует корректировки других. Совершенно бесполезно, например,
создавать высокие интенсивности света, если температура суспензии
10
Биотехнология микроводорослей
значительно ниже оптимальной для данной культуры. Это не только
не повысит продуктивность, но может привести к остановке роста и
гибели культуры.
Можно привести конкретные значения температуры, концентра-
ции СО2, интенсивности света, оптической плотности суспензии для
наиболее распространенных форм, но гораздо важнее понять влияние
этих параметров на рост микроводорослей и степень взаимозависимо-
сти между оптимальными значениями параметров культивирования.
Температура суспензии. Наиболее существенным параметром
культивирования является температура суспензии. Важность поддер-
жания этого параметра при культивировании микроводорослей опре-
деляется тем, что температурные кривые скорости фотосинтеза (рис. 1)
имеют узкое плато оптимума (Владимирова, Таутс и др., 1965, 1966;
Владимирова, Семененко и др., 1966; Семененко, Зимин и др., 1966).
Если снижение температуры приводит к потере продуктивности,
то перегрев культуры на 3-4° выше оптимального значения в течение
нескольких часов может привести к полной гибели клеток. Диапазон
температур, при которых существуют различные формы водорослей,
необычайно широк - от полярных зон до термальных источников. По
температурному признаку одноклеточные водоросли делят на мезо-
Температура суспензии
Рис. 1. Обобщенная температурная кривая скорости фотосинтеза микрово-
дорослей
Параметры культивирования микроводорослей
11
фильные (с оптимумом ниже 28-ЗО°С) и термофильные (выше ЗО°С).
Продуктивность термофильных форм, как правило, значительно
выше, чем мезофильных, но для определенных целей при промыш-
ленном культивирований используются и те и другие.
Углеродное питание. В отличие от температурных кривых, за-
висимость фотосинтетической активности культур от концентрации
СО2 в газовоздушной смеси (ГВС) имеет достаточно широкое плато
оптимумов (рис. 2).
Благодаря этому для многих культур даже значительное (на 10-15%)
увеличение содержания СО2 в ГВС не приведет не только к гибели куль-
туры, но и к потере фотосинтетической активности клеток.
В действительности определяющим фактором является не кон-
центрация углекислого газа в подаваемой воздушной смеси, а парци-
альное давление растворенного СО2 в суспензии. Однако контролиро-
вание этого параметра затруднено, и значительно проще оперировать
содержанием углекислого газа в ГВС.
Потребление углекислого газа клетками микроводорослей зави-
сит от скорости фотосинтеза и составляет от 0,9 до 1,1 л на 1 г сухого
веса синтезированной биомассы. Но при подаче в суспензию количе-
ства СО2, равного ее потреблению, парциальное давление этого газа в
Рис. 2. Обобщенная углекислотная кривая скорости фотосинтеза микрово-
дорослей 1
12
Биотехнология микроводорослей
суспензии будет близким к 0, и этот параметр станет лимитирующим.
Кроме того, некоторое количество СО2 выносится из суспензии с по-
током ГВС и для обеспечения высокой скорости роста культуры не-
обходимо подавать в 2-2,5 раза большее количество углекислого газа,
чем усваивается клетками в процессе фотосинтеза. При снижении
интенсивности света уменьшается скорость фотосинтеза, и насыща-
ющая процесс концентрация углекислого газа смещается в меньшую
сторону (Владимирова, Семененко, 1966; Владимирова, Таутс, 1966).
Плато насыщения для мезофильных форм также наступает при более
низких концентрациях СО2 из-за меньшей фотосинтетической актив-
ности мезофильных клеток и более высокой растворимости газа при
низких температурах суспензии.
Обеспечить необходимое количество СО2 можно или подавая его в
заведомо избыточном количестве, или исходя из предполагаемой ско-
рости фотосинтеза с последующей корректировкой на базе экспери-
ментальных данных по продуктивности фотореактора. При этом кон-
центрацию СО2в ГВС следует поддерживать на невысоком уровне, но
в пределах плато насыщения.
Предположим, что продуктивность культуры составляет 5 г сухой
биомассы с 1 л суспензии в сутки, а концентрация СО2 в ГВС - 2%.
Тогда необходимое количество углекислого газа в расчете 1 л суспен-
зии составит 12,5 л в сутки, и чтобы обеспечить это количество, ско-
рость подачи ГВС должна составлять 0,43 л/мин.
На самом деле зависимость фотосинтеза от концентрации СО2 в
ГВС значительно сложнее представленной на рис. 2. Из приведенных
на рис. 3 кривых видно, что при снижении концентрации углекислого
газа с 1-1,5% до содержания этого газа в воздухе скорость фотосинте-
за должна уменьшиться в 20-30 раз, что и происходит в первые часы
после перехода с ГВС на воздух. Но затем, после нескольких часов
адаптации культуры к новым условиям, фотосинтетическая актив-
ность начинает возрастать и становится только в 4-5 раз ниже, чем
при оптимальной концентрации СО2. Это происходит благодаря актива-
ции СО2-концентрирующих механизмов (ССМ) в клетках многих форм
микроводорослей (Пронина, Семененко, 1984, 1988, 1991, 1992; Фур-
наджиева и др., 1990; Pronina, Semenenko, 1990; Pronina, Borodin, 1993;
Kupriyanova et al., 2007; Dudoladova et al., 2007).
Параметры культивирования микроводорослей
13
Рис. 3. Семейство углекислотных кривых скорости фотосинтеза Chlorella
С-1 * при разных интенсивностях света (числа над кривыми - интенсивность
света, Вт/м2) (Семененко, Зимин и др., 1966)
"Наименования штаммов микроводорослей даны в соответствии с «Каталогом культур
микроводорослей в коллекциях СССР» под редакцией Семененко В.Е. Изд-во АН
СССР. М., 1991, 228 с. В работах до 1991 г. употреблялись другие обозначения
различных штаммов:
Наименование по каталогу Названия штаммов, использованных в ранних работах
Chlorella vulgaris Beijer. var. vulgaris IPPAS C-1 Chlorella spK
Chlorella pirenoidosa Chick IPPAS C-2 Chlorella pirenoidosa 82
Chlorella kessleri Fott et Nov. IPPAS C-9 Chlorella sp. CO-10
Chlorella vulgaris Beijer. IPPAS C-11 Chlorella vulgaris ЛАРГ-1
Porphiridium cruentum (Ag.) IPPAS P-271 Porphiridium cruentum
Scenedesmus obliquus (Turp.) IPPAS S-305 Scenedesmus obliquus
Dunaliella salina Teod. IPPAS D-209 Dunaliella salina
Spirulinaplatensis (Nordst.) Geitl. IPPAS B-256 Shirulina platensis
14
Биотехнология микроводорослей
Данный механизм за счет слаженной работы карбоангидраз (КА)
и системы переносчиков соединений неорганического углерода (СО2,
НСО3‘ и СО32’) создает в районе активного сайта ключевого фермента
фиксации СО2 рибулозобисфосфаткарбоксилазы/оксигеназы (РБФК/О)
концентрацию СО2, на 2-3 порядка превышающую таковую в среде,
окружающей клетку. Это и обеспечивает ее способность эффективно
осуществлять фотосинтез при низкой концентрации СО2 в атмосфере с
образованием соединений органического углерода (Сорг).
В результате индукции ССМ в клетках, выращенных на воздухе
при недостатке СО2, повышается плато световых кривых фотосинтеза
(рис. 4) по мере адаптации микроводорослей к недостатку СО2 в сре-
де, окружающей клетку.
Обобщенная схема действия ССМ в клетках микроводорослей по-
казана на рис. 5. В равновесии с воздухом в водной среде в зависимо-
Рис. 4. Световые кривые скорости фотосинтеза Chlorella С-1 (Пронина, Се-
мененко, 1984, 1988). Скорость выделения кислорода измерена при низкой
(0,03%) концентрации СО2 в суспензии клеток, выращенных при концентра-
ции СО2 2% (high-CO2) и адаптированных к низкой концентрации СО2 в
течение 1 и 2 ч (low-CO2)
Параметры культивирования микроводорослей
15
сти от pH неорганический углерод может присутствовать в различных
формах, связанных с превращением СО2 в соответствии с уравнением:
СО2(газ) Н2О + СО2(раств) Н,СО3 Н+ + НСО 3
Н2О + СО;2
В качестве источника углерода при фотосинтезе микроводорос-
ли могут использовать как диоксид углерода, так и ион бикарбоната.
Способность клеток преимущественно утилизировать из среды СО2
или НСО'3 зависит от таксономической принадлежности, pH среды
культивирования, концентрации доступной для определенного штам-
ма формы неорганического углерода и других внешних параметров.
Основными элементами ССМ является активный транспорт би-
карбоната и диоксида углерода, который индуцируется в клетках при
недостатке неорганического углерода в среде выращивания, а также
система КА, катализирующих преобразование СО2/НСО3‘ в реакции:
СО2 + Н2О Н+ + нсо-3.
На примере сине-зеленых микроводорослей (цианобактерий) по-
казано существование четырех переносчиков иона бикарбоната и од-
Рис. 5. Схема действия ССМ в клетках микроводорослей
16
Биотехнология микроводорослей
ного переносчика молекулы СО2. В результате в клетке накапливается
высокий пул неорганического углерода. При щелочных pH в клетке
основной формой накопленного углерода будет бикарбонат, что пре-
дотвращает утечку СО2 из клетки и обеспечивает удержание более
высокой концентрации углерода по сравнению со средой. Поскольку
формой углерода для включения в состав органических соединений
является молекула СО2, в центрах карбоксилирования бикарбонат
преобразуется в СО2 при использовании кислых значений pH в этих
микрокомпартментах. Во всех этапах действия ССМ - подаче суб-
стратов для переносчиков углерода и для РБФК/О, предотвращении
утечки СО2 из клетки по градиенту концентраций - участвуют кар-
боангидразы. В настоящее время все известные карбоангидразы раз-
делены на три основных класса (альфа, бета и гамма), не имеющих
между собой существенной гомологии. Наиболее полно изучена си-
стема карбоангидраз у Chlamydomonas reinhardtii, в клетках которой
найдены 8 карбоангидраз, принадлежащих к различным классам.
Минеральное питание. Для нормального фототрофного роста
микроводорослей необходимы азот, калий, магний, фосфор, сера,
железо и ряд микроэлементов (Кузнецов, Семененко, 1966). Однако
широчайшее видовое разнообразие микроводорослей и ареалов их
обитания делает невозможным применение какой-либо одной стан-
дартной среды культивирования. Разработано множество разнообраз-
ных сред, каждая из которых имеет свои преимущества и недостатки.
Подробные прописи десятков сред и растворов микроэлементов, при-
меняемых в разных лабораториях, можно найти в «Каталоге культур
микроводорослей» (под ред. Семененко, 1991), но на практике промыш-
ленного культивирования в разных регионах используются среды,
создаваемые на основе местной воды и местных ресурсов, которые
представляют собой модификации сред, наиболее часто применяе-
мых в лабораторных условиях. В таблице 1 приведены прописи четы-
рех сред для наиболее часто культивируемых форм.
Питательные растворы, созданные на основе среды Тамийя с ни-
тратным или аммиачным азотом, применимы для выращивания зеле-
ных одноклеточных водорослей - широкого круга штаммов Chlorella
и Scenedesmus. Количества растворенных в 1 л солей достаточно для
выращивания 12-15 г биомассы (сухой вес). Часто используют рас-
Параметры культивирования микроводорослей
17
Таблица 1
Составы сред для культивирования микроводорослёй
Среда Состав Количество, г/л
Тамийя KNO, MgSO;7H2O КН,РО4 FeSO47H,O ЕДТА Раствор микроэлементов 5,0 2,5 1,25 0,009 0,03 1 мл на 1 л среды
Заррука NaHCO3 К,НРО4 NaNO3 ICSO4 NaCl MgSO47H,O СаС12 FeSO;7H2O ЕДТА Раствор микроэлементов 6,8 0,5 2,5 1,0 1,0 0,2 0,04 0,009 0,08 1 мл на 1 л среды
Артари (модифицированная) NaCl MgSO47H2O KNO3 KH2PO4 FeSO.-7H,O ЕДТА Раствор микроэлементов 116,0 50,0 5,0 1,25 0,009 0,037 1 мл на 1 л среды
Броди-Эмерсона KC1 NaCl MgSO47H2O Ca(NO3), KBr KJ Fe+ЕДТА Раствор микроэлементов 16,03 12,52 2,5 0,17 0,05 0,05 1,0 мл 0,5 мл на 1 л среды
Раствор микроэлементов н,во3 MnCl24H2O ZnSO47H,O МоО3 nh4vo3 2,86 1,81 0,222 0,018 0,023
18
Биотехнология микроводорослей
творы с половиной или четвертью макроэлементов, не изменяя ко-
личества добавляемых в раствор микроэлементов. Среда Заррука
используется для культивирования алкалофильных водорослей и
цианобактерий, в том числе и Spirulina*, среда Артари пригодна для
галофильных форм, таких как Dunaliella, а среда Броди - Эмерсона -
для разных форм Porphyridium.
★Spirulina (Arthrospira) по современной систематике относится к фотосинтезирую-
щим цианобактериям. Принципы и параметры культивирования Spirulina мало от-
личаются от условий выращивания зеленых микроводорослей.
3. ЭНЕРГИЯ СВЕТА И
СВЕТОРАСПРЕДЕЛЕНИЕ В СУСПЕНЗИЯХ
Энергия света является одним из важнейших параметров, опреде-
ляющих продуктивность при культивировании фотосинтезирующих
организмов. При этом энергия света должна поступать в суспензию с
нужной интенсивностью и с необходимой клеткам удельной мощно-
стью. Под удельной мощностью мы подразумеваем количество энер-
гии, приходящее на 1 л суспензии.
Для выражения интенсивности света существует множество еди-
ниц. В биологической литературе наиболее часто встречаются энерге-
тические единицы - эргсм’2-с'' (в основном в работах 50-70-х годов),
Вт/м2 и кал м'2-с'1 - и единицы плотности потока квантов - цЕ м‘2 с'' и
рмоль-м'2-с'‘. Коэффициентов пересчета между квантовыми и энерге-
тическими единицами не существует, поскольку энергия кванта зави-
сит от длины волны, а каждый источник света имеет свои спектраль-
ные характеристики. При промышленном культивировании микрово-
дорослей важное значение имеют энергия света и КПД использова-
ния световой энергии, поэтому в дальнейшем мы будем пользоваться
энергетической величиной интенсивности света - Вт/м2.
Рассмотрим типичную зависимость скорости (интенсивности)
фотосинтеза суспензии микроводорослей от интенсивности падаю-
щего света (фотосинтетическая кривая) при условии оптимальной
температуры и нелимитированного обеспечения клеток углекислым
газом и минеральным питанием (рис. 6).
20
Биотехнология микроводорослей
Рис. 6. Световая кривая фотосинтеза и варианты светораспределения
в суспензиях микроводорослей
А - освещение суспензии с одной стороны; Б - с двух сторон
Энергия света и светораспределение в суспензиях 21
На световой кривой (кривая 1) условно можно выделить следую-
щие точки и зоны:
- скорость дыхания (выделения СО2) суспензии в темноте (I = 0);
- область интенсивностей света, в которой скорость дыхания
выше скорости фотосинтеза (0-1,);
- компенсационный пункт фотосинтеза - интенсивность света
(I,)» при которой скорость дыхания и скорость фотосинтеза становят-
ся равными, и наблюдаемый по приросту биомассы или по поглоще-
нию углекислого газа фотосинтез равен 0;
- зона линейной зависимости (^ - 12), в которой рост скорости
фотосинтеза суспензии пропорционален увеличению интенсивности
света;
- переход к световому насыщению процесса фотосинтеза и, соот-
ветственно, точка 12 - интенсивность света, насыщающая фотосинтез;
- L, - 13 - плато светового насыщения, в пределах которого ско-
рость фотосинтеза клеток максимальна и не растет при дальнейшем
увеличении интенсивности света;
- зона светового ингибирования фотосинтеза (> 13), где увеличе-
ние интенсивности света приводит к снижению скорости фотосинте-
за вплоть до возможной гибели культуры.
Все отмеченные точки и зоны на кривой фотосинтеза существен-
но отличаются у разных форм микроводорослей. Например, для Chlo-
rella С-1 I, равна примерно 5-7 Вт/м2,12 - 150-200 Вт/м2, а фотоинги-
бирование фотосинтеза начинается при интенсивностях света выше
500-600 Вт/м2. Для Chlorella pyrenoidosa С-2 эти значения лежат, со-
ответственно, в пределах 3-4, 80-100 и 300-350 Вт/м2. Важно отме-
тить, что плато светового насыщения фотосинтеза (12- 13), как прави-
ло, имеет значительную протяженность.
Световые кривые фотосинтеза микроводорослей существенно за-
висят от многих физических факторов культивирования. При темпе-
ратуре суспензии, значительно ниже оптимальной, уровень солнеч-
ной радиации может стать ингибирующим даже для светолюбивых
форм.
По мере проникновения в глубину суспензии поглощение света
различных частот происходит по-разному и зависит от пигментного
состава клеток. На рис. 6 представлены кривые светораспределения
22
Биотехнология микроводорослей
(кривые 2-5) без учета изменения спектрального состава света (Семе-
ненко, Зимин и др., 1966; Филипповский и др., 1966,1967).
Естественно, максимальная фотосинтетическая активность су-
спензии микроводорослей может быть получена тогда, когда все
клетки культуры находятся в зоне светового насыщения фотосинтеза
(рис. 6А, кривая 2). Однако такое светораспределение требует или низ-
ких оптических плотностей культуры, или очень тонких слоев суспен-
зии. При этом неизбежны существенные потери световой энергии и
снижение КПД использования света, что особенно важно при искус-
ственном освещении. Фотосинтетическая продуктивность с единицы
поверхности фотореактора, определяемая как произведение активно-
сти клеток на их число под этой поверхностью (или активности едини-
цы биомассы на ее количество), будет относительно невелика.
В свою очередь, максимальный КПД использования света до-
стигается тогда, когда все клетки культуры находятся при освещен-
ностях, соответствующих линейному участку световой кривой фото-
синтеза (рис. 6А, кривая 3). При этом среднее значение фотосинтеза
клеток и суммарная продуктивность популяции будут почти в два
раза ниже, чем на световом плато. Таким образом, задача одновремен-
ного получения максимального КПД утилизации световой энергии и
максимальной продуктивности невыполнима, и в каждом конкретном
случае требуется выбирать более значимый параметр или искать их
оптимальное соотношение.
Интенсивность солнечной радиации при безоблачном небе обыч-
но значительно выше интенсивности света, насыщающего фотосин-
тез, даже у таких светолюбивых форм, как многие штаммы Chlorella,
Scenedesmus и Spirulina. Организация светораспределения в культуре
по рассмотренному принципу, очевидно, выгодна при использовании
искусственного света, где решающее значение приобретает эффек-
тивность использования световой энергии.
Исследование закономерностей светораспределения в суспензи-
ях микроводорослей и экспериментальные данные показывают, что
для обеспечения максимальной эффективности использования энер-
гии искусственного света (рис. 6А, кривая 3) интенсивность падаю-
щей радиации не должна превышать 100-120 Вт/м2 для большинства
термофильных форм микроводорослей, толщина слоя суспензии в
Энергия света и светораспределение в суспензиях
23
фотореакторе должна находиться в пределах 2-3 см при плотности
суспензии от 3 до 5 г/л. Удельная мощность света при этом составляет
от 3 до 6 Вт/л суспензии.
Для естественного освещения наилучшим вариантом является све-
тораспределение, представленное на кривой 4 рисунка 6А, при котором
используется практически весь попадающий в суспензию свет и до-
стигается высокая суммарная продуктивность культуры. Однако такое
светораспределение допустимо только для культур, у которых уровень
интенсивности света, ингибирующего фотосинтез, выше интенсивно-
сти солнечной радиации, а также при обеспечении в течение всего све-
тового дня оптимальной температуры и углеродного питания клеток.
При использовании искусственных источников света часто при-
меняется двухстороннее освещение суспензии, что позволяет вдвое
увеличить светоприемную (освещаемую) поверхность фотореактора и
удельную мощность света. Светораспределение в суспензии, обеспечи-
вающее максимальную эффективность использования световой энер-
гии при двустороннем освещении, представлено на рис. 6Б (кривая 5).
Для культур с низким плато светового насыщения фотосинтеза
и низким уровнем ингибирующей интенсивности света необходимо
применение светораспределяющих систем или такое расположение
светоприемной поверхности, которое снижало бы интенсивность сол-
нечной радиации на поверхности суспензии. Примером такого рас-
положения фотореактора может служить система культивирования
Porphyridium (500 л), разработанная в Институте переработки зерна
(Потсдам, Германия), которая при занимаемой площади в 5 м2 име-
ет светоприемную поверхность в 20 м2. Усредненное на всю поверх-
ность значение интенсивности света даже при полуденном солнце не
превышает 50-60 Вт/м2.
Для условий солнечного освещения и культур с высоким уровнем
плато светового насыщения светораспределение, изображенное на
рис. 6А (кривая 4), может быть получено при толщине слоя суспензии
3-5 см и плотности культуры от 4 до 6 г/л. Оптимальная удельная
мощность света несколько выше, чем для культивирования при искус-
ственном освещении, и составляет от 10 до 20 Вт/л суспензии.
4. ИСТОЧНИКИ СВЕТА И СПЕКТРАЛЬНЫЙ
СОСТАВ СВЕТА
Основные пигменты зеленых микроводорослей - это хлорофиллы
а и b с максимумами поглощения света в областях длин волн 430 и
662 нм и каротиноиды (425-493 нм); для сине-зеленых (цианобакте-
рий) - хлорофилл а, фикоцианин (550-615 нм); для красных одно-
клеточных водорослей, например, Porphyridium - хлорофиллы а, b и
фикоэритрин (495-565 нм). Набор пигментов в клетке микроводорос-
лей перекрывает широкий частотный диапазон видимого света. Неко-
торый провал в спектре поглощения зеленых форм микроводорослей
имеется в области 510-590 нм, но при достаточно высокой концен-
трации биомассы (2-5 г/л) и толщине слоя (2-3 см) суспензия клеток
поглощает практически всю энергию падающего света.
При искусственном освещении целесообразно использовать ис-
точники света с высокой эффективностью преобразования электриче-
ской энергии в световую в видимой области.
Утилизация захваченного кванта света ФАР реакционными цен-
трами фотосистем растений и микроводорослей не зависит от его ча-
стоты, и естественно возникает желание использовать длинноволновое
освещение (650-670 нм) с энергией кванта, в 1,5-1,7 раза меньшей по
сравнению с коротковолновой видимой областью. Однако микроводо-
рослям, так же как и высшим растениям, небезразличен спектральный
состав падающей световой энергии (качество света). Растения сфор-
мировались в условиях непрерывного солнечного спектра, и кроме
первичных реакций фотосинтеза в клетке существует много других
светозависимых реакций, активируемых различными пороговыми зна-
Источники света и спектральный состав света 25
чениями интенсивностей и энергии света в разных областях спектра.
Качество света влияет на метаболизм клеток, на накопление пигментов
и основных компонентов биомассы (Семененко и др.. 1966; Филиппов-
ский и др., 1966). Тем не менее для полноценного ведения процесса
выращивания микроводорослей и большинства растений достаточно
добавки к красному свету небольшого количества (7-10%) синего.
На рис. 7 представлены спектральные характеристики некото-
рых источников света, полученные с помощью спектрорадиометра LI
1800 фирмы Ll-Cor (Цоглин и др., 1990). Все лампы имеют линейчатый
спектр излучения в видимой области.
Наиболее близка к солнечному спектру по видимой области излу-
чения ксеноновая лампа ДКСТ-5000, но КПД светоотдачи этой лам-
пы, как и люминесцентных, не превышает 15%.
Исходя из экономического критерия подходят только специально
разработанные для выращивания растений фитолампы, обеспечиваю-
щие основное излучение в красной и немного (до 7-10%) в синей об-
ласти. К ним относятся ДРОТ-2000, люминесцентная лампа ЛФР-150
и выпускаемая в Германии натриевая лампа SONT-Agro (спектр не
показан на рис. 7). К сожалению, ДРОТ-2000 не производится в на-
стоящее время, а ЛФР-150, как и все люминесцентные лампы, имеет
невысокий световой КПД (12-15%) и нестойкий, быстро теряющий
светоотдачу люминофор. Наилучшими характеристиками по сроку
службы и КПД светоотдачи (27%), кроме SONT-Agro, обладают натри-
евые лампы ДНаТ-400 и ее современная модификация Рефлакс-400,
но доля синего света у них не превышает 3-5%. При работе с мощ-
ными источниками света, такими как натриевые лампы, необходимы
системы светораспределения. Интенсивность излучения на внешней
колбе лампы превышает 4000 Вт/м2, и при слишком близком располо-
жении ламп к поверхности суспензии клетки будут находиться в зоне
светового ингибирования фотосинтеза.
26
Биотехнология микроводорослей
1,9 Г Солнце
300 МО SM ООО 700 000 900 1000 1100
Длина волны, нм
Длина волны, нм
4'° ГдМ4-в000
Длина волны, нм
Рис. 7. Распределение энергии света
3,0 "
ДРОТ-2000
2.0 -
0 Ч___|__L
0,4 Г
ДРФ-1000
0,2
о
300 400 500 000 700 000 900 1000 1100
Длина волны, нм
по спектру различных источников
освещения
Источники света и спектральный состав света
27
Рис. 7. Распределение энергии света по спектру различных источников осве-
щения (продолжение)
Длина волны, им
5. ЗАКОНОМЕРНОСТИ РОСТА КУЛЬТУР
Скорость роста культур одноклеточных водорослей можно из-
мерять по приросту биомассы (прирост сухого веса или объема упа-
кованных клеток в расчете на 1 мл или 1 л суспензии), увеличению
численности клеток в суспензии, скорости выделения кислорода и
скорости поглощения СО2. Значения скоростей роста, полученные
по измерению перечисленных параметров, могут отличаться друг от
друга на 20-30%. Это связано с тем, что в процессе роста культуры
изменяется возрастной (соответственно, и размерный) состав клеток,
и при одном и том же количестве клеток в суспензии их сухая биомас-
са может быть разной. Фотосинтетический коэффициент газообмена
клеток (отношение объемного количества выделенного О2 к погло-
щенному СО2) также может меняться от 0,9 до 1,1.
Типичная временная зависимость роста концентрации биомассы
в суспензии (кривая роста) носит S-образный характер (рис. 8).
Обычно выделяют 4 стадии или фазы роста клеточных культур:
лаг-фазу, фазу экспоненциального (логарифмического) роста, фазу
линейного роста и плато роста. Основная величина, которая опреде-
ляет рост культур, - удельная скорость роста биомассы (при измере-
ниях по биомассе) ц = dP/Pdt или удельная скорость роста числа кле-
ток (размножения) ц = dN/Ndt, где Р и N - соответственно, биомасса
и численность клеток в суспензии в текущий момент. Размерность
р обычно - ч1, при низких скоростях роста иногда используют раз-
мерность сут
В начале культивирования, после засева культуры в фотореактор,
происходит изменение практически всех факторов среды обитания -
Закономерности роста культур
29
фаза альная фаза
фаза
Рис. 8. Кривая роста микроводорослей при накопительном (1) и
квазинепрерывном (2) выращивании
температуры и pH среды, светового обеспечения, - и клетки испы-
тывают стресс. Это приводит к остановке роста биомассы и деления
клеток. Требуется некоторое время для адаптации клеток к новым
условиям среды, что отражается на кривой роста отсутствием при-
роста биомассы или некоторым падением ее концентрации в суспен-
зии. Длительность лаг-фазы зависит от штамма микроводорослей, от
степени стрессового воздействия и может составлять от 2-3 часов до
нескольких суток.
Экспоненциальная фаза роста культуры отражает нелимитиро-
ванное размноже .ие клеток, что достигается при высоком световом
обеспечении и низкой начальной плотности культуры (менее 0,1 г су-
хой биомассы на 1 л). На этой стадии достигается максимальное для
30
Биотехнология микроводорослей
данных условий значение коэффициента ц. Далее появляется фактор,
лимитирующий рост культуры. Как правило, это световое ограниче-
ние, что отражается на кривой роста в виде линейной стадии. На этой
стадии прирост биомассы клеток в суспензии в единицу времени по-
стоянен, определяется постоянным количеством поглощенной свето-
вой энергии, а значение коэффициента ц постепенно снижается.
Наконец, плато кривой роста - максимальная плотность суспен-
зии, которая может быть достигнута данной формой одноклеточной
водоросли в данных условиях культивирования. Плато кривой роста
может возникнуть из-за недостатка элементов минерального питания,
накопления метаболитов в среде, но чаще всего связано с недостаточ-
ностью светового обеспечения клеток при высокой плотности культу-
ры. Скорость фотосинтеза на плато кривой роста становится равной
скорости дыхания клеток. Увеличение интенсивности света, когда
культура достигла плато кривой роста, дает возможность дальнейше-
му росту культуры и выходу на новое, более высокое плато.
Обычно концентрация солей в стандартных минеральных пита-
тельных средах для микроводорослей рассчитана с большим запасом
и позволяет при хорошем световом обеспечении получать плотности
культур на плато в 10-15 г сухой биомассы на 1 л суспензии.
При таких плотностях культуры может возникать и заметное дей-
ствие накопленных в среде метаболитов. В частности, было показано
(Клячко-Гурвич и др., 1966; Таутс, Семененко, 1971; Таутс, Селивано-
ва и др., 1971; Таутс, Семененко, 1976; Назаренко, Акыев и др., 1994)
появление при высоких плотностях культуры метаболитов феноль-
ной природы, ингибирующих рост клеток, в то время как при низких
плотностях в растущих культурах обнаружены вещества индольной
природы, стимулирующие рост.
Режим роста, изображенный на рис. 8, называют накопительным.
При промышленном культивировании микроводорослей для увеличе-
ния продуктивности при накопительном режиме используют только
линейный участок кривой роста. Когда плотность культуры достига-
ет заданного значения, проводят разбавление суспензии, отбирают
часть биомассы (урожай) и добавляют питательную среду. При есте-
ственном освещении фотореактора процесс разбавления проводят
в ночное время.
6. ОСНОВНЫЕ ПРИНЦИПЫ
КУЛЬТИВИРОВАНИЯ
Наиболее простой способ и необходимое оборудование для вы-
ращивания микроводорослей в лабораторных условиях, в коллекциях
культур и для предварительной подготовки водорослей к инокулиро-
ванию промышленных установок изображены на рис. 9.
Альтернативой накопительному режиму (рис. 8) служит проточное
культивирование (рис. 10), при котором непрерывно из фотореактора
отбирается часть суспензии (урожай) и доливается питательная среда.
По способу управления процессом проточное культивирование
делят на хемостат и турбидостат. В случае хемостата поддерживается
одинаковая постоянная скорость отбора урожая и долива питатель-
ной среды (скорость протока), а концентрация биомассы в реакторе
постепенно выходит на стабильный уровень, который определяется
скоростью протока. С увеличением скорости протока концентрация
биомассы в реакторе стабилизируется на более низком уровне и, на-
оборот, при снижении скорости протока суммарная биомасса в реак-
торе растет. Хемостатный режим культивирования применяется, в
основном, в микробиологической промышленности. При культиви-
ровании одноклеточных водорослей чаще используется турбидостат.
При турбидостате управление скоростью протока - слив урожая и
долив питательной среды - ведется по критерию стабильности одно-
го из параметров суспензии. Чаще всего поддерживается постоянной
концентрация биомассы в фотореакторе, определяемая по ее оптиче-
ской плотности. Это обеспечивает постоянство поглощенной клет-
ками культуры энергии света и поддержание на постоянном уровне
32
Биотехнология микроводорослей
Рис. 9. Схема установки для выращивания микроводорослей (Владимирова,
Семененко, 1962).
1 - компрессор; 2 - ресивер; 3 - редуктор; 4 - манометры; 5 - кран регули-
ровки скорости подачи воздуха в смеситель; 6 - ротаметры; 7 - смеситель
воздуха и СО2; 8 - стерильный фильтр; 9 - увлажнитель; 10 - гребенка;
11 - сосуды для культивирования водорослей
Рис. 10. Принцип организации проточного культивирования микроводорослей
Основные принципы культивирования
33
Рис. 11. Принципиальная схема лабораторной установки для высокоинтен-
сивного проточного турбидостатного культивирования микроводорослей
(Семененко, Владимирова и др., 1966).
1 — фотореактор; 2 - рубашка водяного охлаждения; 3 - ультратермостат;
4 - блок термодатчиков; 5 - блок записи температуры; 6 - прибор, регистри-
рующий температуру; 7 - датчик pH; 8 - прибор контроля и управления pH;
9 - прибор, регистрирующий pH; 10 - датчик плотности; 11 - блок контроля
плотности; 12 - блок управления плотностью; 13 - прибор, регистрирующий
плотность; 14 - исполнительная управляющая система регулировки плотно-
сти; 15 - дозирующее устройство; 16 - основная и корректирующие пита-
тельные среды; 17 - исполнительные электромагнитные клапана, управля-
емые системой регулировки pH; 18 - сборник урожая; 19 - циркуляционная
помпа; 20 - командное электропневматическое устройство; 21 - газоанали-
затор СО2; 22 - при? ор, регистрирующий газовый состав; 23 - блок тепловой
защиты ламп; 24 - регулятор напряжения ламп; 25 - пускорегулирующая
аппаратура для ДКСТ-6000; 26 - выпрямитель; 27 - насос; 28 - холодиль-
ник; Л1, Л2 - источники света (на схеме показан Л1)
34
Биотехнология микроводорослей
Время, сутки
Основные принципы культивирования
35
Рис. 12. Характеристика фотосинтетической продуктивности культуры
Chlorella С-1 при ее длительном проточном культивировании (Семененко,
Владимирова и др., 1966).
APS — прирост биомассы в г сухого вещества на м2 поверхности суспензии в
сутки; Ф* - интенсивность фотосинтеза в л СО2 на м2 поверхности суспензии
в сутки; APv — прирост биомассы в г сухого вещества на л суспензии в сутки;
Фг - интенсивность фотосинтеза в л СО2 на л суспензии в сутки; Кеент-коэф-
фициент вентиляции в л ГВС на л суспензии в час; СО, - концентрация СО2
в воздухе в %; t°C - температура суспензии; I - интенсивность света в Вт/м2;
/V- плотность суспензии в млн. клеток/мл. I, II, III - экспериментальные пе-
реключения численности клеток в фотореакторе с 600 106/мл на 300 106/мл
и обратно
практически всех параметров суспензии (pH, концентрации питатель-
ных элементов, содержания метаболитов в среде). На рис. 11 пред-
ставлена принципиальная схема установки для высокоинтенсивного
проточного турбидостатного культивирования микроводорослей, а на
рис. 12 - результаты проведенных на ней экспериментов.
В зависимости от задач культивирования в качестве критерия
управления протоком могут использоваться другие параметры, на-
пример, концентрация в суспензии каких-либо из пигментов или це-
левых продуктов.
Турбидостатное культивирование является самым совершенным
и продуктивным методом для одноклеточных водорослей, но требует
сложной аппаратуры для непрерывного измерения заданного управ-
ляющего параметра суспензии и организации протока.
В промышленном культивировании чаще всего используют метод
периодического накопительного культивирования или, как его иногда
называют, квазинепрерывного (рис. 8).
Культура выращивается до определенной плотности, соответству-
ющей линейной стадии кривой роста в конкретных световых услови-
ях, затем производится отбор части суспензии (урожай), отделение
(сепарирование, фильтрация) биомассы урожая от питательной сре-
ды и возврат питательной среды в фотореактор. Объем возвращае-
36
Биотехнология микроводорослей
мой среды доводится до величины, равной объему слитой суспензии.
В фотореактор добавляются питательные элементы, количество ко-
торых может быть определено по количеству полученной биомассы
урожая. Необходимо учитывать, что при возврате питательной среды
в суспензии накапливаются метаболиты водорослей и периодически
возникает необходимость полной замены раствора на свежий.
7. ПРИЧИНЫ ПОТЕРИ ПРОДУКТИВНОСТИ
КУЛЬТУР И ЭФФЕКТИВНОСТИ
ИСПОЛЬЗОВАНИЯ СВЕТОВОЙ ЭНЕРГИИ
Потери световой энергии. Количество световой энергии, погло-
щенной суспензией микроводорослей в реальных условиях массовой
культуры, всегда значительно меньше радиации, падающей на го-
ризонтальную поверхность за световой день. Это связано, в первую
очередь, с отражением света от стенок фотореакторов и поверхности
суспензии. Потери здесь могут достигать 30-60%. Отметим, что при
использовании солнечной энергии важную роль в уменьшении потерь
света играет правильное расположение фотореактора и ориентация
его светоприемной поверхности по отношению к солнцу.
Трудно найти общее решение для расположения светоприемной
поверхности фотореактора, пригодное для всего многообразия микро-
водорослей и хотя бы только для штаммов, наиболее часто применяе-
мых в практике массового культивирования. Решение этого вопроса в
каждом конкретном случае может быть найдено из закономерностей
распределения энергии света в суспензиях и световых кривых различ-
ных форм микроводорослей.
При искусственном освещении для уменьшения потерь света на
отражение необходимо добиваться направления падения лучей на
суспензию, максимально приближенного к перпендикуляру, но, как
правило, не удается получить потери энергии света менее 20-30% от
падающей радиации.
38
Биотехнология микроводорослей
Темновой объем суспензии. Частой причиной потерь продуктив-
ности является наличие темнового (не освещаемого) объема суспен-
зии. Конструкции многих фотореакторов для солнечного и для искус-
ственного освещения содержат такие звенья, как емкости, обеспечи-
вающие работу циркуляционных насосов, теплообменники и десор-
беры кислорода. Доля темнового объема суспензии в некоторых слу-
чаях может достигать 30% и более от общего количества суспензии.
Скорость дыхания клеток в темноте в покое и, соответственно, потеря
синтезированной биомассы обычно невелики (рис. 6), и ими можно
было бы пренебречь. Но существует фотодыхание (Белл, 1980), уро-
вень которого может достигать 30-40% от интенсивности фотосинте-
за. Попадая в темновой объем, клетка в течение нескольких минут со-
храняет высокий уровень дыхания, соответствующий фотодыханию,
и потери продуктивности при этом могут быть значительными. Для
достижения высоких продуктивностей необходимо стремиться к ми-
нимизации темнового объема суспензии.
Рассогласование параметров культивирования. При культиви-
ровании микроводорослей с использованием солнечного света воз-
никает и ряд других причин, снижающих продуктивность культур.
Рассмотрим их на примере промышленных установок, которые ис-
пользовались в Болгарии (Цоглин и др., 1980).
Площадь светоприемной поверхности установки составляет 225 м2,
объем суспензии 12,5 м3 и длина полосы 30 м. Каждая установка пред-
ставляет собой пять одинаковых светоприемных полос (на рис. 13
представлен профиль одной полосы), расположенных наклонно под
углом 3° к югу. Суспензия с растворенным в ней углекислым газом по-
дается насосом к верхнему краю полос и стекает по ним. Через каждые
15 см на полосе установлены наклонные перегородки, примерно на
1 см не достающие до дна, замедляющие скорость потока суспензии
и создающие турбуленцию. Время прохода суспензии по всей длине
полосы равно 6 мин. Толщина слоя культуры - 5 см.
По мере стекания суспензии по полосе происходит фотосинтети-
ческая утилизация СО2 клетками микроводорослей и выделение кис-
лорода, а также десорбция углекислоты в атмосферу с поверхности
суспензии. Таким образом, к нижнему краю полосы концентрация
Причины потери продуктивности культур...
39
1 - суспензия
2 - резервуар
3 - рециркуляционный
насос
4 - смеситель для СО:
5 - рециркулярный
трубопровод
6 - турбулизирующие
перегородки,
7 - ячейка для измерения
парциального давления
Оз (рОз) и скорости
выделения О2 (Vo )
8 — точки измепения ’
Рис. 13. Схема установки промышленного культивирования микроводорос-
лей, используемой в Болгарии (Цоглин и др., 1980)
СО2 в суспензии уменьшается, а количество растворенного кислорода
растет. В нижнем конце полосы суспензия падает в резервуар, захва-
тывается насосом и подпитывается углекислым газом. Темновой объ-
ем культуры Scenedesmus acutus в установке не превышает 10-12%
от общего объема суспензии.
В конце светового дня суспензия сливается в насосный резервуар,
где постепенно остывает до ночной температуры (18-20°С). В темно-
те, за счет темнового дыхания происходит потеря некоторой части био-
массы (5-7%). Но главная причина потерь заключается в разбалансе
между динамикой изменения температуры суспензии и динамикой из-
менения интенсивности солнечной радиации в течение светового дня.
В 9 часов утра суспензия из резервуара подается в освещаемую
зону установки, при этом интенсивность света к этому моменту до-
стигает 250-300 Вт/м2, а температура суспензии составляет порядка
20°С (рис. 14), что значительно ниже оптимального уровня (35-36°С)
для этой культуры с учетом такой высокой освещенности.
Рост температуры суспензии отстает от увеличения солнечной ак-
тивности и оптимальная температура достигается только к 15-16 ча-
сам, когда начинается заметное снижение солнечной радиации (мак-
симум в 14 часов).
40
Биотехнология микроводорослей
Как видно из температурных и световых кривых фотосинтеза,
приведенных на рис. 1-4, 6, такое рассогласование параметров куль-
тивирования не может не сказаться отрицательно на продуктивности
культуры.
Для снижения эффекта рассогласования параметров можно реко-
мендовать принудительный подогрев суспензии до температур, близ-
ких к оптимальным (например, до 28-ЗО°С) в самом начале светово-
го, дня. Это приведет к дополнительным затратам энергии (порядка
Рис. 14. Динамика скорости выделения кислорода (1), температуры суспен-
зии (2), интенсивности света (3) и скорости дыхания (4) в течение светового
дня на промышленной установке в Болгарии (Цо гл ин и др., 1980)
Причины потери продуктивности культур...
41
100 кВт ч для данной установки), но значительно повысит ее продук-
тивность. Такой метод особенно выгоден, когда имеется дешевый ис-
точник тепла.
Другой метод заключается в постоянной работе установки (без
слива суспензии в резервуар в ночное время) и подсветке суспензии
с интенсивностью света, немного превосходящей компенсационный
пункт фотосинтеза культуры - 10-15 Вт/м2. Расход электроэнергии в
этом случае составит для описанной установки порядка 60-70 кВт ч,
а суточная продуктивность увеличится не менее чем в 1,5 раза.
На примере этой установки уместно проиллюстрировать еще один
важный фактор. Промышленное культивирование микроводорослей
- относительно новое направление биотехнологии, не обеспеченное
пока квалифицированными специалистами. При работе хорошо про-
инструктированного штатного персонала на установках в Болгарии
среднесуточная продуктивность составляла порядка 15-18 г сухой
биомассы в сутки с 1 м2. Когда же приезжали специалисты из Научно-
производственной лаборатории альгологии Болгарской академии наук
(София), они за несколько дней поднимали продуктивность до 20-25 г.
Высокое парциальное давление растворенного в суспензии кис-
лорода. Одним из важных факторов, снижающих продуктивность куль-
тур, является накопление больших количеств кислорода в суспензии,
приводящее к ингибированию процесса фотосинтеза и к изменению хи-
мического состава биомассы клеток (Акыев, Цоглин, 1991, 1992; Akyev
et al., 1993).
Прежде всего отметим, что установки для выращивания микро-
водорослей обычно делят на фотореакторы закрытого и открытого
типа. В фотореакторах закрытого типа суспензия микроводорослей
не имеет непосредственного контакта с атмосферой. Фотореакторы
открытого типа (освещаемая поверхность не закрыта и контактирует
с атмосферой) чаще всего применяются для условий солнечного ос-
вещения.
В процессе фотосинтеза при поглощении клетками углекислого
газа выделяется примерно равное по объему количество кислорода.
Кислород очень тяжело вытеснить из раствора, а учитывая его почти
на порядок более низкую растворимость по сравнению с углекислым
42 Биотехнология микроводорослей
газом и высокую температуру суспензии, особенно для термофиль-
ных штаммов, которая также снижает растворимость газов, парци-
альное давление кислорода в суспензии растет очень быстро и может
достигать высоких значений, ингибирующих процесс фотосинтеза.
На рис. 15 представлены рост парциального давления кислоро-
да в суспензии по длине полосы установки в Болгарии и снижение
интенсивности фотосинтеза. Необходимо учесть, что поверхность
суспензии полностью контактирует с атмосферой, поток суспензии
турбулизован, а время прохождения суспензии от начала до конца по-
лосы составляет только 6 мин. Даже в этих условиях рО2 возрастает
к концу полосы с 22 до 45-50%, а скорость фотосинтеза от 20-го до
30-го метра полосы падает почти в 2 раза.
Рис. 15. Изменение скорости выделения кислорода (А) и парциального дав-
ления растворенного кислорода (Б) по длине полосы установки в течение
светового дня (Цоглин и др., 1980).
А: 1 - ФАР - 228 Вт/м2 (10.02-10.26), 2 - 333 Вт/м2 (10.35-11.02), 3 - 414 Вт/м2
(14.45-15.25), 4 - 368 Вт/м2 (15.35-16.04), 5 - 227 Вт/м2 (17.50-18.18), 6 - 127
Вт/м2 (18.30-19.05);
Б: 1 - ФАР - 319 Вт/м2 (10.26-11.19), 2 - 431 Вт/м2 (12.15-12.52), 3 - 427 Вт/м2
(14.48-15.22), 4 - 227 Вт/м2 (17.50-18.18).
В скобках указаны периоды светового дня, в течение которых проводилось
измерение
Причины потери продуктивности культур...43
В фотореакторах закрытого типа в условиях интенсивного культи-
вирования микроводорослей рО2 может достигать значительно более
высоких величин. Например, в трубчатых фотореакторах при длине
трубы 50-60 м в конце парциальное давление кислорода вырастает
до 80% и выше, что почти полностью останавливает процесс фото-
синтеза.
Выгонка кислорода из суспензии сопряжена с большими техноло-
гическими трудностями и требует существенных затрат энергии для
организации достаточно сильных механических воздействий или об-
лучения суспензии ультразвуком. При этом необходимо помнить, что
эти методы могут приводить к повреждению клеток, особенно таких
форм, как Dunaliella, Porphyridium, Spirulina. Такое же повреждаю-
щее действие на клетки могут оказывать и циркуляционные насосы
(особенно центробежного типа), применяемые в фотореакторах для
организации движения и перемешивания суспензии.
Пока еще нет достаточно надежных и простых методов дегазации
суспензии, и решение этого вопроса остается одной из важных про-
блем массового культивирования. Единственный путь снижения вли-
яния кислорода на фотосинтез заключается в повышении в суспензии
парциального давления углекислого газа, то есть в повышении кон-
центрации СО2 в ГВС, но это увеличивает его расход. Применение
этого метода основано на том, что ключевой фермент цикла Кальви-
на - РБФК/О - имеет сродство к кислороду на порядок выше, чем
к СО2, и при разнице в парциальных давлениях газов более чем на
порядок фермент начинает выполнять оксигеназные функции. Чтобы
избежать этого и необходимо поднимать парциальное давление угле-
кислого газа в суспензии.
8. УПРАВЛЕНИЕ БИОСИНТЕЗОМ
МИКРОВОДОРОСЛЕЙ
Микроводоросли отличаются высокой лабильностью метаболиз-
ма и достаточно быстрыми адаптивными реакциями в ответ на стрес-
совые внешние воздействия. Биохимический состав биомассы микро-
водорослей - соотношение в клетках пигментов, белка, углеводов,
жирных кислот липидов - меняется в широких пределах в зависимо-
сти от условий культивирования и особенно сильно при различных
стрессовых воздействиях (Клячко-Гурвич, Семененко, 1965, 1966;
Клячко-Гурвич, 1966; Клячко-Гурвич и др., 1969, 1973, 1985, 1991,
1994,1997; Клячко-Гурвич, Семенова, 1977). Это служит основой для
реализации методов управления биосинтезом микроводорослей. Раз-
личные формы водорослей реагируют на стрессовое воздействие по-
разному, и для получения целевого продукта с помощью управления
биосинтезом клеток необходим отбор штаммов-продуцентов данного
класса соединений.
Управляющие воздействия и направленный биосинтез. В ка-
честве экстремальных воздействий с целью управления биохимиче-
ской направленностью синтезов микроводорослей могут быть ис-
пользованы:
- для направленного синтеза липидов - отсутствие азота (Клячко-
Гурвич, 1966; Семененко и др., 1967) или повышение концентрации
СО2 (Сергеенко и др., 2000; Мурадян и др., 2004) в среде культивиро-
вания;
Управление биосинтезом микроводорослей 45
— для накопления углеводов - экстремальные температуры (Кляч-
ко-Гурвич, Семененко, 1965, 1966; Семененко, Зверева и др., 1974);
- для синтеза p-каротина и глицерина - сочетание высокой интен-
сивности света и низкой температуры (Абдуллаев, Семененко, 1974;
Семененко, Абдуллаев, 1980; Рамазанов, Клячко-Гурвич и др., 1988).
К экстремальным можно отнести воздействие высокой интенсив-
ности света и кислорода для увеличения синтеза арахидоновой и эй-
козапентаеновой жирных кислот у красной водоросли Porphyridium
cruentum (Клячко-Гурвич, Юрьева и др., 1985; Клячко-Гурвич и др.,
1994; Rogova et al., 1996).
Необходимость в управлении биосинтезом возникает при полу-
чении каких-либо целевых продуктов, например, Р-каротина, глице-
рина, хлорофилла а, фикоэритрина, фикоцианина, эйкозапентаеновой
и арахидоновой жирных кислот, стероидных соединений. Повышение
содержания целевого продукта в биомассе облегчает задачу его выде-
ления и значительно удешевляет процесс производства.
Существуют и другие задачи, при решении которых возникает не-
обходимость управления биохимическим составом микроводорослей.
В 60-70-х годах прошлого века одноклеточные водоросли рассма-
тривались как важнейшее звено биологических систем жизнеобеспе-
чения в длительных (более года) космических полетах. Им отводи-
лась роль не только в регенерации атмосферы, но и в значительной
степени обеспечении пищевого рациона экипажа. Однако отобран-
ные высокопродуктивные и наиболее устойчивые формы, в частно-
сти ChlorellaC-\, имели существенный недостаток. Состав биомассы
не соответствовал требованиям рациона человека - содержание белка
составляло порядка 45-50%, углеводов 15-20%. В соответствии с ра-
ционом эти показатели требовалось поменять местами - значительно
снизить содержание белка и повысить углеводную компоненту (Семе-
ненко и др., 1968).
Направленный синтез углеводов. Поскольку в норме большинство
микроводорослей отличаются высоким содержанием белка, для того что-
бы направить обмен веществ на синтез других компонентов - липидов
или углеводов, необходимо каким-то образом задержать синтез белка. Эта
проблема была решена с помощью воздействия на клетки экстремально
46 Биотехнология микроводорослей
высокой температурой, приводящей к разобщению клеточных функций -
фотосинтеза и деления.
Температурный максимум фотосинтеза культуры Chlorella С-1
имеет более высокое значение, чем максимум размножения клеток
(рис. 16).
Для получения биомассы с высоким содержанием углеводов
культура Chlorella выращивается в оптимальных для роста условиях
(температура суспензии 38°С, интенсивность света 400 Вт/м2, кон-
центрация СО2в ГВС 1,7%). После достижения плотности биомассы
в суспензии порядка 3-5 г/л. проводится повышение температуры до
43-44°С (Семененко и др., 1967, 1968; Семененко, Владимирова и др.,
-О-36°С -в-1,5ч -*-Зч —X—5 ч -0-7 ч -»-9ч
Рис. 16. Характеристика процесса разобщения клеточных функций раз-
множения и фотосинтеза при действии экстремальной температуры 44°С
на культуру Chlorella С-1 (за 100% приняты данные при 36°С) (Семененко,
Зверева, 1972)
А - концентрация биомассы в суспензии (1), число клеток (2), масса индиви-
дуальной клетки (3).
Б - световые кривые фотосинтеза.
Клетки выращены при 36°С (контроль). Значения в ч обозначают продолжи-
тельность действия экстремальной температуры 44°С
Управление биосинтезом микроводорослей 47
1969; Семененко, Зверева, 1972; Семененко, Зверева и др., 1974; Семе-
ненко, Цоглин, 1972; Семененко, 1975). При этом деление клеток пол-
ностью прекращается, а интенсивность фотосинтеза и биомасса клеток
возрастают. В этих условиях идет усиленный синтез углеводов (в ос-
новном крахмала), и все клетки культуры увеличиваются в размерах в
несколько раз (рис. 17). Процесс накопления углеводов продолжается
7-10 часов, затем начинается постепенная гибель клеток. Меняя время
остановки процесса направленного синтеза углеводов от 3 до 10 часов,
можно получить биомассу с заданным количеством углеводов в преде-
лах от 18-20 до 45-50% и, соответственно, белка от 45-50 до 15-20%.
Существуют и другие методы, заставляющие клетку перейти от
преимущественного синтеза белков к усиленному синтезу других со-
единений, наиболее простой из которых - лишение клетки специфи-
ческого материала для построения белка - азота.
Направленность биосинтеза при азотном голодании значительно
отличается у различных форм водорослей. Chlorella С-1, например,
как и при действии экстремальной температуры, переходит к синте-
зу углеводов, и лишь незначительно возрастает содержание липидов
(рис. 18Б).
Направленный синтез липидов. Для направленного синтеза
жирных кислот липидов в условиях азотного голодания (Клячко-Гур-
вич и др., 1969) был отобран продуцент - Chlorella С-2.
Так же, как и при действии экстремальной температуры, культура
выращивается до заданной плотности при оптимальных для нее ус-
ловиях (температура суспензии 28°С, интенсивность света 60 Вт/м2,
концентрация СО2в ГВС 1,7%) и затем переводится в питательную
среду того же состава, но не содержащую азот.
Клетки, лишенные азота, сохраняют фотосинтетическую актив-
ность, и увеличение сухого веса суспензии продолжается. За 3-7 дней
азотного голодания увеличение сухого веса в суспензии примерно
равно увеличению количества липидов в том же объеме (рис. 18А).
Следовательно, на этом этапе азотного голодания хлорелла представ-
ляет систему, синтетическая активность которой направлена на об-
разование липидов. При этом около 75% липидов составляют жирные
кислоты.
48
Биотехнология микроводорослей
Рис. 17. Ультраструктурная организация клеток в норме (А - 36°С) и при
действии экстремальной температуры (Б - 44°С) (Семененко, Владимирова
и др., 1969).
Об - оболочка; Л - ламелла хлоропласта; П - пиреноид; Я - ядро; Кр - граны
крахмала; ПК - пиреноидный крахмал; Ов - осмиофильные включения
Управление биосинтезом микроводорослей
49
Анализ количественного состава жирных кислот позволил выявить
еще более специфичную направленность синтеза. В табл. 2 представ-
лены данные по изменению соотношения жирных кислот Chlorella
в условиях азотного голодания.
Как видно из таблицы, в условиях азотного голодания в клетках
Chlorella резко возрастает доля олеиновой кислоты (с 4 до 43%), и в
результате эта кислота составляет около 30% от веса веществ, синте-
зируемых в период азотного голодания.
Следует отметить, что общее количество липидов или углеводов
увеличивается в результате усиленного синтеза отдельных соедине-
ний этих фракций. Организм, не имея возможности синтезировать все
многообразные вещества, необходимые для его жизнедеятельности,
направляет свою синтетическую активность на образование одного
или немногих веществ.
Дни после начала азотного голодания
Рис. 18. Изменени процентного содержания белков, углеводов и жирных
кислот у Chlorella С-2 (А) и Chlorella С-1 (Б) в условиях азотного голодания:
1 - белки, 2 - углеводы, 3 - жирные кислоты (Клячко-Гурвич, 1966)
50
Биотехнология микроводорослей
Содержание углеводов у Chlorella С-2 не повышается до такой
величины, как у Chorella С-1, и при более длительном азотном голо-
дании начинает снижаться (рис. 18). Однако при этом общее количе-
ство углеводов практически не меняется, а их процентное содержание
падает в результате разбавления при синтезе липидов. В то же время
содержание жирных кислот в период азотного голодания резко воз-
растает, достигая на 9-й день 40% от сухого веса биомассы.
Переход клеток к специализированным биосинтезам и гипертрофи-
рованному накоплению липидов может быть достигнут также при дей-
ствии экстремально высокой концентрации СО2 (Сергеенко и др., 2000;
Мурадян и др., 2004). Микроводоросли существенно различаются по
устойчивости к избытку СО2. На рис. 19 для сравнения представлены
ростовые параметры Chlorella vulgaris, обладающей чрезвычайно высо-
кой устойчивостью к СО2, и чувствительного к высокой концентрации
СО2 штамма Dunaliella salina. У Chlorella при 50%-й концентрации СО2
наблюдалось лишь некоторое ингибирование роста и снижение плато на
стационарной стадии. Эти изменения в росте культуры несколько уси-
ливались с повышением концентрации СО2 до 100%. Способность кле-
ток к росту в атмосфере чистого диоксида углерода до сих пор известна
Таблица 2
Количественный состав жирных кислот (ЖК) липидов Chlorella С-2
в обычных условиях роста и при азотном голодании
(Клячко-Гурвич, Семененко, 1966)
Наименование кислоты Формула ЖК Содержание, весовые %
Обычные условия роста Азотное голодание
Пальмитиновая 16:0 23,5 18,0
9-гексадеценовая 16:1 2,5 1,5
7,10-гексадекадиеновая 16:2 12,0 3,8
7,10,13-гексадекатриеновая 16:3 11,1 5,0
Стеариновая 18:0 0,6 3,0
Олеиновая 18:1 3,9 43,2
Линолевая 18:2 21,0 11,0
Линоленовая 18:3 24,2 13,7
Управление биосинтезом микроводорослей 51
только для этого штамма микроводорослей (Сергеенко и др., 2000). Для
D. salina 10% - это экстремальная концентрация СО2, при которой клет-
ки еще способны адаптироваться к избытку диоксида углерода.
Биохимический анализ клеток D. salina показал, что действие СО2
в концентрации 10% приводит к снижению суммарных белков в рас-
чете на единицу сухой массы, некоторому увеличению углеводов и
значительному росту липидов (рис. 20).
При выращивании культуры в атмосфере с концентрацией СО2
в 10% (табл. 3) в клетках D. salina общая сумма жирных кислот в рас-
чете на единицу сухой массы увеличилась в 2,7 раза по сравнению с
контролем (концентрация СО2 - 2%). При этом возросло содержание
всех жирных кислот, но в разной степени. В результате, их соотношение
значительно отличалось от контрольного варианта. Под воздействием
избытка диоксида углерода С16/С18 (соотношение жирных кислот с 16-ю
и 18-ю атомами углерода) повышается, а 1^ (общий индекс ненасыщен-
ности жирных кислот) снижается. Из таблицы 3 видно, что относитель-
ное содержание 16:0,16:10)9, £-16:1а>13,18:0 кислот больше, 16:4сэЗ на
том же уровне, а 18:1со9 и 18:3<о3 меньше, чем в контрольном варианте.
Рис. 19. Кинетические кривые роста Chlorella vulgaris С-1 и Dunaliella salina
D-209, измеренные по оптической плотности при различных концентрациях
СО2 в ГВС. Стрелкой показан момент повышения концентрации СО, с 2 до
25% (Сергеенко и др., 2000)
52
Биотехнология микроводорослей
Рис. 20. Биохимический состав клеток Dunaliella salina D-209, выращенных
при концентрациях СО2 2% (белые столбики) и 10% (заштрихованные стол-
бики) (Сергеенко и др., 2000)
Среди полярных липидов D. salina идентифицированы следующие
классы: МГДГ (моногалактозилдиацилглицерины), ДГДГ (дигалакго-
зилдиацилглицерины), СХДГ (сульфохиновазилдиацилглицерины), ФГ
(фосфатидилглицерины), ФХ (фосфатидилхолин), ФЭ (фосфатидилэ-
таноламины), ФИ (фосфатидилинозиты) и ДГТС (диацилглицерилтри-
метилгомосерины). Как видно из рис. 21, преобладающее место среди
полярных липидов занимают гликолипиды - МГДГ, ДГДГ и СХДГ. Аб-
солютное содержание МГДГ в расчете на сухую массу клетки увеличи-
вается через сутки действия СО2-стресса почти в 2 раза, тогда как коли-
чество ДГДГ, напротив, снижается более чем в 2 раза.
В клетках D. salina существенно изменяется не только относитель-
ное содержание, но и жирнокислотный состав индивидуальных клас-
Управление биосинтезом микроводорослей
53
Таблица 3
Жнрнокислотный состав липидов клеток D. salina, культивируемых
при 2% и перенесенных на 10% СО на семь суток
Жирные кислоты (ЖК) Концентрация СО, ЖК* 10%/2%
2% 10%
мг/г сухого веса моль% мг/г сухого веса моль%
16:0 24,195±0,012 48,8 76,011±0,014 57,2 3,1
16:1(о9 1,001±0,021 2,1 4,002±0,005 3,1 4,0
F-16:l(ol3 0,302±0,02 0,6 1,899±0,02 1,5 7,4
16:4(03 3,632±0,07 7,3 9,602±0,005 7,3 2,7
18:0 0,211±0,020 0.3 1,919±0,020 1,4 9,7
18:1(о9 7,001±0,012 13,9 14,022±0,027 10,4 2,2
18:2(06 3,100±0,047 6,2 10,299±0,091 7,7 3,3
18:ЗсоЗ 10,422±0,054 20,8 15,387±0,434 11,4 1,5
Сумма 49,864±2,054 100 133,141±2,434 100 2,7
С /С I ИП 1,4 1,1 2,2 0,9
* Отошение количества ЖК, выраженного в мг/г сухой массы при 10 и 2% СО2
сов полярных липидов. Например, в МГДГ увеличивается соотношение
<оЗ/(о6 кислот за счет (оЗ десатурации. В ФГ существенно возрастает со-
держание 2Г-16:1<х»13.
Арахидоновая и эйкозапентаеновая жирные кислоты. Красная
одноклеточная вот эросль Porphyridium cruentum P-Tl 1 представляет со-
бой редкий образец растений, в состав биомассы которой входят чрез-
вычайно важные для рациона человека, а также для фармацевтической
54
Биотехнология микроводорослей
2% С02
10% со2
л,_фиДгтс
4% 2%
ФХ 2%
4%
ФГ
4%
схдг/
12%
мгдг
26%
ДГДГ
46%
Рис. 21. Относительное содержание основных полярных липидов D. salina
(моль%). Клетки выращены при 2% СО2 и перенесены на одни сутки на
10% СО2
промышленности арахидоновая (20:4<в6) и эйкозапентаеновая (20:5<оЗ)
жирные кислоты. Состав жирных кислот липидов Pcruentum отлича-
ется высокой лабильностью, и их содержание существенно изменяется
под влиянием условий культивирования. Однако несмотря на вариа-
бельность состава жирных кислот, пальмитиновая, линолевая, арахи-
доновая и эйкозапентаеновая кислоты являются преобладающими при
разных условиях выращивания (Клячко-Гурвич, Семененко, Юрьева и
др., 1985; Клячко-Гурвич и др., 1994).
В зависимости от условий культивирования концентрация арахи-
доновой кислоты в биомассе варьирует от 0,5 до 1,9%, эйкозапентае-
новой - от 0,3 до 1,0%. Pcruentum относится к мезофильным формам,
и оптимальными условиями для его культивирования являются от-
носительно невысокие температура (25-26°С) и интенсивность света
(50-90 Вт/м2).
При низкой освещенности (ниже 25 Вт/м2) в биомассе водоросли
присутствует большое количество липидов, особенно гликолипидов,
Управление биосинтезом микроводорослей
55
преимущественно содержащих насыщенные и моноеновые жирные
кислоты. Повышение интенсивности света с 25 до 50 Вт/м2 увеличива-
ет относительную концентрацию арахидоновой и эйкозапентаеновой
кислот и их содержание в биомассе (рис. 22). При дальнейшем повы-
шении освещенности до 150 Вт/м2 концентрация арахидоновой кисло-
ты снижается, а эйкозапентаеновой кислоты продолжает увеличивать-
ся (рис. 22А), хотя ее содержание в биомассе не меняется (рис. 22Б).
Таким образом, при оптимальных для фотосинтеза условиях син-
тезируются гликолипиды, обогащенные эйкозапентаеновой кислотой;
при этом пул эйкозапентаеновой кислоты в МГДГ, преобладающем
классе гликолипидов, формируется за счет увеличения количества
молекул МГДГ (при интенсивности света 50 Вт/м2) или в результате
возрастания концентрации эйкозапентаеновой кислоты в МГДГ (при
90 Вт/м2).
Рис. 22. Относительная концентрация (А) и содержание в биомассе (Б) ара-
хидоновой и эйкозапентаеновой жирных кислот в культуре Porphyridium
cruentum Р-271 в зависимости от интенсивности света (Клячко-Гурвич и др.,
1994)
А: 1 - 20:4<в6, 2 - 20:5(оЗ; Б: светлые столбики - 20:4(о6, заштрихованные
столбики - 20:5<пЗ
56 Биотехнология микроводорослей
При низком уровне фотосинтеза образуются гликолипиды с повы-
шенным содержанием полиненасыщенных жирных кислот юб ряда.
При исключении азота из питательной среды (рис. 23) резко снижа-
ется фотосинтетическая активность клеток. Реакцией на азотное го-
лодание при последующем внесении азота в среду культивирования
является накопление нейтральных липидов, обогащенных пальмити-
новой, линолевой и арахидоновой жирными кислотами.
Таким образом, усиленное образование эйкозапентаеновой кис-
лоты происходит в условиях, благоприятных для роста P.cruentum, а
арахидоновой - в условиях, задерживающих деление клеток.
Существенное возрастание концентрации арахидоновой и эйкозо-
пентаеновой жирных кислот в клетках Р cruentum может быть до-
1
3
5
Время, сутки
Рис. 23. Изменение содержания жирных кислот липидов при азотном голо-
дании и в ходе последующего восстановления клеток Porphyridium cruentum-.
1 - 16:0, 2-18:1,3-18:2<о6, 4 - 20:3<о6, 5 - 20:4о)6,6 - 2О:5<оЗ
Управление биосинтезом микроводорослей
57
LfW/HLfW ‘МО1Э1Ш OUOH|-|
Лм1Э1ш вк ju ‘еиоифодоих HMtiediHatiHO»
LfW/HUW ‘МО1Э1Л1 OUOMh
Рис. 24. Характеристика роста числа клеток D. salina (1) и изменения содержания /7-каротина (2) в ус-
ловиях интенсивного накопительного культивирования при 28°С (А); кинетика изменения содержания
p-каротина (1), хлорофилла (2) и числа клеток D. salina (3) при низкой (22°С) температуре выращивания
(Б) (Рамазанов и др., 1988)
58
Биотехнология микроводорослей
стигнуто при увеличении до 70% парциального давления кислорода
в среде культивирования (Rogova et al., 1996; Klyachko-Gurvich et al.,
1999). Воздействие этого стрессового фактора носит кратковремен-
ный характер и связано с возрастанием общего количества ЖК и сни-
жением содержания пальмитиновой кислоты.
Получение биомассы P.cruentum с одновременно высоким содер-
жанием 20:4<а6 и 20:5о>3 кислот может являться предпосылкой для
создания биотехнологии интенсивной массовой культуры водоросли
как продуцента этих соединений. Кроме того, P.cruentum представля-
ет собой источник фикоэритрина - одного из самых интенсивных и
стойких природных пигментов.
Направленный синтез Р-каротина. Высокой концентрации
Р-каротина - важного соединения, которое представляет собой про-
витамин А, - можно достичь с использованием культуры - продуцен-
та галофильной водоросли Dunaliella salina D-209.
Экстремальное воздействие в этом случае представляет собой
резкое, в несколько раз, повышение интенсивности света при одно-
временном снижении температуры (Абдуллаев, Семененко, 1974; Се-
мененко, Абдуллаев, 1980; Рамазанов, Клячко-Гурвич и др., 1988).
Максимальные суточный выход Р-каротина и его концентрация в
клетках (порядка 90 мг на 1 л суспензии в сутки и 7-9% соответствен-
но) (Семененко, Абдуллаев, 1980) достигаются при температуре 22°С
и интенсивности света 370 Вт/м2 (оптимальные свет и температура
составляют 40-60 Вт/м2 и 28°С соответственно). Процессы накопле-
ния Р-каротина при одновременном снижении содержания хлорофил-
ла в клетке при экстремальном воздействии на культуру иллюстри-
рует рис. 24. Такое изменение пигментного состава клетки является
защитной реакцией на избыток световой энергии в условиях фото-
синтеза, подавленного низкой температурой.
9. МЕТОД ДВУХФАЗНОГО КУЛЬТИВИРОВАНИЯ
Применение экстремальных воздействий через определенное вре-
мя приводит к прекращению роста популяции и последующей гибели
клеток. Для обеспечения непрерывности процесса выращивания ми-
кроводорослей в сочетании с направленным биосинтезом был разра-
ботан метод двухфазного проточного культивирования микроводорос-
лей (Семененко, Цоглин, 1969). Схема метода изображена на рис. 25.
Система состоит из двух последовательно включенных фотореак-
торов (рис. 25А). В первом (К]) задаются условия для оптимального
развития культуры, во втором (К2) - условия с действием управля-
ющего фактора. При достижении заданной плотности биомассы в
фотореакторе К] часть суспензии переливается в фотореактор К2, где
в течение заданного времени происходит процесс направленного био-
синтеза, а в К, доливается свежая питательная среда. Переливаемые
в К2 порции суспензии или скорость протока (D) при непрерывном
проточном культивировании, объем фотореактора К2 рассчитываются
исходя из скорости роста культуры в фотореакторе Кр из необходи-
мой длительности процесса направленного биосинтеза и из требова-
ния постоянного нахождения плотности суспензии в фотореакторе К]
на линейной стадии роста. Такой режим позволяет с определенной
периодичностью получать урожай биомассы с направленным изме-
нением ее химического состава без остановки процесса выращивания
культуры в оптимальных условиях.
Схема, изображенная на рис. 25В, позволяет уменьшить длитель-
ность периода получения урожая и снизить колебания плотности био-
массы в фотореакторе Кг Суспензия микроводорослей через равные
60
Биотехнология микроводорослей
Рис. 25. Метод двухфазного культивирования микроводорослей
Метод двухфазного культивирования
61
промежутки времени поочередно поступает из фотореактора К, в сек-
ции К2 и находится в них заданное время. Слив урожая из секций К,
производится в той же последовательности. Перелив суспензии из Кр
долив свежей питательной среды и слив урожая из К2 проводится с
помощью системы клапанов.
На рис. 25Б представлена попытка упростить систему, исключив
из нее клапаны. Из секции в секцию фотореактора К2 суспензия по-
ступает, переливаясь по верхнему уровню. Однако эта попытка не
увенчалась успехом. Расчеты показали, что в условиях барботажа
в каждой секции, чтобы получить отклонение времени нахождения
клетки в экстремальных условиях в интервале ±0,5 ч, необходимо по-
рядка 200 секций.
В условиях действия экстремальной температуры интенсивность
дыхания клеток удваивается, что может привести к значительным по-
терям продуктивности на высоких плотностях суспензии. Чтобы из-
бежать этих потерь в К2 необходимо создать световой режим, соот-
ветствующий началу линейного участка кривой роста, т.е. толщина
слоя суспензии в К2 должна быть уменьшена пропорционально от-
ношению рабочей плотности суспензии в К( к плотности на начале
линейной стадии роста. Если работать при высоких плотностях су-
спензии (в верхней части линейной стадии роста), то толщину слоя
суспензии в К2 надо уменьшить в 4-5 раз. Кроме того, в случае ис-
пользования экстремальной температуры в качестве управляющего
фактора происходит гипертрофированный рост клеток, приводящий
к ухудшению светового режима, и толщину слоя суспензии в не-
обходимо уменьшить еще в 1,5-1,7 раза. Если уменьшить толщину
слоя в К2 в несколько раз, это создаст значительные технические труд-
ности, связанные с организацией подачи ГВС и теплообмена суспен-
зии. Поэтому в большинстве случаев выгоднее работать с невысокой
плотностью суспензии в К,. Толщина слоя в К2 при этом уменьшается
только в 1,5-2 раза.
Учитывая, что при действии управляющих факторов процесс фо-
тосинтеза клетки достаточно долгое время происходит с интенсивно-
стью, не меньшей, чем в условиях оптимальной температуры, фото-
синтетическая продуктивность фотореактора К, в расчете на единицу
освещаемой поверхности может быть получена близкой к таковой для
62 Биотехнология микроводорослей
К! при условии правильного выбора времени нахождения суспензии
в фотореакторе К^.
Таким образом, двухфазный процесс направленного биосинтеза
дает возможность непрерывно получать биомассу микроводорослей с
направленно измененным биохимическим составом без потери фото-
синтетической продуктивности.
10. БИОСИНТЕЗ МЕЧЕНЫХ СОЕДИНЕНИЙ
Высокие адаптивные способности микроводорослей, лабиль-
ность их метаболизма и устойчивость к стрессовым факторам позво-
ляют решать некоторые специфические задачи, такие, например, как
получение биомассы, меченной различными изотопами с разной сте-
пенью обогащения, потребности в которой испытывают современная
медицина и наука.
Нет необходимости рассматривать процесс синтеза биомассы,
обогащенной "С или ,4С изотопами. Одноклеточные водоросли обла-
дают высокой радиационной устойчивостью и не требуют адаптации
к выращиванию на изотопной СО2. Непосредственно процесс культи-
вирования ничем не отличается от обычного выращивания водорос-
лей, и особые меры требуются лишь для защиты от радиации персо-
нала и окружающей среды.
Рассмотрим примеры синтеза биомассы со стабильными изотопа-
ми 13С, ,5N и дейтерием. Выращивание водорослей на ,3СО2 и ,SN даже
при предельно высоком обогащении (99,9%) не вызывает адаптивных
реакций у водорослей. Главное требование заключается в минимиза-
ции потерь дорогостоящих изотопов
Синтез биомассы, равномерно меченной ,3С. Понятно, что при ис-
пользовании 13СО2 открытая на атмосферу система барботажа непригод-
на из-за высоких потерь изотопа. Необходима полностью изолированная,
герметичная система культивирования (рис. 26). Параметры системы
рассчитываются исходя из необходимых объемов производства. В связи с
64
Биотехнология микроводорослей
очень высокой стоимостью высокообогащенных изотопов и получаемой
меченой биомассы, трудно представить производство с производитель-
ностью более 50-100 г сухой биомассы в сутки.
Фотореактор 1 представляет собой плоскопараллельную камеру с
прозрачными стенками (более подробное описание дано в главе «Фо-
тореакторы»), с двухсторонним освещением от ламп Рефлакс-400.
Интенсивность света на поверхностях фотореактора 120-150 Вт/м2.
Толщина слоя суспензии 5 см. Возможен вариант с освещением от
люминесцентных ламп, но при этом толщину слоя суспензии необхо-
димо уменьшить до 2 см. Все газовые коммуникации выполняются из
пластиковых трубок с толщиной стенок не менее 1 мм. Применение
силиконовых трубок недопустимо из-за высокой проницаемости си-
ликона для углекислого газа.
Рис. 26. Схема культивирования микроводорослей для производства биомас-
сы, равномерно меченной IJC. Описание в тексте
Биосинтез меченых соединений
65
Фотореактор устанавливается в поддон, чтобы избежать потерь
биомассы в случае его протечки. В фотореактор заливается питатель-
ная среда на 3/4 от его полного объема (при культивировании Chlorella
- среда Тамийя с половинным набором солей). Температура среды до-
водится до значения, оптимального для клеток водорослей, и на 15 мин
включается продувка установки азотом с открытой в атмосферу газо-
вой системой и включенной воздуходувкой 5. Подача азота и газовой
смеси в суспензию проводится методом барботажа. Трубка, подаю-
щая газовую смесь в фотореактор, и добавочная емкость 4 должны
быть подняты над фотореактором, по крайней мере, на 0,5 м, чтобы
избежать слива суспензии за счет сифона при остановках воздухо-
дувки. Предварительная продувка азотом необходима для выгонки из
системы воздуха и неизотопного СО2, растворенного в питательной
среде. Для этого при включенной воздуходувке 5 открывают вентили
6 и 7, и в добавочную емкость из баллона 8 подается азот.
После остановки продувки азотом закрывают вентили 6 и 7, вы-
ключают воздуходувку 5, перекрывают добавочную емкость 4 вен-
тилями 3 и 6 и через вентиль 9 вакуумным насосом 10 откачивают
из емкости часть азота до показаний манометра 11 порядка -0,5 ати.
Затем закрывают вентиль 9, открывают вентиль 14 и из баллона 15
начинают заполнение добавочной емкости 13СОГ Процесс заполнения
необходимо вести осторожно, поскольку начальное давление в балло-
нах с изотопной углекислотой может быть 50-60 ати. Как только дав-
ление на манометре 11 сравнивается с атмосферным, останавливают
подачу углекислого газа в емкость и закрывают вентиль 14. Далее, от-
крывают вентили 3 и 16, включают подачу холодной воды или другого
хладагента на обратный холодильник 2 и включают воздуходувку 5.
При правильно рассчитанных объемах добавочной емкости показа-
ния газоанализатора 12 будут находиться в пределах 8-10%*.
В течение нескольких минут показания газоанализатора немного
упадут за счет растворения углекислого газа в среде. При этом в си-
стеме образуется бескислородная газовая смесь из азота и ”СО2, что
* Газоанализаторы СО2 градуируются по обычному углекислому газу, и ошибка при
измерении концентрации ”СО2 может составлять 2-3%. Важно то, что нулевые точки
показаний для обычной и изотопной СО2 совпадают.
66
Биотехнология микроводорослей
повышает скорость синтеза биомассы на 20-30% по сравнению с нор-
мальным (21%) парциальным давлением кислорода в среде.
Затем через штуцер 17 в фотореактор вносят засев в таком коли-
честве, чтобы начальная плотность культуры в фотореакторе была в
пределах 0,05-0,1 г/л. Культуру для засева лучше выращивать до вы-
соких плотностей (6-8 г/л), тогда его объем будет небольшим.
В самом начале процесса, когда еще нет водорослей, выращенных
на изотопной СО2, засев в фотореактор обычных клеток вызовет сни-
жение концентрации изотопа на 1-2% в полученной в последующем
культивировании биомассе, Что во многих случаях недопустимо. По-
этому, вначале необходимо подготовить суспензию в объеме, который
требуется для засева фотореактора, предварительно вырастив ее на
|3СО2 в малом объеме (например, в культуральном сосуде) с замкну-
тым контуром циркуляции газа. Засев такой культуры в основной фо-
тореактор также вызовет снижение концентрации изотопа в первой
партии урожая, но снижение не превысит 0,02-0,04%.
После внесения засева включают освещение фотореактора и сле-
дят за процессом по показаниям газоанализатора.
Через 10 мин, после того как показания газоанализатора выйдут
на нулевую точку, останавливают воздуходувку и повторяют про-
цесс заполнения добавочной емкости ,3СО2. После второго цикла
выращивания плотность культуры в фотореакторе достигает свое-
го предельного значения в 6-8 г/л сухой биомассы (учитывая по-
ловинный набор солей, особенно азота, в среде). Однако в процессе
роста кулыуры Chlorella происходит защелачивание раствора, и его
pH может достигать значений 8,0-8,5. Некоторое количество 13СО2
оказывается связанным в виде бикарбоната, и во избежание потерь
изотопа необходимо довести pH суспензии до значения 6,0-6,5.
Подкисление суспензии проводят 0,2 н раствором соляной кисло-
ты, постепенно добавляя ее небольшими порциями в фотореактор
через штуцер 16. Газоанализатор покажет отклонение концентрации
от нулевого значения. Затем, через 10-20 минут после повторного
выхода показаний газоанализатора на ноль, полностью останавли-
вают процесс и сливают культуру, не забывая оставить некоторое ее
количество для засева фотореактора в следующем цикле культиви-
рования.
Биосинтез меченых соединений
67
Утилизация углекислого газа микроводорослями сопровождается вы-
делением примерно равного по объему количества кислорода. Благо-
даря добавочным емкостям его концентрация в системе к концу цикла
не превысит 20-25%, тем не менее очередной цикл биосинтеза надо
начинать с продувки системы азотом.
Синтез биомассы, равномерно меченной 1SN. Значительно про-
ще обстоит дело с синтезом биомассы, равномерно меченной ,5N.
Азот входит, в основном, в белок, и для получения соединений с изо-
топным азотом выгодно использовать Spirulina platensis, имеющую
высокое содержание белка (до 70%) даже при оптимальных условиях
культивирования.
Культивирование можно вести в фотореакторе с плоскопарал-
лельными стенками с двухсторонним освещением и высоким уров-
нем интенсивности света (не менее 120-150 Вт/м2) при толщине слоя
суспензии не более 3 см. Это обусловлено тем, что остановка накопи-
тельного роста культуры должна происходить не по причине свето-
вого ограничения, а за счет полного выедания азота из питательной
среды. С этой же целью количество азота в среде Артари должно быть
уменьшено вдвое. Естественно, KNO3 в среде необходимо заменить
на KI5NO3 или Na15NO3.
Синтез биомассы, равномерно меченной дейтерием. Суще-
ственно сложнее обстоит дело с культивированием микроводорослей
в тяжелой воде. Требуется длительное время для их адаптации к высо-
ким концентрациям D2O, при этом многие формы невозможно адап-
тировать к росту при концентрациях тяжелой воды выше 50-75%.
Для культивирования на тяжелой воде был выбран хорошо изу-
ченный штамм Chlorella С-1, обладающий высокой продуктивностью
и довольно высоким содержанием белков (до 50%), что имеет осо-
бую ценность при последующем получении дейтерированных ами-
нокислот. Кроме того, Chlorella С-1 имеет широкий температурный
и световой оптимумы и высокую устойчивость к экстремальным воз-
действиям и бактериальному загрязнению. Сохранение этих свойств
адаптированной культурой сделало бы ее удобной для производствен-
ного культивирования на D2O.
68
Биотехнология микроводорослей
Адаптация проводилась на среде Тамийя с нитратным азотом в
культуральных сосудах при освещении люминесцентными лампа-
ми. Во избежание понижения концентрации D2O за счет водорода из
влажного атмосферного воздуха культивирование проводилось в си-
стеме с замкнутым контуром циркуляции газа (рис. 27).
При этом газовая среда состояла из N2 и СО2. Газовую смесь про-
качивали насосом через добавочную емкость и культуральный сосуд.
Добавочная емкость служит для увеличения запаса углекислого
газа, и ее объем выбирается из расчета суточной потребности при
нормальной величине фотосинтетической активности суспензии. Раз
в сутки газовый контур продувайся смесью N2 и СО2, при этом исклю-
чалась возможность накопления в среде выделяющегося кислорода
и газообразных метаболитов. Учитывая большую длительность про-
цесса адаптации микроводорослей и более быструю адаптацию бак-
терий к условиям роста в тяжелой воде, все элементы системы куль-
тивирования подвергали тщательной стерилизации.
Рис. 27. Схема культивирования при адаптировании микроводорослей к D2O:
1 - культуральный сосуд, 2 - циркуляционный насос, 3 - добавочная ем-
кость, 4 - бактерицидный фильтр, 5 - переключающие краны, 6 - обратный
холодильник
Биосинтез меченых соединений
69
Перед приготовлением питательной среды соли облучали ультра-
фиолетом высокой интенсивности под лампой ПРК-7. Облученные
соли растворяли в D2O, предварительно прокипяченной в течение
10 мин. Для уменьшения потерь тяжелой воды при кипячении ис-
пользовали обратный холодильник. Полученный таким образом рас-
твор дополнительно фильтровали через бактериальные фильтры.
Процесс адаптации Chlorella С-1 иллюстрирует рис. 28. Через
несколько часов после высева обычной культуры водоросли в среду,
содержащую 75% D2O, отмечается укрупнение клеток и появление
в них четко выраженной зернистости. Клетки, находившиеся в этой
среде 30-36 ч, увеличиваются в размере в два-три раза, примерно в
это же время появляются первые делящиеся клетки. Полный пери-
од адаптации при этой концентрации D2O составляет двое суток. В
активно растущей культуре средний размер клеток приближается к
норме и значительно снижается зернистость. Последовательные по-
вышения концентрации D2O в среде приводят к повторению эффектов
адаптации, отмеченных в среде с 75% D2O вплоть до 99,8%. При вне-
сении неадаптированной водоросли непосредственно в среду с 99,8%
D2O время адаптации увеличивается до 17-20 суток.
Рис. 28. Процесс адаптации ChlorellaC-1 к росту на D,O при последовательном
повышении концентрации тяжелой воды в среде
70
Биотехнология микроводорослей
В полностью адаптированной культуре не наблюдается сколько-
нибудь значительных морфологических изменений. Замена водоро-
да на дейтерий в среде культивирований проявляется в основном в
резком увеличении размеров клеток в процессе адаптации, что, по-
видимому, связано с рассогласованием клеточных функций - более
быстрым приспособлением фотосинтетического аппарата и длитель-
ной задержкой деления клеток.
На рис. 29 приведена зависимость скорости прироста числа клеток
от концентрации D2O в среде и световые кривые фотосинтеза Chlorella
С-1, выращенной на Н2О и на.ЦО. Влияние тяжеловодородной воды
на скорость роста культуры проявляется в основном при ее концентра-
Рис. 29. Изменение ростовых характеристик Chlotella С-1 при различных
концентрациях D2O в среде
А - зависимость скорости прироста числа клеток от концентрации D2O: а -
участок кривой при концентрациях D2O выше 90% с увеличением масштаба
в 4 раза;
Б - световые кривые фотосинтеза Chlorella С-1, выращенной на Н2О (1) и
D2O (2) в линейном (сплошная линия) и полулогарифмическом (пунктирная
линия) масштабах
Биосинтез меченых соединений
71
циях выше 75-80%. Повышение содержания тяжеловодородной воды
более 96-97% уже не сказывается на скорости прироста числа клеток,
что свидетельствует о полной адаптации культуры (рис. 29А).
Увеличение числа клеток е культуре, растущей на О2О-среде, про-
исходит в пять раз медленнее, чем на Н2О. При этом среднее число
автоспор в делящихся клетках не зависит от концентрации тяжелой
воды. Следовательно, замена водорода на дейтерий в среде увеличи-
вает длительность жизненного цикла клетки с 10-11 ч до 55-60 ч,
и это увеличение пропорционально уменьшению скорости прироста
числа клеток.
Значительные изменения наблюдаются в характере световых кри-
вых фотосинтеза, измеренных амперометрическим методом по выде-
лению кислорода (рис. 29Б). Если в Н2О-среде световое насыщение в
данных условиях культивирования наступает при интенсивности све-
та 60 Вт/м2, то для адаптированной культуры, растущей в О2О-среде,
характерна в 4 раза более низкая насыщающая интенсивность света.
При этом максимальная фотосинтетическая активность дейтерирован-
ной культуры в 3,7 раза ниже, чем протонированной. Резко уменьша-
ется также и дыхание культуры в дейтерированной среде, о чем свиде-
тельствует снижение интенсивности света в компенсационном пункте.
Особенностью культивирования на тяжелой воде является также
выделение клетками в среду большого количества метаболитов. Не
удается вырастить в 1 л тяжелой воды более 6-8 г сухой биомассы.
Отфильтрованная от клеток водорослей среда приобретает темно-ко-
ричневый цвет, и ее необходимо регенерировать.
11. ОБОГАЩЕНИЕ БИОМАССЫ
МИКРОЭЛЕМЕНТАМИ
В современном рационе питания человека значительно недостает
микроэлементов, поскольку он получает микроэлементы в основном
с растительной пищей, а большинство посевных земель в настоящее
время сильно обеднены. Недостаток микроэлементов приводит к за-
медлению роста и развития детей и вызывает ряд тяжелых заболева-
ний у взрослых.
Металлы являются необходимой частью ферментных систем жи-
вых организмов, и в то же время они в повышенных концентрациях
отличаются высокой токсичностью. Способность микроводорослей
к сорбции тяжелых металлов (ТМ) была замечена давно и использу-
ется для очистки загрязненных ими водоемов. Вместе с тем контро-
лируемое выращивание микроводорослей на средах с необходимыми
для рациона человека металлами и элементами позволяет получить
биомассу с высоким содержанием одного или нескольких микроэле-
ментов в биогенном состоянии (химически связанном в компонентах
биомассы) и использовать ее в качестве пищевых добавок. Для до-
стижения этой цели необходимо было изучить возможности роста
микроводорослей на средах с добавками различных химических эле-
ментов, определить накопление их в клетках и места локализации,
найти допустимые концентрации в среде культивирования, условия
и методы выращивания водорослей, при которых обеспечивалось бы
высокое качество биомассы, пригодное для использования в пищевых
добавках. Наиболее подходящей для этих целей является цианобакте-
Обогащение биомассы микроэлементами
73
рия Spirulina platensis, которая широко используется в качестве пище-
вых добавок и биологически активных соединений.
Биомасса, обогащенная селеном. S. platensis обладает чрезвы-
чайно высокой устойчивостью к селену и сохраняет (значительно по-
давленную) способность к росту вплоть до 170 мг/л Na2SeO3 (Прони-
на и др., 2002). Допустимая концентрация вводимого в среды селени-
та натрия, еще не вызывающая существенного ингибирования роста
культуры, составляет 10-20 мг/л (рис. 30).
Следует отметить, что в присутствии 100-170 мг/л Na2SeO3 уже в
начале линейной фазы культивирования в среде образуется красный
осадок элементарного селена в результате восстановления селенита
Время, сутки
Рис. 30. Влияние се юнита натрия на рост Spirulina platensis.
Содержание NajSeO3 в среде (мг/л): А - 0 (1 - контроль), 10 (2), 20 (3), 30 (4), 50 (5);
Б - 0 (1 - контроль), 100 (2), 150 (3), 170 (4)
74
Биотехнология микроводорослей
натрия. Способность S. platensis, как и некоторых других представите-
лей этого рода, восстанавливать селениты и селенаты до Se(0) с после-
дующей адсорбцией его пептидогликанами клеточной стенки и выделе-
нием в среду используется при создании систем биологической очистки
сточных вод.
Содержание селена в клетках находится в прямой зависимости от
содержания селена в среде (рис. 31) и заметно повышается уже при
минимальных значениях наружных концентраций селена.
В низких концентрациях селен не оказывает существенного вли-
яния на сдвиг белкового, липидного и углеводного обмена (табл. 4) и
легко метаболизируется. Селенит в этих концентрациях не оказывает
ингибирующего эффекта на рост (рис. ЗОА). В то же время при более
высоких дозах Na2SeO3 (табл. 4) видна сильная обратная зависимость
между концентрацией селенита натрия в среде и содержанием кле-
точного белка и ее прямая связь с содержанием углевбдов и липидов в
Содержание Se в среде, мг/л
Рис. 31. Зависимость количества связанного S. platensis атомарного селе-
на от количества селена, введенного в среду культивирования
Обогащение биомассы микроэлементами
75
Таблица 4
Влияние селенита натрия на биохимический состав 5. platensis
Концентрация Na,SeO3, мг/л % от сухой массы
Белок Хлорофилл Углеводы Липиды
0 65 1,0 17 8
10 64 0,8 19 9
20 62 0,7 16 10
50 54 1,1 22 14
100 46 0,9 24 16
биомассе. Такая зависимость наблюдается у цианобактерий и микро-
водорослей и при других стрессовых условиях (Клячко-Гурвич, 1966;
Семененко, 1985).
Главным образом селен включается в свободные аминокислоты и
белки. Являясь химическим аналогом серы, селен замещает ее в ци-
стеине и метионине с образованием Se-аминокислот, которые прини-
мают участие в синтезе белка наряду с S-аминокислотами.
При снижении в среде культивирования в 10 раз концентрации серы
накопление селена у 5. platensis значительно возрастает (табл. 5) в рас-
чете как на сухую массу (вдвое), так и на белок (втрое). При этом ос-
новная доля селена включается в белковую фракцию, поскольку его со-
держание в белке и в суммарной биомассе в расчете на единицу сухой
массы практически совпадает.
Таблица 5
Влияние концентрации серы в среде культивирования на накопление
селена клетками 5. platensis в присутствии селенита натрия (20 мг/л)
Концентрация S, мг/л Содержание белка, мг/г Содержание Se
в биомассе во фракции белков
мг/г сухой массы мг/г сухой массы мг/г белка
300 0,60 0,155 0,147 0,280
30 0,28 0,306 0,256 0,914
76
Биотехнология микроводорослей
В то же время при дефиците серы содержание суммарного бел-
ка в биомассе уменьшается в 2 раза, что, безусловно, снижает сум-
марное обогащение биомассы селеном и указывает на изменение ее
качественного состава. Таким образом, увеличение отношения Se/S
угнетает синтез белка, хотя при этом и усиливает включение селена в
серусодержащие аминокислоты, позволяя в 3,3 раза обогатить селеном
белок и только в 1,5 раза биомассу.
Биомасса, обогащенная цинком, медью и марганцем. Для полу-
чения биомассы, обогащенной эссенциальными металлами, необходимо
учитывать, что накопление металлов зависит от многих параметров: кон-
центрации металла, времени его внесения в среду и фазы развития куль-
туры, а также от состава соли, включающей металлы (Налимова и др.,
2005; Черникова и др., 2006). Необходимо также учитывать, что многие
эссенциальные микроэлементы в высоких концентрациях выступают в
роли тяжелых металлов, подавляющих рост микроводорослей.
Внесение невысоких концентраций цинка, меди и марганца на линей-
ной стадии вызывает некоторое стимулирование роста 5. platensis по срав-
нению с контролем (без металлов), чего не наблюдается при внесении ме-
таллов одновременно с инокулятом. Максимальная плотность биомассы
достигается в более короткие сроки, но она ниже, чем в контроле и
при действии эквивалентных концентраций металлов, добавленных
одновременно с инокулятом. Кроме того, порог чувствительности
5. platensis к цинку и меди на линейной фазе снижается. Вероятно, это
связано с тем, что в течение лаг-фазы, когда не происходит сколько-
нибудь значительного увеличения биомассы, клетки лучше адапти-
руются к новым условиям, что позволяет цианобактерии увеличить
устойчивость к более высоким концентрациям металлов.
Добавление небольших количеств CuSO4 в начальный период
культивирования одновременно с внесением инокулята приводит к
удлинению лаг-фазы с последующим более быстрым линейным ро-
стом (рис. 32А). При концентрации меди в среде культивирования
0,08 мМ клетки погибают.
В присутствии марганца не отмечено расхождений с контролем
в ходе ростовых кривых в течение лаг-фазы и на линейном участке
(рис. 32Б), однако наблюдается существенное сокращение длительно-
Обогащение биомассы микроэлементами 77
сти стационарной фазы (плато кривой роста) с последующим быстрым
лизисом клеток. Возможно, на фоне замедления метаболизма клетки на
плато кривой роста токсичность Мп проявляется острее в силу сниже-
ния способности S', platensis включать поглощенный клетками марганец
в метаболические процессы.
Токсическое действие цинка на рост S. platensis (рис. 32В) проявляется
в присутствии 8,8 мг/л. В концентрациях, выровненных по содержанию
цинка, Zn(NO3)2 и ZnSO4 оказывали сходный эффект на рост культуры,
тогда как чувствительность S. platensis к ZnCL, была несколько выше (дан-
ные не показаны).
Введение хелатирующих агентов повышает устойчивость
S. platensis к токсическому действию тяжелых металлов. Например,
в присутствии комплексов Си с ЭДТА культура сохраняет способность
к росту даже при летальной без ЭДТА концентрации меди 0,08 мМ.
Рис. 32. Влияние CuSO4, МпС12 и Zn(NO3)2 на рост S. platensis.
Соль вносили вместе с инокулятом.
Количество внесен! ых металов составляло:
А - меди (мМ): 0 ( - контроль); 0,04 (2); 0,06 (3); 0,08 (4);
Б - марганца (мМ): 0 (1 - контроль); 1,3 (2); 2,5 (3); 5,1 (4);
j В - цинка (мг/л): 0(1- контроль); 2,2 (2); 4,4 (3); 6,6 (4); 8,8 (5)
78
Биотехнология микроводорослей
Накопление металлов клетками S. platensis. С повышением
концентрации меди в среде наблюдается увеличение ее внутриклеточного
содержания, которое зависит от времени инкубации цианобактерии
с металлом (рис. ЗЗА). Через час содержание металла в клетках
значительно выше (кривая 1), чем через 1 сутки (кривая 2) и 3 суток
(кривая 3), что свидетельствует о выведении меди из клетки. Однако при
культивировании клеток в присутствии 0,08 мМ Си+2 эта закономерность
нарушается. Содержание металла одинаково высокое (17,3 мкмоль/г
сухой массы) через 1 ч и через 1 суд что приводит в дальнейшем к гибели
клеток, как это видно из ростовой кривой на рис. 32А (кривая 4).
Накопление марганца клетками S. platensis происходит пропорци-
онально времени культивирования и увеличению концентрации ме-
талла в среде с выходом на насыщение при значениях около 2,5 мМ
(рис. ЗЗБ). Пороговая внутриклеточная концентрация этого металла
составляет около 30 мкмоль/г сухой массы. Выход кривых накопле-
ния марганца на плато показывает, что клетки способны ограничивать
поступление и накопление Мп, защищаясь от токсического действия
этого металла.
Динамика накопления цинка зависит от стадии развития культуры,
на которой элемент вносится в питательную среду. При внесении цин-
ка в среду вместе с инокулятом в концентрациях 2,2-4,4 мг/л внутри-
клеточное накопление цинка в расчете на единицу сухой массы проис-
ходит постепенно и достигает максимума на 4-6-й день культивирова-
ния (рис. 34А), что соответствует приблизительно середине линейной
стадии роста (рис. 32В). После этого происходит достаточно быстрый
вынос металла из клетки и к 8-м суткам (начало стационарной стадии
роста) концентрация цинка в клетке становится практически равной
его внутриклеточной концентрации в начале эксперимента.
При внесении цинка на линейной стадии роста наблюдается бы-
страя аккумуляция (в течение 1 ч) тяжелого металла с последую-
щим быстрым выносом металла обратно в среду культивирования
(рис. 34Б). Вероятно, при длительной адаптации цианобактерии к из-
бытку цинка (рис. 34А) этот тяжелый металл комлартментируется во
внутриклеточных структурах, не оказывая влияния на ростовые про-
цессы, а затем постепенно выводится из клетки на поздних этапах
культивирования.
Обогащение биомассы микроэлементами
19
Рис. 33. Зависимость количества связанных меди (А) и марганца (Б) в клетках
5. platensis от количества элементарных металлов, введенных в среду культи-
вирования: 1 -через 1 ч после внесения металла; 2 - через 1 сут; 3 - через 3 сут
Рис. 34. Динамика накопления цинка клетками 5. platensis.
Культуру выращивали в присутствии Zn(NO3)r Соль вносили вместе с ино-
кулятом (А) и на линейной стадии роста (Б) в концентрациях (мг/л): 2,2 (1),
4,4 (2)
80 Биотехнология микроводорослей
Способность клетки секретировать тяжелые металлы хорошо вид-
на на примере меди. Содержание металла в среде культивирования
падает очень быстро благодаря двум процессам (рис. 35): включению
металла в биомассу и ее выведению из клетки с образованием в среде
культивирования нерастворимых комплексов восстановленной меди
(Си1+). Поскольку в среду добавляли сульфат меди, можно полагать,
что S. platensis способна восстанавливать Си2+ и переводить ее в не-
доступную для клетки форму. Осаждение металла из среды культиви-
рования снижает токсическое действие меди и ограничивает накопле-
ние меди в клетке, позволяя ей пройти полный цикл развития.
Влияние света на внутриклеточное накопление металлов. На-
копление некоторых металлов, например меди, является светозависи-
мым процессом. Так, клетки S. platensis и некоторых других циано-
Время.ч
Рис. 35. Изменение содержания меди в клетках 5. platensis (1) и в среде куль-
тивирования (2).
Культуру выращивали в присутствии CuSO4 (0,04 мМ Си2*). Пунктиром (3)
отмечена расчетная кривая концентрации восстановленной меди (Си")
Обогащение биомассы микроэлементами 81
бактерий не способны накапливать медь в темноте (табл. 6). Однако
многие химические элементы могут накапливаться в клетках микро-
водорослей не только на свету, но и в темноте.
Например, на свету S. platensis накапливает цинк только в течение
первого часа экспозиции и далее постепенно выводит его в среду куль-
тивирования, тогда как в темноте наблюдается практически постоянное
накопление цинка в течение 48 ч. Вероятно, на свету в клетках S. platensis
индуцируются металлорегуляторные системы, ограничивающие аккуму-
ляцию цинка и активирующие вынос тяжелого металла в среду культи-
вирования.
Марганец также накапливается в клетках S. platensis как в темно-
те, так и на свету. При внесении соли марганца в темноте содержание
марганца в клетках через 1 сутки, в расчете на единицу сухой массы,
было почти в 5 раза выше, чем на свету. Далее содержание металла в
клетках снижалось, приближаясь через 6 суток к значению, получен-
ному в экспериментах на свету. Возможно, что такая динамика содер-
жания марганца в темноте связана с особенностями сорбции металла
клеточными стенками 5. platensis.
Таблица 6
Накопление меди, марганца и цинка в клетках S. platensis
при внесении металлов в суспензию на свету и в темноте
Концентрация Металл Время Содержание металла в клетке (мг/г сухой массы)
свет темнота
3,8 мг/л Си 1 ч 0,86±0,05 0,03
1 сут 0,76±0,04 0,03
3 сут 0,60±0,03 0,03
137 мг/л Мп 1 ч 0,52±0,02 0,40±0,02
1 сут 0,64±0,05 3,10±0,17
6 сут 1,65±0,09 1,10±0,08
2,2 мг/л Zn 1 ч 2,5±0,09 2,5±0,14
1 сут 1,1 ±0,04 2,3±0,15
2 сут 1.0±0,05 3,3±0,24
82
Биотехнология микроводорослей
Локализация металлов в клетке. Значительный вклад биосорб-
ции можно видеть при сравнении уровня накопления металлов жи-
выми и мертвыми (лиофильно высушенными) клетками S. platensis.
В мертвых клетках уже через 1 час наблюдается резкое увеличение
количества металлов, которое далее не изменяется (рис. 36).
Время, ч
Рис. 36. Динамика накопления
металлов в клетках при внесении
0,06 мМ Си2* (А) и 2,5 мМ Мп2+ (Б)
в суспензию живых клеток (1) и в
суспензию лиофильно высушен-
ных клеток (2) S. platensis
Обогащение биомассы микроэлементами
83
При этом содержание металлов в живых клетках S. platensis зна-
чительно выше, чем у лиофильно высушенных, что свидетельствует
об их включении в состав внутриклеточных структур.
При разделении биомассы 5. platensis, обогащенной цинком, ме-
дью или марганцем, на отдельные фракции было показано (рис. 37),
что большая часть тяжелых металлов содержится в составе фракции,
обогащенной растворимыми белками: меди и цинка - около 55%,
марганца - более 80%. Во фракции нерастворимых клеточных компо-
нентов, которая в основном включала мембранные белки и нераство-
римые углеводы, содержится около 15% металлов. Около 20% меди и
30% цинка обнаруживается в липофильных соединениях.
Сравнение профилей эллюции растворимых белков, выделенных
из клеток 5. platensis, показывает, что при культивировании в присут-
ствии металлов количественное содержание низкомолекулярных бел-
ков возрастает более чем в пять раз по сравнению с контролем. Ана-
лиз фракций, полученных в ходе хроматографического разделения на
содержание металлов, показал, что именно эти белки с молекулярны-
ми массами 2-15 кДа содержат медь, марганец и цинк. Можно пола-
гать, что данные белки относятся к классу металлсвязывающих бел-
ков 5. platensis.
Таким образом, 5. platensis, в отличие от большинства фотосин-
тезирующих микроорганизмов, проявляет высокую толерантность к
Рис. 37. Распределение Си (А) и Мп (Б) в биомассе S. platensis:
Л - липофильные соединения, Нк - фракция нерастворимых клеточных ком-
понентов, Р - фракция растворимых белков
84
Биотехнология микроводорослей
селену, меди, марганцу и цинку. Согласно предложенной Baker клас-
сификации растений и микроорганизмов по степени накопления тяже-
лых металлов, S. platensis можно отнести к гипераккумуляторам меди.
Клетки способны накапливать медь около 1 мг/г сухой массы,
что является пороговой величиной накопления меди клетками-гипер-
аккумуляторами. По способности S. platensis накапливать марганец
(до 1,6 мг/г сухой массы) культуру можно отнести к аккумуляторам.
S. platensis также способна накапливать до 1 мг селена и 4 мг цинка
в грамме сухой массы.
Механизмы детоксикации токсического действия металлов в клет-
ках S. platensis связаны с сорбцией тяжелых металлов на клеточной
поверхности, ограничением их поступления в клетку, индукцией
синтеза металлсвязывающих белков и, возможно, компартментацией
металлов в полифосфатные гранулы и липидные глобулы. При адап-
тации к высоким концентрациям меди клетки S. platensis могут вос-
станавливать Си2+до Си1+с последующим экспортом в среду культи-
вирования в недоступных для клетки соединениях восстановленной
меди. Способность S. platensis к выносу меди является условием вы-
живания клеток в присутствии этого тяжелого металла.
Для практических целей получения обогащенной микроэлемента-
ми биомассы S. platensis с высокой продуктивностью необходимо ис-
пользовать критерии внутриклеточного содержания элемента и выхо-
да биомассы. Максимальное значение произведения этих параметров
соответствует концентрации, которую можно считать оптимальной
для включения исследуемого элемента в клетки цианобактерии. Оп-
тимальная концентрация меди для получения обогащенной этим ме-
таллом биомассы S. platensis составляет 0,04 мМ. Произведение вы-
хода биомассы на внутриклеточное содержание элемента для данной
концентрации максимально. Оптимальной концентрацией марганца
для получения обогащенной биомассы S. platensis, является 2,5 мМ.
12. БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ
ПОПУЛЯЦИЙ МИКРОВОДОРОСЛЕЙ
В исследовательской работе и при практическом применении ми-
кроводорослей мы, как правило, имеем дело не с единичной клеткой,
а с популяцией клеток, физиологические характеристики которой
зависят от параметров среды, популяционных отношений и индиви-
дуальных особенностей каждой особи, определяющихся в основном
стадией развития клетки. Свойства популяции микроводорослей,
таким образом, представляют собой совокупность параметров всех
клеток, составляющих популяцию. Знание закономерностей разви-
тия клеток, проявления их индивидуальных особенностей на более
высоком популяционном уровне необходимо для разработки методов
и аппаратуры интенсивного культивирования микроводорослей и для
правильной интерпретации результатов экспериментов, проводимых
на культурах одноклеточных фотосинтезирующих организмов.
Основной особенностью микроводорослей является существо-
вание в жизненном цикле клетки двух резко отличающихся стадий
- световой и светонезависимой. На световой стадии происходит раз-
витие фотосинтетического аппарата и хлоропласта, интенсивное на-
копление биомассы. На светонезависимой стадии в клетке протекают
процессы, не требующие энергии света: репликация ДНК, деление
ядра, хлоропласта, самой клетки и образование автоспор. Естествен-
но, что столь значительные различия в отношении клетки к главному
«субстрату» - энергии света при переходе из одной стадии развития
в другую обязаны отразиться на фотосинтетической активности и ме-
таболизме клетки.
86
Биотехнология микроводорослей
Учитывая, что длительности жизненных циклов наиболее часто
применяемых и хорошо изученных форм в оптимальных условиях
роста лежат в пределах от 10 до 20 часов, в абсолютной времен-
ной шкале динамика онтогенетических процессов микроводорослей
должна протекать с достаточно быстрыми переходами от одной ста-
дии к другой.
Синхронная культура. Для исследования клеточного цикла ми-
кроводорослей используют синхронную культуру, в которой все клет-
ки находятся на одной стадии онтогенетического развития. Динамика
параметров синхронной культуры дает возможность определить сред-
нестатистические значения физиологических характеристик клетки в
онтогенезе.
Рассмотрим методику получения синхронной культуры и динами-
ку процессов в клеточном цикле Chlorella.
Синхронную культуру обычно получают длительным последова-
тельным чередованием световых и темновых периодов выращивания
микроводорослей. Для ускорения процесса синхронизации культуры
и получения более высокой степени синхронности клеток был ис-
пользован разработанный нами метод, описание которого приводится
ниже (Цоглин, Клячко-Гурвич, 1980).
Водоросли предварительно выращивали в накопительном режиме
в культуральных сосудах (Владимирова, Семененко, 1962) при интен-
сивности освещения 35 Вт/м2, температуре 37°С и концентрации СО2
в ГВС 1,7%. Выращивание проводили на разбавленной в 2 раза среде
Тамийя с нитратным азотом (таблица 1), приготовленной на дистил-
лированной воде. Когда плотность суспензии достигала 4,5-5,0 г/л,
начинали периодические разбавления культуры свежей питатель-
ной средой, которые проводили 3 раза в сутки так, чтобы плотность
суспензии перед каждым разбавлением была близка к 5 г/л. В этом
режиме водоросли выращивали в течение 4 суток. Подготовленную
таким образом культуру использовали для инокулирования фоторе-
акгора с плоскопараллельными стенками, освещаемого ксеноновой
лампой ДКСТВ-6000 (Семененко и др., 1967). Интенсивность света
на поверхности фотореактора составляла 350 Вт/м2, толщина слоя
суспензии - 10 мм. Остальные параметры культивирования оставля-
Биологические особенности популяций микроводорослей
87
ли такими же, как в культуральных сосудах. Плотность суспензии в
фотореакторе после внесения инокулята составляла 0,15-0,20 г/л.
Десятикратное увеличение интенсивности света при пересеве
водорослей из культуральных сосудов в фотореактор вызывало пере-
стройку возрастного состава популяции. Через 6-8 ч, когда числен-
ность крупных и делящихся клеток достигала максимума, выключали
свет. Использование для предварительной синхронизации переход-
ных процессов в изменении возрастного состава популяции позво-
ляло после 5-часового периода темноты получать высокий процент
автоспор без обычного в таких случаях отстаивания или центрифуги-
рования суспензии.
После предварительной синхронизации следовали два светотем-
новых цикла с 7-ю часами освещения и 4-мя часами темноты, что
позволяло получить высокую степень синхронизации культуры. В
третьем, «рабочем», цикле, в течение которого измеряли физиологи-
ческие характеристики культуры, свет в светонезависимый период
развития клеток не выключали. Газообмен культуры по О2 измеряли
непрерывно в течение рабочего цикла с помощью амперометрическо-
го датчика парциального давления растворенного кислорода, встроен-
ного в фотореактор, с помощью инфракрасного оптикоакустического
газоанализатора ОА-2209 (по поглощению СО2) и парамагнитного га-
зоанализатора кислорода МН-5129.
Световые кривые фотосинтеза получали с помощью разработан-
ной установки, схема которой представлена на рис. 38 (Семененко,
Синицкий, Цоглин, 1972), позволяющей достигать интенсивности ос-
вещения ячейки с микроводорослями до 1500 Вт/м2.
Необходимость одновременного измерения фотосинтеза по вы-
делению кислорода и по поглощению углекислого газа связана с
изменением фотосинтетического коэффициента в цикле развития
клетки. Учитывая высокие скорости процессов в клетке, определе-
ние свойств культуры должно проводиться в относительно короткие
промежутки времени.
Для быстрых измерений фотосинтетической активности суспен-
зии и снятия световых кривых использовалась разомкнутая схема
снабжения углекислым газом с записью рО2 в растворе. Размещение
датчика непосредственно в измерительной кювете сводит к миниму-
88
Биотехнология микроводорослей
Рис. 38. Схема установки для измерения скорости фотосинтеза микроводо-
рослей
му инерционность системы, и время полного установления сигнала
колеблется в пределах 3—4 мин, в зависимости от выбираемых усло-
вий, а для снятия световых кривых по 5-7 точкам уходит, таким об-
разом, 30-40 мин.
В качестве источника света 1 в зависимости от эксперимента ис-
пользовался облучатель с шаровой ксеноновой лампой ДКСШ-1000
или с кинолампой мощностью в 500 Вт. Применение ксеноновой лам-
пы позволяло получать высокие облученности в узких спектральных
областях. Световой поток формировался двумя конденсорами 2 так,
чтобы создать на поверхности измерительной кюветы 5 равномерное
поле. Диаметр входного окна кюветы - 100 мм. Перед кюветой стоит
тепловой фильтр 3 и кассета 4 для включения нейтральных (при снятии
световых кривых) или цветных фильтров. Интенсивность падающего
и прошедшего света регистрировалась термостолбиком Козырева 7 и
гальванометром 18. В кювету встроен датчик рО2 8 и элекгротермо-
метр б, сигналы которых регистрируются прибором 20 и самописцем
15. Чувствительность системы измерения рО2 позволяла растягивать
шкалу самописца до 1% при любом начальном значении концентра-
ции растворенного кислорода. Перемешивание и циркуляция суслен-
Биологические особенности популяций микроводорослей 89
зии производились продувкой газовой смеси через газотеплообменник
10. В ячейке 9 происходит отделение газа от жидкости. Краны 11 и
19 служат для включения системы замкнутого контура циркуляции
газа. Темновой объем суспензии, включая газотеплообменник, краны,
газожидкоотводный разделитель и коммуникации, составляют 4% от
общего объема. Полный объем заливаемой суспензии - 80 см3. В цепь
замкнутого газового контура включены циркуляционный насос 14, га-
зоанализаторы СО2(ОА-2209) 12 и О2 (МН-5129) 13, сигналы которых
регистрируются записывающими приборами 16 и 17.
Развитие фотосинтетического аппарата и функциональная
активность хлоропласта в онтогенезе клетки Chlorella. Число ав-
тоспор, которые образуются в клетке за жизненный цикл, зависит от
интенсивности света, а длительность цикла развития (при достаточ-
ном минеральном питании и снабжении углекислым газом) опреде-
ляется в основном температурой суспензии (Цоглин, Владимирова,
1972, 1973, 1974). В заданных условиях культивирования длитель-
ность жизненного цикла исследуемого штамма Chlorella С-1 (Клячко-
Гурвич, Цоглин, Семененко, 1979) составила 10 ч (6-6,5 ч - световая
стадия развития и 3,5-4 ч - светонезависимая, и клетки при этом об-
разовывали по 8 и 16 автоспор; среднее значение - 14).
Рост биомассы клетки (рис. 39) (Цоглин, Клячко-Гурвич, 1980) в
первые 5 часов цикла развития имел характер, близкий к экспонен-
циальному (кривые 2 и 10). Через 5 часов, что по времени соответ-
ствует началу репликации ядерной ДНК, происходило замедление
скорости роста биомассы. Второе снижение скорости роста биомас-
сы, связанное с процессами цитокинеза и делением клетки, наступало
на 9-м часу цикла.
Начало цикла (первые 1,5 часа) характеризуется формировани-
ем фотосинтетического аппарата клетки и наблюдается образование
только хлорофилла а (Хла) при снижении содержания в клетке хло-
рофилла Ь (ХлЬ) (вставка, кривые 4, 5), и отношение Хла/ХлЬ резко
возрастает. Затем начинается постепенное повышение концентрации
ХлЬ. В конце световой стадии развития накопление Хла в клетке пре-
кращается при одновременном более интенсивном образовании ХлЬ
Динамика образования в клетке разных форм хлорофилла (Хл) отра-
90
Биотехнология микроводорослей
жается отношением их содержания (кривая 6), причем величина это-
го отношения в течение цикла развития достигала 10,5. Параллель-
но с синтезом Хл« идет накопление в клетке линоленовой кислоты
и формирование реакционных центров фотосистем (Клячко-Гурвич,
Цоглин, Можайцева, 1981). Синтез линолевой кислоты происходит
одновременно с ростом содержания Хлб, что свидетельствует об об-
разовании светособирающих комплексов фотосистем.
Особый интерес представляет сравнение по циклу развития клет-
ки динамики скоростей выделения кислорода и прироста биомассы
(кривые 7, 8). В начале цикла- скорость выделения кислорода выше
скорости прироста биомассы, но увеличение скорости прироста био-
массы в первые 5 часов цикла происходит значительно быстрее.
За 5 часов скорости этих процессов возросли соответственно в 4,4
и 2,4 раза. Максимумы скоростей выделения кислорода и прироста
биомассы в расчете на клетку достигаются одновременно, примерно к
8 часам клеточного цикла. Однако в силу различного характера их ди-
намики, максимумы удельных скоростей этих процессов (в расчете на
единицу биомассы, кривые 9, 10) существенно сдвинуты по фазе, что
свидетельствует об изменении в процессе онтогенеза клетки значения
фотосинтетического коэффициента (ДО2/ДСО2). При этом максиму-
мы удельных скоростей выделения кислорода в расчете на единицу
биомассы и на единицу Хл совпадают по времени. Измерение дыха-
ния клетки через 1,5-2,0 минуты после выключения света (в расчете
на единицу биомассы, кривая 11) показало его незначительный рост
(в 1,4 раза) в период, совпадающий с максимальной удельной скоро-
стью выделения кислорода.
В этот же период происходит резкое (в 3 раза) увеличение на-
сыщающей фотосинтез интенсивности света с 200 до 600 Вт/м^,
причем это изменение происходит за относительно короткий период
времени (рис. 40).
Представленные результаты свидетельствуют о значительных из-
менениях функциональных свойств хлоропласта в онтогенезе клеток
Chlorella С-1. На первых фазах развития клетки происходит быстрый
рост хлоропласта на фоне очень незначительного увеличения объема
самой клетки. К 4,5-5 часам цикла развития хлоропласт занимает
около 75% общего объема клетки, и примерно к этому моменту удель-
Биологические особенности популяций микроводорослей
91
Время, ч
Рис. 39. Изменение параметров синхронной культуры Chlorella С-1 в онтоге-
незе при оптимальной концентрации СО2.
А: 1 - число клеток, 2 - биомасса клеток, 3 - содержание Хл, 4 - содержание
Хла, 5 - содержание Хл/>, 6 - отношение содержания Хла к ХлЛ;
Б: 7 - скорость выделения кислорода (AO^At), 8 - скорость роста биомассы
(AP/At), 9 - удельная скорость выделения кислорода (AO^AtP), 10 - удельная
скорость роста биомассы (AP/AtP), 11 - удельная скорость дыхания - (AO^AtP).
На вставке масштаб содержания хлорофилла увеличен в 2 раза
92
Биотехнология микроводорослей
Рис. 40. Световые кривые скорости выделения О2 (на единицу биомассы) на
разных стадиях развития клеток культуры при оптимальной концентрации
СО2. Числа около кривых обозначают время от начала цикла развития в часах
ная скорость прироста биомассы достигает максимума. Несомненно,
в онтогенезе клетки происходят качественные изменения фотосинте-
тического аппарата. Об этом говорят последовательность синтезов
Хла и ХлЬ, резкий рост насыщающей фотосинтез интенсивности све-
та и сдвиг по фазе между удельными скоростями выделения кисло-
рода и прироста биомассы. Подобное разнесение во времени между
максимумами выделения кислорода и поглощения СО2 наблюдается
у зеленеющих этиопластов. По-видимому, в начале клеточного цикла
Биологические особенности популяций микроводорослей
93
микроводорослей идут процессы, сходные с формированием хлоро-
пласта de novo у высших растений.
Клеточный цикл Chlorella при концентрациях СО2 в газовой
смеси ниже оптимального уровня. Снижение концентрации СО2 в
газовой смеси до 0,25% мало влияет на характер процессов, протека-
ющих в начале цикла, и вызывает лишь замедление развития клетки
(рис. 41).
Максимум отношения содержания Хла/Хлб смещается с 1,5 до 2,5 ч
от начала клеточного цикла, а его значение уменьшается с 10,5 до 6,0.
Скорости выделения кислорода и прироста биомассы также ниже, чем
при оптимальной концентрации СО2. На более поздних стадиях разви-
тия (примерно с момента наступления максимума удельной скорости
прироста биомассы) отмечается угнетение роста клеток недостатком
СО2. Среднее число автоспор, образуемых клеткой, сохраняется на
прежнем уровне, а длительность цикла вырастает до 20-22 часов.
Уменьшение концентрации СО2 до 0,03% при сохранении высокой
интенсивности света (барботирование суспензии воздухом) (рис. 42)
приводит к снижению скорости развития клеток в 5-6 раз.
После 8 часов культивирования (что больше, чем вся световая стадия
развития клетки при оптимальной концентрации СО2) клетки морфоло-
гически мало отличаются от автоспор, и еще не начинается синтез ХлЛ.
Среднее число автоспор снижается незначительно (с 14 до 9), поскольку
их количество определяется интенсивностью света. Клетки делятся на
4,8 и 16 автоспор, а длительность цикла выросла до 55-60 часов.
Действие различных концентраций растворенного в суспен-
зии кислорода на клеточный цикл и фотосинтез Chlorella. Кон-
центрация кислорода в атмосфере достаточно постоянна, поэтому
кислород не рассматривается обычно в качестве экологического фак-
тора. Однако при культивировании микроводорослей для различных
целей часто приходится использовать бескислородные газовые смеси
как, например, при биосинтезе соединений, равномерно меченных ста-
бильными изотопами (Цоглин, Евстратов, Семененко, 1979). С другой
стороны, высокие концентрации растворенного в суспензии кислоро-
да при промышленном культивировании микроводорослей вызывают
94
Биотехнология микроводорослей
400
зоо
200
100
Рис. 41. Изменение параметров синхронной культуры Chlorella С-1 в онто-
генезе при концентрации СО2 в ГВС 0,25%.
А: 1 - число клеток, 2 - биомасса клеток, 3 - содержание Хл, 4 - содержание
Хла, 5 - содержание Хл/>, 6 - отношение содержания Хла к ХлЬ,
Б: 7 - скорость выделения кислорода, 8 - скорость роста биомассы, 9 - удель-
ная скорость выделения кислорода, 10 - удельная скорость роста биомассы
Биологические особенности популяций микроводорослей
95
Время, ч
Рис. 42. Изменение параметров синхронной культуры Chlorella С-1 при бар-
ботировании суспензии воздухом:
1 - скорость выделения кислорода; 2 - биомасса клеток; 3 - содержание Хла;
4 - содержание ХлЬ
снижение продуктивности фотореакторов и представляют собой одну
из сложных проблем массового культивирования. Как низкие (относи-
тельно равновесной с воздухом - 21%), так и высокие концентрации
растворенного в суспензии кислорода могут по-разному действовать на
протекающие в клетке процессы в зависимости от стадии ее развития.
Динамика фотосинтетической активности клеток при интенсивнос-
ти света 440 Вт/м2 и различном парциальном давлении растворенного
в суспензии кислорода представлена на рис. 43. Пониженная концен-
трация О2 в среде (рО2 4-7%) с самого начала клеточного цикла (Акы-
ев, Цоглин,1991,1992; Akyevatal., 1993) вызывает усиление фотосин-
тетической активности клеток по выделению кислорода (кривая 2)
по сравнению с обычными условиями (рО2 21 -25%) (кривая 1). При
96 Биотехнология микроводорослей
высокой концентрации О2 (рО2 60-73%) удельная скорость выделения
кислорода мало отличается от контроля (кривые 1, 3). Это говорит
о том, что ингибирование фотосинтетического выделения кислорода
клетками Chlorella начинается уже при парциальном давлении О2 в
среде ниже значения, равновесного с воздухом (21%).
Низкие и высокие концентрации растворенного в суспензии кис-
лорода по-разному отразились на процессах синтеза биомассы и вы-
деления кислорода (рис. 43). При низкой концентрации кислорода
в среде прирост биомассы клетки по сравнению с контролем (рО2
21-25%) увеличился только на 15-20%, в то время как скорость выде-
ления кислорода в этих условиях возросла вдвое. При высоком значе-
нии рО2 в суспензии, которое практически не отразилось на выделе-
нии кислорода, скорость накопления биомассы клетками значительно
снизилась. Кроме того, высокая концентрация кислорода вызвала за-
держку деления клеток и удлинение клеточного цикла;
0 2 4 6 8 10
Время от начала клеточного цикла, ч
Рис. 43. Динамика удельной скорости выделения О2 при продувке суспензии
ГВС с различным содержанием О2:
1 - продувка суспензии воздухом + 2% СО2 (рО2 - 21-25%) (контроль); 2 - про-
дувка N2 + 2% СО2(рО2 - 4-7% за счет фотосинтетического выделения кисло-
рода клетками); 3 - продувка смесью N2 + О2 + 2% СО2 (рО2 - 60-73%)
Биологические особенности популяций микроводорослей
91
Действие различных рО, на фотосинтетические процессы нашло
свое отражение и в формировании фотосинтетического аппарата в он-
тогенезе клетки. Скорость накопления Хл заметно падала с повышени-
ем рО2 (рис. 44), причем при высоком значении рО2 максимум отноше-
ния Хла/ХлЬ наблюдался значительно позже (после 6 часов развития
клетки), что свидетельствует о задержке формирования фотосинтети-
ческого аппарата. Подобное уменьшение содержания Хла при одновре-
менном увеличении каротиноидов в условиях высокой концентрации
кислорода характерно и для цианобакгери Spirulina platensis.
Различия в действии кислорода на фотосинтетическое выделение
кислорода и прирост биомассы клетки можно объяснить двумя при-
чинами. Во-первых, при высоких значениях рО2 может происходить
Время от начала клеточного цикла, ч
Рис. 44. Динамика изменения Хла и ХлЬ в в клеточном цикле синхронной
культуры при разли <ной концентрации О2 в суспензии:
1 -3-Хла;4-6- <л6; 7 - 9 - Хла/ХлЬ.
1,4,7 - продувка суспензии воздухом + 2% СО2 (рО, - 21-25%); 2,5,8 - продув-
ка N, + 2% СО2(рО2 - 4-7%); 3,6,9 - продувка N2 + О2 + СО, (рО, - 63-70%)
98
Биотехнология микроводорослей
потеря фиксированной СО2 через гликолат в культуральную среду.
Во-вторых, при низких рО2 метаболизм клетки меняется в сторону
большего накопления липидов, т.е. в сторону синтеза более восста-
новленной (высококалорийной) биомассы, за счет чего увеличивается
скорость выделения кислорода.
Изменение направленности биосинтеза в онтогенезе клет-
ки Chlorella С-1. Основываясь на данных по синхронной культуре,
жизненный цикл клетки Chlorella можно условно разбить на три эта-
па: этап преимущественного синтеза соединений, необходимых для
формирования фотосинтетического аппарата и хлоропласта; синтез
запасных соединений и веществ, необходимых для деления клетки;
формирование автоспор и деление клетки (рис. 45).
Соответственно в процессе онтогенетического развития клетки
происходят изменения в направленности ее метаболизма. Это видно
на примере скорости синтеза Хл, максимум которой наблюдается в
начале клеточного цикла в период формирования фотосинтетическо-
го аппарата клетки.
На рис. 46 представлено изменение содержания белков, углеводов
и суммы жирных кислот липидов в клеточном цикле Chlorella.
В начале клеточного цикла (при нормальной концентрации кис-
лорода в среде - 21-25%) содержание белков (кривая 1) и углеводов
(кривая 2) постепенно растет примерно до 5 часов цикла развития
(начало репликации ДНК). Сумма жирных кислот в начале цикла не-
сколько возрастает и затем, в период от 2 до 4 часов от начала кле-
точного цикла, падает в 1,5 раза (кривая 3). После 5 часов цикла на-
правленность процессов меняется: происходит падение содержания
белков с последующим увеличением суммы жирных кислот. Сниже-
ние содержания углеводов в клетке начинается позднее в конце кле-
точного цикла на светонезависимой стадии развития.
Изменение метаболитной направленности в клетках, по-видимому,
является общей закономерностью для многих видов микроводорос-
лей. Подобное изменение содержания белков и углеводов наблюдает-
ся на синхронной культуре Chlamydomonas и Nannochloropsis sp.
Растворенный в суспензии кислород, наряду с синтезом Хл, ока-
зывает сильное действие на динамику накопления в клетке жирных
99
О
Биологические особенности популяций микроводорослей
Максимум активности
выделения О2 и светового
насыщения фотосинтеза
Максимум
активности по
поглощению СО2
Формирование Формирование
ССК
рц
Формирование хлоропласта
Синтез запасных
соединений и веществ
для образования
автоспоо
Световая стадия развития
Формирование
автоспор и
деление клетки
Светонезависимая
стадия
Рис. 45. Последовательность развития клетки микроводорослей в онтогенезе:
РЦ - реакционные центры фотосистем, ССК - светособирающие комплексы,
Тс - световая стадия развития клетки, Т - длительность клеточного цикла
развития
Рис. 46. Изменение содержания белков (1), углеводов (2) и жирных кислот
липидов (3) в клеточном цикле Chlorella
100
Биотехнология микроводорослей
Рис. 47. Изменение содержания суммы жирных кислот в цикле развития
клетки при разных парциальных давлениях О2, растворенного в суспензии:
1 - продувка суспензии воздухом + 2% СО2 (рО2 - 21-25%) (контроль);
2 - продувка N2 + 2% СО2 (рО2 - 4-7%); 3 - продувка N2 + О2 + СО2 (рО, -
63-70%).
кислот. При низких концентрациях кислорода (рис. 47, кривая 2) ско-
рость увеличения содержания жирных кислот в клетке в несколько
раз выше, чем в контроле (рО2 - 21-25%), и их сумма увеличивается
в 2 раза за первые 2 часа онтогенеза. При высоких значениях рО2 в этот
же период происходит резкое (более чем в 3 раза) падение содержания
жирных кислот в клетке. Это, как отмечалось выше, в какой-то степени
объясняет рассогласование между скоростями выделения кислорода и
прироста биомассы при различных концентрациях кислорода в среде.
Изменение рО2 в среде культивирования может служить одним из
факторов управления направленностью биосинтеза микроводорослей.
13. ВОЗРАСТНАЯ СТРУКТУРА ПОПУЛЯЦИЙ
При синхронном культивировании микроводорослей физиологи-
ческие параметры популяции отражают среднестатистические свой-
ства клетки в конкретный момент времени. В случае несинхронного
культивирования популяция представляет собой совокупность раз-
новозрастных клеток, обладающих различными характеристиками в
зависимости от стадии онтогенеза. Любой параметр такой популяции
может быть выражен в виде соотношения:
[Лт)п(т) Jr, (1)
где F - искомый параметр популяции, т- возраст клетки, fir) - функ-
ция, характеризующая изменение этого параметра отдельной клетки
по жизненному циклу, и(г) - относительное возрастное распределе-
ние клеток в популяции, Т- длительность жизненного цикла.
Возрастное распределение клеток, размножающихся делением,
носит экспоненциальный характер с ростом функции в сторону мо-
лодых особей (Цоглин, 1973, 1974; Цоглин, Сорокин, 1976; Цоглин,
Бакулин, 1977; Цоглин, Семененко, 1979). Для микроводорослей,
клетки которых способны образовывать от 2 до 32 автоспор, параметр
возрастного распределения выразится отношением Ino/T” (а - число
автоспор), которое в пределе равно удельному коэффициенту размно-
жения культуры । и определяется, с одной стороны, генетическими
свойствами штамма, с другой - условиями культивирования. Мак-
симальное значение ц достигается на экспоненциальной фазе роста
культуры и при наиболее продуктивном (Семененко и др., 1966) для
102
Биотехнология микроводорослей
фотосинтезирующих одноклеточных организмов турбидостатном ме-
тоде культивирования.
Относительное возрастное распределение клеток в популяции
микроводорослей выразится соотношением:
и. е*г
= °-Т-Г (2)
где е - основание натурального логарифма.
Соотношение показывает, что относительное возрастное распре-
деление клеток в популяции зависит только от удельной скорости раз-
множения культуры. Изменение условий культивирования приводят к
перестройке возрастного состава популяции микроводорослей.
Проявления особенностей онтогенетического развития клетки
на популяционном уровне. Основываясь на возрастном распределе-
нии клеток в установившемся режиме культивирования и динамике
параметров клетки в онтогенезе можно определить некоторые свойства
популяции. Например, распределение клеток по размерам, исходя из
уравнений (1,2) и динамики роста биомассы клетки Chlorella в онтоге-
незе, может быть выражено уравнением:
игт
d(r) = dQ-e3T' 0<т<Т (3)
где d0 - размер автоспоры; J(r) - среднестатистический размер клетки
возраста г; Т - длительность световой стадии развития клетки.
Средний размер клеток для всей популяции можно определить по
уравнению:
_ ЗТС-Т fi(3Tc-T) цТ
- ЗТ (1-е 3 ) е 3 -е 3
d = .L1—!------2_+£------------— (4)
(ЗТс-Т)(\-е~иТ') 1-е-дГ
Уравнения показывают, что среднестатистический размер кле-
ток популяции зависит от условий культивирования и увеличивает-
ся с повышением интенсивности выращивания. Например, для по-
Возрастная структура популяций
103
пуляции Chlorella С-1, размер автоспоры которой равен 3 мк, при
значении удельной скорости размножения р = 0,09 ч_| средний диа-
метр клетки будет равен 3,75 мк. При увеличении интенсивности
культивирования до р - 0,3 ч_| среднее значение диаметра клетки
становится равным 5,08 мк.
Кроме того, распределение клеток по размерам в популяции имеет
два пика, первый из которых соответствует размеру автоспор, второй
- размеру клеток, находящихся на светонезависимой стадии развития.
На рис. 48 представлены расчетная кривая распределения клеток по
размерам (1) и экспериментально полученные данные (2) для куль-
туры Chlorella С-1, свидетельствующие о достаточной адекватности
теоретических соотношений реальным процессам.
Аналогичным образом, используя функцию возрастного распреде-
ления клеток и динамику скорости выделения кислорода в онтогене-
Рис. 48. Распределение клеток по размерам в культуре Chlorella С-1:
1 - расчетная кривая, 2 - экспериментальная кривая
104 Биотехнология микроводорослей
зе, можно получить соотношение, описывающее фотосинтетическую
активность популяции для различных условий культивирования:
Р = NP-------Ц------------- (5)
" ° (1)(Г / Т -1)
где: Рп - фотосинтетическая активность культуры, N - число клеток
культуры; Ро - величина скорости фотосинтеза автоспоры в заданных
условиях культивирования.
Приведенные соотношения могут быть полезными при расчетах и
построении фотореакторов, для выбора режимов культивирования и
прогнозирования продуктивности промышленных систем.
Необходимо, однако, учитывать, что эти соотношения описывают
состояние популяции при стабильных условиях культивирования, т.е.
при постоянном значении удельного коэффициента размножения ц.
В реальных условиях ц остается постоянной величиной только при
относительно низкой концентрации биомассы в суспензии или при
непрерывном турбидостатном культивировании. После окончания
экспоненциальной фазы роста культуры значение ц начинает сни-
жаться и необходимо использовать его текущее значение, которое в
приближенном виде может быть определено как:
/л=/л N/N,
где ртм - значение удельного коэффициента размножения на экспо-
ненциальной фазе роста, N- общая численность популяции, Na - чис-
ленность популяции в конце экспоненциальной фазы роста.
Индивидуальные особенности цикла развития клетки проявляют-
ся на популяционном уровне при накопительном режиме культиви-
рования. На рис. 49 показана динамика изменения основных харак-
теристик культуры Chlorella С-1 в процессе накопительного куль-
тивирования при постоянных внешних условиях и при изменении
интенсивности света. На светонезависимой стадии развития клетки
микроводорослей не нуждаются в энергии света и независимо от из-
менений условий культивирования образуют то число автоспор, кото-
рое определяется интенсивностью света, падавшего на клетку на све-
товой стадии развития. Это вызывает инерционность изменения в от-
Возрастная структура популяций
105
InN Ы Юв/мл
Время культивирования, ч
Рис. 49. Динамика изменения основных характеристик культуры Chlorella С-1
при выращивании в интенсивных условиях:
А - рост числа клеток в логарифмическом (1) и линейном (2) масштабах.
Числа под кривыми: ц - удельная скорость роста; в кружках - средний диа-
метр клетки в мк.
Б - динамика изм „-нения фотосинтетической активности клетки (1) и сум-
марный фотосинтез суспензии (2). Стрелками на рисунке отмечены моменты
уменьшения и увеличения интенсивности света
106
Биотехнология микроводорослей
вет на внешнее воздействие важнейших параметров популяции, таких
как фотосинтетическая активность, средний диаметр клеток, удельный
коэффициент размножения. В сочетании с перестройками возрастного
состава любое изменение внешних условий культивирования приво-
дит к сложным переходным процессам. В частности, значения р 0,49 и
0,53 ч'1 на рис. 49 отражают колебательный характер перехода культу-
ры из менее интенсивных условий роста в более интенсивные. Макси-
мальное -значение этого коэффициента в установившемся режиме при
длительности цикла развития 10 ч и максимальном числе автоспор 32
составляет 0,347 ч1. Инерционность изменений параметров популяций
при переходе с низкой интенсивности света к высокой легла в основу
описанного выше метода синхронизации культур микроводорослей.
Изменения внешних условий вызывают перестройки в возрастном
составе популяций, которые, в свою очередь, приводят к изменениям
физиологических параметров культур микроводорослей. Это пред-
ставляет собой популяционный уровень адаптации микроводорослей
к условиям среды обитания.
Формирование возрастной структуры популяций для повышения
продуктивности культур и управление химическим составом био-
массы микроводорослей. Исследования изменений метаболизма клеток
в онтогенезе микроводорослей, их проявлений на популяционном уровне,
изучение возрастной структуры популяций в сочетании с методом форми-
рования заданной возрастной структуры открыли новые возможности в
управлении химическим составом биомассы.
Изменение функциональной активности организмов в течение их
жизненного цикла - общебиологическая закономерность. В хозяй-
ственной деятельности при культивировании многолетних высших
растений и животных человек учитывает эту закономерность и фор-
мирует оптимальную возрастную структуру популяции. При этом, как
правило, ставится цель оптимизации по выходу нужного продукта при
условии непрерывности или периодичности (сезонности) процесса.
Микроводоросли также меняют функциональную активность и
направленность биосинтезов в процессе онтогенеза. В этом плане их
отличают лишь микроскопические размеры, что существенно затруд-
няет управление их возрастным составом в популяциях. Формирова-
Возрастная структура популяций
107
ние оптимальной возрастной структуры дает также возможность по-
вышения продуктивности культур.
На светонезависимой стадии развития фотосинтетическая актив-
ность клеток в расчете на единицу биомассы значительно снижается,
клетки на этой стадии имеют крупные размеры и поглощают много
энергии света с малой эффективностью ее преобразования. Выведе-
ние таких клеток из фотореактора должно привести к увеличению
продуктивности культуры. Расчеты показывают, что при равных про-
чих условиях продуктивность фотореактора по биомассе в режиме с
управлением возрастным составом популяции может быть увеличена
в 1,44 раза. Однако при этом меняется качественный состав биомас-
сы в сторону увеличения содержания низкокалорийных углеводов, и
КПД утилизации световой энергии меняется мало.
Выведение «материнских» клеток из культиватора уже через не-
сколько часов приведет к остановке процесса. Для поддержания не-
прерывности процесса необходимо сохранение в популяции части
автоспор, образующихся при делении материнских клеток. Величина
этой части (Ко) зависит от интенсивности процесса культивирования,
соотношения длительностей клеточного цикла и световой стадии раз-
вития в данных условиях, и ее значение определяется соотношением:
к - ^г-(г"'гч'-1> (6)
° ЦТ-Т}) (efT-l)2
Изменение химического состава биомассы микроводорослей ме-
тодом формирования заданной возрастной структуры популяции.
Существенные изменения функциональной активности хлоропласта и
метаболизма в жизненном цикле микроводорослей создают также воз-
можности управления химическим составом биомассы.
Возрастная структура может быть сформирована в различных
вариантах (Цоглин, Бакулин, 1977; Цоглин и др., 1995). На рис. 50
представлены кривые возрастного распределения клеток в популяции
без управления ( .ривая 1) и для трех вариантов идеального разделе-
ния клеток по вс зрастным фракциям (кривые 2-4). При этом кривые
построены с учетом условия одинаковой концентрации биомассы в
фотореакторе во всех четырех случаях. Под возрастом клетки подраз-
108
Биотехнология микроводорослей
умевается временной период развития от автоспоры до текущего мо-
мента. Поскольку длительность клеточного цикла зависит не только
от формы микроводоросли, но и от условий культивирования, возраст
клетки представлен на рисунке в относительных единицах, где за еди-
ницу принята длительность клеточного цикла.
При управлении возрастным составом популяции в фотореакто-
ре в урожай отбираются преимущественно клетки, достигшие свето-
независимой стадии развития, что приводит к изменению биохими-
ческого состава урожая по сравнению с режимом выращивания без
управления. Возрастное распределение биомассы клеток в урожае (ко-
личество биомассы клеток в популяции в зависимости от их возраста)
при выбранных режимах управления примет вид, представленный на
рис. 51. Изменения, которые произойдут при этом в составе биомассы
Рис. 50. Возрастное распределение клеток культуры: 1 - без управления воз-
растным составом, 2 - при выделении из культиватора всех клеток, достиг-
ших светонезависимой стадии развития, 3 - при сохранении в культиваторе
части делящихся клеток, обеспечивающих образование необходимого коли-
чества автоспор, 4 - при поддержании одинакового количества клеток всех
возрастов
Возрастная структура популяций
109
урожая, отображены в таблице 7. В режиме без управления возраст-
ным составом Chlorella С-1 содержит около 42% белка, 24% углеводов
и 18% липидов. В таблице эти значения приняты за единицу.
Расширить пределы изменений химического состава и выхо-
да отдельных компонентов в урожае микроводорослей можно, по-
видимому, за счет сочетания управления возрастным составом с экс-
тремальными воздействиями на культуру.
Режим управления возрастным составом одновременно с повы-
шением продуктивности дает возможность изменения фотосинтети-
ческого коэффициента культуры (отношение объема поглощенного
углекислого газа к объему выделенного кислорода), что может быть
важным для регулирования газового состава атмосферы в замкнутых
Рис. 51. Распределение биомассы клеток в зависимости от их возраста в
урожае без управления (1) и при различных режимах управления возрастной
структурой популяции (2-4)
по
Биотехнология микроводорослей
Таблица 7
Изменение продуктивности и биохимического состава биомассы при
различных режимах управления возрастным составом популяций
Воз- раст- ной состав* Продук- тивность по био- массе Содер- жание белка Выход белка Содер- жание углево- дов Выход углево- дов Содер- жание липи- дов Выход липи- дов
2 1,35 0,69 0,93 1,24 1,67 1,07 1,44
3' 1,44 0,78 1,12 1,22 1,76 0,86 1,23
4 0,98 1,27 1,22 0,68 0,65 0,97 0,95
* Возрастной состав: 2 - при выведении из культиватора всех клеток, достигших све-
тонезависимой стадии развития; 3 - при сохранении в культиваторе части делящихся
клеток, обеспечивающих образование необходимого количества автоспор; 4 - при
поддержании одинакового количества клеток всех возрастов (номер режима соответ-
ствует кривым на рис. 50).
системах жизнеобеспечения. Это представляет собой актуальную
проблему, поскольку дыхательный коэффициент человека (соотноше-
ние поглощаемого кислорода и выделяемого человеком углекислого
газа) постоянно меняется в зависимости от питания, режима работы,
времени суток, а управление дыхательным коэффициентом человека
недопустимо. Возможность управления газовым составом в системе
жизнеобеспечения определяется изменением отношения скоростей
выделения кислорода и поглощения углекислого газа в жизненном
цикле клетки. Расчеты показывают, что фотосинтетический коэффи-
циент может быть изменен в пределах от 1 до 0,79. Существует воз-
можность смещения фотосинтетического коэффициента культуры и в
сторону большую 1, для чего необходимо формирование в фотореак-
торе популяции клеток в возрастном диапазоне от автоспор до 4 часов
клеточного цикла. Однако такой режим приведет к существенной по-
тере продуктивности культуры по выходу биомассы.
Таким образом, управляя возрастным составом популяций
Chlorella в зависимости от задач культивирования, можно увеличивать
продуктивность культуры по биомассе, по выходу отдельных компо-
нентов или менять значение фотосинтетического коэффициента.
Каковы же возможности управления возрастным составом по-
пуляций микроводорослей, имеющих размеры в несколько микрон?
Возрастная структура популяций
111
К концу клеточного цикла клетки не только увеличиваются в разме-
рах, но и меняется их биохимический состав в сторону накопления
углеводов, имеющих большую удельную плотность по сравнению с
другими компонентами клетки. Это существенно увеличивает их се-
диментационные свойства, что и служит основой для управления воз-
растным составом. Для решения этой задачи применим метод двух-
фазного культивирования (рис. 52).
Суспензия микроводорослей из фотореактора 1 прокачивается на-
сосом 2 через сепаратор 3. Благодаря более высоким седиментаци-
онным свойствам клеток, находящихся на светонезависимой стадии
развития, в сепараторе происходит разделение суспензии на фракции.
Фракция, содержащая преимущественно молодые клетки, возвраща-
ется в фотореактор, а фракция, содержащая преимущественно клет-
ки, находящиеся на светонезависимой стадии развития, поступает в
неосвещаемую добавочную емкость 4, где происходит деление кле-
ток, не требующее энергии света. Часть образовавшихся при этом ав-
тоспор возвращается в фотореактор.
При проточном культивировании микроводорослей в устано-
вившемся режиме вероятность попадания в урожай клеток того или
иного возрастного состояния пропорциональна их относительной
S
। Рис. 52. Схема метода управления возрастным составом культуры микро-
» водорослей
112 Биотехнология микроводорослей
численности в популяции. Принудительное изменение вероятности
выхода из культиватора клеток определенного возраста приведет к
установлению нового возрастного распределения в популяции. При
этом длительность переходного периода будет определяться степе-
нью изменения вероятности и скоростью протока. Например, при
ц = 0,2 ч_| вероятность выхода в урожай клеток, находящихся на свето-
независимой стадии развития, составляет 0,12. Увеличение вероятно-
сти до значения 0,25 приведет к возникновению через 4-5 клеточных
циклов (44—55 ч) нового возрастного распределения в культиваторе,
при котором относительная численность клеток на светонезависимой
стадии развития уменьшится в 6-7 раз.
Таким образом, процесс управления возрастным составом попу-
ляций микроводорослей заключается в изменении вероятности выхо-
да в урожай клеток заданных возрастных групп.
Эксперименты с сепарацией суспензии с помощью закручивания
ее в циклон и отбором урожая с внешней поверхности циклона по-
зволили повысить продуктивность фотореактора по выходу биомассы
в 1,35 раза.
Метод управления возрастным составом популяции, не требую-
щий дополнительной энергии на сепарацию суспензии, может быть
реализован при непрерывном турбидостатном культивировании.
В установившемся режиме сливаемая в урожай суспензия по-
ступает в добавочную емкость, объем которой таков, чтобы ее на-
полнение происходило за 2-3 часа от момента включения протока.
Температура суспензии в добавочной емкости поддерживается такой
же, как и в фотореакторе, но суспензия находится в темноте. В доба-
вочную емкость попадают клетки на разных стадиях развития, имею-
щие разные седиментационные свойства. Часть клеток, находящихся
на поздних стадиях развития, делится на автоспоры. В результате, в
добавочной емкости происходит расслоение суспензии, при котором
автоспоры и молодые клетки оказываются в верхней части емкости, а
старые внизу. Часть автоспор и молодых клеток забирается с верхней
части добавочной емкости и возвращается в фотореактор для поддер-
жания непрерывности процесса культивирования, а урожай непре-
рывно со скоростью, равной скорости протока, сливается из нижней
части емкости.
14. АВТОСЕЛЕКЦИОННЫЕ ПРОЦЕССЫ
В ПОПУЛЯЦИЯХ
Распространение различных организмов по ареалам, захват аре-
алов обитания, вытеснение одними видами других определяются во
многих случаях степенью приспособленности видов к условиям сре-
ды, ростом численности их популяций в заданных условиях обитания
или, в конечном итоге, разностью между удельными скоростями раз-
множения и гибели конкретных видов.
Подобные явления вытеснения одним видом другого возникают и
при промышленном культивировании микроводорослей в фотореакто-
рах открытого типа. Так, например, в Рулите (Болгария, в описанных
выше фотореакторах, рис. 13) при инокулировании установок в весен-
ний период культурой Chlorella vulgaris летом эта форма вытеснялась
Scenedesmus obliquus, а осенью опять восстанавливалась монокультура
Chlorella. Аналогичные события происходили и в трубчатых фоторе-
акторах в Душанбе, где культура Chlorella периодически вытеснялась
Scenedesmus или Oocistis в зависимости от температурных условий.
В неконтролируемых условиях открытых установок практически
невозможно противостоять этим явлениям, однако они могут найти и
полезное применение.
В практике работы с микроводорослями часто возникает необхо-
димость подбора форм, обладающих наибольшей продуктивностью
в конкретных условиях. Решение этой задачи представляет значи-
тельную трудность в связи с большим разнообразием штаммов, от-
личающихся по фотосинтетической продуктивности, оптимальному
114
Биотехнология микроводорослей
сочетанию параметров культивирования, степени устойчивости к тем
или иным воздействиям и по ряду других физиологических свойств.
Другие, не менее важные задачи связаны с селекционно-генетической
работой, с выделением из популяции продуктивных мутантов, спон-
танно появляющихся в популяциях, а также с расчетом устойчивости
культур в промышленных установках и в биологических системах
жизнеобеспечения. Уровень спонтанных мутаций в активных культу-
рах микроводорослей составляет 10’5-10’6, а при действии мутаген-
ных факторов вероятность появления мутантов может достигать 1(У3.
При количестве клеток 108-109 в 1 мл суспензии число мутантных
клеток высоко, и необходимо быть уверенным, что какой-либо из му-
тантов не вытеснит основную культуру.
Для решения этих задач были изучены процессы, протекающие в
культурах, состоящих из двух или более различных форм одноклеточ-
ных организмов (многокомпонентных популяциях).
Анализ автоселекционных процессов в многокомпонент-
ных популяциях микроводорослей. При активном росте культур
микроводорослей гибель клеток невысока, и кроме того, исполь-
зуемые нами значения удельного коэффициента размножения р,
определяемые по приросту численности популяций, уже учитывают
гибель клеток. Это позволяет описать конкурентные отношения в
многокомпонентной популяции, используя удельный коэффициент
размножения р и коэффициент замедления процесса для плотных
культур. Изменение численности форм в многокомпонентной попу-
ляции выражается при этом системой дифференциальных уравне-
ний, описывающих динамику численности каждой из форм, кото-
рая может быть легко решена с помощью вычислительной техники
(Цоглин и др., 1967, 1970). Концентрация любой формы (л. = N1YN.,
\ <i<m)n заданный момент времени описывается соотношением:
(7)
Автоселекционные процессы в популяциях
115
в котором п0. - относительная численность форм от l-й до m-й в на-
чальный момент культивирования; ка - коэффициент замедления про-
цесса, учитывающий фототрофные свойства клеток, определяемый
как отношение числа клеток, при котором начинается линейная ста-
дия роста популяции, к общей их численности в текущий момент;
t - время процесса. На экспоненциальной фазе роста культуры ка= 1,
на линейной фазе ка принимает значения меньше 1.
На рисунке 53 представлены расчетные кривые, иллюстрирующие
процесс выделения в монокультуру продуктивного штамма в случае
культивирования смеси из двух форм, отличающихся по удельным
скоростям размножения на 0,05, 0,1 и 0,2 ч'1. Кривые построены для
4-х начальных относительных численностей в популяции продуктив-
ной формы - 0,01,0,1,0,2 и 0,3. Из соотношения (7) и рисунка видно,
что скорость процесса образования монокультуры более продуктив-
ной формы зависит от разности удельных коэффициентов размно-
жения культур и от начальной относительной численности наиболее
продуктивной формы.
Адекватность расчетов по соотношению (7) реальным автоселек-
ционным процессам в многокомпонентной популяции была проверена
Рис. 53. Разделение культур при различных сочетаниях удельных коэффи-
циентов размножения и начальных относительных численностей клеток
штаммов.
Числа сверху - разницы удельных коэффициентов размножения культур
116
Биотехнология микроводорослей
с использованием трех форм микроводорослей: Chlorella vulgaris С-1,
Chlorella kessleri С-9 и Scenedesmus obliquus S-305, которые легко
можно было определить по морфологическим признакам под све-
товым микроскопом. Культивирование проводили в турбидостат-
ном режиме в фотореакторе с плоскопараллельными стенками при
интенсивности света 350 Вт/м2, температуре суспензии 36°С и при
барботировании суспензии ГВС с содержанием СО, 1,7%. Ростовые
характеристики культур в заданных условиях (табл. 8) определяли
по кривым роста в накопительном режиме. Эксперименты проводи-
ли при поддержании суммарной численности многокомпонентной
популяции на уровне экспоненциальной и линейной стадий роста.
Теоретические кривые рассчитывали с учетом и без учета длитель-
ностей лаг-фаз выбранных форм.
Как видно из рисунков 54 и 55, эксперименты показали достаточно
высокую адекватность разработанных моделей реальным автоселек-
ционным процессам в многокомпонентной популяции. За счет более
высоких значений ц образование монокультуры наиболее продуктив-
ной формы происходит несколько быстрее при невысокой численности
популяции, соответствующей экспоненциальной стадии развития. При
наименьшей начальной относительной численности Chlorella С-1 (10%
от общей численности популяции) уже через 80 часов содержание кле-
ток этой культуры в популяции составило более 90%. При плотности
смешанной культуры, соответствующей линейной стадии роста, такой
же результат был получен через 104 часа культивирования.
При развитии многокомпонентной популяции интенсивность фо-
тосинтеза должна возрастать по мере отбора продуктивного штамма.
На экспоненциальном участке роста культуры возрастание фотосин-
теза обуславливается двумя причинами: ростом численности популя-
ции и процессом отбора. На линейном участке, где изменение числа
Таблица 8
Ростовые характеристики культур
Культура Длительность лаг-фазы, ч ц, Ч'1
Chlorella vulgaris С-1 4 0,21
Chlorella kessleri С-9 9 0,16
Scenedesmus obliquus S-305 8 0,07
Автоселекционные процессы в популяциях
117
Рис. 54. Динамика процесса выделения продуктивной формы при плотно-
сти культуры, соответствующей линейной стадии роста:
1 — Chlorella vulgaris С-1; 2 — Chlorella kessleri С-9; 3 - Scenedesmus obliquus
S-305; 4 - суммарное число клеток популяции
Рис. 55. Динамика процесса выделения продуктивной формы при плотности
культуры, соответствующей экспоненциальной стадии роста:
1 -4 - то же, что и на рис. 54
118 Биотехнология микроводорослей
клеток не влияет на суммарный фотосинтез популяции, рост интенсив-
ности фотосинтеза объясняется чисто качественными изменениями,
происходящими в популяции в процессе отбора. Это иллюстрирует
рис. 56, на котором приведены кривые изменения фотосинтетической
активности многокомпонентной популяции в экспериментах на экспо-
ненциальной и линейной стадиях роста микроводорослей. Поскольку
точка стабилизации плотности суспензии в опыте на линейной ста-
дии была высока, то увеличение фотосинтетической активности после
перевода реактора на проточный режим можно объяснить только уве-
личением концентрации продуктивной культуры Chlorella С-1.
Несколько меньшая величина максимального уровня фотосинтеза
в эксперименте на линейной стадии объясняется высокой плотностью
суспензии, при которой часть клеток находится в условиях ниже све-
тового компенсационного пункта фотосинтеза. Максимальный уро-
вень фотосинтеза достигается не к концу эксперимента, когда пода-
вляющее большинство популяции составляют клетки наиболее про-
дуктивного штамма, а значительно раньше, когда концентрация мало-
Рис. 56. Изменение интенсивности фотосинтеза многокомпонентной попу-
ляции в процессе выделения продуктивной формы:
1 - эксперимент на экспоненциальной стадии роста; 2 - эксперимент на ли-
нейной стадии роста. Стрелками отмечено начало включения режима про-
точного культивирования с поддержанием оптической плотности культуры
Автоселекционные процессы в популяциях
119
продуктивной в данных условиях культуры Scenedesmus близка к 0.
В опыте на экспоненциальной стадии это происходит через 30 ч при
относительной численности Chlorella С-1, Chlorella С-9 и Scenedesmus
соответственно 0,62,0,34 и 0,04; в опыте на линейной стадии - через
40 ч при относительной численности культур 0,55, 0,43 и 0,02. Даль-
нейший выход из фотореактора Chlorella С-9 не сказывается на увели-
чении фотосинтеза, поскольку величины фотосинтетической актив-
ности этой культуры и Chlorella С-1 в данных условиях отличаются
только на 16%, а изменение относительных их численностей в попу-
ляции от 0,5:0,5 до образования монокультуры Chlorella С-1 должно
привести к увеличению фотосинтеза только на 8%. Это изменение не
заметно на фоне обычных колебаний фотосинтеза, свойственных лю-
бой популяции микроводорослей в высокоактивных условиях.
Таким образом, математическое моделирование автоселекции в
многокомпонентных популяциях микроводорослей и их эксперимен-
тальное исследование дало объяснение процессам изменения видо-
вого состава культур при промышленном выращивании микроводо-
рослей в фотореакторах открытого типа. Сезонные изменения темпе-
ратурных световых или каких-либо других условий культивирования
могут приводить к выделению в монокультуру другой формы.
Расчеты также показывают, что при постоянном действии повы-
шенного мутагенного фона при использовании биологического звена
в системах жизнеобеспечения может произойти вытеснение перво-
начальной формы мутантной. Однако это может привести только к
улучшению фотосинтетических характеристик культуры, поскольку
условием такого вытеснения является более высокая скорость удель-
ного размножения мутантной формы в заданных условиях.
На основании этих исследований предложен метод выделения
продуктивных форм в селекционно-генетической практике, заключа-
ющийся в воздействии на исходную культуру мутагенного фактора с
последующим ее культивированием в турбидостатном режиме. Необ-
ходимо, однако, отметить, что метод применим только для выделения
продуктивных форм и непригоден для получения мутантов с какими-
либо другими полезными свойствами. Дальнейшие работы в этом на-
правлении показали возможность выделения в монокультуру даже еди-
ничной мутантной клетки с лучшими ростовыми характеристиками.
120
Биотехнология микроводорослей
Применение метода автоселекции для выбора продуктивной
формы при промышленном культивировании микроводорослей.
При массовом культивировании микроводорослей с использованием
солнечного освещения такие важные внешние параметры среды куль-
тивирования, как уровень солнечной радиации, длительность свето-
вого дня, дневные и ночные температуры, зависят от региона и не
поддаются регулированию. Для повышения продуктивности устано-
вок большое значение приобретает выбор штамма микроводоросли,
обладающего наилучшими ростовыми характеристиками при суще-
ствующих условиях культивирования. Важное значение имеют и та-
кие параметры культуры, как длительность лаг-фазы (которая может
возникать в утренние часы), устойчивость к стрессовым факторам, к
различным видам кантоминации.
Возможность выбора наиболее продуктивной формы методом ав-
тоселеции была проверена в условиях промышленного производства
биомассы микроводорослей. Работа проводилась на промышленных
установках Института переработки зерна (г. Потсдам, Германия).
Было проведено сравнение трех методов выбора форм: по параме-
трам синхронных культур, по ростовым кривым и метода автоселек-
ции (Tsoglin et al., 1995).
Учитывая естественный светопериодизм при выращивании на
солнечном освещении, наиболее удачным методом культивирования
может оказаться синхронная культура, поскольку, как было показано
выше, плато светового насыщения фотосинтеза и эффективность пре-
образования световой энергии клетками меняются в ходе онтогене-
за, значительно возрастая к середине цикла развития клетки и затем
снова снижаясь к концу световой стадии. Это наилучшим образом
совпадает с изменением солнечной активности в течение светового
дня. Процессы деления клеток и выхода автоспор в синхронной куль-
туре, не требующие энергии света, могут проходить в ночное время.
Однако ведение синхронной культуры в масштабах промышленных
установок представляет собой трудновыполнимую задачу из-за непо-
стоянства погодных условий и температуры суспензии, влияющих на
длительность клеточного цикла, сезонного изменения длительности
светового дня и высоких плотностей культуры. Тем не менее, получе-
ние хотя бы частичной синхронизации может значительно повысить
Автоселекционные процессы в популяциях
121
продуктивность культуры. Для этого необходимо, чтобы выбранная
форма, кроме перечисленных выше характеристик, имела длитель-
ность световой стадии развития, соответствующую средней за куль-
тивационный период длительности светового дня. Для работы были
отобраны 4 штамма Chlorella vulgaris из разных коллекций микрово-
дорослей, применяемые как продуктивные для массового культиви-
рования в России и Германии:
- А-34 (коллекция Института переработки зерна, Германия);
- 211-11-s (коллекция микроводорослей Геттинген, Германия);
- С-1 (коллекция Института физиологии растений РАН);
- С-11 (коллекция Института физиологии растений РАН).
Снятие ростовых кривых монокультур каждого из выбранных
штаммов, которое проводили в культуральных сосудах под открытым
небом, не дало достоверного результата. Ростовые характеристики
культур менялись в каждом последующем эксперименте в зависимо-
сти от погодных условий.
Определение ростовых характеристик штаммов по параметрам
синхронных культур проводили в лаборатории при интенсивности
света, дневной и ночной температуре, максимально приближенным
к среднестатистическим климатическим условиям региона. Полу-
ченные данные (табл. 9) показывают, что Chlorella С-1 в заданных
условиях имеет самый высокий суточный прирост биомассы и, об-
ладая наиболее короткой световой стадией развития, лучше других
выбранных штаммов подходит для получения синхронной культуры
при естественном светопериодизме.
При отборе формы методом автоселекции в естественных условиях
были инокулированы все 4 штамма с примерно одинаковой начальной
оптической плотностью 0,05 каждой из них при длине волны 750 нм.
Поскольку идентификация выделившейся в результате автоселек-
ции формы под световым микроскопом представляет существенную
трудность, предварительно были сняты спектры размерного распре-
деления клеток каждого из штаммов. После 12 дней культивирова-
ния многокомпон нтной популяции снятый после ночного периода
спектр распределения размеров клеток соответствовал автоспорам
штамма Chlorella С-1, что свидетельствует об образовании в фоторе-
акторе монокультуры этой формы и о ее синхронизации.
122
Биотехнология микроводорослей
Таблица 9
Ростовые характеристики штаммов Chlorella vulgaris, полученные
на синхронных культурах в заданных условиях культивирования:
интенсивность света - 45 Вт/м2, Т - 26°С
Параметры культуры С-1 А-34 211-11-s С-11
Число автоспор 4-8 4-16 4-8 4-8
Длительность жизненного цикла, ч 16 17 20 20
Длительность световой стадии развития, ч 9,5 11,5 14,5 13
Увеличение биомассы за цикл, раз 6,2 4,4 3,9 4,2
Сравнение трех методов выбора формы для промышленного куль-
тивирования показало, что снятие кривых роста культур требует боль-
шого числа повторных экспериментов для получения правильного
результата. Это может быть затруднительно при выборе из большого
количества штаммов. Метод синхронных культур обладает наиболь-
шей информативностью, но получение синхронной культуры - дли-
тельный и трудоемкий процесс, поэтому метод может применяться
только при малом числе конкурентов для отбора. Метод автоселекции
практически не имеет ограничений по числу конкурирующих форм и
является наиболее простым методом выбора продуктивной формы на
заданные условия культивирования. Однако необходимо учитывать,
что его можно применять лишь в тех случаях, когда главное внимание
уделяется получению биомассы, а ее состав, который в определенных
пределах зависит от культивируемого штамма, не имеет принципи-
ального значения.
15. РЕАЛЬНО ДОСТИЖИМАЯ
ПРОДУКТИВНОСТЬ МИКРОВОДОРОСЛЕЙ
Вернемся к вопросу о потенциальной продуктивности микрово-
дорослей.
Максимальная величина скорости фотосинтеза, измеренная по
выделению кислорода, отмечается в начале клеточного цикла, по ско-
рости прироста биомассы - в середине цикла, перед концом свето-
вой стадии развития. Рассогласование между скоростями выделения
кислорода и прироста биомассы связано с изменением качественной
направленности биосинтезов клетки. Если в начале клеточного цикла
синтезируются в основном высококалорийные белки и липиды, то к
концу световой стадии развития клетки биосинтез направлен на на-
копление запасных элементов - углеводов, калорийность которых
в 2-3 раза ниже. Значение же энергетического КПД по использованию
падающего на клетку света, то есть по отношению количества падаю-
щих калорий к синтезированным клеткой, меняется незначительно на
световой стадии развития и составляет 18-19%. На светонезависимой
стадии развития клетки, длительность которой составляет примерно
40-45% от длительности цикла развития, эффективность утилизации
световой энергии резко падает за счет почти полного прекращения
фотосинтеза в моменты последовательного 4-, 5-кратного деления
хлоропластов и клетки и за счет протекания процессов синтеза ДНК,
требующих высоких энергетических затрат (Белл, 1980). Таким обра-
зом, средняя за клеточный цикл эффективность утилизации световой
энергии составляет порядка 15%. Управление возрастным составом
124
Биотехнология микроводорослей
может повысить продуктивность по валовому выходу биомассы на
30-40% за счет выведения из активной зоны реактора малопродук-
тивных делящихся клеток, но КПД использования света изменится
при этом незначительно (на 2-3%) из-за существенного снижения ка-
лорийности биомассы в урожае.
Исходя из перечисленных соображений, полученные в начале
работы значения потенциальной продуктивности необходимо умень-
шить на четверть, кроме того, надо учесть практически неизбежные
20-30%-ные потери световой энергии в результате отражения света
от поверхности суспензии. Реально достижимая продуктивность ми-
кроводорослей при калорийности биомассы 4 ккал/г составит в этом
случае 230-240 г сухой биомассы в сутки для фотореакторов с искус-
ственным круглосуточным освещением и 90-95 г для естественного
освещения.
Полученная в лабораторных условиях эффективность использова-
ния световой энергии суспензиями микроводорослей достигает завет-
ной величины в 15% (Семененко и др., 1967), но только при расчете
КПД по падающей на суспензию энергии, а по отдаваемой источника-
ми света энергии не превышает 9-10%. Продуктивность для промыш-
ленных установок с естественным освещением находится в пределах
10-20 г/м2 в сутки (очень редко до 30 г/м2 в сутки). Для искусствен-
ного освещения в лабораторных условиях было получено значение
140 г/м2 в сутки (Семененко и др., 1967), но при этом КПД утилиза-
ции поглощенной световой энергии не превышал 3%, а при расчете от
падающей энергии ФАР был еще на порядок ниже. Если учесть КПД
ламп по ФАР (полезное преобразование электрической энергии в свет
видимой области), то это число надо уменьшить еще в 3-4 раза.
Таким образом, для получения 1 кг сухой биомассы микрово-
дорослей при искусственном освещении необходимо затратить как
минимум 120-150 кВт-ч электроэнергии без учета других процес-
сов производства (термостатирование, сепарация суспензии, сушка
и пр.). Если при промышленном производстве затраты на электро-
энергию принять порядка 30% от общих затрат, себестоимость про-
дукта будет очень высокой. По-видимому, искусственное освещение
суспензии может быть рентабельным только для получения биомассы
медицинского назначения или для производства целевых продуктов.
Реально достижимая продуктивность микроводорослей
125
Из приведенных данных видно, что пока остается огромное про-
странство для творчества в направлении повышения как продуктив-
ностей, так и КПД утилизации световой энергии при промышленном
производстве биомассы микройодорослей.
Ориентировочную оценку потенциально возможной производи-
тельности фотореакторов по биомассе (Р) можно проводить на основе
той суммарной световой энергии, которую получает его светоприем-
ная поверхность. Для условий круглосуточного искусственного осве-
щения определение падающей суточной световой энергии не пред-
ставляет трудностей, и потенциальную производительность можно
выразить соотношением:
Р = 14,4rjIS(\ - 0,2 Vm/Vc)/Q, (8)
где г] - КПД утилизации света, который (как видно из изложенного)
для оценки потенциальных возможностей может быть взят порядка
0,1-0,12; I - интенсивность света в Вт/м2; S - площадь светоприем-
ной поверхности фотореактора в м2; К и Vm - освещаемый и неосве-
щаемый объемы суспензии; Q - калорийность 1 г биомассы в ккал;
14,4 - коэффициент пересчета падающей суточной радиации в ккал,
учитывающий 30%-ные потери световой энергии на отражение от
поверхности фотореактора и поверхности суспензии.
Определение суммарной световой энергии при использовании
солнечного освещения значительно усложняется постоянным из-
менением интенсивности света и угла падения солнечных лучей, на
светоприемную поверхность фотореактора. Ориентировочная фор-
мула определения потенциальной продуктивности в этом случае
принимает вид:
D 0,б7ТЗ( 1-0,2К./И)
Р=--------*------L—J I (t) cos <p(t)dt (9)
где Т - длительн' >сть светового дня в часах; ф - угол падения солнеч-
ной радиации на светоприемную поверхность фотореактора в момент
времени t; /1 - начало, t2- конец светового дня; 0,6 - коэффициент пе-
ресчета падающей в час радиации в ккал с учетом 30%-ных потерь.
126
Биотехнология микроводорослей
Естественно, значение Т] существенно зависит от культивируе-
мой формы микроводорослей. Приведенные формулы имеют смысл
для высокоинтенсивных термофильных культур таких, как Chlorella,
Scenedesmus, Spirulina, при оптимальных параметрах культивирова-
ния и светораспределения в культуре. В свою очередь, значительные
отклонения реальных продуктивностей от расчетных могут свиде-
тельствовать о конструктивных или технологических ошибках в си-
стеме или в процессе культивирования.
16. ЭКОЛОГИЧЕСКИЕ АСПЕКТЫ
ПРОМЫШЛЕННОГО ПРИМЕНЕНИЯ
МИКРОВОДОРОСЛЕЙ
Кроме перечисленных выше возможностей промышленного ис-
пользования микроводорослей нельзя не упомянуть о направлениях,
рассматриваемых как экологические, - снижение выброса углекис-
лого газа ТЭЦ, очистка сточных вод промышленных и сельскохозяй-
ственных предприятий, получение биотоплива. В основе этих направ-
лений, как правило, лежит интенсивное культивирование микроводо-
рослей в установках открытого типа с использованием солнечного
освещения.
За последнее столетие выброс углекислого газа в атмосферу мно-
гократно вырос, и несмотря на огромную буферную емкость атмос-
феры, концентрация СО2 в воздухе неуклонно растет. Повышение
концентрации СО, практически пропорционально увеличивает фото-
синтетическую продуктивность морей, океанов и наземных растений.
Если сейчас ограничить выброс СО, уже достигнутым уровнем, то
через 5-10 лет концентрация этого газа в атмосфере стабилизируется
на новом, несколько более высоком уровне. По-видимому, именно это
и преследует Киотский договор.
Одним из основных источников СО2 является теплоэнергетика. В
свою очередь дым ТЭЦ - это источник концентрированного углекис-
лого газа, необхо. ;имого для активного ведения процесса фотосинтеза
микроводоросле i.
Рассмотрим сначала идеальный вариант утилизации дымовых га-
зов. При полном сгорании топлива образуется СО, и выделяется опре-
128
Биотехнология микроводорослей
деленное количество тепла (значения зависят от качества топлива). За
счет фотосинтетической утилизации микроводорослями всего выде-
лившегося СО2 биомасса должна накопить то же количество калорий,
что выделилось при сгорании топлива. Таким образом, можно будет
использовать биомассу микроводорослей для сжигания в ТЭЦ, и про-
изойдет «замыкание» цикла. ТЭЦ будет работать за счет солнечной
энергии, накапливаемой в биомассе.
Реально же никогда не происходит полного сгорания топлива,
существуют потери тепла, и они могут быть довольно значительны-
ми. Большое количество энергии требуется на организацию процес-
са культивирования, сепарацию, сушку биомассы, и возврат хотя бы
50-60% энергии в виде биомассы можно считать великолепным ре-
зультатом.
Что для этого требуется? Проведем расчет для небольшой ТЭЦ,
обслуживающей поселок из 100-150 домов. ТЭЦ сжигает в сутки 10 т
мазута. При этом с дымовыми газами выделяется 30 т углекислого
газа в сутки (без учета потерь на неполное сгорание). Чтобы утили-
зировать это количество СО2, должно быть выращено 15-20 т (сухой
вес) биомассы микроводорослей, а это даже при идеальных услови-
ях выращивания при достижении высокой продуктивности и КПД
утилизации света микроводорослями порядка 12-15% потребует
20-30 тыс. м2 освещаемой поверхности фотореакторов. В реальных
же условиях (облачность, низкая освещенность в зимние периоды и
пр.) освещаемую поверхность фотореакторов необходимо увеличить
еще в 5-10 раз, то есть поверхность фотореакторов будет соизмери-
ма с площадью, занимаемой самим поселком. СО2 из дымовых газов
возможно использовать только в дневное время, когда идет процесс
фотосинтеза, в темное время суток его нужно накапливать с после-
дующим использованием в течение светового периода, что требует
организации системы сжижения углекислого газа и хранения в специ-
альных емкостях. Однако несмотря на приведенные несколько пуга-
ющие цифры, фотосинтетическую утилизацию дымовых газов можно
использовать хотя бы для частичного ограничения выбросов СО, в
атмосферу, наряду с химическими способами очистки.
Использование выхлопных газов тепловых станций для промыш-
ленного культивирования микроводорослей существенно снижает се-
Экологические аспекты промышленного применения... 129
бестоимость биомассы (низкая стоимость углеродного питания водо-
рослей и возможность термостатирования суспензии за счет теплых
отводных вод ТЭЦ). Но несмотря на кажущуюся простоту вопроса,
возникает ряд достаточно сложных проблем. Необходима фильтрация
дыма от микрочастиц и от сопутствующих СО2 других газов, в пер-
вую очередь СО, метана и этилена, постоянная регенерация и замена
фильтров, строгий контроль за содержанием в получаемой биомассе
тяжелых металлов и вредных примесей.
Рассмотрим возможности использования микроводорослей для
очистки сточных вод от тяжелых металлов. Выше было показано, что
благодаря процессам метаболизации и восстановления металлов до
нетоксичного состояния микроводоросли способны накапливать боль-
шие количества (в мг/г сухой массы) Se - до 1,0, Zn - до 4,0, Си -
до 1,0, еще большие количества Са, Fe, Mg, Мп, Сг. Сорбционная
способность микроводорослей по тяжелым металлам намного пре-
восходит другие сорбенты. Для сравнения некоторые цианобактерии
способны накапливать до 160 мг Си на г сухого веса, в то время как ак-
тивированный уголь - 10 мг/г, а катионообменные смолы - до 45 мг/г.
Расчет очистных сооружений для очистки от тяжелых металлов
можно легко провести аналогично расчету по дымовым газам, зная ко-
личества металлов в сточных водах. Если количество тяжелых метал-
лов в сточных водах не превышает нескольких г на м3, то для очистки
1 м3 потребуется освещаемая поверхность фотореакторов порядка
10-15 м2, но нужно быть уверенным, что в сточных водах не содержат-
ся вещества, токсичные для роста и размножения микроводорослей.
Что касается переработки сточных вод животноводческих пред-
приятий, то работы Института медико-биологических проблем
М3 СССР (в настоящее время Государственный научный центр РФ
Институт медико-биологических проблем РАН - ГНЦ ИМБП РАН),
направленные на решение задач систем жизнеобеспечения в космосе,
показали возможность практически полной утилизации отходов с по-
лучением целого ряда полезных продуктов.
Микроводоро< лям отводится роль утилизации минеральной со-
ставляющей отхсдов за счет процесса фотосинтеза. В частности,
наши эксперименты показали, что при культивировании Chlorella на
жидкой составляющей 1 кг свиного навоза можно получить 4 г био-
130
Биотехнология микроводорослей
массы (сухой вес), при этом в процессе роста микроводорослей про-
исходит обеззараживание исходной жидкости (практически полная
гибель кишечных палочек и других видов бактерий). К сожалению,
эти методы очистки сточных вод животноводческих предприятий так
и не привлекли внимания специалистов.
Наибольший интерес, особенно в последние годы, вызывает воз-
можность использования фотосинтеза микроводорослей для полу-
чения биотоплива. Нефть, газ, уголь, торф - не что иное, как биото-
пливо, процесс накопления которого шел миллионы лет. За ускорение
этого процесса в миллионы раз необходимо платить энергетическими
единицами.
Не являясь специалистами в политических, экономических, со-
циологических вопросах, мы рассмотрим только энергетическую со-
ставляющую проблемы получения биотоплива.
Потребление энергии человеком в современном мире огромно, и
пищевая составляющая исчисляется долями процента от его общего
потребления. При росте численности населения в сочетании с сокра-
щением полезных площадей, сельское хозяйство с трудом обеспечи-
вает пищевые потребности населения, тратя на получение одной пи-
щевой калории десятки калорий запасенной энергии. По-видимому,
эти соображения существенно снизили интерес к получению биото-
плива из рапса. Использование для получения биотоплива дикорасту-
щих растений, представляющихся, на первый взгляд, бесполезными,
сорными, например, водного геоцинта из болот южных зон, сквер-
но отражается на экологии. Единственно, пока рациональным мож-
но считать переработку в биотопливо органических отходов жизне-
деятельности человека, но и при этом на переработку затрачивается
больше энергии, чем получается в результате переработки. Это и есть
плата за многократное ускорение процесса.
Каковы же в этом плане энергетические возможности микрово-
дорослей? Главные их преимущества - в возможности использова-
ния непригодных для сельского хозяйства районов и в высокой про-
дуктивности. Если взять за основу продуктивность, среднюю между
получаемой в настоящее время и максимально достижимой, то коли-
чество энергии с 1 м2 освещаемой поверхности в сутки составит по-
рядка 250 ккал или, при полной трансформации биомассы, до 25-30 г
Экологические аспекты промышленного применения... 131
биотоплива. С 1 т суспензии, размещенной на 20 м2 освещаемой по-
верхности, мы получим, соответственно, 500-600 г биотоплива в сут-
ки, а энергозатраты на культивирование (перемешивание суспензии,
подача углекислого газа, приготовление питательных сред, сепарация
суспензии, переработка биомассы в биотопливо и т.п., не считая лич-
ных энергетических затрат обслуживающего персонала) составят не
менее 25-30 кВт ч, что эквивалентно примерно 3-4 кг мазута. Таким
образом, на получение 1 кал мы затратим 5-6 кал запасенной энергии.
Остается только повторить, что многократная интенсификация
природных процессов требует платы в энергетических единицах.
17. ФОТОРЕАКТОРЫ ДЛЯ ИНТЕНСИВНОГО
КУЛЬТИВИРОВАНИЯ МИКРОВОДОРОСЛЕЙ
Прежде всего, надо отметить, что нет четкого определения поня-
тия «интенсивное культивирование» и понятий «промышленное куль-
тивирование, промышленные фотореакторы». Приведенные выше
цифры скоростей роста культур в лабораторных условиях многократ-
но превосходят скорости роста в естественных условиях обитания и
это, безусловно, интенсивное культивирование. Но и продуктивности
порядка 0,5-1,0 г/л в сутки или 3-5 г/м2 в сутки также, по-видимому,
можно отнести к интенсивному культивированию, поскольку они зна-
чительно превосходят продуктивности микроводорослей в естествен-
ных условиях обитания.
Что же касается промышленных масштабов культивирования,
то здесь еще труднее определиться. Тонны культивируемой суспен-
зии не говорят ни о чем. Важно количество производимой биомассы.
Но если, например, производится биомасса, равномерно меченная
стабильными изотопами, то и получение 1 кг в сутки можно считать
гигантским производством.
Наконец, какими должны быть промышленные фотореакторы?
Должны ли это быть один или два фотореактора с большим объемом
суспензии или набор стандартных модулей, обеспечивающих необхо-
димый выход продукта, лабильность производства, возможность по-
очередной чистки и профилактики оборудования, быстрого перехода
на другие культуры и другие задачи производства? По-видимому, эти
вопросы необходимо решать в каждом случае отдельно на основе кон-
кретных условий и поставленных задач.
Фотореакторы для интенсивного культивирования...
133
Мы уже рассмотрели в главе «Причины потери продуктивности
культур и эффективности использования световой энергии» наряду с
достоинствами и слабые стороны фотореактора открытого типа, по-
строенного в Болгарии в 1967 г. при участии проф. В.Е. Семененко
и сотрудников Института микробиологии Чехословацкой АН. При-
родные условия Рупите, где расположен этот фотореактор, близки к
идеальным для выращивания микроводорослей: 270 дней в году без-
облачного неба, наличие горячего минерального источника с выходом
углекислого газа и холодной горной реки, обеспечивающие основу
для минерального питания, углекислотного снабжения водорослей
и термостатирования суспензии. Тем не менее, максимальная про-
дуктивность фотореактора составила 30 г/м2 в сутки. Модификации
такого типа открытого фотореактора применяются в нескольких стра-
нах - там, где это позволяют природные условия. Отличаются они в
основном конфигурацией лотков, толщиной слоя суспензии, органи-
зацией потока суспензии и отбора урожая.
Анализ работы различного типа фотореакторов и знание особен-
ностей роста и развития культур микроводорослей позволяют сформу-
лировать основные требования к фотореакторам закрытого типа:
1. Необходимость поиска универсальных решений, обеспечивающих
возможность культивирования различных форм одноклеточных
фотосинтезирующих организмов.
2. Эффективное использование света при равномерном интенсивном
облучении поверхности суспензии в сочетании с высоким массооб-
меном по СО2 и О2.
3. Конструктивные решения должны исключать или минимизировать
обрастание стенок фотореактора и, в особенности, его светопропу-
скающих поверхностей.
4. Требование высокого массообмена должно выполняться такими
методами, которые не разрушали бы клеток культуры и не оказыва-
ли отрицательного влияния на их рост.
5. В условиях высокого массообмена возможно интенсивное цено-
образование, и фотореактор должен обеспечивать в этих условиях
нормальное ведение процесса культивирования.
6. Для получения высоких продуктивностей необходимо исключить
или минимизировать темновые объемы суспензии.
134 Биотехнология микроводорослей
7. При промышленном культивировании важное значение приобре-
тает требование снижения энергетических затрат на организацию
светоприемной поверхности суспензии и массообмен.
Для работы фотореакторов, прежде всего, необходима система по-
дачи ГВС.
Подготовка ГВС осуществляется по схеме, представленной на
рис. 57. Схема проста и не требует дополнительного описания.
Фотореактор трубчатого типа. Из фотореакторов закрытого типа
необходимо отметить трубчатый фотореактор (рис. 58). Интерес к та-
кой конструкции был вызван не столько его продукционными харак-
теристиками, сколько наличием стандартных готовых изделий (сте-
клянных труб, фитингов, насосов), выпускаемых для молочной про-
мышленности. Главными недостатками таких фотореакторов были
перенасыщение суспензии кислородом и быстрое обрастание стенок
К барбатврам
Рис. 57. Схема подготовки газовоздушной смеси:
1 - заборник воздуха и фильтр; 2 - компрессор; 3 - электроконтактный мано-
метр; 4 - ресивер; 5 - редукторы; 6 - ротаметры; 7 - смеситель; 8 - регулиро-
вочные вентили; 9 - распределительная труба; 10 - баллон СО2; 11 - бактери-
цидные фильтры
Фотореакторы для интенсивного культивирования... 135
Б
Рис. 58. Фотореактор трубчатого типа: А - схема, Б - вид промышленного
фотореактора в ИФР РАН
136
Биотехнология микроводорослей
труб водорослями. Кроме того, для организации потока суспензии
использовались мощные насосы, потребляющие электроэнергию и
повреждающие клетки культуры. Многочисленные попытки усовер-
шенствования конструкций, зафиксированные в авторских свидетель-
ствах, не принесли кардинальных изменений.
Фотореактор с плоскопараллельными стенками. В лаборато-
рии проф. В.Е. Семененко в разное время для решения ряда задач
были разработаны фотореакторы закрытого типа для интенсивного
культивирования одноклеточных фотосинтезирующих организмов,
при разработке которых были найдены и использованы конструк-
тивные подходы, в той или иной степени решившие перечисленные
выше проблемы культивирования.
Наиболее простое решение, обеспечивающее равномерное све-
тораспределение на поверхности суспензии при низких потерях све-
товой энергии, хороший СО2/О2 массообмен, представляют собой
фотореакторы с плоскопараллельными стенками (рис. 59 и рис. 60).
Идея и конструкция такого фотореактора предельно проста и трудно
сказать, кто и где использовал ее впервые. Фотореакторы такого типа
у нас широко применялись для решения экспериментальных задач,
для производства биомассы, равномерно меченной стабильными изо-
топами, для длительного турбидостатного культивирования микрово-
дорослей с очень высокой продуктивностью (140 г/м2 в сутки). При
культивировании Chlorella в таком фотореакторе был получен КПД
утилизации света 15%.
Для освещения суспензии в фотореакторе с плоскопараллельными
стенками могут служить люминесцентные лампы или другие более
мощные источники света. В частности, в экспериментальной работе и
при производстве меченых соединений использовались лампы ЛБ-40,
Рефлакс-400 и ксеноновые 6-тикиловаттные лампы ДКСТ-6000. Объ-
ем культивируемой суспензии зависит от габаритов фотореактора.
Поскольку подача ГВС в суспензию производится барботажным ме-
тодом, то чем выше фотореакгор, тем более полно используется СО2.
Но необходимо помнить, что при высоте в 1 м и площади боковой
стенки фотореактора 1 м2 равномерно распределенная нагрузка на
боковые стенки составит 1000 кг. Наиболее рациональная высота
фотореактора составляет 60-70 см. При использовании панелей с лю-
Фотореакторы для интенсивного культивирования...
137
Рис. 59. Фотореактор с плоскопараллельными стенками:
1 - полость для суспензии микроводорослей; 2 - полости для термостатиро-
вания суспензии; штуцеры: 3 - для ввода барботеров; 4 - для ввода датчика
температуры суспензии; 5 - для выхода ГВС в обратный холодильник; 6 -
для возврата воды из обратного холодильника; 7 - для внесения питательной
среды и инокулята; 8 - для слива урожая; 9, 10 - для ввода и вывода термо-
статирующей жидкости
минесцентными лампами длина фотореактора выбирается на 10 см
короче длины ламп, поскольку интенсивность свечения концов ламп
низкая, а температура, наоборот, высокая. Расстояние между лампа-
ми в панели 3-4 см. В зависимости от выбранных ламп длина фото-
реактора составляет от 60 до 90 см. Толщина слоя суспензии 4 см и
полный объем одного фотореактора составляет 20-25 л. При барбо-
тажном методе подачи углекислого газа возможно интенсивное цено-
образование, поэтому на выходе ГВС из каждого фотореакгора можно
установить пеноотбойники, но гораздо проще заливать суспензию в
фотореактор на 3/4 его высоты. Рабочий объем суспензии при этом
будет равен 16-17 л.
138
Биотехнология микроводорослей
Панели с лампами располагаются на расстоянии 2-3 см от боковых
стенок фотореактора. В результате получается достаточно компакт-
ная конструкция, которая при использовании девяти фотореакторов
и десяти панелей с лампами занимает площадь немногим более 1 м2.
Суммарный объем суспензии при этом составляет 150 л, а стабиль-
но получаемая производительность при культивировании Chlorella
- 2,0-2,5 г сухой биомассы с 1 л суспензии в сутки, и общая произ-
водительность такой системы составляет 300-350 г/сутки. Интенсив-
ность света с каждой стороны фотореактора при таком расположении
ламп равна 50-60 Вт/м2, а удельная мощность света (в расчете на 1 л
суспензии) составляет 4,8 Вт/л, что обеспечивает высокую скорость
роста микроводорослей и хороший КПД утилизации света в 10-11%.
Рис. 60. Фотореактор из восьми модулей камер с плоскопараллельными
стенками
Фотореакторы для интенсивного культивирования...
139
1 Как правило, для термостатирования суспензии требуется только
охлаждение, которое производится с помощью расположенной внизу
фотореактора трубки из нержавеющей стали для пищевых целей. По-
дача ГВС производится через два барботера со скоростью 0,5-1,0 л/мин
на 1 литр суспензии.
Конструкция фотореактора из набора стандартных модулей по-
зволяет при наличии 1-2 запасных модулей проводить поочередную
профилактику и замену без остановки процесса культивирования.
Существенным недостатком такой конструкции фотореактора яв-
ляется использование люминесцентных ламп, имеющих КПД по ФАР
не выше 15-16%, и быстрое обрастание стенок фотореактора водорос-
лями, приводящее к необходимости их чистки через каждые 7-8 дней,
а также трудности с использованием естественного освещения. При-
менение более мощных ламп с высоким КПД светоотдачи существен-
но затрудняет создание модульной конструкции из нескольких фото-
реакторов.
Фотореакгоры такого типа можно использовать для промышлен-
ного производства биомассы, особенно для получения дорогостоя-
F щих целевых продуктов, и в качестве промежуточных звеньев про-
| мышленных систем культивирования для наработки инокулята для
। засевов фотореакторов большого объема.
Фотореактор коаксиального типа. Для исключения потерь
энергии света на светораспределяющих системах при использовании
мощных источников света (ДНаТ-400, ДРИ-400) был создан фоторе-
актор, представляющий собой три коаксиально расположенных ци-
линдра (рис. 61). Цилиндры, между которыми находилась суспензия
! микроводорослей, имели диаметры 0,84 м (внешний) и 0,8 м (вну-
: тренний) и высоту 0,25 м. В полость 2, образованную вторым и тре-
• тьим цилиндрами, подавалась термостатирующая суспензию вода. По
• оси цилиндров располагалась лампа ДНаТ-400 или две галогеновые
лампы. Диаметр внутреннего цилиндра был выбран из соображения
1 обеспечения оптимальной (150-170 Вт/м2) интенсивности света на
; поверхности суспензии. Мощность излучения в области ФАР от лам-
пы ДНаТ-400 равна 100 Вт; поверхность внутреннего цилиндра долж-
на быть не менее 0,6 м2.
140
Биотехнология микроводорослей
2
3
Рис. 61. Фотореактор коаксиального типа:
1 - полость для суспензии микроводорослей; 2 - полость для термостатиру-
юшей воды; 3 - источники света; 4 - штуцеры для барботеров, долива пита-
тельной среды, слива суспензии; 5 - штуцеры для термостатируюшей воды
По сути, коаксиальный фотореактор представляет собой плоско-
параллельный, свернутый в трубку, но он позволяет использовать
мощный источник света без системы светораспределения. Объем су-
спензии составлял 15 л, продуктивность 3,5-4,0 г сухой биомассы с
1 л суспензии в сутки и, соответственно, суточная производитель-
ность 55-60 г/сут. КПД утилизации света достигал 12%.
Существенными недостатками фотореактора являются трудности
в масштабировании, сложности при разборке, чистке и последующей
герметизации и большой общий объем (более 600 л) при объеме куль-
тивируемой суспензии 15 л.
Примерами решения специфических задач с помощью микрово-
дорослей могут служить фотореакторы «Фотон» и «Сирень», создан-
ные в 60-х годах прошлого века.
Фотореакторы для интенсивного культивирования... 141
Фотореактор «Фотон». Основная задача при разработке фотореак-
тора «Фотон» состояла в создании полностью автономной системы, спо-
собной работать в условиях невесомости (микрогравитации) в течение
двух недель. Первые испытания Жизнеспособности одноклеточных водо-
рослей в космосе были проведены еще в 1958 г. (Семененко, Владимиро-
ва, 1962), но это были штаммы Chlorella, экспонированные в пробирках
на косяках агар-агара. Необходимо было проверить поведение в космосе
культуры в активном состоянии и найти решения для обеспечения мас-
собмена в условиях невесомости.
На рис. 62 (Цоглин и др., 1971, А.С. № 377030) изображена прин-
ципиальная схема установки «Фотон». Установка состоит из аппарата
для выращивания водорослей 1, газообменника 2, трубопроводов 3,
насоса 4, образующих жидкостной циркуляционный контур 5; побу-
дителя расхода газов 6, газоанализатора 7, определяющего концентра-
цию углекислого газа, газоанализатора кислорода 8, устройства 9 для
удаления кислорода из газовой смеси, образующих газовый циркуля-
ционный контур 10.
Рис. 62. Схема (А) и вид (Б) фотореакгора «Фотон»
142 Биотехнология микроводорослей
В установке также имеются емкость 11 и трубопровод для подачи
углекислого газа и система автоматического контроля и регулирова-
ния параметров, включающая впускной клапан углекислого газа 12,
регулирующий нуль-орган 13, сопоставляющий сигнал от газоанали-
затора 7 с напряжением задатчика процентного содержания углекис-
лого газа 14, регулирующий нуль-орган 15, сопоставляющий сигнал
от газоанализатора 8 с напряжением задатчика процентного содержа-
ния кислорода 16.
Поскольку наземные методы снабжения суспензии углекислым
газом неприменимы в условиях невесомости, эта задача была решена
с помощью газообменника, который представляет собой емкость, со-
стоящую из двух полостей, разделенных газопроницаемой пленкой на
две зоны: газовую и жидкостную. Каждая зона подключена к соответ-
ствующему циркуляционному контуру 5 и 10. Проницаемая для СО2
и О2 пленка изготовлена напылением силиконовой резины на батист
и имеет толщину 50 мк.
Установка работает следующим образом.
При падении в результате фотосинтеза концентрации раство-
ренной в суспензии углекислоты возрастает движущая сила диффу-
зии через газопроницаемую пленку газообменника, что приводит к
движению углекислого газа через пленку из газового контура в жид-
костный. В свою очередь измеряемое газоанализатором уменьшение
концентрации углекислого газа в газовой смеси ниже заданной за-
датчиком приводит к срабатыванию нуль-органа, который включает
впускной клапан. Под действием избыточного давления доза углекис-
лого газа через клапан входит в газовый контур, восстанавливая в нем
исходную концентрацию СО2. Таким образом, в суспензии поддержи-
вается заданная концентрация растворенной углекислоты независимо
от скорости поглощения углекислого газа при росте водорослей.
Одновременно с падением концентрации углекислого газа растет
концентрация растворенного кислорода, возрастает движущая сила
диффузии через пленку, что приводит к выделению газообразного
кислорода и движению его через пленку из суспензии в газовый кон-
тур. Измеряемое газоанализатором увеличение процентного содержа-
ния кислорода в газовой смеси выше заданной задатчиком приводит
к срабатыванию нуль-органа, который включает систему поглощения
Фотореакторы для интенсивного культивирования...
143
кислорода. Восстановление процентного содержания по кислороду
приводит к отключению нуль-органа.
Таким образом, как в суспензии, так и в газовой смеси непрерыв-
но поддерживаются заданные концентрации углекислого газа и кис-
лорода, что создает условия для стабильного культивирования.
Для обеспечения длительной непрерывной работы фотореактора
был применен метод турбидостатного культивирования. Перед на-
чалом культивирования специальная емкость, выполненная в форме
чечевицы, разделенной гибкой мембраной, целиком заполнялась пи-
тательным раствором. По мере роста культуры, датчик оптической
плотности включал дозирующий насос, который отбирал часть су-
спензии из фотореактора и закачивал ее в емкость с питательным рас-
твором с противоположной стороны мембраны. Одновременно рав-
ная по объему порция питательного раствора выдавливалась в фото-
реактор, обеспечивая постоянство объема суспензии и ее плотности в
фотореакторе.
Фотореактор «Фотон» прошел длительные наземные испытания,
но так и не был установлен на спутнике. По-видимому, ко времени
его создания интерес к биологическим системам жизнеобеспечения
несколько поостыл.
Фотореактор «Сирень». Компактный, высокопроизводительный
фотореактор, созданный для проведения экспериментов по обеспече-
нию газообмена человека в гермокабине (Семененко и др., 1967, А.С.
№201137). Фотореактор представляет собой цилиндр диаметром 60 см
и высотой 40 см. Корпус фотореактора (рис. 63) образован цилин-
дрическими прозрачными обечайками - внешней 1, внутренней 2 -
и днищами 3.
Источник света 4 - ксеноновая лампа ДКСТВ-6000 - установлен по
продольной оси фотореактора, в его центре. Для охлаждения источника
света используется вентилятор 5, а для предохранения полости фотореак-
тора от перегрева - водяная рубашка 6, расположенная между обечайкой 2
и дополнительной стенкой 7. Энергия света от источника равномерно
распределяется в суспензии с помощью световода, выполненного в виде
пакета дисков 8 из оргстекла. Суммарная поверхность световода равна
5 м2, а объем суспензии - 25 л. Таким образом, создаваемая на поверх-
144
Биотехнология микроводорослей
Рис. 63. Схема (А) и вид (Б) фотореактора «Сирень». Обозначения в тексте
Фотореакторы для интенсивного культивирования... 145
ности суспензии интенсивность света, с учетом потерь в световоде, равна
170 Вт/м2, а удельная мощность света составляет 35 Вт/л.
Производительность фотореактора «Сирень» по поглощенному
углекислому газу и выделенному кислороду составляет 300 л в сутки
при КПД утилизации световой энергии 6%. Фотореакторы «Сирень»
не одно десятилетие проработали в ГНЦ ИМБП РАН.
Фотореактор «Циклон». В основу конструкции лабораторного
фотореактора «Циклон» заложен предложенный В.А. Жаворонковым
принцип организации светоприемной поверхности суспензии за счет
центробежных сил.
Фотореактор (рис. 64) (Цоглин и др., 1996; Габель и др., 1993, Па-
тент РФ № 2035505) представляет собой герметизируемый сосуд 1 из
нержавеющей стали, внутри которого размещены двустенная охлаж-
даемая водой 10 колба 2 из кварца с источником света и устройство 3,
обеспечивающее массообмен и организацию светоприемной поверх-
ности суспензии (ротор). В корпусе реактора имеется ряд гнезд 4 для
размещения датчиков и гнездо 5 для наблюдения за процессом куль-
тивирования. Термостатирование суспензии осуществляется проточ-
ной водой, поступающей в камеру 6 от термостата.
В отдельной стойке 7 расположены термостат, привод ротора, бло-
ки управления и измерения скорости вращения ротора, температуры
суспензии, измерительные приборы скорости подачи газов, датчики
рО2, pH суспензии и устройство аварийной защиты и сигнализации.
Объем культивируемой суспензии в фотореакторе - от 8 до 12 л.
Интенсивный массообмен обеспечивается при вращении ротора,
благодаря конструкции которого практически исключается ценообра-
зование и возможность разрушения клеток даже безоболочных форм
микроводорослей. Одновременно за счет центробежных сил весь объ-
ем суспензии 8 располагается по внутренней поверхности корпуса
фотореактора таким образом, что исключается контакт суспензии со
светопропускающей поверхностью кварцевой колбы и обеспечивает-
ся равномерное об тучение суспензии с эффективным использованием
светового потока В качестве источников света 9 могут применяться
любые лампы с диаметром не более 65 мм и длиной не более 300 мм.
В экспериментах использовалась натриевая лампа высокого давления
146
Биотехнология микроводорослей
Рис. 64. Схема (А) и вид (Б) фотореактора «Циклон». Обозначения в тексте
мощностью 400 Вт (ДНаТ-400). Конструкция реактора и выбранные
материалы позволяют проводить его стерилизацию химическими
средствами или ультрафиолетом (озоном). Для стерилизации источник
света заменяется ультрафиолетовой лампой, в связи с этим колба 2,
в которой размещен источник света, выполнена из кварца.
На рисунке 65 представлены кривые роста различных форм ми-
кроводорослей и цианобактерии Spirulina platensis в фотореакторе
«Циклон» при оптимальном сочетании внешних условий для каждой
из форм, которые свидетельствуют об отсутствии какого-либо угнете-
ния роста культур. Отрицательного влияния на физиологическое со-
стояние клеток также не обнаружено.
Ниже представлены основные биолого-технические характери-
стики фотореактора «Циклон»:
1. Объем культивируемой суспензии - 8-12 л.
2. Максимальная продуктивность с 1 литра суспензии в сутки -
4,5 г (сухая масса).
Фотореакторы для интенсивного культивирования...
147
Рис. 65. Рост культур в фотореакторе «Циклон»
3. Общая продуктивность фотореактора - 45 г в сутки.
4. Продуктивность в расчете на м2 освещаемой поверхности -
136 г в сут.
5. Максимальная концентрация клеток в суспензии, достигаемая в
фотореакторе: объем упакованных клеток - 22 мл/л; сухой вес -
8,8 г/л.
6. Средняя толщина слоя суспензии в фотореакторе при скорости
вращения ротора 220 об/мин - 27 мм.
148
Биотехнология микроводорослей
7. Освещаемая поверхность суспензии - 0,33 м2.
8. Средняя интенсивность света на поверхности суспензии - 250 Вт/
м2.
9. Удельная мощность света - 10 Вт/л.
10. КПД преобразования энергии света - 11,8%.
11. Энергия, потребляемая для обеспечения массообмена, - 22 Вт/л.
К недостаткам этого фотореактора можно отнести существенные
трудности, возникающие при его масштабировании, и большие затра-
ты энергии на организацию светоприемной поверхности и массобмен.
Фотореактор «Прибой» разработан для лабораторного культиви-
рования широкого ряда фотосинтезирующих одноклеточных организ-
мов, однако заложенные конструктивные решения позволяют легко
масштабировать его для целей промышленного производства биомассы
(Цоглин, Габель и др., Патент РФ № 2067433,1996; Цоглин и др., 1996).
Фотореактор (рис. 66) имеет плоскую горизонтальную светопри-
емную поверхность 1, удобную для работы при солнечном и при ис-
кусственном освещении. Суспензия 2 заливается в кювету из нержа-
веющей стали 3. Толщина слоя суспензии может быть от 3 до 7 см,
при этом объем культивируемой суспензии меняется от 6 до 14 л.
Для освещения суспензии в лабораторных условиях фотореактор
снабжен съемным облучателем 4 с лампой ДНаТ-400. Высота распо-
ложения лампы над светоприемной поверхностью может меняться,
обеспечивая тем самым изменение интенсивности света на поверх-
ности суспензии. Кювета устанавливается на приводе 5, создающем
колебательные движения кюветы по продольной оси. Режим колеба-
ний выбран таким образом, что в кювете возникает эффект прибой-
ной волны, обеспечивающий интенсивное перемешивание суспензии
и массообмен по СО2 и О2. Термостатирование суспензии произво-
дится с помощью проточных рубашек 6, подключаемых к отдельному
термостату. ГВС подается в полость между суспензией и светопри-
емной поверхностью, и СО2 поступает в суспензию благодаря высо-
кому массообмену. Фотореактор снабжен гнездами 7 для введения в
суспензию датчиков параметров среды.
Результаты выращивания различных форм фотосинтезирующих
микроорганизмов в этом фотореакторе в условиях искусственного ос-
Фотореакторы для интенсивного культивирования...
149
Б
Рис. 66. Схема (A) i вид (Б) фотореактора «Прибой»
150
Биотехнология микроводорослей
вещения представлены на рис. 67. Объем культивируемой суспензии во
всех экспериментах составлял 6 л. Интенсивность света на поверхно-
сти суспензии составляла для культур Chlorella и Spirulina - 220 Вт/м2,
а для Porphyridium и Dunaliella была меньше - 95 Вт/м2.
При выращивании культуры Chlorella в условиях естественного
(солнечного) освещения объем культивируемой суспензии был ра-
вен 10 л. Скорость прироста биомассы в этих условиях составила
1,3 г-л_|-сут|, или 13 г/сут со всего фотореактора. В пересчете на 1 м2
освещаемой поверхности производительность фотореактора состави-
ла 64 г/сут. Фотореактор может быть как открытого, так и закрытого
типа. Для изолирования суспензии от воздуха верхняя крышка фото-
реактора выполняется по принципу чашки Петри.
Получены следующие биолого-технические характеристики фо-
тореакгора «Прибой»:
1. Объем культивируемой суспензии - 6-14 л.
2. Максимальная продуктивность при искусственном освещении
с 1 литра суспензии в сутки - 4,2 г (сухая масса).
3. Общая продуктивность фотореактора при искусственном осве-
щении - 25 г в сутки.
4. Продуктивность в расчете на 1м2 освещаемой поверхности при
искусственном освещении - 125 г в сут.
5. Продуктивность при солнечном освещении - 64 г в сутки.
6. Максимальная концентрация клеток в суспензии, достигаемая в
фотореакторе, - 9,2 г/л.
7. Освещаемая поверхность суспензии - 0,21 м2.
8. Максимальная интенсивность света на поверхности суспензии
при использовании лампы ДНаТ-400 - 220 Вт/м2.
9. Удельная мощность света - от 3,3 до 8 Вт/л в зависимости от за-
ливаемого объема суспензии.
10. КПД преобразования энергии света при удельной мощности
света 3,3 Вт/л - 12,5%.
11. Энергия, потребляемая для обеспечения массообмена, - 1,2 Вт
или 0,1 Вт/л.
Как видно из представленных данных, фотореакторы «Прибой»
и «Циклон» близки между собой по биолого-техническим характе-
ристикам. Фотореактор «Циклон» более удобен для лабораторных
Фотореакторы для интенсивного культивирования...
151
Рис. 67. Рост культур в фотореакторе «Прибой» при искусственном
освещении
152 Биотехнология микроводорослей
исследований и для подготовки инокулята при промышленном куль-
тивировании микроводорослей. Фотореактор «Прибой» легко под-
дается масштабированию и может служить основой для разработки
промышленного фотореактора. Основными преимуществами фоторе-
актора «Прибой» перед используемыми в настоящее время для про-
мышленного культивирования микроводорослей являются высокая
эффективность использования света, предельно низкие энергозатра-
ты на обеспечение массобмена и возможность культивирования ши-
рокого круга форм микроводорослей.
18. СТРУКТУРА БИОТЕХНОЛОГИЧЕСКОГО
ПРОИЗВОДСТВА БИОМАССЫ
МИКРОВОДОРОСЛЕЙ
Естественно, центральным звеном такой структуры являются
производственные фотореакторы. Однако для круглогодичного и,
тем более, сезонного производства необходим ряд дополнительных
звеньев. Прежде всего, это хранение штамма (штаммов) водорослей
в экстенсивных условиях с периодическим пересевом их на свежие
среды (рис. 68).
Хранить одноклеточные водоросли можно в пробирках с ватными
пробками (или с проницаемыми для воздуха пробками из полимер-
ных материалов) или в жидкой культуре в колбах объемом 50-100 мл
при температуре 4-10°С. Для хранения можно использовать бытовой
холодильник, оборудованный подсветкой (люминесцентная лампа
мощностью 7-15 Вт). Процесс хранения, питательные среды, актива-
ция культур после хранения подробно описаны в работе (Владимиро-
ва, Семененко, 1962).
Следующее звено - подготовка питательных сред для хранения
культур и производства биомассы. Это звено требует наличия опреде-
ленных запасов компонентов питательных сред. Далее следуют звено
подготовки культур к засеву и звено выращивания инокулята. Послед-
нее должно быть оборудовано небольшим фотореактором, рассчитан-
ным на обеспечение засева производственного фотореактора или хотя
бы одного производственного фотореактора, если их несколько. При-
готовление питательных сред требует водоснабжения, при этом для
154
Биотехнология микроводорослей
Рис. 68. Структура биотехнологического производства биомассы микрово-
дорослей
получения качественной биомассы часто необходима система водо-
подготовки для снижения концентрации солей жесткости, избыточно-
го железа или вредных органических соединений.
Для обеспечения суспензии углекислым газом необходима си-
стема подготовки ГВС или система подачи СО2. Сбор урожая может
производиться сепарацией, центрифугированием, фильтрацией, от-
стаиванием суспензии или каким-либо другим методом, но для этого
должно быть предусмотрено отдельное помещение и оборудование.
Как уже отмечалось выше, возможен возврат отработанной питатель-
ной среды в фотореактор до суммарного количества произведенной
на ней биомассы в 10-12 г/л, но это требует постоянного контроля
концентрации в среде, по крайней мере азота, и за накоплением мета-
болитов. Необходимо учесть, что возврат отработанной среды значи-
тельно увеличивает контаминацию культуры бактериями и паразита-
ми типа амеб и инфузорий.
Хранение суспензии или пасты, полученной после сепарирова-
ния, при комнатных температурах невозможно более суток, а при тем-
пературе 4—6°С - более недели, поэтому обычно предусматривается
звено сушки биомассы, например, распылительным методом.
Структура биотехнологического производства биомассы... 155
Мы перечислили основные звенья системы, необходимые для
производства биомассы. В каждом конкретном случае структура про-
изводства может меняться, дополняться другими звеньями, например,
при производстве целевых продуктов некоторые звенья могут быть
исключены. Нет необходимости в звене хранения и поддержания
культур, если есть по соседству коллекция штаммов микроводорос-
лей; не нужно звено водоподготовки при хорошем качестве местной
воды; можно исключить сепарацию и сушку биомассы при спаивании
суспензии скоту в соседних животноводческих хозяйствах, но звено,
о котором чаще всего забывают, - лаборатория химического и микро-
биологического контроля за состоянием культуры и качеством био-
массы - необходимо всегда.
19. ОШИБКИ И НЕСОСТОЯВШИЕСЯ ИДЕИ
При стремлении создать высокопродуктивные фотореакторы и
повысить эффективность использования света часто возникали, на
первый взгляд, очень привлекательные решения, разработка которых
показывала их ошибочность, несостоятельность. Поскольку и сейчас
некоторые разработчики фотореакторов идут по уже пройденному
нами ложному пути, имеет смысл поделиться опытом ошибок.
Одной из таких ошибок была попытка использования импульсно-
го света.
В основе идеи лежит различие, по крайней мере, на 3 порядка в
скоростях световых и темновых реакций фотосинтеза. Чтобы одно-
временно возбудить все реакционные центры фотосистем в клетке,
плотность потока квантов должна составлять порядка 20-25 тЕ-м'2 с'
(около 10 интенсивностей солнечной радиации), а время импульса -
10 цс. Затем, на период темновых реакций фотосинтеза (10-15 тс)
нет необходимости в свете. Казалось, что освещая суспензию в таком
импульсном режиме, можно получить высокую эффективность ути-
лизации света при предельно высокой продуктивности культуры.
Такой режим освешения вспышкой света длительностью 10-12 цс
и регулируемыми темновыми интервалами от 10 до 100 тс был вос-
произведен с помощью установки с импульсной лампой ИФП-120
(максимальная энергия вспышки 120 Дж). При частоте вспышек 100 Гц
(темновой интервал 10 тс) лампа работала в режиме 0,15 Дж или
выдавала мощность 15 Вт. Расчетная интенсивность света в момент
вспышки равнялась 6000 Вт/м2. Падающая на суспензию суточная
Ошибки и несостоявшиеся идеи
157
энергия составляла ПО ккал. Контрольная культура освещалась лю-
минесцентными лампами, энергия излучения которых была выров-
нена с опытным вариантом. Скорости роста культуры по биомассе в
обоих вариантах в первые сутки были равны, но в опыте рост биомас-
сы происходил только за счет увеличения размеров клеток, а их чис-
ленность не увеличивалась. На третьи сутки в опыте прекратился и
рост биомассы, полностью отсутствовало размножение клеток. Клет-
ки стали приобретать уродливые шишковатые формы. Одинаковый
рост биомассы в первые сутки свидетельствует о главной роли в фо-
тосинтетическом процессе энергии света, поглощенной суспензией.
Блокировка деления клеток может быть связана или с их переоблуче-
нием в момент вспышки, или с недостаточным временем освещения
для каких-либо светозависимых биохимических реакций в клетке.
Так называемое прерывистое освещение, на которое уповали не-
которые разработчики фотореакторов, когда клетки за счет интенсив-
ного перемешивания попадают то в освещенную зону суспензии, то
в глубинные слои, куда свет практически не проникает, не вызывает
физиологических изменений в клетке, но и не повышает продуктив-
ность культуры. Клетка как бы суммирует время нахождения на свету,
и длительность ее световой стадии развития возрастает пропорцио-
нально отношению длительностей нахождения на свету и в темноте.
При этом еще необходимо учесть высокий уровень светового дыха-
ния, сохраняющийся в клетке некоторое время (до нескольких минут)
при попадании в темноту, и большие энергозатраты на организацию
интенсивного перемешивания суспензии.
Еще один принцип построения фотореакторов, с которым прихо-
дилось встречаться на практике, - это погружение источников света
непосредственно в суспензию микроводорослей. Прототипом такого
метода мог бы служить описанный выше коаксиальный фотореактор,
но в нем мощный источник света расположен на расстоянии 40 см
(диаметр внутреннего цилиндра 80 см) от поверхности суспензии, и
образуется большая неиспользуемая полость. Непосредственное же
погружение мощных ламп в защитных кожухах в «чаны» с суспензи-
ей, с которым приходилось встречаться, вызывает на поверхностях,
близких к лампе, переоблучение суспензии интенсивностью света, в
несколько раз превосходящее уровень светового ингибирования фо-
158
Биотехнология микроводорослей
тосинтеза. Конечно, такой метод значительно упрощает конструкцию
фотореактора, но получаемые результаты выглядят удручающе.
Можно использовать погружные источники света, если интенсив-
ность света на их поверхности не превышает 150-200 Вт/м2. К таким
источникам относятся люминесцентные лампы с мощностью све-
тового потока на поверхности, не превышающей 60-80 Вт/м2. Соб-
ственно, такой метод с использованием одной люминесцентной лам-
пы был применен в описанном выше фотореакторе «Фотон» и позднее
был создан фотореактор в виде цилиндра диаметром 30 см и высотой
80 см, пронизанного 20-ю стеклянными трубками, в которые вставля-
лись люминесцентные лампы. Несмотря на хорошие продукционные
качества, работать с таким фотореактором оказалось практически
невозможно, поскольку каждые 3-4 дня возникала необходимость в
сложнейшем процессе разборки, чистки и новой сборке фотореакто-
ра, что занимало 2 дня.
Рис. 69. Действие ультразвука на накопление сухой массы клеток при выра-
щивании Chlorella С-1 в фотореакторе трубчатого типа:
1 - с ультразвуком; 2 - без ультразвука
Ошибки и несостоявшиеся идеи
159
Как уже отмечалось, одной из важных нерешенных проблем куль-
тивирования микроводорослей остается снижение концентрации
растворенного в суспензии кислорода. Для решения этой проблемы
была предпринята попытка воздействия на суспензию ультразвука
с частотой 200 кГц. Предпосылками для такого метода служили дан-
ные о применении ультразвука для дегазации жидкостей и о повыше-
нии проницаемости мембран при ультрафильтрации.
Результаты проведенных экспериментов с выращиванием микро-
водорослей представлены на рис. 69.
Применение ультразвука с удельной мощностью 3 Вт на 1 л су-
спензии давало положительные результаты, выражавшиеся в увели-
чении скорости роста культуры и повышении плато кривой роста, но
такой же и даже больший результат можно было получить, используя
эту мощность на добавочное освещение суспензии.
Нельзя с уверенностью говорить о бесполезности применения
ультразвука, поскольку работы в этом направлении не были продол-
жены, и существует вероятность того, что при других условиях экс-
периментов, других параметрах ультразвука может быть получен по-
ложительный результат.
ПУБЛИКАЦИИ ЛАБОРАТОРИИ В ОБЛАСТИ
БИОТЕХНОЛОГИИ МИКРОВОДОРОСЛЕЙ
1962 г.
1. Владимирова М.Г., Семененко В.Е. Интенсивная культура одноклеточных
водорослей. АН СССР, Москва. 60 с.
2. Владимирова М.Г., Семененко В.Е., Ничипорович А.А. Сравнительное
изучение продуктивности различных форм одноклеточных водорослей.
В кн. «Проблемы космической биологии» под ред. Н.М. Сисакяна и В.И.
Яздовского. Изд-во АН СССР, Москва. С. 314-326.
3. Ничипорович А.А., Семененко В.Е., Владимирова М.Г. Интенсификация
фотосинтетической продуктивности культуры одноклеточных водорос-
лей // Известия АН СССР. 2. С. 163-172.
4. Семененко В.Е., Владимирова М.Г. Влияние условий космического полета
на корабле-спутнике на сохранение жизнеспособности культуры хлорел-
лы. В кн. «Проблемы космической биологии» под ред. Н.М. Сисакяна и
В.И. Яздовского. Изд-во АН СССР, Москва. С. 190-203.
5. Семененко В.Е., Владимирова М.Г., Ничипорович А.А. Некоторые прин-
ципы интенсификации фотосинтетической продуктивности культур
одноклеточных водорослей. В кн. «Проблемы космической биологии»
под ред. Н.М. Сисакяна и В.И. Яздовского. Изд-во АН СССР, Москва.
С. 326-339.
6. Семененко В.Е., Владимирова М.Г. Первые результаты испытаний, про-
веденных с культурой хлореллы, экспонировавшейся в космическом про-
странстве на втором космическом корабле-спутнике. Искусственные спут-
ники земли. Изд-во АН СССР, Москва. С. 56-62.
7. Семененко В.Е., Ничипорович А.А. Установка для изучения водорослей //
Вестник АН СССР. 1. С. 77-79.
Публикации лаборатории в области биотехнологии...
161
1965 г.
8. Владимирова М.Г., Таутс М.И., Феоктистова О.И., Семененко В.Е. Неко-
торые физиологические особенности водорослей Chlorella в связи с их
длительным интенсивным культивированием. Изучение интенсивной
культуры водорослей. Доклады III координационного совещания СЭВ.
Прага. С. 118-136.
9. Клячко-Гурвич Г.Л., Семененко В.Е. Некоторые физиолого-биохимиче-
ские аспекты направленного получения ценных метаболитов и веществ
в условиях интенсивной культуры водорослей. Изучение интенсивной
культуры водорослей. Доклады III координационного совещания СЭВ.
Прага. С. 143-151.
1966 г.
10. Владимирова М.Г., Семененко В.Е., Жукова Т.С., Кованова Е.С. Сравни-
тельное изучение зависимости роста и фотосинтетической продуктив-
ности мезофильного и термофильного штаммов хлореллы от интенсив-
ности света и температуры. В кн. «Управляемый биосинтез». Наука,
Москва. С. 93-104.
11. Владимирова М.Г., Таутс М.И., Феоктистова О.И., Семененко В.Е. Физи-
ологические особенности Chlorella в связи с длительным интенсивным
культивированием водорослей. В кн. «Биология автотрофных микроор-
ганизмов». Труды МОИП. Изд-во МГУ, Москва. С. 142-153.
12. Клячко-Гурвич Г.Л., Семененко В.Е. Физиолого-биохимические аспекты
направленного получения ценных метаболитов в условиях интенсивной
культуры водорослей. В кн. «Биология автотрофных микроорганизмов».
Труды МОИП. Изд-во МГУ, Москва. С. 154-159.
13. Клячко-Гурвич Г.Л., Таутс М.И., Семененко В.Е. Соединения стероидной
природы у одноклеточных водорослей. В кн. «Микроорганизмы в ис-
кусственных экосистемах» под ред. Б.Г. Коврова и В.А. Кордюма. Ин-т
биофизики Сибирского отделения АН СССР, Красноярск. С. 53-61.
14. Кузнецов Е.Д., Семененко В.Е. Сбалансированные среды и перспекти-
вы их использования для стабилизации условий минерального питания
одноклеточных водорослей при длительном интенсивном культивирова-
нии. В кн. «Управляемый биосинтез». Наука, Москва. С. 105-110.
15. Семененко В.Е. Владимирова М.Г., Цоглин Л.Н., Попова М.А. Зависи-
мость роста продуктивности и интенсивности фотосинтеза хлореллы от
концентрации СО2 в газовой смеси и коэффициента вентиляции культу-
ры. В кн. «Управляемый биосинтез». Наука, Москва. С. 128-136.
162
Биотехнология микроводорослей
16. Семененко В.Е., Владимирова М.Г., Цоглин Л.Н., Таутс М.И., Филип-
повский Ю.Н., Клячко-Гурвич Г.Л., Кузнецов Е.Д., Кованова Е.С., Рай-
ков Н.И. Непрерывное управляемое проточное культивирование водо-
рослей и физиолого-биохимическая характеристика продуктивности и
эффективности утилизации лучистой энергии хлореллой при длитель-
ном интенсивном ее выращивании. В кн. «Управляемый биосинтез». На-
ука, Москва. С. 75-86.
17. Семененко В.Е., Зимин М.Б., Владимирова М.Г., Клячко-Гурвич Г.Л., Со-
колов М.В., Ничипорович А.А. Изучение фотосинтетической продуктив-
ности и к.п.д. утилизации лучистой энергии хлореллы в зависимости от
спектрального распределения энергии в равноэнергетическом световом
поле // Физиология растений. 13[6]. С. 949-957.
18. Филипповский Ю.Н., Семененко В.Е., Ничипорович А.А. К вопросу о рас-
пределении лучистой энергии в суспензии хлореллы. В кн. «Фотосинте-
зирующие системы высокой продуктивности». Наука, Москва. С. 193-203.
19. Филипповский Ю.Н., Семененко В.Е., Ничипорович А.А. Оптические
свойства суспензии хлореллы при действии сложных спектров. В кн.
«Фотосинтезирующие системы высокой продуктивности». Наука,
Москва. С. 204-212.
20. Цоглин Л.Н., Семененко В.Е., Бочачер Ф.М., Филипповский Ю.Н. При-
бор для управляемого проточного культивирования водорослей с авто-
матическим измерением, регистрацией и регулированием плотности су-
спензии. В кн. «Управляемый биосинтез». Наука, Москва. С. 324—330.
21. Клячко-Гурвич Г.Л. К вопросу о направленном биосинтезе белков, угле-
водов и липидов у хлореллы. В кн. «Управляемый биосинтез». Наука,
Москва. С. 116-121.
1967 г.
22. Семененко В.Е., Владимирова М.Г., Орлеанская О.Б. К физиологической
характеристике Chlorella sp.K при высоких экстремальных температу-
рах. I. Разобщающее действие экстремальных температур на клеточные
функции хлореллы // Физиология растений. 14(4]. С. 612-625.
23. Филипповский Ю.Н., Семененко В.Е., Ничипорович А.А., Лебедев В.М.,
Цоглин Л.Н. Распределение лучистой энергии в популяции водорослей
в связи с их фотосинтетической продуктивностью. В кн. «Биоэнергетика
и биологическая спектрометрия». Наука, Москва. С. 231-241.
24. Цоглин Л.Н., Семененко В.Е., Поляков А.К. Теоретическое обоснова-
ние принципа автоматического конкурсного отбора продуктивных форм
одноклеточных водорослей на основе математического моделирования
Публикации лаборатории в области биотехнологии...
163
динамики роста многокомпонентной популяции в проточной культуре //
Биофизика. 12[4]. С. 704-714.
1968 г.
25. Владимирова М.Г., Кованова Е.С., Семененко В.Е. Функциональная актив-
ность пигментного комплекса и вопросы количественного определения
хлорофилла у хлореллы. Материалы V Всесоюзного рабочего совещания
по вопросу круговорота веществ в замкнутой системе на основе жизнеде-
ятельности низших организмов. Наукова думка, Киев. С. 187-190.
26. Семененко В.Е. К теоретическому обоснованию принципов расчета и по-
строения замкнутых экологических систем жизнеобеспечения. Материа-
лы V Всесоюзного рабочего совещания по вопросу круговорота веществ
в замкнутой системе на основе жизнедеятельности низших организмов.
Наукова думка, Киев.
27. Семененко В.Е., Клячко-Гурвич ГЛ., Владимирова М.Г., Цоглин Л.Н.
Управление биосинтезом хлореллы и проблема воспроизводства пищи в
экологических системах жизнеобеспечения. Материалы V Всесоюзного
рабочего совещания по вопросу круговорота веществ в замкнутой си-
стеме на основе жизнедеятельности низших организмов. Наукова думка,
Киев. С. 190-192.
28. Филипповский Ю.Н., Маршак И.С., Штаркер А.Я., Семененко В.Е., Ни-
чипорович А.А., Пяцкая Л.М. Ксеноновые трубчатые лампы «холодно-
го» света // Светотехника. 10. С. 8-12.
1969 г.
29. Дилов Хр., Семененко В.Е., Георгиев Д., Шаренкова Ч., Стаев С. Соору-
жение для интенсивного лабораторного культивирования микроводорос-
лей // Доклады Академии с-х наук в Болгарии. 2[3]. С. 201-205.
30. Семененко В.Е., Владимирова М.Г., Орлеанская О.Б., Райков Н.И., Кова-
нова Е.С. К физиологической характеристике Chlorella sp.K при высоких
экстремальных температурах. II. Изменение биосинтеза, ультраструк-
туры и активности фотосинтетического аппарата хлореллы при разоб-
щении клеточных функций экстремальной температурой // Физиология
растений. 16[2]. С. 210-220.
31. Семененко В.Е., Владимирова М.Г., Райков Н.И., Игнатьевская М.А. Ин-
тенсивная культура Anacystis nidulans. В кн. «Биология сине-зеленых
водорослей» под ред. В.Д. Федорова и М.М. Телитченко. Изд-во МГУ,
Москва. С. 163-174.
164 Биотехнология микроводорослей
32. Семененко В.Е., Цоглин Л.Н. К разработке метода непрерывного культи-
вирования хлореллы с направленным изменением химического состава.
Материалы VI Всесоюзного рабочего совещания по вопросу круговорота
веществ в замкнутой системе на основе жизнедеятельности низших орга-
низмов. Наукова Думка, Киев. С. 94-97.
33. Семененко В.Е., Цоглин Л.Н., Данилов В.Н. Исследование переходных
процессов фотосинтеза хлореллы по управляющему световому воздей-
ствию. В кн. «Управляемый биосинтез и биофизика популяций». Крас-
ноярск. С. 44-52.
34. Клячко-Гурвич Г.Л., Жукова Т.С., Владимирова М.Г., Курносова Т.А.
Сравнительная характеристика роста и направленности биосинтеза раз-
личных штаммов хлореллы в условиях азотного голодания // Физиоло-
гия растений. 16[2]. С. 205.
1970 г.
35. Цоглин Л.Н., Владимирова М.Г., Семененко В.Е. Математическое и экс-
периментальное моделирование процесса автоселекции микроводорос-
лей в условиях проточного культивирования // Физиология растений.
17[6]. С. 1129-1139.
1971 г.
36. Таутс М.И., Семененко В.Е. Выделение и идентификация физиологиче-
ски активных веществ индольной природы во внеклеточных метаболи-
тах хлореллы // Доклады АН СССР. 198 [4]. С. 970-973.
37. Таутс М.И., Селиванова Т.М., Семененко В.Е. К расшифровке эффекта
автостимуляции роста хлореллы // Физиология растений. 18[ 1 ]. С. 69-77.
1972 г.
38. Афанасьева В.П., Семененко В.Е. К изучению перехода клетки хлореллы
с автотрофного на гетеротрофный, фотогетеротрофный и миксотрофный
тип питания. Материалы VII Всесоюзного рабочего совещания по во-
просу круговорота веществ в замкнутой системе. Наукова Думка, Киев.
С. 113-116.
39. Семененко В.Е., Зверева М.Г. Сравнительное изучение перестройки в
направленности фотобиосинтеза у двух штаммов хлореллы при разоб-
щении клеточных функций экстремальной температурой // Физиология
растений. 19[2]. С. 229-237.
Публикации лаборатории в области биотехнологии...
165
40. Семененко В.Е., Цоглин Л.Н., Чекулаева Л.Н. Массовое культивирование
одноклеточной водоросли Chlorella в D2O. Материалы VII Всесоюзного
рабочего совещания по вопросу круговорота веществ в замкнутой систе-
ме. Наукова Думка, Киев. С. 28-31.
41. Цоглин Л.Н., Владимирова М.Г. Жизненный цикл клетки и особенности
роста микроводорослей. Материалы VII Всесоюзного рабочего сове-
щания по вопросу кругооборота веществ в замкнутой системе. Наукова
думка. Киев. С. 107-113.
42. Семененко В.Е., Касаткина Т.И., Зверева М.Г. Эндогенная регуляция фо-
тосинтеза и сопряженных процессов. Сообщение II. Перестройка в ком-
плексе индивидуальных белков и направленный синтез белка «фракции I»
при действии экстремальной температуры на клетку хлореллы. Матери-
алы VII Всесоюзного рабочего совещания по вопросу круговорота ве-
ществ в замкнутой системе. Наукова Думка, Киев. С. 120-125.
43. Семененко В.Е., Цоглин Л.Н. Эндогенная регуляция фотосинтеза и со-
пряженных процессов. Сообщение III. Изменение интенсиввности СО2
и О2-газообмена и световых кривых фотосинтеза клеток хлореллы при
температурной индукции светозависимой белок синтезирующей систе-
мы. Материалы VII Всесоюзного рабочего совещания по вопросу круго-
ворота веществ в замкнутой системе. Наукова Думка, Киев. С. 125-127.
44. Семененко В.Е., Синицкий И.Г., Цоглин Л.Н. Установка для изучения
С02-02-газообмена микроводорослей. Материалы VII Всесоюзного ра-
бочего совещания по вопросу круговорота веществ в замкнутой системе.
Наукова Думка, Киев. С. 26-28.
45. Семененко В.Е., Афанасьева В.П. К изучению механизмов авторегуля-
ции фотосинтеза. Обратимый 2-дезокси-Д-гпюкозный эффект репрес-
сии фотосинтетического аппарата клетки // Физиология растений. 9[5].
С. 1074-1081.
1973 г.
46. Клячко-Гурвич Г.Л., Рудова Т.С., Кованова Е.С., Семененко В.Е. Влияние
имидазола на обмен жирных кислот при восстановлении клеток хлорел-
лы после азотного голодания // Физиология растений. 20[3]. С. 326-331.
47. Цоглин Л.Н. Анализ физиологических характеристик популяций микро-
водорослей на основе жизненного цикла и возрастного распределения
клеток // Физио югия растений. 20[3]. С. 532-538.
48. Цоглин Л.Н., Bj адимирова М.Г. Влияние особенностей жизненного цик-
ла клетки на рост популяций микроводорослей // Физиология растений.
2О[5]. С. 960-967.
166
Биотехнология микроводорослей
49. Цоглин Л.Н., Семененко В.Е., Каюшин Л.П., Кутышенко В.П., Лазаре-
ва А.В., Окон М.С., Сибельдина А.А., Чекулаева Л.Н. Особенности роста
Chlorella sp.K в D2O // Физиология растений. 20[6]. С. 1204-1207.
1974 г.
50. Абдуллаев А.А., Семененко В.Е. Интенсивная культура Dunaliella salina
Teod и некоторые ее физиологические характеристики // Физиология
растений. 21[6]. С. 1145-1153.
51. Абдуллаев А.А., Семененко В.Е. К изучению продуктивности галофиль-
ной водоросли Dunaliella в условиях интенсивной культуры. Материалы
VIII Всесоюзного рабочего совещания по вопросу круговорота веществ
в замкнутой системе на основе жизнедеятельности низших организмов.
Наукова Думка, Киев. С. 86-88.
52. Лазарева А.В., Окон М.С., Кутышенко В.П., Цоглин Л.Н., Каюшин Л.П.,
Семененко В.Е., Сибельдина А.А., Чекулаева Л.Н. Массовое культиви-
рование микроводорослей в тяжелой воде И Физиология растений. 21 [2].
С. 359-364.
53. Рудова Т.С., Семененко В.Е. Влияние циклогексимида на перестройку
биосинтеза липидного и углеводного штаммов Chlorella при азотном го-
лодании. Материалы VIII Всесоюзного рабочего совещания по вопросу
круговорота веществ в замкнутой системе на основе жизнедеятельности
низших организмов. Наукова Думка, Киев. С. 66-69.
54. Семененко В.Е., Зверева М.Г., Касаткина Т.И., Цоглин Л.Н. Температур-
ная индукция светозависимой белоксинтезирующей системы Chlorella,
сопровождающаяся увеличением функциональной активности фотосин-
тетического аппарата. Итоги исследования механизма фотосинтеза. АН
СССР, Пущино. С. 179-196.
55. Семененко В.Е., Касаткина Т.И., Купцова Е.С., Рудова ТС. Светозависи-
мый эффект метаболитной авторегуляции синтеза белков хлоропласта.
Материалы VIII Всесоюзного рабочего совещания по вопросу кругово-
рота веществ в замкнутой системе на основе жизнедеятельности низших
организмов. Наукова Думка, Киев. С. 58-66.
56. Цоглин Л.Н., Владимирова М.Г. Закономерности изменений физиологи-
ческих характеристик в процессе роста культур микроводорослей. Ма-
териалы VIII Всесоюзного рабочего совещания по вопросу круговорота
веществ в замкнутой системе на основе жизнедеятельности низших ор-
ганизмов. Наукова Думка, Киев. С. 78-80.
57. Цоглин Л.Н. Математическое моделирование развития популяций микро-
Публикации лаборатории в области биотехнологии...
167
водорослей на основе возрастного распределения клеток. Материалы
совещания СЭВ. Изд-во ЛГУ, Ленинград. С. 12-23.
58. Цоглин Л.Н., Семененко В.Е. Применение одноклеточных водорослей
для биосинтеза дейтерированных соединений. Материалы совещания
СЭВ. Изд-во ЛГУ, Ленинград. С. 34-39.
1975 г.
59. Семененко В.Е. Метаболитная авторегуляция светоиндуцируемой белок-
синтезирующей системы и функциональной активности хлоропласта.
В кн. «Фоторегуляция метаболизма и морфогенеза растений». Наука,
Москва. С. 135-157.
60. Семененко В.Е., Рудова Т.С. Влияние циклогексимида на процесс пере-
стройки биосинтеза клеток хлореллы, вызываемый азотным голоданием
// Физиология растений. 22[5]. С. 958-965.
1976 г.
61. Семененко В.Е., Владимирова М.Г., Кованова Е.С., Рудова Т.С. Динамика
и функциональная активность хлорофилла при адаптивных перестрой-
ках клеток хлореллы в интенсивной культуре. Материалы IX Всесоюзно-
го рабочего совещания по вопросу круговорота веществ в замкнутой си-
стеме на основе жизнедеятельности низших организмов. Наукова Думка,
Киев. С. 121-125.
62. Таутс М.И., Семененко В.Е. О наличии физиологически активных ве-
ществ гормональной природы во внеклеточных метаболитах Chlorella.
Материалы научного симпозиума XI Научно-координационного совеща-
ния по теме 1-184 СЭВ. Изд-во ЛГУ, Ленинград. С. 110-121.
63. Цоглин Л.Н., Владимирова М.Г., Семененко В.Е. Автоселекция штаммов
микроводорослей в условиях проточной культуры. Материалы научно-
го симпозиума XI Научно-координационного совещания по теме 1-184
СЭВ. Изд-во ЛГУ, Ленинград. С. 22-36.
64. Semenenko V Е., Rudova T.S. On the mechanism of biosynthesis reorientation
in Chlorella under the influence of factors limiting cellular division // Arch.
Hydrobiol. Suppl.49. Algological Studies. 15. P. 185-198.
65. Цоглин Л.Н., Сорокин E.M. Модель популяции микроводорослей с уче-
том возрастного распределения и временной зависимости характеристик
клеток в онтогенезе. Материалы конференции «Математическая теория
биологических процессов». Калининград. С. 196-198.
168
Биотехнология микроводорослей
1977 г.
66. Семененко В.Е., Аврамова С., Георгиев Д., Пронина Н.А. Сравнительное
изучение активности и локализации карбоангидразы в клетках Chlorella
и Scenedesmus II Физиология растений. 24[5]. С. 1055-1059.
67. Цоглин Л.Н., Бакулин В.А. Влияние возрастной структуры популяций на
физиологические параметры и продуктивность культур микроводорос-
лей И Физиология растений. 24[6]. С. 1295-1300.
68. Клячко-Гурвич Г.Л., Семенова А.Н. Изменения содержания и жирнокис-
лотного состава моногалактозилдиглицеринов (МГДГ) при повышении
освещенности клеток хлореллы // Физиология растений. 24[1]. С. 75-81.
1978 г.
69. Клячко-Гурвич Г.Л., Семененко В.Е. О количественной экстракции на-
тивных липидов из клеток хлореллы // Физиология растений. 25[2].
С. 412-417.
70. Семененко В.Е. Молекулярно-биологические аспекты эндогенной регу-
ляции фотосинтеза // Физиология растений. 25[5]. С. 903-921.
71. Владимирова М.Г. Ультраструкгурная организация клетки Dunaliella sa-
lina и ее функциональные изменения в зависимости от интенсивности
света и температуры // Физиология растений. 25[3]. С. 571-577.
1979 г.
72. Касаткина Т.И., Пронина Н.А., Семененко В.Е. Рибулозо-1,5-дифос-
фаткарбоксилаза хлореллы и регуляция ее синтеза под действием света
разной интенсивности. В кн. «Роль низших организмов в круговороте
веществ в замкнутых экологических системах». (Материалы X Всесоюз-
ного совещания. Канев, 1979). Наукова Думка, Киев. С. 298-303.
73. Клячко-Гурвич Г.Л., Семененко В.Е. Моногалактозилдиацилглицерины
фотосинтетического аппарата хлореллы и светозависимая регуляция их
биосинтеза. В кн. «Биосинтез и метаболизм липидов у микроорганиз-
мов». Изд-во АН СССР, Москва. С. 191-194.
74. Клячко-Гурвич Г.Л., Цоглин Л.Н., Семененко В.Е. Динамика жирнокислот-
ного состава липидов в связи с изменением активности хлоропластов в
ходе жизненного цикла хлореллы. В кн. «Роль низших организмов в кру-
говороте веществ в замкнутых экологических системах». (Материалы X
Всесоюзного совещания, Канев, 1979). Наукова думка, Киев. С. 188-192.
Публикации лаборатории в области биотехнологии...
169
75. Семененко В.Е., Аврамова С., Георгиев Д., Пронина Н.А. О световой за-
висимости карбоангидразной активности клеток Chlorella и Scenedesmus
// Физиология растений. 26[5]. С. 1069-1075.
76. Цоглин Л.Н., Семененко В.Е. Повышение продуктивности и КПД фото-
синтеза микроводорослей посредством управления возрастным соста-
вом популяции. В кн. «Роль низших организмов в круговороте веществ
в замкнутых экологических системах». (Материалы X Всесоюзного со-
вещания, Канев, 1979). Наукова Думка, Киев. С. 294—303.
77. Цоглин Л.Н., Евстратов А.В., Семененко В.Е. Применение микроводо-
рослей для биосинтеза |3С-соединений И Физиология растений. 26[1].
С. 215-218.
1980 г.
78. Белл Л.Н. Энергетика фотосинтезирующей растительной клетки. Наука,
Москва. 333 с.
79. Цоглин Л.Н., Клячко-Гурвич Г.Л. Изменение функциональной активно-
сти хлоропласта в клеточном цикле хлореллы И Физиология растений.
27[6]. С. 1172-1179.
80. Клячко-Гурвич Г.Л., Семенова А.Н., Семененко В.Е. Липидный обмен
хлоропластов при адаптации клеток хлореллы к снижению освещенно-
сти // Физиология растений. 27[2]. С. 370-379.
81. Семененко В.Е., Абдуллаев А.А. Параметрическое управление биосинте-
зом Р-каротина в клетках Dunaliella salina в условиях интенсивной куль-
туры //Физиология растений. 27[1]. С. 31-41.
82. Цоглин Л.Н., Аврамова С., Гебов А., Дилов Хр., Семененко В.Е. Изуче-
ние О2-газообмена и оптимизация режима культивирования микроводо-
рослей в открытых установках типа «Шетлик» // Физиология растений.
27 [3]. С. 644-652.
1981 г.
83. Пронина Н.А., Аврамова С., Георгиев Д., Семененко В.Е. Динамика кар-
боангидразной активности Chlorella и Scenedesmus при адаптации кле-
ток к свету высокой интенсивности и низкой концентрации СО2 // Физи-
ология растениГ. 28(1]. С. 43-52.
84. Пронина Н.А., I амазанов З.М., Семененко В.Е. Зависимость карбоанги-
дразной активности клеток Chlorella от концентрации СО, // Физиология
растений. 28(3]. С. 494-502.
170 Биотехнология микроводорослей
85. Клячко-Гурвич Г.Л., Цоглин Л.Н., Можайцева Г.И. Обмен липидов в ходе
онтогенеза хлореллы в связи с активностью фотосинтетического аппара-
та // Физиология растений. 28[2]. С. 421-429.
86. Клячко-Гурвич Г.Л., Цоглин Л.Н., Семенова А.Н. К вопросу об участии
моногалактозилдиацилглицеринов (МГДГ) с различным составом жир-
ных кислот в организации мембран хлоропласта // Физиология растений.
28[3]. С. 510-518.
87. Semenenko V.E. Metabolite regulation of chloroplast genome expression and
the activity of the photosynthetic apparatus. In G.Akoyunoglou (ed.), Photo-
synthesis v.Proceeding of the Fifth International Congress on Photosynthesis.
BIS services, Philadelphia. P. 767— 776.
1982 r.
88. Семененко В.Е. Механизмы эндогенной регуляции фотосинтеза и адап-
тивные свойства хлоропласта. В кн. «Физиология фотосинтеза» под ред.
А.А.Ничипоровича. Наука, Москва. С. 164-187.
89. Шаренкова X., Семененко В.Е. Характеристика фотосинтетического вы-
деления кислорода Spirulina platensis (GOM) Geitl // Физиология расте-
ний. 29(3]. С. 572-577.
1984 г.
90. Пронина Н.А., Семененко В.Е. Локализация мембраносвязанной и рас-
творимой форм карбоангидразы в клетках хлореллы // Физиология рас-
тений. 31 [2]. С. 241-251.
91. Касаткина Т.И., Пронина Н.А., Семененко В.Е. Количественное выделе-
ние, фракционирование и характеристика рибулозо-1,5-биофосфаткар-
боксилазы клеток Chlorella // Физиология растений. 31[1]. С. 130-140.
92. Аврамова С., Пронина Н.А., Семененко В.Е., Георгиев Д., Пешева И.С.
Карбоангидразная активность и усвоение бикарбонатного иона клеток
Chlorella и Scenedesmus И Hidrobiologiya. 20. С. 8-15.
93. Semenenko V.E., Zvereva M.G., Kuptsova M.G., Klimova L.A., Vladimiro-
va M.G. Metabolite regulation of the chloroplast genome expression and the
chloroplast-cytoplasm regulatory relationships. In Wiessneret al. (ed.), Com-
partments in algal cells and their interaction. Springer-Verlag, Berlin- Heidel-
berg. P. 128-138.
94. Рамазанов 3.M., Пронина H.A., Семененко В.Е. О кислородной зависимости
индукции синтеза СО2-зависимой растворимой формы карбоангидразы в
клетках хлореллы // Физиология растений. 31 [3]. С. 448-455.
Публикации лаборатории в области биотехнологии... 171
1985 г.
95. Клячко-Гурвич Г.Л., Юрьева М.И., Семененко В.Е. Специфичность жир-
нокислотного состава ацилсодержащих липидов одноклеточной крас-
ной водоросли Porphyridium cruentum И Физиология растений. 32[1].
С. 115-123.
96. Клячко-Гурвич Г.Л., Таутс М.И., Семененко В.Е. Соединения стероидной
природы у одноклеточных водорослей. Микроорганизмы в искусствен-
ных экосистемах. Наука, Новосибирск. С. 53-61.
97. Семененко В.Е. Саморегулирование физиологических функций и
управление фотосинтезом фотосинтезирующих клеток. В кн. «Новые
направления в физиологии растений». Наука, Москва. С. 84-104.
98. Шушанашвили В.И., Семененко В.Е. Влияние свето-темновых перио-
дов и интенсивности света на фотосинтез, прирост биомассы и скорость
деления автотрофных клеток эвглены // Физиология растений. 32[2].
С. 323-331.
1986 г.
99. Рамазанов З.М., Семененко В.Е. Об участии продуктов фотодыхания в
индукции СО2-зависимой формы карбоангидразы // Физиология расте-
ний. 33. С. 864-872.
1988 г.
100. Пронина Н.А., Семененко В.Е. Локализация связанной карбоангидразы
в мембранах клеток хлореллы // Физиология растений. 35[1]. С. 51-61.
101. Рамазанов З.М., Клячко-Гурвич Г.Л., Ксенофонтов А.Л., Семененко В.Е.
Влияние субоптимальной температуры на содержание p-каротина и ли-
пидов у галофильной водоросли Dunaliella salina И Физиология расте-
ний. 35[5]. С. 864-872.
102. Рамазанов З.М., Семененко В.Е. Зависимость содержания СО -
зависимой формы карбоангидразы от интенсивности света и фотосинте-
за // Физиология растений. 35[3]. С. 438-443.
103. Семененко В.Е. Генетические и клеточные механизмы регуляции фото-
синтеза. В кн. «Фотосинтез и продукционный процесс». Наука, Москва.
С. 69-81.
172
Биотехнология микроводорослей
1989 г.
104. Купцова Е.С., Пронина Н.А., Семененко В.Е. Скрининг различных ви-
дов одноклеточных водорослей на содержание лектинов и их внутрикле-
точная локализация. Ученые записки Тартусского университета. Изуче-
ние и применение лектинов. Тарту. С. 154-159.
105. Пронина Н.А., Аллахвердиев С.И., Клячко-Гурвич Г.Л., Климов В.В.,
Семененко В.Е. Локализация карбоангидразы в частицах фотосисте-
мы I и фотосистемы II хлоропластов гороха. Преобразование световой
энергии в фотосинтезирующих системах и их моделях. Тезисы докладов
Всесоюзной конференции. Пущино. С. 172-173.
106. Zachleder V, Kuptsova E.S., Los D.A., Серак V., Kubin S., Shapiguzov J.M.,
Semenenko V.E. Division of chloroplast nucleoids and replication of chloro-
plast DNA during the cell cycle of Dunaliella salina growth under blue and
red light // Protoplasma. 59[3]. P. 160-167.
1990 r.
107. Лось Д.А., Захледер В., Купцова Е.С., Ксенофонитов А.Л., Маркелова
А.Г., Шапигузов А.Ю., Семененко В.Е. Влияние спектрального состава
света на репликацию хлоропластной ДНК и деление хлоропластных ну-
клеоидов зеленой водоросли Dunaliella salina И Физиология растений.
37[6].С. 1045-1052.
108. Маркелова А.Г., Владимирова М.Г., Семененко В.Е. Ультраструктурная
локализация РБФК в клетках водорослей // Физиология растений. 37[5].
С. 907-911.
109. Фурнаджиева С., Пронина Н.А., Андреева Р., Петков Г., Семененко В.Е.
Участие карбоангидразы в ассимиляции бикарбонатного иона клетками
хлореллы и сценедесмуса // Физиология растений. 37[1]. С. 22-30.
ПО. Pronina N.A., Semenenko V.E. Membrane-bound carbonic anhydrase take
part in CO2 concentration in algae cells, In M. Baltcheffsky (ed.), Current re-
search in photosynthesis. Kluwer Academic Publishers, Dordrecht. The Neth-
erlands. P. 498-502.
111. Цоглин Л.Н., Протасова H.H., Уэльс M., Добровольский М.А. Спек-
тральные характеристики источников света и особенности роста рас-
тений в условиях искусственного освещения И Физиология растений.
37[2]. С. 386-396.
112. Петков Г.Д., Клячко-Гурвич Г.Л., Фурнаджиева С.Т., Пронина Н.А., Ра-
мазанов З.М. Генотипические различия и фенотипические изменения
Публикации лаборатории в области биотехнологии...
173
жирно-кислотного состава липидов у штаммов Dunaliella salina II Физи-
ология растений. 37(2]. С. 356-369.
1991 г.
113. Пронина Н.А., Семененко В.Е. Молекулярная и клеточная организация
СО2 концентрирующих механизмов в фотоавтотрофных клетках микро-
водорослей И Альгология. 1 [2]. С. 80-92.
114. Клячко-Гурвич Г.Л., Ладыгин В.Г., Пронина Н.А., Рябых И.Б., Семе-
ненко В.Е. Специфичность состава жирных кислот липидов у мутантов
Chlamydomonas reinhardtii с различной организацией фотосистем хлоро-
пластов И Физиология растений. 38[6]. С. 1171-1180.
115. Семененко В.Е. (ред.) Каталог культур микроводорослей в коллекциях
СССР. Изд-во АН СССР, Москва. 228с.
116. Акыев А.Я., Цоглин Л.Н. Влияние кислорода на клеточный цикл
Chlorella. Международная конференция «Фотосинтез и фотобиотехно-
логия». Пущино. 128 с.
1992 г.
117. Пронина Н.А., Семененко В.Е. Роль пиреноида в концентрировании,
фиксации и генерации СО2 в хлоропласте // Физиология растений. 39[4].
С. 723-732.
118. Сабурова Е.А., Симонова Н.Б., Пронина Н.А., Фалькович Т.Н., Семенен-
ко В.Е. Влияние вязкости на функциональные свойства лактатдегидро-
геназы из Dunaliella salina И Доклады АН СССР. 325[6]. С. 1259-1264.
119. Semenenko V.E. Physiologycal and genetical investigations of the photosyn-
thesis intracellular regulation in algae as objects of biotechnology. In K. Beyer
(ed.), 1st Europian Workshop on Microalgal Biotechnology, Algology. Pro-
ceedings. Print Express, Potsdam. P. 114-122.
120. Semenenko V.E., Tsoglin L.N., Bakulin V.A., Akiyev A. Population age
structure control when unicellular algae are cultivated. In K. Beyer (ed.), 1st
Europian Workshop on Microalgal Biotechnology, Algology. Proceedings.
Print Express, Potsdam. P. 82-86.
121. Semenenko V.E., Gabel B.V., Tsoglin L.N. Closed type photobioreactor. In
K. Beyer (ed.), 1st European Workshop on Microalgal Biotechnology. Algol-
ogy. Proceedings. Print Express, Potsdam. P. 67-70.
122. Акыев А.Я., Цоглин Л.Н. Влияние кислорода на О2-газообмен и на рост
биомассы клетки в цикле развития Chlorella И Физиология растений.
39[3]. С. 495-502.
174
Биотехнология микроводорослей
1993 г.
123. Pronina N.A., Borodin V.V. СО2 stress and CO2 concentration mechanism:
investigation by means of photosystem-deficient and carbonic anhydrase-
deficient mutants of Chlamydomonas reinhardtii // Photosynthetica. V. 28.
P. 515-522.
124. Фалькович Т.Н., Пронина H.A., Семененко В.Е. Определение лекти-
новой активности с использованием клеток микроводорослей в каче-
стве тест-объекта - метод альгоагглютинации // Физиология растений.
40(3]. С. 497—499.
125. Симонова Н.В., Сабурова Е.А., Трошина О.Ю., Семененко В.Е. Влияние
вязкости на функционирование лактатдегидрогеназы из одноклеточ-
ной зеленой водоросли Chlamydomonas II Доклады АН СССР. 332[2].
С. 378-381.
126. Аллахвердиев С.И., Пронина Н.А., Фалькович Т.Н., Климов В.В., Семе-
ненко В.Е. Фотоинактивация фотохимической активности прапаратов
фотосистемы 2, изолированных из клеток Dunaliella salina И Физио-
логия растений. 40[2]. С. 199-203.
127. Pronina N.A., Fumadzieva S., Shapiguzov J.M., Semenenko V.E. Influence
of protein synthesis inhibitor on the carbonic anhydrase system in Chlorella
cells. In vaclinova s. et.al. (ed.), International Symposium on Plant Mineral
Nutrition and Photosynthesis ‘87. Sofia. P. 258-262.
128. Akyev A.Y., Rogova N.B., Tsoglin L.N. Influence of oxygen on the cell de-
velopment in synchronous culture of Chlorella sp. J.Masojidek, I. Setlik
(Eds), 6th International Conference on Applied Algology: Progress in Bio-
technology of Photoautotrophic Microorganisms. Ceske Budejovice. P. 110.
1994 r.
129. Клячко-Гурвич Г. Л., Доуха И., Копецкий И., Рябых И.Е., Семененко В.Е.
Сравнительное исследование состава жирных кислот липидов у раз-
личных штаммов Porphyridium cruentum и Porphyridium aerugineum И
Физиология растений. 41[2]. С. 283-291.
130. Назаренко Л.В., Акыев А.Я., Семененко В.Е. Динамика содержания
индол-3-уксусной кислоты в клеточном цикле синхронной культуры
Chlorella IPPAS - С-1 // Физиология растений. 4[2]. С. 214-219.
131. Семененко В.Е. 1-й Еропейский симпозиум «Микроводоросли и здоро-
вье» (21-22 апреля 1993 г., Монпелье, Франция) Хроника И Физиология
растений. 41 [2]. С. 313-314.
Публикации лаборатории в области биотехнологии...
175
132. Семененко В.Е., Цоглин Л.Н. Биотехнология водорослей. Прогресс в
биотехнологии фотоавтотрофных микроорганизмов. 6-я Международ-
ная конференция по прикладной альгологии (6-11 сентября 1993 г.,
Чешские Буциевицы, Чехия). Хроника И Физиология растений. 41(2].
С. 315-316.
133. Симонова Н.Б., Сабурова Е.А., Фалькович Т.Н., Семененко В.Е. Кинетика
и стабильность лактатдегидрогеназы из двух видов водорослей, живущих
в среде с разным содержанием соли: Dunaliella salina и Chlamydomonas',
pH-зависимость // Доклады АН СССР. 334[6]. С. 794-797.
134. Фалькович Т.Н., Пронина Н.А., Семененко В.Е. Лектиноподобные
свойства полипептидов светособирающего комплекса фотосистемы I
Dunaliella salina И Физиология растений. 41 [2]. С. 184-189.
135. Шитова Л.А., Мещеряков А.Б., Семененко В.Е. Регуляторные мутан-
ты Chlorella с нарушенной системой транспорта экзогенной глюкозы в
клетку // Физиология растений. 41(2]. С. 223-226.
136. Malakhov М.Р., Los D.A., Wada Н., Semenenko V.E., Murata N. A new
type of cytochrome c from Synechocystis PCC6803 // Plant Physiology. 144.
P. 259-264.
1995 r.
137. Симонова Н.Б., Сабурова E.A., Ширшикова Г, Елфимова Л.И., Про-
нина Н.А., Фалькович Т.Н., Семененко В.Е. Тепловая стабильность
лактатдегидрогеназы из галофильной водоросли Dunaliella salina
и негалофильной Chlamydomonas reinhardtii в водных растворах //
Доклады АН СССР. 345. С. 549-554.
138. Pronina N.A., Sergeyenko T.V., Semenenko V.E., Miyachi S. Microalgae
tolerance to low and extremely high CO2 concentration. Proceedings 2-nd
European Workshop Biotechnology of Microalgae, Potsdam. P. 119-122.
139. Semenenko V.E., Physiological and Genetic Potencials of Microalgae in Bio-
technology. Proceedings 2-nd European Workshop Biotechnjlogy of Micro-
algae, Potsdam. P. 138-143.
140. Цоглин Л.Н., Акыев А.Я., Шапигузов Ю.М., Клячко-Гурвич Г.Л. Управ-
ление химическим составом и газообменом культуры микроводорослей
посредством формирования возрастной структуры популяции И Физио-
логия растений. 42(4]. С. 576-581.
141. Tsoglin L.N., Pulz О., Storandt R., Akyev A.Y. Selection of microalgae ac-
cording to their productivity for mass cultivation. Proceedings 2-nd Europ.
Workshop Biotecnology of Microalgae, Potsdam. P. 31-34.
176
Биотехнология микроводорослей
1996 г.
142. Симонова Н.Б., Сабурова Е.А., Пронина Н.А., Фалькович Т.Н., Семе-
ненко В.Е. ЛДГ из микроводорослей: галофильной Dunaliella и негало-
фильной Chlamydomonas. Функция и стабильность И Прикладная био-
химия и микробиология. 32[6]. С. 604-608.
143. Цоглин Л.Н., Габель Б.В., Фалькович Т.Н., Семененко В.Е. Фотобиоре-
акторы закрытого типа для культивирования микроводорослей // Физи-
ология растений. 43[1]. С. 149-155.
144. Semenenko V.E. Physiological and genetic potentials of microalgae and mo-
lecular biology aspects of photoautotrophic biosyntheses biotechnology. TIT
Symposium Microalgal Biotechnology: Basics and Applications. Osaka, Ja-
pan. P. 1-8.
145. Rogova N., Springer M., Tsoglin L., Franke H., Pulz O. The influence of low
and high oxygen concentration on the yield and spectrim of fatty acids in Por-
phyridium cruentum // J.Plant Physiology. 149. P. 241-245.
1997 r.
146. Клячко-Гурвич Г.Л., Пронина H.A., Петков Г, Фурнаджиева С., Рамаза-
нов З.М. Биохимический состав мембран Dunaliella salina при субопти-
мальной температуре // Физиология растений. 44[2]. С. 550-558.
147. Pronina N.A., Alekseeva S.G., Mishina I.M., Mouradian Е.А., Klyachko-Gur-
vich G.L. Response of microalgae cells to CO2-stress. Proceedings 3-nd Euro-
pean Workshop Biotechnology of Microalgae, Beigolz-Rehbuche. P. 119-122.
1998 r.
148. Пронина H.A., Рогова Н.Б., Фурнаджиева С., Клячко-Гурвич Г.Л.
Влияние концентрации СО2 на жирнокислотный состав липидов му-
танта Chlamydomonas reinhardtii Cia-З, дефектного по СО2-концен-
трирующему механизму//Физиология растений. 45[4]. С. 529-538.
149. Максимова И.В., Плеханов С.В., Максимов В.Н., Владимирова М.Г.,
Маслова И.П., Барцевич Е.Д. Хранение мезофильных штаммов
хлорококковых водорослей методом периодических пересевов в
условиях пониженной температуры на свету и в темноте // Физиология
растений. 43[ 1]. С. 131-141.
150. Mouradian Е.А., Klyachko-Gurvich G.L., Pronina N.A. Lipid metabolism
of Spirulina platensis under high CO, concentration. In: Sances J (ed) Ad-
vances in Plant Lipid Research. Univ, of Sevilla, Seville, 1998. P. 511-513.
Публикации лаборатории в области биотехнологии...
177
151. Sasaki Т., Pronina N.A., Maeshima М., Iwasaki I., Kurano N., Miyachi S.
Development of vacuoles and vacuolar H+-ATP-ase activity under extremaly
high-СО, conditions in Chlorococcum littorale cells // Bot. Acta. 111. P. 1-8.
1999 r.
152. Klyachko-Gurvich G.L., Tsoglin L.N., Doucha J., Kopetskii J., Shebalina
(Ryabykh) I.B., Semenenko V.E. Desaturation of fatty acids as an adaptive
response to shifts in light intensity I I Physiol. Plantatum. 107. P. 240-249.
153. Park Y.I., Karlsson J., Rojdestvenski I., Pronina N., Klimov V., Oquist G.,
Samuelsson G. Role of a novel photosystem (I-associated carbonic anhy-
drase in photosynthetic carbon assimilation in chlamydomonas reinhardtii I I
FEBS Lett. 444. P. 102-105.
154. Пронина H.A., Жила H.M., Семененко В.Е. Две формы карбоангидразы
в клетках Dunaliella salina: выделение и свойства // Физиология
растений. 46[1]. С. 74-81.
155. Sasaki Т., Pronina N.A., Maeshima М., Iwasaki I., Kurano N., Miyachi S.
Development of vacuoles and vacuolar ATPase activity under extremely
high-CO2 conditions in Chlorococcum littorale I I Plant Biology. 1. P. 68-75.
2000 r.
156. Цоглин Л.Н., Габель Б.В. Потенциальная продуктивность микроводо-
рослей в промышленных фотобиореакторах // Физиология растений.
47[6]. С. 761-767.
157. Пронина Н.А. Организация и физиологическая роль СО2-концент-
рирующего механизма при фотосинтезе микроводорослей // Физиоло-
гия растений. 47[6]. С. 801-810.
158. Сергеенко Т.В., Мурадян Е.А., Пронина Н.А., Клячко-Гурвич Г.Л., Ми-
шина И.М., Цоглин Л.Н. Влияние экстремально высокой концентрации
СО2 на рост и биохимический состав микроводорослей // Физиология
растений. 47[6]. С. 722-729.
159. Клячко-Гурвич Г.Л., Пронина Н.А., Ладыгин В.Г., Цоглин Л.Н.,
Семененко В.Е. Разобщенное функционирование отдельных
фотосистем. 1. Особенности и роль десатурации жирных кислот //
Физиология растений. 47[6]. С. 688-698.
160. Mouradian Е.А., Klyachko-Gurvich G.L, Pronina N.A. Effect of CO,-stress
on the lipid metabolism in the thylakoid membrane of D. salina. Abstracts of
13,h FESSP Congress. Hersonissos, Crete, 2002.
178
Биотехнология микроводорослей
2002 г.
161. Пронина НА., Ковшова Ю.И., Попова В.В., Лапин А., Алексеева С.Г.,
Баум РФ., Мишина И.М., Цоглин Л.Н. Влияние селенит-ионов на рост
и накопление селена у Spirulinaplatensis II Физиология растений. 49[2].
С. 264-271.
162. Мазо В.К., Гмошинский И.В., Пронина Н.А. Новые пищевые источники
эссенциальных микроэлементов: последние достижения отечествен-
ной биотехнологии. X юбилейная межд. конф, и дискуссионный науч-
ный клуб «Новые информационные технологии в медицине и эколо-
гии». Ялта - Гурзуф. С. 272-273.
2004 г.
163. Мурадян Е.А., Клячко-Гурвич Г.Л., Цоглин Л.Н., Сергеенко Т.В., Прони-
на Н.А. Изменение обмена липидов при адаптации фотосинтетического
аппарата Dunaliella salina к высокой концентрации СО2 // Физиология
растений. 51[1]. С. 62-72.
164. Дудоладова М.В., Маркелова А.Г., Лебедева Н.В., Пронина Н.А. Компарт-
ментация а- и Р-карбоангидраз в клетках гало- и алкалофильной циано-
бактерии Rabdoderma lineare // Физиология растений. 51 [6]. С. 896-904.
2005 г.
165. Налимова А.В., Попова В.В., Цоглин Л.Н., Пронина Н.А. Влияние меди
и цинка на рост Spirulina platensis и аккумуляция клетками тяжелых
металлов // Физиология растений. 52[2]. С. 259-265.
2006 г.
166. Черникова А.А., Цоглин Л.Н., Маркелова А.Г., Зорин С.Н., Мазо В.К.,
Пронина Н.А. Способность Spirulina platensis к накоплению марганца
и его распределение в клетке // Физиология растений. 53[6]. С. 903-909.
2007 г.
167. Kupriyanova Е., Villarejo A., Markelova A., Gerasimenko L., Zavarzin G.,
Samuelsson G., Los D., Pronina N. Extracellular carbonic anhydrases of the
stromatolite-forming cyanobacterium Microcoleus chthonoplastes // Micro-
biology SGM. 153[4]. P. 1149-1156.
Публикации лаборатории в области биотехнологии... 179
168. Dudoladova M.V., Kupriyanova E.V., Markelova A.G., Sinetova M.P., Al-
lakhverdiev S.I., Pronina N.A. The thylakoid carbonic anhydrase associated
with photosystem II is the component of inorganic carbon accumulating sys-
tem in cells of halo- and alkaliphilic cyanobacterium Rhabdoderma lineare
И Biochim. Biophys. Acta. 767[6]. P. 616-624.
2009 r.
169. Маркелова А.Г., Синетова М.П., Куприянова E.B., Пронина Н.А. Распре-
деление и функциональная роль карбоангидразы Cah3 в тилакоидной
мембране стромы и пиреноида Chlamydomonas reinhardtii И Физиоло-
гия растений. 56[6]. С. 844-852.
2012 г.
170. Sinetova М.А. Kupriyanova Е.V., Markelova A.G. Allakhverdiev S.I., Proni-
na N.A. Identification and functional role of the carbonic anhydrase Cah3 in
thylakoid membranes ofpyrenoid of Chlamydomonas reinhardtii 11 Biochim.
Biophys. Acta. 1817. P. 1248-1255.
АВТОРСКИЕ СВИДЕТЕЛЬСТВА
И ПАТЕНТЫ РФ ПО ВОПРОСАМ
БИОТЕХНОЛОГИИ МИКРОВОДОРОСЛЕЙ,
ПОЛУЧЕННЫЕ ИФР РАН
1. Семененко В.Е., Цоглин Л.Н., Иванова Е.А., Маковеев Г.Д., Ме-
зенцев А.Е., Минаева И.Ф., Нестеров Б.Ф., Терещенко В.Я., Фи-
липповский Ю.Н. (1967) Биологический реактор. А.С. № 201137.
2. Филипповский Ю.Н., Штаркер А.Я., Маршак И.С., Семененко В.Е.,
Лебедев В.М., Ничипорович А.А., Чижик Г.А., Пяцкая Л.М. (1969)
Источник излучения. А.С. № 238009.
3. Цоглин Л.Н., Семененко В.Е., Бочачер Ф.М., Борисенко О.Н.,
Отченашенко И.М. (1971) Установка для турбидистатного культи-
вирования микроорганизмов. А.С. № 326874.
4. Цоглин Л.Н., Семененко В.Е., Бочачер Ф.М., Неймарк В.М. (1971)
Установка для культивирования водорослей. А.С. № 377030.
5. Цоглин Л.Н., Семененко В.Е., Бакулин В.А. (1984) Способ культи-
вирования микроводорослей. А.С. № 1130597.
6. Цоглин Л.Н., Семененко В.Е., Бакулин В.А. (1984) Способ регене-
рации атмосферы гермокабины. А.С. № 1111268.
7. Семененко В.Е., Владимирова М.Г., Рамазанов З.М., Лойде М.Э.
(1989) Штамм водоросли Chlorella vulgaris - продуцент зеленой
биомассы. А.С. № 1530637.
8. Семененко В.Е., Рамазанов З.М. (1989) Способ получения мече-
ных соединений. А.С. № 1555354.
Авторские свидетельства и патенты РФ...
181
9 Юрьева М.И., Клячко-Гурвич Г.Л., Семененко В.Е., Темных А.А.
(1990) Способ получения биомассы одноклеточной водоросли
порфиридиум, обогащенной эйкозопентаеновой и арахидоновой
кислотой. А.С. № 1609827.
10. Семененко В.Е., Шитова Л.А. (1991) Способ отбора регуляторных
мутантов фотосинтезирующих микроводорослей и штамм водо-
росли Chlorella sp. - продуцент углеводов. А.С. № 1654337.
II. Семененко В.Е., Лойде М.Э., Лойде Л.О., Рамазанов З.М. (1991)
Установка для культивирования микроводорослей. А.С. № 1642965.
12. Цоглин Л.Н., Семененко В.Е. (1991) Культивирование микроводо-
рослей на D2O. А.С. № 4829042.
13. Пронина Н.А., Семененко В.Е., Фурнаджиева С. (1991) Метод за
култивироване микроводорасли на бикарбонатсъдържащи среди.
Авторско свидетелство BG N50902. Республика Болгария.
14. Цоглин Л.Н., Семененко В.Е., Шапигузов Ю.М., Ежов В.Н. (1992)
Установка для культивирования микроводорослей. А. С. № 1759332.
15. Цоглин Л.Н., Семененко В.Е., Шапигузов Ю.М. (1992) Способ
культивирования микроводорослей. А.С. № 1755742.
16. Цоглин Л.Н., Семененко В.Е., Ежов В.Н. (1992) Установка для
культивирования микроводорослей на меченых соединениях. А.С.
№ 1755742.
17. Фурнаджиева С., Пронина Н.А., Семененко В.Е. (1992) Способ
культивирования зеленых микроводорослей. А.С. № 1740413.
18. Пронина Н.А., Семененко В.Е, Купцова Е.С., Фалькович Т.Н. (1992)
Способ определения пектиновой активности. А.С. № 1778698.
19. Габель Б.В., Цоглин Л.Н., Щербачев Р.В. (1993) Биореактор
для культивирования фотосинтезирующих микроорганизмов.
Патент РФ № 2035505.
20. Цоглин Л.Н., Семененко В.Е., Маслова Н.П. (1993) Способ куль-
тивирования микроводорослей. Патент РФ № 1806184.
21. Цоглин Л.Н., Габель Б.В. (1996) Биореактор для культивирования
фотоавтотрофных микроорганизмов. Патент РФ № 2067433.
22. Габель Б.В., Цоглин Л.Н. (1996) Устройство для культивирования
автотрофных микроорганизмов. Патент РФ № 2057437.
23. Габель Б.В., Цоглин Л.Н. (2000) Устройство для культивирования
автотрофных микроорганизмов. Патент РФ № 2148635.
182 Биотехнология микроводорослей
24. Пронина Н.А., Ковшова Ю.И., Попова В.В., Цоглин Л.Н.,
Габель Б.В.(2003) Способ получения обогащенной селеном био-
массы спирулины (Spirulina platensis). Патент РФ № 2199582.
25. Попова В.В., Черникова А.А., Бедбенов В.С., Цоглин Л.Н., Прони-
на Н.А. (2006) Способ получения биомассы спирулины (Spirulina
platensis). Патент РФ № 2277124.
Научное издание
Лев Наумович Цоглин
Наталия Александровна Пронина
БИОТЕХНОЛОГИЯ МИКРОВОДОРОСЛЕЙ
ООО Издательство «Научный мир»
Тел./факс: +7 (499) 973-2670; +7 (499) 973-2513;
127055, Москва, Тихвинский переулок, 10/12, корп.4
E-mail: naumir@naumir.ru
Internet: http://www.naumir.ru
Подписано к печати 20.11.2012
Формат 60x90/16
Гарнитура Таймс. Печать офсетная. Печ. л. 11,5
Тираж 300 экз. Заказ 514
Издание отпечатано в типографии
ООО «Галлея-Принт»
111024, Москва, ул. 5-я Кабельная, 2-6