Текст
Расчеты
и
экспериментальные
методы построения
диаграмм состояния
ЕТ
Т)
С
(Д
У
«НАУКА*
.НЕТ)
ЛЯТЬ ДРУГИЕ
RT 1
( /А
ПРАВЛЯТЬ ДРУГ
(ДА
ОЛЕ- ТИП"
ЕСЛИ ПОЛЕ-"ТИП
ЕСЛИ ПОЛЕ= УПП
-ТО
-ЕСЛИ ПОЛЕ="
-ЕСЛИ ПО
ТО
ели
ОЛЕ- СИ._ ________,
ТКС(СЧ1) СИН);
И
'ЛИ ПОЛЕ- ФГР"
(ДА,НЕТ)
(ДА,НЕТ)
ТИН("ПОЛЕ : ",П0
1РИН)"ТИП : "ТКС
ПРИН)"ТИП :
(ДА.НЕТ
ПРИН("УПП
ПРИН("СИ
ПРИН("У
ни.
(ДА,НЕТ)
Ш("ЧФЕ : ”ТКС(СЧ1), ЧФЕ);
(ДА,НЕТ)
(ДА,НЕТ)
(ДА,НЕТ)
(ДА,НЕТ)
АКАДЕМИЯ НАУК СССР
ИНСТИТУТ МЕТАЛЛУРГИИ ИМ. А.А. БАЙКОВА
Расчеты
и
экспериментальные
методы построения
диаграмм состояния
Ответственный редактор
академикИ.В. Агеев
в1
IB.
МОСКВА
"НАУКА”
1985
УДК 669.017
Расчеты и экспериментальные методы построения диаграмм состояния. М.:
Наука, 1985.
Изложены новые результаты по анализу и расчету диаграмм состояния
а также по применению современных экспериментальных методов исследова-
ния фазовых равновесий в металлических системах. Рассмотрены различные
аспекты термодинамического расчета диаграмм состояния, вопросы киберне-
тического прогнозирования новых фаз с заданными свойствами и применения
ЭВМ для расчета фазовых равновесий металлических сплавов. Особое внима-
ние уделено вопросам создания автоматизированных банков данных по диа-
граммам состояния и неорганическим материалам, а также результатам расче-
тов диаграмм фазовых равновесий конкретных систем. В сборник включены
статьи по важнейшим направлениям расчета диаграмм состояния, результаты
применения современных экспериментальных методов для исследования
сплавов.
Книга рассчитана на металлургов, металловедов и химиков •
Редакционная коллегия:
академик Н.В. Агеев (ответственный редактор),
член-корреспондент АН СССР Е.М. Савицкий
(заместитель ответственного редактора),
профессор, доктор технических наук С.Б. Масленков
(заместитель ответственного редактора),
профессор, доктор технических наук О А. Банных,
доктор физико-математических наук Д.С. Каменецкая,
кандидат ФизиЙВчнмамадических наук И.Л. Аптекарь,
кандидат х>^иф<|к£Гнаур<
I . UQ
Рецензенты: чКт.'Бф'фЦ^рМ^М&жнов
Расчёш н 'JllUiipiniijQSnHfbi
построения диаграмм сос
Кг
Утверждено к печати
Институтом металлургии им. АА. Байкова Академии наук СССР
Редактор Н.Е. Миронова
Художник Ю.С. Шлепер. Художественный редактор Н.Н. Власик
Технические редакторы ГЛ. Каренина, ГА. Фетисова. Корректор О.А. Пахомова
Набор выполнен в издательстве на наборно-печатающих автоматах
ИБ № 28778
Подписало к печати 04.04. 85. Т - 00992. Формат 60 х 90 1/16. Бумага офсетная N° 1
Гарнитура Пресс-Роман. Печать офсетная.Усл.печ. л. 11,5. Усл.кр.-отт. 11,
Уч.-иэд.л. 13,7. Тираж 1050 экз. Тип. зак. 244. Цена 2р. Юк.
Ордена Трудового Красного Знамени издательство "Наука”
117864 ГСП-7, Москва В-485, Профсоюзная ул., д. 90
Ордена Трудового Красного Знамени 1-я типография издательства ’’Наука”
199034, Ленинград В-34, 9-я линия, 12
2605000000-233
Р--------------308-85-11
042 (02)-85
© Издательство ’’Наука”, 1985
ПРЕДИСЛОВИЕ
Исследования по прогнозу и расчету диаграмм состояния и работы по
созданию новых экспериментальных методов изучения фазовых равно-
весий приобрели- в нашей стране за последние годы большой размах. Это
обусловлено тем, что традиционный метод построения диаграмм состояния,
основанный на разработанном еще Н.С. Курнаковым физико-химическом
анализе, сейчас уже не может обеспечить возрастающие потребности тех-
ники.
В практику вовлекаются все новые элементы и соединения, много-
образней и сложней становятся составы сплавов, расширяется диапазон
условий, в которых они должны работать. Все это вынуждает создавать и
внедрять более эффективные и экономичные методы построения диа-
грамм состояния.
Как известно, диаграмма состояния данной системы определяется ее
термодинамическими свойствами, которые зависят от строения атомов
компонентов и природы их взаимодействия в растворах и соединениях.
Поэтому наряду-с-чисто экспериментальным методом разрабатывается и
уже начал давать результаты феноменологический расчет диаграмм со-
стояния, использующий данные'о термодинамических и других свойствах
системы и сочетающийся с методами прогноза.. В более далекой перспекти-
ве ожидается практическое применение и расчета из ’’первых принципов”.
Расчет позволяет привлечь для построения диаграмм состояния дости-
жения теоретической физики, успехи вычислительной математики, про-
гресс в экспериментальных исследованиях термодинамических и физичес-
ких свойств вещества. Сочетание теории и опыта, методов термодинамики
и физико-химического анализа дает возможность определить аналитичес-
кий вид зависимостей термодинамических потенциалов всех фаз системы
от температуры, давления и состава и рассчитать (на ЭВМ) искомую диа-
грамму состояния.
Такой подход дает информацию не только о характере фазовых равно-
весий, но и о термодинамических стимулах процесса кристаллизации и
других фазовых переходах (знание которых необходимо для описания
кинетики этих процессов), а также о метастабильных фазах, изоконцентра-
ционных превращениях (мартенситного типа) и т.д. Комплексный метод
особенно важен при исследованиях многокомпонентных систем, исследова-
ниях равновесия фаз при высоких температурах и давлениях и при других
экстремальных условиях, в которых прямой эксперимент затруднен или
невозможен. Такой метод построения диаграмм состояния создает пред-
посылки к широкому использованию планирования эксперимента и систем-
3
ного анализа, что позволит оптимизировать работу по труду, затратам и
другим показателям.
Все это требует объединений усилий специалистов разного профиля
(математиков, физиков, химиков, металловедов, экономистов и т.п.).
К настоящему времени уже проведен ряд работ по построению диаграмм
состояния путем сочетания термодинамического расчета и эксперимента.
Хотя этих работ еще мало, они показывают результативность такого пути.
Для развития теории диаграмм состояния необходимы как исследова-
ния по отдельным составляющим эту теорию направлениям (расчет,
прогноз, развитие теории растворов, применение ЭВМ и т.д.), так и ис-
следования, сочетающие эти подходы и закладывающие основы комплекс-
ного метода построения диаграмм состояния.
В настоящий сборник включены статьи, посвященные прогнозированию
и расчету диаграмм состояния металлических систем. Отражены все на-
правления исследований в этой области: применение электронной теории
металлов, развитие моделей растворов, в том числе с учетом атомного и
магнитного упорядочения, кибернетическое прогнозирование и отыскание
общих закономерностей изменения .диаграмм состояния в зависимости
от положения компонентов в Периодической системе элементов
Д.И. Менделеева, особенности равновесий металл—газ, методы расчета
на ЭВМ. Приведены конкретные диаграммы состояния, построенные
сочетанием расчета и эксперимента.
В сборник включены статьи, посвященные новым экспериментальным
методам построения диаграмм состояния. Обращено внимание на актуаль-
ность создания банков данных по диаграммам состояния и свойствам
металлических систем.
1. РАСЧЕТ И АНАЛИЗ ДИАГРАММ РАВНОВЕСИЯ ФАЗ
УЖ 541.123.2:539.89
АНАЛИЗ И РАСЧЕТ ПРИ ПОСТРОЕНИИ Т-Р-С
ДИАГРАММ СОСТОЯНИЯ
Д.С. Каменецкая
Чисто экспериментальный путь исследования равновесия фаз даже
при давлении, равном атмосферному, чрезвычайно трудоемок. Построе-
ние диаграммы состояния (ДС) при высоких давлениях сопряжено с
неизмеримо большими трудностями. Наиболее рациональным при ис-
следовании Т-Р-С ДС (Т — температура, Р - давление, С - концентра-
ция) является сочетание эксперимента с термодинамическим расчетом -
комплексный метод. При этом может быть использован большой объем
имеющейся информации о свойствах рассматриваемой системы для прогно-
зирования влияния давления на равновесие фаз. Работа состоит из ряда
этапов.
Сбор имеющихся сведений о системе и отбор взаимно согласующихся
данных. 1. Свойства компонентов и соединений. Используются экспери-
ментальные Т-Р ДС и данные о термодинамических свойствах компонен-
тов и соединений, скачки объемов и энтропий при превращениях, сжи-
маемости и другие свойства. Прогнозируются возможные фазы компонен-
тов. Прогнозирование осуществляется на основании электронной теории
металлов [1, 2] с использованием периодичности зависимостей свойств
элементов от их атомного номера [3], с учетом обнаруженной связи про-
межуточных фаз на Т-С ДС с фазами высокого давления [4]. При-
влекаются эмпирические закономерности: правило Трутона, правило
гомологии (согласно которому у легких гомологов при высоком давлении
реализуются кристаллические структуры тяжелых гомологов при атмос-
ферном давлении [5]). Прогноз структур компонентов может быть также
сделан на основании сведений о структурах тонких пленок (с соответствую-
щей поправкой на вклад поверхностной энергии).
Т-С ДС могут быть использованы для предсказания свойств вирту-
альных фаз одного из компонентов со структурой второго компонен-
та. Впервые этим методом были найдены температуры плавления вирту-
альных фаз олова со структурой ГЦК и висмута со структурой олова
[6]. В работе [7] найдены разности свободных энергий ГЦК, ОЦК и ГПУ
модификаций таллия (при атмосферном давлении стабильны ОЦК и ГПУ
модификации). В работе [4] отмечено, что рассмотрение бинарных ДС
при атмосферном давлении позволяет предсказать структуру фазы высоко-
го давления по структуре промежуточных фаз: е-фазы железа по ГПУ
5
е -фазе в системе Fe—Мп, ГПУ фазы свинца по промежуточной ГПУ фазе
в системе Bi—РЬ.
Аналогичная связь структур, устойчивых у компонентов при высоких
давлениях, со структурами промежуточных фаз отмечена в работах [8, 9]:
co-фаза титана и циркония [8], Х-фаза в системе Sn—Bi с фазой Bi-VIl
высокого давления [9] (предсказание структуры Л'-фазы и ее идентичность
со структурой Bi-VII впоследствии подтвердилось экспериментально [10]).
ГЦК фаза таллия, стабильная при высоких давлениях, образуется в системе
Т1—Sn. Метод экстраполяции из Т-С ДС широко использован в работе
[3] при определении температур виртуальных переходов элементов и
разностей свободных энергий ГЦК, ОЦК и ГПУ модификаций многих
переходных металлов (при этом энтропия плавления всех элементов при-
нята равной 2 кал/ (град г-ат)).
Автор работы [И] обнаружил корреляцию плотности и полиморфизма
под давлением, использованную им для прогнозирования фаз высокого
давления. В работе [11] дано эмпирическое правило, согласно которому у
элементов, плотность которых выше р = 2,8 + 0,12 z (z — атомный номер),
нет полиморфизма под давлением при комнатной температуре, у элементов
с меньшей плотностью полиморфизм должен быть. Это правило для веществ
с большей плотностью соблюдается у 28 элементов (железо является
исключением в связи с его ферромагнетизмом), из 50 веществ с меньшей
плотностью имеются два исключения (Na и In), не подчиняющиеся этому
правилу. Пользуясь найденной закономерностью, автор [И] предсказал
полиморфизм у Se, Tm и Lu и обнаружил в них превращения при давлениях
100-200 кбар (10-20 ГПа).
Прогнозирование возможных структур и фаз осуществляется также
методом обучения ЭВМ [12]. Обзор методов оценки свойств виртуальных
фаз элементов приведен в работе [13].
2. Свойства двухкомпонентных фаз. В связи с тем, что в общем случае
Т-С ДС являются сложными, включающими области стабильности многих
фаз, целесообразно их расчленять на простейшие (диаграммы равновесия
двух фаз) с учетом виртуальных переходов компонентов [14].
Влияние давления на простейшую ДС определяется объемными со-
отношениями фаз: скачками объемов при превращении компонентов и
избыточным объемом (компрессией) растворов (жидких и твердых)
[15]. Избыточный объем твердых растворов может быть найден из
концентрационных зависимостей параметров решетки (или плотности).
Определение этой характеристики расплава представляет значительные
трудности, особенно в случае систем тугоплавких компонентов. Для
оценки избыточного объема расплава используется экстраполяция (или
интерполяция) этой величины с помощью ее зависимостей от атом-
ного номера одного из компонентов (при заданном втором компонен-
те) [16].
При прогнозировании влияния давления на Т-С сечения Т-Р-С ДС
можно также учитывать эмпирически замеченную однотипность последо-
вательности стабилизации фаз под действием давления и легирования:
замена одного из компонентов на более тяжелый элемент той же группы
приводит к такому же изменению фазовых равновесий, что и воздействие
давления [17].
6
Рис. 1. Объемы фаз и смесей системы Та-С
Соотношение объемов фаз, образую-
щихся в данной системе, дает возмож-
ность прогнозировать влияние давления
на смену стабильности фаз. Анализ объе-
мов разных фаз позволил исследовать
эволюцию под давлением Т-С сечений
ДС ряда систем (Fe-С [18, 19], Со-С
[20], Ni-C[21], Ni-Mn[22], Mn-C[16],
Та-С[23] и др.), предсказать распад
(Cd Sb [24]) или стабилизацию (Со3 С [20])
соединений.
На рис. 1 показаны в качестве примера
объемы фаз и их смесей для системы Та—С
[23, 25]. На рисунке видно, какие фазы
и их смеси должны стабилизироваться
давлением при разных соотношениях
компонентов.
В перечисленных системах переходный
металл-углерод изменение типа Т-С сече-
ния ДС в области равновесия с расплавом
под действием давления определяется как
скачками объемов при плавлении компо-
нентов, так и избыточным объемом рас-
плава. Последний в системах переходный
металл-углерод отрицателен (объем расплава меньше аддитивного — см.,
например, рис. 1) и увеличивается в ряду (Ni-Co-Fe-Mn)-C; в этом же
ряду увеличивается стабильность карбидов. Закономерное изменение
избыточного объема расплава металл-углерод с атомным номером
позволило экстраполяцией прогнозировать эту величину для систем Мп—С
[16] и Та-С [23] и рассчитать ДС этих систем в области равновесия
с расплавом.
Аналитическое описание термодинамических свойств системы. Для
количественного описания термодинамических свойств системы необходим
выбор подходящих моделей. Прежде всего требуется описание свойств
компонентов, удовлетворительно согласующихся с их экспериментальны-
ми Т-Р ДС. Это особенно существенно в случае нелинейной зависимости
температуры превращения от давления. Для расчета Т-Р ДС веществ,
у которых на кривых равновесия имеется экстремум, используются
специальные модели, например модель двух уровней (псевдобинарных
растворов) [26]. Эта модель не только удовлетворительно согласуется с
Т-Р ДС, но и с зависимостями физических свойств от Т и Р. Применение
модели двух уровней для ГЦК структуры позволило рассчитать в согласии
с экспериментом кривую плавления с минимумом, линию ГЦК—ГЦК изо-
морфных переходов с критической точкой и ряд физических свойств
церия [26]. Аналогичная модель для расплава дала возможность описать и
объяснить максимум на кривых плавления цезия [27]* и углерода [28].
* В этой работе не учтено принципиальное отличие псевдобинарных растворов от
истинных.
7
Для магнитных материалов необходимо использовать модели, учитыва-
ющие магнитную составляющую термодинамического потенциала.
Для двухкомпонентных фаз (растворов) выбор модели диктуется
природой этих фаз. Применяются модели растворов замещения, внедрения,
вычитания, упорядоченных растворов и т.д. с различными приближениями
зависимостей термодинамических свойств растворов от концентрации,
температуры, давления. Модель регулярных растворов, несмотря на ее
упрощенность, позволила исследовать роль параметров взаимодействия
в определении типа Т-С ДС [6, 29, 30]. Позднее эта модель была обобще-
на на случай переменного давления и с ее помощью исследовано влияние
давления на эволюцию этих типов [31 ].
В работе [31], однако, не были учтены граничные ДС и не был про-
веден анализ возможных типов Т-С ДС. Эта задача была решена в работах
[32, 33], в которых наиболее полно рассмотрена эволюция Т-С ДС с
изменением параметров стабильности компонентов и их взаимодействия
с учетом граничных ДС.
Использованный в работах [32, 33] метод основан на результатах работы
[34], он состоит в исследовании пространства параметров стабильности
и взаимодействия и может быть использован для анализа эволюции изо-
барических сечений Т-Р-С ДС с изменением давления [35]. Движение
фигуративной точки в пространстве параметров под действием давления
показывает смену типов изобарических сечений.
Эволюция сложных ДС определяется изменением типа простейших
ДС, на которые расчленяется сложная ДС, и их взаимным смещением.
Проиллюстрируем такое сложное влияние давления на изобарические
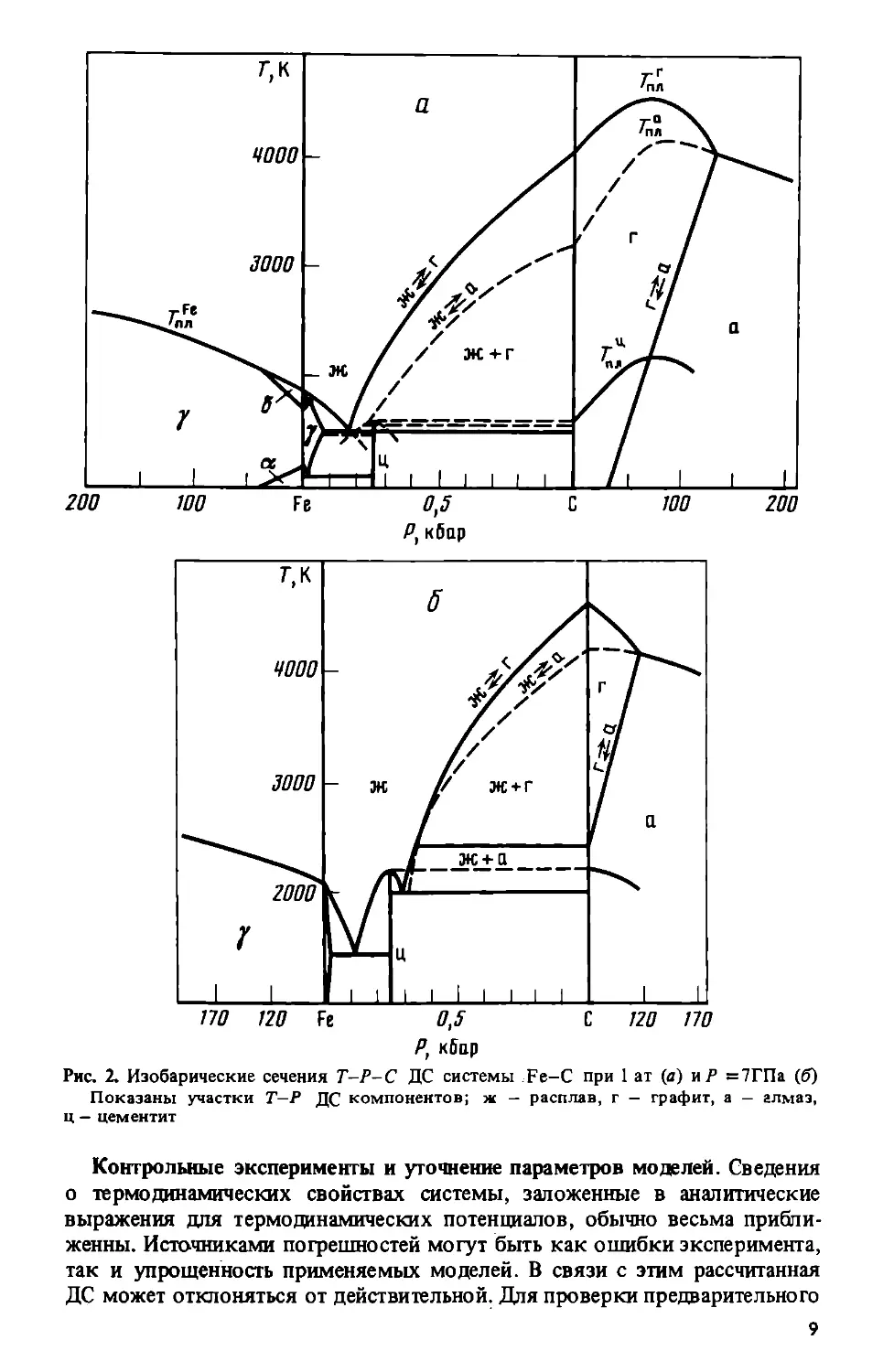
сечения на примере ДС системы Fe-C. На рис. 2, а показано изобаричес-
кое сечение ДС этой системы в области равновесия с расплавом для
атмосферного давления с указанием линий метастабильного равновесия
расплава Fe-C с соединением Fe3C и виртуального равновесия расплава
с алмазом; показаны также ДС компонентов.
На рис. 2, б приведено изобарическое сечение ДС этой же системы
при давлении 7 ГПа [19]. Сопоставление этих двух сечений позволяет
выделить роль параметров стабильности железа и углерода и параметра
их взаимодействия в расплаве в эволюции Т-С сечений под давлением.
Повышение температур плавления железа и углерода (второго — до дав-
ления ~ 6,5 ГПа) вызывает подъем участков ликвидусов, прилегающих
к чистым компонентам. В средней области концентраций на этот эффект
накладывается стабилизирующее действие давления на расплав в связи
с тем, что избыточный объем расплава отрицателен [19]. Это приводит
к расширению области стабильности расплава и стабилизации карбидов
железа (’’вращение ликвидусов” [36]).
Предварительный расчет Т-Р-С ДС. Составление аналитических выра-
жений для разных фаз рассматриваемой системы в зависимости от темпе-
ратуры, давления и концентрации дает возможность рассчитать Т-Р-С ДС.
Это осуществляется либо нахождением общего минимума системы, либо
решением уравнений попарного равновесия. В обоих случаях задача может
быть решена с помощью ЭВМ [3,37]. При расчете могут быть использованы
известные участки Т-С ДС в сочетании с необходимой дополнительной
информацией для однозначности решения обратной задачи [38].
8
200 WO Fe 0,5
C WO 200
Рис. 2. Изобарические сечения T-P-C ДС системы Fe-C при 1 ат (а) иР =7ГПа (б)
Показаны участки Т-Р ДС компонентов; ж - расплав, г - графит, а - алмаз,
ц — цементит
Контрольные эксперименты и уточнение параметров моделей. Сведения
о термодинамических свойствах системы, заложенные в аналитические
выражения для термодинамических потенциалов, обычно весьма прибли-
женны. Источниками погрешностей могут быть как ошибки эксперимента,
так и упрощенность применяемых моделей. В связи с этим рассчитанная
ДС может отклоняться от действительной. Для проверки предварительного
9
о
Рис. 3. Термодинамические потенциалы фаз и их смесей системы Та-С
I - Та + Сг, 2 - ТаС + Сг, 3 - ТаС + Са, 4 - Та + ТаС, 5 - Та + Та2С, 6 - Та2С +
+ ТаС. Т = 2100 К и Р = 75 кбар, AG — уменьшение термодинамического потенциала
при переходах: AG2 - Та + Сг ->ТаС(Та : С =1 :1), AG2 - Та + Сг^ТаС + Сд (Та :С =
= 1 - х:х), &G3 - ТаС + Сг ->ТаС + Сд(Та:С = 1 - х:х)
расчета необходимы контрольные эксперименты. Наиболее информативны
опыты по проверке вычисленной ДС при значениях Т, Р и С, соответствую-
щих узловым точкам диаграммы (точкам равновесия трех фаз и др.). Эти
опыты позволяют внести поправки в параметры, входящие в аналитические
выражения, для термодинамических потенциалов системы.
Расчет Т-Р-С ДС с учетом исправленных значений параметров. Заключи-
тельным этапом работы является расчет полной Т-Р-С ДС системы. Зада-
вая различные значения давления или температуры, можно вычислить (с
любым шагом) соответствующие изобарические или изотермические сече-
ния диаграммы. Этот путь значительно экономнее и информативнее, чем
чисто экспериментальный.
Значение зависимостей термодинамических потенциалов разных фаз от
Т, Р и С и других параметров дает возможность не только вычислить равно-
весные ДС, но и рассмотреть вопросы кинетики фазовых превращений при
высоких давлениях. Оценка термодинамических движущих сил превраще-
ний позволяет объяснить наблюдающееся на опыте различие в скорости
перехода в равновесное состояние при разных исходных состояниях.
Так, например, сопоставления термодинамических стимулов перехода от
смеси тантала и графита к стабильной под давлением смеси монокарбида
тантала ТаС и алмаза (рис. 3) со стимулом перехода от смеси ТаС и графита
к той же стабильной смеси ТаС и алмаза позволило объяснить резкое разли-
чие в скорости достижения равновесного фазового состава при различных
исходных состояниях (Та + Сг или ТаС + Сг) [39].
10
К настоящему времени накоплен ряд примеров построения Т-Р-С ДС
с применением термодинамического расчета и эксперимента. К ним отно-
сятся Т-Р-СДС систем Fe-C [18,19],Со-С [20], Ni—С [21],Ni-Mn [22],
Мп-С [16], Та—С [23, 39], Fe-C— Al и Fe—С—Si [40] и др. ДС этих систем
позволили объяснить многие экспериментальные факты, а также предска-
зать появление новых фазовых состояний.
ЛИТЕРАТУРА
1. Пик Р.М. Самосогласованный расчет функций парного взаимодействия в некоторых
простых металлах методом ортогонапизованных плоских волн. - В кн.: Устойчй-
востьфаз в металлах и сплавах. М.: Мир, 1970, с. 58-71.
2. Григорович В.К. Периодический закон Менделеева и электронное строение метал-
лов. М.: Наука, 1966. 286 с.
3. Кауфман Л., Бернстайн X. Расчет диаграмм состояния с помощью ЭВМ. М.: Мир,
1972.326 с.
4. Генишфт Ю.С. К определению кристаллических решеток фаз высокого давления
без исследования под давлением. -ФММ, 1964, т. 18, вып. 1, с. 116-120.
5. Верещагин Л.Ф., Кабалкина С.С. Рентгеноструктурные исследования при высоком
давлении. М.: Наука, 1979. 150 с.
6. Пинес Б.Я. К расчету простейших диаграмм равновесия бинарных сплавов. -
ЖЭТФ, 1943, т. 13, № 11-12, с. 411-417.
7. Ламсден Дж. Термодинамика сплавов. М.: Металлурги?дат, 1959. 440 с.
8. Аптекарь И.Л., Понятовский Е.Г. О влиянии давления на равновесие между а, <3
и аз-фазами в системах на основе титана и циркония. - В кн.: Проблемы сверх-
проводящих материалов. М.: Наука, 1970, с. 131-140.
9. Аптекарь И.Л., Баскакова В.Б. Термодинамический расчет диаграмм состояния
Bi-Sn при различных давлениях. - Изв. АН СССР. Металлы, 1970, № 6, с. 192-197.
10. Федотов В.К., Понятовский Е.Г., Соменков В.А., Шильштейн С.Ш. Нейтрографи-
ческое исследование полиморфизма висмута до давления 30 кбар. - ФТТ, 1978,
т. 20, №4, с. 1088-1096.
11. Liu L.G. Correlation of density periodity to pressure-induced polymorphic transforma-
tion in solid elements. - J. Appl. Phys., 1973, vol. 44, N 6, p. 2470-2474.
12. Грибуля В.Б. Основные принципы обучения ЭВМ предсказанию свойств физико-
химических объектов. - В кн.: Диаграммы состояния в материаловедении. Киев:
Ин-тпробл. материаловедения АН УССР, 1980, с. 112-116.
13. Аптекарь И.Л., Каменецкая Д.С. Диаграммы метастабильных равновесий и вир-
туальные фазовые переходы. - В кн.: Математические проблемы фазовых равно-
весий. Новосибирск: Наука, 1983, с. 84-102.
14. Аптекарь И.Л., Баскакова В.Б. Термодинамический расчет Т-Р-С-диаграммы
состояния системы висмут-свинец. - ДАН СССР, 1970, т. 191, № 6, с. 1305-1308.
15. Каменецкая Д.С. Анализ диаграммы состояния бинарных систем при переменном
давлении. - ЖФХ, 1964, т. 38, № 1, с. 73-79.
16. Ершова Т.П, Каменецкая ДС. Влияние давления на равновесия расплава с графи-
том, алмазом и карбидом Мп7С3 в системе Мп-С. - Изв. АН СССР. Металлы,
1982, №3, с. 180-184.
17. Дегтярева В.Ф., Понятовский Е.Г. Фазы высокого давления В-элементов - новый
тип электронных фаз. -ФТТ, 1982,т. 24,№9,с. 2672-2681.
18. Ершова Т.П., Понятовский Е.Г. Влияние высоких давлений на линии фазовых
равновесий эвтектоидной части диаграммы железо-углерод. - ФММ, 1964, т. 17,
вып. 4, с. 584-591.
19 Корсунская И.А., Каменецкая Д.С., Ершова Т.П. Расчет Т-Р-С-диаграммы состоя-
ния системы Fe-C в области равновесий с расплавом при давлении до 100 кбар. -
ДАН СССР, 1973, т. 210, № 3, с. 577-580.
20. Ершова Т.П., Каменецкая Д.С., Ильина Л.П. Расчет Т-Р-диаграммы состояния сис-
темы Со—С до давления 100 кбар. — Изв. АН СССР. Металлы, 1982, № 1,с. 15 3-160.
И
21. Ершова Т.П., Каменецкая Д.С., Ильина Л.П. Расчет Т-Р-диаграммы состояния сис-
темы Ni-C до давления 100 кбар. - Иэв. АН СССР. Металлы, 1981, №4, с. 201-210.
22. Ершова Т.П., Фрадкова Н.Д., Литвин ЮЛ. Построение Т'-Р-Л'-диаграммы плав-
кости системы Mn-Ni при давлении до 100 кбар. - Изв. АН СССР. Металлы, 1981,
№5,с. 192-197.
23. Штеренберг Л.Е., Каменецкая Д.С., Дмитриченко А.Р. Равновесие фаз в системе
тантал-углерод при высоких давлениях. -ДАН СССР, 1981, т. 261, № 1, с. 138-141.
24. Aptekar I.L., Belash I.T., PonyatovskiiE.G. Phase transformations in alloys of cadmium
and zinc with antimony: The Cd-Sb system. - High Temp.-High Pressur., 1977, vol. 9,
N 6, p. 641-644.
IS. Каменецкая Д.С., Штеренберг Л.Е. Термодинамические соотношения при образо-
вании алмазов в системе графит—карбидообразующий металл при высоком давле-
нии. -ЖФХ, 1984,т.58,№ 1,с. 212-214.
26. Аптекарь И.Л., Понятовский Е.Г. К теории изоморфного фазового превращения
и критического перехода церия. - ДАН СССР, 1967, т. 173, № 4, с. 851-854.
27. Rapoport Е. Model for melting curve maxima at high pressure. - J. Chem. Phys., 1967,
vol. 46, N 8, p. 2891-2895.
28. Аптекарь И.Л., Каменецкая Д.С., Корсунская И.А. Применение модели двух уров-
ней к расчету фазовой Т-Р-диаграммы углерода. - ДАН СССР, 1972, т. 204, № 4,
с. 909-912.
29. Данилов В.И., Каменецкая Д.С. О влиянии молекулярного взаимодействия на
равновесие фаз в бинарных .системах. - ЖФХ, 1948, т. 22, № 1, с. 69-79.
30. Каменецкая Д.С. Зависимость типа диаграмм состояния бинарных сплавов от
молекулярного взаимодействия. - ЖФХ, 1948, т. 22, № 1, с. 81-89.
31. Каменецкая Д.С. Анализ диаграмм состояния бинарных систем при переменном
давлении. - ЖФХ, 1964, т. 38, № 1, с. 73-79.
32. Аптекарь И.Л., Исаева Л. Г. Новые типы диаграмм состояния простейших двухком-
понентных систем. - ДАН СССР, 1975, т. 224, № 1, с. 120-123.
33. Аптекарь И.Л., Исаева Л. Г. Анализ возможных типов диаграмм состояния двухком-
понентных систем. - ЖФХ, 1977, т. 51, № 9, с. 2353-2355.
34. Mager Т, Lucas H.L., Petzow G. Statistische Konstitutionsanalyse-Thermodynamische
Konstitutionsmorphologie. — Ztschr. Metallk., 1972, Bd. 63, N 10, S. 638—646.
35. Аптекарь И.Л., Исаева Л.Г.Аналиэ возможных типов диаграмм состояния двухком-
понентных систем и эволюция под давлением. - Физика и техника высоких давле-
ний, 1983, № 12, с. 31-53.
36. Ершова Т.П, Корсунская И.А. Расчет влияния давления на диаграмму плавкости
Fe-Crp. - Изв. АН СССР. Металлы, 1970, №4, с. 150-156.
37. Иванов О.С., Удовский А.Л. Современное состояние и перспективы термодинами-
ческого расчета диаграмм состояний металлических систем. - В кн.: Сплавы для
атомной энергетики. М.: Наука, 1979, с. 5-17.
38. Воронин Г.Ф. Расчеты термодинамических свойств сплавов с использованием диа-
грамм фазовых состояний. - В кн.: Математические проблемы фазовых равнове-
сий. Новосибирск: Наука, 1983, с. 5—40.
39. Штеренберг Л.Е., Дмитриченко А.Р., Каменецкая Д.С. и др Влияние высоких давле-
ний на фазовый состав тантал -углерод. - Сверхтвердые материалы, 1982, № 4, с. 3-6.
40. Каменецкая ДС., Корсунская И.А., Литвин Ю.А. Влияние графитизирующих эле-
ментов на равновесие с расплавом в системе железо -углерод при высоких давле-
ниях. - ФММ, 1978, т. 45, вып. 3, с. 569-579.
12
УДК 541.11
ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ ДИАГРАММ
ФАЗОВЫХ СОСТОЯНИЙ
ДЛЯ РАСЧЕТА ТЕРМОДИНАМИЧЕСКИХ СВОЙСТВ СПЛАВОВ
ГФ. Воронин
Три группы термодинамических характеристик любого сплава (а имен-
но свойства промежуточных фаз, свойства чистых компонентов и условия
равновесия фаз), выражающиеся, в частности, с помощью диаграмм состоя-
ний, связаны между собой термодинамическими соотношениями и могут
в то же время независимо друг от друга находиться с помощью эксперимен-
тальных измерений. Естественно стремление использовать такие связи
для расчета требующихся характеристик системы и сокращения трудоем-
кого и медленного эксперимента. В данном случае речь пойдет об извле-
чении сведений о термодинамических свойствах отдельных фаз сплава из
известных условий их равновесия. Специфика таких расчетов заключается
в том, что для получения однозначного результата надо все же иметь пред-
варительно некоторые данные о свойствах фаз.
Ранее предлагалось различать два типа термодинамических расчетов —
корректные и некорректные в зависимости от того учитывается или нет
упомянутая начальная информация о фазах [1]. Ниже рассмотрены особен-
ности и возможности как корректных, так и некорректных термодинами-
ческих расчетов.
Конечной целью термодинамического исследования свойств сплава
можно, как известно, считать нахождение характеристической функции
в явном виде, например энергии Гиббса, каждой из равновесных фаз в
зависимости от интересующих переменных, например от температуры
и концентрации компонентов. Некоторые сведения о характеристических
функциях фаз следуют из общих законов равновесия и устойчивости термо-
динамических систем и известны заранее. Так, для термодинамически ста-
бильных фаз можно использовать условие однозначности и непрерывности
этих функций. Нередко термодинамические функции являются монотон-
ными, как, например, химический потенциал компонента в зависимости
от его концентрации, или монотонными и выпуклыми, как, например,
энергия Гиббса в зависимости от состава. Функции могут иметь в области
определения ограниченные вариации и ряд других априорных качеств.
Такие качественные сведения абсолютно необходимы для аналитической
аппроксимации, интерполяции, дифференцирования и других операций с
экспериментально определяемыми функциями. Необходимы они и для
любых термодинамических расчетов. Однако в случае корректных расче-
тов этих общих сведений достаточно найти конкретные выражения и чис-
ленные значения интересующих термодинамических свойств, в то время
как при некорректных расчетах для достижения конечной цели необхо-
димо еще знать конкретный вид функциональной зависимости свойств
от переменных состояния, т.е. надо использовать вполне определенную
модель термодинамических свойств фазы. Так как в рамках термодинами-
ческого метода никогда нельзя заранее выяснить, в какой степени соблю-
13
дается принятая модель, некорректные расчеты не позволяют количес-
твенно оценить достоверность полученного результата: в этой оценке
всегда будет присутствовать неизвестная ошибка неадекватности модели
фазы.
К числу некорректных термодинамических расчетов относится боль-
шинство публикуемых работ по расчетам свойств сплавов с использова-
нием диаграмм фазовых состояний. Из сказанного следует, что их недостат-
ком является то, что надо угадать правильную модель термодинамических
функций фаз, считая последние, например, регулярными или идеально ас-
социированными растворами, приписывая им определенные уравнения
состояния и т.п. Преимущество же некорректных расчетов заключается в
возможности применять их, располагая очень ограниченными сведениями о
сплаве. Это обстоятельство привлекает многих исследователей и создает
нередко иллюзию безграничных возможностей таких расчетов.
Эффектным примером удачного применения некорректного расчета
может служить работа [2]. В ней исследовалась система пара-толуи-
дин-8О2. До начала работы было известно только, что в системе существу-
ет соединение компонентов состава 1:1 (C6H4CH3NH2SO2). Авторы
измерили давление насыщенного пара в области равновесия этого соедине-
ния с жидкими растворами в зависимости от температуры. Далее, исполь-
зуя гипотезу, что пар состоит только из молекул SO2, что жидкие растворы
являются регулярными, а соединение ’’точечным”, они рассчитали: а) тер-
модинамические свойства (энтальпию и энтропию образования) соедине-
ния, б) термодинамические функции испарения летучего компонента
(энтальпию и энтропию испарения SO2), в) термодинамические функции
образования жидких растворов, г) диаграмму (Т, х)-состояний в области
соединения 1:1 (кривую ликвидуса). Контрольные измерения подтвердили
высокую точность предсказания кривой ликвидуса, а аналогичные расчеты
для системы анилин—SO2 дали практически такие же характеристики
процесса испарения жидкой SO2 [3].
При неверно выбранной модели термодинамических свойств резуль-
таты некорректных расчетов получаются совсем непригодными. В работе
[4] сопоставлены результаты расчетов термодинамических функций жид-
ких сплавов In-Sb и Ga-Sb по кривым ликвидуса соединений 1:1 в этих
системах и энтальпиям их плавления. Использовались модели регулярных
и кваэирегулярных растворов при одних и тех же исходных эксперимен-
тальных данных. Обе модели позволяют адекватно описать кривую ликви-
дуса, однако термодинамические функции расплава получаются не согла-
сующимися ни между собой, ни с экспериментом. Подобных примеров
можно привести немало. Часто термодинамически некорректные расчеты
приводят к результатам, которые катастрофически сильно зависят от ис-
ходных данных, т.е. расчеты явлются некорректными и в математическом
смысле. Но этот признак присутствует не всегда. Так, модели регулярных
растворов приводят, как правило, к вполне устойчивым решениям, не
имеющим, однако, ожидаемого физического содержания [5].
Корректные расчеты могут проводиться без привлечения модельных
представлений. Их точность оценивается по точности исходной информации,
но платой за это существенное преимущество является ее значительный
объем. Для двухкомпонентных систем наиболее интересные варианты та-
14
ких расчетов с использованием данных по энтальпиями энтропиям образо-
вания фаз (Hf и Sf соответственно) показаны ниже:
-cry'), (d
(2)
[H’f,H"f,X',X"} -* ty.S}], (3)
[H'f, S'f, S"f„ X'] -+[H"f,X"]. (4)
Схема (1) означает, что, зная основные термодинамические функции
сосуществующих фаз (*) и (" ), можно рассчитать их составы (X' и X").
Такой теоретический расчет (Т, х)-диаграммы состояний сплава широко
представлен в научной литературе (см., например, [6]). Запись (2) озна-
чает, что при известной диаграмме состояний (х (Т)их" (Т)) и свойствах
одной иЗ соседних фаз (Н?, S?) можно рассчитать свойства второй'фазы
[7, 8]. Вариант (3) относится к расчету термодинамических свойств спла-
вов только по калориметрическим данным и фазовым диаграммам [9,
10], а последняя схема выражает интересную возможность расчета, напри-
мер, кривой солидуса, сплава по кривой ликвидуса либо наоборот [11].
Область двухфазного равнове-
сия (') + (") в трехкомпо-
нентной системе А-В-С
В двух последних вариантах расчетов надо интегрировать уравнения фазо-
вых равновесий, поэтому, помимо знания стоящих справа термодинами-
ческих функций или кривых равновесия фаз, необходимо еще распола-
гать подходящими начальными условиями для такого интегрирования.
Это обстоятельство отмечено разными скобками в схемах (1)-(4). Под-
робности таких расчетов, их ’’технику” можно узнать из цитированной
литературы.
Возможности корректных расчетов в двухкомпонентных системах
не ограничиваются рассмотренными вариантами. Наряду с указанными
термодинамическими функциями в таких расчетах могут применяться и
многие другие функции, например энтальпии плавления промежуточных
фаз, химические потенциалы компонентов в гетерогенных смесях, скачки
парциальных свойств на фазовых границах и т.д. Целесообразность исполь-
зования того или иного свойства связана с возможностью его независимого
экспериментального измерения или наличием соответствующих данных в
справочной литературе. При любом наборе свойств задача будет поставлена
корректно в том случае, если этот набор позволит получить однозначное
решение уравнений фазовых равновесий.
15
Интересные возможности корректных расчетов в трехкомпонентных
системах связаны с интегрированием уравнений Гиббса—Дюгема по путям
моновариантных равновесий [12]. Так, если (см. рисунок) известны актив-
ность компонента С в области гетерогенных смесей двух растворов и
составы сосуществующих фаз, то можно вполне строго рассчитать термоди-
намические свойства этих растворов [13]. Особенно просто выполняется
такой расчет, когда раствор А—В имеет узкую область гомогенности, как
на рисунке. Растворы компонента С в А—В можно тогда считать предельно
разбавленными, и сведений о свойствах граничных двойных систем и ко-
ординатах области расслаивания бывает достаточно для полного расчета
термодинамических функций тройной системы. Подобные расчеты являют-
ся альтернативой часто применяющимся приближенным методам расчета
свойств трех систем по свойствам граничных двух.
Таким образом, изучение диаграмм состояний можно с полным осно-
ванием считать косвенным методом исследования термодинамических
свойств сплавов. В последнее время поэтому все чаще термодинамические
исследования сплавов включают и полный анализ фазовых равновесий.
Такие комплексные термодинамические исследования позволяют выбрать
оптимальные пути проведения эксперимента и не только сокращают время
работы, но и делают более надежным и внутренне согласованным ее резуль-
тат [10].
ЛИТЕРАТУРА
1. Воронин Г.Ф. Расчеты термодинамических свойств сплавов с использованием
диаграмм состояний. - В кн.: Термодинамические свойства интерметаллических
фаз. Киев: ИПМ АН УССР, 1982, с. 134-145. Ротапр.
2. Stals J.A., Peters C.J., Diepen G.A.M. Measurements and calculations of the three-phase
equilibrium (solid compound-Hiquid+gas) in the binary system (sulfur dioxide + p-tolui-
dine) where the compound in the liquid and gas is dissociated into its components. -
J. Chem. Thermodyn., 1979, vol. 11, N 11. p. 1107-1112.
3. Westra J.P., Peters C.J., Diepen G.A.M. Measurements and calculation of the three-
phase equilibrium (solid compound+liquid+gas) in a binary system where the compound
in the liquid and gas is dissodated into its components. - J. Chem. Thermodyn., 1978,
vol. 10, N 4, p. 343-349.
4. Ansara I., Barbier J.N., Mathien J.C., Schaub B. Calcul thermodynamique de 1’e'volution
de la composition de systemes temaires lots de la solidification. - J. Cryst. Growth,
1976, vol. 36, N 2, p. 323-334.
5. Hiskes R., Tiller W.A. Generation of chemical potentials by analysis of phase diagrams.
Pt 1-3. - Mater. Sd. Eng., 1968, vol. 2, N 6, p. 320-330; 1969, vol. 4, N 2/3, p. 163—
172, 173-184.
6. Кауфман Л., Бернстейн X. Расчет диаграмм состояния с помощью ЭВМ. М.: Мир,
1972. 328 с.
7. Термодинамические свойства соединений натрия с сурьмой, висмутом, теллуром
и калия с висмутом, рассчитанные по данным для жидких сплавов/Воронин Г.Ф.
М.: МГУ, 1971, 11 с. Рукопись деп. в ВИНИТИ 27.05.71, № 2963-71. Деп.
8. Морачевский А.Г, Майорова Е.А., Быкова М.А. Термодинамические свойства
интерметаллических соединений натрия. - В кн.: Физико-химические исследования
в технологических процессах. М.: ЛПИ, 1977, с. 39-46.
9. Воронин Г.Ф., Дегтярев С.А. Расчет термодинамических свойств жидких сплавов
галлия и ртути по калориметрическим данным. - ДАН СССР, 1980, т. 254,
№ 5, с. 1146-1149.
10. Воронин Г.Ф., Дегтярев &А.- Расчет термодинамических свойств сплавов по кало-
риметрическим данным и диаграммам фазовых состояний. 3. Сплавы сурьмы с
теллуром. - ЖФХ, 1981, т. 55, № 7, с. 1685-1691.
16
11. Pelton A.D. Calculation of a binary solidus from the liquidus and minimal additional
thermodynamic information. - Ber. Bunsenges. phys. Qiem., 1980, Bd. 84, N 3, S. 212-
218.
12. Gokcen N.A , Chang E.T. Integration of Gibbs-Duhem equation along phase boundaries
in multicomponent systems. - J. Electrochem. Soc., 1972, vol. 119, N 7, p. 876-878.
13. Шульц M.M., СторонкинА.В., Маркова Т.П. Исследование химических потенциалов
и коэффициентов активности компонентов бинарных твердых растворов методом
третьего компонента. - ЖФХ, 1958, т. 32, № 11, с. 2518-2524.
УДК 669.017.14
ЗАКОНОМЕРНОСТИ ПОЛИЭДРАЦИИ
ЧЕТВЕРНЫХ МЕТАЛЛИЧЕСКИХ СИСТЕМ
С ПРОМЕЖУТОЧНЫМИ ФАЗАМИ ПЕРЕМЕННОГО СОСТАВА
А.М. Захаров
В зависимости от характера плавления и протяженности областей го-
могенности промежуточных фаз на диаграмме состава целесообразно разли-
чать следующие виды полиэдрации четверных систем: сингулярную (по
Н.С. Курнакову [1]), неполную (или частично сингулярную), фазовую и
смешанную. Сингулярная полиэдрация (или тетраэдрация1) характерна
для систем с практически отсутствующей растворимостью компонентов
в твердом состоянии и конгруэнтно плавящимися промежуточными фазами
постоянного состава, т.е. определенными соединениями [1, 2], неполная —
для аналогичных систем с инконгруэнтно плавящимися соединениями,
фазовая — для систем с граничными растворами на основе компонентов и
промежуточными фазами переменного состава и, наконец, смешанная —
для так называемых комбинированных систем с различными (по характеру
плавления и составу) промежуточными фазами.
В реальных четверных металлических системах всегда образуются гра-
ничные растворы на основе компонентов и промежуточные фазы имеют
переменный состав, поэтому такие системы подвергают обычно фазовой
полиэдрации.
К промежуточным фазам переменного состава в четверных системах от-
носятся: а) непрерывные ряды твердых растворов между изоморфными
(изоструктурными) соединениями и б) граничные растворы на основе
соединений (или на основе метастабильных полиморфных модификаций
компонентов).
Ниже рассматриваются общие закономерности полиэдрации разных ви-
дов четверных металлических систем с граничными растворами на основе
компонентов и промежуточными фазами переменного состава.
Системы с непрерывными рядами твердых растворов между изоморф-
ными соединениями. Непрерывные ряды твердых растворов в четверных
металлических системах могут образовывать как одинаковые, так и разные
(по числу компонентов) изоморфные соединения. Обычно такие растворы
встречаются в'
си^ьр^.рэбл^а^ьн^^у^н^ш ремя (из четырех)
1 Если вторичны! otcrei
2. Зак. 244
лШ./Ь ШН
17
Числа изоморфных соединевдй, образующих непрерывные ряды
четверных твердых растворов
Соединение Коэффициен- ты в соотно- шениях (1) и (2) Четверные системы
разные ком- поненты два компо- ; нента-анало- га три компо- нента-аналога две пары компонен- тов-анало- гов
Двойные 2 2 3 4
Тройные "1 2 2 2 2
компонентами-аналогами по Периодической системе элементов Д.И. Менде-
леева или их двумя парами.
Анализ опубликованных диаграмм состояния реальных четверных си-
стем [3—6] показывает, что непрерывные ряды твердых растворов могут
образовывать два, три и даже четыре двойных и только два тройных изо-
морфных соединения. Если в таких системах существуют квази- и частично
квазитройные сечения, то их смешанная полиэдрация подчиняется комби-
нированным соотношениям:
Я=(А/КП +7Иинк-п)/л1 + 3 (5КП + 5ИНКП ) / п2
4 из из 7 ' 1 'из ИЗ 7 ' 2’
7’=1+(Мкп +4f"HK-n)/n1 +2(5КП +5инк'п)/и2,
'ИЗ ИЗ /'1 ' Из из //
(1)
(2)
где R — суммарное число квази- и частично квазитройных сечений, Т — сум-
марное число полностью и частично независимых вторичных систем (в виде
различных полиэдров), М**" и Л4ии"к,п, 5^’" и 5""экп - суммарные числа
двойных и тройных конгруэнтно и инконгруэнтно плавящихся изоморф-
ных соединений, nlt п2 — числа этих соединений, участвующих в образова-
нии непрерывных рядов твердых растворов.
В зависимости от числа компонентов-аналогов, образующих ту или иную
четверную систему, коэффициенты п\ и п2 принимают разные значения
(см. таблицу). Четверные соединения непрерывных рядов твердых раство-
ров в четверных системах не образуют.
Если в рассматриваемых системах образуются изоморфные соединения
с одинаковым характером плавления, то соотношения (1) и (2) упрощают-
ся и полиэдрация таких систем принимает сингулярный или частично сингу-
лярный характер.
Неполная (частично сингулярная) полиэдрация рассматриваемых систем
(как и вообще четверных систем с инконгруэнтно плавящимися промежу-
точными фазами1) возможна в ограниченном интервале температур, в
котором существуют названные фазы и твердые растворы между ними.
Из соотношений (1) и (2) следует, что с образованием каждого непре-
рывного ряда твердых растворов между двойными изоморфными соедине-
ниями (при «1=3 или «! = 4) в первичной системе появляется одно квази-
или частично квазитройное сечение и две вторичные системы, а между трой-
ными соединениям (п2 = 2) — соответственно три квази- или частично
квазитройных сечения, а также три вторичные системы.
1 А также фазами, образующимися в твердом состоянии.
18
Более редкими (по крайней мере в настоящее время) являются четвер-
ные металлические системы с непрерывными рядами твердых растворов
между разными (по числу компонентов) изоморфными соединениями.
Как показано в работах [7, 8], их полиэдрация имеет много общегос
тетраэдрацией четверных систем с промежуточными фазами постоянного
состава.
Системы с граничными растворами на основе соединений. Четверные
металлические системы с граничными растворами на основе соединений
(или просто промежуточными фазами переменного состава, если в их осно-
ве нельзя выделить какие-либо соединения) относятся к самым распростра-
ненным и могут быть образованы различными компонентами. В зависи-
мости от характера плавления и мерности областей гомогенности проме-
жуточных фаз на диаграмме состава полиэдрация таких систем носит раз-
ный характер.
Сингулярная тетраэдрация систем с конгруэнтно плавящимися проме-
жуточными фазами переменного состава, имеющими ’’объемные” области
гомогенности (см. рисунок), подчиняется соотношениям, которые легко
получить из общих соотношений между параметрами полиэдрации, предло-
женных в работах [9, 10] для многокомпонентных систем с аналогичными
промежуточными фазами постоянного состава:
R=M к п + 35 к п + 60кп, (3)
пер.с пер.с ' 7
7’=1+7Икп + 35к’п + ЗОКП, (4)
пер.с пер.с ’ v 7
где R — число квазитройных сечений, Т - число независимых вторичных
систем, М к п , S к п и Q к п — соответственно числа двойных, тройных
пер.с’ пер.с ‘‘"пер.с ’ г
и четверных соединений, лежащих в основе конгруэнтно плавящихся про-
межуточных фаз переменного состава.
Из этих соотношений следует, что с образованием каждого двойного,
тройного или четверного соединения число квазитройных сечений увеличи-
вается на одно, три или шесть, а число вторичных систем — соответствен-
но на одну, две или три. Аналогичные закономерности характерны для чет-
верных систем с инконгруэнтно плавящимися промежуточными фазами
переменного состава.
Если в рассматриваемых системах отсутствуют квазитройные (или час-
тично квазитройные) сечения, а именно такая ситуация наблюдается в боль-
шинстве реальных четверных металлических систем с граничными раствора-
ми на основе компонентов и соединений, то полиэдрация неизбежно приоб-
ретает фазовый характер. В таких системах она сводится к разбиению изо-
термических тетраэдров, построенных в твердом состоянии, на фазовые
объемы с различными числами твердых фаз (см. рисунок а). В соответ-
ствии с этим изменяется и трактовка параметров R и Т в соотношениях
(3)и(4).
Теперь эти параметры имеют смысл чисел трех- и четырехфазных объе-
мов в изотермических тетраэдрах. Нетрудно видеть (см. рисунок), что
соотношение (3) учитывает только те трехфазные объемы, которые распо-
лагаются ’’вдоль” возможных квази- и (или) частично квазитройных сече-
ний, и не учитывает трехфазных объемов, прилегающих к граням изотерми-
19
ческого тетраэдра. Кроме того, оба соотношения (3) и (4) не позволяют
судить о числах одно- или двухфазных объемов.
В работе [11] было показано, что числа различных фазовых объемов
в изотермических тетраэдрах четверных систем с граничными растворами
на основе компонентов и промежуточными фазами переменного состава
определяются соотношениями:
Ф1 ~ 4+Afnep.c + 5пер.с + Слер.с> (5)
~ 6 + ЗЛ/пер-с + 45пер с + 42пер.с, (6)
Фз _ 4 + ЗЛ/пер.с + 55пер#с + 62пер.с, (7)
Ф4 = 1+Л/Пвр.с + 2Snep.c + 32пер.с (8)
где Ф]-Ф4 - числа всех одно-, двух, трех- и четырехфазных объемов,
Д/пер с, “^пер.с и 2пер.с — соответственно числа промежуточных фаз пере-
менного состава, в основе которых лежат двойные, тройные и четверные
соединения. Свободный член в (5) представляет собой число граничных
растворов на основе компонентов, а в (6)—(8) - соответственно числа
двух-, трех- и четырехфазньц, объемов в изотермических тетраэдрах исход-
ной четверной системы (без каких-либо промежуточных фаз).
Аналогичным образом можно трактовать параметры R и Т в соотноше-
Изотермические тетраэдры четверных систем A-B-C-D с граничными растворами на
основе всех компонентов и двойного (а), тройного (б) и четверного (в) соединений
в
ниях (1) и (2) для четверных систем с непрерывными рядами твердых раст-
воров между изоморфными соединениями.
Важно подчеркнуть, что соотношения (5)—(8) между параметрами фазо-
вой полиэдрации определяют максимально возможные числа разных фазо-
вых объемов в изотермических тетраэдрах четверных систем с граничными
растворами на основе всех компонентов и промежуточными фазами пере-
менного состава, имеющими ’’объемные” области гомогенности. В изо-
термических тетраэдрах более простых систем, образованных двумя, тремя
(из четырех) или двумя парами компонентов-аналогов по Периодической
системе элементов Д.И. Менделеева, промежуточные фазы переменного
состава могут иметь ’’плоские” и ’’линейные” области гомогенности, поэто-
му числа разных фазовых объемов обычно меньше, а четырехфазные объе-
мы могут вообще отсутствовать из-за образования компонентами-аналога-
ми непрерывных рядов твердых растворов и изменения вариантности фа-
зовых равновесий между этими растворами и промежуточными фазами.
ЛИТЕРАТУРА
1. Курнаков Н.С. Топология равновесной химической диаграммы. - В кн.: Введе-
ние в физико-химический анализ. М.: АН СССР, 1940, с. 143-178.
2. Захаров А.М. Диаграммы состояний четверных систем. М.: Металлургия, 1964.
240 с.
3. Диаграммы состояния металлических систем, опубликованные в 1955-1981 гт.
М.: ВИНИТИ, 1955-1983. Вып. 1-27.
4. Диаграммы состояния систем на основе алюминия и магния: Справ./М.Е. Дриц,
Н.Р. Бочвар, Э.С. Каданер и др. М.: Наука, 1977. 227 с.
5. Твердые растворы в полупроводниковых системах: Справ. М.: Наука, 1978. 197 с.
6. Двойные и многокомпонентные системы на основе меди: Справ./М.Е. Дриц,
Н.Р. Бочвар, Л.С. Гузей и др. М.: Наука, 1979. 247 с.
7. Захаров А.М. Полиэдрация четверных металлических систем с непрерывными ря-
дами твердых растворов между разными (по числу компонентов) изоморфными
промежуточными фазами. - ЖФХ, 1981, т. 55, № 5, с. 1131-1135.
8. Захаров А.М. Полиэдрация четверных металлических систем с промежуточными
фазами. - В кн.: Металлургия и металловедение цветных сплавов. М.: Наука,
1982, с. 32-40.
9. Домбровская Н.С. Топологические свойства равновесной химической диаграм-
мы. - Изв. СФХА, 1949, т. 18, с. 17-32.
10. Домбровская Н.С. Топология многокомпонентных систем. - Изв. СФХА, 1949,
т. 19,с. 103-112.
11. Захаров А.М. О соотношениях между параметрами полиэдрации в четверных сис-
темах с промежуточными фазами переменного состава. - ЖФХ, 1984, т. 58, № 9,
с. 2148-2151.
22
УДК 530.17+536.763
ДИАГРАММЫ ФАЗОВЫХ РАВНОВЕСИЙ
С ТОЧКИ ЗРЕНИЯ ПРИНЦИПА СООТВЕТСТВЕННЫХ СОСТОЯНИЙ
Л.З. Певзнер
Сопоставление свойств различных термодинамических систем упрощает
их изучение и моделирование. Классический принцип соответственных
состояний предполагает, что термическое уравнение состояния одного ве-
щества переводится в термическое уравнение состояния другого вещества
элементарными преобразованиями подобия [ 1 ]
x'i = aixi> (1)
где Xj — некоторое свойство сопоставляемых систем, д, — множитель подо-
бия, штрихом обозначены свойства преобразованной системы.
Указанное предположение выполняется с удовлетворительной точностью
только для близких по свойствам веществ, требует дополнительных допу-
щений при сопоставлении двух и многокомпонентных систем [1-3].
В настоящей работе для сопоставления свойств различных систем вво-
дятся существенно более общие, чем (1), преобразования подобия, кото-
рые могут быть применены как к одно-, так и ко многокомпонентным
системам.
Пусть z =f(x, у) — фундаментальное уравнение состояния термодина-
мической системы [4], где х, у, z - удельные экстенсивные параметры,
например объем, энтропия, внутренняя энергия для одно компонентных
систем; концентрация, энтропия, разность химических потенциалов компо-
нентов для двухкомпонентных систем, рассматриваемых при постоянном
давлении.
Интенсивные параметры системы
р = dz/dx', q = Эг/Эу; w = z — рх — qy. (2)
Детерминант устойчивости [4]
D = ab - с2, где а = Э2z/Эх2; b = Э2 z/Эу2 ; с = Э2г/Эх Эу. (3)
В однофазной области D > 0, в двухфазной D = 0.
Рассмотрим сопоставление однофазных областей. С геометрической
точки зрения однофазная область в координатах х, у, z или р, q, w представ-
ляет собой часть эллиптической поверхности, ограниченной линиями равно-
весия фаз [4, 5]. Для точечного сопоставления эллиптических поверхностей
разработан математический аппарат квазиконформных отображений [6],
который и применяется в настоящей работе. Указанные преобразования
однозначно и непрерывно связывают любые участки эллиптических поверх-
ностей.
Преобразования х' = х' (х, у), у' = у' (х,у) описываются дифференциаль-
ными уравнениями [6]
Ь' ду' b дх' f с' с \ Эх’
-= — = — — - (— + — — , (4)
\JD Эу у/D Эх \ -\/D \/D' ду
23
b'
Vd7'
Эх
с \ дх' а Ьх’
----11 --- + ---- ---
у/Й / Эх--y/D by
где свойства сопоставляемых термодинамических систем определяются со-
гласно (3). Для нахождения преобразований z = z' (х, у, z) необходимо
ввести добавочное условие. Ввведем его в виде соотношения
bz’ [ bx’ by’ Эх' Эу'\
Vo— = yjlfl— —----------------— ), (5)
bz \ Эх by by Эх )
которое обеспечивает сопоставление не только однофазных, но и двухфаз-
ных областей.
Дифференциальные уравнения (4), (5) при задании фазовых границ
сопоставляемых систем и соответствии трех точек на границах полностью
определяют обобщенные преобразования подобия в отличие от преобразо-
ваний, рассмотренных в работе [3].
Рассмотрим свойства обобщенных преобразований подобия.
1. Преобразования обладают групповым свойством, а именно; если
заданы три термодинамические системы, причем свойства первой и второй,
второй и третьей систем связаны введенными преобразованиями, т.е. урав-
нениями (4) и (5), то свойства первой и третьей систем также связаны
уравнениями (4) и, (5).
2. Можно показать, что условия, определяющие критическую точку [4],
инвариантны относительно обобщенных преобразований подобия.
3. Используя обозначения (2) и (3) и термодинамические тождества,
уравнения (4) представим в следующем виде:
Эх
(6)
Из второго уравнения (6) следует, что при сопоставлении двухфазных
термодинамических систем преобразования подобия имеют вид q = q (я),
т.е. конода переходит в коноду.
4. Из теории квазиконформных отображений известно [6], что такие
отображения сохраняют угол в метрике, рассмотренной в работах [7, 8]:
dS2 = \(dx dp + dydq), (7)
где X — произвольная функция.
Угол в между двумя направлениями определяется следующим образом:
dxt dp2 +dyi dq2 zo.
COS0 = -----------------------------------------—. (8)
[(dxi dpi +dyi dq1')(dx2 dp2 +dy2 dq2)] /2
Любые термодинамические системы имеют следующие закономерности
в метрике (7) : линии постоянных значений х и я, а также у и р ортогональ-
ны, фазовые границы, ограничивающие двухфазную область, параллельны,
фазовые границы ортогональны продолжению конод на однофазную об-
ласть в координатах х, у [7]. Для бинарных диаграмм состояния в окрест-
ности чистого компонента фазовые границы, например линии солидуса и
ликвидуса, ортогональны линиям х = 0, х = 1 в метрике (7).
24
Рассмотрим применение введенных преобразований подобия для сопо-
ставления термодинамических систем.
А. Найдем наиболее общие преобразования, относительно которых ин-
вариантны условия равновесия фаз. Пусть дана произвольная гетерогенная
равновесная термодинамическая система. Требуется найти преобразования,
которым можно подвергнуть, систему, чтобы фазы, находящиеся в равно-
весии, перешли в фазы, также находящиеся в равновесии.
Проведенный анализ показывает, что если на любые точечные преобразо-
вания наложить ограничения в виде (4) и (5), то преобразования однознач-
но определяются в виде дробно-линейных функций
, + biy + CiZ + dj , а2х + b2y + c2z + d2
x = ------------------, у = -------------------,
mx+ny + kz+l mx+ny+kz+l
a3x + b3y + c3z + d3
z = ------------------. (9)
mx + ny + kz + I
Отсюда легко получить преобразования интенсивных параметров, кото-
рые также оказываются дробно-линейными функциями:
р' =- w' = р2 q -1 w ^2 Cj 6?2 аз b3 с3 d3 т п к 1 1 , Q = p q -1 w Д1 bi Ci di a3 b3 c3 d3 m n к I (10)
р q -1 w fli bi ci di Дз b2 с2 d2 т п к 1 р q w bi Ci di Дз b2 с2 d2 Дз b3 с3 d3 р q -1 w bi ci di c2 b2 c2 d2 m n к I p q -1 w at bi Ci di ai b2 c2 d2 m n к I
Преобразования (9) и (10) существенно обобщают как элементарнее
преобразования подобия (1), так и преобразования концентраций в двух- и
трехкомпонентных системах при переходе от молярных концентраций к
весовым, электронным или любым другим.
Б. Если известны свойства реальных систем, то согласно (8) можно рас-
считать углы в метрике (7) между определенными линиями, например
фазовыми границами.
На рисунке представлена диаграмма равновесия фаз однокомпонентной
системы [5]. Найдем угол между линиями кипения и сублимации А К и АЕ,
предполагая, что газовая фаза описывается уравнением состояния идеаль-
ного газа, и пренебрегая объемами конденсированных фаз. Согласно (8)
имеем
sin0
&ynjR(cvIR)*
(П)
где Дупл, ДУкип, ДуСубл _ молярные энтропии плавления, кипения и
сублимации.
Ниже представлены значения sin в для ряда веществ (таблица).
Результаты расчета показывают периодическую зависимость величины
в от номера элемента в таблице Менделеева аналогично другим свойствам
Диаграмма равновесия фаз для
однокомпонентной системы в
удельных экстенсивных пара-
метрах, например объем-эн-
тропия
К — критическая точка,
АВС - область равновесия
трех фаз, 1 - газ, 2 — жид-
кость, 3 — твердая фаза
в тройной точке [10], однако сопоставление значений 0 более обоснован-
но, чем сопоставление теплот плавления, кипения или сублимации, так как
значение 0 инвариантно относительно преобразований (9) и (10), в част-
ности, не меняет своего значения при представлении фазовых диаграмм
в координатах х-у, x—q, p—q. Близкие по свойствам вещества имеют близ-
кие 0, даже если тепловые эффекты в тройных точках существенно раз-
личны, например Ga и In.
В то же время значения 0 для различных веществ существенно отли-
чаются, следовательно, преобразования (4) и (5) имеют в тройной точке
особенность (первые производные преобразовашй обращаются в 0 или °°).
Так как дробно-линейные преобразования (9), (10), и в частности (1), не
имеют особенностей при конечных х, у, z, то они не могут связывать свой-
ства реальных веществ, совмещая линии кипения и сублимации.
26
Рассчитанные значения sine по справочным данным [9]
Вещест- во R дУкип R sin0-lO"’| Вещест- во д.упл R АУкип R sinO • IO”3
R
Li 1,5 0,80 41,5 0,585 Al 1,5 1,39 40,4 1,06
Na 1,5 0,85 33,8 0,931 Ga 1,5 2,22 106,1 0,241
К 1,5 0,83 31,2 1,08 In 1,5 0,91 65,5 0,264
Rb 1,5 0,84 30,2 1,17 Si 1,5 3,55 28,0 5,26
Cs 1,5 0,87 31,8 1,24 Ge 1,5 3,68 34,4 3,65
Hg 1,5 1,18 31,7 1,47 Fe 1,5 0,916 25,2 1,84
Zn 1,5 1,26 20,9 3,65 Ar 1,5 1,71 9,47 23,9
Cd 1,5 1,26 20,9 3,65 0, 2,5 0,98 17,0 5,64
Аналогично проведенному рассмотрению окрестности тройной точки
однокомпонентных систем можно рассмотреть окрестность тройной точки
двухкомпонентных систем, а именно рассчитать в метрике (7) угол меж-
ду линиями ликвидуса, сходящимися в эвтектической точке.
ЛИТЕРАТУРА
1 .Филиппов Л.П. Подобие свойств веществ. М.: Изд-во МГУ, 1978. 255 с.
2 . Leland T.W., Chappelear P.S. The corresponding states principle. - Industr. and Eng.
Chem., 1968, vol. 60, N 7, p. 15-43.
З .Перелъштейн Н.И., Парушин Е.Б. Совмещение термических поверхностей нормаль-
ных и слабо ассоциированных веществ по характерным физическим состояниям. -
В кн.: Термодинамические свойства важнейших рабочих веществ холодильных
машин. М.: ВНИИхолодпром, 1976, с. 27.
4 .Гиббс Д.В. Термодинамика. Статистическая физика. М.: Наука, 1982. 584 с.
5 .МлодзеевскийА.Б. Геометрическая термодинамика. М.: Изд-во МГУ, 1956. 90 с.
б.Волковыский Л.И. Квазиконформные отображения. Львов: Изд-во Львов, ун-та
1954. 155 с.
7 .Филиппов В.К. Метрика потенциала Гиббса и теория моновариантных равнове-
сий. - В кн.: Вопросы термодинамики гетерогенных систем и теории поверхност-
ных явлений. М., 1973, вып. 2, с. 20-35.
8 .Salamon Р. The significance of Weinholds length. - J. Chem. Phys., 1980, vol. 73, N 2,
p. 1001-1002.
9 . Термодинамические константы веществ. M.: ВИНИТИ, 1965, вып. 1. 145 с.; 1968,
вып. 3, 221 с.; 1970, вып. 4. 509 с.; 1971. вып. 5. 530 с.; 1972, вып. 6. 369 с.;
1981. вып. 10. 441 с.
Глазов В.М., Жаров В.В. Общие принципы обоснования достоверных уравнений
испарения и сублимации простых тел в широком диапазоне температур. - ЖФХ,
1983, т. 57, № 3, с. 568-572.
27
УДК 541.123
ВНУТРЕННИЕ ПАРАМЕТРЫ В ТЕОРИИ ФАЗОВЫХ РАВНОВЕСИЙ
И.Л. Аптекарь
При расчете диаграмм состояния (ДС) систем, в которых происходят
фазовые превращения типа плавления и полиморфизма, для каждой фазы
используют свою аналитическую зависимость термодинамического потенциа-
ла G от температуры (Г), давления (Р), концентрации (С) и других пара-
метров. Однако в ряде случаев две или несколько фаз можно описать с
помощью одного единого выражения для G. Это, в первую очередь, жид-
кая и газообразная фазы, неупорядоченная и упорядоченная фазы, а также
фазы, образующиеся при расслоении жидких и твердых растворов, при
изоструктурных фазовых переходах в Се и SmS при структурных перехо-
дах типа куб—тетрагон.
При отсутствии внешних полей (электрического, магнитного, поля на-
пряжений и др.) потенциал G есть функция Т, Р, С, V/ (такой потенциал
называют неравновесным), где переменные, являющиеся внутренними
параметрами (ВП), не могут быть заданы произвольно в отличие от Т, Р,
и С, а их равновесные значения должны быть определены из условия мини-
мума G по этим переменным. К таким ВП относятся: объем, компоненты
тензора деформации, намагниченность, поляризация, степень порядка,
концентрация продуктов реакции, концентрации сосуществующих в ге-
терогенном веществе фаз и т.п.
Равновесию системы, у которой мольный объем ‘V является единствен-
ным ВП, соответствует условие
/ Э<? \
\ дУ/т'Р’С = °
(1)
при Э’С/дР2 >0.
Уравнение Ван-дер-Ваальса
а
— +
V2
RT
---- = о,
V-ь
(2)
Р
описывающее равновесие жидкости с паром, представляет собой уравнение
типа (1). Потенциал G в этом случае имеет вид
/ a RT\ а
G = fl— + Р - — \dV= --+PV - RT\n(V - b) + <р(Т). (3)
Равновесию системы, в которой происходит процесс упорядочения,
соответствует условие
где Л - параметр дальнего порядка. Поскольку согласно всем известным
28
теориям упорядочения уравнение (4) всегда имеет корень X = О, его можно
записать в виде
(5)
ТГ трс = Х**Г-Р'С’Х) = О-
\ЭХ
Уравнение (5) разбивается на два: X = 0 и (Т, Р, С, X 0, Первое ха-
рактеризует неупорядоченную фазу, второе — фазу, второе — фазу с даль-
ним порядком.
В системах In-Me (Me-Sn, Pb, Bi, Cd, Hg, Tl) образуются четыре фазы
(ГЦК, ГЦТ1, ГЦТ2 и ОЦК), отличающиеся друг от друга значением па-
раметра с/а. Если за исходную принять элементарную ячейку ГЦК фазы,
то для нее с/а = 1, а ГЦТ1, ГЦТ2 и ОЦК фазы характеризуются значениями
с/а > 1, 1 >с/а > 2^/2 и с/а = 2Уг/2 соответственно. За ВП такой системы
примем т? = 1 - {с/а). Тогда состояние ГЦК и ОЦК фаз описываются соот-
ношениями п = 0и (т? - а) = 0 (а = 1 - (2Уг/2) = 0,294), а состояние тетраго-
нальных фаз — уравнением ф(Т, Р, С, 7?) = 0. По аналогии с (5) уравнение
состояния системы можно записать в виде
( Эб\
— = 7?(т? — а)ф ( Т,-Р, С, т?) = 0. (6)
\ от? /Т,Р,С
Все рассмотренные фазы можно разделить на два класса. К одному из
них относятся фазы со строго фиксированными значениями ВП. Малейшее
отклонение ВП от постоянного значения, соответствующего такой фазе,
приводит к фазовому переходу. Фазами такого типа являются неупорядо-
ченная фаза (X = 0) и кубические фазы (т? = 0 и т? = а). Фазы этого класса
назовем фазами без свободных ВП, или ’’жесткими” фазами (Бокий [1]
назвал их "фазами без параметров").
Фазам другого класса присуще уже не одно определенное значение ВП,
а их интервал. Изменение ВП в этом интервале не приводит к фазовому
переходу. К таким фазам относятся упорядоченные (0< Х<1) и тетра-
гональные фазы. Фазы этого класса назовем фазами со свободными ВП,
или "нежесткими” фазами (по терминологии Бокия — ’’фазы с парамет-
рами”) .
Уравнения состояния типа (5) и (6) подразумевают справедливость
следующего постулата. Фазам, состояние которых описывается постоян-
ными (не зависящими от внешних условий) значениями ВП (по нашей
терминологии, "жестким” фазам), всегда соответствуют экстремумы по
этим ВП. При наличии в системе нескольких таких фаз уравнение состоя-
ния можно записать в виде
—! =(’?-«1) (т?-а2)- • .(т?-а„У0?) = О. (7)
\ °7? 'т,р,с
Соответствующее выражение для G находится путем интегрирования
соотношения (7). Полученная функция G(T, Р, С, т?) вместе с (7) дает
возможность описать фазовую диаграмму данной системы.
Проиллюстрируем такой подход на примере систем In-Pb и In—Т1,
для которых уравнение состояния имеет вид (6). Представим ф(Т, Р, С, т?)
29
в виде полинома
ф( Т, Р, С, 7?) = А ! +А2Т] + Л3т?2 + А47]3 + А5Т}4 +А6Т]5,
где Aj =Ai(T, Р, С). Тогда
G(v) = fr}(n -a)^(7})d7] = Ао
6
+ S
(8)
(9)
— ’ ★
^i+la |+2 , Лб 8
--------- П i + 77° .
i + 2----8
Коэффициенты А, могут быть определены из экспериментальных данных
о зависимости с/а от температуры, давления и концентрации, а также из ДС.
На рис. 1 приведен схематический'вид кривых G(r?) для чистого In и спла-
вов тех концентраций (с,), которым при комнатной температуре соответст-
вует равновесие изоконцентрационных фаз (за с,- приняты концентрации
середины двухфазных областей). В области стабильности ГЦК фазы
(0,132 < сРЬ < 1 и 0,225 < ст1 < 0,75) .наинизший минимум лежит при
с/а = 1 (т? = 0). ГЦТ! фаза (0<сРЬ < 0,132; 0 < сп < 0,225) имеет самый
глубокий минимум при с/а<\ (т? > 0), а ОЦК фаза - при с/а = 2^/2
(т? = а). Отметим, что переход ГЦТ1-ГЦТ2 имеет место в системах In-Pb,
Sn, Bi, т.е. в тех системах, в которых второй компонент имеет валентность
большую, чем у In. Переход где ГЦТ2 ->ГЦК характерен для сплавов In с
Cd, Hg, Mg, Т1, т.е. с элементами, имеющими меньшую или ту же валент-
ность, чем у In. Есть основание предположить, что форма кривых G(t?)
во многом определяется электронной концентрацией сплава.
Специфическую форму кривой G(t?) (два минимума, разделенных мак-
симумом, типа кривой 5), ответственную за фазовый переход, имеют
кривые G(u) в области переходов жидкость—пар, а также кривые G(c)
при расслоении жидких и твердых растворов и изоструктурном фазовом
переходе в так называемых псевдобинарных растворах (например, смеси
ионов разной валентности в Се [2] или смеси мономеров и димеров в
антрацене, находящемся под воздействием УФ света [3]).
Таким образом, G(t?) имеет одинаковую форму при переходах двух
типов: 1) между жесткой и нежесткой (или двумя жесткими) фазами
(переходы типа порядок-беспорядок, ГЦК—ГЦТ, ГЦК—ОЦК) и 2) при пе-
реходах, как бы происходящих ’’внутри” нежесткой фазы (изострук-
турные фазовые превращения в церии, превращения жидкость—пар
и т.п.).
Различие между указанными двумя типами переходов при феномено-
логическом рассмотрении (т.е. при использовании соотношения G(rj) раз-
ного вида) сводится к тому, что у первого типа один или оба минимума
всегда соответствуют постоянным значениям параметра т?, а у второго типа
такой "фиксации” (закрепления) минимума нет и 7?minC непрерывно из-
меняется при изменении Т, Р, и С. Для переходов второго типа различие
между фазами существует только ниже критической точки, когда G(t?)
имеет указанный специфический вид., В эакритической области все три
экстремума сливаются в один минимум. Параметр 17, характеризующий
этот минимум (так же как соответствующие ц обеих фаз), ниже крити-
ческой точки изменяется при изменении внешних условий, т.е. все три фазы
30
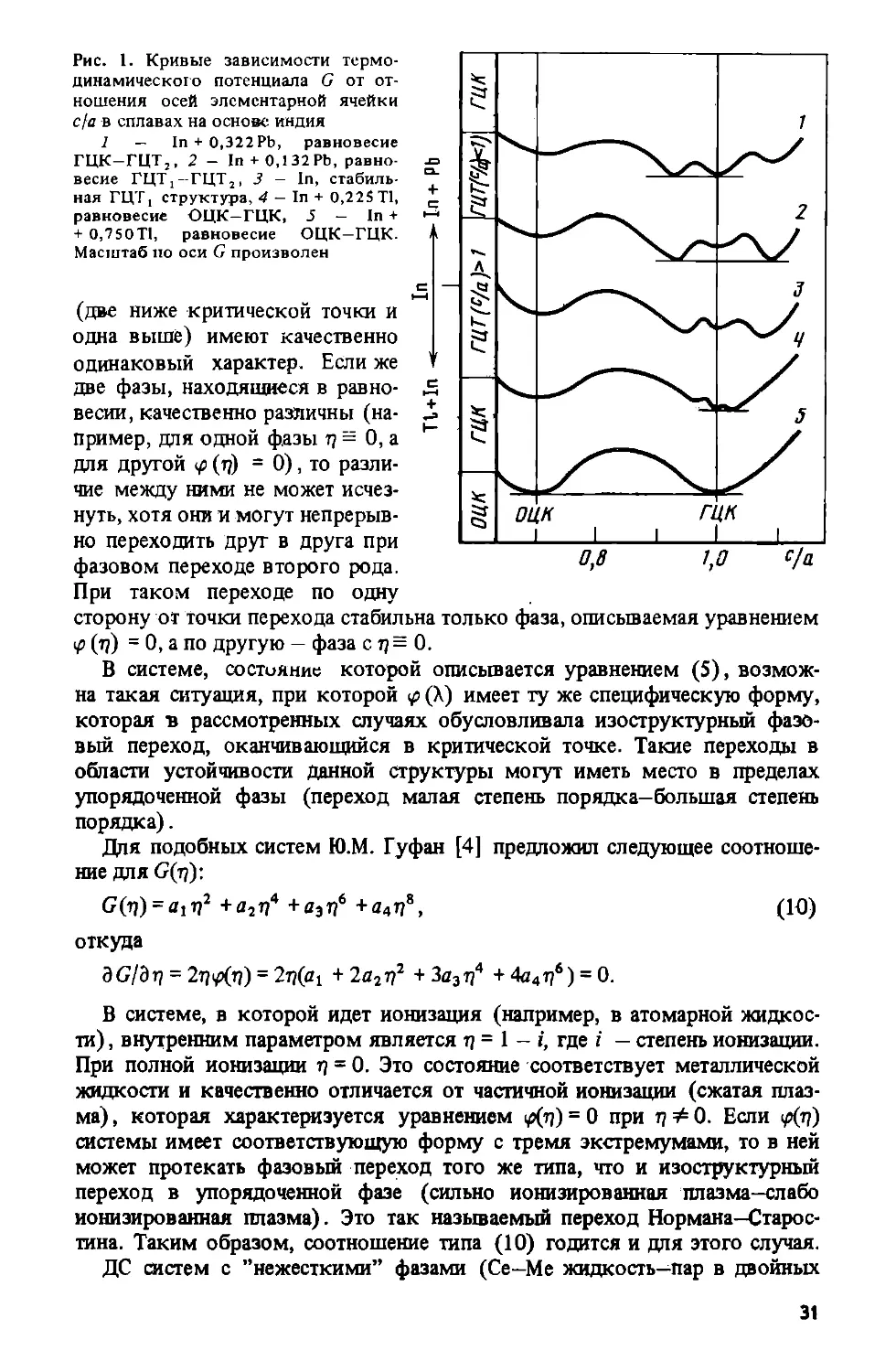
Рис. 1. Кривые зависимости термо-
динамического потенциала G от от-
ношения осей элементарной ячейки
с/а в сплавах на основе индия
1 — In + 0,322Pb, равновесие
ГЦК-ГЦТ,, 2 - In + 0,132 РЬ, равно-
весие ГЦТ;-ГЦТ2, 3 - In, стабиль-
ная ГЦТ, структура, 4 - In + 0,22S Т1,
равновесие ОЦК—ГЦК, 5 — In +
+ О,75ОТ1, равновесие ОЦК—ГЦК.
Масштаб но оси G произволен
(две ниже критической точки и
одна выше) имеют качественно
одинаковый характер. Если же
две фазы, находящиеся в равно-
весии, качественно различны (на-
пример, для одной фазы т? = 0, а
для другой <р (rj) = 0), то разли-
чие между ними не может исчез-
нуть, хотя они и могут непрерыв-
но переходить друг в друга при
фазовом переходе второго рода.
При таком переходе по одну
сторону от точки перехода стабильна только фаза, описываемая уравнением
<р (т?) = 0, а по другую — фаза с т) = 0.
В системе, состояние которой описывается уравнением (5), возмож-
на такая ситуация, при которой (X) имеет ту же специфическую форму,
которая в рассмотренных случаях обусловливала изоструктурный фазо-
вый переход, оканчивающийся в критической точке. Такие переходы в
области устойчивости данной структуры могут иметь место в пределах
упорядоченной фазы (переход малая степень порядка—большая степень
порядка).
Для подобных систем Ю.М. Гуфан [4] предложил следующее соотноше-
ние для G(tj):
G(?j) = aiT?2+а2т?4+дэт?6+а4т?8, (10)
откуда
dG/drj = 2т?<Хт?)= 2т?(Д1 + 2д2т?2 + Зд3 tj4 + 4а4т?6) = 0.
В системе, в которой идет ионизация (например, в атомарной жидкос-
ти) , внутренним параметром является т] = 1 - i, где i — степень ионизации.
При полной ионизации т} = 0. Это состояние соответствует металлической
жидкости и качественно отличается от частичной ионизации (сжатая плаз-
ма) , которая характеризуется уравнением = 0 ПРИ П 0. Если у?(т/)
системы имеет соответствующую форму с тремя экстремумами, то в ней
может протекать фазовый переход того же типа, что и изоструктурный
переход в упорядоченной фазе (сильно ионизированная плазма-слабо
ионизированная плазма). Это так называемый переход Нормана—Старос-
тина. Таким образом, соотношение типа (10) годится и для этого случая.
ДС систем с ’’нежесткими” фазами (Се—Me жидкость—пар в двойных
31
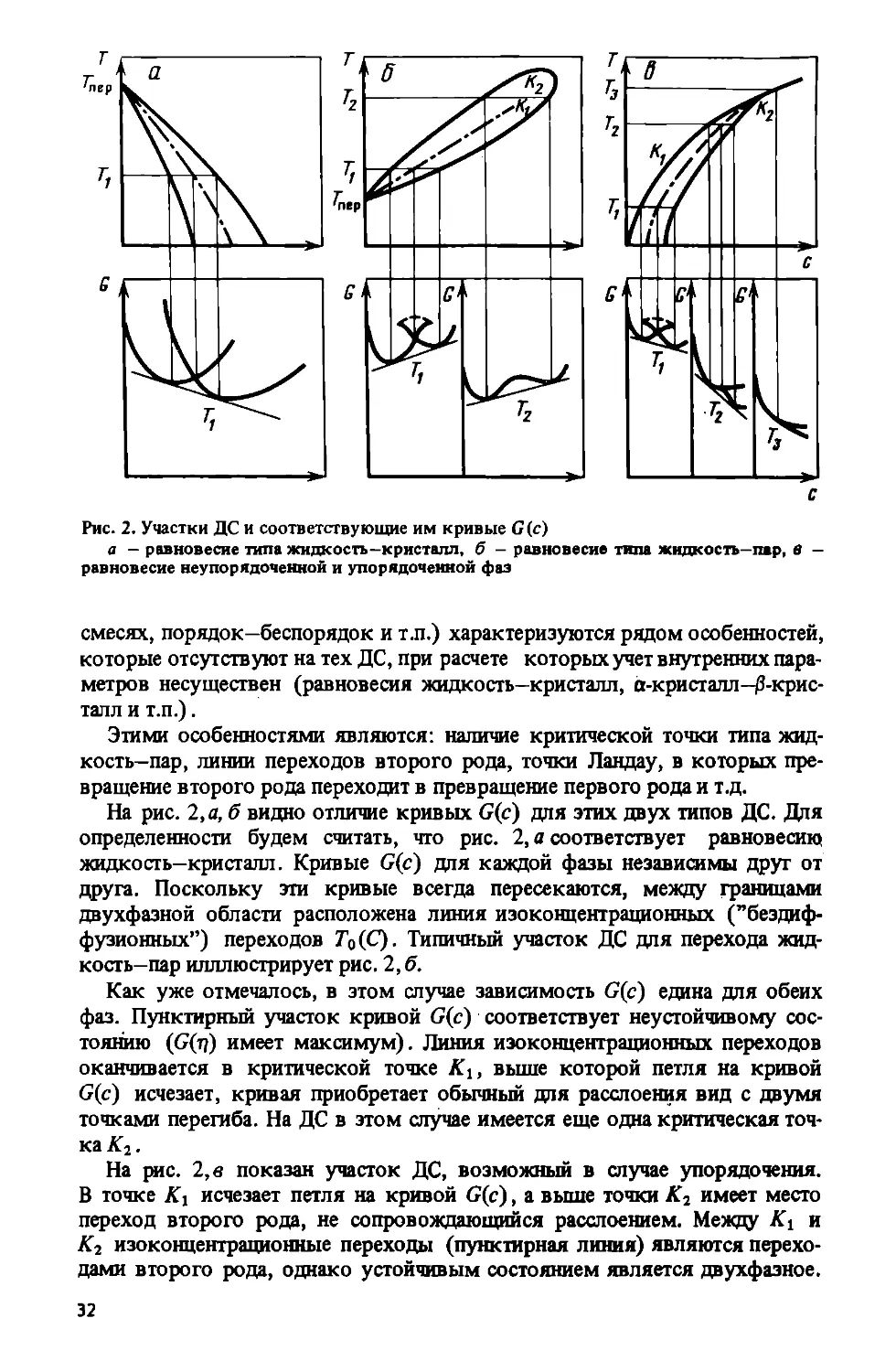
Рис. 2. Участки ДС и соответствующие им кривые G(c)
а — равновесие типа жидкость-кристалл, б - равновесие типа жидкость—пар, в -
равновесие неупорядоченной и упорядоченной фаз
смесях, порядок—беспорядок и т.п.) характеризуются рядом особенностей,
которые отсутствуют на тех ДС, при расчете которых учет внутренних пара-
метров несуществен (равновесия жидкость—кристалл, a-кристалл—Д-крис-
талл и т.п.).
Этими особенностями являются: наличие критической точки типа жид-
кость-пар, линии переходов второго рода, точки Ландау, в которых пре-
вращение второго рода переходит в превращение первого рода и т.д.
На рис. 2, а, б видно отличие кривых G(c) для этих двух типов ДС. Для
определенности будем считать, что рис. 2, а соответствует равновесию
жидкость—кристалл. Кривые G(c) для каждой фазы независимы друг от
друга. Поскольку эти кривые всегда пересекаются, между границами
двухфазной области расположена линия иэоконцентрационных ("бездиф-
фузионных”) переходов То (С). Типичный участок ДС для перехода жид-
кость-пар илллюстрирует рис. 2, б.
Как уже отмечалось, в этом случае зависимость G(c) едина для обеих
фаз. Пунктирный участок кривой G(c) соответствует неустойчивому сос-
тоянию (<7(д) имеет максимум). Линия иэоконцентрационных переходов
оканчивается в критической точке К2, выше которой петля на кривой
G(c) исчезает, кривая приобретает обычный для расслоения вид с двумя
точками перегиба. На ДС в этом случае имеется еще одна критическая точ-
ка^.
На рис. 2, в показан участок ДС, возможный в случае упорядочения.
В точке Ki исчезает петля на кривой G(c), а выше точки А?2 имеет место
переход второго рода, не сопровождающийся расслоением. Между и
К2 изоконцентрационные переходы (пунктирная линия) являются перехо-
дами второго рода, однако устойчивым состоянием является двухфазное.
32
В точке К2 изоконцентрационное превращение из второго рода при пониже-
нии температуры переходит в превращение первого рода и кривые G(c)
приобретают такой же вид, как для переходов жидкость-пар.
Анализ ДС систем, термодинамические свойства которых могут быть
описаны с помощью внутренних параметров ij,, сводится к исследованию
поверхности потенциала G в пространстве Г, Р, С, т?,-, т.е. к той процедуре,
которую в свою время проделал Ван-дер-Ваальс для переходов жидкость-
пар [5].
ЛИТЕРАТУРА
1. Бокий Г.Б. Введение в кристаллохимию. М.: Изд-во МГУ, 1954. 490 с.
2. Аптекарь И.Л., Понятовский Е.Г. К теории изоморфного фазового превращения
и критического перехода церия. - ДАН СССР, 1967, т. 173, № 4, с. 851-854.
3. Аптекарь И.Л., Галашин А.Е. Критическая точка изоструктурного фазового превра-
щения фото модификации антрацена. - Письма в ЖЭТФ 1982, т. 36, № 7, с. 256-259.
4. Гуфан Ю.М. Структурные фазовые переходы. М.: Наука, 1982. 304 с.
5. Ван-дер-Ваальс И.Д., Констамм Ф. Курс термостатики. М.: ОНТИ, 1936. Ч. 2. 439 с.
УДК 669.017.3 :548.4
О ДИАГРАММЕ СОСТОЯНИЯ МЕТАЛЛ - ВАКАНСИЯ
Р.М. Габидуллин, Г.В. Иванищев
В работах Я.И. Френкеля, Б.Я. Пинеса, Я.Е. Гегузина и их школ [1]
показано, что вакансии в металле можно рассматривать как компонент,
имеющий объем, но с нулевой массой. С этой точки зрения введено поня-
тие о концентрации вакансий при данной температуре. Показано, что при
выделении вакансий из пересыщенного раствора должны образоваться
поры. При этом в полном соответствии с теорией фазовых превращений
можно говорить о критическом радиусе поры rk. Если при заданном
пересыщении раствора вакансиями размер пор меньше г к, то она должна
растворяться; при размере, большем гк, пора способна к росту. Рост пор
в этих условиях рассматривается как рост ’’отрицательного” кристалла.
При этом для описания роста поры могут быть использованы обычные
представления теории кинетики фазовых превращений.
Естественным развитием этих идей является представление о диаграм-
ме состояния металл-вакансии [2]. Действительно, образование вакан-
сий по механизму Шоттки можно трактовать как растворение в металле
пустоты. В схеме Шоттки вакансии выступают как элементарные носи-
тели пустоты — ’’атомы” пустоты, замещающие атомы основного
металла в узлах решетки.
На рис. 1, а приведена часть диаграммы металл-вакансии. В области
левее линии предельной концентрации вакансий при постоянном давлении
Р вариантность Ь в соответствии с правилом фаз равна b = к - ф + 1 =
= 2 — 1 + 1=2, где к — количество компонентов (металл и вакансии),
ф - количество фаз (твердый раствор).
Таким образом, ненасыщенные растворы вакансий могут при заданной
3. Зак. 244 33
Рис. 1. Типы диаграмм состояния металл-вакансия
концентрации существовать в интервале температур или при заданной
температуре иметь различные концентрации. В области правее линии
равновесных концентраций b = к — ф + 1 = 2 — 2 + 1 =1.
В этой области при заданном значении температуры сосуществуют твер-
дые растворы с концентрацией, соответствующей предельной концентра-
ции, и вторая фаза. Второй фазой в данной системе следует считать любого
рода несплошности, поры. Если рассматриваемый раствор имеет концентра-
цию вакансий, превышающую предельную при заданной температуре и
давлении, то в соответствии с предельной диаграммой состояния вакансии
будут стремиться к выделению из твердого раствора и дефекты структуры
будут служить стоками для вакансий. Если рассматриваемый раствор
вакансий в металле ненасыщен, то дефекты будут выполнять роль источ-
ников вакансий.
Рассмотрим характер изменения расположения фазовых областей си-
стемы металл-вакансия при изменении температуры и давления.
Из термодинамического анализа следует, что вакансии в металле явля-
ются устойчивыми дефектами кристаллической структуры и температур-
ная зависимость равновесной концентрации их в металле описывается
уравнением [3]
/Д$А (
Nv = exp ----- exp I-------
\ R J \ RT 1
(1)
где Д Sv, ДНи — мольные колебательная энтропия и теплота образования
раствора вакансии, R - универсальная газовая постоянная, Т — абсолют-
ная температура. Величина Д Hv > 0, и растворимость вакансий с возраста-
нием температуры увеличивается. Если металл в рассматриваемом темпе-
ратурном интервале претерпевает полиморфное превращение а # 0, то рав-
новесные концентрации вакансий в а- и 0-растворах могут быть описаны
уравнениями:
IД5а\ ( ДЯа\
= ехр hr ехр (2)
\ IX ] \ 1X1 /
а f дяр
№ = ехр ---— ехр-------—
и I R ’ \ RT
(3)
При равновесии растворов вакансий в а- и 0-фазах вариантность й =
= к- ф + 1= 2- 2 + 1=1и равновесие должно наблюдаться в интервале
34
температур. Следовательно, наличие вакансий в кристаллической структуре
приводит либо к понижению, либо к повышению температуры
полиморфного превращения, а само превращение протекает в интервале
температур. Если > N^, то диаграмма состояния металл—вакансии может
быть представлена рис. 1,6. При N^>N^ соответствующая диаграмма
состояния показана на рис. 1,в. При температуре трехфазного равновесия
будут происходить реакции /3 £ а + поры; 0 + поры а.
Эти реакции в работе [2] названы вакоэвтектоидной и вакоперитектоид-
ной реакциями, а соответствующие диаграммы состояния — вакоэвтектоид-
ной и вакоперитектоидной системами.
При термодинамическом равновесии химические потенциалы вакансий
и металла Дме в а~ и (3-фазах должны быть равны. При этом
= (да)° + ЯТ1паа; д* = (д'5)0 + RT\nap, (4)
y V7 и *v и' v /
Мм =(Мм )° + ЛТ1пв“ , д£, = (д£, )° + RTlnaV , (5)
*^Ме - Me' Me ^Ме v^Me7 Me v ’
где av< aMe - активности вакансий и металла в соответствующих фазах,
д° , д^е - стандартные химические потенциалы вакансий и металла. Если
вакансии в а- и (3-фазах рассматривать как разбавленные растворы и счи-
тать Д Н» и ДЯу независимыми от концентрации и температуры, то из
уравнения (4) получим
„ (bSV-bsA ( Ь.Н&-Ь.На
N^Na = exp-----У----S’ exp-----У----v-
v v V R ' \ RT
(6)
где 7V“ A^- концентрации вакансий в а- и /3-фазах, находящихся в равно-
весии, выраженные в мольных долях. Из уравнения (5) после некоторых
преобразований в предположении о разбавленных растворах получим
[4]
1 -N0 ^На~е ( 1 1 \
In -----= -------------------, (7)
R \Т Tj
где ДЯа-(3, Тп - изменение энтальпии и температура полиморфного
превращения при а-/3-переходе для чистого металла. Система уравнений
(6) и (7) описывает границы области двухфазного равновесия в системе
металл-вакансия.
В ряде работ, например [5], рассматривается зависимость равновесной
концентрации вакансий от величины внешнего давления. Показано, что
если в кристалле имеются напряжения с составляющей всестороннего
сжатия Р от действия внешних сил, то концентрация равновесных вакансий
NU(P) может быть определена по формуле
NV(P) = Л\,(0)ехр , (8)
у кТ у
где Nv (0) — равновесная концентрация вакансий при Р = 0, Я — атомный
объем, к — постоянная Больцмана. Знак минус перед Р означает, что рас-
сматривается сжатие. Формула (8) описывает равновесную концентрацию
35
Рис. 2. Зависимость равновесной (сплошная линия) и предельной (пунктир) кон-
центраций вакансий в алюминии от внешнего давления при температурах 700 (7),
800 (2) и 900 К (5)
Рис. 3. Зависимость равновесной (сплошная линия) и предельной (пунктир) кон-
центраций вакансий в золоте от внешнего давления при температурах 1000 (7),
1100 (2), 1200 (2) и 1300 К (4)
вакансий, находящихся в равновесии с плоской поверхностью под давле-
нием Р. При этом каждому значению давления соответствует свое значение
химического потенциала. Поэтому эта формула не может быть использова-
на для описания равновесия раствора вакансий с внутренними порами.
На поверхности внутренних пор напряжения отсутствуют и в том случае,
когда внешняя поверхность образца сжата. Поэтому внутри металла при
движении от поверхности поры напряжения изменяются и в самом объеме
внутреннее давление переменно. Если наряду с действием внешних напря-
жений с составляющей всестороннего сжатия Р имеются и внутренние
напряжения с составляющей всестороннего сжатия р, то концентрация
вакансий, находящихся в равновесии с внутренними порами, определится
уравнением [6]
Си-(Р + р)Д И
(9)
где nv - концентрация возможных вакантных узлов, G — термодинамичес-
кий потенциал образования вакансий при напряжениях, равных нулю,
Д V - активационный объем, равный объему релаксации при образовании
вакансий.
Определяемые уравнением (9) концентрации вакансий следует назвать
предельными ДП,ред для системы металл—вакансия. Они соответствуют
одинаковым значениям химического потенциала вакансий при переменных
внутренних напряжениях. Как видно из уравнения (9), предельные кон-
центрации возрастают с увеличением давления сжатия и уменьшаются при
наложении на образец растягивающих напряжений. Таким образом, линия
предельной концентрации на рис. 1 ,а сдвигается вправо при сжатии и влево
при растяжении образца.
36
Уравнение (8) определяет концентрацию вакансий, находящуюся в
равновесии со сжатой поверхностью. Ее можно назвать равновесной
дгрвви ЦрИ сжатии Д^Равн уменьшается, а при растяжении возрастает;
д/Равн- и Д^"Ред равны только при отсутствии напряжений в объеме
образца.
Полученные результаты можно резюмировать следующим образом.
При отсутствии напряжений в кристалле вакансии находятся в равновесии
с внутренними порами. При сжатии кристалла в области, прилегающей
К поре, создается неравномерное поле напряжений. Химический потенциал
вакансий в сжатых областях уменьшается и протекает процесс переме-
щения вакансий в направлении повышения сжимающих напряжений. Поры
в этой ситуации являются источниками вакансий и их размер уменьшается.
При растяжении кристалла химический потенциал вакансий возрастает и
они перемещаются из растянутых зон к поверхности пор. Последние в этом
случае служат стоками для вакансий.
На рис. 2 и 3 приведены для примера рассчитанные по уравнениям
(8) и (9) зависимости равновесной и предельной концентраций вакансий
в алюминии и золоте при разных давлениях и температурах. Необходимые
для расчетов термодинамические величины были взяты из работ [6, 7].
Видно, что при достаточно больших давлениях сдвиг линии предельных
концентраций на диаграмме состояния металл—вакансии может быть весь-
ма существенным. Это связано с тем, что одна из сосуществующих фаз
(поры) является неконденсированной.
Развитые представления о диаграмме состояния металл—вакансии могут
быть успешно использованы для анализа всех процессов, развитие кото-
рых определяется концентрацией и перераспределением вакансий (рост
и растворение пор, ползучесть, особенно диффузионная, усталостное
разрушение и т.п.).
ЛИТЕРАТУРА
1. Гегузин Я.Е. Макроскопические дефекты в металлах. М.: Металлургиздат, 1962.
252 с.
2. Гибадуллин Р.М., Колачев Б.А. Диаграмма состояния металл-вакансии. - Изв.
вузов. Цв. металлургия, 1976, № 4, с. 87-91.
3. Физическое металловедение/ Пер. с англ, под ред. Р. Кана. М.: Мир, 1968, вып. 2.
490 с.
4. Могутное Б.М., Томилин И.А., Шварцман Л.А. Термодинамика железоуглеродис-
тых сплавов. М.: Металлургия, 1972. 328 с.
5. Бакштейн Б.С., Бокштейн С.З., Жуховицкий А.А. Термодинамика и кинетика
диффузии в твердых телах. М.: Металлургия, 1974. 276 с.
6. Хирт Дж., Лоте И. Теория дислокаций. М.: Атомиздат, 1972. 600 с.
7. Бокштейн С.З. Строение и свойства металлических сплавов. М.: Металлургия,
1971.496 с.
37
УДК 541.165
РАСЧЕТ ДИАГРАММ СОСТОЯНИЯ
В МЕТОДЕ КЛАСТЕРНЫХ КОМПОНЕНТОВ
Е.Г. Вискова, Н.С. Давыдова, В.М. Камышов,
А.Н. Мень, И.А. Синицкий
В последние годы уделяется большое внимание построению диаграмм
состояния, причем для этих целей используют как экспериментальные,
так и теоретические методы. Настоящая работа посвящена теоретическому
расчету фазовых равновесий в системах переходные металлы IV, V групп—
углерод и построению соответствующих диаграмм состояния.
Теоретический расчет диаграмм состояния проведен с помощью метода
кластерных компонентов (МКК), который в ряде работ применялся для
описания физико-химических свойств различных дефектных фаз [1].
Для расчета фазовых равновесий дефектных соединений в работе пред-
лагаются два подхода. В первом из них был найден способ представления
соединений переменного состава в виде набора кластерных компонентов
(КК) постоянного состава, что позволило применить к ним известные тер-
модинамические соотношения и разработать схему расчета диаграмм со-
стояния многофазных многокомпонентных систем.
Если система состоит из т сортов атомов типа А (i = 1, 2, ..., /, ..., т),
массовое количество которых составляет ряд bt, b2, Ь/, ..., йот,топри
данных температуре и давлении многофазные системы, состоящие из
Лфаз, описываются матрицей вида
д^д*2) ...дО) ...Л(т)
м=( V11 "Vi>" 'Vim) Л1 A (i)
' Vi2 ... Vij... Vim nt Г
у Ин Vt2 ... Vtj... Vtm nt J
где строка матрицы определяет состав i-фазы с мольной долей и,-:
S и,- Vij = bj(i= 1, (2)
i=i
Согласно МКК каждое соединение {Я,-} можно представить в виде набо-
ра КК с соответствующей концентрацией а^. Если число КК равно W(t то
»,Л^> =»,” • (3)
yii vi] 5=1 ' V
Wi Wi «7/ П Л
s aiS = l, = Ъ n,ai5 •.,"*)
S=1 5=1
Обозначив
nts = чане,
(4)
38
можно записать уравнение массового баланса (3) для j А,-|
W'i
П1$Уц(/=1,...,т). (5)
Теперь выражение (1) с учетом (2) —(4) примет вид
(v\x •• / • Л(т)
V^... kUA vim I 1 «1 w,l
Mw= I' П v' r im nh 1 i (6)
yw‘... yWt ywi im niWi J
i п - У1.... t} V* tm
у wt tj •" vwtl tm] ntwt
Матрица Mw представляет собой многофазную многокомпонентную
систему Mt, выраженную в виде набора соединений постоянного состава
КК. Подставляя (5) в (2), получим уравнение массового баланса для
произвольного столбца матрицы.
f t Wi _
Ь, = ^ п{Уц = Х E nisys (7)
i=l i=l S=1 7
Рассматривая систему (6) в виде газа И7 частиц, согласно [2], можно
записать выражение для приведенной свободной энергии Гиббса.
t W t W
G (...niS ...) = E S niS [c,s +ln (niS/E E n/S)], (8)
i=l s=i i=l s=i
ciS = 1/Л [«7° - H°0)/T]iS + 1/ЛГ(ДЯ°298),5. (9)
Далее, используя уравнение массового баланса (7), исключим зави-
симые переменные и запишем общую свободную энергию Гиббса системы
G только как функцию независимых переменных, минимизация которой
по независимым переменным и определяет равновесный состав КК
как функцию температуры — П($ = f(T). Подставим явные значения выра-
жений И/5 в систему уравнений (5), из которой затем, исключая и,, полу-
чим систему уравнений для определения независимых концентраций, .ко-
торые и определяют равновесный состав каждой фазы при данной тем-
пературе.
Изложенный метод применен к расчету фазовых равновесий между
дефектными соединениями на примере бинарных систем типа переход-
ный металл (титан, цирконий, гафний)—углерод. Термодинамические
характеристики ciS, характеризующие приведенные свободные энергии
фаз, рассчитывали по уравнению (9), пользуясь справочными данными
для расчета с,$ чистых компонентов. Величины c,s для КК получали экстра-
поляцией линейной зависимости свободной энергии дефектного соеди-
нения от состава на х = 0 и х = 1 для соответствующих КК. Зависимость
G =f(x) определяли из экспериментальных данных [3].
39
Используя экстраполяционный метод определения термодинамических
характеристик КК, рассчитали границы областей гомогенности карбидов
титана и циркония. Рассчитать полные диаграммы состояния этих сметем
с помощью экстраполяционного метода не представляется возможным
из-за отсутствия в литературе некоторых термодинамических данных
по карбидным системам.
Поэтому в работе был предложен другой метод термодинамического
расчета диаграмм состояния, сущность которого состоит в том, что каж-
дая фаза данной системы рассматривается отдельно и для нее записыва-
ется выражение свободной энергии Гиббса, согласно МКК [1 ]:
(7 = Ед, а/, (10)
I
где а,- - концентрация, д,- - химический потенциал i-KK в растворе.
В простейшем случае свободная энергия может быть представлена тре-
мя КК: А (2) - чистые компоненты, - упорядоченное
соединение определенного состава, зависящее от типа решетки и числа
учитываемых сфер между взаимодействующими атомами в растворе.
При этом наличие ближнего порядка в системе учитывается косвенным
образом через концентрацию КК А 4р2). Матрицы (1), (4) и уравне-
ния массового баланса (5) для бинарной системы примут следующий вид
при условии b2 =у, bt =1 -у:
Л(1) А(»
А^ А™ /1
(1 -у у) ’ Mw I °
I 1-р
+ а3 (1 -р) = 1 -у
0 \ -Л(1)
1 |-Л<2>
(П)
а2 + а3 Р=У-
(12)
Так как в системе из двух уравнений (12) три неизвестных, вводится
дополнительное уравнение связи
Л(1’2р Л(2) = а -р)Л(Ч + рА(2). (13)
Рассматривая равенство (13) как твердофазную химическую реакцию
разложения, запишем константу ее равновесия К, принимая во внимание,
что концентрации КК есть их термодинамические активности:
К^а'-Ра? а’,1. (14)
Из уравнений (12) и (14) следует:
z+plKzP аг
у =------------, 2 =--. (15)
l+z + l/^2p а.
Графическое решение уравнения (15) позволяет найти отношения кон-
центраций КК. С учетом (15) уравнение (10) примет вид
1/KzP
G=yp +(1-у)д ... +------------------GCM, (16)
л(2) - л(1) l+z + l/KZp Р V
40
Диаграмма состояния системы титан-углерод
Данные: 1 - настоящей работы, 2 - [4]
где
Gp“=\(l) л(2) ~РЯЛ(2) “Р)МЛ(1У (17)
л 1-рлр л А
Концентрации на границах двух сосуществующих фаз (у t и у2) при дан-
ных температуре и давлении определяются соотношениями
G* = G\n = G-ydGldy,
А(Ч\у,
G’(2) =g2(2) = G + (1-y)9G/9y. (18)
Достоверность модели расчета диаграммы состояния была проверена на
примерах расчета диаграмм состояния систем титан-углерод (см. рису-
нок), цирконий—углерод, гафний—углерод, а также систем, содержащих
два нестехиометрических соединения, на примере карбидов тугоплавких
металлов V группы Периодической системы: ванадий—углерод, ниобий-
углерод, тантал-углерод. Совпадение расчетных и имеющихся эксперимен-
тальных границ диаграмм состояния вполне удовлетворительное.
В работе показана также возможность применения МКК к расчету диа-
грамм состояния псевдобинарных систем, характеризующихся образова-
нием непрерывного ряда твердых растворов. В качестве примера рассмот-
рены диаграммы состояния псевдобинарных систем, образованных моно-
карбидами переходных металлов IV, V групп Периодической системы.
Приводятся состав и свойства упорядоченных структур, описывающих
несимметричные ликвидусно-солидусные области и кривые распада твер-
дых растворов систем: TiC-ZrC, TiC-HfC, ZrC-HfC, VC-TaC, VC-NbC,
NbC—TaC, а также рассчитанные на этой основе диаграммы состояния.
41
ЛИТЕРАТУРА
1. Мень А.Н., Богданович М.П., Воробьев Ю.П., Камышов В.М. Состав-дефект-
ность-свойство твердых фаз. Метод кластерных компонентов М,- Наука, 1977.
247 с.
2. Coufal О., Fidler A. A contribution to the simultaneous chemical and phase equilibrium
calculation. - Collect. Czech. Chem. Communs, 1979, vol. 44, N 8, p. 2293-2301.
3. Болгар A.C., Турчанин А.Г., Фесенко В.В. Термодинамические свойства карби-
дов. Киев: Наук, думка, 1973. 271 с.
4. Тот Л. Карбиды и нитриды переходных металлов. М.: Мир, 1974. 294 с.
УДК 541.012.2
ПРОГНОЗИРОВАНИЕ И РАСЧЕТ ДИАГРАММ СОСТОЯНИЯ
ПСЕВДОБИНАРНЫХ СИСТЕМ
НА ОСНОВЕ ТУГОПЛАВКИХ СОЕДИНЕНИЙ
ПЕРЕХОДНЫХ МЕТАЛЛОВ
А.И. Гусев
Экспериментальное изучение диаграмм состояния псевдобинарных
систем на основе соединений переменного состава (карбиды, нитриды,
оксиды, бориды переходных металлов) очень трудоемко прежде всего
из-за высоких температур плавления компонентов, поэтому представ-
ляют интерес попытки использования различных эмпирических и полу-
эмпирических зависимостей для оценки характера взаимодействия и вза-
имной растворимости компонентов, определения положения скрытых
областей распада.
Наиболее вероятным результатом взаимодействия между кубичес-
кими карбидами, нитридами, оксидами переходных металлов является
образование неограниченных твердых растворов, поскольку эти соеди-
нения имеют одинаковую кристаллическую структуру типа NaCl и близ-
кие по размерам замещаемые атомы.
В работе [1] в результате систематизации и анализа большого коли-
чества экспериментальных данных по характеру взаимной растворимости
тугоплавких соединений было предложено использовать в качестве кри-
терия взаимной растворимости величину электронной плотности de =
- mc/V (m — число формульных единиц, приходящихся на элементарную
ячейку, с — количество валентных электронов, приходящихся на одну
формульную единицу, V — объем элементарной ячейки) и показано, что
непрерывные ряды твердых растворов образуются, если относительная
разность электронных плотностей Д<7е компонентов псевдо&1нарной си-
стемы не превышает 32,5-33,0%. Оценка Дс/е позволила указать вероят-
ный характер взаимной растворимости компонентов для 153 псевдоби-
нарных систем, в том числе для 92 экспериментально неизученных [1].
В работе [2] в качестве критерия взаимной растворимости было пред-
ложено использовать величину максимальной энергии упругой деформа-
ции Е’тах и показано, что неограниченные твердые растворы образуются в
том случае, если < 37,5 кДж/моль, при этом составу с Етах соответ-
42
ствует вершина скрытой области распада в твердом состоянии и существует
корреляция между Е/пах и критической температурой несмешиваемости.
Предложенные в работах [1, 2] критерии и Етах были использова-
ны для оценки характера взаимной растворимости комплексных соеди-
нений стехиометрического состава или соединений, по составу близких к
стехиометрии. Вместе с тем в работе [1] было отмечено, что на образо-
вание твердых растворов определенное влияние должно оказывать наличие
структурных вакансий, так как их появление добавляет новые позиции
внедрения в соединениях.
В работе [3] на примере 105 псевдобинарных систем, образованных
кубическими карбидами, нитридами и оксидами Ti, Zr, Hf, Th, V, Nb и Та,
было рассмотрено влияние дефектности соединений на их взаимную раство-
римость с использованием в качестве оценочного параметра отношения
электронных плотностей d^1^ fd/2^. Было показано,что для образования
непрерывного ряда твердых растворов отношение электронных плотностей
компонентов должно лежать в пределах 1,481 /dy* > 0,675.
Согласно [3], рассмотренные псевдобинарные системы по соотношению
между характером взаимной растворимости соединений и их дефектностью
можно условно разделить на три типа. К первому относятся системы, в
которых неограниченные твердые растворы образуются при любой дефект-
ности соединений. Ко второму - системы, для которых при любых значе-
ниях дефектности соединений в пределах их областей гомогенности наблю-
дается только ограниченная растворимость. К третьему, промежуточному
типу относятся системы, для которых в зависимости от соотношения
дефектности соединений характер растворимости может меняться от не-
ограниченной взаимной растворимости до ограниченной.
Наиболее последовательно и полно выяснить вид диаграммы состояния
можно путем ее расчета, если известны зависимости параметров, описы-
вающих взаимодействие в системе от состава и температуры.
В общем случае свободную энергию z-фазы в двухкомпонентной систе-
ме можно записать в виде
AGf (х, Т, Р) = (1-х) ДС,- (0, Т, Р) + х ДС,- (1, Т, Р) +
+/Щ(1 —х)1п(1 — х) + xlnx] + ДС,-изб(х, Т,Р), (1)
где х — концентрация второго компонента в гфазе, ДС,- (0, Т, Р) и ДС,- (1,
Т, Р) — свободные энергии исходных компонентов системы. Поскольку
расчет диаграмм состояния будет вестись для постоянного давления, то
обозначение давления Р для сокращения записи далее будет опущено.
Степень отклонения системы от идеальности определяется величиной
избыточной свободной энергии смешения ДС"эб = х(1—х)5,-, где В, -
энергия взаимообмена в г-фазе. В модели регулярных растворов энергия
взаимообмена В, является постоянной, не зависящей от температуры и
состава величиной. В данной работе для описания реальных систем ис-
пользована более сложная модель субрегулярных растворов, в которой
энергия взаимообмена является функцией состава и температуры.
Если хи у - содержание второго компонента в /- и /-фазе соответственно.
ДЯ12 и Г1>2 — теплоты и температуры фазовых переходов исходных
компонентов, ДС"эб =х(1—х)В, (х, Т) и ДС”зб = у(1—y)Bt(у, Т) —
43
избыточные свободные энергии смешения i- и /-фаз соответственно, то
для условий равновесия двух фаз i и / можно получить из соотношений
типа (1) следующие уравнения, позволяющие установить положение фазо-
вых границ, например ликвидуса и солидуса:
ЭВ, (у, Т)
ЛГ1п(1 -у) + у2В,(у, Т)-у2(1 =
9Bi(x, Т) ДЯ1
= ЯГ1п(1 -х) + x2Bi(x, Т)—х2 (1 -х) ----------- +------(Г- Т1), (2)
Эх Г1
ЭВ, (у, Т)
ЯТ1пу+ (1 -у)2В,(у, Т) + у (1 -у)2 —---------=
Эу
ЭВ,(х, Т)
= RT]nx+ (1 -х)2В,(х, Т)+ х(1 —х)2------------- + -----(Т-Т2). (3)
Эх Т2
Для описания в субрегулярном приближении распада твердых раство-
ров примем, что при распаде переход от одной фазы к другой происхо-
дит без скачка энтропии (Д5 = ЛЯ/ Т = 0) и образующиеся при распаде
фазы с содержанием второго компонента хг и х2 имеют равные энергии
взаимообмена Bt (х, Т) =В2 (х, Т) =Bmb(x, Т), в результате чего уравне-
ния (2) и (3) преобразуются в виду
Дп ь
ЯГ1п(1 -xj+ x2Bmb-x2(l — Xi>—----= ЯТ1п(1 —х2)+х2ВтЬ -
, элть "
-xl(l-Xj)-— , (4)
Эх
b
ЯТ1ПХ! + (1 -Xj)2Bmb + xt (1 - Xi)2 —— = ЯТ1пх2 + (1 -x2)2Bmb +
Эх
ЭДпЬ
+ x2(l-x2)2 —— . (5)
Эх
Решение уравнений (4) и (5) позволяет определить положение границы
области распада в твердом состоянии.
Таким образом, для расчета фазовых границ необходимо знать энергии
взаимообмена всех находящихся в равновесии фаз.
Согласно работе [4], энергия взаимообмена для жидкой фазы может
быть описана как сумма двух параметров: электронного взаимодействия
е0 и внутреннего давления ер. Известно, что при расчете параметров взаимо-
действия в системах на основе карбидов в качестве величины, характери-
зующей прочность межатомных связей в рассматриваемых соединениях,
можно использовать энергию атомизации Е [5]. С учетом изменения объе-
ма системы с составом и температурой параметр ер можно определить
как
г Ei 1 . Г Ег 1*М 2
е,- [(1-^, (7)^(7), ] [, (6)
где Vi ,2 (Т) = К1>2 [1 + 3ai,2 (Т-300)], К1>2 - молярные объемы исход-
44
ных компонентов псевдобинарной системы при 300 К; а12 — средние
коэффициенты линейного расширения компонентов, Е12 — энергии атоми-
зации компонентов.
Параметр электронного взаимодействия для жидкой фазы е0 рассчи-
тывался с помощью соотношения
e0 = [(l-x)F1 (П+*МП
( Л_ Г2 Г "Н х
[[МП! 1^(7)+ Г2(Т)1
I Г Е2 1.*/г Г Е2 +Ег -|1/2
Х U Vi (П1 (Г)+ И2(Т)1
(7)
Энергия взаимообмена в твердой фазе включает в себя, согласно [4],
помимо параметров е0 и ер, параметр электронного взаимодействия в твер-
дой фазе и параметр е2, связанный с упругими искажениями кристалли-
ческой решетки, т.е. 2?mb = е0 + ер + Cj + е2, откуда ВтЬ - Вж = е1+е2
Поскольку в жидкости упругие искажения отсутствуют, то величиной,
непосредственно связанной с фазовым переходом твердое—жидкость,
является параметр , отрицательный по знаку, как и параметр е0. Оцен-
ка параметра е i проводилась по формуле
е1=-[(1-х)К1(П+хК2(Г)]
ДЯ1 ДЯ2
МП’ МП
(8)
Параметр е2 вносит, как правило, наибольший положительный вклад в
общую энергию системы и потому является ответственным за распад в
твердом состоянии. Параметр е2 рассчитывался по тому же соотношению,
что и в работе [2]:
=у[П(П- МП]2
с.(П t Г МП <7, (П 1
К1(Г) + И2(П И (Г) J
(9)
где Gj>2 (Г) = Gi,2 [1 - 0i'2 (Т — 300)], G12 — модули сдвига исходных
компонентов системы при ЗООК, 01>2 - средние коэффициенты темпера-
турной зависимости модулей сдвига компонентов системы.
Следует заметить, что параметры электронного взаимодействия е0 и
et по знаку отрицательны, т.е. описывают связующую часть энергии вза-
имообмена, а положительные параметры ер и е 2 описывают антисвяэующую
часть этой энергии. В зависимости от соотношения между связующими и
антисвязующими параметрами энергия взаимообмена может быть положи-
тельной, нулевой (в случае идеальных растворов) или отрицательной.
Поскольку по физическому смыслу энергия взаимообмена является хоро-
шо известной в модели парного взаимодействия величиной, характеризую-
щей превышение энергии взаимодействия разноименных атомов над
энергией взаимодействия одноименных, т.е. В, =UAB — 0,5(С/дл - UBB),
то по ее знаку можно судить о характере перераспределения атомов компо-
нентов по узлам кристаллической решетки в твердой фазе или о преиму-
щественном взаимодействии между одноименными или разноименными
атомами в жидкой фазе.
45
ТаС, мол.%
NbC,M0fl.7«
ТаС,мол.70
Диаграммы состояния систем ZrC-TaC, ZrC-NbC, HfC-TaC
В качестве примера рассчитаны параметры взаимодействия и энергии
взаимообмена для 15 псевдобинарных систем на основе карбидов Ti, Zr,
Hf, V, Nb и Та. Для их определения в качестве исходных были использова-
ны данные по периоду решетки, энергии атомизации, по теплоте и темпе-
ратуре плавления, коэффициенту линейного расширения и модулю сдвига
этих соединений, приведенные в работах [6, 7]. В качестве примера пока-
заны результаты расчета положения фазовых границ на диаграммах состоя-
ния карбидных систем ZrC—ТаС, ZrC—NbC и HfC—ТаС (см. рисунок).
Диаграммы состояния 9 из 15 карбидных систем рассчитаны впервые,
экспериментально построенных диаграмм состояния этих систем не име-
ется.
Расчет диаграммы состояния подтвердил ограниченную растворимость
в системах VCOi8 8-ZrC и VCOi88-HfC и образование непрерывного ряда
твердых растворов в остальных рассмотренных системах. В результате
расчета установлено наличие скрытых областей распада в твердом состоя-
нии в системах TiC-ZrC, TiC-HfC, VC0.88-TiC, TiC-NbC, ZrC-NbC,
ZrC-TaC, NbC-HfC, HfC—TaC, VC0>8 8-NbC, VC0>8 8- ТаС, при этом верши-
нам куполов распада соответствуют температуры 2281, 2075, 488, 316,
681, 1212,821,1161, 1773, 1581К. В системах ZrC-HfC и NbC—ТаС области
распада отсутствуют и твердые растворы стабильны во всем интервале
температур вплоть до температур плавления; близки к идеальным твер-
дые растворы системы TiC—ТаС.
Результаты прогнозирования вида диаграмм состояния псевдобинарных
систем на основе тугоплавких соединений переменного состава с использо-
ванием относительной разности электронных плотностей компонентов
максимальной энергии упругой деформации £тах, отношения эле-
ктронных плотностей компонентов d^P/d^P хорошо согласуются между
собой, а также с рассчитанными диаграммами состояния и с имеющимися
экспериментальными данными. В целом представленные результаты сви-
детельствуют о правомерности использования модели субрегулярных
растворов при расчете диаграмм состояния карбидных систем и о возмож-
ности ее применения для расчета диаграмм состояния других псевцобинар-
ных систем.
46
ЛИТЕРАТУРА
1. Гусев А.И., Швейкин Г.П. Образование твердых растворов изоморфными карби-
дами, нитридами, окислами и боридами переходных металлов IV и V групп. -
Изв. АН СССР. Неорган. материалы, 1974, т.10, № 12, с. 2144-2147.
2. Гусев А.И., Швейкин Г.П. Энергия упругой деформации кристаллической решетки
при образовании твердых растворов карбидов и нитридов переходных металлов,—
Изв. АН СССР. Неорган. материалы, 1976, т. 12, № 9, с. 1565-1568.
3. Гусев А.И. Влияние дефектности структуры на характер взаимной растворимости
тугоплавких соединений переменного состава. — Изв. АН СССР. Неорган. мате-
риалы, 1983,т. 19,№8,с. 1319-1324.
4. Кауфман Л., Бернстейн X. Расчет диаграмм состояния с помощью ЭВМ. М.: Мир,
1972. 326 с.
5. Огородников B.Q., Огородникова А.А. Расчет диаграммы состояния псевдобинар-
ных систем монокарбидов, ванадия, ниобия и тантала. - ЖФХ, 1977. т.51, № 2,
с. 297-301.
6. Гу сев А.И. Расчет диаграмм состояния псевдобинарных систем на основе тугоплав-
ких карбидов титана, циркония, гафния и ванадия. - Изв. АН СССР. Неорган. ма-
териалы, 1984, т. 20, № 2, с. 283-287.
7. Ремпель А.А., Гусев А.И., Швейкин Г.П. Термодинамический расчет диаграмм сос-
тояния систем VC0 e.-NbC, VC„ вв-ТаС, VC0 -HfC, NbC-TaC, NbC-HfC.-ЖФХ,
Ug в в 7 V f S 1} 7 U V 7 7 7
1984, т. 58, № 5. с. 685-689.
2. ПРИМЕНЕНИЕ ЭЛЕКТРОННОЙ ТЕОРИИ
К ОПИСАНИЮ ТЕРМОДИНАМИЧЕСКИХ СВОЙСТВ
И ДИАГРАММ РАВНОВЕСИЯ ФАЗ
УДК 669.017
ГЕНЕЗИС ДИАГРАММ СОСТОЯНИЯ
В АСПЕКТЕ ЭЛЕКТРОННОГО СТРОЕНИЯ МЕТАЛЛОВ
В.К. Григорович
Взаимодействие элементов, определяющее диаграмму состояния, тесно
связано с их кристаллической структурой и электронным строением.
Кристаллическая структура металлов определяется межатомными свя-
зями, возникающими в результате перекрывания орбиталей валентных
коллективизирующихся электронов и орбиталей внешних подвалентных
оболочек атомных остовов. Энергии атомизации — полного разрушения
связей в металлах — в 3—75 раз меньше энергий ионизации, т.е. перевода
валентных электронов в газ из почти свободных электронов. Аппрокси-
мация металлических структур жесткими касающимися положительно
заряженными сферическими остовами, стягиваемыми газом, из почти
свободных электронов, заполняющим межионное пространство, противо-
речит тому факту, что самыми прочными при деформации и превращениях
рядами являютсяплотноупакованные (например,<110> в ГЦК), а самыми
слабыми — неплотные ряды (<100> в ГЦК), проходящие через октапоры,
где концентрируется электронный газ. Модель почти свободных электро-
нов, стягивающих сферические остовы, не отвечает и зонной теории, ука-
зывающей на сохранение s, р, d-состояний валентных электронов при об-
разовании энергетических зон в кристалле.
Теория химической связи рассматривает возникновение межатомных
связей в молекулах и кристаллах как перекрывание внешних орбиталей
атомов [1, 2]. При этом учитывается симметрия волновых функций. Стро-
гое решение уравнения Шредингера ДФ = ЕФ для молекулярного иона
водорода Н2+ с одним электроном и приближенное, но весьма точное
решение для молекулы Н2 с двумя электронами дали следующие резуль-
таты (табл. 1).
Локализованная связь в диамагнитной молекуле водорода Н2, осу-
ществляемая двумя электронами с антипараллельными спинами, представ-
ляет сильную короткую ковалентную связь о-типа. В молекулярном пара-
магнитом ионе Н2+ единственный электрон обобществлен между двумя
атомами, и эта связь близка к металлической.
У всех металлов внешними являются сферические ^-оболочки в виде
шаровых слоев, которые при сближении атомов перекрываются первыми.
Перекрытие представляет наложение или суперпозицию максимумов
электронной плотности Ф$-орбиталей и означает[3, 4]: 1) образование
48
Таблица 1
Результаты решения уравнения Шредингера для молекулярного иона Н,*
и приближенного для двухэлектронной молекулы Н,
Молекула Энергия свя- зи Е, ккал/ моль Длина свя- зи X Число и состо- яние электро- нов Состояние мо- лекулы Тип связи
я* я 61,04 103,24 1,06 0,7414 1, коллекти- визирован 2, локализо- ваны Парамагнитна Диамагнитна Близкая к ме- таллической Ковалентная о-свяэь
металлической связи между ближайшими атомами в плотноупакованных
рядах вследствие концентрации электронов на кратчайшем расстоянии
между ядрами (атомы как бы ’’слипаются” своими s-оболочками) и
2) обобществление s-электронов и появление металлической проводимости
и свойств.
Наиболее сильно связанным с соседними ядрами оказывается коллек-
тивизированный электрон, находящийся в области перекрытия (дно эоны).
Почти свободным оказывается электрон, движущийся в междоузлии,
вдали от ядер (верх зоны). Из условия минимума свободной энергии
стабильной будет структура с максимальным числом связей (перекрытий)
на атом, т.е. плотная упаковка с координационным числом Ki = 12. Реаль-
ные металлические радиусы гмет практически совпадают с радиусами
rs Орб• Отношение радиусов гМет/г$ орб для металлов меняется в пределах
0,95-1,2.
Таким образом, главной причиной образования плотных упаковок
металлов является перекрытие внешних s-оболочек их атомов. Сфери-
ческая симметрия s-оболочек приводит к плотной кубической упаковке
типа Си, а при деформации сферы в сфероид реализуется плотная гекса-
гональная упаковка типа Mg с отношением с/а, характеризующим откло-
нение s-оболочки от сферичности.
Механизм образования металлических структур путем перекрытия
внешних орбиталей, означающих появление металлических связей и кол-
лективизацию валентных электронов, не требует больших затрат энергии
на отрыв (ионизацию) электронов. Сильные металлические связи обра-
зуются между перекрывающимися оболочками, т.е. в плотноупакованных
рядах < 110>гцк < 111>оцки др.
При образовании металлической структуры зоны в значительной степени
сохраняют состояние и симметрию электронов в атоме. Металлические
связи в ГЦК и ГПУ металлах могут быть выражены в обычных критериях
химической связи: длина связи (d = 2гмет = £)мет), число связей (Kt =
= 12), энергия связи (Е = ^атомиз/Ki Д^испар/12), число валентных
электронов, участвующих в связи (пе = (Nv/12) • 2 s Nv/6), валентные
углы (а = 60° (ГЦК) и ~60° (ГПУ)).
Металлические связи в ГЦК металлах направлены вдоль плотноупа-
кованных рядов < 110>, а в ГПУ металлах вдоль потноупакованных рядов
<1120> в плоскости базиса и вдоль шести векторов под углами 30° к
этой плоскости.
4. Зак. 244 49
Образование ОЦК структур происходит вследствие расщепления и
перекрывания внешних остовных р6 (или d6) -оболочек сквозь s-оболочки.
Орбитальные радиусы гр и rd у переходных металлов близки, rd/rp = 0,96-
1,39, однако гр в 2,5-3,5 раза меньше гмет. Поэтому в невозбужденном
состоянии р-электроны попарно связаны внутри р6 оболочек атома и внеш-
них связей не образуют. При сближении в результате спинового расщеп-
ления р6 оболочек протяженность р-орбиталей резко возрастает, их
внешние части перекрываются и образуют валентные о-связи вдоль направ-
лений < 100>, приводя к появлению ОЦК структур металлов [3-5].
Мнение о том, что электроны замкнутых $2 3р6-оболочек инертных газов
принципиально не могут участвовать в образовании химических связей,
оказалось неправильным и было опровергнуто открытием фторидов и
окислов ксенона, криптона, радона. Это ошибочное истолкование принципа
Паули на 50 лет задержало открытие соединений инертных газов и пони-
мание физической причины образования структур типа ОЦК, CsCl, NaCl
и др.
При образовании ОЦК структур происходит перекрытие р-орбиталей
и возникновение шести a-связей вдоль направлений <100> (К2 = 6). При
этом у щелочных и щелочноземельных металлов происходит образование
восьми металлических связей по кратчайшим направлениям < 111> путем
перекрытия внешних валентных s-оболочек. В рядах d-металлов HI—VI
групп эти металлические s-связи усиливаются перекрытием deg -орбиталей,
имеющих симметрию dxyz, и ОЦК структура максимально стабилизируется
и упрочняется у хрома, молибдена, вольфрама (конфигурация d4s2).
Дальнейшее заполнение d-оболочки электронами другой симметрии
t2g(dxy, dxz, dyz) приводит к стабилизации сперва плотной гексагональ-
ной (Тс, Re, Ru, Os, а = Со),азатемГЦК структуры (0 = Со, Ni и их ана-
логи) вследствие перекрытия ^-орбиталей вдоль направлений плотно-
упакованных рядов <110> гцк- При этом перекрытие s-оболочек вдоль
тех же направлений стабилизирует плотные упаковки.
Таким образом, симметрия перекрывающихся s, р, de ,.dt2 -орбиталей
валентных и подвалентных электронов непосредственно определяет сим-
метрию и тип структуры металлов [3—7]. Волновые функции электронов
следующие:
1
(4тг)й
1) Фпз
7?ns(r) (сфера или шаровой слой),
2) ^пРх = x/3/47rsin0cos<pfl„p (г), Флр>, = \/3/4nsin0cos(pR„p(r), Ф„Рг =
= л/3/4тг'со50Rnp(r) (три гантели вдоль осей х, у, z),
3) = х/15'/16nsin2в sin2ipR„d(r), ^паХ2 ~ V13/4л8ш0 cos0 cosipX
X Rnd(r), ^ndyz ~ \Л 5/47r'sin0cos0sinp Ал d(r) (три четырехлепестковые
розетки вдоль биссектрис ху, xz, yz),
4) ^ndxyz = х/5/4яsin20cos0sin2ip/?„d(r) = y/5xyzRnd(r) =
= eg (две четырехлепестковые розетки по двум диагональным плоскос-
тям вдоль объемных диагоналей xyz).
50
Соответствие характеристик кристаллических структур металлов па-
раметрам атомных орбиталей показано в табл. 2.
Ранние исследования электронной плотности в кристаллах показали
наличие электронных мостиков вдоль <100> в NiAl (тип CsCl), <100>
в MgO (тип NaCl), где их не должно бы быть. Найдено, что в ОЦК вана-
дии, хроме и железе имеются электронные мостики вдоль плотноупако-
ванных рядов <111> и вдоль ребер <100>, где они в 1,5—2,6 раза плот-
нее. Эти факты представляют прямое экспериментальное доказательство
перекрывания р6-оболочек и образования валентных о-связей вдоль <100>.
Более высокая электронная плотность мостиков вдоль <100> объяс-
няется тем, что при перекрытии р6 -оболочек в валентной связи вдоль
<100> участвует 2 эл/связь, а в образовании металлической связи вдоль
<111> участвуют
ие = (JVe/8)X2=JVc/4 эл/связь.
Для ОЦК металлов I—VI групп число электронов, участвующих в об-
разовании металлической связи, меняется от 1/4 до 3/2 эл/связь. Поэтому
электронная плотность мостиков вдоль <100> должна быть выше, чем
вдоль <111>. Вклад ковалентных и металлических связей в общую энер-
гию ОЦК решетки зависит также от соотношения числа связей на 1 атом
(8 металлических и 6 ковалентных), т.е. пмет/иКОв ~ 4/3. Кроме того,
энергия связи сильно возрастает с уменьшением расстояния (Е ~ze2/гп,
где п > 2). Кратчайшее расстояние между атомами в плотном ряду < 111>
короче, чем по ребру < 110 >, и энергия £мет > Еков.
Закономерности изменения структур металлов в Периодической сис-
теме элементов Д.И. Менделеева по мере заполнения s, р, d-оболочек сле-
дующие [4—8]: 1) перекрытие внешних остовых р6 -оболочек приводит
к ОЦК структурам металлов I—VI групп, 2) заполнение s-оболочки при
переходе от щелочных (s1) к щелочноземельным (s2) металлам стабили-
зирует плотные упаковки ОЦК Na -> ГПУ Mg и т.п., 3) заполнение dx ^-обо-
лочки четырьмя электронами от III к VI группе Sc, Y, La, Ac (d's2) —
Cr, Mo, W (d4s2) стабилизирует ОЦК структуру, 4) заполнение d6(t2g-
оболочки от VII к X группе стабилизирует ГПУ и ГЦК структуры, 5)
перекрытие s-оболочек стабилизирует ГЦК и ГПУ структуры Си, Zn, Al,
Pb.
Эти закономерности определяют и стабилизацию ГЦК, ГПУ, ОЦК струк-
тур при генезисе диаграмм состояния. Анализ диаграмм состояния титана,
циркония, гафния [9] с d-металлами V—VIII групп (V, Cr, Мп, Fe и ана-
логи) показывает, что заполнение е^-состояния ^^-электронами ведет
к усилению связей вдоль направлений <111> и стабилизации ОЦК 0-фазы
за счет подавления областей a-фазы. Легкие элементы (В, С, N, О) легче
размещаются в более свободных октапорах ГПУ a-фазы и представляют
а-стабилизаторы, так же как алюминий и олово с перекрывающимися
s-оболочками.
Взаимодействие Ti, V, Cr и их тугоплавких аналогов [7] характеризуется
образованием непрерывных рядов ОЦК растворов вследствие заполнения
d(eg) зоны и усиления металлических связей вдоль плотноупакованных
рядов <111>. Подавление областей ГПУ a-фазы при легировании Ti, Zr,
Hf происходит вследствие повышения концентрации d-электронов при
51
Таблица 2
Характеристики типичных кристаллических структур металлов и атомных орбиталей
внешних электронных оболочек
Число ближай- ших соседей К (число связей) Межатомное расстояние (длина связи d) К ри стаяло гра - фическое на- правление Соответствующая симмет- рия атомных орбиталей Предельное число электронов (ne) на одну связь 2/Vy/K Тип и характер межатом- ной связи
в параметрах решетки а в атомных диа- метрах D
К, = 8 ач/З/2 = 0,86а D ОЦК <111> структура От 0,25 до 1,5 Металлическая, сильная
К, = 6 а 2Dlj3 = 1, 15£> Рх. Ру. Рх 2 Ковалентная, о-типа
К, = 12 a\Jl = 1,414а <1005» <221> 2v/2D/>/T= 1J63D <110> Расщепленная р6 Спиново-расщеплен- ная d6 dxy. dxz. dyz (tjg> и s До 1/6 Металлическая, слабая
К, = 12 вч/2/2 = 0,707а D ГЦК структура <110> dxy, dxz, dy z От 1 /6 до 1 Металлическая, сильная
К, = 6 а D-J1 = 1.414D <100> Px. Py. Pz Очень малое Дисперсная, очень слабая
К, = 8 а^/3 = 1,732а Оч/б = 2.45D <111> (нерасщепленная p6) dxyz^eg) То же То же
К, = 12 а D ГПУ (нерасщепленная d*) структура dxy> dyz От 1 /6 до 1 Металлическая, сильная
К, = 6 ayjl = 1,41а Dj2 = 1.414D (tIgc поворотом на 60°) И J Px. Py. Pz Очень малое Дисперсная, очень слабая
Кэ =2 + 6=8 1,633а 1,6330 <1120> (нерасщепленная p6) То же То же
(2 соседа) aV3’= 1,732а (6 соседей) 1,732D - dxyz(eg> (нерасщепленная d*) Очень малое -
легировании элементами V—VI групп, способствующего возбуждению
и расщеплениюр6-оболочек атомов Ti, Zr, Hf [5-8].
Введение 20—30% Re(d5s3), а также Тс, Ru, Os в хром, молибден, вольф-
рам с заполненной ‘dxyz(eg) зоной ведет к заполнению новой tJg зоны
и образованию 12 дополнительных связей вследствие перекрывания dxy,
dxz, dyz орбиталей вдоль направлений < 110> в ОЦК решетке. Эти метал-
лические связи создают всестороннее сжатие, приводящее к сильному
повышению пластичности и к дальнейшему росту прочности, особенно
вблизи предела растворимости. В таких системах ОЦК растворы расши-
рены, а ГПУ растворы подавлены [8,10].
Взаимодействие Си, Ag, Au с Ni, Со и их аналогами характеризуется
диаграммами с широкими или непрерывными растворами вследствие
стабилизации ГЦК структуры перекрывающимися в направлении <110>
s- и d(t2g) -орбиталями. При этом устойчивость и прочность ГЦК растворов
возрастают при повышении числа коллективизированных электронов,
т.е. при легировании Си, Ag, Au (1 эл/ат), Ni, Pd, Pt (2 эл/ат) и еще силь-
нее при введении Со, Rh, Ir (3 эл/ат). Между ГПУ металлами (Тс, Re, Ru,
Os) и ГЦК металлами (Со, Ni, Си и аналоги) образуются системы с ши-
рокими областями ГПУ и ГЦК растворов и промежуточными фазами
о, X, £, д-типа.
Расширяют область ОЦК а-растворов и подавляют ГЦК у-области на
диаграммах Fe—Э ОЦК металлы IV -VI групп, а также Al, Si, Р и их ана-
логи с подвалентными р6- или d6-оболочками, а также Re и а = Со. Рас-
ширяют у-область и подавляют а-растворы ГЦК металлы (0 = Со, Ni, Си,
Rh, Pd, Ir, Pt, Au, Zn, а также Мп и примеси внедрения (C, N) [5].
При легировании одновалентных Си, Ag, Аи элементами II—V групп
(Zn2, Al3, Si4, Р5) вследствие повышения электронной концентрации
происходит сжатие областей ГЦК а-растворов и появление вследствие
перекрытия р6 (d6) -оболочек ОЦК фаз типа 0-латуни и последующих
фаз.
Таким образом, электронное строение валентных и подвалентных обо-
лочек непосредственно определяет закономерности образования диаграмм
состояния.
ЛИТЕРАТУРА
1. Коульсон Ч. Валентность. М.: Мир, 1965. 426 с.
2. Краснов КС Молекулы и химическая связь М.: Высш, шк., 1976. 280 с.
3. Григорович В.К. Периодический закон Д.И. Менделеева и электронное строение
металлов. М.: Наука, 1966. 286 с.
4. Григорович В.К. Связь электронного строения с кристаллической структурой
металлических фаз. - В кн.: Итоги науки и техники. Металловедение и терми-
ческая обработка. М.: ВИНИТИ, 1978. т. 12, с. 5-26.
5. Григорович В.К Электронное строение и термодинамика сплавов железа. М.:
Наука, 1970. 292 с.
6. Григорович В.К Стабилизация кристаллических структур металлов в связи с
симметрией остовных и коллективизированных электронов. - В кн.: Сплавы
редких и тугоплавких металлов с особыми физическими свойствами. М.: Наука,
1979, с. 103-108.
7. Григорович В.К, Шефтелъ Е.Н. Дисперсионное упрочнение тугоплавких метал-
лов. М.: Наука, 1980, с. 7-127.
53
8. Григорович В.К, Григорович К.В. Металлические и ковалентные связи в жаро-
прочных сплавах на основе тугоплавких металлов. - В кн.: Сплавы тугоплавких
и редких металлов для работы при высоких температурах. М.: Наука, 1984, с. 23-
30.
9. Корнилов И.И. Титан. М.: Наука, 1984. 308 с.
10. Тылкина М.А., Савицкий Е.М. Физико-химические основы разработки сплавов
рения с заданными свойствами. - В кн.: Диаграммы состояния в материалове-
дении. Киев: ИПМ АН УССР, 1980, 190 с.
УДК 669.018:546.68
РАСЧЕТ ДИАГРАММЫ ПРЕВРАЩЕНИЯ ГЦТ 2 ГЦК В СИСТЕМЕ In-Г1
М.Ф. Жаров ков, В. В. Кулагина
Характерной чертой диаграммы состояния In с металлами является
присутствие фазовых переходов, при которых меняется отношение осей с/'а.
Чистый In имеет гранецентрированную решетку с отношением осей с/а =
- 1,08. Он образует твердый растворы, обладающие ГЦТ структурой, с
соседними элементами в периодической таблице (Cd, Hg, Ga, Tl, Sn, Pb).
При добавлении в In элементов с большей валентностью (Sn, Pb) с/д
сначала возрастает, а затем начинает падать. При дальнейшем увеличении
содержания примеси в системе происходит фазовый переход, при этом
вновь образующаяся фаза является также тетрагональной, но с/а< 1.
В сплавах In с элементами меньшей валентности (Cd, Hg) и изовалент-
ными Т1 имеет место фазовый переход типа ГЦТ £ ГЦК. Влияние на с/д
и фазовые изменения в сплавах In с разновалентными металлами объясня-
ли с помощью теории Джонса, т.е. изменением электронной концентрации
el А [1, 2], а с изовалентными изменениями - среднего потенциала спла-
ва [3, 4].
Под действием давления и температуры в In также наблюдается аномаль-
ное изменение некоторых физических величин, обусловленное особеннос-
тями кристаллического строения и электронной структуры.
Поэтому In и его сплавы представляют редкую возможность для изуче-
ния одновременного влияния многих факторов (температуры, давления,
вида и концентрации примеси) на структурные фазовые переходы.
Метод псевдопотенциала неоднократно использовался для объяснения
тетрагональных искажений в In. В [5,7] была использована нелокальная
форма псевдопотенциала и получена устойчивая ГЦТ структура In по
сравнению с кубической. Однако равновесные значения с)а Ькаэались
сильно завышенными.
Кроме того, минимальной энергией обладает структура с ГПУ решеткой.
Объем для всех структур принимался равным его экспериментальному
значению в ГЦТ структуре.
Возможность образования структур с отношением с/д, отличным от
идеального значения, в [3] связывается с тем, что тетрагональное искаже-
ние, расщепляющее набор векторов обратной решетки (200), лежащих
около первого нуля псевдопотенциала ш(^0), понижает энергию зонной
структуры. Однако расчет с обычно применяемым локальным псевдопо-
54
тенциалом приводит к неустойчивости ГЦТ структуры In по сравнению
с кубической, несмотря на то что выбор q0 обеспечивает значительный
вклад в энергию зонной структуры ГЦТ решетки за счет расщепления
векторов решетки типа (200). Это означает, что только лишь правильным
выбором положения первого нуля псевдопотенциала не всегда можно
объяснить появление искаженной структуры. В общем случае для этого
нужен псевдопотенциал, обеспечивающий более сильную зависимость энер-
гии зонной структуры от отношения с/а по сравнению с аналогичной зави-
симостью от величины расщепления узлов обратной решетки для электро-
статической энергии. Последняя всегда имеет минимум при значениях с/а,
соответствующих идеальным структурам.
В работе [8] высказывалось предположение, что такая более резкая
зависимость зонной энергии с/а имеет место для металлов, у которых
псевдопотенциал быстро изменяется вблизи определенной группы векторов
обратной решетки при достаточно больших значениях волнового вектора q.
Следует также заметить, что величина расщепления векторов обратной
решетки (200) при тетрагональных искажениях сравнима с изменением
положения векторов обратной решетки, которое происходит при переходе
в расчетах от фиксированного значения объема, равного экспериментально-
му, к значению, равновесному для кубической структуры. Поэтому при
объяснении стабильности ГЦТ структуры по сравнению с кубической и
другими структурами расчеты следует проводить не при фиксированном
объеме, равном для всех структур, а при соответствующих им равновесных
значениях.
В расчетах был использован локальный псевдопотенциал, позволяющий
легко изменять его форму при больших значениях волнового вектора q
без изменения положения первого нуля псевдопотенциала и его первой
производной в точке q0:
co(<7>=(4nz/no<72) (q/q0)2 - 1
1 + (?/?о)
2
2а- 1
у (q) = 1 + exp {[ (<z/<7 о)2 ~c]/b},
(1)
где z — валентность иона, S20 — атомный объем, а, Ь,с — параметры. Псев-
допотенциал (1) отличается от широко известного потенциала [9] множи-
телем у (q). Форма со (q) выбрана таким образом, что практически не меня-
ет значений со (q) при малых волновых числах, но дает возможность менять
в значительных пределах величину формфактора при больших q. Пара-
метр с характеризует положение точки обрезания псевдопотенциала со (<?),
а параметр b позволяет делать это плавным образом. Изменяя эти два пара-
метра, можно получить потенциалы с плавными и резкими хвостами и тем
самым проверить предложения, сделанные в работе [8] о значимости
резкого изменения псевдопотенциала при больших q на стабильность иска-
женной структуры, в нашем случае ГЦТ структуры In.
Расчеты полной энергии Е в различных кристаллических модификациях
проводились во втором порядке теории возмущения по псевдо потенциалу.
Учет обменно-корреляционных поправок в статической диэлектрической
проницаемости выполнен в схеме Гелдарта—Воско.
55
Рис. 1. Зависимость пол-
ной энергии Е для ГЦК
структуры с/а = 1 и ГЦТ
структуры с/а = 1,08 от
параметров псевдопотен-
циала с и b
Рис. 2. Зависимость пол-
ной энергии Е от объема
для ГЦТ (7) и ГЦК (2)
структур
а — без учета допол-
нительных сил отталкива-
ния, б - с учетом этих
сил
Исследуем зависимость полной энергии кристалла Е от параметра псев-
допотенциала с с целью определения области его значений, для которой ГЦТ
структура будет иметь меньшее значение Е, чем кубическая. Параметры q0
и а взяты такими же, как для двухпараметрического потенциала [9].
Выполним расчет полной энергии кристалла при постоянном объеме £20>
равном экспериментальному значению 175,3 ат.ед. для кубической (с/а = 1)
и тетрагональной модификаций. Результаты представлены на рис. l^z.
Как видно на рис. 1,д, имеются три интервала значений параметра с(1— 5),
где можно ожидать, что и после минимизации по объему ГЦТ структура
окажется энергетически более выгодной, чем ГЦК. Анализ показывает,
что положение этих областей определяется положением узлов обратной
ГЦК решетки, расщепляющихся при тетрагональном искажении крис-
талла.
При фиксированном с, взятом в одной из областей его значений, где
выгодна ГЦТ структура, исследуем изменение разности энергии ГЦТ и ГЦК
структур от параметра Ь. Результаты приведены на рис. 1,6. С увеличением
величины b разница энергий ^Гцп—-^гцк уменьшается, а затем и вовсе
исчезает. При b потенциал (7) переходит в двухпараметрический по-
56
Значения полной энергии, равновесного объема и отношения с!а для In,
рассчитанные с потенциалом (1) для трех значений параметра
псевдопотенциала с
N С £20, ат.ед. с/ а —Е, Рб/ат ^ЭКСП» Рб/ат
1 4,999 175,3 1,148 3,99 4,05
2 5,700 170,1 1,142 3,97
3 6,228 175,3 1,080 3,98
тенциал [9], для которого энергетически выгодна ГЦК структура. Для
потенциала [9] характерна плавная зависимость от волнового числа q.
Таким образом, резкое уменьшение псевдопотенциала вблизи групп
волновых векторов обратной ГЦК решетки, расщепляющихся при тетра-
гональных искажениях решетки, совместно с положением первого нуля
псевдопотенциала вблизи расщепляющихся обратных векторов (200) обес-
печивает выгодность тетрагональной структуры In.
На рис. 2/7 представлена зависимость полной энергии от объема при
фиксированных значениях отношения осей с/а = 1 и с/а = 1,08. Как следует
из рис. 2,а, в области объемов, близких к экспериментальному значению,
энергия ГЦТ структуры оказывается ниже, чем ГЦК. Однако абсолютный
минимум энергии соответствует ГЦК структуре при объеме, значительно
меньшем, экспериментального.
В работе [10] отмечается, что псевдо потенциальный расчет для In не дает
стабильной ГЦТ структуры без введения дополнительных сил отталкива-
ния, которые могут быть обусловлены нелокальностью псевдопотенциала,
что соответствует частичному учету нелокальных эффектов, поэтому ока-
залось возможным получить абсолютный минимум значения полной энер-
гии при объеме, близком к экспериментальному значению (рис. 2,6).
Для значения параметра с из областей 2 и 3 (см. рис. 1) результаты расчетов
качественно те же.
В таблице приведены значения полной энергии, равновесного объема и
отношения осей с/а для трех значений параметра с из трех областей парамет-
ра с, приведенных на рис. 1/7. Для случая 3 полученные значения равновес-
ного объема и отношения осей хорошо согласуются с наблюдаемыми.
Для всех трех значений величина полной энергии оказывается несколько
большей, чем ее экспериментальное значение.
Таким образом, показано, что тетрагональные искажения в In и его
сплавах могут быть исследованы на основе метода псевдопотенциала с
локальным псевдопотенциалом при введении дополнительных сил оттал-
кивания, изменяющих среднее значение псевдопотенциала. При этом важное
значение имеет положение обрезания потенциала или величина параметра с.
На рис. 3 приведена зависимость полной энергии от отношения осей с/а
при фиксированном равновесном для ГЦТ структуры In объеме. Из рис. 3
следует, что имеются два близко лежащих минимума энергии. Один при
с/а, несколько меньшем 1, а другой — больше 1. При этом абсолютный
минимум лежит при с/а = 1,08, но разность энергий невелика. Это означа-
ет, что при изменении внешних условий давления, температуры и концент-
57
рации примесей возможен переход из одной тетрагональной модификации
в другую.
Проанализируем влияние среднеквадратичных смещений (и2 > ионов из
положения узлов решетки, которые могут быть вызваны концентрацион-
ными неоднородностями в сплаве или колебаниями решетки. Учет средне-
квадратичных смещений приводит к появлению в формфакторе экс-
поненциального множителя, показатель которого пропорционален (и^кТ.
Поскольку (и2) мало в сравнении с параметром решетки, то существенное
уменьшение формфактора псевдопотенциала имеет место лишь для боль-
ших значений q. Это приводит к смещению точки обрыва псевдопотенциала.
Как было показано, положение точки обрыва потенциала или величина
параметра с определяют стабильность ГЦТ или ГЦК структуры. С ростом
с/а
Ряс. 3. Зависимость пол-
ной энергии в In от отно-
шения осей с/а
температуры происходит увеличение среднеквадратичных смещений, что в
конце концов и вызывает структурный фазовый переход. Чем больше
объем примеси, тем большие статические смещения она вызывает в сплаве,
облегчая переход из ГЦТ структуры In к ГЦК структуре.
Как видно из рис. 2,6, абсолютный минимум энергии для ГЦТ структуры
реализуется в очень узком интервале по объему, причем равновесный
объем ГЦК структуры несколько больше равновесного объема ГЦТ решет-
ки. Вследствие этого всестороннее сжатие должно повышать стабильность
ГЦТ структуры относительно ГЦК. Всестороннее растяжение приводит к
обратному эффекту.
Таким образом, поскольку In изовалентен Т1 и его объем больше, чем
объем In, то он воздействует на решеточную устойчивость ГЦТ структуры
рвумя способами: через увеличение равновесного объема и через вызывае-
мые им статические смещения ионов в сплаве.
ЛИТЕРАТУРА
l .Kiyoshi Yonemitsu. Phase change of the indium rich alloys. - J. Phys. Soc. Jap., 1966,
vol. 21, N 7, p. 1231-1240.
2 .Preece C.M., King H. V. The relationship between axial rations, superconducting transition
temperatures and the electronic structure of In-Pb alloys. - Acta met., 1969, vol. 17,
N l,p. 21-27.
3 .Хейне В., Коне T., УзйрД. Теория псевдопотенциала. М.: Мир, 1973. 557 с.
4 .Matsuo Y., Kogachi М. Axial relation changes in ternary f.c.t. phase alloys of the In-Ga-
Te system. - Acta met., 1971, vol. 19, N 11, p. 1287-1293.
S .Heine V., Weare D. Structure of di- and trivalent metals. - Phys. Rev., 1966, vol. 152,
N 2, p. 603-611.
58
6 .Show R.W. Application of the optimized moved potential to calculation of energy-
wave-numbe, characteristic for simple metals. - J. Phys., 1969, vol. 2, N 12, p. 2335 —
2350.
7 .Williams A.R., Appapillai M. Application of the optimized model potential. - J. Phys.,
1969, vol. 2, N 4, p. 772-780.
Я.Жоровков М.Ф. Методы псевдопотенциала и статических концентрационных волн
в теории упорядочивающихся сплавов с гексагональной плотноупакованной решет-
кой: Авторёф. дис. ... канд. физ.-мат. наук. Томск: Иэд-во Том. ун-та, 1975. 21 с.
9. Краско Г.Л., Гурский З.А. Об одном модельном псевдопотенциале. - Письма в
ЖЭТФ, 1966, № 6, с. 596-599.
10.Matsuo J., Katada К. Axial ration and phase changes of In-Те alloys doped with Cd and
Sn. - Acta met., 1973, vol. 21, N 6, p. 829-934.
УДК 539.2.669.88
ЭНЕРГИЯ ОБРАЗОВАНИЯ И НИЗКОТЕМПЕРАТУРНЫЕ ДИАГРАММЫ
СОСТОЯНИЯ СПЛАВОВ ПЕРЕХОДНЫХ МЕТАЛЛОВ
В.Я. Дворецкий, А.Я. Флат, Ю.А. Хон
В последнее время расчету диаграмм состояния сплавов 3 d-переходных
металлов уделяется пристальное внимание. В работах [1, 2] показано, что
одним из наиболее перспективных методов расчета полной энергии сплавов
является метод функционала электронной плотности [3]. Авторами [1, 2]
построены параметризованные функционалы для полной энергии 3 d-метал-
лов и их сплавов, которые хорошо описывают основное состояние (Г-ОК).
На основе таких функционалов можно получить выражения для эффектив-
ных энергий парного взаимодействия атомов, линейные комбинации кото-
рых являются параметрами статистических теорий [4]. Зная такие энергии,
можно исследовать диаграммы состояния сплавов переходных металлов
в рамках статистических теорий.
В настоящей работе обсуждается природа энергий образования и упоря-
дочения сплавов 3d-переходных металлов, а также возможность исследо-
вания диаграмм состояния этих сплавов.
Природа энергий образования сплавов переходных металлов. Полную
энергию сплава можно записать [2] в виде
E = Eest + Т + Ехс, (1)
где Eest — энергия электростатического взаимодействия, Т — кинетическая
энергия электронов, Ехс — объемная энергия, которую запишем в ха-при-
ближении [5 ]:
Ехс = -3/2 акА / [р(г)]4/3dr> (2)
где р(г) - электронная плотность, кА - 0,75 (З/тг) ^3, V - объем кристалла,
а параметр а выберем равным 2/3 [6]. Для Т используется функционал,
методика расчета которого обсуждается в [1,2]. Полученные результаты
приведены в таблице.
Экспериментальные значения, указанные в скобках, взяты из работы [7].
Сплавы системы V-Ti имеют положительную энергию образования,
поэтому они должны при достаточно низких температурах распадаться.
59
Результаты расчетов ДЕ, Ио, Д/ сплавов
Сплав -ДЕ, P6 Fo, a.e. Tr, К Д2
VTi -5,6 105,95(106,47) 90 0,025
NiCo 0,32(0,015±0,32) 74,28 50 0,02
NiFe 0,88(0,43+0,32) 76,65(77,75) 200 0,03
FeV 9,9(6,4) 84,65(83,18) 990(870) 0,07
NiTi 14,2(25,8+1,6) 98,60(92,45) 3100 0,15
FeCo -0,01(5,0+0,7) 77,43(78,69) 1000 0,02
Примечание. ДЕ — энергия образования, Ко — равновесный объем, приходя-
щийся на атом, Ту — температура упорядочения, вычисленная в приближении Горско-
го—Брэгга—Вильямса, Д2 — величина заряда, перенесенного к элементу с большим
атомным номером.
Оценки температуры распада дают Тр ~900К. Учет ближнего порядка и
статических смещений приведет к уменьшению Д£ и понижению Тр. При
Т > Тр за счет энтропийного вклада в свободную энергию будет существо-
вать в соответствии с экспериментом непрерывный ряд твердых растворов.
В системах Ni—Со, Ni—Fe ДЕ < 0, но энергия упорядочения мала. Поэто-
му в этих системах также образуется непрерывный ряд твердых растворов,
а образование упорядоченных фаз не происходит из-за низкой температуры
упорядочения. В системе Fe-V большее значение TY приводит к образова-
нию упорядоченной фазы. При этом вычисленные характеристики находят-
ся в хорошем согласии с экспериментом.
Более сложная ситуация имеет место в системе Ni—Ti. При расчете в
указанных приближениях энергия образования NiTi оказывается занижен-
ной примерно в 2 раза, а равновесный объем завышенным. Если увеличить
перенос заряда от атомов Ti к атомам Ni (’’растягивая” функцию плотнос-
ти 4$-электронов Ti и ’’поджимая” Ni) так, чтобы вычисленный и экспери-
ментальный объем совпали, то перенос заряда составит 0,21. При этом энер-
гия образования хорошо согласуется с экспериментом. Температура упоря-
дочения NiTi значительно превышает температуру его плавления, поэтому
интерметаллид плавится не разупорядочиваясь. Аналогичная ситуация
имеет место в системах Fe—Ti и Со—Ti. Таким образом, в рассматриваемых
интерметаллидах на основе Ti ионная составляющая энергии связи играет
существенную роль.
Для системы Fe—Со ДЕ” оказывается положительной в парамагнитном
состоянии, т.е. рассматриваемые сплавы должны быть распадающимися.
Причина такого расхождения с экспериментом в неучете ферромагнетизма.
Для оценки роли ферромагнетизма в образовании сплавов Fe—Со обменно-
корреляционная энергия записывалась в спин-зависящем варианте:
Exc = —0,75(6/тг1,/3) J {[р| (г)]4/3 + [pt (г)]4/3 } <7г, (3)
v
где pt, Р( — плотность электронов со спином ’’вверх” и ’’вниз” соответст-
венно. Величина магнитного момента
М = / [pt (г) — рг (г)] dr (4)
связывалась с d-электронами и бралась в соответствии с экспериментом.
60
Расчеты показали, что равновесное значение объема практически не меняет-
ся, энергия образования становится отрицательной, а температура упоря-
дочения — равной 1400 К, что согласуется с экспериментом. Таким обра-
зом, и энергия образования, и энергия упорядочения FeCo имеют сущест-
венно ферромагнитный характер. Заметим, что в сплавах NiCo, NiFe маг-
нитные моменты практически не меняются, поэтому приведенные в таблице
вычисленные характеристики этих сплавов изменяются слабо.
На рис. 1 приведены концентрационные зависимости вкладов от кине-
тической (1,1'), обменно-корреляционной (2,2'), электростатической
(3,3') энергий в энергию образования сплавов Fe—V в упорядоченном
и неупорядоченном состояниях соответственно. Для других систем знак
каждой из составляющих энергии образования такой же, как и в Fe-V,
меняются лишь их абсолютные значения.
Низкотемпературные диаграммы состояния сплавов переходных ме-
таллов. На основе метода параметризованных функционалов электрон-
ной плотности можно построить эффективные энергии взаимодействия
пар атомов в сплавах переходных металлов. Для этого запишем, соглас-
но [2], кинетическую энергию в виде суммы
T=Tc+Th+Tch, (5)
где Тс - кинетическая энергия остовных электронов, Th - валентных
электронов, Tch — вклад, обусловленный перекрыванием волновых функ-
ций остовных и валентных электронов. Будем считать, что атомные ос-
товы не перекрываются. Тогда Тс не дает вклада в энергию взаимодей-
ствия атомов. Два других слагаемых запишем [2] в виде
Th=fak f[p/t (г)] 5/3Jr, (6)
V
Tch= fW(r)ph(r)dr. (7)
V
Здесь рй(г) — плотность валентных электронов, IV(r) — ортогонализаци-
онный псевдопотенциал, кк = 0,3(Зтг2)2/3, /3 - параметр. Выберем плот-
ность электронов в кристалле как суперпозицию атомных плотностей
р(г) = S ря(г - R,), (8)
i
где ра (г - R,) - плотность электронов в атоме, находящемся в узле кри-
сталлической решетки с координатами R,. В этом представлении выра-
жения для Eest и Tch носят парный характер. Чтобы выделить из Th и
Ехс парные члены, представим валентную плотность в виде
Ph(r) = Po + Др(г). (9)
При этом Ро =NhIV, где Nh — число электронов в кристалле. Разлагая
Ехс и jV/, в ряд по AZ’(r), получим
т„ = т?,+ът;, + ^хт,1’ + му,,
I '1 (10)
Ехс = Алс + 2 Ехс + — S я;,. + 6ЕХ(.
< 2 ij
61
Рис. 1. Парциальные вклады в
энергию образования сплавов
системы Fe-V в упорядоченном
и неупорядоченном состоянии
Рис. 2. Кривая температур пере-
хода ’’порядок-беспорядок” в
системе Fe-V
Рис. 3. Кривая температур пе-
рехода ’’порядок-беспорядок”
в системе Fe-Ni
Первые слагаемые в выражениях (10) зависят только от объема си-
стемы, вторые - это одноатомные энергии, третьи - парные энергии вза-
имодействия, a 8Th и 8ЕХС - вклады выше парных. Пренебрегая 8Tlt и
8ЕХС в выражениях для Th и Ехс> получим полную энергию сплава в пар-
ном приближении.
Анализ показал, что 8Th и 8ЕХС составляют около 0,1% от Th и Ехе.
Результаты расчетов для Fe и V, а также для системы Fe-V (энергии свя-
зи, модули всестороннего сжатия, энергии образования и упорядочения),
проведенных в парном приближении, хорошо согласуются с эксперимен-
том и расчетами [2].
Рассчитанные энергии взаимодействия пар атомов на различных коор-
динационных сферах подставлялись в метод вариации кластеров для рас-
чета диаграмм типа ’’порядок—беспорядок” в системах Fe-Vи Fe—Ni.
Кривые температур упорядочения для этих систем приведены на рис. 2
и 3 соответственно. В обоих случаях рассматривалось упорядочение из
ОЦК решетки в сверхструктуру CsCL Из рисунков следует, что в обеих
системах возможно образование сплавов, упорядоченных в сверхструк-
туре CsCl, т.е. FeV и FeNi соответственно, что подтверждается экспери-
ментальными данными [8, 9]. При этом в обеих системах температуры
62
упорядочения для CFe = 50% завышены, так как учитывалось взаимо-
действие лишь на двух координационных сферах.
В системе Fe—Сг имеет место другая ситуация. Энергии образования
для сплавов этой системы положительны, т.е. имеет место распад. Но
энергия упорядочения сплава FeCr отрицательна, и он существует в не-
котором интервале температур, что согласуется с экспериментальными
данными [9]. Рассчитанная величина этого интервала ~300°С также хо-
рошо совпадает с экспериментом, однако он смещен примерно на 220° С
вверх по температуре по сравнению с экспериментом.
Таким образом, разработанная методика в общем верно описывает
диаграммы типа ’’порядок-беспорядок” в системах ^-переходных ме-
таллов и в дальнейшем может применяться для расчета низкотемпера-
турных диаграмм многокомпонентных систем.
ЛИТЕРАТУРА
1. Хон Ю.А., Кузнецов В.М., Дворецкий В.Я., Фадин ВЛ. Расчет полной энергии пере-
ходных металлов методом модельного функционала электронной плотности. -
Изв. вузов. Физика, 1981, № 6, с. 93-97.
2. Дворецкий В.Я., Хон Ю.А., Кузнецов В.М., Фадин В.П. Расчет энергий образования
сплавов методом модельного функционала электронной плотности. - Изв. вузов.
Физика, 1982, № 1, с. 32-35-
3. Hohenberg Р„ Kohn W. Inhomogeneous electron gas. - Phys. Rev. В - Solid State, 1964,
vol. 136, N 3, p. 864-871.
4. Кривоглаз M.A., Смирнов A.A. Теория упорядочивающихся сплавов. Мл Физматгиэ,
1958.388 с.
5. Слэтер Дж. Методы самосогласованного поля в теории молекул и твердых тел. М.:
Мир, 1978. 675 с.
6. Kohn W„ Sham L.J. Self-consistent equations, including exchange and correlation ef-
fects. - Phys. Rev. A - Gen. Phys., 1965, vol. 140, N 4, p. 1133-1138.
7. Вол A.E. Строение и свойства двойных металлических систем. М.: Физматгиэ, 1962.
Т. 2. 982 с.
8. Гоманьков В.И., Пузей И.М., Лошманов А.А., Мальцев ЕЛ. Дальний порядок в спла-
вах системы Fe-Ni. - Изв. АН СССР. Металлы, 1971, № 1, с. 160-163.
9. Эллиот Р.П. Структура двойных сплавов. М.: Металлургия, 1970. Т. 1.455 с.
3. ПРОГНОЗ И КЛАССИФИКАЦИЯ ДИАГРАММ
РАВНОВЕСИЯ ФАЗ
УДК 669.01.018+51:155.001.57
ОБУЧЕНИЕ ЭВМ ПРОГНОЗИРОВАНИЮ ФАЗ И ИХ СВОЙСТВ
В МЕТАЛЛИЧЕСКИХ СИСТЕМАХ
В.Б. Грибуля, Е.М. Савицкий
Известно, что диаграмма состояния является средством описания резуль-
татов эксперимента. Она позволяет представить качественное и количест-
венное изменение состояний вещества с изменением контролируемых воз-
действий. Термодинамическое обоснование диаграммного метода изобра-
жения состояний вещества, данное Д.В. Гиббсом [1], дает исчерпывающий
ответ на вопрос о первичной информации, необходимой для описания фа-
зового равновесия в системе. Источником информации является само
синтезированное вещество.
Неоднозначность эксперимента часто выявляет такие особенности си-
стем, которые не укладываются в рамки единообразного описания систе-
мы. По существу речь идет о различных системах состояний, отвечающих
разным условиям эксперимента. Для практических целей весьма важно
обеспечить относительную устойчивость такого фазового состояния, ко-
торое ответственно за сохранение заданного комплекса и уровня свойств
материала. В связи с этим вопросам критериев образования фаз и их ус-
тойчивости посвящено значительное количество исследований [2, 3]. Раз-
витие новых областей техники, таких, например, как процессы с исполь-
зованием газотранспортных реакций, создание приборов на пленочных
материалах, конструкций с использованием композиционных матери-
алов и т.д., ставит перед физикохимией проблему углубления содержа-
тельности описания возможных состояний вещества.
Неполнота знаний в материаловедении, и в частности в металловедении,
касается прежде всего фаз как главных объектов физико-химических
систем и материальной основы сплавов. Однако вопрос формирования
знаний, как показывает опыт, не решается безграничным накоплением
данных опыта. Выбор эксперимента становится одним из главных эле-
ментов поиска. При этом в качестве одного из основных условий выбора
принимаются затраты на эксперимент.
По этой причине важно найти ответ на вопрос о необходимом и доста-
точном объеме экспериментальной информации, позволяющей оценить
возможность и условия фазовых переходов для неисследованных или
частично исследованных физико-химических систем. Если наука не рас-
полагает теоретическим аппаратом, позволяющим привести исходную
информацию в систему, из которой бы с необходимостью следовали вы-
64
воды о свойствах любой наперед заданной системы, то целесообразно
использовать главный метод формирования знаний — классификацию.
Когда результат эксперимента при данном уровне знаний ясен, т.е. ве
щество может быть отнесено к некоторому заранее известному типу (или
классу), то целесообразно найти хотя бы формальные признаки соответ-
ствия совокупности известных данных указанному типу.
Иными словами, нужно сформировать формально-логические отноше-
ния между исходными параметрами и условным индексом класса. Под
условным индексом класса будем понимать некоторое название, термин,
шифр или просто номер, присваиваемый объектам с экспериментально
установленным для них общим свойством. Например, можно рассматри-
вать классы кристаллических структур, скажем А15, С14, о-фазы и т.д.,
типы кристаллохимических реакций, уровень свойства (больше, меньше
или равно заданной величине) и пр. В последнем случае переходим к рас-
пространению процессов классификации на отображение количественных
характеристик объектов. Как только классификационный критерий сфор-
мирован, любой объект заданной природы может быть рассмотрен на
соответствие этому критерию. Открывается возможность прогноза.
Описанный принцип лежит в основе всякого обучения. Будучи реализо-
ван на ЭВМ, он носит название обучения ЭВМ. ЭВМ обучается классифи-
кации всех или некоторого множества объектов на экспериментальных
примерах отдельных объектов этого множества. Этот научный подход
описан в работе [4].
С применением автоматической обучающейся системы впервые был
получен прогноз существования фаз в металлических и других неоргани-
ческих системах. Каждый химический элемент при этом должен иметь
однозначное описание. Под описанием понимается перечень значений
свойств, качественных характеристик, которые принимаются за признаки
описываемого объекта и в совокупности определяет этот объект. Напри-
мер, каждый химический элемент может определяться положением в
Периодической системе Д.И. Менделеева. Тогда в перечень признаков
войдут: атомный номер, номер периода, номер группы, номер подгруппы
элемента. Это описание может быть дополнено другими данными, если
таковые имеются. Сочетание значений признаков, встречающееся только
в одном классе, образует описание класса или логическое выражение,
которое и позволяет относить каждый новый объект данного множества
к соответствующему классу.
Очевидно, что при обучении ЭВМ логическое выражение для каждого
из классов будет существенно различным. Оно является отображением
описания элементов на свойство класса веществ. Описание элементов
в данном случае может рассматриваться как алфавит, из него по опреде-
ленным правилам образуются слова и своеобразный ’’текст”, который
в принципе может быть расшифрован семантически, т.е. как смысловое
выражение.
Таким образом, из ограниченного множества данных может быть из-
влечена максимально полезная информация. Варьирование обучающим
материалом и набором исходных данных позволяет повышать надежность
результата и совершенствовать знания о рассматриваемых объектах. При-
нятие решений с помощью обучения ЭВМ относится к области кибернетики,
5. Зак.244 65
именуемой искусственным интеллектом. Развитие систем искусственно-
го интелекта существенно связано с совершенствованием поколений ЭВМ.
В этой области ведутся интенсивные исследования, так как оно открыва-
ет перспективы охвата автоматизацией практически всех областей чело-
веческой деятельности. В основе искусственного интеллекта лежит модели-
рование интеллектуальных процессов.
Для того чтобы оценить плодотворность научного подхода, важно рас-
смотреть результаты кибернетического прогнозирования, полученные
десятилетие назад и опубликованные в печати [4]. Эти результаты публи-
куются с 1968 г. [5]. В таблице приводятся данные по материалам прог-
ноза соединений стехиометрических составов.
Результаты сравнения данных прогноза и эксперимента
для трех типов соединений определенного состава
Соедине- ние Количество объектрв Количество ошибочных обучающих примеров Год под- ведения итогов
для обучения прогнозиро- ванных проверенных
+ - а б
АВ 207 155 2929 758 68 Не выявлены 1972
883 81 21 1983
А2В 593 484 6834 586 57 Не выявлены 1972
778 71 14 1983
А3В 730 727 5907 257 25 Не выявлены 1972
511 35 29 1983
Знаками ”+” и обозначены соответственно положительные и отри-
цательные объекты, взятые для обучения, т.е. примеры наличия соедине-
ний данного состава в системе A-В и отсутствия таких соединений. Про-
веряемые объекты по опубликованным экспериментальным данным могут
совпадать (а) или не совпадать (б) с прогнозом. По таблице видно, что
несовпадение с экспериментом составляет менее 10%.
Особый интерес представляет прогноз интерметаллидов. Хорошо из-
вестны работы по поиску критериев образования ряда фаз, например фаз
Лавеса. Обращено внимание на корреляцию образования в системах фаз
с размерами взаимодействующих атомов, электроотрицательностями,
положением элементов в Периодической системе Д.И. Менделеева, соот-
ношением термодинамических величин и др. [3] В то же время авторами
отмечается недостаточность данных, предлагаемых в качестве критерия.
Для интерметаллидов в наибольшей мере наблюдаются расхождения в кор-
реляции критериальных подходов с возможностью образования соответст-
вующих фаз. Даже комплексное использование критериев оказывается не-
достаточным для прогнозирования и оказывается пригодным для описа-
ния качественных моделей.
Полученные прогнозы интерметаллидов с определенной кристалли-
ческой структурой основаны на данных об электронном строению компо-
нентов. Цель исследований состояла в том, чтобы извлечь наибольшую
информацию из ограниченного объема данных об элементах, так как на
66
Фрагмент прогноза металлических соединений типа Си5Са, опубликованного в 1973 г.
[4,6]
Условные обозначения: 1 — соединение должно существовать, 2 — совпадение ре-
зультата прогноза с экспериментом, 3 — несовпадение результата прогноза с экспе-
риментом, 4 — известное ранее соединение, использованное для обучения ЭВМ, 5 —
известный ранее пример отсутствия соединения в системе, использованный для об-
лучения. По вертикальной оси указаны компоненты А, по горизонтальной — компо-
ненты В, соответствующие составу А5В
практике чаще всего в ситуации, требующей прогнозирования, наблюда-
ется ограниченность знаний. Электронное строение изолированных атомов
непосредственно связано с атомным номером.
Таким образом, приходим к использованию Периодического закона
в неявной форме. Полученные результаты для ряда фаз показали, что
использование ЭВМ позволяет вести поиск глубинных аналогий в перио-
дичности изменения свойства, ускользающих от умозрительного анализа.
Более миллиона однообразных логических операций, выполняемых ЭВМ
за часы или даже минуты (в зависимости от типа ЭВМ), освобождают
исследователя от непосильного труда и дают приемлемый практический
результат.
Для примера рассмотрим фрагмент данных прогноза фаз типа СаСи5,
приведенных на рисунке. Эти результаты были получены в 1973 г. [6].
67
Каких-либо убедительных критериев образования фазы этого типа пока
не найдено. Поэтому результаты проверки временем (10 лет с момента
первой публикации) представляют принципиальный интерес для заключе-
ния о плодотворности нового подхода. В момент публикации нам было
известно 103 двойных интерметаллида, имеющих структуру типа СаСи5.
В настоящее время имеется информация о синтезе 20 таких фаз, а для
ряда двойных фаз такого же состава кристаллическая структура пока
не установлена, например для MnsLu, MnsEu, PdsSm и др. Для последних
также прогнозируется структура типа СаСи5. Для обучения ЭВМ было
использовано 38 экспериментальных примеров. Остальные 65 соедине-
ний (из 103 известных) были проверены на сходимость с результатом
прогноза. Несовпадение было обнаружено для соединения эрбия с медью
(ЕгСи5). Проверка результатов прогноза на последующих 20 соединениях
выявила несоответствие еще для двух соединений эрбия (ZnsEr и PtsEr).
Для одного соединения (Cu5Tm) получен отказ в прогнозе. Предполагае-
мая причина отказа — неточность исходной информации по отрицательным
примерам; например в системе Си—Ва, исследованной лишь частично,
соединения рассматриваемого типа не обнаружено. Эта информация ис-
пользована в обучении, но она не дает полной уверенности в окончатель-
ности и надежности этих данных.
Таким образом, ошибка прогноза в сумме по контрольным и вновь
полученным данным составляет 3,5%. Приведенные примеры показывают
относительную достоверность отрицательных данных. Поэтому оценка
отрицательного прогноза в силу специфики второго класса проблематична.
Прогноз, получаемый описанным путем, является первым приближением.
В каждом конкретном случае он может быть уточнен и могут быть оцене-
ны критические точки прогнозируемого вещества [7—10]. Таблицы прог-
ноза в силу большого объема данных (более 10 тысяч точек) не могут
рассматриваться как предписание для эксперимента, но как ориентир
в выборе объектов для опыта они могут служить весьма нужным и по-
лезным справочным материалом.
Существо данного теоретического подхода далеко не исчерпывается
прикладными результатами. Следующий этап применения искусственного
интеллекта в физикохимии состоит в извлечении из материалов обучения
информации о причинно-следственных связях явлений.
ЛИТЕРАТУРА
1. Гиббс Д.В. Термодинамика. Статистическая механика. М.: Наука, 1982. 584 с.
2. Теория фаз в сплавах. М.: Металл у ргиздат, 1961. 358 с.
3. Устойчивость фаз в металлах и сплавах. М.: Мир, 1970. 408 с.
4. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганичееких соединений с
помощью ЭВМ. М.; Наука, 1977. 192 с.
5. Савицкий Е.М., Девингталь Ю.В., Грибуля В.Б. Прогноз металлических соединений
типа А3В с помощью электронно-вычислительной машины. - ДАН СССР, 1968,
т. 183,№5,с. 1110-1112.
6. Савицкий Е.М., Грибуля В.Б. Прогноз двойных кристаллических фаз со структу-
рой типа CaCas при помощи ЭВМ. - ДАН СССР, 1974, т. 214, № 5, с. 1059-1062.
7. Савицкий Е.М., Грибуля В.Б. Прогнозирование тугоплавких соединений в двой-
ных системах при помощи ЭВМ. - В кн.: Структура и свойства жаропрочных
металлических материалов. М.: Наука, 1973, с. 3-10.
8. Савицкий Е.М., Шелест А.Е., Грибуля В.В. Статистическая оценка и анализ прогно-
за температуры плавления тугоплавких соединений. - В кн.: Физико-химические
исследования в металлургии и металловедении с применением ЭВМ. М.: Наука,
1974, с. 101-110.
9. Грибуля В.Б., Савицкий Е.М. Оценка с помощью ЭВМ температуры перехода в
сверхпроводящее состояние двойных соединений типа А15. - ДАН СССР, 1978,
т. 240, №2, с. 316-319
10. Савицкий Е.М., Киселева Н.Н., Шкатова Т.М. Кибернетико-статистический подход
к поиску веществ с заданными свойствами. - Изв. АН СССР. Неорган. материалы,
1982, т. 2. с. 235-238.
УДК 546:681.142.36
КИБЕРНЕТИЧЕСКОЕ ПРОГНОЗИРОВАНИЕ ВОЗМОЖНОСТИ
ОБРАЗОВАНИЯ И СВОЙСТВ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
В ТРЕХКОМПОНЕНТНЫХ СИСТЕМАХ
Е.М. Савицкий, Н.Н. Киселева
Одной из основных научных проблем разработки новых материалов
является поиск веществ с заданными свойствами. Особую важность при
решении этой проблемы представляет априорный расчет и прогнозирова-
ние состава новых веществ и соответствующих этому составу свойств.
Теоретический расчет и прогнозирование следует рассматривать не как
аппроксимацию уже известных экспериментальных данных, а как априор-
ное предсказание свойств сложных физико-химических систем на основе
свойств более простых.
Для прогноза новых веществ авторами использован кибернетический
подход. Возможность образования конкретной фазы и ее свойства прог-
нозируются на основе свойств химических элементов или более простых
соединений с использованием для обучения ЭВМ сведений о других из-
вестных фазах. Физико-химической базой кибернетического прогнозиро-
вания является Периодический закон. Речь идет о существовании периоди-
ческих закономерностей, связывающих свойства химических соединений
с положением в Периодической системе образующих их элементов (или,
точнее, со свойствами элементов, зависящими от атомного номера). Для
простых соединений: окислов, гидридов, галогенидов — закономерности
сравнительно просты. Однако уже для бинарных интерметаллидов и трех-
компонентных соединений периодические связи резко усложняются. Обуче-
ние ЭВМ — это метод поиска сложных закономерностей, связывающих
свойства однотипных объектов и позволяющих отделить последние от
объектов другой природы.
Первые опыты по использованию обучающихся вычислительных машин
для прогноза металлических систем [1, 2] показали перспективность
предложенного подхода. Специфической особенностью прогнозирования
свойств двойных металлических фаз является то, что наибольшую инфор-
мацию о поведении интерметаллидов дает электронное строение изоли-
рованных атомов компонентов [1, 2]. При переходе к тройным фазам,
особенно в тех случаях, где одним из компонентов системы является
неметалл, электронное строение менее информативно, чем физико-хими-
69
Характеристика результатов прогноза тройных фаз
Состав Прогнозируемая ха- ракте ристика Количество объектов Количество проверен- ных прог- нозов Достовер- ность, % Источник
обучения прогно- за
АВО2 Во з мо жно сть о бра- зования соединения 165 360 77 95 [4]
abs2 То же 175 610 23 83 [5]
ABSe2 111 674 20 95 151
АВТе2 73 712 12 99 [5]
АВОЭ 382 1967 84 85 [61
АВОЭ Структура типа перовскита 247 2102 33 56 [6]
аво4 Возможность обра- зования соединения 223 1872 47 99 (6]
ав2о4 То же 313 2194 66 98 [6]
ав2 04 Структура типа шпинели 190 2317 35 89 [6.7]
ab2s4 То же 218 1636 8 99 [7,8]
АВ2 Se4 ъ 167 1003 21 99 П.8]
AB2S4 Возможность обра- зования соединения 375 1479 34 97 [8]
АВ2 Se4 То же 220 950 34 94 [8]
АВ2Те4 »» 40 627 30 79 [9]
а2 в2о, >> 274 674 38 79 [Ю]
а2в2о, Структура типа пиро хлора 174 714 31 77 [Ю]
АВ, Si2 Структура типа ThCr2 Si2 152 399 28 96 ПИ
abf4 Во з мо жно сть о б ра- зования соединения 161 306 26 92 [12]
abci4 То же 107 149 9 89 [12]
АВВг4 45 188 7 72 [12]
ческие свойства химических элементов и бинарных фаз (потенциалы иони-
зации, термодинамические свойства и т.д.).
При использовании различных совокупностей свойств компонентов
для повышения достоверности прогнозирования авторами было предло-
жено сравнивать результаты прогнозов для различных совокупностей
свойств: электронного строения, физико-химических свойств элементов
и свойств бинарных соединений. Решение о существовании той или иной
фазы или ее свойствах принималось, если результаты прогнозов с исполь-
зованием различных свойств химических элементов или простых .«еди-
нений не противоречили друг другу. Физико-химической основой такого
подхода является то, что все свойства элементов и простых соединений
тесно коррелируют друг с другом и с атомным номером. Поэтому прог-
нозы с использованием различных свойств должны в общем совпадать.
70
s
Na Cu Aq
Li К Rb Csi
Se
Li Aq
Nu 3Tl
в
AL
5с
Ti
Сг
Ni
Gq
Y
In
Се
Рг
Nd
Cd
Tb
Dy
HO
Er
Tm
Lu
©□□□□I
©©П©П©ПП©1
ППП©ПСПНП|
© ©©ПКИП!___
© ©©©nn©©©
□□□©□□□□□□□
©□□©□©□ПП©©
□©□©ипппп©п
®®
®±
в
N
Al
Sc
Ti
Fe
Gg
Y
Rh
In
5b
La
Ge
Pr
©©©©©©□©
□□©©□©©©
©©©©©©□©
©©□□□©©□
□©©□□□□a
©©©©©□©□
©©©©©□©□
©©©©□□□©
□□□□©□©□
©©©□□□©□
DK
, _ ©©©©©©П©©П
©©©©©©йн©©п
П©©ПН©©П
©©ЯП©©©
__ n©nczzz
©©©©□©nn©©©
©©©©□©□□©©□
nil
ПЯ
i
©©□□□□n©
ПСССППЙП
|+|®|Ф
©©©©п©ппп©п
©©©©ППППР©П
®1 ©2 +3 -4 •5 Kff
Tb
ЛУ
Ho
Er
Tm
Yb
Lu
Bi
©©©□□□□©
©©©С zion©
©©©□□□□©
©©©□□□□©
©©©ODOD©
©©©CZ 300©
©©©ODOO©
©©©OHOO©
OO©QQOO©
□©©©□©□©
X
©@®l@®
Рис. 1. Фрагмент таблицы прогноза возможности образования соединений состава
ABX2(X = S,Se)
Здесь и на рис. 2 и 3: 1 — соединение образуется и данные об этом использованы
при обучении ЭВМ, 2 — соединение при заданном составе не обнаружено и сведения
об этом использованы при обучении ЭВМ, 3 - ЭВМ прогнозирует образование сое-
динения заданного состава, 4 — ЭВМ прогнозирует отсутствие соединения при задан-
ном составе, 5 — прогноз образования соединения подтвержден экспериментально,
6 — прогноз образования соединения экспериментально не подтвержден. Пустые клет-
ки сортветствуют несовпадениям результатов прогноза по разным совокупностям
свойств компонентов
Рис. 2. Фрагмент таблицы прогноза возможности образования соединений состава
аво2
Несовпадения вызваны малой информативностью свойств, их относитель-
но грубой дискретизацией и ошибками в обучающей выборке. Возможной
физической причиной является также метастабильность соединений и
полиморфизм кристаллических структур при нормальных условиях. В
среднем 75—80% прогнозов не противоречат друг другу, что свидетель-
ствует о правильности подхода.
Для прогноза новых фаз используется программная система обучения
ЭВМ процессу формирования понятий ’’Анализатор” [3].
За время, прошедшее со дня получения прогнозов, в литературе появ-
ляются новые сведения о прогнозируемых системах. В таблице приведены
значения достоверности прогнозирования, рассчитанные на основе сравне-
ния экспериментальных данных с прогнозом. На рис. 1—3 приведены фраг-
менты результатов прогноза возможности образования соединений в окис-
71
Рис. 3. Фрагмент таблицы прогноза возможности образования соединений состава
АВО4
ных и халькогенидных системах. По результатам сравнения прогнозов
с литературными данными подсчитывается достоверность прогнозирова-
ния. Если достоверность прогнозирования мала, то ЭВМ переобучивается
с использованием новых данных. Из таблицы следует, что с наибольшей
ошибкой (по сравнению с литературными данными) прогнозируется
перовскитная структура у окисных соединений состава АВО3 [6]. Срав-
нительно малая достоверность прогноза в этом случае связана с большим
количеством ошибок в экспериментальном определении типа кристал-
лической структуры у соединений, взятых для обучения ЭВМ. Предпо-
лагается переобучивание кибернетической системы с целью получения
уточненных прогнозов о наличии перовскитной структуры у соединений
состава АВО3.
Использование недостоверных и неполных данных ухудшает резуль-
таты кибернетического прогнозирования. Единственным реальным путем
преодоления неполноты информации является создание банков данных
по неорганическим фазам. В настоящее время в ИМЕТ АН СССР создают-
ся банки данных по двойным и тройным фазам. На их основе будут раз-
рабатываться информационно-прогнозирующие системы с использова-
нием технических средств диалогового взаимодействия специалиста
с ЭВМ.
Расширение методологии кибернетического прогнозирования связано
с предсказанием возможности образования четырехкомпонентных фаз
и оценкой их свойств. В настоящее время получены первые результаты
прогноза возможности образования четверных соединений (в двойных
солевых системах с общим кислородсодержащим анионом). Важным
направлением исследований, непосредственно связанным с разработкой
банков данных, является априорная оценка свойств фаз (температур
фазовых переходов, электрических и магнитных свойств и т.д.). Первые
удачные попытки в этой области [2, 13—15] свидетельствуют о плодо-
творности кибернетического подхода к прогнозированию физических
свойств фаз.
ЛИТЕРАТУРА
1. Савицкий Е.М., Девингталь Ю.В., Грибуля В.Б. О распознавании двойных диаграмм
состояния металлических систем. - ДАН СССР, 1968, т. 178, № 1, с. 79-81.
. 2. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 192.
3. Гладун В.П. Эвристический поиск в сложных средах. Киев: Наук, думка, 1977.
166 с.
72
4. Киселева Н.Н., Савицкий Е.М. Прогноз неорганических соединений состава АВО,
с применением обучающейся ЭВМ. - ДАН СССР, 1977, т. 235, № 6, с. 1367-1370.
5. Савицкий Е.М., Киселева Н.Н. Кибернетическое прогнозирование существования
фаз состава АВХ2. - Изв. АН СССР. Неорган. материалы, 1979, т. 15, № 6 с. 1101 —
1102.
6. Киселева Н.Н., Покровский Б.И., Комиссарова Л.Н., Ващенко Н.Д. Моделиро-
вание образования сложных окислов из исходных компонентов на основе кибер-
нетического метода формирования понятий. - ЖНХ, 1977, т. 22, вып. 4, с. 883—
887.
7. Savitskii Е.М., Grihulya V.B., Kiselyova N.N. On the application of cybernetic prediction
systems in the search for new magnetic materials. - J. Less-Common Metals, 1980, vol.72,
p. 307-315.
8. Киселева H.H., Савицкий Е.М. Прогнозирование халькогенидных шпинелей общей
формулы АВ2Х4 с применением метода обучения ЭВМ. - ЖНХ, 1979, т. 24, вып. 6,
с. 1427-1429.
9. Савицкий Е.М., Киселева Н.Н., Ващенко Н.Д. Применение обучающихся ЭВМ
для поиска новых соединений состава АВ2Те4. - ДАН СССР, 1978, т. 239, №5,
с. 1154-1 156.
10. Савицкий Е.М., Гладун В.П., Киселева Н.Н. Прогноз соединения состава А2В2О,
со структурой пирохлора. - ДАН СССР, 1977, т. 233, № 4, с. 657-660.
11. Киселева Н.Н., Савицкий Е.М. Прогнозирование образования тройных силицидов
со структурой типа ThCr2Si2. - Изв. АН СССР. Неорган. материалы, 1983, т. 19,
№3, с. 489-491.
12. Киселева Н.Н., Савицкий Е.М. Прогнозирование соединений состава АВГал4 в
галогенидных системах. - ЖНХ, 1982, т. 27, вып. 11, с. 2880-2884.
13. Савицкий Е.М., Киселева Н.Н. Прогнозирование сверхпроводящих фаз Шевре-
ля. - ДАН СССР, 1978, т. 239, № 2, с. 405-407.
14. Киселева Н.Н., Савицкий Е.М. Кибернетическое прогнозирование селенидных
фаз Шевреля. - ЖНХ, 1981, т. 26, вып. 5, с. 1364-1367.
15. Савицкий Е.М., Киселева Н.Н., Шкатова Т.М. Кибернетико-статистический под-
ход к поиску веществ с заданными свойствами. - Изв. АН СССР. Неорган. ма-
териалы, 1982, т. 17, № 2, с. 235-238.
УДК 669.112.295.24
АНАЛИЗ И КЛАССИФИКАЦИЯ ДВОЙНЫХ ДИАГРАММ
СОСТОЯНИЯ ТИТАНА ПО ТЕРМОДИНАМИЧЕСКИМ ПРИЗНАКАМ
Д.Б. Чернов
Существующие классификации двойных диаграмм состояния титана
либо обладают излишней обобщенностью, как, например, классификация
И.И. Корнилова, включающая всего четыре типа диаграмм [1], либо осно-
ваны на учете фазовых равновесий лишь прилегающей к титану области
[2]. Более последовательный подход к систематизации двойных диаграмм
титана должен быть основан на учете термодинамических факторов, в
частности: 1) параметров межатомного взаимодействия для ОЦК и ГПУ
фаз титана с легирующими элементами, т.е. £°цк и Е’гпу, вычисляемых
с применением широко известной модели регулярных растворов [3, 4];
2) относительной стабильности ОЦК и ГПУ структур самих легирующих
элементов, т.е. параметров стабильности ДууОцк^гпу, д^оцк-^гпу
Систематика проведена с учетом работ о генезисе диаграмм состояния
в зависимости от параметров взаимодействия и стабильности [3, 5].
Анализ экспериментальных данных о двойных системах титана показал,
73
Соотношение параметров межатом-
ного взаимодействия титана с эле-
ментами Периодической системы для
ГПУ и ОЦК фаз и подразделение их
на подгруппы
что большинство противоречий
по виду и строению диаграмм
состояния связано в основном с
различной чистотой исследован-
ных сплавов.
Для вычисления параметров
взаимодействия использовались
границы для высокочистых спла-
вов [6,7], а также методы рас-
чета на основе эмпирических
критериев [4]. Данные о пара-
метрах приведены на рисунке.
По величинам параметров взаимодействия все элементы можно
разбить на три группы. В I группу входят элементы, для которых парамет-
ры взаимодействия в обоих фазах положительны и достаточно велики по
модулю (свыше 50 к Дж/моль). Твердые растворы элементов в ГПУ и ОЦК
модификациях титана очень ограничены, и системы имеют явно выражен-
ную тенденцию к расслоению. Эта тенденция уменьшается от подгруппы
1а к подгруппе 1в, где при высокой температуре имеется непрерывная раст-
воримость в ОЦК фазе (la—Li, Na, Са, Mg; 16—Y, La, РЗМ; 1в—W).
Ко II группе отнесены также элементы с положительной, но умеренной
по модулю избыточной энергией смешения. Параметры взаимодействия
от 4,2 до 4,2 кДж/моль. С учетом относительной стабильности элементов,
а также энергии упорядочения при образовании интерметаллидов в этой
группе выделяются три подгруппы.
В подгруппу Па входят элементы с большей стабильностью ОЦК струк-
туры по отношению к ГПУ структуре V, Nb, Та, Мо. Эти четыре элемента
имеют с титаном простую диаграмму состояния с непрерывно понижаю-
щейся (а + (3) /|3-границей и метастабильной мнимой областью несмешивае-
мости внутри (а + р) -области.
Подгруппа Пб включает элементы-аналоги титана (Hf, Zr, Sc). Из них
Hf и Zr образуют непрерывные ОЦК и ГПУ растворы, a Sc лишь в ОЦК
модификации. Параметры взаимодействия нарастают в последователь-
ности Zr—Hf—Sc. Положительные величины параметров указывают на
возможность появления области несмешиваемости в твердых ГПУ
растворах. Для Sc параметры взаимодействия достаточно велики по
модулю и области бинодального распада значительно расширяются по тем-
пературе и концентрации, а диаграмма состояния включает области
(а, + а2)-, (Pi + Зз)-равновесий и монотектоидную горизонталь и, таким
образом, тяготеет к подгруппе 1в.
В подгруппу Пв включены элементы с относительно большой по модулю
энергией упорядочения при образовании соединений Сг, U. Несмотря на то
что системы характеризуются общей склонностью к расслоению твердых
74
растворов, в них образуются интерметаллиды титана типа фаз Лавеса.
Стабильность этих интерметаллидов невелика.
III группа элементов характеризуется отрицательной величиной избыточ-
ной энергии смешения. Величины параметров взаимодействия отрицатель-
ны, и большинство систем характеризуется высокой склонностью к упоря-
дочению и образованию интерметаллидов. Эта группа также разбита на
подгруппы по принципу возрастания энергии взаимодействия и, как следст-
вие, увеличения количества соединений и роста их стабильности и влияния
на ОЦК Ji ГПУ превращение в титане.
Подгруппа Ша включает элементы с меньшей стабильностью ОЦК
структур по отношению к их ГПУ структурам - Ru, Os, Со, RIth др. и эле-
менты с более высокой стабильностью ОЦК фазы - Fe и Si. Характерной
чертой, которая объединяет все эти элементы, является достаточно большое
значение разности параметров взаимодействия для ГПУ и ОЦК фаз, т.е.
величины (£’ГПУ-£’°Ц!<). Это приводит к тому, что перечисленные эле-
менты активно снижают температуру полиморфного превращения в титане.
Подгруппа III6 включает элементы, для которых параметры взаимо-
действия для ГПУ структуры более отрицательны (Al, Ga, In), т.е.
(£ГПУ _£°ЦК) 4,2 кДж/моль, сюда же тяготеют олово и свинец, для
которых величина (£ГПУ-£<)ЦК) « 0. При этом для А1 и Ga разность
свободных энергий ГПУ и ОЦК фаз при 1155 К составляет - 1,1 и
4,7 кДж/моль соответственно, а для Sn близка к нулю. Таким образом,
эти элементы повышают температуру (а Ji (3) -превращения в титане.
Подгруппа Шв включает элементы, образующие с титаном растворы
внедрения, т.е. кислород и азот, и повышающие температуру полиморфного
превращения в титане.
Ьсобенностью рассматриваемой классификации является возможность
непрерывного перехода от одной группы к другой, а также между под-
группами. Переходным элементом между 1в и Пб подгруппами является
Sc, на диаграмме состояния которого имеется монотектоидная реакция.
Между подгруппами 16 и Пв переходным элементом является U.
Элементы Мп, Тс, Re являются переходными между Пв и Ша подгруп-
пами. Углерод, бор, а также серебро, кадмий и цинк тяготеют к подгруппе
Шб. В целом рассмотрение взаимодействия титана с перечисленными эле-
ментами позволяет сделать следующие выводы.
1. Разбиение элементов на группы по значениям параметров межатомно-
го взаимодействия и относительной стабильности структур самих элементов
позволяет систематическим образом объяснить вид диаграмм состояния.
2. С возрастанием степени межатомного взаимодействия тип диаграмм
состояния сменяется от практически полного расслоения как в жидкой,
так и в твердых фазах (при £°цк ^£Тпу > gg кДж/моль) через моно-
тектоидный (W, Sc : Еои-К ~ 21 кДж/моль) и ретроградный типы
(V, Nb) к диаграммам с фазами Лавеса (Сг, U : £°цк = 17 кДж/моль.)
и устойчивыми интерметаллидами (Ru, Fe Еои-К = 17 ч- 19 кДж/моль)
и далее к соединениям ионного типа (TiO2 и др.).
3. Степень влияния элементов на (а (J)-превращение в титане определя-
ется различием в интенсивности их взаимодействия с ГПУ и ОЦК структу-
рами титана, а также относительной стабильностью ОЦК и ГПУ структур
самих элементов.
75
/r-ГПУ гОЦКч
По величинам разности параметров взаимодействия я )
и относительной стабильности ОЦК и ГПУ структур легирующих элемен-
тов они располагаются в ряд
д gOUK^rny - 1,7 - 1,1 0 0 3,2 10,1 10,1 10,1
Ga А1 Sn Zr Si Та V Nb
£ГПУ£ОЦК -3,3 -4,0 0 5,1 1,0 0,2 0,2 2,1
-0,5 8,4 8,4 8,4 -0,8 -1,9 -2,6 +3,6
Си Сг Мо W Мп Ni Со Fe
10,8 14,2 16,3 18,8 28 29,3 42 20,9
Этот ряд определяет интенсивность влияния элементов на полиморфное
превращение в титане. Галлий и алюминий стабилизируют ГПУ структуру,
олово занимает промежуточное положение, а остальные элементы действу-
ют как ОЦК стабилизаторы и их влияние нарастает в направлении к железу.
Предложенная систематика ближе всего к классификации С.Г. Глазу-
нова, но отличается следующими признаками: 1) учет полного вида
диаграммы состояния, а не только примыкающей к титану области прак-
тически для всех элементов периодической системы; 2) непрерывность
перехода между типами диаграмм.
Рассматривая характер изменения вида диаграмм состояния, отметим,
что вычисленные по фазовым границам параметры взаимодействия имеют
четкую тенденцию к снижению по мере перехода к высокочистым
сплавам. Это связано со снижением содержания в сплавах таких элемен-
тов, как кислород и азот, действие которых приводит к ослаблению меж-
атомных связей между основными компонентами [6, 7]. Трансформация
диаграмм состояния происходит в направлении расширения областей
твердых растворов, уменьшения областей бинодального распада и снижения
’’провисания” кривых ликвидуса. Отмеченные изменения приводят к
переходу двойной системы из одного подкласса в другой, что, очевидно,
можно ожидать при дальнейших исследованиях ряда систем с редкими
и редкоземельными элементами при повышении чистоты материалов.
Такой переход будет наблюдаться в направлении уменьшения алгебраи-
ческих величин параметров взаимодействия.
Термодинамический подход к систематизации двойных диаграмм
состояния целесообразен и для других групп двойных систем различных
сплавов и, кроме того, перспективен для -классификации тройных и
многокомпонентных систем.
ЛИТЕРАТУРА
1. Корнилов И.И. Титан. М.: Наука, 1975. 308 с.
2. Глазунов С.Г. - В кн.: Фазовые равновесия в металлических системах. М.: Наука,
1981,с. 105-112.
3. Каменецкая Д.С. -ЖФХ, 1948, т. 22, № 1, с. 81-89.
4. Кауфман Д., Бернстейн X. Расчет диаграмм состояния с помощью ЭВМ. М.: Мир,
1972. 326 с.
5. Аптекарь И.Л., Каменецкая Д.С. - В кн.: Диаграммы состояния в материаловеде-
нии. Киев: ИПМ, 1979, с. 13-35.
6. Чернов Д.Б., Шиняев А.Я. - Изв. АН СССР. Металлы, 1975, № 5, с. 212-219.
7. Чернов Д.Б., Шиняев А.Я.,Савицкий EJT. - ДАН СССР, 1975, т. 225, № 2, с. 390-
392.
4. БАНКИ ДАННЫХ ПО ДИАГРАММАМ СОСТОЯНИЯ
УДК 541.121.536.7
БАНКИ ДАННЫХ ПО ДИАГРАММАМ СОСТОЯНИЙ
МЕТАЛЛИЧЕСКИХ СИСТЕМ:
СОВРЕМЕННОЕ СОСТОЯНИЕ, ПРОБЛЕМЫ,
ПЕРСПЕКТИВЫ ИХ РАЗВИТИЯ И ПРИМЕНЕНИЯ
С. Б. Масленков, А.Л. Удовский
В данной работе рассматривается проблема создания банков данных
(БД) по диаграммам состояний (ДС) и термодинамическим свойствам
(ТС) металлических систем (МС). При этом основное внимание уделя-
ется следующим вопросам: 1) зачем нужны БД по ДС и ТС МС и насколько
остро стоит этот вопрос; 2) какие задачи могут быть решены с помощью
этих БД, т.е. каковы должны быть результаты их функциональной деятель-
ности и воздействия на узловые вопросы современного материаловедения
и современной технологии создания новых материалов; 3) каким требо-
ваниям должны удовлетворять данные, хранящиеся в памяти БД;
4) какова должна быть структура и инфраструктура БД по ДС и ТС МС.
Известно, что основным носителем информации при разработке новых
сплавов являются ДС. Кратко рассмотрим степень изученности количества
ДС многокомпонентных МС относительно возможного их числа среди
89 элементов Периодической системы, для которых построена хотя бы
одна двухкомпонентная ДС (2ДС).
К настоящему времени построено около 2500 2ДС, что составляет 63%
относительно возможного их числа, около 3100 ЗДС и около 320 4ДС,
составляющих соответственно 3 и 0,01% относительно возможного их
числа. Исходя из существующих среднегодовых темпов исследования
150 неисследованных ранее 2ДС, 150 ЗДС, 10-15 4ДС и примерно по 1 5ДС
в течение 1958—1980 гг., оценки показывают, что для ЗДС необходим
период 575 лет, а для 4ДС - 250 тыс. лет для достижения той же степени
изученности, что и для 2ДС, если их строить только традиционными экспе-
риментальными методами. Эти темпы не соответствуют современным тре-
бованиям развития научно-технического прогресса, которые предъяв-
ляются к материаловедению.
В 1957 г. Мейеринг впервые рассчитал изотермическое сечение (ИТС)
при 1203 К ДС системы Cr-Cu-Ni; он использовал модель регулярных
растворов, параметры которой были им определены из ограниченных
экспериментальных данных по 2ДС систем Сг—Ni, Си—Сг, Си—Ni [1].
Результаты расчета хорошо согласовывались с экспериментальными дан-
ными по ЗДС.
77
На рис. 1 представлена эволюция количества рассчитанных ЗДС и
4ДС МС за период 1957-1981 гг. Данные рис. 1 свидетельствуют о бурном
росте количества рассчитанных ЗДС с использованием термодинамичес-
ких расчетов за последнее десятилетие, а именно: темпы построения
ЗДС с использованием термодинамических расчетов составили в среднем
~ 30 ЗДС в год. Это соответствует 25-30% от среднегодового числа
построенных ЗДС. Таким образом, термодинамические расчеты ДС много-
компонентных МС с использованием ЭВМ — это современный этап разви-
тия физико-химического анализа сплавов [2].
В нашей стране за редким исключением превалирует доля построенных
ЗДС только традиционным экспериментальным методом. Это приводит
к тому, что, во-первых, темпы построения ЗДС в нашей стране на протя-
жении последних 20 лет остались прежними, а во-вторых, опубликованные
советскими исследователями данные по ДС и ТС сплавов служат для
зарубежных исследователей информационным сырьем для построения более
полных и более многокомпонентных ДС для создания целой гаммы новых
материалов. При этом следует учитывать, что более половины всех иссле-
дованных в мире ДС изучается в нашей стране [3].
В последние 5 лет появились сообщения о разрабатываемых и уже
частично функционируемых специализированных БД по ДС и ТС МС
[4-15].
Укажем ряд практически важных задач, которые решаются с помощью
термодинамических расчетов ДС, поскольку расчет ДС не является само-
целью, а существенно ускоряет их решение.
1. Расчет высокотемпературных эвтектик в ЗДС для получения естест-
венных композиционных материалов для лопаток газовых турбин (напри-
мер, для системы Al-Cr-Nb был осуществлен расчет ЗДС [16], для систе-
мы Cr—Со—Zr расчет ЗДС [17], для Al—Mo—Ni [18]).
2. Определение областей устойчивости охрупчивающих фаз в ЗДС и
4ДС (например, авторы [19, 20] вычислили область стабильности о-фазы
в системе Fe—Cr—Ni—Si при 800 К, что представляет существенный интерес
для разработки материалов из нержавеющей стали для ядерных реакторов,
хорошо сопротивляющихся свелингу под облучением).
3. Выбор материалов химически совместимых друг с другом в заданном
рабочем интервале температур (например, были построены с применением
термодинамического расчета ЗДС системы U-C-N [21], U-Pu-N [22],
U—Pu—С [23, 24], Pu—С—N, на базе которых была построена 4ДС системы
U—Pu—С—N [25], одно из ИТС которой приведено на рис. 2. Это позво-
лило выявить область температур и составов монокарбонитридов уран-
плутониевого топлива, химически совместимого с углеродом, которым
можно покрывать микротвэлы из топлива; аналогичная проблема хими-
ческой совместимости возникает при создании композиционных материа-
лов в целях предотвращения растворения материала армирующих волокон
в материале матрицы.
4. Расчет так называемых бездиффузионных Го—состав ДС, позволяю-
щих выбирать оптимально составы сплавов для создания аморфных спла-
вов или металлических стекол.
5. Определение эвтектического состава сплава, обладающего большой
теплотой фазового перехода, для использования его в качестве теплового
78
Рис. 1. Эволюция количества рассчитанных
трехкомпонентных (ЗДС)и четырехкомпо-
нентных (4ДС) диаграмм состояний метал-
лических систем (Д) по годам
Рис. 2. Изотермическое сечение при 1640°С
диаграммы состояния системы U-Pu -
C-N
аккумулятора (например, во Франции для этой цели разработан спла^
эвтектического состава в системе NaCl-KCl-BaCl 2). 1
6. Расчеты ЗДС систем Al—Li—Mg и Са—Li—Mg позволили определить
температурно-концентрационные поля сплавов, разрабатываемых для
отрицательных электродов в высокотемпературных батареях [26].
7. Построение и аналитическое описание фазовых границ 2ДС и ЗДС
позволяет разработать на базе микро-ЭВМ метод экспресс-контроля
определения по кривым охлаждения сплавов концентраций С и Si в чугу-
нах по ходу плавки в целях их модифицирования [27]. Создание БД по
ДС и ТС МС позволит в еще большей степени распространить среди
исследователей метод построения ЗДС и 4ДС с применением термодина-
мических расчетов и ускорит решение многих важных практических задач
материаловедения.
Остановимся на требованиях, которым должны удовлетворять данные,
хранящиеся в БД по ДС и ТС МС. В соответствии с ГОСТ 8.310-78 установ-
лены следующие категории данных: 1) справочные данные (СД) - данные
о свойствах веществ и материалов в числовом, графическом или аналити-
ческом виде, достоверность которых не оценена органами Государственной
службы стандартных справочных данных (ГСССД); 2) рекомендуемые
справочные данные (РСД) — аттестованные органами ГСССД достоверные
данные о свойствах веществ и материалов, точность которых удовлетворяет
требованиям народного хозяйства; 3) стандартные справочные данные
(ССД) - достоверные данные о физических константах и свойствах важ-
нейших веществ и материалов, обладающих наивысшей точностью утверж-
денные Госстандартом.
К настоящему времени нам не известна ни одна 2ДС, ни тем более ЗДС,
которая могла бы быть паспортизована в виде РСД или ССД. Известно
много двухкомпонентных систем, которые имеют по нескольку вариантов
2ДС. Следует также иметь в виду, что по мере усовершенствования изме-
рительной аппаратуры и технологии получения все более чистых веществ
постоянно происходит уточнение данных как по ДС, так и по ТСМС.
Поэтому, учитывая перечисленные задачи для функционирования БД по
ДС и разнородность требований к фактографическим данным, целесообраз-
но создавать многоступенчатую систему сбора и хранения данных по степе-
ни достоверности. В противном случае могут быть затрачены большие
средства на создание целой сети БД по ДС и ТСМС, а результаты, кото-
рые станут окупать затраченные средства, будут получены через долгие
годы.
Перечислим ряд проблем, связанных с созданием БД по ДС иТСМС,
и возможные пути их решения.
1. Что загрузить в БД по ДС и ТС МС? Ответ далеко не однозначен. Целе-
сообразно организовать систему входных данных в виде динамически
изменяемых семейств файлов. Одно семейство файлов следует отнести
к ДС, другое - к ТС МС. Оба семейства должны характеризовать все чистые
компоненты, т.е. однокомпонентные системы, например их Т-Р ДС и
термодинамические характеристики, относящиеся как к фазовым перехо-
дам чистых компонентов, так и к температурным зависимостям теплоем-
кости, сжимаемости, коэффициента термического расширения в виде
наборов констант.
80
Для двухкомпонентных систем целесообразно также иметь по крайней
мере два семейства файлов: одно по 2ДС, второе по ТС МС; аналогично
для трехкомпонентных систем и т.д. Каждое семейство файлов
целесообразно разбить на тома файлов: в 1-м томе можно хранить все
имеющиеся варианты, например по 2ДС, но исключая такие, которые явно
противоречат основным принципам термодинамики фазовых равновесий;
во 2-м томе — отобранные экспертами экспериментальные данные, получен-
ные ими на основе качественного, но не количественного анализа имею-
щихся вариантов; в 3-м томе - данные, которые согласованы термодина-
мическим расчетом между экспериментальными данными по 2ДС и ТС МС,
измеренных в различных фазовых областях 2ДС; в 4-м томе — данные,
полученные путем различных оценок, например, с помощью физико-эмпи-
рических моделей типа модели Мачлина [28] или квантовомеханических
[29, 30].
Авторы [28] рассчитали по физико-эмпирической модели парного потен-
циала концентрационные зависимости теплот образования ОЦК и ГЦК
фаз 66 бинарных систем, образованных всеми комбинациями А1, Со, Сг,
Си, Fe, Мп, Мо, Nb, Ni, Si, Ti и W, и сравнили с экспериментальными термо-
химическими данными, получив для 93% расчетных систем различие в
± 1 ккал/моль. Ватсон и Беннет на основе параметрической модели, учи-
тывающей электронную зонную структуру переходных металлов, вычис-
лили энтальпии образования для 276 двойных сплавов переходных метал-
лов эквиатомного состава, предварительно определив оптимизированные
значения параметров из экспериментальных данных по теплотам образова-
ния для 61 сплава. В 5-м томе можно собирать и хранить данные, которые
аттестованы органами ГСССД как РСД или как ССД.
2. В какой форме следует хранить данные по ДС и ТС МС, которые
в силу исторических причин принято в настоящее время представлять в
виде графиков? Нам представляется более рациональным хранить эти
данные в свернутой форме, например в виде коэффициентов Фурье,
аппроксимирующих зависимостей свойство—состав в виде разложения в
ряд по ортогональным полиномам типа смещенных полиномов Якоби,
если в наличии имеется информация только в графической форме.
Если же информация представлена в виде экспериментальных точек, т.е.
пары или тройки чисел, то в виде числового массива. Для преобразования
информации графического вида как для фазовых границ 2ДС, так и ТС
в зависимости от состава нами решена задача по графоаналитическому
преобразованию гладких зависимостей свойство-состав для двухкомпо-
нентных систем. В качестве примера приведена таблица по графоаналити-
ческой свертке двух кривых ликвидуса и солидуса 2ДС системы U-Zr.
Набор коэффициентов Фурье для каждой кривой позволяет хранить 2ДС
в компактной форме во внешней памяти ЭВМ на магнитных дисках или
лентах.
3. В какой форме следует представлять информацию по 2ДС, ЗДС и
ТС МС для удовлетворения спроса потребителя? Целесообразно
предусмостреть выдачу фактографических данных, во-первых, из
любого семейства и тома файлов; во-вторых, в любой из трех форм:
табличной с распечаткой на АЦПУ с заданным шагом по составу и темпе-
ратуре, в графической с выводом на графический дисплей, в случае необ-
6. Зак. 244 81
Коэффициенты Фурье аппроксимационных зависимостей кривых
ликвидуса и солидуса системы U-Zr
Фазовая граница Температура, °C Концентрация 2-го компонента
L/L + ОЦК 1132-1850 0,00-1,00
Коэффициенты
АО =1132 02 = 281,95 С4 = 74,42 06 = 15,66 08 =0,14 010 = 8,15
А1 =718 С3 = 46,12 С5 =-15,39 07 = 14,41 09 = 0,53
ОЦК/ОЦК + L 1132-1850 0,00-1,00
АО =1132 С2 = -221,89 С4 = 37,03
А1 =718 С3 = 76,66 С5= 13,09
ходимости — на графопостроитель и, наконец, в аналитической в виде
набора коэффициентов Фурье. Причем кроме самих фактографических
данных целесообразно предусмотреть выдачу ссылки на источники полу-
чения этих данных.
4. Должна быть разработана система моделей, позволяющая
рассчитывать и описывать ТС неупорядоченных, частично упорядоченных,
полностью упорядоченных растворов замещения, внедрения, интерметал-
лических соединений с бесконечно узкой и широкой областями гомоген-
ности, соединений с различными подрешетками и твердыми растворами
между ними. В качестве примера применения феноменологической модели
на рис. 3 представлена рассчитанная нами в модели регулярных растворов
ДС разреза UC-UN [31,32].
В качестве примера применения квантовомеханической модели в идеоло-
гии псевдопотенциалов на рис. 4 приведена рассчитанная нами совместно
с А.М. Гайдуковым [33] 2ДС системы K-Rb в сравнении с экспериментом.
Проблема заключается в создании корректных и достаточно унифициро-
ванных моделей и их обобщенного математического описания.
5. Следует разрабатывать достаточно универсальные методы, алгоритмы
и программы для ЭВМ по расчету ДС. Частично эта проблема решена -
разработан общий метод, алгоритм и программа для ЭВМ БЭСМ-6, позво-
ляющая полностью автономно, т.е. без участия расчетчика на всей стадии
расчета, рассчитывать 2ДС для любого числа фаз переменного состава,
каждая из которых может описываться обобщенной феноменологической
моделью неупорядоченных растворов замещения, охватывающей большин-
ство известных для этого класса моделей.
На рис. 3 работы С.Б. Масленкова, А.Л. Удовского, А.М. Гайдукова (см.
наст, сб.) приведена рассчитанная указанными авторами 2ДС системы
Mo—Rh, которая имеет четыре фазы переменных составов й в температур-
ном интервале 2240-2245 К до пяти двухфазных конод; существенно,
что эта 2ДС была рассчитана полностью на ЭВМ за один проход, а не по
частям, как это в настоящее время рассчитывается существующими про-
граммами, тогда как традиционная методика потребовала бы расчета
шести попарных равновесий между четырьмя фазами. Более детально
разработанный метод расчета 2ДС описан в работах [33, 34].
6. Следующая проблема заключается в построении системы методов
62
1 — экспериментальные данные [ 37 ]
Рис. 4. Сопоставление результатов термодинамического расчета с использованием
теории псевдопотенциала для ОЦК растворов в системе K-Rb [33, 34]
1 - экспериментальные данные, 2 - рассчитанные ликвидус и солидус, 3 - рассчи-
танные кривые расслоения
расчета по оптимизации при решении обратных задач. Обратная задача
формулируется в простейшем виде так: в рамках заданного класса моде-
лей путем расчета определить такую модель и соответствующие наборы
коэффициентов-параметров взаимодействия, описывающих избыточные
ТС сплавов в зависимости от состава и температуры, и параметров ста-
бильности для чистых компонентов, чтобы при заданной топологии ДС
минимизировать среднеквадратичную разность между расчетными и экспе-
риментальными данными по ТС сплавов и фазовым границам ДС системы.
В итоге решения этой задачи должны быть получены взаимосогласующиеся
данные по ДС и ТС сплавов, а также ТС для тех фазовых областей ДС,
где экспериментальные исследования не были проведены. Тем самым
данные по семейству файлов по ДС, которых, как правило, на 2-3 порядка
больше числа данных по ТС МС, позволят путем расчета получать ТС МС
и существенно пополнять семейство файлов по ТС МС, а это в свою оче-
редь позволит рассчитывать ДС еще более компонентных систем, опираясь
на полученные ТС для менее компонентных подсистем и разрозненные
экспериментальные данные по многокомпонентным сплавам, позволяю-
щим корректировать рассчитанные ДС.
Первые результаты в этой области получены в ИМЕТ им. А.А. Байкова
АН СССР. На рис. 5 в качестве примера приведена рассчитанная авторами
совместно с А.М. Гайдуковым [34] 2ДС системы Nb—Мо, полученная
термодинамическим методом расчета и прямой оптимизацией фрагментар-
ных экспериментальных данных по солидусу и избыточным термодинами-
ческим функциям ОЦК растворов этой системы. Проведенные недавно
[35] измерения высокотемпературным ДТА в ИСМ АН УССР по определе-
63
Рис. 5. Рассчитанные солидус и ликвидус диаграммы состояния системы Nb-Mo, вы-
численные прямой оптимизацией с использованием экспериментальных данных по
солидусу и термодинамическим данным для ОЦК растворов
Рис. 6. Температурно-концентрационная эволюция <Ui_xPu^Cli5 >-фазных вершин
четырех трехфазных конод [24, 36]
Трехфазные коноды: 3'— МС,jS + а-МС2 + /?'-МС2, 7 — L + /3*-МС2 + МС, 15, 8-
fl-MC2 + Д'-МС2 + МС, >5, 8' - L + /3-МС2 + МС, >5, где L - жидкая фаза, М- (U, Ри)
нию температур содилуса и ликвидуса в пределах ошибки опыта хорошо
согласуются с результатами наших расчетов.
7. Поскольку создание полностью автономных и универсальных про-
грамм термодинамического расчета ЗДС и 4ДС - длительный процесс,
целесообразно также создание методов и пакета прикладных программ
для работы на ЭВМ в интерактивном режиме по термодинамическому
расчету отдельных фрагментов ЗДС, так как это сейчас реализовано во
всех существующих БД по термодинамическим расчетам фазовых равно-
весий [6,9, И, 13,15] .
На рис. 6 в качестве примера разработки и применения такого частного
метода термодинамического расчета двухфазных конод между изоморфны-
ми растворами линейных соединений приведены результаты наших расче-
тов для системы U-Pu—С [24, 36], позволившие описать температурно-
концентрационную зависимость <U1_xPuJCCjj5 >-фазных вершин четы-
рех трехфазных конод и определить температуры и составы вершины
U! _лРилС1>5 при протекании четырехфазных реакций, чему соответствуют
на рис. 6 точки А, В, D и F. Более детально этот метод описан в работе [22].
Следует отметить большую сложность выполнения описанной програм-
мы в целом по всем системам, образованным между всеми парами, трой-
ками и т.д. элементов таблицы Д.И. Менделеева. Поэтому более целесо-
образно создавать специализированные БД по ДС и ТС МС в различных
институтах, в первую очередь в системе АН СССР, обладающей наиболее
квалифицированными научными кадрами. Так, например, в СССР уже на-
чали функционировать БД по ТС индивидуальных веществ: ИВТАНТЕРМО
84
[38] в Москве, АСТРА - Автоматизированная система термодинамических
данных и расчетов равновесных состояний в Информационно-вычисли-
тельном центре ИПМ АН УССР в Киеве [39].
Большого внимания заслуживает вопрос взаимной стыковки банков
данных, например БД по ДС и ТС с БД по кристаллографическим свойст-
вам, по спектроскопическим характеристикам, с системами по квантово-
механическим, в частности зонным, расчетам, с тем чтобы выходные данные
одного БД могли быть непосредственно переданы и использованы как
входные данные для другого БД. Подобная инфраструктура различных
БД позволила бы существенно повысить результативность научных исследо-
ваний в области создания новых материалов, и аккумулированные в БД
экспериментальные и теоретические результаты научных исследований,
полученные в течение многих десятилетий, могли быть материализованы
в виде научно-технических преобразований в области создания новых
неорганических материалов и технологий их получения. А в будущем
БД позволят перейти к созданию единой автоматизированной научно-
информационной системы страны, подобно функционирующей единой
энергетической системе.
ЛИТЕРАТУРА
1. Metering J.L. Calculation of the nickel-chromium-copper phase diagram from binary
data. - Acta met., 1957, vol. 5, p. 257-264.
2. Масленков С.Б., Удовский А.Л. Термодинамические расчеты фазовых диаграмм
многокомпонентных систем - современный этап развития физико-химического
анализа сплавов. - В кн.: XII Менделеевский съезд по общей и прикладной химии:
Рефераты докл. и сообщ. М.: Наука, 1981,№5,с. 104-106.
3. Ageew N. V. Ageewa D.L., Kolesnikova Т.Р., Petrova L.A. Organisation of phase diagram
information in the Soviet Union. - In: Abstracts. Workschop on application of phase
diagrams in metallurgy and ceramics. Gaithersburg: NBS, 1977, p. M3-M4.
4. Chart T.G., Counsell J.F., Jones J.P. et al. Provisioned use of thermodynamic data for
the solution of high temperature practical problems. - Intern. Met. Rev., 1975, vol. 20,
p. 57-82.
5. Dinsdale A.T. The NPL alloydata bank and its use in the calculation of multicompo-
nent alloy phase diagrams. 1978, July. 37 p. (NPL Rep. Chem.; N 90).
6. Chart T.G., Dinsdale A.T., Putland F. The NPL alloydata bank: Its use in calculation
of phase diagrams for superalloys development. - In: The industr. use of thermochem.
data: Proc. conf. L., 1980, p. 235-245. (Spec. Publ. Chem. Soc.; N 34).
7. Barry T.I. Inorganc and metallurgical databanks: Their aims and future. - In: The in-
dustr. use of thermochem. data: Proc. conf. L., 1980, p. 26-36. (Spec. Publ. Chem.
Soc.; N 34).
8. Dewey R.J., Rand M.H. The computer storage and manipulation of thermodynamic
data. Harwell: AERE, 1978.
9. Kaufman L., Nesor H. Systems for storage and retrieval of thermochemical data and
calculation of phase diagrams. - In: Conf, on сотриt. simulat. for mater, appl. Gaithers-
burg: NBS, 1976, p. 1-11.
10. Kaufman L. Utilisation of data bases and computer techniques for solving metallurgical
problems. - In: The industr. use of thermoch. data: Proc. conf. L., 1980, p. 215—
233. (Spec. Publ. Chem. Soc.; N 34).
11. Ansara I. Phase diagram information from computer banks. - In: Application of phase
diagrams in metallurgy and ceramics, 1978, p. 123-141. (NBS Spec. Publ.; N 496).
12. Ansara I. Comparison of methods for thermodynamic calculation of phase diagrams. -
Intern. Met. Rev., 1979, vol. 1, p. 20-53.
13. Barin I., Frassek B., Gallagher R., Spencer P. Aufbau und Nutzung either thermody-
namischen Datenbank fur anorganische Stoffe. - Erzmetall, 1980. Bd. 33, N 4, S. 226-
231.
14. Gallagher R., Nussler H.D., Spencer P.J. Computer calculation of multicomponent phase
equilibria. - Physica B,1981, vol. 103, p. 8-20.
15. Lin P.L., Pelton A.D., Bale C.W., Thompson W.T. An interactive computer program
for calculation ternary phase diagrams. - Calphad, 1980, vol. 4, N 1, p. 47-60.
16. Kaufman L., Nesor H. Prediction of new eutectic systems: Review and forecast. - In:
Conf, in-situ composites. Lexington (Mass.), 1976, vol. 2, p. 11-26.
17. Chart T.G., Putland F.H. A thermodynamic cally calculated phase diagram for the
Co-Cr-Zr system. - Calphad, 1979, vol. 3, N 1, p. 9-18.
18. Kaufman L., Nesor H. Calculation of superalloy phase diagrams. 2. - Met Trans., 1974,
vol. 5,p. 1623-1629.
19. Chart T.G., Putland F.H., Dinsdale A. Calculated phase equilibria for the Cr-Fe-Ni-Si
system. 1. Ternary equilibria. - Calphad, 1980, vol. 4, N 1, p. 27-46.
20. Chart T.G., Putland F.H., Dinsdale A. Calculation of the Cr-Fe-Ni-Si. - In: Calphad
VIII, Stockholm, 21-25 May, 1979. Stockholm, 1979, p. 188-203.
21. Удовский А.Л., Алексеева З.М. Анализ фазовых равновесий в системе U-C-UN. -
В кн.: Сплавы для атомной энергетики. М.: Наука, 1979, с. 17-26.
22. Удовский А.Л., Алексеева З.М. Анализ фазовых равновесий системы U-Pu-C-N
в интервале температур 1400-1750 ° С. - В кн.: Диаграммы состояния тугоплав-
ких систем. Киев: ИПМ АН УССР, 1980, с. 93-119.
23. Удовский А.Л., Алексеева 3JH. Анализ фазовых равновесий в системе уран-
плутоний-углерод в интервале температур 1335-1800°C. - В кн.: Фазовые
равновесия в металлических сплавах. М.: Наука, 1981, с. 230-242.
24. Удовский А.Л., Алексеева З.М. О диаграмме фазовых равновесий системы уран-
плутоний-углерод в интервале 1200-2430 ° С. - ДАН СССР, 1982, т. 262, № 2,
с. 382-386.
25. Удовский А.Л., Алексеева З.М. Анализ фазовых равновесий системы U-Pu-C-N
в интервале 1400-1750°С. - ДАН СССР, 1982, т. 264, № 3, с. 647-65J.
26. Hsu С.С., Sabougni M.L. Calculation of isothermal sections of theCa-Li-Mg. - Ztschr.
Metallk., 1978, Bd. 69, S. 581-586.
27. Масленков С.Б., Удовский А.Л., Шелковый Э.А. и др. Использование аналитическо-
го представления диаграмм состояния, кривых охлаждения сплавов и микро-ЭВМ
для экспресс-контроля углерода и кремния в чугунах по ходу плавки. - В кн.:
IV Всесоюз. совещ. ’’Диаграммы состояния металлических систем”: Тез. докл.
М.: Наука, 1982, с. 62-63.
28. Birnie D., Machlin E.S., Kaufman L., Teylor К. Comparison of pair potential and ther-
mochemical models of the heat of formation of BSS and FCC alloys. - Calphad, 1982,
vol. 6,p. 96-126.
29. Bennet L.H., Watson R.E. A database for anthelpies of formation binary transition
metal alloys. - Calphad, 1981, vol. 5, N 1, p. 19-23.
30. Watson R.E., Bennet L.H. Optimized prediction for heats of formation of transition
metal alloys. - Calphad, 1981, vol. 5, N 1, p. 25-40.
31. Удовский А.Л. Термодинамический расчет фазовой диаграммы системы UC-UN. -
В кн.: Сплавы для атомной энергетики. М.: Наука, 1979, с. 27-33.
32. Удовский А.Л., Иванов О.С. Термодинамический расчет фазовой диаграммы
системы UC-UN. - In: Thermodynamics of nuclear materials, 1979. Vienna: IAEA,
1980, vol. 2, p. 229-246.
33. Масленков С.Б., Удовский А.Л., Гайдуков A.M. Этап разработки общего метода
термодинамического расчета диаграмм состояний двухкомпонентных систем,
его реализации в виде автономных программ для ЭВМ и примеры их применения
для феноменологических и квантовомеханических моделей. - В кн.: IV Всесоюз.
совещ. ’’Диаграммы состояния металлических сплавов”: Тез. докл. М.: Наука,
1982, с. 19.
34. Гайдуков А.М., Удовский А.Л., Масленков С.Б. Алгоритм общего метода термоди-
намического расчета диаграмм состояний двухкомпонентных систем. - В кн.:
III Всесоюз. шк. ’’Применение математических методов для описания и изучения
физико-химических равновесий”: Тез. докл. Новосибирск: ИНХ СО АН СССР,
1980,ч. 1, с. 76-80.
35. Кочержинский Ю.А., Василенко В.И. Диаграмма плавкости системы молибден-
ниобий. - ДАН СССР, 1981, т. 257, № 2, с. 371-373.
36. Удовский А.Л., Алексеева З.М. Термодинамические расчеты фазовых равновесий
86
при построении диаграммы состояния системы U-Pu-C в интервале 1200-
2500°С. - В кн.: XII Менделеевский съезд по общей и прикладной химии: Реф.
докл. и сообщ. М.: Наука, 1981, № 5, с. 111-112.
37. Benz R. - Melting point maxima of ThC-ThN and UC-UN solit solutions. - J. Nucl.
Matei., 1969, vol. 31, p. 93-99.
38. Гурвич Л.В. ИВТАНТЕРМО - автоматизированная система данных о термодинами-
ческих свойствах индивидуальных веществ. - В кн.: 1ХВсесоюз. конф, по калори-
метрии и химической термодинамике: Расширенные тез. докл. Тбилиси: Мецние-
реба, 1982, с. 5-9.
39. Трусов Б.Г., Бадрак С.А., Туров В.П. и др. Автоматизированная система термоди-
намических данных и расчетов равновесных состояний. - В кн.: Математические
методы химической термодинамики. Новосибирск: Наука, 1982, с. 213-218.
УДК 669.017 + 681.32
БАНКИ ДАННЫХ ПО ДИАГРАММАМ СОСТОЯНИЯ
В АВТОМАТИЗИРОВАННЫХ СИСТЕМАХ НАУЧНЫХ ИССЛЕДОВАНИЙ
Ф.С. Новик, И.Ю. Кожевников, И.И. Гулътяй
Актуальной проблемой современного этапа развития науки и техники
является создание автоматизированных систем научных исследований
(АСНИ). Цель такой системы в области металловедения — поиск металли-
ческих материалов с заранее заданным комплексом свойств либо из числа
уже существующих, либо усовершенствование имеющихся или создание
новых. Архитектурно АСНИ в области металловедения может представлять
собой интерактивный пакет прикладных программ, состоящий из управ-
ляющей программы, информационной системы и библиотеки программ
(рис. 1).
Основной частью управляющей программы является входной процессор,
на который поступают вопросы и ответы исследователя. Записанные на
проблемно-ориентированном языке, они проверяются с помощью словаря
и поступают в координирующую программу, которая в зависимости от
задания пользуется информационной системой или библиотекой программ
и формирует вопросы машины и ее ответы. В случае, когда требуется
экспериментальное исследование, координирующая программа с помощью
генератора вычислительных схем и программы-планировщика с использо-
ванием библиотеки программ определяет рабочую программу проведения
эксперимента. Библиотека программ состоит из готовых программ для
часто используемых процедур и библиотеки модулей, из которых коор-
динирующая программа составляет рабочие программы для нечасто встре-
чающихся процедур. Информационная система представляет собой библио-
теку или банки данных, в которых хранятся известные сведения о свойст-
вах материалов, а также диаграммы состояния. Взаимодействие отдельных
частей системы происходит с помощью операционной системы той ЭВМ,
которая используется (например, ОС или ДОС ЕС ЭВМ).
Важной частью информационной системы, рассматриваемой АСНИ,
должны явиться банки данных по диаграммам состояния, которые должны
обеспечивать возможность анализа диаграмм для предсказания по ним
фазового и структурного состояний сплавов, их критических точек и,
87
ИНФОРМАЦИОННАЯ СИСТЕМА
Рис. 1. Архитектура интерактивного пакета прикладных программ для АСНИ в об-
ласти металловедения
следовательно, режимов литья, деформации, термической обработки.
В соответствии с рекомендациями работ [1,2] основными частями банка
данных являются база данных и комплекс средств автоматизации, состоя-
щий из системы управления базой данных, информационно-поисковой
системы и системы управления запросами.
Структура банка данных по диаграммам состояния и содержание отдель-
ных его элементов показаны на рис. 2. Для функционирования банка
данных должны использоваться разные лингвистические средства: неза-
висимый от языков программирования язык описания данных, непроце-
дурный язык запросов высокого уровня и язык манипулирования данны-
ми, представляющий собой операторное или процедурное расширение
языка используемой операционной системы.
При создании банка данных по диаграммам состояния важнейшей про-
блемой является ввод диаграммы в память ЭВМ. Авторы [3], например,
считают, что в настоящее время основной задачей является не усовершен-
ствование или оптимизация фазовых диаграмм, а ввод их большого числа
в память ЭВМ для создания исходной базы данных. Существующие способы
ввода диаграмм можно разделить на две группы: использование методов
машинной графики и построение аналитических моделей диаграмм.
Методы машинной графики, в том числе и интерактивные, являются
основными, используемыми в зарубежных АСНИ (см., например, [3, 4]).
Все они основаны на считывании данных с рисунков диаграмм, изобра-
88
БАНК ДАННЫХ
♦ 1 1
БАЗА ДАННЫХ КОМПЛЕКС СРЕДСТВ АВТОМАТИЗАЦИИ
♦ ♦
Структурные единицы: поле (фазовая область) запись (диаграмма состояния) файл (диаграммы состояния на основе одного металла) база (все диаграммы состояния) СИСТЕМА УПРАВЛЕНИЯ БАЗОЙ ДАННЫХ ИНФОРМАЦИОННО ПОИСКОВАЯ СИСТЕМА СИСТЕМА УПРАВЛЕНИЯ ЗАПРОСАМИ
создание базы данных добавление и исключение записей выбор записи и поля преобразование записей в (из) форму выходных документов арифметические и логические преобразования обеспечение секретности и целостности данных оптимизация состава и структуры базы данных анализ, систематизация и выда<в пользователю проверка достоверности данных перезапись при изменении структуры базы данных обеспечение надежности хранения анализ вопроса и подготовка параметров для ИПС вызов и управление работой ИПС
Рис. 2. Общая структура банка данных по диаграммам состояния и функции отдель-
ных его элементов
женных на телевизионном экране с помощью различных сканирующих
устройств, подключенных к ЭВМ.
Одна из таких схем, по данным работы [4], показана на рис. 3. По этой
схеме рисунок диаграммы без каких-либо цифровых обозначений изобра-
жается на экране дисплея, а затем сканирующим устройством через анало-
го-цифровой преобразователь вводится в ЭВМ и записывается на магнитную
ленту или магнитный барабан. Числовые данные вводятся в машину от-
дельно. Методы машинной графики разработаны достаточно хорошо (см.,
например, [5, 6]), и достоинства их очевидны. Среди недостатков следует
отметить относительно низкую точность представления данных, сложную
логику при пользовании данными, необходимость иметь дорогостоящую
и дефицитную аппаратуру.
89
Рис. 3. Схема записи диаграмм состояния в ЭВМ в системе ADAM and Е ГЕ [4 ]
Ввод диаграмм состояния в память ЭВМ заметно облегчается, если для
диаграммы удается получить ту или иную математическую модель. Запись
модели в ЭВМ, как правило, не вызывает каких-либо сложностей при
программировании.
Широкое распространение получили термодинамические методы расчета
и анализа диаграмм состояния (см., например, [7, 8]). Актуальность и
перспективность этих методов не вызывает сомнений, особенно при изу-
чении еще неизвестных систем. Вместе с тем нельзя не отметить, что термо-
динамические расчеты приводят к построению зависимостей от состава
все же только свойств сплавов (химических потенциалов, энтропии, энталь-
пии, температур ликвидус, солидус и др.). В результате для решения прак-
тических задач полученными уравнениями впрямую не пользуются. Чтобы
их использовать, необходимо все же иметь геометрический образ либо
двойных систем, либо изображение того или иного разреза многокомпо-
нентной диаграммы.
В работах О.С. Иванова [9] впервые и наиболее четко рассмотрена
идея использования алгебраических многочленов для описания зависимос-
тей свойств сплавов от состава (см. также [10,11]). В этом случае появля-
ется возможность не пользоваться геометрическими образами. К сожа-
лению, получающиеся при этом ’’системы систем” уравнений оказываются
очень громоздкими, и если для описания диаграмм состав-свойство метод
вполне применим и используется, то для диаграмм состояния использовать
его пока не удалось.
Способ перестройки диаграмм состояния в так называемые физико-
химические графы был предложен в работах В.С. Штейна [12]. Метод
90
представляет собой попытку построения некоторой логико-аналитической
модели диаграммы, которую затем легко ввести в ЭВМ. К сожалению,
несмотря на ряд попыток, этот метод из-за громоздкости получающихся
графов и сложности их записи сколь-нибудь заметного распространения
не получил.
Для построения банка данных по диаграммам состояния следует при-
знать весьма перспективным метод, предложенный в работе [13]. Рассмот-
рим его подробней. Любую двойную диаграмму состояния предлагается
описывать моделью
У = s i ; у,; t), (1)
i = 1
где i — наименование фазовой области системы; ф,, у, - уравнения пря-
мых и кривых линий диаграммы в координатах f-x; х - содержание в
сплавах одного из компонентов; t — температура. Каждое слагаемое в
уравнении (1) соответствует i-й фазовой области. Функции П сводят в
единую модель уравнения отдельных кривых и прямых диаграммы и опре-
деляют границы существования каждой фазовой области как по температу-
ре П(?), так и по концентрации П(х). По сути дела эти функции являются
индикаторными. Например, функция П (т; и; z) равна 1 в интервале от
т до и и 0 - вне его, т.е.
[ 1 при z G (т, п ],
П(щ; и; z) = _ (2)
[ 0 при z е (т, н].
Подробности аппроксимации индикаторных функций л описаны в рабо-
те [14].
Например, любой сплав диаграммы состояния с непрерывным рядом
двойных твердых растворов может находиться в трех состояниях: при
температурах от комнатной Гк до солидуса Гс в состоянии 1 (фаза а),
в интервале от солидуса гс до ликвидуса (л в состоянии 2 (фазы а и Z),
выше ликвидуса tn до некоторой температуры tm в состоянии 3 (фаза!).
Температуры солидус и ликвидус зависят от состава:
Гс(х) = Сс(0; 1; х), (3)
гл(х)= Сл(0; 1;х). (4)
Таким образом, в соответствии с (1) диаграмма может быть описана
выражением
з
У = 2 г’П(^;; т/; (5)
i = 1
где Ф1 =tK, у! =Сс(0; 1; х), ф2 = уп у2 = Сл(0; 1; х), ф3 = у2, y3 = fm.
Если, например, требуется узнать, какие фазы имеет сплав Х| при тем-
пературе tlt то по уравнению (5) аналитически это выполняется следую-
щим образом. Вначале по (3) для х = Xi рассчитывается солидус сплава
Xi (гс1), а по (4) - ликвидус (гЛ1)- Тем самым определяется модель
изменения с температурой фазового состава сплавах!:
у = 1П(гк; гс1; О +2П(гс1; гл1; г) + ЗП(г„i; tm- г). (6)
91
Далее, та из функций ПС»//,; у,-; г), в интервал которой попала задан-
ная температура t j, принимает значение 1, а остальные оказываются равны-
ми нулю. Тем самым решается задача определения фазового состава спла-
ва при заданной температуре. Кроме того, если сплав оказывается в двух-
фазном состоянии, то уравнение (5) позволяет определить составы и
относительные количества фаз, находящихся в равновесии. В частности,
если сплав *i при температуре tx двухфазный, то состав твердой фазы
х! а (t 1) определяется из решения уравнения (3), а жидкой х, L (t i) -
из решения уравнения (4). Зная х j а (t i) и х1А (Г^, по правилу отрезков
легко определить относительные количества фаз
a/Z, = [x1L (h) —х1]/[х1 -Xia(r,)]. (7)
Аналогично строятся модели двойных диаграмм состояния любой слож-
ности (см., например, модель диаграммы Fe—Fe3C в работе [15]).
Ввод моделей типа (1) в память ЭВМ осуществляется по специально
составленной программе DIAG, состоящей из основной части и двух под-
программ; QV и F. В основную часть программы вводится число фазовых
областей, концентрации всех критических точек и коэффициенты урав-
нений кривых линий диаграммы. В этой части программы для заданного
сплава производится поиск фазовых областей, в которых он находится
в заданном температурном интервале. В подпрограмме QV осуществляется
расчет концентраций фаз, находящихся в равновесии при заданной тем-
пературе, а также относительных количеств фаз. Подпрограмма F пред-
назначена для расчета индикаторных функций. Программа написана на
языке ФОРТРАН и реализована на ЭВМ ЕС-1022.
Описанная в работе методом составлена база данных известных двой-
ных диаграмм состояния на основе алюминия.
ЛИТЕРАТУРА
1. Мартин Дж. Организация баз данных в вычислительных системах. М.: Мир, 1980.
662 с.
2. Дейт К. Введение в системы баз данных. М.: Наука. 1980. 411 с.
3. Murrey J., Orser D. Interactive computer grafics for storing phase diagrams. - Bull.
Alloy Phase Diagrams, 1980, vol. 1, N 1, p. 19-23.
4. Iwata S., Ishino Mishima Y. Alloy design by automatic modelling and estimation
of values from experimental data. - J. Fac. Eng. Univ. Tokyo. B, 1971, vol. 33, N 4,
p. 545-590.
5. Фокс А., Пратт M. Вычислительная геометрия. M.: Мир, 1982. 304 с.
6. Фролов С.А. Автоматизация процесса графического решения задач. Минск: Вы-
шейш. шк., 1980. 312 с.
7. Кауфман Л., Бернстейн X. Расчет диаграмм состояния с помощью ЭВМ. М.: Мир,
1972. 328 с.
8. Удовский А.Л. Современное состояние и перспективы термодинамического расчета
диаграмм состояния трех- и более компонентных систем. - В кн.: Диаграммы
состояния металлических систем. М.: Наука, 1981, с. 17-34.
9. Иванов О.С. Новые возможности в построении, фиксировании, хранении и исполь-
зовании диаграмм состояния многокомпонентных систем. - В кн.: Теоретические
и экспериментальные методы исследования диаграмм состояния металлических
систем. М.: Наука, 1969, с. 120-125.
10. Удовский А.Л., Гайдуков А.М., Иванов О.С. Аналитический метод построения и
изображения диаграмм состояния многокомпонентных систем. - В кн.: Сплавы
для атомной энергетики. М.: Наука, 1979, с. 33-55.
92
11. Новик Ф.С. Планирование эксперимента на симплексе при изучении металлических
систем. М.: Металлургия, 1985. 285 с.
12. Штейн В.С. Возможности и проблемы создания информационно-поисковой систе-
мы для металловедения. - Изв. АН СССР. Металлы, 1969, № 2, с. 141-146.
13. Новик Ф.С., Цейтлин Н.А., Авраменко Э.Н. Аналитическое описание диаграмм
состояния с помощью индикаторных функций. - ЖНХ, 1981, г. 26, вып. 3,
с. 756-760.
14. Новик Ф.С., Цейтлин Н.А., Авраменко Э.Н. Некоторые способы кусочно-гладкой
аппроксимации функций. - Завод, лаб., 1981, г. 47, № 1, с. 48-55.
15. Новик Ф.С. Математическая модель диаграммы состояния Fe-Fe3C. - Изв.
АН СССР. Металлы, 1983, № 1, с. 174-178.
УДК 681.31:546.0:548.30
СТРУКТУРА БАНКОВ ДАННЫХ ПО ФАЗАМ
В ДВОЙНЫХ И ТРОЙНЫХ ФИЗИКО-ХИМИЧЕСКИХ СИСТЕМАХ
Е.М. Савицкий, В.Б. Грибуля, Н.Н. Киселева
Количество информационных сообщений о диаграммах состояния не-
органических систем, о существующих фазах и их свойствах растет с каж-
дым годом. На поиск только библиографии по конкретной системе уходит
несколько недель или даже месяцев. Рост информации ведет к увеличению
затрат на научные исследования на этапе поиска имеющихся данных, при-
водит к неоправданному дублированию работ и к потерям от использо-
вания неполных данных, а также замедляет процесс внедрения новых
материалов.
Многочисленные справочники по физико-химическим системам и свойст-
вам фаз устаревают уже в типографиях. Тематические картотеки, содержа-
щие десятки тысяч карточек, охватывают обычно лишь малый круг систем,
интересный их владельцам, и трудоемки в эксплуатации. Как показывает
наш опыт сбора разнообразных сведений о фазах, поиск нужной информа-
ции в реферативных журналах и справочниках занимает несколько меся-
цев, поиск информации в созданных нами картотеках по двойным и трой-
ным физико-химическим системам - несколько недель, причем огромное
количество ’’переработанной” литературы не гарантирует 60—70%-ной
полноты охвата информации. Следует учесть, что количество карточек
по неорганическим фазам в двойных и тройных системах в наших карто-
теках неуклонно растет, причем теоретически этот рост карточек по пол-
ностью или частично изученным системам может продолжаться до 5 тыс. —
по двойным, до 200 тыс. — по тройным и до 5 млн. — по четверным. Такие
перспективы наводят на мысль об использовании автоматизированных
информационных систем.
Три года назад нами были начаты работы по созданию банков данных
по фазам в двойных и тройных физико-химических системах. Была по-
ставлена задача автоматизации информационного поиска данных о су-
ществовании фаз, их свойствах, а также данных об изученности двойных
и тройных систем и соответствующей библиографии. Необходимость реше-
ния поставленной задачи диктовалась требованиями автоматизации поиска
обучающих примеров для кибернетического прогнозирования новых фаз
93
и их свойств [1], а также актуальностью информационного обеспечения
специалистов, занимающихся изучением тройных физико-химических
систем.
Рост информации и необходимость оперативного обеспечения исследо-
ваний в науке, технике и промышленности стимулировали разработку
автоматизированных информационных систем по свойствам веществ и
материалов [2—9]. Однако в доступной нам литературе нет информации
о том, что кем-либо предпринимались попытки создать автоматизиро-
ванный банк данных по фазам в двойных, тройных или более сложных
системах. Обычно решались частные задачи сбора и упорядочения инфор-
мации для систем с фиксированными одним или двумя компонентами.
Стремление охватить все двойные и тройные системы (металлические,
квазибинарные, окисные и солевые и т.д.) потребовало разработки новых
программных средств, ориентированных на иерархическую структуру
данных и прямой доступ к ним. В то же время многоплановость постав-
ленной задачи имела следствием некоторое ограничение на количество
свойств фаз. Это ограничение связано не с возможностями автоматизиро-
ванной системы, а с трудоемкостью поиска, оценки и ввода дополнитель-
ной информации.
Следует подчеркнуть, что при разработке программного обеспечения
банка данных (БД) авторы отказались от стандартных пакетов приклад-
ных программ информационного поиска (АСОД, АСПИД, АСИОР, ДИСОН
и т.д.). Наш опыт эксплуатации этих пакетов (АСОД и ДИСОН) свиде-
тельствует о том, что они приспособлены для создания простейших инфор-
мационно-поисковых систем, ориентированных в основном только на фор-
мирование массивов данных, поиск и сортировку информации, причем
организация хранения информации наиболее простая - данные одного
типа. Более соответствуют нашим целям идеи построения банков данных
второго и третьего поколений [10—14], в которых обеспечивается не толь-
ко хранение и поиск разнотипной информации со сложной иерархической,
сетевой, реляционной или другой структурами, но и логическая обработка
информационных массивов.
При описании принципов функционирования банка данных по фазам
в двойных и тройных системах будем пользоваться терминологией, приня-
той в работе [13]. БД по фазам состоит из файлов двух типов: файлов
свойств фаз и файла библиографии. Все файлы имеют иерархическую
структуру (рис. 1д, б). Файл библиографии включает порядковый номер
и выходные данные литературного источника с указанием ссылки на
реферативный журнал. Помимо файлов (см. рис. 1,а, б) и библиографии,
создается файл-тезаурус эквивалентных типов кристаллических структур.
Разработанная структура банка данных обеспечивает многократное исполь-
зование данных различными пользователями в разнообразных целях, мини-
мальную избыточность данных и объем памяти для их хранения на внешних
запоминающих устройствах ЭВМ.
В качестве системы управления базой данных (СУБД) была выбрана
система БОЯЗ для ЭВМ БЭСМ-6 (ДОС ДИСПАК). Эта система удовлетво-
ряет подавляющему большинству требований, предъявляемых к СУБД
[10—13], и проста в эксплуатации. Она базируется на алгоритмическом
языке БОЯЗ [14], ориентированном на работу с базами данных. СУБД
94
Рис. 1. Логическая структура файла свойств двойных (а) и тройных (б) фаз
Рис. 2. Конфигруация банка данных по типам кристаллических структур двойных
и тройных фаз
Обозначения: НМЛ — накопитель на магнитной ленте. ТТ — телетайп или пишу-
щая машинка, ВТ — видеотерминал, ПК — ввод -вывод на перфорацию; АЦПУ — ал-
фавитно-цифровое печатающее устройство, ПП — прикладные программы, СУБД —
система управления базами данных, НМД — накопитель на магнитном диске
БОЯЗ выполняет функции доступа к базам данных, их ведения и обнов-
ления, справочные функции, а также функции использования баз данных
многими потребителями. В используемой нами версии СУБД построена
как транслятор с языка БОЯЗ. СУБД на основе БОЯЗ обеспечивает работу
в пакетном и диалоговом режимах.
К настоящему времени система БОЯЗ внедрена и успешно эксплуати-
руется в ИМЕТ АН СССР. На ее основе разрабатывается программное
обеспечение банка данных по фазам (рис. 2). Уже созданы и отлажены
программы ввода документов, а также редактирования и вывода на АЦПУ
и видеотерминал документов файлов тройных фаз в соответствии с задан-
ными формами. В архивы системы ПУЛЬТ (на магнитных лентах) и систе-
ме СЕРВИС (на магнитном диске) ЭВМ БЭСМ-6 уже занесены все имеющиеся
документы файлов тройных фаз. Начата ’’перекачка” документов из архи-
вов системы ПУЛЬТ в банк данных.
96
ЛИТЕРАТУРА
1. Савицкий Е.М., Грибуля В.Б. Прогнозирование неорганических соединений с
помощью ЭВМ. М.: Наука, 1977. 192 с.
2. Штейн В.С. Фактографические информационные системы в химии. - Журн. Все-
союз. хим. о-ва им. Д.И. Менделеева, 1977, т. 22, № 4, с. 375-381.
3. Аданяева Р.В., Говорухина AM., Кудрявцева Л.В. и др. Оценка работы специали-
зированной фактографической' АИПС по химии. - В кн.: Науч.-техн. информ.
М.: ВИНИТИ, 1979, сер. 2, № 9, с. 21-24.
4. Суворова Н.В., Кочанова Н.Н., Гилинская Э.А. Банки данных в области кристал-
лографии. - В кн.; Науч.-техн. информ. М.: ВИНИТИ, 1981, сер. 2, № 9, с. 1-8.
5. Шведкое Е.Л., Ковенский И.И., Денисенко Э.Т. и др. Автоматизированная инфор-
мационно-поисковая система ’’Документ” - первая очередь банка данных по
порошковой металлургии. - Информ. бгол.ГСССД, 1982,вып. 10/11, с. 25-26.
6. Денисенко Э.Т. Некоторые зарубежные информационные системы по веществам
и материалам. М.: Госстандарт, 1980.100 с.
7. Гейвандов ЭД., Рыдник В.И. Автоматизированные банки данных по свойствам
веществ и материалов за рубежом. М.: Госстандарт, 1977. 80 с.
8. Chart Т., Dinsdale A., Putland F. The NPL alloydata bank: Its use in the calculation
of phase diagrams for superalloy development. - In: The industr. use of thermochem.
data: Proc. conf. L., 1980, p. 235-245. (Spec. Publ. Chem. Soc.; N 34).
9. Morgentai J., Fritzlar H. Development of a data base of material characteristics. - Zfl-
Mitt., 1981,N44,p. 108-111.
10. Мартин Дж. Организация баз данных в вычислительных системах. М.: Мир, 1980.
662 с.
11. Дейт К. Введение в системы баз данных. М.: Наука, 1980.463 с.
12. Олле Г.В. Предложения Кодасил по управлению базами данных. М.: Финансы и
статистика, 1981. 285 с.
13. Банк данных технологического назначения: Общие требования. ГОСТ 14.413-80.
М.; Госстандарт, 1980. 6 с.
14. Замулин А.В. БОЯЗ - язык программирования, ориентированный на работу с
базами данных. - В кн.: Алгоритмы и организация решения экономических задач.
М.: Статистика, 1978, вып. 12, с. 40-87.
7. Зак. 244
5. МЕТОДЫ РАСЧЕТА ДИАГРАММ РАВНОВЕСИЯ ФАЗ
С ПРИМЕНЕНИЕМ ЭВМ
УДК 539.121.536.7
ЭТАП РАЗРАБОТКИ ОБЩЕГО МЕТОДА
ТЕРМОДИНАМИЧЕСКОГО РАСЧЕТА ДИАГРАММЫ СОСТОЯНИЙ
ДВУХКОМПОНЕНТНЫХ СИСТЕМ
С.Б. Масленков, АЛ. Удовский, AM. Гайдуков
В настоящее время широкое развитие приобрели методы построения
диаграмм состояния (ДС) трех- и многокомпонентных систем на базе
имеющейся экспериментальной информации по термодинамике и фазовым
равновесиям для бинарных подсистем и небольшого числа дополнительных
экспериментальных данных для многокомпонентных систем с использо-
ванием термодинамических расчетов [1,2].
Это требует многократных расчетов ДС, особенно для двойных подсис-
тем. Поэтому как в отечественной [3], так и в зарубежной [1] литературе
был поставлен вопрос о создании общих термодинамически обоснованных
методов, алгоритмов и автономных программ (АП) расчета ДС на ЭВМ
без промежуточного вмешательства расчетчика. В работах [4-7] создан
общий метод расчета двойных ДС (2ДС) для любого заданного числа конку-
рирующих структур (фаз переменного состава), термодинамические потен-
циалы Гиббса (ТПГ) которых могут быть заданы в широком классе зави-
симостей от температуры (Г), давления (Р) и состава (х - атомная доля
второго компонента).
Метод основывается на следующих ключевых элементах аналитической
термодинамики. На рис. 1 проиллюстрировано для 2ДС правило площадей
[8], являющееся обобщением известного правила Максвелла для равнове-
сия жидкость-газ в однокомпонентной системе. Его дальнейшее обобщвг
ние дает вариационное соотношение [8], выражающее правило объемов
(рис. 1, слева). Правило площадей равносильно уравнениям равновесия
фаз (УРФ) а и /3. Введя в рассмотрения функцию wa/3(Ap) [4, 7] (на рис. 1
она численно равна разности заштрихованных площадей, Дд — разность
химических потенциалов компонентов в сплаве), УРФ можно равносильно
представить так: wa^ (к) = 0. Исследование свойств (&ц) [1 ] позволило
установить [4] условия существования и единственности решения УРФ,
а также определило способ отыскания их решения, исключающий расходи-
мость вычислений. Критерий отбора термодинамически стабильных конод
[4, 7] позволяет производить его на ЭВМ по мере отыскания метаста-
бильных (удается избежать отыскания части метастабильных конод, кото-
рые заведомо не будут стабильными).
98
Рис. 1. Иллюстрации правила площадей, свойств функции условий сущест-
вования и единственности решений уравнений равновесия а- и (3 -фаз [7]
При Т = То : И х@х - составы а- и 0-фаз в равновесии, z01^ — точка равенства
ТПГ фаз; при Дд = к (равновесие фаз) w- = 0, а заштрихованные площади равны
В работах [4, 6, 7] дана принципиальная схема метода расчета 2ДС.
Его алгоритмизация проведена для случая, когда все конкурирующие
структуры — неупорядоченные растворы замещения, избыточные ТПГ
которых — многочлены от Т и х (P-const, степень по х произвольна). Раз-
ности *' (Г) ТПГ а,-й (i = 1, ..., г - 1) и аг -й конкурирующих
структур для обоих чистых компонентов (к = 1; 2) описываются полино-
миально. Однако можно задавать и произвольную зависимость от Т избы-
точных ТПГ фаз и &Grk~' : Алгоритм реализован на ЭВМ в виде частной
(г = 2) и общей (г - входное данное) АП.
Сравним [7] расчет 2ДС Mo—Rh по общей АП с расчетом по традицион-
ной методике [9]. В последнем случае: 1) четыре конкурирующие струк-
туры (г = 4) разбивают на шесть пар; для каждой пары рассчитывают:
2) параметры стабильности и 3) линии равенства ТПГ фаз; 4) графически
определяют То -х диаграмму [9]; 5) рассчитывают шесть пар простейших
2ДС (даны на рис. 2); 6) их графическим наложением (см. рис. 2) с учетом
Т0-х диаграммы получают ’’расчетную” стабильную 2ДС (рис. 3).
По общей же АП сразу получаем, минуя пункты 1 —6, стабильную расчет-
ную 2ДС (см. рис. 3), совпадающую с результатом в работе [9]. Для расче-
та по АП любого заданного числа 2ДС произвольных топологических
типов не требуется никакого промежуточного участия расчетчика и ника-
ких начальных приближений.
Созданные АП были протестированы [7] на воспроизведение пяти рас-
четных 2ДС, а в дальнейшем использованы для новых расчетов.
99
Рис. 2. Система Mo-Rh. Наложение простейших 2ДС
1 — простейшая 2ДС для L и 0 конкурирующих структур, 2 - для 0 и € , 3 - для
а и 0, 4 — для L и е , 5 — для е и L, 6 — для а и L (обозначения по [91)
Рис. 3. Стабильная расчетная 2ДС Mo-Rh [6, 7]
Двумя способами воспроизведен результат авторов [9]. Сравнение с эксперимен-
том см. в работе [9]
Для двойных систем на основе Cs, Rb и К ОЦК растворы описаны в рам-
ках псевдопотенциальной модели. При ОК рассчитаны [10] параметры
псевдопотенциалов сплавов, полные энергии связи (£) и энтальпии смеше-
ния (ДА/). Выявлены и устранены систематические ошибки аналогичного
литературного расчета; в частности, на порядок улучшено согласие расчета
и эксперимента для Е. Рассчитаны [10] прогнозируемые низкотемператур-
ные области несмешиваемости и с учетом литературных эксперименталь-
ных термодинамических данных для жидкости равновесия ОЦК—жид-
кость в качественном согласии с экспериментом. В работе [7] выявлена
и проанализирована существенная зависимость расчетных ДА/ и 2ДС от
весьма малых отрицательных отклонений хода параметра ОЦК решетки
от закона Вегарда.
В рамках феноменологических моделей оптимизацией 2ДС в духе мето-
дики [2] для систем U—Nb и U-Mo провели согласование данных по тер-
модинамике и областям несмешиваемости [7]. Расчет дает хорошее соот-
ветствие с экспериментом ОЦК' /ОЦКи ОЦК/и2Мо равновесий и удовлет-
ворительное - для термодинамических функций ОЦК растворов.
Рассчитаны также экспериментально не установленные ОЦКМо/ОЦКМо +
ОЦК фазовая граница 2ДС, энтропия и энтальпия образования химического
соединения U2Mo. Для 2ДС Pu—U оптимизация в рамках модели регуляр-
100
ных растворов позволила удовлетворительно описать [5, 7] различные
литературные данные для ликвидуса и солидуса.
Однако опыт работы показал наличие серьезных недостатков литератур-
ной методики оптимизации, которые устраняет впервые предложенная
авторами методика прямой оптимизации экспериментальных данных
как по фазовому равновесию, так и по термодинамике при условии соот-
ветствия топологических типов расчетной и экспериментальной 2ДС. Новая
методика непременно должна базироваться на АП расчета 2ДС произволь-
ного топологического типа на ЭВМ. Для ОЦК/жидкость равновесия на
2ДС U—Zr получено [7] хорошее согласие расчета с экспериментом, чего
не удалось достигнуть авторам при использовании косвенной оптимизации
в духе [2].
Для системы Nb—Мо с хорошей точностью [7] описаны термодинами-
ка ОЦК растворов и солидус, рассчитаны неизвестные ТПГ жидкости и
ликвидус в хорошем согласии с независимо полученными позднее экспе-
риментальными данными [11]. Предложенная оптимизация позволяет
производить определенный отсев моделей: доказана неприменимость
модели регулярных растворов для Nb-Mo (заметим, что в книге [9]
ее использование привело к неверному топологическому типу расчетной
2ДС, см. [11]). Примечательно, что при косвенной оптимизации в духе
[2] авторы не смогли получить даже правильный топологическим тип
2ДС Nb-Mo.
АП удобно использовать для проверки согласованности литературных
расчетных данных. Так, расчет авторами [6, 7] эвтектической 2ДС Мо—Тс
(экспериментально 2ДС не построена) устранил несогласованность расчета
[12] по традиционной методике [9].
АП можно использовать для расчета термодинамических функций в
гетерогенных областях 2ДС и их скачков на фазовых границах [13—15].
Итак, задача создания общих методов и АП расчета 2ДС в определенной
степени решена.
ЛИТЕРАТУРА
1. Hillert М. Some viewpoints on the use of a computer for calculating phase diagrams. -
Physica B, 1981, vol. 103, N 1, p. 31-40.
2. Lukas H.L., Henig E.-Th., Zimmerman B. Optimization of phase diagrams by a least
squares method using simultaneously different types of data. - Calphad, 1977, vol. 1,
N 3,p. 225-236.
3. Иванов O.C., Удовский А.Л. Современное состояние и перспективы термодина-
мического расчета диаграмм состояния металлических систем. - В кн.: Сплавы
для атомной энергетики. М.: Наука, 1979, с. 5-17.
4. Гайдуков А.М. Численные методы термодинамического расчета двух- и много-
компонентных диаграмм состояния. - В кн.: Диаграммы состояния в материало-
ведении. Киев: ИПМ АН УССР, 1979, с. 34-100.
5. Иванов О.С., Удовский АЛ., Гайдуков А.М. К разработке общей методики расче-
та на ЭВМ двухкомпонентных диаграмм состояния и извлечению из них термоди-
намической информации. - В кн.: Диаграммы состояния металлических систем
(термодинамические расчеты и экспериментальные методы). М.: Наука, 1981,
с. 60-64.
6. Гайдуков А.М., Удовский А.Л., Масленков С.Б. Алгоритм общего метода термо-
динамического расчета диаграмм состояний двухкомпонентных систем. - В кн.:
Применение математических методов для описания и изучения физико-химичес-
ких равновесий: Тез. докл. 3-й Всесоюэ. шк. Новосибирск: Наука, 1980, с. 76-80.
101
7. Гайдуков AM. Метод расчета двойных диаграмм состояния, аналитическая термо-
динамика и их применение для систем щелочных и тугоплавких металлов: Авто-
реф. дис. ... канд. физ.-мат. наук. М.: ИМЕТ АН СССР, 1983.
8. Гайдуков А.М., Удовский АЛ., Иванов О.С. Векторная форма условий фазового
равновесия и вариационное соотношение для конод Т-Р-х диаграммы ^-компо-
нентной системы. - ДАН СССР, 1975, т. 225, № 5, с. 1093-1095.
9. Кауфман Л, Бернстейн X. Расчет диаграмм состояния с помощью ЭВМ. М.: Мир,
1972. 326 с.
10. Масленков С.Б., Удовский АЛ., Гайдуков А.М. Псевдопотенциальный расчет
энергии связи, термодинамических свойств и фазовых диаграмм сплавов калий-
рубидий, калий-цезий, рубидий-цезий. - В кн.: Теория жидких и аморфных
металлов. Свердловск: УНЦ АН СССР, 1983, ч. 1, с. 231-233.
11. Кочержинский Ю.А., Василенко В.И. Диаграмма плавкости системы молибден-
ниобий. - ДАН СССР, 1981, т. 257, № 2, с. 371-373.
12. Haines H.R., Potter Р.Е., Rand МЛ. Some phase diagrams studies of systems with fis-
sion product elements for fast reactor fuels. - In: Thermodynamics of nuclear materials.
Vienna, 1980, p. 471-500.
13. Udovsky A.L., Gaydukov A.M., Ivanov O.S. Phase boundaries of state diagrams of «/-com-
ponent systems as discontinity surfaces of all second derivatives of the Gibbs equilibrium
thermodynammic potential. - Phys. Lett. A, 1979, vol. 72, N 1, p. 1-4.
14. Гайдуков A.M., Иванов О.С. Удовский АЛ. Уравнения связи между скачками
термодинамических свойств' (теплоемкости, сжимаемости и других) на фазовых
границах диаграмм состояния сплавов. - В кн.: Диаграммы состояния металли-
ческих систем (термодинамические расчеты и экспериментальные методы). М.:
Наука, 1981, с. 67-70.
15. Масленков С.В., Гайдуков А.М. Классификация фазовых переходов в окрестности
3-фазных равновесий Т-Р-х диаграммы состояния. - В кн.: Теория жидких
металлов. Свердловск: УНЦ АН СССР, 1983, ч. 1, с. 237-238.
УДК 621.315.592
РАЗРАБОТКА АЛГОРИТМА РАСЧЕТА НА ЭВМ
ДИАГРАММ СОСТОЯНИЯ СИСТЕМ, ОБРАЗОВАННЫХ ЭЛЕМЕНТАМИ
III И V ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
А.А. Селин, В.А. Ханин
Эпитаксиальная кристаллизация многокомпонентных твердых растворов,
образованных соединениями типа AmBv из обогащенной легкоплавким
металлом жидкой фазы, потребовала определения фазовых границ рас-
плав кристалл в системах с такими твердыми растворами. Условие фазо-
вого равновесия «-компонентного твердого раствора, образованного m
элементами III и п-m элементами V групп Периодической системы с жид-
кой фазой при температуре Т можно записатьв виде/и (п-m) уравнений
типа
ДД?Л (Т*л- Т) - 0,5 а* + ЛГ1п 4x,xz у, = ЯГ1па$в, (1)
где ДД "f1 и Г*1 - энтропия и температура плавления соединения ij,a™ -
активность соединения ij в твердом растворе, а,, — параметр взаимо дейст-
вия элементов i и j в жидкой фазе соответственно. Уравнения типа (1)
с учетом выражений для активностей компонентов в регулярных жидких
и твердых растворах (см. [1]) являются трансцендентными, и для их
решения необходимо привлекать численные методы с использованием
102
ЭВМ. Однако практическая реализация расчетов для конкретных систем
достаточно сложна, причем увеличение числа компонентов приводит к
принципиальным ограничениям на возможность определения корней.
Кроме того, возникают проблемы нахождения корней вблизи границы
определения системы уравнений, описывающей составы равновесных фаз
[2]. Это вызвано слабой связью поведения функций из системы уравнений
типа (1) вблизи корня и вдали от него. В данной статье разработан алго-
ритм расчета, позволяющий устранить отмеченные проблемы.
Рассмотрим случай, когда при известном составе твердой фазы и задан-
ной температуре необходимо определить концентрации компонентов в
равновесной жидкой фазе (xfc). Преобразуем систему уравнений типа (1)
к следующему виду:
ln(/3jt-хк) -lnxfc + (2akm/RT) xk+Fk=0,k^m, (2)
In(6fc -xk) - lnxfc + (2aknIRT)xk +Fk =0,k>m, (3)
lnxm+lnx„ + Fm„ =0. (4)
m — 1 m
Здесь 0k = a — S xp, 5 k = b — S xp, причем a = S xt, b =
p=l, p^fc p-m + 1, рфк /=1
n
= S Xj, a + b = 1, т.е. фактически &k - xk = xm,bk — xk = x„, a Fk - no-
j= m +1
лином, не зависящий от хк, Fmn - полином, зависящий от всех концент-
раций. Систему (2) — (4) без учета (4) можно рассматривать как систему
уравнений для п - 2 неизвестных, и при заданных а и b она определяет
хк, которые в данном случае являются не корнями системы (2) —(4),
а точками на линии, определяемой системой (2) —(4) без уравнения (4).
Корни системы (2)-(4) можно установить при решении уравнения (4)
с одним неизвестным. Таким образом, процедура расчета разбивается на
два этапа - нахождение хк, а затем а.
Будем исследовать случай к ^т, поскольку случай к >т аналогичен.
Рассмотрим (2) как уравнение с одним неизвестным хк, а остальные кон-
центрации и а считаются параметрами, от которых зависит величина корня
этого уравнения. Уравнение (2) имеет область определения 0 < хк < (Зк
и внутри этого интервала имеет хотя бы один корень. Можно показать,
что если
akmIRT<2/pk, (5)
то уравнение имеет единственный корень. Если рассматривать функцию
fk из (2) как функцию от переменной хк, то выполнение условия (5)
соответствует случаю, когда Д в области определения не имеет экстрему-
мов, т.е. она монотонна. Если же условие (5) не выполняется, то fk имеет
локальный максимум и минимум и количество корней уравнения (2)
будет определяться законом экстремумов. Если знаки экстремумов оди-
наковы, то уравнение (2) имеет один корень, в противном случае - три,
причем каждый из этих корней будет находиться в следующих интервалах
(левый, средний, правый соответственно):
/ 1 f,
е 0,... - 2/3| RT/akm)
' 2
103
/ 1 ,_______________, 1 f—_____________, ч
40) e - (0k Vfi -2ft RT/akm), - (ft+Vft - 2ft RT/akm)], (6)
'2 2 7
/ 1 _____________________,
4_1) e - (/3*+V^-2^/?7’/aftm)>^
' 2
Если один из экстремумов соответствует нулю функции fk, то тогда
будет только два корня (это случай кратных корней, когда средний корень
совпадает с левым или правым).
Введем функцию <рк (а, хг, хк_ ltxk + l, хп), равную по величине
корню уравнения (2) и зависящую от а и концентраций всех компонентов
в жидкой фазе, кроме Л-го компонента. Индекс е отражает возможность
существования трех корней (-1, 0, +1). Поскольку уравнение (2) транс-
цендентное, то не выражается через элементарные функции. Следует
также отметить, что <рк является однозначной функцией, т.е. каждому
набору а, X], ..., хк_1у хк+1, ..., хп приводится в соответствие только одно
значение ft из области допустимых значений для ftk (для случая одного
корня область допустимых значений 0 < ftk < /3Л, а в случае двух или
трех корней соответствует интервалам (6)).
С учетом ftk уравнение (2) можно записать в виде
хк -- ftk(a, Xi, ...,xfc_i,x*+i, ...,х„) =0. (7)
При однозначности имеет смысл итерационный процесс
х‘к} = ftk (fl, Xr+i (г = 1,..., к - 1), x'ftr = к + 1,.... и)), (8)
где I — шаг итерации. Будем рассматривать случай одного корня для
уравнения (2) (ftk не зависит от е )*. Поскольку эпитаксию обычно прово-
дят из обогащенного легкоплавким металлом расплава, то концентрация
одного из компонентов (например, т) близка к единице, а для других
xs (s = 1, ..., т - 1, т + 1, ..., ri). Можно показать, что в этом случае итера-
ционный процесс (8) сходится независимо от начального приближения и
близости к границе определения, причем скорость сходимости определяется
выражением
|x/+1 — JCfcl < К(хо)', (9)
где к - константа и Хо — порядка максимального xs.
Можно показать, что для случая близости начального значения к точке
сходимости итерационного процесса, когда согласно (2) выполняется
условие (ЭД/Эхц) ~l/xfr > (ЭД/Эхг) ~ 1, можно записать
dfk = Wfc/9xt) dxk + X (dfkldxr) dxr = 0, (10)
r= 1, r*k
\xk+' -xk\ -xk S |x,+ 1-xj|, (11)
r= 1, rtk
* Основные результаты, полученные в данной работе, выполняются в случае зависи-
мости ft от е , а общее рассмотрение вопроса очень громоздко и не представляет
практической ценности.
104
что приводит к степенной сходимости типа (9). Заметим теперь, что (10)
и (11) выполняются не только вблизи точки сходимости итерационного
процесса, но и вблизи границы области определения функции, т.е. когда
xr < 1. Если же начальное значение х* выбрано вдали от границы области
определения (хг = 1), то уже после первой итерации условие xr < 1 будет
выполнено. Параметр в fk (см. (2)) содержит не зависящий от кон-
центраций член, имеющий порядок
Fk ~ (AS™ <T™rt -Т) T))/RT>1, к i=m.
Поэтому для компенсации величины Fk должно быть после первой итера-
ции | In xj ~ I , хк < 1. Таким образом, итерационный процесс (8)
сходится, его сходимость определяется (9) и не зависит от начального
приближения и близости к границам определения.
Теперь перейдем к решению уравнения (4). Рассмотрим функцию
Ф/Дх,, ...,х„) =д, + д/( (12)
определенную на пространстве хк (к - 1, ..., л) (дА - химический потен-
циал /с-го компонента в жидкой фазе). Рассмотрим семейство линий в
данном пространстве, обладающее свойством
Mp-M.v=A<pJ . (13)
для р, s ^тир, s >т, считая, что Nps не зависит от хк. Параметром вдоль
т п
этих линий будем считать а = Z х, = 1 - Z х, . Поиск конод на втором
1=1 /= т + 1
этапе основывается на применении условия решения уравнений равновесия
двух фаз, которое имеет вид следующей теоремы: функция (12) вдоль
линий (13) по параметру а имеет только один экстремум, находящийся
т п
в точке а = Е х, = S х, = 0,5, и этот экстремум является максимумом.
1=1 j=m + l
Для доказательства теоремы запишем уравнение Гиббса—Дюгема для
жидкой фазы
S XjdPi+ S Xj d Pi =0
i=l i=m + l
(14)
и учтем, что вдоль линий (13) выполняются условия dpp = dps (дляр,
5 или р, s > т). Тогда
ad Pj + (1 - a) d р, =0.
(15)
Из (15) следует, что в точке а = 0,5, и только в ней производная функ-
ции (13) равна нулю, т.е. точка а = 0,5 является экстремумом. Можно
показать, что при а -* 0 и а -♦ 1 функция (12) стремится к - 00 и, следова-
тельно, точка а = 0,5 является максимумом.
Поскольку (4) вдоль линий (13) отличается от (12) только на констан-
ту, значит, и эта функция также имеет максимум в точке и также стремит-
ся к — при а -> 0 и при д -> 1.
105
Таким образом, численное решение уравнения (1) следует проводить
в два этапа. На первом из них определяется линия в пространстве перемен-
ных хк, вдоль которой приращение химических потенциалов компонентов,
относящихся к одной группе Периодической системы, равно между собой.
Второй этап связан с определением на этой линии точки, удовлетворяющей
условию фазового равновесия.
ЛИТЕРАТУРА
1. Селин А.А., Ханин В.А., Вигдорович В.Н. Термодинамический расчет фазового
равновесия для многокомпонентных твердых растворов с эквиатомным катион-
но-анионным соотношением. - ДАН СССР, 1980, т. 252, № 2, с. 406-410.
2. Вигдорович В.Н., Селин А.А., Шутов С.Г. Исследование фазовых равновесий в
системе In-P-As-Sb. - ДАН СССР, 1980, т. 251, №6, с. 1423-1426.
6. РАСЧЕТ ДИАГРАММ РАВНОВЕСИЯ ФАЗ
КОНКРЕТНЫХ СИСТЕМ
УДК 669.01 +669.01
ИССЛЕДОВАНИЕ ДИАГРАММ СОСТОЯНИЯ МЕТАЛЛ-УГЛЕРОД
В.М.Даниленко, Т.Я.Великанова, О.В.Гордийчук, А.А.Рубашевский
При исследовании диаграмм состояния все большую роль начинает иг-
рать комплексный метод их построения на основе сочетания эксперимен-
тальных исследований фазовых равновесий и термодинамических свойств
отдельных фаз с теоретическими разработками моделей фаз. Математичес-
кое согласование всех экспериментальных сведений об изучаемой системе
с помощью численных расчетов необходимо уже на этапе изучения бинар-
ных систем, являющихся опорными при исследовании многокомпонентных
систем.
В настоящей работе проведено построение таких согласованных систем
моделей фаз для практически важных систем Ме-С (Ме-Се, Сг, W).
В качестве расчетной модели использовано приближение квазисубрегу-
лярных растворов, в котором термодинамический потенциал Гиббса для
раствора определяется формулой [ 1 ]
G= S А,х,-+ S 2 Aikx,xk + S S A,ikx?xk +
i=l i = 1 k = i + 1 1=1 k = i + 1
+ S S S AikiXiXkXi + RT S X/lnXj, (1)
i = 1 k = i + 1 I = k + 1 ч » = 1
где n — число компонентов, х{ — атомная доля z-ro компонента; R — газо-
вая постоянная; А - константы, зависящие от температуры по закону
А =a + 0 7’+77’ln Т+8 Т2. (2)
Это же приближение использовалось и для фаз стехиометрического сос-
тава, для которых G выражается непосредственно через температуру по
формуле типа (2).
В системе Се-С образуется два карбида - Се2 С3 и СеС2, для которых
эксперимент дает следующую оценку их температур плавления 1950°С
(2223 К) и скрытый максимум 2200° С (2473 К) - дистектика [2]. На ли-
нии ликвидуса карбида Се2С3 установлено существование точек:
А. С = 0,3, Т = 948 К (для равновесия L 5 + Се2С3).
В. С = 0,48, Т = 1853 К (предположительно температура полиморфного
перехода Се2 С3), где С = х — содержание углерода, 6 — твердый раствор.
С. 6-Се с ОЦК структурой, имеющей состав С = 0,1.
107
По данным [3—5] могут быть определены изменения G при плавле-
нии Се:
’ 461 =2211 -2,052 Т, (3)
графита:
Д62 = 22520 — 5,49 Г, (4)
Се2С3:
Д63 =23350 -3,595 Т, (5)
СеС2:
Д64 =23380-3,414 Т, (6)
Здесь и далее все величины в калориях на грамм-атом. Вначале были рас-
смотрены три варианта моделей жидкой фазы (L) :
А: Д12 = Wt + W2T, В: Ai2=0,5(Wi + W2), С: Я12 = W2 + W2C, (7)
где Wi и W2 определялись в двух случаях: I — по точкам Л и В, II - по точ-
кам плавления карбидов.
Значения А12 приведены в табл. 1.
Таблица 1
Варианты моделей жидкой фазы и исходные
экспериментальные данные о фазовых равновесиях
Исходные данные А В С
I - 55 550 + 0,07054 Т - 55 450 - 55 160 - 610,3 С
II - 38 040 - 6,091 Т - 52 345 - 60 720+ 22840 С
По этим данным были рассчитаны линии ликвидуса двухфазных равнове-
сий: 1) L - 6; 2) L - С; 3) L - СеС2; 4) L - Се2С3, которые оказались
соответствующими характеру реакции в экспериментальной диаграмме
состояния только в случае ПС, для которого карбид СеС2 плавится с от-
крытым максимумом при 2473 К, а Се2С3 - инконгруэнтно при 2080 К
(состав жидкой фазы С = 0,495).
Эвтектическая реакция
L * С + СеС2 (8)
прогнозируется при Т = 2460 К и С = 0,68.
Для описания реакции (3) оказывается необходимым принять сле-
дующие значения констант 6-раствора: At = - 7200, А2 = Д6Ь Л12 =
= - 30 670 (кал/г-ат). При этом равновесие (3) имеет место при темпера-
туре 920 К и составе 6-раствора С = 0,19 и жидкой фазы С = 0,215 (рису-
нок а).
В системе Cr—С три карбида [6]: Сг23С6, Сг7С3 и Сг3С2, из которых
только Сг7С3 плавится с открытым максимумом при 1765°С (2038 К),
а остальные образуются по перитектическим реакциям:
Г = 1575° С (1848 К), С = 0,17, - L + Сг7С3 Сг23С6; (9)
Т=1810°С (2083 К), C = 0,37,-Z +С- Сг3С2; (10)
108
Расчетные диаграммы состояния
систем Се-С (а), Сг-С (б) и
W-С (в)
и вступают в эвтектические реакции:
Т= 1530°С (1803 К), С=0,14,-L - Сг + Сг23С6; (11)
Т= 1726°С (1999-2000 К), С= 0,326,-£ - Сг7С3 +Сг3С2. (12)
Поданным [7—10] были найдены константы моделей твердых фаз:
Сг: Gi = - 550 + 24,35 Т - 4,324 In Т - 0,00183 Т2, (13)
С: G2 =-4544 + 44,87 Т- 6,3355 Г1п Т (14)
и жидких фаз:
Сг: G3 = 988 + 58,63 Т-9,4 Т In Т, (15)’
С: G4 = 17596 + 39,47 Т - 6,3355 Т In Т. (16)
Согласно [9], можно определить также изменение термодинамического
потенциала Гиббса при образовании промежуточных фаз и рассчитать их
константы, а затем построить линии фазовых равновесий. Оказывается,
однако, для удовлетворительного согласования расчета с эксперимен-
том следует ввести поправки в величины температурных зависимостей ДС
для фаз Сг23С6 и Сг3С2, так что окончательные выражения для этих фаз
примут вид:
Сг23С6: С5 =-4994+ 28,56 Т- 4,74 Tin Т- 0,001451 Т2, (17)
Сг7С3: G6 =- 5746 + 30,26 Г-4,927 Tin Т-0,001281 Т2, (18)
Сг3С2: С7 =-6079+ 32,41 Т-5,127 Tin Т-0,001098 Т2. (19)
При этом для жидкой фазы получили согласованные величины констант
Аг = G4, А2 = G3, Ai2 = — 32247, Ап2 = 20507. Рассчитанная диаграмма
состояния Ст—С приведена на рисунке б. Рассогласование остается при
описании реакции (12) (1730 К и с = 0,1) и (13) (2030 К и с = 0,315).
В системе W—С образуются три карбида [6, 11]: W2C (координаты дис-
тектики - с = 0,31, температура 2776°С (3049 К)), WC! _ х (координаты
дистектики — с = 0,39, температура 2747°С (3020 К)) и WC — по перитек-
тической реакции при
Г =2776° С (3049 К), с = 0,42,-£ + С- WC. (20)
В системе наблюдаются эвтектические реакции при
Г =2710° С (2983 К), с = 0,22,-£ - W + W2C, (21)
7=2735° С (3018 К), с = 0,385, -L W2C + WC!_^, (22)
Т=2720°С (2993 К), c = 0,41,-Z - WCj_x + WC. (23)
Карбид WC j _ х распадается по реакции
Г =2530° С (2803 К), с = 0,39, WCi_x - W2C + WC. (24)
По данным [7] можно построить модели твердой и жидкой фаз W с
Gj = - 543 + 30,63 Т - 5,703 Т In Т - 0,0004046 Т2, (25)
G3 =3102 + 51,12 Г-8,5 Г In Г (26)
Для углерода берем прежние формулы для G2 — (14) и G4, — (16), а
по [6,10] находим (после коррекции температурной зависимости ДС) эна-
110
Таблица 2
Нонвариантные точки диаграмм состояния систем Се—С, Cr -С и W—С
по результатам расчета
Система Равновесие Точка T, К С, мол. доли
Се-С Се2С3 £ Се2С3 [2220]* —
СеС2 L СеС2 2473 —
L — 6-Се + Се2С3 «1 680 0,162
L С + СеС2 е1 2460 0,68
L + СеС2 ** Се2С3 р 2080 0,495
L- 6-Се + СеС2 1 [580] 0,196
Сг-С Сг23С6 £ Сг2Э Сб [1897] -
Сг7С3 L Сг7С3 2039 —
Сг3С2 L Сг3С2 [2098] —
L- Сг + Сг„С, е1 1720 0,095
£ Сг7Сэ + Сг3С2 е2 2035 0,134
L + Сг7С3 Сг23£6 Р, 1895 0,190
L + С — Сг3С2 Р, 2090 0,372
L Сг + Сг,С3 1 [1625] 0,115
L- Сг + Сг3С2 2 [1470] 0,146
£- Сг23С„ +Сг3С2 3 [1880] 0,247
Сг23Сб +С 4 [1745] 0,324
Cr,C3 +С 5 [2005] 0,357
W-C W2C^ £ W2C 3034 -
WCi _х L WC^jc 3024 -
WC- £ WC [3080] —
£^ W + W2C ei 2805 0,21
£^ W2C + WCi «2 3023 0,374
£ — WCi _ х + WC «3 3023 0,398
£ + С - WC P 3043 0,42
L~ W + WCi _х 1 [2730] 0,19
L~ W + WC 2 [2620] 0,21
£— W + C 3 [2290] 0,26
£- W2C +WC 4 [ЗОЮ] 0,39
£- W2C + C 5 [2995] 0,41
L- WCi-x +C 6 [3017] 0,41
* Температуры метастабильных равновесий взяты в квадратные скобки.
чения потенциалов карбидов W2C:
Gs = - 3977 + 34,97 Т - 5,914 Т In Т - 0,0002697 7е, (27)
WC: G6 = - 6686 + 38,23 Т - 6,019 Т In Т - 0,0002023 Т2, (28)
дающие после согласования константы расплава
Ai = G4, А2 = G3, Лп= -17 041, Д112= 18 816.
Для фазы WC ] _ х получается интерпотенционное выражение
С7 = - 4366 + 35,89 Т -5,95 Т In Т = 0,0002468Т2, (29)
111
что соответствует следующей формуле для ДС при образовании этого кар-
бида:
Д(7 = - 2259 — 0,29137. (30)
Расчетные линии двухфазных равновесий (рисунок в) существенно от-
клоняются от экспериментальных только для реакции (22) - Т = 2805 К,
с = 0,22 вместо Т= 2983 К и с = 0,177, что обусловлено скорее всего нестро-
гостью модели расплава (как и в системах Се—С и Сг—С).
Координаты нонвариантных точек для рассчитанных систем приведены
в табл. 2.
Проведенное исследование свидетельствует о том, что удается построить
достаточно корректные математические модели диаграмм состояния систем
переходных металлов с углеродом (когда области гомогенности твердых
фаз узки), применяя приближение квазисубрегулярных растворов для опи-
сания потенциала Гиббса для жидкой фазы и зависимость G(T), ограничен-
ную членом, содержащим 72, для всех фаз и используя имеющуюся термо-
динамическую информацию о компонентах и промежуточных фазах и фазо-
вых равновесиях. Как и следовало ожидать, тип нонвариантных равновесий,
получаемый в результате расчета, очень чувствителен к виду функций (7(7)
для промежуточных фаз и точность экспериментально найденных зависи-
мостей, как правило, недостаточна.
Для всех трех систем наибольшее рассогласование расчетной и экспери-
ментальной диаграмм состояния наблюдается для металлической стороны.
Причиной этого может быть неточность модели жидкой фазы в этой области
составов и, возможно, неучтенная растворимость углерода в металле.
ЛИТЕРАТУРА
1. Даниленко В.М. Модели реальных кристаллов. Киев: Наук, думка, 1983. 224 с.
2. Гордийчук О.В., Великанова Т.Я., Еременко В.Н. Диаграммы состояния систем
РЗМ-углерод. - В кн.: Диаграммы состояния карбид- и нитридсодержащих сис-
тем. Киев: ИПМ АН УССР, 1981, с. 104-114.
3. Горшкова Т.И., Резухина Т.Н., Великанова Т.Я., Дмитриева В.Н. Термодинамичес-
кое исследование карбидов редкоземельных металлов. - В кн.: Диаграммы сос-
тояния карбид-и нитридсодержащих систем. Киев: ИПМ АН УССР, 1981, с. 58-71.
4. Физико-химические свойства элементов: Справ./ Под ред. Г.В.Самсонова. Киев:
Наук, думка, 1965,211 с.
5. Ершова Т.П., Каменецкая Д.С. 7-Р-jV-диаграммы состояния двойных систем ме-
талл (марганец, кобальт, никель) -углерод. - В кн.: Диаграммы состояния в мате-
риаловедении. Киев: ИПМ АН УССР, 1980, с. 34-45.
6. Тот Л. Карбиды и нитриды переходных металлов. М.: Мир, 1974. 294 с.
7. Hultgren R., Desai P.D., Haikins D. T. et al. Selected values of the thermodynamic proper-
ties of the elements. - Amer. Soc. Met., 1973, p. 111-117.
8. Chang F.A., Naujock D. The relative stabilities of Cr23C6, Cr7C3 and Cr3C2 and the
phase relationships in ternary Cr-Mo-C system. - Met. Trans., 1972, vol. 3, N 7,
p. 1692-1698. 1
9. Еременко B.H., Сидорко B.P. Термодинамические свойства карбидов хрома. - По-
рошковая металлургия, 1973, №5, с. 51-55.
10. Болгар А.С., Турчанин А.Г., Фесенко В.В. Термодинамические свойства карбидов.
Киев: Наук, думка, 1973. 271 с.
11. Стормс Э. Тугоплавкие карбиды. М.: Атомиэдат, 1970. 304 с.
112
УДК 669.017.12
РАСЧЕТ ЛИНИЙ ЛИКВИДУСА
В СИСТЕМАХ ЩЕЛОЧНОЙ МЕТАЛЛ-ПЕРЕХОДНЫЙ МЕТАЛЛ
СО СТОРОНЫ ЩЕЛОЧНОГО МЕТАЛЛА
А.Н.Кузин, И.Е.Люблинский, Н.М.Бескоровайный
По всем имеющимся экспериментальным данным, взаимодействие ще-
лочных металлов с переходными в твердой фазе практически отсутствует.
Следовательно, при всех реализуемых температурах в равновесии с насы-
щенным жидким раствором на основе щелочного металла будет находить-
ся чистый переходный металл. В этом случае расчет линии ликвидуса в сис-
теме переходный металл-щелочной металл со стороны щелочного металла
сводится просто к расчету температурной зависимости растворимости твер-
дого переходного металла в жидком щелочном металле.
Предлагаемый метод расчета основан на субрегулярной модели раство-
ров, согласно которой интегральная молярная свободная энергия жидко-
металлического раствора запишется в виде
G*(x, Т) =xGf(T) + (1 — x)G?(7) + Я7>1пх + Я7’ (1 -х)1п(1 -х) +
+с:зб(*-г)> О)
где х - мольная доля растворенного переходного металла, 1 - х - мольная
доля щелочного металла (растворителя), G? (х, Т) и Gf (х, Т) - молярные
свободные энергии жидких фаз чистых компонентов, Сжэб (х, Г) - избы-
точная свободная энергия. Ввиду малых концентраций раствора, что имеет
место в рассматриваемых системах, для G?36 достаточно ограничиться
квадратичным по концентрации приближением
G* б (х, Т) = Я?эб (х) - Г5Ж б (х) = х (1 - х) (Я? - га?) (2)
с двумя параметрами взаимодействия Но и S?, численно равными избыточ-
ным парциальным молярным энтальпии и энтропии растворенного элемента
в бесконечно разбавленном растворе. Химический потенциал растворенного
элемента в рассматриваемом приближении равен
Gf(x, Г) =G?(T) +ЯТ1ПХ+ (1 -х)2(Я? - га?). (3)
В насыщенном жидком растворе G? равен его химическому потенциалу
в твердой фазе, т.е. потенциалу Чистого элемента
G?(xHac, Т) =GIB(7)- (4)
Отсюда получаем уравнение для определения концентрации насыщения,
хна с > переходного металла в жидком растворе
AG]B - ж (Г) + RTInхнас + (1 - хнас)2 (Я? - Т5?) = 0, (5)
где AGi” ж (Г) = G? (Г) - G™ (7) - разность молярных свободных энер-
гией жидкой и твердой фаз растворенного элемента.
Поскольку для всех рассматриваемых систем и практически реализуе-
мых температур хнас << 1 [1], то получаем простое выражение для кон-
s. Зак. 244 113
центрации насыщения — уравнение линии ликвидуса
1лхнас = - [ДСтв^ж(Т)+Яож-таож]/ЛТ. (6).
Величины Д6ТВ ’’ ж (Г) для переходных металлов известны [2], и задача
сводится к вычислению параметров Яж и 5Ж.
Для расчета использована полуэмпирическая модель Миедемы [3,4],
которая дает удовлетворительные результаты при вычислении теплоты
смешения металлов разных классов. Согласно этой модели
Яож =2И12/з(и1-1/3 + н2’1/3)’1Р[-е(^Т-^)2(«11/з ~^/3)2],
(7)
где Vi — атомный объем растворенного элемента в жидкой фазе, пг кп2 —
электронная плотность на границе ячеек Вигнера—Зейтца в жидких фазах
компонентов, ^>*и - параметры, характеризующие электрохимический
потенциал электронов в атомных ячейках компонентов, е — заряд электро-
на; Р и Q — корректировочные параметры, общие для всех рассматривае-
мых ниже систем и равные соответственно 0,128 и 1,203.
В качестве #* в модели Миедемы используются скорректированные оп-
ределенным образом значения работы выхода электронов. В данной работе
в отличие от рекомендованной в [4] величины уз* = 2,85 В для лития была
использована величина у?* = 3,05 В, которая лучше согласуется с расчетами
[5] внутреннего химического потенциала электронов для простых метал-
лов и дает наиболее точное совпадение рассчитанных и экспериментальных
значений . Результаты расчета для ряда переходных металлов в систе-
мах с жидкими щелочными металлами представлены в таблице.
В ряде работ отмечается наличие корреляции между избыточной энталь-
пией и энтропией смешения. В частности, О.Кубашевским [6] показано,
что для широкого ряда систем с полной взаимной растворимостью сущест-
вует связь между максимальной избыточной энтропией смешения 5™3а^с и
максимальной избыточной энтальпией смешения Я “agC:
5«абкс = 1,28 [Яи”бакс/(Tki + Tkj)], (8)
где Tki и Тк^ — температуры кипения компонентов.
Можно показать, что подобный вид зависимости 5ИЭВ от Яиэб (или 5Ж
от Яж) вытекает из корреляции параметров самодиффузии компонентов
бинарного раствора с его парциальными термодинамическими функциями.
В работе [7] показано, что коэффициент активности компонента А бинар-
ного раствора замещения можно представить в виде
7а(са) = [^А(са)/^а(^а = О]ехр Ц(2а(са = 1) - <2а(са)]/ЛТ}, (9)
где сА — концентрация элемента А в растворе (сА = 1 соответствует чисто-
му металлу, для которого ?А = 1); (2А (сА) и QA (сА = 1) - энергии акти-
вации самодиффузии компонента А в растворе и чистом металле, уа(са)
и ра (<?А = 1) — характерные частоты тепловых колебаний атомов компо-
нента А в растворе и в чистом металле. Рассматривая QA (сА) как свобод-
ную энергию активации самодиффузии и представляя ее как 0А(сА) =
= h (сА) - Ts (сА), где h (сА) и s (сА) - соответственно энтальпия и энтро-
114
Расчетные и оцененные из экспериментальных данных (в скобках) значения И* (кДж/моль)
для систем переходный—щелочной металлы и параметры уравнения
линии ликвидуса In х (мол. доля) = А - В • 103/Т для этих систем
Переходный металл Модифи- кация Щелочной металл
Литий Натрий Калий Цезий
н* А В ж 41 0 А В
Ti ГПУ 132,3 4,68 18,39 191,6 8,64 25,52 233,1 240,5
ОЦК 4,23 17,86 8,18 24,99
V ОЦК 165,0 5,69 22,05 217,0 9,29 28,30 245,8 245,2
Cr ОЦК 156,0 (153 ± i) 6,48 20,95 202,5 10,45 26,54 224,8 221,2
Ct 1,48 8,29 4,67 12,72
Мп 0 48,1 (58 ± 10) 1,20 8,02 84,8 4,39 12,44 104,9 104,7
ОЦК 7,96 24,59 12,10 30,50
Fe 190,7 (251 ± 38) 239,8 262,1 257,0
ГЦК 8,03 24,70 12,17 30,61
ГПУ 1,80 11,07 4,64 15,88
Со 74,4 (97 ± 13) 114,4 133,2 130,7
ГЦК 1,73 11,02 4,56 15,83
Ni ГЦК 51,6 (43,2 ± 1,0) 0,55 8,32 90,7 3,21 13,03 109,4 107,5
ГПУ 2,98 17,09 6,51 25,45
Zr 120,1 189,5 242,8 255,8
ОЦК 2,53 16,58 6,05 24,94
Nb ОЦК 217,9 6,15 28,96 285,1 9,65 37,05 324,7 326,1
Mo ОЦК 226,7 6,67 30,19 285,2 9,91 37,22 311,7 305,7
W ОЦК 241,3 6,02 32,70 301,3 8,84 39,93 326,8 318,9
пия активации самодиффузии, а 2А (сА = 1) аналогично как 2А (ед = 1) =
= й (сА = 1) — Ts (ед = 1) перепишем (9) в виде
' 7а (са) = [Д> (са)/А» (са = 1)] ехр{ — [й (сА) -й(сА = (10)
Воспользуемся формулой Зинера [8], связывающей предэкспоненциаль-
ный фактор Do с энтальпией активации самодиффузии:
До(са) =^а2УА(сА)ехр[Хй(сд)/Л7’пл]1 (11)
А (са = 1) =^2"a(ca = 1)ехр[Хй(сд = 1)/ЯГпл], (12)
где Тпл — температура плавления металла A, g и а1 — геометрические фак-
торы, которые считаем мало зависящими от концентрации.
Подставляя (11) и (12) в (10), получаем
7а(са) = [^а(^)/^Чса = 1)]ехр|Х[й(сА)-й(са = 1)]/ЯТпЛ I X
Хехр1-[й(сА) -й(сд = 1)]/ЛТ|. (13)
В то же время в рамках используемой термодинамической модели раст-
вора коэффициент активности растворенного элемента (относительно жид-
кой фазы как стандартного состояния) равен
7^ = exp (- SF/R) exp (Hf/RT) . (14)
Сравнивая (13) и (14), получаем вид искомой зависимости
5ож = (Х/ТПЛ)ЯОЖ ~R 1п [М(сд)/ра(сд = 1)]. (15)
Для определения точного вида зависимости S* от Я^ в системах пере-
ходный металл—щелочной металл использованы экспериментальные данные
по растворимости ряда высокочистых переходных металлов в литии с низ-
ким содержанием неметаллических (<1 • 10-3%) и металлических (~0,1%)
примесей, полученные методом абсорбционного рентгеноспектрального ана-
лиза [9]. Результаты, полученные этим методом, наиболее надежны и пред-
почтительны для оценки термодинамических характеристик систем литий-
переходный металл в рамках используемой модели. Температурные зави-
симости растворимости Fe, Сг, Ni и Со взяты из работы [10]. Дополнитель-
но методом абсорбционного рентгеноспектрального анализа была определе-
на растворимость марганца в литии
1пхМп = -[(74,7 ±9,9) 103 - Г(11,5 ±3,8)]/ЯГ. (16)
Используя экспериментальные данные по растворимости Fe, Сг, Ni, Со и
Мп в литии с учетом их статистического веса, получили уравнение, адекват-
но описывающее зависимость S* (Дж/моль • К) отЯж (Дж/моль) (рис. 1):
= (2,184 ± 0,034)Яож/(7\Ме + TfcLi) - (29,1 ± 1,0), ' (17)
где ТкМе и 7\Li - температуры кипения растворяемого металла и лития, К.
Практически с той же степенью адекватности зависимость S’J от Я^ опи-
сывается уравнением, аналогичным (17), с заменой на температуры
плавления. Это соотношение было использовано для вычисления 5Ж Для ос-
тальных систем с литием. Для оценки возможности использования зависи-
мости (17) для расчета 5Ж в системах с натрием экспериментально опреде-
116
Рис. 1. Связь между избыточными пар-
циальными молярными энтропией и
энтальпией металлов, растворенных в
литии
Н~/(Тк + Т )г Дж моль ’ К"’
Рис. 2. Рассчитанные 1 и эксперименталь-
ные 2 линии ликвидуса в системах пе-
реходных металлов с литием (а) и нат-
рием (б) со стороны щелочного металла
лена растворимость серебра в натрии в интервале температур 100—300°С:
ln*Ag = - [(38 ±6) • 103 - Г(29±7)]/ЯГ. (18)
Оцененные отсюда (с учетом образования в системе фазы NaAg2) Я* и
5*, соответственно равные 8 кДж/моль и - 7 Дж/моль • К, удовлетвори-
тельно согласуются с рассчитанными по уравнениям (7) и (17), что послу-
жило основанием для расчета 5* Для систем с натрием, используя соотно-
шение (17). Определив Я* и 5*, рассчитали параметры уравнения линии
117
ликвидуса для систем с литием и натрием (см. таблицу). Считая характер
зависимости (17) постоянным для систем со всеми щелочными металлами,
можно заключить, что растворимость переходных металлов снижается в ря-
ду Li, Na, К, Cs с практически полным сохранением относительного распо-
ложения линий ликвидуса (рис. 2). Полученные результаты хорошо согла-
суются с комплексом экспериментальных данных по взаимодействию ме-
таллов и сплавов с жидкими щелочными металлами [ 1 ].
ЛИТЕРАТУРА
1. Бескоровайный Н.М., Иолтуховский А.Г. Конструкционные материалы и жидко-
металлические теплоносители. М.: Энергоатомиздат, 1983. 168 с.
2. Кауфман Л., Бернстейн X. Расчет диаграмм состояний с помощью ЭВМ. М.: Мир,
1972. 328 с.
3. Miedema A.R. The electronegativity parameter for transition metals: Heat of formation
and charge transfer in alloys. - J. Less-Common Metals, 1973, vol. 32, N 1, p. 117-136.
4. Boom R., de Boer F.R., Miedema A.R. On the heat mixing of liquid alloys-II. - J. Less-
Common Metals, 1976, vol. 46, N 2, p. 271-284.
5. Hodges C.H., Stott M.I. Theory of electrochemical effects in alloy. - Philos. Mag., 1972,
vol. 26, N 2, p. 375-392.
6. Кубашевский О. Термодинамическая стабильность металлических фаз. - В кн.:
Устойчивость фаз в металлах и сплавах. М.: Мир, 1970, с. 110-133.
7. Гуров К.П., Чудинов М.Г. К теории диффузии в бинарных системах. - В кн.: Диф-
фузионные процессы в металлах. Киев: Наук, думка, 1966, с. 45-60.
8. Бокштейн Б.С., Бокштейн С.З., Жуховицкий А.А. Термодинамика и кинетика диф-
фузии в твердых телах. М.: Металлургия, 1974. 280 с.
9. Бескоровайный Н.М., Васильев В.К., Люблинский И.Е. Определение растворимости
железа, никеля и хрома в литии методом абсорбционного рентгеноспектрального
анализа. - В кн.: Металлургия и металловедение чистых металлов. М.: Атомиздат,
1980, вып. 14, с. 135-147.
10. Кузин А.Н., Люблинский И.Е., Бескоровайный Н.М. Экспериментально-теоретичес-
кое определение растворимости переходных металлов в жидком литии. - В кн.:
Материалы для атомной техники. М.: Энергоатомиздат, 1983, с. 33-41.
УДК 669.018 + 669.15.046.552 : 536.7
СТРОЕНИЕ ПОВЕРХНОСТИ РАСТВОРИМОСТИ КОМПОНЕНТОВ
В ЖИДКОМ МЕТАЛЛЕ СИСТЕМЫ Fe-Ca-Al-S-0
Г.Г.Михайлов, Е.М.Вильгельм, Н.М.Танклевская
В связи со значительным влиянием неметаллических включений на эксп-
луатационные и технологические свойства стали в последнее время все
большее внимание уделяется изучению возможностей контроля фазового и
химического состава неметаллических образований в стали [1]. Организа-
ция такого контроля практически невозможна без построения диаграмм
состояний многокомпонентных систем в области существования равнове-
сий жидкой стали с неметаллическими фазами. Достаточно остро такая
проблема встала в связи с необходимостью массового производства авто-
матных сталей повышенной обрабатываемости, легированной кальцием
и серой. Получение кальциевой автоматной стали требует строгого регла-
мента по содержанию серы, кислорода, алюминия и кальция в металле,
способного обеспечить выделение на алюминатных включениях сульфидов
118
кальция, марганца и железа. В связи с этим необходимо установить кон-
центрационные соотношения между компонентами в жидком металле, при
которых возможно выделение из металла в качестве избыточных оксидной
и сульфидной фаз.
Поставленной цели можно достичь, если построить поверхность раствори-
мости компонентов в жидком железе в системе Fe—Са—Al—S—О. Предвари-
тельный анализ показал, что в рассматриваемой системе в зависимости от
состава жидкого металла в равновесии с ним могут существовать корунд,
моно-, би, и гексаалюминаты кальция, практически чистая окись кальция,
а также оксисульфидные расплавы, содержащие в общем незначительное
количество серы на уровне обычных металлургических шлаков рафиниро-
вочного периода . Совокупность всех процессов, которые могут протекать
при раскислении и десульфурации стали кальцием и алюминием, описана
реакциями, представленными в табл. 1. Там же приведены и зависимости
констант равновесия этих реакций от температуры.
Активности компонентов металлического расплава оценивались с по-
мощью параметров взаимодействия, представленных в табл. 2. Активности
компонентов оксисульфидиого расплава оценивались по теории регуляр-
ных ионных растворов для оксисульфидных расплавов, предложенной
В.А.Кожеуровым [2].
Выражения для активностей соответствующих оксидов и сульфидов
в соответствии с этой теорией могут быть записаны следующим образом:
Ig^FeO = 1g (*171) + I У1$ (*2 Д^И2 +Х3Д£’и2) + 71 (*з2 12 + *з21з) +
+ 72 (*2212 + *з2п) +7172212 -71(*1*г212 + *1*з21з + *2*з22з) -
-72 (*1*2 2п +*1*зб2з +*2*з22з) +72$ [*1*2 (212 - 2п) +
+ *1*3 (213 — 21з) +*2*3 (223 - 21з) ] - 72$ (1 — 271) (*1212 +
+ *2 2? + *з2?)1 /4„57 ST-
1g асао =lg(*27i) +172 $(*1^21 +*зД£,232) +71 (*1212 + *з2гз) +
+ 72 (*1212 +*з22з) + 71722? -71 (*1*2212 +*1*з213 -*2*з2гз) -
-72 (*1*2212 +*1*з213 +*2*з22з) +72$ [*1*2 (212 “ 211) +
+ *1*з (213 — 21з) +*2*з (2гз — 22з)] —7г$ (1 — 271) (*12? +
+ *2 2? +*з2?)1 /4,575 7’;
lgflAi2O3 = 1g (*з 71 ) +1 2у2$(*1Д£з2 +х2Д£’37) +2у, (Xi2i3 +
+ *22гз) +2у2(Х122з +*222з) +271712? -271 (*1*2212 +
+ *1*з21з +*2*з2гз) - 2у2 (xjXiQh + x1x3Q2t3 + *2*з22з) +
+ 3у2? [*1*2 (Q'n -2п) +*1*3 (213 -21з) +*2*з (2гз — 21з)] -
-Зу2М(1 -2/1) (х.е? + x2g? +х3е?)] I /4,575 Т;
lg flCaS =lg(*271) +172$(*1£’122 +*2^21) +71 (*1212 +*з21з) +
+ 72 (*1212 + *з21з) +71722? -71 (*1*2212 +*1*з213 +
+ *2*з22з) +71$(1 -2у2)(Х1С? +х22? +Хз2?) -71(*1*2212 +
+ *1*з213 +*2*з21з) — 71 $ [*1*2 (212 -Qn) +*1*3 (213 -22з) +
+ *2*3 (223 — 21з)11 /4,5757’, где = l/(xi +х2 + 1,5х3). П9
Основные химические реакции процесса раскисления
и десульфурации стали Са и А1
Таблица 1
Реакция 1g К = А/Т + В
А В
(ГеО)ж = [Fe] + [О] - 6 320 4,734
(СаО)ж = [Са] + [О] - 21 886 7,4
(А1аО3)ж = 2[А1] +3[О] - 58 317 18,03
(FeS)« = [Fe] + [S] + 959 2,27
(Са8)ж = [Са] + [S] - 15 300 5,65
(А1а5,)ж = 2[А1] + 3[S] - 22 337 15,05
СаО = [Са] + [О] - 24 509 8,32
CaS = [Са] + [S] - 19 200 7,05
А1гОэ = 2[А1] + 3[О] - 64 000 20,48
CaO-AljOj = [Са] +2[А1] +4 [О] - 83 790 25,46
СаО • 2А12О3 = [Са] + 4[А1] + 7[О] - 147 618 45,67
СаО -6А12О3 = [Са] + 12[А1] + 19[О] - 406 432 128,82
FeO-Al2O2 = [Fe] + 2[А1] +4[О] - 71 730 25,25
Таблица 2
Значения параметров взаимодействия е^. при Т = 1873 К
i /
Са А1 О S
Са - 0,002 - 0,072 - 8,1 - 3,75
А1 - 0,047 0,045 - 1,62 0,03
О - 3,24 -0,96 -0,2 - 0,133
S - 3,0 0,035 - 0,27 - 0,028
Если присвоить катионам Fe, Са и А1 номера 1, 2 и 3, а анионам О и S
соответственно 1 и 2, то параметры теории для шлакового расплава будут:
С12 =- 1700; 01з =-4300; 0^3=-115ОО; 0?3 = 0; 013 = 0;
012 =-4800; 012=45ОО; Q\2 = - 4500; 0j2=-11119;
ДЕ22 = ЛЕ12\ = - ДЕ’й = - ДЕ212 = - 2948;
ДЕ1?2 = Д£эг = - = - ^Е32\ = - 54401;
ДЕ3? = ДЕ?? = - ДЕ'Л = - ДЕ?? = + 57349.
С использованием приведенных данных были рассчитаны координаты по-
верхности растворимости компонентов в металле системы Fe—Са—Al—O-S.
При расчете использовались методы, применяемые в ранее опубликованных
работах [3,4]. Результаты расчета представлены на рисунке a-в в виде изо-
термических и изосоставных сечений ПРКМ. Контрастными линиями на ри-
120
Строение ПРКМ системы Ге-Ca-Al-S-O при 7=1873 К
[А1]а - 0,001, б - 0,01, в - 0,03
сунке a-в изображены составы металла, находящегося в равновесии с дву-
мя оксидными фазами.
Так, в области I заданы составы металла, равновесного с корундом, в об-
ласти 11 - с гексаалюминатом, а на линии ав заданы составы металла, равно-
весного одновременно с корундом и алюминатом. На рисунке a-в показа-
ло, какие составы металла с какими оксидными фазами находятся в равно-
весии. В области V заданы составы металла, равновесного с оксисульфид-
ными расплавами, а в области 17 - с твердым СаО. На линии dfhl, с одной
стороны, заданы составы металла, равновесного с сульфидом CaS и соот-
121
6
lq[5,7o]
ветствующими оксидными фазами, с другой — под этой линией скрыты сос-
тавы металла, равновесного только с CaS. В области VII металл, состав ко-
торого задан на линии dfhl (см. рисунок в), находится в равновесии
с твердым сульфидом кальция.
Тонкими линиями на рисунке a-в проведены изокислородные сечения
ПРКМ (1g [О, %]). На рисунке а~в видно, что по мере увеличения концент-
рации алюминия увеличиваются области составов металла, равновесных
с корундом, и области составов, равновесных с алюминатами кальция и
оксисульфидными расплавами, смещаются в сторону больших концентра-
ций кальция. Положение линии dfhl практически не меняется.
Штриховой линией на рисунке a-в нанесена максимальная приводимая
в литературе растворимость кальция в жидком металле (0,06%). Справа
от этой линии существование гомогенных металлических расплавов пробле-
матично.
Совместное выделение сульфидов и алюминатов кальция возможно, если
состав металла задан, например, в районе линииfhl (см. рисунок б). На
рисунке б видно, что в этом случае металл должен быть глубоко раскислен
(содержание кислорода < 0,001 мас.%), должен содержать кальций почти
на уровне предела растворимости (0,02—0,03 мас.%), иметь достаточно вы-
сокое содержание серы (0,03-0,06 мас.%). При более высоком содержании
кислорода, низком содержании серы и малой концентрации кальция будет
происходить образование оксидных включений.
В целом результаты проведенных исследований не противоречат практи-
ке производства автоматных сталей и позволяют сформулировать требова-
ния к химическому составу жидкого металла перед кристаллизацией.
122
ЛИТЕРАТУРА
1. Явойский В.И., Бубенчик Ю.И., Окенко А.П. Неметаллические включения и свойст-
ва стали. М.: Металлургия, 1980. 232 с.
2. Кожеуров В.А., Антоненко В.И. Химические потенциалы компонентов в ионных
растворах с произвольным числом катионов и анионов. - В кн.: Вопр. пр-ва и
обраб. стали. Челябинск: ЧПИ, 1969, № 53, с. 14-19.
3. Михайлов Г.Г., Байбуленко Е.П.'К термодинамике процессов взаимодействия кис-
лорода и серы с кальцием в жидком железе. - Изв. вузов. Чер. металлургия, 1981,
№8,с. 1-4.
4. Михайлов Г.Г., Байбуленко Е.П., Вильгельм Е.М. К расчету поверхности раствори-
мости кислорода и серы в железомарганцовистых расплавах. - В кн.: Вопр. пр-ва
и обраб. стали. Челябинск: ЧПИ, 1980, № 245, с. 7-14.
УДК 669.018.1
ПРИМЕНЕНИЕ ЭВМ К РАСЧЕТУ ДИАГРАММ СОСТОЯНИЯ
СИСТЕМ Al—Cr, Al-Fe, Al-Со, Al-Ni
В.Я. Асанович, Б.П. Бурылев
Существует достаточно большой набор методов расчета фазовых диа-
грамм, в основе которых заложены либо представления статистической фи-
зики молекулярных систем, либо принципы теории псевдопотенциала.
Определенный интерес представляют методы, позволяющие автоматизиро-
вать процедуру вычислений границ сосуществования, в частности методика
Кауфмана и Бернстейна [1]. Указанная методика основана на вычислении
энергии Гиббса смешения сплавов в приближении теории регулярных
растворов. При этом рассчитываются так называемые параметры взаимо-
действия в твердой и жидкой фазах. Для освоения методики расчета по
Кауфману и Бернстейну выбраны системы алюминидов переходных метал-
лов, для которых имеются надежно установленные диаграммы состояния.
Так как данные по расчету параметров взаимодействия имеются не для
всех компонентов, то использовали различные виды аппроксимаций энер-
гии взаимообмена в рамках моделей регулярных и субрегулярных раство-
ров [2, 3]. В связи с этим были созданы собственные программы расчета
кривых растворимости, отличные от программ Кауфмана и Бернстейна [1].
Оптимизирующая подпрограмма определяет значения коэффициентов ап-
проксимирующих функций с целью наилучшего удовлетворения экспери-
менту. Сопоставление наших программ с аналогичными у Кауфмана и
Бернстейна показывает, что последние не оптимизированы и требуют
большего машинного времени.
В монографии [1] представлен метод расчета диаграмм состояния с
помощью ЭВМ для тугоплавких переходных металлов. При этом использо-
ван термодинамический подход, развитый Дж. Ламсденом [4], совместно
с экспериментальными данными, полученными при изучении фазовых
переходов, что позволяло оценить параметры устойчивости решеток различ-
ных кристаллических модификаций ряда металлов. В свою очередь эта ин-
формация использована при расчете теплот и температур плавления неста-
бильных модификаций.
123
Описание жидкой ОЦК, ГПУ, ГЦК фаз дается четырьмя параметрами.
Разработанные для решения уравнений равновесия программы для ЭВМ
применялись при рассмотрении в каждой системе конкуренции как между
растворами, имеющими указанные структуры, так и между этими раство-
рами и соединениями двух классов. Такой подход, как утверждают авто-
ры [1 ], позволяет определить полную фазовую диаграмму и все термодина-
мические свойства данной системы и впервые дает возможность приложить
модель Ван-Лаара к большому числу металлических систем.
Расчет фазовых диаграмм двойных систем основывается на знании отно-
сительной устойчивости разных фаз. Каждая область на фазовой диаграмме
температура—состав соответствует той фазе, энергия Гиббса которой
меньше, чем у других конкурирующих фаз.
Энергия Гиббса жидкой фазы для системы (1), (2) дается выражением
ДСЖ =(1 -х)ДС? + хД6ж + ЛТ[х1пх + (1 -x)ln(1 -х)] + ДСжзб, (1)
где х - мольная доля одного из металлов, Д(7Ж, ДСЖ - энергии Гиббса
жидких фаз компонентов, ДСж3б — избыточная энергия Гиббса смешения.
В приложении регулярных растворов ДСжзб определяется формулой
Д^иэб = <2х(1-х), (2)
где параметр взаимодействия Q — постоянная величина. Парциальные мо-
лярные энергии Гиббса компонентов в случае регулярного раствора опреде-
ляются соотношениями
AGf = Д6? +ЯЛп(1 -х) + х2С,
Д6Ж = Д6Ж+ЯГ1ПХ + (1-x)2(Z
Аналогичные соотношения можно записать и для любой твердой фазы:
Дё? = Д<7“+/?Tln(l - х)+ х2Л,
(4)
ДС“ = ДО? + ЯПпх + (1 -х)2Л,
где А — параметр взаимодействия регулярного раствора с фазой а. Тогда
условия двухфазного равновесия имеют вид
ДС^Ж +АТ1П [(1 — хж)/(1 — х«)] =х2 A -xkQ,
ДС?-1 ж + ЯТ1п(хж/ха) = (1 - ха)2Л - (1 - хж)2б, (5)
где Д6“= Д67ж - Д(7“.
Кривая х0(Г) или Т0(х), определяющая геометрическое место точек,
для которых ДС“ = ДСЖ, и лежащая внутри двухфазной области, нахо-
дится из уравнения
ДС“^ж(х0, Го)=(1-^о)ДС^ж(7,о) + лоДС“^ж(Го) +
+ (Q - Л)х0(1 -х0)= 0. (6)
При фиксированной температуре значение х0 находится между ха и
хж. Если учесть возможность существования 0- и a-фаз, то получают до-
полнительно пять уравнений подобно соотношениям (5). В случае идеаль-
ных растворов (когда Q=A=B = E = 0) фазовые границы зависят только
от разности энергий Гиббса между фазами компонентов.
124
При рассмотрении диаграмм состояния с химическим соединением ф в
конкуренцию включается и данное соединение, существующее при кон-
центрации хж. Тогда энергия Гиббса i/лфазы может быть записана в виде
ДС* =(1 -хж0)ДС? +хЖ1р ДС?+Л7’[(1 - хж^)1п(1 -хжф tf/) +
+ -^жip "* Q(xж — *жip ) • (2)
Аналогичные уравнения могут быть записаны и для условий существо-
вания равновесия соединения ф с твердыми фазами.
С целью проверки методики работы [1] был проведен расчет диаграммы
состояния системы Hf-Re, для которой имеются некоторые результаты.
Расчеты проведены по трем программам: ХОТО (нулевое приближение),
TRSE (приближение регулярных растворов без учета химического соедине-
ния) , LCRSE (с учетом химического соединения). Полученные данные по-
казывают, что и методика, и программы работают удовлетворительно.
Используя полученный опыт, исследователи приступили к расчету диа-
грамм состояния алюминидов переходных металлов. Согласно методике,
для расчета необходимо иметь следующие входные данные: разности эн-
тальпий и энтропий для различных фазовых переходов, значения парамет-
ров взаимодействия для каждой из фаз. К сожалению, комплекса этих дан-
ных для исследуемых нами систем не оказалось. В принципе их можно рас-
считать на основе теории псевдопотенциала, однако таких расчетов проде-
лано не было.
Ввиду этого для описания AGe(xiT) использовали формальное описа-
ние, когда избыточная энергия выражается рядом
AGf(Xi Т) = х(1 — х)[Е - EOiT + Е02Т2 + . .. +х(£1 + ЕцТ +
+ El2T2 + ...) + x2(E2+E2iT + E22T2 +...)]. (8)
Харди [5] использовал часть ряда и предложил модель субрегулярных
растворов, для которой
AGe(x1T) = x(1 -х)[(1 — x)g(T) + xh(T)], ’ (9)
где g(T) относится к переходному элементу, a h(T) — к алюминию. В этом
случае парциальная избыточная энергия Гиббса компонентов определялась
по соотношениям:
4GFi = x2|g(T) + (2x- l)[*(T)-g(T)]J,
AGFi =(1 -х)2и(П + 2эг[й(П-К(П]1- 1
Когда g(T) = h(T), избыточная энергия симметрична, при g(T) = h(T) = const
получаем регулярный раствор, в случае g(T) = й(Г) = 0 имеем идеальный
раствор.
Простейшая линейная аппроксимация для g(T) имеет вид
g(T) = g0 +g1T, (11)
где g0 ugi — константы, определяемые из опыта в небольшом интервале
температур. В отдельных случаях использовалась и кубическая аппрокси-
мация
g(T)=g2 + g3T2 + g4T3, (12)
где g2, g3 и g4 - константы.
125
( -62760-4,6027,
I -108780 + 47,4227,
J -506260- 14,226 7,
I-154810 + 71,137,
В данной работе были использованы следующие значения для параметров
взаимодействия в случае системы Al—Fe в температурном интервале
300:2000К [6]:
-58576 - 14.2267
—175730 + 71,137,
-60670 — 2,6367(Al2Fe),
22180 + 21,767 (Al3Fe2),
84940- 12,55 7 (Al3Fe).
Все значения параметров, в Дж/моль-К. В этом случае выражение для энер-
гии Гиббса расплава, содержащего химическое соединение AlFe2, имеет вид
AG'(AlFe2)= 0,333 7Fe + 0,667 А1 + 0,222 [0,333(—62760 - 4,6027) +
+ 0,667(-108780 + 41,422 7)-(60670 - 2,636 7)] Дж/моль.
Нелинейный случай (12) можно проиллюстрировать следующими соот-
ношениями (система Al—Ni):
С= —203376 — 138,167+ 13,924- 10’272 — 27,313 10’6 73,
А = - 189987 - 149,457+ 13,924 • 10’2 72 - 27,313 • IO'6 73,
В = -220949 - 141,087+ 13,924 • 10’2 72 - 27,313 10“6 73,
126
31800+ 10,8787;
69036 - 21,548 7,
58576 - 25,5227.
С учетом изложенного в (8) —(12) составлены новые программы, с по-
мощью которых проведены расчеты диаграмм состояния алюминидов
переходных металлов. Результаты расчетов представлены на рисунке, а-в.
Как следует из наших данных, улучшенное приближение позволяет рассчи-
тать диаграммы состояния для указанных систем. Однако необходимо ука-
зать, что использованные приближения имеют ряд недостатков, в частности,
они отнимают много машинного времени при определении констант g. По-
этому нахождение параметров взаимодействия ”из первых принципов”
является более предпочтительным, так как более обосновано физически.
ЛИТЕРАТУРА
1. Кауфман Л., Берлстейн X. Расчет диаграмм состояния с помощью ЭВМ: Пер. с
англ./Под ред. И.Л. Аптекаря, А.Я. Шиняева. М.: Мир, 1972. 326 с.
2. Кожеуров В.А., Бурылев Б.П. Растворимость углерода в жидком железе в присут-
ствии марганца и кремния. - Изв. вузов. Чер. металлургия, 1958, № 1, с. 83-93.
3. Бурылев Б.П. Метод расчета термодинамических свойств бинарных растворов на
основе никеля. - Изв. вузов. Цв. металлургия, 1964, № 4, с. 65-72.
4. Ламсден Дж. Термодинамика сплавов/Пер. с англ, под ред. Н.Н. Сироты. М.: Метал-
лургиздат, 1959.440 с.
5. Hardy Н.К. A ”sub-regular” solution model and its application to some binary alloy
systems. - Acta met., 1953, vol. 1, N 2, p. 202-209.
6. Kaufman L., Nesor H. Calculation of the binary phase diagrams of Fe, Co, Ni. - Ztschr.
Metallk., 1973, Bd. 64, H. 4, S. 249-257.
УДК 621.315.592
ИССЛЕДОВАНИЕ ПОЛОЖЕНИЯ КОНОД В СИСТЕМАХ
С МНОГОКОМПОНЕНТНЫМИ ТВЕРДЫМИ РАСТВОРАМИ
М.Г. Васильев, В.Н. Вигдорович, А.А. Селин, В.А. Ханин
Многокомпонентные полупроводниковые твердые растворы на основе
соединений типа AInBv, обычно получаемые методом ориентированного
наращивания (эпитаксии) из жидкой фазы, широко используются в
электронике [1]. Для управляемой кристаллизации таких твердых раство-
ров необходима информация о составах, равновесных с кристаллами жид-
кой фазы при рассматриваемой температуре, т.е. требуется исследовать
положение конод, характеризующих двухфазное равновесие расплав-
кристалл. Многокомпонентность систем вызывает необходимость привлече-
ния расчетного подхода, поскольку при разумном числе опытов удается
изучить только локальные участки фазовых границ. Для «-компонентного
регулярного твердого раствора, равновесного с «-компонентным регуляр-
ным (или ассоциированным регуляторным) жидким раствором, расчетные
выражения для оценки положения конод были получены в работах [2, 3].
127
Аналогичный [2, 3] подход может быть использован и в случае расчета
равновесных составов (п + 1)-компонентной жидкой и «-компонентной
твердой фаз в системах с легкоплавким компонентом-растворителем,
в пренебрежимо малых концентрациях входящим в твердый раствор [4].
Однако вводимые в расчет термодинамические параметры, характери-
зующие взаимодействие компонентов в жидкой фазе, не всегда удается
надежно установить, и поэтому возможно отклонение результатов расчета
от экспериментальных данных.
В данной работе разработан метод расчета, позволяющий оценивать фа-
зовые границы без конкретных значений параметров взаимодействия в
жидкой фазе.
Рассмотрим (« + 1) -компонентную физико-химическую систему, в кото-
рой существует «-компонентный твердый раствор, образованный т эле-
ментами III и п - т элементами V групп Периодической системы (раство-
римостью (и + 1)-компонента (С) в твердом растворе пренебрегаем вслед-
ствие ее малости). Многокомпонентные твердые растворы, образованные
соединениями типа AuiBv,b общем виде записываются как
/ п \
А} А2Х ...А? В'Г’В'?*’, ...В" ( S х,= S у, = 1.
Х1 х2 хт Ут + 1 Ут+2 Уп \ . , 1 </ г
\ i = 1 / = m +1 /
(1)
Здесь А указывает на принадлежность элементов типа А' к III, а В-эле-
мента типа В7 к V группам Периодической системы соответственно, х, и
У) — доли мест атомов А1 и В' на соответствующих подрешетках цинковой
обманки. Особенностью рассматриваемых систем является неограниченная
растворимость элементов А' и В7 и достаточно полная диссоциация соеди-
нений типа А'В7 в жидком состоянии, а также эквиатомное взаимодействие
элементов А' и By с образованием конгруэнтно плавящихся соединений,
практически не растворяющих в себе составляющие их элементы, но обра-
зующие между собой неограниченные или протяженные области растворов
в твердом состоянии.
В пренебрежении растворимость элемента С в твердой фазе для области
первичной кристаллизации «-компонентного твердого раствора из обога-
щенного элементом С (« + 1) -компонентного расплава при температуре Т
можно записать т(пт) уравнений фазового равновесия [2]:
In (xfx*) - In в” = (ГДS$л - ДЯ#Л) + о,5 off/R Т- 1п(47*7*),
г = 1,.. ., т; j = т + 1,.. ., «, (2)
где x/q) и 7^) - атомная доля и коэффициент активности компонента
iff) в жидкой фазе соответственно, а* - параметр взаимодействия компо-
нентов i и j в жидкой фазе, ДЯ;ЛЛ и Д5^л- энтальпия и энтропия плав-
ления соединения А'В7 соответственно, а?-в - активность пс^вдокомпонен-
та (соединения А'В7) в твердом растворе, R - универсальная газовая
постоянная.
Коэффициент активности компонента q в жидкой регулярной смеси
определяется выражением [3]
п+1
АГ1П7* =-S аж (6чр-x*)(5QJ-х*)> (3)
р= 1. р <s
128
a — активность псевдокомпонента ij в твердом регулярном растворе, рав-
ная [2]
п
тглпдтв = RT\n(xiyj)- L atf (^ + bdk-ck)(8ir+ 8/r-cr), (4)
k - 1 к < 2
где 5 — символ Кронекера, cv - xv для К v < т и cv=yv для т < и < п.
Для области первичной кристаллизации соединения А'В7 из обогащенно-
го компонентом С расплава системы С—А'—В7 условие равновесия жидкой
и твердой фаз можно записать в виде [2]
In^xf ) = (TAS*11 - АН"/11 + 0,5 a^)/RT - \п(4уГ у/ж),
(5)
где уж и уж — концентрация и коэффициент активности компонента q в
трехкомпонентной жидкой фазе.
Равновесные составы жидкой и
твердой (Ga^In, _x.As) фаз в систе-
ме Sn-Ga-In-As (сплошные
линии - изотермы, пунктир - изо-
концентраты)
При х : 1 - 0,9, 2 - 0,7, 3 - 0,5,
4 - 0,3, 5 - 0,1
Поскольку рассматривается случай, когда а хж(х^) 1
(к = 1,... , п), то из (3) следует
ЯЛп7*« АПпт* « а*с. (6)
Тогда правые части выражений (2) и (5) равны между собой и получим
ln(x?Kx/yK) = ln(x/Kx7t) + ln4B. (7)
Выражение (7) было получено при хж < 1 (к = 1,... , п), однако можно
сказать, что и для случая, когда концентрация какого-нибудь г-компонента
по порядку величины соответствует единице (так же, как и х*), то (7)
выполняется при условии
(I - ажс/)/RT< 1 (к=1,...,п; к*г). (8)
Величины 1п(хжХ;ж) при различных температурах довольно просто мож-
но установить экспериментально, и, решая систему т(п - т) уравнений
типа (7) при заданных параметрах (из т (п - т) уравнений типа (7) толь-
ко п — 1 являются независимыми [2]), определяем положение конод,
характеризующих двухфазное равновесие расплав—кристалл.
Рассмотренный метод и был использован для равновесных составов
жидкой и твердой фаз в системах Sn—Ga—In—As и Sn—Ga—In—P—As
(рассматривалась обогащенная оловом жидкая фаза). Температурная за-
9. Зак. 244 129
висимость растворимости соединений GaP и InP, GaAs и InAs в олове
устанавливалась экспериментально [5]. Сопоставление результатов расчета
(рисунок) с экспериментальными данными показало их хорошее соответ-
ствие, что позволяет рекомендовать разработанный метод и для расчета фа-
зовых границ в других системах.
ЛИТЕРАТУРА
1. Алферов Ж.И., Гарбузов Д.З., Долгинов Л.М. и др. Многокомпонентные полупро-
водниковые твердые растворы и их применение в оптоэлектронике. - Вести.
АН СССР, 1978, №4, с. 31-36.
2. Селин А.А., Ханин В.А., Вигдорович В.Н. Термодинамический расчет фазовых
равновесий для многокомпонентных твердых растворов с эквиатомным катионно-
ионным соотношением. - ДАН СССР, 1980, т. 252, № 2, с. 406 -410.
3. Селин А.А,, Ханин ВЛ. Термодинамический расчет фазовых равновесий в много-
компонентных системах с ассоциацией в жидкой фазе. - ЖФХ, 1982, т. 56, № 8,
с. 2041-2044.
4. Батура В.П., Селин А.А. Построение поверхности ликвидуса в системе индий-
мышьяк-сурьма-висмут. - В кн.: Технология полупроводниковых соединений.
М.: МИЭТ, 1982, с. 72-75.
5. Васильев М.Г., Вигдорович В.Н., Селин А.А., Ханин В.А. Растворимость соединений
типа AIHBVв олове. - Изв. АН СССР. Неорган. материалы, 1983, т. 19, № 11,
с. 1933-1934.
УДК 669.245’293’784:536.7
ТЕРМОДИНАМИЧЕСКИЙ РАСЧЕТ
И ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ ПОВЕРХНОСТЕЙ
ЛИКВИДУС И СОЛИДУС В ТРОЙНОЙ СИСТЕМЕ
Ni-Nb-C
В.Н. Гриднев, О.М. Барабаш, Т.Н. Легкая
Диаграммы состояния переходных металлов с фазами внедрения имеют
большое значение, являясь научной основой создания новых высокопроч-
ных материалов, способных длительное время работать при повышенных
температурах. Особенно перспективными среди таких материалов являются
сплавы, образованные двумя металлами А и В с элементом внедрения,
в которых в равновесии с металлом-основой А находится термодинамичес-
ки стабильная тугоплавкая и высокопрочная фаза внедрения ВС7. Эти спла-
вы образуют квазибинарную диаграмму состояния эвтектического типа [1 ].
Основным признаком такой диаграммы состояния, в которой ВС7 вы-
ступает как самостоятельный компонент, является наличие эвтектики,
плавящейся при максимальной и постоянной температуре. Точка, соответ-
ствующая составу этой эвтектики, одновременно является перевальной
(седловинкой) точкой диаграммы плавкости тройной диаграммы А—В-С.
В последнее время в работах по фазовым равновесиям тугоплавких
металлов с фазами внедрения показано, что эта точка не лежит в плоскости
политермического сечения А—ВС7, а находится в области сплавов, для
которых В/С >1 [2], т.е. разрезы А—ВС7 не являются квазибинарными
в строгом смысле этого слова.
130
С целью изучения закономерностей, характерных для строения диаграмм
плавкости таких систем, объектом нашего исследования была выбрана
тройная система Ni—Nb— С. Такой выбор был обусловлен тем, что, с одной
стороны, диаграмма состояний этой системы мало изучена. Так, известно
лишь, что в ней существует квазибинарное сечение эвтектического типа
Ni—NbC [3]. По поводу величины температуры плавления эвтектики дан-
ные также противоречивы: от 9 до 12 мас.% NbC при температуре плавле-
ния 1200-13506С [4,5].
С другой стороны, на основе сплавов никеля с карбидом ниобия в на-
стоящее время интенсивно разрабатываются новые жаропрочные сплавы,
получаемые методом направленной кристаллизации, и знание особенностей
строения этой диаграммы необходимо для дальнейшего прогресса их разви-
тия.
Кроме того, сплавы системы Ni-Nb-C имеют относительно низкие тем-
пературы плавления и являются удобными для проведения термического
анализа с достаточной точностью.
Согласно работе [6], перевальная точка в фазовой области между метал-
лом и фазой внедрения образуется при касании двух соответствующих
изотермических границ: изотерм ликвидуса между расплавом и твердым
раствором на основе металла А, а также между расплавом и соединением
ВС7. Пересечение этих кривых указывает состав двойной эвтектики А—ВС7
в тройной системе.
В настоящей работе поверхность ликвидуса между твердым раствором
на основе никеля и расплавом (I) определялась экспериментально с по-
мощью усовершенствованной методики термического анализа. При этом
методе запись термограмм проводилась при постоянной разности темпера-
тур между образцом и термостатом, что позволило с высокой точностью
(±2°) фиксировать начало и конец плавления исследуемых сплавов. По-
верхность ликвидуса между расплавом и карбидом ниобия (П) рассчиты-
валась термодинамическими методами. Расчет этой поверхности выполнял-
ся в приближении квазихимической модели для расплава, а для термоди-
намического потенциала (ф) фазы внедрения использовалось выражение
jVA
Ф = ЛГвд0+,УаА:Пп — + NA<p,
eNB
где Na и Nb — число атомов металлов А и В в фазе внедрения на основе
ВС7; До ~ термодинамический потенциал фазы ВС7, рассчитанный на один
атом металла В.
Тогда поверхность ликвидуса между расплавом и фазой внедрения на
основе ВС7 описывается уравнением
1 Ддвс +ывс(1-2св)-саА+(1+тХ£а^ас+свшвс+сасвА)
Сс = ^ехр-------1------------------Т7------------------------’
ьв г
(1)
где сА, св, сс - концентрации в расплаве соответственно металла-осно-
вы А, легирующего металла В и элемента внедрения С; ДДвс7 ~ термоди-
намический потенциал образования фазы внедрения ВС7 из расплава в
двойной системе В—С; А = соАс + швс ~ шав1 шц ~ 6(2tty - иц - и//),
131
Рис. 1. Изотермы ликвидуса в
тройной системе Ni-Nb-C
где Vif — параметры взаимодействия атомов в расплаве, взятые с обратным
знаком, i, j = А, В, С.
Для системы Ni—Nb—С поверхность ликвидуса между расплавом и кар-
бидом ниобия описывается выражением (у = 1)
<=с =
1 ^NbC+wNbc(l-2cNb)-CNiA+2(CNia>Nic+CBwNbC+ylCNicNb)
= — ехр-------------------------------------------------------.
cNb кТ
(2)
Анализ выражений (1) и (2) показывает, что изотермическое сечение
поверхности ликвидуса между фазой внедрения ВС7 и расплавом пред-
ставляет собой искаженную гиперболу, вытянутую по соединительной ли*-
нии А—ВС7 в сторону металла А и тем больше, чем выше (по абсолютному
значению) термодинамический потенциал образования фазы внедрения.
Увеличение значения Ддвс7 также приводит к уменьшению ширины этой
гиперболы. Асимметрия изотермы ликвидуса между расплавом и твердым
раствором на основе компонента А приводит к смещению точки касания
изотерм ликвидуса I и II. Изотерма (I) в реальных системах смещена в
сторону бинарной металлической системы A-В, что и вызывает перемеще-
ние перевальной точки (точки касания) в область сплавов, обогащенных
легирующим металлом В(В/С > 1).
Таким образом, перевальная точка на диаграмме плавкости определяет-
ся точкой касания двух изотермических кривых ликвидуса. Она сдвигается
тем сильнее в сторону металла—основы и находится тем ближе к линци
А—ВС7, чем выше по модулю термодинамический потенциал образования
фазы ВСу.
Расчет изотерм ликвидуса между расплавом и карбидом ниобия про-
водили с использованием табличных значений термодинамического потен-
циала образования NbC и параметров взаимодействия, полученных при
обработке двойных диаграмм состояния Nb—Ni, Nb—С, Ni—NbC.
132
Рис. 2. Политермическое сечение Ni-NbC (а) и ( Ni + 2 ат. % Nb) -NbCOs,2 (ff)
Термодинамический расчет и термический анализ сплавов показали,
что изотермы ликвидуса между расплавом и карбидом ниобия, а также
между расплавом и твердым раствором на основе никеля располагаются
асимметрично относительно друг друга. Последняя изотерма смещена в
сторону двойной системы Ni-Nb (рис. 1), что вызывает сдвиг седловинкой
точки диаграммы плавкости (во) в сторону сплавов, обогащенных нио-
бием. Эти исследования установили отсутствие квазибинарного сечения по
эквиатомному разрезу Ni—NbC. Так, по данным микроструктурного иссле-
дования и термического анализа эвтектический сплав этого разреза содер-
жит 8,5—9,0 мас.% NbC и плавится в интервале температур от 1333 до
1341 °C (рис. 2, а). Установлено также, что конода трехфазного равнове-
сия, проходящая через точку е0, располагается ниже и параллельно экви-
атомному сечению. Точке е0 соответствует эвтектический сплав: 90 ат.%
Ni, 6 ат.% Nb, 4 ат.% С. Политермический разрез, проходящий через эту
коноду, представлен на рис. 2,6. Сечение, представленное на рис. 2,6, яв-
ляется ’’частично квазибинарным” и в граничной системе Nb—С проходит
через максимум плавления карбида ниобия.
ЛИТЕРАТУРА
1. Шурин А.К. Фазовые равновесия в трехкомпонентных сплавах, содержащих эле-
мент внедрения и стабильность композиционных материалов. - Порошковая ме-
таллургия, 1973, № 1, с. 50-53.
2. Великанова Т.Я., Артюх Л.В., Еременко В.Н. Закономерности строения фазовых
диаграмм систем W-Me(IVA)-C. - В кн.: Диаграммы состояния карбид-и нитрид-
содержащих систем. Киев: ИПМ АН УССР, 1981, с. 39-50.
3. Lemkey F.D., Thompson E.R. —Met.Trans., 1971, vol. 2, N 6, p. 1537-1544.
4. Guha J.P., Kolar D. Systems of niobium monocarbide with transition metals. - J. Less-
Common Metals, 1972, vol. 29, N 1, p. 33-40.
5. Дмитриева Г.П., Шурин A.K., Полотнюк B.B., Золкина C.B. Исследование сплавов
квазитройной системы Fe-Ni-NbC. - Металлофизика 1981, т. 3, № 6, с. 58-62.
6. Сторонкин А.В. Термодинамика гетерогенных систем. Л.: Изд-во ЛГУ, 1969. 189 с.
7. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ПОСТРОЕНИЯ
И ИССЛЕДОВАНИЯ ДИАГРАММ СОСТОЯНИЯ
УДК 621.386.12+669.017.1/3
ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ И АППАРАТУРА
ДЛЯ ИССЛЕДОВАНИЯ И ПОСТРОЕНИЯ ДИАГРАММ
СОСТОЯНИЯ МЕТАЛЛИЧЕСКИХ СИСТЕМ
В.В. Петьков
Применение метода дифракции рентгеновских лучей для исследования и
построения диаграмм состояния металлических систем общеизвестно. По
справедливому выражению авторов работы [1], метод давно уже при-
обрел репутацию классического. Одним из разделов рентгеновского мето-
да является высокотемпературная рентгенография, и в частности ее основ-
ная составная часть — высокотемпературная дифрактометрия, практи-
ческая реализация которой не только не сужает возможностей рентгенов-
ского анализа, а, наоборот, расширяет их, так как дает "in situ” прямые све-
дения о структурном состояния материала непосредственно в условиях
его практического использования или производства, которые нельзя по-
лучить никакими другими методами исследования. Достаточно сослаться
на хорошо известную дискуссию о полиморфизме хрома, конец которой
был положен благодаря высокотемпературным исследованиям, выполнен-
ным авторами работ [2, 3].
Несколько удачных примеров применения высокотемпературной рентге-
нографии для идентификации фаз при высокотемпературных превращени-
ях и построения диаграмм состояния приведены в работе [4]. Несомненно,
дифракционный эксперимент при высоких температурах требует значитель-
но больших затрат времени и средств. Однако он окупает себя объемом
и качеством получаемой информации, особенно в случаях, когда фазо-
вое и структурное состояния не фиксируются или искажаются в процессе
закалки. Особое значение приобретают исследования метастабильных со-
стояний в многокомпонентных системах.
Методические возможности высокотемпературной рентгенографии. Пер-
воначально сйедует разделить информацию, получаемую с помощью высо-
котемпературной рентгеновской съемки, на две основные группы. Первая
группа экспериментальных данных может использоваться для непосред-
ственного построения диаграмм состояния, т. е. определения положения
линий фазового равновесия. Исходные данные получают по резулт гатам
качественного фазового анализа (метод исчезновения фазы) и измерения
параметров кристаллической решетки фаз в зависимости от изменения
температуры или состава. Наиболее эффективно этот прием используется
при определении взаимной растворимости компонентов системы или
134
установлении области гомогенности интерметаллического соединения.
В этом случае можно ограничиться съемкой одного двухфазного сплава,
если, естественно, он достаточно равновесный. Чувствительность рентгено-
фазового анализа составляет несколько процентов, повышение ее при
высоких температурах зависит от многих факторов методического и
аппаратурного характера.
Вторая группа данных получается при изучении полиморфизма метал-
лов и интерметаллических соединений, кристаллической структуры фаз,
участвующих в превращении, процессов атомного и магнитного упорядо-
чения, термического расширения, кинетики высокотемпературных превра-
щений и некоторых других. Планомерное проведение экспериментов, в том
числе и прогнозирование для получения первой группы данных, позволяет
построить полную диаграмму состояния как при постоянной температуре,
так и в зависимости от ее изменения. Вторая группа данных, как правило,
используется для уточнения известных диаграмм состояния или построения
отдельных участков фазовых полей, определения границ фаз в твердом
состоянии, как это сделано в работе [5].
Аппаратурные возможности высокотемпературной рентгенографии.
Конструкции приборов, приемы работ с ними и технические возможности
рассмотрены в работах [6, 7], а опыт отечественных и зарубежных иссле-
дователей по развитию метода высокотемпературной рентгенографии обоб-
щен в монографии В.А. Финкеля [8]. В этой работе кратко освещаются
результаты наших работ по созданию системы установок-приставок к
рентгеновскому дифрактометру, вполне пригодных для эксперименталь-
ного построения или изучения диаграмм состояния металлических систем.
В состав системы входит семь модификаций установок: УРВТ-2000,
УРВТ-2000 М, УРВТ-2000 ВЦ, УРВТ-2000 ВП, УРВТ-2200 ВЦ, УРВТ-2500 и
УВВТ-2500. Каждая установка содержит высокотемпературную камеру,
пост предварительного вакуумирования, стойки управления и регистрации.
При выборе метода исследования и средств осуществления дифракцион-
ного эксперимента требования потребителя должны исходить из физи-
ческой или металловедческой задачи, свойств объекта исследования и
технических возможностей аппаратуры. К последним относят следующие
факторы: рабочая среда, температурный диапазон, особенности позицио-
нирования образца, точность измерения и поддержания температуры, дав-
ления, автоматизация процессов эксперимента, безопасность работы (здесь
не рассматриваются требования к стандартному дифрактометру). Экспе-
риментатор выдвигает условия защиты поверхности образца от внешних
воздействий, предохранение его от физико-химического взаимодействия
с материалами держателя и нагревательного элемента, получения полной
дифракционной картины от материалов, обладающих повышенной склон-
ностью к росту зерен при высоких температурах, к размерам и форме
образцов, технологичности их приготовления и многократности использо-
вания. Рассмотрим удовлетворение этих требований на примере созданной
нами системы.
Создание рабочей среды. Высокотемпературные рентгеновские иссле-
дования чаще всего проводят в вакууме или в среде инертного газа. Среду
выбирают в зависимости от упругости паров компонентов сплава при
температуре эксперимента и его чистоты. В камерах, разработанных нами,
135
можно получить давление от 6,65 10-6 Па (5 • 10-8 мм рт. ст.) до 6,65 X
X 10~* Па (5 • 10 мм рт. ст.) и сохранить его при рабочих температурах
от 300 до 2773 К. Это достигается благодаря оригинальной конструкции
камеры-насоса [9].
Во время работы камера не связана с внешней вакуумной системой и
свободно вращается на гониометре. Принцип встроенного насоса и приме-
нение беэмасляных средств вакуумирования сохраняют чистоту исследуе-
мой поверхности образца и тем самым повышают достоверность данных
ддя построения диаграмм состояния. Исследования объектов с высокой
упругостью паров, например хрома и сплавов на его основе, проводят в
атмосфере инертного газа (гелия, аргона). Газ очищают внешними сред-
ствами очистки или применяют марки ЧДА. Избыточное давление в камере
при предельной температуре (2073 К) может быть рт 10 до 100 кПа.
Получение высоких температур. Нагревательная система должна обеспе-
чивать: сохранение чистоты образца (т. е. предохранять его от напыления
материалом нагревательного элемента), получение возможно высокой
предельной температуры, малоинерционность, отсутствие или содержание
минимального количества элементов конструкции, загрязняющих рабочую
среду, длительную работу в вакууме и атмосфере инертного газа, удобство
смены и экономичность в работе. С этой целью в камерах нагревательные
системы изготовлены из тугоплавких металлов (вольфрама, тантала,
молибдена), а небольшое количество изоляторов - из окиси алюминия,
окиси гафния, окиси циркония и некоторых других высокотемператур-
ных окислов. Особенность всех систем - использование бескерамического
самоподдерживающегося нагревательного элемента. Расположение его по
отношению к образцу самое разнообразное: в камерах — с тыльной сто-
роны [10, 11], нагреватель окружает образец [12, 13], нагреватель рас-
положен внутри полого цилиндрического образца [14]. Способ нагрева -
за счет теплового потока от нагревателя. В двух камерах установок
УРВТ-2200 ВЦ и УРВТ-2500 применен комбинированный нагрев: радиа-
ционный и электронный, что позволило снизить потребляемую мощность
по сравнению с радиационным нагревом при нагревании до тех же температур.
Измерение и поддержание температуры. Методы и средства измерения
температуры в устройствах для высокотемпературной дифрактометрии
обобщены в работе [7]. Выбор чувствительного элемента (термопары)
термоэлектрического преобразователя для измерения температуры опре-
деляется в зависимости от диапазона измерений, рабочей среды, наличия
градуировки, величины погрешности в заданном диапазоне и т. д. Материа-
лы термоэлектродов должны обладать высокой жаропрочностью, корро-
зионной стойкостью, однородностью состава в используемом интервале
температур, стойкостью против физико-химического взаимодействия
друг с другом, объектом измерения и окружающей средой, достаточно
высокой механической прочностью.
В установках широко использована термопара ВР5/2О со стандартной
градуировкой до 2027 К по ГОСТ 3044—77, а также термопара ВАР5/ВР5
с высокой стабильностью термо-ЭДС [15]. Погрешность измерения до
2273 К не превышает ± 1%. Кратковременно термопара ВР5/20 может
использоваться до 2773 К. При этом погрешность возрастает до ±(1,5—2)%.
Повышение точности измерения температуры рентгенографируемой
136
поверхности неподвижного образца связано с условиями размещения
спая термопары: надежный и постоянный контакт, отсутствие посторон-
них элементов, защита спая от прямого нагрева, высокопрочная термо-
изоляция электродов. В камере [11] две термопары: спай одной прижат
к образцу, второй введен в тело образца; в камере [12] спай термопары
прижат к образцу рычагом механизма прижима, один из рычагов которого
является электродом термопары [16]; в камере [14] температура вра-
щающегося образца оценена по температуре неподвижного ’’свидетеля” [17].
В камерах установок УРВТ-2200 и УРВТ-2500 использована ’’струнная
термопара” ВРО/2О. В отличие от работы [18],где градуировка температур-
ной шкалы прибора производится по реперным точкам плавления веществ,
градуировка камер выполнена по результатам съемки чистых веществ,
имеющих фазовый переход в твердом состоянии. Использовались железо
(910, 1400°С), гафний (175О°С), окись бериллия (2070°С), окись гафния
(2520°С), ниобий (по температуре плавления 2468°С). Можно градуиро-
вать камеры по изменению периода решетки стандартных веществ в зави-
симости от температуры, а также контролировать температуру с помощью
бесконтактных датчиков температуры. Для этой цели в камерах установок
УРВТ-2000 ВЦ и УРВТ-2000 УП имеются оптические окна. Градиент темпе-
ратуры по образцу в наших камерах находится в пределах погрешности
измерения температуры [19]. Следует отметить, что аппаратурные средства
позволяют повысить точность измерения температуры. Практически это
может сделать каждый экспериментатор по результатам анализа и коррек-
ции погрешностей термопреобразователей и измерительного прибора [20].
Позиционирование образца. Держатель образца в высокотемпературной
камере должен обеспечивать: вывод исследуемой поверхности на главную
ось гониометра, колебание в небольшом угловом диапазоне, вращение
образца в собственной плоскости (или вокруг оси симметрии), предохра-
нение образца от физико-химического взаимодействия с материалом держа-
теля и нагревателя, простоту установки и удобство смены. Все камеры
имеют механизм перемещения в двух взаимно перпендикулярных направ-
лениях или в направлении, перпендикулярном направлению первичного
пучка рентгеновских лучей. Погрешность измерения перемещения 0,01 мм.
Колебание образца увеличивает количество отражающих объемов по глуби-
не образца. В конструкциях наших камер [11—13] образец колеблется
одновременно с камерой с частотой 60 ± 10 колеб/мин. Для увеличения
площади облучения вращают образец: в камерах установок УРВТ-2000 ВЦ
и УРВТ-2200 ВЦ — вокруг оси цилиндрического образца с частотой вра-
щения от 0,2 до 120 об/мин, в камере установки УРВТ-2000 ВП — в соб-
ственной плоскости образца с частотой от 20 до 120 об/мин.
Форма образцов — пластины 10X10X2 мм, цилиндры высотой 3—4 мм
и диаметром 10 мм с кольцевыми выступами, пластины толщиной ~ 2 мм
неправильной формы (чаще всего для интерметаллических соединений).
Как правило, металлический образец изолируется от держателя кругами
[14], втулками [21] или наконечниками [22] из огнеупорных окислов.
Заменяя материал держателя и изолирующих вставок, можно исследовать
окислы, минералы, карбиды и другие неорганические материалы.
Хорошо зарекомендовали себя держатели цилиндрических и плоских
образцов в камере установки УРВТ-2000 ВП [13]. На кольцевые выступы
137
2,отн.еЗ.
Фрагменты дифрактограмм (а) окиси гафния ГФО-1 и термограммы плавления молибдена (б) в тигле из этого материала
(/- интенсивность)
образца надеты кольца из окиси циркония. Кольцо своим внутренним
диаметром надето на торцевой выступ держателя. Образец в сборе с коль-
цами обжимается разрезной втулкой, состоящей из трех равноценных
частей, и дополнительно фиксируется скруткой проволоки из тантала.
Изоляция образца от держателя повышает реальную температуру исследо-
вания. Для образцов, имеющих форму пластины, на торце держателя вы-
полнены направляющие типа ’’ласточкин хвост”.
Конструкция держателя образца и механизма вращения [23] значитель-
но уменьшила величину теплового потока от образца к подшипникам ме-
ханизма вращения и обеспечила надежную работу, особенно в интервале
2073 до 2273 К.
Обеспечение эксперимента. Электрическая схема каждой установки-
приставки обеспечивает: управление режимами нагрева образца, регистра-
цию температуры образца, измерение давления в рабочем объеме камеры
и посте предварительного вакуумирования, управление встроенным высо-
ковакуумным насосом и цеолитовыми насосами; колебание камеры во-
круг вертикальной оси и вращение образца в собственной плоскости или
вокруг собственной оси; безопасность работы при прекращении подачи
воды, повышении давления в камере или изменении высокого напряжения.
Автоматическое управление нагревом с учетом величины заданного давле-
ния позволяет: при увеличении давления в камере прекратить нагрев и
перейти в режим изотермической выдержки; продолжить нагрев в автома-
тическом режиме с заданной скоростью при снижении давления; произ-
вести охлаждение образца при превышении давления 1,3 • 10-1 Па (1 X
X 10‘3 мм рт. ст.). При снижении давления эти операции осуществляются
автоматически. Эффективность принципиальной вакуумной схемы, реали-
зованной в установках, видна на примере снижения давления на 2-3 поряд-
ка в камере установки УВД-2000 при соединении ее с встроенными высоко-
вакуумным насосом и постом предварительного вакуумирования установ-
ки УРВТ-2000 ВЦ [24].
Таким образом, с помощью установок проведены съемки различных ма-
териалов как с целью градуировки камер, так и получения оригинальных
результатов: изучение природы фаз Лавеса в сплавах на основе хрома [5],
исследование распада титановых сплавов [25], процессов упорядочения
железоникелевых сплавов [26] и др. В камере установки УРВТ-2500 заре-
гистрировано превращение тетрагональной модификации окиси гафния в
кубическую, происходящее при 2823 К. На наличие фазового перехода в
тигле из окиси гафния ГФО-1 указали авторы работы [27] при проведении
ДТА сплавов на основе молибдена (рисунок).
На основе единого подхода разработана система установок-приставок
к рентгеновскому дифрактометру, удовлетворяющая методическим и
аппаратурным требованиям проведения экспериментов для исследования
и построения диаграмм состояния металлических систем.
ЛИТЕРАТУРА
1. Гладышевский Е.И., Гринь Ю.Н. Рентгенографический анализ при изучении диа-
грамм состояния. - В кн.: Диаграммы состояния металлических систем. М.:
Наука, 1981, с. 257-261.
2. Васютинский Б.М., Картмазов Г.Н., Финкель В.А. К вопросу о структуре хрома
при температурах 700-1700° С. - ФММ, 1961, Т. 12, вып. 5, с. 771-773.
139
3. Ross R.G., Hume-Rothery W. High temperature X-ray metallography.- J. Less-Common
Metals, 1963, vol. 5, N 3, p. 258-270.
4. Модель M.C. Применение высокотемпературной рентгенографии для изучения
диаграмм состояния. - В кн.: Теоретические и экспериментальные методы ис-
следования диаграмм состояния металлических систем. М.: Наука, 1969, с. 246-251.
5. Svechnikov V.N., Kocherzhinsky Yu.A., Petkov V.V. et al. Phase transformation in
chronium-titanium compounds. - J. Less-Common Metals, 1972, vol. 29, p. 329-332.
6. Кочержинский Ю.А., Петьков В.В. Высокотемпературные рентгеновские устрой-
ства для исследования порошковых и компактных объектов (обзор). - Порош-
ковая металлургия, 1970, № 5, с. 88-102.
1. Епифанов В.Г., Кочержинский ЮЛ., Петьков В.В. Приборы для высокотемпера-
турных рентгеновских исследований (обзор). - В кн.: Приборы для исследования
физических свойств материалов. Киев: Наук, думка, 1974, с. 16-34.
8. Финкель ВЛ. Высокотемпературная рентгенография металлов. М.: Металлургия,
1968. 204 с.
9. А.с. 212380 (СССР). Высокотемпературная высоковакуумная камера-приставка
к рентгеновскому дифрактометру/Краковецкий-Кочержинский Ю.А., Миклу-
ха П.И., Пан В.М., Петьков В.В. - Опубл, в Б.И., 1972, № 9.
10. Кочержинский ЮЛ., Петьков В.В. Высокотемпературная приставка к рентгенов-
скому дифрактометру. - ПТЭ, 1972, № 1, с. 191-194.
И. Евпрев AJJ., Епифанов В.Г., Кочержинский ЮЛ. и др. Высокотемпературная рент-
геновская установка УРВТ-2000. - В кн.: Аппаратура и методы рентгеновского
анализа. Л.: Машиностроение, 1978, вып. 20, с. 28-39.
12. Петьков В.В., Епифанов В.Г., Тарнавский А.И., Поленур А.В. Высокотемператур-
ная камера-приставка к рентгеновскому дифрактометру. - Завод, лаб., 1977,
т. 43, № 11, с. 1375-1377.
13. Пастернак В.В., Петьков В.В., Подорожный В.П. и др. Установка для рентгенов-
ских исследований структуры материалов при высоких температурах. - В кн.:
Физические методы исследования металлов. Киев: Наук, думка, 1981, с. 186-198.
14. Петьков В.В., Епифанов В.Г., Завилинский А.В. и др. Высокотемпературная ка-
мера-приставка к рентгеновскому дифрактометру. - ПТЭ, 1978, № 1, с. 234-236.
УЗ.Курытнык И.И., Стаднык Б.И. Высокотемпературные термоэлектрические пре-
образователи. - Измерение, контроль,автоматизация, 1980,№5/6 (27/28), с. 12—21.
16. А.с. 537289 (СССР). Высокотемпературная камера-приставка к рентгеновскому
дифрактометру/Епифанов В.Г., Петьков В.В., Тарнавский А.И. - Опубл, в Б.И.,
1976, №44.
17. А.с. 502299 (СССР). Высокотемпературная камера-приставка к рентгеновскому
дифрактометру/Епифанов В.Г., Завилинский А.В., Исьянов В.Э., Петьков В.В. -
Опубл, в Б.И., 1976, № 5.
18. Кочержинский Ю.А. Современный термический анализ в исследовании диаграмм
состояния. - В кн.: Диаграммы состояния металлических систем. М.: Наука,
1981, с. 241-249.
19. Кочержинский Ю.А., Петьков В.В., Поленур А.В. Исследование высокотемператур-
ной приставки к рентгеновскому дифрактометру. - В кн.: Приборы исследования
физических свойств материалов. Киев: Наук, думка, 1974, с. 70-73.
20. Саченко АЛ., Твердый Е.Я. Совершенствование методов измерения температуры.
Киев: Техшка, 1983.104 с.
21. А.с. 382960 (СССР). Нагревательное устройство высокотемпературной приставки
к рентгеновскому дифрактометру/Краковецкий-Кочержинский Ю.А. - Опубл,
в Б.И., 1973, №23.
22. А.с. 457913 (СССР). Устройство для крепления образцов в высокотемпературной
приставке к рентгеновскому дифрактометру/Епифанов В.Г., Краковецкий-Кочер-
жинский Ю.А., Тернавский А.И., Подорожный В.П., Петьков В.В. - Опубл, в Б.И.,
1975, №3.
23. А.с. 684410 (СССР). Высокотемпературная камера-приставка к рентгеновскому
дифрактометру/Епифанов В.Г., Петьков В.В., Поленур А.В., Тернавский А.И. -
Опубл, в Б.И., 1979, № 33.
24. Гусев КЛ„ Петьков В.В., Котович В.Ю. и др. Об улучшении вакуумных характе-
ристик установки УВД-2000. - Приборы и системы управления, 1981, № 10,
28-30.
140
25. Азаматова Ф.И., Петьков В.В., Поленур А.В. и др. Структурное состояние титано-
вых сплавов при высоких температурах. - Металлофизика, 1980, т. 2, № 5,
с. 97-102.
26. Лариков Л.Н., Усов Ю.В., Поленур А.В., Петьков В.В. Об энергии образования
точечных дефектов в железоникелевых сплавах. - Укр. физ. журн., 1980, т. 25,
№ 10, с. 1675-1678.
27. Кочержинский ЮА., Василенко В.И., Шишкин Е.И. Прибор для дифференциаль-
ного термического анализа в интервале температур 1500-3000 К. - В кн.: Опти-
ческие методы измерения температуры в металлургии. М.: Наука, 1979, с. 96-100.
УДК 541.121.536.7
ПРИМЕНЕНИЕ МЕТОДОВ СВЕРХСКОРОСТНОГО ОХЛАЖДЕНИЯ
МЕТАЛЛИЧЕСКИХ СПЛАВОВ
ДЛЯ ИССЛЕДОВАНИЯ И ПОСТРОЕНИЯ ДИАГРАММ СОСТОЯНИЯ
Д.А. Петров
Существенно важным элементом диаграммы состояния при разработке
и применении конструкционных сплавов, работающих при высоких темпе-
ратурах, является солидус диаграммы. Определение солидуса диаграммы
состояния всегда представляет значительные трудности ввиду того, что на
кривых охлаждения он всегда неопределен, на кривых же нагрева, если
они снимаются без предварительной термической обработки образца, тем-
пература солидуса обычно устанавливается значительно ниже температуры
истинного солидуса вследствие всегда имеющей место сегрегации при за-
твердевании сплава.
Определение истинного солидуса требует поэтому проведения предва-
рительных длительных нагревов до предельно высоких температур вблизи
солидуса для приведения сплава в равновесное состояние.
Эта предварительная - перед снятием кривой нагрева — обработка тре-
бует, как правило, значительного времени, до десятков и сотен часов и даже
дней (можно сравнить с определением кривой солидуса в системах Bi-Sb
[1—3] и Ge—Si [4,5]), впрочем, без достаточной уверенности в достижении
равновесного состояния, если обработка не сопровождается тщательным
микроскопическим или рентгеновским поэтапным анализом.
Достигнутые к настоящему времени огромные успехи в разработке
и применении сверхскоростного охлаждения металлических сплавов из
расплава дают возможность поставить метод определения солидуса по
кривым нагрева на новые пути, делая этот метод высокопроизводительным.
Определенное ограничение всех методов сверхскоростного охлаждения
из расплава состоит в том, что материал с присущими ему характеристика-
ми сверхскоростного охлаждения может быть сформирован только в тон-
ких сечениях, в диапазоне толщин обычно 30—70 мкм. Впрочем, для тонких
методов термического анализа это ограничение не является существенным,
к тому же тонкие сечения могут быть компенсированы существенной ши-
риной или длиной образца.
В условиях сверхскоростного охлаждения из расплава в значительной
мере или полностью подавляется диффузия в жидкой фазе. Процессы за-
141
Типичные значения времен гомогенизации твердого
раствора вольфрама в никеле
Таблица 1
Параметр Обычное затвердевание Быстрое затвердевание
1, мкм 1000 100 10 1
t 10 недель 16 ч 10 мин 6 с
твердевания в этих условиях характеризуются захватом твердой фазой
пересыщенных концентраций растворенных компонентов и примесных
атомов, так иго в пределе твердая фаза может иметь тот же состав, что и
породившая ее жидкость. Масштабы сегрегации снижаются до степени,
при которой она не выходит за пределы концентраций в области твердых
растворов, оставаясь внутри твердорастворной или гомофазной сегрегаци-
ей, и не сопровождается выделением вторых фаз — исключается гетеро-
фазная сегрегация.
Диффузия в этих условиях может распространяться лишь на короткие
расстояния, так что в жидкости возникает множество микрообъемов,
в которых превращение протекает и завершается практически одновре-
менно. Этим обеспечивается практически полная однородность форми-
рующихся из жидкости тончайших кристаллов твердого раствора на ми-
кронном и субмикронном уровнях.
Достойна внимания приводимая в работе [6] табл. 1, иллюстрирующая
снижение во времени t диффузии при 1600 К, требуемой для достижения
99%-ной гомогенизации вольфрама в никеле для двух сегрегатных рас-
стояний /, типичных для обычного затвердевания, и то же — для двух сегре-
гатных расстояний, типичных для быстрого (сверхскоростного) затвер-
девания.
Из этих результатов следует, что для приведения в равновесие сверх-
быстроохлажденного из расплава образца достаточно нескольких минут,
если равновесным является однофазный твердый раствор.
Таким образом, прежде отдельная предварительная операция отжига
не является необходимой на сверхбыстроохлажденных образцах, посколь-
ку она по существу совмещается с операцией непосредственного нагрева
образца для записи кривой нагрева. Продолжая нагрев образца до темпе-
ратур выше ликвидуса сплава и охлаждая его затем для снятия кривой
охлаждения, получаем дополнительную информацию о ликвидусе того
же сплава, для которого при нагреве была определена точка солидуса.
Эти сплавы целесообразно использовать также для определения кривых
растворимости в твердом состоянии, применяя световую и электронную
микроскопию для определения растворяющихся и выделяющихся фаз
при нагреве и охлаждении.
Насколько эффективен этот метод в применении даже к очень сложным
по составу сплавам, можно видеть на примере определения солидуса на
образцах сплавов на основе никеля, изготовленных методом порошковой
металлургии с применением сверхбыстрого охлаждения интенсивным
потоком гелия мельчайших капель расплава, распыляемых на вращаю-
щемся со скоростью 24 000 об/мин горизонтальном диске. Скорость охлаж-
142
Таблица 2
Температура начала плавления (°C) сплавов никеля
в обычном литом (1) и сверхбыстроохлаждеином (2)
состояниях
Сплав 1 2
1 1190 1250
2 1210 1292
3 1180 1280
4 1265 1340
Составы сплавов никеля, мае. %
Таблица 3
Сплав С Сг Со Мо W Ti Al В Zr
1 0,18 10,0 15,0 3,0 — 4,7 5,5 0,014 0,06
2 0,15 9,0 10,0 — 12,5 (l,8Nb) 2,0 5,0 0,015 0,05
3 0,35 12,0 10,0 3,0 6,0 3,0 4,6 0,015 0,10
4 - - - 18,0 - - 8,0 - -
При меча н и е. В сплавах 1 — 3 — остальное Ni.
Составы сплавов приводятся в табл. 3.
дения, достигаемая в этих условиях, составляет от 107 до 105 град/с для
частиц размером от 10 до 100 мкм соответственно [7].
Данные термического анализа, полученные на изготовленном материа-
ле, приведены в табл. 2.
Температура начала плавления сверхбыстроохлажденных образцов
(см. табл. 2) отвечает истинному солидусу сплавов.
Для получения сплавов (образцов) в сверхбыстроохлаждеином состоя-
нии лаборатория, занимающаяся изучением и построением диаграмм со-
стояния, должна быть оснащена необходимой аппаратурой. В лабораторных
условиях удобно, по нашему мнению, использовать установки двух типов.
В устройстве [8], схема которого показана на рис. 1, сплав помещается
в трубку £>из плавленого кварца с небольшим отверстием в донной части
(подобно глазной капельнице) и доводится до расплавления с помощью
нагревателя Е. Отверстие в трубке таково, что расплавленный металл мо-
жет начать течь сквозь него только при небольшом давлении газа, который
в нужный момент подается в трубку; А — фиксированная наковальня,
В — боек, мгновенно ускоряемый сжатым газом.
Пластины С - сменяемые из Си или СиВе. Боек в начальной стадии на-
ходится под давлением газа, но удерживается пальцем F, действующим от
соленоида. Когда капля расплава подается под некоторым давлением из
трубки, она пересекает пучок света между источником Си фотоэлементом
Ни триггер с задержкой запускает боек.
Под влиянием удара капля раздавливается и затвердевает в виде листоч-
ка (фольги) диаметром ~ 25 мм при толщине 30—75 мкм. Для никелевых
143
Рис. 1. Схема устройства
боек-наковальня
Рис. 2. Схема устройства для
получения тонких лент на вра-
щающемся колесе
сплавов, например, это по массе составляет 0,15—0,30 г за одну операцию
(за одну каплю). Скорость охлаждения в этих условиях достигает 106 -
107 град/с.
Другое устройство [9], схема которого показана на рис. 2, рассчитано
на получение непрерывной ленты шириной от 3 мм и более при толщине
30—70 мкм.
Расплавленная тонкая струя металла диаметром от 0,3 до 1 мм под дав-
лением газа в 1^-2 атм подается из трубки непрерывно на быстро вращаю-
щееся (до 2000 об/мин и более) медное колесо, с которого лента сходит
со скоростью до 2000 м/мин и более. Небольшая лабораторная установка
этого типа описана в работе [10].
Изготовление образцов сплавов для термического анализа можно произ-
водить на установках для катодного (атомарного) распыления. Скорость
осаждения в таких установках достигает 1-3 мкм/мин. Достоинством этих
распылительных устройств является полное сохранение стехиометрии
(химического состава) распыляемой мишени в осаждаемом материале, его
к тому же высокая (’’теоретическая”) плотность. Скорости охлаждения,
которые достигаются в оптимальных условиях этого метода (охлаждаемые
катод (мишень) и подложка-образец), достигают 1013—1015 град/с.
ЛИТЕРАТУРА
1. Хансен М. Структуры бинарных сплавов. М.: Металлургиэдат, 1941, с. 320-323.
2. Хансен М., Андерко К. Структуры двойных сплавов. М.: Металл у ргиэдат, 1962.
357 с.
3. Вечер АЛ., Полещук ПЛ., Козыро АЛ., Кусаков А.Г. Диаграмма состояния
системы Bi-Sb. - В кн.: IV Всесоюз. совещ. "Диаграммы состояния металли-
ческих сплавов”: Тез. докл. М.: Наука, 1982. 96 с.
4. Хансен М., Андерко К. Структуры двойных сплавов. М.: Металлургиздат, 1962.
822 с.
5. Петров ДЛ. Нарушения равновесия при кристаллизации твердых растворов. -
ЖФХ, 1947, т. 21, вып. 12, с. 1449-1460.
6. Cohen MJ Kear В.Н., Mehrabian R. Rapid solidification processing. 6. An Outlook. -
In: Rapid solidification processing, principles and technologies: Proc. П Intern, conf.
1980, p. 1-23.
144
7. Boudeau R.G., Moore J.В. Thermomechanical processing of RSR superalloy powders. -
In: Rapid solidification processing: Proc. I Intern, conf. 1977, p. 344-336.
8. Duwez P. Structure and properties of alloys rapidly quenched from the liquid state. -
Progr. Solid State Chem., 1967, vol. 3, p. 377-406; Trans. ASM, 1967, vol. 60, p. 607-
633.
9. Gilman J J. Metallic glasses. - Science, 1980, vol. 208, p. 856-861.
10. Lieberman H.H. Gas boundary layer effects in processing glassy alloy ribbons: Rapidly
quenched metals. 3. - In: Proc. Ill Intern, conf., 1978, vol. 1, p. 34-40.
УДК 543.422.8+548.734
КОЛИЧЕСТВЕННЫЙ РЕНТГЕНОВСКИЙ ФАЗОВЫЙ АНАЛИЗ
ПО ДИФРАКТОГРАММАМ С НАЛОЖЕННЫМИ ЛИНИЯМИ ФАЗ
О. Г. Карпинский, Л.Е. Шелимова
Для определения фазового состава и границ.областей существования
фаз при изучении диаграмм состояния применяется метод количественно-
го фазового анализа. Этот метод основан на количественном сравнении
интенсивности линий разных фаз друг с другом, которые прямо пропор-
циональны объемным долям этих фаз в сплаве. Существует много разно-
видностей метода. Однако в любом из них для сравнения выбирают доста-
точно яркие, близко расположенные линии, свободные от наложения дру-
гих линий анализируемой или остальных фаз многофазного образца [1].
Необходимость избегать наложений при выборе аналитических пар
линий ограничивает возможность применения метода при близости пара-
метров элементарных ячеек фаз или в том случае, когда структура фаз
различается только характером деформации некоторого атомного мотива.
Примером последнего являются структуры трех изученных авторами
полиморфных модификаций монотеллурида германия. Эти модификации
существуют в узкой области концентраций (порядка 1%): высокотемпе-
ратурная кубическая 0-фаза типа NaCl и две низкотемпературные — ромбо-
эдрическая а-фаэа и ромбическая 7-фаза, структуры которых являются
производными от структуры типа NaCl и разделены двухфазными об-
ластями [2]. Наиболее интенсивные и характерные линии указанных фаз
в двухфазных сплавах налагаются друг на друга.
Нами разработан метод количественного анализа, который позволяет
точно определять фазовый состав сплава и в тех случаях, когда дифрак-
ционные линии фаз налагаются друг на друга. Он использует автомати-
ческую запись рентгенограммы на дифрактометре ”по точкам” с после-
дующей обработкой полученных данных на ЭВМ. Метод основан на том,
что интенсивность отражения в каждой точке многофазной рентгенограм-
мы есть сумма аддитивных вкладов интенсивностей отдельных фаз
N
i=l
где Ц (к) — интенсивность спектра ьфазы в точке с координатой к, а; — до-
ля z-фазы в сплаве, N — количество фаз в образце, 1(к) — интенсивность
спектра многофазного образца в той же точке.
1/2 10. Зак. 244 145
2в
Рис. J. Фрагменты дифрактограмм однофазных (а) сплавов с содержанием 50,3
(7) и 51 ат. % Те (2) и двухфазного (б) а + у с содержанием 50,8 ат. % Те (5, 4)
3 — эксперимент, 4 — расчет
Рис. 2. Диаграмма состояния системы Ge-Te в области соединения GeTe
1 — результаты дилатометрического анализа, 2 — результаты ДТА, 3 — точки
получены в результате изучения электрофизических свойств, 4 — результаты рентгено-
фазового анализа
Для проведения анализа нужно иметь эталонные рентгенограммы опре-
деляемых фаз и рентгенограмму исследуемого сплава, снятые ”по точкам”
в одинаковых условиях (форма, дисперсность образца, геометрия съемки,
режим аппарата). По этим данным можно составить столько линейных
уравнений, в скольких точках спектра проводились измерения интенсив-
ности. Обработка результатов измерений методом наименьших квадра-
тов позволяет количественно определить фазовый состав многофазных
сплавов. Метод был использован авторами для количественного фазового
анализа сплавов теллурида германия и определения границ двухфазной
области. Съемка рентгенограмм выполнена на дифрактометре ДРОН
(Fe Ка-излучение, пропорциональный счетчик; запись ”по точкам” с выво-
дом на перфоленту). Расчет проведен на ЭВМ ”Минск-22”.
Блок-схема программы расчета фазового состава для двухфазного
образца:
1. Ввод рентгенограмм эталонов (Д, /2) и образца (7).
146
2. Коррекция исходных данных по положению.
3. Составление нормальных уравнений
п п п
Л + S. д (k)I2 (к)а2 = S Л (*)/(*),
K~l *=i it = i
” п п
S Л (к)12 (к)<11 + S Я(Л)д2=Е 12(к)1(к).
*=1 fc = l fc=l
4. Решение системы нормальных уравнений.
5. Вычисление профиля изучаемого участка спектра.
6. Определение относительных погрешностей.
7. Нормализация и определение погрешности анализа.
8. Печать фазового состава образца и его ошибки.
Проверка метода выполнена на модельном образце, приготовленном
смешением порошков а- и у-фаз в соотношении 1:1, Расчет по программе
дал содержание а- и у-фаз в образце, равное 5,0 ± 2%.
Иллюстрацией метода служит рентгенограмма двухфазного а + у сплава
теллурида германия с 50,8 ат. % Те, приведенная на рис. 1. В верхней части
рисунка помещены фрагменты дифрактограмм двух фаз: дублет 220 -
220 ромбоэдрической a-фазы и триплет 002 - 411 — 020 ромбической
у-фазы. Внизу сплошной линией показан фрагмент двухфазного а + у спла-
ва, кружками - вычисленный профиль. Содержание a-фазы в сплаве 22 ±
± 2% и у-фазы - 78 ± 3%.
Исследование литых сплавов, проведенное после длительного гомо-
генизирующего отжига при 340° С, позволило уточнить диаграмму состоя-
ния системы Ge—Те вблизи области гомогенности теллурида германия,
включая области фазовых переходов в GeTe [2].
Диаграмма состояния представлена на рис. 2. Границы двухфазной об-
ласти были рассчитаны исходя из фазового и химического составов двух-
фазных сплавов. При 340°С двухфазная а + у область лежит в пределах
50,5-50,9 ат. % Те, что хорошо согласуется с результатом микроструктур-
ного анализа. Точность определения положения границ не хуже 0,05 ат. %.
ЛИТЕРАТУРА
1. Уманский Я.С., Скоков Ю.А., Иванов А.Н., Расторгуев Л.Н. Кристаллография,
рентгенография и электронная микроскопия. М.: Металлургия, 1982. 632 с.
2. Абрикосов Н.Х., Карпинский О.Г., Шелимова Л.Е., Коржуев МА. Физико-хими-
ческое исследование теллурида германия в области фазовых переходов. - Изв.
' АН СССР. Неорган. материалы, 1977, № 12, с. 2160-2164.
147
УДК 539.2+ 669.295
ИССЛЕДОВАНИЕ ФАЗОВЫХ РАВНОВЕСИЙ
В ТРОЙНОЙ СИСТЕМЕ Ti-Al-Fe
МЕТОДОМ МЕССБАУЭРОВСКОЙ СПЕКТРОСКОПИИ
С.Н. Пастушенко
В настоящей работе для исследования фазовых равновесий в тройной
системе Ti-Al-Fe в области малых (до 1%) концентраций железа применен
метод ядерного 7-резонанса (ЯГР). Ранее в работах [1, 2] была проде-
монстрирована возможность индикации отдельных фазовых составляющих
сплавов системы Ti—Fe путем выделения в спектрах ЯГР компонентов,
соответствующих отдельным фазам. Вместе с тем результаты различных
авторов относительно сверхтонкой структуры мессбауэровских спектров
(СТС МС) противоречивы [1-4], что обусловлено, на наш взгляд, отсут-
ствием единого мнения о предельной растворимости железа в a-Ti и а- ,
а2 -сплавах системы Ti- Al.
Согласно работам [5, 6], растворимость железа в a-Ti при 550—600° С
не более 0,5%, а в сплавах Ti-Al предельная растворимость железа в об-
ласти а- и а2-фаз также не превышает 0,5% [7]. В работах [5-7] положе-
ние фазовых границ a-0}> а-а + TiFe определялось на основании анализа
микроструктур и рентгенограмм сплавов при минимальном содержании
железа в сплавах 0,5%. Очевидно, эта концентрация соответствует предель-
ной, ниже которой на микроструктуре нельзя выявить наличие второй фа-
зы. Такой же, вероятно, предел возможностей определения фазовых границ
методом измерения магнитной восприимчивости сплавов Ti-Fe [8]. Зна-
чительно большей чувствительностью для регистрации в сплавах Ti-Fe
малой доли второй фазы обладает метод ЯГР на атомах 5 7 Fe [ 1J.
В настоящей работе представлены результаты изучения МС поглощения
на атомах s 7Fe, вводимых в сплавы Ti-Al в количествах от 0,1 до 2 мас.%.
Сплавы выплавляли из химически чистого алюминия, йодидного титана
и железа, обогащенного изотопом 5 7Fe. Из отожженных при 1 lOCfC слитков
напяливанием и истолчением в агатовой ступке получали порошок диспер-
сностью 20-25 мкм, который затем отжигали в вакууме 1 ч при 550 и 780° С.
Охлаждение кварцевой трубки с порошком от 780° С производили на воз-
духе в течение 20 мин. Мессбауэровские измерения проводились на спект-
рометре ЯГРС-4 в режиме постоянных ускорений с использованием много-
канального анализатора АИ 256-6. Источник - s7Co в хроме. Выделение
составляющих в МС производилось на ЭВМ М-220 по программе, реализую-
щей метод наименьших квадратов. Калибровку полученных спектров и
расчет данных по изомерному сдвигу (ИС) производили относительно
нитропруссида натрия Na2 [Fe(CN)5 NO] -2Н2О. Ошибка в определении
изомерного сдвига составляла не более ± 0,02 мм/с.
Результаты анализа СТС МС сплавов Ti-Al-Fe представлены в таблице,
а на рис. 1 показаны некоторые спектры. Разложение спектров на состав-
ляющие показало, что они представляют суперпозицию либо двух сингле-
тов (сплавы Ti—0,1 Fe), либо синглета и дублета (сплавы Ti-Al-Fe). Шири-
на лоренцевых компонентов в спектрах - в пределах 0,32—0,38 мм/с. Ле-
вый одиночный компонент (6£ = 0,9 мм/с) присутствует во всех спектрах,
148
Рис. 1. Мессбауэровские спектры сплавов
Ti—О,I мае. % 5,Fe (/) и Ti24 g A^Feg^
(2) при 550° С
Пунктир — лоренцевы составляющие
спектров, е — поглощение, v — доплерова
скорость источника, мм/с; 1,2 — сплавы
из таблицы
Рис. 2. Предельная растворимость Fe
в Ti-AI сплавах по результатам анализа мес-
сбауэровских спектров
и его интенсивность всегда увеличивается после отжига при 550° С. Правый
компонент спектров - синглет в случае сплавов Ti-Fe и дублет в случае
сплавов Ti—Al—Fe. С увеличением содержания алюминия в изученных спла-
вах а- и а2-фаз доля дублета в спектрах увеличивается (см. рис. 1).
Согласно работам [5, 6], в сплавах Ti-Fe, богатых титаном, при темпе-
ратурах ниже температуры эвтектоидного превращения(3—а + TiFe (590° С)
в равновесии находятся a-твердый раствор Fe в Ti и интерметаллид TiFe.
Изомерный сдвиг левого компонента МС (0,09 мм/с) совпадает в пределах
погрешности эксперимента с величиной §£’ = 0,11 мм/с для соединения
Ti-Fe [2, 9], и это обстоятельство, а также рост интенсивности левого
компонента МС после отжигов литых и закаленных сплавов при 550°С
свидетельствуют о наличии в сплавах Ti -Fe интерметаллидной фазы TiFe и
об увеличении количества этой фазы при отжиге. Доля правого компонен-
та МС сплавов Ti—Fe уменьшается в случае отжига литого сплава при
550°С и вновь увеличивается при отжиге и быстром охлаждении порош-
ка от 780°С. ИС этого синглета, равный 0,31 мм/с, согласно [2], совпа-
дает с соответствующей величиной для атомов 57 Fe в a-Ti. Все это позво-
ляет утверждать, что левый и правый компоненты спектров соответствуют
фазам TiFe и a-Ti.
Если считать, что доля соответствующего компонента в эксперименталь-
ном спектре пропорциональна числу атомов железа, растворенных в данной
фазе, то можно утверждать, например, что при 550° С в a-Ti растворяется
17% от общего числа атомов железа, имеющихся в сплаве Ti—0,1% Fe.
Отсюда следует, что растворимость железа в титане составляет около
149
Режимы термообработки, доля дублета в МС (х2)
и фазовый состав сплавов Ti-Al-Fe по результатам анализа СТС МС
Номер образца Состав, ат.% Режим термообработки хг, % Фазовый состав
1 Ti,4Al, 0,1 мас.% Fe Литой 52 a’ + TiFe
2 Ti, s Ats(O,l% Fe) Отжиг 550° С, 1 ч 34 а + TiFe
3 Ti85,3A114,3Fe0,4 Отжиг 550° С, 1 ч 15 а + а, + TiFe
4 Ti74,6A125Fe0,4 Литой 83 & + а2 + TiFe
5 Ti74,6A12SFe0,4 Закалка от 1150° С в масло 88 0 + а2
6 Ti74,6A125Fe0,4 Отжиг 550° С, 1 ч 28 а2 + TiFe
7 Ti74,6A125Fe0,4 Отжиг 780° С, 1 ч 54 а2 + TiFe
8 Ti75,7A123,9Fe0,4 Отжиг 780° С, 1 ч 30 а2 + TiFe
9 Ti73,7 A125,9Fe0,4 Отжиг 780° С, 1 ч 66 а2 + TiFe
10 Ti69,6A130Fe0,4 Отжиг 550° С, 1 ч 61 а2 + TiFe
При нансной мечание. x, - отношение площади дублета ко всей площади под резо- кривой поглощения.
0,017 ат. % (0,02 мае. %) при 550° С. Этот результат находится в хорошем
согласии с недавней работой [10], в которой фазовые равновесия
в сплавах Ti-Fe в области малых концентраций железа изучались методом
измерения электросопротивления.
Как следует из таблицы, в спектре сплава Ti9 s Als увеличивается доля
второй (правой) компоненты, что свидетельствует о повышении содержа-
ния железа в a-Ti, легированном алюминием. Анализируя далее спектры,
соответствующие сплавам стехиометрических составов Ti6 Al и Ti3 Al с при-
месью 57Fe, можно выявить закономерное увеличение растворимости же-
леза в ГПУ решетке а- и а2 -фаз в ряду сплавов Ti-Al при увеличении со-
держания алюминия.
Так, из таблицы следует, что доля правой компоненты в спектре образ-
ца 3 (сплав Ti6 А1) составляет 15%, а содержание железа в сплаве - 0,4 ат. %
(0,5 мае. %). Отсюда можно заключить, что растворимость железа в сплаве,
соответствующем составу Ti6Al (фазовая область a + a2) составляет
0,06 ат. % (0,075 мае. %) при 550° С. Растворимость железа увеличивается
также в пределах области гомогенности а2-фазы при увеличении содержа-
ния алюминия по сравнению со стехиометрическим составом Ti3Al , о чем
свидетельствуют значения х2 в МС образцов 8,9 и 5, 10. Увеличение доли
дублета в МС при увеличении температуры (образцы 5-7) свидетельствует
о повышении растворимости железа в а2-фазе с ростом' температуры.
На рис. 2 приведена построенная авторами кривая зависимости предель-
ной растворимости железа от содержания алюминия в сплавах Ti—Al
(0-50 ат.% Al) при 550° С.
Таким образом, проведенный анализ СТС МС на атомах s7Fe в сплавах
Ti-Al-Fe показывает, что растворимость железа в сплавах Ti-Al возрас-
тает как при повышении температуры, так и при увеличении содержания
алюминия в областях гомогенности а- и а2 -фаз.
150
ЛИТЕРАТУРА
1. Rupp G. Mossbauereffekt messungen im titanreichen Eisen-Titan-System - Ztschr
Phys., 1970, Bd. 230, N 3, S. 265-277.
2.Stupell M.M., Ron M., Weiss B.Z. Phase identification in titanium-rich Ti-Fe system
by Mossbauer spectroscopy. - J. Appl. Phys., 1976, vol. 47, N 1, p. 6-12.
Ungals I., Driskamer H.G., de PascuaUi G. Isomer shift of in transitional metal under
pressure. - Phys. Rev., 1967, vol. 155, N 2, p. 165-170,-
4.Бокштейн Б.С., Войтковский Ю.Б. Исследование электронной структуры атомов
железа в а- и р- твердом растворе на основе титана методом Мессбауэра. - ФММ
1970, т. 29, вып. 4, с. 893-896.
5.Хансен М., Андерко К. Структуры двойных сплавов. М.: Металлургиэдат, 1962
т. 1. 608 с.
6.Борискина Н.Г., Мясникова К.П. Изучение растворимости Fe, Мп и Си в ce-Ti. -
В кн.: Титан и его сплавы. М.: Изд-во АН СССР, 1962, вып. 7, с. 61-67.
7.Волкова М.А., Корнилов И.И. Фазовые равновесия в сплавах Ti-Al-Fe, богатых
титаном. - Изв. АН СССР. Металлы, 1970, № 3, с. 187-193.
8. Федченко Р.Г., Онищенко Т.Н. Влияние фазового состава на магнитную восприим-
чивость сплавов Ti-Fe. - Металлофизика, 1979, вып. 75, с. 86-89.
9.Swartzendruber L.J., Bennet L.H., Watson R.E. Mossbauer studies of hydrides TiFe. -
J. Phys. F: Metal Phys., 1976, vol. 6, N 12, p. L331-L334.
IQ. Maty ka J., Faudot F., Bigot G. Study of iron solubiliti in titanium. - Scr. met., 1979,
vol. 13, N7, p. 645-648.
УДК 669.018.1 +543.42.
ИССЛЕДОВАНИЕ ЧЕТВЕРНОЙ ДИАГРАММЫ СОСТОЯНИЯ Re-Ta-W-Mo
МЕТОДОМ ДИФФУЗИОННЫХ СЛОЕВ
С ИСПОЛЬЗОВАНИЕМ ЛОКАЛЬНОГО
РЕНТГЕНОСПЕКТРАЛЬНОГО АНАЛИЗА
И.А. Трегубов, Л.Н. Евсеева
Известно, что при изотермической диффузии между металлами и спла-
вами образуются, как правило, все промежуточные фазы в той же после-
довательности, в какой они существуют на соответствующей диаграмме
состояния при данной температуре.Важно,чтобы температура диффузии была
достаточно высокой и время диффузии длительным, это обеспечит зарожде-
ние всех термодинамически устойчивых фаз на поверхности раздела об-
разцов и их рост до видимых размеров.
Данная работа является продолжением серии исследований по разработ-
ке метода диффузионных слоев в построении диаграмм состояния двой-
ных, тройных и более сложных систем с использованием локального рентге-
носпектрального анализа. В данном исследовании метод диффузионных
слоев был применен для построения трех изоконцентрационных сечений
(с постоянным содержанием рения 85,73 и 63 мас.%) изотермического тет-
раэдра диаграммы состояния четверной системы Re-Ta-W-Mo при 2300° С.
Исходные двойные системы W—Та, Та—Мо, Мо—W, Re—W, Re—Мо и трой-
ные системы W-Ta-Re, W-Mo-Re и Та—Mo-Re, ограничивающие четвер-
ную, были исследованы ранее методом диффузионных слоев при темпе-
ратуре диффузионного отжига 2300° С [1,2].
151
Концентрационные области существования фаз
Номер диффузионной леры /3 X
Re W Та № Re W Та Мо Re W Та Мо
1 97 0,5 2,0 0,3 89 1,0 10 0,6 63,0 3 33 0,9
2 96 0,1 2,0 0,5 87,5 0,2 12 1,5 62 1,0 34 2,5
3 96 1.5 2,0 0,1 88 2 10 0,5 61 8,5 29,5 1,0
4 94,5 — 3,0 1,5 87 — 10,5 2,5 63,5 3,5 26,5 4,0
5 97 0,1 2,0 1,5 86 0,2 11 3,5 64 1,0 28,5 7,0
6 94,5 0,5 5,5 2,0 85 2,5 9,0 3,5 65,5 6,0 23,0 5,5
7 96 0,5 1,5 2,0 87,5 1,0 8,5 4,5 71 2,0 22,5 8,0
8 92,5 3,0 1,0 2,0 84,5 4,0 6,0 5,0 72,0 9,0 11 6,0
9 92,5 0,5 1,5 4,5 86 1,0 6,0 8,0 74,0 2,0 14 11
10 85,0 11 2,0 1,5 77,5 14,5 6,5 2,0 72,5 17,0 .8,5 2,0
11 91 4,0 1,0 4,0 83 6,0 4,5 5,0 81,0 8,0 6,0 7,5
12 92,5 0,5 1,0 4,5 84 1,0 4,0 9,0 81,5 1,1 6,0 10,5
Номер диффузионной пары О а
Re W Та № Re W Та № Re 1 W 1 Та Mb
1 58 3,5 38 1,0 1 53 5 41 1,5 47,5 1 1 5,5 45 2,0
2 — — — — 48 1,5 49 3,0
3 54,0 10 35 1,3 51 12 35 1,5 43' 14 41 2,0
4 60 4,5 29,5 5,0 52 6,0 34 7,0 45 7,0 38 8,0
5 — — — — 55 1,5 35 9,0 46 2,0 39,5 12,5
6 60,0 9,5 24,5 7,5 55 11,5 26 8,5 43,5 15,5 30,5 12,0
7 63,5 3,0 25 12 60,0 3,5 28 13,5 49,5 4,5 32 19,0
8 68,0 11 12 9,0 53 19 13 10 44,5 23,5 15 15
9 68,0 3,0 12,5 15,5 59,5 3,5 15,5 21,0 49,5 5 17,5 27,5
10 70 22 6,5 3,0 42,5 47 7,5 3,0 34,5 54 8,5 4,0
И 78 11,5 4,5 9,5 56,5 26,5 7,0 14,0 46,5 31,5 8,0 17,5
12 77,5 2,0 4,5 14,5 71 4,0 6,0 23,5 51,5 6,0 7,0 34,5
Для построения изоконцентрационных сечений изотермического тетраэд-
ра четверной системы Re-Ta-W-Mo при 2300°С было исследовано 12 диф-
фузионных пар:
1. Re - (15% W + 80% Та + 5% Мо),
2. Re - (5% W + 80% Та + 15% Мо),
3. Re - (30% W + 65% Та + 5% Мо),
4. Re - (15% W + 65% Та + 20% Мо),
5. Re - (5% W + 65% Та + 30% Мо),
6. Re - (25% W + 50% Та + 25% Мо),
7. Re - (10% W + 50% Та + 40% Мо),
8. Re - (35 % W +: 35%Та + 30%Мо),
9. Re - (10%W + 30%Та + 60%Мо),
10. Re - (75% W + 15% Та + 10% Мо),
11. Re - (45% W + 15% Та + 40% Мо),
12. Re- (10% W.+ 15% Та + 75% Мо).
Для изготовления диффузионных пар четверной системы использова-
ли: Re - 99,8%, танталовую ленту чистотой 99,95%, вольфрам технической
чистоты (99,95% W) и молибден электронно-лучевой плавки.
Сплавы для диффузионных пар весом 10 г плавились в дуговой пе-
чи с нерасходуемым вольфрамовым электродом на медном водоохлаждае-
мом поддоне в атмосфере аргона. Для достижения лучшей однородности
слитков сплавы переплавлялись 4—5 раз.
Диффузионные пары между рением и тройными сплавами Ta-W-Mo
спекались в вакууме прямым пропусканием тока через образцы в тече-
ние 10 ч.
Съемка концентрационных кривых распределения элементов в зоне
диффузии проводилась по всем компонентам сплава в режиме непрерыв-
ной записи на самописец при одновременном перемещении образца под
электронным зондом со скоростью 17 мкм/мин. Анализ проводился по
линиям LOt, Re, W, Та и Мо при ускоряющем напряжении 20 кВ. Кривые
зависимости интенсивности по глубине диффузионной зоны были получе-
ны усреднением 2-3 кривых, снятых в разных участках слоя. В отношении
интенсивностей при расчете концентрации элементов в диффузионных
слоях вводились поправки на поглощение и обратное рассеяние электронов.
Концентрационные области существования фаз, установленные по полу-
ченным концентрационным кривым, приведены в таблице.
На всех микроструктурах изученных диффузионных пар отчетливо
видны слои а- и х-фаз. Так же как и в тройных системах этих металлов,
двухфазные области четверной системы представлены в диффузионных
слоях поверхностями раздела однофазных слоев. Подобную тенденцию
к подавлению образования двухфазного слоя можно объяснить тем, что
энергия системы увеличивается введением фазовой поверхности раздела.
Ровная граница между однофазными слоями соответствует минимальной
площади поверхности раздела, а двухфазный слой — большей площади
11. Зак.244
153
поверхности раздела. Диффузионный путь искривляется в двухфазной об-
ласти и идет по коноде из-за стремления системы к минимуму поверхност-
ной энергии. Ни один из диффузионных путей не пересекает и трехфазные
области, хотя образование трехфазного слоя в четырехкомпонентном диф-
фузионном образце возможно, так как трехфазное равновесие четырех-
компонентной системы при изобарическо-изотермическом процессе имеет
одну степень свободы, а потому возможен и градиент концентрации в трех-
фазном слое. Линии, показывающие изменение состава в однофазных
слоях данной системы, вблизи трехфазной области искривляются и оги-
бают ее, т.е. опять наблюдается та же тенденция к подавлению образования
фазовых поверхностей раздела в диффузионных слоях.
Конечной целью данного исследования являлось построение изокон-
центрационных сечений изотермического тетраэдра четверной системы
Re-Ta-W-Mo при 2300° С, основываясь на информации, полученной из кон-
центрационных кривых изученных диффузионных пар. Полученные скач-
ки концентраций лежат на поверхностях, ограничивающих одно- и двух-
фазные объемы четверной системы при 2300® С. Бели принять концентра-
цию Re постоянной, численно равной концентрации Re в скачке на кон-
центрационной кривой, то точка с концентрациями трех других элементов
в этом же скачке будет лежать на соответствующем изоконцентрационном
сечении на границе одно- и двухфазных областей. Чем больше изучается
154
диффузионных пар, тем больше вероятность получения скачков с одинако-
вой концентрацией Re в них.
На рисунке а приведено концентрационное сечение четверной диаграммы
состояния Re-Ta-W-Mo при 2300°С с постоянным содержанием рения,
равным 85 мае. %.
Граница между областью существования х-фазы и областью двухфаз-
ного состояния х + 0 построена по данным диффузионных пар 6, 8, 9 и 12
(нижняя граница скачка от 0-твердого раствора к х-фазе) (таблица). На
этом сечении существует еще небольшая область Д-твердого раствора, гра-
ница которого с двухфазной областью х + Д может быть проведена в соот-
ветствии с верхней границей скачка из 3-области к х-фазе диффузионной
пары 10. Остальные области этого сечения проведены условно по данным
тройных диаграмм, ограничивающих четверную.
Изоконцентрационное сечение с постоянным содержанием рения 73 мас.%
приведено на рисунке б.
Граница между областью существования х-фазы и двухфазной областью
а + X приведена по данным диффузионных пар 8, 9 и 10 (нижняя граница
существования х-фазы или верхняя граница второго скачка от х-фазы
к а-фазе). Остальные фазовые поля этого сечения проведены условно, по
данным тройных диаграмм, ограничивающих четверную.
На рисунке в приведено изоконцентрационное сечение с постоянным
содержанием рения 63 мас.%. Граница между х-фазой и двухфазной об-
ластью а + х проведена по данным диффузионных пар 1, 2 и 3 (верхняя
граница скачка от х-фазы к а-фазе). Нижняя граница скачка от х-фазы к
a-фазе диффузионной пары 7 лежит на границе двухфазной области а + х
и однофазной области а рассматриваемого изоконцентрационного сечения.
Остальные фазовые поля этого сечения (а + х и а + а) проведены условно
по данным тройных диаграмм состояния, изученных ранее.
Построенные изоконцентрационные сечения можно проверить, изучая
микроструктуру небольшого количества сплавов, лежащих вблизи по-
строенных фазовых границ и отожженных при 2300° С, что позволяет
снизить число сплавов, необходимых для построения изоконцентрацион-
ных сечений четверных систем.
ЛИТЕРАТУРА
1. Трегубов И.А., Евсеева Л.Н., Иванов О.С. Построение диаграммы состояния
Re-Ta-Mo методом диффузионных слоев при 2300° С. - Изв. АН СССР. Металлы,
1977, № 2, с. 213-218.
2. Трегубов И.А., Евсеева Л.Н. Микрорентгеноспектральный анализ в исследовании
диаграмм состояния. - В кн.: Диаграммы состояния металлических систем. М.:
Наука, 1981, с. 201-210.
155
УДК 620.181.5. + 621.317.44
ВЫСОКОТЕМПЕРАТУРНЫЙ МАГНИТОМЕТР
ДЛЯ ИССЛЕДОВАНИЯ ФАЗОВЫХ ПРЕВРАЩЕНИЙ В СТАЛЯХ
С. А. Зубко, Л.Н. Войцехович, И.П. Ковашевич
Для исследования кинетики изотермических превращений и анализа
фазового состава сталей наиболее универсальным и удобным в практи-
ческом отношении является магнитный метод [1,2] .Такойметод реализо-
ван в анизометре Акулова [2]. Высокая точность фазового анализа на ани-
зометре обеспечивается благодаря измерению намагниченности в области
подхода к насыщению контролируемого материала. Однако пондеромотор-
ный метод измерения намагниченности, используемый в анизометре, создает
серьезные препятствия на пути разработки автоматизированной аппарату-
ры, отвечающей современным требованиям.
На базе аустенитометра АМ-1 разработан магнитометр для исследования
фазовых превращений при высоких температурах. Установка позволяет
проводить фазовый анализ сталей как в процессе фазовых превращений,
так и после их завершения, а также моделировать различные виды термо-
обработки.
Принцип действия магнитометра основан на измерении намагниченности
вибрационным методом угловых колебаний образца [3,4]. Сущность ме-
тода заключается в следующем. Стержневой образец 1 (рис. 1) закреплен
в держателе 2 и расположен вдоль постоянного магнитного поля Н в зазо-
ре электромагнита. Образец совершает угловые колебания со с амплитудой
около 1° вокруг оси, перпендикулярной направлению магнитного поля.
При колебаниях образца в датчике 3, представляющем собой измерительный
контур специальной конфигурации [5], наводится ЭДС, пропорциональ-
ная намагниченности образца 1.
Высокотемпературный магнитометр включает систему термованн,
расположенную на механизме их перемещения. Система состоит из двух
термованн с теплоносителем, температура в которых может поддерживаться
от комнатной до 1100° С, и третьей ванны с закалочной средой. Температур-
ный режим образца может быстро изменяться путем смены термованн
с помощью механизма их перемещения. Это обеспечивает возможность
исследования кинетики изотермических превращений при различных тем-
пературах.
Возможность магнитного фазового анализа в сильных полях обуслов-
лена зависимостью намагниченности насыщения Мо исследуемого материа-
ла от его фазового состава [ 1 ]
п
Мо = S SiMsi, (1)
1=1
где Msi — намагниченность насыщения Z-й ферромагнитной фазы, 5; — от-
носительное объемное содержание г-й фазы.
В случае двухфазной системы с одной ферромагнитной фазой выражение
(1) упрощается до вида
Мо = 8MS. (2)
156
Рис. 1. Измерительный преобразователь
высо котемпературного магнитометра
Рис. 2. Зависимость относительной
величины намагниченности M/Ms от со-
держания ферромагнитной фазы 6
Отсюда Ь=Мй/М^ а содержание немагнитной фазы 1-3 = 1 -М/Мо.
Намагниченность насыщения М может быть определена по эталонному
образцу, не содержащему немагнитной фазы, т.е. с 3 = 1, и имеющему тот
же химический состав, что и у измеряемого образца, либо по образцу с
известным фазовым составом [1 ].
Основная трудность при фазовом анализе в сильных полях заключается
в достижении насыщения исследуемого материала. Как показано в работах
[1, 6], для этого необходимо магнитное поле напряженностью не менее
600 кА/м, что технически трудноосуществимо. Поэтому чаще всего для
целей фазового анализа используют более слабые поля, а содержание ферро-
магнитной фазы 3 определяют по экспериментальным градуировочным
кривым зависимости намагниченности исследуемого образца от 3 при по-
стоянной величине магнитного поля. Вид этих кривых существенно зависит
от величины поля, приближаясь в полях порядка 600 кА/м к прямой ли-
нии. В более слабых полях начинают сказываться внутренние свойства
материала. Указанные обстоятельства резко снижают точность метода.
На основе ранее полученного выражения зависимости намагниченности
исследуемого материала от содержания ферромагнитной фазы и напряжен-
ности намагничивающего поля нами разработана методика фазового ана-
лиза, позволяющая снизить отмеченные погрешности.
В области подхода к насыщению величины намагниченности М опреде-
ляется следующим выражением [7,8]:
NMS Г/ мй/Г Ж-1
M/Ms = 2S/1 + + Д/(1 + — )2- 48— , (3)
77/ * \ 71/ / 77/
где N — эффективный размагничивающий фактор частиц ферромагнитной
157
фазы исследуемого материала, Н, - напряженность внутреннего намагничи-
вающего поля в материале.
При измерениях в разомкнутой магнитной цепи величина внутреннего
поля, как известно, определяется соотношением
Hj = Н - КМ, (4)
где Н — напряженность внешнего намагничивающего поля, К — коэффи-
циент размагничивания исследуемого образца. Подставляя (4) в (3), по-
лучим
M/Ms = 26/1 + (N + ЬК)— +
д/ 1 + (N + 8K)
Л/Я2
У 1
М?
45(А + К)— .
н
(5)
Отметим, что если положить К = 0, то уравнение (5) переходит в (3),
а при Я->«> уравнение (5) сводится к (2). Как видно из выражения (5),
причина неоднозначности функции M/Ms = /(6) заключается в непостоянст-
ве величин N, К и Ms для различных материалов.
В то же время, как показано в работе [7 ], величина N не зависит от хи-
мического состава исследуемого образца и размеров ферромагнитных час-
тиц, а определяется лишь их формой, причем для каждого типа структуры
величина N постоянна и лишь незначительно различается для разных типов
структур. В частности, для мартенситных образцов независимо от способа
их получения и химического состава величина N = 0,025.
Коэффициент' размагничивания К в области подхода к насыщению оп-
ределяется методом измерения намагниченности и формой образца. В за-
висимости от метода измерения различают баллистический коэффициент
(при измерении намагниченности в центральном сечении образца, напри-
мер на баллистической установке), магнитометрический (при измерении
усредненной намагниченности по всему объему или магнитного момента
образца) и дроссельный (при измерении намагниченности для любой,
отличной от центральной части образца). При использовании одного метода
измерения и стандартных размеров образцов коэффициент К является ве-
личиной постоянной. В случае измерений на описанном высокотемператур-
ном магнитометре при использовании стандартных образцов длиной 30 мм
и диаметром 3 мм коэффициент К является дроссельным и можно принять
К = 0,1.
Намагниченность насыщения ферромагнитной фазы Ms определяется
температурой, при которой производятся измерения, химическим составом
материала, и ее максимальное значение для армко-железа Ms = 1710 кА/м.
При наличии эталонного образца, не содержащего ферромагнитной фазы,
величина Ms измеряется непосредственно на высокотемпературном магни-
тометре. При наличии эталонного образца с известным фазовым составом
намагниченность насыщения ферромагнитной фазы исходя из (5) может
быть рассчитана по формуле:
Ms = М 1
NH I
-----/6 -
H-KN I
NM
Н - КМ ’
(6)
где М — намагниченность эталонного образца.
158
Если измерения проводятся при температуре, отличной от комнатной,
то для величины Ms должен быть проведен перерасчет в соответствии с кри-
вой Кюри.
На рис. 2 приведена зависимость относительной величины намагничен-
ности M/Ms от содержания ферромагнитной фазы S при величине эффек-
тивного размагничивающего фактора частиц А = 0,025, коэффициенте раз-
магничивания К = 0 (7) иА’ = 0.1 (2), намагниченности насыщения ферро-
магнитной фазы Ms = 1710 кА/м и напряженности максимального намагни-
чивающего поля в зазоре электромагнита Н = 240 кА/м.
Кривая 2 соответствует измерению в замкнутой магнитной цепи. В этом
случае она может служить, как следует из выражения (5), в качестве
градуировочной для всех материалов, если при измерениях поддержи-
вается постоянным отношение
NMS/H = с = const. (7)
Поскольку величины N и Ms являются характеристиками материала
и не могут быть изменены в процессе измерений, то постоянство отношения
достигается выбором соответствующего значения напряженности поля Н.
Таким образом, в замкнутой магнитной цепи кривая 1 может служить
в качестве градуировочной для всех материалов, если величину Н выбрать
в соответствии с соотношением
Н = c~l NMS;
(8)
где с'1 - постоянный коэффициент и для приведенных условий, как сле-
дует из (7), с"1 = 5,6.
При измерениях в разомкнутой магнитной цепи, как видно из выраже-
ния (5), зависимость М/М5Л/(8) не может быть сделана однозначной изме-
нением величины поля Н для всех материалов с различным значением
размагничивающего фактора частиц N. При исследованиях различных
материалов одной структуры с одинаковым значением 7V такая зависи-
мость может быть сделана однозначной, если поддерживать постоянным от-
ношение Ms/H. Так, кривая 2 может служить в качестве градуировочной
для всех материалов с N = 0,025, если поле Н выбирать в соответствии с
соотношением Я = 0,14 Ms. Для материалов с другим значением N необ-
ходимо построение новой градуировочной кривой.
Во всех случаях содержание ферромагнитной фазы 8 можно определить
по формуле
М NM. I М \1
8 = — 1 + ---- 1---.
L н~км\ ms /1
(9)
Формула (9) является решением уравнения (5) относительно 8.
В комплект высокотемпературного магнитометра входит микро-ЭВМ
типа ’’Электроника ДЗ-28”, с помощью которой можно производить рас-
чет содержания ферромагнитной фазы 8 по формуле (9) с учетом темпе-
ратурной зависимости намагниченности, а также производить автоматиче-
скую обработку результатов исследования кинетики изотермического
превращения аустенита в сталях.
159
ЛИТЕРАТУРА
1. Апаев Б.А. Фазовый магнитный анализ сплавов. М.: Металлургия, 1976. 281 с.
2. Черепиц В.Т. Экспериментальная техника в физическом металловедении. Киев:
Техника, 1968. 279 с.
3. А.с. 504146 (СССР). Устройство для котроля распада аустенита/Зубко С.А., Вой-
цехович Л.Н., Трусов Н.К. - Опубл, в Б.И., 1976, № 12.
4. Зубко С.А., Войцехович Л.Н. Магнитометрический метод и прибор для контроля
превращений аустенита в стали. - В кн.: Докл. 5-й нац. науч.-техн. конф. ’’Эффек-
тивность и качество без разрушения”. София: НТС по машиностроению, 1977,
г. 1, с. 242-250.
5. А.с. 642644 (СССР). Устройство для контроля распада аустенита/ Зубко С.А.,
Трусов Н.К., Войцехович Л.Н., Ковашевич И.П. - Опубл, в Б.И., 1979, № 2.
6. Толомасов В.А., Апаев Б.А. Исследование измерительных схем баллистического
магнитометра и анизометра. - Завод, лаб., 1957, т. 23, № 7, с. 821-826.
7. Войцехович Л.Н. Процессы намагничивания и контроль фазового состава гете-
рогенных материалов в области подхода к насыщению - В кн.: Новые физические
методы и средства контроля промышленных изделий. Минск: ОФНК АН БССР,
1978, с. 84-89.
8. Войцехович Л.Н. Исследование процессов намагничивания гетерогенных ферромаг-
нетиков, разработка методов и автоматизированной аппаратуры для контроля
кинетики фазовых превращений и магнитного фазового анализа в сталях: Автореф.
дне.... канд. техн. наук. Минск: ИПФ АН БССР, 1982. 20 с.
УДК 621.386 + 548.734
ПРЕЦИЗИОННОЕ ОПРЕДЕЛЕНИЕ ПАРАМЕТРОВ РЕШЕТКИ
ВЕЩЕСТВ СИНГОНИИ НЕ НИЖЕ РОМБИЧЕСКОЙ
ПО ДЕБАЕГРАММАМ С ОТНОСИТЕЛЬНОЙ ТОЧНОСТЬЮ 10’5
М.О. Рикель, З.М. Алексеева
Основная проблема при прецизионном измерении параметров решетки
методом Дебая-Шеррера состоит в правильном учете систематических
сдвигов рефлексов на рентгенограммах. О правильности введения попра-
вок на эти сдвиги обычно судят с помощью статистических критериев [ 1 ].
Однако только статистических критериев недостаточно. Например, в ме-
тоде экстраполяции [2] при использовании произвольных экстраполя-
ционных функций хорошее согласие экспериментальных и расчетных дан-
ных может гарантировать точность параметров аппроксимационной зави-
симости, но не их физический смысл.
Кроме того, в большинстве применяемых статистических процедур
(например, в методе отношения правдоподобия [3]) исходят из предпо-
ложения о статистической независимости значений вульф-брэгговских
углов 0°. Это предположение часто не выполняется, поскольку введение
поправок Д0, (х) к измеренным значениям углов дифракции 0,- : 9° =
= 0,- - Д0(-(х) приводит к корреляции 0° из-за ошибок определения па-
раметров х, характеризующих съемку (радиус образца, эксцентриситет
камеры и т.д.). Неучет этих факторов приводит к заниженное™ оценок
ошибок параметров решетки.
Целью настоящей работы является разработка метода измерения рент-
генограммы и расчета параметров решетки, позволяющего гарантировать
160
правильную оценку ошибок параметров решетки при относительной точ-
ности измерения ~10-5.
Расчет параметров решетки. Чтобы не учитывать корреляцию значений
0°, предлагается находить параметры съемки х из самой рентгенограммы
при расчете параметров решетки. В случае веществ сингонии не ниже ром-
бической задача сводится к решению системы уравнений
А{/а2 + B,/b2 +Ct/c2 +(2lditgei)S6(0hx)= l/d2=yh i= 1,2,. . . ,N,
(1)
где a, b, с — параметры решетки, A,, Bit Ci — коэффициенты, зависящие
от Миллеровских индексов г-го рефлекса, dt = X,-/2sin0,- — приближен-
ное значение межплоскостного расстояния, Д0(0, х) - функциональная
зависимость систематического сдвига рефлекса на рентгенограмме от
угла дифракции 0 и параметров съемки x(xj, х2,. .. , хр).
Отсутствие коррелированное™ измерений 0,- позволяет использовать
простые статистические критерии для проверки правильности расчета
(мы используем И2-критерий [4]). Сравнение рассчитанных значений
параметров съемки хк с известными из независимого эксперимента х°
позволяет судить о корректности расчета с точки зрения физического
смысла. Такое сравнение можно также производить с помощью К2-кри-
терия. Для этого система (1) дополняется уравнениями хк = хк с весом,
обратным дисперсии хк.
Решая систему (1), находим оценки параметров решетки и их ошибок.
/VI
Решение считается корректным, если величина V2 = [£(>', -
,=1
_ уРасг)2/а2.] /N2 (где NI - число уравнений, N2 — число степеней свобо-
ды, о2. - дисперсия yt) меньше уровня И2-распределения V2_a(N2, NI)
[4]. При этом в случае V2 > 1 априорная ошибка параметров решетки
умножается на V. Превышение V2 над уровнем И2_а может быть след-
ствием как неправильного измерения (требуется перепромер), так и не-
правильности формулы для поправок. Вопрос о том, как рассчитывать
ошибки в случае установления неприменимости формулы для поправок,
остается открытым. Оценку сверху можно получить, умножив расчетные
значения ошибок на ЛЧ1/2 *.
Измерение рентгенограммы. Каждая рентгенограмма характеризуется
предельно возможной точностью измерения углов дифракции 0,-. Ограни-
чение точности в основном связано с нецилиндричностью закладки пленки
в камеру и нелинейными эффектами изменения размеров пленки при ее
фотообработке. Предлагается процедура измерения рентгенограммы, ко-
торая обеспечивает нахождение этой предельно допустимой точности.
Пусть LCj и LKt — координаты центров тяжести z-го дифракционного
кольца в середине (LC) и на краю (LK) рентгенограммы при асимметрич-
ной закладке пленки в камеру. Тогда величины АО,- = LC, + LK, должны
* Умножая априорную ошибку на V, гарантируем, что проведенная кривая отлича-
ется от экспериментальных точек в среднем на ошибку измерения. Умножение на
(N\ А) означает отказ от усреднения.
161
удовлетворять системе уравнений
\ АО/ = £0 ± 2еу cos 20,
(2)
где L0 = const, еу — проекция эксцентриситета камеры на направление,
перпендикулярное оси камеры и направлению пучка (знак в (2) зависит
от установки пленки в камеру и в компаратор). Проверяя справедливость
соотношения (2) с помощью И2-критерия, можно судить о корректности
проведения эксперимента*. При уменьшении ошибки измерения коорди-
нат oL 0 можно достичь такой точности a'L 0, при которой соотношение
(2) уже не выполняется. Величина а£0 характеризует предельно допусти-
мую точность измерения рентгенограммы.
В случае принятия решения о корректности эксперимента можно из (2)
найти длину пленки Lp усреднением по всем измерениям и рассчитать
значения углов дифракции 0, и их ошибок ов.. Иначе необходимо отка-
заться от усреднения по всем рефлексам как при расчете Lр, так и при рас-
чете параметров, решетки.
Формула для поправок и ее проверка. Применяемые в настоящей работе
формулы для поправок относятся к сдвигу центров тяжести рефлексов.
В предположении точечного источника, находящегося на расстоянии F от
образца радиусом р, и отражения рентгеновских лучей с поверхности об-
разца основная по значимости поправка на поглощение в образце имеет
вид (в градусах)
Д0, = (18O//,F)p(0ctg0 + /?C/Fcos20), (3)
где Rc — радиус камеры. Остальные поправки взяты из [2, 5]:
Д02 = — (exsin20 -
Lp
а2 _ 360 6
6/?cctg20 я sin20
(За)
где еЛ. — проекция эксцентриситета на направление пучка, 2а — длина об-
разца, 1—5 — коэффициент преломления.
Проверка формул для поправок проведена на рентгенограммах порош-
ков металлов (Мо, Pb, W), снятых на медном излучении с образцов, при-
готовленных накатыванием на стеклянную палочку с помощью коллодия,
в имеющихся камерах РКУ-86, позволяющих производить поворот камеры
на пучке для определения ех [2]. Показано, что при точности эксперимента
ов = 0,002° значения эксцентриситета ех, еу являются постоянными с ве-
роятностью ошибки меньше 5% и могут быть использованы в качестве пас-
портных данных камер.
На рисунке представлены значения разницы углов дифракции Д0 =
= 0р — 0р для рентгенограмм смеси (Мо, РЬ). Эта зависимость анализи-
ровалась в терминах проверки гипотез. Рассмотрены три "типа формул:
Н\ — Д0 = xcos20; Н2 — ДО =x0ctg0 (параллельный пучок); НЗ —
формула (3).
Гипотеза HI отвергается с вероятностью ошибки меньше 0,5%. Гипоте-
зы Н2 и НЗ статистически неразличимы при 95%-ном уровне значимости,
* Оценки дисперсий величин £0,- можно получить из статистических свойств суммы
(разности) координат рефлексов, измеренных как минимум при двух закладках
пленки в компаратор.
162
= ,граО
Разница в измеренных значениях углов дифракции Д0 = 0р - в р2 ДЛЯ образцов
смеси (Mo, РЬ) радиусами р, = 0,19 мм и р2 = 0,11 мм
Кривые Hl, Н2, НЗ относятся к зависимостям Д в = 2/ЗДр/( 0) ; Н1: /( fl) = cos2 в
(Ар = 0,148 (20), И2=6,7); Н2 : Дв) = 0 ctg 0 (Др = 0,115 (8) , К2 = 1,22) ; НЗ:
/(0) = 0 ctg 0 + Rc/F cos2 0 (Др = 0,079, И2 =0,65)
однако для гипотезы НЗ полученное значение разницы радиусов более
близко к истинному значению. Таким образом, формула для поправки
на поглощение применима к исследуемым объектам при точности ад
> 0,003°.
Измерение параметра решетки вольфрама. С помощью описанной мето-
дики измерен параметр решетки международного эталона вольфрама (а =
= 3,16522 ± 9 • 10~5 А при 25°С [6]). Съемка производилась в камере
РКУ-86 с известным значением эксцентриситета (ех = —0,035 ± 0,003 мм)
с образца радиусом р = 0,10 мм. Температура съемки 21 ± 0,5°С; излуче-
ние медное. Поправки на преломление и длину образца ввели до расчета.
В табл. 1 приведены результаты расчета параметров решетки и съемки
при увеличении точности эксперимента. Однократное измерение рентгено-
граммы дает относительную точность определения параметра решетки
• 10-5. Расчетное значение радиуса на 0,02 мм меньше измеренного в
независимом эксперименте, что хорошо согласуется со средней глубиной
проникновения рентгеновских лучей в образец. Увеличение точности изме-
рений в Араз (N< 5) приблизительно в NV1 раз уменьшает ошибку опре-
деления параметра решетки. Значение V2 при этом практически не меня-
ется. Дальнейшее увеличение точности измерения не приводит к уменьше-
нию ошибки расчета, а величина V2 растет, оставаясь меньше 95%-ного
уровня Kq>95 (15,18) = 2,27. Отсюда сделан вывод о невозможности даль-
нейшего увеличения точности при дополнительных измерениях рентгено-
граммы. Вероятной причиной этого является неприменимость формулы
для поправки на поглощение при достигнутой точности эксперимента.
В табл. 2 приведены результаты расчета с использованием неправиль-
ных формул (Я1 и Н2) для поправки на поглощение. Без введения априор-
163
Таблица 1
Результаты расчета параметра решетки вольфрама
Число измерений o^,град a(oa 10‘), A ₽(op) > MM ex(.°ex), мм K* 1 2 3 4 5 (15,18)
1 0,007 3,165180(139) 0,078(5) -0,035 (4) 1,42
5 0,0035 3,165202(55) 0,075 (3) -0,037(3) 1,34
9 0,0025 3,165190(54) 0,076 (3) -0,037 (4) 1,85
Таблица 2
Результаты расчета параметра решетки вольфрама
с применением неправильных формул для поправки на поглощение
Формула Способ* а(°а • 106), А Р(стр), мм еу(стеу),мм к2
Я1 A 3,165036(68) 0,110(8) -0,017(6) 1,73
Hl A 3,165320(70) 0,144 (9) -0,071 (9) 1,89
H\ Б 3,164926(61) 0,125 (6) -0,030(4) 2,34
Hl Б 3,165210(65) 0,115(8) -0,041 (5) 3,15
• A — расчет без использования априорной информации о параметрах съемки, Б —
с использованием паспортных данных.
ной информации о параметрах съемки оба расчета удовлетворяют И2-кри-
терию. Расчетная точность составляет 7 • 10-5 А, в то время как разница
значений параметра решетки - 3 10-4 А. Используя паспортные данные
камеры, о неправильности расчета можно судить по значениям V2.
Полученные результаты хорошо иллюстрируют недостаточность статис-
тических критериев для вынесения решения о точности определения па-
раметров решетки. Предлагаемый метод нахождения уже известных пара-
метров съемки из самой рентгенограммы позволяет с большей степенью
достоверности судить о достигнутой в эксперименте точности.
ЛИТЕРАТУРА
1. Burke J. The precision measurement of lattice constants. - In: Proc. conf, on appl. crys-
tallogr. Katowice, 1979,p. 174-216.
2. Русаков АЛ. Рентгенография металлов. М.: Атомиздат, 1977. 480 с.
3. Веи К.Е., Musil F.Y., Whitney D.R. Further developement in likelihood ratio method
for the precise and accurate determination of lattice parameters. - Acta crystallogr.,
1967, vol. 22, p. 932-936.
4. Клепиков Н.П., Соколов CM. Анализ и планирование эксперимента методом мак-
симума правдоподобия. М.: Наука, 1964.184 с.
5. Блохин МЛ. Физика рентгеновских лучей. М.: ТИТТЛ, 1957. 518 с.
6. Parrish W. Results of the I.U.Cr. precision lattice parameters project. - Acta crystallogr.,
1960,vol. 13,p.838-843.
164
УДК 620.193.55001.5
ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
И ПОСТРОЕНИЯ ДИАГРАММ
СОСТОЯНИЯ МЕТАЛЛ-ВОДОРОД
Н.П. Сердюк, В.В. Трофименко, А.П. Семик,
В.И. Долженков, А.Л. Титков
Для изучения термодинамических характеристик с целью построения
диаграмм состояния Fe-H, Fe-C-H, Ni-H, Со-Н, Cr-H, Mn-H, Cu-H,
Al—H, Mg-H и Ti—H авторами была разработана аппаратура, позволяю-
щая проводить эксперименты в широком интервале температур и давлений.
Немногочисленность экспериментальных работ по исследованию систем
металл-водород [1, 2] в значительной мере объясняется техническими
трудностями одновременного сочетания высокой температуры (1000—
2000 К) и высокого давления газовой фазы (10-200 МПа), а также вы-
сокой диффузионной подвижностью водорода, теплопроводностью, почти
на порядок большей, чем у других газов, и сильнейшим негативным воз-
действием на механические свойства деталей аппаратуры. Все это не позво-
ляет получить надежные данные о растворимости водорода в соответст-
вующих металлах и определить его влияние на положение критических
точек в широком диапазоне температур и давлений.
Как показал анализ имеющихся литературных данных, для определения
растворимости водорода в металлах чаще используются метод Сивертса
и метод закалки. Другие методы находятся на стадии усовершенствова-
ния и пока не дают надежных результатов.
Метод Сивертса известен давно, хорошо изучен, дает возможность про-
изводить исследования как в твердом, так и в жидком металле. Он осно-
ван на прямом измерении объема поглощенного водорода при определен-
ных температуре и давлении (изобарный вариант) или на измерении вели-
чины изменения давления водорода в реакционной камере при постоянных
объеме и температуре (изохорный вариант). Метод распространен, срав-
нительно прост, но имеет существенные недостатки [3,4], так как при об-
работке экспериментальных данных вводится большое число поправок.
Во-первых, водород растворяется как в исследованном металле, так и
в деталях установки, а также адсорбируется поверхностью образца и стен-
ками аппаратуры. Во-вторых, водород и калибровочный инертный газ, чаще
гелий, применяющиеся в экспериментах, обладают разными физическими
свойствами, в частности теплопроводностью, а следовательно, и различным
распределением температур в горячей зоне. В-третьих, высокая химическая
активность водорода приводит к тому, что он образует с различными при-
месями устойчивые даже при высоких температурах соединения. Это также
приводит к непредсказуемым колебаниям давления и значительным по-
грешностям измерений.
Метод закалки [5] заключается в насыщении исследуемого металла во-
дородом до равновесного состояния при известных температуре и давле-
нии, быстром его охлаждении до комнатной температуры с последующей
дегазацией путем вакуумной экстракции в твердом или жидком состоянии.
165
Принципиальная схема установки для насыщения металла водородом с последующей
закалкой образцов и определения влияния водорода на положение критических точек
I — камера высокого давления, 2 — вспомогательное уплотнение, 3 — мембранный
насос, 4 — бустер, 5 — блок контроля и управления, 6 — блок электропитания, 7 — за-
калочный отсек, 8 — термопарный отсек, 9 — образец
Ж N2
Он лишен серьезных недостатков, присущих метпт/
пока единственным для надежного u-ЛлГ етоду СивеРтса, и является
при высоких Давлениях Этот метоп » к Р610”1 растворимости водорода
для опоепеления °Т метод и был использован в данной работе
Та™ Растворимости водорода во всех металлах.
и растворение газообразного водорода в исследуемых металлах
р ормальных условиях затруднено, то был применен метод равновес-
ного насыщения при высоких температурах и давлениях. Типы лаборатор-
ных аппаратов высокого газового давления (до 500 МПа) различны [6].
Основной узел этих аппаратов — автоклав, представляющий собой тол-
стостенный стальной корпус, имеющий затвор с одной стороны. Затвор
выполняет функции стержня уплотнения и корпуса электроввода в ка-
меру давления. К основным недостаткам этих аппаратов следует отнести
сложные устройства для компримирования газа [7]. В них уплотнение
осуществляется гидравлическими прессами или затворами, а также муль-
типликаторами со встроенной реакционной камерой.
Авторами накоплен некоторый опыт конструирования высокотем-
пературной аппаратуры высокого газового давлешгя с внутренним нагре-
вом. В разработанной установке (см. рисунок) камера высокого давле-
ния представляет собой толстбстенный стальной стакан, имеющий затвор
с одной стороны и вспомогательное уплотнение с другой. В гнездо вспо-
могательного уплотнения в зависимости от задачи исследования может
вкручиваться либо закалочный, либо термопарный отсек (см. рисундк).
В качестве запирающего устройства камеры высокого давления служит
фланец и мягкие уплотнительные прокладки из вакуумной резины. Зат-
вор работает по методу нескомпенсированной площади. В этом случае
фланец равномерно поджимается к корпусу 6—8 болтами и для затяжки
мягкого уплотнения не требуется больших усилий.
Удачная конструкция аппарата позволяет при загрузке и разгрузке
образца оставлять на месте нагреватель и затвор аппарата с основными
уплотнениями; отворачивается вспомогательное уплотнение и проводится
смена образца. При работе аппарата даже в экстремальных условиях тем-
пература внутренней стенки камеры, охлаждавшейся проточной водой,
не превышала 673 К. Для обеспечения быстрого охлаждения (закалки)
образца при рабочем давлении газа реакционный модуль поворачивался
вокруг горизонтальной оси на 90°, при этом образец быстро скатывался
в охлаждаемую среду закалочного отсека. Скорость охлаждения изменя-
лась в интервале 250—400 град/с в зависимости от массы, формы, темпе-
ратуры и физико-химической природы образца, давления и состава газо-
вой фазы, охлаждающей жидкости. Для определения скорости охлаждения
в образец зачеканивалась хромель-алюмелевая термопара диаметром
0,15 мм. Как показали предварительные исследования, оптимальные раз-
меры и форма образцов для изучения растворимости водорода были сле-
дующие: для Ni, Со, Сг, Си, Мп они имели форму шара d = 5-8 мм, для
Al, Mg - цилиндра, d = 10 мм, I = 15 мм, для Ti - d = 3 мм и / = 6 мм
соответственно.
Сочетание высоких температуры и давления в установках с внутренним
нагревом осложняет конструирование нагревателя. Нагрев сжатого водо-
рода, теплопроводность которого на порядок выше, чем у других газов,
вызывает сильную конвекцию, и подводимая к нагревателю мощность
резко возрастает.
167
Борьба с конвекцией предъявляет особые требования к конструкции
нагревателя, системе теплоизоляции и качеству сборки. Особенно велики
трудности при высокой температуре, что отмечено различными исследова-
телями. Поэтому в качестве нагревателя исследовали молибденовый про-
вод сечением 0,5—1,0 мм, навитый на алундовую трубку в один слой. Спи-
раль покрывали цементом на основе окиси алюминия. После этого спи-
раль сушили и обжигали при температуре 1600 К. Между печью и корпусом
аппарата установлен цилиндрический экран из высококачественного фар-
фора. Рабочая зона в печи при d = 12 мм имела длину 60—80 мм. С боков
реакционная зона термически изолировалась заглушками из алунда и квар-
ца. Изоляция электросплавной и термопарной линий достигалась специаль-
ной конструкцией изоляторов. Блок питания установки позволял в широ-
ком диапазоне (0-50 А) регулировать силу тока и температуру в печи.
Дня равномерного нагрева и охлаждения образцов с заданной скоростью
было предусмотрено программное устройство.
Температура рабочей зоны печи контролировалась тщательно калибро-
ванной вольфрамрениевой термопарой. Для сжатия газов обычно исполь-
зуют поршневые компрессоры, мультипликаторы, беспорпшевые газовые
компрессоры теплового действия [6, 8]. Поршневые компрессоры при
компримировании загрязняют газ смазочными маслами в виде тумана, мел-
ких капель и растворов водород—масло, что затрудняет или исключает
постановку опытов. Поглощение масел адсорбентом или его конденсация
охлаждением малоэффективны и дороги.
В наших экспериментах давление в газовой фазе выше 20 МПа созда-
вали мембранным насосом, работающим на жидком азоте, основное пре-
имущество которого заключается в том, что он не загрязняет газ при-
месями.
Нагнетательное устройство состоит из трех бустеров и мембранного на-
соса (см. рисунок) сообщающихся между собой, а также с камерой высо-
кого давления системой толстостенных трубопроводов с вентилями. Бустер
для заливки жидкого азота представляет собой толстостенный металли-
ческий стакан, в который помещена кварцевая пробирка с нагревателем.
Мембранный насос состоит из двух полусферических камер, разделен-
ных мембраной из двух слоев тонкой (1 мм) вакуумной резины. После за-
ливки азота бустер герметично закрывали. Испаряясь, азот создавал дав-
ление 50-60 МПа, которое нагревом доводили до 70-80 МПа. Зажатая
между двумя полусферами мембрана насоса, деформируясь, сжимала во-
дород в камере высокого давления от 15 до 70-80 МПа. Последующий
внутренний нагрев доводил давление водорода до 90-100 МПа.
Содержание водорода определяли методом вакуум-нагрева [9]. В от-
личие от метода вакуумного плавления, где всегда определяется практи-
чески весь имеющийся в образце водород, этот способ выгодно отличается
тем, что позволяет отделить связанный в соединениях или коллекторах
(микропустотах) водород от растворенного в кристаллической решетке.
Проводя дегазацию при низких температурах (до 573-673 К), выделяли
легкоподвижный в атомарном состоянии водород. С повышением тем-
пературы до 1123 К (исключая А1 и Mg, плавящиеся при 923 и 933 К)
медленно диссоциировал и выделялся молекулярный или связанный в
соединениях (Н2О, СН4, H2S, NH3 и др.) водород. С целью повышения
168
точности экспериментов основную дегазацию проводили при низких тем-
пературах, стараясь полностью выделить растворенный в кристаллической
решетке металла водород, и лишь после этого для полного его извлечения
образец быстро нагревали до высоких температур. Вследствие высокой
частоты и низкой дефектности применяемых нами металлов ’’высокотем-
пературного” водорода выделялось всего 5—8%.
Еще одно преимущество метода вакуум-нагрева перед методом ваку-
умного плавления заключается в отсутствии необходимости производить
анализ выделяющегося газа, так как в указанном интервале температур
выделение водорода заканчивается относительно быстро, в то время как
азот и кислород, имеющие коэффициенты диффузии при 573 К на 6-8 по-
рядков и при 1123 К на 2-4 порядка меньше, чем водорода, еще не вы-
деляются.
Для определения влияния водорода на положение критических точек
соответствующих металлов вместо закалочного модуля в торец камеры
высокого давления ввинчивался термопарный узел с исследуемым образ-
цом. Эти исследования проводили с помощью простого термического ана-
лиза (ПТА), метода разрыва термопарной цепи (МРТЦ) и дифференциаль-
ного термического анализа (ДТА).
В первом методе, подробно описанном в работе [10], образцы имели
форму цилиндра с отверстием для ввода термопары. Использовали как
сплошные, так и набранные из тонких пластин образцы. Последние приме-
няли при необходимости быстрого установления равновесия газ-металл.
МРТЦ применен авторами впервые и заключался в том, что исследуемый
металл включали последовательно в термопарную цепь в виде короткой
и тонкой проволоки. Этот участок термопары помещался в зону безгра-
диентного нагрева. Образец медленно нагревался со скоростью 2—5 X
X 10-2 град/с, при этом непрерывно измерялась его температура. В момент
плавления металла термопарная цепь размыкалась, снимая электрический
сигнал с термопары. Конечное ее показание принимали за температуру
плавления. Преимущество этого метода при исследовании систем металл-
газ заключается в возможности использовать тонкие небольшие образцы,
в которых равновесие между газообразным и растворенным водородом
достигается очень быстро.
Схема соединения термопар в ДТА, использованная авторами, имела
принципиальное отличие от описанной ранее [10], заключающееся в на-
личии дополнительной термопары, непрерывно измеряющей температуру
образца. Это позволило повысить точность измерений. Материалом эталона
служил никель, не имеющий полиморфных превращений в изучаемых ин-
тервалах температур. Образец и эталон перед экспериментами дегазирова-
ли в вакууме (10-2 Па) в течение 5 ч при 1073 К. Для изоляции их друг от
друга применялись кварцевые пластины. Скорость нагрева и охлаждения
варьировали от 2 • 102 —10-1 град/с, исходя из природы металла, давления
газовой среды и температуры исследований. Вблизи температур фазовых
превращений всех исследуемых металлов делалась выдержка для дости-
жения равновесия газ-металл.
Для измерения температуры образца использовались вольфрамрениевые
(типа ВР-20/5) и хромель-алюмелевые термопары, тщательно отградуиро-
ванные с прибором ПП-63 (класс точности 0,05).
12. Зак. 244
169
ЛИТЕРАТУРА
1. Левинский Ю.В. Диаграммы состояния металлов с газами. М.: Металлургия, 1975.
296 с.
2. Шаповалов В.И., Полторацкий Л.М., Трофименко В.В., Сердюк Н.П. Исследование
диаграмм состояния металл-водород. - В кн.: Фазовые равновесия в металличес-
ких сплавах. М.: Наука, 1981, с. 280-285.
3. Морозов А.Н. Водород и азот в стали. М.: Металлургия, 1968. 284 с.
4. Маро-Ока А., Савади С., Мори Т. Влияние легирующих элементов на растворимость
водорода в аустените. - В кн.: Взаимодействие газа с металлами. М.: Наука, 1976,
с. 159-172.
5. Hill M.L., Johnson E.W. The solubility of hydrogen in alpha iron. - Trans.Met.Soc.
AIME, 1961, vol. 221, p. 622-628.
6. Циклис Д.С. Техника физико-химических исследований при высоких и сверхвысо-
ких давлениях. М.: Химия, 1976.431 с.
7. Лебедев Е.Б. Сравнительная характеристика установок высокого газового дав-
ления с внутренним нагревом. - В кн.: Эксперимент и техника высоких газовых
и твердофазовых давлений. М.: Наука, 1978, с. 20-29.
8. Бондаренко МД. Некоторые особенности конструирования высокотемпературной
газовой аппаратуры высокого давления. - В кн.: Эксперимент и техника высоких
газовых и твердофаэовых давлений. М.: Наука, 1978, с. 49-64.
9. Шаповалов В.И. Отклонения от закона Сивертса в области высоких давлений. -
Изв. вузов. Чер. металлургия, 1976, № 12, с. 92-96.
10. Бунин К.П., Шаповалов В.И., Трофименко В.В. О диаграмме состояния системы
железо-водород. - ЖФХ, 1977, т. 41, № 8, с. 1967-1970.
УДК 669.01.584.2
ТЕРМИЧЕСКИЙ АНАЛИЗ
ПРИ ВЫСОКИХ СКОРОСТЯХ ОХЛАЖДЕНИЯ
С.Б. Масленков, А.Н. Кобылкин, Д.Н. Ситников
В настоящее время в технике находит все большее распространение
получение необходимых свойств изделий за счет различных способов об-
работки, важнейшим из которых являются высокие скорости охлаждения,
например закалка.
Цель работы — разработка способа охлаждения объектов исследования,
позволяющего проводить физико-химические исследования непосредствен-
но в процессе самого охлаждения методом термического анализа. Решение
таких задач позволит изучить кинетику образования метастабильных
состояний сплавов в зависимости от состава и скорости охлаждения. Пред-
лагаемый способ был реализован на серийной установке термического ана-
лиза ДТА-4 [1].
Известны способы получения высоких скоростей охлаждения [1-5].
Общим недостатком всех этих способов является низкая чувствитель-
ность проводимого термического анализа из-за отсутствия плавного охлаж-
дения [4] либо из-за больших присоединенных к образцу масс [5].
Исходя из того, что ни выключением нагревателя образца, ни выдерги-
ванием объекта исследования из горячей зоны невозможно достижение
высоких скоростей охлаждения, было решено проанализировать возмож-
ность охлаждения образца непосредственно в горячей зоне.
170
Рис. 1. Схема к расчету теплопроводности устройства
быстрого охлаждения
Для этого рассмотрим теоретически схему охла-
ждения образца на рис. 1, согласно которой на
образец, находящийся в горячей зоне, надвигался
холодный стакан, экранирующий его от печного
пространства. Такая схема охлаждения при правиль-
но подобранных соотношениях диаметра полости
(d2) к ее глубине (Н) и геометрическим размерам
образца (dt) должна в значительной степени пре-
пятствовать возникновению турбулентных пото-
ков газа, заполняющего полость стакана, и,
естественно, при этом будет отсутствовать эф-
фект присоединения к образцу дополнительной
массы, значительно снижающей чувствительность
термического анализа.
В общем случае теплопередача от одного тела к другому осуществляется
тремя механизмами: теплопроводностью через промежуточную среду, кон-
векцией и излучением. Для выяснения доли каждого механизма в процессе
теплопередачи от образца к стенкам холодного Стакана необходимо выяс-
нение влияния начальных условий на весь процесс. В данном случае под на-
чальными условиями понимаются температурная область исследования, со-
отношение геометрических размеров всех элементов, входящих в систему,
и некоторые их физические свойства.
Исходя из того, что устройство для проведения термического анализа
при высоких скоростях охлаждения предназначено для использования на
конкретной (стандартной) установке дифференциального термического
анализа (от ДТА-3 до ДТА-5, выпускаемых ИМЕТ), авторами для началь-
ных стадий расчета были приняты следующие размеры образца и охлаж-
дающего стакана: диаметр образца dt = 1 мм, масса образца т = 5 мт,
внутренний диаметр стакана d2 = 6 мм, глубина стакана Н = 25 мм.
При этом устройство для проведения термического анализа при высо-
ких скоростях охлаждения работает по следующей схеме: в разогретую
до необходимой температуры печь помещается образец с присоединенной
к нему термопарой, далее на этот образец надвигается холодный стакан,
экранирующий его от печи. Предполагается, что при соответствующем под-
боре материала и конструкции стакана нагревание последнего будет незна-
чительным за время охлаждения образца. В качестве рабочей среды рассмат-
ривается гелий.
Вследствие ограничения настоящей работы по объему не представляется
возможным привести весь теоретический расчет скоростей охлаждения в
зависимости от рассматриваемых механизмов теплопередачи от образца
к холодному стакану через гелий.
На основании проведенного анализа расчетов сформулированы следую-
щие выводы: основной механизм теплопередачи — конвекция и тепло-
проводность, излучение не вносит существенного вклада в теплопередачу,
ориентировочные скорости охлаждения микрообразцов на уровне 1000° С
составляют 1,5 X 103 град/с.
171
Экспериментальные и расчетные значения скоростей
охлаждения образца
Уровень Т на термограмме, °C иохл.ф> град/с ^ф иохл.» теор» град/с ^теор ГНе/С Nu
1000 1580 0,477 1470 0,425 670 1,37
500 800 0,434 550 0,300 570 1,35
250 216 0,232 238 0,256 150 1,28
100 43 0,197 62 0,157 50 1,26
Дтя экспериментальной проверки разработанного способа термического
анализа были проведены исследования процесса быстрого охлаждения на
медных образцах. Выбор меди обусловлен ее относительно небольшой
температурой плавления и высокой теплопроводностью. Образцы готови-
лись из медной проволоки массой т = 5 мг. В качестве образца для изуче-
ния быстрых охлаждений в твердом состоянии использовалось чистое
железо, имеющее несколько характерных превращений в твердом состоя-
нии, масса образца в этом случае была т = 50 мг. Первые же эксперименты
показали работоспособность метода получения высоких скоростей охлаж-
дения. В экспериментах с термопарой без образца была получена скорость
охлаждения иохл = 5 X 103 град/с. В дальнейшем условия эксперимента
менялись с тем, чтобы выяснить влияние различных факторов на скорость
охлаждения образца: массы образца, конструкции держателя, давления
газа-теплоносителя.
Рассмотрим, как влигтот на скорость охлаждения образца перечислен-
ные факторы.
Уже из общих физических соображений очевидно, что с увеличением
массы образца скорость охлаждения его будет уменьшаться, поскольку
чем больше масса образца, тем большее количество тепла надо, отобрать
у него в единицу времени для получения необходимой скорости охлаж-
дения. Масса образца прямо пропорциональна объему, а объем его изме-
няется пропорционально кубу радиуса (для сферы), в то время как теп-
лоотдающая поверхность образца пропорциональна квадрату радиуса.
Из анализа экспериментального материала видно, что при массе более
50 мг скорость охлаждения меняется незначительно, а для масс менее
10 мг начинается резкое увеличение скоростей охлаждения с уменьше-
нием массы образца. Этот факт может быть объяснен увеличением отно-
шения поверхности теплосброса к объему образца с уменьшением массы.
Для проверки влияния давления рабочего газа в камере на скорость
охлаждения образца использовался гелий, давление которого меняли от
10-3 до 760 мм рт.ст.
На основании полученных данных построен график в полулогарифми-
ческой шкале, представленный на рис. 2, из которого видно, что, изменяя
давление рабочей атмосферы, можно получить любое заданное значение
скорости охлаждения образца в пределах от итах до vmin-
Анализ результатов проведенных экспериментов показал хорошее
согласование экспериментально полученных скоростей охлаждения с
расчетными значениями. Эти данные представлены в таблице.
172
Рис. 2. График зависимости скорости охлаждения образца от давления гелия в ка-
мере
Рис. 3. Термограмма железа с применением устройства дифференцирования
Величины фактических скоростей и теплопроводности Не получены сле-
дующим образом: фактическая скорость охлаждения определялась мето-
дом касательной к точке термограммы соответствующего уровня темпера-
туры образца. Фактическая теплопроводность Не определялась исходя из
этой скорости аналитически по уравнению Хф = собр^обриохлф/Д7’£,
где собр - теплоемкость образца, шобр - масса образца, иохл.ф - факти-
ческая скорость охлаждения, ДГ — разность температур между образцом
и стаканом, L - коэффициент формы.
Проведенные теоретические расчеты и экспериментальные результаты
показывают, что разработанное устройство для быстрого охлаждения
позволяет проводить термический анализ материалов с высокими ско-
ростями охлаждения и открывает перспективы дальнейшего совершен-
ствования системы с целью увеличения скоростей охлаждения. Рассмотрим
некоторые перспективные, на наш взгляд, способы улучшения параметров
устройства.
На пути осуществления еще больших скоростей охлаждения есть не-
сколько способов.
1. Увеличение разности температур образца и падающего охлаждающего
экрана, что может быть осуществлено предварительным охлаждением экра-
на до начала падения при помощи ванны с жидким азотом или иным охлаж-
дающим веществом, окружающей направляющую трубку вне рабочей
камеры.
2. Изменение формы образца, в частности увеличение его эффективной
теплоотводящей поверхности.
3. Уменьшение массы образца. В данном случае необходимо учитывать,
что механизм теплоотвода может измениться за счет большого теплоот-
вода по термопарным электродам, что может сказаться на точности отсчета
температуры, поэтому наряду с уменьшением массы образца необходимо
уменьшать массу держателя, применяя все более тонкую проволоку тер-
мопар.
4. В ряде случаев возможно применение в качестве среды газа с еще
большей теплопроводностью, чем гелий, например водорода. Но это воз-
173
можно только в тех случаях, когда конструкционные материалы рабочей
камеры, нагревателя и сам образец не вступают с водородом во взаимодей-
ствие при повышенной температуре.
5. И наконец, возможно еще одно усовершенствование — уменьшение
зазора между образцом и стенками надвигающейся плотности охлаждаю-
щего экрана. Тем самым уменьшается время достижения тепловой волны
стенок экрана, что в конечном счете ведет к возрастанию скорости охлаж-
дения образца.
Как видим, существует достаточно много вариантов увеличения скорос-
ти охлаждения, и надеемся, что работы в этих направлениях позволят про-
водить термический анализ в области еще больших скоростей.
Разработанные метод и устройство для термического анализа с высо-
кими скоростями, обладая сравнительной простотой и технологичностью,
позволят применять их практически для любой установки, где имеется ра-
бочая камера с вертикальным расположением нагревательного элемента,
оснащенная вакуумно-газовой системой. Система регистрации температур
образца может быть самой различной.
Для исследования процессов со слабыми тепловыми эффектами (на-
пример, магнитные превращения, полиморфные превращения, мартенсит-
ный распад и т.п.), где чувствительность прямого термического анализа
недостаточна для выявления указанных эффектов, было разработано спе-
циальное устройство для проведения производного термического ана-
лиза. В этом случае регистрируется первая производная температуры
охлаждения объекта исследования в зависимости от его температуры.
Эффективность применения разработанного дифференцирующего ус-
тройства ясна из рис. 3, где приведены термограммы железа, полученные
с применением указанного устройства.
ЛИТЕРАТУРА
1. Кобылкин А.Н., Масленков С.Б., Николаев А.Г. и др. Установки дифференциаль-
ного термического анализа ДТА-4. - Завод, лаб., 1982, № 4, с. 49-51.
2. Мирошниченко И.С. Закалка из жидкого состояния. М.: Металлургия,1982,с.5-14.
3. Салли И.В. Кристаллизация при сверхбыстрых скоростях охлаждения. Киев: Наук,
думка, 1974.163 с.
4. Кучеренко Е.С. Температурный режим кристаллизации двойных сплавов при
быстром охлаждении. - Изв. АН СССР. Металлы, 1980, № 2, с. 85-89.
5. Иванов О.С., Терехов Г.И., Тагирова Р.Х. Влияние легирующих элементов на тем-
пературы фазовых превращений т- и ^-твердых растворов урана при резком ох-
лаждении. - В кн.: Строение и свойства сплавов урана, тория и циркония. М.:
Госатомиздат, 1963, с. 37-46.
СОДЕРЖАНИЕ
Предисловие............................................................ 3
1. Расчет и анализ диаграмм равновесия фаз............................. 5
Анализ и расчет при построении Т-Р-С диаграмм состояния. ДС. Каменец-
кая ................................................................... 5
Возможности использования диаграмм фазовых состояний для расчета тер-
модинамических свойств сплавов. Г.Ф. Воронин....................... 13
Закономерности полиэдрации четверных металлических систем с промежу-
точными фазами переменного состава. А.М. Захаров ..................... 17
Диаграммы фазовых равновесий с точки зрения принципа соответственных
состояний. Л.З. Певзнер............................................... 23
Внутренние параметры в теории фазовых равновесий. И.Л. Аптекарь.... 28
О диаграмме состояния металл-вакансия. Р.М. Габидуллин, Г.В. Иванищев 33
Расчет диаграмм состояния в методе кластерных компонентов. Е.Г. Вискова,
Н.С. Давыдова, В.М. Камы шов, А.Н. Мень, И.А. Синицкий................ 38
Прогнозирование и расчет диаграмм состояния псевдобинарных систем на
основе тугоплавких соединений переходных металлов. А.И. Гусев......... 42
2. Применение электронной теории к описанию термодинамических свойств
и диаграмм равновесия фаз ............................................ 48
Генезис диаграмм состояния в аспекте электронного строения металлов.
В.К. Григорович....................................................... 48
Расчет диаграммы превращения ГЦТ ГЦК в системе In-TL М.Ф. Жоров-
ков, В.В. Кулагина.................................................... 54
Энергия образования и низкотемпературные диаграммы состояния сплавов
переходных металлов. В.Я. Дворецкий, А.Я. Флат, Ю.А. Хон.............. 59
3. Прогноз и классификация диаграмм равновесия фаз.................... 64
Обучение ЭВМ прогнозированию фаз и их свойств в металлических систе-
мах. В.Б. Грибуля, Е.М. Савицкий...................................... 64
Кибернетическое прогнозирование возможности образования и свойств хи-
мических соединений в трехкомпонентных системах. Е.М. Савицкий, Н.Н. Ки-
селева ............................................................. (><)
Анализ и классификация двойных диаграмм состояния титана по термодина-
мическим признакам. Д.Б. Чернов....................................... чу
4. Банки данных по диаграммам состояния............................... 77
Банки данных по диаграммам состояний металлических систем: современ-
ное состояние, проблемы, перспективы их развития и применения. С.Б. Мас-
ленков, А.Л. Удовский ................................................ 77
Банки данных по диаграммам состояния в автоматизированных системах
научных исследований. Ф.С. Новик, ИМ. Кожевников, ИИ. Гультяй...... Ц7
Структура банков данных по фазам в двойных и тройных физико-химиче-
ских системах. Е.М. Савицкий, В.Б. Грибуля, Н.Н. Киселева............. 93
175
5. Методы расчета диаграмм равновесия фаз с применением ЭВМ............. 98
Этап разработки общего метода термодинамического расчета диаграммы
состояний двухкомпонентных систем. С.Б. Масленков, А.Л. Удовский,
А.М. Гайдуков .......................................................... 98
Разработка алгоритма расчета на ЭВМ диаграмм состояния систем, образо-
ванных элементами III и V групп Периодической системы. А.А. Селин,
В.А. Ханин............................................................. 102
6. Расчет диаграмм равновесия фаз конкретных систем.................... 107
Исследование диаграмм состояния металл-углерод. В.М. Даниленко, Т.Д. Ве-
ликанова, О.В. Гордийчук, А.А. Рубашевский ............................ 107
Расчет линий ликвидуса в системах щелочной металл-переходный металл
со стороны щелочного металла. Л.Я. Кузин, И.Е. Люблинский, Н.М. Бескоро-
вайный ................................................................. ИЗ
Строение поверхности растворимости компонентов в жидком металле систе-
мы Fe-Ca-Al-S -О. Г.Г. Михайлов, Е.М. Вильгельм, Н.М. Танклевская . ... 118
Применение ЭВМ к расчету диаграмм состояния систем Al-Cr, Al-Fe, А1-Со,
Al-Ni. В.Я. А санов и ч, Б.П. Бурылев.................................. 123
Исследование положения конод в системах с многокомпонентными тверды-
ми растворами. М.Г. Васильев, В.Н. Вигдорович, А.А. Селин, В.А. Ханин 127
Термодинамический расчет и экспериментальное исследование поверхностей
ликвидус и солидус в тройной системе Ni-Nb-C. В.Н. Гриднев, О.М. Бара-
баш, Т.Н. Легкая....................................................... 130
7. Экспериментальные методы построения и исследования диаграмм состоя-
ния ................................................................... 134
Экспериментальные методы и аппаратура для исследования и построения
диаграмм состояния металлических систем. В.В. Петьков.................. 134
Применение методов сверхскоростного охлаждения металлических сплавов
для исследования и построения диаграмм состояния. Д.А. Петров.......... 141
Количественный рентгеновский фазовый анализ по дифрактограммам с
наложенными линиями фаз. О.Г. Карпинский, Л.Е. Шалимова................ 145
Исследование фазовых равновесий в тройной системе Ti -Al-Fe методом
мессбауэровской спектроскопии. С.Н. Пастушенко......................... 148
Исследование четверной диаграммы состояния Re-Ta-W-Mo методом диф-
фузионных слоев с использованием локального рентгеноспектрального ана-
лиза. И.А. Трегубов, Л.Н. Евсеева...................................... 151
Высокотемпературный магнитометр для исследования фазовых превращений
в сталях. С.А. Зубко, Л.Н. Войцехович, И.П Ковашевич .................. 156
Прецизионное определение параметров решетки веществ сингонии не ниже
ромбической по дебаеграммам с относительной точностью 10"5. М.О. Ри-
кель, З.М. Алексеева................................................... 160
Экспериментальные методы исследования и построения диаграмм состоя-
ния металл-водород. Н.П. Сердюк, В.В. Трофименко, А.П. Семик, В.Н. Дол-
женков, А.Л. Титков.................................................... 165
Термический анализ при высоких скоростях охлаждения. С.Б. Масленков,
А.Н. Кобылкин, Д.Н. Ситников........................................... 170
УДК 541.123.2:539.89
Каменецкая Д.С. Анализ и расчет при построении Т-Р-С диаграмм
состояния. - В кн.: Расчеты и экспериментальные методы построения диа-
грамм состояния. М.: Наука, 1985.
Кратко изложен метод построения диаграмм состояния (ДС) при пере-
менном давлении с использованием термодинамического расчета и анализа
возможных типов ДС в сочетании с экспериментом. Приведены примеры
прогнозирования фаз при высоком давлении в одно- и двухфазных
системах.
Ил. 3. Библиогр. 40 назв.
УДК 541.11
Воронин Г.Ф. Возможности использования диаграмм фазовых состоя-
ний для расчета термодинамических свойств сплавов. - В кн.: Расчеты и
экспериментальные методы построения диаграмм состояния. М.: Наука,
1985.
Методы термодинамических расчетов, использующие условия равнове-
сия фаз, предлагается разделить на две группы: корректные и некоррект-
ные. Дается определение обеих групп методов, рассмотрены их возмож-
ности и примеры применения к двух- и трехкомпонентным системам.
Ил. 1. Библиогр. 13 назв.
УДК 669.017.14
Захаров А.М. Закономерности полиэдрации четверных металлических
систем с промежуточными фазами переменного состава. - В кн.: Расчеты
и экспериментальные методы построения диаграмм состояния. М.: Наука,
1985.
В зависимости от характера плавления и протяженности областей гомо-
генности промежуточных фаз на диаграмме состава полиэдрация четвер-
ных металлических систем может быть сингулярной (по Н.С. Курнакову),
частично сингулярной (неполной), фазовой или смешанной. Рассмот-
рены общие закономерности полиэдрации чётверных металлических систем
с граничными растворами на основе компонентов и промежуточными
фазами переменного состава (непрерывными рядами твердых растворов
между изоморфными соединениями и граничными растворами на основе
соединений), в том числе соотношения между ее параметрами, которые
можно использовать при экспериментальном исследовании фазовых равно-
весий в этих системах.
Табл. 1. Ил. 1. Библиогр. 11 назв.
УДК 530.17+536.763
Певзнер Л.З. Диаграммы фазовых равновесий с точки зрения принципа
соответственных состояний. - В кн.: Расчеты и экспериментальные методы
построения диаграмм состояния. М.: Наука, 1985.
Рассмотрены обобщенные преобразования подобия, совмещающие
линии равновесия фаз различных термодинамических систем. Исследова-
ны свойства преобразований, их связь с элементарными преобразования-
ми подобия. Получены наиболее общие преобразования, относительно
которых инвариантны условия равновесия фаз. Для однокомпонентных
систем рассчитаны инварианты преобразований.
Табл. 1. Ил. 1. Библиогр. 10 назв.
УДК 541.123
Аптекарь И.Л. Внутренние параметры в теории фазовых равнове-
сий. - В кн.: Расчеты и экспериментальные методы построения диаграмм
состояния. М.: Наука, 1985.
Рассматривается равновесие фаз, для описания которых достаточно
одной функциональной зависимости неравновесного термодинамического
потенциала от внутренних параметров. Анализируются особенности диа-
грамм состояния систем с такими фазами.
Ил. 2. Библиогр. 5 назв.
177
УДК 669.017.3 : 548.4
Габидуллин Р.М., Иванищев Г.В. О диаграмме состояния ме-
талл-вакансия. - В кн.: Расчеты и экспериментальные методы построения
диаграмм состояния. М.: Наука, 1985.
Вакансии в металле можно рассматривать как "атомы” пустоты. Пред-
лагается описание системы металл -вакансии в виде диаграммы состояния.
Предложена система уравнений, описывающая линии фазовых равновесий.
Введено понятие предельной концентрации вакансий и рассмотрено измене-
ние положения линий равновесия с изменением напряженного состояния
в объеме металла.
Ил. 3. Библиогр. 7 назв.
УДК 541.165
Вискова Е.Г., Давыдова Н.С., К а м ы ш о в В.М., Мень А.Н.,
Синицкий И.А. Расчет диаграмм состояния в методе кластерных ком-
понентов. - В кн.: Расчетные и экспериментальные методы построения
диаграмм состояния. М.: Наука, 1985.
Излагаются основы метода теоретического расчета равновесных соста-
вов многофазных многокомпонентных систем дефектных фаз с позиций
метода кластерных компонентов. Приводится схема расчета бинарных
диаграмм состояния. Рассчитаны диаграммы состояния карбидов переход-
ных металлов IV, V групп Периодической системы, а также диаграммы
состояния псевдобинарных систем, образованных монокарбидами пере-
ходных металлов IV, V групп.
Ил. 1. Библиогр. 4 назв.
УДК 541.012.2
Гусев А.И. Прогнозирование и расчет диаграмм состояния псевдобинар-
ных систем на основе тугоплавких соединений переходных металлов. -
В кн.: Расчеты и экспериментальные методы построения диаграмм состоя-
ния. М.: Наука, 1985.
Рассмотрены прогнозирование диаграмм состояния псевдобинарных
систем тугоплавких соединений переходных металлов с помощью соот-
ношения электронных плотностей компонентов и энергии упругой де-
формации, а также расчет таких диаграмм состояния в рамках модели
субрегулярных растворов, учитывающей зависимость параметров взаимо-
действия в этих системах от состава и температуры. Рассчитаны положе-
ния фазовых границ на диаграммах состояния 15 псевдобинарных карбид-
ных систем.
Ил. 1. Библиогр. 7 назв.
УДК 669.017
Григорович В.К. Генезис диаграмм состояния в аспекте электрон-
ного строения металлов. - В кн.: Расчеты и экспериментальные методы
построения диаграмм состояния. М.: Наука, 1985.
Показано, что кристаллическая структура металлов определяется
электронным строением их атомов, а именно симметрией внешних пере-
крывающихся орбиталей. Перекрытие s-оболочек и d (Тэд)-орбиталей
стабилизирует плотные ГЦК и ГПУ упаковки, перекрытие р‘ (d4)-обо-
лочек и d (eg) -орбиталей стабилизирует ОЦК структуру в металлах и в
сплавах, расширяя соответствующие области первичных твердых раство-
ров на диаграммах состояния при легировании. Появление промежуточ-
ных фаз и соединений на диаграммах также определяется перекрытием
внешних орбиталей образующих их атомов. Рассмотрено влияние электрон-
ного строения легирующих элементов на характер диаграмм состояния,
образуемых Ti, Zr, тугоплавкими металлами IV -VI групп, Fe, Си и дру-
гими металлами.
Табл. 2. Библиогр. 10 назв.
УДК 669.018:546.68
Жоровков М.Ф., Кулагина В.В. Расчет диаграммы превращения
ГЦТ ГЦК в системе !п-Т1. - В кн.: Расчеты и экспериментальные мето-
ды построения диаграмм состояния. М.: Наука, 1985.
178
В локальном приближении метода псевдопотенциала показано, что
устойчивость ГЦТ структуры In относительно ГЦК связана не только с
положением первого нуля псевдопотенциала, но и с положением точки
его обрыва. ГЦТ структура In имеет меньшую энергию, чем ГЦК в узком
интервале значений объема. Поэтому И уменьшает стабильность ГЦТ
структуры In двумя механизмами: через увеличение объема сплава и через
статические среднеквадратичные смещения, возникающие в сплаве. Учет
смещений изменяет положение точки обрыва псевдопотенциала. Влияние
их на стабильность ГЦТ структуры аналогично воздействию тепловых
колебаний.
Табл. 1. Ил. 3. Библиогр. 10 назв.
УДК 539.2.699.88
Дворецкий В.Я., Флат А.Я., Хон Ю.А. Энергия образования и
низкотемпературные диаграммы состояния сплавов переходных метал-
лов. - В кн.: Расчеты и экспериментальные методы построения диаграмм
состояния. М.: Наука, 1985.
Проанализирована природа энергий образования и упорядочения спла-
вов 3</-переходных металлов. Показано, что при расчете свойств интер-
металлидов на основе Ti необходимо учитывать перенос заряда. Выявлен
характер влияния ферромагнетизма на величину и знак энергий образова-
ния в системах Fe-Со, Ni-Со, Ni-Fe. Предложена методика расчета низко-
температурных диаграмм состояния. Рассчитаны диаграммы типа "поря-
док-беспорядок” для систем Fe-V и Fe-Ni. Определен температурный
интервал существования сплава FeCr. Проведено сравнение полученных
результатов с экспериментом.
Табл. 1. Ил. 3. Библиогр. 9 назв.
УДК 669.01.018+51:155.ОО1.57
Г р и б у л я В.Б., Савицкий Е.М. Обучение ЭВМ прогнозированию
фаз и их свойств в металлических системах. - В кн.: Расчеты и экспери-
ментальные методы построения диаграмм'состояния. М.: Наука, 1985.
В работе дается анализ свойств первичной информации о физико-хими-
ческих системах. В качестве главного объекта прогноза рассматриваются
фазовые состояния системы. Кратко описываются принципы систематиза-
ции данных для обучения ЭВМ, отражающие информативные особенности
объектов. Приводится анализ результатов прогноза интерметаллидов на
примере фаз типа СаСи5, опубликованных в 1974 г. Совпадение прогноза
с опубликованными результатами синтеза наблюдается более чем в 90%
случаев. Новое научное направление распространено на прогнозирование
количественных характеристик.
Табл. 1. Ил. 1. Библиогр. 10 назв.
УДК 546:681.142.36
Савицкий Е.М., Киселева Н.Н. Кибернетическое прогнозирова-
ние возможности образования и свойств химических соединений в трех-
компонентных системах. — В кн.: Расчеты и экспериментальные методы
построения диаграмм состояния. М.: Наука, 1985.
Рассмотрены основные принципы кибернетического прогнозирова-
ния существования тройных фаз и оценки их свойств. Дан обзор работ
авторов по этому вопросу. Обсужден вопрос оценки достоверности резуль-
татов и приведены значения достоверности прогнозирования, определен-
ные из сравнения опубликованных прогнозов с новыми эксперименталь-
ными данными. Приведены фрагменты таблиц прогноза тройных фаз.
Рассмотрены проблемы создания банков данных и информационно-прогно-
зирующих систем.
Табл. 1. Ил. 3. Библиогр. 15 назв.
УДК 669.112.295.24
Чернов Д.Б. Анализ и классификация двойных диаграмм состояния
титана по термодинамическим признакам. - В кн.: Расчеты и эксперимен-
тальные методы построения диаграмм состояния. М.: Наука, 1985.
179
На основе анализа экспериментальных данных и имеющихся сведений
о параметрах межатомного взаимодействия предложена систематика двой-
ных диаграмм состояния титана, включающая три класса: I класс - пара-
метры взаимодействия свыше 50 кДж/моль, 11 - от 4 до 45 кДж/моль,
III - от 4 кДж/моль до значительных по модулю отрицательных величин.
Дополнительные подклассы учитывают стабильность ОЦК и ГПУ струк-
тур легирующих элементов. Предложенная систематика позволяет опре-
делить тенденцию изменения вида экспериментальных диаграмм состоя-
ния при повышении чистоты исследуемых сплавов. Термодинамический
подход к систематизации двойных систем может быть распространен на
тройные и многокомпонентные системы титана и использован при класси-
фикации диаграмм состояния других элементов.
Ил. 1. Библиогр. 7 назв.
УДК 541.121.536.7
Масленков С.Б, Удовский Л. Л. Банки данных по диаграммам
состояний металлических систем: современное состояние, проблемы,
перспективы их развития и применения. - В кн.: Расчеты и эксперимен-
тальные методы построения диаграмм состояния. М.: Наука, 1985.
Рассматриваются вопросы создания банков данных (БД) по диаграммам
состояний (ДС) и термодинамическим свойствам (ТС) металлических сис-
тем: форма свертки информации по ДС и ТС, формы выдачи пользова-
телю выходной информации по ДС и ТС, проблема создания унифици-
рованных физических моделей и их обобщенного математического опи-
сания, разработки как универсальных программ расчета на ЭВМ ДС, так
и пакета прикладных программ для расчета ДС на ЭВМ в интерактивном
режиме для оптимизационных расчетов по согласованию эксперименталь-
ных данных по ДС и ТС сплавов. Дан краткий обзор применений созда-
ющихся Б Д по ДС и ТС.
Табл. I. Ил. 6. Библиогр. 39 назв.
УДК 669.017+681.32
Новик Ф.С., Кожевников И.Ю., Г у л ь т я й И.И. Банки данных по
диаграммам состояния в автоматизированных системах научных исследо-
ваний. — В кн.: Расчеты и экспериментальные методы построения диаграмм
состояния. М.: Наука, 1985.
Рассмотрена проблема создания автоматизированной системы научных
исследований (АСНИ) в области металловедения. Представлена структура
банка данных по диаграммам состояния в информационной системе такой
АСНИ. Проанализированы различные способы ввода диаграмм состояния
в память ЭВМ. Показан способ аналитического описания двойных систем
с помощью индикаторных функций.
Ил. 3. Библиогр. 15 назв.
УДК 681.31:546.0:548.30
Савицкий Е.М., Грибуля В.Б., Киселева Н.Н. Структура бан-
ков данных по фазам в двойных и тройных физико-химических системах.—
В кн.: Расчеты и экспериментальные методы построения диаграмм состоя-
ния. М.: Наука, 1985.
Показана необходимость создания автоматизированных банков дан-
ных (БД) по свойствам неорганических веществ. Описаны принципы, по-
ложенные в основу функционирования БД по свойствам фаз в двойных
и тройных неорганических системах. Обоснован выбор программной систе-
мы БОЯЗ для ЭВМ БЭСМ-6 в качестве системы управления разрабатывае-
мым БД. Рассмотрены логические структуры двух файлов свойств двой-
ных и тройных неорганических фаз и конфигурация разрабатываемого БД.
Ил. 2. Библиогр. 14 назв.
УДК 539.121.536.7
Масленков С.Б., Удовский А.Л., Гайдуков А.М. Этап раз-
работки общего метода термодинамического расчета диаграммы состоя-
180
мий двухкомпонентных систем. - В кн.: Расчеты и экспериментальные
методы построения диаграмм состояния. М.: Наука, 1985.
Дан обзор работ авторов по разработке аналитической термодинамики
фазовых равновесий и на ее базе общего метода расчета двойных диаграмм
состояния. Метод реализован на ЭВМ в виде не требующих промежуточ-
ного вмешательства специалиста (автономных) программ и применен для
расчетов в рамках различных моделей.
Ил. 3. Библиогр. 15 назв.
УДК 621.315.592
Селин А.А., Ханин В.А. Разработка алгоритма расчета на ЭВМ диа-
грамм состоянии систем, образованных элементами III и V групп Перио-
дической системы. - В кн.: Расчеты и экспериментальные методы построе-
ния диаграмм состояния. М.: Наука, 1985.
Предложен алгоритм расчета равновесных составов жидкой и твер-
дой фаз в л-компонентных системах путем решения системы трансцендент-
ных уравнений фазового равновесия в два этапа. На первом из них с по-
мощью сходящегося итерационного процесса определяется пиния в про-
странстве переменных х^ (концентраций компонентов в жидкой фазе),
вдоль которой приращение химических потенциалов компонентов, отно-
сящихся к одной группе Периодической системы, равно между собой.
Второй этап связан с определением на этой линии точки, удовлетворяю-
щей условию фазового равновесия.
Библиогр. 2 назв.
УДК 669.01+669.01
Даниленко В.М., Великанова Т.Я., Г орлий чу к О.В., Р у ба-
ше в с к и й А.А. Исследование диаграмм состояния металл-углерод. -
В кн.: Расчеты и экспериментальные методы построения диаграмм состоя-
ния. М.: Наука, 1985.
Описаны фазовые равновесия с участием жидкой фазы в системах
Се-С, Ст-С, W-С (без учета областей гомогенности твердых фаз). При
описании потенциала Гиббса для всех фаз используется зависимость G (Г)
вида а + ЬТ + cTinT + dT1. При построении моделей фаз использована
имеющаяся термодинамическая информация о компонентах и промежу-
точных фазах и необходимый минимум (две точки) сведений о фазовых
равновесиях. Получено удовлетворительное согласие с эксперименталь-
ными диаграммами состояния.
Табл. 2. Ил. 1. Библиогр. 11 назв.
УДК 669.017.12
Кузин АН., Люблинский И.Е., Бескоровайный Н.М. Расчет
линий ликвидуса в системах щелочной металл-переходный металл со сто-
роны щелочного металла. - В кн.: Расчеты и экспериментальные методы
построения диаграмм состояния. М.: Наука, 1985.
Предложен метод расчета линий ликвидуса в системах щелочной ме-
талл-переходный металл, основанный на субрегулярной модели раство-
ров. Избыточная парциальная молярная энтальпия смешения 77 ж в систе-
мах с Li, Na, К, Cs рассчитана с использованием модели Миедемы. Были
использованы экспериментальные результаты по растворимости ряда
металлов в литии и получена зависимость избыточной парциальной моляр-
ной энтропии смешения от 7/ж, с ее использованием рассчитали уравнения
линий ликвидуса в системах с литием и натрием.
Табл. 1. Ил. 2. Библиогр. 10 назв.
УДК 669.018+669.15.046.552:536.7
Михайлов Г.Г.. Вильгельм Е.М., Танклевская Н.М. Строе-
ние поверхности растворимости компонентов в жидком металле системы
Fe-Ca-Al-S-О. - В кн.: Расчеты и экспериментальные методы построе-
ния диаграмм состояния. М.: Наука, 1985.
181
Проведен термодинамический анализ фазовых равновесий в системе
Fe-Ca-Al-S-O. Рассчитаны области составов жидкого металла, находя-
щегося в равновесии с различными оксидными и сульфидными фазами.
Установлено влияние температуры и содержания алюминия на картину
фазовых равновесий в системе. Построены изотермические изосоставные
сечения поверхности растворимости компонентов в жидком металле
системы Fe-Ca-Al-S-O.
Табл. 2. Ил. 1. Библиогр. 4 назв.
УДК 669.018.1
Асанович В.Я., БурылевБ.П. Применение ЭВМ к расчету диаграмм
состояния систем Al-Cr, Al-Fe, Al-Со, Al-Ni. -Вкн.: Расчеты и экспе-
риментальные методы построения диаграмм состояния. М.: Наука, 1985.
Для систем из алюминидов с переходными металлами 4-го периода
расчет диаграмм состояния выполнен с применением ЭВМ. Использованы
разные виды аппроксимации энергии взаимообмена в рамках моделей
регулярных и субрегулярных растворов. Созданы программы расчета кри-
вых растворимости. Оптимизирующая подпрограмма определяет значения
коэффициентов аппроксимирующих функций с целью наилучшего совпаде-
ния с экспериментом.
Ил. 1. Библиогр. 6 назв.
УДК 621.315.592
Васильев М.Г., Вигдорович В.Н., Селин А.А., Ханин В. А.
Исследование положения конод в системах с многокомпонентными твер-
дыми растворами. - В кн.: Расчеты и экспериментальные методы построе-
ния диаграмм состояния. М.: Наука, 1985.
Разработан метод расчета положения конод, характеризующих равно-
весные составы жидкой и твердой фаз в системах с многокомпонентными
твердыми растворами на основе соединений типа A^*BV.
Ил. 1. Библиогр. 5 назв.
УДК 669.245’293’784:536.7
Гриднев В.Н., Барабаш О.М., Легкая Т.Н. Термодинамический
расчет и экспериментальное исследование поверхностей ликвидус и соли-
дус в тройной системе Ni-Nb-C. - В кн.: Расчеты и экспериментальные
методы построения диаграмм состояния. М.: Наука, 1985.
В приближении квазихимической модели твердых и жидких бинарных
металлических растворов, содержащих элемент внедрения, с применением
ЭВМ выполнен расчет поверхности ликвидуса между расплавом и
карбидом натрия в тройной системе Ni-Nb-C. Экспериментально опре-
делена поверхность плавкости в никелевом углу этой системы.
Ил. 2. Библиогр. 6 назв.
УДК 621.386.12+669.017.1/3
Петьков В.В. Экспериментальные методы и аппаратура для исследова-
ния и построения диаграмм состояния металлических систем. - В кн.:
Расчеты и экспериментальные методы построения диаграмм состояния. М.:
Наука, 1985.
Рассмотрены экспериментальные методы и аппаратура для высокотем-
пературной дифрактометрии материалов, проведен анализ достижений в
этой области и указаны возможности и приемы практического примене-
ния. Обсуждены способы получения высоких температур и вакуума, точ-
ное позиционирование образца, обеспечение чистоты его поверхности,
предотвращение физико-химического взаимодействия при высоких тем-
пературах, автоматизация эксперимента, повышение точности измерений.
Описана система установок-приставок к рентгеновскому дифрактометру,
пригодная для исследования и построения диаграмм состояния. Приве-
дены примеры исследования фазовых превращений в диапазоне темпера-
тур от 300 до 2773 К в вакууме от 6,65 • 10~‘ до 6,65 10'4 Па (от
5 • 10"‘ до 5 • 10"6 мм рт. ст.) или в среде инертного газа.
Ил. 1. Библиогр. 27 назв.
182
УДК 54 1. 121.536.7
Петров Д.А. Применение методов сверхскоростного охлаждения метал-
лических сплавов для исследования и построения диаграмм состояния. -
В кн.: Расчеты и экспериментальные методы построения диаграмм состоя-
ния. М.: Наука, 1985.
Определение солидуса диаграммы состояния требует обычно значитель-
ного времени для предварительного (перед снятием кривой нагрева) при-
ведения сплава в .равновесное состояние. При сверхбыстром охлаждении
из расплава существенно подавляется сегрегация в сплавах. Приведение в
равновесие такого материала требует нескольких минут. Операция может
быть совмещена с нагревом образца непосредственно для записи кривой
нагрева.
Табл. 3. Ил. 2. Библиогр. 10 назв.
УДК 543.422.8+548.734
Карпинский О.Г., Шел и мова Л.Е. Количественный рентгенов-
ский фазовый анализ по дифрактограммам с наложенными линиями фаз. -
В кн.: Расчеты и экспериментальные методы построения диаграмм состоя-
ния. М.: Наука, 1985.
Предложен метод количественного анализа, использующий автоматиче-
скую запись дифрактограмм по точкам, основанный на аддитивности вкла-
дов отдельных фаз в интенсивность спектра многофазного образца во
всех точках. Дана блок-схема программы расчета фазового состава на ЭВМ.
Метод проверен на модельном образце, приготовленном смешением двух
фаз монотеллурида германия и использован при изучении диаграммы
состояния системы Ge-Te.
Ил. 2. Библиогр. 2 назв.
УДК 539.2+669.295
Пастушенко С.Н. Исследование фазовых равновесий в тройной
системе Ti-Al-Fe методом мессбауэровской спектроскопии. - В кн.:
Расчеты и экспериментальные методы построения диаграмм состояния.
М : Наука, 1985.
Методом мессбауэровской спектроскопии исследовались сплавы
Ti-Al-Fe, содержащие от 0 до 50 ат. % А1 и от 0,1 до 1,33 ат. % 5,Fe. На
основании анализа сверхтонкой структуры мессбауэровских спектров по-
казано, что в чистом титане растворимость железа при 550°С мала (около
0,02 ат. %). Растворимость железа повышается как при увеличении тем-
пературы от 550 до 780°С, так и при увеличении содержания алюминия в
сплавах. В о,-фазе (Ti,Al) при 55О°С растворяется уже около 0,1 ат. % Fe,
а в у-фазе СПА1) - 1,2 ат. % Fe. Второй фазой, выделяющейся при отжигах
литых сплавов при 550°С, является интерметаллид Ti -Fe.
Табл. 1. Ил. 2. Библиогр. 10 назв.
УДК 669.018.1+543.42
Трегубов И.А., Евсеева Л.Н. Исследование четверной диаграммы
состояния Re-Ta-W-Mo методом диффузионных слоев с использова-
нием локального рентгеноспектрального анализа. - В кн.: Расчеты и экспе-
риментальные методы построения диаграмм состояния. М.: Наука, 1985.
Методом локального рентгеноспектрального анализа диффузионных
слоев между Re и тройными сплавами W, Та и Мо построены три изокон-
центрационных сечения изотермического тетраэдра диаграммы состояния
четверной системы Re-Ta-W-Mo при 23ОО°С с постоянным содержанием
рения 85.73 и 63 мае. %. Анализ концентрационных кривых и микрострук-
тур диффузионных слоев показал, что при изотермической диффузии
между Re и тройными сплавами W, Та и Мо образуются лишь однофазные
слои Новых фазовых областей, которые бы не встречались в двойных и
тройных системах, в четверной системе при 2300°С не обнаружено.
Табл. 1. Ил. 1. Библиогр. 2 назв.
183
УДК 620.181.5+621.317.44
Зубко С. А., Войцехович Л.Н., Ковашевич И.П. Высокотем-
пературный магнитометр для исследования фазовых превращений в ста-
лях. - В кн.: Расчеты и экспериментальные методы построения диаграмм
состояния. М.: Наука, 1985.
В работе приведено краткое описание вибрационного высокотемпера-
турного магнитометра для исследования кинетики фазовых превращений
и фазового анализа сталей. Обоснована возможность проведения фазового
анализа в области подхода к насыщению с применением эталонного образ-
ца. Приведены аналитические выражения, связывающие намагниченность
исследуемого образца с содержанием ферромагнитной фазы. Показано,
что при выборе определенных значений магнитного поля устраняется влия-
ние внутренних свойств материала образца на результаты измерений. Опи-
саны практические методики проведения анализа.
Ил. 2. Библиогр. 8 назв.
УДК 621.386+548.734
Рикель М.О., Алексеева З.М. Прецизионное определение парамет-
ров решетки веществ сингонии не ниже ромбической по дебаеграммам с
относительной точностью 10“5. - В кн.: Расчеты и экспериментальные
методы построения диаграмм состояния. М.: Наука, 1985.
Предложен метод измерения рентгенограмм и расчета параметров решет-
ки, основанный на применении теории статистических выводов к анализу
корректности эксперимента и расчета. Выведена и экспериментально про-
верена формула для поправок при схеме по Дебаю-Шерреру. Параметр
решетки международного эталона вольфрама измерен с относительной точ-
ностью 2 • 10"s.
Табл. 2. Ил. 1. Библиогр. 6 назв.
УДК 620.193.55001.5
Сердюк Н.П., Трофименко В.В., Семик А.П., Должен-
ков В.И., Титков А.Л. Экспериментальные методы исследования и по-
строения диаграмм состояния металл—водород. — В кн.: Расчеты и экспери-
ментальные методы построения диаграмм состояния. М.: Наука, 1985.
Разработан ряд методик для изучения термодинамических характери-
стик систем металл-водород при высоких температурах и давлениях водо-
рода в равновесных условиях. Основная экспериментальная установка
позволяет производить программный нагрев, охлаждение, изотермические
выдержки, закалку в газовой фазе любого состава, простой и дифферен-
циальный термический анализ при температурах до 2273 К и давлениях
от 10"7 до 100 МПа. Сжатие водорода до высоких давлений осуществля-
ется специально разработанным нагнетательным модулем, не допускаю-
щим загрязнение газа кислородом, азотом и другими примесями.
Ил. 1. Библиогр. 10 назв.
УДК 669.01.584.2
Масленков С.Б., Кобылкин А.Н., Ситников Д.Н. Термиче-
ский анализ при высоких скоростях охлаждения. - В кн.: Расчеты и экспе-
риментальные методы построения диаграмм состояния. М.: Наука, 1985.
Работа посвящена вопросу разработки способа и создания устройства
для проведения термического анализа с высокими скоростями охлажде-
ния (1000-5000 град/с). На основании анализа и проведенных расчетов
разработан способ быстрых охлаждений, пригодный для реализации в
термическом анализе. Экспериментально показана возможность проведе-
ния термического анализа со скоростями в несколько тысяч градусов в
секунду. Приведены данные о влиянии массы образца, среды и давления
рабочей атмосферы на скорость охлаждения его. Разработано дифферен-
цирующее устройство, значительно повышающее чувствительность метода
при регистрации слабых тепловых эффектов.
Табл. 1. Ил. 3. Библиогр. 5 назв.