Автор: Банных О.А. Дрица М..Е.
Теги: металлургия черных металлов железо, чугун и сталь металлургия
Год: 1986
Текст
ДИАГРАММЫ
СОСТОЯНИЯ
ДВОЙНЫХ
И МНОГО-
КОМПОНЕНТНЫХ
СИСТЕМ
НА ОСНОВЕ
ЖЕЛЕЗА
ДИАГРАММЫ СОСТОЯНИЯ
ДВОЙНЫХ
И МНОГОКОМПОНЕНТНЫХ СИСТЕМ
НА ОСНОВЕ ЖЕЛЕЗА
Под редакцией докт. техн, наук проф. О. А. Банных
и докт. техн, наук проф. М. Е. Дрица
Согласовано с Государственной службой
стандартных справочных данных
10г
МОСКВА, МЕТАЛЛУРГИЯ, 1986
УДК 669.15.017.12(083)
О. А. Банных, П. Б. Будберг, С. П. Алисова, Л. С. Гузей, М. Е. Дриц,
Т. В. Добаткина, Е. В. Лысова, Н. И. Никитина, Е. М. Падежнова,
Л. Л. Рохлин, О. П Черногорова
Рецензент докт. техн, наук Л. А. ПЕТРОВА
УДК 669.15.017.12(083)
Диаграммы состояния двойных и многокомпонентных систем на основе
железа: Справ. изд./Банных О. А., Будберг П. Б., Алисова С. П. и др.
М.: Металлургия. 1986. 440 с.
Приведены обширные и наиболее достоверные данные о диаграм-
мах состояния систем на основе железа. Впервые обобщены сведения
о трех- и многокомпонентных диаграммах, которые позволят обосновать
и быстро определить оптимальный состав сплава, режим его плавки,
литья, обработки давлением и термической обработки, что имеет очень
большое значение для правильного выбора конструкционных сплавов,
содержащих несколько элементов. Рассмотрены особенности взаимодей-
ствия железа с элементами периодической системы. При построении не-
которых диаграмм состояния использованы аналитические методы рас-
чета.
Для инженерно-технических работников и специалистов металлур-
гической, машиностроительной и других отраслей промышленности.
Может быть полезно преподавателям, аспирантам и студентам вузов.
Ил. 545. Табл. 20. Библиогр. список 975 назв.
2605000000—074
040(01)—86
54—86
© Издательство «Металлургия», 1986
СОДЕРЖАНИЕ
Предисловие 8
Железо — азот 9
Железо — алюминий . . . 11
Железо — барий 13
Железо — бериллий . . . 14
Железо — бор 16
Железо — ванадий .... 18
Железо — висмут .... Железо — водород (дейте- 20
рий, тритий) 20
Железо — вольфрам . . . 23
Железо — гадолиний . . . 25
Железо — галлий . , 26
Железо — гафний .... 28
Железо — германий . . 39
Железо — гольмий .... 31
Железо — диспрозий . . 32
Железо — золото .... 34
Железо — индий . . 35
Железо — иридий .... 36
Железо — иттербий . . . 38
Железо — иттрий . . 39
Железо — кадмий 40
Железо — калий . 40
Железо — кальций . . 40
Железо — кислород . . 41
Железо — кобальт . . 43
Железо — кремний .... 45
Железо — криптон .... 47
Железо — лантан 47
Железо — литий . . 48
Железо — лютеций . . . 48
Железо — магний 49
Железо — марганец . . . 49
Железо — медь 51
Железо — молибден . . . 53
Железо — мышьяк .... 55
Железо — натрий . . , 57
Железо — неодим .... 57
Железо — никель . . . 59
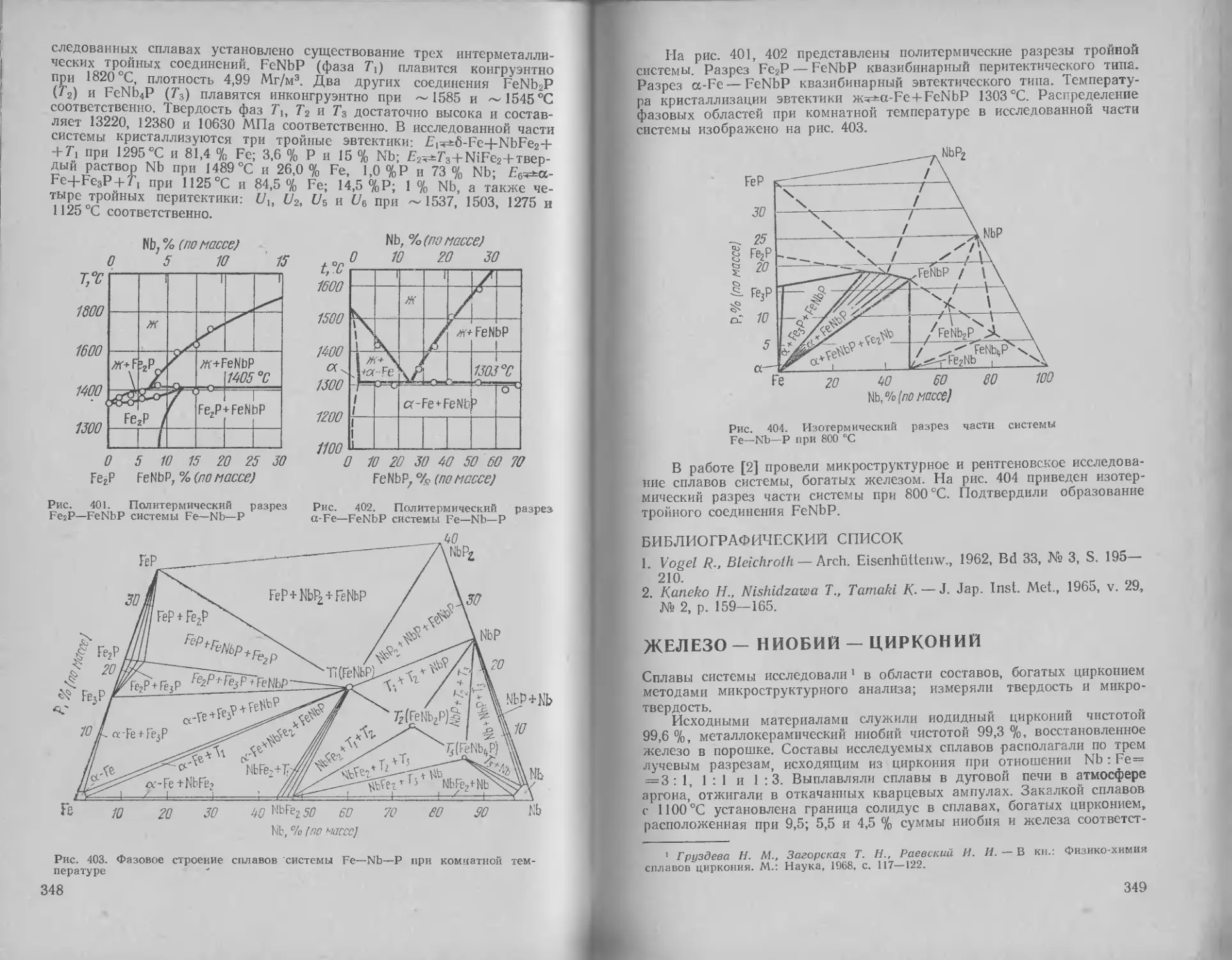
Железо — ниобий .... 61
Железо — олово .... 63
Железо — осмий . . 64
Железо — палладий . . 65
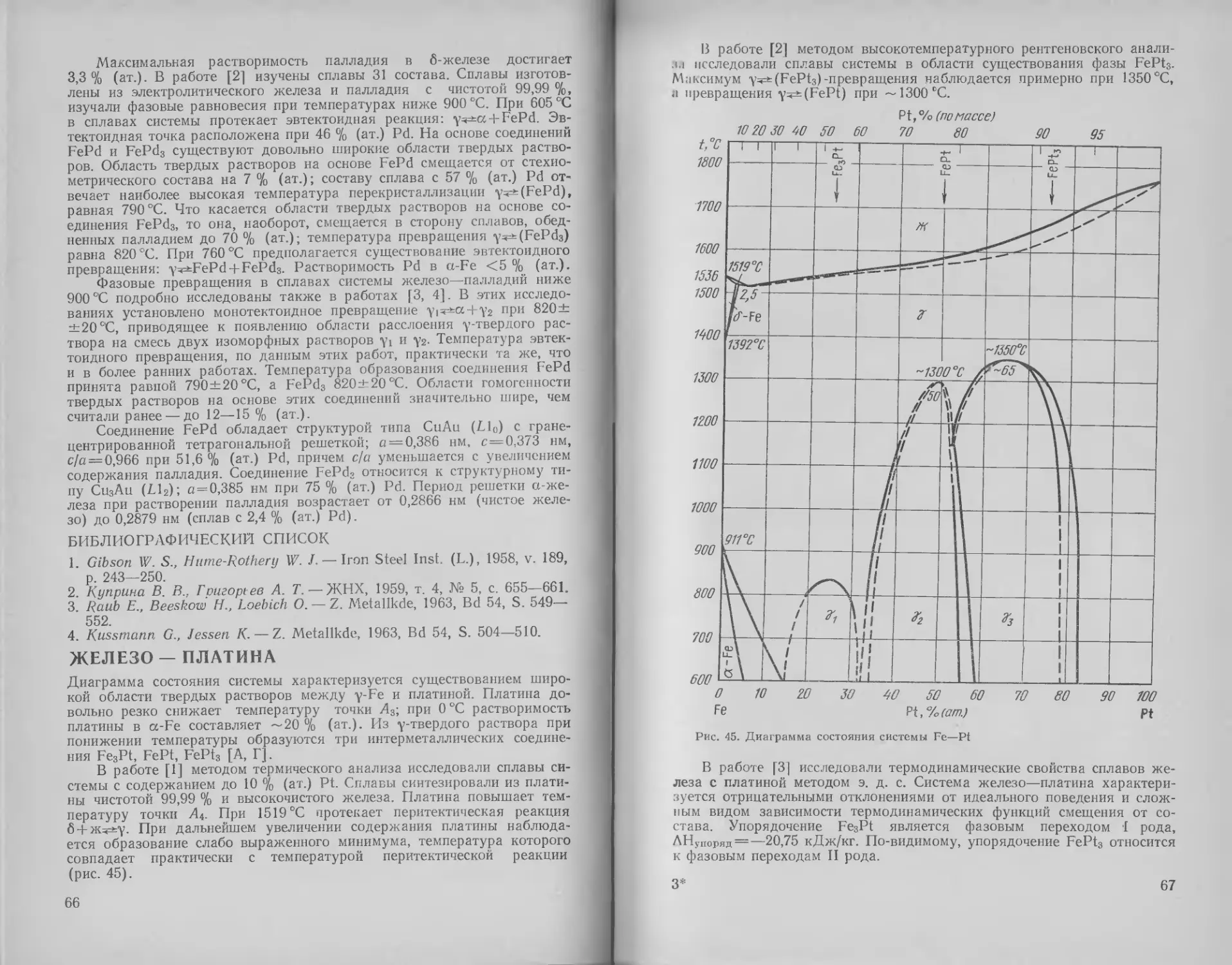
Железо — платина .... 66
Железо — плутоний . . 68
Железо — празеодим . . . 69
Железо — прометий . . 71
Железо — радон 71
Железо — рений ... 71
Железо — родий .... 72
Железо — ртуть . . . 73
Железо — рубидий . . 73
Железо — рутений . . 73
Железо — самарий .... 74
Железо — свинец .... 75
Железо — селен............. 76
Железо — сера.............. 78
Железо — серебро .... 80
Железо — скандий .... 81
Железо — стронций ... 82
Железо — сурьма .... 83
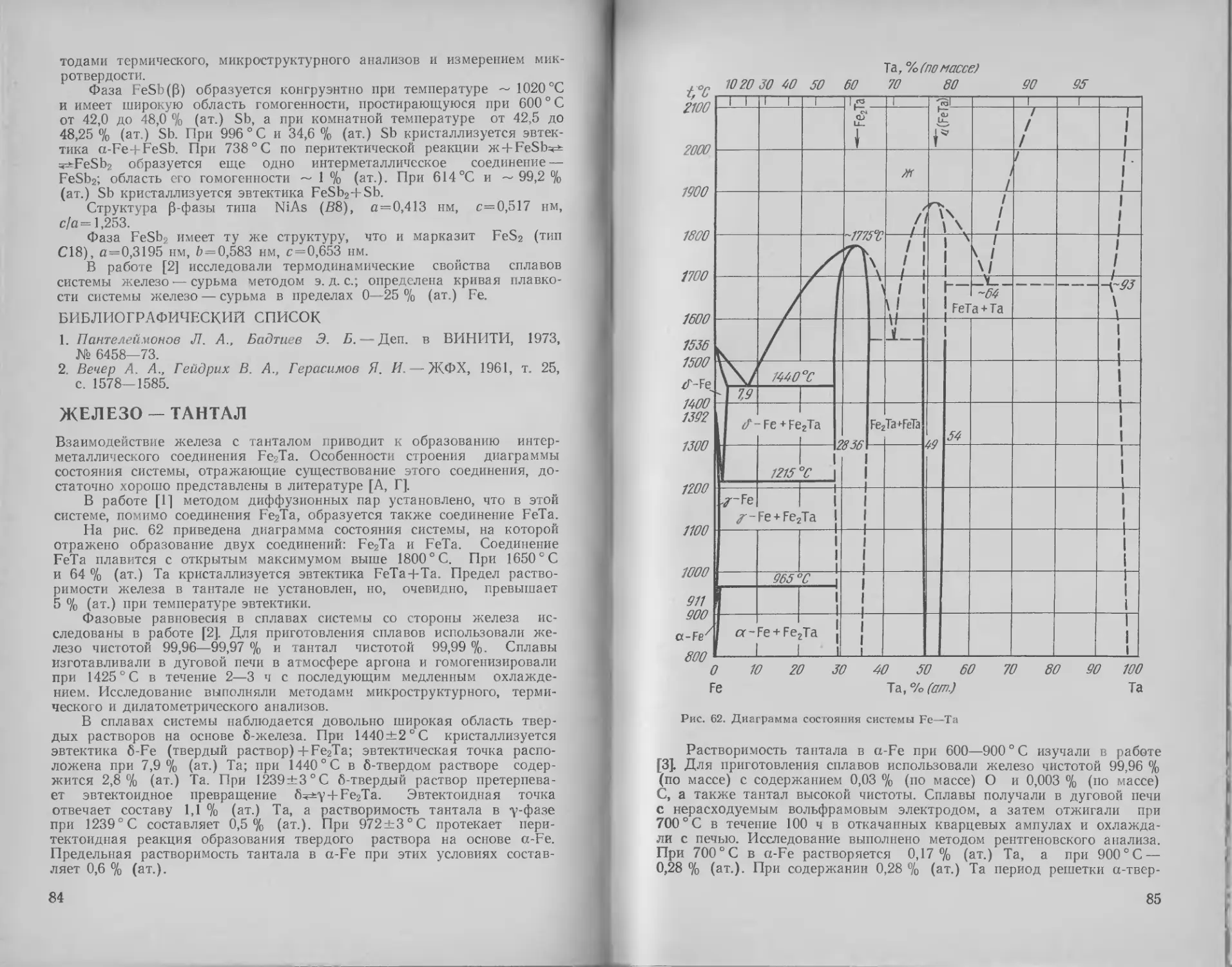
Железо — тантал .... 84
Железо — таллий .... 86
Железо — теллур .... 86
Железо — тербий .... 88
Железо — технеций ... 90
Железо — титан............. 91
Железо — торий............. 93
Железо — тулий............. 94
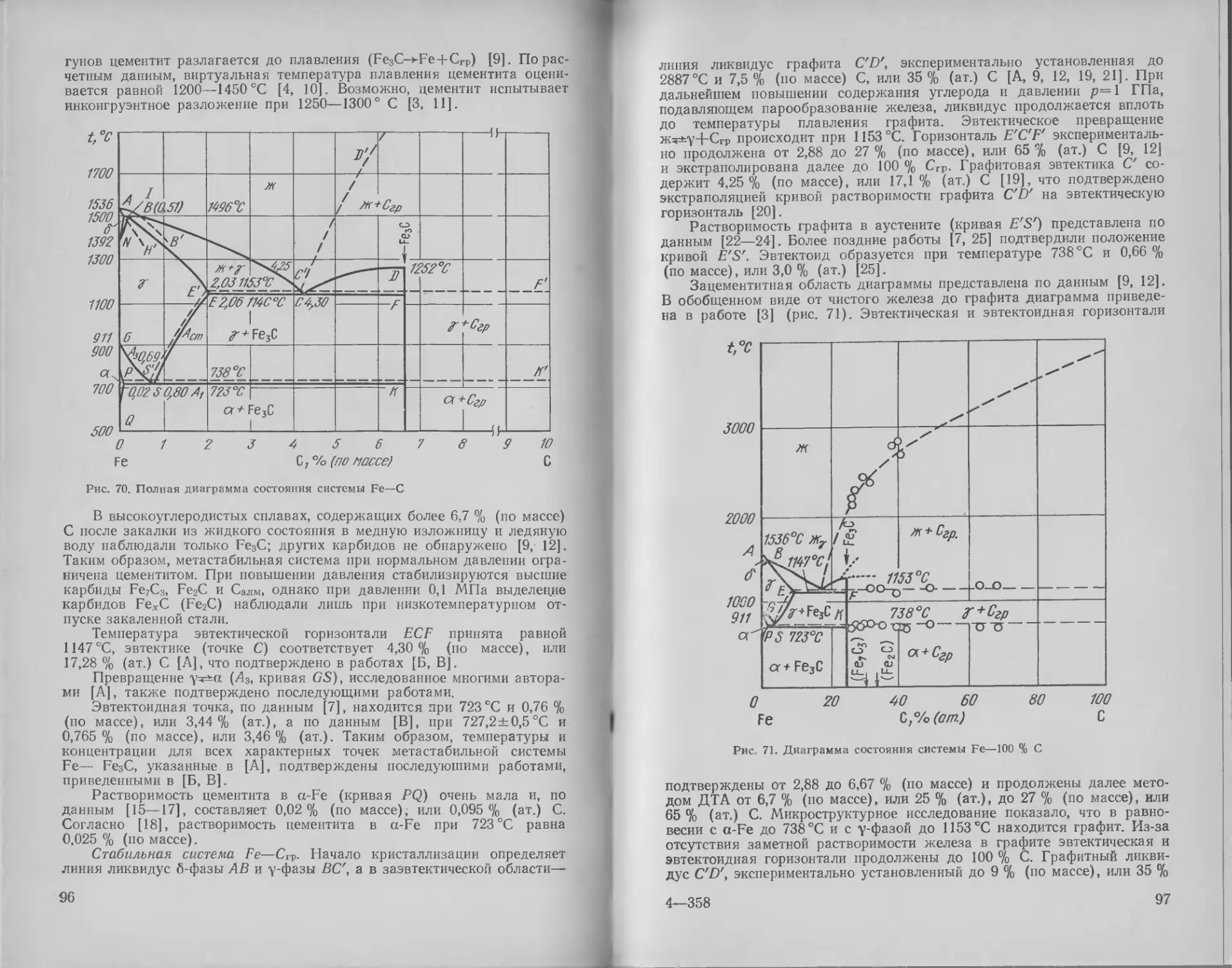
Железо — углерод .... 95
Железо — уран............. 100
Железо — фосфор .... 101
Железо — хром............. 102
Железо — цезий............ 105
Железо — церий............ 105
Железо — цинк............. 107
Железо — цирконий . . . 109
Железо — эрбий............ 112
Железо — азот — алюминий 113
Железо — азот — бор . . . Н4
Железо — азот — ванадий . 115
Железо — азот — галлий. . 115
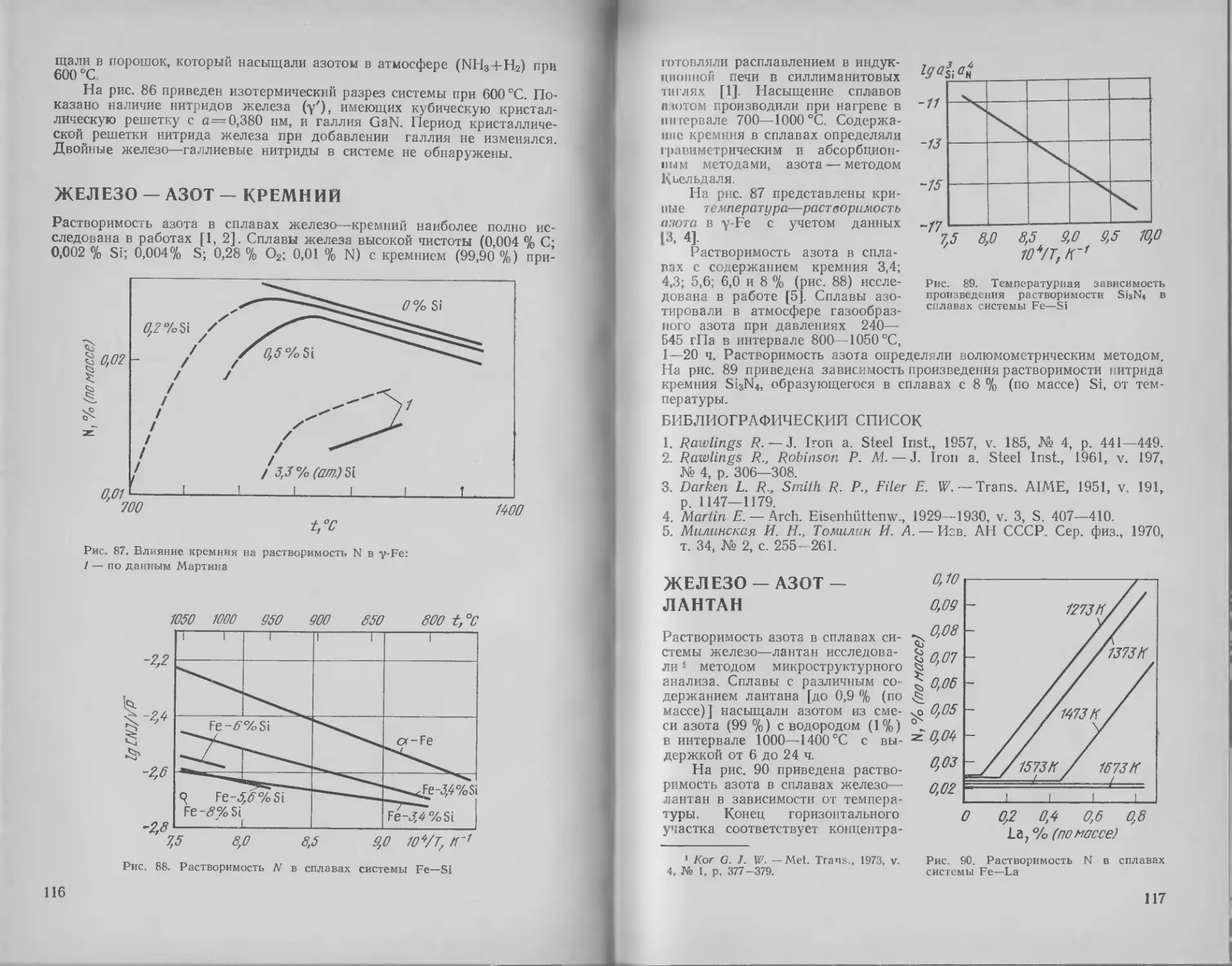
Железо — азот — кремний . И 6
Железо — азот — лантан . 117
Железо— азот — марганец 118
Железо — азот — никель . . 119
Железо — азот — ниобий . 120
Железо — азот — платина . 120
Железо — азот — тантал . 120
Железо — азот — титан . . 121
Железо — азот — углерод . 121
Железо — азот — уран . . 124
Железо — азот-—-хром . . 124
Железо — азот — церий . . 126
Железо — азот — цинк . . 127
Железо — алюминий — бе-
риллий ................. 127
Железо — алюминий — бор 128
Железо — алюминий — га-
долиний .................. 129
Железо — алюминий — гаф-
ний .................... 130
Железо — алюминий — гер-
маний .............. 131
Железо — алюминий — ит-
трий ................... 131
Железо — алюминий—каль-
ций .................... 132
3
Железо — алюминий — ко-
бальт .................. ’33
Железо — алюминий—крем-
ний .................... 134
Железо — алюминий — мар-
ганец .................. 136
Железо — алюминий — медь 138
Железо — алюминий — мо-
либден ................. 139
Железо — алюминий — нео-
дим .................... 140
Железо — алюминий — ни-
кель ................... 141
Железо — алюминий — нио-
бий ................... 142
Железо — алюминий — са-
марий .................. 142
Железо — алюминий — се-
ребро ....... 144
Железо — алюминий —
скандий................. 145
Железо — алюминий — тан-
тал . ............ 145
Железо — алюминий — ти-
тан .................... 146
Железо — алюминий — уг-
лерод .................. 148
Железо — алюминий — уран 150
Железо — алюминий — фос-
фор . . 150
Железо — алюминий — хром 152
Железо — алюминий — це-
рий .................... 152
Железо — алюминий — цинк 153
Железо — алюминий — цир-
коний .................. 155
Железо — алюминий — эр-
бий .................... 156
Железо — бериллий — ко-
бальт ................. 156
Железо — бериллий — крем-
ний .................... 157
Железо — бериллий — фос-
фор .................... 159
Железо — бор — ванадий . 161
Железо — бор — галлий . . 162
Железо — бор — гафний . . 163
Железо — бор — германий . 164
Железо — бор — кобальт . 164
Железо — бор — кремний 164
Железо — бор — марганец . 166
Железо — бор — молибден . 167
Железо — бор — никель . . 168
Железо —бор — ниобий . . 169
Железо — бор — тантал . . 170
Железо — бор — титан . . 173
Железо — бор — углерод . 173
4
Железо — бор — хром . . 174
Железо — бор — церий . . 176
Железо — бор — цирконий . 177
Железо — ванадий — водо-
род ...................... 178
Железо — ванадий — кисло-
род ................ 179
Железо — ванадий — ко-
бальт ............... ... 180
Железо — ванадий — крем-
ний ...................... 181
Железо — ванадий — марга-
нец ..................... 183
Железо — ванадий — никель 184
Железо — ванадий — нио-
бий ...................... 184
Железо — ванадий —сера . 184
Железо — ванадий — титан 186
Железо — ванадий — угле-
род ...................... 186
Железо — ванадий — фос-
фор . . . . . 188
Железо — ванадий — хром 189
Железо — ванадий — цирко-
ний ...................... 191
Железо — висмут — сера . 191
Железо — водород — воль-
фрам ..................... 192
Железо — водород — гер-
маний ............... . . 193
Железо — водород — ко-
бальт . ............. 194
Железо — водород — мо-
либден ................... 194
Железо — водород — ни-
кель ..................... 195
Железо — водород — ниобий 196
Железо — водород — тантал 197
Железо — водород — титан 197
Железо — водород — угле-
род .......................199
Железо — вольфрам — кис-
лород .................... 200
Железо — вольфрам — ко-
бальт .................... 200
Железо — вольфрам — крем-
ний ...................... 201
Железо — вольфрам — мо-
либден . . . . 202
Железо — вольфрам — ни-
кель ..................... 203
Железо — вольфрам — нио-
бий ...................... 204
Железо — вольфрам — сера 204
Железо — вольфрам — ти- .
тан....................’. 205
Железо — вольфрам — уг-
лерод .................. 206
Железо — вольфрам — фос-
фор ................ - . 207
Железо — вольфрам — хром 208
Железо — вольфрам — цинк 209
Железо — гадолиний — угле-
род ................ . 209
Железо — галлий — мышьяк 211
Железо — гафний — ниобий 211
Железо — гафний — угле-
род .................... 211
Железо — гафний — цирко-
ний . 213
Железо — германий — ко-
бальт .................. 214
Железо — германий — ни-
кель ................... 214
Железо — германий — сера 215
Железо — германий — се-
ребро . . . . . 216
Железо — золото — кобальт 216
Железо — золото — никель 218
Железо — иридий — родий 218
Железо — иттрий — марга-
нец .................... 218
Железо. — иттрий — руте-
ний .............. . . 218
Железо — иттрий — сама-
рий .................... 219
Железо — иттрий — хром . 220
Железо — кальций — крем-
ний . ............. 221
Железо — кальций — сера . 223
Железо -— кальций — фос-
фор .....................224
Железо — кислород — ко-
бальт .................. 225
Железо — кислород — крем-
ний .................... 225
Железо — кислород — мар-
ганец .................. 226
Железо — кислород — ни-
кель ................... 227
Железо — кислород — сера 229
Железо — кислород — ти-
тан .................... 229
Железо — кислород —• угле-
род .. . ... 230
Железо — кислород — фос-
фор .................... 231
Железо — кислород — хром 232
Железо — кислород — цир-
коний .................. 234
Железо — кобальт — крем-
ний .................... 235
Железо — кобальт — марга-
нец ...................... 237
Железо — кобальт — медь 238
Железо — кобальт — молиб-
ден ...................... 239
Железо — кобальт — никель 241
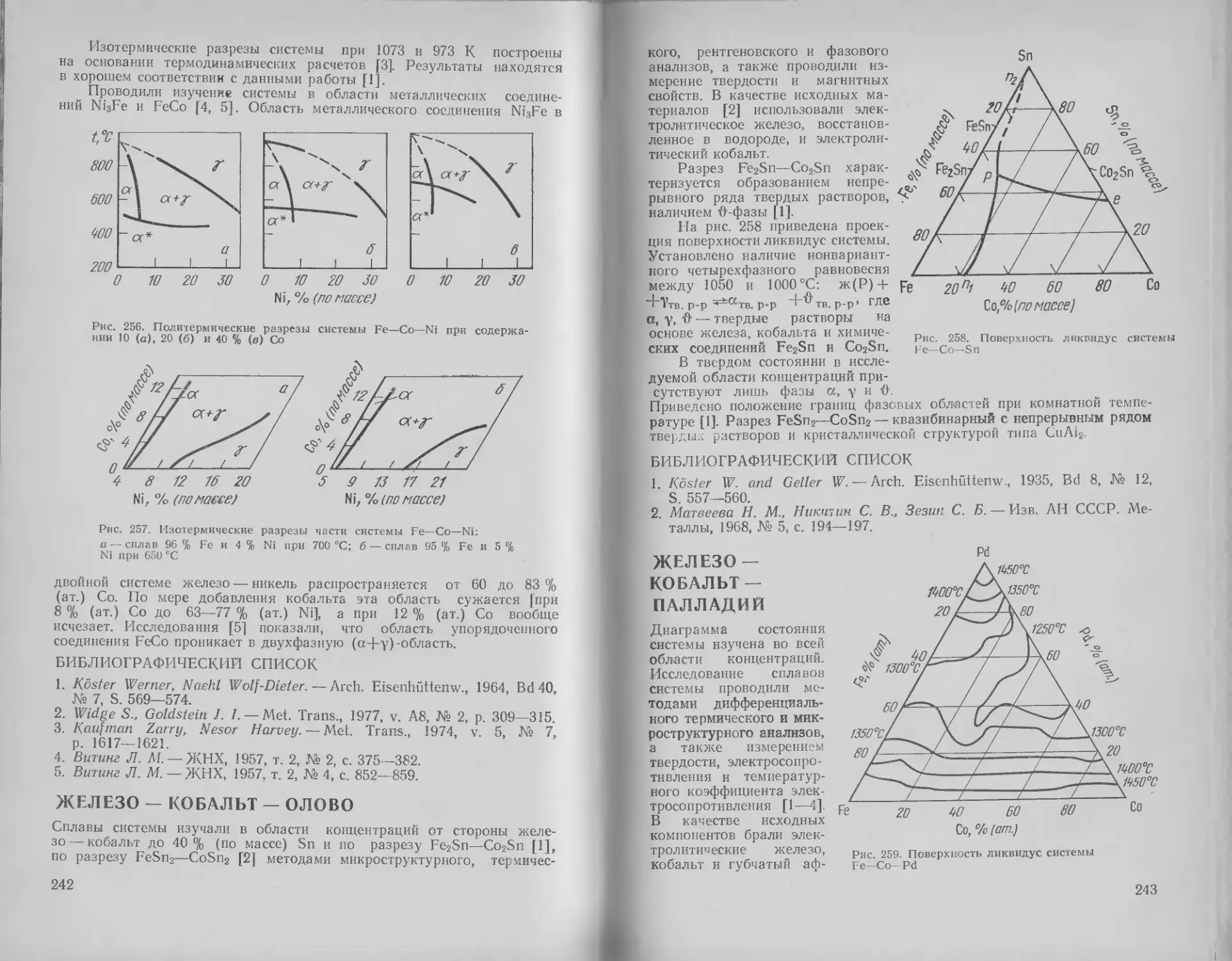
Железо — кобальт — олово 242
Железо — кобальт — палла-
дий ...................... 243
Железо — кобальт — рений 244
Железо — кобальт — ртуть 245
Железо — кобальт — сера 245
Железо — кобальт — сурьма 247
Железо — кобальт — тан-
тал ...................... 248
Железо — кобальт — титан 249
Железо — кобальт — угле-
род ...................... 251
Железо — кобальт — уран 251
Железо — кобальт — фос-
фор .... ... 255
Железо — кобальт — хром 256
Железо — кобальт — церий 258
Железо — кобальт — цинк 259
Железо — кремний — лан-
тан ...................... 260
Железо — кремний — мар-
ганец ............ ... 261
Железо — кремний — медь 262
Железо — кремний — мо-
либден .... . . 262
Железо — кремний — ни-
кель ............. . . 265
Железо — кремний — нио-
бий ...................... 266
Железо — кремний — олово 267
Железо — кремний — сера 269
Железо — кремний — сереб-
ро ... . .... 270
Железо — кремний — скан-
дий ...................... 271
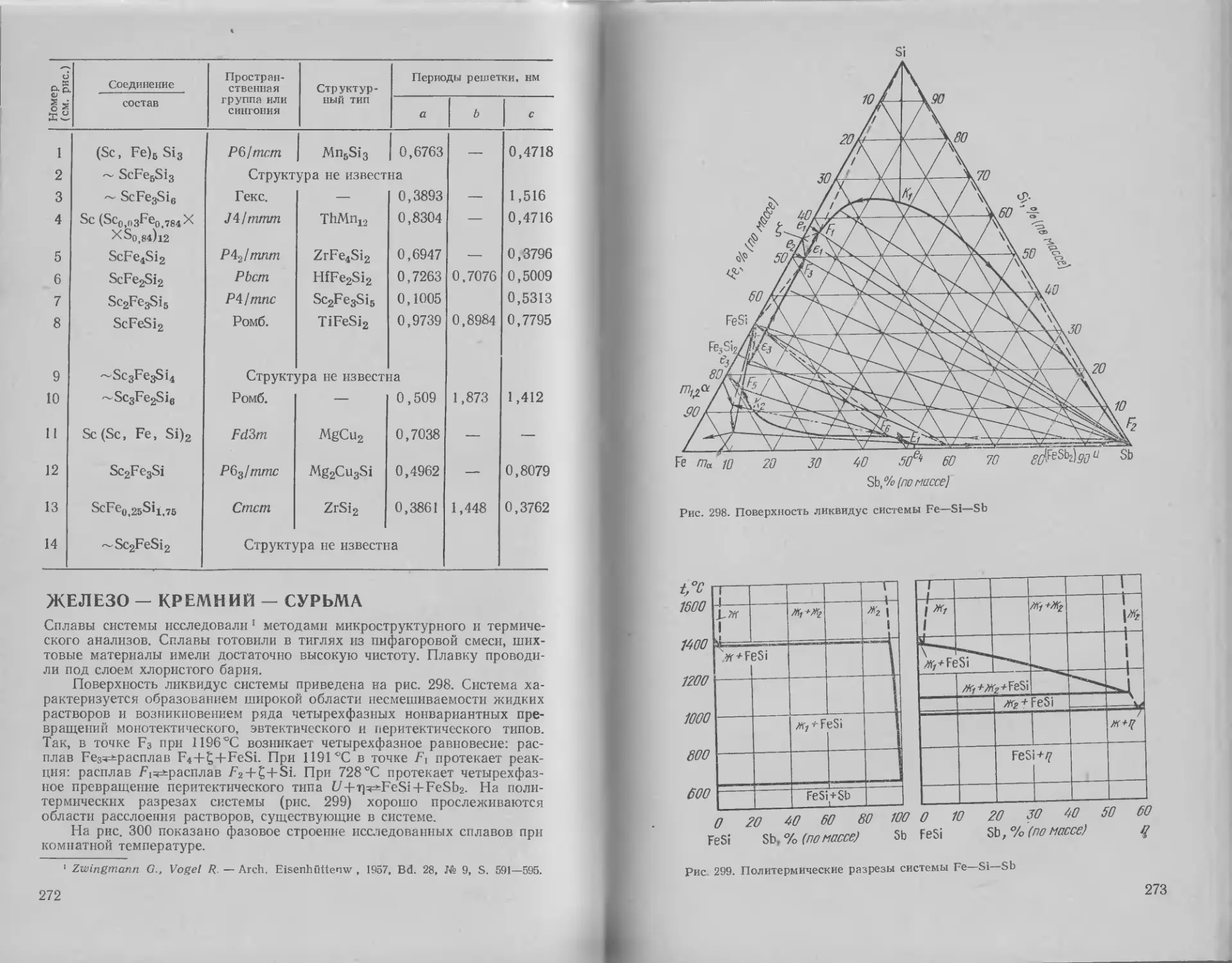
Железо — кремний — сурь-
ма ....................... 272
Железо — кремний — титан 274
Железо — кремний — угле-
род ...................... 276
Железо — кремний — уран 277
Железо — кремний — фос-
фор ...................... 278
Железо — кремний — хром 280
Железо — кремний — церий 281
Железо — кремний — цинк 282
Железо — марганец —
мышьяк.....................283
Железо — марганец — ни-
кель ......................284
5
Железо—марганец—олово . 285
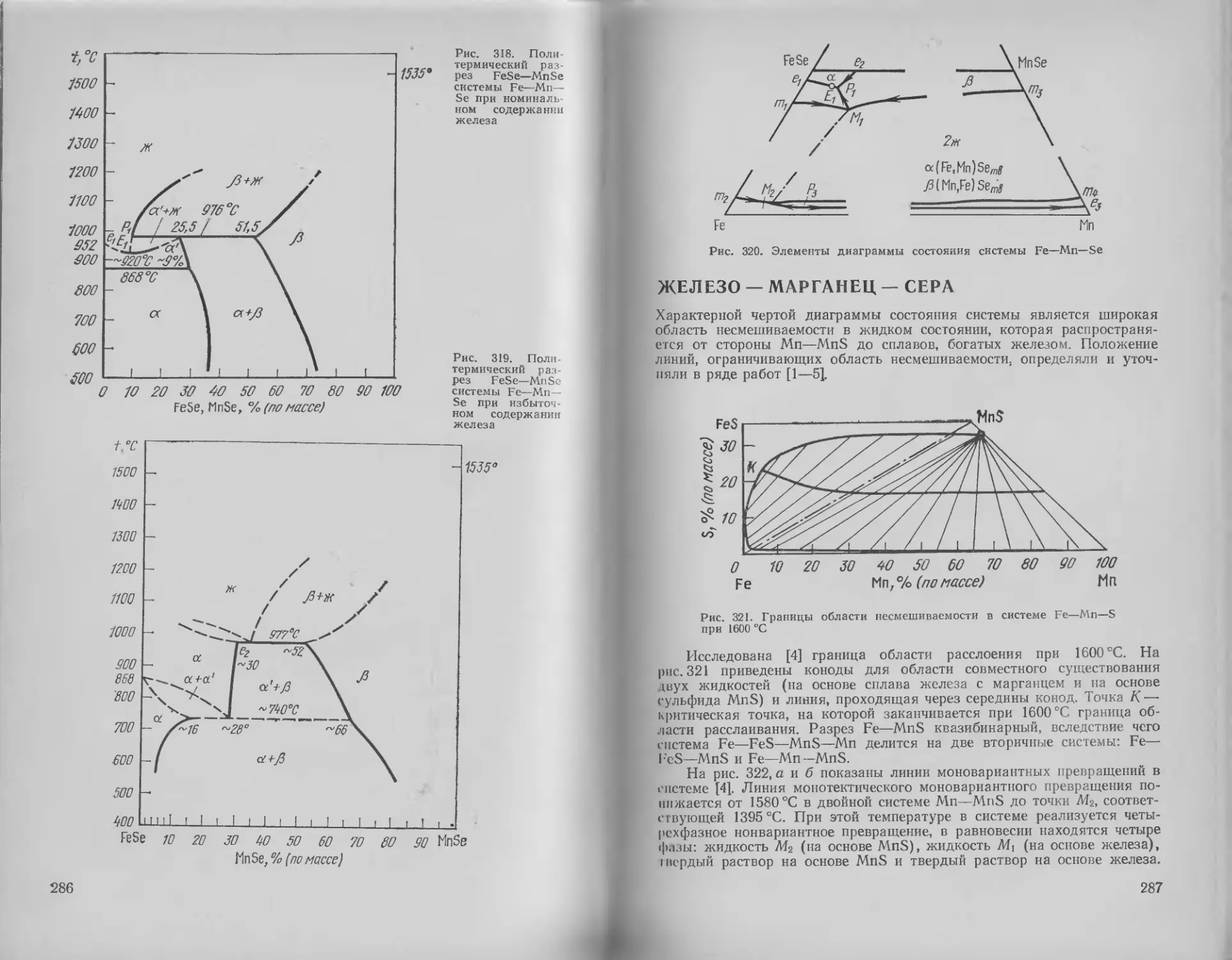
Железо—марганец—селен . 285
Железо — марганец — сера 287
Железо—марганец — сурьма 289
Железо —- марганец — тел-
лур .................... 290
Железо—марганец—титан . 291
Железо — марганец — угле-
род .................... 292
Железо — марганец — уран 294
Железо — марганец — фос-
фор ........ 294
Железо — марганец — хром 296
Железо — марганец — цинк 298
Железо — марганец — цир-
коний .................. 299
Железо — медь — мышьяк 299
Железо — медь — никель 300
Железо — медь — палладий 302
Железо — медь — платина 303
Железо — медь — свинец . 303
Железо — медь — сера . . 303
Железо — медь — серебро . 307
Железо — медь — сурьма . 308
Железо — медь — титан . . 309
Железо — медь — углерод . 310
Железо — медь — фосфор . 311
Железо—медь — цинк . . 313
Железо — медь — цирконий 314
Железо — молибден — ни-
кель ................... 315
Железо—молибден—ниобий 317
Железо — молибден — сера 317
Железо — молибден — титан 318
Железо — молибден — угле-
род .................... 318
Железо — молибден — фос-
фор .................... 320
Железо — молибден — хром 322
Железо — молибден — цир-
коний .................. 324
Железо — мышьяк — ни-
кель .................... 324
Железо—мышьяк—углерод 328
Железо — никель — ниобий 329
Железо — никель —олово 330
Железо — никель —- палла-
дий .................... 331
Железо—никель—платина 331
Железо — никель — рений . 333
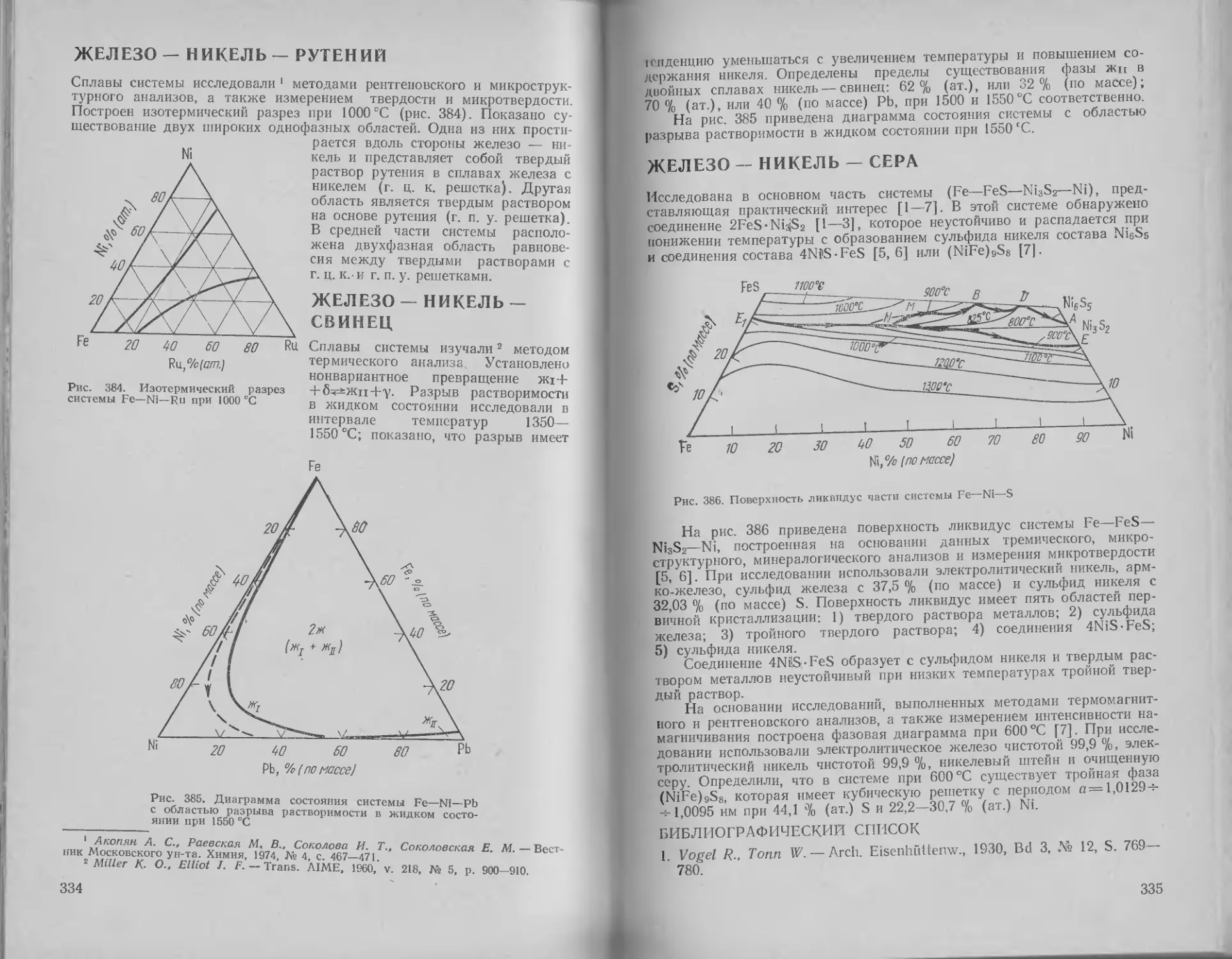
Железо — никель — рутений 334
Железо — никель — свинец 334
Железо — никель — сера . 335
Железо — никель — сурьма 336
Железо — никель — титан 337
Железо — никель — углерод 338
Железо — никель — уран . 340
6
Железо — никель — фосфор 340
Железо — никель — хром . 342
Железо — никель — цинк . 344
Железо — никель — цирко-
ний ..................... 344
Железо — ниобий — сера •. 345
Железо — ниобий — угле-
род ..................... 345
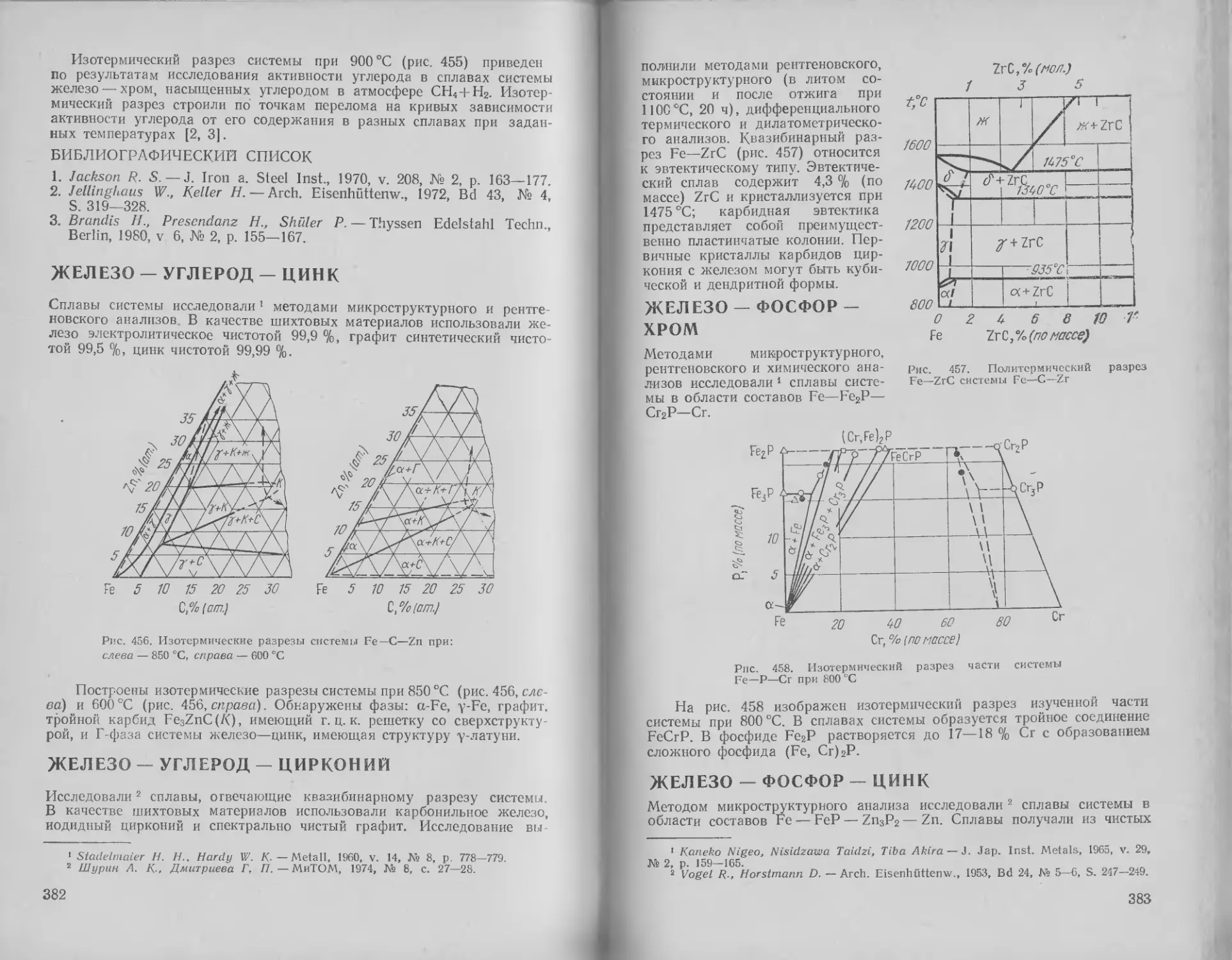
Железо — ниобий — фосфор 347
Железо — ниобий — цирко-
ний ..................... 349
Железо —олово — ртуть . 351
Железо — олово — сера . . 351
Железо — олово — углерод 351
Железо — олово — хром . . 352
Железо — олово — фосфор 352
Железо — олово — цирко-
ний ..................... 354
Железо — палладий — се-
ребро ................... 355
Железо — плутоний — уг-
лерод ................ 356
Железо — плутоний — уран 358
Железо — плутоний — церий 358
Железо — ртуть -— хром . . 359
Железо — ртуть — цинк . . 359
Железо — свинец — сера . . 359
Железо — свинец — теллур 360
Железо — сера — серебро . 361
Железо — сера — сурьма . . 362
Железо — сера — титан . . 363
Железо — сера — углерод . 364
Железо — сера — фосфор . 366
Железо — сера — хром . . 367
Железо — сера -— цирконий 368
Железо—сурьма—углерод 370
Железо — сурьма — фосфор 370
Железо — сурьма — хром . 372
Железо — титан — углерод 372
Железо — титан — цирконий 374
Железо — титан — фосфор 374
Железо — титан — хром . . 377
Железо — торий — уран . 378
Железо — углерод — уран . 379
Железо — углерод — фосфор 380
Железо — углерод — хром 381
Железо — углерод — цинк . 382
Железо — углерод — цирко-
ний ................... . 382
Железо — фосфор — хром . 383
Железо — фосфор — цинк . 383
Железо — фосфор — цирко-
ний . ....... 384
Железо — хром — цирконий 386
Железо — азот — крем-
ний — марганец .... 388
Железо — азот — марга-
нец — хром.............. 389
Железо — азот — угле-
род — хром................390
Железо — алюминий —
кремний — углерод . . . 392
Железо — алюминий —
марганец — медь . . . 393
Железо — алюминий — мар-
ганец — уран............. 393
Железо — алюминий — мар-
ганец — хром............. 395
Железо — бор — углерод —
хром..................... 396
Железо — ванадий — крем-
ний — марганец .... 396
Железо —- ванадий — молиб-
ден — хром............... 397
Железо —- ванадий — угле-
род — хром............... 398
Железо — водород — ко-
бальт — никель .... 399
Железо — вольфрам — мо-
либден — углерод . . . 400
Железо — вольфрам — ни-
кель — углерод .... 401
Железо — вольфрам — ни-
кель — хром.............. 403
Железо —- вольфрам — уг-
лерод — хром ..... 403
Железо — кислород — маг-
ний — никель............. 405
Железо — кислород — мар-
ганец — сера............. 405
Железо —• кислород — се-
ра — хром................ 406
Железо — кобальт — марга-
нец — уран............... 407
Железо — кремний — марга-
нец — углерод............ 409
Железо — кремний — ни-
кель — сера...............409
Железо — кремний — ни-
кель— хром .... 410
Железо — кремний — угле-
род— хром................ 411
Железо — марганец —
медь — никель............ 412
Железо — марганец —
мышьяк—углерод . . . 412
Железо — марганец — ни-
кель— сера............... 413
Железо — марганец — ни-
кель— хром............... 414
Железо — марганец — уг-
лерод— хром.............. 414
Железо — молибден — ни-
кель — хром ............
Железо — молибден — угле-
род — хром..............
Железо — никель — сера —
фосфор . . . . . .
Железо — никель — сви-
нец — углерод . . . .
Железо — никель — сурь-
ма — хром...............
Железо — никель — ти-
тан — хром .............
Железо — никель — угле-
род — уран . . . . .
Железо — никель — угле-
род — хром .............
Железо — азот — марта,
пец — никель — хром . .
Железо — азот — марга-
нец — углерод —- хром . .
Железо — алюминий — мар-
ганец — углерод — хром
Железо — бор — никель —
углерод — хром ....
Железо — вольфрам — ко-
бальт — никель —- хром .
Железо — кобальт — молиб-
ден — никель — хром . .
Железо — кремний — мар-
ганец — селен —- углерод
Железо — марганец —
медь — никель — хром .
Железо — алюминий —
бор — кремний — титан —
хром....................
Железо — алюминий — ва-
надий — кобальт — медь—
никель .................
Железо — алюминий —
вольфрам — никель —
титан — хром ....
Железо — алюминий — ко-
бальт — кремний —
медь — никель ....
Железо — алюминий — ко-
бальт — медь — никель —
ниобий .................
Железо — алюминий — ко-
бальт — медь — никель —
титан ..................
Железо — алюминий — ко-
бальт—кремний — медь —
никель — цирконий . . .
Железо — ванадий — крем-
ний — марганец — ни-
кель — ниобий — хром -.
Приложение..............
416
417
419
420
421
421
423
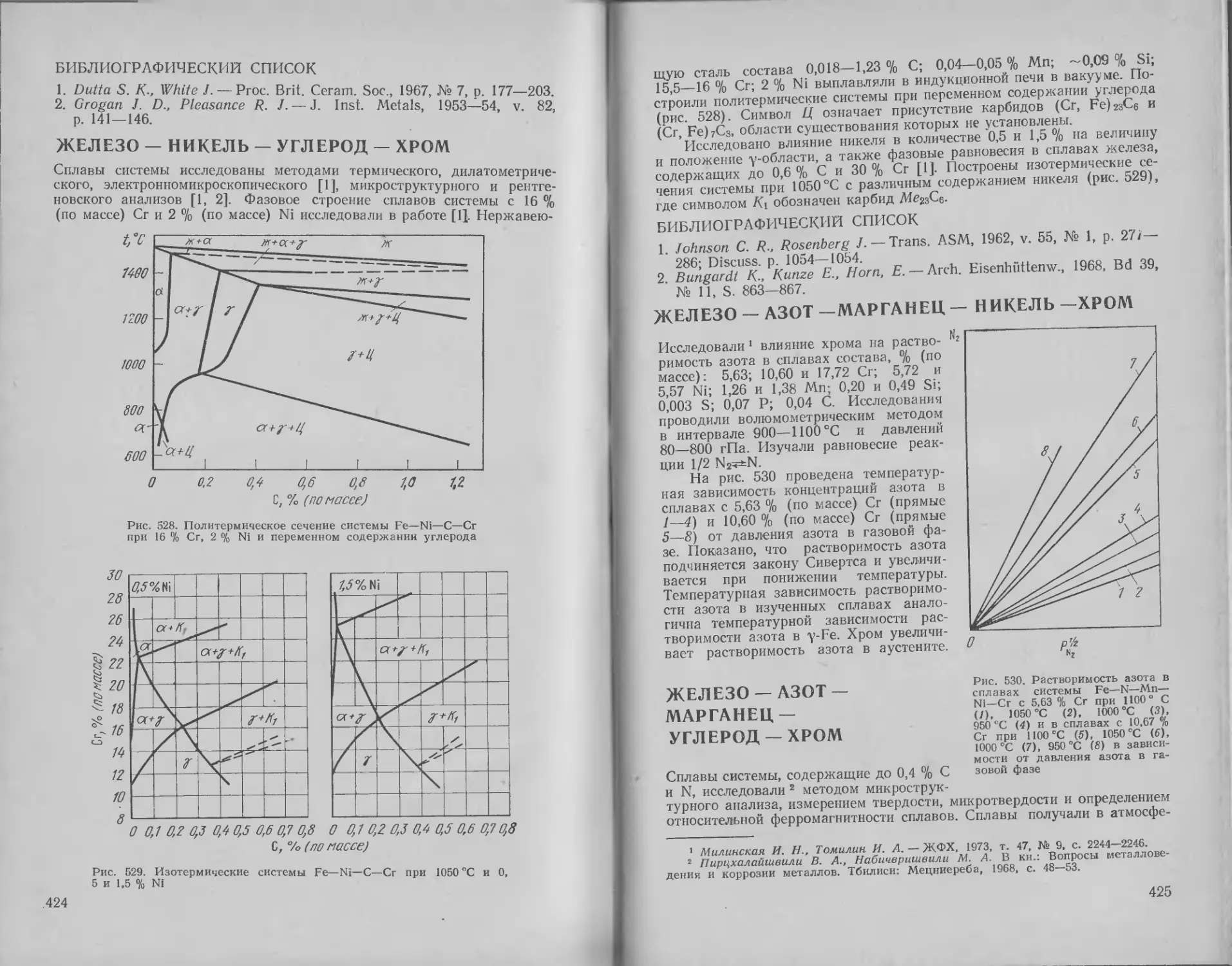
424
425
425
426
427
427
428
428
429
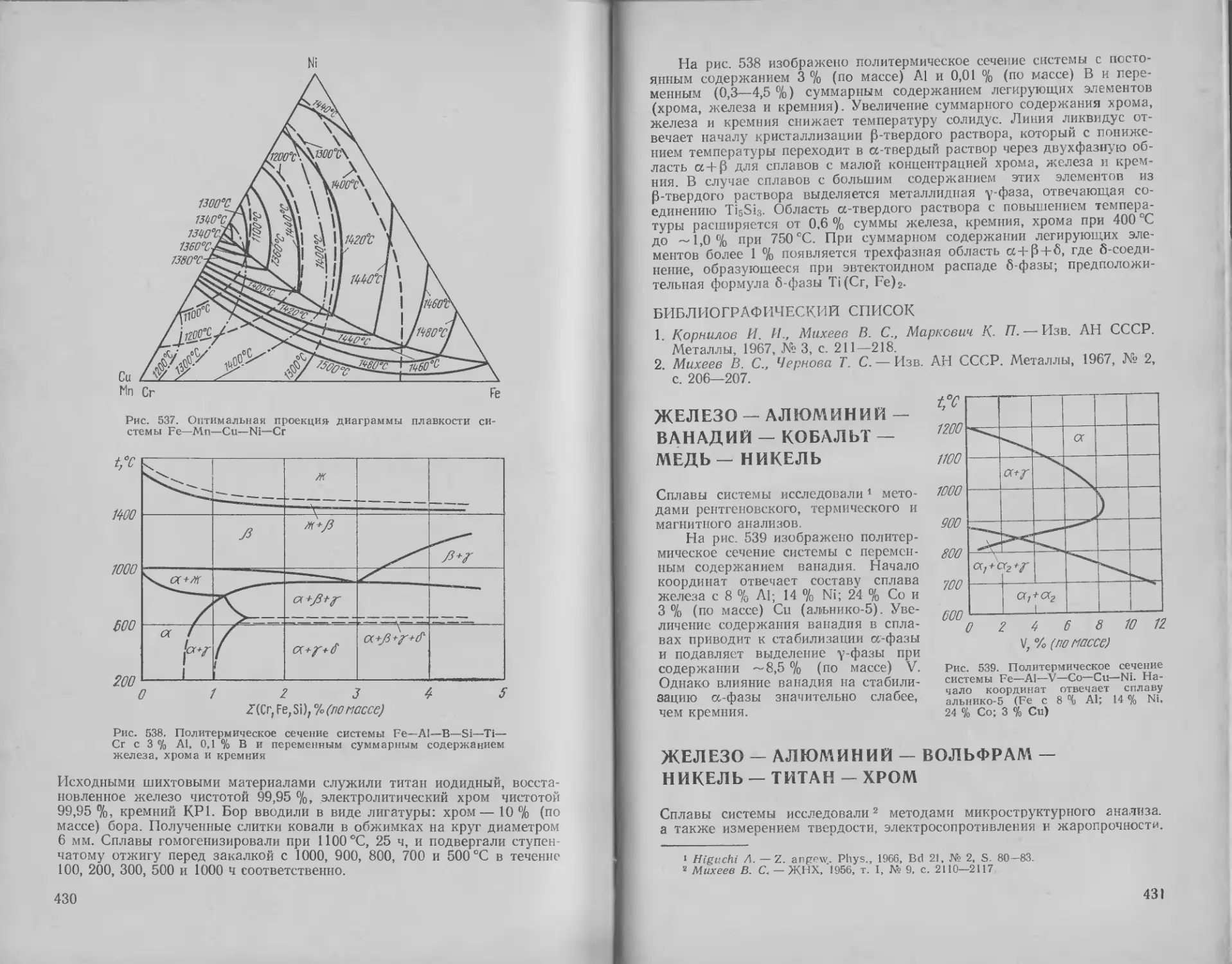
429
431
431
432
433
433
434
434
436
7
: —Д ПРЕДИСЛОВИЕ
В настоящее время партией принят курс на ускорение научно-техни-
ческого прогресса как главного направления экономической стратегии.
Одна из важнейших задач при этом — разработка новых материалов
и технологии их производства. Диаграммы состояния являются прак-
тически единственной научной основой для решения этой задачи.
Современные конструкционные сплавы довольно сложны по свое-
му составу, поэтому особое значение имеют диаграммы состояния
трех- и многокомпонентных систем. Между тем в настоящее время
наиболее полно изучены одно- и двухкомпонентные системы.
Следует отметить, что оригинальные работы по исследованию
диаграмм состояния обычно публикуются в весьма многочисленных и
часто труднодоступных периодических изданиях. Поэтому уже срав-
нительно давно предпринимают попытки обобщения известных диаг-
рамм состояния в едином издании. Советским читателям известны
вышедшие в переводе на русский язык книги М. Хансена и К. Андер-
ко [А], Р. П. Эллиота [Б], Ф. А. Шанка [В], в которых дается обзор
литературы по диаграммам состояния двойных систем и кристалличес-
кой структуре образующихся фаз соответственно на 1956 (частично
на 1957), 1961 и 1964 гг. включительно. В справочнике А. Е. Вол и
И. К. Каган, в отличие от справочников М. Хансена и др., помимо
диаграмм состояния и структуры фаз, приведены физические, механи-
ческие и химические свойства сплавов.
Большую роль в распространении информации о диаграммах
состояния металлических систем, публикуемых в периодической пе-
чати, играют приложения к РЖ Металлургия, «Диаграммы состояния
металлургических систем», издаваемые ВИНИТИ с 1955 г.
Несмотря на периодически выходящую информационную литера-
туру по диаграммам состояния двухкомпонентных систем, ее явно не-
достаточно. Книги М. Хансена, Р. П. Эллиота, Ф. Шанка, А. Е. Вол,
И. Г. Каган стали библиографической редкостью, не говоря уже о
том, что в них обобщен материал 20-летней давности по двухкомпо-
нентным диаграммам состояния и не содержится сведений о диаграм-
мах состояния трехкомпонентных и более сложных систем. Поэтому
назрела настоятельная необходимость в создании справочника, обоб-
щающего имеющиеся сведения как по двух-, так и по многокомпо-
нентным диаграммам состояния. Предлагаемый справочник — первый
опыт и в отечественной и в зарубежной литературе по систематиза-
ции данных о двойных и многокомпонентных диаграммах состояния на
основе железа. О выборе элемента — основы много говорить не прихо-
дится: объем производства сплавов на основе железа во много раз
превосходит объем производства сплавов на основе всех других элемен-
тов, вместе взятых. Авторы с благодарностью примут все замечания и
пожелания читателей, направленные на улучшение их труда.
Основополагающие, фундаментальные работы, встречающиеся
практически во всех диаграммах состояния, обозначены прописными
буквами и приведены ниже отдельным библиографическим списком.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
А. Хансен М., Андерко К. Структуры двойных сплавов. В 2-х т. М.: Металлургия,
1962. 1488 с.
Б. Эллиот Р. //.'Структуры двойных сплавов. В 2-х т. М.: Металлургия, 1970.
922 с.
В. Шанк Ф. А. Структуры двойных сплавов. М.: Металлургия, 1973. 760 с.
Г. Вол А. Е. Строение и свойства двойных металлических систем. Т. II. М.: Нау-
ка, 1962. 982 с.
Д. Kubaschewski О. Iron — Binary Phase Diagrams. Berlin: Springer-Verlag, 1982.
185 S.
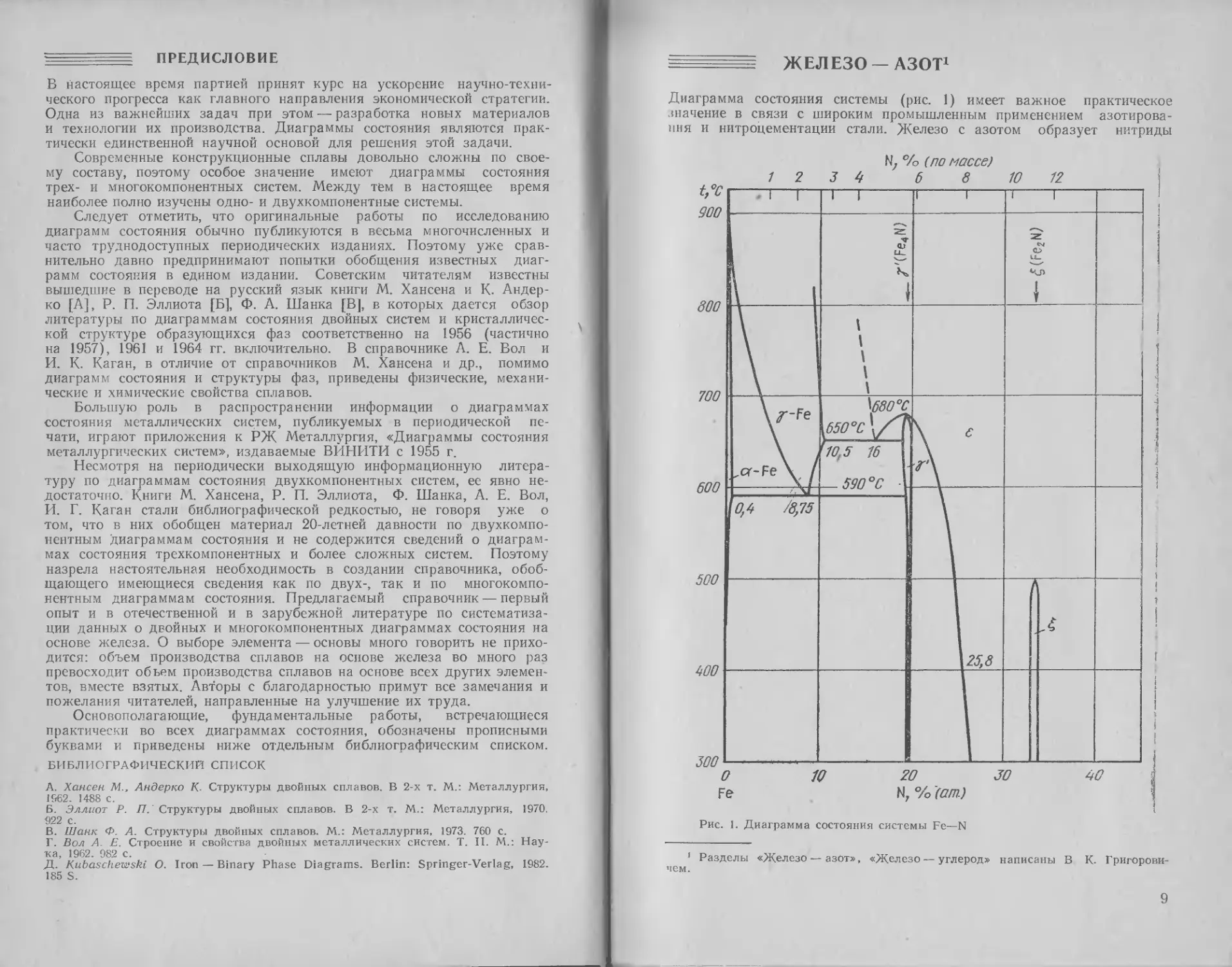
= ЖЕЛЕЗО — АЗОТ1
Диаграмма состояния системы (рис. 1) имеет важное практическое
значение в связи с широким промышленным применением азотирова-
ния и нитроцементации стали. ^Железо с азотом образует нитриды
Рис. 1. Диаграмма состояния системы Fe—N
1 Разделы «Железо—азот», «Железо — углерод» написаны В К- Григорови-
чем.
9
0,1 МПа в интервале 590—1100 С
где N — азот, % (ат.).
Растворимость газообразного азота
нии 0,1 МПа [12]: lg N = —457/7 — 0,5,
N, */а (по масве)
Fe4N(y7), Fe2N(£), 8-фазу и мета стабильный нитрид Fei6N2 (азотистый
мартенсит).
Фазовые равновесия Y=t*a+y7, е^*у+у7 установлены в работах
[1, 2], а также термодинамическими расчетами [3, 4].
Растворимость газообразного азота в феррите при давлении 0,1
МПа в интервалах температур 700—900 ° С (a-Fe) и 1392 1539 С
(б-Fe) [5—8]: lg N = — 1700/7—30, где N — азот, % (ат.).
Растворимость газообразного азота в аустените при давлении
[6, 8—11]: lg N= 155/7—1,1,
в жидком железе при давле-
где N— азот, % (ат.).
Данные о растворимости
азота в а-, у-, 6-модификациях
железа и жидком железе со-
держатся в работе [13].
Растворимость азота в а-
Fe, находящемся в равновесии
с Fe4N (у7), по данным [5, 6,
14—17], — см. рис. 2. Макси-
мальная растворимость при
590 °C составляет 0,4 % (ат.),
или 0,1 % (по массе). По дан-
ным [12], предельная раствори-
мость равна 0,46 % (ат.), или
0,115% (по массе).
Превращение у^ос+у7
происходит при 590 °C. Эвтек-
тоидная точка расположена
при содержании азота 8,75 %
(ат.), или 2,35 % (по массе).
___ Второе эвтектоидное превра-
0 0,1 0,2 0,3 0,0 0,5 щение е+*у+у7 протекает при
Fe N, % (ат.) 650 °C, эвтектоид содержит
16,0 % (ат.), или 4,55 % (по
Рис. 2. Диаграмма состояния системы массе) N. Предельные раство-
Fe—N (область a-фазы) римости составляют 10,3 %
(ат.), или 2,8 % (по массе) N
в у-фазе и 19,1 % (ат.), или
5,6 % (по массе) N в у7-фазе
соответственно. Фаза у7 кристаллизуется из е-твердого раствора при
680±5°С; область гомогенности при 650 ° С составляет 19,1—20 %
(ат.), или 5,7—6,1 % (по массе) N. Соединение Fe2N кристаллизуется
из 8-твердого раствора при 500 °C и 33,3 % (ат.), или 11,14 % (по
массе) N. Область гомогенности этого соединения не превышает
1,14—1,35 % (по массе).
Фаза а — твердый раствор внедрения азота в о. ц. к. a-Fe. Раство-
римость азота в a-Fe при 590 ° С незначительна и составляет 0,1 %
(по массе), или 0,4 % (ат.) N, поэтому период решетки этого раствора
практически совпадает с периодом решетки a-Fe.
Фаза у — твердый раствор внедрения азота в г. ц. к. y-Fe, изо-
морфный аустениту в системе Fe — С. Период решетки у-фазы при
увеличении содержания азота увеличивается с 0,3637 нм (y-Fe,
910 ° С) до 0,3646 нм при содержании 8,67 % (ат.), или 2,33 % (по
массе) N [18].
Фаза у7 имеет г. ц. к. структуру с атомом азота, расположенным
в центре ячейки. В узкой области гомогенности период решетки фазы
10
и (меняется от 0,3791 до 0,3801 нм [15], По данным [19, 20], область
гомогенности у'-фазы при 500 ° С расположена в интервале 19,6—
19,95% (ат.) N.
Фаза е имеет г. п. у. решетку с упорядоченным расположением
атомов азота. С увеличением содержания азота от 19,42 % (ат.),
или 5,7 % (по массе), до 33,02 % (ат.), или 11,0% (по массе), пе-
риоды решетки изменяются от а = 0,2660 нм; с = 0,4343 нм; с/а—1,633
до а=0,276 нм; с = 0,4420 нм; с/а —1,599 [21]. Область гомогенности
к-фазы при 20°С составляет 26,0—33,2 % (ат.), или 8,1—11,1 % (по
массе) N [Б].
Фаза £ обладает орторомбической структурой с периодами а=
0,2764 нм; Ь — 0,4829 нм; с = 0,4425 нм [21, 22].
библиографический список
1. Lehrer A. Z. — Z. Electrochem., 1930, Bd 36, S. 383—392, 460—473.
2. Eisenhut A., Kaupp E. — Z. Electrochem., 1930, Bd 36, S. 392—404.
3. Hillerl M., Jarl M — Met. Trans., 1975, v. 6A, p. 553—561.
4. Argen J. — Met. Trans., 1979, v. 10A, p. 1842—1852.
5. Fast J. D., Verrijn M. B. — J. Iron Steel Inst., 1955, v. 180, p. 337—
343.
6. Corney N. S., Turkdogan E. T. — J. Iron Steel Inst., 1955, v. 180,
p. 344—348.
7. Sakamoto M., Masumoto T., Imai Y. — J. Jap. Inst. Met., 1973, v. 37,
p. 343—349.
8. Ziller H., Habel L. — Arch. Eisenhiittenw., 1973, Bd 44, S. 181—187.
9. Schenck H., Frohberg M. G., Reinders F. — Stahl u. Eisen, 1963, Bd
83, S. 93—99.
10. Sievert A., Zapf G., Morits H. — Z. Phys. Chem., 1938, Bd 183 (A),
S. 9—16.
11. Atkinson D., Bodsworth C. — J. Iron Steel Inst., 1970, v. 208, p. 587—
593.
12. Spencer P. J. Commission des Communautes Europeennes, Research
project CECA. Nov. 1977, N 6210—Ca/I/107, p. 112—117.
13. Фромм E., Гебхардт E. Газы и углерод в металлах. — М.: Метал-
лургия, 1980. 711 с.
14. Paranjpe V. G., Cohen М., Bever М. В., Floe С. F. — Trans. AIME,
1950, v. 188, р. 261—267.
15. Dijkstra L. J. — Trans. AIME, 1949, v. 185, p. 252—260.
16. Borelius G. — Trans. AIME, 1951, v. 191, p.*477—484.
17. Astrom H. U„ Borelius G. — Acta metal., 1954, v. 2, p. 547—549.
18. Jack K. H — Proc. Roy. Soc. (L), 1951, v. A208, p. 200—216.
19. Grabke II. J. — Bor. Btmsenges Phvs. Chem., 1969, v. 73, p 596—602.
20. Wriedt H. A. — Trans. AIME, 1969, v. 245, p. 43—46.
21. Jack K- H. — Acta Cryst., 1952, v. 5, p. 404—411.
22. Канторович И. E„ Совалова А. А. —Изв. АН СССР OTH, № 11,
1949, c. 1675—1684.
ЖЕЛЕЗО — АЛЮМИНИЙ
В основных чертах диаграмма состояния системы железо — алюминий
во всем интервале концентраций рассмотрена в работах [А, Г]. Уточ-
нения и дополнения, внесенные в последующих исследованиях [1—3]
связаны главным образом с процессами упорядочения а-твердого
раствора.
На рис. 3 приведена уточненная диаграмма состояния системы.
Алюминий — «-стабилизирующий элемент, хорошо растворяется в
11
a-Fe, образуя широкие области твердых растворов с о. ц. к. струк-
турой.
Растворимость алюминия в y-Fe при 1150 ° С составляет 1,285 %
(ат.); у-фаза полностью исчезает при 1,95 % (ат.) А1 [4].
В сплавах системы Fe—Al образуется пять стабильных фаз;
Fe3Al, е, FeAl2(£), Fe2Al5(T]), FeAl3('&), каждая из которых обладает
определенной областью гомогенности. Фаза ct2(FeAl) с упорядочен-
ной о. ц. к. решеткой типа B2(CsCl) [2] образуется непосредственно
А1, % (г, о массе)
12
при кристаллизации сплавов по перитектической реакции ж + a-Fe^
^a2(FeAl). В работе [1] с использованием методов термического, ди-
латометрического анализов и измерения модуля нормальной упругости
изучали сплавы системы с содержанием 0—50 % (ат.) А1. Сплавы
гомогенизировали при II50 °C, а затем охлаждали с печью и вы-
держивали при 900; 700; 500 и 460 ° С в течение 1 ч. При 300 ° С
сплавы отжигали 14 сут, а при 250 ° С — 6 мес. Фаза а2 существует
в двух полиморфных модификациях: высоко- и низкотемпературной.
Превращение а2 (в)+*а2 (н) сплава с 51 % (ат.) А1 наблюдается при
803 ° С и несколько снижается при увеличении содержания железа.
Согласно [5], превращение а2 (в)ч=*=а2 (н) связано с упорядочением ва-
кансий в решетке В2.
Сплавы, содержащие 32—40 % (ат.) А1, в интервале температур
1022 — 700 °C претерпевают вторичное упорядочение а2 (в)-> а2,
связанное, очевидно, с изменением типа дальнего порядка. Вторичное
упорядочение типа В2—>В2' наблюдается также в сплавах систем
Fe—Si и Fe—Ge.
При 552 ° С и 26,8 % (ат.) А1 реализуется вырожденное перитек-
тоидное превращение a + a.->^Fe3Al; точку с указанными выше коор-
динатами называют иногда двойной точкой Кюри, так как в ней
сосуществуют ферромагнитная фаза a-Fe и парамагнитная Fe3Al.
Кристаллическая решетка упорядоченной фазы Fe3Al — кубическая
типа Z)O3 (BiFe3). Ниже 400 ° С в сплавах системы, содержащих до
50 % (ат.) А1 наблюдается следующее распределение фазовых обла-
стей: a, Ki, a + Fe3Al, Fe3Al, К2, а2(н), где К\ и К2— области своеоб-
разного расслоения твердого раствора, так называемое А-состояние
[6].
Области гомогенности и условия образования фаз, богатых алю-
минием, хорошо видны на рис. 3.
Чистый алюминий плавится при 660,46 ° С; при 652 ° С и 99,1 %
(ат.) А1 кристаллизуется эвтектика FeAl + a-Al. При эвтектической
температуре в алюминии растворяется 0,03 % (ат.) Fe.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Koster W., Godecke T. — Z. Metallkde, ’980, Bd 71, S. 765—769.
2. Warlimont H. — Z. Metallkde, 1969, Bd 60, S. 195-203.
3. Schuzman E. — Arch. Eisenhflttenw., 1980. Bd 51, S. 325—327
4. Rocguer P., Jegaden G., Petit C. — J. Iron a. Steel Inst., 1967, v. 205,
№ 4, p. 437—441.
5. Fouzdeux A., Bruges FI., Weber D. a. o.— Scripta met., 1980, v. 14,
p. 485.
6. Thomas H. — Z. Metallkde, 1950, Bd 41, S. 185—190.
ЖЕЛЕЗО — БАРИЙ
Сплавы системы изучали методами рентгеновского и микрорентгено-
спектрального анализов, а также растровой электронной микроскопии.
Железо и барий не взаимодействуют ни в жидком, ни в твердом
состояниях Изучена1 диффузия жидкого бария в сталь с 0,08—0,15 %
(по массе) С. Установлено, что диффузия бария при 1200 ° С отсутст-
вует.
1 Агеев Н. В., Замоторин М. И. — Изв. ЛПИ, Отд. физ.-мат. наук, 1928, т. 31,
№ 2. с. 183—197.
13
Be, % (no массе)
Рис. 4. Диаграмма состояния системы Fe—Be
ЖЕЛЕЗО — БЕРИЛЛИЙ
Диаграмма состояния системы Fe—Be по обобщенным данным [1—3]
приведена на рис. 4. В работе [1] изучали сплавы, содержащие до
13 % (ат.) Be; определены ликвидус, положение у-области и темпе-
ратура магнитного превращения. В работе [2] изучали сплавы с более
высоким содержанием бериллия — до 54 % (ат.).
Растворимость бериллия в a-Fe определена в работе [3], в кото-
14
рой изучали микроструктуру двух сплавов, содержащих 12,9 и 21 %
(ar.) Be, отожженных при 700 и 860°C соответственно.
В сплавах системы обнаружены три промежуточных соединения
FeBe2, FeBe5, FeBei2 (по более поздним данным FeBe7), которые име-
ют широкие области гомогенности. Железо и соединение FeBe2 обра-
зуют эвтектику при 1165 ° С и содержании 36 % (ат.), или 8,3 % (по
массе) Be.
Соединение FeBe2 имеет гексагональную решетку типа MgZn2 с
периодами а = 0,4223 нм и с = 0,6827 нм при содержании 68 % (ат.)
Рис. 5. Часть диаграммы состояния системы Fe—Be
Be. Кристаллическая решетка соединения FeBei2 (FeBe7) пока одно-
значно не установлена. Есть предположение, что она либо гексаго-
нальная с периодами а=0,413 нм и с—1,072 нм [6], либо объемно-
центрированная тетрагональная типа ThMn12 с а = 0,7253 нм и с =
=0,4232 нм [7].
Штриховой линией на рис. 4 показана растворимость бериллия в
a-Fe по данным [4]. В равновесии с a-Fe находите? фаза FeBe2.
Влияние магнитных превращений на растворимость бериллия в a-Fe
изучали в работе [5]. Сплавы получали [4, 5] из железа чистотой
99,95 % и бериллия чистотой 99,5 % в высокочастотной печи в вакуу-
ме, гомогенизировали и отжигали в интервале 950—600 ° С в течение
300—7000 ч. При температурах ниже 700 ° С наблюдалось отклонение
значений растворимости бериллия в a-Fe от уравнения Аррениуса,
15
что связано с влиянием магнитных превращений в a-Fe. На рис. 5
показан участок диаграммы состояния системы Fe—Be со стороны
бериллия.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Wever F., Muller А. — Z. anorg. Chem., 1930, Bd 192, S. 337—340.
2. Гаев Я. С., Соколов Р. С. — Металлург, 1937, т. 4, с. 42—48.
3. Teitel Г. Y., Colion М. — Trans. AIME, ?949, v. 185, р. 285—296, 1950,
V. 188, р. 1028—1029.
4. Musong К., Taiyi N. — J. Jap. Inst. Metals, 1979, v. 43, № 2, p. 118—
126.
ЖЕЛЕЗО — БОР
Диаграмма состояния (рис. 6) приведена по обобщенным данным
В области сплавов, богатых железом, в системе реализуется
эвтектическое превращение при 1177 ° С ж^у-Ее + Ее2В при — 17 %
(ат.) В. При 1381 ° С протекает кататектическое превращение б-Fe^t
^y-Fe+ж. Промежуточное соединение Fe2B образуется по перитекти-
ческой реакции ж + РеВ^*Ре2В при 1407 ° С. Промежуточное соедине-
ние FeB (моноборид железа) плавится конгруэнтно при 1590 ° С.
В работе [1] определено наиболее богатое бором соединение FeBn,
что последующими исследованиями не подтвердилось. При 1497 ° С и
содержании 64 % (ат.) В кристаллизуется эвтектика FeB + B.
Кристаллическая решетка Fe2B — типа СиА12 с 12 атомами в
элементарной ячейке. Моноборид железа FeB имеет ромбическую ре-
шетку с 8 атомами в элементарной ячейке [7]. Растворимость бора в
a-Fe мала и при 906 ° С составляет 0,008 % (ат.), а в y-Fe она еще
меньше [1]; это невозможно изобразить в принятом на рис. 6 масш-
табе.
Растворимость бора в y-Fe [9]:
Температура, °C . . 1131 1103 1049 1008 919 915
Растворимость бора,
% (ат.) .............. 0,0182 0,0143 0,0089 0,0061 0,0034 0,0024
Растворимость бора в a-Fe [9]:
Температура, °C...........
Растворимость бора, % (ат.)
906 887 794 710
0,082 0,0061 0,0011 0,0002
Предположительно [9] твердый раствор бора на основе a-Fe
представляет собой твердый раствор замещёния, а на основе y-Fe —
внедрения.
Растворимость бора в а- и y-Fe также определяли в работе [И].
Влияние бора на свойства железа подобно влиянию углерода, но
в несколько раз более сильное. Добавка бора в количестве —0,02 %
(ат.) способствует измельчению зерна железа и дает возможность
использовать термическую обработку (закалку) для повышения его
свойств [10].
Температура Кюри (Гс) составляет 769 °C.
16
В? % (со массе)
Рис. 6. Диаграмма состояния системы Fe—В
библиографический список
1. Портной К. И., Левинская М. X., Ромашов В. М. — Порошковая ме-
таллургия, 1969, № 8, с. 66—70.
2. Портной К. И., Ромашов В. М., Чубаров В. XI. и др. — Порошко-
вая металлургия, 1967, № 2, с. 15—21.
3. Самсонов Г. В. Тугоплавкие соединения. М.: Металлургиздат, 1963,
398 с.
17
4. Криштал М. А., Пигу зов Ю. В., Головин С. А. Внутреннее трение
в металлах и сплавах. М.: Металлургия, 1964 245 с.
5. Приданцев М. В., Мещеринова О. Н., Пигузов Ю. В. — ДАН СССР,
1956, т. Ill, № 1, с. 98—101.
6. Криштал Л1. А., Туркельтауб Г. М. — МиТОМ, 1967, № 8, с. 17—22.
7. Матюшенко Н. И. Кристаллические структуры двойных соединений.
М.: ЛАеталлургия, 1969. 303 с.
8. Ворошнин Л. Г, Ляхович Л. С., Панич Г. Г., Протасевич Г. Ф. —
МиТОМ, 1970, № 9, с. 14—17.
9. McBride С. С., Spretnak I. W., Speiser R.—Trans. ASM, 1954, v. 46,
p. 499—507.
10. Самсонов Г. В., Цейтина Н. Я. — ФММ, 1955, т. 1, № 2, с. 303—306.
11. Brown A., Garnish J. D., Honeycombe R. W. К. — Metal Sci., 1974,
v. 8, № 10, p. 317—324.
ЖЕЛЕЗО — ВАНАДИЙ
Диаграмма состояния системы железо — ванадий (рис. 7) изучена
достаточно подробно, и ранние исследования обобщены в работах
[А-Г].
При высоких температурах в сплавах этой системы существует
непрерывный ряд твердых растворов между б-Fe и ванадием. Ликви-
дус имеет точку минимума при 31 % (по массе), или 33 % (ат.) V,
и 1468 ° С.
По данным [1], в области эквиатомного состава в твердом со-
стоянии обнаружена промежуточная фаза о (FeV). В дальнейшем
показано, что эта фаза образуется в результате превращения в твер-
дом состоянии при 1219 ° С и 48 % (ат.) V. Область ее гомогенности
простирается от 37 до 57 % (ат.), или 35—55 % (по массе) V при
700 ° С [2] и от 39 до 54,7±1 % (ат.), или 37—52 % (по массе) V
при 1075 ° С [3]; по данным [Д], область гомогенности о-фазы не-
сколько шире, рис. 7.
В работах [4, 5] обнаружено, что выделению стабильной о-фазы
(в результате старения a-твердого раствора при 600 ° С) предшеству-
ет образование метастабильной упорядоченной фазы со структурой
CsCl. Упорядочение a-твердого раствора в области существования
о-фазы исследовано в работах [6, 7].
Соединение FeV изоструктурно фазе о в системе железо — хром,
обладающей тетрагональной решеткой с 30 атомами в элементарной
ячейке [8, 9]. Периоды решетки соединения: а = 0,895 нм и с = 0,462 нм;
а/с=0,516. В работе [10] показано, что периоды решетки о-фазы ме-
няются от а = 0,8865±0,0004 нм и с=0,4650±0,0007 нм в двухфазной
области для сплава с 29,8% (ат.) V до а=0,9015±0,0004 нм и с =
= 0,4642±0,0007 нм для сплава с 60 % (ат.) V.
Влияние ванадия на а^у-превращение железа изучено в ряде
работ. Методом термомагнитного анализа установлено, что макси-
мальная ширина области гомогенности у-фазы наблюдается при
1150°С и достигает 1,28 % (по массе), или 1,4 % (ат.) V. Двухфазная
область («+у) простирается при этой температуре до 1,82 % (по
массе), или 2% (ат.) V [И]. Эти результаты подтверждены в рабо-
те [2]. Экспериментально и теоретически по термодинамическим дан-
ным определено положение у- и о-фаз при давлениях 100; 2000;
4000 и 5000 МПа в зависимости от температуры. С повышением дав-
ления расширяются температурный и концентрационный интервалы
существования у-фазы, несколько повышается температура ее образо-
18
V, % (по массе)
Рис. 7. Диаграмма состояния системы Fe—V
нания [1]. Согласно термодинамическим расчетам, о-фаза стабильна
до 1157 °C [14].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Wever F., Jellingshaus IE.— Mitt. Kais. Wilhelm-Inst. Eisenforsch.,
Dusseldorf, 1930, Bd 12, S. 317—322.
2 Martens H., Duwez P. — Trans. ASM, 1952, v. 44, p. 484—493.
3 Greenfild P., Beck P. A. — Trans. AIME, 1954, v. 200, p. 253—257.
4. Beck P. A. et a/. — Trans. AIME, 1956, v. 206, p. 148—149.
19
5. Philip T. W., Beck P. A. — Trans. AIME, 1957, v. 209, p. 1269—1271.
6. Chandross R. J., Shoemaker D. P. — J. Phys. Soc. Jap., 1962, Suppl.,
B—111, v. 17, p. 16—19.
7. Daire M — Comt. Rend., 1964, v. 259, p 2640—2642.
8. Wever F., Jellinghaus W.—Mitt. Keis.-Wilhelm-Inst. Eisenforsch.,
Dusseldorf, 1931, Bd 13, S. 93—109, 143—147.
9. Andrews R. W.— Research, 1948, v. 1, p. 478—479.
10. Hanneman R. E., Mariano A. N. — Trans. AIME, 1964, v. 230, p 937—
939.
11. Fischer W. A., Lorenz R.. Fabritius H„ Schlegel D. — Arch. Eisenhiit-
tenw., 1970, Bd 41, № 5, S. 489—498.
12. Rovacova R., Rralik F. — Kovove mater., 1973, v. 11, № 2, p. 93—97.
13. Hanneman R. E., Ogilvie R. E., Galos M. C. — Trans. AIME, 1965,
v. 233, № 4, p. 685—691.
14. Spencer P. J., Connsell J. F. — Z. Metallkde, 1973, Bd 64, S. 662—665.
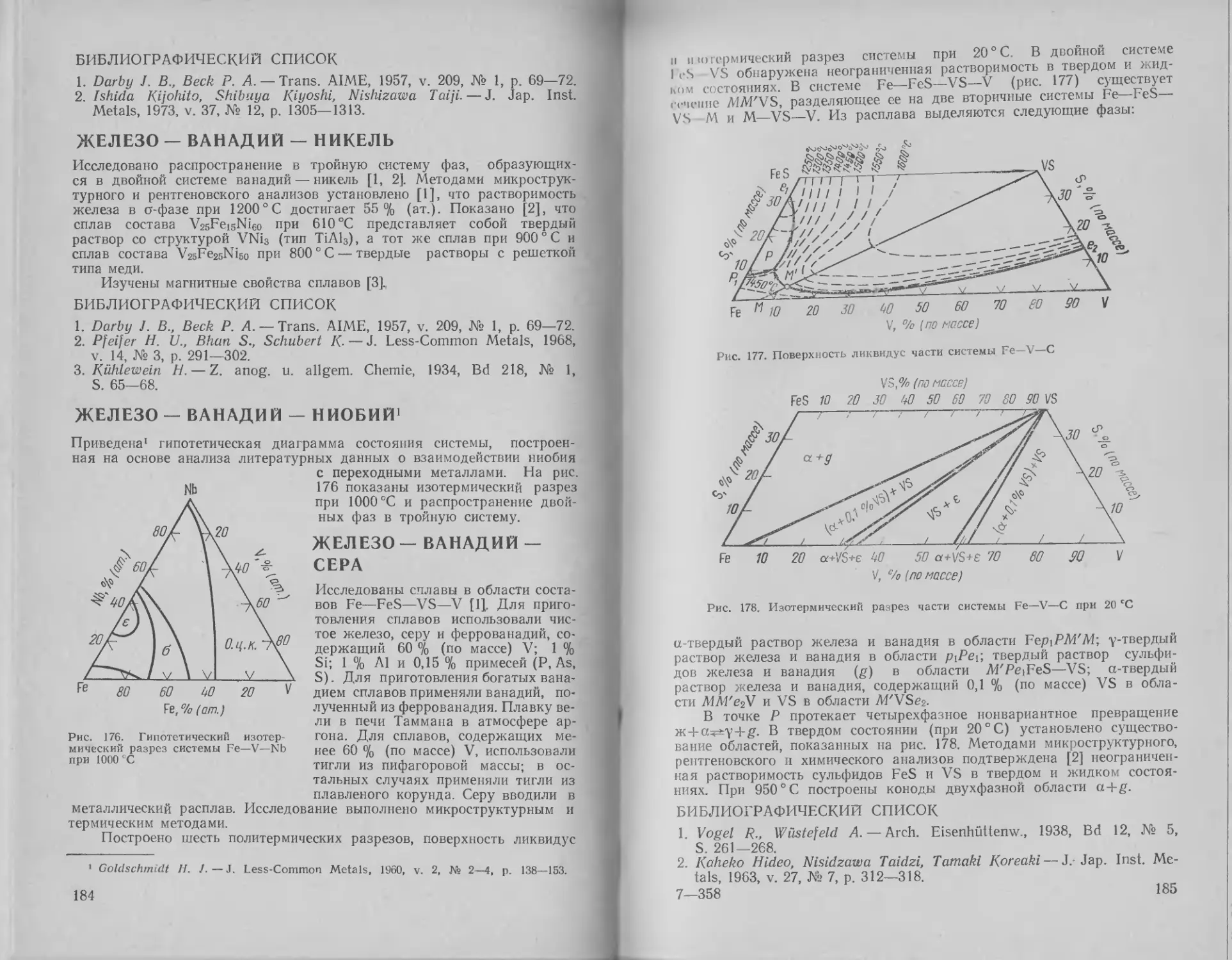
ЖЕЛЕЗО — ВИСМУТ
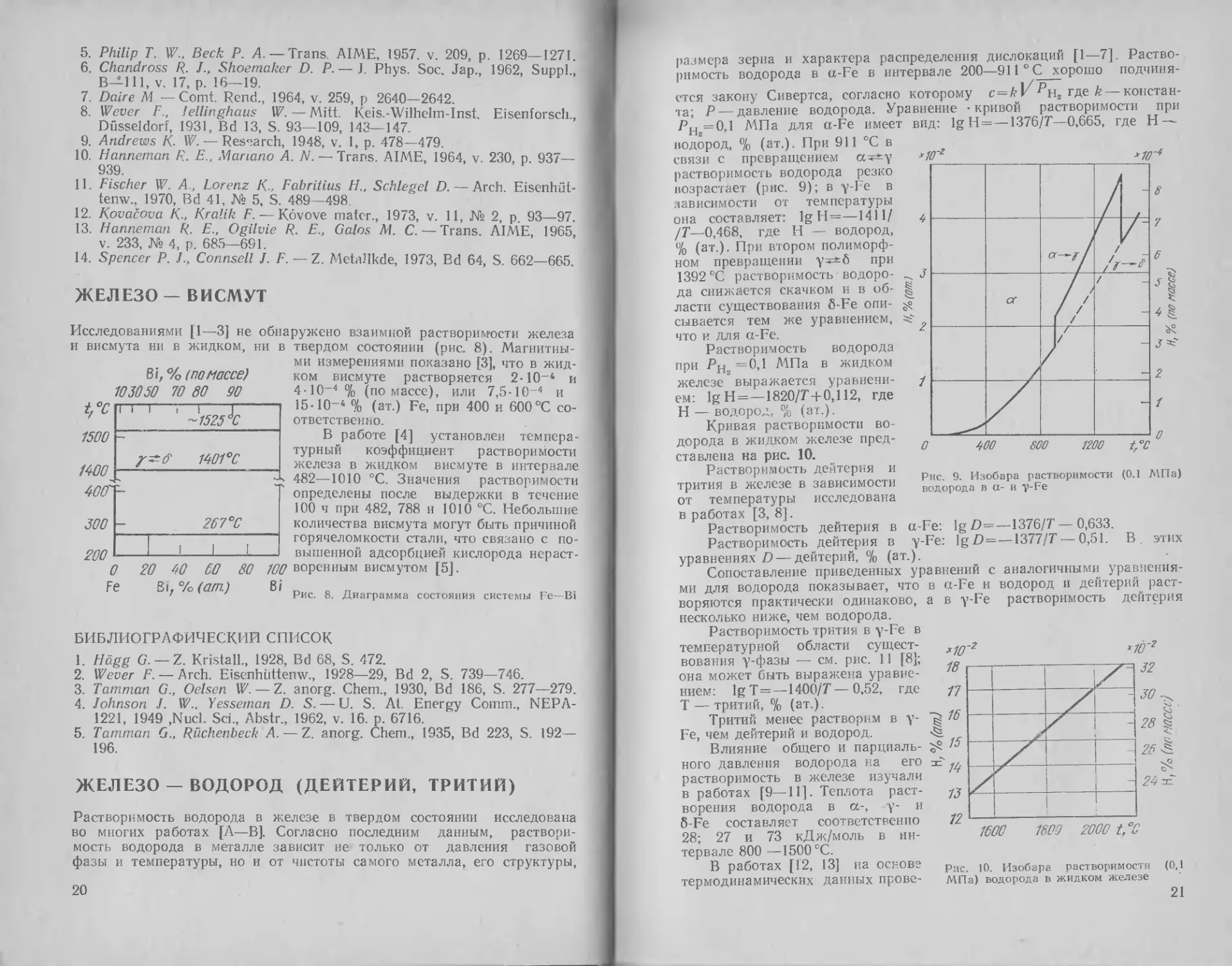
в
Исследованиями [1—3] не обнаружено взаимной растворимости железа
и висмута ни в жидком, ни
Bi, % (помассе)
103050 70 80 90
t,°C
твердом состоянии (рис. 8). Магнитны-
ми измерениями показано [3], что в жид-
ком висмуте растворяется 2-104 и
4-10~40/о (по массе), или 7,5-10~4 и
15-10-4 % (ат.) Fe, при 400 и 600°C со-
ответственно.
В работе [4] установлен темпера-
турный коэффициент растворимости
железа в жидком висмуте в интервале
482—1010 °C. Значения растворимости
определены после выдержки в течение
100 ч при 482, 788 и 1010 °C. Небольшие
количества висмута могут быть причиной
горячеломкости стали, что связано с по-
вышенной адсорбцией кислорода нсраст-
1500
300
1400
400'
ГТ 1 ' 1 J -15254
1401°С
-
— 267°C
J 1 1
200 ...
О 20 40 00 80 7/7Z? веренным висмутом [5].
Fe Si, % (am.) Bi
7 Рис. 8. Диаграмма состояния системы Fe—Bi
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Hagg G. — Z. Kristall., 1928, Bd 68, S. 472.
2. Wever F. — Arch. Eisenhiittenw., 1928—29, Bd 2, S. 739—746.
3. Tamman G., Oelsen W. — Z. anorg. Chem., 1930, Bd 186, S. 277—279.
4. Johnson J. W.. Yesseman D. S. — U. S. At. Energy Comm., NEPA-
1221, 1949 ,Nucl. Sci., Abstr., 1962, v. 16. p. 6716.
5. Tamman G„ Riichenbeck A.—Z. anorg. Chem., 1935, Bd 223, S. 192—
196.
ЖЕЛЕЗО — ВОДОРОД (ДЕЙТЕРИЙ, ТРИТИЙ)
Растворимость водорода в железе в твердом состоянии исследована
во многих работах [/X—В]. Согласно последним данным, раствори-
мость водорода в металле зависит не только от давления газовой
фазы и температуры, но и от чистоты самого металла, его структуры,
20
размера зерна и характера распределения дислокаций [1—7]. Раство-
римость водорода в a-Fe в интервале 200—911 ° С хорошо подчиня-
ется закону Сивертса, согласно которому с = ^1/<^’н2 где k — констан-
та; Р —давление водорода. Уравнение - кривой растворимости при
РНг=0,1 ЛАПа для a-Fe имеет вид: 1g Н = — 1376/7—0,665, где Н —
водород, % (ат.). При 911 °C в
связи с превращением сс^у
растворимость водорода резко
возрастает (рис. 9); в y-Fe в
зависимости от температуры
она составляет: 1g Н=—1411/
/7—0,468, где Н — водород,
% (ат.). При втором полиморф-
ном превращении у*±б при
1392 °C растворимость водоро-
да снижается скачком и в об-
ласти существования б-Fe опи-
сывается тем же уравнением,
что и для a-Fe.
Растворимость водорода
при =0,1 МПа в жидком
железе выражается уравнени-
ем: 1g Н=—1820/7+ 0,112, где
Н — водород, % (ат.).
Кривая растворимости во-
дорода в жидком железе пред-
ставлена на рис. 10.
Рис. 9. Изобара растворимости (0.1 МПа)
водорода в а- и v-Fe
Растворимость дейтерия и
трития в железе в зависимости
от температуры исследована
в работах [3, 8].
Растворимость дейтерия в
Растворимость дейтерия в
уравнениях D — дейтерий, % (ат
Сопоставление приведенных
a-Fe: lg D=—1376/7 — 0,633.
y-Fe: ]gZ) =—— 0,51. В. этих
уравнений с аналогичными уравнения-
ми для водорода показывает, что в
воряются практически одинаково, а
несколько ниже, чем водорода.
Растворимость трития в y-Fe в
температурной области сущест-
вования у-фазы — см. рис. 11 [8];
она может быть выражена уравне-
нием: lgT = —1400/7—0,52, где
Т — тритий, % (ат.).
Тритий менее растворим в у-
Fe, чем дейтерий и водород.
Влияние общего и парциаль-
ного давления водорода на его
растворимость в железе изучали
в работах [9—11]. Теплота раст-
ворения водорода в ос-, у- и
6Fe составляет соответственно
28; 27 и 73 кДж/моль в ин-
тервале 800 —1500 °C.
В работах [12, 13] на основе
термодинамических данных прове-
a-Fe и водород и дейтерий раст-
в y-Fe растворимость дейтерия
Рис. 10. Изобара растворимости (0,1
МПа) водорода в жидком железе
21
Рис. 11. Растворимость трития в v-Fe
Дейтерий, % (по массе)
t,°c
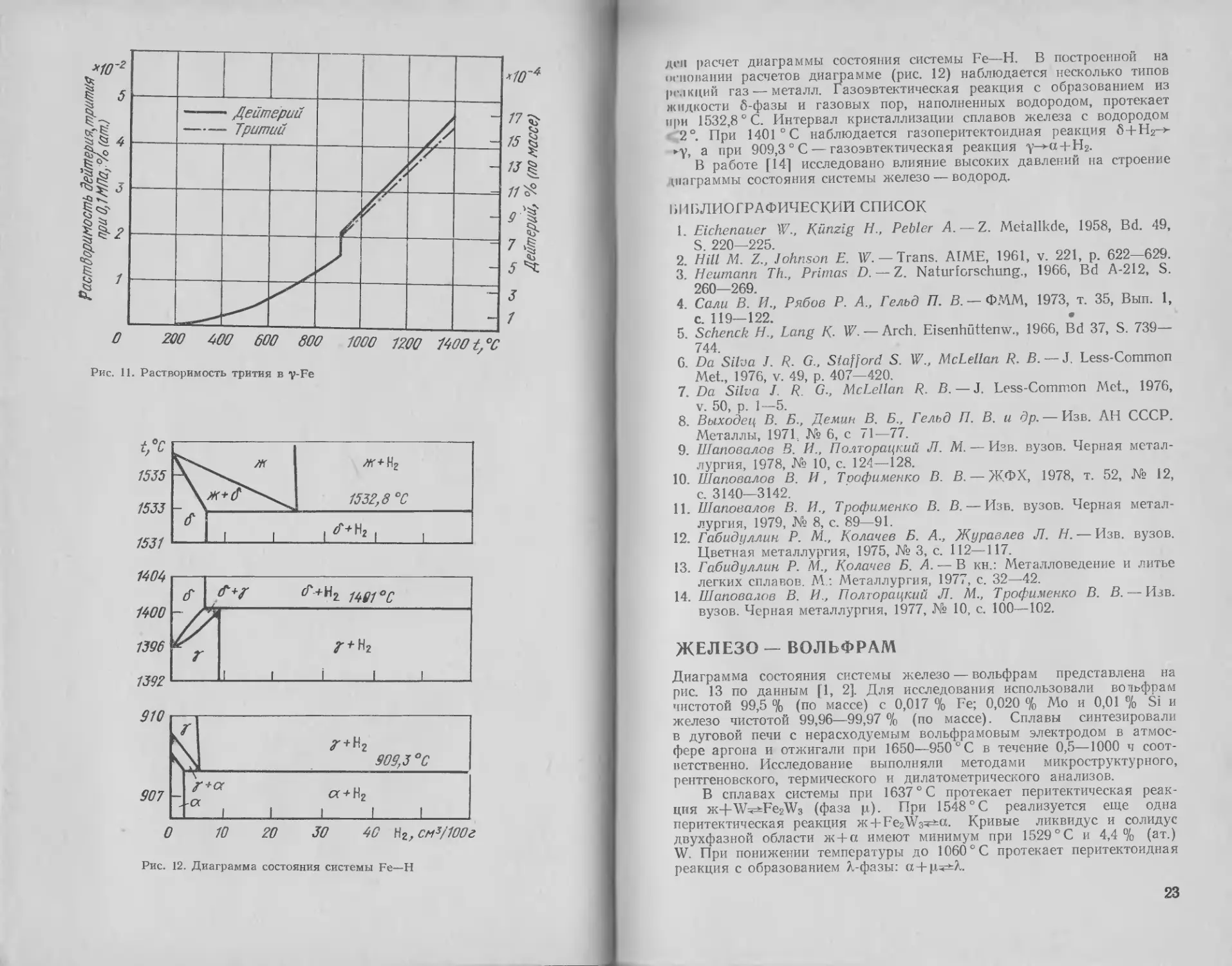
1535
1533
Z + Hz
909,3 ° С
а + Н2
30 90 Нг,см3/100г
Рис. 12. Диаграмма состояния системы Fe—Н
дсп расчет диаграммы состояния системы Fe—Н. В построенной на
основании расчетов диаграмме (рис. 12) наблюдается несколько типов
реакций газ — металл. Газоэвтектическая реакция с образованием из
жидкости 6-фазы и газовых пор, наполненных водородом, протекает
при 1532,8 ° С. Интервал кристаллизации сплавов железа с водородом
'2° При 1401 °C наблюдается газоперитектоидная реакция 6 + Н2->-
►у, а при 909,3 ° С — газоэвтектическая реакция у->-« + Н2.
В работе [14] исследовано влияние высоких давлений на строение
щаграммы состояния системы железо — водород.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Eichenauer W., Kunzig И., Pebler А. — Z. Metallkde, 1958, Bd. 49,
S 220____225
2. Hill M. Z„ Johnson E. IF.— Trans. AIME, 1961, v. 221, p. 622—629.
3. Heumann Th., Primas D. — Z. Naturforschung., 1966, Bd A-212, S.
260—269.
4. Сали В. И., Рябов Р. А., Гельд П. В. — ФММ, 1973, т. 35, Вып. 1,
с 119____122. •
5 Schenck Н., Lang К- W.— Arch. Eisenhiittenw., 1966, Bd 37, S. 739—
744.
6. Da Silva J. R. G., Stafford S. W., McLellan R. B. — J. Less-Common
Met., 1976, v. 49, p. 407—420.
7. Da Silva J R. G., McLellan R. B. — J. Less-Common Met., 1976,
v. 50, p. 1—5.
8. Выходец В. Б., Демин В. Б., Гельд П. В. и др. — Изв. АН СССР.
Металлы, 1971.. № 6, с 71—77.
9. Шаповалов В. И., Полторацкий Л. М. — Изв. вузов. Черная метал-
лургия, 1978, № 10, с. 124—128.
10. Шаповалов В. И, Тоофименко В. В. — ЖФХ, 1978, т. 52, № 12,
с. 3140—3142.
11. Шаповалов В. И., Трофименко В. В. — Изв. вузов. Черная метал-
лургия, 1979, № 8, с. 89—91.
12. Габидуллин Р. М., Колачев Б. А., Журавлев Л. Н. — Изв. вузов.
Цветная металлургия, 1975, № 3, с. 112—117.
13. Габидуллин Р. М., Колачев Б. А. — В кн.: Металловедение и литье
легких сплавов. М.: Металлургия, 1977, с. 32—42.
14. Шаповалов В. И., Полторацкий Л. М., Трофименко В. В. — Изв.
вузов. Черная металлургия, 1977, № 10, с. 100—102.
ЖЕЛЕЗО — ВОЛЬФРАМ
Диаграмма состояния системы железо — вольфрам представлена на
рис. 13 по данным [1, 2]. Для исследования использовали вольфрам
чистотой 99,5 °/о (по массе) с 0,017 % Fe; 0,020 % Мо и 0,01 % Si и
железо чистотой 99,96—99,97 % (по массе). Сплавы синтезировали
в дуговой печи с нерасходуемым вольфрамовым электродом в атмос-
фере аргона и отжигали при 1650—950 ° С в течение 0,5—1000 ч соот-
ветственно. Исследование выполняли методами микроструктурного,
рентгеновского, термического и дилатометрического анализов.
В сплавах системы при 1637 ° С протекает перитектическая реак-
ция ж+ААЧ^Еег'Мз (фаза ц). При 1548 ° С реализуется еще одна
перитектическая реакция » + Fe2W3^:a. Кривые ликвидус и солидус
двухфазной области ж + а имеют минимум при 1529 ° С и 4,4 % (ат.)
W. При понижении температуры до 1060 ° С протекает перитектоидная
реакция с образованием Х-фазы: а +
23
Рис. 13. Диаграмма состояния системы
Fe—W
Фаза X имеет гексагональ-
ную элементарную ячейку с
0 = 0,4737 нм, с = 0,7720 нм,
с/о= 1,630 [3] со структурой
типа MgZn2 [4]. По данным
[5], периоды решетки фазы Л
следующие: о = 0,4745 нм; с —
= 0,7722 нм, с/а= 1,625. Фаза
р, обладает гексагональной эле-
ментарной ячейкой с периодами
0 = 0,4741 нм, t = 2,581 нм,
с/о = 5,440 [3J; по данным [4],
элементарная ячейка р-фазы
ромбоэдрическая с о = 0,904 нм
и а=30°3'. В элементарной
ячейке содержится 13 атомов,
что соответствует идеальному
составу W6Fe7.
Влияние вольфрама на
ач^у-превращение железа изу-
чено довольно хорошо. Суще-
ствование замкнутой у-обла-
сти обнаружено в работе [6] и
подтверждено работами [1, 2,
7, 8]. Область у-петли простира-
ется до 1,25 % (ат.), или 4,12%
(по массе) W [7] при 1150 °C.
Область (cc-f-y) простирается
до 1,83 % (ат.), или 6,03 (по
массе) W.
Растворимость вольфрама в
ct-Fe определяли в работе [9]
методом рентгеноструктурного
анализа. Установлено, что она
составляет 1,68; 1,72; 1,96 и
2,24, % (ат.) W при 600, 700,
800 и 900 °C соответственно.
По-видимому, полученные в
этой работе результаты завыше-
ны из-за недостаточного времени отжига. В более поздних работах
[10, 11], выполненных методами рентгеновского и микрорентгено-
спектрального анализов, в результате увеличения времени отжигов
получены меньшие значения растворимости:
Температура отжига, °C . 700
Продолжительность отжига,
ч........................... 3000
Растворимость вольфрама,
% (ат.).................... 1,0
800 950 1100
1500 600 250
1,3 2,5 4,3
Период о. ц. к. решетки железа возрастает с 0,28682 до 0,28745±
±0,00002 нм при растворении 2,24 % (ат.) W. ,
Термодинамический анализ на основе модели регулярных раство-
ров сплавов системы Fe—W выполнен в работе [12]
24
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Sinha А. К., Hume-Rothery W. — J. Iron a. Steel Inst., 1967, v. 205,
№ 11, p. 1145—1149.
2. Kirchner G„ Narvig H., Uhurenius B. — Met. Trans., 1973, v. 4, №4,
p. 1059—1067.
3. Arnfelt H. — Iron Steel Inst. (London), Carnegie Scool Mem., 1928,
v. 17, p. 1—13.
4 Arnfelt EL, Westgren A. — Jernkont. Ann., 1935. Bd 119, S. 185—196.
5. Schneider R., Vogel R.— Arch. Eisenhiittenw., 1955, Bd 26, S. 483—
484.
6. Sykes W. P. — Trans. AIME, 1936, v. 24, p. 541—550.
7. Fischer W. A., Lorenz K., Fabritius H., Schlegel D. — Arch. Eisen-
hiittenw., 1970, Bd 41, № 5, S. 489—498.
8. Kovdcovd K., Krdlik F. — Kovove mater., 1973, v. 11, № 2, p. 93—97.
9. Abrahamson E. P., Lopata S. L. — Trans. AIME, 1966, v. 236, № 1,
p. 76—87.
10. Ko Musong Nishizawa Taiji — J. Jap. Inst. Metals, 1979, v. 43, № 2,
p. 126—135.
11. Ko Musong Nishizawa Taiji — J. Jap. Inst. Metals, 1979, v. 43, № 2,
p. 118—126.
12. Kaufman L., Nesor H —Met. Trans., 1975, v. A6, № 11, p. 2123—
2131.
ЖЕЛЕЗО — ГАДОЛИНИЙ
Диаграмма состояния системы рассмотрена в работах [1—4].
На рис. 14 представлена диаграмма состояния системы железо —
гадолиний по данным [1] с учетом данных других исследований. В ра-
боте использовали дистиллированное железо чистотой (99,9 %) и
металлический гадолиний (чистотой 99,00 %). Сплавы синтезировали
и атмосфере очищенного гелия, отжигали в откачанных ампулах при
700—800 ° С в течение 50 ч.
В системе Fe—Gd образуются по перитектическим реакциям два
промежуточных соединения Fei7Gd2 и Fe2Gd при 1335 и 1080 ° С
соответственно. При 830 ° С и 88 % (по массе) Gd кристаллизуется
жтектика Fe2Gd + (a-Gd). В работе [5] приведены сведения о суще-
ствовании в сплавах системы соединения Fe3Gd. В интервале кон-
центраций 40—60 % (по массе) Gd наблюдали [1] термические оста-
новки, однако рентгеновские и микроструктурные исследования не да-
ли возможности сделать заключение о существовании в системе еще
одного промежуточного соединения.
Согласно [1, 2], соединение Fei7Gd2 имеет структуру типа Th2Znj7
с периодами решетки tz = 0,8519 нм, с= 1,2404 нм, Да = 1,456. Соедине-
ние Fe2Gd имеет кубическую структуру типа MgCu2 с периодом о =
0,735 нм. Добавка гадолиния до 3 % (по массе) повышают темпе-
ратуру полиморфного превращения a-Fe->y-Fe. При 932 °C происхо-
дит перитектоидная реакция: у[~1,5% (по массе) Gd]+Fei2Gd2
|24,8 % (по массе) Gd]^a[2,0 % (по массе) Gd].
Микротвердость соединения Fe]7Gd2 — 5800 МПа, a Fe2Gd —
7000 МПа [1].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I Савицкий Е. М., Терехова В. Ф., Буров И. В., Чистяков О. Д.—
ЖНХ, 1961, т. 6, № 7, с. 1732—1734.
25
Рис. 14. Диаграмма состояния системы Fe—Gd
2. Крипякевич П. И., Терехова В. Ф„ Заречнюк О. С., Буров И. В. —
Кристаллография, 1963, т. 8, с. 268—270.
3. Буров И. В., Терехова В. Ф., Савицкий Е. М. — В кн_: Вопросы тео-
рии и применение редкоземельных металлов. М.: Наука, 1964, с. 116—
123.
4 Крипякевич П. И., Гладышевский Е. И —Кристаллография, 1961,
т. 6, с. 118—120.
ЖЕЛЕЗО — ГАЛЛИЙ
Диаграмма состояния системы железо — галлий исследована метода-
ми дифференциального термического, микроструктурного, рентгенов-
ского и дилатометрического анализов в работах [1—7]. В приводи-
26
мой па рис. 15 диаграмме [4, 5] учтены также результаты более ранних
рябот. При синтезе сплавов использовали железо чистотой 99,98 %
(.it.) и галлий чистотой 99,999 % (ат.). Символом Д обозначен
твердый раствор галлия в y-Fe, а ,4г в a-Fe. Максимальная раствори-
мость галлия в a-Fe достигает 35,1 °/о (ат.) при 1037 ° С. При этой
Fe 0а, % (ат.) Са
Рис. 15. Диаграмма состояния системы Fe—Gd
твердый раствор с о. ц. к. структурой — фаза В2. При 950 ° С и 31,1 %
(ат.) Ga образуется вторая упорядоченная фаза с о. ц. к. структурой,
обозначенная В2'. При 681 °C протекает фазовая перекристаллиза-
ция, связанная с переходом одной упорядоченной фазы в другую
/12'^7)019, имеющую гексагональную кристаллическую решетку с пе-
риодами а = 0,5218 нм; с = 0,4237 нм; с/а = 0,8120 [5]. По вырожденной
27
перитектоидной реакции при — 680 ° С образуется упорядоченная ку-
бическая фаза DCk со структурой типа BiFe3. При 625 ° С фаза В2
эвтектоидно распадается па смесь фаз DO\S и фазу R — низкотемпе-
ратурную модификацию соединения Fe6Ga5. При 619 °C по вырожден-
ной перитектоидной реакции бразуется упорядоченная фаза с куби-
ческой структурой типа Ll2 и периодом решетки а = 0,370 нм [2].
Высокотемпературная модификация соединения Fe^Gas — фаза И
образуется по перитектоидной реакции при 800 ° С. По перитектичес-
ким реакциям при 906 и 824 ° С кристаллизуются соединения Fe8Gau
и FeGa3 соответственно. Фаза М на основе предполагаемого соеди-
нения Fej3Ga9 метастабильна. Соединение Fe8Gau обладает тетраго-
нальной структурой с периодами: а= 1,260 нм; с = 0,551 нм; da—
= 0,4365. Тетрагональная структура установлена и у соединения FeGa3:
ц = 0,620 нм, с = 0,6580, da — 1,05 [1].
Максимальная растворимость галлия в y-Fe составляет 2,8 % (ат-)
при 1140°C [1].
Растворимость галлия в a-Fe при комнатной температуре состав-
ляет 17 % (ат.) [7].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Dasarathy С, Hume-Rothery W.— Proc. Roy Soc., 1965, v. A286,,
№ 1405, p 141—157.
2. Meibner H.-G., Schubert K--—Z. Metallkde, 1965, Bd 56, № 8, S. 523—
530.
3. Wachtel E„ Maier J. — Z. Metallkde, 1967, Bd 58, № 11, S. 761—767.
4. Koster W., Godecke T. — Z. Metallkde, 1977, Bd 68, № 10, S. 582—
589.
5. Koster W., Godecke T. — Z. Metallkde, 1977, Bd 68, № 10, S. 661 —
666.
6. Маркие В. Я., Рачинский В. Г., Стороженко А. И. и др. — ДАН
УССР, 1977, № 8, с. 755—760.
7. Couderc I. JBras J. Fagot M.— Phys. Status Solid! (a), 1977,
v. 41, № 2. p. 595—605.
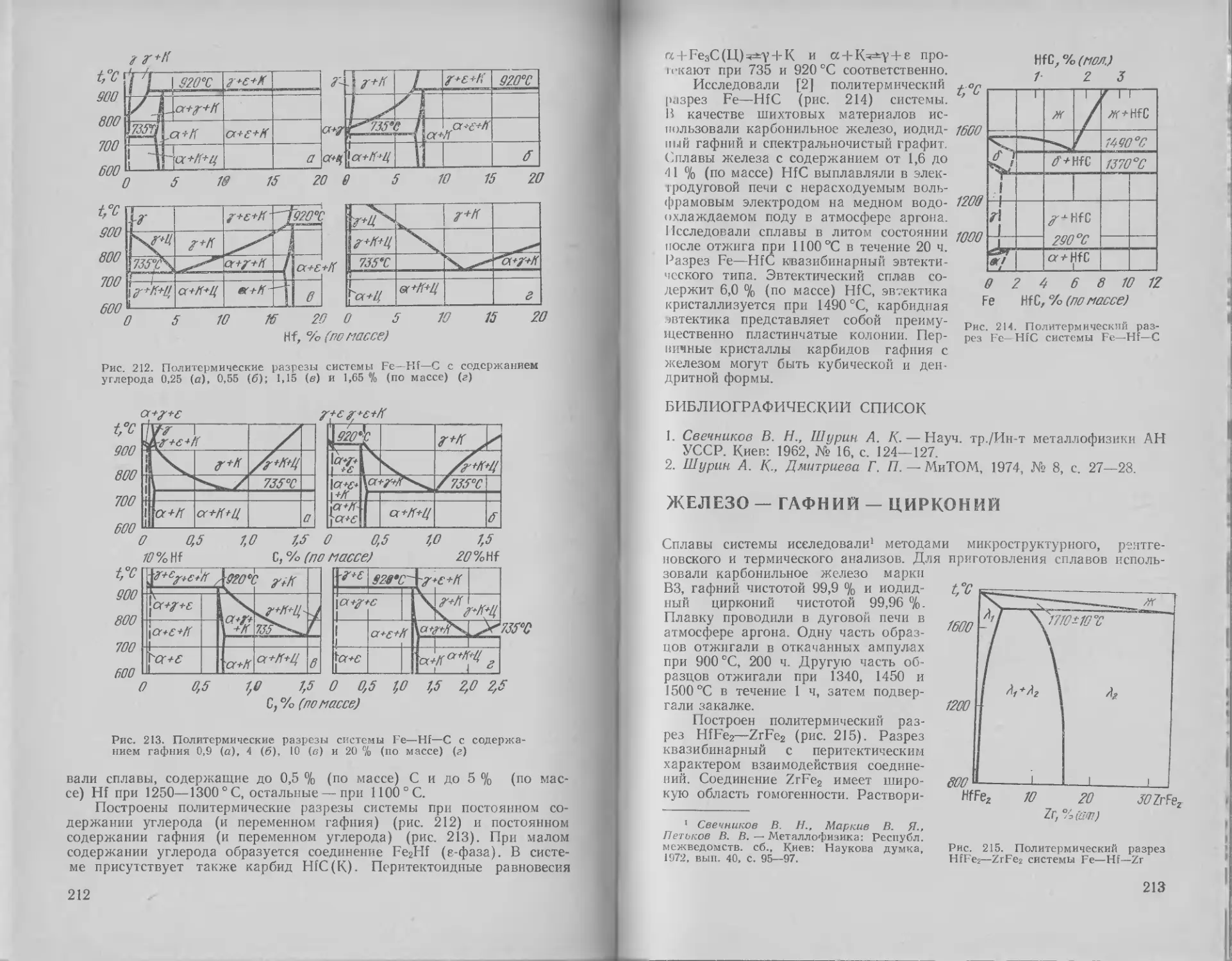
ЖЕЛЕЗО — ГАФНИЙ
Диаграмму состояния системы Fe—Hf исследовали в работах [1—6].
В работе [1] сплавы изучали методами термического, дилатометри-
ческого, рентгеновского и магнитного анализов в области всех концен-
траций. Для приготовления сплавов использовали железо электролити-
ческое, очищенное путем отжига в водороде и затем в вакууме, а так-
же железо карбонильное и гафний иодидный, содержащий 0,5 % Zr и
0,2 % Мо. Установлено наличие в этой системе одного промежуточного
соединения HfFe2, имеющего кристаллическую решетку типа MgZn2.
В работах [2—4] установлено, что в сплавах системы Fe—Hf об-
разуется, кроме того, соединение Hf2Fe со структурой типа TiaNi. Эти
результаты подтверждены в более поздней работе [5] методами диф-
ференциального, термического, микроструктурного и рентгеновского ана-
лизов (рис. 16). Показано, что в системе существуют два соединения
HfFe2 и Hf2Fe. Соединение Hf2Fe образуется в твердом состоянии при
1260 °C, а соединение HfFe2 кристаллизуется из расплава при 1810 СС.
Кристаллическая решетка FeHf2 — г. ц. к., типа Ti2Ni с периодом а =
= 1,2053 нм, а кристаллическая решетка HfFe2 — гексагональная, типа
MgZn2 с периодами о = 0,4978 нм, с = 0,8124 нм.
28
Растворимость гафния в cc-Fe при 1330 °C составляет ~0,06 % (ат.)
[1], что близко к значению <0,1 % (ат.), приведенному в работе [6].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I. Свечников В. Н., Шурин А. К. — ДАН СССР, 1961, т. 139, с. 895—
899.
2 Nevitt М. V., Downey 1. М., Morris R. А.— Trans. /ИЛАЕ, 1960, v. 218,
р. 1019.
3. Крипякевич П. И., Тылкина М. А., Цыганова И. А.— ЖНХ, 1964,
т. 9, с. 2599—2601.
1. Свечников В. И., Шурин А. К., Дмитриева Г. П., Алфинцева Р. А.—
В кн.: Диаграммы состояния металлических систем. М..: Наука, 1968,
с. 153—156.
29
бе, % (по массе)
Рис. 17. Диаграмма состояния системы Fe—Ge
5. Шурин А. К., Алфинцева Р. А. — В кн.: Фазовые превращения. Киев:
Наукова думка, 1968, с. 62—63.
6. Reinbach R. — Z. Metallkde, 1960, Bd 51, S. 292—294.
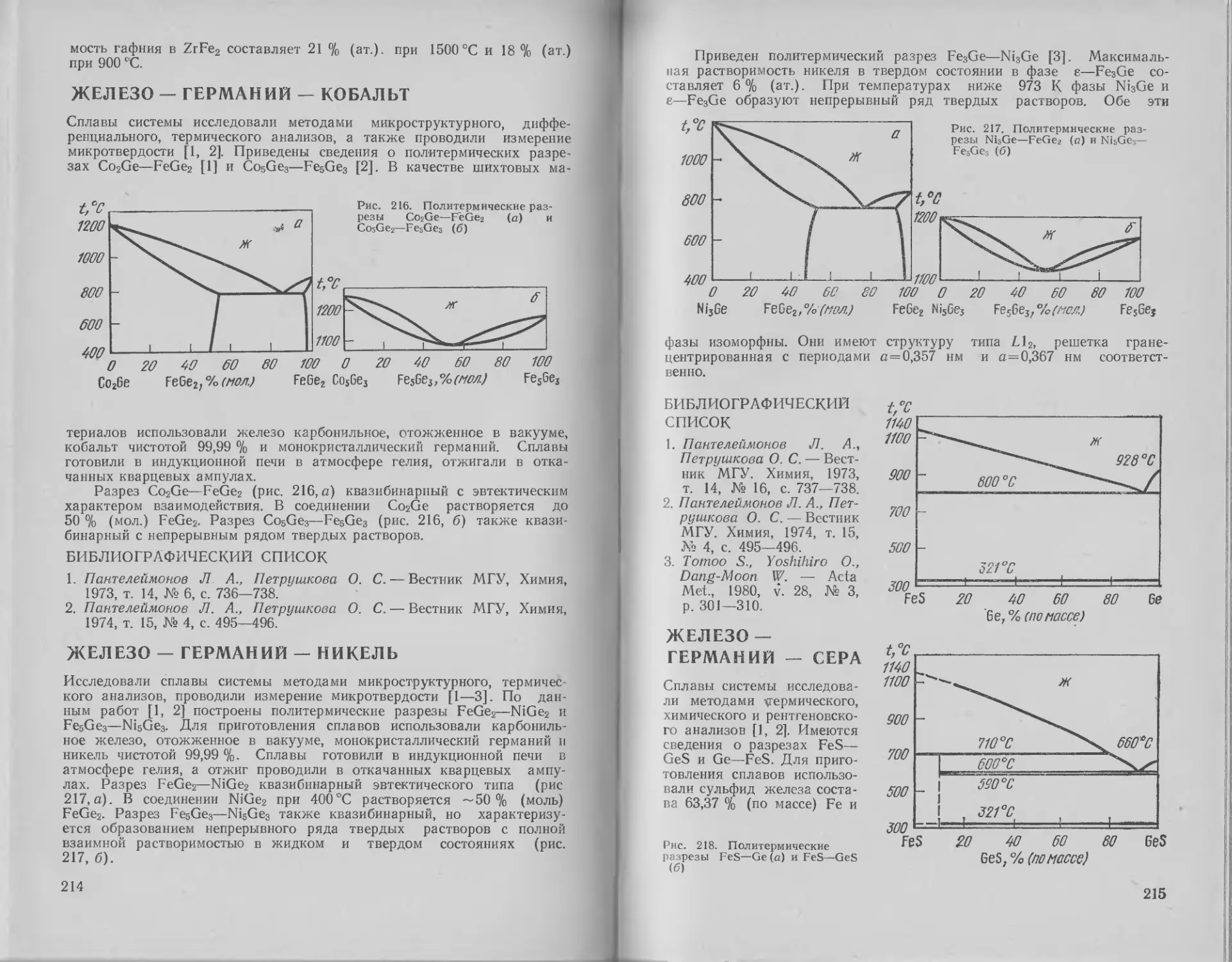
ЖЕЛЕЗО — ГЕРМАНИЙ
Диаграмма состояния системы железо—германий по обобщенным мате-
риалам исследований [1—6] приведена на рис. 17 [Д]. В сплавах сис-
темы образуется шесть промежуточных фаз Fe3Ge, р, д, % (Fe6Ge5),
30
I Hie ii FeGe2. Предельная растворимость германия в y-Fe составляет
3,8 I % (ат.) при 1150 °C, в a-Fe при этих условиях растворяется до
13% (ат.) Ge. При понижении температуры растворимость германия в
Ге снижается и при 300 °C составляет —10% (ат.). В широком ин-
тервале температур и составов существует упорядоченная на основе
о. ц. к. решетки фаза а'.
Интерметаллическое соединение Fe3Ge (е-фаза) образуется по пе-
ритектоидной реакции при —1050 °C, гомогенно в интервале составов
"3,8—26 % (ат.) Ge, претерпевает, очевидно, при 700 °C полиморфное
превращение 8^*е'. При 400 °C фаза £' эвтектоидно распадается на
смесь а'- и p-фаз. Фаза Р плавится с открытым максимумом при 1170 °C
и содержании 37,5 % (ат.) Ge. При 1100 °C фаза р гомогенна в интер-
вале составов 34—40 % (ат.) Ge, при понижении температуры область
। омогенности p-фазы незначительно сужается. Фаза т) образуется по
перитектической реакции при 928 °C и эвтектоидно распадается при
520 °C на смесь фаз р и %. Соединение Fe6Ge5 образуется по перитек-
тоидной реакции между ц-фазой и соединением FeGe. При 748 °C по
перитектоидной реакции ц + FeGe2^FeGe образуется соединение FeGe;
соединение FeGe2 образуется при 840 °C по перитектической реакции
между г]-фазой и жидкостью. При 838 °C и 75,5 % (ат.) Ge кристалли-
(уется эвтектика FeGe2+Ge. Растворимость железа в германии очень
мала и при 850°C не превышает 3,3-10~6 % (ат.).
Кристаллическая структура фазы е при высоких температурах (700—
1000 °C)—гексагональная, типа DOl9, при температурах <700 °C фаза
г/ имеет структуру типа £12 (Cu3Au) [1]. По данным [6], фаза [3 име-
ет структуру В8 типа (Ni/\s). Фаза ц имеет структуру типа В8 [5].
Кристаллическая структура соединения FeGe — гексагональная типа
/135 [3].
[БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I. Predel В., Frebel М. — Z. Metallkde, 1972, Bd 63, S. 393—397.
2. Chessin H., Arajs S., Colvin R. V., Miller D. S. — J. Phys. Chem., So-
lids, 1963, v. 24, p. 261—265.
3. Richardson M. — Acta Chem. Scand., 1967, v. 21, p. 2305—2309.
4. Maier J., Wachtel E.—Z. Metallkde, 1972, Bd 63, S. 411—418.
5. Ranematsu R., Ohojama T. — J. Phys. Soc. Jap., 1965, v. 20, p. 236—
240.
6. Штольц A. R., Гельд П. В., Загряжский В. Л. — ЖНХ, 1964, т, 9,
№ 1, с. 140—146.
ЖЕЛЕЗО — ГОЛЬМИЙ
Сплавы системы исследованы методами микроструктурного, рентгенов-
ского и термического анализов. Сплавы синтезировали [1] из железа
чистотой 99,9 % Fe и гольмия чистотой 99,0 % плавкой в дуговой печи.
В сплавах системы (рис. 18) образуются четыре соединения. Два из
них Fe17Ho2 и Fe23Ho6 плавятся с открытым максимумом при 1343 и
1332 °C соответственно. Соединения Fe3Ho и Fe2Ho образуются по пе-
ритектическим реакциям при 1293 и 1288 °C соответственно. Кристалли-
зуются три эвтектики: ,y-Fe+Fei7Ho2; Fei7Ho2+Fe23HoG и Fe2Ho + a-Ho
при 9; 18; 63,4 % (ат.) Но и 1338; 1285 и 875 °C соответственно. Чистый
гольмий плавится при 1472 °C, а при 1440 °C претерпевает полиморфное
a^tp-превращение. Соединение Fei7Ho2 имеет гексагональную решетку
типа Th2Ni17 с периодами а = 0,844, с —0,832 нм; соединение Fe23Ho6 —
кубическую типа Th6Mn23 с периодом а—1,204 нм [2]. Соединение Fe3Ho
31
Но, % (по массе)
Рис. 18. Диаграмма состояния системы Fe—Но
имеет решетку типа PuNi3 с периодами а —0,5084 нм, с = 2,545 нм. Со-
единение Fe2Ho принадлежит к семейству фаз Лавеса; имеет решетку
типа MgCu2 с периодом а = 0,728 нм.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Roc G. J., O’Keefe Т. J. — Metall Trans., 1970, v. 1, p. 2565—2568.
2. Крипякевич П. И., Франкевич Д. П. — Кристаллография, 1965, т. 10,
№ 4, с. 560
ЖЕЛЕЗО — ДИСПРОЗИЙ
Диаграмма состояния системы по данным работы [1] приведена на
рис. 19. Сплавы синтезировали из диспрозия чистотой 99,9 % и железа
чистотой 99,999 %. Установлено, что образуются четыре интерметал-
лических соединения; два из них Fei7Dy2 и Fe3Dy плавятся с открытым
максимумом при 1375 и 1305 °C соответственно. Соединения Fe23Dy6 и
Fe2Dy образуются по перитектическим реакциям при 1290 и 1270 °C со-
ответственно. В сплавах системы кристаллизуются три эвтектики:
y-Fc+Fei7Dy2; Fe23Dy6+Fe3Dy и Fe2Dy + a-Dy при 1360, 1285 и 890 °C
32
<(>(>iветственно. Заметной растворимости компонентов системы в соеди-
нениях не обнаружено Чистый диспрозий плавится при 1412 СС, а при
1390 °C претерпевает полиморфное превращение а^р. Кристаллическую
решетку соединения FeZ3Dy6 как изоморфную Th6Mn23 с периодом а =
Гу, % (помассе)
Рис. 19. Диаграмма состояния системы Fe—Dy
= 1,206 нм определили в работе [2]. Соединение Fe2Dy имеет решетку
типа MgCu2, о=0,732 нм; решетка Fe3Dy изоморфна PuNi3, cz = 0,5116;
г = 2,4555 нм. Гексагоналвную решетку типа Th2Nii7 имеет соединение
l'C|7Dy2, а=0,8453, с— 0,8287 нм.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Goot A. S., Buschow К. Н. — J. Less-Comm. Met., 1971, v. 21, № 2,
р. 151—157.
2. Крипякевич П. И., Франкевич Д. П. — Кристаллография, 1965, т. 10,
№ 4, с. 560.
2—358
33
ЖЕЛЕЗО — ЗОЛОТО
Сплавы системы исследованы методами термического, микроструктур-
ного. рентгеновского и дилатометрического анализов. Исследования
проведены во всем интервале составов [1—4]. На рис. 20 приведен обоб-
щенный вариант диаграммы [1—3]. Промежуточных соединений не об-
Auz % (по массе)
Рис. 20. Диаграмма состояния системы Fe—Au
наружено. При 1431 °C в сплавах системы протекает перитектическая
реакция (здесь и далее содержание Au в атомных процентах): ж (10,3 %
Au)+6 (2,3% Au)^y (2,8% Au).
Вторая перитектическая реакция реализуется при 1171 °C: ж (43 %
Аи)+у (4,1 % Аи)^Тв. р-р Au (25,5 %).
При 903 °C в сплавах системы наблюдается эвтектоидное превра-
щение: y-Fe (2,3 % Au)4=Mz-Fe+Au (менее 45 % Au).
В работе [4] была определена растворимость золота в a-Fe, кото-
рая при 500°C составляет 0,5 % (ат.).
34
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Pan S. Т., Kaufmann A. R., Bitter F.—J. Chem. Phys., 1942, v. 10,
p. 318—323.
2. Raab E., Walter P.- Z. Metallkde, 1950, Bd 41, S. 234—238.
3. Buckley R. A., Hume-Rothery W. — J. Iron a. Steel Inst. (L.), 1963,
v. 201, p. 121—124.
4. Royen P., Reinhardt H. — Z. Anorg. Allgem., Chem., 1955, Bd 281,
S. 18—36.
ЖЕЛЕЗО — ИНДИЙ
Сплавы системы исследовали методами микроструктурного, рентгенов-
ского и электронномикроскопического анализов [1—5]. На рис. 21 по
данным [Д] диаграмма состояния системы представлена в обобщен-
ном виде. В сплавах системы при 1470 °C и 3,4 % (ат.) In протекает
монотектическая реакция расслоения жидкой фазы на два несмешиваю-
Рис. 21. Диаграмма состояния системы Fe—In
2* 35
щихся жидких слоя. Область расслоения расположена в широком ин-
тервале составов от 3,4 до 91 % (ат.) In. Критическая точка кривой рас-
слоения Ткр лежит выше 2100 °C [6].
При —1320 °C и 0,7 % (ат.) In протекает кататектическая реакция:
б-Реч=ьу'Ре + ж; максимальная растворимость индия в б-Fe составляет
0,9 % (ат.). При 920 °C реализуется перитектическое превращение y-Fe+
+ ж«^а-Ее; максимальная растворимость индия в a-Fe 0,5 % (ат.).
При комнатной температуре в a-Fe растворяется <0,28 % (ат.) In.
При 156 °C в сплавах системы кристаллизуется эвтектика ж^а-Fe + In.
Чистый индий плавится при 156, 634 СС.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Stadelmaier Н. Н„ Fiedler М. Z. — Z. AAetallkde, 1967, Bd 58, S. 633—
634.
2. Dasarathy С. — Z. Metallkde, 1967, Bd 58, S. 279—283.
3. Dasarathy C. — Trans. AIM.E, 1969, v. 245, p. 1838—1839.
4. Dasarathy C. — Z. Anorg. Allg. Chem., 1974, Bd 403, H 2, S. 173—
178.
5. Dasarathy C. — Z. Metallkde, 1972, Bd 63, S. 209—211.
6. Wobst M. — Scr. Metall., 1971, v. 5, p. 583—585.
ЖЕЛЕЗО — ИРИДИЙ
Диаграммы состояния системы железо—иридий рассмотрены в работах
[1-31.
По данным [1], при высоких температурах железо и иридий обра-
зуют непрерывный ряд твердых растворов.
В работе [2] методом термического анализа изучали сплавы, содер-
жащие до 20 % (по массе) 1г; были использованы железо чистотой
99,95 % и иридий чистотой 99,99 %. Установлено, что при 1538°C в
сплавах, богатых железом, реализуется перитектическое превращение
(содержание иридия — в атомных процентах): ж (1,98 % 1г)+
+у(2,84 % 1г)->б(2,80 % 1г).
В отожженных и медленно охлажденных сплавах в результате упо-
рядочения образуется соединение Felr. Диаграмма состояния системы
(рис 22) приведена по данным [2, 3]. В работе [3] методами обычного
и высокотемпературного рентгеновского анализа сплавов, приготовлен-
ных из железа чистотой 99,96 % и иридия чистотой 99,9%, изучена кон-
центрационная область существования упорядоченного соединения.
Промежуточная фаза е имеет гексагональную решетку и образуется при
температурах ниже 625 °C. Область гомогенности этой фазы простира-
ется при 400 °C и ниже в пределах 22—45 % (ат.) 1г. Периоды решетки
фазы в сплавах, богатых железом, а —0,258 нм, с = 0,415 нм, а со сто-
роны сплавов, богатых иридием, а = 0,265 нм, с — 0,429 нм.
Иридий понижает температуру полиморфного превращения y-Fe^
^a-Fe. Эвтектоидное превращение y-Fe^a-Fe + e протекает при темпе-
ратуре — 470 °C. Сплавы железа с иридием обладают малой пластич-
ностью [1].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Немилое В. А., Видусова Т. А. — Изв. Сектора платины АН СССР,
1947, т. 20, с. 240—249.
2. Buckley R. A., Hume-Rothery W. — J. Iron Steel Inst. (L.), 1963, v. 201,
p. 121 — 124.
3. Raubl E., Loebich O., Beeskow H. — Z. Metallkde, 1964, Bd 55, H. 7,
S. 367—370.
36
Ir7 % (по массе)
Рис. 22. Диаграмма состояния системы Fe—Ir
37
ЖЕЛЕЗО — ИТТЕРБИЙ
Диаграмма состояния системы рассмотрена в работах [1—3]. При син-
тезе сплавов использовали исходные металлы высокой чистоты.
Обобщенная диаграмма состояния системы (рис. 23) представлена
по данным [Д]. В сплавах отмечены два интерметаллических соедине-
Рис. 23. Диаграмма состояния системы Fe—Yb
ния: Fei7Yb2 и Fe23Yb6. Первое из этих соединений имеет гексагональ-
ную решетку типа ThaNin, второе — кубическую типа Th6Mn23. В спла-
вах системы при 1310 °C протекает монотектическая реакция, приводя-
щая к расслоению жидкой фазы. Природа превращения при 1290 °C,
которое хорошо фиксируется при термическом анализе, не установлена.
Чистый иттербий плавится при 815 °C, а при 765 °C претерпевает поли-
морфное превращение.
38
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Buschow К. Н. — J. Less-Comm. Metals, 1972, v. 26, № 3, р. 329—
333
2. Jaridelli A., Palenzona А. — J. Less-Comm. Metals, 1972, v. 29, № 3,
p. 293—297.
3. Gschneidner K. A. — J. Less-Comm. Metals, 1969, v. 17, № 1, p. 13—24.
ЖЕЛЕЗО — ИТТРИЙ
Диаграмма состояния системы железо—иттрий рассмотрена в работах
[1—5]. На рис. 24 представлена диаграмма состояния по данным [2],
построенная на основании результатов микроструктурного и рентгенов-
ского анализов. Для приготовления сплавов использовали железо чис-
тотой 99,99 % и иттрий чистотой 99 %. В сплавах системы существуют
четыре промежуточных соединения: YFeg, YFe4, YFe3 и YFe2. Первые
Y, % (по массе)
Рис. 24. Диаграмма состояния системы Fe—Y
39
три плавятся с открытым максимумом при 1350, 1300 и 1350 °C соот-
ветственно. Соединение YFe2 образуется по перитектической реакции
при 1125 СС.
Определены составы четырех эвтектик и температуры их кристал-
лизации: Жч^б-Р'е-ЬYFe9 при 1350 °C; ж=ё±УГе9 +YFe4 при 1280 °C;
Жч^УРе4 +YFe3 при 1250 °C; ;i<^YFe2 + p-Y при 900 °C;
Соединение YFe4 имеет гексагональную решетку типа СаСи5 [2].
Согласно [4], соединение YFe4 обладает тетрагональной решеткой с пе-
риодами а — 0,487 нм и с = 0,406 нм. Соединение YFe2 относится к се-
мейству фаз Лавеса с кубической решеткой типа MgCu2 и периодом а =
= 0,7355 нм.
В работе [2] полагают, что соединение YFe9 более точно может
быть описано формулой YgFei?; оно имеет гексагональную решетку ти-
па Th2Nii7 с периодами а = 0,849 нм; с = 0,832 нм.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Domagala R. F., Rausch J. J., Levinson D. W.— Trans. ASM, 1961,
v. 53, p. 137—155.
2. Гшнейднер R. Сплавы редкоземельных металлов. Ml: Мир, 1965,
426 с.
3. Заречнюк О. С., Крипякевич П. И. — ДАН УССР, 1964, № 12,
с 1593___1595
4. Nassau К. — Phys. Chem. Solids. 1960, v. 13, p. 123—130.
5. Dwight A. E. — Trans. ASM, 1961. v. 53, p. 479—500.
ЖЕЛЕЗО — КАДМИЙ
Диаграмма состояния сплавов системы Fe—Cd в литературе отсутст-
вует. В работе [1] изучали диффузию кадмия в железо при 750 °C. Чув-
ствительным радиохимическим методом определена растворимость же-
леза в жидком кадмии: 2,2-10-3 % (по массе), или 4,4-10~4 % (ат.)
при 647°С и 1,2-10~4% (по массе), или 2,4-10— 4 % (ат.) [2]. На ос-
новании исследования поверхностных диффузионных процессов сделан
вывод, что существуют твердые растворы на основе кадмия и желе-
за [3].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Агеев Н. В., Замоторин М. И. — Тр. ЛПИ, т. 31. Л.: 1928, с. 15—28.
2. Chasanow М. G., Hunt Р. D., Feder Н. М. — Trans. AIME, 1952,
v. 224, р. 935—939.
3. Парфенова М. И., Изгарышев Н. А. — ЖПХ, 1952, т. 25, с. 752—756.
ЖЕЛЕЗО — КАЛИЙ
Диаграмма состояния в литературе отсутствует. Имеются данные *, что
сплавы системы железо—кадмий удалось приготовить, используя калий
и стружку железа; сплавы получали в бойлере и при нагревании же-
леза с солями калия.
ЖЕЛЕЗО — КАЛЬЦИЙ
Диаграмма состояния системы в литературе отсутствует. Попытки об-
наружить жидкие и твердые растворы на основе обоих компонентов не
увенчались успехом. В работе [1] установлено, что при избыточном
Петров П. Г. — Литейное дело, 1934, т. 10, с. 1—4.
40
давлении (1,4 МПа) растворимость кальция в жидком железе при
1607°C составляет 0,032 % (по массе), или 0,045 % (a?-)- Там же по-
казано, что в жидком состоянии кальций и железо не растворяются
друг в друге. В работе [2] диффузии кальция в железо не обнаружено
после отжига при 1000 °C (в течение 3 ч).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Sponseller D. L., Flinn R. А. — Trans. AIME, 1964, v. 230, p. 876—
888.
2. Агеев H. В., Замоторин M. H. — Изв. ЛПИ, Отд. физ.-мат. наук,
1928, т. 31, № 2, с. 183—197.
ЖЕЛЕЗО — КИСЛОРОД
Сплавы системы исследованы во многих работах [см. А—Г].
В системе (рис. 25) установлено существование трех промежуточ-
ных фаз: вюстита (близко к FeO), магнетита (Fe3O4) и гематита
(Fe2O3).
Вюстит — соединение переменного состава, близкого к FeO, устой-
чиво при избытке кислорода. Вюстит образуется при 1430—1435 °C по
Рис. 25. Диаграмма состояния системы Fe—О
41
перитектической реакции ж + Ре3О4=ё±вюстит. Область гомогенности этой
фазы определена и подробно описана в [А—В]. По данным электро-
химических измерений [1], границы области гомогенности вюстита при
различных температурах:
t, °C . . 1000 900 800 700 650 600 570
О, % (ат.) 51,13— 51,18— 51,25— 51,34— 51,36— 51,43---51,60
52,89 52,69 52,52 52,44 52,30 51,84
Распадается вюстит по эвтектоидной реакции: вюстит=ёьа-Ре+
+Fe3O4 при 560 °C; эвтектоидная точка расположена при 51,41 %
(ат.) О.
Решетка вюстита типа NaCl. С увеличением содержания кислорода
период решетки уменьшается почти линейно; при 20 °C он равен:
О, % (ат.) ... 51,5 52,8
а, нм .... 0,43088 0,42800
Ниже —70 °C кубическая решетка превращается в ромбоэдрическую
[А].
Магнетит Fe3O4 [57,15 % (ат.) О[ плавится с открытым максимумом
при ~ 1600 °C. В сплавах, более богатых кислородом, при 1583 °C про-
текает реакция ж^Ее3О4 + О2. В равновесии с кислородом магнетит
находится до 1457 °C. Он имеет решетки типа шпинели с периодом а—
= 0,8397 нм.
Гематит Fe2O3 образуется по реакции Fe3O4 + O2=f±Fe2O3 при 1457 °C.
Он существует в двух формах: стабильной a-Fe2O3 и метастабильной
у-Ре20з. Структура a-Fe2O3— ромбоэдрическая типа корунда с а=
=0,54271 нм и сс=55°'15,8'’. Ее также интерпретируют как гексагональ-
ную с 30 атомами в элементарной ячейке и периодами а = 0,50345 нм,
с= 1,3749 нм, с/а = 02,737. y-Fe2O3 обладает решеткой типа шпинели с
периодом а = 0,834 нм. Имеются указания и на более сложную структу-
ру— тетрагональную сверхструктуру с периодом решетки а = 0,833 нм,
с = 2,499 нм [В].
В богатых железом сплавах при высоких температурах наблюда-
ется область несмешиваемости; температура монотектики 1523 °C; моно-
тектическая точка 0,56 % (ат.) О. При 1371 °C кристаллизуется эвтек-
тика ж=₽±у-Ее + вюстит.
При повышении температуры растворимость кислорода в жидком
железе увеличивается и при 1700°C составляет 1,10 % (ат.). Эти ре-
зультаты подтверждаются данными работы [2], в которой была опре-
делена растворимость при 1550, 1600 и 1650 °C, равная соответственно
0,69, 0,83 и 0,94 % (ат.) О. Расчет растворимости кислорода [3] удов-
летворительно согласуется с приведенными выше данными.
При монотектической температуре, по данным различных исследо-
ваний, растворимость кислорода в б-Fe составляет 0,02—0,21 % (ат.)
[В; 4]. В y-Fe при 1345°С растворяется 0,01+0,01 % (ат.) О, а при
950 °C <0,02 % (ат.) О. В a-Fe растворимость кислорода не превышает
0,1 % (ат.).
Растворимость кислорода в деформированном железе более, чем на
порядок, превышает его растворимость в литом.
В работе [5] рассчитано равновесное давление кислорода над вюс-
титом.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Barby G. В. — J. Phys. Chem., 1964, v. 68, р. 2912—2916.
2. Аверин В. В., Поляков А. 10., Самарин А. М. — Изв. АН СССР.
ОТН, 1957, № 8, с. 120—122.
42
3. Takins E. S., Gokeen N. A., Belton G. R.— Trans. AIME, 1964, v. 230,
p. 820—827.
4. Kusano Akihito, Ito Koin, Sano Kokichi — Trans. Iron a. Steel Inst.
Jap., 1970, v. 10, № 2, p. 78—82.
5. Spencer P. J., Kubaschewski O. — CALPHAD, 1978, v. 2, № 2, p. 147—
167.
ЖЕЛЕЗО — КОБАЛЬТ
Диаграмма состояния системы приведена на рис. 26. В сплавах системы
при 1499 °C протекает перитектическая реакция ж + [1] в интер-
вале составов 16,5—19,5 % (ат.) Со. В области 55—60 % (ат.) Со на
кривой ликвидус имеется минимум при температуре около 1477 °C. Фа-
Со, % (по массе)
Fe Со, % (ат.) Со
Рис. 26. Диаграмма состояния системы Fc—Со
43
за 6 образует замкнутую область, существующую до 1392 °C. Положе-
ние двухфазной области 6+у подтверждено в работе [2], выполненной
методом термомагнитного анализа.
Кобальт повышает температуру полиморфного превращения железа
от 911 до 985 °C при 45 % (ат.) Со [3]. В богатых кобальтом сплавах
область а+у расширяется, и при 300 °C она располагается между 73,5
и 92,5 % (ат.) Со [4]. Положение области а+у, определенное в работе
[5] методами измерения теплоемкости и теплоты превращения в интер-
вале температур 620—1590 К (447—1317 °C) с помощью сферического
адиабатического калориметра и в работе [6] методом электросопротив-
ления, совпадает с результатами более ранних работ.
В твердых растворах, богатых кобальтом, происходит бездиффузи-
онное превращение у^е. По данным, обобщенным в работе [А], тем-
пература превращения снижается до комнатной в сплавах с 91—93 %
(ат.) Со.
В сплавах системы образуется одно или несколько промежуточных
соединений, характер взаимодействия между которыми до сих пор точ-
но не определен. Установлено существование упорядоченной структуры,
базирующейся на составе соединения FeCo, содержащего 51,35 °/о (по
массе) Со. Впервые предположение о ее существовании было высказа-
но в работе [7], а затем подтверждено экспериментально рентгеновским
и нейтронографическим анализами в работах [3, 5, 8, 9]. По данным
термического анализа, проведенного в работе [3], упорядочение начи-
нается примерно при 730 °C, а термические эффекты наблюдаются в
сплавах, содержащих 40,5—60,3 % (ат.) Со. Температура начала упоря-
дочения 725—732 °C подтверждена в [5, 8, 9]. При измерении электро-
сопротивления, твердости, магнитных и других свойств обнаружены ано-
малии в поведении соединения FeCo, скачкообразное изменение свойств
при некоторых температурах. Полагают, что превращение при 730 °C
является переходом второго рода.
Основываясь на результатах измерений некоторых физических
свойств в [8, 10] высказано предположение о существовании сверх-
структур, базирующихся на составах FegCo и FeCog, а при изучении ре-
кристаллизации [11] —предположение о существовании трех промежу-
точных фаз в системе.
Для окончательного установления характера равновесий в данной
системе ниже 730 °C нужны дополнительные исследования, поэтому на
рис. 26 соединения CogFe, FeCo и Fe3Co лишь обозначены.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1 Harris С. В., Hume-Rothery IF.—J. — Iron a. Steel Inst., 1953, v. 174,
p. 212—218.
2 Fisher W„ Klaus L„ Fabritius H., Schlegel D. — Arch. Eisenhiittenw.,
1970, Bd 41, № 5, S. 489—498.
3 . Ellis W. C„ Greiner E. S. — Trans. ASM, 1941, v. 29, p. 415—432.
4 Lihl F., Wagner H., Zemisch P. — Z. Electrochem., 1952, Bd 56,
S. 619—624.
5 Normanto A. S., Bloomfild R. P., Sale F. R., Argent В. B. — Metal
Sci., 1975, v. 9, № 11, p. 510—517.
6 Лесник II. Г., Сквсрчук В. П. — Сб. науч, работ Ин-та металлофи-
зики АН УССР, 1961, т. 12, с. 102—110.
7 Kussman В., Scharnow В., Schulze А. — Z. tech. Physik, 1932, Bd 10,
S. 449—460; Z. Metallkde, 1933, Bd 25, S. 145—146.
8 . Masumoto H. — Sci. Kept. Research Inst., Tohoku Univ., 1954, v. 6,
p. 523—528.
9 . Грум-Гржимайло H. B. — ДАН СССР, 1952, т. 87. № 1, с. 57—58.
10. Yokoyata Т. — Nippon Kinzoku Gakkai-Shi., 1953, v. 17, p. 259—263.
44
11. Гольденберг А. А., Селисский Я. П. — ФММ, 1963, т. 15, № 6,
с. 717—724.
ЖЕЛЕЗО — КРЕМНИЙ
В сплавах системы установлено существование следующих фаз: а- и
у-твердых растворов на основе железа, а2-фазы, FesSi (aj, Fe2Si (а"),
Fe5Si3 (т]), FeSi (g), Fe2,Si5 (£a), FeSi2 (£') и кремния (рис. 27).
Обзор работ о влиянии кремния на а=^у-превращение железа сде-
лан в [А]. На основе рентгенографических, дилатометрических, магнит-
ных исследований и теоретических расчетов установлено существование
замкнутой у-области. В работе [В] уточнено, что область у-фазы прости-
рается до 2 % (по массе), или 3,9 % (ат.) Si.
Рис. 27. Диаграмма состояния системы Fe—Si
Давление в 4200 МПа [1] значительно расширяет у-область, пони-
жая ее низкотемпературную границу до 675—700 °C. При том же дав-
лении и температуре 1200 °C [2] граница у-петли, по данным металло-
графического и микродюрометрического анализов, расположена при
10 % (ат.) Si. Полученные данные удовлетворительно совпадают с дан-
ными термодинамических расчетов.
Области существования фаз a, ai и а2 обсуждены во многих ра-
ботах [3—8]. Ранее полагали, что фаза а] образуется при 1250 СС вбли-
зи состава Fe3Si, т. е. 14,36 % (по массе) Si, по перитектической реак-
ции ж+a^aj [6]. Позднее термическим, дилатометрическим анализами
и измерением магнитной восприимчивости сплавов было установлено, что
«гфаза (Fe3Si) образуется в результате упорядочения a2^ai при
1140 °C с наибольшим эффектом упорядочения в сплаве с 21,3% (ат.)
S< [3]
45
В работах [4, 5] микроструктурным, электронномикроскопическим
и термическим анализами установлено, что по перитектической реакции
при 1275 °C образуется фаза а2 (ж+си^а2), которая с понижением
температуры до 1140 °C [4] в результате упорядочения превращается в
фазу <Х1 на основе соединения Fe3Si. Фаза а2 эвтектоидно распадается
с образованием а- и агфаз: а2 [9 % (ат.) Si]^<x [8 % (ат.) Si] 4-
+ 04 [15 % (ат.) Si] при 540+10°С, а при 965+5°С— на и, и г|
(Fe5Si3): (аг^Оч + 'П)- Положение фазовых границ в твердом состоянии
для этой части диаграммы на основании данных по диффузному рент-
геновскому рассеянию определили в работе [17]. В работе [8] электрон-
номикроскопическим методом установлены границы двухфазных облас-
тей упорядоченных фаз.
Фаза Fe2Si, ранее обозначавшаяся как а", плавится с открытым
максимумом при 1215 °C [4]. Это соединение участвует в двух эвтек-
тических реакциях ж+±а2+Ре251 при 1190 °C 31 % (ат.) Si и Жт±Ре2Э! +
+ FeSi при 1202 °C [4, 5] при 35,3 % (ат.) Si соответственно. Соедине-
ние Fe2Si стабильно до 1040 [4] или 1045 °C [5]. При этой температуре
оно эвтектоидно распадается по реакции Fe2Si^a24-Fe5Si3.
Фаза Fe5Si3 (т]) образуется по перитектоидной реакции Fe2Si +
+ FeSi^Fe5Si3 при 1090 °C, устойчива до температур 825 [4, 5] или
830 °C [6]; при этих температурах распадается по перитектоидной ре-
акции Fe5Si34^ai+FeSi. Однако эта фаза обнаруживается и при более
низких температурах в метастабильном состоянии; ниже 90 °C т]-фаза
ферромагнитна, области ее гомогенности не обнаружено. Фаза FesSi3
имеет гексагональную решетку типа Mn5Si3 с периодами, а = 0,6755,
с = 0,4717 нм, c/tz=0,6983.
Фаза FeSi (£) плавится с открытым максимумом при 1410 °C [4, 6].
Это единственная промежуточная фаза в системе, существующая во
всем интервале температур — от плавления до комнатной. Область
гомогенности этой фазы расположена между 49 и 50,5 % (ат.) Si [9].
Кристаллическая структура соединения FeSi явилась прототипом
для широкого класса кубических структур, известных как тип В20, а =
= 0,4489+0,0005 нм [4].
Фаза £ а (лебоит) плавится с открытым максимумом при 1220 СС
[10—12] и расположена при 70 % (ат.) Si. Состав £а-фазы близок к
стехиометрии Fe2Sis. Эта фаза неустойчива и распадается по эвтекто-
идной реакции ^FeSi2+Si при 940 °C. Фаза участвует в двух эв-
тектических реакциях ж^:FeSi + ^0, при 1212 °C и ж^Е^-pSi при 1206 +
+ 2 °C [16]. Фаза FeSi2 (£') образуется по перитектоидной реакции
FeSi + ^a5+^' при 982 °C [12]. В работах [14, 15] полагают, что фаза
образуется при более низких температурах.
В работе [16] указано, что при быстром охлаждении сплавов от
температур выше 1100 °C растворимость железа в кремнии может до-
стигать 4 % (по массе). При охлаждении с более низких температур
этой растворимости не обнаружено.
В работе [17] на основании обобщения литературных данных и до-
полнительных исследований, относящихся к областям равновесий при
высоких температурах, построена диаграмма состояния системы. Эта
работа выполнена методами дифференциального термического, микро-
скопического и микрорентгеноспектрального анализов. Сплавы готовили
из технически чистого или электролитического железа и кремния чис-
тотой 99,6%. В качестве примесей сплавы содержали в среднем
0,019 % Мп, 0,09 % Р; 0,018 % С; 0,006 % S. Результаты этой работы
хорошо согласуются с обобщенными данными, представленными на
рис. 27. Ряд вопросов упорядочения фазы Fe3Si исследован в [18].
46
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Tanner L. Е., Kulin S. A. — Acta metall., 1961, v. 9, № 11, p. 1038—
1040.
2. Schatz M., Kaufman L. — Trans. AIME, 1964, v. 230, № 7, p. 1564—
1566.
3. Cbelaeher Erich — Colloq. intern. Centre nat. rech. sci., 1967, № 157,
p. 171—173.
4. Koster W., Godecke T. — Z. Metallkde, 1968, Bd 59, № 8, S. 602—605.
5. Warlimont H.— Z. Metallkde, 1968, Bd 59, № 8, S. 595—602.
6. Lihl F., Ebel H.—Arch. Eisenhiittenw., 1961, Bd 32, № 7, S. 489—
491.
7. Semenovskaya S. V., Umidov D. M.— Phys. stat, solidi (b), 1974,
v. 64, № 2, p. 627—633.
8. Schlatte G.—Phys, status solidi (a), 1974, v. 23, № 1, p. K91—K92.
9. Сидоренко Ф. А.. Рабинович Б. C. — Науч. тр./Уральский политехи,
ин-т, 1965, № 144, с. 71—73.
10. Holdhus Helge — J. Iron a. Steel Inst., 1962, v. 200, № 12, p. 1024—
1032.
11. Piton J.-P., Fay M.-F. — Cr. acad. Sci., 1968, v. C266, № 8, p. 514—
516.
12. Wachtel E„ Mager T. — Z. Metallkde, 1970, Bd 61, № 10, S. 762—766.
13. Абрикосов H. X. — Изв. сект. физ.-хим. анализа ИОНХ АН СССР,
1965, т. 27, с. 157—163.
14. Струков Й. Н., Гельд П. В. — В сб. Физ.-хим, основы производства
стали. М.: Изд-во АН СССР, 1960, с. 61—73
15. Сидоренко Ф. А., Гельд П. В., Ремпель П. С. — Изв. вузов. Черная
металлургия, 1962, № 4, с. 102—108.
16. Wefer К, —Metall, 1963, Bd 17, № 5, S. 446—451.
17. Schilrmann E., Heusgen U. — Arch. Eisenhuttenw., 1980, Bd 51, № 1,
S. 1—4.
18. Sagane Hiromichi, Oki Kensuke — J. Jap. Inst. Metals, 1979, v. 43,
№ 6, p. 569—575.
ЖЕЛЕЗО —
КРИПТОН
По данным [Г], электроли-
тическое железо при 1200—
1500 °C не адсорбирует
криптон. Это указывает на
невозможность образования
в системе железо—криптон
твердых растворов и про-
межуточных фаз.
ЖЕЛЕЗО — ЛАНТАН
Диаграмма состояния си-
стемы исследована метода-
ми термического, микро-
структурного и рентгенов-
ского анализов [1—4]. По-
строена [1] диаграмма со-
стояния железо — лантан
Рис. 28. Диаграмма состояния
системы Fe—La
47
(рис. 28). В сплавах системы эвтектика кристаллизуется при 785 °C и
содержании лантана ~ 91,5 % (ат.). При 1400 и 900 °C протекают пе-
ритектические реакции, инициируемые полиморфными превращениями
6-Fe=f^y-Fe и y-Fe^a-Fe.
Промежуточных соединений в системе не обнаружено.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Гшнейднер К. Сплавы редкоземельных металлов. — М.: Мир, 1965.
426 с.
2. Nassau К. — Phis. Chem. Solids, 1960, v. 16, p. 123—130.
3. Савицкий E. М, — МиТОМ, 1961, № 9, c. 19—33.
4. Richerd J. —Met. Sci. Rev. Met., 1952, v. 59, p. 539—544.
ЖЕЛЕЗО —ЛИТИЙ
Железо с литием практически не взаимодействуют ни в жидком, ни в
твердом состояниях.
ЖЕЛЕЗО — ЛЮТЕЦИЙ
Методами термического, микроструктурного и рентгеновского анализов
изучены 1 сплавы, приготовленные из карбонильного особо чистого же-
леза (99,98 % Fe) и лютеция чистотой 99,2 % Lu. Сплавы получали в ду-
говой печи в атмосфере аргона. Богатые железом сплавы отжигали при
Рис. 29. Диаграмма состояния системы Fe—Lu
1 Колесниченко В. Е., Терехова В. Ф., Савицкий Е. М. — В кн.: Металловеде-
ние цветных металлов и сплавов. М.: Наука, 1972, с. 31—33.
48
1000 °C в вакууме, а богатые лютецием -— при 900 °C в атмосфере очищен-
ного аргона. Диаграмма состояния приведена на рис. 29. В системе су-
ществует четыре промежуточных соединения; LuFe2, LuFe3, Lu6Fe23 и
I HfFe17.
Соединение LuFe2 плавится конгруэнтно при 1345 °'С, а три других
соединения образуются по перитектическим реакциям: при 1310 °C
/К + LuFe^LuFes; при 1290°С M + LuFe3->Lu6Fe23; при 1320°С ж +
I (y-Fe)->Lu2Fe17.
В системе кристаллизуются две эвтектики: ж^Ьи + ЬиРе2 при 970 "С
и >K=F±Lu6Fe23+Lu2Fe17 при 1275 "С.
Соединение LuFe2 имеет кубическую решетку типа MgCu2, о —
= 0,7218 нм; LuFe3—ромбоэдрическую типа PuNi3; Lu6Fe23 — кубиче-
скую решетку с периодом а —
= 1,2014 нм; Lu2Fe17—гексаго-
нальную типа Th2Nii7, а —
= 0,8369 нм, с = 0,8259 нм.
ЖЕЛЕЗО — МАГНИЙ
Диаграмма состояния системы не
построена, хотя работы по изуче-
нию особенностей взаимодействия
этих элементов имеются [1-—3].
Отсутствие диаграммы состояния
связано [А], по-видимому, со
сложностью получения сплавов
|,ля исследования из-за различия
в температурах плавления магния
и железа, а также вследствие вы-
рожденности эвтектического рав-
новесия [/э = 650,5°С и содержа-
ние железа в эвтектике 0,015—
0,03 % (аг.)] — рис. 30.
В работе [1] использовали
железо с 0,057 % (по массе) С,
при 1600 °C и давлении 2,5 МПа,
в аргоне насыщали железо и маг-
ний; при исследовании оно содержало
[0,2 %. (ат.)].
Мд, % (по массе)
Рис. 30. Растворимость Fe в Mg
0,19 % (по массе) Mg
БИБЛИОГРАФИЧЕСКИШ СП! ICOK
1. Левченко 10. М., Хохолков В. М., Горшков А. А. — ДАН УССР, 1963,
№ 12, с. 1602—1606.
2. Ланда А. Ф.— Литейное производство, 1957, № 8, с. 27—29.
3. Тавадзе Ф. И., Картозия Е. С., Шиняев А. Я. — МиТОМ, 1961, № 1,
с. 33—35.
ЖЕЛЕЗО — МАРГАНЕЦ
Диаграмма состояния системы железо—марганец исследована во всем
интервале составов.
В работах [1—5] методом термического анализа построена диаграм-
ма, приведенная на рис. 31. Для приготовления сплавов использовали
железо чистотой 99,95 % и марганец чистотой 99,9 %
49
Рис. 31. Диаграмма состояния системы Fe—Мп
Установлено, что в сплавах системы протекают два перитектических
нонвариантных превращения: ж13О/о(ат )Mn + 6-Fe96%(aT),Мп
^Y-Feio^/olaTjMn11?11 1473°C и ж+Т87%(ат.)Мп ^'Мп88%Мп ПРИ 1232 СС.
«Пинии ликвидус и солидус у-фазы имеют точку минимума при концен-
трации марганца 86 % (ат.). В сплавах системы существует непрерыв-
ный ряд твердых растворов на основе у-модификаций железа и марган-
ца. Изучение влияния марганца на превращение a-Fe^y-Fe методами
микроструктурного и рентгеновского анализов показало [4], что грани-
цы двухфазной области а+у при 400 СС расположены в интервале со-
ставов 3,2—30 % (ат.) Мп.
Установлено также, что в сплавах с 16—25 % (ат.) Мп существует
метастабильная мартенситная е-фаза. Имеются указания на существо-
50
и.।пие в-фазы в сплавах и с более высоким содержанием марганца.
11олагают [6], что е-фаза является равновесной и образуется по пери-
гектоидной реакции a-Fe+y-Fe^e.
Используя ЭВМ и термодинамические данные о сплавах системы,
и работе [1] рассчитали положение кривых ликвидус и солидус систе-
мы, подтвердили существование непрерывного ряда твердых растворов
у-модификаций железа и марганца.
Изменения периодов кристаллической решетки a-Fe в зависимости
от содержания марганца, по данным [7]:
Мп, % (ат.) . . 0,86 1,76 2,6 4,0
а, нм ... . 0,28609 0,28621 0,28627 0,28631
По данным [8], период решетки изменяется в пределах 0,28610—
0,28702 нм при изменении содержания марганца от 0 до 8,5 % (ат.).
Период кристаллической решетки у-фазы при содержании 13,19 и
50,43 % (ат.) Мп соответственно равен 0.35807 и 0,36237 нм [5].
Метастабильная фаза е сплава с 18,5 % (ат.) Мп имеет г. п. у. ре-
шетку типа Mg с периодами а = 0,2530 нм, с=0,4079 нм, с/п= 1,612 [9].
Методами термического анализа, измерением твердости, микротвер-
дости, удельного электросопротивления, а также микроструктурным и
рентгеновским анализами установлено [10], что непрерывный у-раствор
претерпевает превращения в твердом состоянии. Сингулярные точки на
кривых состав—свойство указывают на образование соединения FeMn
и, возможно, Fe2Mn.
Расчет диаграммы состояния системы железо—марганец (с исполь-
зованием литературных данных) по термодинамическим свойствам от-
дельных сплавов этой системы показал ее хорошее совпадение с постро-
енной по экспериментальным данным [12, 13].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Hellawell A., Hume-Rothery W. — Phil. Trans. Rov. Soc. (L.), 1957,
v. A249, p. 417—459.
2. Gayler M. L. У.--J. Iron Steel Inst., 1953, v. 128, p. 293—340.
3. Isobe M. — Sci. Repts Research Tohoku Univ., 1951, v. A3, p. 151—
154.
4. Troiano A., McGuire F.— Trans. ASM, 1943. v. 31, p. 340—359.
5. Hume-Rothery W., Buckley R. A. — J. Iron Steel Inst. (L.), 1964,
v. 202, № 6, p. 534—539.
6. Геншафт IO. C—ФММ, 1964, t. 18, вып. 1, c. 116—120.
7. Гуляев А. П., Трусова E. Ф.— Ж.ТФ, 1950, r. 20, c. 66—71.
8. Варивода И. X., Курилех Д. Г. — Науч. тр./Днепропетровский хи-
мико-технологический ин-т, 1960, № 10, с. 3—7.
9. Parr J. G. — J. Iron a. Steel Inst., 1952, v. 171, р. 137—139; Acta
Crist., 1952, v. 5, p. 842—844; J. Inst. Metals, 1953, v. 82, p. 91—94.
10. Соколовская E. M., Григорьев А. И., Алтунина Ю. Ф. — ЖНХ, т. 7,
вып. 12, с. 2809—2811.
11. Vikram R. M., Tiller W. A.—Mater. Sci. a. Eng., 1974, v. 15, № I,
p. 87—89.
12. Dew-Hughes D. — CALPHAD, 1979, v. 3, p. 175—203.
13. Kaufman L.— CALPHAD, 1978, v. 2, № 2, p. 117—146.
ЖЕЛЕЗО —МЕДЬ
Диаграмма состояния системы изучалась многими исследователям!;
результаты их работ обобщены в [А, Г].
Данные о полной или частичной смешиваемости железа и меди в
жидком состоянии противоречивы. Установлено отсутствие расслаива-
51
ния в системе железо-—медь, однако в переохлажденном состоянии (сте-
пень переохлаждения 100 С и больше) оно наблюдается Область не-
смешиваемости почти симметрична оси, соответствующей эквиатом но-
му составу, а критическая температура смешивания лежит на 20 °C
ниже температуры ликвидус при эквиатомном составе.
Рис. 32. Диаграмма состояния системы Fe—Си
Диаграмма состояния системы железо—медь приведена на рис. 32
по данным работы [2], выполненной методами калориметрического
анализа и термодинамического расчета. В системе существуют три об-
ласти первичной кристаллизации фаз 6, у и е, и три превращения (два
перитектических и одно эвтектоидное), протекающих при 1480, 1094 и
850 °C по реакциям1: ж1130/лСи +6 6,8%Cu =^Y 7,4%Cu * ж97,2%Си +
+ Y8%cu:₽±e 9,6%Cu> Y 2,l%Cu l,4%Cu+e 98,7%Cu.
Растворимость меди в a-Fe изучали в работах [3—6], а в y-Fe —
в работах [2, 5—7], причем данные работ [2] и [7] хорошо совпадают
и свидетельствуют о наличии ретроградного солидуса. Растворимость
меди в б-Fe определена в работах [2, 8].
Границы е-фазы (твердого раствора на основе меди) построены по
данным микроскопического [9] и рентгеновского [10] анализов. Данные,
приводимые в более поздних исследованиях [В], соответствуют работе
[10] Растворимость железа в меди при 1025, 900, 800 и 700 °C состав-
Содержание меди в фазах — в процентах по массе
52
лист 2,5; 1,5; 0,9 и 0,5 % (по массе) соответственно. По данным [8],
растворимость железа в меди, определенная методом микрорентгено-
спектрального анализа, несколько ниже, чем приведенная выше; при
800 и 700 °C она составляет 0,642 и 0,322 % (по массе). Период решет-
ки a-Fe возрастает от 0,28662 до 0,28682 нм при добавлении 0,38 % (ат.)
Си [4].
Период решетки твердого раствора на основе меди е, по данным
|1()]: для сплава, содержащего 2,39 % (ат.) Fe, а = 0,36092 нм (для чис-
той меди « = 0,36076 нм).
В работах [11—14] диаграммы состояния системы построены по
расчетным данным; в основном эти диаграммы согласуются с постро-
енными по данным эксперимента.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Nakagawa У —Acta Metall., 1958, v. 6, № И, р. 764—711.
2. Oelsen W., Schurmann E., Florin C.—Arch. Eisenhiittenw., 1961,
Bd 32, № 10. S. 719—728.
3. Wriedt H. A., Darker L. S. — Trans. AIME, 1960, v. 218, № 1, p. 30—
36.
4. Abrahamson E P, Lopata S. L. — Trans. AIME, 1966, v. 236, № 1,
p. 76—78.
5. Harvig H., Kirchner G., Hillert M. — Metall. Trans., 1972, v. 3, № 1,
p. 329—332.
6. Salje G., Feller-Kniepmeier M. — Z. Metallkde, 1978, Bd 69, № 3,
S. 167—169.
7. Бочвар A. A.t Екатова А. С., Панченко E. В., Сидохин Ю. Ф.—
ДАН СССР, 1967, т. 174, № 4, с. 863—864.
8. Ilellawell А., Нume-Rothery W. — Phyl. Trans. Roy. Soc. (L.), 1957,
v. A249, № 968. p. 417—459.
9. Hansen D., Ford G. W.—S. Inst. Met., 1924, v. 32, p. 335—361.
10. Anderson A. G. H., Kingsbury A. W. — Trans. AIME, 1943, v. 152,
p. 38—47.
11. Kubaschewski O. Smith J. F., Bailey D. M. — Z. Metallkde, 1974,
Bd 68, № 7, S. 495—499.
12. Smith J. F., Bailey D. M. — U. S. Dep. Commer. Nat. Bur. Stand.
Spec. Publ., 1978, № 496/2, p. 1027—1046.
13. Kaufman £. —CALPHAD, 1978, v. 2, № 2, p. 117-146.
14. Lindqvist P.-А., Uhrenius — CALPHAD, 1980, v. 4, № 3, p. 193—200.
ЖЕЛЕЗО — МОЛИБДЕН
Диаграмма состояния системы железо—молибден исследована в ряде
работ. В работе [1] изучали сплавы системы, содержащие до 40 %
(ат.) Мо. Была обнаружена новая фаза R, а также подтверждено су-
ществование фаз li и А; последняя фаза была выявлена ранее в работе
|2]. В работе [4] исследовали сплавы, отожженные при 800, 900, 1125,
1255, 1320 и 1405 °C. Показано, что фаза ц образуется примерно при
40 % (ат.) Мо, фаза R — при 37 % (ат.) Мо; фаза о образуется по пе-
ритектической реакции при 1540 °C в сплавах, содержащих 50 % (ат.)
Мо, и устойчива до температуры 1235СС, при которой распадается на
смесь A-фазы и твердого раствора на основе молибдена.
На рис. 33 приведена диаграмма состояния системы железо—мо-
либден [4—8]. Фаза ц находится в равновесии с a-Fe при температу-
рах ниже 1200 °C, а присутствует в сплавах до 1370 °C. Фаза R обра-
зуется при 1488 °C по перитектической реакции и распадается по эвтек-
53
Рис. 33. Диаграмма состояния системы Fe—Мо
тоидной при 1200 °C на смесь a-Fe+p.. При 950 °C по перитектоидной
реакции образуется %-фаза на основе соединения FezMo.
В работе [8] рассчитали диаграмму состояния системы железо—
молибден, используя термохимические данные. Она отличается от при-
веденной на рис. 33 тем, что определено существование лишь двух про-
межуточных фаз: Fe3Mo2 (ц) и FeMo (о). Кроме того, температуры
нонвариантных превращений несколько выше установленных опытным
путем.
В работе [3] методом микрорентгеноспектрального анализа опреде-
54
лили растворимость молибдена в y-Fe, а также состав a-Fe, находящий-
ся в равновесии с y-Fe при различных температурах:
t, °C . . . . 990 1037 1137 1257 1300
Мо, % (ат.):
в y-Fe 1,10 1,34 1,69 1,27 1,02
в a-Fe 1,48 1,85 2,26 1,67 1,31
Несколько более высокая растворимость молибдена в y-Fe уста-
новлена в работе [9]: 2,3 % (ат.) при 1060 “С.
Растворимость молибдена в a-Fe исследовали в работе [7]. Сплавы
синтезировали из железа чистотой 99,95 % и молибдена чистотой 99,9 %
в высокочастотной печи в вакууме. Затем их гомогенизировали и отжи-
гали при 1200—600 °C в течение 250—7000 ч. Полученные результаты
нашли отражение в диаграмме состояния системы.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1 Sinha А. К., Buckley R. A., Hume-Roihery IF.— J. Iron Steel Inst.,
1967, v. 205, p. 191 — 197.
2. Залетаева P. П., Лашко H. Ф., Нестерова M. Д., Яганова C. A. —
ДАН СССР, 1957, т. 81, с. 215—219.
3. Kirchen G., Harvig H., Urhenius B. — Met. Trans., 1973, v. 4, p. 1059—
1063.
4. Rawlings R. D., Newey C. W. A. — J. Iron Steel Inst., 1968, v. 206,
p. 723—725.
5. Heiywegen С. P., Rieck G. D. — J. Less-Common Metals, 1974, v. 37,
p. 115—121.
6. Itinose Hidedsi J. — Iron and Steel Inst. Jap., 1979, v. 65, № 11,
p. 170—176.
7. Ko Musong, Nishizawa. Taiji — J. Jap. Inst. Metals, 1979, v. 65, № 2,
p. 118—135.
8. Kaufman L.. Nesor H. — Met. Trans., 1975, v. A6, № 11, p. 2123—2131.
9. Alberry P. J., Haworth C. IF.— Metal Sci., 1975, v. 9, № 3, p. 140—
142.
ЖЕЛЕЗО —МЫШЬЯК
Диаграмма состояния системы железо—мышьяк по обобщенным дан-
ным [1—3, 7, 8] 1 приведена на рис. 34. В сплавах системы установлено
четыре промежуточных соединения: Fe2As, Fe3As2, FeAs и FeAs2. Со-
единение Fe3As2 образуется по перитектической реакции при 1002 °C,
имеет область гомогенности и существует в интервале температур до
824 СС. При этой температуре оно эвтектоидно распадается по реакции
I e3As2^±:Fe2As + FeAs. Другие соединения практически не имеют облас-
тей гомогенности и плавятся конгруэнтно: Fe2As при 930 СС; FeAs при
1030 °C и FeAs2 при 1016 °C.
В системе Fe—-As установлено существование следующих эвтекти-
ческих равновесий: жч=ьа-Ее4-Ее2А8 при 845 °C; ж^>Рё2А5 + Ре3А82 при
922 °C; ж^РеАз+РеАз2 при 1008 °C и, по-видимому, жч^РеАз2-|-As при
800 СС.
Растворимость мышьяка в а- и y-Fe определяли в работах [2, 3].
При 1150 °C предельное содержание мышьяка в y-Fe составляет
1,75 % (ат.). Ширина двухфазной области а+у доходит до 2,4 % (ат.)
1 См. также: Шурин А. К. Диаграмма состояния Fe—As и Fe—С—As. Авто-
рсф. канд. дне. Днепропетровск: 1957, 24 с.
55
As, % (по пассе)
Рис. 34. Диаграмма состояния системы Fe—As
56
As при этой же температуре. Предельное содержание мышьяка в cc-Fe
при температуре эвтектики составляет 10,5 % (ат.), снижаясь до ~5 %
(.и.) при комнатной температуре [4]. При этом концентрационная за-
висимость периода о. ц. к. решетки cc-Fe имеет следующий вид: а =
=0,28606 нм+0,00023 % (ат.) As.
В работе [5] была установлена зависимость периода решетки <х-фа-
«ы от содержания в ней мышьяка, нм: « = 0,28609 +17-10~5 CAs (C\s —
концентрация мышьяка, % (ат.). Кристаллическая структура соедине-
ния Fe2As тетрагональная, типа Cu2Sb; « = 0,3627 нм, с = 0,5973 нм;
с/а= 1,646. По этим же данным, соединение FeAs имеет орторомбиче-
скую структуру типа MnF с периодами « = 0,6016 нм; 6 = 0,5428 нм;
с — 0,3366 нм. Согласно [6], это соединение имеет ромбическую решетку
с периодами « = 0,3372 нм, 6 = 0,6023 нм, с=0,5432 нм.
Соединение FeAs2 обладает орторомбической структурой с перио-
дами: « = 0,520 нм; 6 = 0,592 нм; с=0,286 нм [7].
В работе [8] определена температура магнитного превращения спла-
вов железа. Эти данные нанесены штриховой линией на диаграмме.
Добавки мышьяка снижают ударную вязкость железа при температу-
рах ниже 500 °C и увеличивают его окисляемость при высоких темпера-
турах.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I. Friedrich К. — Metallurgie, 1907, v. 4. р. 129—136.
2. Свечников В. Н„ Шурин А. К.— ДАН УССР, 1957, № 1, с. 27—33.
3. Clark L. А. — Есоп. Geel., 1960, v. 55, р. 1345—1381.
4. Сандлер И. И., Левиков Е. А., Коткис М. А. — ФММ., 1955, т. 1,
с. 523—526.
5. Н aiding R. D., Calvert L. D. — Canad. J. Chem., 1957, v. 35, № 5,
p. 449—452.
6. Buerger M. J. — Z. Kristallogr, 1932, Bd A82, S. 165—167.
7. Sawamura EL. Mori T. — Mem. Fac. Eng. Kvoto Univ., 1952, v. 14,
p. 129—132; 1954, v. 16, p. 182—184.
8. Bozic B. — Bull. Acad. Serbe sci. et arts, 1979, v. 63, № 14, p. 1—16.
ЖЕЛЕЗО — НАТРИЙ
Диаграмма состояния сплавов системы не построена, так как в обыч-
ных условиях их невозможно приготовить. Имеются сведения об опре-
делении растворимости железа в жидком натрии, которая чрезвычайно
мала *.
ЖЕЛЕЗО — НЕОДИМ
('плавы системы исследованы методами микроструктурного, термиче-
ского, рентгеновского анализов, измерением микротвердости и электро-
сопротивления.
В работе [Ц сплавы получали из карбонильного железа и неодима
чистотой 99 % в дуговой печи в атмосфере гелия при давлении 39,9—
53,2 кПа. Богатые железом сплавы гомогенизировали при 900 °C, осталь-
ные при 600°C в течение 130 ч.
В сплавах системы (рис. 35) образуется по перитектическим реак-
циям два интерметаллических соединения — Fei7Nd2 и Fe2Nd — при
1емпературах 1185 и ИЗО °C соответственно. При 640 °C и 75% (ат.)
1 Корнилов И. И. Железные сплавы. М.: Изд-во АН СССР, 1951, т. 2 с. 97.
57
Nd, % (попассе)
Рис. 35. Диаграмма состояния системы Fe—Nd
Nd кристаллизуется эвтектика Fe2Nd+cz-Nd. Чистый неодим плавится
при 1017 °C, а при 860 °C претерпевает полиморфное а^р-превращение.
Неодим несколько повышает температуру полиморфного превращения
железа
По данным [2], соединение Fei7Nd2 имеет гексагональную решетку
типа Th2Nin с периодами п = 0,859 нм, с—1,247 нм.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Терехова В. Ф., Маслова Е. В., Савицкий Е. М. — Изв. АН СССР,
Металлы, 1965, № 6, с. 50—55.
2. Крипякевич П. И., Терехова В. Ф„ Заречюк О. С., Буров И. В.—
Кристаллография, 1963, № 8, с. 268.
58
ЖЕЛЕЗО — НИКЕЛЬ
Диаграмма состояния системы, обобщающая результаты исследований,
выполненных до середины 50-х годов, приведена на рис. 36 [А, Г].
y-Fe и никель образуют между собой непрерывный ряд твердых
растворов. Никель, растворяясь в железе, повышает температуру у^б-
превращения от 1390 до 1512 °C; при этой температуре протекает пери-
тектическая реакция б + ж^у. Максимальная растворимость никеля в
Рис. 36. Диаграмма состояния системы Fe—Ni
б-Fe составляет 3,24 % (ат.), перитектическая точка расположена при
4,3 % (ат.) Ni, а концентрация этого элемента в жидкой фазе равна
5,9 % (ат.). Сплавы системы кристаллизуются в узком интервале тем-
ператур, не превышающем 10—15 °C. Кривые ликвидус и солидус для
сплавов с содержанием 5,9—100 % (ат.) Ni имеют вид слегка провисаю-
щей цепи с минимумом при 1436 °C и содержании 68 % (ат.) Ni. В точ-
ке минимума кривые соприкасаются.
Равновесная концентрация никеля в tz-твердом растворе на основе
железа при понижении температуры возрастаег и при 300 °C достигает
~7,5 % (ат.). С понижением температуры значительно расширяется
59
двухфазная область сс+у, и при 300°C граница (tz+y)/y располагается
при 56 % (ат.) Ni. Диффузионные процессы в сплавах системы ниже
500 °C крайне замедленны, поэтому установление граничных концентра-
ций ос/(а+у) и (а + у)/у сопряжено с большими экспериментальными
трудностями.
Fe Ni, °/о(ат.) Ni
Рис. 37. Часть диаграммы системы Fe—Ni при темпера-
турах ниже 900 °C
По результатам исследований длительно отожженных сплавов ни-
же 500 °C установлено образование интерметаллического соединения
FeNi3 при содержании —74 % (ат.) Ni. Образование этого соединения
связано с упорядочением у-твердого раствора, причем температура упо-
рядочения, по данным различных исследователей, находится в интерва-
ле 493-э 503±2 °C. Упорядочение у-твердого раствора при соотношении
компонентов 1 : 1 не было экспериментально подтверждено.
В работе [1] изучали фазовые равновесия в сплавах системы ниже
500 °C; сплавы высокой чистоты синтезировали путем осаждения паров
железа и никеля на подложку. На рис. 37 представлена низкотемпера-
турная часть диаграммы. При 345 °C протекает эвтектоидная реакция:
y=F*c4 + FeNi3; эвтектоидная точка расположена при 52 % (ат.) Ni; твер-
дый раствор на основе соединения FeNi3 обладает широкой областью
гомогенности: —20% (ат.) при 300 °C.
Равновесное фазовое состояние сплавов, соответствующее диаграм-
мам, приведенным на рис. 36 и 37, как правило, не реализуется в про-
изводственных условиях быстрого охлаждения.
Диаграмма метастабильного состояния сплавов системы для обла-
60
сти, богатой железом (рис. 38), построены в работе [2]. Исследование
выполняли измерением электросопротивления при скорости нагрева и
охлаждения 5 °С/мин.
Штриховые линии отвечают рав-
новесным границам областей а/(а+
ру) и у/(со+у). Кривые Мн и Ан
отвечают соответственно началу об-
разования мартенсита при охлажде-
нии и аустенита при нагреве. Сплавы
с 6—25 % (ат.) Ni после быстрого
охлаждения имеют мартенситную
структуру; в сплавах, содержащих
свыше 30 % (ат.) Ni, мартенсит при
быстром охлаждении, как правило,
не образуется и фиксируется у-твер-
дый раствор, который при нагреве
распадается на смесь а+у-фаз.
Более поздние исследования диа-
граммы [3, 4] полностью подтверди-
ли изложенные выше сведения.
Кристаллическая структура спла-
вов системы характеризуется тремя
основными типами структур: о. ц. к. —
a-твердый раствор на основе a-Fe,
тип А2; г. ц. к. — у-твердый раствор
на основе y-Fe, тип А1 и упорядочен-
ная фаза FeNi3 с кубической струк-
турой типа Cu3Au (Ll2).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Рис. 38. Диаграмма метастабильно-
го состояния системы Fe—Ni
1. Heuman fl., Karsten G. — Arch. Eisenhuttenw., 1963, Bd 34, S. 781 —
785.
2. Kaufman Z., Cohen M. — Trans. AIME, 1956, v. 206, p. 1393—1395.
3. Vikzani Rao 44., Tiller W. A. — Mater. Sci. a. Eng., 1974, v. 14, № 1,
p. 47—54.
4. Schuznienn E., Brauckmann J. — Arch. Eisenhuttenw., 1977, Bd 48,
№ 3, S. 3—7.
ЖЕЛЕЗО — НИОБИЙ
Различные варианты диаграммы состояния сплавов системы, опублико-
ванные до 1964 г., достаточно хорошо освещены в справочной лите-
ратуре [А, Б, Г]. Первоначально предполагалось существование трех
промежуточных фаз на основе интерметаллических соединений NbFe2 (е),
Nb,9Fe21 (о), Nb3Fe2 (т]). Фазы е и т] плавятся конгруэнтно при 1655
п —1800 °C, а фаза о образуется по перитектоидной реакции при
— 1500 °C из е- и трфаз и при —600 °C эвтектоидно распадается на
смесь этих же фаз.
На рис. 39 приведена диаграмма состояния системы по данным [1].
I кследование выполнено методами микроструктурного и рентгеновско-
1о анализов; сплавы получали в дуговой печи в атмосфере аргона из
железа чистотой 99,85 % и ниобия чистотой 99,9 %, а затем отжигали в
вакууме при 1300 °C и в откачанных кварцевых ампулах при 1000 °C.
< )бразование о-фазы не подтвердилось. При составе Nb19Fe2o из рас-
плава кристаллизуется ц-фаза, которая гомогенна в интервале 51—
53 % (ат.) Fe. Авторы предполагают, что ц-фаза претерпевает поли-
морфное превращение без изменения типа решетки. Соединение NbFe2
61
Nb Ге,%(ат.) Fe
Рис. 39. Диаграмма состояния системы Fe—Nb
Рис. 40. Область v-фазы в сплавах систе-
мы Fe—Nb
(s-фаза) также образуется
конгруэнтно и гомогенно в
интервале составов 64—72 %
(ат.) Fe.
В работе [I] не подтверж-
дено также образование про-
межуточных фаз а и т]. Тем-
пературы нонвариантных пре-
вращений и кристаллизации
фазы е приняты из более ран-
них работ. В частности, эвтек-
тика б-Fe+e кристаллизуется
при 1372 ±2 °C, эвтектическая
точка расположена при 89,4 %
(ат.) Fe, максимальная раство-
римость ниобия в б-железе со-
ставляет 2,8 % (ат.). При
1200 °C протекает эвтектоид-
ная реакция б-Fe^s+y-Fe,
при 989 °C — перитектоидная
s + y-Fe^a-Fe. Максимальная
растворимость ниобия в y-Fe
0,6% (ат.), а в a-Fe 1,1 %
(ат.).
Сплав состава Nb48Fe52
(ц-фаза) индицируется в гек-
сагональной (ромбоэдрической)
решетке типа W6Fe7 с периода-
62
ми а=0,4926 нм, с=2,680 нм, с/а=5,441. Соединение NbFe2 относится
к семейству фаз Лавеса с решеткой типа MgZn2, а = 0,4874 нм, с=
= 0,7992; с/а= 1,629.
Методом термомагнитного анализа исследовали сплавы системы в
области существования твердых растворов на основе y-Fe [2]. Сплавы
готовили в высокочастотной вакуумной печи; слиток массой 25 кг про-
ковывали на прутки размером 8X8 мм при 1000—960 °C, которые затем
отжигали при 1250 °C.
Па рис. 40 изображена область существования у-фазы в сплавах
системы. При 1190 °C протекает эвтектоидная реакция б^у + е; при
лой температуре максимальное содержание ниобия в у-фазе составля-
ет 1 % (ат.). Эвтектоидная точка S расположена при 1,56 % (ат.) Nb.
При 960 °C протекает перитектоидная реакция y + e^tz; содержание
ниобия в a-твердом растворе при этой температуре достигает
0,72 % (ат.).
1П1БЛИОГРАФИЧЕСКИЙ СПИСОК
I. Raman А.— Proc. Indian Acad. Sci., 1967, A 65, № 4, p. 256—264.
2. Fischer W. A., Lorenz K., Fabritius H., Schlegy D. — Arch. Eisen-
hiittenw., 1970, Bd 41, № 5, S. 489—498.
ЖЕЛЕЗО — ОЛОВО
11еречень работ по изучению диаграммы состояния сплавов системы име-
ется в справочных руководствах [А, В, Г].
На рис. 41 приведена диаграмма состояния системы [1]. Сплавы
исследовали методом диффузионных пар, при этом использовали желе-
зо с содержанием 0,001 % С; 0,015 % N; 0,001 % О; <0,025 % Si;
Fe Sn, Sn Sn,7o^mj
I’iic. 41. Диаграмма состояния системы Fe— Рис. 42. Область v-фазы в
‘•и сплавах системы Fe—Sn
63
0,0001 % других элементов, а также олово чистотой 99,999 %. Отжигали
сплавы при температурах выше 910 °C 2 ч, при температурах ниже 910 °C
6 дней. При высоких температурах существуют непрерывные ряды жид-
ких растворов железа и олова. При ИЗО °C протекает монотектическая
реакция ж^у + ж2. Двухфазная область Ж]+ж2 при монотектической
температуре располагается в интервале составов 30-^70 % (ат.) Sn.
Критическая температура кривой расслоения 1630 °C. В сплавах систе-
мы существует пять интерметаллических соединений; FesSn, Fe5Sn3,
Fe3Sn2, FeSn, FeSn2. Первое из указанных соединений образуется по
перитектоидной реакции при 838 °C, остальные по перитектическим ре-
акциям при 910, 806, 770 и 513 °C соответственно.
Методом рентгеновского анализа изучали положение у-петли в
сплавах системы [2] (рис. 42). Сплавы готовили в дуговой печи с не-
расходуемым вольфрамовым электродом; шихтовыми материалами слу-
жили железо электролитическое чистотой 99,95 %, олово чистотой
99,99 %. При 1100°С границы у/(у + а) и (у + а)/а расположены при
0,71 и 1,29 % (ат.) Sn, что хорошо согласуется с расчетными данными
[3], согласно которым при 1100 °C эти концентрации соответственно
равны 0,75 и 1,34 % (ат.) Sn. В работах [4, 5] исследованы различные
участки диаграммы состояния системы; результаты этих работ учте-
ны в варианте диаграммы, приведенной на рис. 41.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Treheux D., Guiraldend Р. — Scripta Metallurg., 1974, v. 4, p. 363—
366.
2. Speight E. .4. — Metal Sci. J., 1972, v. 6, № 3, p. 57—60.
3. Hillert M. — J. Iron Steel Inst., 1967, v. 205, p. 539—541.
4. Shiraishi S. Y„ Bell EE B. — Trans. AIME, 1968, v. 77, № 6, p. 104—
105.
5. Алексанян О. T„ Кузьмин Р. ЕЕ, Матвеева ЕЕ М. — В кн.г Диаграм-
мы состояния металлических систем. М.: Наука, 1974, с. 148—151.
05, % (по массе)
Рис. 43. Часть диаграм-
мы состояния системы
Fe—Os
ЖЕЛЕЗО-ОСМИЙ
Количество исследований системы крайне огра-
ничено. Методом термического анализа спла-
вов, изготовленных из шихтовых материалов
высокой чистоты, изучали1 * влияние осмия
[до 10 % (ат.)] на температуру начала плав-
ления сплавов системы (рис. 43). Показано,
что осмий, растворяясь в железе, повышает
температуру его плавления и при 1543 °C про-
текает перитектическая реакция жЦ-у^б.
Максимальная растворимость осмия в б-Fe
составляет 2,7 % (ат.). Одновременно осмий
повышает температуру чистого железа, рез-
ко снижает температуру сс^у-превращения
последнего при нагреве и при охлаждении, а
также температуру магнитного превращения
железа [Г].
1 Buckley R. A., Hume-Rothery W7. J. — Iron Steel
Inst. (London) 1963, v. 201, p. 121—124.
64
ЖЕЛЕЗО — ПАЛЛАДИЙ
Диаграмма состояния системы железо—палладий характеризуется су-
ществованием непрерывных рядов твердых растворов между y-Fe и пал-
ладием. С достаточной степенью достоверности установлена диаграм-
ма плавкости системы и факт образования непосредственно из у-твер-
дого раствора интерметаллических соединений FePd и FePd3 [А, Б, Г],
что касается фазовых равновесий при более низких температурах, то
здесь наблюдаются определенные различия в вариантах диаграммы.
На рис. 44 приведена диаграмма по данным [1, 2]. В исследовании
[1] изучали перитектическую реакцию, протекающую в сплавах, бога-
тых железом. Для выплавки сплавов использовали железо чистотой
-99,96 % и палладий, содержащий 0,0361 % примесей. Методом терми-
ческого анализа установили, что при 1478 °C протекает превращение
б-Ре+ж^у-Fe.
РЛ,°/О (по массе)
Рис. 44. Диаграмма состояния системы Fe—Pd
3—358
65
Максимальная растворимость палладия в 6-железе достигает
3,3 % (ат.). В работе [2] изучены сплавы 31 состава. Сплавы изготов-
лены из электролитического железа и палладия с чистотой 99,99 %,
изучали фазовые равновесия при температурах ниже 900 °C. При 605 °C
в сплавах системы протекает эвтектоидная реакция: y^a + FePd. Эв-
тектоидная точка расположена при 46 % (ат.) Pd. На основе соединений
FePd и FePd3 существуют довольно широкие области твердых раство-
ров. Область твердых растворов на основе FePd смещается от стехио-
метрического состава на 7 % (ат.); составу сплава с 57 % (ат.) Pd от-
вечает наиболее высокая температура перекристаллизации y^t(FePd),
равная 790 °C. Что касается области твердых растворов на основе со-
единения FePd3, то она, наоборот, смещается в сторону сплавов, обед-
ненных палладием до 70 % (ат.); температура превращения y^(FePd3)
равна 820 °C. При 760 °C предполагается существование эвтектоидного
превращения: y^>FePd + FePd3. Растворимость Pd в ci-Fe <5 % (ат.).
Фазовые превращения в сплавах системы железо—палладий ниже
900 °C подробно исследованы также в работах [3, 4]. В этих исследо-
ваниях установлено монотектоидное превращение yi^a-hy2 ПРН 820±
±20 °C, приводящее к появлению области расслоения у-твердого рас-
твора на смесь двух изоморфных растворов yi и у2. Температура эвтек-
тоидного превращения, по данным этих работ, практически та же, что
и в более ранних работах. Температура образования соединения FePd
принята равной 790±20°С, a FePd3 820±20°С. Области гомогенности
твердых растворов на основе этих соединений значительно шире, чем
считали ранее — до 12—15 % (ат.).
Соединение FePd обладает структурой типа CuAu (£10) с гране-
центрированной тетрагональной решеткой; а = 0,386 нм, с= 0,373 нм,
da — 0,966 при 51,6% (ат.) Pd, причем с/а уменьшается с увеличением
содержания палладия. Соединение FePd3 относится к структурному ти-
пу Cu3Au (Ll2); ц = 0,385 нм при 75 % (ат.) Pd. Период решетки «-же-
леза при растворении палладия возрастает от 0,2866 нм (чистое желе-
зо) до 0,2879 нм (сплав с 2,4 % (ат.) Pd).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Gibson W. S., Hume-Rothery W. J. — Iron Steel Inst. (L.), 1958, v. 189,
p. 243—250.
2. Куприна В. В.. Григорьев А. Т. — ЖНХ, 1959, т. 4, № 5, с. 655—661.
3. Raub Е., Beeskow Н., Loebich О. — Z. Metallkde, 1963, Bd 54, S. 549—
552
4. Kussmann G., Jessen K. — Z. Metallkde, 1963, Bd 54, S. 504—510.
ЖЕЛЕЗО — ПЛАТИНА
Диаграмма состояния системы характеризуется существованием широ-
кой области твердых растворов между y-Fe и платиной. Платина до-
вольно резко снижает температуру точки А3; при 0 °C растворимость
платины в a-Fe составляет ~20 % (ат.). Из у-твердого раствора при
понижении температуры образуются три интерметаллических соедине-
ния Fe3Pt, FePt, FePt3 [А, Г].
В работе [1] методом термического анализа исследовали сплавы си-
стемы с содержанием до 10 % (ат.) Pt. Сплавы синтезировали из плати-
ны чистотой 99,99 % и высокочистого железа. Платина повышает тем-
пературу точки At. При 1519 °C протекает перитектическая реакция
б + ж^у. При дальнейшем увеличении содержания платины наблюда-
ется образование слабо выраженного минимума, температура которого
совпадает практически с температурой перитектической реакции
(рис. 45).
66
В работе [2] методом высокотемпературного рентгеновского анали-
.4.1 исследовали сплавы системы в области существования фазы FePt3.
Максимум y=pt(FePt3)-превращения наблюдается примерно при 1350°C,
а превращения y^(FePt) при ~1300сС.
Pt, % (по пассе)
Рис. 45. Диаграмма состояния системы Fe—Pt
В работе [3] исследовали термодинамические свойства сплавов же-
леза с платиной методом э. д. с. Система железо—платина характери-
зуется отрицательными отклонениями от идеального поведения и слож-
ным видом зависимости термодинамических функций смещения от со-
става. Упорядочение Fe3Pt является фазовым переходом I рода,
АНупоряд = —20,75 кДж/кг. По-видимому, упорядочение FePt3 относится
к фазовым переходам II рода.
3*
67
Соединение FePt относится к структурному типу CuAu, а=
= 0,2719 нм, с— 0,3722 нм, cfa —1,369. Упорядоченные фазы Fe3Pt и
FePt обладают структурой типа Cu3Au (Ll2).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Buckley R. A., Hume-Rothery W. J. — Iron Steel Inst (L.), 1959,
v. 193, p. 61—62.
2. Crandle J., Shaw J. A. — Phil Mag., 1962, v. 7, p. 207—212.
3. Сундаресен M., Герасимов Я. И., Гейдрих В А., Васильева И. А. —
ЖФХ, 1963, т. 37, № 11, с. 2462—2466.
ЖЕЛЕЗО — ПЛУТОНИЙ
Диаграмма состояния системы приведена на рис. 46. В сплавах этой си-
стемы [1, 2] кристаллизуются две эвтектики: ж^у-Её+ЕегРи при
t,°C
5-Fe-
1200
1000
Ри, % (по массе)
20 90 50 60 10 75 80 85 90 95 97 99
500
° 1 и т f.C'Pf'S
№4°С\
910°С
ЪЛ41О±4°С
100
+-1165°С
1 I 18
ГУ-Fe
450
FePu+
бГ-Рщ
^\°95 97,5
кРи,% (ат.)
800
600
a-Fe
400
200
428°С
сх-Ри
с- Ри
415°СУ
г-Рц„
< 640°С
\430°С
\гО'-Р\\
-J*-Pu
,Я25°С
,-225°0
~435°0
10 20
90 50 60
Ри,°/О(ат.).
90 100
Ри
Рис. 46. Диаграмма состояния системы Fe—Ри
1165 СС; эвтектическая точка отвечает 18 % (ат.) Ри; ж^б-Ри + ЕеРи6
при 413 °C и —90 % (ат.) Ри; образуется два интерметаллических со-
единения Fe2Pu и FePue- Первое из этих соединений плавится конгру-
энтно при 1240 СС, второе образуется по перитектической реакции ж+
+ Fe2Pu^tFePu6 при 428 °C. Указанные соединения не обладают замет-
ными областями гомогенности. Фазовые превращения в сплавах на ос-
нове плутония отличаются большой сложностью в связи с пятью поли-
морфными превращениями, претерпеваемыми этим металлом. Плутоний
плавится при 640°С. При 462 °C протекает перитектоидная реакция
Е-Ри+б'-Ршрьб-Ри, а при 430 °C — кататектическая е-Ри^ж + б-Ри.
Превращения б-Pu^y-Pu, у-Ри«^[3-Ри, P-Pu+*a-Pu соответственно про-
текают при 325; 225 и 135 °C.
68
Соединение Fe2Pu относится к семейству фаз Лавеса и имеет куби-
ческую структуру типа MgCu2 с периодом 0,719 нм.
Соединение FePu6 имеет объемноцентрированную тетрагональную
структуру, изоморфную MnUe, а = 0,5349 нм, с= 1,0405 нм.
Ы1БЛИОГРАФИЧЕСКИЙ СПИСОК
1. Maradon Р. G. — J. Inst. Metals, 1957—1958 v. 86, р. 166—171.
2. Бочвар А. А. — В кн.: Труды II Международной конференции по
мирному использованию атомной энергии. Доклады советских уче-
ных, Т. 3. Ядерное горючее и реакторные металлы. М.: Атомиздат,
1959, с. 376—395.
ЖЕЛЕЗО — ПРАЗЕОДИМ
Диаграмма состояния системы (рис. 47) приведена по данным [Д].
В сплавах системы образуется два интерметаллических соединения
Fei7Pr2 и Fe2Pr [1—-8]. Первое из них наблюдали при микроструктурном
Рис. 47. Диаграмма состояния системы Fe—Рг
69
исследовании в интервале составов 11,1—16,7 % (ат.) Рг [4, 6]; мето-
дом нейтронной дифракции установили, что соединение имеет ромбоэд-
рическую структуру типа Th2Zni7 [8] с периодами а=0,858 нм, с=
= 1,247 нм [2].
Соединение Fei7Pr2 образуется по перитектической реакции при
1108 °C, а соединение Fe2Pr при —1030 °C. Чистый празеодим плавится
при 918 °C, а при 790 °C претерпевает полиморфное а+*|3-превращение.
При —620 °C и 79 °/о (ат.) Рг кристаллизуется эвтектика Fe2Pr+tz-Pr.
Растворимость железа в а-Рг <1 % (ат.).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Крипякевич П. И., Франкевич Д. П„ Заречнюк О. С. — В1сн. Льв1в.
Ун-ту. Сер. xiM., 1965, вып. 8, с. 61—74.
2. Крипякевич П. И., Франкевич Д. П. — Кристаллография, 1965, т. 10,
№ 4, с. 560.
70
3. Bushow к. FI. J. — J. Less-Common Metals, 1966, v. 11, № 3, p. 204—
208.
4. Ray A. E. — Acta Cryst., 1966, v. 21, № 3, p. 426—430.
5. Johnson Q., Wood D. H., Smith G. S., Ray A. E.—Acta Cryst., 1968,
v. 24, № 2, p. 274—276.
6. Ray A. E., Strnat K., Feldman D. — In: Rare Earth Research. T. II:
Proc. Third. Conf., 1963, N.-Y.: 1964, p. 443—457.
7. Strnat K., Hoffer G., Ray A. E. — IEEE Trans. Magnet, 1966, v. 23,
p. 489—493.
8. Weik FI., Fischer P., Haig W., Stoll E. — В кн.: Rare Earth Research
T. Ill: Proc. Fourth Conf., 1964, N.-Y.: 1965, p. 19—25.
ЖЕЛЕЗО — ПРОМЕТИЙ
Гипотетическая диаграмма состояния системы приведена на рис. 48 [Д];
построена на основании близости электронного строения и химических
свойств прометия с празеодимом и неодимом, исходя из предположения,
что в этой системе также образуется два интерметаллических соедине-
ния и кристаллизуется эвтектика Fe2Pm + a-Pm.
ЖЕЛЕЗО - РАДОН
На основании исследований сделано предположение, что железо и ра-
дон не образуют ни твердых растворов, ни соединений.
ЖЕЛЕЗО —РЕНИЙ
На основании исследования [1] сплавов системы методами термическо-
го, микроструктурного и рентгеновского анализов построили диаграмму
состояния в области составов до
70 % (по массе) Re (рис. 49).
Установлено существование двух
соединений: т^-фазы, содержащей
20—60 %, (по массе) Re и ста-
бильной выше 1205 °C и е-фазы,
содержащей 70 % (по массе) Re
и устойчивой в исследованном ин-
тервале температур. Согласно
[А], приведенную диаграмму со-
стояния нельзя считать равновес-
ной. Она отражает только взаи-
модействие фаз. В дальнейших ис-
следованиях подтверждено суще-
ствование фазы е [2—3] и уста-
новлено образование, двух новых
соединений у' [4] и Re3Fe2 [5].
Имеющиеся сведения по диаграм-
ме состояния требуют дальнейше-
го уточнения.
Фаза е, отвечающая стехио-
метрическому составу Fe3Re2, име-
ет структуру о-фазы [2]. Выше
1050 °C она находится в равнове-
сии с y-Fe [4]. Фаза у, содержа-
щая ~60 % (по массе) Re, име-
ет структуру типа tz-Mn с упоря-
доченным распределением атомов
Рис. 49. Диаграмма состояния системы
Fe—Re
71
в элементарной ячейке, период которой а=0,8960 нм, и находит-
ся в равновесии с a-Fe и y-Fe [4]. Структура соединения Fe2Re3, содер-
жащего ~40 % (ат.) Fe, кубическая примитивная типа |3-Мп с а=
=0,643 нм [5].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Eggers И. — Mitt. Kaiser-Wilhelm-Inst. Eisenforsch., 1938, v. 20,
p. 147—153; Metallurgist, 1939, v. 28, p. 22—24
2. Niemec J., Trzebiatowski A.— Bull. acad. polon. sci., 1956, v. 4,
p. 601—603; Met. Abstr., 1957, v. 24, p. 819.
3. Агеев H. В., Шехтман В. Ш. — ДАН СССР, 1959, т. 127, № 5,
с. 1011 — 1013.
4. Агеев И. В., Шехтман В. Ш. — ДАН СССР, 1962, т. 143, № 5,
с. 1091 — 1093.
5. Кузьма Ю. Б., Крипякевич П. И. — Кристаллография, 1965, т. 10,
№ 4, с. 558—559.
системы
Рис. 50. Диаграмма состояния
Fe—Rh
ЖЕЛЕЗО — РОДИЙ
В сплавах системы (рис. 50)
при 1515 °C протекает перитек-
тическая реакция 6-Fe [2,9 %
(ат.) RhJ + ж [4,3 % (ат.) Rh>±=
^y-Fe [3,4% (ат.) Rh] [1].
Область ж-j-y очень узкая, и
положение минимума на кри-
вых ликвидус и солидус опре-
делить трудно. Непрерывный
ряд твердых растворов с г. ц. к.
решеткой — у-фаза — сущест-
вует при температурах выше
750—1450 °C в зависимости от
содержания родия в сплавах.
При эквиатомном составе при
1450 °C образуется соединение
FeRh (а'), имеющее упорядо-
ченную решетку типа CsCl
[2—5]. При 20% (ат.) Rh и
распадается на фазы а и а'.
750 °C у-твердый раствор эвтектоидно распадается на фазы а и а'.
Диаграмма давление — температура для сплава с 47 % (ат.) Fe и
53 % (ат.) Rh построена в работе [6].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Gibson W. S., Hume-Rothery IF.— J. Iron a. Steel Inst, 1958, v. 189,
№ 3, p. 243—250.
2. Konvel J. S., Hartelius С. C. — J. Appt Phys, 1962, v. 33, p. 1343—
1344.
3. De Bergevin F., Muldawer L. — Comt. Rend., 1961, v. 152, p. 1347—
1349.
4. Muldawer L., de Bergevin F. J.—Chem. Phys., 1961, v. 35, p. 1904—
1905.
5. Chao Clinton C., Duwez Pol, Tsuei Chang — J. Appl. Phys., 1971, v. 42,
№ 11, p. 4282—4284.
6. Leger J. M.. Susse C„ Vogar B. — Cr. acad. Sci., 1967, v. C265, № 10,
p 892—895.
72
ЖЕЛ ЕЗО — РТУТЬ Fe, % (попассе)
12 3 4 5 6-10'л
Определяли растворимость железа
в ртути при 29 °C [А, В]. Однако
приводимые значения сильно раз-
личаются между собой: от 10-2 до
1,5-10-5 % (по массе) Fe. По дан-
ным калориметрического и спек-
трального анализов [1], в ртути
при комнатной температуре рас-
творяется 5,7-10~7 % (по массе)
Fe; при этом растворимость мало
меняется в интервале температур
20—211 °C [2]. Растворимость же-
леза в ртути может быть описана
[3] уравнением lg[°/o (ат.) Fe] =
=—1200/Г—2,41 для интервала
температур 0—700 °C (рис. 51).
По данным рентгеновского,
химического и ряда других мето-
дов исследования установлено,
что железная амальгама представ-
ляет собой суспензию мелкодис-
персных частиц железа в ртути
[А, В].
библиографический список
1. W de J. F„ Haul R. А.— 7. anorg. Chem., 1954, Bd 277, S. 96—112.
2. Palmer E. — Z. Elektrochem., 1932, Bd 38, S. 70—76.
3. Marschall A. L„ Epstein L. E., Norton F. J. — J. Amer. Chem. Soc.,
1950, v. 72, p. 3514—3516.
ЖЕЛЕЗО — РУБИДИЙ
Рубидий нерастворим 1 в твердом железе.
ЖЕЛЕЗО — РУТЕНИЙ
Диаграмма состояния системы [1—3], представлена на рис. 52. Иссле-
дование выполнено методами микроструктурного, рентгеновского, тер-
мического и дилатометрического анализов. Перитектическая реакция ж +
+ у^=>6 протекает при 1536 °C. Вторая перитектическая реакция, в кото-
рой участвует твердый раствор на основе рутения, содержащий <35 %
(ат.) Ru, и у-твердый раствор с содержанием —29 °/о (ат.) Ru, проте-
кает при 1590 °C. При 500 °C протекает эвтектоидный распад у-твердо-
го раствора на a-Fe и твердый раствор на основе рутения. Предельная
концентрация рутения в a-твердом растворе составляет 4,8 % (ат.). Эв-
тектоидная точка расположена при 9,3 % (ат.) Ru.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Gibson W. S.. Hume-Rothery W. J.— J. Iron Steel Inst. (L.), 1968,
v. 189, p. 243—250.
2. Obrowski W.— Naturwissenschaften, 1959, Bd 46, № 9, S. 624—625
3. Raub E., Plate W. — Z. Metallkde, 1960, Bd 51, № 7, S. 477—481.
1 Wefer F. — Arch. Eisenhuttenw., 1928—29, Bd 2, S. 739—746.
73
Ru, % (по пассе)
t°c
2200
2000
1800
1600
1400
1200
1000
600
600
400
200
О 10 20 30 40 SO 60 70 80 90 100
Fe Ru, °/o (am.) Ru
Рис. 52. Диаграмма состояния системы Fe—Ru
Рис. 53. Диаграмма состояния системы
Fe—Sm
ЖЕЛЕЗО — САМАРИЙ
Диаграмма состояния системы1
представлена на рис. 53. Сплавы
изготавливали из железа чистотой
99,99 %, и самария чистотой 99,9 %
путем плавки в корундовых тиг-
лях в вакууме. Исследование вы-
полняли методами рентгеновского
и термического анализов.
В сплавах системы существу-
ют три интерметаллических соеди-
нения: SmFe2, SmFe3, Sm2Fei7, ко-
торые образуются по перитектиче-
ским реакциям при 900, 1010 и
1260 °C соответственно. При 720 °C
1 Buschow К. Н. — J. Less-Common
Metals, 1971, v. 25, Ns 2, p. 131—134.
74
кристаллизуется эвтектика Sm+SmFe2; эвтектическая точка расположе-
на при ~25 % (зт.) Fe. Взаимной растворимости компонентов не обна-
ружено. Соединение SmFe2 обладает кубической решеткой типа MgCu2,
а ==0,7417 нм, а соединение SmFes—ромбоэдрической решеткой типа
PuNi3, а = 0,5187 нм, с = 2,4910 нм; также ромбоэдрическую решетку
имеет соединение Sm2Fei7, тип Th2Znt7.
ЖЕЛЕЗО — СВИНЕЦ
Ранее полагали [А], что железо и свинец практически не взаимодейст-
вуют друг с другом ни в жидком, ни в твердом состоянии, диаграмму
состояния этой системы изображали в виде двух горизонтальных ли-
ний, одна из которых отвечала температуре плавления свинца, а вто-
Рис. 54. Взаимная растворимость Fe и РЬ в жидком состоянии
75
рая — железа. В дальнейшем было установлено *, что в сплавах системы
при 1535 °C протекает монотектическая реакция; растворимость свинца
в жидком железе при этих условиях составляет —0,07 % (ат.) —рис. 54.
ЖЕЛЕЗО — СЕЛЕН
селеном
Взаимодействие железа с
тилетий [А, Б, Г].
Диаграмма состояния
лена на рис. 55. Сплавы
изучается в течение многих деся-
по данным работы [1], представ-
системы,
изготавливали ампульным методом, исполь-
Рис. 55.
Fe—Se
Диаграмма состояния системы
зуя в качестве лигатур соеди-
нения FeSe и FeSe2. Лигатуры
выплавляли из железа чистотой
99,99 %, аналогичную чистоту
имел селен. Исследование про-
водили методами термического
и рентгеновского анализа.
В сплавах системы при
1520 ±5 °C протекает монотек-
тическая реакция расслоения
на две жидкие фазы. Монотек-
тическая точка расположена
при — 5 % (ат.) Se. В сплавах
с содержанием железа до 35 %
(ат.) установлен тепловой эф-
фект при 1490 °C, причина ко-
торого пока не установлена.
При 1400+5 °C протекает
^6-превращение железа. При-
рода термического эффекта
в сплавах, богатых железом
пока тоже не установлена.
В сплавах системы при
температуре — 1000 °C кри-
сталлизуется с открытым мак-
симумом соединение "FeSe",
которое обладает значительной
областью гомогенности, а при
385 °C претерпевает полиморф-
ное превращение.
Со стороны селена при
790+5 °C в интервале составов
73,9—99,98 % (ат.) Se протекает вторая монотектическая реакция. Ку-
пол расслоения не симметричен и смещен в сторону селена. При 585 °C
образуется соединение FeSe2 по перитектической реакции, а при 220 °C
протекает вырожденная перитектическая реакция, связанная с образо-
ванием твердого раствора железа в селене.
Соединение FeSe существует в двух модификациях: ниже 385 °C
устойчива tz-модификация, которая обладает тетрагональной структу-
рой типа (В 10) с периодами а—0,3773 нм, с—0,5529 нм, с/а= 1,466;
при температурах выше 385 °C устойчива ^-модификация, обладающая
структурой типа NiAs (В8).
Исследованиями [2, 3] значительно уточнен характер фазовых пре-
вращений в сплавах системы, что позволило представить диаграмму со-
1 Lord А. Е., Partlee N. А. — Trans. AIME, 1960, v. 218, р. 644—646.
76
стояния в более сложном виде — рис. 56 [Д]. В сплавах системы су-
ществуют два соединения постоянного состава Fei,04Se (фаза (3) и
FeSe2 (фаза е), а также ряд фаз переменного состава 6, 6', у, у' со
структурой типа NiAs.
Моноселенид Fei^Se существует при 49,0—49,4 % (ат.) Se и об-
разуется при 475 °C по перитектоидной реакции; обладает тетрагональ-
Рис. 56. Диаграмма состояния системы Fe—Se
ной структурой типа РЬО, периоды которой совпадают с приведенны-
ми в работе [1].
Фаза 6 со структурой типа NiAs, гомогенная в интервале 49—56 %
(ат.) Se при 900 °C; в процессе нагрева претерпевает полиморфное пре-
вращение и при 1065 °C для состава 52,8 % (ат.) Se переходит в фазу
6', которая плавится при 1075 °C.
Ниже 728 “С фаза 6 находится в равновесии с у'-фазой. При уве-
личении содержания селена реализуется Х-переход, связанный с пере-
стройкой гексагональной структуры в искаженную моноклинную, отве-
77
чающую у'-фазе Область гомогенности этой фазы при 550 °C очень уз-
кая и не превышает 0,3 % (ат.) Se. В интервале составов 54,6—56,4 %
(ат.) Se существует двухфазная область у'+у. Фаза у также обладает
моноклинной структурой, но период с у этой фазы вдвое больше, чем
у у'. Фаза у образуется по перитектической реакции при 728 °C и 58,5 %
(ат.) Se. Область гомогенности этой фазы при 585 °C расположена в пре-
делах 56,7—61,5 % (ат.) Se. При этой же температуре по перитектиче-
ской реакции образуется е-фаза на основе соединения FeSe2. Кристал-
лическая структура е-фазы орторомбическая.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Dutrizac J. Е., Janina М. В., Togure J. М. — Canad. J. Chem., 1968,
v. 46, № 8, р. 1171—1174.
2. Schuster W„ Mikler H., Komarek К. Z.— Zvlonatsh. Chem., 1979,
Bd 110, № 10, S. 1153- 1157.
3. Svendsen S. P.— Acta Chem. Scanat, 1972, v. 26, p. 3757—3761.
ЖЕЛЕЗО — СЕРА
Диаграмма состояния системы достаточно подробно исследована толь-
ко в области составов до 50 % (ат.) S из-за большого различия в фи-
зико-химических свойствах компонентов.
В обобщенном виде, с учетом данных работ, подробно рассмотрен-
ных в справочниках [А, В, Г], диаграмма приведена на рис. 57; часть
диаграммы, примыкающая к чистому железу дана на рис. 58.
В сплавах системы образуются два соединения: FeS и FeSs. Моно-
сульфид железа обладает довольно широкой областью гомогенности.
При 1365 °C в сплавах протекает кататектическая реакция: б^у + ж.
Максимальная растворимость серы в у-твердом растворе составляет
0,09 % (ат.), или 0,05 % (по массе). При 988°C кристаллизуется эвтек-
тика y + FeS; эвтектическая точка расположена при 44 % (ат.) S. При
913 °C протекает перитектоидное превращение y + FeS^a. Максималь-
ная растворимость серы в a-Fe составляет 0,035 °/о (ат.). В работе [1]
показано, что растворимость серы в a-Fe в зависимости от температуры
хорошо описывается уравнением: lg S =—3800/74-1,44, где Т — темпе-
ратура, К; S — сера, % (по массе). Теплота растворения серы в a-Fe
определена равной 405 ±260 кДж/кг.
В работе [2] изучали давление диссоциации сульфидов железа, ис-
пользуя метод определения паров серы по точке росы.
На рис. 59 показана проекция Т—х общей Р—Т—х диаграммы, эле-
менты которой были исследованы в рассмотренной работе. Авторы ра-
боты [2| отмечают, что диаграмма состояния системы изучена еще не
полностью, особенно в области сплавов, богатых серой. В частности,
в самой работе [2] не нашла никакого отражения нонвариантная ре-
акция эвтектического типа при 1082 °C. По диаграмме Р—х, построен-
ной в этой же работе, хорошо прослеживается влияние давления на по-
вышение температуры нонвариантной реакции при 743 °C, связанной с
образованием дисульфида FeSg-
В работе [3] была предпринята попытка на основании измерения
упругости паров серы над расплавом железа, содержащим до 38,35 %
(по массе) S, рассчитать изменение активности, теплоты и энтропии
смешения в зависимости от содержания серы в расплаве; расчет про-
вели для температуры 1400 “С.
Полученные термодинамические параметры служили основой для
расчета части диаграммы состояния системы.
78
8, % (по массе)
1----------Г
1539°С ж
0,056
S, % (по массе)
0,1 0,2 0,3
t°c
1500
1400
1300
1200
1100
1000
900
800
^-Fe+FeS
- 0,023 j 988°С
0,009 Q13°c
0,035
I or - Fe + FeS
169 °C___
I -I_____
0 0,2 0,6
Fe $,70 (am.) 5
Рис. 58. Часть диа-
граммы состояния
системы Fe—S
Рис. 57. Диаграмма
состояния системы
Fe—S
Фаза FeS при содержании свыше 51 % (ат.) S обладает структу-
рой типа NiAs (В8). Периоды решетки типа NiAs в сплаве с 50 %
(ат.) S: а = 0,345 нм; с=0,588 нм, с/(2=1,7О.
Фаза FeS2 существует в виде двух модификаций: кубического пи-
рита (тип С2) и ромбического марказита (типа С18). Период решетки
пирита (2 = 0,5405 нм; периоды решетки марказита: (2 = 0,4445 нм; Ь =
= 0,5425 нм; с=0,3388 нм. Температура превращения марказита в пи-
рит при нагреве 365 °C.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
J. Herrnstein W. И., Beck F. FL, Fontana М. G. — Trans. AIME, 1968,
v. 242, № 6, р. 1049—1056.
79
Р$=1000 кПа
138°С
/э Fe5z 1
Y ‘Fe^S+м+Г I |l
£Г I 1Х ♦ 743°С II.
fe,.xS tFeS,+1—-U.
—1202£.\\г^^г ||
\119°С '
t,°c
1200
1000
800
600
400
200
О
35 40 45 50 55 60 95 WO
5, % (no массе)
Рис. 59. Часть диаграммы состояния системы Fe—S при
Р=0,1 МПа
2. Быстров В. П., Бабашов И. С., Ванюков А. В. — Цветные металлы,
1971, № 6, с. 21—25.
3. Schilzmann Е. — Giessereiforschung, 1972, Bd 24, № 1, S 14—16.
ЖЕЛЕЗО — СЕРЕБРО
Железо практически не взаимодействует с серебром ни в жидком, ни в
твердом состоянии. При сплавлении этих двух металлов в любом со-
отношении наблюдается расслоение жидкости. При 1600 °C в жидком
серебре растворяется 6-10~4, а при 1000 °C — 4-10~4 % (по массе)
Fe [1].
В работе [2], используя метод контактной диффузии, исследовали
растворимость серебра в y-Fe в широком интервале температур. Для
интервала температур 1234—1665 К получено аналитическое выражение,
описывающее насыщение y-Fe жидким серебром: JgAg =—6027/7+
+ 2,289, где Ag — серебро, % (по Массе).
Данные о растворимости серебра, рассчитанные по этой зависимо-
сти, приведены ниже:
Температура Ag, % (по массе) Температура Ag, % (по массе)
к °C К cc
1234 961 0,0025 1473 1200 0,0157
1273 1000 0,0036 1573 1300 0,0287
1373 1100 0,0079 1665 1392 0,0470
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R., Massenhausen W. — Arch. Eisenhiittenw., 1956, Bd 27, S.
143—147.
2. Wriedt H. A., Morrison W. B., Cole W. E. — Aletal Trans., 1973, v. 4,
p. 1453—1456.
80
ЖЕЛЕЗО — СКАНДИЙ
Диаграмму состояния системы (рис.
ференциального термического [1, 7],
новского [1, 7], дилатометрического
60) исследовали методами диф-
микроструктурного [1, 7], рентге-
[1] и локального рентгеноспект-
Ге7%/по массе)
Рис. 60. Диаграмма состояния системы Fe—Sc
рального [7] анализов. В более ранних работах изучали кристалли-
ческую структуру соединения Fe2Sc [2—4] и определяли раствори-
мость скандия в железе [5].
Для приготовления сплавов [1] использовали железо чистотой
99,91 Fe и скандий после вакуумной дистилляции чистотой 99,8 %.
Сплавы получали в дуговой печи на водоохлаждаемом медном поду
с нерасходуемым вольфрамовым электродом в атмосфере очищенного
гелия. В результате исследования установили существование соедине-
ний Fe2Sc и FcSc3. Соединение Fe2Sc плавится конгруэнтно при
1600 °C и входит в состав двух эвтектик: ж^а-Ре + Ре28с и ж^
=p*Fe2Sc-Fp-Sc, образующихся при температурах 1200 и 910 ° С, и
содержании скандия в эвтектической точке ~ 9 и 80 % (ат.) соответ-
ственно. Соединение FeSc3 образуется по перитектоидной реакции
Fe2Sc+ p-Sc+±FeSc3 при 800 ° С и участвует в эвтектоидной реакции
P-Sc^Fe3Sc3+a-Sc при 750 ° С.
Сплавы для исследования [7] синтезировали в электродуговой
печи в атмосфере аргона, используя скандий чистотой 99,9 % и карбо-
нильное железо (99,91 %). Подтверждено существование соединения
81
Fe2Sc, плавящегося конгруэнтно при 1565 ° С. Эвтектики a-Fe+Fe2Sc
и Fe2Sc+|3-Sc кристаллизуются при 1280 и 975 ° С соответственно.
Установлено наличие температурного (Х]+±А3) и концентрационного
(Zi^tZ2^±Z3) полиморфизма фазы Лавеса Fe2Sc. Найдена фаза соста-
ва FeSc7, которая образуется в результате реакции Fe2Sc-h Sc^Sc7Fe.
Соединение FeSc3 не обнаружено.
Легирование железа скандием повышает температуру у+*р-прев-
ращения до 925 ° С [1] и снижает температуры превращений Р^а
до 723 [1].
Растворимость скандия в a-Fe мала и составляет менее 0,5 %
(ат.) [1], что согласуется с данными работы [5]; растворимость желе-
за в скандии также менее 0,5 % (ат.) при комнатной температуре, а
при 700 ° С составляет 0,8 % (ат.) [1].
Соединение Fe2Sc относится к семейству фаз Лавеса. Его высо-
котемпературная модификация имеет структуру типа MgNi2(Z3) с
периодами решетки п = 0,7974 нм; с= 1,6290 нм [7]; п = 0,4972 нм; с =
= 1,6278 нм [2]. Низкотемпературная модификация кристаллизуется
со структурой типа MgZn2(Zi) a = 0,4977 нм; с = 0,8146 нм [7]; ц =
= 0,495 нм; с = 0,815 нм [4]. При содержании 36,5 % (ат.) Sc найдена
кубическая модификация фазы Лавеса Л2 со структурой типа MgCu2,
a=0,7039 нм [7], a = 0,7090 нм [3].
Структура соединения FeSc7 не установлена.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Наумкин О. П, Терехова В. Ф., Савицкий Е. М. — Изв. АН СССР.
Металлы, 1969, № 3, с. 161—165.
2. Dwight А. Е. — Trans. ASM, 1961, v. 53, р. 479—500.
3. Гладышевский Е. И., Крипякевич П. И., Кузьма Ю. Б., Прота-
сов В. С. — В кн.: Вопросы теории и применения редкоземельных ме-
таллов. М.: Наука, 1964, с. 153—154.
4. Протасов В. С., Крипякевич П. И., Черкашин Е. Е. — Кристаллогра-
фия, 1966, т. 11, вып. 4, с. 689—692.
5. Hellawell A. J. — Less-Common Metals, 1962, v. 4, № 1, р. 101—103.
6. Ikeda К., Nakamichi Т., Yamada Т., Yamamoto М. — J. Phys. Soc.,
Jap., 1974, v. 36, № 2, p. 611.
7. Бодак О. И., Котур Б. Я., Гавриленко И. С. и др. — ДАН УССР,
Сер. А, 1978, № 4, с. 366—371.
ЖЕЛЕЗО — СТРОНЦИЙ
Сведения о диаграмме состояния системы отсутствуют. Приготовле-
ние сплавов сопряжено с трудностями, так как температура кипения
стронция ниже температуры плавления железа. Сообщается [1] о
способе приготовления сплавов из ртутной амальгамы этих метал-
лов, при котором ртуть удаляют испарением, а полученную смесь
сплавляют. Стронций нерастворим в твердом железе [2, 3].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Шапошников А. А., Сиходский В. А. — Цветные металлы, 1932, № 1,
с. 100.
2. Wever F. — Arch. Eisenhuttenw., 1929, Bd 2, № 11, S. 739—746.
3. Wever F. — Nalurwissenschaften, 1929, Bd 17, № 18/19, S. 304—309.
82
ЖЕЛЕЗО — СУРЬМА
Диаграмма состояния этой системы исследована достаточно подробно
|А, Г], на рис. 61 она представлена по данным [1]. Сплавы для иссле-
дования изготавливали в высокочастотной печи в атмосфере гелия.
I [сходными материалами служили карбонильное железо, отожженное
в вакууме, и сурьма чистотой 99,999 %- Исследование выполнили ме-
Рис. 61. Диаграмма состояния системы Fe—Sb
83
•годами термического, микроструктурного анализов и измерением мик-
ротвердости.
Фаза FeSb(p) образуется конгруэнтно при температуре — 1020 °C
и имеет широкую область гомогенности, простирающуюся при 600 ° С
от 42,0 до 48,0 % (ат.) Sb, а при комнатной температуре от 42,5 до
48,25 % (ат.) Sb. При 996 ° С и 34,6 % (ат.) Sb кристаллизуется эвтек-
тика a-Fe+FeSb. При 738 ° С по перитектической реакции ж + FeSb^
4=tFeSb2 образуется еще одно интерметаллическое соединение —
FeSb2; область его гомогенности — 1 % (ат.). При 614°C и —99,2%
(ат.) Sb кристаллизуется эвтектика FeSb2+Sb.
Структура P-фазы типа NiAs (88), а = 0,413 нм, с=0,517 нм,
с/а= 1,253.
Фаза FeSb2 имеет ту же структуру, что и марказит FeS2 (тип
С18), а = 0,3195 нм, 6 = 0,583 нм, с = 0,653 нм.
В работе [2] исследовали термодинамические свойства сплавов
системы железо •— сурьма методом э. д. с.; определена кривая плавко-
сти системы железо — сурьма в пределах 0—25 % (ат.) Fe.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Пантелеймонов Л. А., Бадтиев Э. Б. — Деп. в ВИНИТИ, 1973,
№ 6458—73.
2. Вечер А. А., Гейдрих В. А., Герасимов Я. И. — ЖФХ, 1961, т. 25,
с. 1578—1585.
ЖЕЛЕЗО — ТАНТАЛ
Взаимодействие железа с танталом приводит к образованию интер-
металлического соединения Fe2Ta. Особенности строения диаграммы
состояния системы, отражающие существование этого соединения, до-
статочно хорошо представлены в литературе [А, Г].
В работе [1] методом диффузионных пар установлено, что в этой
системе, помимо соединения Fe2Ta, образуется также соединение FeTa.
На рис. 62 приведена диаграмма состояния системы, на которой
отражено образование двух соединений: Fe2Ta и FeTa. Соединение
FeTa плавится с открытым максимумом выше 1800 ° С. При 1650 ° С
и 64 % (ат.) Та кристаллизуется эвтектика FeTa+Ta. Предел раство-
римости железа в тантале не установлен, но, очевидно, превышает
5 % (ат.) при температуре эвтектики.
Фазовые равновесия в сплавах системы со стороны железа ис-
следованы в работе [2]. Для приготовления сплавов использовали же-
лезо чистотой 99,96—99,97 % и тантал чистотой 99,99 %. Сплавы
изготавливали в дуговой печи в атмосфере аргона и гомогенизировали
при 1425 ° С в течение 2—3 ч с последующим медленным охлажде-
нием. Исследование выполняли методами микроструктурного, терми-
ческого и дилатометрического анализов.
В сплавах системы наблюдается довольно широкая область твер-
дых растворов на основе б-железа. При 1440±2°С кристаллизуется
эвтектика б-Fe (твердый раствор)+Fe2Ta; эвтектическая точка распо-
ложена при 7,9 % (ат.) Та; при 1440 ° С в б-твердом растворе содер-
жится 2,8 % (ат.) Та. При 1239±3°С б-твердый раствор претерпева-
ет эвтектоидное превращение 6^y + Fe2Ta. Эвтектоидная точка
отвечает составу 1,1 % (ат.) Та, а растворимость тантала в у-фазе
при 1239° С составляет 0,5 % (ат.). При 972±3°С протекает пери-
тектоидная реакция образования твердого раствора на основе a-Fe.
Предельная растворимость тантала в a-Fe при этих условиях состав-
ляет 0,6 % (ат.).
84
Та, °/о(ат.)
Рис. 62. Диаграмма состояния системы Fe—Та
Растворимость тантала в a-Fe при 600—900 ° С изучали в работе
[3]. Для приготовления сплавов использовали железо чистотой 99,96 %
(по массе) с содержанием 0,03 % (по массе) О и 0,003 % (по массе)
С, а также тантал высокой чистоты. Сплавы получали в дуговой печи
с нерасходуемым вольфрамовым электродом, а затем отжигали при
700 ° С в течение 100 ч в откачанных кварцевых ампулах и охлажда-
ли с печью. Исследование выполнено методом рентгеновского анализа.
При 700°С в a-Fe растворяется 0,17 % (ат.) Та, а при 900°С —
0,28 % (ат.). При содержании 0,28 % (ат.) Та период решетки а-твер-
85
дого раствора составляет 0,2867 нм, в то время как чистого железа —
0,2866 нм.
Изучали растворимость тантала в а- и y-Fe [4]. Сплавы готовили
в высокочастотной вакуумной печи. Слиток массой 25 кг проковывали
на пруток размером 8x8 мм при 1000—950 ° С и отжигали при
1250 ° С. Шихтовым материалом служили железо высокой чистоты с
содержанием 0,001—0,008 % С; 0,001—0,005 % Si; 0,001—0,002 % Мп;
0,003—0,004 % Р; 0,003—0,004 % S, а также тантал высокой чистоты.
В сплавах системы выше образуется интерметаллическая е-фаза
(Fe2Ta), что приводит к появлению двухфазной области у + Е. При
1215 ° С протекает эвтектоидная реакция 6=«=ty4-E; при этой темпера-
туре максимальное содержание тантала в у-фазе составляет 0,86 %
(ат.). Эвтектоидная точка расположена при 1,38 % (ат.) Та. При
965 ° С протекает перитектоидная реакция у + в=₽т; содержание тан-
тала в a-твердом растворе при этой температуре достигает 0,71 %
(ат.).
Соединение Fe2Ta по своей кристаллохимической природе отно-
сится к фазам Лавеса с кристаллической решеткой типа MgZn2; пе-
риоды ее « = 0,4816 нм, с = 0,7868 нм, с/а= 1,633.
Соединение FeTa также обладает гексагональной кристаллической
решеткой типа MgZn2; предполагают [1], что при образовании этого
соединения часть атомов железа в соединении Fe2Ta замещается тан-
талом.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Бурлаков В. Д., Коган В. С. — ФММ, 1959, т. 7, вып. 5, с. 708—712.
2. Sinha А. К-, Hume-Rothery W. — J. Iron and Steel Inst., 1967, v. 205,
№ 6, p. 671—673.
3. Abrahamson E. P„ Lopata S. L. — Trans. AIME, 1966, v. 236, № 1,
p. 76—87.
4. Fischer W. A . Lorenz K., Fabritius H., Schleger D. — Arch. Eisenhut-
tenw., 1970, Bd 41, № 5, S. 489—498.
ЖЕЛЕЗО —ТАЛЛИЙ
Железо и таллий не взаимодействуют1.
ЖЕЛЕЗО — ТЕЛЛУР
Диаграмма состояния системы (рис. 63) приведена по данным иссле-
дования сплавов методами термического, рентгеновского и изопьезо-
метрического анализов [1]; результаты более ранних работ были
противоречивы [2—5]. Авторы работы [1] для приготовления сплавов
использовали железо чистотой 99,9 % и теллур чистотой 99,99 %- По-
лученные данные [1] согласуются с результатами исследования [2] и
более поздней работы [9]. Подтверждено существование фаз 0, у, б,
£ [6] и высокотемпературной Р'-фазы [7]. Высокотемпературные фазы,
обнаруженные в работах [3, 4], в исследовании [1] найдены не были.
Фаза р ( — ТеЕеи.э) образуется, вероятно, по перитектоидной ре-
акции Fe+0'ч^Р при 844 ° С, хотя авторы допускают и эвтектоидный
характер реакции при этой температуре. Эта фаза стабильна до
комнатной температуры, имеет тетрагональную решетку с периодами
« = 0,382 нм; с = 0,628 нм, что хорошо согласуется с данными [3, 6, 8].
Высокотемпературная фаза р' образуется в результате перитекти-
ческой реакции ж + Fe^P' при 914 ° С. При 800 ° С Р'-фаза распада-
1 Wever F. — Arch. Eisenhuttenw., 1929, Bd. 2, № 11, S. 739—746.
86
Те % (по массе)
Рис. 63. Диаграмма состояния системы Fe—Те
ется на смесь 0+у- Фаза |3' имеет гексагональную структуру с перио-
дами (/ = 0,4013 нм, с = 2,096 нм при 835 ° С и (/ = 0,4030 нм, с = 2,109 нм
при 870 ° С [7].
Фаза у существует в области температур 636—809 ° С и имеет
узкую область гомогенности, а именно: 54—55 % (ат.) Те.
Фаза б образуется по перитектической реакции при 812 ° С,
содержит 55,2 % (ат.) Те, стабильна до 565 ° С и имеет моноклинную
разупорядоченную структуру типа NiAs с периодами решетки а—
=0,3860 нм, 6 = 0,6660 нм, с = 0,5640 нм, 0 = 90,2° при температуре
715 ° С и содержании 57,8—57,9 % (ат.) Те.
Фаза б', содержащая 59,7—62,6 % (ат.) Те, имеет гексагональ-
ную структуру с периодами решетки (/ = 0,3816 нм, с = 0,5654 нм [7] и
существует в области температур 766—519 ° С.
Фаза е, находящаяся в равновесии с теллуром и отвечающая сте-
хиометрическому составу Te2Fe, образуется по перитектической реак-
ции ж + б'ч^Е при 649 ° С, что согласуется с данными [2, 3, 9, 10].
Эта фаза имеет ромбическую структуру типа марказита (FeS2) с пе-
риодами (/ = 0,626 нм, 6 = 0,525 нм, с = 0,387 нм.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Ipser Н„ Komarek К. L„ Mikler Н. — Monatsh. Chem., 1974, Bd 105,
№ 6, S. 1321—1333..
87
2. Chiba S. — Phys. Soc. Jap., 1955, v. 10, № 10, p. 837—842.
3. Абрикосов H. X., Дюльдина К. А., Жданова В. В. — Халькогениды,
1970, вып. 2, с. 98—114.
4. Llewellyn J. Р., Smith Т. — Proc. Phys. Soc. (L.), 1959, v. 74, № 1,
p. 65—69.
5. Гейдрих В. А., Герасимов Я. И., Никольская А. В. — ДАН СССР,
1961, т. 137, № 6, с. 1399—1401.
6. Gronvold F., Haraldson Н., Vihovde J. — Acta chem. Scand., 1954,
v. 8, p. 1927—1942.
7. Rost E., Webjornsen S. — Acta Chem. Scand., 1974, v. A28, № 3,
p. 361—362.
8. Leciejewicz J. — Acta Chem. Scand., 1963, v. 17, № 10, p. 2593—2599.
9. Mann G. S., Vlack L. H. — Met. Trans., 1977, v. 8B, № 1, p. 53—59.
10. Дудкин Л. Д„ Вайданич В. И.— ФТТ, 1960, т 2, № 7, с. 1526—
1532.
ЖЕЛЕЗО — ТЕРБИЙ
Сплавы системы исследованы методами микроструктурного, рентге-
новского анализов [1, 2] и определения температур плавления [1], а
также методами дифференциального термического анализа и электрон-
ной микроскопии [2]. На рис. 64 приведена диаграмма, построенная
по данным [2]. Исходными материалами для получения сплавов слу-
жили железо чистотой 99,99 % и тербий чистотой 99,9 %. Плавку
проводили электродуговым методом на водоохлаждаемом медном
поду в атмосфере аргона с циркониевым геттером. Сплавы отжигали
в откачанных ампулах. При температурах отжига выше 1100°C ампу-
лы заполняли аргоном. Установлено, что соединения TbFe2 [2—5],
TbFe3 [2, 7, 8], Tb6Fe23 [2, 6], Tb2Fei7 [2, 6—8] образуются по перитек-
тическим реакциям и плавятся соответственно при температурах 1187,
1212, 1276, 1312 ° С. При температуре 847 ° С и содержании 28 %
(ат.) железа имеет место эвтектическая реакция. Легирование железа
тербием незначительно повышает температуру а^у-превращения и
снижает температуру
Соединение TbFe2 имеет ромбоэдрическую структуру типа дефор-
мированной MgCu2 с периодами кристаллической решетки а = 0,51896
нм, с= 1,28214 нм [5]. Ранее структура TbFe2 была определена как
кубическая типа MgCu2 [1, 3, 4]; период ее а по разным данным ра-
вен 0,740 нм [4]; 0,7369 нм [3]; 0,7341 нм [1]. TbFe2 имеет область
гомогенности, расширяющуюся в сторону увеличения содержания
железа.
Структура соединения TbFe3 — ромбоэдрическая, типа PuNi3 с а=
= 0,5139 нм, с = 2,4610 нм [2]; « = 0,514 нм, с=2,458 нм [1]; а =
= 0,5135 нм, с=2,4620 нм [7]; «=0,5122 нм, с = 2,4745 нм [8]. В отли-
чие от [1, 4] авторы работы [2] не обнаружили области гомогенности
для этого соединения.
Соединение Th6Fe23 обладает кубической структурой типа
Th6Mn17 с «=1,2007 нм [1]; 1,2085 нм [2]; 1,207 нм [6].
Соединение Tb2Fei7 существует в двух модификациях: ромбо-
эдрической типа Th2Zn)7 со стороны тербия и гексагональной типа
Th2Nii7 со стороны железа. Ромбоэдрическая структура Tb2Fei7
имеет периоды решетки: «=0,852 нм, с= 1,248 нм [1]; « = 0,8504 нм,
с =1,2413 нм [2], а = 0,854 нм, с =1,243 нм [6]; а = 0,849, с =1,242 нм
[8]. Периоды решетки гексагональной модификации Tb2Fei7 следую-
щие: « = 0,8491 нм, с=0,829 нм [1]; « = 0,8472 нм; с = 0,8321 нм [2];
« = 0,8451 нм, с = 0,8298 нм [7]; « = 0,8467 нм, с = 0,8309 нм [8].
88
t,°c
10 20 30 40 50 60 70 80 90 100
Tb Fe, % (am.) Fe
Рис. 64. Диаграмма состояния системы Fe—Tb
Определены некоторые физические и магнитные свойства дефор-
мированной фазы Лавеса ТЬЁег [9, 10].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Орлова И. Г., Елисеев А. А., Чуприков Г. Е., Рукк Ф. — ЖНХ, 1977,
т. 22, вып. 9, с. 2557—2562.
2. Dariel М. Р. — J. Less-Common Metals, 1976, v. 45, № 1, р. 91—101.
3. Крипякевич П. И., Тес люк М. Ю., Франкевич Д. П. — Кристаллогра-
фия, 1965, т. 10, вып. 3, с. 422—423.
4. Gilmore G. М., Wang F. Е. — Acta cryst., 1967, v. 23, № 1, р. 177—
179.
5. Dwight А. Е., Kimball С. W. — Acta Cryst., 1974, v. B30, № 11,
p. 2791—2793.
6. Крипякевич П. И., Франкевич Д. П. — Кристаллография, 1965, т. 10,
вып. 4, с. 560.
7. Oesterreicher И. — J. Less-Common Metals, 1975, v. 40, № 2, р. 207—
219.
89
8. Buschow К- В. J. — J. Less-Common Metals, 1966. v. 11, № 2,
p. 204—208.
9. Klimker H., Rosen M„ Dariel M. P., Atzmony U.— Physical Review,
1974, v. 10B, № 7. p. 2968—2972.
10. Clark A. E., Belson H. S. — Physical Review, 1972, v. 5B, № 9,
p. 3642—3644.
ЖЕЛЕЗО — ТЕХНЕЦИЙ
Сплавы системы изучены методом дифференциального термического
анализа [1, 2]. Определены [1] температуры ликвидус, солидус и
6^*у-превращения в сплавах, богатых железом. На основании полу-
ченных данных и с учетом результатов химического анализа (по
Рис. 65. Диаграмма состояния системы
Fe—Тс выше 1300 °C
потере массы) построена диаграм-
ма состояния при температурах
выше 1300 °C (рис. 65). Чистота
использованного железа 99,95 %,
чистота технеция не указана. Ле-
гирование технецием слабо влияет
на температуры плавления и крис-
таллизации железа. Будучи сла-
бым стабилизатором феррита, тех-
неций при добавлении в железо
приводит к незначительному сни-
жению температуры фазового пе-
рехода бч±\’.
В работе [2| методом рентге-
новского анализа изучены сплавы
Тс —40% (ат.) Fe (/Отж =
= 1075 °C), Тс —50% (ат.) Fe
(^отж — 700°C), Тс—60% (ат.) Fe
(/отж = 700°С).
Сплавы получали в дуговой
печи под давлением 0,15 МПа в ат-
мосфере аргона и гелия. В каче-
стве шихтовых материалов ис-
пользовали железо чистотой
99,873 % и технеций, содержащий
2,4523 % примесей.
В исследованной области об-
наружена фаза о с периодами: п = 0,9130±0,0005, с = 0,4788±0,0005 нм,
с/а —0,524 для сплава Тс—40% (ат.) Fe; а = 0,9077+0,0003 нм, с=
= 0,4756+0,0003 нм, с/а = 0,524 для сплава Тс —50% (ат.) Fe; а —
= 0,9010+0,0001 нм, с = 0,4713+0,0001 нм, с/п —0,523 для сплава
Тс — 60 % (ат.) Fe.
Учитывая имеющиеся в литературе сведения по сплавам системы,
а также то обстоятельство, что большинство о-фаз образуется по
перитектике [3], в работе [4] привели схему наиболее вероятного
строения диаграммы состояния системы (рис. 66).
библиографический список
1. Buckley R. A., Hume-Rothery W. — J. Iron a. Steel Inst., 1963, v. 201,
№ 2, p. 121 —124.
2. Darby J. B„ Lam D. J., Norton L. J., Downey J. W.—J. Less-Common.
Metals, 1962, v. 4, № 6, p. 558—563.
3. Raynor G. V. — J. Less-Common Metals, 1972, v. 29, № 6, p. 333—336.
90
Тс, °/о( по массе)
Рис. 66. Диаграмма состояния системы Fe—Тс
4. Moffatt W. G. Handbook of Binary Phase Diagrams. — Generie Elec-
tric Company, 1976—1981.
ЖЕЛЕЗО — ТИТАН
Полный перечень работ по исследованию взаимодействия железа с
титаном, выполненных до начала 60-х годов, можно найти в справоч-
ной литературе [А, Г], там же рассмотрены варианты диаграммы
состояния указанной системы. Обобщенный вариант диаграммы пред-
ставлен на рис. 67 [Б].
Титан стабилизирует о. ц. к. модификации железа и способствует
выклиниванию г. ц. к. модификаций. Поэтому наблюдается как бы
непрерывный переход между 6- и a-Fe при изменении температуры,
и область существования б-Fe выделить практически невозможно.
В сплавах системы образуются два интерметаллических соединения:
TiFe2 и TiFe Первое из этих соединений кристаллизуется с открытым
максимумом при 1427 ° С и обладает довольно широкой областью
гомогенности в пределах ~ 10 % (ат.) при 1300 ° С. С понижением
температуры эта область сужается незначительно. Соединение TiFe
образуется по перитектической реакции при 1317 ° С, область его
гомогенности не превышает ~ 4 % (ат.). Предельная растворимость
титана в a-Fe не превышает 9,8 % (ат.). При 1289 ° С кристаллизу-
ется эвтектика TiFe2+a-Fe. Растворимость титана в y-Fe при 1100 ° С
составляет ~ 1,0 % (ат.). Со стороны титана при 1085 ° С кристалли-
зуется эвтектика TiFe+P-Ti, эвтектическая точка располагается при
91
~ 71 % (ат.) Ti. Максимальная растворимость железа в £-Ti дости-
гает ~ 22 % (ат.). Примерно при 590 ° С протекает эвтектоидная
реакция: P-Ti^tTiFe+a-Ti. Растворимость железа в a-Ti незначи-
тельна. По данным [1], максимальная растворимость железа в a-Ti
при эвтектоидной температуре составляет 0,44 % (ат.), снижаясь при
400 ° С до 0,34 % (ат.). По данным [2], растворимость титана в a-Fe
Ti, % (попассе)
Рис. 67. Диаграмма состояния системы Fe—Ti
достигает 3,08 % (ат.) при 900 °C, снижаясь до 1,86 % (ат.) при
600 ° С
В работе [3] установлено, что соединение TiFe плавится конгру-
энтно примерно при 1500 °C, однако последующими работами этот
вывод не подтвержден. Наиболее достоверный вариант диаграммы
приведен на рис. 67.
Соединение TiFe2 обладает гексагональной структурой типа
MgZn2 с а = 0,4774 нм, с=0,7794 нм при 27,4 % (ат.) Ti и а =
= 0,4814 нм, с = 0,785 нм при 37 % (ат.) Ti [4]. Соединение TiFe обла-
дает кубической структурой типа CsCl с периодом а—0,2976 нм при
49,5 % (ат.) Ti [4].
92
1.1 IIJII1ОГРЛФИЧЕСКИЙ список
I Борискина H. Г., Мясникова К. П. — Титан и его сплавы: Сб. М.:
Изд-во АН СССР, 1962, вып. 7, с. 61—67.
2 Abrahamson Е. Р., Lopata S. L. — Trans. AIME, 1966, v. 236, № 1,
в. 76—87.
3. Корнилов И. И., Борискина Н. Г.—ДАН СССР, 1956, т. 108,
с. 1083—1085.
1 Murakami У. О. Q. — Trans. Nat. Res. Inst. Metals (Tokyo), 1959,
v. 1, p. 7—21.
ЖЕЛЕЗО — ТОРИЙ
Сплавы системы изучены в работах [1—5]. Установлено существова-
ние четырех соединений Th7Fe3, ThFe3, ThFes, ThsFe,?. Диаграмма
состояния системы приведена на рис. 68 [4]. При исследовании диа-
граммы использовали спектрально чистое железо и иодидный торий,
содержащий 0,024 % приме-
сей. Соединения Th7Fe3,
ThFes, ThFes плавятся инкон-
груэнтно, а соединение
ThsFen — конгруэнтно при
температурах 962+12,
1200+12, 1212+12 и 1462+
+ 12°С соответственно. В си-
стеме имеются два нонва-
риантных равновесия эвтек-
тического типа: ж=+ТЬ7Ре3+
+ ThFe3 при 875±12°С и
45 % (ат.) Fe и ж=+ТИ2Ре!7
при 1412+12°С и 94 %
(ат.) Fe. Растворимость то-
рия в железе <3 % (ат.).
Соединение Th7Fe3, со-
держащее 28 % (ат.) Fe,
имеет гексагональную ре-
шетку с периодами а =
= 0,985 нм, « = 0,615 нм [2];
« = 0,9823 нм, с=0,6211 нм
[3]; « = 0,9830 нм, с =
= 0,6214 нм [4]; соединение
ThFe3 обладает гексагональ-
ной структурой с периода-
ми: « = 0,522 нм, с =
= 2,496 нм [2]; « = 0,5207 нм,
« = 2,518 нм [4]; соединение
ThFes имеет гексагональную
структуру типа CaZn5 с
периодами « = 0,513 нм, с —
= 0,402 нм [2]; соединение
Th2Fej7 [-90% (ат.) Fe]
имеет моноклинную решетку
с « = 0,968 нм, & = 0,856 нм,
с = 0,646 нм, |3 = 99°20' [2].
Сплавы системы изучены в работах
пне четырех соединений Th7Fe3, "" '
т°с
1500
1600
1300
1200
1100
1000
900
800
+i
1392 °C
Tf?7Fe3+ThFe
90 60
?е,7о(ат.)
Рис. 68. Диаграмма состояния системы Fe—
Th
962±12°0 5
1212±
1602±12 0 I
4*. 1
/
I
/
12°С I
1200±12 °C £
\875±12 °C
93
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Florio J. V., Rundle R. E., Snow A. I. — Acta Cryst, 1952, v. 5, № 4,
p. 449—457.
2. Florio J. V., Baenziger N. C„ Rundle R. E. — Acta Cryst., 1956, v. 9,
№ 4, p. 367—372.
3. Matthias В. T., Compton V. B., Corenzwit E. — Phys. Chem. Solids,
1961, v. 19, № 1/2, p. 130—133.
4. Thomson J. R. — J. Less-Common Metals, 1966, v. 10, № 6, p. 432—438.
5. Smith J. F., Hansen D. A.—Acta Cryst., 1965, v. 19, № 6, p 1019—
1024.
ЖЕЛЕЗО —ТУЛИЙ
Сплавы системы исследовали методами дифференциального термичес-
кого, микроструктурного и рентгеновского анализов [1—6]. На рис. 69
Рис. 69. Диаграмма состояния системы Fe—Tm
превращения до 925 ° С и не влияет на
приведена диаграмма со-
стояния по данным [1]
Сплавы получали в дуго-
вой печи, используя в ка-
честве шихты карбониль-
ное железо чистотой
99,98 % Fe и дистилли-
рованный тулий чистотой
99,9 % Tm.
Подтверждено нали-
чие в системе четырех
интерметаллических со-
единений: TmFe2 [2],
TmFe3 [3], Tm6Fe23 [4J,
Tm2Fe17 [3, 5, 6]. Соеди-
нение TmFe2 плавится
конгруэнтно при 1300 °C.
Соединения TmFe3,
Tm6Fe23, Tm2F'e17 образу-
ются по перитектическим
реакциям при 1280, 1270
и 1300 °C соответственно.
В системе существует
пять нонвариантных
равновесий: ж+±
^Tm6Fe25 + Tm2Fe17 при
1255 °C и -82% (ат.)
Fe; ж^*Тт + ТтРё2 при
937 СС и ~26 % (ат.) Fe;
ж + Ре=ё>Тт2Ре17 при
1300 °C; ж+Tm6Fe23^=fc
=<±TmFe3 при 1280 СС;
ж+Тт2Ре17^Тт6Ре2з при
1270 °C.
Легирование желе-
за тулием повышает тем-
пературу полиморфного
температуру б^у-прев-
ращения.
Богатое тулием соединение TmFe2 имеет кубическую решетку типа
MgCu2: « = 0,7246 нм [1], «=0,7247 нм [2], « = 0,723 нм [7].
Структура соединения TmFe3 — ромбоэдрическая типа PuNi3 [3].
94
Соединение Tm6Fe23 имеет кубическую решетку типа Th6Mn23 с пе-
риодом п=1,1985 нм [1]; а=1,198 нм [4]. Соединение Тт2Ре[7 облада-
ет гексагональной решеткой типа Th2Nii7 с периодами а=0,8301 нм,
, 0,8298 нм [1]; а = 0,8427—0,8428 нм, с=0,8285 = 0,8289 [7].
библиографический список
I. Колесниченко В. Е., Терехова В. Ф„ Савицкий Е. М. — В кн.: Метал-
ловедение цветных металлов и сплавов. М.: Наука, 1972, с. 31—33.
2. Haszko S. Е. — Trans. AIME, 1960, v. 218, № 15, р. 958.
3. Ray А. Е. — In: The seventh Rare Earth Research conference in Co-
lorado. Colifornia, Oct., 1968, p. 484.
1. Крипякевич П. И., Франкевич Д. И., Ворошилов Ю. В. — Порошко-
вая металлургия, 1965, т. И, с. 55—61.
5. Крипякевич П. И., Франкевич Д. П„ Заречнюк О. С. — Bich. Льв!в.
ун-ту, Сер. xiM., 1965, вин. 8, с. 61—74.
6. Strnat К., Hoffer G„ Ray А. Е. — IEEE Trans. Magnet., 1966, v. 23,
p. 489—494.
7. Гладышевский E. И., Бодак О. И. Кристаллохимия интерметалличе-
ских соединений редкоземельных металлов. Льв1в: Вища Школа,
1982. 56 с.
ЖЕЛЕЗО — УГЛЕРОД
Начало изучения диаграммы связано с открытием критических точек в
стали Д. К. Черновым в 1868 г. [1]. Исторический обзор исследований
диаграммы приведен в работе [2]. Обзор работ, опубликованных до
1958 г. — в справочнике [А].
На рис. 70 приведена полная диаграмма состояния системы (ста-
бильная система Fe—Сгр и метастабильная система Fe—FeC).
Метастабильная система Fe—Fe$C. Перитектическое превращение
б+ж^*у протекает при 1494±2°С. Предельная концентрация углерода
в 6-фазе (точка Н) отвечает 0,1 % (по массе), или 0,46 % (ат.) [4].
Для точки J по данным [4] приняты значения 0,16 % (по массе), или
0,74 % (ат.), для точки В — значения 0,51 % (по массе), или 2,33 %
(ат.). По данным термического анализа [5], линия ликвидус 6-фазы
АВ — почти прямая, точке В соответствует 2,47 % (ат.), предельная
растворимость углерода в б-Fe составляет 0,5 % (ат.). По данным [6],
температура перитектической горизонтали равна 1496±2°С, точке /
отвечает 0,18 % (по массе), или 0,83 % (ат.).
Кривая ликвидус аустенита ВС, установленная по данным Руэра,
Хондо, Эдкока, Умино и др. [А], подтверждена в работе [6]. Почти
прямолинейный вид линии солидус у-фазы (JE) подтвержден в рабо-
тах |5, 6]. Предельная растворимость углерода в y-Fe при 1147 °C со-
ставляет 2,14 % (по массе), или 9,2 % (ат.) [6]; при 1150°С 2,02 %
(по массе), или 8,7 % (ат.) [7].
Обычно из расплавов, содержащих более 0,51 % (по массе) С, вы-
деляется у-фаза. Однако при переохлаждении расплавов, содержащих
0,5—1,5 % (по массе) С, наблюдалась кристаллизация б-фазы по мета-
стабильным ликвидусу ВВ' и солидусу НН' с последующей перекристал-
лизацией пересыщенной углеродом б-фазы в равновесную у-фазу по
реакции жб 4-бПересыщ->ж? +у [8], что указывает на существование в
расплавах, содержащих 0,5—1,5 % (по массе) С, смешанного ближнего
порядка ж 6 +ж v .
Кривая ликвидус цементита CD экспериментально не фиксируется.
Первичный цементит выделяется только при закалке расплавов, содер-
жащих до 5,5 % (по массе) С, а при нагреве белых заэвтектических чу-
95
Гунов цементит разлагается до плавления (Fe3C->Fe+Crp) [9]. По рас-
четным данным, виртуальная температура плавления цементита оцени-
вается равной 1200—1450 °C [4, 10]. Возможно, цементит испытывает
инконгруэнтное разложение при 1250—1300° С [3, 11].
Рис. 70. Полная диаграмма состояния системы Fe—С
В высокоуглеродистых сплавах, содержащих более 6,7 % (по массе)
С после закалки из жидкого состояния в медную изложницу и ледяную
воду наблюдали только Fe3C; других карбидов не обнаружено [9,- 12].
Таким образом, метастабильная система при нормальном давлении огра-
ничена цементитом. При повышении давления стабилизируются высшие
карбиды Fe7C3, Fe2C и Сал.м, однако при давлении 0,1 МПа выделение
карбидов FexC (Fe2C) наблюдали лишь при низкотемпературном от-
пуске закаленной стали.
Температура эвтектической горизонтали ECF принята равной
1147 °C, эвтектике (точке С) соответствует 4,30 % (по массе), или
17,28 % (ат.) С [А], что подтверждено в работах [Б, В].
Превращение у^+а (А3, кривая GS), исследованное многими автора-
ми [А], также подтверждено последующими работами.
Эвтектоидная точка, по данным [7], находится при 723 °C и 0,76 %
(по массе), или 3,44 % (ат.), а по данным [В], при 727,2+0,5 °C и
0,765 % (по массе), или 3,46 % (ат.). Таким образом, температуры и
концентрации для всех характерных точек метастабильной системы
Fe— Fe3C, указанные в [А], подтверждены последующими работами,
приведенными в [Б, В].
Растворимость цементита в a-Fe (кривая PQ) очень мала и, по
данным [15—17], составляет 0,02 % (по массе), или 0,095 % (ат.) С.
Согласно [18], растворимость цементита в a-Fe при 723 °C равна
0,025 % (по массе).
Стабильная система Fe—Сгр. Начало кристаллизации определяет
линия ликвидус 6-фазы АВ и у-фазы ВС', а в заэвтектической области—
96
линия ликвидус графита C'D', экспериментально установленная до
2887°С и 7,5 % (по массе) С, или 35 % (ат.) С [А, 9, 12, 19, 21]. При
дальнейшем повышении содержания углерода и давлении р= 1 ГПа,
подавляющем парообразование железа, ликвидус продолжается вплоть
до температуры плавления графита. Эвтектическое превращение
ж^у+Сгр происходит при 1153 °C. Горизонталь E'C'F' эксперименталь-
но продолжена от 2,88 до 27 % (по массе), или 65 % (ат.) С [9, 12]
и экстраполирована далее до 100 % СГр. Графитовая эвтектика С' со-
держит 4,25 % (по массе), или 17,1 % (ат.) С [19], что подтверждено
экстраполяцией кривой растворимости графита C'D' на эвтектическую
горизонталь [20].
Растворимость графита в аустените (кривая E'S') представлена по
данным [22—24]. Более поздние работы [7, 25] подтвердили положение
кривой E'S'. Эвтектоид образуется при температуре 738 °C и 0,66 %
(по массе), или 3,0 % (ат.) [25].
Зацементитная область диаграммы представлена по данным [9, 12].
В обобщенном виде от чистого железа до графита диаграмма приведе-
на в работе [3] (рис. 71). Эвтектическая и эвтектоидная горизонтали
Рис. 71. Диаграмма состояния системы Fe—100 % С
подтверждены от 2,88 до 6,67 % (по массе) и продолжены далее мето-
дом ДТА от 6,7 % (по массе), или 25 % (ат.), до 27 % (по массе), или
65 % (ат.) С. Микроструктурное исследование показало, что в равно-
весии с a-Fe до 738 °C и с у-фазой до 1153 °C находится графит. Из-за
отсутствия заметной растворимости железа в графите эвтектическая и
эвтектоидная горизонтали продолжены до 100 % С. Графитный ликви-
дус C'D', экспериментально установленный до 9 % (по массе), или 35 %
4—358
97
(ат.) С, продолжен до температуры плавления графита (3870°C). Та-
ким образом, полностью определена стабильная диаграмма состояния
системы железо — углерод.
Метастабильная система Fe—Fe3C проявляется только при содер-
жании углерода до 6,67 % (по массе) С (Fe3C). При высоких давлениях
Fe3C стабилизируется и появляется карбид Fe7C3, находящийся в рав-
новесии с алмазом. Метастабильная система Fe—Fe3C представляет
фрагмент полной диаграммы Fe—Салм [3, 11, 13], проявляющейся пол-
ностью только при высоких давлениях, когда стабильными становятся
карбиды Fe3C, Fe7C3 и алмаз. Цементит имеет узкую область гомоген-
ности, изображаемую обычно вертикалью.
Кристаллическая структура. Ферри г имеет о. ц. к. структуру a-Fe.
Период решетки a-Fe равен 0,2862 нм при 20 °C и линейно возрастает
до 0,2899 нм при 910 °C [26]. При 769 °C (точка Кюри) ферромагнитное
a-Fe переходит в «немагнитное a-Fe» (точнее, в упорядоченное анти-
ферромагнитное [З-Fe) [3, 13, 27]. Вследствие малой растворимости
углерода в a-Fe [0,02 % (по массе)] период решетки и феррита
практически такие же, как и чистого a-Fe. Атомы углерода в феррите
занимают преимущественно октапоры. Выше 1392 °C y-Fe превращается
в парамагнитную б-фазу, существующую при 1392—1536 °C. Период
решетки о. ц. к. б-Fe равен 0,2925 нм при 1392 °C и линейно растет до
0,2935 им при 1536 °C [26]. Температурная зависимость периода решет-
ки для а-(Р-) и y-Fe различны. Период решетки б-феррита с повыше-
нием температуры увеличивается сильнее, чем а(|3)-фазы и, по-видимо-
му, растет с увеличением содержания углерода.
Аустенит имеет г. ц. к. структуру y-Fe. Период решетки y-Fe линей-
но возрастает от 0,3637 нм при 911 °C до 0,368 нм при 1390 °C [26].
Углерод растворяется в y-Fe в виде С4+ и занимает октапоры, образуя
твердые растворы внедрения. С увеличением содержания углерода в
аустените период решетки у-фазы увеличивается [27, 28].
Цементит Fe3C имеет ромбическую структуру типа DO\\. Периоды
решетки: а=0,45244±0,0005 нм, b = 0,50885±0,0005 нм, с--0,67431 +
±0,0005 нм [29—32]; последующие исследования [6] подтвердили эту
структуру и дали близкие значения периодов. Нейтронографический
анализ также подтвердил ромбическую структуру цементита [В]. Тем-
пература перехода цементита из ферромагнитного в парамагнитное со-
стояние (7С) равна 215°C [А].
Карбид Fe7C3 получен только при высоких давлениях. Он имеет
гексагональную структуру типа Сг7С3. Периоды решетки а—0,6882 нм,
с = 0,4540 нм. Установлено существование метастабильного карбида
Fe2C (е-карбид), выделяющегося при отпуске стали. При 150—200 °C
из закаленной стали выделяется е-карбид с гексагональной решеткой,
имеющей периоды а=0,627 нм, с=0,214 нм [33]. Высшие карбиды весь-
ма неустойчивы и при построении диаграммы состояния при нормаль-
ных условиях не учитываются.
Термодинамический расчет метастабильной диаграммы железо —
углерод при р = 0,1 МПа показал [34], что Fe3C разлагается инконгру-
энтно по перитектической реакции. По термодинамическим расчетам
[35], достаточно точно подтвердившим все экспериментально установ-
ленные фазовые равновесия в стабильной и метастабильной системах,
плавлению цементита отвечает открытый очень пологий максимум при
1499 К (1226°C), не исключающий возможности пнконгруэнтного разло-
жения цементита при давлении 0,1 МПа. Расчетом [36, 37] установлено,
что при давлениях 6,5 ГПа и выше появляется эвтектика Fe3C — алмаз
с равновесием ж + Сгр=+ж-]-Салм при 2300 К (2027°C). С повышением
давления плавление цементита происходит конгруэнтно при одновре-
98
Менном возрастании температуры плавления [36]. При этих условиях
предполагают существование эвтектического равновесия ж^Ее3С+Ее7С3
|37].
Ближний порядок расплавов. Обнаружение методом магнитной вос-
приимчивости кристаллизации железа в о. ц. к. 6-фазу при переохлаж-
дении в области у-фазы [8] подтвердило рентгеноструктурные данные
об о. ц. к. ближнем порядке железа [4, 38]. Область смешанного ближ-
него порядка ж6 +ж7в расплавах Fe—С [4] простирается от 0,5 дс
1,5 °/6 (по массе) С [31]. При более высоких содержаниях углерода
ближний порядок расплавов отвечает г. ц. к. y-Fe, а выше 4,3 % С —
г. п. у. e-Fe [4, 38].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Чернов Д. К. — Избранные труды по металлургии и металловеде-
нию. М_: Наука, 1983. 447 с.
2. Тыркель Е. — История развития диаграммы железо — углерод. М.,
Машиностроение, 1968. 221 с.
3. Григорович В. К. Электронное строение и термодинамика сплавов
железа. М.: Наука, 1970. 292 с.
4. Adcock F. — J. Iron Steel Inst., 1937, v. 135, p. 281—292.
5. Buckley R. A., Hume-Rothery W.— J. Iron Steel Inst. (L.), 1960,
v. 196, p. 403—406.
6. Benz M. G., Elliot J. F. —Trans. AIME. 1961, v. 221, p. 323—331.
7 Schell E., Schmid1. T., Wanning J. — Arch. Eisenhuttenw., 1961, Bd 32,
S. 251—260.
8 Лякуткин А. В., Григорович В. К., Ивахненко И. С. — ДАН СССР,
1984, т. 275, № 6, с. 1449—1451.
9. Бертман А. А., Григорович В. К., Недумов Н. А., Самарин А. М.—•
Литейное производство, 1965, № 2, с. 27—33.
10. Kaufman L., Nesor И.— CALPHAD, 1978, v. 2, № 4, р. 295—318.
11. Бертман А. А., Григорович В. К-, Недумов Н. А., Самарин А. А.—
ДАН СССР, 1964, т. 159, № 1, с. 121—124.
12. Григорович В. К. — Изв. АН СССР. Металлы, 1969, № 1, с. 53—68.
13. Smith R. Р.—Trans. AIME, 1959, v. 215, р. 954—957.
14. Difkstra L. J. — Trans. AIME, 1949, v. 185, p. 252—260.
15. Wert C. A.—Trans. AIME, 1950, v. 188, p. 1249—1244.
16. Stanley J. K. — Trans. AIME, 1949, v. 185, p. 752—761.
17. Sasshi G. — Riv. mecc., 1972, v. 23, № 518, p. 8—12.
18. Земский С. В., Грузин П. Л. — В кн.: Оптимизация металлургичес-
ких процессов. М.: Металлургия, 1970, вып. 4, с. 54—64.
19. Ruer R., Biren J. — Z. anorg. Chem., 1920, v. 113, p. 98—122.
20. Chipman J.— Trans. ASM, 1952, v. 44, p. 1215—1230.
21. Cahill J. A., Kirschenbaum A. D., Grosse A. V. — Trans. ASM, 1964,
v. 57, p. 417—426.
22. Wells C. — Trans. ASM, 1938, v. 26, p. 289—344.
23. Gurry R. IF. —Trans. AIME, 1942, v. 150, p. 147—153.
24. Smith R. P. — J. Am. Chem. Soc., 1946, v. 68, p. 1163—1175.
25. Heumann T. — Arch. Eisenhuttenw., 1959, v. 30, № 1, p. 35—39.
26. Basinski Z. S.—J. Sci. Roy Soc., 1955, v. 229A, p. 459—465.
27. Лякуткин А. В., Григорович В. К., Ивахненко И. С. — ДАН СССР,
1981, т. 257, № 2, с. 398—400.
28. Hume-Rothery W. — Introduction to Iron Alloys. L.: Elsier, 1966,
257 p.
29. Голубцова P. 5.— ДАН СССР, 1959, т. 124, c. 91—93.
30. Jack К. H. — Proc. Roy. Soc. (L.), 1948, v. A 195, p. 56—61.
31. Lipson H., Petch N. J. — J. Iron Steel Inst., 1940, v. 142, p. 95—113.
32. Petch N. J. — J. Iron Steel Inst., 1944, v. 149, p. 143—150.
4* 99
33. Jack К. H. — J. Iron Steel Inst. (L.), 1951, v. 169, p. 26—31.
34. Ершова T. П., Каменецкая Д. С., Корсунская И. A. — ЖФХ, 1970,
т. 44, № 11, c. 2930—2931.
35. Argen J.—Met. Trans., 1979, v. 10A, p. 1847—1852.
36. Strong H. M., Chrenko R. M. — J. Pbvs. Chemie, 1971, v. 75, № 12,
p. 1838—1843.
37. Жуков А. А.. Штеренберг Л. E., Томас В. К., Березовская Н. А.—
Изв. АН СССР. Металлы, 1973, № 1, с. 181—184.
38. Ватолин Н. А., Пастухов Э. А. Дифракционные исследования строе-
ния высокотемпературных расплавов. М.: Наука, 1980. 189 с.
ЖЕЛЕЗО —УРАН
Сплавы системы изучали в работах [1—8]. По результатам микро-
структурного, дифференциального термического, рентгеновского [1, 2]
и дилатометрического анализов [2] построена диаграмма состояния.
Установлено существование двух соединений UFe2 и U6Fe. Соединение
Fe, % (по массе)
Рис. 72. Диаграмма состояния системы Fe—U
UFe2 плавится конгруэнтно при 1230 [1] или 1235 °C [2], а соединение
U6Fe — инконгруэнтно при 805 [1] или 815 °C [2].
В системе образуются две эвтектики: >K^y-Fe + UFe2 при 1055 [1]
или 1080'°C [2] и 78% (ат.) Fe и H^UFe2+U6Fe при 725°С и 34 %
(ат.) Fe. При 805 °C протекает перитектическая реакция ж+у-П^±ПбРе.
Растворимость урана в б-Fe незначительна. Растворимость железа в
твердом уране увеличивается с температурой от 0,018 % (ат.) при 600 °C
до 1,5 % (ат.) при 805 °C.
Позднее было проведено более подробное исследование диаграммы
состояния в области, богатой железом [3]. Сплавы, содержащие до
22,2 % (по массе) U плавили в вакуумной индукционной печи и иссле-
довали методами дифференциального термического, дилатометрического
и металлографического анализов. Использовали железо спектральной
чистоты, содержащее менее 10~3 % металлических примесей, и наибо-
100
лее чистый промышленный уран. На рис. 72 приведена диаграмма со-
стояния, построенная по данным работ [2, 3].
Установлено, что соединение UFe2 плавится при 1235 °C, а двойная
шгсктика y-Fe + UFe2— при 1055 СС. Температуры превращений 6+*у
и у^*а в железе незначительно изменяются при легировании его ураном.
Соединение UFe2 имеет кубическую структуру типа MgCu2 [4] с
периодом а, равным 0,704 нм [1]; 0,7050 нм [2]; 0,7061 нм [5];
0,7051 нм [6]; 0,7045 нм [7]. Структура UFe6 не установлена.
Методом э. д. с. исследованы термодинамические свойства сплавов
системы в интервале температур 550—870 °C [8].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Grogan J. D. — J. Inst. Metals, 1950, v. 77, p. 571—580.
2. Gordon P., Kaufmann A. R.— Trans. AIME, 1950, v. 188, p. 182—184.
3. Michaud G. G -— Canadian Met. Quart., 1966, v. 5, № 4, p. 355—365.
4. Baenziger N. C., Rundle R. E., Snow A. 1., Wilson A. S. — Acta Cryst.,
1950, v. 3, p. 34—40.
5. Katz G., Jacobs A. J. — J.
Nuclear Materials, 1962, v. 5,
№ 3, p. 338—340.
6. Brook G. B., Williams G. I.,
Smith E. M. — J. Inst. Met.,
1954—1955, v. 83, № 6,
p. 271—276.
7. Kuo K- — Acta Met., 1953,
v. 1, p. 720.
8. Лебедев В. А., Назаров
H. В., Пятков В. И. и др. —
Изв. АН СССР. Металлы,
1973, № 2, с. 212—216.
ЖЕЛЕЗО — ФОСФОР
Первые публикации относятся
к началу текущего столетия и
принадлежат русскому исследо-
вателю Н. С. Константинову
[1, 2]. Он, в частности, впервые
обнаружил, что соединение
Fe3P образуется по перитекти-
ческой реакции ж + Ге2Р+*
5ptFe3P, а в случае равновесной
кристаллизации образуется эв-
тектика oc-Fe + Fe3P. Сплавы,
содержащие более 20 °/о (ат.)
Р, очень склонны к переохлаж-
дению; в этом случае образует-
ся метастабильная эвтектика
tz-Fe+Fe2P. Последующими ис-
следователями вывод, сделанный
в работах [1, 2], подтвержден.
Рис. 73. Часть диаграммы состоя-
ния системы Fe—Р: штриховая ли-
ния — нестабильная, сплошная —
стабильная.
a-Fe
800
ООО
400
t°C
1534 °С
1400
1200
1000
А, % (ат.)
10 20
C*r*FezP
945 °C
cr-Fe + Fe3P
735 °C
10,5 I
\Г
1305
11,0 Магнитное
I превращение
1 420 °С
| Магнитное
превращение^ Fe3 Р
11 66 °C
Fe2P+FeP
О 5 10 15 20 25 30
Fe Р, % (по наосе) Р
101
На рис. 73 представлена диаграмма состояния системы по обобщен-
ным данным [Г]. В сплавах системы, помимо Fe3P и Fe2P, существуют
и более богатые фосфором соединения FeP и FeP2. Фосфор вы-
клинивает у-фазу и, наоборот, как бы стабилизирует a-твердый раствор.
Температура образования соединения Fe3P 1166 °C; соединение Fe2P
плавится с открытым максимумом при 1365 °C. При 1050 °C плавится
равновесная эвтектика a-Fe+Fe3P, а примерно при 945 °C — метаста-
бильная a-Fe+Fe2P. Максимальная растворимость фосфора в a-Fe со-
ставляет 4,9 % (ат.), а в y-Fe не превышает 0,25—0,3 % (ат.) при
1150 °C.
Соединение Fe3P имеет объемноцентрированную тетрагональную
решетку с 24 атомами в элементарной ячейке; а = 0,9108 нм, с~ 0,4455 нм,
с]а=0,4891. Соединение Fe2P имеет гаксагональную решетку типа С22
(девять атомов в элементарной ячейке): а = 0,5864 нм, с=0,3460 нм;
с/а=0,5921. Соединение FeP изоморфно МпР (531): а=0,5794 нм, 6 =
= 0,5187 нм, с=0,3095 нм. Соединение FeP2 изоморфно FeS2, структур-
ный тип С18; а= 0,2730 нм; 6 = 0,4985 нм; с= 0,5668 нм.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Константинов Н. С. Журнал Русского физико-химического общества.
Ч. хим., 1909, т. 41, № 8, с. 1220—1225.
2. Konstantinow N. — Z. anog. Chem., 1910, Bd 66, S. 209—227.
ЖЕЛЕЗО — ХРОМ
Наиболее ранние исследования сплавов системы относятся к началу
текущего столетия. Подробный обзор работ, выполненных до середины
50-х годов, содержится в [А, Г]. К этому времени были достаточно
точно установлены кривые плавкости, область существования твердых
растворов хрома в y-Fe, а также концентрационные и температурные
пределы образования о-фазы.
Диаграмма состояния в обобщенном виде по данным [А] приведе-
на на рис. 74. На кривых ликвидус и солидус при 22 % (ат.) Сг и
1507 °C наблюдается минимум. Хром стабилизирует о. ц. к. модифика-
ции железа и образует с этими модификациями непрерывные ряды
твердых растворов. Область твердых растворов хрома в г. ц. к. моди-
фикации железа сравнительно узкая и простирается до 13,3 % (ат.) Сг.
Хром снижает температуру полиморфного а^у-превращения железа от
910 до 830°C при содержании — 7,5 % (ат.). При дальнейшем увеличе-
нии содержания хрома эта температура резко возрастает. При содер-
жании в сплавах —50 % (ат.) Сг и температуре —815 °C происходит
фазовая перекристаллизация a-твердого раствора с образованием так
называемой о-фазы. Реакция а->о протекает крайне медленно, и необ-
ходимы продолжительные выдержки для ее завершения. Фаза о обла-
дает сложной тетрагональной структурой с 30 атомами в элементарной
ячейке и обычно образуется в системах на основе переходных метал-
лов. Фазы а, как правило, обладают достаточно широкими областями
гомогенности. В системе железо — хром эта область при 600 °C прости-
рается от 43 до 49 % (ат.) Сг. Периоды решетки о-фазы а = 0,880 нм,
с—0,5444 нм и мало изменяются в пределах области гомогенности.
В работах [1, 2] показано, что в сплавах системы образуются три
сверхструктурные фазы Р, 0, о с областями гомогенности 41,9—44,2 %
(ат.) Сг; 45,7—47,2 % (ат.) Сг и 49,2—51,5 % (ат.) Сг. Однако данные
этих работ, как и работ [3, 4], о наличии в хроме пяти полиморфных
модификаций не получили подтверждения в дальнейших исследованиях.
Между тем в работе [5] предложена диаграмма состояния системы,
102
Рис. 74. Диаграмма состояния системы Fe—Сг
авторы которой считают, что существует высокотемпературная модифи-
кация хрома со структурой типа Д15.
В настоящее время методами высокотемпературного термического
анализа и измерением электросопротивления показано, что хром явля-
ется мономорфным металлом.
В работах [6, 7] проведен расчет диаграммы плавкости системы.
В обоих случаях подтверждена форма кривых ликвидус и солидус
этой системы, приведенная на рис. 74.
В работе [8] диаграмму плавкости сплавов системы при содержа-
нии хрома до 35 % (ат.) исследовали методами микроструктурного, тер-
103
мического, микрорентгеноспектрального анализов. Показано, что мини-
мум на кривых плавкости отвечает содержанию 21 % (ат.) Сг и темпе-
ратуре 1510 °C.
В работах [9, 10] уточнены положение и форма у-петли в сплавах
системы. Исследование [9] выполняли методами микроструктурного и
микрохимического анализов после длительных изотермических выдер-
жек при различных температурах. Содержание углерода в сплаве из-
Fe Сг, мол. доля Сг
Рис. 76. Диаграмма состояния системы
Fe—Ст при температурах ниже 800 °C
Рис. 75. Область у-петли в сплавах
системы Fe—Сг
меняли от 0,001 до 0,005 % (по массе), азота — от 0,002 до 0,009 % (по
массе). На рис. 75 показана у-область в сплавах системы. Положение
минимума на кривой при 0,005 % (по массе) С и 0,009 % (по массе) N
определяется координатами 820 °C и 8,9 % (по массе) Сг. При сниже-
нии содержания углерода до 0,0025 и азота до 0,005 % (по массе) точ-
ка минимума сдвигается к 840—845 °C и 7,8 % (по массе) Сг.
При содержании 0,001 % (по массе) С и 0,002 % (по массе) N так-
же при изменении концентрации углерода и азота в указанных преде-
лах несколько смещается в сторону увеличения содержания хрома (на
0,7—0,8 %) положение у/(сс+у)- и (а+у)/а-границ двухфазной области,
разделяющей у- и a-твердые растворы.
На основе измерения электросопротивления, твердости и намагни-
ченности построена низкотемпературная часть диаграммы состояния
системы железо — хром [11]. Ниже 550 °C твердый раствор а и о-фаза
становятся неустойчивыми и расслаиваются на два твердых раствора
(богатых и бедных хромом) с о. ц. к. решеткой. В отсутствие о-фазы
расслоение «-твердого раствора начинается при более высокой темпе-
ратуре. На рис. 76 приведена низкотемпературная часть диаграммы со-
стояния системы железо — хром, штриховой линией показано начало
расслоения «-твердого раствора при отсутствии о-фазы.
Наличие области расслоения в системе согласуется с термодинами-
ческими данными, а именно: положительным отклонением от закона
идеальных растворов и положительной теплотой смещения. Это озна-
чает, что твердые растворы а- и «-фаза при понижении температу-
ры становятся менее устойчивыми и должны распадаться на твердые
растворы с меньшим и большим содержанием хрома [12, 13, 14]. Тем-
пературный интервал стабильности «-фазы соответствует 440—820 °C.
104
ЫI ГЕЛИОГРАФИЧЕСКИЙ СПИСОК
1. Корнилов И. И., Михеев В. С. — ДАН СССР, 1949, т. 68, № 3,
с. 527—529.
2. Михеев В. С. — Изв. Сектора физ.-хим. анализа, 1949, т. 19, с. 413—
417.
3 Григорьев А. Т., Соколовская Е. М., Симакова Ю. П. и др. — ЖНХ,
1960, т. 5, № 9. с. 2136—2138.
4 Григорьев А. Т., Соколовская Е. М., Пятигорская Л. И., Максимо-
ва М. А. — ЖНХ, 1962, т. 7, № 5, с. 1105—1109.
5. Vikram Rao М„ Tiller 117. A.— Mater. Sci. and Eng., 1974, v. 14,
№ 1, p. 47—54.
6. Кожеуров В. А., Рысс M. А., Пигасов С. Е. и др. — Науч. тр./Челя-
бинский электрометаллургический комбинат. Челябинск: 1970, вып. 2,
с. 53—61.
7. Yukawa N., Hida М, Ymura Т. а. о.—Met. Trans., 1972, v. 3, № 4,
р. 887—895.
8. Schilzmann Е., Brauckmann J. — Arch. Eisenhiittenw., 1977, Bd 48,
№ 1, S. 3—7.
9. Kirchner G., Nishizawa T., Uhrenius Bjorh. — Met. Trans., 1973, v. 4,
№ b p. 167—174.
10. Williams R. O., Raxton H W.—J. Iron a. Steel Inst, 1957, v. 185,
pt. 3, p. 358—374.
11. Poyet P., Guiraldeng P., Hoehmann J. — Mem. sci. Rev. met., 1972,
v. 69, № 11, p. 775—783.
12. Винтайкин E. 3., Колонцов В. Ю., Медведев Э. А. — Изв. АН СССР,
Металлы, 1969, № 4, с. 169—172.
13. Rao М. V., Tiller W. А. — Scr. met, 1972, v. 6, № 5, р. 417—421
14. Spencer Р. J., Counsell J. F. — Z. Metallkde, 1973, Bd 64, № 9,
S. 662—665.
ЖЕЛЕЗО — ЦЕЗИЙ
Цезий не растворяется в твердом железе 1 и не взаимодействует с же-
лезом при температуре кипения (690 °C) [А].
ЖЕЛЕЗО — ЦЕРИЙ
Диаграмму состояния системы впервые исследовали методом дифферен-
циального термического анализа [1]. Были установлены существование
двух соединений Ce2Fe5 и CeFe2 и значительная растворимость церия в
а- и y-Fe, равная соответственно 12 и 15 % (по массе). Методами диф-
ференциального термического, микроструктурного, рентгеновского ана-
лизов в работе [2] проведено подробное исследование сплавов системы
в области до 5 % (по массе) Се и построена часть диаграммы состоя-
ния, богатая железом. Установлены существование фаз CeFes и CeFe2
и незначительная растворимость церия в а- и y-Fe.
Дальнейшими исследованиями подтверждена правильность этих
уточнений [3—11], однако показано, что истинный состав промежуточ-
ной фазы CeFeg находится в интервале 84,5—88,5 или 87,5—89,5 % (ат.)
Fe и соответствует CeFe7 [9] или Ce2Fei7 [8, 10]. В работе [10] уста-
новлено существование двух модификаций фазы Ce2Fe)7.
На рис. 77 приведена диаграмма состояния системы железо — церий
1 Wever Д. — Arch. Eisenhiittenw., 1929, Bd 2, № 11, S. 739—746.
105
[10], которая несколько отличается от приведенной в работе [1], но
близка к построенной в работах [2, 4, 13].
Соединения CeFe2 и Ce2Fei7 плавятся инконгруэнтно при 940 и
1070 °C соответственно. В системе кристаллизуется эвтектика ж=?*Се+
+ CeFe2 при 590°С и —18% (ат.) Fe. Церий повышает температуру
а^у-превращения железа до 925 °C. Растворимость церия в железе со-
ставляет менее 0,1 % (по массе) [5] или 0,4 % (по массе) [2]. В работе
Рис. 77. Диаграмма состояния системы Fe—Се
[3] определена растворимость церия в железе при 600 °C, которая со-
ставляет 0,35—0,4 % (по массе). Фаза Ce2Fei7 имеет две модификации:
а с гексагональной решеткой типа Th2Nii7 и периодами а— 0,8490 нм,
£=0,8281 нм [10] и [3 с ромбоэдрической решеткой типа Th2Zni7 и пе-
риодами а=0,8490 нм, с= 1,2416 нм [10]; ц=0,847 нм, с= 1,241 нм [8].
Соединение CeFe2 имеет структуру типа MgCu2 с а—0,7302 нм [2,
7, 10, 11]; а=0,725 нм [6].
Магнитные свойства сплавов системы исследованы в работе [12];
определена точка Кюри для некоторых составов сплавов.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R.— Z. anorg, chemie, 1917, v. 29, № 1, p. 25—49.
2. Jepson J. O., Duwez P. — Trans. ASM, 1955, v. 47, p. 543—553.
3. Richerd J. — Mem. Sci. Rew. Met., 1962. v. 59, № 6, p. 527—648.
4. Critchley J. K. — Atomic Energy Res. Establ., 1959, № M488, p. 488,
17p.
5. Gaume-Mahn T.— Mem. Sci. Rew. Met., 1960, v. 57, № 8, p. 638—642.
106
6 Nassau К. J. — Phys. Chem. Solids, 1960, v. 16, № 1/2, p. 123—130.
7. Wernick J. H„ Geller S. — Trans, AIME, 1960, v. 218, № 5, p. 866—
868.
8. Заречнюк О. С., Крипякевич П. И. — Кристаллография, 1962, т. 7,
№ 4, с. 543—554.
9. Ray А. Е. — Acta Cryst., 1966, v. 21, р. 426—433.
10. Buschow К. Н. J., Wieringen J. S. — Phys. Status Solidi, 1970, v. 42,
№ 1, p. 231—239.
11. Mansey R. S„ Raynor G. V., Harris J. R. — J. Less-Common Metals,
1968, v. 4, p. 329.'
12. Крипя’кевич П. I., Франкевич Д. П„ Заречнюк О. С. — Bien. Льв1в,
ун-ту. Сер xiM., 1965, вип. 8, с. 61—74.
ЖЕЛЕЗО —ЦИНК
Материалы по диаграмме состояния системы, опубликованные до се-
редины 60-х годов, обобщены в работах [А, Б, Г]. Более поздние ис-
следования в значительной степени изменили ранее сложившиеся пред-
ставления.
Рис. 78. Диаграмма состояния системы Fe—Zn
В работе [1] исследования выполняли методом микрорентгеноспект-
рального анализа. Изучали богатые железом сплавы системы, которые
изготовляли из весьма чистых шихтовых материалов. Заполненные цин-
ком железные капсулы наружным диаметром 20 мм и внутренним 7 мм
выдерживали при 700—1400 °C в течение 20—120 мин. По химическому
анализу цинковой фазы, насыщенной железом, установлена кривая лик-
107
видус. Построены кривые солидус и растворимости цинка в а- и y-Fe.
На рис. 78 приведена диаграмма состояния системы железо —
цинк. Максимальная растворимость цинка в y-Fe достигает 5,73 % (по
массе) при 1050 °C; при этой температуре двухфазная область а+у
простирается до 9,6 % (по массе) Zn. Область у-петли при 800 °C имеет
характерный минимум, содержа-
ние цинка в точке минимума кри-
вой отвечает 4,4 % (по массе).
Растворимость цинка в a-Fe при
780 °C достигает 43 % (по массе).
При 780 °C протекает перитектиче-
ская реакция образования фазы
Г : ж+а=ё*Г.
В работе [2] методом диффу-
зионных пар синтезировали спла-
вы системы; полученные слои ис-
следовали методами микрострук-
турного и рентгеновского анали-
зов, а также путем измерения мик-
ротвердости.
В сплавах, богатых цинком,
обнаружили новую фазу Г i, имею-
щую г. ц. к. решетку с периодом
1'7963 нм. Период решетки фазы
Г] примерно вдвое больше перио-
да решетки фазы Г, имеющей
о. ц. к. решетку типа у-латуни
(Cu5Zn8) с а = 0,895 нм. На рис.
79 изображен исследованный учас-
ток диаграммы состояния. Фаза
при 380 °C имеет область гомо-
генности 18,5—23,5 % (ат.) Fe.
60 80 100 При повышении температуры об-
Zn, % (ат.) ласть гомогенности фазы сужа-
ется; в интервале 500—600СС фа-
Рис. 79. Часть диаграммы состояния за Г[ исчезает.
системы Fe—Zn g работе [3] изучали раство-
римость цинка в а- и y-Fe. Спла-
вы синтезировали по методике [I],
проводили длительные диффузионные отжиги. Продукты взаимодейст-
вия исследовали методами микроструктурного и микрорентгеноспект-
рального анализов. Максимальная растворимость цинка в y-Fe достига-
ет 0,057 атомных долей при 1400 К. Точка минимума на кривой, огра-
ничивающей у-область, не обнаружена. Данные [3] растворимости цин-
ка в a-Fe хорошо подтверждаются материалами работы [I].
В работе [4] методами микроструктурного, рентгеновского и диф-
ференциального термического анализов исследовали сплавы системы со
стороны цинка. Фазовые соотношения в области сплавов, богатых цин-
ком, показаны на рис. 80. Фаза £ образуется по перитектической реак-
ции при 531 ±10 °C и гомогенна в интервале составов 6,7—-7,2±0,1 %
(ат.) Fe. Фаза 61 образуется по перитектической реакции при 667±3°С
и гомогенна в интервале составов 8,5 ±0,2-4-13,5 ±0,5 % (ат.) Fe.
Методом дифференциального термического анализа не обнаружена
высокотемпературная модификация фазы 6, о существовании которой
сообщалось в работе [2]. фаза Гх образуется по перитектоидной реак-
ции при 550±10°С. Период решетки фазы Г\ определен равным 1,799±
±0,002 нм.
108
Zn, % (помассе)
Рис. 80. Часть диаграммы состояния системы Fe—Zn
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Budurov S., Kovatchev Р., Stoicev Nikola, Kamenova Z. — Z. Metallk-
de, 1972, Bd 63, № 6, S. 348—350.
2. Bastin G. F., Van Loo F. J., Rilck G. D. — Z. Metallkde, 1974, Bd 65,
№ 10, S. 656—660.
3. Kirchner G., Harving H., Moduost K. R-, Hilbert M. — Arch. Eisen-
hiittenw., 1973, Bd 44, № 3, S. 227—234.
4. Gettings P. J., Gier man G., Koster D., Knit J. — Z. Metallkde, 1980,
Bd 71, № 2, S. 70—74.
ЖЕЛЕЗО — ЦИРКОНИЙ
Первые систематические исследования диаграммы системы были выпол-
нены методами термического и микроструктурного анализов [1]. Уста-
новленоо существование при 5213 % (по массе) Zr конгруэнтно плавя-
щегося соединения FesZr2, которое участвует в двух эвтектических ре-
акциях: с у-Fe при 1330 °C и 16 % (по массе) Zr и с (З-Zr при —1350 °C
и 88 % (по массе) Zr. При добавке циркония к железу температура
б^у-превращения железа снижается с 1392 до 1335 °C, при этой темпе-
ратуре и 7 % (по массе) Zr протекает кататектическая реакция: б^*у + ж.
Цирконий также снижает температуру уч^сс-превращения железа от
911 до 835 °C. Предельная растворимость циркония в y-Fe не превы-
шает 0,3 % (по массе).
Состав химического соединения, образующегося в сплавах систе-
мы, был уточнен в работах [2, 3] методом рентгеновского анализа. По-
109
казано, что это соединение отвечает стехиометрии Fe2Zr и содержит
44,95 °/о (по массе) Zr.
Дальнейшими исследованиями, которые проводили методами микро-
структурного, рентгеновского, дифференциального термического и дю-
рометрического анализов, в строение диаграммы состояния внесены до-
Рис. 81. Диаграмма состояния системы Fe—Zr
полнения [4—8] —рис. 81. Сплавы для исследования выплавляли в ду-
говой печи в атмосфере аргона. Исходными материалами служили элек-
тролитическое рафинированное в водороде железо и иодидный цирконий.
Все сплавы гомогенизировали при 1250 °C, 8 ч, в атмосфере аргона.
Сплавы, содержащие >29 % (по массе) Zr, дополнительно отжигали
при 1250 °C, 56 ч, и 1450 °C, 8 ч.
Установлено образование двух промежуточных фаз. Одна из них,
в основе которой лежит соединение Fe2Zr, плавится конгруэнтно при
1675 °C и имеет область гомогенности в пределах 40—48 % (по массе)
Zr (е-фаза).
В~ работах [5—7] подтвержден вывод исследований [2, 3] о том,
что фаза е отвечает стехиометрии Fe2Zr, а не Fe3Zr2. Вторая фаза, по
данным микроструктурного исследования, гомогенна в пределах 30—
34 % (по массе) Zr (т]-фаза). Эта фаза плавится с разложением при
1480 °C по перитектической реакции т]^ж + е. Эвтектика б+т] кристал-
лизуется при 1325 °C, а при 1350 °C б-фаза распадается на смесь
y-Fe + ж. Предельная растворимость циркония в a-Fe достигает 0,05 %
(по массе) при 925 °C; при этой температуре протекает перитектоидная
реакция у + ц^а. При 910 °C кристаллизуется эвтектика E + |3-Zr; эв-
тектическая точка отвечает 85 % (по массе) Zr. При 740 °C протекает
эвтектоидная реакция: p-Zr^a-Zr+e. Растворимость железа в [3- и a-Zr
не определена.
НО
В работе [8] систему исследовали со стороны циркония при содер-
жа.... до 10 % (ат-) Fe.
Температура эвтектической реакции определена равной 947±3°С.
максимальная растворимость же-
леза в P-Zr составляет 6,75 %
(ат.). Эвтектоидная реакция
(PZr^a-Zr+Fe2Zr протекает при
795±5 °C. Максимальная раство-
римость железа в a-Zr составляет
0,035 % (ат.) Fe; при 700 °C в
a-Zr растворяется 0,02 % (ат.) Fe
(рис. 82).
В работах [2—4] показано,
что соединение Fe2Zr относится к
семейству фаз Лавеса со структу-
рой типа MgCu2, период решетки
п = 0,705 нм.
Методом рентгеновского ана-
лиза в работе [9] изучали раство-
римость циркония в ct-Fe, которая
достигает 0,044 % (ат.) Zr при
600 °C, 0,067 —при 700 °С; 0,082 —
при 800 °C и 0,106 % (ат.) Zr —
при 900 °C. Период о. ц. к. решет-
ки а-твердого раствора железа
возрастает от 0,28662 до 0,28673 нм
при добавлении 0,106 % (ат.) Zr.
В работе [10] методом термо-
магнитного анализа исследовали
сплавы железа с небольшим содер-
жанием циркония — до 5 % (ат.).
Результаты этой работы хорошо
согласуются с данными [4—8].
В работе [11] при рентгенов-
Fe, % (по пассе)
Рис. 82. Часть диаграммы состояния
системы Fe—Zr
ском исследовании сплавов систе-
мы в интервале составов 20—35 %
(ат.) Zr, кроме фазы Лавеса со структурой типа MgCu2, была обнару-
жена фаза (Zro,8Feo,2)Fe2 с гексагональной структурой типа MgZn2.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R., Топп IF. — Arch. Eisenhiittenw., 1931—1932, Bd 5, № 4,
S. 387—389.
2. Wallbaum H. J. — Z. Krist., 1941, Bd 103, S. 391—402.
3. Wallbaum H J. — Arch. Eisenhiittenw., 1940—1941, Bd 14, № 5,
S. 521—526.
4. Hayes E. T., Roberson A. H., O’Brien W. Z. — Trans. ASM, 1951,
v. 43, p. 888—904.
5. Свечников В. H., Спектор А. Ц. — Вопросы физики металлов и ме-
талловедения, АН УССР, 1960, № 11 с. 30—35.
6. Свечников В. Н., Спектор А. Ц. — Вопросы физики металлов и ме-
талловедения, АН УССР, 1962, № 16, с. 136—143.
7. Свечников В. Н„ Спектор А. Ц. — ДАН СССР, 1962, т. 143, № 3,
с 613—615.
8. Tanner L. Е, Levinson D. IF. — Trans. AIME, 1959, v. 215, p. 1066—
1067.
9. Abrahamson E. P., Lopata S. L.— Trans. AIME. 1966, v. 236, № 1,
p. 76—87.
Ill
10. Fischer W. A., Lorenz IL, Fabritius FL, Schlegel D. — Arch. Eisen-
huttenw., 1970, Bd 41, № 5, S. 489—498.
11. Гусева JI. Fl., Малахова T. O. — Металлофизика: Респ. межвед. сб.„
Киев: Наукова думка, 1973, вып. 46, с. Ill—113.
ЖЕЛЕЗО —ЭРБИЙ
Сплавы системы исследовали в работах [1—9]. Диаграмма состояния
системы во всем интервале концентраций построена методами диффе-
ренциального термического, микроструктурного, рентгеновского анали-
зов [1, 2]. В работе [2] использовали также методы измерения твер-
Рис. 83. Диаграмма состояния системы Fe—Ег
дости, микротвердости, электросопротивления. Предложенные диаграм-
мы состояния несколько различаются по температурам нонвариантных
равновесий, стехиометрии и числу образующихся соединений.
На рис. 83 приведена диаграмма состояния системы [2]. Для при-
готовления сплавов использовали эрбий чистотой 99,9 % и железо чис-
тотой 99,98 %. Синтезировали сплавы в дуговой печи с нерасходуемым
вольфрамовым электродом на медном поду. Рентгеновским исследова-
112
пнем подтвердили существование соединений ErFe2, Er6Fe23, Er2Fei7,
ErFe3 [1, 4—7] и обнаружили новое соединение ErFe5. Соединение
ErFe3 плавится конгруэнтно при 1380 °C. Соединения Er2Fei7, ErFe5,
Er6Fe23 и ErFe2 образуются по перитектическим реакциям при 1350,
1345, 1345, 1355 °C соответственно. Кроме четырех нонвариантных рав-
новесий перитектического типа, в системе реализуются два эвтектических
и одно эвтектоидное равновесие: ж^Ег + ЕгЕе2 при 895 °C, ж^Ег6Ре23+
+ ErFe5 при 1310 °C и ErFe5=f±Er6Fe23+Er2Fe17 при 1285 °C.
Железо и эрбий незначительно растворяются друг в друге. Раство-
римость эрбия в a-Fe при 900 °C составляет 0,3—0,4 % (по массе) [2]
или 0,005% (по массе) [1]. Растворимость железа в эрбии при 895 °C
равна 0,1 % (по массе) [2], при 900сС — 0,03 % (по массе) [1]. Леги-
рование железа эрбием незначительно повышает температуру а=?±у-пре-
вращения железа и практически не влияет на температуру полиморф-
ного превращения у=<=^6 [2].
Соединение ErFe2 имеет кубическую решетку типа MgCu2 с периодом
a = 0,7273 нм [4; Б]. Соединение ErFe3 обладает ромбоэдрической ре-
шеткой типа PuNi3 с периодами a = 0,5096; с=2,448 [1].
По данным [6], соединение Er6Fe23 принадлежит к структурному ти-
пу Th6Mn23 с периодом решетки а—1,201 нм.
Соединение Er2Fei7 имеет гексагональную решетку типа Th2Nii7 с
периодами a = 0,8423 нм, с = 0,8284 нм [7]. Микротвердость фаз ErFe2
и ErFe3 составляет соответственно 7900 и 4800 МПа [2]. Для соедине-
ния ErFe2 определены некоторые физические и магнитные свойства
[9, Ю].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Meyer А. — J. Less-Common Metals, 1969, v. 18, № 1, р. 41—48.
2. Колесников В. Е., Терехова В. Ф., Савицкий Е. М. — Изв. АН СССР.
Неорган. материалы, 1971, т. VII, № 3, с. 495—497.
3. Савицкий Е. М., Терехова В. Ф„ Наумкин О. П. — Цветные метал-
лы, I960, № 1, с. 43—48.
4. Wernick J. И., Geller S. —Trans. AIME. 1960, v. 18, № 5, p. 866—
868.
5. Dwight A. E. — Trans. ASM, 1961, v. 53, p. 479—500.
6. Крипякевич П. И., Франкевич Д. П. — Кристаллография, 1965, т. 10,
вып. 4, с. 560.
7. Buschow К. Н. J. — J. Less-Common Metals, 1966, v. 11, № 2, р. 204—
208.
8. Koon N. C., Schindler Д. I., Carter F. L. — Phys. Letters, 1971, v. 37A,
№ 5, p. 413—414.
9. Klimker H., Rosen M., Dariel M. P., Atzmony U. — Phys. Review,
1974, v. 10B, № 7, p. 2968—2972.
10. Buschow К. H. J., van der Goot A. S. — Phys. Status Solidi, 1969,
v. 35, p. 515—518.
ЖЕЛЕЗО — АЗОТ — АЛЮМИНИЙ
Растворимость азота в сплавах железо—алюминий исследована 1 при
температурах 1050—1350 °C. Алюминий добавляли в расплавы на ос-
нове железа, содержащие, %: 0,10 С; 0,41—0,44 Мп; 0,01 Si; 0,010—
0,012 Р; 0,023—0,025 S в количестве 0; 0,1; 0,2; 0,4; 0,8; 1,6 кг на тонну.
Для насыщения азотом образцы в форме дисков помещали в вертикаль-
1 Darken L. S., Smith R. Р., Filer Е. W. — Trans. AIME, 1951, v. 191, p. 1174—
1179.
113
ную трубчатую печь и выдерживали при заданной температуре в атмо-
сфере очищенного газообразного азота [содержание 1,05 % (объемн.)
водорода], подававшегося при атмосферном
О
0,05 0,10
А1, % (по пассе)
давлении через специаль-
ное устройство. После за-
калки образцы исследо-
вали химическим и мик-
роструктурным метода-
ми. Построена зависи-
мость содержания азота
в аустените от содержа-
ния алюминия при 1050,
1200 и 1350 °C (рис. 84).
Точки перелома кривых
соответствуют составу
аустенита, находящегося
в равновесии с нитридом
алюминия.
ЖЕЛЕЗО—АЗОТ —
БОР
Рис. 84. Равновесное содержание азота в сплавах
системы Fe—N—А1 Сплавы системы ис-
следовали методом рент-
геновского анализа [1].
Исходными материалами для получения сплавов служили бориды же-
леза Fe2B и FeB, которые подвергали азотированию в потоке сухого ам-
мония. Содержание азота в продукте определяли по приросту массы
образцов.
Фазы, образующиеся в результате реакции: борид железа+азот=ё*
^нитрид бора + нитрид железа (при высоких температурах — чистое же-
лезо), приведены ниже:
t, °C Исходный борид железа
Fe2B FeB
352 Fe2B FeB
400 g + BN FeB + BN
448 e + BN —
505 e + У' + BN —
550 y' J- 8 -j- BN у -j- 8 BN
602 a-Fe -j- y' -j- 8 BN y' -j- 8 a-Fe BN
702 a-Fe -j- BN
768 a-Fe -j- BN a-Fe + BN
Примечание. Греческими буквами £, е, у обозначены нитриды железа
согласно [2].
Исследование периодов решетки нитридов железа показало, что
они не содержат бора.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Kiessling R., Liu У. Н. — Trans. AIME, 1951, v. 191, р. 639—643.
2. Hagg G. — J. Sen. Phys. Chem., 1930, v. 11B, p. 152—154.
114
ЖЕЛЕЗО — АЗОТ — ВАНАДИЙ
Рис. 85. Растворимость нитрида вана-
дия в железе:
1 — фазовый анализ; 2 — электронная
микроскопия
1’асгворимость нитрида ванадия в железе исследована методами фа-
лоного анализа и электронной микроскопии*. Приведена зависимость
растворимости VN в железе от температуры в интервале 750—1200 °C,
Для приготовления сплавов использовали карбонильное рафинирован-
ное железо. Сплавы приготовляли в индукционной электропечи путем
введения в расплавленное железо дисперсного порошка нитрида вана-
дия. Спектральным анализом в сплавах обнаружены следы марганца,
кремния, алюминия, титана и хро-
ма. Сплавы отжигали в течение
30 мин при 750, 850, 950, 1050 и
1200 СС. Растворимость VN по
данным электронномикроскопиче-
ского анализа значительно мень-
ше, чем по данным фазового ана-
лиза (рис. 85). Показано резкое
увеличение растворимости VN в
железе выше 900 °C.
ЖЕЛЕЗО — АЗОТ —
ГАЛЛИЙ
Сплавы системы изучали 2 рентге-
новским методом. Приведен изо-
термический разрез при 600 °C, ко-
торый характеризует фазовые рав-
новесия в сплавах, содержащих до
40 % (ат.) Ga и до 50 % (ат.) N.
Для приготовления сплавов
использовали железо и галлий чи-
стотой 99,95 %. Сплавы, превра-
1 Гуляев А. П., Анашенко В. Н.,
№ 8, с. 6—8.
2 Stadelmaier Н. Н.. Fraker А. С. — Z. Metallkde, 1962, Bd. 53, № 1, S. 48—51.
Карчевская Н. И. и др. — МиТОМ, 1973,
Рис. 86. Изотермический разрез системы Fe—N—Ga при
600 °C
115
щали в порошок, который насыщали азотом в
600 °C
атмосфере (NH3+H2) при
На рис. 86 приведен изотермический разрез системы при 600 °C. По-
казано наличие нитридов железа (у'), имеющих кубическую кристал-
лическую решетку с а = 0,380 нм, и галлия GaN. Период кристалличе-
ской решетки нитрида железа при добавлении галлия не изменялся.
Двойные железо—галлиевые нитриды в системе не обнаружены.
ЖЕЛЕЗО — АЗОТ — КРЕМНИЙ
Растворимость азота в сплавах железо—кремний наиболее полно ис-
следована в работах [1, 2]. Сплавы железа высокой чистоты (0,004 % С;
0,002 % Si; 0,004% S; 0,28 % О2; 0,01 % N) с кремнием (99,90 %) при-
Рис. 87. Влияние кремния на растворимость N в т-Fe:
1 — по данным Мартина
Рис. 88. Растворимость N в сплавах системы Fe—Si
116
готовляли расплавлением в индук-
ционной печи в силлиманитовых
тиглях [1]. Насыщение сплавов
плотом производили при нагреве в
интервале 700—1000°C. Содержа-
ние кремния в сплавах определяли
гравиметрическим и абсорбцион-
ным методами, азота — методом
Кьельдаля
На рис. 87 представлены кри-
пые температура—растворимость
азота в y-Fe с учетом данных
|3, 4].
Растворимость азота в спла-
вах с содержанием кремния 3,4;
4,3; 5,6; 6,0 и 8 % (рис. 88) иссле-
дована в работе [5]. Сплавы азо-
тировали в атмосфере газообраз-
ного азота при давлениях 240—
Б45 гПа в интервале 800—1050 °C,
Рис. 89. Температурная зависимость
произведения растворимости S13N4 в
сплавах системы Fe—Si
1—20 ч. Растворимость азота определяли волюмометрическим методом.
На рис. 89 приведена зависимость произведения растворимости нитрида
кремния S13N4, образующегося в сплавах с 8 % (по массе) Si, от тем-
пературы.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Rawlings R.—J. Iron a. Steel Inst, 1957, v. 185, № 4, p. 441—449.
2. Rawlings R., Robinson P. M.— J. Iron a. Steel Inst., 1961, v. 197,
№ 4, p. 306—308.
3. Darken L. R., Smith R. P., Filer E. W. — Trans. AIME, 1951, v. 191,
p. 1147—1179.
4. Martin E. — Arch. Eisenhiittenw., 1929—1930, v. 3, S. 407—410.
5. Миланская И. H., Томилин И. А. — Изв. АН СССР. Сер. физ., 1970,
т. 34, № 2, с. 255—261.
ЖЕЛЕЗО — АЗОТ —
ЛАНТАН
Растворимость азота в сплавах си-
стемы железо—лантан исследова-
ли 1 методом микроструктурного
анализа. Сплавы с различным со-
держанием лантана [до 0,9 °/о (по
массе)] насыщали азотом из сме-
си азота (99 %) с водородом (1 %)
в интервале 1000—1400 °C с вы-
держкой от 6 до 24 ч.
На рис. 90 приведена раство-
римость азота в сплавах железо—-
лантан в зависимости от темпера-
туры. Конец горизонтального
участка соответствует концентра-
Рис. 90. Растворимость N в сплавах
системы Fe—La
1 Дог G. J. W. — Met. Trans., 1973, v.
4, № 1, р. 377-379.
117
ции лантана и азота, находящихся при данной температуре в равнове-
сии с нитридом LaN. Температурная зависимость растворимости нитри-
да лантана в y-Fe может быть представлена уравнением 1g —6730/
ЖЕЛЕЗО — АЗОТ — МАРГАНЕЦ
Растворимость азота в сплавах системы железо—марганец определяли
в работах [1, 2].
В работе [1] приведена растворимость азота при 1550 °C и давле-
нии 0,1 МПа в области концентраций марганца от 0 до 100 %. Для при-
готовления сплавов использовали электролитические железо и марганец
Рис. 91. Растворимость N в сплавах
системы Fe—Мп при 1550 °C и 0,1 МПа
Рис. 92. Растворимость N в сплавах
системы Fe—Мп в зависимости от тем-
пературы при давлении Na, равном
0,1 МПа
чистотой 99,9 %. Растворимость азота возрастала от 0,040 в чистом же-
лезе до 1,41 % в чистом марганце (рис. 91).
В работе [2] рассчитаны кривые растворимости азота при 900, 950,
1000, 1050, 1100 и 1150 °C по данным экспериментов, выполненных на об-
разцах, изготовленных из электролитических железа (с 0,05 % О) и мар-
ганца. Для их азотирования использовали очищенный азот. Сплавы при-
готовляли в тигле из А12О3 в атмосфере аргона при давлении 332 гПа,
а затем разливали в медную водоохлаждаемую изложницу. Слитки го-
могенизировали при 850 °C в откачанных кварцевых ампулах, а затем
отжигали при 900—1200 °C. При 900 °C равновесие достигалось в тече-
ние 15 ч при давлении азота 1,0 или 2,6 кПа. С повышением температу-
ры и давления время до достижения равновесия сокращалось. После
отжига образцы быстро охлаждали. Содержание азота определяли экс-
тракционным методом.
Во всем исследованном температурном интервале растворимость
азота возрастала с увеличением содержания марганца в сплавах
118
(|нк 92). При одной и той же молярной доле марганца в сплавах (до
0,1/) с повышением температуры от 900 до 1100°C наблюдалось умень-
шение растворимости азота. С повышением давления азота его раство-
римое и, в сплавах железо—марганец возрастала в соответствии с за-
коном Сивертса: ХМ=КР^2-
1.11БЛИОГРАФИЧЕСКИЙ СПИСОК
1. Dodd R. A., Goksen N. A —Trans. AIME, 1961, v. 221, № 2, р. 233—
236.
2. Grabke Н. J., J yer S. K-, Srinivasan S. R.— Z. Metallkde, 1975, Bd 66,
№ 5, S. 286—292.
ЖЕЛЕЗО — АЗОТ — НИКЕЛЬ
Сплавы системы исследованы рентгеновским методом [1, 2] в широком
диапазоне концентраций железа и никеля. В работе [1] в качестве ших-
ты использовали восстановленное железо и чистую никелевую проволо-
ку, которые сплавляли при 1500—1600 °C в печи Таммана в атмосфере
водорода. Азотирование стружки проводили в потоке аммиака в тече-
Рис. 93. Растворимость NbN в v-Fe
Рис. 94. Растворимость NbN в v-Fe
ние 24 ч при 300—1000 °C. Показано, что в сплавах системы при содер-
жании 10—70 % (ат.) Fe и менее 5 % (по массе) N наблюдается смесь
двух фаз с г. ц. к. структурой. Одна из этих фаз является нитридом,
в котором часть атомов железа замещена никелем. При содержании азо-
та более 5 % (по массе) в сплавах с 10—70 % (ат.) Fe наблюдается
только г. ц. к. нитридная фаза.
В сплавах, содержащих более 80 % (ат.) Fe и до 3 % (по массе) N,
появляется дополнительная о. ц. к. фаза (a-Fe), которая растворяет
очень мало азота, и гексагональная нитридная фаза, соответствующая
FegN, в которой только очень малая часть железа замещена никелем.
Комплексный нитрид Fe3NiN описан в работе [2]. Установлено, что
нитрид Fe3NiN имеет упорядоченную г. ц. к. структуру. Элементарная
ячейка состоит из пяти атомов, азот занимает октаэдрическую пору в
центре ячейки.
По методу взвешивания в неоднородном магнитном поле определе-
на намагниченность насыщения нитрида Fe3NiN, составляющая 166 элек-
тромагнитных ед. на 1 г и температура Кюри, равная 487 °C.
119
библиографический список
1. Hahn Н., Miilberg Н. — Z. Anorg. Chem., 1949, Bd 259, S. 121—125.
2. Wiener G. W„ Berger J. A. — Trans. AIME, 1955, Bd 203, S. 360—366.
ЖЕЛЕЗО — АЗОТ — НИОБИЙ
Сплавы системы изучали методом микроструктурного анализа [1],
а также методами электронной микроскопии и фазового анализа [2]. По
данным [1], зависимость растворимости нитрида ниобия в y-Fe от тем-
пературы в интервале 1191—1336 °C может быть представлена уравне-
нием 1g(% Nb- % N) = —10230/7"+4,04 (рис. 93). Молярная теплота рас-
творения NbN в y-Fe определена равной 11,18 кДж/моль.
В работе [2] изучена растворимость нитрида ниобия в железе в
интервале 750—1200 °C. Сплавы приготовляли в индукционной электро-
печи введением порошка нитрида ниобия в расплавленное железо. От-
жиг сплавов проводили при 750, 850, 950, 1050 и 1200 °C с выдержкой
30 мин при каждой температуре. С повышением температуры в изучен-
ных пределах растворимость NbC в y-Fe возрастает (рис. 94).
Абсолютные значения растворимости, полученные по данным хими-
ческого фазового анализа, оказались значительно выше, чем по дан-
ным электронномикроскопического исследования (последние можно счи-
тать более достоверными). При температурах ниже 900 °C растворимость
NbC в железе значительно меньше 0,05 %, а при 1100°C она составляет
-0,05 %•
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Smith R. Р, — Trans, AIME, 1962, v. 224, № 1, р. 190—191.
2. Гуляев А. П., Анашенко В. И., Карчевская И. И. и др. — МиТОМ,
1973, № 8, с. 6—8.
ЖЕЛЕЗО — АЗОТ — ПЛАТИНА
Соединение системы (нитрид Fe3PtN) изучали 1 методом рентгеновского
анализа. Заготовки сплава железа с 55,3 % (по массе) Pt вакуумной
выплавки после холодной прокатки до толщины 0,05 и 0,1 мм подвер-
гали азотированию в кварцевой трубчатой печи в атмосфере газовой
смеси NH3/H2. Установлено, что Fe3PtN имеет упорядоченную г. ц. к. ре-
шетку, элементарная ячейка которой состоит из пяти атомов. Азот за-
нимает октаэдрическую пору в центре ячейки. Методом взвешивания в
неоднородном магнитном поле определили намагниченность насыщения
нитрида Fe3PtN, температуру Кюри, равную 369 ЕС.
ЖЕЛЕЗО — АЗОТ — ТАНТАЛ
Исследование соединений системы выполняли2 методом фазового и
структурного анализа по методу Дебая на СиКа- и СгКа-излучениях.
Для приготовления сплавов тонко измельченные металлы высокой чис-
тоты (99,5 %) тщательно смешивали, спрессовывали и спекали в цир-
кониевых тиглях в высокочастотной вакуумной индукционной печи при
температуре примерно 1500 °C. Азотирование проводили в сухом аммиа-
ке при температурах 650—950 °C; продолжительность выдержки варьи-
ровали между двумя часами и двумя неделями. Азотированные образ-
цы охлаждали в аммонии до комнатной температуры.
__________ <
1 Wiener G. W., Berger J. Л. — Trans. AIME, 1955, v. 203, p. 360—366.
2 Shonberg N. — Acta. Chem. Scand., 1954, v. 8, p. 213—220.
120
Фазы, полученные в результате аммиачного азотирования железо-
г.нналовых сплавов при температуре 900 °C в течение 50 ч были сле-
дующими: Ta2FeNs+TaN в сплаве Tao,8oFeQ,20; Та2РеЫз в сплаве
Т.|(.,о7рео,зз; Ta2FeN3 +нитриды ______________________________________________________________________
железа в сплаве Ta0,5oFe0,so.
Фаза TaN(e) имеет гекса-
гональную решетку с периода-
ми 61 = 0,5185, с— 0,2908 нм и
отношением cfa = 0,561.
Фаза Ta2FeN2i5 обладает
гексагональной решеткой с че-
тырьмя металлическими атома-
ми в элементарной ячейке. Me-
таллические атомы в фазе име-
ют плотную упаковку. Раство-
римость нитридов железа в
TaN. как и тантала в богатых
азотом нитридах железа, не
установлена.
ЖЕЛЕЗО —АЗОТ —
ТИТАН
Сплавы системы исследовали в
работах [1, 2]. Исходными ма-
териалами служили железо чис-
тотой 99,97 %; титан с приме-
сями 0,10% Fe; 0,05 % N;
0,0011 % Н; 0,007 % О. Раство-
римость азота в сплавах желе-
зо—титан в жидком состоянии
в присутствии нитрида титана
и без него изучали методом от-
бора проб при 1600, 1650 и
1700 °C в концентрационной об-
ласти от 0 до 0,5 % Ti. Влия-
О 0,1 0,2 0,3 0,0 0,5 0,6
Ti, % (попассе)
Рис. 95. Растворимость N в сплавах систе-
мы Fe—Ti:
а— 1600 °C; б— 1650СС; е — 1700 °C
нием кислорода на раствори-
мость азота пренебрегали.
Полученные результаты приведены на рис. 95. Нитрид титана иден-
тифицирован как кубический TiN.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Morita Zen-ichi-ro, Kunisada Kyoji.— J. Iron a. Steel Inst. Jap., 1976,
v. 62, № 9, p. 563—569.
2. Morita Zen-ichi-ro. Kjmisada Kyoji— J. Iron a. Steel Inst. Jap.,
1977, v. 63, № 10, p. 1663—1671.
ЖЕЛЕЗО — АЗОТ — УГЛЕРОД
Сплавы системы наиболее полно изучены в работе [1]. Для исследова-
ния использовали методы рентгеновского и химического анализа. Для
получения сплавов карбонильное железо в виде порошка нагревали в
смеси водорода, аммиака и оксида углерода при 500—700 °C. Построе-
ны изотермические разрезы системы в указанном интервале температур
121
(рис. 96, 97). Предел растворимости азота и углерода в a-Fe не уста-
новлен. Растворимость азота в цементите не превышает 0,1 %, в Х-кар-
биде (Fe7C3 или Fe20C9 при 500°C) составляет 0,5 %. При 565 °C проте-
Рис. 97. Изотермический разрез системы Fe—N—С при
700 °C
122
h.icr четырехфазное превращение
у 4 -а+у'+ЕезС, при 575 °C — пре-
вращение у+Е^у' + ЕезС. Нитрид
у растворяет при 500 °C от 5,4 до
6,1 % N; при 550 °C — от 5,3 до
5,9 % N; при 600 °C — от 5,2 до
5,7 % N. Выше 680 °C фаза у' не-
устойчива. С повышением темпера-
туры растворимость углерода в
(-фазе уменьшается. Она состав-
ляет 4,1 % при 500 °C; 3,8 % при
550 °C, 3,4 % при 600 °C; 3,0 % при
700 °C. На рис. 98 изображен по-
литермический разрез системы
между е- и %-фазами, на рис. 99 —
проекция диаграммы состояния на
Рис. 98. Политермический разрез си-
стемы Fe—N—С между е- и %-фазами
треугольник составов.
В работе [2] исследование проводили методами рентгеновского и
термического анализов, что позволило построить проекцию моновариант-
пого равновесия на треугольник составов (рис. 100). Сплавы приготов-
ляли методом порошковой металлургии. Увеличение содержания азота
в сплавах снижает температуру эвтектоидного превращения, при этом
Рис. 99. Проекция системы Fe—N—С на треугольник составов
одновременно уменьшается и содержание углерода в эвтектоиде. В спла-
ве с 1,75 % N и 0,38 % С превращение y^a+Fe3(CN) протекает при
520 СС.
123
Рис. 100. Проекция моновариантных равновесий в системе
Fe—N—С на треугольник составов
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Naumann F. N-, Langensheid G. — Arch. Eisenhiittenw., 1965, Bd 36,
№ 9, S. 677—682.
2. Burdese A., Lucco Borlera M„ Pradelli G.— Metallurgica I tai., 1967,
v. 59, № 12, p. 949—952.
ЖЕЛЕЗО — АЗОТ — УРАН
Исследование 1 выполнено методами микроструктурного и рентгеновско-
го анализов. Приведены сведения о квазибинарном разрезе UN—Fe.
Рис. 101. Политермический разрез
UN—Fe системы Fe—N—U
Для приготовления сплавов
использовали порошок спектраль-
но чистого железа и UN в виде
порошка. Сплавы готовили прес-
сованием смесей из UN и железа
с последующим сплавлением при
1250—1800 °C в ториевых тиглях
в атмосфере очищенного аргона.
Железо предварительно отжигали
при 600—700 °C в сухом водороде.
UN получали разложением U2N3 в
вакууме при 1500 °C.
Квазибинарный разрез UN—
Fe (рис. 101) —эвтектического ти-
па с кристаллизацией эвтектики
при 1430+10 °C и 48,5+0,5 % (по
массе) Fe.
ЖЕЛЕЗО — АЗОТ — ХРОМ
Сплавы системы исследовали методами микроструктурного, электронно-
микроскопического, рентгеновского и химического анализов, а также тер-
мического анализа [1—3]. Образцы сплавов железо—хром азотировали
при 800 °C в смеси NH3+H2 и гомогенизировали при 1200 °C, 6 ч. Изу-
чили большое число сплавов, содержащих до 1 % (по массе) N и до
1 Briggs A G , Guha L., Barta L., White L. — Trans. Brit. Ceram. Soc., 1963,
v. 62, № 3, p. 221—246.
124
N, % (по массе)
Рис. 102. Изотермический разрез системы Fe—N—Сг при
1000 °C
40 % (по массе) Сг. Построены
изотермические разрезы при 1300,
1200, 1100, 1000, 900, 800 и 700 °C.
Разрез при 1000 °C представлен на
рис. 102. Выше 1300 'С наблюдает-
ся четырехфазное равновесие пе-
ритектического типа ж + а^у-Ь
+ Cr2N. При 790 °C наблюдается
четырехфазное равновесие у+
+ Cr2N4=ta+Cr2N, а при 760 °C
y+CrN^a+Fe4N. Построено про-
странственное изображение изу-
ченной части системы (рис. 103).
В области высоких темпера-
тур изучали [3] сплавы, получен-
ные из электролитического железа,
электролитического хрома и азоти-
рованного феррохрома, содержа-
щего % (по массе): 0,074 С; 0,285
Si; 0,022 Р; 0,0035 S; 0,19 А1; 60,82
Сг; 1,545 N. Сплавы азотировали
при 1250 °C при атмосферном дав-
лении чистого азота. Построены
политермические разрезы системы
при 0,2 и 0,3 % (по массе) N и 25,
30, 35 и 40 % (по массе) Сг (рис.
104, 105). При 1328 °C наблюдает-
ся перитектико-эвтектическое пре-
вращение ж + сг^у+СггМ.
Рис. 103. Пространственное изображе-
ние части системы Fe—N—Сг
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Iman Ynosin, Masumoto Zuesi, Maeda Keikili— J. Jap. Inst. Metals,
1965, v. 29, № 9, p. 860—865.
2. Iman Ynosin, Masumoto Zuesi, Maeda Keikili — J. Jap. Inst. Metals,
1965, v. 29, № 9, p. 866—871.
125
Or, % (no массе)
Рис. 104. Политермические разрезы системы Fe—N—Сг
при 0,2 и 0,3 % N
Рис. 105. Политермические разрезы системы Fe—N—Сг при 25; 30; 35 и
40 % Сг
3. Okamoto Masadzo, Naito Takesi — J. Iron a. Steel Inst. Jap., 1963,
v. 49, № 13, p. 1915—1921.
ЖЕЛЕЗО — АЗОТ — ЦЕРИЙ
Растворимость азота в сплавах системы железо—церий исследовали 1
методами микроструктурного и химического анализов.
Сплавы железа с различным содержанием церия насыщали азотом
в смеси 99 % N+1 % Н в интервале 1000-^1400 °C с выдержками от
6 до 24 ч.
1 Kor G. J. W. — Met. Trans., 1973, v. 4, № 1, р. 377—379.
126
Получены данные о
растворимости азота в
сплавах при температу-
рах азотирования 1000—
1200 °C (рис. 106). Конец
горизонтального участка
кривой соответствует
концентрации церия и
азота в y-Fe, находящем-
ся в равновесии с нитри-
дом CeN.
Температурная зави-
симость растворимости
нитрида церия в y-Fe мо-
жет быть представлена
уравнением 1g /<=—9040/
/Г+ 4,25.
ЖЕЛЕЗО—АЗОТ—
ЦИНК
Сплавы системы исследо-
вали 1 методами рентге-
новского анализа. Изучен
изотермический разрез
при 500 °C в области кон-
Рис. 106. Растворимость N в сплавах системы
Fe—Се
центраций цинка до 50 %
(ат.) и азота до 35 %
(ат.). Для приготовления сплавов ис-
пользовали электролитическое железо
чистотой (99,9 %) и цинк чистотой
99,99 %. Сплавы подвергали азотирова-
нию в атмосфере NH3+H2 при 500 °C в
течение 20 ч.
Показано, что в нитриде железа (у')
может растворяться при 500 °C более
20 % (ат.) Zn (рис. 107).
Период кристаллической решетки
нитрида железа, имеющего кубическую
структуру типа £12 с увеличением кон-
центрации цинка слабо уменьшается: от
0,280 нм (при 0 % Zn) до 0,279 нм [при
22,3 % (ат.) Zn].
ЖЕЛЕЗО — АЛЮМИНИЙ —
БЕРИЛЛИЙ
Сплавы системы практически не изучены
Рис. 107. Изотермический раз-
рез части системы Fe—N—Zn
[1, 2]. В работе [1] исследовано неболь-
шое число сплавов и установлено суще-
ствование соединения примерного соста- при 500 'С
ва А1?РезВе7. В работе [2] показано, что
тройного соединения FeAl2Be2,3. на существование которого указывалось
в более ранних работах, в системе железо—алюминий—бериллий не
имеется.
1 Stadelmaier Н. И., Yun Tong S. — Z. Metallkde, 1961, Bd. 52, № 7, S. 477—480.
127
библиографический список
1. Raynor G. V. — Acta Metallurgica, 1953, v. 1, p. 629—648.
2. Black P. Y. — Acta Crist., 1956, v. 8, p. 39—42.
ЖЕЛЕЗО —АЛЮМИНИЙ — БОР
Сплавы системы изучены методами микроструктурного и рентгеновского
анализов. В работе [1] приведен изотермический разрез при 800 °C
(рис. 108). Для приготовления сплавов использовали электролитическое
железо чистотой 99,5 %, алюминий чистотой 99,99 % и кристаллический
Рис. 108. Изотермический разрез системы Fe—Al—В при 800 °C
бор чистотой 98,5—98,9 %. Сплавы выплавляли в атмосфере аргона, от-
жигали при 800 °C и закаливали в воде. Установлено, что при 800 °C в
равновесии с твердым раствором на основе железа a-Fe находятся фазы
Fe2B и FeB. В фазе Fe2B растворяется 11 % (ат.) А1. В системе обна-
ружено одно тройное соединение <p(Fe3AlB3), которое плавится ин-
конгруэнтно.
Кристаллическая структура фазы Fe2B гексагональная с периодами
<2=0,5109 нм, с=0,4249 нм, с/п=0,8316. При растворении в ней 11 %
(ат.) А1 периоды возрастают: <7 = 0,5120; с=0,4258 нм, с/п = 0,8316 [1].
В работе [2] исследовали кристаллическую структуру тройного со-
единения. Для приготовления сплавов использовали спрессованные по-
рошки железа (99,99 %), алюминия (99,99 %) и бора (99,3%); плавку
проводили в атмосфере очищенного аргона в электродуговой печи. Го-
могенизирующий отжиг при 800 °C, 240 ч, осуществляли в кварцевых
откачанных ампулах, после чего образцы закаливали в воде. Полагают,
что соединение отвечает формуле Fe2AlB2 и имеет решетку типа Мп2А1В2
с периодами а—0,2923, 6 = 1,1046, с=0,2875 нм.
128
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I. Stadelmaier Н. Н„ Burgess А. Е., Davis М. S. — J. Metall, 1966,
V. 33, № 3, р. 33—34.
2. Кузьма Ю. Б., Чабан Н. Ф. — Изв. АН СССР. Неорган. материалы,
1969, т. V, № 2, с. 384—385.
ЖЕЛЕЗО — АЛЮМИНИЙ — ГАДОЛИНИЙ
Сплавы системы изучали методами микроструктурного [1] и рентгенов-
ского [1,2} анализа. Для приготовления сплавов использовали карбо-
нильное железо чистотой 99,98 %, алюминий AB000 (99,98 % AI) и га-
долиний чистотой 99,5 %. Плавку проводили в электродуговой печи в
атмосфере аргона. Отжигали сплавы при 500'°C, 1200 ч. Построен изо-
термический разрез при 500 СС части системы в области сплавов, со-
держащих до 33,3 % (ат.) Gel (рис. 109). Обнаружены три тройные фа-
Fe, % (ат.)
Рис. 109. Изотермический разрез части системы Fe—Al—Gd при 500 °C
зы: ip(GdFe4AI8), 4p'(GdFc2AI10) и Ai(GdFei-^.iAli-xi.e), ограниченные
области твердых растворов на основе фаз qr'(Gd2Fe17-*i4,5Alo->2,.>),
cp2(Gd2Fe6,o->.8,oAlo-^o,9) и соединений GdFe2(GdFc2->i,7Alo*>o,.-i) и
GdAl2(GdAl2-^i,i!iFeo->o,85) со структурами фаз Лавеса MgCu2(A2).
Фаза ф имеет тетрагональную рещетку типа ТЬМщг с периодами
а = 0,875; с = 0,501; с/п = 0,57. Фаза имеет решетку типа MgZn2 с пе-
риодами а=0,541, с = 0,881 нм, с/п=1,63 для состава GdFeAI, а для со-
става GdFei,4Alo,6 а=0,535 нм; с = 0,865 нм, с/й=1,62. Фазы <pi и <р2 от-
носятся к гомеотектическим структурным типам Th2Nii7 и ThgZrhz.
Кристаллическая решетка г^'-фазы не установлена.
В работе [2] исследовали сплавы разреза GdAI2—GdFe2. Сплавы
отжигали в откачанных ампулах при 800 °C в течение 100—300 ч, а за-
тем закаливали в воде. Фазовый состав изучали на дифрактометре.
Ниже приведены структура и периоды решетки сплавов:
% (Мол.) GdAl2 Структура а0, нм с0, нм с0/а
0 С15 0,739
25 С15 0,7521
27 015 0,7521
5—358
129
Продолжение
% (Мол.) GdAl2 Структура а0, нм с„, нм с0/а
С14 0,5339 0,8629 1,62
31 С14 0,6349 0,8651 1,62
36,5 С14 0,5367 0,8735 1,62
40 С14 0,5395 0,8730 1,62
50 С14 0,5414 0,8812 1,63
56,5 С15 0,7750
62,5 С15 0,7753
70 С15 0,7768
100 С15 0,7903
Примечание:
Структура С15 — кубическая,
а С14 — гексагональная.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. В1ечар О. I., Заречнюк О. С., Рябое В. Л —ДАН УРСР, 1973, № 11,
с. 1040—1042.
2. Oesterreicher II., Wallace W. Е. — J. Less-Common Metals, 1967, v. 13,
p. 91—102.
ЖЕЛЕЗО — АЛЮМИНИЙ — ГАФНИЙ
Сплавы системы изучены 1 частично методами рентгеновского и микро-
структурного анализов. Приведен изотермический разрез части системы
при 800'“С для сплавов, богатых железом и алюминием, при содержа-
нии до 33,3 % (ат.) Hf (рис. ПО). Для приготовления сплавов исполь-
Рис. 110. Изотермический разрез части системы Fe—-Al—Hf при 800 °C
зовали алюминий (99,7 %), гафний иодидный (99,95 %) и карбониль-
ное железо (99,98 %). Сплавы готовили в дуговой печи в атмосфере
очищенного аргона и отжигали в откачанных кварцевых ампулах при
800 СС, 700 ч. Установлено два тройных соединения ф и X. Фаза ф
имеет область гомогенности в пределах от 37 до 61 % (ат.) А1 и по-
стоянное содержание гафния: 7,7 % (ат.). Эго соединение обладает
кристаллической решеткой типа ТЬМп^, период а меняется от 0,85
[при 37 % (ат.) А1} Д° 0,865 нм [при 61 % (ат.) A1J при с=»0,492 нм.
1 Бурнашова В. В., Рядов В. Р., Марксе В. Я. — Доповш АН УРСР, 1969,
т. А, № 8, с. 741—743.
130
•I>.i 1.1 X имеет состав: 14 % (ат.) Hf, 20 % (ат.) Fe и 66 % (ат.) Al; ее
<«руктура не установлена.
ЖЕЛЕЗО — АЛЮМИНИЙ — ГЕРМАНИЙ
( плавы системы исследовали1 методами микроструктурного и рентге-
ппвского анализа,
11 (учили сплавы, богатые же-
ле «>м, содержащие до 27 % (по
массе) А1 и 25 % (по массе) Ge.
Для приготовления сплавов ис-
пользовали карбонильное железо,
кристаллический германий и алю-
миний AB000. Плавку проводили
и высокочастотной индукционной
печи в корундовых тиглях и атмо-
сфере аргона. Гомогенизирующий
in жиг осуществляли в атмосфере
водорода при 1100 °C, 4 ч, с по-
следующим медленным охлажде-
нием до комнатной температуры.
Изотермический разрез систе-
мы при комнатной температуре
приведен на рис. ill. Кроме твер-
а также путем измерения электросопротивления.
Рис. 111. Изотермический разрез ча-
сти системы Fe—Al—Ge при комнатной
температуре
дого раствора на основе железа, в
сплавах существует двухфазная
•бласть с соединениями Рез (Al, Ge),
I'e.iGe, а также образуется упорядоченная структура типа Fe3Al. Уста-
новлена граница существования упорядоченного твердого раствора.
С увеличением содержания германия упорядоченная структура образу-
ется при меньших концентрациях алюминия. Приведена зависимость пе-
риодов решетки твердого раствора железа от состава сплавов.
ЖЕЛЕЗО — АЛЮМИНИЙ — ИТТРИЙ
(’плавы системы изучали методом рентгеновского анализа. Исследова-
ны [1, 2] области сплавов, содержащих до 33,3 % (ат.) Y. Исходными
шихтовыми материалами для приготовления сплавов служили карбо-
нильное железо чистотой 99,99 %, алюминий AB000 чистотой 99,98 %
п иттрий чистотой 99,6 %. Плавку вели в электродуговой печи в атмос-
фере очищенного аргона. Отжиг проводили в вакууме при 500 °C,
2000 ч, после чего осуществляли закалку в воде. Построен изотерми-
ческий разрез при 500 °C (рис. 112). В системе существуют три тройных
соединения гр, гр' и ?ч. а также широкие области твердых растворов на
основе двойных соединений Z2(A1), X2(Fe), дц и <р2. Фаза гр имеет пере-
менный состав, описываемый формулой YFe^o-^sAls-^a, что включает
состав тройного соединения YFe4AI8, которое было установлено в рабо-
те [2]. Кристаллическая решетка гр-фазы — тетрагональная типа
Г11МП12; периоды решетки изменяются от а=0.872, с=0,504 нм, с/а=
0,578 (для состава YFe4Al8) до а=0,876, с—0,491 нм, с/а=0,559 (для
состава YFe5,8Al6,2).
Состав фазы гр' выражается формулой YFe2Al10, ее структура не
определена. Фазы X2(Fe) и Х2(А1) изоструктурны, представляют твердый
раствор алюминия в соединении YFe2 [—17% (ат.) АЦ и железа в
YA12 [—25 % (ат.) Fe], структурный тип MgCu2. Между этими соеди-
нениями на разрезе YFe2—YAI2 образуется тройное соединение
1 Елютин О. П., Хачатрян М. X. — МиТОМ, 1972, Ns 11, с. 15—18.
5*
131
X—YFei,o->i,2Ali,o->.o,8 co структурой типа MgZn2. Периоды решетки ме-
няются от « = 0.541, с = 0,881 нм, с/«= 1,628 для сплава YFeAl до а=
= 0,536 нм, с = 0,874, cfa— 1,631 для сплава YFei,2Al0,8.
Al, % (am.}
Рис. 112. Изотермический разрез части системы Fe—Al—Y при 500 °C
Двойные соединения YFe)7 (фазы epi и ср2 гомеотектических струк-
турных типов Th2Nii7 и Th2Zn)7 соответственно) растворяют значитель-
ное количество алюминия.
В фазе ср растворяется примерно до 55 % (ат.) А1, а в фазе ф1
примерно 20 % (ат.) А1. Периоды решетки фазы ср2 при этом изменяют-
ся от « = 0,851 нм, с—1,238 нм, с/«= 1,455 для Y2Fe)7 до « = 0,881, с=
= 1,277 нм, с/«= 1,450 при максимальном содержании алюминия. Перио-
ды решетки epi фдзы меняются от а=0,846, с=0,831 нм, с/а=0,982 для
Y2Fei7 до «=0,860, с=0,836 нм, с/«=0,972 для максимального содержа-
ния иттрия в твердом растворе. Фазы гр2 и дд несколько различаются
по содержанию железа. Область двухфазного равновесия между этими
фазами определить очень трудно.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Заречнюк О. С., Рыхаль Р. М„ Рябов В. Р., Вивчар О. И. — Изв.
АН СССР. Металлы, 1972, № 1, с. 208—210.
2. Заречнюк О. С. — ЦРЛХ УРСР, 1966, № 6, с. 767—768.
ЖЕЛЕЗО — АЛЮМИНИЙ — КАЛЬЦИЙ
Сплавы системы исследовали методами термического, микроструктур-
ного и рентгеновского анализов [1, 2]. Установлена область несмешива-
емости. Сплавы для исследования приготовляли из электролитического
железа и кальция чистотой 99,5 °/о> плавку проводили в дуговой печи
на медном водоохлаждаемом поддоне в атмосфере аргона. Область
несмешиваемости, существующая в двойной системе железо—кальций,
распространяется в тронную систему; критическая точка на кривой,
ограничивающей эту область, расположена при 33 % (по массе) Са и
34 % (по массе) А1.
В работе [21 изучали сплавы, прилегающие к стороне железо—алю-
миний и содержащие до ~33 % (ат.) Са. Для приготовления сплавов
использовали карбонильное железо чистотой 99,99 %, алюминий АВ00О
чистотой 99,98 % и кальций чистотой 99,6 %. Сплавы готовили в дуго-
вой печи в атмосфере аргона и отжигали при 500 °C, 2500 ч, затем за-
каливали в воде. На рис. 113 приведен изотермический разрез при
132
!i()() "С исследованной части системы. Установлено существование трой-
ной фазы ф состава CaFe4Al8 с тетрагональной структурой типа ТЬМхИг
и периодами а=0,885; с = 0,489 нм, с/о=0,553.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1 Ototani Tohei, Kat aura Yasuzi. — Sci. Repts. Res. Inst. Tohoku Univ.,
1969, v. A21, № 2, p. 69—82.
2 . Заречнюк О. С., В;.вчар О. I., Рябов В. Р. — ДАН УРСР, 1970, № 10,
с. 943—945.
ЖЕЛЕЗО — АЛЮМИНИЙ
- КОБАЛЬТ
Сплавы системы изучены сравни-
тельно подробно. Первоначально
полагали, что разрез Fe—CoAl яв-
ляется квазибинарным с непрерыв-
ным рядом твердых растворов.
Позднее И, 2] были исследованы
сплавы этого же разреза в интер-
вале от 300 до 1600 °C методами
дилатометрического анализа, а
также измерения электросопротив-
ления и коэрцитивной силы.
На рис. 114 приведен поли-
термический разрез Fe—CoAl [1].
При низких температурах сущест-
вует значительная область двух-
фазных сплавов Р-Ь Ря- Выше
750 °C между железом и CoAl
имеется широкая область твердо-
го раствора р, так как фазы р и
р2 взаимно растворяются. Высокая
коэрцитивная сила сплавов этой
системы достигается при чрезвы-
чайно медленном охлаждении от
температур 750—800 °C.
Рис. 114. Политермический разрез
Fe—CoAl системы Fe—Al—Со
5а—358
133
В работе [3] определяли область упорядочения фазы СоА1 в мед-
ленно охлажденных сплавах. Использовали алюминий чистотой
99,992 %, железо карбонильное и кобальт губчатый чистотой 99,99 %.
Образцы выплавляли при низком давлении водорода и гомогенизирова-
ли при 1000—1200 °C, 7 дней. Затем образцы охлаждали от 1000 до
300 °C со скоростью 10 °С/ч. Рентгеновским методом установлено, что
граница области на основе упорядоченной фазы СоА1 проходит при
50 % (ат.) А1. В сплавах образуются структуры с дефектами типа ва-
кансий. Приведены данные измерения периода кристаллической решетки
сплавов с 48—54 % (ат.) Со. Электросопротивление, твердость, коэрци-
тивную силу сплавов изучали в работе [4], также используя методы
рентгеновского и дилатометрического анализов. Свойства определяли
после закалки с 1000 °C (разупорядоченнсе состояние) и после медлен-
ного охлаждения со скоростью 25°C за 2 ч (упорядоченное состояние).
Авторы приводят также сведения о фазовом состоянии сплавов.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Иванов О. С. — Науч. тр./Ин-т металлургии АН СССР, 1958, № 3,
с 195____202.
2. Иванов О. С. — Изв. С. Ф. — X. А. 1949, т. XIX, с 503—513.
3. Ridley N. — J. Inst Metals, 1966, v. 94, № 7, p. 255—258.
4. Булычева 3. И., Кондратьев В. К., Погосов В. 3. и др. — Сб. трудов
Центрального научно-исследовательского института черной металлур-
гии, М.: Металлургия, 1969, вып. 71, с. 55—62.
ЖЕЛЕЗО —АЛЮМИНИЙ — КРЕМНИЙ
Сплавы системы изучены практически полностью [1—8]. Критический
обзор исследований этой системы с учетом собственных данных приве-
AL, % [по массе)
134
ion и [1]. На рис. 115 представлена проекция поверхности кристаллиза-
ции системы, обнаружено шесть полей первичной кристаллизации трой-
ных фаз, состав которых следующий [2]:
< Хнмначение фазы Формула Соединение, % (по массе) Область гомогенности, % (ат.)
Al Fe Si
'И Al3Fe3Si2 26,6 55,0 18,4
Т2 Al12Fe6Si5 40,5 41,9 17,6
Т3 Al9Fe5Si5 36,6 42,1 21,2 2—3
т4 Al3FeSi2 41,9 28,9 29,1
т5 Ali5Fe6Si5 46,0 38,1 16 5
Тб Al4FeSi 56,3 29,1 14,6
Ниже приведены характеристики нонвариантных точек системы,
включая температуру и тип реакций:
Точка Температура Нонвариантная реакция Содержание, % (по массе)
А1 Fe Si
6/1 1120 ж -ф- е a6Fe + ч] 46 51 3
Pl 1050 ж + cc6Fe-J- РTi 31 50 19
6/2 1030 ж + a6Fe т] 37,5 48,5 14
U3 1020 ж + 0 + Ti 38 48 14
1000 Ж ф р Й -L Ц 26 42 32
р. 940 ж 9 -J- т2 41 40 19
Рз 935 ж -j- Ti + т2 т3 39 39 22
Us 885 ж 4- тх (0 + т3 36 28 36
uG 880 ж + х±т3 (Si) 38 26 36
Р4 865 ж + т3 + (Si) т4 45 23 32
Р5 855 ж + 0 -ф- т2ха т5 58 25 17
и. 835 ж 4“ Т3 Т2 + Т4 56 22 22
и, 790 ж4-т2^т44-т5 61 18 21
р6 700 ж 4- т4 4- т5 т6 78 8 14
и9 620 ж 4- е (А1) 4- т5 95 2 3
6/10 615 ж + т5^ (А1) + т6 93 2 5
6/ц 600 ж 4“ т4 т6 4- (Si) 85 1 14
Е1 577 ж^т64-(А1)4-(50 88,4 — 11,6
Пространственное изображение системы в области сплавов, богатых
железом, по данным [2], представлено на рис. 116.
Кристаллическую структуру тройных фаз системы исследовали в
ряде работ. По данным [3], фаза т2 имеет кубическую кристаллическую
решетку с периодом а= 1,603 нм, по данным [4), моноклинную с перио-
дами «=1,78; Ь = 1,025; с=0,89 нм; Р = 132° [4]. Фаза т4 обладает тетра-
гональной кристаллической решеткой. Согласно [51, при составе
Al57Fei5Si28 периоды этой фазы а = 0,630 и с=0,941 нм, а при составе
Al47Fei5Si38 « = 0,612 и с = 0,953 нм. Фаза т5, по данным [6], имеет куби-
ческую кристаллическую решетку с периодом а= 1,2548 нм, а по дан-
5а
135
Рис. 116. Пространственная диаграмма ча-
сти системы Fe—Al—Si
ным [7], структура этой фазы
гексагональная с периодами о=
— 1,23, с=2,62 нм. Фаза т6, со-
гласно [6], имеет моноклинную
кристаллическую решетку с пе-
риодами tz = 0,612; £> = 0,612; с=
= 0,415 нм; р = 9Г°, а по дан-
ным [8], она имеет тетрагональ-
ную кристаллическую решетку
с параметрами я=6,18; с =
= 4,25 нм.
БИБЛИОГРАФИЧЕСКИЙ
СПИСОК
1. Koster W., Godecke Т. — Z.
Metallkde, 1980, Bd 71, № 12,
S. 765—769.
2. Lihl F., Burger R., Sturm F.,
Ebel H. — Arch. Eisenhut-
tenw., 1968, Bd 39, № 11,
S. 877—880.
3. Armand M. — Congres inter-
national de 1’aluminium, Pa-
ris, 1954, v. 1, p. 303—327.
4. Munson D. — J. Inst. Met.,
1967, v. 95, p. 217—219. Dis-
cussion Sun C. Y., Mondol-
fo L. F. — J. Inst. Met., 1967,
v. 95, № 12, p. 384.
5. Муравьева А. А., Герман
H. B., Заречнюк О. С., Гла-
дышевский Е. И. — В кн.:
II Всесоюзная конференция по кристаллохимии интерметаллических
соединений. Львов, 1974, с. 35—36.
6. Phragmen G. — J. Inst. Met., 1950, v. 77, p. 489—552.
7. Robinson K., Black P. У. — Phil. Mag., 1’953, v. 44, p. 1392—1397.
8. Black P. — J. Phil. Mag., 1955, v. 46, p. 401—409.
ЖЕЛЕЗО — АЛЮМИНИЙ — МАРГАНЕЦ
Сплавы системы изучали методами рентгеновского, микроструктурного
и дилатометрического анализов, а также измерением магнитных свойств,
твердости и микротвердости [1—31.
В работах [1,2] приведены изотермические разрезы системы для
температур 1040, 980, 760 °C [1] и 1000 °C (рис. 117) [2], На рис. 117
представлен изотермический разрез системы при 1000 °C [3]. Сплавы по-
лучали в атмосфере аргона, используя шихтовые материалы высокой
чистоты; продолжительность отжига при 1000 °C составляла 7 дн.
Система характеризуется наличием широких областей твердых рас-
творов на основе исходных компонентов в двойных соединений.
В работе [3] изучали сплавы системы, богатые железом. Для при-
готовления сплавов использовали армко-железо, электролитический мар-
ганец и алюминий AB000. Плавку проводили в индукционной печи в
атмосфере аргона. Продолжительность отжига при 1150, 1000, 850, 750,
650 и 550 °C составляла соответственно 15, 30, 96, 240 и 480 ч. Построе-
ны изотермические разрезы при 650, 750, 850 и 1000 и 1150 °C, а также
136
Рис. 117. Изотермический разрез системы Fe—Al—Мп при 1000 °C
Рис. 118. Политермические разрезы системы Fe—Al—Мп при постоянном
содержании алюминия:
а — 4; 6 — 7; в — 10 % (по массе)
политермические в области указанных температур для сплавов с по-
стоянным содержанием алюминия: 4; 7 и 10 % (по массе)—рис. 118.
11о данным [3], магнитная проницаемость изученных сплавов не изме-
няется с изменением содержания в них марганца. По мере увеличения
к структуре сплавов количества немагнитных фаз и при понижении
137
температуры относительная магнитная проницаемость понижается при
1000 °C от 9,3 до 3,8, при 850 °C от 9,2 до 0, при 750 °C от 8,45 до 0
и при 650 °C от 7,8 до 0. Твердость сплавов в а- и (а-Ьу)-областях
составляет 800—980 МПа. Микротвердость феррита 2950—3450 МПа,
у-твердого раствора 1610—2050 МПа, р-Мп — 9810—11760 МПа.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Schmatz D. Y. — Trans. AIME, 1959, v. 215, № 1, p. 112—114.
2. Chakrabarti D. Y. — Met. Trans., 1977, v. 8B, № 1, p. 121—123.
3. Шведов Л. И., Гдрецкий Г. П. — В кн.: Структура и свойства метал-
лов и сплавов. Минск: Наука и техника, 1974, с. 199—204.
ЖЕЛЕЗО — АЛЮМИНИЙ — МЕДЬ
Сведения о диаграмме состояния в основном относятся к сплавам, бо-
гатым алюминием, однако в работах [1, 2] имеются сведения и о других
сплавах системы. В работе [1] исследован изотермический разрез систе-
мы при 600 °C (рис. 119). Для приготовления сплавов использовали
алюминий чистотой 99,98 %, железо чистотой 99,99 % и медь чистотой
Рис. 119. Изотермический разрез системы Fe—AI—Си при 600'С
99,999 %. Плавку проводили в дуговой печи в атмосфере аргона, от-
жигали сплавы в откачанных кварцевых ампулах при 800 и 600°C в те-
чение 200 н 400 ч, после чего закаливали в воде. Установлено образо-
вание трех соединений FeCu2Al6 (ф), FeCu2Ab (<о), FeCuwAli0 (Ф).
Фаза ф имеет небольшую область гомогенности: 8—13 % (ат.) Fe;
17—25 % (ат.) Си и 65—70 % (ат.) А1. Фаза Ф имеет также область
138
омогсп пости: 1—6 % (ат.) Fe; 44—50 % (ат.) Си и 47—51 % (ат.) А1.
При температуре 800 °C в системе Fe—Си—А1 существует одна трой-
ная фаза ф.
В работе [2] исследован политермический разрез системы при по-
стоянном содержании железа 25 % (ат.).
ЫПЗЛИОГРАФИЧЕСКИЙ СПИСОК ч
1. Нрсварский А. П. — Изв. АН СССР. /Металлы, 1971, № 4, с. 220—
222.
?. Pantasis A., Wachtel Е. — Z. Metallkde, 1978, Bd 69, № I, S. 50—59.
ЖЕЛЕЗО — АЛЮМИНИЙ — МОЛИБДЕН
Сплавы системы исследовали 1 методами рентгеновского и микрострук-
турного анализов [1]. Для приготовления сплавов были использованы
железо карбонильное чистотой 99,95 %, алюминий AB000 чистотой
99,97 %, молибден чистотой 99,95 %. Сплавы для исследования получа-
ли в дуговой печи в атмосфере аргона, отжигали при 1050 и 800 °C в те-
чение 8 и 800 ч соответственно, а затем закаливали в воде. Построены
два изотермических разреза — при 1050 и 800°С (рис. 120, 121). При
температуре 1050 °C в системе существуют две тройные промежуточные
фазы N и S. Фаза N содержит 25 % (ат.) Мо: 7 % (ат.) Fe и 68 % (ат.)
1 Марков В. Я., Бурнашова В. В, Рябов В. Р. — ДАН УРСР, 1970, т. А, № 1,
с. 69—72.
139
Al; фаза S — 5 % (ат.) Mo; 35 % (ат.) Fe и 60 °/o (ат.) Al. При пони-
жении температуры эти фазы претерпевают распад: М-фаза — ниже
900 °C и S-фаза в интервале 1050—1000 °C. При 800 °C в изученной час-
ти системы промежуточных фаз не обнаружено.
Фаза N имеет структуру типа Т1А13 с периодами: а=3,767; с=
= 8,438 нм; с/а = 2,24 (MoFeo,28Al2,72).
ЖЕЛЕЗО — АЛЮМИНИЙ — НЕОДИМ
Сплавы системы в области содержания до 33,3 % (ат.) Nd исследова-
ли 1 методом рентгеновского анализа. Для приготовления сплавов ис-
пользовали карбонильное железо чистотой 99,99 %, алюминий AB000
чистотой 99,98 °/о и неодим чистотой 98,6 %. Продолжительность отжига
при 500 °C составляла 2500 ч, после чего сплавы закаливали в воде.
Построен изотермический разрез системы при 500 °C (рис. 122). В изу-
ченной области сплавов обнаружены три промежуточных тройных
соединения N, ф' и ф; установлена большая растворимость алюминия в
фазе Nd2Fei7 (<р2). В равновесии с твердым раствором на основе железа
находятся фазы на основе двойных соединений Nd2Fei? и FeAl2 и трой-
ная фаза ф переменного состава NdFe3,3-*4Al8,7->8; кристаллическая ре-
шетка тетрагональная и принадлежит к типу ThMni2. Периоды решет-
ки для сплава состава NdFe3,3Al8,7 а=0,878, с = 0,505 нм, с/а=0,571;
для состава NdFe4Al8 а=0,878, с=0,504 нм, с/а = 0,574.
1 Вивчар О. И., Заречнюк О. С., Рябов В. Р. — Изв. АН СССР. Металлы,
1970, № 1, с. 211—213.
140
Максимальное содержание алюминия в фазе срг, или Nd2(Fe, А1) п,
ингаиляет 45 % (ат.). Эта фаза имеет тригональную структуру типа
Г1|;/П17. Увеличение содержания алюминия в ср-фазе приводит к изме-
нению периодов решетки от а=0,858, с= 1,246 нм, с/п= 1,452 для Nd2Feiy
Al, % lam.)
Рис. 122. Изотермический разрез части системы Fe—Al—Nd при 500 °C
до п=0,889, с== 1,290 нм, с/а= 1,451 для сплава Nd2Fe8,5Al8,5. Фаза ф
имеет состав, приблизительно соответствующий формуле NdFe2Ali0; ее
структура не определена. Структура фазы N также не известна, состав
ее переменный: NdFei,2^.i,65Alo,8-*o,3s-
ЖЕЛЕЗО — АЛЮМИНИЙ — НИКЕЛЬ
Данные об изучении сплавов системы содержатся в ряде работ. В ра-
боте [1] на основании литературных данных и результатов собственных
работ предложено пространственное изображение диаграммы состояния
(рис. 123). Исследование проводили методами микроструктурного и
рентгеновского анализов, а также путем измерения удельного электро-
сопротивления, коэрцитивной силы и магнитного насыщения.
Несколько позднее [2] с учетом данных [1] был проведен термоди-
намический расчет фазовых равновесий в сплавах системы, что позво-
лило построить пять политермических разрезов, проходящих через же-
лезный угол при отношении Ni—Al (в атомных процентах), равном
25 : 75, 35 : 65, 40 : 60, 45 : 55 и 50 : 50.
В работе [3] представлены изотермические разрезы при 1700, 1600,
1400 и 1200 К, равновесия в которых получены расчетным методом.
В работе [4] приведены изотермы ликвидус части системы Fe—Al—
Ni2Al3, построенные методом планирования эксперимента, однако на
поверхности ликвидус не нанесены моновариантные линии и нонвари-
антные точки.
На основании исследования диаграммы состояния разработан ряд
магнитнотвердых сплавов.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Иванов О. С. —Изв. СФХА. АН СССР, т. 19, с. 503—513.
2. Roesber U. H. — J. Metals, 1956, v. 8, № 10, Sec. 2, p. 1285—1289.
3. Kaufman L., Nesor //. — Met. Trans., 1974. v. 5, № 7, p. 1623—1629.
4. Идирисов А. И., Каирбаева 3. К., Сейтжанов С. В. — Комплексное
использование минерального сырья; 1979, № 8, с. 30—33.
141
Рис. 123. Пространственная диаграмма части системы Fe—А!—Ni
ЖЕЛЕЗО — АЛЮМИНИЙ — НИОБИЙ
Диаграмма состояния системы изучена частично *. Приведен изотерми-
ческий разрез при 1000 °C, построенный по результатам рентгеновского
анализа (рис. 124). Для приготовления сплавов использовали алюминий
чистотой 99,999 %. Сплавы получали в дуговой печи в атмосфере арго-
на, отжиг проводили в откачанных кварцевых ампулах. Система желе-
зо—алюминий—ниобий характеризуется широкими областями гомоген-
ности на основе железа, ниобия, двойных соединений NbFe2, Nb2Al, так-
же установлено тройное соединение ^'(NbsoAbsFe^), которое родственно
по структуре фазе р двойной системы железо — ниобий. Раствори-
мость алюминия в соединении NbFe2 составляет ~45 % (ат.); раство-
римость железа в соединении Nb2Al равна ~ 10 % (ат.), а в соединении
NbAl3 не превышает 5 % (ат.).
Кристаллическая решетка соединения NbFe2 типа MgZn2; соедине-
ние Nb2Al изоструктурно о-фазе.
ЖЕЛЕЗО — АЛЮМИНИЙ — САМАРИЙ
Сплавы системы изучали 1 2 методом рентгеновского и микроструктурного
анализов. Для приготовления сплавов использовали железо карбониль-
1 Raman Aravamudhan — Z. Metallkde, 1966, Bd. 57, № 7, S 535 —540.
2 В1вчар О. И., Заречнюк О. С., Рябов В. Р. — ДАН УРСР, сер А, 1974, № 4,
с. 363—365.
142
AL % (am.)
Рис. 125. Изотермический разрез части системы Fe—Al—Sm при 500 °C
ное чистотой 99,99 %, алюминий AB000 чистотой 99,98 % и самарий чис-
тотой 99,96 %. Сплавы получали в электродуговой печи в атмосфере
очищенного аргона и отжигали при 500 °C в течение 1000 ч, а затем за-
каливали в воде. Построен изотермический разрез при 500 °C части си-
стемы при содержании 33,3 % (ат.) Sm (рис. 125). Обнаружены три
тройных соединения: SmFe2Ali0 (ф'-фаза), SmFe3,3-^5,6A18.7-*6,4 (ф-фаза);
SmFei.i->i,4Alo,9->o,6 (Х,-фаза). Двойные соединения Sm2Fei7 (<р2-фаза) и
SmFe2 (Х,2(Ре)'фаза) растворяют алюминий — соответственно 35 и 7 %
(ат.); соединение SmAl2 (?v2(А1)-фаза) растворяет ~28 % (ат.) Fe. Дру-
гие двойные соединения не образуют широких областей гомогенности.
143
Кристаллическая структура соединения SmFe2Al10 не установлена.
Соединение SmFe3,3^-5,6Als,7->б,4 имеет структуру типа ThMni2, периоды
решетки а = 0,871 нм, с=0,501 нм для состава SmFes.eAh^ и а=
= 0,881 нм, с=0,505 нм для состава SmFe3,3Al8,7. Соединение
SmFei,i->i,4Alo,9->o,6 представляет собой фазу Лавеса со структурой ти-
па MgZn2 и периодами решетки а= 0,540, с= 0,875 нм для состава
SmFei,iAl0r9 и а=0,536, с = 0,868 нм для состава SmFei.iAlo.e- Соедине-
ния SmFe2 и SmAl3 являются фазами Лавеса со структурой типа
MgCu2. Соединение Sm2Fei7 имеет структуру типа Th2Zni7 с периодами
решетки а = 0,854, с= 1,243 нм.
ЖЕЛЕЗО — АЛЮМИНИЙ — СЕРЕБРО
Диаграмма состояния системы исследована1 частично методами
рентгеновского и микроструктурного анализов. Приведен изотермичес-
кий разрез при 500 ° С. Для приготовления сплавов использовали
карбонильное железо чистотой 99,99 %, алюминий AB000 чистотой
Рис. 126. Изотермический разрез системы Fe—Al—Ag при 500 °C
99,97 % и серебро чистотой 99,9 %. Сплавы получали в дуговой печи
в атмосфере аргона, а затем отжигали в эвакуированных кварцевых
ампулах при 500 ° С, 600 ч, а затем закаливали в воде. По результа-
там рентгеновского и микроструктурного анализов построен изотерми-
ческий разрез при 500 ° С (рис. 126). Штриховой линией ограничена
1 Бурнашова В. В., Заречнюк О. С., Строганов Г. Б. и др. — ДАН УРСР, 1973,
сер. А, № 6, с. 552—554.
144
широкая область несмешиваемости компонентов в жидком состоянии,
которая простирается от двойной системы железо — серебро вглубь
। ройной. Алюминиды железа и серебра находятся в равновесии.
ЖЕЛЕЗО — АЛЮМИНИЙ — СКАНДИЙ
('плавы системы исследовали1 методами рентгеновского и микрострук-
typnoro анализов. Для приготовления сплавов использовали карбо-
нильное железо (99,99 %), алюминий AB000 (99,98 %) и скандий
(99,96%). Плавку проводили в дуговой печи в атмосфере аргона;
сплавы отжигали при 500 ° С в течение 2500 ч, а затем закаливали в
поде. Построен изотермический разрез системы при 500 ° С (рис. 127).
Обнаружены две тройные промежуточные фазы ф и которые соот-
Рис. 127. Изотермический разрез части системы Fe—Al—Sc при 500 °C
нстственно имеют состав ScFe4i0->-7,i А18,о->4,9 и ScFe0,30_>1)35 А1|,7->о,65.
Фаза ф обладает тетрагональной структурой типа ThMnj2 с пе-
риодами н = 0,870—0,868, с—0,481—0,477; с/а = 0,553—0,551. Фаза
относится к семейству фаз Лавеса; ее кристаллическая структура от-
вечает типу MgZn2. Периоды решетки изменяются в зависимости от
состава и для сплава ScFeo,3o Ahjo имеют значения а = 0,5301, с=
Л,8587, с/а=1>62, а для сплава ScFei 35 А1О,65 а=0,5108 нм, с=
0,8319 нм, с/а=1,63.
ЖЕЛЕЗО — АЛЮМИНИЙ — ТАНТАЛ
Сплавы системы исследовали2 методом рентгеновского анализа. Для
приготовления сплавов использовали железо чистотой 99,99 %; алю-
миний чистотой 99,999 %; тантал чистотой 99,9 %; плавку проводили
в дуговой печи в атмосфере аргона и отжигали в откачанных квар-
цевых ампулах 1000 ° С, 7 дн., охлаждали на воздухе. Построен
изотермический разрез (рис. 128). В изученной части системы обна-
ружена тройная фаза р/, обладающая областью гомогенности — от
20 до 40 % (ат.) А1 и от 20 до 30 % (ат.) Fe. Периоды решетки
p-фазы в двойных сплавах: а = 0,4911 нм, с = 2,698 нм, с/н = 5,494; для
сплава состава Fe27Al27Ta46 периоды фазы р/ н=0,4973; с=2,731 нм;
cja=5,490.
1 Заречнюк О. С., В1вчар О. I., Рябов В. Р. ДАН УРСР, 1970, сер. А, № 10,
с. 943—945.
2 Hunt Coy R., Raman Aravamudhan. — Z. Metallkde, 1968, Bd. 59, № 9,
S. 701—707.
145
Рис. 128. Изотермический разрез части системы Fe—Al—Та
при 1000 °C
ЖЕЛЕЗО — АЛЮМИНИЙ — ТИТАН
Диаграмму состояния системы исследовали в работах [1—3], особен-
но в области сплавов, богатых титаном и алюминием. Сплавы изучали
методами микроструктурного, рентгеновского и микрорентгеноспект-
рального анализов, проводили измерение температур плавления и
микротвердости. Сплавы выплавляли из иодидного и губчатого тита-
на, электролитических железа и алюминия чистотой 99,99 % в электро-
дуговой печи в атмосфере аргона, подвергали отжигу в откачанных
ампулах при 1000 ° С, 20 ч; 900 ° С, 74 ч и 800 ° С, 192 ч и закалке
в воде. Полученные результаты позволили представить поверхность
ликвидус (рис. 129); построены изотермические разрезы при 800 и
20 ° С. В системе обнаружено три тройных соединения Ti(TiAlFe2);
T2(TiAl2Fe) и ^(—TigAl^Feg). Эти соединения плавятся конгруэнтно
при 1270, 1240 и 1330 ° С соответственно. Поверхность кристаллизации
сплавов системы сложна и характеризуется 14 нонвариантными
превращениями, температуры которых приведены на диаграмме, а
также четырьмя нонвариантными равновесиями в твердом состоянии.
Изотермический разрез при 800 ° С (рис. 130) характеризуется боль-
шой сложностью в распределении фазовых областей и широкими
областями гомогенности на основе железа и двойных соединений
TiFe и TiFe2. При 800 ° С растворимость алюминия в этих соедине-
ниях составляет 25 и 37 % (ат.) соответственно, а при 20 ° С в соеди-
нении TiFe растворяется до 20 % (ат.) А1.
Сведения о характере взаимодействия элементов в системе в
твердом состоянии содержатся в работе [1]. Материалами для приго-
товления сплавов служили железо чистотой 99,999 %, алюминий чи-
стотой 99,98 % и титан чистотой 99,9 %. Построен изотермический
146
разрез при 1000 ° С (отжиг в течение 500 ч). Изотермический разрез
сплавов системы отожженных при 800 ° С в течение 600—900 ч харак-
1еризуется существованием тройных соединений: А-фаза [25 °/о (ат.)
I’i; 9 % (ат.) Fe; 66 % (ат.) АЦ, х-фаза [6 % (ат.) Ti; 25 % (ат.) Fe;
69 % (ат.) A1J и Т-фаза [25 % (ат.) Fe; 40—50 % (ат.) Alj. Эти дан-
ные хорошо согласуются с результатами работы [2].
Кристаллическая структура фазы Ту кубическая, период решетки
«=0,414 нм [2]. Фаза Т2 имеет г. ц. к. решетку и <7=1,182 нм, а фаза
/’j кубическую решетку типа Cu3Au и <7 = 0,393 им [2].
В работе [3] для соединения 7’2(TiAl2Fe) установлен тип структу-
ры Mg6Cui6Si7, а для соединения 73(~Ti8Al22Fes) аналогично данным
более поздней работы [2] — тип структуры Z.l2 (Cu3Au).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I. Dew-Hughes D. — Met. Trans., 1980, All, № 7, p. 1219—1225.
2. Seibolcl A. — Z. Metallkde, 1981, Bd 72, № 10, S. 712—719
3. Маркие В. Я., Бурнашова В. В. — Металлофизика. Респ. межвед. сб.
АН УССР, Киев: Наукова думка, 1973, вып. 46, с 103—НО.
147
Al
Fe, % (am.)
Рис. 130. Изотермический разрез системы Fe—Al—Ti при 800 °C
ЖЕЛЕЗО — АЛЮМИНИЙ — УГЛЕРОД
Исследовали [1] сплавы с 1,92—4,0 % С и 4,56—25,2 % А1 в интервале
1000—1250 ° С. Построены изотермические разрезы (рис. 131) и поли-
Рис. 132. Политермический разрез си-
стемы Fe—Al—С с 3 % С
О 2 4 6 8 101214 16 1820222426
А1, % (по пассе)
148
к-рмпчсские при 2 и 3 % С (рис. 132). Сплавы системы изучали мето-
л.|мн микроструктурного, рентгеновского и термического анализов, а
пипке проводили измерение твердости. Карбидная фаза К на всех
Рис. 133. Политермические разрезы системы Fe—Al—С
с 15, 20, 25 и 30 % А1 (соответственно а—г)
Изучали также [2] сплавы, содержащие 15—30 % А1 и до 2,5 % С,
приготовленные расплавлением в высокочастотной печи (с использова-
нием алюминия чистотой 99,5%). Построены политермические разрезы
при содержании 15, 20, 25 и 30 % А1 (рис. 133) и изотермический
разрез при 1000 ° С.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Nisida Keidzo. — Bull. Fac. Eng. Tokkaido Univ., 1968, № 48, p. 71—
108.
2. Vyklicky M., Тшпа H. — Hutn. listy, 1959, t. 14, S. 118—127.
149
ЖЕЛЕЗО — АЛЮМИНИЙ — УРАН
Диаграмма состояния системы в основном изучена 1 2 в области спла-
вов, богатых ураном. Исследован политермический разрез UFe2 — UA12.
Для приготовления сплавов использовали алюминий чистотой 99,996 %,
железо чистотой 99,96 % и
О 10 20 30 90 50 60 70 80 90 100
UFez UAl2, °/о (мол.) UAT2
Рис. 134. Политермический разрез UFez—
UAlz системы Fe—Al—U
уран чистотой 99,99 %; плавку
проводили в дуговой печи в ат-
мосфере аргона и гелия. Изо-
термический отжиг при I000 °C
в течение одной—двух недель
осуществляли в откачанных
кварцевых ампулах, образцы
завертывали в молибденовую
фольгу. Политермический раз-
рез UF'e2—UAl2 по данным тер-
мического микроструктурного и
рентгеновского анализов при-
веден на рис. 134. Разрез яв-
ляется квазибинарным; сущест-
вует широкая область твердых
растворов на основе соедине-
ний. При 700+Ю °C по пери-
тектоидной реакции образуется
соединение UF'eAl, практически
не обладающее областью гомо-
генности.
Соединение U(AlFe)2 от-
носится к фазам Лавеса типа
MgZn2 (Cl4). Сплав, закален-
ный с 675 °C и содержащий
35 % (мол.) LTAl2, имеет перио-
ды а = 0,5212 нм, с=0,8036 нм,
гексагональной решеткой с пе-
с/а= 1,542. Соединение UF'eAl обладает
риодами <3 = 0,6672 нм, с = 0,3981 нм; с/п=0,597.
ЖЕЛЕЗО — АЛЮМИНИЙ — ФОСФОР
Диаграмма состояния системы изучена2 в области сплавов, богатых
железом. Для приготовления сплавов использовали чистые железо,
алюминий и красный фосфор, вводимый в сплавы в виде лигатуры,
содержащей ~ 30 % (по массе) Р. Методами термического и микрост-
руктурного анализов построена проекция поверхности ликвидус си-
стемы в области сплавов, богатых железом — 35 % (по массе) А1 и
25 % (по массе) Р (рис. 135). В изученной области сплавов не обна-
ружено тройных соединений. Разрезы М — А1Р и Fe2P — А1Р явля-
ются квазибинарными. Нонвариантные превращения описываются сле-
дующими данными. Перитектическое превращение (Ui) при ~ 1025 °C
JKui+Fe3P->a+Fe2P; точка U, расположена при 12 % (по массе) Р
и 8 % (по массе) А1. Эвтектическое превращение (£]) протекает при
995 °C: ж£1^=а+А1Р+Ре2Р; точка Е[ расположена при 12 % (по
массе) Р и 17 % (по массе) А1. На рис. 136 приведен изотермический
разрез системы при комнатной температуре. Содержание алюминия в
«1 и а2 при этой температуре составляет — 15 и 29 % (по массе)
соответственно.
1 Dam D. J., Darby J. В. а.о.—З. Nucl. Mater., 1967, v. 22, № 1, p. 22—27.
2 Vogel R., Klose H. — Veh. Eisenhuttenw., 1952, Bd. 23, H. 7/8, S. 287—291.
150
Рис. 136. Изотермический разрез системы Fe—Al—Р при
комнатной температуре (20 °C)
151
ЖЕЛЕЗО —АЛЮМИНИЙ — ХРОМ
Сплавы системы исследовали в работах [1—5] методами термического
и микроструктурного анализов, измерением твердости и электрической
проводимости. Определили фазовое строение сплавов богатых желе-
зом и хромом, включая область тройных твердых растворов на осно-
Рис. 137. Ликвидус (а) и солидус (6) системы Fe—А1—Сг
ве FeAl. При определении исходили из диаграмм состояния двойных
систем, образующих тройную систему.
В работе [2] изучали сплавы политермических разрезов FeAl3—
СгА13 и Fe3Al—Fe3Cr, закаленные с 1000 ° С и медленно охлажденные
со скоростью 25 ° С. Установлено изменение температур упорядочения
твердых растворов на основе соединений Fe3Al и FeAl в зависимости
от состава сплава.
Сведения о диаграмме состояния системы, полученные при ис-
пользовании разных методов расчета, позволили построить проекции
поверхностей ликвидус и солидус [3] (рис. 137), а также политерми-
ческие и изотермические разрезы [4, 5].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Корнилов И. И., Михеев В. С., Коненко-Грачева О. К. — ДАН СССР,
1939, т. XXIV, № 9, с. 907—910.
2. Булычева 3. Н., Кондратьев В. К. — Сб. трудов ЦПИИЧЕРМЕТ,
1969, вып. 71, с. 55—62.
3. Вяткин Т. П._ Мищенко В. Я., Поволоцкий Д. Я. — Изв. вузов. Чер-
ная металлургия, 1974, № 8, с. 9—12.
4. Кожеуров В. А., Рысс М. А. — Сб. трудов Челябинского электроме-
таллургического комбината, 1970, вып. 2, с. 69—76.
5. Kaufman I,., Nesor И. — Met. Trans., 1975, v. A6, № 11, p. 2123—2131.
ЖЕЛЕЗО — АЛЮМИНИЙ — ЦЕРИЙ
Диаграмма состояния системы изучена в области сплавов, содержа-
щих до 33,3 % (ат.) Се. Сплавы получали из алюминия чистотой
99,98 %, железа карбонильного чистотой 99,99 % и церия чистотой
99,567 °/о в дуговой печи в атмосфере очищенного аргона. Слитки
отжигали при 500 ° С в течение 2000 ч в откачанных кварцевых ампу-
лах и закаливали в холодной воде. По результатам рентгеновского
152
анализа построен изотермический разрез изученной части системы
при 500 ° С (рис. 138). В работе [1] подтверждено существование
। ройного соединения CeFe4AI8 (ф-фаза) [2] и образование еще трех
iровных соединений ф' (CeFe2Ali0), А\ (CeFe2Al7) и N2 (Сереем
Ah .о.б)- Обнаружили значительную растворимость алюминия в фазе
Ф (Ce2Fei7) с образованием твердого раствора Се2 (Fe, Al) и, содер-
ivrtiinc алюминия в котором достигает 60 % (ат.). Фаза ф2 имеет
Рис. 138. Изотермический разрез части системы Fe—Al—Се при 500 °C
структуру типа Th2Zn17 с периодами при составе Ce2Fej7: 0=0,8512 нм,
с=1,245 нм, с/а= 1,463, а при составе СеюРезоА16о: 0=0,8998 нм, с—
= 1,287 нм, с/а= 1,442. Фаза ф имеет структуру типа СеМп4А18 (сверх-
структура к типу ThMni2 с периодами а=0,886 нм, с=0,508 нм, с/а=
0,573 [2].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Заречнюк О. С., Мыськив М. Г., Рябов В. Р. — Изв. АН СССР. Ме-
таллы, 1969, № 2, с. 164—166.
2. Заречнюк О. С., Крипякевич П. И. — Кристаллография, 1962, т. 7,
с. 543—547.
ЖЕЛЕЗО — АЛЮМИНИЙ — ЦИНК
Сплавы системы исследовали методами термического, рентгеновского
и микроструктурного анализов; изучен характер кристаллизации и
фазовые равновесия [1, 2]. Для приготовления сплавов использовали
лрмко-железо, алюминий и цинк чистотой 99,99 %.
Поверхность ликвидус сплавов системы в области содержания
алюминия от 20 до 60 % (по массе) и цинка до 40 % (по массе) при-
целена на рис. 139. Разграничены поля первичной кристаллизации
фаз: a-Fe; a2-Fe; е; Fe2Al5; FeAl3. Установлено существование двух
нопвариантных превращений перитектического типа. В точке щ при
1200 ° С протекает реакция жи1 + а2ч=>а+е. В точке и2 при ИЗО ° С
происходит превращение жи2+е^*а+Ре2А15. Приведен подробный
анализ моно- и нонвариантных превращений в сплавах системы. Об-
разование тройных промежуточных соединений не обнаружено. На
тотермическом разрезе системы при 700 ° С в области сплавов, бога-
п,lx железом, разграничено существование твердых растворов на
основе a-Fe и а2-фазы (рис. 140). При 500 ° С установлено сущест-
вование агфазы. Фазы ai и а2 соответствуют твердым растворам на
основе соединений Fe3Al и FeAl. При анализе фазового строения спла-
6 358
153
Zn
Рис. 140. Изотермический разрез системы Fe—Al— Zn при 700 °C
154
поп разреза были учтены результаты исследования двойной системы
железо — алюминий в работе [3].
Изотермический разрез при 450 °C приведен в работе [2]; на этом
p;i ipese фазовые области, включающие богатые железом фазы «1 и
<i не разграничены.
IИ1БЛИОГРАФИЧЕСКИЙ СПИСОК
I. Koster W., Godecke T. — Z. Metallkde, 1970, Bd 61, № 9, S. 649—658.
?. Urednicek M., Kirkaldy J. S. — Z. Metallkde, 1973, Bd 64, № 6, S. 419—
427.
I Warlimont H. — Z. Metallkde, 1969, Bd 60, № 2, S. 195—192.
ЖЕЛЕЗО — АЛЮМИНИЙ — ЦИРКОНИЙ
Сплавы системы исследовали1 методами микроструктурного и рентге-
новского анализов. Для приготовления сплавов использовали алюми-
Zr, °/о (ат.)
Рис. 141. Изотермический разрез системы Fe—Al—Zr при 900 °C
ний чистотой 99,97 %, железо карбонильное чистотой 99,98 % и
иодидный цирконий. Сплавы получали в дуговой печи в атмосфере
аргона; сжигали в откачанных кварцевых ампулах при 900 ° С в тече-
ние 2100 ч, а затем закаливали в воде. Построен изотермический
разрез при 900 ° С (рис. 141). Кроме известных ранее соединений
1 Бурнашова В. В,, Марше В, Я. — ДАН УРСР, 1969, Сер. А, № 4, с. 351—353.
б* 155
X, (ZrFei ,25->o,5oA1o,75->i,5o) и X2 (ZrFeo,35->o,3oAli,65->i,7o) > обнаружены еще
два соединения Zr6FeAl2 и ZrFe7-4Al5_8. Соединение Zr6FeAl2 имеет
гексагональную решетку, относящуюся к пространственной группе
Dg — Р6322, с периодами: «=0,794, с=0,332 нм, с/« = 0,42. Соедине-
ние Zr6Fe7-4Al5_8 имеет тетрагональную решетку со структурой типа
ThMni2 с периодами: а=0,858 нм, с=0,495 нм, с/а = 0,58.
ЖЕЛЕЗО — АЛЮМИНИЙ — ЭРБИЙ
Сплавы системы исследовали1 рентгеновским методом. Для приготов-
ления сплавов использовали железо карбонильное чистотой 99,98 %,
алюминий марки AB000 чистотой 99,98 % и эрбий чистотой 99,7 %.
Плавку проводили в дуговой печи в атмосфере аргона и отжигали
при 500 ° С в течение 1000 ч. Построен изотермический разрез системы
при 500°C в области сплавов, содержащих до 33,3 % (ат.) Ег
Рис. 142. Изотермический разрез части системы Fe—А1—Ег при 500 °C
(рис. 142). Установлено образование четырех тройных промежуточных
фаз: ф'(ErFe2Alw), ф (ErFe4,o^5,6Al8,o^6i4), M~ErFe1>2Al0 8), ф2
(Ег2РецА18) В системе на основе некоторых двойных ’ соединений
имеются широкие области гомогенности: Er2Fe17->iOAlo-^7 (g),
ЕгбЕе2з-^-14,5 Alo->8,5 (Fi), ErAl2j0^0i6 Fe0^.li4 (Z2). Фаза ф имеет структу-
ру типа ThMn[2 с периодами: « =
— 0,873 = 0,868 нм, с = 0,0504 =
= 0,499 нм. Фаза ф2 кристаллизуется
в структурном типе Th2Zn17 и имеет
периоды: « = 0,879 нм, с= 1,268 нм,
с[а= 1,440. Соединение ErFei,2Al0,8
относится к фазам Лавеса со струк-
турой MgZn2 (?vi).
ЖЕЛЕЗО — БЕРИЛЛИЙ —
КОБАЛЬТ
В работе [1] методами рентгеновско-
го и микрорентгеноспектралыюго
Fe Be, % (am.) Be
Рис. 143. Влияние кобальта на рас-
творимость Be в a-Fe
1 Заречнюк О. С., В1вчар О. /., Рябое
В. Р., — В1сник Льв1’в. ун-ту, Сер. х!м.,
1972, вип. 14, с. 16—19.
156
iii.i.пион изучали влияние кобальта [5 и 10 % (ат.)] на изменение
р.кгнорп мости бериллия в a-Fe (рис. 143). Для приготовления спла-
|цhi использовали железо чистотой 99,95 %, бериллий чистотой 99,5 %
и кобальт чистотой 99,5 %. Плавку проводили в высокочастотной печи
и ..<ууме. Полученные сплавы подвергали длительному отжигу и
последующей закалке в воде при 900, 850, 800, 750, 700, 650 и 600 ° С
и течение 400, 500, 700, 1200, 2000, 3000 и 7000 ч соответственно.
Ус1.,п1овлено, что в равновесии с твердым раствором на основе железа
и.। ходится промежуточная фаза—твердый раствор кобальта в FeBe2
и 'in (Fe, Со) Ве2.
В работе [2] рассчитали кривую растворимости бериллия в a-Fe
при постоянном содержании кобальта 7 % (ат.).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I Ко Mussong, Nishizawa Taiji — J. Jap. Inst. /Petals, 1979, v. 43. № 2,
p. 126—135.
Nishizawa T., Hasele Al., Ko Al. — Acta Met., 1979, v. 27, № 5, p. 817—
828.
ЖЕЛЕЗО — БЕРИЛЛИЙ — КРЕМНИЙ
Сплавы системы изучали1 методами термического и микроструктурно-
к) анализа. Исследовали сплавы, соответствующие пяти политерми-
ческим сечениям: FeSi—BeFe2, ср — BeFe2, FeSi—Be, ф—Be и с посто-
янным содержанием Si, равным 5 % (по массе). По результатам
исследования большого числа сплавов уточняли положения .замечатель-
ных точек и линий моновариантных превращений на диаграмме
Рис. 144. Политермический разрез системы Fe—Be—Si для сплавов с содер-
жанием 5 % Si
1 Vogel R., Geske H.-J. — Arch. Eisenhiittenw., 1960, Bd. 31, № 5, S. 319—330.
157
плавкости и границ фазовых областей на изотермическом разрезе.
Сплавы готовили из чистых материалов. Приведен (рис. 144) один
из изученных политермических разрезов для сплавов с постоянным
содержанием кремния, равным 5 % (по массе) и поверхность ликви-
дус рассмотренной системы (рис. 145). Составы сплавов, отвечающих
замечательным точкам на диаграмме, приведены ниже:
Точка t, °C Состав, % (по массе) Точка t, °C Состав, % (по массе)
Fe Si Be Fe Si Be
Г 1160 59,0 30,0 11,0 U2 1105 42,0 49,0 9,0
ф 1260 (см. рис. 145) E3 £3 1100 1110 42,7 34,2 48,3 49,1 10,0 16,7
uf 1130 68,5 22 9,5 e4 1050 19,8 46,2 34,0
Ef 1120 67,5 22,5 10,0 u5 1100 27,0 24,1 48,9
и3 1135 63,5 24,0 12,5 u4 1230 52,9 9,6 37,5
8f 1140 56,0 28,0 16,0 e2 1235 58,5 17,0 24,5
e2 1125 47,5 50,5 2,0
158
Обнаружено существование двух тройных конгруэнтно плавя*
ШПХСЯ соединений Г (FeSiBe) и Ф (FeSiBea). Соединение Г имеет
шчоиюсть 5,13 Мг/м3 и микротвердость 10,5 ГПа, а Ф плотность
3,80 Мг/м3 и микротвердость 14,9 ГПа. Соединение Г не имеет обла-
сти гомогенности, а соединение Ф обладает значительной областью го-
могенности с шестью точками предельной растворимости элементов, со-
ответствующими определенным трехфазным областям.
Изотермический разрез системы для комнатной температуры при-
веден на рис. 146. Кремний и бериллий увеличивают растворимость
друг друга в твердом растворе на основе железа.
Рис. 146. Изотермический разрез системы Fe—Be—Si при комнатной тем-
пературе
ЖЕЛЕЗО — БЕРИЛЛИЙ — ФОСФОР
Диаграмма состояния системы изучена1 в области сплавов, ограничен-
ных областью Fe—Fe2P—Be2F. Методами термического и микрострук-
турного анализов построено пять политермических разрезов:
Fe2P—Be2Fe, Fe3P—Be2Fe, два разреза, проходящих через железный
угол при отношениях содержаний бериллия и фосфора, равных 5:8 и
* Vogel R., Zwingmann G. — Arch. Eisenhiittenw., 1955, Bd. 26, № 12, S. 701—704,
159
1600
1600
1200
1000
800
О 5 10 15 20 25
Fe3P Be,% (по массе) Be2Fe
Рис. 147. Политермические раз-
резы Fe2P—Ве»Р (а) и Fe3P—
Be2Fe (6) системы Fe—Be—Р
1 : 1, а также разрез с постоянным со-
держанием бериллия, равным 2,5 %
(по массе).
Разрезы Fe2P—Be2Fc и Fe3P—
Be2Fe являются квазибинарными
(рис. 147, а и б) с эвтектическим ха-
рактером взаимодействия. Поверх-
ность ликвидус системы в области со-
держания фосфора и бериллия до
25 % (по массе) каждого приведена
на рис. 148. В изученной части систе-
мы не обнаружено тройных соедине-
ний; установлено существование двух
нонвариантных превращений: пери-
тектического типа жи-гРе2Р->Ре3Р +
4-Be2F при 997 °C и содержании
4,75 % (по массе) Be и 10,25 % (по
массе) Р, а также эвтектического ти-
па ж£->ос-Ре+Р'е3Р-|-Ве2Ре при 961 °C
и содержании 3,75 % (по массе) Be и
8,25 % (по массе) Р.
На изотермическом разрезе систе-
мы (рис. 149) видно, что тройные со-
единения в сплавах системы не обра-
зуются в твердом состоянии в процес-
се охлаждения до комнатной темпе-
ратуры.
Рис. 148. Поверхность ликвидус системы Fe—Be—Р
160
25
Рис. 149. Изотермический разрез системы Fe—Be—Р при комнатной
температуре
ЖЕЛЕЗО — БОР — ВАНАДИЙ
Сплавы системы исследовали1 методами микроструктурного и рентге-
новского анализа. Для приготовления сплавов использовали порошки
железа чистотой 99,99 %, алюмотермического ванадия чистотой 99,5 %
п бора чистотой 99,3 %- Смеси порошковых компонентов спрессовы-
вали и переплавляли в электродуговой печи с медным водоохлаждае-
мым подом в атмосфере очищенного аргона. Сплавы отжигали в
вакуумной печи и охлаждали медленно от 1400 до 800 ° С, 3 ч. Окон-
чательный отжиг при 800 ° С, 300 ч, проводили в откачанных кварце-
вых ампулах; по окончании отжига сплавы закаливали в воде.
Построен изотермический разрез системы при 800°C (рис. 150). Как
видно, в равновесии с твердым раствором на основе железа а могут
находиться фазы Fe2B, VB и сг-фаза двойной системы железо — вана-
дий. В фазе Fe2B растворимость ванадия не превышала 5 % (ат.),
структура типа СиА12 с периодами а=0,5118 нм, с=0,4251 нм при
максимуме растворенного в ней ванадия. Тройных соединений в си-
стеме не обнаружено.
1 Кузьма Ю. Б., Стародуб П. К. — Изв. АН СССР, Неорган. материалы, 1973,
т. 9, № 3, с. 376—381.
Рис. 150. Изотермический разрез системы Fe—В—V при 800 °C
ЖЕЛЕЗО — БОР — ГАЛЛИЙ
Сплавы системы изучали1 методом рентгеновского анализа. Для при-
готовления сплавов использовали порошок железа (99,99 %), поро-
Рис. 151. Изотермический разрез части системы Fe—В—Ga при 600 °C
1 Чабан Н. Ф., Кузьма Ю. Б. — Допов1д1 АН УРСР, 1973, Сер. А, № 6, с. 550—
551.
162
шок бора (99,3 %) и галлий (9,999 %). Спрессованные брикеты желе-
(.1 и бора сплавляли с галлием в дуговой печи в атмосфере очищенного
аргона. Отжигали сплавы при 8000С в течение 500 ч в откачанных
мшрцевых ампулах, а затем при 600 ° С в течение 600 ч с последую-
щей закалкой в воде. Изотермический разрез системы при 600 ° С
приведен на рис. 151.
Тройных промежуточных фаз в изученной части системы не обна-
ружено. Бориды железа Fe2B и FeB находятся в равновесии с гал-
лпдамн железа. На изотермическом разрезе при 800 ° С в связи с
распадом соединения Fe7Gas при 775 ° С отсутствуют фазовые рав-
новесия с участием фазы на основе этого соединения.
ЖЕЛЕЗО — БОР — ГАФНИЙ
Диаграмма состояния системы исследована частично. В работе [1]
методами микроструктурного, дифференциального термического и
дюрометрического анализов изучали сплавы разреза Fe—HfB2. Спла-
вы синтезировали из карбонильного железа, иодидного гафния и
Рис. 152. Политермический разрез Fe—НГВг системы
Fe—В—Hf
кристаллического бора (98,45 %). Плавку проводили в дуговой печи
с нерасходуемым вольфрамовым электродом в атмосфере аргона.
Сплавы содержали от 0,5 до 25 % (по массе) HfB2. Исследованный
разрез Fe—HfB2 является квазибинарным (рис. 152). Эвтектика
ж+±у-)-Н{В2 кристаллизуется при 1265°C и содержании 6,9 % (мол.)
ШВ2 [21 % (по массе)]. По данным работы [2], содержание HfB2 в
>втектике составляет 14 % (объемн.).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I. Шурин А. К., Панарин В. Е. — Изв АН СССР. Металлы, 1974, № 5,
с. 235—239.
2. Локтионоз В. А. — В кн.: Литые износостойкие материалы. Киев: Нау-
кова думка, 1975, с. 76—81.
163
ЖЕЛЕЗО — БОР — ГЕРМАНИЙ
Имеются сведения1 об изучении взаимодействия отдельных фрагмен-
тов в системе. Сплавы приготовляли из железа чистотой 99,99 %,
бора чистотой 99,3 % и германия чистотой 99,993 %. Образцы изго-
тавливали методом спекания спрессованных порошков в дуговой печи
Ge. % (ат.)
Рис. 153. Изотермический разрез системы Fe—В—Ge при 700 сС
в атмосфере очищенного аргона и отжигали в откачанных кварцевых
ампулах при 700 ° С, 360 ч. По результатам микроструктурного и
рентгеновского анализов построили изотермический разрез части си-
стемы при 700 ° С (рис. 153). Бориды железа FeB и Fe2B находятся
в равновесии с германидами железа.
ЖЕЛЕЗО — БОР — КОБАЛЬТ
Диаграмма состояния системы изучена мало. Приведены2 некоторые
сведения по исследованию центральной части диаграммы в области
сплавов, содержащих 33—50 % (ат.) бора и расположенных между
соединениями СоВ—FeB и Со2В—Fe2B. Для приготовления сплавов
были использованы железо чистотой 99,9 %, кобальт чистотой 99,12 %
и электролитический бор чистотой 99 %. Сплавы получали в печи с
высоким вакуумом при температуре около 1500 °C, отжигали при
1100 °C, 10—24 ч, затем закаливали. Изменение периода решетки а
для фазы (Fe, Со)2В, имеющей тетрагональную решетку типа СиА12,
и для фазы (Fe, Со) В, имеющей орторомбическую решетку типа FeB,
определяли рентгеновским методом.
ЖЕЛЕЗО — БОР — КРЕМНИЙ
Диаграмма состояния системы исследована методом рентгеновского
анализа [1, 2].
В работе [1] для приготовления сплавов использовали бор чисто-
той 99,3 %, железо чистотой 99,99 % и кремний чистотой 99,5 %-
* Марко М. Л., Кузьма Ю. Б., Гладышевский Е. И. — В кн.: Структура фаз,
фазовые превращения и диаграммы состояния металлических систем. М.: Наука,
1974, с. 25—27.
2 Hagg G., Kiessling R.—J. Inst Metals, 1952—53, v. 81, p. 57—60
164
Брикеты из спрессованных порошков плавили в дуговой печи в
нмосфсре аргона. Образцы отжигали в откачанных кварцевых ампу-
>1.|х при 900 и 700 ° С, 450 и 840 ч соответственно, и закаливали.
Построены изотермические разрезы при 700 и 900 ° С (рис 154).
Б системе обнаружены три промежуточных соединения: FesSiB2
Рис. 154. Изотермический разрез системы Fe—В—Si при 900 °C
(Л-фаза), Fe4>7Si2B и (Fe, Si)3B (В-фаза). После отжига при 700 ° С
обнаружена фаза Fe5Si3. Видимо, бор стабилизирует эту фазу в двой-
ной системе. Исследовали также сплавы, закаленные с 1000 ° С
(отжиг 240 ч), но фазу Fe4SiB, на существование которой указано в
работе [2], не удалось обнаружить. Соединение Fe5SiB2 имеет тетра-
гональную структуру типа Сг5В3 с периодами: tz = 0,5527—0,5528 нм,
г= 1,026—1,032 нм. Структура фазы Fe4,7Si2B относится к типу
W5Si3 с периодами решетки: п = 0,8814 нм, с=0,4330 нм. Фаза (Fe, Si)3B
обладает ромбической структурой типа Fe3Si с периодами: а=
— 0,446 нм, 6 = 0,541, с=0,660 нм.
Согласно [2], в системе существует четыре тройных фазы. Авторы
этой работы использовали бор чистотой 99 % и кремний чистотой
99,9 %; образцы для исследования готовили методом порошковой
металлургии с плавлением в дуговой печи. Установлено, что Fe4,7Si2B
изоструктурно соединению Co4,7Si2B, которое в свою очередь изо-
структурно W5Si3; соединение Fe5SiB2 изоструктурно Сг3В3; соединение
Fc3(B, Si) или (Fe, Si)3B изоструктурно Fe3C; структура соединения
Fc4BSi не установлена.
165
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Чабан Н. Ф., Кузьма Ю. Б. — Изв. АН СССР. Неорган. материалы,
1970, т. 6, № 5, с. 1007—1008.
2. Aronsson В., Lundgren G. — Acta Chernica Scandinavica, 1959, v. 13,
№ 3, p. 433—441.
ЖЕЛЕЗО — БОР — МАРГАНЕЦ
Сплавы системы изучали в ряде работ [1—3].
В работе [1] показано, что между изоструктурными соединения-
ми Мп2В и Fe2B, а также МпВ и FeB существуют непрерывные ряды
твердых растворов.
Рис. 155. Поверхность ликвидус системы Fe—В—Мп
В работе [2] установлено, что разрез Мп2В—Fe2B является квази-
бинарным лишь при температурах ниже линии солидус. Методами
термического, микроструктурного и дюрометрического анализов иссле-
довали сплавы системы, содержащие до ~ 60 % (ат.) В; проекция
поверхности ликвидус представлена на рис. 155.
В работе [3] исследовано фазовое состояние сплавов системы,
отожженных после гомогенизирующего отжига в течение 300—500 ч
при 800 ° С. Образцы готовили из карбонильного железа чистотой
99,99 %, электролитического марганца чистотой 99,5 % и бора чисто-
той 99,5 %• Тщательно перемешанные порошки указанных металлов
спрессовывали и спекали при 1300—1500 ° С в вакууме в течение 3 ч.
Часть образцов, содержащих до 20 % (ат.) В, выплавляли в атмосфе-
ре аргона в корундовых тиглях. Изотермический разрез системы при
800 ° С приведен на рис. 156. Подтверждены сведения о существова-
нии непрерывных твердых растворов (Мп, Fe)2B и (Мп, Fe)B, о кото-
рых сообщали авторы работы [1].,
В равновесии с твердым раствором на основе a-Fe могут нахо-
диться фазы (Мп, Fe)2B и у, которая представляет непрерывный ряд
твердых растворов между у-модификациями железа и марганца.
В равновесии с у-фазой находятся фазы (Мп, Fe)2B и р-Мп.
166
Рис. 156. Изотермический разрез системы Fe—В—Мп при 800 °C
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Hogg G., Kiessling R.— J. Inst. Met., 1952, v. 81, № 1, p. 51—69.
2. Pradelli G., Gianoglio C. — Met. ital., 1976, v. 68, № 1, p. 19—23.
3. Кузьма Ю. Б., Чепига ,M. В., Плахина А. М. — Изв. АН СССР. Нсор-
ган. материалы, 1966, т. II, № 7, с. 1218—1224.
ЖЕЛЕЗО — БОР — МОЛИБДЕН
Диаграмма состояния системы частично изучена в работах [1—2].
В работе [1] для изготовления сплавов использовали железо,
молибден и бор (все чистотой 99,9 %). Шихту перемешивали, прес-
совали и спекали. Затем проводили плавку образцов в среде гелия в
электродуговой печи с медным водоохлаждаемым подом и с вольфра-
мовым нерасходуемым электродом. Образцы с большим содержанием
бора отжигали предварительно при 1500°C, 10 ч. Окончательный
отжиг проводили при 1000 ° С, 500 ч, с последующей закалкой в хо-
лодной воде.
Приведен (рис. 157) изотермический разрез системы при 1000 ° С
по данным рентгеновского и микроструктурного исследований. В рав-
новесии с твердым раствором на основе железа находятся двойные
фазы Mo2Fe3 и Fe2B, а также тройное соединение Mo2FeB2, которое
имеет область гомогенности 20—28 % (ат.) Fe; 40—32 % (ат.) Мо и
10 % (ат.) В. Кроме того, в системе существуют еще два тройных
167
соединения (Mo, Fe)B и MoFe2B4; на существование последнего ука-
зано также в работе [2].
Фаза Mo2FeB2 характеризуется тетрагональной структурой типа
UsSb с периодами а = 0,5807 ±0,0004 нм, с=0,3141 ±0,0003 нм, с]а —
= 0.5410.
Рис. 157. Изотермический разрез системы Fe—В—Мо при 1000 °C
Фаза (Mo, Fe)B обладает ромбической структурой типа СгВ [1].
Соединение MoFe2B4 имеет ромбическую структуру типа ТазВ4 с пе-
риодами а = 0,3128±0,0005, & = 1,1270±0,001, с = 0,2984±0,0005 нм.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Гладышевский Е. И., Федотов Т. Ф., Кузьма Ю. Б., Сколоздра Р. В.—
Порошковая металлургия, 1966, № 4, с. 55—60
2. Steinitz R., Binder У. — Powder Metallurgy, 1953, v. 6, p. 123—129.
ЖЕЛЕЗО — БОР — НИКЕЛЬ
Диаграмма состояния системы изучена в области сплавов, богатых
железом и никелем и содержащих до 40 % (ат.) В [1—3]. Для при-
готовления сплавов использовали [1, 2] карбонильный никель [99,8 %
(по массе)], электролитическое железо [99,5 % (по массе)] и кристалли-
ческий бор [99,4 % (по массе)]. Образцы плавили в откачанной квар-
цевой системе в индукционной печи, отжигали при 800 °C, 300 ч,
затем закаливали в воде. Исследование выполняли методами микро-
структурного [1, 2] и термического [3] анализов, а также измерением
168
микротвердости и магнитных характеристик. Изотермический разрез
системы при 800°C [1] приведен на рис. 158. На этом же рисунке
пл несена проекция трех эвтектических линий моновариантных реакций,
которые встречаются в точке нонвариантного превращения эвтекти-
ческого типа ж=₽*у+(Ре, Ni)2B-]-(Fe, Ni)3B. Максимальная раствори-
мость железа в Ni3B составляет 45 % (ат.) при 25 % (ат.) В. В си-
стеме обнаружено существование метастабильной фазы т (Fe3Ni2oB6)
с кристаллической структурой типа Сг23С6 и периодами решетки а=
-1,0501 ±0,0003 нм [1].
Рис. 158. Изотермический разрез системы Fe—В—Ni при 800 °C
В работе [3] построен политермический разрез системы, проходя-
щий через двойные соединения Fe2B—Ni2B. Для приготовления спла-
вов использовали железо чистотой 98,8 %, бор аморфный и никель
чистотой 99,4 %• Сплавы готовили методом порошковой металлургии,
спекание проводили при 1050—1200 ° С в атмосфере аргона в течение
12—15 ч. Гомогенизировали сплавы при 1100 ° С в откачанных квар-
цевых ампулах в течение 250 ч. Разрез Fe2B—Ni2B является квази-
бинарным с неограниченной взаимной растворимостью боридов в жид-
ком и твердом состояниях.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I. Stadelmaier И. И.. Pollock С. В. — Z. Metallkde 1969, Bd 60, Н. 12,
S. 960—961.
2. Kaheko Hidzo, Nisidzawa Taidzi, Tibet Akira. — J. Jap. Inst. Metals,
1966, v. 30, № 2, p. 157—163.
3. Тавадзе Ф. H., Долшиивили К. А., Ломая T. П., Авлохашвили Д. В.—
Вопросы металловедения и коррозии металлов, № 3. Тбилиси: Мец-
ииереба, 1972, № 3, с. 12—19.
ЖЕЛЕЗО — БОР — НИОБИЙ
( ведения о диаграмме состояния системы весьма ограничены. Приве-
leii1 один изотермический разрез, характеризующий фазовые равно-
весия при 800 ° С. Для приготовления сплавов использовали порошки
ниобия чистотой 99,6 %, железа чистотой 99,98 % и бора чистотой
'>9,3 %. Шихту тщательно перемешивали и спрессовывали в таблетки.
За гем образцы либо плавили в электродуговой печи, если содержание
1 Кузьма Ю. Б„ Цеолковский Т. И., Бабурова О. П. — Изв. АН СССР. Не-
opiiiii. материалы, 1968, т. IV, № 7, с. 1081—1085
169
бора было менее 50 % (ат.), либо спекали в течение 10 ч в вакууме
при 1500 ° С. Все образцы подвергали высокотемпературному отжигу
при 1300 ° С, 5 ч, и затем медленно понижали температуру до 1000 ° С
со скоростью 50°С/ч. Окончательный отжиг при 800 ° С, 480 ч,
проводили в откачанных кварцевых ампулах с последующей закалкой
в холодной воде. Исследование выполнили методами рентгенострук-
турного и микроструктурного анализов. В равновесии с твердым
раствором на основе железа при температуре 800 ° С (рис. 159)
Рис. 159. Изотермический разрез системы Fe—В—Nb при 800 °C
находятся фазы на основе двойных соединений Fe2B и NbFe2 и трой-
ного соединения NbFeB. Соединение NbFeB образуется по перитекти-
ческой реакции при взаимодействии NbB и расплава.
Обнаружено одно тройное соединение Y состава Nb3Fe3B4; в соеди-
нении Nb3B2 растворяется при 800 ° С до 20 % (ат.) Fe.
Соединение NbFeB имеет гексагональную структуру типа ZrAlNi,
сверхструктура типа Fe2P, пространственная группа P6 2m—£>зЛ
с периодами «=0,6015 + 0,0004 нм, с=0,3222 + 0,0003 нм, с/« = 0,53.
Кристаллическая структура соединения У не установлена.
ЖЕЛЕЗО — БОР — ТАНТАЛ
Сплавы системы изучали методами рентгеновского и микроструктурного
анализов [1, 2]. В работе [1] для приготовления сплавов использовали
порошки железа чистотой 99,9 %, тантала чистотой 99,6 % с 0,14 % С
170
it мелкокристаллический бор чистотой 99,6 %. Образцы прессовали, ene-
к.i ли, а затем плавили в среде гелия в дуговой печи с нерасходуемым
вольфрамовым электродом; гомогенность по химическому составу дос-
ыпалась многократной переплавкой (3—5 раз). Сплавы, богатые тан-
i.ijiom, предварительно отжигали при 1650 °C, 100 ч и при 1450 °C, 250 ч.
()коичательный отжиг всех сплавов проводили в откачанных кварце-
вых ампулах при 950 °C в течение 1000 ч.
На рис. 160 приведен изотермический разрез при 950 °C. В равно-
весии с твердым раствором на основе железа находятся фазы на осно-
ве двойных соединений Fe2B и ТаВ2 и тройного соединения TaFeB.
В системе существует еще два тройных соединения Ta3Fe3B4 и TaFeB3.
Двойное соединение Та3В2 растворяет при 950 СС до 20 % (ат.) Fe.
Кристаллическая структура соединения TaFeB является гексаго-
нальной типа ZrNiAl с периодами £=0,5984+0,0004, с=0,3195+
±0,0003 нм, с/а=0,534 (пространственная группа Р&2т—D^h ). Атомы
тантала занимают в структуре положения с координационными числа-
ми 15, атомы железа 12 и атомы бора 9 [2].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Кузьма Ю. Б., Соболев А. С., Федотов Т. Ф. — Порошковая метал-
лургия, 1971, № 5, с. 81—85.
2. Кузьма 10. Б. — ДАН УССР, 1967, № 10, с. 939—941.
171
Ti B2, % (no массе)
Рис. 161. Политермический разрез Fe—Т1В2 системы
Fe—В—Ti
В
Fe 20 TiF% kQ TlFe 60 Ti^Fe qq TI
t. Ti, % (am.)
Рис. 162. Изотермический разрез системы Fe—В—Ti при 1000 °C
172
ЖГЛЕЗО — БОР — ТИТАН
Диаграмму состояния системы изучали в ряде работ [1—3]. Ис-
I целования проводили методами микроструктурного, термического, дю-
рометрического [2] и рентгеновского [3] анализа. При изучении [1] спла-
вов разреза Fe—TiB2 показано, что этот разрез является квазибинар-
ным эвтектического типа. Эвтектика кристаллизуется при 3,4 % (мол.)
hB2 и 1320сС. На рис. 161 этот разрез представлен по данным [2]. Для
приготовления сплавов использовали карбонильное железо, иодидный
in таи и кристаллический бор чистотой 98,45 %.
Сплавы системы, отожженные при 1000 “С исследовали в работе [3].
На рис. 162 показан изотермический разрез системы при 1000 °C; трой-
ных соединений в сплавах не обнаружено.
В равновесии с твердым раствором на основе железа находятся
двойные соединения F'e2B, TiB2 и TiFe2. Кристаллическая структура
I с2В типа СпА12 с периодами а = 0,5109; с=0,4249 нм. Соединение TiFe2
имеет структуру типа MgZn2 с периодами а = 0,4779 нм; с=0,7761 нм,
j соединение TiB2 изоструктурно А1В2 с периодами а = 0,3030; с=
0,3227 нм.
Г>| 1БЛИОГРАФИЧЕСКИЙ СПИСОК
I. Кузьма Ю. Б., Лах В. И., Ворошилов Ю. В. и др. — Изв. АН СССР.
Металлы, 1965, № 6, с. 127.
Шурин А. К., Панарин В. Е. — Изв. АН СССР. Металлы, 1974, № 5,
с. 235—239.
3 Федоров Т. Ф., Кизьма Ю. Б. — Изв. АН СССР. Неорган. материалы,
1967, т 3, № 8, с. 1498—1499.
ЖЕЛЕЗО — БОР — УГЛЕРОД
Сплавы системы исследовали методами микроструктурного и рентге-
новского анализов [1—3]. В качестве шихтовых материалов использова-
/111 кристаллический бор чистотой 98,5 %, электролитическое железо чис-
1огой 99,5 % и синтетический графит чистотой 99,94 %• Сплавы гото-
вили в тиглях из оксида алюминия в индукционной печи на воздухе,
отливали в медную изложницу и
после кристаллизации закаливали
и воде. Часть сплавов отжигали в
вакууме при 800+5 СС, 200 ч,
с последующим охлаждением в
воде.
Построена проекция поверхно-
стей ликвидус (рис. 163) диаг-
раммы состояния. Четырехфазное
превращение протекает в точках
Ci (ж1=е*у+т+цементит), е2(ж2=+
-y + r + Fe2B) и, вероятно, в точ-
ке (ж3ч=ьт+Fe2B + цементит).
В работе [2] приведены изо-
термические разрезы системы. Для
сплавов использовали шихту из
армко-железа, ферроуглерода с
4 48 % С и ферробора с 13,51 % В.
('плавы готовили в индукционной
печи в атмосфере аргона или по-
лучали методом порошковой ме-
Рис. 163. Поверхность ликвидус части
системы Fe—В—С
173
Рис. 164. Изотермический разрез части
системы Fe—В—С при 900 °C
обладает кубической решеткой типа
таллургии. Отжигали сплавы в or
качанных кварцевых ампулах при
1000, 950, 900, 850, 800 и 700 СС.
Построили изотермическип
разрез системы при 900 °C (рис
164).
При 700 °C борокарбид — фа-
за т — существует в пределах
Fe23 (СоодВо.б) 6—Fe23(Co,73Bo,27) б и
находится в равновесии с бороце-
ментитом Рез(С0>41В0,59), боридом
Fe2B и a-Fe. Состав фазы т при
800 °C изменяется в пределах
Ре2з(Со,з8Во,б2)б — Ре23(Со,77Во,2з)о,
при этих условиях она находится
в равновесии с бороцементитом и
аустенитом. Область существова-
ния фазы т с повышением темпе
ратуры сужается, и при 965+5 С
протекает реакция r->y + Fe3(C, В),
поэтому при 1000сС находятся в
равновесии только аустенит, бо-
рид Fe2B и бороцементит. Фаза т
Сг23С6 с периодами а = (1,058 +
+1,063)+0,001 нм. Термодинамический анализ тройной равновесной
системы приведен в работе [3]. Шихтовыми материалами служили элек-
тролитическое железо чистотой 99,95 %, ферробор с 21,19 % В и спе-
циальный белый чугун, содержащие 0,46—5,25 % (ат.) С и 0,49—1,93 %
(ат.) В. Сплавы готовили в вакуумной высокочастотной печи. Слитки
ковали, гомогенизировали в вакууме при 800—1000 °C, 24—200 ч, и за
каливали в воде. Установлено фазовое состояние сплавов системы при
700 °C и проведен расчет фазовых равновесий в сплавах системы при
различных температурах. Также определяли растворимость карбидов
Fe3(C, В), Fe23(B, С)6 и Fe2B в аустените.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Stadelmaier И. Н., Gregg R. А.— Metall, 1963, Bd 17, № 5, S. 412—
414.
2. Lucco Borlera M., Pradelli G. — Metallurgia Ital., 1967, v. 59, № 11,
p. 907—916.
3. Hasebe Mitsuhito, Nishizawa Taiji — J. Jap. Inst. Metals, 1974, v. 38,
№ 1, p. 46—54.
ЖЕЛЕЗО — БОР — ХРОМ
Исследовали фазовые равновесия сплавов системы методами рентгенов-
ского и микроструктурного анализов при 1100 и 1250 °C [1, 2] и 900,
700 °C [4J. Для приготовления сплавов [1] использовали карбонильное
железо, хром чистотой 99,77 %, мелкокристаллический бор чистотой
98,8 %• Порошки исходных материалов тщательно перемешивали, прес-
совали и спекали, затем дважды переплавляли в электродуговой печи в
атмосфере гелия. При содержании бора более 50 % (ат.) сплавы гомо-
генизировали при 1500 °C, 11 ч. Все сплавы отжигали в откачанных
кварцевых ампулах при 1100 °C, 320 ч, а затем закаливали в ледяной
воде. На рис. 165 приведен изотермический разрез системы при 1100 °C.
174
II |1.1111К»несми c y-Fe находятся фазы a-Fe и Fe2B. В равновесии с а-фа-
к>|| находятся y-Fe, Fe2B, Сг2В и Сг4В. Фазы Fe2B и особенно Сг2В
ог>р,1 (уют широкие области твердых растворов.
В работе [2] использовали более чистые материалы для приготов-
ления сплавов. Исследована область сплавов, содержащих до 50 %
(и.) В после отжига при 1250°С. Результаты работ хорошо согласу-
пися между собой. Тройных промежуточных фаз в системе при 1100—
Рис. 165. Изотермический разрез системы Fe—В—Сг при 1100 °C
1250 °C не образуется. Фазы Fe2B и Сг5В3 имеют тетрагональную ре-
шетку. Фазы FeB, у-СгВ, б-Сг2В обладают ромбической решеткой, а
। СгВ — гексагональной.
Предложен схематический политермический разрез сплавов систе-
мы с постоянным содержанием хрома: 10 % (по массе) [3].
Изучено фазовое состояние сплавов системы при 900 и 700 °C [4].
Для приготовления сплавов использовали карбонильное железо чисто-
гоп 99,99 %, бор чистотой 99,5 % и электролитический хром. Сплавы
готовили методом порошковой металлургии с последующим переплавом
в дуговой печи, отжигали при 900 и 700 °C в течение 400 и 500 ч соот-
1к гственно и закаливали в холодной воде. Образования тройных соеди-
нений в системе при 900 и 700 °C не установлено. Следует отметить, что
результаты работ [1, 2] и [41 хорошо согласуются между собой.
В11БЛИОГРАФИЧЕСКИЙ СПИСОК
I. Горбунов А. Е., Бодурян Ф. М. — В кн.: Науч тр./ВНИИТС, 1976,
№ 16, с. 172—178.
175
2. Lucco Bprlera M., Pradelli G. — Met. Ital., 1973, v. 65, № 7—8,
p. 421—424.
3. Kaneko Hidzo. Nisidzawa Taidzi, Tiba Akira. — J. Jap. Inst. Metals,
1966, v. 30, № 2, p. 157—163.
4. Черига M. В., Кузьма Ю. Б. — Изв. вузов. Черная металлургия, 1970,
№ 3, с. 127—130.
ЖЕЛЕЗО — БОР — ЦЕРИЙ
Сплавы системы изучены1 методами микроструктурного и рентгенов-
ского анализов. Для приготовления сплавов использовали карбониль-
ное железо чистотой 99,98 °/о, бор мелкокристаллический чистотой 99,4 %
и церий чистотой 99,56 %. Плавку проводили в дуговой печи в атмосфе-
ре аргона, сплавы отжигали в откачанных кварцевых ампулах при 700
и 500 °C в течение 300 и 500 ч соответственно, а затем закаливали
в воде.
Рис. 166. Совмещенный изотермический разрез системы Fe—В—Се при
700 и 500 °C
На рис. 166 приведены совмещенные изотермические разрезы при
700 °C для сплавов, содержащих до 33,3 % (ат.) С1 и при 500 °C для
остальных сплавов. В системе обнаружено три тройных соединения
A (~Ce3Fei6B), B(CeFe2B2) и C(~Ce2FeB3). В-фаза имеет тетрагональ-
ную структуру собственного типа (пространственная группа Р4псс—
* Билонижко Н. С., Кузьма Ю. Б. — Изв. АН СССР. Неорган. материалы,
1972, т. 8, № 1, с. 183—184.
176
с периодами а=0,707±0,002, с=2,76±0,01 нм. Структура фаз А
и (' не установлена.
ЖЕЛЕЗО — БОР — ЦИРКОНИЙ
( планы системы исследовали методами рентгеновского [1, 2], диффе-
ренциального термического, микроструктурного и дюрометрического [3]
Рис. 167. Изотермический разрез системы Fe—В—Zr при 850 °C
иылизов. Определено [1] фазовое состояние сплавов - при 850 °C. Для
приготовления сплавов использовали порошки исходных компонентов:
железо карбонильное, цирконий чистотой 99,5 %, бор чистотой 99,5 %.
( плавы синтезировали спеканием хорошо перемешанной и спрессован-
ной шихты. Гомогенизирующий отжиг проводили при 1600 °C, 2 ч. Об-
разцы медленно охлаждали с печью, а затем при 850 °C отжигали в
н-чение 500 ч, после чего закаливали в воде. Сплавы, близкие по соста-
ву к соединению Zr6Cr23, отжигали при 1250 °C, 70 ч, а затем при 850 °C,
ЫК) ч, что вызвано малой скоростью образования фазы Zr6Cr23.
При 850 °C в системе тройных соединений не обнаружено (рис. 167).
В равновесии с твердым раствором на основе железа находятся двой-
ные фазы Fe2B, ZrB2 и Zr6Cr23. Сплавы, расположенные на разрезе Fe—
гВ2, двухфазные. Это противоречит результатам исследования [2]. Изу-
чены [3] сплавы разреза Fe—ZrB2. Для приготовления сплавов исполь-
ННГ1ЛИ карбонильное железо, иодидный цирконий и кристаллический бор
чистотой 98,45 %• На рис. 168 приведен квазибинарный разрез эвтек-
ыческого типа с температурой кристаллизации при 1275 °C и концентра-
цией 6,6 % (мол.) ZrB2 (рис. 168).
177
Zr B; % (по пассе)
Рис. 168. Политермиче-
ский разрез Fe—ZrB2 си-
стемы Fe—В—Zr
Кристаллическая структура Fe2B тетрагональная, типа СнА12 с пе-
риодами <7 = 0,5109, с=0,429 нм, с/а = 0,832. Соединение ZrB2 имеет ре-
шетку типа А1В2 с периодами а—0,3168 ч- 0,3170, с=0,3525 ч- 0,3533 нм,
с/а=1,14. Соединение Zr6Fe23(ZrFe3) обладает кубической решеткой ти-
па Th6Mn23.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Кузьма Ю. Б., Лах В. И., Ворошилов Ю. В. и др. — Изв. АН СССР.
Металлы, 1965, № 6, с. 127—129.
2. Функе В. Ф„ Юдковская С. И. — Изв. АН СССР. ОТН. Металлургия
и топливо, 1962, № 4, с. 126—129.
3. Шурин А. К., Панарин В. Е. — Изв. АН СССР. Металлы, 1974, № 5,
с. 235—239.
ЖЕЛЕЗО —
ВАНАДИЙ —
ВОДОРОД
Исследована1 растворимость
водорода в сплавах вана-
дий—железо методами рент-
геноспектрального и газово-
го анализов. Сплавы гото-
вили из ванадия чистотой
99,9 % и железа чистотой
1 Eguchi Toyoaki, Morozuml
Shotaro — J. Jap. Inst. Metals.
1974, v. 38, № 11, p. 1025—1030.
Рис. 169. Изменение раствори-
мости водорода в сплавах си-
стемы Fe—V
178
%• Сплавы ванадий—железо [с 0,91; 3,02; 4,95 и 10 % (ат.) Fe] по-
лучали в вакуумной дуговой печи, отжигали в вакууме при 1100 °C
К) ч, и насыщали в токе водорода при давлении 0,1 МПа в интервале
н-мператур от 600 до 1200 °C.
На рис. 169 показано изменение растворимости водорода в спла-
вах ванадий — железо.
ЖЕЛЕЗО — ВАНАДИЙ — КИСЛОРОД
('.плавы системы исследовали методами микроструктурного, рентгенов-
ского анализов [1], а также с использованием метода э. д. с. [2]. Изуче-
на [1] система в интервале температур 600—1000 °C. Сплавы готовили
методом порошковой металлургии (спеканием металлических порошков
железа и ванадия, а также их оксидов).
Приведена схема фазовых равновесий в системе (рис. 170). Соеди-
нения FeO, Ре¥гО4, V2O3 и VO находятся в равновесии с чистым же-
лезом. Соединение FeV2O4 растворяет до 40 % (мол.) FeO; при этом
период решетки изменяется от 0,846 до 0,842 нм. Шпинельные фазы
1'г.(О4 и FeV?O3 образуют между собой непрерывный ряд твердых рас-
творов с периодом решетки, меняющимся от 0,839 до 0,846 нм. Непре-
рывный ряд твердых растворов образуют также оксиды Fe2O3 и V2O3.
Фазы VOX находятся в равновесии с Fe2O3. В образцах, насыщенных
кислородом, наблюдаются двухфазные равновесия Fe2O3—VO2, Fe2O3—
leV2O6, Fe2O3—FeVO4, FeV2O6—FeVO.;, V60i3—FeV2O6, V6O3—FeVO4 и
V,O5—FeVO4.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I. Villi J., Rahmel A., Rork R. — Arch. Eisenhiitlenw., 1963, Bd 34, № 4,
S. 291—295.
*. Лушичкова T. В, Михайлов Г. Г., Лыкосов А. А., Леонович Б. И.—
Науч. тр./Челябинск. политехнич. ин-т. Челябинск: 1975, № 163,
с. 9—11.
179
ЖЕЛЕЗО — ВАНАДИЙ — КОБАЛЬТ
Сплавы системы исследованы методами
ческого, магнитного [1, 2], микроструктурного, рентгеновского
зов [1—3] и методами растровой
ными материалами служили [1,
2]
Рис. 171.
Fe—V—Со
Поверхность ликвидус системы
термического, дилатометра
> анали
электронной микроскопии [4]. Исход
армко-железо, кобальт чистотой
99,5 % и феррованадий двух
сортов, % (по массе): сорт
1 — 91,7 V; 7,1 Fe; 1,14 Si;
0,04 Al; сорт II — 79,8 V,
18,7 Fe, 1,37 Si, 0,1 Al
Сплавы изготавливали в ат
мосфере водорода или ар
гона.
Построена поверхность
ликвидус и изотермические
разрезы при 1300, 1200,
1000 и 600 °C, а также ряд
политермических разрезов.
На рис. 171 приведена
проекция поверхности лик-
видус с тремя областями
первичной кристаллизации
фаз: «-твердого раствора
кобальта в железованадие-
вых сплавах (область
Fet7iS{72V), у-твердого рас-
твора на основе кобальта
(область I7|S£Co) и о-фазы
(область U2SE). В точке Е\
протекает реакция ж + а^у.
Рис. 172. Изотермические разрезы системы Fe—V—Со при 1300 (а) и
1200 °C (б)
180
ii точке U2— реакция ж+а?±о и в точке Е— ж=^у + сг. При температуре
около 1330 °C происходит четырехфазное превращение ж + а^у + а.
На рис. 172 приведены изотермические разрезы при 1300 и
! '.’00 ° С. При 1300 ° С установлено существование однофазных обла-
। к н а-, у- и cr-твердых растворов и расплава ж, двухфазных обла-
гай а + у, у + о, у + ж, ж+сг и а + сг, а также трехфазных а+у + о и
.к |-у+о. На разрезе при 1200 ° С жидкая фаза исчезает, появляется
область непрерывных сг-твердых растворов между сторонами кобальт —
нипадий и железо — ванадий. При 1000 ° С появляются области, свя-
|.и1пые с образованием упорядоченной у'-фазы. Разрез при 600 ° С
содержит также области, обусловленные образованием упорядочен-
ной фазы и интерметаллического соединения CoV3.
Результаты, приведенные в работе [3], не подтверждают наличия
непрерывного ряда твердых растворов между сг-фазами систем ко-
бальт— ванадий и железо — ванадий при 1200 ° С; указывается, что в
о (разе растворяется при этой температуре до 52 % (ат.) Fe.
Область а^у-равновесий для более чистых металлов при 950,,
425 и 900 ° С уточнена данными работы [4].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I. Koster W., Schmid И. — Arch. Eisenhuttenw., 1955, Bd 26, № 4,,
S. 345 -353.
2. Koster W., Schmid H. — Arch. Eisenhuttenw., 1955, Bd 26, № 5,
S. 421—425.
3. Darby J. B., Beck P. A. — Trans. AIME. 1957, v. 209, № 1, p. 69—72.
I Bennett J. E. Pinnel Al. R.— J. Mater. Sci.. 1974, v. 9, № 7, p. 1083—
1090.
ЖЕЛЕЗО — ВАНАДИЙ — КРЕМНИЙ
Изучена [1] область Fe—FeSi—VSi2—V и установлено существование
соединения VsFe4Si4. В работе [2] установлено, что это соединение
имеет кристаллическую структуру типа а-Мп. Показано [3], что соеди-
нению с такой структурой отвечает состав V3Fe5Si2 (а = 0,8843±
1 0,0001 нм). Определена область распространения сг-фазы из двой-
ной системы железо — ванадий в тройную [4]. В сплавах системы
установлено также существование второго тройного соединения, обла-
дающего структурой типа фазы 7? [5—7]. Состав этого соединения
\Z37Fe4lSi22 [5] или V2Fe2Si (6, 7], периоды решетки а= 1,0799, с =
-1,9243 нм.
Методами микроструктурного и рентгеновского анализа [8] изуча-
ли литые сплавы системы, закаленные с 1200, 1000 и 800 ° С с вы-
держкой 30, 100 и 500 ч соответственно. Сплавы синтезировали из
кремния чистотой 99,99 %, карбонильного железа чистотой 99,96 % и
ванадия чистотой 99,62 %. Часть образцов получали в печи Таммана
п атмосфере аргона и после затвердевания закаливали в воде, дру-
гую часть — в дуговой печи с нерасходуемым вольфрамовым электро-
дом в атмосфере гелия.
В литых сплавах и сплавах, закаленных с 1200 и 1000 ° С, уста-
новлено существование трех тройных соединений %, К и б. После
закалки с 800 ° С обнаружено присутствие также фазы б' в области
состава VFeSi. Структура этой фазы не установлена.
Фаза х включает состав V3Fe5Si2 (о = 0,8843±0,0001 нм) и при-
надлежит к структурному типу о-Мп. Область гомогенности этой фа-
зы при температурах, близких к температуре плавления,
10—55 % (ат.) Fe и 15—30 % (ат.) Si и сужается при
температуры. В области гомогенности фазы у находится
составляет
понижении
соединение
181
Si5(V8,7Fei4,5Sio,8) co сверхструктурой типа Zr5Re24. Координационное
число соединения SigfVsjFeis.s) —максимальное.
Фаза R при 1000 ° С существует в области концентраций 35—
45 % (ат.) V и 18—26 % (ат.) Si и включает состав V2Fe2Si. Эта
фаза индицируется в тригональной сингонии и принадлежит к типу
R-фаз; а= 1,0799±0,0003 нм, с = 1,9243±0,0010 нм, с/а= 1,782. Фаза 6
при 1000 ° С имеет область гомогенности при 33—38 % (ат.) V и 27—
32 % (ат.) Si, которая включает состав V5Fe4Si4. Рентгенограмма этой
фазы индицируется в тетрагональной сингонии при с/а=0,976 (а=
=0,888±0,001 нм, с=0,867±0,001 нм). Ее структура родственна струк-
туре 6 (MoNi). Кроме
тройных интерметалли-
ческих фаз в системе при
1000 °C существуют твер-
дый раствор на основе
a-Fe, твердый раствор
на основе ванадия, крем-
ний, соединения FesSi3,
FeSi, FeSi2, VSi2, VsSi3,
V3Si и о-фаза системы
железо—ванадий.
Растворимость желе-
за в V3Si при 1000 °C со-
ставляет 23 % (ат.), а в
V5Si3 (структура
Mo5Si3) —13 % (ат). Рас-
творимость ванадия в
Fe5Si3 (структура
Mn5Si3) составляет 35 %
(ат.). В присутствии не-
больших количеств при-
месей углерода, кисло-
рода, азота соединение
VsSi3 кристаллизуется в
структуре типа Mn5Si3.
В этом случае между
Fe5Si3 и VsSi3 возможен
непрерывный ряд твердых растворов. Соединение FeSi растворяет до
14 % (ат.) V. Растворимость компонентов в других двойных соединени-
ях небольшая. Ванадий растворяет 36 % (ат.) Fe и ~2 % (ат.) Si при
1000 °C. Железо и ванадий в кремнии не растворяются.
Изотермический разрез системы [8] при 1000 ° С приведен на
рис. 173. Твердый раствор на основе железа находится в равновесии
с фазами Fe5Si3, у и a
Методами микроструктурного и рентгеновского анализов (9] исследо-
ваны сплавы, приготовленные из кремния чистотой 99,98, железа чи-
стотой 99,9 и ванадия чистотой 99,9 %. Сплавы получали в дуговой
печи в атмосфере гелия или в индукционной печи в атмосфере аргона.
Построен изотермический разрез системы при 1100 ° С при содержании
кремния до 50 % (по массе). Подтверждено существование трех трой-
ных фаз: /?-фазы, фазы со структурой a-Mn (о=0,8799 нм), которой
приписан состав V2iFe6i,5Sii7,5, и .D-фазы состава Vo,265Fo,44Sio,295- По-
следняя имеет тетрагональную решетку а = 0,8833, с=0,8646 нм. Таким
образом, подтверждено существование фаз, аналогичных фазам R, у
и 6. В то же время имеются различия в характере взаимодействия
фаз между собой. Так, по мнению авторов [8], в равновесии с a-Fe
182
при 1000 ° С находится фаза Fe5Si3, а по данным [9] (при 1100 ° С),—
,|,.i и l'e3Si. Кроме того, в этих работах приведены разные трехфазные
1и.1пмодействия между фазами ct-Mn (х), R, б (£>), и Fe5Si3 или Fe3SL
l»l II БИОГРАФИЧЕСКИЙ СПИСОК
I Vogel R., Jeutsch-Uschinski— Arch. Eisenhiittenw., 1940, Bd 13, № 4,
S. 403—407.
'• Гладышевский E И., Крипякевич П. И. — В кн.: VIII Менделеевский
съезд. Рефераты докладов. Секция металлов и сплавов. М.: Изд-во
АН СССР, 1958, с. 44.
1 Гладышевский Е И., Крипякевич П И., Теслюк М. Ю. и др. — Кри-
сталлография, 1961, т. 6, с. 267—270.
I Gupta К- Р-, Rajan N. S., Beck Р. А.— Trans. AIME, 1960, v. 218,
р. 617—622
Bardos D. E, Gupta К- P-, Beck P. A —Nature 1961, v. 192, p. 744—
748.
(> Гладышевский E. И. — Порошковая металлургия, 1962, № 4, с. 46—
49.
7 Борусевич Л. К., Гладышевский Е. И. — В кн.: Юб1лейна наукова
сешя, секгця бюлогй, xiMii. Льв1в. Львовск. гос. ун-т, 1961, с. 44.
Н. Гладышевский Е. И., Швец Г. Н. — Изв. АН СССР. Металлы, 1965,
№ 2, с. 120—127.
ч Bardos D. I., Beck Р. А.—Trans. AIME, 1966, v. 236, № 1, р. 64—69.
ЖЕЛЕЗО — ВАНАДИЙ-
МАРГАНЕЦ
В сплавах системы при 1000 °C метода-
ми микроструктурного и рентгеновского
.шализов изучено [1] взаимодействие
<>-фаз, образующихся в двойных систе-
мах ванадий — железо и ванадий — мар-
i.nieu. Эти фазы образуют непрерывный
ряд твердых растворов (рис. 174).
Изучена область равновесий
при температурах 900—1200 °C метода-
ми металлографического и рентгено-
спектрального анализов в сочетании с
результатами термодинамического расче-
ia [2]. На рис. 175 приведены получен-
ные в этой работе изотермы в области
а^ьу-превращения.
Мп
Рис. 174. Изотермический раз-
рез системы Fe—V—Мп при
1000 °C
Рис. 175. Изотермические разрезы системы Fe—V—Мп в области
а-*у-превращения при 1200 (а), 1100 (б), 1000 (в) и 900 ° С (а)
183
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Darby J. В., Beck Р. А. — Trans. AIME, 1957, v. 209, № 1, p. 69—72.
2. Ishida Kjjohito, Shibuya Kiyoshi, Nishizawa Taiji.—J. Jap. Inst.
Metals, 1973, v. 37, № 12, p. 1305—1313.
ЖЕЛЕЗО — ВАНАДИЙ — НИКЕЛЬ
Исследовано распространение в тройную систему фаз, образующих-
ся в двойной системе ванадий — никель [1, 2]. Методами микрострук-
турного и рентгеновского анализов установлено [1], что растворимость
железа в сг-фазе при 1200 ° С достигает 55 % (ат.). Показано [2], что
сплав состава V25Fei5Ni60 при 610 °C представляет собой твердый
раствор со структурой VNi3 (тип TiAl3), а тот же сплав при 900 ° С и
сплав состава V25Fe25Ni50 при 800 °C — твердые растворы с решеткой
типа меди.
Изучены магнитные свойства сплавов [3].,
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Darby J. В., Beck Р. A. —Trans. AIME, 1957, v. 209, № 1, р. 69—72.
2. Pfeifer Н. U., Bhan S., Schubert K.—J. Less-Common Metals, 1968,
v. 14, № 3, p. 291—302.
3. Kuhlewein H. — Z. anog. u. allgem. Chemie, 1934, Bd 218, № 1,
S. 65—68.
ЖЕЛЕЗО — ВАНАДИЙ — НИОБИЙ1
Приведена1 гипотетическая диаграмма состояния системы, построен-
ная на основе анализа литературных данных о взаимодействии ниобия
с переходными металлами. На рис.
176 показаны изотермический разрез
при 1000 °C и распространение двой-
ных фаз в тройную систему.
Рис. 176. Гипотетический изотер-
мический разрез системы Fe—V—Nb
при 1000 °C
ЖЕЛЕЗО — ВАНАДИЙ —
СЕРА
Исследованы сплавы в области соста-
вов Fe—FeS—VS—V [1]. Для приго-
товления сплавов использовали чис-
тое железо, серу и феррованадий, со-
держащий 60 % (по массе) V; 1 %
Si; 1 % Al и 0,15 % примесей (Р, As,
S). Для приготовления богатых вана-
дием сплавов применяли ванадий, по-
лученный из феррованадия. Плавку ве-
ли в печи Таммана в атмосфере ар-
гона. Для сплавов, содержащих ме-
нее 60 % (по массе) V, использовали
тигли из пифагоровой массы; в ос-
тальных случаях применяли тигли из
плавленого корунда. Серу вводили в
металлический расплав. Исследование выполнено микроструктурным и
термическим методами.
Построено шесть политермических разрезов, поверхность ликвидус * 184
1 Goldschmidt Н. J. — J. Less-Common Metals, 1960, v. 2, № 2—4, р. 138—153.
184
,, „ «> термический разрез системы при 20 ° С. В двойной системе
I cS VS обнаружена неограниченная растворимость в твердом и жид
ком состояниях. В системе Fe—FeS—VS—V (рис. 1?71 сУЩес™Ует
гсчепие MM'VS, разделяющее ее на две вторичные системы Ге е
VS Ми М—VS—V. Из расплава выделяются следующие фазы:
Рис. 177. Поверхность ликвидус части системы Fe—V—С
Рис. 178. Изотермический разрез части системы Fe—V—С при 20 СС
«-твердый раствор железа и ванадия в области FepiPM'M’, у-твердый
раствор железа и ванадия в области р\Рер, твердый раствор сульфи-
дов железа и ванадия (g) в области M'PeiFeS—VS; a-твердый
раствор железа и ванадия, содержащий 0,1 % (по массе) VS в обла-
сти и VS в области M'VSe2-
В точке Р протекает четырехфазное нонвариантное превращение
ж+у + g. В твердом состоянии (при 20 ° С) установлено существо-
вание областей, показанных на рис. 178. Методами микроструктурного,
рентгеновского и химического анализов подтверждена [2] неограничен-
ная растворимость сульфидов FeS и VS в твердом и жидком состоя-
ниях. При 950 ° С построены коноды двухфазной области a+g.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R., Wilstefeld А. — Arch. Eisenhiittenw., 1938, Bd 12, № 5,
S. 261—268.
2. Kaheko Hideo, Nisidzawa Taidzi, Tamaki Koreaki— J. Jap. Inst Me-
tals, 1963, v. 27, Ks 7, p. 312—318.
7—358 185
ЖЕЛЕЗО — ВАНАДИЙ — ТИТАН
В сплавах системы методом дилатометрического анализа определена
граница твердого раствора на основе y-Fe при различных температу-
рах (рис. 179) [1].
Рис. 179. Граница области твердого раствора на ос-
нове v-Fe при 970—1091 °C в системе Fe—V—Ti
Сплавы, прилегающие к стороне ванадий — титан и содержащие
до 50 % (по массе) Fe, подробно изучены в [2—5]. Построены поли-
термические разрезы TiFe2—V, TiV—V и разрез с отношением Ti: Fe=
= 84: 16, а также изотермические разрезы при 1000, 800 и 20 °C. В си-
стеме установлено существование твердых растворов на основе титана,
ванадия, соединений TiFe и (Ti, Fe)V. Последнее соединение имеет
гексагональную решетку с а = 0,488 нм, с = 0,796 нм, с/а= 1,63.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Lucasa W. R.. Fishel IF. Р. — Trans. ASM, 1954, v. 46, p. 277—285.
2. Би Цин-Хуа, Корнилов И. И. — Изв. АН СССР. ОТН. Металлургия
и топливо, 1959, № 6, с. НО—112.
3. Би Цин-Хуа, Корнилов И. И. — ЖНХ, 1960, т. 5, № 4, с. 902—907.
4. Би Цин-Хуа, Корнилов И. И. Науч. тр./Ин-т металлургии АН СССР,
1961, вып. 8, с. 54—57.
5. Би Цин-Хуа, Корнилов И. И. — ЖНХ, 1961, т. 6, № 6, с. 1351 — 1354.
ЖЕЛЕЗО — ВАНАДИЙ — УГЛЕРОД
Сплавы системы в широком интервале составов изучены микрострук-
турным и рентгеновским методами [1]. Исходными материалами слу-
жили ванадий чистотой 99,25 %, железо чистотой 99,99 %, спектраль-
но чистый графит. Сплавы готовили в дуговой печи с вольфрамовым
электродом в атмосфере гелия. Отжигали в откачанных кварцевых
ампулах при 1050, 750 и 500 ° С с выдержкой при каждой температуре
186
с
50 Va 80 70\'^б SO 50 б ^06^30 20 Fea 10
V, % lam.)
Рис. 180. Изотермический разрез системы Fe—V—С при 500 °C
~ 100 ч. По результатам исследования построен изотермический раз-
рез системы при 500 ° С (рис. 180). Разрезы VC—Fe и V2C—Fe квази-
бинарные, между разрезами существует трехфазная область VC —
V2C 4- Fe. При более
низких содержаниях уг-
лерода имеется область
железованадиевого кар-
бида (Fe3V3) С. Этот кар-
бид устойчив и находит-
ся в равновесии с a-Fe.
V2C и о-фазой.
Символом Fea обо-
значен твердый раствор
углерода и ванадия в же-
лезе с о. ц. к. решеткой,
Va — твердый раствор
железа и углерода в ва-
надии, о. ц. к.; V2C —
малоуглеродистый кар-
бид ванадия с гексаго-
нальной решеткой; VC •—
монокарбид ванадия,
г. ц. к.; (Fe3V3) С —фа-
за Т), г. ц. к.; сг-фаза —
электронное соединение
с соотношением числа
валентных электронов
7,1; С-фаза — графит;
%-фаза — соединение с
г. ц. к. решеткой.
Рис. 181. Изотермический разрез части системы
Fe—V—С при 1000 °C
187
По данным исследования влияния ванадия на активность углеро-
да в аустените [2] построен изотермический разрез части системы при
1000 ° С (рис. 181). Сплавы железа с ванадием (ванадий чистотой
99,9 %, железо электролитическое чистотой 99,9 %) изготавливали
индукционной плавкой в атмосфере аргона в тиглях из оксида алю-
миния. Образцы в виде пластин толщиной 0,25 мм выдерживали в
смеси Н2+СН4 при 848 (185—284 ч), 1000 (49—91 ч), 1200 °C (44—
50 ч). Границы у/(у + карбид) определяли по изломам линий изоак-
тивности углерода.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Грдина Ю. В., Лыхин И. Д., Федоров Т. Ф. — Изв. вузов. Черная
металлургия, 1966, № 6, с. 156—160.
2. Wada Т., Wada Н., Elliot J. F., Chipman J.—Met. Trans., 1972, v. 3,
№ 11, p. 2865—2872.
ЖЕЛЕЗО — ВАНАДИЙ — ФОСФОР
Сплавы системы изучены методами термического, микроструктурного и
рентгеновского анализов [1, 2]. Проведено [1] систематическое иссле-
дование области Fe—Fe2P—V2P—V до 60 % (по массе) V и 20 %
(по массе) Р.' Для приготовления сплавов использовали электролити-
ческое железо, красный фосфор, феррованадий с 53 и 60 % (по массе)
V и алюмотермический ванадий. Плавки вели в атмосфере азота и
аргона в тиглях из корунда.
Построены политермические разрезы с 2,5; 5; 10; 15; 20 и 30 %
(по массе) V, разрез Fe2P—V2P, разрез с 12 % (по массе) Р, изотер-
Рис. 182. Поверхность ликвидус в богатых железом сплавах систе-
мы Fe—V—Р
мический разрез при комнатной температуре и проекция поверхности
ликвидус на треугольник составов..
В изученной части системы обнаружены следующие фазы:
«-твердый раствор на основе железа и ванадия с содержанием
фосфора 0,2 % (по массе) при 45 % (по массе) V и о. ц. к. решеткой;
P-твердый раствор на основе фазы ЕезР. Эта фаза распространя-
ется в тройную систему до 12 % (по массе) V;
л-фаза (Fe, V)2P — тройной твердый раствор на основе Fe2P.
При содержании в л-фазе 4,5 % (по массе) V периоды ее решетки
188
1оставляют a = 0,586 нм, с = 0,349, с/а= 1,680. В то же время для
nioiiiioro соединения Fe2P а = 0,5852 нм, с=0,3453 нм, с!а=1,695;
л/-фаза (Fe, V)2P — тройной твердый раствор на основе V2P.
Разрез между Fe2P и V2P квазибинарный перитектического типа с
небольшой областью несмешиваемости между 11 и 12 % (по массе) V
и температурой нонвариантного превращения 1415 °C (ж + л'^л).
Па рис. 182 показана поверхность ликвидус с четырьмя областя-
ми первичного выделения фаз а, Р, л и л' В изученной части системы
егаповлено протекание двух четырехфазных нонвариантных превра-
щений ж + л'^сНф в точке Pi при 1045 ° С и ж + Лт*Р+л' в точке
Рис. 183. Изотермический разрез системы Fe—V—Р при комнатной тем-
пературе
Р2 при ~ 1150 ° С. В точках еь рь р2 происходят трехфазные нонва-
риантные превращения: Жч=ш + Ре3Р(|3), У2Р(л') +ж^Ре2Р и
Ре2Р(л)+ж^*Ре3Р(Р) соответственно. В точке М — минимум на кри-
вой моновариантного равновесия.
Изотермический разрез при комнатной температуре приведен на
рис. 183. Установлено существование трехфазной области «4-
+ (Fe, V)2P4-(Fe, V)3P и предполагается существование области а +
+ e(FeV) 4- (Fe, V)2P, где е — фаза, образующаяся в результате упоря-
дочения в сплавах системы железо — ванадий при понижении темпера-
туры.
По значениям свободной энергии образования фосфидов термо-
динамическим расчетом определена граница a-твердого раствора на
основе железа, равновесного с V3P (возможно, с твердым раствором
Fe3P—V3P). Граница в координатах 1g Мр—IgA’v (Ni— мольная доля
i-того компонента) представляет собой прямую линию [3].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Stengel В., Vogel R. —Arch. Eisenhiittenw., 1955, Bd 26, № 9, S. 547—•
554.
2. Kaneko Hideo, Nisadzawa Tadzi, Tamaki Koreaki.— J. Jap. Inst. Me-
tals, 1965, v. 29, № 2, p 159—165.
3. Шварцман Л. А., Емельяненко Л. П., Ульянов В. И. — Изв. АН
СССР. Металлы, 1979, № 1, с. 69—72.
ЖЕЛЕЗО — ВАНАДИЙ — ХРОМ
Вариант диаграммы состояния системы был предложен в работе [1].
На основании анализа общего характера взаимодействия химических
элементов с железом предполагалось, что при высоких температурах
189
в системе должна наблюдаться непрерывная растворимость — «-твер-
дый раствор. При охлаждении в двойных системах появляются
изоморфные фазы FeCr и FeV, образующие твердый раствор о, отде-
ленный от а двухфазной областью « + о. Такое строение системы
подтверждено дальнейшими исследованиями [2—4].
Методом рентгеноструктурного анализа изучен [2] изотермический
разрез при 700 ° С. Этим же методом исследованы политермический
разрез, проходящий через соединения FeV и FeCr, изотермический
разрез при комнатной температуре и область распространения о-фазы
в тройную систему при различных температурах [3, 4].
Рис. 184. Изотермические разре-
зы части системы Fe—V—Сг при
427 (а), 700 (б) и 900 °C (в)
Однако приведенные в работах [3, 4] данные о фазовых равно-
весиях не согласуются с современными данными о строении двойной
системы железо — хром, согласно которым о-фаза, образующаяся при
— 820 ° С, эвтектоидно распадается при температурах <500 или
520 ° С, давая широкую область несмешиваемости при низких темпе-
ратурах [2]. Эту область изучали [5] методом термического анализа
и измерением эффекта Мессбауэра. Определили ее границы при раз-
личных температурах и построили изотермический разрез части си-
стемы, прилегающей к стороне железо — хром при 480 ° С.
Расчетным путем, исходя из термодинамических данных по двой-
ным системам, построены [6] изотермические разрезы при 427, 700 и
900 °C, т. е. при температурах ниже и выше интервала стабильности
190
i) фазы (рис. 184). Эти результаты хорошо согласуются с эксперимен-
1.1 льны ми данными работы [2].
Ы IБЛИОГРАФИЧЕСКИИ СПИСОК
I Корнилов Т. И. Железные сплавы. М.: Изд. АН СССР, 1951, т. И,
с. 328.
?. Marden Н., Duwez Р. — Trans. ASM, 1952, v. 44, р. 484.
3. Корнилов И. И., Матвеева Н. М. — ДАН СССР, 1954, т. 98, № 5,
с. 787—790.
'1. Корнилов И. И., Матвеева Н. М, — ЖНХ, 1957, т. 2, № 2, с. 355—366.
5. Mima Cenjiro, Yamaguchi Masaharu.— Trans. Jap. Inst. Metals, 1970,
v. 11, № 4. p. 239—244.
6. Spencer P. J., Counsel! J. F. — Z. Metallkde, 1973, Bd 64, № 9,
S. 662—665.
ЖЕЛЕЗО — ВАНАДИЙ — ЦИРКОНИЙ
I кследовали 1 сплавы системы методами микроструктурного, рентгенов-
ского и термического анализов. Изучен разрез ZrFe2—ZrV2 тройной
системы. Сплавы для иссле-
дования готовили из вана-
дия ВЭЛОО, карбонильного
железа ВЗ и иодидного цир-
кония чистотой 99,96 % в
дуговой печи в атмосфере
аргона. Отжиг вели при тем-
пературах 1450 и 900 °C в
гонение 11 и 350 ч соответ-
с гвенно.
В изученной части си-
стемы обнаружены твер-
дые растворы на основе
двойных фаз Лавеса ZrFe2
п ZrV2 со структурой типа
MgCu2(X2) и тройная фаза
Лавеса М со структурой ти-
па MgZn2. Соединение ZrFe2
при 900 °C растворяет ~9-%
(ат.) V, а соединение ZrV2—
около 20 % (ат.) Fe.
Рис. 185. Политермический разрез ZrFe2—•
ZrV2 системы Fe—V—Zr
Политермический разрез ZrFe2—ZrV2 системы приведен на рис. 185.
ЖЕЛЕЗО — ВИСМУТ — СЕРА
Исследовали2 диаграмму состояния системы в области, прилегающей к
стороне висмут — железо методами термического и микроструктурного
анализов сплавов. Построено пять (I—V) политермических разрезов
(рис. 186), определены граница расслаивания и поверхность ликвидус.
Исходными материалами для приготовления сплавов служили
висмут чистотой 99,9 %, сера в виде «серного цвета» и железо чисто-
1 Петьков В. В., Свечников В. М. — ДАН УРСР, 1972, Сер. А, № 7, с. 664—
ы>7, 672.
2 Уразов Г. Г., Большаков К- А., Федоров П. И., Василевская И. И.—ЖНХ,
I960, т. 5, № 3, с. 630—636.
191
Рис. 186. Схема расположения раз-
резов в системе Fe—Bi—S
той 99,7 %. Сульфид железа готовили
двукратным сплавлением железной
стружки с серой. Сплавы получали в
корундовых или фарфоровых тиглях
под слоем угольного порошка.
В изученной части системы фазо-
вые равновесия определяются лишь
взаимодействием фаз, образующихся
в двойных системах. На рис. 187 по-
казана проекция диаграммы плавкос-
ти. В системе первично кристаллизу-
ются четыре фазы: твердые растворы
на основе висмута и железа, FeS и
Bi2S3. Фазы FeS и Fe имеют большие
поля выделения, а область первичной
кристаллизации висмута практически
отсутствует. Диагональ, соединяющая
висмут и сульфид железа, делит по-
верхность ликвидус на две вторичные
тройные системы: Bi—FeS—Bi2S3 и
Bi—FeS—Fe. В первой из них крис-
таллизуется эвтектика Bi + FeS + Bi2S3, а во второй Bi + FeS + Fe. Линия
кристаллизации железа и его сульфида пересекает область расслаива-
ния. Вследствие этого здесь наблюдается четырехфазное равновесие
Ж1=ё^ж2+FeS-|-Fe. Для определения области расслаивания (штриховая
Рис. 187. Поверхность ликвидус и граница области рассла-
ивания (штриховая линия) в системе Fe—Bi—S
линия на рис. 187) ряд сплавов закаливали с температуры 1200 °C, а
сульфидный и металлический слои подвергали химическому анализу.
Эта область, начинающаяся от стороны железо—висмут концентрацион-
ного треугольника, занимает почти всю площадь системы Fe—Bi—FeS.
ЖЕЛЕЗО — ВОДОРОД — ВОЛЬФРАМ
Методами гетерогенных равновесий и рентгеновского анализа иссле-
довано восстановление вольфрама железа FeWO4 водородом в интер-
вале 850—1100 ° С [1]. Установлено образование соединения Fe7We;
тройных фаз не обнаружено.
Определили [2] растворимость водорода L по значениям коэффи-
циентов проницаемости Р и диффузии газа D в металле (L = P:£>).
Сплавы готовили в индукционной печи из карбонильного железа чи-
стотой 99,98 % и технического вольфрама. Гомогенизированные при
1150 ° С образцы прокатывали, вырезали диски диаметром 25 мм,
толщиной 3 мм и насыщали их водородом.
192
На рис. 188 приведена температурная зависимость растворпмостй
водорода в железовольфрамовых сплавах. Абсолютные значения рас-
; воримости водорода в сплавах больше, чем в чистом железе. Теплота
растворения водорода в сплаве Fe — 39. % (ио массе) W составляет
18,8 кДж/моль Н (в чистом железе 24,0 кДж/моль Н).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Резухина Т. Н., Симанов Ю. П., Герасимов Я. Я. — ЖФХ, 1951, т. 25,
№ 3, с. 305—311.
2. Житенев В. И, Рябов Р. А., Левченко П. В. — Сб. Физико химия ис-
следования металлургических процессов, М.: Наука, 1976, с. 76—77.
0,9 1,0 1,1 1,2 1,3 1,9 1,5
103/Т,К'1 '
Рис. 188. Температурная зависи-
мость растворимости водорода в
сплавах системы Fe—W
Рис. 189. Кривые концентраци-
онно-температурной зависимо-
сти растворимости водорода в
жидких сплавах системы
Fe—Ge:
сплошная кривая — расчетные
данные, штриховые — экспери-
ментальные
ЖЕЛЕЗО — ВОДОРОД — ГЕРМАНИЙ
Изучали растворимость водорода в расплавах железо — германий,
содержащих до 20 % (ат.) Ge, в интервале 1450—1670 °C [1—3].
Результаты этих исследований удовлетворительно согласуются с дан-
ными более поздней работы [4], выполненной во всем интервале
концентраций германия и железа.
Сплавы для исследования [4] готовили в высокочастотной индук-
ционной печи из карбонильного железа марки ВЗ, предварительно об-
работанного водородом при 900—1200 ° С, и германия чистотой 99,999.
Растворимость водорода определяли методом горячего объема в
изохорном варианте при давлениях 67—200 гПа.
На рис. 189 приведены температурно-концентрационные зависи-
мости растворимости водорода в расплавах железа с германием по
данным [1—4]. Повышение температуры приводит к увеличению раст-
воримости водорода.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I. Weinstein N„ Elliot J. F. — Trans. AIME, 1963, v. 227, № 2, p. 382—387.
2. Someno M„ Nagasaki K„ Nadal /(. — J Jap. Inst. Metals, 1967, v. 31,
№ 6, p. 729—734.
193
3. Бэн-я Ш., Фуба Т. — В кн.: Физико-химические основы металлурги
ческих процессов. М.: Наука, 1973, с. 729—734.
4. Петрушевский М. С., Гельд П. В., Абрамычева Л. Е. и др. — Изв.
вузов. Черная металлургия, 1976, № 6, с. 5—8.
ЖЕЛЕЗО — ВОДОРОД — КОБАЛЬТ
Изучали растворимость водорода в расплавах железо
3]. В отличие от данных [1, 3] при исследовании [2] не
х^ог
Со 0,2 0,4 0,6 0,8 Fe
Fe, мольная доля
Рис. 190. Изотермы раствори-
мости водорода в жидких спла-
вах системы Fe—Со при 1600 °C:
1 — расчетные данные; 2 — по
данным [3]
— кобальт [1—
обнаружено
отклонений изотерм растворимости
водорода от законов идеальных рас-
творов.
В наиболее поздней работе [3[
методом Сивертса в изохорном вари-
анте при давлениях 67—213 гПа и
расчетным путем определена темпера-
турно-концентрационная зависимость
растворимости водорода в двойных
расплавах железо — кобальт при
1400—1800 °C во всей области соста-
вов сплавов (Ocx/cl).
Сплавы готовили из электроли-
тического кобальта К00 и карбо-
нильного железа марки ВЗ, содержа-
щих не более 0,01 % примесей, вы-
плавляли в вакуумной высокочастот-
ной печи в тиглях из оксида берил-
лия. Для уменьшения содержания
кислорода исходные материалы и
сплавы обрабатывали водородом в
твердом и жидком состояниях, дега-
зировали и охлаждали в вакууме.
Обнаружено [3] отрицательное отклонение изотермы растворимости
водорода от аддитивной прямой (рис. 190).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Морозов .4. Н. Водород и азот в стали. М.: Металлургия, 1968 158 с.
2. Blossey R. G., Pehlke R. D. — Met. Trans., 1971, v. 2, № 11, p. 3157—
3161.
3. Петрушевский M. С., Гельд П. В., Абрамычева Л. Е., Лостина Т. К —
ДАН СССР, 1976, т. 227, № 2, с. 337—340.
ЖЕЛЕЗО — ВОДОРОД — МОЛИБДЕН
В сплавах системы по экспериментальным значениям коэффициентов
проницаемости (Р) и диффузии (D) в металле определена1 раствори-
мость водорода (L = P:D). Сплавы изготавливали из карбонильного
железа марки В2 чистотой 99,98 % и технического молибдена в высо-
кочастотной индукционной печи. Гомогенизированные при 1150 ° С
сплавы прокатывали и вырезали образцы в виде дисков диаметром
25 мм и толщиной 3 мм.
На рис. 191 приведена температурная зависимость растворимости
1 Житнев В. И., Рябов Р. А., Левченко П. В. — В сб.: Физико-химические ис-
следования металлургических процессов. 1976, с. 76—77.
194
водорода в сплавах системы
железо — молибден. Абсолют-
ные значения растворимости
водорода в сплаве больше, чем
н чистом железе. Теплота рас-
ширения водорода в сплаве
I •' — 3,11 % (по массе) Мо рав-
на 18,07 кДж/моль II, в чистом
железе — 24,02 кДж/моль Н.
ЖЕЛЕЗО — ВОДОРОД
— НИКЕЛЬ
Изучали [1—4] растворимость
водорода в сплавах системы.
Данные работы [2], в отличие
or данных других исследова-
ний, показали слабые отклоне-
ния изотерм растворимости во-
дорода от законов идеальных
растворов.
Методом Сивертса в изохор-
ном варианте при давлении 66,5—
212 гПа и расчетным путем опре-
делена [4] температурно-концеп-
грационная зависимость раствори-
мости водорода в двойных спла-
вах железо—никель при 1400—
1800 °C во всей области составов
сплавов (OcXjd), где Xt— мо-
лярная доля железа.
Сплавы получали в вакуум-
ной высокочастотной печи в тиг-
лях из оксида бериллия. Исходны-
ми материалами для сплавов слу-
жили карбонильное железо и
глектролитический никель Н00,
содержащие не более 0,01 % при-
месей. Для уменьшения содержа-
ния кислорода- исходные материа-
лы и сплавы обрабатывали водо-
родом в твердом и жидком состо-
яниях, обезгаживали и охлаждали
в вакууме.
Обнаружено [3, 4] отрица-
тельное отклонение растворимости
водорода от аддитивной прямой
(рис. 192).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
Рис. 191. Температурная зависимость рас-
творимости водорода в сплавах системы
Fe—Мо
Ni 0,2 Д4 0,6 0,8
Fe? мольная доля
Рис. 192. Изотермы растворимости во-
дорода в жидких сплавах системы
Fe—Ni:
1 — расчетные данные; 2 — [3]; 3—[4]
1. Морозов А. Н. Водород и азот в стали. М.: Металлургия, 1968. 158 с.
2. Blossey R. G., Pehlke R. D.—Met. Trans., 1971, v. 2, № 11, p. 3157—
3161.
3. Schneck H., Lauge К. M. — Arch. Eisenhiittenw., 1966, Bd B37, № 6,
S. 739—745.
4. Петрушевский M. С., Гелъд П. В., Абрамычева Л. Е„ Костина Т. К.—
ДАН СССР, 1976, т. 227, № 2, с. 337—340.
195
ЖЕЛЕЗО — ВОДОРОД — НИОБИЙ
Исследованы1 сплавы системы в интервале температур 1685—1560 ° С
и давлений 13—40 гПа. Определена растворимость и скорость раство-
рения водорода в жидких сплавах железо — ниобий. Изучены влияние
температуры и давления на процесс растворения водорода и возмож-
КЬ, % (по массе)
Рис. 193. Растворимость водорода в
сплавах системы Fe—Н—Nb (сплош-
ная линия) и количество связанного
водорода (штриховая линия) при дав-
лении 2,9 кПа
ность образования гидридов в
жидком железе, легированном нио-
бием в количестве 5,01; 8,97 и
15,12 % (по массе).
Сплавы для исследования го-
товили из железа, содержащего
0,02 % Мп и следы углерода, рас-
кисленного небольшими количест-
вами кремния или алюминия. Нио-
бий вводили в виде ферросплава,
содержащего 69,8 % (по массе)
Nb и 0,09 % (по массе) С. Раство-
римость и скорость растворения
водорода в жидком металле изме-
ряли по изменению давления в ре-
акционном сосуде. Насыщение во-
дородом одного и того же сплава
проводили при двух конечных дав-
лениях водорода и постоянной
температуре металла.
Исходя из найденной для каждого сплава зависимости между
давлением и объемом растворенного в металле водорода, рассчитали
растворимость водорода при 1685 и 1560 ° С и 29 гПа (рис. 193).
Показано, что объем растворенного газа не пропорционален кор-
ню квадратному из давления. Показатель степени п в выражении
(Pi/P ”) = V1/V2 имеет значение между 0,57 и 0,68, причем с повыше-
нием содержания ниобия он увеличивается, что свидетельствует о
наличии двух механизмов растворения. Во-первых, происходит обыч-
ное растворение с атомизацией водорода и, во-вторых, образование
гидрида NbH2. Вычислен тепловой эффект растворения, составляющий
66,9; —41,4 и —23,4 кДж/моль для сплавов с 5,01, 8,97 и 15,12 %
(по массе) Nb соответственно.
Рассчитано количество водорода, находящегося в виде гидрида
при 2,9 кПа и 1685 ° С (см. рис. 193, штриховая линия). Относитель-
ное количество связанного водорода невелико и уменьшается с умень-
шением содержания ниобия.
Применяющийся в сталеплавильной практике ниобий не может
связать весь водород в виде гидрида, так как, во-первых, количество
ниобия невелико, а во-вторых, он может находиться в стали в виде
химических соединений с другими элементами, в частности, с угле-
родом.
Растворение водорода в сплавах железо — ниобий протекает с
несколько меньшей скоростью, чем в чистом железе. При охлаждении
насыщенных водородом сплавов происходит его выделение из жидко-
го, а затем и твердого металла, причем скорость выделения уменьша-
ется с понижением температуры. Сплавы с ниобием теряли водород
интенсивнее, чем чистое железо.
1 Карнаухов М. М., Морозов А Н. — Изв. АН СССР, ОТН, 1948, № 12, с. 1845—
1855.
196
ЖЕЛЕЗО — ВОДОРОД — ТАНТАЛ
Исследовали1 процесс растворения водорода в жидких сплавах желе-
за с танталом в интервале 1685—1560 ° С и давлений 13—40 гПа, а
также возможность образования гидридов в железе, легированном
танталом.
Сплавы для исследования готовили из железа, содержавшего 0,02 %
Мп и следы углерода, раскисленного небольшими количествами кремния
или алюминия и тантала чистотой 99,8 %. Методика эксперимента та же,
что в вышеописанной системе железо — водород — ниобий.
Из зависимости между объемом растворенного водорода и давле-
нием (Pi/P2)’i= V1/V2 установлено, что объем растворившегося газа не
пропорционален корню квадратному из давления. Показатель степени п
лежал между 0,83 и 0,86 и повышался с увеличением содержания танта-
ла в сплаве. Это свидетельствует о двух механизмах растворения: рас-
творение с автомизап.ией водорода и с образованием гидрида ТаН2.
Применяющийся в сталеплавильной, технике тантал не может свя-
зать весь водород в виде гидридов, так как содержание его невелико и
он может находиться в стали в виде химических соединений с другими
элементами, в частности, с углеродом. При охлаждении насыщенного
водородом расплава происходит выделение водорода.
ЖЕЛЕЗО — ВОДОРОД — ТИТАН
Изучали процесс растворения водорода в сплавах железа с 0,18; 0,45;
0,70; 2,67 и 3,41 % (по массе) Ti в интервале температур 1685—1560 °C
и давлений 13—40 гПа, кинетику процесса и возможность образования
гидридов в расплаве железа с титаном [1].
Сплавы для исследования го-
товили из железа, содержавшего
0,02 % Мп и следы углерода, рас-
кисленного небольшими количест-
вами кремния или алюминия. Ти-
тан вводили в виде предваритель-
но переплавленного в вакууме
ферросплава, содержавшего, %
(по массе): 16,3 Ti; 0,04 С; 0,22
А1 Методика эксперимента та же,
что в выше описанной системе же-
лезо -— водород — ниобий.
Из зависимости между объ-
емом растворенного водорода и
давлением рассчитана раствори-
мость водорода при 1685 и 1560 °C
и 29 гПа (рис. 194). Показано, что
объем растворенного газа не про-
порционален корню квадратному
из давления. Показатель степени
Ti, °/о(помассе)
Рис. 194. Растворимость водорода в
сплавах системы Ре—Н—-Ti (сплошные
линии) и количество связанного в гид-
риды водорода (пунктирная линия)
при давлении 2,9 кПа
п в выражении (Л/Р^У./Уг
лежит между 0,53 и 0,72, причем с
повышением содержания титана он увеличивается. Такая зависимость сви-
детельствует о двух механизмах растворения водорода: о растворении с
атомизацией и с образованием гидрида TiH2. Вычислен тепловой эффект
1 Карнаухов М. М., Морозов А. Н. — Изв. АН СССР, ОТН, 1948, № 12,
с. 1845—1855?
197
растворения, составляющий —45,6; —45,6; —36,8 и —23,4 кДж/моль
для сплавов железа с 0,18; 0,45; 0,70 и 3,41 % (по массе) Ti соответст-
венно.
Рассчитано также количество водорода, находящегося в виде гид-
рида при 29 гПа и 1685 °C для каждого сплава (рис. 194, штриховая
линия). Относительное количество связанного водорода невелико и па-
дает с уменьшением содержания титана. Например, в сплаве с 0,45 %
(по массе) Ti связано лишь около 10 % водорода, растворенного в
сплаве.
Применяющийся в сталеплавильной практике титан не может свя-
зать весь водород в виде гидрида.
Amon.ное отношение H/(. Fe + Т i)
Рис. 195. Политермический разрез
FeTi—Н системы Fe—Н—Ti
так как его содержание невелико и
он может находиться в стали в
виде химических соединений с дру-
гими элементами, в частности, с
углеродом. В железотитановых
сплавах водород растворяется мед-
леннее, чем в чистом железе. При
охлаждении насыщенных водоро-
дом сплавов происходит выделе-
ние водорода из жидкого и твер-
дого металла. Скорость выделения
уменьшается с понижением тем-
пературы. Присутствие в стали ти-
тана не задерживает выделения
водорода.
Методом рентгеновского ана-
лиза исследовали [2] политерми-
ческий разрез FeTi—Н системы в
области температур до 70 °C (рис.
195). Обнаружены а-, |3- и у-фазы,
а также две двухфазные области.
Растворимость водорода в a-фазе постоянна ниже 55 °C и увеличи-
вается при повышении температуры. Двухфазная область Р+у появля-
ется при охлаждении сплавов ниже 55 °C и расширяется с понижением
температуры.
Калориметрическим способом определена теплота адсорбции и де-
сорбции водорода для фазы FeTi [3]. Соединение FeTi готовили индук-
ционной плавкой железа и титана высокой чистоты в атмосфере очищен-
ного аргона. Сплав измельчали до получения частиц размером 10 мкм.
Методами микроструктурного, а также рентгеновского флюоресцентного
и дифракционного анализов, растровой электронной микроскопии и
рентгеноспектрального анализа обнаружено присутствие следов
Fe7Tiio03. Построены Р—х-кривые для сплавов Feo.sTio.sHx при 274, 298,
314 и 344 К в интервале концентраций 0<х^1 и на их основе — диаг-
рамма состояния квазибинарного разреза Feo.sTio.s—Н. Обнаружены три
гидридные фазы: а, Р и у.
Рассчитаны термодинамические характеристики сплавов.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Карнаухов М. М., Морозов А. Н.— Изв. АН СССР. ОТН, 1948,
№ 12, с. 1845—1855.
2. Sadrock G. D., Reilly J. J., Johnson J R. — U. S. Dep. Commer. Nat.
Bur. Stand. Spec. Publ., 1978, № 496/1, p. 483—507.
3. Wenzl H„ Lebsanft E.—J. Phys. F.: Metal Phys., 1980, v. 10, № 10,
p. 2147—2156.
198
ЖЕЛЕЗО — ВОДОРОД — УГЛЕРОД
Исследовали [1] растворимость водорода в сплавах железа с 0,03—
0,80 % С (0,05—0,06 % Сг; 0,01—0,03 % Ni; 0,004—0,16 % М!щ 0,007—
0,06 % Si; 0,003—0,03 % S; 0,0022 % Р). Сплавы, полученные в индук-
ционной вакуумной печи, после ковки и
отжига насыщали водородом при темпе-
ратуре 400 °C и давлении водорода
30 МПа. Растворимость водорода опре-
деляли методом быстрого охлаждения
под давлением с последующей вакуум-
ной экстракцией водорода. Показано
(рис. 196), что равновесное содержание
водорода в сплаве железа с 0,8 % С, как
и в техническом железе, достигается за
2—2,5 ч выдержки и практически не ме-
няется в течение 6 ч, а затем количество
поглощенного водорода резко увеличива-
ется, что вызывает межкристаллитное
Рис. 196. Растворимость Н2 в
техническом железе (/) и в
сплаве Fe—0,8 % С (2)
растрескивание.
Определена [2] растворимость водорода (рис. 197) в сплавах с вы-
соким содержанием углерода (стали с 1,18 % С и модифицированный
магнием белый чугун с 3,1 % С и 0,5 % Si). Насыщение водородом про-
водили в специальном устройстве. Для определения растворимости во-
Рис. 197. Растворимость Н2 в сплаве
Fe.—1,18% С (/) и Fe —3,1% С+
+ 0,5 % Si (2)
Рис. 198. Изотермический разрез части
системы Fe—С—Н при 820 °C
дорода в цементите и графите вначале находили интегральную раство-
римость в белом, ковком чугуне и стали, затем проводили расчет по
правилу смешения.
Изотермические разрезы системы в области сплавов, богатых желе-
зом [3], при 1135, 820 и 715 °C приведены на рис. 198. Сплавы, изготов-
ленные из спектрально чистого графита, железа чистотой 99,995 % и
спектрально чистого водорода, изучали методами термического анализа
в специальной установке, позволяющей сочетать высокие температуры
(до 2000°C) с высоким давлением водорода (до 90—100 МПа). Уста-
новлено, что водород снижает температуры эвтектического и эвтектоид-
ного равновесий в системе железо — углерод, уменьшает растворимость
углерода в y-Fe и стабилизирует аустенитную фазу. Растворимость гра-
фита в аустените водород снижает в значительно большей степени, чем
цементит.
199
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Арчаков Ю. И., Шумахер Л. Н.— ЖПХ, 1973, т. 46, № 3, с. 644—646.
2. Шаповалов В. И, —В кн.: Термодинамические свойства металличе-
ских сплавов. Баку: «ЭЛМ», 1975, с. 270—274.
3. Шаповалов В. И., Полторацкий Л. М., Трофименко В. В., Сердюк
Н. П. — Фазовые равновесия в металлических сплавах. М.: Наука,
1981, с. 280—285.
ЖЕЛЕЗО — ВОЛЬФРАМ — КИСЛОРОД
Спеканием в вакууме в интервале температур 1400—1800 °C порошко-
образных оксида железа (I) и вольфрама получен двойной оксид сос-
тава (W, Fe)Ox с 0,2сх<0,5 и отношением атомов металлов, близким к
единице [1]. Рентгеновское исследование в камере типа Гинье показало,
что образуется тройное соединение Fe3WsO со структурой типа ц-кар-
бидов. Определены периоды решетки этого оксида: а = 1,0954-1,097 нм
[2]. Показано, что в этой системе существует также гексагональный ок-
сид (Fe, W)O2 со структурой, родственной структуре моноклинного ок-
сида WO2. Отношение в ней железа к вольфраму точно установить не
удалось. Оно, по-видимому, лежит между 1 : 4 и 1:2. Периоды кристал-
лической решетки: а— 1,146 нм; с=0,4749 нм; с/а=0,415, V=0,4500 нм3;
вероятное число формульных единиц в элементарной ячейке 16.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Schonberg N. — Acta Chem. Scand., 1954, v. 8, № 4, p. 630—632.
2. Schonberg N. — Acta Chem. Scand., 1954, v. 8, № 6, p. 932—936.
ЖЕЛЕЗО — ВОЛЬФРАМ — КОБАЛЬТ
Методом микроструктурного анализа закаленных с разных температур
сплавов (изотермические выдержки не менее 20 ч) исследовали политер-
мические разрезы системы с постоянным содержанием кобальта 5; 8; 10;
15; 20; 25 и 30 % (по массе) и содержанием вольфрама до 25 % (по
массе). Для приготовления сплавов использовали металлы, не содержав-
шие углерода. Термообработку образцов проводили путем многократного
нагрева и охлаждения, что гарантировало равновесность получаемых
структур. Равновесия с участием жидкой фазы приняты по данным [2].
На рис. 199 приведен в качестве наиболее характерного разрез с посто-
янным содержанием кобальта 20 % (по массе). Рентгеновским методом
подтверждены данные [2] о непрерывном ряде твердых растворов меж-
ду двойными соединениями Fe3W2 и WCo (е-фаза). Более подробно при
525—530 °C изучен сплав железа с 30 % (по массе) Со и 17 % (по мас-
се) W [3].
Для определения области твердых растворов на основе железа ис-
пользовали чистые металлы (железо чистотой 99,95 %, вольфрам чисто-
той 99,9 %, кобальт чистотой >99,5 %) и отжиг продолжительностью от
250 ч при 1100 °C до 3000 ч при 700 °C [4]. Полученные методами рент-
геновского и микрорентгеноспектрального анализов результаты в основ-
ном подтвердили данные работы [1], за исключением того, что при низ-
ких температурах в равновесии с железом находится не Е-фаза, а сое-
динение (Fe, Co)2W.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Sykes W. Л — Trans. ASM, 1937, v. 25, р. 953—1012.
2. Koster W., Tonn W.— Arch. Eisenhiittenw., 1931—32, Bd 5, № 8,
S. 431—441.
200
3. Sykes IF.— Trans. ASM, 1943, v. 31, p. 284—303.
4. Ko MusonP, Nishizawa Taiii — J. Jap. Inst. Metals, 1979, v. 43, № 2,
p. 126—135.
ЖЕЛЕЗО — ВОЛЬФРАМ — КРЕМНИЙ
Данные о первом частичном исследовании системы приведены в рабо-
те [1].
Более полное исследование системы во всем интервале концентра-
ций провели в работе [2] с использованием методов рентгеновского и
микроструктурного анализов. Сплавы синтезировали из порошков с со-
держанием основного металла не менее 99,9 %; плавку проводили в пе-
чи Таммана в корундовых тиглях в атмосфере аргона. Образцы, содер-
жавшие более 60 % (ат.) Si, не доводили до плавления и исследовали
в спеченном состоянии. Изучали литые и отоженные при 1000 °C в тече-
ние 350 ч сплавы.
Авторы работы [2] подтвердили установленное ранее [1] существо-
вание двух тройных соединений WFeSi. W2FeSi. Первое соединение пла-
вится конгруэнтно при ~1900 °C, а второе образуется в результате
превращения в твердом состоянии. Соединение WFeSi принадлежит к
структурному типу MgZn2 (а=0,4738 нм, с = 0,7666 нм) и изострук-
турно двойному соединению WFe2. Между фазами WFe2 и WFeSi су-
ществует непрерывный ряд твердых растворов. Соединение W2FeSi(V)
имеет кристаллическую структуру, родственную структуре o’-фазы.
Фазовые равновесия в системе при 1000 °C по данным работы [2]
приведены на рис. 200. Приблизительно определена растворимость ком-
понентов в двойных соединениях: W6Fe? растворяет 5 % (ат.) Si,
201
Fe5Si3—5 % (ат.) W, W5Si3<5 % (ат.) Fe, FeSi<3 % (ат.) W, FeSi2<
<1 % (ат.) W, WSi<3 % (ат.) Fe. Растворимость вольфрама в oc-
твердом растворе железо—кремний уменьшается от 3 до 1 % (ат.) при
увеличении содержания кремния.
В литых сплавах интерметаллические соединения WFe, FesSi3 и
W2FeSi отсутствуют.
Рис. 200. Изотермический разрез системы Fe—W—Si при
1000 °C
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R., Topker Н. — Arch. Eisenhiittenw., 1939, Bd 13, № 7, S.
183—189.
2. Гладышевский E. И., Сколоздра О. В. — ЖНХ, 1964, т. 9, № 10,
с. 2411—2415.
ЖЕЛЕЗО — ВОЛЬФРАМ — МОЛИБДЕН
Сплавы системы исследовали1 методами микроструктурного и микро-
рентгеноспектрального анализов, провели термодинамический расчет по-
ложения фазовых границ в приближении регулярных растворов.
Сплавы готовили из электролитического железа, содержавшего (по
массе): 0,001 % Си; 0,001 %Si, молибден чистотой 99,96 % и вольфрам
чистотой 99,97 %. Сплавы с содержанием 2,5—40 % (ат.) Мо и 5,1—
40 % (ат.) W отжигали при 1373 и 1578 К в течение 720 и 120 ч соог
ветственно и закаливали в воде.
В сплавах, закаленных с 1373 К, обнаружено присутствие следую-
щих фаз: а- и у-твердых растворов на основе железа, ц-фазы — твер-
1 Kirchner G., Harvig Н., Uhrenius В. — Met. Trans., 1973, v. 4, № 4, p. 1059—
1067.
202
дого раствора двойных pi-фаз систем железо—молибден и железо—воль-
фрам. Изотермический разрез при 1373 К приведен на рис. 201.
При 1578 К в равновесии с «-твердым раствором находятся ц-фаза
и тройной твердый раствор на основе высокотемпературной /?-фазы
системы железо—молибден. Установлено наличие трехфазного равнове-
сия аЧ-ц+7?. На изотермическом разрезе при 1578 К показано распре-
деление фазовых областей (рис. 202).
ЖЕЛЕЗО — ВОЛЬФРАМ — НИКЕЛЬ
Микроструктурным и рентгеновским методами определена1 раствори-
мость вольфрама в y(Fe, Ni)-твердом растворе при температурах 1350,
Рис. 203. Изотермы растворимости вольфрама в v-твер-
дом растворе сплавов системы Fe—W—Ni
1250, 1150 и 800 °C для сплавов с отношением (проценты по массе)
Ni : Fe, равным 4 : 1, 7 : 3, 3 : 2, 1 : 1, 2 : 3 и 3 : 7. Сплавы для исследова-
1 Агабабова В. М., Чапорова И. Н — Порошковая металлургия, 1969, № 7,
с. 65—72.
203
ния готовили из порошков вольфрама чистотой 99,74 %, электролити
ческого никеля чистотой 99,8 % и железа чистотой 97,93 % металлоке-
рамическим методом и плавкой в вакуумной печи в тиглях из оксида
алюминия при 1500—1450 °C в среде гелия. Слитки отжигали в водоро-
де при 1350 и 1150 °C, 12 ч, и при 800 °C, и закаливали в воде.
Изотермы растворимости вольфрама в у-твердом растворе системы
при 1350, 1250, 1150 и 800 °C приведены на рис. 203.
ЖЕЛЕЗО — ВОЛЬФРАМ — НИОБИЙ
На основании анализа литературных данных о взаимодействии ниобия
с переходными металлами приведена 1 гипотетическая диаграмма состоя-
ния системы при 1000 °C. На рис. 204 показано распространение двой-
ных фаз в тройную систему.
Рис. 204. Гипотетический изотермический разрез систе-
мы Fe—W—Nb при 1000 °C
ЖЕЛЕЗО — ВОЛЬФРАМ — СЕРА
Сплавы системы изучали 2 методами микроструктурного и термическо-
го анализов. В качестве исходных материалов использовали вольфрам
и триоксид вольфрама, порошок железа с примесями (0,05 % С, 0,28 %
Мп; 0,025 % Р и 0,022 % S) и черенковую серу. Сплавы готовили в пе-
чи Таммана в атмосфере аргона. Использовали графитовые или корун-
довые тигли, а для сплавов с большим содержанием серы применяли
тигли из пифагоровой массы.
Построены политермические разрезы Fe—W2S, FeS—W, FeS—
WS2, FeS—Fe3W2 и разрезы с постоянным содержанием серы 10 и
1 Goldschmidt Н. J. — J. Less-Common Metals, 1960, v. 2, № 2—4, р. 138—153.
2 Vogel R., Weizerkorn H.-H. — Arch, Eisenhiittenw., 1961, Bd. 32, № 6.
S. 413—420.
204
20 % (по массе), а также изотермический разрез Fe —
I cS — WS2 — W при комнатной температуре (рис. 205). В исследо-
ванных сплавах тройных соединений не обнаружено. Область твердого
раствора на основе железа и двухфазные области Fe + FeS, FeS + Fe2W,
FeS + Fe3W2 и FeS + W очень узки и на рисунке не показаны.
Рис. 205. Изотермический разрез системы Fe—W—S при ком-
натной температуре
ЖЕЛЕЗО — ВОЛЬФРАМ — ТИТАН
Сплавы системы исследовали1 методами микроструктурного и терми-
ческого анализов. Исходными материалами служили железо с 0,05 °/о С,
титан чистотой 95 % и чистый вольфрам. Образны готовили в тиглях
Fe3Wz
Рис. 206. Поверхность ликвидус системы Fe—Fe3W—Fe2Ti
1 Vogel R., Ergang R. — Arch. Eisenhiittenw., 1938, Bd. 12, № 3, S. 149—154.
205
из пифагоровой массы в атмосфере аргона. Для сплавов, богатых тита-
ном, тигли футеровали диоксидом титана или нитридом бора.
Построено одиннадцать политермических разрезов и диаграмма
плавкости. Из жидкости в качестве первичных фаз кристаллизуются а-
тверДый раствор на основе железа, твердый раствор интерметаллидов
Fe3W2— Fe2Ti(V) и тройной вольфрамовый твердый раствор, содержа-
щий 98—99 % (по массе) W. В твердом состоянии диаграмма состоит
из полей а- и V-фаз и двухфазной области между ними.
На рис. 206 показана проекция поверхности ликвидус в системе Fe—
Fe3W2—Fe2Ti. По линии ei£2 протекает реакция ж^а + V, а по линии
рр', имеющей минимум, проходит перитектическая реакция ж+Ж^К
Тонкими линиями показаны изотермы солидус. Штриховой линией про-
ведены границы a-фазы при различных температурах, а линия аб
показывает растворимость компонентов в железе при температуре соли-
дуса.
Следует отметить, что авторы работы считали взаимодействие в
сплавах, богатых железом, эвтектическим. В настоящее время на осно-
вании изучения двухкомпонентной системы Fe—W этому взаимодейст-
вию приписывают перитектический характер.
ЖЕЛЕЗО — ВОЛЬФРАМ — УГЛЕРОД
Проведено подробное исследование сплавов системы методами микро-
структурного и рентгеновского анализов [1]. В качестве шихтовых мате-
риалов использовали порошки вольфрама чистотой 99,9 %, железа чи-
стотой 99,4 % и графит чистотой 99,94 %. Сплавы изготавливали ме-
тодом порошковой металлургии с последующим переплавом спеченных
Рис. 207. Изотермический разрез системы Fe—W—С при 1000 °C
брикетов в дуговой печи в атмосфере аргона Сплавы отжигали в от-
качанных кварцевых ампулах при 1200 Х, 30 ч, и при 1000 °C, 200 ч.
Построен изотермический разрез системы при 1000 °C (рис. 207).
При этих условиях в сплавах существуют три тройных соединения:
два тркарбида составов Fe6W6C(Mi2C), Fe3W3C(M6C) и карбид FeW.;C.
Разрез Fe—WC квазибинарный. Карбид М6С находится в равновесии
206
c y-Fe, WC, M12C, FeW3C; карбид M12C — c y-Fe, Fe3W, W, M6C; карбид
FeW3C— c WC, W2C, W, M6C. Карбиды Mi2C и M6C обладают кубичес-
кой решеткой (a = 1,0596-f 1,0598 нм и 1,1102-е-1,1146 нм соответствен-
но) ; периоды их решеток возрастают при увеличении содержания воль-
фрама. При исследовании тркарбидов в системе Fe — W — С при
1250 °C установлено [2], что с повышением содержания вольфрама
период решетки карбида (Fe, W)3C увеличивается, а карбида
(Fe, W) 12С — уменьшается. Карбид FeW3C имеет гексагональную ре-
шетку с периодом а=с—0,7806—0,7810 нм.
Исследовали сплавы системы при 900, 1000 и 1100 °C методом оп-
ределения активности углерода в зависимости от его содержания [3].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Pollok С. В., Sdadelmaier Н. Н.—Met. Trans., 1970, v. 1, № 4,
ра 767—770.
2. Brandis Н., Preisendanz Н., Schiller Р. — Thyssen Edelstahl Techn.,
Ber., 1980, v. 6, № 2, p. 155—467.
3. Bergstrom M. — Mater. Sci. a. Eng., 1977, v. 27, № 3, p. 257—269.
ЖЕЛЕЗО — ВОЛЬФРАМ — ФОСФОР
Сплавы системы исследовали методами микроструктурного и термиче-
ского анализов в области Fe—Fe2P—WP—W [1]. Сплавы готовили
в печи Таммана из электролитического железа, вольфрамовой проволо-
ки и красного фосфора в тиглях из пифагоровой массы или корундо-
вых. Тигель с железом нагревали примерно до 1100 °C и добавляли ли-
гатуру железо — фосфор. В расплав вводили вольфрам.
W, % (пО массе)
Ге2Р
20
75
ю
WP
Fe3P+Fe?p+WP
Fe 10 20 30 40 50 Fe2W Fe3w2 gp дд W
W, % (no массе)
d + Fe3P.+WP
cY+FeyW+WP
Fe3P+a
FezW2 + Fe3W2+WB
Рис. 208. Поверхность ликвидус системы Fe—W—Р (a) и
изотермический разрез части системы Fe—W—Р при комнат-
ной температуре (б)
.a + FezW
l r-—r
Fe3W2+
WP + W
207
В системе не обнаружено образования тройных соединений. Па
основании изучения пяти политермических разрезов построена проекция
поверхности ликвидус (рис. 208, а). Она состоит из пяти областей пер-
вичного выделения фаз a-Fe, Fe3P, Fe2P, WP и Fe3W2. Фаза Fe2W обра-
зуется по перитектоидной реакции и на рисунке отсутствует. В точках
(состав по массе) pi (53,5 % Fe; 10,5 % Р; 36,0 % W), р2 (39,5 % Fe;
8,5 % Р; 52 % W) и рз (31 % Fe; 8 % Р; 61 % W) происходят нонвари-
антные перитектические реакции JK + Fc2P=<^Fe3P-t-WP при 1033 °C, ж+
+ Fe3W24^Fe-]-WP при 1105 "’С и ж +W=<=tFe3W2 + WP при 1144 °C соот-
ветственно. Кристаллизация сплавов заканчивается в эвтектической
точке Е [49,5 % (по массе) Fe; 8,5 % (по массе) Р, 42 % (по массе) W]
при 971 °C по реакции ж^Ее+ЕезР+WP.
Фазовые равновесия при комнатной температуре показаны на
рис. 208, б. Установлено существование пяти трехсЬазных областей:
Fe3P + Fe2P+WP, a+Fe3P+WP, a + Fe2W+WP, Fe2W+Fe3W2+WP и
Fe3W2+WP + W. Эти области разделены столь узкими двухфазными об-
ластями, что последние на рисунке не показаны.
Термическим расчетом [2] из значений свободных энергий образо-
вания фосфидов определена граница a-твердого раствора на основе
железа, равновесного с WP. Эта зависимость в координатах 1g Мр—
Ig (где Ni — мольная доля i-того компонента) представляет со-
бой прямую линию.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Schneider R., Vogel R.— Arch. Eisenhiittenw., 1955, Bd 26, № 8,
S. 483—490.
2. Шварцман Л. А.. Емельяненко Л. П., Ульянов В. И. — Изв. АП
СССР. Металлы, 1979, № 1, с. 69—72.
ЖЕЛЕЗО — ВОЛЬФРАМ — ХРОМ
Исследовали [1] сплавы системы, богатые хромом [40 % (по массе) W
и 55 % (по массе) Сг], методами микроструктурного, рентгеновского и
термического анализов, а также проводили измерение мнкротвердости
и твердости.
Рис. 209. Изотермические разрезы системы Fe—W—Сг при 2000 (а)
и 1375 К (б)
20Б
Расчетным путем построены [2] изотермические разрезы системы
но всей области концентраций при 2000, 1725, 1550 и 1375К. Расчет вы-
полняли с использованием данных по двойным системам, образующим
данную тройную. На рис. 209 приведены изотермические разрезы при
2000 и 1375К-
ВИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Алфинцева Р. А., Дмитриева Г. П., Коробейникова В. Г. и др. — На-
учи. тр./Ин-т металлофизики АН УССР, 1964, № 20, с. 108—124.
2. Kaufman L., Nesor И. —Met. Trans., 1975, v. A6, № 11, p. 2123—2131.
ЖЕЛЕЗО — ВОЛЬФРАМ — ЦИНК
Исследовали1 возможность получения тройных сплавов. Непосредст-
венное сплавление этих металлов провести нельзя из-за высокого дав-
ления пара цинка. Выплавляли сплав при температуре 1100 °C, 4 ч, в
закрытом железном тигле, в который слоями были уложены вольфра-
мовый порошок и цинк. Исследования проводили методами микрострук-
турного, микрорентгеноспектрального и микродюрометрического анали-
зов. Обнаружены двойные соединения систем железо — цинк и желе-
зо — вольфрам, чистый вольфрам и тройная фаза, содержащая по
данным микрорентгеноспектрального анализа 36 % (по массе) Fe, 57 %
(по массе) W и 5 % (по массе) Zn.
ЖЕЛЕЗО — ГАДОЛИНИЙ — УГЛЕРОД
Исследовали 2 6 двойных и 132 тройных сплавов, изготовляемых в элек-
тродуговой печи в атмосфере очищенного аргона из материалов высо-
кой чистоты [графита (99,94 %), электролитического железа (99,99 %)
Рис. 210. Поверхность ликвидус части системы Fe—С—Cd
и гадолиния в слитке (99,9 %)]. Для приведения в равновесное состоя-
ние сплавы отжигали в откачанных кварцевых ампулах при 900±10°С
1 Matting Habel A., Kruger U. — Metall, 1968, Bd. 22, № 10, S. 992—994.
2 Stadelmaier H. H., Park H. K. — Z. Metallkde, 1981, Bd. 72, № 6, S. 417—422.
209
в течение 300 ч и закаливали в воде. Сплавы системы исследовали ме-
тодами микроструктурного, микрорентгеноспектрального и рентгеновско-
го анализов.
Построены проекция поверхности ликвидус (рис. 210) и изотерми-
ческий разрез при 900 °C (рис. 211).
В сплавах системы обнаружено шесть тройных карбидных фаз, из
которых только FeGdC плавится конгруэнтно (рис. 210). Нонвариант-
ные точки, отвечающие составам жидкой фазы, принимающей участие
в четырехфазных равновесиях, приведены ниже:
Рис. 211. Изотермический разрез системы Fe—Gd—С при
900 °C
1 — ж + СбС2^±РезС + Ре40б4С7 (метастабильное перитектическое
равновесие) или ж+С1НС2=ё*Ге4,Об4С7-|-С (стабильное равновесие);
2 — ж^у-Ре + РечОсЦСуЧ-РезС + С (метастабильное эвтектическое
равновесие) или жч=^у-Ре + Ре40с14С7+С (стабильное равновесие);
3 — ж + Ре4Об4С7=<^у-Ге4-Ре2Сб2Сз;
4 — ж + Ре2Сс12Сзч=±у-Ре+ОНС;
5 — ж^у-Ре+Са2С3-г FeGdC;
6 — ж + у-Ре^±Ре17Сй2 + РеОбС;
7 — жЧ-Ре17Ойч=ьРе^ОбЧ-РеОбС;
8 — ж=?*Рез|ОйЧ-FeGdC H-Gd3C;
9 — ж + C=<=fcFe3C^-Gd2C (равновесие, существование которого про-
блематично) ;
10 — ж+Об2Сч^Ре4Об4С7Ч-Об2С3;
11 — ж + Ре^4С7^Ге^12Сз+^с12Сз.
Штриховые моновариантные кривые в области сплавов, богатых
железом, связаны с метастабильными равновесиями в системе желе-
зо-цементит. Арабскими цифрами на рис. 211 обозначены шесть трой-
ных карбидов, характеристика которых приведена ниже:
210
Цифры на рис. Карбид Тип структуры Кристалли- ческая решет- ка Периоды, нм
а С
1 Fe20Gd3C Pu3Zn22(?) Тетраг. 0,876 1,181
2 Fe31Gd4C Th2Zn17 Ромбоэдр. 0,8647 1,2461
3 FeGdC FeTaSi или Fe4Ta4Si7 Гекс. 0,912 0,597
4 Fe2Gd2C2 Mn^AlB? Орторомб. 0,3678* 1,45
5 re2Gd2C3 — Гекс. 0,8388 1,260
6 Fe4Gd4C7 — Тетраг. 0,7045 1,023
* £=0,2995.
Гадолиний оказывает сфероидизирующее действие на включение
графита в железоуглеродистых сплавах.
ЖЕЛЕЗО — ГАЛЛИЙ — МЫШЬЯК
Диаграмма состояния системы изучена1 мало. Имеются сведения по
расчету кривой солидус разреза Fe—GaAs. Максимальная раствори-
мость железа в GaAs при 1150°C равна 3,38’1018 см-3.
ЖЕЛЕЗО — ГАФНИЙ — НИОБИЙ
Диаграмма состояния системы изучена2 мало. Приведен изотермиче-
ский разрез при 1000 °C, построенный по данным о двойных системах.
В равновесии с твердым раствором на основе железа находятся фазы
£i и L3. Эти фазы являются фазами Лавеса с кубической решеткой
типа MgCu2—Li и с гексагональной решеткой типа MgZn2—А3.
ЖЕЛЕЗО — ГАФНИЙ — УГЛЕРОД
Сплавы системы исследованы методами термического, дилатометри-
ческого, рентгеновского и микроструктурного анализов [1, 2]. В каче-
стве шихтовых материалов для сплавов системы [1] использовали
гафний иодидный, железо электролитическое, графит спектрально
чистый. Сплавы получали расплавлением шихты в дуговой печи в
атмосфере аргона четырех—пяти-кратным переплавом; гомогенизиро-
1 Кузнецова С. К. — Изв. АН СССР. Неорг. материалы, 1975, т. 11, № 5,
1
2 Goldschmidt Н. Y.—J. Less-Common Metals, 1960, v. 2, № 2—4, р. 138—153.
211
Hf, % (no пассе)
Рис. 212. Политермические разрезы системы Fe—Hf—С с содержанием
углерода 0,25 (а), 0,55 (б); 1,15 (в) и 1,65 % (по массе) (г)
0,5 1,0 1,5 О 0,5 1,0 1,5 2,0 2,5
С, % (помассе)
Рис. 213. Политермические разрезы системы Fe—Hf—С с содержа-
нием гафния 0,9 (а), 4 (б), Ю (с) и 20 % (по массе) (г)
вали сплавы, содержащие до 0,5 % (по массе) С и до 5 % (по мас-
се) Hf при 1250—1300° С, остальные — при 1100 ° С.
Построены политермические разрезы системы при постоянном со-
держании углерода (и переменном гафния) (рис. 212) и постоянном
содержании гафния (и переменном углерода) (рис. 213). При малом
содержании углерода образуется соединение Fe2Hf (е-фаза). В систе-
ме присутствует также карбид HfC(K). Перитектоидные равновесия
212
а + РеаС(Ц)ч=^у + К и ссЧ-К^Т+е про-
никают при 735 и 920 °C соответственно.
Исследовали [2] политермический
разрез Fe—HfC (рис. 214) системы.
В качестве шихтовых материалов ис-
пользовали карбонильное железо, иодид-
пый гафний и спектралъночистый графит.
С плавы железа с содержанием от 1,6 до
41 % (по массе) HfC выплавляли в элек-
гродуговой печи с нерасходуемым воль-
фрамовым электродом на медном водо-
охлаждаемом поду в атмосфере аргона.
Исследовали сплавы в литом состоянии
после отжига при 1100 °C в течение 20 ч.
Разрез Fe—HfC квазибинарный эвтекти-
ческого типа. Эвтектический сплав со-
держит 6,0 % (по массе) HfC, эвтектика
кристаллизуется при 1490 °C, карбидная
эвтектика представляет собой преиму-
щественно пластинчатые колонии. Пер-
вичные кристаллы карбидов гафния с
железом могут быть кубической и ден-
дритной формы.
HfC, % (пол.)
Рис. 214. Политермический раз-
рез Fe—HfC системы Fe—Hf—С
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Свечников В. Н., Шурин А. К. — Науч. тр./Ин-т металлофизики АН
УССР. Киев: 1962, № 16, с. 124—127.
2. Шурин А. К., Дмитриева Г. /7. — МиТОМ, 1974, № 8, с. 27—28.
ЖЕЛЕЗО — ГАФНИЙ — ЦИРКОНИЙ
Сплавы системы исследовали1 методами микроструктурного, рентге-
новского и термического анализов. Для приготовления сплавов исполь-
зовали карбонильное железо марки
ВЗ, гафний чистотой 99,9 % и иодид-
ный цирконий чистотой 99,96 %.
Плавку проводили в дуговой печи в
атмосфере аргона. Одну часть образ-
цов отжигали в откачанных ампулах
при 900 °C, 200 ч. Другую часть об-
разцов отжигали при 1340, 1450 и
1500 °C в течение 1 ч, затем подвер-
гали закалке.
Построен политермический раз-
рез HfFe2—ZrFe2 (рис. 215). Разрез
квазибинарный с перитектическим
характером взаимодействия соедине-
ний. Соединение ZrFe2 имеет широ-
кую область гомогенности. Раствори-
1 Свечников В. Н., Маркие В. Я.,
Петьков В. В.—Металлофизика: Республ.
межведомств, сб., Киев: Наукова думка,
1972, вып. 40, с. 95—97.
Рис. 215. Политермический разрез
HfFe?—ZrFes системы Fe—Hf—Zr
213
мость гафния в ZrFe2 составляет 21 % (ат.), при 1500°C и 18 % (ат.)
при 900 °C.
ЖЕЛЕЗО — ГЕРМАНИЙ — КОБАЛЬТ
Сплавы системы исследовали методами микроструктурного, диффе-
ренциального, термического анализов, а также проводили измерение
микротвердости [1, 2]. Приведены сведения о политермических разре-
зах Co2Ge—FeGe2 [1] и Co5Ge3—Fe5Ge3 [2]. В качестве шихтовых ма-
териалов использовали железо карбонильное, отожженное в вакууме,
кобальт чистотой 99,99 % и монокристаллический германий. Сплавы
готовили в индукционной печи в атмосфере гелия, отжигали в отка-
чанных кварцевых ампулах.
Разрез Co2Ge—FeGe2 (рис. 216, а) квазибинарный с эвтектическим
характером взаимодействия. В соединении Co2Ge растворяется до
50 % (мол.) FeGe2. Разрез Co5Ge3—Fe5Ge3 (рис. 216, б) также квази-
бинарный с непрерывным рядом твердых растворов.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Пантелеймонов Л А.. Петрушкова О. С. — Вестник МГУ, Химия,
1973, т. 14, № 6, с. 736—738.
2. Пантелеймонов Л. А., Петрушкова О. С. — Вестник МГУ, Химия,
1974, т. 15, № 4, с. 495—496.
ЖЕЛЕЗО — ГЕРМАНИЙ — НИКЕЛЬ
Исследовали сплавы системы методами микроструктурного, термичес-
кого анализов, проводили измерение микротвердости [1—3]. По дан-
ным работ [1, 2] построены политермические разрезы FeGe2—NiGe2 и
FesGe3—Ni3Ge3. Для приготовления сплавов использовали карбониль-
ное железо, отожженное в вакууме, монокристаллический германий и
никель чистотой 99,99 %. Сплавы готовили в индукционной печи в
атмосфере гелия, а отжиг проводили в откачанных кварцевых ампу-
лах. Разрез FeGe2—NiGe2 квазибинарный эвтектического типа (рис
217, а). В соединении NiGe2 при 400°C растворяется —50 % (моль)
FeGe2. Разрез FesGe3—Ni5Ge3 также квазибинарный, но характеризу-
ется образованием непрерывного ряда твердых растворов с полной
взаимной растворимостью в жидком и твердом состояниях (рис.
217, б).
214
Приведен политермический разрез Fe3Ge—Ni3Ge [3]. Максималь-
ная растворимость никеля в твердом состоянии в фазе в—Fe3Ge со-
ставляет 6% (ат.). При температурах ниже 973 К фазы Ni3Ge и
е—Fe3Ge образуют непрерывный ряд твердых растворов. Обе эти
фазы изоморфны. Они имеют структуру типа Ll2, решетка гране-
центрированная с периодами а = 0,357 нм и ц=0,367 нм соответст-
венно.
БИБЛИОГРАФИЧЕСКИЙ
СПИСОК
1. Пантелеймонов Л. А.,
Петрушкова О. С. — Вест-
ник МГУ. Химия, 1973,
т. 14, № 16, с. 737—738.
2. Пантелеймонов Л. А., Пет-
рушкова О. С. — Вестник
МГУ. Химия, 1974, т. 15,
№ 4, с. 495—496.
3. Tomoo S., Yoshihiro О.,
Dang-Moon W. — Acta
Met., 1980, v. 28, Ke 3,
p. 301—310.
ЖЕЛЕЗО —
ГЕРМАНИЙ — СЕРА
Сплавы системы исследова-
ли методами термического,
химического и рентгеновско-
го анализов [1, 2]. Имеются
сведения о разрезах FeS—
GeS и Ge—FeS. Для приго-
товления сплавов использо-
вали сульфид железа соста-
ва 63,37 % (по массе) Fe и
Рис. 218. Политермические
разрезы FeS—Ge (а) и FeS—GeS
(б)
215
36,6 % (по массе) S, полученный сплавлением порошкообразного железа,
восстановленного водородом с элементарной серой чистотой 99,99 %.
Смесь в стехиометрическом соотношении помещали в откачанную до
133,3 МПа ампулу и нагревали при 500—600 "’С. Моносульфид германия
69,8 % (по массе) Ge и 30,15 % (по массе) S получали сплавлением
монокристаллического германия и серы в откачанной кварцевой ампуле
при 1000 °C.
Политермический разрез FeS—Ge (рис. 218, а) эвтектического
типа, эвтектическая точка лежит при 800 ° С и 94 % (по массе) Ge.
Политермический разрез FeS—GeS квазибинарный, эвтектика кристал-
лизуется при 600 ° С и 6 % (по массе) FeS; при 590 и 312 ° С проте-
кают полиморфные превращения фаз GeS и FeS соответственно.
В сплавах разреза обнаружено неустойчивое соединение, ориентиро-
вочная формула которого GeS-llFeS. Это соединение плавится инко-
груэнтно при 710 ° С.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Чижиков Д. М., Никифоров Л. В., Лайнер Ю. А. — Изв. АН СССР
Неорган. материалы, 1969, т. 5, № 2, с. 290—294.
2. Чижиков Д. М„ Лайнер Ю. А., Никифоров Л. В. — В кн.: Исследо-
вания в металлургии цветных и редких металлов. М.: Наука, 1969,
с. 71—73.
ЖЕЛЕЗО — ГЕРМАНИЙ — СЕРЕБРО
Сплавы системы изучены1 частично химическими методами исследова-
ния. Для приготовления сплавов использовали железо чистотой
99,99 %, германий монокристаллический и серебро чистотой 99,9 %.
Рис. 219. Изотермический разрез части системы Fe—Ge—
Ag при 1550 °C
На рис. 219 приведена часть изотермического разреза системы при
15500 С. Показано положение области несмешиваемости при этой
температуре. Наблюдается увеличение взаимной растворимости желе-
за и серебра в присутствии германия.
ЖЕЛЕЗО — ЗОЛОТО — КОБАЛЬТ
В литературе имеется сообщение2 о растворимости золота в сплавах
системы, богатых кобальтом.
1 Иванова В. Д., Бурылев Б. П. — Изв. АН СССР. Металлы, 1972, № Б,
с. 167—168.
2 Lynch L„ Krauss G. Venkatesan P. S. — Met. Trans.. 1970, v. 1, № 5, p. 1471 —
1472.
216
8—358
217
ЖЕЛЕЗО — ЗОЛОТО — НИКЕЛЬ
Сплавы системы исследовали1 методами термического, микроструктур-
ного, рентгеновского, дилатометрического анализов, измерением элект-
Рис. 222. Р—Т диаграмма спла-
ва состава, % (ат.): 50 Fe, 46
Rh и 41г системы Fe—Ir—Rh
росопротивления, твердости и магнит-
ных характеристик. Для приготовления
сплавов использовали армко-железо, ни-
кель и золото, чистота которых не ука-
зана. Сплавы выплавляли в атмосфере
аргона. Построили поверхность ликвидус
и изотермический разрез системы при
20 СС (рис. 220 и 221). Приведено прост-
ранственное изображение диаграммы со-
стояния; подробно исследованы свойст-
ва сплавов, особенно богатых золотом.
ЖЕЛЕЗО — ИРИДИЙ —
РОДИЙ
В литературе 1 2 имеются сведения о диа-
грамме давление—температура для спла-
ва 50 % (ат.) Fe, 46 % (ат.) Rh и 4 %
(ат.) 1г. Тройная точка для ферро-, па-
ра- и антимагнитных фаз «ф, ап «эф рас-
положена при 327 °C и давлении 3 ГПа
(рис. 222).
ЖЕЛЕЗО — ИТТРИЙ — МАРГАНЕЦ
Сплавы системы исследовали3 методом рентгеновского анализа. При-
ведены некоторые данные, относящиеся к разрезам YeFe23—УбМп23 и
YFe2—YMn2. Для приготовления сплавов использовали иттрий чисто-
той 99,9 %, электролитические марганец чистотой 99,9 % и железо
чистотой 99,9, %• Показано, что сплавы этих разрезов образуют не-
прерывные ряды твердых растворов Y6(Fe, Мп)23 и Y(Fc, Мп)2 со
структурами типа ThcMn23 и MgCu2 соответственно. Периоды кристал-
лических решеток (а) соединений Y6Fe23 и YeMn23 изменяются от 1,21
и до 1,242 нм, а соединений YFe2 и YMn2 — от 0,735 до 0,765 нм.
ЖЕЛЕЗО — ИТТРИЙ — РУТЕНИЙ
Сплавы системы исследовали методами микроструктурного, рентге-
новского и микрорентгеноспсктрального анализов [1, 2]. Для приготовле-
ния сплавов использовали железо чистотой 99,95 %, иттрий чистотой
99,63 % и рутений чистотой 99,82 %• Плавку проводили в дуговой
печи с нерасходуемым вольфрамовым электродом в атмосфере очи-
щенного гелия; отжигали сплавы при 600 ° С.
Построен изотермический разрез системы при 600 ° С (рис. 223).
В сплавах не обнаружено тройных промежуточных соединений. Двойные
соединения YFe2, YRu2, Y2Fei7 и YFe3 образуют широкие области твер-
дых растворов, располагающиеся вдоль изоконцентрат с постоянным
содержанием иттрия 33,3; 10,5 и 25 % (ат.). Растворимость рутения
1 Koster W., Ulrich W.—Z. Metallkunde, 1961, Bd. 52, № 6, S. 383—391.
« Leger J.-M., Susse C., Vogar B.—C. r. Acad. Sci., 1967, C. 265, № 17, p. 892—895.
3 Kirchmayr H. R. — Monatshefte fiir Chemie, 1966, Bd. 97, № 6, S. 1587—1589
218
Рис. 223. Изотермический разрез системы Fe—Y—Ru при 600 °C
в фазе YFe2 при 600 ° С составляет 46 % (ат.) [1] или 40 % (ат.) [2].
Растворимость железа в фазе YRu2 достигает 10 % (ат.). Раствори-
мость рутения в фазе YFe3 и Y2Fei7 составляет соответственно 3 и
12% (ат.).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Толкунова Е. Ф„ Бурнашова В. В., Раевская М. В., Соколовская
Е. М. — Вестник МГУ. Химия, 1974, т. 15, № 5, с. 559—562.
2. Толкунова Е. Ф., Бурнашова В. В., Раевская М. В., Соколовская
Е. М. — Металлофизика: Рссп. межведомственный сб. Киев: Науко-
ва думка, 1974, вып. 52, с. 109—111.
ЖЕЛЕЗО — ИТТРИЙ — САМАРИЙ1
Сплавы системы исследовали1 методом рентгеновского анализа. Для
приготовления сплавов использовали карбонильное железо чистотой
99,96 %, самарий чистотой 97,7 % и иттрий чистотой 99,9 %. Сплавы
получали в электродуговой печи в атмосфере очищенного аргона. От-
жиг проводили в кварцевых ампулах при температуре 600 ° С, 144 ч.
Часть образцов, богатых железом, предварительно отжигали при
1000 ° С, 168 ч. Построен изотермический разрез системы при
600 ° С (рис. 224). В системе не обнаружено тройных промежуточных
1 Кошель О. С., Бодак О. И., Черкашин Е. Е. — ДАН УССР, 1976, Сер. А,
№ 5, с. 452—456.
8* 219
Рис. 224. Изотермический разрез системы Fe—Y—Sm при 600 °C
соединений. Обнаружены непрерывные твердые растворы между соеди-
нениями Y2Fei7—Sm2Yi7_x, YFe3—SmFe3 и YFe2—SmFe2.
ЖЕЛЕЗО — ИТТРИЙ — ХРОМ
Исследовали1 диаграмму состояния системы. Построены изотермические
разрезы системы при 1250, 1100, 900 и 600 ° С в области сплавов,
богатых железом; один из разрезов при 900 ° С приведен на рис. 225.
В изученной части системы не обнаружено тройных соединений.
Рис. 225. Изотермический разрез части системы Fe—Y—Сг при 900 °C
1 Гшнейднер К. А.—Сплавы редкоземельных металлов. М.: Мир, 1965. 427 с.
220
ЖЕЛЕЗО — КАЛЬЦИЙ — КРЕМНИЙ
Сплавы системы исследовали методами микроструктурного и терми-
ческого анализа [1—3]. Наиболее полно диаграмма системы рассмот-
рена в работе [1], в которой полностью построены поверхность лик-
видус системы, а также ряд политермических разрезов.
На рис. 226 изображена поверхность ликвидус системы.
Рис. 226. Поверхность ликвидус системы Fe—Са—Si
Двойные сплавы системы железо — кальций характеризуются об-
разованием широкой области несмешиваемости расплавов на основе
железа и кальция. Эта область со стороны системы железо — кальций
глубоко проникает в тройную систему. Координаты точек кристаллиза-
221
ции тройных эвтектик, перитектик, критических точек и некоторых
других на проекции поверхности ликвидус приведены ниже:
Обозначение точек Состав, % (по массе) Температура, °C Обозначение точек Состав, % (по массе) Температура, °C
Fe Si Са Fe Si Са
Ei 0,2 4,1 95,7 (763) ж3 3,4 25,4 71,2 (1295)
Ру 87,3 12,4 0,3 1268 мл 82,5 16,4 1,1 (1395)
Ez 81,2 18,4 0,4 1173 м5 80,2 19,4 0,4 1200
Р2 81,7 18,9 0,4 1184 S1 13,8 41,9 44,3 1280
Е3 79,3 20,3 0,4 1183 <$2 60,2 32,0 7,8 1280
Р3 3,2 59,3 37,5 1023 S3 4,6 29,6 65,8 1242
Е. 2,2 61,1 36,7 1015 s4 78,9 19,5 1,6 1242
Р< 2,9 60,4 36,7 1017 S5 2,0 19,9 78,1 1285
К 34,9 42,6 22,5 1340 S6 88,2 11,3 0,5 1285
Mi 10,0 39,1 50, у 1290 IF, 26,8 60,3 12,9 1170
м2 67,2 28,0 4,8 1290 W2 80,8 18,7 0,5 1200
На рис. 227 приведен политермический разрез системы, проходя-
щей через интерметаллические соединения CaSi и FeSi, а на рис.
228 — политермический разрез от чистого кремния к стороне каль-
ций — железо при соотношении этих двух компонентов, равном 4 : 1.
Рис. 227. Политермический разрез CaSi—FeSi системы Fe—Са—Si
Определено положение критической точки на кривой расслоения
жидких фаз в тройной системе: 33 % Fe, 33 % Са, 34 % Si [2, 3].
Авторы указанных работ считают, что разрез CaSi—FeSi квазибинар-
ный.
222
Рис. 228. Политермический разрез Si—(Ca;Fe--4:l) систе-
мы Fe—Са—Si
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1 Schilztnann Е., Litterschneidl И., Funders Р. — Arch. Eisenhiittenw.,
1975, Bd 46, № 7, S. 427—432.
2. Ototani. T., Kataura Y. — J. Jap. Inst, metals, 1968, v. 32, № 5,
p. 458—463.
3. Ototani T., Kataura Y. — Sci. Repts Res. Inst. Tohoku Unev., 1969,
A21, № 2, p. 69—82.
ЖЕЛЕЗО — КАЛЬЦИЙ — СЕРА
Методами микроструктурного и термического анализов исследовали
сплавы системы в области составов Ее—FeS—CaS—Fe [1]. Железо и
кальций не взаи?лодействуют в жидком состоянии, образуя широкую
область несмешиваемости растворов, глубоко проникающую в тройную
систему.
На рис. 229 граница этой области проходит через точки fi, fa, К,
g2, gi, асимптотически приближаясь к разрезу FeS—CaS. Критичес-
Рис. 229. Поверхность ликвидус части системы Fe—Са—S
223
Рис. 230. Политермический раз-
рез FeS—CaS системы Fe—Са—S
кая точка несмешиваемости К распола-
гается при 1800 °C, при этой же темпе-
ратуре в точке Е кристаллизуется вы-
рожденная тройная эвтектика.
На рис. 230 приведен политермиче-
ский квазибинарный разрез FeS—CaS
эвтектического типа; температура крис-
таллизации эвтектики 1120 °C при 20 %
CaS. Значительной растворимости одно-
го сульфида в другом не обнаружено.
Температура плавления сульфида CaS
определена равной ~2450 °C. Показано,
что при эвтектической температуре в CaS
растворяется до 2 % FeS [2].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R., Неитапп Т. — Arch. Eisen-
hiittenw., 1941/42, Bd 15, № 4m, S.
195—199.
2. Heumann T. — Arch. Eisenhiittenw.,
1941/42, Bd 15, № 12, S. 557 - 558.
ЖЕЛЕЗО — КАЛЬЦИЙ — ФОСФОР
Сплавы системы исследовали1 методом термического анализа. Сплавы
готовили из лигатуры железо — фосфор в специальных тиглях в ат-
мосфере аргона. После расплавления лигатуры вводили кальций.
На рис. 231 приведена проекция изученной части диаграммы со-
стояния. Штриховой линией нанесена область несмешиваемости двух
жидких растворов на основе железа и кальция, которая проникает в
тройную систему со стороны двойной системы железо — кальций. Эта
область расслоения не достигает квазибинарного разреза Fe2P—Са3Р2,
фазовое строение сплавов этого разреза показано на рис. 232. При
1275 ° С кристаллизуется эвтектика ГегР + СазРг; эвтектическая точка
расположена при 8,5 % Са; 23 % Р и 68,5 % Fe или 12,9 % Са3Р2 и
87,1 Fe2P (по массе).
ЖЕЛЕЗО — КИСЛОРОД — КОБАЛЬТ
Фазовая диаграмма системы1 при 900 ° С приведена на рис. 233.
Двухфазная область, в которой присутствуют гематит и шпинель,
существует при более высоких температурах и ее граница с увеличе-
нием содержания кобальта смещается в сторону больших давлений
кислорода. Исследована фаза СоО Гематитовая фаза присутствует в
образцах, богатых железом.
Границы фаз определяли по изменению давления кислорода в
запаянной трубке; исследование выполнено рентгеновским методом.
Рис. 233. Фазовая диаграмма системы Рис. 234. Комодное равновесие в спла-
Fe—Со—О при 900 °C вах системы Fe—О—Si
ЖЕЛЕЗО — КИСЛОРОД — КРЕМНИЙ
Изучали2 влияние кремния на растворимость кислорода в жидком и
твердом б-Fe, а также определяли коэффициент распределения
кислорода между жидкой и твердой фазами в условиях равнове-
сия. Для этой цели тигли с расплавом медленно охлаждали в печи
Таммана в атмосфере аргона. Исходными материалами при изготов
лении сплавов служили электролитическое железо, металлический
кремний чистотой свыше 98 %. Кислород вводили в виде диоксида
кремния. На рис. 234 изображены составы жидких и твердых фаз,
находящихся в равновесии.
1 Phase diagram in iron — cobalt — oxyden system. Experimental Study, Jiola
Shuichi, 1956.
№ 11. p 153.
2 Фудзидзава T., Немура M., Сакао X. — J. Japan, Inst- Metals., 19/7, v. 63,
225
Fe 0,2 0,0 0,6 0,8 1,0 1,2 1,0 1,6
Мп, % (am.)
Рис. 235. Поверхность ликвидус части системы Fe—О—Мп
ЖЕЛЕЗО — КИСЛОРОД — МАРГАНЕЦ
Изучали [1,2] влияние марганца на растворимость кислорода в жидком и
твердом б-Fe, а также определили коэффициент распределения кисло-
Mn,%[Z7/77J
Рис. 236. Комодное равновесие в сплавах
системы Fe—О—Мп
рода между жидкой и твердой
фазами в условиях равновесия.
Для этой цели тигли с распла-
вом медленно охлаждали в пе-
чи Таммана в атмосфере арго-
на. Исходными материалами
для изготовления сплавов слу-
жили электролитическое желе-
зо, электролитический марганец
чистотой свыше 99,9 %; кисло-
род вводили в виде оксида мар-
ганца.
На рис. 235 изображена
поверхность ликвидус изучен-
ной части системы в виде про-
екции изотерм на треугольник
составов. На рис. 236 изобра-
жены составы жидких и твер-
дых фаз, находящихся в равно-
весии.
БИБ Л ИОГРАФИЧЕСК11И
СПИСОК
1. Nishikawa К-, Kusako А.,
Ito К-, Sana К. — J. Iron а.
Steel Inst. Jap., 1969, v. 55,
№ 13, p. 1193—1198.
2. Nishikawa K-, Kusano A., Ito K-, Sana K-—Trans. Iron a. Steel Inst.
Jap.. 1970, v. 10. № 2, p. 83—88.
226
ЖЕЛЕЗО — КИСЛОРОД — НИКЕЛЬ
Методами термического и рентгеновского анализов изучали влияние
парциального давления кислорода, температуры и состава на фазовые
Рис. 237. Изотермический разрез системы Fe—О—Ni при
1050 °C
Рис. 238. Фазовые равновесия в сплавах системы Fe—О—Ni при 1050 С
равновесия в системе [1]. Построили изотермические разрезы системы
при 1050, 900 и 757 ° С. На рис. 237 изображен общий вид разреза
при 1050 ° С, а на рис. 238 в более крупном масштабе — средняя часть
системы. В равновесии находятся следующие фазы: Н — гематит
(Fe2O3); М — магнетит (Fe3O4); IF — вюстит (Fei-.XO); F — никель—
227
феррит (NiFe2O4); М—оксид никеля; S — шпинель (Ni,¥Fe3_JCO4); А —
сплавы Fe—-Ni—О. На рис. 239 приведены соотношения фаз в зависи-
мости от парциального давления кислорода и соотношения никеля и
железа в системе при 1050 ° С.
Рис. 239. Влияние Р ~ на фазовые равновесия в сила-
вах системы Fe—О—Ni:
1 — шпинель; 2 — шпинель — сплав; 3 — шпинель — вюс-
тит; 4 — вюстит — сплав; 5 — вюстит
Аналогичные результаты при исследовании системы были получе-
ны в работе [2]. Определили концентрации никеля в вюстите, шпинели
в твердом растворе (А2), образующих трехфазную область Si + U73 +
+ А2. Эти концентрации соответственно равны 0,51; 0,60 и 79,6 %
(ат.) Ni.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Оно /(., Yokogawa К.. Yamaduchi A., Morijama J. — J. Jap. Inst. Me-
tals, 1971, v. 35, № 8, p. 750—756.
2. Davi A. D., Smeltzer W. W.—J. Electrochem. Soc., 1970, v. 117, № 11,
p. 1431—1436.
228
ЖЕЛЕЗО — КИСЛОРОД — СЕРА
1 Сучили1 влияние кислорода на растворимость серы в
1324 ° С. Сплавы для исследования изготавливали путем
железа в расплаве серой и кислородом.
На рис. 240 изобра-
жен изотермический раз-
рез системы Fe—FeS—
FeO при указанной тем-
пературе.
ЖЕЛЕЗО —
КИСЛОРОД —
ТИТАН
y-Fe при
насыщения
Методами
турного и
анализов
сплавы системы в облас-
ти составов 1,6—16,9 %
(ат.) О и 24,3—55,7 %
(ат.) Fe. Сплавы получа-
ли в дуговой печи с не-
расходуемым вольфрамо-
вым электродом. Шихто-
выми материалами служили железо
0,0052 — 0,0072 % О, иодидный титан
микрострук-
рентгеновского
исследовали
Рис.
Fe—О—Si
240. Изотермический разрез системы
при 1324 °C
чистотой 99,95 %, содержащее
чистотой 99,98 % Ti, 0,002 % О,
диоксид титана ТЮ2 высокой чистоты. Отжигали сплавы в откачанных
кварцевых ампулах в атмосфере аргона при 1000 °C в течение 50 и 350 ч,
а также при 800 °C в течение 500 ч.
На рис. 241 приведен изотермический разрез изученной части
системы при 1000 ° С. В сплавах системы существуют две тройные
Рис. 241. Изотермический разрез системы Fe—О—Ti при
1000 °C
фазы у и е. Фаза у имеет сравнительно небольшую область протяжен-
ности и может быть описана формулой Ti6Fe2O [22,2 % (ат.) Fe и
11,1 % (ат.) О]. Тройная фаза е простирается вдоль изоконцентраты
с 30 % (ат.) Fe и существует при изменении содержания кислорода
1 Parlee N., Shahe D., Phelps W. - Trans AIME, 1965, v. 233, K° 7, p. 1428—1129.
229
от — 4 до 17 % (ат.). Внутри области гомогенности е-фазы располагает-
ся тройное соединение Ti4Fe2O. Фаза е обладает сложной кубической
структурой, период которой зависит от содержания кислорода и сни-
жается по мере увеличения содержания последнего от 1,130 нм
(в трехфазной области p+TiFe+e) до 1,118 нм в сплаве с 16,9 %
(ат.) О.
Авторы работы [2], используя результаты работы [1], предложили
свой вариант изотермического разреза при 1000 ° С. Они полагают,
j3-t-TiFe TiFe+TiFe2
Ve,°/o[am.)
Рис. 242. Изотермический разрез системы Fe—О—Ti при
1000 °C
что в исследованной части системы существует только одна тройная
фаза, которую они обозначили символом Т (рис. 242). Область гомо-
генности фазы Т располагается параллельно стороне титан — железо
при среднем содержании кислорода ~ 15 % (ат.). Соединение состава
Ti4Fe2O располагается внутри фазы Т.
Некоторые вопросы фазовых равновесий в системе, главным об-
разом с участием оксидных фаз, рассмотрены в работах [3, 4].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Епсе Е., Margolin Н. — J. Metals, 1956, v. 8, № 5, sec. 2, р. 572—577.
2. Rostoker W., Van Thyne R. У.—J. Metals, 1956, v. 8, № 10, Sec. 2,
p. 1417—1419.
3. Шахин E. Л., Михайлов Г. Г. — Науч. тр./Челябинский политехи,
ин-т. Челябинск: 1975, № 12, с. 12—15.
4. Stieher J., Schmalzried Н. — Arch. Eisenhiittenw., 1976, Bd 47, № 5,
S. 261—266.
ЖЕЛЕЗО — КИСЛОРОД — УГЛЕРОД
Исследовали' сплавы системы, содержащие до 0,5 % С. Растворимость
кислорода в этих сплавах ниже 800 ° С крайне мала (рис. 243). Она
1 Ziegler М. А. — Trans. ASST, 1932, v. 20, р. 73—83.
230
Рис. 243. Растворимость кислорода в сплавах системы
Fe—С
возрастает при повышении температуры до 1000 ° С. Присутствие
углерода резко снижает способность железа растворять кислород.
ЖЕЛЕЗО — КИСЛОРОД — ФОСФОР
Изучали сплавы системы, богатые железом [1, 2]. Методами микро-
структурного и термического анализов исследована [1] вторичная
система FeO—Fe2O3—Р2Ое и подтверждено существование следующих
соединений: 2FeO-P2O5; FeO-P2O5; Fe2O-P2Os; Fe2O3-3P2Os; Fe3Ov
•2FeO-P2O5. Вероятно также существование соединений 3FeO-P2Os
и 2Fe2O3- ЗР2О5.
Исследованы фазовые равновесия систем Fe2O3—Р2О5 [от 30 до
50,6 % (по массе) Fe] и FeO—Р2О5 [от 46,9 до 59,8 % (по массе) Fe].
Построили разрез между соединениями 3FeO-P2O5 и 2Fe2O3-3P2Os.
В качестве исходных веществ при исследовании системы Fe2O3—Р2О3
применяли ферриортофосфат, феррипирофосфат и очищенный оксид
железа; для системы FeO—P2Os использовали трехосновный ферро-
фосфаг.
Установлено, что соединения Fe2O3-P2Os; 2FeO-3P2Og и 2FeO-
•Р2О5 плавятся конгруэнтно при 1240, 1270 и 1238°C соответственно,
а соединение 2Fe2O3-P2O5 — инконгруэнтно при 1095°C. В системе
Fe2O3—Р2О5 существует два эвтектических превращения при 34,6 °/о
(ат.) Fe и 964 ° С (между соединениями 2Fe2O3-3P2O5 и Fe2O3-P2Os)
и при 42,6 % (ат.) Fe и 968 ° С (между соединениями Fe2O3-P2O5 и
2Fe2O3-P2Os) и перитектическое превращение при 1095 ° С, а также
а-, |3- и у- или а- и ^-модификации названных соединений.
В системе FeO—3FeO-P2Os эвтектическое превращение наблюда-
ется при 53,9 % (ат.) Fe и 1008 ° С. На рис. 244 приведено схемати-
ческое изображение фазовых равновесий в системе в виде изотерми-
ческого разреза при температурах между 570 ° С (точкой распада
231
вюстита FeO) и 911 °C (точкой а^у-превращсния железа) [2].
В равновесии с сс-твердым раствором на основе железа находятся в
точке В фазы xFeO-P2O5 и FeO, а в точке С — 3FeO-P2Os и xFeO-
Р2О5. Соединение xFeO-P2Os [2] соответствует составу 3FeO-P2Og
[1]. Установлено также, что фаза %FeO-P2O5 более богата железом,
чем фаза 3FeO-P2O5 [2]. С увеличением температуры однофазная об-
ласть a-твердого раствора на основе железа расширяется.
Рис. 244. Схематическое изображение фазовых равновесий в сплавах си-
стемы Fe—О—Р в интервале температур 570—910 СС
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Wentrup Н. — Arch. Eisenhiittenw., 1935, Bd 9, № 1, S. 57—60.
2. Fischer W. A., Schmitz J. A.— Arch. Eisenhiittenw., 1962, Bd 33, №10,
S. 817—826. ,
ЖЕЛЕЗО — КИСЛОРОД — ХРОМ
Данные о диаграмме состояния системы приводятся в работах [1—8].
Наиболее подробно систему исследовали в области составов до 70 %
(ат.) Сг и 70 % (ат.) О, ограниченных на концентрационном треуголь-
нике двойными соединениями Fe2O3, Сг2О3 и стороной железо — хром
[4—8]. Исследования сплавов проводили методами химического [4],
микроструктурного, рентгеновского [4, 8] и термического [8] анали-
зов; измеряли электросопротивление, т. э. д. с. и плотность [8].
Однако сведения о характере фазовых превращений в сплавах,
богатых хромом, противоречивы. Это связано с тем, что одни авторы [4]
признают существование оксида Сг3О4 как стабильной фазы, другие
[8] указывают, что фаза Сг3О4 метастабильна, существует только вы-
ше 1600 ° С, а при более низких температурах распадается на Сг2О3 и
хром.
На рис. 245 приведена поверхность ликвидус системы [4]. В ка-
честве исходных материалов использовали электролитическое железо
и электролитический хром. Для приготовления сплавов расплавляли
электролитическое железо в вакууме, подавали аргон под давлением,
немного превышающим атмосферное, насыщали расплав кислородом,
добавляя оксид железа FeO, а затем вводили хром.
В системе обнаружены следующие фазы:
1) хромит — твердый раствор Fe3O4 в FeO-Cr2O3 типа кубической
шпинели с периодом решетки, изменяющимся от 0,823 до 0,830 нм в
зависимости от содержания Fe3O4;
2) дефектная шпинель, состав которой является средним между
Сг3О4 и FeO-Cr2O3; это соединение стабильно при высоких темпера-
232
турах, ниже температуры кристаллизации распадается на FeOCr2O3
и СГ3О4; решетка гранецентрированная тетрагональная с периодом а,
изменяющимся от 0,83 до 0,848 нм, и отношением с/а, изменяющимся
от 0,98 до 0,95;
3) твердый раствор Fe2O3 в Сг2О3;
4) твердый раствор FeO;
Рис. 245. Поверхность ликвидус системы Fe—О—Ст:
1 — твердый раствор FeO-Cr2O3—Fe3O4; 2—дефектная шпинель; 3 — твердый
раствор Cr2O3—Fe2O3; 4 — твердый раствор FeO; 5 — твердый раствор Сг2О3;
6 — твердый раствор Fe—Сг
5) твердый раствор Сг3О4;
6) твердый раствор железо — хром.
В тройной системе обнаружена область несмешиваемости, прости-
рающаяся от стороны хром — кислород до стороны железо — кисло-
род. Характер нонвариантных реакций в системе точно не установлен.
Предполагают, что дефектная шпинель образуется по перитектической
реакции из жидкости и FeO-Cr2O3. Установлено существование трой-
ной эвтектики, которая кристаллизуется при 1500 ° С и содержании
(по массе) около 8 % Сг и 0,015 % О и состоит из твердого раствора
железо — хром, Сг3О4 и дефектной шпинели. При увеличении кон-
центрации хрома растворимость кислорода в расплаве железо — хром
уменьшается, достигая минимума 0,017; 0,025 и 0,034 % (по массе) О
и температурах 1550; 1600 и 1650 ° С соответственно при содержании
6 % (по массе) Сг. При увеличении содержания хрома растворимость
кислорода при тех же температурах увеличивается и при 40 % (по
массе) Сг достигает 0,057; 0,073 и 0,095 % (по массе) О.
Приведен [8] изотермический разрез системы при 1600 ° С (рис.
246). В сплавах с содержанием хрома менее 1 % (ат.) присутствует
хромит с кубической структурой. Увеличение содержания хрома до
7 % (ат.) приводит к уменьшению отношения с/а решетки хромита
до 0,95 (Feo,26CrOi74). При содержании в сплавах более 7 % (ат.)
существует соединение Сг2О3. В работе определено также влияние
хрома на положение монотектической горизонтали системы железо —
кислород. При содержании ~ 3 % (ат.) Сг температура двойной моно-
тектики снижается от 1528 до 1510 ° С и остается постоянной до 10 %
(ат.) Сг. В равновесии с расплавом железо — хром находятся хромит
(FeCr)3O4 и Сг2О3. Эти оксиды стабильные, при низких температурах
233
о
Рис. 246. Изотермический разрез системы Fe—О—Сг при
1600 °C:
/ — ж (Fe, Сг) [ниже 7 % (ат.) Сг] —(Fe, Сг)3О4; 2 — (Fe,
Сг)3О4—Сг2О3; 3—ж (Fe, Сг)(7~57% Сг); 4 — твердый
раствор Fe—Сг (выше 75 % Сг)— Сг2О3; 5 — ж (Fe, Сг)
[7 % (ат.) Сг]—(Fe g go Сг 0 7^) 3 04 О4—Сг2О3; 6 — ж
(Fe, Сг) [57 % (ат.) Сг] — твердый раствор (Fe-Cr) [75 %
(ат.) Сг]—Сг2О3
прямое наблюдение других возможных фаз затруднено, и попытки их
идентификации нередко приводят к ошибкам.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Chen Н. М., Chipman J.— Trans. ASM, 1947, v. 38, p. 70.
2. Wentrap H., Knapp B. — Tech. Mitteillungen Krupp, 1944, Bd 4, № 11,
S. 237—256.
3. Линчевский Б. В., Самарин A. M. — Изв. АН СССР. ОТН, 1953, № 5,
с. 691—704.
4. Hiliy D. С., Forgeng W., Folkman R. L.—Trans. AIAIE, 1955, v. 203,
№ 2, p. 253—268.
5. Ribond P. V., Muan A.—Trans. AIME, 1964, v. 230, № 1, p. 88.
6. Hoffmann A.—Arch. Eisenhiittenw., 1965, Bd 36, № 2, p. 155—157.
7. Johnson R, E., Muan A. J. — J. Amer. Ceram. Soc., 1968, v. 651, p. 430.
8. Iwamoto N., Takano M., Kanajama H., Adachi A.—J, Iron a. Steel
Inst. Jap., 1970, v. 56, № 6, p. 727—733.
ЖЕЛЕЗО — КИСЛОРОД — ЦИРКОНИЙ
Диаграмма состояния системы полностью не исследована. Имеются
лишь сведения о растворимости кислорода в фазе типа Ti2Ni (обозна-
ченной е) [1]. Методика приготовления сплавов, чистота исходных ма-
териалов и методы исследований (микроструктурный, рентгеновский
анализ и измерение плотности) изложены в работах [2, 3]. В качестве
шихтовых материалов использовали высокочистое железо (99,9 %) и
234
оксид ZrO2. Сплавы готовили в дуговой печи, затем отжигали в ва-
кууме. Построена приблизительная граница области существования
фазы е при 1000 ° С, которая невелика и соответствует составу
(ZrgFeJi-x-Ox (рис. 247). Сплав, содержащий 63,5 % (ат.) Zr; 31,5 %
Zr
0, % (ат.)
Рис. 247. Изотермический разрез части системы Fe—
О—Zr при 1000 °C
Fe; 5 % О при отношении Zr : Fe=2,02, имеет период решетки а==
= 1,2189±0,001 нм. Максимальная растворимость кислорода в фазе е
составляет 10 % (ат.).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Nevitt М. V., Downey J. W., Morris R. А. — Trans. AIME. 1960,
v. 218, № 6, p. 1019—1023.
2. Nevitt M. V., Schwartz L. H.— Trans. AIME. 1958, v. 212, № 4,
p. 700.
3. Nevitt M. V. — Trans. AIME. 1960, v. 218, № 2, p. 327.
ЖЕЛЕЗО — КОБАЛЬТ — КРЕМН Ий
Сплавы системы исследовали методами рентгеновского и микрострук-
турного анализов [1].
В более ранних исследованиях [2, 3] было установлено существо-
вание непрерывного ряда твердых растворов между изоструктурными
соединениями FeSi и CoSi, а в [3, 4] — наличие квазибинарного разре-
за эвтектического типа FeSi2 — CoSi2 с ограниченной взаимной раство-
235
римостью дисилицидов: FeSi2 (а-лебоит) растворяет при 1080 ° С 8 %
CoSi2, а соединение CoSi2 — менее 3 % (по массе) а-лебоита
Сплавы получали в электродуговой печи в атмосфере аргона из
железа чистотой 99,96 %, кобальта чистотой 99,98 % и кремния чисто-
той 99 99 % и выдерживали при 800 ° С в течение 6 мес. в запаянных
кварцевых ампулах [1]
На рис. 248 приведен изотермический разрез системы при 800 ° С.
Установлены границы области гомогенности твердого раствора на ос-
Si
Со, % (ат.)
Рис. 248. Изотермический разрез системы Fe—Со—Si при 800 °C, об-
ласти:
1 — однофазные; 2 — двухфазные; 3 — трехфазные
нове железа и изопериодные линии этого твердого раствора; период
решетки меняется от 0,2860 до 0,2820 нм. Подтверждено существование
непрерывного ряда твердых растворов FeSi—CoSi и весьма ограни-
ченной растворимости дисилицидов железа в CoSi2 составляет ~ 7%
(ат.). Тройных соединений в системе не обнаружено, что может быть
связано с небольшими различиями в размерах атомов металлов и по-
добием их электронной структуры.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Федорова Л. К, Гладышевский Е. И. — Изв АН СССР. Неорган.
материалы, 1975, т II, № 2, с. 373—375.
2. Гладышевский Е И. — Порошковая металлургия, 1962, № 4, с. 46.
3. Wittmann A., Burger К- О., Nowotnii Н.—Monatsh. Chem., 1961,
Bd 92, S. 961.
4. Зеленин Л. П„ Сидоренко Ф. А., Шипанов Л. В. — Науч тр /УПИ,
1965, сб. 144, с. 74—77.
236
ЖЕЛЕЗО — КОБАЛЬТ — МАРГАНЕЦ
Сплавы системы исследовали методами микроструктурного и рентге-
новского анализов [1].
На рис. 249 приведена диаграмма плавкости системы, а на рис.
250 — изотермический разрез при 20 0 С. Fe—П\—п2 — область первич-
ной кристаллизации
б-твердого раствора на
основе железа; П\П2-—
линия моновариантного
перитектического превра-
щения ж + б^у, исходя-
щего от двойной систе-
мы железо — кобальт
(при 1493СС) к такому
же превращению в сис-
теме железо—марганец
(1455 °C); S]S2 — линия,
соединяющая точки ми-
нимумов на кривых лик-
видус двойных систем,
образующих тройную.
Ниже 1400 °C тройные
сплавы в исследуемой
концентрационной обла-
сти состоят только из
Рис. 249. Поверхность ликвидус системы
Fe—Со—Мп
у-твердого раствора с
г. ц. к. структурой. Спла-
вы с содержанием до
30% (по массе) Мп, пре-
терпевают в твердом со-
стоянии полиморфное
превращение, при кото-
ром г. ц. к. решетка
-у-твердого раствора пе-
реходит в о. ц. к. решет-
ку ос-твердого раствора
или гексагональную ре-
шетку е-твердого рас-
твора на основе железа и
кобальта. На изотерми-
ческом разрезе при 20 СС,
который авторы считают
метастабильным, показа-
ны области существова-
ния этих фаз. Указыва-
ется, что переход г. ц. к.
модификации в гексаго-
нальную в-модификацию
твердого раствора на ос-
нове железа системы же-
лезо — марганец подобен
полиморфному превра-
щению чистого кобальта
при 400 °C в е-модифика-
цию.
Изучены изотермиче-
Со
Мп, % (по массе)
Рис. 250. Изотермический разрез системы
Fe—Со—Мп при 20 СС
237
Рис. 251. Изотермический разрез системы
Fe—Со—Мп при 800 СС
новлено, что в сплавах, содержащих ь
ходит порядочение а-фазы.
ские разрезы сплавов системы
с содержанием до 82 % (по
массе) Со при 600, 700 и
800 СС [2]. Сплавы готовили в
вакуумных печах; исходными
материалами служили армко-
железо, гранулированный ко-
бальт, содержащий 0,25 % Ni,
и электролитический марганец
чистотой 99,9 %. Затем сплавы
гомогенизировали 10 ч при
1000 СС и отжигали при 600,
700 и 800 СС в откачанных ам-
пулах в течение 3000, 1500 и
750 ч соответственно.
На рис. 251 приведен изо-
термический разрез системы
при 800СС. Этот разрез отли-
чается от изотермических раз-
резов при 600 и 700 °C тем, что
при повышении температуры
от 600 до 800 °C области а- и
(а+у)-фаз сужаются, а об-
ласть у-фазы расширяется и
занимает при 800 СС почти всю
площадь треугольника. Уста-
;нее 4 % (по массе) Мп, проис-
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Koster W., Schmidt W. — Arch. Eisenhiittenw., 1933, Bd 7, № 2,
S. 121—126.
2. Koster W., Speidel M. — Arch. Eisenhiittenw., 1962, Bd 33, № 12,
S. 873—876.
ЖЕЛЕЗО — КОБАЛЬТ — МЕДЬ
Сплавы системы исследовали методами термического, микроструктур-
ного, дилатометрического и рентгеновского анализов, а также прово-
дили измерение твердости и плотности [1—3].
На рис. 252 приведена проекция поверхности ликвидус [1]; наблю-
дается полная смешиваемость в жидком состоянии. По линии н2«з
наблюдается перитектическое равновесие ж+бре**уВе, при этом пери-
тектическое равновесие двойной системы железо — кобальт переходит
в перитектическое равновесие двойной системы железо — медь с по-
нижением температуры от 1499 до 1484 ° С.
Линия П1П4 характеризует перитектическое равновесие ж+уСоч*
4=t«Cu, температура которого понижается от 1110 °C — температуры
•перитектического равновесия ж+уСо^аСи системы кобальт — медь —
до 1094 ° С — температуры перитектического равновесия ж-]-уре^аСи
системы железо — медь.
Fenins — область первичной кристаллизации твердого раствора
на основе б-Fe: Cu«in4— область первичной кристаллизации твердого
раствора на основе меди ctCu; Пг^зСощ/?!— область первичной кристал-
лизации тройного твердого раствора на основе y-Fe и у-Со—y-(Fe—
Со).
238
Сплавы двойных систем
железо—медь, кобальт—медь в
твердом состоянии имеют огра-
ниченную растворимость и пре-
терпевают эвтектоидный рас-
пад, при котором y-Fe или у-Со
распадаются на а-Cu и a-Fe и
a-Со. Температура эвтектоид-
ного превращения в системе
железо—медь при добавке ко-
бальта возрастает, достигая
950 СС при 48 % (по массе) Со.
Приведены [1, 2] политер-
мические разрезы с постоянным
содержанием кобальта 10, 25,
50, 70, 75 % (по массе) и со-
держанием меди до 12 % (по
массе); дано гипотетическое
распределение фазовых облас-
тей при комнатной температу-
ре. Приведены также данные о
влиянии кобальта на изменение
растворимости меди в желе-
зе [3].
Рис. 252. Проекция поверхности ликвидус
системы Fe—Со—Си
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Jellinghaas W.— Arch. Eisenhiittenw., 1936, Bd 10, № 3, S. 115—118.
2. Jellinghaus W. — Metallurgist, 1936, Bd 10, S. 180-182.
3. Roll F. — Z. Anorg. Chem., 1933, Bd 216, № 2, S. 135—137.
ЖЕЛЕЗО — КОБАЛЬТ — МОЛИБДЕН
Сведения о диаграмме состояния системы приведены в рабтах [1—5].
Методами микроструктурного, микрохимического [1, 2] и рентгеновско-
го [2] анализов исследовали сплавы системы. Изучены [1] три изотер-
мических разреза системы в области сплавов, богатых железом [до
30 % (по массе) Со+Мо]. В работе использовали шихтовые материа-
лы высокой чистоты. Сплавы приготовляли в дуговой печи в атмосфе-
ре аргона, подвергали холодной прокатке и отжигали при температу-
рах 1205, 1095 и 980 °C в течение 50, 75 и 100 ч соответственно.
Полученные результаты хорошо согласуются с данными работы [2], в
которой исследовали сплавы системы при 1100 °C. Сплавы выплавляли
по методике, изложенной в работе [1], затем отжигали в вакууме при
1100 ° С в течение 3—10 сут. Изотермический разрез при 1100 ° С
приведен на рис. 253. В системе образуется непрерывный ряд твердых
растворов р,— (Fe^Co, _х)7Мо6, простирающийся между фазами Fe7Mo6
и Со7Мо6 соответствующих двойных систем. Фазы а и у представляют
собой твердые растворы на основе модификаций железа с о. ц. к. и
г. ц. к. структурой. Фаза 0 — двойное соединение Со9Мо2. Раствори-
мость железа в 0-фазе очень небольшая.
Исследовали структуру сплавов системы по разрезу с 10 % (ат.)
Мо после закалки с 1200 и 800 ° С [3]. При 1200 ° С в структуре спла-
вов обнаружили две фазы: а- и у-твердые растворы; с увеличением
содержания кобальта происходит изменение кристаллической решетки
твердого раствора от о. ц. к. (a-фаза) к г. ц. к. (у-фаза). Изотерми-
239
Рис. 254. Изотермический разрез системы Fe—Со—Мо
при 800 °C
ческий разрез при 800 ° С приведен на рис. 254 [3]. Показано сущест-
вование трех однофазных областей (а, у и р), пяти двухфазных
(а+у, а+р, у+р, у+Со3Мо, р+Со3Мо), двух трехфазных (а+у + р и
у + р+СозМо).
Термодинамический анализ влияния кобальта на изменение раст-
воримости молибдена в a-Fe изложен в работах [4, 5].
240
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I. Doniagala R. F., Simcoe C. R. — Cobalt, 1972, № 54, p. 14—17.
2. Van Loo F. J. J.. Bastin G. F., Vrolijk J. W. G. A., Hendrike J. J. M.—
J. Less-Common Metals, 1980, v. 72, № 2, p. 225—230.
3. Прокофьев Д. И., Курбаткина О. Л. — Изв. АН СССР. Металлы,
1979, № 2, с. 204—208.
4 Nishizawa Т., Hasebe N., Ко М. — Acta Met., 1979, v. 27, № 5, р. 817—-
828.
5. Ко М., Nishizawa Т. — J. Jap. Inst. Metals, 1979, v. 43, № 2, p. 126—
135.
ЖЕЛЕЗО — КОБАЛЬТ — НИКЕЛЬ
Сплавы системы исследовали методами микроструктурного [1, 2, 4, 5],
термического, дилатометрического [1] и микрорентгеноспектрального
|2] анализов, проводили измерения твердости и плотности [1, 4, 5],
модуля упругости [1], удельного сопротивления [1, 4, 5] и магнитных
свойств [1].
На рис. 255 приведены изотермические разрезы системы при 500,
600 и 800 ° С. Отмечено присутствие следующих фаз: а с о. ц. к. ре-
шеткой, у с г. ц. к. решеткой и упорядоченной а* на основе соединения
Рис. 255. Изотермические разрезы системы Fe—Со—Ni при 500 (а),
600 (б), 800 °C (в); штриховой линией показана упорядочивающая-
ся область ct-твердых растворов
FeCo. По мере увеличения температуры сужается область существования
а*-фазы, так как снижается степень упорядочения, исчезая выше кри-
тической температуры. Поэтому на изотермическом разрезе при 800 ° С
область а*-фазы отсутствует. По мере увеличения температуры сужа-
ется область а+у. На рис. 256 приведены политермические разрезы
системы с постоянным содержанием кобальта 10, 20 и 40 % (по мас-
се) [1]. На сечениях показана область появления упорядоченной
а*-фазы, температурный интервал существования которой расширя-
ется по мере увеличения содержания кобальта.
Изучены сплавы системы, богатые железом, при содержаниях ко-
бальта до 16 % (по массе) [2]. Изотермические разрезы системы при
700 и 650 ° С приведены на рис. 257. Добавление кобальта к железо-
никелевым сплавам сдвигает границы областей а/(а+у) и (а+у)/у к
более высокому содержанию никеля.
241
Изотермические разрезы системы при 1073 и 973 К построены
на основании термодинамических расчетов [3]. Результаты находятся
в хорошем соответствии с данными работы [1].
Проводили изучение системы в области металлических соедине-
ний Ni3Fe и FeCo [4, 5]. Область металлического соединения Ni3Fe в
Ni, % (по пассе)
Рис. 256. Политермические разрезы системы Fe—Со—Ni при содержа-
нии 10 (а), 20 (б) и 40 % (в) Со
Рис. 257. Изотермические разрезы части системы Fe—Со—Ni:
а —сплав 96 % Fe и 4% Ni при 700 °C; б — сплав 95 % Fe и 5%
Ni при 650 °C
двойной системе железо — никель распространяется от 60 до 83 %
(ат.) Со. По мере добавления кобальта эта область сужается [при
8 % (ат.) Со до 63—77 % (ат.) Ni], а при 12 °/о (ат.) Со вообще
исчезает. Исследования [5] показали, что область упорядоченного
соединения FeCo проникает в двухфазную (а+у)-область.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Koster Werner, Naehl Wolf-Dieter. — Arch. Eisenhilttenw., 1964, Bd40,
№ 7, S. 569—574.
2. Wfee S., Goldstein J. /. — Met. Trans., 1977, v. A8, № 2, p. 309—315.
3. Kaufman Zarry, Nesor Harvey.—Met. Trans., 1974, v. 5, № 7,
p. 1617—1621.
4. Витинг Л. AL— ЖНХ, 1957, т. 2, № 2, с. 375—382.
5. Витинг Л. М. — ЖНХ, 1957. т. 2, № 4, с. 852—859.
ЖЕЛЕЗО — КОБАЛЬТ — ОЛОВО
Сплавы системы изучали в области концентраций от стороны желе-
зо— кобальт до 40 °/о (по массе) Sn и по разрезу Fe2Sn—Co2Sn [1],
по разрезу FeSn2—CoSn2 [2] методами микроструктурного, термичес-
242
кого, рентгеновского и фазового
анализов, а также проводили из-
мерение твердости и магнитных
свойств. В качестве исходных ма-
териалов [2] использовали элек-
тролитическое железо, восстанов-
ленное в водороде, и электроли-
тический кобальт.
Разрез ЕегЗп—Co2Sn харак-
теризуется образованием непре-
рывного ряда твердых растворов,
наличием О-фазы [1].
На рис. 258 приведена проек-
ция поверхности ликвидус системы.
Установлено наличие нонвариант-
ного четырехфазного равновесия
между 1050 и 1000 °C: ж(Р) +
"^“Ттв. р-р *^атв. р-р тв. р-р’ где
а, у, О —- твердые растворы на
основе железа, кобальта и химиче-
ских соединений Fe2Sn и Co2Sn.
В твердом состоянии в иссле-
Sn
Co,%f/7Z7 массе)
Рис. 258. Поверхность ликвидус системы
Не—Со—Sn
дуемой области концентраций при-
сутствуют лишь фазы а, у и О.
Приведено положение границ фазовых областей при комнатной темпе-
ратуре [1]. Разрез FeSn2—CoSn2 — квазибинарный с непрерывным рядом
твердых растворов и кристаллической структурой типа СнА12
библиографический список
1. Koster W. and Geller W.— Arch. Eisenhilttenw., 1935, Bd 8, № 12,
S. 557-560.
2. Матвеева H. M., Никитин С. В., Зезин С. Б. — Изв. АН СССР. Ме-
таллы, 1968, № 5, с. 194—197.
ЖЕЛЕЗО —
КОБАЛЬТ —
ПАЛЛАДИЙ
Диаграмма состояния
системы изучена во всей
области концентраций.
Исследование сплавов
системы проводили ме-
тодами дифференциаль-
ного термического и мик-
роструктурного анализов,
а также измерением
твердости, электросопро-
тивления и температур-
ного коэффициента элек-
тросопротивления [1—4].
В качестве исходных
компонентов брали элек-
тролитические железо,
кобальт и губчатый аф-
Pd
Со, % (ат.)
Рис. 259. Поверхность ликвидус системы
Fe—Со—Pd
243
финированный палладий с содержа-
нием примесей до 0,01 %.
На рис. 259 приведены изотермы
поверхности ликвидус системы, по-
лученные в работе |1] при исследо-
вании сплавов девяти разрезов с по-
стоянным содержанием палладия —
от 10 до 90 % (ат.).
Результаты исследований фазо-
вых превращений в сплавах железа
с кобальтом и палладием в твердом
состоянии (ниже 1U00 °C) содержат-
ся в работах [2—4]. Изучены разрезы
с постоянным содержанием палладия
2, 5, 10, 20, 30, 40 и 50 (ат.) и, кро-
ме того, разрезы FeCo—Pd; FeCo—
PdFe; FeCo—Pd3Fc; Pd3—Fe—Co;
PdFe—Co. В изученных сплавах при
понижении температуры у-твердый
раствор, образующийся после крис-
таллизации, претерпевает полиморф-
Со; % (am.)
Рис. 260. Политермический разрез
системы Fe—Со—Pci при содержа-
нии 10 % (по массе) Pd
ное превращение, а также пре-
вращения, связанные с образованием упорядоченных фаз yi (соедине-
ние PdFe) и у2 (соединение PdsFe).
Полиморфное превращение у^*« сопровождается образованием
области «+у, а для сплавов богатых железом — области a+y+yi.
Область тройных у-твердых растворов сохраняется до комнатной тем-
пературы для сплавов, богатых кобальтом, и сплавов, содержащих
до 52 % (ат.) Pd [3]. Ниже 700 ° С происходит превращение «-твердо-
го раствора с образованием упорядоченной фазы «1 (твердый раствор
на основе соединения FeCo). На рис. 260 показан один из политерми-
ческих разрезов, параллельных стороне железо — кобальт с постоян-
ным содержанием палладия 10 % (ат.) [2].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Куприна В. В., Григорьев А. Т. — ЖНХ, 1958, т. 3, № 12, с. 2736—
2739.
2. Куприна В. В., Григооьев А. Т. — ЖНХ, 1959, т. 4, № 7, с. 1606—
1612.
3. Куприна В. В., Григорьев А. Т. — Изв. вузов. Химия и химическая
технология, 1961, т. 4, № 1, с. 7—10.
4. Григорьев А. Т.. Куприна В. В. — ЖНХ, 1961, т. 6, № 8, с 1891—
1901.
ЖЕЛЕЗО — КОБАЛЬТ — РЕНИЙ
Исследованы'• сплавы системы методами микроструктурного и рентге-
новского анализов. Построены изотермические разрезы при 800 и
1000 °C, обнаружено тройное соединение примерного состава ReCoFes,
обозначенное Z и имеющее область гомогенности от 37 до 45 % (по
массе) Re при содержании кобальта от 6 до 19 % (по массе).
На изотермическом разрезе при 1000 ° С присутствуют две обла-
сти тройных твердых растворов на основе чистых компонентов:
«-твердый раствор с гексагональной плотноупакованной решеткой на
1 И. А. Нютина, В. В. Куприна, Е. М. Соколовская, Н. А. Спасов — В кн.:
Исследование и применение сплавов рения. М.: Наука, 1975, с. 56—58.
244
основе рения и |3-твердый раствор на основе кобальта и железа, при-
чпаюгций к стороне железо — кобальт. На изотермическом разрезе
при 8000 С имеется также у-тройной твердый раствор на основе желе-
за. Максимальная растворимость железа в «-твердом растворе на
обоих разрезах составляет ~ 12 % (по массе).
На рис. 261 приведены изотермические разрезы при 1000 (а) и
800 ° С (б).
Со, %.(по массе) Со, % (по массе)
Рис. 261. Изотермический разрез системы Fe—Со—Re при 1000 (а) и 800 °C
(б)
ЖЕЛЕЗО — КОБАЛЬТ — РТУТЬ
Сплавы системы изучали1 методом рентгеновского анализа порошков,
выделенных из амальгам железокобальтовых сплавов. Сплав с 90,8 %
(ат.) Со оказался гомогенным у-твер-
дым раствором, а на дебаеграммах спла-
вов с 85,2 и 77,5 % (ат.) Со обнаружи-
ли линии у- и «-фаз (твердых раство-
ров). На рис. 262 приведен изотермиче-
ский разрез системы при комнатной тем-
пературе, на котором можно видеть од-
нофазную область (расплав на основе
ртути), три двухфазные области с комо-
дами, соединяющими составы жидкой и
твердых фаз (расплав -Fez- или у-твердый
раствор) и две трехфазные области (рас-
плав +два насыщенных твердых раство-
ра). Растворимость кобальта и железа
в ртути при электролитическом методе
получения амальгам составляет около
ю-6 %.
Рис. 262. Схематическое изо-
бражение изотермического раз-
реза системы Fe—Со—Hg при
комнатной температуре
ЖЕЛЕЗО — КОБАЛЬТ — СЕРА
Изучение фазовых равновесий в системе проводили в области кон-
центраций сплавов от двойной системы железо — кобальт до разреза
1 Zihl F. — Z. Metallkde, 1955, Bd. 46, S. 434-441.
245
FeS—CoS [1, 2] и до разреза FeS—Co4S3 [3], а также по разрезам,
соединяющим различные сульфиды железа и кобальта [4, 5].
В работе [3] показано, что наиболее устойчивым при высоких тем-
пературах и нормальном давлении является соединение кобальта с
серой, отвечающее стехиометрии Co4S3 [3]. Термодинамические расчеты
[6] подтвердили, что в интервале 850—1200 ° С наиболее устойчивым
является соединение Co4S3.
В работе [4] сплавы системы исследовали термическим, микрост-
руктурным, дилатометрическим методами, а также проводили измере-
ние плотности и микротвердости в области, простирающейся от раз-
реза FeS—Co4S3 до сплавов, содержащих 15 % (по массе) S.
Исходными веществами для получения сплавов служили хими-
чески чистые сульфаты железа и кобальта, очищенная элементарная
сера, железо и кобальт чистотой 99,9 %.
Изучен квазибинарный разрез FeS—Co4S3, восемь политермичес-
ких разрезов: три из них проходят параллельно стороне железо —
кобальт и пять пересекают ее, приведены изотермы ликвидус. Разрез
Со, % [по массе)
Рис. 263. Структурная диаграмма состояния системы
Fe—Со—S
FeS—CojS3 — квазибинарный эвтектического типа с ограниченной
растворимостью компонентов. Растворимость сульфида кобальта Co4S3
в сернистом железе FeS изменяется от 42,4 % (по массе) при эвтекти-
ческой температуре 900 ° С до 24,5 °/о (по массе) при комнатной;
растворимость сульфида железа в сульфиде кобальта почти не изме-
няется с температурой и составляет 20 % (по массе) FeS.
В системе имеются три поверхности первичной кристаллизации:
феррокобальта (твердый раствор железа и кобальта друг в друге),
«-твердого раствора (твердый раствор FeS в Co4S3) и [З-твердого
раствора (твердый раствор Co4S3 в FeS). Эти поверхности пересека-
ются по моновариантным эвтектическим кривым. Точное положенно
точки тройной эвтектики не установлено.
На рис. 263 показана структурная диаграмма состояния, состоя-
щая из восьми областей. Ниже указаны фазовые и структурные со-
ставляющие этих областей [3]:
Струк- турная область Первичные выделения Фазовые составляющие Структурные составляющие
I Тв р. (Fe—Со) Тв. р. (Fe—Со) 4-р Тв. р. (Fe—Со) -J- + [₽ + тв. р. (Fe—Со)]
246
Продолжение
Струк- турная область Первичные выделения Фазовые составляющие Структурные составляющие
II Тв. р. (Fe—Со) Тв. р. (Fe—Со) -ф + к + Р Тв. р. (Fe—Со) 4- + +Р+ТВ- Р- (Fe—Со)]
III Тв. р. (Fe—Со) Тв. р. (Fe—Со) -фа Тв. р. (Fe—Со) -ф 4- [а4-тв. р. (Fe—Со)]
IV а Тв. р. (Fe—Со) -ф а а4- [а 4- тв. р. (Fe — Со)]
V а а а
VI Р Р 4- тв. р. X X (Fe—Со) 4~« Р+ [«+Р + 4- тв. р. (Fe—Со)]
VII Р Р 4- тв. Р- (Fe—Со) Р4-1Р + тв. р. (Fe—Со)]
VIII Р Р Р
библиографический список
1. Vogel R., Hiller G. F. — Arch. Eisenhiittenw., 1953, Bd 24, № 3/4,
S. 133—141.
2. Asauti P., Kohlmeyer E. J. — Z. Anorg. Chem., 1951, Bd 265, № 1,
S. 90—95.
3. Молева M. Г, Кусании П. С., Ветренко Е. А., Диев Н. П. — ЖНХ,
1958, т. 3, № 4, с? 900—910.
4. Vogel R., Au Р. — Z. Metallkde, 1949, Bd 40, № 8, S. 290—295.
5. Cuzlook W., Pigdeon L. M. — Canad. Min. Met. Bull., 1953, v. 46,
№ 493, p. 297—301.
6. Rosenqvist K-—-J. Iron a. Steel Inst., j954, v. 176, p. 128—131.
ЖЕЛЕЗО — КОБАЛЬТ — СУРЬМА
Сплавы системы исследовали методами микроструктурного, термичес-
кого и дилатометрического анализов во всей области концентраций
[1]. Кроме фаз, присутствующих в двойных системах, никаких новых
фаз в тройной системе не обнаружено. Фаза е системы железо —
сурьма образует с соединением CoSb непрерывный ряд твердых раство-
ров, причем каждая из этих фаз имеет решетку типа арсенида нике-
ля. Фазы FeSb2 и CoSb2 также образуют между собой непрерывный
ряд твердых растворов.
На рис. 264 приведена проекция поверхности ликвидус системы
[1]. Можно выделить пять областей первичной кристаллизации:
I — «-твердый раствор на основе железа;
II — у-твердый раствор на основе кобальта;
III, IV — твердый раствор на основе изоморфных фаз е(Ш) и
CoSb(IV);
V — твердый раствор на основе соединений FeSb2 и CoSb2;
VI — твердый раствор на основе сурьмы.
В системе существует четырехфазное равновесие эвтектического
типа, которое реализуется при ~ 1000 ° С: ж^«+у + е.
247
В части системы CoSb—E-Sb по линии протекает перитекти-
ческое равновесие ж + (CoSb—s)TB р ^*(CoSb2—FeSb2)TBp с переходом
перитектических равновесий двойных систем одного в другое и пони-
жением температуры от 884 ° С в системе кобальт — сурьма к 730 ° С
в системе железо—сурьма. Линия 63^4 характеризует эвтектическое
равновесие ж^=>(Со8Ь2—FeSb2)+Sb, температура которого понижается
от 628 °C в системе железо—сурьма до 618 °C в системе Со—Sb.
В работе [1] приведены изотермы ликвидус и разграничение фа-
зовых областей при комнатной температуре.
Со
Sb, % (по пассе)
Рис. 264. Поверхность ликвидус системы Fe—Со—Sb
В работе [2] подтверждено образование непрерывного ряда твер
дых растворов между изоморфными фазами CoSb и е. Показано, что
тройные никельарсенидные фазы относятся к фазам внедрения. Све-
дения о границах существования тройных твердых растворов в обла-
сти, богатой кобальтом, приводимые авторами указанных работ [1, 2],
не совпадают.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Geller IF.— Arch. Eisenhiittenw., 1939, Bd 13, № 6, S. 263—266
2. Агеев H. В., Макаров E. С. — Изв. АН СССР. OXH, 1943, № 3
c. 161 — 169.
ЖЕЛЕЗО — КОБАЛЬТ — ТАНТАЛ
Сплавы системы изучали 1 в области концентраций Fe—Со—Со5Та2—
Fe2Ta методами микроструктурного анализа, а также определяли
механические и магнитные свойства. Исследовали сплавы трех разре-
1 Koster W., Becker G. — Arch. Eisenhiittenw., 1939, Bd. 13, № 2, S. 93—94
зов из танталового угла при содержании тантала 10, 20, 30 и 40 %
(по массе) и отношении Fe:Co=l:3, 1:1 и 3:1, а также сплавы разре-
за CosTa—Fe2Ta. Шихтовыми материалами служили армко-железо и
металлические кобальт и тантал.
Соединения Со5Та2 и Fe2Ta образуют между собой непрерывный
ряд твердых растворов, обозначенный авторами О’. На рис. 265 при-
Рис. 265. Поверхность ликвидус системы Fe—Со—Та
ведена проекция поверхности ликвидус системы Fe—Со—CosTa—Fe2Ta.
Наблюдается четырехфазное равновесие перитектического типа при
1390 ° С: ж (Р) +а-ги.р=е±:Утв.р+Отв.р.
Показано положение границ фазовых областей при комнатной
температуре.
ЖЕЛЕЗО — КОБАЛЬТ — ТИТАН
Диаграмма состояния системы исследована в области сплавов, богатых
железом, при содержании титана до 22 % (по массе). Применяли ме-
тод микроструктурного анализа и измерение твердости [1]. При при-
готовлении сплавов использовали ферротитан с содержанием 38 % (по
массе) Ti; 7,5 % (по массе) А1 и 3,5% (по массе) Si; в сплавах содер-
жалось до 2,5 % (по массе) А1 и 1,5 % (по массе) Si. В системе суще-
ствует квазибинарный разрез между соединением Fe3Ti и предполага-
емым [1] соединением Co3Ti; указанные соединения образуют между со-
248
9—358
249
Ti, % (по массе)
Рис. 266. Поверхность ликвидус части системы Fe—Со—Ti
бой непрерывный ряд твердых растворов. Однако более поздние
исследования [2] не подтвердили существования соединения Co3Ti. В си-
стеме кобальт — титан образуется соединение Co2Ti. По данным [2],
в системе имеется четырехфазное равновесие перитектического типа
при 1150 °C, которое можно описать уравнением ж+ач^'О’+у, где «-фа-
за — твердый раствор на основе железа, у-фаза — твердый раствор на
основе кобальта, 'О’-фаза — твердый раствор на основе соединений Fe2Ti
(рис. 266). В работе [2] исследовали политермический разрез Со—Fe2Ti
и установили границы растворимости Fe2Ti в твердом растворе на ос-
нове кобальта.
250
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1, Koster W. и. Geller W. — Arch. Eisenhiittenw., 1935, Bd 8, № 10,
S. 471—472.
2. Austin C. R., Samans С. H. — Trans. AIME, 1941, v. 141, № 2, p. 216.
ЖЕЛЕЗО — КОБАЛЬТ — УГЛЕРОД
Растворимость углерода в сплавах системы железо—кобальт исследова-
ли методом химического анализа [Ц. Сплавы изготавливали индукци-
онной плавкой в инертной атмосфере и
насыщали углеродом при 1000 °C в тече-
ние 72 ч. Показано, что повышение со-
держания кобальта в сплавах приводит
к уменьшению растворимости в них уг-
лерода (рис. 267).
В работе [2] сделали попытку опре-
делить растворимость углерода в ферри-
те в сплавах Fe-0,03 % (по массе)
С-0,9 % (по массе) Со и Fe-0,03 % (по
массе) С-4,53 % (по массе) С. Сплавы
закаливали с 730, 800, 900, 1000, 1100 °C.
Рис. 267. Растворимость угле-
рода в сплавах системы Fe—Со
и исследовали с использованием метода
внутреннего трения.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Fray D. Chipman J. — Trans. AIME, 1969, v. 245, № 5, p. 1143—
1144.
2. Агеев В. С., Тихонова И. В., Морозюк А. А., Головин И. С. — Сб.
Взаимодействие дефектов кристаллической решетки и свойства ме-
таллов. Тула: 1979, с. 137—143.
ЖЕЛЕЗО — КОБАЛЬТ — УРАН
Методами микроструктурного, термического, дилатометрического и
рентгеновского анализов исследовали сплавы системы в области соста-
вов U—UFe2—UCo2—и[Ц. Сплавы выплавляли в дуговой печи в ат-
мосфере аргона из урана атомной чистоты, железа, переплавленного в
высоком вакууме и кобальта чистотой 99,99 %. Сплавы отжигали в от-
качанных кварцевых ампулах при 820 °C, 2 ч; при 800 °C, 3 ч; при
750 °C, 4 ч; при 700 °C, 12 ч; при 600 °C, 72 ч; при 500 °C, 240 ч.
На рис. 268 приведена поверхность ликвидус исследованной части
системы. Соединения UFe2 и UCo2 по своей кристаллической природе
относятся к фазам Лавеса со структурой типа MgCu2 (С15) и между
ними образуется непрерывный ряд твердых растворов [2J. Политерми-
ческий разрез UFe2—UCo2 (рис. 269) является квазибинарным, по это-
му разрезу проведена триангуляция системы железо — кобальт — уран
с выделением вторичной системы U—UCo2—UFe2. При 730 °C в сплавах
системы протекает четырехфазное нонвариантное превращение перитек-
9*
251
Рис. 268. Поверхность ликвидус части системы
Fe—Со—U:
1 — трехфазные области
10 20 30 40 50 ВО
Рис. 269. Политермический раз-
рез UFej—UC02 системы Fe—
Со—U
тического типа ж + UCo^U6(Fe, Со) +
+ U(Fe, Со) 2, которое хорошо видно на
пространственном изображении системы
(рис. 270). К этому превращению от высо-
ких температур подходят две трехфазные
области: ж+и6(Ре, Co)+UCo и ж+
+U(Fe, Co)2+UCo. Последняя из этих
областей хорошо видна на изотермиче-
ском разрезе при 750 °C (рис. 271). От
плоскости нонвариантного превращения
отходят две трехфазные области, одна
из которых U6(Fe, Со)+UCo+U(Fe, Со)2
хорошо прослеживается на изотермичес-
ком разрезе системы при 700 °C (рис.
272). Вторая трехфазная область ж+
+ U6(Fe, Co)+U(Fe, Со)2 при 725°C за-
кончила свое существование по эвтекти-
ческой реакции в двойной системе U—
UFe2. Период решетки соединения UFe2
а=0,7036 нм, период решетки UCo2 а—
= 0,699 нм.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I. Petzow С., Sampaio О. А. — Z. Metallkde, 1965, Bd 56, № I, S. 14—20.
2. Petzow G.. Steeb S. — 3rd U. N. Internal. Conf, Peaceful Uses Atom
Energy, 1964 (Preprint), № 475, p. 15.
252
Рис. 270. Пространственное изображение системы Fe—UC02—
UFes
ЖЕЛЕЗО — КОБАЛЬТ — ФОСФОР
UFez
Со, % lam.)
Рис. 271. Изотермический разрез системы U—UFes—
UC02 при 750 °C
Сплавы системы исследовали методами микроструктурного, термическо-
го и рентгеновского анализов в области концентраций между стороной
железо—кобальт и разрезом Fe2P—Со2Р [Ц.
Разрез Fe2Co—Со2Р является квазибинарным, перитектического ти-
па с очень узкой гетерогенной областью и с широкими областями твер-
дых растворов этих соединений. Твердый раствор на основе соединения
Рис. 273. Поверхность ликвидус части системы Fe—Со—Р
Рис. 272. Изотермический разрез системы U—UFea—
UC02 при 700 °C
Fe2P имеет гексагональную решетку, а на основе соединения Со2Р —
псевдогексагональную.
На рис. 273 приведена проекция поверхности ликвидус системы
Fe—Fe2P—Со2Р—Со. В исследуемой области концентраций можно
выделить пять областей первичной кристаллизации:
— область «-твердого раствора на основе железа — FeeiPifti;
— область у-твердого раствора на основе кобальта — п1Р[Р2е2Со-,
— область гексагонального твердого раствора на основе Fe2P—
n2(Fe2P)n3P3;
— область псевдогексагонального твердого раствора на основе
Со2Р—п3 (Со2Р) е2Р2Р3;
— область твердого раствора (Fe, Со)3Р па основе Fe3P, e\ti2P2P\.
Установлено наличие четырех нонвариантных равновесий, а именно:
трех перитектического типа, которые протекают при температурах 1015,
1010 и 1002 °C по реакциям (1) — (3) и одного перитектоидного типа,
протекающего при температуре 940 °C по реакции (4):
ж(Р0 +«^±(Fe, Со)3Р+у; (1)
ж(Р3) + (Ре, Со)2Р (гекс.)(FeCo)3Р+(FeCo)2Р (псевдогекс.) (2)
ж(Р2) +(FeCo) 3Р^у+(FeCo) 2Р (псевдогекс.); (3)
(Fe, Со)3Р + + (Fe, Со)2Р. (4)
В работе [2] была изучена растворимость Р в a-Fe при содержании
5; 8 и 10 % (ат.) Со и установлено, что в равновесии с a-твердым рас-
твором на основе железа в сплавах системы находится промежуточная
фаза (Fe, Со)3Р или твердый раствор кобальта в фосфиде Fe3P.
254
255
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Berak J. — Arch. Eisenhiittenw., 1951. Bd 22, № 2, S. 131—135.
2. Nishizawa T., Ko M. — J. Jap. Inst. Metals, 1979, v. 43, № 2, p. 126—
135.
ЖЕЛЕЗО — КОБАЛЬТ — ХРОМ
Сплавы системы исследовали методом рентгеновского анализа [Ц.
Сплавы получали в вакуумной индукционной печи. Исходными мате-
риалами служили армко-железо, кобальт чистотой 99 % с содержанием
0,92 % Fe; 0,03 % Си; 0,02 % S, а также хром чистотой 95 % с 3,5 % Fe
и 1,5 % Ni. Слитки прокатывали на прутки диаметром ~7 мм, отжига-
Рис. 274. Изотермический разрез системы Fe—Со—Сг при
600 °C
системы Fe—Со—Сг
Рис. 275. Изотермический
при 20 °C
Рис. 276. Граница т/а+р в сплавах
системы Fe—Со—Сг при 1200 °C
разрез
ли в откачанных кварцевых ампулах. Предварительно сплавы гомогени-
зировали при 1150—1200 °C в течение 12 ч. Продолжительность отжига
при 600 и 700 °C в случае сплавов с о. ц. к. кристаллической решеткой
составляла 500 ч, в случае г. ц. к. — 1000 ч.
На рис. 274 приведен изотермический разрез системы при 600 °C.
Имеется область непрерывных твердых растворов со структурой ст-фа-
зы, простирающаяся от стороны железо — хром к стороне хром — ко-
бальт. По мере снижения температуры сплавов фазовое строение упро-
щается. При комнатной температуре (рис. 275) область твердых
растворов на основе кобальта с гексагональной решеткой — е-фаза —
проникает глубоко в тройную систему.
Диаграмма состояния системы во всем концентрационном интерва-
ле исследована в работе [2].
256
Методами микроструктурного и рентгеновского анализов определя-
ли коэффициенты распределения хрома и кобальта К q- и Д Со соот-
ветственно между а- и у-твердыми растворами [3]. Сплавы приготовля-
ли в атмосфере аргона, прокатывали при 1150°C с обжатием 30—50 %,
отжигали при 1000—1200 °C, 25—100 ч, и закаливали в воде. На части
изотермического разреза системы при 1200 °C (рис. 276) показана гра-
ница у/а+у, рассчитанная по экспериментально найденным величинам
^Сг и % Со-
Положение фазовых границ в сплавах системы рассчитано для
1700, 1500, 1473, 1300, 1200 и 1175 К [4, 5]. На рис. 277 приведен изо-
термический разрез системы при 1473 К по данным термодинамическо-
го расчета [5].
257
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Koster W., Hofmann G. — Arch. Eisenhiittenw., 1959, Bd 30, № 4,
S. 249—251.
2. Свечников В. И., Спектор А. Ц., Майстренко Е. Е. — Вопросы физики
металлов и металловедения, 1959, № 10, с. 168—181.
3. Kralik F., Kovacova К.— Kovove mater., 1973, t. 11, № 1, s. 6—13.
4. Kaufman L., Nesor H.— Met. Trans , 1974, v. 5, № 7, p. 1617—1621.
5. Kaufman L., Nasor H.—Met. Trans., 1975, v. 6, № 11, p 2115—2122.
ЖЕЛЕЗО - КОБАЛЬТ — ЦЕРИЙ
Сплавы системы исследовали 1 методом термического анализа. Сплавы
получали в дуговой печи с нерасходуемым электродом в атмосфере ар-
Рис. 278. Поверхность ликвидус системы Fe—Со—Се
Се
Рис. 279. Изотермический разрез части системы
Fe—Со—Се при 450 СС
1 Critchley J. К. — Atomic Energy Res. Establ., 1959, № 4488, p. 17.
258
гона. Исходными материалами служили железо и кобальт спектраль-
ной чистоты, церий с содержанием 0,5 % Fe и 0,5 % неметаллических
примесей.
На рис. 278 показана поверхность ликвидус изученных сплавов си-
стемы, а на рис. 279 — изотермический разрез изученной части системы
при 450 °C. При 400 °C из жидкости, содержащей 2,2 % Fe и 9,4 % Со(
кристаллизуется тройная эвтектика а-Се, Се3Со и Се (Со, Fe)2.
ЖЕЛЕЗО — КОБАЛЬТ — ЦИНК
Сплавы системы исследовали методом микроструктурного анализа, оп-
ределяли магнитные свойства [1]. Приведена проекция поверхности кри-
сталлизации этой системы и показано, что к стороне железо — кобальт
примыкает большая область первичной кристаллизации у-твердого рас-
твора. В качестве исходных веществ использовали порошок карбониль-
ного железа, содержавшего <0,03 % С и 0,08 % Ni и некоторое коли-
чество кислорода, порошок карбонильного кобальта с 0,0075 % Са;
0,028 % Си; 0,07 % Fe; 0,2 % Ni и цинк чистотой 99,995 %.
При изучении политермического разреза с 30 % (по массе) Zn и
трех изотермических разрезов во всей области концентраций при 800
(рис. 280), 650 и 500 °C новых фаз, кроме фаз, присутствующих в двой-
ных системах, на этих разрезах не обнаружили [1]. Фаза у имеет г. ц. к.
решетку, фаза а — о. ц. к., фаза а' представляет собой упорядоченную
фазу состава FeCo, фаза |3i имеет решетку p-Мп с 20 атомами в эле-
ментарной ячейке, фаза Г имеет кубическую решетку с 52 атомами в
элементарной ячейке.
259
Рассмотрено влияние магнитных превращений на искажение Сино-
дальной кривой в системе [2].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Koster W., Schmid Я.—Arch. Eisenhiittenw., 1956, Bd 27, № 3
S. 211—217.
2. Miodownik A. P. — Bull. Alloy Phase Diagr., 1982, v 2, № 4 n 406_
412. ’ 1
ЖЕЛЕЗО — КРЕМНИЙ — ЛАНТАН
Методами микроструктурного и рентгеновского анализов, а также из-
мерением микротвердости исследовали 1 сплавы системы. Сплавы гото-
вили в дуговой печи в атмосфере очищенного аргона; исходными мате-
риалами служили карбонильное железо чистотой 99,96 %, кремний чис-
тотой 99,99 %, лантан чистотой 99,48 %. Сплавы с содержанием до 33 %
(ат.) La отжигали при 800 °C, 100 ч, и при 600 °C, 150 ч, в откачанных
Рис. 281. Изотермический разрез системы Fe—Si—La при 900 °C
кварцевых ампулах и закаливали в воде. Сплавы, содержащие 33—
100 % (ат.) La, отжигали в откачанных квапцевых ампулах только
при 600 °C.
На рис. 281 изображен изотермический разрез системы при 900 °C.
В сплавах системы существует пять интерметаллических тройных со-
единений. При 7,14 % (ат.) La и в интервале 12,5—22,5 % (ат.) Si су-
1 Бодак О. И., Гладышевский Е. И. — В1сник JIbBiB. Ун-ту. Сер. xim., 1972,
вип. 14, с. 29—34.
260
ществует соединение LaFen,3-i,8Sii,7-3,2, которое находится в равно-
весии с соединением LaFe2Si2. При 20 °/о (ат.) La существует еще одно
тройное соединение LaFei,3Si2,7. На изоконцентрате с 33 °/о (ат.) La
подтвердили существование соединения LaFeSi. Вдоль этой изокон-
центраты располагается еще одно тройное соединение LaFeo,3-o,5Sii,7-i,5,
которое содержит от 50 до 57 % (ат.) Si. На рисунке эти соединения
обозначены цифрами 1—5 соответственно.
Определили структуру соединения LaFe2Si2, которая относится к
типу GeGa2Al2, пространственная группа /4/mmm, а=0,4042 нм, с=
= 1,014 нм. Структуру соединения LaFei,3Si2,7 установить не удалось.
Структура остальных соединений была изестна ранее.
ЖЕЛЕЗО — КРЕМНИЙ — МАРГАНЕЦ
Сплавы системы исследовали методами рентгеновского [1, 3], микро-
рентгеноспектрального [2], микроструктурного и термического [2, 3] ана-
лизов. Сплавы изготавливали [1]. в дуговой печи в атмосфере аргона,
отжигали в откачанных кварцевых ампулах при 950 °C в течение 8 сут.
Рис. 283. Политермический разрез
Fe—(Si : Mn=l : 1) системы Fe—Si—
Мп в области а-’-Р-превращения
Рис. 282. Изотермический разрез систе-
мы Fe—Si—Мп при 950 °C в области
существования соединений Mn5Si—
MnSi
На рис. 282 приведен изотермический разрез системы при 950 °C в
области существования соединений Me5Si3—MeSi, где Me— Мп или Fe.
В системе образуются два ряда твердых растворов: MngSi3—Fe5Si3
(тип Mn5Si3) и MnSi—FeSi (тип FeSi), между которыми существует
двухфазная область.
Исследовали некоторые особенности фазовых равновесий в сплавах,
богатых железом [2J. На рис. 283 приведен политермический разрез
Fe—Si :Mn=I : 1 в области а/|3-превращения.
Исследовали сплавы политермического разреза MnSii,72—FeSi2
тройной системы [3]. Сплавы синтезировали ампульным методом из
261
чистейших исходных материалов. Разрез MnSii,72—FeSi2 квазибинар-
ный эвтектического типа. Эвтектика кристаллизуется при 60 % (мол.)
MnSii,72+40 % (мол.) FeSi2. Область твердых растворов на основе
FeSi2 при 900 °C распространяется до 20 % (мол.) MnSii,72.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Aronsson В. — Acta chem. scand., 1958, v. 12. № 2, p. 308—312.
2. Jashira K., Shibuja K-, Nishizawa T. — J. Jap. Inst. Metals, 1973, v. 37,
№ 12, p. 1305—1313.
3. Абрикосов H. X., Иванова Л. Д., Петрова Л. И. — Изв. АН СССР.
Неорган. материалы, 1974, т. 10, № 12, с. 2226—2227.
ЖЕЛЕЗО — КРЕМНИЙ — МЕДЬ
Сплавы системы исследовали 1 2 методами микроструктурного, рентгенов-
ского и термического анализов. Сплавы синтезировали ампульным ме-
t,°C
1200
1000
800
ООО
О 20 40 60 80 100
FeSij, cu3Si; % (мол.) CiijSi
Рис. 284. Политермический разрез
FeSi2— Cu3Si системы Fe—Si—Си
тодом, давление аргона в ампулах
составляло 332 гПа. Отжигали
сплавы при 750 °C 200 ч, охлаж-
дали на воздухе. Исходными ма-
териалами служили железо карбо-
нильное особой чистоты с суммар-
ным содержанием примесей
— 0,01 %, кремний зонноочищен-
ный, поликристалшический, медь
особой чистоты с Суммарным со-
держанием примесей —0,004 %.
На рис. 284 приведен политер-
мический квазибинарный разрез
эвтектического типа системы
FeSi2—Cu3Si. Соединение FeSi2 при
960 °C претерпевает полиморфное
превращение.
ЖЕЛЕЗО — КРЕМНИЙ — МОЛИБДЕН
Сплавы системы исследовали методами микроструктурного [1, 2], терми-
ческого [1] и рентгеновского [2] анализов.
Изучены сплавы в области составов Fe—FeSi—MoSi2—Мо [1].
Сплавы готовили в печи Таммана в корундовых тиглях или тиглях, из-
готовленных из пифагоровой смеси. Исходными материалами служили
железо высокой чистоты, технический .кремний и молибденовая жесть
с содержанием 0,005 % С; 0,28 % Мп; 0,025 % S и 0,22 % Р.
На рис. 285 приведена поверхность ликвидус исследованной части
системы. Обнаружили кристаллизацию двух тройных соединений 7\ и
Т2. Фазе Ti отвечает состав Fe2MoSi2, фазе Т2 — Fe3Mo2Si. Фаза Л
плавится инконгруэнтно при 1440 °C, фаза Т2— конгруэнтно при
1610°C. Состав фазы2 1\— 42,5 % Fe; 34,5 % Мо; 23 % Si; состав фа-
зы Т2 — 42 °/о Fe, 49 % Мо, 9 % Si. В исследуемой части системы кри-
сталлизуются две тройные эвтектики: Ei^FeTB.p+FeSi + ri при 1170 °C,
E2^±FeSi + Ti + MoSi2 при 1331 °C. Микротвердость фазы Т\ — 11 ГПа,
1 Абрикосов Н. X., Петрова Л. И. — Изв. АН СССР, Неорган. материалы,
1975, т. II, № 2, с. 223—225.
2 Проценты по массе.
262
Т2— 12 ГПа. В точках Ui, U2, U3, U4, U5 протекают нонвариантные че-
тырехфазные превращения перитектического типа.
На рис. 286 изображено фазовое строение исследованных сплавов
при комнатной температуре, а на рис. 287 политермический разрез
FeSi—Ti изученной части системы.
Исследованы сплавы системы, отожженные при 800 °C в течение
1500 ч [2].
Рис. 286. Фазовое строение сплавов системы Ге—Si—Мо при комнатной
температуре
263
Рис. 287. Политермический разрез FeSi—Л системы Fe—
Si—Mo
Si
Рис 288. Изотермический разрез системы Fe—Si—Мо при
800 °C
На рис. 288 изображен изотермический разрез системы при 800 °C.
Обнаружили существование двух новых тройных фаз Mo3FeSi и
(Моо,17Рео,8з) Si3 (N-фаза). Фаза Mo3FeSi находится в равновесии с
Mo3Si, R-фазой (MogSisFe?) и ц-фазой, являющейся твердым раствором
в Mo6Fe7. N-фаза находится в равновесии с FeSi, фазой 1\ (MoFe2Si2),
264
фазой X] и твердым раствором на основе a-Fe. Подтвердили существо-
вание фазы Т\, имеющей незначительную область гомогенности. Фаза Т\
находится в равновесии с FeSi, MoSi2, M05S13, Zi и N фазами. Найден-
ное ранее соединение MoFeSi оказалось твердым раствором на основе
МоРег, стабилизированным кремнием. Растворимость кремния в ц-фазе
равна ~ 13,5 % (ат.). Растворимость железа и молибдена в двойных
силицидах незначительна. Стабилизирующее действие кремния на X.]- и
р,-фазы связано с увеличением электронной концентрации при раство-
рении кремния в MoFe2 и Mo2Fe3.
Mo3FeSi принадлежит к тетрагональной сингонии с периодами ре-
шетки: а= 1,2697 нм, с = 0.4891 нм. N-фаза имеет кристаллическую
структуру типа Mn5Si3. Структура MoFe2Si2 принадлежит к ромбиче-
ской сингонии с периодами решетки: а=0,494±0,005 нм; &=1,288±
±0,005 нм; с= 1,541 ±0,005 нм.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R., Gerhardt R.— Arch. Eisenhiittenw, 1961, Bd 32, № 1,
S. 47—56.
2. Сколоздра P. В., Гладышевский E. И. — Изв. АН СССР. Неорган.
материалы, 1966, т. 2, № 8, с. 1448—1453.
ЖЕЛЕЗО — КРЕМНИЙ — НИКЕЛЬ
Исследовали сплавы системы методами микроструктурного, дилатомет-
рического и магнитного анализов [1],. Рассмотрены также некоторые осо-
бенности взаимодействия силицидов FeSi2 и NiSi2 [2].
Рис. 289. Политермические разрезы системы Fe—Si—Ni с постоянным
содержанием железа 70 % (с) и 63 % (б)
NL, % (по массе)
265
Рис. 290. Политермические разрезы
содержанием никеля 30 % (а) и 35 %
(б)
На рис. 289, 290 приведены политермические разрезы системы-с по-
стоянным содержанием железа 70 и 63 % и никеля 30 и 35 %. ст-фазе,
существующей в сплавах системы, приписывается стехиометрический
состав FenNisSi^ Образуется эта фаза при —920°C по перитектоидной
реакции а+у-хг в области составов —29 % Ni, 11 % Si и 60 % Fe.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Takeda S., Ywama Y., Sakakura A. — J. Japan Inst. Metals, 1960, v. 24,
№ 8, p. 534—538.
2. Сидоренко Ф. А., Мирошников Л. А., Гельд П. В. — Порошковая ме-
таллургия, 1968, № 4 (64), с. 53.
ЖЕЛЕЗО — КРЕМНИЙ — НИОБИЙ
Результаты исследования сплавов системы методами микроструктурного
и рентгеновского анализов содержатся в работе [1]. Сплавы получали в
дуговой печи с нерасходуемым вольфрамовым электродом в атмосфере
аргона. Исходными материалами служили железо чистотой 99,9 %,
кремний чистотой 99,9 °/о. ниобий чистотой 99,9 %. Гомогенизировали
сплавы в откачанных кварцевых ампулах при 1100 °C в течение 72 ч.
На рис. 291 изображен изотермический разрез изученной части си-
стемы при 1100сС. Фаза ц (на основе соединения Nb6Fe7) узкой по-
лосой проникает в тройную систему [до 10 °/о (ат.) Si] вдоль изокон-
центраты с 50 % (ат.) Fe. Твердый раствор кремния в фазе NbFe2 с
решеткой типа С14 распространяется в тройной системе до 25 % (ат.)
Si. Двойная фаза NbFe2 при 1100 °C гомогенна в интервале составов
64—72 % (ат.) Fe. Ширина этой области сохраняется и в тройных
сплавах. Твердый раствор на основе ц-фазы находится в равновесии
с твердыми растворами на основе a-Nb, Nb5Si3, NbFe2. Твердый раствор
на основе NbFe2 находится в равновесии с фазами ц и Nb5Si3.
Рис. 291. Изотермический разрез части системы F—Si—
Nb при 1100 °C
Диаграмма состояния системы подробно исследована в работе [2],
однако ряд соединений, установленных в этой работе не получили под-
тверждения в последующих исследованиях.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Singh В. N., Gupta К. Р. — Met. Trans., 1972, v. 3, № 6, р. 1427—1431.
2. Goldschmidt Н. J. — J. Iron a. Steel Inst., 1960, v. 194, № 2,
p. 169—180.
ЖЕЛЕЗО — КРЕМНИЙ — ОЛОВО
Методами микроструктурного и термического анализов исследовали1
сплавы системы в области Fe — фаза £—Sn, где L. — твердый раствор на
основе FeSi2. Сплавы готовили в печи Таммана в тиглях из пифагоро-
вой массы. Исходными материалами служили железо высокой чистоты,
химически чистый кремний и олово. В двойной системе железо — олово
существует ряд интерметаллических соединений: Fe2Sn, Fe3Sn2, у-фаза,
FeSn, FeSn2. Все они образуются по перитектическим реакциям при
температурах ниже 940 °C и, как правило, образуют довольно широкие
двухфазные области (соединение плюс расплав). При температуре вы-
ше 1132°С в двойной системе железо — олово в интервале составов
60—83 % Sn протекает монотектическая реакция расслоения расплава
на две несмешивающиеся жидкости Ж1 и ж2. Эта область несмешивае-
мости переходит в тройную систему железо — кремний — олово, по-
верхность ликвидус которой характеризуется обширной областью рас-
слоения, простирающейся до 60 % Si, — рис. 292. Критическая точка
купола расслоения Ко расположена при (по массе): 6,3 % Fe; 39,5 % Si;
54,2 °/о Sn и температуре 1300 °C.
На рис. 293 показано распределение фазовых областей в сплавах
системы при комнатной температуре.
1 Vogel g., Jungclaus Н. J. — Arch. Eisenhiittenw., 1960, Bd. 31, № 4, S. 243—258.
267
266
268
ЖЕЛЕЗО — КРЕМНИЙ — СЕРА
( ведения о диаграмме состояния системы приведены в работах [1—3].
Ангоры [2], исследовали систему в области составов сплавов, ограничен-
ных на концентрационном треугольнике разрезом FeS—FeSi. На рис. 294
приведена проекция поверхности ликвидус сплавов системы, построенная
но результатам термического и химического анализов. В верхнем углу
рисунка показаны фазовые равновесия в сплавах, богатых серой. В си-
Рис. 294. Поверхность ликвидус системы Fe—Si—S
стеме обнаружена область несмешиваемости двух жидких растворов,
насыщенных кремнием и серой. Критическая точка области несмешива-
емости расположена при концентрации 0.5 % (по массе) Si и темпера-
туре 1330 °C. Установлено наличие тропной эвтектики у + FeSi + FeS, ко-
торая кристаллизуется при 970 °C, 30 % (по массе) S и 0,15 % (по мас-
се) Si.
Определена растворимость серы в сплавах железа с различным со-
держанием кремния [2]. Исходными материалами служили электролити-
ческое железо, кремний чистотой 98 % и сульфид кремния; содержание
таких примесей, как барий, магний, титан, хром, медь в сульфиде было
не более 0,005 % (по массе). Сплавы после горячей прокатки отжигали
в кварцевых ампулах при температурах 1000, 1100 и 1150 °C от 24 до
150 ч. Растворимость серы в сплаве железа с 3,1 % Si составляла
0,01; 0,015; 0,02 % (по массе) при 1000, 1100 и 1150°С соответственно.
Увеличение содержания кремния приводит к уменьшению растворимо-
сти серы. Так, в сплаве железо — 5,1 % (по массе) Si растворимость
серы при 1150°C составляет 0,013 % (по массе).
269
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel Е. — Arch. Eisenhiittenw., 1941, Bd 14, № 5, S. 455.
2. Schurmann E., Schafer K.— Giessereiforschung, 1968, Bd 20, № 1,
S. 21—33.
3. Fiedler H. C. — Trans. AIME, 1967, v. 239, № 2, p. 260—263.
ЖЕЛЕЗО — КРЕМНИЙ — СЕРЕБРО
Исследовали1 сплавы системы методами микроструктурного, рентге-
новского и термического анализов. Сплавы готовили в корундовых тиг-
лях в атмосфере азота, шихтовыми материалами служили армко-желе-
зо, серебро и кремний технической чистоты. Кремний в сплавы вводили
в виде предварительно выплавленной лигатуры FegSig или FeSi
Рис. 295. Поверхность ликвидус системы Fe—Si—Ag
На рис. 295 изображена проекция поверхности ликвидус тройной
системы на плоскость треугольника составов. Двойная система железо—
серебро характеризуется существованием широкой области несмеши-
ваемости жидких расплавов, которая глубоко проникает в тройную
систему. Установили ряд четырехфазных нонвариантных монотектиче-
ских превращений:
Расплав Fi^a-Fe+FeSi + расплав F2 при 1140 °C;
Расплав Рзч^Ре8Ц-Ре2815+расплав F4 при 1198 °C;
Расплав F5=F±Fe2Si5+Si +расплав F6 при 1190 °C.
1 Vogel Massenhausen IF.—Arch. Eisenhiittenw., 1956, Bd. 27, № 2,
S. 143-145.
270
Рис. 296. Политермические разрезы системы Fe—Si—Ag
На рис. 296 приведены политермические разрезы системы, на кото-
рых хорошо видны монотектические превращения в сплавах.
ЖЕЛЕЗО — КРЕМНИЙ — СКАНДИЙ
Сплавы системы изучали 1 методами рентгеновского и микроструктурно-
го анализов после отжига при 800 °C, 750 ч. Сплавы синтезировали пу-
тем плавки смеси компонентов в
гона. Исходными материалами
служили железо карбонильное
чистотой 99,96 %, скандий чис-
тотой 99,96 %, кремний поли-
кристаллический чистотой
99,99 %-
На рис. 297 приведен изо-
термический разрез системы
при 800 °C, на котором цифра-
ми отмечены существующие в
системе 14 тройных соединений.
Составы этих соединений и их
некоторые кристаллохимиче-
ские характеристики приведены
ниже.
1 Гладышевский Е. И., Кон-
гур Б. Я., Бодак О. И., Скворчук
Б. П. — ДАН УССР, 1977, Сер. А.
№ 8, с. 751—754.
электродуговой печи в атмосфере ар-
Sc, % (ат.)
Рис. 297. Изотермический разрез системы
Fe—Si—Sc при 800 °C
271
1 Номер 1 (см. рис.) Соединение Простран- ственная группа или сингония Стр уктур- ный тип Периоды решетки, нм
состав а ь С
1 (Sc, Fe)5 Si3 P&lmcm Mn5Si3 0,6763 — 0,4718
2 ~ ScFe5Si3 Структура не известна
3 ~ ScFe3Si6 Гекс. — 0,3893 — 1,516
4 Sc (ScOio3FeOi784X XS0 84)12 ThMn12 0,8304 — 0,4716
5 ScFe4Si2 P^lmnm ZrFe4Si2 0,6947 — 0,3796
6 ScFe2Si2 Pbcm HfFe2Si2 0,7263 0,7076 0,5009
7 Sc2Fe3Si5 РЩтпс Sc2Fe3Si5 0,1005 0,5313
8 ScFeSi2 Ромб. TiFeSi2 0,9739 0,8984 0,7795
9 ~Sc3Fe3Si4 Структ? /ра не извест! ia
10 ~Sc3Fe2Si6 Ромб. — 0,509 1,873 1,412
11 Sc (Sc, Fe, Si)2 Fd3m MgCu2 0,7038 — —
12 Sc2Fe3Si P6s/mmc Mg2Cu3Si 0,4962 — 0,8079
13 ScFeo25Sii<75 Cmctn ZrSi2 0,3861 1,448 0,3762
14 ~Sc2FeSi2 Структ} rpa не известна
ЖЕЛЕЗО — КРЕМНИЙ — СУРЬМА
Сплавы системы исследовали 1 методами микроструктурного и термиче-
ского анализов. Сплавы готовили в тиглях из пифагоровой смеси, ших-
товые материалы имели достаточно высокую чистоту. Плавку проводи-
ли под слоем хлористого бария.
Поверхность ликвидус системы приведена на рис. 298. Система ха-
рактеризуется образованием широкой области несмешиваемости жидких
растворов и возникновением ряда четырехфазных нонвариантных пре-
вращений монотектического, эвтектического и перитектического типов.
Так, в точке F3 при 1196 °C возникает четырехфазное равновесие: рас-
плав Резч^расплав F4+^+FeSi. При 119Г°С в точке F\ протекает реак-
ция: расплав Г^расплав P2 + ^+Si. При 728 °C протекает четырехфаз-
ное превращение перитектического типа H+'r]^>FeSi+FeSb2. На поли-
термических разрезах системы (рис. 299) хорошо прослеживаются
области расслоения растворов, существующие в системе.
На рис. 300 показано фазовое строение исследованных сплавов при
комнатной температуре.
1 Zwitigmann G., Vogel R. — Arch. Eisenhiittenw , 1957, Bd. 28, № 9, S. 591—595.
272
Sb, % (по массе]
Рис. 298. Поверхность ликвидус системы Fe—Si—Sb
Рис. 299. Политермические разрезы системы Fe—Si—Sb
273
Sb, % (no массе)
Рис. 300. Фазовое строение сплавов системы Fe—Si—Sb при ком-
натной температуре
ЖЕЛЕЗО — КРЕМНИЙ — ТИТАН
Методом дилатометрического анализа исследовали влияние небольших
добавок кремния и титана на положение температуры превращения Лез
в сплавах [1],; проведены также микроструктурные и рентгеновские ис-
следования сплавов системы [2]. Сплавы [1] готовили в индукционной
Si,% [помассе]
Рис. 301. Влияние кремния и титана на темпера-
туру превращения Асз в сплавах системы
Fe—Si—Ti
274
печи в алундовых тиглях. Исходными материалами служили армко-же-
лезо; кремний чистотой 99,86 %, титан чистотой 98,5 %. На рис. 301
показано влияние кремния до 1,8 % и титана до 0,8 % на температуру
Лсз-превращения в тройных сплавах.
Сплавы [2] готовили в дуговой печи в атмосфере очищенного арго-
на. Исходными материалами служили железо карбонильное чистотой
99,98 %, кремний поликристаллический чистотой 99,99 %, титан иодид-
ный чистотой 99,97 %. Огжигали сплавы в откачанных кварцевых ампу-
Рис. 302. Изотермический разрез системы Fe—Si—Ti при 800 °C
лах при 800 °C в течение трех месяцев. На рис. 302 приведен изотер-
мический разрез системы при 800 °C. В сплавах системы образуется
пять тройных соединений: TiFeSi2, ~Ti46FeioSi44(X,)> ~Ti45Fei5Si4o(Xv),
Т112ре5281зб(тз), TiFeSi.
Соединение TiFeSi2 имеет некоторую область гомогенности, осталь-
ные характеризуются постоянными составами. В соединении TiFe2 рас-
творяется до 27 % (ат.) Si. Область гомогенности твердого раствора
Ti(FeSi)2 вытянута вдоль изоконцентраты 33,3 % (ат.) Ti.
Соединение TiFeSi2 имеет ромбическую решетку с периодами: ц =
=0,746 нм, 6 = 0,953 нм, с=0,856 нм, число атомов в элементарной ячей-
ке соединения 44. Кристаллическая решетка соединения TiFeSi гексаго-
нальная с периодами а=0,624 нм, с = 0,696 нм, число атомов в элемен-
тарной ячейке соединения 18. Фаза тз имеет также гексагональную ре-
шетку а—1,697 нм, с=3,179 нм. Кристаллическая структура фаз X' и X"
не определена.
275
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Bente G., Fishel W.— J. Metals, 1956, v. 8, № 10, Sec. 2, p. 1345—
1348.
2. Маркие В. Я., Лысенко Л. А., Гладышевский Е. И. — Изв. АН СССР,
Неорган. материалы, 1966, т. 2, № И, с. 1980—1984.
ЖЕЛЕЗО — КРЕМНИЙ — УГЛЕРОД
Исследованы сплавы системы методами микроструктурного [1—3] и тер-
мического [1] анализов. Изучены сплавы [1], с содержанием кремния до
25 % и углерода до 5,5 %. Построена поверхность ликвидус (рис. 303)
Рис. 303. Поверхность ликвидус части системы Fe—Si—С
текает перитектическая реакция между а- и у-твердыми растворами и
расплавом; аналогичная реакция между аН-си (FeeSi) твердыми раство-
рами и расплавом осуществляется по линии По линии EBEt кри-
сталлизуется эвтектика FesSi+FeSi.
Приведены политермические разрезы метастабильной системы Fe—
Si—С для сплавов, содержащих 0,25; 0,5 и 0,7—0,8 % (по массе) С
(рис. 304). Сплавы изготавливали из армко-железа, синтетического чу-
гуна, полученного на основе армко-железа и древесного угля, и
75 %-ного ферросилиция плавкой в индукционной печи с магнезитовым
тиглем. Сплавы отжигали в течение 1—30 мин в расплавленной соли
при 740, 790, 820, 840, 870, 900, 950, 1000 и 1100 °C и закаливали в во-
де. При содержании кремния в пределах ц=с в сплавах разрезов при
820 °C осуществляется четырехфазное превращение: А+/<-*Ф+Д где
А — аустенит; К — карбиды; Ф — феррит; Ц — цементит. При избытке
К в интервале b—с превращение заканчивается образованием Ф+Ц +
+К, при избытке А в интервале а—Ь — образованием Ф + Ц. Эти дан-
276
ные хорошо согласуются с результатами исследования сплавов систе-
мы с содержанием 0,3—2,5 % (по массе) С и 3,4 и 5 % (по массе)
Si [3].
Рис. 304. Политермические разрезы метастабильной си-
стемы Fe—Si—С с 0,25 {вверху)-, 0,5 (посередине) и 0,7—
0,8 % С (внизу)
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Schiirmann Е., Hirch J. — Giesserei, 1966, Bd 53, № 12, S. 198—400.
2. Горев К. В., Шевчук Л. А., Дудецкая Л. Р. — ДАН БССР, 1968,
т. 12, № 2, с. 136—139.
3. Малиночка Я. II., Ковальчук Г. 3., Слинько Л. А. — Металлофизика:
Респ. межвед. сб. Киев: Наукова думка, 1974, вып. 56, с. 91—95.
ЖЕЛЕЗО — КРЕМНИЙ — УРАН
Сплавы системы исследовали 1 методами микроструктурного и термиче-
ского анализов, проводили измерение твердости.
1 Бадаева Т. А., Алексеенко Г. К., Александрова Л. Н. — В кн.: Строение
и свойства сплавов для атомной энергии. М.: Наука, 1973, с. 38—45.
277
U 20 U3Si
Si, % (am.)
Рис. 305. Нонвариантное превраще-
ние в сплавах системы Fe—Si—U
при 800 °C
Сплавы получали в дуговой пе-
чи на медном водоохлаждаемом под-
доне с нерасходуемым вольфрамовым
электродом в атмосфере чистого ар-
гона. Гомогенизировали сплавы при
750 °C, 240 ч. Исходными материала-
ми служили армко-железо, кремний
полупроводниковый, уран компактный
чистотой 99,76 %.
Схема реакций в области спла-
вов, богатых ураном, показана на
рис. 305. В сплавах системы при
810 °C реализуется четырехфазное
нонвариантное равновесие: ж+у^
^UeFe-f-UaSiz, возникающее в резуль-
тате наложения в тройной системе
двух равновесий, исходящих из двой-
ных систем жч^+иг812 (985 °C) и
ж+у=^и6Ре (815°C).
ЖЕЛЕЗО — КРЕМНИЙ — ФОСФОР
Исследовали 1 сплавы системы в области составов Fe—FeP2—SiP—Si
методами микроструктурного и термического анализов. Сплавы готовили
1 Vogel R., Gieben. В. — Arch. Eisenhiittenw., 1959, Bd. 30, № 10, S. 619—626.
Рис. 306. Поверхность ликвидус системы Fe—Si—Р
278
и печи Таммана в тиглях из пифагоровой массы. Исходными материа-
лами служили армко-железо, фосфор и кремний, которые вводили в
сплав в виде лигатуры £-фазы в сплавах железо—кремний и соединения
Г’еРг. Плавку проводили под слоем шлака, состоящего из смеси хлори-
дов бария и калия.
Рис. 308. Фазовое строение сплавов системы Fe—Si—Р при
комнатной температуре
На рис. 306 приведена поверхность ликвидус исследованной части
системы. Обнаружили образование в сплавах системы тронного соеди-
нения состава FeSi4₽4 — фаза Т с температурой плавления ~ 1210 °C.
В исследованной части системы кристаллизуются пять эвтектик: Ei, Е3,
Е3, Et, Е$ при температурах 1166, 1095, 1096, 1113 и И16 °C соответст-
венно. В точке Ei протекает реакция жч=ьРе2Р + РеР + Ре81, в точке Е3—
ж^=ьРе81 + РеР + Ре814Р4; в точке Е3 — x^tFeSi4-^ + FeSi4P4; в точке
£4 — ж^£+81 + Ре81'4Р4; в точке Е$— ж^81Р + 81 + Ре814Р4-
279
Рис. 309. Изотермический разрез системы Fe—Si—Сг при 900 °C
На рис. 307 приведен политермический квазибинарный разрез FeP —
FeSi эвтектического типа. Фазовое строение сплавов системы при ком-
натной температуре приведено на рис. 308.
Рис. 310. Политермический разрез
FeSi2—CrSi2 системы Fe—Si—Сг
ЖЕЛЕЗО — КРЕМНИЙ —
ХРОМ
Сплавы системы исследовали ме-
тодами микроструктурного и рент-
геновского анализов [1]. Сплавы по-
лучали в высокочастотной печи в
корундовых тиглях в атмосфере
аргона, часть сплавов приготовля-
ли в электродуговой печи в атмо-
сфере гелия. Отжигали сплавы в
откачанных кварцевых ампулах
при 900 ° С в течение 400 ч.
На рис. 309 изображен изо-
термический разрез системы при
900 °C. Соединения FeSi и CrSi об-
разуют непрерывные ряды твср
дых растворов, а между соедипе
280
пнями FeSi2 и CrSi2 наблюдается ограниченная растворимость. Также
ограничено растворимы Друг в друге неизоморфные соединения Fe5Si3
(гип Mn5Si3) и Cr5Si3 (тип Mo5Si3). При 900 °C Fe5Si3 растворяет 18 %
(дт.) Сг, a Cr5Si3 — 5% (ат.) Fe. В присутствии примесей углерода
| —1 % (по массе)] соединение Cr5Si3, точнее, тройное соединение
Cr5Si3(C) изоморфно FegSi3; в этих условиях образуется непрерывный
ряд твердых растворов.
При 900°C сг-фаза стабилизируется кремнием и содержит 37—48 %
(ат.) Сг (в двойной системе железо — хром о-фаза образуется ниже
815 °C).
По данным работы [2] политермический разрез £(а)—CrSi2 трой-
ной системы [где £(а)—твердый раствор на основе FeSi2]—квазиби-
нарный, эвтектического типа (рис. 310). Эвтектика кристаллизуется при
1150± 10 °C и — 18 % (мол.) CrSi2. Растворимость хрома в FeSi2 не вы-
ше 1 % (ат.), а растворимость железа в CrSi2 составляет —0,9 % (ат.)
[—2 % (мол.) FeSi2].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Гладышевский Е. И., Борусевич Л. К- — Изв. АН СССР Металлы,
1966, № 1, с. 159—164.
2. Дубровская Л. Б., Гельд П. В. — ЖНХ, 1962, т. 7, № 1, с. 145—150.
ST
Fe 10 20 30 ~
СеГе7 СеГб2
Се, °/а (ат.)
Рис. 311. Изотермический разрез части систе-
мы Fe—Si—Се при 800 °C:
1 — CeFe2Si2; 2 — CeFeSi2; 3 — CeFeSi;
4 — Ce2FeSi3
ЖЕЛЕЗО —
КРЕМНИЙ —
ЦЕРИЙ
Сплавы системы в обла-
сти концентраций 0<-
<-33,3 % (ат.) Се при
800 °C [1, 2] и в области
концентраций 33,3 <-
<-100% (ат.) Се при
400 °C [1] исследовали
методами микрострук-
турного и рентгеновско-
го анализов. В качестве
шихтовых материалов
использовали карбониль-
ное железо чистотой
99,96 %, поликристалли-
ческий кремний чистотой
99,99 % и церий чисто-
той 99,56 %.
Подтверждено суще-
ствование установленных
ранее соединений Ce(Fe,
Si)2 со структурой типа
CeAl2Ga2 (а=0,3991,
с —0,9881 нм) и CeFeSi3
со структурой типа А1В2
(а = 2,4065, с=0,4191
нм), а также найдены
цва новых соединения
CeFeSi2 с ромбической
10—358
281
структурой типа CeNiSi2 (п = 0,4094, b = 1,6854, с=0,4031 нм) и CeFeSi
с тетрагональной структурой (а = 0,4062, с=0,6752 нм).
На рис. 311 приведен изотермический разрез системы при 800 °C.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Бодак О. И., Гладышевский Е. И., Кардаш А. В., Черкашин Е. Е.—
Изв. АН СССР. Неорган. материалы, 1970, т. 6, № 6, с. 1069—1072.
2. Бодак О. И., Гладышевский Е. И. — В кн.: Редкоземельные металлы
и сплавы. М.: Наука, 1971, с. 67—72.
ЖЕЛЕЗО — КРЕМНИЙ — ЦИНК
Сплавы системы исследовали 1 в интервале составов Fe—FeSi—Zn ме-
тодами микроструктурного, рентгеновского и термического анализов.
Ее 10 20 30 90 50 60 70 80 90 ™ Zn
Zn, % (по пассе)
Рис. 313. Политерми-
ческие разрезы систе-
мы Fe—Si—Zn:
а — 95 % Zn;
6 — 98 % Zn
1 Koster W., Godecke T. — Z. Metallkunde, 1968, Bd. 59, № 8, S 605 -613
282
Рис. 312. Изотермиче-
ский разрез части си-
стемы Fe—Si—Zn при
750 °C
Сплавы синтезировали в откачанных кварцевых ампулах. Исходны-
ми материалами служили армко-железо чистотой 99,9 %, кремний чис-
тотой 99,9 %, цинк чистотой 99,9 %. Гомогенизировали сплавы при
850 °C в течение трех дней.
Политермический разрез Zn—FeSi — эвтектического типа, с темпе-
ратурой кристаллизации эвтектики 417°С. Указанный разрез делит си-
стему на две вторичные Fe—FeSi—Zn и FeSi—Si—Zn. На рис. 312
Рис. 314. Фазовое строение сплавов системы Fe—Si—Zn
при комнатной температуре
изображен изотермический разрез системы Fe—FeSi—Zn при 750 °C.
При этой температуре большинство сплавов системы находится еще в
жидко-твердом состоянии. В интервале температур 1170—450 °C реали-
зуется 14 нопвариангных четырехфазных превращений. Некоторые из
этих превращений хорошо прослеживаются на политермических разре-
зах системы (рис. 313). Фазовое строение сплавов системы при комнат-
ной температуре показано на рис. 314.
ЖЕЛЕЗО — МАРГАНЕЦ — МЫШЬЯК
Сплавы системы исследовали 1 методами рентгеновского анализа, ней-
тронографии, а также проводили измерение плотности, магнитной вос-
приимчивости и намагниченности. Сплавы получали ампульным методом
из предварительно синтезированных арсенидов железа и марганца.
1 Selte К., Kjekshus A., Andresen A. F.—Acta Chem. Scahal, 1974, v. A28,
№ 1, p. 61—70.
10* 283
MnAs AF {=ед5
Рис. 315. Политермический раз-
рез MnAs—FeAs системы
Fe—Mn—As
Синтез сплавов осуществляли при 850 СС
в течение 8 сут. Затем все образцы дро-
били и подвергали трем последующим
отжигам при 850 °C с промежуточным
дроблением. Охлаждение после послед-
него отжига проводили в течение трех
суток; часть образцов после последнего
отжига закаливали в воде.
На рис. 315 изображено фазовое
строение сплавов разреза MnAs—FeAs,
обозначено магнитное состояние сплавов:
Р — парамагнитное, AF — антиферромаг-
нитное. Символом Н обозначена гели-
коидальная структура сплава.
МП МП; (по кассе)
Рис. 316. Поли.ермические раз-
резы системы Fe—Mn—Ni:
а — Mn(Fe : Ni=l : 1); б—Мп—
(Fe:Ni=l:4); в — Мп—
(Fe : Ni=4 : 1)
ЖЕЛЕЗО — МАРГАНЕЦ —
НИКЕЛЬ
Сплавы системы исследовали1 мето-
дами микроструктурного и дилато-
метрического анализов, а также про-
водили измерение электрической про-
водимости. Сплавы изготавливали из
армко-железа и электролитических
марганца и никеля Выплавку проводили в корундовых тиглях.
На рис. 316 изображены политермические разрезы системы:
1 Курнаков Н. Н.,
1954, т. 24, с. 132—147.
Тронева И. Я- — Изв. сектора физико-химического анализа.
284
а. Мп—Fe:Ni = l:l; 6. Mn—Fe : Ni= 1 : 4; в. Мп—Fe:Ni=4:l. В ис-
следуемых сплавах обнаружили у-твердый раствор на основе у-Мп,
в котором неограниченно растворяются y-Fe и никель. На основе ин-
терметаллического соединения MnNi образуется е-фаза. В равновесии
принимают участие также твердые растворы на основе а- и 0-Мп.
ЖЕЛЕЗО — МАРГАНЕЦ — ОЛОВО
Исследовали 1 политермический разрез MnSn2—FeSn2 системы. Оба со-
единения FeSn2 и MnSn2 изоморфны и образуют непрерывный ряд твер-
дых растворов с тетрагональной и объемноцентрированной кристалличе-
ской решеткой типа СиА12
4/7/7 -
3/7/7 __________I---------L----------1----------1---------
/7 2/7 4/7 /7/7 <577 //7/7
MnSnz FeSn2? % (пол.) Fe5nz
Рис. 317. Солидус разреза MnSr2—FeSn2 си-
стемы Fe—Мп—Sn
(пространственная группа
lAlmcm). При замещении
железа в FeSn2 марганцем
отношение с/а остается не-
изменным, а периоды а и с
увеличиваются па 20 %. При
нагревании соединения
FeSn2 и MnSn2 распадают-
ся по перитектической реак-
ции. На рис. 317 показана
температура этой реакции
в зависимости от состава
сплавов.
ЖЕЛЕЗО — МАРГАНЕЦ — СЕЛЕН
В откачанных кварцевых ампулах при 600 °C синтезировали 2 сначала
соединение FeSe, полученное в результате взаимодействия тонкой про-
волоки из чистого железа с парами селена. После растирания продук-
тов реакции избыток железа отбирали магнитом. MnSe. получали при
взаимодействии порошка марганца с жидким селеном при 400 °C в те-
чение двух суток с последующим повышением температуры до 600 °C и
выдержкой при этой температуре в течение недели. Использовали не-
большой избыток селена.
На рис. 318, 319 приведены политермические разрезы FeSe—MnSe.
Первый из этих разрезов построен для случая номинального содержа-
ния железа, второй — при его избыточном содержании. Избыток железа
в значительной степени изменяет характер фазовых превращений, про-
текающих в сплавах разреза. При 977±3°С растворяется (по массе)
до 30 % MnSe в FeSe и 48 % FeSe в MnSe с понижением температуры
растворимость MnSe в FeSe уменьшается и при —740 °C составляет
28 %.
На рис. 320 изображена часть диаграммы состояния системы в об-
ласти составов Fe—FeSe—MnSe—Мп. Вероятно, в сплавах системы
при ~920 °C в точке Ех кристаллизуется тройная эвтектика, а при
976 °C — тройная перитектика в точке Р\.
Соединения имеют структуру: a[(Fe, Mn)i-feSe]— типа NiA(BS),
a'[(Fe, Mn)Se] — неизвестную структуру, (3[(Mn, Fe) Se] — типа
NaCl (Bl).
1 Матвеева H. M., Никитина С. В., Зезин С. Б. — Изв. AH СССР, Металлы,
1968, № 5. с. 194—197.
2 Vari Vlack L H. —Met. Trans., 1977, v. B8, Ke 1, p. 47—51.
285
Рис. 318. Поли-
термический раз-
рез FeSe—MnSe
системы Fe—Мп—
Se при номиналь-
ном содержании
железа
Рис. 319. Поли-
термический раз-
рез FeSe—MnSe
системы Fe—Мп—
Se при избыточ-
ном содержании
железа
MnSe, % (помассе)
286
Рис. 320. Элементы диаграммы состояния системы Fe—Мп—Se
ЖЕЛЕЗО — МАРГАНЕЦ — СЕРА
Характерной чертой диаграммы состояния системы является широкая
область несмешиваемости в жидком состоянии, которая распространя-
ется от стороны Мп—MnS до сплавов, богатых железом. Положение
линий, ограничивающих область несмешиваемости, определяли и уточ-
няли в ряде работ [1—5].
Рис. 321. Границы области несмешиваемости в системе Fe—Мп—S
при 1600 °C
Исследована [4] граница области расслоения при 1600 °C. На
рис. 321 приведены коноды для области совместного существования
1вух жидкостей (на основе сплава железа с марганцем и на основе
сульфида MnS) и линия, проходящая через середины конод. Точка К —
критическая точка, на которой заканчивается при 1600 °C граница об-
ласти расслаивания. Разрез Fe—MnS квазибинарный, вследствие чего
система Fe—FeS—MnS—Мп делится на две вторичные системы: Fe—
FeS—MnS и Fe—Мп—MnS.
На рис. 322, а и б показаны линии моновариантных превращений в
системе [4J. Линия монотектического моновариантного превращения по-
нижается от 1580 °C в двойной системе Мп—MnS до точки М2, соответ-
ствующей 1395 °C. При этой температуре в системе реализуется четы-
рехфазное нонвариантное превращение, в равновесии находятся четыре
фазы: жидкость М2 (па основе MnS), жидкость (на основе железа),
твердый раствор на основе MnS и твердый раствор на основе железа.
287
£С
Рис. 322. Проекции линий моновариантных
онный треугольник в системе Fe—Мп—-S
превращений на концентраци-
Состав, соответствующий точке М2:
массе) S; состав, соответствующий
13 % (по массе) S.
Мп, % (по массе)
Рис. 323. Изменение с температурой
состава точек соответствующих линии
монотектического превращения и ли-
ний эвтектического превращения в си-
стеме Fe—FeS—MnS—Мп (сплошные
линии); штриховой линией показан по-
литермический разрез FeS—MnS
Мп; 0,5 % (по массе) S. Авторы
системе реализуются также два нонвариантных четырехфазных превра-
щения— при 1371 и 1004 °C. Последнее связано с эвтектическим пре
вращением ж-э-Fe+FeS, которое в двойной системе протекает при 988 °C.
17 % (по массе) Мп; 30,8 % (по
точке М1: 1,5 % (по массе) Мп,
После точки Af2 линия моно-
тектического моновариантного пре-
вращения продолжает снижаться
до критической точки Д’о при
1370 °C. Линия эвтектического пре-
вращения, идущая от стороны
Мп—MnS, имеет максимум в точ-
ке, соответствующей пересечению
с квазибинарным разрезом Fe—
MnS при 1505 °C. Это температу-
ра эвтектического превращения на
квазибинарном разрезе Fe—MnS.
Изменение положения линий моно-
вариантных превращений с темпе-
ратурой показано на рис. 323 [4|
На этом же рисунке штриховыми
линиями показан квазибинарный
разрез FeS—MnS.
Положение линий эвтектичс-
ского превращения в системе, иду-
щих от стороны Мп—MnS, уточ-
нили в работе [5]. Температура
эвтектического превращения ж->
->F'e + MnS сплавов квазибинар-
ного разреза Fe—MnS составляет
1500+3 °C; эвтектическая точка
расположена при 3,2 % (по массе)
работы [5] полагают, что в тройной
288
Учитывая строение двойных диаграмм состояния систем железо —•
марганец и железо—сера, можно предположить протекание в тройной
системе моновариантных трехфазных превращений с участием фаз на
основе б-Fe и ж.
Марганец снижает растворимость серы в железе в твердом состоя-
нии [6]:
Растворимость серы, % (по массе), при содержании Мп,
% (по массе)
0 0,37 1,07 1,30
1200 0,031 0,0018 0,0007 0,0006
1335 0,046 0,0058 0,0031 0,0018
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R., Baur Н. — Arch. Eisenhiittenw., 1933, Bd 6, № 11, S. 495—
500.
2. Meyer O., Schulte F. — Arch. Eisenhiittenw., 1934, Bd 8, № 5, S. 187—
195.
3. Kbrber A.— Stahl und Eisen, 1936, Bd 56, № 15, S. 433—444.
4. Schurmann E., Strosser H. J. — Arch. Eisenhiittenw., 1975, Bd 46,
№ 12, A. 761—766.
5. Ito Y., Yonezawa N., Matsubara K. — Trans. Iron a. Steel Inst. Jap.,
1980, v. 20, № 1, p. 19—25.
6. Turkdogan E. T., Ignatowicz S., Pearson J. — J. Iron a. Steel Inst.,
1955, c. 180, v. 4, p. 249—354.
ЖЕЛЕЗО — МАРГАНЕЦ — СУРЬМА
Сплавы системы исследовали 1 методами микроструктурного, рентгенов-
ского и термического анализов. Исходными материалами для получе-
ния сплавов служили марганец электролитический, очищенный двойной
вакуумной дистилляцией; сурьма спектрально чистая; железо карбониль-
ное порошковое ВЗ с содержанием основного вещества 99,98 %. Сплавы
Рис. 324. Политермические разрезы системы Fe—Мп—Sb
1 Дюльдина К. А., Поименов И. Л., Кобылкин А. Н. — Изв. АН СССР, Неор-
ганические материалы, 1978, т. 14, № 10, с. 1018—1028.
289
синтезировали путем сплавления рассчитанных количеств компонентов
импульсным методом в высокочастотной печи со вторичной переплавкой
при 1200 °C в вертикальной печи сопротивления. Образцы отжигали в
атмосфере аргона при 650 °C в течение 14 сут., закаливали в холодной
воде.
На рис. 324 приведены политермические разрезы Feo.55Sbo.45—
Mno.55Sbo.45 и Feo.54Sbo.46—Mno.54Sbo.46. Оба эти разреза являются ква-
зибинарными с неограниченным растворением компонентов друг в
друге.
ЖЕЛЕЗО — МАРГАНЕЦ — ТЕЛЛУР
Политермический разрез Fe]i2Te—МпТе представлен 1 на рис. 325. Со-
единение Fei,2Te синтезировали в откачанных кварцевых ампулах при
600 °C из теллура и тонкой железной проволоки; полученный продукт
Рис. 325. Политермический разрез F Те—МпТе системы
Fe—Мп—Те
переплавляли в запаянном железном тигле в атмосфере очищенного ар
гона. Теллурид марганца МпТе получали путем взаимодействия мар
ганцевого порошка и теллура. Избыточный теллур в виде фазы МпТе
удаляли нагревом образцов в вакууме при 600 °C в течение 3—5 ч, чг<>
позволяло получать чистое соединение МпТе. Исследование проводили
методами микроструктурного, рентгеновского и термического анализов
На рис. 326 приведена часть диаграммы состояния системы в об
ласти составов Fe—Fei.aTe—МпТе—Мп. Установлены четырехфазныс
1 Van Vlack L. Н. — Met. Trans., 1977, v. B8, № 1, p. 53-57.
290
Рис. 326. Элементы диаграммы состояния Fe—Мп—Те
понвариантные превращения при температурах 830 °C (точка Pi) и
895 °C (точка М2).
Модификация (Д, или (Fe, Mn)i12Te, имеет структуру типа РЬО (В 10),
а, или (Мп, Fe)Te, — структуру типа NiAs (В8); (Зм, или (Мп, Fe)Te,—
структуру типа NaCI (Bl).
ЖЕЛЕЗО — МАРГАНЕЦ — ТИТАН
Диаграмму состояния системы исследовали в области концентраций,
примыкающей к титановому углу [1—3]. Исследована область сплавов,
богатых марганцем [4], и область концентраций, близких к соединению
I’iFe [5]. Диаграмма состояния в области сплавов, богатых железом, в
ьгих работах приведена предположительно.
На рис. 327 показана проекция поверхности ликвидус. Установлено
два нонвариантных четырехфазных превращения: ж+Т1(Ре, Мп)^
Vi
Fe ?О W 60 60 Мп
Мп, °/о (ат.)
Рис. 327. Поверхность ликвидус системы Fe—Мп—Ti
291
4=fcTiFe + TiMn при 1100 °C и ж^Т1Ее+Т1+Т1Мп при 1050 °C. Состав
жидкой фазы первого превращения соответствует точке Р, а второго —
точке Е.
В системе наблюдается широкая область твердого раствора Ti(Fe,
Мп) 2 [2]. Фазы двойных систем TiFe2 и TiMn2 по кристаллохимической
природе являются фазами Лавеса с одинаковой кристаллической решет-
кой гексагонального типа MgZn2 [6]. Между ними существуют непре-
Рис. 328. Изотермический разрез части системы Fe—Мп—Ti при 1000 °C
рывные твердые растворы. В двойной системе железо—титан в равно-
весии с твердым раствором на основе железа находится фаза TiFe2,
в тройной системе в равновесии с твердым раствором на основе желе-
за находится твердый раствор Ti(Fe, Мп)2.
На рис. 328 приведен изотермический разрез системы при 1000 °C
[4]. Для твердого раствора на основе соединения TiFe2 установлена
ограниченная область гомогенности, которая не доходит до стороны
марганец—титан. Изотермический разрез системы при 1273 К (1000 °C)
теоретически рассчитан в работе [6].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Yotaro М., Toshio Е. — J. Jap. Inst. Metals, 1958, v. 22, № 5, p. 265—
269.
2. Yotaro M., Toshio E. — J. Jap. Inst. Metals, 1958, v. 22, № 6, p. 328—
332
3. Craighead С. M.. Simmons O. W., Eastwood L. W. — Trans. AIME,
1950, v. 188, № 4, p. 514—538.
4. Panigrahu P. C., Gupta К. P. — Trans. AIME, 1969, v. 245, № 7,
p. 1533—1536.
5. Dew-Hughes D. — Met. Trans., 1980, v. 11A, № 11, p. 1219—1225.
6. Dew-Hughes D. — CALPHAD, 1979, v. 3, № 3, p. 175—203.
ЖЕЛЕЗО — МАРГАНЕЦ — УГЛЕРОД
Сплавы системы исследовали методами микроструктурного, рентгенов-
ского, микрорентгеноспектрального [1] и дифференциальнотермического
[2] анализов. В качестве шихтовых материалов [4] использовали угле-
род спектральной чистоты, железо и марганец высокой чистоты. Спла-
вы синтезировали в индукционной печи в атмосфере аргона в тиглях
из ZrO2. Сплавы, содержащие в структуре свободный графит, выплав-
ляли в графитовых тиглях. Отжиг проводили в кварцевых ампулах с
аргоном: 0,5 ч при 1100 °C; 2 сут. при 800 СС; 2 нед. при 600 СС.
Установлены изотермические разрезы системы 1100, 1000, 900, 800,
600 °C. Два из них — при 1000 и 600 °C—приведены на рис. 329.
292
Рис. 329. Изотермический разрез части системы Fe—Мп—С:
вверху — при 1000 °C; внизу — при 600 °C
Политермические разрезы системы для сплавов с содержанием 5,
10 и 20 % (по массе) Мп приведены на рис. 330 [2]. В качестве шихто-
вых материалов использовали древесный уголь, армко-железо, карбо-
нильное железо, электролитический марганец и графит. Сплавы, содер-
жащие до 5 % (по массе), получали расплавлением в высокочастотной
печи в корундовом тигле в атмосфере аргона. Образцы сплавов с 5—
8 % (по массе) С синтезировали прессованием тонких порошков
(0,01 мм) карбонильного железа, марганца и графита и спеканием в ва-
кууме —10~2 Па при 1050 °C, 3 ч. После отжига в откачанных квар-
цевых ампулах при 1050°C 400 ч образцы нагревали до 1100, ИЗО и
1150 °C, 1 ч, и закаливали в воде.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Benz R„ Elliot J. F., Chipman J.—Met. Trans., 1973, v. 4, № 8,
p. 1975—1986.
2. Шевчук Л. А., Дудецкая Л. P., Ткачева В. A. — Литейное производ-
ство, 1976, № 2, с. 7—8.
293
Рис. 330. Политермические разрезы системы
Fe—Мп—С с 5, 10 и 20 % Мп
Рис. 331. Политермический разрез
UFes—UMn2 системы Fe—Мп—U
ЖЕЛЕЗО — МАРГАНЕЦ -
УРАН
Диаграмму состояния системы ис-
следовали со стороны уранового
угла до концентраций, соответст-
вующих разрезу, проходящему че-
рез соединения UFe2 и UMn2 [1—
3]. Квазибинарный разрез UFe2—
UMn2, построенный по результа-
там работы [1], приведен на рис.
331. Соединения UFe2, UMn2 об-
разуют непрерывный ряд твердых
растворов.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Petzow G„ Steeb S„ Kiessler G. — Z. Metallkde, 1963, Bd 54, № 8,
S. 473—477.
2. Petzow G., Sampaio A. O., De Lourdes Pinto M — J. Nuclear Mat.,
1968, v. 26, № 3, p. 331—337.
3. Бадаева T. А., Кузнецова P. И. — В кн.: Строение и свойства спла-
вов для атомной энергетики. М.: Наука, 1973, с. 30—34.
ЖЕЛЕЗО — МАРГАНЕЦ — ФОСФОР
В области сплавов, богатых железом и марганцем, образуются соеди-
нения: Fe3P, Fe2P, Мп3Р, Мп2Р. Фосфиды Fe2P и Mn2P образуют не-
прерывный ряд твердых растворов [1, 2]. Разрез Fe2P—Мп2Р является
квазибинарным (рис. 332). Максимальная температура плавления спла-
294
bob этого сечения составляет 1385 °C.
Это соответствует составу Fe2P-Mn2P.
Два других фосфида с одинаковой сте-
хиометрией Fe3P и Мп3Р непрерывного
ряда твердых растворов не образуют.
На рис. 333 приведена поверхность
ликвидус в ограниченной области Fe—
Fe2P—Mn2P—Мп [2]. Поля первичной
кристаллизации фаз: FeeiPipi—6-Fe,
PiPiP?T ,пРз^4Л>р7—Y-Fe, Р7Р5Р4Р5Р6—
y-Мп, РбРбМп—6-Мп, РиР^Р^2—Р-Мп,
е2Р4Р3Рз—Mn3P, p3PzTmP2p2Fe2PM.n2P—
(Fe, Mn2) Р, р2Р2Ле1—Fe3P.
t,°C ___________________
1400 — __1385 °С
1200 - (Fe;Mn)2P
'—.I_____L___L___1_
О 20 40 60 60 100
Fe2P (по массе} НпгР
Рис. 332. Политермический раз-
рез Fe2P—Мп2Р системы
Fe—Мп—Р
Ниже приведены характеристики нонвариантпых четырехфазных
превращений в системе, происходящих при кристаллизации:
Реакция Точка, соот- ветствующая составу жидкой фазы Температу- ра, °C
ж -J- 6 - Fe Fe3P -ф у - Fe Р1 1025
ж -ф Fe3P у - Fe -ф (Fe, Mn)2P Рг 1015
ж -ф Mn3P (Fe, Mn)2 Р -ф у - Мп Рз 955
ж -ф р - Мп у - Мп -ф Мп3Р Рь 958
Точка минимума Тт на кривой моновариантного превращения ж=<=>
4±y-Fe+ (Fe, Мп)2Р соответствует 950 СС.
На рис. 334 приведены фазовые области в системе Fe—Fe2P—Mn2P—
Мп при комнатной температуре [2].
Рис. 333. Поверхность ликвидус системы Fe—FesP—Mn2P—Мп
295
Fe, % (по массе)
Рис. 334. Фазовое строение системы Fe—Мп—Р при комнатной темпера-
туре
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Nowotny Н., Heuglein Е.—Monatsh. Chem. 1948, Bd В79, № 3/4,
S. 385—393.
2. Vogel R., Berak L — Arch. Eisenhiittenw., 1952, Bd B23, № 1/2,
S. 217—223.
ЖЕЛЕЗО — МАРГАНЕЦ — ХРОМ
Наиболее полное исследование диаграммы состояния системы выпол-
нили в работах [1—5].
На рис. 335 приведены изотермические разрезы системы при 1000
(а) и 900 °C (б) по данным работы [4] При этих условиях в твердом
состоянии присутствуют фазы: а (о. ц. к. решетка), у (г. ц. к. решетка)
и сг (тетрагональная решетка). При 1000°C значительную часть разре-
Рис. 335. Изотермические разрезы системы Fe—Мп—Сг при:
а — 1000 °C; б — 900 “С
Fe 20 00 60
Мп, °/о [по массе)
296
за занимает поле a-твердого раствора, прилегающее к системе железо—
хром. Область a-фазы с двумя гетерогенными областями сс+сг появля-
ется при 20 % (по массе) Мп и 25 % (по массе) Сг. При понижении
температуры до 900 °C область «-твердого раствора значительно со-
кращается. Области
a-фазы, а + ст- и а+у+
+ о-фаз значительно рас-
ширяются, а область ос +
+у сужается. На рис.
336 приведен разрез
тройной системы при
комнатной температуре
[4]. Для этого разреза
характерна малая протя-
женность области а-фа-
зы. Трехфазная область
ос+у + п имеет вид тре-
угольника, вершины ко-
торого определяются сле-
дующими точками, %
(по массе): А (6Мп;
21Сг); В (29Мп; 28Сг);
С (15Мп; 14Сг).
Введение в сплавы
системы железо—хром
марганца снижает тем-
пературу магнитного
превращения. Так, до-
бавки 5,5 И 9,5 °/о (ПО Рис. 336. Фазовое строение сплавов системы
массе) Мп к двойному Fe—Мп—Сг при комнатной температуре
сплаву железа с 5—6 %
(по массе) Сг приводят
к снижению температуры Кюри от 770 до 720 и 650 °C соответственно,
а те же добавки марганца к сплаву железа с 10—12 % (по массе) Сг
снижают температуру Кюри от 750 до 700 и 600 °C соответственно [6J.
В работе [7] изучали изотермические разрезы системы при 1100 и
700 °C до 20 % (по массе) Мп и 20 % (по массе) Сг. При 1100 °C двух-
фазная область а + у появлялась лишь при содержании хрома выше
9—12 % (по массе). При 700°C присутствует в структуре сплавов
о-фаза. Фаза у, находящаяся в равновесии с а- и сг-фазами в трехфаз-
ной области сс+у + с> при 700 °C содержит 12 % (по массе) Мп и 12 %
(по массе) Сг, что согласуется с [4]. Данные работы [4] находятся в
соответствии также с более поздними исследованиями [8, 9], в которых
определены границы областей у, а+у и а при разных температурах.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Григорьев А. Т., Кудрявцев Д. Л. — Изв. АН СССР. ОХН, 1947, №4,
с. 329 -336.
2. Григорьев А. Т., Кудрявцев Д. Л. — Изв. АН СССР. ОХН, 1948,
№ 2, с. 165—173.
3. Григорьев А. Т., Кудрявцев Д. Л. — Изв. Сектора физ.-хим. анализа
АН СССР, 1946, т. 16, вып. 2, с. 82—99.
4. Григорьев А. Т., Груздева Н. М. — Изв. Сектора физ.-хим. анализа
АН СССР, 1949, т. 18, с. 92—116.
297
5. Григорьев А. Т., Кудрявцев Д. Л., Груздева Н. М, — ЖПХ, 1950,
т. 23, № 6, с. 566—574.
6. Коренев И. И., Коренева Е. И. — Изв. Сектора физ.-хим. анализа АН
СССР, 1950, т. 20, с. 54—65.
7. Тавадзе Ф. Н., П ирцхалайшвили В. А., Набичвришвили М. А. — Со-
общ. АН Груз. ССР, 1968, т. 49, № 3, с. 641—646.
8. Kralik Frantisek, Kovacova Katarina. — Kovove mater., 1973, t 11,
№ 1, S. 6-15.
9. Kirchner G., Uhrenius B. — Acta Met, 1974, v. 22, № 5, p. 523—532.
ЖЕЛЕЗО — МАРГАНЕЦ — ЦИНК
Изотермические разрезы системы при 800, 720 и 625 °C приведены на
рис. 337 [1, 2]. Разрезы пересекают области твердых растворов на ос-
нове а- и у-фаз железа, границы которых с разделяющей их двухфаз-
ной областью сс+у определены только при 1000 °C. При 1000 °C а- и
у-фазы находятся в равновесии с жидкой фазой, богатой цинком, при
625 и 720 °C — в равновесии с фазой Г, образующейся в двойной сис-
теме железо—цинк. При 625 и 720 °C цинк находится в жидком состоя-
Zn, % (по массе)
А
Рис. 337. Изотермические разрезы системы
Fe—Мп—Zr при:
а — 800 °C; б — 720 °C; в — 625 °C
298
пии; на разрезах при этих температурах со стороны цинкового угла,
помимо области фазы Г, должны быть также другие фазовые области,
включая области жидкой фазы, богатой цинком.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Budurov S., Russev К., Kovatchev Р., Toncheva S. — Z. Metallkde,
1974, Bd 65, № 11, S. 683—685.
2. Буду ров С., Тончева С., Ковачев П„ Русев К. — Материалозн. и тех-
нол., 1980, № 9, с. 101—109.
ЖЕЛЕЗО — МАРГАНЕЦ -
ЦИРКОНИЙ
Изучен 1 разрез ZrFe2—ZrMn2 си-
стемы. Фазы ZrFe2 и ZrMn2 явля-
ются фазами Лавеса с различны-
ми кристаллическими решетками.
Фаза ZrMn2 имеет гексагональ-
ную решетку типа MgZn2 (Xi-фа-
за) , а фаза ZrFe2 — кубическую
решетку типа MgCu2 (Х2-фаза).
Разрез ZrFe2—ZrMn2 — квазиби-
нарный перитектического типа
(рис. 338), температура перитек-
тического превращения 1570+
+ 10 °C. Фазы X] и Х2 образуют
твердые растворы, при 900 °C в
ZrFe2 растворяется —18% (ат.) А
ZrFe2 40 60ZrMtt%
Мп, % fam.)
Рис. 338. Политермический разрез
ZrFe2—ZrMn2 системы Fe—Мп—Zr
i, а в ZrMn2 — 38 % (ат.) Fe. С по-
вышением температуры растворимость изменяется незначительно.
ЖЕЛЕЗО — МЕДЬ — МЫШЬЯК
Исследовали 2 диаграмму состояния системы. Установлены границы фа-
зовых областей ниже 300 °C (рис. 339). В исследованной области кон-
центраций наблюдали твердый раствор на основе железа (Fe), твердый
Си,% (ат.)
Рис. 339. Границы фазовых областей сплавов системы Fe—Си—As
ниже 300 °C
1 Петьков В, В. — Изв. АН СССР. Металлы, 1972, № 5, с. 155—157.
2 Hennig U., Pawlek F. — Z. Erzbergbau und Metalihuttenw., 1965, Bd. 18, № 5.
S. 293—297.
299
раствор на основе меди (Си), твердый раствор на основе соединения
Fe2As: (FeCu)2As, соединения двойных систем FeAs, FeAs2, Cu3As.
В сплавах системы при 680 °C реализуются четырехфазные нонвариант-
ные эвтектические превращения: ж^СизАв+РеАв+РеАвг и ж^*Си3АйЧ-
+ (Fe, Cu)2As4-Cu. В сплавах разреза (Fe, Cu)2As—Cu3As протекает эв-
тектическое превращение при 750 °C с выделением из расплава двух фаз:
(Fe, Cu)2As и Cu3As. Эвтектическая точка расположена при —6,2 % (ат.)
Fe, 67,6 % (ат.) Си, 26,2 % (ат.) As.
ЖЕЛЕЗО — МЕДЬ — НИКЕЛЬ
В системе имеется широкая область твердых растворов с г. ц. к. решет-
кой (у), которая распространяется от чистого никеля к стороне желе-
зо—медь [1—3].
На рис. 340 приведена проекция поверхности ликвидус системы на
концентрационный треугольник [2]. Линия PiP2 соответствует монова-
риантному перитектическому превращению ж-рб^у, линия P3Ki — мо-
новариантному перитектическому превращению ж+у^е. Линия ei к yi
ограничивает трехфазную область ж+у + е и одновременно является
линией максимальной совместной растворимости железа и меди в твер-
дом растворе с г. ц. к. решеткой. Точка К — критическая точка взаим-
ного перехода твердых растворов на основе меди и y-Fe друг в друге
На рис. 340 показаны также линии, соответствующие изотермическим
сечениям области гомогенного твердого раствора с г. ц. к. решеткой
при 800, 600 и 20 °C. Линия КК' показывает положение критических
точек на поверхности, ограничивающей твердый раствор с г. ц. к. ре
щеткой.
300
На рис. 341 приведено фа-
зовое строение сплавов систе-
мы при комнатной температу-
ре, полученное при медленном
охлаждении от 900 °C [3].
Штриховыми линиями обозна-
чена область, в которой име-
лись признаки распада твердо-
го раствора с г. ц. к. решеткой.
Границы области твердого рас-
твора с г. ц. к. решеткой опре-
деляли также в работах [4—7].
При 900 °C в твердой меди
растворяется 3 % (по массе)
Fe при добавке 5 % Ni и 4,5 %
Fe при добавке 20 % Ni [7].
В твердых растворах с
г. ц. к. решеткой могут проис-
ходить процессы распада и упо-
рядочения [8—15]. На основа-
нии измерений электросопро-
тивления и гальваномагнитных
эффектов в переохлажденных
тпойных сплавах высказано
Рис. 341. Фазовое строение сплавов систе-
мы Fe—Си—Ni при медленном охлажде-
нии до комнатной температуры
предположение [16], что в системе образуется несколько соединений со-
става: 2FeNi5-CuNi]2‘, SCiiNivFeNis; CiiaNi^FeNis’SCuNi*; CuNi4-2FeNi.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R.— Z. anorganische Chemie, 1910, Bd 67, № 1, S. 1—16.
2. Koster W., Dannohl W. — Z. Metallkde, 1935, Bd 27, № 9, S. 220—226.
3. Bradley A. J., Cox W. F., Goldschmidt H. J. —J. Inst. Met., 1941,
v. 67, p. 189—201.
4. Roll F. — Z. anorganische und allgemeine Chemie, 1933, Bd 212, № 1,
S. 61—64.
5. Chevenard P. A., Portevin A. M., War,he X. F. — J. Inst. Met., 1929,
№ 2, p. 337—374.
6. Palmer E. W., Wilson F. H. — Trans. AIME. 1952, v. 194, № 1, p. 55—
64.
7. Bailey G. L.~ J. Inst. Met., 1951, v. 79, № 5, p. 243—292.
8. Chevenard P., Josso E. — Compt. Rend. Seanc. L’Academie des Sci.,
1951, t. 233, № 6, p. 539—541.
9. Балли Д., Захарова M. И. — ДАН СССР, 1954, т. 96, № 4, с. 737—
740.
10. Балли Д., Захарова М. И.—ДАН СССР, 1954, т. 96, № 3, с. 453—
456.
11. Лифшиц Б. Г., Рахштадт А. Г. — ЖТФ, 1941, т. И, № 12, с. 1098—
1108.
12. Daniel V. — Proc. Roy. Soc., 1948, Ser. A, v. 192, № 1031, p. 575—
592
13. Josso E. — Rev. Metalk, 1950, v. 47, № 10, p. 778.
14. Hargreaves M. E. — Acta Crystallogr., 1949, v. 2, № 4, p. 259.
15. Bumm H., Muller H. G. — Wassenschaftliche Veroffentlichungen aus
den Siemens-Werken, 1938, Bd 27, № 2, S. 14—38.
16. Грум-Гржимайло H. B. — Изв. Сектора физ.-хим. анализа АН СССР,
1953, т. 23, с. 101 — 109.
301
ЖЕЛЕЗО — МЕДЬ — ПАЛЛАДИЙ
Политермические разрезы системы при постоянно увеличивающемся со-
держании палладия приведены на рис. 342. Видно сужение двухфазной
хд fin резы системы Fe—Си—Pd при:
чи ои а__ 10 %. б _ 20 %. е _ 30 %
Fe, % (ат.) Pd; 1 — магнитное превращение
области твердого раствора на основе меди (е-фаза) и y-Fe. Области
твердых растворов е и у замыкаются при 33 и 38 % (ат.) Pd соответ-
ственно при температуре солидус и комнатной. В сплавах при темпе-
ратуре, близкой к 735 °C, наблюдаются превращения в твердом состоя-
нии. Эти превращения, по мнению [1], соответствуют эвтектоидному
распаду, связанному с превращением у->а в двойных системах с учас-
тием железа. В этой же работе наблюдали термические эффекты при
665 °C, которые предположительно рассматривали как соответствующие
магнитному превращению. В области твердых растворов на основе пал-
ладия при 1070 °C образуется соединение Pd2FeCu [1, 2]. По данным
термического анализа, это соединение при 650 °C претерпевает полиморф-
ное превращение [1]. Соединение Pd2FeCu имеет тетрагональную ре-
шетку с периодами а=0,502 нм; с=0,437 нм [2].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Григорьев А. И., Пожарская Г. В. — ЖНХ, 1963, т. 8, № 1, с. 141—
145.
2. Григорьев А. Т., Пожарская Г. В. — ЖНХ, 1963, т. 8, № 12,
с. 2694—2699.
302
ЖЕЛЕЗО — МЕДЬ — ПЛАТИНА
Сплавы системы исследовали в работах [1, 2] методами микроструктур-
ного и термического анализов. Сплавы, содержащие свыше 20 % (ат.) Pt
при 1200 °C представляют собой взаимные твердые растворы железа, меди
и платины. При понижении температуры в этих растворах происходит
превращение с образованием соединений PtFe, PtCu, PtCu3, Pt2FeCu.
Рис. 343. Политермический разрез системы Fe—Си—Pt при
отношении %Cu/%Fe=l/l
По разрезу Pt2FeCu—PtFe существуют непрерывные области твер-
дых растворов. Соединение Pt2FeCu ограниченно растворимо в PtCu.
Образование соединения Pt2FeCu подтвердили в работе [3]. На
рис. 343 приведен, по данным [1, 2], политермический разрез системы
для постоянного отношения Fe: Си (в атомных процентах), равного
1:1. Этот разрез проходит через тройное соединение Pt2FeCu.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Немилое В. А., Ридницкий А. А. — Изв. Сектора физ.-хим. анализа
АН СССР, 1941, т. 14, с. 263—281.
2. Немилое В. А. — Изв. Сектора физ.-хим. анализа АН СССР, 1943,
т. 16, вып. 1, с. 167 -183.
3. Солоденников А. И. — Ученые записки Кировского Гос. пед. ин-та им.
В. И. Ленина, 1951, вып. 6, с. 3—14.
ЖЕЛЕЗО — МЕДЬ — СВИНЕЦ
Диаграмма состояния системы характеризуется 1 значительной областью
несмешиваемости в жидком состоянии, образованной аналогичными об-
ластями боковых систем железо—фосфор и медь—фосфор.
ЖЕЛЕЗО — МЕДЬ — СЕРА
Исследованию диаграммы состояния системы посвящено большое чис-
ло работ [1—10]. В работе [1] исследовали возможность образования
соединений в этой системе. В атмосфере паров серы при давлении
600 гПа образуется пять соединений (рис. 344); CuFe2S3, Cu3Fe4Se,
1 Guertler W., Menzel F. — Zeitschrift fur anorganische und allgemeine Chemie,
1924, Bd. 132, № 2/3, S. 201—208.
303
CuFeS2, Cu5FeS6, CusFeS4. Большинство соединений, в том числе и двой-
ных FeS и Cu2S, образуют широкие области гомогенности и непрерыв-
ные твердые растворы друг с другом. Некоторые соединения (или твер-
дые растворы на их основе) встречаются в природных условиях: халь-
козин (Cu2S), ковеллин (CuS), пирит (FeSg), пиррохотин (FeS), бор-
Рис. 344. Фазовые области в системе Fe—Си—S
при совместном нагреве соединений CujS и FeS
при давлении 600 гПа
образующиеся
в парах серы
Рис. 345. Поверхность ликвидус системы Fe—Си—S
нит (Cu3FeS4), халькопирит (CuFeS2), кубанит
дения об образовании соединений: 5Cu2S-FeS
Cu4FeS3 [8].
Основная особенность системы, примыкающей к
VIUpUllC
железо—медь, — наличие области несмешиваемости в жидком состоянии
[3—8]. Эта область начинается от боковой системы
(CuFe2S3). Имеются све-
[2], 2Cu5S-FeS [3] или
к боковой стороне
медь—сера и прони-
кает глубоко в тройную. На рис. 345 приведена проекция поверхности
ликвидус системы [8]. Область расслаивания ограничена линией
m2Af2m47Cm3Mie7, коноды поверхности характеризуют отдельные ее точ-
ки, находящиеся в равновесии, при расслаивании образуются металли-
ческая и сульфидная фазы. Линия, ограничивающая область расслаи-
вания, имеет критическую точку, в которой находящиеся в равновесии
сульфидная и металлическая жидкие фазы имеют одинаковый состав.
Состав точки К, % (по массе): 5,0 Си; 77,5 Fe; 17,0 S; температура
1355 °C. Характеристики нонвариантпых превращений в системе [2],
указанные на рис. 345, приведены ниже.
Крити- ческая точка Темпера- тура, °C Реакция Концентрация. % (по массе)
Си Fe S
е2 896 ж ф* FeS -ф CuFeS2 30,5 34,0 35,5
е3 -965 ж Cu3Fe4S6 -ф FeS 31 ,0 37,0 32,0
-930 ж Cu3Fe4S6 -ф Cu4FeS3 35,5 34,5 31,0
«5 1085 ж у- Fe 4- Cu4FeS3 61,0 15,5 23,5
«6 875 ж Cu5FeS4 -ф CuFeS2 43,5 24,5 32,0
е? 940 ж Cu4FeS3 -ф FeS 34,6 35,0 30,4
Ег 910 жy-Fe-ф Cu4FeS -ф FeS 30,5 39,5 30,0
е2 -930 ж Cu3Fe4S6 -ф FeS -ф Cu4FeS3 35,0 34,2 30,8
Р 1070 ж -ф у - Fe Cu4FeS3 -ф Си 97,3 2,1 0,6
м2 1077 1077 } ЖЛ12 жЛф + т - Fe -ф Cu4FeS3 64,5 96,3 12,8 2,7 22,7 1,0
тз 1375 1375 } жтз<-ж/щ + Т-Ре 11,0 29,0 83,0 47,0 6,0 24,0
На рис. 346 представлен изотермический разрез системы при 900 °C
[8]. При этой температуре в равновесии с твердым раствором на осно-
ве y-Fe находятся FeS и соединение Cu4FeS3, образующее с Cu2S не-
прерывный ряд твердых растворов.
Разрез FeS—Cu2S (рис. 347) квазибинарный [8]. В сплавах раз-
реза образуется соединение Cu4FeS3, между Cu4FeS3 и Cu2S возникает
т + FeS
Си, % (по массе}
Рис. 346. Изотермический разрез системы Fe—Си—S при 900 °C
304
305
непрерывный ряд твердых растворов. Это соединение, по мнению [8],
представляет собой минерал борнит, которому в работе [1] приписыва-
лась формула Cu5FeS4. Соединение Cu4FeS3 плавится при 1090 °C. Ни-
же — 700 °C твердый раствор Cu4FeS3 с Cu2S претерпевает распад.
Рис. 347. Политермический разрез FeS—Cu2S системы
Fe—Си—S
Политермический разрез FeS—Cu2S исследовали также в работах
[2, 5, 9, 10]. Полученные результаты подтвердили характер эвтектиче-
ской кристаллизации и образование ограниченных твердых растворов
на основе FeS и Cu2S; образование соединения Cu4FeS3 установлено не
было. Данные [2, 5, 9, 10] и [8] несколько различаются (температуры
эвтектического превращения и максимальная взаимная растворимость
Cu2S и FeS).
В сплавах разреза FeS—Cu2S предполагается превращение в твер-
дом состоянии, протекающее при температурах на 45—70 °C ниже тем-
пературы эвтектического превращения [5, 8—10].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Merwin Н. Е., Lombard R. Н.— Economical Geology, 1937, v. 32,
№ 2, р. 203—284.
2. Hof man H. О., Caypless W. S., Harington E. E. — Trans. AIME,
1907, v. 38, p. 142—153.
3. Guertler W.— Metall und Erz., 1927, Bd 24, № 5, S. 97—99.
4. Tamman G., Bohner H. — Z. anorgran. u. allgem. Chemie, 1924, Bd
135, № 3, S. 161—168.
5. Reuleaux O. — ATetall und Erz., 1927, Bd 24, № 5, S. 99—111.
6. Bogitch M. B. — Compt. Rend. Seanc. de L’academie Sci., 1926,
t. 182, № 7, p. 468—470.
7. Аветисян X. К., Карамуллин С. А.— Цветные металлы, 1953, №4,
с. 20—26.
8. Schlegel Н., Schiiller А. — Z. Metallkde, 1952, Bd 43, № 12, S. 421—
428.
306
9. Fedotieff P. P. (rnit Nedrigalloff D. N.) —Z. anorg. u. allgem. Che-
mie, 1927, Bd 167, № 3/4, S. 329—340.
10. Carpenter С. B., Hayward С. P. — Eng. a. Min. J. — Press, 1923,
v. 115, № 24, p. 1055—1061.
ЖЕЛЕЗО — МЕДЬ — СЕРЕБРО
Диаграмма состояния системы характеризуется широкой областью не-
смешиваемости в жидком состоянии. Эта область распространяется от
боковой системы железо—серебро [1]. Границы области несмешиваемо-
сти в жидком состоянии приведены на рис. 348 в виде проекции на тре-
угольник составов.
При расслоении образуются два слоя: один обогащенный железом,
второй — расплав, обогащенный серебром. В двойной системе медь—
серебро имеет место эвтектическое превращение, а в системе железо—
медь — перитектическое, вследствие чего в тройной системе можно пред-
полагать протекание нонвариантных четырехфазных превращений с уча-
стием одной или двух жидких фаз. Характеристики этих превращений
в работе [1] не установлены. В твердом состоянии в системе образуют-
ся только твердые растворы на основе железа, меди и серебра. В твер-
дой меди может растворяться 5 % (по массе) Ag и 3 % (по массе) Fe,
в твердом серебре — 8 % (по массе) Си, но железо нерастворимо в нем.
В cc-Fe медь и серебро практически нерастворимы, а в y-Fe может рас-
творяться несколько процентов меди [1J. В работе [2] исследовали рас-
творимость серебра в твердой меди в присутствии железа в количестве
до 0,03 % (по массе). Установили, что присутствие железа в указан-
ных количествах практически не сказывается на растворимости серебра
в меди.
307
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Litder E. — Z. Metallkde, 1924, Bd 16, № 1, S. 61—62.
2. Архаров В. И., Вангенгейм С. Д., Магат Л. М. и др. — ЖТФ, 1954,
т. 24, № 7, с. 1247—1253.
ЖЕЛЕЗО — МЕДЬ — СУРЬМА
Диаграмму состояния системы исследовали1 во всем диапазоне кон-
центраций. В системе образуются твердые растворы на основе а-, у-
и б-фаз железа, твердый раствор на основе меди (фаза е), твердый
раствор на основе конгруэнтно плавящегося соединения FeSb (фаза р),
инконгруэнтно плавящееся соединение FeSb2 (фаза £>), сурьма (фаза С),
инконгруэнтно плавящееся соединение Cu2Sb. Кроме того, в системе
образуются два тройных соединения состава, % (по массе): FeCuSb
(23,15 Fe; 26,35 Си; 50,5 Sb) и FeCu4Sb2 (10,1 Fe; 45,9 Си; 44,0 Sb). Соеди-
нение FeCuSb обозначается Т\, а соединение FeCu4Sb2— Т2. Оба трой-
ных соединения Д и Г2 открытых максимумов не имеют. Эти соединения
не образуют между собой твердых растворов, однако образуют не-
прерывные ряды твердых растворов с конгруэнтно плавящимся соеди-
нением Cu5Sb2 двойной системы медь—сурьма. При этом соединение Т2
образует твердые растворы с твердыми растворами меди в Cu5Sb2, а со-
единение Т] — с твердыми растворами сурьмы в Cu5Sb2. Твердые рас-
творы 7\ с Cu5Sb2 в работе [1] обозначены как фаза р, а твердые рас-
творы Т2 с Cu5Sb2 — как фаза v. При понижении температуры фаза р
может распадаться с выделением соединения В твердом состоянии
в системе может образовываться еще одна фаза — тртвердый раствор
* Vogel R., Dannohl W.—Arch. Eisenhiittenw., 1934, Bd. 8, Аз 2, S. 83—92.
308
па основе соответствующей фазы в двойной системе медь—сурьма. На
рис. 349 представлена проекция на концентрационный треугольник по-
верхности ликвидус системы. Точками Р\, Р2 и Р3 обозначены составы
жидких фаз, участвующих в перитектических нонвариантных четырех-
фазных превращениях. Составы жидких фаз и температуры соответст-
вующих нонвариантных точек указаны ниже:
Точка на диаграмме состояния Состав, % (по массе) t, °C
Fe Си Sb
Pl 6,5 44,8 48,7 780
Р2 5,0 48,8 46,2 758
Рз 1,3 73,5 25,2 909
В соответствии с характером превращений в твердом состоянии в
двойных системах в тройной системе в твердом состоянии должен про-
исходить ряд трехфазных и четырехфазных превращений. На рис. 350
схематически показаны фазовые области в системе при комнатной тем-
пературе. С твердым
растворов на основе a-Fe
находятся в равновесии
фазы: е, т], Тъ р.
ЖЕЛЕЗО —
МЕДЬ —ТИТАН
Диаграмма состояния
системы исследована * 1 в
области сплавов, бога-
тых медью до 5 % (по
массе) Fe и до 5 % (по
массе) Ti. Установлено,
что в равновесии с твер-
дым раствором на осно-
ве меди находится со-
единение TiFe2 двойной
системы железо—титан.
Разрез Си—TiFe2 — ква-
зпбинарный, он делит
тройную систему на две
вторичные: Си—Fe—
TiFe2 и Си—TiFe2—Cu3Ti.
Рис. 350. Фазовые равновесия в сплавах системы
Ее—Си—Sb при комнатной температуре
Во вторичной системе Си—Fe—TiFe2 в равновесии с твердыми раствора-
ми а- или y-Fe находятся твердый раствор на основе меди и соединение
TiFe2. Соединение TiFe2 обладает ограниченной растворимостью в твер-
дой меди, уменьшающейся с понижением температуры. При 1065 СС в
твердой меди растворимо около 2 % (по массе) TiFe2, при 600 °C —
около 0,5 % (по массе) TiFe?.
1 Хан М. Г., Захаров А. М„ Захаров М. В. — Изв. вузов. Цветная металлур-
I пя, 1970, № 1, с. 104—109.
309
ЖЕЛЕЗО — МЕДЬ — УГЛЕРОД
Сплавы системы исследованы методами микроструктурного и рентгенов-
ского анализов [1]. В качестве шихтовых материалов использовали арм
ко-железо, электролитическую медь и реакторный графит. Построена
проекция на треугольник составов поверхности ликвидус системы при
стабильной и метастабильной кристаллизации (рис. 351). Показано, что
Рис. 351. Фазовая диаграмма системы Fe—Си—С при
стабильной (штриховая линия) и метастабильной (сплош-
ная линия) кристаллизации
в случае стабильной кристаллизации с увеличением содержания меди
повышается температура образования графитовой эвтектики При тем-
пературе 1184 °C и концентрации 4,2 % Си и 4 % С наблюдается четы-
рехфазное превращение: Ж1+ж2^*С+у. При 1096°C протекает пери-
тектоидная реакция, в результате которой образуется трехфазная об-
ласть у+C+Cu. При метастабильной кристаллизации с увеличением
содержания меди эвтектическая температура снижается до 1134 СС и в
сплавах с концентрацией 3,6—4 % Си и 4,3—4,4 % С начинается мопо-
тектическая реакция Ж1^=ж2+у + Рё2С.
Влияние меди на фазовое состояние сплавов системы железо—угле-
род исследовали методами микроструктурного, микрорентгеноспектраль-
ного, химического анализов [2], а также измеряли микротвердость.
Сплавы с 0,5—4 % Си и 0,2—0,4 % С получали методом смешения
порошков железа, графита и меди, холодного прессования их и спека
ния при 1100 °C в течение 1 ч в атмосфере сухого водорода. После
ковки и гомогенизации при 1250 °C в течение 100 ч в атмосфере чистого
аргона образцы отжигали при температурах, соответствующих сс+у-об
ласти сплавов системы железо—углерод в течение 16 ч и закаливали и
воде.
Определили растворимость меди и углерода в аустените в равновесии
с tx-Fe, y-Fe и медью (рис. 352) и рассчитали положение Л3-границы и
тройной системе железо—медь—углерод.
310
Рис. 352. Растворимость Си и С в аустените в равновесии
с a-Fe, v-Fe и Си
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Lohberg К., Kohrig К- — Giesserei. Techn. — Wiss. Beih., 1965, v. 17»
№ 3, c. 91—98.
2. Larsson L. E. — Z. Metallkde, 1975, Bd 66, № 4, S. 220—223.
ЖЕЛЕЗО — МЕДЬ — ФОСФОР
Диаграмму состояния системы исследовали в области концентраций,
ограниченных разрезом Fe2P—Cu3P [1—3]. Этот разрез квазибинарный,
эвтектического типа (рис. 353).
Эвтектика кристаллизуется { °Q
при 1013 °C, эвтектическая 7
точка соответствует 97,5 %
(по массе) Си3Р. Фосфид же- 1200
леза Fe3P с фосфидом меди,
имеющим аналогичную сте-
хиометрию Си3Р, в равнове-
сии не находится.
Особенностью диаграммы
состояния в области "
Fe2P—Cu3P—Си
несмешиваемость в
состоянии, которая наблюда-
ется при сравнительно неболь-
ших концентрациях фосфора.
Па рис. 354 область несмеши-
ваемости ограничена линией
KiMiMsMsKoMeMiMs. На этой
линии имеются две критические
точки, соответствующие макси-
мальным температурам превращений: при 1210°С. Составы жидких
(раз, находящихся в равновесии, следующие:
Fe-
является
жидком
woo
ЛГ+Си3Р
800
WO
FezP+CUjP
FezP 20 00 00 80 Си3Р
Си3Р, % (по массе)
Рис. 353. Квазибинарный разрез Fe2P—
СизР системы Fe—Си—Р
311
Ниже приведены температуры четырехфазных превращений в си
стеме, СС:
жл)1^Тт«+жл)г ..... 1094
жР1 4- Т Z? ос + е..... 1090
ж^ + Ре^-РезР + ж^ . . 1103
жР2 + Ре2р Ре3Р 4-е . . . . 1070
жЛ4а-жЛ11 + а + резР- ' • * 1030
ж£1 Fe3P 4-сс + е...... 1028
Жг Fe Р 4-Сп„Р4-s • • • • 714
312
Рис. 355. Фазовое строение сплавов системы Fe—Си—Р
при комнатной температуре
Символами а, у, е обозначены твердые растворы на основе a-, y-Fe
и меди. На рис. 355 показано распределение фазовых областей в систе-
ме при комнатной температуре [1]. В работе [3] изучена совместная рас-
творимость железа и фосфора в твердой меди при температурах от
200 до 950 °C, которая составляет:
С °C.......... 950 700 600
Р, % (ат.) ... 1 3 2,75
Fe, % (ат.) . . 1,5 0,5 0,3
Наличие точек перегиба на изотермах совместной растворимости
фосфора и железа в твердой меди указывает на возможность химиче-
ского взаимодействия между ними.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R„ Berak J.— Arch. Eisenhiittenw., 1950, Bd 21, № 9/10,
g 327____336
2. Nowotny H., Henglein E.—Monatsh. Chem. 1948, Bd 79, № 5,
S. 385—393.
3 Глазов В M., Степанова М. В. — Изв. вузов. Цветная металлургия,
1967, № 4, с. 129—131.
ЖЕЛЕЗО — МЕДЬ — ЦИНК
На рис. 356 приведены изотермические разрезы системы при 700 и
1000 °C по данным работ [1, 2J. Для разрезов характерна широкая об-
ласть жидкой фазы, обусловленная низкой температурой цинка. В си-
стеме образуются тройные твердые растворы меди и цинка в а- и y-Fe.
Разрез, отвечающий комнатной температуре, приведен на рис. 356, в.
Твердый раствор на основе a-Fe (а) находится в равновесии с фазами
а* (твердый раствор на основе меди), |3 и у системы медь—цинк. Фа-
зовые равновесия в области концентраций, примыкающей к стороне же-
лезо—цинк, в работе [3] не установлены.
11—358
313
Рис. 356. Изотермические
разрезы системы Fe—Си—Zn
при:
а — 700 °C; б — 1000 °C; в —
при комнатной температуре
В работе [4] определяли влияние железа на границы а/(сс + Р)- и
(сс+|3)/|3-областей в сплавах меди с цинком. Установлено, что при со-
держании железа около 6 % (ат.) границы этих областей отклоняются
приблизительно на 2 % (ат.) в сторону меньших содержаний цинка.
Растворимость железа в а- и |3-фазах системы медь—цинк очень ма-
ла [4].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Будуров С., Тончева С., Ненчев Н.— Матеоиалозн. и технол., Киев,
1978, т. 6, с. 50—54
2. Будуров С., Тончева С., Ковачев П., Русев К.— Материалозн. и тех-
нол., Киев, 1980, т. 9, с. 101—109.
3. Bauer О., Hansen М. — Z. Metallkde, 1934, Bd 26, № 6, S. 121—128.
4. Haworth J. B„ Hume-Rothery W. — Phil. Mag. 1952, Ser. 7, v. 43,
№ 341, p. 613—629.
ЖЕЛЕЗО — МЕДЬ — ЦИРКОНИЙ
В работе исследовали 1 фазовые равновесия в сплавах системы в обла-
сти, примыкающей к циркониевому углу [до 33 % (ат.) суммарного со-
держания меди и железа]. В этой области концентраций в твердом со-
стоянии наблюдались следующие фазы: твердый раствор на основе
a-Zr, твердый раствор на основе |3-Zr, твердые растворы на основе со-
единений Zr2Cu, Zr2Fe, Zr3Fe. Область гомогенности в тройной системе
твердых растворов на основе соединений Zr2Cu и Zr3Fe невелика [до
— 10 % (ат.)], а па основе соединения Zr2Fe довольно большая [до
— 40 % (ат.)].
1 Малахова Т. О. — В кн.: Структура фаз, фазовые превращения и диаграммы
состояния металлических систем. М.: Наука, 1974, с. 144—147.
314
ЖЕЛЕЗО — МОЛИБДЕН — НИКЕЛЬ
Диаграмму состояния системы исследовали в работе [1] до соединений
Fe3Mo и MoNi. Эти соединения образуют между собой в тройной си-
стеме непрерывный ряд твердых растворов. Фазы, находящиеся в рав-
Рис. 357. Поверхность ликвидус системы Fe—Mo—Ni
Мо
Рис. 358. Изотермический разрез системы Fe—Мо—Ni при
1200 °C
11*
315
новесии: а, у и О (твердый раствор соединений Fe3Mo и MoNi). На
рис. 357 приведены проекции поверхности ликвидус на плоскость кон-
центрационного треугольника. Равновесия с участием расплава в трой-
ных системах заканчиваются плоскостью четырехфазного равновесия
ж4-«^у+0, отвечающего температуре 1350 °C. На этой плоскости окан-
чиваются идущие от высоких температур трехфазные равновесия:
^tzi + O! и рь + cz/i^Y/, а равновесия и а**у + 0 отходят в
сторону более низких температур.
Рис. 359. Изотермический разрез системы Fe—Мо—Ni при
1000 °C
В работах [2, 3] по результатам исследования диаграммы метода-
ми микроструктурного и рентгеновского анализов построили изотерми-
ческие разрезы при 1200 и 1100 °C. Не подтверждено, что фазы РезМо2
и MoNi образуют непрерывный ряд твердых растворов. На изотерми-
ческом разрезе системы [2] при 1200 °C (рис. 358) г. ц. к. твердый рас-
твор обозначен ос, а о. ц. к. твердый раствор — е. Фаза ц образует
удлиненную узкую область вдоль изоконцентраты с 40 % (по массе) Fe.
На рис. 359 приведен изотермический разрез системы при 1000сС [3].
Область гомогенности фазы p[(FexNii_x)A4o] простирается от х—1 до
х=0,25. Химический состав тройной P-фазы описывается формулой
FeuNiseMosg. Эта фаза имеет орторомбическую решетку с периодами
п = 0,9091 нм, й = 1,7002 нм, с=0,4795 нм.
В работе [4] исследовали сплавы системы железо—молибден—ни-
кель методами микроструктурного и рентгеновского анализов в области
сплавов, богатых никелем. Показано, что в широком интервале концен-
траций сплавы этой системы представляют собой твердый раствор на
основе никеля.
316
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Koster W7.— Arch. Eisenhiittenw., 1934, Bd 8, S. 169—171.
2. Das D. K-, Rideont S. P., Beck P. A.— J. Metals, 1952, v. 4, № 10,
p. 1071—1075.
3. Van Loo F. J. J., Bastin G. F., Vrolijk J. W. G. A., Hendricks J. J. M. —
J. Less-Common Metals, 1980, v. 72, № 2, p. 225—230.
4. Францевич-Заблудовская T. Ф., Францевич И. FL, Модылевская
К. Д. — ЖПХ, 1954, т. 27, № 4, с. 413—420.
ЖЕЛЕЗО — МОЛИБДЕН — НИОБИЙ
Предложен гипотетический изотермический разрез системы при 1000 °C.
На рис. 360 1 показаны области существования о. ц. к. твердого раство-
ра, образованного молибденом и нио-
бием, твердого раствора на основе же-
леза с г. ц. к. решеткой, области сущест-
вования фаз |3, о и Ls (Ls— фаза Ла-
веса с гексагональной решеткой типа
M.gZn2). Остальное поле разреза зани-
мают двух- или трехфазиые области.
ЖЕЛЕЗО — МОЛИБДЕН —
СЕРА
Сплавы системы исследовали методами
микроструктурного, химического, рент-
геновского [1] и дифференциально-тер-
мического [2J анализов. На рис. 361
Рис. 360. Гипотетический изо-
термический разрез системы
Fe—Мо—Nb при 1000 °C
приведен изотермический разрез этой
системы при 950 °C [1].
В работе [2] изучали политерми-
ческий разрез Fe—MoSx системы. Раз-
рез — квазибинарный (рис. 362), эв-
тектического типа. Температура кристаллизации эвтектики ж^*6-Ее +
+MoSx 1150 °C, эвтектическая точка расположена при 30 % (по мас-
1 Goldschmidt И. J. — J. Less—Common Metals, 1960, v. 2, Ke 2, p. 138—153,
Рис. 361. Изотермический разрез системы Fe—Мо—S при 950 ГС
317
ce) MoSx. Эвтектоидное превращение S-Fe^y-Fe+MoSx протекает
при 1120°C, а температура превращения незначительно отличает-
ся от равновесной для чистого железа (911 °C). Растворимость суль-
фида молибдена в 6- и y-Fe довольно велика, а в ct-Fe не превышает
0,5 % (по массе). Образующийся в сплавах сульфид молибдена, по дан-
ным [Ц, имеет состав MoSx (х~1,8) и кристаллическую структуру,
близкую к структуре MoS2 [1].
Рис. 362. Политермический разрез Fe—MoS2 системы
Fe—Мо— S
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Kaneko Н„ Nishizawa Т., Tamaki К.—J. Jap. Inst. Metals, 1963,
v. 27, № 7, р. 312—318.
2. Шурин А. К., Кмндрачук М. В., Разумова И. А. — Металлофизика.
Респ. межвед. сб. Киев: Наукова думка, 1978, № 71, с. 61—63.
ЖЕЛЕЗО — МОЛИБДЕН — ТИТАН
Построены1 изотермические разрезы при 700; 800; 900 и 1000 °C систе-
мы в области сплавов, богатых титаном и содержащих от 1,25 до 16,84 %
(по массе) Fe и от 2,03 до 27,83 % (по массе) Мо. Исследования про-
водили методами микроструктурного и рентгеновского анализов, а так-
же измеряли твердость и микротвердость.
ЖЕЛЕЗО — МОЛИБДЕН — УГЛЕРОД
Сплавы системы исследовали методами микроструктурного, рентгенов-
ского, термического [1—3], химического и микрорентгеноспектрального
[2, 3] анализов. Проводили измерение твердости, плотности и электро-
сопротивления [1]; исследовали методом количественной металлографии
и электрохимического выделения карбидных фаз [3].
По данным работы [1] построена поверхность ликвидус системы.
Шихтовыми материалами служили порошки электролитического желе-
за, молибдена и карбида молибдена. Сплавы спекали в вакууме при
1500 °C в течение 24 ч. На поверхности ликвидус (рис. 363) в интерва-
1 Агеев Н. В., Рогачевская 3. М, — ЖНХ, 1959, т. 4, № 10, с. 2323—2328.
318
MozC 2W0°C
Рис. 363. Поверхность ликвидус части системы Fe—Мо—С
Мо, глол. долл
Рис. 364. Изотермический разрез части системы
Fe—Мо—С при 1000 °C
ле 1470—1120 °C протекает восемь нонвариантных реакций. При 1080 °C
кристаллизуется тройная эвтектика Жч^у-Ре + Ре3С+Мо2С.
Изотермический разрез части системы при 1000 СС (рис. 364) под-
робно исследован в работе [2]. Сплавы электролитического железа чис-
тотой 99,9 °/о с молибденом изготавливали в тиглях из оксида алюми-
ния в атмосфере аргона, гомогенизировали и насыщали углеродом при
1000 °C, 100 ч в кварцевых ампулах в присутствии водорода.
Построены [3] изотермические разрезы системы при 1143, 1198 и
1253 К. Сплавы, изготовленные из армко-железа, железа с высоким со-
держанием углерода и ферромолибдена с 60 % Мо, ковали, гомогени-
зировали и отжигали в откачанных кварцевых ампулах в атмосфере ар-
гона при 1143 (1000 ч), 1198 (500 ч) и 1254 К (500 ч). На рис. 365
319
приведен изотермический разрез при 1143 К. Штриховые линии нане-
сены по литературным данным. При всех изученных температурах в рав-
новесии с твердым у-раствором находятся карбидные фазы Ме3С,
О 0,01 0,02 0,03 0,00
Рис. 365. Изотермический раз-
рез части системы Fe—Мо—С
при 870 °C
Fe2MoC, Мо2С и Л4е6С. Карбид Ме23Сб
не обнаружен. В сплаве железа с
4,90 % (по массе) Мо и 0,85 % (по мас-
се) С карбид Л4е6С, образующийся при
ковке, метастабилен при 1143 К и пол-
ностью не растворяется даже после
отжига при этой температуре в течение
2500 ч.
Карбидная фаза Fe2MoC имеет
ромбическую решетку с периодами а—
= 1,613 нм; b =0,996 нм; с= 1,109 нм
[в сплаве — железа с 2,66 % (по мас-
се) Мо и 1,01 % (по массе) С, закален-
ном с 1143 К]; карбид Мо2С — г. п. у.
решетку с периодами о=0,300 нм, с =
= 0,471 нм [в сплаве железа с 4,12 %
(по массе) Мо и 0,95 % (по массе) С,
закаленном от 1198 К), карбид 7Ие6С—
кубическую решетку с периодом а =
= 1,106 или 1,107 нм [в сплаве железа
с 4,90 % (по массе) Мо и 0,85 % (по
массе) С, закаленном соответственно с 1143 и 1253 К].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Jellinghaus W.—Arch. Eisenhiittenw., 1968, Bd 39, № 9, S. 705—718.
2. Nishizawa Taiji — Scand. J. Met., 1972, v. 1, № 1, p. 41—48.
3. Woodyatt L. R., Kraus G. — Met. Trans., 1979, v. A10, № 12, p. 1893—
1900.
ЖЕЛЕЗО — МОЛИБДЕН — ФОСФОР
Сплавы системы исследовали методами термического, химического, мик-
роструктурного анализов [1, 2], а также применяли метод электроли-
тического выделения избыточных фаз [1]. В изученной части системы
протекает пять нонвариантных четырехфазных превращений; два эвтек-
тического типа и три перитектического. Характеристики этих превраще-
ний указаны ниже:
Крити- ческая точка Реакция Темпера- тура, °C Состав жидкой фазы % (по массе)
Fe Мо Р
ж -ф Fe2P МоР -ф Fe3P 1125 78 10 12
Ег ж a-Fe + Fe3P -ф МоР 1023 82 9 9
Рг ж -ф Мо МоР -ф FeMo 1320 32 59 9
Е2 ж a-Fe -ф Fe3P -ф МоР 1035 72 22 6
Р3 ж -f- a-FeМоР -ф Fe3Mo2 1233 56 37 7
320
Mo, % (no массе)
Рис. 366. Поверхность ликвидус системы Fe—Мо—Р
На рис. 366 приведена поверх-
ность ликвидус системы по данным
работы [1]. Точка в, так называемая
перевальная точка, в которой проте-
кает эвтектическое превращение
ж^а-Fe+MoP, квазибинарного раз-
реза Fe—МоР, — см. рис. 367. На
рис. 368 представлено фазовое строе-
ние сплавов системы при комнатной
температуре.
По результатам работы [2] по-
строен изотермический разрез при
800 °C (рис. 369). Показано, что в
сплавах системы образуется трой-
ной фосфид FeMoP.
Рис. 367. Политермический разрез
Fe—МоР системы Fe—Мо—Р
Мо? % (по массе)
Рис. 368. Фазовое строение сплавов систе-
мы Fe—Мо—Р при комнатной температу-
ре
Мо, % (по массе)
321
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R., Horsmann D.—Arch. Eisenhiittenw., 1953, Bd 24, S. 369—
374.
2. Kaneko H., Nishizawa T., Tanaka R.— J. Jap. Inst. Metals, 1965, v. 29,
№ 2, p. 159—165.
ЖЕЛЕЗО — МОЛИБДЕН — ХРОМ
По данным работы [1], в системе реализуется три нонвариантных четы-
рехфазных превращения: ж + о+е^%, ж+о^а+х и Жч^а+х+е при
1455, 1385 и 1345 °C соответственно. Установлено существование пяти фаз:
а (о. ц. к.), у (г. и. к.), е (Fe3Mo2— гексагональная решетка), о (FeMo
и FeCr — тетрагональная решетка) и тройное соединение х
(Ее3бСг12Мо10 — о. ц. к. решетка).
Диаграмму состояния системы исследовали также в работе [2].
Изучены сплавы, содержащие до 70 % (по массе) Сг и до 60 % (по
массе) Мо, построены изотермические разрезы при 900, 1100 и 1300 °C.
Установлено наличие твердых растворов на основе железа, молибдена,
хрома (а, у, т]) и двух интерметаллических соединений: е (Fe3Mo2),
<7 (FeMo).
Между сьфазой системы железо—хром и о-фазой системы железо—
молибден образуется непрерывный ряд твердых растворов [3]. Со сто-
роны железо—хром о-фаза устойчива до температуры <850 °C, а со сто-
роны железо—молибден она сохраняется до 1540 СС.
В работах [4, 5] установлено существование интерметаллического
соединения—Х’Фазы- Наличие х-фазы установлено и в работе [6]. Она
появляется при добавлении молибдена к сплаву железо—хром, содер-
жащему 8—27 % (по массе) Сг. В сплавах, содержащих около 27 %
(по массе) Сг, могут присутствовать две фазы: о и у. У сплава с 54 %
(по массе) Fe; 17 % (по массе) Сг и 27 % (по массе) Мо, лежащего в
центре области у-физы, период решетки равен а = 0,8920 нм. На рис. 370
представлен изотермический разрез системы при 900 °C [6]. При этой
температуре область о-фазы не простирается до стороны Fe—Сг.
322
Кристаллическую структуру %-фазы (соединение Fe36Cri2Mo1(l) ис-
следовали в работе [7]; показали, что она может быть отнесена к типу
а-Мп.
В работе [8] исследовали фазовые равновесия в тройной системе в
твердом состоянии. Средний состав о-фазы: Ре^Сго.вбМоо^д; х_Фазы:
Fe36Cri5Mo7. Фаза ст в сплаве железа с 28 % (по массе) Сг и 5 % (по
массе) Мо имеет периоды решетки а = 0,8799 нм; с = 0,4566 нм, а %-фа-
за в сплаве железа с 20 % (по массе) Сг и 5 % (по массе) Мо — о =
= 0,8854 нм.
Рис. 370. Изотермический разрез системы Fe—Мо—Сг
при 900 °C
0 12 3 4 S'
Рис. 371. Политермические разрезы системы Fe—Мо—Сг при содержании
хрома 20 (а), 24 (б) и 28 % (в)
На рис. 371 приведены политермические разрезы системы при по-
стоянном содержании 20; 24 и 28 % (по массе) Сг. При 20 % (по мас-
се) Сг и содержании молибдена менее 2 % имеет место двухфазная об-
ласть (сс + о). При больших содержаниях молибдена появляются трех-
323
фазная область (а + о+х) и двухфазная (а + х); последняя с увеличе-
нием содержания молибдена расширяется. С увеличением содержания
хрома двухфазная область (а + о) расширяется, а область (сс+х) ис-
чезает. Штриховая линия обозначает границу нестабильного образова-
ния Х'Фазы и ее распада с образованием о-фазы. Критерием границы
трехфазной области взят сплав с 5 % (по массе) Мо, в котором Х'Фа'
за полностью распадается после 5000 ч отжига при 800 СС и после
10000 ч при 750 °C. При 950 °C достаточно 100 ч выдержки, чтобы вы-
павшая х-фаза полностью перешла в фазу о.
В работе [9] расчетным путем построены изотермические разрезы
системы при 923, 1373, 1573 и 2000 К. Исходными служили данные о
диаграммах двойных систем, а также данные о стабильности кристал-
лических решеток модификаций железа.
Диаграмму состояния системы железо—молибден—хром в области
сплавов, богатых хромом, исследовали в работах [10, II].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Taked S., Jukawa N. — J. Jap. Inst. Metals, 1957, v. 21, № 4, p. 275 —
279.
2. Pulman J. W., Potter R. D., Grant N. J.—Trans. ASM, 1951, v. 43,
p. 824—852.
3. Buckle H. — Rev. metallurgy, 1957, v. 54, № 1, p. 9—15.
4. Andrews K. W.— Nature, 1949, v. 164, p. 1015.
5. Kok P. K. — Trans. AIME, 1953, v. 197, p. 339—343.
6. McMullen J. G., Rider S. F. — Trans. ASM, 1954, v. 46, p. 799—806.
7. Kasper J. S. —Acta Met., 1954, v. 2, № 3, p. 456—461.
8. Kiesheyer H., Brandis H. — Z. Metallkde, 1976, Bd 67, № 4, S. 258—
263.
9. Kaufman Z., Nezo^ H. — Met. Trans., 1975, v. A6, № 11, p. 2123—2131.
10. Григорьев A. T., Соколовская E. M., Соколова И. T., Максимова
М. В. — В кн.: Исследование по жаропрочным сплавам Т. 8. М.:
Изд. АН СССР, 1962, с. 42—46.
И. Алфшщева Р. А... Дмитриева Г. П„ Коробейникова В. Т. и др. —
Науч. тр./Ин-т металлофизики АН УССР, Наукова думка, 1964,
№ 20, с. 108—124.
ЖЕЛЕЗО — МОЛИБДЕН — ЦИРКОНИЙ
Исследован 1 циркониевый угол диаграммы состояния системы. Приве-
дена проекция диаграммы состояния системы на плоскость концентра-
ционного треугольника и изотермические разрезы при 700, 800, 900 и
1000 °C. Процесс кристаллизации тройных сплавов характеризуется на-
личием четырехфазного перитектического превращения ж + 2гМо2^
4=^P + ZrFe2 (—1000°C). В твердом состоянии происходит четырехфаз-
ное эвтектоидное превращение fUta-rZrMo2+ZrFe2 ( — 650°C). Эвтек-
тоидная точка лежит при 2,5 % (по массе) Мо и 1,25 % (по массе) Fe.
аир — твердые растворы на основе циркония.
ЖЕЛЕЗО — МЫШЬЯК — НИКЕЛЬ
Сплавы системы исследовали методами микроструктурного и термине
ского анализов [1]. На рис. 372 приведена проекция поверхности ликви-
дус системы. Существуют два четырехфазных метастабильных равно-
1 Груздева Н. М.. Трегубов И. А. — В кн.: Физико-химия сплавов циркония,
М.: Наука, 1968, с. 102—107.
324
Рис. 373. Диаграмма состояния системы Fe—As—Ni
весия: >K + Ni5As2^NiAs4 MjAs при 799 °C и jK^NiAs + FesAs-pAfegAs
при 784 °C (Afe2As— тройная фаза вероятного состава FeNiAs). Указан-
ные равновесия, возникшие на поверхности ликвидус, не оказывают влия-
ния на последующее формирование и фазовое строение сплавов.
На рис. 373 дана проекция изученной части системы на треуголь-
ник составов. В интервале 900—791 °C протекают восемь нонвариантных
четырехфазных реакций, характеристики которых приведены ниже:
325
%NiW/(%Fe + %Ni)
Рис. 374. Политермический разрез Fe2As—Ni2As системы
Fe—As—Ni
Точка Реакция Темпера- тура, °C Фазы Состав, % (по массе)
Fe As Ni
Ei Ж NiuAs8 4~ Fe3As2 4- 797±2 Ж 15 43 42
-J- N inAs8 12 48 40
Fe3As2 15 47 38
M2As 17 39 44
e2 ж Fe2As —NikAso 791 ±2 ж 51 32 17
+ Mev Fe2As 45 40 15
Ni5As2 45 35 20
mv 74 12 14
Pi ж + FeAs <> NiAs 4- 900+5 ж 27 45 28
+ Fe3/ls2 FeAs 22 57 21
NiAs 21 56 23
Fe3As2 28 47 25
Рг ж 4- FeAs <> NiuAs8 + 830+2 ж 13 46 47
4- Ale2As NiAs 11 56
Fe3As2 15 47
NiuAs8 12 48 40
Рз ж 4- Ni5As2; NinAs8 4- 813+2 ж 6 43
4- Ale2As N i5As2 5 34 61
N inAs8 з 48 4Q
M2As 7 39 54
P< ж 4- Fe2As Fe3As2 4- 860+5 ж 36 41 23 15 19 22
4- Ale2As Fe2As 45 40
Fe3As2 34 47
M2As 38 40
326
П родолжение
Точка Реакция Темпера- тура, °C Фазы Состав, % (по массе)
Fe As Ni
Ръ ж + A4e2As Fe3As + 825±5 Ж 41 36 23
+Ni6As M2As 38 40 22
Fe2As 45 40 15
Ni5As 37 35 28
p. ж -{- Mea Fe2As+Ale? -835 ж 69 30 1
Ма 87 12 1
Fe2As 60 40 0
mv 86 12 2
ж /l
TO p-p
up __|П III 'Л
1 1 III III III || 1— —. Ill III “1
1 1 1 III III III L! 1 In III III III 2Fe2As-Ni5As2 + Ni5As2 । L
1 I’1 1 Fe2As+4Fe2As-Ni5As2 III CM CD CM III III III 1 1 L
l 1 1 III III ill t/> 2 co III III III 1 1
1 1 1 J 1 » II hl I 4Fe2A III III III I 1 1
t°C
1000
ООО
SOO
700
ООО
500
ООО
300
200
100
О
Fe2As 4Fe2AsNi5A$z2Fe2As Ni5As2 Ni5As2
О 10 20 30 00 50 00 70 80 90 100
N i 5As2 , % (no массе)
Рис. 375. Политермический разрез Fe2As—NisAs2 системы Fe—As—Ni
327
Соединение Me2As образуется по перитектической реакции ж+
+ Fe2As=e=fcMe2As, протекающей при 870±5 °C. Состав жидкой фазы,
участвующей в реакции 36 % (по массе) Fe; 40 % (по массе) As; 24 %
(по массе) Ni; состав соединения Fe2As: 45 % (по массе) Fe; 40 % (по
массе) As; 15 % (по массе) Ni; состав соединения Me2As: 38 % (по
массе) Fe; 40 % (по массе) As; 22 % (по массе) Ni. Точка То (рис. 374)
является конгруэнтной точкой плавления соединения Me2As. Состав
этой точки: 24 % (по массе) Fe; 39 % (по массе) As; 37 % (по массе)
Ni; температура 851 ±5 ‘"С.
В работе [2] проводили исследование сплавов тройной системы по
разрезам между всеми возможными соединениями двойных систем же-
лезо—мышьяк и никель-—мышьяк с целью выяснения возможности су-
ществования квазибинарных разрезов. Установлено наличие в системе
трех квазибинарных разрезов: FeAs—Ni5As2 и Fe3As2—NisAs2 (оба эв-
тектического типа с ограниченными твердыми растворами) и Fe2As—
Ni5As2. Последний разрез приведен на рис. 375. Соединения Fe2As и
Ni5As2 образуют непрерывный ряд твердых растворов, которые ниже
600 °C распадаются на 2Fe2As-Ni5As2 [35,9 % (по массе) Ni; 27,4 % (по
массе) Fe; 36,7 % (по массе) As и 4FeAs-Ni5As2], [24,6 % (по массе)
Ni; 37,6 % (по массе) Fe; 37,8 % (по массе) As],
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Maes R., Strycher R.— Trans. AIME, 1967, v. 239, № 12, p. 1887—
1894.
2. Guert W., Savelsberg IF.—Metall. a. Erz., 1932, v. 29. p. 84—91.
ЖЕЛЕЗО — МЫШЬЯК — УГЛЕРОД
Сплавы системы исследованы методами микроструктурного и дилатомет-
рического анализов и измерения электросопротивления при нагреве [1J.
Шихтовыми материалами служили мышьяк металлический чистотой
96 %, армко-железо и электролитическое железо. Сплавы изготавлива-
ли в печи Таммана в тиглях из оксида алюминия. Мышьяк и углерод
вводили в расплавленное железо в виде лигатуры. Сплавы гомогени-
зировали при 900—1200 °C в течение 6—8 ч. Построены политермические
разрезы системы при постоянном содержании мышьяка 0,8; 1,4; 2,8 и
4,5 % (рис. 376). Мышьяк повышает температуры превращения железа
А] и А3 и выклинивает область у-твердого раствора. Превращение сс +
+ Fe3C^*y при 4,5 % As происходит в интервале температур 15—20 °C
с образованием трехфазной области, с увеличением содержания мышья-
ка температура начала превращения a + Fe3C=pta-|-y+ Fe3C повышает-
ся и при 4,5 % As равна 775 °C; температура эвтектического превраще-
ния ж+±у + Ре3С при 4,5 % As понижается до 960 °C. Максимальная
растворимость углерода в аустените уменьшается с 1,85 до 1,65 % при
повышении содержания мышьяка с 0,8 до 4,5 %.
Для изучения влияния мышьяка на растворимость углерода в фер-
рите [2] использовали карбонильное железо, предварительно рафиниро-
ванное в токе водорода при 830—850 °C в течение 50 ч, и мышьяк в
виде 35 %-ного ферромышьяка. Сплавы получали в вакууме (1,ЗЗХ
Х10”4 гПа). Образцы для измерения внутреннего трения после холод-
ного волочения подвергали отжигу в вакууме при 650 °C в течение 3 ч
с последующим медленным охлаждением и затем насыщали углеродом
при 500; 600; 650; 680; 700 и 720 °C в смеси газов СО и СО2. Мак-
симум растворимости углерода в феррите, полученный методом внут-
реннего трения, наблюдается при 0,15 % As. Методы химического ана-
лиза и меченых атомов показали снижение содержания углерода в фер-
328
Рис. 376. Политермические разрезы системы Fe—As—С с
0,8 (а), 1,4 (б), 2,8 (в) и 4,5 % As (г)
рите при введении в сплав мышьяка. Различие, по-видимому, связано с
особенностями метода внутреннего трения и влиянием структурного со-
стояния образцов.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Шурин А. К.. Свечников В. Н. — Сб. науч, работ Ин-та металлофи-
зики АН УССР, 1957, № 8, с. 58—64
2. Шумилов М. А., Козин А. П„ Якушечкина Л. И., Соколов К. И.—
Изв. АН СССР. Металлы, 1974, № 4, с. 119—122.
ЖЕЛЕЗО — НИКЕЛЬ — НИОБИЙ
Методами рентгеноструктурного, микрорентгеноспектрального и микро-
структурного анализов исследовали 1 сплавы системы по двум разрезам:
Fe2Nb— к Ni2Nb и FeNb — к NiNb. Соединение Fe2Nb представляет со-
бой фазу Лавеса со структурой типа MgZn2; периоды решетки а—
= 0,4837+0,0002 нм и с = 0,7885+0,0006 нм. Область гомогенности фа-
зы Fe2Nb определена в интервале 29,5—34,5 % (ат.) Nb.
Периоды решетки, соответствующие этим границам, следующие: а —
= 0,4827 нм; с=0,7784 нм и а=0,4856 нм, с = 0,7930 нм. При составах
' Варли К. В., Дружинина Т. И., Дьякова Н. П. и др. — Изв. вузов. Черная
металлургия, 1981, № 9, с. 116—118.
329
FeNb и NiNb образуются ц-фазы. Во всех сплавах по разрезу между
g-фазами наблюдали присутствие твердого раствора на основе g-фаз
(тип Fe7W6).
ЖЕЛЕЗО — НИКЕЛЬ — ОЛОВО
На рис. 377 приведен изотермический разрез системы при 600 °C [1J.
В равновесии с твердым раствором на основе железа в двойной систе
ме железо—олово находятся фаза FeSn, фаза Fe5Sn3 и фаза Ni3Sn2 в
Методом рентгеновского анализа иссле-
сплавах, богатых никелем.
Рис. 377. Изотермический
разрез части системы
Fe—Ni—Sn при 600 °C
3. Пантелеймонов Л. А.,
довали растворимость олова в a-Fe при
1 % (по массе) Ni [2]. Показали, что до-
бавки никеля в указанных пределах спи
жают растворимость олова в a-Fe при
600 °C от 6,5 % (чистое железо) до 5,2 %
(по массе) при наличии никеля; период ре-
шетки a-Fe уменьшается от 0,28893 до
0,28847 нм.
На рис. 378 представлен квазибинар-
ный разрез эвтектического типа Ni3Sn2—Fe
системы [3]. Температура эвтектического
превращения ж^у + е составляет 1100 °C;
эвтектическая точка расположена при
40 % (ат.) Fe.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Cranshaw Т. Е. — J. Phys., 1980, v. 10,
№ 6, р. 1323—1340.
2. Nageswararao М., McMahon С. J., Нег-
man И.—Met. Trans., 1974, v. 5, № 5,
р. 1061 — 1068.
Бабанская И. А. — Вестник Моск. Ун-та. Хи
мия, 1973, т. 14, № 4, с. 486—487.
330
ЖЕЛЕЗО - НИКЕЛЬ — ПАЛЛАДИЙ
< -плавы системы исследовали 1 методом термического анализа. Диаграм-
мы плавкости разрезов системы с постоянным содержанием палладия
Рис. 379. Поверхность ликвидус системы Fe—Ni—Pd
указывают на образование в тройных сплавах непрерывного ряда твер-
дых растворов непосредственно после затвердевания. На рис. 379 при-
ведены изотермы поверхности ликвидус системы.
ЖЕЛЕЗО — НИКЕЛЬ — ПЛАТИНА2
Показано, что в системе образуются тройные твердые растворы между
соединениями FePt и NiPt, Fe3Pt и Ni3Pt. Первые из этих растворов
имеют тетрагональную структуру типа Zl0 с периодами решетки для
сплава с 25 % (ат.) Fe; 25 % (ат.) Ni (остальное Pt) о —0,337 нм, с—
= 0,3656 нм, da — 0,953. Вторые обладают кубической структурой типа
Ll0. Период решетки г. ц. к. фазы сплава с 12,5 % (ат.) Fe и 45 %
(ат.) Ni (остальное Pt) равен а = 0,3604 нм.
На рис. 380 и 381 приведены изотермические разрезы системы при
600 и 475 °C. При содержании —60 % (ат.) Pt при 600 °C В системе су-
ществуют две тетрагональные фазы с близкими значениями с/а. Об-
ласть тройных твердых растворов, образованных соединениями Fe3Pt
и Ni3Pt при 600 °C не доходит до боковой стороны платина—никель, как
при 475 °C.
1 Пантелеймонов Л. А., Бирун Н. А., Губаева Д. Н. — ЖНХ, 1960, т. 5, № 7,
с. 1635—1637.
2 Stevens G. Т., Hatherly М., Bowles J. S. — J. Mater. Sci, 1978, v. 13,
p. 499—504.
331
Рис. 380. Изотермический разрез системы Fe—Ni—Pt при 600 СС
Рис. 381. Изотермический разрез системы Fe—Ni—Pt при
475 °C
332
ЖЕЛЕЗО — НИКЕЛЬ — РЕНИЙ
Часть диаграммы состояния системы исследована 1 в области сплавов
60—40 % (по массе) Fe; 50—32 % (по массе) Ni и до 20 % (по мас-
се) Re. Исследование выполне-
но методами микроструктур-
ного, рентгеновского и терми-
ческого анализов, а также из-
мерением твердости и микро-
твердости.
На рис. 382 приведен по-
литермический разрез систе-
мы от сплава состава 50 %
(по массе) Fe+50 % (по
массе) Ni на рений. В трой-
ной системе происходит пери-
тектическое моповариантное
превращение с образованием
у-твердого раствора. Раство-
римость рения заметно возрас-
тает с увеличением температу-
ры. Политермические разрезы
при отношении железа к нике-
лю, равном 5:4 и 3:2, имеют
аналогичный вид.
На рис. 383 в виде проек-
ции на треугольник изображе-
ны изотермы растворимости
Рис. 382. Политермический разрез системы
Fe—Ni—Re от сплава состава 50 %Fe +
+ 50 %Ni на рений
рения в железоникелевом твер-
дом растворе при 600, 800,
1000 и 1100 °C. С повышением
температуры расширяется
концентрационная область ус-
тойчивости у-твердого раство-
ра за счет увеличения в нем содержания рения. Основной структурной
составляющей исследованных сплавов является железоникелевый
у-твердый раствор с г. ц. к. решеткой. Фаза Р представляет собой твер-
дый раствор на основе рения с гексагональной решеткой.
№, % (по массе)
Рис. 383. Изотермы растворимости рения в железонике-
левом твердом растворе при 600; 800; 1000 и 1100 °C
’ Иофис Н. А., Будберг П. Б., Троян М. В., Фонштейн Н. М. — Электронная
техника. Науч.-технический сб. Материалы, 1970. сер. 14, вып. 5, с. 20—24.
333
ЖЕЛЕЗО — НИКЕЛЬ — РУТЕНИЙ
Сплавы системы исследовали 1 методами рентгеновского и микрострук-
турного анализов, а также измерением твердости и микротвердости.
Построен изотермический разрез при 1000 °C (рис. 384). Показано су-
шествование двух широких однофазных областей. Одна из них прости-
Рис. 384. Изотермический разрез
системы Fe—Ni—Ru при 1000 °C
рается вдоль стороны железо — ни-
кель и представляет собой твердый
раствор рутения в сплавах железа с
никелем (г. ц. к. решетка). Другая
область является твердым раствором
на основе рутения (г. п. у. решетка).
В средней части системы располо-
жена двухфазная область равнове-
сия между твердыми растворами с
г. ц. к.-и г. п. у. решетками.
ЖЕЛЕЗО — НИКЕЛЬ —
СВИНЕЦ
Сплавы системы изучали2 методом
термического анализа Установлено
нонварпантное превращение Ж1~Ь
+ бч±жп+у. Разрыв растворимости
в жидком состоянии исследовали в
интервале температур 1350—
1550 °C; показано, что разрыв имеет
Рис. 385. Диаграмма состояния системы Fe—Ni—Pb
с областью разрыва растворимости в жидком состо-
янии при 1550 °C
1 Акопян А. С., Раевская М, В.. Соколова И. Т., Соколовская ЕМ. — Вест-
ник Московского ун-та. Химия, 1974, № 4, с. 467—471.
2 Miller К- О., Elliot J. F. — Trans. AIME, 1960, v. 218, № 5, p. 900—910.
334
тенденцию уменьшаться с увеличением температуры и повышением со-
держания никеля. Определены пределы существования фазы жц в
двойных сплавах никель — свинец: 62 % (ат.), или 32 % (по массе);
70 % (ат.), или 40 % (по массе) РЬ, при 1500 и 1550°C соответственно.
На рис. 385 приведена диаграмма состояния системы с областью
разрыва растворимости в жидком состоянии при 1550 СС.
ЖЕЛЕЗО — НИКЕЛЬ — СЕРА
Исследована в основном часть системы (Fe—FeS—Ni3S2—Ni), пред-
ставляющая практический интерес [1-7]. В этой системе обнаружено
соединение 2FeS-Ni^S2 [1—3], которое неустойчиво и распадается при
понижении температуры с образованием сульфида никеля состава NieSs
и соединения состава 4Ni'S-FeS [5, 6] или (NiFe)9S8 [7].
Рис. 386. Поверхность ликвидус части системы Fe—Ni—S
На рис. 386 приведена поверхность ликвидус системы Fe—FeS—
Ni3S2—Ni, построенная на основании данных тремического, микро-
структурного, минералогического анализов и измерения микротвердости
[5, 6]. При исследовании использовали электролитический никель, арм-
ко-железо, сульфид железа с 37,5 % (по массе) и сульфид никеля с
32,03 °/о (по массе) S. Поверхность ликвидус имеет пять областей пер-
вичной кристаллизации: 1) твердого раствора металлов; 2) сульфида
железа; 3) тройного твердого раствора; 4) соединения 4NiS-FeS;
5) сульфида никеля.
Соединение 4NiiS-FeS образует с сульфидом никеля и твердым рас-
твором металлов неустойчивый при низких температурах тройной твер-
дый раствор.
На основании исследований, выполненных методами термомагнит-
ного и рентгеновского анализов, а также измерением интенсивности на-
магничивания построена фазовая диаграмма при 600 °C [7]. При иссле-
довании использовали электролитическое железо чистотой 99,9 %, элек-
тролитический никель чистотой 99,9 %, никелевый штейн и очищенную
серу. Определили, что в системе при 600 °C существует тройная фаза
(NiFe)9S8, которая имеет кубическую решетку с периодом п=1,0129-^-
1,0095 нм при 44,1 % (ат.) S и 22,2—30,7 % (ат.) Ni.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R., Totrn IF. —Arch. Eisenhiittenw., 1930, Bd 3, № 12, S. 769—
780.
335
2. Guertler W., Savelsberg W.—Metall u. Erz., 1932, Bd 29, S. 84—91.
3. Уразов Г. Г., Филин Н. А.— Металлург, 1938, № 2, с. 3—17.
4. Hawley J. Е., Colgrove G. L., Zurbrigg Н. Е. — Econ. Geol., 191.1,
V. 38, № 5, р. 335—388.
5. Ванюков В. А., Ванюков А. В., Таращук Н. Т.—Цветные металлы,
1955, № 4, с. 23—27.
6. Ванюков В. А., Ванюков А. В., Таращук Н. Т. — Науч. тр./Москон-
ский ин-т цветных металлов и золота. М.: Металлургия, 1957, вып.
26, с. 108—119.
7. Nishihara Kjyokado, Kondo Yoshio. — Memoris Faculty Eng. Kyoto
University, 1961, v. 23, № 2, p. 242—263.
ЖЕЛЕЗО — НИКЕЛЬ — СУРЬМА
Исследованы сплавы системы, лежащие на разрезе Fe—NiSb, методами
дифференциального термического, микроструктурного анализов; прово
дили измерение твердости и магнитной восприимчивости [1]. Политер
мический разрез Fe—NiSb системы приведен на рис. 387. Разрез являет
ся квазибинарным эвтектического типа с эвтектической точкой при 40 %
Рис. 387. Политермический разрез Fe—Ni—Sb системы
Fe—Ni—Sb
(ат.) Fe. Компоненты незначительно растворимы друг в друге.
Показано [2], что при 600 °C растворимость сурьмы в a-Fe в при
сутствии 1 % (по массе) Ni снижается от 5,3 до 3,5 % (по массе),
а период решетки a-Fe уменьшается от 0,2884 до 0,2878 нм.
Установлено [3-5], что между соединениями FeSb и NiSb обра-
зуется непрерывный ряд твердых растворов. Твердые растворы трон
ной системы, лежащие от разреза FeSb—NiSb в сторону, обогащенную
железом и никелем, построены по типу фаз внедрения, а сплавы, ле-
жащие в сторону, богатую сурьмой, обладают решеткой с вакансиями,
т. е. междоузлиями, не занятыми атомами железа и никеля.
336
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I. Пантелеймонов Л. А., Бабанская И. А. — Вестник Моск. Ун-та. Хи-
мия, 1973, т. 14, № 3, с. 373—374.
2 Nageswararao М., McMahon С. J., Herman Н. — Met. Trans., 1974,
v. 5, № 5, р. 1061—1068.
3. Агеев Н. В., Макаров Е. С. — Изв. АН СССР. ОХН, 1943, № 3,
с. 161—169.
4. Агеев Н. В., Макаров Е. С, —ДАН СССР, 1943, т. 38, № 1, с. 23—25.
5. Агеев Н. В., Макаров Е. С.—ЖОХ, 1943, т. 13, № 3, с. 242—248.
ЖЕЛЕЗО — НИКЕЛЬ — ТИТАН
Сплавы системы исследовали методами микроструктурного, рент-
геновского [1], термического анализов и измерением твердости [2]. На
Рис. 388. Изотермическое сечение системы Fe—Ni—Ti при
900 °C
рис. 388 приведен изотермический разрез системы при 900 °C. Тройных
промежуточных фаз не обнаружено. Фазы TiNi и TiFe образуют непре-
рывный ряд твердых растворов. На основе фаз TiNi3, Ti2Ni и TiFe2 су-
ществуют широкие области твердых растворов, глубоко проникающие
п тройную систему.
Исследование взаимодействия между соединениями TiFe и TiNi
проведено в работе [2]. На рис. 389 приведена кривая солидус этого
разреза. Как и в работе [1], установлено, что между соединениями TiFe
и TiNi образуется непрерывный ряд твердых растворов.
337
Рис. 389. Солидус разреза TiNi—TiFe системы Fe—Ni—Ti
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Van Loo F. I. J., Vrolijk J. W. G. A., Bastin G. F. — J. Less-Common
Metals, 1981, v. 77. № 1, p. 121 —130.
2. Дудкина Л. П., Корнилов И. И. — Изв. АН СССР. Металлы, 1967,
№ 4, с. 184—188.
ЖЕЛЕЗО — НИКЕЛЬ — УГЛЕРОД
Поверхности ликвидус и солидус в сплавах системы, богатых железом,
исследовали в работе [1]. Сплавы изготавливали плавлением в ваку-
уме, в тиглях из оксида алюминия. В качестве шихтовых материалов
использовали железо чистотой 99,95%, никель чистотой 99,4 %, графит
чистотой 99,99%. После гомогенизации при 1200 °C в течение
слитки ------- '
сплавов
лизов.
„ ______.е недели
отжигали в атмосфере водорода при 1450 °C. Исследования
проводили методами микроструктурного и термического ана-
Рис. 390. Поверхность ликвидус части системы Fe—Ni—С
Рис. 391. Поверхность солидус части системы Fe—Ni—С
Рис. 392. Изотермический разрез части системы Fe—Ni—С
при 773 К (500 °C)
Ход конод в области между линиями ликвидус и солидус опреде-
лен расчетным путем и микрорентгеноспектральным анализом. Построе-
ны поверхности ликвидус (рис. 390) и солидус (рис. 391) сплавов си-
стемы с содержанием до 40 % (ат.) Ni и до 5 % (ат.) С.
Сплавы системы в области более низких температур исследованы
с помощью микроструктурного и микрорентгеноспектрального анализов
[2]. Исходными материалами для сплавов служили железо чистотой
99,999 %, никель чистотой 99,999 %, никель в порошке чистотой 99,9 %
и графит чистотой 99,999 %. Сплавы получали в индукционной печи в
тиглях из А12О3 в атмосфере аргона и водорода. Гомогенизировали
сплавы при 1473 ±10 К в течение 10—14 сут в кварцевых ампулах и
закаливали в воде. Построены изотермические разрезы сплавов, про-
шедших термическую обработку по режимам, предусматривающим дли-
тельные выдержки при температурах 1003; 923; 873; 773 К. На рис. 392
приведен изотермический разрез изученной части системы при 773 К.
339
338
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Buckley R. A., Hume-Rothery W.— J. Iron a. Steel Inst., 1964, v. 202,
№ 11, p. 895—898.
2. Romig A. D., Goldstein /. — Met. Trans., 1978, v. A9, № 11, p. 1599—
1609.
ЖЕЛЕЗО — НИКЕЛЬ — УРАН
Методами микроструктурного и рентгеновского анализов изучена 1 ква-
зибинарная система UFe2—UNi2. Сплавы синтезировали в дуговой печи
с использованием железа и урана особой чистоты. Уран содержал неко-
торое количество оксидных примесей. Сплавы отжигали в вакууме при
900 и 700 °C в течение одной и четырех недель соответственно, а затем
закаливали в воде Установлено существование двойных фаз UFe2, UNi2
и тройной фазы 7Fe, определены фазовые границы при 900 и 700 °C.
Данные о растворимости железа и никеля на границах фазовых обла-
стей приведены ниже:
Граница *отж=900 °c 'отж=700 °C
Ni, % (ат.) Fe, % (ат.) Ni, % (ат.) Fe, % (ат.)
UNi2/(UNi2+TFe) 56,9 9,8 56,7 10,0
TFe/(UNi2+TFe) 54,5 12,2 54,5 12,2
TFe/(TFe+UFC2) 53,9 12,8 53,9 12,8
UFe2/(TFe+UFc2) 47,7 19,9 47,6 19,1
На схемах изотермических сечений при 900 и 700 °C присутствуют
одни и те же фазовые области, границы которых практически совпадают
Фаза UFe2 имеет кубическую структуру типа MgCu2 с периодом
« = 0,7051 нм, а фаза UNi2 гексагональную структуру типа MgZn2 с
периодами решетки « = 0,4949, с = 0,8228 нм. Фаза Т имеет гексаго-
нальную структуру типа MgNi2 с периодами решетки « = 0,4963, с=
= 1,6397 нм со стороны UFe2 и « = 0,4961 нм, с= 1,6390 нм со стороны
UNi2.
ЖЕЛЕЗО — НИКЕЛЬ — ФОСФОР
Сплавы системы, содержащие до 15 % (по массе) Р, исследовали в ра-
боте [1] методами микроструктурного и термического анализов. Спла-
вы получали в электрической печи сопротивления. В качестве шихтовых
материалов использовали элекролитическое железо (для богатых желе
зом сплавов), железо, содержащее 0,05 % С (для бедных железом спла-
вов), электролитический никель и сплавы Fe — 22,3 % (по массе) Р и
Ni—10 % (по массе) Р.
В изученной концентрационной области тройных соединений не об
наружено. Соединения Fe3P и Fe3Ni образуют непрерывный ряд твер-
дых растворов (Fe, Ni)3P, что подтверждено более поздними работами
1 Brook G. В. — J. Inst. Metals, 1954—1955, v. 83, № 6, р. 271—276.
340
12, 3]. По результатам исследования восьми политермических разрезов
построена диаграмма состояния системы Fe—Ni—Ni3P—Fe3P при тем-
пературах выше 400 °C; эта диаграмма позволяет судить о равновесиях
между Fe3P, Ni3P, NisP2, Fe2P. В области Fe—Fe3P—Ni3P существует
понвариантное равновесие ж + аРе^уМ1 + (Fe, Ni)3P при 970°C или
при 1000 °C [3].
Между фазами aFe, у Ni и (^с> Ni)3P образуется тройная область
несмешиваемости. Разграничены области первичной кристаллизации
фаз: a-твердого раствора на основе железа, у-твердого раствора на
основе никеля, Fe2P, Ni5P2, твердого раствора (Fe, Ni)3P на основе Fe3P
п Ni3P.
С целью изучения фазового строения железоникелевых сплавов в
интервале температур от 1100 до 550 °C исследованы сплавы, содержа-
Рис. 393. Изотермический разрез части системы Fe—Ni—Р
при 1000 °C
Рис. 394. Изотермический разрез части системы Fe—Ni—Р
при 750 °C
341
щие до 16,5 % (по массе) Р [3]. Сплавы синтезировали в индукционной
печи в атмосфере аргона, используя корундовые тигли. Шихтовыми ма-
териалами служили железо чистотой 99,95 %'Fe, фосфор чистотой
99,999 % Р и никель, содержащий 0,002 % примесей. При 1100 и 1000 °C
проводили отжиг в вакууме в течение 5—10 сут. Ниже 1000 °C сплавы
отжигали в откачанных кварцевых ампулах. По результатам исследо-
вания построены изотермические разрезы при 1100, 1060, 1010, 1000,
995, 875, 750, 650 и 550 °C. Два из них приведены на рис. 393, 394.
При температурах ниже 1040 °C между Fe3P и Ni3P образуется фос
фидная фаза (FeNi)3P, обозначенная на рис. 393 Ph и представляющая
собой непрерывный ряд твердых растворов. Эта фаза участвует в че
тырехфазном равновесии ж+a^y + Ph при 1000±5°С. При понижении
температуры растворимость фосфора в а- и у-фазах снижается от 2,7
и 1,4 % (по массе) при 1000 °C до 0,25 и 0,08 % (по массе) при 550 °C
соответственно. Добавка фосфора в жслезоникелевые сплавы повышает
устойчивость a-фазы и снижает стабильность у-фазы.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R., Baur Н. — Arch. Eisenhiittenw., 1931, Bd 5, № 5, S. 269—
278.
2. Nowotny H., Hanglein E.—Monatsh. Chem., 1948, Bd 79, S. 385-
393
3. Doane A. S., Goldstein J. I. — Met. Trans., 1970, v. 1, № 6, p. 1759 —
1767.
ЖЕЛЕЗО — НИКЕЛЬ — ХРОМ
Одной из первых работ по изучению сплавов системы было исследова-
ние [1], в котором с использованием метода микроструктурного ана-
лиза построен изотермический разрез при 1300 °C (рис. 395). Со сто-
роны двойной системы железо — никель наблюдается широкая область
у-твердых растворов; со стороны железо — хром — область твердых рас-
творов а с о. ц. к. кристаллической решеткой.
В работах [2, з] иссле-
довали политермические
Сг
Рис. 395. Изотермический разрез системы
Fe—Ni—Сг при 1300 °C
разрезы систем, исходящш
из чистого хрома при раз-
личном соотношении двух
других компонентов. Уста
новлено существование ня
ти полиморфных модифика
ций хрома, что не нашло
подтверждения в дальней-
ших исследованиях.
В работе [4] изучали
фазовое строение нержавс
ющих сталей, содержащих
24—30 % Ni и 17—34 % Сг.
а также 0,3—0,5 % Si,
<0,4 % С и 0,03 % N. Ис
следование проводили в ни
тервале температур 1150
650 °C. При температурах
ниже 950—960 °C обнару
жено присутствие о-фазы.
Рентгеновское исследи
342
панне кристаллической структуры фаз в сплавах системы выполнено в
работах [5, 6]. Период решетки a-твердого раствора в зависимости от
состава изменяется в пределах 0,2862—0,288 нм; у-фазы — в пределах
0,3576—0,3585 нм; о-фазы от « = 0,863 нм; с=0,4559 нм при «/«=0,528
Ю « = 0,8768 нм; с = 0,4530 нм при «/« = 0,517. Структура о-фазы индици-
рована в структуре типа |3-U. По мнению авторов [5, 6], существует
высокотемпературный 6-Сг, имеющий структуру типа А15 (WO3).
Рис. 396 Изотермические разрезы системы Fe—Ni—Сг при 1427 (а), 1327
(б), 1100 (е) и 700 °C (г)
Исследовали влияние титана, алюминия, кремния и ниобия на по-
ложение фазовой границы у/у+а' в сплавах системы в интервале тем-
ператур 816—1260 °C. Указанная граница в сплавах двойной системы
никель — хром располагается при 37—47,7 % Сг и при увеличении со-
держания железа в сплавах снижается до 24,0—32,4 % Сг.
На рис. 396 приведены изотермические разрезы системы при тем-
пературах 1700; 1600; 1373 и 923 К, построенные на основании термо-
динамических расчетов в приближении регулярных растворов с исполь-
юванием ЭВМ [7].
В работе [8] методом термического анализа исследованы сплавы
системы, содержащие до 20 % (ат.) Ni и 35 % (ат.) Сг. Построена по-
верхность ликвидус изученной части системы в виде проекции изотерм
н,1 треугольник составов.
343
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Price Р„ Grant.N. — Trans. AIME, 1959, v. 215, № 4, p. 635—637.
2. Григорьев А. И., Соколовская E. M. — Вестник Моск. Гос. Ун-та.
Химия, 1961, № 6, с. 6—15.
3. Григорьев А. И., Куприна В. В. — ЖНХ, 1963, т. 8, № 11, с. 2563—
2565.
4. Hattersley В., Hume-Rothery W.— J. Iron a. Steel Inst., 1966, v. 204,
№ 7, p. 683—701.
5. Yukawa N., Hida M., Imura T. a. o.—Met. Trans., 1972, v. 3, № 4,
p. 887—895. \
6. Yukawa N., Hida M., Imura T. a. o. — J. Jap. Inst. Metals, 1971, v. 35,
№ 11, p. 1100—1101.
7. Kaufmann Z., Nesor H.—Met. Trans., 1974, v. 5, № 7, p. 1617—1621.
8. Schiizmann E.. Brauchmann J. — Arch. Eisenhiittenw., 1977, Bd 48,
№ 1, S. 3—7.
ЖЕЛЕЗО — НИКЕЛЬ — ЦИНК
Методами химического и микроструктурного анализов изучали диффу-
зионные слои сплавов, полученных путем погружения железоникелсвых
сплавов в расплавленный цинк при 700 °C [1]. В образующихся диффу-
зионных слоях обнаружены соединения NiZn3, FeZn7, FesZiin.
В работе [2] исследованы сплавы системы в области содержания
до 5 % (по массе) Fe.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Глускин Д. Я. — ЖТФ, 1940, т. 10, вып. 18, с. 1486—1501.
2. Raynor G. V., Noden J. D. — J. Inst. Metals, 1957—58, v. 86, № 6,
p. 269—271.
ЖЕЛЕЗО — НИКЕЛЬ — ЦИРКОНИЙ
Диаграмма состояния системы исследована в области, богатой цирко
нием [1—4]. По результатам исследования построены изотермические
разрезы при 900, 820 и 700 °C и проекция поверхности кристаллизации
В области сплавов, ограниченных треугольником Zr—Zr2Ni—ZrFc2, су
ществуют следующие нонвариантные равновесия:
ж + ZrFe2^Zr2 (FeNi)-ф Zr2 (NiFe) при 950 °C;
ж^р + Zr2 (FeNi) + Zr2 (NiFe) при 930 °C;
P + Zr2 (FeNi) Z Zr4 (FeNi) + Zr2 (NiFe) при 850 °C;
P^a -ф Zr4 (FeNi) -ф Zr2 (NiFe) при 760 °C.
Соединения Zr2Ni и Zr2Fe имеют структуру типа CuA12 с близкими
периодами решетки: для Zr2Ni п=0,647, с=0,524 нм; для Zr2Fc
= 0,646, с—0,554 нм.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Тарараева Е. М„ Григорьев А. Т. — В кн.: Физико-химия сплавин
циркония. М.: Наука, 1968, с. 107—113.
2. Rhines F. N„ Gould R. W., Advances—X-Ray Analysis, 1963, v. G,
p. 62.
344
3. Кузьма Ю. Б., Маркие В. Я., Ворошилов Ю. В., Сколоздра Р. В. —-
Изв. АН СССР. Неорган. материалы, 1966, т. 2, № 2, с. 259—263.
4. Тарараева Е. М„ Иванов О. С. — В кн.: Строение и свойства сила*
вов для атомной энергетики. М.: Наука, 1973, с. 131—138.
ЖЕЛЕЗО — НИОБИЙ — СЕРА
Методами микроструктурного, рентгеновского и термического анализов
исследовали 1 сплавы системы в области Fe—FeS—NbS—Nb. На рис. 397
приведен изотермический разрез изученной части системы при 950 °C.
В сплавах разреза FeS—NbS предполагается образование тройно-
го соединения Njb2FeS3, однако авторы не уверены в том, действительно
ли это соединение или предельный твердый раствор железа в соеди-
нении NbS.
Nb, % (по массе)
Рис. 397. Изотермический разрез части системы Fe—Nb—S
при 950 СС
ЖЕЛЕЗО — НИОБИЙ — УГЛЕРОД
Сплавы системы исследовали методами микроструктурного, рентгенов-
ского [1—4], дюрометрического и дифференциального термического [4]
анализов.
Образцы, спеченные из смешанных и спрессованных порошков нио-
бия чистотой 99,5 %, железа чистотой 99,9 % и спектрально чистого
графита, дважды переплавляли в электродуговой печи с вольфрамовым
нерасходуемым электродом на медном водоохлаждаемом поду. Ступен-
чатый отжиг проводили в печи с графитовым нагревателем в интерва-
ле температур от 1700 до 1050 °C в течение 600—700 ч при вакууме
0,0798 Па [1]. На рис. 398 изображен изотермический разрез системы
при 1050 °C. Тройных соединений в сплавах системы не обнаружено.
Карбид NbC при 1050 °C находится в равновесии с NbFe2, ц-фазой
(соединение состава NbFe с тригональной структурой), a-Fe и Nb2C,
а карбид Nb2C — в равновесии с ниобием и ц-фазой. Растворимость
углерода в двойных соединениях NbFe и NbFe2 практически отсутству-
ет. Карбид Nb3C2 в системе не обнаружен.
Политермический разрез Fe—NbC системы исследован в работах
[2—4]. Этот разрез является квазибинарным, эвтектического типа. Уста-
1 Kaneko Н., Nishizawa Т., Tamaki K.—J. Jap. Inst. Metals, 1963, v. 27,
f>. 312—318.
12—358
345
с
Ее, % (ат.)
Рис. 398. Изотермический разрез части системы Fe—Nb—С
Рис. 399. Политермический разрез Fe—NbC системы
Fe—Nb—С
новлены температуры плавления и состав эвтектики: 1310±10°С при
91,2 % Fe (по массе) [2]; 1460°C при 7,8 % NbC [3] и 1450±20°С при
7,8 % (по массе) NbC [4].
На рис. 399 приведен политермический разрез системы Fe—Nb—С по
данным [4]. В качестве шихтовых материалов использовали карбониль-
ное железо, электроннолучевой ниобий и спектрально чистый графит.
346
Сплавы получали в дуговой печи с нерасходуемым вольфрамовым элек-
тродом в атмосфере очищенного аргона многократным переплавом ших-
ты. Отжиг проводили при 1000 °C, 10 ч, с последующим медленным
охлаждением с печью. Исследовали сплавы как в литом, так и в отож-
женном состоянии.
Максимальная растворимость карбида ниобия в б-Fe при 1450 °C
составляет 2% (по массе); при 920±10сС происходит перитектоидная
реакция y+NbC^a. Предельная растворимость карбида ниобия в
a-Fe — менее 0,5 % (по массе). При 755 °C в сплавах разреза Fe—NbC
наблюдается магнитное превращение а-фазы.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Федоров Т. Ф., Кузьма Ю. Б., Сколоздра Р. В., Попова Н. М. — По-
рошковая металлургия, 1965, № 12, с. 63—68.
2. Guha J., Kolar D. — J. Less-Common Metals, 1972, v. 29, № 1, p. 33—
40.
3. Диаграмма состояния сплавов NbC—Бе — Мэйкоси гидзюцу нюсу,
1975, № 278, РЖМ, 1975, II, с. 5.
4. Шурин А. К, Дмитриева Г. П., Литвин Е. Г. — Металлофизика:
Респ. межвед. сб. Киев: Наукова думка, 1978, вып. 71, с. 23—25.
ЖЕЛЕЗО — НИОБИЙ — ФОСФОР
Сплавы системы в области составов Fe — FeP — Nb исследовали мето-
дами микроструктурного, рентгеновского и термического анализов.
Сплавы приготовляли в печи Таммана в атмосфере аргона. Исходны-
ми материалами служили железо высокой чистоты, красный фосфор и
ниобий. Фосфор вводили в виде эвтектического сплава Fc+Fe3P или
фосфида с более высоким содержанием фосфора.
На рис. 400 изображена часть диаграммы состояния системы. Ряд
превращений в области FeP — Nb — NbP2 нанесен гипотетически. В ис-
Nb, °/о (помассе)
Рис. 400. Поверхность ликвидус системы Fe—Nb—Р
12*
347
следованных сплавах установлено существование трех интерметалли-
ческих тройных соединений. FcNbP (фаза 7Д плавится конгруэнтно
при '820 С плотность 4,99 Мг/м3. Два других соединения FeNb2P
(/2) и FeNb4P (73) плавятся инконгруэнтно при ~ 1585 и ~ 1545 °C
соответственно. Твердость фаз 7\, Т2 и Тз достаточно высока и состав-
ляет 13220, 12380 и 10630 МПа соответственно. В исследованной части
системы кристаллизуются три тройные эвтектики- E|^6-Fe4-NbFe2+
+ Л при 1295 °C и 81,4 % Fe; 3,6 % Р и 15 % Nb; E2^T3+NiFe2+твер-
дый раствор Nb при 1489 °C и 26,0% Fe, 1,0 % Р и 73 % Nb; E6Uz-
е-ЬРезР + ^1 при 1125 °C и 84,5 % Fe; 14,5 %Р; 1 % Nb, а также че-
тройных пеРитектикИ: Ui, U2, Us и U6 при ~ 1537, 1503, 1275 и
1125 С соответственно.
FezP FeNbР, % (по пассе)
FeNbP, % (попассе)
Рис. 403. Фазовое строение сплавов системы Fe—Nb—Р при комнатной тем-
пературе
348
На рис. 401, 402 представлены политермические разрезы тройной
системы. Разрез Fe2P — FcNbP квазибинарный перитектического типа.
Разрез a-Fe — FeNbP квазибинарный эвтектического типа. Температу-
ра кристаллизации эвтектики ж=г*а-Ее +FeNbP 1303 °C. Распределение
фазовых областей при комнатной температуре в исследованной части
системы изображено на рис. 403.
Рис. 404. Изотермический разрез части системы
Fe—Nb—Р при 800 °C
В работе [2] провели микроструктурное и рентгеновское исследова-
ние сплавов системы, богатых железом. На рис. 404 приведен изотер-
мический разрез части системы при 800 °C. Подтвердили образование
тройного соединения FeNbP.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R., Bleichroth — Arch. Eisenhiittenw., 1962, Bd 33, № 3, S. 195—
210.
2. Kaneko H„ Nishidzawa T., Tamaki R.— J. Jap. Inst. Met., 1965, v. 29.,
№ 2, p. 159—165.
ЖЕЛЕЗО — НИОБИЙ — ЦИРКОНИЙ
Сплавы системы исследовали 1 в области составов, богатых цирконием
методами микроструктурного анализа; измеряли твердость и микро-
твердость.
Исходными материалами служили иодидный цирконий чистотой
99,6 %, металлокерамический ниобий чистотой 99,3 %, восстановленное
железо в порошке. Составы исследуемых сплавов располагали по трем
лучевым разрезам, исходящим из циркония при отношении Nb : Fe=
— 3:1, 1:1 и 1:3. Выплавляли сплавы в дуговой печи в атмосфере
аргона, отжигали в откачанных кварцевых ампулах. Закалкой сплавов
с 1100 °C установлена граница солидус в сплавах, богатых цирконием,
расположенная при 9,5; 5,5 и 4,5 % суммы ниобия и железа соответст-
1 Груздева Н. М., Загорская Т. Н., Раевский И. И. — В кн.: Физико-химия
сплавов циркония. М.: Наука, 1968, с, 117—122.
349
20
20
-/? + ZrFe2
z^-|M^ZrFe2
16
1Z
/?+ZrFe2
Zr 4 8 12 16 20 Zr 4 8 12 16 20
Fe, % [no массе/ Fe, % [П0 mcce/
Рис. -105. Изотермические разрезы части системы Fe—Nb—Zr при 1000 (a),
900 (б), 800 (в) и 700 °C (г)
Nb
Fe,7е [по массе)
Рис. 406. Проекция части системы
Fe—Nb—Zr на треугольник составов
венно на разрезах Fe:Nb = 3:l;
1; 1:1; 1 : 3. На рис. 405 приведе-
ны изотермические разрезы изу-
ченной части системы при 1000;
900; 800 и 700 °C. При понижении
температуры наблюдается сокра-
щение области Р-растворов на ос-
нове циркония. Предельная рас-
творимость ниобия и железа в |3-Zr
при 1000 °C по разрезам 3:1; 1:1
и 1 : 3 составляет 13; 6,5 и 5,5 %,
а при 900 °C — 5,8; 4,4 и 4,0 °/о со-
ответственно.
Фазовое равновесие при
800 °C отвечает концу превраще-
ния ач=*Р циркония в системе цир-
коний—железо. Растворимость
ниобия и железа в a-Zr незначи-
тельна. Точка трехфазного равно-
весия a-rP + ZrFe2 находится на
350
стороне цирконий—железо при 2,5 % Fe. При 700 °C трехфазная область
u+P + ZrFe2 занимает большую часть разреза, область располага-
ется вдоль стороны цирконий—ниобий.
На рис. 406 показана проекция изученной части системы на тре-
угольник составов.
ЖЕЛЕЗО — ОЛОВО — РТУТЬ
При исследовании1 взаимодействия оловянных амальгам с железом
установлено образование двух соединений: SnFe2, SnFe6Hg.
ЖЕЛЕЗО — ОЛОВО — СЕРА
Сплавы системы исследовали [1] в области реальных оловянно-желе-
зистых штейнов методом термического анализа. Полученные результа-
ты позволили лишь ориентировочно ограничить область расслаивания.
В дальнейшем было изучено взаимодействие SnS + Fe^Sn + FeS с целью
уточнения границы области расслаивания [2]. Сплавы получали сплав-
лением SnS и FeS в графитовых тиглях, в криптольной печи в парах
серы и исследовали методами дифференциального термического и мик-
роструктурного анализов. Построили три политсрмических разреза и
диаграмму плавкости системы, ограниченную соединениями SnS и
FeS. Определили области первичных выделений железа, FeS, SnS и
области расслаивания. В зоне расслаивания, прилегающей к разрезу
Sn — FeS, верхний слой состоит из сульфидов металлов, а нижний
представляет собой фазу, богатую металлическим оловом с небольшим
содержанием сульфидов. Исследование микроструктуры сплавов Fe —
FeS — Sn нс показало образования тройной эвтектики Fe+FeS + Sn.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1 Мурач Н II —Науч. тр./Минцветметзолото, 1938, вып. 6, с. 150—152.
2. Соколова М. А —Изв. СФХА, АН СССР, 1949, т. 18, с. 186—200.
ЖЕЛЕЗО — ОЛОВО -
УГЛЕРОД
Сплавы системы исследовали 2 ме-
тодами микроструктурного и рент-
геновского анализов. Материалами
для изготовления сплавов служи-
ли электролитическое железо чис-
тотой 99,9 %, олово чистотой
99,97 % и синтетический графит
чистотой 99,94 %. Выплавку про-
водили в высокочастотной печи в
графитовых тиглях из оксида алю-
миния (сплавы с низким содержа-
нием углерода). Построены по-
верхность ликвидус (рис. 407) и
изотермический разрез при 800 СС
(рис. 408). Установлены следую-
щие фазы: феррит, аустенит, цс-
1 Russell Д. S., Lyons Н. Л. М. —
J. Chem. Soc., 1932, № 8, р. 857—866.
2 Stadelmaier Н. Н., Waller J. М. —
Metall, 1961, v. 15, № 2, р. 125-126.
Рис. 407 Поверхность ликвидус части
системы Fe—Sn—С:
Ф — феррит; А — аустенит; К — карбид;
Ц — цементит
351
25
a + Fe35n + К
₽3
a+J3
20
части системы
Рис. 408. Изотермический разрез
Fe—Sn—С при 800 °C
15
С, % (ат.)
(^f/c+FejC)
ментит, тройной карбид (г.ц. к. решетка со сверхструктурой) и Fe3Sn
(гексагональная решетка).
ЖЕЛЕЗО — ОЛОВО — ХРОМ
Известно единственное исследование 1 влияния хрома на растворимость
олова в железе. Сплавы приготовляли в индукционной печи в атмосфе-
ре аргона, используя в качестве шихтовых материалов железо чисто-
той 99,9 % (по массе) и олово чистотой 99,98 %, (по массе). Сплавы
запаивали в откачанные ампулы, гомогенизировали при 1000 °C, 60 ч,
и закаливали. На основании рентгеновского исследования порошков
сплавов Fe—10 % (по массе) Sn и Fe— 10 % (по массе) Sn — 1%
(по массе) Сг, отожеиных при 600 °C, 26 дн., установлено, что до-
бавка 1 % (по массе) Сг снижает растворимость олова в a-Fe с 6,5 до
5,2 % (по массе). Также установлено, что в равновесии с твердым
раствором на основе железа при 600 °C в двойном сплаве Fe — 10 %
(по массе) Sn находится фаза FeSn, а в тройном сплаве Fe—10 %
(по массе) Sn—1 % (по массе) Сг — предположительно фаза Fc3Sn2,
имеющая моноклинную решетку.
ЖЕЛЕЗО — ОЛОВО — ФОСФОР
Сплавы системы изучали2 методами термического и микроструктурно-
го анализов в области Fe — FeP — Sn4Pg. Исходными материалами
служили армко-железо, красный фосфор и чистое олово. Олово и фос-
фор добавляли в нагретое до 1100— 1200 °C железо в виде лигатур
железо — фосфор и олово — фосфор. Сплавы отжигали при 200 °C,
80 ч.
1 Nageswararao М., McMahon С. з., Herman Я. — Met. Trans., 1974, v. 5,
№ 5, p. 1061—1068.
2 Vogel R., Zwingmann G. — Arch. Eisenhiittenw., 1955, Bd. 26, № 10, S. 631—640.
На основании исследования сплавов, отвечающих квазибинарным
разрезам Fe2P—Sn, Fe3P—FeSn, Fe3P—FeSn2, Fe2P—FeSn2 и не-
скольким политермическим разрезам, построена диаграмма состоя-
ния в области Fe — FeP — Sn4P3 — Sn (рис. 409). Концентрацию эле-
ментов в точках Ui, U1, Uз не определяли, так как эти точки, практи-
Рис. 409. Поверхность ликвидус системы Fe—Sn—Р
Рис. 410. Фазовое строение части системы Fe—Sn—Р при комнат-
ной температуре
чески, совпадают с чистым оловом. Особенностью тройной системы яв-
ляется наличие широкой области расслоения в жидком состоянии.
Ниже приведены температура и концентрация характерных точек рас-
сматриваемой системы:
353
Точка Концентрация, % (по массе) t, °C Точка Концентрация; % (по массе) t. °C
Fe Sn Р Fh | Sn р
Fi 74,8 16,7 8,5 981 62 2,2 97,2 0,6 -1315
F3 74,2 15,1 10,7 1105 Hi — — — -800
F6 63,3 15,7 21,0 1235 U2 — — — -490
«г Bf 85 66,7 15 14,7 18,6 -981 1315 Уз Fs — — — -490 -500
На рис. 410 приведена часть тройной диаграммы состояния с ука-
занием фазовых областей при 20 °C.
ЖЕЛЕЗО — ОЛОВО — ЦИРКОНИЙ
Сплавы системы исследованы в области, богатой цирконием, при со-
держании до 24,5 % Sn и 55 % (по массе) Fe [1] и до 18 % (по мас-
се) Sn и Fe [2].
В работе [1] в широких концентрационных пределах изучили
сплавы, богатые цирконием. В качестве материалов для сплавов ис-
пользовали иодидный цирконий, олово чистотой 99,9978 % и железо
чистотой 99,949 %. На основании данных рентгеновского и микрострук-
турного анализов построены изотермические разрезы изученной части
системы при 1100, 1000 (рис. 411), 900, 800, 700 и 600°C. Установлено,
Ve, % (по массе)
Рис. 411. Изотермический разрез системы Fe—Sn—Zr при 1000 °C
что в зависимости от температуры отжига в равновесии с а- и Р-твер
дыми растворами на основе циркония могут находиться фазы ZrFe2,
Zr4Sn, Zr5Sn3 и 0. Тройная фаза 0 существует при содержании около
24,5 % (по массе) Sn и 7—8 % (по массе) Fe.
На рис. 412 приведен политермический разрез, проходящий через
составы сплавов с постоянным содержанием циркония 90 % (по мае
се). Установлено существование четырех нонвариантных равновесий:
354
x=₽*P + 0 + ZrFe2 между 930 и 935 °C; P + Zr4Sn«=>a+Zr5Sn3 и р +
+ Zr5Sn3^a + 0 между 980 и 900 °C; P + 0^a+ZrFe2 между 790—
800 °C. Температуру плавления определяли оптическим пирометром.
Исходя из того, что фаза ZrFe2 находится в равновесии с твердым
раствором на основе железа, можно сделать вывод о существовании
трехфазного равновесия Fe+0 + ZrFe2.
t,°C
1600
1500
1600
1300
1000
1100
1000
ООО
800
100
ООО
500
01236567 89 10
Sn, % (по массе)
i । II__I_I_J—.1—।—1—1
10 987 6563Z10
Fe, % (по пассе)
Рис. 412. Политермический разрез системы Fe—Sn—Zi
при содержании циркония 90 %:
1 — 0+Zr4Sn5z±a-rZr6Sn3; 2— P+Zr5Sn3^z^a+6;
3 — ж7~>Р+0+2гР2; 4 — P + 0^zi a+ZrF2
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Tanner L. Е., Levinson D. W.— Trans. ASM, 1960, v. 52, p. 1115—1133.
2. Кудрявцев Д. А., Трегубов И. A. — В кн.: Физико-химия сплавов
циркония. М.: Наука, 1968, с. 133—138.
ЖЕЛЕЗО — ПАЛЛАДИЙ — СЕРЕБРО
Сплавы системы изучали [1] в области сплавов, богатых палладием,
при содержании до 36 %, (по массе) Ag и 31 % (по массе) Fe. Исполь-
ювали методы дифференциального термического, микроструктурного
355
анализов, проводили измерение твердости, электросопротивления и его
температурного коэффициента. Сплавы изготавливали в криптольной
печи под слоем хлористого бария, используя в качестве шихтовых ма-
териалов палладий, восстановленный муравьиной кислотой, железо
электролитическое и серебро, полученное сплавлением хлористого се-
ребра с содой. По результатам исследования были построены политер-
мические разрезы с постоянным содержанием палладия 89,5 % (ат.),
80 % (ат.), 70 % (ат.) и установлено положение фазовых областей в
сплавах системы при комнатной температуре.
В работе [2] изучали фазовые равновесия в сплавах системы в
пределах всего треугольника концентраций при температурах 1000,
Рис. 413. Изотермический разрез системы Fe—Pd—Ag при 1000 °C
1100, 1200°C. Использовали материалы чистотой 99,9 % (по массе).
Сплавы получали в тиглях из оксида алюминия в защитной атмосфере.
На основании результатов микроструктурного и рентгеновского анали-
зов построены изотермические разрезы при указанных температурах.
Изотермический разрез при 1000 °C приведен на рис. 413. Область не-
смешиваемости занимает большую часть концентрационного треугольни-
ка. В двухфазной области определено положение конод.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Григорьев А. Т., Пантелеймонов Л. А., Озерова 3. П., Акатова Е. В.—
ЖНХ, 1950, т. 5, вып. 11, с. 2335—2402.
2. Миап А. — Trans. AIME, 1962, v. 224, № 5, р. 1080—1081.
ЖЕЛЕЗО — ПЛУТОНИЙ — УГЛЕРОД
Сплавы системы исследовали1 микроструктурным, рентгеновским и
термическими методами анализов. Для получения сплавов использова-
ли спектрально чистое железо, плутоний чистотой 99,7 % и углерод.
Сплавы приготовляли дуговой плавкой в атмосфере аргона на медном
водоохлаждаемом поду.
1 Nichols J. L., Marples I. А. С.—Carbides Nucl. Energy, v. 1, 1964. p. 246 —
260, Discuss., p. 260.
356
Рис. 415. Изотермический разрез системы Fe—Pti—С при
1197 °C
Построены высокотемпературные изотермические разрезы системы
(рис. 414, 415). Обнаружены два интерметаллических соединения:
PuFeC2 и т]-фаза, образующиеся по перитектическим реакциям при
1316 и 1197 °C соответственно. Состав т] фазы [25 % (ат.) Рщ 33,3 %
(ат.) Fe; 41,7 % (ат.) С] отвечает формуле РпзРедСб. При 1165 °C про-
текает эвтектическая реакция ж^РиРе2+у-Ре, при 1037 °C образуется
357
тройная эвтектика ж^=РиРе2+1]+у-Ре. При 1143 и 1051 °C наблюда-
ются четырехфазные равновесия: ж+РиРеС2ч=ьт]+у-Ре; ж+Ри2С3^±т] +
+ PuFe2.
Соединение PuFeC2 изоморфно UFeC2, т)-фаза имеет о. ц. к. ре-
шетку с периодом 1,0105 ±0,001 нм.
ЖЕЛЕЗО — ПЛУТОНИЙ — УРАН
Приведена1 модель диаграммы состояния тройной системы. Между
эвтектиками двойных сплавов проходит линия моновариантных равно-
весий, по которой расположены низкотемпературные композиции спла-
вов системы.
ЖЕЛЕЗО — ПЛУТОНИЙ — ЦЕРИЙ
Сплавы системы исследовали2 методами микроструктурного и рентге-
новского, термического и микрорентгеноспектрального анализов. Спла-
Рис. 416. Поверхность ликвидус системы Fe—Pu—Се
вы синтезировали в танталовых ампулах из железа спектральной чи-
стоты с 0,03 %С, плутония с суммарным содержанием примесей 0,05 %,
церия чистотой 99,8 %.
1 Конобв веский С. Т. — В кн.: Сессия АН СССР по мирному использованию
атомной энергии 1—5 июля 1955 г. Заседание Отделения хим. наук. М.: Изд-во
АН СССР, 1955 с. 362.
2 Tucker Р., Etter D., Gebhart J.—Plutonium 1965 (L.), Chapman a. Hall, 1967,
p. 392—404.
358
На рис. 416 изображена поверхность ликвидус системы. Области
первичной кристаллизации имеют следующие фазы: б-Се, у-Се, e-Pu,
б-Pu, PueFe, PuFe2, CeFe7, Fe. Тройные соединения и тройные эвтекти-
ки в сплавах системы не установлены. Большую область занимает по-
ле первичной кристаллизации твердого раствора (CuPu)Fe2. На по-
верхности ликвидус существуют три перитектические точки и одна пе-
ревальная (все нонвариантные). Перитектические точки расположены
при 1050±5°С и 64 % (ат.) Fe, 7 % (ат.) Рп и 29 % (ат.) Се; при
435+2 и 12 % (ат.) Fe; 76 % (ат.) Ри; 12 % (ат.) Се; при 415±3°С и
10 % (ат.) Fe; 89 % (ат.) Pu; 1 % (ат.) Се. Координаты седловинкой
точки: 660±5°С и 14 % (ат.) Fe; 7 % (ат.) Ри; 79 % (ат.) Се.
Соединения CeFe2 и PuFes
относятся к семейству фаз Ла-
веса с кубической решеткой
типа MgCu2 (С15). Между
этими соединениями существу-
ет в твердом состоянии непре-
рывный ряд твердых раство-
ров. Период решетки CeFe2:
а = 0,73 нм; PuFe2: а —
= 0,719 нм.
Рис. 417. Схема изотермического разреза
системы Fe—11g—Сг при 20 °C
ЖЕЛЕЗО — РТУТЬ —
ХРОМ
Сплавы системы получали1
амальгамным способом. Мето-
дом рентгеновского анализа ис-
следовали порошки сплавов.
Показано, что при данном спо-
собе получения сплавов хром
и железо не взаимодействуют
между собой. На рис. 417 при-
ведена схема изотермического
разреза системы при комнатной температуре.
ЖЕЛЕЗО — РТУТЬ — ЦИНК
При исследовании 2 взаимодействия цинковых амальгам с железом об-
наружено существование двух двойных соединений Zn2Fes и Zn2Feg и
трех тройных соединений Zn2Fe6Hg, Zn2Fei2Hg и Zn2FeieHg2.
ЖЕЛЕЗО — СВИНЕЦ — СЕРА
Сплавы системы изучали в работах [1—4]. В работе [3] изучали ха-
рактер взаимодействия сернистого свинца с металлическим железом.
Методами химического, дифференциального термического и микро-
структурного анализов исследовали сплавы девяти политермических
разрезов.
На основании полученных результатов построена поверхность
ликвидус в области Fe — FeS — PbS — Pb (рис. 418).
В качестве исходных материалов использовали мягкое железо и
металлический свинец чистотой 99,9 %, искусственно приготовленный в
криптольной печи PbS путем насыщения серой металлического свинца,
1 Ltthl F. — Z. Metallkde, 1955, Bd. 46, № 6, S. 434 —441.
2 Russell A S., Lyons H. A. 41. — J. Chem Soc., 1932, p. 857-866.
359
а также сернистое железо высокой чистоты. Исходные сплавы готови-
ли сплавлением сульфидов PbS и FeS в графитовых тиглях в крип-
тольной печи. Расплавленные сульфиды насыщались серой.
Рис. 418. Поверхность ликвидус системы Fe—Rh—S
На приведенной диаграмме плавкости показаны области первичной
кристаллизации железа, FeS, PbS, область расслаивания в жидком со-
стоянии, а также изотермы ликвидус.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Leitgebel W.— Metal! u. Erz., 1926, Bd 23, S. 439.
2. Leitgebel W., Mikosh E.—Metal! u. Erz., 1934, Bd 31, № 13, S 290—
293.
3. Уразов Г. Г., Воробьев 77. А., Айнбиндер Я. В. — Металлург 1936
№ 2, с. 9—26; № 3, с. 15—27.
4. Friedrich К. — Metallurgie, 1907, Bd 4, S. 480.
Рис. 419. Политермический разрез PbTe—Fe
системы Fe—РЬ—Те
ЖЕЛЕЗО —
СВИНЕЦ-
ТЕЛЛУР
Сплавы системы исследова-
ли 1 в работе методами, тер-
мического, рентгеновского,
микроструктурного и микро-
рентгеноспектрального ана-
лизов. Использовали армко-
железо. Общее содержание
примесей не превышало
0,15 % (по массе).
По результатам иссле-
дования построен квазиби-
нарный разрез PbTe—Fe
1 Wald F., Stormont R. W. —
Trans. AIME, 1968, v. 248, № 1
n. 72—75.
360
(рис. 419). В области содержания железа от —5 до 10 % (ат.) наблю-
дается незначительное отклонение от истинной квазибинарности разреза.
Установлено существование монотектического характера взаимодейст-
вия элементов в системе
с двумя нонвариантными
превращениями эвтекти-
ческого типа при —1250
и 875 °C. По данным
рентгеновского анализа,
сплавы квазибипарного
разреза при комнатной
температуре имеют фа-
зовое строение oc-Fe+
+ РЬТе.
В твердом состоянии
PbTe в железе не рас-
творяется; растворимость
железа в PbTe составля-
ет 0,3 % (ат.).
ЖЕЛЕЗО-
СЕРА—СЕРЕБРО
Рис. 420. Изотермический разрез системы
Fe—S—Ag при 1200 СС
Сплавы системы исследо-
вали 1 методами микро-
Рис. 421. Изотермический разрез системы Fe—S—Ag при 700 С
Taylor L. А. — Met. Trans., 1970, v. 1, № 9, р. 2523—2529.
361
Рис. 422. Политермический разрез Ag—FeS
системы Fe—S—Ag
волом X обозначена тройная
структурного, рентгеновского и
термического анализов. Исход-
ными материалами служили
железо чистотой 99,995 %, се-
ра чистотой 99,999 %, серебро
чистотой 99,999 %.
На рис. 420 показан изо-
термический разрез системы
при 1200 °C. Имеется широкая
область несмешиваемости жид-
ких растворов на основе сереб-
ра и сульфида жРе$. Во
всех фазовых областях су-
ществует при этой температуре
паровая фаза (V). Вторая об-
ласть несмешиваемости наблю-
дается в области сплавов, бога-
тых серой, жз+ж+И Сим-
фаза, существование которой предпола-
галось, но не подтверждено в настоящем исследовании.
На рис. 421 изображен изотермический разрез системы при 700 °C.
При этих условиях в сплавах, богатых Ag2S и расположенных вдоль
разреза Ag2S—FeS2, существует жидкая фаза. В двойной системе се-
ребро— сера сульфид Ag2S плавится при 740 ±2 °C.
На рис. 422 изображен политермический квазибинарный разрез
Ag—FeS. При 1004 °C в сплавах разреза протекает монотектическая
реакция ж(Ре8)ч=*=ж(Ag) +FeS. При 955°C в сплавах разреза кристал-
лизуется эвтектика ж(Ag)ч=>Ag+FeS.
ЖЕЛЕЗО — СЕРА — СУРЬМА
Сплавы системы исследовали1 в области составов Fe—FeS—Sb2S3—Sb
методами микроструктурного и термического анализов [1].
Рис. 423. Поверхность ликвидус части системы Fe—S—Sb (б), об-
ласть расслоения тройных жидких растворов (а)
1 Уразов Г. Г., Большаков К, А., Федоров [Ц И., Василевская И.И. — ЖНХ,
1960, т. 5, № 2, с. 449—455.
362
t,cC
1200
1000
800
600
ООО
О 00 00 60 80 100
Sb2Sj Fe, % (noпассе) Fe
Рис. 424. Политермические разрезы системы Fe—S— Sb
100 80 60 00 20 0
Sb Sb,% (no массе) FeS
Сплавы синтезировали, используя в качестве исходных материалов
железо чистотой 99,7 %, черенковую серу х. ч., сурьму марки СуО чис-
тотой более 99,7 %. Лигатурой служили предварительно приготовлен-
ные соединения SbgSs [71,4—72,4 % Sb (по массе)] и FeS [63,2—
64,4 % (по массе) Fe], Первое из этих
соединений получали двукратным пе-
реплавом сурьмы с серой, а второе —
взаимодействием железа с серой при
высокой температуре.
На рис. 423, а, б приведена по-
верхность ликвидус изученной части
системы и показано, что область рас-
слоения жидких растворов, сущест-
вующая в двойной системе сурьма—
сера, довольно глубоко проникает в
тройную систему.
Установили три нонвариантных
превращения эвтектического типа —
Е., Е2, Е$ и перитектического — Р.
Превращения Е2 и Р протекают в
сплавах, богатых сурьмой. На рис.
424, 425 приведены некоторые поли-
термические разрезы изученной части
системы. Все эти разрезы в той или
иной степени пересекает область рас-
слоения жидких растворов. На этих
разрезах хорошо прослеживаются
нонвариантные превращения, проте-
кающие в сплавах системы.
Sb }%(ло массе)
Политермический
разрез
Рис. 425. ___ _____ _ _
FeSb2—FeS системы Fe—S—Sb
ЖЕЛЕЗО — СЕРА — ТИТАН
Сплавы системы исследовали в области составов Fe—FeS—TiS—Ti ме-
тодами микроструктурного, рентгеновского и термического анализов
[I]. На рис. 426 представлен изотермический разрез изученной части
системы при 950'°C. В сплавах разреза FeS—TiS предположено образо-
вание тройного соединения Ti2FeS3, которое находится в равновесии с
363
ЪМомассе)
Рис. 426. Изотермический разрез
части системы Fe—S—Ti при 950 °C
твердым раствором на основе железа.
В сульфиде FeS растворяется до 6 %
(по массе) Ti. Штриховой линией по-
казано фазовое строение разреза
FeS—TiS. Данные работы [2] отлича-
ются от данных работы [1]. В частно-
сти, согласно [2], в сульфиде FeS рас-
творяется до 27 % Ti, перитектиче-
ская реакция ж+(й, Fe)+±(Fe, Ti) S
протекает при 1550 °C, а не при
1380 °C, как это установили в работе
[1]. В работе [2] также не установле-
но существование тройного соедине-
ния Ti2FeS3.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Kaneko Н., Nishizawa Т., Tamaki
К- — J. Jap. Inst. Metals, 1963,
v. 27, № 7, р. 312—317.
2. Vogel R., Koster G. — Arch. Eisen-
huttenw., 1948, Bd 19, № 1, S. 65—
73.
ЖЕЛЕЗО — СЕРА — УГЛЕРОД
Сплавы системы изучали методами микроструктурного [1, 2], терми-
ческого [1] и химического [2, 3] анализов; применяли также метод
внутреннего трения [3].
Исследовали фазовые равновесия в сплавах системы в интервале
составов Fe—FeS—Fe3C при содержании углерода от 0,05 до 0,80 % и
серы до 0,2 % [Ц. Сплавы синтезировали в откачанных кварцевых труб-
ках насыщением сплавов железо—углерод серой в твердом состоянии при
температуре 1149—1427 °C. Построены изотермические разрезы этих
Гед Z/7 £ 2 3 it 5 6 Fe3C
С % (по пассе}
Рис. 427. Поверхность ликвидус части системы Fe—S—С
364
сплавов при 1149, 1204, 1260, 1316, 1371, 1399 и 1427 °C. На разрезах
при 1204 —1316 °C нанесена граница между y-Fe и двухфазной областью
y-Fe+ж. На остальных разрезах вдоль стороны железо—сера пока-
зано образование фазы б-твердого раствора серы в железе. Существова-
ние трехфазной области y-Fe+6+ж экспериментально не установлено.
С,% (по пассе)
Рис. 428. Проекция диаграммы состояния части системы
Fe—S-C
На рис. 427 изображена проекция поверхности ликвидус на плос-
кость концентрационного треугольника. В широком интервале составов
наблюдается несмешиваемость (рас-
слоение) в жидком состоянии (кри-
вая FiFkF2) Вблизи точки Fi распо-
лагается точка Е — тройная эвтекти-
ка с координатами 0,15 % С, 31,0 % S
и 975 °C. При этой температуре про-
текает четырехфазное нонвариантпое
превращение: ЖЕ^у+Fe.sC + FeS. При
кристаллизации в точке Е одновре-
менно образуются три фазы: FeS,
Fe3C и у-твердый раствор. Количест-
во цементита и аустенита в трой-
ной эвтектике невелико. При 1100 °C
в сплавах системы реализуется еще
одно нопвариантное, так называемое
монотектическое превращение: жР( ч*
+ Жидкость состава
Fi (4,0 % С и 0,8 % S) ниже 1100 °C
затвердевает в виде двойной эвтекти-
ки y+Fe3C (ледебурита). Из высоко-
сернистой жидкости системы F2
(0,25 % С и 29,5 % S) при дальней-
шем охлаждении сначала выделяет-
ся небольшое количество ледебурита;
состав оставшейся жидкости изменя-
ется по линии F2E, при 975 °C жид-
кость приобретает состав Е и затвер-
девает в виде тройной эвтектики у +
+ FeS+Fe3C.
Z ,7> (по пассе)
Рис. 429. Влияние серы на раство-
римость углерода в a-Fe:
a — данные химического анализа;
б — данные метода внутреннего
трения
365
Сплавы с содержанием до 5 % углерода и 30 % серы выплавляли в
графитовых тиглях в атмосфере аргона [2]. Показали, что в исследо-
ванной области составов при температурах 1400, 1500 и 1600 °'С суще-
ствует широкая область несмешиваемости жидких растворов, насыщен-
ных углеродом и серой. На рис. 428 показана в виде проекции на плос-
кость концентрационного треугольника исследованная часть диаграммы
состояния железо — сера — углерод. В сплавах системы при 975 °C
кристаллизуется тройная эвтектика y + FeS-l-Fe3C; эвтектическая точка
отвечает составу 31 % S и 0,1 % Q. Критическая точка области несме-
шиваемости расположена при 14,8 % S, 0,3 % С и 1300 °C.
Показано также, что в сплавах системы, помимо высокосернистой
малоуглеродистой тройной эвтектики с температурой кристаллизации
975 °C, образуется еще одна малосернистая высокоуглеродистая тройная
эвтектика с температурой кристаллизации 1117 °C. Примерный состав
этой эвтектики: 4 °/0 С и 1 % S (по массе).
Изучали влияние серы на растворимость углерода в a-Fe на спла-
вах железа с содержанием серы 0,001, 0,01 и 0,02 % [3]. Слитки дефор-
мировали с промежуточными отжигами в вакууме и получали проволо-
ку, которую также отжигали в вакууме при 1150 °C, 2 ч и 860 °C, 25 ч.
Содержание азота в образцах не превышало Ю-3 %. Образцы наугле-
роживали при 600, 650, 680 и 700 °C в атмосфере СО и СО2.
Растворимость углерода в a-Fe возрастает с увеличением содержа-
ния серы в железе как по данным химического анализа (рис. 429, а),
так и по данным, полученным при использовании метода внутреннего
трения (рис. 429, б). При 728 °C растворимость углерода в a-Fe с
0,001 °/о S составляет 0,039 %; в a-Fe с 0,02 % S растворимость углеро-
да при тех же условиях возрастает до 0,045 %.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R., Ritzau G.—Arch. Eisenhiittenw., 1931, Bd 4, H. 11, № 7,
S. 549—554.
2. Малиночка Я. H„ Здоровец С. А., Багнюк Л. И. — Изв. АН СССР.
Металлы, 1983, № 2, с. 210—219.
3. Barboda А. М„ Bock К. R„ Parlee М —Trans. AIME, 1961, v. 221,
№ 2, р. 173—179.
4. Schurmann Е., Schafer К-— Gissereiforsh., 1968, Bd 20, № 1, S. 21—
33.
5. Шумилов A. H., Козак А. П., Соколов К. И. и др. — Изв. вузов. Чер-
ная металлургия, 1973, № 10, с. 123—126.
ЖЕЛЕЗО — СЕРА — ФОСФОР
Методами термического и химического анализов исследовали1 сплавы
системы, содержащие до 32 % S и 24 % Р. Сплавы выплавляли в печи
Таммана в атмосфере аргона. Исходными материалами служили арм-
ко-железо, сернистое железо и феррофосфор.
На рис. 430 показано положение области несмешиваемости двух
жидких растворов, насыщенных серой и фосфором в сплавах рассматри-
ваемой системы при 1400 и 1600 °C. На рис. 431 приведена в виде про-
екции на плоскость концентрационного треугольника часть диаграммы
состояния системы, ограниченная разрезом FeS—Fe2P. На этом же ри-
сунке вверху^в другом масштабе показано фазовое строение сплавов,
богатых серой. Тройная эвтектика y-|-FeS + Fe2P кристаллизуется при
1 Schuzmann Е., Schafer К. — Giessereiforschung, 1968, Bd 20, № 1, S. 21—23.
366
30
Рис. 431. Проекция диаграммы состоя-
ния части системы Fe—S—Р
970 °C, эвтектическая точка расположена при 30 % S и 0,2 °/о Р (по мас-
се). Критическая точка области несмешиваемости отвечает 0,7 % Р>
15 % S (по массе) и 1280 °C.
ЖЕЛЕЗО — СЕРА — ХРОМ
Сплавы системы исследованы в области составов Fe—FeS—CrS—Сг
Рис. 432. Изотермический разрез части систе-
мы Fe—S—Сг при 950 °C
На рис. 432 приведен изотермический разрез изученной части сис-
темы при 950 °C [1, 2]. Между сульфидами железа и хрома существует
непрерывный ряд твердых растворов.
Растворимость серы в сплавах системы железо — хром с использо-
ванием радиоизотопа серы 35S исследовали в работе [3].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Kcmeko И., Nishiza Т„ Tamake R.— J. Jap. Inst. Metals, 1963, v. 27,
№ 7, p. 312—317.
2. Vogel R., Reinbach R. — Arch. Eisenhiittenw., 1937/38, Bd 11, № 6,
S. 457—462.
3. Groliere R., Barbouth N.—Metal sci., 1976, v. 73, № 1, p 71—76
ЖЕЛЕЗО — СЕРА — ЦИРКОНИЙ
Сплавы системы исследовали в области составов Fe—FeS—ZrS—Zr
методами микроструктурногс, рентгеновского и термического анализов
[1]. На рис. 433 приведен изотермический разрез изученной части систе-
мы при 950 °C. В сплавах системы образуется тройное соединение
ZrFeS2, которое находится в равновесии с твердым раствором на основе
Рис. 433. Изотермический разрез части системы
Fe—S—Zr при 950 °C
железа. Штриховой линией сверху показана диаграмма разреза FeS—
ZrS. В сульфиде FeS растворяется до 4 % Zr.
Ранее систему исследовали в работе [2]. Согласно [2], в FeS раст-
воряется до 27—28 % Zr; образование тройного соединения не установ-
лено. Авторы работы [2] считали, что взаимодействие между FeS и
ZrS отвечает простой эвтектической системе, а не перитектической, как
это показано в [1]. Различия работ [1] и [2] обусловили различное
расположение фазовых областей на изотермическом разрезе при 950 °'С.
На рис. 434 представлена [2] проекция диаграммы состояния
368
Fe—FeS—ZrS2—ZrFe, на плоскость концентрационного треугольника.
В боковой системе ZrS2—Fe2S существует широкая область несмешива-
емости компонентов в жидком состоянии, которая проникает глубоко
в тройную систему. Область несмешиваемости ограничена кривой
f 1 f2 В сплавах, расположенных за указанной кривой, реали-
зуются два нонвариантных превращения эвтектического типа в точках
Ei и Е2. Фазовое строение исследованных сплавов при комнатной тем-
пературе показано на рис. 435.
369
т
Fs « 10 20 30 40 Fegr
ZrS2
Zv,°/o [no'массе}
Рис. 435. Фазовое строение сплавов системы Fe—S—Zr при
комнатной температуре
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Kaneko Н., Nishizawa Т., Tamaki К- — J. Jap. Inst. Metals, 1963,
v. 27, № 7, р. 312—315.
2. Vogel R., Hartung A. — Arch. Eisenhiittenw., 1941/42, Bd 15, № 9,
S. 413—418.
ЖЕЛЕЗО — СУРЬМА — УГЛЕРОД
Сплавы системы исследованы 1 методами термокинетического и микро-
структурного анализов. В качестве исходных материалов использовали
чугун, содержащий 3,66 %С; 0,15 % Si; 0,2 % Мп; 0,08 % S и очищен-
ную сурьму. Сплавы с 5,83—59,32 % Sb и 0,30—3,12 % С выплавляли
в графитовых тиглях, облицованных магнезитом. Добавление сурьмы
в сплавах железа с содержанием ~3 % С снижает температуру ликви-
дус В частности, для сплава железа, содержащего 2,9 °/о С и 13,82 %
Sb, температура ликвидус соответствует 1070 °C.
ЖЕЛЕЗО — СУРЬМА — ФОСФОР
Диаграмма состояния системы характеризуется сложным распределе-
нием фазовых областей, что обусловлено образованием ряда фосфидов
при взаимодействии железа с фосфором в двойной системе и антимо-
нидов в системе железо — сурьма. При температурах, превышающих
635 °C, в равновесии может участвовать газообразный фосфор, так на-
зываемая паровая фаза.
Сплавы системы изучали2 в области составов Fe—FeP—Sb ме-
тодами термического и микроструктурного анализов. Проекция диаг-
раммы состояния на треугольник составов представлена на рис. 436.
В исследованных сплавах системы кристаллизуются две эвтектики: Ei при
77 % Fe; 7 % Р и 16 % Sb (по массе) и 956 °C; Е2 при 47,8 % Fe;
1,7 % Р и 50,5 %Sb (по массе) и 999 °C.
Штриховой линией нанесена область, в которой при более высоком
содержании фосфора уже присутствует паровая фаза. Распределение
1 Goerens Р., Ellingen К. — Metallurgie, 1910, v. 7, № 2, р. 72—79.
2 Vogel R., Horstmann D. — Arch. Eisenhuttenw., 1959, Bd 23, № 2, S. 127—134.
370
Sb, % (по массе)
Рис. 437. Фазовое строение сплавов системы Fe—Sb—Р при ком-
натной температуре
371
фазовых областей в изученной части системы при комнатной темпера-
туре приведено на рис. 437; на рис. 438 изображен политермический
разрез Fe2P — FeSb2.
t°C
800
600
(Fe+Z£%'Cr)2 4 6 в 10
Sb,%f.по массе)
Рис. 439. Влияние хрома на
расторимость сурьмы в a-Fe
Рис. 438. Политермический разрез
Fe2O—FeSba системы Fe—Sb—Р
ЖЕЛЕЗО — СУРЬМА — ХРОМ
Влияние хрома на растворимость сурьмы в «-железе исследовали1
методом рентгеновского анализа. Сплавы изготавливали в индукцион-
ной печи в тиглях из MgO в атмосфере аргона. Исходными материа-
лами служили железо электролитическое чистотой 99,9 % с содержани-
ем углерода ~ 0,005 % и сурьма чистотой 99,99 %. Сурьму вводили в
виде лигатуры железа с 38 % Sb (по массе).
На рис. 439 показано влияние 0,5 % Сг (штриховая линия) на
растворимость сурьмы в a-Fe (сплошная линия). Показано, что до-
бавка 0,5 % Сг понижает растворимость сурьмы при 600 °C от 5,3 до
5,0 %. При этом период решетки a-твердого раствора сурьмы в железе
при 600 °C снижается от 0,2884 (без хрома) до 0,288831 нм с 0,5 % Сг.
ЖЕЛЕЗО — ТИТАН — УГЛЕРОД
Сплавы системы исследовали методами микроструктурного и рентге-
новского анализов [1—3]. В качестве шихтовых материалов использо-
вали титан магниетермический, железо электролитическое рафиниро-
ванное, графит спектрально чистый. Сплавы, содержащие до 26 %С и
0—'100 % Fe, приготовляли расплавлением в дуговой печи. Построены
поверхность ликвидус (рис. 440) и изотермический разрез системы при
1000 °C (рис. 441). В сплавах системы имеются следующие фазы: а- и
|3-твердый раствор на основе титана, графит, 6-фаза — твердый рас-
твор на основе TiC, TiFe, TiFe2; тройных соединений не найдено.
1 Nageswarazao М., McMahon С. J., Jr. Herman Н.—Met. Trans., 1974, v. 5,
p. 1061—1068.
372
Область однородности 6-фазы при 1000 °C существует в пределах
13—20 % С и 15 % Fe. Установлена возможность сингулярной триан-
гуляции системы по разрезам TiC — Fe и TiC — TiFe2 с выделением
трех вторичных систем TiC — Fe — С; TiC — Fe — TiFe2 и TiC —
TiFe — Ti. Разрез TiC — Fe — квазибинарный, эвтектического типа.
Рис. 440. Поверхность ликвидус системы Fe—Ti—С
Рис. 441. Изотермический разрез системы Fe—Ti—С
при 1000 °C
Эвтектика ж^6-|-(Fe)6 кристаллизуется при 1350 °C и содержит 7 %
Ti и 1,7 % С. Разрез TiC — TiFe2 — также эвтектического типа с тем-
пературой кристаллизации эвтектики ж^6+Т1Ре2 при 1520 °C. Во вто-
ричной системе TiC — Fe — С установлены три нонвариантных равно-
весия: >K+(Fe)6^TiC+(Fe)v при 1320°С; ж=^Т1С+(Fe) v -J-С при
1140 °C; (Fe) vFTiC<±(Fe)a+C. В системе TiC — Fe — TiFe протекает
тройная эвтектическая реакция: ж=ёУПРе2+Т1С+ (Fe) 6 при 1340 °C. Во
373
вторичной системе TiC—TiFe2 — Ti существует три нонвариантных
равновесия: ж + TiFe^TiC + TiFe при 1310 °C; ж + TiC^TiFe-l- (Tip
при 1100 °C; (Ti)p 4-TiC^(Ti)a-|-TiFe. Установлено, что твердый рас
твор на основе TiFe при 1080 °C однороден в интервале 52—54 % Fe.
Это соединение имеет о. ц. к, решетку, период которой в гомогенной
области при увеличении содержания железа уменьшается от 0,2978
до 0,2977 нм. Твердый раствор на основе TiFe2 при 1200 °C однофазен
в интервале концентраций 68,5—77 % Fe. Соединение TiFe2 имеет гек-
сагональную решетку типа MgZn2, период которой уменьшается с уве-
личением содержания железа. Период кристаллической решетки б-фа
зы с увеличением содержания Fe уменьшается от 0,4325 (TiC) до
0,4310 нм (сплав с 17 % С и 15 % Fe).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Murakami Jotaro, Kimura Hirozo, Nishimura Joshio — J. Jap. Inst.
Metals, 1957, v. 21, № 11, p. 669—673.
2. Murakami Jotaro Kimura Hirozo, Nishimura Joshio. — J. Jap. Insi.
Metals, 1957, v. 21, № 12, p. 712—716.
3. Murakami Jotaro, Kimura Hirozo, Nishimura Joshio. — Nem. Fac.
Engng Kyoto Univ., 1957, v. 19, № 3, p. 302—324.
ЖЕЛЕЗО — ТИТАН — ЦИРКОНИЙ
Сплавы системы исследовали 1 в области составов TiFe2—ZrFe2 мето-
дами микроструктурного, рентгеновского и термического анализов. Ис-
Рис. 442. Политермический разрез
TiFes—ZrFes системы Fe—Ti—Zr
ходными материалами служили
карбонильное железо чистотой
99,99 %, титан иодидный чистотой
99,8 %, цирконий иодидный чисто
той 99,96 %- Сплавы изготавлива-
ли в дуговой печи в атмосфере ар-
гона, отжигали при 900 СС, 200 ч,
в откачанных кварцевых ампулах
и закаливали в воде.
На рис. 442 изображен поли-
термический разрез TiFe2—ZrFe2.
При 1470СС протекает перитектп
ческая реакция ж+Х2^Хь Уста-
новлено образование широких об-
ластей твердых растворов со
структурами MgZn2(M) и
MgCu2(X2).
ЖЕЛЕЗО — ТИТАН — ФОСФОР
Сплавы системы исследовали в области составов Fe — FeP — FeTiP —
Fe—Ti методами микроструктурного, рентгеновского и термическо-
го анализов. Сплавы выплавляли в печи Таммана в корундовых или
цирконовых тиглях в атмосфере аргона. Исходными материалами слу-
жили чистое железо, красный фосфор и титан чистотой 99,73 %• Фос-
фор вводили в сплавы в виде лигатуры, в качестве которой использо-
1 Петьков В. В., Кочержинский Ю. А., Маркиев В, Я,— ДАН УРСР, 1971,
Сер. А, с. 942—944.
374
вали фосфиды железа или некоторые специально изготовленные спла-
вы системы железо — фосфор [I].
На рис. 443 изображена поверхность ликвидус исследованной части
системы Fe — FeP — FeTiP — FeTi. Фазовые превращения в осталь-
ной части рисунка нанесены гипотетически. Экспериментально уста-
новлены два четырехфазных нонвариантных превращения эвтектичес-
кого типа —- точки Е[ и £5 и два четырехфазных перитектических пре-
вращения— точки U2 и U3. В точке £1 при 1330 °C протекает реакция:
>A4=ta-Fe+Fe2Ti + FeTiP; в точке £5 при 1047 °C идет превращение
Жч=ьРе3Р-|-РеТ1Р-|-а-Ре. При 1290 °C в точке U2 осуществляется че-
рне. 443. Поверхность ликвидус системы Fe—Ti—Р
FC2P Ti,. % (попассе) FeTiP Fe3P Ti, % (попассе) FeTiP
Рис. 444. Политермические разрезы системы Fe—Ti—Р
375
тырехфазное превращение II класса: K+FeTiP<±FeP+Fe2P, а при
1160 °C в точке Us—превращение >K+Fe2P+±Fe3P+FeTiP. В исследо-
ванных сплавах установлено образование тройного соединения FeTiP,
которое плавится конгруэнтно при 1850 °C. Это соединение принимает
непосредственное участие практически во всех нонвариантных превра-
щениях.
На рис. 444 и 445 изображены некоторые политермические разре-
зы изученной части системы и фазовое строение сплавов при комнат-
ной температуре.
В работе [2] методами микроструктурного, рентгеновского и хими-
ческого анализов исследовали сплавы в области составов Fe — Fe2P —
FeTiP—Fe2Ti; построен изотермический разрез исследованной час-
ти системы при 800 еС (рис. 446). Подтверждено образование соедине-
ния FeTiP и распределение фазовых областей в сплавах на основе же-
леза в системе, ранее установленное в работе [1].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R., Giesen В. — Arch. Eisenhiittenw., 1959, Bd 30, № 9, S. 565—
576.
2. Kaneko H„ Nisidzawa T„ Tamaki K. — J. Jap. Inst. Metals, 1965, v. 29,
Ke 2, p. 159—165.
ЖЕЛЕЗО — ТИТАН — ХРОМ
Рис. 445. Фазовое строение сплавов системы Fe—Ti—Р пои
комнатной температуре ’
Сплавы системы исследовали [1] в области составов Fe — TiFe2 —
TiCr2— Сг методами микроструктурного, рентгеновского анализов, а
также проводили измерение твердости и микротвердости. Сплавы изго-
тавливали в дуговой печи из электролитического железа, иодидного ти-
Fe ВО
60 50 20 Сг
Рис 446. Изотермический разрез части системы Fe—Ti—Р
при 800 С
$ $
Fe 80 а 60 50 20 Сг
20 Сг
Ге,% (по массе)
ап *Ai <2
20
aTif^TiCrz^
ar, + TiCr2
50 TiCr2
aCr + TiCr2
80
асг+Л7'।'Сг2
Рис. 447 Изотермиче-
ские разрезы системы
Fe—Ti—Сг при 1000 (а),
800 (б) и 550 °C (в)
тана и электролитического хрома. Построены изотермические разрезы
исследованной части системы при 550 и 1000 °C. Обнаружено сущест-
вование тройного соединения (фазы %), отвечающей составу TisCrjFeiz
со структурой сс-Мп.
Исследование диаграммы состояния системы во всем концентраци-
онном интервале проведено в работе [2]. Подробно исследовали взаи-
модействие фаз Лавеса TiFe2 и TiCr2 в тройной системе. Эти фазы об-
разуются в соответствующих двойных системах и непрерывно раство-
ряются друг в друге в тройной системе. Разрез TiFe2 — TiCr2 является
квазибинарным. По этому разрезу можно триангулировать первичную
тройную систему на две вторичные. На рис. 447 изображены изотерми-
376
13—358
377
ческие разрезы системы при 1000, 800 и 550 °C. В сплавах системы при
1200 °C протекает перитектическая реакция: ж-|-Т1(Сг, Fe)24±|3-Ti+TiFe;
состав перитектики 30 % Fe и 12 % Сг (по массе). При дальнейшем
снижении температуры р-Ti претерпевает эвтектоидный распад по
схеме: |3-Ti^cc-Ti + TiFe+Ti(Fe, Сг)2. Совместная растворимость же-
леза и хрома в cc-Ti при 550 °C не превышает 0,4 %.
Рис. 448. Изотермические разрезы системы Fe—Ti—Сг при 1427, 1227 и
1000 °C
Термодинамический расчет фазовых равновесий в сплавах системы
с учетом диаграмм состояния двойных боковых систем опубликован в
работе [3]. На рис. 448 изображены изотермические разрезы системы
при 1700, 1500 и 1273 К.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Борискина Н. Г., Корнилов И. И. — Изв. АН СССР. ОТН. Металлур-
гия и топливо, 1960, № 1, с. 50—53.
2. Борискина Н. Г., Корнилов И. И. — ЖНХ, 1964, т. 9, № 5, с. 1163—
1168.
3. Kaufman L., Nesor Я.— Met. Trans., 1975, v. A6, № II, p 2115—
2122.
ЖЕЛЕЗО — ТОРИЙ — УРАН
Сплавы системы изучали в области, ограниченной концентрационным
треугольником U — UFe2 — Th методами дифференциального термичес-
1600
1600
1200
1000
ureZ'
800
к. zr/UFe2 / i
PV / i
‘ / Ю25°С ’
Th
600
l~ UFe^r
О
UFe;
7*ат(1
20 60 60 80 100
Th, % (помассе) Th
Рис. 449. Политермический разрез
UFe2—Th системы Fe—Th—U
кого, микроструктурного [I, 2], рент-
геновского анализов [2], а также про-
водили измерением твердости и мик-
ротвердости [1]. Использовали ком-
пактные материалы: уран (99,8 % U),
торий (99,6 % Th) и армко-железо
Сплавы получали в дуговой печи с
вольфрамовым электродом на медном
водоохлаждаемом поддоне в атмосфе-
ре чистого аргона.
На основании полученных резуль-
татов построены проекция диаграм-
мы состояния, проекция поверхности
ликвидус, изотермический разрез при
650 °C, пространственное изображе-
ние диаграммы состояния U—UFe2—
Th [1] и квазибинарный разрез UFe2—
Th [1, 2] (рис. 449). В равновесии с
твердым раствором на основе урана
378
могут находиться UsFe, CFe2, r(UFe2Th2) и твердый раствор на основе
тория. Тройная фаза Т образуется при 1025 °C, имеет область гомоген-
ности ~2 % (ат.) и принадлежит к ромбической сингонии с периодами
а = 0,5950 нм; Ь — 0,385 нм, с = 0,9670 нм [2].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Бадаева Т. А., Александрова Л. Н. — В кн.: Физико-химический ана-
лиз сплавов урана, тория и циркония. М.: Наука, 1974, с. 123—129.
2. Александрова Л. Н., Алексеева 3. М. — В кн.: Сплавы для атомной
энергетики. М.: Наука, 1979, с. 106—110.
ЖЕЛЕЗО — УГЛЕРОД — УРАН
Сплавы системы исследовали методами микроструктурного и рентге-
новского анализов в работе [1]. В качестве шихтовых материалов ис-
пользованы UC (4,68—
4,75 % С) в форме дроби,
порошок урана с примеся-
ми (1,0 % О; 0,198 % N;
0,047 % Н; 0,021 % Са;
0,2 % Fe; 0,126 % Si; 0,77 %
С; 0,064 % F; <0,05 % Al),
графитовые стержни, содер-
жащие 0,03 % золы, спек-
трально чистое железо в ви-
де порошка, UC2 (8,6 % С;
0,055 % N; 0,1 % Fe; 0,1 %
Сг). Сплавы получали путем
спекания в ториевых тиглях
в атмосфере очищенного ар-
гона при 1000—2000 °C. По-
лученные слитки подвергали
дроблению в среде керосина
Рис. 450. Политермический разрез UC2—Fe си-
стемы Fe—С—U
и просеивали через сито
—60+300 меш.
Разрез UC—Fe — эвтек-
тического типа с кристал-
лизацией эвтектики при 51,5+0,5 % (по массе) Fe и 1105±5°С. В раз-
резе UC—UFe2 эвтектика наблюдается при 92± 1 % (по массе) UFe2 и
1040+20 °C, а в разрезе UC2—Fe при 61,0±0,5 °/о (по массе) Fe и 1150+
+ 10 °C (рис. 450). Соединение UFeC2 образуется по перитектической
реакции при 1615+10 °C из твердого UC2 и жидкой фазы, содержащей
19 % (по массе) Fe.
Рис. 451. Схематическое изображение
изотермических разрезов системы Fe—
U—С в интервале 1160—1115 °C:
а — в интервале 1160—1129 °C; б—выше
1129 °C; в — в интервале 1129—1115 °C
13*
379
Изотермические разрезы тройной системы UC — UFe2 — Fe изуча-
ли в работе [2]. Сплавы получали из урана чистотой 99 %, спектраль-
но чистого железа и углерода в атмосфере аргона на медном водоохла-
ждаемом поду. Исследование выполнили методами микроструктурно-
го, рентгеновского и термического анализов. На рис. 451 представлено
схематическое изображение трех изотермических разрезов системы
ИС — UFeC2—Fe в интервале 1115—1160 °C. Предполагается сущест-
вование четырехфазного равновесия ж+иЕеС2ч±иС4-Ее при 1129 °C.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Briggs G., Guha J., Barta J., White J. — Trans. Brit. Ceram. Soc.,
1963, v. 62, № 3, p. 221—246.
2. Nichols J. L., Marples J. A. C. — Carbides Nucl. Energy, v. 1, L.: Mac-
millan a. Co, Ltd, 1964, p. 246—260, Discuss, p. 260.
ЖЕЛЕЗО — УГЛЕРОД — ФОСФОР
Проекция диаграммы состояния Fe — Fe3C — Fe3P построена [1] по
результатам исследования сплавов системы методами термокинетичес-
кого и микроструктурного анализов (рис. 452).
Рис. 452. Диаграмма состояния Fe—Fe3C—FesP:
А', т', Г, s' — тройной твердый раствор а; г', К', D', п' — то
же. V; еледебурит; фосфидная эвтектика; —эвтек-
тика РезР и FesC; £' — тройная фосфидная эвтектика
380
Растворимость углерода в расплаве железо—фосфор при 1550 °C
(рис. 453) исследовали методами химического и спектрального анали-
зов [2].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel Р, —Arch. Eisenhiittenw., 1929, Bd 13, № 5, S. 369—381.
2. Шюрман Э., Крамер Д. — В сб.: 35 Международный конгресс литей-
щиков, 1968. М.: Машиностроение, 1972, с. 5—14.
С, % /по массе)
Az=(Cr,Fe)23 Се; /Гг-(Сг,Ге)7С5; Кс=(Ге,Cr)3С
Рис. 453. Растворимость углеро-
да в расплаве системы Fe—С—Р
при 1550 °C
Рис. 454. Поверхность ликвидус части
системы Fe—Сг—С
ЖЕЛЕЗО — УГЛЕРОД — ХРОМ
Предложен метастабильный вариант диаграммы состояния системы
[1]. В этом же исследовании по результатам термического анализа
сплавов, выплавленных из шихтовых материалов высокой чистоты, по-
строена поверхность ликвидус части системы (рис. 454).
Рис. 455. Изотермический разрез части системы
Fe—Сг—С при 900 °C
381
Изотермический разрез системы при 900 °C (рис. 455) приведен
по результатам исследования активности углерода в сплавах системы
железо —хром, насыщенных углеродом в атмосфере СН4+Н2. Изотер-
мический разрез строили по точкам перелома на кривых зависимости
активности углерода от его содержания в разных сплавах при задан-
ных температурах [2, 3].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Jackson R. S.— J. Iron a. Steel Inst., 1970, v. 208, № 2, p. 163—177.
2. Jellingkaus W., Keller H. — Arch. Eisenhiittenw., 1972, Bd 43, № 4,
S. 319—328.
3. Brandis H., Presendanz H., Shuler P. — Thyssen Edelstahl Techn.,
Berlin, 1980, v 6, № 2, p. 155—167.
ЖЕЛЕЗО — УГЛЕРОД — ЦИНК
Сплавы системы исследовали 1 методами микроструктурного и рентге-
новского анализов. В качестве шихтовых материалов использовали же-
лезо электролитическое чистотой 99,9 %, графит синтетический чисто-
той 99,5 %, цинк чистотой 99,99 %-
Ге 5 10 15 20 25 30
С,% [ат.]
Рис. 456. Изотермические разрезы системы Fe—С—Zn при:
слева — 850 °C, справа — 600 °C
Ге 5 10 15 20 25 30
Z,D/olam.]
Построены изотермические разрезы системы при 850 °C (рис. 456, слс
ва) и 600°C (рис. 456, справа). Обнаружены фазы: a-Fe, y-Fe, графит,
тройной карбид Fe3ZnC(K), имеющий г. ц. к. решетку со сверхструкту-
рой, и Г-фаза системы железо—цинк, имеющая структуру у-латуни.
ЖЕЛЕЗО — УГЛЕРОД — ЦИРКОНИЙ
Исследовали2 сплавы, отвечающие квазибинарному разрезу системы.
В качестве шихтовых материалов использовали карбонильное железо,
иодидный цирконий и спектрально чистый графит. Исследование вы-
1 Stadelmaier Н. Н.. Hardy V/. К- —Metall, 1960, V. 14, № 8, р. 778—779.
2 Шурин А. К., Дмитриева Г, П. — МиТОМ, 1974, № 8, с. 27—28.
382
полнили методами рентгеновского,
микроструктурного (в литом со-
стоянии и после отжига при
11 ОС °C, 20 ч), дифференциального
термического и дилатометрическо-
го анализов. Квазибинарный раз-
рез Fe—ZrC (рис. 457) относится
к эвтектическому типу. Эвтектиче-
ский сплав содержит 4,3 % (по
массе) ZrC и кристаллизуется при
1475 °C; карбидная эвтектика
представляет собой преимущест-
венно пластинчатые колонии. Пер-
вичные кристаллы карбидов цир-
кония с железом могут быть куби-
ческой и дендритной формы
ЖЕЛЕЗО — ФОСФОР —
ХРОМ
Методами микроструктурного,
рентгеновского и химического ана-
лизов исследовали 1 сплавы систе-
мы в области составов Fe—Fe2P—
СггР—Сг.
2гС,%мт7
Рис. 457. Политермический разрез
Fe—ZrC системы Fe—С—Zr
Рис. 458. Изотермический разрез части системы
Fe—Р—Сг при 800 °C
На рис. 458 изображен изотермический разрез изученной части
системы при 800 °C. В сплавах системы образуется тройное соединение
FeCrP. В фосфиде FegP растворяется до 17—18 % Сг с образованием
сложного фосфида (Fe, Сг)гР.
ЖЕЛЕЗО — ФОСФОР — ЦИНК
Методом микроструктурного анализа исследовали 2 сплавы системы в
области составов Fe — FeP — Zn3P2 — Zn. Сплавы получали из чистых
1 Kaneko Nigeo, Nisidzawa Taidzi, Tiba Akira — J. Jap. Inst. Metals, 1965, v. 29,
2, p. 159—165.
2 Vogel R., Horstmann D. — Arch. Eisenhiittenw., 1953, Bd 24, № 5—6, S. 247—249.
383
шихтовых материалов, фосфор вводили в виде фосфидов Fe3P
(15,6 %Р), Fe2P (22,75 % Р (по массе), а также лигатуры с 8 или
25 % Р- При 750 °C протекает четырехфазное нонвариантное превра-
щение: Fe3P (тв.) +2п(ж)^*Ре2Р(тв.)+Г (тв.). При более низких тем-
пературах протекают еще два четырехфазных нонвариантных превра-
щения II класса:
Fe3P (тв.) +2п(ж)^Ре2Р + 61 (тв.);
Fe3P (тв.)+/п(ж)чр*Ре2Р+^ (тв.).
Fe й? 20 30 W 50 60 70 80 90 Zn
Zn, % [по массе}
Рис. 459. Изотермический разрез части системы Fe—Р—Zn при
750 СС:
1 — Fe2P+FeP+Zn3P2; 2— Fe2P+ZnsP2; 3 — Fe2P+Zn3P2+Zn; 4—
Fe2P+Zn; 5 —Fe2P+Zn+F; 6 — Fe2P+F; 7 — Fe2P+Fe3P+F; 8 —
РезР+Г; 9 — Fe3P+Fe+F
ЖЕЛЕЗО — ФОСФОР — ЦИРКОНИЙ
Методами микроструктурного и термического анализов исследовали
сплавы системы в области составов Fe — FeP — Zr. Сплавы (масса
100— 150 г) получали в печи Таммана в корундовых или цирконовых
тиглях в атмосфере аргона. Исходными материалами служили железо
с низким содержанием углерода, красный фосфор и цирконий, полу-
ченный термическим разложением тетраиодида циркония, не содержа-
щий кислорода и азота. Общее содержание металлических примесей в
цирконии было ниже 0,5 %. Фосфор вводили в сплав в виде фосфидов
железа или специальной железо-фосфидной лигатуры [1].
О 10 20 30 90KJs50 60 70 80 8^90 100
Fe Zr, % (помассе) Zr
Рис. 460. Поверхность ликвидус части системы Fe—Р—Zr
384
На рис. 460 приведена диаграмма состояния экспериментально
исследованной области Fe — FeP — Zr. Фазовые превращения области
FeP — Zr — ZrP2 проведены гипотетически. В исследованной части си-
стемы образуются два конгруэнтно плавящихся тройных соединения
FeZrP (7\) и Fe4ZrP2 (Г2), температура плавления которых превыша-
ет 1600 °C.
В исследованной области сплавов кристаллизуются четыре трой-
ные эвтектики Ei, Е2, Е3, Е4 и две тройные перитектики Ui и U2. Харак-
теристики превращений в системе приведены ниже:
Точка, соответствую- щая составу кристаллизации Температура, °C Реакция
Fi 1225 ж Fe4ZrP2 + FeP + Fe2P
£2 1040 ж Fe4ZrP2 + Fe3P -Г a-Fe
F3 1290 ж y-Fe + Fe2Zr + FeZrP
£4 1330 ж Fe2Zr + ₽-Zr + FeZrP
t/i ИЗО ж 4- Fe2P Fe3P Fe4ZrP2
t/2 1240 ж 4- FeZrPFe4ZrP2 + a-Fe
Рис. 461. Фазовое строение сплавов системы Fe—Р—Zr при комнатной темпе-
ратуре
Ге 5 10 15 ^Fe4ZrP2Fe3P 5 10 15
Zr, % (по массе) 2г, % (помассе)
Рис. 462. Политермические разрезы системы Fe—Р—Zr
385
Микротвердость структурных составляющих следующая: Т\ —
11500 МПа; Т2— 10800 МПа; FeP — 8000 МПа, Fe2P — 5500 МПа;
Fe3P — 6550 МПа; Fe2Zr — 7000 МПа. На рис. 461 приведено фазовое
строение исследованной части системы при комнатной температуре, а на
рис. 462 — два политермических разреза системы, в которых участвует
тройное соединение Fe4ZrP2(F2).
Рис. 463 Изотермический разрез части системы Fe—Р—Zr
при 800 °C
В работе [2] методами химического, микроструктурного и рентге-
новского анализов исследовали сплавы системы в области составов
Fe—Fe3P—FeZrP—Fe2Zr. Построили изотермический разрез при 800 °C,
а также подтвердили образование в сплавах двух тройных фаз Fe4ZrP2
и FeZrP (рис. 463).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Vogel R., Dobbener R.— Arch. Eisenhiittenw., 1958, Bd 29, № 2,
2. Kaneko H., Nisidzawa T., Tamaki K..—J. Jap. Inst. Met., 1965, v. 29,
№ 2, p. 159—165.
ЖЕЛЕЗО — ХРОМ — ЦИРКОНИЙ
В работах [1, 2] содержатся сведения о сплавах системы в областях
Fe—ZrFe2—ZrCr2—Zr и ZrCr2—ZrFe2. Методами микроструктурного,
рентгеновского, дюрометрического и термического анализов исследовали
сплавы системы. Сплавы изготавливали из электролитического хрома,
электролитического железа и иодидного циркония. Авторы работ [1, 2]
ошибочно определили, что низкотемпературная модификация соединения
ZrCr2 изоморфна MgZn2, а высокотемпературная — MgCu2. Это повлекло
за собой неверное описание фазовых областей в построенных авторами
изотермических и политермических разрезах тройной системы.
По данным работы [3] на рис. 464 нанесено положение линий мо-
новариантных равновесий сс, у- и г]-фаз и нонвариантного четырехфаз-
386
Рис. 464. Пространственное изображение части системы Fe—Сг—Zr
Рис 465. Изотермические разрезы части системы Fe—Сг—Zr в интервале
910—925 °C
ного равновесия перитектического типа ос+ж^у+т], где сс и у — твер-
дые растворы на основе железа с о. ц. к. и г. ц. к. структурами соот-
ветственно, ai] — фаза, образующаяся в сплавах железа с цирконием
( — 35 %) по реакции ж+7гЕе2(е)-^т].
Указанное равновесие возникает при температурах несколько более
высоких, чем б-Fe^y-Fe, вблизи двойной стороны железо — цирконий
и по у-петле снижается до температуры y-Fe^cc-Fe превращения. На
рис. 465 схематически изображены изотермические разрезы исследован-
ной части системы при температурах ниже 925 и выше 910 °C. При
910 °C два конодных треугольника cc+y-j-i] фаз вырождаются в одну
прямую линию пт.
387
О 10 20 30 40 50 60
ZrFe2 Сг, % (am.) ZrCr2
Рис. 466. Политермический разрез
ZrFe2—ZrCr2 системы Fe—Сг—Zr
На рис. 466 показан политер-
мический разрез системы ZrFe2—
ZrCr2 по данным работы [4]
Сплавы получали в дуговой печи
в атмосфере очищенного аргона и
отжигали при 1600 °C в течение
0,5 ч; при 1575, 1550, 1500 и
1450 °C — по 1 ч, при 1200 °C —
2 ч, при 900 °C — 200 ч. Исходны-
ми материалами при изготовлении
сплавов служили железо карбо-
щльное марки ВЗ, хром электро-
литический чистотой 99,96 %, цир-
коний иодидный чистотой 99,96 %.
Сплавы исследовали методами
микроструктурного, рентгеновского
и термического анализов. Показа-
но, что ZrCr2 относится к группе фаз Лавеса, обладающих тремя по-
лиморфными модификациями — высокотемпературной типа MgZn2(Xi),
промежуточной типа MgNi2(X3) и низкотемпературной типа MgCu2(?i2).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Свечников В. И., Спектор А. Ц. — Вопросы физики металлов и ме-
талловедения, 1963, № 17, с. 181—186.
2. Свечников В. Н., Спектор А. Ц. — Вопросы физики металлов и ме-
талловедения, 1962, № 16, с. 145—151.
3. Свечников В. Н., Спектор А. Ц. — Металлофизика: Респ. межве-
домств. сб. Киев: Наукова думка, 1970, вып. 32, с. 33—38.
4. Свечников В. Н., Петьков В. В. — Металлофизика: Респ. межве-
домств. сб. Киев: Наукова думка, 1972, вып. 42, с. 112—116.
ЖЕЛЕЗО — АЗОТ — КРЕМН Ий — МАРГАНЕЦ
Методами химического, микроструктурного, рентгеновского, электронно-
микроскопического и масс-спектроскопического анализов вторичных
Рис. 467. Растворимость MnSiN2 в a-Fe
при 800 °C
1 Mortimer В. Svedung D. — Scand.
Рис. 468. Растворимость MnSiN2 в а-Г'с
при 660 °C
Metall, 1975, v. 4, № 3, р. 113—120.
388
Растворимость MnSiN2 в феррите определена для сплавов, содер-
жащих, %: 0,15—1,9 Мп; 0,11—1,02 Si; 0,009—0,2 N; 0,005—0,007 С;
0,002 А1; 0,006—0,009 Р; 0,006—0,007 S; 0,01—0,03 О. Сплавы получали
в индукционной печи, отжигали при 1100 °C, 3 ч, затем прокатывали на
пластины толщиной 15 мм. Образцы размером 15X15X180 мм после
отжига при 900 °C, 1 ч, охлаждали с печью до требуемой температуры,
при которой выдерживали до 160 ч, и закаливали в воде.
Растворимость MnSLN2 в a-Fe показана на рис. 467 (800 °C) и 468
(660°C). MnSIN2 имеет орторомбическую решетку с периодами о —
—0,5273 нм, Ь — 0,6504 нм и с —0,5070 нм. Свободная энергия образо-
вания MnSiN2 в температурной области 660—850 °C равна 360,41 +
+ 142,327’ Дж/моль.
ЖЕЛЕЗО — АЗОТ — МАРГАНЕЦ — ХРОМ
р ^2, кПа
Рис. 469. Зависимость растворимо-
сти азота от его давления при
1245 °C в сплавах системы
Fe—Мп—Ст, содержащих:
1— 12,87 % Мп+4,60 % Сг; 2 —
12,22 % Мп+9,37 % Сг; 3—13,48%
Мп+14,10 % Сг
Исследовали растворимость азота в сплавах системы при содержании
хрома от 4,6 до 22 % и марганца от 3 до 18,74 % (по массе) в интер-
вале температур от 995 до 1400 °C [1, 2]. Сплавы получали в высоко-
вакуумной (1,333-10-5 гПа) печи с молибденовым нагревателем [1].
Содержание углерода и кислорода составляло тысячные, а азота — со-
тые доли процента. Сплавы деформировали и гомогенизировали в ва-
куумной печи сначала при 1200 °C, а затем, после удаления поверхност-
ного слоя,— при 1300—1350 °C, 1 ч. Содержание легирующих элементов
после гомогенизации определяли методами химического и рентгено-
спектрального анализов. Диффузионное насыщение азотом осуществля-
ли при различных температурах и
давлениях газов в высокотемператур-
ной камере. Количество растворенно-
го азота после закалки определяли
на специальных установках. Для при-
готовления сплавов в работе [2] ис-
пользовали железо чистотой 99,85 %,
хром чистотой 98,4 % и марганец
чистотой 99,82 %. Гомогенизировали
сплавы в течение 24 ч при 1150 °C в
вакууме.
Показано [1], что при'увеличении
содержания хрома в сплавах от 4,60
до 21,81 % и практически постоян-
ном содержании марганца (12,14—
13,58 %) растворимость азота значи-
тельно возрастает (рис. 469); наблю-
дается линейная зависимость раство-
римости азота в сплавах от корня
квадратного из величины давления
азота. При повышении температуры
азотирования от 995 до 1400 °C про-
исходит заметное уменьшение раство-
римости азота. Так, при 995 °C для сплава, легированного 21 % Сг+
+ 5 % Мп, растворимость азота составляет 0,731 %, а при 1400 СС —
0,129 %; для сплава, легированного 22 % Сг + 3 % Мп, — соответственно
0,679 и 0,099 % при этих же температурах [2].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1 Георгиев И., Печняков И., Димова В., Ячков Н. — Техн, мысъл, 1978.
т. 15, № 5, с. 101—107.
389
2 . Димова В., Георгиев И., Печнякое И., Добрев Р. — Материалознание
и технология, 1978, т. 6, с. 9—14.
ЖЕЛЕЗО — АЗОТ — УГЛЕРОД — ХРОМ
Сплавы системы в большом объеме изучены в работах японских иссле-
дователей [1—3]. Методами микроструктурного, рентгеновского анали-
зов [1—3] и измерением твердости [3] исследованы изотермические и
Рис. 470. Изотермическое сечение части системы Fe—N—
С — 7 % Сг при 700 °C
Рис. 471. Политермический разрез
части системы Fe—N—С—7 % Сг с
0,2 % N
О ОД ОД 0,3 од
N, % (по пассе)
Рис. 472. Изотермический разрез части
системы Fe—N—С — 12 % Сг при 775 °C
0,4
i
• О
390
политермические сечения сплавов, содержащих 7 % [1]; 12 [2], 18 %
(по массе) Сг [3]. Построены также проекции изученной части системы
на плоскость основания тетраэдра и приведены схемы нонвариантных
равновесий в системе. В качестве шихтовых материалов для сплавов с
7 % (по массе) Сг использовали электролитические железо и хром. Образ-
цы изготавливали в индукционной печи, используя в качестве лигатуры
железохромистые сплавы с 6 % (по массе) N и сплавы железа с 5 % (по
массе) Сг. Исследованы составы с 0,012—0,34 % (по массе) С и 0,04—
0,25 % (по массе) N. Суммарное содер-
жание марганца и кремния около 0,1 %
(по массе). Термическую обработку про-
водили в откачанных кварцевых ампулах
при 800—1300 °C. Построены изотермиче-
ские сечения части системы Fe—N—С—
7 % (по массе) Сг при 900, 875, 850, 825,
800, 775 и 700 °C (рис. 470). Политермп-
ческое сечение части системы с 0,2 % (по
массе) N изображено на рис. 471. При
780 и 770 °C наблюдаются нонвариант-
ные равновесия у4-Сг23С^сс4-Сг7С34-
+ Cr2N и Y+Cr2N=^a4-Cr7C3+CrN соот-
ветственно.
Исследовались [2] сплавы с 12 % (по
массе) Сг, 0,07—0,27 % (по массе) N и
0,01—0,49 % (по массе) С. Сплавы изго-
тавливали в индукционной печи на воз-
Q 0,1 0,2 0,0 o/f 0,5
N, 7о (по массе)
Рис. 475. Политермический раз-
рез части системы Fe—N—С —
18 % Сг с 0,3 %С
духе с использованием электроли-
тических железа и хрома. Суммарное со-
держание марганца и кремния — 0,2 %
(по массе). Образцы отжигали в отка-
чанных кварцевых ампулах. Построены
изотермические сечения части тетраэдра
системы Fe—С—N—12 % (по массе) Сг при 1300, 1200, 1100, 950, 900,
850, 800, 790, 775 °C (рис. 472). Политермическое сечение части системы
391
с 0,2 % (по массе) N изображено на рис. 473. При 780 °C наблюдается
реакция II класса: у+Сг23Сбчэ=а+Сг7Сз+Сг2Н.
Сплавы с 18 % (по массе) Сг изготавливали [3] в индукционной
печи, прокатывали вгорячую, отжигали при 1300 °C, затем медленно ох-
лаждали до температуры изотермической выдержки (1200 °C, 1 ч; 1100 °C,
2 ч; 1000 °C, 4 ч; 900 °C, 10 ч; 800 ° С, 20 ч; 700 °C, 100 ч) и закаливали в
воде. Исследовали сплавы, содержащие до 0,5 % (по массе) N, до 0,5 %
(по массе) С при суммарном содержании кремния 0,2 % (по массе).
Построены изотермические сечения системы при 1300, 1200, 1100, 1000
900, 800 и 700 °C (рис. 474). Минимальное суммарное содержание угле-
рода и азота, равное 0,4 % (по массе), вызывает появление аустенитной
структуры. Ниже 1100 °C выделяются фазы Сг2зСб, Сг?С3 и Cr2N. На
рис. 475 изображено политермическое сечение четверной системы с по-
стоянным содержанием углерода 0,3 % (по массе).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Masumoto Tsuyoshi, Imai Junoshin, Naka Masaaki — Sci. Repts. Res.
Inst., Tohoku Univ., 1972, v. A23, № 5—6, p. 167—177.
2. Imai Junoshin, Masimoto Tsuyoshi, Naka Masaaki—Sci. Repts. Res.
Inst. Tohoku Univ., 1972, v. A23, № 5—6, p. 153—166.
3. Imai Junoshin, Masimoto Tsuyoshi, Naka Masaaki — Sci. Repts. Res.
Inst. Tohoku Univ., 1967, v. A19, № 2, p. 83—96.
ЖЕЛЕЗО — АЛЮМИНИЙ — КРЕМНИЙ — УГЛЕРОД
Сплавы системы исследовали1 методами микроструктурного, рентгенов-
ского и термического анализов В качестве шихтовых материалов исполь
Рис. 476. Разрез системы Fe—Al—Si—С
через поверхности двойного насыщения
зовали алюминий чистотой 99,7 %,
железо электролитическое чисто-
той 99,99 % и кремний чистотой
99,7 %. Сплавы, полученные в
графитовых тиглях в печи Там-
мана в атмосфере аргона, подвер-
гали отжигу при 1200, 1150, 1100
и 800 °C в течение 5—10 ч при
каждой температуре.
В сплавах тройной системы
железо—алюминий—углерод при
1297, 1285 и 1280 °C существуют
соответственно три нонвариантных
четырехфазных равновесия: Ж1 +
+cci^Yi + K; ж2+К^±сс2+Г; ж4+
+ Кэ^а4+Г. Эти равновесия, пере-
ходя в четверную систему при до-
бавлении кремния, образуют пяти-
фазное нонвариантное равновесие
при 1220 °C: ж + Кч^у + а + Г, где
Г — графит, а К — карбид состава
Fe3AlCx при х=0,65.
Схематический разрез четверной системы через поверхности двойно-
го насыщения показан на рис. 476.
1 Lohberg К., Ueberschauer А. — Giessereiforschung, 1969, Bd 21, № 4,
S. 163—169.
ЖЕЛЕЗО — АЛЮМИНИЙ — МАРГАНЕЦ - МЕДЬ
Изучали 1 фазовые равновесия системы в области содержания 7 % (по
массе) А1 и 3 % (по массе) Си. Сплавы получали в индукционной печи
с использованием армко-железа, электролитических марганца и меди,
алюминия марки А99. Отливку сплавов проводили в кокиль, отжигали в
откачанных ампулах при температурах 1150, 1000, 850, 750 и 650 °C в
течение 15, 30, 60, 120 и 240 ч и закаливали в воде. В работе использо-
Ржс. 477. Политермические сечения системы Fe—А1—Мп—Си при
7 % AI и 1 % (а) и 3 % Си (6)
ваны микроструктурный, рентгеновский, дюрометрический и магнитный
методы анализов. По результатам исследования построены политерми-
ческие сечения системы для сплавов с постоянным содержанием алюми-
ния [7 % (по массе)], меди [1 % (по массе) и 3% (по массе)] — рис.
477, а и б. При содержании меди 30 % (по массе) и температуре ниже
750 °C в системе наблюдается фаза е, которая является твердым раство-
ром железа в меди.
ЖЕЛЕЗО — АЛЮМИНИЙ — МАРГАНЕЦ — УРАН
Характер фазовых равновесий в сплавах системы изучен в области,
ограниченной составами U—UMn2—UFe2 и UA12—UMn2—UFe2 [1, 2].
При исследовании использовали методы термического, рентгеновского,
микроструктурного и дилатометрического анализов, установили проек-
ции поверхностей кристаллизации, пятифазные нонвариантные объемы,
фазовое строение изотермических сечений и политермических разрезов.
Для приготовления сплавов использовали алюминий чистотой 99,99 %,
атомно-чистый уран, дегазированные в высоком вакууме железо и мар-
ганец. Сплавы получали в дуговой печи в атмосфере аргона, отжигали
в эвакуированных кварцевых ампулах при 800, 700 и 500 °C в течение
5 ч, 4 и 14 дней соответственно и закаливали в воде.
На рис. 478, 479 приведены некоторые сведения о вторичной систе-
ме UA12—UMn2—UFe2. На рис. 478 показаны поля первичной кристал-
лизации фаз UA12, U(A1, Fe, Мп)2 и U(Fe, Mn)2, разграниченные двумя
линиями моновариантных равновесий: LhUz — перитектического типа ж+
+UA124^U(A1, Fe, Мп) 2 в интервале от 1190 до 1060 °C и eie2— эвтекти-
ческого типа ж^и(Ре, Mn)2+U(A1, Fe, Мп)2 в интервале от 1090 до
1 Шведов Л. И., Горецкай Г. П„ Чалек Т. А. — В кн.: Фазовые равновесия в
металлических сплавах. М.: Наука, 1981, с. 197—201.
392
393
Рис. 478. Поля первичной кристаллизации фаз в си-
стеме UA12—иМп2—UFe2
Рис. 479. Совмещенные изотермические сечения в
системе UA12— UMn2—UFe2:
1 — при 1000 °C; 2 — при 800 °C; 3 — при 700 °C;
4 — при 600 °C
1015 СС. На рис. 479 приведено изотермическое сечение в системе UAI2—
UFe2—UMn2 при температуре 600 °C. В изученной части системы
U—UMn2—UA12—UFe2 обнаружены два нонвариантных перитектиче
ских превращения при 760°C ж+UAh^Y+U(Al, Fe, Mn)2 + U6(Fe, Мп)
и при 715 °C ж+уч±р + и(А1, Fe, Mn)2+Ue(Fe, Мп), а также два нон
вариантных эвтектоидных распада при 660 °C: y->P + UAl2+T+U6X 11
при 590 °C: (j->« + UA12+U(Al, Fe, Mn)2+U6(Mn, Fe), где сс, В и у
полиморфные модификации урана.
394
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Petzow G„ Satnpaio A. O. — Z. Metallkde, 1966, Bd 57, № 8, S. 625—
632; № 10, S. 741—746.
2. Petzow G., Sampaio А. О., M. De Lourdes Pinto — J. Nuclear Mate-
rials, 1958, v. 26, p. 331—337.
ЖЕЛЕЗО — АЛЮМИНИЙ — МАРГАНЕЦ — ХРОМ
Фазовые равновесия в сплавах системы изучали1 методами микро-
структурного, рентгеновского, дюрометрического и магнитного анализов
1 Шведов Л. И., Горецкий Г. П., Чилек Т. А. — В кн.: Фазовые равновесия
в металлических сплавах. М..: Наука, 1981, с. 197—201.
Рис. 480. Политерми-
ческие сечения систе-
мы Fe—Al—Мп—С
при постоянном со-
держании:
а — 2 % Сг; 6 % АГ,
б - 4 % Сг; 4 % А1;
в — 4 % Сг; 2,4 % А1;
г— 10 % Сг; 2,4 % А1
395
в области составов до 4 % (по массе) А1, 10 % (по массе) Сг и 50 %
(по массе) Мп. Сплавы получали в индукционной печи и отливали в ко
киль. В качестве шихтовых материалов использовали армко-железо,
электролитический марганец, алюминий марки А99 и хром марки 0
Образцы отжигали при 1150, 1000, 850, 750 и 650 °C в течение 15, 30,
60, 120 и 240 ч, а затем закаливали в
Fe 2fl 2fl 6,0 8fl ю,0 12,0
Crfl/flao массе)
Рис. 481. Фазовая диаграмма системы
Fe—В—Сг — 0,2 %С при 700 °C
воде.
Построены шесть политерми
ческих сечений, четыре из которых
приведены на рис. 480. Хром при
содержании в сплавах до 8 % (по
массе) практически не влияет ил
расположение границ у-областп
При дальнейшем увеличении со
держания хрома в алюминии у-об
ласть резко сужается.
ЖЕЛЕЗО — БОР —
УГЛЕРОД — ХРОМ
В сплавах системы при 700 °C оо
наружены ' боридные фазы Fe2B,
Сг2В и карбид (Сг, Fe)23(C, В),
(рис. 481). Соотношение атомных
концентраций бора и углерода мс
няется от 0 до 2,5 в зависимости
от содержания бора, углерода и
хрома в сплаве. С увеличением
температуры борокарбидная фа '.л
растворяется в аустените в отлп
чие от боридов Fe2B и Сг2В.
ЖЕЛЕЗО — ВАНАДИЙ — КРЕМНИЙ — МАРГАНЕЦ
Сплавы системы исследовали1 методами микроструктурного и рептгс
новского анализов с целью выяснения кристаллохимической природы
промежуточных фаз, образованных переходными металлами с кремни
ем. Сплавы готовили в дуговой печи в атмосфере гелия из шихтовык
Рис. 482. Изотермическое сечение системы
Fe—V—Si—Мп при 1100 °C и 30 % (ат.) Мп
1 Kaneko Nigeo, Nisidzawa Taidzi, Tiba Akira — J. Japan Inst. Metals, !.)(><•
v. 30, № 2, p. 157—163.
2 Bardos D. J., Beck P. —Trans. AIME, 1966. v. 236, № 1, p. 64—69.
396
материалов чистотой 99,9—99,98%
и отжигали сплавы в откачанных
кварцевых ампулах. Для сложных
сплавов переходных металлов ха-
рактерно образование тетраэдри-
ческих плотно упакованных
франк-касперовских фаз типа о,
р,, R. Эти фазы, как и структуры
типа ot-Mn, принято относить к
так называемым электронным фа-
зам.
На рис. 482 изображено изо-
термическое сечение системы при
1100 °C с 30 % (ат.) Мп. Большую
часть сечения занимает область
существования о-фазы, наряду с
которой существуют узкие области
электронных фаз R, сс-Мп и фазы
D. Фаза D, имеющая тетрагональ-
ную структуру, обнаружена в
Рис. 483. Изотермическое сечение си-
стемы Fe—V—Si—Мп при 1100 С и
50 % (ат.) Мп
сплавах переходных металлов с
кремнием. 'Периоды ее решетки в
сплаве V26.5Fe44Si29,5 «=0,8833 нм, с=0,8646 нм. Кажущаяся электрон-
ная концентрация этих фаз ~6,5—7,0 эл/ат.
Аналогичное распределение фазовых областей наблюдается на изо-
термическом сечении системы с 50 % (ат.) Мп (рис. 483). Хорошо вид-
но, что разрез между фазами Новотного Fe^Sis и VsSi3 является квази-
бинарным.
ЖЕЛЕЗО — ВАНАДИЙ — МОЛИБДЕН — ХРОМ
При исследовании 1 методом рентгеновского анализа определили равно-
весное фазовое состояние сталей с 0—6 % (по массе) Сг; 0—2 % (по
О 0,5 1,0 1,5 2,0 2,5
Мо,% (по пассе)
Рис. 484. Изотермическое сечение си-
стемы Fe—V—Мо—Сг при 650 °C и
1 % V
О 0,5 1,0 1,5 2,0 2,5
Но, % (по массе)
Рис. 485. Изотермическое сечение си-
стемы Fe—V—Мо—Сг при 700 °C и
1 % V
J Andrews К., Hugnes Н., Dyson D.—J. Iron and Steel Inst., 1972, v. 210, № 5,
p. 337—350.
397
Рис. 486. Изотермическое сечение си-
стемы Fe—V—Мо—Сг при 700 °C и
1 % Мо
Рис. 487. Изотермическое сечение си
стемы Fe—V—Мо—Сг при 700 °C и
1 % Мо
массе) Мо; 0—1 % (по массе) V при постоянном содержании углерода
0,12 %, марганца 0,5 %, кремния 0,5 % и температурах 650—700 °C.
Стали отжигали при 1050 °C, 30 мин, закаливали, а затем повторно от
жигали при 650 и 700 °C в течение 20, 100, 400 и 1000 ч и медленно
охлаждали. Проводили также карбидный анализ осадка, выделенного
из стали путем электрохимического растворения основы.
На рис. 484, 485 приведены изотермические разрезы системы при
650 и 700 °C при содержании в сплавах 1 % V, а на рис. 486, 487 —
изотермические разрезы системы при 700 °C при содержании 1,0 и
2,0 % Мо в сплавах. Увеличение содержания молибдена в сплавах при
водит к исчезновению ряда карбидных фаз.
ЖЕЛЕЗО — ВАНАДИЙ — УГЛЕРОД — ХРОМ
Сплавы системы и карбидные фазы, выделенные электрохимическим сн<>
собом [1, 2], исследовали методами микроструктурного и рентгеновски
Рис. 488. Изотермическое сечение
системы Fe—V—С—Сг с 0,3 % С при
1150 °C
го анализов [1—3]. Сплавы, приготов
ленные из стали, содержащей 0,3 %
(по массе) С; 0,39 % Мп; 0,16 % Si;
0,027 % Р, 0,029 % S; 0,12 % Си;
0,10 % Ni; 0,040 % Al и химически
чистых ванадия и хрома, отжигали
при 1150 и 1000 °C в течение 25 и
200 *ч соответственно и закаливали в
водном растворе едкого кали. При
850 и 700 °C сплавы отжигали в те
чение 400 и 500 ч и закаливали в тон
же среде.
Построено изотермическое сече
ние системы с 0,3 % (по массе) С при
1150 °C (рис. 488).
В работе [3] исследовано влияние
398
ванадия в количестве 0,5 и 1 % на величину и положение у-области и
фазовые равновесия сплавов железа, содержащих 10—22 % (по массе)
Сг и до 0,6 % (по массе) С. Построены изотермические сечения систе-
мы с 0,5 и 1,0% (по массе) V при 1050 °C (рис. 489); символами и
Кг обозначены карбиды Л4е2зС6 и Afe7C3, приведены схемы, описываю-
щие смещение фазовых границ диаграммы при переменном содержа-
нии компонентов.
Рис. 489. Изотермические сечения части системы Fe—V—С—Сг с 0,5 % (а)
и 1 % V (б) при 1050 °C
В работе [4] построены предполагаемые политермические сечения
системы при переменном содержании ванадия [от 0 до 8 % (по мас-
се) V] и постоянном [1; 2; 6; 13 % (по массе)] содержании хрома,
а также при переменном [от 0 до 18 % (по массе)] содержании хрома
и постоянном [1; 3; 5 % (по массе)] — ванадия.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Cadek J., Freiwillig R. — Hutn. listy, 1965, v. 17, № 4, p. 273—282.
2. Cochnar Z., Cadek J., Dubsky J. a. o. — Kovove mater., 1967, v. 5,
№ 5, p. 395—407.
3. Bungardt K-, Kunze E., Horn E. — Arch. Eisenhiittenw., 1968, Bd 39,
№ 12, S. 949—951
4. Cochnar Z., Dubsky J., Cilia K. a. o. — Kovove mater., 1975, v. 13, №2,
p. 159—168.
ЖЕЛЕЗО — ВОДОРОД — КОБАЛЬТ — НИКЕЛЬ
В работе [1] изучали температурно-концентрационные зависимости рас-
творимости водорода в жидких расплавах, в .частности Fe—Co0,5Ni0,s
(1400—1800°C, OcXiCl). Исходными материалами служили карбониль-
ное железо марки ВЗ, электролитический кобальт К00 и электролити-
399
О 0,2 0,4 0,6 0,8 1,0
Co7Ni $ъ,нап,доля Fe
Рис. 490. Изотерма растворимо-
сти водорода при 1600 °C в
сплавах системы Fe—Со—Ni
ческий никель Н00, содержащие не бо-
лее 0,01 % примесей. Сплавы получали в
высокочастотной печи в тиглях из окси
да бериллия. Для уменьшения содержа-
ния кислорода сплавы дегазировали и
охлаждали в вакууме. Растворимость во
дорода определяли методом горячего
объема в изохорном варианте [2] при
давлении от 67 до 180 гПа. Установлено,
что растворимость водорода в чистых ме-
таллах и сплавах хорошо описывается
уравнением: 1g /г=А/Т-1-В.
На рис. 490 приведена изотерма рас-
творимости водорода при 1600 °C в жид-
ких сплавах системы.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Петрушевский М. С., Гельд П. В., Абрамычева Л. Е., Костина Т. К.—
ДАН СССР, 1976, т. 227, № 2, с. 337—340.
2. Морозов А. И. — Водород и азот в сталях. М.: Металлургия, 1968,
158 с.
ЖЕЛЕЗО — ВОЛЬФРАМ — МОЛИБДЕН — УГЛЕРОД
Сплавы системы исследовали1 методами экстракционной и растровой
электронной микроскопии, микроструктурного, рентгеновского и микро-
Рис. 491 Положение двухфазной области карбид+
+ аустенит в системе Fe—W—Мо—С при 1000 °C для
ctQ =0,53
1 Urgenius В., Harvig И. —Metal Sci., 1975, v. 9, № 2, р. 67—82.
400
рентгеноспектрального ана-
лизов. Провели также тер-
модинамический расчет фа-
зовых границ в рамках мо-
дели регулярных растворов.
Сплавы железа с воль-
фрамом и молибденом вы-
плавляли в атмосфере ар-
гона в тиглях из оксида
алюминия. В качестве ших-
товых материалов исполь-
зовали электролитическое
железо чистотой 99,94 %,
молибден чистотой 99,90 %,
содержащий <0,04 % Ni,
специально очищенный мо-
либден, вольфрам чистотой
99,95 %. Для науглерожи-
вания образцы толщиной
0,2—0,5 мм запаивали в за-
полненные водородом квар-
цевые ампулы вместе с чис-
Рис. 492. Положение двухфазной области
МоС+аустенит в системе Fe—W—Мо—С при
1000 °C для ас=0(53
тым железным образцом и
сплавом железо—углерод и выдерживали в водородной печи при 1000 °C
в течение 600—1200 ч. Для реализации низкой активности углерода при-
меняли углеродистую сталь с 0,2 °/о (по массе) С; промежуточная и вы-
сокая активность углерода достигалась при использовании специально
приготовленных чистых сплавов железа с 3—4 % (по массе) С. Закалку
проводили путем мгновенного разрушения капсул в соленой воде.
На рис. 491 показано положение двухфазной области ^-карбидН-
Ч-аустенит при 1000 °C и активности углерода ас =0,53. На рис. 492
показано положение двухфазной области МоС + аустенит; квадратные
точки на рисунке нанесены по расчетным данным.
ЖЕЛЕЗО — ВОЛЬФРАМ — НИКЕЛЬ — УГЛЕРОД
Сплавы системы исследовали методами микроструктурного, дифферен-
циального термического и рентгеновского анализов [1]. Сплавы изго-
товляли методом металлокерамики. Смеси порошков вольфрама, WC с
6,2 % Ссвяз и 0,09 % Ссвоб, железа и никеля прессовали под давлением
80 МПа и спекали при 1300—1500 °C в атмосфере аргона в печи с мо-
либденовым нагревателем. Сплавы выдерживали при 1200сС, 1 ч, и
охлаждали в холодной зоне печи до комнатной температуры в течение
5 мин.
По результатам исследования построено изотермическое сечение при
1200 СС части системы при отношении железа к никелю 3,15:1
(рис. 493). Двухфазная область y+WC— очень узкая и практически
вырождается в прямую, соединяющую эти две фазы. При 1326 и 1260 °C
в сплавах системы установлены нонвариантные равновесия ж+*\¥Сч-цЧ~
Ч-у и ж^у + WC + C. Фаза у имеет г. ц. к. решетку с периодом а =
= 1,087 нм. Фаза 0 образуется на основе соединения Ni3W6C2, имеет
кубическую решетку с периодом а—1,121 нм. Фаза х образуется на
основе соединения Ni3Wi6C6, обладает гексагональной решеткой с пе-
риодами с=0,782; с=0,782 нм. Карбид вольфрама WC имеет гекса-
гональную решетку с периодами о = 0,290, с=0,283 нм.
В работе [2] на основании исследований, выполненных методами
дифференциального термического и дилатометрического анализов, по-
401
Рис. 493 Изотермическое сечение системы W—С—(Fe : Ni=3,15 : 1) при
1200 °C
Рис. 494. Участок политермического сечения системы
Fe—W—Ni—С для соотношения вольфрама и ферронике-
ля, соответствующего составу сплава WC—Fe, Ni с 20 %
Fe, Ni (Fe : Ni=85 : 15)
строен участок политермического сечения системы (рис. 494), проходя-
щего через углерод при соотношении вольфрама и ферроникеля равном
1 : 1 в области составов сплавов, расположенных по обе стороны от точ-
ки пересечения исследуемого сечения с сечением WC—FeNi : Ni с 20 % Fe,
Ni (Fe : Ni = 85 : 15). На этом разрезе по горизонтальной оси отложено
условное расчетное количество углерода в процентах по отношению к
сумме вольфрама и углерода, обозначаемое как содержание углерода
в WC.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Merz A., lllden L. — Neue Hiitte, 1964, Bd 9, № 12, S. 733—736.
2. Чопорова И. H., Кудрявцева В. И., Сапронова 3. Н. — Науч, тр/
ВНИИТС, 1975, № 15, с. 171—175.
402
ЖЕЛЕЗО — ВОЛЬФРАМ — НИКЕЛЬ — ХРОМ
Методом микроструктурного анализа и измерением твердости исследо-
вали 1 сплавы системы, фигуративные точки составов которых распола-
гали на сечении тетраэдра с постоянным содержанием хрома, равным
20 % (по массе).
Исходными материалами при синтезе сплавов служили вольфрам
чистотой 99,0 %, железо электролитическое чистотой 99,0 %, никель
Рис. 495. Изотермическое сечение системы Fe—W—Ni—Сг
при 1200 °C и 20 % Сг
чистотой 99,7 % и хром чистотой 99,2 %. Сплавы выплавляли в печи
Таммана в корундовых тиглях и отливали в медные изложницы. От-
жигали сплавы при 1200 °C, 48 ч, и закаливали в воде. На рис. 495
изображено изотермическое сечение системы при 1200 °C и постоянном
содержании хрома 20 % (по массе). Растворимость вольфрама в у-твер-
дом растворе на основе никеля при этих условиях снижается от 22 %
(по массе) при 0 % (по массе) до 15 % (по массе) при 30 % (по мас-
се) Fe.
ЖЕЛЕЗО — ВОЛЬФРАМ — УГЛЕРОД — ХРОМ
Методами микроструктурного, рентгеновского, микрохимического и кар-
бидного анализов исследовали сплавы системы, содержащие 0,2 % С.
Изотермические сечения системы при 700, 850, 1000, 1150 °C (рис. 496).
Содержание примесей: 0,18 % Мп; 0,13 %, Si; 0,025 % Р; 0,024 % S;
0,16 % Си; 0,06 % Ni; 0,02 % Al. При 700 °C растворимость хрома в
7Йе6С и Л1еС составляет 8 и 5—7 % соответственно; растворимость воль-
фрама в Л4е3С и МеуСд составляет <1 и 2—2,5 % соответственно. Уста-
новлена широкая область существования фазы Лавеса Fe2W.
1 Brandis Н., Lehmann К., Wiebkind К- — DEW-Techn. Вег., 1969, Bd. 9, № 2,
S. 204-213.
403
Изотермические сечения при 700 °C построены [3] для сплавов, со
держащих 4; 7; 10; 15 % (ат.) С. Сплавы изготавливали методом по-
рошковой металлургии с использованием порошков вольфрама, карбо
нилыюго железа, углерода и хрома, а затем переплавляли в вакууме.
Методами микроструктурного, рентгеновского и магнитного анализом
изучены сплавы, содержащие, % (ат.): до 13,7 W; 10 и 19,3 С. Выяв-
лено 15 фазовых областей, четыре из которых являются двухфазными,
семь — трехфазными и четыре — четырехфазными. На рис. 497 пред-
ставлено сечение системы при 700 °C для сплавов с 10 °/о (ат.) С. Рим-
Рис. 497. Изотермический разрез систе-
мы Fe—W—С—Сг с 10 % С при 700 °C
W, % (ап)
Рис. 498. Изотермический разрез системы Fe—W—С—Сг с
2 % (ат-) Сг при 1250 “С
404
скими цифрами на рисунке обозначены следующие области: / — a-Fe-f-
+Ее2ДУ2Сб; II— a-Fe-l-Fe2iW2C6+WC; HI — a-Fe+Fe2i W2C6+XVC +
+Fe3W3C; IV — a-Fe+WC+Fe3W3C; V — a-Fe-HFe2iW2C6+FesC4-
+Fe3W3C; VI — a-Fe+Fe2lW2C6+Fe3C; VII — a-FeFFe3C; VIII—
a-Fe+Fe3C + Fe3W3C; IX — a-Fe + Fe3C+Cr23C6+Fe3W3C; X — a-Fe-b
4-Cr23C6 + Fe3W3C; XI — a-Fe + Fe3C + Cr?C3; XII — о'.-ре+Ре3С+Сг7Сз+
-|-Cr2sCg; XIII — а-Ре4-Сг7С3+Сг23С6; XIV — ос-Ре+Сг23Сб; XV ot-Fe-f-
Н-СгуСз.
Изотермические сечения системы при 1250 °C построены [4] для
сплавов, содержащих 0; 2; 4; 6; 8; 10; 15 и 20 % (ат.) Сг. На рис. 498
представлено изотермическое сечение системы при 1250 °C, для сплава
с 2 % (ат.) Сг. Сплавы спекали, а затем плавили в дуговой печи в атмо-
сфере аргона. Слитки отжигали при 1250 °C, 750—1000 ч, в чистом су-
хом азоте. Исследование выполнили методами микроструктурного, рент-
геновского, химического, микрорентгеноспектрального анализов, а так-
же измерением микротвердости.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Cadek J., Freiwillig R., Sie Si San — Hutn. listy, 1962, t. 17, № 7,
p. 507—516.
2. Freiwillig R., Dubsky J., Cilia K. a. o. — Kovove mater., 1970, v. 8,
№ 5, p. 419—432.
3. Jellinghaus W.— Arch. Eisenhiittenw., 1971, Bd 42, № 11, S. 829—836.
4. Bergstrom M. — Mater. Sci. a. Eng., 1977, v. 27, № 3, p. 271—286.
ЖЕЛЕЗО — КИСЛОРОД -
МАГНИЙ — НИКЕЛЬ
Установлено1 образование не-
прерывного ряда твердых рас-
творов между MgO и NiO,
а также MgO и «FeO». По-
казана возможность триангуля-
ции системы по разрезу Fe2O3—
MgO—NiO.
На рис. 499 изображена
фазовая диаграмма MgO—NiO—
«FeO» при 800 °C, а на рис. 500 —
пространственная модель изу-
ченной части четверной системы.
Показано положение конод в
двухфазной области железо—ни-
келевый твердый раствор + раствор
шпинели.
Рис. 499. Распределение фазовых обла-
стей во вторичной системе MgO—NiO—
FeO при 800 °C
ЖЕЛЕЗО — КИСЛОРОД — МАРГАНЕЦ — СЕРА
Сплавы системы исследовали2 методами микроструктурного, электрон-
номикроскопического и термического анализов. Содержание компонен-
тов в сплавах варьировали в следующих пределах: марганец 1,1—4,8 %,
сера 0,14—0,53 %; кислород 0,008—0,03 %-
1 Perrot Р., Dufour М. — Met. Sci., 1970, v. 67, № 11, р. 741—746.
а Kor G., Turkdagan Е. — Met. Trans., 1972, v. 3, № 5, р. 1269-1278.
405
На рис. 501 показано влияние марганца на фазовые равновесия в
системе в присутствии жидкой фазы оксисульфида, появляющейся в
сплавах выше 900 °C.
ЖЕЛЕЗО — КИСЛОРОД — СЕРА — ХРОМ
Сплавы системы исследовали 1 методами микроструктурного и электрон
номикроскопического анализов. Исходными материалами при изготов
лении сплавов служили железо чистотой 99,9 %, электролитический хром
чистотой 99,94 %, кислород в виде соединения Fe2O3, сера в виде соеди
нения FeS. Из сплавов системы железо — хром с переменным содержа
нием 0—10 % Сг изготавливали цилиндрические образцы диаметром п
высотой 1,2 см. В этих образцах просверливали отверстия диаметром
0,63 см и глубиной 0,95 см. В полученную капсулу помещали оксид или
1 Dahl J. М., Van Vlack L. Н. — Trans. AIME, 1965, v. 233, № 1, p. 2—7.
406
Рис. 502. Поверхность ликвидус части системы Fe—О—
S—Сг в отсутствие кислорода
Рис. 503. Изотермическое сечение части системы Fe—О—
S—Сг при 1090 °C
сульфид железа или их смесь. Отверстие капсулы заваривали, и в та-
ком виде она проходила термическую обработку в интервале 1490—
1090 °C продолжительностью 1 —175 ч соответственно с последующей
закалкой в воде.
На рис. 502 изображена поверхность ликвидус системы Fe—Сг—
FeS—CrS, а на рис. 503 — изотермическое сечение этой системы при
1090 °C. Установлено, что четверную систему при содержании хрома в
сплавах <0,2 % можно рассматривать как тройную железо — кисло-
род — сера. При содержании в сплаве 0,2 % Сг образуется шпинель ти-
па Fei.6Crii4O4, которая при увеличении содержания хрома переходит
в FeCr2O4. Сульфидные фазы в сплавах четверной системы появляются
при тех же температурах и концентрациях металлов, что и в системе
железо — хром — сера. Количество сульфидных и оксидных фаз зави-
сит от соотношения серы и кислорода в сплавах четверной системы.
ЖЕЛЕЗО — КОБАЛЬТ — МАРГАНЕЦ — УРАН
Сплавы системы исследовали 1 методами микроструктурного, рентгенов-
ского, термического и химического анализов. Фигуративные точки со-
1 Petzow G., Steeb S., Kiessler G. — Z. Metallkde, 1963, Bd 54, № 8, S. 473—477.
407
ставов сплавов располагали на сечении тетраэдра, проходящего череч
соединения UFe2, UC02, UMn2, расположенные на ребрах тетраэдра.
Сплавы получали в дуговой печи с вольфрамовым электродом н
атмосфере аргона и гомогенизировали при 1150, 1100, 950 и 700 °C в
течение 5 и 12 ч, 3 и 8 сут. соответственно. Исходными материалами
служили железо вакуумной плавки с 0,02,% С, кобальт с 0,01 % С,
электролитический марганец вакуумной плавки с 0,07 % С и уран с
0,015 % .С.
На рис. 504 приведены поверхности ликвидус и солидус; фазы
UFe2, UCo2, UMn2 образуют между собой непрерывный ряд твердых
растворов в жидком и в твердом состояниях. Поэтому LJFe2—UC02
Рис. 504. Диаграмма плавкости вторичной системы UFe?—UMn2—
UCo2
Мп, % (ат.) Со, % (ат.) Со, % (ат.)
Рис. 505. Политермические сечения системы Fe—Со—Мп—U:
а — 11,7 % (ат.) Со; 6 — 5 % (ат.) Мп; в — 11,8 % (ат.) Fe
408
UMn2 можно считать квазитройным сечением, по которому можно про-
вести тетраэдрацию всей системы.
На рис. 505 изображены некоторые политермические разрезы вто-
ричной тройной системы UFe2—UCo2—UMn2 с 11,7% (ат.) Со (а),
5 % (ат.) Мп (б) и 11,7 % (ат.) Fe (в).
Но своей кристаллохимической природе соединения UFe2, UCo2,
UMn2 относятся к семейству фаз Лавеса со структурой типа MgCu2.
ЖЕЛЕЗО — КРЕМНИЙ — МАРГАНЕЦ — УГЛЕРОД
Сплавы системы исследованы в работах [1, 2]. Установлено, что спла-
вы разреза MnSi—FeSi образуют непрерывный ряд твердых растворов
и растворимость углерода в них
превышает 0,08 % (по массе).
Структура заэвтектоидной
стали, легированной кремнием и
марганцем, исследована в работе
[3]. В качестве шихтовых мате-
риалов использовали армко-желе-
зо, древесный уголь, металличе-
ские марганец и кремний. Сплавы
получали в индукционной печи в
корундовых тиглях, подвергали
гомогенизирующему отжигу в от-
качанных кварцевых ампулах
при 1000 °C в течение 200 ч,
охлаждали с печью до 700 °C;
дальнейшее охлаждение проводи-
ли со скоростью 20 °С/ч.
На основании исследования
сплавов методом микроструктур-
ного анализа построена часть по-
Рис. 506. Часть политермического сече-
ния системы Fe—Si—Мп—С с 1 % С и
5 % Мп
литермического сечения системы
Fe—С—Si—Мп для концентрации
1 % (по массе) и 5 % (по массе) Мп (рис. 506).
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
I. Тавадзе Ф. Н., Долиашвили К. А.— Сообщение АН Груз. ССР, 1957,
т. 18, № 2, с. 211—216.
2. Тавадзе Ф. Н., Цкитишвили М. Д. — Труды Ин-та металлургии АН
Груз. ССР, 1958, т. 9, с. 77—81.
3. Шевчук А. А., Дудецкая Л. Р., Ткачева В. А. — Весщ АН БССР.
Сер. ф!з.-тэхн. наук, 1975, № 3, с. 36—38.
ЖЕЛЕЗО — КРЕМНИЙ — НИКЕЛЬ — СЕРА
Сплавы системы исследовали1 методами микроструктурного анализа.
Сплавы готовили в электрических печах сопротивления в атмосфере
аргона. Шихтовыми материалами служили чистый никель и кремний,
а также лигатура состава 68 % Fe + 32 % S.
1 Vogel R., Romund A.—Arch. Eisenhiittenw., 1964, Bd 35, № 10, S. 1019—1021.
14—358
409
Изучено влияние кремния на область существования расслоения
жидких растворов в системе железо — никель -— сера.
На рис. 507 приведены сечения четверной системы при содержании
2,9 и-4,1 % Si. Эти сечения обозначены цифрами I и II соответственно.
Четверная система изображена в виде призмы, в основании которой
расположена тройная система железо — никель — сера, а содержание
Ni, °/о (помассе)
Рис. 507. Распространение области несмешиваемости в сплавах систе-
мы Fe—Si—Ni—S при 2,9 % Si (I) и 4,1 % Si (//)
кремния отложено по вертикальной оси. При содержании 2,9 % Si об-
ласть существования несмешиваемости расплава простирается в четвер-
ной системе до 37 % (по массе) Ni, а при 4,7 % Si — до 60 % (по мас-
се) Ni.
Рис. 508. Влияние кремния
на положение границы v/v+
+а' в сплавах системы Fe—
Si—Ni—Сг с 20 % Fe
ЖЕЛЕЗО — КРЕМНИЙ —
НИКЕЛЬ —ХРОМ
Методом микроструктурного анализа ис-
следовали ’ влияние кремния на поло-
жение границы у/у + о/ в сплавах си-
стемы. Сплавы выплавляли в дуговой
печи в атмосфере аргона, гомогенизирова-
ли при 1260 °C, 1ч, и закаливали в
воде. Закаленные сплавы осаживали на
кузнечном молоте и отжигали при 1204,
1093, 982, 899 и 816 °C в течение 100, 170,
400, 1000 и 1000 ч соответственно.
На рис. 508 показано влияние 1 %
Si на положение границы у/у+о/ облас-
тей в сплавах в исследованном интервале
температур и при содержании 20 % (по мас-
се) Fe. Добавки кремния уменьшают устой-
чивость у-фазы, сдвигая границу у/у-Ьо/
в сторону сплавов с более низким со-
держанием хрома.
1 Schultz J. V7, Merrick Н. F. — Met Trans.. 1972, v. 3, № 9, p. 2479—2483.
410
ЖЕЛЕЗО — КРЕМН ИЙ — УГЛЕРОД — ХРОМ
Сплавы системы исследовали 1 методами микроструктурного, дифферен-
циального термического, рентгеновского, микрорентгеноспектрального и
t,°C
1600
1500
1600
1500
1200
1100
Рис. 509. Проекция поверхности ликвидус системы Fe—
Si—С—Сг при 8 % С
ж X ЛГ
- ж+К, ^0522- WK, Ж+Kf
- 1 u _1 I L— /Т/f'67'/ лг*#/ V i i i J 1 1 1 I I
1,0 2,0 1,0 2,0 1,0 2,0 1,0 2,0 1,0 2,0
ж ж "ж+ii, i । 1_ Ж ж ,Vf
Ж+1^~~ /f ^/fz
.I..-1 u_ A'-'/'/</^'7
J 1 1
i,l ll J—! 1 L
}10%S\
1600
1500
1600
1500
1200
1100
1,0 2,0 1,5 2,5 2,0 2,7 2,0 2,8 2,0 5,0
CNFe
Рис. 510. Политермические разрезы системы Fe—Si—С—Сг при 4—
8 % С; 5 и 10 % Si и отношение Сг: Fe= 1,00-^3,00
1 Wethmar J. С. М., Howard D. D., Jochens P. R. — Metal Sci., 1975, v. 9, № 6,
p. 291—296.
14* 411
химического анализов. Составы сплавов выбирали таким образом, что-
бы изучаемый объем системы разделить на пять частей с содержанием
углерода 4; 5; 6; 7 и 8 % (по массе). Сплавы содержали 50—55 %
(по массе) Сг, 0—10 % (по массе) Si, 4—8 % (по массе) С, Fe — осталь-
ное. Плавку проводили в тиглях из А12О3 в печах с графитовыми на-
гревателями в атмосфере очищенного
лргона с гомогенизацией при
высоких температурах.
Построены проекции по-
верхности ликвидус при 4,
5, 6, 7 и 8 % (по массе) С —
рис. 509. Политермические
сечения при постоянном со-
держании углерода — 4—
8 % (по массе), постоянном
содержании кремния — 0,5 и
10 % (по массе) и перемен-
ном отношении Сг : Fe
(1,00—3,00) приведены на
рис. 510.
ЖЕЛЕЗО -
МАРГАНЕЦ —
МЕДЬ —
НИКЕЛЬ
Рис. 511. Ориентировочная диаграмма плавко-
сти системы Fe—Ni—Си—Мп:
а — в области сплавов, обогащенных медью и
марганцем (/ — Си—Мп—Ni; 2—Си—Мп—Fe);
б — сплавы, обогащенные железом и никелем
(1 — Fe—Ni—Си; 2 — Fe—Ni—Мп)
Рис. 512. Ориентировочная диаграмма
плавкости системы Fe—Ni—Си—Мп: а —
в области сплавов, обогащенных медью и
марганцем (/ — Си—Мп—Ni; 2 — Си—Мп—
Fe); б — сплавы, обогащенные никелем
(/ — Fe—Ni—Си; 2 — Fe—Ni—Мп)
Методом оптимальных про-
екций построены 1 ориенти-
ровочные диаграммы плав-
кости системы на основе
сведений о диаграммах
тройных систем, образую-
щих данную четверную си-
стему (рис. 511, 512).
ЖЕЛЕЗО —
МАРГАНЕЦ —
МЫШЬЯК —
УГЛЕРОД
Сплавы системы исследова-
ны 2 методами измерения
твердости, дифференциаль-
ного дилатометрического и
микроструктурного анали-
зов. В качестве шихтовых
материалов использовали
железо электролитическое;
ферромарганец [88,2 % (по
массе) Мп и 0,187 % (по
1 Перельман Ф. М. — ЖНХ,
1956, т. I, вып. 11, с. 2577—2587.
2 Свечников В. Н., Шурин
А. К- — Сб. науч, работ Ин-та
металлофизики АН УССР, 1960,
№ 11, с. 53—60.
412
массе CJ; ферромышьяк [35 % (по массе) As и 0,05 % (по массе) С];
марганец электролитический [0,016 % (по массе) Si и 0,024 % (по мас-
се) Fe); чугун синтетический, содержащий 4,5—5 % (по массе) С. Угле-
родистые сплавы приготовляли в печи Таммана в тиглях из А12О3, без-
углеродистые — в печи в атмосфере аргона. Сплавы подвергали диффу-
зионному отжигу при 1100 °C в течение 13—17 ч.
Построены политермические сечения системы (рис. 513). Увеличе-
ние содержания марганца и мышьяка приводит к снижению темпера-
туры распада аустенита в сплавах с 0,2—0,3 % С. В системе образуется
карбид (Fe, Мп)зС, в котором мышьяк нерастворим.
ЖЕЛЕЗО — МАРГАНЕЦ — НИКЕЛЬ — СЕРА
Сплавы системы исследовали 1 с целью выяснения фазового состава ме-
теоритных тел. Методом микроструктурного анализа изучали влияние
добавок марганца до 1 % (по массе) на неограниченную растворимость
компонентов в системе железо — никель — сера в жидком состоянии.
На основании исследования сплавов трех сечений с постоянным со-
держанием марганца 0,4; 0,5 и 1 % (по массе) и при определенном
1 Vogel R., Gerhardt R.—Arch. Eisenhiittenw., 1961, Bd 32. № 12, S. 879 -882.
413
Рис. 514. Область расслоения в
системе Fe—Ni—Мп—S:
/ — 0,4% Мп; II — 0,5 % Мп;
/// — 1 % Мп
основного шлака. Исходными
отношении Fe : Ni : S установлена чет-
верная область расслоения (рис. 514).
Добавление 1 % (по массе) Мп при со-
держании 8 % (по массе) Ni снижает
растворимость серы до 1 % (по массе),
что ниже расчетного содержания серы,
равного 2 % (по массе) в метеоритной
системе Fe—Ni—FeS, и позволяет объяс-
нить расслоение в ней.
ЖЕЛЕЗО — МАРГАНЕЦ —
НИКЕЛЬ —ХРОМ
Сплавы системы, расположенные на се-
чении тетраэдра с постоянным содержа-
нием никеля, равным 10 %, исследовали
методом микроструктурного анализа,
а также измерением электросопротивле-
ния и твердости [1].
Сплавы выявляли в индукционной
печи в корундовых тиглях под слоем
шихтовыми материалами служили армко-
железо, никель и марганец электролитические, хром металлический. Го-
товили сплавы с переменным содержанием хрома 10; 20; 30; 50; 60 и
75 % (по массе) и марганца от 0 до 70 % (по массе).
На рис. 515 приведена фазовая диаграмма отожженных сплавов
исследованного сечения четверной системы. В работе [2] методом опти-
мальных проекций построена ориентировочная диаграмма плавкости
системы.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Корнилов И. И., Канторович Л. Е. — Изв. АН СССР. ОХН, 1959,
№ 6, с. 963—970.
2. Перельман Ф. И. — ЖНХ, 1956, т. 1, № 11, с. 2577—2587.
ЖЕЛЕЗО — МАРГАНЕЦ — УГЛЕРОД — ХРОМ
Сплавы системы исследовали [1,2] методами микроструктурного, рент-
геновского и дилатометрического анализов, измерением магнитных
свойств, твердости и микротвердости.
В работе [1] приведены изотермические сечения тетраэдра в обла-
сти сплавов, богатых железом, с постоянным содержанием углерода
0,05 % (по массе). Эти сечения характеризуют фазовые равновесия при
1150, 1000, 850, 750 и 650 °C и содержании марганца до 50 % (по мас-
се) и хрома до 30 % (по массе). Политермические сечения системы при
4 и 8 % (по массе) Сг и 0,05 % (по массе) С, по которым можно про-
следить влияние марганца [до 40 % (по массе)] на температуры фазо-
вых переходов, исследовали в работе [2]. Для приготовления сплавов
использовали металлический хром марки 04, электролитический марга-
нец и армко-железо. Плавку проводили в индукционной электропечи
в магнезитовом тигле под защитным слоем шлака. Образцы, запаянные
в откачанные кварцевые ампулы, закаливали от указанных температур
после выдержек в течение 15, 30, 65, 95 и 240 ч.
Построенные изотермические сечения (рис. 516), позволили опре-
делить растворимость хрома в у-фазе (г. ц. к. твердом растворе на
414
Рис. 515. Фазовая диаграмма сплавов системы Fe—Мп—Ni—Сг с 10 % Ni
Мп, % (по массе)
Мп, % (по массе)
Рис. 516. Изотермические сечения части системы Fe—Мп—С—Сг при 0,05 %
С и температурах-
а — 1150; б — 850; в — 750; г — 650 °C
основе железа) в зависимости от содержания марганца в сплавах, а
также положение области у+с на концентрационном треугольнике.
Установлено, что во всем изученном температурном интервале раство-
римость хрома в у-фазе с увеличением концентрации марганца сначала
возрастает, а затем уменьшается. Максимум растворимости хрома при
1150°C [~15 % (по массе)] соответствует содержанию марганца 23 %
(по массе) и с понижением температуры смещается в сторону меньших
концентраций марганца, соответствуя ~ 13 % (по массе) Мп при 650 °C.
На политермических сечениях показано, что с увеличением концен-
трации марганца от 12 до 27 % в сплавах с 4 и 8 % (по массе) Сг
наблюдается снижение температурного интервала превращения (уч=*е);
фаза с гексагональной кристаллической решеткой существует в этих
сплавах не выше 400 °C.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Шведов Л. R —Докл. АН БССР, 1975, т. 13, № 8, с. 709—710.
2. Шведов Л. И., Павленко 3. Д. — Изв. АН БССР. Серия физ.-техн.
наук, 1975, № 2, с. 22—27.
ЖЕЛЕЗО — МОЛИБДЕН — НИКЕЛЬ — ХРОМ
Сплавы системы, составы которых располагали на сечении тетраэдра с
постоянным содержанием хрома 20 % (по массе), исследовали1 мето-
дом микроструктурного анализа и измерением твердости. Сплавы вы-
плавляли в печи Таммана в корундовых тиглях и отливали в медные
изложницы. Отжигали сплавы при 1200 °C, 48 ч и закаливали в воде.
1 Brandis И., Lehmann К., Wiebkind К. — DEW-Techn. Вег., 1969, Bd 9, № 2,
S. 204—213.
416
На рис. 517 изображено изотермическое сечение при 1200 °C и по-
стоянном содержании 20 % (по массе) Сг четверной системы. Раствори-
мость молибдена в у-твердом растворе на основе никеля при этих усло-
виях снижается до 23 % в отсутствие железа и до 10—11 % (по массе)
при 30 % (по массе) Fe.
Рис. 517. Изотермическое сечение системы Fe—Мо—Ni—Сг при 1200 ’С
с 20 % Сг
ЖЕЛЕЗО — МОЛИБДЕН — УГЛЕРОД — ХРОМ
Сплавы системы изучали методами микроструктурного, рентгеновского
[1—3], магнитного [1], микрохимического, карбидного [2], микрорент-
геноспектрального [3] анализов.
Изотермические сечения час-
ти системы построены [1] для
сплавов, синтезированных методом
порошковой металлургии и содер-
жащих S(Cr+Mo) до 30% (ат.) С
и 50 % (ат.)
На рис. 518 приведено схема-
тическое строение изотермическо-
го сечения системы при 700 °C и
7,5 % (ат.) С:
I — a-Fe + Fe3C -|-Ре2Мо2Сб;
II — a-Fe+Fe3C + Fe2Mo2Ce -F
-J-Fe^MoC;
III — oc-Fe+Fe3C+Fe2MoC +
4* Mo2C;
IV — a-Fe + Fe3C+Mo2C+
+Сг7Сз;
Рис. 518. Изотермическое сечение ча-
сти системы Fe—Мо—С—Сг при 700 ’С
и 7,5 % С
417
V — a-Fe+Cr7C3+Mo2C;
V / ос-Ре + СгуСз + ЕезМозС + СгазСб;
V // — a-Fe+Сг2зС6 + Fe^Mo^;
V III — ос-Fe+F63M03C + Сг2зС6+FcxMo^j
I X — а-Ре+СггзСб+РехМоу;
Via— a-Fe-bMo2C + Fe3Mo3C;
Villa — a-Fe + РезМозС + РехМоу.
Рис. 519. Изотермическое сечение системы Fe—-Мо—С—Сг при 700 "С с
0,35 % С
Установлены три трехфазных и шесть четырехф^зных равновесий.
Изотермическое сечение системы (рис. 519) с содержанием 0,35 % С
построено в работе [2].
Обозначение фазовых областей:
А : oc-Fe+Me3C; В : oc-Fe+Me7C; С : cc-Fe + Afe23C6; D : oc-Fe+MeC;
Е : oc-Fe+Afe6C; F : a-Fe+Me3C+Me7C3; G : а-Ре+Ме7С34-Ме23Сб;
H : «-Fe+7l4e3C-[ AfeC; К : a-Fe+MeC+Me6C; L : а-Ре+Ме23Сб +
-}-7WeC;
M : a-Fe+Afe3C + Afe23C6; N : а-Ре-ЬЛ4е23Сб+МеС; О : a-Fe+Me6C-r
+X;
P : а-Ре+ЛГе3С+Л1е7Сз+А1е2зСб; R : сс-Ре+Л1езС+Л1е2зСб+МеС;
S : а-Ре+Л1е2зСб + Л[еС + Л1ебС; I : а-Ре + Ме2зСб+Ме4С-1-Х.
Сплавы системы, содержащие до 2,5 % С; 15,5 % Сг и 13,7 % Мо
[примеси, % (по массе): 0,15—0,25 Мп; 0,15—0,30 Si и ^0,02 Р и S
каждого] исследованы при 1100 °C [3]. Сплавы готовили в индукцион-
ной печи, отжигали 4 ч при 1100 °C и закаливали в масле. Установлена
область гомогенности у-твердого раствора на основе железа (рис. 520).
Максимальная растворимость молибдена в у-твердом растворе при
0,4 % С и 10,5 % Сг составляет 5 %; в Л1е3С—5,5—9 %; при 14 % Сг
в Ме7С3 13 % при 22—43 % Сг; в Me23C6 — 11 % при ^50 % Сг.
418
Mol ^V*M23C6 + MSC
Рис. 520. Пространственное изображение области гомо-
генности v-фазы в системе Fe—Мо—С—Сг при 1100 °C;
прямоугольником ограничены области v-фазы, гранича-
щие с двухфазными областями
библиографический список
1. Jellinghaus W. — Arch. Eisenhiittenw., 1971, Bd 42, № 2, S. 133—142.
2. Cadek J., Freiwillig R., Sie Si San — Hutn. listy, 1962, t. 17, № 7,
s. 507—516.
3. Staska E., Bloch R., Kulmburg A.—Microchim. Acta, 1974, Suppl.
№ 5, p. 117—127.
ЖЕЛЕЗО — НИКЕЛЬ — СЕРА — ФОСФОР
Сплавы системы исследовали 1 по трем сечениям с постоянным содер-
жанием фосфора 2,3 и 7 % и переменным содержанием серы от 5 до
30 % и никеля от 3 до 75 % (по массе) методами микроструктурного и
термического анализов.
На рис. 521 приведена диаграмма четверной системы, изображен-
ная схематически в виде тетраэдра. Ио кривой fqxps/W проходит грани-
ца области несмешиваемости в жидком состоянии в системе Fe3P—
FeS—P2S5 и в системе Fe3P—P2S5—Ni3P в области богатых фосфором
соединений железа и серы. Ио кривой /2А2Ф2 проходит разрез через чет-
верную область расслоения в плоскости системы Fe3P—Ni3P—P2S5; кри-
вая kk2 служит границей области расслоения. На рис. 522 приведены
кривые области расслоения в четверной системе, расположенные на се-
чениях с 2,3 и 7 % (по массе) фосфора. Область несмешиваемости про-
стирается до —35 % Ni при 2 % Р и до 70 % Ni при 7 % (по массе) Р.
1 Vogel R.— Arch. Eisenhiittenw., 1963, Bd 34, № 3, S. 211—216.
419
Рис. 521. Схематичное изображение системы
Fe—Ni—S—Р
S, °/о [по массе)
Рис. 522. Распространение области несмешиваемости в сплавах системы
Fe—Ni—S—Р при различном содержании фосфора
При содержании в сплавах 25 % S влияние фосфора на расслаивание в
сплавах системы железо—никель—сера становится заметно, начиная с
0,5 % (по массе).
ЖЕЛЕЗО — НИКЕЛЬ — СВИНЕЦ — УГЛЕРОД
Изучали 1 диаграмму состояния части системы в интервале температур
1300—1550 СС.
Для приготовления сплавов использовали электролитическое желе-
1 Elliot J. F., Miller К. О. — Trans. AIME, 1960, v. 218, № 5, р. 900—910.
420
зо (содержавшее 0,018 % С; 0,080 % О и тысячные доли процента Со,
Ni и Sn), никель (содержавший 0,05 % Fe и тысячные доли процента
РЬ, Со), высокочистый свинец и графит электродный. Сплавы получали
в графитовом тигле. Проводили термический анализ в жидком состоя-
нии. Приведены эскизные фазовые диаграммы этой системы, а также
изотермические сечения для различных плоскостей с содержанием нике-
ля [3 = 0,00; 0,20; 0,40, т. е. 0, 20 и
40 % (по массе)] На рис. 523
приведено изотермическое сечение
фазовой диаграммы для плоскос-
тей, соответствующих 0, 20 и 40 %
(по массе) Ni. Характерные точки
имеют следующий состав, % (по
массе): D — 40 0 Ni; 60,0 Fe; Е —
20,0 Ni; 80,0 Fe; F —100,0 Fe;
J —3,67 C; 57,8 Fe; 38,5 Ni; K —
4,51 C; 76,4 Fe; 19,1 Ni; L — 5.38C;
94,6 Fe; P — 2,77 C; 1,1 Pb; 57,7
Fe; 38,4 Ni; Q — 4,14 C; 0,4 Pb;
76,4 Fe; 19,1 Ni; R — 5,21 C;
<0,01 Pb; 94,8 Fe; V —2,5 Pb;
Рис. 523. Изотермические сечения си-
стемы Fe—Ni—Pb—С при 1550 °C, где
3=0: 20 и 40 % Ni
58,5 Fe; 39,0 Ni; W— 1,2 Pb; 19,0 Fe; 19,8 Ni; X — 0,6 Pb; 99,4 Fe. В интер-
вале 1350—1550 °C наблюдается разрыв растворимости в жидком со-
стоянии, область которого с повышением температуры и увеличением
содержания никеля сужается, а при увеличении содержания углерода —
расширяется.
ЖЕЛЕЗО — НИКЕЛЬ — СУРЬМА — ХРОМ
Исследовали 1 совместное влияние никеля и хрома на раствори-
мость сурьмы в a-Fe в интервале 600—800 °C методом рентгеновского
анализа.
В качестве шихтовых материалов ис-
пользовали железо электролитическое
чистотой 99,9 % с содержанием
—0,005 % С, сурьму чистотой 99,99 %.
Предварительно изготавливали лигату-
ру— сплав железа с 38 °/о Sb. Плавку
проводили в индукционных печах в тиг-
лях из MgO в защитной атмосфере ар-
гона.
Рис. 524. Влияние совместной
добавки 1 % (по массе) Ni И
0,5 % (по массе) Сг на раство-
римость сурьмы в a-Fe
На рис. 524 приведена кривая рас-
творимости сурьмы в a-Fe в зависимо-
сти от температуры (сплошная линия);
показано влияние на растворимость сов-
местной добавки 1 % Ni. и 0,5 % Сг.
При 600 °C эти добавки снижают рас-
творимость сурьмы в a-Fe от 5,3 до 3,1 %
(по массе). Период решетки
a-Fe под влиянием добавок уменьшается с 0,2884 до 0,28768 нм.
ЖЕЛЕЗО — НИКЕЛЬ — ТИТАН — ХРОМ
Методами микроструктурного [1, 2] и рентгеновского [1, 3] анализов
исследовали влияние различных добавок титана на положение фазовых
1 Nageswazarao М., McMahon С. J., Herman Н.—Met. Trans., 1974, v. 5, Я® 5,
р. 1061-1068.
421
границ в системе [1]. В работе [1] получали сплавы индукционной
плавкой на воздухе. В готовых сплавах содержалось до 1,7 % Ti;
0,25—0,35 % Si; 0,04—0,05 % С; 0,18—0,25 % N. Сплавы отжигали по
следующему режиму: 1150 °C, 24 ч; 1050 °C, 100 ч; 950° С, 180—250 ч;
900 °C, 270—305 ч; 850 °C, 600—640 ч; 800 СС, 675—700 ч, 750 ° С, 830—
895 ч; 650 °C, 850—895 ч.
t,°c
1000
950
900
850
800
750
700
850
Fe;J35%Ni;jJ,J%Cr
сплавы не содержат ° \oocoo_
_ Ц-фйЗЫ сгтуГ осггссп-,0
Fejf4,5%Ni;/^%Cr
Сплавы содержат р- сразу
о - следы р - (разы
/ А
। -iii
о
о
0,5 0,5 0,7 0,9 1,1 1,5 1,5 1,7 1,9 2,1
Ti; % (по массе)
Рис. 525. Условия существования ц-фазы в сплавах системы Fe—
Ni—Ti—Сг в зависимости от температуры и содержания титана
Рис. 526. Влияние титана на положение границы у/у+а в сплавах си-
стемы Fe—Ni—Ti—Сг при 0 (а); 10 (б) и 20 % Fe (в)
Добавки титана повышают верхний температурный предел устой-
чивости cr-фазы, способствуют стабилизации феррита и особенно сг-фазы,
сужая область у-фазы. С повышением содержания железа раствори-
мость титана увеличивается. Выше предела растворимости титана в
аустените образуется трфаза (Ni3Ti). На рис. 525 показано влияние
температуры, состава основы и добавки титана на область существова-
422
ния т]-фазы. Титан также стабилизирует богатую хромом фазу а' и
смещает трехфазную область у + о+а' в сторону сплавов, богатых Fe.
В работе [2] также изучали влияние титана на положение границы
у/(у + а') в сплавах системы. Сплавы получали в дуговой печи в атмо-
сфере аргона; шихтовыми материалами служили железо электролити-
ческое чистотой 99,95 %, никель чистотой 99,7 %, хром иодидный чис-
тотой 99,99 %- Полученные сплавы гомогенизировали при 1200°C, 1 ч,
и закаливали в воде. Гомогенизированные сплавы осаживали на кузнеч-
ном молоте вхолодную, а затем отжигали при 1204, 1093, 982, 899 и
816 °C в течение 100, 170, 400, 1000 и 1000 ч соответственно. На рис. 526
показано влияние титана в пределах 0,5—1,5 % на положение границы
у/(у + а') -областей в сплавах системы в исследованном интервале тем-
ператур и при содержании 0, 10 и 20 °/о Fe. Увеличение содержания ти-
тана в сплавах сдвигает эту границу в сторону сплавов с меньшим со-
держанием хрома, т. е. как бы снижает устойчивость у-фазы.
В работе [3] установили в сплавах системы образование и-фазы
примерного состава Рез5Сг1зМ13Т17 с решеткой, близкой к а-Мп; период
с = 0,8838 нм.
библиографический список
1. Hattersley В., Hime-Rothery W. — J. Iron a. Steel Inst., 1966, v. 204,
№ 7, p. 683—701.
2. Schultz J. W., Merrick H. F. — Met. Trans., 1972, v. 3, № 9, p. 2479—
2483.
3. Hughes FI., Liewelyn J. D. — J. Iron a. Steel Inst., 1959, v. 192, № 2,
p. 170—196.
ЖЕЛЕЗО — НИКЕЛЬ — УГЛЕРОД — УРАН
В работе [1] исследовали поля первичной кристаллизации фаз в сече-
нии Fe—UC—Ni. Монокарбид урана, железо и никель сплавляли при
температурах в интервале 1290—
1750 °C. Сплавы изучали микро-
структурным методом после быст-
рого охлаждения от температур
плавления.
На рис. 527 приведено распре-
деление фазовых сочастей в сече-
нии Fe—UC—Ni в твердом состоя-
нии при 20 °C. Область UC—Fe—
[Р] соответствует существованию
UC и твердого раствора железо-
никель. В области UC—Р—С уста-
новлено наличие карбидов UC,
UNiC2 и Х/Y. В двойной системе
Рис. 527. Поля первичной кристаллиза-
ции фаз в области Fe—UC—Ni системы
Fe—Ni—С—U
обнаружили трудно различимые
0 и г-фазы, содержащие 77 и 78—
79 % (ат.) Ni. Эти фазы плавятся
инконгруэнтно; в первом случае
образуются У-фаза и жидкость, во
втором — UNi5 и жидкость [2]. Область С—Р—А отвечает существова-
нию смеси фаз UNiC2, X/Y, UNi5. В области Р—А—Q обнаружены
UNiC2, UNi5, а также твердый раствор железо—никель, а в области
Q—А—В—UNiC2, UNis и графит. Область Q—В—N отвечает равнове-
сию фаз UNi3, графита и твердых растворов железо—никель.
Т J423
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Duita S. К., White /. — Proc. Brit. Ceram. Soc., 1967, № 7, p. 177—203.
2. Grogan J. D., Pleasance R. J. — J. Inst. Metals, 1953—54, v. 82,
p. 141 — 146.
ЖЕЛЕЗО — НИКЕЛЬ — УГЛЕРОД — ХРОМ
Сплавы системы исследованы методами термического, дилатометриче-
ского, электронномикроскопического [1], микроструктурного и рентге-
новского анализов [1, 2]. Фазовое строение сплавов системы с 16 %
(по массе) Сг и 2 % (по массе) Ni исследовали в работе [1]. Нержавею-
Рис. 528. Политермическое сечение системы Fe—Ni—С—Сг
при 16 % Сг, 2 % Ni и переменном содержании углерода
Рис. 529. Изотермические системы Fe—Ni—С—Сг при 1050 °C и 0,
5 и 1,5 % Ni
.424
щую сталь состава 0,018—1,23 % С; 0,04—0,05 % Мп; ~0,09 % Si;
15,5—16 % Сг; 2 °/о Ni выплавляли в индукционной печи в вакууме. По-
строили политермические системы при переменном содержании углерода
(рис. 528). Символ Ц означает присутствие карбидов (Сг, Fe)2sC6 и
(Сг, Fe) 7С3, области существования которых не установлены.
’Исследовано влияние никеля в количестве 0,5 и 1,5% на величину
и положение у-области, а также фазовые равновесия в сплавах железа,
содержащих до 0,6 % С и 30 % Сг [1]. Построены изотермические се-
чения системы при 1050°C с различным содержанием никеля (рис. 529),
где символом Ki обозначен карбид Ме^Се.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Johnson С. R., Rosenberg J. — Trans. ASM, 1962, v. 55, № 1, p. 27/ —
286; Discuss, p. 1054—1054.
2 Bungardt R., Runze E., Horn, E. — Arch. Eisenhiittenw., 1968, Bd 39,
№ 11, S. 863—867.
ЖЕЛЕЗО — АЗОТ —МАРГАНЕЦ — H ИКЕЛЬ —ХРОМ
Исследовали 1 влияние хрома на раство-
римость азота в сплавах состава, % (по
массе): 5,63; 10,60 и 17,72 Сг; 5,72 и
5,57 Ni; 1,26 и 1,38 Мп; 0,20 и 0,49 Si;
0,003 S; 0,07 Р; 0,04 С. Исследования
проводили волюмометрическим методом
в интервале 900—1100 °C и давлений
80—800 гПа. Изучали равновесие реак-
ции 1/2 N2^N.
На рис. 530 проведена температур-
ная зависимость концентраций азота в
сплавах с 5,63 % (по массе) Сг (прямые
1—4) и 10,60 % (по массе) Сг (прямые
5—8) от давления азота в газовой фа-
зе. Показано, что растворимость азота
подчиняется закону Сивертса и увеличи-
вается при понижении температуры.
Температурная зависимость растворимо-
сти азота в изученных сплавах анало-
гична температурной зависимости рас-
творимости азота в y-Fe. Хром увеличи-
вает растворимость азота в аустените.
Рис. 530. Растворимость азота в
сплавах системы Fe—N—Мп—
Ni—Сг с 5,63 % Сг при 1100° С
(7), 1050 °C (2), 1000 °C (3),
950 °C (4) и в сплавах с 10,67 %
Сг при 1100 °C (5), 1050 °C (6),
1000 °C (7), 950 °C (8) в зависи-
мости от давления азота в га-
зовой фазе
ЖЕЛЕЗО —АЗОТ —
МАРГАНЕЦ —
УГЛЕРОД— ХРОМ
Сплавы системы, содержащие до 0,4 % С
и N, исследовали 2 методом микрострук-
турного анализа, измерением твердости, микротвердости и определением
относительной ферромагнитности сплавов. Сплавы получали в атмосфе-
1 Миланская И. Н., Томилин И. А. — ЖФХ, 1973, т. 47, № 9, с. 2244—2246.
2 Пирцхалайшвили В. А., Набичвришвили М. А. В кн.: Вопросы металлове-
дения и коррозии металлов. Тбилиси: Мецниереба, 1968, с. 48—53.
425
ре газовой смеси 25 % (объемы.) Не с 75 % (объемы.) N высокой чис-
тоты в тиглях из оксида алюминия. Слитки, приготовленные методом
насасывания жидкого металла в
Рис 531. Политермические сечения
системы Fe—N—Мп—С—Сг с 12 %
Мп; 0,4 % N; 0,1 % С (/) и 12 %
Мп; 0,1 % С; 0,4 % N (2)
кварцевые трубки диаметром 8—10 мм,
подвергали деформированию в горя-
чем состоянии при 950—1050 °C со
степенью обжатия 45—55 %, а затем
отжигали в течение 1 ч при 1200 °C с
охлаждением в воде. Образцы зака-
ливали через каждые 50 °C с выдерж-
кой 1 ч в интервале 900—1200 °C в от-
качанных кварцевых ампулах и в ин-
тервале 1200—1400 °C в атмосфере
гелия в печи сопротивления с графи-
товым нагревателем.
Изучены две группы хромомар-
ганцевых сталей, содержащих 12 %
Мп с различной концентрацией хро-
ма; в первой группе содержалось
0,4 °/о С и 0,1 % N, во второй — 0,1 %
С и 0,4 °/о N. По результатам иссле-
дования построены политермические
сечения, совмещенное изображение
которых приведено на рис. 531. Влия-
ние азота и углерода на величину
у-области одинаково только до 11UU—
1150с'С; выше этих температур азот
способствует несколько большему
расширению у-области в сторону
сплавов с более высоким содержани-
ем хрома.
ЖЕЛЕЗО — АЛЮМИНИЙ — МАРГАНЕЦ —
УГЛЕРОД— ХРОМ
Исследовали 1 сплавы системы методами микроструктурного и рентге-
новского анализов, проводили измерение магнитных свойств электро
сопротивления и твердости. В качестве шихтовых материалов'исполь-
зовали армко-железо, никель Н1, хром 0, алюминий А00.
Изучали три группы сплавов с 8- 15
и 25 % (по массе) Мп; 0—7 % (по мас-
се) А1; 0,06 % (по массе) С; 12 % (по
массе) Сг. Слитки выплавляли в индук-
ционной печи в основном тигле и дефор-
мировали в горячем состоянии. Сплавы
гомогенизировали в течение 15 ч при
1150 °C в откачанных кварцевых ампу-
лах, после чего часть из них закаливали
2 4 6
Д1; % (по массе}
Рис. 532. Политермическое се-
чение системы Fe—Al—Мп—С—
Сг с 15 % Мп
в воде; температуру печи снижали и от-
жиг продолжали при 1000, 850, 750 и
650 СС с выдержками 30, 65, 95 и 240 ч
соответственно. С каждой температуры
закаливали необходимое количество об-
разцов.
Шведов Л. И., Павленко 3. Д. В кн.: Структура и свойства металлов в
сплавов. Минск: Наука и техника, 1974, с. 187—193.
На рис 532 показано политермическое сечение системы при 15 /о
(по массе) Мп; 12 % (по массе) Сг; 0,06 % (по массе) С и перемен-
ном количестве’ алюминия. Исследованы также политермические сече-
ния системы при 8 и 25 % (по массе) Мп.
ЖЕЛЕЗО — БОР — НИКЕЛЬ — УГЛЕРОД — ХРОМ
В сплавах системы при 700 °C обнаружены1 три фазы; Fe2B, Сг2В и
борокарбидная фаза, предположительный состав которой
(Сг Fe)2q(C В)6. На рис. 533 приведено изотермическое сечение систе-
мы ’железо-бор-хром с 10 %. Ni-0,2 % С (по массе) при 1000 С.
При повышении температуры
борокарбидная фаза в отли-
чие от боридов Fe2B и Сг2В рас-
творяется в аустените. Соотноше-
ние атомных концентраций бора и
углерода меняется от 0 до 2,5 в
зависимости от содержания бора,
углерода и хрома в сплаве.
ЖЕЛЕЗО — ВОЛЬФРАМ —
КОБАЛЬТ — НИКЕЛЬ —
ХРОМ
Исследовали2 методом микро-
структурного анализа и измерени-
ем твердости сплавы пятерной си-
стемы, содержащие по 20 % Со и
Сг. Исходными материалами при
выплавке служили электролитиче-
ское железо чистотой 99,0 °/о, воль-
фрам чистотой 99,0 %, кобальт
2 4 б 8 10 12
Сг % (по массе)
0,7
о,о
^0;4
0,3
“ 0,2
0,1
О
Рис. 533. Изотермическое сечение си-
стемы Fe—В—Сг — 10 %Ni — 0,2 % С
при 1000 °C
Рис. 534. Изотермическое сечение системы Fe—W—Со—Ni Сг
при 1200 °C и постоянном содержании кобальта и хрома
1 Kamako Hideo, Nisidzawa Taidzi — J. Jap. Inst. Metals, 1966, v. 30, № 2,
P‘ Brandis H., Lehmann K., Wiebkind K. — DEW-Techn. E'er., 1969, Bd 9, № 2.
S. 204—213.
426
427
электролитический чистотой 99,9 %, никель чистотой 99,7 %, хром чис-
тотой 99,2 %. Сплавы выплавляли в печи Таммана в корундовых тиглях
и отливали в медные изложницы; отжигали сплавы при 1200 °C, 48 ч, и
закаливали в воде.
Изотермическое сечение при 1200 °C и постоянном содержании ко-
бальта и хрома приведено на рис. 534. Максимальная растворимость
вольфрама в у-никелевом твердом растворе, содержащем кобальт и
хром, достигает 22 %.
ЖЕЛЕЗО — КОБАЛЬТ — МОЛИБДЕН — НИКЕЛЬ —
ХРОМ
Исследовали1 сплавы пятикомпонентной системы, расположенные на
сечении с постоянным содержанием по 20 % Со и Сг Применяли ме-
тоды микроструктурного анализа, а также проводили измерение твер-
дости. Шихтовыми материалами служили железо электролитическое
чистотой 99,0 %, кобальт электролитический, молибден чистотой 99,0 %,
никель чистотой 99,7 %, хром чистотой 99,2 %• Сплавы готовили в печи
Таммана в корундовых тиглях и отливали в медные изложницы.
Ni;2/7%Co;Z/7%Cr
10 20 30 40
Мо, % що массе)
Рис. 535. Изотермическое сечение системы Fe—Со—Мо—Ni—Сг при
1200 °C и постоянном содержании кобальта и хрома
Отжигали сплавы при 1200 °C, 48 ч, и закаливали в воде.
Изображено изотермическое сечение системы при 1200 °C при со-
держании кобальта и хрома по 20 % (рис. 535). Максимальная раство-
римость молибдена в никелевом твердом растворе при содержании в
нем кобальта и хрома достигает 20 %.
ЖЕЛЕЗО — КРЕМНИЙ — МАРГАНЕЦ — СЕЛЕН —
УГЛЕРОД
Исследовали2 сплавы системы с переменным содержанием углерода
(0,01—0,033 %), марганца (0,03—0,09 %) и селена (0,010—0,40 %) и со-
1 Brandis Н., Lehmann К., Wiebkind К. — DEW-Techn. Вег., 1969, Bd 9, № 2,
S. 2Э4—213.
2 Simidzu Hirosi, Ida losiaku, Imanaku Takuitu — S. Iron a Steel Inst Jan
1974, v. 60, № 11, p. 493-497. ₽"
428
держанием 0,002 % P; 0,003 % S; 0,003 % Al; 0,0010 % N, 0,0003 % O.
Катаные пластинки выдерживали в кварцевой ампуле в атмосфере
аргона при 1200—1400 °C, 1 ч, затем закаливали в воде. Растворимость
селена в твердом растворе в сплаве с 3 % Si определяли из соотноше-
ния lg Se (%) = — 10,2 Г-» (К-1)-3,85 Мп (%) —1,50 С (%)+5,01.
Показана растворимость селена в твердом растворе в зависимости
от содержания марганца и углерода (рис. 536). При содержании селена
МО 1050 1300 1250 t,°C
0,00 0,62 0,64 0,66 0,66
1/Т,К
0,60 0,62 0,64 0,66 0,68
1/Т;К
Рис. 536. Растворимость селена в
твердом растворе на основе железа
в сплавах системы Fe—Si—Мп—Se—
С в зависимости от содержания
марганца и углерода:
а _ о,О1 % С; 0,09 % Мп; б — 0,03 7о
С; 0,06 % Мп; в —0,01 % С; 0,03 %
Мп
выше предельной растворимости наблюдается выделение фазы MnSe с
размерами частиц >100 им. Эта фаза имеет решетку типа NaCl. Рас-
пределение селена между твердым раствором и MnSe зависит от со-
отношения Mn/Se и содержания углерода в сплаве.
ЖЕЛЕЗО — МАРГАНЕЦ — МЕДЬ — НИКЕЛЬ —
ХРОМ
Построены 1 ориентировочные диаграммы плавкости некоторых участ-
ков пятерной системы с использованием метода оптимальных проекций.
На рис. 537 изображена одна из возможных оптимальных проекций рас-
сматриваемой пятикомпонентной системы для сплавов, обогащенных же-
лезом и никелем. Сплошной линией показаны данные по системе желе-
зо—никель—хром; штрих-пунктирные линии отвечают системе желе-
зо—никель—медь, а штриховые—.железо—никель—марганец.
ЖЕЛЕЗО — АЛЮМИНИЙ — БОР — КРЕМНИЙ —
ТИТАН — ХРОМ
Сплавы системы исследовали [1, 2] методами микроструктурного, рент-
геновского и термического анализов, а также измерением зависимости
электросопротивления от температуры. Сплавы получали бестигельной
индукционной плавкой во взвешенном состоянии в атмосфере гелия.
1 Перельман Ф. Н. — ЖНХ, 1956, т. I, № 11, с. 2577—2587.
429
Рис. 537. Оптимальная проекция диаграммы плавкости си-
стемы Fe—Мп—Си—Ni—Сг
Рис. 538. Политермическое сечение системы Fe—Al—В—Si—Ti—
Сг с 3 % Al, 0,1 % В и переменным суммарным содержанием
железа, хрома и кремния
Исходными шихтовыми материалами служили титан иодидный, восста-
новленное железо чистотой 99,95 °/о» электролитический хром чистотой
99,95 %, кремний КР1. Бор вводили в виде лигатуры: хром— 10 % (по
массе) бора. Полученные слитки ковали в обжимках на круг диаметром
6 мм. Сплавы гомогенизировали при 1100 °C, 25 ч, и подвергали ступен-
чатому отжигу перед закалкой с 1000, 900, 800, 700 и 500 °C в течение
100, 200, 300, 500 и 1000 Ч соответственно.
430
На рис. 538 изображено политермическое сечение системы с посто-
янным содержанием 3 % (по массе) А1 и 0,01 % (по массе) В и пере-
менным (0,3—4,5 %) суммарным содержанием легирующих элементов
(хрома, железа и кремния). Увеличение суммарного содержания хрома,
железа и кремния снижает температуру солидус. Линия ликвидус от-
вечает началу кристаллизации |3-твердого раствора, который с пониже-
нием температуры переходит в ос-твердый раствор через двухфазную об-
ласть сс + Р для сплавов с малой концентрацией хрома, железа и крем-
ния. В случае сплавов с большим содержанием этих элементов из
p-твердого раствора выделяется металлидная у-фаза, отвечающая со-
единению TisSis. Область a-твердого раствора с повышением темпера-
туры расширяется от 0,6 % суммы железа, кремния, хрома при 400 °C
до ~1,0% при 750 °C. При суммарном содержании легирующих эле-
ментов более 1 % появляется трехфазная область сс + р + 6, где 6-соеди-
нение, образующееся при эвтектоидном распаде 6-фазы; предположи-
тельная формула 6-фазы Ti(Cr, Fe)2.
библиографический список
1. Корнилов И. И., Михеев В. С., Маркевич К- П. — Изв. АН СССР.
Металлы, 1967, № 3, с. 211—218.
2. Михеев В. С., Чернова Т. С. — Изв. АН СССР. Металлы, 1967, № 2,
с. 206—207.
ЖЕЛЕЗО — АЛЮМИНИЙ —
ВАНАДИЙ — КОБАЛЬТ —
МЕДЬ — НИКЕЛЬ
Сплавы системы исследовали 1 мето-
дами рентгеновского, термического и
магнитного анализов.
На рис. 539 изображено политер-
мическое сечение системы с перемен-
ным содержанием ванадия. Начало
координат отвечает составу сплава
железа с 8 % А1; 14 % Ni; 24 % Со и
3 % (по массе) Си (альнико-5). Уве-
личение содержания ванадия в спла-
вах приводит к стабилизации а-фазы
и подавляет выделение у-фазы при
содержании —8,5 % (по массе) V.
Однако влияние ванадия на стабили-
зацию a-фазы значительно слабее,
чем кремния.
V, % (по массе)
Рис. 539. Политермическое сечение
системы Fe—Al—V—Со—Си—Ni. На-
чало координат отвечает сплаву
альнико-5 (Fe с 8 % А1; 14 % Ni,
24 % Со; 3 % Си)
ЖЕЛЕЗО — АЛЮМИНИЙ — ВОЛЬФРАМ —
НИКЕЛЬ — ТИТАН — ХРОМ
Сплавы системы исследовали2 методами микроструктурного анализа,
а также измерением твердости, электросопротивления и жаропрочности.
1 Higuchi Л. —Z. angew. Phys., 1966, Bd 21, № 2, S. 80 —83.
2 Михеев В. С, — ЖНХ, 1956, т. I, № 9, с. 2110—2117
431
Сплавы получали в высокочастотной печи в корундовых тиглях под
слоем основного шлака. Образцы для исследования готовили методом
насасывания расплава в подогретые фарфоровые трубки. Сплавы отжи-
гали при 1150 °C, в течение 18 ч с последующим медленным охлажде-
нием в течение 3 сут. Закаливали сплавы в ледяной воде.
Рис. 540. Фазовое строение сплавов системы Fe—Al—W—Ni—Ti—
Сг при 800 °C
На рис. 540 схематически изображено фазовое строение сплавов с
40 % Ni; 16 % Сг; 1,5 % Ti; 5,5—6,0 % (по массе) W и переменным со-
держанием алюминия от 1,5 до 8 %. Аналогично построены диаграммы
Рис. 541. Политермическое сечение
системы Fe—Al—Со—Si—Си—Ni. На-
чало координат отвечает сплаву
альнико-5 (Fe с 8 % А1, 14 % Ni;
24 % Со; 3 % Си)
для сплавов с постоянным содержа-
нием никеля 20; 30; 35 и 50 % (по
массе). Установлено, что при 800°C с
увеличением содержания никеля в
сплавах повышается растворимость
алюминия в шестикомпонентном аус-
тенитном твердом растворе приблизи-
тельно от 2 [разрез с 20 % (по мас-
се) Ni] до 4—5 % [разрез с 50 % (по
массе) Ni], Область твердых раство-
ров закаленных сплавов простирает-
ся до 3 [разрез с 20 °/о (по массе)
Ni] и до 6,5 % А1 [разрез с 50 % (по
массе) Ni],
ЖЕЛЕЗО — АЛЮМИНИЙ —
КОБАЛ ЬТ — КР ЕМН И Й —
МЕДЬ — НИКЕЛЬ
Сплавы системы исследовали 1 мето-
дами рентгеновского, термического и
1 Higuchi А. — Z. angew. Phys., 1966,
Bd 21, № 2, S. 80—83.
магнитного анализов. На рис. 541 изображено политермическое сечение
этой системы с переменным содержанием кремния. Начало координат
отвечает составу сплава железа с 8 % А1; 14 % Ni; 24 % (по массе) Со
и 3 % Си (алнико-5). Увеличение содержания кремния приводит к ста-
билизации сплавов со структурой a-фазы и подавляет выделение у-фа-
зы при содержании —1,5 % (по массе) Si.
ЖЕЛЕЗО —
АЛЮМИНИЙ —
КОБАЛЬТ — МЕДЬ —
НИКЕЛЬ — НИОБИЙ
В литературе имеются весьма
ограниченные сведения1 о ха-
рактере фазовых взаимодейст-
вий в сплавах систем. Сплавы
исследовали методами рентге-
новского, микрорентгеноспект-
рального и термического ана-
лизов, а также измерением
магнитных свойств в зависимо-
сти от температуры.
Приведено политермиче-
ское сечение, определяющее из-
менение фазового состава
сплава железо — алнико-5 [8 °/о
А1; 14 % Ni; 24 % Со; 3 % (по
массе) Си, остальное Fe] в за-
висимости от температуры и
содержания ниобия (рис. 542).
При введении в сплав ниобия
в структуре сплава появляется
фаза е на основе Fe2Nb, кото-
рая является фазой Лавеса со
структурой типа MgZns.
ЖЕЛЕЗО —
АЛЮМИНИЙ —
КОБАЛЬТ — МЕДЬ —
НИКЕЛЬ —ТИТАН
Опубликованы 1 данные по ис-
следованию фазового состояния
сплавов системы (алнико-5)
[8 % А1; 14 % Ni; 24 % Со; 3 %
(по массе) Си, Fe — остальное]
в зависимости от температуры
и содержания в них титана от
0 до 10 % (по массе). Приме-
няли рентгеновский, микрорент-
геноспектральный и термиче-
ский анализы, а также измеря-
Рис. 542. Политермическое сечение систе-
мы Fe—Al—Со—Си—Ni—Nb при постоян-
ном содержании элементов, %: 8 А1; 14 Ni;
24 Со; 3 Си
Рис. 543. Политермическое сечение системы
Fe—Al—Со—Си—Ni—Nb при постоянном
содержании элементов, %: 8 А1; 14 Ni; 24
Со; 3 Си
433
1 Higuchi А. — Z. angew. Phys.,
1966, Bd. 21, № 2, S. 80 -83.
432
ли магнитные свойства в зависимости от температуры. Введение в ис-
следуемый сплав (алнико-5) титана приводит к образованию в струк-
туре сплавов фазы е на основе соединения FegTi. Это соединение явля-
ется фазой Лавеса с кристаллической структурой MgZna. Как видно,
в узком интервале температур существует четырехфазная область cti +
+ CZ2+Y + 6.
ЖЕЛЕЗО — АЛЮМИНИЙ — КОБАЛЬТ —
КРЕМНИЙ — МЕДЬ — НИКЕЛЬ — ЦИРКОНИЙ
В литературе имеются некоторые сведения 1 о фазовых равновесиях в
системе, изученной в связи с исследованием дополнительного легирова-
Рис. 544. Политермическое сечение системы
Fe—Al—Со—Си—Ni—Fe при постоянном со-
держании элементов, %: 8 А1; 14 Ni; 24
Со; 3 Си и отношении Zr : Si = l : 1
\\, % Inc массе)
Рис. 545. Растворимость алюминия, вольфра-
ма, титана при 1000 °C в т-твердом растворе
системы Fe—V—Si—Мп—Ni—Nb—Сг
ния сплава алнико-5 цир-
конием и кремнием в рав-
ных количествах. Исходным
служил сплав альнико-5 со-
става, % (по массе): 8 А],
14 Ni, 24 Со, 3 Си, осталь-
ное Fe. На политермическом
сечении (рис. 544), постро-
енном по данным исследова-
ния сплавов методами рент-
геновского, микрорентгено-
спектрального и термиче-
ского анализов и измерени-
ем магнитных свойств, по-
казано изменение фазового
состояния сплава в зависи-
мости от температуры и со-
держания циркония и крем-
ния в соотношении 1:1. Их
введение в сплав приводит
к образованию Е-фазы на
основе соединения FeaZr, ко-
торое является фазой Лаве-
са со структурой типа
MgNi2. При суммарном со-
держании этих элементов в
количестве около 2,4 °/о (по
массе) выделение у-фазы
подавляется.
ЖЕЛЕЗО —
ВАНАДИЙ —
КРЕМНИЙ —
МАРГАНЕЦ —
НИКЕЛЬ —
НИОБИЙ — ХРОМ
Методами микроструктурно-
го анализа, измерением
твердости, микротвердости,
удельного электросопротив
ления и жаропрочности ис-
следовали 1 сплавы с переменным содержанием алюминия, вольфрама и
титана. Построено 16 сечении системы с постоянным отношением леги
рующих компонентов 58,5 % Fe; 15 % Сг; 15 % Ni; 10 % Мп; 0,5 % Nb;
0,5 % V; 0,5 °/о Si (у-твердый раствор).
На рис. 545 приведена диаграмма фазового состояния сплавов на
основе указанного выше у-твердого раствора. Точка А отвечает исход-
ному составу твердого раствора. Кривые на соответствующих плоскостях
ограничивают область растворимости в указанном растворе алюминия,
вольфрама и титана. Показано, что в исходном у-твердом растворе при
1100 °C растворяется до ~2,8 % Ti; ~3,5 % А1; ~5,5 % W. Раствори-
мость каждого из этих элементов в у-твердом растворе снижается при
введении двух других компонентов.
1 Тавадзе Ф. Н., Пряхина Л. И., Симонишвили Т. В. ДАН СССР, 196z,
т. 145, № 1, с. 112—114.
1 Higuchi А.— Z. angew. Phys., 1966, Bd. 21, № 2, S. 80—83.
434
ТЕПЛОВЫЕ И ТЕРМОДИНА.
Элемент t °C / °C 4кип’ ь eD, К Д ^пл’ кДж/кг
1 2 3 4 5
Азот -210 —196 25,7
Актиний 1200 -3297 62,5 389 4
Алюминий 660 2520 432
Америций 850 2610
Аргон —189 —186 93 29 5
Астат 304 334 113,7
Барий 710 1640 96 56,0
Бериллий 1287 2450 1060 1625Д
Берклий 987
Бор Бром 2075 —7 3707 59 1219 2090,0 67 6
Ванадий 1917 3392 339 345,4
Висмут 271 1557 117 54,7
Водород —259 —252 — 58,0 (На) 192,0
Вольфрам 3380 5367 384
Г адолиний 1312 3233 155 64,9
Галлий 30 2205 333 80,2
Гафний 2230 5225 178 122,0
Гелий —270 при 10 МПа —269 (0,1 МПа) — 5,2
Германий 937 2734 406 443,0
Гольмий 1470 2720 161 85,9
Диспрозий 1409 2335 158 64,2
Европий 822 1597 121 60,8
Железо 1538 2872 478 272,0
Золото 1064 2877 162 64,4
Индий 156 2050 109 28,5
Иридий 2447 4577 420—425 137,1
Иттербий 816 1193 118 44,3
Иттрий 1520 3337 235 (по Ср) 192 (по р) 193,1
Иод 114 183 — 62,2
Кадмий 321 766 213 57,0
Калий 63 759 90 59,5
Калифорний 300 — —
Кальций 852 1484 220 216,0
Кислород —218 —183 — 13,9
Кобальт 1494 2957 445 263,2
Кремний 1417 3249 645 1773,0
Криптон —156 —153 72 19,5
Ксенон —111 —108 65 17,5
Кюрий 1340 -—. —
Лантан 920 3454 135 44,7
Литий 180 1342 370 416,0
Лютеций 1663 3315 166 68,2
Магний 650 1107 386 357,0
Марганец 1244 2119 450 267,0
Медь 1083 2573 345 239,0
Молибден 2622 4804 380 382,0
Мышьяк 436 817 615 285 290,9
.МПЧЕСКИЕ СВОЙСТВА ПРИЛОЖЕНИЕ
"исп- кДж/кг- при /кип ср, Дж/(кг-К), при 298 К К, Вт/(м-К), при 298 К а-10% К-1
6 7 8 9
1040,0 0,2 —
1748,9 119,8 —• —
10885,8 903,8 221,5 23,4
981,9 — — 6,2—7,5
163,5 520,0 0,1 3676,0
430,5 0,3 — —
1289,0 0,2 — 18
34395,0 1976,0 194,0 12 (|| с) 9 (хс)
51935,0 1025,8 26,0 (300 К) 1,1-8,3 1110,0 (объемн.)
187,6 473,8 —
8974,9 0,5 31,0 8,7
857,5 129,0 8,4 13,4
450,0 (Н2) 14208,0 0,2 2950,0 (объемн.)
4007,0 136,0 160,0 4,5 (473 К)
2527,0 (субл,) 175,0 10,2 8.3
3917,1 1364,0 33,0 (300 К) 20.0
143,0 22,2 (373 К) 6,6 (300 К)
20,9 5190,0 0,1 (273 К) 3658,0 (объемн.)
4700,3 322,0 60,7 (п-типа) 57,0 (р-типа) 5,7
1823,0 (субл.) 165,0 22,011 а 14,01 а 10,7
1834,0 (субл.) 169,0 10,9 10,0
952,2 178,0 •—.
6095,0 0,5 74,0 12,1
0,130 310,0 14,0
2026,4 238,6 87,0 (250 К) 30,0
3186,4 128,0 (250 К) 148,0 (300 К) 5,7
880,0 149,0 24,9
4420,5 0,3 15,8 7,6
164,4 214,5 0,4 93,0 ( 273 К)
886,0 231,0 103,0 31,0
2082,0 765,0 97,1 84,0
3830,0—4169,0 625,0 (250 К) 125,0 22,0
918,0 0,02
6502,0 406,0 (250 К) 70,9 12,0 (273 К)
13709,0 714,0 152,0 (300 К) 2,4
107,9 248,0 0,01 1000,0 ( 70 К)
966,0 150,0 0,05 3552,0 (373 К)
1508,0 -—. -— —
3102,0 (субл.) 188,6 20,9 10.4
21290,0 3517,0 76,1 56,0
2443,8 154,0 18,1 12,5 (673 К)
5498,0 1047,5 167,0 26,0
5057,0 478,0 157,0 22,3
4790,0 384,2 397,2 (350 К) 16,7
6191,0 248,0 138,0 о
424,4 (субл. 615°С) 329,5 3,9 437
П родолжение
Элемент / °C ГПЛ’ С / °C eD . к Д ^пл’ кДж/кг
1 2 3 4 5
Натрий 98 278 160 117,0
Неодим 1016 3127 138 49,5
Неон —248 —246 75 16,6
Нептуний 637 3900 —
Никель 1455 2915 476 302,0
Ниобий 2469 4842 276 (по упругим пост.) 238 (по Су) 296,6
Олово 232 2270 200 (белое) 212 (серое) 59,6
Осмий 3047 5000 500 140,9
Палладий 1554 2877 275 156,9
Платина 1772 3827 235 100,9
Плутоний 639 3235 — 11,6
Полоний 246 962 — 59,7
Празеодим 931 3212 138 49,1
Прометий 1080 2460 — 56,1
Протактиний 1575 4230 — 63,4
Радий 700—960 1140—1500 •— 37,1
Радон —71 —62 — 14,7
Рений 3180 5630 415 178,0
Родий 2053 3627 362—480 219.6
Ртуть —39 357 357 11,7
Рубидий 39 686 55 27,4
Рутений 2523 4350 580 222,8
Самарий 1073 1778 148 57,4
Свинец 327 1745 105 23,4
Селен 217 657 89 69,1
Сера 113 445 180 49,8
Серебро 960 2167 225 104,6
Скандий 1530 2700 231 —.
Стронций 770 1380 129 960,0
Сурьма 630 1635 204 162,4
Таллий 303 1457 79 21,1
Тантал 2997 5287 26 (по упругим ПОСТ.) 240 (по Ср) 216 (по р) 173,7
Теллур 450 1012 129 137,2
Тербий 1353 3041 158 64,8
Технеций 2200 4700 — 232,0
Титан 1668 3169 430 3583,0
Торий 1695—1757 3297-4787 180 67,4
Тулий 1545 1727 167 104,7
Углерод 4000 4200 1860 (алмаз) —
Уран 1133 3862 200 82,7
Фосфор 44 280 — 81,0
Франций 27 677 -— 94,0
Фтор —220 —188 — 13,4
Хлор —101 —34 — 90,4
Хром 1877 2200 357 265,6
Цезий 28 670 39 16,1
Церий 798 3257 138 37,0
Цинк 419 907 305—320 110,0
Цирконий 1852 3600—3700 237—310 220,0
Эйнштейний 860 — -—. —
Эрбий 1522 2510 163 65,6
"исп’ КДЖ/КГ- при /кпп Ср, Дж/(кг-К) при 298 К Z, Вт/(м-К), при 298 К а-10“ К~1
6 7 8 9
3869,0 1224,0 150,0 (273 К) 72,0
2271,0 (субл.) 190,0 12,9 10,0
85,9 1030,0 0,05 0,5
1666,9 (субл.) — 7,7 (300 К) 41,0
6376,0 450,0 88,5 13,5
7359,1 269,0 53,2 7,1
2446,7 222,0 (белое) 217,0 (серое) 65,0 26,2
4121,9 129,0 (273 К) 86,0 ( 300- 500 К) 6,1 (273 К)
3399,0 238,0 (250 К) 76,2 12,8 (289—773К)
2577,3 132,0 (250 К) 74,0 ( 300 К) 8,0 (82—289 К)
1578,6 143,4 (260 К) 4,6 (200 К) 42,4
480,0 125,0 — 20,8
2523,0 (субл.) 2400,0 191,0 13,2 6,8
1822,0 -—. — 9,0
1993,7 .— — 11,2
716,9 136,0 18,6 —
73,9 90,0 —. —
3822,0 138,0 71,0—59,0 6,6
4800,8 234,0 (250 К) 152,0 (300 К) 8,7 (273—473 К)
304,6 141,1 (233 К) 139,0 (293 К) 8,4 41 (195-234 К)
-— 367,0 35,6 90,0
5857,0 0,273 ( 250 К) 116,3 9,9
1374,0 180,0 13,3 10,4
— 127,6 35,0 28,3
885,5 320,0 0,5 25,5 (273 К)
287,2 984 0,3 74,0
— 237,0 453,0 18,8 ( 300 К)
-—. 558,0 15,5 11,4
1763,0 737,0 — 23,0
1371,7 209,0 18,8 10,8
795,1 129,8 38,9 28,0
— 140,3 45,2 6,6 (373 К)
820,9 202,0 1,8 ( 350 К) 0,2
2445,0 (субл.) 179,0 10,2 10,3
6560,0 (субл.) 245,0 49,8 8,1
9790,0 (субл.) 521,0 21,9 9,5
2202,0—2844,0 1152,0 (250 К) 35,6 (300 К) 11,3
1374,0 (субл.) 160,0 18 13,3
59700,0 (субл.) 710,0 545,0 (алмаз) 27,3 (270 К)
1876,0 113,1 (250 К) 22,5 (300 К) 10,7
1891,9 769,1 0,6 376,0
-— 136,5 .— —-
178,9 (Т-85,2 К) 828,0 0,02 (273 К) —
1288,1 497,9 0,008 3830,0 (объема.)
1798,0 474,0 88,6 4. 1
494,0 236,0 19,0 97,0
3105,0 271 (V-Ce) 193,0 10,9 8,5
1765,0 394,0 119.0 31.0
6357,0 289,0 29,5 5,9
1863,0 (субл.) 168,0 1 1,1 12.3
438
439
Справочное издание
Олег Александрович БАННЫХ, Петр Борисович БУД БЕРГ,
Светлана Павловна АЛИСОВА, Людмила Сергеевна ГУЗЕЙ,
Михаил Ефимович ДРИЦ, Татьяна Владимировна ДОБАТКИНА,
Евгения Васильевна ЛЫСОВА, Надежда Ивановна НИКИТИНА,
Елена Михайловна ПАДЕЖНОВА, Лазарь Леонович РОХЛИН,
Ольга Павловна ЧЕРНОГОРОВА
ДИАГРАММЫ СОСТОЯНИЯ ДВОЙНЫХ
И МНОГОКОМПОНЕНТНЫХ СИСТЕМ
НА ОСНОВЕ ЖЕЛЕЗА
Под редакцией Олега Александровича Банных
и Михаила Ефимовича Дрица
Редактор издательства Л. М. Гордон
Художественный редактор Ю. И. Смурыгин
Технический редактор Г. Б. Жарова
Корректоры Ю. И. Королева, Т. В. Морозова
ИБ № 2076
Сдано в набор 27.11.85. Подписано в печать 15.02.86. Т-03665. Формат бумаги
84Х108’/з2- Бумага типографская Кв 2. Гарнитура литературная. Печать высокая.
Усл. печ. л. 23,31. Усл. кр.-отт. 23,31. Уч.-изд. л. 29,52. Тираж 3700 экз. Заказ 358.
Цена 1 р. 80 к. Изд. Кв 0488.
Ордена Трудового Красного Знамени издательство «Металлургия»,
119034, Москва, Г-34, 2-й Обыденский пер., д. 14
Владимирская типография Союзполиграфпрома при Государственном
комитете СССР по делам издательств, полиграфии и книжной торговли
600000, г. Владимир, Октябрьский проспект, д. 7
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛ^гнгОВ Д.И. МЕНДЕЛЕЕВА
Пери оды А I В А УП В А ЕШ В
1 Н 1 н 1,007 Водород 2 Не 4,003 Гелий
А II В A III В A 1Y В А V I A VI В
2 3 Li 6,941 Литий 4 Be 9,013 Бериллии 5 В 10,811 бор 6 с 12,01! Углерод 7 N 14,006 Азот в 0 15,999 Кислород 9 F 18,998 Фтор ю Ne 20,179 Неон
3 и Na 22,989 Натрий к Мд 24,320 Магний 13 А1 26,981 Алюминий 14 Si 28,080 Кремний 15 Р 30,974 Фосфор 5 S 52,064 Сера 17 С1 35,453 Хлор 18 Аг 39,948 Аргон
4 19 К 39,098 Калий 20 Са 40,080 Кальций 21 SC 44,960 Скандий 22 Ti 47,900 Титан 23 50,4 Вана|р 24 Сг 51,996 Хром 25 Мп 54,938 Марганец 26 Fe 55,847 Железо 27 Со 58,933 Кобальт 28 Ni 58,700 Никель
29 Си 63,540 Медь зо Zn 65,370 Цинк 31 Ga 69,720 Галлий 32 бе 72,590 Германий зз As 74,922 Мышьяк 1 34 se 78,960 Селен 35 ВГ 79,904 Бром 36 Кг 83,800 Криптон
5 37 Rb 85,470 Рубидий 38 Sr 87,620 Стронций 39 Y 88,905 Иттрий 40 Zr 91,220 Цирконий 41 N< 92,90 Ниобю 42 Мо 95,940 Молибден 43 ТС 99,000 Технеций 44 Ru 101,070 Рутений 45 Ph 102,905 Родий 46 Pd 106,400 Палладий
47 Ад 107,869 Серебро 48 Cd 112,400 Кадмий 49 In 114,820 Индий 50 5п 118,690 Олово 51 Sb 121,750 Сурьма 52 Те 127,610 Теллур 53 I 126,904 иод 54 Хе 131,300 Ксенон
Е 55 Cs 132,905 Цезий 56 Ва 137,340 Барий 57 La* 138,910 Лантан 72 Hf 178,490 Гафний 73 Т 180,94 Танта I 74 W 183,92 Вольфрам 75 Re 186,310 Рений 76 05 190,200 Осмий 77 1Г 192,220 Иридий 78 Pt 195,090 Платина
79 AU 196,967 Золотя ао Нд 200,590 Ртуть 81 Т1 204,370 Таллий 82 РЬ 207,190 Свинец 83 Bi 208,980 Висмут 84, Ро [210] Полоний 85 At [210] Астат 86 Rn [222] Раден
7 87 Fr [223] Франций 88 Ra 226,025 Радий 89 AS** [227] Актиний 104 KU Курчатовий 105 N (Нильсборий) 106 107 Атомный —_ номер Атомная масса — 92 U — 238,029 Уран
*Л а н т • а и о и д ы
54 Се 59 Рг 60 Nd ei Pm 62 Sm 63 Ей 64 Gd (.5 ТЬ 66 Цу 67 НО 68 Ег 69 Тт 70 Yb 71 Lu
140,120 140,907 144,240 [147] 150,350 151,960 157,250 1 158,924 162,500 164,930 167,200 168,934 173,040 174,970
Ц рии Празеодим Неодим Прометий Самарий Европий Гадолиний Гербий Диспрозий Гольмий Эрбий Тулий Иттербий Лютеций
** Актиноиды
о Th 2.1?, 0,18 ЪриИ 9i Fa 231.030 Протзминий 92 U 238,029 Уран 93 Np 237,048 Нептуний 94 Ри [2441 Плутоний 95 Ат [243] Америций 96 Ст [247J Кюрий 9/ ВК 1247] Берклий 98 Cf [251] Калифорний 99 ES [254] Эйнштейний юо Fm [257] Фермий 101 Md [258] Менделевий 102 Ко [254] Нобелий юз (Lr) [256] (Лоуренсий)
ПЕРИОДИЧЕСКАЯ tMCTlMA пЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
g 1 py
at ex IA HA ША T?A VA ИА YEA WI1A IB ПВ ШВ IYB VB V1B TUB 0
1 1 (H) 1,007 (H) He 4,00
2 3 Li 6,94 4 Be 9,01 Л в id,8f IIII I т к—’ T ' T TT t tt 6 7 8 or 10 I I I II II C N 0 F Ne I til 1 111 111 12,01, 14,00 16,00 19,00 20,18 I HH i Ц11 |l||i . щи t|| Jl
3 11 Na 22,99 12 Mg 24,32 13 Al 26,98 Металлы переходной группы xi I II II II | И N 14 15 16 17 18 X 1 11 1 I II II Si P S Cl Ar 4 lui 11 in nil 28,04 10,97 32,06 35,45 39,95 : Jj, ЛЖ 4-Ш- # Д—
4 19 К 39,10 20 Ca 40,08 21 Г Sc 44,96 -ТП—--J]-- 22 23 Ti у 47,900 50,94 --TTT- 24| 25 С г Мп 52,00 54,94 26 Fe 55,85 .»/ (II 11 ' 28 Ni 58,71 29 Cu 6.1.11 30 Zn 65,-17 Ji Ga 1.0, TI \ III II II 32 33 X 34 35 36 « 11 11 11 Ge Аб Se Br | Kr /?,!>» 74,92 70,9Ц 79,90 ; 83,80
5 37 Rb 85,47 38 Sr 87,62 39 Y 88,90 II II 40 41 Zr Nb 91,22 92,91 Hill Hill -# ГТГГ’ 42 43 1 ! 1 t 1 Мо Тс nil tit 95,94 [99] IIIII 1 IIIII ffl |Ru 101,07 T 1 1 Rli IU •« ..1O 46 1 Pd 106,4 4/ A (J 107,87 48 Cd 112,40 4'1 III 1И.82 \ 50 51 52 53 54 Sn Sb те 1 хё V I 1 fill 118, 6<h 121J5 127,60 126,90 151,30 \ zzzzzz/, z llllll.. .-llLLkl
55 CS 132,91 56 Ba 137,34 57 La 138,91 58 59 Ce Pr 140,12 140,91 60 61 Nd Pm 144,24 [145] 62 Sm 150,35 > л «J / 1Н0ИДЫ 7 Атомный номер Символ Ее 5 и Атомная масса
6 63 Eu 151,96 64 Gd 157,25 65 66 Tb By 158,92 162,50 67 68 Ho Er 164,93 167,26 69 Tu 168,93
70 Yb 174,04 71 Lu 174,97 11? ?? Hf та 178Л9 180,95 lllllll llllll "ЛТ "W" 74 75 W Re 183^85 186,2 llllll llllll 111 fi?. 190,2 IIIII 1 llLUlL.. 74 Au 1111 Н6,в7 ЯО H(| .no DO HI 11 1)4,1 ПТ ТТТ - '1? .83 84 • 85 86 РЬ : Ро At Rn 0/19 ’08.98 f| >101 |2ll)| [222] : ПИЛ „ШИЛ...
87 Fr [2231 88 Ra [2261 89 Ac [227J 90 91 Th Pa 232,04 [231] 92 93 U Np 238,03 [2377 94 PU [242] / »'оиды I I — Mr Uhl МЫ I J — HO'HJM '1.1ЛЛЫ ffinim - j j — УА nan aflhlM ] — lyeoaodflnur
7 95 Am [243] 96 Cm [247] 97 98 Bk Cf [247] [249] 99 100 Es Fm [254] [253] 101 Md [256]
102 No [256] 103 Lw [257] 104 105 Ku Ns [260] 106 107