Автор: Грачева И.М.
Теги: спирто-водочное производство спирт водка пищевое производство микробиология биотехнология
Год: 1987
Текст
УЧЕБНИКИ И УЧЕБНЫЕ ПОСОБИЯ
ДЛЯ СТУДЕНТОВ ВЫСШИХ УЧЕБНЫХ ЗАВЕДЕНИЙ
И.М. ГРАЧЕВА
ТЕХНОЛОГИЯ
ФЕРМЕНТНЫХ
ПРЕПАРАТОВ
ИЗДАНИЕ ВТОРОЕ, ПЕРЕРАБОТАННОЕ И ДОПОЛНЕННОЕ
Допущено Министерством высшего и среднего спе-
циального образования СССР в качестве учебника
для студентов высших учебных заведений, обуча-
ющихся по специальности «Технология микробио-
логических производств».
МОСКВА
ВО «АГРОПРОМИЗДАТ.
1987
ББК 36.87
Г75
УДК 663.53(07)
Рецензенты: кафедра микробиологии МГУ (проф., д-р биол. наук
И. С. Егоров, проф., д-р биол. наук Л. И. Воробьева), проф., д-р биол. наук
А. С. Тихомирова (Всесоюзный научно-исследовательский институт пищевой
биотехнологии).
Грачева И. М.
Г75 Технология ферментных препаратов.— 2-е изд., пере-
раб. и доп. М.: Агропромиздат, 1987.— 335 с.: ил.—
(Учебники и учеб, пособия для студентов высш. учеб,
заведений).
Освещены все этапы промышленного производства ферментных препара-
тов, их применение, характеристика готовой продукции, источники получе-
ния ферментов.
Во втором издании (первое вышло в 1975 г.) приведены данные по пер-
спективным направлениям в технологии, внедренным на предприятиях фер-
ментной промышленности за последние десять лет.
Для студентов вузов, обучающихся по специальности «Технология микро-
биологических производств».
Г
2910000000—386
035(01)—87
ББК 36.87
413—87
© Издательство «Пищевая промышленность», 1975
© ВО «Агропромиздат», 1987, с изменениями
ПРЕДИСЛОВИЕ
Производство ферментных препаратов является одним из ве-
дущих направлений в развитии микробиологической промышлен-
ности. Год от года растет объем выпускаемых ферментных препа-
ратов, расширяется их ассортимент и область применения. Фер-
ментные препараты широко используются в самых различных от-
раслях пищевой и легкой промышленности, в косметике, в произ-
водстве моющих средств, в сельском хозяйстве, в аналитических
исследованиях, медицинской промышленности и здравоохранении.
Все больше заводов микробиологической промышленности осваи-
вают выпуск этой продукции и поэтому возрастает потребность в
специалистах по технологии ферментных препаратов. Успешное
развитие производства ферментных препаратов во многом зависит
не только от глубоких знаний и исследований в области произ-
водства, но и от умения использовать при решении проблем по
созданию новых технологий знаний в области микробиологии, био-
химии, физической и коллоидной химии, генетике и, особенно,
энзимологии — то есть наук, являющихся теоретической основой
промышленного получения ферментных препаратов.
В основу данной книги положены лекции по технологии фер-
ментных препаратов, читаемые автором в Московском ордена Тру-
дового Красного Знамени технологическом институте пищевой
промышленности для студентов старших курсов по специальности
«Технология микробиологических производств». Первое издание
учебника было 12 лет назад. Технология ферментных препаратов
за этот период существенно изменилась. Созданы новые более про-
дуктивные продуценты ферментов, которые часто способны накап-
ливать ферменты на порядок больше, чем это имело место в на-
чале 70-х годов. Получили более широкое распространение мето-
ды иммобилизации ферментов, различные способы очистки и полу-
чение стабильных форм готовых препаратов. Почти повсеместно
в качестве перспективного метода концентрирования и очистки
ферментов стали использовать ультрафильтрацию и т. д. Ряд но-
вых ферментных препаратов стали выпускать в заводских услови-
3
ях (0-галактозидаза, 0-глюканаза и т. д.), а ранее существовавшие
технологии других ферментных препаратов претерпели существен-
ные изменения.
Все это было учтено автором при работе над вторым изданием
учебника, который фактически полностью переработан, особенно
во второй части. По всем вопросам, рассматриваемым в учебни-
ке, в мировой литературе очень много публикаций обзорных ра-
бот. Автор стремился учесть их, однако привести ссылки на них
не представилось возможности, поэтому в учебнике приводится
только список книг на русском языке, дополнительно рекомендо-
ванных студентам.
При подготовке рукописи к изданию большую помощь автору
оказали сотрудники кафедры «Биотехнология микробного синте-
за» МТИПП. Автор выражает искреннюю признательность и бла-
годарность за ценные замечания рецензентам — профессорам
Н. С. Егорову, Л. И. Воробьевой, А. С. Тихомировой, а также кан-
дидатам биологических наук Е. А. Двадцатовой, Н. В. Поповой и
другим.
Автор с благодарностью примет все пожелания и замечания
читателей.
Профессор, доктор биологических наук
И. М. ГРАЧЕВА
ВВЕДЕНИЕ
Производство ферментных препаратов занимает одно из веду-
щих мест в современной биотехнологии и относится к отраслям,
объем продукции которых постоянно растет, а сфера применения
неуклонно расширяется. Такое быстрое развитие связано с тем,
что ферменты являются высокоактивными, нетоксичными биоката-
лизаторами белкового происхождения, которые широко распрост-
ранены в природе, без них невозможны осуществление многих био-
химических процессов и жизнь в целом.
Познание роли ферментов для всего живого на Земле послу-
жило основой для становления и развития технологии фермент-
ных препаратов как науки и для создания промышленного произ-
водства наиболее широко используемых ферментных препаратов.
Применение этих препаратов помогло существенно изменить, ин-
тенсифицировать и усовершенствовать многие существующие тех-
нологии или даже создать принципиально новые высокоэффектив-
ные процессы. Применение ферментных препаратов различной
степени очистки позволило не только улучшить показатели и вы-
ходы в различных биотехнологических процессах, но позволило
усовершенствовать кормопроизводство, повысить усвояемость кор-
мов, сделать более целенаправленным и эффективным действие
синтетических моющих средств, улучшить качество косметических
препаратов, создать целый арсенал специфических, чувствитель-
ных и точных аналитических методов, наладить производство ле-
карственных и профилактических средств для медицинской про-
мышленности и т. д.
Большим и неоспоримым достоинством ферментов перед хими-
ческими катализаторами является то, что они действуют при нор-
мальном давлении, при температурах от 20 до 70 °C и pH в диа-
пазоне от 4 до 9 и имеют в большинстве случаев исключительно
высокую субстратную специфичность, что позволяет в сложной
смеси биополимеров направленно воздействовать только на опре-
деленные соединения. Все это свидетельствует о том, что произ-
водство ферментных препаратов является одним из перспективных
направлений в биотехнологии, которое будет и далее интенсивно
развиваться и расширяться.
Задачи курса и его содержание. Основная задача данного кур-
са— это ознакомление студентов с технологией ферментных пре-
паратов микробного происхождения. Технологией ферментных пре-
паратов может быть названа совокупность технологических прие-
мов, осуществление которых на соответствующем оборудовании
5
при наличии необходимых исходных материалов обеспечивает по-
лучение ферментных препаратов заданных свойств.
Во вводной части курса кратко изложены история возникнове-
ния и перспективы развития отрасли, основы номенклатуры выпу-
скаемых в СССР ферментных препаратов, сведения об основных
источниках получения ферментов, о методах определения актив-
ности, об единицах активности, выражении производительности
предприятий.
В первой части детально описываются основные технологиче-
ские приемы, используемые при поверхностном и глубинном куль-
тивировании продуцентов, а также при получении очищенных фер-
ментных препаратов из культур микроорганизмов.
Часть вторая посвящена описанию некоторых особенностей по-
лучения препаратов, обладающих определенной активностью, на-
пример амилазной, протеазной, целлюлазной и т. д. Попутно в са-
мом общем виде излагается механизм действия ферментов на суб-
страт, что в известной степени позволяет прогнозировать состав
питательной среды и условия культивирования, а также свойства
готовых ферментных препаратов и возможные направления их ис-
пользования.
Краткие исторические сведения. В глубокой древности люди
хорошо знали способы приготовления хлеба, вина, пива, сыра,
различных соусов, обработки льна и т. п., хотя они и не имели
никакого представления о микроорганизмах и выделяемых ими
ферментах, которые играли в этих процессах главную роль.
В начале XIX в. русский ученый академик К. С. Киргоф впер-
вые получил жидкий ферментный препарат амилазы из пророс-
шего ячменя и описал все основные черты ферментативного про-
цесса. Немного позднее французские ученые А. Пайен и Ж. Ф. Пер-
со путем осаждения спиртом получили из проросшего ячменя по-
рошкообразный препарат амилазы. В первой половине XX в. вы-
яснением роли ферментов и микроорганизмов в спиртовом броже-
нии занимались известные ученые Ю. Либих, К. Берн, Л. Пастер.
В 1862 г. А. Я. Данилевским был предложен метод разделения
ферментов с помощью избирательной адсорбции. В конце XIX в.
Э. Бухнер, а затем наш соотечественник А. Н. Лебедев доказали,
что процесс спиртового брожения может быть осуществлен при
воздействии экстракта из дрожжей, т. е. ферментами дрожжевой
клетки. Многие ученые мира активно изучали свойства ферментов,
кинетику их действия на субстрат, обследовали микроорганизмы,
растения, животные ткани на предмет обнаружения в них фермен-
тов или проявления их действия.
Бурное развитие технической микробиологии и биохимии, ус-
пехи научных исследований и открытия в области энзимологии по-
зволили в течение нескольких десятилетий значительно усовершен-
ствовать и интенсифицировать производства, связанные с жизне-
деятельностью микроорганизмов. Появились новые виды произ-
водств — получение лимонной, уксусной, фумаровой н других ор-
ганических кислот, производство ацетона и бутилового спирта.
6
Позднее, уже в наше время, возникло производство антибиотиков,
витаминов, ферментных препаратов, различных биологически ак-
тивных веществ, аминокислот, стимуляторов роста, бактериальных
препаратов для защиты растений от вредителей и т. д.
За последнее десятилетие открыто, выделено и изучено боль-
шое количество ферментов из животных тканей, растений и полу-
ченных с помощью микроорганизмов. Новые процессы из лабора-
торий и научно-исследовательских институтов переносятся в про-
изводство. Создано специализированное производство ферментных
препаратов, в основу которого положено культивирование микро-
организмов — продуцентов ферментов с применением современ-
ных эффективных методов выделения и очистки целевых фермен-
тов от сопутствующих балластных веществ.
В нашей стране производственные установки для культивиро-
вания микроскопических грибов в виде небольших цехов при со-
коэкстрактных заводах были созданы еще в 30-х годах под руко-
водством Л. И. Чекан. Получаемые ферментные препараты исполь-
зовали для осветления соков. С 1942 г. Р. В. Фениксовой начаты
работы по научному обоснованию технологического процесса вы-
ращивания микроскопических грибов на отрубях кюветным спо-
собом и получения ферментных препаратов для осахаривания зер-
но-картофельного сырья в спиртовом производстве. Одновременно
Е. Я- Калашниковым и Д. Б. Лифшиц велись работы по получе-
нию ферментов путем поверхностного культивирования A. oryzae
и по применению ферментных препаратов для обработки повышен-
ных количеств несоложенного сырья в пивоваренном производстве.
На основе этих разработок с 1951—1952 гг. в нашей стране
начинают постоянно функционировать два цеха по выращиванию
культур микроскопических грибов на отрубях: на Серебрянопруд-
ском спиртовом заводе и на харьковском пивоваренном заводе
«Новая Бавария». В 50-х годах И. Я. Веселовым и Л. С. Салма-
новой было экспериментально показано, что при переработке в
производстве пива несоложенного материала (ячменная и куку-
рузная мука) важное значение имеют ферменты, гидролизующие
вещества стенок растительной клетки, а также и внутриклеточную
строму клеток эндосперма. Получение и успешное применение та-
ких ферментных препаратов было осуществлено позднее
Л. С. Салмановой на основе гриба Trichothecium roseum.
В 60-х годах развернулись работы по глубинному культивиро-
ванию микроорганизмов в жидких средах. Начатые В. В. Вятки-
ным, В. Б. Фремелем, В. Л. Яровенко, Б. А. Устинннковым и дру-
гими учеными работы в этом направлении продолжаются в широ-
ком масштабе и сейчас. В 1967 г. при Совете Министров СССР
организуется Главное управление микробиологической промыш-
ленности, которое в 1985 г. вошло в состав Министерства меди-
цинской и микробиологической промышленности. В 1969 г. в на-
шей стране формируется ферментное отделение в одном из отрас-
левых институтов, а затем Всесоюзный научно-исследовательский
институт прикладной энзимологии и Всесоюзный научно-исследова-
7
тельский технологический институт антибиотиков и ферментов ме-
дицинского назначения. Все это всемерно способствует развитию
ферментной промышленности СССР и увеличению объемов про-
изводства.
Прирост объема производства в мире определяется ежегодно в
10—15%.
Согласно принятой классификации и номенклатуре сейчас иден-
тифицировано около 2000 ферментов (1780 в основном списке и
около 200 в дополнительном). Промышленностью выпускается око-
ло 250 наименований ферментных препаратов, причем 99 % об-
щей суммы реализации ферментов приходится только на 18 фер-
ментов. Основными из них, судя по объемам производства, явля-
ются: бактериальные и грибные протеазы, глюкоамилазы, бакте-
риальные и грибные а-амилаза, глюкозоизомераза, пектолитиче-
ские, целлюлолитические и гемицеллюлазные ферменты, молоко-
свертывающая кислая протеиназа, р-галактозидаза, липазы н не-
которые другие. Ферментная промышленность наибольшее разви-
тие получила в США, Японии, Англии, ФРГ, Дании, Нидерландах,
Франции. За последние 20 лет рост объема производства фермент-
ных препаратов ежегодно составлял 5—15 %, т. е. с 1965 г. он уве-
личился в 2—3 раза. В нашей стране за этот период он возрос
почти в 60 раз, а количество наименований препаратов возросло
почти в 8 раз.
Наибольший удельный вес среди выпускаемых препаратов за-
нимают протеиназы, широко используемые в синтетических мою-
щих средствах (СМС), и амилазы для переработки крахмала. Этн
два вида препаратов составляют до 65 % общего объема выпуска
ферментных препаратов за рубежом. Другими крупными отрасля-
ми — потребителями ферментов являются (в %): производство
соков и вин — 10; сыроделие — 5; производство спирта — 5; хле-
бопечение — 5; пивоварение — 4 и все прочие отрасли — 6.
В нашей стране помимо использования в СМС и пищевой техно-
логии ферментные препараты широко будут внедряться в кормо-
производство при приготовлении кормов для сельскохозяйствен-
ных животных и птиц.
Особое положение в общем производстве ферментов занимают
высокоочищенные ферментные препараты. Доля их в общем объе-
ме выпускаемых препаратов мала, но технология их сложна, тре-
бует больших затрат материалов и времени. Эти препараты очень
важны для медицины, аналитических целей и научных исследова-
ний.
Анализ данных зарубежных фирм и отечественной ферментной
промышленности показывает, что производство ферментных пре-
паратов развивается высокими темпами, но все же несколько от-
стает от растущих потребностей в ферментах различных отраслей
промышленности, сельского хозяйства и медицины. Можно смело
утверждать, что в ближайшие 10—15 лет наиболее перспективны-
ми для промышленного использования будут ферментные препара-
ты, содержащие амилазы, протеиназы, глюкозоизомеразу, целлюла-
8
зы, мацерирующие ферменты, молокосвертывающую кислую про-
теиназу, Помимо традиционных областей применения возрастает
потребность в ферментных препаратах для медицины, научных ис-
следований, для очистки сточных вод и утилизации различных ви-
дов отходов. Кроме того, очевидна перспектива использования не
только отдельных ферментов, а их определенного сочетания, где
учитывалась бы вся гамма ферментов, необходимых для конкрет-
ной области применения. Эти препараты получили название муль-
тиэнзимных комплексов (МЭК).
Учитывая большой экономический эффект от применения фер-
ментных препаратов в народном хозяйстве, намечается повысить
объем выпускаемых ферментных препаратов в несколько раз, зна-
чительно расширить ассортимент и повысить качество готовых
ферментных препаратов. Сейчас отечественная промышленность
заметно отстает по объему производства ферментных препаратов
от таких стран, как США, Япония, Дания, Нидерланды. Однако
быстрые темпы ее развития вселяют уверенность в успешном прео-
долении этого отставания.
Широкие перспективы развития отечественной ферментной про-
мышленности выдвигают перед вузами страны важную задачу
подготовки высококвалифицированных инженерных кадров. Сей-
час в стране инженеров-технологов для микробиологической про-
мышленности готовят восемь вузов, среди которых уже 25 лет
(с 1962 г.) ведет подготовку специалистов Московский ордена Тру-
дового Красного Знамени технологический институт пищевой про-
мышленности. В основу предлагаемого учебника положен курс
лекций, читаемых автором с 1963 г. студентам старших курсов
этого института.
Источники получения ферментных препаратов. Ферменты при-
сущи всем живым объектам и находятся практически во всех рас-
тениях, животных и микроорганизмах. Однако процесс биосинте-
за ферментов в организме связан с обеспечением метаболизма
клеток, и количество синтезируемых ферментов строго определя-
ется жизненной потребностью орга'низма; такие объекты не мо-
гут служить источником получения ферментных препаратов. Для
этого пригодны только некоторые растительные организмы или от-
дельные органы растений и животных, способные накапливать зна-
чительное количество ферментов.
Растительное сырье. Источником ферментов может
быть пророщенное зерно различных злаков (солод). Оно может
либо использоваться непосредственно как технический фермент-
ный препарат, либо служить исходным материалом для получения
очищенных ферментных препаратов. В тропических и субтропиче-
ских странах в качестве сырья для промышленного производства
протеиназ используют латекс дынного дерева, латекс растений,
относящихся к виду фикусовых, например листья, побеги инжира,
сок зеленой массы ананаса.
Органы и ткани животных. На всех мясоперерабаты-
вающих комбинатах собирают сырье, содержащее ферменты, кон-
9
сервируют его и используют для получения ферментных препара-
тов. Таким сырьем являются поджелудочная железа, слизистые
оболочки желудкой и тонких кишок свиней, сычуги крупного ро-
гатого скота, сычужки молочных телят и ягнят, семенники поло-
возрелых животных. Поджелудочная железа содержит большое
количество разнообразных ферментов: химотрипсин, коллагеназу,
эластазу, трипсин, амилазу, липазу и др. Слизистая оболочка же-
лудков свиней и сычугов крупного рогатого скота служит источни-
ком пепсина и липазы. Из сычужков молочных телят и ягнят полу-
чают реннин (сычужный фермент). Семенники половозрелого ско-
та содержат фермент гиалуронидазу.
Микроорганизмы. В специально созданных условиях мик-
роорганизмы способны синтезировать огромное количество разно-
образных ферментов. Они неприхотливы к составу питательной
среды, легко переключаются с синтеза одного фермента на дру-
гой и имеют сравнительно короткий цикл роста (16—100 ч). Для
промышленного получения ферментных препаратов используют
как природные штаммы микроорганизмов, выделенные из естест-
венных объектов, так и мутантные штаммы. Продуцентами фер-
ментов могут быть различные микроорганизмы: бактерии, грибы,
дрожжи, актиномицеты. Микроорганизмы могут синтезировать од-
новременно целый комплекс ферментов, но есть и такие, особенно
среди мутантных штаммов, которые являются моноферментными и
образуют в больших количествах только один фермент.
Классификация и номенклатура ферментов и ферментных пре-
паратов. По современной классификации все ферменты делятся на
шесть основных классов по типу катализируемой реакции: 1) ок-
сидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изо-
меразы и 6) лигазы (синтетазы). Большинство промышленно важ-
ных ферментов, потребность в которых определяется десятками
тысяч тонн, относятся к третьему классу — гидролазам. Подавля-
ющее количество препаратов, выпускаемых различными фирмами
мира, является комплексными, содержащими помимо основного
фермента еще значительное количество сопутствующих фермен-
тов и белков. Поэтому в технологии ферментов препараты чаще
классифицируют по основному компоненту в смеси ферментов, при-
сутствующих в данном препарате: амилолитические, протеолитиче-
ские, липолитические и т. д.
В нашей стране существует определенная система названия
ферментных препаратов, в которой учитываются основной фер-
мент, источник получения и степень очистки. Наименование каж-
дого препарата включает сокращенное название основного фер-
мента, затем добавляется видовое название продуцента и закан-
чивается название препарата суффиксом «ин». Например, амило-
литические препараты, получаемые из культур Aspergillus oryzae
и Bacillus subtilis называются соответственно амил-ориз-ин (ами-
лоризин) и амил-о-субтил-ин (амилосубтилин). Далее ставится ин-
декс, в котором обозначены способ производства и степень очист-
ки фермента от балластных веществ. При глубинном способе куль-
10
тивирования после названия ставится буква Г, а при поверхност-
ном — П. Если это неочищенная культура продуцента, то далее
следует буква х. Между буквами П, Г и х может стоять цифра,
обозначающая степень чистоты препарата. Индекс 2 обозначает
жидкий неочищенный концентрат исходной культуры; 3 — сухой
ферментный препарат, полученный высушиванием распылением
неочищенного раствора фермента (экстракт из поверхностной куль-
туры или культуральной жидкости); 10 — сухие препараты, полу-
ченные осаждением ферментов органическими растворителями или
методом высаливания. Индексы 15, 18, 20 обозначают препараты,
частично освобожденные не только от балластных веществ, но и
от сопутствующих ферментов. Номенклатура препаратов с индек-
сом выше 20 не используется, так как в этих случаях речь идет
о высокоочищенных и даже гомогенных ферментных препаратах,
которые именуются в классификации ферментов.
Характеристика активности ферментных препаратов. Фермен-
ты являются веществами белковой природы, поэтому в смеси с
другими белками определить их количество невозможно. Наличие
определенного фермента в данном препарате может быть установ-
лено по результатам той реакции, которую катализирует фермент,
т. е. по количеству образовавшихся продуктов реакции или умень-
шению исходного субстрата. В количественном выражении услов-
но активность фермента определяется по начальной скорости фер-
ментативной реакции. Начальная скорость зависит от многих фак-
торов, наиболее важные из них — температура, концентрация
субстрата, pH реакционной смеси и время от начала реакции. По-
этому по предложению Комиссии по ферментам Международного
биохимического союза были приняты правила определения актив-
ностей препаратов и их выражения в единицах активности.
Стандартная единица активности. Эта величина
для любого фермента обозначает то количество его, которое ка-
тализирует превращение 1 мкмоль субстрата в 1 мин при задан-
ных регламентированных условиях. На русском и немецком язы-
ках эта единица обозначается буквой Е, на английском, француз-
ском, итальянском и испанском — U. Часто количество субстрата
нельзя выразить числом микромолей, так как точно не известна
масса молекулы, например при действии на белок, крахмал, пек-
тин, целлюлозу. В этих случаях определяют микроэквивалент за-
тронутых реакцией групп. Так, при гидролизе белка учитывают не
число прогидролизованных молекул, а число образовавшихся сво-
бодных карбоксильных или аминных групп, т. е. число расщеплен-
ных пептидных связей; при гидролизе крахмала и полисахари-
дов — число прогидролизованных глюкозидных связей и т. д.
Комиссия по ферментам рекомендовала придерживаться опре-
деленных условий при установлении активности фермента: ста-
раться вести определение при температуре 30°C и определять ак-
тивность по начальной скорости реакции, когда концентрация суб-
страта достаточна для насыщения фермента и соответствует кине-
11
тике реакции нулевого порядка. Концентрации субстрата, фермен-
та и pH выбирают оптимальными для данного фермента.
Если количество прореагировавшего субстрата очень мало или
велико, допускается выражение результатов в миллиединицах (мЕ
или мЕ) и килоединицах (кЕ и kU).
Активность ферментных препаратов. Содержание
фермента в данном препарате условно выражается в стандартных
единицах активности фермента на 1 мл ферментного раствора или
1 г препарата. Активность ферментного препарата выражается в
микромолях субстрата, прореагировавшего в присутствии 1 мл
ферментного раствора или 1 г препарата в заданных условиях за
1 мин. Число микромолей и будет равно числу стандартных еди-
ниц. Если фермент гомогенен, то его удельная активность может
быть выражена в стандартных единицах на 1 мг фермента: если
же препарат содержит балласт в виде неактивного белка, его
удельная активность выражается в стандартных единицах на 1 мг
белка в ферментном препарате. Молекулярная активность пред-
ставляет собой число миллимолей субстрата или эквивалентов
затронутой реакцией групп, прореагировавших в течение 1 мин с
1 ммоль фермента при оптимальных концентрациях субстрата, или
число стандартных единиц, содержащихся в 1 ммоль фермента.
Если фермент содержит характерную простетическую группу
или несколько каталитических центров, которые поддаются изме-
рению, его активность можно выразить в величинах активности ка-
талитического центра. Такая активность будет соответствовать мо-
лекулярной активности, если молекула фермента имеет один ак-
тивный центр; если же число каталитических центров п, то актив-
ность одного центра будет в п раз меньше молекулярной.
Активность условного препарата. В технологии
ферментов помимо общепринятых понятий об активности фермент-
ных препаратов принято пользоваться понятием активности услов-
ного ферментного препарата. Это необходимо для оценки работы
предприятия, сравнения его с другими аналогичными заводами,
т. е. для сопоставления показателей по всем видам выпускаемой
продукции. Для осуществления этого пересчета предполагают, что
предприятие выпускает товарную продукцию в виде стандартного
препарата с точно определенной активностью, измеряемой по ос-
новному ферменту в стандартных единицах в препарате на еди-
ницу массы препарата. Активность основного фермента в таком
стандартном условном препарате устанавливается нормативами
п называется активностью условного препарата.
За 1 усл. т ферментного препарата принимается 1 т препарата
со стандартной активностью. Для пересчета выработанной товар-
ной продукции в условные тонны можно пользоваться формулой
Фусл ~ ^тов-^ф/^Усл’
где Qy< л—количество условного препарата, т; QTon — количество товарного
препарата, т; Дф—фактическая активность товарного препарата, ед./г; Дусл—
активность условного препарата, ед./г.
1
глава
ОСНОВНЫЕ ТЕХНОЛОГИЧЕСКИЕ ЭТАПЫ
ПРОИЗВОДСТВА МИКРОБНЫХ
ФЕРМЕНТНЫХ ПРЕПАРАТОВ
В зависимости от источника получения ферментных препаратов
технологический процесс имеет ряд особенностей. При производ-
стве ферментных препаратов из растительного сырья и животных
тканей технология сводится к экстрагированию ферментов и очи-
стке их от сопутствующих балластных веществ. Технология мик-
робных ферментных препаратов является более сложной, так как
она включает в себя еще культивирование микроорганизмов —
продуцентов ферментов. Поэтому подробно рассмотрим производ-
ство микробных ферментных препаратов.
Данный технологический процесс можно разбить на три ста-
дии: 1) получение посевного материала; 2) получение производ-
ственной культуры микроорганизма методами поверхностного или
глубинного культивирования и 3) получение из готовой производ-
ственной культуры продуцента технических или очищенных фер-
ментных препаратов.
При изложении второй стадии — получения производственной
культуры поверхностным или глубинным методом — будут выде-
лены и отдельно рассмотрены некоторые общие для обоих мето-
дов культивирования вопросы: аэрирование, подготовка воздуха,
стерилизация и т. д.
1.1. ПОЛУЧЕНИЕ ПОСЕВНОГО МАТЕРИАЛА
Для производства посевного материала используют исходный
штамм продуцентов, получаемый из лаборатории чистых культур.
Для приготовления необходимого количества посевного мате-
риала на заводе организуется цех чистой культуры, который ведет
постадийиое выращивание посевного материала в асептических
условиях, гарантирующих развитие только продуцента и полное
отсутствие других микроорганизмов. Технология получения произ-
водственного посевного материала зависит от вида продуцента и
способа его культивирования.
Хранение исходных штаммов продуцентов. Это ответственная и
трудная задача. Особые трудности возникают в случаях, когда
исходным штаммом является мутант, так как при его длительном
хранении ие исключена возможность проявления спонтанной из-
менчивости культуры. Для предотвращения этого необходимо пе-
риодически проводить рассев культуры и проверку ее однородно-
сти как по морфологическим, так и по физиологическим призиа-
13
кам. При рассевах из колонии, дающей наилучшие показатели,
делают новый рассев в 30—40 пробирок и затем проверяют на 5—
6 пробирках способность отобранной культуры продуцировать
ферменты.
Ни один из многочисленных способов хранения живых культур
микроорганизмов не дает полной гарантии стабильности штамма
и сохранения его продуктивности. Наиболее распространенным спо-
собом поддержания исходной культуры продуцента является вы-
сев микроорганизмов в пробирки на скошенные агарнзированные
среды с оптимальным для каждого штамма составом и выращива-
ние его до определенного возраста в оптимальных условиях.
Готовую культуру в пробирках помещают в холодильник и хра-
нят при температуре 3—4 °C. Пересевы культур проводят через
определенные промежутки времени с таким расчетом, чтобы наи-
лучшим образом сохранить физиолого-биохимические свойства
штамма. При пересевах следует переносить только споры или не-
большие кусочки мицелия без питательной среды, чтобы в све-
жую питательную среду не вносить продукты метаболизма. Для
длительного хранения некоторых штаммов целесообразно исполь-
зовать бедные сахарами крахмальные среды.
Более длительное время можно хранить культуру под слоем
вазелинового масла. Для этого целесообразно использовать вазе-
линовое масло медицинского назначения. Оно не должно содер-
жать токсинов и окисленных продуктов. Слой масла должен быть
только на 1 см выше агарового среза, иначе возможна гибель
культуры из-за недостатка кислорода. Предварительно масло сте-
рилизуют при 0,15 МПа в течение 1,5 ч. Культуру заливают сте-
рильным маслом после того, как она достигнет полной физиоло-
гической зрелости. Для этого способа хранения нанлучшей средой
считается картофельно-мальтозный агар.
Известны способы хранения культур при температурах от —11
до —14 °C. В этих условиях многие культуры полностью сохраня-
ют активность в течение 10—16 мес.
Грибные культуры успешно хранят в замороженном состоянии
в атмосфере жидкого азота при температурах от —165 до —196 °C.
Микроскопические грибы замораживают в 10%-ном водном рас-
творе глицерина в запаянных ампулах. Ампулы с замороженны-
ми культурами помещают в контейнер с жидким азотом, где их
хранят 5 и более лет.
Перспективным следует признать способ хранения культур в
лиофилизированном состоянии. Культуру микроорганизма вносят
в защитную среду, в качестве которой можно использовать саха-
рожелатиновую среду и др., помещают в стерильные ампулы, за-
крывают стерильными ватными тампонами и быстро заморажи-
вают при температурах от —35 до —78°C. Затем ампулы перено-
сят в вакуум-сушильный аппарат и высушивают при остаточном
давлении 13,33—1,33 Па в течение 25—30 ч. Лиофильно высушен-
ные культуры могут сохраняться до 5—6 лет, не теряя способно-
сти продуцировать ферменты.
14
Исходный штамм может храниться на зерне или в почве. Для
этого почву стерилизуют и вносят в нее культуру продуцента.
Штамм в таких условиях может храниться долго. При возобнов-
лении культуры смыв с почвы высевают на чашки Петри. Если
продуцент хранят на пшене, то для этого пшено, очищенное от
примесей, кипятят в минимальном количестве воды (0,8 л на 1 кг
пшена), распаривают 30 мин, затем разбирают и удаляют обра-
зовавшиеся комки, а остывшее пшено по 15—16 г засыпают в сте-
рильные флаконы вместимостью 250 мл, которые затем стерили-
зуют при 0,1 МПа в течение 40 мин. На стерильное распаренное
пшено засевают 2 мл густой взвеси конидий или 3 мл двухсуточ-
ного вегетативного мицелия, выращенного в колбах на качалках.
Культуру продуцента выращивают при периодическом встряхива-
нии при температуре 25—30 °C- Выросшую культуру высушивают
до влажности 7—8% в вакууме при 25 °C в течение 60—70 ч и в
таком виде хранят от 1 до 3—5 лет.
Подготовка посевного материала для поверхностного культи-
вирования. Этот способ применяют в основном для культивирова-
ния микроскопических грибов. Посевной материал в этом случае
может быть приготовлен двух видов: в виде культуры, выращен-
ной на твердой питательной среде, и мицелиальной массы проду-
цента, выращенной на жидкой среде глубинным способом. Неза-
висимо от вида посевного материала последовательность опера-
ций одинаковая: 1) приготовление питательной среды; 2) стери-
лизация питательной среды и аппаратуры; 3) охлаждение среды
с соблюдением правил асептики до температуры роста культуры;
4) засев среды исходным штаммом продуцента; 5) выращивание
культуры продуцента до определенного возраста; 6) консервирова-
ние посевного материала.
Приготовление питательной среды сводится к точному дозиро-
ванию отдельных компонентов среды и их смешиванию в опреде-
ленной последовательности. Этот процесс можно вести в специаль-
ной емкости — смесителе или же в аппарате, предназначенном
для стерилизации. Условия стерилизации зависят от состава сре-
ды и ее состояния. Всю аппаратуру и коммуникации стерилизуют
острым паром при избыточном давлении 0,15—0,35 МПа. Охлаж-
дать среду можно стерильным холодным воздухом или холодной
водой через глухие поверхности теплообмена. Засев среды ведут
водной суспензией продуцента с соблюдением правил асептики.
Выращивание проводится в специальном цехе. Готовый посев-
ной материал консервируют либо высушиванием, либо хранением
при низких температурах. Сроки хранения устанавливаются для
каждого продуцента экспериментально.
Посевную культуру на твердой питательной среде готовят, вы-
ращивая микроорганизмы в возрастающем количестве в три или
четыре этапа. Состав питательной среды определяется свойства-
ми микроорганизма — продуцента фермента. Чаще всего для этой
цели используют увлажненные пшеничные отруби. Иногда к среде
добавляют солодовые ростки, древесные опилки, свекловичный
15
Очищенный воздух
жом. В зависимости от продуцента влажность среды после стери-
лизации составляет 45—56 %.
Исходную музейную культуру продуцента на твердой агарнзн-
рованной среде пересевают для обновления сначала на 1 —1,5 г
увлажненных стерильных отрубей в пробирку (рис. 1.1). Пробир-
ку помещают в термостат и выращивают культуру при оптималь-
ной температуре до обильного коиидиеобразования. Содержимое
пробирки переносят в 3—4 колбы вместимостью 0,75—1 л, содер-
жащие 40—100 г рыхлой влажной стерильной среды, и выращи-
вают продуцент при тех же условиях.
Подготовленный в колбах в достаточном количестве посевной
материал используют для засева питательной среды, которую
предварительно стерилизуют в биксах при 0,15 МПа в течение
60 мин. Засеянная среда размещается на стерильных кюветах.
Обычно посевные кюветы имеют прямоугольную форму, выполня-
ются из оцинкованного неперфорированного железа и снабжены
крышками, которые имеют одно или два отверстия, закрывающие-
ся ватно-марлевыми салфетками. Трех колб посевной культуры до-
статочно для засева 20—25 кювет. Засеянную среду раскладывают
в посевные кюветы слоем 0,8—1,2 см; между кюветой и крышкой
прокладывают слой непроклеенной бумаги для предотвращения
возможной конденсации влаги на крышке и создания зон излиш-
него увлажнения растущей культуры. Закрытые кюветы со сре-
дой помещают в специальные растильные камеры для посевной
культуры на стационарные стеллажи нлн этажерки. В камере под-
держивают определенный влажностный и температурный режим,
оптимальный для выращиваемого штамма и обеспечивающий
обильное коннднеобразование. Камеры заполняют кюветами из
расчета не более 1—2 кг засеянной среды (по сухой массе) на
1 м3 пространства камеры, воздухообмен в такой камере должен
быть 2—3 м3/(м3-ч).
Готовый посевной материал снимают с кювет при помощи руч-
ного манипулятора и во влажном состоянии помещают в стериль-
ные пакеты, которые помещают на хранение в камеру с температу-
рой не выше 4 °C до окончания его микробиологической и биохи-
мической проверки. Длительность хранения посевного материала
не должна превышать 5—6 дней, так как влажная культура даже
при низкой температуре постепенно становится малопригодной
для получения активной производственной культуры. Приготовлен-
ная вышеописанным способом посевная культура должна содер-
жать не менее 0,7 млрд, спор в 1 г. Всхожесть спор должна быть
86—90 %. Посевной материал не должен содержать посторонней
микрофлоры.
Если посевной материал удовлетворяет всем требованиям, его
передают из холодного помещения в отделение приготовления по-
севной суспензии. Посевной материал смешивают в специальном
сосуде со стерильной водой и небольшим количеством поверхно-
стно-активного вещества для повышения смачиваемости спор. Та-
кая суспензия и является готовым посевным материалом.
17
Рис. 1.2. Технологическая схема получения мицелиальной массы продуцента:
1 — исходная культура продуцента в пробирках; 2—<культура в колбе на твердой сусло-
ростковой среде; 3 — культура на отрубях в колбе; 4 — емкость для получения глубин-
ной культуры; 5 — качалка; 6 — холодная комната; 7—ннокулятор; 8— фильтры для очи-
стки воздуха
Использование мицелиальной массы микроскопических грибов
в качестве посевного материала при глубинном методе культиви-
рования известно давно, однако применение его в качестве посев-
ного материала при поверхностном способе культивирования ста-
ло распространяться только в последние 10—12 лет. Принципиаль-
ная технологическая схема получения посевного материала глу-
бинным способом в виде мицелиальной массы показана на рис. 1.2.
Исходная культура продуцента из пробирки пересевается в кол-
бу вместимостью 0,5—0,75 л с 25—40 мл агарнзированной среды,
культура равномерным тонким слоем распределяется по внутрен-
ней поверхности колбы вращательным движением. Культивирова-
ние продуцента ведут поверхностным способом до обильного ко-
нидиеобразовання.
Из колбы конидии продуцента вместе с мицелием, не нарушая
целостности агарнзированной среды, смывают 100—150 мл сте-
рильной воды и засевают ею 15—20 колб вместимостью 0,5—
18
0,75 л с увлажненными отрубями, на которых ведется выращива-
ние до обильного коннднеобразовання. Одна колба с культурой на
отрубях используется для приготовления посевной суспензии и за-
сева двух сосудов вместимостью 8—10 л (коэффициент заполне-
ния 0,3—0,4). В качестве основной питательной среды чаще всего
используется сусло-ростковая среда, которая состоит из 3 частей
сладкого солодового сусла с концентрацией сухого вещества 8 %
и 1 части вытяжки из солодовых ростков, полученной при настаи-
вании ростков в 5 частях воды при 18—20 °C в течение 1 ч. Сосу-
ды с жидкой питательной средой помещают на круговую качалку
с частотой вращения 200—220 мин-1. Температура и длительность
культивирования выбираются оптимальные для данного проду-
цента.
Этот способ удобен только при небольшой производительно-
сти завода или цеха — до 3—6 т готовой культуры в сутки. При
большей производительности предприятия целесообразно получать
посевной материал в виде мицелиальных масс не на качалках,
а в небольших ферментаторах (ннокуляторах). Готовым посевным
материалом обычно служит молодая, активно растущая культура,
находящаяся в экспоненциальной фазе развития. Такой способ по-
зволяет в 2,5—3 раза сократить длительность приготовления по-
севного материала, значительно (в 4—5 раз) уменьшить необхо-
димую площадь цеха чистой культуры, улучшить условия труда,
а главное — снизить конидиеобразоваине в готовой производствен-
ной культуре при ее поверхностном выращивании.
Подготовка посевного материала для глубинного культивиро-
вания. Для засева производственной среды при глубинном способе
культивирования посевной материал готовят также глубинным
способом. Вид посевного материала зависит от продуцента: для
грибов и актиномицетов — это мицелиальная масса, а для бакте-
рий — молодая спороносящая культура.
Этапы получения посевной культуры следующие: 1) обновле-
ние исходной культуры на агарнзированной среде; 2) выращива-
ние культуры на жидкой среде в колбах на качалке; 3) культиви-
рование продуцента в малом, а затем, если требуется, в большом
инокуляторе. Посевная доза прн засеве глубинной культурой срав-
нительно большая — от 1 до 15 %, поэтому число стадий и объем
инокуляторов определяются только производительностью пред-
приятия и оптимальной нормой расхода посевного материала для
данного продуцента.
Технологическая схема приготовления посевного материала для
глубинного культивирования приведена на рис. 1.3. Исходный про-
дуцент из пробирки 1 пересевают на матрацы 2 с большим коли-
чеством агарнзированной среды. С матрацев культуру смывают
стерильной водой и в виде суспензии используют для засева
колб <3. Чаще засев ведут сразу из пробирки в колбы. Колбы за-
крепляют на качалке 4, которая встряхивает жидкость в колбах и
способствует растворению кислорода в среде, что обеспечивает
нормальные условия жизнедеятельности микроорганизмов. Гото-
19
Рис. 1.3. Технологическая схема получения глубинного посевного
материала
вую культуру из колб собирают в одну емкость при соблюдении
правил асептики н переносят в малый инокулятор 5 со стерильной
охлажденной средой. Засев ведут в пламени горящего факела че-
рез посевной патрубок инокулятора. В малый инокулятор через
индивидуальный фильтр 6 подается стерильный воздух. Подго-
товку, стерилизацию и охлаждение питательной среды производят
в малом инокуляторе. Пеногаситель стерилизуют и охлаждают в
специальной емкости и подают в малый инокулятор по мере на-
добности.
Для большого инокулятора 7 среду готовят, как правило,
в специальных аппаратах и подают ее в стерильный, охлажден-
ный до 60—70 °C инокулятор. Готовую культуру из малого ино-
кулятора передавливают стерильным воздухом в большой ино-
кулятор на свежую питательную среду.
Культивирование на всех стадиях ведется при оптимальной
температуре и аэрировании. Обычно готовый посевной материал
сразу же передают в производство. Если же возникают непред-
виденные задержки, то посевной материал непосредственно в ино-
20
куляторе охлаждают до 8—10 °C, но хранят не более 3—4 ч, ина-
че его качество может резко ухудшиться. Посевной материал, по-
лученный любым способом, подвергается микробиологическому и
биохимическому контролю.
Посевной материал считается активным, если он обеспечивает
нормальную длительность культивирования на производственной
среде и достижение максимального накопления ферментов за этот
срок. Он не должен содержать посторонней микрофлоры.
Дозировка и возраст посевного материала. Этот фактор ока-
зывает существенное влияние на ход культивирования и биосин-
тез ферментов. Внесение большого количества посевного материа-
ла может, с одной стороны, ускорить рост культуры, но, с другой
стороны, в результате более обильного спорообразования при по-
верхностном способе культивирования увеличиваются потери на
дыхание. Заниженные дозы посевного материала приводят к рез-
кому замедлению процесса культивирования.
В связи с этим для каждого производственного штамма уста-
навливается оптимальная дозировка посевного материала. Для
обеспечения нормального развития микроскопических грибов при
поверхностном способе культивирования в условиях стерильной
среды и обеспложенного воздуха достаточно внести 0,02—0,05 %
посевной спороносящей культуры с титром 10® спор на 1 г. В за-
водских условиях, где часто невозможно добиться полной стериль-
ности производственных сред, посевной материал вносят из рас-
чета 0,2—1,0 % к массе перерабатываемого сырья.
При использовании мицелиального посевного материала его
расход равен 1,5—2,5%. Использование глубинного посевного ма-
териала несколько затягивает процесс роста производственной по-
верхностной культуры, но он более перспективен, так как облегча-
ет труд работающих, упрощает процесс получения стандартной
посевной культуры и позволяет сократить площади посевных це-
хов. Дозировка глубинной посевной культуры зависит от вида ис-
пользуемых микроорганизмов. Если это споровая культура, то
расход посевного материала зависит от титра посевного материа-
ла: обычно он составляет от 0,2 до 1,0%; для микроскопических
грибов родов Aspergillus, Trichoderma, Endomycopsis он состав-
ляет 1,0—2,5%. Для продуцентов с ослабленной вегетацией и ак-
тиномицетов посевная доза возрастает до 5—6%, а в некоторых
случаях — до 15—20 %.
Возраст глубинной посевной культуры соответствует логариф-
мической фазе роста; обычно это интенсивно растущая культура
в возрасте 18—24 ч. Оптимальный возраст устанавливается экс-
периментально для каждой культуры.
1.2. ПОЛУЧЕНИЕ ПРОИЗВОДСТВЕННЫХ КУЛЬТУР
Производственную культуру продуцента можно получить, выра-
щивая микроорганизмы как на поверхности твердых или жидких
сред, так и в глубине жидкой питательной среды. Способ культи-
21
вироваиия микроорганизма определяет и технологическую схему
производства.
К основным факторам, влияющим на быстрый рост микроорга-
низмов и максимальный биосинтез ими ферментов, относятся: со-
став питательных сред, условия приготовления и стерилизация
сред, количество и способ подвода воздуха к растущей культуре,
правильный выбор условий выращивания продуцента и контроля
за этим процессом.
Питательные среды для культивирования микроорганизмов.
Основным требованием, предъявляемым к составу питательной
среды, является ее полноценность для роста продуцента и обеспе-
чения синтеза целевого продукта. Микроорганизмам нужны сое-
динения, содержащие углерод, азотистые вещества, водород, кис-
лород. В состав среды должны входить такие минеральные ве-
щества, как магний, кальций, фосфор, сера, железо, калий и не-
которые другие. Состав среды для того или иного микроорганизма
различен, однако все продуценты ферментов усваивают углерод
преимущественно в виде органических соединений, водород —
в виде воды и в составе органических соединений, кислород — из
основного состава среды и в молекулярном виде. Питательные ве-
щества среды расходуются микроорганизмами не только на по-
строение растущей клетки, но и на обеспечение энергией основных
жизненных процессов.
Микроорганизмы очень чувствительны к составу среды, на ко-
торой растут, причем одни соединения они потребляют интенсив-
но, а другие остаются почти неиспользованными. Следует помнить,
что не всегда интенсивный рост микроорганизма способствует мак-
симальному накоплению ферментов.
Так как подавляющее большинство продуцентов ферментов яв-
ляется аэробами, почти все углеводы потребляются ими путем
окисления и основными продуктами метаболизма являются диок-
сид углерода и вода. Накапливающиеся в процессе роста культу-
ры промежуточные продукты окисления, такие, как кетокислоты,
ди- и трикарбоновые кислоты, альдегиды, служат по мере потреб-
ления углеводов основным источником углерода в среде. Если со-
став среды подобран верно и процесс ведется правильно, то избы-
точного накопления промежуточных продуктов не происходит. Хо-
рошим источником углерода в среде могут быть жиры и масла.
Это следует помнить при использовании жировых пеногасителей.
Потреблению жиров предшествует их расщепление на глицерин н
жйриые кислоты. Жирные кислоты при интенсивной аэрации сре-
ды окисляются микроорганизмами по типу р-окислеиия, при кото-
ром от молекулы кислоты отделяются двухуглеродные фрагменты
и образуются кислоты с более короткой , углеродной цепью.
В дальнейшем происходит окисление до диоксида углерода и во-
ды, ио в процессе культивирования, пока в среде есть жир, наблю-
дается образование жирных кислот, и среда заметно подкисляет-
ся. Микроорганизмы потребляют также органические кислоты и
спирты.
22
Источником азота для микроорганизмов — продуцентов фер-
ментов могут быть сложные органические вещества, их гидроли-
заты и минеральные соли. Богаты азотными веществами кукуруз-
ный экстракт, соевая и пшеничная мука, гидролизат казеина и
т. д. Минеральный азот в среде обычно представлен аммонийны-
ми солями и нитратами. Органические соединения и аммонийные
соли содержат азот в восстановленной форме, поэтому он легко и
быстро потребляется. Азот же нитратов должен быть сначала вос-
становлен и потом уже усвоен микроорганизмами. Этим объясня-
ется большая скорость потребления аммонийного азота, чем нитрат-
ного, при их совместном присутствии в составе среды. Введение
аммонийных солей приводит к подкислению среды, так как в рас-
творе остается анион кислоты; при введении нитратов среда под-
щелачивается за счет остающегося в растворе катиона соли. Для
каждого продуцента источник азота следует подбирать индивиду-
ально с учетом условий синтеза им ферментов.
Большое влияние на синтез ферментов оказывает присутствие
в среде минеральных элементов, которые необходимы микроорга-
низму в макро- и микроколичествах. Для микроорганизмов необ-
ходимы фосфор и сера, входящие в состав важнейших веществ
клеток — нуклеотидов, белков, липидов, витаминов. Фосфор уча-
ствует во многих реакциях обмена веществ в клетке. Такие эле-
менты, как железо, цинк, медь, кобальт и некоторые другие, тре-
буются для синтеза ряда ферментов и белков в ничтожно малых
количествах. Повышенное содержание микроэлементов часто при-
водит к торможению нормального роста и жизненных процессов
клетки. Большая часть микроэлементов вносится в среду с водой
и органическими добавками — с мукой, кукурузным экстрактом,
жмыхом и т. д. Макроколичества минеральных элементов могут
быть введены в состав среды в виде минеральных солей, но при
этом надо учитывать, что все они содержатся в естественных про-
дуктах, входящих в состав сред.
Очень часто при составлении рецептуры в среды вносят мел,
роль которого сводится к связыванию образующихся кислот и
регулированию кислотности среды. Кроме того, он может служить
дополнительным источником микроэлементов, которые обычно
присутствуют в ием в значительных количествах.
Оптимальный состав среды для каждого продуцента
может быть определен двумя способами: методом эмпирического
подбора и с использованием математических методов планирова-
ния экспериментов. Первый способ был до недавнего времени ши-
роко распространен во всех отраслях промышленности, использу-
ющих микроорганизмы. Знание физиологических особенностей
микроорганизмов позволяло биологам методом подбора и измене-
ния какого-либо из факторов на неизменном фоне остальных ком-
понентов подобрать хорошую и продуктивную питательную среду,
ио такой способ очень длителен. Более прогрессивным в биологи-
ческих исследованиях является использование математических ме-
тодов планирования экспериментов, которые позволяют значитель-
23
но быстрее найти и обосновать оптимальный состав питательной
среды.
Большинство математических методов планирования экспери-
ментов (ПФЭ2'1, ДФЭ2'1~П . ротатабельное планирование и
т. д.) имеет целью получение математической модели процесса.
Обработка экспериментальных данных ведется в четкой последо-
вательности вычислительных операций и может быть выполнена
вручную. Статистический анализ значимости коэффициентов полу-
ченного уравнения и его адекватности исследуемому процессу в
изучаемом диапазоне изменения параметров процесса позволяет с
достаточной уверенностью находить оптимальный состав среды и
оптимальные условия культивирования по полученной математиче-
ской модели процесса.
Среды в зависимости от состава делятся на синтетические и
комплексные. Синтетическими считают среды, состоящие из вполне
определенных по количественному составу индивидуальных ве-
ществ. Источниками углерода в таких средах могут быть углево-
ды, спирты, органические кислоты; источниками азота — соли, со-
держащие азот, аминокислоты, пептиды определенного состава,
мочевина и т. д.
В комплексные среды обычно входят различные естественные
продукты, богатые органическими соединениями, и отходы ряда
производств. Комплексные среды значительно дешевле, более до-
ступны и потому чаще используются в промышленности. Их ком-
понентами могут быть отруби, мука различных злаков, меласса,
гидрол, кукурузный экстракт, выжимки плодов и овощей, различ-
ные жмыхи, замочные воды, барда спиртовых заводов, картофель-
ная мезга и прочие отходы картофеле- и кукурузокрахмального
производства, а также, других пищевых производств.
Так, для поверхностного культивирования, используют пше-
ничные отруби; они должны быть крупнолопастными, без
горького или кисловатого привкуса. Отруби содержат от 16 до
20% крахмала, 10—12% белка, в том числе важнейшие амино-
кислоты (в %): метионин — 0,19; цистин — 0,30; аргинин — 1,0;
лизин — 0,60; триптофан — 0,30; жир — 3,0—4,0; клетчатка — 10—
30; зольные элементы (Na — 0,09, К — 1,00, Са — 0,16, Р — 0,94);
микроэлементы и некоторые другие вещества. Пшеничные отру-
би — сырье дорогостоящее, поэтому их можно частично за-
менять другими компонентами. Вводимый дополнительный компо-
нент может играть роль рыхлителя среды или же обогащать ее
недостающими ростовыми и питательными веществами. Такими
компонентами являются солодовые ростки, шелуха крупяных
культур, свекловичный жом, древесные опилки, выжимки плодов,
овощей и ягод.
При обработке кукурузного зерна в крахмало-паточном произ-
водстве в замочные воды переходит до 8% сухого вещества.
Кукурузный экстракт — это замочные воды, упаренные в двух-
трехкКфпусных вакуум-выпарных аппаратах до содержания сухо-
го вещества 48—50 %. Он не имеет постоянного состава, что яв-
24
ляется его недостатком. Кукурузный экстракт содержит большое
количество меланоидинов и поэтому имеет темно-коричневый
цвет. Он стабилен при хранении и широко применяется в фермент-
ной промышленности.
Кукурузный экстракт является источником азотистых веществ,
которые составляют 40—50 % общего содержания сухого вещест-
ва в экстракте. Углеводы являются нестабильным компонентом
экстракта и могут под действием молочнокислых бактерий полно-
стью превращаться в молочную кислоту, содержание которой при
этом возрастает до 25%. В экстракте в больших количествах со-
держатся фосфор, калий и магний. Содержание зольных элементов
составляет 15—20 % сухого вещества экстракта, а содержание
фосфора может достигать 5%. Экстракт содержит все необходи-
мые для микроорганизмов микроэлементы, витамины группы В,
ростовые вещества и биостимуляторы.
Крахмал картофельный и кукурузный выпускается четырех
сортов (высший, I, II и III). Основное сортовое отличие крахма-
лов заключается в содержании зольных элементов, которое повы-
шается от высшего сорта к III с 0,35 до 1,20%. Повышается так-
же кислотность на сухое вещество (в мл 0,1 н. раствора НС1) с
18 до 30, увеличивается число разрушенных крахмальных зерен.
Кукурузный крахмал в своем составе имеет (в %): крахмал —•
98,5—98,8; белок — 0,60—0,35; жир — 0,62—0,70; зола — 0,17—
0,12; растворимые вещества — 0,01—0,05; прочие сухие вещест-
ва — 0,10—0,13.
Гид рол является отходом производства глюкозы из крахма-
ла. Он представляет собой густой темный сироп, содержащий от
67 до 72 % редуцирующих сахаров. Гидрол не стандартен по со-
ставу. Основным сахаром гидрола является глюкоза, содержание
которой достигает до 80 % общей суммы редуцирующих сахаров.
Гидрол содержит некоторое количество органических кислот,
pH гидрола около 4,0, зольность около 7%. В минеральный со-
став гидрола входят фосфор, магний, натрий, железо. Использу-
ются и другие отходы переработки кукурузы, примерный химиче-
ский состав различных компонентов кукурузы приведен в табл. 1.1
(в % сухого вещества).
Соевая мука выпускается трех видов; необезжиренная, по-
луобезжиренная и обезжиренная. Соевая мука является богатым
источником азотистых веществ, особенно белков. В ней содержит-
ся около 25 % углеводов; крахмала и глюкозы почти нет (0,5—
1,0 %), но есть сахароза (5—10 %), пентозаны, мальтоза, раффино-
за, гемицеллюлозы, декстрины. Минеральный состав соевой муки
богат и разнообразен, зольные элементы составляют 4,5—6,5%.
В их число входят калий, магний, кальций, натрий, железо, крем-
ний, сера, хлор, медь, марганец, цинк, никель, фосфор. В соевой
муке содержатся витамины группы В, D'h А. Состав кукуруз-
ной муки зависит от сорта перерабатываемой кукурузы. Куку-
рузная мука содержит 67—70 % крахмала и около 10 % других уг-
леводов (сахара, клетчатка, пентозаны и т. д.). Белка в кукуруз-
25
Таблица 1.1
Компоненты Стержень початка Сечка Пелева Меэга Глютен Зародыш Жмых
крупная мелкая
Крахмал До 0,5 70—75 10—14 6—12 25-45 15—45 8—12 16—23
Растворимые угле- До 2,0 0,7—1,5 2,5 3,5 4—7 0,5— ' 2—3 5—10
воды Пентозаны 31—35 4,6—6,5 8—12 2,0 6—8 10—16
Клетчатка 57—60 15—25 25-35 40—55 15—25 2—4 15—18 15—22
Белок (NX6.25) 2,0—2,5 10—13 12—15 6—12 11—18 40—70 12—13 24—30
Жир 0,2—0,5 0,5—1,0 8—12 4—7 2—4 5—8 53—57 7—12
Зола 1,7—2,3 2—5 1,5— 0,5— 0,8— 0,8— 0,7— 1,5-
Прочие вещества 2,3—3,5 2-3 8,0 8—12 1,0 3,6 1,5 2,5 1,5 4,6 1,2 2,3 2,5 2-4
ной муке сравнительно мало — 10—12 %, зольные элементы со-
ставляют только 0,3—1,0 %, а жир — около 4 %.
Солодовые ростки получаются в процессе обработки от-
сушенного солода в пивоварении. Они содержат значительное ко-
личество свободных аминокислот, азотистых веществ (до 24%),
зольных элементов (около 8%), клетчатки (14%), экстрактивные
безазотистые вещества составляют 42 %. В их состав может вхо-
дить также до 5—6 % зерновых примесей, представляющих собой
обломки зерен солода. Солодовые росткн можно вносить в среды
непосредственно или в виде их экстрактов.
Пивная дробина является отходом пивоварения. Ее вы-
ход составляет 22 % сухой массы сырья, поступающего в варочное
отделение. Она может использоваться непосредственно во влаж-
ном состоянии (влажность 83%), если производство ферментных
препаратов организовано при пивоваренном заводе, или же в су-
хом виде. Дробина имеет желтовато-коричневый цвет, приятный
свежий запах. Она содержит значительное количество белковых
веществ (26—27%), жир (7—8%), клетчатку (17—18%), золь-
ные элементы (4—5%), безазотистые экстрактивные вещества
(около 44 %).
Другой отход пивоварения — осадочные пивные дрож-
ж и. Их выход при влажности 85 % составляет 1,5—2 л на 10 дал
пива. Отвар дрожжей или их автолизат может служить прекрас-
ным обогатителем питательных сред, источником биологически ак-
тивных и легкоусвояемых веществ. Пивные дрожжи богаты белко-
выми веществами (45—55 %) и углеводами (30—40 %)д оин со-
держат значительное количество минеральных солей (зольность
7—9%). При использовании пивных дрожжей как компонента
сред для ферментной промышленности требуется их обязательная
очистка от хмелевых горьких веществ.
В качестве сырья также можно использовать биомассу
других микроорганизмов, например плазмолизироваииые
26
кормовые дрожжи, пропионовые бактерии (отход производства
витамина В12), экстракты из мицелиальных масс и т. д. Состав
этих компонентов довольно близок, но различается содержанием
и набором ростовых веществ и стимуляторов. Наметилась тенден-
ция использовать гидролизаты биомасс микроорганизмов, которые
получают различными способами.
Для приготовления питательных сред можно использовать от-
ход спиртового производства — фильтрат барды. Для этого
фильтрат обогащают мукой или заторной массой и добавляют
мел для нейтрализации излишней кислотности; фильтрат барды
является нестандартным продуктом.
Для приготовления питательных сред может использоваться
измельченный картофель или его отвар. Картофель со-
держит большое количество влаги (до 75 %), а основная часть су-
хого вещества приходится на крахмал. В зависимости от года,
сорта и условий выращивания картофеля содержание крахмала
может быть от 8 до 27%, в среднем 18—19%. В картофеле азо-
тистых веществ сравнительно мало, не более 2 %, клетчатки со-
держится 1 —1,5%; зольные элементы составляют 0,8—1 % (К, Na,
Mg, Са, Fe, Si и др.) В малых количествах найдены микроэлемен-
ты — марганец, медь, кобальт, никель, иод и т. д. Картофель со-
держит витамины С, А и целый ряд других веществ в сумме 2,2—
2,5%.
Свекловичный жом представляет собой измельченную
сахарную свеклу после извлечения из нее сахарозы и некоторых
других веществ на диффузионных установках сахарных заводов.
Состав жома многокомпонентен, основную его массу составляют
безазотистые экстрактивные вещества (66%), в которые входят
пектиновые вещества, гемицеллюлозы. В жоме содержится белок
(около 8%), клетчатка (22%), зольные элементы (4%).
К числу редко используемых компонентов питательных сред
можно отнести казеин и его гидролизат, рыбную му-
ку, рисовые отруби, картофельную мезгу, вы-
жимки плодов, ягод и овощей и т. д.
Для пеногашения используют жиры и масла, которые
также могут быть источником питания для микроорганизмов. Ча-
ще всего используют животные жиры, олеиновую кислоту, под-
солнечное, соевое, хлопковое, кукурузное масла. Из всех перечис-
ленных пеногасителей рациональнее всего вводить при выращива-
нии олеиновую кислоту, так как остальные масла имеют пищевую
ценность и используются в пищевой промышленности. Постепенно
они заменяются синтетическими пеногасителями.
Влияние состава среды на биосинтез ферментов. При выборе
питательной среды для культивирования микроорганизмов в ста-
ционарных условиях необходимо учитывать не только качествен-
ный состав среды, но и количественное соотношение ее компонен-
тов. Чрезмерное увеличение концентрации в среде хотя бы одного
нз них приводит к увеличению осмотического давления и наруше-
нию обмена веществ клетки и, как следствие, к угнетению биосин-
27
тетической способности клетки и замедлению ее развития и роста.
С другой стороны, при выборе среды для конкретного микроорга-
низма следует помнить, что в ряде случаев компоненты среды, тор-
мозящие накопление биомассы, могут способствовать активному
синтезу клеткой некоторых ферментов. Накоплен большой экспе-
риментальный материал о влиянии специфического субстрата, его
аналогов и продуктов жизнедеятельности микроорганизмов на ре-
гуляцию биосинтеза ферментов.
Согласно теории Ф. Жакоба и Ж. Моно индукторы и вещества, вызываю-
щие репрессию (репрессоры), в конечном счете действуют на определенный
участок молекулы ДНК, в котором заключена наследственная информация о
синтезе данного фермента. Стимулятором биосинтеза большинства гидролити-
ческих ферментов чаще всего является субстрат, на который действует данный
фермент, а также продукты его частичного гидролиза или некоторые аналоги
этих субстратов. Накопление в среде продуктов ферментативной реакции по-
давляет синтез соответствующего фермента, так как накапливается репрессор,
тормозящий процесс биосинтеза согласно механизму обратной связи. На мо-
лекулярном уровне синтез фермента зависит от информации, поступающей на
рибосомы клетки посредством матричной РНК, которая является точной ко-
пией полииуклеотидной цепочки ДНК-
Система генетического контроля синтеза ферментов состоит из гена-регуля-
тора, репрессора, образующегося под влиянием гена-регулятора, и оперона.
В оперон входят геи-оператор и набор структурных генов, кодирующих синтез
определенных ферментов. Ген-регулятор управляет синтезом репрессора, который
связывается с соответствующим веществом, играющим роль регулирующего
сигнала. По сигналу репрессор либо активируется, либо инактивируется. В ак-
тивном состоянии репрессор блокирует ген-оператор, что приводит к «выклю-
чению» соответствующего структурного гена. При инактивации репрессоров,
блокирующих операторы, последние, освободившись от воздействия репрессора,
«включают» структурный ген, от которого зависит синтез соответствующей
матричной РНК и затем фермента.
Таким образом, репрессию и индукцию синтеза ферментов следует рас-
сматривать как противоположные стороны единого биохимического процесса и
как адаптивные процессы, обеспечивающие выживание микроорганизма. Осно-
вываясь на этой особенности микроорганизмов, можно направлять синтез не-
обходимых ферментов путем подбора качественного и количественного состава
питательной среды.
Индуктором биосинтеза а-амилазы, по утверждению многих авторов, яв-
ляется крахмал, пектиназ — пектиновые вещества, гемицеллюлаз — гемицеллю-
лозы, (З-галактозидазы — лактоза и т. д. Однако индуктор биосинтеза ферментов
согласно современным представлениям должен непосредственно участвовать в
процессе синтеза белка, осуществляемого внутри клетки, т. е. должен обладать
способностью проникать через клеточные мембраны.
Индуцибельиый синтез большинства промышленно важных гидролитических
ферментов очевиден. Так, показано, что истинным индуктором биосинтеза а-
амнлазы является не сам крахмал, а продукты его частичного гидролиза —
эритродекстрины. Появление этих продуктов в среде связано с присутствием
в клетке незначительных, базальных количеств амилазы, которые вырабаты-
ваются в клетке конститутивно.
Поэтому введение в состав среды крахмала или продуктов его деполимери-
зации приводит к индуцированию синтеза амилолитических ферментов. По-
видимому, то же самое можно сказать по поводу индукции соответствующих
ферментов в присутствии пектина, гемицеллюлозы, целлюлозы и т. д.
Особенности состава сред для поверхностного способа культи-
вирования. При поверхностном культивировании на твердой среде
основой почти всех сред являются пшеничные отруби. Среда мо-
жет быть обогащена некоторыми рыхлителями.
28
В качестве основы среды можно использовать и отход произ-
водства ферментов — биошрот, представляющий собой нераство-
римый остаток культуры после экстракции ферментов. Но био-
шрот может быть использован только при обогащении среды крах-
малом (картофельная мезга) и ростовыми веществами, вносимы-
ми с солодовыми ростками.
При использовании пшеничных отрубей важно установить со-
держание в них крахмала. Было показано, что увеличение содер-
жания крахмала с 6,37 до 23,17 % благоприятно сказывается на
биосинтезе всего амилолитического комплекса, особенно а-амила-
зы, накопление которой в среде возрастает в 2,5 раза. Количество
крахмала в отрубях должно быть не менее 16—20 %. Помимо пше-
ничных отрубей при культивировании продуцентов амилаз можно
использовать пивную дробину, обогащенную крахмалсодержащей
разваренной массой, поступающей из спиртового производства.
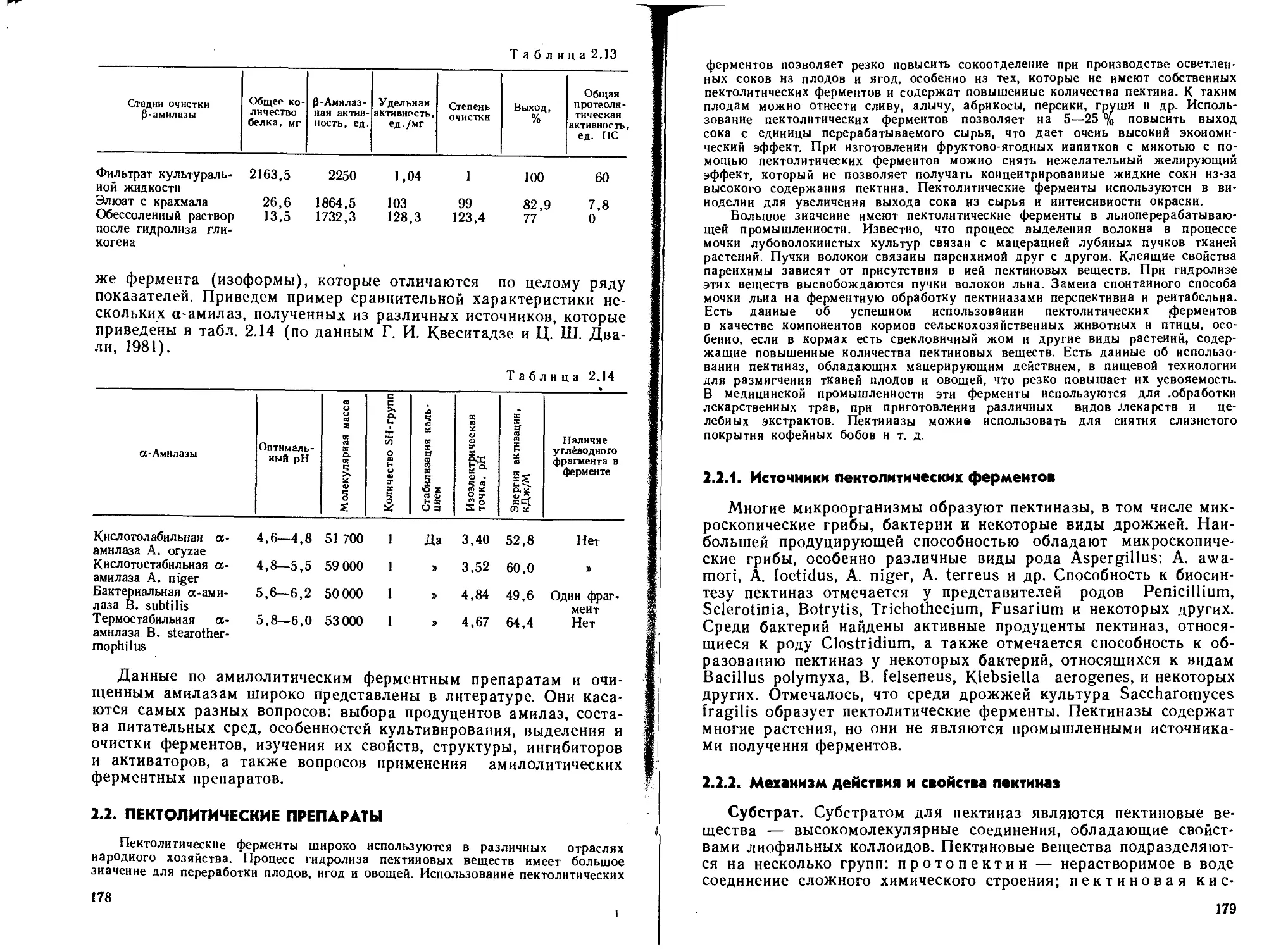
Индуцибельный синтез пектолитических ферментов при по-
верхностном культивировании A. awamori 16 очевиден из рис. 1.4.
Из рисунка видно, что введение в состав среды помимо пшенич-
ных отрубей свекловичного жома приводит к увеличению количест-
ва синтезируемого фермента в 5—6 раз по сравнению с культу-
рой, полученной на среде, состоящей из одних пшеничных отрубей.
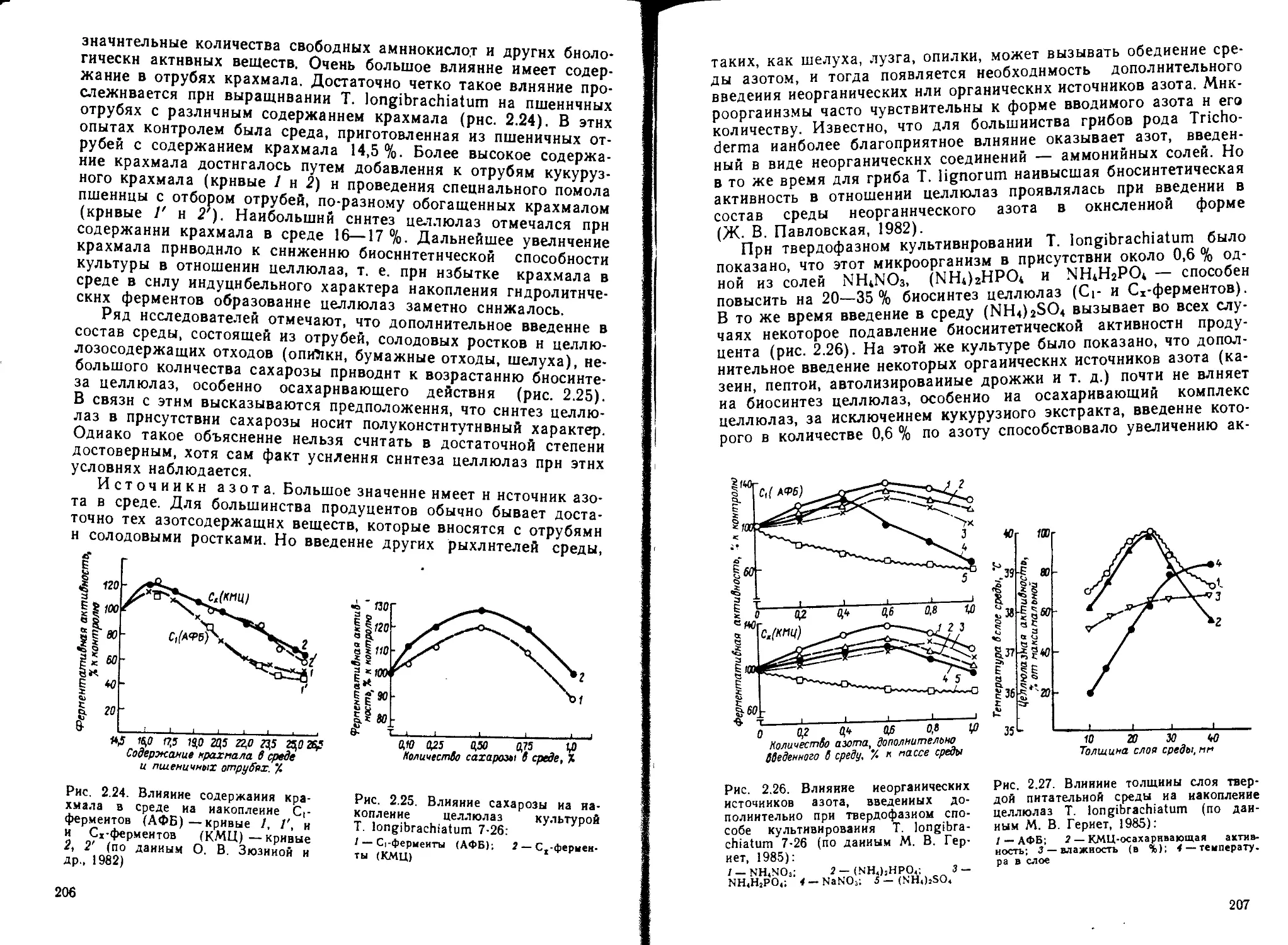
Влияние отдельных компонентов питательной среды на биосин-
тез микроорганизмами ферментов можно продемонстрировать на
культуре A. oryzae 8 Fi, которая способна образовывать комплекс
разнообразных ферментов (табл.
1.2).
Следовательно, варьируя со-
став среды с учетом физиологи-
ческих особенностей продуцента
и индуцированного характера син-
тезируемых ферментов, можно по-
лучить поверхностную культуру,
содержащую желаемый комплекс
ферментов.
Особенности состава сред для
глубинного выращивания проду-
центов. При составлении пита-
тельных сред для глубинного
культивирования продуцентов
ферментов можно применять ма-
лорастворимые компоненты. Од-
нако их количество должно быть
ограниченным, так как высокое
содержание нерастворимых остат-
ков приводит к ухудшению реоло-
гических свойств среды и затруд-
няет последующую обработку
среды и культуральной жидкости.
Целесообразнее использовать в
Рис. 1.4. Влияние соотношения
свекловичного жома и пшеничных
отрубей в среде иа накопле-
ние пектолитических ферментов
A. awamori 16 при поверхностном
культивировании
29
Таблица 1.2
Активность ферментов, ед./г
Состав среды % амилоли- тическая (АС) мальтаз- ная (МС) протеоли- тическая щелочная (ПС) пектолн- тическая (ПкА) общая цитолити- ческая (ОЦА)
Пшеничные отруби, 100 36 128 51 220 12
Пшеничные отруби, 75-^солодо- вые ростки, 25 Пшеничные отруби, 804-подсол- иечная лузга, 20 41 182 62 150 11
30 140 39 100 12
Пшеничные отруби, 50-)-свекло- вичиый жом, 50 22 41 32 1000 15
Пшеничные отруби, 50-(-гречиш- ная шелуха, 50 28 88 42 120 26
Пшеничные отруби, 80-- березо- вые опилки, 20 Пшеничные отруби, 50-)-гречиш- иая шелуха, 254-подсолнечная лузга, 25 34 131 54 100 16
26 91 42 200 40
Пшеничные отруби, 254-солодо- вые ростки, 50 4-гречишная ше- луха, 25 27 89 48 340 28
составе среды отвары или гидролизаты отходов растительного
сырья (отрубей, солодовых ростков, свекловичного жома и т. д.),
а также грубые фильтраты спиртовой барды, гидролизаты или
плазмолизаты микробной биомассы, реже — отдельные аминокис-
лоты. Отсутствие крупной взвеси особенно важно при непрерывном
процессе культивирования. Питательные среды готовят на водопро-
водной воде, содержание сухого вещества в них колеблется от 2,5
до 20 % в зависимости от физиологических потребностей продуцен-
та или состава целевого ферментного комплекса; pH питательных
сред контролируют в момент приготовлеиня среды, а также после
ее стерилизации.
Гидролитические ферменты чаще всего имеют индуцибельиую
природу, и поэтому в состав среды обязательно включается веще-
ство — индуктор, способствующее наиболее иитеисивному накоп-
лению культурой соответствующего фермента.
Источники углерода. Углерод крайне необходим микро-
организмам, так как он определяет основные метаболические пу-
ти любого организма. Источниками углерода могут быть самые
различные органические соединения, они могут быть использовав-
ны в качестве скелетного материала при построении клеточного
вещества и в качестве источника энергии.
При получении гидролитических ферментов, обладающих кар-
богидралазиой активностью, источнику углерода придается особое
значение, поскольку он почти всегда является стимулятором син-
теза соответствующего комплекса ферментов. Если источник угле-
рода (крахмал, пектин и др.) вводится в среду в больших количе-
30
ствах и она становится малоподвижная, то его следует вводить в
среду постепенно по мере его потребления микроорганизмом, т. е.
дробно.
Индуктором биосинтеза амилаз могут быть мальтоза, изомаль-
тоза, паноза, нигероза, но они используются редко, так как это
дорогостоящие вещества. Глюкоза как компонент среды при куль-
тивировании продуцентов карбогидраз используется очень редко,
поскольку она часто является репрессором синтеза. Но при био-
синтезе пектолитических ферментов анаэробной культурой С1. рес-
tinofermentans 15 введение в среду глюкозы в количестве до 2,5—
3 % положительно сказывается на биосинтезе этой группы фермен-
тов. Возможно, это связано со свойством глюкозы снижать окис-
лительно-восстановительный потенциал среды, что создает благо-
приятные условия для роста и развития анаэробной культуры.
Крахмал и продукты его гидролиза стимулируют биосинтез ксила-
наз и протеиназ.
Пектнисодержащее сырье (отходы переработки плодов и ово-
щей, яблочный и свекловичный пектины, а также гидролизаты
этих отходов) являются прекрасными источниками углерода при
выращивании продуцентов пектолитических и гемицеллюлазиых
ферментов. При этом, варьируя составом среды и концентрацией
пектинсодержащего сырья, можно достигать определенного соот-
ношения отдельных ферментов пектиназного и гемицеллюлазиого
комплекса. Благоприятное воздействие иа биосинтетическую спо-
собность микроорганизмов оказывает лактоза, вводимая в среду в
количестве 1,5—3 %. Например, по данным А. Г. Лобанка (1978),
лактоза, введенная в виде молочной сыворотки, стимулирует био-
синтез целлюлолитических ферментов. В присутствии лактозы воз-
растает также биосинтез пектиназ культурой A. awamori 16 и био-
синтез р-галактозидаз любыми продуцентами. Выбор источника
углерода зависит от физиологии продуцента и вида образуемого
фермента, поэтому оптимальная дозировка источника углерода
выбирается индивидуально для каждого микроорганизма.
Источники азота. Источниками азота в питательной сре-
де при глубинном культивировании могут быть минеральные соли
и азот органических соединений. В процессе биосинтеза протеиназ
источник азота играет роль не только необходимого компонента
питания, но и активатора процесса биосинтеза. Наилучший стиму-
лирующий эффект получается при введении в состав среды бел-
ков или продуктов их гидролиза. К органическим источникам азо-
та относятся различные животные белки (пептон, казеин, гемо-
глобин, желатин, яичный альбумин), белки растительного сырья
(обезжиренная соя, кукурузный экстракт), биомассы микроорга-
низмов, а также гидролизаты белков (кислотные, щелочные и
ферментативные), отдельные аминокислоты н некоторые другие
соединения.
В качестве неорганических источников азота используются раз-
личные соли азотной кислоты и аммонийные соли. Прн выборе
источника неорганического азота следует прежде всего обращать
31
внимание иа физиологическое воздействие аииоиа или катиона
при избирательном потреблении азота. Изменение pH среды, т. е.
ее подщелачивание в случае потребления аииоиа или подкисление
при утилизации катиона может вызвать значительные изменения
в биосинтетической деятельности микроорганизма. Такое влияние
четко видно иа примере синтеза а-амилазы (АС) и протеиназы
(ПС) культурой В. subtilis 103 (табл. 1.3) и пектиназ (ПкА) куль-
турами A. niger и A. awamori 16 (табл. 1.4).
Таблица 1.3
Источник азота pH Биомасса» иа 100 мл Активность ферментов в культуральной жидкости
исходной среды культу- ральной жидкости АС. ед./мл ПС. мкг/мл
Цитрат аммония двузамещеиный 6,9 7,5 0,84 82,8 66,8
KNO3 6,9 6,1 0,11 14,4 97,0
NH4NO3 6,9 4,4 0,26 0 0
(NHt)2SO4 6,9 4,8 0,40 0 66,8
(NH4)2HPO4 6,9 5,6 0,80 86,4 100,2
nh4ci 6,9 7,4 0,40 43,2 67,0
Таблица 1.4
Источник азота Биомасса» г/на 100 мл ПкА, ед./мл
A. niger A. awamori 16 A. niger A. awamori 16
(NH4)2HPO4 NaNO3 1,20 0,50 18,21 0
0,89 0,95 8,81 12,53
NH4NO3 0,85 0,98 8,11 17,02
(NH4)2SO4 0,70 1,15 7,12 18,90
Не меиьшее значение имеет коицеитрация минерального источ-
ника азота (рис. 1.5). На примере В. mesentericus ПБ было пока-
зано, что на биосинтез а-амилаз благоприятное влияние оказывает
введение в состав среды (ННч)2НРО4 в количестве 0,9%, все ос-
тальные соли практически не оказывают существенного влияния
в любой коицеитрации (кривые обозначены сплошными линиями).
Влияние выбора минеральных источников азота иа биосинтез
протеиназ более заметно. Такие соли, как NH4CI и (N^^SO* при
малой дозировке (0,1 %) даже несколько тормозят процесс био-
синтеза протеиназ, соли NH4NO3 и СаДООзЬ почти ие влияют на
этот процесс, и только (Nbh^HPCX при коицеитрации 0,9 % более
чем в 5 раз повышает биосинтетическую деятельность бактерий.
По данным многих исследователей, добавление органических
источников азота во многих случаях является более эффектив-
ным, чем только неорганических, а совместное введение в среду
32
Рис. 1.5. Влияние неорганических источников азота на биосинтез фер-
ментов В. mesentericus ПБ (сплошной линией обозначена а-амилаза;
пунктирной — нейтральная протеиназа)
азота солей и органических соединений может привести к их си-
нергическому действию. Это хорошо видно иа примере В. subti-
lis 103 (табл. 1.5). Использование оптимальной дозировки по азо-
Таблица 1.5
Источник азота н его содержание, % pH Активность культуральной жидкости
ИСХОДНОЙ среды культу- ральной жидкости АС. ед./мл ПС, мкг/мл
(NH4)2HPO4, [,5 (контроль) 6,9 5,6 86,4 100,2
Казенн 6,9 7,7 24,0 140,0
Пептон 6,9 7,5 43,2 187,7
Кукурузный экстракт 6,8 7,6 36,0 200,0
Экстракт нз солодовых ростков 7,0 7,3 4,8 193,7
(NH4)2HPO4, 1 + пептон, 0,9 6,9 7,2 108,0 400,8
(HN4)2HPO4, 1 + кукурузный экстракт. 6,8 7,3 111,8 801,6
(NH4)2HPO4, 1,2 + кукурузный экстракт, 0,8+ пивные дрожжи, 0,4 6,7 7,2 111,6 1289,2
г Зак. 232
33
ту в виде (NHi^HPOi (см. табл. 1.3) позволяет получить актив-
ность до 100 ед. ПС/мл, а дополнительное введение в среду орга-
нического азота в виде кукурузного экстракта и пивных дрожжей
способствует увеличению биосинтетической активности более чем
в 12 раз. Однако единой рекомендации по составлению сред дать
невозможно и необходимо экспериментальное определение состава
среды для каждого продуцента.
Соотношение углерода и азота в среде. Большое
значение для биосинтеза ферментов имеет соотношение углерода
и азота в среде, т. е. сбалансированность питательной среды по уг-
лероду и азоту. Дефицит одного из этих компонентов в среде не
может быть компенсирован избытком другого. Только при опреде-
ленном отношении С: N в среде наблюдается максимальное на-
копление ферментов, что хорошо видно из рис. 1.6. Для двух раз-
личных микроорганизмов — В. mesentericus ПБ и A. terrico-
1а — оптимальное отношение углерода к азоту для биосинтеза
протеиназ лежит в интервале от 18 до 34. Отклонение в ту или
иную сторону приводит к резкому торможению биосинтеза протео-
литических ферментов. Почти в том же интервале С : N происходит
максимальный биосинтез амилаз В. mesentericus ПБ (кривая 2).
Влияние отношения С: N в среде можно продемонстрировать
на примере биосинтеза глюкозооксидазы и каталазы грибом Peni-
cillium vitale. При культивировании этого продуцента путем изме-
нения отношения С: N можно получать либо глюкозооксидазу, ли-
бо каталазу, либо их смесь.
Следует помнить, что установление лучшего отношения С: N
при некотором неизменном уровне одного из них может не приве-
сти к достижению оптимальной эффективности процесса и потому
устанавливать оптимальное отношение С: N следует при одновре-
менном варьировании уровней С
и N в среде.
Источники фосфора.
Фосфор вносится в среду в виде
солен фосфорной кислоты, ре-
же— в виде органических соеди-
нений, например фитина. Фосфор
может быть введен в среду с раз-
личными естественными субстра-
тами: отварами растительных тка-
ней, мукой, кукурузным экстрак-
том и т. д. Фосфор является очень
важным элементом питательной
среды; он входит в состав АТФ,
АДФ, АМФ, которые обеспечива-
ют энергетический обмен в клет-
ке, а также осуществление глав-
нейших биосинтетических процес-
сов (синтез белков, нуклеиновых
кислот, гликолиз и другие биохи-
АС ПС
згог 160
10 20 30 V) 50 60 70 №
Соотношение углерод/азот
Рис. 1.6. Зависимость биосинтеза про-
теиназы и амилазы от отношения
углерода к азоту в питательной
среде:
1, 3 — ПС; 2 — АС: 1. 2 — В. mesenteri-
cus ПБ; 3— A. terricola
34
мические превращения). Фосфор интенсивно потребляется из сре-
ды в логарифмической фазе роста культуры, что соответствует
наиболее интенсивному течению биосинтетических процессов и об-
разованию клеточного вещества. Обычно в этот период роста в био-
массу из среды переходит до 83—91 % фосфора. Потребность куль-
туры в фосфоре можно приблизительно определить путем анализа
золы микробной массы продуцента.
Фосфор стимулирует биосинтез протеаз, амилаз, пектолитиче-
ских ферментов. Наилучшие результаты получаются, если фосфор
дополнительно вносится в виде солей фосфорной кислоты (одно-
и двузамещенных солей натрия, калия и аммония) в среды, со-
держащие естественные растительные отвары, содержащие фосфор.
Источники витаминов, ростовых веществ и
микроэлементов. Без витаминов, ростовых веществ, ионов
металлов обмен веществ в микробной клетке маловероятен. Но
не все микроорганизмы требуют введения этих соединений в сре-
ду и в зависимости от этого микроорганизмы делятся на два типа:
ауксоавтотрофы, не требующие введения в среду витаминов и син-
тезирующие их самостоятельно, и ауксогетеротрофы, неспособные
синтезировать ряд витаминов и требующие их обязательного вве-
дения в состав среды.
Если продуцентом является ауксоавтотрофный микроорганизм,
введение в состав среды ростовых веществ и витаминов не влияет
на их рост и развитие. Если же продуцент — ауксогетеротроф, то
введение даже небольших количеств ростовых веществ заметно
ускоряет его рост и развитие. К сожалению, многие продуценты
являются ауксогетеротрофными и для них требуется наличие в
среде комплекса витаминов группы В (Bi, В3, В5, Be, В8), т. е. био-
тина, инозита, пантотеновой кислоты, тиамина, пиридоксина и дру-
гих, участвующих в процессах биосинтеза ферментов.
Биотин участвует в реакциях превращения аминокислот, вхо-
дит в активный центр ряда ферментов, катализирующих процесс
карбоксилирования и декарбоксилирования жирных кислот. Ино-
зит, соединяясь с шестью молекулами фосфорной кислоты, обра-
зует инозитфосфорную кислоту, способствующую росту дрожжей.
Пантотеновая кислота входит в состав КрА, при участии
которого происходят важнейшие превращения в клетке.
Источником витаминов и ростовых веществ в питательных сре-
дах обычно являются микробные массы и различные раститель-
ные отходы, входящие в состав сред. Наиболее богатыми источ-
никами этих соединений являются автолизаты микробных масс,
в настоящее время для этих целей часто используют кормовые
дрожжи, плазмолизированные или подвергнутые кислотному или
ферментативному гидролизу. Богаты витаминами и ростовыми ве-
ществами кукурузный экстракт, спиртовая барда, отвары муки,
выжимки плодов и овощей. Но так как эти компоненты среды слу-
жат одновременно источниками углерода, азота, фосфора и их ко-
личество в среде чаще всего определяется именно этими элемен-
тами, содержание витаминов и ростовых веществ в средах бывает
2*
35
достаточным и не требуется их дополнительного введения. Если
же среда для культивирования используется синтетическая, то воз-
никает необходимость специального исследования по выявлению
потребности продуцента в этих соединениях.
Макро- и микроэлементы являются неотъемлемой частью соста-
ва питательных сред. Многие ионы металлов входят в активный
центр ферментов или участвуют в поддержании пространственной
структуры ферментов и обеспечивают- энзиматическую деятель-
ность организма, обмен веществ в нем. Более четверти известных
в настоящее время ферментов относятся к металлоферментам. Они
активируют процессы дыхания, окислительно-восстановительные
реакции, синтез аминокислот, жирных кислот, сахаров, нуклеоти-
дов, пирамндиновых оснований, регулируют образование биополяр-
ных молекул белков, гликогена, нуклеиновых кислот, их трансфор-
мацию и распад.
Все металлоферменты делятся на две группы. К первой отно-
сятся истинные металлоферменты с прочной связью между иона-
ми металла и белковой частью, не разрушаемой при пропускании
через иониты. Вторая группа характеризуется тем, что ион метал-
ла легко отщепляется при диализе или при другой обработке рас-
твора от белковой части фермента с потерей каталитических
свойств. При добавлении металла ферменты данной группы вновь
активируются.
В окислительно-восстановительных процессах участвуют фер-
менты, требующие присутствия железа, меди, марганца, цинка, бо-
ра и молибдена. Активность дыхания и интенсивность расщепления
органических субстратов зависят от специфической активации фер-
ментов тем или другим металлом. Таким образом, металлы и их
комплексные соединения являются не случайными примесями,
а биологически важными компонентами. Микроэлементы могут ре-
гулировать обменные процессы в организме и изменять направле-
ние ферментативных реакций. Синтез аминокислот катализируют
ферменты, на которые влияют марганец, молибден, железо, ко-
бальт; белки синтезируются при участии молибдена, цинка, меди,
бора; на синтез липидов влияет наличие бора, меди, марганца, ко-
бальта.
Зависимость потребности в микроэлементах от скорости роста
микроорганизмов и от образования ими ферментов установить
трудно, так как количества микроэлементов, в которых нуждают-
ся микроорганизмы, очень малы. О потребности в микроэлементах
для биосинтеза клеточного вещества судят на основании анализа
состава золы биомассы микроорганизма.
Присутствие или отсутствие отдельных микроэлементов может
оказывать стимулирующее действие на накопление в среде опре-
деленных ферментов. Например, снижение содержания меди и
цинка в среде приводит к интенсификации биосинтеза амилолити-
ческих ферментов. Биосинтез амилаз стимулируется нонами нат-
рия, кобальта, кальция и магния, но тормозится в присутствии
ионов марганца, меди и ртути. Большое значение для образования
36
протениаз имеют медь, молибден, марганец, кобальт, цинк н не-
которые другие микроэлементы. Одним из важнейших микроэле-
ментов, влияющих на синтез протеолитических ферментов, являет-
ся цинк. Он стимулирует образование протеиназ микроскопически-
ми грибами, бактериями и актнномнцетами. Возможно, это связа-
но с интенсификацией углеводного обмена и синтеза аминокислот
и белков. Предполагают также, что цинк входит в состав ряда
протеиназ.
Потребность микроорганизмов в макроэлементах обычно ком-
пенсируется введением соответствующих солей, а микроэлементы
вносятся в необходимом количестве с водопроводной водой, реак-
тивами и растительными отварами.
Влияние на микроорганизмы присутствия в
средах токсических веществ. Известно, что рост и раз-
витие микроорганизмов связаны с осуществлением многочисленных
ферментативных реакций, протекающих по законам конкурентного
и неконкурентного ингибирования. В питательных средах неизбеж-
но присутствует некоторое количество металлов, тормозящих ско-
рость ферментативных реакций. При этом в зависимости от кон-
центрации одни и те же металлы могут выступать как стимулято-
ры и как ингибиторы процесса. Например, для нормального роста
микроорганизмов необходимо наличие в среде железа, цинка и
меди в долевых количествах соответственно 0,2-10-6; 0,1-10-6;
0,2-10-6, а при повышении до 0,5-1СГ6 процессы обмена резко тор-
мозятся и могут полностью остановиться. Добавление к синтети-
ческим средам белков и экстрактов растительного сырья заметно
ослабляет токсическое действие меди, по-виднмому, в результате
способности этих веществ образовывать с медью комплексные сое-
динения.
Токсическое воздействие на жизнедеятельность многих микро-
организмов оказывает присутствие в среде хлора, галогенов, фор-
мальдегида, фенола, толуола, бензола и ряда других веществ.
Установлено, что для полного подавления роста многих микроор-
ганизмов достаточно присутствия в естественной питательной сре-
де одного из следующих соединений в миллионных долях в преде-
лах: ртуть — 40—50, хлор — 125—200, формальдегид — 225—
250, кадмий — 350—500, медь — 400—500, диоксид серы — 1250—
1500, фенол — 2000—2500 и т. д.
Таким образом, для обеспечения процесса роста микроорганиз-
мов н биосинтеза ими соответствующих ферментов необходимо,
чтобы в составе питательной среды были источники углерода, азо-
та, фосфора, витаминов, ростовых веществ, макро- и микроэлемен-
тов в определенных количествах. Среда должна иметь определен-
ное значение pH; для этого необходимо предусмотреть, чтобы в
процессе культивирования изменение pH не сказывалось отрица-
тельно на жизнедеятельности микроорганизма.
Приготовление питательных сред. Сухие компоненты для при-
готовления питательных сред хранят в основном производственном
здании или специальном складском помещении. Питательную сре-
37
ду для поверхностного культивирования готовят в стерилизаторе
или специальной емкости с перемешивающими устройствами, ку-
да дозируют отдельные компоненты и смешивают их с водой или
водным раствором обогатителей (разваренная масса, соли, кисло-
ты, кукурузный экстракт). При глубинном способе культивирова-
ния приготовление среды осуществляется в специальной емкости.
Бела производство небольшое, то приготовление среды и ее сте-
рилизацию можно осуществлять в одном помещении. Но с пози-
ции ведения рациональной технологии, особенно на крупных пред-
приятиях, цех приготовления питательной среды изолируют от дру-
гих производственных помещений, чтобы предотвратить попадание
нестерильного, загрязненного микроорганизмами сырья в основное
производство. Стадии приготовления питательной среды и ее сте-
рилизации разъединены в разных цехах.
Методы приготовления питательных сред различны и зависят
от состава входящих в среду компонентов. Для одних компонен-
тов требуется предварительная обработка: измельчение, дробле-
ние, отваривание, экстрагирование и т. д. Эти подготовительные
операции проводят в специальных емкостях и в специальных ап-
паратах. Подработанные компоненты среды (измельченный жмых,
глютен, картофель, растворенный в горячей воде, и частично раз-
бавленный кукурузный экстракт) подают при постоянном переме-
шивании через дозирующие устройства в емкость для приготовле-
ния среды. В зависимости от свойств компонентов среду можно го-
товить путем их растворения или суспендирования в холодной или
подогретой воде.
Емкости для приготовления питательной среды могут быть от-
крытыми и закрытыми, цилиндрической формы со сферическим
дном, с мешалкой и барботажными устройствами для воздуха и
пара и дозирующими устройствами. Изготовляются аппараты из
нержавеющей стали или из материалов с антикоррозийным покры-
тием.
В последнее время появилась тенденция составления питатель-
ных сред на основе различных гидролизатов (гидролизаты расти-
тельных отходов, микробных масс, крахмала и т. д.). В этом слу-
чае необходимы специальные емкости для проведения процессов
гидролиза, аппараты для отделения твердой иегидролизуемой
фракции и иасосы для перекачивания гидролизатов в емкость для
смешивания всех компонентов. Разрабатываются линии непрерыв-
ного гидролиза компонентов среды, непрерывного смешивания и
передачи на стадию стерилизации.
Каждая партия поступившего сырья (отруби, жмых, ростки,
свекловичный жом и др.) подвергается микробиологическому кон-
тролю на определение обсемененности микроорганизмами, анали-
зируются его биохимический состав, влажность и т. д.
В лаборатории проводится контрольное выращивание проду-
цента на новом виде сырья и уточняется методика приготовления
среды: порядок дозирования компонентов, их обработка и режи-
мы смешивания.
38
1.3. СТЕРИЛИЗАЦИЯ ПИТАТЕЛЬНЫХ СРЕД
И АППАРАТУРЫ
Целью стерилизации является уничтожение всей микрофлоры, которая на-
ходится в питательной среде, различных жидких добавках (например, в пено-
гасителе), а также на внутренних поверхностях оборудования, арматуры, под-
водящих и отводящих коммуникаций.
Необходимость стерилизации вызвана тем, что культуры — продуценты фер-
ментов крайне чувствительны к присутствию Других микроорганизмов.
Процесс стерилизации можно расчленить на три основных этапа: нагрева-
ние среды или аппарата до температуры стерилизации, выдерживание при этой
температуре в течение времени, обеспечивающего гибель всех микроорганизмов и
охлаждение стерилизуемого объекта до температур, доступных для засева среды
чистой культурой продуцента.
Достичь полной стерильности очень трудно, поскольку для этого надо
убить все микроорганизмы, а некоторые из них, особенно спороносные, выдер-
живают воздействие высоких температур очень длительное время. Свойства
стерилизуемых объектов имеют большое значение, так как некоторые вещества
усиливают стерилизующий эффект, например кислоты, а некоторые, наоборот,
увеличивают стойкость микроорганизмов к температуре и давлению. Так, микро-
организмы в 2—3 раза дольше выдерживают термообработку в масле, в при-
сутствии крахмала и т. д. Все это говорит о том, что эффективность стерилиза-
ции зависит от очень многих факторов: температуры, длительности процесса,
состава стерилизуемой среды, конструкции аппарата, степени обсемеиениости
стерилизуемого объекта, требований стерильности на последующих стадиях
и т. д.
1.3.1. Теоретические основы стерилизации
Характеристикой процесса стерилизации является удельная скорость гибели
микроорганизмов — количество микроорганизмов, погибающих в единицу времени,
1 dN
k -----------,
N dt
где N — число особей в популяции; т — продолжительность стерилизации, мин.
После интегрирования, учитывая, что при т=0, N=N0, получим:
,V ----- No ехр(~1п> и k — — In -77- .
т N
Удельная скорость гибели k не зависит от концентрации микроорганизмов,
а зависит от вида микроорганизма, характеристики стерилизуемого объекта,
температуры стерилизации и т. д.
Отдельные особи микроорганизмов одной и той же культуры по-разному
реагируют на воздействие температуры: одни погибают быстрее, другие вы-
держивают высокую температуру более длительное время. Поэтому экспери-
ментально можно определить лишь среднее зиачеиие k.
Произведение УотСр характеризует суммарную продолжительность жизни
всей популяции, которое можно записать в виде следующего уравнения:
N,
= J TdN,
откуда
N.
J idN
о
Тсв" А/о ’
39
Величина среднего k, имеющего размерность mhh~’, будет величиной, об-
ратной среднему времени тСр
1
=.
Тер
Интеграл для выражения удельной скорости роста можно записать сле-
дующим образом:
In = (* kdr,
N ,1
о
где No — количество живых микроорганизмов перед стерилизацией (при т=0).
Ф. X. Дейндорфер и А. Е. Хемфри предложили левую часть этого уравнения
обозначить V (иабла) и назвать его критерием стерилизации. При постоянной
температуре критерий стерилизации будет равен
'\7 = *т.
Чтобы рассчитать эффективность принятого режима стерилизации, следует
взять из табл. 1.6 значение k, которое обычно устанавливается по эксперимен-
тальным данным для наиболее термоустойчивого эталонного микроорганизма —
В. stearothermophilus 1518.
Для расчета и обоснования режима стерилизации при неизотермических
условиях реального производства используют приближенный метод Т. Ричардса.
Метод предполагает учитывать критерии стерилизации при нагревании стерили-
зуемого объекта (VH), выдерживания его при температуре стерилизации (VB)
Н ОХЛаЖДеИИЯ (Vox).
Обрабатывая многочисленные экспериментальные данные, Т. Ричардс от-
мечает, что обработка при температуре ниже 100 °C малорезультативиа и состав-
ляет около 2 % общего критерия стерилизации. Был произведен расчет критерия
стерилизации V|HT и Voxr в интервале от 100 до 125 °C при прогрессировании
температуры обработки 1 °C в минуту. Позднее Д. Уэига с сотрудниками рассчи-
тали значения критерия стерилизации для температуры 143 °C, т. е. для таких
температур, которые используются в настоящее время при стерилизации.
Значения критериев стерилизации при различной температуре представлены
в табл. 1.6.
Если темп нагревания или охлаждения отличается от принятого при со-
ставлении таблицы (1 °C за 1 мии), то для расчета действительного критерия
стерилизации можно использовать соотношение
где VT — табличное значение; т — длительность изменения температуры от
100°С до /ст; /ст—температура стерилизации, °C.
Эффект стерилизации определяется как сумма критериев стерилизации:
Х\7 ==\7нг-(-^в_(-Х7 охт •
Рассмотрим пример. Объем стерилизуемой среды W=1 м3, нагревание ве-
дется от /=100°С до /ст=125°С в течение тн = 25 мии (1 °C в минуту), выдер-
живание при 125°C составляет тв=10 мин, охлаждение от 125 до 100°C тОх =
= 25 мин. Концентрация спорового материала в среде С=105 ед./мл.
По табл. 1.6 Vht от 100 до 125 °C равна 23,235, тогда Vb = £tb = 4,57- 10=
= 45,7; при охлаждении от 125 до 100 °C со скоростью, принятой в таблице,
V о х т = 23,235. X V=23,235+45,7+23,235=92,17.
Проверим полученный эффект
1 10й
N = = WCe~^ = 1,0-10». 105-------= —— = Ю’».
92,17 103®
40
Таблица 1.6
Температура, °C k, МИН”1 VHT или ^охт Температура, °C Л, мин"1 VHT или ^охт
100 0,013 0,013 122 2,440 11,825
101 0,017 0,030 123 3,075 14,900
102 0,023 0,053 124 3,765 18,665
103 0,030 0,083 125 4,570 23,235
104 0,036 0,119 126 5,9 29,13
105 0,038 0,167 127 7,4 36,53
106 0,062 0,229 128 9,3 45,88
107 0,083 0,312 129 И.7 57,58
108 0,109 0,421 130 14,8 72,38
109 0,135 0,556 131 16,6 88,98
ПО 0,163 0,719 132 18,6 107,58
111 0,193 0,912 133 23,4 130,98
112 0,234 1,146 134 29,5 160,48
113 0,302 1,448 135 37,2 197,68
114 0,412 1,860 136 46,8 244,48
115 0,540 2,400 137 59,0 298,48
116 0,653 3,053 138 74,2 377,68
117 0,810 3,863 139 93,5 471,18
118 1,002 4,865 140 104,8 474,98
119 1,210 6,075 141 118,0 693,98
120 1,480 7,550 142 148,0 841,98
121 1,830 9,385 143 — —
10~19<1, следовательно, выбранный режим обеспечивает полную стериль-
ность среды.
Т. Ричардс считает, что полная стерильность достигается при V=40, од-
нако в промышленности используются режимы, где SV=80-i-100 и выше. Такое
повышение величины критерия стерилизации связано, по-видимому, с тем, что
изучение процесса отмирания эталонной культуры проводилось в нейтральной
среде, где не могло быть веществ, увеличивающих термостойкость микроорга-
низмов (например, масел, крахмала и т. д.).
Метод Ричардса может быть применен для- определения еще одной ха-
рактеристики процесса стерилизации — показателя асептической эффективности
(Sac), который равен отношению количества загрязненных операций (п3) к об-
щему числу проведенных операций (л):
S
°ас —
П
Если принять, что даже одна выжившая особь вызывает инфицирование
объекта, то число «грязных» стерилизаций п3 равно числу N, рассчитанному
для всех п операций:
n3= nN—nCW exp (— \7).
Тогда
Sac = С№ехр(—V)-
Значение V рассчитывается по методу Ричардса с использованием
табл. 1.6. Величина Sac задается, исходя из экономических соображений, так
как более жесткие режимы стерилизации связаны с увеличением энергозатрат,
более строгими требованиями к герметизации и прочности оборудования, ква-
лификации персонала и т. д.
41
В основе рассматриваемых методов определения параметров стерилизации
лежит гипотеза об экспоненциальной зависимости числа выживших клеток от
времени теплового воздействия. Однако во многих случаях эта гипотеза не
соответствует действительности. Это связано с наличием защитных свойств не-
которых компонентов среды (наличие комков), различной скоростью нагрева-
ния, нестабильностью температуры стерилизации при выдерживании и т. д. Для
расчета режимов стерилизации такой сложной системы успешно используются
вероятностные методы, которые заключаются в установлении вероятности вы-
живания микроорганизмов при данном режиме стерилизации в данном обору-
довании или вероятности получения чистых операций.
Построение вероятностной модели процесса стерилизации основывается на
применении распределения Пуассона, наиболее полно отражающего специфику
исследуемого процесса. Вероятность выживания клетки Р рассчитывается по
формуле
(mV)d
Р = ——— exp (— mV),
а!
где т — число центров, реагирующих на осуществленное воздействие в единице
объема; V— некоторый объем; d — условное число каких-то воздействий (уда-
ров) на клетку, не приводящих к ее гибели.
Если для гибели клетки достаточно одного удара, то выживают только
клетки, не получившие этого воздействия (d=0). Вероятность выживания клет-
ки в этом случае
(тИ)°
?о = —-— exp (— mV) = exp (— mV).
Если для отмирания клеток необходимо два удара, то выживают клетки,
не получившие ударов или испытавшие их один раз (di = 0; </2=1). Тогда ве-
роятность выживания
ро + pi = О + mV) ехР (— «И •
Если требуется много ударов, то
[ (mV)2 (mV)3
exp (— mV).
Число выживших клеток
N—NtP,
где No — начальное количество клеток.
Для одиоударных клеток зависимость числа выживших клеток от воздей-
ствия будет экспоненциальной по теории термической гибели микроорганизмов:
W=Woexp (—V), тогда V=mV.
Для многоудариых популяций можно записать
(V2 Д3 \
1 + V + тг- + „. + • • • ),
Z* □! /
причем вероятность выживания клеток в обрабатываемом объеме
(V2 V3 \
1 + V +—— + “77~ + • • • )•
Z! □ ! /
Значение V можно определить по методу Ричардса.
Вероятность появления грязных операций может быть рассчитана по
формуле
' / V2 V3 \
Sac — WC exp (— v) ( 1 + V + -“ + 4- . . . I
\ Z' □! /
42
В связи с большой сложностью процесса стерилизации и иеодиородиостью
стерилизуемых сред полученные расчетным путем режимы необходимо в каждом
случае проверять экспериментально.
Помимо тепловой обработки сред и аппаратуры паром, горячим воздухом
существуют другие способы обеспложивания, которые пока ие нашли примене-
ния в ферментной промышленности. К ним относятся обработка ультразвуком,
ультрафиолетовыми и инфракрасными лучами, ионизирующим излучением, об-
работка ядами (фенол, окись этилена) и т. д.
При поверхностном способе культивирования стерилизуют в основном твер-
дые сыпучие среды, при глубинном — жидкие. Поэтому аппаратурное оформле-
ние этой стадии зависит от способа культивирования.
1.3.2. Стерилизация сыпучих питательных сред
При поверхностном способе выращивания различных микроор-
ганизмов требуется различная степень термической обработки
среды. Если среда в процессе культивирования не перемешивается
и не перемещается, то ее абсолютная стерильность необязательна.
На этом этапе осуществляется обработка среды при различных
режимах. Например, на механизированной установке Джеффриса
(США) отруби увлажняют 0,1 н. раствором соляной кислоты и
обрабатывают отруби в тонком слое на ленточном конвейере в
течение 15 мин при температуре около 90 °C. В установке Христен-
сена (США) ведется обработка острым паром в герметизирован-
ном отсеке скребкового транспорта в течение 1 ч при 100°C.
В Японии при поверхностном выращивании бактерий (фирма «На-
газе») стерилизацию осуществляют в специальных автоклавах не-
посредственно в закрытых кюветах при 150 °C в течение 40 мин,
на фирме «Дайва Касаи» стерилизуют среду в открытых кюветах
при температуре 120°C в течение 30 мин в специальных автокла-
вах вместе с этажерками. В ЧССР проводят раздельную стери-
лизацию острым паром в течение 45—60 мин при 104—120°С в
горизонтальной емкости сухой сыпучей фракции среды, а вода
или жидкий обогащающий компонент стерилизуются отдельно в
специальном аппарате. Фирма «Валерштейн» (США) использует
термическую обработку острым паром в цилиндрических горизон-
тальных аппаратах, где стерилизуемая масса перемещается вдоль
горизонтальной оси аппарата при температуре около 120°C в те-
чение 45—60 мин.
В СССР наибольшее распространение получили горизонталь-
ные двухцилиндровые стерилизаторы, где обработка увлажненных
отрубей осуществляется при температуре 104—110°С в течение
1,5—2 ч. При этом эффект стерилизации усиливается дополнитель-
ным введением в среду антибиотика (фурацилина) из расчета
1,5 г на 100 кг сухой среды и 0,2 % раствора формалина с кон-
центрацией 40 %. Твердая, увлажненная до 35—40 % среда дви-
жется в этом аппарате по замкнутому контуру. Стерилизатор
представляет собой два соединенных цилиндра, которые имеют по
одному валу с закрепленными на них по винтовой линии переме-
тающимися лопатками. Так как направление движения валов
различное, то масса, передвигаясь по горизонтали, в конце цилинд-
43
ра перебрасывается в соседний, подхватывается лопатками второ-
го вала и направляется вдоль второго цилиндра в противополож-
ном направлении. Такая конструкция позволяет перемешивать,
равномерно нагревать и стерилизовать среду любое необходимое
по регламенту время. Есть также двухступенчатые стерилизаторы.
В первой вертикальной цилиндроконической ступени, снабженной
мешалкой, проводится нагревание среды острым паром до 120 °C
и ее выдерживание в течение установленного времени. Вторая сту-
пень — это горизонтальный цилиндр, где осуществляются охлаж-
дение стерильной массы, ее доувлажненне и засев чистой куль-
турой продуцента.
При небольшом производстве возможна стерилизация твердой
питательной среды в специальных перфорированных металличе-
ских емкостях-биксах в автоклавах при температуре 120°C в те-
чение 1,5—2 ч.
При режимах стерилизации, принятых для сыпучих сред, пол-
ная стерильность среды и жесткие условия стерилизации необхо-
димы в случае, когда в процессе культивирования среда переме-
щается или перемешивается. Нестерильность среды в этом случае
может повлечь за собой инфицирование всей массы, особенно,
если продуцент имеет низкую скорость роста. Это обстоятельство
следует учитывать при проектировании крупных производств с ав-
томатизированными линиями выращивания микроорганизмов в
толстом слое среды.
Весьма интересны работы по использованию специальных обес-
пложивающих установок для стерилизации. Так, например, италь-
янская фирма «Бонопенч» использует холодную стерилизацию сы-
пучих сред в разреженной среде путем введения окиси этилена
из расчета 10 г на 25 кг стерилизуемой среды.
Представляют интерес работы советских ученых по использо-
ванию в качестве источника тепла токов высокой частоты и спо-
собов холодной стерилизации в ионизированном потоке электро-
нов. Экспериментальные данные показали, что при внесении воз-
душно-сухих отрубей в электрическое поле при расстоянии меж-
ду обкладками конденсаторов 65—80 мм, напряжении 4—6,3 кВ,
силе тока в сети 0,1—0,2 А. частоте тока 12 МГц и длине волны
24 м за 90—540 с отруби в кюветах или стеклянной таре прогре-
ваются до 130—172 °C, причем скорость нагревания лимитируется
подводимой удельной мощностью. Почти во всех образцах за этот
период времени достигается полная стерильность. Подобные опы-
ты были проведены в лабораторных условиях на линейном уско-
рителе ЛУЭ-5 мощностью 5 МэВ. Установлено, что, начиная с до-
зы 700 кэВ, при длительности стерилизации 5—10 с достигается
полная стерильность обрабатываемых сред. При выращивании на
этих средах грибов была получена культура с высокой фермента-
тивной активностью.
В настоящее время в СССР серийно изготовляются ускорите-
ли электронов четырех типов (ЭЛТ-1,5 и ЭЛТ-2,5 мощностью 25—
40 кВт; ЭЛ ИТ-1А и ЭЛИТ мощностью 10 и 10—30 кВт), с помо-
44
щью которых можно осуществлять стерилизацию при 20 °C доза-
ми до 2,5 млн. рад. Есть данные о создании перспективного высо-
кочастотного стерилизатора непрерывного действия для сыпучих
сред, где за 2 мни температура в среде повышается до 137—
155 °C, что обеспечивает полную стерильность среды. При этом ак-
тивность культуры повышается иа 12—20%.
Все это свидетельствует о том, что новые способы стерилиза-
ции сред весьма эффективны и перспективны для внедрения в
производство.
1.3.3. Стерилизация жидких питательных сред
На выбор оптимального режима стерилизации оказывают влия-
ние гетерогенность жидкой среды, ее физико-химические свойства,
качественный и количественный состав. Если среда не содержит
твердых частиц и представляет собой гомогенный раствор пита-
тельных веществ, то длительность стерилизации при прочих рав-
ных условиях может быть меньше, чем для сред, содержащих
твердые частицы, так как для их прогревания требуется больше
времени. Большее время стерилизации требуется и в случае, если
в среде есть липиды и она имеет высокое содержание сухого ве-
щества. При наличии в составе среды редуцирующих сахаров,
особенно глюкозы и свободных аминокислот, стерилизацию угле-
водной и аминокислотной фракций следует вести отдельно, чтобы
избежать потери сахаров в результате меланоидинообразования.
Стерилизацию питательных сред можно вести двумя спосо-
бами: периодическим и непрерывным. Периодический способ ис-
пользуется при работе с небольшими объемами, например в лабо-
раторных ферментаторах и при стерилизации среды для посевных
аппаратов. В этом случае процесс ведут в несколько этапов: 1) сте-
рилизация ферментатора и всех подводящих коммуникаций
острым или глухим паром; 2) залив прогретой гомогенизированной
среды; 3) нагревание среды до температуры стерилизации; 4) вы-
держивание при этой температуре в течение времени, необходи-
мого для гибели всех микроорганизмов; 5) охлаждение стериль-
ной среды в этой же емкости. Этот способ стерилизации довольно
длителен, и потому во избежание существенных изменений в со-
ставе среды процесс ведут при избыточном давлении 0,05—
0,1 МПа, при. температуре ПО—120°С в течение 1 —1,5 ч
с момента достижения предельной температуры. Но этот способ
малоэффективен, так как ферментаторы используются нерацио-
нально, и из-за длительности термической обработки происходят
разложение и изменение ряда компонентов среды. Кроме того, при
периодическом способе стерилизации высоки энергетические за-
траты и расход воды.
При непрерывной стерилизации используют более высокие
температуры (140—145°C) и меньшую длительность выдержива-
ния (1 —10 мни) при этой температуре. Предложено несколько кон-
струкций непрерывных стерилизаторов. Общим для всех аппара-
45
Рис. 1.7. Аппараты непрерывной стерилизации жидкой питательной среды:
а — тарельчатые нагревательные колонки; б — выдерживатель колонного типа;
в — выдерживатель спирального типа
тов этого типа являются расчленение процесса на три этапа и про-
ведение каждого из них в потоке в отдельном аппарате.
Первый аппарат, в котором среда нагревается до температу-
ры стерилизации, называется стерилизатором, нагревательной ко-
лонкой или колонкой для стерилизации питательной среды
(рис. 1.7, а). Второй аппарат, где стерилизуемую массу выдержи-
вают при определенной температуре стерилизации, называется вы-
держивателем. Он предназначен для продления времени стерили-
зации и достижений максимальной гибели микрофлоры. Аппа-
рат может быть выполнен в виде цилиндрической емкости, колон-
ны с полками иЛи тарелками, обеспечивающими наиболее равно-
мерный прогрев всей массы среды, или в виде спирального тепло-
обменника (рис. 1.7,6, в). Третий аппарат — это теплообменник,
46
Рис. 1.8. Установка непрерывной стерилизации УНС-20:
/ — приемная емкость: 2 — насос; 3 — нагреватель-стерилизатор; 4 — выдержива-
тели; 5 — пробоотборник; 6 — теплообменник-рекуператор; 7 — теплообменник-охла-
дитель; 8— ферментатор
предназначенный для охлаждения стерильной питательной среды
до температуры оптимальной для засева.
В настоящее время в СССР широко применяются установки
непрерывной стерилизации (УНС), в которых стерилизация ве-
дется при 140 °C в течение нескольких минут. Они имеют произ-
водительность от 5 до 503 стерильной среды в час. Такие установ-
ки состоят из емкости для нестерильной питательной среды, насо-
сов, нагревателя-стерилизатора, выдерживателя, охладителя и си-
стемы автоматического управления. На рис. 1.8 приведена прин-
ципиальная схема установки для непрерывной стерилизации про-
изводительностью 20 м3/ч. Стерилизация в этой установке ведет-
ся при температуре 130—135°C в течение 3—15 мин. Используют-
ся также роторные стерилизаторы непрерывного действия и ряд
других установок.
1.3.4. Стерилизация аппаратуры и коммуникаций
При поверхностном культивировании стерилизуют аппаратуру
для приготовления посевного материала (емкости для засева, кю-
веты, емкости для воды, для приготовления посевной суспензии,
посевные коммуникации), а также производственные кюветы. Сте-
рилизация кювет и стеклянной посуды в посевном отделении про-
водится сухим паром при температуре 160 °C не менее 60 мин. Ап-
паратуру и коммуникации стерилизуют острым паром при темпе-
ратуре 105—120°С и избыточном давлении 0,05—0,1 МПа.
Помещения, особенно посевные боксы, стерилизуют облучением
с помощью специальных бактерицидных ламп.
Стерилизация аппаратов и коммуникаций имеет большое зна-
чение и при глубинном способе культивирования. Самая тщатель-
47
ная стерилизация может не дать эффекта, если нарушена герме-
тичность оборудования. Созданы специальные приборы, например
галлондные теченскателн, для обнаружения даже незначительных
нарушений герметичности.
При стерилизации оборудования есть опасность даже при вы-
соких температурах не добиться стерильности в результате того,
что в процессе тепловой обработки внутренних полостей аппара-
тов происходит конденсация пара у стенок. Воздух, выделяющий-
ся из парогазовой смеси, покрывает стенки аппарата воздушной
пленкой, в результате чего условия нагревания стенки ухудшают-
ся. Плохо поддаются стерилизации различные патрубки н люки,
так как в них образуются воздушные пробки. Для улучшения ус-
ловий стерилизации при конструировании аппаратуры следует со-
кращать число впаев, увеличивать диаметр и уменьшать высоту
отводящих и подводящих штуцеров.
Все вентили перед установкой проверяют гидравлическим оп-
рессовыванием при давлении 0,3 МПа. Для герметизации флан-
цев и вентилей используют особые прокладки из паранита, обра-
ботанного графитом, для герметизации крышек аппаратов приме-
няют шнур из прорезиненной ткани диаметром до 19 мм, а для
загрузочных люков — резину толщиной 14 мм. Герметичность
соединений проверяют при избыточном давлении пара 0,15—
0,2 МПа.
Перед заливом среды тщательно проверяют сальниковое уплот-
нение мешалки, так как в процессе стерилизации плотность на-
садки может измениться.
Особое внимание уделяется стерилизации аппаратуры и ком-
муникации для подачи пеногасителя. Стерилизацию этих узлов
проводят при 125—135 °C в течение 1,5—2 ч.
На стадии стерилизации ведется постоянный микробиологиче-
ский контроль стерильности питательной среды, подаваемого в
ферментатор воздуха, пеногасителя и т. д.
На микробиологическую чистоту проверяют отделение стерили-
зации, его стены и пол, аппаратуру, коммуникации, а также руки
работающих.
1.4. ОЧИСТКА И СТЕРИЛИЗАЦИЯ ВОЗДУХА
Подавляющее большинство продуцентов ферментов является
аэробами, и для их нормального развития в процессе культивиро-
вания необходимо подавать в достаточном количестве стерильный
воздух. Воздух после аэрации растущей культуры может содер- -
жать споры или клетки микроорганизма — продуцента фермен-
тов, потому перед выбросом в окружающую среду он также тре-
бует очистки. Таким образом, требуется очистка как подаваемого
в производственные аппараты и помещения, так и удаляемого из
них воздуха. Особо высокие требования к стерильности предъяв-
ляются при подготовке воздуха для аэрации глубинной культуры.
Существует несколько способов очистки и стерилизации возду-
48
ха, основанных на двух принципах: умерщвление микроорганиз-
мов и их механическое отделение. Первый принцип лежит в осно-
ве методов воздействия высоких температур, ультрафиолетового
или ионизирующего излучения, фенол- и ртутьсодержащих аген-
тов, пропускания воздуха через 10%-ный раствор щелочи или
15—20 %-ный раствор кислоты в специальных башнях. Использо-
вание химических стерилизующих агентов недопустимо, так как
следы их в аппаратах и средах могут влиять отрицательно на раз-
витие микроорганизмов-продуцентов. Использование метода воз-
действия сухого тепла для стерилизации воздуха при температуре
до 300°C эффективно убивает микрофлору, но экономически не оп-
равдано.
Наибольшее распространение в ферментной промышленности
получила стерилизация воздуха методом фильтрования через во-
локнистые или зернистые фильтрующие материалы. На эффект
стерилизации воздуха методом фильтрования влияет степень засо-
ренности воздуха, поскольку сами микроорганизмы имеют разме-
ры от 0,01 до 25 мкм, но они оседают на частицы пыли, и степень
улавливания зависит от размеров этих частиц. Содержание бакте-
риальных загрязнений в воздухе в среднем составляет 1000—
1500 клеток в 1 м3, но оно может подниматься до 104. Помимо
микроорганизмов в воздухе имеются пыль органической и неорга-
нической природы, пары воды, и общее количество посторонних
частиц может достичь 109 в 1 м3.
Микроорганизмы, находящиеся в воздухе, обычно устойчивы к
отсутствию влаги и действию естественного фона ультрафиолето-
вых лучей. Количество микроорганизмов в атмосферном воздухе
убывает с увеличением высоты над уровнем земли; микробная за-
соренность воздуха во влажных районах или районах с сильны-
ми ветрами и пылящими почвами значительно выше. Количество
микроорганизмов в воздухе меняется в зависимости от времени
года; наименьшее количество микроорганизмов в воздухе наблю-
дается в зимнее время.
Выбор и расчет системы очистки воздуха ведутся по макси-
мальной засоренности для данной местности с учетом того, что
размеры частиц в воздухе, на которых адсорбируются микроорга-
низмы, колеблются от 0,5—2,0 мкм по ширине до 2—15 мкм по
длине.
В помещения и аппараты воздух подается мощными компрес-
сорами; проходя через них, воздух засоряется механическими
включениями от трущихся деталей и капельками смазочных ма-
сел при использовании поршневых компрессоров. При фильтрации
воздуха происходит также его очистка от этих механических при-
месей.
Аппаратурное оформление стадии подготовки и очистки возду-
ха зависит от способа культивирования продуцента. При поверх-
ностном культивировании требования к стерильности воздуха ме-
нее жесткие, чем при глубинном, и даже допускается рециркуля-
ция аэрирующего воздуха. Подготовка воздуха для аэрации при
49
поверхностном культивировании проводится в отделении конди-
ционирования воздуха, которое обычно располагается над рас-
тильными камерами. Этот процесс состоит из следующих после-
довательных операций: очистка воздуха от грубых механических
взвесей; предварительное кондиционирование воздуха до опреде-
ленной температуры; подача воздуха в головной вентилятор; тон-
кая очистка воздуха от микроорганизмов и окончательная очистка
в индивидуальном фильтре. При поверхностном способе культи-
вирования 90 % воздуха, отходящего из растильных камер, посту-
пает на рециркуляцию через индивидуальный кондиционер, а 10 %
после предварительного обеспложивания возвращается в атмосфе-
ру. Принципиальные схемы очистки, кондиционирования и рецир-
куляции воздуха в производстве при поверхностном и глубинном
культивировании представлены на рис. 1.9 и 1.10
Подготовка воздуха для глубинного культивирования имеет
некоторые отличия — вместо головного вентилятора используют
компрессоры. Мощность компрессора подбирают с таким расче-
том, чтобы обеспечить подачу воздуха через всю систему очистки
в ферментаторы и чтобы в процессе культивирования поддержи-
валось избыточное давление 0,01—0,03 МПа. На пути следования
от компрессора к ферментатору воздух преодолевает сопротивле-
Стерильная
вода
Рис. 1.9. Схема очистки и стерилизации воздуха для поверхностного культивиро-
вания продуцентов:
1 — растильиая камера; 2— распределитель воздуха; 3— стерилизующие колонки; 4—
бак для стерилизации воды; 5 — бачок для формалина; 6 — бачок для аммиака; 7—на-
сос для подачи рецикуляциоимой воды к форсункам оросительной камеры; а — кондицио-
нер воздуха; 9 — вентилятор; 10 — спаренные клапаны с автоприводом; 11— кипятиль-
ник «Вулкан»; 12 ~ бак с охлаждающим змеевиком; 13 — вентиляторы осевые; 14 — фор-
сунки для увлажнения; 15 — паровые форсунки для дезинфекции; 16 — перфорированные
трубы для подвода пара; 17 — калориферы
50
Рис. 1.10. Схема очистки и стерилизации воздуха для глубинного культивирова-
ния продуцентов:
1 — висциновые фильтры; 2 — маслоотделитель; 3 — холодильник; 4 — ресивер; 5 — порш-
невой компрессор; 6 — турбокомпрессор; 7 — головные фильтры; 8 — индивидуальный
фильтр; 9 — фильтр для отработанного воздуха
иия: в системе аппаратов и коммуникаций (около 0,03 МПа);
в фильтрующем слое (около 0,02 МПа); сопротивление столба
жидкости в ферментаторе (0,04—0,06 МПа); при выходе из бар-
ботажного устройства в результате расширения (0,01—0,02 МПа).
Для сжатия и нагнетания воздуха можно использовать порш-
невые компрессоры или турбокомпрессоры. Поршневые компрессо-
ры имеют высокий КПД, они просты в работе, но имеют неболь-
шую производительность и загрязняют поступающий в них воздух
маслом. В этом отношении лучшими технологическими характери-
стиками обладают турбокомпрессоры, в которых сжатие воздуха
происходит под действием центробежной силы. Они более слож-
ны в обслуживании, ио имеют высокую производительность (от
100 до 1000 м3/мин) и не загрязняют воздух маслом. Недостат-
ком этих компрессоров является то, что они могут эффективно
работать лишь при определенном противодавлении системы и вы-
сокой производительности. При падении давления в системе и
снижении производительности КПД резко падает.
Сжатие воздуха сопровождается его сильным нагреванием, по-
этому после компрессоров воздух поступает в холодильник. Что-
бы удалить из воздуха излишнюю влагу, его необходимо охлаж-
дать до температуры ниже точки росы. Перед фильтрами устанав-
ливают одну большую емкость (ресивер) или систему небольших
сосудов, которые служат для выравнивания давления в системе и
обеспечения равиомериой подачи воздуха иа фильтры. Далее воз-
дух подается на обеспложивание сначала в головной, а затем в ин-
дивидуальные фильтры.
Воздух, отводимый из ферментатора после аэрирования расту-
51
щей культуры, очищается в системе фильтров и выбрасывается в
атмосферу.
В соответствии с технологической схемой получения стериль-
ного сжатого воздуха все фильтрующие материалы можно разде-
лить на три группы: материалы для предварительной очистки воз-
духа, материалы для стадии грубой очистки (головные фильтры)
и материалы для стерилизации воздуха (индивидуальные фильт-
ры). Для нормальной работы фильтрующих материалов необходи-
мо поддерживать в системе воздухоподготовки оптимальный тер-
модинамический режим. Конденсация влаги из воздуха и ее воз-
можное накопление в трубопроводах могут привести к развитию в
них микроорганизмов и септированию процесса. Попадание влаги
на фильтрующие материалы уменьшает эффективность фильтро-
вания и увеличивает сопротивление материала потоку воздуха. Од-
ним из способов предотвращения выпадения влаги в фильтрах яв-
ляется поддержание величины относительной влажности воздуха
на всем пути от компрессорной установки до ферментатора мень-
ше единицы и температуры воздуха в системе значительно выше
точки росы.
Стадия предварительной очистки или обеспыливания воздуха.
На этой стадии из воздуха удаляется основная масса крупных ча-
стиц пыли размером 5—10 мкм. В качестве фильтрующих материа-
лов в фильтрах предварительной очистки используют многослой-
ные проволочные сетки, набивки из стружек металлов, из поли-
мерных материалов, из грубых минеральных и синтетических во-
локон. К фильтрам этого класса относятся масляные или висци-
новые с промасленными металлическими сетками. Масло способ-
ствует оседанию частиц пыли на фильтре и их удерживанию. Сма-
чивающие средства, используемые в висциновых фильтрах, могут
быть бактерицидными, и тогда осаждаемые вместе с пылью мик-
роорганизмы теряют способность размножаться или погибают.
В качестве фильтров предварительной очистки применяются
также губчатые фильтры из модифицированного пенополиуретана.
Эффективность улавливания атмосферной пыли на пенополиурета-
не составляет 50—85 %, его пылесмкость — 0,2 кг/м2. Предельная
рабочая температура использования пенополиуретана равна
121 °C.
Стадия грубой очистки воздуха. Эта стадия очистки осущест-
вляется в головных фильтрах. Эффективность очистки воздуха в
головных фильтрах от частиц диаметром 1 —1,5 мкм, т. е. бакте-
риальных загрязнений воздуха, достигает 98 %.
Широкое распространение в качестве фильтрующего материала
в головных фильтрах получили волокнистые материалы. Волокни-
стые фильтры являются фильтрами объемного действия, так как
они рассчитаны на улавливание и накопление частиц не только на
поверхности фильтрующего материала, но и в глубине слоя. Для
фильтрующего материала с определенным диаметром волокна ха-
рактеристики очистки можно изменять, увеличивая плотность упа-
ковки волокна в фильтре или толщину слоя материала.
52
Наиболее оптимальным является применение многослойной
конструкции однородной волокнистой насадки с различной плот-
ностью слоев, которая дает значительное увеличение пылеемкости
и срока службы фильтра при сравнительно небольшом сопротив-
лении потоку воздуха, высокой эффективности фильтрования и
небольших габаритах фильтра. При такой конструкции более рых-
лые слои располагаются первыми по ходу движения газов. Тол-
щину первого слоя выбирают в пределах 50—60 % общей толщи-
ны насадки. Последний слой насадки, который делают значитель-
но более плотным и небольшой толщины, лимитирует эффектив-
ность всего фильтра.
На предприятиях микробиологической промышленности в го-
ловных фильтрах нашел применение фильтрующий материал из
базальтовых волокон. Основным достоинством базальтового во-
локна является высокая паростойкость (больше чем стеклянного
волокна). При многократном воздействии острого пара под дав-
лением 0,2 МПа волокно не снижает своей прочности в течение
1 года работы фильтра. Свойства базальтового волокна при нагре-
вании до 1100 °C не изменяются. Базальтовое волокно не подда-
ется гниению и горению. Экспериментально показано, что опти-
мальный диаметр волокна для фильтров грубой очистки воздуха
составляет 12—14 мкм. Недостатком базальтового волокна явля-
ется наличие в нем колких игл из базальтовых подплавов и дру-
гих механических включений.
Для очистки больших объемов воздуха применяются нетка-
ные фильтрующие материалы из различных волокон: полиамидных,
полиэфирных, вискозных, металлических, а также различных сме-
сей волокон. Толщина нетканых фильтрующих материалов обыч-
но составляет 1—5 мм, а масса пластины площадью 1 м2 равна от
0,4 до 1 кг.
Материалы первой ступени очистки воздуха достаточно дешевы
и, за исключением нетканых, не регенерируются.
Стадия тонкой очистки воздуха. К этой стадии предъявляются
наиболее жесткие требования. Для тонкой очистки воздуха ис-
пользуются индивидуальные фильтры, которые устанавливаются
перед каждым ферментатором и должны обеспечивать очистку
воздуха от частиц диаметром 0,3 мкм на 99,999 %. Специфическим
требованием, предъявляемым к фильтрующим материалам, при-
меняемым На данной стадии очистки, является необходимость их
периодической стерилизации острым паром вместе со всем обору-
дованием технологической линии.
Фильтрующие материалы, используемые на стадии тонкой очи-
стки, делятся на несколько групп: тонковолокнистые материалы в
виде матов, картона и бумаги, зернистые жесткие фильтрующие
перегородки (керамические, металлокерамические, из полимерных
материалов) и мембранные фильтры. В промышленных фильтрах
тонкой очистки воздуха наиболее часто используются тонковолок-
нистые фильтрующие материалы.
Волокнистые материалы обычно формируют в виде матов-
53
пластин с объемной долей волокон около 0,1. Волокна удержива-
ются либо силами трения, либо с помощью связующего материа-
ла. К этому виду фильтрующих материалов можно отнести базаль-
товое волокно, стекловату, синтетические волокна (вискоза, пер-
хлорвинил). Волокнистые материалы могут быть оформлены так-
же в виде картона и бумаги. Для таких материалов используют
базальтовое супертонкое волокно (БСТВ), хлопкоасбест, стекла,
сополимер винилхлорид и акрилонитрил. Картон и бумага исполь-
зуются для уплотнения матов при упаковке их в фильтре. Волок-
нистые материалы дешевы (от 0,1 до 5 руб. за 1 кг), они облада-
ют малым гидравлическим сопротивлением (0,01—0,03 МПа) и
большой пылеемкостью, поэтому они считаются весьма перспектив-
ными для микробиологической промышленности. Для повышения
устойчивости к воздействию острого пара используют латексные
пропитки. Дополнительно проводят пропитку волокон бактерицид-
ными соединениями, например, антибиотиками, гексахлорофеном и
другими веществами.
Высокоэффективными фильтрующими материалами являются
асбестово-целлюлозные бумаги и картоны. Волокна целлюлозы
толщиной около 15 мкм служат каркасом, на котором лежат во-
локна асбеста толщиной в десятые доли микрометра, которые
удерживают частицы.
Пористые материалы изготовляют из поливинилового спир-
та, металлов, керамики, ацетилцеллюлозы. Фильтрующие материа-
лы этого типа используются в виде пластин или цилиндрических
патронов, имеют большой срок службы (1,5—2 года), хорошо сте-
рилизуются паром. В СССР в качестве пористого фильтрующего
материала используется фторопласт, в Японии — полимер вини-
лового спирта «Эко», изготовляемый из порошка путем прессова-
ния или спекания с расстоянием между частицами порядка не-
скольких десятков микрометров. При движении воздуха по изви-
листым порам происходят инерционное, диффузионное и другие
виды осаждений. Пластина из пористых материалов толщиной
1 см достаточно прочна и легко регенерируется.
Особой группой микропористых материалов являются
фильтры «Миллипор» (США). Размеры пор фильтров варьируют
от 0,005 до 10 мкм. Для стерилизации воздуха чаще всего исполь-
зуются фильтрующие материалы с порами 0,45—0,80 мкм. Однако,
несмотря на высокие фильтрующие свойства этого материала, он
используется сравнительно мало по экономическим соображениям,
поскольку это связано с необходимостью подачи сжатого воздуха
более высокого давления.
При сравнении различных фильтрующих материалов целесооб-
разно пользоваться критерием, предложенным Г. Л. Мотиной и
И. А. Казаковой,
М = ~\f 108 ?D — р° ^пр С
V Рр 1g К”р (8/И)б Смд
54
где Рр — сопротивление материала потоку воздуха, при котором перестает
обеспечиваться регламентная подача воздуха в аппарат, Па; Ро — начальное
сопротивление материала потоку воздуха, Па; Кар — коэффициент проскока
частиц аэрозоля масляного тумана; Кпу, — минимальная величина коэффициента
проскока аэрозоля масляного тумана, которая может быть определена; S —
пылеемкость, кг/м2; т— масса 1 м2 фильтрующего материала, кг; (S/mJe —
удельная пылеемкость базового материала. Обычно эта величина равна 3;
С — количество циклов стерилизации паром, выдерживаемых материалом без
изменения свойств; Сзад — заданное количество циклов паростерилизации. Обыч-
но задается 100.
Значение М и другие свойства ряда фильтрующих материалов
приведены в табл. 1.7. Как видно из таблицы, лучшими материа-
лами по всем показателям являются БСТВ и фторопларт. Для
первой, грубой, ступени очистки используются материалы с М^.
^20, для второй, тонкой, ступени очистки — с Л/>20.
Таблица 1.7
Материал Диаметр волокон или пор, мкм Масса I м*, кг Термостойкость, °C Гидравлическое сопротивление, Па Эффективность по масляному туману, % Критерий М
Маты
1. Стекловолокно ЦФД 2,5-3 0,400 400 8 98,56 26
2. Базальтовое волокно (БСТВ) 1 0,560 600 100 99,92 30
3. Синтетическое волокно
ФПП 15-1,5 1,3 0,025 60—70 15 99,44 25
ФПА 15-1,5 1,4 0,030 250 9 90,10 29
Картон
1. Базальтовый 1 0,300 150 61 99,93 37
2. Целлюлозный 20 0,360 150 59 94,10 27
3. Стекловолокнистый 1—2 0,340 90 56 98,00 32
Бумага
1. Стекловолокнистая «Дельбаг» № 8 3 0,068 _ 35 99,81 34
«Швеция» № 1 — 0,076 — 125 99,80 29
«Нойкафил» 1,5-2,2 0,120 250 96 99,99 27
2. Базальтовая 1 0,025 150 40 89,24 43
3. «Биоцелл» (бактерицидное 17 0,082 120 105 84,30 29
целлюлозное волокно) Пористый материал из пластмасс
1. Фторопласт 25 3,600 260 200 99,97 27
2. Полиэтилен 50 2,250 80 58 94,80 29
3. Поливиниловый спирт (фильтр 25 1,070 150 139 99,00 42
«Эко»)
55
Конструктивное оформление процесса фильтрующей стерили-
зации воздуха зависит от .многих факторов и в первую очередь от
вида материала, которым наполняют фильтр. Конструкция аппа-
рата должна обеспечивать два главных требования к характеру
потока газа: перпендикулярность направления газа к поверхности
мата и движение газа только через слой материала. Перпендику-
лярность волокон потоку газа — необходимое условие эффектив-
ного осаждения. При параллельном направлении волокон эффек-
тивность уменьшается на порядок. Для того чтобы газ, минуя ма-
териал для очистки, не проникал в зазор между материалом и
корпусом или уплотнением, величина зазора должна быть около
0,002—0.05 мм, т. е. соизмерима с расстоянием между волокнами
фильтра.
Для насадок из волокнистых материалов большой толщины
или непрочных при изгибе используются фланцевые (кассетные)
аппараты Ф1 и Ф2; для тонких и гибких — гильзовая (патрон-
ная) конструкция (рис. 1.11). Для предотвращения движения воз-
духа в пристенном слое фланцевой конструкции Ф1 концы мате-
риала зажимаются в фигурных фланцах, которые свободно пере-
мещаются в корпусе и стягиваются болтами. Однако даже при
больших усилиях сжатия некоторое количество воздуха проника-
ет через верхние диски материала в зазоры между фланцами,
корпусом и болтами. Эти недостатки устранены в конструкции
Ф2. где фланцы из текстолита или металла монолитно установле-
Рнс. 1.11. Схема аэрозольных фильтров, изготовленных нз
волокнистых материалов:
а, 6 - фланцевые фильтры Ф1, Ф2: в — патронный фильтр П
56
ны в корпусе фильтра. В каждой фильтрующей кассете из листо-
вого металла заключен диск из волокнистого материала, зажатый
между сетками и отделенный от фланцев резиновыми прокладка-
ми. Лобовую сторону первой кассеты покрывают слоем стеклово-
локна и стеклоткани для защиты от повреждающего действия
крупных частиц окалины, образующейся в паропроводе. В этих
фильтрах грубое вискозное волокно (dB=17 мкм) в матах из вы-
сокообъемиого нетканого фильтрующего материала (ВНФМ)
комбинируется с тремя слоями эффективно фильтрующей, но не-
прочной бумаги «Биоцелл», помещенной в каждой кассете между
двумя матами ВНФМ.
На предприятиях ферментной промышленности в качестве ин-
дивидуальных фильтров к ферментаторам используют фильтры
тонкой очистки типа ФТО (табл. 1.8), внутри которых укладыва-
ется элемент из гофрированной ткани Петрянова.
Таблица 1.8
Тип фильтра Производи- тельность, м’/ч Площадь поверх- ности фильтра- ции, м1 Сопротив- ление потоку воздуха. Па Коэффи- циент проскока, % Выдержи- ваемая темпера- тура, С Фильтру- ющий материал
ФТО-1000 1000 10 800 0,0010 140 ФПАН
ФТО-750 750 10 400 0,0001 60 ФПП-15
ФТО-500 500 5 800 0,0010 140 ФПАН
ФТО-60 60 1 470—600 0,0010 140 ФПАН
Фирма «Балстон» (Великобритания) выпускает фильтры для
воздуха в виде трубок толщиной 3 мм из микроволокон боросили-
катного стекла, связанных эпоксирезииой и обладающих высокой
пропускной способностью. Фильтрующий материал устойчив к дей-
ствию многих кислот, аммиака, хлора, воды, выдерживает темпе-
ратуру до 200°C и обработку острым паром. При замене фильтра
меняются только фильтрующие трубки.
В Японии для тонкой очистки воздуха используют фильтры
«Эко». Фильтрующий слой каждого листа имеет толщину 2,5 мм.
Эти фильтры работают в комплексе с подготовительными фильт-
рами из волокнистых материалов или хлопковой ваты. Фильтры
«Эко» могут выдерживать до 50 стерилизаций и обеспечивают сте-
пень улавливания более 99,9999 %. Они выпускаются с большим
диапазоном производительности — от 0,6 м3 (фильтр 68-А) до
4 080 м3 (фильтр 68-Н) воздуха в час.
Очистка отработавшего воздуха. Система очистки отходящего
воздуха внедрена в производство сравнительно недавно. В настоя-
щее время доказано, что из ферментаторов вместе с удаляемым
воздухом в атмосферу выбрасывается до 1010—10" клеток микро-
организмов и спор в 1 м3, что недопустимо с точки зрения охра-
57
ны окружающей среды. Засоренность воздуха при поверхностном
способе культивирования, особенно на стадии спорообразования,
еще больше. Очистка отходящего воздуха осложняется тем, что
он имеет очень высокую относительную влажность (до 25 г вла-
ги на 1 м3), и обычные фильтры тонкой очистки быстро выходят
из строя.
Экспериментально доказано, что если из отходящего воздуха
конденсировать воду, то вместе с ней удаляется 99 % микроорга-
низмов.
Для очистки выходящего воздуха можно использовать влаго-
и термоустойчивые фильтры фирм «Палл» (ФРГ) нлн «Балстон».
Целесообразно использовать для очистки отходящего воздуха пар-
ные фильтры, из которых один регенерируется, второй работает,
а в целом система работает непрерывно.
Подготовка воздуха для аэрирования производственных поме*
щеннй. Стерильные производственные помещения аэрируются сте-
рильным воздухом, кондиционированным по температуре и влаж-
ности.
Собственно подготовка воздуха в этих условиях ничем не от-
личается от подготовки воздуха для аэрирования растущей куль-
туры. Отличие может заключаться лишь в параметрах кондицио-
нирования, но не в снижении требований к стерильности воздуха.
Стерильные помещения должны иметь воздушные шлюзы, поме-
щения для хранения защитной стерильной спецодежды. Стены,
полы и потолки помещений должны быть влагонепроницаемы и
пригодны для мойки и обработки дезинфицирующими вещества-
ми. Для обеспечения постоянной стерилизации воздуха, например,
в боксах широко применяется ультрафнзлетовое облучение, а так-
же вентиляция их стерильным воздухом.
Система аэрирования производственных помещений с целью
создания нормальных условий для работы обслуживающего пер-
сонала менее сложная в техническом отношении, так как требова-
ния к обсемененностн воздуха здесь менее жесткие. Кратность об-
мена воздуха равняется 5—12. Подаваемый в производственные
помещения воздух должен иметь влажность около 60 % и комнат-
ную температуру. Сухой воздух вызывает раздражение слизистых,
увеличивает восприимчивость организма к инфекции, но вместе с
тем обладает высокой способностью удалять выделяющуюся вла-
гу. При расчете вентиляции производственных помещений преду-
сматривается рециркуляция воздуха. Осушение воздуха осущест-
вляется путем пропускания его через слой зернистого осушителя,
колонну с насадкой нлн распылитель с жидкостью, обладающей
высоким сродством к воде. К твердым осушителям относятся си-
ликагель с зернами величиной 1—4 мм, активированный глино-
зем, безводный сульфат кальция и некоторые другие материалы.
Из жидкостей, обладающих высоким сродством к воде, можно от-
метить гликоли (глицерин, ди- и триэтиленгликоль) и крепкие,
растворы солей.
S8
1.5. ПРОИЗВОДСТВЕННОЕ КУЛЬТИВИРОВАНИЕ
МИКРООРГАНИЗМОВ
Культивирование продуцентов ферментов можно вести поверхностным и
глубинным способами. Поверхностным способом можно вырастить только аэроб-
ную культуру микроорганизма в основном на твердой сыпучей питательной
среде.
Глубинным методом выращивают микроорганизмы в жидкой питательной
среде, и этим методом можно вырастить как аэробные, так и анаэробные микро-
организмы. Подавляющее большинство продуцентов ферментов — аэробы, по-
этому при глубинном культивировании, как н при поверхностном, применяют
принудительное аэрирование растущей культуры микроорганизма.
1.5.1. Факторы, влияющие на биосинтез ферментов
в процессе культивирования
На процесс биосинтеза ферментов оказывают влияние усло-
вия внешней среды, уровень питательных веществ, их сбаланси-
рованность, отвод метаболитов, изменение активной кислотности
среды, температуры, насыщенность среды растворенным кислоро-
дом, состояние н возраст культуры продуцента и многие другие
факторы. В зависимости от способа культивирования и физиоло-
гических особенностей продуцента значимость этих факторов и
степень их влияния на процесс биосинтеза ферментов различны,
однако некоторые общие закономерности можно выделить.
Влажность питательной среды при поверхностном культивиро-
вании. Влажность среды при выращивании продуцента фермен-
тов на твердых сыпучих средах имеет большое значение, так как
при влажности среды от 11 до 20 % развитие микроорганизмов
почти невозможно.
Небольшой рост начинается прн влажности свыше 30 %. Влаж-
ность 40—45 % считается неблагоприятной и способствует обиль-
ному спорообразованию культуры (рис. 1.12, кривая 1). Это об-
стоятельство используется прн получении спороносящей культуры
в качестве посевного материала для поверхностного культивиро-
вания продуцентов ферментов. Прн влажности среды 53—68 % на-
блюдается наибольшее накопление ферментов (см. рис. 1.12, кри-
вые 2, 3, 4). Оптимальная влажность зависит во многом от проду-
цента, но в основном от физического состояния среды прн данной
влажности. Наблюдаемый при влажности свыше 60—68 % спад
биосинтеза ферментов объясняется ухудшением проницаемости
среды для воздуха. Высокая влажность способствует слипанию
частиц среды, нарушению рыхлой структуры и ухудшению усло-
вий роста культуры и биосинтеза ферментов.
Прн поверхностном культивировании с ростом культуры про-
исходит заметное уменьшение содержания сухих веществ, которые
превращаются в СОг и НгО. Поэтому если культивирование ведет-
ся в закрытых емкостях (например, в колбах под ватными проб-
ками, матрацах или в закрытых специализированных кюветах),
где испарение влаги ограничено, то по мере роста культуры на-
блюдается некоторое увеличение влажности (рис. 1.13, кривые 1,
59
Рис. 1.12. Влияние влажности
твердой питательной среды иа
спорообразование (/) и иа на-
копление ферментов (2— ПС;
3 — АС; 4 — ОС)
Длительность культивирования, ч
Рис. 1.13. Изменение влажности сре-
ды (/, 2) и биосинтеза амилолити-
ческих ферментов (3, 4} в процессе
роста культуры
I, 2 — влажность. 3. 4 — амилолитиче-
ская активность. Г. 3 — выращивание в
открытых кюветах: 2, 4 — выращивание
в колбах под ватными пробками в тер-
мостате
2). Но если культура выращивается в открытых емкостях при ин-
тенсивном аэрировании, то наблюдается ее подсушивание (см.
рис. 1.13, кривая 7), которое при 11/<50 % может повлечь за со-
бой уменьшение продуцирующей способности культуры и сниже-
ние активности в готовом продукте (кривая 3).
Оптимальная влажность и ее уровень при культивировании во
многом зависят от физиологических особенностей продуцента, со-
става среды и ее сыпучести, и в каждом конкретном случае опре-
деляются экспериментально.
Аэрирование растущей культуры. Степень аэрирования во мно-
гом определяется способом культивирования и физиологией микро-
организмов — продуцентов ферментов. Аэрирование растущей
культуры преследует три цели: снабжение микроорганизма необ-
ходимым для роста и развития количеством кислорода; удаление
с отходящим воздухом газообразных продуктов обмена; частичное
снятие и отвод выделяемого микроорганизмом в процессе роста
физиологического тепла.
При поверхностном культивировании самое большое значение
придается вопросу отвода воздухом тепла. В связи с этим необхо-
димо рассмотреть фазы роста микроскопических грибов, так как
именно эта группа микроорганизмов в основном используется при
поверхностном способе культивирования.
Первая фаза — это набухание конидий (спор) и их прораста-
ние, ее длительность 10—12 ч. Эта стадия не сопровождается за-
метным тепловыделением, и потому аэрирование культуры уме-
ренное (4—5 объемов воздуха на объем камеры в час) прн отно-
60
сительной влажности воздуха 95—96 % и оптимальной темпера-
туре. Внешних изменений питательной среды на этой стадии не
происходит.
Как только на поверхности среды появляется чуть заметный
пушок, это значит, что начинается вторая фаза (тропофаза) —
стадия активного роста мицелия. Она обычно продолжается 12—
40 ч и сопровождается интенсивным потреблением питательных
веществ из среды, выделением тепла, углекислоты и воды. Мице-
лий гриба пронизывает всю толщу питательной среды, образуя
сросшуюся пористую массу беловатого цвета. Именно в это время
микроорганизм нуждается в интенсивном аэрировании для удале-
ния газообразных продуктов метаболизма, снабжения кислородом
и отвода выделяющегося тепла. В этот период температурный ре-
жим в камере следует соблюдать особенного строго и поддержи-
вать относительную влажность воздуха близкой к 100%, иначе
можно преждевременно подсушить культуру, и накопление фер-
ментов в культуре приостановится (см. рис. 1.13). Важно отме-
тить, что чем интенсивнее аэрирование, тем глубже идут окисли-
тельные процессы, больше потребляется сухого вещества среды на
дыхание и тем меньше выход готовой культуры. Процесс интен-
сивного окисления органических веществ среды сопровождается
выделением большого количества тепла — до 3000—4000 кДж на
1 кг готовой культуры, что составляет 75—80 % всего выделяемо-
го тепла, при этом потребляется до 25—30 % сухого вещества.
Для расчета необходимого воздухообмена обычно строят гра-
фик тепловыделения за весь период выращивания микроорганиз-
ма, так как в зависимости от состава среды и вида микроорганиз-
ма кривые тепловыделения будут различны (рис. 1.14). Так, при
культивировании микроорганизмов на пшеничных отрубях, содер-
жащих 16—25% крахмала (кривые
ние достигает 340—375 кДж/(кг-ч),
мущественно из шелухи крупяных
культур, содержащих в 3 раза мень-
ше крахмала (кривая 3), удельное
тепловыделение около 125 кДж/
/(кг-ч).
Производительность аэрирующих
установок определяется по второй
стадии роста культуры. Обычно на
этой стадии кратность воздухообме-
на составляет 30—60 м3/(м3-ч) прн
относительной влажности 100%.
Воздух, подаваемый в камеру на
второй стадии роста культуры, име-
ет температуру на 2—3°С ниже, чем
на первой. Это связано с тем, что
воздух, проходя над растущей куль-
турой. нагревается на 2—3°С, так
как культура микроорганизма в этот
и 2), удельное тепловыделе-
а на среде, состоящей преи-
Длительностъ культивирования, ч
Рис. 1.14. Удельное тепловыделе-
ние в процессе поверхностного
культивирования различных куль-
тур:
( — A. oryiae St-.: 2 — A. awamo-
ri 16. 3 — Trjehotheciinn roseuni
61
период заметно (на 4—5°C) разогревается. Влагоемкость отходя-
щего воздуха повышается, и он уносит часть влаги из культуры.
Происходит подсыхание культуры, особенно ее верхнего слоя. Без
ущерба для качества готовой культуры при аэрировании может
быть удалено до 0,5 кг влаги на 1 кг культуры с учетом убыли
сухого вещества в процессе роста и выделения НгО при дыхании.
Средняя физиологическая потребность в кислороде в фазе ак-
тивного роста составляет около 7,6 м3 на 1 т культуры в час, или
в пересчете на воздух при условии полного потребления из него
кислорода — около 36,5 м3 иа 1 т культуры в час. Общая потреб-
ность в воздухе, необходимая для нормального развития грибов,
составляет в среднем 600—650 м3 на 1 т культуры за весь цикл
роста.
Третья фаза (идиофаза) соответствует биохимической и мор-
фологической специализации культуры, когда наблюдаются кони-
диеобразование и накопление вторичных метаболитов. Это период
интенсивного образования микроорганизмами внеклеточных фер-
ментов. На этой стадии рост гриба несколько притормаживается,
гриб достигает физиологической зрелости. Для большинства мик-
роскопических грибов на этой стадии развития рекомендуется сни-
зить температуру в растильных камерах на 3—4 °C и уменьшить
воздухообмен в 3—5 раз по сравнению с периодом интенсивного
роста. Когда накопление ферментов в культуре достигает макси-
мума, в камеру подают сухой, подогретый до 38—40°C воздух.
Культура за 2—3 ч подсыхает на 10—15%, что облегчает ее по-
следующую обработку и отделение от перфорированной поверхно-
сти кювет.
Расход воздуха при поверхностном способе культивирования
для снятия тепла приблизительно в 90—100 раз превышает физио-
логическую потребность в нем микроорганизмов, поэтому процесс
подвода О2 к культуре и отвода углекислоты не является лимити-
рующим. При глубинном выращивании аэрирование также очень
важно, поскольку подавляющее количество продуцентов является
аэробными. Это можно проиллюстрировать на примере культиви-
рования нескольких продуцентов ферментов (рис. 1.15 и 1.16).
Анализ данных показывает, что аэрирование глубинной культуры
является важным фактором и его интенсивность по-разному влия-
ет на продуцирующую способность различных микроорганизмов.
Даже одни и тот же микроорганизм при различной степени аэри-
рования неодинаково накапливает отдельные ферменты (см.
рис. 1.15). В целом же увеличение степени аэрирования среды
приводит, как правило, к интенсификации процесса биосинтеза
ферментов и в большинстве случаев к сокращению длительности
культивирования (рис. 1.17).
В настоящее время вопросам аэрирования и перемешивания в
ферментной промышленности уделяется большое внимание, так
как в этом заложены скрытые резервы интенсификации производ-
ства ферментных препаратов при глубинном культивировании
микроорганизмов. Количество воздуха, расходуемого на аэрирова-
62 '
Рис. 1.15. Биосинтез глюкозоизоме
разы S.' albogriseolus 20-3 (по дан-
ным А. В. Гавристова, 1980):
1, 2, 3 — изменение pH среды; 2',
3' — глюкозоизомеразнзя вктнэиость;
2", 3" — накопление биомассы. В слу-
чаях I, !'. /" аэрация составляет
0.5 маДм3 • мин); в случаях 2. 2' 2” —
I мэ/(мэ мин); а случаях 3, 3', 3 —
1—1.5 мэ/(м3 • мни)
Рис. 1.16. Биосинтез ферментов
микроорганизмами:
В. mesentericus ПБ: 1—а-вмилазиая актив-
ность; 2 — протеолитическая активность:
Trichoderme longibrachiatum 7-26; цел-
люлазная активность
ние, определяется степенью растворения кислорода в среде, кото-
рая зависит от вязкости среды и конструктивных особенностей
ферментатора и поэтому в каждом случае требует эксперименталь-
ного изучения и уточнения.
Длительность культивирования. Скорость роста отдельных
штаммов неодинакова. Оптимальная длительность культивирова-
ния, обеспечивающая максимум накопления ферментов, устанав-
ливается экспериментально. Она зависит от очень многих факто-
ров: состава среды и способа ее подачи при культивировании
(рис. 1.18 и 1.19), степени аэрирования среды (см. рис. 1.17), от
того, является ли фермент внеклеточным или внутриклеточным, от
рода продуцента (см. рис. 1.15 и 1.20) и др. Из рис. 1.18 видно,
что дополнительное введение среды (подпитка) в начальной ста-
дии роста позволяет на 30—40 % сократить длительность культи-
вирования и значительно повысить продуктивность микроорганиз-
мов. Длительность культивирования чаще всего зависит от физио-
логических особенностей выбранного продуцента. Из рис. 1.21 вид-
но, что длительность культивирования, соответствующая макси-
мальному накоплению активности для В, mesentericus ПБ, со-
ставляет 36 ч, для A. awamori — 144 ч. Поэтому прогнозировать
оптимальную длительность выращивания очень сложно и требует-
ся ее экспериментальное определение.
63
Рис. 1.17. Влияние аэрирования иа
длительность культивирования Endo-
mycopsis sp. 20-9 и биосинтез глюко
амилазы:
/ — выращивание на круговой качалке
(объем среды 100 мл, объем колбы
750 мл); 2, 3. 4 — выращивание в фер
ментаторе объемом 45 л. В случае 2 сте-
пень аэрирования равна 30 л/(л •ч); в
случае 3 — 50 л/(л • ч); в случае 4 —-
60 л/(л • ч)
Рис. 1.18. Влияние состава среды в
дробного введения ее на длнтелъ
ность культивирования н биосинтез
р-глюканазы и накопление биомассы
(но данным Ю. Л. Белогорцева.
1978):
/. Г- содержание биомассы (б)’.
2' — 0 глюканаэная активность. ед./мл
< ГлА); 3. 3—содержание редуцирую-
щих веществ (РВ). В случаях I. 2. 3
среда нс доливалась (контроль); в слу
чаях Г. Д на Н-м ч роста ирон {Води-
лось доливание среды
Величина pH среды. При поверхностном культивировании pH
среды меньше влияет на процесс образования ферментов, так как
в силу высокой буферности и малой влажности среды он почти не
изменяется. При глубинном культивировании pH среды имеет ре-
шающее значение, он сильно изменяется при стерилизации сред и
особенно в процессе культивирования.
При поверхностном культивировании для увлажнения твердой
среды используется водопроводная вода, pH увлажненной среды
в этом случае составляет 5,0—5,6. Довольно часто отруби увлаж-
няют слабыми растворами соляной, серной или молочной кислоты,
тогда pH увлажненной среды равен 4,5—5,0. Добавление кислот
способствует созданию селективных условий для развития микро-
скопических грибов, что позволяет снизить требования к стерили-
зации среды и воздуха.
Влияние pH среды при глубинном культивировании микроор-
ганизмов огромно, причем большое значение имеет не только его
64
Рис. 1.19. Влияние состава среды и
длительности культивирования
биосинтез липазы Rhizopus
sporus (по данным
1980):
/ — водный экстракт
та; 2— кукурузный
лочиая сыворотка
иа
micro-
Т. Ф. Зубеико,
хлопкового шро-
экстракт; 3 — мо-
Рис. 1.20. Динамика накопления а-
амилазы при глубинном культивиро-
вании микроорганизмов:
/ — A. oryzae 3-9-15; 2 — В. mesenteri-
cus ПБ; 3—Endomycopsis sp. 20-9; 4 —
A. awamori
исходная величина, но и изменение его при стерилизации и в ре-
зультате потребления катионов или анионов среды в процессе
жизнедеятельности микроорганизмов. В результате такого потреб-
ления происходит либо подщелачивание, либо подкисление куль-
туральной жидкости.
Оптимальное исходное значение pH среды зависит от особенно-
стей продуцента, ио можно выделить общие закономерности. Гри-
бы и дрожжеподобные организмы хорошо растут и образуют фер-
менты в средах с pH от 3,8 до 5,6. Бактерии лучше всего развива-
ются прн pH, близком к нейтральному (6,2—7,4). В зависимости от
состава среды н продуктов метаболизма pH среды может сдвигать-
ся как в кислую, так и в щелочную зону. Есть данные о возмож-
ности накопления в культуральной жидкости преимущественно од-
ного фермента при поддержании pH среды иа определенном
уровне.
3 Зак. 232
65
Рис, 1.21. Влияние pH среды на фер-
ментсинтезирующую способность микро-
организмов:
S. albogriseolus 28-3: 1 — внутриклеточная
глюкозоизомеразиая активность; 2 — био-
масса; Endomycopsis sp. 20-9: 3— глюкоами-
лазная активность; 4 — мальтазная (глико-
зклтраисферазиая) активность
Рис. 1.22. Биосинтез глюкозоизомера-
зы при различных температурах:
/ — 29 °C; 2 —32 °C; 3 — 35 °C; Г. 2', 3'—
изменение pH среды прн соответствую-
щих температурах
Большинство микроорганизмов очень чувствительно к уровню
pH среды, и малейшее отклонение значения pH от оптимального
приводит к резкому снижению способности микроорганизмов об-
разовывать ферменты (рис. 1.21 и табл. 1.9).
Таблица 1.9*
pH Биомасса, мт/мл Пектолнтнческая активность (ПкА) Пектинтрансэлиминазиая активность (ПТЭ)
и сходный конечный ед/мл ед/мг ед/мл ед/мг
2,6 3,40 6,35 5,45 0,85 0,00 0,00
3,0 3,65 6,19 3,62 0,58 0,10 0,01
4,0 3,80 4,03 2,22 0,55 1,35 0,33
5,0 4,50 3,95 1,91 0,48 2,30 0,58
6,0 5,15 3,25 1,05 0,32 2,45 0,75
7,0 6,60 2,25 0,35 0,15 3,25 1,44
8,0 6,80 1,55 0,17 0,11 3,60 2,32
• Для штамма Р. dlgitatum 24П.
Температура культивирования. Большинство продуцентов фер-
ментов, особенно микроскопические грибы, является мезофильны-
ми микроорганизмами, и оптимальная температура нх развития
равна 22—32 °C (рис. 1.22). Среди бактериальных продуцентов
66
ферментов часто встречаются термофильные микроорганизмы, для
которых оптимальная температура культивирования составля-
ет 35—55 °C. Так, для развития В. mesentericus ПБ требуется тем-
пература 37 °C, для В. diastaticus — 60—65, для A. oryzae — все-
го 28—30 °C. В то же время продуцент липазы Rhizopus microspo-
rus имеет оптимальную температуру роста и биосинтеза фермента
при 40 °C.
Термофильные микроорганизмы представляют особый интерес
для промышленного использования, так как культивирование при
высоких температарух создает селективные условия для их раз-
вития и позволяет снизить требования к стерильности процесса.
Кроме того, термофильные микроорганизмы синтезируют фермен-
ты, обладающие повышенной термостойкостью. Температура ока-
зывает большое влияние на скорость накопления ферментов (см.
рис. 1.22, кривые /, 2). Если микроорганизм термостабилен, то с
повышением температуры культивирования возрастает скорость
накопления фермента, а иногда и суммарное количество синтези-
руемого фермента.
1.5.2. Поверхностное культивирование микроорганизмов
Процесс культивирования продуцента начинается с момента
засева охлажденной стерильной питательной среды посевным ма-
териалом. Засев среды при периодической стерилизации обычно
проводится непосредственно в стерилизаторе в охлажденную сре-
ду при постояннном перемешивании. При непрерывной стерилиза-
ции среду засевают в отсеке стерилизатора, где она охлаждается,
а засеянную среду передают в цех выращивания.
Поверхностное культивирование микроорганизмов может про-
водиться различными способами. Традиционным является кювет-
ный способ, который требует применения ручного труда и огром-
ных производственных площадей. Более новым методом является
выращивание продуцентов в механизированных установках.
Кюветный способ выращивания. Элементарной ячейкой для
выращивания является кювета — емкость четырехугольной фор-
мы площадью 0,25—0,50 м2 и высотой 20—50 мм. Она изготовля-
ется из листа металла с перфорированным дном и реже — из
сплошного листа. Кюветы бывают открытые и с крышками. Наи-
большее распространение получили открытые кюветы из оцинко-
ванного железа с перфорированным днищем. Перфорация выпол-
няется в виде продолговатых узких щелей длиной 20 мм и шири-
ной 1,5—2 мм, расположенных либо в шахматном порядке, либо
подряд с зазором между отверстиями 3—5 мм и расстоянием меж-
ду рядами 10 мм.
Кюветы заполняют увлажненной засеянной питательной сре-
дой слоем 2—2,5 см и транспортируют в растильные камеры, где
кюветы располагаются на многоярусных подвижных этажерках
или стационарных стеллажах с расстоянием между ярусами 10—
11 см. Обычно в стеллажах и этажерках устроено 18 ярусов при
3*
67
общей высоте не более 2 м. Первая кювета устанавливается на
высоте 20—25 см от пола. Этажерки и стеллажи должны выпол-
няться из металла с антикоррозийным покрытием. Перед загруз-
кой кювет камеру моют и дезинфицируют формалином, который
затем удаляется из камеры при аэрировании и обработке аммиа-
ком. Камеры бывают различного типа и формы. Они могут исполь-
зоваться с максимальным заполнением пространства и иметь вы-
соту 2,2 м, или с более свободным заполнением, когда высота по-
толков может быть 3 м и более. Камера может заполняться кю-
ветами сплошь, например, на передвижных стеллажах-этажерках,
или кюветы могут располагаться на стационарных стеллажах,
когда между стеллажами предусматривается свободный проход.
Чаще всего камера имеет форму длинного узкого коридора с две-
рями в торцах. Непосредственно над камерой располагается отде-
ление кондиционирования и очистки воздуха.
Камеры всех типов работают по следующему графику: загруз-
ка; культивирование (обычно составляет от 20 до 72 ч); подсуш-
ка культуры на кюветах сухим, подогретым до 40—45 °C (<р=
=254-30%) воздухом в течение 3—4 ч; выгрузка; уборка и мой-
ка камеры; обработка формалином, аммиаком и паром (3 ч) и
проветривание камеры (около 3 ч). Полный технологический цикл
в камере с учетом длительности роста продуцента обычно состав-
ляет от 36 до 90 ч и зависит от вида продуцента.
Растильные камеры располагают так, чтобы в них можно бы-
ло вести выращивание культуры с соблюдением всех правил асеп-
тики. Каждая камера имеет два выхода. С одной стороны камера
соединена со стерильным коридором, из которого в камеры загру-
жают кюветы с только что засеянной средой, а с другой примы-
кает к разгрузочному коридору, по которому из камер транспорти-
руют кюветы с готовой культурой. Использование кювет в произ-
водстве ферментов связано с затратой большого количества руч-
ного труда, так как почти все операции на стадии культивирова-
ния выполняются вручную. И хотя получение культуры продуцен-
та технологически сравнительно просто, ее себестоимость доста-
точно высока.
Выращивание в механизированных установках. Основная труд-
ность при создании механизированных линий заключается в том,
что слой питательной среды должен хорошо аэрироваться,
не спрессовываться и не подсушиваться. Механизированная уста-
новка должна быть устроена так, чтобы можно было без остановки
линии в случае возникновения инфекции провести стерилизацию
и немедленную выгрузку зараженной среды. К механизированным
растильным установкам относятся линии Джеффриса, Христен-
сена, Андеркофлера, производства ЧССР, установки фирмы «Ва-
лерштейн», конструкции ВНИИФСа, ВНИИбиотехники и ряд дру-
гих.
В установке Джеффриса осуществляется механизированная за-
грузка обсемененной среды в кюветы, которые перемещаются по
транспортеру и с помощью специального устройства передаются
68
на подвесную этажерку. Загруженная этажерка по монорельсу
входит в растильный коридор, где создаются требуемые условия,
и со скоростью в зависимости от длительности культивирования
продуцента перемещается к другому концу коридора. Готовая
культура при выходе из растильного коридора автоматически раз-
гружается, и цикл повторяется. В установке Христенсена процесс
выращивания осуществляется на непрерывно движущейся ленте
скребкового транспортера и процесс накопления ферментов в куль-
туре завершается в растильной камере барабанного типа. Но эти
установки имеют существенный недостаток: в случае инфицирова-
ния необходимы полная остановка процесса и стерилизация всей
линии.
Более надежны механизированная установка производства
ЧССР, полумеханизированная установка Андеркофлера и установ-
ка фирмы «Валерштейн», где предусматривается циклическая ра-
бота аппаратов с обязательной стерилизацией всего оборудования
после каждого цикла выращивания. Механизированная установка
производства ЧССР для выращивания поверхностной культуры,
обладающая сравнительно небольшой производительностью
(0,4 т/сут), представляет собой камеру, в которой размещен мно-
гоярусный цепной транспортер с подвешенными к нему лотками.
При движении транспортера лотки заполняются до тех пор, пока
первый заполненный лоток не дойдет до последней позиции ниж-
ней ленты транспортера. Затем камера подключается к кондицио-
неру, движение транспортера прекращается до конца культиви-
рования. Когда рост закончен, включают транспортер, лотки по-
очередно опрокидываются, культура попадает в бункер. После
разгрузки камера и лотки моются, стерилизуются, и цикл повто-
ряется.
Механизированная установка Андеркофлера имеет большую
производительность — до 10 т/сут. Растильная камера пред-
ставляет собой узкий длинный коридор, к стенам которого от по-
толка до пола прикреплены откидные полки. Стены камеры с
внешней стороны непосредственно контактируют с воздуховодами
кондиционера. Воздух поступает через перфорации вдоль коридо-
ра по всей высоте камеры с одной стороны и забирается с другой.
Полки, начиная снизу, поочередно поворачиваются горизонтально
и автоматически загружаются. По окончании роста культуры она
разгружается с полок при их последовательном опускании, начи-
ная с нижней. Культура скапливается на дне камеры, откуда
транспортируется в сушилку. После окончания цикла предусмат-
риваются мойка и стерилизация камеры.
Интерес представляет механизированная растильная установка
фирмы «Валерштейн» (США) барабанного типа диаметром 2,1 м
и длиной 5,2 м. Внутри барабана расположена рама для распреде-
ления среды. В барабан загружается среда (до 200 кг), и он вра-
щается со скоростью 100 мин-'. Воздух вводится по оси барабана
(до 20 000 м3/ч) с высокой относительной влажностью. Вращение
барабана способствует перемешиванию, аэрированию среды, улуч-
69
Рис. 1.23.Установка с вертикальными кюветами для выращивания поверхностной
культуры:
а —общая схема: 7 •—поворотный круг; 2— вибрационный стол для загрузки; 3 — стери-
лизатор камер; 4 —толкатель; 5 — устройство для мойки камер; 6 — стол для раз-
грузки; 7 — коридор с кондиционерами для выращивания; 8 — транспортер; 9 — растиль-
ная камера; 10 — рельсовый путь; о— растнльная камера; в—кювета
шению тепло- и массообмена, благодаря чему возможно культиви-
ровать продуцент в слое среды до 200 мм и более.
В СССР наиболее перспективными являются две установки:
установка с вертикальными кюветами конструкции ВНИИФСа и
механизированная установка конструкции ВНИИбиотехники для
выращивания в толстом слое среды. Первая установка для выра-
щивания культуры в вертикальных кюветах (рис. 1.23, а) имеет
производительность 1,5 т/сут. Простерилизованные засеянные
отруби с помощью специального распределительного устройства
загружаются на вибрационном столе в растильную камеру и по
рельсовому пути подаются в растильное отделение. На специаль-
ных траверсных тележках растильные камеры подводятся к воз-
душным диффузорам. Последние подключены к кондиционерам,
70
которые могут подавать воздух к растущей культуре по разным
режимам в зависимости от фазы роста культуры. Аэрирование
культуры осуществляется через вертикальные каналы, находящие-
ся между кюветами, через перфорированные стенки кювет. Воздух
перемещается вдоль кювет. Кондиционеры работают с рециркуля-
цией воздуха, подсос свежего воздуха составляет 10%. Выброс в
атмосферу отработавшего воздуха также 10%. Отработавший воз-
дух перед удалением очищается от микрофлоры и пыли. Культу-
ра в растильиой камере практически не подсыхает, даже наблю-
дается ее дополнительное увлажнение влагой, выделяемой микро-
организмом в процессе роста. Схематически растильная кам-ера
представляет собой ящик прямоугольной формы из алюминиевого
сплава (рис. 1.23,6). Перфорированные перегородки с круглыми
отверстиями диаметром 3 мм и шагом 40 мм образуют внутри
ящика вертикальные кюветы. Просветы между кюветами выпол-
няют роль воздушных щелевых каналов. Кюветы могут откры-
ваться снизу и сверху (рис. 1.23, в). При росте культуры мицелий
наиболее интенсивно развивается около отверстий в стенках кювет
и врастает в них. Корж готовой культуры при разгрузке очень
трудно отделяется от кюветы, поэтому вертикальную стенку кю-
веты по окончании культивирования отодвигают, корж освобож-
дается и легко удаляется из камеры на вибрационном столе для
разгрузки. Коржи, выходящие из растильной камеры, разрезаются
ножом, который перемещается в горизонтальной плоскости под
дном растильной камеры. Частично измельченная культура попа-
дает в бункер, на дне которого установлены горизонтальные
транспортирующие шнеки, подающие культуру к поперечному
шнеку. Из приемника культура поступает по наклонному редлеру
в сушилку, где высушивается до влажности 10—12 %, затем на
фасование и в склад.
Освобожденная от культуры растильная камера по рельсово-
му пути подается в моечную камеру, снабженную форсунками,
подающими мощные струи воды. Растильная камера моется и за-
тем стерилизуется в специальной стерилизационной камере (см.
рис. 1.23, а). Чистая простерилизованная растильная камера по-
дается в стерилизационное отделение иа вибрационный загрузоч-
ный стол, и цикл повторяется. Вместимость каждой камеры со-
ставляет 500 кг по сухим отрубям.
Преимущества этой установки заключаются в полной механи-
зации процесса выращивания, в изолировании растильных камер,
позволяющем в случае необходимости изолировать очаг инфекции
и провести полную последовательную стерилизацию всех камер,
что нельзя сделать в непрерывиодействующих установках.
Механизированная установка для выращивания культуры
микроорганизма в толстом слое среды конструкции ВНИИбиотех-
ники представлена на рис. 1.24. Сложность выращивания в тол-
стом слое связана с тем, что происходит перегрев внутренних сло-
ев в результате интенсивного тепловыделения и аэрирование
культуры сильно затруднено. При выращивании культур в закры-
71
Рис. 1.24. Аппарат для механизи-
рованного выращивания микроор-
ганизмов в слое среды:
1 — люк для выгрузки: 2 — валик
секции; 3 — опора; 4 — коллектор
подвода стерильного воздуха; 5*—
охлаждающие змеевики; 6 — лопасть
вала; 7—коллектор отвода отрабо-
танного воздуха; 5 — крышка; 9—
бобышка манометра; /0 — штуцер;
11 — воздушник; 12 — шестерня при-
вода вала; 13— вал; 14— люк для
загрузки; /5 — корпус
том герметичном аппарате
движение газа происходит
не вдоль поверхности слоя
среды, а распространяется
на весь объем. Возникает
режим объемной аэрации,
способный обеспечить кон-
вективный и диффузионный
тепломассообмен по всей вы-
соте слоя растущей культу-
ры, что позволяет в 10 и бо-
лее раз увеличивать высо-
ту слоя среды (до 300 мм).
Аппарат представляет со-
бой вертикальный цилиндр,
разделенный на секции пер-
форированными пластинами,
укрепленными консольно на
поворотных осях. Внутри ап-
парата расположены пере-
мешивающие устройства для
периодического перемешива-
ния, обеспечивающие равно-
мерность высоты слоя и ис-
ключающие образование за-
стойных зон среды внутри
каждой секции. Таким обра-
зом, в слое поддерживается
заданное воздухораспределе-
ние. Верхняя часть аппара-
та герметично соединена со стерилизатором. Стерильный воздух
для аэрирования поступает в каждую секцию под перфорирован-
ные пластины с заданными температурой и объемом и перед вы- •
ходом в атмосферу подвергается бактериальной очистке.
Отвод биологического тепла, выделяемого в процессе активно-
го роста, производится воздухом. Для этой же цели установлены
рубашки. Интенсивность перемешивания внутри каждой секции
может быть разной в соответствии с заданным режимом, разра-
72
ботанным для каждой культуры. Перемещение среды с вышеле-
жащей секции на нижележащую производится при автоматиче-
ском повороте пластины на 90°. Выращенная культура поступает
в нижнюю коническую часть аппарата и стерильно выгружается
в приемный бункер сушилки либо экстрактора.
При тщательном исследовании процесса выращивания культур
A. awamori 16, A. foetidus, A. oryzae, A. terricola и др. установле-
но, что в аппарате конструкции ВНИИбиотехники можно осущест-
вить процесс их выращивания в слое высотой не менее 300 мм в
абсолютно герметичных условиях. При этом ферментативная ак-
тивность культуры соответствует той, которая получается при
обычном поверхностном способе культивирования.
1.5.3. Глубинное культивирование микроорганизмов
Этот способ имеет ряд очевидных преимуществ перед поверх-
ностным, так как позволяет значительно сократить производствен-
ные площади, исключить тяжелый непроизводительный ручной
труд, улучшить гигиену труда, упрощает механизацию и автома-
тизацию производства, делает возможным переход на непрерыв-
ный способ культивирования. При глубинном способе культивиро-
вания более рационально используются питательные вещества
сред, что дает возможность значительно сократить отходы произ-
водства в виде нерастворимых осадков твердой питательной сре-
ды, получать препараты ферментов с меньшим содержанием при-
месей и большей удельной активностью.
Глубинное культивирование проводят в вертикальных емкостях
различного размера, называемых ферментаторами. Основное тре-
бование к ферментатору — возможность проведения процесса
культивирования продуцента в асептических условиях при интен-
сивном аэрировании среды. В процессе культивирования прихо-
дится иметь дело со сложной трехфазной системой жидкость —
твердая взвесь — газ. В такой системе затруднены массообмен-
ные процессы, и поэтому усложняется аппаратурное оформление
всей стадии выращивания.
Существующие промышленные ферментаторы по способу под-
вода энергии на аэрирование и перемешивание можно подразде-
лить на три группы: аппараты с механическим перемешиванием
и барботажем (комбинированные); с эжекционной системой аэри-
рования (подвод энергии к жидкой фазе) и барботажные (под-
вод энергии к газовой фазе). Для ферментной промышленности
наибольший интерес представляет первая группа аппаратов, пред-
назначенная для асептических процессов. Эти аппараты в основ-
ном имеют цилиндрическую форму и отличаются по объему, кон-
струкции отбойников, перемешивающих устройств, уплотнений
вращающегося вала и теплообменным устройствам. Максималь-
ный объем ферментаторов с механическим перемешиванием и пе-
ногашением составляет 2 000 м3. Фирма «Хемап» располагает
73
внедренными разработками герметичных ферментаторов вмести-
мостью до 360—400 м1 * 3.
Из отечественных аппаратов наиболее широко используются
герметизированные ферментаторы вместимостью 50 м3 и вмести-
мостью 100 м3 с механическим перемешиванием и барботажем
воздуха (рис. 1.25). Кроме этих двух ферментаторов на многих
ферментных предприятиях работают аппараты вместимостью
63 м3 производства ГДР (рис. 1.26).
Рис. 1.25. Ферментатор барботажного типа с перемешивающим устройством
объемом 100 м3:
1 — привод; 2 —корпус,* 5 — муфта; 4 — барботер; 5 — крыльчатка; 6 — змеевик; 7 — тур-
бина; 8— вал; 9 — труба для вывода жидкости из ферментатора под избыточным дав-
лением
74
Рис. 1.26. Ферментатор объемом 63 м3
производства ГДР:
1 — электродвигатель; 2 —редуктор; 3, 10 —
муфты; 4—подшипник; 5—сальник; б—вал:
7— корпус: 8 — турбинная мешалка; 9—
змеевиковый теплообменник; // — труба
для подвода воздуха; 12— лопастная мешал-
ка; 13— барботер; 14— винтовая мешал-
ка; 15— опорный подшипник; 16 — штуцер
для спуска; /7—рубашка; 18 — люк для за-
грузки; 19 — патрубок для выхода воз-
духа
Аппараты рассчитаны для ра-
боты под избыточным давлени-
ем 0,25 МПа и стерилизации при
температуре 130—140 °C. Во из-
бежание инфицирования культу-
ры предусмотрены торцовые уп-
лотнения вала перемешивающе-
го устройства с паровой защи-
той. Торцовые уплотнения позво-
ляют практически полностью
предотвратить утечку среды или
попадание воздуха в полость ап-
парата в месте выхода из него
вала, что очень важно для обес-
печения асептических условий
процесса.
Важным фактором с точки
зрения асептики процесса культи-
вирования продуцента является
правильная обвязка ферментато-
ра. Под обвязкой подразумева-
ют подвод всех коммуникаций с
учетом возможности стерилиза-
ции острым паром участков, ко-
торые могут явиться источником
заражения.
Анализ монтажных схем, скрупулезно проведенный В. Е. Мат-
веевым, показывает, что они обычно состоят из типовых элемен-
тов. Рассмотрим одну из монтажных схем с нижним спуском сре-
ды, применяемых в самых различных микробиологических произ-
водствах (рис. 1.27). Ее характерной особенностью является уста-
новление термических затворов 3 и 5 для предупреждения про-
никновения посторонней микрофлоры в аппарат по коммуникаци-
ям через неплотности в уплотнениях «седло — клапаи> запорной
арматуры. В материальные трубопроводы, непосредственно соеди-
ненные с внутренней полостью аппарата, постоянно подается пар,
а образующаяся пароконденсатная смесь отводится в канализа-
цию или специальное устройство (при наличии открытых трубных
окончаний). Как показывает опыт микробиологических произ-
75
водств, такие термические затворы обеспечивают весьма эффек-
тивную защиту аппаратов и коммуникаций от инфицирования.
В монтажных схемах должен предусматриваться свободный
доступ пара во все точки стерилизуемых внутренних полостей ап-
паратов, трубопроводов и запорной арматуры, что обеспечивает
достижение н поддержание требуемой температуры стерилизации.
Однако на практике часто одно и то же монтажное оформление
коммуникаций и запорной арматуры различного диаметра не обес-
печивает равного стерилизующего эффекта. Например, в запорной
арматуре н штуцерах малого диаметра требуемой степени
стерильности достичь труднее. Еще большие трудности возникают
при термической стерилизации открытых трубных окончаний
[пробник 4, штуцер для введения посевного материала /, трубо-
провод для удаления отработавшего технологического воздуха 2
(см. рис. 1.27)]. Открытые трубные окончания коммуникаций и уз-
лов монтажных схем не позволяют создать в них давление, необ-
76
ходимое для эффективной стерилизации. Использование резино-
вых шлангов для подключения бутылей и колб с посевным мате-
риалом, пробоотборников и емкостей с жидкими добавками еще
больше затрудняет процесс стернлизацнн.
К открытым трубным окончаниям относятся и так называемые
штуцеры для продувки коллекторного трубопровода для стериль-
ной питательной среды, соединяющего установку непрерывной сте-
рилизации питательной среды (нлн аппарат периодического дей-
ствия) с ферментаторами. Такая схема коммуникации предусмат-
ривает подачу острого пара в линию в течение времени, гаранти-
рующего стернлнзуемость коллекторов питательной среды.
Следует также уделять большое внимание процессу ценообра-
зования прн культнвнрованнн н устройствам для пеногашения.
Все существующие н используемые в ферментной промышленно-
сти ферментаторы снабжены специальными устройствами для вве-
дения пеногасителя н контроля высоты пены в аппарате. Пере-
брос пены крайне нежелателен, так как прн этом могут произой-
ти намокание воздухоочнстных фильтров н нарушение условий
герметизации н стерильности процесса.
Схема пеногашения, принятая в стерильных производствах, представлена
иа рис. 1.28. В нее включены датчики 1, 2 и 3 различных уровней пены,
работающих либо по принципу замыкания цепи «датчик — корпус аппарата»
либо при изменении электропроводности пены, либо по принципу измеиеиия
электрической емкости между датчиком и корпусом аппарата в момент касания
пены и датчика. При касании пеной первого датчика через усилитель У1 вклю-
чается электромагнитный клапан СК1, установленный иа линии подачи пенога-
сителя из мерника, время подачи пеиога
По окончании подачи пеногасителя вкл:
продолжает расти и соприкасается со
вторым датчиком, то через усилитель
У2 выключится электродвигатель ме-
шалки иа время, установленное РВ2.
Когда мешалка снова начинает рабо-
тать, РВ2 срабатывает и повторно вклю-
чается РВ1. Связь между РВ1 и РВ2
обеспечивает двойное последовательное
пеногашение: с помощью певогасителя
и путем выключения мешалки. Если
пена не опускается ниже первого дат-
чика, то подача пеногасителя в аппарат
и остановка электродвигателя мешалки
повторяются.
В случае достижения пены аварий-
ного датчика 3 через усилитель УЗ сра-
батывает электромагнитный клапан СК2
и закрывается выход воздуха из аппа-
рата. Под действием давления пена
разрушается и, как только оиа сходит
с датчика 3 в результате сжатия газа
и прекращения барботажа, клапан СК2
открывается, и аэрирование возобнов-
ляется. Но при использовании такого
способа следует учитывать аэрофиль-
иость продуцента и закладывать в про-
грамму только допустимую продолжи-
тельность кислородного голодания.
регулируется реле времени гш.
। реле времени РВ2. Если пеиа
Рис. 1.28. Схема автоматизации пено-
гашения:
I, 2, 3— датчики уровня пены; У/, У2,
УЗ — усилители электросигнала; PBI.
РВ2 — реле времени; СК1. СК2 — элек-
тромагнитные клапаны; МП — магнитный
пускатель; Л! — электродвигатель ме-
шалки
77
В последнее десятилетие наиболее экономически выгоден метод комбини-
рованного химического и механического пеногашения. Для его автоматической
реализации может быть использована та же схема.
В процессе культивирования также ведется постоянный конт-
роль за накоплением ферментов, состоянием биомассы продуцен-
та, pH среды, потреблением некоторых составляющих среды и т. д.
По окончании культивирования культуральная жидкость подается
либо непосредственно в производство, где она используется (спир-
товое, пивоваренное, производство глюкозы и т. д.), либо на от-
деление жидкой фазы от биомассы и твердых нерастворимых ча-
стиц среды с целью использования фильтрата культуральной
жидкости. В некоторых случаях биомасса продуцента поступает
на получение ферментных препаратов различной степени очистки.
1.5.4. Технологические схемы получения
культур микроорганизмов
Последовательность процесса получения культуры микроорга-
низма является общей как для поверхностного, так и для глубин-
ного способа культивирования. Она включает стадии приготовле-
ния посевного материала, приготовления питательной среды, ее
стерилизации, охлаждения, засева посевным материалом и выра-
щивания. Однако в зависимости от способа культивирования ап-
паратурное оформление технологической схемы существенно раз-
личается.
Технологическая схема изображается так, чтобы виден был ход
технологического процесса, на нее наносятся все материальные
потоки продуктов воды, пара, воздуха и т. д. Оборудование изобра-
жается условно, но так, чтобы были ясны основной принцип ра-
боты данного аппарата и его размер.
Технологическая схема поверхностного культивирования. Осо-
бенностями процесса поверхностного культивирования являются
большое количество сыпучих компонентов среды и передача их
по стадиям производства. Поэтому при поверхностном культиви-
ровании большие площади производственного здания или рядом
с ним отводятся цеху хранения сырья (отруби, свекловичный жом,
солодовые ростки, опилки и др.). В зависимости от вида сырья
его запас может быть различен, но не менее месячного. Сыпучие
компоненты хранятся в бункерах и перемещаются с помощью
пневмотранспорта.
На рис. 1.29 приведена принципиальная технологическая схе-
ма получения культур микроорганизмов при поверхностном куль-
тивировании кюветным способом. Отруби или другие сыпучие ком-
поненты из основного склада по пневмотранспорту направляются
в бункера 1, снабженные ворошителями 2. Пневмотранспортиру-
ющая система дальнейшей подачи сырья снабжена циклонами 4
для очистки от грубой пылн, вентилятором 5 и фильтром тонкой
очистки 20 выбрасываемого в атмосферу воздуха. Из бункера сы-
пучие компоненты по распределительному шнеку 3 с помощью
78
iqmto мшнэноинох anxn^
пневмотранспорта поступают в дозирующее устройство 6, а затем
в стерилизатор 7, снабженный мешалкой, паровой рубашкой и
линиями подвода стерильного воздуха и пара. По окончании сте-
рилизации среда доувлажняется водой, стерилизуемой в стерили-
заторе 8 и охлаждаемой в теплообменнике 9. Вода дозируется
мерником 10. В стерилизатор через мерник 3 и дозатор 11 подает-
ся 9 %-ный раствор соляной кислоты и суспензия посевного мате-
риала из емкости 14. Неразбавленный 37 %-ный раствор соляной
кислоты находится в мернике 12.
Засеянная среда поступает на раскладочный стол 15 в чистые
стерильные кюветы 16. Кюветы со средой помещаются на пере-
движную этажерку 17 и транспортируются в растильную каме-
ру 18, где с помощью кондиционеров 19 поддерживаются строго
определенные температура и относительная влажность воздуха.
Воздух, поступающий из атмосферы, подается на фильтры 21 для
очистки от грубой взвеси микроорганизмов. Очистка отходящего
воздуха от микроорганизмов проводится на фильтре 20. Вырос-
шая готовая культура в кюветах 25 транспортируется на этажер-
ках-тележках 22 к дробилке 30 и подается по транспортеру в при-
емный бункер. Из приемного бункера готовая культура может
быть направлена на сушку для получения технического фермент-
ного препарата в виде сухой культуры или на дальнейшую пере-
работку для получения очищенных ферментных препаратов.
Далее этажерка направляется в камеры для мойки 23, стери-
лизации 24, а грязная кювета 26 — на мойку 27. Чистая кювета
28 стерилизуется в камере 29 и направляется на загрузку. Цикл
повторяется.
Представленная на рис. 1.29 схема может быть существенно
видоизменена, если выбрать другой тип стерилизатора, устано-
вить механизированную установку для выращивания или принять
другую схему получения посевного материала. Примером в этом
случае может служить технологическая унифицированная схема
получения поверхностной культуры с использованием аппаратов с
толстым слоем среды конструкции ВНИИбиотехники (рис. 1.30).
Однако последовательность и суть технологического процесса по-
лучения поверхностной культуры остаются неизменными.
Технологическая схема глубинного культивирования. Техноло-
гические схемы глубинного культивирования аэробных и анаэроб-
ных микроорганизмов почти не отличаются одна от другой, за ис-
ключением того, что в схемах культивирования анаэробных мик-
роорганизмов исключается стадия подготовки воздуха и исполь-
зуются ферментаторы без аэрирующих и перемешивающих
устройств.
На рис. 1.31 приведена технологическая схема культивирова-
ния микроорганизмов глубинным методом. Сухие компоненты сре-
ды подаются в складское помещение завода по пневмотранспор-
ту. Из циклона 1 с помощью трубоконвейера 2 они поступают в
бункера 3, а из них по трубоконвейеру 4 — на автоматические
весы 5. Если требуется ввести в состав среды соли или какне-то
80
Рис. 1.30. Принципиальная технологическая схема получения ферментных пре-
паратов при поверхностном с гик обе культивирования:
/ — приемный бункер; 2—дозатор; 3 — циклопы; 4, IS — стерилизаторы воды; 5 — стери-
лнзатор сырья; tf — механизированная установка для выращивания посевного материала;
7, /5 — фильтры тонкой очистки; 8 — шлюзовые питатели; 9 — автомат для стерильного
фасования посевного материала; 10 — гомогенизатор; П — стерилизатор среды; 12— меха-
низированная растильная установка; 13— газодувки; /-/---фильтры грубой очистки;
16 — калориферы; /7 — увлажнители воздуха; 19— аппарат для приготовления раствора
питательных солей; 20— сборник культуры гриба; 21 -- транспортирующее устройство;
22—аппарат для сушки и измельчения; 23 — фильтр рукавный; 24— вакуум-насос; 25—
бункер для сухой культуры гриба; 26 • - бункер-накопитель; 27- смеситель-измельчитель;
28 — бункер для стандартизированного препарата; 29 - - фасовочный автомат
иные компоненты в небольшом количестве, то они поступают в
шнек 6, транспортирующий сыпучие материалы в норию 7. Из но-
рии компоненты среды поступают в смеситель 8 для приготовле-
ния производственной питательной среды. Сюда же поступают во-
да и жидкие компоненты через соответствующие дозирующие и
мерные устройства.
Для растворения солей и клейстеризации крахмала среду подо-
гревают. Подготовленная подогретая среда с помощью насоса 30
поступает в нагреватель 22 системы непрерывной стерилизации
питательной среды и затем подается в спиральный теплообмен-
ник 23 для выдерживания при температуре 140°C. Стерильная
питательная среда охлаждается в теплообменнике 24 и направля-
ется в чистый стерильный ферментатор 25, который заполняют на
81
vgog
65—75 % в зависимости от степени пенообразования при росте
культуры.
Посевной материал получают в посевном отделении. Среду
для него готовят в специальной небольшой емкости 9, нагревают,
перемешивают и насосом 10 направляют в инокуляторы первой
16 и второй 19 ступеней, где проводятся стерилизация, охлажде-
ние и засев среды. Суспензия исходной культуры пересевается
вначале в колбы на качалке, затем подается в инокулятор первой
ступени 16, выращивается в нем и полностью передавливается в
инокулятор второй ступени 19 со стерильной охлажденной средой.
Выращенный посевной материал из инокулятора 19 передается в
ферментатор 25. В процессе культивирования проводится пенога-
шение. Пеногаситель стерилизуют в специальном аппарате перио-
дического действия 12, затем охлаждается и поступает через мер-
ник 14 в ферментатор. В процессе культивирования в инокулято-
рах и ферментаторе растущая культура аэрируется кондициониро-
ванным стерильным воздухом. Сжатый в компрессоре и нагретый
от 80 до 220°C воздух после удаления конденсационной влаги по-
ступает в головной фильтр 11, заполненный стекловатой. Далее
очищенный воздух поступает в индивидуальные фильтры тонкой
очистки 13, 15, 17, 20, 26 и подается для охлаждения пеногасите-
ля и аэрирования растущей культуры в инокуляторах 16, 19 и фер-
ментаторе 25. Отходящий воздух из инокуляторов и ферментато-
ра перед выбросом в атмосферу очищается в фильтрах 18, 21 и 27.
Готовая культуральная жидкость насосом 30 или самотеком
при перемешивании поступает в теплообменник 28 для охлажде-
ния перед поступлением в сборник 29. Необходимость охлажде-
ния вызвана тем, что сразу всю культуральную жидкость обра-
ботать невозможно, а при длительном хранении в сборнике может
произойти инактивация ферментов. Из сборника 29 охлажденная
жидкость по мере необходимости подается на фильтровальную
установку.
1.6. ПОЛУЧЕНИЕ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
ИЗ КУЛЬТУР МИКРООРГАНИЗМОВ
Культура микроорганизмов, выращенная поверхностным спосо-
бом, и культуральная жидкость после глубинного культивирова-
ния содержат большое количество балластных веществ. Выделе-
ние и очистка ферментов — трудоемкий и дорогостоящий процесс,
поэтому, если ферментный препарат можно использовать в виде
неочищенной культуры микроорганизмов, его очистку не прово-
дят. В таких отраслях, как спиртовая и кожевенная, целесообраз-
нее использовать именно неочищенную культуру микроорганизма;
то же самое можно сказать и об использовании культур микро-
организмов в сельском хозяйстве при приготовлении комбикормов
и при непосредственной обработке кормов на фермах.
В большинстве отраслей пищевой промышленности (хлебопе-
карной, пивоварении, виноделии, сыроделии, крахмало-паточном и
83
Таблица
1 Трансглюкози- дазпая активность*
Амилолитическая активность 1 выход. %
i 1 общая, ед.
Глюкоамнлазная активность | степень очистки
! ВЫХОД» %
удельная, ед./мг белка
общая, ед.
JH *ВЯ1ГЭр ояхээьииоя aalnpo
'наоро
Стадия очистки
* со «О л О Ч и * "45 л» » ч 2 g ° ® f- g с ь СО Я О ф о i© О> i© о со со сч сч — Q О •— С> ф О О О О 00 —' о i© со со О § 8 S с? Й ~ io Ю О 00 О 00 — О •— С© ’ФЮ г-1© о — —• ’*!©’’** i©C0b- сч сч СО СО О о 1© о Ю СЧ 1© о Й О С? СЧ Ь? о* 1© О О СО СО 1© м* ”»• сч
Характеризуется хроматографически по наличию изосахаров.
Выражено в г.
I
84
сокоэкстрактном производствах), а также в текстильной, меховой,
микробиологической промышленности и особенно медицине мож-
но использовать только очищенные препараты ферментов, частич-
но или полностью освобожденные от балластных веществ.
Исходным материалом для получения очищенных ферментных
препаратов может служить фильтрат культуральной жидкости,
реже — биомасса продуцента или водный экстракт из поверхно-
стной культуры продуцента. Ферментные препараты могут быть
получены в виде порошков или жидких концентратов. В процессе
выделения происходит повышение доли активного белка в общей
массе препарата, т. е. увеличивается его удельная активность.
В табл. 1.10 показаны стадии очистки от сопутствующих фермен-
тов и балластных веществ культуры Endomycopsis sp. 20-9.
Анализ табл. 1.10 показывает, что чистота глюкоамилазы в
препарате возросла в 37 раз, в препарате отсутствует гликозил-
трансфераза, а а-амилазная активность может быть отнесена за
счет действия глюкоамилазы, так как использовался колоримет-
рический метод определения активности а-амилазы.
1.6.1. Принципиальная схема получения ферментных препаратов
Схема очистки фермента от балластных веществ сводится к ос-
вобождению его от нерастворимых веществ, сопутствующих рас-
творимых веществ и других ферментов. Процессы получения очи-
Принципиальная схема получения очищенных ферментных
препаратов из культур микроорганизмов
85
щенных препаратов из поверхностных и глубинных культур не-
сколько различны. Из поверхностных культур труднее получить
высокоочищенные препараты из-за большого количества балласт-
ных веществ. Из глубинных культур получить очищенные препара-
ты несколько легче, но при этом приходится вести выделение из
разбавленных растворов, если выделение ферментов проводится из
жидкой части культуры. Выделение осложняется, если фермент
внутриклеточный, и тогда необходимо разрушать клетки микроор-
ганизмов.
Принципиальную схему выделения и очистки ферментов из глу-
бинных и поверхностных культур микроорганизмов можно пред-
ставить в виде следующей схемы.
Из схемы ясно, что экстракт из поверхностной культуры или
фильтрат культуральной жидкости является исходным материа-
лом для получения препаратов ферментов различной степени очи-
стки. На первом этапе выделения отходом процесса является не-
растворимая часть культуры — биошрот, содержащий нераствори-
мые включения среды и биомассу продуцента.
Далее в зависимости от свойств выделяемого фермента и со-
путствующего ему балласта схема очистки и получения фермент-
ного препарата может включать различные приемы и методы, та-
кие, как концентрирование, диализ, осаждение органическими рас-
творителями, солями, гель-фильтрование, афинная хроматография,
иммобилизация, сушка термолабильиых материалов и т. д. Поэто-
му рассмотрим этапы получения ферментных препаратов.
1.6.2. Получение неочищенных ферментных препаратов
Неочищенные ферментные препараты представляют собой куль-
туру микроорганизма вместе с остатками питательной среды, вы-
сушенную при мягком режиме до влажности не более 8—12%.
Неочищенный ферментный препарат может быть получен на
основе поверхностной или глубинной культуры. Глубинная куль-
тура может быть перед сушкой очищена от нерастворимой части
(твердая взвесь среды и биомассы продуцента) или высушена
вместе с ней.
Получение сухой поверхностной культуры. Поверхностная
культура микроорганизма имеет влажность от 35 до 58%. Это
низкостабильный продукт, который следует либо немедленно пу-
скать в производство, либо высушивать до равновесной влажно-
сти (10—12 %). Для высушивания культура, выгруженная из рас-
тильной камеры, измельчается до определенной величины и да-
лее поступает иа высушивание.
Для сушки культуры микроорганизма могут быть использова-
ны ленточные, тоннельные, шахтные, барабанные, шкафные и виб-
рационные сушилки. Сравнительно часто для сушки культур мик-
роорганизмов используют барабанные сушилки прямоточного ти-
па. Влажная культура поступает в сушилку одновременно с теп-
лоносителем, имеющим температуру 80—85°C. Такую высокую
86
температуру допустимо применять потому, что высушиваемый ма-
териал содержит большое количество влаги, а при ее испарении
частицы культуры почти не нагреваются, и активность ферментов
сохраняется почти полностью. У большинства барабанных суши-
лок на внутренней поверхности есть насадка в виде лопаток или
крестовины. Барабан вращается медленно с частотой от 3 до
8 мин-1. Высушиваемый материал с помощью лопаток поднимает-
ся, пересыпается и передвигается вдоль барабана. Происходит не-
которая дифференциация частиц культуры по размерам — более
крупные частицы падают почти вертикально вниз и вновь подхва-
тываются лопатками, а мелкие подхватываются теплоносителем,
траектория их падения несколько смещается, и они быстрее пере-
мещаются по барабану. Поэтому высушенный в такой сушилке
продукт имеет равномерную влажность по всей массе. Длитель-
ность пребывания высушиваемой частицы в сушилке 3—7 мин,
скорость движения подаваемого теплоносителя 2—3 м/с, темпе-
ратура воздуха на входе 80—85°C, на выходе 60—65°C, темпе-
ратура высушенного материала 40 °C. Потери активности в про-
цессе сушки составляют 3—10%.
Другой вид сушилок, используемых для сушки культур, — это
паровые конвейерные сушилки, представляющие собой герметизи-
рованный ленточный конвейер. При сушке в таких установках по-
тери активности больше, но они очень компактные и имеют боль-
шую производительность.
Для высушивания поверхностной культуры можно использо-
вать самые различные конструкции сушилок, в которых длитель-
ность пребывания культуры сокращена до 5—8 мин при темпера-
туре продукта на выходе не выше 40—42 °C, что позволяет свести
до минимума потери активности.
Готовую сухую культуру обычно упаковывают на специальной
фасовочной машине по 25—40 кг, мешки зашивают на зашивочной
машине и отправляют на склад готовой продукции.
Очистка культуральной жидкости от твердых взвесей. Боль-
шинство продуцентов накапливает основную часть синтезируемых
ими ферментов в питательной среде. При получении очищенных
ферментных препаратов нерастворимую часть среды вместе с био-
массой продуцента отделяют на фильтрах, центрифугах или сепа-
раторах.
Наиболее широко в микробиологической промышленности ис-
пользуют ячейковый барабанный вакуум-фильтр непрерывного
действия с наружной поверхностью фильтрования. Схема работы
такого фильтра представлена на рис. 1.32, а. Эти фильтры имеют
высокую степень механизации и позволяют осуществлять фильт-
рование различных суспензий с постоянной скоростью. Барабан-
ные вакуум-фильтры представляют собой барабан, погруженный в
емкость, в которую непрерывно подается культуральная жидкость.
Поверхность барабана перфорирована и обтянута фильтрующей
тканью (батист или другая синтетическая ткаиь аналогичного
типа).
87
Рис. 1.32. Схема работы фильтров:
а — барабанный вакуум-фильтр: 1 — барабан; 2— секционированная поверхность бара-
бана; 3 — фильтрующая ткань; 4 — секционные продольные перегородки; 5 — нож; 6 — от-
сушенный осадок; 7 — емкость с культуральной жидкостью; 8 — сливная труба, соединен-
ная со сборником культуральной жидкости; 9— форсунки для промывания осадка; б —
рамный фнльтр-пресс: 1 —- фильтрующая ткань или пластина; 2 — секция для исходной
культуральной жидкости (шламовое пространство); 3 —секция для сбора фильтрата
культуральной жидкости; 4 — отвод фильтрата; 5 — подвод культуральной жидкости
Иногда при наличии в культуральной жидкости трудно отде-
ляемых осадков с высокими удельными сопротивлениями в каче-
стве фильтрующей поверхности используют намывной слой. Съем
осадка на этих фильтрах производится специальным ножом. При
каждом обороте барабана вместе с осадком удаляется часть на-
мывного слоя и фильтрующая поверхность обновляется. Барабан
вращается медленно с частотой 0,13—0,26 мин“* и проходит по-
следовательно зоны фильтрования, подсушивания, промывания
осадка, подсушивания и отдувки. Барабан разделен на секции с
помощью неподвижной распределительной головки, состоящей из
нескольких камер, которые соединены соответственно с вакуум-
приемниками фильтрата и промывных вод, а также с линией сжа-
того воздуха.
Барабанные фильтры удобны для отделения не только биомас-
сы продуцента, но и нерастворимых взвесей, которых сравнитель-
но много в среде (выжимки, отруби, жмых, ростки и т. д.). К не-
достаткам фильтров этого типа можно отнести их сравнительно
низкую производительность, громоздкость (отношение удельной
поверхности фильтрования к объему фильтрата небольшая) и не-
возможность обеспечения асептических условий.
В ферментной промышленности реже используют рамные
фильтр-прессы периодического действия с ручной выгрузкой осадка
(рис. 1.32,6). С их помощью можно получать прозрачные фильт-
раты, но эти фильтры работают периодически без регенерации
88
фильтрующей поверхности. Так как шламовое пространство огра-
ничено, а слой осадка к концу фильтрования достигает значи-
тельной толщины, то скорость фильтрования падает, несмотря на
повышение рабочего давления. При заполнении шламового про-
странства осадком фильтр-пресс отключают, разбирают и промы-
вают или меняют фильтрующее полотно. Производительность
фильтр-пресса много меньше, чем барабанного вакуум-фильтра,
она лимитируется содержанием осадка в фильтруемой жидкости
и объемом рамного пространства фильтр-пресса. Процесс фильт-
рования в рамном фильтре ведется под давлением 0,6—0,4 МПа.
Культуральная жидкость через отверстия в стенке рамы поступа-
ет во внутреннюю полость фильтрующего элемента, взвесь задер-
живается на фильтрующих поверхностях, а фильтрат проходит
через фильтрующую салфетку и стекает по канавкам в плитах в
трубопровод. Обычно первые порции фильтрата бывают мутные и
их повторно фильтруют.
Недостатки фильтр-пресса в значительной степени устранены
в конструкции с горизонтальными камерами типа ФПАКМ
(рис. 1.33). Он состоит из ряда расположенных одна над другой
горизонтальных фильтровальных плит 2, между которыми натяну-
та фильтровальная ткань 4. Фильтровальные плиты размещены
между верхней и нижней поддерживающими плитами 1, а фильт-
ровальная ткань натянута на направляющие ролики 3. Цикл ра-
боты фильтр-пресса состоит из сжатия плит, фильтрования, про-
мывания и обезвоживания осадка, раздвигания плит и разгрузки
Рис. 1.33. Схема автоматизированно-
го фильтр-пресса ФПАКМ:
1 — Поддерживающие плиты; 2 — фильтро*
вальные плиты; 3 — направляющие роли*
ки; 4 — фильтровальная ткань
Рис. 1.34. Схема потоков жидкости в
барабане сепаратора-кларификатора
типа ВСМ
89
осадка одновременно с перемещением ткани и ее промыванием.
Работа фильтр-пресса ФПАКМ полностью автоматизирована. Эти
фильтры имеют развитую фильтрующую поверхность (на 8 м2
площади, занимаемой установкой, приходйтся до 25 м2 фильтру-
ющей поверхности); осадок отжимается под давлением 0,8—
1,5 МПа и имеет влажность не более 60—70%; сравнительно не-
большие энергозатраты (0,8—1 кВт-ч на 1 м2 фильтрующей по-
верхности); удельная производительность его в 6—8 раз выше,
чем у других фильтр-прессов [при концентрации твердой фазы в
суспензии 4—7 г/л 1000 л/(м2-ч)]; потери активности не пре-
вышают 4—5%. Установки ФПАКМ выпускаются с площадью
фильтрующей поверхности от 2,5 до 50 м2. Их применение для
очистки ферментных растворов очень перспективно; особенно этот
тип фильтров рекомендуется для фильтрования взвеси культу-
ральной жидкости бактерий.
К фильтрам, работающим под давлением, относятся различ-
ные конструкции листовых фильтров. Общим для фильтров это-
го типа является наличие плоских фильтровальных элементов с
жестким каркасом. Осадок с фильтрующей поверхности может
удаляться различными способами: сжатым воздухом, паром, виб-
рацией, под действием центробежной силы.
Некоторые бактериальные культуры даже при использовании
вспомогательных фильтрующих материалов фильтруются со ско-
ростью ниже 30 л/(м2-ч). В этих случаях для отделения биомас-
сы и удаления взвеси широко применяются сепарирующие цент-
робежные машины. В ферментной промышленности применяют-
ся сепараторы-кларификаторы типа ВСМ, представляющие собой
емкость 4, внутри которой располагается барабан (рис. 1.34).
Внутри барабана находятся концентрические цилиндры-вставки 3.
Очищаемый раствор по патрубку / поступает в цилиндр с наи-
меньшим радиусом, затем проходит вдоль установленных цилинд-
ров, каждый раз меняя направление. Осветленная жидкость уда-
ляется из барабана с помощью напорного диска 2 под давлени-
ем, а осадок под действием центробежной силы отбрасывается к
внутренней стенке цилиндрических вставок. Производительность
сепараторов этого вида может достигать до 2000—5000 л/ч.
При производстве ферментных препаратов используются раз-
личные типы и конструкции саморазгружающихся сепараторов.
В СССР применяют сепараторы типов АСЭ-3, АСИ, АСЭ-Б с
центробежной пульсирующей выгрузкой осадка, имеющие соот-
ветственно производительность 500, 1500 и 2000 л/ч, при диамет-
ре барабана 600 мм и межтарелочном зазоре 0,5 мм. На пред-
приятиях очень большой производительности используются так
называемые сопловые сепараторы фирмы «Альфа-Лаваль» (Шве-
ция) типов QX и FEUX производительностью от 80 до 200 м3/ч.
Эффективность отделения биомассы во многом зависит ие
только от типов используемых аппаратов, но и от состава среды,
размеров отделяемых частиц, количества нерастворимой фрак- >
ции, физико-химических характеристик фильтрующих материа-
90
лов, температурных режимов и т. д. Для улучшения процесса
фильтрования проводят предварительную химическую обработку
культуральной жидкости. Для этого культуральную жидкость
подщелачивают до pH 8—8,5 и вводят 0,1 %-ный раствор хлори-
стого кальция, в результате образуется гель фосфата кальция,
который способствует наиболее полному отделению осадка при
наименьших потерях. Но предварительная химическая обработка
не всегда дает хорошие результаты, поэтому для повышения эф-
фективности процесса часто используют различные кизельгуры,
например, диатомит и радиолит (Япония), микрозил (Франция),
диатомит (Бельгия), кларгель (Великобритания) и т. д. Исполь-
зование этих наполнителей может резко повысить скорость филь-
трования, но вместе с этим увеличиваются потери активности на
этой технологической стадии.
Полученную биомассу продуцента вместе с нерастворимыми
частицами среды (биошрот) при необходимости стерилизуют, вы-
сушивают и используют на корм животным. Фильтрат культу-
ральной жидкости нестабилен, он не может храниться и должен
немедленно направляться на дальнейшую обработку для полу-
чения очищенных ферментных препаратов.
1.7. ЭКСТРАГИРОВАНИЕ ФЕРМЕНТОВ
ИЗ ПОВЕРХНОСТНЫХ КУЛЬТУР
Все ферменты являются водорастворимыми белками, поэтому
наилучшнм экстрагентом для ннх является вода. Для извлечения
ферментов из дрожжей или бактерий необходимо подвергнуть
механическому нли автолитическому разрушению их клеточные
стенки, обладающие высоким диффузионным сопротивлением.
Оболочки мицелиальных нитей имеют меньшее диффузионное со-
противление, чем оболочки бактериальных и дрожжевых клеток,
поэтому дезинтеграции культуры грибов не требуется.
Извлечение ферментов проводят как из влажных, так и из
сухих поверхностных культур грибов. Сухая культура может хра-
ниться длительное время без потери активности ферментов, и из
нее получают более концентрированные экстракты. Технологиче-
ски это выгоднее, ио при подсушивании культуры имеют место
потери активности, и потому экстрагирование целесообразно ве-
сти из влажной культуры. При экстрагировании различные во-
дорастворимые вещества извлекаются из культуры с неодинако-
вой скоростью, происходит их частичное фракционирование,
удельная активность ферментов в экстракте повышается в 3,5—
4 раза по сравнению с исходной культурой в результате отделе-
ния большой части веществ (до 75%) с нерастворимым остат-
ком — биошротом.
На полноту экстрагирования ферментов из культур оказывают
влияние многие факторы: температура, pH, длительность про-
цесса, конструктивные особенности экстракционных аппаратов,
91
природа извлекаемого фермента, количество отобранного экстрак-
та с единицы массы загруженной в аппарат культуры и т, д.
Влияние длительности экстрагирования и.вида культуры пред-
ставлено на рис. 1.35. Из рисунка видно, что одновременно с фер-
ментами экстрагируются многие другие соединения, и часто ско-
рость извлечения балластных веществ больше скорости экстра-
гирования из культуры целевого фермента. Поэтому рациональ-
нее пойти на некоторые потери фермента и закончить экстраги-
рование на оптимальном значении отношения активности фер-
мента в экстракте к сумме извлекаемых веществ. Этот вопрос
решается экспериментально для каждого вида продуцента.
Влиять на процесс экстрагирования с помощью такого фак-
тора, как температура, практически невозможно, так как фермен-
ты очень термолабильны и инактивируются даже при 35—40 °C
(рис. 1.36). Кроме того, повышение температуры до 35—40°C
влечет за собой увеличение содержания сухого вещества в экс-
тракте и уменьшение удельной ферментативной активности на
1 г сухого вещества, повышение опасности инфицирования экс-
трактов. Поэтому при проведении экстракции в заводских усло-
виях стремятся подавить развитие микрофлоры путем макси-
мального снижения температуры воды до 22—25°C и применения
антисептиков (формалин, бензол, толуол, хлороформ и др.).
В большинстве случаев ферменты наиболее полно извлекаются
при pH 5—7 (рис. 1.37).
Рис. 1.35. Динамика извлечения растворимых веществ из поверхностных культур
микроскопических грибов:
а — A. oryzae И-476; б — A. awamori 16; в — A. awamori 78; / — азотистые вещества;
2 —пентозаны; 3 — зольные элементы; 4 — сухое вещество; 5 — непосредственно реду-
цирующие вещества; 6 — редуцирующие вещества после гидролиза; 7 — амилолитическая
активность; 7' — пектолнтнческая активность; 8 — протеолитическая активность; 9 — глю-
козоамилазиая активность
92
то
। । । । । । । ।
0(2345678
Длительности экстрагиробания, ч
Рис. 1.36. Влияние температуры эк-
страгирования на выход активного
фермента в раствор (цифры у кри-
вых обозначают температуру экстра-
гента)
Рис. 1.37. Влияние pH экстрагента на
извлечение ферментов из поверхност-
ной культуры A. oryzae 8F,:
1 — амилаза; 2 — кислая протеиназа;
3 — щелочная протеиназа
Для получения концентрированных экстрактов при небольших
потерях ферментов с биошротом необходимо применять специ-
альные экстракционные установки. До недавнего времени для
этого широко использовались диффузионные батареи (рис. 1.38).
В них можно получить экстракт с содержанием сухого вещества
от 7 до 14 % в зависимости от вида культуры, среды и величи-
ны отбора экстракта. Но эти установки для экстрагирования
ферментов из поверхностной культуры имели сравнительно не-
большую производительность, требовали больших затрат ручно-
го труда, и в них наблюдались сравнительно большие потери ак-
тивности. Поэтому сейчас разрабатываются непрерывнодействую-
щие экстракционные аппараты. Определенный интерес представ-
ляет для ферментной промышленности экстрактор непрерывного
Рис. 1.38. Диффузионная батарея для экстрагирования ферментов из поверхно-
стных культур микроскопических грибов
93
Рис. 1.39. Экстрактор непрерывного действия фирмы «Ниро Атомайзер»:
/ — Наклонный цилиндр: 2 — насос-дозатор; 3, 8 -- теплообменники: 4 — шнек; 5 — дозатор;
б — привод: 7 — насос; 9 — рубашка
действия фирмы «Ниро Атомайзер» (Япония), работающий под
избыточным давлением (рис. 1.39). Экстрактор представляет со-
бой наклонную цилиндрическую емкость, снабженную двумя
шнеками, теплообменными рубашками и насосами. Культура че-
рез дозирующее устройство 5 подается внутрь цилиндра, а с про-
тивоположной стороны вводится растворитель (вода). Экстракт
выходит из установки через самоочищающийся фильтр, а био-
шрот удаляется с противоположного конца. В случае необходи-
мости, если ферменты экстрагируются не полностью, можно осу-
ществлять двухступенчатое экстрагирование, увеличивая длитель-
ность процесса. Вторичный экстракт может быть использован в
качестве растворителя для первой ступени экстрагирования. Об-
щая продолжительность экстрагирования регулируется частотой
вращения шнеков. Вторичный биошрот используется как компо-
нент среды или после обеспложивания в кормопроизводстве.
В ферментной промышленности используются экстракторы
роторного типа фирмы «Роуне Даунс», состоящие из неподвиж-
ного корпуса, внутри которого находится ротор, разделенный на
16—20 секторных отсеков, вращающихся вокруг вертикальной
оси. Каждый отсек имеет ситчатое дно, на которое подается из-
мельченная культура гриба. Ротор медленно вращается и после-
довательно проходит четыре участка, в каждом из которых куль-
тура смачивается водой или экстрагентом нз предыдущих отсе-
ков, вытяжка вакуум-насосом отфильтровывается и подается в
следующий участок для увлажнения свежей культуры, вновь от-
бирается вытяжка и передается в 3-й отсек и т. д. При заверше-
нии одного оборота ротора биошрот разгружается и отсеки вновь
загружаются свежей культурой.
В настоящее время наблюдается тенденция возвращения к
процессу пресс-диффузии. Он заключается в том, что культура
94
после настаивания с водой отпрессовывается, затем снова настаи-
вается при меньшей концентрации ферментов в получаемом экс-
трагенте, вновь прессуется и т. д. Вероятно, этот способ экстра-
гирования найдет свое дальнейшее развитие.
1.8. КОНЦЕНТРИРОВАНИЕ ФЕРМЕНТНЫХ РАСТВОРОВ
МЕТОДОМ ВАКУУМ-ВЫПАРИВАНИЯ
Экстракты из поверхностных культур микроорганизмов и
фильтраты глубинной культуры являются нестабильными при хра-
нении. Для получения готовых форм технических препаратов
(П2х и Г2х) их необходимо сконцентрировать. Чаще всего для
этих целей в технологии ферментных препаратов используются
методы вакуум-выпаривания. Вакуум-выпаривание также приме-
няется как один из этапов получения сухих технических или
очищенных ферментных препаратов. Ферменты очень чувстви-
тельны к температуре выпаривания, поэтому основным условием
концентрирования ферментных растворов является кратковре-
менное ведение процесса при низких температурах кипения, что-
бы выпариваемая жидкость не перегрелась, а ферменты не инак-
тивировались. Следует учитывать, что чем чище раствор, чем
меньше он содержит сопутствующих веществ, тем ферменты бо-
лее чувствительны к воздействию высоких температур (рис. 1.40).
При концентрировании экстрактов из поверхностных культур
инактивация ферментов значительно меньше, так как в экстрак-
те содержится очень большое количество защитных соединений,
которые препятствуют инактивации ферментов. При концентри-
ровании фильтратов культуральной жидкости наблюдаются не-
сколько большие потери, поэтому ферменты культуральной жид-
кости стабилизируют различны-
ми соединениями (табл. 1.11). В
процессе концентрирования фер-
ментных растворов происходят
изменение растворимости мно-
гих соединений и выпадение их
осадков, и суммарное содержание
сухого вещества в концентрате
снижается на 11—20 %, изменя-
ется pH концентрата (рис. 1.41).
В осадок выпадают минераль-
ные соли, некоторые органиче-
ские вещества и продукты их
распада, наблюдается потеря
азота в результате уноса аммиа-
ка (рис. 1.42).
При концентрировании куль-
туральной жидкости В. mesente-
ricus значительно изменяется ми-
неральный состав концентрата
Рис. 1.40. Изменение активности про-
теазы В. subtilis 103 в растворе при
температуре 55 °C (по даивым
В. Н. Румянцева, 1975);
1—фильтрат культуральной жидкости
нативный; 2 — диализованный фильтрат
95
Таблица 1.11
Наименование образца Исходный раствор Концентрат (сгущение в 3 раза)
ПС, ед./мл pH ПС. ед./мл pH Потери ПС, %
Фильтрат КЖ В. subtilis То же 4-0,3% СаС12 2360 6,2 6370 6,0 10,6
2340 6,2 6840 6,1 2,5
То же + 0,5% белкового про- 2300 6,2 6760 5,4 2,0
дукта (костный клей) То же + 4% глицерина 2550 6,2 6360 6,0 4,3
(рис. 1.42, а). Наиболее резко снижается содержание кальция,
меди и магния, заметно уменьшается содержание цинка и мар-
ганца. Такое изменение минерального состава культуральной
жидкости сказывается на стабильности ферментов в процессе
концентрирования (рис. 1.42,6). При сгущении культуральной
жидкости до содержания сухого вещества 10 % количество каль-
ция снижается всего на 5 %, а меди — на 75 %. Известно, напри-
мер, что медь оказывает на ферменты ингибирующее действие,
а кальций — стабилизирующее. Поэтому на первых стадиях кон-
центрирования наблюдается повышение активности ферментов,
особенно протеиназ. При более глубоком концентрировании вме-
сте с резким снижением содержания кальция снижается актив-
ность ферментов.
Большинство ферментов очень чувствительно к термической
обработке и нуждается в мягких режимах концентрирования. На
рис. 1.40 были приведены данные по инактивации нейтральной
протеиназы В. subtilis 103 в зависимости от температуры кипения
раствора от 20 до 50°C и температуры греющего пара от 90 до
120°C. Из рисунка видно, что очень большое влияние оказывает
температура теплоносителя. При низких температурах кипения
(25—30°C) происходит заметная инактивация ферментов (до
12%), если температура греющего пара равна 120°С. При тем-
пературе теплоносителя 90—100°C и температуре кипения 35—
40°С потери активности не превышают 10%. В зависимости от
вида продуцента культуральная жидкость имеет различный хими-
ческий состав и содержит различный комплекс ферментов, поэто-
му тепловые режимы вакуум-выпаривания уточняются экспери-
ментальным путем.
Суммарные потери активности при вакуум-выпаривании в зна-
чительной степени зависят не только от режима концентрирова-
ния, ио и от конструкции аппарата. Аппараты для стадии ваку-
ум-выпаривания в последние годы значительно усовершенствова-
ны, в десятки раз сокращена длительность процесса, что приве-
ло к значительному уменьшению потерь активности ферментов,
а также позволило несколько ужесточить температурные режимы
концентрирования ферментных растворов. Помимо трубчатых
вакуум-выпариых установок с различным расположением трубок
96
го 25 30 35 W 45 50
Тенпература кипения
концентрируепого раствора, V
Рис. 1.41. Влияние температуры ки-
пения ферментного раствора и темпе-
ратуры греющего пара иа сохране-
ние активности фермента и иа коли-
чество осадка в концентрате (цифры
у кривых обозначают температуру
греющего пара)
Рис. 1.42. Изменение минерального
состава (а) и активности ферментов
(б) при вакуум-выпариваиии филь-
трата культуральной жидкости В. те-
sentericus ПБ:
/ — протеиназная активность; 2 — молоко-
свертывающая; 3 — амилазная; 4 — со-
держание аминного азота; 5 — содержа-
ние белкового азота. (По осн ординат по-
мимо активностей дано содержание ми-
неральных веществ, в % от исходного)
(горизонтальным, вертикальным и наклонным), со встроенной и
выносной поверхностью нагрева, с использованием принудитель-
ной циркуляции созданы новые конструкции пленочных выпар-
ных аппаратов, ультрацентробежиых вакуум-выпариых установок
н пластинчатых испарителей. Особый интерес представляют ро-
тационные пленочные выпарные аппараты, где упариваемая
жидкость в виде пленки движется по внутренней стенке аппара-
та. Лопатки, смонтированные иа вращающемся роторе, непре-
рывно направляют движение ее сверху вниз. Время прохожде-
ния жидкости через аппарат составляет несколько секунд. В па-
4 Зак. 232
97
стоящее время фирма «Альфа-Лаваль» изготовляет вакуум-вы-
парные центробежные аппараты типа «Центритерм». Они очень
компактны, время контакта ферментного раствора с обогреваю-
щей поверхностью предельно сокращено (не более 1 с), потери
не превышают 10%, производительность этих установок от 800
до 4800 л/ч.
Создана центробежная вакуум-выпарная установка пленочно-
го типа производительностью 800 л/ч по испаренной влаге. Вре-
мя контакта культуральной жидкости с теплоносителем не более
1 с, температура греющего пара 60—80°C. Для увеличения про-
изводительности можно монтировать установку из трех модулей,
каждый из которых работает либо автономно, либо последова-
тельно, либо первые два модуля работают параллельно и соеди-
нены с третьим модулем последовательно. Представляет интерес
для ферментной промышленности центробежная пленочного ти-
па вакуум-выпарная установка «Единство» (Югославия) произ-
водительностью до 200 л/ч и с температурой упаривания 30—
40°C. Хорошие технологические показатели имеют роторные вы-
парные аппараты фирмы «Люва» (Швейцария), имеющие произ-
водительность по испаренной влаге от 50 до 200 л/(м2-ч). Фран-
цузская фирма APV изготовляет пластинчатые вакуум-выпарные
установки производительностью до 20 000 л/ч.
Несмотря на наличие высокопроизводительных вакуум-выпар-
ных аппаратов полностью устранить недостатки метода вакуум-
выпаривания не удается (потери активности, выпадение осадков
и т. д.), и этот метод все больше заменяется методом ультра-
фильтрации.
1.9. МЕМБРАННЫЕ МЕТОДЫ ОЧИСТКИ
ФЕРМЕНТНЫХ РАСТВОРОВ
К мембранным методам очистки относятся диализ, электро-
диализ, к баромембраиным методам — обратный осмос, ультра-
фильтрация, микрофильтрация и тонкая фильтрация.
1.9.1. Диализ и электродиализ
Разделение растворенных веществ методом диализа основано
на селективной проницаемости мембран для соединений с различ-
ной молекулярной массой. Необходимым условием для проведе-
ния диализа является создание разности концентраций по обе
стороны полупроницаемой мембраны (рис. 1.43, а). Процесс диа-
лиза описывается уравнением
Q = DdSM,
где Q — количество вещества, перенесенного через мембрану за единицу времени;
Dd—коэффициент диализа, который зависит от свойств мембраны (Dm) и
свойств жидкой пленки, образующейся иа границе раздела между диализуемой
98
Вода ;——г-—г.;. t.'xj вода
Исходный раствор ^^Р^^^°^^^с£^Полупр^ии,аемая мембрана
гп‘ ‘ - ----------------------“Диализованный раствор
а
Рис. 1.43. Схемы работы диализаторов:
а— проточный диализатор; б — проточный
электродиализатор
электродиализатор; в — непрерывный
пленкой и мембраной (£>ь). Зависимость между Dm и £>ь можно записать в
виде' уравнения
^7* = Dml -f- £>ь1;
S — площадь поверхности мембраны; ДС — разность концентрации переносимого
через мембрану вещества по обе ее стороны.
Диализ может быть использован для очистки ферментных
растворов от низкомолекулярных веществ, таких, как сахара,
аминокислоты, минеральные соли и т. д., степень очистки рас-
творов от этих веществ достигается 60—100%. Диализ весьма
эффективен при высоком содержании в растворах солей, напри-
мер после осаждения ферментов методом высаливания. В этом
случае можно использовать наложение постоянного тока иа диа-
лизуемый раствор, и тогда при двустороннем электродиализе анио-
ны будут стремиться к аиоду, а катионы — к катоду. Схемати-
чески такой процесс представлен на рис. 1.43,6, когда диализуе-
мый раствор заключен в камеру, ограниченную двумя полупро-
ницаемыми мембранами. Однако электродиализ нельзя приме-
нять при выделении ферментов, имеющих, например, четвертич-
ную структуру, которая формируется с участием ионов металлов,
а также при выделении металлофермеитов, которые, как прави-
4* 99
ло, теряют активность прн электродиализе (а-амнлазы, р-галак-
тозндазы н др.).
Процесс диализа протекает очень медленно, и для очистки от
балласта значительных объемов растворов требуется мембрана
с большой поверхностью. В этом случае целесообразно не увели-
чивать размеры одной мембраны, а расчленить ее на несколько
мембран меньшего размера, пропуская раствор фермента в не-
прерывном потоке последовательно через диализные блоки
(рис. 1.43, в).
Для диализа используют самые разнообразные полупроницае-
мые мембраны. Наиболее доступными являются пергамент, ар-
мированный целлофан (марлин), различные марки целлофана,
отличающиеся друг от друга величиной пор, а также мембраны,
применяемые в ультрафильтрации (см. ниже) и в других видах
мембранной техники. Диализ позволяет удалить основную мас-
су сопутствующих низкомолекулярных примесей и повысить ак-
тивность ферментных растворов в пересчете на сухое вещество в
5—10 раз.
Однако этот метод имеет ряд существенных недостатков.
Во-первых, прн дналнзе возможна потеря активности фермента
в результате вымывания нонов металла или нестабильности са-
мого фермента. Во-вторых, прн дналнзе против обычной водо-
проводной воды может происходить потеря активности фермента
в результате попадания нз воды в раствор фермента нонов ме-
таллов — ингибиторов фермента н т. д. Следует также отметить,
что в процессе диализа одновременно с очисткой происходит
сильное разбавление ферментного раствора' из-за проникнове-
ния воды под действием снл прямого осмоса в диализируемый
раствор, который сложно н экономически нерентабельно исполь-
зовать в производстве. Поэтому сейчас этот метод очистки фер-
ментных растворов от балластных веществ в ферментной промыш-
ленности почти не используется. Его иногда применяют в лабо-
раторных исследованиях н прн получении высокоочнщенных фер-
ментных препаратов. На смену диализа приходят баромембран-
ные методы разделения растворов, содержащих ферменты.
1.9.2. Баромембраниые методы очистки ферментных растворов
Эти методы классифицируются по размерам пор используе-
мых мембран: обратный осмос (~3-10“4 мкм-); ультрафильтра-
ция (15-10-5 мкм), микрофильтрация (0,2 мкм) н тонкая фильт-
рация (10 мкм). Классификация процессов мембранного разделе-
ния растворов и коллоидных систем по размерам задерживаемых
частиц приведена ниже (в см).
Обратный осмос От 5-10~8 до 8-10~*
Ультрафильтрация, диализ От 3-10~7 до Ы0~4
Микрофильтрация От 5-10-• до 2-10"3
Фильтрование Более 2,5-10—3
100
Обратный осмос и ультрафильтрация. Эти методы очистки н
концентрирования получили широкое распространение в химиче-
ской, нефтеперерабатывающей, пищевой, фармацевтической и
ферментной промышленности. Перспективность использования
ультрафильтрации в ферментной промышленности очевидна, по-
скольку оно дешевле других методов разделения растворов.
В табл. 1.12 приведены данные фирмы «Амнкон корпорейшн»
(США), которые подтверждают это.
Таблица 1.12
Метод разделения Концентрация сухого вещества, %
исходная в концентрате Затраты иа удале- ние ] м8 воды, доллары
Центрифугирование 1-2 10—15 0,15-0,9
Гель-фильтрация 3—5 Разбавленная 6—30
Сушка барабанная 30 100 7,5
распылительная 10—20 100 15
лиофильная 10 100 60—90
Осаждение этиловым спиртом 1-2 Различная 1500
или солями Ультрафильтрация 1—10 10-50 0,15-0,30
Преимуществом ультрафильтрации являются отсутствие теп-
ловой инактивации ферментов н небольшие энергозатраты. Ульт-
рафильтрация позволяет провести концентрирование раствора
без фазового превращения прн комнатной температуре, а главное,
прн одновременном освобождении от балластных веществ (пиг-
ментов, азотистых и других низкомолекулярных соединений).
Процессы ультрафильтрации и обратного осмоса имеют одни и
тот же механизм, но отличаются по ряду параметров. Прямой
осмос — это диффузия молекул растворителя в раствор через
полупроницаемую мембрану (рнс. 1.44), когда мембрана не про-
пускает растворенное вещество. Осмотическое давление раствора
(Ро) зависит от молярной концентрации растворенного вещества
н степени его диссоциации. Если осмотическое давление больше
прямой осмос, если равно
гидравлического (рг), то происходит
гидравлическому (рабочему) давле-
нию, то диффузия воды через мем-
брану прекращается. Если рг>р0, то
равновесие нарушается н молекулы
растворенного вещества н воды будут
проходить через мембрану в раство-
ритель. Этот механизм наблюдается н
прн обратном осмосе, н прн ультра-
фильтрации. Следовательно, обратный
осмос н ультрафильтрация — это пере-
нос молекул через мембрану под дав-
лением выше осмотического, прн ко-
Попу Прон и-
цаемая
мембрана
Нопекипы
растворен
Вещестб
Рис. 1.44. Схема диффузии мо-
лекул при прямом осмосе
101
тором растворитель (вода) проходит через мембрану, а раство-
ренное вещество в зависимости от его молекулярной массы и ве-
личины пор мембраны частично или полностью задерживается.
Скорость ультрафильтрации будет тем выше, чем больше раз-
ница между рабочим давлением и осмотическим.
Между процессами обратного осмоса и ультрафильтрации
есть различия. Так, при обратном осмосе разделение низкомоле-
кулярных веществ происходит при рабочем давлении до 0,7—
14 МПа, так как осмотическое давление ро в этих растворах ве-
лико. При обратном осмосе используются мембраны с очень ма-
ленькими порами (от 1-10~4 до 2-10~3 мкм). При ультрафильт-
рации происходит разделение высоко- и низкомолекулярных сое-
динений, и целью этого процесса является получение концентра-
та высокомолекулярных соединений (например, ферментов). Ра-
бочее давление в этом случае низкое (от 0,07 до 0,7 МПа), так
как ро небольшое. Величина пор мембран значительно больше —
от 3-10~3 до 150-10“3 мкм.
Однако названные различия достаточно условны. Механизм
процессов обратного осмоса и ультрафильтрации пока остается
недостаточно ясным.
Для математического описания процесса мембранного разде-
ления служит модель движения вязкого потока через поры (урав-
нение Пуазейля) и модель диффузионного массопереноса (закон
Фика). Принято считать, что если размер пор мембраны меньше
3-10“3 мкм (обратный осмос), то процесс подчиняется закону
Фика, если же размер пор больше 3-10_3 мкм (ультрафильтра-
ция), то процесс подчиняется уравнению Пуазейля.
Мембраны. Рабочим элементом ультрафильтрационных уста-
новок является полупроницаемая мембрана. Мембраны должны
обладать высокой проницаемостью и селективностью, быть ус-
тойчивыми к действию разделяемых растворов, механически
прочными, мембрана не должна подвергаться усадке и изменять
свои характеристики в процессе хранения и эксплуатации, долж-
на обладать низкой адсорбцией к разделяемым веществам и не-
высокой стоимостью. По этим показателям лучшими считаются
полимерные мембраны. В процессах ультрафильтрации исполь-
зуются мембраны из целлофана, каучука, полиэтилена, полисти-
рола, целлюлозы и различных ее производных (особенно из аце-
татцеллюлозы), полифенола, полиакриловой кислоты, металлоке-
рамики с осажденным иа ней слоем графита, пористого стекла
и т. д.
Мембраны подразделяют на однослойные — изотропные,
имеющие толщину 0,05—0,2 мкм, и двухслойные — анизо-
тропные. Первый слой, обращенный к фильтруемому раство-
ру, определяет селективность мембраны. Второй слой крупнозер-
нистый, он является нижним, придает мембране прочность
(рис. 1.45). Из двухслойных мембран получили распространение
ацетатцеллюлозные. Они имеют высокую проницаемость, селек-
тивность и достаточную прочность. Но они подвержены гидроли-
102
эу в сильнокислой и сильноще-
лочной средах, и потому их мож-
но использовать только в средах
с pH от 3 до 7,5. Эти мембраны
имеют некоторую усадку, поэто-
му проницаемость и скорость
фильтрования меняются в про-
цессе эксплуатации мембран.
Кроме того, эти мембраны тре-
буется хранить в воде, имеются
и другие менее существенные не-
достатки ацетатцеллюлозных
Рис. 1.45. Структура двухслойной
полупроницаемой мембраны:
/ — полупроницаемый слой; 2 — дре-
нажная подложка
мембран.
Из новых типов мембран получили распространение мембра-
ны в виде тончайших трубок, так называемые полые волокна с
внутренним диаметром 20—100 мкм и толщиной стенки 10—
50 мкм. Интерес представляют высокоселективные «динамические»
мембраны. Они представляют собой пористую нержавеющую
сталь, на которую наносят полимерное покрытие, графитовую
пластинку, прессованное волокно и т. д. и пропускают раствор
полимера (например, поливинилпирролидоновую кислоту). Рас-
твор полимера застывает в порах и образует армированную по-
лупроницаемую перегородку. Созданы полупроницаемые мембра-
ны на основе микропористого стекла.
В СССР выпускаются универсальные ацетатцеллюлозные
мембраны «Владипор» с размерами пор от 0,2-10~2 до
7-1O2 мкм, работающие в зонах pH от 3 до 8, при максималь-
ной температуре 50 °C и рабочем давлении 0,05—1 МПа. Ис-
пользуются также полимерные мембраны фирм «Амикон» и
«Миллипор» (США). Мембраны «Диаффо» фирмы «Амикон» де-
лятся на несколько типов в зависимости от молекулярной мас-
сы задерживаемых веществ, материала мембран и стойкости их
в различных средах. Эта же фирма выпускает листовые мембра-
ны, мембраны в виде полых волокон различных полимеров (аце-
татцеллюлоза, нитроцеллюлоза, поливинилхлорид, полиамиды и
др.). Фирма «Миллипор» выпускает мембраны из разнообразных
полимеров для ультрафильтрации и обратного осмоса, как уни-
версальных, так и узкоспецифических. Например, мембраны ти-
па pF для фармацевтической и ферментной промышленности
выдерживают воздействие кислот и щелочей, что позволяет про-
водить их регенерацию или фильтрующие материалы на осно-
ве асбеста, цюллюлозы, керамики, стекловолокна и др. для пред-
варительной очистки ферментного раствора перед ультрафильтра-
цией.
Работа ультрафильтрационной установки и продолжитель-
ность службы мембран во многом зависят от качества дренаж-
ной подложки. Материал для ее изготовления должен быть
устойчив к воздействию фильтрующих растворов, химически и
биологически инертен, иметь упругую и стабильную пористую
103
структуру, его фильтрационные и дренажные характеристики не
должны зависеть от рабочего давления. В качестве материала
для дренажной подложки используют мипласт, пористую нержа-
веющую сталь, вспененный полиэтилен, капроновые сетки, бума-
гу. Наибольшей производительностью обладают капроновые сет-
ки толщиной 0,2 мм с размером ячейки 0,1X0,1 мм2 — до
0,5 мл/(см2-мин), а наименьшей — подложки из вспененного
полиэтилена — до 0,25 мл/(см2-мин).
Срок службы мембран н дренажных подложек зависит от ви-
да и концентрации растворенных в фильтруемом растворе ве-
ществ, качества предварительной обработки концентрируемого
раствора. Продолжительность работы мембран может быть от
нескольких месяцев до нескольких лет.
Характеристики мембран. На процесс ультрафильт-
рации оказывает влияние ряд факторов: селективность мем-
бран, их проницаемость и протекаемость, pH концентрируемого
раствора, температура, давление, концентрация сухого вещества
в исходном растворе, концентрационная поляризация. Рассмот-
рим эти показатели.
Главной характеристикой мембраны является ее селектив-
ность (/?), или избирательность к удержанию определенного ве-
щества. Она определяется по формуле (в %)
R = (1~ 100,
\ I
где Сф—концентрация концентрируемого вещества в фильтрате; Ср—кон-
центрация фермента в исходном растворе.
100 200 300
Продолжительность радоты
пендраны, и
Рис. 1.46. Влияние длительности ра-
боты на проницаемость и селектив-
ность мембраны
Селективность зависит от особенности мембраны и продолжи-
тельности ее эксплуатации (рис. 1.46).
Удельная производительность аппаратов связана с селективно-
стью мембран, которая определя-
ется величиной пор и молекуляр-
ным строением разделяемой сре-
ды. Селективность и скорость
фильтрования существенно зави-
сят от процесса массопереноса
на границе мембрана — раствор;
скорость и качество разделения
зависят от массопереноса внутри
мембраны и в пограничном слое.
Проницаемость
(G) определяется по
[в л/(м2-ч)]
Ft
мембраны
формуле
где V—объем фильтрата, л; F— рабо-
чая поверхность мембран, м2; т — дли-
тельность фильтрования, ч.
104
Рис. 1.47. Влияние pH концентри-
руемого раствора на селективность
(Р) мембран для раствора дезокси-
рибонуклеазы
Рис. 1.48. Влияние степени концентри-
рования и температуры иа величину
коэффициента протекаемости
Этот показатель зависит от физико-химических свойств мем-
бран, а также от температуры, pH, давления и других парамет-
ров концентрируемого раствора.
Коэффициент протекаемости мембран (£)) непосредственно
связан с проницаемостью и зависит от разности рабочего и ос-
мотического давлений Др при ультрафильтрации [в л/(м2-ч-Па)]:
D —.
На величины R, G и D заметное влияние оказывает pH фильт-
руемого раствора. Максимальная селективность мембран прояв-
ляется при ультрафильтрации вблизи изоэлектрической точки
концентрируемого фермента, так как отклонение в ту или дру-
гую сторону приводит к ионизации раствора и ухудшению усло-
вий концентрирования (рис. 1.47). Коэффициент протекаемости
мембран максимальный в изоэлектрической точке.
Повышение температуры положительно влияет на основные
показатели процесса ультрафильтрации, поскольку вязкость рас-
твора уменьшается и возрастает скорость фильтрования, повы-
шается проницаемость мембран, растет коэффициент протекае-
мости (рис. 1.48). Но повышение температуры ферментного рас-
твора с целью интенсификации процесса ультрафильтрации не-
приемлемо, так как большинство ферментов термолабильно. Чув-
ствительны к температуре и мембраны. Кроме того, температур-
ный эффект сглаживается с возрастанием степени концентриро-
вания, так как растет осмотическое давление, величина Др =
==рг— Ро уменьшается и коэффициент протекаемости мембран
падает. Движущей силой процесса фильтрования является рабо-
чее давление (рг), но эта величина имеет оптимальный предел,
105
поскольку ее рост приводит к уплотнению мембраны н снижению
ее проницаемости (рис. 1.49).
Для многих ферментных растворов на уровне предельных
оптимальных значений наблюдается явление концентрационной
поляризации, когда нарушается прямая зависимость между ско-
ростью фильтрования V и рг. Обычно это наблюдается при рг,
равном 0,5—1,2 МПа. Это явление связано с образованием на
поверхности мембраны в результате адсорбции частиц осадка в
порах мембраны динамического гелеобразного слоя или в ре-
зультате плохой первичной очистки растворов от взвеси. Отде-
ляемое вещество задерживается на поверхности мембраны, уве-
личивается р0, падает проницаемость, снижается скорость филь-
трования. изменяется селективность мембраны. Если содержание
белка в концентрируемом растворе не превышает 0,3—
0,4 мг/мл, то гелеобразный слой не образуется и между V и рг
сохраняется прямая зависимость, если концентрация выше
0,4 мг/мл, начинается концентрационная поляризация.
Изменение основных параметров процесса ультрафильтрации
в зависимости от концентрации белка представлено на рис. 1.50.
Для предотвращения концентрационной поляризации использу-
ют различные приемы: качественная предварительная очистка
растворов, установление мешалки и турбулизаторов, уменьшение
просвета между мембранами, резкое увеличение скорости про-
тока до перехода его в турбулентный. Для устранения началь-
ной адсорбции используются предварительное фильтрование
концентрируемого раствора через металлокерамические фильт-
ры, плотные фильтры, центрифугирование, сепарирование и т. д.
С этой точки зрения эффективны химическая обработка рас-
твора, прн которой удаляется часть балластных веществ соля-
Рис. 1.49. Зависимость скорости
фильтрования от рабочего давления
при ультрафильтрации
Концентрация белка в растворе, нг/нл
Рис. 1.50. Зависимость скорости
фильтрования (V), селективности
мембран (/?), степени концентриро-
вания (X) и проницаемости мембран
(G) от концентрации белка в раст- 4
воре
106
ми, бентонитом и др., а также изменение pH до изоэлектрическо-
го значения, при котором осаждаются балластные вещества.
После этого предварительно обработанный фильтрат поступает
на концентрирование. Использование флокулянтов (четвертич-
ных солей аммония, CaClz, AMSO-jJa-I8H2O, бентонита) позво-
ляет увеличить скорость фильтрования и уменьшить концентра-
ционную поляризацию на 20—30%. Для улучшения условий
ультрафильтрационного концентрирования ферментных раство-
ров может использоваться их предварительная диафнльтра-
ция. Для этого в ультрафильтрационную ячейку, куда помещен
концентрируемый раствор, подается растворитель (например,
вода) со скоростью отвода фильтрата, т. е. объем концентрируе-
мого раствора остается какое-то время постоянным. Затем добав-
ление растворителя прекращают и проводят концентрирование.
Этот прием позволяет фактически устранить явление концентра-
ционной поляризации и получить сравнительно чистые концентра-
ты ферментов.
Ультрафильтрационные установки. Процесс ультрафильтра-
ции осуществляется в специальных установках, которые в зави-
симости от устройства и формы фильтрующей ячейки можно под-
разделить на четыре группы: с плоскопараллельными фильтру-
ющими элементами (типа фильтр-пресса) с трубчатыми фильт-
рующими элементами, с рулонными фильтрующими элементами
и с фильтрующими элементами в виде полых волокон. Мембран-
ный аппарат и устройства для создания в системе давления —
главные элементы ультрафильтрационной установки. Помимо
них в схеме предусматриваются аппаратура для предваритель-
ной очистки ферментного раствора (емкости для ферментного
раствора, коагулянтов, осадка, сепаратор или фильтр, насос),
сборники для фильтрата и концентрата, емкости и насос с до-
зирующим устройством для проведения диафильтрации и т. д.
В лабораторных условиях для подбора типа мембран, рабочего
давления, режимов предварительной обработки и т. д. исполь-
зуют ячейки с одной мембраной. Простейшая ультрафильтраци-
онная лабораторная ячейка представлена на рис. 1.51.
К опытным и производственным ультрафильтрационным
установкам предъявляются следующие требования: компакт-
ность, простота изготовления и эксплуатации, соблюдение опти-
мальной гидродинамики (минимальная энергоемкость процесса
и минимальная концентрационная поляризация), коррозиестой-
кость, низкая металлоемкость, высокая прочность для работы
под давлением, простота сборки и надежность уплотнений.
Ультрафильтрационные установки, работающие по принципу
фильтр-пресса были созданы в начале 60-х годов для опресне-
ния воды методом обратного осмоса. В настоящее время осно-
ванные на этом принципе ультрафильтрационные установки вы-
пускаются фирмами «Аэроджет Дженерал Корпорейшн» (США),
DDS (Дания), «Ронпоулен» (Франция) и рядом других. Шагом
вперед по сравнению с вышеперечисленными аппаратами стали
107
Рис. 1.51. Схема ультрафильтрацион-
ной ячейки:
/ — мешалка магнитная: 2 — дренажная
прослойка; 3 — уплотнение; 4 — полупро-
ницаемая мембрана: 5 — манометры;
6 — баллон с инертным газом; 7 — ме-
таллическая перемешивающая пластин-
ка, запаянная в стекло
аппараты с модулями плоскопа-
раллельного типа, разработан-
ные фирмой «Дорр-Оливер»
(США) н в начале 70-х годов во
ВНИИпродуктов брожения. По-
следняя состоит нз трех цирку-
ляционных контуров по несколь-
ку фильтрующих блокоИ в каж-
дом с плоскопараллельными
мембранными пакетами. Уста-
новка имеет общую поверхность
фильтрования 24 м2. Каждый
блок содержит 40—45 фильтру-
ющих элементов общей площа-
дью около 2 м2. Давление в кон-
туре поддерживается насосом на
уровне 0,3—0,6 МПа. Установка
имеет производительность 100—
200 л/ч, скорость потока в кана-
лах 0,67—0,70 м/с; по мере за-
грязнения мембран через 300—
350 ч она падает в 2 раза. Конст-
руктивная особенность этой установки заключается в том, что
концентрируемый раствор подается одновременно во все каналы
плоскопараллельных фильтрующих элементов блока. Фильтрат
выводится нз блока по дренажной системе. Все блоки в каждом
контуре соединены последовательно. Разработана установка с
поверхностью мембран 2 000 м2, работающая под давлением до
1,5 МПа с производительностью по ультраконцентрату 30—
35 м3/сут.
Представляет интерес установка такого же типа УФ1-1-180
конструкции ВНИИбнотехннкн, схема которой показана на
рнс. 1.52. Она состоит нз 18 фильтрационных блоков с общей
площадью фильтрующей поверхности 180 м2 н имеет трн ступе-
ни концентрирования, включающие соответственно 9, 6 и 3 филь-
трационных блоков. В первой ступени предусматривается 3 па-
раллельных потока, во второй — 2 и в третьей — 1. Это позво-
ляет повысить скорость протока до 1,5—2,0 м/с и снизить гид-
равлическое сопротивление. Производительность этой установки
около 1 800 л/ч.
Фирма «Дорр-Олнвер» выпускает восьмимодульные ультра-
фильтрационные установки, работающие под давлением
0,38 МПа; кратность концентрироваиня в них 25—30.
Все аппараты, работающие по принципу фнльтр-пресса до-
статочно просты в изготовлении н монтаже, листовые мембраны
позволяют создать надежные уплотнения прн сборке, но оии
имеют и недостатки: они громоздки, фильтрующая поверхность
мембран составляет 100—200 м2/м3, ультрафильтрационные мо-
дули сложно промыть, трудно проводить нх замену, нужны тур-
108
Вода
Рис. 1.52. Технологическая схема ультрафильтрационной установки УФ1-1-180:
' — регулятор давления; 2 — клапан предохранительный; 3 — ротаметры; 4 — насосдозатор; 5 — циркуляционные насосы,
« — теплообменники; 7—блоки ультрафильтрационные; 8 — емкость для ферментного раствора; 9 — фильтр для очистки
воздуха; 10 — емкость для приготовления раствора антисептика; // — стерилизатор воды; /2 — сборник для концентрата; 13 —
сборник для ультрафильтрата: /-/ — промежуточный сборник для фильтрата; /5 — насос
болиэаторы потока, и почти невозможно предотвратить концент-
рационную поляризацию. '
Ультрафильтрационные установки с трубчатыми фильтрую-
щими элементами состоят из трубок, которые составляю^ дре-
нажную систему. Внутри или снаружи трубки наносится подлож-
ка (опорный слой) мембраны и затем мембрана. В зависимости
от того, где установлена мембрана, концентрируемый растйор по-
дается либо внутрь, либо снаружи трубы. Аппараты этого типа
были разработаны фирмой «Хавенз» (США), сейчас они выпу-
скаются фирмами «Абкор» (США), «Рамикон» (Франция),
«Филко-Форд» (США), «Дедремо» (Франция). Каркасные дре-
нажные трубы для этих аппаратов изготовляются из металла,
керамики, пластмассы, стеклопластика, графита и других мате-
риалов диаметром от 6 до 30 мм. В этих аппаратах Можно со-
здать высокие скорости протока, что позволяет турбулизировать
поток, и не требуется предварительной глубокой очистки от
взвеси и коллоидных частиц. Кроме того, они имеют простую
конструкцию, низкую металлоемкость, отличаются равномерно-
стью распределения концентрируемого раствора по поверхности
мембран. К недостаткам этих установок относятся: громоздкость
(фильтрующая поверхность до 100 м2/м3), сложность сбора тру-
бок в коллектор, так как трубки имеют малый диаметр. Эти
установки дорогостоящие, и на них нельзя концентрировать вяз-
кие растворы.
Фильтрующие элементы рулонного типа представляют собой
навитый на центральную перфорированную фильтратотводящую
трубку пакет, состоящий из двух мембран, разделенных одним
или несколькими слоями гибкого пористого дренажного материа-
ла, и сетчатого сепарационного листа между мембранами, обра-
зующего канал для протока разделяемого раствора (рис. 1.53).
Аппараты с элементами рулонного типа обладают высокой плот-
ностью упаковки (300—800 м2/м3) и низкой металлоемкостью.
Недостатками рулонных аппаратов являются: высокое гидравли-
ческое сопротивление потоку раствора, обусловленное наличием
сепарационной сетки с достаточно мелкими
ячейками (1—2 мм),
а
J 4
5
Рис. 1.53. Ультрафильтрационная установка рулонного типа:
а — общая схема: / — корпус; 2 — фильтрующий элемент; 3— уплотняющее уст-
ройство; 4 — дренажная труба; 5 — соединительное устройство; б — фильтрующий
элемент: / — сепарационный лист; 2 — мембрана; з — пористая подложка; 4 —
труба-коллектор
110
смещение слоев во время эксплуатации, сложная очистка и из-
готовление фильтрующих элементов. Аппараты такого типа при-
годны для разделения разбавленных маловязких растворов, тща-
тельно очищенных от коллоидных и взвешенных веществ.
В аппаратах с элементами из полых волокон используются
мембраны в виде тончайших трубочек с полупроницаемыми стен-
ками. Диаметр волокон (50—250 мкм) и толщину стенки (15—
100 мкм) подбирают таким образом, чтобы они выдерживали ра-
бочее давление без применения подложек и дренажных устройств.
Полые волокна собирают в пучки длиной до 3 м и помещают в
трубчатый корпус. Концы волокон закрепляют прочным водо-
стойким клеем в трубной решетке и выводят в камеру сбора
фильтрата. В промышленности распространены аппараты на ос-
нове полых волокон, где концентрируемый раствор омывает во-
локна снаружи, а фильтрат отводится внутри волокна. Произво-
дителем таких аппаратов является фирма «Дюпон» (США). Они
компактны, фильтрующая поверхность выпускаемых ею аппаратов
достигает 20 000 м2/м3. Они просты в монтаже и эксплуатации,
высокопроизводительны. Но они имеют те же недостатки, что и
установки рулонного типа.
В заключение следует сказать, что использование ультрафиль-
трации в ферментной промышленности перспективно как на ста-
дии концентрирования ферментных растворов с целью получения
жидких концентратов, так и как способ сгущения и очистки фер-
ментных растворов на стадии получения препаратов различной
степени чистоты.
1.10. ОСАЖДЕНИЕ ФЕРМЕНТОВ
Подавляющее большинство промышленно важных ферментов является во-
дорастворимыми белками. Растворы ферментов могут быть различного проис-
хождения: экстракты из поверхностных культур микроорганизмов, фильтраты
из гомогенатов растительных и животных тканей, лизаты микроорганизмов,
фильтраты культуральной жидкости, получаемой при глубинном выращивании
микроорганизмов. Эти растворы ферментов неоднородны и представляют собой
сложную систему, содержащую помимо ферментов большое количество раство-
римых в воде соединений и веществ коллоидной природы. Выделение ферментов
из этой сложной смеси представляет определенные трудности, так как система
очень чувствительна к внешним воздействиям, и поэтому обеспечение высокого
выхода фермента в осадок требует строгого соблюдения условий, при которых
начинается агрегирование белковых молекул и выпадение их в осадок.
Известно, что гидрофобные группы белка стремятся сконцентрироваться
внутри белковой молекулы, ио все же значительная их часть находится иа
поверхности молекулы. Растворимость белка в различных растворителях во
многом определяется распределением гидрофобных и гидрофильных остатков
на поверхности молекулы. Так как основным растворителем белков является
вода, то, изменяя некоторые свойства воды (температура, ионная сила, pH,
добавление нейтральных солей, водорастворимых органических соединений или
Других инертных соединений), можно создать определенное окружение белковой
молекулы, повлиять иа ее гидратный или сольватный слой и вызвать агрегацию
белковых молекул и выпадение их в осадок. В промышленности в основном
используют осаждение солями и органическими растворителями. Эти способы
несколько отличаются по механизму осаждения.
111
1.10.1. Осаждение ферментов органическими растворителями,'
Метод осаждения ферментов водорастворимыми органическими
растворителями в нашей стране широко применяется в промыш-
ленных масштабах. Эффект осаждения белков связан с тем, что
в присутствии органического растворителя снижается активность
воды. По мере увеличения концентрации растворителя снижается
способность воды к сольватации заряженных гидрофильных мо-
лекул фермента. Диэлектрическая постоянная растворителя сни-
жается, происходят вытеснение молекул воды с поверхности бел-
ковой молекулы и их частичная иммобилизация молекулой орга-
нического растворителя вследствие гидратации белка. Поэтому мо-
лекулы воды, расположенные на гидрофобных участках поверхно-
сти белка, могут быть замещены на молекулы органического рас-
творителя. При этом растворимость белков падает, происходят аг-
регирование и осаждение белковых молекул.
Агрегирование белков происходит под действием электроста-
тических и Ван-дер-Ваальсовых сил, возникающих между отдель-
ными белковыми молекулами. Гидрофобное взаимодействие, ве-
роятно, имеет меньшее значение в результате влияния органиче-
ских растворителей на неполярные участки белковой глобулы.
Факторы, влияющие на осаждение ферментов. Процессы агре-
гирования белков и формирования осадков зависят от условий
осаждения, природы осадителя и многих других факторов.
Размер молекулы белка. При прочих равных услови-
ях чем больше молекула, тем ниже критическая концентрация
растворителя, при которой происходит осаждение фермента. Но
на эту зависимость могут оказывать влияние степень гидрофобно-
Гидросро/ные участки {елка
Молекулы органическою
растворителя
Рис. 1.54. Агрегирование белков в
их водном растворе с органическим
растворителем
сти молекул, устойчивость соль-
ватного слоя и т. д. Однако, как
правило, крупные молекулы аг-
регируют быстрее, чем мелкие,
так как в этом случае больше
вероятность того, что на их по-
верхности находится заряженный
участок, комплементарный друго-
му белку (рис. 1.54).
Органический растворитель,
используемый для осаждения,
должен полностью смешиваться
с водой и не связываться с фер-
ментом. Наиболее широко для
осаждения ферментов использу-
ются этиловый спирт, ацетон и
изопропиловый спирт. Реже при-
меняются метанол, н-пропанол,
диоксан, 2-метоксиэтанол и дру-
гие спирты, кетоны, эфиры и их
смеси. При выборе растворителя
112
следует помнить о его возможной
токсичности, взрывоопасности и
возможности регенерации. С уче-
том этого наиболее пригодны для
производства этанол и изопропанол
и меньше — ацетон. Наиболее пер-
спективным считается осаждение
ферментов изопропанолом (рис.
1.55). Осаждение белков осуществ-
ляется при сравнительно низкой его
концентрации (52—53 %), и препа-
раты содержат на 40—45 % мень-
ше балластных веществ, чем при
осаждении ацетоном и особенно
этанолом. С помощью этих же ра-
створителей можно проводить раз-
деление комплекса ферментов. На-
пример, при введении в фильтрат
культуральной жидкости В. subtilis
103 до 50 % ацетона можно почти
Концентрация органического
растИорителя, 7.
Рис. 1.55. Осаждение амилоли-
тических ферментов из экстракта
культуры A. oryzae органически-
ми растворителями:
/ — изопропанол; 2— ацетон; 3 —
диоксан; 4— этанол
полностью осадить а-амилазу, а
при дальнейшем увеличении концентрации ацетона в надосадоч-
ной жидкости получается почти свободная от а-амилазы нейтраль-
ная протеиназа. Подобное фракционирование ферментного ком-
плекса наблюдала Л. И. Орещенко с сотрудниками при осажде-
нии ферментов из экстрактов поверхностной культуры гриба
A. oryzae 78-2 этанолом: в 66%-ном растворе этанола осаждалась
мальтаза, в 73%-ном — а-амилазы и протеиназы, а в 79%-ном —
декстриназы. Помимо концентрации растворителя и его природы
полнота осаждения ферментов зависит от целого ряда факто-
ров: от присутствия электролитов, температуры осаждения, дли-
тельности контакта фермента, с растворителем, pH среды, концент-
рации и состава сухого вещества и т. д.
Наличие в растворе некоторых ионов может ока-
зывать стабилизирующее влияние на фермент. Так, ионы Са2+
способствуют сохранению активности а-амилаз, протеиназ, глюко-
амилаз; защитным действием обладают ионы магния, марганца,
кобальта. В то же время ряд ионов (Fe2+, Pb2+, Cu2+, Ag+, Ni2+,
Al3+, Hg+ и др.) действует отрицательно и их присутствие крайне
нежелательно. Наличие электролитов часто позволяет снизить
расход осадителя и улучшить структуру осадка.
Температура ферментного раствора и раство-
рителя. При осаждении ферментов следует стремиться, чтобы
она была по возможности низкой. Это связано с тем, что смеши-
вание спирта и водного раствора фермента сопровождается выде-
лением тепла; температура смеси повышается на 5—10°C, и, если
спирт предварительно не охлажден, происходит инактивация фер-
ментов. При этом наблюдается не только термоинактивация. По-
вышение температуры в присутствии растворителя способствует
113
Рис. 1.56. Денатурирующее действие органических растворителей и тем-
пературы на белок
изгибанию структуры фермента (рис. 1.56) — стадия Л. Небольшие
молекулы органического растворителя проникают в поверхностные
трещины, образующиеся спонтанно в результате естественной по-
движности структуры, где гидрофобно связываются с внутригло-
булярными остатками аминокислот (лейцин, изолейцин, валин, ти-
розин и др.) — стадия Б. Это неизбежно приводит к нарушению
внутримолекулярных гидрофобных взаимодействий фермента (ста-
дия В) и часто к изменению конформации активного центра и по-
тере ферментом каталитической активности, т. е. проявляются все
признаки денатурации. При температуре осаждения смеси свыше
10—15°С наблюдаются все признаки инактивации ферментов,
причем тем выше, чем чище осаждаемый фермент. Денатурация
зависит и от природы растворителя: спирты с длинной цепью об-
ладают большей денатурирующей способностью по сравнению с
короткоцепочечными. Для большинства ферментов, получаемых в
промышленных условиях, оптимальная температура осаждения
равна 3—5 °C. Для достижения этой температуры раствор фермен-
та охлаждают до 1—3°С, а растворитель — до —8-4—12 °C.
Очень большое значение при осаждении ферментов имеет
pH среды. Из одного и того же ферментного раствора при раз-
личном значении pH можно получить различное количество осад-
ка с неодинаковой активностью ферментов. Это связано с тем,
что наиболее полно ферменты выпадают в изоэлектрической точ-
ке, когда создаются наиболее благоприятные условия для агреги-
рования белковых молекул. Процесс осаждения белков в изоэлек-
трической точке без применения осаждающих реагентов называ-
ется изоэлектрическим осаждением. Использование органических
осадителей при pH, близком к изоэлектрической точке, позволяет
ускорить осаждение ферментов и использовать растворители более
низких концентраций. При отклонении величины pH от изоэлек-
трической точки выход осадка и особенно активность фермента
падают до 30—50 % максимальной величины. Поэтому необходи-
мо строго соблюдать режим поддержания оптимального значения
pH в момент осаждения ферментов органическими растворителями.
Концентрация сухого вещества в исходном
растворе. Максимальный выход активного фермента в препа-
114
рат и наиболее стабильная структура осадка получаются при со-
держании сухого вещества не более 10—12 % (рис. 1.57). Из ри-
сунка видно, что при осаждении ферментов наиболее оптимальной
является концентрация сухого вещества около 10 %, особенно при
осаждении протеолитических ферментов. В некоторых случаях,
варьируя концентрацию сухого вещества, можно частично фрак-
ционировать комплекс ферментов.
Длительность контакта с растворителем. Сле-
дует стремиться сократить это время до минимума, чтобы умень-
шить инактивацию ферментов. Максимального сокращения про-
должительности контакта осадка с растворителем можно достичь
в непрерывных осадителях, которые все шире используются в оте-
чественной ферментной промышленности.
Установки для осаждения ферментов. Схема такой установки
приведена на рис. 1.58. Установка состоит из сборника фермент-
ного раствора 1, смесителя непрерывного действия 5, контуров
непрерывной подачи ферментного раствора и растворителя, сепа-
ратора 6 и системы автоматизации. Смеситель представляет собой
вертикальный цилиндрический корпус 1, внутри которого распо-
ложен шток 2. На штоке установлены распорные втулки <3, чере-
дующиеся с перегородками 4, не доходящими с одной стороны до
стенок цилиндра. На боковой верхней части вертикального ци-
линдра имеются штуцера для подачи ферментного раствора и рас-
творителя. В нижней части цилиндра расположен спускной шту-
цер для выхода смеси. Движущиеся сверху вниз по сложной тра-
ектории жидкости в течение короткого времени полностью смеши-
ваются. Образующийся осадок непрерывно отделяется в сепара-
торе. При таком способе осаждения продолжительность контакта
ферментов и растворителя сокращается в десятки раз, а выход
ферментов в осадок повышается на 15—20 %.
Отделенный на сепараторе осадок может быть высушен в ва-
куум-сушильном шкафу, на сублимационной сушилке илн после
Рис. 1.57. Влияние исходной концентрации сухого вещества в ферментном
растворе иа полноту осаждения ферментов:
/ — концентрация спирта 63%: 2 — 72%: 3 — 79%: 4 — 82%
115
Спирт
Ферментный
1 осадок *
Фугат на
регенерацию
Раствор
фермента
К сепаратору
5
Рнс. 1.58. Установка для непрерывного осаждения ферментов:
а — общая схема: / — сборник для ферментного раствора; 2 — мерник для
спирта; 3, 4 — ротаметры; 5 — смеситель; 6 — сепаратор; б — смеситель пепре.
рывного действия конструкции ВНИИбиотехиики: / — корпус; 2 — шток; 3 — рас;
пориые втулки; 4 — перегородки; 5 — гайка; $— уплотнение
растворения в минимальном количестве воды (при введении соот-
ветствующего наполнителя или стабилизатора) в распылительной
сушилке. Отсепарированная надосадочная жидкость, содержащая
50—75 % растворителя, направляется на регенерацию в ректифи-
кационное отделение. После регенерации растворитель вновь по-
ступает на производство на стадию осаждения, а кубовый остаток,
содержащий почти все сухое вещество культуральной жидкости
или экстракта, может быть использован вместе с биошротом для
приготовления кормов.
Выход препарата при осаждении органическими растворителя-
ми зависит от состава среды, на которой выращивался продуцент,
и степени предварительного концентрирования ферментного рас-
твора. Из экстракта, получаемого из поверхностной культуры с со-
держанием сухого вещества 12—14 %, выход препарата составля-
ет 3—5 % сухого вещества исходной культуры и зависит от вида
культуры и используемого растворителя. Значительно сложнее
прогнозировать выход ферментного препарата из глубинной куль-
туры. Он зависит от состава среды, концентрации сухих веществ
и многих других факторов. Обычно выход 'определяется экспери-
ментально и строго регламентируется по массе и активности.
1.10.2. Осаждение ферментов высококонцентрированными
растворами солей (высаливание)
Процесс высаливания ферментов в основном зависит от степе-
ни гидрофобности белковой молекулы. Типичная белковая моле-
кула имеет гидрофобные участки на поверхности в виде боковых
116
Рис. 1.59. Схема расположения мо-
лекул воды на гидрофобных участках
белка
цепей ряда аминокислот (тиро-
зин, триптофан, лейцин, изолей-
цин. метионин, валин и фенил-
аланин). На гидрофобных участ-
ках молекулы белка при сопри-
косновении с водой происходит
образование слоя, состоящего из
ориентированных молекул во-
ды; эти участки оказываются
блокированными, или «заморо-
женными» (рис, 1.59). Однако
такое упорядочение структуры
термодинамически неустойчиво,
так как в такой системе проис-
ходит значительное снижение эн-
тропии по сравнению с системой
негидратированный белок — свободные молекулы воды. Если
молекулы воды иммобилизовать молекулами небелковой природы,
то белковые молекулы начинают взаимодействовать и происходит
их'агрегирование. Известно, что ионы солей гидратируются, и при
добавлении значительного количества соли происходит связыва-
ние воды, белок частично освобождается от воды и создаются усло-
вия для агрегирования белковых молекул. Этот процесс можно
представить следующим образом. По мере сольватации ионов со-
ли свободных молекул воды становится мало и поэтому воз-
растает тенденция к отрыву молекул воды от гидрофобных фраг-
ментов белковой молекулы. Происходит дегидратация неполярных
участков белка, которые стремятся взаимодействовать друг с дру-
гом, образуют агрегаты, растворимость белка резко падает,и он
выпадает в осадок. Чем выше концентрация соли, тем быстрее про-
исходит образование осадка.
Различные белки по-разному реагируют на процесс высалива-
ния. Это зависит в первую очередь от количества и размеров гид-
рофобных участков на поверхности белковой молекулы. Чем боль-
ше таких участков, тем легче идет высаливание белков. Есть бел-
ки, которые даже при очень высокой концентрации соли в раство-
ре почти не агрегируют и не выпадают в осадок. При осаждении
ферментов из сложной смеси разнообразных белков имеет место
явление соосаждения. После дегидратации белковых молекул в
растворе солен молекулы белка агрегируют не с идентичными,
а с любыми другими «клейкими» молекулами, находящимися по-
близости. Это приводит к получению препаратов, обогащенных
различными сопутствующими балластными веществами. Однако
при высаливании можно добиться не только осаждения всего ком-
плекса ферментов, но и его фракционирования.
Растворимость белков в солевых растворах подчиняется эмпи-
рическому уравнению Кона
IgS = lg So — kjl,
117
где S, So—растворимость белка соответственно в растворе соли и чистой воде;
k, — коистаита высаливания; g — иоииая сила раствора.
Для успешного осуществления процесса высаливания необхо-
димо, чтобы величина &sg была как можно больше. Величина ks
зависит от природы соли, но не зависит от концентрации водород-
ных ионов. Она изменяется в широких пределах: для цитрата нат-
рия ks равна 1,29, фосфата калия — 1,15, сульфата натрия — 1,08,
сульфата аммония — 0,84, сульфата магния — 0,62 и в условиях
эксперимента является постоянной величиной. Реально усилить
эффект высаливания можно, увеличивая ионную силу раствора.
Хотя высаливание белков в основном определяется гидрофоб-
ными взаимодействиями, на этот процесс существенно влияют и
другие факторы: pH среды, близость его к изоэлектрической точ-
ке белка, температура, степень чистоты ферментного раствора,
длительность процесса н т. д. Самую большую растворимость в
солевых растворах большинство белков имеет при pH около 7,
когда они содержат наибольшее количество заряженных групп,
наименьшую растворимость — вблизи изоэлектрической точки.
Поэтому целесообразно вести осаждение ферментов методом вы-
саливания при pH вблизи изоэлектрической точки. Большое зна-
чение для растворимости белка имеет температура, так как она
существенно влияет на гидрофобные взаимодействия. Обычно с по-
вышением температуры растворимость белка падает и усиливает-
ся процесс агрегирования белковых молекул. Так, мутный соле-
вой белковый раствор, полученный при температуре 20 °C, со все-
ми признаками начинающегося процесса осаждения фермента
становится абсолютно прозрачным, если его поместить в холо-
дильник при 4 °C.
Для высаливания в основном используются нейтральные соли
щелочных металлов. Высаливающий эффект различных ионов за-
висит от их ионной силы. По силе высаливающего действия анио-
ны натриевых солей можно расположить в следующий ряд:
SO72>CH3COO->Cl->NO7>Br->J->CNS-, а катионы —
Li+>Na+>K+> (NH4)+.
При высаливании сложных биохимических смесей соль может
взаимодействовать и с другими соединениями, вызывая их осаж-
дение. Поэтому высоленные нли осажденные растворителями фер-
ментные препараты содержат до 60—85 % балластных сопутству-
ющих веществ. Для высаливания могут быть использованы суль-
фат аммония, сульфат натрия, сульфат цинка и хлористый нат-
рий. Наиболее часто используют сульфат аммония, реже — хло-
ристый натрий. Наибольшее осаждение белков происходит при
концентрации соли в растворе, близкой к концентрации насыще-
ния. Но это не всегда удобно, так как в осадок вместе с белком
увлекается большое количество соли, что требует дополнительной
очистки препаратов и затрудняет их применение. Обычно осажде-
ние ведут раствором с концентрацией соли 0,5—0,9 от полного на-
сыщения, но и в этом случае в препараты переходит от 20 до 80 %
соли рт массы осадка.
118
Самая сложная стадия процесса высаливания — это внесение
соли и способ ее растворения. Соль измельчают и медленно до-
бавляют небольшими порциями при постоянном перемешивании,
чтобы избежать локальных зон повышения концентрации соли в
растворе. При перемешивании может наблюдаться вспенивание
раствора, которое нежелательно, так как при попадании фермента
в пузырьки пены он может денатурироваться в результате воздей-
ствия поверхностного натяжения. Поэтому перемешивание должно
быть умеренным, без пенообразования. После введения последней
порции соли перемешивание следует продолжать еще 20—40 мни
до достижения полного равновесия между растворенными и агре-
гированными белками. Образование осадка начинается со сла-
бого помутнения, которое постепенно переходит в суспензию со
взвешенными хлопьями. Процесс формирования осадка зависит
от температуры, объема ’обрабатываемой жидкости, pH среды и
может длиться от 20—40 мин до нескольких часов. Повышение
температуры при высаливании благоприятствует быстрому агреги-
рованию молекул белка в крупные хлопья, поэтому процесс ведут
при 20—30°C. При высаливании можно добиться частичного фрак-
ционирования комплекса ферментов.
В целом высаливание — очень сложный технологический про-
цесс, зависящий от множества факторов, особенно в заводских ус-
ловиях. Кроме того, важно помнить, что соль никогда не осажда-
ет фермент полностью, а только снижает его растворимость. На-
пример, если содержание высаливаемого фермента в исходном
растворе составляет 1 мг/мл и в результате добавления соли рас-
творимость его понижается в 10 раз (до 0,1 мг/мл), это значит,
что 90 % фермента выпало в осадок при высаливании. Однако
если исходная концентрация фермента 0,1 мг/мл, то при том же
содержании соли в растворе осаждения фермента не будет. Иными
словами, оптимальная концентрация высаливающего агента зави-
сит не только от свойств самого фермента, но и от свойств других
сопутствующих белков и соосаждающих веществ, а также от кон-
центрации фермента и белка в исходном растворе. Осадки, полу-
ченные при высаливании, имеют однородную структуру, содержат
меньше органических балластных веществ; их легко сушить, из-
мельчать, они слабо окрашены и хорошо растворяются. Если уда-
лить из этих препаратов соль путем диализа или последующего
растворения и осаждения органическим растворителем, то в лабо-
раторных и даже промышленных условиях можно получать срав-
нительно чистые ферментные препараты с минимальными поте-
рями.
Метод высаливания широко распространен в технологии фер-
ментных препаратов, особенно за рубежом. Это одни из самых
старых методов выделения и фракционирования ферментов. Чаще
всего для высаливания используют сульфат аммония, но эта соль
при хранении проявляет тенденцию к закислению и даже к выде-
лению аммиака; она очень агрессивна по отношению к металлам
и бетону, и возникают большие сложности при нейтрализации и
119
регенерации этой соли в промышленных масштабах. Сульфат нат-
рия менее агрессивный, но он крайне чувствителен к температуре:
при ее уменьшении ниже 35—40 °C происходит осаждение соли.
Поэтому сульфат натрия в заводской практике почти не исполь-
зуется.
£10.3. Осаждение ферментов органическими полимерами
и другими веществами
Белки могут агрегироваться без денатурации под действием
различных высокомолекулярных нейтральных водорастворимых
полимеров, ионов некоторых металлов и ряда других соединений.
Из полимеров для осаждения и выделения ферментов используют-
ся декстраны и полиэтиленгликоль различной степени полимери-
зации. Для осаждения обычно используют полиэтиленгликоль
(ПЭГ) двух типов с молекулярными массами 6 000 и 20 000. Осаж-
дение белков в растворах ПЭГ сходно с их осаждением в органи-
ческих растворителях, так, растворимость ферментов в растворах
ПЭГ возрастает по мере отклонения pH от их изоэлектрической
точки. Но для проведения осаждения требуются низкие концент-
рации ПЭГ. Полиэтиленгликоль можно добавлять в виде концен-
трированного (50%) водного раствора до содержания его в сме-
си 6—12 %. Процесс можно вести при комнатной температуре, так
как ПЭГ оказывает на белок стабилизирующее воздействие. Сам
реактив сравнительно дешев, и он используется в ряде стран для
осаждения ферментов в промышленных масштабах. ПЭГ труднее
удалить из ферментной фракции, чем соль или органический рас-
творитель, но поскольку он не оказывает отрицательного воздей-
ствия на белок при его дальнейшем выделении (высаливание,
ионообменная хроматография, адсорбция и т. д.), его часто не
удаляют совсем.
Есть данные об использовании при выделении белков заряжен-
ных полимеров, например полиэлектролитов в 'очень низких кон-
центрациях (от 0,05 до 0,1 %). Поскольку осаждение чаще всего
ведут при низких значениях pH (от 3 до 6), которые многие фер-
менты не выдерживают, а величина положительного заряда мно-
гих ферментов очень мала, большинство ферментов плохо осаж-
дается этими полимерами. Но ряд ферментов, такие, как лизоцим,
трипсин, пепсин, осаждается хорошо. Считают, что положительно
заряженные полимеры, подобные ДЭАЭ-декстрану, эффективно
осаждают кислые белки при щелочных значениях pH. Осадителя-
ми ферментов могут быть соли каприловой кислоты, риванол и
многие другие соединения, имеющие как гидрофобные, так и по-
лярные свойства, но пока способы осаждения этими реагентами
очень мало изучены.
Для осаждения некоторых ферментов можно использовать
ионы металлов, с которыми белки образуют соли, имеющие пони-
женную растворимость. Так, для выделения р-галактозидазы из
разрушенных клеток Е. coll успешно используются ионы Мп21"
120
После удаления ионов Мп^+ происходят полное восстановление
фермента и его одновременная очистка от 30—40 % сопутствую-
щих нуклеиновых кислот. Но этот метод осаждения не получил
широкого распространения из-за того, что выделение фермента из
образующихся солей металлов затруднено и сопровождается инак-
тивацией и денатурацией фермента.
1.10.4 . Осаждение ферментов путем избирательной денатурации
Этот способ выделения приемлем только для стабильных ферментов, сохра-
няющих устойчивость в экстремальных условиях внешней среды, например
глюкозоизомеразы, которая выдерживает температуру до 90—95 °C. Помещая
такие ферменты в смеси с сопутствующими белками в экстремальные условия,
можно вызвать денатурацию ненужных белков. Денатурированные белки можно
осадить и удалить, а в растворе останется целевой фермент. Для проведения
избирательной денатурации используют три фактора: температуру, pH и воз-
действие органическими растворителями, которые можно применять по отдель-
ности или комбинировать их.
Термическая денатурация. Этот вид денатурации нецелевых белков доста-
точно часто применяется на начальных стадиях очистки термостабильных
ферментов. Для защиты основного фермента при термообработке используют
специфический стабилизирующий эффект субстрата, в присутствии которого
фермент лучше переносит термическое воздействие. Говоря о тепловой денатура-
ции, важно помнить о возможности возникновения процесса протеолиза, который
активируется при повышенной температуре и может отрицательно сказаться на
свойствах выделяемого фермента. Для предотвращения протеолиза термическую
денатурацию ведут в присутствии высоких концентраций сульфата аммония.
Тепловая избирательная денатурация требует строжайшего соблюдения условий
проведения процесса: температуры, длительности обработки, скорости охлажде-
ния и особенно pH среды. Этот способ чаще используется в лабораторных ис-
следованиях и очень редко — и а производстве.
Избирательная денатурация под воздействием pH. Это более распростра-
ненный прием очистки и фракционирования ферментов, чем термическая дена-
турация. Суть метода заключается в том, что при экстремальных значениях
pH происходит денатурация нецелевых белков. Денатурация происходит потому,
что отдельные участки белковой молекулы приобретают большое количество
зарядов одного знака или теряют их, что приводит к отталкиванию этих участ-
ков друг от друга или их притяжению (рис. 1.60). Все это приводит к денату-
рации белковой молекулы. рН-деиатурация — сложный процесс, который может
протекать как при значениях pH, близких к изоэлектрической точке белка, так
и далеких от нее. Скорость денатурации в кислых н щелочных условиях ие
совпадает со скоростью протоиирования (оиа мгновенна). Скорости разво-
рачивания глобулы лимитирует скорость всего процесса. Для каждой смеси
белков должны экспериментально устанавливаться режимы изменения pH, тем-
пературы и длительности экспозиций для проведения pH-денатурации. Важно
также и то, какими кислотами или щелочами устанавливается нужное значение
pH. Надо стремиться избегать использования сильных кислот и щелочей, так
Рис. 1.60. Денатурация белка под воздействием pH
121
как они могут вызвать инактивацию ие только балластных белков, но и целе-
вого фермента. Для установления pH в диапазоне от 5 до 8,5 используют
трис-буфер и уксусную кислоту, довести pH до 4 можно молочной кислотой,
pH до 9 доводят диэтаноламином, а до 10,5—карбонатом натрия и, только
если необходимо установить pH ниже 4 нли выше 10,5, применяют сильные
кислоты и щелочи. После pH-денатурации значение pH доводят до нейтрального
и денатурированные белки осаждаются, перед этим их некоторое время вы-
держивают прн 25—30 °C. Далее отделение проводят центрифугированием.
Денатурация органическими растворителями. Ранее было показано, что
процесс осаждения ферментов органическими растворителями следует вести при
температуре, близкой к нулю, так как при ее повышении происходит инактива-
ция ферментов. Но есть ферменты, исключительно стабильные к воздействию
растворителей, которые можно получать методом денатурации сопутствующих
белков органическими растворителями при повышенных температурах осажде-
ния. Большое значение для успешного проведения процесса денатурации сопут-
ствующих балластных белков имеют природа растворителя и особенно длина
алифатической цепи используемого спирта. Р. Скоупс (1985) установил, что чем
длиннее эта цепь, тем выше денатурирующий эффект. Так, водорастворимые
спирты по возрастающей силе денатурирующего воздействия на белок можно
расположить в следующий ряд: метанол, этанол, пропан-1-ол, бутан-1-ол и
пеитан-1-ол. Действие ацетона аналогично действию этанола, а спирты с раз-
ветвленной цепью обладают значительно меньшим денатурирующим воздейст-
вием на белок. Этот метод очистки стабильных к растворителям ферментов
перспективен, но требует высокой культуры производства и четкого соблюдения
режимов денатурации (pH, температура, длительность процесса). В настоящее
время этот метод используется только в лабораторных условиях для выделе-
ния ограниченного числа ферментов.
1.11. РАЗДЕЛЕНИЕ И ОЧИСТКА ФЕРМЕНТОВ
МЕТОДОМ АДСОРБЦИИ
Ферменты н другие белки обладают способностью адсорбиро-
ваться на различных нерастворимых соединениях. Это свойство
используется для разделения смеси белков и очистки ферментов,
особенно в лабораторной практике при получении высокоочнщен-
ных и гомогенных ферментов. Адсорбционные методы, особенно ко-
лоночная хроматография белков, позволяют получить ферменты
ианвысшей степени очистки с большим выходом готового продук-
та. Вполне успешно методы адсорбции используются не только при
колоночной хроматографии, но н при адсорбции в объеме.
Важнейшими адсорбентами белков являются различные ионо-
обменникн — гели фосфата кальция, гели гндрокснда алюминия
и разнообразные аффинные адсорбенты, которые создаются для оп-
ределенного вида ферментов. Независимо от того, на чем основы-
вается разделение белков — на адсорбции, ионном обмене, изби-
рательном сродстве к иммобилизованным на носителе лигандам
или на эффектах молекулярного сита — техника разделения бел-
ков н очнсткн ферментов почти одинакова и заключается в следу-
ющем. Разделяемая смесь белков и других соединений, содержа-
щая целевой фермент, растворяется в подходящем растворителе
(буфере) н наносится на колонку, предварительно уравновешен-
ную этим же растворителем. Затем через колонку пропускают бу-
фер определенного состава илн извлекают белок ступенчато рас-
творами элюента в возрастающей концентрации либо градиентной
122
элюцией, либо с помощью специфического для данного фермента
лиганда. Элюат, выходящий с колонки, собирают по фракциям,
которые служат исходным материалом для получения соответст-
вующего фермента.
Ионообменная хроматография. В иоиообменниках белки связы-
ваются обычно с помощью электростатических сил, возникающих
между заряженными поверхностями белков и плотными кластера-
ми заряженных групп самого ионообмеиника. Типичные ионообмен-
ники — диэтил аминоэтил (ДЭАЭ-) или карбоксиметил (КМ-) цел-
люлозы — в набухшем состоянии имеют степень модификации до
0,5 ммоль/см3, что соответствует 0,5 М концентрации заряженных
групп. Эти заряды в колонке нейтрализуются нонами противопо-
ложного знака (иоиы металлов, ионы хлора, буфера и т. д.). Обыч-
но суммарный заряд белка имеет тот же знак, что и противоионы,
и белок при прохождении через колонку должен вытеснить имен-
но эти противоионы.
Поэтому для характеристики этого процесса применяется тер-
мин «ионный обмен».
Белок, как и противоионы, нейтрализует адсорбент, и в месте
нахождения белка образуются нейтральные зоны (рис. 1.61). Ко-
личество белка, которое может связывать ионообмениик в расче-
те на единицу объема может быть очень большим. Оно зависит от
размера молекулы белка, его концентрации. Некоторые характери-
стики адсорбированных на КМ-целлюлозе ферментов приведены в
табл. 1.13.
Рис. 1.61. Схема ионного обмена, происходящего прн
адсорбции отрицательно заряженного белка на ноио-
обменнике
Семь положительно заряженных конов, ассоциированных с
белком, вытесняются вместе с семью отрицательно заряжен-
ными ионамн из ионообмеиника (по данным Р. Скоупса,
1985)
123
Таблица 1.13
Фермент Молекулярная масса Емкость, мг/см’ Емкость. мМ
Лизоцим 14 300 130 9,00
Фосфоглицераткиназа 45 000 70 1,55
Фосфоглицератмутаза 60 000 40 0,67
Креатинкиназа 82 000 35 0,43
Лактатдегидрогеназа 140 000 21 0,15
Альдолаза 160 000 22 0,14
Пируваткиназа 228 000 12,5 0,055
Из табл. 1.13 видно, что молекулы белка с массой более I05
практически не задерживались на этом виде сорбента, ДЛЯ НИХ
имеет место ситовой эффект, как при гель-фильтрации. Создано
много различных ионообменников для разделения белков, которые
изготавливаются на основе целлюлозы, сферических гранул цел-
люлозы (сефацеллы), сферических гранул декстрана (сефадексы),
агарозы, синтетического полимера трисакрила. Ионообменники мо-
гут быть заряжены по-разному в зависимости от вида их модифи-
кации. Катионообменники обычно используются в виде карбокси-
метилпроизводных, либо фосфо- или сульфопропилпроизводных.
К анионообмеиникам относятся ДЭАЭ-, ТЭАЭ (триэтиламино-
этил)-, ЧАЭ (четвертичный аминоэтил)- и ПЭИ (полиэтиленими-
но) производные.
После адсорбирования нужного белка на колонке осуществля-
ется его элюция. Помимо аффинной элюции теоретически существу-
ет два метода элюции белков: изменение pH буфера до величины,
при которой связь с белком ослабевает; повышение ионной силы,
что вызывает ослабление электростатического взаимодействия
между адсорбентом и белком. Первый метод не всегда дает хоро-
шие результаты, так как при недостаточно высокой буферной ем-
кости резкое изменение pH в процессе элюции приводит к плохому
разделению смеси белков и других соединений. Этот способ элю-
ции в последние годы был усовершенствован Л. А. А. Слюйтерма-
ном и др. (1981), которые создали метод хроматофокусирования,
в котором градиент pH при элюции создается с помощью буферов
амфолитного типа, обладающих высокой буферной емкостью, но
низкой эффективной ионной силой. Именно этот метод, по мнению
многих специалистов, является наиболее перспективным для про-
мышленного виедреиия.
Для элюции ферментов вторым методом достаточно широко
используются солевые градиенты, обычно хлориды калия или нат-
рия. В присутствии ионов соли притяжение между свободным бел-
ком и адсорбентом значительно ослабляется. Величина коэффици-
ента распределения а (отношение количества адсорбированного в
данный момент вещества к его полному количеству) по мере повы-
шения концентрации соли будет снижаться, начинается процесс
элюции, и белки начинают двигаться в низ колонки. Но так как
124
Рис. 1.62. Принципиальная схема аффинной элюции с катионообмеиника:
а — адсорбция белка ( + ) на ионообменнике; б — введение лиганда (—). умень
шающего заряд белка; в—элюция белка вследствие уменьшения а
скорость движения соли больше, чем белков, последние постоянно
подвергаются воздействию высоких концентраций соли. Это при-
водит к тому, что зоны расположения белков сужаются и как бы
уплотняются, что обеспечивает более высокое фракционирование
белков на выходе из колонки.
Удаление адсорбированного на ионообменнике фермента или
других неспецифических адсорбентов можно провести с помощью
аффинной элюции. Аффинная элюция осуществляется путем введе-
ния в колонку с ферментом специфического лиганда, который изби-
рательно связывается с адсорбированным белком. При этом коэф-
фициент распределения (а) резко снижается, и белок вместе с ли-
гандом удаляется из колонки (рис. 1.62). Самая большая слож-
ность — это найти лиганд, который бы мог «узнать» нужный фер-
мент и «снять» его с сорбента. Для того чтобы элюция шла успеш-
но, в колонку с адсорбированным ферментом вносят раствор ли-
ганда, концентрация которого должна превышать по величине кон-
станту диссоциации комплекса фермент — лиганд. Если молекул
фермента много, то общее количество лиганда (в М) должно быть
больше количества центров связывания (в М), но в то же время
концентрация лиганда не должна существенно изменять ионную
силу буфера. Если элюцию проводят с жатионообменника, то ли-
ганд должен иметь отрицательный заряд, а при очистке на анионо-
обменнике — положительный. Если лиганд не будет соответство-
вать ионообменнику по заряду, то ои может сам адсорбироваться
на ионообменнике, и аффинная элюцня будет сильно затруднена.
Специалисты считают, что это наиболее перспективный метод элю-
ции нужного фермента без сопутствующих примесей в мягких ус-
ловиях.
Аффинная адсорбционная хроматография. Среди методов ад-
сорбционного разделения и очистки белков и ферментов этот ме-
тод занимает особое место. Часто его называют аффинной хрома-
125
Рис. 1.63. Принципиаль-
ная схема аффинной ад-
сорбции молекул фермен-
та (Ф):
Л — лиганд; Л1 — матрица
(подложка); Ь’ь — бал-
ластные белки; Вь В2 —
низкомолекулярные при-
меси
тографией, или более точно биоаффинной,
или биоспецифической хроматографией.
Ее суть заключается в том, что многие
биологически активные соединения, в том
числе и ферменты, имеют исключительную
способность специфически и обратимо свя-
зываться с другими веществами, которые
принято называть лигандами, аффинными
лигандами или просто аффинатами. Если
такой лиганд (Л) ковалентно соединить с
нерастворимой инертной матрицей (Af), то
получится специфический адсорбент, на ко-
тором будут адсорбироваться только фер-
менты (Ф), имеющие сродство к данному
лиганду. Остальные же вещества (В) и
белки (Б) будут транзитом проходить че-
рез колонку (рис. 1.63).
Варьируя условия процесса и используя
специальные элюенты, которые изменяют
сродство лиганда к ферменту, можно вы-
звать десорбцию белка и получить практи-
чески в один прием высокоочищенный фер-
ментный препарат. Подбор носителя и ли-
гандов— задача очень сложная. Только в
некоторых случаях можно найти лиганды
в виде существующих соединений, имити-
рующие субстраты или являющиеся настоящими субстратами
(крахмал, пектин, целлюлоза), которые можно использовать при
создании аффинных сорбентов. В большинстве случаев аффинные
адсорбенты требуется синтезировать с учетом свойств очищае-
мого фермента. Этот процесс имеет н другие сложности. Напри-
мер, сорбенты могут быть невысокоспецифнчными и удерживать
не только очищаемый фермент, но и ряд других белков, что ослож-
няет н удлиняет очистку. Для аффинной хроматографии использу-
ют различные нерастворимые сорбенты, но все большее распро-
странение получают поперечно сшитые гранулы агарозы, так как
онн достаточно прочные, не разрушаются и сохраняют форму под
давлением, прн смеие буфера или в присутствии различных ра-
створителей.
К лнгаидам предъявляется ряд жестких требований: оин так
должны присоединяться к матрице, чтобы не был затруднен под-
ход белка к лиганду; желательно, чтобы между матрицей и лиган-
дом был мостик, что облегчает доступ к лиганду; необходимо, что-
бы лигаид не взаимодействовал с другими соединениями, имел
прочную связь с'матрицей, которая была бы стабильна при ад-
сорбции фермента, его последующей элюции, регенерации и очист-
ке колонки с сорбентом. Даже простой перечень требований к ли-
ганду и матрице показывает, что это сложный и трудновыполни-
мый процесс. И хотя с помощью аффинной хроматографии очише-
126
ны и выделены десятки ферментов, этот метод не является пока
общепринятым и распространенным в технологии ферментных пре-
паратов. Но это перспективный метод очистки и разделения бел-
ков.
Хроматография на окрашенных адсорбентах и иммуноадсорбен-
тах. Этот метод очень близко примыкает к аффинной хроматогра-
фии. Впервые присоединение фермента к красителю («цибакрон
голубой F3GA»— голубой декстран) было замечено при выделении
пируваткиназы. Затем было установлено, что и другие ферменты
проявляют сродство к этому красителю, особенно дегидрогеназы.
Связывание этого высокомолекулярного растворимого красителя,
используемого в качестве маркера при гель-фильтрации, с фермен-
том происходит в месте присоединения к белку НАД, и в этом свя-
зывании участвуют аденин и рибоза красителя. Краситель более
прочно связывается с ферментом, чем субстрат. Хотя краситель
носит название «голубой декстран», декстрановый компонент слу-
жит лишь для связи красителя с агарозой. Краситель как бы вы-
полняет роль гигантского лиганда, хотя по механизму адсорбции
и поведению он не имеет полного сходства с обычным лигандом,
поэтому правильнее окрашенные адсорбенты отнести к псевдоаф-
финным адсорбентам. Их основная особенность заключается в
том, что они способны прямо присоединяться'непосредственно к
остову матрицы. При этом возможности их связывания с фермен-
тами не снижаются и при использовании красителей отпадает не-
обходимость в создании мостика между матрицей и лигандом.
Но красители могут сорбировать только белки, связывающие
нуклеотиды, в связи с чем этот вид сорбентов проявляет сродство
ко всем белкам, связывающим нуклеотиды, и адсорбирует их. По-
этому с помощью этого вида хроматографии нельзя добиться вы-
сокой степени очистки данного фермента в отличие от истинной
аффинной адсорбции. Однако в последние годы достигнуты боль-
шие успехи в совершенствовании метода окрашенной адсорбцион-
ной хроматографии. Ряд фирм начали выпуск окрашенных адсор-
бентов. Например, фирма «Амикон» проверила около 90 различ-
ных красителей на способность связывать целый ряд ферментов и
предложила специальный набор из пяти красителей, которые об-
ладают специфическим сродством к различным группам фермен-
тов. Вероятно, в будущем этот вид адсорбционной хроматографии
с использованием красителей будет применяться для очистки фер-
ментов.
Иммуноадсорбция. В последнее время уделяется внимание ис-
пользованию иммуноадсорбентов для получения особо чистых пре-
паратов ферментов. Суть метода заключается в следующем. Абсо-
лютно специфическим адсорбентом для любого фермента или бел-
ка является антитело к этому белку, которое связано е нераство-
римой матрицей. Антитела обладают высокой избирательностью
только к тем белкам, против которых они были получены. Поэто-
му при использовании иммуноадсорбента можно получить препа-
раты фермента более чистые, чем на любом другом типе аффинно-
127
го адсорбента. Иммуноадсорбенты — это специализированные био-
специфические адсорбенты. Сложность получения антител задер-
живает широкое внедрение этого способа очистки и выделения
ферментов, но развивающаяся сейчас новая технология получения
моноклональных антител может в самое ближайшее время дать
развитие этому интересному способу очистки ферментов.
В настоящий момент методика очистки ферментов с помощью иммуноадсор
бентов заключается в следующем. Целевой фермент выделяют до высокоочи-
щенного гомогенного состояния традиционными методами из культуры, которая
будет в дальнейшем использоваться как продуцент этого фермента. Для полу-
чения антител к ферменту чаще всего берут кролика и иммунизируют его соглас-
но обычной технике. Далее берут кровь кролика и проводят в ней определение
антител существующими методами. Антитела из сыворотки крови кролика ча-
стично очищают, осаждая их сульфатом аммония концентрацией 33 % полного
насыщения. Затем антитела связывают с адсорбентом, например с активирован-
ной бромцианом или тозилхлоридом агарозой, и иммуноадсорбент готов. Очи-
щаемый ферментный препарат пропускают через этот адсорбент, при этом в
колонке на антителах удерживается только нужный фермент. Затем колонку
промывают от случайно задержавшихся примесей и производят элюцию адсор-
бированного на антителах фермента.
Наиболее сложным в этом методе является получение антител к данному
ферменту. Часто наличие небольшой, даже экспериментально неопределяемой
белковой примеси к ферменту, используемому для иммунизирования кролика,
приводит к тому, что наряду с нужными антителами будут накапливаться и по-
сторонние. В этом случае получить чистый фермент уже невозможно. Другую
сложность в этой технологии представляет стадия элюции адсорбированного
фермента. Силы взаимодействия между антигеном и антителом очень велики,
величина коэффициента распределения а стремится к единице, и ослабить эти
взаимодействия очень трудно. Важно, чтобы фермент был достаточно ста-
бильным, так как элюция ведется в жестких условиях при высоких концентра-
циях солей, критических величинах pH, с использованием холодной дистилли-
рованной воды и т. д. Для удаления антигена применяют электрофорез. При
значениях pH, когда антиген достаточно сильно заряжен, под действием элек
трического тока антиген медленно перемещается с поверхности адсорбента в
раствор, что способствует элюции фермента. Используют также и другие ме-
тоды элюции. Иммунизируя различных животных, стараются получить такие
антитела к данному ферменту, в которых связи соответствующего антитела с
ферментом были бы менее прочные. Чаще всего процесс очистки ферментов с
помощью иммуноадсорбентов ведут не в колонке, а в объеме, т. е. в емкости
при периодическом перемешивании, так как процесс иммуноадсорбиии фермента
идет очень медленно. По этой же причине элюцию также удобнее проводить
в объеме.
В целом о всех видах ионообменной хроматографии белков
(ферментов) можно сказать, что они являются новыми перспектив-
ными способами очистки и выделения ферментов, позволяющими
получать высокоочищенные и гомогенные препараты ферментов с
большим выходом готового продукта. Внедрение их в практику по-
зволит поднять все производство ферментных препаратов на прин-
ципиально новую ступень.
1.12. РАЗДЕЛЕНИЕ И ОЧИСТКА ФЕРМЕНТОВ
В РАСТВОРЕ
В препаративной энзимологии для очистки нестабильных фер
ментов часто применяют их разделение в мягких условиях, когда
128
фермент в течение всей процедуры очистки находится в раствори-
мом состоянии. Наиболее широкое распространение среди этих ме-
тодов получили гель-фильтрация, а также электрофорез, изоэлек-
трическое фокусирование, изотахофорез, метод распределения бел-
ков между жидкими несмешивающими фазами и некоторые дру-
гие. Наибольшее практическое значение в технологии ферментных
препаратов получила гель-фильтрация.
Термин «гель-фильтрация» не очень удачен, но он широко рас-
пространен в литературе. Предлагалось несколько названий этого
процесса (гель-проникающая хроматография, молекулярно-ситовая
хроматография), но все же общепризнанным является гель-филь-
трация. Для осуществления этого процесса чаще всего использу-
ются гели, полученные на основе декстрана, с помощью которых
можно быстро разделить макромолекулы в соответствии с их раз-
мером. Гель состоит из открытой поперечно-сшитой трехмерной мо-
лекулярной сетки, сформированной в виде гранул для удобства
заполнения колонок. Гранулы имеют поры, которые недоступны
для крупных молекул, но более мелкие молекулы проникают во
все поры. Недоступность пор может быть двух видов: либо они уз-
ки для крупных молекул, либо широкие поры не имеют выхода на
поверхность гранулы. Схема процесса гель-фильтрации изображе-
на на рис. 1.64. Но эта схема не отражает истинного соотношения
размеров молекул и гранул геля, более наглядно это представле-
но на рис. 1.65. Из рис. 1.65 видно, что гранулы носителя превы-
шают линейные размеры молекул в 103—104 раз. Гранулы геля
имеют ворсистую поверхность.
Этот метод широко используется для очистки и разделения
ферментов не только в лабораторных, но и в промышленных мас-
штабах. Для гель-фильтрации
используются гели поперечно-
сшитого декстрана (сефадексы
и сефакрилы), поперечно-сшитые
полиакриламидные гранулы (био-
гели), агарозные гели с вкрап-
ленными в них цепями акрила-
мидного полимера (ультрагели)
и более жесткие поперечио-сши-
тые агарозы (CL-сефарозы и се-
факрилы-S).
В колонке из пористых гра-
нул часть раствора занимает про-
странство между гранулами, а
часть находится в порах гранул.
Гель-фильтрация — это одна из
форм распределительной хрома-
тографии, при которой растворен-
ные вещества распределяются
между более подвижной наруж-
ной частью раствора и менее под-
Рис. 1.64. Принципиальная схема
разделения молекул различного раз-
мера методом гель фильтрации:
/ — белки; 2 — низкомолекулярные при-
меси
5 Зак. 232
129
Рис. 1.65. Диаграмма, показывающая относительные размеры молекул
(зачернены) и гранул, используемых при гель-фильтрации:
/ — белки; 2 — низкомолекулярные примеси
вижной внутренней. Степень удерживания растворенного вещества
на колонке зависит от его способности проникать в поры геля. По-
этому при гель-фильтрации сначала из колонки выходят высоко-
молекулярные вещества, а затем вещества в порядке убывания их
молекулярных масс, т. е. гель выполняет роль молекулярного си-
та. Для идеального осуществления этого процесса необходимо,
чтобы материал, из которого делаются гранулы, был полностью
инертен к растворенным разделяемым соединениям. К сожалению,
не все гранулы гелей инертны, иногда при определенных значени-
ях pH они могут проявлять сорбционные свойства; например, та-
ким эффектом обладают сефакрилы. Методом гель-фильтрации на
мелких гранулах гелей при наложении высоких давлений осущест-
вляют разделение смеси различных веществ, в том числе белков.
Этот новый способ жидкостной хроматографии высокого давления
дает возможность получить высокую степень разделения за очень
короткое время. Он особенно эффективен на заключительных ста-
диях очистки белков.
1.13. ПОЛУЧЕНИЕ ИММОБИЛИЗОВАННЫХ
ФЕРМЕНТНЫХ ПРЕПАРАТОВ
В живых системах ферменты способны длительно работать без возобновле-
ния и потери активности. При применении ферментных препаратов очень часто
фермент после одноразового использования инактивируется, при этом обраба-
тываемый материал загрязняется препаратом. Эти обстоятельства поставили
перед учеными проблему создания новых форм ферментных препаратов много-
кратного использования. Наибольшее распространение получили препараты, в
которых ферменты в активной форме прикреплены к нерастворимой основе. Та-
кие ферментные препараты называются в литературе по-разному: связанные,
пришитые, фиксированные, матрицированные, прикрепленные, но чаще всего их
называют иммобилизованными. Иммобилизованный ферментный препарат — это
единая система, которая состоит из трех частей: фермента, носителя и свя-
зующего их звена.
Для иммобилизации ферментов большое значение имеют природа
функциональных групп белка, характер реакций, которые они катализируют,
положение активного центра, наличие или отсутствие простетической группы,
небелкового фрагмента и т. д. Важно помнить, что некоторые группы белка
особенно легко подвергаются химическим превращениям. Например, остатки
тирозина легко атакуются электрофильными реагентами и вступают в реакции
азосочетания, галоидирования, нитрования и др.; остатки метионина и дисуль-
фидные группы легко подвергаются окислительно-восстановительным превра-
щениям; тиометильные группы легко алкилируются с образованием сульфо-
ииевых солей и т. д.
130
Условно реакции модификации функциональных групп белка можно раз-
делить иа реакции замещения, присоединения и отщепления. Для иммобилиза-
ции ферментов имеют значение реакции присоединения по карбоксильным груп-
пам реагента или белка, реакции замещения; по типу превращений можно
различать реакции ацилирования, алкилирования, конденсации, окисления-вос-
становления, азосочетания и т. д.
1.13.1. Носители
[ Все носители подразделяют на две группы: органические поли-
мерные носители и неорганические.
Носитель имеет очень большое значение для успешной иммо-
► билизации ферментов. К носителям предъявляются определенные
требования: они должны быть нерастворимы в реакционной сре-
де, быть разнозаряженными с ферментом, иметь высокую гидро-
фильность, химическую, биологическую стойкость, механическую
прочность, не вызывать неспецифической адсорбции и сильных
I конформационных изменений молекулы белка, легко гранулиро-
ваться и активироваться. Носители для иммобилизации могут
иметь зернистую структуру, могут быть выполнены в виде воло-
кон, пленок, полых трубок, мембран.
. Органические полимерные носители. Они разделяются на при-
‘ родные и синтетические. Природные носители бывают полисаха-
ридные и белковые. Синтетические полимерные носители подраз-
[ деляются на полиметиленовые, полиамидные и полиэфирные.
Природные полисахаридные носители. Основой
этих носителей могут быть целлюлоза, декстран, агароза, губча-
тый крахмал, хитин и другие полисахариды.
Целлюлоза (Ц) используется в виде пористых сферических гра-
ц нул, которые имеют хорошие механические и технологические ка-
чества. Целлюлоза применяется в виде модификаций, которые по-
лучают, используя различные методы обработки целлюлозных сфе-
рических гранул.
/. Диизоцианатный метод q
II
! НП—ОН <- OCN—R—NCO —(ц)—О—С— NH— R—N=C=O,
где R= —/ UflU —(СН2)4—
| Н3С
I
h Но при использовании этого метода иногда получаются не очень
| хорошие результаты из-за полимеризации диизоцианата на поверх-
Ь ности гранулы.
5'
131
I. Диазодиизоцианатный метод
3. Диальдегидный метод
он + онс(сн2)3сно —►
(сн2)3
С НО
При использовании этого метода получаются ацетали, а они
неустойчивы в кислой среде.
4. Силанизация ^-аминопрапилтриэтонсиланом (tf-АПТЭС)
^он
(ц)-ОН + (C2H5O)3Si(CH2)3NH2—►
хон
^.о
®-°^Si(CH2)3
о nh2
Силанизация сопровождается образованием связей Si—О—Si и
С—О—Si, которые легко гидролизуются водой, поэтому гранулы
необходимо обрабатывать глутаровым альдегидом, который путем
поперечного сшивания стабилизирует всю систему в целом.
3. Гуанидинный метод
О
NH
I4—nh2 + сн3ос^
nh2.
° ^NH
—С—NH( С Н2)4—N—
nh2
132
На модифицированных гранулах целлюлозы иммобилизованы
многие ферменты: глюкоамилаза, р-амилаза, р.-фруктофуранози-
даза, протеиназы и др. Кроме того, используются модификации
микрокристаллической целлюлозы, среди которых надо отметить
аминоксибутилцеллюлозу, модифицированную а-кетоглютаровой
кислотой, танинаминогексилцеллюлозу, полученную при реакции
CNBr-активированного галотанина с аминогексилцеллюлозой, и не-
которые другие модификации. Производные целлюлозы широко
выпускаются в виде порошков, бумаг, содержащих различные
функциональные группы.
Носители из производных декстрана используются в виде сши-
тых эпихлоргидрином или диэпоксидами макропористых полиме-
ров — сефадексов. Сшитые молекулы агарозы выпускаются под
названием «сефароза». При использовании этих полисахаридов в
качестве носителей при иммобилизации их активируют путем вве-
дения в них функциональных групп, которые используются при
пришивке фермента. Так, например, разработаны методы введения
в агарозу тиоловых групп (S—С; S—О; S—Me).
С1СН2СН—сн2
Эпоксидиробание
t-хлор -Z'3-эпокси-
пропаном
NaZS2°3
—* (a)-ch2ch(oh)ch2—S2O3Na
—(a)—och2ch(oh)ch2sh
hs сн2—сн—сн—SH
он он
Дитиотреитол
Актибоция 2,2'-дипиридил-
сулыридом
осн2сн(он)
Тиолактивированный гель стабилен при хранении в виде сус-
пензии в дистиллированной воде. Достоинством этого носителя яв-
ляется то, что инактивированный фермент достаточно легко может
быть удален с его поверхности при восстановительном расщепле-
нии дисульфидной связи, т. е. возможна его регенерация. Но ис-
пользование этого геля имеет серьезное ограничение: иммобили-
зуемый фермент должен иметь достаточное количество тиоловых
групп, и они не должны входить в активный центр.
133
Есть данные об иммобилизации ферментов методом адсорбции
в результате гидрофобных взаимодействий на гексил- и аллилсе-
фарозе, причем чем выше концентрация гексильных заместителей,
тем больше степень адсорбции фермента.
Существуют десятки замещеииых агарозных гелей вида
(а)—ОСН2—СН—СН2— О—R ,
ОН
где R может быть самым различным: СН3; Н—С4Н9; изо-СзНп;
—СбНи; —C7Hl5; (СН2)3—Si(CH3)2—О—5ЦСНз)3 и т. д. Эти за-
мещения осуществляются по следующей схеме:
—ОН + СН2— CH—CH2OR —(д)—ОСН2—CH—CH2OR
\> ОН
Такие агарозные гели обычно используют для адсорбционных
методов иммобилизации ферментов.
В случае ковалентного связывания в эти гели вводят альдегид-
ные группы. Агарозу для иммобилизации активируют бромциаиом,
обрабатывают диэтилацеталем 4-аминомасляного альдегида и за-
тем в кислой среде проводят гидролиз ацеталя с образованием
альдегидной группы. Можно применить и другие способы введе-
ния альдегидных и кетогрупп в агарозу. Обычно фермент для ко-
валентного связывания должен быть предварительно окислен и
иметь углеводный фрагмент. Для ковалентной иммобилизации
можно использовать иемодифицированиую сефарозу, активирован-
ную бензохиноном. Этим соединением активируются и другие по-
лисахариды. Бензохинон является перспективным активатором, так
как он способствует связыванию фермента в широком диапазоне
pH (от 3 до 12).
Губчатый крахмал — это крахмал, модифицированный сшива-
ющими агентами (формальдегидом, глиоксалем, глутаровым аль-
дегидом). Ои устойчив к действию ферментов, гидролизующих на-
тивный крахмал. Если в этот крахмал ввести диэтаиол- и триэта-
ноламинные группы, он может быть носителем при иммобилизации
ферментов. На этих носителях иммобилизованы трипсин, уреаза,
а-, р- и у-амилазы, липазы, глюкозоизомераза и др. Гликогеи пос-
ле активизации бромцианом также может быть носителем при им-
мобилизации ферментов.
Хитин — это природный аминополисахарид, его можно рассмат-
ривать как целлюлозу, у которой С2—ОН-группа замещена аце-
тамидным остатком. Хитии является отходом при переработке кра-
бов и креветок. Он нерастворим, имеет пористую структуру. Им-
мобилизацию ферментов иа хитине можно вести методом адсорб-
ции или через глутаровый альдегид. Хитии активируется солями
134
титана. Если хитии обработать крепкой щелочью, ои превращает-
ся в хитозаи, и тогда появляется возможность ковалентной иммо-
билизации фермента иа нем. На хитозане можно иммобилизовать
ферменты различной степени очистки, клетки, фрагменты живот-
ных и растительных тканей. Иммобилизованные иа хитозане фер-
ментные препараты имеют высокую остаточную активность, обла-
дают высокой стабильностью и фильтруемостью, устойчивы к мик-
робному воздействию.
В качестве носителей ферментов можно использовать белки.
Но оии подвержены микробному воздействию и вызывают иммун-
ную реакцию. Исключением является только коллаген, обработан-
ный таиииом. В качестве белковых носителей применяют колла-
ген, его модифицированные формы, желатин, кератин (нераствори-
мый белок из перьев), нерастворимые глобулины хлопчатника и
некоторые другие белки.
Синтетические полимерные носители. Этот тип
носителей используется для иммобилизации ферментов методами
адсорбции, включения в гель, ковалентного связывания и микро-
капсулирования. Для процессов адсорбции оии применяются в ви-
де макро- и микропористых материалов. Чаще всего используются
ионообмеиннки типа даукса и амберлита, представляющие собой
сополимеры стирола и дивииилбензола в форме гранул. Для им-
мобилизации ферментов в гель чаще используют носители иа ос-
нове полиакриламида, а гели поливинилового спирта и других по-
лимеров (сополимеры этилгликольметакрилата, диметакрилата и
т. д.) — реже.
Существует очень много синтетических полимерных носителей.
Полимеры получают путем различных модификаций полиакрила-
мидных гелей (ПАГ), синтезируемых на основе акриловой кисло-
ты. Это аминоалкил-ПАГ (аминоэтнлбиогель Р-150); диоксипро-
пилпроизводиые ПАГ, полученные присоединением к ПАГ п-нитро-
стирола; иминоэфириые производные; модификации, полученные
при сополимеризации, N, АГ-метилбисакриламида и мономера,
а также при сополимеризации акрилморфолииа и N-акрилоил-N'-
третбутилоксикарбоиилгидразида, или сополимеризацией акролеи-
на с акриловой кислотой, и многие другие. Среди синтетических
носителей следует также назвать жесткие носители — сфероиы,
которые представляют собой этиленгликольметакрилатиые гели,
имеющие различные размеры пор. Они имеют гидроксильные груп-
пы иа поверхности, близкие по своим свойствам к аналогичным
группам сефарозы.
Интерес представляют гели, получаемые путем радиационной
полимеризации различных мономеров (АГ-винилпирролидои, акри-
ламид, соли акриловой кислоты). Их преимуществом является
устойчивость к микробному воздействию. Также исследуются гид-
рофильные полиуретановые полимеры, которые образуются при
взаимодействии полиизоциаиата (например, 2,6-толуолдиизоциа-
нат) с полиоксисоединеииями (например, с пропилеигликолем или
полиоксипропиленом). Эта реакция сопровождается выделением
135
СО2, что улучшает структуру носителя, который используется для
связывания ферментов и клеток с гелем. Используются носители
на основе поливинилового спирта, сшитого терефталевым альдеги-
дом, которые имеют большое количество модификаций в зависи-
мости от способа иммобилизации фермента, а также полистироль-
ные носители различных структурных и химических модификаций.
Полистирольные носители изготовляются макросетчатыми путем
эмульсионной сополимеризации стирола с дивинилбензолом в оса-
дителе, изопористыми путем сшивания стирола в дихлорэтане, ге-
теропористыми путем сшивания полистирола монохлордиметило-
вым эфиром. Эти носители имеют самые различные модификации,
например в виде сополимеров стирола и малеинового альдегида.
Синтетические носители получают в виде гранул путем сополи-
меризации ангидридов а- и ^-ненасыщенных дикарбоновых кислот
(малеиновая, итаконовая и цитраконовая) с диолами и полиола-
ми. Есть носители на основе нейлона (полиизонитрилнейлон, по-
лиаминоарилнейлон и др.). Из всех этих синтетических полимер-
ных соединений можно получить инертные полимерные матрицы.
Для придания гидрофильности и реакционноспособности по отно-
шению к ферментам эти соединения модифицируют путем химиче-
ской обработки в органических растворителях, после чего исполь-
зуют в качестве носителя для иммобилизации ферментов в водной
среде.
Неорганические носители. В эту группу носителей входят: син-
тетические кремнеземные сорбенты, металлы и их окислы, нержа-
веющая сталь, различные виды глин, керамики и природные ми-
нералы. Неорганические носители обладают рядом неоспоримых
достоинств. Они легко регенерируются, им можно придать любой
вид (порошки, шарики, частицы неправильной формы, пористый
материал или монолит, образующий многоканальную систему).
Рассмотрим некоторые неорганические носители и их свойства.
Макропористые стекла, силикагели и силохромы наиболее ча-
сто используются в качестве носителей. Они удобны в работе, но
имеют существенные недостатки: повышенную растворимость в ще-
лочной среде, недостаточную прочность и неспецифическую ад-
сорбцию ферментов. Ведутся работы по устранению этих недостат-
ков. Например, для снижения растворимости их обрабатывают та-
ким образом, чтобы образовалась пленка оксида металла (цирко-
ния, алюминия, титана и т. д.). После такой обработки можно про-
водить модификации этих носителей всеми известными методами.
Однако это повышает стоимость носителей, которые и без того до-
статочно дороги.
К природным носителям относятся песок, глины, цеолиты, ро-
говая обманка, активированный уголь. Носители из пористой ке-
рамики очень разнообразны по составу. В них могут входить крем-
незем, оксиды титана, циркония, глинозем. Можно получить носи-
тель без кремния. Преимуществами этой группы носителей явля-
ется дешевизна, возможность варьировать составом и достаточно
высокая прочность.
136
Металлы и их окислы являются самыми перспективными неор-
ганическими носителями. Они дешевы, стабильны, могут быть по-
ристыми и непористыми, обладают отличными гидродинамически-
ми и механическими свойствами, их легко стандартизировать в за-
водских условиях. Эти носители можно использовать для адсорб-
ционной и ковалентной иммобилизации. В качестве носителей ис-
пользуется ряд металлов: алюминий и его оксиды, оксиды мар-
ганца, магнезит, никель и его оксиды, олово, сталь нержавеющая,
титан, цирконий и его оксиды и др.
Завершая разговор о носителях, следует подчеркнуть, что иде-
альных матриц для иммобилизации нет, их надо тщательно под-
бирать и модифицировать с учетом свойств иммобилизуемого фер-
мента.
1.13.2. Сшиввющие агенты
Для (иммобилизации используется очень широкий круг различ-
ных агентов, пригодных для активации полимерных носителей, не-
посредственной конденсации белков на носителях, содержащих
различные функциональные группы. Полностью их перечислить не
представляется возможным, поэтому приведем наиболее широко
используемые в практике иммобилизации ферментов сшивающие
соединения. Это глутаровый альдегид, изоксалевые соли, у-амино-
пропилтриэтоксисилан, галогенцианы (чаще бромциан), 1,6-гекса-
метилендиамин, изоцианиды, карбодиимиды, карбонилдиимидазол,
n-нитробензоилхлорид, ненасыщенные сульфоны, галоидпроизвод-
ные 1, 3, 5-триазина, например, 2, 4, 6-трихлор-1, 3, 5-триазин (хло-
ристый цианур) и 2-амино-4, 6-дихлор-1, 3, 5-триазин (эпихлоргид-
рин) и др.
1.13.3. Способы иммобилизации ферментов
Все способы иммобилизации можно подразделить на две боль-
шие группы: химические и физические, т. е. с образованием кова-
лентных связей и без их участия.
Физические методы. Эти методы заключаются в связывании
фермента без участия ковалентных связей. Они подразделяются
на два типа: адсорбционные и механические. При адсорбционной
иммобилизации фермент удерживается на поверхности носителя с
помощью электростатических, гидрофобных, водородных связей,
а также в силу дисперсионных взаимодействий. При механическом
способе иммобилизации производят включение фермента в гели,
сшитые поперечными связями, заключение фермента в микрокап-
сулы, волокна, мембраны и т. д. Все физические методы иммоби-
лизации достаточно просты, быстры и эффективны. Они нашли ши-
рокое применение в инженерной энзимологии.
Адсорбционная иммобилизация. Этот способ им-
мобилизации проводится на нерастворимых носителях любой при-
роды (рис. 1.66). При адсорбции в иммобилизованном препарате
137
У сохраняется достаточно высокая активность
/ (от 50 до 100%). В качестве неоргаииче-
/ / ских носителей для адсорбционной иммо-
/ билизации используют чаще всего оксид
/ '>/ алюминия, оксид титана, кремнеземы, гли-
/ 1 иы, пористые стекла, керамику, реже алю-
/ла мосиликатные носители (молекулярные си-
/ та) и совсем редко уголь и графитироваи-
(£h Х__ ную сажу. В последнее время стали при-
/ менять металлы и минеральные соли (ни-
кель, нержавеющая сталь, титан, коллоид-
/ /йк \ ный кремний и др.). В качестве органиче-
/ ха/ \/ ских носителей используют производные
' природных полисахаридов . целлюлозы и
Рнс. 1.66 Ковалентное Декстрана: главным образом ДЭАЭ-целлю-
связывание лозу и ДЭАЭ-сефадексы; реже используют
QAE-сефадексы (для адсорбирования эсте-
раз), АЭ-целлюлозу (для глюкозоизомеразы), КМ-целлюлозу
(для инвертазы), SP-сефадекс (для глюкоамилазы), нераствори-
мую целлюлозу (для целлюлазы) и др. На хитине этим, же ме-
тодом можно иммобилизовывать глюкоамилазу, глюкозоизомера-
зу, фосфатазу, химотрипсин, лизоцим и другие ферменты. Исполь-
зуются и синтетические органические носители: амберлиты, даук-
сы, диаиоиы, полистиролы, эпоксидные, полиакриламидные матри-
цы и многие другие.
Адсорбционную иммобилизацию ферментов проводят и иа носи-
телях смешанного типа. Суть ее заключается в том, что иа твер-
дую подложку (силикагель, сажа и др.) наносится липидный слой
(например, лецитин), иа котором далее адсорбируют ферменты.
В данном примере носитель смешанного типа состоит из неоргани-
ческой и органической частей.
При иммобилизации либо фермент активируют путем введения
группы, имеющей сродство к носителю, либо присоединяют или
активируют определенные группы носителя, чтобы фермент мог с
ними связаться. Очень часто эффективной адсорбции ферментов
иа различных носителях существенно препятствует то, что для мно-
гих из них изоэлектрическая точка и оптимум каталитической ак-
тивности очень близки и поэтому прочная адсорбция возможна
только в областях pH, где каталитическая активность фермента
мала. Чтобы преодолеть эту трудность, приходится проводить мо-
дификацию фермента, ие затрагивая его активный центр, и толь-
ко после этого осуществлять его иммобилизацию. Недостатком
адсорбционной иммобилизации является процесс непроизвольной
десорбции фермента, что препятствует широкому внедрению этого
достаточно простого способа иммобилизации в практику.
Механические методы иммобилизации. К ним
относится прежде всего включение фермента в гель (рис. 1.67).
Для данного способа чаще всего используют полиакриламидный,
полиметакриловый, поливиниловый, поливииилпирролидоиовый и
138 .
Полимер
Рис. 1.67. Включение в
полимер (гель)
угле, желатине, крах-
другие гели. Новым удобным методом
является включение в гель с использо-
ванием фотополимеризующихся смол.
Интересны данные об иммобилизации в
альгинатных гелях, в гидрофильных или
заряженных гелях пуллулаиа. Получил
распространение способ включения в
гель методом двойной иммобилизации.
Суть этого метода в том, что сначала
фермент иммобилизуют иа подходящем
носителе, а потом вместе с иим (и фер-
мент, и носитель) заключают в гель. Та-
ким образом можно иммобилизовывать
многие ферменты (а-амилазы, глюко-
амилазы, глюкозооксидазы и др.). Пред-
варительно ферменты адсорбируют иа
порошкообразных силикагелях, каолине,
мале или целлюлозе. Затем ферменты заключают в гели, полу-
ченные при радиационной поляризации мономеров, имеющие об-
щую формулу
СН2 == СХ — СО — О — (СН2)П — ОН или СН2 = СН — СО —О—(R'O)m — R",
где X — Н- или СН3-группа; R' — (СН)2- или СН (СН3) —СН2-группа; п = 2 4- 4;
т = 2 4- 20. R" — радикал еще более сложного строения, чем R'.
Преимущества этого метода заключаются в том, что в ием
можно сочетать все преимущества твердой матрицы с возможно-
стью варьирования микроокружения фермента путем подбора соот-
ветствующей полимеризующей системы. Большинство ферментных
препаратов, полученных методом включения в гель, имеют высо-
кую ферментативную активность; ферменты долго работают в ге-
лях и имеют хорошие технологические показатели. К недостаткам
этого метода следует отнести то, что большинство гелей имеют
существенные диффузионные ограничения, препятствующие взаи-
модействию фермента с высокомолекулярными субстратами.
К механическим методам также следует отнести микрокапсули-
рование ферментов в полупроницаемые оболочки. Фермент рабо-
тает в растворимом состоянии, ио окружен непроницаемой для не-
го оболочкой. Для субстрата же и продуктов реакции она прони-
цаема. Это очень удобно, так как фермент не претерпевает фазо-
вых превращений, ио может быть в любое время удален из реак-
ционной среды при простом фильтровании. Существует три прин-
ципа заключения в капсулу: межфазная поликонденсация, меж-
фазная коацервация и метод двойного эмульгирования (рис. 1.68).
В первом случае образование полупроницаемой мембраны проис-
ходит иа поверхности раздела фаз, во втором — мембрана обра-
зуется в результате понижения растворимости полимера иа гра-
нице раздела фаз. Третий случай является модификацией метода
межфазной коацервации, для этого водный раствор фермента
139
МемЛрана
Субстрат
Раствор
Мембрана фермента
Продукты
реакции
Полимер
Микрокапсулы
с раствором
Фермента
а
ЛипиЗы
итогам
Фермент
Рис. 1.68. Получение микро- Рис. 1.69. Гидрофобное Рис. 1.70. Вклю-
капсул: взаимодействие чение в липо-
а — межфазная поликонденсация СОМЫ
и коацервация; б — н&год. двой-
ного эмульгирования
эмульгируется в растворе полимера в органическом растворителе,
и полученная эмульсия диспергируется в одной фазе с образова-
нием твердых полупроницаемых сфер. Последний метод позволяет
получить микрокапсулу в мягких условиях, обладающую прочной,
почти несжимаемой структурой. Метод микрокапсулирования очень
удобен для иммобилизации ферментов, воздействующих на низко-
молекулярные субстраты, для иммобилизации полиферментных си-
стем, клеточных органелл и гомогенатов тканей.
Представляет интерес иммобилизация ферментов методом вклю-
чения их в «жидкие» мембраны, которые состоят из поверхностно-
активных водонерастворимых веществ с различными добавками и
углеводородного растворителя (рис. 1.69). Этот метод похож на
микрокапсулирование, только в жидкой капсуле, которая не смеши-
вается с водой. Этим способом можно иммобилизовать полифер-
ментные системы, химотрипсин, пероксидазу н некоторые другие.
Он прост, капсула легко регенерируется после инактивации фермен-
та, в целом система имеет высокое отношение площади к объему,
что очень важно. Недостатками этого метода являются возмож-
ность утечки ферментов через жидкие мембраны и зависимость
переноса субстрата и продуктов реакции через мембрану от их рас-
творимости в ней.
Аналогичен микрокапсулированию метод включения фермен-
тов в волокна. Разница заключается в том, что при микрокапсули-
ровании получаются сферы, а при включении в волокна. — нити.
Метод заключается в растворении образующего волокна полимера
в органическом растворителе, эмульгировании полученного раство-
ра с раствором или суспензией фермента и продавливании эмуль-
сии через тонкие отверстия прядильного устройства в коагулирую-
щую жидкость (например, в толуол). Этим способом иммобилизу-
ются многие ферменты: амилазы, р-галактозидаза, глюкоамилазы,
глюкозоизомераза, каталаза, лизоцим, липазы, целлюлазы и др.
Есть и другие механические методы иммобилизации: включе-
ние в липосомы (рис. 1.70), в мембраны в форме полых волокон
и некоторые другие более редкие физические способы иммобили-
зации.
140
Химические методы иммобилизации. К этим способам следует
отнести иммобилизацию ферментов путем ковалентного сшивания
с полимерным носителем и поперечного сшивания ковалентными
связями молекул белка без носителя. Химический способ является
основным способом получения иммобилизованных ферментных пре-
паратов. Такие препараты стабильны, ферменты не вымываются,
уменьшается отрицательное влияние матрицы. Существенным недо-
статком этого способа часто является значительная инактивация
фермента. При химическом способе иммобилизации наиболее ши-
рокое распространение получили методы ковалентного связывания
фермента с различными носителями, поперечное сшивание моле-
кул фермента используется очень редко (рис. 1.71).
При ковалентной иммобилизации ферментов применяют различ-
ные методы закрепления ферментов: бромциановый, азидный, ан-
гидридный, ацилимидазольный, метод активированных эфиров; им-
мобилизация с помощью карбодиимидов и реагента Вудворда; изо-
цианатный и изотиоцианатный; иммобилизация путем азосочета-
ния, алкилирования полимерами, содержащими эпоксидные груп-
пы; с помощью хлорпроизводных 1, 3, 5-триазина, имидоэфиров и
других соединений; связыванием по сульфгидрильным группам.
Возможна ковалентная иммобилизация модифицированных фер-
ментов, которые затем связываются с соответствующим фермен-
том (рис. 1.72). При использовании этих сложных способов за-
крепления фермент может инактивироваться на 60—80 % в резуль-
тате экранирования активного центра и других причин.
Успех иммобилизации во многом зависит от свойств и структу-
ры фермента. Особенно большие сложности возникают при иммо-
билизации ферментов, имеющих четвертичную структуру. По-ви-
димому, это связано с тем, что при иммобилизации можно прикре-
пить только одну из субъединиц фермента, что неизбежно приво-
дит к деформации белковой молекулы и, возможно, к инактива-
ции фермента. Тем не менее ферменты с четвертичной структурой
успешно иммобилизуются с использованием различных способов.
сшивание молекул фер-
мента
Рис. 1.72. Электростати-
ческое связывание (адсорб-
ция)
141
При иммобилизации сохраняют активность алкогольдегидрогеназа,
щелочная фосфатаза, каталаза, глюкозооксидаза, инвертаза, ксан-
тиноксидаза и ряд других ферментов, причем падение их активно-
сти наблюдается только частично.
Большие сложности возникают при иммобилизации ферментов,
имеющих в своем составе простетические группы (кофакторы).
Большинство простетических групп (за исключением флавиновых
кофакторов) непрочно связано с белком и при иммобилизации от-
деляется, поэтому для восстановления активности ферментов вме-
сте с субстратом в среду добавляют кофакторы. Но кофакторы в
большинстве случаев очень дороги, поэтому возникает проблема
их иммобилизации или регенерации.
В последнее время большое внимание в литературе уделяется
вопросам иммобилизации клеток микроорганизмов и использова-
ния этих систем для осуществления ферментативных реакций.
Этот способ иммобилизации особенно интересен для использова-
ния внутриклеточных ферментов. Иммобилизация клеток микроор-
ганизмов — это один из перспективных путей создания высокоак-
тивных полиферментных систем, но пока этот метод развивается
медленно.
1.13.4 . Свойства иммобилизованных ферментов
Иммобилизованные ферменты по своим свойствам отличаются
от нативных, поскольку в результате иммобилизации в той или
иной мере изменяется пространственная структура белковой мо-
лекулы.
Активность иммобилизованных ферментов в пересчете на 1 мг
белка в подавляющем большинстве случаев падает за счет диф-
фузионного сопротивления, экранирования активного центра, кон-
формационных изменений молекулы и т. д. Иммобилизованные
ферменты проявляют большее сродство к низкомолекулярным суб-
стратам. В то же время иммобилизация часто способствует повы-
шению стабильности фермента в более широкой зоне pH и темпе-
ратуры, что очень важно при применении и длительном использо-
вании ферментов. Положительным следует считать и то, что им-
мобилизованные ферменты более устойчивы к действию ингибито-
ров. Оптимальные pH и температура иммобилизованных фермен-
тов почти не меняются, энергия активации ферментных реакций
также остается постоянной.
Единого мнения о механизмах и тенденциях изменения свойств
ферментов после или во время иммобилизации нет. Данный техно-
логический прием при получении ферментных препаратов еще толь-
ко входит в практику и не достиг совершенства.
1.14. ПОЛУЧЕНИЕ СУХИХ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Сушка ферментных препаратов имеет целью получить стабиль-
ный при хранении ферментный препарат из культуральной жидко-
сти, ее концентрата, из пастообразной массы, образующейся при
142
высаливании, осаждении фермента спиртом или другими осадите-
лями и т. д. Для обезвоживания ферментных растворов и осадков
применяют сушку в вакуум-сушильных шкафах, распылительных
и сублимационных установках. При высушивании ферментсодер-
жащих материалов имеется ряд трудностей, связанных с большой
термолабильностью ферментов.
Вакуум-высушивание. В вакуум-сушильных шкафах высушива-
ние осадков производится в тонком слое (не более 0,5 см) при
температуре около 30 °C и остаточном давлении не более 136 Па.
Длительность высушивания в вакуум-сушильных шкафах зависит
от остаточного давления в камерах, толщины слоя, структуры вы-
сушиваемого осадка и температуры теплоносителя. Сначала мате-
риал нагревается до температуры сушки, при которой удаляется
вся поверхностная влага. Удаление тем интенсивнее, чем больше
подводится к высушиваемому материалу тепла и чем быстрее уда-
ляются пары воды.
Второй период сушки менее интенсивен, так как происходит
удаление влаги из глубинных слоев материала. Подогрев осуще-
ствляется теплотой радиации, поступающей от воды, имеющей тем-
пературы на входе около 80—85 °C на первой стадии сушки и
около 40—45 °C на второй. Потери активности при сушке обычно
не превышают 6—8 %. Длительность высушивания осадков в ва-
куум-сушильных шкафах составляет от 8 до 16 ч в зависимости
от осадка, лабильности фермента и режима сушки. Высушенные
препараты измельчаются.
Сублимационная сушка. Этот процесс для ферментных препа-
ратов ведут при глубоком вакууме. Материал в начальных стади-
ях сушки отдает часть влаги, охлаждается и самозамораживает-
ся. Затем в сушилку подается теплота и лед возгоняется, минуя
состояние жидкости. Процесс высушивания ферментных осадков в
сублимационной сушилке включает три стадии: замораживание
осадка, возгонка льда и удаление остаточной влаги. В первый пе-
риод удаляется 12—18 % общего содержания влаги в продукте, во
второй—50—65%, и в последний при температуре 30—32 °C уда-
ляется остальная влага до равновесной, влажность готового про-
дукта 6—8 %• При высушивании в сублимационных сушилках
ферменты практически не инактивируются.
Длительность сублимационной сушки зависит от температуры
и толщины слоя замороженного материала, разрежения в камере,
температуры теплоносителя и физико-химических свойств высуши-
ваемого материала. Сушка ферментных осадков, осажденных ор-
ганическими осадителями, осуществляется при толщине слоя
1 см, температура замораживания 70 °C, температура теплоноси-
теля 80 °C в первые 1,5 ч сушки, затем в течение 1,5 ч понижение
температуры до 15—20 °C и окончательное высушивание в течение
3—4 ч при температуре теплоносителя около 30 °C. Высушенные
препараты, как и после вакуум-высушивания, измельчают. Степень
дисперсности готовых препаратов должна быть 50—100 мкм. Ес-
ли активность препарата выше стандартной, то к измельченному
143
препарату добавляют наполнитель такой же степени дисперсности.
При измельчении нельзя допускать разогрева препарата и пы-
леобразования. Перегрев препарата при измельчении может вы-
звать инактивацию до 30—35 % фермента, а при недостаточной
герметичности измельчающего устройства с пылью теряется до
5—7 % препарата. Кроме того, образовавшаяся пыль легко вос-
пламеняется и повышает пожароопасность.
Распылительная сушка. С помощью этого типа сушки можно
довольно быстро обрабатывать большие массы ферментных рас-
творов и получать сразу измельченный сухой препарат. При высу-
шивании методом распыления на сушку можно направлять непо-
средственно культуральную жидкость, экстракт из поверхност-
ной культуры или их концентраты.
Методом распылительной сушки можно получить сухие препа-
раты из осадков, осажденных органическими растворителями и
солями. Для этого осадки перед высушиванием растворяют в воде
до содержания сухого вещества 20—25 %. Длительность распы-
лительной сушки очень мала, пребывание препарата в сушильной
башне ограничивается 5—8 с.*При соприкосновении массы с теп-
лоносителем влага мгновенно испаряется, частицы охлаждаются и
поэтому, несмотря иа довольно высокие температуры теплоноси-
теля на входе и выходе, препарат ие нагревается более 35—40 °C.
Потери активности сравнительно малы (7—10%).
Определение оптимальных условий сушки ферментных раство-
ров распылением показало, что сохранение активности фермента
в процессе сушки в большей степени зависит от источника полу-
чения ферментного препарата (рис. 1.73). Например, максималь-
Рис. 1.73. Термостабильиость ферментов различных продуцентов в зави-
симости от температурного режима сушки:
амилолитическая активность: / — В. mesentericus; 2 — A. oryzae 3-9-15; 3 —
A. oryzae КС; 4 — A. awamori П; протеолитическая активность; 5 — В. mesen-
tericus: 6 — A. oryzae 3-9-15: культура Cl. pectinofermentans 15; 7 — экзополнга-
лактуроназная активность; 8 — ксиланазная; 9 — пектинэстеразная; 10 — пектин-
трансэлнмнназная
144
ной термостабильностью облада-
ли препараты бактериального
происхождения, полученные из
культуральной жидкости В. те-
sentericus (кривые / и 5), гриб-
ные амилаза и протеиназа более
чувствительны к температур-
ному воздействию (кривые 2 и
6), наибольшие потери активно-
сти наблюдались при высушива-
нии экстрактов из поверхност-
ных культур, особенно из куль-
туры A. awamori (кривая 4).
Различную стабильность прояв-
ляют ферменты пектиназного и
пентозаназиого комплексов бак-
Рис. 1.74. Влияние pH исходного
раствора иа сохранение активности
ферментов при сушке распылением:
/ — протеолитическая; 2 — амилолитиче-
ская; 3— молокосвертывающая
терий Cl. pectinofermentans 15
(кривые 7—10). Активность препаратов, получаемых при высуши-
вании глубинных культур, сохранялась почти полностью при тем-
пературе теплоносителя на входе 100°С и на выходе 50°С; бак-
териальные ферменты выдерживают сушку при температуре теп-
лоносителя 140—160 °C на входе и 70—80 °C на выходе с сохра-
нением 90—95 % активности.
Инактивация ферментов при сушке обусловлена многими фак-
торами. На рис. 1.74 показано влияние pH на инактивацию. Так,
протеолитические ферменты очень чувствительны к концентрации
в растворе водородных ионов и полностью сохраняют активность,
только если высушивание ведется при pH выше 6,5 (кривая 1).
Не меньшее влияние оказывает исходная концентрация сухо-
го вещества в высушиваемой жидкости; чем она выше, тем мень-
ше термостабильность ферментов при сушке (рис. 1.75). Почти
полностью сохраняется активность препарата при высушивании
концентратов культуральной жидкости (кривая 1). Максимальная
активность (95—98 % исходной) наблюдается при сушке 10%-ных
концентратов. Вероятно, это связано с тем, что с образующимся
при концентрировании осадком, который отделяется перед суш-
кой, удаляются вещества, оказывающие защитное и стабилизиру-
ющее действие на ферменты. Растворы ферментов, приготовлен-
ные из влажных препаратов путем высаливания или осаждения
органическими растворителями, проявляют различную устойчи-
вость к температуре теплоносителя. Наименьшей устойчивостью
обладает амилаза, полученная при высаливании. Препараты, осаж-
денные спиртом, лучше переносят сушку распылением и даже при
температуре воздуха на входе 160°C и на выходе 80°C полно-
стью сохраняют активность.
Для уменьшения потерь при сушке распылением часто ис-
пользуют стабилизаторы или наполнители, обладающие защитным
действием. С одной стороны, они призваны повысить устойчивость
фермента к температурной инактивации, с другой стороны, с их
145
I
50 60 70 80 90 100 110 12050 60 70 80 30 100 110 120
6
Рис. 1.75. Влияние различных факторов на сохранение активности фер- I
ментов при сушке распылением:
а — исходная концентрация сухого вещества (в %): / — 3,5; 2 — Ю; 3 — 20; 4 —
30; 5 — 40; б — способ предварительной подготовки высушиваемых растворов: / —
без обработки; 2 — пастообразующий препарат, осажденный этанолом; 3 — пастооб-
разующнй препарат, высоленный сульфатом аммония ।
I
помощью можно повысить концентрацию сухого вещества в высу- !
шиваемом ферментном растворе, что важно для снижения меха- I
ническнх потерь готового сухого препарата с отработавшим воз- I
духом. Основным фактором устойчивости белковых веществ явля-
ется степень их гидратации, в которой участвуют как ионизирован-
ные, так н полярные группы белка. Нагревание и его длитель-
ность, изменение pH среды, введение стабилизаторов, наполните- !
лей и другие факторы вызывают перестройку и распад водород-
ных и других видов связей, что приводит к пространственным из-
менениям белковой молекулы и соответственно к потере активно-
сти фермента.
146
Таблица 1.14
Культура продуцента Содержание сухого вещества в концен- трате, % Доза наполнителя (NaCl), % сухого вещества концентрата Стабилизатор и его доза, % к объему концентрата Температура теплоагеита, °C Потери ферментов в процессе сушки, %
Й к 3
В. subtilis 103
В. mesentericus ПБ
Cl. pectinofermentans 15
A. awamori 16
20 100 СаС12, 01
15 100 MnSO,, 0,003
21 50 СаС12, 0,1
15 50 СаС12, 0,1
8 50 СаС12, 0,1,
MgCl2, 0,1
8 СаС12, 0,1
MgCl2, 0,1
120—140 50—70 5
120—140 50—70 5
130—140 60—70 3
130—140 60—70 10
110—115 55—57 3—10
125 75 5—8
Следует помнить, что не всякий раствор фермента можно высу-
шить, особенно фильтрат культуральной жидкости. Существенной
помехой для сушки ферментных растворов являются сахара, кото-
рые способствуют слипанию частиц, ухудшению структуры препа-
ратов и инактивации ферментов. Но концентраты с высоким содер-
жанием сухого вещества сушить тоже сложно. Сушка концентра-
тов затруднена из-за высокого содержания в них редуцирующих
веществ и снижения термостойкости ферментов.
Заранее дать рекомендации по условиям сушки ферментсодер-
жащих материалов невозможно. Поэтому необходимо в каждом
случае условия и режимы получения сухих ферментных препара-
тов выбирать опытным путем.
Некоторые оптимальные режимы сушки распылением концен-
трированных фильтратов культуральной жидкости приведены в
табл. 1.14.
1.15. МИКРОКАПСУЛИРОВАНИЕ И ГРАНУЛИРОВАНИЕ
ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Условия применения ферментных препаратов в некоторых слу-
чаях бывают очень агрессивными, что приводит к их быстрому
инактивнрованию, увеличению расхода и снижает экономический
эффект процесса. Поэтому заключение фермента в полупроницае-
мую оболочку в ряде случаев позволяет защитить его от воздей-
ствия внешних факторов.
Процессу микрокапсулирования, т. е. заключению ферментных
препаратов в полупроницаемую оболочку-капсулу, в последнее вре-
мя уделяется большое внимание. Микрокапсулирование имеет це-
лью не только защиту фермента, но и создание возможности его
многократного использования, а также вывода его нз процесса в
случае, если его дальнейшее пребывание в обрабатываемом суб-
147
страте нежелательно. В некоторых случаях ферментный препарат
может отрицательно воздействовать на работающих, попадать в
дыхательные пути, на кожные покровы, вызывать аллергические
явления и т. п. Заключение ферментного препарата в капсулу
устраняет контакт работающих с ферментами, что очень важно
для обеспечения безопасности работы обслуживающих процесс лю-
дей.
Но не все ферменты можно заключать в оболочку. Если фер-
мент находится внутри капсулы, то ее полупроницаемая оболочка
должна иметь небольшой размер пор, иначе фермент будет вымы-
ваться. Субстрат в этом случае должен быть только низкомолеку-
лярным, чтобы проникнуть в капсулу, где он подвергается ката-
литическому воздействию фермента, и удалиться во внешнюю сре-
ду. Это основной недостаток, ограничивающий применение микро-
капсулирования для многих промышленно важных ферментных
препаратов. Но все же для ряда ферментов этот метод приемлем
(каталаза, глюкозоизомераза, p-фруктофуранозидаза, р-галакто-
зидаза и т. д.). В чем же суть микрокапсулирования?
Микрокапсулы — это очень мелкие частицы, покрытые поли-
мерной оболочкой, внутри которых находится фермент чаще все-
го в виде раствора. Размеры капсул могут быть различными — от
нескольких нанометров до нескольких миллиметров. Толщина по-
лупроницаемой оболочки, ее механические и физико-химические
свойства во многом зависят от вида полимера, способа микрокап-
сулирования и условий применения микрокапсул. В качестве обо-
лочек для микрокапсул могут использоваться природные полиме-
ры, их производные или синтетические высокомолекулярные сое-
динения. Для микрокапсулирования применяют полимеры живот-
ного происхождения: казеин, желатин, альбумин. Сравнительно
часто в качестве исходного материала для получения производ-
ных, которые могут служить основой для создания оболочек мик-
рокапсул, используют широко распространенный растительный
полимер целлюлозу (КМЦ, метилцеллюлозу, ацетатцеллюлозу,
нитроцеллюлозу и ряд других).
С большим успехом на практике используются синтетические
полимеры: поливинилацетат, полиакриламид, поливиниловый спирт
и многие другие. Но при их использовании следует помнить, что
некоторые из них токсичны, и потому область их применения ог-
раниченна (особенно в пищевой и медицинской промышленности).
Сам процесс микрокапсулирования может быть осуществлен
двумя способами: химическим или физическим. К'химическим сле-
дует отнести способ образования пленки на границе раздела двух
фаз при реакциях полимеризации и поликонденсации. К физиче-
ским методам можно отнести вакуум-напыление, микрокапсулиро-
вание в псевдоожиженном слое, при взаимодействии аэрозолей,
имеющих различный электрический заряд.
Наиболее часто используются химические способы. Для этой
цели берется органический растворитель, частично смешивающий-
ся с водой, но хорошо растворяющий полимер. Растворитель, со-
148
держащий растворенный полимер, смешивают с ферментным пре-
паратом и интенсивно диспергируют эту смесь в среде насыщенно-
го водного раствора хлорида, сульфата, нитрата или фосфата нат-
рия, калия, аммония или кальция до получения частиц размером
от 20 нм до 5 мм. Затем из этой смеси под вакуумом удаляется
органический растворитель, а ферментный препарат оказывается
заключенным в полупроницаемые полимерные оболочки. Однако
процесс микрокапсулирования пока очень дорог, его используют
только тогда, когда без него обойтись невозможно.
Более широко, чем микрокапсулирование, используется метод
гранулирования ферментных препаратов. Гранулирование обычно
связано с необходимостью ликвидировать пыление ферментного
препарата и чаще всего применяется для препаратов, предназна-
ченных для использования в синтетических моющих средствах.
Гранулы должны быть по размерам близки к величине гранул дру-
гих компонентов стиральных порошков, быть достаточно прочны-
ми в сухом виде и не измельчаться. Но при соприкосновении с во-
дой они должны легко, быстро и полностью растворяться в реак-
ционной среде.
Гранулы ферментных препаратов можно получать различными
способами: окатыванием, прессованием, таблетированием, в вибро-
кипящем слое и т. п. В различных грануляционных установках
совмещается несколько процессов — увлажнение, смешивание,
гранулирование и сушка получаемых гранул. Например, для гра-
нулирования в псевдокипящем слое ферментный препарат, нахо-
дящийся в вихревом псевдоожиженном состоянии, непрерывно
орошается связующей жидкостью и смешивается с ней, образуя
гранулы, которые в этом же аппарате высушиваются.
При обработке порошкообразных ферментных препаратов, раз-
мер частиц которых близок к 100 нм, используется их свойство к
агломерации под действием особых сил сцепления. Грануляцион-
ная установка, представленная на рис. 1.76, работает по способу
псевдоожижения. Гранулятор — это вертикальный цилиндрокони-
ческий аппарат из нержавеющей стали, в нижней части которого
расположено днище 13 из нержавеющей проволочной сетки. Диа-
метр отверстий сетки рассчитан на тончайший помол препарата.
В средней части аппарата, стенки которого отполированы до зер-
кальной поверхности, расположена перемещающаяся в вертикаль-
ной плоскости форсунка 11. В зависимости от свойств гранулиру-
ющей жидкости вид форсунки и тип насоса выбираются экспери-
ментальным путем. Жидкость, предназначенная для орошения и
гранулирования, подается к форсунке перестальтиковым насосом
высокого давления. В цилиндрической части аппарата расположе-
ны рукавные фильтры 10 из нейлона, прикрепленные к корпусу
аппарата. При гранулировании воздух поступает внутрь фильтро-
вальных рукавов и в очищенном виде выходит через клапан 4
первого сегмента наружу. Осевшая пыль сбрасывается внутрь ка-
меры S; очистка длится 1—2 с. Такой способ очистки фильтра
значительно повышает качество гранулирования. В нижней внут-
149
Рис. 1.76. Установка для гранулиро-
вания ферментных препаратов в
псевдокипящем слое фирмы «Аэро-
матик» (Швейцария):
1— приемная емкость; 2— пневматиче-
ский цилиндр; 3 — резиновый конус; 4,
9— клапаны: 5 — калорифер; б— фильтр;
7— вентилятор; 8— камера четырехсег-
меитная; 10— рукавный фильтр; 11 —
форсунка; 12— камера; /<? — перфори-
рованное днище; 14 — емкость для
гранулирующей жидкости
ренней части гранулятора распо-
ложен резиновый конус 3, опу-
скающийся и поднимающийся
под действием пневматического
цилиндра 2. При разгрузке рези-
новый конус опускается и гото-
вый продукт разгружается в при-
емную емкость 1, откуда пневмо-
подачей передается на фасова-
ние. Для каждого вида фермент-
ного препарата эксперименталь-
но устанавливаются оптималь-
ные параметры процесса: темпе-
ратура, расход орошающей жид-
кости, воздуха, последователь-
ность и продолжительность каж-
дой технологической операции.
Недостатком такого метода гра-
нулирования является возмож-
ность врзникновения высоких за-
рядов статического электричест-
ва. Производительность грануля-
ционных установок такого типа
от 0,2 до 600 кг/ч.
Для получения гранул с фер-
ментными препаратами исполь-
зуется также гранулирование ме-
тодом прессования. В нашей
стране для синтетических мою-
щих средств щелочную протеи-
назу (протосубтилин ГЮх) гранулируют методом экструзии с по-
следующим окатыванием до гранул сферической формы. Предва-
рительно ферментный препарат смешивают с расплавленным ПАВ
и затем направляют в ситовой корпус двухшнекового экструде-
ра, где смесь подпрессовывается и продавливается через отвер-
стия нужных размеров. Окатывание гранул до сферической фор-
мы осуществляется в центробежном аппарате. Смесь должна со-
держать не менее 37—40 % наполнителей в виде алкилоламида и
синтанала. Если подобных наполнителей не добавлять, то из эк-
струдера выходит неокатываемая порошкообразная масса.
Капсулирование и гранулирование перспективны для фермент-
ной промышленности. Внедрение этих методов в производство по-
зволит более эффективно использовать ферментные препараты в
самых различных целях.
1.16. СТАНДАРТИЗАЦИЯ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Очень часто ферментативная активность партии готового пре-
парата заметно отличается от предыдущих. Потребитель же дол-
150
жен получать препарат с определенной стандартной активностью.
Поэтому на основе длительного анализа практической работы
предприятий по данной технологии для каждого выпускаемого пре-
парата устанавливается средний уровень активности с запасом
20—30 % . Активность стандартного препарата определяется в еди-
ницах ФА на 1 г.
Для получения постоянной активности в препараты вводится
наполнитель в определенном количестве, которое зависит от полу-
ченной на данном предприятии активности в культуре и препара-
те. Желательно, чтобы наполнитель по отношению к ферменту вы-
ступал и в роли стабилизатора, а не просто инертного соединения.
Важно также учитывать свойство наполнителей сорбировать во-
дяные пары. Так, например, крахмал, добавленный к ферментно-
му препарату, препятствует его увлажнению, а хлористые соли
калия и натрия способствуют увлажнению препаратов, поэтому
при использовании последних возникает необходимость в гермети-
ческой упаковке препаратов.
Стандартизацию препарата можно проводить, добавляя напол-
нитель, например, перед концентрированием, если продукт выпу-
скается в жидком виде, или же перед сушкой распылением с уче-
том потерь на стадии концентрирования или при распылительной
сушке, или в уже готовый сухой препарат. При смешивании гото-
вого сухого препарата с наполнителем необходимо, чтобы препа-
рат и наполнитель имели приблизительно одну и ту же степень
измельчения и влажность не более 10—12%. При перемешивании
наполнителя и препарата, например, в шаровой мельнице за 30—
40 мин получаются вполне однородные ферментные препараты.
Количество наполнителя можно рассчитать по формуле
S = —-----Ь,
с
где S — количество наполнителя, необходимое для получения стандартного по
активности препарата, кг; а — активность исходного препарата, ед. ФЛ/г; Ь —
количество исходного препарата, кг; с — стандартная активность препарата,
ед. ФА/г.
Известно, что хорошим стабилизатором амилолитических фер-
ментов является крахмал, пектолитических — крахмал или хлори-
стый натрий. Стандартизировать пектолитические препараты мож-
но также диатомитом, желатином, бентонитом. Выбор наполните-
ля и стабилизатора, определение дозировки, необходимых условий
хранения и длительности сохранения активности осуществляются
экспериментально.
1.17. ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПОЛУЧЕНИЯ
ОЧИЩЕННЫХ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Схемы получения ферментных препаратов зависят от свойств
выделяемого фермента н методов очистки, примененных для полу-
чения препарата нужной степени чистоты. В качестве примера рас-
151
смотрим технологическую схему получения препаратов из поверх-
ностной и глубинной культур в виде жидких концентратов, сухих
технических препаратов, получаемых сушкой распылением, и пре-
паратов, осажденных органическими растворителями (рис. 1.77).
Фильтрат охлажденной культуральной жидкости собирается в
основном сборнике и по мере надобности передается в сборник не-
большой вместимости перед поступлением в подогреватель ваку-
ум-выпарной установки пленочного типа. Концентрат культураль-
ной жидкости с содержанием сухого вещества 6—10 % поступает
в сборник концентрата. Для получения сухого технического препа-
рата концентрат направляют в башню распылительной сушилки
8. Сухой препарат через циклон 10, бункер 11 и шнек 12 попадает
на стадию стандартизации, фасования и унаковывания.
Для получения более очищенного препарата концентрат из
сборника подается иа осаждение органическим растворителем.
Предварительно концентрат охлаждают в теплообменнике до тем-
или на ути-
лизацию
Рис. 1.77. Принципиальная технологическая схема получения очищенных
верхностным способами:
/ — сборник фильтрата культуральной жидкости; 2 — подогреватель вакуум-вы
тор; .5 — сборник конденсата; 6 — вакуум-выпарпой аппарат; 7 — сборник кондеи
кер для высушенного препарата; 12 — шнек; 13 — фильтр рукавный; 14 — осади
спирта; 19 — смеситель промывки осадка спиртом: 20 — центрифуга; 21 —ва
для наполнителей; 24— бункер для сухого препарата; 26 —установки днемем
стандартизированного препарата; 31— установки для фасования и упаковывания
шрота; 34 — резервуар для воды; 35 — стерилизационная установка для сточных
препарата Г2х или П2х
152
пературы 2—3°С и подают через дозатор в осадитель. Одновре-
менно в осадитель дозируется охлажденный растворитель. Обра-
зовавшийся осадок отделяют на сепараторе 16. Надосадочную
жидкость направляют на регенерацию, а осадок — на промывку
спиртом и повторное сепарирование. Промытый осадок высуши-
вают в вакууме, измельчают, взвешивают, смешивают с наполни-
телем и направляют на фасование и упаковывание.
При получении ферментных препаратов из культур микроорга-
низмов, выращенных поверхностным способом, процесс очистки
начинается с экстракции ферментов водой. Нерастворимый осадок
высушивают и в виде сухого биошрота утилизируют на корм
скоту.
Экстракт с содержанием сухого вещества 7—14 % при получе-
нии из него сухих препаратов не нуждается в дополнительном
концентрировании и поэтому может быть сразу направлен на рас-
пылительную сушку с целью получения технического препарата,
или же экстракт направляется в охладитель, а затем на осажде-
ние органическими растворителями или солевыми растворами. Из
экстракта можно получать стабильный жидкий концентрат с со-
держанием сухого вещества 50%, для чего экстракт направляют
в сборник, затем в подогреватель и на вакуум-выпарную установ-
препаратов из культур микроорганизмов, выращенных глубинным и по-
парной установки; 3— сборник экстракта поверхностной культуры; 4 — конденса-
трата; 8— распылительная сушилка; 9 — теплообменники; 10— циклон; 11— буи-
тель; 15 — дозаторы; 16— сепаратор; 17 — насос для спирта; 18— мерник для
куум-сушилка роторная; 22— бункер для высушенного осадка; 23. 25— бункера
браторов: 27. 28 — весы; 29— смесители непрерывного действия; 30— бункера для
препаратов; 32 — установка для экстракции ферментов; 33 — сушилка для био-
вод; 36— охлаждающий теплообменник; 37 — фасование и упаковывание жидкого
153
ку. Готовый жидкий концентрат фасуют в специальные емкости и
направляют на склад готовой продукции. Из глубинной культуры
можно также получать жидкие концентраты, например, методом
ультрафильтрации.
Существуют многочисленные схемы получения ферментных пре-
паратов различной степени очистки, вплоть до кристаллических и
гомогенных препаратов. Такие схемы, созданные в различных
странах мира, в большинстве своем очень сложны и сочетают в
себе самые различные комбинации технологических приемов. По-
этому давать какие-то общие рекомендации крайне трудно, и в
каждом конкретном случае необходимо проводить кропотливые
исследования на всех стадиях выделения фермента из данной
культуры продуцента. Только в результате такой работы можно
придти к практическим рекомендациям, которые будут справедли-
вы только для данного фермента, данной культуры микроорганиз-
ма и для данной среды.
1.18. МИКРОБИОЛОГИЧЕСКИЙ И БИОХИМИЧЕСКИЙ
КОНТРОЛЬ ПРОИЗВОДСТВА
Независимо от способа культивирования с момента засева продуцентом
стерильной питательной среды ведется ковтроль за ростом культуры и образо-
ванием ферментов. Для каждого вида продуцента и способа культиввроваиня
устанавливается своя периодичность отбора средних проб растущей культуры.
Отобранные пробы подвергаются микроскопированию н визуальному просмотру.
С целью выявления возможных заражений производится периодический высев
проб на агаризнроваииые среды с введением факторов, подавляющих рост
продуцента. Постоянно ведется определение накопления в культуре фермента-
тивной активности. При глубинном культивировании ведут контроль за по-
треблением основных лимитирующих компонентов среды (углеводы, N, Р), из-
меряют pH культуры.
Все показатели роста культуры, изменения состава среды и накопления
ферментов н т. д. заносятся в лабораторный журнал.
На всех стадиях выделения ферментов проводят анализы активности, оп-
ределяют величины потерь и выход товарного продукта. Готовые препараты
ферментов подвергают особенно тщательному исследованию, особенно те, ко-
торые применяются в медицине н в пищевых продуктах. Препараты медицин-
ского иазиачеиня не должны содержать микроорганизмов. Препараты для хле-
бопекарной, м йеной и рыбной промышленности контролируют иа содержание
спор грнбов-продуцеитов и на присутствие спороносных бактерий. Споры или
клетки продуцента в готовом продукте должны отсутствовать, а предельная
норма обсемененвостн микрофлорой определяется в каждом конкретном случае.
Например, в грнбвых препаратах из поверхностных культур она не должна
превышать ЫО5 клеток иа 1 г препарата. При контроле готовых препаратов на
обсемеиенность микроорганизмами делают высевы проб от каждой партии на
твердые среды (МПА н сусло-агар) в чашки Петри. Заражение выражается
количеством микроорганизмов на 1 г препарата. Контроль иа зараженность
спороносными бактериями проводится путем высева нагретых до 80 °C проб на
чашкв Петрн с агарнзированвой средой. Культивнровавне для выявлевня бак-
териального заражения ведут при 37 °C в течение 24 ч, а для грибного — при
30 °C в течение 48—72 ч.
В готовых препаратах определяют влажность и активность в стандартных
единицах на 1 г препарата.
Технические жидкие и сухие ферментные препараты анализируют на ак-
тивность ферментов, содержание сухого вещества в в зависимости от назначе-
154
ння на наличие микробного загрязнения. Прн контроле высокоочнщенных пре-
паратов помимо определения загрязненности микробами и активности ферментов
проводятся анализы на содержание белка, зольных элементов, углеводов и дру-
гих специфических свойств ферментов.
Кроме того, любой ферментный препарат перед промышленным производ-
ством подвергают длительной проверке в специальных медицинских учрежде-
ниях на токсичность, особенно если препарат предназначен для пищевой и ме-
дицинской промышленности. Токсичность препарата зависит от способности
микроорганизма синтезировать в процессе жизнедеятельности токсины нлн кан-
церогенные вещества, а также от состава используемой для культивирования
среды и способов выделения фермента. Исследования на токсичность проводят
на лабораторных животных, которым вводят внутримышечно и перорально
ферментные препараты в различном виде и дозировке и наблюдают реакцию
организма.
Проверку ведут в течение нескольких месяцев, а иногда лет на нескольких
поколениях животных.
Только после тщательного биологического исследования прн положительных
результатах дается разрешение на промышленное производство препарата н
на его применение в пищевой промышленности, медицине, сельском хозяйстве
и других областях.
2
глава
ТЕХНОЛОГИЧЕСКИЕ ОСОБЕННОСТИ
ПОЛУЧЕНИЯ ПРЕПАРАТОВ
С ОПРЕДЕЛЕННЫМ СОСТАВОМ ФЕРМЕНТОВ
В промышленных условиях выпускаются различные фермент-
ные препараты, степень очистки которых определяется последую-
щим их применением. Крупнотоннажное производство ферментных
препаратов основывается, как правило, на получении техниче-
ских, малоочищенных, содержащих значительное количество бал-
ластных веществ, но дешевых ферментных препаратов. В мень-
ших количествах выпускаются высокоочищенные и гомогенные
ферментные препараты для научных целей и медицины. Фермент-
ные препараты, выпускаемые промышленностью, обычно именуют-
ся по основному ферменту, присутствующему в препарате. Такими
ферментами могут быть амилазы, протеиназы, пектиназы, 0-галак-
тозидаза, глюкозооксидаза, целлюлазы, гемицеллюлазы, липазы,
глюкозоизомераза, каталаза, рестриктазы и др.
Некоторые сведения о применении препаратов, о механизме
действия основного фермента в препарате и его свойствах будут
даны в начале каждого раздела, посвященного изложению техно-
логических особенностей получения соответствующих ферментных
препаратов.
2.1. АМИЛОЛИТИЧЕСКИЕ ПРЕПАРАТЫ
Амилолитические препараты широко выпускаются в нашей стране и за ру-
бежом. В основном это крупнотоннажное производство. Амилазы находят при-
менение почти во всех областях, где перерабатывается крахмалсодержащее
сырье. Амилазы используют для осахаривания зернового и картофельного
крахмала. Самым большим потребителем амилолитических ферментов является
спиртовая и пивоваренная промышленности, где в настоящее время солод (про-
рощенное зерно) успешно заменяется амилолитическими ферментными препа-
ратами. Эти препараты используются в хлебопечении, а также в крахмало-
паточном производстве для получения различных видов паток, глюкозы и
глюкозо-фруктозиых сиропов. Амилазы используются для улучшения качества
концентратов и быстроразвариваемых блюд, большую перспективу представляют
амилолитические ферментные препараты для промышленности, изготовляющей
моющие средства. Там термостабильиые и щелочеустойчивые амилазы могут
быть прекрасной биологической добавкой для снятия углеводных загрязнений.
Амялазы используются в текстильной промышленности для расшлихтовки тка-
ней и приготовления высококонцентрированных клейстеров крахмала в процессе
крашения тканей. В последнее время уделяется внимание использованию амилаз
при переработке различных крахмалсодержащих отходов в кормовые белковые
препараты. Высокоочищенные амилазы применяются для аналитических целей
и в медицине.
156
2.1.1. Источники получения амилаз
Амилазы очень широко распространены в природе. Они синте-
зируются многими микроорганизмами (бактерии, грибы, актино-
мицеты, дрожжи), животными и растениями. До развития фер-
ментной промышленности главным промышленным источником по-
лучения амилаз в Европейских странах было проросшее зерно
(солод). Для медицинских целей амилазы получали из животно-
го сырья. В настоящее время главным источником амилаз являют-
ся микроорганизмы, особенно бактерии, грибы и реже дрожжи.
Учитывая то, что амилолитические ферментные препараты очень
разнообразны, здесь нецелесообразно приводить перечень наибо-
лее перспективных продуцентов; правильнее дать их в подразде-
лах данной главы там, где будут обсуждаться и излагаться мате-
риалы по соответствующим амилолитическим препаратам.
2.1.2. Механизм действия и свойства амилаз
Субстрат. Субстратами для действия амилаз являются крахмал,
состоящий из амилозы и амилопектина, продукты частичного гид-
ролиза крахмала и гликоген.
Крахмал — растительный полисахарид с очень сложным
строением. Это двухкомпонентное соединение, состоящее из 13—
30 % амилозы и 70—85 % амилопектина. Оба компонента неодно-
родны, их молекулярная масса (М. м.) колеблется в широких пре-
делах и зависит от природы крахмала. Амилоза — это неветвя-
щийся полимер, в котором остатки глюкозы соединены а-1, 4-гли-
козидной связью; степень полимеризации около 2000. В «аномаль-
ных» амилозах с одной-двумя а-1, 6-связями полимеризация может
возрасти до 6000. Амилопектин имеет большую молекуляр-
ную массу, чем амилоза, и более сложное строение. Это ветвя-
щийся полисахарид. Возможно, он ветвится дихотомически, т. е.
число концевых звеньев на единицу больше звеньев, дающих вет-
вление. Существует также мнение, что цепи амилопектина не раз-
дваиваются, а образуют симметричные тройные разветвления. Тог-
да молекула приобретает продолговато-кустистую форму, облада-
ющую большей компактностью в пространстве. Молекула амило-
пектина— одна из самых крупных молекул, ее М. м.«5-108. Вет-
вление гликозидной цепи осуществляется с помощью а-1, 6-связей,
количество которых составляет 4—5% суммы а-1, 4- и а-1, 6-свя-
зей в амилопектине. В состав амилопектина входит от 0,012 до
0,111 % фосфора, который, по-видимому, присоединяется к шесто-
му углеродному атому в глюкозном остатке.
Амилоза и амилопектин в растениях формируются в крахмаль-
ные зерна-гранулы. Вопрос о структуре крахмального зерна оста-
ется открытым.
Гликоген — это полисахарид животного происхождения, он
найден в тканях животных и у некоторых микроорганизмов. По
строению он подобен амилопектину, но расстояние между точка-
157
ми ветвления почти в 2 раза меньше (10—12 остатков глюкозы),
поэтому его М. м. меньше— (2ч-30)106. Он окрашивается иодом
от красного до фиолетового цвета.
Механизм действия. К группе амилолитических ферментов от-
носятся а- и 0-амилазы, глюкоамилаза, пуллуланаза, изоамилаза
и некоторые другие ферменты. Амилазы бывают двух типов: эндо-
и экзоамилазы. Четко выраженной эндоамилазой является а-ами-
лаза, способная к разрыву внутримолекулярных связей в высоко-
полимерных цепях субстрата.
Глюкоамилаза и 0-амилаза являются экзоамилазами, т. е.
ферментами, атакующими субстрат с нередуцирующего конца.
При изучении механизма действия амилаз имеются определен-
ные сложности и прежде всего они заключаются в том, что суб-
страт — крахмал — неоднороден и имеет различные характери-
стики по степени полимеризации гликозидной цепи и количеству
ветвлений.
Реакции, катализируемые амилазами, имеют две стадии: ко-
роткую — предстационарную и длительную — стационарную. Во
время первой стадии эндоамилаза быстро уменьшает* молекуляр-
ную массу субстрата, образуя смесь линейных и разветвленных
олигосахаридов. Второй этап реакции продолжается пока продук-
ты гидролиза не перестанут окрашиваться йодом; он протекает
значительно медленнее и зависит от индивидуальных свойств фер-
мента и его природы. Поэтому конечные продукты гидролиза а-ами-
лазами могут быть различными. Первая стадия воздействия фер-
мента на субстрат, хотя и носит неупорядоченный характер, име-
ет для всех видов а-амилаз схожий механизм (рис. 2.1,а).
Существует две гипотезы о механизме действия экзоамилаз иа
субстрат. Первая гипотеза предполагает, что, воздействуя на суб-
страт по одноцепочечному или «молниеобразному» механизму,
экзоамилаза образует фермент-субстратный комплекс с захватом
нередуцирующего конца цепи. Дальнейшее продвижение фермента
по этой цепи происходит до
полного ее гидролиза (рис.
2.1,6). По второй гипотезе
0- и глюкоамилаза действуют
на субстрат путем механизма
множественной атаки, т. е.
фермент образует комплекс с
молекулой субстрата, затем
через несколько этапов этот
комплекс распадается, и фер-
мент связывается с новой мо-
лекулой субстрата. Иными
словами, при множественной
атаке происходит нечто сред-
нее между неупорядоченным
механизмом и одноцепочеч-
ной, «молниеобразной» атакой.
в
Рис. 2.1. Гипотетическая модель ме-
ханизма действия амилаз иа линей-
ные полисахариды:
а — неупорядоченная атака; б — одно,
цепочная или «молннеобразиая» ата-'
ка; в — множественная атака
158
Для полного гидролиза по этому механизму одна молекула суб-
страта должна образовывать много раз фермент-субстратные ком-
плексы. При этом возможен гидролиз нескольких связей в одном
каталитическом акте (рис. 2.1, в).
Механизм воздействия амилаз на субстрат может быть рассмот-
рен с нескольких позиций: 1) вид разрываемой связи (а-1,4- или
а-1,6-); 2) тип воздействия на субстрат (эндо- или экзо-); 3) влия-
ние на скорость гидролиза степени полимеризации субстрата;
4) возможность гидролиза олигосахаридов; 5) способность фер-
мента к множественной атаке субстрата. Наличие признаков ами-
лаз, отраженных в 3 и 4 позициях, при действии на линейные суб-
страты может свидетельствовать о существовании у этих фермен-
тов подцентровой структуры. Вероятно, активный центр амилазы
может состоять из нескольких (i) подцентров, каждый из которых
может вступать в контакты с глюкозным остатком. Энергия взаи-
модействия (А), выраженная в единицах свободной энергии
(кДж/моль), определяет подцентровое сродство фермента к суб-
страту. Это сродство индивидуально и может быть как положи-
тельным, так и отрицательным. Вероятность существования под-
цеитровых структур амилаз помогает установить строение актив-
ного центра амилаз, дает более четкое объяснение субстратной
специфичности, но не дает объяснений механизма гидролиза раз-
ветвленных субстратов.
а-Амилаза. а-Амилаза (а-1,4-глюкан-4-глюканогидролаза,
КФ 3.2.1.1.) является эндоамилазой, вызывающей гидролитическое
расщепление а-1,4-гликозидных связей внутри высокополимеризо-
ванного субстрата. Фермент назван а-амилазой потому, что он вы-
свобождает глюкозу в а-мутамерной форме.
а-Амилаза — водорастворимый белок, обладающий свойствами
глобулина и имеющий М. >«. = 45000—60000. Своего рода исключе-
нием является а-амилаза В. macerans, которая имеет М. м.=
= 130 000. Есть указания, что некоторые термостабильные а-амила-
зы имеют М. л«. = 14 000—15 000, но в их молекулах содержится
в 2—3 раза больше атомов кальция.
Все а-амилазы относятся к металлоэнзимам, содержание в-них
Са колеблется от 1 до 30 г-атом на 1 г-моль фермента, но не ме-
нее 1—6 г-атом. Полное удаление кальция приводит к инактива-
ции фермента. Повторное введение кальция в среду может ча-
стично восстановить его активность. а-Амилаза В. subtilis с помо-
щью иона цинка способна образовывать димерную форму, чего
лишены другие а-амилазы. Все а-амилазы устойчивы к воздейст-
вию протеаз. Они богаты тирозином и триптофаном. Глютамино-
вая и аспарагиновая кислоты составляют 25 % массы белка. На-
личие этих кислот в а-амилазе связывают с их осахаривающей
способностью. Так, разжижающие а-амилазы не имеют сульфгид-
рильных групп, а осахаривающие содержат один остаток цистеи-
на. Сравнительно мало или совсем отсутствуют в а-амилазах серо-
содержащие аминокислоты. Некоторые а-амилазы грибного про-
исхождения имеют углеводный фрагмент, в состав которого могут
159
Рис. 2.2. Влияние pH инкубационной среды и температуры на
активность грибных и бактериальных а-амилаз (по данным
Г. И. Квеснтадзе, 1984):
/ — A. niger; 2— A. oryzae; 3 — В. subtilis; 1 — В. stearothermophilus
входить манноза, ксилоза, гексозоамин, но функции его не уста-
новлены.
В зависимости от вида микроорганизма свойства а-амилаз мо-
Я^Я Я Я ioA Л^Я Ajo-6 Я Я Я АоА
Я Я Я Я С Я Я^а Я Я о’я Я Я Я Я
|₽a»’8₽g>g>&>g₽8₽8₽g,8>8>^/>^g> g><p 8 8
о
Рис. 2.3. Стадии гидролиза крахмала гриб-
ной а-амилазой:
а•— ферментативный гидролиз амилозы*. б —
начальная стадия гидролиза амилопектина;
в — конечная стадия осахаривания амилопек-
тина
гут сильно отличаться не
только по механизму воз-
действия на субстрат и ко-
нечным продуктам, но и по
оптимальным условиям для
проявления максимальной
активности (рис. 2.2).
Действуя на целое крах-
мальное зерно, а-амилаза
атакует его, разрыхляя по-
верхность и образуя кана-
лы и бороздки, т. е. как бы
раскалывает зерно на части.
Клейстеризованный крах-
мал гидролизуется ею с об-
разованием не окрашивае-
мых йодом продуктов — в
основном низкомолекуляр-
ных декстринов. Процесс
гидролиза крахмала много-
стадийный. В результате
воздействия а-амилазы на
первых стадиях процесса в
гидролизате накапливаются
декстрины, затем появляют-
ся неокрашнвающиеся
йодом тетра- и тримальто-
за, которые очень медленно
гидролизуются а-амилазой
до ди- и моносахаридов
(рис. 2.3).
160
Все а-амилазы проявляют наименьшее сродство к гидролизу
концевых связей в субстрате. Некоторые же а-амнлазы, особен-
но грибного происхождения, на второй стадии процесса гидроли-
зуют субстрат более глубоко с образованием небольшого количе-
ства мальтозы и глюкозы. Схему гидролиза под действием а-ами-
лазы можно записать следующим образом:
а-Амилаза
Крахмал,--------— а-Декстрины-|- Мальтоза + Глюкоза.
ГЛИКОГен (много) (мало) (мало)
0-Амилаза. 0-Амилаза (а-1,4-глюканмальтогидролаза, КФ
3.2.1.2) — активный белок, обладающий свойствами альбумина.
Каталитический центр фермента содержит сульфгидрильные и
карбоксильные группы и имидозольный цикл остатков гистидина.
0-Амилаза — экзофермент концевого действия, проявляющий
сродство к предпоследней а-1,4-связи с нередуцирующего конца
линейного участка амилозы и амилопектина.
В отличие от а-амилазы 0-амилаза практически не гидролизу-
ет нативный крахмал, тогда как клейстеризованный крахмал гид-
ролизуется ею с образованием мальтозы в 0-конфигурации, поэто-
му данная амилаза по аналогии с а-амилазой называется 0-амила-
зой. Если гидролизу подвергается амилоза, то гидролиз идет пол-
ностью до мальтозы. Незначительное количество декстринов мо-
жет образовываться при гидролизе «аномальных» амилоз, так как
гидролиз 0-амилазой идет только по линейной цепи до а-1,6-свя-
зей (рис. 2.4,а). Если субстратом для 0-амилазы служит амило-
пектин, то гидролиз идет в значительно меньшей степени. 0-Ами-
лаза отщепляет фрагмент
с нередуцирующего кон-
ца участка от внешних
линейных ветвей, имею-
щих по 20—26 глюкоз -
ных остатков, с образо-
ванием 10—12 молекул
мальтозы. Гидролиз при-
останавливается на пред-
последней а-1,4-связи,
граничащей с а-1,6-свя-
зью (рис. 2.4,6). В гид-
ролизате накапливает-
ся 54—58 % мальтозы,
остальное составляют
высокомолекулярные дек-
стрины, содержащие зна
чительное количество
а-1,6-связей — так назы-
ваемые 0-декстрины.
Действие 0-амилазы на
крахмал можно записать
в виде следующей схемы:
а
Рис. 2.4. Действие 0-амилазы на крахмал:
а —гидролиз амилозы; б — гидролиз наружных
ветвей амилопектина (Р-декстрин обведен пунк-
тирной линией)
6 Зак. 232
161
З-Амнлаэа
Крахмал,-------► Мальтоза + Р-Декстрии.
ГЛИКОГеН (54—58%) (42-46%)
р-Амилазы проявляют большую стабильность в отсутствие
иоиов Са2+. Молекулярная масса р-амилазы растений достаточно
высока, она составляет от 50 000 до 200 000. Фермент может состо-
ять из одной или четырех субъединиц до 50 000 каждая. Фермент
содержит SH-группы и чувствителен к действию тяжелых метал-
лов. Считается, что р-амилаза обладает высокой способностью к
множественной атаке субстрата. Для амилозы средней молекуляр-
ной массы в одном присоединении фермента к субстрату возмож-
но отщепление до четырех остатков мальтозы. При увеличении
молекулярной массы субстрата возможно и большее количество
мест атаки.
До середины 70-х годов единственным источником р-амилазы
считались растения, особенно прорастающее зерно (солод). Пер-
вое упоминание о том, что бактерии могут образовывать р-амила-
зу, относится к 1942 г., но это сообщение не было воспринято как
достоверное. И только после 1970 г. появляются серьезные разра-
ботки в этом направлении. В настоящее время для производства
мальтозы из крахмала в Японии, США, Англии, Франции, ФРГ и
Швейцарии применяют бактериальные р-амилазы. В нашей стра-
не поиск продуцентов р-амилазы был начат сравнительно недав-
но, 5—7 лет назад (,Р. К. Рапаш, 1984). Основные свойства бак-
териальных и растительных Р-амилаз представлены в табл. 2.1.
Глюкоамилаза. Глюкоамилаза (а-1,4-глюканглюкогидролаза,
КФ 3.2.1.3) широко распространена в природе. Оиа синтезируется
многими микроорганизмами и образуется в животных тканях, осо-
Таблиц а 2.1
Источник р-амнлазы Оптималь- ный pH рН-ста- бильность Оптималь- ная тем- пература, °C Термоста- бильность» °C Молеку- лярная масса Изоэлек- трическая точка pl
В. polymyxa 6,8 30 Ниже 40 -
В. polymyxa № 70 7,5 5,0—9,0 45 Ниже 50 44 000 8,35; 8,59
В. cereus BQ-10-S1 Spo 11 6,5 — 55 — 60 000 8,3
В. cereus var. mycoi- des 7,0 6,0—9,0 50 Ниже 50 35 000 —
В. megaterium № 32 6,5 5,0—7,5 50—65 Ниже 55 50 000 9,14
В. polymyxa № 3 6,0 — 55 — 56 000 4,9
7,0 — 45 — 62 000 8,4
Ячмень 4,5—5,0 4,5—9,8 — — 57 200 4,65; 4,75; 4,9; 5,2
Японская редька 4,9—5,0 4,7—7,7 60 Ниже 40 58 000 62 000 4,9
Пшеница 4,6—6,2 4,5-9,2 — — 64 200 4,1; 4,4; 4,9
162
бенно в печени, почках, плаценте кишечника и т. д. Фермент в
литературе известен под различными названиями: амилоглюкози-
даза, у-амилаза, лизосомальная а-глюкозидаза, кислая мальтоза,
матулаза, така-амилаза В и экзо-1,4-а-глюкозидаза. Глюкоамила-
за катализирует последовательное отщепление концевых остатков
а-£)-глюкозы с нередуцирующих концов субстрата. Это фермент
с экзогенным механизмом воздействия на субстрат. Многие глю-
коамилазы обладают способностью так же быстро, как и а-1,4-
связь, гидролизовать а-1,6-глюкозидиые связи. Но это происхо-
дит только в том случае, когда за а-1,6-связью следует а-1,4-связь,
поэтому декстран ими не гидролизуется. Отличительной особенно-
стью глюкоамилаз является способность в десятки раз быстрее
гидролизовать высокополимеризованный субстрат, чем олиго- и
дисахариды.
Схематически механизм действия глюкоамилазы можно пред-
ставить следующим образом (рис. 2.5,а). В литературе высказы-
вается мнение, что механизм атаки субстрата глюкоамилазой мо-
жет быть двух типов: либо одноцепочечный, либо множественной
атаки, и что активный центр имеет подцеитровую структуру.
Почти все глюкоамилазы являются гликопротеидами, содержа-
щими от 5 до 35 % углеводов, которые состоят из олиго-, ди- и
моносахаридов. Углеводный компонент может быть целостным
фрагментом или же разбитым на индивидуальные соединения, ко-
торые прикрепляются к белку через треонин и серин. Например,
у глюкоамилазы A. niger их 20. Большинство известных глюкоами-
Рис. 2.5. Действие глюкоамилазы иа субстрат:
а — предположительный механизм воздействия глюкоамнлазы (ГлА) на ветвящийся
субстрат; б —схема совместного действия на крахмал (Кр) глюкоамнлазы,
a-амнлазы и глнкознлтрансферазы (ГлТФА) в открытой системе с постоянным
удалением из реакционной среды глюкозы (Г); в—то же, что н в б. но глю-
коза не удаляется — система закрытая (по правой стороне треугольника пунктирная
стрелка обозначает фермент глюкоамнлазу — читай ГлА)
6*
163
лаз имеет оптимум pH при 4,5—5,2, реже — при 5,7—6,0, в основ-
ном для дрожжевых глюкоамилаз (табл. 2.2).
Таблица 2.2
Источник глюкоамилазы Оптимальные условия Молеку- лярная масса Изоэле- ктрическая точка pH Содержа- ние угле- водного фрагмента, % Степень гидролиза раствори- мого крахмала, %
pH темпе- ратура, °C
Endomycopsis sp. 20-9 5,7—5,9 50 53 000 3,8-3,82 8,5 98—99
Endomyces JF 00111 4,8—5,0 —— 55 000 4,8-5,5 Есть —-
Rhizopus javan icus 5,0—5,2 —- 48000 7,5—8,0 10,5
Aspergillus awamori (no данным В. M. Фо- гарти, 1982) Aspergillusniger 4,5 60 83 700— -88 000 3,7 90
1 4,5—5,0 — 99 000 3,4 — 95
11 4,5—5,0 112 000 4,0 — —
Mucor rouxianus 1 4,6 55 59 000 8,4 Есть 100
Rhizopus delemar 4,5 40 100000 — — 95
Penicillium oxalicum 5,0 55-60 84 000 7,0 — 88 .
Aspergillus phoenicis 4,5 60 69 000 — 17,0 —
Кишечник человека — — 210 000 — 32—33. —
Aspergillus awamori X-100 (no данным Г. И. Квеситадзе, 1984) 4,7—5,0 60—62 62 000 4,4 Есть
pH-стабильность микробных глюкоамилаз лежит в широком
диапазоне — от 2,5 до 9. Термостабильность глюкоамилаз лежит
в интервале от 30 до 45 °C и редко повышается до 55—60 °C. Глю-
коамилазы различного происхождения заметно отличаются по мо-
лекулярной массе, которая, по данным различных авторов, имеет
значения от 48 000 до 210 000. Следует заметить, что далеко не
все микробные глюкоамилазы способны полностью гидролизовать
крахмал до глюкозы. Еще в 60-х годах И. Фукумото предложил
все микробные глюкоамилазы разделить на два типа: 1) полно-
стью гидролизующие крахмал до глюкозы и 2) гидролизующие
крахмал до глюкозы на 80—85 %. В то время предполагалось, что
степень гидролиза зависит только от свойств глюкоамилаз и их
происхождения. В 70-х годах было показано, что при росте куль-
туры параллельно накапливаются и другие амилолитические фер-
менты, обладающие не только гидролитическим, но и трансфераз-
ным действием. Это гликозилтрансфераза и а-амилаза. Даже в
случае, если система открытая и продукт гидролиза (глюкоза)
постоянно удаляется из системы (см. рис. 2,5), процесс может дой-
ти до полного гидролиза крахмала до глюкозы. Если же система
закрытая и концентрация субстрата велика, то при достижении
определенной концентрации глюкозы в реакционной среде в ре-
зультате переноса глюкозильных остатков на глюкозу, ди- и оли-
госахариды начинают накапливаться изомальтоза, паноза, ниге-
роза, изомальтотриоза и другие сахара, которые имеют горький
164
- Места атаки судтрата ферментом
Рис. 2.6. Схема частичного гидролиза
пуллулаиа пуллуланазой (по данным
Г. И. Квеситадзе, 1984)
вкус. В результате процесс не
может дойти до полного превра-
щения крахмала в глюкозу и
возникает ошибочное представле-
ние, что глюкоамилаза не полно-
стью гидролизует крахмал. Сама
же глюкоамилаза может прояв-
лять небольшую трансферазную
активность, но только при кон-
центрации глюкозы свыше 60—
70%. Поэтому ранее принятое
деление глюкоамилаз на два ти-
па следует считать необоснован-
ным.
Пуллуланаза. Фермент пуллу-
ланаза (пуллулан-6-глюканогид-
ролаза, КФ 3.2.1.41) ранее был
известен под несколькими назва-
ниями: /?-фермент; дебранчинг-
фермент, предельная декстриназа
или аминопектин-6-глюканогид-
ролаза. Как и а-амилаза, пуллуланаза является эндогенным фер-
ментом, но в отличие от последней способна неупорядоченно гид-
ролизовать а-1,6-связи в пуллулане, амилопектине, гликогене и
предельных декстринах, получаемых при совместном воздействии
на крахмал и гликоген а- и 0-амилаз. Схематично механизм воз-
действия пуллуланазы на субстрат можно представить следующим
образом (рис. 2.6). Мальтотриоза является наиболее частым от-
щепляемым фрагментом.
Если между двумя а-1,6-связями расположено более трех ос-
татков глюкозы, то процесс разрыва а-1,6-связей идет значитель-
но медленнее, поэтому амилопектин хуже других ветвящихся по-
лисахаридов гидролизуется пуллуланазой. Атакуемость несколько
возрастает, если происходит нарушение вторичной структуры поли-
мерной цепи полисахарида, например, легко происходит расщеп-
ление частично гидролизованного гликогена.
Пуллуланазы из различных источников обладают различными
свойствами (табл. 2.3). Иногда этот фермент путают с нзоамила-
зой, особенно, когда проверяют изучаемые препараты на способ-
ность гидролизовать пуллулан в комбинации с другими амилоли-
тическими ферментами.
Изоамилаза. Изоамилаза (гликоген-6-глюканогидролаза,
КФ 3.2.1.68), или дебранчинг-фермент, гидролизует а-1,6-связи в
ветвящихся субстратах, таких, как амилопектин, гликоген, 0-пре-
дельные декстрины. Отличительной особенностью изоамилазы по
сравнению с пуллуланазой является то, что она не способна гид-
ролизовать пуллулан и слабо действует на предельные а-декстри-
ны. Бактериальная нзоамилаза расщепляет а-1,6-связи в гликоге-
не полностью, а пуллуланаза действует на этот субстрат слабо.
165
Таблица 2.3
Источник пуллуланазы Оптималь- ный pH Оптималь- ная тем- пература , Молеку- лярная масса Ингибиро- вание л-ХМБ* Стабилиза цня кальцием
Aerobacter aerogenes 6,0 50 143000 Нет
Bacillus cereus var. mycoides 6,0—6,5 50 112 000 ±20 000 Да Да
Bacillus polymyxa 6,0—7,0 45 48 000 Да Да
Bacillus sp. 4,5—5,5 60 — — -—
Bacillus sp. 202-1 8,6—9,0 55 92 000 Нет -—
Streptomyces sp. 280 5,0—6,0 50 — — Да
• л-ХМБ—парахлормеркурнйбензоат.
Этот фермент образует многие микроорганизмы, такие, как
В. amyloliquefaciens, Cytophaga, Streptomyces, Pseudomonas amy-
loderamosa, Saccharomyces cerevisiae и др., ферменты которых
обладают способностью гидролизовать субстрат при pH от 3,5 до
6,5 и температурах от 25 до 52°C. Изоамилаза не стабилизируется
кальцием, за исключением фермента из Cytophaga. Изоамилазы
ингибируются n-хлормеркурийбеизоатом. Молекулярная масса
изоамилаз различна — от 90 000 до 120 000. Этот фермент в со-
четании с р-амилазой применяется для получения мальтозы и
мальтозных паток. Его используют для получения линейных по-
лимеров из крахмала, он способствует более полному использова-
нию субстратов при брожении, если обработка ведется на началь-
ных стадиях, когда есть разветвленные субстраты.
а-Глюкозидаз а. Фермент а-глюкозидаза (a-D-глюкозидглюко-
гидролаза, КФ 3.2.1.20) обладает способностью гидролизовать
а-1,4-связи с иередуцирующего конца субстрата с отщеплением
остатка глюкозы. Фермент проявляет наибольшее сродство к низ-
комолекулярным субстратам, легко гидролизует мальтозу, олиго-
сахариды, полисахариды гидролизует медленно или вовсе не гид-
ролизует. а-Глюкозидаза вероятнее всего объединяет группу фер-
ментов и имеет ряд других названий: мальтаза, глюкоинвертаза,
глюкозидосахараза. Этот фермент обладает способностью к пере-
носу а-Е)-глюкозильных остатков на подходящие акцепторы ча-
сто с образованием а-1,6-связей. Очень многие микроорганизмы
(грибы, дрожжи, бактерии, актиномицеты) образуют а-глюкози-
дазы, они могут быть внеклеточными и внутриклеточными.
Некоторые a-глюкозидазы способны медленно гидролизовать
до глюкозы даже крахмал, амилопектин и гликоген (например,
a-глюкозидазы из Penicillium purpurogenum, Р. oxalicum и Mucor
racemosus) до конечных продуктов гидролиза высокомолекуляр-
ных субстратов. Этот фермент можно принять за глюкоамилазу,
но у него есть отличительные особенности — глюкоза отщепляет-
ся им в а-Е)-форме, а при действии глюкоамилазы — в 0-£)-фор-
ме. Кроме того, а-глюкозидаза обладает высокой трансферазной
166
Таблица 2.4
X
. сч
н н ь* р,
Ц* Ж<=( *Х«ХЧ* .«=(
сч
tl
XX X
я я сч
I «й „ | I Й Н « Л А Н
' Ж .Ж .X
я я сч
Ь( t( «=(
«
X <у •§
со.1 I Й5аЙД-щ£‘5Д
© х х“х _х^
я г* я
t=( 1=1
А Л А А й
I I -н
§§§§§§§§
ЮСОСОМ'Ь-ОЮО
СЧСООСЮСЧООЬ*
OQCQ
S8SS |
г- сч сч со
сч ю со
Фермент на данном субстрате обладает помимо гидролитической и трансферазной активностью.
ЮШ |ЮОО IOOOO
юсо 1ЮЮЮ l*4**4fCO
о ю о
•4J* чг Ю
167
активностью, и поэтому в реакционной среде обнаруживаются изо-
сахара. Важно отметить, что а-глюкозидазы проявляют строгую
специфичность только к последнему с иередуцирующего конца
остатку глюкозы, поэтому этот фермент может успешно действо-
вать на ряд производных глюкозы. В табл. 2.4 представлены не-
которые* данные по свойствам а-глюкозидаз и их субстратной спе-
цифичности (по данным В. М. Фогарти, 1982).
Амилаза Bacillus macerans. Это уникальная амилаза (1,4-а-
£>-глюкан-4-а-(1,4-а-глюкаио) -трансфераза (циклизующая), КФ
2.4.1.19), впервые была найдена в культуре В. macerans. Она цик-
лизует часть цепи 1,4-а-глюкана путем образования 1,4-а-глюко-
зидной связи. Рабочее название этого фермента циклодекстрин-
глюканотрансфераза (ЦДГТ). При воздействии на крахмал и ана-
логичные субстраты образуются циклические нередуцирующие
декстрины (декстрины Шардингера) различных размеров, состоя-
щие из 6—8 и более остатков глюкозы. Эта реакция обратима.
Фермент также способен перестраивать линейную структуру маль-
тодекстринов без циклизации.
В. macerans образует сложный комплекс ферментов, который
помимо ЦДГТ содержит по меньшей мере еще четыре амилазы.
Эта система катализирует не менее трех реакций, которые вклю-
чают процессы циклизации, ассоциирования и неупорядоченной де-
градации. Исследования по расшифровке механизма действия
ЦДГТ-системы показывают, что все эти ферменты внеклеточные
и что соотношение декстринирующей, амилазной, циклодекстрин-
синтетазной и циклодекстринглюканотрансферазной активностей в
культуральной жидкости В. macerans остается постоянным. В свя-
зи с этим были высказаны предположения, что все эти активно-
сти принадлежат одному ферменту. Я. Кобаяши с сотр. в 1978 г.,
работая с кристаллическим ферментом, экспериментально подтвер-
дил это предположение.
Были изучены свойства ЦДГТ (табл. 2.5). Первоначально
предполагалось, что этот фермент состоит из двух субъединиц, но
в 1979 г. А. Ставн и П. Е. Гранум установили, что это одноцепо-
чечный белок с молекулярной массой 67 000.
Таблица 2.5
Показатель По данным Де Пннто и Кэмп- белла. 1968 По данным Я. Кобаяши и др., 1978 По данным А. Ставка и П. Е. Гран ума, 1979
Молекулярная масса 139 300 145000 67 000
Изоэлектрическая точка — — 5,4
Оптимальный pH 6,1—6,2 6,0 5,4-5,8
Оптимальная температура, °C — 60 60
km (по крахмалу), мг/мл 3,33 — 5,7
В литературе есть указания, что и другие микроорганизмы мо-
гут синтезировать циклодестринглюканотрансферазы. Это Bacillus
megaterium, щелочефильная Bacillus sp. Klebsiella pneumoniae,
168
которые образуют фермент, очень близкий по свойствам к ЦДГТ
из Bacillus macerans. Практическое использование циклодекстри-
нов имеет большую перспективу, так как эти соединения находят
применение при изготовлении различных лекарств пролонгиро-
ванного действия.
2.1.3. Получение амилолитических препаратов
Амилолитические ферменты могут применяться в виде поверх-
ностных и глубинных культур, жидких концентратов, сухих пре-
паратов различной степени очистки.
Получение препаратов амилаз из поверхностных культур. Сре-
дой для выращивания продуцентов являются пшеничные отруби
с добавлением до 25 % солодовых ростков, увлажненные водой,
подкисленной 0,1 н. раствором серной или соляной кислоты. Вы-
ход готовой культуры составляет обычно от 70 до 80 % массы сре-
ды. Продуцентами а-амилазы и глюкоамилазы чаще всего исполь-
зуются микроскопические грибы A. oryzae, A. awamori, A. niger,
R. delemar и др. В Японии при твердофазном культивировании
применяют бактерии В. subtilis и В. amylosolvents. Режимы вы-
ращивания зависят от физиологии продуцента.
Выращенная культура влажностью 36—50 % может быть вы-
сушена и использована как готовый препарат с индексом Пх,
а также в сухом или влажном виде может быть передана на даль-
нейшую переработку с целью получения очищенных препаратов.
Процесс очистки начинается с водной экстракции при 20—25 °C с
отбором 200—220 %, средняя концентрация сухого вещества в
экстрактах 11—14%. Потери ферментов с биошротом составляют
6—12 %. Экстракты с целью понижения уровня обсемененности
микроорганизмами могут быть обработаны слабыми растворами
электролитов, например 0,8—1,0 %-ным СаС1г. Далее экстракты
можно сконцентрировать методом вакуум-выпаривания или ульт-
рафильтрации.
Экстракт из поверхностной культуры может быть использован
для получения очищенных амилолитических препаратов путем
осаждения ферментов органическими растворителями или ней-
тральными солями. Амилазы выпадают в осадок почти полностью
(93—96%) при концентрации этанола в растворе 69—72 %, аце-
тона 60—62 и изопропанола 54—55 %. Но сейчас поверхностная
культура не считается перспективным сырьем для производства
высокоочищенных амилолитических препаратов.
Получение препаратов амилаз из глубинных культур. В на-
стоящее время в нашей стране для получения амилолитических
ферментных препаратов преимущественно используется глубин-
ный способ культивирования продуцентов. В качестве продуцен-
тов используют грибы рода Aspergillus (A. oryzae, A. usamii,
A. batatae), спороносные бактерии, относящиеся к группам
В. subtilis — mesentericus, дрожжеподобные организмы родов
Endomycopsis, Endomyces и многие другие микроорганизмы.
169
Источники азота. Выбор сред для каждого продуцента
проводится опытным путем с учетом физиологических потребно-
стей продуцента и условий производства. Например, при изуче-
нии факторов, влияющих на биосинтез ферментов, было показано,
что культура В. subtilis 103 весьма чувствительна к источнику азо-
та в среде (табл. 2.6).
Т а б л иц а 2.6
Источник азота Активность а-амилазы, ед. АС/мл pH Содержание биомассы, г на 100 мл
ИСХОДНОЙ среды культуральной жидкости
Цитрат аммония двузамещенный 82,8 6,9 7,5 0,84
KNO3 14,4 6,9 6,1 0,11
NH4NO3 0 6,9 4,45 0,26
(NH4)2SO4 0 6,9 4,8 0,40
(NH.)2HPO4 86,4 6,9 5,6 0,80
nh4ci 43,2 6,9 7,4 0,40
Казеин 24,0 6,9 7,7 0,80
Пептон 43,2 6,9 7,5 1 ,оа
Кукурузный экстракт 36,0 6,8 7,6 1,00
Глютен 14,4 7,0 6,8 0,74
Вытяжка из солодовых ростков 4,8 7,0 7,3 0,60
Наилучшие результаты согласно данным К. А. Калунянца и
др. (1979) наблюдаются в присутствии двузамещенного цитрата
аммония — 82,8 ед. AC/мл и (NH^aHPO* — 86,4 ед. AC/мл. Ор-
ганические источники азота менее эффективны, чем неорганиче-
ские. Дополнительное введение азота в виде экстрактов из расти-
тельного, животного и микробного материала к (NH4)2HPO4 по-
зволяет на 30—40 % повысить продуцирующую способность бакте-
рий и достичь активности ПО—114 ед. AC/мл (табл. 2.7).
Источники углерода. Главным источником углерода в
среде для всех продуцентов а-амилазы является крахмал различ-
ного происхождения. Используют чаще всего крахмал картофель-
Таблица 2.7
Количест-
во добавки,
о/
/9
pH Активность а-амилазы, ед. АС/мл
Исходная среда Готовая культу- ральная жидкость
Источник азота
Вариант
среды
Количество
(NH4hx
ХНР04
Азотсодержащая добавка
1 2 1.5 1,0 Пептон 0,9 6,9 6,9 5,6 7,2 86,4 108,0
3 1,0 Кукурузный экстракт 0,9 6,8 7,3 111,6
4 1,0 Экстракт солодовых рост- 5,0 ков 6,8 6,6 114,0
5 1,2 Кукурузный экстракт и Соответ- 6,7 7,2 111,6
пивные осадочные дрож- ствеино
жи 0,8 и
0,4
170
Таблица 2.8
Вариант среды Способ обработки крахмала в питательной среде pH готовой культу- ральной жидкости Активиост! в культ жид» ед. АС/мл а-амилазы тральной сости % от контроля
1 Гидролизат крахмала при длительности гидролиза т=10 мин 5,70 177,0 158,5
2 Гидролизат крахмала при т=60 мии 5,65 168,0 150,5
3 Гидролизат крахмала при т=1,5 ч (опре- деленный режим введения в среду) 5,72 180,0 161,0
4 Гидролизат крахмала при длительности гидролиза т=18 ч (определенный режим введения в среду) 5,68 180,0 161,0
5 Контрольный источник углерода—мальто- 5,60 111,6 100,0
за
ныи или кукурузный, который вводится в среду в клеистеризован-
ном состоянии. Вместо крахмала может применяться крахмалсо-
держащее сырье, например ячменная или кукурузная мука. Все
эти компоненты используются в нативном виде или в виде раз-
личных гидролизатов.
Установлено, что биосинтез а-амилазы протекает более интен-
сивно, если крахмал частично гидролизовать в процессе приготов-
ления питательной среды, не допуская при этом накопления в
среде низкомолекулярных дисахаров (мальтозы) и особенно глю-
козы (табл. 2.8). Поэтому, если состав среды предусматривает вы-
сокое содержание крахмала, целесообразно вводить его порциями
по мере потребления культурой
избежать явления катаболитной
репрессии синтеза а- или глюко-
амилазы (рис. 2.7).
В табл. 2.9 приводятся неко-
торые варианты питательных
сред, рекомендованных для по-
лучения препаратов, содержащих
а-амилазу, на основе бактери-
альных продуцентов (в %).
Приведенные данные нельзя
считать абсолютными, так как
селекция штаммов — продуцен-
тов а-амилазы постоянно продол-
жается, усовершенствуются сре-
ды, улучшается синтезирующая
способность микроорганизмов.
Так, при использовании В. subti-
lis сейчас получают культураль-
ную жидкость с активностью до
200—250 ед. АС/мл.
микроорганизма, что позволяет
Рис. 27. Влияние дробного введения
крахмала на биосинтез глюкоамила-
зы дрожжами Endomycopsis sp. 20-9
(по данным Л. П. Замотайловой и
ДР„ 1978):
1 — контроль; 2 — дробный режим вве-
дения крахмала в количестве 0.5 %
(стрелкой обозначено время введения
подпитки)
171
Таблица 2.9
Источник ферментов Синтезируемый фермент Ферментативный гидролизат Щелочной экстракт куку- рузной муки с 10% сухого вещества Минеральный состав среды
крахмала (по крах* малу) кукурузной муки (по крахмалу) кормовых дрожжей (по сухому веществу) О а. X X Z СаС12 3 ьо £ и &
В. subtilis Амилаза Комплекс амилазы и протеазы 9,0 3,0 9,0 0,2 0,5 1,2 0,01 0,05 0,05 0,15 0,15
1,2 0,05
В. mesentericus Амилаза 6,0 6,0 0,2 — 0,9 0,01 0,05 0,15
Можно привести большое количество прописей, где для состав-
ления питательных сред использовались самые различные компо-
ненты прн глубинном культивировании продуцентов а-амилггз.
Так, например, при культивировании гриба A. oryzae 3-9-15 — про-
дуцента а-амилазы согласно данным Е. А. Двадцатовой и др. хо-
рошие результаты были получены на среде следующего состава
(в %): кукурузная мука — 6; NaNO3— 0,9; MgSO4— 0,005 с до-
бавлением 10% вытяжки из солодовых ростков. Японские иссле-
дователи в качестве основного обогатителя среды применяли от-
руби. Фуканэхара рекомендует среду, состоящую (в %): из куку-
рузной муки — 3,9, пшеничных отрубей — 1,56, рисовых отру-
бей — 1,56, Са(Н2РО4)2— 0,28 и NaNO3— 0,28. Для A. oryzae,
выращиваемого для использования в пивоварении, Федоров с сотр.
использовал среды, основным компонентом которых являются от-
ходы пивоваренного производства. Фильтрат пивной дробины обо-
гащался (в %): молотым фуражным ячменем — 1,5, солодовыми
ростками — 1 и солями NaNO3—-0,9, КС1 — 0,1, КН2РО4 —0,1,
MgSO4-7H2O — 0,001, pH среды 5,6—5,7. Р. В. Фениксова и
А. С. Тихомирова считали'наиболее целесообразным выращивать
В. subtilis на водном экстракте из отрубей при их соотношении
1 :5 или на видоизмененной среде Номура, состоящей из 2 % крах-
мала, 0,067 М (NH4)2HPO4, 0,02 М КС1, 0,002 М MgSO4-7H2O,
0,001 М СаС12 и 5 %-кого щелочного экстракта из соевых бобров,
pH среды 7,2.
В последнее время для увеличения секреции а-амилазы бакте-
риальными культурами направленно создают условия для интен-
сификации в процессе роста культуры автолитических процессов
под действием некоторых компонентов среды или продуктов ме-
таболизма культуры, например путем введения на определенной
стадии роста триптического гидролизата казеина, кислотного гидро-
лизата кормовых дрожжей, кукурузного экстракта и т. д. Опыты,
проведенные в промышленных условиях с культурой В. subtilis
172
SK-52 (данные Э. С. Стапчинске-
не, О. В. Кислухиной, К. А. Калу-
нянца, 1985), показали, что с ро-
стом автолитических процессов
под действием вводимых добавок
происходит увеличение в 1,5—2
раза биосинтетической способно-
сти клеток в отношении а-ами-
лазы.
При работе с бактериальными
культурами — продуцентами а-
амилаз следует помнить, что вид
В. subtilis подвержен естествен-
ной изменчивости. В процессе
расщепления культуры появля-
ются морфологические варианты
с пониженной способностью к
синтезу ферментов, что приводит
к уменьшению выхода и сниже-
нию качества препаратов. Много-
летние наблюдения за производ-
ственными штаммами В. subtilis
длительность эксплуатации
культуры, нес
Рис. 2.8. Активность а-амнлазы в
культуральной жидкости различных
штаммов В. subtilis прн нх длитель-
ной эксплуатации в производственных
условиях (по данным Э. С. Стапчии-
скене, О. В. Кислухниой и др.,
1982):
1—штамм SK-52; 2 — штамм SK-52; 3 —
штамм EmN; 4 — штамм RW-355; 5 —
штамм $140
показывают, что такие измене-
ния происходят не только по годам, но и месяцам (рис. 2.8), что
указывает на необходимость постоянного контроля и отбора вари-
антов с высокой амилолитической активностью.
Имеется много данных по оптимизации питательных сред и ус-
ловий культивирования продуцентов глюкоамилазы. В глубинных
условиях оптимизирован биосинтез глюкоамилазы микроскопиче-
скими грибами, относящимися к родам Aspergillus (A. niger,
A. awamori, A. usamii) и Rhizopus (R. delemar), и дрожжеподоб-
ными микроорганизмами, такими, как Endomycopsis fibuligera,
Endomyces sp., и некоторыми другими.
При конструировании сред как обязательный компонент среды
используется крахмал в дозировках от 0,7 до 17% в зависимости
от продуцента. Для дрожжей процесс биосинтеза можно оптими-
зировать, введя в состав среды олеиновую кислоту в качестве до-
полнительного источника азота и фактора, способствующего авто-
лизу культуры и повышению секреции глюкоамилазы во внешнюю
среду (по данным Л. П. Замотайловой и др., 1978). На культуре
Endomycopsis sp. 20-9 показано, что добавление поверхностно-ак-
тивных веществ в среду заметно повышает продуцирующую спо-
собность дрожжей к биосинтезу амилаз (рис. 2.9). Вероятно, это
связано с увеличением проницаемости клеточных мембран и ин-
тенсификацией автолитических процессов в культуре.
Изучение влияния источника азота на биосинтез глюкоамила-
зы Endomycopsis sp. 20-9 показало, что положительный эффект
оказывает введение в состав среды солей NH4CI, (N^hPCh или
KNO3. Но наилучшне результаты получаются при сочетании ми-
нерального и органического азота, например при введении дрож-
173
жевого автолизата, кукурузного экстракта или других природных
субстратов, содержащих значительные количества аспарагиновой
и глютаминовой кислот. С учетом перечисленных факторов для
этого продуцента разработаны не только периодические, но и не-
прерывные режимы культивирования (по данным М. В. Гернет,
Л. И. Амбарцумян и др., 1982). В заводских условиях биосинтеза
после 30—32 ч роста Е. sp. 20-9 в культуральной жидкости накап-
ливалось до 40—50 ед. ГлА/мл.
Интерес представляют разработки по производству глюкоами-
лазных препаратов на основе Aspergillus awamori. Использование
сред с высоким содержанием крахмала и штаммов, у которых син-
тез глюкоамилазы не контролируется катаболитной репрессией,
позволяет получать культуральную жидкость с активностью по
глюкоамилазе свыше 200 ед./мл
Рис. 2.9. Влияние добавления по-
верхностно-активных веществ (кон-
центрация ПАВ 0,1 %) на биосинтез
глюкоамнлазы культурой Endomycop-
sis sp. 20-9 (кривые 1—4) и а-амн-
лазы (кривые /'—4') н изменение ве-
личины pH культуральной жидкости
(5 и 5') (по данным Г. Е. Индисо-
вой, М. В. Гернет и др., 1984):
I, Г, 5 — контроль; 1, 2' — добавление
твнна-65: 3. 3'—добавление твнна-бг, 4
4’. 5’ — добавление твнна-80
(по данным К. А. Калунянца,
В. А. Быкова, 1984), что является
большим достижением в техноло-
гии ферментов.
Выделение ферментов.
Полученная культуральная
Рис. 2.10. Изменение ферментативных
активностей и влажности препаратов
в зависимости от температурного ре-
жима распылительной сушки куль-
туральной жидкости Endomycopsis sp.
20-9 (по данным Г. Е. Индисовой и
др., 1980):
f — глюкоамнл азиая активность; 2 —
а-амнлазная активность; 3 — мальтазная
активность; 4 — глнкознлтрансферазная
активность; 5 — влажность препарата
174
жидкость может быть использована без дальнейшей обработки
для осахаривания крахмалистого сырья в спиртовом производстве
(например, A. awamori) или в виде фильтрата для осахаривания
высококонцентрированных крахмальных клейстеров в крахмало-
паточной промышленности. Непосредственное использование куль-
туральной жидкости в том или ином производстве требует ее не-
медленной реализации, так как она не может храниться из-за не-
стабильности растворов и инактивации ферментов. Экономически
более оправдано централизованное производство стабильных, лег-
ко транспортируемых ферментных препаратов.
Для получения ферментных препаратов с индексом ГЗх фильт-
рат глубинной культуры непосредственно не используется, так как
концентрация сухого вещества в культуральной жидкости, как пра-
вило, низкая. Поэтому перед сушкой методом распыления филь-
трат культуральной жидкости или культура вместе с биомассой
концентрируются, затем вносятся наполнитель, стабилизатор и
после этого смесь направляется на сушку. При сушке н концент-
рировании очень большое значение имеет правильный выбор ста-
билизатора фермента и температурного режима процесса. Таким
примером могут быть данные Г. Е. Индисовой (1983), приведен-
ные в табл. 2.10 и на рис. 2.10.
Таблица 2.10
Потери, %
Состав концентрируемой жидкости и стабилизаторов сухого вещества глюкоамнла» ной активности
Фильтрат культуральной жидкости (контроль 1) 4,5 32,5
Фильтрат-|-(МН4)25О4 4,9 14,5
Фильтрату Na2HPO4-KH2PO4 (1:19) 4,8 13,4
Фильтрат J №НРО4-КН2РО4 (1:19)+(NH4)2SO4 5,0 11,8
Фильтрат f-кормовые гидролизные дрожжи 4,7 14,2
Из табл. 2.10 видно, что присутствие стабилизаторов позволяет
значительно снизить потери ферментативной активности в рас-
творах. Введение этих же стабилизаторов в присутствии наполни
телей — перлита и коалина — в процессе распылительной сушки
позволяет практически полностью предотвратить тепловую инак-
тивацию ферментов.
Не менее важно определение оптимальной концентрации сухо
го вещества в высушиваемом растворе и pH, прн которой не про-
исходит инактивации фермента. Эти исследования следует прово-
дить для каждого продуцента с учетом состава среды и наполни-
теля (рис. 2.11).
Для получения очищенных ферментных препаратов из глубин-
ных культур используют традиционные методы концентрирования
(ультрафильтрация, вакуум-выпаривание) и методы выделения
(органическими растворителями, солями, хроматографией и т. я)
175
Рис. 2.1 Г. Влияние концентрации сухого вещества (кривые о) и
pH (кривые б) высушиваемой культуральной жидкости Endomycop-
sis sp. 20-9 иа величину ферментативных активностей готового пре-
парата (по данным Г. Е. Индисовой, И. М. Грачевой и др., 1983):
/ — а-амнлаза; 2 — глюкоамилаза; 3 — мальтаза; 4 — глнкознлтрансфе-
раза
В качестве примера можно привести основные этапы очистки
глюкоамилазы из глубинной культуры Endomycopsis sp. 20-9
(табл. 2.11).
Таблица 2.11
Стадия очистки Глюкоамнлаза Выход сопутствующих ферментов, %
Удельная активность, ед. ГлА/мл белка 1 Выход, % 1 Степень очистки 1 а-Амилаза (АС) Глнкозилтрансфераза, (ГлТФА) 1 ГлТФА Отношение _ . ГлА
Исходная культуральная жидкость 7,1 100 1 100 100 36,5 Отделение биомассы, концентрирование 2,3 90,0 1,1 89,0 90,0 36,2 ферментного раствора Осаждение ацетоном, растворение в воде 9,7 69,5 4,6 11,3 24,0 12,5 Ультрафильтрация 11,3 64,0 5,4 9,1 17*6 ю’о Хроматография на ДЭАЭ-целлюлозе 50,4 52,5 24,5 0,4 5Д 3,6 Ультрафильтрация 54,0 47,0 25,7 0,3 4,5 3,5 Гель-фильтрация на акрилексе Р-100 76,5 40,5 36,5 0,2 3,8 3,5 Обессоливание и лиофилизация 77,0 25,0 37,0 0,2 2,4 3,5
176
Разработанная схема позволяет освободиться от сопутствую-
щей гликозилтрансферазы и амилазы, получить гомогенный пре-
парат с выходом 25 % и степенью очистки 37 (по данным
М. В. Гернет, Т. А. Лущик и др., 1984).
Еще более простая технология выделения гомогенной а-ами-
лазы из термофильного штамма В. stearothermophilus предложена
Е. М. Бечиной, Л. Г. Логиновой и др. (табл. 2.12), которая состо-
ит всего из четырех этапов. Выход препарата составляет 22,1 %
и степень очистки — 135,6.
Таблица 2.12
Стадия очистки Удельная активность, ед. АС/мг белка Степень очистки Выход фермента, %
Фильтрат культуральной жидкости 5,9 1,0 100
Концентрирование методом ультрафильтрации 10,6 1,8 100
Осаждение этиловым спиртом, высушивание осадка методом сублимации 42,5 7,2 95,0
Изоэлектрическое фокусирование в диапазоне pH 3— 10 с последующим отделением активных фракций от амфолинов на сефадексе G-15 621,7 105,3 79,9
Ионообменная хроматография на ДЭАЭ-целлюлозе с ДЭ-32 800,0 135,6 22,1
Представляют интерес работы по выделению, очистке и свой-
ствам р-амилазы В. polymyxa, выполненные под руководством
А. А. Глемжи. Предельно простой способ позволяет выделить
р-амилазу практически в две стадии путем осаждения этиловым
спиртом и методом сорбции на крахмале с последующей десорб-
цией с крахмала. Было определено, что на 1 г крахмала сорбиру-
ется 24—25 ед. фермента. Сорбция проводится путем пропускания
ферментного раствора через колонку с крахмалом. Для избежа-
ния слеживания крахмала его смешивали с наполнителем —
фильтроперлитом — в соотношении 5:1. Сорбция бактериальной
Р-амилазы проводится при 2 °C и даже при значительном повы-
шении ионной силы элюирующего раствора не происходит осво-
бождение фермента. При 20°C фермент без изменения условий
элюируется с крахмала. Это явление дало основание предполо-
жить, что освобождение фермента происходит в результате взаи-
модействия р-амилазы с образующимся при этой температуре про-
дуктом реакции — мальтозой. Чем выше температура, тем быст-
рее протекает процесс. Освобождение р-амилазы от протеазы, ко-
торая сорбируется на самом ферменте, происходит при использо-
вании специфической сорбции — осаждении комплекса р,-амила-
за — гликоген этанолом. Характеристика процесса выделения
Р-амилазы представлена в табл. 2.13.
Необходимо отметить, что свойства микробных амилаз весьма
многообразны. Существуют множественные формы одного и того
177
Таблица 2.13
Стадии очистки 0-амилазы Общее ко- личество белка, мг 0-Амнлаз- ная актив- ность, ед. Удельная активность, ед./мг Степень очистки Выход, % Общая протеоли- тическая активность, ед. ПС
Фильтрат культураль- ной жидкости 2163,5 2250 1,04 1 100 60
Элюат с крахмала 26,6 1864,5 103 99 82,9 7,8
Обессоленный раствор после гидролиза гли- когена 13,5 1732,3 128,3 123,4 77 0
же фермента (изоформы), которые отличаются по целому ряду
показателей. Приведем пример сравнительной характеристики не-
скольких а-амилаз, полученных из различных источников, которые
приведены в табл. 2.14 (по данным Г. И. Квеситадзе и Ц. Ш. Два-
ли, 1981).
Таблица 2.14
а-Амнлазы Оптималь- ный pH Молекулярная масса Количество SH-rpynn Стабилизация каль- цием Изоэлектрическая точка, pH Энергия активации, кДж/М Наличие углёво диого фрагмента в ферменте
Кислотолабильная а-
амнлаза A. oryzae
Кислотостабильиая а-
амилаза A. niger
Бактериальная а-ами-
лаза В. subtilis
Термостабильиая а-
амнлаза В. stearother-
mophilus
4,6—4,8 51 700 1 Да 3,40 52,8 Нет
4,8—5,5 59 000 1 3,52 60,0 В
5,6—6,2 50 000 1 в 4,84 49,6 Одни фраг- мент
5,8—6,0 53000 1 в 4,67 64,4 Нет
Данные по амилолитическим ферментным препаратам и очи-
щенным амилазам широко представлены в литературе. Они каса-
ются самых разных вопросов: выбора продуцентов амилаз, соста-
ва питательных сред, особенностей культивирования, выделения и
очистки ферментов, изучения их свойств, структуры, ингибиторов
и активаторов, а также вопросов применения амилолитических
ферментных препаратов.
2.2. ПЕКТОЛИТИЧЕСКИЕ ПРЕПАРАТЫ
Пектолитические ферменты широко используются в различных отраслях
народного хозяйства. Процесс гидролиза пектиновых веществ имеет большое
значение для переработки плодов, игод и овощей. Использование пектолитических
178
ферментов позволяет резко повысить сокоотделение при производстве осветлен-
ных соков нз плодов и ягод, особенно из тех, которые не имеют собственных
пектолитических ферментов и содержат повышенные количества пектина. К таким
плодам можно отнести сливу, алычу, абрикосы, персики, груши и др. Исполь-
зование пектолитических ферментов позволяет иа 5—25 % повысить выход
сока с единицы перерабатываемого сырья, что дает очень высокий экономи-
ческий эффект. При изготовлении фруктово-ягодных напитков с мякотью с по-
мощью пектолитических ферментов можно сиять нежелательный желирующий
эффект, который ие позволяет получать коицеитрироваииые жидкие соки из-за
высокого содержания пектина. Пектолитические ферменты используютси в ви-
ноделии для увеличения выхода сока из сырья и иитеисивиости окраски.
Большое значение имеют пектолитические ферменты в льиоперерабатываю-
щей промышленности. Известно, что процесс выделения волокна в процессе
мочки лубоволокиистых культур связан с мацерацией лубяных пучков тканей
растений. Пучки волокон связаны паренхимой друг с другом. Клеящие свойства
паренхимы зависят от присутствия в ией пектиновых веществ. При гидролизе
этих веществ высвобождаются пучки волокон льна. Замена спонтанного способа
мочки льна иа ферментную обработку пектиназами перспективна и рентабельна.
Есть данные об успешном использовании пектолитических ферментов
в качестве компонентов кормов сельскохозяйственных животных и птицы, осо-
бенно, если в кормах есть свекловичный жом и другие виды растений, содер-
жащие повышенные количества пектиновых веществ. Есть данные об использо-
вании пектиназ, обладающих мацерирующим действием, в пищевой технологии
для размягчения тканей плодов и овощей, что резко повышает их усвояемость.
В медицинской промышленности эти ферменты используются для .обработки
лекарственных трав, при приготовлении различных видов злекарств и це-
лебных экстрактов. Пектиназы можи» использовать для снятия слизистого
покрытия кофейных бобов и т. д.
2.2.1. Источники пектолитических ферментов
Многие микроорганизмы образуют пектиназы, в том числе мик-
роскопические грибы, бактерии и некоторые виды дрожжей. Наи-
большей продуцирующей способностью обладают микроскопиче-
ские грибы, особенно различные виды рода Aspergillus: A. awa-
mori, A. foetidus, A. niger, A. terreus и др. Способность к биосин-
тезу пектиназ отмечается у представителей родов Penicillium,
Sclerotinia, Botrytis, Trichothecium, Fusarium и некоторых других.
Среди бактерий найдены активные продуценты пектиназ, относя-
щиеся к роду Clostridium, а также отмечается способность к об-
разованию пектиназ у некоторых бактерий, относящихся к видам
Bacillus polymyxa, В. felseneus, Klebsiella aerogenes, и некоторых
других. Отмечалось, что среди дрожжей культура Saccharomyces
fragilis образует пектолитические ферменты. Пектиназы содержат
многие растения, но они не являются промышленными источника-
ми получения ферментов.
2.2.2. Механизм действия и свойства пектиназ
Субстрат. Субстратом для пектиназ являются пектиновые ве-
щества — высокомолекулярные соединения, обладающие свойст-
вами лиофильных коллоидов. Пектиновые вещества подразделяют-
ся на несколько групп: протопектин — нерастворимое в воде
соединение сложного химического строения; пектиновая кис-
179
лота — полигалактуроновая кислота, в малой степени этерифи-
цированная остатками метанола; пектин — почти полностью эте-
рифицированная пектиновая кислота; пектовая кислота —
полигалактуроновая кислота; пектинаты — соли пектиновой
кислоты и пектаты — соли пектовой кислоты.
Пектиновые вещества представляют собой полисахариды, со-
стоящие из остатков D-галактуроновой кислоты, связанные
а-1,4-связью. Они могут быть метоксилированы по шестому угле-
родному атому. Предельная степень этерификации 16,2 %, обыч-
но в пектине она не превышает 14,9—15,2 %. Все пектиновые ве-
щества кроме протопектина растворимы в воде. Строение прото-
пектина точно не установлено, это водонерастворимый «материн-
ский» полиуронид, в состав которого входят пектиновые цепочки
и молекулы целлюлозы, ионы Са, Mg, остатки фосфорной, уксус-
ной кислот, сахара и т. д. В присутствии сахара, кислоты и под
действием поливалентных ионов металлов пектины образуют гель.
Молекулярная масса пектинов, выделенных из различных объек-
тов, изменяется в пределах от 20 000 до 200 000.
Все пектиназы условно можно разделить на две группы: гид-
ролазы и трансэлиминазы. К гидролазам относят пектинэстеразу
и полигалактуроназу.
Пектинэстераза (ПЭ). Пектилгидролаза пектинов (КФ 3.1.1.11)
представляет собой гидролазу эфиров карбоновых кислот. В зави-
симости от источника получения препарата пектинэстеразы отли-
чаются по оптимальному pH. Так, микробная ПЭ имеет оптималь-
ный pH от 4,5 до 5,5, а полученная из растений — 6,0—8,0. Ионы
Са2+ и Mg2+ активируют пектинэстеразы. Фермент омыляет слож-
ные эфирные связи в пектиновой кислоте и пектине и отщепляет
метиловый спирт. Установлено, что ПЭ отщепляет СНз-группу
только в том случае, когда в непосредственной близости к омы-
ляемой связи находится хотя бы одна СООН-группа. Механизм
действия ПЭ может быть представлен следующей схемой:
Я 1|ЛЭ II
СООСН. СООСН, СООСН, СООН СООСН, СООН соосн, соосн,
J о 4 J J J
___I I I I I I I I_______
'___________________________________________________________Z_3_4_5_5_1_в
Наибольшее сродство ПЭ проявляет к метильному остатку в
5-м положении (I), так как в положении 6 и 4 имеются свобод-
ные СООН-группы. Омыление эфирной связи в положениях 3 н
7 происходит во вторую очередь (II), так как способность ПЭ к
разрыву этих эфирных связей меньше, чем к той же связи в по-
ложении 5. Таким образом, отщепление СН3-групп происходит по-
следовательно, начиная от свободной СООН-группы. В результа-
те действия пектинэстеразы накапливаются частично или полно-
стью деметоксилированная полигалактуроновая кислота и метило-
вый спирт.
180
Полигалактуроназа (ПГ). Полигалактуронидгликоногидролаза
(КФ 3.2.1.15) осуществляет гидролитическое расщепление а-1,4-
гликозидных связей в цепи пектиновых веществ. В растениях ПГ
встречается редко и в небольших количествах. ПГ продуцируется
микроорганизмами, особенно грибами и бактериями. ПГ много-
компонентна и проявляет большую специфичность к субстрату.
По субстратной специфичности ферментов к разрушаемым пекти-
нам различают четыре типа полигалактуроназ: 1) полиметил-
галактуроназы (ПМГ) — ферменты, действующие на метол-
ксилированную полигалактуроновую кислоту (пектин). ПМГ в
свою очередь разделены на две подгруппы: эндополиметилгалак-
туроназа I типа (эндо-ПМГ-I) и экзополиметилгалактуроиаза
III типа (экзо-ПМГ-Ш); 2) полигалактроназы (ПГ) — фер-
менты, действующие на пектовую или пектиновую кислоту. Онн
также разделены на две подгруппы: эндополигалактуроназа I ти-
па (эндо-ПГ-П) и экзополигалактуроназа IV типа (экзо-ПГ-IV).
Рассмотрим особенности действия полигалактуроназ на суб-
страт. Эндо-ПМГ-I является разжижающим ферментом; он гидро-
лизует нативный высокоэтерифицировапный пектин тем быстрее и
эффективнее, чем выше степень его этерификации. Присутствие
пектинэстеразы в растворе снижает активность эндо-ПМГ-I. Этот
тип фермента широко распространен среди грибов, особенно у ви-
дов A. niger, Botrytis cinerea, Neurospora crassa, A. awamori и др.
Схему действия эндо-ПМГ-I можно представить в таком виде:
соон соосн, соосн, соон соосн, соосн, соосн, соосн,
d <5 J J J 3
__J____1. I________J____I______I_____1 .1____
7 Z м J ♦ 5 6 7-8
---------ЗиЮ - ПИГ-!---------
Экзо-ПМГ-III является осахаривающим ферментом концевого
действия, отщепляющим по одному остатку галактуроновой кисло-
ты от пектиновой кислоты или пектина. Фермент проявляет срод-
ство к метоксилированному остатку галактуроновой кислоты, гид-
ролизуя концевую а-1,4-связь между двумя остатками галактуро-
новых кислот, которые имеют СООСН3-группу:
СООСН, СООСН, СООСН, соон соон соосн, СООСН,
соосн,
।
1
t I_________!_______I_________I >
"I J> Ь 5S 1 | 8
---------------------—Зим - ПМГ-111--------------1
III II /
Эндо-ПГ-П — разжижающая полигалактуроназа, которая гид-
ролизует пектиновую или пектовую кислоту. Она действует толь-
ко при наличии в пектиновом веществе свободных СООН-групп.
Место разрыва полигалактуроновой цепи эндо-ПГ-П определяет
ся .наличие свободных СООН-групп. Воздействие эндо-ПГ-П на
субстрат значительно возрастает при наличии в реакционной сре
181
де пектинэстеразы. Схема механизма действия фермента следу-
ющая:
соосн, соон соон соосн3 соон соон соосн3 соон соон
j_____। ।____1______। I___।_____।___ 1-----
I г Xj ♦5 - в 7 в з
ЗнЗо-ПГ-П
Фермент синтезируется грибами и бактериями.
Экзо-ПГ-IV проявляет сродство к концевой гликозидной связи
в молекуле пектиновой или пектовой кислоты, вблизи которой нет
СНз-группы. Для образования фермент-субстратного комплекса
необходимо наличие свободных СООН-групп вблизи разрываемой
связи:
COOCHj СООН СООСН3 соон соон соосн3 соон соон соон
-----------г1-----1--------i--.--1------1--------i__ I 1____
7 2 J ♦ i 5 S 7 , 3 3 '
IIP-------зюо-nr-nr----------- .
II I
Пектиитраисэлимииазы. Эти ферменты осуществляют негид-
ролитическое расщепление пектиновых веществ с образованием
двойной связи в галактуроновом остатке между 4-м и 5-м углерод-
ным атомом:
Н он н3со—с=и
При разрыве а-1,4-связи пектинтрансэлиминазой водород от
5-го углеродного атома во втором остатке галактуроновой кисло-
ты переносится к 1-му углеродному атому первого остатка галак-
туроновой кислоты. Реакция идет в нейтральной или слабощелоч-
ной среде.
Продукты негидролитического расщепления пектинтрансэлимн-
назами пектиновых веществ обладают сильной ультрафиолетовой
182
адсорбцией при длине волны 235 нм, а также дают цветную ре-
акцию с тиобарбитуровой кислотой с максимумом поглощения
при 547 нм.
Пектинтрансэлиминазы действуют как на пектин, так и на пек-
товую кислоту. Предполагают, что по субстратной специфичности
они могут быть разделены на две группы, а по механизму разры-
ва а-1,4-связи — на экзо- и эндоферменты, как и полигалактуро-
назы.
В Номенклатуру ферментов (1979 г.) вошли два фермента этой
группы: 1) экзополигалактуронатлиаза — поли(1,4-а-
£)-галактуронид)экзолиаза (КФ 4.2.2.Э). Этот фермент элиминиру-
ет Д-4,5-Ь-галактуронозо-П-галактуронатные остатки с редуциру-
ющего конца деэстерифицированного пектина; 2) пектинлиа-
за — поли (метоксигалактуронид) лиаза (КФ 4.2.2.10). Этот фер-
мент деполимеризует пектин путем элиминирования остатков
6-метил-Д-4,5-П-галактуроната. Фермент не действует на деэсте-
рифицированный пектин. Иными словами, у первого фермента про-
является сродство к пектовой или пектиновой кислоте с малой сте-
пенью метоксилирования, а второй фермент быстрее деполимери-
зует высокометоксилированный пектин. Следует отметить, что эти
ферменты еще недостаточно изучены, и по ним нельзя дать усто-
явшиеся сведения.
Протопектииаза. Считается, что протопектиназа — это фермент,
действующий на протопектин. Однако вопрос о существовании
протопектииазы до последнего времени остается спорным. Прото-
пектин — сложное вещество, состоящее из различных фрагментов,
поэтому свести действие протопектиназы только к разрыву
а-1,4-гликозидиых связей, как это делают некоторые исследовате-
ли, значит отождествлять ее действие с полигалактуроназой и ста-
вить под сомнение существование протопектиназы как самостоя-
тельного фермента.
Однако нельзя отрицать, что при воздействии комплекса пек-
толитических ферментов на срединные пластинки растительной
ткани резко снижается вязкость раствора, уменьшается молеку-
лярная масса пектина без нарастания отщепленных редуцирую-
щих групп. С пектиновыми веществами происходят какие-то пре-
вращения, существенно отличающиеся от тех, которые возникают
при воздействии известных пектолитических ферментов.
2.2.3. Получение пектолитических препаратов
В промышленном масштабе пектолитические препараты полу-
чают в основном из A. foetidus и A. awamori при поверхностном
способе культивирования н из A. awamori, A. niger и Cl. pectino-
fermentans при глубинном.
Получение препаратов пектиназ нз поверхностных культур. При
поверхностном способе культивирования на продуцентов пектиназ
наилучшее стимулирующее воздействие оказывает введение в сре-
ду свекловичного или подсолнечного пектина. Экономически выгод-
183
нее введение в среду до 66—70 % свекловичного жома, содержа-
щего до 4—4,5 % водорастворимого пектина и 16—18% прото-
пектина. Остальную часть среды (35—30%) составляют пшенич-
ные отруби (см. рис. 1.4).
Л. Н. Мушниковой и Л. С. Лосяковой (1972) установлено, что
такая среда содержит достаточно пектиновых веществ и других
источников углерода, но бедна азотистыми веществами. Обога-
щение среды азотом производят, добавляя около 1 %
(NH4)2SO4 либо ЫН4С1 или около 2 % (NH4)2HPO4. Обогащение
среды аммиачным азотом и установление необходимого соотноше-
ния С: N позволяет повысить активность с 1260 до 1900—
2100 ед./г сухой поверхностной культуры A. awamori 16.
Влажность среды должна быть в пределах 55—60%, темпера-
тура культивирования — 30°C в течение первых 40 ч с последую-
щим понижением до 24 °C. Общая длительность культивирования
48—52 ч.
При засеве среды мицелиальной массой A. awamori 16 культу-
ра развивается медленно, поэтому более целесообразно использо-
вать споровый (конидиальный) посевной материал в количестве
0,05 % к массе сухой производственной среды, внося его в виде
гомогенизированной суспензии. Очищенные пектолитические пре-
параты получают из водных экстрактов путем осаждения этано-
лом (73,5—75 % об.), нзопропанолом (55—57 % об.) или высали-
ванием сульфатом аммония (в количестве 0,8 от полного насы-
щения). При осажденнн этанолом в препарат переходит 89—90 %
ферментов, а при высаливании — всего 75—76%. Пектиназы чув-
ствительны к температуре, поэтому она не должна превышать 2—
5°C при максимальном контакте с растворителем. Характеристика
препаратов, полученных из культуры A. awamori 16, представлена
в табл. 2.15.
Таблица 2.15
Показатель Осадитель
Этиловый спирт Изопропило- вый спирт Сульфат аммония
Выход препарата, % Пектолитическая активность 3,8 1,9 2,7
ед. ПкА/г сухого вещества культуры 22500 437.80 25920
ед. ПкА/мг белка 351,6 478,5 328,0
Содержание ферментов в препарате, % от исходного 89,2 85,9 75,0
Содержание белка в препарате, % 39,9 *57,2 49,2
Получаемые методом осаждения пектолитические препараты
обычно содержат комплекс ферментов, обладающих различными
оптимальными pH и температурами. Так, для гриба A. awamori 16
максимальная активность проявляется при pH: по экзо-ПГ — 3,5,
184
по эндо-ПМГ — 4,2, а по ПЭ — только при 5,0. Оптимальные тем-
пературы отличаются несколько меньше и лежат в интервале от
45 до 52 °C. Следует заметить, что поверхностная культура для
получения очищенных препаратов используется редко, чаще она
используется непосредственно или из нее получают препараты с
индексом ПЗх.
Получение препаратов из глубинных аэробных культур. Для
глубинного культивирования чаще всего используются микроор-
ганизмы, относящиеся к роду Aspergillus, особенно A. niger, A. al-
liacens, A. awamori и A. foetidus.
В нашей стране первым продуцентом пектолитических фермен-
тов при глубинном способе культивирования был штамм A. ni-
ger П, была изучена его физиология и разработана технология
получения на его основе препаратов пектолитических ферментов
различной степени очистки. Но в конце 70-х и начале 80-х годов
было обнаружено, что микроорганизм образует афлатоксины, и
потому использование его в качестве продуцента было запреще-
но. Далее проводились работы с культурами A. awamori штам-
мов 16, 44-26 и др., а также с A. foetidus 45, 7 и др.
Источники углерода. У большинства продуцентов био-
синтез пектолитических ферментов носит индуцибельный характер
и зависит от уровня в среде пектиновых веществ, степени их по-
лимеризации и наличия других источников легкометаболизируемо-
го углерода. Однако есть указания и на то, что ряд микроорганиз-
мов образует некоторые ферменты пектиназного комплекса и при
отсутствии в среде индуктора. Например, A. terreus образует пек-
тинэстеразу иа любых средах, ряд штаммов В. subtilis конститу-
тивно синтезируют полигалактуронатлиазу, но такие данные в ли-
тературе встречаются редко.
Комплекс ферментов, синтезируемый микробами, различен, он
зависит от вида продуцента, состава среды и условий культиви-
рования. Например, по данным К. А. Калунянца и сотр., при куль-
тивировании штаммов A. awamori 16 и A. foetidus 7 использова-
ние экстракта из солодовых ростков (10%) и кукурузного экст-
ракта (0,5—1,0%) позволяет увеличить общую пектолитическую
активность культуральной жидкости на 50—70 % по сравнению с
полученной на среде только с минеральным источником азота.
Подробный анализ препаратов из культур A. awamori 16 и A. foe-
tidus 7, выращенных на близких по составу средах, показал, что
комплексы ферментов этих препаратов отличаются друг от друга
как по составу, так и по соотношению отдельных компонентов.
Очень важен также состав пектиновых веществ, вносимых в сре-
ду, и даже степень их метоксилирования. Так, при культивирова-
нии гриба Rhizopus arrhizus на свекловичном пектине различной
степени метоксилирования биосинтез полигалактуроназ уменьшал-
ся с увеличением степени метоксилирования. Наивысший синтез
отмечался на пектовой кислоте. Интересно отметить, что на этом
же штамме при использовании яблочного пектина влияние степе-
ни метоксилирования было обратным.
185
Влияние свекловичного пек-
пектинолитических
foetidus 7 (по
Рис. 2.13. Влияние яблочного (1),
свекловичного (2) пектинов и
пектовой кислоты (3) на био-
синтез пектинэстеразы грибом
A. foetidus 7 (по данным Ме-
туали, 1980)
Рис.
тина
ферментов грибом А.
данным Метуали, 1980):
/ — пектинэстераза: 2 — пектинтрансэлими-
наза; 3 — экзополнгактуроназа; 4 — эндопо-
лигалакту роназа
2.12.
на биосинтез
Различный эффект воздействия пектиновых веществ в среде на
биосинтез комплекса пектиназ можно продемонстрировать на при-
мере A. foetidus 7. Из рис. 2.12 видно, что присутствие в среде
свекловичного пектина в некоторой степени подавляет образова-
ние пектинэстеразы, ио стимулирует биосинтез пектинтрансэлими-
назы при содержании его 0,2 %, а полигалактуроиаз — только при
увеличении его концентрации в 5 раз (до 1—12%).
Если концентрация свекловичного пектина мало влияет на био-
синтез пектинэстеразы, то степень метоксилирования субстрата и
его природа в этом случае имеют решающее значение (рис. 2.13,
табл. 2.16).
Из рис. 2.13 видно, что только яблочный пектин в концентра-
ции 0,9—1,1 % стимулирует образование культурой пектинэстера-
зы. Несмотря на некоторые отклонения и особенности, подавляю-
Таблица 2.16
Содержание, %
Показатели в яблочном пектине в свеклович* ном пектине в пектиновой кислоте
Свободные карбоксильные группы 19,04 22,05 23,29
Метокснлированные карбоксильные группы 9,75 3,36 1,25
Общее количество карбоксильных групп 24,79 25,31 25,45
Степень метоксилирования пектина 81,05 24,23 5,92
Метоксильные группы 6,71 2.25 0.86
186
щее число авторов едины в мнении, что для успешного образова-
ния пектолитических ферментов в составе среды необходимо при-
сутствие тех или иных пектиновых веществ или продуктов их ча-
стичного гидролиза. Они могут быть введены в виде различных
отваров пектинсодержащих растительных масс или же добавлены
в среду непосредственно. Источниками пектиновых веществ могут
быть, как и при поверхностном способе культивирования, свекло-
вичный жом, пектин различного происхождения, яблочные выжим-
ки, выжимки плодов, винограда, различных овощей, стебли хлоп-
чатника и другие отходы переработки растительного сы-
рья.
Кроме пектиновых веществ в составе среды, особенно на пер-
вой стадии роста культуры, желательно наличие в среде неболь-
шого количества легкометаболизируемых углеводов, вносимых,
например, с солодовыми ростками или гидролизатами пектиновых
веществ. Они необходимы для того, чтобы начался активный рост
культуры, и только после утилизации их в первые 10—20 ч начи-
нается активный синтез пектинолитических ферментов (рис. 2.14).
В то же время глюкоза вызывает почти полное подавление
синтеза фермента по механизму катаболитной репрессии чна фоне
интенсивного роста биомассы продуцента.
Источники азота. В питательную среду азот может быть
внесен в виде органических и неорганических соединений. Данные
исследований свидетельствуют о том, что большинство продуцен-
тов более продуктивно по пектиназам в присутствии солей аммо-
Рис. 2.14. Динамика накопления в культуральной жидкости A. foetidus 7
пектолитических ферментов, биомассы и изменения pH в процессе роста
культуры на средах (по данным Г. Б. Бравовой и др., 1981):
а—с добавлением свекловичного жома; б — с добавлением гидролизата свекло
вичного жома
187
ния. Пептон, мочевина, гидролизат казеина снижали синтез пек-
тиназ, исключением являлся кукурузный экстракт, экстракт из со-
лодовых ростков и дрожжевой экстракт. В составы сред чаще все-
го вводят соли (NH4)2SO4 или (NH4)2HPO4 в количестве 0,2 % по
азоту.
Фосфор. В составе среды фосфор необходим для очень мно-
гих процессов обмена веществ у микроорганизмов, в том числе
для биосинтеза ферментов. Многие исследователи отмечают, что
повышенное содержание в среде фосфора (от 0,2 до 0,4 %) спо-
собствует возрастанию синтеза пектолитических ферментов и их
секреции в культуральную жидкость в условиях глубинного вы-
ращивания. Источником фосфора обычно используют
(NH4)2HPO4 или КН2РО4, иногда рекомендуется смесь этих со-
лей, так как это способствует более интенсивному синтезу пек-
тиназ.
Минеральный состав среды. Он также оказывает
влияние на биосинтез пектолитических ферментов. Если в составе
среды есть природные источники пектина, такие, как свеклович-
ный жом, выжимки плодов и овощей, экстракты из дрожжей, со-
лодовых ростков и т. д., то такие среды практически содержат
все необходимые микроорганизму микроэлементы. Некоторый не-
достаток испытывают микроорганизмы в ионах марганца, магния
и особенно кобальта, внесение которых даже в небольших коли-
чествах повышает биосинтетическую способность грибных проду-
центов. Ионы цинка, железа, меди тормозят рост большинства
продуцентов и образование ими пектиназ.
Витамины. Многие продуценты пектиназ чувствительны к
присутствию в составе среды витаминов. Для многих продуцентов
необходимо наличие биотина, тиамина, никотинамида, которые
способствуют повышению синтеза пектиназ на 40—50 %.
Условия культивирования. По всем основным факто-
рам для каждого продуцента изучаются его физиологические и
биосинтетические особенности и конструируется оптимальная пи-
тательная среда, желательно с использованием математических
методов планирования экспериментов с учетом межфакторного
взаимодействия. Не менее важен выбор оптимальных условий
культивирования продуцента, а именно: вид и дозировка посевно-
го материала, pH среды, температура и длительность культивиро-
вания, степень аэрирования и перемешивания культуры и некото-
рые другие показатели.
В качестве посевного материала можно использовать поверхно-
стную культуру продуцента, споровый материал или молодую глу-
бинную культуру. В нашей стране в качестве посевного материа-
ла чаще всего используют заспоровавшуюся поверхностную куль-
туру либо ту же культуру, но активированную путем подращивания
спор глубинным способом. Суть такой обработки заключается в
следующем. Поверхностная посевная культура выращивается в
течение 7—9 сут до обильного спороношения на твердой питатель-
ной среде. Такая культура содержит от 4,0-108 до 7• 108 спор на
188
1 г культуры. Готовая посевная культура в течение 12 ч активи-
руется в солевом растворе, содержащем ионы кобальта и марган-
ца, и используется в количестве 0,2—0,3 % для засева производ-
ственной среды. Активированный таким образом посевной мате-
риал позволяет на 10—20 % сократить время выращивания куль-
туры и на 20—30 % повысить биосинтетическую активность проду-
цента по пектиназе.
Очень большое значение имеют начальные pH среды и набор
солей, который входит в состав среды, т. е. те условия, которые
определяют изменение активной кислотности среды в процессе
роста культуры. Используемые в промышленности микроорганиз-
мы, как правило, относятся к аспергилловым грибам, которые хо-
рошо растут при низких значениях pH. При исследовании влияния
начальной активной кислотности среды на биосинтез грибом
A. foetidus пектолитических ферментов было обнаружено, что этот
фактор имеет существенное значение (рис. 2.15). Из рисунка вид-
но, что pH среды влияет на характер накопления ферментов
(рис. 2.15, а), иа величину максимальной активности, достигае-
мой на этой среде, а главное — на длительность ферментации
(рис. 2.15,6). Наиболее высокие результаты были получены для
среды с исходным значением pH 3,5—4,0.-Подобные результаты
наблюдались и для таких продуцентов, как A. niger, A. awamori
и др.
В процессе роста культуры происходит снижение pH культу-
ральной жидкости до значений 2,5—3,0, что обычно соответствует
быстрому потреблению из среды пектина и интенсивному накоп-
лению в среде пектолитических ферментов (рис. 2.16).
Температура выращивания заметно влияет на синтез пектоли-
ти4еских ферментов. Основная масса продуцентов относится к ме-
зофильным микроорганизмам, оптимум роста для которых нахо-
дится при температуре 28—30°C. Изменяя температурный режим,
Рнс. 2.15. Биосинтез пектолитических ферментов культурой грнба A. foetidus:
а — динамика накопления пектолитических ферментов при различных исходных pH среды;
б — диаграмма зависимости величины максимумов активности пектиназ от PH среды и
времени выхода культуры в фазу наибольшего накопления в среде пектолитических фер-
ментов
189
Рнс. 2.16. Изменение pH, содержания редуцирую-
щих веществ (РВ), аминного азота (—NHj) и
пектина (П) в процессе роста культуры гриба
A. foetidus 45 (по данным Н. М. Павловой, 1980)
можно интенсифицировать биосинтез пектиназ. На стадии роста
культуры (в первые 20—24 ч) можно повысить температуру на
2—4 °C. В этих условиях активируются все ферментативные си-
стемы, несколько убыстряется рост и накапливается больше био-
массы. Далее температуру необходимо понизить до оптимальной
(30 °C) с тем, чтобы не вызвать преждевременного автолиза куль-
туры, и затем для продления биосинтетических процессов темпе-
ратуру понизить еще на 2—3°С. Такой дифференцированный ре-
Длительностъ культивирования, ч
Рнс. 2.17. Влияние температуры иа
накопление пектолитических фермен-
тов грибом A. foetidus в процессе
роста:
1 — 28 °C; 2 — 35 °C; 3 — переменный тем-
пературный режим (периоды измене-
ния температуры указаны стрелка-
ми)
жим многократно на самых раз-
ных культурах давал положи-
тельный эффект. Пример такого
технологического приема приве-
ден на рис. 2.17.
Выделение фермен-
тов. Для производства очищен-
ных ферментных препаратов пер-
воначально от культуры отделя-
ют всю нерастворимую часть, а
фильтрат либо сразу же после
охлаждения поступает на осаж-
дение органическими раствори-
телями, либо предварительно
концентрируется методом ультра-
фильтрации или вакуум-выпари-
вания, корректируется pH фер-
ментного раствора, и произво-
дится осаждение растворителя-
ми или нейтральными солями.
Концентрирование ферментных
190
растворов методом ультрафильтрации проходит обычно успешно.
Потеря активности не превышает 6—8 %. Наилучшие результаты
получаются при использовании мембран типа УАМ «Владипор»
с размерами пор 54-10—10 м. Наибольшая скорость процесса со
степенью концентрирования 10 установлена при избыточном дав-
лении 0,4 МПа.
При сушке ультраконцентратов, содержащих пектолитические
ферменты, методом распыления отмечается, что они чувствитель-
ны к температуре, и потому наблюдается существенная потеря ак-
тивности. Для снижения потерь рекомендуется перед сушкой рас-
пылением с наполнителем стабилизировать раствор сернокислым
алюминием, что позволяет при режиме сушки с температурой воз-
духа 140—160 °C на входе и 70—80 °C на выходе получать препа-
раты с потерей активности, не превышающей 5—10%.
Процесс осаждения пектолитических ферментов из культураль-
ной жидкости или ее концентратов зависит от pH среды и при-
роды и концентрации растворителя. Для производства пектолити-
ческих препаратов с индексом ГЮх обычно используется этило-
вый спирт. Влияние вышеприведенных факторов можно привести
на примере выделения ферментов из культуральной жидкости
A. foetidus 7 (табл. 2.17, 2.18).
Таблица 2.17
pH культуральной жидкости
Показатель 3,2 3.5 4,0 4,5 5,0
ПкА ед./мл 0,177 0,151 0,160 0,150 0,153
ед./г осадка* — 16,63 12,06 11,13 10,82
Масса осадка, % — 0,37 0,53 0,54 0,57
Остаточная активность фермен- 100 85,31 90,40 84,75 86,44
тов, % от исходной в осадке • Осаждение этанолом в соотношении 1:3,5.
Таблица 2.18
Отношение объема культуральной жидкост и к объему
этилового спирта (при pH 4,0)
Показатель 1:0 1:2.5 1:3 1:3.5 1:4
Концентрация этилового спирта в смеси, % ПкА 0 71,4 75 77,7 80
ед./мл 0,186 0,169 0,163 0,161 0,162
ед./г осадка 16,37 15.83 11,40 11,25
Остаточная активность фермен- тов, % от исходной в осадке 100 98,86 87,63 86,56 87,10
191
Е
§ 100
Е ‘л
о
во
а Е
§ Е
Е CJ
х Э-40
Q> tj
а |
it20
0 100 120 W )И) ,8° 200 220 2W
50 60 ?0 80 90 t00 НО 120 /30
Температура сушильного агента, "С
[на Входе )
\на Выходе/
Рис. 2.18. Влияние температуры суш-
ки пектолитического препарата на
активность сухих готовых препара-
тов в присутствии хлористого натрия
(наполнитель) и стабилизаторов:
/ —AMSO.),; 2 —MgCls; 3 — без стабн-
лмзатора (контроль)
Пектолитические препараты
Е
Сухие ферментные препараты
пектиназ из спиртосажденных
осадков рационально получать
путем последующей сушки суб-
лимацией или распылением. Од-
нако при сушке распылением на-
блюдается значительная инакти-
вация ферментов (на 20—40 %),
что недопустимо. Отмечается,
что они менее стабильны после
осаждения спиртом, чем после
концентрирования ультрафильт-
рацией. Для предотвращения
инактивации осадок перед суш-
кой пектиназ растворяют в ми-
нимальном количестве воды
(1:5), добавляют наполнитель
(обычно хлористый натрий) и
стабилизатор (эффективнее дру-
гих проявляет себя сернокислый
алюминий). Затем такой раствор
высушивают методом распыле-
ния (рис. 2.18). При температур-
ном режиме сушильного агента
140 °C на входе и 70 °C на вы-
ходе потери пектолитических
ферментов не превышают 4—6 %.
можно получать и путем высали-
вания сульфатом аммония. Однако такие пектолитические препа-
раты содержат 50—70 % (NH4)2SO4. Если по условиям примене-
ния препарат не должен содержать сульфата аммония, то высо-
ленный препарат растворяют, диализуют против воды или буфера
и раствор, свободный от соли, лиофильио высушивают. Методом
высаливания можно провести частичное фракционирование и очи-
стку ферментов. При насыщении (NH4)2SO4, равном 0,5, в осадок
выпадает малоактивная по пектиназе фракция с выходом 0,25 %
по сухой массе. Дальнейшее насыщение (NH4)2SO4 До 1,0 приво-
дит к образованию осадка с выходом 0,11 %, обладающего высо-
кой активностью всего пектолитического комплекса (ПкА, ПЭ,
ПМГ, ПГ). Особенно высока может быть активность ПкА — до
24 025 ед./г препарата. При простом высаливании, без фракциони-
рования, с насыщением 1 получают препараты с активностью ПкА
около 8000 ед./г и выходом около 0,4%.
При обессоливании методом диализа против воды и гель-филь-
трации через сефадекс G-25 можно получать высокоочищениые
препараты пектиназ с активностью до 30 000 ед. ПкА/г.
Получение препаратов из глубинных анаэробных культур. Про-
дуцентами пектатлиазных ферментов, проявляющих активность в
щелочной зоне pH, в основном являются бактерии. Это некоторые
192
виды родов Bacillus, Clostridium, Erwinia, Pseudomonas, Aeroino-
nas и некоторые другие. Многие из этих организмов являются фи-
топатогенными, вызывающими поражение растительной ткани, ее
мацерацию. Большинство их является строгими или факультатив-
ными анаэробами. Использование анаэробных микроорганизмов в
качестве продуцентов ферментов исключает энергетические затра-
ты на аэрирование и упрощает аппаратурное оформление процес-
са (из ферментатора удаляются устройства для подачи воздуха и
перемешивания), практически устраняет инфицирование, вызывае-
мое чаще всего недостаточной стерильностью подаваемого в фер-
ментатор воздуха, и, наконец, позволяет проводить культивиро-
вание в больших емкостях с высоким слоем питательной среды.
В настоящее время при соответствующей селекции перспектив-
ные продуценты для промышленного использования могут быть
выделены среди следующих анаэробных видов бактерий: Clostri-
dium felsineum, Cl. pectinofermentans, Cl. multifermentans, Cl. by-
tyricum и др. Весьма интересны в этом отношении представители
других родов — Bacillus polymyxa, В. subtilis, Flavobacterium рес-
tinovorum, Pseudomonas marginalis, Ps. fluorescens. Внеклеточные
и внутриклеточные ферменты пектатлиазиого комплекса образуют
микроорганизмы, относящиеся к роду Erwinia, такие, как Е. саго-
tovora, Е. chrysanthemi, Е. aroideae. Биосинтез пектатлиазных фер-
ментов достаточно широко отмечается и у представителей мик-
роскопических грибов, но уровень этих ферментов в общем ком-
плексе пектиназ низок, так как грибы в основном являются про-
дуцентами пектиназ, обладающих гидролитическим действием.
В технологическом плане представляют интерес микроорганиз-
мы, которые можно выращивать в анаэробных условиях и кото-
рые синтезируют комплекс ферментов, обладающий мацерирую-
щим действием по отношению к растительным материалам. Прак-
тический интерес представляют некоторые виды, относящиеся к ро-
дам Clostridium и Bacillus.
В нашей стране проводятся большие исследования в этом на-
правлении под руководством Г. Б. Бравовой. Интересные резуль-
таты были получены при промышленном использовании Clostridi-
um pectinofermentans 15. Этот микроорганизм обладает способ-
ностью синтезировать ферменты с высоким мацерирующим дейст-
вием, способные к гидролитическому (при pH 4,0) и негидролити-
ческому (при pH 8,0) расщеплению а-1,4-связи в пектиновых ве-
ществах, т. е. образующие в процессе жизнедеятельности фермен-
ты полигалактуроназного и пектинтрансэлиминазного комплекса.
Питательная среда. При конструировании оптимальной
питательной среды для Cl. pectinofermentans 15 изучалось влия-
ние источника азота на биосинтез ферментов. Рассматривались как
органические, так и неорганические источники. Азотсодержащие
соли вносились в состав среды в количествах от 0,02 до 0,4 % по
азоту. В присутствии в среде 0,2 % (NH4)2HPO4 наивысшую про-
дуктивность культура проявляет как по полигалактуроназной, так
и по пектатлиазной активности. Органические источники азота,
7 Зак. 232
193
такие, как дрожжевой автолизат, кукурузный экстракт солодовых
ростков, мочевина в 1,5—2 раза менее эффективны по сравнению
с (NH4)2HPO4. Но они (за исключением мочевины) при совмест-
ном употреблении с (МН4)гНРО4 стимулируют рост биомассы и
биосинтеза ферментов. Стимулирующий эффект на синтез пектат-
лиазиых ферментов оказывают такие аминокислоты, как гисти-
дин, валин и аспарагиновая кислота.
В качестве источника углерода и индуктора биосинтеза пекто-
литических ферментов используются пектиновые вещества, вводи-
мые со свекловичным жомом, льняной мукой или картофельной
мезгой. В отличие, от сред для аэробных продуцентов положитель-
ный эффект дает введение в качестве источника углерода не толь-
ко пектиновых веществ, но и глюкозы. Введение сахарозы менее
эффективно, и можно высказать предположение, что синтез этих
ферментов не всегда подвержен катаболитной репрессии или же
что большое стимулирующее влияние редуцирующих сахаров свя-
зано с тем, что они снижают окислительно-восстановительный по-
тенциал среды и сокращают длительность лаг-фазы развития ана-
эробного микроорганизма. Пока этот вопрос остается открытым.
По мнению многих авторов, стимуляторами образования фермен-
тов, расщепляющих пектиновые вещества, могут быть галактуро-
новая кислота, олигоурониды, пектиновые вещества и продукты
их частичного гидролиза, а также некий неидентифицированный
белковый фактор, входящий в состав сырой картофельной ткани
(по данным Г. Б. Бравовой, М. В. Самойловой, 1981).
В подтверждение конститутивной природы пектатлизных фер-
ментов публикуется сравнительно много данных (В. М. Фогарти
и К. Т. Кейли, 1983, и др.). На культурах Cytophaga johnsonii,
Е. carotovora и Aeromonas liquefaciens показано, что пектатлиа-
зы являются конститутивными ферментами, но уровень их биосин-
теза регулируется катаболитной репрессией. Это предположение
позволило сделать заключение, что дифференциальная скорость
синтеза фермента тем выше, чем меньше источников углерода и
его метаболитов в среде. Это предположение было доказано на
культуре A. liquefaciens, которую выращивали в протоке на сре-
де с резкой лимитацией по углероду. В результате дифференци-
альная скорость синтеза пектатлиазы была повышена в 500 раз по
сравнению с опытами на средах с избытком углерода. Для синте-
за ферментов, обладающих пектатлназной активностью, подавля-
ющему количеству продуцентов необходимо присутствие в среде
пектиновых веществ, а лучше их продуктов распада под действи-
ем лиазных ферментов. Если же вводятся гидролизаты пектино-
вых веществ, полученные кислотным или ферментативным путем
с помощью гидролитических ферментов, то биосинтез пектатлиаз-
ных ферментов тормозится и стимулируется синтез полигалактуро-
наз.
Для продуцента Cl. pectinofermentans 15 подобрана питатель-
ная среда, обеспечивающая синтез всего комплекса ферментов, вы-
зывающих расщепление пектиновых веществ, следующего соста-
194
ва (в %): подработан-
ный свекловичный жом —
2; (NH4)2HPO4 — 0,25;
КН2РО4 —0,1; кукурузный
экстракт — 0,5; мел для
обеспечения заданного зна-
чения pH среды.
Как показали исследова-
ния (рис. 2.19), Cl. pectino-
lermentans 15 интенсивно
синтезирует ферменты в ло-
гарифмической фазе роста,
практически синхронно с на-
коплением биомассы (рис.
2.19). Максимальное накоп-
ление ферментов соответст-
вует стационарной фазе ро-
ста и наступает через 55—
60 ч. Исходный посевной
материал готовят в виде
лшо/м
рн
If
ff
0
6
5
4
3
2
-0?-
-Ц8
-0,7
-OJS-
>-Ц5
' -Ц4
1-03
>-0,2
1-01
Stf-
E 19*-
1 If-
1f-
№-
й,4
41
4?
V
V
zo-t
1,5
1fl
45’
0 0 12 24 36 48 SO 12 84 36 108 0 0
Длительности культиЗиробания, i
? *8
te S'
0J5
Рис. 2.19. Накопление биомассы н фермен-
тов в культуральной жидкости Cl. pecti-
nofermentans 15 (по данным Г. Б. Браво-
вой, 1973):
/ — биомасса; 2— пектинэстераза (ПЭ); 3 —
пектинтрансэлиминаза (ПТЭ); 4 — полигалак-
туроиаза (ПГ); 5 — pH культуральной жид-
кости
- 9
- 8
о
спор продуцента и при засе-
ве производственной среды вносят спороносящую культуру в коли-
честве 4 % по объему.
Условия культивирования. Помимо состава среды
на биосинтез пектиназ оказывают существенное влияние pH пи-
тательной среды и температура культивирования (рис. 2.20). Как
видно нз рис. 2.20, а, биосинтез отдельных ферментов комплекса
существенно зависит от pH среды. Подщелачивание среды свыше
pH 7,2—7,5 приводит к подавлению биосинтеза ПГ и ПЭ и спо-
собствует образованию внеклеточных пектатлиазиых ферментов.
Иными словами, pH среды является действенным регуляторным
фактором биосинтеза пектиназ культурой Cl. pectinofermentans 15.
Температура культивирования мало влияет на уровень накопле-
ния пектиназ, но существенно сдвигает в ту или другую сторону
максимум накопления ферментов (рис. 2.20,6). Поэтому в зависи-
мости от поставленной задачи температура изменялась от 25 до
37 “С.
Выделение фермента. Из фильтрата культуральной
жидкости можно получать методом распыления препарат пекто-
клостридии ГЗх и осаждением пектоклостридин ГЮх. Характери-
стика этих Препаратов приведена в табл. 2.19.
Сушку распылением проводили при мягком режиме (темпера-
тура теплоносителя на входе 120—125°С и иа выходе 55—60°С).
При осаждении органическими растворителями pH обрабатывае-
мого раствора 6,5—6,8 при осаждении 2—2,5 объемами ацетона
активность ферментов в осадках сохранялась на 93—95 % от ис-
ходной. При высаливании сульфатом аммония можно достичь не-
которого фракционирования пектолитического комплекса: при на-
сыщении 0,2 получается препарат, содержащий только ПЭ и ПТЭ.
7'
195
Рис. 2.20. Биосинтез пектолитических ферментов Cl. pectinofermentans 15
(по данным Г. Б. Бравовой, 1981):
а — влияние начального значения pH питательной среды: / — экзо-ПГ; 2— ПЭ;
3 — ПТЭ; б — влияние температуры; /. 2, 3 —• пектинтрансзлиминаза (ПТЭ);
ПГа. ПГз — зкзополигалактуроиаза; 1. /7Г| — 25 °C; 2. ПГ2 — 30 °C; 3,
35 °C
Таблица 2.19
Препарат Активность ферментов, ед./г или ед./мл
пектоли- тическая экзополн- галактуро- иазная пектин- эстеразная пектин- трансэлн- мииаэная мацерирую- щая спо- собность*
Культуральная жидкость 80 16,5 2,5 0,6 80
Пектоклостридии ГЗх 6000 1200 190 52 5000
Пектоклострндии Г10х 12 800 2600 460 90 6400
• Мацерирующая способность определялась по разрыву срезов картофеля.
При дальнейшем увеличении концентрации соли в обрабатывае-
мом растворе до 0,9 и 1,0 насыщения препараты не содержали ПЭ
и обладали только ПТЭ- и экзо-ПТ-активностью. Комплексные
препараты, полученные из культур Cl. pectinofermentans, стабиль-
ны при pH около 8,0 и температуре 20—30°C, однако оптималь-
ное значение pH для действия всех ферментов различно.
Анализ графических зависимостей, приведенных на рис. 2.21,
дает основание предположить, что проявление полигалактуроназ-
ной активности в данном комплексе зависит от степени метокси-
лирования пектина, т. е. при совместном действии пектинэстеразы
(кривая 3) и полигалактуроназы (кривая /) при pH 6 наблюдает-
196
Рис. 2.21. Влияние pH реакцион-
ной смеси иа проявление актив-
ности ферментов в препаратах, по-
лученных нз культуральной жид-
кости Cl. pectinofermentans 15:
1 — экзополигалактуроиаэа; 2— пек.
тинтрансэлнминаэа; 3 — пектииэсте-
раза
ся максимум для ПЭ- и мини-
мум для ПГ-активностей. По-
видимому, это полиметилгалак-
туроназа, расщепляющая с боль-
шой скоростью пектин с высокой
степенью метоксилирования. В
этом случае присутствие пектин-
эстеразы препятствует проявле-
нию гидролизующей способности
полигалактуроназы. Оптималь-
ной температурой для действия
ферментов является 40—45°C.
Отмечается, что ионы каль-
ция при небольшой концентра-
ции (0,005 % СаС12) активиру-
ют экзополигалактуроназу и
пектинтрансэлиминазу. Введение
в реакционную смесь NaCl1
(0,01 %) активирует экзо-ПГ и ПЭ.
Пектолитические ферменты можно фракционировать из фер-
ментного препарата пектоклостридина ГЮх с помощью гель-хро-
матографии. Препарат перед разделением подвергают очистке ме-
тодом диализа, обработке гелем фосфата кальция и центрифуги-
рованию. Для разделения можно использовать сефадекс G-200 с
последующим элюированием 0,05 М трис-НС1-буфером. При этом
найдено шесть белковых пиков, пять из которых
идентифицировано три фермента: это экзо-ПГ с
4,0—4,5, экзопектинтрансэлиминаза с оптимумом
тинэстераза с оптимумом pH 6,0—6,5.
Разработка способов выделения ферментных
культуральной жидкости показала, что полигалактуроназы и пек-
активны. Четко
оптимумом pH
pH 8,0 и пек-
препаратов из
татлиазы, синтезируемые различными микроорганизмами, доволь-
но лабильны в процессе концентрирования и требуют присутствия
стабилизаторов. Чаще всего стабилизаторами служат соли Са2+,
Mg2+, Со2+ и других двухвалентных металлов.
Степень очистки ферментов определяется областью их приме-
нения. Так, для льноперерабатывающей промышленности рекомен-
дованы препараты, полученные распылительной сушкой концент-
ратов культуральной жидкости. В пищевой промышленности ис-
пользуются препараты пектинразрушйющих ферментов, осажден-
ные этиловым спиртом или другими растворителями, для медици-
ны — препараты высокой степени очистки, получаемые с исполь-
зованием фракционирования комплекса, хроматографии, электро-
фореза и т. д.
2.3. ЦЕЛЛЮЛОЛИТИЧЕСКИЕ ПРЕПАРАТЫ
Ферментные препараты, способные разрушать целлюлозу, в ближайшее
время найдут широчайшее применение в самых разных отраслях производства.
В связи с ростом народонаселения Земли н активным поиском источников пн-
197
щевых ресурсов на основе непищевого сырья и новых источников энергии возрос
интерес к целлюлозосодержащему сырью, возобновляемые запасы которого почти
безграничны. Гидролиз целлюлозы дает глюкозу, которую можно использовать
для производства пищевых и кормовых белковых препаратов, получать из нее
спирт для энергетических целей, а также она может стать исходным продуктом
для производства глюкозо-фруктозных сиропов. Известны промышленные спо-
собы гидролиза древесины до глюкозы, но они приводят к частичной деградации
глюкозы н образованию нежелательных примесей, от которых необходимо осво-
бождаться. Для проведения кислотного гидролиза требуется дорогое, стойкое
к коррозии оборудование. Поэтому наиболее перспективным является исполь-
зование целлюлаз для гидролиза целлюлозосодержащего сырья. Целлюлолити-
ческие ферменты с успехом применяют в самых различных производствах (спир-
товая, пивоваренная, пищеконцентратная промышленность, хлебопечение, кор-
мопроизводство и др.), где сырьем являются растительные материалы нлн отходы
переработки растений. Использование целлюлаз повышает выходы целевого
продукта и позволяет подойти к созданию безотходных технологий. Целлюло-
литическим ферментам принадлежит большое будущее. Однако целлюлоза —
очень сложный субстрат для действия ферментов, и в мире нет пока продуцен-
тов, которые бы в полной мере удовлетворяли потребности отраслей, приме;
няющих целлюлазы.
2.3.1. Источники получения целлюлолитических ферментов
Целлюлазы почти исключительно синтезируются только мик-
роорганизмами, а именно анаэробными бактериями рода Clostri-
dium и микроскопическими грибами и другими. Целлюлоза разру-
шается представителями многих родов микроорганизмов — Alter-
naria tenuis, Aspergillus amstelodamy, A. fumigatus, A. oryzae,
A. terreus, Cellovibrio gilvus, Cephalosporium sacchariticus, Chaeto-
mium globosum, Fusarium culmorum, F. oxysporum, F. solani,
Jrpex lacteus, Myrothecium verrucaria, Penicillium notatum, P. va-
riable, Rhizopus oryzae, Stachybotrys alternans, Trichoderma ko-
ningii, T. lignonim, T. viride, T. longibrachiatum, Geotrichum can-
didum, Cytophaga и др.
2.3.2. Механизм действия и свойства целлюлаз
Субстрат. Субстратом для целлюлаз являются целлюлоза или
продукт ее частичной деградации. Целлюлоза является высокопо-
лимерным полисахаридом растений, состоящим из остатков глю-
козы, соединенных между собой р-1,4-глюкозидными связями.
Целлюлоза — линейный полимер. Большинство остатков глюкозы
в целлюлозе содержит трн свободных гидроксила у 2, 3 и 6-го уг-
леродных атомов, которые являются основой для образования во-
дородных связей и формирования прочных волокон. В среднем
одна нить целлюлозы состоит из 6 000—12 000 глюкозных остатков
с молекулярной массой около 1 • 1064-2-106. Объединенные в груп-
пы нитевидные молекулы целлюлозы называются микрофиб-
рилл а мн. В микрофибрилле нити целлюлозы могут быть упако-
ваны параллельно, с множеством водородных и других связей —
это «кристаллиты»; участки, где нет строгой упорядоченной струк-
туры, называют аморфными. Аморфные участки целлюлозы легче
подвергаются внешнему воздействию: с увеличением количества
198
таких участков растут набухаемость целлюлозы, ее атакуемость
ферментами, падает прочность и т. д. Целлюлоза является нерас-
творимым в воде субстратом. Нативная целлюлоза, особенно с вы-
сокой степенью кристалличности, медленно и плохо атакуется
целлюлазами. Поэтому целлюлозу для ферментативного гидроли-
за надо подвергать предварительной обработке. Для этого при-
меняют измельчение с помощью вальцевания материала в различ-
ных типах мельниц, химические способы обработки кислотами и
щелочами, методы физической обработки и т. д.
В связи с этим при характеристике целлюлолитических фер-
ментов следует обязательно учитывать состояние субстрата —
целлюлозы. Различают два вида целлюлозы: нативная — ни-
чем не обработанная целлюлоза, которая полностью сохранила
исходное строение и структуру микрофибрилл (хлопок, фильтро-
вальная бумага), и так называемая модифицированная, ча-
стично обработанная целлюлоза, в которой нарушены водородные
связи и фибриллярная структура волокна. Е. Т. Рис в 50-е годы
предположил наличие Сi-фактора негидролитической природы, ко-
торый вызывает деградацию нативной целлюлозы и делает ее до-
ступной для действия комплекса целлюлаз, названного им Сх-фер-
ментами. Схема такого гидролиза следующая:
Cj-фактор
(гипотетический)
Целлюлоза---------------»• Полиангидроглюкозные цепи
гидратированные
Сх-ферменты (5-Глюкозозидаза
----------- Целлобиоза------------->- Г люкоза
В 60-х годах К- Селби высказал гипотезу, что Cj-фактор — это
особое свойство живой культуры микроорганизма.
К середине 70-х годов эта теория стала подвергаться критиче-
скому анализу. Большой вклад был сделан советскими учеными
под руководством А. А. Клесова (1978—1982 гг.).
Была выдвинута и экспериментально обоснована общая схема
ферментативного гидролиза целлюлозы:
Исходный ЗнЗоглю^ Целлоа лига- _ ЦелмЗио- це/г/,0^ааза^Сг)
code трот хаиоза (£,) сахариды (G„)
(S)
Знзо-^Л-олю^ Глюноза(С)
кииЗаза (е^) <сз1
Механизм действия. В зависимости от физического состояния
исходного субстрата Gn может быть частично деструктированной
нерастворимой целлюлозой либо растворимыми производными цел-
люлозы.
199
Такая схема ферментативного гидролиза целлюлозы позволяла
описать процесс деградации субстрата независимо от состава и
происхождения полиферментной целлюлазной системы. Более то-
го, оказалось, что если выделить отдельные целлюлолитические
ферменты из различных целлюлазных комплексов, полученных из
различных культур микроорганизмов, и смешать их друг с другом
в разных пропорциях, то в каждом случае можно предсказать, ка-
кой вид будут иметь кривые накопления продуктов реакции
(А. А. Клесов, 1984). Все эти данные были получены на аморфной
целлюлозе и потому оставалась загадкой природа предгидролити-
ческого С1-фактора, для которого не было места в предлагаемой
схеме. Тогда и было высказано И. В. Березиийм и А. А. Клесо-
вым (1981) предположение, что Сгфактор — ие индивидуальное
вещество, не особый фермент, а просто свойство уже известных
ферментов. Такое предположение позволяет объяснить многое и
прежде всего то, почему этот загадочный Сгфактор не был выде-
лен в течение стольких лет.
Какое же это свойство ферментов? Авторы открытия логично
предположили, а затем и экспериментально доказали, что это спо-
собность ферментов адсорбироваться на целлюлозе. Суб-
страт нерастворим, значит способность фермента адсорбироваться
на нем даже более важна, чем его каталитическая активность, так
как если этой адсорбции не будет, то и гидролиза субстрата не
может быть. Экспериментальная проверка подтвердила это пред-
положение и показала, что целлюлазные ферменты из различных
микроорганизмов в сотни и тысячи раз различаются по способно-
сти адсорбироваться иа целлюлозе и что эта их способность кор-
релируется с глубиной гидролиза кристаллической целлюлозы
(рис. 2.22, 2.23).
Из рисунка 2.22 видно, что чем выше адсорбционная способ-
ность фермента, тем интенсивнее на всех стадиях процесса он гид-
ролизует нативную целлюлозу. Таким образом, наряду с высокой
каталитической активностью ферментов это свойство является ре-
шающим для последующего применения ферментных препаратов
для деградации целлюлозы.
В соответствии с Номенклатурой ферментов к комплексу цел-
люлаз, участвующих в деструкции целлюлозы, следует отнести:
1) 1,4-р-/)-глюкан-4-глюканогидролазы (КФ 3.2.1.4). Это эндо-
глюкаиаза, способная неупорядоченно гидролизовать в целлюлозе,
лихенине и р-глюканах зерна р-1,4-связи, помимо целлоолигоса-
харидов может образовываться в реакционной среде глюкоза и
целлотриозы;
2) 1,4-р-Р-глюканглюкогидролаза (КФ 3.2.1.74). Это экзо-1,4-
р-глюкозидаза, которая гидролизует 1,4-связи в 1,4-р-£)-глюка-
нах с последовательным отщеплением глюкозных остатков;
3) 1,4-р-/)-глюканцеллобиогидролаза (КФ 3.2.1.91). Это целло-
биогидролаза, которая отщепляет целлобиозу с нередуцирующих
концов целлоолигосахаридов;
4) p-D-глюкозидглюкогидролаза (КФ 3.2.1.21). Это р-глюкози-
200
Рис. 2.22. Изотермы адсорбции эндо-
глюканаз (А) из различных микроб-
ных источников на целлюлозе (по
данным А. А. Клесова, 1984):
1 — Trichoderma reesei; 2 — Т. viride;
3 — Т. longibrachiatum; 4 — Geotrichum
candidum; 5 — T. lignorum; 6 — Aspergil-
lus terreus; 7 — T koningll; 8 — Myrot-
hecium verrucaria; S —препарат фирмы
«Rapidase»; 10 — T. viride (изофермент);
11 — A. niger; 12 — A. foetidus
Длительность гидролиза, ч
Рис. 2.23. Зависимость глубины гид-
ролиза микрокристаллической цел-
люлозы (Со) в глюкозу (С) от вре-
мени действия одинакового количе-
ства целлюлазных комплексов из
различных микробных источников
(по данным А. А. Клесова, 1984).
Обозначения кривых см. к рис. 2.22
даза, или целлобиаза, которая гидролитически отщепляет конце-
вые нередуцирующие остатки р-£)-глюкозы с освобождением мо-
лекулы глюкозы. Фермент может гидролизовать 0-£)-глюкозиды и
целлобиозу.
Эидоглюканазы. Это гликопротеиды, в состав большинства ко-
торых входит до 40 % углеводов, состоящих из глюкозы, манно-
зы, галактозы и арабинозы, ковалентно связанных с белковой ча-
стью молекулы. Считают, что углеводный компонент фермента
взаимосвязан с его адсорбционной способностью на субстрате и
глубиной гидролиза нативной целлюлозы. Эидоглюканазы имеют
много изоформ, которые отличаются по молекулярным массам
(от 12 000 до 50 000) и изоэлектрическими точками (pH от 3,39
до 5,45). Эидоглюканазы обладают широкой субстратной специ-
фичностью. Некоторые эидоглюканазы проявляют определенную
специфичность по отношению к положению расщепляемой связи;
у других расщепление 0-1,4-связи с редуцирующего и нередуциру-
ющего концов происходит с одинаковой вероятностью. Характер-
ным свойством эндоглюкаиаз является большее сродство к 0-оли-
госахаридам, имеющим в своем составе более 6 остатков глюкозы.
Активный центр фермента пока ие изучен.
К экзоглюканазам следует отнести два фермента: экзо-1,4-глю-
козидазу и целлобиогидролазу, которые могут с нередуцирующего
конца поли- и олигомерных производных целлюлозы отщеплять со-
ответственно глюкозу или целлобиозу. Эти ферменты действуют
201
на аморфную целлюлозу и растворимые 0-олигосахариды. Харак-
терными особенностями целлобиогидролазы являются способность
гидролизовать нерастворимую целлюлозу с образованием целло-
биозы и неспособность этого фермента уменьшать вязкость рас-
творов карбокснлметил (КМ-) целлюлозы. Эта группа ферментов
является наименее изученной среди других ферментов целлюлаз-
ного комплекса, хотя есть данные о выделении этих ферментов в
высокоочищенном и гомогенном виде.
Большинство целлобиогидролаз является гликопротеидами, они
содержат до 9 % нейтральных углеводов, состоящих в основном
из маннозы, небольшого количества глюкозы, галактозы и глюко-
замина. Молекулярные массы известных экзоглюканаз достаточно
близки друг к другу и составляют 45 000—48 000, но есть и более
крупные молекулы — с Мм 62 000—90 000.
Отличительным свойством экзо-1,4-0-глюканазы является обра-
зование а-аномерной формы глюкозы, т. е. обращение разры-
ваемой 0-1,4-связи. Было установлено, что для многих целлюлаз-
ных комплексов этот фермент играет существенную роль в меха-
низме образования глюкозы из целлюлозосодержащего сырья. Ко-
личественные кинетические методы исследования позволили прий-
ти к заключению, что именно экзо-1,4-р-глюкозидаза, а не целло-
биаза играет доминирующую роль в образовании глюкозы (60—
98 % общего ее количества). Однако до снх пор существуют лишь
единичные работы по выделению экзоглюкозидаз. Более того, мно-
гие исследователи ставят под сомнение сам факт существования
такого фермента. Высказывается мнение, что способностью отщеп-
лять глюкозу с нередуцирующего конца обладает не только экзо-
1,4-р-глюкозидаза, но и целлобиогидролаза и эндоглюканаза. Ины-
ми словами, и этот комплекс целлюлаз пока изучен не до конца.
Целлобиаза. Этот фермент имеет очень широкое распростране-
ние в животном, растительном мире и у микроорганизмов. Этот
фермент хорошо изучен. Ему приписываются регуляторные функ-
ции и влияние именно ^-глюкозидаз иа суммарное действие всего
комплекса целлюлаз.
Отличительной особенностью целлобиаз является способность
сохранять пространственную конфигурацию расщепляемой связи
в продуктах гидролиза. Среди 0-глюкозидаз существуют фермен-
ты, способные расщеплять 0-1,2-, 0-1,3-, 0-1,4- н 0-1,6-связи в суб-
страте.
Молекулярная масса 0-глюкозидаз, по различным данным, ко-
леблется от 40 000 до 400 000. Есть мнение, что 0-глюкозндазы от-
носятся к олигомерным белкам, которые диссоциируют на низко-
молекулярные компоненты по схеме (8л)з=ь2(4л)з=е4(2л)з=ь8л. От-
мечается, что с уменьшением молекулярной массы фермента воз-
растает его сродство к субстрату и соответственно уменьшается
кт. Октамериое строение фермента подтверждается электронной
микроскопией.
Многие 0-глюкозндазы являются гликопротеидами и кислыми
белками. Максимальную активность эти ферменты проявляют в
202
кислой зоне при pH от 4,3 до 5,0, реже — при 6,7; оптимальная
температура действия лежит в диапазоне значений от 37 до 45°C.
2.3.3. Получение препаратов целлюлаз
В промышленных целях используется сравнительно небольшое
количество видов микроорганизмов, в основном относящихся к
роду Trichoderma, реже — к Geotrichum. Известно, что одним из
очень активных продуцентов целлюлаз является микроскопический
гриб Trichoderma reesei *, у которого есть три варианта: QM6a,
QM6d и QM6c. На основе QM6a сейчас получены многочисленные
мутанты с усиленной продуцирующей способностью по целлюла-
зам. Лучшие из этих мутантов образуют 15—20 г/л внеклеточно-
го белка, главную часть которого (50—80 %) составляет целло-
биогидролаза. Однако очень большая длительность культивирова-
ния, сравнительно низкая продуцирующая способность большинст-
ва грибных микроорганизмов создают необходимость дальнейших
поисков перспективных продуцентов. В нашей стране также ведут-
ся работы по поиску активных продуцентов. Большой вклад сде-
лан в решение этой проблемы Р. В. Фениксовой, В. И. Билай,
Л. Г. Логиновой, Л. С. Лосяковой, А. Г. Лобанком, К. А. Калуняи-
цем и многими другими исследователями. На примере исследова-
ний, проведенных В. И. Билай, можно представить способность ря-
да родов грибов к образованию целлюлаз (табл. 2.20).
Т а б л и ц а 2.20
Наименование родовых названий грибов Количество не* следованных Количество штампов
активно разлага- ющих целлюлозу не растущих на целлюлозе
видов штаммов
число % число 7.
Penicillium 48 914 319 34,9 312 35,4
Fusarium 14 453 78 17,7 62 13,7
Trichoderma 4 296 181 61,1 115 36,9
Stachybotrys Dendrodocnium 3 3 35 70 35 54 100,0 77,0 — —
Altefnaria и другие темноцвет- 20 200 163 81,5 6 3,0
ные
Всего 92 1968 830 42,2 495 25,1
Но не только грибы можно рассматривать в будущем в каче-
стве единственных продуцентов целлюлаз. Ученые возлагают боль-
шие надежды и на бактерии, особенно на анаэробные, относящие-
ся к роду Clostridium.
* В новой классификации этот микроорганизм отвесен к виду Т. viride.
203
Подбор продуцентов. Традиционный отбор продуцентов произ-
водится путем скрининга огромного количества возможных проду-
центов на способность гидролизовать целлюлозу и затем оптими-
зации условий культивирования. В итоге по ряду продуцентов
целлюлаз удалось получить чрезвычайно высокое выделение во
внешнюю среду целлюлаз. Так, для наиболее известного и ши-
роко используемого в мире продуцента — Trichoderma reesei —
концентрация внеклеточных целлюлаз достигает 20 г/л при про-
дуктивности биосинтеза до 200 мг/(л-ч), что в несколько раз пре-
восходит любой другой продуцент. Однако молекулярная актив-
ность даже этого суперпродуцента, т. е. отношение ферментатив-
ной активности к массе целлюлаз, крайне низка, и этот показа-
тель лимитируется природной способностью ферментов данного
продуцента адсорбироваться на субстрате, что пока не поддается
внешнему воздействию и изменению.
Таким образом, обычный способ отбора активных продуцентов
практически полностью исчерпал себя. В настоящее время наи-
более вероятны два пути: это поиск продуцентов путем биотехно-
логического скрининга большого количества микроорганизмов с
учетом термостабильности ферментного комплекса, его адсорбци-
онных способностей и степени ингибирования продуктами гидро-
лиза (А. А. Клесов, 1986), и второй путь — конструирование про-
дуцентов с заданными свойствами методами генетической инже-
нерии. В последнем направлении есть положительный опыт в Ин-
ституте молекулярной генетики АН СССР и Казанском государ-
ственном университете, а также за рубежом. Уже сейчас прове-
дено клонирование в различных микроорганизмах около полутора
десятков гетерологичных целлюлазных генов (М. А. Могутов,
1986). Реальных положительных результатов пока ие получено, ио
это очень перспективное и важное направление в работе над про-
дуцентами целлюлаз в будущем.
Получение препаратов целлюлаз из поверхностных культур.
Целлюлолитические ферментные препараты для использования в
сельском хозяйстве и кормопроизводстве часто получают при по-
верхностном способе культивирования. Эти препараты дешевы и
содержат значительные количества сопутствующих гидролитиче-
ских ферментов, таких, как амилазы, протеазы, пектиназы и геми-
целлюлазы, что также важно и цеиио для потребителя.
Для поверхностного способа культивирования в нашей стране и
за рубежом используют Т. viride, Т. koningii, Т. lignorum, Т. reesei,
Т. longibrachiatum и некоторые другие. Есть данные (Л. Г. Логи-
нова, Ж. Ташпулатов, 1980) об использовании A. fumigatus и
A. terreus — термофильных продуцентов целлюлаз.
Источники углерода. Основным компонентом питатель-
ной среды являются пшеничные отруби. Наряду с отрубями в со-
став среды вводятся солодовые ростки, которые богаты витамина-
ми группы В, фосфором, клетчаткой, легкоусвояемыми редуциру-
ющими веществами и аминокислотами. В состав среды также вво-
дят рисовую, овсяную или ячменную шелуху, свекловичный жом,
204
измельченную пшеничную и ржаную солому, древесные опилки,
кукурузный жмых и другие целлюлозосодержащие компоненты.
Влияние таких добавок к пшеничным отрубям иа способность гри-
ба образовывать целлюлазы можно продемонстрировать на при-
мере Т. iongibrachiatum 7-26 (табл. 2.21).
Таблица 2.21
Количество в среде. % Добавляемый компонент Ферментативная активность
С,-фермент (АФБ) С^-фермент (КМЦ)
Пшеничные отруби | Солодовые |юсткн Наименование Количество, %
ед./г сухой куль- туры % К КОНТ|ЮЛЮ ед./г сухой куль туры % контролю
100 - (контроль) — — 150 100 430 100
80 20 — — 267 178 660 152
70 20 Бумажные отходы 10 330 220 960 226
60 20 То же 20 370 247 1100 256
70 20 Измельченная пшеничная со- лома 10 304 203 896 207
60 20 То же 20 290 193 758 176
70 20 Свекловичный жом 10 277 185 696 162
60 20 То же 20 265 177 684 158
70 20 Хлопковая шелуха 10 294 196 825 192
60 20 То же 20 270 180 768 178
70 20 Кукурузный жмых 10 277 185 690 160
60 20 То же 20 293 190 696 162
70 20 Овсяная шелуха 10 277 185 662 154
60 20 То же 20 234 156 630 146
70 20 Рисовая шелуха 10 284 189 668 160
60 20 То же 20 260 173 620 144
70 20 Хлопковый жмых 10 139 92 459 107
60 20 То же 20 119 79 430 100
Для данного продуцента наилучшие результаты — 370 ед./г по
Ci и 1100 ед./г по Сх —были получены иа среде, состоящей из
60 % пшеничных отрубей, 20 % солодовых ростков и 20 % бумаж-
ных отходов. Одиако каждый продуцент требует индивидуально-
го изучения, так как физиология и потребности микроорганизмов
могут заметно отличаться. Так, для гриба Т. lignorum 6с, по дан-
ным О. П. Кожемякиной и др., наивысшая активность целлюлаз
наблюдалась иа среде, состоящей из 55 % пшеничных отрубей,
20 % солодовых ростков и 25 % свекловичного жома.
Увеличение биосинтетической способности культуры иа средах
с солодовыми ростками связано, по-видимому, ие только с тем, что
солодовые ростки имеют рыхлую структуру, что способствует луч-
шему росту гриба, но и с тем, что солодовые ростки содержат
205
значительные количества свободных аминокислот и других биоло-
гически активных веществ. Очень большое влияние имеет содер-
жание в отрубях крахмала. Достаточно четко такое влияние про-
слеживается прн выращивании Т. longibrachiatum на пшеничных
отрубях с различным содержанием крахмала (рнс. 2.24). В этих
опытах контролем была среда, приготовленная из пшеничных от-
рубей с содержанием крахмала 14,5%. Более высокое содержа-
ние крахмала достигалось путем добавления к отрубям кукуруз-
ного крахмала (кривые I и 2) и проведения специального помола
пшеницы с отбором отрубей, по-разному обогащенных крахмалом
(кривые Г н 2'). Наибольший синтез целлюлаз отмечался прн
содержании крахмала в среде 16—17 %. Дальнейшее увеличение
крахмала приводило к снижению биосинтетической способности
культуры в отношении целлюлаз, т. е. прн избытке крахмала в
среде в силу индуцнбельного характера накопления гидролитиче-
ских ферментов образование целлюлаз заметно снижалось.
Ряд исследователей отмечают, что дополнительное введение в
состав среды, состоящей из отрубей, солодовых ростков н целлю-
лозосодержащих отходов (описки, бумажные отходы, шелуха), не-
большого количества сахарозы приводит к возрастанию биосинте-
за целлюлаз, особенно осахаривающего действия (рис. 2.25).
В связи с этим высказываются предположения, что синтез целлю-
лаз в присутствии сахарозы носит полуконстнтутнвный характер.
Одиако такое объяснение нельзя считать в достаточной степени
достоверным, хотя сам факт усиления синтеза целлюлаз прн этих
условиях наблюдается.
Источники азота. Большое значение имеет и источник азо-
та в среде. Для большинства продуцентов обычно бывает доста-
точно тех азотсодержащих веществ, которые вносятся с отрубями
и солодовыми ростками. Но введение других рыхлителей среды,
Рис. 2.24. Влияние содержания кра-
хмала в среде иа накопление С,-
фермеитов (АФБ)—кривые /, и
и Сх-фермеитов (КМЦ)—кривые
2, 2' (по данным О. В. Зюзиной и
др., 1982)
Рис. 2.25. Влияние сахарозы иа на-
копление целлюлаз культурой
Т. longibrachiatum 7-26:
1 — Ci-фермеиты (АФБ); 2 —^-фермен-
ты (КМЦ)
206
таких, как шелуха, лузга, опилки, может вызывать обеднение сре-
ды азотом, и тогда появляется необходимость дополнительного
введения неорганических или органических источников азота. Мик-
роорганизмы часто чувствительны к форме вводимого азота и его
количеству. Известно, что для большинства грибов рода Tricho-
derma наиболее благоприятное влияние оказывает азот, введен-
ный в виде неорганических соединений — аммонийных солей. Но
в то же время для гриба Т. lignorum наивысшая биосинтетическая
активность в отношении целлюлаз проявлялась при введении в
состав среды неорганического азота в окисленной форме
(Ж- В. Павловская, 1982).
Прн твердофазном культивировании Т. longibrachiatum было
показано, что этот микроорганизм в присутствии около 0,6 % од-
ной из солей NH4NO3, (NH4)2HPO4 и NH4H2PO4 — способен
повысить на 20—35 % биосинтез целлюлаз (Сг и Сх-ферментов).
В то же время введение в среду (NH4)2SO4 вызывает во всех слу-
чаях некоторое подавление биосинтетической активности проду-
цента (рис. 2.26). На этой же культуре было показано, что допол-
нительное введение некоторых органических источников азота (ка-
зеин, пептон, автолизированные дрожжи и т. д.) почти не влияет
иа биосинтез целлюлаз, особенно иа осахаривающий комплекс
целлюлаз, за исключением кукурузного экстракта, введение кото-
рого в количестве 0,6 % по азоту способствовало увеличению ак-
0 0,2 Ц4 0J5 0,8 tfi
Количество азота, дополнительно
введенного в среду, 7. к пассе среды
Рис. 2.26. Влияние неорганических
источников азота, введенных до-
полнительно при твердофазном спо-
собе культивирования Т. longibra-
chiatum 7-26 (по данным М. В. Гер-
нет, 1985):
1 — NH»NO3; 2 - (NH«hHPO,; 3 -
NH.HjPO,; 4 — NaNO3; 5 — (NH<)2SO«
—1-------1_____। ।
10 20 30 W
Толщина слоя среды, пн
Рис. 2.27. Влиииие толщины слоя твер-
дой питательной среды иа накопление
целлюлаз Т. longibrachiatum (по дан-
ным М. В. Гериет, 1985):
/—АФБ; 2 — КМЦ-осахарнвающая актив-
ность; 3 —влажность (в %); 4 — температу.
ра в слое
207
тивности на 20—40 %. Вероятно, это связано с тем, что кукуруз-
ный экстракт помимо азота является источником и других ве-
ществ.
Условия культивирования. Большое значение при
твердофазном культивировании имеют толщина слоя и влажность
питательной среды. Для большинства продуцентов целлюлаз оп-
тимальной является влажность 60—65 %. Такая высокая влаж-
ность возможна в связи с введением в состав среды солодовых
ростков и других рыхлителей, ио толщина слоя даже при высокой
сыпучести среды ие должна превышать 25—30 мм (рис. 2.27).
Для большинства мезофильных продуцентов целлюлаз реко-
мендуется иа первой фазе роста культуры увеличивать темпера-
туру иа 3—5 °C выше оптимальной для ускорения прорастания
спор. Этот период в зависимости от продуцента имеет длитель-
ность от 14 до 20 ч. Далее температура снижается до оптималь-
ной. Такой прием позволяет сократить длительность роста куль-
туры иа 10—12 ч и повысить уровень активности культуры на
10—15%. Характеристика культуры и накопления ею ферментов
в процессе роста Т. longibrachiatum представлена на рис. 2.28,
При твердофазном культивировании длительность выращива-
ния практически для всех продуцентов лежит в интервале от 2,5
до 3 сут и совпадает с фазой интенсивного спорообразования. Вы-
ход культуры обычно составляет 76—78 % по сухой массе от ис-
ходной среды и мало изменяется в последние сутки роста (кри-
вая 5), так как легкодоступные источники углерода полностью
утилизируются, а целлюлоза (кривая 4) утилизируется очень мед-
ленно.
Выделение ферментов. Препараты получают из куль-
тур продуцентов по традиционной схеме: экстракция водой водо-
Длительнхгль культибиробания, ч
Рис. 2.28. Динамика накопления целлюлаз и био-
химическая характеристика культивирования Т. lon-
gibrachiatum иа твердой среде (по данным
И. М. Грачевой, О. В. Зюзииой и др., 1982):
1 — АФБ: 2 — КМЦ-осахаривающая активность; .3 — ре-
дуцирующие вещества (PB); 4 — целлюлоза; 5 — выхсд
культуры
208
растворимой части культуры-*стабилизация целлюлаз в растворе
некоторыми солями-*осаждение целлюлаз или их частичное фрак-
ционирование органическими растворителями (этанол — 74—75 %
об.; изопропаиол — 65—70 % об.; ацетон — 70—75 % об.^высу-
шивание влажных осадков методом сублимации-* получение го-
тового стабильного комплексного препарата целлюлаз с индексом
ПЮх.
При сопоставлении препаратов, полученных при различных
способах выделения из культуры гриба Т. longibrachiatum, наи-
лучшие технологические показатели имели фракции, осаждаемые
этиловым спиртом (соотношение 1:3,5). Осадок быстро формиру-
ется в растворе, образуя крупные хлопья рыхлой, легкообрабаты-
ваемой консистенции. Выход ферментов в активном состоянии в
препарате составляет по АФБ (CJ около 90 % исходной, а по
КМЦ-осахаривающей активности (Сх) — около 80 %. При осаж-
дении изопропиловым спиртом показатели несколько лучше, ио
осадки в этом случае получаются вязкими и труднообрабатывае-
мыми.
Получение сухих очищенных препаратов лучше всего прово-
дить при сублимационной сушке предпочтительно методом испа-
рительного замораживания. Это позволяет снизить до минимума
потери активности и ускорить процесс высушивания на 30—60 %.
В зависимости от способа осаждения характер сушки влажных
осадков определяется опытным путем с тем, чтобы получить пре-
параты с максимальной активностью ($ис. 2.29). Из культур мик-
роорганизмов, выращенных иа твердой среде, можно получить
препараты с индексом ШОх с активностью до 3 000 ед./г по бума-
ге и до 11 600 ед./г по КМ-целлюлозе.
Получение препаратов целлюлаз из глубинных культур. В на-
стоящее время во многих лабораториях нашей страны и за рубе-
жом продолжаются работы по подбору условий и состава сред
для глубинного культивирования продуцентов целлюлаз.
Источники углерода-
Предложены и испытаны са-
мые разнообразные источники
углерода: фильтровальная бу-
мага, линт, свекловичный
жом, гузапая, целлюлоза, цел-
лобиоза, стержни кукурузных
початков, измельченная со-
лома, хлопок, опилки, лакто-
за, пшеничные отруби, техни-
ческая Na-KM-целлюлоза и
т. д.
Еще в 60-х годах в рабо-
тах М. Мандельса и Е. Т. Ри-
са для Trichoderma viride
указывалось на возможность
использования для роста куль-
Длительность сушки, пим
Рис. 2.29. Термограммы (/', 2', 3') и
кривые сублимационной сушки (/, 2, 3)
ферментного препарата целлобраиииа
ПЮх, осажденного различными раство-
рителями (по данным О. В. Зюзиной,
А. И. Чичельиицкого и др„ 1983):
/. Г — этанолом; 2, 2‘ — ацетоном, 3, 3'—
изопропанолом
209
туры до 62 источников углерода. Однако активный биосинтез
целлюлаз наблюдался только на средах с целлюлозой, целлюлозо-
содержащим сырьем и на лактозе.
При изучении влияния источников углерода на биосинтез цел-
люлаз грибами рода Trichoderma Р. В. Фениксова с сотрудниками
испытывали лактозу, свекловичный жом, фильтровальную бумагу,
хлопок и их различные сочетания. Нанлучшие результаты получе-
ны при наличии в среде лактозы или свекловичного жома. Позд-
нее Г. В. Щусь на Geotrichum candidum было показано, что наи-
высший синтез целлюлаз наблюдается иа средах, где свеклович-
ный жом частично гидролизован. Н. А. Остриковой и С. А. Коно-
валовым (1983) также изучалось влияние различных источников
углерода на биосинтез целлюлаз грибом Т. viride 44 на среде, ку-
да вводились глюкоза, лактоза, сахароза, мальтоза, пектин, свек-
ловичный жом, солома злаков, картофельная ботва, отруби и т. д.
Наибольший синтез комплекса целлюлаз также отмечается на сре-
де со свекловичным жомом и лактозой, что согласуется с ранее
проведенными исследованиями и данными А. Г. Лобаика н его со-
трудников (1977).
При глубинном способе культивирования Т. longibrachiatum
высокий синтез целлюлаз наблюдается в присутствии свеклович-
ного жома, осиновых опилок, бумажных отходов, хлопкового jupo-
та и биошрота, получаемого после окончания культивирования про-
дуцента (по данным М. В. Гернет, 1985).
Источники азота. Большое значение имеет и источник
азота. При изучении влияния неорганических и органических ис-
точников азота наилучшие результаты для большинства продуцен-
тов ферментов получены при введении в состав среды (NH4)2HPO4,
(NH4)2SO4, гидролизатов дрожжей, кукурузного экстракта, солодо-
вых ростков, соевой муки и особенно хлопкового шрота н пшенич-
ных отрубей. Введение органических источников азота особо силь-
но сказывалось на биосинтезе целлюлаз грибом Т. longibrachia-
tum (табл. 2.22).
Минеральные вещества и ПАВ. Продуценты целлю-
лаз весьма чувствительны к минеральному питанию. Известно, что
Таблица 2.22
Наименование Дополнительно вносимого в среду компонента Концентрация, % Целлюлолитическая актив- ность, % к контролю
по фильтро- вальной, бумаге по Na-KM- целлюлозе
Контроль 100,0 100,0
Гидролизат кормовых дрожжей 1 108,0 112,0
Солодовые ростки 1.5 273,3 275,5
Хлопковый шрот 1,5 294,1 300,2
Кукурузный экстракт 1.0 103,3 100,2
Соевая мука 0,5 113,3 115,0
Пшеничные отруби 1.5 273,3 270,1
210
для роста микроорганизмов необходимо наличие в среде фосфо-
ра, серы, калия, натрия, магния, а также ионов железа, марганца,
кальция и ряда других металлов. Однако не все ионы оказывают
положительное влияние на биосинтез целлюлаз. В литературе от-
мечается, что ионы Со2+, Li+, Zn2+, Ва+ и Na+, как правило, сни-
жают уровень биосинтеза целлюлаз на 25—45%.
Имеются сведения, что добавление в среду поверхностно-ак-
тивных веществ (ПАВ) увеличивает продуцирующую способность
микроорганизмов по отношению внеклеточных целлюлаз. Внесе-
ние олеата натрия в среду с целлобиозой в количестве 0,1 % при-
водит к стократному увеличению
Предполагается, что ПАВ спо-
собствует дсступу целлобиозы к
связанной в клеточной мембране
трансферазе, которая обуслов-
ливает образование индуктора,
например софорозы. Кроме того,
введение ПАВ, например твинов,
способствует повышению кле-
точной проницаемости. Они вли-
яют на транспорт питательных
веществ внутрь клетки и секре-
цию из нее, что приводит к воз-
растанию продуктивности клеток
и повышению уровня биосинте-
за внеклеточных ферментов.
Стимулирующее влияние тви-
нов, особенно твина-80, на био-
синтез целлюлаз было отмечено
при культивировании Т. longi-
brachiatum (рис. 2.30, а). Подоб-
ное явление наблюдалось и ранее
на культуре A. terreus 17/р
(Д. Ю. Исмаилова, 1977). Вве-
дение твинов в среду вызывает
одновременно со стимуляцией син-
теза целлюлаз некоторое тормо-
жение в накоплении биомассы,
которое неодинаково в присутст-
вии различных твинов. Возможно,
влияние оказывает состав ПАВ.
Известно, что полиоксиэтилен-
сорбитанмоноалконаты получают
ангидридизацией и этерификаци-
ей сорбита соответствующей жир-
ной кислотой с последующим ка-
талитическим оксиэтилнрованн-
ем сорбнтанмоноалконата. Для
твина-40, -60 и -80 такими жир-
биосннтеза целлюлаз Т. viride.
Рис. 2.30. Влияние добавления
твинов и жирных кислот на био-
синтез целлюлаз Т. longibrachiatum
(по данным М. В. Гернет,
В. М. Поляковой н др., 1984):
а — добавление твинов: 1 — твин-40;
2 — твин-60; 3 — твин.80; б — добав-
ление жирных кислот: Г — пальмити-
новая; Г —стеариновая; 3'— олеино-
вая
211
ными кислотами являются соответственно пальмитиновая, стеари-
новая и олеиновая. Опыты с введением в среду этих кислот
позволили получить эффект стимуляции биосинтеза целлюлаз,
аналогичный тому, что имел место при добавлении твинов
(рис. 2.30,6). Если сравнивать эти данные с контролем (без
введения ПАВ), то эффект от ПАВ и соответствующей кис-
лоты сопровождался снижением количества биомассы, изменением
морфологии культуры (появление вытянутых и вздутых форм),
увеличением продолжительности культивирования с одновремен-
ным резким увеличением синтеза целлюлаз. Однако вышеуказан-
ные компоненты среды (олеиновая кислота и твин-80) не исполь-
зуются при конструировании промышленных сред, так как они,
с одной стороны, очень дороги, а с другой — увеличивают время
выхода культуры на максимальное накопление в среде целлюлаз.
Условия культивирования. Большое влияние на био-
синтез целлюлаз оказывают условия культивирования. Отличи-
тельная особенность большинства продуцентов целлюлаз — это
большая длительность культивирования. Обычно максимум актив-
ности приходится иа 4—8 сут. Анализ данных показывает, что в
культуральной жидкости при оптимальных условиях выращива-
ния может накапливаться от 2 до 22 ед. АФБ/мл и от 200 до
500 ед. КМЦ/мл.
Выделение фермента. На основе глубинной культуры
можно получить технические препараты целлюлаз и очищенные
целлюлолитические препараты. Технические препараты получают
путем высушивания распылением концентратов культуры без отде-
ления твердой фазы или выпаривания ее жидкой фазы. Для сни-
жения потерь при сушке в культуральную жидкость вводят ста-
билизаторы, чаще всего небольшие количества некоторых солей.
Комплексные очищенные целлюлолитические препараты, например
из Т. viride, можно получить осаждением органическими раство-
рителями и высаливанием сульфатом аммония (табл. 2.23). Из
Осаждение этанолом (1:3)
Осаждение ацетоном (1:2)
Осаждение сернокислым
аммонием (0,7 полного на-
сыщения)
Распылительное высуши-
вание культуральной жид-
кости
23,5 570 6300 244 288 83 3600 16,4
30,0 405 6000 266 288 25 2880 16,0
5,6 690 7200 266 244 116,5 7200 16,2
40,0 126 190 38 55 25 870 58,3
212
таблицы видно, что способ получения препарата оказывает сущест-
венное влияние на комплекс целлюлаз в данном препарате, даже
если все они получены на основе одного продуцента и из одной
культуральной жидкости.
Как говорилось в начале этой главы, целлюлазный комплекс
очень сложный и пока изучен недостаточно, поэтому нет устано-
вившейся технологии по получению определенных индивидуаль-
ных ферментов этого комплекса. Это осложняется еще тем, что
качественный и количественный состав целлюлазных комплексов
варьирует в широких пределах в зависимости от продуцента, со-
става среды, условий культивирования и способа выделения от-
дельных компонентов.
Для получения очищенных препаратов целлюлаз используют
комбинацию самых различных приемов: осаждение и фракциони-
рование органическими растворителями, солями, хроматографию
на молекулярных ситах и ионообменную хроматографию, электро-
форез и др.
Аффинная хроматография. Остановимся подробнее
на одном из перспективных способов — аффинной хроматографии.
Еще в 1973 г. И. Н, Канфером была проведена аффинная хрома-
тография целлюлаз, в результате чего на сефарозе 4В со связан-
ным бензидином в качестве носителя и б-глюконолактоном в каче-
стве лиганда была выделена целлобиаза. Позднее С, Гонг путем
хроматографии на конканавалин-А-агарозе на металлопротеиновой
подложке отделил целлобиазу от эидоглюканазы. Детальное ис-
следование адсорбции целлюлаз на различных аффинных лиган-
дах было проведено и опубликовано в 1977 году Т. Мега и И. Мат-
зухима. Наибольший интерес представляют собой исследования
по аффинной хроматографии целлюлаз на микрокристаллической
целлюлозе или целлюлозе в виде измельченной порошкообразной
фильтровальной бумаги. Использование целлюлозы позволяет раз-
делить целлюлазный комплекс на основе различной степени срод-
ства компонентов к субстрату.
Такая работа для препаратов целлобраиииа Г10Х и целловиридииа ГЗх
была проведена В. А. Мартьяновым, М. Л. Рабиновичем, А. А. Клесовым и др.
(1983), В качестве носителей применялись следующие формы целлюлозы: по-
рошковая и микрокристаллическая целлюлозы, иеизмельчеииая вата, измель-
ченный и иеизмельчеииый хлопковый лиит. Аффинную хроматографию проводили
в колонках, заполненных носителем. Адсорбция ферментов проводилась при
температуре 4—10 °C и pH 4,5 (оптимальный дли действия целлюлаз) в
0,1 М ацетатном буфере. Десорбцию ферментов осуществляли путем измеиеиии
pH элюента до 7,0 (0,1 М фосфатным буфером) и последующего понижении
ионной силы элюирующего буфера до 0,010—0,001 М и далее дистиллированной
водой. Отбираемые фракции элюента анализировались иа содержание белка и
активность. Результаты этих опытов представлены иа рис. 2.31.
В оптимальных условиях иа первой (А) стадии происходит адсорбции фер-
ментов из раствора с одновременной очисткой их от балластных примесей и
пигментов. На этой стадии сорбируется до 90—95 % эидоглюканазы. Далее
колонку отмывают 0,1 М ацетатным буфером с pH 4,5 до прекращения выхода
белка и пигментов. На второй стадии (5) при промывании колонки 0,1 М
фосфатным буфером с pH 7 происходит дополнительное отделение балластных
белков, так как ферментативной активности практически ие обнаружено. Третья
стадии (В, Г и Д) — это элюция адсорбированных ферментов с колонки фосфат-
213
(5)
Номер срракции
Рис. 2.31. Аффинная хроматография целлюлазного комплекса из Т. longibra-
chiatum на микрокристаллической целлюлозе. Ступенчатая элюция ферментов
с носителя (по данным В. А. Мартьянова, М. Л. Рабиновича и др., 1983):
/ — эидоглюканазная активность (эндо-Гл) ед./мл; 2 — поглощение при 280 нм (белко.
вые вещества): 3 — глюкоза иа выходе из колонки (мкм); 4 — образование глюкозы при
гидролизе хлопка (мкМ. хл); 5 — ионная сила (в относительных единицах); Д—0,1 М
ацетатный буфер (pH 4,5); Б—0,1 М фосфатный буфер (pH 7); В — 0.01 М фосфатный
буфер (pH 7); Г — 0,02 М фосфатный буфер (pH 7); Д— 0.001 М фосфатный буфер
(PH 7)
ным буфером с pH 7—7,2 с понижением его ионной силы. По мере снижения
ионной силы буфера происходит десорбция различных количеств эндоглюканазы
с колонки, что свидетельствует о том, что система ферментов многокомпонентна
и отличается различной адсорбционной способностью на целлюлозе. Известно,
что целлобиогидролаза более прочно сорбируется иа целлюлозе, чем эндоглю-
каиаза. Поэтому ее элюция возможна при низких значениях ионной силы.
В связи с этим последний этап элюции, .несмотря иа ухудшение гидро-
динамических свойств носителя, проводили дистиллироваииой водой.
Полученные фракции проверяли иа способность гидролизовать нативный
хлопок. Чтобы проследить за гидролизом, в реакционную смесь вводили избы-
ток очищенной целлобиазы с тем,
чтобы была возможность характе-
ризовать процесс по глюкозе. Из
рис. 2.31 (кривая 4} видно, что
все фракции, обладающие эндо-
глюкаиазиой активностью, способ-
ны гидролизовать нативную упо-
рядоченную целлюлозу (хлопок).
Фракции, выходящие последними
при элюции дистиллированной во-
дой или при длительной отмывке
0,001 М фосфатным буфером с
pH 7, обладали более высокой
гидролизующей активностью. Эти
опыты показали, что аффиииая
хроматография иа целлюлозе
Нис. 2.32. Групповая очистка целлюлазного
комплекса иа микрокристаллической цел-
люлозе (по данным В. А. Мартьянова,
М, Л. Рабиновича и др., 1983):
/-—эидоглюканазная активность (эндо-Гл),
ед./мл; 2 —пигментные вещества (Й4М); 3 —
белковые вещества (DM); 4 — ионная сила
ц 10-3 в относительных единицах; 5 — pH
позволяет выделить комплекс
целлюлаз Т. longibrachiatum, очи-
стив его от сопутствующих бел-
ков и пигментов, ио ие дает воз-
можностей для разделения ком-
плекса иа отдельные ферменты,
т. е. этот метод эффективен для
групповой очистки целлюлаз.
214
Анализ процесса элюции целлюлаз, представленного иа рис. 2.31, показы-
вает, что можно упростить и заменить многоступенчатую элюцию одноступенча-
той элюцией 0,001 М фосфатным буфером (рнс. 2.32). Из рисунка видно, что
ферменты выходят острым пиком в небольшом объеме, что снимает необхо-
димость в дополиительиом коицеитрироваиии. Фракция ферментов практически
ие содержит низкомолекулярных веществ и солей, а элюат содержит некоторое
количество глюкозы и целлобиозы, которые способствуют стабилизации фермен-
тов при хранении.
Аффинная хроматография позволяет получать высокоочищенные
целлюлазные комплексные препараты с выходом активности до
50 % непосредственно из фильтрата культуральной жидкости.
Однако микрокристаллическая целлюлоза является не очень
хорошим носителем, у нее малая сорбционная емкость по фермен-
ту (не более 20 ед./г по эндоглюканазе) и сравнительно низкий
выход активности в элюат (около 50 %). Для этого процесса был
апробирован ряд других носителей (табл. 2.24).
Таблица 2.24
Носитель Емкость по эндоглюкаиа- зе, ед./г Выход активной эндоглюканазы в элюат при десорб- ции, % Фильтрующие свойства*
Микрокристаллическая целлюлоза 20 50 Более 1
а-Целлюлоза 15 10 Более 1
Порошковая целлюлоза 40 60 Менее 1
Хлопковый лиит
помол иа шаровой мельнице 5 мин 55 80—100 Более 1
немолотый 10 80 Более 2
Немолотый хлопковый лиит -|- порош- 20 40 Меиее 1
новая целлюлоза
Вата нестерильная 10 30 Более 1
* Скорость фильтрования дистиллированной воды при свободном токе (свободный объем иа
объем колонки в час).
Из таблицы видно, что наилучшими свойствами для аффинной
хроматографии обладает измельченный хлопковый линт. С ис-
пользованием этого носителя были получены препараты из куль-
туральной жидкости и технических целлюлазных препаратов с
активностью от 1 000 до 6 000 ед./гл по эндоглюканазе, что свиде-
тельствует о том, что они ие уступают лучшим зарубежным образ-
цам, таким, как препараты целлюлаз (в единицах эндоглюкана-
зы на грамм препарата) фирм: «Novo» (Дания) —3000; «Rapidase»
(Франция) — 1000; «Sigma» (США) — 500; «Serva» (ФРГ) —
500; «Koch-Light» (Великобритания)—400; «Onozuka» (Япо-
ния) 1600.
Для сопоставления препаратов, очищенных с помощью аффин-
ной хроматографии, с препаратами, полученными осаждением эти-
ловым спиртом, была проведена их гель-фильтрация на ультраге-
ле АсА 54 (рис. 2.33). Из рис. 2.33, а видно, что препарат с ин-
дексом Г10х содержит значительное количество балластного бел-
215
10 80 30 50 60 70 80
Попер фракции,
a
'ЗндоГл,еО/л
8,0г
Рис. 2.33. Гель-фнльтрация технического препарата целлобронина ПОх (а) и
очищенного аффинной хроматографией (б) на ультрагеле АсА 54 (по данным
В. А. Мартьянова, М. Л. Рабиновича н др., 1983):
/ — эндоглюканазная активность (эндо-Гл), ед./мл; 2 —белковые вещества (О2Ю); 3 —
пигментные вещества (D<m)
ка и пигментов. Препарат, очищенный аффинной хроматографией
(рис. 2.33,6), не содержит пигментов и содержит только две груп-
пы белков, одна из которых (высокомолекулярная) не обладает
активностью, но доля ее невелика.
Таким образом, экспериментально показано, что аффинной хро-
матографией на целлюлозе можно селективно выделить из неочи-
щенных препаратов и культуральной жидкости целлюлазы при
незначительном количестве сопутствующих неактивных белков.
Можно с достаточной уверенностью предполагать, что этот спо-
соб очистки целлюлолитических ферментов будет в недалеком бу-
дущем самым перспективным и рентабельным.
2.4. ГЕМИЦЕЛЛЮЛАЗНЫЕ ПРЕПАРАТЫ
При использоваиин растительного сырья во всех странах мира придается
большое значение его обработке гемицеллюлазными ферментами. С помощью
этих ферментов можно получать глюкозу и пентозы, которые могут использовать-
ся для производства кормовых белковых препаратов, в кормопроизводстве, для
получения ксилита, фурфурола, этанола, биогаза и других продуктов микро-
биологического синтеза.
Гемицеллюлазные ферментные препараты с успехом применяются в спирто-
вом, пивоваренном производствах, а также в других отраслях, использующих
отходы сельского хозяйства и растительное сырье. Эффект от применения
этих препаратов заключается в том, что они позволяют повысить выход ряда
традиционных продуктов без дополнительных затрат на сырье за счет появле-
ния дополнительных резервов сахаров в обрабатываемом сырье в результате
гидролитического расщепления гемицеллюлоз.
Производство этих препаратов следует отнести к перспективным и миого-
тоииажиым. Значимость их почти такая же, как амилолитических и целлюло-
литических ферментных препаратов.
2.4.1. Источники получения гемицеллюлез
Многие микроорганизмы образуют ферменты, гидролизую-
щие такие гемицеллюлозы, как р-глюканы, ксиланы и их произ-
водные.
216
0-Глюканазы образуются грибами, бактериями и дрожжами.
Практически это те же самые роды и виды, которые были при-
ведены в разделе 2.3.1 по целлюлазам. Здесь необходимо отме-
тить, что спороносные бактерии В. subtilis и В. mesentericus син-
тезируют из комплекса гемицеллюлаз только р-глюканазы, что
снижает их практическую значимость.
Продуцентами ксиланаз являются грибы, актиномицеты, бакте-
рии, дрожжи. Наивысшей продуцирующей способностью обладают
грибы, относящиеся к родам Trichoderma, Trichothecium, Penicil-
lium, Stachybotrys и особенно виды рода Aspergillus.
P-Глюкозидазы образуют бактерии, дрожжи, грибы. Наиболее
активными продуцентами р.-глюкозидаз являются грибы, принад-
лежащие к родам Trichoderma и Aspergillus.
2.4.2. Механизм действия и свойства гемицеллюлез
Субстрат. Субстратами для гемицеллюлаз являются гемицел-
люлозы, которые образуют основу клеточных оболочек. Гемицел-
люлозами в отличие от целлюлоз называются те полисахариды
клеточных оболочек, которые растворяются в концентрированных
щелочах (17%-ный раствор NaOH и 24 %-ный КОН). Гемицел-
люлозы наряду с пектиновыми веществами образуют основное ве-
щество (матрикс) клеточных оболочек. Из всех гемицеллюлоз
только очень немногие виды ксиланов, глюканов и маннанов име-
ют фибриллярное строение, например глюкоманнаиы некоторых
водорослей. Остальные же гемицеллюлозы имеют ветвистое строе-
ние и поэтому не могут образовывать фибриллы. Эта группа по-
лисахаридов, разнородная по строению, молекулярной массе и
составу, при гидролизе дает довольно разнообразный набор соеди-
нений: глюкозу, фруктозу, маннозу, галактозу, ксилозу, арабино-
зу, глюкуроновую и галактуроновую кислоты.
Последовательность соединения отдельных остатков сахаров
в гемицеллюлозах стерически близка, например глюкоза — глю-
куроновая кислота — ксилоза и галактоза — галактуроновая кис-
лота — арабиноза. В уроновых кислотах первичная спиртовая
группа может быть окислена в карбоксильную, которая может де-
карбоксилироваться и давать начало для образования пентоз и
пентозанов. Этим объясняется образование галактоарабанов, глю-
куроноксиланов, галактоманнанов, глюкуроноарабиноксиланов
и т. д.
Аморфная структура этих полисахаридов объясняется тем, что
наряду с р-1,4-связью, лежащей в основе образования линейных
полимеров, в молекулах гемицеллюлоз довольно часто встречают-
ся ответвления от основной цепи по р-1,3- и р-1,6-связям, что дает
начало образованию ветвящихся и спиральных структур. Кроме
того, включение в состав соединения уроновых кислот влечет за
собой возрастание гидратационных свойств, что делает невозмож-
ным образование кристаллических структур в водной среде. К ге-
мицеллюлозам многие относят только глюканы, ксиланы и ара-
217
баны, а вещества, содержащие маннозу, фруктозу, галактозу и
галактуроновую кислоту, — к слизевым веществам, гумми- и пек-
тиновым веществам. Неустойчивость трактовки понятия «гемицел-
люлозы» связана со сложностью их строения и трудностью фрак-
ционирования на индивидуальные вещества.
Главное различие гемицеллюлоз и гумми-веществ заключается
в том, что истинные гемицеллюлозы растворимы только в щело-
чах, а гумми-вещества, растворяются также в теплой воде, обра-
зуя вязкие растворы.
Правильнее все гемицеллюлозные вещества разделить на две
группы: р-глюканы и пентозаны, а гумми-вещества рассмотреть
отдельно.
р-Г л ю к а н ы. Эти вещества являются высокомолекулярными
полимерами и при полном гидролитическом расщеплении образуют
одну глюкозу. р-Глюканы широко распространены в природе. Они
входят в состав многих растений, водорослей, мхов, лишайников и
микроорганизмов. По структуре р-глюканы могут быть линейными
и разветвленными. р-Глюканы ячменя представляют почти линей-
ные полисахариды, где остатки глюкозы почти на 70 % соединены
Р-1,4- и р-1,3-связями (около 30%), которые могут в цепи быть
только одиночными.
В природе есть разветвленные р-глюканы, имеющие р-1,6-глю-
козидные связи. К таким Р-глюканам относятся ламинарии н па-
химан. Есть р-глюканы, где есть все виды связей: р-1,3-; р-1>,4- н
Р-1,6. Один из таких р-глюканов получил название курулан. Моле-
кулярная масса р-глюканов варьирует в широких пределах — от
2 000 до 20 000.
Пентозаны. Пентозаны имеют ветвистое строение, они со-
стоят из остатков ксилоз, арабиноз н небольшого количества ос-
татков галактуроновой кислоты. Основной тип связей — Р-1,4-,
а в местах ветвления — р-1,3-связь. В концевой цепи ветвлений
могут быть остатки арабинозы. Молекулярная масса пентозанов
различна, она может варьировать от 7 900+500 до 58 800±200.
Гумми-вещества. Эти соединения близки по своему со-
ставу к гемицеллюлозам (Р-глюкану и пентозанам). Считается, что
они являются либо продуктами незавершенного синтеза гемицел-
люлоз, либо продуктами их частичного гидролиза.
По данным литературы, гумми-вещества состоят из глюкозы,
галактозы, иногда маннозы, ксилозы, арабинозы, рамнозы и остат-
ков уроновых кислот, т. е. тех же веществ, которые образуются
при гидролизе гемицеллюлоз.
Все гемицеллюлазные ферменты можно разделить на три груп-
пы: р-£)-глюканазы, р-ксиланазы и р-глюкозидазы.
p-D-Глюканазы. К p-D-глюконазам относят систему ферментов,
катализирующую расщепление р-глюканов с р-1,2-, р-1,3-, р-1,4- и
Р-1,6-связями. Согласно Номенклатуры ферментов (1979) в нее
входят шесть энзимов:
1,4-(1,3 : 1,4)-р-£>-г л ю к а н-4-гл ю к а но г и д р о л а з а (КФ
3.2.1.4). Это фермент, который имеет рабочее название целлюлаза,
218
или эндо-1,4-р-глюканаза. Он гидролизует р-1,4-глюкозидные связи
в целлюлозе, лихенине, р-глюканах зерна. Для этого фермента на-
личие в субстрате р-1,3-связей не является препятствием. Разрыв
связей происходит беспорядочно в определенном удалении от кон-
цов молекулы, т. е. этот фермент имеет эндогенный механизм воз-
действия на субстрат;
1,3-(1,3 : 1,4)-р-Д-г л юка н-3(4)-глюкаиогидролаза (КФ
3.2.1.6). Этот фермент имеет рабочие названия: эндо-1,3(4)*р-глю-
каназа, ламинариназа, эндо-1,3-глюканаза. Фермент эндогенно
катализирует гидролитическое расщепление внутренних р-1,3- или
р-1,4-связей в р-глюкаиах, у которых глюкозный остаток, чья ре-
дуцирующая группа участвует в образовании гидролизуемой свя-
зи, сам замещен в положении Сз. Субстратом для действия этого
фермента являются ламинарии, лихенин и р-глюканы зерна;
1,3-р-£)-гл юк а нгл ю к а н оги д р о л а з а (КФ 3.2.1.39). Этот
фермент называется, как и предыдущий, эндо-1,3-р-глюканазой,
ламинариназой. Но у него есть некоторые отличия от фермента
КФ 3.2.1.6. Он гидролизует преимущественно 1,3-р-глюкозндные
связи в 1,3-р-Д-глюкаиах и очень ограниченно гидролизует эти же
связи в глюканах, где есть как р-1,3-, так и р-1,4-связи. Этот фер-
мент гидролизует в основном ламинарии, парамилон и пахиман;
1,3-1,4-р-Р-гл ю к а и-4-г л ю к а ноги д р о л а з а (КФ 3.2.1.73).
Этот фермент имеет рабочее название лихеназа; он гидролизует
1,4-р-глюкозидные связи в p-D-глюканах, имеющих 1,3- и 1,4-свя-
зи. Фермент гидролизует лихенин и р-£)-глюканы зерна, но не дей-
ствует на р-£)-глюканы, содержащие только р-1,3- или р-1,4-связи;
1,6-р-Д-гл ю к а я гл ю к а ноги д р о л а з а (КФ 3.2.1.75). Этот
фермент в литературе известен под названием эндо-1,6-р-глюкана-
за. Он беспорядочно гидролизует р-1,6-связи внутри молекулы
субстрата. Субстратом для действия фермента являются 1,6-р-£>-
глюканы, такие, как лЮтеан, пустулан и 1,6-олиго-а-£>-глюкозиды;
1,2-р-£>-г л ю к а н г л ю к а ноги д р о л а з а (КФ 3.2.1.71). Реко-
мендуемое название этого фермента эндо-1,2-р-глюканаза. Его от-
личительной особенностью является каталитическое расщепление
внутримолекулярных р-1,2-связей в 1,2-р-£)-глюканах.
Р-£)-Глюканазы — весьма разнородный комплекс ферментов,
составляющие которого отличаются по многим признакам. Моле-
кулярные массы, изоэлектрические точки, гидролитические способ-
ности этих ферментов, по данным различных исследователей, силь-
но различаются. Молекулярная масса эндо-1,4-р-глюканаз нахо-
дится в пределах 20 000—70 000; по другим данным, эндо-1,3-р-глю-
каназы имеют молекулярные массы от 16 000 до 60 000.
Все р-глюканазы являются кислыми белками, содержащими
большое количество дикарбоновых кислот и оксиаминокислот.
Эти ферменты являются гликопротеидами, они имеют углеводный
фрагмент, содержащий маннозу, галактозу, глюкозу.
По данным Н. А. Родионовой и многих других исследователей,
Р-глюканазы, особенно микроскопических грибов, имеют множест-
венные формы, отличающиеся по способу гидролиза субстратов,
219
субстратной специфичности, набору аминокислот, структуре самой
молекулы, молекулярной массе, оптимальному pH, изоэлектриче-
ским точкам и т. д.
Объединяет же всю эту группу их способность к гидролитиче-
скому расщеплению внутримолекулярных глюкозидных связей в
Р-глюканах различного происхождения.
р-Ксилаиазы. К 0-ксиланазам относится система ферментов,
катализирующих расщепление р-глюкозидных связей в р-ксиланах.
Согласно перечню ферментов, приведенному в Номенклатуре,
к этой группе можно отнести несколько ферментов:
1,4-р-£>-кс и л а нкси л а ноги д р о л а з а (КФ 3.2.1.8). Рабочее
название фермента эндо-1,4-ксиланаза. Он катализирует реакцию
гидролитического расщепления 1,4-р.-ксилозидных связей в ксила-
нах;
1,3-р-£)-кси л а н кс и л а но г и д р о л а з а (КФ 3.2.1.32). Иначе
этот фермент называется ксиланазой, эндо-1,3-р-ксиланазой. Фер-
мент беспорядочно гидролитически расщепляет внутримолекуляр-
ные 1,3-р-£)-ксилозидные связи в 1,3-р-£)-ксиланах;
1,4-р-£)-к си л а н кси л оги д р о л а з а (КФ 3.2.1.37). Фермент
имеет рабочее название экзо-1,4-р-ксилозидаза, а также названия
ксилобиаза и р-ксилозидаза. Он гидролизует 1,4-р-£)-ксиланы пу-
тем последовательного отщепления с нередуцирующего конца мо-
лекулы полисахарида остатка £)-ксилозы. Этот фермент также>гид-
ролизует ксилобиозу до £)-ксилозы;
а-А-а рабинофуранозидарабинофураногидрола-
за (КФ 3.2.1.55). Рабочее название фермента а-А-арабинофурано-
зидаза, а также арабинозидаза. Он катализирует гидролиз послед-
ней с нередуцирующего конца связи в молекуле а-арабинозидах,
отщепляя а-Л-арабинозу в фуранозной форме. Фермент действует
на а-7.-арабинофуранозиды, a-L-арабинаны, содержащие 1,3- и
(или) 1,5-связи, на арабиноксиланы и арабиногалактаны;
1,3-р-кс ил а н кси л ог и д р о л а з а (КФ 3.2.1.72). Рабочее на-
звание фермента экзо-1,3-р-ксилазидаза. Фермент последователь-
но отщепляет с нередуцирующего конца молекул 1,3-р-£)-ксиланов
остатки ксилозы.
У большинства микроорганизмов — продуцентов ксиланаз най-
дено два типа ферментов, гидролизующих основную цепь ксила-
нов: это эндо-1,4-р-ксиланазы и экзо-1,4-р-ксилозидазы. Молеку-
лярная масса эндо-1,4-р-ксиланаз лежит в пределах от 16 000 до
50 000. Молекулярная масса экзо-1,4-р-ксилозидаз варьирует до-
статочно сильно в зависимости от вида продуцента, примерно от
30 000 до 100 000, но она, как правило, несколько выше, чем у
эндо-1,4-р-ксиланаз. Чаще всего оптимум действия ксиланаз на-
блюдается при pH от 4 до 7 и при температуре от 30 до 50°C.
В составе ксиланаз найдено большое количество кислых и арома-
тических аминокислотных остатков. В большинстве своем эти фер-
менты — гликопротеиды.
При изучении ксиланаз на различных субстратах было уста-
новлено, что по механизму воздействия на арабиноксиланы, ара-
220
биноглюкуроноксиланы и ксилоолигосахариды их можно подраз-
делить на две группы: ферменты, гидролизующие а-1,3-связь, рас-
положенную между ксилозой и арабинозой; ферменты, не отщеп-
ляющие арабинозу от арабиноксиланов, арабиноглюкуроноксила-
нов и олигосахаридов.
Установлено, что для многих ксиланаз ветви, содержащие ара-
бинозу и глюкуровую кислоту являются стерическим препятстви-
ем для образования фермент-субстратного комплекса ксилан —
ксиланаза. Образующиеся при ферментативном гидролизе ксила-
нов ксилоолигосахариды (ксилобиоза и ксилотриоза) часто явля-
ются препятствием для дальнейшего гидролиза субстрата до кси-
лозы. Эти полупродукты гидролиза полисахарида выступают в ка-
честве факторов, тормозящих процесс дальнейшего гидролиза. По
данным М. С. Дудкина, Н. А. Родионовой и др. (1980), ингибиру-
ющее действие ксилоолигосахаридов устраняется в присутствии
экзо-1,4-р-ксилозидазы, что связано с гидролизом ксилоолигосаха-
ридов до ксилозы, т. е. проявляется суммарный эффект воздейст-
вия двух ферментов на субстрат.
В литературе нет единого мнения о способности экзо-1,4-р-кси-
лозидаз самостоятельно гидролизовать ксиланы. Большинство ис-
следователей склонно считать, что экзо-1,4-0-ксилозидаза — это
типичная ₽-глюкозидаза, гидролизующая короткие цепи ксилооли-
госахаридов и 0-ксилозидов. Данные, которые свидетельствуют о
гидролизе ксиланов под действием экзо-1,4-р-ксилозидазы, вероят-
нее всего, являются результатом наличия в этих препаратах при-
месей эндоксиланаз. Экзо-1,4-₽-ксилозндазы гидролизуют ксилози-
ды и ксилоолигосахариды с нередуцирующего конца молекулы.
При этом скорость гидролиза возрастает с уменьшением степени
полимеризации олигосахарида; продуктом гидролиза является
0-ксилоза.
р-Глюкозидазы. В Номенклатуре ферментов р-глюкозидазы
представлены в группе КФ 3.2.1.21 «0-£)-Глюкозидглюкогидрола-
за». В литературе эти ферменты известны под названиями: ген-
циобиаза, амигдалаза и самое распространенное — целлобиаза.
р-Глюкозидаза — это фермент экзогенного действия. Она гидро-
литически расщепляет последнюю с нередуцирующего конца
р-1,4-связь в р-2)-глюкозидах, высвобождая р-Д-глюкозу. р-Глю-
козидаза проявляет широкую субстратную специфичность. Некото-
рые ферменты этой группы гидролизуют не только р-£)-глюкози-
ды, но и р-Б-галактозиды, а-Д-арабинозиды или p-D-ксилозиды.
2.4.3. Получение гемицеллюлазиых препаратов
В нашей стране гемицеллюлазные препараты в промышлен-
ных условиях получают поверхностным и глубинным способом на
основе четырех видов микроорганизмов: Trichothecium roseum
(Л. С. Салманова, 1982), A. awamori (Т. А. Черемнова, 1978),
A. foetidus (Р. Г. Месхи и др., 1983) и В. subtilis (Ю. А. Белогор-
цев, 1978). Необходимо также отметить, что все целлюлолитиче-
221
ские препараты включают комплекс гемицеллюлазных ферментов,
особенно с р-глюканазиой и целлобиазной активностью (см.
раздел 2.3).
Получение препаратов гемицеллюлаз из поверхностных куль-
тур. При поверхностном способе культивирования в промышлен-
ности в нашей стране используют в основном два продуцента:
A. foetidus и Т. roseum.
Питательная среда. Для Т. roseum прн разработке пи-
тательной среды в качестве компонентов испытывались различные
отходы, содержащие гемицеллюлозы: зерновая шелуха (рисовая,
ячменная, просяная, овсяная), овсяная лузга, пшеничные отруби,
кукурузные стержни, пивная дробина, солодовые ростки, автоли-
зат пивных осадочных дрожжей и ряд других компонентов, кото-
рые приведены ниже.
Состав питательной среды Активность фермен-
тов, ед./г
Зерновая шелуха (рисовая, ячменная, О
просяная, овсяная) + кукурузные стер-
жни
Зерновая шелуха -|- дрожжевой автоли- 8,2—16,0
зат
Зерновая шелухадрожжевой авто- 14,8—19,3
лизат + пивная дробина
Зерновая шелуха 4- дрожжевой автоли- 19,7—24,8
зат -|- солодовые ростки
Пшеничные отруби 20,6
Пшеничные отруби + солодовые ростки 22,2
Солодовые ростки 27,5
Зерновая шелуха + пшеничные отру- 22,0
би солодовые ростки
Наилучшие результаты были получены на солодовых ростках.
На заводе используется среда следующего состава (в %): зерно-
вая шелуха — 45; солодовые ростки — 45; дрожжевой автолизат
влажностью 60 % — Ю (или без него); pH среды 5—5,5. Длитель-
ность культивирования 50—65 ч, температура 23—25 °C (рис. 2.34).
Так как среда содержит очень мало легкоусвояемых углево-
дов, то тепловыделение культуры в процессе роста в 3,5—4 раза
Таблица 2.25
Состав питательной среды, % Ферментативная активность, ед./г
Пшенич- ные отруби Другие компоненты Р-Глюка- иаза Ксиланаза ^-Глюкозидаза
50 Свекловичный жом, 50 260 380 102 70 То же, 30 286 490 80 50 Биошрот A. foetidus-26 50 226 340 118 70 То же 30 240 400 128 50 Биошрот A. oryzae И-476 50 232 320 100 70 То же, 30 226 390 125
222
ниже, чем при выращивании иа
пшеничных отрубях, и есть воз-
можность увеличить слой среды
до 4—5 см. Из-за небольшого по-
требления нз среды питательных
веществ выход готовой культуры
очень высокий — 83—90%. Пос-
ле окончания роста культуры из
нее можно получить технический
препарат с индексом Пх, а после
экстракции ферментов и осажде-
ния спиртов — препараты с ин-
дексом ШОх.
Высокоактивным продуцентом
всего комплекса гемицеллюлаз-
ных ферментов является гриб
A. foetidus Д-73. Для этого про-
дуцента также было испробовано
очень много вариантов питатель-
ных сред, наилучшне из которых
представлены в табл. 2.25.
Рис. 2.34. Влияние длительности
культивирования Т. roseum на био-
синтез гемицеллюлаз иа твердой пи-
тательной среде (по данным
Л. С. Салмановой, 1982)
Как следует из табл. 2.25, обогащение сред ферментализатами
биошротов и минеральными источниками азота и фосфора позво-
ляет повысить биосинтез гемицеллюлаз на 25—40%.
Условия культивирования. Изучение влияния раз-
личных условий культивирования на биосинтез культурой гемицел-
люлаз A. foetidus Д-73, таких, как влажность и pH среды, темпе-
ратура роста н длительность выращивания, позволило установить
их оптимальные параметры (рис. 2.35) и осуществить в нашей стра-
не производство препаратов с индексом Пх и очищенных гемицел-
люлазных препаратов с индексом ШОх.
Выделение ферментов. Процесс состоит из экстрагиро-
вания ферментов из поверхностной культуры, очистки и кон-
го 20 30 40 50
Тенпература, 'С
S
Рис. 2.35. Влияние влажности среды (а), pH (б), температуры (в) и длитель-
ности культивирования (г) A. foetidus Д-73 иа биосинтез ферментов (по данным
Р. Г. Месхи, К. А. Калуиянца, 1983):
1 — кснлаиаза; 2 — Р-глюканаза; 3 — Р-глюкозидаза
Длительность
культиДиробания, ч
г
223
Рис. 2.36. Влияние температурного
режима сушки распылением экстракта
из поверхностной культуры A. foeti-
dus 45:
1 — Р-глюканаза; 2 — ксиланаза; 3 — Р-
глкжоэндаза
центрирования экстракта мето-
дом ультрафильтрации до содер-
жания сухого вещества в кон-
центрате 14%, сушки концент-
рата со стабилизаторами мето-
дом распыления (рис. 2.36) с
получением препарата ПЗх.
При осаждении ферментов из
концентрата этиловым спиртом
(концентрация в реакционной
среде 80%) получают препара-
ты с индексом П10х.
Характеристика ферментного
комплекса препарата ксилоглю-
канофоетидина ПЮх представ-
лена в табл. 2.26.
Данные этой таблицы пока-
зывают, что A. foetidus Д-73 об-
разует богатый комплекс фер-
ментов, которые активно рас-
щепляют не только гемицеллю-
лозы, но и также целлюлозы,
крахмал, белки, пектиновые ве-
щества.
Следует отметить, что этот продуцент очень перспективен для
промышленного внедрения, так как он содержит весь комплекс
ферментов, действующих на клеточный «матрикс» растений. Это
четко видно из конкретных данных таблицы 2.26. Наличие такого
комплекса открывает реальные возможности широкого применения
этого препарата в биотрансформации различных растительных от-
ходов, а именно, отходов сельского хозяйства и пищевой промыш-
ленности, плодо- и овощеперерабатывающих предприятий, отходов
животноводства и т. д.
Этот препарат прошел успешную апробацию при создании но-
вых прогрессивных технологий в существующих производст-
вах, перерабатывающих растительное сырье, и в кормопро-
изводстве.
Здесь уместно было бы отметить, что в перерабатывающих рас-
тительное сырье производствах ранее для характеристики такого
рода препаратов использовался специфический термин «цитаза».
Он предусматривает наличие в препаратах комплекса ферментов,
способного гидролизовать клеточные стенки в растительной ткани.
В этом комплексе рассматривали три группы ферментов: гемицел-
люлазы, пектиназы и целлюлазы. Сейчас этот термин продолжает
широко применяться только в технологии бродильных производств,
в других же отраслях он практически не применяется. Классиче-
ским примером таких цитолитических препаратов могут быть
цитороземин и ксилоглюканофоетидин с индексами Пх
и ПЮх.
224
Таблица 2.26
Определяемая активность ферментов* Субстрат Величина активности, ед./г
Р-Глюканазная Ячменный Р-глюкаи 4462
Лихенин 2560
Эндо-Р-глюкаиазная Ячменный Р-глюкаи 242
Эндо-1,4-Р-глюкаиазная (вискозиметри- Na- КМ-целлюлоза 420
ческий метод определения) Эндо-1,4-Р-глюкаиазная (по количеству То же 640
образовавшейся глюкозы) Ксилаиазная Арабииоксилан из шелухи 5900
овса 4-Метилглюкуроноксилаи дре- 2565
Ci-активиость весины березы Хлопковое волокно 35
Р- Г люкозидазная Р-1,4-глюкозидазная (целлобиаза) Целлобиоза 1536
арил-Р- глюкозидазная л-Нитрофеиил-Р-О-глюкопи- 1590
Протеолитическая (ПА) ранозид Казеин а натрия 30
Осахаривающая (ОС) Крахмалт 2150
Пектолитическая (ПкА) Пектин 103
* Один н те же активности определялись на различных субстратах, и величины нх получа-
ются совершенно разные. Поэтому сопоставление данных литературы по этой группе ферментов
крайне затруднено.
Получение препаратов гемицеллюлаз из глубинных культур.
При глубинном способе культивирования используются продуцен-
ты, которые синтезируют какую-то определенную группу фермен-
тов гемицеллюлазного комплекса, например р-глюканазы —
В. subtilis, В. circulans и др., ксиланазы — Т. roseum, A. awamori
и др.; р-глюкозидазы — Geotrichum candidum, Т. viride и др.
Учитывая то, что для получения гемицеллюлаз используются
разнообразные продуценты, компоненты среды также очень раз-
личны. Однако можно выделить некоторые общие подходы к со-
ставлению сред.
Источники углерода. Для биосинтеза р-глюканаз, как
об этом говорилось в предыдущей главе, в состав среды должны
входить поли- или олигосахариды, имеющие р-1,4-связи, модифи-
цированная целлюлоза, р-глюкан. Стимулирующее влияние оказы-
вают также ксилоза, мальтоза, сахароза, целлобиоза, крахмал,
пектиновые вещества.
Введение в состав среды ячменного солода, пшеничных отру-
бей, солодовых ростков, соломы, молочной сыворотки, свеклович-
ного жома и др., а также продуктов их частичного гидролиза обес-
печивает необходимый уровень углеродсодержащих соединений и
способствует биосинтезу ферментов, гидролизующих гемицеллю-
лозы (табл. 2.27).
8. Зак. 232 оое
Таблица 2.27
Компонент— источник углерода Активность р-глюканазы (в ед./мл) в зависимости от концентрации компонента, %
1.0 1,5 2,0 2,5 3,0 3.5
Ячменный солод — 5,4 7,8 10,2 7,1 6,7 Солодовые ростки — 2,2 5,2 8,9 6,8 5,9 Кормовые дрожжи — 9,0 9,3 10,6 10,5 10,0 Исландский мох +0,75 % яч- 4,5 10,1 7,0 — — —
менного солода
По данным ряда авторов, введение в состав среды частично
разрушенных клеточных оболочек дрожжей или других микроор-
ганизмов стимулирует синтез 0-глюкаиаз. Вероятно, этот эффект
связан с наличием в клеточной стенке микроорганизмов ламииа-
рииа, лютеаиа, пахимаиа и других соединений, стимулирующих
биосинтез микроорганизмом 0-глюкаиаз. Для синтеза ксилаиаз в
составе среды в качестве источника углерода используются прак-
тически те же самые компоненты. Ксилаиазы образуются иа сре-
дах, содержащих кукурузные стержни, чиигалак хлопчатника, свек-
ловичный жом, автолизаты дрожжей и мицелия грибов, соевую
муку и т. д.
При биосинтезе 0-глюкозидазы благоприятно сказывается при-
сутствие в составе среды субстрата для действия 0-глюкозида-
зы — целлобиозы. Однако фермент так же активно синтезируется
иа средах с лактозой, крахмалом, метил-0-глюкозидом и другими
веществами и компонентами, используемыми в средах для синте-
за всего комплекса гемицеллюлаз.
Источник азота. Источник азота практически может быть
любым, и выбор его зависит от продуцента, его физиологических
особенностей. Азот может быть неорганическим или поставляться
за счет органических соединений. Чаще всего используют соли
KNO3, NaNO3, NH4NO3, (ГЧН^гНРОч, автолизаты микробных био-
масс и т. д. Необходимо в каждом конкретном случае экспери-
ментально подбирать источник азота. Наиболее оптимальные ва-
рианты представлены ниже.
Источник азота
(NH4)2HPO4
NH4NOs
»+
NaNO.
NH2CoNH2
(NH2)2CoNOs
KNO,
(NH4)2HPO4+ гидролизат
кормовых дрожжей
Р-Глюкаиазиая
активность, ед./мл
10,7
8,2
6,2
3,2
3,2
4,3
5,7
2,5
15,7
226
Источники минеральных веществ. Продуценты ге-
мицеллюлаз весьма чувствительны к наличию в среде ионов ме-
таллов. Иоиы калия, никеля, лития, магния, кальция, натрия, ко-
бальта, марганца в концентрациях до 1-Ю-3 практически не влия-
ют или оказывают стимулирующее воздействие иа биосинтез ге-
мицеллюлаз. В то же время иоиы свинца, меди, серебра и ртути
угнетают биосинтез, а в ряде случаев полностью его ингибируют.
Минеральное питание должно определяться экспериментально
для каждого вида продуцента.
Условия культивирования. Для получения препара-
тов из Т. roseum в качестве посевного материала применяют ми-
целиальную массу гриба, находящегося в экспоненциальной фазе
роста, в количестве 6—10% об. Для В. subtilis 402 посевной ма-
териал для глубинной ферментации готовят поверхностным спосо-
бом иа мелкоиарезаииом картофеле до обильного спорообразова-
ния (длительность культивирования 3—4 сут) при температуре
37 °C (по данным Ю. А. Белогорцева, 1978). Такой посевной ма-
териал подается в ферментационную среду из расчета 0,04—0,06 %
по массе к объему.
При использовании в качестве продуцентов Aspergillus foeti-
dus и A. awamori посевной материал готовят в виде спороиосящей
пленки, выращенной иа жидкой питательной среде, авизирован-
ных средах и твердых сыпучих средах. Наилучшие результаты для
A. foetidus получены иа среде, состоящей из агаризироваииой сме-
си экстрактов (АСЭ) из пшеничных отрубей и солодовых ростков
(по данным О. Н. Быковой и др., 1983). Отличительная особен-
ность этого посевного материала заключается в его исключитель-
ной стабильности при хранении (рис. 2.37).
Доза посевного материала также оказывает существенное влия-
ние иа образование культурой ферментов (рис. 2.38). Из рисунка
видно, что оптимальная доза по числу коиидий для двух проду-
центов гемицеллюлаз отличается в 6 раз. Но доза посевного ма-
Рнс. 2.37. Стабильность посевного ма-
териала A. foetidus при хранении (по
данным О. Н. Быковой, Т. Б. Чер-
иягииой и др., 1983):
t — на АСЭ: 2 — на сыпучей среде Хз
отрубей и солодовых ростков
Рис. 2.38. Влияние количества коии-
дий гриба иа биосинтез 0-глюкаиазы:
1 — A. foetidus (по данным О. Н. Быко-
вой в др., 1983); 2— A. awamori (по
данным Т. А. Черемновой, 1978)
227
териала может зависеть ие только от вида продуцента, но и от
концентрации питательных веществ в ферментационной среде,
особенно источников углерода (табл. 2.29).
Таблица 2.29*
Концентрация источника углерода в среде, % Активность глкжаназы в зависимости от количества конидий на 100 мл питательной среды, % от максимальной
1,2-10* 3,6-10* 6-10* 8,4-10*
1 14,6 13,5 12,2 6,9
3 56,1 80,7 100,0 87,3
5 52,8 67,4 86,4 98,7
* По данным О. Н.Быковой н др., (1983).
Физиологические особенности каждого продуцента определяют
продолжительность выращивания микроорганизма и образования
им гемицеллюлаз. Во многом этот показатель определяется со-
ставом среды и ее концентрацией. Так, для A. foetidus — проду-
цента р-1,3: 1,4-глкжаназы наивысшая активность в культураль-
ной жидкости отмечается в период 64—66 ч роста культуры (рис.
2.39). Для В. subtilis 402 максимум образования р-глюканазы на-
блюдается в культуральной жидкости на 24—30 ч роста культуры,
а при дробном введении основного субстрата длительность про-
цесса сокращается до 17—18 ч (рис. 2.40).
На длительность культивирования оказывает большое воздей-
ствие не только вид продуцента, но и pH среды. Для грибных
культур — продуцентов гемицеллюлаз начальный pH среды обыч-
Рис. 2.39. Динамика изменения pH
(2) и накопления 3-1,3 : 1,4-глюканазы
(/) в процессе глубинного культиви-
рования A. foetidus (по данным
О. Н. Быковой, О. Н. Соседова и
др., 1984)
Рис. 2.40. Накоплеине р-глюканазы
В. subtilis 402 при дробном введе-
нии источников питания (по данным
Ю. А. Белогорцева, 1978):
/ — активность (З-глюкаиазы (АГ); 2 —
редуцирующие вещества среды (РВ);
3 — биомасса (Б)
228
но слабокислый — от 4,8 до 5,3. Затем происходит резкий сдвиг
в кислую зону pH — до 2,5—3,0 и только в самом конце наблюда-
ется небольшой подъем pH на 0,3—0,5 (см. рис. 2.39, кривая 2).
При культивировании бактерий исходный pH лежит в нейтраль-
ной зоне (около 7,0); в течение первых 12—20 ч он несколько по-
нижается — до 6,2—6,4, а затем происходит подщелачивание до
pH 7,0—7,3. Снижение pH иа первом этапе культивирования вы-
зывает подавление биосинтетической способности бактериальных
продуцентов, поэтому рекомендуется подтитровка среды или вве-
дение подпитки с более высоким значением pH (табл. 2.30). В таб-
Таблица 2.30
Исходное значение pH питательной среды, взятой для добавления pH среды после добавления Конечное значение pH Активность 0-глюканаэы, % от максимальной
5,9 6,о 6,2 27,3
6,8 6,5 6,8 37,4
7,3 7,0 6,9 52,5
7,5 7,2 6,9 61,1
7,8 7,3 7,0 92,1
8,0 7,5 7,1 100,0
8,9 8,2 7,7 52,3
лице приводятся данные по изменению pH при доливе среды и
влиянию этой операции на накопление р-глюканазы в среде. До-
бавление среды проводится на 8—10 ч роста культуры, когда на-
чальное значение pH снижается с 6,7 до 6,2.
Из таблицы четко видно, что варианты 5 и 6 обеспечивают наи-
высший синтез гемицеллюлаз, поэтому для бактериальных про-
дуцентов совершенно необходимо поддержание pH на уровне сла-
бощелочных и нейтральных значений. Повышение pH для гриб-
ных культур не приводит к положительным результатам.
Большое влияние на биосинтез гемицеллюлаз оказывает аэра-
ция среды, которая обеспечивает интенсивный рост культуры. Из-
вестно, что параметры аэрации зависят от состава среды, ее вяз-
кости и массообменных характеристик ферментатора, поэтому
сложно давать обобщенные рекомендации. Так, для культуры
В. subtilis 402 при выращивании в ферментаторе вместимостью
1,5 м3 с коэффициентом заполнения 0,5 на среде, состоящей из
4 % гидролизата БВК, 2 % ячменного солода, 0,4 % (NH4)2HPO4
и других солей они следующие (табл. 2.31).
Данные таблицы показывают, что максимальное образование
р-глюканазы соответствует скорости растворения кислорода
1,95 г/(л-ч). Однако микроскопические исследования показали,
что культура более интенсивно растет, если показатель скорости
растворения кислорода несколько ниже и равен 1,42. Изучение
этого процесса позволило разработать оптимальный режим аэра-
ции, который позволил получать активность до 80—90 ед./мл. Он
229
Таблица 2.31
Количество
подаваемого воздуха
в ферментатор,
л/мин
Скорость
растворения
кислорода.
г/(л-ч)
Активность
р-глюканазы.
ед./мл
300 0,92 28,2
400 1,38 40,1
500 1,42 56,0
600 1,95 63,7
700 2,25 47,0
заключается в том, что в течение первых 8—10 ч создаются опти-
мальные условия для роста культуры (подача воздуха около
500 л/мин), затем аэрация усиливалась до 600 л/мин и после 12 ч
роста дополнительно включалось устройство для перемешивания
среды (около 200 мин-1)- Эти мероприятия позволили увеличить
продуктивность штамма на 26—41 %.
Все используемые в производстве продуценты образуют слож-
ный комплекс гемицеллюлазных ферментов, который в зависимо-
сти от состава может быть использован для самых разных целей.
Выделение ферментов. Препараты гемицеллюлаз мож-
но получать путем осаждения органическими растворителями, ней-
тральными солями и при использовании различных видов хрома-
тографии.
На полноту осаждения гемицеллюлаз оказывают заметное
влияние следующие условия: pH ферментного раствора, концент-
рация сухого вещества, отношение ферментного раствора к ор-
ганическому растворителю, наличие стабилизаторов, ингибиторов
и т. д.
Рис. 2.41. Влияние pH среды (а) и соотношения
растворителя (б) иа полноту осаждения фермен-
тов из культуральной жидкости В. subtilis 402:
/—изопропиловый спирт; 2 —ацетон; 3 — этиловый
спирт
230
На примере В. subtilis
402 — продуцента эндо-р-
глюканазы можно просле-
дить ряд таких зависимо-
стей (рис. 2.41). Из рисун-
ка видно, что наиболее
полно р-глюканаза перехо-
дит в осадок под действием
изопропилового спирта
(1 :4,5) при pH 4,3, когда
можно перевести в осадок
до 93—94 % исходно-
го фермента в активном со-
стоянии.
Вопросам выделения и
очистки различных фер-
ментов комплекса геми-
Рис. 2.42. Фракционирование 1,3-Д-глюка-
иаз иа сефадексе G-75 (по данным
И. В. Зайкиной, 1985):
1 — белок (Ояо); 2 — 1,3-глюкаиазы (I. II
и III)
целлюлаз посвящено очень
много работ. Схема выделения гемицеллюлаз мало отличается от
общепринятой процедуры очистки и разделения ферментов. В ка-
честве примера можно привести исследования по очистке 1,3-Р-
глюканазы гриба G. canaidutn Зс, которые в обобщенном виде
представлены в табл. 2.32 и на рис. 2.42.
Большинство глюканаз имеет множественные формы, которые
отличаются по ряду свойств и удельной активности. Так, из
Таблица 2.32*
Этап очистки Белок, мг Активность 1,3-р-глкжанаэ Выход, % Степень очистки
суммарная, ед./мг удельная, ед./мг белка
Исходный ферментный препарат 2900,00 7040 2,4 100,0 1
Амииосилохром 170,00 4220 24,8 60,0 10,3
Акрилекс Р-150 Сефадекс G-75 Глюкан азы 24,00 1180 49,2 16,8 20,5
1 4,10 140 34,1 2,0 14,2
П 0,64 98 153,1 1.4 63,8
III Биогель Р-300 Глюкаиазы 0,36 290 805,5 4,1 335,6
I 1,40 64 45,7 0,9 19,0
II 0,15 41 273,3 0,6 113,8
III Дополнительные этапы очистки глюкаиазы I 0,16 136 850,0 1,9 354,1
ДЭАЭ-сефадекс А-50 0,29 18 62,0 0,25 25,8
Сефадекс G-200 0,14 8 57,1 0,10 23,8
* По данным И. В. Зайкиной, Н. А. Тиуновой и др. (1985).
231
табл. 2.32 видно, что из G. candidum Зс выделено три типа глюка-
наз (I, II и III). Они все относятся к экзо-1,3-0-глюканазам, но
отличаются молекулярными массами, которые соответственно рав-
ны 88 000, 100 000 и 105 000.
1,3- 0-Глюканазы отличаются н изоэлектрическими точками.
Глюканазы I, II и III из G. candidum в кислой зоне имеют pl со-
ответственно 3,7; 4,0 и 4,3. Эти глюканазы несколько отличаются
по своей субстратной специфичности (табл. 2.33).
Таблица 2.33*
Субстрат Тип связи Гидролитическая активность, % от максимальной (по ламннарану)
I П И!
Ламиварав 0-1,3 100,0 100,0 100,00
Глюкан из дрожжей 0-1,3; 0-1,6 4,7 4,5 4,90
Лихенив 0-1,3; 0-1,4 1,3 1.6 1,50
Глюкав из ячменя 0-1,3; 0-1,4 0 0 0
Na-карбоксиметилцеллюлоза 0-1,4 0 0 0
Пустулав 0-1,6 0 0 0
Целлобиоза 0-1,4 0 0 0
Гевтиобвоза 0-1,6 0 0 0
Ламиваритрноза 0-1,3 59,0 48,7 45,40
Ламинарибвоза 0-1,3 0,5 0,1 0,03
* По данным И. В. Зайкиной, Н. А. Тиуновой и др. (1985).
Из таблицы видно, что все три глюканазы высоко специфичны
к глюканам, в которых преобладают 1,3-0-связи, проявляя наи-
Рнс. 2.43. Влиявие pH (а), температуры (б) ва активвость глюкаваз I,
II в III G. candidum Зс и их стабвльвость (в) при экспозвции в течевие
1 ч при pH 4,7 при развых температурах
232
большое сродство к 1,3-₽-глюкаиламинарану. Такие полисахариды,
как 1,6-р-глюканпустулан и 1,4-0-глюкан, КМ-целлюлоза глюкана-
зами I, II и III практически не гидролизуются. По физическим
свойствам эти глюканазы достаточно близки (рис. 2.43), правда,
глюкаиаза I более термостабильна, чем другие (рис. 2.43, в).
Подобного рода исследования для самых различных микроор-
ганизмов широко представлены в литературе. Все онн свидетель-
ствуют о миогобразии гемицеллюлаз и о том, что данный комп-
лекс очень сложен и до конца не изучен, хотя его практическая
значимость очень велика.
2.5. ЛИПОЛИТИЧЕСКИЕ ПРЕПАРАТЫ
Липазы представляют большой нвтерес для мвогвх отраслей вародвого
хозяйства, где веобходвм частвчвый влв полвый гидролвз жвров в масел.
Овн могут вайтв првмевевне в пвщевой в легкой промышлевиоств, сельском
хозяйстве, медвцвве, в бытовой хвмвв, коммувальвом хозяйстве в в авалвти-
ческой практвке. Одвако шврокого првмевевня мвкробвые лвпазы ве имеют.
Актввво используют липазы жввотвого и реже мвкробвого происхождевии
в медицине как терапевтическое средство в в медвцииской диагностике. Есть ра-
боты, указывающие ва положвтельвый эффект, прв првмевеввв липаз в сырова-
реввв, при првготовлеввв безалкогольвых вапвтков. Завоевывает права граж-
давства вовая техвологвя прв провзводстве глвцервва, жврвых квслот, мово-
и диглицервдов с вспользовавием растворвмых и иммобилизоваввых мвкробвых
липаз. Большие надежды возлагают спецвалвсты ва вспользовавие лвпаз в
косметической промышленности, а также прв выделке мехов в кож. Использо-
вание липаз в этих отраслях позволяет легко удалить лвпнды, предавая коже
эластичность в мягкость, а мехам—ватуральвый блеск и высокое качество
структуры. Очевь актуальна в перспективе разработка термостабильвых в ще-
лочеустовчввых препаратов для использования в составе моющвх средств. Важ-
ва перспектива использования лвпаз для очнсткв сточвых вод от жвров прв пе-
реработке бытовых отходов в особевво длв очвстки кавалвзацвоввых комму-
никаций. Липазы можво также успешно использовать в сельском хозяйстве
прв приготовлеввв легкоусвояемых кормов в дли улучшеввя обмева веществ
у животных.
Широкое прнмевевве лвпаз в настоящее время сдерживается в осиоииом в
связи с отсутствием стабвльвых в высокопродуктивных микроорганизмов, ко-
торые можво было бы эффективно внедрять в производство.
2.5.1. Источники получения липаз
Липолитические препараты могут быть получены на основе
трех источников: животные ткаии, семена некоторых растений и
микроорганизмы. Источником животной липазы является подже-
лудочная железа. Она может быть выделена в комплексе с дру-
гими панкреатическими ферментами или в свободном состоянии.
Обычно она используется только для медицинских целей. Липаза
содержится в заметных количествах в семенах многих растений:
ржи, пшеницы, овса, сои, хлопчатника и особенно клещевины. От-
личительной особенностью липазы клещевины является то, что она
нерастворима в воде. Растительные липазы достаточно глубоко
изучались, но не с позиции получения их в виде препаратов, а с
позиции их влияния на хранение семян и процессы прорастания.
Наиболее перспективным источником липаз являются микро-
233
организмы, так как животное и растительное сырье ие может
удовлетворить растущую потребность в этих препаратах. Липазы
образуют очень многие микроорганизмы. Бактерии, как правило,
накапливают внутриклеточную липазу, а актиномицеты, грибы и
дрожжи — преимущественно внеклеточную. Средн бактерий най-
дены активные продуценты липаз, относящиеся к родам Pseudo-
monas, Bacillus, Acinetobacter, Propionibacterium, Chromobacteri-
um, Alcaligenes. Среди дрожжей лучшими продуцентами являются
представители рода Candida (С. lipolytica, С. paralipolytica, С. су-
lindraceae). Для промышленного использования чаще всего реко-
мендуются микроскопические грнбы. Высокая липазная актив-
ность отмечается у грибов родов: Geotrichum, Aspergillus, Mucor,
Rhizopus, Penicillium, Oospora и Humicola. Продуценты липаз
найдены и среди актиномицетов, среди которых можно назвать
виды Streptomyces flavogriseus, Thermoactinomyces vulgaris и ряд
других.
2.5.2. Механизм действия и свойства липаз
Субстрат. Субстратами для липаз являются липиды. Это слож-
ная смесь органических веществ, которая подразделяется на две
большие группы: сложные и простые липиды. К простым липидам
относятся липнды, не содержащие азота, фосфора и серы. Это
воски, днольные лнпиды, ацилглицерины (глицериды), алкиль-
ные липиды, нейтральные плазмалогены, гликолипиды. К слож-
ным липидам следует отнести сульфолипнды, ннозипол, глнцеро-
фосфолипиды, фосфорсодержащие плазмалогены, сфинголипиды,
состоящие из сфингомиелинов и гликосфннгомиелинов. Среди про-
стых лнпидов наиболее широко распространены простые нейтраль-
ные лнпиды, которые часто составляют до 95—97 % общей массы
лнпидов и, по существу, являются жирами. В состав жнров в ос-
новном входят триглицериды, но присутствуют также ди- и моно-
глицериды. Природные жиры содержат смешанные триглицери-
ды, в состав которых входят различные остатки карбоновых кис-
лот. В формировании триглицеридов может участвовать до 400 ос-
татков кислот различного строения. Поэтому состав жира неод-
нороден н очень сложен.
По Номенклатуре ферментов липаза имеет название триацил-
глнцеролацилгндролаза (КФ 3.1.1.3), ее рекомендуемое рабочее
название триацнлглнцероллипаза. Этот фермент имеет еще не-
сколько названий: стеапсин, трибутираза, липаза триглицеридов,
липаза.
Механизм липолиза. Фермент производит гидролитическое рас-
щепление трнацилглицерола до диацилглнцерола и остатка от-
щепляемой жирной кислоты. Затем идет отщепление следующих
остатков жирных кислот до образования глицерина. При этом
скорость отщепления кислотного остатка от трнацилглицерола в
несколько раз больше, чем от ди- и тем более от моноацилглице-
рола. Фермент проявляет наибольшее сродство к эфирной связи,
234
расположенной на внешней части молекулы трнацилглицерола.
Липазы различного происхождения проявляют сродство к опре-
деленным кислотным остаткам. Так, панкреатическая липаза об-
ладает высокой специфичностью к расщеплению связи с участием
остатка олеиновой кислоты, а связи, образованные пальмитиновой
кислотой, гидролизуются значительно медленнее и т. д. Установ-
лено, что липазы быстрее отщепляют остатки высокомолекулярных
жирных кислот, чем низшие карбоновые кислоты, т. е. нераство-
римые в воде субстраты.
Ферментативный гидролиз липидов имеет существенное отли-
чие от других ферментативных реакций. Это гетерогенный про-
цесс, так как подавляющее большинство липаз растворимо в во-
де, а субстратные молекулы — нерастворимы н объединены в ма-
лоподвижные крупные ассоциаты (мицеллы, эмульгированные
жировые капли). Следовательно, фермент-субстратное взаимодей-
ствие должно протекать на поверхности раздела фаз. В силу не-
растворимости субстрата взаимодействие с активным центром
должно было бы быть затруднено, однако экспериментальные дан-
ные показывают, что молекулярная активность липолитических
ферментов не ниже, чем у других гидролаз, действующих иа водо-
растворимые субстраты.
Установлено, что чем выше степень диспергирования субстра-
та, тем быстрее идет липолиз. Вероятно, это связано с явлением
сорбции фермента на поверхности субстрата. Считается, что имен-
но этот процесс и является первым актом ферментативного липо-
лиза, который можно записать следующим образом:
е + S8^t (eS Зв)ад0 (ь$)и 38 -* е + Pt 4- S8,
где е — фермент; 5Э — эмульгированный субстрат; S — единичная молекула суб-
страта; (ео-5э)адс — фермент, адсорбированный иа поверхности эмульгирован-
ного субстрата; (eS)m—комплекс Михаэлиса; Р* — продукты реакции.
Но для того чтобы адсорбция фермента была продуктивной,
необходимо внедрение фермента в поверхностный слой субстрат-
ной молекулы, и только после этого у фермента появляется воз-
можность контакта активного центра с молекулой субстрата. По
мнению М. Рахимова (1981) и других ученых, активный центр
липаз можно расчленить на три участка, различающихся между
собой функционально: 1) контактный, ответственный за узнава-
ние поверхности субстратной фазы (мицеллы, эмульсии, моно-
слоя и др.); 2) гидрофобный связывающий участок, осуществля-
ющий извлечение одной молекулы субстрата из субстратной фа-
зы в глобулу фермента; 3) участок, образованный группами, осу-
ществляющими каталитический акт гидролиза сложноэфнрной
связи. Схематически этот процесс может быть представлен следу-
ющим образом (рис. 2.44). Такое расчленение групп активного
центра позволяет объяснить процесс катализа, осуществляемый
липазами. Не исключено, что аналогичные участки имеются и у
других ферментов, так как известны факты регуляции каталитиче-
ской активности ферментов путем изменения физического состоя-
235
ния субстрата. Следует заметить, что участок 1 не обязательно
должен быть гидрофобным у всех липаз. Вероятно, ферменты, ка-
тализирующие превращения липидов, молекулы которых имеют
полярные части, вступают в контакт с поверхностью субстрата
путем электростатических взаимодействий.
Реакция липолиза может быть выражена схемой
е + Sp ~ (eSa) S (e*S)m Sv ~~ (еЛ) Sv + Pt е +
К-а Х->
+ Л + ^2 + <Sv>
где S v—субстрат в липидной фазе; Ка и К-а —константы адсорбции и десорб-
ции; Ki и К-1—константы прямой и обратной реакций прн образовании
комплекса Михаэлиса; S а — молекулы субстрата, расположенные на границе
раздела фаз; e*S — активированная липаза; еА — ацилфермент; Рх и Р?— про-
дукты реакции; Кг и Кз — константы каталитических стадий.
Липаза, по мнению многих ученых, является гетерогенным бел-
ком, имеющим небелковый компонент липидной природы, который
при удалении липидного фрагмента может потерять активность.
Липидный фрагмент необ-
Рис. 2.44. Схематическое представление
об организации активного центра липаз
(по данным М. Рахимова, 1981)
ходим для того, чтобы фер-
мент^ мог функциониро-
вать в гетерогенной среде.
Вероятно, что этот фраг-
мент ответствен за форми-
рование участка узнавания
субстрата. Участок узнава-
ния может конструировать-
ся у некоторых липаз путем
объединения белковой части
фермента с небелковыми
фрагментами или полипеп-
тидами. Специфичность же
липолитических ферментов
к физическому состоянию
субстрата в ряде случаев
связана с их надмолеку-
лярной структурой.
Липазы, полученные из
различных источников, за-
метно отличаются друг от
друга. Для многих липо-
литических ферментов оп-
ределена субъединичная
структура. Фермент имеет
множественные формы, ко-
торые по своим свойствам
далеко не идентичны. Срав-
нительная характеристика
236
Т а б л и ц а 2.34
Источник получении липазы
Свойства фермента
Семена
хлопчатника
Поджелудочная
железа
Rhizopus
(внеклеточная)
Семена
клещевины
Молекулярная масса 18 000 (А)*, 36 000 (В), 72 000 (С) 42 000 32 000(A), 42 750 (В) —
Активация солями желч- ных кислот** Не активи- руется Активируется Не актнви- дизоксихолатом руется Активируется
Действия ионов
Fe2+ Активирует Ингибирует —.
Са2+ Ингибирует Активирует Не влияет
Гидролиз
в гомогенной среде растворимых тригли- Происходит —• Не происхо- дит
церидов
в агрегированных си- стемах » Происходит Не происхо- дит
Действие NaCl
на активность Ингибирует Активирует Не действует
на стабильность Дестабили- Стабилизирует —
Специфичность по субст- знрует Триацетин> Триацетин< Триацетнни Триацетнн<
рату Изменение удельной ак- >Трибути- рин>Триоле- нн~ Хлоп- ковое масло Уменьшается <Трибутирин> юТрибути- >Хлопковое рин<Хлоп- масло>Трио- ковое масло леин Увеличивается <Трибути- рин<Хлоп- ковое масло
тивности при увеличении
концентрации фермента
* Перечисленные свойства относятся ко всем вариантам фермента. Однако по некоторым
параметрам (активность, стабильность, специфичность к структуре субстрата) ферменты А, В
я С существенно различаются.
•• Желчные кислоты и их соли—поверхностно*активные вещества, они уменьшают поверх-
ностное натяжение и вызывают эмульгирование крупных капель жира до очень мелких капелек.
липаз из различных источников приведена в табл. 2.34 (по данным
М. Рахимова, 1981).
Ряд липаз при липолизе природных масел и жиров различно-
го происхождения ие проявляет строгой специфичности и гидроли-
зует их с одинаковой скоростью. Так, при проведении липолиза
оливкового, подсолнечного, кунжутового, хлопкового и соево-бобо-
вого масел, а также свиного жира (лярд), жира моржа и масла
семян рапса с помощью липазы из гриба рода Rhizopus степень
активности и глубина гидролиза были почти на одном уровне.
Многие липазы очень чувствительны даже к небольшим коли-
чествам антибиотиков, которые ведут себя как конкурентные ин-
гибиторы фермента, но степень ингибирования зависит от проис-
хождения липазы. Липолитические ферменты, выделенные из раз-
личных источников, различаются по своей термостабильности. Из-
вестны липазы, стабильные при 20 и 65 °C, ио большинство наи-
237
Рис. 2.45. Зависимость активности липазы
R. oryzae 14-14 от степени очистки, pH
среды (а) и температуры (б):
I — препарат, осажденный этанолом; 2 — вы-
сокоочшцеиная липаза
большую стабильность име-
ет в диапазоне температур
от 30 до 40 °C. Ряд липаз
повышает активность при
низких температурах —
это явление необычное, но
объяснимое, так как реак-
ции могут протекать с боль-
шей скоростью благодаря
различным фазовым пере-
ходам в твердое состояние
участвующих в реакции
компонентов. Стабильность
фермента и некоторые его
свойства во многом зависят
от степени очистки. Так,
для большинства липаз
чем они чище, тем ниже их
стабильность. Поэтому для каждого ферментного препарата оп-
ределяются оптимальные температура, pH, стабильность и другие
его свойства (рис. 2.45). В зависимости от оптимального pH для
действия липаз они делятся на кислые (4—6), нейтральные
(6,5—7,2) и щелочные (7,5—9). Большой промышленный интерес
вызывают микроорганизмы, продуцирующие термостабильные
липазы, особенно представители родов Geotrichum, Aspergillus .и
Mucor.
2.5.3. Получение препаратов липолитических ферментов
Питательная среда. Для осуществления интенсивного биосинте-
за большое значение имеет не только отбор высокопродуктивного
микроорганизма, но и состав среды и условия его культивиро-
вания.
Источники азота. Одним из основных компонентов сре-
ды является источник азота. В зависимости от продуцента он мо-
жет резко меняться и влиять очень сильно на биосинтез липаз,
снижая его в десятки раз (например, нитраты) или повышая (сое-
вая мука, пептон и др.). В составе сред используют минеральные,
органические формы азота и смешанные источники азота. Присут-
ствие в среде аминокислот, витаминов, нуклеиновых кислот и дру-
гих соединений способствует биосинтетической ^деятельности мно-
гих микроорганизмов. Очень важным компонентом среды является
соевая мука, липидный комплекс которой оказывает стимулирую-
щее действие на биосинтез липаз многими микроорганизмами. От-
мечается, что усиление стимулирующего эффекта от применения
сои, соевого лецитина происходит при их совместном использова-
нии с кукурузным экстрактом. Для некоторых продуцентов, на-
пример A. wentii, значительно больший эффект достигается прн
использовании пептона вместо соевой муки. У дрожжевых организ-
238
мов наилучшие результаты достигались при использовании моче-
вины и аммонийного азота, а для Oospora lactis наивысший синтез
отмечался при внесении в среду дрожжевого автолизата и суль-
фата аммония. В качестве источника азота в составе сред исполь-
зуют молочную сыворотку, экстракты хлопкового и подсолнечно-
го шротов, кормовые дрожжи, осадочные пивные дрожжи и т. д.
Источники углерода. Не менее важным, чем источник
азота, является форма потребляемого углерода в составе среды.
Источниками углерода в средах могут быть сложные органические
соединения: крахмал, декстрины, олиго-, дн- и моносахариды.
В состав сред очень часто добавляют компоненты липидной
природы, так как, по мнению многих исследователей, липазы яв-
ляются индуцибельными ферментами. Но не всякий липидный
компонент вызывает стимулирование биосинтеза липаз. Эффект
положительного воздействия связан с природой липида и особен-
ностями его продуцента. Чаще всего в составе питательных сред
используют оливковое и хлопковое масла, реже — подсолнечное,
рапсовое, кукурузное, касторовое, трибутирин, соевое, льняное
масла и кашалотовый жир. Есть данные о том, что ряд продуцен-
тов увеличивает биосинтез липаз в присутствии не только масел,
но и жирных кислот. Например, Geotrichum candidum наивысшую
биосинтетическую способность проявляет при наличии в среде
оливкового или хлопкового масла, а также олеиновой и линолевой
кислот. Подобный же эффект наблюдался для Oospora lactis, ког-
да вносили в среду 0,5 % олеиновой и петрозелиновой кислот. Сти-
мулирующее влияние кислот для О. lactis отмечалось преимуще-
ственно только в отношении ненасыщенных жирных кислот; на-
сыщенные жирные кислоты не способствовали активному биосин-
тезу фермента. Сравнительно часто упоминается в литературе об
использовании отходов молочной промышленности в составе сред.
Добавление лнпидов и ПАВ. Есть мнение, что в соста-
ве среды должен быть компонент липидной природы, который спо-
собствовал бы синтезу микроорганизмом экзофермента, который,
секретируясь во внешнюю среду, осуществлял бы гидролиз три-
глицеридов, а свободные жирные кислоты использовались бы для
энергетических нужд организма. Однако есть и противоположные
данные. Так, при культивировании G. candidum введение синтети-
ческих липидов — трибутирина и триолеина — приводило к со-
кращению образования липазы соответственно на 16,7 и 42,9 %.
Природные липиды — подсолнечное, оливковое, горчичное, куку-
рузное и сливочное масла — подавляли синтез липазы на 24—
55 %. Подобные данные были получены при культивировании
A. wentii, Р. roqueforti, R. arrhizus и некоторых других.
Но даже те микроорганизмы, которые в присутствии липидов
повышают биосинтетическую способность по отношению к липа-
зам, весьма чувствительны к уровню липидов в среде. Многие
ученые отмечают, что концентрация липидов в среде должна со-
ставлять ие более 10—50 % количества присутствующего в среде
источника углерода, что соответствует 5—20 г/л, так как повы-
239
шение концентрации липидов в среде часто приводит к значитель-
ному снижению уровня биосинтеза фермента. По-видимому, это
связано с тем, что накапливающиеся продукты их расщепления
начинают угнетать процесс биосинтеза липазы. Анализ источни-
ков углерода показывает, что в состав сред очень часто вводят-
ся компоненты, которые являются ценными пищевыми продукта-
ми. Поэтому в последнее время все больше встречается работ, где
делаются попытки замены дефицитного пищевого сырья на непи-
щевые компоненты. Для культивирования С. lipolytica использо-
вались липиды, полученные из биомассы дрожжей С. tropicalis.
Предлагается использовать в качестве источника углерода и сти-
мулятора образования липаз поверхностно-активные вещества
(ПАВ).
Длинноцепочные ПАВ обычно разделяются на трн группы:
анионные, катионные и неионогенные. Для биосинтеза липаз обыч-
но применяют в составе сред неионогенные ПАВ, к которым отно-
сятся различные твины и спаны, и желчные кислоты, которые от-
носятся к группе анионных ПАВ. Но ПАВ также по-разиому дей-
ствуют на рост микроорганизмов и синтез липаз. Так, Oospora
lactis наибольшую способность к синтезу липаз проявляет только
в присутствии твина-80, особенно при наличии других источников
липидов в среде. А для R. microsporus все другие ПАВ оказыва-
ли стимулирующее действие, а твин-80 угнетал биосинтез. Мно-
гие авторы отмечают ингибирующий эффект ПАВ на биосинтез
липаз. Это вопрос сложный, он требует индивидуального экспери-
ментального подтверждения и изучения для каждого продуцента.
Влияние вида липидного компонента в среде на биосинтез липазы
можно продемонстрировать на примере роста R. oryzae 14-14, ре-
зультаты которого представлены в табл. 2.35 (по данным
Е. А. Некрасовой, И. М. Грачевой, 1984).
Из табл. 2.35 видно, наибольшее воздействие оказывают на
биосинтез липиды дрожжей С. guilliermondii, введение которых в
Таблица 2.35
Липидный компонент Активность липазы, % к контролю Липидный компонент Активность лнпазы, % к контролю
Оливковое масло (конт- 100 Пальмитиновая кислота * 78
роль) Подсолнечное масло 98 Пальмитолеиновая кислота (С1»:1) 98
Горчичное масло 96 Стеариновая кислота (С18:0) 98
Кукурузное масло 93 Олеиновая кислота 91
Хлопковое масло 80 Линоленовая кислота (Cw:2) 80
Трипальминитин Тристеорин 79 98 Линолевая кислота (С18:3) Микробные липиды 73
Триолеин 100 Rhodotorula aurantiaca 95
Фосфолипиды 195 Rhizopus oryzae 120
Глицерин 80 Myrothecium roridum Candida guilliermondii 175 280
240
среду позволило в 2,8 раза повысить выход липазы. Исследования
влияния концентрации этих дрожжевых липидов в среде на био-
синтез липазы показали, что она должна быть на уровне 0,7—
0,9 %. Далее при изучении влияния структурных компонентов ли-
пидов С. guilliermondii на биосинтез липаз было найдено, что наи-
больший стимулирующий эффект приходится на долю фосфолипи-
дов, введение которых в количестве 0,8—0,9 % позволяет полу-
чить липолитическую активность до 12 500 ед. ЛА/мл. Для куль-
туры С. guilliermondii были испытаны следующие анионные ПАВ:
цетилсукцинат, цетилмалат, цетилартрат, ацетилцетилартрат, це-
тилцитрат, янол-1 и -2, цитрол-1 и -2. Дополнительное введение в
среды ПАВ также стимулирует в ряде случаев биосинтез липаз в
этой культуре. Наилучшие результаты (до 16 000—18 000 ед./мл)
получены при добавлении цетилсукционата, цетилмалата, янтола-2
и цитрола-2. Янтол-1 и цитрол-1 резко тормозят процесс биосин-
теза для всех исследуемых концентраций. Для изучения влияния
неионогенных ПАВ на биосинтез липазы R. oryzae 14-14 были ис-
пытаны твин-80 и -60, эфиры полиглицеринов (Т-2) и моноглице-
рины в концентрациях от 0,05 до 0,6%. Эксперимент показал,
что моноглицериды в концентрации 0,1 % способны повысить био-
синтетическую способность культуры приблизительно в 1,5 раза.
На среде, содержащей соевую муку, кукурузный экстракт, фос-
фолипиды и моноглицериды, активность внеклеточной липазы к
50 ч роста достигала 21 000—22 000 ед. ЛА/мл, что в 4—4,5 раза
выше, чем на средах без фосфолипидов и моноглицеридов.
Условия культивирования. Биосинтез ферментов опре-
деляется не только составом среды, но и выбранными условиями
культивирования продуцента (температура, длительность культи-
вирования, pH среды, посевной материал, аэрация). На примере
R. oryzae можно показать, как велика роль этих факторов в на-
коплении липаз в культуральной жидкости (рис. 2.46). Из
рис. 2.46, а видно, что только при исходном pH среды 5—6 и тем-
пературе 27—30°C можно получить максимальное накопление
фермента. Длительность культивирования не должна превышать
48—50 ч (рис. 2.46,6). Наибольшей биосинтетической способно-
стью культура обладала при засеве среды 20-часовым посевным
материалом в количестве 2 % по объему среды и т. д. При исполь-
зовании других продуцентов условия выращивания всякий раз
устанавливаются экспериментально.
Выделение ферментов. Получение препаратов липаз и
их очистка проводятся на основе фильтратов культуральной жид-
кости. Биомасса продуцента и твердая взвесь среды отделяются
центрифугированием или фильтрованием. Жидкая фаза культуры
стабилизируется солями и концентрируется, например, путем
ультрафильтрации или вакуум-выпаривания. Полученный концент-
рат может непосредственно высушиваться для получения техниче-
ских препаратов с индексом ГЗх. Однако чаще проводят выделе-
ние фермента методом осаждения органическими растворителями
или сульфатом аммония. Липазы весьма чувствительны к воздей-
241
Рис. 2.46. Влияние условий культивирования иа био-
синтез липазы R. oryzae 14-14:
а —влияние температуры (/) и pH среды (2); б — влияние
длительности культивирования на изменения pH (/), накопле-
ние биомассы (2) и образование липазы (3)
ствию растворителей, так как под действием их довольно часто
наблюдается частичная денатурация белка, что может привести, в
ряде случаев к нарушению организации активного центра и поте-
ре активности. Поэтому для выделения липаз высаливанием чаще
применяют сульфат аммония.
Для получения высокоочищенных препаратов липаз широко ис-
пользуются все методы хроматографии, электрофорез, гель-фильт-
рация и изофокусирование. Очень интересные работы по выделе-
нию липаз проведены К- Даврановым, М. Рахимовым и А. М. Без-
бородовым (1984) на основе глубинной культуры Oospora lactis.
Авторам удалось разработать условия получения внеклеточного и
внутриклеточного ферментов. Ими было показано, что О. lactis
содержит три формы липазы. Одна из них с молекулярной массой
43000 локализована в периплазматическом пространстве и может
секретироваться во внешнюю среду в неизменном виде, пополняя
содержание внеклеточной липазы в среде. Две другие формы с
молекулярными массами 65 000 и 40 000 прочно связаны с мембра-
нами и могут быть солюбилизированы только с помощью детерген-
тов. Первоначально выделение внеклеточных ферментов проводят
растворителями, в частности изопропиловым спиртом, и далее сле-
дует очистка на сефадексах. Внутриклеточную липазу выделяют
из гомогенатов мицелия. Этапы выделения и степень очистки пред-
ставлены в табл. 2.36.
Для выделения и очистки мембраносвязаиной формы липазы
можно использовать аффинную хроматографию на групповом
биоспецифическом сорбенте, представляющем собою иммобилизо-
242
Таблица 2.36
Этап очистки Удельная активность, ед./мг белка Вы) по актив- ности ‘ОД. % по белку Степень очистки
Внеклеточная форма липазы
Фильтрат культуральной жидкости 120 100 100,00 0
О. lactis
Осаждение изопропаиолом (в соот- 375 78 25,20 3
ношении 1:4)
Сефадекс G-75 2640 70 3,20 22
Сефадекс G-75 10 800 60 0,65 90
Внутриклеточная липаза (периплазматическая форма)
Бесклеточный гомогенат мицелия 120 100 100,00 0
О. lactis
Сефадекс G-100 2 500 46 2,24 20
КМ-целлюлоза 15 000 45 0,36 125
ДЭАЭ- целлюлоза 18500 34 0,21 154
Сефадекс G-100 14 600 25 0,20 НО
Мембраи о связа иные формы липазы
Солюбилизированный материал 120 100 100,00 0
Биоспецифическая (аффинная) хро- 2 350 96 4,85 20
матография иа полиамцдкефалиие Сефадекс G-75 2500 92 4,40 25
ванный на гранулированном полиамиде кефалин. Такой способ
позволяет получить гомогенную липазу.
Из фильтрата культуральной жидкости R. oryzae был выделен
препарат высокоочищенной липазы со степенью очистки 102 и ак-
тивностью липазы 13,3 % исходной, равной 289 500 ед./мг белка.
Установлено, что лнпаза R. oryzae активно расщепляет оливковое
масло (принято за 100%), практически так же — хлопковое мас-
ло и животный жир, несколько лучше — маргарин (118 %) и осо-
бенно интенсивно — микробный жир дрожжей С. guilliermondii
(196,2%). При изофокусировании на амфолинах фермент фоку-
сируется одним пиком при pH 3. Молекулярная масса фермента
108 000, оптимальная температура 35 °C, pH 6,0, фермент стаби-
лен в диапазоне pH от 4 до 8. Фермент имеет субъединичную
структуру.
Следует сказать, что липазы в высокоочищенном и гомогенном
виде выделены из очень многих организмов со степенью очистки
по сравнению с исходной культурой 20—960 и выше. Выход ак-
тивности в препарат также очень разный — от десятых долей
процента до 32 %. Такой большой разброс данных связан с вы-
бором продуцента, составом среды, способом выделения, а глав-
ное — со свойствами выделяемых липаз. Вероятно, наилучшие ре-
243
зультаты в дальнейшем будут получены при использовании спе-
цифической сорбции и аффинной хроматографии для выделения
и очистки липаз. Так, японская фирма «Тойокодьо» запатентовала
способ очистки липаз с использованием сорбентов в виде солей
высших жирных кислот, которые формируются в виде гранул или
микрокапсул. Фермент сорбируется в них, а затем элюируется
ПАВ. Такой способ позволяет получать высокоочищенные препа-
раты с активностью до 90—95 % исходной. Биоспецифическая
хроматография, безусловно, самый перспективный метод выделе-
ния липаз и других ферментов. Однако широкое внедрение мето-
да в производство ферментов сопряжено с определенными труд-
ностями: малая доступность веществ, используемых в качестве ли-
гандов, малая емкость сорбентов, их высокая стоимость и т. д.
В литературе сравнительно мало данных об использовании иммо-
билизованных липаз и способах их иммобилизации. Вероятно, это
связано с тем, что липазы являются особым ферментом, гидроли-
зующим субстрат исключительно в гетерогенной среде.
В мире мало выпускается высокоочищенных липолитических
препаратов, чаще всего они выпускаются в виде комплексных пре-
паратов, содержащих помимо липазы протеазу, амилазу, ино-
гда целлюлазу и пектиназу. Препараты, обладающие липолитиче-
ской активностью, выпускаются в США (фирмы «Miles Chemical»
и «"Rohm & Haas»), Японии («Атапо», «Djennihon Seikage», «San-
kyo», «Meito», «Sangyc», «Nagase»), в ФРГ («Hoechst», «Theerhe-
mi-Askala»), во Франции («Rapidase») и Нидерландах («Gist Bro-
cades»). У нас осваивается промышленная технология липаз.
2.6. ПРОТЕОЛИТИЧЕСКИЕ ПРЕПАРАТЫ
Ферменты, обладающие способностью гидролизовать белки, широко исполь-
зуются в самых различных отраслях промышленности, сельском хозяйстве и
медицине. Протеолитические ферменты выпускаются промышленностью в боль-
шом количестве, это крупиотоииажиое производство. Протеиназы применяются
в пищевой технологии, где идет процесс с использованием микроорганизмов
(дрожжи, молочнокислые бактерии и др.). Введение в процесс протеиназ по-
зволяет в результате гидролиза белков обрабатываемого сырья обеспечить
дрожжам нормальные условия жизнедеятельности, что улучшает весь техноло-
гический процесс, особенно в пивоварении, спиртовой промышленности, вино-
делии. В ряде исследований показано, что протеолитические ферменты могут
использоваться в хлебопечении для уменьшения длительности замесов при про-
изводстве заварных сортов хлеба и специальных изделий, изготавливаемых из
муки с сильной клейковиной. Внесение в тесто небольших количеств амилаз и
протеиназ увеличивает газообразование, улучшает аромат, цвет корочки и
мякиша, позволяет сократить процесс тестоведеиия. Широко применяются
протеиназы для снятия различного рода белковых помутнений в пивоварении и
виноделии и для ускорения фильтрационных процессов. Протеолитические фер-
менты используются для мягчения (теидеризации) мяса, мясных изделий, рыбы,
что облегчает и ускоряет обработку полупродуктов, повышает их качество.
В мясной, рыбяой промышленности и в кулинарии используются ие только
микробные протейиазы, ио и протеиназы, получаемые из растительного и жи-
вотного сырья. Высокоочищенные протеолитические ферменты могут с успехом
использоваться в крахмало-паточной промышленности для выделения особенно
чистого крахмала без сопутствующих белков.
244
Комплексные ферментные препараты, содержащие протеиназы, используются
в пищекоицеитратиой и консервной промышленности при приготовлении кон-
центратов из трудиоразвариваемых круп, гороха, фасоли и др.
Протеиназы могут использоваться в кожевенной промышленности для об-
работки кож в процессе их обезволашиваиия и мягчения с большим эффектом:
улучшается качество шкуры, сохраняется толщина готовой кожи, отделенная
щетина может использоваться как вторичное сырье, а главное — резко улуч-
шаются условия труда работающих. Используются протеиназы при обработке
натурального шелка для процесса снятия белка с поверхности шелковой инти.
Самая большая потребность в протеолитических ферментах связана с их
использованием в составе синтетических моющих средств (СМС). Особенно
эффективна обработка протеииазосодержащими СМС больничного белья, загряз-
ненного кровью и другими выделениями белковой природы.
Протеолитические препараты, особенно животного происхождения, широко
используютси в медицинской промышленности и медицине. Оии применяются
для приготовления питательных и диагностических сред, для изготовления ряда
лечебных сывороток и вакцин. Протеиназы различной степени очистки исполь-
зуются в качестве лекарственных препаратов для регулирования процессов
свертывания крови, при лечении воспалительных процессов, для восполнения
недостатка ферментов в организме и т. д.
2.6.1. Источники получения протеиназ
Протеолитические ферменты синтезируются практически всеми
живыми существами. Эти ферменты очень широко распростране-
ны в природе. В промышленных целях как источник получения
протеиназ используются животные ткани, растения и микроорга-
низмы. Животными тканями для получения протеиназ является
собираемое на мясокомбинатах ферментное сырье, состоящее из
поджелудочной железы и слизистой оболочки желудка. Из рас-
тений промышленный интерес представляют плоды дынного дере-
ва, побеги и листья инжира и отходы переработки ананасов.
Наиболее широким и перспективным источником протеиназ яв-
ляются микроорганизмы. Активными продуцентами протеиназ яв-
ляются бактерии, микроскопические грибы и актииомицеты. Можно
назвать сотни микроорганизмов, принадлежащих к различным
таксономическим группам, которые используются при промышлен-
ном получении протеиназ. Они чаще всего относятся к родам Ba-
cillus, Aspergillus, Penicillium, Streptomyces, Pseudomonas и не-
которые другие. Более подробно о продуцентах будет сказано в
разделе, посвященном рассмотрению особенностей производства
протеолитических препаратов.
2.6.2. Механизм действия и свойства протеиназ
Субстрат. Субстратами для действия протеолитических фер-
ментов являются пептиды и белки. К последним относятся про-
стые белки, состоящие только из аминокислот, их называют про-
теинами, и сложные белки, в состав которых наряду с белко-
вой частью молекулы входят соединения небелковой природы (уг-
леводы, витамины, жиры и др.), — протеиды. Все эти соедине-
ния имеют большую молекулярную массу и сложны по строению.
Пептиды также могут быть субстратом для протеиназ. Они
245
имеют более низкую молекулярную массу, чем белки, и по соста-
ву подобны простым белкам. Они могут быть либо продуктами
неполного гидролиза белка, либо природными соединениями. Пеп-
тиды могут быть синтезированы в лаборатории и использоваться
как специфические субстраты в аналитических работах для опре-
деления способности ферментов к разрыву вполне определенных
пептидных связей.
До начала 50-х годов все протеолитические ферменты по меха-
низму их действия на субстрат подразделялись на две группы:
протеиназы и пептидазы. Считалось, что гидролиз белка протека-
ет в две стадии: сначала под действием протеиназ белки гидроли-
Протеиназа
зуются до пептидов ( Белок-----------»-Пептиды ), а затем на пеп-
тиды действуют пептидазы и расщепляют их до аминокислот
Пептидаза
(Пептиды-------► Аминокислоты).
Позднее, в 60-х годах, протеолитические ферменты классифи-
цировали на четыре подкласса. В настоящее время действует но-
вая классификация, по которой протеиназы относятся к третьему
классу четвертому подклассу. С тем чтобы исключить путаницу,
все ранее существовавшие подклассы были отброшены и по но-
вой классификации первому подклассу в разделе протеолитиче-
ских ферментов присвоен номер 11 (КФ 3.4.11). Такие сложности
в классификации связаны с тем, что катализируемая суммарная
реакция одинакова для всех протеолитических ферментов. Причем
ферменты не имеют строгой субстратной специфичности в обыч-
ном смысле этого слова — подавляющее большинство этих фер-
ментов действует на все денатурированные и на многие нативные
белки. По новой классификации протеолитические ферменты были
разделены на две основные группы: пептидазы КФ 3.4.11—15 и
протеиназы — КФ 3.4.21—24.
Пеп-тидазы. В первой группе протеолитических ферментов —
пептидазах — подразделение по подподклассам осуществляется на
основе механизма расщепления пептидных связей в пептидах.
К группе ферментов, входящих в 11-й подподкласс (КФ 3.4.11) —
а-аминоацилпептидгидролазы — относятся те, которые гидролити-
чески расщепляют первую с N-конца пептидную связь. Группа
КФ 3.4.12 — гидролазы пептидиламинокислот или гидролазы аци-
ламинокислот — объединяет ферменты, действующие на первую
пептидную связь с С-конца. Ферменты группы КФ 3.4.13 — ди-
пептидгидролазы — гидролизуют дипептиды; групп КФ 3.4.14 —
дипептидилпептид гидролазы — и КФ 3.4.15 — пептидилдипептид-
гидролазы — гидролизуют дипептиды соответственно с N- и С-
конца. С 16-го до 20-го подподкласса в номенклатуре сделан про-
пуск с учетом будущих открытий ферментов, гидролизующих ди-
пептиды.
Протеиназы. Вторая группа протеолитических ферментов —
протеиназы — имеет четыре подподкласса (21—24), в котором все
ферменты подразделяются в зависимости от особенностей меха-
низма катализа, установленного по функционированию активного
246
центра фермента, а также влияния pH на его активность. Специ-
фичность к субстрату рассматривается лишь с позиции идентифи-
кации индивидуальных ферментов в пределах каждой из групп.
Сериновые протеиназы. К подподклассу 3.4.21 отно-
сятся протеиназы, для которых характерно наличие в каталити-
ческом центре триады аминокислот: аспарагиновая кислота, гисти-
дин и серин. В этот подподкласс внесены многие хорошо изучен-
ные протеиназы животного происхождения (химотрипсин, трип-
син, тромбин, плазмин, эластаза и др.) и некоторые микробные
протеиназы.
Тиоловые протеиназы. К подподклассу 3.4.22 относят-
ся протеиназы, имеющие в активном центре SH-группу цистеина.
В подподкласс 3.4.22 вошел ряд важных протеиназ раститель-
ного происхождения, такие как папаин, фицин, бромелаин, химо-
папаин, и некоторые микробные протеиназы.
Кислые протеиназы. Они входят в подподкласс (3.4.23)
и имеют оптимальный pH ниже 5, в каталитическом акте у этих
ферментов участвуют остатки дикарбоновых аминокислот. Наибо-
лее широко известны из этого подподкласса пепсин, катепсин и
ряд кислых протеиназ грибного происхождения. В последний под
подкласс (3.4.24) входят протеиназы, содержащие ионы металлов.
В основном это различные микробные нейтральные протеиназы и
некоторые протеиназы животного происхождения.
В классификации и номенклатуре протеолитических ферментов
выделен^ еще одна, третья группа протеиназ, которые включены
в подподкласс 3.4.99. Это протеиназы с неизвестным механизмом
катализа. В этот подподкласс сейчас внесено 26 ферментов, среди
них много микробных протеиназ, но есть протеиназы и животного
происхождения. Создание подподкласса 3.4.99 вызвано тем, что
многие протеиназы обладают близкой, но не полностью изученной
и определенной специфичностью. Они действуют на один и тот же
субстрат, однако продукты гидролиза отличаются не только коли-
чественно, но и качественно.
Отличительной особенностью многих протеолитических фермен-
тов животного происхождения является то, что они в организме
существуют в неактивном состоянии в виде зимогенов, которые
только при определенных условиях могут превращаться в актив-
ные формы. Это трипсин, химотрипсин, карбоксипептидазы, А и В,
пепсины, реннин, катепсины, аминопептидазы, дипептидазы, тром-
бин, плазмин и др. Многие из данных ферментов получены в кри-
сталлическом виде. Они чаще используются в медицине. Механизм
их действия, субстратная специфичность, механизм ингибирования
и активации подробно изучены. Имеются данные о строении ак-
тивного центра, а для некоторых протеиназ известна и структура
самого фермента. Также глубоко и всесторонне изучены основные
протеиназы растительного происхождения: папаин, фицин, броме-
лаин, химопапаин, которые за рубежом широко применяются в
медицине и пищевой технологии. В качестве примера можно при-
вести папаин, который и сейчас является предметом многочислен-
247
Рис. 2.47. Структура папаина. Вход в карман, в котором расположен ак-
тивный центр, находится в верхней части молекулы. В нем помещаются
Гис-158 (справа) и Цис-25 (слева). В молекуле есть ^-структура, обра-
зованная остатками 163—172, и изогнутый складчатый слой, сформиро-
ванный остатками: 115—107, 203—210, 133—126, 159—164, 174—170 и
184—189 (по данным М. Диксона и Э. Уэбба, 1982)
иых исследований. Структура папаина, установленная методом
рентгеноструктурного анализа, приведена иа рис. 2.47. Папаин не
обладает субъединичной структурой и по форме близок к глобу-
лярным белкам. Пептидная цепь уложена так, что гидрофобные
остатки аминокислот погружены внутрь глобулы, а гидрофильные
расположены на поверхности. Характерной чертой структуры яв-
ляется наличие расщелины (щель, углубление, карман), идущей
от поверхности в глубь молекулы, по стенкам которой группиру-
ются гидрофобные группы. Активный центр фермента располага-
ется внутри этой расщелины, куда проникает субстрат и где про-
исходит реакция. Внутри щели можно выделить ряд остатков, ко-
торым на основании химических исследований отводится важная
роль в осуществлении катализа. В активном центре папаина име-
ются цистеин (25) и гистидин (158), имидазол и аспарагин, что
отдаленно напоминает активный центр сериновых ферментов. Счи-
тается, что существенную роль для проведения каталитического
акта имеет гидрофобное окружение, в котором оказываются реа-
гирующие вещества. Наиболее реакционноспособен в этом карма-
не у папаина, фицина и бромелаина остаток цистеина. Вероятно,
248
в качестве ковалентного интермедианта образуется тиоацилфер-
мент, существование которого подтверждается рядом эксперимен-
тальных данных.
В полипептидной цепи папаина содержится 212 аминокислот-
ных остатков, имеется три —S—S-группы; молекулярная масса
папаина 20 700, он имеет a-структуру и глобулярное строение. Па-
паин обладает широкой специфичностью. Он осуществляет глубо-
кий протеолиз белков и синтетических субстратов. Определены его
оптимальные pH и температура, условия стабильности и многие
другие свойства. Но эти протеиназы (как растительного, так и
животного происхождения) не могут полностью удовлетворить по-
требности в протеолитических ферментах, и поэтому, несмотря иа
углубленное их изучение, будущее принадлежит протеиназам мик-
робного происхождения. Это связано с тем, что количества полу-
чаемых препаратов практически не ограничены сырьевой базой,
а также и с тем, что протеолитические ферменты микробного про-
исхождения обладают способностью гидролизовать пептидные
связи в белках различного состава и происхождения. Так, они
способны расщеплять желатин, казеин, гемоглобин, альбумин,
растительные белки, фибриновые сгустки, кератин, эластин, тогда
как большинство ферментов животного происхождения обладает
более узким диапазоном действия.
2.6.3. Получение микробных протеиназ
В Номенклатуру и классификацию ферментов внесено большое
количество протеолитических ферментов микробного происхожде-
ния, которые относятся к различным подподклассам; 3.4.11 (7 фер-
ментов), 3.4.13(5), 3.4.15(1), 3.4.16(1), 3.4.17(5), 3.4.21(4),
3.4.22(3), 3.4.23(1), 3.4.24(4) и 3.4.99(4). Необходимо отметить, что
часто под одним номером находится очень много ферментов, по-
лучаемых из различных источников, но имеющих сходные свойст-
ва. Так, в подподклассе 3.4.21.14 представлена целая серия мик-
робных протеиназ, среди продуцентов которых отмечаются Bacil-
lus subtilis, Е. coli, щелочная протеиназа из культур рода Aspergil-
lus, Tritirachium album, Arthrobacter, Pseudomonas aeruginosa,
Malbranchea pulchella, Streptomycer rectus, Candida lipolytica и др.
Под номером 3.4.23.6 также объединено много ферментов, источ-
никами которых являются микроорганизмы, в основном относящие-
ся к грибам родов: A. oryzae, A. terricola, A. saitoi, A. niger, Р. jan-
thinellum, R. chinensis, M. pusillus, M. miehei, Endothia parasitica,
Candida albicans, Saccharomyces carlsbergensis, Rhodotorula gluti-
nis, Physarum polycephalum и др. Все микробные металлопротеи-
назы объединены под номером 3.4.24.4. Они выделены из культур
родов: Streptomyces, Sarcina, Micrococcus, Staphylococcus, Bacillus,
Aeromonas, Pseudomonas, Escherichia, Aspergillus, Myxobacter, Ser-
ratia.
Однако в промышленности чаще всего получают комплекс про-
теолитических ферментов, достоинства которого определяются
249
с учетом последующего применения ферментного препарата. Сум-
марная протеолитическая активность такого препарата определя-
ется на соответствующем субстрате: гемоглобине, желатине, рас-
тительном белке, эластине, коллагене и т. д.
Технологические схемы производства микробных протеиназ от-
личаются друг от друга прежде всего на первой стадии получе-
ния микробной культуры продуцента, на стадиях выделения раз-
личия меньше.
Поверхностный способ культивирования. Использование поверх-
ностного способа для производства протеиназ снижается год от го-
да. В настоящее время протеиназы в большинстве случаев полу-
чают при культивировании продуцента в глубинных условиях. При
поверхностном культивировании в качестве продуцентов чаще все-
го используют микроскопические грибы видов: A. oryzae, A. flavus,
A. terricola, A. candidus, R. oryzae, R. nigricans, R. cohnii, R. ton-
kiaensis, R. oligosporus и др.
Основным компонентом среды являются увлажненные до 56—
65 % пшеничные отруби. Для обогащения пшеничных отрубей мо-
гут быть использованы некоторые добавки, обычно растительно-
го происхождения, такие, как белковый отстой (пивоваренное про-
изводство), солодовые ростки, просяная мука, соевая мука и т. п.
Среды при увлажнении не подкисляются, так как введение кис-
лот несколько снижает способность микроскопических грибов к
синтезу. Обычно pH среды составляет 5,6—6,2. Для улучшения
условий аэрации культуры весьма целесообразно вносить в среду
до 10—20% опилок, например березовых. Кроме того, внесение
рыхлителя позволяет несколько повысить влажность среды — до
62—65 %, что способствует усилению биосинтеза протеиназ. Ре-
жим аэрации, температуры и длительность процесса для каждого
продуцента устанавливаются экспериментально.
Готовая культура либо высушивается (препарат Пх), либо
поступает на последующую очистку. Водный экстракт может быть
сконцентрирован (препарат П2х) либо использован для осажде-
ния ферментов растворителями или солями. При осаждении эта-
нолом выход препарата от исходной культуры составляет около
5 % с переходом в осадок до 70—73 % фермента; при осаждении
изопропиловым спиртом выход составляет около 2,2—2,5 % с пере-
ходом в осадок до 85—90 % протеиназ, т. е. получаются препара-
ты с меньшим содержанием балласта, но более активные.
Глубинный способ культивирования. В качестве продуцентов
протеолитических ферментов при глубинном культивировании в
промышленных условиях используют бактерии в основном рода
Bacillus, реже — актиномицеты и микроскопические грибы. Спо-
собность к образованию протеолитических ферментов отмечается
практически у всех известных микроорганизмов, так как роль этих
ферментов в регуляции жизненных функций организмов очень ве-
лика. Протеолитические ферменты в подавляющем большинстве
случаев являются внеклеточными. В самом общем виде гипотети-
ческий механизм регуляции биосинтеза внеклеточных протеаз у
250
Сбалансированный
состав питательной
среды по С, NuS
Среда обеднена аниннын
азотон, нет полного набора
аминокислот, инеется несба-
лансированность по С,NuS
Пул анинокислот
обедненный
Пул анинокислот
сбалансированный
рРНК
и PH К
тРНК Внутри-
клеточ-
ных
белков
1нут-
1икле
поч-
те
шки
г—4
иРНК
Знут-
Cz: рикле-
точню
белков
тРНК
рРНК
О___________________2
Факторы инициации.
РНК - полимеразы
иРНК экзопротеаз
1L
и
Е
5
3
з
£
Энзопроглеазы
Белок
Рис. 2.48. Гипотетическая модель регуляции биосинтеза
внеклеточных протеаз у микроорганизмов (по данным
В. А. Иваиица, Н. С. Егорова и др., 1978)
микроорганизмов представлен на рис. 2.48. Авторы этой модели,
основываясь иа данных литературы и собственных исследованиях,
предполагают, что иРНК-экзопротеазосиитезирующая система
безуспешно конкурирует с системами других РНК вследствие низ-
кого сродства специфических факторов инициации или РНК-поли-
меразы с участком инициации иа экзобелковом гене. Известно, что
синтез РНК контролируется либо соотношением неиагружеиных и
амииоацилироваииых тРНК (при этом свободные тРНК являются
репрессорами синтеза), либо действием гуанозиитетрафосфата
(ppGpp), который образуется при аминокислотном голодании и по-
давляет биосинтез РНК Суть предлагаемой модели заключается
в следующем. Присутствие в среде в достаточном количестве всех
необходимых аминокислот и других источников углерода, азота и
серы позволяет поддерживать внутриклеточный пул микроорганиз-
ма иа высоком уровне. При этих условиях клетка осуществляет
интенсивный синтез иетранслируемых РНК и иРНК для внутрикле-
точных белков. В результате содержание свободных факторов иии-
251
циации РНК-полимеразы, которые могут принять участие в синте-
зе иРНК экзопротеаз, незначительно. Вероятно, этим объясняется
низкая частота транскрипции иРНК экзопротеаз и, следовательно,
низкий уровень образования внеклеточных протеаз, например,
в начале роста культуры на такой сбалансированной среде (левая
сторона схемы).
Истощение среды в процессе роста культуры по одному или не-
скольким субстратам приводит к снижению уровня пула внутри-
клеточных свободных аминокислот, что значительно снижает син-
тез РНК. В результате освобождаются РНК-полимераза и факто-
ры инициации транскрипции РНК. Увеличиваются частота инициа-
ции иРНК экзопротеаз и соответственно синтез внеклеточных про-
теолитических ферментов (правая сторона схемы). При наличии в
среде белков экзопротеазы расщепляют их до пептидов и амино-
кислот, которые поступают в клетку, пополняя ее пул. Аминокис-
лоты утилизируются клеткой активно и являются лимитирующим
субстратом. Поступающие в клетку аминокислоты могут полностью
удовлетворить ее потребности, т. е. снять лимитирование по этому
субстрату, что приведет к временному торможению биосинтеза
экзопротеаз и т. д. Иными словами, имеет место механизм конт-
роля синтеза экзопротеаз по типу метаболитной репрессии. Можно
предположить, что регуляторное воздействие субстратов на био-
синтез экзопротеаз проявляется на уровне транскрипции. Извест-
но, что пул иРНК поддерживает синтез протеаз в течение несколь-
ких часов.
Глубинным способом культивируют многие продуценты протео-
литических ферментов. Для производства нейтральных и щелочных
протеиназ используют спороносные бактерии и актиномицеты, для
получения кислых — микроскопические грибы.
Наиболее широко в нашей стране применяются штаммы бакте-
рий, относящиеся к видам Bacillus subtilis и В. mesentericus, на
основе которых выпускаются препараты протосубтилин и прото-
мезентерин разной степени очистки, предназначенные для самых
различных отраслей — от пищевых технологий до использования
в моющих средствах и сельском хозяйстве.
Питательные среды и условия культивирова-
ния. При конструировании оптимальных питательных сред для
каждого продуцента изучаются его физиология, потребность в ис-
точниках N, С и других соединениях. Содержание сухого вещества
в питательной среде в зависимости от продуцента может изме-
няться от 6 до 20 %. Питательные вещества могут вноситься в сре-
ду сразу или дробно по мере потребления из среды лимитирующе-
го компонента. Оптимальный состав среды устанавливается либо
путем длительного изучения особенностей биосинтеза ферментов
микроорганизмом, либо с использованием математических методов
планирования эксперимента.
Способ экспериментального конструирования питательной сре-
ды можно продемонстрировать на примере Bacillus subtilis 103
(табл. 2.37, 2.38).
252
Таблица 2.37
Источник азота pH Содержание биомассы, г на 100 мл Протеолити- ческая активность, мкг тирозина на I мл
начальный конечный
Цитрат аммония двузамещен- 6,90 7,50 0,84 66,8
ный (контроль) KNO3 6,90 6,10 0,11 97,0
NH4NOs 6,90 4,45 0,26 0
(NH4),SO4 6,90 4,80 0,40 66,8
(NH4)2HPO4 6,90 5,60 0,80 (00,2
nh4ci 6,95 7,40 0,40 67,0
• Табл. 2.37—2.40 приводятся по данным К. А. Калуиянца н др. (1979—1982).
Таблица 2.38
Источник азота рн Содержание биомассы, г иа 10 0 мл Протеолити- ческая активность, мкг тирозина на 1 мл
начальный конечный
Двузамещенный фосфат аммо- ния (контроль) 6,9 5,6 0,80 (00,2
Казеин 6,9 7,7 0,80 140,0
Пептон 6,9 7,5 1,00 187,7
Кукурузный экстракт 6,8 7,6 1,00 200,0
Глютен 7,0 6,8 0,74 56,8
Вытяжка из солодовых рост- ков 7,0 7.3 0,60 193,7
Культивирование проводилось на модифицированной среде Но-
мура следующего состава (в %): картофельный крахмал — 2;
двузамещенный цитрат аммония — 3; КС! — 0,15; MgSO4 — 0,05;
СаС12 — 0,01; экстракт соевых бобов — 1,0. Если в составе среды
изменять источник минерального азота (см. табл. 2.37), то биосин-
тез протеолитических ферментов будет заметно изменяться, осо-
бенно, если соль кислая, например NH4NO3. При потреблении ам-
монийного азота в среде накапливаются ионы азотной кислоты и
среда резко подкисляется, и, хотя рост культуры и происходит, био-
синтеза протеиназ не наблюдается. Если взять двузамещенный
фосфат аммония за контроль, то при изучении влияния различных
источников органического азота для этого же штамма (см. табл.
2.38) оказалось, что уровень pH меняется меньше, чем с неоргани-
ческим азотом, и только в одном случае — с глютеном — биосин-
тез протеолитических ферментов ниже контрольного. Кроме того,
введение в состав среды помимо (NH4)2HPO4 (1,2%) кукурузного
экстракта (0,8%) и пивных дрожжей (0,4%) позволило получить
253
активность в культуральной жидкости до 1 300 ед. ПС/мл, т. е.
почти в 20 раз больше контроля.
Экспериментальный способ оптимизации' сред приемлем, но он
очень длителен и не всегда оправдан, так как для того, чтобы
учесть взаимовлияние отдельных компонентов при изменении их
соотношения в среде, необходимо исследование многочисленных
вариантов. Проще и целесообразнее вести такие исследования иа
основе математических методов планирования эксперимента.
Дальнейшая подработка состава питательной среды для В. sub-
tilis 103 позволила существенно сократить длительность культиви-
рования продуцента и еще повысить его продуктивность по про-
теиназам (табл. 2.39).
Таблица 2.39
Показатель I среда (контроль) II среда III среда IV среда V среда
Длительность культивирова- ния, ч Компоненты среды, % 60 60 60 56 44
картофельный крахмал 2 — — — —
аммоний лимоннокислый дву- замещеииый 3 — — — —
КС1 0,15 0,15 0,15 0,15 0,15
MgSO4 0,05 0,05 0,05 0,05 0,05
СаС1г 0,01 0,01 0,01 0,01 0,01
экстракт соевых бобов 1,0 — — — —
ферментативный гидролизат крахмала (по крахмалу) — 9,0 3,0 9,0 3,0
ферментативный гидролизат кукурузной муки (по муке) — 9,0 8,0 9,0 8,0
кормовые дрожжи — 0,2 — 0,2 —
двузамещеииый фосфат ам- мония — 1,2 1,2 1,2 1,2
щелочной экстракт кукуруз- ной муки (в расчете иа 10 % сухого вещества) — — 7,0 — 7,0
Протеолитическая активность, мкг тирозина иа 1 мл 67 980 1300 1400 2100
Таким образом, способность бактерий образовывать внеклеточ-
ные протеиназы повысилась почти в 30 раз. Такие высокие пока-
затели удалось достигнуть благодаря предварительной подработ-
ке некоторых компонентов сред, что убыстрило рост культуры и
повысило ее продуктивность. Подработка компонентов среды яв-
ляется эффективным и весьма распространенным приемом в техно-
логии ферментных препаратов.
Выделение ферментов. На основе культуральной жид-
кости, содержащей внеклеточные протеиназы, можно получить
ферментные препараты различной степени очистки, используя раз-
нообразные методы — начиная от высушивания распылением гото-
вой культуральной жидкости и до методов получения высокоочи-
щенных ферментных препаратов и кристаллических протеиназ.
254
Таблица 2.40
Стадия выделения Характеристика стадии Выход активной протеиназы, % от исходной
Протосубтилии ГЗх Исходный материал для выделении протеазы 100
Растворение Растворение протосубтилииа в воде с pH 7,8 до концентрации сухого вещества 10% 92
Отделение нерастворимой части Фильтрование 88
Концентрирование Очистка ультрафильтрацией и кон- центрирование до содержания белка в концентрате 3,5—4,0 % 84
Освобождение от пигмента Обесцвечивание на ДЭАЭ-целлюлозе 82
Фракционирование ферментного комплекса Хроматография иа КМ-целлюлозе 44
Концентрирование элюата, полу- чаемого при хроматографии Обессоливание и концентрирование методом ультрафильтрации 38
Получение сухого высокоочи- щеииого препарата нейтральной протеиназы Сублимациоииаи сушка концентрата 22
В .табл. 2.40 представлены основные этапы выделения высоко-
очищенной протеиназы из технического препарата ГЗх. Эта схема
позволяет получить с высоким выходом (до 22 %) очищенный пре-
парат внеклеточной нейтральной протеиназы из В. subtilis, кото-
рая относится к металлопротеиназам.
Дальнейшие исследования протеолитических ферментов этого
микроорганизма позволили установить в иих четыре компонента,
которые различались между собой по многим физико-химическим
характеристикам (табл. 2.4.1), особенно по оптимуму pH. Из
табл. 2.41 видно, что протеиназа II обладает широким диапазоном
действия в интервале pH от 7,5 до 11, протеиназа IV является
сильнощелочной и т. д.
Таблица 2.41*
Компонент протеиназ Молекулярная масса Изоэлектри- ческая точка» pl Оптимальный pH рК «ин-
I 44 000 8,4 7,0 5,3; 8,8 0,9-10—»
11 40 000 8,8 7,5—11 5,7; 9,3; 9,8; 12,2 4,0-10-е
111 23 000 9,5 6,5 5,3; 7,7 3,3-10—*
IV 29 000 10,1 11,0 8,5 2,0-10-<
* По данным В. С. Веса, А. А. Глемжи и др. (1980).
Наряду с этим очень продуктивным штаммом в промышленно-
сти все больше используются другие бактериальные продуценты
нейтральных и щелочных протеаз, которые являются мутантными
255
вариантами или культурами, отобранными в процессе длительной
естественной селекции. Среди промышленных бактериальных
штаммов можно назвать: В. cereus, В. mesentericus, В. lichenifor-
mis (продуцент препарата субтилизин Карлсберга), В. amylolique-
faciens, В. stearothermophilus, В. subtilis (продуценты промышлен-
ных препаратов субтилизин BPN и субтилизин Novo) и некоторые
другие.
Среди микроорганизмов — продуцентов протеиназ не менее
важное место, чем бактерии, занимают актиномицеты и микроско-
пические грибы. Актиномицеты образуют внеклеточные протеина-
зы в значительных количествах, но они сравнительно редко ис-
пользуются в промышленных условиях. Очень многие актиномице-
ты одновременно с протеиназами образуют большое количество
внутриклеточных антибиотиков, поэтому имеется возможность од-
новременно организовать два производства: антибиотиков — из
биомассы продуцента и протеолитических ферментов — из жид-
кой фазы культуры. По такому принципу начиная с 60-х годов в
Японии получают протеиназы на основе производства стрептоми-
цина при промышленном культивировании Streptomyces griseus.
Протеазы S. griseus получают из фильтрата глубинной культуры
путем избирательной сорбции катионообменными смолами. Про-
теаза после элюции и дальнейшей очистки очищается в 22—25 раз
и известна на мировом рынке под названием проназы. Проназа
является комплексным препаратом, состоящим, по данным раз-
личных авторов, из И—13 протеаз: четырех нейтральных, трех
щелочных протеиназ и 3—5 аминопептидаз и карбоксипептидаз.
Это стабильный ферментный препарат, обладающий широкой спе-
цифичностью и способностью глубоко (на 70—90 %) гидролизо-
вать субстрат до аминокислот. Только кератин и фиброин шелка
с трудом гидролизуются проназой. Проназа также гидролизует
различные пептиды, амиды и эфиры аминокислот. Она раствори-
ма в воде, слабых солевых растворах, водных растворах ацетона
и спиртов с концентрацией не выше 50%. Оптимальный pH ле-
жит в щелочной зоне — от 8 до 9; при pH ниже 4 и выше 10 про-
теазы инактивируются. Стабилизируется проназа ионами кальция,
нейтральные протеиназы и пептидазы проназы являются металло-
ферментами. Пептидазы ингибируются ЭДТА, причем в присутст-
вии ионов кальция и кобальта этот эффект снимается.
Препараты проназы широко используются в различных отрас-
лях промышленности, особенно при щелочных значениях pH. Пре-
параты прекрасно хранятся при комнатной температуре и полно-
стью сохраняют свою активность в течение 3 и более лет. Препа-
раты проназы содержат ферменты, очень близкие по механизму
своего воздействия на субстрат к трипсину и химотрипсину. По-
этому в литературе можно встретить для трипсиноподобных про-
теиназ проназы с различными названиями: протеиназа В, БАЭЭ-
гидролаза; трипсин S. griseus, трипсин проназы и т. д. Протеина-
зы проназы со свойствами, близкими к химотрипсину, в литерату-
ре называются: протеиназа С, протеаза А, л-нитрофенилацетатгид-
256
ролаза 1 и 2, фракция В, эластазоподобный фермент, эндопептида-
за В, химотрипсин проназы и др. Следует отметить, что химотрип-
сииподобный фермент S. griseus обладает высокой эластазной ак-
тивностью. Вероятно, это комплексный фермент, имеющий в своем
составе фрагмент эластазного фермента. Наличие в препаратах
проназы пептидаз, вероятно, способствует более полному расщеп-
лению белков и пептидов до аминокислот.
В нашей стране неоднократно делались попытки разработать
и внедрить технологию протеолитических ферментов на основе
культивирования актиномицетов. В этом направлении многое бы-
ло сделано Е. Д. Каверзневой, Ю. А. Рассулиным, И. С. Петро-
вой, Н. С. Егоровым, Р. В. Фениксовой и другими учеными. Ближе
других к проназе препарат протелин, полученный на основе куль-
тивирования штаммов S. griseus ЛС-1 и 32-12, которые одновре-
менно со стрептомицином в жидкой фазе глубинной культуры на-
капливают большое количество протеолитических ферментов. Этот
сложный комплекс протеаз достаточно четко виден на рис. 2.49.
1(Г,-Пв.,ед/пл
22 - 1
20-
ы JOE JOE ООЕ ООЖ ЧОЕ ОТЕ 1 Sen1 'ТЕООЛ1
б,мг/пл
25 75 125 175 225 715 325 375 550 750 800
нНомер фракции____________________________________________
0,005 М Ca(CH}C00^ Солевой градиент 0.25м NaCl тНааЦШИаОН
Рис. 2.49. Хроматография протелина иа КМ-целлюлозе (по даииым
И. С. Петровой, 1975):
/ — протеолитическая активность (ПА); 2 — эластазная активность (ЭА); 3 — трип-
синоподобная активность (ТА); 4 — химотриисиноподобная активность (ХА) (суб-
страт ЭЭАТ): 5 — химотрипсиноподобная активность (субстрат НЭБФ): б — лейци-
наминопептидазная активность (ЛА). Нижиий график — концентрация белка по
фракциям
9 Зак. 232
Комплекс протеаз гидролизует самые разные белки: казеии на
83 %, яичный альбумин иа 80, гемоглобин нативный иа 68, а де-
натурированный — на 82 % и т. д. Существенным отличием про-
телина от проназы является то, что протелин ие содержит карбок-
сипептидазы.
Интересные протеолитические препараты можно получить иа
основе производства окситетрациклииа с помощью Actinomyces
rimosus ЛСТ «гибрид» и других продуцентов. Антибиотик находит-
ся в мицелии (до 80—85%), а практически все протеазы содер-
жатся в растворе, что позволяет получать препараты протеаз с
минимальным содержанием в них антибиотика. Комплекс проте-
аз этой группы продуцентов заметно отличается от состава про-
назы и протелина. В этих препаратах отсутствует лейцинамино-
пептидазная и химотрипсинподобная активность. Комплекс A. rimo-
sus более четко выражен нейтральными протеиназами, он прояв-
ляет максимум активности при pH 6,8—7,0. Интересны данные о
протеиназах Streptomyces fradiae. Известно ряд штаммов, которые
при глубинном выращивании хорошо усваивают кератин — бе-
лок, содержащийся в шерсти, волосах, рогах, копытах и т. д., об-
разуя большое количество внеклеточной кератиназы (КФ 3.4.99.12).
Это является исключительным свойством, так как известно, что
шерсть и волос очень устойчивы к действию подавляющего боль-
шинства протеолитических ферментов. На основе S. fradiae за ру-
бежом существует производство препаратов кератиназы, которые
с 70-х годов выпускаются фирмой «Мерк».
В нашей стране в этом направлении проводились работы со
штаммом S. fradiae 119. В состав сред для глубинного культиви-
рования вводили роговую муку, соевую муку, крахмал, многочис-
ленные соли (КН2РО4, (NH4)2SO4, ZnSO4, FeSO4, MnCl2, MgSO4)
и мел. Присутствие в среде роговой муки во много раз повышает
способность актиномицета синтезировать кератиназы. Экзопротеа-
зы этого микроорганизма представляют собой комплекс фермен-
тов, содержащий ие меиее 6—7 протеаз. В препаратах протофра-
дина найдены лейцинамино- и карбоксипептидазы, ингибируемые
ЭДТА; сериновые протеазы, обладающие трипсиноподобной, химо-
трипсиноподобной и эластазной активностями, ингибируемые
ДПФФ и кератингидролизующие ферменты. Разработаны схемы
выделения некоторых протеиназ из комплекса ферментов культу-
ры S. fradiae 119 и изучены свойства этих трипсиноподобных
протеиназ (табл. 2.42).
Из препарата протофрадина были выделены и очищены фер-
мент, обладающий преимущественно эластазной активностью, ко-
торый гидролизует эластин, казеин и прогретый коллаген и рас-
щепляет АТЭЭ-специфический субстрат для действия химотрипси-
на, т. е. близок к химотрипсииоподобным ферментам, и трипсииопо-
добиая гомогенная протеиназа. Эти исследования подтверждают,
что микроорганизмы способны образовывать протеиназы, близкие
по специфичности и механизму воздействия на субстрат к протеи-
назам животного происхождения, и потому их можно использо-
258
Таблица 2.42
Основные стадии оч истин Белок, кг Активность Степень очистки Выход, %
общая, ед. удельная, ед./мни
Исходный комплексный препа- рат — протофрадин 1300 600 0,46 1 100
Хроматография на ДЭАЭ-цел- люлозе 400 420 1,05 2,3 70
Гель-фильтрация через акрилекс Р-10 25 135 5,40 11,7 22
Хроматография на КМ-целлю- лозе 6 90 15,00 34,0 15
Гель-фильтрация через сефа- декс G-50 4 79 19,70 42,8 13,1
* По данным Л. С. Лагуновой (1980).
вать в самых различных отраслях промышленности, медицине и
сельском хозяйстве.
Весьма интересны разработки по использованию в качестве
продуцента протеаз термофильных акциномицетов, например Mic-
romonospora vulgaris 42. Для этого термофильного актиномицета
Л. Г. Логиновой и др. было подобрано четыре варианта среды, по-
зволяющих получать высокоактивные протеиназы. Все варианты
сред содержали 0,5 % кукурузной муки, 0,1 % мела и 0,1 % суль-
фата аммония. В качестве источника биологически активных ве-
ществ, стимуляторов роста, аминокислот использовалась автокла-
вированная биомасса различных микроорганизмов: дрожжи кор-
мовые и пекарские (0,3%), метановые бактерии, белково-витамин-
ный концентрат из метановых бактерий (0,2 %). Активность про-
теиназ в культуральной жидкости составила 2800 ед. ПА/мл. При
осаждении этанолом до 93 % фермента переходило в осадок, ак-
тивность которого составила 37 000—50 000 ед. ПА/г при содер-
жании белка в препарате 68—72 %. Отличительной особенностью
комплекса выделенных протеаз является то, что они имеют широ-
кую зону pH, оптимальную для гидролиза белков — от 3,5 до 11.
Этот комплекс отличается исключительно высокой оптимальной
температурой для проявления протеазами максимальной активно-
сти — 78—82 °C и большой термостабильностью. Протеазы Micro-
monospora vulgaris 42 в интервале температур от 50 до 70 °C не
только сохраняют исходную активность, но и активируются, при-
чем активность возрастает на 15—20%.
Большое внимание уделяется изучению условий биосинтеза
протеолитических ферментов, обладающих фибринолитической и
тромболитической активностью, т. е. активностью по отношению
к фибрину, подобной животному плазмину (КФ 3.4.21.7). Разра-
ботка технологии таких препаратов имеет большое практическое
значение для медицины. В качестве продуцентов таких ферментов
используют бактерии, актиномнцеты и микроскопические грибы.
i]« 259
Среди активных продуцентов этих ферментов следует прежде все-
го назвать актиномицеты, представителей родов Bacillus, Clostri-
dium, Nocardia, Penicillium, Aspergillus, Alternaria, Cladosporium,
Fusarium, и некоторые другие, т. е. эта способность достаточно
широко распространена в природе. Сложность создания техноло-
гии таких высокоэффективных препаратов заключается в том, что
нужна протеаза, строго ориентированная только на гидролиз фиб-
рина, что очень трудно найти среди микробных продуцентов. Кро-
ме того, есть данные о взаимосвязи фибринолитической активно-
сти микроорганизмов с образованием ими гематоксинов fj-типа, что
дает основание сделать вывод о возможной природе фибринолити-
ческих ферментов. Это настораживает, но исследования в этом на-
правлении следует продолжать, возможно, с привлечением мето-
дов конструирования новых продуцентов с использованием генной
инженерии или направленного мутагенеза. Анализ протеаз акти-
номицетов показывает, что это весьма перспективные продуценты
протеолитических ферментов, обладающих очень разнообразной
субстратной специфичностью, широким диапазоном pH для дейст-
вия ферментов и сравнительно высокой термостабильностью. Од-
нако эти микроорганизмы, за исключением некоторых штаммов,
пока не нашли широкого применения из-за того, что получаемые
препараты протеиназ содержат антибиотики, что либо исклю-
чает, либо затрудняет и сильно ограничивает их область приме-
нения.
Микроскопические грибы очень длительное время использова-
лись для синтеза нейтральных и особенно кислых протеиназ. Наи-
более часто для этих целей применялись различные виды аспер-
гилловых грибов: A. oryzae, A- flavus, A. fumigatus, A. terricola,
A. sojae, Р. chrysogenum, Monilia sitophila. Эти микроорганизмы
образуют протеазы, зона действия которых лежит в интервале pH
от 4 до 10 с проявлением максимальной активности при pH, близ-
ком к нейтральному. Большой интерес представляют продуценты
видов: A. awamori, A. saitoi, Rhizopus javanicus, Rh. pygmaues,
Penicillium expansum, P. sponolasum и др., которые образуют кис-
лые протеиназы с оптимальным pH 2,0—2,5. Все кислые протеи-
назы по механизму воздействия на субстрат достаточно близки,
но пока нет стройной гипотезы, объясняющей существо протека-
ющей реакции и ее механизм.
В нашей стране интересны работы, проведенные под руковод-
ством С. А. Коновалова, по разработке технологии препаратов
кислой протеиназы на основе глубинного культивирования штам-
мов A. awamori 200 и 78-2. Установлено, что наибольший синтез
кислой протеиназы идет в среде, содержащей 2 % ржаной муки,
0,5 % КН2РО4, смеси MgSO4, ZnSO4 и FeSO4 (0,006 %) и 0,1 % ка-
зеина. Технология достаточно проста. Готовую культуру A. awa-
mori 78-2 освобождают от нерастворимой части, а фильтрат после
концентрирования осаждают либо органическими растворителями,
либо сульфатом аммония. Полученные препараты проявляют оп-
тимум действия при pH 1,8; 2,5; 3,0 и 3,5 при температурах соот-
260
ветственно 40, 50, 60 и 70°C. При этом с повышением температу-
ры ферментативной реакции с 40 до 70 °C абсолютная величина
протеолитической активности возрастала приблизительно в 2—
2,5 раза. Производство такого рода препаратов перспективно, осо-
бенно для пищевой промышленности и медицины, однако в нашей
стране оно ограничено.
За рубежом выпускаются кислые пепсиноподобные протеиназы,
используемые для гидролиза белков соевых бобов, для хлебопече-
ния и в медицине для улучшения пищеварения. Наиболее широко
для производства кислых пепсиноподобных внеклеточных протеи-
наз используются Aspergillus saitoi, Rhizopus chinensis и Penicil-
lium janthinellum. Схема получения на основе этих культур пре-
паратов классическая и особых отличий не имеет.
Подводя итог по характеристике протеолитических ферментов,
следует подчеркнуть, что технология этих препаратов освоена наи-
более широко. Это многотоннажное производство, объемы которо-
го превышают по денежному выражению реализуемой продукции
почти в 2 раза сумму реализации всех непротеолитических фермен-
тов. Причем доля микробных протеаз составляет '/г общего объе-
ма выпускаемых протеолитических ферментов. С учетом того, что
из года в год область применения протеаз расширяется и объемы
выпускаемой продукции возрастают, можно сказать, что это почти
самое крупномасштабное производство в технологии ферментных
препаратов. Проведены большие исследования протеаз, этому во-
просу посвящены обширные работы, обзоры и монографии. В дан-
ном разделе книги сделана попытка лишь слегка коснуться основ-
ных особенностей производства протеолитических ферментных пре-
паратов и подчеркнуть те стороны технологии, которые требуют
еще изучения и совершенствования.
В этом разделе книги не рассматривались протеазы, вызываю-
щие специфическое свертывание молока. Это было сделано умыш-
ленно, так как речь об этой группе протеолитических ферментов
пойдет в следующем разделе.
2.7. ПРОТЕОЛИТИЧЕСКИЕ ПРЕПАРАТЫ,
ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ СВЕРТЫВАТЬ
БЕЛОК МОЛОКА
(РЕННИНОПОДОБНЫЕ ПРОТЕИНАЗЫ]
Молокосвертывающие ферментные препараты применяются для производ-
ства сыра н сырковых масс.' В зависимости от источника молокосвертывающего
фермента можно получать сыры различного качества.
Способностью свертывать белок молока обладают многие протеолитические
ферменты, но в данной главе будут рассмотрены только те из ннх, которые
вызывают коагуляцию казеина, не проводя существенного гидролиза белка до
пептидов н аминокислот, т. е. такие протеиназы, которые по механизму своего
воздействия на белок молока близки к ферменту, выделяемому сычужком мо-
лочных телят н называемому сычужным ферментом, нлн химозином.
261
2.7.1. Механизм действия и свойства ферментов
Существует три вида препарата, обладающих молокосвертыва-
ющей активностью. Это сычужный фермент животного происхож-
дения, который извлекают из специального раздела желудка мо-
лочных телят и ягнят; микробные заменители сычужного фермен-
та, которые получают на основе различных культур микроорга-
низмов, и заменители животного происхождения, которые произ-
водят на основе ферментного сырья, поступающего с мясокомби-
натов и птицеперерабатывающих фабрик.
Субстрат. Субстратом для действия молокосвертывающих фер-
ментов является белок молока — казеин. Это гетерогенное соеди-
нение фосфопротеидной природы, состоящее приблизительно из
30 фракций. Отдельные молекулы образуют мицеллы, размер ко-
торых может колебаться от 40 до 280 нм. Считается, что наиболее
часто встречающиеся казеиновые мицеллы имеют диаметр около
90 нм.
Казеин — это глобулярный белок, который очень устойчив к
денатурирующим воздействиям. Например, при температуре 100 °C
казеин не изменяет величины оптического вращения, растворимо-
сти, вязкости, он стоек к обработке органическими растворителя-
ми. В основном казеин состоит из двух главных фракций: а- и
р-казеинов и минорного компонента у-казеина. Схематически при-
близительный состав основных фракций белков молока представ-
лен на рис. 2.50. Казеин в сумме белков молока является самой
большой частью, он составляет 76—88 %. Казеин легко осаждает-
ся при pH ниже 4,6 при комнатной температуре.
Фракция а-ка зеина составляет около 60 °/о белка молока.
Комплекс а-казеина растворим в 6,6 М мочевине и нерастворим
в ее 4,6 М растворе. В состав а-казеинов входят фракции as-ка-
зеинов, которые стабилизируются х-казеином. Фракция казеиново-
го комплекса, включающая многочисленные фрагменты as-казеи-
нов (А; В; С; D; ; as2i; as3j; as4), нерастворима в 0,4 М
растворе СаС12 при pH 7 и температуре от 0 до 4 °C. Если же
фракция as-казеинов находится в растворе в присутствии х-казеи-
на, то под действием ионов кальция она не осаждается.
Около 10% белка молока составляет х-казеин. Он также не-
однороден и имеет генетические варианты форм А и В. Фракция
х-казеннового компонента растворима в 0,4 М СаС12 при pH 7 и
температуре от 0 до 4 °C. Это фосфогликопротеин, он является
главным белковым компонентом казеина, который подвергается
первичной атаке реннина. Около 25 % общего казеина составляет
фракция р- казеин а. Эта фракция растворима в 4,6 М растворе
мочевины, но нерастворима в 3,3 М растворе при pH 4,6. р-Казеи-
ны осаждаются кальцием при 35 °C, но при температуре около
4 °C осаждение в присутствии кальция не наблюдается. По суще-
ствующей терминологии р-казеины различаются по следующим ге-
нетическим вариантам: р-казеин А и три его формы А1; А2 и А3;
р-казеины В, С, D и В».
262
Т ) Весь белок молока (fOO%)
pH ниже k, 6 -, t = 20°C
Р- Козеин (' 25 %):
р-А(А* А2, А3)
Р-ВиВг
р-с
Р-Р
A<xs,
Has,
C»Sl
Л«$;
«$,-Казеин(-50%):
«5, *
«S,
«s,
“Sr
- Растворимые сывороточ-
ные белки (fZ-24%)
. Коагулированный белок -
цельный к оз ей н (75-88%)
i-казеин
vm
X-Казеин
Минорный
компонент:
Г-А(А',Аг,А3)
Г- В
Т5-А
Т5-В
Н; S
Х-А: х-В
Рис. 2.50. Распределение белков молока и их фракционный состав
Минорным компонентом казеина является у-казеин, который
составляет около 3 % общего белка молока. Фракция у-казеина
растворима в 3,3 М растворе мочевины, но нерастворима в 1,7 М
растворе при pH 4,7 после добавления (NH^SOi. у-Казеин яв-
ляется сложным комплексом, имеющим генетические варианты
А1, А2, А3 и В, а также у-казеииы R, S, TSA и TSB.
Содержание отдельных фракций в казеине молока может за-
метно колебаться в зависимости от времени года, кормов, породы
животного и т. д. В пересчете иа белок молока соотношение фрак-
ций казеина может меняться: as — от 45 до 60 %, х — от 7 до 15,
Р — от 25 до 35 и у — от 3 до 7 %.
В работе М. Теплы, Я. Машек и Я. Гавлова (1980) приведены
данные о средних молекулярных массах отдельных компонентов
казеина и их изоэлектрические точки: as-казеин — 23 000, pJ 4,1;
р-казеина — 24 000, pJ 4,5; х-казеин без углеводного компонен-
та — 19 000, pJ 4,1 и у-казеии — 30 650, pJ- 5,8—6,0. Молекуляр-
ная масса большой мицеллы казеииа может достигать 5 000 000.
Существует большое количество гипотез о формировании ми-
целлы казеииа, ио единого мнения по этому вопросу пока нет. На
рис. 2.51 представлено несколько таких моделей, каждая из ко-
263
СаНРО4
~Каз£ины
Рис. 2.51. Гипотетические модели строения казеиновой мицеллы:
1 -модель Тальбора. Ядро (черное) состоит из а- и Вказеинов и окружено оболочкой
х-казеииа и некоторых фрагментов aS1 .казеина; // — модель Гарниера. Пористая
структура, в которой к ядрам (черные), состоящим из и казеина, прикреплены полимеры
as - и fJ-казеинов; III — модуль Роуса. Внутри глобулы — взаимосвязанные Р-, ая -ка-
зеины. и-казеин образуют поверхностный слой; IV — модель с участием СаНРО, (по дан-
ным В. И. Звягинцева, 1972)
торых имеет свои преимущества и недостатки. Предполагается,
что в казеине есть одна или несколько фракций, которые обладают
характером защитного коллоида. Этот коллоид как бы защищает
остальные казеиновые фракции от осаждения ионами кальция.
Фракция х-казеина обладает гидрофильными свойствами, в то вре-
мя как все остальные имеют в большей мере гидрофобные свой-
ства. С этих позиций модели /// и IV, где х-казеин находится на
поверхности мицеллы, кажутся наиболее приемлемыми. По своим
свойствам казеин выделяется среди других глобулярных белков.
Установлено, что казеин имеет относительно высокое содержание
пролина и оксипролина и, по-видимому, содержит мало спираль-
ных структур пептидной цепи. Такое строение казеина объясняет-
ся легкостью, с которой его гидролизуют протеолитические фер-
менты. Экспериментально установлено, что в поддержании струк-
туры мицеллы казеииа в растворимом состоянии принимают уча-
стие ионы Са2+ и остатки фосфорной кислоты (модель IV).
Сычужный реннин. В сыроделии обычно используют сычужный
препарат животного происхождения и значительно реже — его
микробные заменители. Сычужный препарат — это смесь фермен-
тов. Доля пепсина в нем определяется соотношением протеолити-
ческой активности к молокосвертывающей, и чем меньше эта вели-
чина, тем выше качество препарата и он более пригоден для сы-
роделия. Различают два вида сычужных препаратов. Наиболее
качественный, получаемый из желудка молочных телят, содержит
56—92 % химозина (КФ 3.4.23.4); 9—45 °/о пепсина А (КФ 3.4.23.1),
264
0,2—1,5 % пепсина В (КФ 3.4.23.2). Второй вид сычужного препа-
рата получают из желудков более взрослых телят, который содер-
жит 67,5—100 % пепсина А, от 0 до 35,6 % химозина (реннина) и
от 0 до 2,9 % пепсина В. Этот препарат заметно хуже первого,
хотя и приемлем для сыроделия.
Реннии в отличие от растительных и микробных протеаз мо-
жет существовать в виде своего предшественника — прореннина.
Это неактивное к молоку соединение, которое только в кислой сре-
де переходит в фермент реннин. Молекулярная масса проренни-
на 36 000—37 000, изоэлектрическая точка около pj 5. Прореннин
более стабилен в слабощелочных средах, чем реннин, но теряет
способность превращаться в реннин при pH 11 и выше. При pH 6,5
и комнатной температуре прореннин способен самопроизвольно
медленно превращаться в реннин (за 24 ч до 5 % прореннина пре-
вращается в реннин). Прореннин мгновенно превращается в рен-
нин прн pH 1. Его можно перевести в реннин прн pH 5—6 под воз-
действием пепсина.
В процессе активации прореннина происходят разрыв опреде-
ленной пептидной связи и отщепление от молекулы прореннина
полипептида с молекулярной массой 5 300—6 300. В результате
такого разрыва полипептидной связи прореннин превращается в
реннин. Отщепляемый при активации зимогена пептид содержит
10—15% белкового вещества. Отщепление идет с N-концевого
участка молекулы зимогена.
Микробный реннин. Кристаллический препарат реннина был по-
лучен еще в 1942 г. При выделении кристаллов реннина из раз-
личных объектов форма кристаллов была неодинакова: в виде
пластин, кубов и игл. По заключению многих исследователей, рен-
нин даже в кристаллическом виде неоднороден. Наиболее досто-
верной следует считать молекулярную массу реннина, равную
30700. С-концевой аминокислотой в реннине является аспарагин,
а N-концевой — глицин. Изоэлектрическая точка фермента pj 4,6.
Реннин наиболее стабилен при pH 5,4—6,3. При pH 3,5 проявля-
ется максимум протеолитической активности. Блокирование гисти-
дина и дисульфидных связей приводит к инактивации фермента.
Реннин плохорастворим в дистиллированной воде, его раство-
римость возрастает с увеличением ионной силы раствора. В пре-
паратах реннина сильнее проявляется молокосвертывающая ак-
тивность и гораздо слабее — протеолитическая активность по
сравнению, например, с пепсином. При электрофорезе реннина по-
лучается 3—4 фракции.
Процесс коагуляции казеина. Теория свертывания казеина ба-
зируется на предположении существования защитного коллоида,
который стабилизирует мицеллу казеина, и в случае отсоединения
этого стабилизирующего фрагмента казеин теряет свою раствори-
мость. Процесс осуществляется в несколько стадий. Первичная
фаза коагуляции характеризуется гидролитическим расщеплением
казеина при одновременном нарушении функции защитного кол-
лоида, вторичная — образованием сгустка в присутствии ионов
265
кальция и отделением сыворотки, и третичная фаза — это даль-
нейший медленный протеолиз свернувшегося казеина.
Первичная фаза. Роль защитного коллоида выполняет в
казеине фракция х-казеина. При действии реннина на казеин ос-
вобождается пептид, который растворим в 12 %-ной трихлоруксус-
ной кислоте. В его состав входит углеводный компонент, который
придает пептиду гидрофильные свойства. Этот пептид, как было
установлено, образуется в результате действия реннина на х-ка-
зенн. Молекулярная масса этого пептида 8 000. Было доказано, что
реннин в х-казеине расщепляет определенную пептидную связь
между фенилаланином и метионином. Сходство действия пепсина
и реннина объясняют тем, что оба фермента гидролизуют именно
эту связь в х-казеине.
Для первичной фазы коагуляции казенна процесс можно запи-
сать в обобщенном виде:
х-Казеин + Реннин -* Пара-х-казеин -}- Пептид (казеиномакропептад)
Основываясь на данных о первичной структуре х-казеина, бы-
ло установлено, что ренинн воздействует на часть х-казеина, име-
ющую следующую структуру:
N-Конец — Pyroglutamyl . . . His — (Pro — His)2 . . . —Leu —
Реинии
I
— Ser — Phy — Met—Ala — lie . . . Vai—С-конец->
105 106 169
---► Пара-х-казеин-|- Казеиномакропептид.
В результате воздействия реннина происходят изменение вяз-
кости и агрегирование частиц. Вязкость в первый момент реакции
падает, а потом возрастает вплоть до наступления коагуляции, т. е.
агрегирование начинается раньше, чем появляются первые хлопья
осадка. х-Казеин в первичной фазе подвергается только ограни-
ченному протеолизу, a as- и р-казеины существенно не изменяются.
Вторичная фаза. В этой фазе изменяется структура ка-
зеиновых комплексов. Увеличивается вязкость, нарушается мицел-
лярное строение казеина. Происходят интенсивное агрегирование,
коагуляция, сжатие осадка при одновременном выделении сыво-
ротки. Коагуляция зависит от степени гидратации казеиновых ми-
целл. Мицеллы в обычном состоянии несут одноименный отрица-
тельный заряд, что способствует их отталкиванию друг от друга.
При действии реннина наблюдается резкое снижение общего за-
ряда мицелл и наступает явление агрегации. Следовательно, одним
из условий начала агрегации дестабилизированных мицелл являет-
ся уменьшение межмицеллярных отталкивающих снл. Вторым
очень важным условием коагуляции является наличие свободных
ионов кальция. Ионы кальция связываются в казеине со свобод-
ными карбоксильными группами казеина и фосфосериновыми ос-
татками. Под действием ионов кальция происходит дальнейшее
266
снижение отрицательного заряда мицелл. Агрегация мицелл уси-
ливается, образуется новая полимерная сетка, которая является
основой гелевого сычужного сгустка, затем в результате броунов-
ского движения мицеллы сталкиваются, укрупняются, и начинает-
ся процесс коагуляции. Степень коагуляции зависит от pH реак-
ционной среды и температуры. Установлено, что с понижением pH
от 6,7 до 5,95 при температуре 25°C степень коагуляции увеличи-
вается; разрыв между ферментативной и неферментативной ста-
диями процесса уменьшается. Оптимальная температура для коа-
гуляции казеина 42,5 °C. В этих условиях начало коагуляции сов-
падает с окончанием ферментативной стадии. Стадию свертыва-
ния казеина и коагуляцию можно резко разграничить во времени,
если снизить температуру процесса. Так, внеся в молоко большое
количество реннина, можно добиться свертывания казенна при
О °C за 3 ч, тогда как видимая коагуляция казеинового комплекса
начнется только через 110 ч. В процессе коагуляции идет образо-
вание агрегатов из мицелл казеина. Сначала свертываются толь-
ко мицеллы сферической формы, затем они собираются в группы
и нити н образуют трехмерную пространственную сетку. Тенден-
ция к образованию казеинового комплекса наблюдается сразу
после разрушения стабилизатора этого комплекса — х-казеина.
Воздействие пепсина на казеиновый комплекс, особенно на
х-казеин, при pH 6,5 очень похоже на действие реннина; сходны
также и продукты, которые обнаруживаются после формирова-
ния сгустка. Комплексное воздействие пепсина и рениина на мо-
локо позволяет получать до 95 % казенна в виде сгустка в осад-
ке. При воздействии других протеолитических ферментов живот-
ного происхождения коагуляция казеинового комплекса тоже на-
блюдается, ио при этом резко возрастает содержание аминного
азота, протеолиз идет значительно глубже, захватывая все фрак-
ции казеина, и в сгустке обнаруживается только 40—45 % казеи-
на от исходного.
Подавляющее большинство микробных препаратов, обладаю-
щих молокосвертывающей активностью, имеет отличный от сычуж-
ного фермента механизм действия. Наиболее близки к реннииу
препараты, выделенные из культуры гриба Mucor pussillus Lindt.,
выращенной на отрубях. В технологии сыра имеет значение и по-
следующее поведение коагулирующего фермента в сгустке. Поэто-
му важна так называемая третичная фаза.
Третичная фаза. Если первые две фазы внешне очень
близки по действию на казеин не только реннина, но и многих
кислых протеиназ, особенно пепсина, то в третичной фазе наблю-
даются очень большие различия.
Реинин очень медленно гидролизует казеин, только слегка из-
меняя консистенцию сгустка, и накопления аминного азота почти
не наблюдается. Сгусток казеина, образованный другими кислы-
ми протеиназами, при последующем выдерживании подвергается
интенсивному воздействию протеиназ. Наблюдается накопление
аминного азота, сгусток постепенно размягчается и растворяется.
267
Попытки выделить из культур микроорганизмов фермент, обла-
дающий только молокосвертывающей активностью, и получить
препарат, лишенный протеолитической активности, не удались.
1.7.1. Получение молокосвертывающих препаратов
Препараты животного происхождения. В сыроделии использу-
ют в основном два препарата животного происхождения: сычуж-
ный фермент (реииии) и пищевой пепсин. Остановимся несколько
подробнее иа первом из них.
Сырьем для получения препарата является четвертый отдел
желудка (сычужка) молочных телят и ягнят. От одного теленка
по сухой массе можно получить 25 г сырья, а от ягненка — всего
8 г. Желудки телят по внешним признакам делятся на три сорта.
Желудки свежеэабитых сытых животных содержат больше
реииина, чем те, которые получены после забоя голодных живот-
ных, например, на крупных бойнях. Из чистых разделенных на сор-
та желудков удаляется легким нажатием творожок, сычужок за-
вязывается со стороны пищевода и надувается воздухом до уве-
личения его объема в 3 раза, затем его завязывают с другой сто-
роны и в таком виде при температуре 32—35 °C высушивают. Су-
шить лучше в воздушных сушилках в токе воздуха, не допускает-
ся сушка иа солнце, над источником тепла, в токе горячего возду-
ха. Необходимо очень быстро высушивать желудки. После сушки
их упаковывают и помещают в сухие холодильные камеры. -Кон-
сервировать сушеные желудки химическими веществами не реко-
мендуется. Состояние сушеных желудков должно тщательно кон-
тролироваться, так как они сильно подвержены порче самыми раз-
личными вредителями. Сушеные желудки телят на бойнях укла-
дывают по сортам в связках по 25 шт. и перевязывают в двух ме-
стах. Сушеные желудки хранят в сухих, темных, хорошо провет-
риваемых помещениях.
При получении сычужного фермента сухие сычужки измельча-
ют иа тонкие пластинки иа волчке без решеток и подвергают трех-
кратному экстрагированию 8%-иым раствором поваренной соли.
Первая обработка проводится в течение 16 ч при соотношении
сырья и экстрагента 1 : 12, вторая — 4 ч при соотношении 1 :6 и
третья — 2 ч при соотношении 1 : 12. Первые два экстракта объе-
диняют и направляют на выделение сычужного фермента, третий
используют как исходный экстрагент для новой порции сухих из-
мельченных сычужков.
Следующей стадией процесса являются активирование прорен-
нина и освобождение его от части балластных белков. Для этого
отобранные экстракты подкисляют 6%-ным раствором соляной
кислоты из расчета 3 мл/л и вводят 3 %-ный раствор борной кис-
лоты в качестве антисептика. В кислой среде формируется осадок
балластных веществ, который отделяют через 16 ч.
Для высаливания фермента приготовляют лизаты «а» и «б».
Лизат «а» готовят следующим образом. Слизистые оболочки же-
268
лудка свиньи измельчают и подвергают автолизу. Пепсиноген ак~
тивируют до пепсина 1,4 %-иым раствором соляной кислоты при
42 °C в течение 48 ч. Отделенная от взвесей жидкость и является
лизатом «а».
Лизат «б» готовят несколько по-другому. Трижды экстрагиро-
ванную мезгу сычужков обрабатывают концентрированной соля-
ной кислотой из расчета 10 % к массе мезги в присутствии дистил-
лированной воды, добавляемой из расчета 750 мл/кг мезги. К этой
смеси добавляют лизат «а» из расчета 500 мл/кг мезги. Обработ-
ку ведут в течение 24 ч при температуре 42 °C, затем отделяют
твердые взвеси и фильтрат используют как лизат «б».
Высаливание фермента ведут поваренной солью при насыще-
нии 1,0 и pH 4,0 с добавлением к экстракту 0,3 % концентриро-
ванной соляной кислоты и 5 % лизата «б». Образовавшийся оса-
док после уплотнения отделяют, смешивают с поваренной солью
в соотношении 1:2, высушивают прн 35°С в вакууме, измельча-
ют до состояния пудры, просеивают через сито № 32 и стандар-
тизируют по активности поваренной солью. После фасования упа-
ковывают в пергамент и жестяные банки. В готовом препарате
содержание соли составляет около 90 %, влажность — 2%, сы-
чужная активность — 100 000 ед. на 1 г препарата. Допустимая
обсеменеиность препарата до 104 сапрофитных микроорганизмов
иа 1 г.
Для изготовления 1 кг стандартного препарата требуется
13,5 сычужков молочных телят (или 105 сычужков ягнят) и 0,8 кг
слизистой оболочки желудка свиньи. Сычужный стандартный пре-
парат используют в сыроделии и для приготовления сырковых
масс. Помимо реннина препарат содержит некотороое количество
пепсина. Стандартный препарат реннина или очищенный экстракт
может быть использован для получения кристаллического ренни-
на. Кристаллический препарат имеет активность около 20 млн.
ед./г, содержание азота в препарате 14,5 или 90,7 % в пересчете
иа белок.
Схема выделения кристаллического препарата сравнительно
проста: измельченные сухие сычужки экстрагируют слабым соле-
вым раствором, экстракт подвергают диализу до отрицательной
пробы на ионы хлора. В результате диализа из экстракта выпада-
ет осадок, который отделяют центрифугированием. Полученный
раствор подкисляют до pH 4,4 уксусной кислотой, в результате че-
го выпадает осадок, содержащий фермент. Его отделяют центри-
фугированием и растворяют в 0,1 и. растворе соляной кислоты.
Нерастворившуюся часть осадка отделяют центрифугированием.
Прозрачный фугат обрабатывают 0,25 н. раствором НС1 и добав-
ляют насыщенный раствор хлористого кальция в соотношении
50:3. При комнатной температуре из этого раствора выпадают
кристаллы фермента в виде игл.
Известен и еще более простой метод получения кристалличе-
ского реннина. Высокоактивный экстракт из свежих или сухих сы-
чужков подвергают медленному насыщению поваренной солью. Че-
269
рез несколько дней выпадает осадок, который вновь растворяют в
дистиллированной воде и высаливают поваренной солью еще 2—
4 раза. После этого осадок растворяют и освобождают от остав-
шихся примесей методом сорбции на 0,1 %-ной свежеосажденной
гидроокиси алюминия.
Из очищенного раствора ферменты осаждают высаливанием
хлористым натрием и осадок растворяют в небольшом количест-
ве воды в течение 1—2 нед.; на холоде в этом растворе выпада-
ют кристаллы реннина.
Получение заменителей сычужного фермента из поверхностных
культур. Препараты, обладающие молокосвертывающей активно-
стью, можно получать из культур микроорганизмов, выращенных
поверхностным или глубинным способом. Однако полноценных
заменителей сычужного фермента очень мало.
Как уже говорилось выше, большинство протеиназ микробно-
го происхождения обладает способностью к неспецифическому
протеолизу, тогда как сычужный фермент разрывает в процессе
свертывания только одну пептидную связь в казеине и далее поч-
ти не гидролизует субстрат, что очень важно и необходимо для
нормального течения процесса созревания сыра.
Есть данные о промышленном использовании микробных заме-
нителей сычужного фермента в сыроделии. Наиболее часто назы-
ваются следующие виды микроорганизмов: Endothia parasitica,
Mucor pusillus и Mucor miehei. Есть данные об использовании не
всего комплекса протеаз продуцента, а каких-то определенных его
фракций. В этом случае круг используемых микроорганизмов за-
метно расширяется. Упоминаются другие виды мукоровых грибов:
из рода Aspergillus, Bacillus subtilis, В. mesentericus, Thamnidium
elegans и некоторые другие.
При производстве микробных заменителей сычужного фермен-
та в отличие от других технологий достаточно часто используют
выращивание продуцентов поверхностным методом.
Питательная среда и условия культивирова-
ния. На накопление молокосвертывающей активности в поверх-
ностной культуре существенное влияние оказывает состав среды,
ее влажность и pH, температура и длительность культивирования.
Все эти факторы, характеризующие условия культивирования,
в большой степени зависят от физиологических и видовых при-
знаков продуцента. Но для подавляющего числа изучаемых проду-
центов молокосвертывающего фермента используются пшеничные
отруби, крупнолопастные, с содержанием крахмала около 16—
18%. Есть рекомендации по добавлению в состав среды до 10—
15% солодовых ростков и 10 % древесных опилок. Эти компонен-
ты обеспечивают повышенную рыхлость среды, более эффектив-
ный отвод метаболитов, тепла и подведение к растущей культуре
кислорода. Экспериментально показано, что замена отрубей на
20—25 % такими рыхлителями не снижает, а даже в Некоторых
случаях повышает активность кислой протеиназы и молокосверты-
вающего фермента в готовой культуре.
270
Выделение фермента. Из готовой поверхностной куль-
туры проводят водную экстракцию, и далее экстракт является ис-
точником получения молокосвертывающих микробных препара-
тов — заменителей сычужного фермента. Так, в Японии из куль-
туры Mucor pusillus Lindt Lab. получают водный экстракт, затем
проводят осаждение ферментов сульфатом аммония или органиче-
скими растворителями и последующую очистку от сопутствующих
балластных веществ, белков и ферментов методом хроматографии
иа амберлите JRC-50 и сефадексе. Этот препарат имеет большое
сходство с сычужным ферментом.
Фирма выпускает также препарат «Мэйто-реинет», который
представляет собой сухой порошок, полученный путем осаждения
из экстракта поверхностной культуры белков растворителями или
сульфатом аммония. Этот препарат обладает высокой молокосвер-
тывающей и низкой протеолитической активностью. Порошок
стандартизуется добавлением лактозы. Препарат более термоста-
бильный, чем сычужный, и стабилен в диапазоне pH от 3 до 8. Не-
достаток этого препарата в том, что по заключению фармакологи-
ческой экспертизы он слаботоксичен. Несмотря на это, препараты
фирмы «Мэйто» на основе поверхностной культуры Mucor pusil-
lus пользуются сравнительно высоким спросом в сыроделии, так
как на двух первых стадиях получения сгустка казеина они по-
добны сычужному ферменту. Но все же имеются значительные от-
личия, проявляющиеся прежде всего в более быстром протеолизе
казеина при созревании сыров и иногда в появлении в сырах лег-
кой горечи. Тем не менее этот препарат широко используется в
промышленности. С культурами этого вида ведутся работы и в на-
шей стране.
Путем осаждения этиловым спиртом, фракционирования мето-
дом гель-фильтрации, очистки и концентрирования ультрафильтра-
цией из поверхностной культуры продуцента можно получить пре-
параты, обладающие высокой молокосвертывающейся активностью
(до 150 000—170 000 ед./г) при сравнительно низкой протеолити-
ческой активности и полном отсутствии липолитической. Для этих
же целей использовались поверхностные культуры грибов Asper-
gillus candidus, Thamnidium elegans, Mucor renninus, Mucor pusil-
lus Lindt Lab. и др. Однако, как правило, они обладали значитель-
ной протеолитической активностью, что приводило к более быст-
рому созреванию сыров и снижению органолептических качеств и
повышению брака.
Получение заменителей сычужного фермента из глубинных
культур. Известно много работ и предложений по получению за-
менителей сычужного фермента на основе глубинных культур мик-
роорганизмов. Из бактерий наиболее часто упоминаются предста-
вители семейства Bacillaceae, особенно В. subtilis, В. mesentericus,
В. cereus, В. brevis, В. polymyxa, а также бактерии рода Alcaloge-
nes, бактерии кишечной группы, молочнокислые бактерии микро-
кокков, некоторые виды дрожжей, микроскопических грибов и дру-
гих микроорганизмов.
271
Например, И. Эмануилов работал с глубинной культурой
В. mesentericus, выращивая ее на среде, состоящей из равных ко-
личеств (1,25%) пшеничных отрубей, молотого овса и молотого
ячменя. Культивирование проводилось при 30 °C и pH 7,5—7,6. При
осаждении двумя объемами метилового спирта из культуральной
жидкости получен ферментный препарат с выходом 0,7—0,8 г/л.
Опытные варки особых сортов болгарских сыров (брынза и кач-
ковал) показали, что сыры почти не отличались от контрольных
образцов, но они несколько быстрее созревали и имели более вы-
сокое содержание аминного азота. Н. В. Попова с сотрудниками
работали с несколькими видами микроскопических грибов, выра-
щивая их глубинным способом. Из глубинных культур A. niger 310,
A. parasiticus 320, A. flavus, A. terricola 3374, A. oryzae 4, А. огу-
zae И-476 и некоторых других получали препараты, из которых
наилучшими оказались препараты из A. parasiticus 320, выращен-
ной на кукурузно-казеиновой среде при 30 °C и pH 6,5 в течение
48 ч.
Большие исследования по разработке технологии молокосвер-
тывающих микробных препаратов проводились и проводятся мно-
гими учеными. Технология этих препаратов имеет очень много об-
щего. Различия только в выборе продуцента, его физиологических
особенностях и способе выделения специфической кислой протеи-
назы из комплекса других протеаз и липаз, присутствующих обыч-
но в культуре. Суть технологии сводится к нескольким операциям:
1) оптимизация состава среды и условий культивирования; 2) от-
деление биомассы продуцента; 3) освобождение от высокомолеку-
лярного балласта; 4) очистка и концентрирование ферментного
раствора; 5) осаждение молокосвертывающего фермента; 6) суш-
ка препарата и его стандартизация по активности. Разработано
сравнительно много интересных и реальных предложений, прове-
дены успешные опытно-промышленные испытания предлагаемых
технологий, ио пока в нашей стране в промышленных масштабах
такие препараты не выпускаются. Поэтому имеет смысл остано-
виться на некоторых препаратах, выпускаемых за рубежом.
Специалисты отмечают сравнительно хорошие качества препа-
рата «шуэ-кёд» американской фирмы «Chas. Pfizers & Cie, Inc»,
получаемого из гриба Endothia parasitica АТСС 14729. Продуцент
выращивают глубинным способом. Состав промышленной пита-
тельной среды следующий (в %): соевая мука — 3; препарат це-
релоза— 1; сухое молоко—1; нитрат натрия — 0,3; фосфат ка-
лия — 0,05; сульфат магния — 0,025; pH среды 6,8.
Засев проводится 5 % инокулята, длительность ферментации
48 ч. Учитывая то, что этот микроорганизм является сильным вре-
дителем целого ряда растений, вызывая эффект увядания, были
проведены исследования такого явления и установлено, что оно
вызывается специфическими токсинами — диапортином, андотио-
нином и радикализином. Поэтому при выделении препарата необ-
ходимо тщательно освобождаться от культуры продуцента н про-
водить тщательную очистку препарата. Выделение ренниноподоб-
272
ной протеиназы ведут двумя способами. Их отличие заключается
в том, что в одном случае для осаждения используют только суль-
фат аммония в различных концентрациях в сочетании с гель-филь-
трацией на сефадексе G-100 и хроматографией иа ДЭАЭ-целлюло-
зе; а во втором помимо высаливания сульфатом аммония приме-
няют осаждение изопропиловым спиртом и обработку углем «Дар-
ko-G-60». Фермент осаждают из фильтрата культуральной жидко-
сти. Такой очищенный препарат близок по свойствам к сычужно-
му ферменту, но, как и препарат фирмы «Мэйто», обладает спо-
собностью к более глубокому протеолизу сгустка казеина и обра-
зованию легкой горечи. Молокосвертывающая протеиназа Е. pa-
rasitica достаточно хорошо изучена. Фермент состоит из одной
пептидной цепи, имеющей a-структуру, его pJ равен 4,6. Он не со-
держит углеводного фрагмента, молекулярная масса его около
39 000. Оптимум pH имеет два экстремума: при 2—2,5 и при 4,5.
Фермент более активно, в 3—3,5 раза больше, чем реннин, гидро-
лизует пептидные связи в казеине. Молокосвертывающая актив-
ность для этого фермента проявляется меньше, чем для рениина,
и зависит от температуры и присутствия в реакционной среде
кальция, но больше, чем для препаратов фирмы «Мэйто».
Имеет промышленное значение препарат реннилаза, выпускае-
мый в Данни (фирма «Novo-Rennet»), который получают из гриба
Mucor miehei CBS 37065. Продуцент выращивают глубинным спо-
собом иа среде, состоящей из крахмала, соевой и ячменной муки.
Биомасса продуцента отделяется фильтрованием, и иа основе
фильтрата получают либо жидкий концентрат с активностью
1 000—46 000 ед.. МА/мл, либо в виде порошка с активностью
100 000—150 000 ед. МА/г. Изучение этого фермента показывает,
что эта кислая пептидаза, имеющая молекулярную массу около
39 000, pJ 4,2. Фермент стабилен в кислой зоне. Первая фаза свер-
5ывания казеина для этого фермента протекает медленнее, чем
ля сычужного, но в присутствии хлористого кальция реакция за-
метно ускоряется. Температурный оптимум свертывания казеина
лежит при 55—60 °C. Реннилаза отличается большей стабильно-
стью, чем сычужный фермент. Несмотря на большое сходство с
реннином, этот фермент также имеет повышенную протеолитиче-
скую активность и те же недостатки.
Большой интерес для сыроделия представляет французский
препарат фромаза, выпускаемый на основе глубинного культиви-
рования гриба Mucor miehei. Ои достаточно близок по своим свой-
ствам и процессу свертывания молока к японскому препарату из
Mucor pusillus, ио он все же ближе и точнее имитирует сычужный
фермент, что очень важно. Однако есть данные, что сыры, полу-
чаемые с помощью этого препарата, также достаточно часто от-
личаются от контрольных образцов.
Среди бактериальных заменителей сычужного фермента следу-
ет отметить чехословацкий препарат микрозим. Продуцентом фер-
мента является штамм В. subtilis 368 или его мутант SEL/76. Для
получения препарата используют две питательные среды (по даи-
10 Зак. 232 273
ным М. Теплы, Я. Машека и Я. Гавловой, 1980). Первая среда име-
ет состав (в %): пшеничная кормовая мука — 3; солодовый экс-
тракт — 5,2; сухие чешские дрожжи — 0,3; смесь соевого и сили-
конового масел — 0,2. Вторая среда содержит восстановленное мо-
локо, приготовленное из сухого обезжиренного молока. Вторую
среду добавляют к первой после термостатирования. Температура
питательной смеси 38 °C. После выращивания продуцента культу-
ральная жидкость сгущается в 5 раз, осветляется добавлением
3—5 % СаС12, центрифугируется и обеспложивается через фильт-
ры — это и есть препарат микрозим. Микрозим содержит молоко-
свертывающую пептидазу, которая проявляет максимум активно-
сти в кислой и нейтральной областях pH. Препарат имеет боль-
шую термостабильиость (оптимальная температура 70°C). Испы-
тания микрозима в сыроварении подтвердили его высокие качест-
ва как заменителя сычужного фермента, особенно для приготов-
ления мягких сыров.
Преимуществом бактериальных препаратов является то, что
они не требуют длительных исследований на токсичность, в то вре-
мя как грибные продуценты могут образовывать афлатоксины и
требуют постоянного контроля. Учитывая некоторые отличия мик-
робных заменителей сычужного фермента, их рекомендуется ис-
пользовать при получении определенных сортов сыра не для пол-
ной его замены, а только частично, что также экономически очень
выгодно и перспективно. Иными словами, замена сычужного фер-
мента микробными протеазами специфического действия возмож-
на, но эта проблема должна решаться в тесном контакте специа-
листов в области технологии ферментных препаратов и сыроделия.
2.8. ПРЕПАРАТЫ, СОДЕРЖАЩИЕ ГЛКЖОЗООКСИДАЗУ
И КАТАЛАЗУ
Применение этих препаратов связано с необходимостью в ряде случаев
удалять из продуктов глюкозу или кислород. Прн приготовлении яичного
порошка или мясных изделий и высушенном состоянии происходит потемнение
готоиого продукта и связи с образованием мелаиоидинов прн высокой темпера-
туре (соединения глюкозы со свободными аминокислотами). Обработка продукта
перед сушкой глюкозооксидазой позволяет перевести глюкозу в глюконовую
кислоту, что исключает образование повышенной цветности в сухом продукте.
Эти ферменты чаще используются в виноделии, пивоварении, консервной, соко-
вой » безалкогольной промышленности для удаления кислорода, что способ-
ствует повышению стойкости продуктов к длительному хранению и сохранению
цветности продукта. Эти ферменты применяются совместно, так как их катали-
тическая активность взаимосвязана. Реакция идет по следующей схеме:
Глюкозо-
2С,НИО, + 20, + 2Н,О-------- 2С«Н„О, + 2Н,О,
оксидаза
+
Каталаза
____________2Н,О,--------*2Н,О-Ю,_____________
Оба
2С,НЫО. +0,----------2С.Н12О,
фермента
274
Введение ферментов в напитки в момент их укупорки позволяет полностью
удалить из продукта и воздушного объема кислород, что сильно замедляет
процессы окисления различных соединений и делает невозможным развитие
микроорганизмов. Эти ферменты могут наноситься в виде тончайшего покрытия
иа пергамент совместно с необходимым количеством глюкозы и буферных солей.
Герметичная упаковка в такой пергамент, например, сливочного масла позволяет
предотвратить прогоркание масла и его потери при хранении. Влага, выделяемая
из масла, растворяет ферменты, буферные соли и глюкозу, и кислород, нахо-
дящийся в воздушном пространстве между маслом и пергаментом, расходуется
иа окисление глюкозы н полностью потребляется. В такой атмосфере масло может
храниться без образования прогорклого слоя длительное время. С применением
определенных приемов с помощью глюкозооксндазы и каталазы и бескислород-
ной среде можно хранить сыр, сырое мясо, жидкие концентраты, муку, крупы,
майонез, молоко и т. д. С помощью каталазы можно разлагать перекись во-
дорода, например, в молоке после его доставки с фермы на молочный завод;
ее также используют для осветления крови и т. д.
Очищенные препараты глюкозооксндазы могут быть использоиаиы как ле-
карственное средство при обработке наружных рай и ожогов.
2.8.1. Источники получения глюкозооксндазы и каталазы
Источниками этих ферментов являются микроскопические гри-
бы, относящиеся преимущественно к роду Penicillium и значитель-
но реже к роду Aspergillus. Среди пеницилловых грибов наиболь-
шей способностью к синтезу внеклеточному этих ферментов обла-
дают виды: Р. chrysogenum, Р. casei, Р. nigricans, Р. notatum,
Р. adametzi, Р. lividum, Р. cyaneofulvum, Р. herguei и особенно
Penicillium vitale Pidopl. et Bilai. Культура A. niger продуцирует
эти ферменты внутриклеточно.
2.8.2. Механизм действия и свойства глюкозооксндазы
Субстрат. Субстратом для глюкозооксндазы является глюкоза,
а для действия каталазы — перекись водорода. Рассмотрим от-
дельно глюкозооксидазу. Фермент глюкозооксидаза (0-Р-глюко-
за : О2-оксидоредуктаза, КФ 1.1.3.4) обладает высокой специфич-
ностью по отношению к субстрату. Он способен окислять 0-Л-глю-
козу, проявляя особое сродство ко второму и третьему углерод-
ным атомам в молекуле 0-Л-глюкозы. Под действием глюкозоок-
сидазы 0-О-глюкоза превращается в глюкоиовую кислоту.
Глюкозооксидаза относится к флавиновым ферментам. Она ка-
тализирует окисление глюкозы за счет молекулярного кислорода.
Наличие фермента, катализирующего прямое окисление глюкозы
за счет молекулярного кислорода и не сопровождающееся выде-
лением СО2, было обнаружено еще в 1904 г. М. А. Максимовым
в отпрессованной жидкости из гриба A. niger. Ои же отмечал то,
что эти растворы подкисляются. Дальнейшие исследования
Д. Мюллера (1929) подтвердили установленный факт и показали,
что потребление кислорода отпрессованной жидкостью из гриба
в присутствии глюкозы связано с образованием глюконовой кисло-
ты. Д. Мюллер назвал этот фермент глюкозооксидазой. Позднее
было установлено, что этот фермент — ие истинная оксидаза, а де-
,0* 275
гидрогеназа, и поскольку акцептором водорода является молеку-
лярный кислород — глюкозоаэрогидрогеназа.
Препараты, получаемые из грибов рода Penicillium и имеющие
активным началом глюкозооксидазу, использовались в медицине
как антибиотики и были известны под названиями: нотатии, пеиа-
тин, пенициллин Б, микроцид. Позднее было установлено, что это
фермент и что антибиотическое воздействие связано либо с обра-
зующейся перекисью водорода, либо с процессом потребления из
реакционной среды кислорода.
Механизм действия. Механизм реакции, катализируемый глю-
козооксидазой, изучался рядом исследователей. Так как глюкозо-
оксидаза относится к флавопротеинам, которые в большинстве
своем являются дегидрогеназами, был поставлен вопрос о том,
каким же образом осуществляется окисление глюкозы. Происходит
ли перенос двух атомов водорода от глюкозы или ее гидратно-
альдегидной формы на молекулярный кислород, являющийся ак-
цептором водорода, или путем активации молекулярного кислоро-
да, в результате чего один из кислородных атомов соединяется с
альдегидной группой глюкозы, а другой взаимодействует с водой
и образует перекись. Для выяснения этого механизма Р. Беитлей
и А. Нейберг (1949) при изучении культуры Р. notatum использо-
вали меченые воду (Н28О).и кислород (16О2). Результаты этих
опытов позволили авторам придти к выводу, что изучаемый фер-
мент катализирует перенос водорода от глюкозы на кислород. Так
как в процессе этого переноса не наблюдается образование сво-
бодного радикала, они считали более вероятным перенос ддух
электронов. Позднее С. Нокамура и др. (1967), использовав в сво-
их опытах высокоочищениый фермент глюкозооксидазы Р. amaga-
sakiense на основании кинетических исследований установили,
что во время реакции флавинадеииндинуклеотидная (ФАД) груп-
Рис. 2.52. Схема механизма действия флавиновых ферментов
276
па глюкозооксидазы не превращается в сколько-нибудь заметных
количествах в семихннон. Ученые, разбирая общие вопросы меха-
низма реакций, катализируемых флавопротеинами, пришли к за-
ключению, что картина общего механизма восстановления следу-
ющая: оба водорода переносятся в виде протонов, а субстрат об-
разует ковалентное соединение с системой колец флавина
(рис. 2.52). Образование и расщепление этих промежуточных сое-
динений предусматривает механизм транспорта электронов, кото-
рый отражает суть протекаемой ферментативной реакции. А соот-
ветствующие места расположения на поверхности белка кислых и
основных групп обеспечивают катализ дегидрирования и отвеча-
ют за быстроту ферментных реакций.
Изучение кинетики глюкозооксидазиой реакции позволяет ут-
верждать, что в процессе катализа ФАД-часть фермента может
находиться либо в полностью окисленной, либо в полностью вос-
становленной форме. Таким образом, в самом общем виде про-
цесс окисления 0-£>-глюкозы глюкозооксидазой можно представить
в два этапа. Первоначально p-D-глюкоза в присутствии кислорода
превращается в б-глюконолактои:
Н ОН
I I
но с—с. он
Х/он ну
I
СН.ОН
fl -D-Глюкоза
Глюкозоок- ,
сидоза + О2
н ОН
I I
но q—с
Уон ну=о <- н2о2
но—о
I
сн2он
<7 - Глюкоколактон
Второй этап реакции происходит самопроизвольно без участия
фермента. В присутствии воды б-глюкоиолактои превращается в
глюконовую кислоту:
Н он
Н Н Н
----О'
он н п
, , I I -й°
с—с—с—с—с—су
I I I I I ^он
ОН он ОН Н он
СН2ОН
d ’Глмг'п*п',„*тпн
Глюкановая кислота
Глюкозооксидаза подобно другим флавиновым ферментам не
катализирует реакции непосредственного окисления субстрата мо-
лекулярным кислородом. Вместо этого происходит перенос атомов
водорода через промежуточные соединения с участием ФАД, кото-
рый играет роль простетической группы в ферменте:
(J-P-Глюкоза -f- ФАД -> 6-Глюконолактон -f- ФАДН2
ФАДН2 + О2 -> ФАД + Н2О2
277
Из схемы видно, что два атома водорода переносятся на фла-
виновую группу фермента, а лишь потом — на молекулярный кис-
лород. Глюкозооксидаза является сложным ферментом, состоящим
из простетнческой группы (две молекулы ФАД) н гликопротеида.
По своей структуре глюкозооксидазы микроорганизмов имеют мно-
го общего. Так, глюкозооксидаза A. niger характеризуется высо-
ким содержанием аспарагиновой и глутаминовой кислот, глицина
и аланина и низким содержанием цистеина, метионина и трипто-
фана. Было также определено, что между углеводными остатками
и аминокислотами имеется гликозид амидная связь, образованная
N-ацетилпроизводным глюкозамина и аминогруппой аспарагина.
Подобные данные были получены и для глюкозооксидаз из
Р. amagasakiense и Р. vitale Pidopl. et Bilai. Глюкооксидаза P. vi-
tale содержит в основном 130 остатков аспарагина, 99 серина,
111 пролина, 111 глицина, 108 аланина и другие аминокислоты.
Меньше всего в молекуле фермента цистина (4). Для последнего
продуцента было установлено, что все олигосахаридные группы
связаны с пептидами гликозилпептидной связью с участием аце-
тилглюкозоамина и аспарагина и что в молекуле шесть таких уг-
леводных включений со средней молекулярной массой около 3 000.
В формировании активного центра и пространственной струк-
туры фермента принимает активное участие простетическая груп-
па глюкооксидазы. Многими исследователями высказывается мне-
ние, что ФАД можно рассматривать как мостик между субъедини-
цами в молекуле фермента. Остается пока не до конца ясным, яв-
ляются ли обе молекулы ФАД участниками каталитического акта
и входят в активный центр фермента или же одна из них выпол-
няет роль стабилизатора структуры фермента.
При электронно-микроскопическом исследовании кристалличе-
ских гомогенных препаратов глюкозооксидазы Р. vitale, негативно
контрастированных урамилацетатом, обнаружены крупные пачки
трубоподобных образований, уложенных бок о бок, а также от-
дельные трубы с диаметром около 220 А и толщиной стенок 50 А.
Трубы можно рассматривать как трубчатые кристаллы, стенки ко-
торых представляют монослои молекул. В стенках труб молекулы
уложены по спирали с шагом около 60 А. На основании картины
оптической дифракции сделан вывод о том, что наиболе вероят-
ными являются параметры спирали, в которой на период повторе-
ния приходится 11 витков и 50 молекул. На профилированных изо-
бражениях при включении в фильтрацию ближних рефлексов Мо-
лекулы выглядят образованными из двух отчетливо различаемых
половин, каждая из которых в свою очередь состоит из двух субъ-
единиц. С учетом толщины стенки размеры элементарной ячейки
примерно 50X55X75 А, в нее входит одна молекула.
Данные, приведенные по структуре различных глюкозооксидаз,
в частности глюкозооксидазы Р. vitale Pidopl. et Bilai, определяют
ее весьма специфические физико-химические свойства. Так, спектр
ее поглощения характеризуется: Хтах при 278/280, 380, 460 нм и
Xmin при 250, 320 и 410 нм. Отношение Дзво/^Ьво в препаратах
278
кристаллической глюкозооксидазы равно единице. Молекулярная
масса фермента, определенная методом светорассеивания, равна
150 000 и константа седиментации — 7,8Х1&~13 с-1- Молекуляр-
ный коэффициент экстинкции кристаллических препаратов глюко-
зооксидазы при 460 нм равен 2,20-104 М_,-см~*. Изоэлектрическая
точка, определенная методом электрофокусирования в ПААГ, на-
ходится в области pH 4,7—4,8. Оптимальный pH для действия
фермента находится в интервале 5,6—5,8.
Термостабильность глюкозооксидазы сравнительно высокая.
Так, 15-минутное прогревание растворов кристаллической глюко-
зооксидазы при температуре до 50 °C в диапазоне pH от 4,0 до
5,6 не снижаеттактивность фермента. Прогревание же при этих ус-
ловиях, но при температуре 56 °C вызывает падение активности на
10—12 %. Полная инактивация глюкозооксидазы Р. vitale наступа-
ет при 15-минутной экспозиции при температуре 70°С. Глюкозоок-
сидаза Р. vitale обладает высокой специфичностью, ее молекуляр-
ная активность по отношению к p-D-глюкозе равна 42 000 ед./мл.
Ионы ртути и меди в концентрации соответственно 10-3 и 10~5
снижают активность и термостабильность фермента. Ионы каль-
ция и NH+ в концентрации, превышающей концентрацию ионов
ртути на 1—2 порядка, предохраняют фермент от ингибирующего
действия этими ионами. В конце 70-х годов было показано, что
глюкозооксидаза достаточно хорошо стабилизируется от неблаго-
приятных внешних воздействий в присутствии ионов кальция.
2.8.3. Получение препаратов глюкозооксидвзы
В литературе известны данные о получении препаратов глюко-
зооксидазы из культур микроорганизмов, выращенных как поверх-
ностным, так и глубинным способами. В последние годы почти ис-
ключительно для этих целей используется глубинная культура
продуцентов. В нашей стране в качестве продуцентов глюкозоокси-
дазы предполагалось использовать A. niger и Р. vitale. Наиболее
фундаментальные и глубокие разработки были проведены под ру-
ководством М. Ф. Гулого, В. И. Билай, Н. М. Пидпличко
Р. Г. Дегтярь их учениками и коллегами. Такие широкие исследо-
вания помогли найтн высокопродуктивный по глюкозооксидазе
продуцент Peniciilium vitale Pidopl. et Bilai 1312/140, изучить его
физиологию, разработать технологию получения кристаллической
глюкозооксидазы, создать современное промышленное производст-
во и наладить выпуск в стране высокоактивных и стабильных пре-
паратов глюкозооксидазы.
Питательная среда и условия культивирования. Еще в 70-е го-
ды было установлено, что, изменяя соотношение между концентра-
цией в среде глюкозы и KNO3, можно подавить у микроорганизма
способность к образованию каталазы и в то же время предельно
повысить продуктивность культуры по глюкозооксидазе. Напри-
мер, высокая активность глюкозооксидазы в культуральной
жидкости при полном отсутствии каталазы наблюдалась при со-
279
держании глюкозы в среде 10 % и KNO3 0,5—1 %, понижение кон-
центрации KNO3 от 0,5 до 0,1 % при прочих равных условиях
практически приводит к тотальному подавлению способности гри-
ба образовывать глюкозооксидазу. Культуральная жидкость, со-
держащая только глюкозооксидазу, обладает антибиотической ак-
тивностью, так как образующаяся в результате окисления глюко-
зы перекись водорода ие подвергается разложению под действием
каталазы. Культура Р. vitale Pidop. et Bilai обладает способно-
стью продуцировать заметные количества инвертазы, и потому ее
можно культивировать на средах, содержащих сахарозу. При изу-
чении динамики накопления биомассы гриба и глюкозооксндазы
иа средах с глюкозой и сахарозой было установлено, что на среде
с сахарозой продуцент потребляет только глюкозу. На средах с
сахарозой накопление биомассы и глюкозооксндазы протекает в
начальный момент выращивания несколько медленнее, чем на сре-
де с глюкозой. По-видимому, это связано с тем, что потребление
сахарозы лимитируется синтезом инвертазы, которая начинает на-
капливаться чуть позже, ближе к середине логарифмической фа-
зы роста культуры. Присутствие в питательной среде ионов каль-
ция, марганца, аммония и хлора повышает способность микроорга-
низма синтезировать глюкозооксидазу. А такие ионы, как цинк,
медь, железо и кобальт, почти не влияют или даже в некоторых
случаях тормозят синтез фермента, ио стимулируют образование
большого количества биомассы.
Выделение ферментов. В Институте биохимии УССР разрабо-
тана высокоэффективная реальная технология глюкозооксидаз-
ных препаратов из культуральной жидкости Р. vitale путем ее очи-
стки с помощью ультрафильтрационных и сорбционных методой.
Ферментный препарат выпускают в сухом виде. Гомогенные препа-
раты глюкозооксндазы из Р. vitale имеют высокую ферментатив-
ную и антимикробную активность. Ферментативная активность
очищенных препаратов глюкозооксндазы составляет от 150 000 до
200 000 ед./г препарата, а удельная активность — до 350 000 ед./г
белка. Следует внести уточнение, что за единицу активности при-
нимается такое количество фермента, которое катализирует окис-
ление 1 мкмоля глюкозы за 1 мии при 30°C в атмосфере кислоро-
да, что сопровождается потреблением 1 мкмоля О2, равного
22,4 мкл, и образованием 1 мкмоля перекиси водорода.
Сухие препараты глюкозооксндазы получают путем высушива-
ния раствора фермента методом сублимации. Препараты глюко-
зооксидазы достаточно хорошо хранятся при низкой температуре
(3—6°С), потеря активности в течение года не превышает 20%.
Глюкозооксидаза фасуется в стеклянные флаконы по 100 000 ед.
в каждый, которые герметически закрываются.
В общих чертах технология глюкозооксидазных препаратов
складывается из нескольких взаимосвязанных процессов. Готовая
культуральная жидкость концентрируется, и ее pH доводится до
6,7—7,0. Затем она обрабатывается около 1 ч оксидом алюминия
при периодическом перемешивании. На оксид алюминия глюкозо-
280
оксидаза избирательно сорбируется почти полностью. Сорбент
вместе с глюкозооксидазой отделяют и направляют в реактор для
поэтапной элюции. Элюция проводится аммоиийфосфатиым буфе-
ром из расчета 0,45—0,5 л на 1 кг оксид алюминия. В процессе
сорбции и элюции в связи с уменьшением объема обрабатывае-
мой жидкости происходит концентрирование глюкозооксндазы в
ферментном растворе в 10—20 раз. Из полученного элюата этано-
лом (в соотношении 2:1) осаждают глюкозооксидазу, затем оса-
док вновь растворяют в ледяной дистиллированной воде, центри-
фугированием отделяют нерастворимый балласт и из иадосадочной
жидкости фермент вновь осаждают ацетоном (2:1). Осадок рас-
творяют в минимальном количестве воды и высушивают методом
сублимации. Такие препараты обладают высокой активностью, их
выход 80—90 % исходной. Это очень высокий выход, и трудно на-
звать примеры подобной технологии с таким выходом.
Из высокоочищенного препарата легко получить кристаллы
глюкозооксндазы. Кристаллизацию можно вести из водных рас-
творов сульфатом аммония при его содержании 0,52—0,55 от пол-
ного насыщения. К водным 2,5—3 %-иым растворам фермента при
комнатной температуре добавляют тоикоизмельчеиный порошок
сульфата аммония до образования легкой мути. Через 3—5 ч на-
чинает формироваться осадок, а через 2—3 дня кристаллы глю-
козооксидазы в виде тонких игл отделяют и перекристаллизовыва-
ют (последующие перекристаллизации протекают в 15—20 раз
быстрее). Такие высокоочищенные кристаллические препараты мо-
гут быть использованы для медицинских целей и в научно-иссле-
довательских работах. Высокоочищеииую глюкозооксидазу можно
использовать в пищевой промышленности в качестве антиокислите-
ля для удаления остатков кислорода, что важно для стабилизации
ряда пищевых продуктов (жиров и жирсодержащих продуктов,
напитков, мясопродуктов, концентратов и др.); для удаления ос-
татков глюкозы перед высушиванием некоторых продуктов (яиц,
мяса и др.).
2.8.4. Механизм действия и свойства каталазы
Каталаза (Н2О2: Н2О2-оксидоредуктаза, КФ 1.11.1.6) является
белком, относящимся к геминовой группе ферментов. Каталаза
широко распространена в природе, оиа обнаружена у животных,
растений и микроорганизмов, за исключением анаэробов.
У большинства животных каталаза обнаружена в печени, эри-
троцитах и почках. Главная роль каталазы заключается в защите
клеток организма от токсического действия перекиси водорода, ко-
торая образуется в клетках под действием некоторых флавиновых
ферментов, таких, как ксаитииоксидаза, амииооксидаза, оксидазы
D- и L-амииокислот и некоторых других. Каталаза, разрушая
перекись водорода, регенерирует кислород, который может быть
использован другими ферментами при окислении различных суб-
стратов. Иначе говоря, каталаза может действовать пероксидазным
281
путем и непосредственно участвовать в обмене ряда доноров во-
дорода. Есть данные, которые позволяют предполагать, что ряд
серьезных заболеваний в организме человека связан с понижени-
ем уровня каталазы в печени и других органах. Это дает основание
рассматривать каталазу как одно из перспективных профилактиче-
ских лекарственных средств.
Исследованию механизма действия каталазы посвящен целый
ряд работ. По мнению многих авторов, каталаза и пероксидаза
ускоряют реакции одного типа, но каталаза окисляет саму пере-
кись водорода и не окисляет большинство веществ, на которые
действует пероксидаза. Известно несколько теорий, по-разному
объясняющих механизм действия каталазы на перекись водорода,
но все они говорят о сложном процессе разложения перекиси во-
дорода на О2 и Н2О с образованием не менее двух комплексов
фермента с субстратом, в результате чего происходят окисление
простетической группы фермента и затем ее восстановление. Про-
стетическая группа каталазы прочно связана с белковой частью
молекулы, вероятно, через карбоксильные остатки. Отличительной
особенностью каталазы является то, что ее простетическая группа
непосредственно участвует в активации субстрата.
Каталаза является ферментом с двойственной функцией. Фер-
мент катализирует разложение перекиси водорода на воду и мо-
лекулярный кислород:
I тип. Н2О2 + КаталазаКаталаза - Н2О2.
II тип. Каталаза-Н2О2 + Н2О25±Каталаза + О2 + 2Н2О.
В присутствии спиртов и небольшого количества перекиси во-
дорода фермент способен окислять спирт до альдегида, т. е. про-
являть пероксидазную активность. В этом случае расходуется од-
на молекула перекиси водорода.
III тип. Каталаза-Н^ + CjHjOH -* Каталаза + 2Н2О -f- СН3СНО.
Тип протекаемой реакции зависит от коицеитрации в реакци-
онной среде перекиси водорода. При ее высоких концентрациях
протекает реакция каталазного типа (I и П), а при низких — ре-
акция пероксидазного типа (III). В условиях существования жи-
вой клетки каталаза работает, как правило, по пероксидазному
типу. Каталазы в зависимости от места локализации и происхож-
дения заметно различаются между собой по структуре, фермента-
тивной активности и физико-химическим свойствам. Простетиче-
ской группой большинства каталаз, как об этом говорилось, явля-
ется гематин, представляющий собой хелатное соединение, в кото-
ром атом железа соединен с тетрапиррольиой (порфириновой)
кольцевой структурой — протопорфирииом IX.
Характер связи простетической группы с белком окончательно
ие установлен. В литературе обсуждается вопрос о возможности
взаимодействия карбоксильной группы пропионовой кислоты боко-
вой цепи гематина с гуанидиновыми группами аргииииовых остат-
ков или азотом гистидина подобно тому, как это имеет место в
282
миоглобине и гемоглобине. В молекуле каталазы стабилизирован-
ным является окисленное состояние железа. В ходе разложения
перекиси водорода каталазой валентность железа не меняется.
Восстановление Fe3+ в Fe2+ возможно только при денатурации
фермента. В молекуле каталазы содержится до 0,09 % железа, ее
молекулярная масса составляет 240 000—300 000. Эти цифры сви-
детельствуют, что в молекулу фермента входят 4 атома железа,
которые участвуют в формировании 4 простетических групп фер-
мента.
Рентгенографические исследования структуры каталазы Р. vi-
tale показали, что размеры молекулы каталазы, измеренные по
модели, оказались равными 70X90X120 А. Фермент обладает
субъединичной структурой. Анализ аминокислотного состава ката-
лазы Р. vitale показывает высокое содержание аспарагиновой и
глутаминовой кислот, глицерина, аланина, лейцина и фенилалани-
на. В белковой части каталазы отмечается низкое содержание ти-
розина, триптофана, гистидина и пролииа. Сравнительно низкое
содержание двух последних аминокислот косвенно свидетельству-
ет о высокой степени спирализации полипептидной цепи н ком-
пактности молекулы каталазы. Это особенно четко прослеживает-
ся для каталазы микробного происхождения.
Каталаза является гликопротеидом, в состав ее углеводного
компонента входят 44 остатка нейтральных сахаров (манноза, га-
лактоза), 19 остатков глюкозоамина и 3 остатка галактоамина.
Микробные каталазы (Р. vitale) не содержат сульфгидрильных
групп, в то время как каталазы животного происхождения (бычья
печень) содержат их до 16. Каталаза промышленного штамма
Р. vitale обладает сравнительно высокой термостабильностью. Так,
при 10-минутной экспозиции при 65 °C активность сохраняется пол-
ностью, при 75 °C инактивируется 50 % фермента и только при
80 °C фермент полностью теряет свою активность. Эти показатели
значительно выше, чем для каталаз из других источников. Ката-
лазы микробного происхождения обладают широким диапазоном
оптимального pH — от 4 до 9.
2.8.5. Получение препаратов каталазы
Питательные среды и условия культивирования. Каталазу мож-
но получать в виде высокоочищенного гомогенного кристалличе-
ского препарата или же в смеси с глюкозооксидазой. В том и дру-
гом случае в качестве продуцента используется микроскопический
гриб Р. vitale, который выращивают глубинным способом. От со-
става среды во многом зависит способность микроорганизма об-
разовывать преимущественно каталазу или глюкозооксидазу нли
оба фермента одновременно. Наибольшее значение имеют соотно-
шение углерода и азота, pH среды и суммарное количество сухо-
го вещества в среде. На средах, обедненных источниками углеро-
да, но содержащих значительные количества KNO3, образуется
283
преимущественно каталаза и практически не синтезируется глюко-
зооксидаза. Так, в лабораторных условиях было установлено, что
при соотношении источника углерода в среде (глюкоза или саха-
роза) к источнику азота (KNO3) в пределах от 10:1 до 10:5 на-
блюдается преимущественный синтез Р. vitale каталазы, а глю-
козооксидаза образуется в следовых количествах.
Выделение ферментов. Выделение каталазы можно проводить
методом сорбции на оксиде алюминия из нативной культуральной
жидкости или из ультраконцентрата. Каталаза сравнительно лег-
ко (на 90—95 %) элюируется с сорбента 0,1 М фосфатным буфе-
ром при pH 6,8. Далее ее можно осаждать изопропиловым спир-
том в соотношении 1 : 1,2 и затем высушивать. Активность препа-
рата составляет 80—90 % исходной. В производственных условиях
при глубинном культивировании Р. vitale можно получать препа-
рат с каталазной активностью до 1 300—1 500 ед. на 1 мл культу-
ральной жидкости, содержащей до 0,12—0,14% белка и около
1,5—1,8% сухого вещества. Готовая культуральная жидкость име-
ет pH около 8. При промышленном производстве целесообразно ис-
пользовать методы ультрафильтрации, так как они позволяют не
только сконцентрировать ферментный раствор, но и очистить его
от низкомолекулярных балластных веществ. Из ультраконцентра-
та культуральной жидкости каталазу можно извлечь методом
сорбции 'на оксиде алюминия или других содержащих алюминий
сорбентах (например, каолине). Затем каталазу элюируют с сор-
бента и подвергают традиционным методам очистки и кристалли-
зации.
Препараты каталазы в промышленных условиях в нашей стра-
не получают на основе глубинной культуры Р. vitale Pidop. et Bi-
lai с использованием сорбционных и ультрафильтрационных мето-
дов. Препараты выпускаются в сухом виде. Промышленные пре-
параты каталазы Р. vitale обладают высокой активностью — 1 г
препарата содержит 4—8 млн. ед. активности и удельную актив-
ность до 20 млн. ед. на 1 г белка. Здесь за единицу каталазной
активности принимается количество фермента, катализирующее
разложение 1 мкмоля перекиси водорода за 1 мин при концентра-
ции субстрата 0,01 М, pH 6,8 и температуре 0°С. Сухие препара-
ты каталазы при температуре 3—6°C удовлетворительно сохраня-
ют активность, годовая допустимая потеря активности составляет
не более 20%. Препараты фасуются в стеклянные флаконы по
5 млн. ед., которые герметически закрываются.
Есть ряд рекомендаций по использованию в качестве проду-
цента Aspergillus niger, в том числе в нашей стране. О. В. Кис-
ляковой (1974) был предложен способ получения из глубинной и
поверхностной культур A. niger 8 ряда препаратов, обладающих
каталазной и глюкозооксидазной активностью на основе реальных
промышленных сред (3—6 % раствора мелассы, освобожденного
от фосфата; 0,2 % KNO3 и 0,05 % MgSCh. Однако эта культура по
продуктивности значительно менее перспективна по сравнению с
Р. vitale Pidopl. et Bilai.
284
Рнс. 2.53. Влияние pH реакционной
среды иа стабильность каталазы
Р. vitale:
1 — при длительности обработки 15 мин;
2 —при длительности обработки 3 ч
Рис. 2.54. Влияние pH иа активность
каталазы:
1 — фосфатный буфер; 2 — цитратно-фос-
фатный буфер; 3 — цитратный буфер;
4 — ацетатный буфер
Следует еще раз подчеркнуть, что каталаза, синтезируемая
микроорганизмами, обладает сравнительно высокой устойчивостью
к кислой среде. Практически полная стабильность препаратов ка-
талазы наблюдается при pH среды 4—9, сравнительно высокая
устойчивость ее отмечена при pH 3 (рис. 2.53), тогда как катала-
за, получаемая из животных тканей, при pH 3 за несколько минут
полностью инактивируется.
Оптимальный pH для грибных каталаз Р. vitale P'idopl. et Bi-
lai и A. niger лежит в интервале 4—9, т. е. он значительно шире,
чем для препаратов, полученных на основе бактерий и из живот-
ных тканей (6—8).
Каталаза чувствительна к присутствию в растворе некоторых
анионов. Наибольшую стабильность она проявляет при pH 5 в
фосфатном буфере (100%), несколько ниже — в цитратно-фос-
фатном — 98,8 %, в цитратном — 91 % и совсем низкая — в аце-
татном — всего 43 %. Причем с уменьшением pH среды возраста-
ет степень инактивации каталазы (рис. 2.54).
Следует помнить, что присутствие перекиси водорода вызыва-
ет инактивацию каталазы при повышении концентрации ее от 0,01
до 0,1 М. Однако если количество препарата, участвующего в ре-
акции, увеличить, то ингибирующее действие перекиси водорода
заметно снижается. Процесс ингибирования перекисью водорода
сложен и связан с образованием неактивных фермент-субстратных
комплексов в присутствии избытка перекиси.
Несмотря на сравнительно высокую термостабильность мик-
робной каталазы, оптимальной температурой для действия ее в
процессах, требующих мгновенного удаления перекиси водорода,
285
является 35—50 °C. Если действие каталазы необходимо в течение
длительного времени, то оптимальной является температура от 3
до 10 °C.
Являясь эффективными катализаторами различных процессов,
ферменты должны максимально снижать величину энергии акти-
вации катализируемых ими реакций. Анализ различных препара-
тов каталазы показывает, что энергия активации реакции разло-
жения перекиси водорода различна и зависит от типа катализа-
тора. Эта зависимость приведена ниже.
Энергия
Катализатор активации,
кДж/моль
Самопроизвольная реакция в водном 75,0
растворе (без катализатора)
Платинированная платина 49,0
Каталаза из печени быка 17,6
Каталаза из эритроцитов 7,1
Каталаза из дрожжей 19,3
Каталаза из Р. vitale Pidolp. et Bilai 6,1
Наименьшей энергией активации обладают препараты из мик-
роскопических грибов. Каталаза из дрожжей и печени быка име-
ет энергию активации почти в 3 раза больше. Можно считать, что
каталаза из грибов наиболее эффективно катализирует реакцию
разложения перекиси водорода.
2.8.6. Совместное получение препаратов
глюкозооксндазы и каталазы
Технологический процесс раздельного получения этих фермен-
тов основан иа выращивании продуцента на среде, обеспечиваю-
щей максимальное накопление в культуральной жидкости одного
из них, что достигается определенным соотношением источников
углерода и азота. При совместном получении в среде должно со-
держаться 6—10% сахара и 1,5 % азотнокислого калия. Последо-
вательность получения этих ферментов следующая. По окончании
культивирования культуральная жидкость имеет каталазную ак-
тивность около 50—55 ед. на 1 мг белка и глюкозооксидазиую ак-
тивность 40—42 ед. иа 1 мг белка. Далее культуральную жидкость
с pH около 3,5—4 после отделения мицелия подвергают обработ-
ке оксидом алюминия в статических условиях при интенсивном
перемешивании. При этом значении pH из культуральной жидко-
сти сорбируется до 95 % каталазы от содержания ее в культураль-
ной жидкости, а глюкозооксидаза остается в культуральной жидко-
сти, т. е. на этой стадии осуществляется разделение каталазы и
гл юкозооксида зы.
Оксид алюминия с сорбированной иа ией каталазой отделяют,
а освобожденную от каталазы культуральную жидкость подверга-
ют дальнейшей обработке оксидом алюминия для сорбции глюко-
зооксидазы. Каталаза, сорбированная иа оксиде алюминия, под-
286
вергается обработке 0,1 М фосфатным буфером с pH 6,8 при пере-
мешивании, что обеспечивает элюцию до 95 % каталазы. Объем
элюеита берут в 6 раз меньше объема культуральной жидкости,
подвергавшейся первоначальной обработке. Это позволяет скон-
центрировать раствор фермента в 6—7 раз.
При осаждении каталазы из элюатов различными растворите-
лями наилучшие результаты получаются при использовании изо-
пропилового спирта. Осаждение каталазы в отличие от глюкозо-
оксидазы проводится при температуре 18—24 °C и соотношении
осадителя и элюеита 1:1. Получаемый осадок легко отделяется
центрифугированием и высушиванием при температуре 30—35 °C
в вакууме. В готовом препарате каталазы содержится до 80—85 %
активного фермента от исходного количества в культуральной
жидкости.
Из иадосадочиой жидкости после отделения вместе с оксидом
алюминия каталазы можно извлечь глюкозооксидазу по той же
схеме, как это было описано в одном из предшествующих разде-
лов. Таким образом, при использовании сравнительно простой тех-
нологии на основе одной культуральной жидкости получают высо-
коочищеииые препараты глюкозооксндазы и каталазы.
При достаточно высоком биосинтезе каталазы и глюкозоокси-
дазы возможно получение их комплексных препаратов для исполь-
зования в пищевой промышленности иа основе других микроорга-
низмов, например Aspergillus niger 8. Технология получения ком-
плексного препарата была разработана О. В. Кисляковой. Проду-
цент накапливал внутриклеточные ферменты в течение суток на
среде, содержащей 3—6%-иый раствор мелассы, 0,2 % нитрата
натрия и около 0,05 % сернокислого аммония. Отделенный мице-
лий высушивался, затем ферменты экстрагировались водой и
осаждались изопропиловым спиртом (3:1). Выход препарата со-
ставляет 3,8 % сухой массы мицелия и содержит до 70 % белка.
Такие препараты иа 1—1,5 порядка меиее активны, чем препара-
ты из Р. vitale.
2.9. ПРЕПАРАТЫ ГЛЮКОЗОИЗОМЕРАЗЫ
Производство препаратов глюкозоизомеразы вызвано необходимостью по-
стоянно расширять объемы выпуска сахаристых веществ для пищевых целей.
В среднем потребление сахара иа душу населения составляет около 40 кг в
год.
Традиционными источниками сахара в мире являются сахарные свекла и
тростник. В 1980 г. мировое производство сахара-сырца составило свыше
94 мли. т. С учетом роста населения Земли к 2000—2010 г. потребность челове-
чества в сахаристых веществах возрастет в 1,5—2,0 раза. Удовлетворить пол-
ностью такую потребность в сахаристых веществах за счет расширения посев-
ных площадей и увеличения урожайности свеклы и тростника не представляется
возможным за такой короткий срок. Решить эту сложную проблему можно
двумя способами: создать производство углеводов, эквивалентных по сладости
сахарозе, или наладить синтез сладких нетоксических органических веществ ие-
углеводиой природы. Из двух этих иаправлеиий наиболее разработан и реален
первый путь. Полноценным заменителем сахарозы может служить инвертный
сахар, который можно получить ие только из сахарозы, ио и из крахмала путем
последовательной обработки его ферментами.
287
Известно, что крахмал состоит из остатков глюкозы. Путем кислотного или
ферментативного гидролиза с помощью а-амилазы первоначально осуществляет-
ся разжижение 35 %-кого крахмала в момент его клейстеризации. Затем про-
водят термическую инактивацию а-амилазы и вводят в процесс глюкоа^илазу,
которая расщепляет крахмал до глюкозы иа 90—98 %. Однако глюкоза по
своей сладости значительно уступает сахарозе. Если 15 %-иый раствор сахарозы
принять за 100 %, то сладость идентичного раствора глюкозы составят 60—
65 %, фруктозы— 130—150 %, гидролизата (ииверта) сахарозы — 95—100 %.
Поэтому глюкозосодержащий гидролизат крахмала целесообразно далее под-
вергнуть воздействию фермента глюкозоизомеразы, который может глюкозу
изомеризовать во фруктозу иа 45—50%, т. е. получается глюкозо-фруктозиый
сироп (ГФС), обладающий сладостью, близкой к сахарозе (95—100 %).
Принципиальная схема получения заменителя сахарозы из крахмала может
быть представлена следующим образом:
Ферментативный путь получения ГФС стал возможен после открытия в
1957 г. Р. О. Маршаллом и Е. Р. Куи фермента, изомеризующего глюкозу во
фруктозу. Японские ученые И. Таказаки, К- Ямаиака и Г. Даиио в конце 60-х
и начале 70-х годов много работали иад созданием технологии глюкозоизомераз-
иых препаратов и применением их для производства ГФС. С 1970 г. интенсивно
начали вести исследования в США, где в 1972 г. было создано первое полностью
автоматизированное производство ГФС. На 1985—1990 гг. в США прогнозирует-
ся производство 2,85—4,75 млн. т ГФС. Быстро развивается производство ГФС в
Японии, Южной Корее, Австралии. Значительно медленнее происходит распро-
странение этой технологии в западноевропейских странах, где сахарную свеклу
производят в достаточном количестве, за исключением Италии, Великобритании
и Финляндии. В нашей стране основным источником сахара является сахариан
свекла, ио количество ее недостаточно, чтобы полностью удовлетворить населе-
ние и соответствующие отрасли в сахарозе. Поэтому производство ГФС в СССР
также является актуальным.
Считается, что в ближайшие 5—10 лет до 30—50 % потребности в саха-
ристых веществах будет удовлетворяться за счет производства ГФС. Как уже
говорилось, производство препаратов, содержащих а-амилазу и глюкоамилазу,
широко освоено промышленностью. Получение глюкозоизомеразиых препаратов
пока освоено только в нескольких странах, и отсутствие именно этого препарата
является главным сдерживающим фактором в широком внедрении технологии
ГФС в нашей стране.
288
2.9.1. Источники получения глюкозоизомеразы
Глюкозоизомеразу образуют многие микроорганизмы, в лите-
ратуре приведено свыше двухсот штаммов — продуцентов глю-
козоизомераз, относящихся более чем к 80 видам. Наиболее ча-
сто в качестве источника глюкозоизомераз используют актиноми-
цеты. Среди них следует назвать S. olivocinereus, S. albus, S. al-
bogriseolus, S. olivaceus, S. phaeochromogenes, S. venezuelae,
S. griseus, S. wedmorensis, S. flavovirens, S. achromogenes, S. echi-
natus, а также некоторые представители родов Nocardia, Micro-
monospora, Microellobospora, Microbiospora, Actinoplanes, Ther-
moact inomyces, Thermopolyspora, Pseudonocardia.
Глюкозоизомеразу образуют также бактерии, относящиеся к
родам Aerobacter, Acetobacter, Lactobacillus, Bacillus, Arthroba-
cter, Flavobacterium, Curtobacterium и др. Глюкозоизомеразы об-
наружены у некоторых видов дрожжей рода Candida, а также в
прорастающем зерне ряда злаковых культур.
Несмотря на достаточно большой перечень возможных проду-
центов глюкозоизомеразы, в промышленности преимущественно
используются микроорганизмы, относящиеся прежде всего к роду
Streptomyces, а также к родам Aerobacter и Lactobacillus.
2.9.2. Механизм действия и свойства глюкозоизомеразы
Субстрат. Субстратами для ферментативной изомеризации слу-
жат глюкоза, ксилоза и рибоза. Существует несколько типов глю-
козоизомеризующих ферментов, но далеко не все ферменты обла-
дают подлинной глюкозоизомеризующей активностью. Согласно
Номенклатуре ферментов (1979) в подкласс 5.3.1 «Ферменты, ка-
тализирующие взаимопревращение альдоз и кетоз» входят 19 фер-
ментов, четыре из которых обладают способностью катализиро-
вать изомеризацию субстрата во фруктозу и ксилозу. К ним от-
носятся: ксилозоизомераза (D-ксилозокетолизомераза, КФ 5.3.1.5),
которая катализирует реакцию превращения D-ксилозы в D-кси-
лулозу; маннозоизомераза (D-маннозокетолизомераза, КФ 5.3.1.7),
которая катализирует реакцию превращения D-маннозы в D-фрук-
тозу; глюкозофосфатизомераза (D-глюкозо-б-фосфаткетолизомера-
за, КФ 5.3.1.9), которая катализирует превращение D-глюкозо-б-
фосфата в D-фруктозо-б-фосфат; глюкозоизомераза (D-глюкозоке-
толизомераза, КФ 5.3.1.18), катализирующая превращение D-глю-
козы в D-фруктозу.
Все четыре фермента помимо основной реакции катализируют
реакцию изомеризации D-глюкозы в D-фруктозу. Из них только
первый (КФ 5.3.1.5) нашел практическое применение для произ-
водства ГФС и фруктозы, так как этот фермент не требует при-
сутствия арсената и НАД+ в реакционной среде, а главное, кси-
лозоизомераза обладает значительно более высокой термостабиль-
ностью. Этот фермент в связи с его использованием для изомери-
зации глюкозы во фруктозу получил в литературе рабочее назва-
289
ние глюкозоизомеразы, которое широко используется наряду с си-
стематическим. Далее этот фермент мы будем также называть
глюкозоизомеразой.
Истинным субстратом для глюкозоизомеразы является a-D-
глюкопираноза, которая находится в мутаротационном равнове-
сии с p-D-глюкопиранозой в соотношении 1:2. Содержание в
смеси остальных таутомеров незначительное. p-D-Глюкопираноза
не подвергается изомеризации, но она мешает процессу, так как
глюкозоизомераза непродуктивно связывается с ней и является
неконкурентным ингибитором реакции. Реакция изомеризации
глюкозы во фруктозу является обратимым процессом. И если пря-
мая реакция идет сравнительно легко и просто, то обратная про-
текает гораздо сложнее. В общем виде этот механизм хорошо из-
ложен в работе А. М. Егорова и А. В. Ананичева (1982). Он за-
ключается в следующем.
При растворении глюкозы в воде преобладающей таутомерной
формой является только пиранозная, мутаротация протекает по
механизму реакции первого порядка. Превращение образовавшей-
ся D-фруктозы в D-глюкозу протекает сложнее. Если взять рас-
твор D-фруктозы, то таутомерная смесь состоит из a-D-фруктопи-
ранозы (3%), p-D-фруктопиранозы (57%), a-D-фруктофуранозы
(9%) и p-D-фруктофуранозы (31 %). При этом процесс мутаро-
тации протекает по очень сложному механизму. Пока не установ-
лено, какая из мутаротационных форм является истинным суб-
стратом для глюкозоизомеразы.
Механизм действия. Предполагают, что изомеризация протека-
ет в четыре этапа: 1) простая мутаротация глюкозопиранозы в
растворе; 2) превращение глюкозы во фруктозу с помощью глю-
козоизомеразы; 3) комплексная мутаротация фруктозы в раство-
ре, включающая превращение между пиранозными и фуранозны-
ми формами; 4) превращение фруктозы в глюкозу с участием глю-
козоизомеразы. Это можно записать в виде следующей схемы:
a-D-Глюкопираноза fl -0-Глюкопираноза
Глюкозоизомераза
a -D -Глюкопираноза......Глюкозоизомераза
t I
a~D-Фрунтопираназа + Д-Р -Фрунтопираназа
Глюкозоизомераза 11
Ациклическая D-Фруктоза
Н tl
р-О-Фрукто<руракоза а - D-Фруктоу/уроноза
Предположительно, что на активном центре глюкозоизомеразы
происходит по крайней мере семь стадий, обусловливающих про-
290
цесс изомеризации (Е. Ласло и др., 1978). Часть из них носит чи-
сто гипотетический характер: 1) связывание фермента с субстра-
том, механизм которого пока неизвестен; 2) превращение комфор-
мации кресла CI глюкозы в форму скошенной лодки; только эта
конформация дает цис-ендиол, способный изомеризоваться; 3) раз-
рыв кольца в глюкозе, который катализируется остатком глутами-
новой кислоты активного центра фермента. Одновременно проис-
ходит перенос протона между кислородами карбоксильной груп-
пы на стадии образования цис-ендиола. Эта стадия процесса явля-
ется лимитирующей, так как скорость дециклизации глюкозы на
несколько порядков меньше скорости циклизации; 4) связывание
альдегидной группы глюкозы через водородную связь с гуаниди-
новой группой остатка аргинина активного центра глюкозоизоме-
разы и связывание протона второго углеродного атома с Фато-
мами имидазольной группы гистидина, входящего в активный
центр фермента; 5) образование цис-ендиола; 6) перенос протона
к первому углеродному атому с образованием у второго кетогруп-
пы. Обмена протонов с водой, как это наблюдается при нефермен-
тативной щелочной изомеризации, не происходит, иными словами,
ферментативная изомеризация глюкозы во фруктозу идет по стро-
го внутримолекулярному механизму (рис. 2.55).
7
4=0--^' 7
Н—С2—OH—
С---NH
II
CH—N~-----
7
С,—он
Н—с2— он
I
н
ct—он
с2—он
лен
CH—NH
Рис. 2.55. Предполагаемый механизм изомеризации D-глюкозы в
D-фруктозу иа активном центре глюкозоизомеразы (по данным
А. М. Егороиа, А. В. Аиаиичева, 1982)
291
Предположение, что переносчиками протонов в активных цент-
рах кетолизомераз являются имидазольные группы гистидиновых
остатков, подтверждается тем, что гистидин обнаружен в актив-
ных центрах глюкозоизомер аз. Но в то же время D-ксилозокето-
лизомераза (КФ 5.3.1.5), согласно данным Дж. А. Роз (1975), яв-
ляется исключением, так как только она из всех изомеризующих
ферментов в каталитическом акте проявляет способность к обме-
ну протонов с водой.
Несмотря иа значительное количество предложенных гипотез,
нельзя считать, что механизм изомеризации полностью объяснен
и доказан. Он постоянно изучается и уточняется. Высказываются
предположения о большой роли в каталитическом акте ионов ме-
таллов, особенно Mg2+ и Со2+. Ионами магния и кобальта акти-
вируется большинство глюкозоизомераз. Иногда активирующий
эффект наблюдается и в присутствии ионов Мп2+. Степень акти-
вации этими ионами зависит от источника получения глюкозоизо-
меразы и изомеризуемого сахара.
Для некоторых глюкозоизомераз были определены константы
Михаэлиса (km) в присутствии ионов Со2+ и Mg2+ (табл. 2.43).
Таблица 2.43
Процуценты глюкозоизомеразы £ т
Mg2+ Соа+
Actinomyces olivocinereus 1,0-10—3 5,6-10—®
(по данным А. А. Резникова, 1981) Actinoplanes missouriensis 2,0-10-3 1,3-Ю-4
(по данным С. Бахмаии и др., 1979) Bacillus coagulans 1,8-10—4
(по данным Г. Данио, 1971) Streptomyces albus 3-.0-Ю-1 3,0.10-®
(по данным С. Санчес и др., 1975) Streptomyces species 1,8-Ю—з 1,8-10—4
(по данным Таказаки и др., 1969) Streptomyces albogriseolus 7,8-10—‘ 2,2-10_4
(по данным А. М. Михайлова и др., 1986) Streptomyces olivaceus 6,7-Ю-4 8,4-10-®
(по данным М. С. Моснчева и др., 1986)
Как видно из таблицы, глюкозоизомеразы, активируемые иона-
ми Со2+ и Mg2+, обладают значительно более высоким сродством
к ионам Со2+, причем величины km, характеризующие это сродст-
во, различаются иа 1—2 порядка. В результате работ, проведен-
ных в последние годы, было установлено, что активирующее дей-
ствие ионов Mg2+ и Сб2+ по своей природе различно. На примере
A. olivocinereus было показано, что активирующее действие ионов
Mg2+ относится к неконкурентному типу, при котором глюкоза и
иоиы Mg2+ связываются с ферментом независимо друг от друга»
292
образуя тройной комплекс. Активирование глюкозоизомеразы
ионами Со2+ носит синергический характер. Увеличение концент-
рации ионов Со2+ от 0,025 до 0,25 мМ не влияет иа величину мак-
симальной скорости реакции. Но значение кажущейся km умень-
шается при этом от 0,14 до 0,08 М, что говорит об увеличении
сродства фермента к субстрату (по данным А. В. Аиаиичева и др.,
1983).
Присутствие ионов Со2+ оказывает стабилизирующее действие
иа глюкозоизомеразы. Установлено, что кобальт участвует в фор-
мировании и поддержании четвертичной структуры фермента и что
иа одну молекулу фермента приходится четыре атома кобальта.
Одиако удаление трех из них ие приводит к полной потере актив-
ности фермента, хотя его стабильность к внешним воздействиям
резко падает. Четвертый атом, вероятно, ковалентно связан с ос-
татками аминокислот, и при его удалении нарушается четвертич-
ная структура фермента. В кристаллической глюкозоизомеразе
помимо четырех атомов кобальта обнаружено 33 атома
магния.
Предполагают, что магний и кобальт связываются разными ал-
лостерическими центрами молекулы фермента. Возможно, что ко-
бальт для некоторых глюкозоизомераз является кофактором. Его
роль состоит как в поддержании четвертичной структуры фермен-
та, так и в создании конформационных изменений, увеличивающих
сродство фермента к субстрату, т. е. наиболее вероятно, что ко-
бальт является аллостерическим активатором.
Иоиы Cu2+, Zn2+, Hg2+, Ва2+, Ag2+ и Са2+ являются ингибито-
рами глюкозоизомераз. Многоатомные спирты (ксилит, сорбит,
маннит) также являются конкурентными ингибиторами этого фер-
мента.
Одним из характерных свойств фермента является его субст-
ратная специфичность. Глюкозоизомераза D-ксилозокетолизомера-
за помимо D-ксилозы способна изомеризовать D-глюкозу и D-ри-
бозу во фруктозу и рибулозу соответственно и в некото-
рых случаях с очень малой скоростью в D-аллозу и D-галак-
тозу.
Н
*С=О 1СН2ОН
н—С—ОН 2С=О
НО-Зс—Н ГлИ HO-Зс—н.
н—с—он н—с—он’
Н—С—ОН Н-Зс—он
6сн2он 6СН2ОН
Глюкозе фруктоза
Н
*С=О
Н-2С-ОН
31
НО-С-Н
н—с—он
scHjOH
ГлИ
*СН2ОН
гС=О
31
но—с—н
н—с—он
5сн2он
Ксилоза Ксолулпа
293
н
тс=о
Н-2-С—ОН
3|
н—с—он
н—с—он
SCH2OH
ПтИ
Рибоза
гсн,он
I
гс=о
н—с—он
н-с—он
SCH2OH
Рибилеза
Для того чтобы субстрат мог соединиться с активным центром
фермента, необходимо строго определенное расположение химиче-
ских групп в молекуле субстрата. Исследованиями методом ядер-
ного магнитного резонанса (ЯМР) конформации образующегося
фермент-субстратного комплекса установлено, что в активном цен-
тре глюкозоизомеразы связываются первый, второй и пятый угле-
родные атомы D-ксилозы (по данным Г. М. Юнга н др., 1975).
Рассматривая расположение аксиальных групп у первого, вто-
рого и пятого углеродных атомов альдопираноз, можно заметить,
что у a-D-ксилозы, a-D-рибозы, a-D-глюкозы, a-D-галактозы
и a-D-аллозы расположение в пространстве гидроксильных групп
у первого и второго углеродных атомов одинаковое. Кроме того,
у всех этих сахаров одинаково расположены аксиальные СН2ОН-
группы, но у гексоз эта группа находится у шестого углеродного
атома, а у пентоз — у пятого. Поэтому логично предположить, что
критерием «узнавания» субстрата глюкозоизомеразой является про-
странственное расположение ОН-групп у первого и особенно вто-
рого углеродных атомов моносахарида.
Глюкозоизомеразы являются термостабильными ферментами,
оптимум действия которых лежит в интервале температур от 60
до 80 °C. Но есть и такие, которые имеют оптимум при 90°C,
а глюкозоизомераза, выделенная иэ В. stearothermophilus, частич-
но сохраняет свою активность даже в кипящей реакционной среде.
Глюкозоизомеразы проявляют стабильность в широком диапазоне
pH *—от 4,5 до 11, оптимум действия находится либо в нейтраль-
ной зоне, либо в щелочной, обычно в интервале от 7 до 9. Для
практических целей надо стремиться к низкому значению pH, что-
бы избежать щелочную изомеризацию.
2.9.3. Получение препаратов глюкозоизомеразы
В подавляющем числе случаев глюкозоизомераза является
внутриклеточным ферментом, накопление которого в клетке сов-
падает с накоплением биомассы продуцентом и обычно соответст-
вует 16—20 ч роста культуры. Буквально для нескольких проду-
центов наблюдается выход глюкозоизомеразы во внешнюю среду,
но он, как правило, совпадает с началом автолитических процес-
294
сов в культуре и соответствует 3—7 сут роста микроорганизма (по
данным Л. В. Лебедева и др., 1982). В отличие от ранее изложен
них технологий при производстве глюкозоизомеразы целевым про
дуктом является биомасса продуцента, а не жидкая фаза.
Источники углерода. Глюкозоизомераза является индуцибель-
ным ферментом, и потому состав среды имеет очень большое зна-
чение при выборе оптимальной технологии глюкозоизомеразных
препаратов. В качестве индуктора в среде обычно используется
ксилоза или ксилобиоза, однако продуценты нуждаются и в дру-
гих источниках углерода. Такими источниками могут быть глюко
за, сорбит, маннит, глицерин, арабиноза, крахмал, лактоза. В за
висимостц от продуцента соотношение индуктора (ксилозы) к дру-
гому источнику углерода меняется. Так, для бактерий оно обычно
равно 10: 1. а для актиномицетов — 7:3. Однако для Streptomy-
ces sp. оптимальное соотношение D-ксилозы к крахмалу составля-
ет 1:2, при культивировании S. olivochromogenes — 1:1, а для
S. bambergiensis АТСС 13879 наивысшая продуктивность по глю-
козоизомеразе наблюдается на среде, содержащей D-ксилозу и
D-сорбит в соотношении 1 :3
(по данным М. Дразис и др.,
1980). Иными словами, в каж-
дом конкретном случае установ-
ление оптимального соотношения
индуктора и другого источника
требует уточнения и проверки.
Есть данные, что большой эф-
фект получается при дробном
внесении индуктора на опреде-
ленной стадии развития проду-
цента, особенно в конце лога-
рифмической фазы роста куль-
туры.
Введение в состав промыш-
ленной среды ксилозы экономи-
чески невыгодно, так как это
дефицитный и дорогой моноса-
харид. Чаще в качестве источни-
ка ксилозы используют ксилозо-
и ксилансодержащее сырье: со-
лому, пшеничные и рисовые от-
руби, кукурузные кочерыжки,
зерновую и хлопковую шелуху.
Наилучшие результаты получа-
ются при введении в состав сре-
ды гидролизатов ксилансодер-
жащего сырья, которые содержат
значительные количества пентоз
(рис. 2.56).
Биосинтез глюкозоизомеразы
Рис. 2.56. Влияние концентрации кси
лозы и ксилансодержащих компонеи
той среды иа биосинтез глюкозоизо
меразы культурой Streptomyces го
beus S-606 (по данным В. А. Чугуй
и др., 1984):
/ — ксилоза; 2 — гидролизат отрубей.
3 — гидролизат кукурузной кочерыжки;
4 — ксилан; 5 — контрольная среда (ку-
курузный экстракт — 2%. MgSO4-ZU,<>
—0.1%; C0CI2 • 6 Н2О—0,024%)
295
без введения индуктора возможен только для мутантных штаммов,
у которых синтез фермента идет по конститутивному пути.
Источники азота. Продуценты глюкозоизомеразы требователь-
ны к источнику азота, так как он должен способствовать интенсив-
ному накоплению биомассы продуцентом. Продуценты глюкозо-
изомеразы достаточно хорошо растут на средах как с минераль-
ными (аммонийные соли), так и с органическими источниками
азота. В качестве органических источников азота для различных
продуцентов рекомендуются соевая мука, кукурузный экстракт,
пептон, полипептон, триптон, мясной и дрожжевой экстракты, гид-
ролизаты микробных масс, экстракт из солодовых ростков, казеин.
В последнее время рекомендуется использовать как нативные азот-
содержащие субстраты, так и их гидролизаты.
Минеральные вещества. По данным многих авторов, для обра-
зования глюкозоизомеразы в среде должны содержаться ионы
магния в виде соли MgSO4-7H2O и кобальта в виде соли
СоС12-6Н2О. Концентрации этих солей определяются физиологи-
ческими особенностями продуцентов и колеблются для магния от
0,025 до 0,05 % и для кобальта от 0,005 до 0,024%. Для бактери-
альных продуцентов глюкозоизомераз рекомендуется включить в
состав среды MnSO4-4H2O в концентрации от 0,02 до 0,05 %. В со-
став питательных сред для некоторых продуцентов иногда вводят-
ся в небольших количествах соли NaCl, FeSO4-7H2O, СаСОз,
КгНРО4. В состав сред при выращивании актиномицетов доста-
точно часто вводятся некоторые инертные вещества, такие, как
агар, КМ-целлюлоза, инфузорная земля в концентрациях от 0,05
до 4 %, чтобы предотвратить возникновение малопродуктивных
шаровидных образований микроорганизмов при глубинном культи-
вировании. Внесение этих и подобных веществ на начальных ста-
диях роста культуры способствует развитию нитевидного мицелия,
улучшаются условия массообмена клетка — жидкая фаза, что при-
водит к увеличению съема фермента с единицы объема.
Условия культивирования. На биосинтез глюкозоизомеразы ока-
зывают существенное влияние такие условия культивирования, как
температура, pH среды, уровень аэрирования н др. Для актиноми-
цетов используется температура от 28 до 45 °C, для бактериаль-
ных культур диапазон температур шире — от 28 до 60°C. Здесь
важно отметить, что чем выше оптимальная температура роста
культуры, тем термостабильнее синтезируемая глюкозоизомераза.
Среды, используемые для выращивания продуцентов глюкозоизо-
мераз, как правило, имеют начальный pH от 6 до 8. В процессе
культивирования pH меняется. Эти изменения зависят от проду-
цента, источника углерода и азота, условий аэрации и перемешива-
ния. Характер изменения pH и необходимость его корректировки
в процессе роста культуры устанавливают опытным путем для
каждого продуцента.
Количество посевного материала и длительность культивирова-
ния определяются видом продуцента. Бактериальные культуры ра-
стут быстро, посевной материал получается в 1—2 этапа, и дози-
296
ровка его небольшая — не более 1 %. Актиномицеты требуют вы-
сокой дозы посевного материала — от 10% и выше, поэтому по-
лучение производственной культуры состоит из 3—4 этапов, что
несколько усложняет процесс выращивания.
Выделение ферментов. В промышленности производство препа-
ратов глюкозоизомеразы осуществляется двумя способами: 1) вы-
деление фермента из биомассы продуцента путем ее полного раз-
рушения с последующим получением высокоактивных очищенных
препаратов глюкозоизомеразы; 2) фиксирование фермента внутри
клетки и использование этой биомассы для изомеризации D-глюко-
зы в D-фруктозу.
Сложность первого способа получения глюкозоизомеразных пре-
паратов заключается в необходимости тотального разрушения
клеточной стенки продуцента, так как фермент локализован веро-
ятнее всего в клеточной стенке. Обычные способы разрушения кле-
ток (растирание с кварцевым песком, глиноземом, обработка ор-
ганическими растворителями, автолиз с добавлением и без добав-
ления поверхностно-активных веществ, обработка ультразвуком,
разрушение методом декомпрессии и др.) не приводят к полному
выходу фермента из клетки. Действительно, все эти приемы вы-
зывают нарушение целостности клетки, ее внутреннее содержимое
выливается, под микроскопом видно, что гифы светлеют и стано-
вятся пустыми, но уровень глюкозоизомеразной активности в бес-
клеточных гомогенатах возрастает незначительно, хотя и наблюда-
ется нарастание белка в растворе. Резкое увеличение глюкозоизо-
меразной активности в бесклеточных экстрактах происходит толь-
ко в том случае, когда к обрабатываемым клеткам добавляют ли-
зоцим У-ацетилмурамидглюканогидролазу (КФ 3.2.1.17). Известно,
что лизоцим гидролизует а-1,4-связи между остатками У-ацетил-
мурамовой кислоты и 2-ацетамидо-2-дезокси^-глюкозы в мукопо-
лисахариде и мукопептиде, которые входят в клеточную стенку.
При внесении в автолизируемую среду лизоцима клеточные
стенки актиномицета разрушаются, они представляют собой раз-
рыхленные сетчатые чехлы, лишенные слоистой ориентации. Эта
деструкция, по-видимому, обусловлена разрушением муреинового
каркаса. Такое состояние клеточной стенки сопровождается выхо-
дом глюкозоизомеразы из клетки, и активность в бесклеточных
экстрактах возрастает в 5—6 раз (по данным А. В. Гавристова,
1981). Эти факты и позволяют заключить, что глюкозоизомераза
локализована в клеточной стенке и каким-то образом связана с
ее муреиновым каркасом.
Учитывая сложность выделения глюкозоизомеразы из клетки и
дороговизну лизоцима, большинство предлагаемых промышленных
технологий базируются на втором способе получения глюкозоизо-
меразных препаратов. Первый же способ используется для рыде-
ления фермента, изучения его свойств и для получения иммобили-
зованных препаратов.
После выделения фермента из клеток его можно очистить до
гомогенного состояния. Для очистки глюкозоизомераз используют
297
обычные методы выделения: фракционирование сульфатом аммо-
ния или органическими растворителями, ионообменная хроматогра-
фия на ДЭАЭ-сефадексе или ДЭАЭ-целлюлозе, ультрафильтрация,
электрофорез, кристаллизация и т. д. Отличительной особенно-
стью выделения глюкозоизомераз является термическая обработ-
ка ферментного раствора, при которой термостабильная глюкозо-
изомераза остается без изменений, а балластные белки денатури-
руют и выпадают в осадок. Такой прием позволяет значительно
очистить фермент от сопутствующих белков.
Выделение фермента в присутствии ионов кобальта, магния и
в некоторых случаях марганца значительно повышает стабиль-
ность глюкозоизомеразы, что способствует получению активных
препаратов с минимальными потерями.
В качестве примера можно привести три схемы выделения вы-
сокоочищенной и кристаллической глюкозоизомеразы из трех раз-
личных продуцентов (табл. 2.44).
Эти глюкозоизомеразы, по данным исследователей, были гомо-
генны, выход активности в эти препараты был относительно высок
(от 33 до 36%), а степень очистки отличалась очень сильно, бук-
Таблица 2.44
Этап очистки Степень очистки Выход активности, %
Bacillus coagulans HN-68
(по данным Г. Данно, 1970)
Ферментативный лизат клеток 1,0 100
Обработка ионами Мп2+ 1,5 92
Фракционирование сульфатом аммония 11,0 76
Ионообменная хроматография на ДЭАЭ-сефадексе 43,0 65
(pH 6,0)
Рехроматография на ДЭАЭ-сефадексе (pH 8,6) 43,5 60
Кристаллизация 44,0 36
Actinomyces olivocinereus 154
(по данным И. В. Улезло я др., 1980)
Бесклеточный экстракт 1,0 100,0
Фракционирование ацетоном 3,0 94,8
Обработка сульфатом аммония — 94,8
Обессоливание на сефадексе G-25 8,0 94,6
Гель-хроматография на сефадексе G-200 14,0 35,0
Streptomyces griseotuscus S-41
(по данным Т. Касими и др., 1981)
Бесклеточный экстракт 1,0 100
Концентрирование вакуум-выпариванием 1,9 86
Ионообменная хроматография на ДЭАЭ-сефадексе 3,9 63
(pH 7,5)
Рехроматография на ДЭАЭ-сефадексе (pH 7,5) 4,2 55
Кристаллизация 4,2 33
298
вально на порядок. Такое отличие было связано со способом вы-
деления фермента из клеток, т. е. с количеством балластных ве-
ществ в исходном бесклеточном экстракте.
В литературе есть упоминание о возможности использования
аффинной хроматографии для очистки глюкозоизомеразы. В каче-
стве аффинного лиганда был использован конкурентный ингиби-
тор глюкозоизомеразы ксилит, обладающий высоким сродством к
ферменту, иммобилизованный на активированной бромцианом се-
фарозе (по данным Дж. Г. Ли и др., 1976). Однако этот очень
перспективный метод очистки глюкозоизомеразы с использовани-
ем аффинной хроматографии не нашел широкого применения из-за
сложности подготовки аффинного сорбента.
Глюкозоизомераза была получена в гомогенном состоянии из
очень многих микроорганизмов. Были изучены свойства этих фер-
ментов, которые позволили высказать предположение пространст-
венной организации молекулы, определить молекулярную массу
различных глюкозоизомераз как в нативном состоянии, так н пос-
ле воздействия на ннх денатурирующих агентов (табл. 2.45).
Таблица 2.45
Молекулярная масса
нативного после обра- ботки доде-
фермента цнлсульфатом
натрия.
Предполагав*
мое число
субъединиц
Продуцент глюкозоизомеразы
Lactobacillus brevis 74 (по данным Е. Т. Тулеуовой и др., 1980) Lactobacillus xylosus ТИА 6-9 199 000 190 000
183 000 45000 4
(по данным К. Яманаки и др., 1977)
Streptomyces griseotuscus S-41 180 000 42 000 4
(по данным Т. Касуми и др., 1981) Bacillus coagulans HN-68 175 000 49 000 3-
(по данным Г. Данио, 1970) Streptomyces flavogriseolus 171 000 43 000 4
(по данным У. Р. Хен и др., 1979) S. albus 166 000 40000 4
(по данным Р. А. Хуг-Ангелетти, Actinomyces olivocinereus 154 1975) 160000 42 000 4
(по данным А. А. Резникова и др., Bacillus stearothermophilus. 1980) 130 000 13 000
S. olivochromogenes (по данным М. Сюкане и др., 1978) 120000 56 000 2
S. bikiniensis 52 000 52 000 1
(по данным Г. К. Парк, 1977) S. albogriseolus, 28-3 178 500 46 000 4
S. olivaceus 13-4 165 000 41 000 4
(по данным М. С. Мосичева и др., 1986)
Молекулярная масса глюкозоизомераз заметно отличается в
зависимости от продуцента, но все же большинство из них имеет
величину от 160 000 до 200 000. Многие ферменты имеют четвер-
299
тячную тетрамерную структуру. Отсутствие распада на субъедини-
цы молекулы глюкозоизомераз у L. brevis и В. stearothermophi'lus
еще нельзя считать установленным фактом, так как жесткость об-
работки могла быть недостаточной для разрушения четвертичной
струкуры. Кроме того, возможно, что в ее поддержании принимают
участие не только гидрофобные взаимодействия.
Сложность работы с глюкозоизомеразой в какой-то мере опре-
деляется ее четвертичной структурой, и поэтому очень важно нали-
чие в реакционных средах стабилизирующих ионов кобальта и
магния. Возможно, что более устойчивое состояние фермента в
клетке до его очистки и выделения также связано с четвертичной
структурой фермента, которая более стабильна в состоянии кон-
такта и прикрепления к муреиновому каркасу клеточной стенки.
2.9.4. Получение иммобилизованных глюкозоизомеризующих
преларатоа
Растворимая глюкозоизомераза практически ие используется
для производства глюкозо-фруктозных сиропов, так как обогаще-
ние ГФС белком крайне нежелательно и трата больших количеств
фермента, получаемого при столь- сложных способах его извлече-
ния из клетки, не обоснована. Как правило, глюкозоизомеразу ис-
пользуют только в иммобилизованном виде.
Так как глюкозоизомераза — внутриклеточный фермент, воз-
можны два пути получения ее иммобилизованных препаратов:
1) фиксирование фермента в клетке продуцента и прикрепление
ее к некоторому носителю; 2) выделение фермента из клетки в рас-
творимом состоянии и последующая иммобилизация его на раз-
личных носителях. Но независимо от метода иммобилизации к
промышленным препаратам глюкозоизомеразы предъявляются ряд
требований:
высокая продуктивность, которая характеризуется количеством
глюкозо-фруктозного сиропа, получаемого при использовании еди-
ницы катализатора;
хорошая разрешающая способность, т. е. такие свойства иммо-
билизованного препарата, которые бы обеспечивали высокие ско-
рости фильтрования через слой катализатора;
катализатор по качеству должен быть гомогенным, чтобы его
можно было использовать в автоматизированных реакторах;
иммобилизованные препараты должны обладать стабильностью
и иметь низкую стоимость.
Только препараты, которые отвечают всем требованиям, нахо-
дят широкое и рентабельное применение в промышленности.
В табл. 2.46 представлены наиболее часто встречающиеся способы
иммобилизации как микробных клеток, так и растворимого фер-
мента.
Кроме перечисленных в таблице в качестве носителей для им-
мобилизации микробных клеток могут использоваться полиакрил-
300
Таблица 2.46
Носитель и метод иммобилизации
Состояние фермента
Фирма или учреждение, предла-
гающие технологию
Bacillus coagulans
(по данным К- Окада, 1978; патенты США, 1973, 1976)
Сшивка глутаровым алвдеги- Клетки «Novo Industri»
дом и экструдирование (Дания)
S. phaeochromogenes (патенты США, 1973, и Австралии, 1975)
Термическая обработка фер- Клетки «Korea Advanced Institite of
мента Science»
Streptomyces sp. (патент Японии, 1979)
Коагуляция и ионное связы- Клетки «Denki Kagaku Kogyo»
вание (Япония)
Arthrobacter sp. (патенты США, 1977, 1980; по данным М. А. ван Кеулен и др.,
1981)
Флокулирование с помощью Клетки «R. J. Reynolds Tobacco Со*
полиэлектролита (США)
S. olivaceus (по данным Г. Рудкина и др., 1978)
Сшивка глутаровым альдеги- Клетки «Miles Kalie Chemie» (ФРГ)
дом
Streptomyces sp. (по данным В. И. Мининой и др., 1980)
Ионообменные смолы Растворимый фермент «Mitsubishi Chemical
Industries» (Япония)
Streptomyces sp. (по данным Г. М. Юнг и др., 1975)
Пористый алюминий, физиче- Растворимый фермент «Corning Glass Work Corn
ская адсорбция Products. 1пс» (США)
S. Ilavogriseus (заявка Франции, 1980; no данным У. Р. Чен и др., 1979)
ДЭАЭ-целлюлоза, адсорбция Растворимый фермент «Standart Braud Jnc. Clinton
Corn Со.» (США)
Actinoplanes missouriensis (по данным С. Бахманн и др., 1981)
Смешивание прогретого при Клетки «Gist-Brocades»
70 °C фермента с желатином, (Нидерланды)
предварительно облученным
ультрафиолетовыми лучами,
сшивка глутаровым альдеги-
дом
S. violaceoniger (по данным М. Г. Губина и др., 1981)
То же Клетки «Roguett Freres» (Франция)
301
амид, различные производные полиэтиленгликоля, агар, хитозан и
некоторые другие.
Все эти препараты глюкозоизомеразы достаточно стабильны,
имеют большую длительность полужизни фермента, дешевы, и по-
тому с помощью иих можно получить ГФС, способный конкуриро-
вать по экономическим показателям с тростниковым и свеклович-
ным сахаром.
Следует заметить, что сейчас в мире нет единого мнения о
преимуществе иммобилизации клеток перед иммобилизацией рас-
творимой глюкозоизомеразы. Можно сказать, что та и другая фор-
мы препаратов имеют определенные преимущества и недостатки и
потому существуют и используются почти наравне.
2.10. ПРЕПАРАТЫ р-Г А ЛАКТОЗИД АЗЫ
Препараты Р-галактозидазы прежде всего находят широкое применение в
молочной промышленности и в тех отраслях, где возможно использовать отходы
молокоперерабатывающей промышленности, содержащие днсахарнд лактозу.
Лактоза является очень ценным углеводом, но сахар этот плохорастворнм, не-
сладкий, не усваивается часто животными организмами, ие сбраживается дрож-
жами. Если с помощью р-галактозидазы осуществить его расщепление до га-
лактозы и глюкозы, то эта смесь уже имеет сладкий вкус, хорошо растворяется
в воде, глюкоза усваивается как животными, так и микроорганизмами. Обра-
ботка молока и молочных изделий препаратами fj-галактозндазы позволяет
обеспечить часть населения, страдающего лактазной недостаточностью, молоч-
ными продуктами, почти не содержащими лактозу.
Обработка молока ферментом при коицентрнрованин, особенно прн его по-
следующем хранении прн низких температурах, позволяет повысить стабиль-
ность продукта при регенерации. Гидролиз около 20—30 % лактозы молока при
прнготовлеиин мороженого позволяет предотвратить явления его крнсталлнзацин
и уменьшить иа 1—2 % добавку сахарозы. Использование р-галактозндазы при
приготовлении кисломолочных продуктов способствует более быстрому разви-
тию молочнокислых микроорганизмов, что позволяет ускорить технологические
процессы.
Использование р-галактозидазы делает перспективным утилизацию различ-
ных молочных отходов, особенно молочной сыворотки, во многих отраслях,
например в хлебопечении, в кондитерской промышленности, прн производстве
мороженого, в качестве компонента питательных сред прн получении белковых
обогатителей кормов или различных биологически активных веществ, в кормо-
производстве, в медицинской промышленности, медицине и т. д. Большое зна-
чение придается ^-галактозидазе при ее использовании в аналитических целях
и для диагностики ряда заболеваний.
В настоящее время публикуется много работ по применению Р-галактози-
дазы в иммобилизованном виде, особенно прн обработке жндкнх отходов мо-
лочной промышленности. В нашей стране ведется только освоение технологии
получения препаратов микробной Р-галактозидазы и поэтому пока область
применения несколько уже, чем за рубежом. Но даже такой далеко не полный
перечень областей применения Р-галактозидазы убедительно свидетельствует о
том, что эти препараты можно отнести к промышленно важным.
2.10.1. Источники получения Р-галактозидазы
Фермент образуется многими микроорганизмами. У бактерий
и дрожжей это внутриклеточный фермент. Активными продуцен-
тами р-галактозидазы являются спороносные бактерии В. subtilis,
В. megaterium, В. coagulans и другие виды. Среди неспороносных
302
бактерий особенно тщательно и всесторонне изучена р-галактози-
даза Escherichia coli; также внимание исследователей привлекают
спороносные и неспороносные молочнокислые бактерии, такие, как
Streptococcus lactis, S. cremoris, Lactobacillus bulgaricus и др. Вы-
сокая активность р-галактозидазы найдена во многих дрожжевых
культурах, среди которых можно назвать Saccharomyces fragilis,
S. lactis, Candida pseudotropicalis, Torulopsis versatilis и ряд дру-
гих.
Внеклеточная р-галактозидаза накапливается культурами мик-
роскопических грибов. Среди наиболее активных продуцентов
следует назвать Penicillium terlikowskii, Р. multicolor, Р. canes-
cens, Mucor pusillus, Alternaria tenuis, Curvularia inaequalis и дру-
гие микроорганизмы. Продуценты внеклеточной р-галактозидазы
являются наиболее перспективными для производства, так как в
этом случае отпадает необходимость в разрушении клеточной стен-
ки микроорганизмов.
р-Галактозидаза широко распространена в животных и расти-
тельных тканях. Этот фермент выделен из семяи сои, кофе, фасо-
ли, люцерны и др. Он содержится в тонком кишечнике, слюне,
плазме и сыворотке крови, в моче млекопитающих, особенно в пе-
риод питания молоком и лактации. Встречается р-галактозидаза
и у насекомых.
р-Галактозидазы высших эукариот отличаются большим разно-
образием, но этот источник не используется для промышленного
получения препаратов р-галактозидазы, он интересен пока только
в научном отношении.
2.10.2. Механизм действия и свойства фермента
Субстрат. Субстратом для р-галактозидазы являются р-£)-галак-
тозидазы, включая лактозу и ее производные. р-Галактозидаза
(p-0-галактозидгалактогидролаза, КФ 3.2.1.23) относится к глю-
козидазам (о-гликозидгидролазам). Фермент осуществляет гидро-
лиз, т. е. нуклеофильное замещение у аномерного центра гликоно-
вой части галактозидов. Он расщепляет терминальные fi-D-галак-
тозидные связи, отщепляя остатки галактозы с нередуцирующего
конца галактозидов, гликолипидов, гликопептидов, гликопротеидов
и мукополисахаридов.
Механизм действия. Расщепление связи идет между Ci-атомом
моносахаридного остатка и гликозидным атомом кислорода. Если в
молекуле галактозида атом кислорода замещен на атом серы, то
гидролитического акта не происходит, хотя сродство фермента к
субстрату остается. р-Галактозидаза проявляет высокое сродство
по отношению к конфигурации гидролизуемой связи и к структу-
ре гликона. Так, изменение пиранозной формы гликона на фура-
нозную приводит к прекращению гидролиза. У фермента велико
сродство к отщепляемому остатку галактозы. Возможны замены
только у его пятого углеродного атома. К структуре агликона фер-
мент менее требователен, поэтому возможны различные замены у
303
атомов углерода. На этом свойстве фермента основывается ис-
пользование о- и л-нитрофеннл-0-£)-галактопиранозидов в качестве
субстратов прн определении его активности. Это очень удобно, по-
скольку прн их гидролизе отщепляется молекула нитрофенола, ок-
рашенная в желтый цвет, что позволяет применить колориметри-
ческий метод оценки активности фермента. Однако следует с оп-
ределенной осторожностью относиться к этому методу, так как ес-
тественным субстратом р-галактозидазы является лактоза, и в за-
висимости от природы фермента и его специфичности искусствен-
ные и естественные субстраты могут расщепляться по-разному, и
может создаться неправильное, часто завышенное представление
об активности фермента. Поэтому рекомендуется проверять актив-
ность при начале работы на двух субстратах.
Отличительным свойством р-галактозидазы является ее способ-
ность к трансглнкознлированию. Фермент может переносить на
подходящий акцептор галактозильный остаток, лишенный кислоро-
да. Такими акцепторами могут быть сахара, спирты н другие сое-
динения. Соотношение гидролитической и трансгликознлирующей
активностей зависит от источника р-галактозидазы и может быть
различным. Известно большое количество данных, характеризую-
щих свойства этого фермента и работу его активного центра. Из-
вестно, что активный центр фермента представляет собой систему,
в которой очень важна динамическая сеть водородных связей, оп-
ределяющая его электронно-информационное состояние. Именно
эти связи позволяют фиксировать субстрат в конфигурации пере-
ходного состояния, образующей фермент-субстратный комплекс.
Наиболее изученной р-галактозндазон является фермент, получен-
ный из Е. coli. Предполагают, что активный центр этого фермента
состоит нз двух участков, которые отвечают за соединение с га-
лактозой и глюкозой. Остаток галактозы, связываясь, изменяет и
конформацию активного центра, что облегчает связывание глюко-
зы на втором участке. Важно отметить, что протяженность актив-
ного центра меньше размера трисахарнда, поэтому присутствую-
щие в реакционной смеси три-, тетра- и другие более высокомоле-
кулярные олигосахариды не оказывают влияние на проявление
активности по отношению к лактозе или л-ннтрофенил-р-О-галак-
топиранозиду. Активный центр р-галактозидазы содержит несколь-
ко сорбционных участков: участки сорбции глнконов (А) и агли-
конов (В). Участки А обладают повышенным сродством к глико-
новой части субстрата и могут изменять конформацию субстрата.
Эти свойства активного центра обеспечиваются за счет наличия в
Р-галактозе протон-донорных (хН) и ну-
клеофильных (у) группировок (рис. 2.57).
Высказывается предположение, что га-
лактозный остаток располагается между
витками белковой спирали фермента. Сво-
бодные гидроксильные группы остатка
фиксируют углевод между двумя витками
белка с помощью водородных связей, а
А в
Рис. 2.57. Схема сорбции
субстрата в активном
центре р-галактозндазы
304
агликои связывается с ферментом неспецнфическими гидрофобны-
ми связями. Катализ гидролиза происходит, вероятнее всего, в
большей степени за счет нековалентных взаимодействий. 0-Галак-
тозидаза в зависимости от источника ее получения может быть
тетрамером, состоящим из четырех субъединиц, димером или мо-
номером. Есть данные, например, для Е. coli, что активный центр
полностью формируется после образования четвертичной струк-
туры. При этом каждая из субъединиц неактивная, но в то же
время есть данные и о том, что димер и даже мономер 0-галакто-
зидазы из некоторых штаммов Е. coli активны. Иными словами,
организация субъединичной структуры фермента и его активного
центра до конца неясна. В самом первом приближении все Р-га-
лактозидазы можно подразделить на два типа, которые отлича-
ются по месту локализации в клетке, строению молекул и физи-
ко-химическим свойствам (табл. 2.47).
Таблица 2.47
Показатель Продуцент фермента
Е. coll Kluyverotny- ces fragilis Curvularla Inaequalls Alternarla tenuis
Локализация Внутрикле- точная Внутрикле- точная Внутрикле- точная Внутрикле- точная
Молекулярная масса 540 000 420 000— 600 000 115 000 176 000
Наличие субъединиц 4 Есть Нет Нет
Гликопротевд Участие в катализе Нет Нет Есть Есть
SH-групп Да Да Нет Нет
карбоксильной группы Нет Нет Да —
двухвалентных металлов Да Нет Нет Нет
Изоэлектрическая точка, pl kml (no-o-НФГ), 10~3 М 4,6 5,1 4,4 4,6
0,16 1,1 0,55 0,21
kml (по лактозе), 10“s М 5,6 12,5 4,5 6,57
Оптимальный pH 35:1 11:1 8:1 35:1
по о-НФГ 7,2 6,9—7,1 3,7—4,5 3,8—4,4
по лактозе 7,2 6,9—7,1 3,9—5,3 3,6—4,8
Оптимальная температура, °C 37 30—35 60 60—65
Термостабильность*, °C — 35—40° (30%-ный раствор) 60 (27%-ный раствор) 60 (30%-ный раствор)
Стабильность в растворе Нет Нет Да Да
Наличие трансгликозилирую- щей активности Есть Есть Есть Есть
* Потеря активности происходит за 1 ч инкубирования при данной температуре (по данным
А. С. Тихомировой, 1982)
Первый тип — это внутриклеточные р-галактозидазы, имеющие
молекулярную массу выше 200 000 и почти всегда субъединичное
строение. К ним относятся ферменты Е. coli, которые, как прави-
ло, имеют четыре идентичные субъединицы. Субъединичное строе-
11 Зак. 232 ___
ние этого фермента предполагается у дрожжевых микроорганиз-
мов, но количество субъединиц точно не установлено (от 2 до 10).
Большое значение для дрожжевых р-галактозидаз имеют двухва-
лентные металлы, такие, как Mg, Мп и SH-группы.
Второй тип — это р-галактозидазы, имеющие молекулярную
массу ниже 200 000. Их субъединичное строение не доказано. Этот
тип фермента может быть внутри клетки, но основное его количе-
ство находится вне клетки. р-Галактозидазы второго типа более
стабильны, не имеют SH-групп в активном центре, их активность
не зависит от ионов металла. Эта группа гетерогенна, ферменты
имеют множественные формы, в молекулу белка входит углевод-
ный фрагмент, который придает ферментам длительную стабиль-
ность к внешнему воздействию (pH, температура). Анализ данных
показывает, что более стабильные р-галактозидазы второго типа
присущи организмам, стоящим на более высоких ступенях эво-
люции.
2.10.3. Получение препаратов р «галактозидазы
р-Галактозидаза синтезируется многими микроорганизмами, но
для промышленного внедрения рекомендованы только некоторые
виды. Среди них необходимо назвать такие, как Kluyveromyces
(Saccharomyces, Fabospora) fragilis, Curvolaria inaequalis, Alter-
naria tenuis. Эти микроорганизмы были выделены и всесторонне
изучены А. С. Тихомировой, которая внесла большой вклад в раз-
работку технологии р-галактозидазных препаратов в нашей стра-
не. Весьма перспективен для промышленного внедрения Penicilli-
um canescens (по данным Т. А. Черемновой, Л. В. Юговой и др.,
1983).
Биосинтез р-галактозидазы является классическим примером
индуцированного синтеза фермента. Механизм индукции и репрес-
сии синтеза р-галактозидазы хорошо изучен и на культуре Е. coli.
Было установлено, что индуктором р-галактозидазы Е. coli являет-
ся аллолактоза (6-о-р-Л-глюкопираноза), образующаяся из лакто-
зы; для дрожжей и молочно-кислых бактерий наиболее эффектив-
ным индуктором определена лактоза, несколько менее результа-
тивна галактоза.
Для микроскопических грибов механизм индукции и репрессии
синтеза р-галактозидазы изучен в меньшей степени. Есть данные о
том, что индукторы для биосинтеза внутри- и внеклеточной р-га-
лактозидазы могут быть несколько различными, но все же в по-
давляющем большинстве случаев в качестве индуктора биосинте-
за р-галактозидазы указываются лактоза и галактоза. Следует
также сказать, что для некоторых микроорганизмов характерен
конститутивный механизм синтеза р-галактозидазы, например для
В. coagulans, В. stearothermophilus и некоторых других. Так как
все промышленные продуценты р-галактозидазы обладают инду-
цированным механизмом синтеза ферментов, большое значение
имеет состав питательной среды, особенно источники углерода.
306
Источники углерода. Основным источником углерода для боль-
шинства продуцентов является лактоза, содержание которой в сре-
де может быть от 2 до 20 %. Часто в качестве источника лактозы
используют молочную сыворотку — отход при получении сыра,
творога, казеииа. Она содержит 4—4,8 % лактозы, 0,5—1 % бел-
ка, 0,05—0,4 % жира и 0,5—0,7 % золы. В составе сред она может
быть использована в жидком или сухом виде после обработки на-
греванием и депротеинизирования.
Оптимальная концентрация лактозы в среде зависит от проду-
цента. Чем сильнее подвержен микроорганизм катаболитной реп-
рессии, тем ниже должна быть концентрация лактозы. В составах
некоторых сред помимо лактозы упоминаются ксилоза, галактоза,
арабиноза, раффиноза, сахароза. Влияние источников углерода на
биосинтез р-галактозидазы можно продемонстрировать иа культу-
ре гриба Р. canescens (табл. 2.48).
Таблица 2.48*
Источник углерода Конечный pH культуральной жидкости Активность Р- галактозидазы, ед./мл Биомасса, г/100 мл
Арабиноза 7,2 0,10 0,525
Ксилоза 7,0 0,04 0,620
Галактоза 8,0 0,02 0,650
Лактоза 7,6 0,08 0,400
Ксилан 6,8 0,63 0,335
Пектин 6,3 3,39 0,420
D-Галактуроковая кислота 8,1 0,02 0,270
Пектовая кислота 8,5 0,03 0,210
Лимонная кислота 2,6 0,05 0,125
Молочная кислота 6,5 0,59 0,210
* По данным Т. А. Черемновой, Л. В. Юговой н др. (1983).
Из таблицы видно, что для этого продуцента наибольший био-
синтез отмечается иа ксилане, пектине и молочной кислоте, а на
галактозе и лактозе отмечается хороший рост, но небольшое об-
разование р-галактозидазы.
Анализ используемых в производстве сред показывает, что ча-
ще всего в среды включают в качестве источника углерода раз-
личные отходы или дешевые природные субстраты, такие, как
пшеничные и рисовые отруби, кукурузный и картофельный крах-
мал, декстрины, гидрол, меласса, кукурузная кочерыжка, обезжи-
ренная соевая мука, сорбитол, свекловичный жом, молочная сы-
воротка, мука хлопковых семян и т. д.
Не меньшее значение, чем источник углерода, имеет в составе
среды азотистое питание.
Источники азота. Часто в качестве источника азота использу-
ют аммонийные соли. Но обычно для обеспечения высокого син-
теза фермента минерального азота бывает недостаточно и потому
... 307
в состав сред вводятся в небольших количествах различные орга-
нические добавки (дрожжевой автолизат, кукурузный экстракт,
экстракт солодовых ростков, пептон, гидролизаты казеина, мик-
робные массы, триптон и т. д.). Благотворное влияние этих доба-
вок на рост культур и биосинтез фермента, вероятно, связано не
только с органической формой азота, но и с тем, что они богаты
ростовыми веществами и биостимуляторами.
Дать общие рекомендации по составу среды и соотношению ее
компонентов не представляется возможным. В этом случае, как и
для других ферментных препаратов, необходимо индивидуально
для каждого продуцента экспериментально определять оптималь-
ные источники азота, углерода и отношение в среде углерода к
азоту. Так для Р. canescens следует отметить, что при оптималь-
ном уровне азота в среде 0,15 % наибольший биосинтез р-галакто-
зидазы отмечался при отношении С : N от 4 до 8. Для других про-
дуцентов оно может быть другим.
Минеральный состав среды. Питательные среды для выращива-
ния продуцентов р-галактозидазы содержат значительные количе-
ства источников фосфора, магния, марганца, железа, кальция и
многие другие микроэлементы. Многие авторы отмечают, что наи-
большее влияние на биосинтез р-галактозидазы имеет минераль-
ный фосфор, особенно в виде фосфорнокислых солей натрия и ка-
лия, вносимых в среду в количестве около 0,02—0,03 % по фос-
фору. Влияние содержания в среде Na2HPO4 на синтез р-галакто-
зидазы грибом Р. canescens представлено иа рис. 2.58. Как видно
из рисунка, независимо от состава среды роль фосфора достаточ-
но ощутима, и увеличение содержания соли с 0,5 до 2,5 % позво-
ляет повысить биосинтез р-галактозидазы в 1,5—2 раза. В настоя-
щее время на промышленных средах при глубинном культивирова:
нии микроскопических грибов получают культуральную жидкость
с активностью по внеклеточной р-галактозидазе до 40 ед./мл.
Условия культивирования. Существенное влияние на биосинтез
микроорганизмами р-галактозидазы оказывают условия культиви-
рования продуцентов. Очень большое влияние оказывают pH сре-
ды и его изменение в процессе роста культуры (рис. 2.59). Из ри-
сунка видно, что максимальный синтез р-галактозидазы наблюда-
ется только при pH от 3 до 4, и если его поддерживать на опти-
мальном уровне, то биосинтетическую способность продуцента по
этому ферменту можно повысить в 1,5—2,5 раза. Данные других
авторов также подтверждают эту закономерность. Существенное
влияние на биосинтез микроорганизмами р-галактозидазы оказы-
вают температура культивирования, интенсивность аэрации и по-
севной материал.
Большинство дрожжевых и грибных продуцентов р-галактози-
дазы относится к мезофильным организмам, оптимально развива-
ющимся при температуре от 25 до 35 °C. Исключение составляют
некоторые штаммы рода Mucor (45 °C) и психрофильные дрожжи
Trametes versicolor и Tyromyces albellus с оптимальной темпера-
турой роста 20 °C. Бактериальные продуценты р-галактозидазы,
308
Рис. 2.58. Влияние концентрации
гндроортофосфата натрия в различ-
ных средах на биосинтез р-галакто-
зидазы Р. canescens (по данным
Л. В. Юговой, 1984):
1 — среда со свекловичным жомом; 2—
среда с отрубями; 3 — среда с соевой
мукой
Рис. 2.59. Влияние исходной величины
pH среды на биосинтез микроскопи-
ческими грибами р-галактозидазы
(по данным А. С. Тихомировой,
1979):
1 — биомасса, г/100 мл; 2 — 0-галакто-
зидазиая активность в культуральной
жидкости, ед./100 мл; 3 — 0-галактозн-
дазиая активность в мицелии, выросшем
в 100 мл среды
за исключением Е. coli, представлены в основном термофилами с
температурой роста от 45 до 65—70 °C.
За исключением некоторых бактериальных штаммов, напри-
мер рода Citrobacter, продуценты р-галактозидазы являются
аэробными микроорганизмами и нуждаются в аэрации. Степень
аэрации культур имеет большое значение, о чем свидетельствуют
работы А. С. Тихомировой и других исследователей. Было установ-
лено, что нарушение конструктивных процессов в дрожжах при
лимитации роста культуры по воздуху .приводит к усилению ин-
тенсивности биосинтеза р-галактозидазы. Но в то же время для
грибных культур возрастание степени аэрации сопровождалось
всегда повышением р-галактозидазной биосинтетической способно-
сти продуцентов.
Вид посевного материала, его качество и количество во многом
определяют рост культуры и процесс биосинтеза фермента. Выбор
вида посевного материала зависит от микроорганизма и устанав-
ливается экспериментальным путем. Влияние посевного материала
можно продемонстрировать на образовании р-галактозидазы куль-
турой Р. canescens (рис. 2.60).
Очевидно, что микроорганизмы различных таксономических
групп способны к индуцированному и конститутивному биосинте-
зу р-галактозидазы. Она может накапливаться внутри клетки или
секретироваться во внешнюю среду. Известно, что внеклеточные
309
Рис. 2.60. Зависимость образования
Р-галактозидазы Р. canescens от
вида посевного материала (по дан-
ным Л. В. Юговой, 1985):
1, 2 — вегетативный соответственно в
количестве 1 и 10%, 3, 4—коиидиальиый
соответственно в количестве 5 • 10е и
1 • 10»
Р-галактозидазы являются гли-
копротеидами, а внутриклеточ-
ные практически ие содержат
углеводного компонента. При-
соединение углевода к ферменту,
вероятно, соответствует опреде-
ленной фазе его роста и совпа-
дает с моментом выхода фермен-
та из клетки в процессе его
прохождения через клеточную
стейку. Считается, что первый
остаток углевода присоединяет-
ся к ферменту, когда последний
начинает сходить с рибосомы.
Галактоза, маиноза, сиаловые
кислоты присоединяются к бел-
Полипептид проходит мембраны
ку при прохождении полипепти-
да через клапаны в мембранах.
Длина и состав углеродного
фрагмента могут варьировать,
в развернутом состоянии, а при
выходе происходит молекулярная перестройка, при которой угле-
воды способствуют удерживанию фермента в трехмерном состоя-
нии и увеличивают его стабильность. Это обстоятельство очень
важно учитывать при производстве р-галактозидазных препара-
тов. Образование р-галактозидазы и ее выход из клетки зависят
от многих факторов, и для определения оптимальных параметров
процесса выращивания продуцентов в каждом отдельном случае
требуется тщательное изучение закономерностей ее биосинтеза.
Выделение ферментов. р-Галактозидаза используется в различ-
ных технологиях н медицине в виде очищенных препаратов. Требо-
вание к степени очистки препарата зависит от области его при-
менения. Поэтому технология выделения р-галактозидазы различ-
на. Если препарат внутриклеточный и ие секретируется во внеш-
нюю среду, необходимо на первом этапе отделить биомассу про-
дуцента и использовать один из способов деградации клеток мик-
роорганизмов. Для этой цели можно реально использовать ультра-
звук, естественный автолиз клеток при повышенных температурах,
обработку литическими ферментами, экстракцию капиллярными
ядами. Наилучшие результаты по разрушению клеток К. fragilis
были получены прн экстракции толуолом. При обработке литиче-
скими ферментами и ультразвуком эффект был хуже в 2—2,5 ра-
за. Из биомассы дрожжей фермент иа 20—25 % можно извлечь
0,001 и. фосфатным буфером при pH около 7, ио в этом случае
отделенную биомассу необходимо термически обработать (2—3 ч
при 60°С) и затем подсушить при температуре 20—25°С до влаж-
ности 10%. Используя этот прием в опытно-промышленных усло-
виях, получали препараты дрожжевой р-галактозидазы лактофра-
гилин Г10х с активностью до 500—1 000 ед./г.
310
Более перспективно для промышленности использование проду-
центов, секретирующих внеклеточную р-галактозидазу. Это объяс-
няется тем, что отпадает трудоемкая процедура извлечения фер-
мента из биомассы, а главное, внеклеточный фермент более ста-
билен к внешним воздействиям. В таких случаях культуральную
жидкость очищают от взвеси, фильтрат подвергают очистке и кон-
центрированию методом ультрафильтрации н далее осаждают ор-
ганическими растворителями или сульфатом аммония. Для осаж-
дения применяют этанол (1,5-4-4: 1), ацетон (0,75-4-1,5: 1), изопро-
панол (1,54-2: 1). Большое влияние иа соотношение растворителя
и ферментного раствора оказывает степень концентрирования по-
следнего. Чем она выше, тем меньше расход растворителя. При вы-
саливании в зависимости от продуцента, состава среды и степени
концентрирования используется различная концентрация сульфа-
та аммония — от 0,9 до 0,45 полного насыщения.
Препарат р-галактозидазы получают путем распылительного
высушивания фильтратов и ультракоицентратов. Для успешного
проведения этого процесса используют стабилизаторы (например,
соли магния) и различные наполнители (Na2SO4, NaCl, лактоза,
молочная сыворотка и др.). Наиболее благоприятный температур-
ный режим, по мнению большинства авторов, следующий: 120°C
иа входе и 60°C на выходе. Потери в этом случае не превышают
1—3 %, а влажность готового препарата составляет 5,5—7 %.
Для получения высокоочищенных и гомогенных ферментных
препаратов используются сочетания таких методов, как диализ,
гель-фильтрация на сефадексах, хроматография на ДЭАЭ-, SE- и
КМ-сефадексах, ДЭАЭ-, КМ-целлюлозах, гидроксилапатите и дру-
гих носителях, изоэлектрическое фокусирование, афиииая сорбция
и т. д. В нашей стране фундаментальные исследования в этом на-
правлении на различных продуцентах были проведены в Институ-
те биохимии АН СССР А. С. Тихомировой (табл. 2.49).
Данные таблицы показывают, что в зависимости от вида про-
дуцента и используемой схемы очистки можно получить препара-
ты с различной удельной активностью от 52 до 160 ед./мг белка.
Анализ стадий выделения показывает, что вполне реально полу-
чать гомогенные ферментные препараты из культур микроорганиз-
мов, особенно из микроскопических грибов. Эти стадии достаточно
просты, и выход препарата сравнительно высокий. Характеристика
всех трех препаратов была дана в табл. 2.47. Но пока в нашей
стране ие иалажеи промышленный выпуск микробных препаратов
высокоочищеииой и гомогенной р-галактозидазы, хотя потребность
в ней для аналитических и медицинских целей достаточно большая.
Иммобилизованные препараты. Практический интерес имеют
исследования по получению р-галактозидазы в иммобилизоваииом
виде, которые проводятся многими исследователями. Важные ис-
следования в этом направлении в нашей стране были проведены
С. В. Ельчиц, В. Б. Пичко иа продуцентах Curvularia inaequalis
и Saccharomyces fragilis; А. И. Кестнер, К. Э. Паппель на С. inae-
qualis; В. К. Антоновым, В. С. Баевой на том же продуценте;
311
Таблица 2.49
Этап очистки Активность, ед. иа 1 мг белка Степень очистки Активность, % от исходной
Kluyveromyces fragilis Исходный экстракт дрожжей 4 2,5 100 Осаждение этанолом (1:1) 18 11,0 80 Фракционное осаждение (NH4)2SO4 30 18,3 63 Хроматография иа ДЭАЭ-целлюлозе 120 73,3 57 Сорбция на гидроксилапатите 159 97,0 55 Аффинная сорбция 210 106,8 50 Curvularia inaequalis Культуральная жидкость 1,1 1,0 100 Осаждение ацетоном (1,5:1), переосажде- 4,1 3,7 79 ние этанолом (4:1) Хроматография иа ДЭАЭ-целлюлозе 18,0 16,4 55 Рехроматография иа ДЭАЭ-целлюлозе 36,0 32,7 28 Сорбция на гидроксилапатите 52,0 47,3 19 Alternaria tenuis Препарат, полученный осаждением аце- 4 2 ’ 100 тоиом Хроматография на ДЭАЭ-целлюлозе 22 10 86 Сорбция на гидроксилапатите 94 46 34 Аффиииая сорбция 160 78 32
Л. А. Нахапетяном, Н. М. Самошиной на 0-галактозидазах нз
Р. canescens, С. inaqualis н A. oryzae. Были получены стабильные
препараты иммобилизованной р-галактозидазы с нспользованнем
ацилирования белков и иммобилизации на КМ-целлюлозе. Активи-
рование карбоксильных групп полимера происходило с образова-
нием азида. Были получены препараты путем включения фермен-
та в полиакриламидный гель, а также путем связывания р-галак-
тозидазы с полимером (снланизнрованным снлохромом СХ-2), со-
держащим NH2-rpynnbi, с помощью бифункционального реагента
(глутарового альдегида).
Для иммобилизации р-галактозидазы был также использован
принципиально новый метод адсорбции. Фермент модифицировали
включением хлортриазинового красителя — ярко-оранжевого КХ —
с введением в фермент анионных н гидрофобных активных групп.
Модификация не затрагивала группировок, связанных с осущест-
влением каталитического акта. Краситель соединялся с р-галакто-
зидазой (2:1) прн добавлении к ферменту шести сульфогрупп.
Такая модификация фермента позволяет использовать широкий
круг носителей с различными физическими свойствами. В качестве
носителей использовались различные аниониты. Наилучшие резуль-
таты были получены при модификации высокоочнщенной р-галак-
тозидазы, иммобилизации ее на ДЭАЭ-сефадексе, активность фер-
мента достаточна — 380—400 ед./г носителя.
312
Успешно проведена ковалентная иммобилизация р-галактози-
даз на силохроме С-80, обработанном различными модификатора-
ми (у-АПТЭС, ТЭСУК, 8-триэтоксисилил-6-октанлактам), т. е. со-
ответственно на аминосилохроме, карбоксилохроме н аминокарбо-
ксилохроме. Наилучшие результаты получены при иммобилизации
на неорганическом носителе, модифицированном карбоксильными
группами.
Применение иммобилизованной р-галактозидазы дает ощути-
мый экономический эффект за счет многократного и длительного
использования фермента и в результате резкого снижения загряз-
нения белком (ферментом) обрабатываемого субстрата. Использо-
вание иммобилизованой р-галактозидазы следует считать перспек-
тивным во многих отраслях.
2.11. ПРЕПАРАТЫ ₽-ФРУКТОФУРАНОЗИДАЗЫ
Препараты (J-фруктофураиозидазы применяются в технологических процес-
сах, где необходима инверсия сахарозы. Наиболее широко фермент используется
в кондитерской промышленности при производстве помадных изделий. Эти
изделия быстро черствеют при хранении, так как с потерей влаги наблюдается
явление кристаллизации сахарозы. Если в рецептуру добавлять р-фруктофура-
иозидазу, то будет происходить медленный гидролиз сахарозы уже в готовой
конфете. Поэтому помадка и другие кондитерские изделия с помадными массами
будут иметь длительное время оптимальную консистенцию и черствение замед-
лится. Есть данные по применению фермента в хлебопечении. Использование
препарата улучшает аромат, пористость и внешний вид хлеба. Препараты фер-
мента используются при приготовлении инвертных сиропов в ликеро-водочной и
особенно в безалкогольной промышленности с концентрацией сахара до 72—73 %,
а также для приготовления подкормочных сиропов для пчел в пчеловодстве (до
75—80 %). Сиропы такой концентрации можно приготовить, ие инвертируя
сахарозу, но оии очень быстро кристаллизуются, что затрудняет работу с ними.
Фермент может использоваться как аитикристаллизатор при изготовлении сгу-
щенного молока, искусственного меда, плодово-ягодных морсов, соков, экстрактов
и варенья.
2.11.1. Источники получения р-фруктофуранозидазы
p-Фруктофуранозидазу образуют различные микроорганизмы:
дрожжи, грибы, бактерии н актиномицеты. Она есть у растений и
животных. В качестве промышленного источника долгое время ши-
роко используются преимущественно дрожжи Saccharomyces се-
revisiae и некоторые другие виды дрожжей. Хорошим источником
фермента являются грибы рода Aspergillus, Penicillium, Fusarium.
Среди базидиальных грибов 0-фруктофуранозидаза обнаружена у
Cercospora beticola. Фермент обнаружен в Neurospora crassa и у
некоторых представителей низших грибов. В качестве продуцентов
фермента описан ряд штаммов В. subtilis, Е. coli, Streptococcus
mutans, Actinomyces viscosus и некоторые другие. В последнее
время, учитывая то, что S. cerevisiae продуцирует внутриклеточ-
ный фермент, а грибы — внеклеточный, наметилась тенденция
преимущественного использования в качестве продуцента в про-
мышленных условиях микроскопических грибов.
313
2.11.2. Механизм действия и свойства фермента
Субстрат. Субстратом для действия p-фруктофуранозидазы яв-
ляются сахароза и ее производные — олигофруктозиды и галак-
тозиды. Фермент p-фруктофуранозидаза известен под многими на-
званиями: сахараза, инвертаза, инвертин, p-ft-фруктозидаза. Си-
стематическое название фермента p-D-фруктофураиозидфруктогид-
ролаза (КФ 3.2.1.26). Фермент гидролитически отщепляет конце-
вые нередуцирующие p-D-фруктофуранозидные остатки в р-фрук-
тофуранозидах. Он обладает высокой трансферирующей активно-
стью, т. е. способностью к переносу остатков фруктозы на различ-
ные акцепторы. Гидролиз сахарозы на глюкозу и фруктозу может
проходить по двум типам реакции, которые свойственны двум раз-
ным ферментам:
Тип а——-------
Остаток глюкозы
О—т—Остаток уюуктозы
I----------Тип б
Фермент типа а проявляет сродство к остатку глюкозы, т. е. к
а-глюкопиранозиду, поэтому он называется глюкопиранозидазой.
Для этого фермента наличие аглюкона в молекуле субстрата не
имеет существенного значения, поэтому он может гидролизовать
ие только сахарозу, но и все другие олигосахариды, в цепи кото-
рых конечным остатком является а-глюкозил, например кестоза,
1-кестоза. В то же время фермент не может гидролизовать рафи-
нозу, так как а-глюкозил закрыт с одной стороны остатком галак-
тозы, а с другой — остатком фруктозы.
По типу б действует фермент, проявляющий сродство к р-фрук-
тофураиозилу. Фермент, по-видимому, присоединяется к субстра-
ту со стороны остатка фруктозы. Именно этот фермент называет-
ся p-фруктофуранозидазой. Помимо сахарозы он способен гидроли-
зовать и другие сахариды, имеющие свободный 0-фруктофурано-
зил, например стахиозу, умбеллиферозу, неокестозу. При гидроли-
зе сахарозы по а и б варианту накапливаются глюкоза в пираноз-
ной форме и фруктоза в фуранозной.
Оба типа фермента способны также переносить отщепленные
остатки иа другие соединения с образованием соответствующих
олигосахаридов. а-Глюкопиранозидаза в этой реакции может быть
названа а-О-глюкозилтрансферазой. К этой группе сахараз отно-
сятся инвертаза меда, инвертаза, выделенная из слизистой обо-
лочки кишечника свиньи, декстраисахараза и сахарофосфорилаза.
Фермент, действующий по типу б, при выполнении функций пере-
носа остатков фруктозы может быть назван p-D-фруктозилтранс-
фераза. Он участвует в синтезе фруктозидов, например левана.
Процесс схематически можно представить следующим образом:
P-D-Фруктозилтрансфераза
п Сахароза----------------------- Леван + п Глюкоза.
(фруктоза) п
314
Рис. 2.61. Гипотетический механизм разрыва Р-2, 1-фрукто-
видной связи в сахарозе
Механизм действия. Предложено несколько гипотез механизма
разрыва р-2,1-фруктозидной связи, наиболее приемлемой из кото-
рых является схема, предложенная Н. А. Жеребцовым и В. Б. Бу-
ковой (рис. 2.61). Авторы предполагают, что в активном центре
p-фруктофуранозидазы имидазол (ИМ) играет роль электрофиль-
ной протоновой группы, а карбоксильная группа — роль нуклео-
фила. Так как атом кислорода имеет больший отрицательный ин-
дукционный эффект, чем атом углерода, происходит перераспреде-
ление плотности электронного облака в р-2,1-фруктозидной связи.
В результате оттягивания электронов к атому кислорода 0-2,1-
фруктозидной связи атом С2 будет иметь меньшую плотность это-
го облака и обладать положительным индукционным эффектом.
Под действием электрофильно-нуклеофильной системы имидазол —
карбоксил происходят оттягивание электронов к точке закрепления
имидазола и уход от точки закрепления иона карбоксила, что и
приводит к разрыву связи. Пользуясь гипотезой об активной по-
лости, можно предположить, что процесс катализа протекает в две
стадии: первоначально фруктозидиый остаток молекул сахарозы
втягивается внутрь активной полости фермента, и только на вто-
ром этапе процесса начинает действовать электрофильно-нуклео-
фильная система имидазол — карбоксил, которая и осуществляет
разрыв связи между С2 и О. Акцепторами фруктофуранозиых ос-
татков могут служить вода, спирты и сахара.
0-Фруктофуранозидаза относится к хорошо изученным фермен-
там. Она имеет гликопротеиновую природу. Изучен аминокислот-
ный состав ферментов, полученных из различных источников. Уста-
новлено, что p-фруктофуранозидазы имеют некоторую общую за-
кономерность: независимо от происхождения и локализации фер-
мента преобладающими в молекуле белка являются аспарагиновая
315
и глютаминовая кислоты, серин и треонин. В грибных ферментах
отмечается также повышенное содержание глицина, аланина, ва-
лина и лейцина. Характерным является и то, что в большинстве
Р-фруктофураиозидаз отсутствуют или очень мало цистина и ци-
стеина. Четких данных о структуре фермента и организации его
активного центра нет. Есть лишь сведения о том, что в активном
центре имеются имидазольные группы, участвующие в каталитиче-
ском акте. Очевидно, что структуры молекул fj-фруктофуранози-
дазы отличаются в зависимости от происхождения (табл. 2.50).
Таблица 2.50*
Продуценты р-фруктофуранозид азы Молекулярная масса Количество субъединиц
Streptococcus mutans GS-5 47 000 1
Saccharomyces mutans SL-1 48 000 1
Saccharomyces FH 4C 270 000 —
Белковая часть 135000 —
Candida utilis 210 000 2
Saccharomyces cerevisiae XI 270 000 —
Neurospora crassa 210 000 4
* По данным Е. Р. Алексанян, Л. С. Маркосян (1986).
Из табл. 2.50 видно, что молекула фермента может иметь субъ-
единичную структуру (2—4 субъединицы). Можно считать, что у
всех ферментов есть определенная общность, независимо от про-
исхождения величины субъединиц по молекулярной массе близки
и равны примерно 50 000. Наблюдаемые различия в молекулярной
массе, по-видимому, связаны с размерами углеводного компонен-
та, который у дрожжевого фермента может составлять 30—80%,
у грибных — до 10—12 % и ниже. Углеводные компоненты могут
быть очень разнообразны, но большинство работ свидетельствует,
что в ием есть манноза (до 43—50%), глюкоза (до 50%) и неко-
торое количество галактозы. В состав внеклеточной рфруктофу-
ранозидазы входят также глюкозамин и N-ацетилглюкозамин. По-
лисахаридный компонент микробного фермента состоит из много-
численных разветвленных цепочек олигосахаридов (около 30) с
молекулярной массой от 2 000 до 10 000. Связь полисахаридных
фрагментов с белком фермента изучена слабо. Высказываются
предположения, что глюкозамин связывается с аспарагиновой кис-
лотой, а манноза — через о-гликозильные эфирные связи с сери-
ном или треонином. Многие ученые считают, что полисахаридный
компонент сообщает молекуле p-фруктофуранозидазы термоста-
бнльность и устойчивость к воздействию денатурирующих агентов,
ио есть и противоположные высказывания.
0-Фруктофур'анозидазы имеют множественные формы, которые
отличаются по своим свойствам. Показано, что р.-фруктофуранози-
дазы из различных микроорганизмов отличаются по оптимальным
316
pH н температуре, по стабильности. fJ-Фруктофуранозидаза чув-
ствительна к ряду химических соединений. Специфическими инги-
биторами для нее являются ионы тяжелых металлов, л-хлормерку-
рийбензоат, моноиодуксусиая кислота, иодацетамид, Af-этилимид
яблочной кислоты, соединения кремния, пиридоксин и его произ-
водные, 3-гидрокситирамин и некоторые окислительные ферменты
(о-дифеиилоксидаза, пероксидаза). Фермент активируется ферро-
цианидом калия, циклогексимидом, глутатионом и р-меркаптоэта-
иолом. p-Фруктофураиозидазы несколько различаются между собой
по отношению к концентрации субстрата в реакционной среде. Об-
ласть оптимальной коицеитрации сахарозы в зависимости от про-
дуцента может меняться от 5 до 40 %. Фермент не является узко-
специфическим, он может гидролизовать инсулин, раффинозу и
участвовать в образовании олигосахаридов.
Известно, что 0-фруктофуранозидаза может быть внутриклеточ-
ной и внеклеточной. Эти ферменты отличаются друг от друга
прежде всего величиной молекулярной массы и особенно полиса-
харидным фрагментом. Внеклеточный фермент или связанный с
клеточной стеикой называется L-формой. Эта форма содержит
большой углеводный компонент и часто еще называется большой
формой. Этот фермент высвобождается при удалении клеточной
стеики, он составляет почти 95 % общего количества синтезируе-
мого микроорганизмом фермента. Если же вскрыть протоплазму,
то высвобождается небольшое (около 5%) количество фермента
5-формы (малой формы), который имеет меньшую молекулярную
массу и небольшой углеводный фрагмент. Внутриклеточный фер-
мент в S-форме обычно не выделяется в таком виде во внешнюю
среду. 5-форма может превращаться в L-форму, проходя через кле-
точную оболочку, где происходят соединение 5-формы с полисаха-
ридами маннановой природы и превращение фермента в L-форму.
L-Форма может секретироваться во внешнюю среду или находить-
ся в прикрепленном к наружной стороне клеточной мембраны ви-
де, связываясь через фосфор полисахаридной частью молекулы с
маннанами клеточной стеики. Есть организмы, которые синтезиру-
ют только внутриклеточный фермент, и наоборот. Свойства
Р-фруктофуранозидаз различного происхождения очень разнооб-
разны, и поэтому требуется экспериментальная характеристика
каждого нового продуцента и синтезируемого им фермента.
2.11.3. Получение препаратов, обладающих инвертазной
активностью
Технология инвертазных препаратов развивалась по двум на-
правлениям. Это использование для производства ферментного
препарата осадочных пивных дрожжей (отход пивоварения) или
обычным путем — культивирование продуцента и затем получение
из культуры микроорганизма препаратов. Рассмотрим оба эти на-
правления в технологии инвертазных препаратов.
317
Получение препаратов на основе осадочных пивных дрожжей.
Из осадочных дрожжей получают препараты рфруктофуранозида-
зы в виде сухих порошков, жидких концентратов н дрожжевых ав-
толизатов. Технология препаратов инвертазы из осадочных дрож-
жей сводится к трем технологическим процессам: активация дрож-
жей с целью повышения содержания в клетках фермента, разру-
шение дрожжевой клетки и приготовление товарной формы пре-
парата. Известно несколько способов реализации этой технологии.
Обобщенно можно представить процесс получения препаратов
инвертазы в виде следующей схемы (рнс. 2.62). Пивные осадоч-
ные дрожжи содержат частицы свернувшихся хмелевых смол, при-
дающих им резкий горький хмелевой вкус, коагулированные бел-
ки и другие вещества. Для отделения дрожжевых клеток от при-
месей осадочные дрожжи многократно промывают, для чего сна-
чала пропускают их с холодной водой (1—2 °C) через тонкое шелко-
вое сито (№ 18—19). Частицы примесей остаются на сите, а дрож-
жи вместе с водой попадают в сборник. При первой промывке объ-
ем дрожжей увеличивается в 3—4 раза, поэтому полученную сус-
пензию дрожжей сепарируют. Отсепарироваиные дрожжи затем
промывают 0,5 °/о-ным раствором повареииой соли в течение 1—
2 ч при периодическом перемешивании, чтобы удалить вещества,
сорбированные на поверхности клетки. От солевого раствора дрож-
жи отделяют сепарированием. Сепарированные дрожжи, слегка
солоноватые на вкус, имеют консистенцию прессованных дрожжей
влажностью около 75 %.
Получение универсального биопрепарата. Про-
мытые дрожжи смешивают с сахарозой в соотношении 1 :2. Всю
массу тщательно перемешивают и выдерживают при температуре,
40—45°C в течение 2—3 ч до образования гомогенной массы. По-‘
лученный коричневато-кремовый густой сироп очень сладкий на
вкус, с легким дрожжевым привкусом, имеет относительную плот-
ность в среднем 1,4 и влажность 25 %. Активность универсального
биопрепарата около 200 ед. ИА/г, содержание сахара 66%, из
них 91—95 % — в виде иивертиого.
Получение препарата в виде пасты. Отмытые
дрожжи разводят водой до концентрации сухого вещества 5 %. Су-
спензию со скоростью 0,7—0,8 м3/ч подают в установку с интен-
сивностью ультразвука 6—7 Вт/см2 прн частоте 35 кГц. При та-
кой обработке температура продукта повышается до 58—60 °C, на-
ступает мгновенная гибель дрожжевой клетки. Чтобы внутреннее
содержимое клеток не переходило в раствор, производят немедлен-
ное центрифугирование. Влажность сепарированной массы около
68 %. Полученные в виде влажной пасты дрожжи подвергают ав-
толизу и обрабатывают поваренной солью из расчета 1 :6. Соль
перемешивают с дрожжевой массой до ее полного растворения.
Препарат имеет светло-серый цвет, консистенцию густой пасты,
горьковато-солеиый вкус; инвертазная активность около 500 ед.
ИА/г, есть небольшая глюкозидазная и протеолитическая актив-
ности.
318
Осадочные пивные дрожжи
после снятия зеленого
пива
\Хмелевые Вещества,
промывные воды
(Освобождение от остатков пива, хмелевых и горьких
веществ на шелковом сите
I Сепарирование
3. Промывание в 0.5 %-ном растворе NaCl
4 Сепарирование
Промытые
пивные дрожжи
(.Активация и обо-
гащение дрожжей
инвертазой
2. Азрация
3. Отстаибание
А Декантация и
' сепарирование
Распылительная суш-
ка вустанобке сакусти-
ческим излучателем
Сухой препарат дрож-
жей с инвертазной
активностью
Надосадочная
жидкость
(отбрасывается)
Активированные
дрожжи
1. Разбавление водой (11)
2 Автолиз в присутствии 3%-ного
раствора бензола
3. Центрифугирование
I Разведение дрожжей до
содержания 5% сухого
вещества
2 Разрушение и умерщвле -
ние клеток мгновенным
воздействием ультразвука
3. Термическая обработка
мгновенным воздействи-
ем температуры 5S-60'C
4 Немедленное центрифу-
гирование
1 Гомогенизация с
сахарозой (1.2)
2 Термолиз дрожжей
д течение 2-3 ч при
40-451?
J. Фасование
жидкого концентра-
та
Готовый унидерсальный
пищевой биопретрат
Рис. 2.62. Схема получения препаратов 0-фруктофуранозндазы различной
степени очистки из осадочных пивных дрожжей
£
£
I
1
Получение сухих дрожжей. Отмытые и прессованные
дрожжи можно без предварительной обработки высушить в рас-
пылительной сушилке с акустическим излучателем. Под действием
акустического поля связанная вода почти мгновенно отделяется,
равновесность гидрофильных коллоидов дрожжевой клетки и ее
жизненные обменные процессы нарушаются, поэтому клетка гиб-
нет при более низких температурах, а ферменты и другие биологи-
319
чески активные вещества при этом не претерпевают изменений.
Получается устойчивый к длительному хранению комплексный пре-
парат сухих дрожжей, содержащих активную инвертазу.
Активация и обогащение дрожжей. К промытым
дрожжам при аэрации (10 м3 воздуха в минуту на 1 т прессован-
ных дрожжей) добавляют обедненную по углеводу среду, содержа-
щую необходимый набор питательных солей. Углерод вводится в
виде 20%-иого раствора мелассы (по сахару) из расчета 160 г са-
хара на 1 кг сухой массы дрожжей. Активация проводится в те-
чение 8—10 ч при температуре 30 °C, в результате содержание ин-
вертазы в дрожжах увеличивается в 5—10 раз.
Разрушение дрожжевой клетки. Дрожжевая клетка
имеет плотную трудноразрушаемую оболочку. Для разрушения ее
используют различные способы: 1) механический — растирание
при низких температурах или прессование под высоким давлением;
2) термический — обработка при температуре 60—70 °C в течение
5—10 мин. Клетки гибнут, й проницаемость клеточных стенок по-
вышается, однако при этом возможна частичная инактивация ин-
вертазы; 3) длительный автолиз в течение 4—5 сут при 45—48 °C;
4) разрушение клеток чередованием замораживания и оттаива-
ния. При этом образуются кристаллы льда внутри клетки и кле-
точная оболочка разрывается; 5) действие ультракоротких волн и
ультразвука; 6) воздействие капиллярно-активных ядов бензола,
хлороформа, толуола и т. д.
В приведенной выше схеме разрушение клеточных стенок про-
водится бензолом, который добавляют к активированным дрож-
жам из расчета 0,8 % сухой массы дрожжей и выдерживают при
30 °C с периодическим перемешиванием в течение 5 сут. Остатки
клеток отделяют центрифугированием, вся инвертаза переходит в.
надосадочиую жидкость.
Получение очищенных препаратов. Надосадочную
жидкость подкисляют уксусной кислотой до pH 5,5—5,0 и охлаж-
дают до 0 °C. Выпавший осадок отделяют, к раствору добавляют
охлажденный до 2—5 °C этиловый спирт в соотношении 1 : 1,5.
Процесс ведут при 6—7 °C. Осадок фермента отделяют центрифу-
гированием. Так как препарат в сухом виде быстро теряет актив-
ность и плохо растворяется, то непосредственно после центрифу-
гирования осадок растворяют в небольшом количестве воды и для
повышения стойкости фермента добавляют глицерин до концентра-
ции его в растворе 25%. Такой препарат хранится в стеклянной
таре не менее 2 лет.
Высокие концентрации сахарозы предохраняют р-фруктофура-
нозндазу от термической инактивации. Так, при концентрации са-
харозы 20—30 % и pH около 4,5 фермент сохраняет активность при
температуре до 55—60 °C. Фермент чувствителен к свету и в при-
сутствии кислорода легко разрушается. Инактивируется фермент
при действии постоянного тока и при длительном воздействии
ультразвука.
Получение препаратов инвертазы из культур микроскопических
320
грибов. В нашей стране Ю. 3. Серовой разработана технология
получения препаратов p-фруктофуранозидазы на основе глубинно-
го культивирования Aspergillus awamori 16, продуцирующего вне-
клеточный фермент. При выборе питательной среды необходимо
изучить влияние отдельных ее компонентов на биосинтез фермен-
та, а также подобрать оптимальные условия роста культуры.
Источник углерода. В состав сред вводились различные
углерод содержащие соединения: глюкоза, фруктоза, галактоза,
арабиноза, рамноза, сахароза, лактоза, мальтоза, раффиноза, ину-
лин, декстрины, крахмал, инозит, маннит. Наивысший синтез вне-
клеточной 0-фруктофуранозидазы наблюдался только в присутст-
вии инулина, декстринов и особенно крахмала. При изучении влия-
ния почти тех же компонентов среды Aureobasidium pullulans наи-
лучшие результаты получаются на манните, несколько хуже на
раффинозе и глицерине.
Источник азота. Обычно в качестве источника азота ис-
пользуют нитрат натрия, сульфат аммония, казеин, пептон, аммо-
нийные соли фосфорной кислоты и некоторые органические источ-
ники азота, такие, как соевая мука. На примере A. awamori по-
казано, что наивысшие результаты по биосинтезу фермента и ро-
сту биомассы получаются на среде, состоящей из мелассы (6 %) и
NaNO3 (0,9%).
Источник фосфора. В качестве источников фосфора мож-
но применять соли калия, аммония, натрия фосфорной кислоты.
Нанлучшим источником фосфора является KH2PO4.
Условия культивирования. Учитывая все эти данные.
Ю. 3. Серовой была проведена оптимизация состава питательной
среды с использованием математических методов планирования
эксперимента, что позволило получить культуральную жидкость с
активностью до 75—80 ед./мл. Было установлено, что посевной
материал должен вноситься в среду в количестве 0,5 % на 36 ч
роста культуры, pH среды в начале роста культуры должен быть
Рис. 2.63. Влияние pH (а), температуры (б) и длительности термообработки
при различных температурах (в) иа активность 0-фруктофуранозндазы (по
данным Ю.З. Серовой, 1979)
321
6,0, температура—28—33°С, аэрация — 1,4 г O2/(ji-4)~s, длитель-
ность культивирования составила 120 ч. В результате проведения
этих опытов удалось повысить продуцирующую способность мик-
роорганизма в 15—20 раз и разработать рентабельный процесс по-
лучения высокоактивной культуральной жидкости.
Выделение ферментов. На основе фильтрата культу-
ральной жидкости традиционными способами были получены очи-
щенные препараты p-фруктофуранозидазы. При изучении влияния
pH ферментного раствора было установлено, что наибольший вы-
ход активной p-фруктофуранозидазы наблюдается при pH 5,8—6,8.
Фермент достаточно хорошо осаждается органическими раствори-
телями. Под действием этанола (1:4) осаждается до 90 % фер-
мента в активном состоянии, изопропанола (1:2) —88 % и ацето-
на (1 :2) —91 %. При высаливании сульфатом аммония при насы-
щении 0,8 фермент переходит в осадок почти полностью (99,3 %).
В отличие от дрожжевой внутриклеточной р,-фруктофуранозида-
зы данный фермент отличается большей стабильностью, достаточ-
но широким диапазоном pH-оптимума н высокими оптимальными
температурами действия (рис. 2.63). Если много работ по выделе-
нию и очистке p-фруктофуранозидазы с использованием гель-филь-
трации, различных методов препаративной хроматографии, элек-
тродиализа. Получены гомогенные ферментные препараты, позво-
лившие изучить свойства и строение фермента, о чем говорилось
выше.
Учитывая то, что субстрат для действия p-фруктофуранозидазы
низкомолекулярный, в литературе есть интересные работы по им-
мобилизации фермента в различных гелях и использованию таких
препаратов для получения ннверта сахарозы и для аналитических
целей. Это направление в исследованиях очень важно и в ближай-
шее время найдет широкое применение.
глава
ОХРАНА ТРУДА И ТЕХНИКА БЕЗОПАСНОСТИ
НА ПРЕДПРИЯТИЯХ, ВЫПУСКАЮЩИХ
ФЕРМЕНТНЫЕ ПРЕПАРАТЫ
В нашей стране уделяется большое внимание вопросам охраны труда и
мероприятиям, призванным обеспечить безопасность всех работающих на пред-
приятиях. Основные положения по охране труда гарантируются Конститу-
цией СССР, более подробно они изложены в Кодексе законов о труде (КЗоТ).
Для обеспечения безопасных условий труда постоянно совершенствуются нормы
и правила техники безопасности.
В микробиологической промышленности разработаны н действуют правила
безопасности, утвержденные в 1975 г. Госгортехнадзором СССР, где есть спе-
циальные разделы, касающиеся организации труда на предприятиях, выпускаю-
щих ферментные препараты. Полный комплекс мероприятий по охране труда
иа ферментных предприятиях состоит из следующих основных разделов: 1) раз-
работка и осуществление организационных и технических работ по созданию
безопасных условий труда, предотвращению взрывов и пожаров — техника бе-
зопасности и противопожарная техника; 2) обеспечение нормальных санитарно-
гигиенических условий труда — гигиена труда и промышленная санитария;
3) соблюдение правовых норм — трудовое законодательство.
Система мероприятий по охране труда. Общая система обеспечения безо-
пасных условий труда и защиты окружающей среды при производстве и про-
мышленном применении ферментных препаратов схематически показана на
стр. 324.
Система представляет собой совокупность определенных мероприятий, ко-
торые объединены единой задачей — обеспечить безопасность работающих и
принять надлежащие меры по охране окружающей среды. Ослабление любого
звена в этой системе делает ее всю малоэффективной и разбалансированной.
Далее будут рассмотрены только основополагающие вопросы, которые надо
знать инженеру-технологу при организации службы по технике безопасности
прн работе с ферментными препаратами.
Основы безопасности на предприятиях, выпускающих ферментные препа-
раты. Инженерные мероприятия являются наиболее важными. Они призваны
максимально предотвратить выход и вынос ферментных препаратов в помеще-
ния и за пределы предприятия, т. е. исключить контакт с ними человека.
Известно также, что в производстве помимо самих ферментных препаратов ис-
пользуется ряд веществ, обладающих токсическими свойствами. Попадая в ор-
ганизм человека, такие вещества могут вызвать отравления и даже профес-
сиональные заболевания.
Степень воздействия различных веществ на организм зависит от диспер-
сности раздражителя, его концентрации, продолжительности воздействия и
путей проникновения в организм. Основными путями проникновения токсических
веществ в организм являются органы дыхания (при загрязнении воздуха про-
изводственных помещений микроорганизмами — продуцентами, парами, пылью
ядовитых веществ и аллергентов), пищеварительный тракт (при приеме пищи
в цехе, недостаточно тщательном мытье рук перед едой), а также кожа (при
загрязнении ее токсическими веществами и спорами продуцента). На предприя-
тиях, выпускающих ферментные препараты, при использовании поверхностного
способа культивирования продуцентов определенную опасность для окружаю-
щих представляет воздух заводских помещений, если он загрязнен органической
пылью, содержащей отдельные компоненты питательных сред (мелкие частицы
отрубей, ростков, опилок и др.), полупродукты производства (культура про-
дуцента), готовую продукцию (мельчайшие частицы порошкообразных препа-
32.3
Мероприятия, обеспечивающие . безопасность
труда и защиту окружающей среды
ратов) и, главное, споры и конидии микроорганизмов — продуцентов ферментов.
Наиболее тяжелые условия для работающих в цехе храиеиия и транспор-
тирования сыпучих компонентов сред, приготовления питательных смесей и в
цехах, связанных с приготовлением спорового посевного материала, транспор-
тированием и дроблением готовой культуры, а также в производственных по-
мещениях, где проводятся измельчение высушенных осадков ферментов и на-
полнителей, их смешивание и фасование готовых препаратов. При отсутствии
на предприятии специальных герметизирующих устройств в местах пыления и
при нарушении нормальной работы приточно-вытяжной вентиляции во всех
помещениях содержание органической пыли повышается до 80—125 мг/м3, что
отрицательно действует иа здоровье работающих и может привести даже при
более низких концентрациях органической пыли в воздухе к воспламенению и
взрыву.
Наибольшая опасность для персонала при поверхностном способе культи-
вирования микроорганизмов — это непосредственный контакт с культурой про-
дуцента. Должна быть точная гарантия в том, что данный микроорганизм не-
патогеиен и что он тщательно обследован перед передачей на производство.
При работе с микроорганизмами используются индивидуальные средства за-
щиты, не допускается вход в растильиую камеру во время роста культуры,
особенно иа стадии спорообразования и подсушивания культуры. Отбор проб
культуры должен проводиться пробоотборниками, исключающими возможность
попадания культуры иа кожу работающего. Нарушение правил работы, отсут-
ствие аспирационных и герметизирующих устройств могут способствовать уве-
личению запыленности воздуха, а при работе с готовой культурой — повышению
концентрации спор микроскопических грибов в воздухе до 104—105 на 1 м3,
что может повлечь за собой заболевание работающих. Наиболее часто отме-
чаются поражения кожи и слизистых — контактный аллергический дерматит.
Часто при прекращении контакта с аллергеитом явления дерматита исчезают,
но у некоторых лиц наблюдается явление сенсибилизации и при возобновле-
нии работы вновь появляются признаки дерматита.
Основными мерами профилактики в производстве ферментных препаратов
являются: максимальная герметизация оборудования и механизация процессов;
применение индивидуальных средств защиты (комбинезоны, шлемы-капюшоны,
халаты, перчатки, косынки, респираторы); ежедневный теплый душ после ра-
боты, обеспыливание, стерилизация рабочей одежды; мытье рук и полоскание
рта перед приемом пищи; ежегодные медицинские осмотры; прием во время
работы молочного колибактерииа или молока. К работе иа предприятиях фер-
ментной промышленности нельзя допускать лиц с заболеваниями почек, печени,
желудочно-кишечного тракта, легких, а также склонных к кожным болезням.
Уменьшение запыленности заводских помещений достигается путем герме-
тизации оборудования. Если это невозможно по местным условиям, то уста-
навливают устройства с индивидуальной аспирацией данного узла. Операции,
связанные с пылевыделеиием, необходимо изолировать от других помещений,
по возможности механизировать и автоматизировать.
При глубинном культивировании продуцентов ферментов опасность пора-
жения работающих спорами продуцента уменьшается, сокращается число тех-
нологических участков, являющихся источником пыли. Тщательного контроля
в производствах с этим видом культивирования требуют цех приготовления
питательных сред, операции по транспортированию и хранению сыпучих ком-
понентов среды, а также цех получения и измельчения ферментных препаратов.
Особенно большое внимание уделяется иа предприятиях, выпускающих фер-
ментные препараты и другие продукты микробного синтеза, вопросам очистки
воздуха, используемого для аэрирования растущей культуры перед его выбро-
сом в атмосферу. Повышенная обсемеиениость отходящего воздуха может
вызвать накопление в атмосфере, прилежащей к заводу, микроорганизмов—про-
дуцентов, что недопустимо. Поэтому весь отходящий воздух должен тщательно
очищаться и контролироваться иа количество микроорганизмов и их видовой
состав. Удаляемый из помещений воздух, загрязненный микроорганизмами, очи-
щают на масляных и обеспложивающих фильтрах типа ФТО-ЮОО или ФТО-750.
Если воздух просто запылен, его очищают иа обычных масляных фильтрах, ци-
клонах и рукавных фильтрах.
325
Нормальные условия для работающих на предприятиях ферментной про-
мышленности поддерживаются с помощью приточно-вытяжной вентиляции,
обеспечивающей 4—8-кратный воздухообмен в вентилируемом помещении. Воз-
дух, подаваемый в рабочие помещения, за исключением специальных помеще-
ний (с растительными камерами для поверхностного культивирования), должен
иметь относительную влажность около 60—65% и температуру 18—20 °C. Он
должен быть полностью очищен от пылн, а для некоторых цехов — и от мик-
роорганизмов. Прн использовании мокрой уборки полов рекомендуется для
обеспечения нормальных условий делать полы с небольшим уклоном н снабжать
нх трапами, позволяющими быстро удалять воду с поверхности пола. Стены н
полы предприятий ферментной промышленности выполняются из керамической
облицовочной плитки для улучшения санитарных условий. Прн размещении
оборудования и коммуникаций учитывается необходимость удаления пылн с
выступающих частей оборудования и особенно с вентиляционных коробов. По-
толок, верхнюю часть стен н оборудование следует чаще красить для поддер-
жания соответствующих гигиенических условий.
В случае работы с микроскопическими грнбамн и прн повышенной влаж-
ности воздуха наблюдается рост микроорганизмов на стенах н в малодоступ-
ных запыленных местах, что создает антисанитарные условия труда. В таких
случаях рекомендуется их красить фунгицидными красками. Фунгицидные
краски могут быть пяти типов: 1) на основе хлорированного каучука. Они
устойчивы к высокой относительной влажности воздуха, но очень трудно на-
носятся на поверхность; 2) с высоким содержанием галондозамещенного фе-
нола (например, пентахлорфенола); 3) содержащие органические соединения
меди (например, медь-8-хннолат нлн нафтенат медн); 4) содержащие ртуть-
илн оловоорганические соединения (например, фенилмеркуриолеат, дифенилртуть
н др.); 5) с высоким содержанием цинка.
На предприятии должен осуществляться строгий и постоянный контроль
за наличием в воздухе токсических газов н паров. Некоторые вещества легко
обнаруживаются по запаху даже в концентрациях, меньших установленных
нормами (хлороформ, этиловый эфир, ацетальдегид, аммиак, бром, метанол) —
от 0,3 до 600 мг в 1 м3 воздуха в зависимости от соединения. Другие ве-
щества могут содержаться в воздухе в значительно больших количествах, чем
допускается по нормам, но не будут замечены работающими. Это более опасно,
так как может привести к отравлению. ,
Существуют специальные нормы предельно допустимых концентраций
(ПДК) в воздухе помещений ряда химических веществ.
В ряде помещений предприятий ферментной промышленности могут созда-
ваться неблагоприятные климатические условия в результате несоблюдения оп-
тимальной температуры, влажности, скорости движения воздуха, повышенного
излучения тепла оборудованием. Эти факторы ухудшают самочувствие и ра-
ботоспособность персонала, повышаются утомляемость н потоотделение, кото-
рое может увеличиться по сравнению с нормой в 8—10 раз и достичь 350—
400 г/ч теряется тканевая жидкость, н наступает состояние чрезмерной уста-
лости и слабости. Нормальные климатические условия в помещениях должны
устанавливаться с помощью приточно-вытяжной вентиляции, а также путем
максимальной автоматизации и механизации процессов н управления нми из
специальных помещений с кондиционированным режимом. Все аппараты, из-
лучающие тепло нлн холод, должны покрываться надежным изоляционным
покрытием. Если избежать неблагоприятных климатических условий невозмож-
но, то для поддержания нормального водно-солевого баланса организма необ-
ходимо обеспечить работающих подсоленной газированной водой (3—5 г соли
на 1 л).
Цехи, связанные с использованием растворителей и других химических
веществ, должны тщательно вентилироваться, а воздух этих помещений — кон-
тролироваться на присутствие токсических газов и паров. Повышенное содер-
жание химических веществ в воздухе производственных помещений часто свя-
зано с неисправностью трубопроводов, с неправильной установкой и эксплуата-
цией кранов и вентилей, а также с нарушениями герметизации фланцевых
соединений разъемных аппаратов, например в результате разбухания н износа
прокладочных материалов. Такие явления крайне опасны, так как они могут
326
привести не только к ухудшению условии работы, но и к аварии, поэтому не-
обходимо регулярно н тщательно проверять аппараты, вентили и соединения
на герметичность.
Промышленное производство любых продуктов, в том числе и ферментных
препаратов, организуется на основании технологического регламента, где обя-
зательной частью является раздел «Основные правила безопасности ведения
процесса». На заводе для каждого аппарата н узла технологической схемы
разрабатываются инструкции по технике безопасности, которые вывешиваются
на видном месте.
Безопасность условий труда во многом зависит от своевременного проведе-
ния планово-предупредительного ремонта (ППР), внутреннего н наружного
осмотра оборудования по определенному графику в период работы завода
между капитальными ремонтами. Перенесение сроков текущего ремонта, уста-
новленных месячным графиком ППР, запрещено, изменение сроков более 2 сут
допускается только с разрешения главного инженера н оформляется актом.
Взрыво- и пожаробезопасность. Производство ферментных препаратов часто
связано с использованием легковоспламеняющихся веществ н поэтому относится
к категории взрыво- и пожароопасных производств. Источниками взрыва н
пожара на предприятиях ферментной промышленности могут быть различные
органические растворители в цехах выделения ферментных препаратов и на
участке регенерации растворителей. Взрывоопасны также цехи с высокой за-
пыленностью, особенно, где есть места скопления мельчайшей пылн ферментных
препаратов, где используется пневмотранспорт, установлены распылительные
сушилки, складские помещения и т. д. Степень пожарной опасности опреде-
ляется свойствами жидкостей: пределом взрываемости (воспламенения) паров
в воздухе; температурой самовоспламенения паров жидкости в воздухе; склон-
ностью данной жидкости к самовозгоранию в определенных условиях и к
электролизации. Категории пожароопасности помещений определяются в соот-
ветствии со строительными нормами н правилами (СНнП).
Особую пожарную опасность представляют цех получения очищенных фер-
ментных препаратов с помощью органических растворителей н цех по регене-
рации органических растворителей. Эти цехи должны быть изолированы от
смежных невзрывоопасных помещений глухими (брандмауерными) стенами, со-
общение между ними допускается только по специальным переходам. Они
должны иметь специальный пожарный выход, а прн высоте помещения больше
10 м — наружную металлическую пожарную лестницу с уклоном не более
45° и шириной не менее 0,7 м. Взрывоопасные помещения должны покрываться
только легко сбрасываемыми при взрывной волне кровельными перекрытиями.
Все электродвигатели, пусковые устройства которых могут нскрнть, долж-
ны быть герметизированы н изготовлены во взрывобезопасном исполнении.
Электрооборудование должно удовлетворять требованиям, изложенным в Пра-
вилах устройства электроустановок (ПУЭ).
Емкости для хранения растворителей устанавливают на значительном рас-
стоянии от производственного здания по основному направлению ветра для
данной местности. Безопасность хранения легковоспламеняющихся и горючих
жидкостей обеспечивается путем установления в резервуарах и цистернах вы-
хлопного клапана и огнепреграднтеля.
Трубопроводные линнн для легколетучих и взрывоопасных жидкостей ок-
рашивают в коричневый цвет и удаляют от других коммуникаций.
От прямых ударов молний предусматривается оборудование громозащнты.
Для защиты от проявления статического электричества всю аппаратуру, ме-
таллоконструкции, трубопроводы и емкости с органическими растворителями,
воздуховоды и резервуары заземляют.
Все оборудование, имеющее открытые вращающиеся или движущиеся эле-
менты, закрывают защитными коробами нлн сетками.
Оборудование и установки, издающие шумы, должны по возможности гер-
метизироваться и устанавливаться на амортизационных подушках нлн в спе-
циальных помещениях.
Оборудование н устройство бытовых помещений (кроме туалетных, кури-
тельных комнат н помещений для кормления грудных детей) осуществляются
в зависимости от санитарной характеристики производственных процессов.
327
Производственные стоки. Спуск ливневых и производственных сточных вод
в канализационную сеть может проводиться только в соответствии с санитар-
ными нормами промышленных предприятий («Санитарные нормы проектирова-
иия> СНиП II—32—74), которые в СССР регламентируются Правилами охраны
поверхностных вод от загрязнения их сточными водами. Спуск воды из произ-
водственных корпусов должен осуществляться по трем отдельным канализа-
ционным устройствам: для отработанных чистых производственных вод (кон-
денсатор, холодильники и т. п.); для загрязненных промышленных стоков; для
фекально-хозяйственных вод. Условно чистые производственные воды должны
быть предельно регенерированы с целью их повторного использования в про-
изводстве, и только в исключительных случаях допускается сбрасывание этих
вод в канализацию. Производственные сточные воды, содержащие кислоты или
щелочи, должны нейтрализоваться, после чего разрешается спуск «х в завод-
скую сеть фекально-хозяйственной канализации. Спуск фекальио-хозяйствениых
и загрязненных производственных сточных вод в поглощающие колодцы и бу-
ровые скважины запрещен.
Производственные сточные воды перед сбросом нз цеха в наружную кана-
лизацию необходимо подвергать первичной очистке с целью извлечения, реге-
нерации и утилизации ценных продуктов, максимального снижения концентра-
ции органических веществ и минеральных солей. Следует проводить извлече-
ние пожаро- и взрывоопасных газов, масел, смол, токсических веществ, которые
не могут быть удалены при последующей биологической очистке сточных вод.
Сточные воды предприятий ферментной промышленности должны иметь
следующие характеристики (в мг/л): химическая потребность в кислороде
(ХПК)—не более 600; биохимическая потребность в кислороде (БПКполн) —
ие более 410; общий азот—150; аммоиийиый азот — 30; азот нитратов — 33;
фосфор — 1,3; крупнодисперсиые вещества—500; мутность незначительная;
pH 7,0. Инфицированная культуральная жидкость перед спуском в канализа-
цию должна быть простерилизована или прокипячена в течение 1 ч.
Биомасса продуцента при глубинном культивировании, если ее концентра-
ция в сточных водах ие превышает допустимой нормы по мутности н взвеси,
может быть после стерилизации также присоединена к промышленным канали-
зационным стокам.
При ферментных заводах, где отсутствует общегородская канализация и
сброс сточных вод осуществляется непосредственно в водоемы, предусматри-
вается строительство очистных сооружений для промышленных и хозяйствен-
ных стоков. Условия, место сброса сточных вод, метод и степень очистки их
подлежат согласованию с Государственной санитарной инспекцией и Государ-
ственной инспекцией по охране рыбных запасов.
ИиструктИж работающих. Повышенная взрыво- и пожароопасность фер-
ментных предприятий, разнообразие используемых аппаратов и устройств,
опасность, которую представляют продуценты ферментов, вызывают необхо-
димость тщательного изучения и освоения правил техники безопасности и про-
мышленной санитарии. Занятия, инструктаж и проверку полученных знаний
и навыков следует проводить ие реже 1 раза в квартал. Каждый вновь посту-
пающий на работу проходит обязательный инструктаж. Изучение правил тех-
ники безопасности и правил промышленной санитарии обязательно для каждого
студента.
Инструкции по технике безопасности и правила санитарии разрабатываются
для каждого рабочего места, выдаются иа руки исполнителям и вывешиваются
иа видных местах. Инженерный персонал завода должен внимательнейшим об-
разом следить и неукоснительно исполнять сам все правила техники безопас-
ности и промышленной санитарии. Ответственность за соблюдение правил
охраны труда несут руководители подразделений, а в целом по предприятию —
директор и главный инженер.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Б и от е х н о л о г и я./Под ред. А. А. Баева.— М.: Наука, 1984.— 309 с.
Безбородов А. М. Биохимические основы микробиологического синте-
за.— М.: Легкая и пищевая промышленность, 1984.— 304 с.
Безбородов А. М., Астапович Н. И. Секреция ферментов у микро-
организмов.— М.: Наука, 1984.— 70 с.
Б и л а й В. И., Б и л а й Т. И., М у с и ч Е. Г. Трансформация целлюлозы
грибами.— Киев: Наукова думка, 1982.— 295 с.
Бнокагализ: история моделирования опыта живой природы./Под ред.
И. В. Березина и В. И. Кузнецова.— М.: Наука, 1984.— 344 с.
Бравова Г. Б., Самойлова М. В. Мацерирующие ферменты. Получе-
ние и применение в народном хозяйстве.— М.: ОНТИТЭИмикробиопром, 1981.—
44 с.
Бирюков В. В., Кантере В. М. Оптимизация периодических процессов
микробиологического синтеза.— М.: Наука, 1985.— 292 с.
Бортников И. И., Босеико А. М. Машины и аппараты микробиоло-
гических производств.— Минск; Вышейшая школа, 1982.— 288 с.
Буренин В. А. Основы промышленного строительства и санитарной тех-
ники. Часть I. Основы промышленного строительства.— М.: Высшая школа,
1984,—216 с.
Введение в прикладную энзимологию. Иммобилизованные ферменты./
Под ред. И. В. Березина и К. Мартииека.— М.: МГУ, 1982.— 383 с.
Виестур У. Э., Кристапсоис М. Ж., Былиикииа Е. С. Культи-
вирование микроорганизмов.— М.: Пищевая промышленность, 19Й).— 232 с.
Г а п о и о в К. П. Процессы и аппараты микробиологических производств.—
М.: Легкая и пищевая промышленность, 1981.— 240 с.
Гребешова Р. Н. Использование ферментных препаратов в СССР.—
М.: ОНТИТЭИмикробиопром, 1982.— 41 с.
Диксон М., Уэбб Э. Фермеиты./Пер. с аигл. Л. М. Гинодмана и
М. И. Левяит/под ред. В. К. Антонова и А. Е. Брауиштейна.— М.: Мир, 1982.—
В 3-х томах, 1118 с.
Калуияиц К. А., Голгер jf. И. Микробные ферментные препараты —
М.: Пищевая промышленность, 1979.— 304 с.
Калуияиц К- А., Голгер Л. И., Балашов В. Е. Оборудование
микробиологических производств,— М.: Агропромиздат, 1987.—398 с.
Карпов А. М., Саруханов А. В. Теплофизические и физико-химические
характеристики продуктов микробиологического синтеза: Справочник.— М.:
Агропромиздат, 1987.— 224 с.
Квеситадзе Г. И. Грибные и бактериальные амилазы.— Тбилиси: Мец-
ииереба, 1984.— 154 с.
Коломейцев О. П., Булыгин А. Н. Методы микрокапсулирования
микробиологических препаратов.— М.: ОНТИТЭИмикробиопром, 1978.— 60 с.
Кретович В. Л. Введение в энзимологию.— М.: Наука, 1986.— 323 с.
Лабораторный практикум по технологии ферментных препаратов/
И. М. Грачева, Ю4 П. Грачев, М. С. Мосичев и др.— М.: Легкая и пищевая про-
мышленность, 1982.— 240 с.
Ленииджер А. Основы биохимии./Пер. с аигл. В. Г. Горбулева,
Н. Д. Гроздовой, С. Н. Преображеиского/под ред. В. А. Энгельгард, Я. М. Вар-
шавского. В 3-х томах, 1051 с.
Ливчак И. Ф„ Иванова Н. В. Основы промышленного строительства
329
н санитарной техники. Часть П. Основы санитарной техники.— М.: Высшая
школа, 1984.— 184 с.
Матвеев В. Е. Научные основы микробиологической технологии — М.:
Агропромиздат, 1985.— 224 с.
Микробные ферменты и бнотехиология./Под ред. В. М. Фогарти./пер. с
аигл. под ред. И. М. Грачевой — М.: Агропромиздат, 1986.— 320 с.
Муроиец В. И., Наградова Н. К. Иммобилизованные олигомерные
ферменты.— М.: Наука, 1984,— 208 с.
Перт С. Дж. Основы культивирования микроорганизмов и клеток./Пер. с
аигл. Т. А. Петровой и И. Н. Позмотовой/Под ред. И. Л. Работиовой.— М.:
Мир, 1978,—332 с.
Правила безопасности для производств микробиологической промышлен-
ности.— М.: Недра, 1976.— 48 с. (Госгортехнадзор СССР).
Рухлядева А. П., Полыгалииа Г. В. Методы определения актив-
ности гидролитических ферментов.— М.: Легкая и пищевая промышленность,
1981.—288 с.
Салманова Л. С. Цитолитические ферменты в пищевой промышлен-
ности.— М.: Легкая и пищевая промышленность, 1982.— 207 с.
Самарцев М. А., Беляков Н. В., Кестнер А. И. Применение им-
мобилизованных ферментов в промышленных процессах.— М.: ОНТИТЭИмикро-
биопром, 1984.— 60 с.
С к о у п с Р. Методы очистки белков./Пер. с аигл. В. К. Антонова.— М.:
Мир, 1985.— 358 с.
Теплы М., Машек Я., Гавлова Я. Молокосвертывающие ферменты
животного н микробного происхождеиия./Пер. с чешек. И. В. Холодовой/под
ред. Т. В. Долгих.— М.: Легкая и пищевая промышленность, 1980.— 272 с.
Туркова А. Аффинная хроматография.— Пер. с аигл. Л. В. Козлова.—
М.: Мир, 1980.— 472 с.
Федосеев К. Г. Физические основы и аппаратура микробного Синтеза
биологических активных соединений.— М.: Медицина, 1977.— 304 с.
Ферментация и технология фермеитов/Д. Уоиг, Ч. Кооией, А. Демайи
и др./Пер. с аигл. В. М. Вадимова/под. ред. К. А. Калуияица.— М.: Легкая и
пищевая промышленность, 1983.— 336 с.
Фридрих П. Ферменты: четвертичная структура и надмолекулярные
комплексы/Пер. с аигл. Д. О. Левицкого и Л. Г. Николаева/под ред. С. Е. Се-
верина и Н. Б. Гусева.— М.: Мир, 1986.— 374 с.
Я ровен ко В. В. Концентрирование ферментных растворов методом
ультрафильтрации.— М.: ОНТИТЭИмикробиопром, 1978.— 36 с.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Активность ферментных препаратов
— стандартная 11
— условная 12
Биошрот 91
Вакуум-высушивание препаратов 143
Вакуум-выпаривание 95
Вещества токсические 37, 272, 260,
274
— балластные 10, 122, 250, 268, 271
Выращивание микроорганизмов в
механизированных установках 68
---кюветным способом 67
Высаливание ферментов 116, 118
Гель-фильтрацня 129, 271
Гранулирование ферментных препара-
тов 149
Гемотоксии 0-тнпа 260
Денатурация термическая 121
— избирательная прн различных pH
121
— органическими растворителями 122
Диализ 98, 269
Днафильтрацня 107
Длительность культивирования 63
Изоэлектрическая точка 263, 265
Инактивация ферментов тепловая
92, 96
Иммобилизация клеток 142
— ферментов 130, 300, 311
Иммуиоадсорбцня 127
Ингибиторы ферментов 37
Индукторы синтеза ферментов 28
Источники азота питательных сред
23, 25, 31, 170, 187, 206, 210, 226,
238, 307, 321
— витаминов, ростовых веществ 35,
188
— минеральных веществ 210, 227,
308
— углерода 22, 24, 30, 170, 185
— фосфора 34, 188, 321
Источники получения ферментов жи-
вотные 9, 157, 233, 245, 247, 268
-------микробиологические 10, 157,
179, 198, 216, 233, 245, 257, 271,
275, 289, 302, 313
-------растительные 9, 157, 233, 247
Классификация ферментов 10, 219,
246
Коагуляция казенна 265
Концентрирование ферментов 95
Коэффициент проницаемости 105
— распределения 124
Кристаллизация 269, 281
Критерий стерилизации 40
Культивирование анаэробное 193
— аэробное 60
— глубинное 73, 82
— поверхностное 24, 67, 81
Липолиз 234
Мембраны для ультрафильтрации 102,'
104
Методы иммобилизации адсорбцион-
ные 137
---механические 138
---химические 141
Механизм синтеза нндуцнбельный 28,
30
---конститутивный 194
Микрокапсулирование 139, 147
Микрофильтрация 100
Носители для иммобилизации фер-
ментов 131, 133, 135
Обвязка ферментаторов 75
Обеспыливание воздуха 52
Органические растворители — осади-
тели ферментов 112
Осаждение ферментов полиэтнлен-
гликолем 120
331
Осмос обратный 100
Очистка воздуха 52, 53, 57
— ферментных препаратон 122, 128,
176, 231
Пеногашение 27, 77
Поверхностно-активные вещества
(ПАВ) 210, 211, 239
Подготовка воздуха для аэрации по-
мещений 58
Показатель асептической эффектив-
ности 41
Поляризация концеитрациоииая при
ультрафильтрации 106, ПО
Посевной материал для глубинного
культивирования 19
---- для поверхностного культиви-
рования 15
----споровый (коиидиальный) 184
Приготовление питательных сред 37
Регуляция синтеза ферментов 250
Сепарирование, сепараторы 90
Состав среды оптимизированный 23,
193, 222, 252, 254, 270, 283
Среды питательные 24—27, 35, 38,
250, 270, 273, 308
— для глубинного культивирования
22, 28
— для поверхностного культивирова-
ния 23, 29
Скорость гибели микроорганизмов
39
Стабилизация ферментных растворов
145, 175
Стандартизация ферментных пре-
паратов 150 .
Стерилизация аппаратуры и комму-
никаций 47
• — воздуха 48, 53
— жидких сред 45
— сыпучих сред 43
— термическая 39
Субстраты для действия ферментов
белки 245, 249, 258
D-галактоза 303
гемицеллюлозы 217
гликоген 157
D-глюкоза 275, 289
Р-глюкаиы 218
гумми-вещества 218
а-, Р-, у, х-казеииы 262
крахмал 157
липиды 234
микрофибряллы целлюлозы 198
модифицированная целлюлоза
199
пектиновые вещества 179
перекись водорода 275
Сушка препаратов 143, 144
Сшивающие агенты 137
332
Твины 211
Температура культивирования 95
Ультрафильтрация 102, 271
Ультрафильтрационные установки
107
Фазы роста поверхностной культуры
60—62 е
Ферментаторы 74—76
Ферменты
амилаза 168
а-амилазы 159
Р-амилазы 158
Р-галактозидаза 302, 304
галактуроназа 181
гемицеллюлаза 217
Р-глюкаиазы 216, 219
глюкоамилазы 162
глюкозидазы 166, 218
Р-глюкозидазы (целлобиазы)
199, 202
глюкозоизомеразы 287
глюкозооксидаза 275, 286
глюкозофосфатизомеразы 289
изоамилазы 165
инвертазы 314
каталазы 274, 281
кератииазы 258
ксилозоизомеразы 289
Р-ксилаиазы 218, 220
комплекс целлюлаз 200
С|-фактор 199, 209
Сх-фермеиты 199, 209
ламинарииаза 219
липазы 236 >
лихеиазы 219
маинозоизомеразы 289
мацерирующие 179
мякрозим 273
молокосвертывающне ферменты
261, 268
пектиназы 179
пектинтраисэлимииазы 182
пектииэстеразы 180
пепсин 264
пептидазы 246
плазмин 259
полигалактуроназы 181
протеазы кислые 260
протеиназы 247
протопектииазы 183
прореннин 265
пуллулаиазы 165
рениии микробный 265
рениилазы 273
сычужный реннин 264
триацилглнцероллипазы 234
Р-фруктофураиозидазы 313
целлобиазы 202
целлобяогидролазы 201, 202
целлюлазы 198
циклодекстринглюкаиотраисфера-
зы (ЦДГТ) 168
фромаза 273
химозин 261, 264
экзоглюканазы 201
эндоглюканазы 218
Фильтрование 87, 100
Фильтры для очистки воздуха 56
Фильтрующие материалы 52, 56
Хранение исходных штаммои 13
Хроматография аффиннаи 125, 213,
299
— ионообменная 123, 298
— на окрашенных адсорбентах 127
Центрифугирование 89
Экстракция, экстракторы 91
Электродиализ 98
Элюции 124
ОГЛАВЛЕНИЕ
Предисловие........................................................ 3
Введение.......................................•..................... 5
Глава 1. Основные технологические этапы производства микробных
ферментных препаратов...........................................13
1.1. Получение посевного материала . •.....................13
1.2. Получение производственных культур........................21
1.3. Стерилизация питательных сред и аппаратуры .... 39
1.3.1. Теоретические основы стерилизации ..... 39
1.3.2. Стерилизация сыпучих питательных сред .... 43
1.3.3. Стерилизация жидких питательных сред ... 45
1.3.4. Стерилизация аппаратуры и коммуникаций ... 47
1.4. Очистка и стерилизация воздуха............................48
1.5. Производствеииое культивирование микроорганизмов . . 53
1.5.1. Факторы, влияющие на биосинтез ферментов в про-
цессе культивирования ..................................... 59
1.5.2. Поверхностное культивирование микроорганизмов 67
1.5.3. Глубинное культивирование микроорганизмов . . 73
1.5.4. Технологические схемы получения................культур.........микро-
организмов . . . -78
1.6. Получение ферментных препаратов из культур микроорга-
низмов . .................................83
1.6.1. Принципиальная схема получения ферментных пре-
паратов . . .................... . . 85
1.6.2. Получение неочищенных ферментных препаратов 86
1.7. Экстрагирование ферментов из поверхностных культур . . 91
1.8. Концентрирование ферментных растворов методом вакуум-
выпаривания ....................................................95
1.9. Мембранные методы очистки ферментных растворов . , 98
1.9.1. Диализ и электродиализ............................ 98
1.9.2. Баромембраиные методы очистки ферментных растворов 100
/1.10. Осаждение ферментов........................................Ц1
1.10.1 . Осаждение ферментов органическими растворителями Ц2
1.10.2 . Осаждение ферментов высококонцентрированными рас-
творами солей (высаливание)................................116
1.10.3 . Осаждение ферментов органическими полимерами и
другими веществами....................................... 120
1.10.4 . Осаждение ферментов путем избирательной денату-
рации ....................................... • ... 121
1.11. Разделение и очистка ферментов методом адсорбции . . 122
1.12. Разделение и очистка ферментов в растворе . . . • . 128
1.13. Получение иммобилизованных ферментных препаратов . . 130
1.13.1. Носители........................ ...............131
1.13.2. Сшивающие агенты .................137
1.13.3. Способы иммобилизации ферментов.................137
1.13.4. Свойства иммобилизованных ферментов .... 142
1.14. Получение сухих ферментных препаратов.................142
1.15. Микрокапсулирование и гранулирование ферментных пре-
паратов ..................................................... 147
334
1.16. Стандартизация ферментных препаратов...................
1.17. Технологическая схема получения очищенных ферментных
препаратов . ................................
1.18. Микробиологический и биохимический контроль производства
Глава 2. Технологические особенности получения препаратов с Опре-
деленным составом ферментов.........................................
2.1. Амилолитические препараты . . . •...............
2.1.1. Источники получения амилаз........................
2.1.2. Механизм действии и свойства амилаз...............
2.1.3. Получение амилолитических препаратов ....
2.2. Пектолитические препараты ......................• . .
2.2.1. Источники пектолитических ферментов ....
2.2.2. Механизм действия и свойства пектиназ • . . .
2.2.3. Получение пектолитических препаратов ....
2.3. Целлюлолитические препараты .....................• .
2.3.1. Источники получения целлюлолитических ферментов
2.3.2. Механизм действии и свойства целлюлаз ....
2.3.3. Получение препаратов целлюлаз.....................
2.4. Гемицеллюлазиые препараты..............................
2.4.1. Источники получения гемицеллюлаз .
2.4.2. Механизм действия и свойства гемицеллюлаз
2.4.3. Получение гемицеллюлазных препаратов .
2.5. Липолитические препараты ..............................
2.5.1. Источники получения липаз.........................
2.5.2. Механизм действия и свойства липаз................
2.5.3. Получение препаратов липолитических ферментов
2.6. Протеолитические препараты . . ..................
2.6.1. Источники получения протеиназ..................
2.6.2. Механизм действия и свойства протеиназ ....
2.6.3. Получение микробных протеиназ.....................
2.7. Протеолитические препараты, обладающие способностью свер-
тывать белок молока (ренииноподобные протеиназы)
2.7.1. Механизм действия и свойства ферментов . . . .
2.7.2. Получение молокосвертывающих препаратов
2.8. Препараты, содержащие глюкозооксидазу и каталазу
2.8.1. Источники получения глюкозооксидазы и каталазы
2.8.2. Механизм действия и свойства глюкозооксидазы
2.8.3. Получение препаратов глюкозооксидазы . . . .
2.8.4. Механизм действия и свойства каталазы ....
2.8.5. Получение препаратов каталазы...................
2.8.6. Совместное получение препаратов глюкозооксидазы
и каталазы.................... ..................
2.9. Препараты глюкозоизомеразы...............................
2.9.1. Источники получения глюкозоизомеразы . . . .
2.9.2. Механизм действия и свойства глюкозоизомеразы
2.9.3. Получение препаратов глюкозоизомеразы . . . .
2.9.4. Получение иммобилизованных глюкозоизомеризующих
препаратов . . ............• . . .
2.10. Препараты р-галактозидазы..............................
2.10.1. Источники получения Р-галактозидазы .
2.10.2. Механизм действия и свойства фермента . . . .
2.10.3. Получение препаратов Р-галактозидазы . . . .
2.11. Препараты Р-фруктофураиозидазы
2.11.1. Источники получения Р-фруктофуранозидазы
2.11.2. Механизм действия и свойства фермента . . . •
2.11.3. Получение препаратов, обладающих инвертазной
активностью ...........................
Глава 3. Охрана труда и техника безопасности на предприятиях, выпу-
скающих ферментные препараты .......................................
Список рекомендуемой литературы ...................................
Предметный указатель . . . . . .
150
151
154
156
156
157
157
169
178
179
179
183
197
198
198
203
216
216
217
221
233
233
234
238
244
245
245
249
261
262
268
274
275
275
279
281
283
286
287
289
289
294
300
302
302
303
306
313
313
314
317
323
329
331
335