Автор: Батыгина Т.Б.
Теги: эмбриология растений общее растениеводство иллюстрации эмбриологические признаки характеристики репродукция цветковых растений
ISBN: 5-9212-0027
Год: 2000
Текст
n
i ,1
ft - N
1 '
- ■?
ТЕ'
-**• ' ГТ"--'^
A*;f-^
^<^?5t,
ЭМБРИОЛОГИЯ ЦВЕТКОВЫХ РАСТЕНИИ
ТЕРМИНОЛОГИЯ И КОНЦЕПЦИИ
В 3-х томах
СИСТЕМЫ РЕПРОДУКЦИИ
Том 3
ТАТЬЯНА БОРИСОВНА БАТЫГИНА
Редактор
МИР И СЕМЬЯ
САНКТ-ПЕТЕРБУРГ
2000
EMBRYOLOGY OF FLOWERING PLANTS
TERMINOLOGY AND CONCEPTS
Three volume edition
REPRODUCTIVE SYSTEMS
Volume 3
TATYANA B. BATYGINA
Editor
WORLD AND FAMILY
ST. PETERSBURG
2000
РОССИЙСКАЯ АКАДЕМИЯ НАУК
Ботанический институт им. В. Л. Комарова
ОТДЕЛ ЭМБРИОЛОГИИ
И РЕПРОДУКТИВНОЙ БИОЛОГИИ
Российский Фонд
Фундаментальных Исследований
Рецензенты
Э. С. ТЕРЕХИН, И. П. ЕРМАКОВ
Редакционная коллегия
Е. В. АНДРОНОВА, Т. Б. БАТЫГИНА (редактор),
В. Е. ВАСИЛЬЕВА, О. П. КАМЕЛИНА,
Г. Е. ТИТОВА, И. И. ШАМРОВ (секретарь)
О
RUSSIAN ACADEMY OF SCIENCES
V. L. Komarov Botanical Institute
DEPARTMENT OF EMBRYOLOGY
AND REPRODUCTIVE BIOLOGY
Russian Foundation
for Fundamental Researches
Reviewers
E. S. TERYOKHIN, I. P. ERMAKOV
Editorial board
E. V. ANDRONOVA, Т. В. BATYGINA (editor),
O. P. KAMELINA, 1.1. SHAMROV (secretary),
G. E. TITOVA, V. E. VASILYEVA
ББК 41.8
УДК 581.3
ISBN 5-9212-0027
ЭМБРИОЛОГИЯ ЦВЕТКОВЫХ РАСТЕНИЙ. ТЕРМИНОЛОГИЯ И КОНЦЕПЦИИ.
Т.З. СИСТЕМЫ РЕПРОДУКЦИИ (ред. Т. Б. Батыгина).
В третьем томе издания рассмотрены эмбриологические основы, а также молекулярно-гснетические и
популяционно-экологические аспекты репродукции цветковых растений. Излагаются новые представления о
типах и способах размножения (эмбриоидогения как особый тип размножения, вивипария и др.). Даиы
оригинальные классификации основных репродуктивных структур и процессов. На примере ряда редких и
хозяйственно-ценных видов растений описан весь спектр процессов и факторов, составляющих
репродуктивную стратегию. Специальное внимание уделено вопросам, имеющим практическую значимость (генетическая
гетерогенность семян, репродуктивный успех, семенная продуктивность, банк семян и др.). Гекст включает
авторские трактовки основных терминов и понятий, используемых в современной литературе при описании
репродуктивных структур и процессов, составляющих семенное и вегетативное размножение.
Издание носит монографический и энциклопедический, характер. 11редназначено для эмбриологов,
физиологов, генетиков, селекционеров и ботаников широкого профиля. Рассчитано иа научных работников,
аспирантов и студентов-биологов.
Книга иллюстрирована рисунками, схемами, таблицами и фотографиями (свыше 700) и включает более
4000 литературных источников.
Публикация поддержана Российским Фондом Фундаментальных исследований (№ издательского
гранта - 00-04-62013).
Авторы:
Е. В. Андронова, Г. М. Анисимова, М. В. Баранова, Р. 11. Барыкина, А. Е. Баталов, Т. Б. Батыгина, Е.
А. Брагина, В. И. Василевич, В. Е. Васильева, К. 11. Глазунова, М. А. Гусаковская, Е. И. Демьянова, Н. X.
Еиалеева, И. 11. Ермаков, Н. А. Жинкииа, А. А. Захарова, Ю. А. Злобин, О. 11. Камелина, А. С. Кашин,
П. В. Куликов, Л. П. Лобанова, Л. А. Лутова, И. В. Лянгузова, Е. А. Мазная, А. П. Меликян, О. Б. Миха-
левская, Н. М. Найда, Т. Н. Наумова, Л. В. Новоселова, А. Н. Пономарев, У. А. Рахманкулов, Г. Б.
Родионова, О. В. Смирнова, Н. П. Старшова, Э. С. Терсхин, Г. Е. Титова, О. Н. Тиходеев, В. Л. Тихонова, В. С.
Тырнов, Е. Г. Филиппов, Е. А. Ходачек, Н. Н. Цвелев, И. И. Шамров, Н. А. Шишкинская, Н. И. Шорина,
0. И. Юдакова, J. G. Carman, G. G. Franchi, H. P. Linder, E. Pacini, К. Schneitz, С. С. Wilcock.
In the third volume of the Edition, embryological bases as well as molecular-genetic aspects of reproduction in
flowering plants are considered. New ideas about types and modes of propagation (embryoidogeny as a special type of
reproduction, viviparity etc.) are staled. Original classifications of the main reproductive structures and processes arc
given. On an example of some rare and crop plant species the whole spectrum of processes and factors combined the
reproductive strategy is described. An especial attention is paid to practical aspects (genetic heterogeneity of seeds,
reproductive success, seed productivity, soil seed bank). The text includes author's interpretations of the terms and
notions used in the modern botanical literature for describing the main structural elements of seed and vegetative
propagation.
This is a monographic and encyclopedic edition intended for embryologists, taxonomists, physiologists, geneticists,
plant-breeders and botanists. The book is illustrated with drawings, schemes, tables and photographs (more than 700)
and includes more than 4000 bibliographic sources.
The book is supported by the Russian Foundation for Fundamental Researches (grant № 00-04-62013).
Authors:
E. V. Andronova, G. M. Anisimova, M. V. Baranova, R. P. Barykina, A. E. Batalov, Т. В. Batygina, E. A.
Bragina, J. G. Carman, E. I. Demyanova, N. Kh. Enaleeva, I. P. Ermakoy, G. G. Franchi, K. P. Glazunova, M. A.
Gussakovskaya, O. P. Kamelina, A. S. Kashin, E. A. Khodachek, P. V. Kulikov, H. P. Linder, L. P. Lobanova, L. A.
Lutova, I. V. Lyanguzova, E. A. Maznaya, A. P. Melikyan, O. B. Mikhalevskaya, N. M. Nayda, T. N. Naumova, L.
V. Novosyelova, E. Pacini, E. G. Philippov, A. N. Ponomarev, U. A. Rakhmanculov, G. B. Rodionova, K. Schneitz, 1.
1. Shamrov, N. A. Shishkinskaya, N. I. Shorina, O. V. Smimova, N. P. Starshova, E. S. Teryokhin, O. N. Tikhodeev,
V. L. Tikhonova, G. E. Titova, V. S. Tyrnov, N. N. Tzvelev, V. I. Vasilevich, V. E. Vasilyeva, С. С. Wilcock, О. I.
Yudakova, A. A. Zakharova, N. A. Zhinkina, Yu. A. Zlobin.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ 13
БЛАГОДАРНОСТИ 19
ЧАСТЬ I — РЕПРОДУКЦИЯ РАСТЕНИЙ
ОБЩЕЕ ПРЕДСТАВЛЕНИЕ
Репродуктивная биология (Э. С. Тере.хин) 21
Экологическая эмбриология (Э. С. Терехин) 24
Воспроизведение, размножение и возобновление (Т. Б. Батыгина) 35
Вивипария (Т. £. Батыгина, Е. А. Брагина) 39
Метаморфоз (Э. С. Терехин) ^
Жизненные циклы (Г. Б.Родионова) 69
ЧАСТЬ II — СИСТЕМЫ ОПЫЛЕНИЯ И СКРЕЩИВАНИЯ
СИСТЕМЫ ОПЫЛЕНИЯ
Антэкология (А. Я. Пономарев, Е. И. Демьянова) 72
Половой полиморфизм (А. П. Меликян) 73
Моноэция (£. И. Демьянова) ' 75
Гинодиэция (£. И. Демьянова) 78
Гетеростилия (Я. А. Жинкина) 82
Дихогамия (Я. А. Жинкина) 34
Популационные аспекты детерминации пола (Я. П. Старшова) 88
Способы переноса пыльцы и агенты опыления (А. П. Меликян) 93
Хазмогамия (£. И. Демьянова) 96
Клейстогамия (Е. И. Демьянова) 96
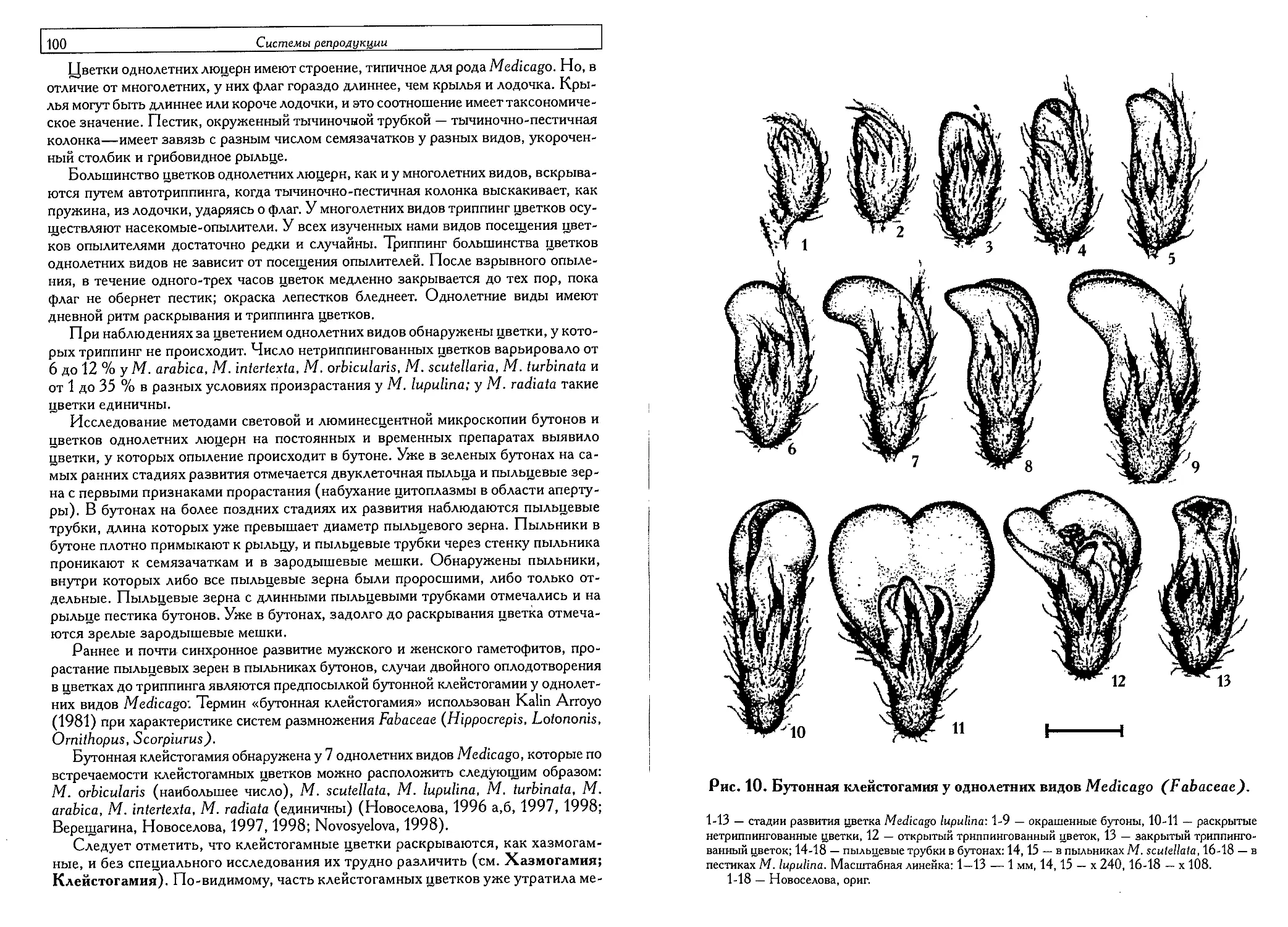
Особенности клейстогамии у однолетних видов рода Medicago L.
(Fabaceae) (Л. В. Новоселова) 99
Эволюция ветроопыления (Н. P. Linder) |Q3
и
_6
СИСТЕМЫ СКРЕЩИВАНИЯ
Автогамия (Е. И. Демьянова) И^
Аллогамия (Е. И. Демьянова): "^
о 115
Гейтоногамия llJ
11А
Ксеногамия и
Соотношение пыльцевых зереи и семязачатков при разных
системах скрещивания (И.И.Шамров) "9
Восприимчивость рыльца и семязачатка: факты и гипотезы
(E.Pacini. С. С. Franchi) , 120
Недостаток опыления в естественных популяциях: значение для сохранения
редких видов растений (С. С. Wilcock) 126
О значении гибридизации вэволюции высших растений (Н. Н. Цвелев) 137
ЧАСТЬ III — СЕМЕННОЕ РАЗМНОЖЕНИЕ
АМФИМИКСИС И АПОМИКСИС
Амфимиксис (Т. Б. Батыгина) "*■
Апомиксис(Т. Б.Батыгина)
Апоспория (Т. Н. Наумова) 1™
Диплоспория (Т. Н. Наумова) . . I-**
Партеногенез (В. С. Тырнов) ^°
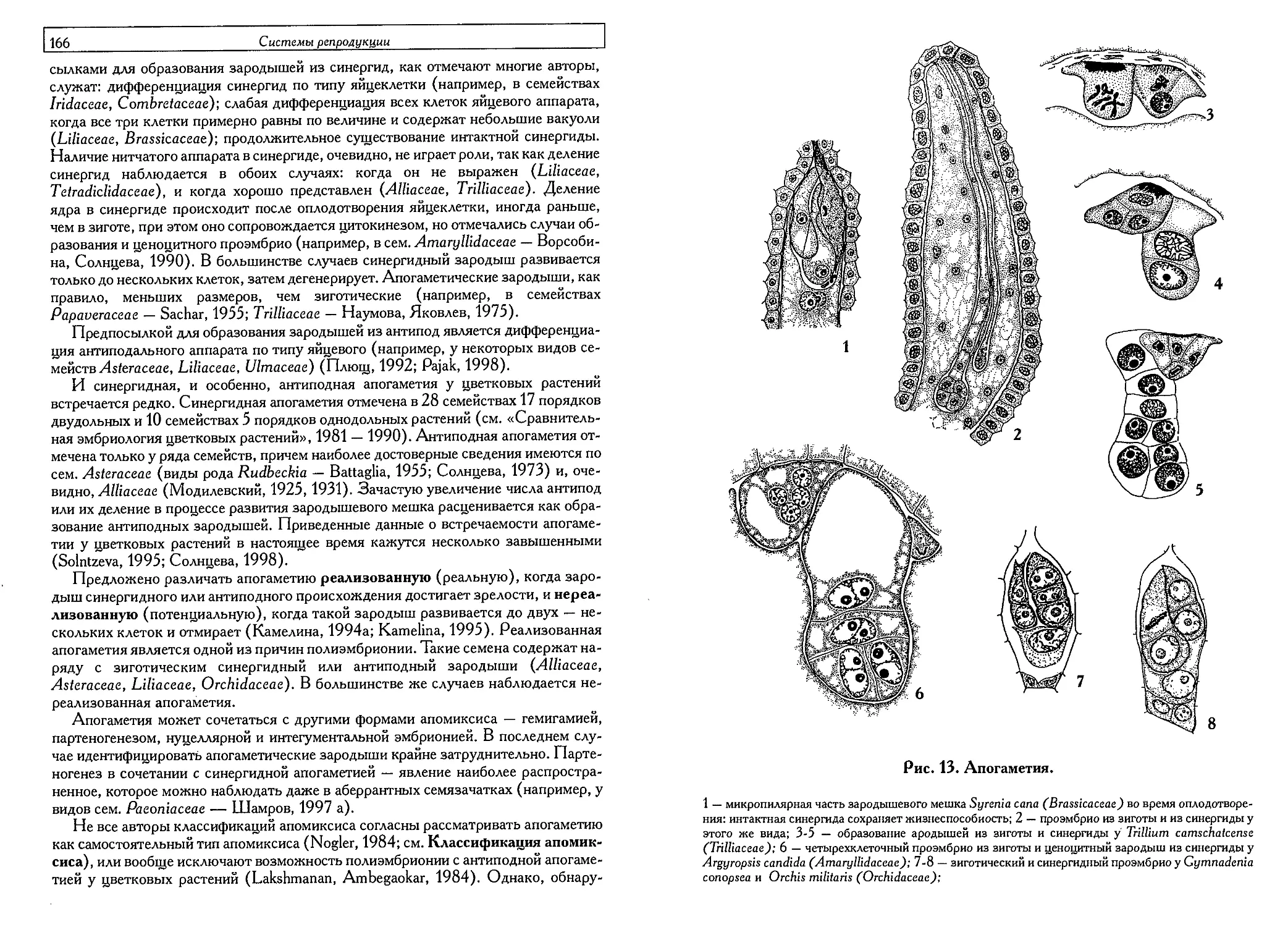
Апогаметия (О. П. Камелина) 1°->
Классификация апомиксиса (Н. А.Шишкинская, О. И. Юдакова) . ........ 169
Взаимоотношения зародыша и эндосперма при апомиксисе (В. С. Тырнов) . . . 180
Ультраструктурные аспекты апомиксиса (Т. Н. Наумова) loo
Пространственная и временная организация мегаспоро-
и мегагаметофитогенеза у амфимиктичных и апомиктичных
растений (М.А.Гусаковская, И. П. Ермаков) 192
Экспериментальная индукция апомиксиса in situ, in vivo и in vitro
(А. С. Кашин) 201
Прикладные аспекты гаметофитного апомиксиса (В. С. Тырнов) 203
Род Alchemilla L. (Rosaceae) — классический объект для изучения
факультативного апомиксиса (К. П. Глазунова) ^06
Проблема эволюционной значимости апомиксиса
(Н.А.Шишкинская,В. С.Тырнов) 214
Эволюция гаметофитного апомиксиса (}. С. Carman) ^1о
СЕМЕННОЕ РАЗМНОЖЕНИЕ
Семя и семенное размножение (Т. Б.Батыгина) /46
Репродуктивное усилие (Ю. А.Злобин) ^4/
Репродуктивный успех (Ю. А.Злобин) ^51
Потенциальная семенная продуктивность (Ю. А. Злобин) ^5о
Реальная семенная продуктивность (Ю. А. Злобин) ^oU
Семенная продуктивность видов рода Symphytum L. (Boraginaceae)
(Н.М.Найда) 262
Семенная продуктивность апомиктов (VI. С. Кашин) 266
Аберрантные семязачатки и семена: строение и диагностика (И. И. Шамров). . 272
Гетероспермия (Г. М.Анисимова) 279
Банк семян (В. А. Тихонова) 286
Плод (Э. С. Терехин) 289
Гетерокарпия (А. П. Меликян) 296
ЧАСТЬ IV — ВЕГЕТАТИВНОЕ РАЗМНОЖЕНИЕ
Вегетативное размножение (Н. И. Шорина) 299
Сарментация СР. П. Барыкина) 302
Партикуляция (Р. П. Барыкина) 306
Почка СЯ. И. Шорина, О. Б. Михалевская) 310
Выводковая почка (Т. Б. Батыгина, Е. А. Брагина) 315
Луковица (М. В. Баранова) 321
Луковичка (М. В. Баранова) 327
ПротокормС£. В. Андронова, Т. Б.Батыгина, В. Е.Васильева) 329
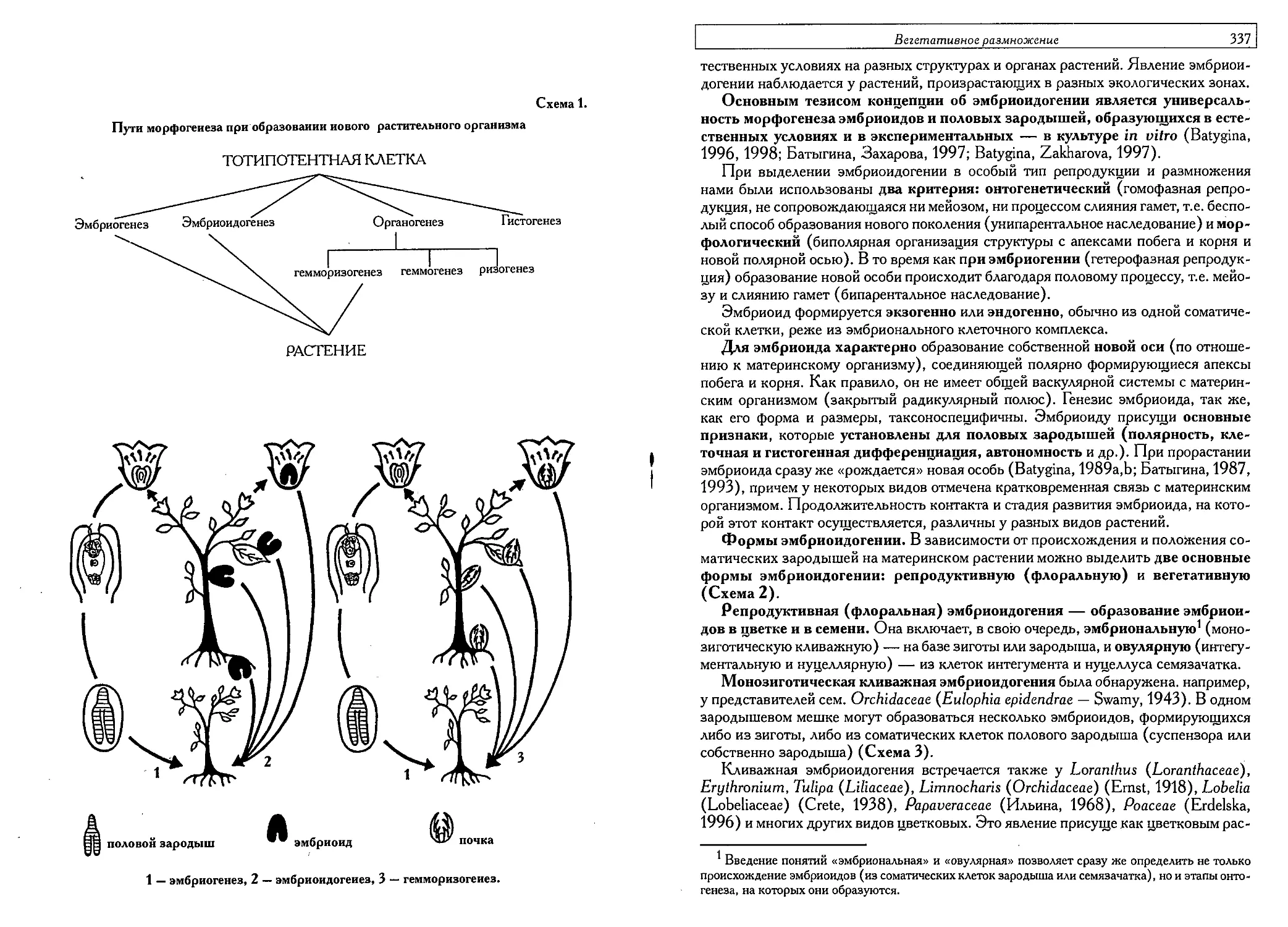
Эмбриоидогения — новый тип вегетативного размножения
(Т. Б. Батыгина) 334
Концепция фитомера и эволюция высших растений (Н. Н. Цвелев) 350
ЧАСТЬ V — МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ АСПЕКТЫ
РЕПРОДУКЦИИ
Генетика развития цветка (Л. А. Лутова) 355
Генетический анализ развития семязачатка (К. Schneitz) 370
Гаметофитные мутации СЯ. Х.Еналеева, В. С. Тырнов) 378
Модификационная изменчивость гаметофита
(Л.П.Лобанова, Н. Х.Еналеева) 384
Эмбриогеиетика растений (В. С. Тырнов) 389
Генетический контроль апомиксиса (О. Н. Тиходеев) 392
Генетическая гетерогенность семян (Т. Б. Батыгина) 397
ЧАСТЬ VI — ПОПУЛЯЦИОННЫЕ И ЭКОЛОГИЧЕСКИЕ
АСПЕКТЫ РЕПРОДУКЦИИ
Фитоценоз СВ. И. Василевич) 406
Экологическая ниша (В. И. Василевич) 409
Популяция (В. И. Василевич) 412
Жизненная форма (Н. И. Шорина) 415
Диаспора(Е. А. Брагина, Т.Б.Батыгина) 420
Популяциониое и ценотическое регулирование
репродукции (Ю. А. Злобин) 428
Популяциоиный и ценотический аспекты изучения репродукции
растений в условиях Арктики (Е. А. Ходачек) 432
Система репродукции на примере синузий трав в лиственных
лесах (О. В. Смирнова) 439
Поливариантность способов вегетативного размножения и расселения
(на примере сем. Ranunculaceae) (Р. П. Барыкина) 442
Онтогенез видов рода Ferula L. (Apiaceae) (У. А. Рахманкулов) 446
ЧАСТЬ VII — ЭМБРИОЛОГИЧЕСКИЕ ОСНОВЫ
РЕПРОДУКТИВНЫХ СТРАТЕГИЙ
Адаптивные возможности и репродуктивная стратегия водноореховых
(Тгарасеае) (Г.Е.Титова,А.А.Захарова) 451
Репродуктивная стратегия роголистниковых (Ceratophyllaceae)
(И. И. Шамров) 469
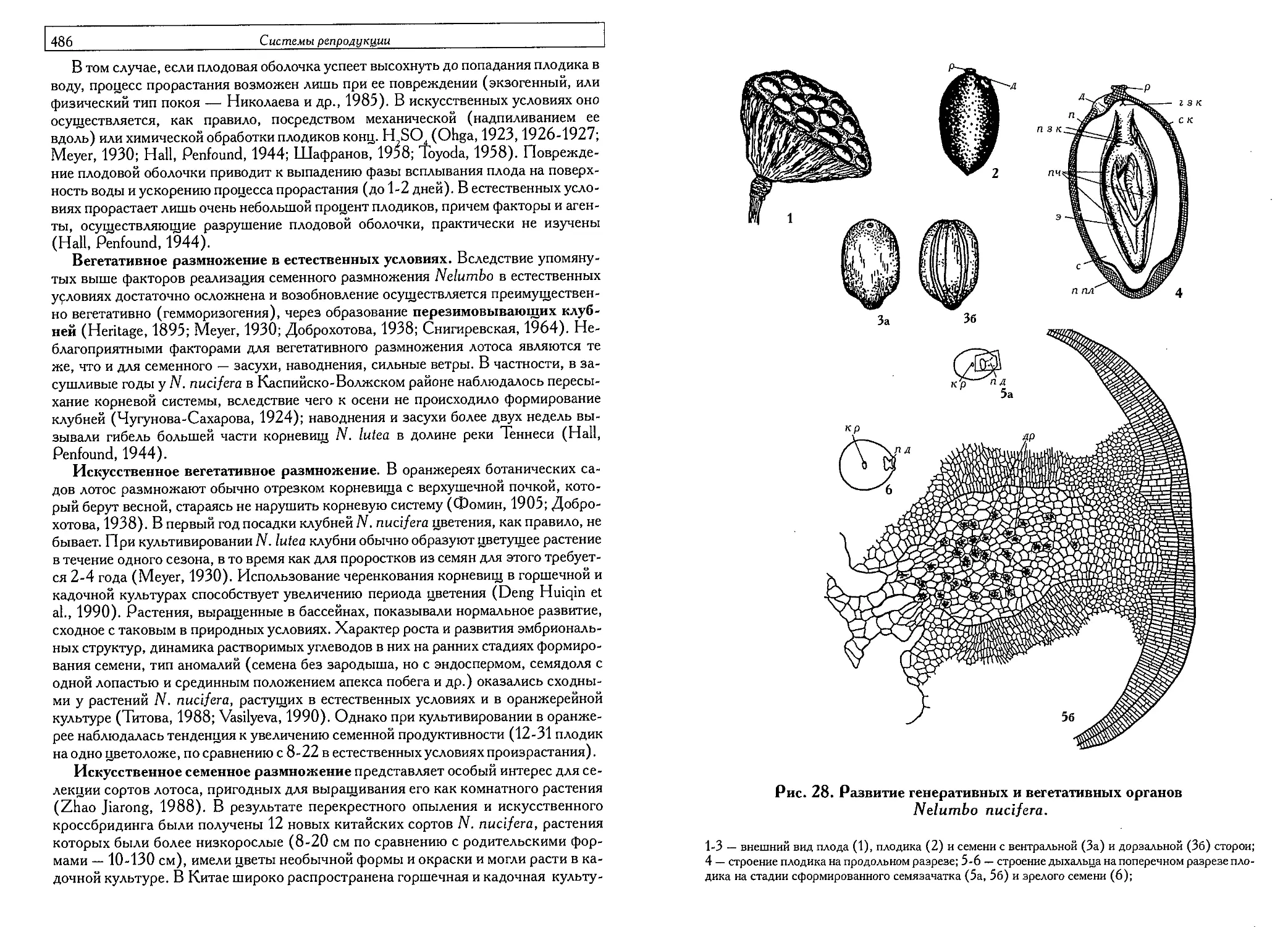
Репродуктивная стратегия лотосовых (Nelumbonaceae)
(Г.Е. Титова,В.Е.Васильева) 479
Семенное и вегетативное размножение Vaccinium myrtillus L.
(Ericaceae) (Е.А.Мазная, Г. М.Анисимова) 500
Репродуктивная стратегия живородящих растений
(Т.Б.Батыгина.Е.А.Брагина) 507
Репродуктивная стратегия орхидных умеренной зоны
(П. В. Куликов,Е.Г.Филиппов) 510
Проблемы и перспективы семенного размножения in vitro орхидных
умеренной зоны (Е.В. Андронова, П. В. Куликов,
Е. Т. Филиппов, В.Е.Васильева, Т. Б. Батыгина) 513
Состояние популяций Gymnadenia conopsea (L.) R. Br. (Orchidaceae)
в различных фитоцеиозах (/!.£. Баталов) 524
Влияние условий загрязнения окружающей среды на репродукцию
растений (Т. М.Анисимова, И. В. Лянгу зова, И. И. Шамров) . ...... 532
ЛИТЕРАТУРА 537
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 645
НА ВКЛЕЙКЕ: КЛАССИКИ МОРФОЛОГИИ, ЭМБРИОЛОГИИ
И ГЕНЕТИКИ; АВТОРЫ ТОМА
CONTENTS
INTRODUCTION 17
ACKNOWLEDGEMENTS 20
PART I - PLANT REPRODUCTION
GENERAL IDEA
Reproductive biology (E. S. Teryokhin). . . 21
Ecological embryology (E.S. Teryokhin) 24
Reproduction, propagation and renewal (TB.Batygina) 35
Viviparity (ТВ. Batygina,E.A.Bragina) 39
Metamorphosis (E. S. Teryokhin) . . 62
Life cycles (С. В. Rodionova) 69
PART II — THE SYSTEMS OF POLLINATION AND BREEDING
POLLINATION SYSTEMS
Anthecology (A. N. Ponomarev,E. I. Demyanova) 72
Sex polymorphism (A. P. Melikyan) . . 73
Monoecy(E. I.Demyanova) 75
Gynodioecy (E. I. Demyanova) 78
HeterostylyC/V.AZ/jin/einaJ 82
Dichogamy (TV. A.Zhinkina) 84
Population aspects of sex determinaton (TV. P. Starshova) 88
The modes of pollen transfer and agents of pollination (A. P. Melikyan) 93
Chasmogamy (E. I. Demyanova) 96
Cleistogamy (E. I. Demyanova) 96
Specific features of cleistogamy in annual species of Medicago L.
(Fabaceae) (L.V.Novosyelova) 99
The evolution of wind pollination (H. P. Linder) 103
JO I
BREEDING SYSTEMS
Autogamy (E.I. Demyanova) 112
Allogamy (E. I. Demyanoua): 115
Geitonogamy 115
Xenogamy 116
Pollen-ovule ratios in different breeding systems (I. I. Shamrov) 119
Stigmatic and ovular receptivity — facts and hypotheses
(E.Pacini, С. С Franchi) 120
Pollination failure in natural populations: implications for the conservation
of rare plants (С. С Wilcock) 126
Significance of hybridization in the higher plant evolution (N.N. Tzvelev) 137
PART HI — SEED PROPAGATION
AMPHIMIXIS AND APOMIXIS
Amphimixis (Т. В. Batygina) 142
Apomixis (ТВ. Batygina) 143
Apospory (T. N. Naumova) 146
Diplospory (T. N. Naumova) '. 151
Parthenogenesis (V. S. Tyrnov) 158
Apogamety (O. P. Kamelina) 165
The classification of apomixis (TV. A Shishkinskaya, O.I. Yudakova) . . 169
Embryo-endosperm interrelations in apomixis (V. S. Tyrnov) 180
Ultrastructural aspects of the apomixis (T. N. Naumova) 186
Space and time organization of megaspore- and megagametophytogenesis
in amphymictic and apomictic plants
(M.A.Cussakovskaya.I.P.Ermakov) 192
Experimental induction of apomixis in situ, in vivo
and in vitro(A.S.Kashin) 201
Applied aspects of gametophytic apomixis (V. S. Tyrnov) 203
The genus Alchemilla L. (Rosaceae) is a classical object for studying
facultative apomixis (K. P. Glazunova) 206
The problem of evolutionary significance of apomixis
(N.A.Shishkinskaya.V.S. Tyrnov) 214
The evolution of gametophytic apomixis (/. C. Carman) 218
SEED PROPAGATION
Seed and seed propagation (Т. В. Batygina) . 246
Reproductive effort (Yu.A.Zlobin) 247
Reproductive success (Yu.A.Zlobin) 251
Potential seed productivity (Yu.A.Zlobin) 258
Real seed productivity (Yu.A.Zlobin) 260
Seed productivity of Symphytum L. species (Boraginaceae)
(N.M.Nayda) 262
The seed productivity in apomicts (A. S.Kashin) 266
Aberrant ovules and seeds: structure and diagnostics (I. I. Shamrov) 272
Heterospermy (C.M.Anisimova) 279
Seed bank (V. L. Tichonova) 286
Fruit (E.S.Teryokhin). .289
Heterocarpy (A. P. Melikyan) 296
PART IV — VEGETATIVE PROPAGATION
Vegetative propagation (TV. I.Shorina) 299
Sarmentation (R. P. Barykina) 302
Particulation (R. P. Barykina) 306
Bud (N. I. Shorina.O.B.Michalevskaya) 310
Bulbil (ТВ. Batygina, E. A. Bragina) 315
Bulb (M. V. Baranova) 321
Bulhlet (M.V.Baranova) 327
Protocorm (E. V.Andronova, T. B. Batygina, V. E. Vasilyeva) 329
Embryoidogeny is a new type of vegetative propagation (ТВ. Batygina) 334
The phytomer conception and the higher plant evolution (N. N. Tzvelev) 350
PART V — MOLECULAR-GENETIC ASPECTS
OF REPRODUCTION
Flower development genetics (L.A.Lutova) 355
The genetic analysis of ovule development (K.Schneitz) 370
Gametophytic mutations (N. Kh.Enaleeva, V.S. Tyrnov) 378
Modifiable variability of gametophyte (L. P. Lobanova, N. Kh. Enaleeva) 384
Embryogenetics of plants (V. S. Tyrnov) 389
The genetic control of apomixis (O. N. Tichodeev) 392
The genetic heterogeneity of seeds (Т. В. Batygina) 397
PART VI — POPULATION AND ECOLOGICAL
ASPECTS OF REPRODUCTION
Phytocenosis (V. I. Vasilevich) 406
Ecological niche (V. I. Vasilevich) 409
Population (V.I. Vasilevich) 412
Life form (TV. /. Shorina) 415
Diaspore (E.A. Bragina, ТВ. Batygina) 420
Population and coenotic regulation of reproduction СУы./l.Z/ofcin,) 428
Population and coenotic aspects of the plant reproduction research
in Arctic conditions (E. A. Khodachek) 432
The synusia of herbs in deciduous forests as an example of reproduction
system (O. V. Smirnova) 439
Multiplicity of modes of vegetative propagation and expantion
in the Ranunculaceae(R. P. Barykina) 442
The ontogenesis of FerulaL. species (Apiaceae) (U. A. Rakhmankulov) 446
и
PART VII - EMBRYOLOGICAL BASES
OF REPRODUCTIVE STRATEGIES
Adaptive possibilities and reproductive strategy in Trapaceae
(C.E.Titova.A.A.Zakharova) 451
Reproductive strategy in Ceratophyllaceae (I.I.Shamrov) 469
Reproductive strategy in Nelumbonaceae (C.E.Titova, V. E. Vasilyeva) 479
Seed propagation and vegetative multiplication in Vacclnlum myrtillus L.
(Ericaceae) (E. A. Maznaya, CM. Anlsimova) 500
Reproductive strategy in viviparous plants (Т. В. Batygina.E. N.Bragina) 507
Reproductive strategy of orchids in moderate zone (P. V. Kulikov, E. C. Philippov) . . 510
Problems and perspectives of in vitro seed propagation of orchids of moderate zone
(E. V. Andronova, P. V. Kulikov, E. C. Philippov,
V.E Vasilyeva, T.B.Batygina) 513
The analysis of Gymnadenia conopsea (L.) R.Br. (Orchidaceae) population
in different phytocenoses (A. E. Batalov) 524
Effects of environmental pollution on plant reproduction.
(C. M. Anisimova,I. V.Lyanguzova,I.I.Shamrov) 532
REFERENCES 537
INDEX 645
INSERTS: CLASSICS OF MORPHOLOGY, EMBRYOLOGY
AND GENETICS; CONTRIBUTORS OF THE VOLUME
Введение
13
Посвящается светлой памяти
Елены Николаевны Герасимовой-Навашиной,
Веры Алексеевны Поддубной-Арнольды,
Вероники Казимировны Василевской,
Катрин Эзау и Барбары Хациус —
женщин-ученых, внесших большой вклад в разработку
сложных проблем морфогенеза и репродукции
ВВЕДЕНИЕ
Эмбриология растений за последние десятилетия стала разветвленной областью
биологии. Такие открытия XX века, как выращивание растений из соматических
клеток, экспериментальная гаплоидия, парасексуальная гибридизация, имели
общебиологическое значение. Они активизировали работы в области морфогенеза
репродуктивных структур.
Эмбриология растений — наука о закономерностях зарождения организма —
переживает полосу расцвета, обусловленного общим прогрессом в
естествознании. Дальнейшее развитие биологии немыслимо без знания первых этапов
онтогенеза. Эмбриологическая информация становится все более необходимой
для теоретических и экспериментальных исследований, касающихся вопросов
репродукции. Вот почему эмбриология оказалась в центре внимания не только
эмбриологов, но и генетиков, геоботаников, биохимиков, физиологов,
цитологов, биофизиков, селекционеров (Схемы 1 и 2). Совместными усилиями
эмбриологов, генетиков, молекулярных биологов в последние десятилетия XX
века были открыты специфические гены, контролирующие мейоз, развитие
яйцеклетки и ранние этап:ы онтогенеза. В последнее время все более ярко
проявляется тенденция к синтезу эмбриологических и генетических данных. Это
связано с тем, что большинство проблем, связанных с морфогенезом
(дифференциация, специализация, оценка признаков, определение понятий «ген и признак»,
«генотип и фенотип»), в той или иной степени касаются эмбриологии и генетики
(эмбриогенетики).
В эволюционной эмбриологии зародился новый подход к изучению проблем
адаптации растений. В связи с проблемой сохранения биологического
разнообразия в условиях экологического стресса особое внимание уделяется важнейшему
направлению в исследованиях раннего онтогенеза и выявлению в нем критических
периодов — экологической эмбриологии. Познание пластичности и толерантности
систем репродукции на уровне вида и популяции в настоящее время является одной
из центральных проблем б>иологии. При этом, важное значение имеет изучение
эмбриональных структур типов, способов и форм репродукции, а также их
соотношения с позиций выявления резервов и надежности биологических систем. Изучение
вариабельности морфогенеза и фенотипа популяции (вариации жизненного цикла и
многообразие систем репродукции) является важнейшим направлением в популя-
ционной эмбриологии растений.
Схема 1. Связи репродуктивной биологии семенных растений
с различными отраслями науки и практики (по Левиной, 1981, с измен.)
Репродуктивная биология семенных растений
генетика растении-
I!
эмбриология
растений
энтомология
1
I
I
о
■о
I
о
о
W
■о
Г5
в
п
п
о
£
семенная продуктивность
потенциальная и реальная
фитопатология •<-
селекция
семеноводство
о — —
S т о
а ■§ §
§!
£ °
1 1
->• фитоценология
-► лесоводство
-► луговодство
морфология
растений
> экология
>■ животных
-► физиология
растений
семеноведение
семенной
-►аэродинамика
контроль
интродукция
О
о
се
X)
о
s
о
я
S
о
Sc
V
г
OV
рио
>
о
S
S
"О
SJ
о
н .
г&
S
S
Sc
О
х
р&
г
&>
ю
О
о
S
О
со
S
о
Я
я
9>
ее
>
р&
S
S
а
16
Системы репродукции
Впервые все эти аспекты в той или иной степени освещены в последнем, третьем
томе настоящего энциклопедического словаря. Это издание не имеет аналогов в мире и
является оригинальной попыткой совместить принцип терминологического словаря с
монографическим описанием отдельных структур и процессов. Оно состоит из трех
томов. Первый том «Генеративные органы цветка»(1994) содержит три части:
«Цветок», «Пыльник», «Семязачаток». Второй том «Семя» (1997) состоит из шести
основных частей: «Оплодотворение», «Эндосперм», «Перисперм», «Зародыш»,
«Семенная кожура», «Проросток». Третий том «Системы репродукции» включает семь
основных частей: «Репродукция растений», «Системы опыления и скрещивания»,
«Семенное размножение», «Вегетативное размножение», «Молекулярно-гене-
тические аспекты репродукции», «Популяционные и экологические аспекты
репродукции», «Эмбриологические основы репродуктивных стратегий».
В третьем томе дана трактовка специалистами различных дисциплин ботаники
(эмбриологии, морфологии, генетики, геоботаники, экологии и др.) таких
многогранных понятий, как: «системы репродукции», «жизненные стратегии»,
«репродуктивные стратегии». В связи с этим рассмотрены следующие ключевые понятия:
«воспроизведение (репродукция) », «возобновление», «размножение», «амфимиксис»,
«апомиксис», «репродуктивное усилие», «репродуктивный успех», «потенциальная
семенная продуктивность», «реальная семенная продуктивность» и др.
В отличие от традиционной структуры словаря, «терминологические статьи» в
книге расположены не в алфавитном порядке, а по тематическому принципу, в
целях создания целостной картины событий, происходящих в репродуктивных
органах. Предметный указатель дается в конце книги.
Текст включает ряд обобщающих концептуальных статей и терминологических
(понятийных) статей, посвященных отдельным структурам и процессам. В них
содержатся определение термина, его семантика, история вопроса, краткие данные по
генезису, функциям, а также общепризнанные и оригинальные классификации
генеративных структур и процессов.
Названия концептуальных статей, а также разделов и ряда подразделов
выделены отдельной строкой, а названия терминологических статей напечатаны в
начале строки, без абзаца. Из-за необходимости краткого изложения приводится
минимум ссылок на авторов, связанных, главным образом, с приоритетностью
открытий, терминологией или уникальностью обнаруженного признака. Ссылка на
авторов отсутствует в тех случаях, когда высказываются общепризнанные мнения
или описываемый признак широко распространен. В конце каждой статьи дано
краткое цитирование литературы (автор и год издания), а полные
библиографические данные представлены в общем списке литературы в конце тома. Каждая
статья снабжена иллюстративным материалом в виде рисунков, микрофотографий,
схем, графиков. Номер рисунка указан в конце статьи.
атыгина
КЛАССИКИ МОРФОЛОГИИ, ЭМБРИОЛОГИИ И ГЕНЕТИКИ
CLASSICS OF MORPHOLOGY, EMBRYOLOGY AND GENETICS
АСТАУРОВ Б. Л.
ASTAUROV B. L.
1904-1974
ВАВИЛОВ Н. И.
VAVILOV N. I.
1887-1943
ВАСИЛЕВСКАЯ В. К.
VASILEVSKAYAV.K
1912-1982
КАРПЕЧЕНКО Г. Д.
KARPECHENKO G. D.
1899-1941
КОЛЬЦОВ Н. К.
KOLTZOV N. К.
1872-1940
КУПРИЯНОВА Л. А
KUPRIANOVA L. А.
1914-1987
ЛЕВИНА Р. Е.
LEVINA R. Е.
1908-1987
ЛЕВИТСКИЙ Г. А.
LEVITSKY G. А.
1878-1942
ЛОБАШОВ М. Е.
LOBASHOV М. Е.
1907-1971
НАВАШИН С. Г. ПОДДУБНАЯ-АРНОЛЬДИ В. А
NAWASCHINS G PODDUBNAYA-ARNOLDIV. А.
1857-1930 1902-1985
МЕНДЕЛЬ Г.
MENDEL G.
• 1822-1884
ПОНОМАРЕВА. Н.
PONOMAREVA. N.
1906-1978
СЕРЕБРЯКОВА Т. И.
SEREBRYAKOVAT. I.
1922-1986
РАБОТНОВ Т. А.
RABOTNOV Т. А.
1903-2000
ХОХЛОВ С. С.
KHOKHLOV S. S.
1910-1974
1880-1959
ЭСАУЛ.
ESAU L.
1898-1996
ФИЛИПЧЕНКО Ю. А.
PHILIPCHENKO Yu. A.
1882-1930
HACCIUS В.
ХАЦИУС Б.
1914-1983
ГЕРАСИМОВА-НАВАШИНА Е. Н.
GERASSIMOVA-NAVASHINA E. N.
1905-1993
АВТОРЫ 3 ТОМА
AUTHORS OF VOLUME 3
Андронова Е. В.
Andronova E. V.
Анисимова Г. М.
Anisimova G. M.
Баранова М. В.
Baranova M. V.
***ч
Барыкина Р. П.
Barykina R. Р.
Батыгина Т. В.
BatyginaT. В.
Брагина Е. А.
Bragina E. А.
Васильева В. Е.
Vasilyeva V. E.
Василевич В. И.
Vasilevich V. I.
Вилкок С. С.
Wilcock С. С.
щ^л £?Ш
Глазунова К. П.
Glazunova К. Р.
Злобин Ю. А.
Zlobin Yu. A.
Камелина О. П.
Kamelina О. Р.
Гусаковская М. А.
Gussakovskaya M. А.
Еналеева Н. X.
Enaleeva N. Kh.
Карман Дж. Г.
Carman J. G.
Жинкина Н. А.
Zhinkina N. А.
Ермаков И. П.
Ermakov I. P.
Кашин А. С.
Kashin A. S.
Линдер X. П.
Under H. Р.
Лобанова Л. П.
Lobanova L. Р.
Лутова Л. А.
Lutova L. А.
Лянгузова И. В.
Lyanguzova I. V.
Мазная Е. А.
Maznaya E. А.
Меликян А. П.
Melikyan А. Р.
ЩЬ^Ъ £** 'к
Михалевская О.Б.
Mikhalevskaya О.В.
Найда Н. М.
Nayda N. М.
Наумова Т. Н.
Naumova Т. N.
Новоселова Л. В.
Novoselova L. V.
Родионова Г. Б.
Rodionova G. В.
Терехин Э. С.
Teryokhin E. S.
Пацини Е.
Pacini E.
Смирнова О. В.
Smirnova О. V.
Титова Г. Е.
Titova G. Е.
Рахманкулов У. А
RakhmanKulov U. А
Старшова Н. П.
Starshova N. Р.
Тиходеев О. Н.
Tikhodeev О. N.
Тырнов В. С.
Tyrnov V. S.
Франчи Г. Г.
Franchi G. G.
Ходачек Е. А.
Khodachek E. А.
Цвелев Н. Н.
Tzvelev N. N.
Шамров И. И.
Shamrov I.I.
Шнайц К.
Schneitz К.
Шорина Н. И.
Shorina N. I.
Шишкинская Н. А.
Shyshkinskaya N. А.
Юдакова О. И.
Yudakova О. I.
Введение
17
In serene memory
of Elena Gerassimova-Navashina,
Vera Poddubnaya-Arnoldi, Veronika Vasilevskaya,
Katherine Esau and Barbara Haccius —
women-scientists, who made a great input to the developing
of complicated problems of plant morphogenesis and reproduction
INTRODUCTION
In last decades plant embryology has become a ramified area of biology. Such
discoveries of XX century as raising plants from single somatic cell, experimental
haploidy, parasexual hybridisation were of general biological significance. They
promoted works in the field of morphogenesis of reproductive structures. Plant
embryology, which concerns the regularities of initiation and the first stages of
development of organism, undergoes a flourishing period now, caused by the
general progress of natural sciences. In its turn the further development of biology is
unthinkable without knowledge of the first stages of ontogenesis. Embryological
information becomes more and more essential for theoretical and experimental
studies of reproduction. Due to this reason embryology appeared in the center of
attention of geneticists, biochemists, geobotanists, biochemists, physiologists,
cytologists, biophysicists and selectionists. In the last decades of XX century
common efforts of embryologists, geneticists, molecular biologists yielded the
discovery of specific genes, which control meiosis, egg cell development and early
stages of embryogenesis. The tendency to synthesize data of embryology and
genetics becomes more and more striking in the last time. It is connected with the
fact that the majority of problems connected with morphogenesis such as
differentiation, specialization, the evaluation of features, the definition of the
notions «gene and feature», «genotype and phenotype», concern embryology and
genetics (embryogenetics) one way or another.
The evolutionary embryology has given rise to the new approach to the study of the
problems of evolutionary adaptation in plants. In connection with the problem of
preserving of biological diversity under the conditions of ecological stress, a special
attention is paid to ecological embryology — one of the most important directions of study
of early ontogenesis and revealing its periods. The study of plasticity and tolerance of
reproductive systems at the level of species and population is now one of the central
problems in biology. The study of variability of morphogenesis and phenotype in
population (the study of life cycle variations and the diversity of reproductive systems) is
the most important point in the population embryology of plants.
For the first time all these aspects are elucidated one way or another in the last,
third volume of the present encyclopedic dictionary. This edition has no analogies in
the world. It is an original endeavour to combine the principles of constructing
terminological dictionary with monographic description of structures and processes.
18
Системы репродукции
The edition consists of three volumes. The first volume (1994) titled «The
Generative Organs of Flower» includes three parts, these are «Flower», «Anther»,
«Ovule». The second volume (1997) titled «The Seed» consists of six main parts,
namely «Fertilization», «Endosperm», «Perisperm», «Embryo», «Seed coat»,
«Seedling». The third volume titled «Reproductive systems» includes seven
principle parts: «Plant reproduction», «The Systems of pollination and breeding»,
«Seed propagation», «Vegetative propagation», «Molecular-genetic aspects of
reproduction», «Population and ecological aspects of reproduction» and «Embryo-
logical bases of reproductive strategies».
Specialists in different disciplines of botany such as embryology, morphology, genetics,
geobotany, ecology, etc., gave their interpretation of such many-sided notions as «systems
of reproduction», «living strategies». In this connection some key notions are considered,
namely «reproduction», «renewal», «propagation», «amphimixis», «apomixis»,
«reproductive effort», «reproductive success», «potential seed productivity», «real seed
productivity» and others.
Unlike the traditional structure of a dictionary «terminological articles» are arranged
according to the subject, not alphabetically, for the purpose of creating an integrated picture
of events which occur in the reproductive organs. The index is given at the end of the book.
The text includes a number of generalising conceptual articles and terminological
articles devoted to some structures and processes. Each article includes the definition of a
term, its semantics, the history of the- question, short data on genesis and functions of
different embryonal structures, the accepted and original classifications of generative
structures and of their development.
The titles of conceptual articles, chapters and number of subchapters are marked by
separate line and the titles of terminological articles are printed in the beginning of the line
without iridention. For the purpose of brief exposition the citation of authors is minimised
to those connected mainly with the priority of discoveries, terminology or unique features
found. The citation is omitted in the cases when the generally acknowledged opinion is
stated or the widely spread feature is described. In the end of every article the main short
references are given (the author's name and the date of publication). The full
bibliographical data are placed in the general list at the end of the volume. Each article is
supplied with illustrative material such as drawings, microphotographs, schemes and
graphs. The illustration number is indicated at the end of the article.
Tatyana B. Batygina
Введение
19
БЛАГОДАРНОСТИ
Выражаю искреннюю благодарность всему авторскому коллективу. Особенно
признательна коллегам из разных городов России (А. Е. Баталов — Архангельск;
П. В. Куликов, Е. Г. Филиппов — Екатеринбург; Р. П. Барыкина, К. П.
Глазунова, М. А. Гусаковская, И. П. Ермаков, А. П. Меликян, О. Б. Михалевская,
О. В. Смирнова, В. Л. Тихонова, Н. И. Шорина — Москва; Е. И. Демьянова,
Л. В. Новоселова — Пермь; Н. X. Еналеева, А. С. Кашин, Л. П. Лобанова,
В. С. Тырнов, Н. А. Шишкинская, О. И. Юдакова — Саратов; М. В. Баранова,
В. И. Василевич, И. В. Лянгузова, Л. А. Лутова, Е. А. Мазная, Н. М. Найда,
Э. С. Терехин, О. Н. Тиходеев, Е. А. Ходачек, Н. Н. Цвелев, —
Санкт-Петербург; Н. П. Старшова — Ульяновск) и стран мира (Е. Pacini и
G. G. Franchi — Италия; С. С. Wilcock — Великобритания; J. G. Carman —
США; К. Schneitz - Швейцария; Н. P. Linder -ЮАР; Ю. А. Злобин -
Украина; У. А. Рахманкулов — Узбекистан).
Особую благодарность хотелось бы выразить В. Е. Васильевой (редактору),
И. И. Шамрову (секретарю издания), а также Е. В. Андроновой, Г. М. Анисимо-
вой, О. П. Камелиной, Т. Н. Наумовой и Г. Е. Титовой за их многостороннюю
помощь в подготовке издания. Сердечно благодарна Н. А. Жинкиной за прекрасные
репродукции многих рисунков и Л. М. Ротенфельд — за безукоризненное
выполнение фотографий, а также Е. А. Брагиной, О. Н. Вороновой, О. Г. Бутузовой,
Т. Н. Голубевой, Е. Е. Евдокимовой, Н. О. Золотухиной за техническую помощь
при оформлении рукописи. Очень признательна А. А. Захаровой за неоценимую
помощь при переводе отдельных материалов на английский язык.
Я благодарна также сотрудникам издательства «Мир и семья» за
доброжелательное отношение, эффективное и плодотворное сотрудничество.
Монография смогла увидеть свет благодаря финансовой поддержке
Российского Фонда Фундаментальных Исследований.
Т. Б. БАТЫГИНА
20
Системы репродукции
ACKNOWLEDGEMENTS
As the editor of the present volume I would like to thank the whole team of
contributors. I am especially thankful to the colleagues from different cities of Russia
namely A. E. Batalov (Arkhangelsk), P.V.Kulikov and E.G.Philippov
(Ekaterinburg), R.P.Barykina, K. P. Glazunova, M. A. Gussakovskaya,
I. P. Ermakov, A. P. Melikian, O. B. Mikhalevskaya, G. B. Rodionova,
O. V. Smirnova, V. L. Tikhonova and N. I. Shorina (Moskow), E. I. Demyanova and
L. V. Novoselova (Perm'), N. Kh. Enaleeva, A. S. Kashin, L. P. Lobanova,
V. S. Tyrnov, N. A. Shishkinskaya and O. I. Judakova (Saratov), M. B. Baranova,
V. I. Vasilevich, I. V. Lyanguzova, L. A. Lutova, E. A. Maznaya, N. M. Nayda,
E. S. Teryokhin, O. N. Tikhodeev, E. A. Khodachek and N. N. Tzvelev
(Sankt-Petersburg), N. P. Starshova (Ul'ianovsk) and different countries namely
E. Pacini and G. G. Franchi (Italy), С. С. Wilcock (Great Britain), J. G. Carman
(USA), K. Schneitz (Switzerland), H. P. binder (SAR), Yu. A. Zlobin (Ukraine),
U. A. Rakhmankulov (Uzbekistan).
My special thanks are to V. E. Vasilyeva (editor) and I. I. Shamrov (secretary)
and also to E. V. Andronova, G. M. Anisimova, O. P. Kamelina, T. N. Naumova
and G. E. Titova for their great help in preparing of the edition. My cordial thanks to
N. A. Zhinkina for beautiful reproduction of many drawings, L. M. Rotenfeld for
perfect photography, A. A. Zakharova for help in translation of some materials into
English and to E. A. Bragina, O. N. Voronova, O. G. Butuzova, T. N. Golubeva,
E. E. Evdokimova, N. O. Zolotukhina for technical assistance.
I am sincerely grateful to the colleagues of «World and Family» Publishing House for
their benevolence, effective and fruitful collaboration.
This monograph appeared due to the financial support of Russian Foundation for
Fundamental Researches.
T. B. BATYGINA.
Репродукция растений
21
ЧАСТЬ I — РЕПРОДУКЦИЯ РАСТЕНИЙ
ОБЩЕЕ ПРЕДСТАВЛЕНИЕ
РЕПРОДУКТИВНАЯ БИОЛОГИЯ
Изучению процессов воспроизведения и размножения цветковых растений в
современной ботанике уделяется явно недостаточное внимание. Этот вывод
основывается на сознании того исключительного значения, которое процессы
репродукции имеют не только в регулярном возобновлении растительного покрова, но и
восстановлении нарушенной, вследствие все возрастающего антропогенного
давления, самой основы нашего существования — многообразного мира растений.
Поэтому вполне оправданы возобновляющиеся время от времени попытки привлечь
внимание научных кругов к проблемам репродукции и особенно семенной
репродукции растений.
Одна из таких попыток была предпринята Левиной (1981) в ее книге
«Репродуктивная биология семенных растений. Обзор проблемы». Высоко оценивая этот
труд и осознавая его значение для развития наших представлений о процессах
репродукции у растений и подходах к их изучению, тем не менее, необходимо сегодня
критически оценить некоторые аспекты тех представлений, которые вошли в нашу
научную практику в виде обобщенного понятия «репродуктивная биология». Это
необходимо сделать потому, что репродуктивная биология в книге Левиной
представлена нам в виде нового синтетического подхода к изучению репродуктивных
циклов. Вопрос, который может и должен быть сегодня поставлен, как раз и
заключается в том, отражает ли понятие «репродуктивная биология» новую научную
проблему и, следовательно, новый научный подход (направление исследований)
или же это лишь более современное обозначение определенной области
исследования в ботанике.
По мнению Левиной, репродуктивная биология растений постепенно развилась
из того направления в исследованиях размножения и воспроизведения растений,
которое ранее обозначалось термином «биология размножения». Она
подчеркивает, что репродуктивная биология отличается прежде всего иным, большим объемом
исследований, связанным с разными уровнями изучения процессов размножения.
Если биология размножения изучалась исключительно на организменном уровне и
22
Системы репродукции
учитывала наследственные морфофизиологические особенности организма, то
репродуктивная биология выходит на уровень вида и отражает зависимость
размножения от экологической обстановки. Таким образом, «репродуктивная биология
вида в целом, на всех ее этапах определяется не только генетической программой,
но и экологическими связями и взаимозависимостями всего процесса
размножения» (Левина, 1981, с. 5).
Здесь необходимо, по-видимому, сделать несколько замечаний по существу
обсуждаемых терминов. Пономарев (1969), рассматривая сходный предмет, пришел
к заключению, что следует отказаться от традиционных терминов «биология
цветка» и «биология цветения и опыления», как неопределенных по содержанию и не
отражающих точно сути явлений. По его мнению, более приемлемым является
термин «антэкология», который точнее по смыслу, удобнее в пользовании и более
емкий по содержанию, поскольку включает как экологию цветка, так и экологию
опыления. При этом экология цветка представляет, в сущности, его экологическую
морфологию, отражая различные структуры, механизмы и особенности развития
цветка со стороны их приспособительного значения к осуществлению присущих
цветку функций. Пономарев раскрывает широкий спектр подходов к изучению
цветка и его функций в рамках антэкологии. Под биологией же правильнее
понимать науку о живых организмах в целом, охватывающую все ее разделы, как это и
предложил в свое время Гексли.
Таким образом, с вышеприведенной позиции выражение «репродуктивная
биология» выглядит предпочтительнее в качестве термина для обозначения
конкретной области исследований, чем в качестве названия нового научного
подхода, проблемы или направления. Перспектива целостного (и в этом
смысле — комплексного) подхода к изучению репродуктивного процесса
несомненно привлекательна, поскольку дает существенное прибавление новых
знаний. Однако за этим «прибавлением знаний» подразумевается, как можно
думать, скорее их расширение и обобщение, нежели ступенька к более
глубокому познанию закономерностей репродукции.
Старшова (1989) предприняла попытку всесторонне оценить вклад Левиной в
разработку репродуктивной биологии как проблемы, который заключается по ее
мнению в создании синтетического подхода к изучению репродуктивных циклов.
Главные идеи такого подхода состоят в следующем. Репродуктивная биология
вида должна изучаться на организменном, популяционно-видовом и биоценоти-
ческом уровнях. С нашей точки зрения, то, что Левина и Старшова называют
«уровнями» -— скорее «поля» исследований или же их методические аспекты.
Сами по себе эти «уровни» организации живого не имеют прямого отношения к
обсуждаемой проблеме. Например, антэкология только и может изучаться в це-
нотическом и популяционном «полях» (точнее, в этих аспектах — 3. Т.), вне
зависимости от того, рассматриваются ли такие исследования в рамках
репродуктивной биологии или вне ее. С другой стороны, эмбриология и карпология в
зависимости от поставленных задач вполне могут быть ограничены исследованиями
на организменном уровне. Таким образом, этот тезис, на наш взгляд, не
свидетельствует о принципиально новом подходе к исследованиям репродукции.
Следующая идея состоит в том, что «биология семенного размножения» и
«репродуктивная биология» проявляют себя различно с точки зрения
действующих в них систем управления. Первая относится к организменному уров-
Репродукция растений 23
ню, для которого характерна структурированная система управления. Вторая,
как процесс, протекающий в надорганизменных системах, характеризуется
стохастическим типом управления. На наш взгляд, стохастичность присуща
управлению и на уровне особи, и на уровне популяции, равно как и
«структурированная» система управления. Вопрос заключается лишь в их
соотношении в том или другом «поле».
В арсенале средств борьбы за сохранение вида главная роль действительно
принадлежит репродуктивной биологии (точнее, процессам репродукции — Э. Т.).
Она характеризуется большими количественными резервами и экологической
пластичностью отдельных этапов. С этим тезисом нельзя не согласиться. Однако
данный тезис не содержит ничего, что подтверждало бы необходимость выделения
репродуктивной биологии (а не изучения процессов репродукции — Э. Т.) в особую
научную проблему.
В этой связи утверждение, что репродуктивная биология — это особая
целостная и комплексная проблема, требующая коллективной разработки по единым
методикам, также достаточно уязвимо для критики.
По нашему мнению, действительно научной проблемой является изучение
конкретных особенностей процессов репродукции в различных таксонах и
экологически дифференцированных группах растений на всех уровнях их
организации (Salisbury, 1942; Терехин, 1988; Teryokhin, 1997). Целостность научных
представлений о том или другом репродуктивном цикле создается при этом
постепенно, в результате анализа конкретных результатов исследований. При
таком подходе не требуется (да и не нужна вовсе) «коллективная разработка по
единой методике». Это требование, пожалуй, больше подходит к
экспериментальным исследованиям в области биотехнологии, нежели к изучению
особенностей репродукции в естественных условиях.
В связи с вышеизложенным нельзя обойти вниманием такой важный аспект
обсуждаемого предмета, как вопрос об экологизации исследований в области
репродукции растений.
Беру на себя смелость утверждать, что представления Левиной (1981) об
экологии вполне созвучные тому времени, когда готовилась к печати ее книга,
кажутся сегодня довольно односторонними. Как видно из контекста книги, экология, в
том числе экология репродукции, понимается ею как многообразные влияния
биотических и абиотических факторов на репродуктивный процесс. Между тем
экология — это «наука о взаимодействиях организмов друг с другом и с
окружающей средой» (Рейвн и др., 1990, с. 255).
В этой связи вполне уместно сравнение труда Левиной с книгой Вилсон
«Экология репродукции растений» (Wilson, «Plant Reproductive Ecology», 1983). Это
сравнение показывает, что между содержанием обеих работ мало общего, что
особенно заметно в подходах к исследованию одноименных структур и процессов, в
анализе взаимосвязанных явлений и факторов.
Таким образом, сосуществуют два различных подхода к исследованию
репродуктивных циклов. И это — одна из причин, благодаря которым возникла
необходимость в настоящей статье. Все это отнюдь не означает, что взгляды на
репродуктивные процессы у Вилсон предпочтительнее взглядов Левиной. Они
просто различны. По нашему мнению, экологические трактовки Вилсон
отличает излишне «экономизированный» подход к анализу явлений репродукции.
24
Системы репродукции
Он вполне правомочен, но, видимо, недостаточен. Необходимо, на наш взгляд,
более адекватное отражение роли и значения активных функций (поведения)
растений в репродуктивном цикле.
В этой связи нельзя не привести высказывания Faegri и van der Pijl (1966) из их
книги «The Principles of Pollination Ecology» в отношении исследования цветка. По
их мнению, структуру цветка следует рассматривать с точки зрения экологии
опыления, т. е. как функциональную единицу. Если не учитывать этого обстоятельства,
то морфология цветка теряет всякий смысл, а само развитие цветка и его элементов
становится непонятным и может трактоваться лишь с позиций ортогенеза или
подобных теоретических концепций. И еще одно важное замечание авторов,
относящееся к проблеме адаптивного значения процессов репродукции. Было бы
чрезвычайно опрометчиво полагать, пишут они, что многие исключительно точные и
сложные связи между, например животными и растениями, наблюдающиеся в
процессе опыления, появились случайно, в результате ненаправленной изменчивости.
Адаптивная полезность органа не может отрицаться из-за того, что мы не знаем его
функций.
Таким образом, научное сообщество уже ответило на вопрос, является ли
репродуктивная биология растений областью ботаники, включающей всестороннее
исследование процессов репродукции или особой научной проблемой. Оно ответило
на этот вопрос в виде таких новых конкретных направлений исследований, как ан-
тэкология (Пономарев, 1969; Faegri, Pijl van der, 1966), экологическая карпология
(van der Pijl, 1969), экологическая эмбриология (Терехин, 1977, 1988; Teryokhin,
1997) и т. п. В последние годы, в связи со стремительным развитием новых идей и
методов в области генетики развития и биотехнологии, возникли и быстро
прогрессируют такие новые направления репродуктивной биологии, как исследования
тонких механизмов опыления (проблема самонесовместимости), генетический
контроль развития цветка, генетическая инженерия гамет и зародышей, генетический
контроль апомиксиса и генетический контроль развития гибридных семян.
Эти конкретные направления, представленные в 3-м томе, как раз и отражают
действительные актуальные проблемы и новые подходы в области репродуктивной
биологии растений.
Трудно предугадать новые открытия в области репродуктивной биологии растений
и их практическую ценность. Но уже и то, что достигнуто, поражает воображение.
Левина, 1981; Пономарев, 1969; Старшова, 1989; Терехин, 1977,1988; Faegri, Pijl van der, 1966;
Pijl van der, 1969; Raven et al, 1986; Salisbury, 1942; Teryokhin, 1997; Wilson, 1983.
ЭКОЛОГИЧЕСКАЯ ЭМБРИОЛОГИЯ
Экологическая эмбриология— раздел эмбриологии, включающий изучение
причинных взаимосвязей между факторами среды, поведением растений и
адаптивными особенностями организации генеративных и эмбриональных структур.
Как следует из определения, эта область исследований является частью
эволюционной ботаники. Экологический каузальный подход к эмбриологическим
исследованиям близок по своей сущности к каузально-функциональному анализу в
карпологии (Pijl van der, 1969), антэкологии (Фегри, Пейл ван дер, 1982), но отличает-
Репродукция растений
25
ся иной направленностью в изучении экологических функций, а также спектром
исследуемых структур.
Согласно Фэгри и ван дер Пэйлу (1982, с. 31), «...структуру цветка следует
рассматривать с точки зрения экологии опыления, т.е. как функциональную
единицу. Если не учитывать этого обстоятельства, то морфология цветка теряет всякий
смысл, а само развитие становится непонятным и может быть объяснено лишь с
позиций ортогенеза и подобных теоретических концепций».
Экологическая эмбриология находится сегодня в стадии становления, что
обусловливает определенные ограничения в выборе объектов исследования. Такие
объекты должны быть, во-первых, экологически контрастными, во-вторых,
доступными для достаточно точного и подробного экологического анализа и,
в-третьих, быть хорошо изученными морфологически.
Этим критериям отвечают сегодня такие группы покрытосемянных, как расте-
ния-ксенопаразиты с разными способами чужеядного питания (Scrophulariaceae —
подсемейства Orobanchoideae и Rhinanthoideae; Balanophoraceae, Cuscutaceae,
Hydnoraceae, Loranthaceae, Rafflesiaceae, Viscaceae), микопаразитные растения
(Ericaceae — подсем. Monotropoideae и Pyroloideae, Burmanniaceae, Orchidaceae,
некоторые роды сем. Gentianaceae), а также хищные растения, в том числе водные
(Droseraceae и Lentibulariaceae). К таким растениям относятся и некоторые
таксоны водных погруженных растений (Potamogetonaceae, Ruppiaceae, Zosteraceae)
(Схема 1).
Теоретической основой экологической эмбриологии служат следующие
концепции. Во-первых — положение об адаптивной направленности
эволюционных преобразований онтогенеза. Мы распространяем понятие
адаптивных преобразований и на процессы макроэволюции непосредственно, имея
ввиду механизмы таких преобразований в соответствии с концепцией «нового
синтеза» (Gilbert et al., 1996). Во-вторых — признание эволюционной
первичности и направляющей роли экологических функций по отношению к
эволюционным структурным преобразованиям. При этом, мы понимаем
экологию в том же смысле, что и Lemee (1976). Согласно его представлениям,
исследование связей между факторами среды и организмами имеет два аспекта:
1) изучение характера среды, в контакте с которой живут
организмы — мезологическая экология, или мезология; 2) изучение поведения и
реакций организмов в этой среде — этологическая экология, или
этология. Мы полагаем, что реакции организмов на влияние мезологических
факторов складываются в определенные комплексы, которые называют поведением
(например, пищевое или репродуктивное поведение), в зависимости от целей
направленной активности. Поведение присуще всем типам организмов,
включая растения (Терехин, 1972,1977).
Поведение играет, на наш взгляд, особую роль в эволюции онтогенеза,
поскольку именно изменения поведения направляют эволюционные
преобразования структур (Терехин, 1991). При обсуждении изменений поведения, а вслед
за ними и соответствующих структурных преобразований, весьма
продуктивной является концепция стресса как триггерного фактора. Как можно
предположить, стрессы и, в частности, «экологические» стрессы (т.е. стрессы,
вызванные мезологическими факторами), являются эффективным триггерным
механизмом эволюции, особенно в процессах смены экологических ниш, например
ЦВЕТКОВЫЕ
РАСТЕНИЯ
АВТОТРОФНЫЕ
I
Наземные
и эпифитные
Водные
Погруженные Свободно-
(Ruppia, плавающие
Zostera) (Lemna)
ХИЩНЫЕ
Наземные
(Drosera)
Водные
(Urticularia)
ГЕТЕРОТРОФНЫЕ
ПАРАЗИТНЫЕ
КСЕНОПАРАЗИТНЫЕ
«Корневые»
паразиты
(Orobanche)
«Стеблевые»
паразиты
(Cuscuta,
Viscum)
МИКОПАРАЗИТНЫЕ
(Neottia, Burmannia,
Pyrola)
Схема 1. Основные способы питания цветковых растений
Репродукция растений
27
при переходе от автотрофного к паразитическому (гетеротрофному) способу
питания (Терехин, 1996).
Рассмотрим взаимодействие экологических (мезологических и этологических)
факторов на примере адаптивной эволюции некоторых экологически контрастных
групп цветковых растений.
Экологическая ниша представителей подсем. Rhinanthoideae (Scrophu-
lariaceae) — «корневой» паразитизм, т.е. паразитизм на корнях подходящих
растений-хозяев, обычно, однодольных растений (Схема 2). Это подсемейство
особенно интересно тем, что в него входят виды и роды с разной степенью
специализации к «корневому» паразитизму: от факультативных паразитов (Euphrasia
minima, Melampyrum lineare) до высокоспециализированных бесхлорофильных
паразитов (Harveya coccinea, Hyobanche sanguinea, Striga gesnerioides).
Наиболее наглядно степень специализации этих растений к корневому паразитизму
отражена в редукции их зародышей (Схема 3).
По мнению Костычева (1937), переход ряда цветковых растений к
«корневому» паразитизму был вызван в основном недостаточной влажностью почвы. Этот
лимитирующий фактор, по-видимому, вызывал состояние стресса
(напряженности, дискомфортности) у попавших в подобные условия автотрофных растений.
Дискомфорт предполагает поиск выхода из стрессового состояния. При частых
спонтанных срастаниях корней автотрофных растений в почве возможным
выходом из стресса могла служить «перекачка» воды из клеток одного из сросшихся
корней в клетки другого. Этот процесс мог происходить при условии различного
осмотического давления в клетках сросшихся корней. Действительно, в литературе
имеются сведения о том, что осмотическое давление в клетках растений-паразитов
выше, чем в клетках их растений-хозяев. Так, осмотическое давление в клетках
паренхимы стебля у «корневого» паразита Orobanche crenata составляло 14 атм., в
клетках его гаустории 12,7 атм., а в клетках паренхимы пораженных корней
хозяина — 8 атм. (Гойман, 1954).
Можно предположить, что в этих условиях естественный отбор способствовал
закреплению таких выгодных для паразита многократно повторяющихся
спонтанных контактов, переводя их в закономерные явления. Очевидно, при этом, что па-
. разитизм на начальных этапах его эволюции должен был осуществляться на
факультативной основе. Действительно, в некоторых наименее специализированных
родах чужеядных норичниковых были обнаружены виды с факультативным
паразитизмом (Euphrasia minima, Melampyrum lineare, Odontites verna, Rhinanthus
minor, некоторые виды Castilleya) (Heinricher, 1917; Hambler, 1958; Curtis,
Cantlon, 1965). Факультативные паразиты способны завершать свое развитие и в
отсутствие их растений-хозяев. Их паразитизм основывается на случайных
контактах с корнями подходящих растений-хозяев. Факультативные паразиты уже
способны к образованию гаусторий, но не имеют каких-либо специальных механизмов
(например, химических) для поиска подходящих растений-хозяев. За
исключением способности образовывать гаустории при случайных контактах,
факультативные паразиты в своих функциях и в своем развитии совершенно подобны
родственным автотрофным растениям. Инициация (экспрессия) гаусториальных структур
еще не является обязательным свойством их генома.
Очевидно, что при подходящих условиях, о которых сегодня мало что
известно, факультативные формы паразитизма преобразовывались в облигат-
ЦВЕТКОВЫЕ РАСТЕНИЯ-ПАРАЗИТЫ
КСЕНОПАРАЗИТЫ
паразитируют на корнях
растений- хозяев
("корневые" паразиты)
Olacaceae
Opiliaceae
Santalaceae (Santalum, Thesium,
Exocarpus — некот. виды)
Scrophulariaceae — Oroban-
choideae
Scrophulariaceae —
Rhinanthoideae
Krameriaceae
Balanophoraceae
Cynomoriaceae
Lennoaceae
Hydnoraceae
Rafflesiaceae — Cytinoideae
Loranthaceae (Atkinsonia,
Nuytsia,Melixanthera и др.)
паразитируют иа стеблях
растений-хозяев
( "стеблевые" паразиты)
Santalaceae (Phacellaria,
Hylomyza, Dufrenoya и др.)
Loranthaceae (Loranthus,
Oryctanthus и др.)
Viscaceae
Rafflesiaceae
Lauraceae (Cassytha)
Cuscutaceae
МИК0ПАРАЗИТЫ
(АЛЛЕЛ0ПАРАЗИТЫ)
I
1-я форма 2-я форма
Burmanniaceae Orchidaceae
Corsiaceae
Ericaceae — Pyroloideae
Ericaceae — Monoiropoideae
Centianaceae (Bartonia,
Obolaria, Cotylanthera,
Leiphaimos, Voyria и др.)
Lobeliaceae (Lobelia)
Polygalaceae (Salomonia)
Petrosaviaceae
Triuridaceae
Схема 2. Основные группы паразитных цветковых растений
N. Вид
N. растения
Степень N*
адаптации N.
к паразитизму >ч
ФАКУЛЬТАТИВНО-
ПАРАЗИТНЫЕ
РАСТЕНИЯ
S
X
РАСТЕ
ы
2
т
н
РАЗИ
<•
С
АТНО-
[_
ОБЛИ
Растения-паразиты с
зелеными листьями
Бесхлорофнлльные
растения с фотосии-
тезнрующими
репродуктивными
побегами
Бесхлорофнлльные
растения с
биполярным развитием
проростков
(без стадии
"клубенька")
Бесхлорофнлльные
растения с фото-
еннтеэирующими
побегами,
биполярным развитием
проростка и стадиен
«клубенька»
Бесхлорофнлльные
растения с
биполярным развитием
проростка и стадией
"клубенька"
Бесхлорофнлльные
растения с
униполярным развитием
проростка, стадией
"клубенька"и
метаморфозом
. к
Euphrasia mimma
Mdampymm line
4ll"\
*liM
tj: /
\jg/
Cast'iUeya pallldc
Rhinchocorys
orientalis
/\f\
/'1
1 ** \
1 ч 1
1 */
I #*-
ч
4
4
1 *«/
I ill 1
>s/
Tozzia alpina
Г\С\
I i\lS} I
Lathraea squam
(V)
ш
a
о
и
-с
|>5
(¥1 /?»
11/Ш
<*>
-a
'о
•с
С
а
■с
|>5
ДОФ
Harveya сосете
0
Схема 3. Эволюционная редукция зародышей в подсемействе
Rhinanthoideae (Scrophulariaceae) в процессе адаптации к «корневому»
паразитизму (по: Терехин, 1977)
30
Системы репродукции
ные. Такому переходу возможно способствовало продолжающееся
«стрессовое давление».
После перехода чужеядных растений в облигатную форму «стрессовое давление»
приобретает иную направленность. Это связано с тем, что дальнейший прогресс в
направлении усиления адаптивной специализации растений-паразитов был обусловлен
воздействием такого мезологического фактора, как дискретное распределение
источника питания (растений-хозяев) в ареале того или иного вида паразитных растений
(Salisbury, 1942; Терехин, 1977). Этот мощный фактор, воздействуя посредством
естественного отбора, вызывает изменения, прежде всего в экологических функциях,
связанных с поиском подходящего растения-хозяина. Дело в том, что экологическая
специфика облигатного паразитизма заключается в необходимости (циклически
повторяемой в каждом новом поколении) поиска подходящего партнера по
паразитному симбиозу и установлении с ним метаболического контакта. Такой контакт
устанавливается каждый раз посредством гаусториального внедрения проростка паразита в
ткани корня растения-хозяина. В то же время проблема поиска подходящего хозяина
остается на стохастической основе. Достаточно очевидно в этой ситуации, что чем
больше семян произведет растение-паразит, тем, следовательно, будет выше
вероятность встречи его проростка с подходящим источником питания.
Проблема при этом заключается в ограниченных энергетических ресурсах
паразитного растения. Выход из подобной ситуации растения-паразиты
находят в приобретении двух новых адаптации: установление донор-зависимого
прорастания и увеличение количества производимых редуцированных семян
(Терехин, 1977, 1988, 1997). Донор-зависимое прорастание заключается в
том, что семя растения-паразита прорастает только под влиянием корневых
выделений растений-хозяев. При этом проросток паразита изменяет
геотропические функции апекса зародышевого корешка на хемотропические, приобретая
новый, способствующий выживанию, вектор прорастания.
Увеличение количества семян, производимых паразитным растением,
обеспечивается двумя путями: во-первых, увеличением поверхности плацентарных
структур за счет их разрастания и руминации и, во-вторых, редукцией
семязачатков. Переход к полному облигатному питанию за счет метаболических
связей с растением-хозяином приводит к замене биполярного развития проростка
паразита униполярным (в случае «корневого» паразитизма за счет сохранения
морфогенетического потенциала в базальном, «корневом» полюсе зародыша).
Редукция одного из морфогенетических потенциалов обеспечивает
возможность существенной редукции органов и тканей зародыша.
Таким образом, довольно сложные взаимодействия мезологических и этоло-
гических факторов приводят паразитные растения к существенным адаптивным
структурным изменениям. Основные структурные перестройки в этом
направлении: редукция семязачатков и зародышей при одновременном весьма
значительном увеличении количества производимых паразитным растением семян.
Крайние формы этих изменений можно видеть на примере наиболее
специализированных таксонов. При далеко зашедшей специализации к «корневому»
паразитизму, проростки Harveya coccinea, H. obtusifolia, Hyobanche sanguined
(подсем. Rhinanthoideae) и всех представителей подсем. Orobanchoideae
переходят к развитию с метаморфозом (см. Метаморфоз). Сходный путь
эволюционных преобразований совершают и «корневые» паразиты из семейств
Репродукция растений
31
Hydnoraceae и Rafflesiaceae, что также приводит к крайней редукции семян и
зародышей у этих растений.
В связи с крайней редукцией семян (приводящей к тому, что их называют
«пылевидными» семенами) происходит переход к анемофильной дисперсии семян
вместо, например мирмекохории в родах Melampyrum или Pedicularis. Безадресное
анемофильное распространение семян — мощный этологический фактор,
способствующий редукции семян и зародышей в условиях дискретного распространения
питающего субстрата (растений-хозяев).
Несколько иная картина складывается в «древних» семействах «корневых»
паразитов, таких как Balanophoraceae и Cynomoriaceae. У Cynomorium
coccineum, на фоне значительной редукции зародышей, в семени сохраняются
развитые структуры семенной кожуры и эндосперма. Единицей дисперсии
здесь служит односемянный плод, а агентами распространения — насекомые
(жуки, муравьи). При этом зародыш редуцирован до глобулярной структуры.
Эти особенности редукции обусловливаются характером агентов
распространения. Здесь сохраняется мирмекохория, что и объясняет, на наш взгляд, особую
организацию плодосеменного комплекса. Увеличение числа диаспор
проявляется у этого вида в увеличении числа плодов на соцветии. При этом мощные
соцветия циномориума располагаются всегда у самой поверхности почвы, что
несомненно способствует мирмекохории.
Несколько по иному, но в сходном направлении, происходили эволюционные
преобразования генеративных структур в сем. Balanophoraceae. У переходных
форм в этом семействе можно наблюдать постепенную редукцию (с последующей
элиминацией) структур семязачатков, а затем и плаценты (Терехин, 1985). Так
что у наиболее высокоспециализированных таксонов (Balanophora,
Langsdorffia) крайне мелкие пылевидные диаспоры представляют собой плоды,
которые содержат эндосперм с крайне редуцированным зародышем, но
совершенно лишены семян. Это тот редкий случай, когда плод полностью замещает
семя и в эколого-функциональном, и в морфологическом смысле.
Иной набор и соотношение факторов, а также результатов адаптивной
эволюции структур можно наблюдать в семействах «стеблевых» паразитов. Среди
этих растений четко различимы три пути адаптации к «стеблевому»
паразитизму. Первый путь связан с прямым адресным переносом генеративных диаспор
(плодов) со стеблей растения-паразита на стебли растения-хозяина (Viscum
album). Плоды у омелы белой довольно крупные, не имеют семян, но содержат
в своей полости хорошо дифференцированные на органы зародыши и
эндосперм. Однако радикула у таких зародышей преобразована в мощную гаустори-
альную структуру. В мезокарпе плодов содержится липкое вещество (висцин),
способствующее адгезии плодов на ветвях растений-хозяев, после их
выбрасывания птицами вместе с экскрементами. Геотропизм проростков замещен у этих
растений негативным фототропизмом. Омела белая в Европе состоит, по
меньшей мере, из трех биотипов (физиологических рас), связанных с разными
таксономическими группами растений-хозяев (Tubeuf, 1923). Адресное
распространение диаспор у омелы белой исключает необходимость образования их
большого числа каждым растением. Кроме того, необходимость достижения
проводящей системы хозяина через мощную кору его ветвей обусловливает
сохранение у зародыша паразита мощной гаусториальной структуры.
Рис. 1. Зародыши в семенах представителей подсем. Rhinanthoideae
(Scrophulariaceae) с разной степенью адаптации к паразитизму.
1 — Castilleya pallida, 2 — Striga baumanii, 3 — Lathraea squamaria, 4 — Striga hermonthica, 5
Harveya obtusifolia; бпз — базальный полюс зародыша, г — гипокотиль, р — радикула, с —
мядоля, энд — эндосперм. Масштабная линейка — 0,05 мм.
1—5 — по: Терехин, 1977.
Рис. 2. Редуцированные зародыши в зрелых семенах
паразитных представителей подсем. Orobanchoideae (Scrophulariaceae).
1 — Conopholis americanum, 2 — Epifagus americanum, 3 — Mannagettaea hummelii, 4 —
Phacellanthus tubiflorus, 5 — Xylanche himalaica; бпз — базальный полюс зародыша, зар —
зародыш, с к — семенная кожура, энд — эндосперм. Масштабная линейка — 0,05 мм.
1—5 — по: Терехин, Никитичева, 1981.
34
Системы репродукции
Второй путь эволюции стеблевого паразитизма связан с безадресным
распространением генеративных диаспор по схеме: растение-паразит — почва —
стебель растения-хозяина (Lauraceae — p. Cassytha, Cuscutaceae). Особенность
этой группы растений состоит в том, что проростки паразита, укрепившись в
почве, начинают активный поиск подходящих растений-хозяев. Именно с этим
связаны особенности эволюционных адаптивных преобразований зародышей этих
растений (избирательная редукция семядолей и радикулы), оригинальное
преобразование ткани эндосперма в зрелом семени, особенности роста и организации
проростков (Терехин, 1977).
Характер настоящего издания не позволяет нам столь же подробно обсудить
особенности адаптивной эволюции микопаразитов, свободноплавающих хищных
растений и некоторых групп водных погруженных растений (Терехин, 1977,1985).
Мы отметим здесь только некоторые основные аспекты этих процессов.
Довольно очевидно, что адаптивная эволюция в перечисленных выше
контрастных экологических группах подчинена в целом тем же закономерностям, что и в
группах ксенопаразитных растений, с учетом особенностей мезологических и это-
логических факторов, оказывающих влияние на их морфологическую эволюцию.
Мезо-этологические комплексы таких факторов инициируют вполне определенные
направления адаптивных эволюционных преобразований онтогенеза и
обусловливают их результаты. В частности, в группе «монотропоидных» микопаразитных
растений (Схема 2) из семейств Ericaceae (Monotropoideae, Pyroloideae), Bur-
manniaceae и некоторых других, мы обнаруживаем резкую интенсификацию
семенного размножения при существенной редукции зародыша и эндосперма.
Именно в этой группе растений можно наблюдать крайнюю степень редукции
зародышей в зрелых семенах, когда зародыш состоит всего из 2-3 клеток (Allotropa
virgata, Hypopitys monotropa). При этом, как и у Orobanche, морфогенетический
потенциал развития проростков сохраняется в базальном («корневом») полюсе
зародыша. Напротив, в сем. Orchidaceae морфогенетический потенциал в
редуцированных же, но с иной формой редукции, зародышах сосредоточен в апикальном
(«стеблевом») полюсе (Терехин, 1977). Безадресная анемохорная дисперсия
семян у всех микопаразитных растений при определенной дискретности в
распространении хозяев (микоризных грибов определенных таксонов) сопряжена с
образованием огромного числа пылевидных семян в плоде; у некоторых видов орхидей
образуется более 4 млн. семян в каждом плоде.
Для водных хищных растений характерна избирательная редукция зародышей,
при обязательном преобразовании базальной области зародыша в паренхимную
запасающую структуру, подобно таковой у орхидных (Терехин, 1977, 1985).
Теоретическое значение развиваемого нами направления — эволюционной
экологической эмбриологии — состоит в том, что эколого-морфологический подход
позволяет объективно определять направления эволюционных преобразований
онтогенеза, выявляя обусловливающие такие преобразования комплексы
мезологических и этологических факторов. Рис. 1, 2.
Гойман, 1954; Костычев, 1937; Терехин, 1972, 1977, 1985, 1988, 1991,1996; Фегри, Пейл ван
дер, 1982; Curtis, Cantlon, 1965; Gilbert eta)., 1996; Hambler, 1958; Heinricher, 1917; Lemee, 1976;
Pijl van der, 1969; Salisbury, 1942; Tubeuf, 1923.
Репродукция растений
~35~|
ВОСПРОИЗВЕДЕНИЕ, РАЗМНОЖЕНИЕ И ВОЗОБНОВЛЕНИЕ РАСТЕНИЙ
Самовоспроизведение и размножение является основным свойством живых
существ.
Размножением в широком смысле слова (sensu lato) называются все процессы,
которые приводят к увеличению биологических единиц, при этом предполагается,
что между старыми и новыми структурами имеется преемственность. Размножение
может происходить на разных уровнях — молекулярном, клеточном, тканевом,
органном, организменном и популяционном. Основой размножения является деление
клеток (цитогония — Hartman, 1929, 1936).
Несмотря на большое число исследований, посвященных различным сторонам
явления размножения, остается не совсем ясной биологическая сущность
отдельных типов, способов и форм репродукции и их взаимосвязи.
Классификация типов размножения (половое, бесполое и вегетативное
размножение), вероятно, должна быть пересмотрена, несмотря на то, что она
общепринята и опубликована в учебниках и в специальных работах (Battaglia, 1963; Васильев
и др., 1978; Письяукова, 1980; Серебрякова, 1980; Embryology of Angiosperms,
1984; Сладков и др., 1986).
Нет полной ясности в отношении таких терминов, как «вегетативное
размножение» и «возобновление». Необходимо также уточнить содержание термина
«репродукция», поскольку в литературе имеется разная его трактовка. В
последнее время, в связи с получением новых фактов, оказался дискуссионным и вопрос
об объеме таких понятий, как «половой процесс» и «половая репродукция». Все
эти понятия требуют уточнения, и совершенно правильно отметил van der Pijl
(1969): «...дифференциация терминов это не просто игра словами, но совершенно
необходимое условие, чтобы разобраться в природе вещей». На примере понятия
«половой процесс» нетрудно убедиться, насколько запутана терминология,
касающаяся размножения.
Mogie (1986) рассмотрел вопрос о биологическом и генетическом смысле
понятия «половой процесс» в связи с явлением автомиксиса. Он предложил
объединить в понятие «половой процесс» все репродуктивные процессы, включающие
слияние ядер, независимо от их происхождения (от разных или одного мейоза).
Fincham (1983) исключает из полового процесса слияния спермия с мей-
отически нередуцированной яйцеклеткой. Между тем Harlan и Wet De
(1975) считали, что это явление, спорадически встречающееся у большинства
организмов из-за нарушения мейоза, имеет важное значение для филогении
растений. Таков, как считают многие авторы, обычный путь полиплоидиза-
ции у растений (см. Франк, 1988).
Под половым процессом в типичной его форме у растений понимают слияние
двух половых клеток — гамет и образование зиготы (см. Ботаника, 1978).
Таким образом, в трактовке понятия «половой процесс» у цветковых растений
игнорируется один из его ключевых периодов (фаз) — мейоз.
С нашей точки зрения половой процесс включает мейоз и слияние гамет (от
разных мейозов), в результате чего образуется зигота, т. е. новый индивидуум.
36
Системы репродукции
Термин «половой процесс» в литературе часто подменяется понятием
«половое размножение». Однако эти термины не являются синонимами. При половом
процессе не происходит увеличения числа особей, так как из зиготы,
образовавшейся от слияния мужской и женской гамет, образуется, как правило, один новый
организм (Жуковский, 1964). Поэтому, когда имеет место только один половой
процесс, следует говорить о воспроизведении, а не о размножении. Увеличение
полового потомства обеспечивается только множественностью семязачатков,
пыльцевых зерен, гамет и зигот, а значит «множественностью половых
процессов». Все вышесказанное позволяет отказаться от термина «половое
размножение» применительно к цветковым растениям (Жуковский, 1964; Серебрякова,
1978 — см. Васильев и др., 1978), исключить его из общепринятой классификации
типов размножения (половое, бесполое и вегетативное).
Определения «половой» и «бесполый» следует использовать только для
способа образования новой особи (с участием мейоза и гамет или без участия).
У различных групп растений встречаются разные типы полового процесса: изо-
гамный, гетерогамный, оогамный и др. Цветковым растениям присуща только
оогамия (см. Васильев и др., 1978).
В отечественной и зарубежной литературе часто смешивают понятия
«размножение», «воспроизведение», «репродукция», а иногда под последним даже
понимают «половой процесс». В этом ключе еще Darlington (1958), а позднее Johri
и Lewis (1975) и другие авторы определяли «половую репродукцию» (а не половой
процесс — Т.Б.) как процесс, включающий мейоз и оплодотворение. Dick (1987)
также использовал термин «половая репродукция» для объяснения полового
процесса (процесса слияния ядер, производных разных мейозов (алло- и автогамия)).
В отличие от Mogie (1986), слияние ядер одного мейоза он определял как
«псевдосексуальную репродукцию». Практически и в этом случае автор смешивает
различные понятия. Вероятно, корректнее говорить о псевдосексуальном процессе.
Сладков (1986) заменяет понятие «воспроизведение» понятием «генеративное
размножение», которое связывает со сменой ядерных фаз. При этом в него
включает и бесполое размножение (спорами) и половое размножение. Все
вышесказанное говорит о том, насколько сложна и дискуссионна эта проблема и как сильно это
осложняет понимание всех явлений, наблюдаемых при размножении растений.
Одним из источников такого смешения понятий в отечественной литературе, вероятно,
является перевод на русский язык термина «reproduction» (англ., фр.) или
«reproduktion» (нем.) как репродукция, воспроизведение, размножение,
возобновление (растений) (Англо-русский, немецко-русский и
французско-русский биологические словари). Сходная ситуация в большинстве случаев
имеет место и в зарубежной литературе. Только анализ контекста статьи, в которой
употребляется термин «reproduction» позволяет понять, в каком значении авторы
его используют — в плане ли воспроизведения или размножения.
Один из крупных итальянских ученых Battaglia (1963) внес определенную
ясность в этот сложнейший биологический вопрос. Известно, что организмы могут
возникать в одной и той же фазе (в онтогенетическом смысле, т.е. спорофит от
спорофита) или в противоположной (антитетической) фазе (т.е. спорофит от га-
метофита). С этой точки зрения репродукцию можно разделить, соответственно,
на гомофазную и гетерофазную. В этой связи, Battaglia предлагает
использовать два различных термина: «репродукция» («reproduction») (для гетерофаз-
Репродукция растений
37
ного увеличения численности) и «размножение» («multiplication») (для гомо-
фазного увеличения).
Мы полагаем, что термин «репродукция» или «воспроизведение» следует
использовать независимо от способа образования одной новой особи (с помощью
полового процесса или бесполого), а для увеличения числа половых и неполовых
потомков — термин «размножение» (Батыгина, 1992, 1993). Вероятно, для того,
чтобы знать с каким типом потомков мы имеем дело, к термину «репродукция», но
не к термину «размножение», можно добавить определение «половая» (гетерофаз-
ная репродукция) или «бесполая» (гомофазная репродукция).
Однако процессы, связанные с различными формами размножения,
разнородны, и, прежде чем анализировать их биологическое значение, необходимо
условиться о разграничении. На первый взгляд, все поставленные вопросы, связанные с
размножением, могут многим показаться чистой риторикой, так как размножение
растений, его формы и типы, якобы нам хорошо известны. Однако, к сожалению,
как мы убедились в этом, трактовка многих понятий не отражает сути явления как с
генетической, так и общебиологической точек зрения.
Рассмотрим термины «бесполое» и «вегетативное» размножение. О
бесполом типе размножения говорят «в узком смысле» и «в широком». В первом
случае имеется в виду размножение спорами, а во втором — вегетативное
размножение, осуществляемое вегетативными частями, органами и отдельными
клетками растения. Вегетативное размножение способствует сохранению ге-
терозисных, полиплоидных форм и различных соматических мутаций
(Петров, 1966; Письяукова, 1980; см. Ботаника, 1978; БСЭ, 1987; Солнцева,
1991). Письяукова предложила использовать только термин «вегетативное
размножение», считая, в общем, применение термина «бесполое
размножение» тавтологией. Мы разделяем ее точку зрения. Попытаемся это
объяснить. Принято считать, что у цветковых растений споры утратили свои
основные функции, связанные с размножением и расселением. С этой точки зрения,
у цветковых растений бесполое размножение отсутствует1.
Если материнское растение образует множество дочерних особей без участия
полового процесса, т.е. бесполым способом, то такой процесс обычно принято
называть вегетативным размножением.
Следует отметить, что в процессе эволюции пути морфогенеза при
образовании нового индивидуума бесполым способом, вероятно, претерпели изменения.
Свидетельством этого является то, что у некоторых цветковых растений
вегетативное размножение идет не только почками и корнями (гемморизогенез), но и
специализированными биполярными вегетативными диаспорами — пропагула-
ми, представленными либо эмбриоидами (гомофазная вивипария) (Batygina et
al., 1996), либо «выводковыми почками», луковичками, бульбочками и т.д.
(Batygina, 1989, 1990) (см. Диаспора).
Следовательно, вегетативное размножение у цветковых — один из типов
размножения, при котором новые индивидуумы (особи) образуются двумя способами
— гемморизогенным и эмбриоидогенным.
Действительно, в ходе эволюции у цветковых растений процесс образования новых особей из
мега- и микроспор, практически утратил свое значение. Тем не менее, следует отметить, что эти
потенции (резервы) сохранились, что подтверждается экспериментальными данными по получению
гаплоидных и диплоидных особей из микро- и мегаспор в культуре in vitro (Батыгина, 1987).
38 Системы репродукции
Понятие «размножение растений» помимо вегетативного включает и семенное
размножение (см. Семя и семенное размножение).
При рассмотрении семенного и вегетативного размножения продолжает
оставаться неясным очень важный вопрос о соотношении этих процессов у различных
таксонов. Это, вероятно, можно объяснить методическими сложностями изучения
этих длительных процессов. Кроме того, при обсуждении различных типов, форм и
способов воспроизведения и размножения возникают вопросы: как соотносятся
между собой «семенное размножение» и «семенное воспроизведение», а также
«вегетативное размножение» и «вегетативное возобновление». Этой проблеме
большое внимание было уделено многими авторами (Шалыт, 1960; Работнов,
1969,1974; Серебряков, 1952; Серебрякова, 1978; Левина, 1981).
Термины «размножение» и «возобновление» обычно обсуждаются вместе, но
следует их различать, так как первый относится к особи, а второй — к
популяции. Кроме того, следует отметить, что, хотя в основе возобновления вида в целом
(или популяции) лежит размножение особей, термин «размножение» к системам
надорганизменного уровня не применяется (см. Левина, 1981: 10).
При таком разграничении понятий под «вегетативным возобновлением»
понимают возобновление популяции на базе вегетативного размножения. Процесс
восстановления утраченных надземных частей называют «отрастанием»,
выделено 4 типа отрастания (Работнов, 1974).
Как известно, семенное размножение, так же как и вегетативное, приводит к
увеличению числа особей, но возобновления размножающейся особи при этом
не происходит. Поддержание оптимальной плотности популяции за счет
семенного размножения особей Левина определяет как «семенное
возобновление». Семенное возобновление определяет биологическую результативность
процесса репродукции.
Семенное размножение, так же как и вегетативное возобновление, зависит от
множества различных факторов и поэтому является процессом стахостическим.
Основными факторами, вероятно, являются метеорологические, эдафические,
аллелопатические, паразитические и конкуренция.
Все выше рассмотренные процессы и явления — половой и бесполый
процессы, гетерофазая и гомофазная репродукция, семенное и вегетативное
возобновление — протекают сопряженно, при этом между ними выявляются
определенные корреляции, которые позволяют сохранять гомеостаз вида и популяции.
Дискуссионным также является использование термина «чередование
поколений». Термин был предложен Hofmeister (1851) и перенесен им из
зоологической литературы. Впоследствии классическими исследованиями Hofmeister,
Strasburger, Горожанкина, Беляева, Арнольди, Навашина, Мейера было
показано, что все растения (моховидные, плауновидные, папоротниковидные,
голосеменные и цветковые) проходят в своем развитии две чередующиеся друг с
другом фазы: бесполого — спорообразующего поколения (фазу спорофита) и
полового — гаметообразующего поколения (фазу гаметофита). С легкой руки
Гофмейстера большинство исследователей для этих фаз используют понятие
«чередование поколений», которое, однако, не отражает суть тех явлений,
которые имеют место в жизненном цикле цветковых растений.
Как совершенно справедливо отмечает Поддубная-Арнольди (1976), в прежних
исследованиях, особенно на цветковых, часто гаметофит и спорофит рассматривали в
Репродукция растений
39
отрыве друг от друга, приписывая им слишком самостоятельное значение, что,
возможно, и явилось одной из причин называть эти разные фазы развития в жизненном
цикле «поколениями». Поэтому Поддубная-Арнольди полагала, что правильнее
говорить о фазах, так как они настолько тесно связаны друг с другом, что их нельзя
рассматривать в отрыве друг от друга, поскольку растение является одним
целостным организмом. Автор подчеркивает, что главное различие этих фаз кроется не в
числе хромосом, а в их биологии. В этом аспекте высказывался также Голлербах
(цит. по Левиной, 1961), предложив понятие «смена форм развития». Следует еще
раз напомнить, что не всегда чередование этих фаз («поколений») протекает со
сменой ядерных фаз, так как известно, что при некоторых формах апомиксиса у
некоторых растений в индивидуальном развитии отсутствует смена ядерных фаз.
Кроме того, термин «смена поколений» занят генетиками, которые используют
его в полном смысле слова как воспроизведение новых особей, рожденных
материнским организмом, (при этом каждое новое поколение, образующееся в процессе
размножения, обычно представляет вид с основными его морфологическими и
биологическими особенностями).
Вероятно, можно согласиться с Левиной (1961), что в настоящее время, в свете
новых данных, для цветковых растений лучше не использовать понятие
«чередование поколений», как не отвечающее существу явления. Однако, следует сказать,
что понятие «чередование поколений» сыграло положительную роль в науке, так
как помогло выявить единство происхождения различных групп растений.
Батыгина, 1987,1992,1993; Васильев и др., 1978; Жуковский, 1964; Васильев и др., 1978;
Левина, 1981; Петров, 1966; Письяукова, 1980; Поддубная-Арнольди, 1976; Работнов, 1969,1974;
Серебряков, 1952; Серебрякова, 1980; Сладков, 1986; Солнцева, 1991; Ботаника, 1978; Франк,
1988; Шалыт, 1960; Battaglia, 1963; Batygina, 1989,1990; Batygina et al., 1996; Darlington, 1958;
Dick, 1987; Frincham, 1983; Harlan, Wet De, 1975; Hartman, 1929,1936; Hofmeister, 1851; John,
Lewis, 1975; Mogie, 1986; Pijl van der, 1969.
ВИВИПАРИЯ (лат. vivus — живой, pario — рождать), или живорождение —
способ воспроизведения и размножения, при котором генеративная диаспора,
содержащая зародыш, или вегетативная диаспора без периода покоя, образуют
проростки (пропагулы) еще на материнском организме.
Феномен живорождение у животных был известен еще во времена Аристотеля
(IV век до н.э.). Он использовал вивипарию как признак, при составлении
классификации животных (живородящие и яйцеживородящие).
Вивипарию у растений (Festuca ovina) впервые описал Linnee (1737). Нами
установлена вивипария у 173 видов цветковых растений1, принадлежащих 43
семействам, расположенным как в основании филогенетической системы
(Nymphaeaceae, Ranunculaceae), так и в верхней ее части (Orchidaceae,
Роасеае). Приуроченность образования проростков к определенным
генеративным и вегетативным органам таксоноспецифична (Батыгина, 1996).
Первый обзор живородящих растений был сделан Braun (1859), который
понимал явление вивипарии широко. Позднее к этой точке зрения присоединились
многие исследователи (Semarder, 1927; Stebbins, 1951; Heslop-Harrison, 1953; Ва-
Кроме цветковых растений, известно 197 видов живородящих папортников, принадлежащих к
8 семействам (Мс Veigh, 1937).
40
Системы репродукции
сильев и др., 1978; Генкель, 1979; Batygina, 1989; Batygina et al., 1996). Braun
разделил живородящие растения на 6 групп по следующим признакам:
1. Зрелые семена прорастают на материнском растении в раскрывшихся плодах
(Juncus, Epilobium, Agrostemma) или внутри закрытых плодов (Cucurbita
me.lope.po, Carica papaya, Persea gratissima, Araucaria brasiliensis, Bulbine
asiatica, представители родов Rhizophora, Ceriops, Kandelia, Bruguiera). При
этом такое прорастание может происходить регулярно и спорадически.
2. В плодах вместо семян образуются вегетативные почки (представители сем.
Amaryllidaceae). Однако сам автор ставит под сомнение возможность такого
типа вивипарии, указывая на необходимость дополнительных исследований.
3. Живородящие структуры возникают в результате преобразования пестика
(Nymphaea alba, N. lotus).
4. На месте или вблизи цветков образуются выводковые почки (луковички, буль-
бочки) (нем. Brutknospen) (например, Polygonum viviparum, Allium oleraceum,
Cagea bulbifera, Lilium tigrinum, Dioscorea batatas, Locheria pedunculata,
Alisma natans).
5. Соцветие или только его верхняя часть преобразуется в вегетативный побег
{Ananas, Plantago lanceolata, Eryngium viviparum, Poa alpina var. vivipara, P.
bulbosa var. vivipara).
6. Выводковые почки образуются на листьях (Cardamine, Nymphaea, Kalanchoe
= Bryophyllum, Hammarbya paludosa). В зависимости от их местоположения
на листе автор разделяет эти растения на несколько групп (см. подробнее
Выводковая почка).
Объем понятия «вивипария» до настоящего времени остается дискуссионным, в
связи со слабой изученностью его структурных основ.
На основании того, что существуют два типа диаспор (генеративные и
вегетативные) (см. Диаспора), Sernarder (1927) предложил разделить вивипарию на
генеративную (образование проростков у мангровых) и вегетативную (образование
проростков в соцветии у Poa bulbosa, Festuca ovina var. vivipara). В зависимости от
роли, которую играет это явление в жизни растения, он различал облигатную и
факультативную вивипарию.
Однако некоторые исследователи считают вивипарией только случай
прорастания зародыша на материнском растении у ряда мангровых, так называемая
истинная, или настоящая вивипария (Goebel, 1932; van der PijI, 1969, 1982;
Robyns, 1971). Случаи же трансформации отдельных цветков или их частей, или
всех цветков соцветия в вегетативные побеги, служащие нередко органами
вегетативного размножения (выводковые почки, луковицы, клубеньки), относят к
так называемой «ложной вивипарии», или «псевдовивипарии» (Goebel, 1932;
van der PijI, 1969, 1982). По мнению Шульц (1939), псевдовивипария — это
один из случаев пролифекации.
Ряд авторов рассматривают некоторые случаи вивипарии — образование
выводковых почек на месте цветков или соцветий (Winkler, 1908; Stebbins, 1951;
Heslop-Harrison, 1953), а также их образование в дополнение к цветкам
(Gustafsson, 1946) — как вегетативный апомиксис.
Случай, когда только верхние цветки в соцветии преобразованы в выводковые
почки, а нижние цветки имеют нормальное строение, некоторые авторы называют
полувивипарией (Turesson, 1926-1931; Wycherley, 1953).
Репродукция растений
41
Иногда к живорождению относят случаи аномального видоизменения цветка
(Гандилян, 1961), при этом используется словосочетание «тератологическая
вивипария» (Juncosa, 1982).
Попытка учесть все случаи вивипарии была предпринята Генкелем (1979),
который предложил следующую классификацию:
I. Эувивиария
1 — репродуктивная вивипария — прорастание единственного семени на
материнском растении;
2 — криптовивипария — зародыш прорастает внутри плода, находящегося на
материнском растении;
3 — репродуктивно-вегетативная вивипария — вместо семян в соцветиях
образуются выводковые почки.
II. Псевдовивипария
1 — вегетативная псевдовивипария — образование почек на стебле, в пазухах
листьев и на листьях;
2 — репродуктивная псевдовивипария — прорастание семян в снопах при
влажной погоде.
С нашей точки зрения, принцип, положенный автором в основу разделения
явления вивипарии на эу- и псевдовивипарию, не совсем корректен, так как случаи
вивипарии, имеющие общую структурную основу, Генкель рассматривает в
качестве разных проявлений вивипарии. Так, несмотря на то, что выводковые почки,
образующиеся в цветке, соцветии, на листе и стебле, имеют одинаковое
происхождение — из соматических («телесных») клеток спорофита — автор отнес их к
разным категориям вивипарии. Прорастание семян в снопах при влажной погоде
логичнее отнести к эувивипарии, поскольку, оно происходит без периода покоя,
как и при развитии полового зародыша мангровых.
Разделение вивипарии на истинную (эувивипарию) и ложную
(псевдовивипарию), на наш взгляд не оправдано, так как в обоих случаях образуется новое
жизнеспособное растение. Предложенная Генкелем классификация вряд ли может быть
использована, так как она не только не вносит ясности в понимание сложного
явления вивипарии, но и запутывает многие его аспекты. Однако несомненной заслугой
автора является выделение, в качестве особого типа вивипарии, прорастания
семени в плоде (криптовивипария).
Классифицируя различные случаи вивипарии, мы исходили из того, что
репродукция растений бывает гетерофазной (мейоз и оплодотворение) и гомофазной
(без мейоза и оплодотворения) (Battaglia, 1963; см. Воспроизведение,
размножение и возобновление). При разработке классификации мы использовали
разделение вивипарии на генеративную и вегетативную, предложенное Sernarder
(1927). При этом нами учитывалось происхождение нового растения, т.е. его
генотип, способ его образования и путь морфогенеза (Табл.).
Генеративная вивипария осуществляется на базе генеративной диаспоры,
содержащей половой зародыш, который прорастает на материнском растении. При
этом образовавшийся проросток либо освобождается от плодовых оболочек (фа-
неровивипария, греч. phaner(o) — явный + vivus + pario), либо остается в них
(криптовивипария, греч. kriptos — скрытый + vivus + pario).
Вегетативная вивипария осуществляется на базе вегетативной диаспоры,
возникшей без участия полового процесса (мейоза и оплодотворения). Следует учитывать,
42
Системы репродукции
что развитие вегетативной диаспоры может идти двумя путями морфогенеза — геммо-
ризогенным или эмбриоидогенным (Батыгина, 1987, 1992, 1993, 1997; Batygina,
1989,1991). На основании этого мы разделяем вегетативную вивипарию на геммори-
зогенную и эмбриоидогенную. При систематизации явления вивипарии учитывалось
место формирования вегетативных диаспор на растении (соцветие — инфлоральная
вивипария, лист — фолиарная, стебель — каулигенная, корень — ризогенная).
Под полувивипарией мы понимаем образование и прорастание вегетативных диаспор
в соцветии, при наличии в нем нормальных цветков, а также формирование растением
двух типов соцветий (только с вегетативными диаспорами и только с цветками). Как
генеративная вивипария, так и вегетативная могут иметь облигатную и
факультативную форму. В отличие от классификации Sernarder (1927), мы считаем, что к
вегетативной вивипарии следует относить также случаи образования проростков на листьях и
формирование их в результате метаморфоза пестика.
Таблица: Классификация явления вивипарии
ВИВИПАРИЯ
ГЕНЕРАТИВНАЯ
(гатерофазпая)
фанеровивипария
криптовивипария
ВЕГЕТАТИВНАЯ
(гомофазная)
гем моризогенная
инфлоральная
фолиарная
каулигенная
ризогенная
инфлоральная*
фолиарная
каулигенная
ризогенная*
эмбриоидогенная
фанеровивипария*
криптовивипария*
*Такие формы вивипарии у растений еще не обнаружены, но теоретически они возможны
у видов, имеющих семена с несколькими зародышами.
Следует разделять случаи образования жизнеспособных вегетативных диаспор,
прорастающих на материнском растении, от случаев метаморфоза цветка
вследствие пролификации.
Генеративная вивипария
У многих растений мангровых зарослей, расположенных в различных частях
тропического пояса земного шара отмечена облигатная вивипария. Это типичная
прибрежная растительность морских заливов, проливов, лагун и устьев больших
Репродукция растений
43
рек. Растения, входящие в состав мангровых, произрастают при временном или
постоянном затоплении соленой водой (Генкель, Фан И-сунь, 1958). Для
многих из них (в частности, Rhizophora, Bruguiera, Ceriops) характерно необычное
прорастание семени: зародыш развивается без периода покоя, выходит из
семенной кожуры и пробивает стенку плода, которая остается вместе с проростком на
материнском растении (Ray, 17 век, цит. по Davis, 1940; Braun, 1859; Warming,
1883; Goebel, 1886; Karsten, 1891; Haberlandt, 1897; Guppy, 1906; Kipp-Goller,
1940; Морщихина, 1981; Плиско, 1996).
В завязи Rhizophora формируются 4 семязачатка, однако после
оплодотворения в большинстве случаев развивается только один (Cook, 1907;
Kipp-Goller, 1940). Эмбриогенез зародыша по Onagrad-типу. Способ
заложения и ранние этапы развития семядолей у представителей Rhizophoraceae
необычны для покрытосемянных. Семядоли в результате конгенитального
срастания долгое время растут как единое «семядольное тело». В позднем
эмбриогенезе и постсеменном развитии представителей родов Rhizophora,
Bruguiera и Ceriops выделяют три фазы роста и прорастания зародыша: 1
— рост зародыша в семени; 2 — «прорастание» и 3 — подготовка к
отделению проростка (Cook, 1907; Juncosa, 1982).
В период первой фазы наиболее активный рост происходит в апикальной
части «семядольноготела». «Семядольное тело» срастается с внутренним инте-
гументом, образуя плацентарный орган, через который осуществляется питание
зародыша. После того как «семядольное тело» заполнит полость семени, в
результате активного роста в базальной части зародыша формируется гипоко-
тиль. Также происходит активный рост эндосперма, который выступает из
раскрывшегося микропиле и глубоко внедряется в аэренхимную часть плода, а
также проникает между семенной кожурой и стенкой плода, функционируя как
гаусторий, при этом его наружные слои обнаруживают меристематическую
активность (Chapman, 1962, Плиско, 1996). В самом наружном слое эндосперма
проявляются признаки специализации, характерные для передаточных клеток
(Gunning, Pate, 1969). Большая часть эндосперма внутри семени к концу 1
фазы разрушается и потребляется зародышем.
В фазу «прорастания» сначала происходит разрастание гипокотиля,
дифференциация его тканей (Никитичева, Яковлев, 1985; Плиско, 1996). Из крошечной
структуры 1 мм длиной проросток вырастает до 15-65 см, а иногда и до 1 м
(Haberlandt, 1895; Kipp-Goller, 1940). Одновременно происходит уплотнение
тканей гипокотиля и кончика корня (накапливаются танины, откладываются друзы ок-
салата кальция, дифференцируются трихобласты, каменистые клетки) (Kipp-Goller,
1940; Плиско, 1996). Когда кончик главного корня только на несколько сантиметров
выходит из плода, закладываются адвентивные и боковые корни (5-10 шт.).
Обычно, главный корень отмирает до отделения проростка, у Bruguiera он сохраняется
(Kipp-Goller, 1940). На поверхности гипокотиля дифференцируются чечевицепо-
добные образования (Rhizophora, Ceriops) или устьица (Bruguiera),
осуществляющие газообмен (Kipp-Goller, 1940; Juncosa, 1982; Плиско, 1996). Тело семядоли
снаружи от микропиле приобретает форму «фригийского колпачка» и служит опорой
для тяжелого проростка. В процессе развития проростка происходит
дифференциация его проводящей системы (Haberlandt, 1895; Cook, 1907; Carey, 1935;
Cipp-Goller, 1940; Juncosa, 1982). В результате активности апикальной меристемы
44
Системы репродукции
побега у R. mangle и Ceriops candolleana возникают три пары эпикотилярных листьев
с прилистниками (первая из которых у R. mangle отмирает) (Juncosa, 1982).
В фазу подготовки к отделению проростка продолжается дифференциация
проводящей системы проростка и дальнейшее развитие боковых корней.
Начинается активный рост базальной части «семядольного тела» и формирование
семядольной трубки, прикрывающей почечку. Базальный рост имеет место до тех пор,
пока почечка в окружении семядольной трубки не окажется за пределами плода.
Отделительный слой, образуется у Rhizophora на уровне почечки в семядольном
узле, а у Bruguiera — между семядолями и гипокотилем (Кернер, 1899; Cook,
1907; Juncosa, 1982). Проростки остаются на дереве 30-39 недель, а иногда год
(Морщихина, 1981).
Под действием силы тяжести проростки падают (у В. eriopetala вместе с
плодом) и втыкаются в ил почти вертикально (Karsten, 1891; Haberlandt, 1895;
Schimper, 1898; Kipp-Goller, 1940). Опавшие проростки, лежащие на более
плотном грунте, укореняются лежа, постепенно поднимаясь. Проростки
мангровых способны сохранять жизнеспособность, находясь в морской воде (до года)
или при длительном высушивании (до 68 дней) (Морщихина, 1981). Во время
прилива отмечено перемещение проростков на значительные расстояния,
дальность которых во многом зависит от веса проростков (Schimper, 1898; Генкель,
Фан И-сунь, 1958).
Генеративная вивипария установлена также yAvicenia (Avicenniaceae) и
морской травы из рода Amphibolis (Cymodoceaceae) (Chapman, 1962; Цвелев, 1981;
Juncosa, 1982). Кроме того, это явление характерно для ряда мутантов Zea
(Robertson, 1955) и Arabidopsis (Koornneef et al., 1984; Koornneef, 1986;
Giraudatetal.,1992).
К факультативной генеративной вивипарии следует отнести случаи
преждевременного прорастания зародышей в зерновках хлебных злаков и в плодах у
некоторых плодовых растений (яблоня, земляника, некоторые тыквенные).
Факультативную вивипарию может вызвать стресс (например, изменение влажности и
температуры) (Chapman, 1962).
Вегетативная вивипария
Гемморизогенная вивипария
Инфлоральную вивипарию впервые описал Linnee (1737, 1755) у Festuca
ovina. В настоящее время живородящие формы отмечены у многих видов злаков. У
одних видов они являются редким исключением, у других встречаются довольно
часто. Живородящие формы злаков тяготеют к горным странам Европы,
прилегающим к Атлантике вплоть до Северного Ледовитого океана, а также к
территориям всего континентального севера России, к горам Средней Европы и Альпам
(Шульц, 1939). Из 130 видов злаков, произрастающих в Шотландии, 4 вида
являются живородящими (Festuca vlvipara, Poa alpina, P. xjemtlandica и Deschampsia
alpina) и 28 — способны к пролиферации (Harmer, 1984). Растения, выросшие из
вегетативных диаспор, образовавшихся на соцветии, обладают большей
тенденцией к вивипарии, чем растения, полученные из семян. Вероятно, живородящие
формы злаков являются экотипами, тесно связанными с формами, которые образуют
нормальные семена (Salvesen, 1986). Возможно, живородящие формы заменили
семенные в их прежних местообитаниях (Harmer, 1984).
Репродукция растений
45
Вивипарные овсяницы высокогорных широт (о. Шпицберген и восточная
часть Канадского архипелага) размножаются только вегетативно,
генеративные органы у них полностью отсутствуют (Fernald, 1933; Scholander, 1934).
Однако по южной окраине ареала наблюдается «полувивипария» (Turesson,
1926-1931; Wycherley, 1953), при которой становится возможной
гибридизация вивипарных овсяниц с другими, невивипарными видами, если таковые
произрастают поблизости (Сипливинский, 1973).
Подробно изучено образование выводковых почек (луковичек) у живородящих
и полувивипарных форм Poa bulbosa (Пополина, 1960,1962; Рожановский, 1961;
см. также Выводковая почка). На начальной стадии формирования колосок
живородящей формы по своему строению подобен вегетативному побегу, который в
процессе дальнейшего развития превращается в луковицу. Зрелая выводковая
луковичка в естественных условиях впадает в покой, длительность которого
определяется конкретными условиями обитания. Вопрос о том, прорастает ли она на
материнском растении, остается открытым (Рожановский, 1961). Размножение с
помощью вегетативных диаспор характерно также для двух близкородственных
видов P. alpigena и P. sublanata (Сарапульцев, 1998). У некоторых видов злаков
(например, P. alpina var. vivipara) возможен временный возврат живородящей
формы к плодоносящей (Hunger, 1887; Schuster, 1910; Exo, 1916).
Заслуживает внимания экспериментальная работа по индукции вивипарии у
Deschampsia flexuosa nAgrostis vulgaris (Шульц, 1939). Выращивание растений
на коротком дне (10 час.) вызывало усиление ветвления, удлинение периода
вегетации и появление на подгоне метелок с вивипарными колосками. Было отмечено
увеличение числа цветков в колоске и изменение строения нижних колосков либо
всех колосков, либо всей метелки. Наблюдалось позеленение оснований
колосковых и цветковых чешуи, а также редукция тычинок и завязей. Большинство
метелок имело полувивипарный характер — часть колосков были фертильные, другие
представляли собой укороченные побеги. Однако самопроизвольного падения
этих укороченных побегов в условиях эксперимента не наблюдалось.
Отмечены случаи метаморфоза цветка или колоска Triticum в вегетативный
побег, в основании которого формировались корни (Гандилян, 1961). При этом
ось цветка превращалась в листовую пластинку, а чешуя — во влагалище листа.
Инфлоральная гемморизогенная вивипария наблюдается также у Polygonum
viviparum — широко распространенного вида, произрастающего от арктической до
умеренной зоны. Габитус этого растения значительно варьирует в зависимости от
условий местообитания. Изменчивость касается размеров растения, количества
цветков и клубеньков в соцветии, окраски околоцветника и клубеньков (Белявская, 1949;
Engell, 1973; Law et al., 1983). Выявлена обратная корреляция между количеством
цветков и клубеньков (Law et al., 1983). Несмотря на наличие цветков в соцветии,
некоторые авторы ставили под сомнение эффективность половой репродукции, так
как в изученном материале не было найдено жизнеспособных семян (Callaghan,
1973; Engell, 1973). Позже было показано, что при благоприятных условиях половая
репродукция все же возможна (Law et al., 1983).
Внутренние (генотип растения, количество соцветий на одном растении) и
внешние (плотность растительного покрова) биотические факторы
окружающей среды играют определенную роль в контроле образования и развития
цветков и клубеньков (Law et al., 1983). Клубеньки у P. viviparum трогаются в рост
46
Системы репродукции
в условиях повышенной влажности (Callaghan, 1973; Engell, 1973, 1978;
Petersen, 1981).
Наблюдение за семяобразующими и вивипарными представителями рода
Allium показали, что, по-видимому, между ними есть последовательные
переходы (Устинова, 1944). По мнению Устиновой, типичные вивипарные виды
должны рассматриваться как разновидности, обособившиеся в процессе
эволюции. Бульбочки у Allium закладываются в пазухах прицветников после
заложения цветочных почек.
Факультативная инфлоральная вивипария отмечена у представителей рода
Cymbopogon (Dutt, Bradu, 1973; Naveen et al., 1977). Увеличение влажности
воздуха и почвы (после сезона дождей) привело к образованию новых растений
на прошлогодних соцветиях: либо на каждом узле соцветия, либо на оси оберток
старых кистей. Формирование проростков на соцветии наблюдалось нами у
Kalanchoe daigremontiana в конце цветения.
Фолиарная вивипария. Образование новых растений на листьях описано у
Cardamine pratensis и Nymphaea guianensis (Braun, 1859; Кернер, 1902; Ильинский,
1945), Hammarbya paludosa (Dichie, 1875; Fuller, 1966; Taylor, 1967; Reeves,
Reeves, 1984; Вахрамеева, 1991; Татаренко, 1996; Bragina et al., 1996; Batygina,
Bragina, 1997). Вегетативные пропагулы Н. palludosa образуются на листьях и в
редких случаях на прицветниках. Число пропагул на одном листе колеблется от 7 до 35
штук, при этом на нижних листьях их больше, чем на верхних. Пропагулы
формируются экзогенно за счет пролиферации верхнего эпидермиса листа. Из
образовавшихся меристематических очагов развиваются меристематические бугорки, имеющие
дорсовентральное строение. На внешней стороне меристематического бугорка
начинаются периклинальные деления, которые распространяются по всей окружности.
Это приводит к образованию серповидного валика и затем, в процессе его
дальнейшего роста, к формированию сплошного кольца (примордия первого листа). Первый
лист пропагулы постепенно обрастает среднюю часть меристематического бугорка, в
то же время происходит формирование внутренней части пропагулы. Последняя в
ходе своего развития приобретает яйцевидную форму.
Позднее наблюдается дифференциация клеток внутренней части пропагулы
(«яйцевидной структуры»), в которой можно выделить три зоны — апикальную, среднюю
и базальную. Эти зоны отличаются по клеточному составу и содержанию в клетках
крахмала. На более поздней стадии развития «яйцевидная структура» приобретает
дорсовентральное строение за счет разрастания одной из ее латеральных сторон. В
результате чего меристематические клетки в апикальной зоне «смещаются» на
латеральную сторону верхушки «яйцевидной структуры». От зоны этих клеток через всю про-
пагулу проходит центральный тяж вытянутых клеток. За счет дериватов апикальной
меристемы формируется апекс побега с примордиями трех листьев.
Первый лист пропагулы выполняет защитную и трофическую функции.
Особенностью развития первого листа пропагулы является высокая степень тотипо-
тентности его клеток, за счет которых в определенных условиях образуются
вторичные пропагулы. Формирование адвентивного корня пропагулы в конце периода
вегетации (ноябрь) не наблюдалось. Возможно, его заложение и развитие
происходит после отделения пропагулы от листа (зимой или ранней весной). Вероятно,
можно предположить, что формирование корней в пропагуле зависит от
местообитания материнского растения и метеорологических условий каждого сезона. Воз-
Репродукция растений 47_
можно, в процессе эволюции способность к формированию пропагул и развитию из
них новых растений сохранилась как резерв системы репродукции Hammarbya,
I проявляющийся в условиях стресса.
Эмбриоидогенная вивипария
Фолиарная вивипария характерна для представителей рода Kalanchoe
(Yarbrough, 1932, 1934; Батыгина, 1987; Batygina, 1989; Batygina et al., 1996; см.
I Эмбриоидогения — новый тип вегетативного размножения). Развитие
вегетативных пропагул происходит только в условиях длинного дня (Dostal, 1944; Catarino,
, 1965; Хованская, 1970). Регулярно вегетативные пропагулы формируются из
меристемы в выемках по краям листьев у К. daigremontiana, К. tubiflorum и К. rosei.
Спорадически они возникают у К. pinnata\ К. crenatum и К. fedtschenkoi, но на ранней
стадии развития впадают в состояние покоя. В пределах листа пропагулы находятся
на разных стадиях развития. Разброс в стадиях развития пропагул в большей мере
' проявляется при увеличении возраста листьев и материнского растения.
Развитие пропагул в условиях длинного дня связано с изменением в базипеталь-
ном транспорте ауксина из апекса побега и индукцией синтеза ауксина в самих про-
пагулах (Warden, 1970). В этот период эндогенное содержание цитокининов в лис-
, товой пластинке возрастает от основания листа к его верхушке. Такое
распределение гормона, вероятно, является одним из факторов, определяющих базипетальное
развитие вегетативных пропагул (Slaby, Sebanek, 1984). По мере своего развития
вегетативные пропагулы становятся аттрагирующими центрами не только ассими-
лятов, но и кинетинов, поступающих к ним из корней (Казарян, Геворкян, 1985).
Вероятно, увеличение соотношения содержания 3+ЗР/ИУК, индуцирует
деления клеток в меристематической зоне края листа, из которой формируется меристе-
i матический бурогок пропагулы. На стадии «сердечка» изменение соотношения
3+ЗР/ИУК (3+ЗР/ИУК > 1) сопровождается инициацией прокамбия в
большей «семядоле» (Полевой, Брагина, неопублик. данные).
В условиях короткого дня подавление роста пропагул, вероятно, обусловлено
высоким содержанием ИУК и соотношением 3+ЗР/ИУК < 1. Специфической
способностью индуцировать образование вегетативных пропагул в условиях
короткого дня у Kalanchoe' обладают только 6-бензиламинопурин и кинетин (Vardar,
Acarer, 1957; Catarino, 1965; Чайлахян и др., 1969; Yazgan, 1970). ИУК, гиббе-
реллины и трийодбензойная кислота способны стимулировать развитие
вегетативных пропагул только при наличии цитокинина (Dostal, 1970). Стимулирующее
действие на их рост оказывает а-нафтилуксусная кислота (Чайлахян, 1988).
Каулигенная вивипария отмечена у Ranunculus sceleratus (см. подробнее
Эмбриоидогения, Т. 2).
Генетические аспекты вивипарии
При нормальном развитии семени фаза созревания включает синтез запасных
< питательных веществ, прекращение роста зародыша и развитие устойчивости к
засухе (McCarty, 1995). Как известно, ключевым регулятором генной
экспрессии в позднем эмбриогенезе является АБК, которая опосредует ответы на раз-
Данные по морфогенезу вегетативных пропагул у некоторых видов Kalanchoe позволяют
считать пропагулу у К. pinnata соматическим зародышем (эмбриоидом), а у К. daigremontiana —
переходной формой между соматическим зародышем и почкой (Batygina et al., 1996).
48 Системы репродукции ^
личные экстремальные воздействия (Skriver, Mundy, 1990; Rock, Quatrano,
1994; Giraudat, 1995; см. подробнее Экспрессия генов в эмбриогенезе, Т. 2).
Изменение в синтезе и чувствительности к АБК может быть одной из причин,
приводящих к вивипарии.
По содержанию и степени чувствительности к АБК вивипарные мутанты
кукурузы были разделены на 2 класса (Neill et al., 1986, 1987). У мутантов 1-го
класса (vp2, vp5, ps\(vpl), vp8, vp9) отмечается пониженный уровень АБК
(Neill et al., 1986) и изменение синтеза каротиноидов (за исключением vpo)
(Robertson, 1955).
У мутанта vp\, относимого ко второму классу, уровень эндогенной АБК в
зародыше не изменен (Neill et al., 1987), однако мутант нечувствителен к
экзогенному гормону (Robichaud et al., 1980; Robichaud, Sussex, 1986). Кроме того, у
vp\ мутанта подавлен синтез антоцианов в клетках алейронового слоя (Robertson,
1955; Dooner, Nelson, 1979; Dooner, 1983a, b, 1985; Come, Burr, 1986; Paz-Ares
et al., 1987). Установлено, что продукт гена Viviparous-1 (VPA) входит в состав
регуляторных белков, которые стимулируют созревание и покой зерновки
(McCarty, Carson, 1991; McCarty et al., 1991). Продукт гена VPA является
фактором транскрипции (VcCarty et al., 1989a, b; McCarty, 1991; Hattori et al., 1992;
Hoecker et al., 1995) и требуется для экспрессии генов С/, Globulin и Ет
(McCarty et al., 1989b; Hattori et al., 1992; Thomann et al., 1992; Paiva, Kriz,
1994; Vasil et al., 1995; Hill et al., 1996). Кроме того, белок VP1 является репрес-
сором для генов а-амилазы, функционирующих при прорастании в клетках
алейронового слоя (Hoecker et al., 1995).
В семенах вивипарных мутантов кукурузы обнаружены гены, участвующие в
синтезе и узнавании АБК (Tan et al., 1997). Зародыши одного из мутантов (vp 14)
имеют нормальную чувствительность к АБК. Однако, содержание АБК у мутант-
ных зародышей было на 70 % ниже, чем у зародышей дикого типа, что указывает
на нарушение в синтезе АБК. Белок VP14 катализирует реакцию расщепления
каротиноидов (Schwartz et al., 1997).
Многие вивипарные мутанты арабидопсиса имеют аналогичные с вивипарными
мутантами кукурузы фенотипы (например, мутант аЫЗ). Мутация аЪ'хЪ
затрагивает покой семени, накопление запасных белков и жиров, распад хлорофилла,
способность отвечать на АБК и устойчивость к высыханию (Koornneef et al., 1984,
1989; Koornneef, 1986; Finkelstein, Somerville, 1990; Nambaraetal., 1992; Giraudat
et al., 1992; Parcy et al., 1994). Характеристики существующих мутантных аЫЗ
аллелей подтвердили гипотезу о том, что ABI3 белок участвует в каскаде реакций
восприятия и трансдукции АБК (Giraudat et al., 1992). Нормальное восприятие
АБК геном АВ13 необходимо, но недостаточно для многих критических этапов,
связанных с эмбриогенезом у арабидопсиса (Meinke et al., 1994). Сходные
последовательности и аналогичные фенотипы VP\ и АВ\3 наводят на мысль о том, что
они являются функционально гомологичными генами (Giraudat et al., 1992).
У leafy cotyledon (lec\) и /us3 мутантов арабидопсиса преждевременно
проросшие семена встречаются редко (Muller, Heidecker, 1968; Meinke, 1992; Meinke et
al., 1994). Сравнение этих мутантов дает основание полагать, что гены L£C1 и
FUS3 могут выполнять связанные, но не идентичные функции во время
эмбриогенеза (Meinke et al., 1994). Они кодируют регуляторные факторы, которые
активируют широкий спектр эмбриогенетических программ начиная со стадии сердечка.
Репродукция растений
49
FUS3 и LEC\ позитивно регулируют повышенное содержание белка ABI3 в
семени (Parcy et al., 1997).
Возможно, что механизмы регуляции вивипарии у мангровых окажутся сходными с
таковыми у мутантов кукурузы и арабидопсиса. Вероятно, можно будет найти
некоторое сходство в регуляторных процессах, происходящих при вегетативной вивипарии.
Многие исследователи пытались выявить причины возникновения
вегетативной вивипарии у цветковых растений. В частности, некоторые авторы считают,
что живородящие формы злаков являются спонтанно возникшими,
наследственными и более или менее устойчивыми мутациями (Schroter, 1908; Jenkin, 1922;
Turesson, 1926-1927,1930,1931). Однако Ernst (1918), на основании сходства в
характере деградации полового аппарата у живородящих форм злаков и многих
гибридов, выдвинул гипотезу о гибридном происхождении живородящих
растений. Некоторые исследователи пытались связать живорождение с полиплоидией
(Turesson, 1930, 1931).
Некоторые формы вивипарии (например, у Triticum, Deschampsia flexuosa,
Agrostis vulgaris) были выявлены при культивировании растений в условиях
короткого дня (Шульц, 1939; Заблуда, 1948). Эти данные и данные о разной степени
проявления вивипарии у растений одного вида из разных точек ареала говорят о
том, что на вивипарию оказывают влияние условия местообитания растения.
Потенциальная способность к вивипарии является универсальной для
цветковых растений (см. Автономность зародыша, Т. 2). Вивипария, возникшая,
вероятно, независимо у разных групп растений (Joshi, 1933), играет существенную роль
в системе репродукции растений (Батыгина, 1994).
Явление вивипарии наблюдается у растений, произрастающих в различных
экологических условиях. Так, облигатная генеративная вивипария характерна для
растительности мангровых. Эта особенность, наряду с другими приспособлениями,
явилась адаптацией к жизни в условиях периодического затопления и высокого
засоления. Прорастание семени у мангровых на материнском растении способствует
формированию солеустойчивого и способного к быстрому укоренению проростка
(Joshi, 1933; Генкель, Фан И-сунь, 1958; Морщихина, 1981). Содержание солей в
проростке увеличивается с его возрастом (Walter, Steiner, 1936). Процесс
приспособления к засолению идет за счет солей, постепенно поступающих из
материнского растения в проросток. Проросток является значительно более пластичным, чем
взрослое растение с вполне сложившимися приспособлениями к определенной
степени засоления почвы. Чем более солеустойчиво материнское растение, тем
быстрее и легче осуществляется адаптация молодого растения к засолению (Генкель,
1962). Выдвинуто интересное предположение, что вивипария у мангровых
возникла в результате задерживающего влияния хлор-иона на опадение плодов и это
влияние сочетается с отсутствием периода покоя в образовавшемся семени (Строганов
и др., 1956; Соловьев, 1960; Генкель, 1962).
Способность растения к факультативной генеративной вивипарии является
одним из резервов системы репродукции. При изменении внешних условий
какая-то часть семян способна дать жизнеспособные проростки.
Живородящие растения, для которых характерна вегетативная вивипария, в
основном произрастают в полярных, высокогорных и пустынных районах. Эти
растения имеют в своем распоряжении очень короткий период с благоприятными
условиями для того, чтобы оставить потомство. В ряде случаев образование у них семян
9 10 Ц прбк
Рис. 3. Вивипария. Выводковая почка.
1-21 — облигатная генеративная внвипария у видов сем. Rhizophoraceae (1-20) и сем. /luicenniaceae (21):
1-3 — строение цветка (1, 2) и завязи (3) у Rhizophora conjugata (1, 3) и R. mucronala (2); 4 — внешний вид
проросших плодов R. conjugata на ветви дерева; 5-12 — последовательные стадии прорастания плода у
R. conjugata (5,6, 8-11) и R. mucronata (7, 12): 5, 6 — начало второй фазы прорастания — выход
гипокотиль-корневой оси из покровов семени, 7 — конец второй фазы — базальная часть зародыша вышла за
пределы плода, 8-12 — третья фаза — удлинение основания «семядольного тела» (семядольной трубки) (2
месяца после созревания семени) (8), отделение гипокотиль-корневой оси с апексом побега от «семядольного
тела» (через 8 месяцев после созревания семени) (9-10), развитие зачатков листьев на апексе побега (11) и
заложение боковых корней в гипокотиле (12);
МК
Рис. 3 (продолжение).
13-18 — развитие зародыша и стадии его прорастания у R. mangle: 13 — зигота, 14 — выход эндосперма,
окружающего зародыш, из семязачатка через микропиле, базальная часть суспензора граничит с клетками
эндосперма, содержащими таннины (указаны стрелкой), 15 — строение зародыша в начале первой фазы роста,
формирование «семядольного тела», 16 — строение плода с «проросшим» зародышем во время первой фазы
его роста (преобладает рост апикальной части «семядольного тела», зародыш еще не вышел полностью за
пределы интегумента), 17 — то же, но на второй фазе прорастания, преобладает рост базальной части
«семядольного тела», идет увеличение длины продольной оси проростка, 18 — строение оси проростка во второй фазе
развития (см. рис. 17), выход гипокотиль-корневой оси из семенной кожуры, через микропиле, но не из плода;
Vf~^,
«tm-t
Рис. 3 (продолжение).
19, 20 — плод R. mucronata с двумя прорастающими зародышами (19) и его сформированный
проросток (20), 21 — зрелый плод Avicennia officinalis, выход зародыша и окружающего его
эндосперма из семенной кожуры.
Рис. 3 (продолжение).
22-75 — облигатиая вегетативная вивипария у видов сем. Роасеае (22-40), Polygonaceae
(41-51), Orchidaceae (52-66), Crassulaceae (67-74): 22-40 — развитие выводковой почки
(луковички) у Роа bulbosa на соцветии: 22-36а — строение колоска на различных стадиях развития у
семенной (22-27а), вивипарной (28-ЗЗа) и полувивипарной (34-36а) форм; 27а, 33а, 36а — увел.;
Рис. 3 (продолжение).
37, 38 — строение луковички на продольном (37) и поперечном (38) срезах в зоне апекса побега,
39, 40 — внешний вид непроросшей (39) и проросшей (40) луковичек;
Рис. 3 (продолжение).
41-51 — последовательные стадии формирования выводковых почек (клубеньков) на соцветии у
Polygonum viviparum и их прорастания при полувивипарии (41) и вивипарии (42): 43, 44 —
строение клубенька до его отделения от материнского растения (43) и запасающая паренхимная ткань в
его нижней части (44); 45-50 — последовательные стадии развития клубенька после отделения от
материнского растения (45а — то же, что на дет. 45, увел.), 51 — отделившийся от материнского
растения клубенек на более поздней стадии, чем на дет. 45;
ад с
Рис. 3 (продолжение).
52-66 — развитие выводковой почки (пропагулы) на листе у Hammarbya paludosa: 52 — внешний вид пропагул
на адаксиальной поверхности листа на разных стадиях развития (в центральной части листа они более развиты,
чем в его латеральных частях), 53 — разросшийся край листа, на котором будут формироваться прогкиулы, 54 —
внешний вид трех пропагул (I, II, III), на стадии заложения первого листа в их апикальной части (I пропагула —
еще без примордия листа), 55, 55а — пропагула, на стадии сформированного первого листа, края листа на
верхушке могут быть не сомкнуты (55а) или сомкнуты (56, 57) (55 — вид сбоку, 55а — вид сверху), 56, 57 — прогшулы
на более поздней стадии развития: 57 — формирование вторичной пропагулы на краю первого листа;
п вч
Рис. 3 (продолжение).
58-66 — внутреннее строение пропагулы на стадиях формирования меристематического бугорка
(58-61), развития его дорсовентральности (61), заложения примордия первого листа (62-64) (на
дет. 64 показано образование инвагинаций материнского листа (окружающих в виде чаши нижнюю
часть пропагулы) и развития апекса побега (65, 66).
Рис. 3 (продолжение).
67-74 — строение вегетативной пропагулы Kalancho'e daigremontiana на разных стадиях развития:
67 — край листа с выемкой, где будет формироваться выступ, несущий пропагулу; 68, 68а — мери-
стематический бугорок на коротком выступе выемки листа, 69 — формирование примордиев двух
«семядолей», адаксиальный примордий больше, выступ выемки листа стал длиннее, 70 —
формирование в большей «семядоле» прокамбиальных тяжей и отложение в ее клетках таннинов,
Рис. 3 (продолжение).
71 — общий вид пропагулы (см. дет. 70), 72, 72а — рост большей «семядоли» и уплощение ее
апикальной части (72а — вид сверху), 73 — выступ выемки листа с местом прикрепления пропагулы,
которая уже отделилась, 74 — соцветие К. daigremontiana с отцветвшими цветками и
вегетативными пропагулами в пазухах брактей (факультативная инфлоральная вивипария), 75 — растение
образовавшееся из вегетативной пропагулы.
ад к
адк
79
80
Рис. 3 (продолжение).
76-79 — факультативная вегетативная вивипарня, отдельные стадии развития вегетативной пропагулы у
Kalanchoe pinnata: 76 — строение края листа с выемкой, где видна меристематическая зона из клеток которой
будет формироваться пропагула, 77 — пропагула, имеющая две «семядоли», два примордия адвентивных
корней, проводящая система пропагулы связана с проводящей системой материнского листа, 78, 78а,б — общий
вид пропагулы, находящейся в выемке края листа, видны два примордия «семядолей» (адаксиальный примор-
дий больше) и разрастания адаксиальной поверхности листа вследствие эндогенного заложения адвентивных
корней пропагулы под ними (78 — вид сбоку, 78а — вид снизу, 78б — вид сверху), 79, 80 — сложный лист
К. pinnata (79) и побег Kalanchoe sp. (80) с новыми растениями, образовавшимися из пропагул. (1-3, 5, 6, 8,
9, 13-18, 21, 27а, 33а, 36а, 37, 43, 44, 58-70, 76, 77 - продольные срезы, 12, 38 - поперечные срезы);
13-18, 67-70,76, 77 - СМ, 52-57, 71-73, 78, 78а,б - СЭМ. 13 - х 490,14, 72, 73 - х 50,15,
16-х 2,5, 17-х 150, 18-х 35, 19-х 0,43, 20-х 0,3, 21, 43-х 25, 44-х 250, 45,
46-50 - х 2; масштабная линейка: 52, 78, 78а = 1000 мк, 53-57. 71-73 = 100 мк, 55а, 78б = 10 мм,
58-66 = 0,03, 74, 75 = 5 мм. an — апекс побега, ас — абортированный семязачаток, а м к — апе-
кальная меристема корня, ад к — адвентивный корень, ад с — адаксиальная сторона листа, вмк —
выемка края листа, вые — выступ выемки края листа, ей — внутренний интегумент, в п —
вегетативная пропагула, вт п — вторичная пропагула, выв п — выводковые почки, z — гипокотиль, а —
зародыш, им — интерколярная меристема, к — корпус, кл — колеоптиль, кор — корень, к к —
каменистые клетки, к н — конус нарастания, к ч — колосковые чешуи, л( — первый лист пропагулы, л2, л3 —
второй и третий лист пропагулы, соответственно, ло — лодикулы, л в — листовой валик, лч — листо-
подобные чешуи, м з — меристематическая зона, мл — молодой лист, м т — механическая ткань,
нцч — нижняя цветковая чешуя, нч с — нижняя часть столбика, п — пыльник, пс — пестик, пб —
пестичный бугорок, п к — примордий корня, п л — примордий листа, п п — проводящий пучок,
п П]— проводящий пучок, идущий к семязачатку, пп2 — проводящий пучок, идущий к проростку,
прбк — примордий бокового корня, пвч — примордий внутренней части пропагулы, с —
семязачаток, см — семядоля, син — оставшаяся синергида, сте — укороченный стебель, с к — семейная
кожура, cm — «семядольное тело», т — тычинка, ту — туника, т б — тычиночный бугорок, ч —
чашелистик, ча — инвагинация поверхности листа "чаша", цв — цветки, и, б — цветковый бугорок,
и, ч — цветковая чешуя, чеч — чечевичка, чл — чешуеподобные листья, э — эндосперм.
72-80 — густоплазменные клетки показаны плотной точкой, крахмал — редкой точкой, фиброзные
утолщения — штриховкой, центральный тяж клеток, изображен с ядрами.
1, 3-5, 7-11 - по: Кернер, 1902; 2, 6,12 - по: Kipp-Goller, 1940; 13-18 - по: Juncosa, 1982; 19,
20 - по: Carey, 1934; 21 - по: Padmanabhan, 1964; 22-38, 40 - по: Пополина, 1960; 39, - по:
Пополнив, 1962; 41, 42, 45-50, 79 - по: Кернер, 1902; 43, 44 - по: Engell, 1973; 51 - по:
Серебряков, 1952; 52-55, 58-66 - по: Batygina, Bragina, 1997; 55а, 56, 57, 74, 75, 77, 78а - по: Брагина
(ориг.); 67, 71, 72а, 73, 76, 78, 78б - по: Batygina et al., 1996; 80 - по: Васильев и др., 1978.
Ul Системы репродукции
янтрудпепо или невозможно из-за отсутствия опылителей, нарушений в развитии
мужского и женского гаметофита (например, некоторые виды Allium). Тогда
почти единственной возможностью поддерживать и увеличивать численность
популяции становится способность к вегетативной вивипарии.
Как известно, у ряда растений в системе репродукции сочетаются процессы
нормального развития семян и формирования живородков, что обеспечивает
накопление в популяции потомков с различными генотипами (виды рода Роа и
Polygonum viviparum). Способность к вивипарии у арктических видов злаков позволила
им быстро заселить освободившиеся от ледника земли (Salvesen, 1986).
В зависимости от конкретных условий растение может оставить достаточное
количество потомков либо за счет размножения семенами, либо за счет вегетативных
вивипарных диаспор. Полувивипарные особи или популяции способны
увеличивать свою численность двумя способами. Как было отмечено выше, гетерогенность
популяций по степени выраженности вивипарии оставляет возможность для
гибридизации с половыми формами (F. vivipara).
Формирование живородков на вегетативных органах позволяет разнести в
пространстве, а в некоторых случаях во времени семенное и вегетативное размножение
(Cardamine, Hammarbya, Kalanchoe).
Разная степень выраженности вивипарии в той или иной популяции
обеспечивает пластичность системы репродукции. Сохранение биологического
разнообразия во многом зависит от успешного сочетания различных способов размножения
(в том числе и образование вивипарных диаспор) в общей системе репродукции
вида. Рис. 3.
Батыгина, 1987, 1992-1994, 1996, 1997; Гандилян, 1961; Генкель, 1962, 1979; Генкель, Фан
И-сунь, 1958; Ильинский, 1945; Казарян, Геворкян, 1985; Кернер, 1902; Морщихина, 1981; Ники-
тичева, Яковлев, 1985; Плиско, 1996; Пополина, 1960, 1962; Сарапульцев, 1998; Васильев и др.,
1978; Соловьев, 1960; Строганов и др., 1956; Татаренко, 1996; Устинова, 1944; Хованская, 1970;
Чайлахян, 1988; Шульц, 1939; Battaglia, 1963; Batygina, 1989, 1991; Batygina, Bragina, 1997;
Batygina et al., 1996; Braun, 1859; Callaghan, 1973; Carey, 1935; Catarino, 1965; Chapman, 1962;
Come, Burr, 1986; Davis, 1940; Dooner, 1983a, b, 1985; Dooner, Nelson, 1979; Dostal, 1970; Dutt,
Bradu, 1973; Engell, 1973,1978; Ernst, 1918; Fernald, 1933; Finkelstien, Somerville, 1990; Fuller, 1966;
Giraudat, 1995; Giraudat et al., 1992; Guppy, 1906; Harmer, 1984; Hattori et al., 1992; Hill et al., 1996;
Hoecker et al., 1995; Jenkin, 1922; Joshi, 1933; Juncosa, 1982; Karsten, 1891; Kipp-Goller, 1940;
Koornneef, 1986; Koornneef et al., 1984, 1989; Law et al., 1983; McCarty, 1991, 1995; McCarty et al.,
1989a, b, 1991; McCarty, Carson, 1991; Meinke, 1992; Meinke et al., 1994; Muller, Heidecker, 1968;
Nambara et al., 1992; Naveen et al., 1977; Neill et al., 1986,1987; Paiva, Kriz, 1994; Parcy et al., 1994;
Paz-Ares et al., 1987; Petersen, 1981; Pijl van der, 1982; Robertson, 1955; Robichaud, Sussex, 1986;
Scholander, 1934; Schwartz et al., 1997; Sernarder, 1927; Skriver, Mundy, 1990; Slaby, Sebanek 1984;
Tan et al., 1997; Taylor, 1967; Thomann et al., 1992; Turesson, 1926-1927, 1930, 1931; Vasil et al.,
1995; Walter, Steiner, 1936; Warden, 1970; Yarbrough, 1932,1934.
МЕТАМОРФОЗ (греч. metamorphosis — превращение) — общее глубокое
преобразование строения индивида в процессе развития. При этом происходит замещение
одной формы организации индивида другой1. Метаморфоз обусловлен изменением
среды обитания и, соответственно, образа жизни в течение индивидуального развития.
В теоретической морфологии термин «метаморфоз» используют также для обозначения
эволюционных преобразований отдельных органов растений.
Репродукция растений
63
Метаморфоз широко распространен в мире животных: он свойствен
большинству таксонов беспозвоночных, а также некоторым группам позвоночных
(земноводным, миногам, двоякодышащим рыбам). Как подчеркивал Гиляров
(1957), именно далеко зашедшие адаптации к разным функциям животного в
личиночной и имагинальной стадиях являются причиной метаморфоза. У
земноводных метаморфоз связан с переходом от водного к наземному образу
жизни, а у многих насекомых — с переходом от водного (или же скрытого в
субстрате) к открытому воздушному обитанию. Очевидно, что при этом резко
изменяются и основные жизненные функции животного. Например, функция
питания в стадии личинки у насекомых сменяется функциями размножения и
расселения в имагинальной стадии. В таких случаях говорят о голометаболии
(полном превращении).
Метаморфоз часто наблюдается и среди покрытосемянных растений.
По-видимому, у растений следует различать три основных типа метаморфоза. В
первом случае («метаморфоз органов» — понятие впервые ввел Goebel, 1898
-1901) происходят эволюционные преобразования меристематических органов,
обусловленные изменением их функций. Примерами могут служить
преобразования листьев (Berberis, представители сем. Cactaceae) или стеблей (Crataegus,
Prunus spinosa) в колючки, выполняющие функции защиты растения от
травоядных животных. К этому же типу метаморфозов относится образование пневмато-
форов (надземных дыхательных корней) у растений мангров (Jussiena repens,
Sonneratia alba и др.) или корневищ (подземных побегов) выполняющих функции
вегетативного размножения или запасающие функции и, иногда, функции
расселения (Elytrigia, Convallaria, Vaccinium и др.). При этом типе метаморфоза
изменяется способ развития зачатков органов и их изменившееся строение сохраняется у
следующих поколений.
При втором типе метаморфоза (временный, или сезонный метаморфоз)
у растений в течение онтогенеза происходит временное преобразование
организации, с последующим возвращением к исходному строению. Этот тип
метаморфоза связан с адаптациями к переживанию неблагоприятных сезонных
условий у многолетних травянистых растений. Наиболее яркий пример —
образование луковиц у видов сем. Liliaceae.
Наконец, третий тип метаморфоза, которому и посвящен настоящий очерк,
связан с полным и необратимым превращением (голометаболией)
организации спорофита в течение индивидуального развития, обусловленным переходом
растения к паразитическому («чужеядному») питанию. При этом типе адаптивных
преобразований, сопровождающихся глубокими процессами редукции, семенное и
вегетативное размножение происходят за счет образования адвентивных органов
из новых меристематических очагов (подобных «имагинальным дискам» в
личинках животных) в результате редифференциации некоторых участков нового
специализированного органа — «клубенька». Такой способ развития с метаморфозом
свойствен представителям некоторых высокоспециализированных таксонов
цветковых растений, адаптированных к «корневому» паразитизму (Balanophoraceae,
Lennoaceae, Orobanchaceae, Rafflesiaceae, Scrophulariaceae и др.).
Метаморфоз с полным превращением организации спорофита в течение
онтогенеза, сопровождающийся некрозом выполнивших свою функцию структур и
образованием адвентивных структур из вновь образующихся меристематических оча-
64 Системы репродукции
гов, наиболее близок по характеру и глубине преобразований к голометаболическо-
му метаморфозу в животном мире (Гиляров, 1957; Терехин, 1968, 1977, 1988).
В отличие от наземных автотрофных растений, развитие которых
происходит биполярно (побег-корень) в двух средах, воздушной и почвенной,
зародыши и проростки специализированных паразитных растений функционально и
морфологически подготовлены к выполнению основной функции — поиску
растения-хозяина и внедрению в ткани его корня для установления
метаболических связей с проводящей системой последнего. Корень подходящего вида
растения-хозяина является единственным источником питания паразитного
растения. Поскольку, как отметил еще Salisbury (1942), растения-хозяева
расположены в окружающем пространстве более или менее дискретно,
растение-паразит должно производить много семян. В этой ситуации, при
ограниченных энергетических ресурсах паразитного растения, естественный отбор
ведет к все большей и большей редукции семян и зародышей (Терехин, 1977).
Так, в пылевидных семенах высокоспециализированного паразитного растения,
например у Orobanche crenata, можно видеть редуцированные зародыши,
лишенные всех основных органов (семядолей, эпикотиля, радикулы, гипокотиля)
и представляющие собой овальное скопление клеток («глобулярный проэм-
брио»), неясно дифференцированных на две тканевые зоны. При этом, морфо-
генетический потенциал сохраняется у таких зародышей лишь в базальном
(«корневом») полюсе. Поэтому, развитие «нитевидных» проростков из таких
зародышей происходит униполярно. Клетки апикального («стеблевого»)
полюса редуцированного зародыша выполняют, при этом, гаусториальную функ-'
цию в эндосперме, а затем эта зона отмирает вместе с прилегающей к семенной
кожуре частью проростка.
Следует отметить, что такой способ развития проростков сопровождается
рядом обстоятельств. Для специализированных паразитных растений характерно так
называемое донор-зависимое прорастание. Это означает, что прорастание их
зародышей обусловлено не наличием влаги и подходящей температуры, а
специфическими химическими выделениями из корней растений-хозяев. Поэтому семена
прорастают лишь вблизи (обычно на расстоянии до 0,5 см) от растущего корня
«хозяина» и направление роста «нитевидных» проростков определяется не
геотропизмом, а градиентом концентрации веществ, выделяемых корнем «хозяина».
Достигнув поверхности корня подходящего растения-хозяина, проросток
прикрепляется к ней посредством выделяемой слизи (Терехин, 1988). Апикальные клетки
«нитевидного» проростка паразита преобразуются в гаусториальные и проникают в
корень по межклеточным пространствам (Joel, Losner-Goshen, 1996).
Установив метаболические связи с проводящей системой корня растения-хозяина,
проросток паразита в месте внедрения образует «клубенек» — структуру, не
имеющую гомологов в мире растений и служащую первоначально целям накопления
питательных веществ. С началом развития клубенька начинается преобразование всей
организации проростка. В клубеньке, в связи с необходимостью образования
репродуктивного побега, в результате редифференциации некоторых участков паренхим-
ной ткани возникают, как уже было упомянуто, меристематические очаги. Из такого
эндогенного очага образуется апекс побега и две его первые чешуи. Третья и
последующие чешуи возникают уже на апексе стебля репродуктивного побега. Из
латеральных меристематических очагов образуются вторичные гаусториальные корни —
Репродукция растений
65
органы формирования вторичных гаусторий, а иногда и органы вегетативного
размножения (Orobanche cernua ssp. rajahmundrica).
Последовательные этапы эволюционного становления метаморфоза с
полным превращением можно видеть на примере паразитных представителей сем.
Scrophulariaceae. Так, у некоторых видов рода Striga, еще не утративших
зеленые листья, уже видна постепенная редукция зародышей, весьма существенная
у бесхлорофилльного вида Striga gesnerioides. Проростки этих растений
сохраняют биполярное развитие, при том, что у S. hermonthica и S. gesnerioides
развитие проростков уже сопровождается образованием «клубеньков», еще не
приобретших функций, ведущих к метаморфозу. Для видов Harveya и Hyobanche
характерно развитие проростков с полным превращением организации.
Редукция зародышей в зрелых семенах этих растений сравнима с таковой у Orobanche
crenata (Терехин, 1977). У высокоспециализированных таксонов ксенопара-
зитных растений с «корневым» типом паразитизма адаптации, связанные с
осуществлением метаморфоза, приводят к существенным изменениям всего хода
развития спорофита чужеядного растения. На приведенном рисунке (Рис. 4)
внутренний круг показывает развитие слабоспециализированного «зеленого»
паразитного растения Euphrasia (Scrophulariaceae), а наружный — развитие
высокоспециализированного, бесхлорофилльного растения Orobanche
(Orobanchaceae).
До сих пор мы говорили о так называемых ксенопаразитных растениях, когда
паразит использует для своего питания другие, цветковые же растения. Другая
экологическая группа — микопаразитные (аллелопаразитные) растения, для
которых партнерами по паразитическому симбиозу являются некоторые группы
грибов, образующих микоризу (Schmucker, 1959; Raven et al., 1986). Расте-
ния-микопаразиты обмениваются с грибами различными метаболическими
веществами. К высокоспециализированным микопаразитным растениям относится
ряд таксонов однодольных растений (Burmanniaceae, Corsiaceae, некоторые
роды бесхлорофилльных Orchidaceae —например, Epipogon и Corallorrhiza), a
также двудольных (сем. Ericaceae — подсемейства Monotropoideae и
Pyroloideae). Эти растения имеют, конечно, свои особенности развития, однако
принципиальные черты метаморфоза спорофита присущи и им.
У представителей ряда других, менее специализированных или с иными
способами адаптации к паразитизму таксонов (Cuscutaceae, Loranthaceae, Viscaceae и
др.,) метаморфоз не является столь же глубоким, как у описанных выше растений.
Он занимает некоторое переходное положение между метаморфозом отдельных
органов у автотрофных цветковых и полным метаморфозом у
высокоспециализированных паразитных цветковых растений-.
Семенное воспроизведение у многих ксенопаразитных и микопаразитных
растений характеризуется резким усилением r-стратегии. Они производят подчас
огромное количество очень мелких семян с редуцированными зародышами. Так, у
«корневого» ксенопаразита Aeginetia indica (Orobanchaceae) в каждом плоде
образуется до 70 тыс. семян (Kuijt, 1969). Ярко выраженной r-стратегией характеризуются
и микопаразитные растения. Имеются данные, что у некоторых представителей
сем. Orchidaceae (например, Anguloa и Cattleya), даже еще не утративших
хлорофилл, в одном плоде образуется до 4 млн. крайне редуцированных семян
(Schmucker, 1959; Поддубная — Арнольди, 1964).
Рис. 4. Метаморфоз в онтогенезе представителей сем. Scrophulariaceae.
1 — развитие спорофита без метаморфоза у Euphrasia (Rhinanthoideae);
2 — развитие спорофита с метаморфозом у Orobanche (Orobanchoideae)
(сектором выделены сходные стадии жизненного цикла).
По: Терехин, 1977.
Репродукция растений
69
Метаморфоз у паразитных цветковых растений свидетельствует о глубоких
общих закономерностях в адаптивных эволюционных преобразованиях
жизненных циклов растений и онтогенеза животных. Такие преобразования у растений,
как и у животных, связаны с резким изменением жизненных функций в течение
индивидуального развития. Рис. 4, 5.
Гиляров, 1957; Поддубная-Арнольди, 1964; Терехин, 1968, 1977, 1988; Goebel, 1898; Joel,
Losner-Goshen, 1994; Kujit, 1969; Raven et al., 1986; Salisbury, 1942; Schmucker, 1959.
ЖИЗНЕННЫЕ ЦИКЛЫ
Жизненные циклы растений разнообразны и различаются в первую очередь
временем и местом мейоза, а также степенью развития и протяженностью
(продолжительностью) диплофазы и гаплофазы. Большинство зеленых водорослей в
вегетативном состоянии гаплоидны, и диплоидна у них только зигота (вольвоксовые,
хлорококковые, конъюгаты). Мейоз происходит при прорастании зиготы (зиготи-
ческая редукция, или зиготический мейоз), после чего образуются четыре
гаплоидных клетки, делящиеся затем митотически с образованием новых гаплоидных
клеток или многоклеточного таллома, который в конечном итоге дает гаметы.
У диатомовых водорослей и у фукуса диплоидны талломы, в клетках которых
после мейоза образуются гаметы (гаметическая редукция, или гаметический
мейоз), которые затем, сливаясь, образуют диплоидную зиготу. Зигота прорастает
без редукционного деления в новый диплоидный таллом.
Эти два типа жизненных циклов встречаются только у низших растений — у
водорослей, и характеризуются продолжительностью гаплофазы при зиготическом
мейозе, а при гаметическом мейозе — продолжительностью диплофазы.
Третий тип жизненного цикла со спорическим мейозом, или спорической
редукцией, характерен для растений с чередованием, или сменой поколений,
когда ритмично сменяют друг друга два поколения (бионта) — спорофит (диплоби-
онт) и гаметофит (гаплобионт), различающиеся генетически и способом
размножения. Спорофит — диплоидное бесполое поколение, на котором образуются
зооспоры в обычных клетках таллома (некоторые водоросли), в
специализированных органах бесполого размножения — зооспорангиях (многие бурые
водоросли) или споры в спорангиях (все высшие растения). Перед образованием спор
в спорангиях происходит мейоз (спорическая редукция), из спор развиваются
многоклеточные гаплоидные организмы — гаметофиты. Гаметофит — половое
поколение жизненного цикла, которое продуцирует гаметы либо в обычных
вегетативных клетках таллома (некоторые водоросли), либо в специализированных
органах полового размножения — гаметангиях, оогониях и антеридиях (низшие
растения), архегониях и антеридиях (высшие растения, за исключением
цветковых). После слияния гамет образуется зигота, которая без редукционного
деления прорастает в диплоидный спорофит.
Органы полового и бесполого размножения у низших растений, как правило,
одноклеточные, за исключением харовых и многих бурых водорослей, а у высших
растений многоклеточные. Типы полового процесса у водорослей разнообразны,
и слияние гамет происходит в воде при изогамии и анизо-, или гетерогамии
(многие зеленые водоросли) или в оогонии при оогамном типе полового процесса (ха-
ровые, многие бурые водоросли). У высших растений женская гамета — яйце-
70 Системы репродукции
клетка всегда неподвижна, и само половое поколение — гаметофит обеспечивает
процесс оплодотворения.
В жизненных циклах с чередованием поколений спорофит и гаметофит могут
быть идентичны морфологически и по продолжительности жизни. Такую смену
поколений называют изоморфной. При резком различии спорофита и
гаметофита по форме, структуре и продолжительности жизни чередование поколений
называют гетероморфным.
У низших растений встречается как изоморфное, так и гетероморфное
чередование поколений. При изоморфной смене поколений у водорослей каждое из
поколений представлено самостоятельно живущей особью (Ulva, Ectocarpus, Dictyota),
так что в жизненном цикле существует два (при обоеполом гаметофите) или три
(при раздельнополом гаметофите) независимых и одинаковых растения.
При гетероморфной смене поколений оба развиваются либо независимо друг от
друга (ламинариевые водоросли, равноспоровые папоротники, плауны, хвощи),
либо одно из поколений, будучи лишенным самостоятельного развития, существует
за счет другого (мхи и все семенные растения), но доминирует в жизненном цикле
всегда одно из поколений — либо спорофит, либо гаметофит.
Так, у бурых ламинариевых водорослей чередуются многолетний, сложно
дифференцированный спорофит, доминирующий в жизненном цикле, и
микроскопические нитевидной структуры гаметофиты (заростки), живущие от одного
до четырех месяцев (Петров, 1977).
Высшие растения имеют только гетероморфное чередование поколений. К
гаметофитной линии эволюции с преобладанием в жизненном цикле гаметофита
относятся только моховидные, у которых спорофит, называемый спорогоном,
развивается в виде коробочки со спорами на самом зеленом растении мха,
представляющем собой гаметофит. На гаметофите развиваются антеридии и архего-
нии. Зигота образуется в брюшке архегония и прорастает в спорогон,
состоящий из коробочки со спорами и ножки, посредством которой спорогон
внедряется в тело гаметофита и получает от него необходимые питательные вещества.
Споры развиваются в коробочке в результате спорического мейоза и
прорастают на почве в протонему (первичную нить), которая, развиваясь далее,
образует взрослое растение мха (гаметофит).
Все остальные высшие растения (плауны, хвощи, папоротники и все семенные
растения) относятся к спорофитной линии эволюции с преобладанием в жизненном
цикле бесполого поколения — спорофита. При этом спорофит — листостебельное
растение, на котором развиваются спорангии и образуются споры, а гаметофит
(заросток) развит слабее и недолговечен. Так, у равноспоровых плаунов, хвощей и
папоротников гаметофиты имеют вид талломных растений — заростков, не
дифференцированных на органы, зеленых или бесцветных (плауны), от нескольких мм до
3 см., живущих несколько недель (редко несколько лет, как у плаунов или марат-
тиевых папоротников). У равноспоровых папоротниковидных заростки обоеполые.
Разноспоровые высшие растения, включая семенные, имеют раздельнополые
гаметофиты, развивающиеся из микро- и макроспор.
Разноспоровость связана с сильной редукцией заростков. Постепенная редукция
гаметофита является основным направлением эволюции высших растений и хорошо
прослеживается в ряду Pteridophyta-Cymnospermatophyta-Angiospermatophyta (Ko-
марницкий и др., 1975).
Репродукция растений
71
Так, у разноспоровых плаунов и папоротников гаметофиты развиваются, не
покидая микро- и мегаспор, и состоят нередко из 1-2 вегетативных клеток (например,
мужские заростки Selaginella, Salvinia) или из нескольких (женские заростки тех
же растений).
У семенных растений гаметофиты, как мужской, так и женский,
редуцированы в еще большей степени. Прорастание макроспоры и образование женского
заростка у этих растений, оплодотворение и развитие нового спорофита
(зародыша) всегда происходит внутри макроспорангия (или нуцеллуса семязачатка),
когда он находится еще на материнском растении. Таким образом, женское
половое поколение семенных растений полностью утратило способность к
самостоятельному образу жизни, и все его развитие протекает на спорофите внутри
макроспорангия.
У голосеменных женский гаметофит — многоклеточный гаплоидный эндосперм
с двумя (у сосны) или несколькими (у других голосеменных) архегониями, также
значительно упрощенными. Женский гаметофит (зародышевый мешок)
покрытосемянных редуцирован обычно до семи клеток, архегониев не имеет.
Мужской гаметофит семенных растений развивается из микроспоры и
представляет собой пыльцу, прорастающую впоследствии в пыльцевую трубку.
Пыльцевая трубка проводит мужские гаметы — спермин, потерявшие у большинства
семенных растений подвижность, к женским гаметам — яйцеклеткам, скрытым
внутри макроспорангия на женском заростке. Мужское половое поколение
семенных растений подверглось еще большей редукции, чем женское. Все развитие
мужского гаметофита, например у сосны, включая образование спермиев, сводится к
пяти митотическим делениям, три из которых происходят внутри микроспорангия
(гнезда пыльника), а два последних — в пыльцевой трубке.
Цветковые растения характеризуются крайним упрощением мужского
гаметофита (Тахтаджян, 1980), в развитии которого происходит всего два митотических
деления. Первое из делений происходит под оболочкой микроспоры, а второе
совершается в одних случаях в пыльцевом зерне (зрелая трехклеточная пыльца
встречается чаще у более подвинутых порядков, в том числе у всех сложноцветных
и злаков), а в других — лишь позднее, в пыльцевой трубке (зрелая двухклеточная
пыльца характерна для многих относительно примитивных групп, в том числе для
порядков магнолиевых, лавровых, нимфейных).
Таким образом, в жизненных циклах подавляющего большинства высших
растений доминирует крупное, сложно организованное, независимое в отношении
питания диплоидное бесполое поколение — спорофит. Усиление доминирования
спорофита и подавления гаметофита — одно из наиболее четких направлений в
спорофитной линии эволюции. По мнению Рейвна и соавторов (1990), диплои-
дия позволяет накапливать больше наследственной информации и гораздо
тоньше регулировать проявление генетического материала организма в ходе его
развития. В жизненных циклах растений половое размножение с регулярным
чередованием мейоза и сингамии имеет высокое селективное преимущество, поскольку
служит основным механизмом возникновения и поддержания изменчивости
природных популяций.
Комарницкий и др., 1975; Петров, 1977; Рейвн и др., 1990; Тахтаджян, 1980.
72
Системы репродукции
ЧАСТЬ II — СИСТЕМЫ ОПЫЛЕНИЯ
И СКРЕЩИВАНИЯ
СИСТЕМЫ ОПЫЛЕНИЯ
АНТЭКОЛОГИЯ (греч. anthos — цветок, oikos — дом, жилище, logos — учение)
— наука об экологии цветка и опыления растений.
Термин предложен Robertson (1904). Из отечественных авторов им
пользовались Козо-Полянский (1947а, б, 1950,1951) и Руцкий (1937,1938,1967,1980).
Однако, в учебной и научной литературе до сих пор широко используются в
качестве синонимов понятия «биология цветения» и «биология цветения и опыления»,
которые имеют одинаковое экологическое содержание. По нашему мнению
(Пономарев, 1969,1970), от них следует отказаться, как от неопределенных по смыслу, и
заменить более лаконичным и емким по содержанию термином «антэкология»,
включающим «экологию цветка» и «экологию опыления». Однако в иностранной
литературе эти понятия обычно считаются идентичными (Kugler, 1955, 1970;
Faegri, Pijl van der, 1980).
Под экологией цветка (или традиционной «биологией цветка») следует
понимать разнообразные приспособления в цветке (морфологические и
физиологические), способствующие перекрестному опылению или самоопылению. Экологию
цветка необходимо изучать с позиций эволюционной морфологии и
филогенетической систематики. По внешнему виду цветков нельзя судить о способах их
опыления: экология цветка может не соответствовать современным условиям обитания
вида и даже находиться в глубоком противоречии с ними. Так, несмотря на энтомо-
фильный облик многие растения Фарерских островов (Hagerup, 1951), полярных
тундр (Шамурин, 1958а), темнохвойной тайги (Пономарев, Верещагина, 1973)
перешли на самоопыление из-за недостатка насекомых-опылителей.
Многочисленные примеры несоответствия морфологического облика цветков и способов их
опыления приведены Первухиной (1970, 1979).
Экология опыления исследует зависимость процессов опыления не только от
непосредственных агентов, осуществляющих его, но и от многих других, косвенно
действующих экологических факторов. Последние могут способствовать или,
напротив, препятствовать успеху опыления. Так, у анемофилов опыление зависит от
климатических и биотических условий, определяющих дальность рассеивания
Системы опыления и скрещивания
73
пыльцы (ветер, температура и относительная влажность воздуха, дожди,
массовость произрастания и т.д.). У энтомофилов опыление обусловлено не только
наличием и обилием насекомых-опылителей, но и зависит от ландшафтной и биоценоти-
ческой обстановки в целом (погодных условий, стаций гнездования, присутствия и
обилия конкурирующих растений и т.д.). Экологию опыления следует изучать в
эколого-географическом и биоценотическом аспектах, в разных биотических
областях (зонах) соответствующих биогеоценозов. Подобные наблюдения
проведены в разных ботанико-географических районах: в тундровой зоне (Шамурин,
1958а, 1960; Кайгородова, 1972, 1976) , темнохвойной тайге (Верещагина, 1966;
Пономарев, Верещагина, 1973), широколиственных лесах (Антонова, 1976),
степях (Пономарев, 1954, 1960; Шамурин, 19586; Пономарев, Демьянова, 1978;
Демьянова, 1981), пустынях юго-восточного Казахстана (Демьянова, 1970),
высокогорьях Памира (Новожилова, 1984).
В последние годы в зарубежной литературе термин «антэкология» используется
в более широком понимании, включая различные аспекты систем размножения,
эволюции и видообразования, функционирования экосистем (Baker, 1979).
С нашей точки зрения, значительное расширение термина «антэкология» вряд
ли целесообразно. В то же время можно считать вполне обоснованным
использование результатов антэкологических исследований при рассмотрении вопросов
эмбриогенеза, систем размножения, семенной продуктивности и
распространения семян. Важным разделом антэкологии, получившим наибольшее развитие в
последнее десятилетие XX века, является изучение несовместимости у
цветковых растений (Heslop-Harrison. 1992; Pacini, 1992; Вишнякова, 1997;
Stephenson, 1998).
Антонова, 1976; Верещагина, 1966; Вишнякова, 1997; Демьянова, 1970, 1981; Кайгородова,
1972, 1976; Козо-Полянский, 1947а,б, 1950, 1951; Новожилова, 1984; Первухина, 1970, 1979;
Пономарев, 1954, 1960, 1969, 1970; Пономарев, Верещагина, 1973; Пономарев, Демьянова,
1978; Руцкий, 1937, 1938, 1967, 1980; Шамурин, 1958а,б, i960; Baker, 1979; Hagerup, 1951;
Heslop-Harrison, 1992; Kugler, 1955, 1970; Pacini, 1992; Robertson, 1904; Stephenson, 1998.
ПОЛОВОЙ ПОЛИМОРФИЗМ (греч. poly - много, Morpha - форма) -
различия цветковых растений, связанные с половым типом цветков в пределах одной
особи или популяции.
В процессе эволюции у цветковых растений выработались наследственно
устойчивые морфо-физиологические различия, связанные с дифференциацией
пола особей и способствующие успеху перекрестного опыления, расширению
ареалов видов и т.д.
Linne (1735) впервые предложил различать четыре основные половые формы:
гермафродитные, однодомные, двудомные и полигамные растения. Позднее,
Кернер (1902) выделил 15 половых типов цветковых растений. Однако его
классификация не получила дальнейшей поддержки, хотя и наглядно
продемонстрировала многообразие в выражении пола у цветковых растений. Существуют и
более детальные классификации половых типов покрытосемянных (Yampolsky С,
Yampolsky Н, 1922; Correns, 1928; Розанова, 1935; Кожин, 1941; Кордюм, Глу-
щенко, 1976; Демьянова, 1990).
74 Системы репродукции
Выделяют 5 основных половых типов цветковых растений, которые
подразделяются на несколько половых форм (по классификации Демьяновой, 1990, с
некоторыми изменениями).
I тип. Гермафродитные растения — подавляющее большинство цветковых
растений с обоеполыми цветками; механизмами, препятствующими
самоопылению, являются дихогамия либо ди- и тристилия.
II тип. Однодомные растения (монойкисты) — в пределах одной особи
встречаются различные половые типы цветков.
Выделяют следующие половые формы:
1 — моноэцичные (собственно однодомные) растения — тычиночные
(мужские) и пестичные (женские) цветки развиваются на одной особи (Alismataceae,
Araceae, Cyperaceae, Juglandaceae, Typhaceae);
2 — андромоноэцичные растения — обоеполые и тычиночные цветки
развиваются на одной особи (Apiaceae, Poaceae, Ranunculaceae, Rosaceae);
3 — гиномоноэцичные растения — обоеполые и пестичные цветки находятся
на одной особи (Asteraceae, Caryophyllaceae, Chenopodiaceae);
4 — тримоноэцичные растения — на одной особи развиваются обоеполые,
тычиночные и пестичные цветки (Amaranthaceae, Cucurbitaceae, Polygonaceae и др.).
III тип. Двудомные растения (диойкисты) — обоеполые и тычиночные либр
обоеполые и пестичные, либо тычиночные и пестичные цветки развиваются на
разных особях. Выделены следующие половые формы:
1 — диэцичные (собственно двудомные растения) — одни особи формирует
только пестичные цветки, другие — только тычиночные (Elaeagnaceae, Moraceae,
Urticaceae);
2 — андродиэцичные растения — одни особи формируют обоеполые цветки,
другие — только тычиночные (Lardizabalaceae, Liliaceae, Ranunculaceae,
Rosaceae и др.);
3 — гинодиэцичные растения — одни особи формируют обоеполые цветки,
другие — только пестичные (Asteraceae, Campanulaceae, Dipsacaceae, Lamiaceae);
4 — многобрачно-двудомные растения (полидиойкисты) — тычиночные,
пестичные и обоеполые цветки расположены на разных особях (Rumex — сем.
Polygonaceae).
IV тип. Трехдомные растения (триойкисты) — разные половые типы цветков
(обоеполые, пестичные, тычиночные) и их сочетания проявляются в пределах трех
и более особей вида (Calligonum — сем. Polygonaceae).
V тип. Полигамные, или многодомные растения — наряду с обоеполыми
цветками развиваются однополые цветки в различном их сочетании на одной — трех и
более особях (андромоно- и андроэцичные, гиномоно- и гинодиэцичные, триэцич-
ные) (представители семейств Asteraceae, Cucurbitaceae, Dipsacaceae и др.).
Половая дифференциация цветковых растений достаточно четко скоррелирова-
на с морфологическими признаками вегетативной и репродуктивной сфер, что в
первую очередь связано с их разными требованиями к условиям внешней среды
(Демьянова, 1990). Различным половым формам свойственна асинхронность в
физиологических и суточных сроках и длительности цветения в пределах
популяции и отдельных особей. Тем самым они представляют собой как бы разные
экологические расы в пределах вида, отличающиеся приспособлениями к перекрестному
опылению, стратегией и тактикой цветения. Неодинаковая требовательность поло-
Системы опыления и скрещивания 75
вых форм цветковых растений к условиям обитания уменьшает внутривидовую
конкуренцию и повышает жизнеспособность вида в целом.
Демьянова, 1990; Кернер, 1902; Кожин, 1941; Кордюм, Глущенко, 1976; Розанова, 1935; Correns,
1928; Linne, 1735; Yampolsky С, Yampolsky H., 1922.
МОНОЭЦИЯ (греч. monos — один, oikos — дом), или однодомность — наличие
на одном и том же растении однополых цветков — женских и мужских. Синоним:
монэция. Термин предложен Linne.
Согласно сводке Yampolsky С, Yampolsky H. (1922), однодомные растения
составляют около 7% мировой флоры. В немногих изученных ботани-
ко-географических районах пропорция однодомных может быть иной. Так,
британская флора содержит 5.4-8.7% однодомных видов (Lewis, 1942; McComb
1966; Kay, Stevens, 1986), южно—австралийская флора—3.1% (Parsons, 1958).
Примерно такая же пропорция моноэцичных растений и во флоре Западной
Австралии (McComb, 1966). В тропической флоре Пуэрто-Рико и Виргинских
островов (Flores, Schemske, 1984) и тропических листопадных лесов Мексики
(Bullock, 1985) доля однодомных видов значительно выше (соответственно 10.5
и 12%). Такое положение связано, вероятно, с широкой представленностью
древесных в тропических флорах, среди которых значительно распространена
однодомность. К однодомным растениям относятся все виды семейств Begoniaceae,
Betulaceae, Casuarinaceae, Fagaceae, Juglandaceae, Lemnaceae, Palmae,
Pandanaceae, Platanaceae, Sapindaceae, Sparganiaceae, Typhaceae и др.
Преимущественно однодомные формы характерны для семейств Achariaceae и
Cucurbitaceae (Yampolsky С, Yampolsky H., 1922; Кордюм, Глущенко, 1976).
Наличие однодомности в разных семействах, часто не имеющих родственных
связей между собой, приводит к убеждению о независимом происхождении
однодомности в разных филах цветковых. Некоторые авторы придерживаются мнения
о взаимосвязи однодомности и двудомности. Так, Lewis (1942) на основании
анализа британской флоры сделал вывод, что двудомность могла часто, но не всегда,
возникнуть из однодомности.
Моноэция в большей степени свойственна однодольным по сравнению с
двудольными (Yampolsky С, Yampolsky Н., 1922; Daumann, Synek, 1968; Kugler,
1970; Daumann, 1972). По-видимому, обособление полов среди однодольных
заканчивается на этапе однодомности, а у двудольных оно идет дальше до полной
двудомности (Монюшко, 1937; Уильяме, 1968).
Однодомность, как правило, сопряжена с ветроопылением, например, у
однодомных видов семейств Cyperaceae, Chenopodiaceae, а также видов родов Alnus,
Betula, Carpinus, Fagus, Quercus (Кернер, 1902; Sporne, 1949; Meeuse, 1965;
Daumann, Synek, 1968; Kugler, 1970; Faegri, Pijl van der, 1980). Однако поданным
McComb (1966), 38% негермафродитных видов (в том числе однодомных и
двудомных) относятся к энтомофилам. Из этого следует, что однополые растения
Британских островов возникли как в насекомоопыляемых филах, так и ветроопы-
ляемых. Не исключено, что взаимосвязь между однополостью (в частности,
однодомностью) и насекомоопылением может быть неадекватной в разных районах
Земного шара.
76 __^_ Системы репродукции
В литературе отмечена корреляция между раздельнополостью, в частности
однодомностью, и дихогамией в форме протогинии. В первую очередь это относится к
ветроопыляемым однодомным растениям, как древесным, так и травянистым
(Knuth, 1898a, Ь, 1899,1904,1905; Кернер, 1902; Меце, Кнут, 1911). У
большинства подобных растений, особенно у кустарников и деревьев, пыльца
освобождается из пыльников лишь после того, как рыльца уже в течение 2 — 3 дней (а часто и
раньше) становятся восприимчивыми к пыльце. В течение этого времени у них
происходит только перекрестное опыление.
По современным представлениям, проявление признаков пола у растений
контролируется не только генотипом, но и факторами внешней среды (Лобашов и др.,
1979; Чайлахян, Хрянин, 1982; Гершензон, 1983; Алиханян, 1985; Дубинин,
1986). Heslop-Harrison (1957, 1972), Рыжков (1966), Уильяме (1968) и другие
авторы подчеркивают, что среда имеет особенно большое влияние на реализацию
признаков пола. Например, у однодомных растений при определенных условиях
признаки одного из полов могут усиливаться либо полностью подавляться
(Чайлахян, 1947; Минина, 1952,1965; Джапаридзе, 1963,1965; Heslop-Harrison, 1972;
Чайлахян, Хрянин, 1980, 1982; Френкель, Галун, 1982).
Кроме того, соотношение цветков разной сексуализации может меняться в ходе
онтогенеза у многолетних однодомных растений. Так, на молодых экземплярах
Eucommia ulmoides, Diospyros kaki, Aleurites sp. формируются преимущественно
мужские цветки, а по мере старения — женские (Минина, 1952). Пропорции
мужских и женских цветков могут изменяться и в течение одного сезона. Так, у Musa spp.
происходит переход от женских цветков к мужским, а у Ricinus communis, как и у
Cucumis sativus, наблюдается противоположное явление (Френкель, Галун, 1982).
Авторы приходят к заключению о неслучайном соотношении цветков разной
сексуализации и о постепенных изменениях в этой пропорции в ходе онтогенеза.
Все вышесказанное относится к однодомным растениям в узком смысле слова.
К моноэцичным растениям в широком понимании ряд исследователей относит все
половые формы, которые содержат цветки разной сексуализации (обоеполые и
раздельнополые) в пределах одного растения (Correns, 1928; Розанова, 1935; Мо-
нюшко, 1937; Кожин, 1941; Кордюм, Глушенко, 1976; Демьянова, 1990).
Согласно такой классификации, к однодомным растениям относят, кроме моноэцичных
форм, гиномоноэцичные (гиномонойкисты), андромоноэцичные (андромонойки-
сты) и тримоноэцичные (тримонойкисты) виды (см. Половой полиморфизм).
Абсолютное большинство гиномоноэцичных видов относится к Asteraceae.
Здесь гиномоноэция является вполне устойчивым систематическим признаком.
Количественные соотношения между обоеполыми и женскими цветками вполне
стабильны в пределах соцветия, генетически закреплены и мало подвержены
влиянию условий среды (Lloyd, 1972a,b). Как правило, женские цветки
располагаются по периферии корзинок, центр которых занимают обоеполые (Achillea,
Artemisia (подрод Artemisia Less.), Erigeron, Filago, Inula и др.). Наибольшее
число гиномоноэцичных видов среди сложноцветных обнаружено в трибе
Anthemideae (Поляков, 1967).
По мнению Lewis (1942) и Полякова (1967), у сложноцветных возможна
параллельная эволюция двудомности и однодомности из гермафродитизма.
Возникновение моноэции совершалось независимо у разных видов Asteraceae. Вероятно,
также самостоятельно происходило и развитие гиномоноэции.
Системы опыления и скрещивания
77
Андромоноэция описана в семействах Chenopodiaceae, Fabaceae,
Ranunculaceae и др., но наиболее распространена среди Apiaceae и Роасеае
(Knuth, 1898-1905; Yampolsky С, Yampolsky H., 1922; Fryxell, 1957; Кордюм,
Глущенко, 1976). Мужские цветки служат дополнительным источником пыльцы
при перекрестном опылении.
Примером андромоноэцичных злаков могут служить виды Andropogon,
Arrhenatherum, Hierochle, Holcus, Panicum, Phragmites, Setaria, Sorghum
(Пономарев, 1964). У подавляющего большинства указанных злаков обнаружена
очередность в цветении обоеполых и мужских цветков. Как правило, мужские цветки
раскрываются позднее, чем обоеполые. Разница во времени может достигать 2-4
дней (Пономарев, 1964). Раздельнополость и временной разрыв в раскрывании
цветков разной сексуализации способствует перекрестному опылению.
У Apiaceae андромоноэция известна давно и довольно хорошо изучена
(Knuth, 1898b; Кернер, 1902; Braak, Kho, 1958; Пономарев, 1960, 1961;
Кордюм, 1967; Тюрина, 1971, 1974; Singh, Ramanujam, 1973; Кордюм,
Глущенко, 1976). Локализация мужских цветков в пределах растения подчинена
определенной закономерности: количество мужских цветков увеличивается с
возрастанием порядка зонтика. Реже они находятся в зонтиках всех порядков
вместе с обоеполыми цветками (например, у Coriandrum sativum). Мужские
цветки преобладают над обоеполыми в количественном отношении (Doust,
1980). Увеличение количества мужских цветков, особенно в зонтиках высших
порядков, повышает общую пыльцевую насыщенность популяции.
Локализация мужских цветков неодинакова в пределах зонтичков у разных растений:
они могут быть краевыми, срединными, срединными и краевыми или иметь
другую позицию. Тенденция к формированию мужских цветков определяется
генетически, но на нее могут влиять и окружающие условия (Braak, Kho,
1958; Singh, Ramanujam, 1973).
У зонтичных андромоноэция сопровождается дихогамией в форме
протандрии, свойственной отдельным цветкам и зонтикам, а нередко и всему растению в
целом (Бекетов, 1889; Knuth, 1898; Кернер, 1902; Меце, Кнут, 1911;
Пономарев, 1960,1961; Демьянова, 1990). Распускание цветков, прохождение и смена
пыльниковой и рыльцевой фаз во всех зонтиках любого порядка происходит
последовательно и многократно у каждой особи. Протерандрия, охватывающая
всю особь в целом, обеспечивает строгое перекрестное опыление и полностью
исключает гейтоногамию.
Тримоноэция отмечена у Anacardiaceae, Apiaceae, Araliaceae, Chenopodiaceae,
Fabaceae, Orchidaceae, Palmae и некоторых других (Yampolsky С., Yampolsky H.,
1922). Эта половая форма встречается крайне редко. В отечественной флоре она
известна у некоторых Araliaceae (Acanthopanax sessiliflorus, Eleutherococcus senticosus
— Елумеев, 1970 и Oplopanax elatus — Симонова, 1980). Разделение полов
сопровождается у них резко выраженной протандрией обоеполых цветков, что еще более
способствует перекрестному опылению.
Однодомности (в широком понимании этого термина) свойственна не только
раздельнополость, но и другие атрибуты перекрестного опыления: дихогамия (обычно в
форме протогинии, реже — протандрии) и самонесовместимость (Fryxell, 1957;
Nettancourt, 1977). В то же время среди однодомных растений много и апомиктич-
ных форм (Asteraceae и Роасеае — Хохлов, 1967; Хохлов и др., 1978). Совокуп-
78
Системы репродукции
иость столь разных жизненных стратегий способствует прочному становлению
однодомности у покрытосемянных.
В цитоэмбриологическом отношении, согласно сводке Кордюм и Глущенко
(1976), имеет место довольно четкое разграничение двух типов однополых
цветков: а) цветки без зачатков (рудиментов) органов другого пола (структурно
однополые цветки); б) цветки с зачатками (рудиментами) органов другого пола,
степень развития которых может варьировать (потенциально обоеполые цветки).
У последних (например, Cucurbitaceae) ранние этапы органогенеза протекают
сходно с таковыми у обоеполых цветков: в процессе дифференциации цветочных
бугорков закладываются зачатки тычинок и плодолистиков. Начальные этапы
органогенеза цветков одинаковы независимо от половой формы растения.
Развитие органов другого пола останавливается, как правило, на стадии
недифференцированных зачатков.
По мнению Кордюм и Глущенко (1976), структурно однополые и потенциально
обоеполые (мужские и женские) цветки формируются у цветковых, занимающих
различное положение в филогенетической системе и представленных разными
половыми формами — однодомными, андро- и гиномоноэцичными, полигамными,
двудомными, гинодиэцичными и полигамно диэцичными формами. Тип
однополого цветка (структурно однополый или потенциально обоеполый) константен у
разных половых форм в пределах вида и рода. Вариации отмечены лишь в степени
развития элементов стерильного пола в потенциально обоеполых цветках.
Алиханян, 1985; Бекетов, 1889; Гершензон, 1983; Демьянова, 1990; Джапаридзе, 1963; 1965;
Дубинин, 1986; Елумеев, 1970; Кернер, 1902; Кожин, 1941; Кордюм, 1967; Кордюм, Глущенко,
1976; Лобашов и др., 1979; Меце, Кнут, 1911; Минина, 1952, 1965; Монюшко, 1937; Поляков,
1967; Пономарев, 1960, 1961, 1964; Розанова, 1935; Рыжков, 1936; Симонова, 1980; Тюрина,
1971,1974; Уильяме, 1968; Френкель, Галун, 1982; Хохлов, 1967; Хохлов и др., 1978; Чайлахян,
1947; Чайлахян, Хрянин, 1980, 1982; Braak, Kho, 1958; Bullock, 1985; Correns, 1928; Daumann,
1972; Daumann, Synek, 1968; Doust, 1980; Flores, Schemske, 1984; Heslop-Harrison, 1957, 1972;
Fryxell, 1957; Kay, Stevens, 1986; Knuth, 1898a,b, 1899, 1904, 1905; Kugler, 1970; Lewis, 1942;
Linne, 1735; Lloyd, 1972a,b; McComb, 1966; Meeuse, 1965; Nettancourt, 1977; Parsons, 1958;
Singh, Ramanujam, 1973; Sporne, 1949; Yampolsky C, Yampolsky H., 1922.
ГИНОДИЭЦИЯ (греч. gyne — женщина, di — двойной, дважды, oikos — дом),
или женская двудомность — т.е. наличие в популяции одного вида особей гермаф-
родитных и особей с функционально женскими цветками.
Термин предложен Darwin (1877), который дал морфологическое описание
этого явления на примере представителей Asteraceae, Boraginaceae, Dipsacaceae,
Lamiaceae и Plantaginaceae. Согласно автору, андростерильные цветки, по
сравнению с обоеполыми, характеризуются редукцией андроцея, полной стерильностью
пыльцы, уменьшением размеров околоцветника (особенно венчика). У гиноди-
эцичных видов наряду с обоеполыми и женскими растениями обнаружены особи с
цветками переходного типа, что указывает на происхождение женских особей от
гермафродитных путем редукции андроцея. Независимо от степени дегенерации
андроцея, пыльники таких цветков содержат небольшое количество фертильной
пыльцы (Darwin, 1877). Становление гинодиэции как половой формы связано с
возросшей семенной продуктивностью женских форм. Полустерильные особи у ги-
нодиэцичных видов относятся к интерсексам (Гроссет, 1974).
Системы опыления и скрещивания
79
В качестве важного фенотипического признака женской двудомности Darwin
(1877) рассматривал меньшие размеры околоцветника. Однако не во всех
семействах морфологические различия половых форм выражены вполне отчетливо. Так, у
некоторых представителей семейств Campanulaceae (Campanula bononiensis, С.
wolgensis) и Scrophulariaceae (Pedicularis kaufmannii, P. dasystachys) размеры
венчиков значительно варьируют, что затрудняет определение половой формы
цветка (Демьянова, Титова, 1981). Только просмотр большого материала и его
математическая обработка позволяют с достоверностью судить о больших размерах
обоеполых цветков по сравнению с женскими. Полустерильные цветки занимают
по размерам срединное положение между обоеполыми и женскими цветками.
На размеры околоцветника у женских форм, согласно гипотезе Baker (1957) и
Plack (1957), влияют гормоны, выделяемые тычинками. Редукция пыльников и
пыльцы, проходящая на ранней стадии, сказывается более губительно по
сравнению с дегенерацией их в более поздний период. В андростерильных цветках
редукция мужской сферы коррелятивно никак не связана с женской, на что указывал еще
Darwin (1877). Лучше выраженную воспринимающую поверхность рылец
женских цветков, отмеченную у гинодиэцичных видов (Eleuterius, McDaniel, 1974;
Демьянова, 1990), следует рассматривать как приспособление у женских форм к
перекрестному опылению — единственному и неизбежному.
После работы Darwin (1877) список гинодиэцичных видов значительно
пополнился (Muller, 1881; Knuth, 1898-1905; Yampolsky С, Yampolsky H., 1922;
Хохлов, 1968; Пономарев, Демьянова, 1975). Наиболее полный перечень включает
613 видов из 185 родов, относящихся к 52 семействам цветковых из разных
флористических районов Земли (Демьянова, 1985). Наибольшее число гинодиэцичных
видов отмечено в подклассах Caryophyllidae и Lamiidae в семействах
Caryophyllaceae и Lamiaceae. Нередка гинодиэция у Apiaceae, Boraginaceae,
Dipsacaceae, Ceraniaceae, Plantaginaceae. Как и в пределах подклассов, она чаще
встречается в семействах, наиболее продвинутых в филогенетическом отношении.
Подавляющее большинство из них занимают верхнее положение в
филогенетической системе цветковых растений (Takhtajan, 1980) и характеризуются трехклеточ-
ной зрелой пыльцой. В семействах, где отмечена дву- и трехклеточная зрелая
пыльца, гинодиэция, как правило, приурочена к видам с трехклеточной пыльцой и
отсутствует или встречается крайне редко у видов этого же семейства с двуклеточной
(например, Boraginaceae, Centianaceae, Lamiaceae). Особенно четко такая
взаимосвязь прослеживается в сем. Lamiaceae (Демьянова, 1981), где гинодиэция
найдена у видов с трехклеточной пыльцой (в родах Glechoma, Origanum, Salvia,
Thymus и др.) и не обнаружена у видов с двуклеточной пыльцой (в родах Ajuga,
Galeopsis, Leonurus, Phlomis и др.). Такая корреляция между гинодиэцией и
зрелой трехклеточной пыльцой, имеющей определенные преимущества перед
двуклеточной (Hoekstra, 1973; Hoekstra, Bruinsma, 1978), вероятно, связана с
необходимостью и неизбежностью перекрестного опыления у женских форм. Для них
крайне важна степень готовности репродуктивной сферы к восприятию пыльцы и
оплодотворению.
Гинодиэция встречается в основном у многолетних форм и реже у однолетников
и двулетников. Даже в пределах одного рода (например, Salvia) женская
двудомность не обнаружена у однолетних видов и весьма обычна у многолетников.
Исключение представляет лишь сем. Caryophyllaceae, где женская двудомность не-
80
Системы репродукции
редко отмечается и у однолетников (например, в родах Dianthus, Silene). Однако и
в этом случае в природных популяциях таких растений доля женских особей
сравнительно невелика. Гинодиэция гораздо чаще встречается у энтомофильных
растений в сравнении с анемофильными.
Женская двудомность может сочетаться с другими половыми формами — ан-
дромоноэцией (например, у Apiaceae — Knuth, 1898 б; Пономарев, 1961;
Webb, 1979; Тюрина, 1987) и гиномоноэцией (Asteraceae, Lamiaceae,
Polemoniaceae, Valerianaceae и др.). У некоторых гинодиэцичных видов гино-
моноэцичные особи встречаются даже чаще, чем женские (например, у
Dracocephalum thymiflorum, Polemonium caeruleum, Silene noctiflora, Stellarla
nemorum, Valeriana rossica, V. tuberosa).
Численность женских особей в популяции у разных гинодиэцичных видов
колеблется в очень широких пределах (от десятых долей процента до 60% и более),
но у каждого вида она довольно определенна и обычно сравнительно устойчива на
значительном протяжении ареалов таксонов (Пономарев, Демьянова, 1975;
Демьянова, Пономарев, 1979; Демьянова, 1981, 1988, 1990,1997).
Интерпретация соотношения полов у гинодиэцичных видов крайне затруднена
из-за почти полного отсутствия данных по генетике женской двудомности, в том
числе и по наследованию пола. Только на примере немногих изученных видов
доказана как цитологическая обусловленность женской двудомности (Correns, 1928;
Scalinska, 1931; Гостев, 1971; Simmonds, 1971), так и ядерный характер
наследования пола (Lewis, Crowe, 1956). У гинодиэцичного злака Cartaderia richardii
мужская стерильность наследуется как рецессивный признак (Connor, 1965). Таким
образом, характер наследования мужской стерильности у гинодиэцичных видов
довольно разнообразен и может быть неодинаков у представителей одного
семейства и даже рода, например, у Salvia (Linnert, 1955,1958; Гостев, 1971). Крупное
(1973) рассматривает гинодиэцию как особый случай мужской стерильности.
Не вызывает сомнения происхождение женских цветков от обоеполых. Цито-
эмбриологические исследования показали, что первоначально женские цветки
закладываются как потенциально обоеполые. В дальнейшем наблюдается целая
гамма отклонений от нормального течения эмбриологических процессов на разных
стадиях формирования андроцея в пределах всего растения. Признаки дегенерации
могут обнаруживаться на стадиях спорогенных клеток, микроспороцитов в разных
фазах мейоза, на стадии тетрад микроспор, микроспор, дву- и трехклеточных
пыльцевых зерен. В профазе I деления мейоза в микроспороцитах потенциально
женских цветков нередко отмечается цитомиксис (Верещагина, Маланина, 1974;
Демьянова, Покатаева, 1977; Демьянова, 1978; Верещагина, 1980).
Многочисленные примеры различных аномалий в ходе микроспорогенеза у женских форм
гинодиэцичных видов приведены в сводке Кордюм и Глущенко (1976).
Гинодиэция часто рассматривается в качестве промежуточного этапа на пути от
гермафродитизма к истинной двудомности (Монюшко, 1937; McComb, 1966; Ross,
1970). Впервые эту идею высказал Darwin (1877). Случаи, когда двудомность
развилась через гинодиэцию, отмечен у Braussaisia arguta (Saxifragaceae), видов p.
Couldia из сем. Rubiaceae (Carlquist, 1966), Pimelea из сем. Thymelaeaceae
(Burrows, 1960). Другие авторы, напротив, считают, что гинодиэция, будучи вполне
устойчивой половой формой с хорошо сбалансированной системой скрещивания, не
обнаруживает тенденции к двудомности (Lewis, 1942; McComb, 1966).
Рис.6. Гинодиэция у Salvia stepposa (1-3), Dianthus versicolor (4 -6)
и Gypsophila altissima (7-9).
1,4 — обоеполый цветок, 2, 5 - женский цветок, 3, 6 — он же в разрезе (видны редуцированные
тычинки); 7 — морфологически обоеполый, но функционально мужской цветок (не образующий
плодов), 8 — морфологически обоеполый, но функционально женский цветок, 9 — он же, без
околоцветника (видны редуцированные тычинки).
1-9 — по: Пономарев, Демьянова, 1980.
82
Системы репродукции
Широкое распространение гинодиэции среди цветковых связано, вероятно,
прежде всего с возможностью успешного сочетания перекрестного опыления (у
обоеполых и женских особей) и самоопыления (у обоеполых). Поскольку у
женских растений перекрестное опыление служит единственным способом опыления,
это обстоятельство значительно усиливает гибридизационные процессы, часто
«размывая» границы между близкими видами. Широко представленная женская
двудомность (например, у Thymus и Mentha) оказывает существенное влияние на
внутри- и межпопуляционную изменчивость видов. Рис. 6.
Верещагина, 1980; Верещагина, Маланина, 1974; Гостев, 1971; Гроссет, 1974; Демьянова, 1978,
1981,1985,1988,1990,1997; Демьянова, Покатаева, 1977; Демьянова, Пономарев, 1979;
Демьянова, Титова, 1981; Кордюм, Глущенко, 1979; Крупное, 1973; Монюшко, 1937; Пономарев, 1961;
Пономарев, Демьянова, 1975; Тюрина, 1987; Хохлов, 1968; Baker, 1957; Burrows, I960; Carlquist,
1966; Connor, 1965; Correns, 1928; Darwin, 1877; Eleuterius, McDaniel, 1974; Hoekstra, 1973;
Hoekstra, Bruinsma, 1978; Knuth, 1898-1905; Lewis, 1942; Lewis, Crowe, 1956; Linnert, 1955,1958;
McComb, 1966; Miiller, 1881; Plack, 1957; Ross, 1970; Scalinska, 1931; Simmonds, 1971; Takhtajan,
1980; Webb, 1979; Yampolsky C, Yampolsky H., 1922.
ГЕТЕРОСТИЛИЯ (греч. heteros — другой, stylos — столбик), или разностолбчатость
— наличие у разных особей двух или более форм цветков, различающихся по длине
столбиков и тычиночных нитей, вследствие чего рыльца и пыльники расположены на
разной высоте. Термин предложил Persoon (1794, цит. по Schneider, 1905).
Наиболее ярко гетеростилия проявляется в существовании двух форм цветков:
длинностолбчатых и короткостолбчатых. Существуют два типа гетеростилии:
диморфная (гетеродистилия) и триморфная (гетеротристилия).
Диморфная гетеростилия — у одного и того же вида имеются два типа цветков:
с длинными и короткими столбиками (например, Fagopyrum, Linum, Primula). У
диморфных первоцветов (Primula) в цветках длинностолбчатой формы тычинки
располагаются в глубине венчика, тогда как у короткостолбчатой формы — в его
зеве. Классический диморфный тип гетеростилии известен у представителей
семейств Boraginaceae, Caesalpiniaceae, Capparidaceae, Commelinaceae,
Centianaceae, Iridaceae, Oleaceae, Oxalidaceae, Plumbaginaceae, Polygonaceae,
Primulaceae, Rubiaceae, Turneraceae, Verbenaceae (Vogel, 1955; Vuillemier, 1967).
Гетеростильные формы растений различаются и по другим признакам. Так, корот-
костолбчатые цветки по сравнению с длинностолбчатыми характеризуются более
крупной пыльцой и более мелкими сосочками рыльца. Самоопыление в той или
иной форме, а также переопыление между особями одного морфологического типа
дает ничтожное количество семян (самонесовместимость), тогда как перенос
пыльцы между растениями с разной длиной столбика высокоэффективен.
Триморфная гетеростилия — у одного и того же вида имеется три типа
цветков: с длинными, средними и короткими столбиками (Lythrum salicaria). Тычинки
в цветке каждой формы имеют ту же длину, что и столбики цветков двух других
форм. Оплодотворение оказывается наиболее эффективным при опылении рыльца
каждой формы цветка пыльцой тычинок соответствующей длины из двух других
форм цветка. Эта форма гетеростилии обнаружена у видов семейств Linaceae,
Lythraceae, Oxalidaceae, Pontederiaceae (Baker, 1962).
Рис. 7. Гетеростилия у Primula sp (1-6) и Lythrum salicaria (7-9).
1-3 - короткостолбчатая форма: 1 - цветок в разрезе, 2 - столбик с сосочковидной поверхностью
рыльца, 5 - поверхность рыльца (увел.); 4-6 - длинностолбчатая форма: 4 - цветок в разрезе 5 -
столбик с сосочковидной поверхностью рыльца, 6 - поверхность рыльца (увел.); 7 -
длинностолбчатая форма, 8 - среднестолбчатая форма, 9 - короткостолбчатая форма.
1-9 — по: Пономарев, Демьянова, 1980.
84
Системы репродукции
Гетеростилия препятствует автогамии и способствует ксеногамии. Опыление
происходит в том случае, если рыльце и пыльники находятся в одинаковом
положении, т.е. например, короткому столбику одного цветка соответствуют
короткие тычинки второго. Такое опыление является легитимным и всегда
оказывается перекрестным (Leven, 1968; Mulcahy, Caporello, 1970). Гетеростилии
сопутствует явление самонесовместимости (Ornduff, 1970; см.
Самонесовместимость: структурно-функциональные аспекты, Т. 2).
Возможно, что гетеростилия способствует видообразованию. Так, Leven и Berube
(1973) описали два разных, но очень близких вида Phlox, которые характеризуются
разными типами гетеростилии. По мнению Baker (1960), у видов p. Mussaenda
именно гетеростилия является одним из путей, ведущих к образованию однополых
растений. Это предположение, высказанное еще Дарвином, является весьма
существенным для объяснения, как в группах, защищенных от инбридинга различными
механизмами, могла возникнуть двудомность, например, у Nymphoides (Ornduff,
1966). Baker (1960) предположил следующую последовательность возникновения
гетеростилии в сем. Plumbaginaceae: несовместимость — диморфизм пыльцы —
диморфизм рыльца — гетеростилия. Последнюю можно рассматривать как
структурно-функциональный механизм, препятствующий самоопылению. Рис. 7.
Пономарев, Демьянова, 1980; Baker, 1960, 1966; Faegri, Pijl van der, 1966; Iversen, 1940; Leven,
1968; Leven, Berube, 1973; Mulcahy, Caporello, 1970; Ornduff, 1966, 1970; Smith, 1970; Vogel,
1955; Vuillemier, 1967.
ДИХОГАМИЯ (греч. diche — раздельный, gamos — брак) — разновременное
созревание пыльников и рылец в одном цветке. При этом цветки находятся то в
мужской (пыльниковой), то в женской (рыльцевой) фазе, что рассматривается как
приспособление к перекрестному опылению, препятствующее или ограничивающее
самоопыление. Термин предложил Sprengel (1793, цит. по Schneider, 1905).
Различают две формы дихогамии: протандрия (протероандрия) и протогиния
(протерогиния) (Hildebrand, 1867). В случае протандрии раньше созревает
пыльца и пыльники вскрываются до того, как рыльце готово к ее восприятию. Бывают
случаи опадения пыльников до того, как созреет рыльце (например, Saxifraga и
Impatiens). При протогинии происходит более раннее созревание рылец.
Дихогамия, однако, не всегда исключает самоопыление. Нередко в конце
цветения возможна автогамия, если по каким-либо причинам произошло одновременное
созревание пыльцы и рылец. Кроме того, самоопыление возможно у дихогамных
растений при наличии на одном растении многочисленных цветков, находящихся в
разных фазах развития. Сочетание перекрестного опыления и самоопыления
играет, несомненно, положительную роль в эволюции.
Протандрия встречается чаще, чем протогиния и более соответствует
нормальной последовательности в развитии частей цветка. Эта форма дихогамии
наблюдается у многих представителей семейств Asteraceae, Campanulace.ae, Caryo-
phyllaceae, Fabaceae, Lamiaceae, Malvaceae, Ranunculaceae. В сем. Campanulaceae
пыльники вскрываются еще в бутоне. Пыльца высыпается на верхнюю часть
столбика пестика, а также на наружную поверхность плотно сомкнутых лопастей
рыльца и удерживается короткими одноклеточными волосками, которые служат своего
рода коллектором пыльцы, или «пыльцеснимателем». После того, как пыльники
Системы опыления и скрещивания
85
освободились от пыльцы, венчик раскрывается и все тычинки, кроме оснований
тычиночных нитей, засыхают, скручиваются и откидываются к основанию
чашечки, открывая таким образом доступ насекомых к ярко окрашенному нектарнику.
Некоторое время столбик служит лишь для подачи пыльцы опылителям, которые в
поисках нектара неизбежно касаются покрытых пыльцой волосков столбика,
находящихся на прямом их пути к нектарному диску. Цветок переходит в женскую фазу
после того, как пыльца будет собрана насекомыми. Лопасти рыльца (их число
обычно 3-7) начинают раскрываться и закручиваться своей внутренней
поверхностью к столбику. Рыльце готово к восприятию пыльцы, и теперь уже при
посещении цветка опылитель так или иначе заденет сосочки рыльца, и, если на нем есть
пыльца, то произойдет опыление. Многие исследователи предполагают, что в тех
случаях, когда на столбике еще сохранились остатки пыльцы, может произойти
самоопыление. Самоопыление принципиально возможно также у видов со
свисающими вниз цветками, у которых пыльца, если она еще осталась на столбике, может
попасть на отогнутые лопасти рыльца (Жинкина, 1995).
У Silene multiflora, S. chlorantha цветки распускаются вечером и находятся в
пыльниковой фазе. Утром цветки закрываются и тычинки увядают. И только на
третьи сутки выдвигаются рыльца. Таким образом, автогамия исключается.
У видов сем. Apiaceae протандрия типична и охватывает не только отдельные
сложные зонтики, но и всю особь в целом. Это достигается благодаря строгой
очередности в цветении зонтиков разного порядка и полной его синхронности у
зонтиков одного порядка. Вследствие этого цветки на одной особи последовательно
несколько раз находятся то в пыльниковой, то в рыльцевой фазе, причем эти фазы
(например, у Libanotis intermedia), как правило, не совпадают. Этот тип
протандрии с многократной сменой пыльниковой и рыльцевой фаз получил название
Libanotis-тип. Значительно реже встречается другой тип протандрии —
Peucedanum-тип, характеризующийся однократной сменой фаз одновременно у
всех цветущих зонтиков особи независимо от того, к какому порядку они
принадлежат. Такая протандрия описана только у Peucedanum lubimenkoanum (Пономарев,
Демьянова, 1980).
Четкая протандрия в пределах одного соцветия, а также одновременная или
неодновременная смена фаз в цветении соцветий разных порядков свойственны
и некоторым видам сем. Dipsacaceae — Knautia arvensis, Scabiosa ochroleuca
(Камелина, 1981).
Явление протогинии характерно для семейств Berberidaceae, Brassicaceae,
Caprifoliaceae, Caricaceae, Poaceae, Juncaceae, Rosaceae, Thymelaeaceae. У
видов Parietaria (сем. Urticaceae) и в сем. Аппопасеае наблюдается опадение
столбика до раскрывания пыльников. У цветков-ловушек, характерных, например,
для сем. Calycanthaceae., протогиния является одним из главных признаков
синдрома опыления (Faegry, Pijl van der, 1980). Более резко выражена протогиния у
ветроопыляемых растений, причем не только у обоеполых, но и у однодомных и
двудомных растений (Cariaceae, Poaceae, Chenopodiaceae-Artemisia и Plantagi-
naceae-Plantago). Роль протогинии в этих случаях заключается в том, что
заблаговременная экспозиция рылец благоприятствует быстротечному опылению
ветром во время кратких суточных периодов рассеивания пыльцы.
У некоторых растений наблюдается частичная дихогамия, т.е. рыльце созревает
еще до того, как прекратят функционировать пыльники.
Рис. 8. Протогиния у Juncus gerardii (1, 2) и Plantago cornutii (3-7).
1 — цветок в рыльцевой фазе вечером, 2 — раскрывшийся цветок утром в момент опыления, 3 —
стадия бутона, 4 — появление рыльца, 5 — увядание рыльца, 6 — раскрывание цветка и начало
выдвижения тычинок после увядания рыльца, 7 — тычиночная стадия цветка.
1-7 — по: Пономарев, Демьянова, 1980.
10 11
Рис. 9. Протандрия у Scabiosa ochroleuca (1-4), Silene dichotoma (5-7)
и видов Campanula (8-11).
1 — краевой цветок в тычиночной стадии, 2 — он же в рьиьцевой стадии, 3 — срединный цветок в тычиночной
стадии, 4 — он же в рьиьцевой стадии, 5 — цветок в тычиночной стадии первого дня цветения, 6 — он же в
тычиночной стадии второго дня цветения, 7 — он же в рьиьцевой стадии третьего дня цветения (все тычинки увяли),
8 — стадия бутона, пыльники, образующие трубку вокруг столбика вскрываются, отбрасывая пыльцу на столбик,
густо покрытый волосками, в основании столбика находится кольцевидный нектарник, 9 — ранняя стадия
цветения, столбик вытягивается, а тычиночные иити изгибаются и касаются пыльниками поверхности столбика, однако
лопасти рыльца сомкнуты и самоопыление невозможно, 10 — средняя стадия цветения, пыльники,
освободившись от пыльцы, подсыхают и, скручиваясь, остаются в глубине цветка, лопасти рыльца раскрываются, и рыльце
готово к восприятию пыльцы, в этот период цветок посещают насекомые — опылители, il — поздняя стадия
цветения, доли рыльца продолжают расти, затем они изгибаются и соприкасаются с пыльцой, оставленной на
верхней части опушения столбика, происходит автогамное опыление, но эта последняя стадия присуща не всем видам,
эффективность процесса опыления насекомыми увеличивается приуменьшении опушенности столбика.
1-7 — по: Пономарев, Демьянова, 1980; 8-11 — по: Фегри, Пейл ван дер, 1982.
88
Системы репродукции
Дихогамия носит приспособительный характер, при этом необходимо отметить,
что протогиния — более эффективный механизм, препятствующий самоопылению,
чем протандрия. При протандрии вся собственная пыльца должна быть вынесена
из цветка до того, как рыльце будет готово к восприятию пыльцы. Только в случае,
если пыльники полностью опали до того, как рыльце готово к восприятию пыльцы,
возможность попадания собственной пыльцы полностью исключается, хотя часть
пыльцы может остаться в цветке и смешаться с другой пыльцой.
Помимо временного разделения пыльниковой и рыльцевой фаз наблюдается
пространственное разделение пыльников и рылец (херкогамия). Так, у Plantago
major столбик выступает из закрытого венчика и значительно позднее открывается
венчик и развиваются тычинки. Херкогамия, вызванная протандрией, коррелирует
с привычкой шмелей садиться на нижнюю часть соцветия и затем подниматься
вверх; подъем по соцветию вверх обеспечивает лучшее положение опылителей по
отношению к каждому цветку, чем спуск вниз. В этом случае опылители посещают
сначала цветки в женской стадии развития с воспринимающим рыльцем и только
позднее покрываются пыльцой с молодых, более высоко расположенных цветков в
мужской стадии развития — с открытыми пыльниками. Напротив, осы,
являющиеся основными опылителями Scrophularia nodosa, характеризующейся протоги-
нией, ползают сверху вниз. В тропиках постоянное нахождение одних растений в
мужской фазе, а других в женской (Persea — Stout, 1926; Nephelium — Khan,
1929) может привести к вторичной двудомности. Рис. 8, 9.
Жинкина, 1995; Камелина, 1981; Пономарев, Демьянова, 1980; Тахтаджян, 1981; Faegri, Pijl van
der, 1966,1980; Khan, 1929; Stout, 1926.
ПОПУЛЯЦИОННЫЕ АСПЕКТЫ ДЕТЕРМИНАЦИИ ПОЛА
м еханизмы (онтогенетические, физиолого-биохимические, цитоэмбриологиче-
ские и генетические) детерминации пола у семенных растений на организменном
уровне обсуждаются уже давно (Jampolsky С, Jampolsky H., 1922; Correns, 1928;
Розанова, 1935; Монюшко, 1937; Loewing, 1938; Lewis, 1942; Минина, 1952;
Lewis, Crowe, 1956; Fryxell, 1957; Heslop-Harrison, 1957 a, b; Westergaard, 1958;
Джапаридзе, 1963, 1965; Львова, 1963; Рыжков, 1966; Baker, 1966; Чайлахян и
др., 1969; Kugler, 1970; Ross, 1970; Kubicki, 1972; Молчан, 1974; Кордюм, Глу-
щенко, 1976; Френкель, Галун, 1982; Сидорский, 1991).
Рассмотрение важнейших аспектов детерминации пола на популяционном и
видовом уровнях отражает стремление исследователей охватить разные стороны
репродуктивного цикла и оценить эффективность различных моделей разделения
полов с позиций репродуктивной стратегии. Терминология, связанная с популяцион-
ным анализом проявлений пола, находится в стадии становления. Исходные
понятия (половая дифференциация, или сексуализация, детерминация пола,
половой полиморфизм) сложились на организменном уровне изучения и были затем
адаптированы к популяционному. Ряд новых терминов связан с различными
аспектами исследований, отдельными концепциями и методами, разработкой
относительных показателей оценки пола.
Детерминация пола (лат. determinatio — ограничение, определение) —
совокупность генетических, цитоэмбриологических, физиолого-биохимичес-
Системы опыления и скрещивания
89
ких и других механизмов, способствующих формированию первичных и
вторичных половых признаков. Совокупность популяционных механизмов,
обусловливающих половое состояние популяции, мы предлагаем называть
детерминацией пола популяции.
Половая дифференциация (лат. differentia — различие, разность) —
совокупность половых различий на разных структурных уровнях организации
биологических систем как следствие механизмов детерминации пола. Наиболее четкое
определение этого понятия дано Левиной (1979, 1981). Часто встречающийся в
современных работах термин «сексуализация» (англ. sex — пол) является
синонимом «половой дифференциации».
Половой полиморфизм традиционно определяется как одновременное
наличие в популяции двух или более половых типов особей, отличающихся по
совокупности морфологических признаков (диморфизм — частный случай
полиморфизма). У цветковых растений он обычно проявляется только в репродуктивной
сфере: структура цветков, линейные размеры цветков и соцветий. Половой
полиморфизм в вегетативной сфере слабо выражен и изучен недостаточно. При
популяционных исследованиях он выявляется только статистически на уровне
достоверности различий средних значений признаков. Meagher (1984) в
определение полового диморфизма включает не только морфологические, но также
экологические и поведенческие признаки, жизненный цикл, распределение ресурсов
между полами. Автор предполагает наличие в популяциях генетических и
экологических механизмов, лимитирующих дальнейшее усиление полового
диморфизма, что обеспечивает достаточное экологическое общение полов и способность к
эффективному семенному размножению. Механизмы эволюционного
становления полового диморфизма дискуссионны: преимущества перекрестного
опыления, половой отбор, дивергенция на основе дизруптивного отбора, независимое
влияние отбора на мужские и женские особи (Bawa, 1980, 1984; Willson, 1982;
Baker, 1984; Meagher, 1984; Sun, Genders, 1986; Sakai et al., 1997).
Для характеристики полового полиморфизма на популяционном уровне Си-
дорским (1991) предложены понятия «половой тип популяции» и «половая
организация популяции». Половые типы популяций он определяет по наличию и
сочетаниям половых форм цветков, а под половой организацией понимает
деление популяций на подсистемы в зависимости от числа половых групп особей. В
70-х — 90-х годах в связи с разработкой системного подхода к изучению
семенного размножения стал использоваться термин «система репродукции» (гер-
мафродитная, диэцичная, моноэцичная и т.д.) (Lloyd, 1972; Willson, 1982;
Anderson, Stebbins, 1985; Sutherland, 1986 a).
Половая структура — одна из основных характеристик раздельнополых
популяций. Первоначально это понятие определяли как численное соотношение разных
половых типов особей в пределах популяции (Демьянова, Пономарев, 1979), а
позднее расширили до рамок вида (Демьянова, 1987). Делаются попытки выявить
связь половой структуры с общим состоянием популяции и ее основными
характеристиками (численность, плотность, возрастной спектр, виталитет) (Dommee et
al., 1978; Антонова, 1982,1988; Escarre et al., 1987; Лебедев, 1989; Zimmermann,
1989; Ackerly, Jasinski, 1990; Belhassen et al., 1990; Delph, 1990; Korpelainen,
1992; Klinkhamer et al., 1993). Широко обсуждаются также лабильность полового
состояния и ее адаптивное значение, влияние экологических факторов на процесс
90
Системы репродукции
детерминации пола, степень толерантности половых типов особей в условиях
экологического стресса (Волкович, 1972; Верещагина, 1980; Freeman et al., 1980,
1984; Conn, Blum, 1981 a,b; Doust, Cavers, 1982; Шереметьев, 1983; Freeman,
McArthur, 1984; Демьянова, 1981, 1985, 1987 !996; Rapp, 1987; Лебедев, 1989;
Sakai, 1989; Zimmermann, 1989; Delph, 1990; Sakai, Weller, 1991; Schlessman,
1991; Старшова, 1993; Сидорский, 1994; Garcia, Ramon, 1995; Старшова,
Баранникова, 1998).
Для большого числа моноэцичных, диэцичных и субдиэцичных видов
характерно изменение полового статуса в ответ на гетерогенность или изменение среды, а
также в зависимости от размера и возраста особей (Freeman et al., 1980; Day,
Aarssen, 1997). Авторы объясняют это способностью растений перераспределять
ресурсы между мужской и женской функциями и отмечают тенденцию к усилению
первой в условиях экологического стресса.
Существует несколько гипотез, касающихся детерминации половой структуры
популяций и оценки адаптивного значения полового полиморфизма.
Согласно гипотезе «экологических ниш», разработанной Шереметьевым
(1983) для доказательства адаптивного значения половой дифференциации у
цветковых растений, преимущество полового полиморфизма связано не только с аут-
бридингом, но и с уменьшением внутривидовой конкуренции за счет размещения
полов по разным экологическим нишам, что способствует повышению общего
уровня адаптированности видов. Эта гипотеза основана на анализе различного
отношения полов к экологическим факторам. Она соответствует общему понятию
«экологическая ниша», принятому в геоботанике. Сходные позиции занимают
Baker (1984) и Meagher (1984). Некоторые авторы считают эту гипотезу
недостаточно обоснованной, придавая более важное значение пространственному
размещению полов в связи с особенностями их репродуктивной биологии (Bierzychudek,
Eckhart, 1988).
Гипотеза «мозаичности, или очаговости» в распределении половых типов в
популяции (Brockmann, Bosquet, 1977; Демьянова, Пономарев, 1979) предложена
для гиноэцичных видов и близка к гипотезе «экологических ниш».
Широко известна гипотеза регуляции половой структуры популяций через
механизм отрицательной обратной связи между третичным и вторичным
соотношением полов (Геодакян, 1965; 1977; 1978; Геодакян, Кособутский, 1967).
Центральным положением гипотезы является вывод о большем фенотипическом
разнообразии (дисперсии) мужского пола и консервативности женского.
«Старую» (наследственную) информацию от поколения к поколению эффективнее
передает женский пол, «новую» (экологическую) информацию — мужской.
Вторичное соотношение полов (число жизнеспособных проростков) является
переменной величиной и зависит от третичного (соотношение разных половых типов
особей в генеративном состоянии). При отклонении от оптимума в третичном
соотношении полов обратная связь реализуется через количество пыльцевых зерен,
попадающих на рыльце и несущих информацию об обилии мужских растений.
При большом количестве пыльцевых зерен реализуется пыльца с женской
потенцией, при малом — с мужской. Но эта гипотеза приемлема только при ряде
ограничений: истинная двудомность при строгом генетическом контроле за
проявлением пола, определенном возрасте (однолетнее растение) и отсутствии
вегетативного размножения.
Системы опыления и скрещивания
91
Кожин (1941) выдвинул концепцию, в основе которой лежит представление о
поле у растений как явлении количественном. Суть ее заключается в том, что
внутри популяций раздельнополых и обоеполых видов имеет место различная
выраженность мужской и женской функций; популяции характеризуются
множеством количественных модификаций фенотипического проявления пола.
Выраженность пола у цветковых растений он рассматривает как результат проявления
генетического механизма определения пола и влияния на него общего метаболизма и
внешних условий. Последние два десятилетия эта концепция успешно
разрабатывается (Lloyd, 1972,1980 а, Ь, с; Cruden, 1976,1977; Horovitz, 1978; Berlin, 1982;
Doust, Cavers, 1982; Doust J., Doust L., 1983; Bawa, 1984, Freeman et al., 1984;
Lloyd, Bawa, 1984; Bell, 1985; Mc Kone, Tonkyn, 1986; Preston, 1986; Robbins,
Travis, 1986; Sun, Ganders, 1986; Sutherland, 1986 a, b; Campbell, 1989).
В качестве идеальной оценки мужской и женской функций было предложено
«соотношение пыльцевой продукции и семязачатков« (см. Соотношение
пыльцевых зерен и семязачатков при разных системах скрещивания). Этот
показатель широко используется для анализа внутрипопуляционной и межпопуля-
ционной изменчивости и для сравнения различных систем семенной репродукции
(Cruden, 1976,1977).
Willson (1979, 1982, 1991) обосновала гипотезу полового отбора для гермаф-
родитных популяций, согласно которой предполагается соревнование особей за
«право» выноса пыльцы и «право» ее получения, что создает определенное
соотношение между мужской и женской функциями.
Половая специализация обоеполого цветка — это его преимущество как
донора или акцептора пыльцы. В гермафродитной популяции есть соответствующие этой
специализации группы особей (Willson, 1982; Ellstrand, Marshall, 1986; Robbins,
Travis, 1986; Brunet, Charlesworth, 1995). С гипотезой полового отбора тесно связано
утверждение о том, что в обоеполом цветке доминирует мужская функция
(Sutherland, Delph, 1984). Экспериментами подтверждено, что эволюция аттрактан-
тов направлена на вынос пыльцы, т.е. на мужской репродуктивный успех (Bell, 1985;
Stanton et al., 1986; Stanton, Preston, 1988; Mitchell, 1993). Женский
репродуктивный успех (производство семязачатков и семян) повышается, в основном, за счет
накопления биомассы. Несмотря на индивидуальную изменчивость, в среднем, в
половозрелой популяции мужская и женская функции выражены одинаково. В связи с
варьированием мужской функции обоеполого цветка представляет интерес явление
частичной андростерильности, имеющей структурное и функциональное проявление
(например, у Caryophyllaceae — Демьянова, 1982; Старшова, 1996).
«Флоральное соотношение полов» — еще один показатель для оценки
мужской и женской функций популяции. Он вычисляется как соотношение
цветков — доноров и акцепторов пыльцы, с учетом половых форм цветков, а также
мужской и женской репродуктивных сфер обоеполого цветка (Sutherland, 1986 а,
Ь). На примере анализа четырех систем репродукции (гермафродитная
самосовместимая, андромоноэцичная, андроэцичная и диэцичная) выявлено
флоральное соотношение полов, сдвинутое в сторону большей эффективности мужской
функции. Под флоральным соотношением следует понимать пропорции
цветков разных половых форм (Старшова, 199?, 1996), а участие в процессе
опыления всех потенциальных доноров и акцепторов пыльцы целесообразнее называть
опылительным потенциалом.
92
Системы репродукции
С переходом к концепции количественного проявления пола в англоязычной
литературе утвердилось понятие «gender», которое, вероятно, можно трактовать как
степень выраженности пола (Lloyd, 1972,1980 а-с; Lloyd, Bawa, 1984; Мс Копе,
Топкуп, 1986; Robbins, Travis, 1986). Это понятие охватывает, кроме
производства гамет, фактический репродуктивный успех, т.е. генетический вклад в
оплодотворение, образование семян, их рассеивание и жизненность потомства до достижения
им половой зрелости. Это центральное понятие в концепции. Разработан
количественный метод определения степени выраженности пола и предложены еще два
базисных понятия: «фенотипический пол» и «функциональный пол» (Lloyd,
1972, 1980 а — с; Lloyd, Bawa, 1984).
Фенотипический пол — это вложение родительских ресурсов в производство
пыльцевых зерен и семязачатков к моменту опыления, потребление энергии на
половую стратегию. Для измерения фенотипического пола используется соотношение
мужских и женских цветков, пыльцевых зерен и семязачатков или весовые доли
репродуктивных ресурсов, которые были вложены отцовской и материнской
функциями в производство пыльцы и семян. Фенотипический пол одной особи может
отличаться от такового других членов популяции. У моноэцичного вида Ambrosia
artemisifolia показано его варьирование от полностью женских до почти мужских
особей (McKone, Tonkyn, 1986). Размах варьирования фенотипического пола
особи по сравнению с средним значением для популяции Lloyd и ряд других авторов
называют «экспрессией пола в популяциях». На примере шести видов Atriplex
показана ведущая роль изменчивости пола в определении соотношения полов в
естественных популяциях (Freeman, McArthur, 1984).
Функциональный пол — это реальный генетический вклад родителей в
потомство через мужскую и женскую функции в сроки от опыления до взрослого
потомства (результат, исход половой стратегии). Он отражает генетическое
участие родителей в третичном соотношении полов. Отдельные особи
неравнозначны как доноры пыльцы, производители семян и жизнеспособного потомства.
Средняя выраженность фенотипического и функционального пола в популяции
равна 0.5, независимо от полового типа популяции, системы скрещивания и
абсолютных размеров ресурсов, вложенных в мужскую и женскую функции.
Фенотипический и функциональный пол тесно связаны, но не идентичны. Второй
показатель более подвижен, так как экологическая обстановка варьирует: различные
шансы для пыльцевых зерен и семязачатков в процессе опыления и
оплодотворения, занос пыльцы и семян из других источников, жизнеспособность семян и
конкурентная способность проростков. В связи с этим, анализируя модификации пола,
Lloyd и Bawa опираются на фенотипический пол.
Количественный подход продуктивен для изучения процессов
детерминации пола при разных системах скрещивания в эволюционном,
таксономическом и экологическом аспектах, а также для выявления значимости сексуали-
зации в репродуктивной биологии вида. Анализ основных понятий
показывает необходимость формирования их целостной системы и разработки новых
концепций о сущности механизмов детерминации полов в связи с адаптивным
значением их модификаций.
Антонова, 1982,1988; Верещагина, 1980; Волкович, 1972; Геодакян, 1965,1977,1978; Геодакян,
Кособутский, 1967; Демьянова, 1981, 1982, 1985, 1987, 1996; Демьянова, Пономарев, 1979;
Джапаридзе, 1963, 1965; Кожин, 1941; Кордюм, Глущенко, 1976; Лебедев, 1989; Левина, 1979,
Системы опыления и скрещивания
93
1981; Львова, 1963; Минина, 1952; Молчан, 1974; Монюшко, 1937; Пономарев, Демьянова,
1975; Розанова, 1935; Рыжов, 1966; Сидорский, 1991,194; Старшова, 1993; Старшова,
Баранникова, 1998; Френкель, Галун, 1982; Чайлахян и др., 1969; Шереметьев, 1983; Ackerly, Jasienski,
1990; Anderson, Stebbins, 1985; Baker, 1966, 1984; Bawa, 1980, 1984; Belhassen et al., 1990; Bell,
1985; Bertin, 1982; Bierzychudek, Eckhart, 1988; Brockmann, Bosquet, 1978; Brunet, Charlesworth,
1995; Campbell, 1989; Conn, Blum, 1981a, b; Correns, 1928; Cruden, 1976, 1977; Day, Aarssen,
1997; Delph, 1990; Dommee et al., 1978; Doust, Cavers, 1982; Doust J., Doust L., 1983; Ellstrand,
Marshall, 1986; Escarre et al., 1987; Freeman, McArthur, 1984; Freeman et al., 1980,1984; Fryxell,
1957; Garcia, Antor, 1995; Heslop-Harrison, 1957 a, b; Horovitz, 1978; Jampolsky C, Jampolsky H.,
1922; Klinkhamer et al., 1993; Korpelainen, 1992; Kubicki, 1972; Kugler, 1970; Lewis, 1942; Lewis,
Crowe, 1956; Lloyd, 1972,1980 a, b, c; Lloyd, Bawa, 1984; Loewing 1938; McKone, Tonkyn, 1986;
Meagher, 1984; Mitchell, 1993; Preston, 1986; Rapp, 1987; Robbins, Travis, 1986; Ross, 1970; Sakai,
1989; Sakai, Weller, 1991; Sakai et al., 1997; Schlessman, 1991; Stanton, Preston, 1988; Stanton et al.,
1986; Sun, Ganders, 1986; Sutherland, 1986 a, b; Sutherland, Delph, 1984; Westergaard, 1958;
Willson, 1979,1982,1991; Zimmermann, 1989.
СПОСОБЫ ПЕРЕНОСА ПЫЛЬЦЫ И АГЕНТЫ ОПЫЛЕНИЯ
Основным типом опыления у цветковых растений является перекрестное
опыление, которое поддерживает высокий уровень гетерозиготности популяций,
определяя целостность вида (Грант, 1984). Значение перекрестного опыления в
эволюции цветковых растений весьма велико, ибо использование ими множества
абиотических и биотических компонентов биосферы для осуществления опыления дало им
значительные преимущества в сохранении потомства по сравнению с другими
высшими растениями. Именно перекрестное опыление имело решающее значение в
трансформации и специализации цветков и соцветий, определив многие
направления их эволюции (Меликян, 1981).
Эффективность опыления во многом связана со способом переноса пыльцы с
цветка на цветок (Faegri, Pijl van der, 1980).
Абиотическое опыление. Транспорт пыльцы при помощи ветра (анемофилия) и
воды (гидрофилия) довольно расточителен, так как подавляющее количество
пыльцы обычно теряется, не достигая пестиков цветка своего вида. Анемофилия является
преобладающим типом абиотического опыления (Betulaceae, Cyperaceae, Fagaceae,
Juncaceae, Poaceae и др.). Для успешного ветроопыления необходима высокая
концентрация пыльцы вблизи источника ее возникновения и определенная для каждого
таксона площадь массового оседания пыльцы, в среднем эта величина варьирует от
нескольких десятков до нескольких сотен метров, а при исключительных
обстоятельствах — и до километра. Анемофильные растения характеризуются упрощенным
строением цветка: околоцветник малозаметный, сильно редуцированный или вообще
отсутствует; пыльники и рыльца вынесены над остальными частями цветка и
соцветия; рыльце с большой воспринимающей поверхностью, легко улавливающей пыльцу
из воздуха; пыльцы много, она, как правило, довольно мелкая, сухая, сыпучая,
легкая, поверхность ее гладкая, практически лишена скульптуры.
У многих анемофильных растений наблюдаются однополые цветки,
распускающиеся до появления листьев (сережкоцветные), а у злаков высокая эффективность
опыления достигается благодаря определенной суточной ритмике опыления,
которая регулируется взрывным высвобождением пыльцы из пыльников и динамикой
экспонирования рылец. Анемофилия представляет собой особую форму адаптации
94
Системы репродукции
цветковых растений к неблагоприятным условиям среды, ограничивающим
возможность биотического опыления из-за отсутствия агентов — животных. В
средних, и особенно в высоких широтах, на высокогорьях и в пустынях, ветер является
более надежным агентом опыления, чем случайные животные.
Гидрофилия может происходить как на поверхности (эпигидрофилия), так и
в толще воды (гипгидрофилия). Она характерна для незначительного числа
водных растений (Ceratophyllaceae, Cymodoceaceae, Najadaceae, Posidoniaceae,
Potamogetonaceae). Их цветки распускаются в воде, не выступая над ее
поверхностью. Своеобразная структура пыльцевых зерен с хорошо развитой интиной и
с сильно редуцированной экзиной, в которой практически нет спорополленина,
повышает их плавучесть и способствует успеху опыления в толще воды.
Особенностью сем. Cymodoceaceae является наличие нитевидных пыльцевых зерен,
достигающих в длину 5000 мкм (Yamashita, 1976). Эпигидрофилия, в отличие от
гипгидрофилии, происходит в двухмерной среде. При эпигидрофилии пыльца,
высвобождаясь из пыльников в воде, всплывает на ее поверхность, быстро
распространяется по поверхностной пленке воды и достигает рылец,
экспонированных также на поверхности воды (Callitriche, Neptunia, Ruppia, Vallisneria). Такое
опыление обеспечивает большую экономию пыльцы, поэтому эпигидрофильные
виды водных растений, как правило, формируют сравнительно небольшое число
пыльцевых зерен в пыльниках.
Биотическое опыление осуществляется при помощи различных животных.
Прогрессивный характер биотического опыления по сравнению с абиотическим
состоит в том, что оно стимулирует трансформацию обоих компонентов: в
процессе сопряженной эволюции совершенствуется как строение цветка или соцветия,
так и изменяются поведение и строение самого опылителя (Гринфельд, 1978).
Определенные взаимоотношения между растением и агентом устанавливаются
благодаря наличию в цветках различных аттрактантов, отвечающих за приближение
и посещение опылителя. Выделяются первичные аттрактанты, отвечающие за
посещение цветка или соцветия опылителем, и вторичные, обеспечивающие
привлечение опылителей. К первичным аттрактантам относятся пыльца, нектар, пищевые
тельца, масла и др. Наиболее важными вторичными аттрактантами являются запах,
форма и окраска цветков и соцветий. Именно опыление различными биотическими
агентами уже на ранних этапах эволюции цветковых стимулировало появление
большого морфологического разнообразия цветков (Меликян, Тихомиров, 1994).
Наиболее широко распространенными агентами биотического опыления
являются насекомые. Существует несколько форм энтомофилии.
Кантарофилия (опыление жуками). Жуки — одна из наиболее древних групп
насекомых, которые часто своим поведением повреждают части цветков. Цветки
кантарофильных растений обычно крупные, блюдцевидные, с плоскими частями
околоцветника; первичные аттрактанты, а именно пыльца, пищевые тельца и масла
в них наиболее доступны.
Мелиттофилия (опыление пчелами, шмелями, осами). Пчелы, шмели, осы
представляют собой наиболее важную и весьма эффективную группу опылителей.
Взрослые особи в основном используют нектар, но для питания личинок они
собирают в цветках не только нектар, но и пыльцу, масла и другие первичные
аттрактанты. Очень важным является то, что они в течение определенного времени
посещают цветки одного вида, что обеспечивает успешное перекрестное опыление.
Системы опыления и скрещивания
95
Психофилия (опыление дневными бабочками) и фаленофилия (опыление
ночными бабочками). Бабочки, так же как и пчелы, являются «интеллигентными»
опылителями, так как не нарушают структуру цветка и не «воруют» нектар.
Цветки, опыляемые ночными бабочками, обычно белого, палевого цвета, они сильно
пахнут и раскрываются поздно вечером. Некоторые цветки имеют посадочную
площадку, однако большинство фаленофильных растений опыляется бражниками,
которые парят около цветка.
Миофилия (опыление двукрылыми насекомыми — мухами, комарами,
журчалками, жужжалами и др.). Эта группа насекомых не очень хорошо приспособлена
для осуществления перекрестного опыления. Они являются «неинтеллигентными»
насекомыми, поэтому их поведение в цветках обычно бывает беспорядочным.
Помощь таким опылителям обычно оказывают специальные указатели нектара,
образующиеся на околоцветнике, которые во многом ограничивают бесполезные и
вредные для растений действия этих двукрылых в цветках. Большинство
двукрылых охотно посещает колокольчатые, трубчатые, воронковидные цветки, которые
часто служат им убежищем при заморозках в ночное время, особенно в крайних
условиях существования (тундра, тайга, альпийская зона и др.).
Мирмекофилия (опыление муравьями). Муравьи также не очень удачные
опылители, их гладкое тело не приспособлено к переносу пыльцы. Однако в
крайних условиях существования (полупустыни, пустыни и т. д.), где число опылителей
весьма ограничено, муравьи участвуют в переносе пыльцы. У растений на
поверхности пыльцы обычно сильно выражена трифина (пыльцевой клей), благодаря
которому пыльца приклеивается к телу муравья. Благодаря своим небольшим
размерам эти насекомые имеют возможность свободного доступа в цветок любого типа,
при этом муравьи далеко не всегда производят опыление, чаще всего они
выступают как нектарные воришки.
В процессе опыления участвуют, по-видимому, также другие беспозвоночные
животные. На цветках и соцветиях неоднократно наблюдались уховертки,
кузнечики, улитки, трипсы и др. Однако их роль в перекрестном опылении неясна и их
следует причислять к случайным опылителям.
Большое значение как опылители имеют позвоночные (птицы, летучие мыши,
ящерицы, нелетающие млекопитающие и др.). В Америке, Африке и Австралии,
отмечены весьма интересные их взаимоотношения. В Европе же их роль весьма
незначительна.
Орнитофилия — опыление птицами, которые являются лидерами среди
позвоночных опылителей. Этому способствует то, что они обладают хорошим зрением.
Тело их покрыто перьями, к которым хорошо прикрепляется пыльца. Благодаря
высокой скорости и точности полета, приспособленности к посещению одного вида
цветущего растения в определенное время птицы являются весьма эффективными
опылителями, ибо многие из них в состоянии за день посетить сотни и даже тысячи
цветков. Птицы-опылители относятся к разным систематическим группам. Так, в
Америке это — колибри и цветочницы, в странах Старого Света — нектарницы,
медоносы, белоглазки, в Австралии — мелкие попугаи, лорикеты и др.
Хироптерофилия — опыление летучими мышами. Летучие мыши — хорошие
опылители, так как поверхность их тела, одетая мехом, надежно удерживает пыльцу
и они, так же как и птицы, быстро летая, перемещаются на большие расстояния и
ведут ночной образ жизни. Хотя растения, опыляемые летучими мышами, относятся к
96
Системы репродукции
разным систематическим группам, их цветки и соцветия имеют ряд общих черт,
возникших в результате стабилизирующего отбора. Эти растения зацветают поздно
вечером или ночью, цветки у них белые, кремовые, желтоватые, обладают сильным,
обычно приятным запахом, околоцветник твердый, пыльцы и нектара обычно много.
Летучие мыши обычно парят около цветков и соцветий, реже садятся на них.
Опыление нелетающими позвоночными. К ним относятся большие группы
сумчатых животных, грызунов, ящериц и даже обезьян. Все они посещают цветки
и соцветия ради нектара, пыльцы, разного рода пищевых телец и других первичных
аттрактантов. Растения, опыляемые этими агентами, относятся к разным
семействам однодольных и двудольных, имеют твердый околоцветник, образуют много
пыльцы и выделяют обильный нектар.
Таким образом, растения в процессе эволюции стали использовать множество
биотических и абиотических агентов, чтобы обеспечить перекрестное опыление и
дать начало жизнеспособному потомству.
Грант, 1984; Гринфельд, 1978; Меликян, 1991; Меликян. Тихомиров, 1994; Пономарев,
Демьянова, 1980; Faegri, Pijl van der, 1980; Yamashita, 1976.
ХАЗМОГАМИЯ (греч. hasma — отверстие, щель, gamos — брак) — перенос
пыльцы на рыльце в открытом цветке. Термин предложен Axell (1869).
При хазмогамии опыление цветков происходит с помощью различных агентов
(ветра, насекомых, птиц и др.), в отличие от клейстогамии, когда пыльца
попадает на рыльце еще в бутоне или закрытом цветке при отсутствии агентов (см.
Клейстогамия; Особенности клейстогамии у однолетних видов Medicago L.
(Fabacae)). Согласно Darwin (1877), открытые для опыления цветки
называются совершенными.
Общеизвестно, что околоцветник выполняет функции привлечения опылителей
и защиты генеративных органов. В результате коэволюции в цветках
сформировались сложнейшие механизмы, направленные на осуществление перекрестного
опыления (Church, 1908; Козо-Полянский, 1946; Grant, 1949; Armstrong, 1979).
Однако, на основании только морфологического облика цветка нельзя судить о
способе опыления. Для многих растений характерна пластичность механизмов
опыления (Первухина, 1970, 1979). В зависимости от конкретных условий
существования в различных районах своего ареала одни и те же виды могут опыляться
разными способами.
Козо-Полянский, 1946; Первухина, 1970, 1979; Armstrong, 1979; Axell, 1869; Church, 1908;
Darwin, 1877; Grant, 1946.
КЛЕЙСТОГАМИЯ (греч. kleistos — закрытый, gamos — брак) — это одна из форм
самоопыления в нераскрывшемся цветке. Термин предложен Kuhn (1867).
Клейстогамия широко распространена у дикорастущих и культурных растений
(Darwin, 1877; Uphof, 1938; Lord, 1981; Нарматов, 1988). Она обнаружена у 287
видов однодольных и двудольных растений из 59 семейств (Balsaminaceae,
Commelinaceae, Fabaceae, Malpighiaceae, Orchidaceae, Oxalidaceae, Poaceae,
Violaceae и др.) (Lord, 1981). Клейстогамия чаще наблюдается у однолетников по
сравнению с многолетниками. Наиболее известными примерами клейстогамных
Системы опыления и скрещивания
97
растений нашей флоры могут служить виды Viola (V. collina, V. hirta, V. mirabilis)
и Oxalis acetosella.
Клейстогамия экологически обусловлена и вызывается неблагоприятными
условиями внешней среды, такими как: недостаток или избыток воды в
окружающей среде, повышенная или пониженная относительная влажность воздуха,
затенение, низкая или высокая температура, бедность почвы, почвенная засуха,
несоответствие длины фотопериода, недостаток опылителей и т.д. (Uphof, 1938).
Правильное объяснение действия многих факторов затрудняется тем, что на
одном и том же растении хазмогамные цветки появляются вслед за клейстогамными
и наоборот. Тем не менее в ряде работ влияние экологических факторов на
появление клейстогамных цветков нашло экспериментальное подтверждение (Uphof,
1938; Mayers, Lord, 1983a, b).
Клейстогамия — явление крайне неоднородное. Общепринятой
классификации по клейстогамии не существует (Darwin, 1877; Goebel, 1904; Hackel,
1906; Uphof, 1938; Lord, 1981; Френкель, Галун, 1982). Наиболее
приемлемым представляется разделение клейстогамии на облигатную и
факультативную (Пономарев, Демьянова, 1980).
К облигатной клейстогамии относятся случаи, когда у вида постоянно
образуются клейстогамные цветки, обнаруживающие черты более или менее далеко
зашедшей редукции. Как правило, у облигатных клейстогамов на одной и той же
особи образуются обычные хазмогамные цветки и редуцированные клейстогамные,
причем последние являются плодущими. Хазмогамные цветки при неудавшемся
перекрестном опылении часто оказываются бесплодными.
Обе формы цветков одного вида развиваются в разные вегетационные сроки,
реже одновременно. Крайне редко у растений отмечаются только клейстогамные
цветки, (например, у злаков Leersia oryzoides, Sporolobus subinclusus, Tetrapogon
spathaceus — Hackel, 1906; Uphof, 1938). Указанные примеры требуют
дополнительных исследований, поскольку чисто клейстогамных популяций не
обнаружено. Единичны случаи, когда цветки обеих форм располагаются на разных особях,
например, у некоторых Cistaceae (Uphof, 1938). Иногда на одной и той же особи,
наряду с хазмогамными цветками, формируются два типа клейстогамных цветков
и соответственно два типа плодов. У однолетнего бобового растения Amphicarpa
bracteata подземные и надземные клейстогамные цветки закладываются
соответственно на семядольном узле и на первых трех надсемядольных узлах, а
хазмогамные — на самых верхних узлах (Juncosa, Webster, 1989). Хазмогамные
цветки у клейстогамных видов могут быть перекрестно- или самоопыляемыми.
Соотношение клейстогамных и хазмогамных цветков у облигатных
клейстогамов определяется экологическими причинами и бывает неодинаковым в разные
вегетационные сезоны. Баланс между клейстогамией и хазмогамией — весьма
динамичный адаптивный признак (Wilken, 1982). Клейстогамные цветки у них гораздо
мельче хазмогамных, никогда не раскрываются и напоминают бутоны. Как
правило, они не выделяют нектар и не имеют запаха. Все части цветка в большей или
меньшей степени редуцированы. Чашечка видоизменена в целом слабее, чем
другие части цветка, но, тем не менее, и она уменьшена в размерах. Венчик обычно
утрачивает характерную окраску, лепестки рудиментарны или совсем отсутствуют.
Нектарники редуцированы. У злаков наблюдается полная или частичная редукция
лодикул и колосковых чешуи (Hackel, 1906; Пономарев, 1964). В клейстогамных
98
Системы репродукции
цветках число тычинок уменьшено, пыльники мельче, чем в хазмогамных цветках и
содержат мало пыльцы. Пыльцевые зерна мелкие, причем часть из них может быть
стерильной. Пыльцевые зерна в хазмогамных и клейстогамных цветках могут
иметь разную форму (Madge, 1929). Эндотеций развит слабо. Обычно пыльцевые
зерна не высыпаются на рыльце, а прорастают либо через стенку пыльника, либо
через разрыв в стенке пыльника (Gorczynski, 1929; Madge, 1929; Верещагина,
1965, 1980; Поддубная-Арнольди, 1976; Anderson, 1980; Mayers, Lord, 1983
а,Ь). В клейстогамных цветках ковылей может происходить растрескивание
пыльников (Солнцева, 1965). Механизм роста пыльцевых трубок к рыльцу исследован
у небольшого числа растений и зависит, вероятно, от принадлежности растения к
определенному семейству.
Число плодолистиков нередко уменьшено. Столбики укорочены, а слабо
развитая поверхность нередко отмечается только на верхушке плодолистиков.
Пыльники располагаются на одном уровне с рыльцами и в непосредственной
близости с ними, что облегчает самоопыление. Все исследователи единодушно
указывают на синхронность формирования пыльцы и зародышевых мешков в
клейстогамных цветках. Мейоз в зародышевых мешках протекает без особых
отклонений от нормы. Иногда в клейстогамных цветках, в отличие от хазмогамных,
оплодотворение не обнаружено, что позволяет предполагать апомиктичную
природу зародыша (Lorenzo, 1981).
По мнению Uphof (1938), клейстогамные цветки следует рассматривать как
запаздывающие в развитии, рано функционирующие формы хазмогамных цветков. У
многих клейстогамных растений (виды Viola, Oxalis acetosella) хорошо заметен
постепенный переход от хазмогамных цветков к клейстогамным, сопровождающийся
нарастающей редукцией околоцветника. Клейстогамные цветки похожи на бутоны
хазмогамных и узко специализированы к постоянному самоопылению.
При факультативной клейстогамии заметной редукции в цветках может и не
наблюдаться. Факультативная клейстогамия представляет собой как бы начальную
стадию развития этого явления. Она обнаруживается на более поздних стадиях,
когда цветок готов к распусканию, и проявляется лишь при определенных
сочетаниях условий среды, неблагоприятных для открытого цветения. В зависимости от
экологических условий цветение происходит открыто или закрыто, при этом оба
типа цветков могут переходить друг в друга. Таким образом, в случае
факультативной клейстогамии ее происхождение от хазмогамии еще более очевидно.
Факультативная клейстогамия нередко встречается у дикорастущих хлебных
злаков (Avena, Hordeum, Sorghum, Triticum); наиболее подробно она изучена у
Stipa (Hackel, 1906; Пономарев, 1961, 1964; Солнцева, 1965). Клейстогамное
цветение вызывается у них почвенной засухой или пониженной температурой в
период цветения (Пономарев, 1964).
Недостатком почвенной влаги и высокими температурами во время цветения
обусловлена и клейстогамия у пустынных видов сем. Chenopodiaceae
(Climacoptera brachiata, Girgensohnia oppositiflora, Halimocnemis villosa,
Petrosimonia triandra — Пономарев, Лыкова, 1960; Лыкова, 1964). В этом
семействе клейстогамия, вероятно, находится еще в стадии становления.
Околоцветник клейстогамных цветков сомкнут, пыльники не показываются наружу, а
муфточкой со всех сторон окружают рыльце. Цветки облекаются прицветниками
и никогда широко не открываются. Это создает благоприятные предпосылки для
Системы опыления и скрещивания
99
клейстогамии или вернее почти клейстогамии, поскольку у них наблюдается едва
заметное раздвигание листочков околоцветника.
В генетическом отношении клейстогамия изучена слабо. По мнению Maheshwari
(1962), ее следует рассматривать как продукт взаимодействия генотипа и среды.
Немногочисленные сведения говорят о наследуемом характере облигатной
клейстогамии (Uphof, 1938). При факультативном проявлении клейстогамные
вариации не наследуются в потомстве: они вызываются к жизни окружающими
условиями (температурой, светом, водой и т.д.). Наличие клейстогамных и хазмогамных
цветков у одного и того же вида делает устойчивой его систему размножения,
сочетающую выгоды перекрестного опыления и самоопыления (Шмальгаузен, 1968).
Особое значение приобретает клейстогамия (как и другие формы
самоопыления) при миграции растений на новые места обитания. По наблюдениям Campbell
(1982), клейстогамные виды космополитного рода Andropogon наиболее успешно
завоевывают нарушенные места обитания. Одновременно автор подчеркивает, что
клейстогамия выступает как важный фактор репродуктивной изоляции близко
родственных внутривидовых таксонов Andropogon. У злака Danthonia spicata
обнаружена более высокая выживаемость всходов, происходящих из семян
клейстогамных цветков, в сравнении с «хазмогамными» всходами (Clay, 1983). Согласно
Schemske (1978), энергетические затраты на опыление при хазмогамии в 2-3 раза
выше, чем при клейстогамии.
Несомненна связь между клейстогамией и автогамией. Эта корреляция видна
особенно наглядно на примере Orchidaceae (Catling, 1983), где широко
представлены оба способа самоопыления. Клейстогамия, вероятно, представляет собой в
сущности дальнейшее развитие автогамии, ее крайнюю форму.
Верещагина, 1965, 1980; Лыкова, 1964; Нарматов, 1988; Поддубная-Арнольди, 1976;
Пономарев, 1961,1964; Пономарев, Демьянова, 1980; Пономарев, Лыкова, 1960; Солнцева, 1965;
Френкель, Галун, 1982; Шмальгаузен, 1968; Anderson, 1980; Campbell, 1982; Catling, 1983; Clay, 1983;
Darwin, 1877; Goebel, 1904; Gorczynski, 1929; Hackel, 1906; Juncosa, Webster, 1989; Kuhn, 1867;
Lord, 1981; Lorenzo, 1981; Madge, 1929; Maheshwari, 1962; Mayers, Lord, 1983a, b; Schemske,
1978; Uphof, 1938; Wilken, 1982.
ОСОБЕННОСТИ КЛЕЙСТОГАМИИ У ОДНОЛЕТНИХ ВИДОВ РОДА
MEDICAGO L. (FABACEAE)
Род Medicago включает в себя 83 вида, из которых 62 являются однолетними
(Small, Jomphe, 1989). Наибольшее разнообразие однолетних люцерн
сосредоточено в Среднеазиатском, Средиземноморском и Австралийском генетических
центрах (Иванов, 1980).
Размеры цветков однолетних видов значительно меньше многолетних — 5,1 ±
0,29 мм и 7,6 ± 0,37 мм, соответственно (Small, 1988). Исследование 16
многолетних и 29 однолетних видов выявило корреляцию между размером цветков с системой
скрещивания: у инбредных однолетних Medicago цветки достоверно мельче, чем у
аутбредных многолетних. Самые мелкие цветки в роде Medicago имеет люцерна хме-
левидная — до 3 мм. Максимальное число цветков в соцветии этого вида достигает
40 при среднем 23,60,8 в условиях Предуралья (Новоселова, 1996 а).
100
Системы репродукции
Цветки однолетних люцерн имеют строение, типичное для рода Medicago. Но, в
отличие от многолетних, у них флаг гораздо длиннее, чем крылья и лодочка.
Крылья могут быть длиннее или короче лодочки, и это соотношение имеет
таксономическое значение. Пестик, окруженный тычиночной трубкой — тычиночно-пестичная
колонка—имеет завязь с разным числом семязачатков у разных видов,
укороченный столбик и грибовидное рыльце.
Большинство цветков однолетних люцерн, как и у многолетних видов,
вскрываются путем автотриппинга, когда тычиночно-пестичная колонка выскакивает, как
пружина, из лодочки, ударяясь о флаг. У многолетних видов триппинг цветков
осуществляют насекомые-опылители. У всех изученных нами видов посещения
цветков опылителями достаточно редки и случайны. Триппинг большинства цветков
однолетних видов не зависит от посещения опылителей. После взрывного
опыления, в течение одного-трех часов цветок медленно закрывается до тех пор, пока
флаг не обернет пестик; окраска лепестков бледнеет. Однолетние виды имеют
дневной ритм раскрывания и триппинга цветков.
При наблюдениях за цветением однолетних видов обнаружены цветки, у
которых триппинг не происходит. Число нетриппингованных цветков варьировало от
6 до 12 % у М. arabica, M. intertexta, M. orbicularis, M. Scutellaria, M. turbinata и
от 1 до 35 % в разных условиях произрастания у М. lupulina; у М. radiata такие
цветки единичны.
Исследование методами световой и люминесцентной микроскопии бутонов и
цветков однолетних люцерн на постоянных и временных препаратах выявило
цветки, у которых опыление происходит в бутоне. Уже в зеленых бутонах на
самых ранних стадиях развития отмечается двуклеточная пыльца и пыльцевые
зерна с первыми признаками прорастания (набухание цитоплазмы в области
апертуры). В бутонах на более поздних стадиях их развития наблюдаются пыльцевые
трубки, длина которых уже превышает диаметр пыльцевого зерна. Пыльники в
бутоне плотно примыкают к рыльцу, и пыльцевые трубки через стенку пыльника
проникают к семязачаткам и в зародышевые мешки. Обнаружены пыльники,
внутри которых либо все пыльцевые зерна были проросшими, либо только
отдельные. Пыльцевые зерна с длинными пыльцевыми трубками отмечались и на
рыльце пестика бутонов. Уже в бутонах, задолго до раскрывания цветка
отмечаются зрелые зародышевые мешки.
Раннее и почти синхронное развитие мужского и женского гаметофитов,
прорастание пыльцевых зерен в пыльниках бутонов, случаи двойного оплодотворения
в цветках до триппинга являются предпосылкой бутонной клейстогамии у
однолетних видов Medicago: Термин «бутонная клейстогамия» использован Kalin Arroyo
(1981) при характеристике систем размножения Fabaceae (Hippocrepis, Lotononis,
Ornithopus, Scorpiurus).
Бутонная клейстогамия обнаружена у 7 однолетних видов Medicago, которые по
встречаемости клейстогамных цветков можно расположить следующим образом:
М. orbicularis (наибольшее число), М. scutellata, М. lupulina, M. turbinata, M.
arabica, M. intertexta, M. radiata (единичны) (Новоселова, 1996 а,б, 1997, 1998;
Верещагина, Новоселова, 1997,1998; Novosyelova, 1998).
Следует отметить, что клейстогамные цветки раскрываются, как хазмогам-
ные, и без специального исследования их трудно различить (см. Хазмогамия;
Клейстогамия). По-видимому, часть клейстогамных цветков уже утратила ме-
Рис. 10. Бутонная клейстогамия у однолетних видов Medicago (Fabaceae).
1-13 — стадии развития цветка Medicago lupulina: 1-9 — окрашенные бутоны, 10-11 — раскрытые
нетриппингованные цветки, 12 — открытый трнппингованный цветок, 13 — закрытый триппинго-
ванный цветок; 14-18 — пыльцевые трубки в бутонах: 14,15 — в пыльниках М. scutellata, 16-18 — в
пестиках М. lupulina. Масштабная линейка: 1-13 — 1 мм, 14,15-х 240, 16-18 - х 108.
1-18 — Новоселова, ориг.
Системы опыления и скрещивания
103
ханизм автотриппинга, так как присутствуют нетриппингующие цветки. Хаз-
могамные и клейстогамные цветки встречаются на одном растении и даже в
одном соцветии. Бутонная клейстогамия сочетает признаки облигатной формы
(небольшое количество пыльцевых зерен, прорастающих через стенку
пыльника) и факультативной (непостоянность явления и отсутствие редукции
венчика). Рис. 10.
Верещагина, Новоселова, 1997, 1998; Иванов, 1980; Нарматов, 1988; Новоселова, 1996 а,б,
1997, 1998; Френкель, Галун, 1982; Kalin Arroyo, 1981; Novosyelova, 1998; Small, 1988; Small,
Jomphe, 1989.
THE EVOLUTION OF WIND POLLINATION1
ЭВОЛЮЦИЯ ВЕТРООПЫЛЕНИЯ
Before we can address questions concerning the evolution of wind pollination in the
angiosperms, we need to establish that it did, indeed, evolve in the angiosperms. If wind
pollination is merely the persistence of an ancestral trait, then its presence in the
angiosperms requires no further explanation. Wind pollination is virtually the only mode
of pollen dispersal used by modern plants without flowers (Ginkgoales, Coniferales,
Cycadales and Gnetales). However, Stevenson (in prep.) argues for extensive biotic
pollination in the cycads, and Meeuse et al. (1990) present convincing evidence for
entomophily in Ephedra aphylla. In addition, the spore-plants (ferns, lycopsids,
sphenopsids, bryophytes) are all wind dispersed. Crepet (1983) suggests that the
insect — pollen interactions may date from the Carboniferous, but there is little
evidence that anything but wind pollination was the most common mode of pollen
dispersal. From this it is obvious that wind pollination is the ancestral mode of spore or
pollen dispersal in land-plants, but that the ancestral angiosperms were probably
biotically pollinated (Whitehead, 1969; Faegri, van der Pijl, 1980). Wind pollination
in the angiosperms is a derived feature, that evolved numerous times from the ancestral
biotic pollination system. Consequently, we can ask questions about the evolution of
wind pollination in the angiosperms, as we not simply dealing with the persistence of an
earlier pollination syndrome.
There are three central questions in the evolution of wind pollination.
1. Under what ecological conditions can we expect wind pollination to evolve? These
are factors extrinsic to the plants that select for wind pollination or against biotic
pollination.
2. What morphological features may pre-dispose a lineage to the evolution of wind
pollination? This addresses the conditions internal to the plants, that may facilitate the
transition to wind pollination.
3. What macro-evolutionary patterns may be associated with wind pollination, and what
could these tell us about the consequences of the evolution of wind pollination.
In this chapter I shall review the published works, but will present no new data. Wind
pollination has been a rather neglected area, it lacks the glamour of animal/plant
interactions, which has recently excited a spate of research. Therefore, many aspects of
This research was conducted with financial assistance from the Foundation of Research Development,
South Africa, and the University of Cape Town.
104
Системы репродукции
wind pollination are still poorly understood. Consequently this review raises more
questions than answers, and will hopefully stimulate further research into the problems
associated with the evolution of wind pollination.
Ecological questions. Wind pollination is thought to be advantageous in open,
cold, windy environments, where the vegetation is low and open. There are several
large-scale eco-geographical patterns that illustrate this. One of the earliest was
documented by Knuth (1906) who showed that anemophily increased in frequency on
the more exposed, bleaker North Sea islands. He suggested that the increased
dominance of anemophily might be due to the insects being blown away by the
persistent winds on the more exposed islands. This highlights the two central variable
linking the environment and wind pollination: environmental factors which increase the
efficiency of wind pollination, and environmental conditions which inhibit biotic
pollination. This could be expressed as the cost of wind pollination (in greater pollen
wastage, or pollination limitation of seed-set, or whatever factor might increase the cost)
versus the cost of biotic pollination. In theory, a shift from biotic to wind pollination may
occur when the cost of wind pollination is less than the cost of biotic pollination, and so
to understand why in any environment a shift to wind pollination may occur, it is
necessary to examine both these variables.
Wind pollination is said to be more frequent at higher latitudes and with increasing
altitude (Faegri, Pijl van der, 1980; Regal, 1982; Whitehead, 1983), but there has
been no global survey of wind pollination to test this pattern. At one extreme, lowland
equatorial rainforests have very few wind pollinated plants, while temperate woodlands
are dominated by anemophilous trees (Daubenmire, 1972). Regal (1982)
demonstrated both these patterns at a finer scale for trees in North America, but it is not
evident how the patterns will change if herbaceous plants, especially grasses and sedges,
were included in the study, as it is possible that the tropics could be very rich in these
species. A further variable that should be taken into account is the cover or abundance
of the different species and pollination types in the communities which are being
compared, rather than the number of species.
The reasons for these trends are not clear. Whitehead (1983) listed the possible
environmental causes of these geographical patterns.
1. Decreased species diversity, leading to denser populations of anemophilous species.
The assumption is that wind pollination is only effective in dense populations, when
individuals of the same species are close together. Regal (1982) suggested that
even in very species-rich rainforests individuals still often occur clumped, and
Midgley (1989) showed that even isolated individuals of Podocarpus falcatus in
the South African temperate forests were being successfully pollinated.
2. Longer dry seasons during which the pollen would not be washed out of the air.
3. A more open vegetation that would not interfere with pollen movement between the
plants. This is supported by the dominance of deciduous trees in the largely
anemophilous north-temperate woodlands (Sprengel, 1793). However, the southern
temperate forests are evergreen, and there is some indication that there is successful air
movement even in dense forests (Bawa, Crisp, 1980).
4. More distinct seasonality leading to more precise flowering cues.
5. Regal (1982) suggested that in unpredictable environments there is selection for
longer-distance outcrossing, and hence for biotic pollination.
Системы опыления и скрещивания
105
However, it is clear that there are exceptions to each of these patterns, and it is not
obvious that the community ecology approach can find «reasons» for these ecogeographical
trends. It is difficult to disentangle unrelated factors and causes, such as the north-temperate
correlation of high-latitude vegetation, deciduous trees and anemophily. A more productive
research programme might be to look for the environmental conditions associated with the
transitions from biotic to wind pollination.
There have been very few studies which correct for the phylogenetic pattern: most
research has been based on the numbers of wind-pollinated species in each ecosystem,
and their dominance in the system. Such species counts could lead to incorrect answers on
the ecological parameters which might select for wind pollination. One approach is to do
comparative infra-specific or infra-generic studies of sister-taxa of wind and insect
pollinated groups. Gomez and Zamora (1996) showed that high-altitude populations of
Hormathophylla spinosa (Cruciferae) are wind-pollinated, while low-altitude
populations are insect pollinated. They interpreted this as a dual response to a shortage of
pollinators, as well as an abundance of wind, operating in a situation where the population
density of the plants is high, and the surrounding vegetation low. A similar situation was
documented for Urginea maritima, which flowers in autumn in the Levant, when
pollinators are rare. Wind dispersal gradually removes the dry pollen from the anthers,
and is moderately efficient in effecting pollination (Dafni, Dukas, 1986). In a careful
study, Berry and Calvo (1989) demonstrated that two high-altitude species of Espelethia
(Asteraceae) were wind pollinated, while the remaining 11 species, both at high and lower
altitudes, were insect or humming-bird pollinated. Increase in altitude was correlated to
decreasing temperatures and rainfall, and possibly more significantly, to decreasing insect
numbers. Species with wide altitudinal ranges showed decreased seed-set at higher
altitude, probably due to pollinator-limitation. This suggests that the shift to wind
pollination at higher altitudes is at least to some extent due to the decreased efficacy of
insect pollination. This study could neither demonstrate nor falsify the hypothesis that
wind pollination was more efficient at higher altitude than at lower altitude, but overall
from the few studies available it appears as if pollinator limitation might be important in
driving plants towards wind pollination.
There is clearly a need for more comparative studies like the Berry and Calvo work. It may
be possible to avoid the need for phylogenies by working on ambophilous species. A number
have been documented over the years: Plantago lanceolata (Clifford, 1962; Stelleman,
1978), Dichromena ciliata (Leppik, 1955), Acrocomia aculeata (Scariot, Lleras, 1991),
Calluna vulgaris (Faegri, Pijl van der, 1980) and several species of Salix (Argus, 1974;
Vroege, Stelleman, 1990). It might be possible in these complexes to show which
environmental attributes are regularly associated with the transition to wind pollination. A
more penetrating analysis would be to use species pairs or genera, such as the Berry and Calvo
study, but ideally this sort of work should be based on a phylogenetic hypothesis. It would also
be of great value if the costs of the various approaches could be quantified.
Morphological conditions. Generalities. The morphological attributes of wind
pollination are well documented, in most detail by Faegri and van der Pijl (1980), but
also by others, such as Sprengel (1793), Knuth (1906), Whitehead (1969, 1983)
and Proctor et al. (1996).
— Flowers clustered in dense inflorescences often on outside of plants.
— Flowers small.
— Perianth reduced or absent; when present often dully coloured.
106
Системы репродукции
— No nectar production with nectaries often totally absent.
— Anthers with abundant pollen and explosive dehiscence mechanisms although the
number of anthers are not usually increased. The anthers are often borne on long
filaments outside the flowers.
— Stigma surface expanded, often variously elaborated as brushes or feathers, sometimes
enlarged and sticky and usually projecting beyond the perianth.
— Sexes separated, either monoecious or dioecious; bisexual flowers dichogamous.
— Pollen grains small, smooth, surface dry (Sprengel, 1793; Wodehouse, 1935; Hesse,
1978,1979 a-c).
— Frequently a reduction in the number of ovules, often to a single ovule per ovary
(Pohl, 1929 a).
These features are often used to infer the pollination mode of the plants, but there are
so many exceptions that this can be quite misleading. A further problem is that there is a
danger of circularity when morphological features are used to establish wind pollination,
and these so-called wind pollinated plants are then used to support the «wind
pollination syndrome».
Some features, however, are universal in all wind-pollinated plants. Dry pollen, that is
freely distributed by the wind, is always found in anemophilous species. Reduction in
pollenkitt has long been postulated to be associated with wind pollination (Sprengel, 1793;
Pohl, 1929b), and the details of the reduction were meticulously documented by Hesse
(1978, 1979a-c), who showed that this reduction was achieved by a variety of different
methods, from storing the kitt out of reach in intratectal cavities, to «wasting» it on the
anther wall, or producing substantially less kitt. Hesse showed that in species-pairs
comparisons of European wind and biotic pollinated species, dry pollen was always found in
the wind pollinated species. The functional importance of dry pollen is obvious, as sticky
pollen forms large clumps which do not stay entrained in the air, are difficult to remove from
the anther, and will stick to any surface they come into contact with. Dry pollen does not
preclude biotic pollination, and such plants may either be ambophilous (such as many Erica
species and Calluna vulgaris), or primarily insect pollinated. Sprengel (1793) made the
interesting observation that sticky pollen could be an adaptation to insect pollination, as it
would stop the wind from blowing the pollen away before the insects could get to it. Dry
pollen could therefore be an exaptation (Gould, Vrba, 1982) for wind pollination.
binder (1998) argued for small, actinomorphic flowers as a pre-condition for the
evolution of wind pollination. There are very few known instances of the origination of
wind pollination in lineages with zygomorphic flowers, and it is very rare in lineages with
large, showy flowers. For example, there are numerous originations of wind pollination in
the asterids, which are frequently zygomorphic, but the originations are all in
actinomorphic groups, such as Asteraceae, Oleaceae and Rubiaceae. The only exception
would is Plantago, which is embedded within the complex-flowered, zygomorphic
Scrophulariaceae. But even in this group, the sister-group to Plantago is Veronica, which
is insect pollinated and has simple, actinomorphic flowers (Reeves, Olmstead, 1998).
Wind pollination evolved most commonly in the rosids, with their simple, actinomorphic
flowers. The Chenopodiaceae — Amaranthaceae complex and the Palmae, in which
probably numerous shifts between biotic and wind pollination occurred, have small,
simple, actinomorphic flowers. By contrast, in groups characterised by large, showy
flowers, wind pollination did not evolve at all. Pollen stickiness, by contrast to perianth
type, appears to be more labile, and appears to switch readily from sticky to dry. This
Системы опыления и скрещивания
107
change might be able to occur readily, and its absence probably would not constrain the
evolution of wind pollination.
Most of the morphological features of the wind pollination syndrome appear to
evolve after wind pollination, and could be interpreted as adaptations which make wind
pollination more efficient, but which are not essential for the functioning of the
pollination system. For example, multiple ovules in the ovaries are found in Juncaceae;
bisexual flowers in the wind pollinated species of Erica; nectaries are still present in
Cannabis and the wind pollinated species of Espelethia (Berry et al., 1989); simple
stigmas in Olea and Fraxinus.
binder postulated a model where the «general» angiosperm condition would be a small,
simple, actinomorphic flower, like the open flowers typical of many of the rosids. These simple
flowers could be either wind or insect pollinated. Once a lineage becomes either wind or insect
pollinated, then a series of adaptations to these new pollination systems become established. In
the case of biotic pollination, it usually involves the elaboration of the perianth in various ways,
in addition to the various specializations typical of the different pollinators. In the case of wind
pollination, it tends to result in a reduction of the perianth, its further simplification, and
ultimately the loss the means to attract insects and other pollinators. Once these specializations
are established, it becomes difficult for the process to be reversed. The few cases of reversals
from wind to biotic pollination illustrate the morphological changes that have to occur to adjust
to a different pollination mode, and to re-invent the means of attracting pollinators.
The evolution of the wind-pollinated syndrome can be illustrated using the Poales —
Cyperales clade, which is the largest clade of wind-pollinated plants. The phylogenetic
relationships among the families in the clade are reasonably well understood (Linder,
Kellogg, 1995) (Fig.), and those portions of the phylogeny about which there is some
doubt would not affect the interpretations below.
Wind pollination in the Poales — Cyperales evolved once. The evolution of the
«typical» wind pollination characters can be traced by optimising the characters of
the extant families to the internal nodes of the phylogeny. For this, we can establish
the following:
Perianth: at th e ancestral node, the perianth lobes were all colourless and
bract-like. It would appear that, since Bromeliaceae are closely related to this
lineage, the reduction to at least a bract-like outer perianth-whorl occurred before
wind pollination. Further reduction in the perianth occurred after the evolution of
wind pollination: a reduction to bristles in Cyperaceae, in some cases complete loss
of the perianth in Centrolepidaceae and some species of Restionaceae, and the
reduction of the perianth lobes to lodicules in Poaceae. The most extreme form of
reduction in the clade is found in Centrolepidaceae, where flowers appear to be
reduced to the gynoecia, and these are then fused to form a «capitulum» type
inflorescence, which looks like a bunch of grapes, consisting the of partially fused
ovaries and numerous free styles (Hamann, 1962, 1975).
Nectaries:, these appear to have been lost at the origination of wind-pollination. If they
were lost afterwards, then they were lost in all wind-pollinated species of the group, as
none of them currently have nectaries. Nectaries generally disappear quickly after the
transition to wind pollination, and there are few records of functional nectaries in wind
pollinated plants (for example in Espelethia — Berry et al., 1989).
Reductions in the gynoecium: at the ancestral node the gynoecium consists of three
locules, each with numerous ovules. This situation is currently found in most species of
CENTROLEPIDACEAE
RESTIONACEAE
ECDEIOCOLEACEAE
ANARTHRIACEAE
JOINVILLEACEAE
POACEAE
FLAGELLARIACEAE
SPARGANIACEAE
TYPHACEAE
THURNIACEAE
JUNCACEAE
CYPERACEAE
Commelinaceae
Bromeliaceae
Fig. Phylogeny of the Poalean clade of monocots.
Системы опыления и скрещивания
109
Juncaceae, as well as in Prionaceae (see Munro, Linder, 1997, 1998). In most
descendent families each carpel is fertile with a single ovule (Flagellariaceae,
Anarthriaceae, many genera of Restionaceae), and this is followed by the loss of two
carpels, thus leaving each flower with a pseudomonomerous gynoecium containing a
single ovule (Cyperaceae, Poaceae, many Restionaceae). Thus the reduction is taken as
far as possible, where each female flower produces a single ovule.
The stigmas are all feathery in the clade, this condition probably arose at the ancestral
node. The degree of branching is somewhat varied, from feathery to densely plumose, but
this pattern has not been explored here.
The pollen grains are all porate with a smooth exine. The transition to a smooth
exine occurs at the same time as the shift to wind pollination, and a smooth exine has
been shown to be associated with wind pollination in the Asteraceae (Berry et al.,
1989; Bolick, 1990). We argue that porate pollen is linked functionally to wind
pollination, but it is not clear how. The outgroups of the wind pollinated monocots all
have colpate pollen, thus it is probable that the ancestor of the wind pollinated
monocots had a porate grain. There are interesting modifications in the structure of
the pore margins in the group (see Linder, Ferguson, 1985), as well as the
development of pollen tetrads in Cyperales, and the reduction of these to
pseudomonads in Cyperaceae (Zavada, 1983).
Inflorescence structure: the ancestral lineages of this clade have large, paniculate
inflorescences (e.g. Juncaceae, Flagellariaceae, Anarthriaceae, Joinvilleaceae), but this
is followed by various forms of aggregation of the flowers, either in great elongated
spike-like inflorescences (e.g. Typha), globules (Sparganium) or into spikelets (e.g.
Poaceae, Cyperaceae, Ecdeiocoleaceae, many Restionaceae). It is not clear what the
functional advantage of these «spikelets» are, but it is interesting that in this clade
spikelet-like structures evolved at least six times.
The breeding system of the flowers shifts from bisexual flowers at the base of the tree
(Prionium, Flagellaria, Joinvillea) to unisexual flowers, and in a few cases to dioecy.
This reduction happened numerous times, but in few cases does it characterise large
clades. For example, almost all of Restionaceae are dioecious, suggesting that this evolved
once at the base of the Restionaceae. By contrast, in Poaceae there are many cases of
unisexual flowers, often characteristing large groups. However, this must have evolved
several times. Similarly, the reduction to dioecy occurs occasionally in the grasses, and
must have evolved numerous times.
There have been no comparable analyses in any Dicotyledonae. The evolution of the
pollen characteristics in response to wind pollination have received most attention. Bolick
(1990) documented the pollen transitions in the Asteraceae, and Hesse (1978;
1979a-c) did the same for a number of dicotyledonous genera, but there has been no
analysis of the sequential character change in a large clade. The pollen aperture evolution
was surveyed for the angiosperms by Linder (1998), in a broad-scale comparative
analysis, but this has not been done for all possibly involved characters on a
clade-by-clade basis. There are some very interesting clades to analyse, and the prime
candidate would be Urticales. What makes Urticales particularly interesting is the
apparent reversal to wasp pollination in Ficus, and in particular the morphological shifts
that attract pollinators to unisexual flowers (which consequently cannot offer pollen as a
reward) which have lost their nectaries. However, the problems with such an analysis at
the moment is the lack of a phylogeny for the Urticales (Berg, 1989). In addition, the
pollination biology of many of the tropical members of the clade is still unknown.
110
Системы репродукции
Phylogenetic Patterns. Wind pollination is much more common in the monocots
(ca. 40% of the species), than in the angiosperms as a whole (10.8%), with the
ranunculids, magnolids, asterids and rosids under-represented, while the caryophillids
and monocots are over-represented (Table). When the proportion of genera in each of
these angiosperm groups are compared, a similar pattern to that shown for species is
observed, but the pattern for families is rather different. This could be due to the way of
counting: with the exception of the relatively small number of ambophilous species, all
species are either totally wind or biotically pollinated, and this also applies largely to
genera. The families, however, are very different, and more than half the families in
which wind pollination occurs, have significant numbers of biotically pollinated families.
The second confusing factor that is families cannot all be regarded as being equal. In
this survey I have followed the family delimitations of Cronquist (1981), these are very
different from the delimitations of Takhtajan (1997), as well as from the system being
proposed by Bremer, Chase and Stevens (1998). It appears as if in the Cronquist
system several wind pollinated groups were separated at family level from their biotically
pollinated «ancestors», thus creating paraphyletic families. Clearly, the counts of the
numbers of wind pollinated families therefore becomes confusing.
It is very difficult to establish the number of times that wind pollination could have
evolved, and the figures in the first column of Table have are highly conservative. The
number of times of origination was established by starting at the smallest unit for which the
information was available — either a genus or family. I then search for the sister-taxon
(either genus or family, respectively), if it is biotically pollinated, then this counts as an
origination. If not, the search continues for the next sister-taxon, until the transition to
biotic pollination is located. This method requires the minimum phylogenetic information
to establish the number of times wind pollination has evolved, but in many cases even this
information is not available. The major source of error might be with families like
Arecaceae and Chenopodiaceae, which possibly contain a large number of wind
Table. Distribution of anemophily in the different groups of angiosperms.
Subclass
Angiosperms
Magnoliids
Ranunculids
Rosids
Caryophyllids
Asterids
dicots
Originations
65
7
2
28
8
16
61
Genera
Anemophiles
1322
10
5
180
185
24
408
Total
13573
303
180
3964
601
4596
10865
Percentage
9.8
3
3
5
31
0.5
3.8
., ^
Species
Anemophiles
26000
50
20
2800
2800
8004
5125
Total
241000
8010
3654
74872
9462
7710
189000
Percentage
10.8
0.6
0.5
3.7
29.6
1
2.8
Note. The groups are largely based on the molecular phylogeny of the angiosperms, based on the analysis
by Chase et al. (1993)
Системы опыления и скрещивания 111
pollinated species, but also many biotically pollinated species, and the pollination mode of
the species has not been adequately documented — these are like ambophilous families. I
have not included the Arecaceae in this count, and included Chenopodiaceae as a single
origination. The second source of error is that I counted each genus with more than one
species of wind pollinated plants as a single origination, and this may constitute a severe
underestimate. In the mega-genus Erica, for example, wind pollination originated
independently in a number of lineages (Oliver, pers. com.). This underestimate would be
extended to family level in cases where there is no generic-level phylogeny available (most
of the cases!). The last source of error is that I have almost certainly missed a very large
number of originations of wind pollination, which are reported in local natural history
publications, but which may be difficult to access.
Despite these caveats, it is clear that there is no relationship between the frequency of
wind pollination in any large angiosperm group, and the number of originations.
Twenty-one thousand of the 26 000 wind pollinated species are found in the monocots,
almost all of these originated from a single origination, which led to the Poales —
Cyperales — Typhales radiation. Most of the originations of wind pollinated result in
groups of less than 10 species, only a few have more than 100 species (e.g. the «higher
Hamamelids» which include Betulaceae, Nothofagaceae, Fagaceae, Casuarinaceae,
Juglandaceae and Rhoipteleaceae — 296 species; Chenopodiaceae — 2000 species;
Artemisia (Asteraceae) — 390 species and Urticales — 1500 species).
Is it possible to made deductions about the phylogenetic consequences of a shift to wind
pollination? One of the frequent questions is whether it leads to an increase in the number of
species in the lineage, or whether it constitutes a «dead end» for the evolution in that lineage.
There is enormous variation in the results of the originations of wind pollination: in some
instances it has resulted in a single species, scarcely distinct from its sister-group, and in
extreme cases the differentiation has not yet led to species — this might be the case in some
of the ambophilous species. In other cases the resulting species are so different from their
relatives that their taxonomic affinities are obscure (e.g. Theligonia, see Rutishauser et al.,
1998). Some of these anemophilous segregates have even been separated at family level —
this could apply to Julianaceae (separated from Anacardiaceae) and Achatocarphaceae
(separated from Phytolaccaceae) due to strong morphological differences which might be
more reflective of the pollination system than the phylogeny. At the other extreme are rather
speciose groups clades of wind pollinated plants — these tend to be herbaceous (Poales,
Chenopodiaceae, many Urticales, Artemisia), and here the large numbers of species might
be the result of a herbaceous habit, rather than wind-pollination.
Clearly questions as to the phylogenetic effects of a shift to wind pollination can only
be evaluated by comparing sister-lineages to ensure that both groups, one biotically
pollinated and the other wind pollinated, are of the same age. It would further be useful if
the two groups are as similar to each other as possible, to avoid other factors (herbaceous
is woody, for example) from confusing the analysis. Such analyses are not yet available.
I set three evolutionary questions concerning wind pollination: under what extrinsic
conditions (ecological conditions) is it most likely to evolve, what intrinsic
(morphological) factors favour the evolution of wind pollination, and what are the likely
phylogenetic consequences of the evolution of wind pollination.
The ecological conditions favouring wind pollination are those that increase the cost
(or decrease the likelihood) of biotic pollination, while also increasing the efficiency of
wind pollination. However, there have been no studies that have explicitly investigated
112
Системы репродукции
these, as most have either summarised the community conditions (which is not
informative on the circumstances at which the transition to wind pollination occurs), or
emphasized either the climatic conditions or the shortages or otherwise of pollinators.
The intrinsic, morphological conditions have received more attention, and it appears as
if dry pollen and small, simple flowers are pre-requisites for the evolution of wind
pollination, while the suite of furth er characters (further reduction in the perianth, loss of
nectaries, etc) are adaptations that might enhance the efficiency of wind pollination, but
which are not absolute requirements for its functioning.
The phylogenetic effects of a transition to wind pollination are hardly known, except
that they are highly variable — from enormous success, as in the Poales lineage, to hardly
any differentiation.
Argus, 1974; Bawa, Crisp, 1980; Berg, 1989; Berry, Calvo, 1989; Bolick, 1990; Chase et al, 1993;
Clifford, 1962; Crepet, 1983; Cronquist, 1981; Dafni, Dukas, 1986; Daubenmire, 1972; Faegri, Pijl van
der, 1980; Gomez, Zamora, 1996; Gould, Vrba, 1982; Hamann, 1962, 1975; Hesse, 1978, 1979 a-c;
Knuth, 1906; Leppik, 1955; Under, 1998; binder, Ferguson, 1985; binder, Kellogg, 1995; Meeuse et
al., 1990; Midgley, 1989; Munro, binder, 1997, 1998; Pohl, 1929a,b; Proctor et al., 1996; Reeves,
Olmstead, 1998; Regal, 1982; Rutishauser et al., 1998; Scariot, Lleras, 1991; Sprengel, 1793;
Stelleman, 1978; Takhtajan, 1997; Vroege, Stelleman, 1990; Whitehead, 1969, 1983; Wodehouse,
1935; Zavada, 1983.
СИСТЕМЫ СКРЕЩИВАНИЯ
АВТОГАМИЯ (греч. autos — сам, gamos — брак) — одна из форм самоопыления,
которое осуществляется при попадании пыльцы на рыльце пестика своего же
цветка. Термин предложен Delpino (1867, 1871).
Автогамия свойственна хазмогамным обоеполым цветкам. Она возникает на
базе перекрестного опыления в результате нарушения важнейших его механизмов
— херкогамии, дихогамии (см. Дихогамия) или самонесовместимости.
Дихогамия становится как бы стертой из-за удлинения во времени начальных фаз (пыль-
никовой или рыльцевой) в развитии цветка, благодаря чему эти фазы
совмещаются или налегают друг на друга. Кроме того, постепенно происходит сдвиг от
самонесовместимости в сторону более или менее полной самосовместимости (Lewis,
1954).
Автогамия происходит в разные периоды развития цветка: в бутоне (бутонная
автогамия1), в самом начале его цветения, на протяжении всего периода цветения
или в самом конце его.
При бутонной автогамии, которая встречается сравнительно редко, пыльники
обычно растрескиваются в бутоне. Эта форма самоопыления отмечена для
растений из разных семейств, произрастающих на Фарерских островах: Caryophyllaceae
(Cerastium caespitosum, Stellaria media), Fabaceae (Lotus corniculatus), Rosaceae
(Potentilla erecta), Rubiaceae (Galium saxatile), Scrophulariaceae (Euphrasia
borealis, Veronica beccabunga) (Hagerup, 1951). Бутонная автогамия известна не
только у дикорастущих видов (например, Agropyron trachycaulon, Lolium
temulentum), но и у культурных растений, в частности, у бобовых (Arachis
hypogaea, Phaseolus aureus, P. vulgaris, Pisum sativum, Vicia sativa) и злаков
См. также: Особенности клейстогамии у однолетних видов рода Medicago L.(Fabaceae).
Системы опыления и скрещивания
ИЗ
(Avena, Hordeum, Oryza, Triticum) (Френкель, Галун, 1982). У злостного
паразита хлебных злаков Shiga asiatica (Scrophulariaceae) в штате Северная Каролина
(США) пыльца осыпается на рыльце в фазу бутонизации цветка. Пыльцевые
зерна немедленно прорастают и оплодотворение совершается ко времени раскрытия
цветка. При исследовании природных популяций этого же вида в Нигерии
автогамии не обнаружено (Nickrent, Musselman, 1979). Бутонная автогамия по своему
функциональному значению весьма близка к клейстогамии.
Более обычна автогамия в конце цветения, когда перекрестное опыление с
помощью ветра или насекомых по каким-либо причинам (дождливая и холодная погода,
отсутствие опылителей и др.) не произошло. В этом случае страхующая функция
автогамии выступает очень наглядно.
В цветке покрытосемянных имеются разнообразные приспособления к
автогамии, не менее удивительные, чем те, которые выработались у них для обеспечения
перекрестного опыления. Автогамия реализуется разными способами: при прямом
соприкосновении рыльца и пыльников (контактная автогамия), при высыпании
пыльцы из пыльников и оседании ее на рыльце под действием собственной тяжести
(гравитационная автогамия), ветра (ветроавтогамия), мельчайших насекомых,
обитающих в цветке (трипе — автогамия).
Наиболее обычна контактная автогамия (термин предложен Hagerup, 1954). В
начале цветения, когда еще не утрачены возможности перекрестного опыления,
пыльники и рыльца созревают обычно в разное время или взаиморасположены
таким образом, что непосредственный контакт между ними невозможен. Позднее в
цветке происходят изменения во взаимном расположении пыльников и рыльца.
Они связаны с ростовыми движениями и проявляются в удлинении или изгибе
тычинок или столбиков, благодаря чему вскрытые пыльники и восприимчивое рыльце
располагаются на одном уровне и в непосредственной близости, что делает
возможным их соприкосновение (Knuth, 1898-1905; Кернер, 1902; Kugler, 1970).
Контактную автогамию можно наблюдать у характерных растений темнохвойной
тайги — Circaea alpina, Majanthemum bifolium, Trientalis europaea (Knuth, 1898b;
Пономарев, Верещагина, 1973). Аналогичный механизм автогамии отмечен у
некоторых культурных Fabaceae — Arachis hypogaea, Glycine max, Pisum sativum,
Vicia angustifolia и др. (Френкель, Галун, 1982).
Контактная автогамия может происходить и другими способами. Так, yArmeria
vulgaris, Hypericum pulchrum, Lychnis flos-cuculi увядающий венчик, сжимаясь,
охватывает и прижимает друг к другу рыльца и тычинки, обеспечивая
самоопыление (Hagerup, 1951). По наблюдениям Hagerup (1951, 1954), позднее
подтвержденным Шамуриным (1960), у некоторых Ericaceae (Andromeda polifolia,
Arctostaphylos uva ursi, Cassiope tetragona) опадающий венчик, проскальзывая
мимо рыльца, способствует нанесению пыльцы на него. К автогамии может
привести и закрывание венчика на ночь или перед дождем (Knuth, 1898-1905; Кернер,
1902;JCugler, 1970). У перечисленных растений автогамия имеет более или менее
случайный характер. Никаких структурных приспособлений к автогамии и
связанных с ней редукций в цветке не выявлено. При посещении цветков насекомыми
вполне возможно перекрестное опыление.
Облигатная контактная автогамия отмечена у Asarum europaeum (Daumann,
1972; Пономарев, Верещагина, 1973): при еще функционирующем рыльце
(цветки протогиничны) пыльники шести длинных тычинок внутреннего круга
114
Системы репродукции
вдвигаются между лопастями рыльца и, вскрываясь оставляют на них пыльцу.
Прорастание пыльцы и рост пыльцевых трубок наблюдается уже ко времени
вскрывания пыльников. Поэтому облигатная автогамия у А. еигораеит очень
близка к клейстогамии. Иногда у этого растения обнаруживаются закрытые
цветки, в которых произошло самоопыление. Облигатная контактная автогамия
выявлена и у Hypopitis monotropa (Monotropaceae) (Hagerup, 1954; Пономарев,
Верещагина, 1973).
Гравитационная автогамия весьма нередка у Представителей Ericaceae,
Pyrolaceae и Vacciniaceae: выпадающая из поникающих цветков пыльца
оказывается на рыльце. При этом столбик направлен не отвесно в их цветках, а косо вниз,
что облегчает попадание пыльцы на рыльце. Ветер может благоприятствовать
гравитационной как автогамии, так и гейтоногамии, содействуя более энергичному
высыпанию пыльцы из пыльников (Knuth, 1898b; Кернер, 1902).
Трипс-автогамия встречается у представителей разных семейств (обычно с
мелкими цветками в скученных соцветиях), чаще всего у Asteraceae и Ericaceae
(Knuth, 1898-1905; Кернер, 1902; Hagerup, 1950; Hagerup E., Hagerup О., 1953;
Шамурин, 1956).
Самоопыление (в любой его форме) рассматривается как вторичное явление,
вызванное условиями среды, неблагоприятными для перекрестного опыления. В
этих случаях оно выполняет страхующую функцию. Автогамия может играть
положительную роль при заселении новых территорий, когда создание однородной
популяции может быть выгодным, при отсутствии нужных опылителей, раннем
цветении до вылета опылителей и др.
Автогамия в большей мере свойственна однолетним растениям, чем
многолетним (Fryxell, 1957; Baker, 1959; Уильяме, 1968; Френкель, Галун, 1982). По
мнению Stebbins (1957), это связано со следующими обстоятельствами. Популяции
однолетних растений подвержены значительным колебаниям численности в разные
годы. Автогамия позволяет такой популяции более легко и быстро восстановиться,
если она сократилась до малого числа особей или даже единственного экземпляра.
Кроме того, однолетние растения обычно связаны с узко ограниченными и вполне
определенными местообитаниями. Благодаря автогамии адаптация их к
соответствующим местообитаниям вполне устойчива, что дает им определенные
преимущества в конкурентной борьбе (Levin, 1972 a,b; Solbrig, Rollins, 1977). Тем не менее и
в группе автогамных однолетников не утрачена возможность перекрестного
опыления, что может повысить гетерозиготность популяций и создать предпосылку для
их расселения и освоения ими новых местообитаний. Даже незначительный
процент скрещивания может поддержать достаточную гетерозиготность,
обеспечивающую постепенную адаптацию популяций к колебаниям климата и другим
факторам внешней среды. Определенный уровень генетической изменчивости
поддерживается и в самоопыляемых популяциях (Allard et al., 1968).
Для прогрессивной эволюции необходимо как свободное скрещивание, так и
некоторое его ограничение (Шмальгаузен, 1946; Heslop-Harrison, 1964).
Перекрестное опыление повышает уровень гетерозиготности в популяции, а
самоопыление, напротив, — гомозиготности. Благоприятные результаты перекрестного
опыления фиксируются в чистых линиях благодаря самоопылению. В этом
заключается положительное значение для эволюции покрытосеменных сочетания в
ряду поколений самоопыления и перекрестного опыления.
Системы опыления и скрещивания
115
Кернер, 1902; Пономарев, Верещагина, 1973; Уильяме, 1968; Френкель, Галун, 1982; Шамурин,
1956, 1960; Шмальгаузен, 1946; Allard et al., 1968; Baker, 1959; Daumann, 1972; Delpino, 1867,
1871; Fryxell, 1957; Hagerup, 1950, 1951, 1954; Hagerup E., Hagerup O.. 1953; Heslop-Harrison,
1964; Knuth, 1898-1905; Kugler, 1970; Levin, 1972 a, b; Lewis, 1954; Nickrent, Musselman, 1979-
Solbrig, 1976; Solbrig, Rollins, 1977; Stebbins, 1957.
АЛЛОГАМИЯ (греч. alios — другой, gamos — брак) — чужеопыление, т. е.
опыление пестика пыльцой другого цветка.
Термин предложен Kerner (1891). Автор подразделял аллогамию на гейтонога-
мию (соседственное опыление, при котором пыльца с одних цветков попадает на
другие в пределах одной особи) и ксеногамию (этот же процесс между разными
особями одного и того же вида). В настоящее время гейтоногамия рассматривается
как одна из форм самоопыления в генетическом отношении.
Понятия «самоопыление» и «перекрестное опыление» в классической экологии
опыления (Knuth, 1898-1905) использовали только по отношению к цветку.
Отсюда возникла путаница в терминах «аллогамия» и «ксеногамия», нередко
считающихся равнозначными (Faegri, Pijl van der, 1980; Биологический словарь, 1986).
По отношению к перекрестному опылению исторически более оправдано
употребление термина «ксеногамия» (Викторов, 1964; Ригер, Михаэлис, 1967; Kugler,
1970; Гуляев, Мальченко, 1975).
Гуляев, Мальченко, 1975; Ригер, Михаэлис, 1967; Kerner, 1891; Knuth, 1898-1905; Kugler, 1970.
ГЕЙТОНОГАМИЯ (греч. geiton — сосед, gamos — брак) — соседственное
опыление, т. е. перенос пыльцы с цветка на цветок в пределах одного растения
различными способами. Термин предложен Kerner (1891).
Гейтоногамия возможна не только у обоеполых растений, но и у однодомных.
Она может совершаться различными путями. Пыльца с верхних цветков соцветия
может попасть на рыльца нижерасположенных цветков под влиянием собственной
тяжести. Таким способом происходит опыление в однобоких кистях многих
Ericaceae и Vacciniaceae, у которых поникающие цветки направлены зевом в одну
сторону — косо вниз. При неудавшейся энтомофилии, которая у них преобладает
(Reader, 1975), пыльца с верхних цветков легко попадает на нижние. В конце
цветения рыльце всегда выступает далеко за пределы околоцветника, что значительно
облегчает улавливание им пыльцы соседних цветков.
Гейтоногамии может содействовать ветер или посещающие цветки животные —
чаще всего насекомые или птицы (в тропиках). Передвигаясь в поисках нектара и
пыльцы, они попутно осуществляют гейтоногамию. Последняя возможна и при
непосредственном контакте восприимчивых рылец одних цветков со вскрывшимися
пыльниками соседних цветков. В таких случаях часто наблюдается удлинение
столбиков или тычиночных нитей, что облегчает соприкосновение генеративных
органов. Подобный контакт нередко отмечается в густых соцветиях, состоящих из
множества мелких цветков (у некоторых Apiaceae, Asteraceae, Brassicaceae,
Caryophylla ceae, Juncaceae). Многочисленные примеры гейтоногамии указаны в
сводках Knuth (1898-1905), Кернера (1902), Hagerup (1951), Kugler (1970) и др.
Обращает на себя внимание тот факт, что гейтоногамия совершается обычно только
в конце цветения, когда утрачены шансы на перекрестное опыление.
116
Системы репродукции
В генетическом отношении гейтоногамия равноценна автогамии, поскольку
опыление происходит внутри одного генотипа. Гейтоногамии способствует
самосовместимость. Однако соседственное опыление возможно и у дихогамных и
самонесовместимых растений как резервный способ опыления при несостоявшемся
перекрестном опылении. В таких случаях происходит подавление генов
самонесовместимости (S — генов) и сдвиг в сторону более или менее полной самосовместимости
(Уильяме, 1968). Дихогамия становится как бы стертой по причине удлинения
начальных фаз (пыльниковой или рыльцевой) в развитии цветка, благодаря чему эти
фазы совмещаются, что способствует гейтоногамии.
Гейтоногамия как одна из форм самоопыления встречается чаще у однолетних
растении в сравнении с многолетниками (Baker, 1955, 1959; Fryxell, 1957;
Stebbins, 1957; Faegri, Pijlvander, 1980; Френкель, Галун, 1982). Важное
значение она имеет у сорных растений, где согласно «закону» Baker (1955, 1967)
самоопыление является предпосылкой для успешных миграций.
Как и автогамия, она нередка в условиях, затрудняющих перекрестное опыление
— в тундрах (Шамурин, 1969; Кузнецова, 1970; Тихменев, Левковский, 1973),
темнохвойной тайге (Пономарев, Верещагина, 1973), высокогорьях
(Новожилова, 1984) и пустынях (Hagerup, 1932; Демьянова, 1970).
Демьянова, 1970; Кернер, 1902; Кузнецова, 1970; Новожилова, 1984; Пономарев, Верещагина,
1973; Тихменев, Левковский, 1973; Уильяме,. 1968; Френкель, Галун, 1982; Шамурин, 1969;
Baker, 1955, 1959, 1967; Fryxell, 1957; Hagerup, 1932, 1951; Kerner, 1891; Knuth (1898-1905);
Reader, 1975; Stebbins, 1957.
КСЕНОГАМИЯ (греч. xenos — чужой, gamos — брак) — перекрестное опыление,
т. е. перенос пыльцы с цветка одного растения на рыльце цветка другого растения.
Термин предложен Kerner (1891). В современной литературе перекрестное
опыление часто обозначают термином «аллогамия» (Faegri, Pijl van der, 1980;
Биологический энциклопедический словарь, 1986).
Перекрестное опыление совершается при помощи абиотических (вода, ветер) и
биотических (животные) факторов (см. Способы переноса пыльцы и агенты
опыления). В эволюции энтомофилии, орнитофилии и хироптерофилии у растений
и животных возникло множество взаимных приспособлений, способствующих
перекрестному опылению. Во многих случаях изменение их признаков шло вместе
путем коэволюции (Grant, 1949; Берг, 1956, 1958; Baker, 1961, 1963; Proctor, Yeo,
1972; Susman, Raven, 1978; Armstrong, 1979; Ford et al., 1979; Гринфельд, 1982;
Faegri, Pijl van der, 1980).
Анемофилия у цветковых вторична, она произошла от энтомофилии. Ветроопы-
ление характеризуется высокой специализацией и представляет особую форму
адаптации покрытосемянных к условиям, ограничивающим возможности
биотического опыления, в частности энтомофилии. В средних и особенно высоких широтах
ветер иногда является более надежным агентом перекрестного опыления в
сравнении с насекомыми (Daumann, 1968, 1972; Kugler, 1970; Пономарев, Демьянова,
1980; Фегри, Пэйл ван дер, 1982).
Перекрестное опыление рассматривается как основной тип опыления
покрытосемянных со времен Sprengel (1793) и Darwin (1876). В цветках
покрытосемянных имеются приспособления морфологического и физиологического харак-
Системы опыления и скрещивания
117
тера, предотвращающие или хотя бы ограничивающие самоопыление.
Главнейшие из них — разделение полов, дихогамия, гетеростилия, самонесовместимость.
Разделение полов считается важнейшим приспособлением для ксеногамии, при
этом двудомное состояние — как наиболее эффективное. Однако среди ботаников
нет единодушного мнения в эволюционной оценке двудомности как конечного
этапа разделения полов. По мнению одних, именно двудомность наилучшим образом
обеспечивает гетерозиготность, а, следовательно, изменчивость и
жизнеспособность (Жуковский, 1967). Иной точки зрения придерживаются другие
исследователи, не склонные к переоценке роли двудомности в эволюции цветковых. Так,
Уильяме (1968) полагает, что двудомность представляет лишь кратковременную
реакцию на аутбридинг: в соревновании с гермафродитами, где инбридинг снижает
система самонесовместимости, двудомным видам предстоит исчезнуть или
возвратиться к гермафродитизму.
Перекрестному опылению содействуют и другие половые формы
(однодомность, гино- и андромоноэция, гино- и андродиэция, тримоно- и триэция и др.),
классификация которых разработана Уатрокку С., УатроЬку Н. (1922),
Кернер (1902), Розановой (1935), Монюшко (1937), Кордюм, Глущенко (1976).
Известно, что в пределах вида многие растения встречаются в различных
комбинациях половых форм. Так, у Plantago media, помимо гермафродитизма,
отмечены еще четыре половые формы: гиномоноэция, гинодиэция,
андромоноэция и андродиэция (Knuth, 1898 b). Разнообразие половых форм велико и у
культурных растений. Например, у многих однодомных Cucurbitaceae,
относящихся к одному виду, но разным сортам, часто варьируют не только
количественные соотношения тычиночных и пестичных цветков, но и их распределение
на растении. По мнению Кожина (1941), в каждой реальной обстановке
направление отбора создавало формы, состав и характер которых наилучшим
образом удовлетворял задачам перекрестного опыления.
Многообразие половых форм увеличивает мужская и женская стерильность
(Sears, 1947; Jain, 1959; Сэджер, 1966; Крупное, 1973). В подобных случаях гер-
мафродитные цветки в зависимости от степени стерильности гинецея или андроцея
выступают как однополые или функционально однополые, и такие растения
называют физиологически мужскими или физиологически женскими (Розанова, 1935;
Рыбин, 1935). Гроссет (1974) относит подобные растения к интерсексам.
Дихогамия как функциональная раздельнополость рассматривается в
литературе как эффективное приспособление к перекрестному опылению и как
средство предотвращения самоопыления. Это традиционное представление о
дихогамии нуждается в уточнении, поскольку она далеко н& всегда предупреждает
самоопыление. При несостоявшейся ксеногамии дихогамия становится
невыразительной из-за наложения пыльниковой и рыльцевой фаз друг на друга в конце
цветения. Истинное значение дихогамии, вероятно, следует рассматривать в
большем или меньшем ограничении самоопыления. Лишь при строгой
дихогамии, охватывающей не только отдельные цветки и соцветия, но и все растение в
целом, она действительно предотвращает самоопыление в форме как автогамии,
так и гейтоногамии. Подобная строгая дихогамия в виде протерандрии отмечена
у многих зонтичных (Пономарев, 1961; Webb, 1979; Демьянова, 1990). Она
проявляется в резкой демаркации мужской и женской (рыльцевой) фаз
цветения в пределах цветков, зонтиков и строгой очередности в цветении зонтиков
118
Системы репродукции
разных порядков. Такая всеобъемлющая протерандрия приводит к тому, что
одно и то же растение выступает последовательно и многократно то в мужской,
то в женской фазе, т. е. как функционально однополое растение. Строгая
протерандрия действительно предотвращает самоопыление в любой его форме.
Важно различать морфологическое и физиологическое проявление дихогамии,
которые не всегда совпадают. В таких случаях весьма затруднительно судить о
приспособлениях цветков к перекрестному опылению или самоопылению. Так, у
некоторых гомогамных злаков (например, у Triticum) на самом деле имеет место
физиологическая протогиния (Пономарев, 1964). Рыльца созревают несколько раньше
(иногда за 2-3 дня) до раскрывания цветков. Подобная физиологическая
протогиния, не содействуя перекрестному опылению, благоприятствует автогамии.
Гетеростилия (разностолбчатость) в форме ди- и тристилии рассматривается
как действенная мера против самоопыления еще со времен Darwin (1877). Полная
плодовитость гетеростильных форм наблюдается только при определенных
комбинациях скрещивания, когда пыльца переносится на рыльце одной формы от
тычинок соответствующей высоты другой. Не будучи морфологически
раздельнополыми, коротко-, средне- и длинностолбчатые особи в популяциях гетеростильных
растений выступают по отношению друг к другу как функционально однополые.
Рассмотренные приспособления к перекрестному опылению
(раздельнополость, дихогамия, гетеростилия) связаны со структурными особенностями цветков.
В качестве наиболее эффективной меры, создающей физиологический барьер
против самоопыления и самооплодотворения, рассматривается самонесовместимость.
Она широко распространена среди цветковых (Lewis, 1949,1954,1979; Bateman,
1952; Fryxell, 1957; Nettancourt, 1977; Charlesworth D., Charlesworth В., 1979).
Особый интерес представляют случаи сочетания у одного и того же вида различных
систем, способствующих перекрестному опылению. Так, например, у Zea mays
однодомность сочетается с дихогамией, а у однодомных видов Betula pendula и В. pubescens
обнаружена самонесовместимость. У гетеростильных растений, помимо
морфологических барьеров против самоопыления и самооплодотворения, широко представлена
самонесовместимость. Сочетание гетеростилии и самонесовместимости носит
закономерный характер, в связи с чем гетеростильную систему перекрестного скрещивания
принято рассматривать как одну из форм само несовместимости (гетероморфная
несовместимость) (Lewis, 1949, 1954, 1979; Baker, 1953 a, b; Crowe, 1964; Vuilleumier,
1967; Суриков, 1972; Nettancourt, 1977; Ganders, 1979; Вишнякова, 1997).
Тем не менее, несмотря на многочисленные приспособления к перекрестному
опылению, в случае его неудачи большинство растений способно самоопыляться. Чаще
всего самоопыление происходит в конце цветения и сопровождается расстройством
механизмов дихогамии и самонесовместимости. Более того, в зависимости от
складывающихся условий, благоприятствующих ксеногамии или препятствующих ей
(нелетная для насекомых погода, отсутствие необходимых насекомых, расселение в
новые местообитания и т.д.) одни и те же виды способны проявлять склонность к
перекрестному опылению или самоопылению. Цветковым свойственна высокая
подвижность, лабильность способов опыления (Первухина, 1970).
Берг, 1956, 1958; Вишнякова, 1997; Гринфельд, 1962; Гроссет, 1974; Демьянова, 1990;
Жуковский, 1967; Кернер, 1902; Кожин, 1941; Кордюм, Глушенко, 1976; Крупное, 1973; Монюшко,
1937; Первухина, 1970; Пономарев, 1961, 1964; Пономарев, Демьянова, 1980; Розанова, 1935;
Рыбин, 1935; Суриков, 1972; Сэджер, 1966; Уильяме, 1968; Armstrong, 1979; Baker, 1953 а, Ь,
Системы опыления и скрещивания
119
1961, 1963; Bateman, 1952; Charlesworth D., Charlesworth В., 1979; Crowe, 1964; Darwin, 1876,
1877; Daumann, 1968,1972; Fordetal., 1979; Fryxell, 1957; Ganders, 1979; Grant, 1949; Jain, 1959;
Kerner, 1891; Knuth, 1898-1905; Kugler, 1970; Lewis, 1949,1954,1979; Nettancourt, 1977; Proctor,
Yeo, 1973; Sears, 1947; Sprengel, 1793; Susman, Raven, 1978; Vuilleumier, 1967; Webb, 1979;
Yampolsky C, Yampolsky H., 1922.
СООТНОШЕНИЕ ПЫЛЬЦЕВЫХ ЗЕРЕН И СЕМЯЗАЧАТКОВ
ПРИ РАЗНЫХ СИСТЕМАХ СКРЕЩИВАНИЯ
Воспроизведение и размножение растений при разных системах скрещивания
сопряжено с определенными энергетическими затратами на опыление. Затраты на
опыление одного цветка обычно выражают как «соотношение пыльцевых зерен
и семязачатков» (англ. pollen-ovule ratio — Р/О) (Cruden, 1976 а, Ь; 1977).
Системы скрещивания, или рекомбинационные системы, обеспечивают
равновесие между процессами, создающими изменчивость, и процессами,
обеспечивающими воспроизведение генотипов. Различают три их модальных состояния:
открытые, ограниченные и закрытые рекомбинационные системы. Для них характерны
соответственно широкий ауткроссинг, преимущественная автогамия и агамоспер-
мия (Solbrig, 1976; Grant, 1981). Существует мнение, что открытые
рекомбинационные системы требуют больших энергетических расходов. Это связано прежде
всего с выработкой приспособлений цветка (изменение его морфологии, размеров,
окраски) для привлечения опылителей и образованием избытка пыльцы для
перекрестного опыления (Ornduff, 1969; Solbrig, 1976; Cruden, 1977; Grant, 1981; Te-
рехин, 1996). Перекрестноопыляемые растения производят больше пыльцы, чем
самоопыляющиеся (Baker, 1967; Gibbs et al., 1975), при этом число пыльцевых
зерен на семязачаток у первых значительно выше, чем у вторых (Cruden, 1977).
Анализ 86 видов цветковых растений (Cruden, 1977) показал, что самый
низкий показатель Р/О (4,7) характерен для клейстогамных растений. В направлении
увеличения Р/О располагаются облигатные автогамы (27,7), факультативные ав-
тогамы (168,5), факультативные аллогамы (796,6) и, наконец, облигатные аллога-
мы (5859,2). Исключение составляют представители семейств Asclepiadaceae,
Mimosaceae, Onagraceae и Orchidaceae, у которых коэффициент Р/О очень
низкий по сравнению с другими перекрестноопыляемыми растениями. Однако
эффективность опыления является относительно высокой вследствие того, что пыльца у
них собрана в массулы и поллинии (Cruden, 1977; Назаров, 1995).
Затраты на опыление в виде энергетических расходов в калориях подтвердили
выявленную закономерность. Так, например, у Impatiens capensis расходы на
семена, образующиеся в хазмогамных цветках в результате перекрестного
опыления, значительно выше (135 кал.), чем затраты на семена в клейстогамных
цветках (65 кал.), формирующиеся за счет самоопыления (Waller, 1979).
Выявление коэффициента Р/О становится необходимым элементом
исследований в области репродуктивной биологии. Например, у тропических лиан
Combretum farinosum и С. fruticosum, характеризующихся низкой семенной
продуктивностью, было выявлено высокое значение коэффициента Р/О (4569,9),
что свидетельствует о том, что эти растения являются перекрестноопыляемыми и
для них характерна самонесовместимость. При этом независимо от активности
опылителей степень ауткроссинга у них довольно низкая (Schemske, 1980;
Bernardello et al., 1994). У видов Potamogeton была обнаружена взаимосвязь ме-
120
Системы репродукции
жду типами цветков (подводные и надводные) и типом рекомбинационной
системы. Определение коэффициента Р/О показало, что растения с подводными
цветками являются автогамными формами и имеют низкий коэффициент Р/О,
тогда как для форм с надводными цветками характерны аллогамия и высокое
значение этого коэффициента, при этом последним присуща и более крупная пыльца
(Philbrick, Anderson, 1987).
Известно, что становление различных систем скрещивания у цветковых растений
имеет адаптивное значение. По мере освоения новых территорий растения первых
стадий экологической сукцессии (однолетники пустынь, сорняки и др.) проходят
стадии от облигатных автогамов до облигатных аллогамов через промежуточные
системы с факультативной авто- и аллогамией (Lloyd, 1972; Arroyo, 1973; Baker, 1974;
Grant, 1981). При этом смена систем скрещивания сопровождается повышением
показателя соотношения пыльцевых зерен и семязачатков (Cruden, 1977).
Назаров, 1995; Терехин, 1996; Arroyo, 1973; Baker, 1967, 1974; Bernardello et al., 1994; Cruden,
1976 a,b, 1977; Gibbs et al., 1975; Grant, 1981; Lloyd, 1972; Ornduff, 1969; Philbrick, Anderson,
1987; Schemske, 1980; Solbrig, 1976; Waller, 1979.
STIGMATIC AND OVULAR RECEPTIVITY — FACTS
AND HYPOTHESES
ВОСПРИИМЧИВОСТЬ РЫЛЬЦА И СЕМЯЗАЧАТКА:
ФАКТЫ И ГИПОТЕЗЫ
In angiosperms, unlike in gymnosperms, the stigma-style forms a barrier between the
pollen and the ovules. This barrier makes male gametophytic competition possible and
hence natural selection (Ottaviano, Mulcahy, 1989); it also enables recognition between
the male gametophyte and the female counterpart which, according to the type of
incompatibility, may occur at different points in the pistil (Heslop-Harrison, 1983;
Williams et al., 1994).
Although many studies and reviews exist on pollen viability and how to prolong it,
little work has been done on female receptivity. The length of female receptivity is
important because the response of the male gametophyte may vary in relation to when
pollination occurs (van der Walt, Littlejohn, 1996). In Trifolium repens, 60% fewer
seeds are produced when pollination takes place on the fifth day that the flower is open,
than on the first day (Jacobsen, Martens, 1994). The aim of the present study was to
define female receptivity and to make some hypotheses on what it depends on and how
to prolong it.
Definitions. With reference to a reproductive structure, the term «receptivity»
indicates a disposition to accept or encounter the opposite sex. Many terms have been
used to indicate different aspects of male and female receptivity; these aspects differ in
concept and in the way they can be detected.
Pollen becomes available to dispersing agents when the anthers open. The fact is often
overlooked but is crucial because male receptivity, which decreases in time at a rate that
varies from species to species (Pacini et al., 1997), begins from this moment. Pollen is
regarded as viable when it has the capacity to germinate and to produce a pollen tube
capable of reaching the ovules. The various ways of determining whether pollen has this
capacity are reviewed by Stone et al. (1995).
Системы опыления и скрещивания
121
Female receptivity can be regarded as the capacity of the gynoecium to allow pollen
germination, pollen tube growth and fertilization of the ovules. When the stigma and style
are distinct in the pistil, there is not only ovular receptivity but also stylar and stigmatic
receptivity. The latter allows pollen germination, whereas stylar receptivity allows the
pollen tubes to grow. Ovular receptivity enables the ovules to be penetrated by the tubes
and fertilization to occur. For fertilization to take place, in most cases these three types of
receptivity must coincide for at least a few hours. Stigmatic receptivity, on the other hand,
may last longer than ovular receptivity (Nepi, Pacini, 1993).
Receptivity of the sexes in time. The anthers may open before the flower and female
receptivity may begin before the flower opens (Pacini 1992). In Cucurblta pepo, female
receptivity begins the day before the flower opens (Nepi, Pacini, 1993); in Mercurialis
annua, it begins few days afterwards (Lisci et al., 1994).
The pollen can come from the flower that carries the pistil in the case of hermaphrodite
flowers, from unisexual flowers on the same plant in monoecious plants, or from unisexual
flowers on different plants in dioecious plants. Male and female receptivity must therefore
work together to bring about fertilization and often to avoid self-fertilization.
In hermaphrodite plants, both sexes are not always receptive at the same time (Bertin,
Newman, 1993). Bacause of the arrangement of the fliwer involucres, the male part,
which is more external, is usually receptive first (Heslop-Harrison, 1972). In
Macadamia integrifolia, the anthers open two days before the flower and the stigma
becomes receptive two days after anthesis (Sedgley et al., 1985). The receptivity of the
two sexes is limited in time in plants in which anthesis occurs between opening and closing
of the flower. However, female receptivity varies considerably from species to species, and
may be short or long. Examples of short duration range from a few hours in the Poaceae to
a day in most Compositae (Heslop-Harrison, 1983). Examples of long duration range
from three weeks or more in Helleborus foetidus and H. bocconei (Vesprini, unpubl.
data) to more than a month in some Orchidaceae. However, there is a fundamental
difference between the orchids and the genus Helleborus: in the former the female
gametophyte is not mature and completes its development after pollination (Fredrikson et
al., 1988), whereas in Helleborus it is mature.
In cleistogamic plants, since the pollen does not travel in the atmosphere and the
flowers do not open, the two types of receptivity have to be perfectly synchronized.
Receptivity may be phased in the flower or in the inflorescence, whether the latter
consists of hermaphrodite flowers as in the sunflower or flowers of one sex such as the male
and female flowers in Ricinus. This mechanism may be designed to avoid self-pollination,
especially in hermaphrodite flowers. On the other hand, if the inflorescence has many
flowers that are receptive at the same time, geitonogamy may occur.
Dry and wet stigmas. Stigmas have been classified by Heslop-Harrison, Shivanna
(1977) as dry and wet according to whether or not there is stigmatic exudate. Stigmatic
exudate is coupled with characteristics such as type of self-incompatibility, number of cells
and so forth. The stigma oiFabaceae such as Cassia sp. may have a crater or orifice which
is a continuation of the style canal (see below) and the ovary cavity (Dulberger et al.,
1994; Owens et al., 1995): only pollen falling on the orifice germinates. The stigmatic
surface may be smooth as in Fuchsia or papillate as in many Solanaceae; the papillae may
be unicellular as in Actinidia deliciosa (Gonzalez et al., 1995) or pericellular as in
watermelon and other Cucurbitaceae (Sedgley, 1981; Nepi, Pacini, 1993). Stigma
morphology is also related to the type of pollination and hence to the type of pollen
122
Системы репродукции
dispersing unit (Pacini, Franchi, 1997). For example, the feathery stigmas of the
Gramineae and Urticaceae are well exposed so that they can trap pollen on the wind.
The surface of dry stigmas has a protein layer which often has esterase activity,
determinant for pollen-stigma recognition (Mattsson et al., 1974; Shivanna, Sastri,
1981). The rapid loss of receptivity of the stigma (silk) in maize seems due to loss of water
and withering, which cause the cuticular rods to come together, preventing pollen
hydration and pollen tube emission (Heslop-Harrison, 1979; Schoper et al., 1987).
Stigmatic exudate is produced by stigmatic cells under the papillae and by the papillae
themselves before anthesis; it builds up under the cuticle which detaches from the wall
(Kreitner, Sorenzen, 1985). In species such as Acacia retinodes, stigmatic receptivity begins
as soon as there is exudate (Knox et al., 1989); in others, such as Petunia and Nicotiana,
receptivity does not depend on the presence of exudate (Shivanna, Sastri, 1981).
The type of stigma is a constant characteristic of the families; one of the few exceptions
to this rule is found in the Liliaceae (Heslop-Harrison, Shivanna, 1977). Just as the
stigma may be dry or wet, the pollen may or may not have a viscous coating of materials
such as pollenkitt or tryphine. Various combinations of the properties of these two
reproductive surfaces exist (Pacini, Franchi, 1997). The duration of receptivity is not
related to stigma type. In dry stigmas such as those of grasses, the duration is usually
short, e.g. 6 h in barley (Pande et al., 1972).
Solid and hollow styles. Styles can be defined as solid or hollow. They are hollow, as
in many monocots, when they have a roughly prismatic cavity and the pollen tubes grow
on the wall surface of this cavity. They are solid, as in the Solanaceae and Compositae,
when this cavity is absent and the pollen tubes grow in the intercellular spaces as in kiwi
(Hopping, Jerram, 1979) or inside the cells as in spinach (Wilms, 1981).
Many species such as the lily, which has a wet stigma, have a hollow style containing
exudate of a different chemical composition to that of the stigma (Miki-Hirosige et al., 1987).
Number and position of ovules. The placenta surface has an outer layer of transmitting
tissue on which the pollen tubes grow before penetrating the ovules. In Lilium regale this
tissue consists of cells with wall ingrowth of the transfer cell type (Singh, Walles, 1995).
The number of ovules per ovary may vary from one to many thousand as in the orchids.
The fewer the ovules, the higher the male gametophyte competition; the more the ovules,
the higher the female gametophyte competition. In some cases, as in the Cucurbitaceae
and some Liliaceae, the ovules, which are normally arranged in one or more rows in the
ovary, are not all receptive at the same time, but some closer to the stigma or the opposite
pole mature and are fertilized first (Stephenson et al., 1988). This mechanism may
enable pollen that is not the first to land on the stigma or that grows more slowly, to
fertilize. Hence these ovules/seeds are spatially separate from the first ones fertilized.
Functional limitations of receptivity. The duration of female receptivity depends on
the receptivity of the various components of the pistil and also on functional limitations
such as the opening and closing of flowers. In Cucurbita pepo the pistil is already receptive
the day before anthesis but is inaccessible to insects (Nepi, Pacini, 1993). Female
receptivity also begins before the flower opens in the Cruciferae, and bud pollination can
be performed to overcome self-incompatibility (Shivanna et al., 1978). The same is true
in Linaria vulgaris, Myrtus communis, Silene dioica and Solanum aviculare (Pacini,
Franchi, unpubl. data).
Opening of the flower indicates that one or both sexes are receptive; closure or wilting
of the flower, however, may indicate different things. It may be reversible in species with
Системы опыления и скрещивания
123
long periods of receptivity such as Dalechampsia stipulacea (Euphorbiaceae) and Vicia
faba, the flowers of which open for a few hours a day, closing at night (see, Nepi, Pacini,
1993). In Nymphaea elegans they open for three consecutive days (Schneider, 1982),
the first day at 9 AM, the second and third at 8.30 AM, and are already closed by 2
PM. The flowers presumably close at certain times of day to limit access to pollinators
and/or keep pollen viability and stigmatic receptivity high by protecting them from water
loss during the heat of the day (Nepi, Pacini, 1993).
The flower may close or wilt as soon as pollination occurs; in many orchids this takes
only 5-15 minutes, and occurs after a given period, whether or not fertilization has taken
place (Endress, 1994).
Pollen tube growth is initially autotrophic (Mascarenhas, 1993), using only the water
supplied by the female counterpart to rehydrate the pollen (Pacini, 1990), but as soon as
the tubes reach the style it becomes heterotrophic. This means two things, namely, that
stigmatic receptivity is influenced by the water status of the plant, temperature and relative
humidity (RH), especially in the case of dry stigmas (Schoper et al., 1987; Jacobsen,
Martens, 1994), and that stylar receptivity depends on substances that become available
for pollen tube growth (Mascarenhas, 1993).
Pollen tube growth does not occur without obstacles or gaps which in turn affect the
duration of female receptivity. Obstacles include thinning of the transmitting tissue, as
occurs in the Gramineae (Heslop-Harrison et al., 1985) and Cucurbita pepo (Nepi,
Pacini, submitted). This may increase competition. Gaps include the ovary cavity between
the end of the style and the placenta, as in Lycopersicum peruvianum (Webb, Williams,
1988), and between the base of the style and the obturator of the peach ovary, where the
tubes stop for five days until the starch of the obturator hydrolyses to form a polysaccharidic
layer (Arbeloa, Herrero, 1987). A similar phenomenon but with a slightly different
physical mechanism occurs in Pistacia vera (Martinez-Palle, Herrero, 1995).
Methods of determining receptivity duration.
Stigmatic receptivity can be evaluated from a cytological point of view, by
observing the turgidity of the stigmatic papillae as described by Gonzalez et al.
(1995) for the kiwi. Other empirical methods include changes in colour and the
presence of exudate, which may be reabsorbed when receptivity ceases, as in Arum
italicum (Pacini, Franchi, 1981, and more recent unpubl. data). Another empirical
method is histochemical evaluation of enzymatic activities (esterase, peroxidase,
etc.)(Dafni, 1992).
The only objective method consists in pollinating the stigmas at a known stage of
development and checking whether the pollen germinates. The percentage of germination
varies with stigma age (Nepi, Pacini, submitted), eventually falling to zero. In Ricinus
communis, for example, the pollen fails to adhere to the papillae in the last days of
stigmatic receptivity and percentage of germination drops sharply. Stigmatic receptivity is
long in this species, and the stigma withers a few hours after pollination.
Stylar receptivity. There are no empirical methods for evaluating this type of
receptivity. The only way is to check for pollen tubes in style sections or crushed material if
the style is short. A measure of stylar receptivity is obtained by comparing the number of
pollen tubes at the apex and base of the style. No data are available on any differences in
the duration of receptivity of hollow and solid styles.
124
Системы репродукции
Ovular receptivity. The ovary has generally already formed when pollination occurs.
When this is not so, the ovary clearly has to develop and a sign of receptivity is the
resumption of pollen tube growth.
Ovular receptivity can only be determined by direct methods, namely: a) by observing
whether pollen tubes penetrate the ovule; b) by observing the growth of the ovary and its
transformation into fruit; and c) by observing the number of seeds produced and their
position in relation to the ovary axis in polyspermic fruits. The latter method, however, is
affected by competition for nutrients between developing seeds.
Growth of the ovary and development of seeds also occurs in apomictic plants. To
ascertain that the plant is not apomictic, the stamens must be removed and the flowers
bagged before the anthers open. If they develop seeds then they are apomictic.
In angiosperms, the pollen germinates on the stigma; experimentally, however, it can
also germinate on stumps of style devoid of stigma or on ovaries without style and stigma
(Bowman, 1984). This type of research has only been done only for a basic
understanding of pollen germination, particularly to overcome self-incompatibility, but it
has never been used to determine the duration of ovular receptivity.
The duration of female receptivity can be determined by the presence or release, by
part of the pistil, normally the ovules, of chemiotrophic substances that attract the pollen
tubes (Hepler, Boulter, 1987).
The duration of stigmatic and ovular receptivity is correlated with the duration of
pollen viability, as in Cucurbita pepo (Nepi, Pacini, 1993). On the contrary, many
orchids have long pollen viability and stigmatic receptivity (more than a month) but the
ovules do not have a mature gametophyte and resume development only after pollination
has occurred. Short and long stigmatic and ovular receptivity are found both in zoophilous
and anemophilous species (Table).
Chronology of receptivity. The following examples are drawn from the observations
of our research group, unless otherwise stated.
Cucurbita pepo (Cucurbitaceae). In this species anthesis lasts from just after dawn to
about midday of the same day, after which the flower closes. It has been shown
experimentally that stigmatic receptivity lasts 4 days, from the day before to two days after
anthesis. Stylar receptivity lasts 3 days, from the day before to the day after anthesis.
Ovular receptivity lasts only 2 days, the day before and the day of anthesis. The ovary is
not fertilized when pollination occurs one day after anthesis, but the pollen tube reaches
the ovary. Two days after anthesis, the stigma is still receptive but the tubes fail to go
beyond it (Nepi, Pacini, 1993).
Table. Examples of long and short stigmatic and ovular receptivity in relation
to type of pollination.
Mode
of
pollination
Anemophily
Zoophily
Stigmatic and ovular receptivity
long
Mercunalis annua: SR — 12 d, OR — 6 d
Convallaria majalis:, SR — 20 d, OR — 17 d
short
Grasses: SR — few h
Cucurbita pepo: SR - 4d, OR - 2 d
SR — stigmatic receptivity, OR — ovular receptivity, d — days, h — hours.
Системы опыления и скрещивания 125
Linaria vulgaris (Scrophulariaceae). Stigmatic receptivity lasts 15 or 16 days,
starting two days before anthesis. The plant has a corolla with a spur in which nectar
accumulates; the corolla withers and falls 3-7 days after anthesis, depending on the
temperature regime. The stigma remains receptive for approximately another week.
Murtus communis (Myrtaceae). Stigmatic receptivity is very long (11 days).
Ovular receptivity lasts 5 days. The flower has more than 100 stamens which present
pollen simultaneously for a mean period of 3 days, which corresponds to the period of
anthesis of the flower. The stigma and ovules are receptive from a day before anthesis
until after the petals and stamens have fallen. The same occurs in other members of the
family, e.g. Feijoa sellowiana. In these species, as in Linaria, the attractants for insects
are lost when the corolla and stamens fall, and the type of pollination changes.
Helkborus foetidus and H. bocconei (Ranunculaceae). The gynoecium of H.
foetidus consists of two carpels and that of H. bocconei — of three to five. The carpels
are fused at their base. The stigma is dry with unicellular papillae; the styles are long and
the ovary contains an average of 10 ovules in both species. Female receptivity was
studied in these species without distinguishing the two components. The stigmas are
receptive from when the flowers open until a week after pollination, irrespective of the
period of receptivity in which this occurs. The stigma then withers. Flowers bagged to
prevent insects from visiting them are receptive a month after the flower opens. The
flower withers after 35 days, by which time it has lost its stamens and nectar. In both
species, the sepals and petals, transformed into nectaries, are photosynthetic; this may
explain the long life of the flower and its receptivity. The flower is self-sufficient and
does not consume other reserves of the plant (Vesprini, unpubl. data).
Arum italicum (Araceae). This species has a spadix type inflorescence with the
female flowers below and the male flowers above. The first day of anthesis, only the
former are receptive and insects bring foreign pollen. If pollination does not occur the
first day, the female flowers remain receptive for an extra day and are self-pollinated by
the pollen that falls from the overhanging anthers (Franchi, Pacini, 1996). Male and
female receptivity are out of phase so that cross pollination can occur. Failing this,
female receptivity is prolonged for self-pollination.
Conclusions. The duration of stigmatic receptivity is closely correlated with: a) the
type of pollination; b) the number of ovules per ovary, and c) the type of environment.
Many pollen grains at a time can reach the stigma by entomophilous pollination. In the
case of Cucurbita pepo, bees take an average of 224 ± 181 pollen grains each time they
visit a male flower, and most of them can be deposited on the stigma (Nepi, Pacini,
1993). With anemophilous pollination, the pollen grains mostly travel in ones, as it occurs
e.g. in conifers and grasses, since grains are not coated with pollenkitt. They reach the
stigma in clouds which become more and more rarified with increasing distance from the
pollen source (Lisci et al., 1996). When the number of ovules per ovary is very high,
stigmatic receptivity should be longer to enable many pollen grains to fall on the stigma
and germinate. However, if an appropriate number of pollen grains reaches the stigma at
an early stage, stigmatic receptivity ceases almost at once. This happens in anemophilous
(Cramineae, Mercunalis annua, etc.) and entomophilous (Helleborus, Orchidaceae,
etc.) plants. The environmental parameters that most affect stigmatic receptivity are
temperature, RH and soil moisture (Jacobsen, Martens, 1994; Fan et al., 1995).
As far as ovular receptivity is concerned, we have two modes of maturation of the
female gametophyte: 1) the female gametophyte may be mature before the pollen reaches
126
Системы репродукции
the stigma; 2) the female gametophyte is not ready, but completes its development once
the pollen reaches the stigma. The advantages of the various types of receptivity being out
of phase are discussed by Bertin and Newman (1993). Protracted receptivity, however,
is uneconomical because energy is required to keep the female gametophyte viable. This
may be why in many orchids, stigmatic receptivity lasts more than a month and the ovules
only develop the gametophyte once the pollen tubes have begun to grow in the style.
The high cost of maintaining male and female receptivity over a long period is often
correlated with the maintenance of floral accessories such as nectaries, corollas, and so
forth. In the Gramineae and Cactaceae, male and female receptivity are brief. There
are plants in which both male and female receptivity are long but intermittent, so as to
protect exposed pollen and the stigma during the night or the heat of the day. Finally,
there are plants in which male and female receptivity occur at different times; for
example in the hazelnut, the plant first invests only in the stigma and style, the other
parts of the flower developing once pollination has occurred. This takes place in the
hazelnut from January to April, according to the latitude; the ovary and ovules develop
16-20 weeks after pollination. In the meantime the pollen tubes wait in the style (Jona,
1985). In the Gymnosperms, fertilization occurs in a similar manner, and can be
regarded as a way of reducing the initial investment in female structures; the second part
of the investment is made when the pollen tubes are growing in the style, that is, when
fertilization is certain.
Arbeloa, Herrero, 1987; Bertin, Newman, 1993; Bowman, 1984; Dafni, 1992; Dulbergeret al., 1994;
Endress, 1994; Fan et al., 1995; Franchi, Pacini, 1996; Fredrikson et al., 1988; Gonzalez et al., 1995;
Hepler, Boulter, 1987; Heslop-Harrison, 1972, 1979, 1983; Heslop-Harrison, Shivanna, 1977;
Heslop-Harrison et al., 1985; Hopping, Jerram, 1979; Jacobsen, Martens, 1994; Jona, 1985; Knox et
al., 1989; Kreitner, Sorenzen, 1985; Lisci et al., 1994, 1996; Martinez-Palle, Herrero, 1995;
Mascarenhas, 1993; Mattsson et al., 1974; Miki-Hirosige et al., 1987; Nepi, Pacini, 1993; Ottaviano,
Mulcahy, 1989; Owens et al., 1995; Pacini, 1990,1992; Pacini, Franchi, 1981, 1997; Pacini et al.,
1997; Pande et al., 1972; Schneider, 1982; Schoper et al., 1987; Sedgley, 1981; Sedgley et al., 1985;
Shivanna et al., 1978; Shivanna, Sastri, 1981; Singh, Walles, 1995; Stephenson et al., 1988; Stone et
al., 1995; Walt van der, Littlejohn, 1996; Webb, Williams, 1988; Williams et al., 1994; Wilms, 1981.
POLLINATION FAILURE IN NATURAL POPULATIONS: IMPLICATIONS
FOR THE CONSERVATION OF RARE PLANTS
НЕДОСТАТОК ОПЫЛЕНИЯ В ЕСТЕСТВЕННЫХ ПОПУЛЯЦИЯХ:
ЗНАЧЕНИЕ ДЛЯ СОХРАНЕНИЯ РЕДКИХ ВИДОВ РАСТЕНИИ
The familiar adaptations of angiosperm flowers to pollination by wind, animals and water
are widely known (Proctor et al., 1996). They have been accumulated from the
achievements of outstanding field biologists applying painstaking precision and
single-mindedness to their studies, particularly during the end of the last century and the
beginning of the present one (Muller, 1883; Knuth, 1906-1909; Church, 1908). More
recently pollination biological research has perceptibly shifted from an observational phase
to an experimental one (Wilcock, 1980) and this new development has prompted a renewed
research interest in an area which during the 1960's and 1970's, almost completely
disappeared from the British University curriculum. Several sources are now available which
highlight the applicability of new developments (Handbook of Experimental Pollination
Biology, 1983; Pollination Biology, 1983) and also the practical techniques employed in
Системы опыления и скрещивания
127
these new approaches (Dafni, 1992; Kearns, Inouye, 1993). It is now possible, for
example, to document changes in pollen viability with time and climate; study germination
and stylar growth using the fluochromatic reaction (FCR) test (Thomson J., Thomson В.,
1992); track pollen flow by paternity analysis using polymorphic marker loci (Meagher,
1986); identify supporting nectar sources on pollinated stigmas by identification of foreign
pollen (Neiland, Wilcock, 1994); detect pollen carryover by radioactive labelling
(Schlising, Turpin, 1971) and determine the presence of non-random mating after
pollination from anatomical studies (Hill, Lord, 1986).
Pollination is the primary step in seed formation and pollen spread is a critical dispersal
phase that permits the mating of genetically different individuals during sexual
reproduction. The central role played by pollination mechanisms in the breeding system
of angiosperms is widely recognised (Richards, 1986) and the outcomes of interbreeding
have a major influence on evolution and population structure. The integrated roles of
pollination and breeding system are best understood as part of the reproductive process as
a whole, including the processes of seed formation and development, dispersal and
seedling establishment, and it is only from studies in all these areas that reproductive
success can be fully established. Volumes such as «Plant Reproductive Biology, Patterns
and Strategies» (Lovett Doust J., Lovett Doust L., eds., 1988) and «Ecology and
Evolution of Plant Reproduction» (Wyatt, ed., 1992) have served more to highlight the
diversity of achieving successful plant reproduction rather than to uncover guiding
principles but, nevertheless, these complexities provide fascinating insights into our
present knowledge of reproductive processes. At the same time, a considerable
broadening of our understanding of the physiological processes of sexual reproduction has
been achieved by plant biochemists using as laboratory organisms agriculturally
important crop plants such as maize (Heslop-Harrison, 1987), but the full impact of
these studies for wild plants in a natural environment has not yet been fully appreciated.
Pollination in the ecosystem, environmental change
and reproductive failure
Many different mechanisms of pollen transfer can exist within a single ecosystem,
including both biotic and abiotic modes, and most communities exhibit a wide diversity,
often within a small area (the Mediterranean — Aronne, Wilcock, 1994).
Three broad types of pollination syndrome have been identified by Proctor (1978)
which he supposed evolved at an early stage in angiosperm evolution and between which
plants have been continuously changing. These types are: 1) wind pollination, 2)
specialised zoophily and 3) generalist zoophily (Table 1). Both Proctor and Moldenke
(1975, for data from California) show that a wide spectrum of pollination mechanisms is
present in most communities and that the more stable communities have slightly higher
proportions of specialised zoophily.
However, neither Moldenke nor Proctor point to the likely responses to
environmental stress inherent in the different types, although Proctor notes that in some
important families adaptations have apparently reached a dead end. This clearly applies
to the specialist resource-independent pseudo-copulation mechanisms present in such
orchids as Ophrys spp., where adaptations inevitably lead to a closer and closer
simulation between mimic and model. Indeed, from the most recent data the mimics not
only bear the olfactory and optical characteristics of the model, but also tactile ones as
well (Agren et al., 1984). In such circumstances these specialised mechanisms are
clearly at great risk from the loss of the specialist pollinator, even if environmental
128
Системы репродукции
conditions change only enough to remove the bee out of the area of distribution of the
orchid to a more favourable environment.
The two large families Asteraceae and Apiaceae are classic examples of generalist
pollination mechanisms with easily accessible food rewards and dense, flat-topped
inflorescences. These are usually visited by a wide range of promiscuous pollinators with
most inflorescence adaptations characteristically diverted towards improvement of
display. In both Apiaceae and Asteraceae, peripheral flowers in the inflorescences exhibit
enlargement of one or more petals of the corolla (e.g. Heracleum sphondylium and
Chrysanthemum leucanthemum). Further, the presence of a dark red central sterile
flower in Daucus carota has been shown to increase pollinator visitation by stimulating the
interest and aggregative behaviour oiMuscidae and thereby increasing pollination activity
(Eisikowitch, 1980). Such species, which are effectively pollinated by a wide taxonomic
diversity of pollinators, are clearly more environmentally buffered than their specialist
counterparts. Small-scale environmental fluctuations are unlikely to cause any long-term
reproductive failure in these plants. Only those in an area subjected to an environmental
catastrophe, such as caused by pesticide use or reduction of insect population due to
extensive agriculture, will be likely to experience a significant depression in seed set.
The pollination of anemophilous species is independent of animals and, at first sight,
appears to be of greatest adaptational benefit for long-term pollination success, but this
potential benefit must be balanced by the greater need to produce more pollen to achieve
successful reproduction and therefore imposes an additional resource cost (Aronne,
Wilcock, 1994).
While the specialist zoophilous mechanisms should be closely examined for any effects
of pollinator loss, pollen itself may be at risk from loss of viability in a changing
environment. Only recently have the effects of growing conditions on pollen viability been
recognised. Pollen viability decreases more rapidly on exposure to higher humidities and
temperatures, and Pacini and Franchi (1984) have shown that the male gametophyte is
more sensitive to drought than the female.
Pollination, resource allocation and reproductive failure
Resource allocation to male and female function at the time of reproduction places an
additional demand on the nutrient balance of an individual plant (Aronne, Wilcock,
1994), and the critical resource may be energy, a mineral nutrient, or even water
(Wilson, 1983). Energy efficient means of pollen transfer have evolved (Richards,
1986) and it is increasingly clear that the resources allocated to pollination are subject to
Table 1: Pollination syndromes, pollen economy and their sensitivity
to the effects of environmental change
Pollination syndrome
Specialist zoophily
Non-specialist zoophily
Anemophily
Pollen economy
Highly efficient
Intermediate
Highly wasteful
Pollinator sensitivity
to environmental change
Environmentally sensitive
Environmentally buffered
Independent of animals
Examples of plant
families
Orchidaceae
Asteraceae
Apiaceae
Poaceae
Cyperaceae
Системы опыления и скрещивания
129
selection for economy. Aronne and Wilcock (1994), for example, have shown that while
both anemophily and zoophily occurs in the Mediterranean ecosystem, the primary
selective factor operating on the diversity of pollination and breeding system is resource
limitation caused by nutrient and water stress. The anemophilous species produce pollen
of lower caloric value than the entomophilous taxa (Petanidou, Vokou, 1990) but this
must be balanced against the need to produce greater quantities of pollen because of a
less-efficient mechanism of pollen transfer. The formation of nectar as a reward poses a
cost to reproduction. Руке (1991) has shown that increasing nectar production
experimentally from flowers by its removal (as in pollination) decreases seed number as a
direct result of the additional costs of extra nectar production. Within the Mediterranean
the entomophilous species follow two diverging trends. A group of dioecious taxa, in
which nectar production is lower or absent in the females, is pollinated by small
nectar-seeking insects which visit females by mistake, e.g. Osyris alba (Aronne et al.,
1993). The second group are hermaphroditic but do not maintain the advantage of
hermaphroditism (over dioecy) without substantial reductions in pollination costs which
we have termed 'pollination on the cheap' (Aronne, Wilcock, 1994). Such examples
range from the offer of pollen-only rewards, like the Asteraceae and Fabaceae, through
the interfloral mimics within a population (where the mimic is nectarless such as Cerinthe
major — Gilbert et al., 1991), to the numerous Mediterranean orchid taxa, which
provide no reward at all for insect pollinators (Dafni, 1987) and are pollinated by deceit.
Evidence that deceptive pollination mechanisms may be affected by pollinator
discrimination has been shown by Le Corff et al. (1998), where rewarding male flowers of
Begonia tonduzii are visited 15.4 times more frequently by bees than the non-rewarding,
mistake pollinated females. This indicates that a high level of pollinator discrimination
may operate in communities of flowers with varying degrees of floral rewards such that
rewardless plants may be threatened by a reproductive bottleneck caused by pollinator
behaviour. The inability to produce a nectar reward may pose a substantial threat to the
reproductive potential of rewardless plants. Reproductive success in orchids worldwide is
affected in this way with nectariferous species being, on average, twice as successful as
nectarless ones in fruit set and, in addition, the absence of this reward is linked to rarity in
British orchids (Neiland, Wilcock,1998 a).
So, clearly, pollination mechanisms must now be viewed as subject to the same rule of
evolutionary efficiency in resource allocation as every other facet of the life of the
angiosperm. Soil nitrogen levels have recently been shown to affect pollen performance
and spatial heterogeneity in soil nitrogen can influence the paternity of seeds in plant
population (Lau, Stephenson, 1993). Work with Zea mays have shown that water stress
alone (rather than lack of assimilate supply) during flowering can decrease reproductive
success (Zinselmeier et al., 1995; Zhou et al., 1997). Taken together the presence of
resource limited reproduction suggests that the reproductive success of plants may be
significantly reduced when growing in soils of low nutrient status and in environments
subject to increasing temperatures and/or drought.
Recent studies of the pollination biology of Daciylorhiza lapponica have shown that
successful pollination of this non-rewarding species is dependent on floral mimicry with
Pedicularis sylvatica (Neiland, Wilcock, 1998 b). Evidence of effective floral mimicry
was shown by the presence of holes punctured into the functionless spur, probably by
short tongued bees. This attempt at nectar robbing is typical of some bee behaviour at P.
sylvatica (Koeman-Kwak, 1973). There is no evidence of self-pollination in D.
130
Системы репродукции
lapponica and the capsule set is very low (<18%). With such low frequencies of
successful pollination, the maintenance of a threshold level of pollinator density in the
community is clearly critical. The recognition of the association between D. lapponica
and P. syluatica is an important step in obtaining a fuller understanding of the
reproductive biology of this rare marsh orchid. Clearly, successful long-term management
must also include in the protocol the maintenance of the nectar rewarding P. syluatica, so
that pollination levels may be sufficient to maintain the pollinator population.
There is a high proportion of non-rewarding orchids in the Scottish flora and these
generally exhibit lower levels of reproductive success than their rewarding confamilials.
Community-dependent pollination in generalist orchids (which are conservation-sensitive)
requires the recognition and conservation of the critical co-flowerers in the local habitat
(Neiland, Wilcock, 1994). D. lapponica is just one of several orchids which probably
belong to this category.
Pollen limitation and reproductive failure
Discrepancies in an ovary between the number of ovules produced and the number of
seeds formed is sometimes due to the quantity and quality of pollen transferred (pollen
limitation). Variations in abundance of pollinators can have a considerable overall impact
on reproductive success. Fluctuations in pollinator abundance can occur naturally by
environmental change or by human disturbance such as pesticide use and transformation
of natural habitats into agricultural land.
Pollen limitation caused by loss of specific pollinators. Specialist mechanisms of
pollen transfer are clearly at risk from the loss of the specific pollinator. Plants with this
sort of pollination usually exhibit adaptations to the specific requirements of the pollinator,
with much structural modifications of the flower, accurate pollen and stigma presentation,
and high pollen economy [for example, the Yucca moth — Yucca flower interaction
(James et al., 1993) and the specific bee and wasp interactions with Ophrys spp.
(Kullenberg, 1973)]. In these cases the disappearance of the pollinator leads to total
reproductive failure, from which there may be no evolutionary return (because of the
extreme floral adaptation) except self-pollination or apomixis.
Ixianthes retzioides is a very rare shrub of the southwest Cape in S. Africa and its
floral morphology suggests pollination by a large oil-collecting bee. However, no such
bee has been observed at the sites, in spite of several years of observation, and fruit and
seed set is very low (Steiner, 1993; see Table 2). Crossing data show that the species is
self-compatible and that a limited amount of fruits (10.6%) and seeds (2.6%) forms
by self-pollination. Over and above this level are the small amounts of additional fruit
and seed set caused by pollinating visits from pollen collecting insects. Steiner
concludes that Ixianthes has lost its specific pollinating bee, and suggests that
environmental fluctuations in the past may have eliminated or critically reduced the
specialised pollinator population. Persistence of Ixianthes is the result of
self-compatibility resulting in some self-pollination and the occasional pollinating
activities of pollen collectors. The long-term future of the species will depend on floral
flexibility and the gradual adoption of new pollinators.
A similar situation may have occurred in some European Ophrys spp., a few of which
have extended ranges well beyond the Mediterranean region where there is the greatest
species concentration. O. apifera and O. sphegodes are both frequently self-pollinated by
the falling of the pollinia from the rostellum onto the stigmatic surface below. Visitation
Системы опыления и скрещивания
131
Table 2: Fruit and seed set in Ixitanthes retzioides, a rare shrub of the Scrophulariaceae
from the southwest Cape (Data modified from Steiner, 1993)
Treatment
Open pollination
Bagged, unmanipulated
Selfed
Outcrossed
n
251
211
48
97
Fruit set (%)
19,1
3,3
100
96,9
Seed set (%)
6,5
12,3
37,3
43,8
and effective pollination of these two species is rare and most fruit set is probably
attributable to selfing events. The specialist pollinators of these taxa are rare or absent
and, again, the plant-pollinator interaction appears to have become uncoupled. The
frequency of self-pollination appears to maintain populations and has permitted dispersal
well beyond the probable range of the specialist pollinator (Godfrey, 1921).
Pollen limitation caused by fragmentation of the habitat and reduction of
pollinator abundance. Fragmentation of the habitat and subsequent distribution
restrictions of a plant species range has been shown to reduce reproductive success.
Jennersten (1988) has shown that habitat fragmentation of the butterfly-pollinated
Dianthus deltoides in southwest Sweden reduced pollination success by 75% in the
fragmented area because of lower diversity and abundance of flower-visiting insects
compared within the larger area of distribution (see Table 3). «Island» populations
generally may have lower seed set than «mainland» populations because lower
pollinator availability results in pollen limitation (Spears, 1987) and the presence of
a higher proportion of generalist pollination mechanisms in islands has been
interpreted as a result of island-induced reductions in pollinator diversity (Linhart,
Feinsinger, 1980).
The loss of seed set observed in Victorian coastal populations of the rewardlesss
Australian orchid, Thelymitra epipactoides, has been attributed to the reduction of
the flowering plants in these heathland communities by constant fires, and the
consequent lack of ability of the floral community to remain attractive to potential
pollinators (Cropper, Calder, 1990). Elsewhere, the orchid is pollinated deceptively
by polylectic bees of the genus Nomia, which forage for pollen in the more floral-rich
communities.
Table 3: Effect of habitat fragmentation on seed set in 'mainland' and 'island' sites of open
pollinated Dianthus deltoides in southwestern Sweden (Data taken from Jennersten, 1988)
I Year
1986
1987
Site
Mainland
Island
Mainland
Island
Mean seed number
65,34
27 i|***
52,22
23,65***
Mean ovule number
120.06
113,09ns
97,06
99,97ns
*** — island mean significantly different from the mainland value;
ns — island mean not significantly different from the mainland value.
•132 Системы репродукции
The impact of fragmentation on population size may causes widespread reproductive
failure for a variety of reasons (see also section 5). The annual herb, Clarkia concinna,
fails to produce seed in small, isolated populations because it receives insufficient
pollinator services (Groom, 1998). Small, isolated patches attract few pollinators, have
chronically low reproductive success, and correspondingly higher extinction rates than
large patches, regardless of their degree of isolation.
Pollination limitation caused by competition for pollinators. Competition for
pollinators may induce pollen limitation in poor competitors and frequently occurs among
co-flowering species sharing the same set of pollinators (Rathcke, 1988). Karron (1987)
has shown that the rare Astragalus linifolius receives significantly lower levels of pollinator
visitation than its more widespread congener, A. osterhouti, when growing together in the
same habitat (see Table 4). It is possible that this low success in competition for pollinators
may have contributed to, and probably helps to maintain, the rarity of A. Linifolius.
Nectarless species should be outcompeted for pollinators by nectariferous species when
sharing the same habitat. These species may reward their pollinators by pollen presentation or
be completely non-rewarding. The presence of floral mimicry, e.g. Orchis israelitica with
Bellevalia flexuosa (Dafni, 1987) and Cephalanthera rubra with Campanula spp. (Nilsson,
1983), amongst the non-rewarders has been reported for several other orchids (Weins, 1978;
Dafni 1984) but is probably more widespread than generally realised. Pollen-only rewarders
appear to achieve high levels of pollination success in many habitats, without the need to
support their pollinators with nectar. The pollinators are generalists, often being physiologically
maintained entirely by other co-flowering species in the community. The strategy of deceptive
pollination, although energy saving, appears to be less reproductively successful when
compared with closely related rewarding counterparts (Melampy, Hayworth, 1980) and at
great risk from learned avoidance behaviour by intelligent pollinators.
From studies of the corbicular contents of bees visiting Cimicifuga rubifolia and C. elata,
two restricted N. American endemics, Pellmyr (1986) has shown that the two species exhibit
different solutions to the problem of insufficient pollinator attraction. Although possessing the
same general floral morphology, C. elata is geitonogamous while C. rubifolia is obligately
xenogamous and dependent on associated nectar-producing plants for attraction of its
pollinators. Consequently there was pollen of only one other floral species amongst the
corbicular pollen of bees collecting in the habitat of C. elata, whereas the loads were much
more diverse on bees collecting from C. rubifolia. The possibility of between flower
self-pollination in C. elata ensures that virtually every bee visit results in pollination when visit
frequencies are low. Self-incompatible individuals will be at a strong selective disadvantage by
having high reproductive failure with low pollinator frequency and mutations inducing
Table 4: Visitation rate to two co-occnring Astragalus spp. From Colorado
(Data adapted from Karron, 1987)
A. /ini/oZius(restricted)
A. /inc/zicarpus(widespread)
per plant
1984
4
16*
1986
4
10*
per 100 flowers
1984
8
28*
1986
7
32*
: — value significantly different from A. linifolius.
Системы опыления и скрещивания
133
self-compatibility will be of selective advantage (Baker, 1955). In C. elata there is a much
higher pollen: ovule ratio than in C. rubifolia and pollinators are rewarded with pollen.
However, C. elata has insufficient pollen (as well as being nectarless) to ensure pollinator
constancy and is dependent for pollination on the pollinator density maintained by other
rewarding species in the habitat. Nectar-seeking bees apparently encounter this species
accidently while foraging in the community. This conclusion was supported by 1) negative
correlation between fruit set and nearest nectar source (Fig.), 2) extended flowering period
and 3) fruit set independent of Cimicifuga floral display and density.
80
60
" 40
В
to
20
01
0 20 40 60 80 100
Distance to nearest nectar source (m)
Fig. Relationship between fruit set and nearest nectar source in Cimicifuga spp.
(Data taken from Pellmyr, 1986)
Incompatible pollination and reproductive failure
Plants have a wide range of mechanisms to prevent self pollination, but genetically
determined self incompatibility poses potential difficulties in seed formation to rare plants
living in isolated patches composes of one or a few genotypes, especially where pollen
movement is limited in dispersal distance.
Linnaea borealis is a clonal, highly self-incompatible, dwarf-shrub that forms widespread
patches in boreal forests. Fruit formation is reported to be rare (British Flowering Plants, 1939;
Polunin, 1959; Clapham et al., 1962; Barrett, Helenuim, 1987; Ross, La Roi, 1990; Eriksson,
1992). Open and experimental pollination at two sites in D. Aberdeenshire (Table 5) has shown
fruit set is not pollen limited but the result of lack of xenogamous pollination within large patches of a
single genet (Wilcock, Jennings, 1999). Seed set is increased amongst different genets in mixed
patches of smaller size and hand cross-pollination increases seed set (Table 6). Limitation of seed
set by the lack of xenogamous pollen transfer in large, self-incompatible clonal plants has been
referred to as partner limitation (Eriksson, 1989). It has been reported to occur in Rubus arcticus
(Tammisola, 1982), Podophyllumpeltatum (Swanson, Sohmer, 1976) and in the gynodioecious
Glechoma hederacea (Widen, 1992). Widen B. and Widen M. (1990) have shown that the
reproductive success of female clones was inversely related to the distance from the nearest
hermaphrodite clone, and Laverty and Plowright (1986) have shown a negative correlation
134
Системы репродукции
Table 5: Percentage seed set in experimentally manipulated and open pollinated flowers
of Linnaea borealis at Deeside, Aberdeenshire (Data from Wilcock, Jennings, 1999)
Treatment
Xenogamous pollination
Autogamous pollination
Bagged, unmanipulated
Open pollination
De-sexed
No. inflorescences
10
9
64
93
6
No. flowers
21
16
126
173
12
Percent seed set
28.6*
0.0
1.6
16.2
0.0
* — percentages significantly higher than bagged, unmanipulated treatment (p<0.005).
Table 6: A comparison of seed set in Linnaea borealis at two different sites in NE. Scotland
(Data from Wilcock, Jennings, 1999)
Site
Deeside
Huntly
No. of genets
>4
1
No. of inflorescences
281
66
Percent seed set
25.1*
1.5*
* — percentages significantly different (p<0.05).
between patch size and seed set in mixed populations of the self-incompatible P. peltatum. Partner
limitation is probably a relatively common occurrence in clonal plants and may be especially
common in rare or restricted populations.
In distant populations of highly self-incompatible species such as Linnaea borealis,
composed of single, or a few, genets, it is improbable that pollen could move between them
by natural pollination. Partner limitation reduces their capacity to produce seed so that
population survival will depend on vegetative maintenance by the stolons alone. Recovery of
such populations to new sites, without constant artificial intervention of new plants, depends
on their capacity to produce seed. Evidence from this study, which effectively restored
sexual reproduction to an isolated clone by artificial importation of pollen (Table 7),
suggests that it is the absence of potential mating partners which is the main cause of
reproductive failure in Linnaea borealis in Scotland. Thus, by transplanting small pieces of
Linnaea of a suitable compatible mating type into sterile populations composed of single or
only a few genets, it should be possible to greatly increase seed set through natural
xenogamous pollen transfer. It will be important to establish the genetic structure of small
widely scattered populations. If they mostly turn out to be composed of one or a few genets,
the results of this study suggest a possible technique that may be employed in their
long-term conservation without constant human intervention.
A similar impact of low population densities in a self-incompatible plants on
reproductive success has been reported in Diplotaxis erucoiides, where widely spaced
plants had lower fruit set and fewer seeds per silique than did plants growing close to
conspecific neighbours (Kunin, 1992). More recently (Daehler, 1998), evidence that
founding populations of self-incompatible plants may experience reproductive failure has
Системы опыления и скрещивания
135
Table 7: Restoration of sexual reproduction at an isolated population of Linnaea borealis,
where the recorded level of natural fruit set is extremely low, by using imported pollen
from another location (Data from Wilcock, Jennings, 1999)
Flowers hand
pollinated with pollen
from a distant
population
Flowers tagged and
open pollinated
at the site
Number
studied
40
26
Number
aborted
26
26
Number of
fruits set
14
0
Number with
embryo and
endosperm
14
"
Seed set
(%)
35
0
been found in Spartina alterniflora, where most plants in small populations flowered
prolifically but set little or no seed. A few clones appeared to have consistently (from year
to year) higher selfing capacities and produced most of the viable seeds in the population.
Clearly, in recovering populations of rare, SI plants a great deal of dependence will need to
be placed on those genotypes, if any, with some degree of selfing capability.
Implications of reproductive failure for conservation
It is increasingly evident that knowledge of the breeding system and reproductive
biology of rare species is an important consideration in the development of protocols for
their long-term conservation. Fieldwork, experimental pollination and laboratory studies
are necessary to obtain a full appreciation of the critical steps of the reproductive cycle and
to highlight the place where significant failure occurs. Examination of pollination failure is
just one aspect of this process. From the evidence presented, studies of pollination biology
in rare species are most likely to be of greatest relevance in the following situations:
1) species pollinated by specialist pollinators;
2) rewardless species/female flowers which depend on other co-occurring rewarding
plants/male flowers for the maintenance of their pollinators;
3) species on the margins of agricultural land, or otherwise with a fragmented distribution;
4) populations of clonal, self-incompatible species with reduced genetic diversity;
5) species exposed to environmental change by performing experimental pollinations;
6) species living in soils with low nutrient status or water stress.
Ex situ conservation of a large number of rare plants is unlikely to be undertaken because of
the high maintenance costs to conserving institutes (Wilcock, 1990), and in situ programmes
are likely to prove most cost effective. Detailed management schemes usually emphasize the
need for reduction in large scale herbivory and long-term monitoring of population changes.
The pollination ecology of species with restricted ranges, or composed of only a few
individuals, has received very little attention (Karron, 1987), but the value of biological
studies of the plants concerned and particularly of their breeding systems is beginning to be
recognised (Karron, 1991). Some reports are accumulating to show that the reproductive
success of wild plants is extremely variable and susceptible to environmental changes (Travis,
1992) and that when carefully examined many plant populations exhibit very low levels of seed
136
Системы репродукции
set in nature (Neiland, Wilcock, 1994). Pollination limitation is, of course, only one aspect of
the reproductive process which may cause loss of seed set in plants, but recent data gathered in
my laboratory have indicated that failure of pollination might be a major concern for
conservation of rare plant species or populations.
The impacts of lack of pollination or successful fertilization in rare plants may lead
directly to their extinction if they have no means to propagate vegetatively. As pointed out
by Bond (1994), some rare species at high risk from reproductive failure survive in situ
through regular vegetative propagation. Because of their lack of reproductive success,
however, the capacity of these species to respond to changing environments through
evolution is severely compromised. Moreover, and perhaps more critically in the short
term for their conservation, their capacity to recover and spread by seed recruitment is
also compromised. As a result, such species are completely dependent on the
identification (and removal) of any threats to their local habitats, since if these habitats are
destroyed the only possible conservation action is immediate removal of the rare plants
and their ex situ conservation.
We might expect rare species with reproductive difficulties but vegetative maintenance to
accumulate in a community subject to increasing fragmentation and only slowly be subject
to extinction, whereas those species with reproductive failure but no capacity to maintain
themselves by vegetative propagation would more rapidly face extinction. It may be that the
identification of whether a rare species has the capacity for maintenance by vegetative
propagation might be the first, most telling, step in the development of any conservation
action plan aimed at its recovery. These two groups have been identified within the rarest
Scottish plants and reproductive failure appears to be associated with species more restricted
in Scotland than their distribution elsewhere would suggest (Wilcock, Neiland, 1998).
Identification of the causes of reproductive failure should indicate whether there is any
possibility of restoring natural reproduction within a population by conservation
management (e. g., introduction of compatible mating partners as with Linnaea borealis)
and the potential for longer term survival without constant intervention. Recognition that
species with reproductive failure but without the possibility of its restoration by intervention
should warn conservation action to place a high priority on in situ habitat protection. Rare
annuals, biennials and those species without vegetative propagation, need regular
monitoring to check that the population is not diminishing in numbers.
Agren et al., 1984; Aronne, Wilcock, 1994; Aronne et al., 1993; Baker, 1955; Barrett, Helenurm, 1987;
Bond, 1994; Church, 1908; Clapman et al., 1962; Cropper, Calder, 1990; Dafni, 1984, 1987, 1992;
Daehler, 1998; Eisikowitch, 1980; Eriksson, 1989,1992; Gilbert et al., 1991; Godfrey, 1921; Groom, 1998;
Heslop-Harrison, 1987; Hill, Lord, 1986; James et al., 1993; Jennersten, 1988; Karron, 1987,1991; Keams,
Inouye, 1993; Knuth, 1906-1909; Koeman-Kwak, 1973; Kullenberg, 1973; Kunin, 1992; Lau, Stephenson,
1993; Laverty, Plowright, 1988; LeCorff etal., 1998; Linhart, Feinsinger, 1980; Meagher, 1986; Melampy,
Hayworth, 1980; Moldenke, 1975; Muller, 1883; Neiland, Wilcock, 1994,1995,1998 a,b; Nilsson, 1983;
Pacini, Franchi, 1984; Pellmyr, 1986; Petanidou, Vokou, 1990; Polunin, 1959; Proctor, 1978; Proctor et al.,
1996; Руке, 1991; Rathcke, 1988; Richards, 1986; Ross, La Roi, 1990; Schlising, Turpin, 1971; Spears,
1987; Steiner, 1993; Swanson, Sohmer, 1976; Tammisola, 1982; Thomson J., Thomson В., 1992; Travis,
1992; Weins, 1978; Widen, 1992; Widen В., Widen M., 1990; Wilcock, 1980, 1990; Willson, 1983;
Wilcock, Jennings, 1999; Wilcock, Neiland, 19.98; Zhou et al., 1997; Zinselmeier et al., 1995.
Системы опыления и скрещивания
137
О ЗНАЧЕНИИ ГИБРИДИЗАЦИИ В ЭВОЛЮЦИИ ВЫСШИХ РАСТЕНИЙ
Гибридизация у высших растений была хорошо известна уже Карлу Линнею,
который сам получал искусственные гибриды и предполагал гибридное
происхождение для некоторых видов. Однако гибридизации долго не придавали
сколько-нибудь существенной роли в эволюции, так как считалось, что гибриды
или стерильны, или в дальнейшем расщепляются, вновь давая родительские виды.
К началу 20 века накопилось много новых данных о гибридизации, что
позволило Lotsy (1916) выдвинуть гипотезу о гибридизации как основном факторе
эволюции растительного мира. Эта гипотеза была позднее поддержана Поповым (1927,
1954,1956) и Anderson (1934,1949), которые были склонны считать, что все
покрытосемянные возникли в результате древней гибридизации между первичными
саговниковыми (Cycadopsida) и гнетовыми (Gnetopsida). Высоко оценивал роль
гибридизации в эволюции также Stebbins (1956,1959,1969,1985), полагая, в
частности, что эволюция покрытосемянных была в значительной степени «сетчатой»,
и что основное значение имела не столько частота успешной гибридизации, сколько
перспективность ее результатов для дальнейшей эволюции.
Более скептически роль гибридизации в эволюции оценивали Heiser (1949),
Wagner (1968) и некоторые другие авторы вплоть до настоящего времени. Такое
отношение к гибридизации обычно определяется действительно имеющей место
полной или частичной (с образованием нежизнеспособных или стерильных
гибридов) генетической изоляцией, существующей между встречающимися в
каком-либо конкретном районе видами одного и того же рода. Однако, если бы
растущие вместе виды могли бы успешно гибридизировать, то очень скоро можно
было бы ожидать превращения их в один, сформировавшийся в результате
гибридизации новый вид. Поэтому нельзя не согласиться с Поповым (1927) в том, что
массовое формирование новых гибридогенных видов (в том числе родоначальников
таксонов более высокого ранга) происходит в критических ситуациях, во время
более или менее существенных изменений земной поверхности или климата, в
результате чего становятся возможными контакты между ранее обособленными друг от
друга видами и даже целыми флорами (например, после пересыхания восточной
части древнего Тетиса). Вообще между географически обособленными, даже
далекими друг от друга видами не всегда имеется генетическая изоляция.
Во время плейстоценовых оледенений стали возможными контакты видов,
спускавшихся на равнины с разных горных систем, а во время отступания ледника
на территории Евразии — контакты видов сибирского происхождения с
европейскими, в результате чего также формировались многие виды. При совместной
культуре человеком видов различного происхождения возникли многочисленные,
сначала спонтанные, затем искусственно получаемые гибридогенные культивируемые
виды, подобные садовым шпажникам (Gladiolus) и «хризантемам» (Dendran-
thema), происходящим от скрещиваний целого ряда дикорастущих видов этих
родов. Гибридизация, в том числе скрещивание достаточно далеких в
систематическом отношении видов, и в настоящее время широко используется селекционерами.
При отдаленном скрещивании разные виды естественно ведут себя очень
различно. Карпеченко (1935) предложил в этом случае делить скрещивания на
конгруэнтные — между видами с совместимыми геномами, и инконгруэнтные — между
138
Системы репродукции
видами со значительными генетическими различиями, препятствующими
успешному скрещиванию.
Противники большого эволюционного значения процессов гибридизации часто
ссылаются еще на невозможность при их участии создать что-либо новое в
результате перекомбинации уже имеющихся у родительских видов генов. Действительно
гибриды часто имеют промежуточные признаки, нередко уклоняясь в сторону то одного,
то другого из родительских видов. Однако еще Lotsy (1916) отмечал на примере
видов Antirrhinum, что в результате гибридизации могут появиться и совершенно
новые признаки. Но наиболее важным является то обстоятельство, что в результате
рекомбинации генов открываются совершенно новые возможности эволюции, которые
могут привести к формированию новых таксонов самых высоких рангов.
Возможность быстрой прогрессивной эволюции гибридогенных таксонов
определяется имеющей место при гибридизации некоторой деспециализациеи их по
сравнению с родительскими таксонами. Это отчасти происходит уже вследствие
наличия у гибридов двух различных наследственных основ, что создает их
большую приспособляемость к новым условиям среды. Родительские таксоны, обычно
первичные диплоиды, как правило, обладают незначительной активностью и
сокращают свои ареалы, в то время как гибридогенные таксоны, обычно амфиполип-
лоиды, становятся очень активными и быстро расширяют свои ареалы. Так, тетрап-
лоидный (2п = 28) Aegilops triuncialis обычен почти для всего древнего Средизе-
мья, а его диплоидные (2п = 14) предки A. caudata и A. umbellulata имеют
ограниченные ареалы в Юго-Западной Азии и на Балканском полуострове.
Абсолютный возрасти, triuncialis определяется всего в 8000-10000 лет. Другим
примером может служить ставший почти космополитом вид Роа annua (2n = 28),
который сформировался в плейстоцене в результате гибридизации диплоидных (2п =
14) видов: средиземноморского P. infirma и преимущественно сибирского Р.
supina. P. annua не только оказался приспособленным к значительно большему
диапазону экологических условий (от Арктики до тропиков), но и приобрел
совершенно новую особенность — способность цвести в течение всего сезона, от ранней
весны до осенних заморозков, тогда как его предки имеют вполне определенные и
короткие периоды цветения.
Не менее существенной особенностью многих гибридогенных таксонов
является и их деспециализация в отношении морфологических (а, вероятно, и
других) признаков, которая может быть следствием доминирования у гибридов
более древних, а потому и более примитивных признаков их родителей (Цвелев,
1975, 1992). Именно поэтому виды гибридогенного рода Elymus (2n=28,42)
из сем. Роасеае выглядят по совокупности признаков менее
специализированными по сравнению с их диплоидными (2п=14) предками из родов Elytrigia s.l.
и Hordeum s.l. Отсюда понятно, что при сравнении только морфологических
признаков близких родов или видов можно легко ошибиться, признав более
древние предковые таксоны за более молодые по сравнению с их деспециализи-
рованными потомками. Подобных примеров деспециализации можно привести
еще много, и то, что гибридизация позволяет древним высоко
специализированным таксонам хоть в какой-то степени деспециализироваться, уже имеет
большое эволюционное значение. Некоторая деспециализация гибридогенных
таксонов создает значительные трудности при реконструкции филогении методом
кладистического анализа. Возможности преодоления этих трудностей обсуж-
Системы опыления и скрещивания
139
даются в работе Funk (1985), также признающего существенную роль
гибридизации в эволюции высших растений.
Роль гибридизации в эволюции тесно связана с общебиологическим значением
полового процесса, возникновение которого у групп первичных организмов было
мощным стимулятором их эволюции. Слияние при половом процессе двух гамет с
не вполне тождественными генотипами тоже создает возможность некоторой
деспециализации потомков по сравнению с их родителями, и отсюда, как указывал
Darlington (1937), особи всех видов, имеющих половой процесс, являются в
какой-то степени гибридами.
Гибридизацию можно считать одним из основных факторов увеличения
биологического разнообразия в природе (Попов, 1927; Anderson, 1949; Gates, 1958;
Бобров, 1980; Цвелев, 1992). У наиболее высоко организованных животных
(позвоночных и членистоногих) главным препятствием для успешной гибридизации
становится их высокая организация. Не случайно генетическая изоляция
принимается многими зоологами за основной критерий видов в отличие от подвидов. У
высших растений, находящихся на значительно более низком уровне организации, этот
критерий не выдерживает критики.
Впрочем, и у покрытосемянных растений более высокая специализация цветков
к энтомофилии ведет к значительному сокращению возможностей гибридизации.
Так, в семействах Fabaceae и Lamiaceae, многие представители которых имеют
цветки, опыляемые определенными видами насекомых, случаи гибридизации
крайне редки, в то время как в сем. Rosaceae с открытыми для посещения насекомыми
цветками или в анемофильном сем. Роасеае известны даже спонтанные
межродовые гибриды: Sorbocotoneaster, Elyhordeum и др. (Knobloch, 1972).
Отметим еще, что возможности успешной стабилизации гибридов у
однолетников, как правило, значительно меньше, чем у гибридов — многолетников. Это,
вероятно, объясняется тем, что при первом цветении гибридов цветки часто
оказываются стерильными, а при последующих цветениях фертильность их хотя бы отчасти
восстанавливается. У однолетников же первое цветение единственное. Отсюда
нередко наблюдаемое наличие у однолетников первичного диплоидного числа
хромосом, в то время как близкие многолетние виды оказываются полиплоидами. В этом
случае, исходя из хромосомных чисел, легко ошибиться, считая диплоидное
хромосомное число однолетников производным от полиплоидного.
Разумеется, для того чтобы гибриды стали самостоятельным таксоном, они
должны стабилизироваться и занять определенное место в природе. Stebbins (1959)
отмечает два основных способа стабилизации гибридов у высших растений. Во-первых,
она очень часто достигается путем амфиполиплоидии, которая обычно имеет место
уже во время гибридизации, и тогда ее результатом являются вполне устойчивые и
фертильные гибриды — амфиполиплоиды. Так, гибридизация первичной
диплоидной (2п=14) пшеницы — однозернянки (Triticum monococcum) с диплоидными
(2п=14) видами секции Sitopsis рода Aegilops привела к возникновению тетраплоид-
ных (2п=28) видов пшениц, которые, в свою очередь, гибридизируя с диплоидным
(2п=14) видом Aegilops tauschii, дала наиболее продуктивную и широко
культивируемую мягкую пшеницу (Triticum aestivum) с 2п=42.
Другой способ стабилизации гибридов осуществляется в ходе достаточно широко
распространенной в природе интрогрессивной гибридизации (Anderson, 1949;
Zimmerman, 1966; Бобров,1980), когда при повторных скрещиваниях гибрида с од-
140
Системы репродукции
ним из предковых видов его фертильность постепенно восстанавливается. В этом
случае за счет дополнительного проникновения генов этого предка в генотип гибрида
он может стабилизироваться без изменения хромосомных чисел. Интрогрессивная
гибридизация часто имеет место во время направленных климатических изменений,
когда один из видов, более приспособленный к новым условиям, наступает на
позиции менее приспособленного вида, который нередко оказывается полностью
«поглощенным» наступающим видом с образованием нового, гибридогенного таксона.
Распространенным способом стабилизации гибридов у высших растений
является также переход к апомиксису (комплексы апомиктических видов — обычно
результат гибридизации немногих исходных видов), вивипарии или к вегетативному
размножению. Заслуживает упоминания также тот факт, что в крайних условиях
существования возможности гибридизации расширяются. Примером могут
служить виды рода Роа из секций Роа и Stenopoa, которые в умеренно теплой зоне не
гибридизируют между собой, а в Арктике и высокогорьях межсекционная
гибридизация становится возможной, и ее результатом являются промежуточные по
признакам межсекционные гибриды.
Крайне интересны данные по геномному анализу родов из трибы Triticeae сем.
Poaceae (Dewey, 1982,1984), с несомненностью показывающие очень большое
значение гибридизации в эволюции этой трибы. Согласно этим данным, наиболее крупные
роды трибы — Elymus и Leymus (2n=28,42) произошли в результате гибридизации
диплоидных (2п=14) видов родов Hordeum и Elytrigia (из родства Е. strigosa) — в
случае Elymus, и родов Psathyrostachys и Elytrigia (из родства Е. juncea) — в случае
Leymus. Генотип американского вида Elytrigia smithii оказался состоящим даже из 4
различных геномов, как результат гибридизации между видами Elymus и Leymus
(Dewey,1975). Love (1982,1984), основываясь на геномном анализе, предложил
новую систему трибы Triticeae, число родов в которой увеличилось почти вдвое, причем
родов этой трибы с первичными геномами оказалось 24, включающих около 200
видов, а вторичных, габридогенных родов со сложными геномами — 15, включающих
около 300 видов. Некоторые из выделенных Love родов морфологически слабо
обособлены, однако возможно, что имеющаяся в их генотипах избыточная информация
существенно скажется на их дальнейшей эволюции.
Очевидно, что триба Triticeae не является исключением среди
покрытосемянных, а лишь очень основательно изучена генетически вследствие наличия в ней
таких важнейших культур, как пшеница, рожь, ячмень, и многих ценных кормовых
растений. Некоторые данные имеются и по другим группам покрытосемянных.
Так, предположение Stebbins (1959) о возможном происхождении подсемейства
Pomoideae сем. Rosaceae в результате гибридизации между предками подсемейств
Spiraeoideae и Prunoideae подтверждается цитологическими и биохимическими
исследованиями.
Таким образом, гибридизация является если не основным, то одним из
ведущих факторов эволюции высших растений. Гибридизация может дать начало
очень перспективным филумам, которые со временем могут стать таксонами
самых высоких рангов. Она позволяет многим высокоспециализированным
таксонам в какой-то степени деспециализироваться и продолжить эволюцию,
способствует увеличению биологического разнообразия на Земле, поставляя обильный
материал для естественного отбора, и играет весьма существенную роль в
селекции культивируемых растений
Системы опыления и скрещивания 141
Бобров, 1980; Попов, 1927, 1954, 1956; Цвелев, 1972, 1975, 1991, 1992; Anderson, 1934,
1949; Barber, 1970; Darlington, 1937; Dewey, 1975, 1982, 1984; Funk, 1985; Heiser, 1949;
Knobloch, 1972; Lotsy, 1916; Love, 1982, 1984; Stebbins, 1956, 1959, 1969, 1985; Wagner,
1968; Zimmerman, 1966.
142
Системы репродукции
ЧАСТЬ III — СЕМЕННОЕ РАЗМНОЖЕНИЕ
АМФИМИКСИС И АПОМИКСИС
АМФИМИКСИС (греч. amphi — оба, двойственный, mixis — смешение) —
процесс объединения женской и мужской гамет, приводящий к образованию нового
индивидуума. Синонимы: оплодотворение, половой процесс.
Термин впервые предложен Weismann (1892). Способы образования
спорофита при амфимиксисе разнообразны, например, у низших растений различают холо-,
изо-, гетеро- и оогамию и др. У животных под собственно амфимиксисом понимают
короткую фазу слияния мужского и женского пронуклеусов (гаплоидных ядер
гамет) и образование диплоидного ядра зиготы — синкариона. Она следует за фазой
активации и отсутствует при гиногенезе (Реймерс, 1991).
У цветковых растений амфимиксис в узком смысле слова представлен сингами-
ей, т.е. «истинным оплодотворением», а в широком — двойным оплодотворением
— сингамией и тройным слиянием (см. Сингамия; Тройное слияние, Т. 2).
Термин амфимиксис обычно используют при противопоставлении апомиксису
(гаметофитному — в узком смысле). При этом амфимиксис рассматривают в
разных аспектах: как половой процесс, или оплодотворение, как одно из
репродуктивных явлений (наряду с апомиксисом и псевдомиксисом) и как систему
репродукции (см. The Oxford English Dictionary, 1989).
Как половой процесс амфимиксис включает кариомиксис (греч. karyon —
ядро, mixis — смешение), в результате чего образуются синкарион зиготы и синка-
рион центральной клетки зародышевого мешка, и плазмомиксис (греч. plasmat —
плазма + mixis) — слияние цитоплазмы мужских и женских гамет.
Однако исходя из первоначального определения амфимиксиса, предложенного
Weismann (1892) — «...смешение наследственной субстанции двух
индивидуумов», можно видеть, что этот термин подчеркивает, прежде всего, генетический
характер и половой способ образования нового индивидуума, т.е. он более точно и
более полно отражает биологическую сущность явления, чем просто
«оплодотворение» или половой процесс.
Во многих учебниках и словарях, в частности в Биологическом
энциклопедическом словаре (1986, с. 24) дается следующее определение:«амфимиксис — способ
полового размножения растений и животных». В связи с этим следует еще раз
напомнить, что термины «амфимиксис» и «апомиксис» нельзя считать синонимами
терминов «половое» и «бесполое размножение», соответственно (см. подробнее
Семенное размножение
143
Воспроизведение, размножение и возобновление). Биологическое значение
амфимиксиса следует связывать с биологической сущностью определенных сторон
процесса оплодотворения. Дарвин, открывший «великий закон природы», говорил
о прогрессивном значении появления полового процесса в истории органического
мира, рассматривая при этом перекрестное опыление как источник обогащения
наследственности. Благодаря бипариентальному наследованию (материнское — от
яйцеклетки и отцовское — от спермия) в результате амфимиксиса получаются
более жизнеспособные организмы, обладающие более широким спектром
изменчивости по сравнению с апомиктичными растениями.
Реймерс, 1991; The Oxford English Dictionary, 1989; Weismann, 1892.
АПОМИКСИС (греч. аро — без, mixis — смешение) — образование зародыша без
слияния гамет. Впервые термин «апомиксис» был введен Нааске (1893а,Ь) для
животных, а позднее использован Maire (1900), но несколько в иной трактовке.
Более ста лет в литературе обсуждаются различные аспекты апомиксиса, в том
числе и вопрос об объеме самого понятия «апомиксис», которое используется либо
в широком, либо в узком смысле слова.
Winkler (1908), рассматривая апомиксис у различных групп растений, определил
его как «образование спорофита из клеток гаметофита без слияния гамет». В одной
из последних работ (1934) он расширил это понятие, включив в него и вивипарию
(вегетативное размножение — Т.Б.). Такую интерпретацию термина «апомиксис»
(все способы воспроизведения и размножения, не связанные с половым процессом)
приняли большинство авторов (Fagerlind, 1940; Stebbins, 1941; Gustafsson,
1946-1947; Maheshwari, 1950; Левина, 1961, 1981; Поддубная-Арнольди, 1976;
Петров, 1979,1988; Grant, 1981; Crane, 1989; Czapik, 1996). Широкое понимание
апомиксиса, заключающее ряд разнородных явлений, требовало уточнения
некоторых положений. Чтобы отличить случаи образования семян без оплодотворения от
семян, где зародыш образуется за счет сингамии, было введено понятие «агамоспер-
мия» (Fackholm, 1922). Fagerlind (1940) и Stebbins (1941) разделяли в этой связи
апомиксис на «агамоспермию» и «вегетативный апомиксис». Gustafsson (1947)
также принял термин«апомиксис»в его широком понимании, выделив при этом в нем
две группы процессов: размножение посредством вегетативных органов
(вегетативное размножение, в которое включает и вивипарию) и размножение
посредством семян, в которых зародыш образуется без оплодотворения, т.е.
агамоспермию. Он включает в агамоспермию: диплоспорию — партеногенез,
апоспорию — партеногенез и адвентивную эмбрионию.
Взгляды Gustafsson были восприняты Grant (1981) и развиты им в отношении
уточнения некоторых особенностей половой репродукции (в частности, четкое
разделение представлений о вицинизме и автогамии). Следует отметить, что Grant в то же
время считает, что «...адвентивнаяэмбриония (нуцеллярная и интегументальная)
представляет собой тот тип агамоспермии, который в наибольшей степени
приближается к живорождению как одной из форм вегетативного размножения (или
ложному живорождению, согласно van der Pijl, 1972 — см. Грант, 1984: 396).
Апомиксис в широком смысле слова некоторыми авторами подразделяется на 4
типа (см. Maheshwari, 1950). 1. Нерегулярный апомиксис, при котором
нормально протекает мейоз, образуется гаплоидный зародышевый мешок, зародыш разви-
144
Системы репродукции
вается из яйцеклетки (гаплоидный партеногенез) либо из других клеток
гаметофита (гаплоидная апогамия). Растения, возникающие таким путем, содержат
один набор хромосом (п), обычно стерильны; процесс апомиксиса не повторяется в
следующих поколениях. 2. Регулярный апомиксис, при котором образуется
диплоидный зародышевый мешок либо из клетки археспория (генеративная
апоспория), либо из клеток нуцеллуса (соматическая апоспория); зародыш может
возникать из яйцеклетки (диплоидный партеногенез) или из иной клетки
гаметофита (диплоидная апогамия). 3. Адвентивная эмбриония, или спорофитное
почкование1 — зародыши образуются из спорофита — соматических клеток
нуцеллуса и интегумента, независимо от способа возникновения и плоидности
гаметофита. Winkler рассматривает его как особый случай вегетативного размножения. 4.
Тип апомиксиса, при котором цветки заменены луковичками или другими
образованиями, предназначенными для вегетативного размножения, которые часто
прорастают на растении (вивипария).
Однако широкая интерпретация термина «апомиксис» не выявляет различий
между формами репродукции на основе чередования поколений (гетерофазная
репродукция) и без чередования поколений (гомофазная репродукция).
Вероятно, поэтому Battaglia (1963) впервые предложил рассматривать понятие
апомиксис в его логически более точном и узком смысле, т.е. как процесс гетеро-
фазного воспроизведения, но без участия амфимиксиса. Соответственно, явления
спорофитной (адвентивной) эмбрионии, которое он относит к категории гомофаз-
ной репродукции, и вегетативное размножение исключает из понятия апомиксиса.
Позднее Хохлов (1967) также исключил вегетативное размножение из
апомиксиса, определив его как бесполосеменное размножение. Известный русский
исследователь Петров (1988) рассматривает апомиксис как бесполое
размножение, при этом относит к нему лишь те формы, которые сохраняют прямую связь с
образованием семян.
Asker (1980) и Nogler (1984) сделали следующий шаг в этом направлении,
выделив понятие«гаметофитный апомиксис». При гаметофитном апомиксисе
женский гаметофит как морфологическое образование существует, но обычно
происходит редукция мейоза и оплодотворения.
При гаметофитном апомиксисе возможны два пути образования женского
гаметофита — апоспория и диплоспория (см. Апоспория; Диплоспория). В литературе
чаще рассматривается развитие диплоидного гаметофита и диплоидных зародышей,
образующихся из клеток женского гаметофита. Диплоспория и апоспория позволяют
сохранить чередование поколений и в отсутствие чередования ядерных фаз.
При апоспории зародышевый мешок образуется посредством митоза из
соматических клеток нуцеллуса или халазы семязачатка. При диплоспории
женский гаметофит образуется непосредственно из археспория или «материнской»
клетки зародышевого мешка обычно без участия мейоза. Зародышевые мешки в
случае апоспории и диплоспории развиваются относительно нормально и клетки
женского гаметофита способны образовывать партеногенетические зародыши.
Таким образом, возникают два направления развития: диплоспория-пар-
теногенез и апоспория-партеногенез. Каждая из этих последовательностей
встречается в четко выраженной форме. У цветковых растений они могут присутст-
Термин соответствует английскому «sporophytic budding».
Семенное размножение
145
вовать и одновременно в тех случаях, когда развиваются и диплоспоровые и апос-
поровые зародышевые мешки.
Диплоспория и апоспория не полностью исключают мейоз и оплодотворение. В
исключительных случаях при апоспории и диплоспории происходит созревание
редуцированного зародышевого мешка, и оплодотворение может происходить как
редуцированных, так и нередуцированных яйцеклеток (Nogler, 1984).
Клетки синергид или антипод также могут образовывать диплоидные
партеногенетические зародыши, реже гаплоидные. Апогамное развитие зародышей
описано у ряда цветковых растений: из синергид — у Taraxacum, Hieracium,
Alchemilla, Alnus, Lilium и Роа и из антипод — у Hieracium, Elatostema и Allium
(Maheshwari, 1950; Nogler, 1984).
Таким образом, агамоспермное растение производит семена, в которых
зародыши или эмбриоиды образуются исключительно бесполым путем, но
иногда может давать потомство в результате полового процесса. В первом случае
имеет место облигатный, а во втором — факультативный апомиксис. Например, у
Hieracium aurantiacum в Карпатах (Польша) образуются жизнеспособные
семязачатки двух типов в одном соцветии. Некоторые семязачатки содержат
редуцированные зародышевые мешки, образовавшиеся в результате нормального мейоза,
тогда как другие содержат нередуцированные зародышевые мешки, возникшие в
результате апоспории. В последних зародыш и эндосперм развиваются автономно,
тогда как в первых им необходимо оплодотворение как предпосылка к дальнейшему
развитию. Вследствие этого в одном соцветии зародыши образуются как половым,
так и бесполым путем. Соотношение семянок с зародышами двух типов различно у
разных растений (Brow, Wilson, 1956).
При гаметофитном апомиксисе наблюдается образование нормального матрок-
линного потомства (обычно облигатный апомиксис), иногда аберрантного (в
случае факультативного апомиксиса). Существуют разнообразные способы развития
аберрантов (Asker, 1977; Kimber, Riley, 1977; Nogler, 1984).
Различные формы гаметофитного апомиксиса и сексуальность (половой
процесс), как совершенно справедливо отмечает Nogler (1984), не являются
альтернативными (в формальном смысле) и представляют собой независимые
способы образования нового спорофита, которые могут сосуществовать у одного
вида одновременно. Гаметофитный апомиксис не подавляет амфимиксис и не
приводит к полной утрате сексуальности, как предполагалось ранее. У всех
изученных апомиктов отмечена частичная гетерозиготность.
Кроме того, следует отметить, что растения с нормальным половым процессом
имеют потенциальные возможности образовать нередуцированный зародышевый
мешок, которые при определенных условиях могут стать реальными.
Скрещивание апомиктов возможно, поскольку почти все они образуют
определенное количество жизнеспособной пыльцы, т.е. при апомиксисе «...в принципе
существует возможность ограниченной рекомбинации генов и изменчивости,
следовательно, адаптивности в определенных пределах» (Nogler, 1984, р. 66).
Вероятно, прав Nogler, говоря о том, что у большинства растений половой
процесс и формирование женского гаметофита — это единый
(неразрывный) процесс, а у апомиктов эта связь, вероятно, разорвана, что и объясняет
«сложности» и своеобразие формирования партеногенетических (гаметофит-
ных) зародышей.
146
Системы репродукции
Nogler, отдавая дань широкому представлению о феномене агамоспермии как
о некоем«едином»процессе (осуществляемом посредством семян, но без слияния
гамет), использовал компромиссное понятие «семенной апомиксис» (=апо-
миксис), объединяющее процессы гаметофитного апомиксиса и адвентивной
(нуцеллярной) эмбрионии. По нашему мнению, соматические зародыши (эм-
бриоиды), образующиеся при адвентивной эмбрионии, нельзя объединять с га-
метофитными зародышами и включать их в одно понятие апомиксиса (семенного
апомиксиса), вследствие разного механизма их развития (гомофазная и гетеро-
фазная репродукция, соответственно), хотя они и развиваются в семени.
Вероятно, правы были Fagerlind, Stebbins, Battaglia, Grant и многие другие, которые,
рассматривая феномен апомиксиса, выделяли гаметофитный апомиксис, а
отдельные формы спорофитного апомиксиса (в том числе и нуцеллярную эмбрио-
нию) — в особый тип вегетативного размножения.
Кроме того, согласно логике рассуждений Nogler'a, в апомиксис
следовало бы включить явление монозиготической кливажной эмбрионии
(образование однояйцевых близнецов — двойней, тройней и т.д.), а также и интегу-
ментальную эмбрионию. Однако, по непонятным причинам, автор игнорирует
это явление, хотя оно также имеет место в семени и часто встречается у различных
видов цветковых (см. Webber, 1940; Maheshwari, 1950; Lakshmanan,
Ambegaokar, 1984).
Таким образом, в литературе нет единого мнения относительно емкости понятия
апомиксис. Большинство авторов в настоящее время чаще используют его в узком
смысле (гаметофитный апомиксис) или несколько шире (гаметофитный апомиксис
+ нуцеллярная эмбриония).
С нашей точки зрения, многие вышеуказанные противоречия, связанные с этой
проблемой, в частности, о роли различных форм эмбриоидогении (нуцеллярной,
интегументальной и монозиготической кливажной) в системах репродукции, могут
быть сняты благодаря рассмотрению в качестве новой категории вегетативного
размножения — эмбриоидогении (см. Эмбриоидогения — новый тип
вегетативного размножения). При гаметофитном апомиксисе и адвентивной эмбрионии
происходит клонирование материнского организма (из клеток одного и того же
семязачатка) и образование матроклинного потомства. В первом случае,
клонирование осуществляется посредством партеногенетических зародышей из яйцеклетки,
синергид, антипод, центральной клетки (обычно без участия процесса
оплодотворения), а во втором — в результате формирования нуцеллярных и интегументаль-
ных эмбриоидов. При монозиготической кливажной эмбрионии происходит
клонирование нового, дочернего организма и образование также матроклинного
потомства, но обычно другого генотипа.
Грант, 1984; Левина, 1961,1981; Петров, 1979,1988; Поддубная-Арнольди, 1976; Хохлов, 1967;
Asker, 1977,1980; Battaglia, 1963; Brow, Wilson, 1956; Crane, 1989; Czapik, 1996; Fackholm, 1922;
Fagerlind, 1940; Grant, 1981; Gustafsson, 1946-1947; Haacke, 1893a,b; Kimber, Riley, 1977;
Lakshmanan, Ambegaokar, 1984; Maire, 1900; Maheshwari, 1950; Nogler, 1984; Pijl van der, 1972;
Stebbins, 1941; Webber, 1940; Winkler, 1908, 1934.
АПОСПОРИЯ (греч. apo- без, spora- семя) — формирование диплоидного
зародышевого мешка не из мегаспоры, а из клетки нуцеллуса посредством митоза. Синонимы:
I Семенное размножение 147
соматическая апоспория, соматическая эвапоспория, эвапоспория, апомеиотическая
спория. Термин был впервые введен Bower (1885) для папоротников.
Апоспория описана у разных в систематическом отношении групп цветковых
растений (Хохлов и др., 1978; Zhou- Zhi Qin et al., 1995; Carman, 1997). Наиболее
широко это явление распространено у представителей таких семейств, как Asteraceae,
Роасеае и Rosaceae. В целом ряде других семейств (Adoxaceae, Boraginaceae,
Brassicaceae, Chenopodiaceae, Cyr'dlaceae, Cucurbitaceae, Globulariaceae, Myrtaceae,
Ochnaceae, Orchidaceae, Polygonaceae, Ranunculaceae, Rutaceae, Taccaceae,
Urticaceae) апоспория отмечается спорадически у отдельных видов.
Систематические, цитогенетические и цитоэмбриологические исследования,
проведенные на популяционном уровне, свидетельствуют об образовании апо-
миктичными видами агамных комплексов. Для агамных комплексов характерны
такие явления, как апомиксис, гибридизация и полиплоидия. Агамный комплекс,
по определению Stebbins (1950), включает в себя группы близких видов,
произрастающих в тесном контакте друг с другом. По мнению других авторов, агамный
комплекс состоит лишь из одного, очень полиморфного вида, где присутствуют
особи с различной плоидностью: диплоиды, тетраплоиды, полиплоиды, а также
возможны триплоиды и анеуплоиды (Norrmann et al., 1989; Asker, Jerling, 1992).
Цито-эмбриологические и молекулярно-генетические исследования семенной
репродукции в агамных комплексах позволили выдвинуть гипотезы о
существовании определенных репродуктивных циклов, включающих чередование способов
репродукции (амфимиксис, апомиксис) и уровней плоидности в поколениях.
Одна из гипотез предполагает такое чередование в поколениях, как диплоид-те-
траплоид-дигаплоид ( Wet de, Harlan, 1970; Valle do et al., 1989), а другая —
диплоид-тетраплоид-диплоид (Hanna, Burton,1986). Обе эти гипотезы
предполагают существование в популяциях облигатных диплоидов, формирование семян
которых определяют процессы мейоза и двойного оплодотворения. Однако в
последнее время показано отсутствие в природных популяциях Panicum,
Ranunculus и Paspalum представителей, которые могли бы быть
охарактеризованы как облигатные половые диплоиды. В процессе эволюции облигатные
половые диплоиды возможно вымирают, и теоретически репродуктивный цикл в
агамных комплексах может быть представлен как чередование в поколениях: дигапло-
ид-тетраплоид-дигаплоид (Naumova, Wagenwoort, 1998). Отсутствие половых
диплоидов должно быть учтено при проведении генетико- селекционных работ,
которые затруднены из-за присутствия апомиксиса (Carman, Hatch, 1982;
Hanna, Burton, 1986; Burson,1989; Nakagawa, 1990, 1993; Nakagawa, Hanna,
1992; Sherwood et al., 1994). Дигаплоиды и тетраплоиды в агамных комплексах
являются, как правило, факультативными апомиктами, доля апомиксиса
(апоспории) у которых непостоянна, причем с повышением плоидности возрастает доля
апомиктов в потомстве. Однако вопрос о существовании в природе облигатных
апомиктов (Cenchrus glaucus — Shanthamma, 1982; Schizachyrium sanguinemum
var. brevipedicillatum — Carman, Hatch, 1982) остается открытым, так как часто
при более тщательных исследованиях удается обнаружить у них и половой
процесс, что свидетельствует о факультативном характере апомиксиса.
Положительное значение апомиксиса в эволюции апомиктичных цветковых было выявлено
при цитоэмбриологических и молекулярно-генетических исследованиях агамных
комплексов на примере родов Роа и Panicum (Assienan, Noirot, 1995; Mazuccato
ы репродукции
etal., 1995,1997). Показано, что апомиксис не ведет к уменьшению
внутривидового разнообразия, а, наоборот, увеличивает адаптационные и эволюционные
возможности факультативных апомиктов.
Апоспория цитологически может быть обнаружена на ранних этапах развития
семязачатка от подготовки мегаспороцита к мейозу до формирования тетрад
мегаспор. В большинстве случаев в нуцеллусе параллельно происходят два процесса:
дифференциация мегаспороцитов с последующим вступлением их в мейоз и
дифференциация инициальных клеток апоспорических зародышевых мешков. В одном
семязачатке инициальные клетки могут соседствовать с мегаспороцитом либо с
мегаспорами, образовавшимися после завершения мегаспорогенеза. Часто наиболее
конкурентноспособными оказываются апоспорические зародышевые мешки. В
некоторых семязачатках имеет место нормальный мейоз с последующим
образованием зародышевых мешков, клетки которых имеют гаплоидный набор хромосом.
Первоначально в нуцеллусе выявляются одна-две инициальные клетки. Число их
возрастает по мере развития семязачатка, однако репродуктивные потенции
большинства из них остаются нереализованными и зародышевые мешки формируются лишь из
тех инициалей, которые дифференцировались раньше других. Положение апоспоро-
вых инициалей в семязачатке не является строго определенным, но тем не менее они не
могут быть субэпидермальными (Chen, Kozono, 1994a; Naumova, Willemse, 1995).
Эффект положения имеет большое значение, и зародышевый мешок, наиболее близко
расположенный к микропиле, имеет значительно больше шансов к дальнейшему
развитию (Chen, Kozono, 1994a). В процессе дифференциации инициальных клеток
апоспорических зародышевых мешков происходят определенные
структурно-функциональные преобразования (см. Ультраструктурные аспекты апомиксиса).
Описаны два основных типа развития апоспорических зародышевых мешков —
Panicum и Hieracium (Rutishauser, 1969). Существуют и переходные вариации.
Число митозов в инициальной клетке, приводящих к образованию зародышевого
мешка, а также число ядер, клеток и характер их расположения в сформированном
зародышевом мешке являются основными критериями выделения этих типов.
Hieracium-тип развития зародышевого мешка характеризуется тем, что ядро
инициальной клетки претерпевает три митотических деления без образования
клеточных оболочек. В результате этих делений образуются три клетки яйцевого
аппарата, центральная клетка с двумя полярными ядрами и три клетки-антиподы.
Сформированный зародышевый мешок Hieracium-типа является биполярным, се-
миклеточным и морфологически сходен с мейотическим зародышевым мешком
Polygonum-типа. Hieracium-тип апоспорического зародышевого мешка был
впервые описан у Hieracium subg. Pilosella.
Panicum-тип развития зародышевого мешка формируется в результате лишь
двух последовательных митотических делений инициальной клетки.
Сформированный зародышевый мешок монополярный, имеет яйцевой аппарат,
представленный яйцеклеткой и двумя синергидами либо яйцеклеткой и одной синергидой, а
также центральную клетку с одним либо с двумя полярными ядрами. Антиподы
отсутствуют. Впервые описан у Panicum maximum.
При Hieracium- и Panicum-типах развития зародышевого мешка все ядра
диплоидны и генетически идентичны между собой. В частности, у Pennisetum ciliare
содержание ДНК в ядрах клеток зародышевого мешка Panicum-типа,
определенное цитометрически по Фельген-реакции, составляет 2С (Sherwood, 1995).
Рис. 11. Апоспория.
1-10 — апоспория у Brachiaria dccumbans): l — семязачаток с двумя сформированными апоспорическими
зародышевыми мешками Panicum-типа, 2 — ссрормированный апоспорическнй зародышевый мешок Panicum-типа,
в микропилярной области отчетливо видны яйцеклетка и контуры одной из сипергид, антиподы отсутствуют,
3 — семязачаток с апоспорическим зародышевым мешком и инициальной клеткой апоспорического
зародышевого мешка, 4 — микропилярпая часть апоспорического зародышевого мешка с яйцевым аппаратом, состоящим
из яйцеклетки и двух сипергид, в центральной клетке одно полярное ядро, 5 — инициальная клетка
апоспорического зародышевого мешка в ткани пупеллуса,
Рис. 11 (продолжение).
6 — апоспорический зародышевый мешок, в центре видно многоядрышковое полярное ядро, 7 — апоспориче-
ский зародышевый мешок с клетками яйцевого аппарата и ядрами эндосперма, 8 — яйцеклетка апоспорическо-
го зародышевого мешка перед делением, приводящим к образованию партепогенетического зародыша, 9 —
многоядрышковое полярное ядро (фрагмент апоспорического зародышевого мешка, показанного на рис. 6),
10 — многоклеточный партеногенетический зародыш, находящийся в апоспорическом зародышевом мешке,
эндосперм отсутствует; а з м — апоспорический зародышевый мешок, а и — инициальная клетка
апоспорического зародышевого мешка, п з — партеногенетический зародыш, п я — полярные ядра, эн — эндосперм, я —
яйцеклетка, я а — яйцевой аппарат; 1,3 - х 700, 2,6,7,10 - х 800, 4,5,8,9 - х 1600,
По: Naumova, Wagenvoort, 1998.
Семенное размножение
151
Диплоидная яйцеклетка апоспорических зародышевых мешков по
ультраструктуре не отличается от гаплоидной (см. Ультраструктурные аспекты апомиксиса).
Это подтверждается существованием триплоидов в природе, возможностью их
получения в результате селекции (Hanna, Burton, 1986). Как было показано на
злаках (Мирошниченко, 1964; 1978; Matzk, 1991; Naumova et al., 1993), яйцеклетка
обладает способностью к образованию зародыша без оплодотворения. Причем,
формирование такого зародыша часто начинается до цветения, но является ли
проникновение пыльцевой трубки в семязачаток стимулом к развитию партеногенети-
ческого зародыша, остается неясным.
Характер развития эндосперма в апоспорических зародышевых мешках, как и
способность формирования жизнеспособных семян при апоспории исследованы
очень слабо. С помощью метода проточной цитофотометрии было показано
образование пентаплоидного эндосперма (Naumova et al., 1993). Такой эндосперм
мог возникнуть лишь при оплодотворении диплоидных полярных ядер
гаплоидным спермием (2n+2n+n).
В последнее время продолжают разрабатываться методы скрининга апоспории у
цветковых растений: молекулярно-генетические (поиск молекулярных маркеров),
цитофотометрические (определение плоидности генеративных структур),
гистохимические (реакция на каллозу), а также классические эмбриологические методы с
применением световой и трансмиссионной электронной микроскопии (Lubbers et al.,
1994; Luts et al., 1994; Ozias-Akins et al., 1994; Naumova, 1997). Для получения
количественных показателей апоспории у потомства при генетико-селекционых и цито-
генетических исследованиях на популяционном уровне может быть рекомендовано
исследование просветленных препаратов семязачатков с Panicum-типом
зародышевого мешка методом фазово-контрастной микроскопии (Cruz et al., 1989; Naumova,
Wagenvoort, 1998). Рис. И.
Мирошниченко, 1964, 1978; Хохлов и др., 1978; Asker, Jerling, 1992; Assienan, Noirot, 1995;
Burson,1989; Carman, 1997; Carman, Hatch, 1982;Cruz et al., 1989; Hanna, Burton, 1986;
Lubbers et al., 1994; Luts et al., 1994; Matzk et al., 1991; Mazuccato et al., 1995,1997; Nakagawa,
1990, 1993; Nakagawa, Hanna, 1992; Naumova, 1993, 1997; Naumova, Wagenvoort. 1998;
Naumova, Willemse, 1995; Naumova et al., 1993; Norrmann et al., 1989; Ozias-Akins et al., 1994;
Rutishauser, 1969; Shanthamma, 1982; Sherwood, 1995; Sherwood et al., 1994; Stebbins, 1950;
Valle do et al., 1989; Wet de , Harlan, 1970; Zhou-Zhi Qin et al., 1995.
ДИПЛОСПОРИЯ (греч. diplos — двойной, spora— семя) — формирование
зародышевого мешка из нередуцированного мегаспороцита или диплоидной мегаспоры
вследствие аномального мейоза либо полной замены его на митоз. Синоним:
генеративная апоспория.
Впервые диплоспорию описал Gustafsson (1939) и позднее включил в
классификацию апомиксиса Fagerlind (1940). Выделены несколько типов
аномальных мейотических делений: апогомотипное, семигетеротипное, псевдого-
мотипное и митотическое (Fagerlind, 1940; Battaglia, 1963; Солнцева, 1969;
Longly, 1984; Solntzeva, 1989).
При семигетеротипном делении (представители сем. Asteraceae) в отличие
от нормального мейоза (Схема, А) аномалии наблюдаются в профазе
редукционного деления мейоза. Нормального образования пар хромосом не происходит
152
Системы репродукции.
(асиндезис), униваленты не смещаются к полюсам, а остаются в центре клетки,
метафазная пластинка также не образуется. В анафазе встречается много
отставших хромосом и ядерная оболочка закладывается таким образом, что
включает весь хромосомный набор в одно диплоидное реституционное ядро, которое
сначала имеет гантелевидную форму, а затем округляется. Оно вступает во
второе деление мейоза, которое проходит нормально и завершается образованием
клеточной стенки и диады диплоидных «мегаспор». Одна из «мегаспор» даёт
начало зародышевому мешку Taraxacum-типа (Схема, Б).
Псевдогомотипный тип деления мегаспороцита, описанный Gustafsson
(1946), встречается у представителей сем. Asteraceae наряду с семигетеро-
типным. При этом типе деления хромосомы (униваленты) концентрируются в
центре клетки, образуют хроматиды, которые затем расходятся к полюсам.
Деление завершается образованием диады клеток с диплоидными ядрами.
Подобный тип был описан Jongedjik ( 1985, 1991) у аберрантной диплоидной
линии Solanum tuberosum. Следует отметить, что некоторые авторы
(Rutishauser, 1967) ставили под сомнение существование псевдогомотипного
типа деления мегаспороцита.
При апогомотипном делении мегаспороцит вступает в профазу мейоза I, при
этом имеет место асиндезис, способствующий образованию реституционного ядра,
которое вступает во второе деление мейоза. Это деление проходит без клеткообра-
зования, и два возникших диплоидных ядра в результате трех последовательных
митотических делений образуют зародышевый мешок Ixeris- типа (Схема, В).
Митотическое деление мегаспороцита (митотическая диплоспория) сходно с
обычным митозом по способу деления ядра, но ядро мегаспороцита, вступающее в
это деление, является реституционным, с диплоидным набором хромосом. В
результате первого и последующих митозов формируется диплоспорический
зародышевый мешок Antennaria-типа (Схема, Г).
Кроме описанных выше типов аномальных делений мейоза существует
множество других вариаций. Все большее число исследователей приходят к
мысли о том, что разница между описанными типами не столь велика, а
выделение их можно считать формальным (Nogler, 1984). Автор указывает,
что определенное их сближение можно наблюдать у целого ряда
сложноцветных (Antennaria, Eupatorium, Taraxacum). К аналогичному
заключению пришли также другие исследователи (Izmailov, 1986; Czapik, 1996),
изучающие диплоспорию у представителей сем. Rosaceae и некоторых
других семейств цветковых растений, которые характеризуются наличием
многоклеточного археспория. В этих случаях практически стираются границы не
только между характером делений, но и между способами развития апомик-
тического зародышевого мешка (см. Апоспория).
Одним из характерных признаков мегаспороцита при диплоспории является
отсутствие вокруг него каллозной оболочки (см. также Ультраструктурные
аспекты апомиксиса). В то же время у мегаспороцитов, претерпевающих
нормальный мейоз, каллозная оболочка формируется. Это явление обнаружено у
ряда видов из родов Elymus и Tripsacum, у которых диплоидные формы были
половыми, а тетраплоидные, гексаплоидные — диплоспорическими (Crane,
Carman, 1987; Carman et al., 1991; Leblanc et al., 1995b). Тест на каллозу может
быть использован для поиска диплоспории у цветковых.
Схема. Мейоз и мегаспорогенез в норме и при диплоспории.
^ (ы\ (©"
^
W
А
W
ИИ
V2/
«ft I
®
W
/
Г\
®
W
ГТ\
W
в
А — нормальный мейоз и мегаспорогенез; Б — семигетеротипное деление и образование двух клеток с
реституционными ядрами, из халазальной клетки формируется зародышевый мешок Taraxacum-типа; В —
апогомотипное деление и образование двуядерной клетки с реституционными ядрами, из которой
образуется зародышевый мешок Ixeris-типа; Г — замена мейоза митозом с последующим формированием
зародышевого мешка Antennaria-типа. По: Fagerlind (1944) с модификацией Nogler (1984).
154
Системы репродукции
Развитие диплоспорических зародышевых мешков укладывается в несколько
типов. Первоначально были описаны Taraxacum-, Antennaria- и Ixeris-типы
(Gustafsson, 1946; Battaglia, 1963; Солнцева, 1969; Nogler, 1984). Различия
между типами касаются числа митотических делений, распределения и плоидности ядер
в пределах одного зародышевого мешка. Диплоспорические зародышевые мешки
обычно являются диплоидными, но могут быть анеуплоидными или тетраплоидны-
ми (Solntzeva, 1989).
Зародышевый мешок Taraxacum-типа — биполярный, восьмиядерный, семи-
клеточный; возникает из микропилярной клетки диады, образовавшейся в
результате семигетеротипного деления. Ядро этой клетки претерпевает три
митотических деления. Сформированный зародышевый мешок имеет трехклеточный
яйцевой аппарат, состоящий из яйцеклетки и двух синергид, центральную клетку с
двумя полярными ядрами и три антиподальные клетки. Все ядра зародышевого
мешка являются диплоидными. Зародышевый мешок Taraxacum-типа встречается
в ряде родов семейств Asteraceae, Brassicaceae (Arabis), Poaceae (Agropyron,
Paspalum) (Asker, Jerling, 1992).
Зародышевый мешок Antennaria-типа — биполярный, восьмиядерный, семи-
клеточный, формируется из мегаспороцита с реституционным ядром, которое
претерпевает три последовательных деления митоза (например у Роа palustris и Р.
nemoralis — Жиров, 1967, 1969; Osadchiy, Naumova, 1996). Antennaria-тип,
подобно Taraxacum- и Ixeris-типам зародышевых мешков, морфологически
неотличимы от гаплоидного Polygonum-типа зародышевого мешка, характерного для
подавляющего большинства цветковых растений.
Зародышевый мешок Ixeris-типа — биполярный, восьмиядерный, семикле-
точный, развивается из двуядерной клетки, образовавшейся в результате апого-
мотипного деления; в дальнейшем ядра этой клетки претерпевают два
митотических деления. Сформированный зародышевый мешок имеет трехклеточный
яйцевой аппарат, центральную клетку с двумя полярными ядрами и три антиподы.
Ixeris-тип зародышевого мешка описан в роде Ixeris а также у Statice olealifolia и у
некоторых других представителей Asteraceae. Некоторые авторы не считают
существенными различия между Ixeris- и Taraxacum-типами и склонны рассматривать
их как единый Taraxacum-тип (Nogler, 1984).
Описаны также дополнительные типы образования диплоспорических
зародышевых мешков: Rudbeckia, Oxyria, Potentilla и др. (Crane, 1989; Solntzeva, 1989).
Диплоспория достаточно широко распространена среди цветковых растений
(Allium, Antennaria, Artemisia, Cucumis, Elymus, Hieracium, Ixeris, Paeonia, Poa,
Potentilla, Rubus, Rudbeckia, Sorbus, Sorghum, Taraxacum, Tripsacum,
Zephyranthes) (Хохлов и др., 1978; Carman, 1997; Шамров, 1997а). У некоторых
из указанных родов, наряду с диплоспорией, обнаружена и апоспория.
Диплоспория отмечена у некоторых экономически важных видов: Manihot esculenta и
Sorghum bicolor (Wu-ShuBiao et al., 1994; Ogburia, Adachi, 1996).
Причины возникновения диплоспории, как и факторы ее контролирующие,
остаются неясными. Существует несколько точек зрения, основанных на
генетических и цитоэмбриологических исследованиях. Модель генетической регуляции
диплоспории на примере Taraxacum была предложена Mogie (1988,1992). Согласно
этой гипотезе, контроль мейоза осуществляется только одним локусом хромосомы,
где аллель дикого типа контролирует мейотическую редукцию, в то время, как ее
Рис. 12 (продолжение).
5, 7, 8 — фрагменты цитоплазмы одноядерного диплоспорического зародышевого мешка, видны
мультимембранная структура (5), развитый ЭР (7), многочисленные пластиды и митохондрии,
находящиеся вблизи ядра, и цистерны ЭР, контактирующие с ядерной мембраной (8); м — мегаспо-
роцит, м с — мультиламеллярная структура, одзм — одноядерный диплоспорический
зародышевый мешок, п — пластида, эр — эндоплазматический ретикулум, я — ядро, яд — ядрышко;
1,2 - х 680, 3-х 340, 4,6 - х 5500, 5,7,8 - х 30000.
По: Naumova et al., 1999.
Семенное размножение
157
дополнительные копии мутантного апомиктического гена контролируют амейоти-
ческие процессы, приводящие к формированию нередуцированных яйцеклеток.
Доминантные отношения между аллелями определяются их соотношением и
внешними факторами.
Генетическая регуляция диплоспории исследовалась также на примере
представителей родов Ame.lana.zr, Beta, Potentilla и некоторых гибридов (Asker,
1979; Nogler, 1986; Jassem, 1990; Rieger et al., 1993; Peel et al., 1997). При этом
только ядерные гены рассматривались в качестве возможных генетических
регуляторов апомиксиса, роль цитоплазматического фактора не обсуждалась. Этот
вопрос представляет особый интерес в связи с тем, что диплоспория наследуется,
но это наследование не подчиняется законам Менделя. Предполагается, что
полифункциональность митохондрий, а также пластид как носителей собственной
ДНК и канонических генов может играть в этом процессе существенную роль
(Birky, 1991, 1994). Вопрос о роли цитоплазмы рассмотрен лишь в нескольких
работах. Авторами (Maccklintock, 1956; Жакоб, Вольман, 1962; Жиров, 1967,
1969; Жиров, Шевцова, 1970) на основании экспериментальных исследований
представителей рода Роа, была выдвинута гипотеза контролирующих факторов.
К аналогичному заключению о значимости цитоплазматического фактора
пришли другие авторы, наблюдавшие утрату апомиксиса у апомиктичных растений,
выращиваемых в культуре тканей (Lehnhardt, Nitzsche, 1988). Они считают, что
плазмиды или генетический материал клеточных органелл может влиять на
экспрессию апомиксиса. Цитологические и генетические аспекты диплоспории
интенсивно обсуждаются (Наппа et al., 1991; Burson, 1994; Carman, 1997). Тем не
менее вплоть до настоящего времени регуляторные механизмы диплоспории и
апомиксиса остаются неизученными.
Количественные данные о встречаемости диплоспории, развитии партеноге-
нетического зародыша и формировании жизнеспособных семян в пределах вида,
вариации или сорта весьма ограничены. Практически лишь для одного
диплоспорического вида Allium tuberosum показано количественное соотношение
диплоспории, партеногенеза и образования апомиктичных семян, которое
соответственно составляло: 98% , 94% и 98% (Kojima, Nagato, 1997). Эти данные, а также
исследования гибридов, возникающих при скрещиваниях растений с половым и
апомиктическим способами воспроизведения (Наппа, Burton, 1986; Kindiger,
Dewald, 1994; Leblanc et. al., 1995a; Kindiger et al., 1996; Peel et al., 1997)
представляют интерес для познания генетических механизмов регуляции диплоспории
и апомиксиса. Рис. 12.
Грант, 1984; Жакоб, Вольман, 1962; Жиров, 1967,1969; Жиров, Шевцова, 1970; Модилевский,
1948; Петров, 1964; Солнцева, 1969; Хохлов, 1958; Хохлов и др., 1978; Asker, 1979; Asker,
Jerling, 1992; Battaglia, 1963; Birky, 1991, 1994; Burson, 1994; Carman, 1997 Carman et al, 1991;
Crane, 1989; Crane, Carman, 1987; Czapik, 1996; Fagerlind, 1940; Gustafsson, 1939, 1946-1947;
Hanna et al., 1991; Hanna, Barton, 1986; Izmailov, 1986; Jassem, 1990; Jongedijk, 1985, 1991;
Kindiger, Dewald, 1994; Kindiger et. al., 1996; Kojima, Nagato, 1992 a, b; 1997; Leblanc et al.,
1995a,b; Lehnhardt, Nitzsche, 1988; Longly, 1984; Macklintock, 1956; Mogie, 1988,1992; Naumova,
1993, 1997; Nogler, 1984; Ogburia, Adachi, 1996; Osadchiy, Naumova, 1996; Peel et al.,1997;
Rhoades M.M. , 1933; Rieger et al., 1993; Rutishauser, 1967; Solntzeva, 1989; Stebbins, 1941, 1950;
Wu-ShuBiaoetal.,1994.
158
Системы репродукции
ПАРТЕНОГЕНЕЗ (греч. parthenos — девственница, genus — происхождение) —
развитие зародыша без оплодотворения. Термин предложил Owen (1849). По
существу такая формулировка принимается всеми эмбриологами, хотя имеются
некоторые специфические особенности, характерные для партеногенеза у животных
(Ригер, Михаэлис, 1967; Токин, 1987) и растений (Maheshwari, 1950;
Поддубная-Арнольди, 1976; Банникова, Хведынич, 1982; Nogler, 1984). Это
связано с хромосомным определением пола у животных, двойным
оплодотворением у растений. Что касается растений, то у них партеногенез подразделяется на
редуцированный и нередуцированный. В первом случае зародыш имеет гаплоидное
число хромосом, во втором — диплоидное или полиплоидное (как результат апо-
мейоза). Ниже приведены синонимы, которые употреблялись с начала 20-го века
(Поддубная-Арнольди, 1976).
Нередуцированный партеногенез— партеноапогамия, овоапогамия,
соматический партеногенез, зигофатический партеногенез, диплоидный партеногенез,
гениальная апоспория, зигоидный партеногенез, диплопартеногенез, диплоспория с
последующим партеногенезом, генеративная апоспория, апоспоровая и апоархес-
поровая апозиготия, анеуспория.
Редуцированный партеногенез— генеративный партеногенез, гамофатиче-
ский партеногенез, истинный партеногенез, гаплоидный апозиготный
партеногенез, гаплопартеногенез, эуспория, споровая апозиготия.
Нередуцированный партеногенез у покрытосемянных растений впервые
описал Juel (1898), редуцированный — Goldschmidt (1912) и Kusano (1915). В
дальнейшем обе формы партеногенеза были обнаружены у нескольких сотен
видов из разных семейств.
К настоящему времени выявлены многие эмбриологические и генетические
причины, ведущие к редуцированному и нередуцированному партеногенезу
(Поддубная-Арнольди, 1976; Тырнов, 1976 а,б; Nogler, 1984; Петров, 1988;
Tyrnov, 1992).
На первый взгляд явление партеногенеза кажется достаточно простым. Однако
возникает много вопросов в связи с: а) неоднозначностью трактовок ряда понятий;
б) новыми фактическими данными; в) выявлением общих закономерностей в
разнородных явлениях; г) отсутствием ясного понимания эволюционных и генети-
ко-селекционных последствий партеногенеза. От их решения зависят генетические
и биотехнологические подходы к экспериментальному получению партеногенеза.
Все это не имеет полного отражения в существующих классификациях и
используемой терминологии.
Прежде всего, необходимо решить вопрос о том, что в определении
партеногенеза является главным — «развитие без оплодотворения» или «развитие без
оплодотворения яйцеклетки». Первоначально термин партеногенез использовался по
отношению к животным. Поскольку у них нет других, кроме яйцеклеток, женских
инициалей, основная смысловая нагрузка термина партеногенеза заключалась
именно в «развитии без оплодотворения». Механическое перенесение термина на
растения сместило акценты и породило определённые терминологические
проблемы. У растений помимо яйцеклетки зародышевый мешок содержит другие клетки
(синергиды, антиподы), которые предположительно также могут давать зароды-
Семенное размножение 159
ши без оплодотворения. Не исключена возможность возникновения зародыша
даже из клеток эндосперма (Джори, Амбегаокар, 1990).
Исходя из этого под партеногенезом следовало бы понимать развитие
зародыша без оплодотворения не только из яйцеклеток, но и из любых клеток
зародышевого мешка. Возможно, это так и воспринимается некоторыми исследователями.
Например, говорится о «партеногенетическом развитии полярных ядер» (Nogler,
1984), «партеногенетическом развитии синергид» (Лакшманан, Амбегаокар,
1990). Однако для случаев развития зародышей не из яйцеклеток, а из других
клеток зародышевого мешка чаще всего используется термин апогаметия
(Поддубная-Арнольди, 1976; Czapik, 1997,1998).
Введение дополнительного термина, выделяющего одну сторону проблемы,
требует ответа, по крайне мере, на два существенных вопроса: 1) насколько
точно и однозначно термин апогаметия отражает существо явления? 2) является ли
апогаметия одной из форм партеногенеза или партеногенез и апогаметия —
самостоятельные явления. Ответ на второй вопрос будет дан в конце статьи.
Ответ на первый вопрос однозначно положительным быть не может, если учесть
следующие моменты:
1) синергиды и антиподы, не выполняющие свои типичные функции и ведущие
себя как яйцеклетки, не могут считаться, по крайней мере функционально, си-
нергидами или антиподами;
2) известно большое число фактов, касающихся слабой дифференциации клеток
яйцевого аппарата и встречаемости так называемых яйцеклетко-подобных
синергид; встречаются также зародышевые мешки с почти морфологически
идентичными яйцевым аппаратом и антиподами (Герасимова-Навашина, Батыгина,
1959;Е налеева, 1979). Следовательно, термин «апогаметия» нельзя признать
удачным. Такая оценка следует из работ других ученых (см. Классификация
апомиксиса). Некоторые из них считают этот термин вообще излишним
(Nogler, 1984). Последняя точка зрения, видимо, пока недостаточно
оправдана. Общеизвестна эпигенетическая изменчивость специализированных клеток.
У них возможна даже потеря части генетического материала, ставшего
избыточным в связи с сужением функций. Поэтому дедифференциация (или иное
направление дифференциации) может привести к определенным генетическим
последствиям. Следовательно, потенциально возможный не совсем типичный
ход гаметогенеза должен найти отражение в терминологии. Кроме того,
необходима проверка того, действительно ли невозможна дедифференциация
типичных синергид и антипод (например, при некоторых экспериментальных
воздействиях и в культуре in vitro). Полагаем, что в случаях, когда некоторые
клетки зародышевого мешка ведут себя функционально как яйцеклетки, но по
каким-либо признакам (топография, морфология и др.) имеют сходство с
какими-то другими клетками, для их обозначения более подходит,
применяемый для животных, термин гаметоиды (гаметоиды — структуры, которые
ведут себя как гаметы) (Ригер, Михаэлис, 1967). Следовательно, можно
говорить о гаметоидном партеногенезе. Если же переходят к эмбриогенезу
клетки в чем-то сходные с синергидами или антиподами или находящиеся на их
типичном месте, то это может быть отражено как дополнительная
характеристика (например: гаметоидный синергидный партеногенез). При этом
подразумевается не непосредственное возникновение зародыша из синергиды, что
160
Системы репродукции
и
действительно следовало бы считать апогаметией, а лишь то, что клетка,
которая могла бы стать синергидой, ведет себя как гамета.
Второй круг вопросов связан с так называемым«девственным»развитием. К
категории партеногенеза иногда относят явления, которые можно характеризовать
как результат «незавершенного», «нетипичного», «не полностью реализованного»
полового процесса. Они могут быть связаны с гиногенезом, андрогенезом in vivo
(мужской партеногенез), гемигамией (семигамией).
Гиногенез — развитие зародыша, при котором мужская гамета проникает в
яйцеклетку, активирует ее к морфогенезу, но в дальнейшем развитии не участвует или
участвует в незначительной степени (Ригер, Михаэлис, 1967). Иногда между
партеногенезом и гиногенезом практически ставится знак равенства и гиногенез
считается «женским партеногенезом» (Поддубная-Арнольди, 1976; Банникова, Хве-
дынич, 1982).
Вместе с тем, эффекты, наблюдаемые при гиногенезе, могут существенно
отличаться от таковых, возникающих при действительно девственном размножении,
когда развитие зародыша происходит без какого-либо участия мужских гамет. Это
связано с тем, что при проникновении спермия в яйцеклетку в нее могут вноситься
внехромосомный хроматин, цитоплазматические автодуплицирующиеся частицы,
органеллы (Ригер, Михаэлис, 1967). Мужская гамета может быть источником
дезорганизованного ядерного хроматина, а следовательно ДНК и РНК.
Общеизвестно, что экзогенные нуклеиновые кислоты вызывают мутагенные,
трансформационные и другие генетические эффекты, а с органеллами связано ци-
топлазматическое наследование ряда важнейших признаков. Следовательно,
гиногенез потенциально может вести к значительным генетическим, эволюционным и
селекционным последствиям.
В последнее время гиногенезом иногда называют явление возникновения
растений в культуре in vitro из неоплодотворенных завязей и семязачатков. По нашему
мнению, это совершенно недопустимо, даже если принять во внимание только
определение сущности термина «гиногенез». Вероятно, более приемлемым термином
мог бы быть«партеногенез in vitro. Но в ряде случаев гиногенез in vitro
действительно может иметь место. Например, известны опыты по получению гаплоидов, в
которых сначала проводилось опыление пыльцой, облученной большими дозами, а
затем культивирование изолированных завязей (Raquin, 1985). Это лишний раз
подтверждает недопустимость смешения понятий.
При андрогенезе ( мужском партеногенезе) ядро спермия замещает ядро
яйцеклетки. Ее собственное ядро не функционирует и в дальнейшем каким-то образом
полностью элиминируется (Тырнов, 1986).
Следовательно, с партеногенезом это явление объединяет лишь то, что зародыш
развивается из яйцеклетки, и полного (истинного) оплодотворения не происходит.
Однако, тем не менее, о «девственности» здесь вообще не может быть речи.
Степень участия гамет в оплодотворении здесь намного выше, чем при гиногенезе. При
мужском партеногенезе возникают особи, имеющие ядро отцовской формы и
материнскую цитоплазму, которые называют ядерно-цитоплазматическими гибридами,
или аллоплазматическими формами. Это доказано при использовании линий с
различными типами ЦМС (Тырнов, 1986). Известно также, что цитоплазма может
оказывать влияние на многие важнейшие признаки: иммунитет, длину
вегетационного периода, продуктивность, устойчивость к различным биотическим и абиоти-
Семенное размножение
161
ческим факторам и др. Следовательно, по своим генетическим, эволюционным и
селекционным последствиям мужской партеногенез может существенно
отличаться от женского партеногенеза. Но может быть и такая ситуация, когда мужские и
женские партеногенетические особи будут идентичными, например при их
возникновении после самоопыления гомозиготных (чистых) линий. Вместе с тем
нарушение девственности обусловлено не только самим фактом оплодотворения и
влиянием цитоплазмы матери. Установлено, что андрогенные растения и их потомство
могут нести отдельные ядерные признаки материнской формы. Предполагается, что
это может быть результатом влияния дезинтегрированной ДНК яйцеклетки.
Такое явление обнаружено у кукурузы (Тырнов, 1986).
При гемигамии (семигамии) (см. Гемигамия, Т.2) отмечены следующие
варианты ее проявления: 1) ядро спермия проникает в яйцеклетку, однако само не
делится; 2) ядра яйцеклетки и спермия делятся одновременно с образованием
клеточных стенок или без них.
Последствия проникновения спермия в яйцеклетку уже рассмотрены выше.
Вместе с тем, при гемигамии наблюдаются дополнительные явления: могут
возникнуть химерные зародыши, ткани которых имеют клетки материнского,
отцовского и гибридного типов. Происхождение последних связано со слиянием на
ранних стадиях эмбриогенеза ядер материнской и отцовской форм. У хлопчатника
(Turcotte, Feaster, 1973,1974) и кукурузы (Тырнов, 1986) были найдены линии,
дающие с повышенной частотой андрогенные растения и растения, имеющие
химерные ткани отцовского и материнского типа. Их происхождение, вероятнее
всего, также связано с гемигамией.
Андрогенно-матроклинные двойни, а также андрогенные и матроклинные
проростки в сочетании с гибридами мы встречали у кукурузы. Данное явление
характерно для партеногенетических линий (Тырнов, 1986). Матроклинно-андро-
генные двойни также обнаружены при скрещивании кукурузы с апомиктичными
кукурузо-трипсакумными гибридами (Белоусова, Фокина, 1984). В связи с
этим мы считаем, что гемигамия может быть связана не со стимулированием
яйцеклетки спермием, а с тем, что у апомиктов спермий попадает в цитоплазму
яйцеклетки, уже активированной к морфогенезу. Это препятствует кариогамии и
одновременно ведет к делению ядер и клеток, производных от спермия. Таким
образом, гемигамия может быть следствием партеногенеза, а не наоборот.
Одновременное проявление как женского, так и мужского партеногенеза, можно
определить как бипарентальный партеногенез.
Особого рассмотрения заслуживает проблема возникновения растений
материнского или отцовского типа в результате элиминации хромосом. Показано, что
при некоторых отдаленных скрещиваниях может возникать зигота, но затем,
начиная с первых делений клеток проэмбрио, хромосомы одного из родителей
постепенно, но достаточно быстро элиминируются (Davies, 1974; Bennet et al., 1976; Jensen,
1977; Lourieetal., 1990; Першина, 1995). Таким образом, вначале зародыш
развивается как половой, но конечный результат выглядит как«девственный».
Результаты взаимодействия геномов в таких случаях не изучены в полной мере. Можно
предполагать внесение в яйцеклетку органелл мужского родителя, соматический
кроссинговер, включение отдельных хромосом. Тем не менее, можно допустить
вариант, когда сохраняются исключительно признаки матери (внешне чаще всего это
так и выглядит). В этом случае конечные результаты не будут отличаться от тако-
162
Системы репродукции
вых при истинном партеногенезе. Соответствующий термин для выше
рассмотренного явления отсутствует. Поскольку происходит оплодотворение, образуется
зигота, но в результате элиминации хромосом происходит возврат (реверсия) к
исходному геному одного из родителей, его можно назвать реверсивным
партеногенезом.
Говоря о партеногенезе нельзя не коснуться одного принципиального различия
партеногенеза у животных и растений. Как известно, покрытосемянным растениям
свойственно двойное оплодотворение, а большинству апомиктичных видов —
псевдогамия, то есть явление, когда яйцеклетка развивается без оплодотворения, а
эндосперм — в результате оплодотворения.
Формально такие случаи можно было бы отнести к чисто «девственному»
размножению, поскольку мужская гамета может даже близко не подходить к
яйцеклетке. Однако, известны факты, что при использовании разных пыльцевых
родителей псевдогамные апомикты могут отличаться друг от друга по ряду признаков
(Nogler, 1984; см. Взаимоотношения зародыша и эндосперма при апомикси-
се). Предполагается влияние на потомство через эндосперм. Следовательно, к
истинному партеногенезу следует относить только случаи, когда развитие зародыша
сочетается с автономным развитием эндосперма. При половом происхождении
эндосперма возможно употребление термина псевдогамный партеногенез.
Таким образом, существует ряд явлений, имеющих много общего—
партеногенез, гиногенез, андрогенез, гемигамия, апогаметия (гаметоидный партеногенез),
реверсивный партеногенез. Для создания какой-то классификации и однозначной
трактовки явлений и понятий необходимо прийти к соглашению по
нижеследующим вопросам.
1. Является ли каждое из перечисленных явлений самостоятельным или некоторые из
них есть только детализация другого? Например, гиногенез можно считать и
самостоятельным явлением и одной из форм партеногенеза. Отражают ли конкретные
понятия некие конечные результаты или только пути и причины партеногенеза?
2. Можно ли считать партеногенез вершиной в иерархии понятий или одной из
форм другого явления более высокого порядка?
На наш взгляд по отношению к покрытосемянным растениям нельзя класть в
основу определения и классификации понятия партеногенез ни возникновение
зародыша только из яйцеклетки, ни«абсолютную девственность».
Поэтому понятие партеногенез должно относиться именно к явлению гамето-
фитного апомиксиса и рассматриваться как способ (путь) возникновения апо-
миктичного зародыша. Другие понятия лишь подчеркивают некоторые
дополнительные разнородные характеристики партеногенеза (структурные,
функциональные, топографические) или отражают причинно-следственные связи
сопутствующих процессов и явлений. Например, гиногенез и реверсивный
партеногенез можно считать путями или причинами возникновения партеногенеза,
мужской партеногенез и апогаметию (гаметоидный партеногенез) —
структурными характеристиками. Кроме того, мужской партеногенез может быть
следствием гемигамии и элиминации хромосом материнской формы. Следовательно,
другие явления можно рассматривать как формы партеногенеза, различающиеся
некоторыми специфическими особенностями.
Учитывая все изложенное, предлагается общая схема взаимосвязей
партеногенеза с разными явлениями. В ее основу положены:
Семенное размножение 163
1) развитие зародыша из любых клеток женского гаметофита, способных
выполнять роль гамет без оплодотворения, включая в это понятие выпадение
типичного объединения геномов родительских форм, в случае проникновения в
клетку женского гаметофита мужских гамет;
2) разделение на формы, связанные с оплодотворением;
3) явления, которые предшествуют или сопутствуют партеногенезу;
4) пути и причины партеногенеза, структурные особенности.
Ниже дается краткое толкование дополнительных терминов и комментарий к
общей схеме.
Апосингамия — развитие зародыша без какого-либо участия мужских гамет.
Псевдосингамия — развитие зародыша после слияния мужской и женской
гамет без типичной кариогамии, в результате чего потомство имеет кариотип и
признаки, свойственные полностью или в основном одному из родителей.
Партеногаметия — возникновение зародышей из яйцеклетки без участия
мужских гамет.
Партеноандрия — развитие зародыша из яйцеклетки, у которой собственное
ядро замещено ядром спермия. Этот термин предлагается вместо «андрогенеза»,
который является более широким понятием.
Гаметоидный партеногенез — развитие зародыша из клеток, которые по
каким-либо признакам можно отнести к другим клеткам зародышевого мешка,
помимо яйцеклетки.
Бипарентальный партеногенез — мужской и женский партеногенез
одновременно в одном зародышевом мешке; возможно образование гибридных и
химерных зародышей.
Реверсивный партеногенез — возникновение зародыша в результате
элиминации хромосом одного из родителей после кариогамии.
Использование других конкретных определений, включённых в схему, зависит от
связанных с ними проблемами и решаемыми вопросами. Понятия псевдогамный и
автономный введены потому, что при псевдогамии наличие пыльцы можно
рассматривать как условие образования семян, источник ошибок при диагностике
партеногенеза, предпосылку к возврату на половое размножение и выщеплению новых парте-
ногенетических форм после гибридизации; автономность (независимость от
опыления) — чрезвычайно важный эволюционный и селекционный признак.
Понятия нередуцированный и редуцированный служат важными
геномными характеристиками, поскольку гаплоиды и нередуцированные апомикты
различаются по селекционным и эволюционным возможностям. Введение в схему
понятий апосингамия и псевдосингамия целесообразно потому, что несмотря на
отсутствие типичного оплодотворения, само проникновение в женский гаметофит
мужских гамет может вести к серьезным генетическим, эволюционным и
селекционным последствиям. Во многих случаях мы не знаем, что произошло после
опыления — гиногенез, элиминация хромосом и т.д. Поэтому термин
«псевдосингамия» может использоваться как частично интегрирующее понятие.
В ряде случаев могут вводится дополнительные характеристики, не указанные
в схеме. Для нередуцированного партеногенеза могут использоваться термины,
уточняющие пути выпадения редукции— аутомиксис, апомейоз, апо- и диплос-
пория. С ними связаны важнейшие цитогенетические процессы,
обусловливающие кроссинговер, рекомбиногенез, поддержание гомо- и гетерозиготности.
Схема. Партеногенез у цветковых растений.
автономный
редуцированный
псевдогамныи
уцированныи
апосингамия
А
ПАРТЕНОГЕНЕЗ
1 Т
псевдосингамия
Л
->партеногаметия
-> гаметоидныи
партеногенез
гиногенез ■<—
партеноандрия •<-
бипаретальный ^_
партеногенез
реверсивный ^_
партеногенез
Семенное размножение
165
Возможно введение дополнительных характеристик — индуцированный и
наследуемый партеногенез. Это обусловлено тем, что он может быть вызван
либо воздействием внешних факторов (температура, гормоны, аномалии
пыльцы), либо генетическими причинами. При индукции партеногенеза он не
наследуется в последующих поколениях, что затрудняет работу по отбору партеногене-
тических форм. В связи с этим, указания на индуцированную или генетически
обусловленную природу партеногенеза могут быть полезными во многих случаях,
особенно для селекционеров.
Не исключено в соответствующих случаях добавление таких определений,
как партеногенез облигатный, факультативный, циклический,
абортивный. Последние два чаще всего применяются к зоологическим объектам (Ри-
гер, Михаэлис, 1967). Абортивный партеногенез может оказаться
распространенным термином для растений, поскольку случаи, когда у них партеноге-
нетическое развитие не реализуется до конца и останавливается на какой-либо
стадии, встречаются довольно часто.
Рассмотренные явления могут изучаться и вызываться также в культуре
изолированных завязей, семязачатков, зародышевых мешков. К соответствующим
терминам в этих случаях обычно добавляется характеристика in vitro ( например, анд-
рогенез in vitro, гиногенез in vitro).
Банникова, Хведынич, 1982; Белоусова, Фокина, 1984; Джори, Амбегаокар, 1990; Еналеева,
1979; Лакшманан, Амегаокаор, 1990; Ноглер, 1990; Першина, 1995; Поддубная-Арнольди,1976;
Ригер, Михаэлис, 1967; Тырнов, 1976 а,б, 1986; Bennet et al., 1976; Czapik, 1997,1998; Davies,
1974; Goldschmidt, 1912; Jensen, 1977; Juel, 1898; Kusano, 1915; Laurie et al.,1990; Owen,1849;
Raquin, 1985; Turcotte, Feaster, 1973,1974; Tyrnov, 1992.
АПОГАМЕТИЯ (греч. apo — без, gameta — гамета, женская половая клетка) —
развитие дополнительных зародышей из неоплодотворенных клеток зародышевого
мешка — синергид (синергидная апогаметия) или антипод (антиподная апогаме-
тия). Синонимы: апогамия, эвапогамия.
Это явление впервые описано у папоротников как апогамия (de Вагу, 1878), или
эвапогамия (Farmer, Digby, 1907). В первых классификациях апомиксиса у
цветковых растений использован термин«апогамия»(Winkler, 1908, 1920), но в
дальнейшем он был заменен более точным — «апогаметия» (Renner, 1916), который
употребляется и в современных классификациях.
Апогаметия обнаружена в гаплоидных зародышевых мешках у амфимиктов и в
диплоидных — у апомиктов. В первом случае ее называют по-разному: мейотиче-
ской (Farmer, Digby, 1907), генеративной (Winkler, 1908, 1920), гаплоидной
(Hartmann, 1909; Renner, 1916; Fagerlind, 1940; Поддубная-Арнольд и, 1940),
споровой (Хохлов, 1958), редуцированной апогаметией (Поддубная-Арнольди,
1964, 1976) и др. Во втором случае — соматической (Winkler, 1908, 1920;
Hartmann, 1909; Ernst, 1918), диплоидной (Renner, 1916; Fagerlind, 1940;
Поддубная-Арнольди, 1940; Gustafsson, 1946-1947), зигофатической (Winkler,
1934), апоспоровой и апоархеспоровой (Хохлов, 1958), нередуцированной
апогаметией (Поддубная-Арнольди, 1964, 1976) и др.
Апогаметия в гаплоидных зародышевых мешках может рассматриваться как
один из возможных источников возникновения гаплоидных зародышей. Предпо-
166
Системы репродукции
сылками для образования зародышей из синергид, как отмечают многие авторы,
служат: дифференциация синергид по типу яйцеклетки (например, в семействах
Iridaceae, Combretaceae); слабая дифференциация всех клеток яйцевого аппарата,
когда все три клетки примерно равны по величине и содержат небольшие вакуоли
(Liliaceae, Brassicaceae); продолжительное существование интактной синергиды.
Наличие нитчатого аппарата в синергиде, очевидно, не играет роли, так как деление
синергид наблюдается в обоих случаях: когда он не выражен (Liliaceae,
Tetradiclidaceae), и когда хорошо представлен (АШасеае, Trilliaceae). Деление
ядра в синергиде происходит после оплодотворения яйцеклетки, иногда раньше,
чем в зиготе, при этом оно сопровождается цитокинезом, но отмечались случаи
образования и ценоцитного проэмбрио (например, в сем. Amaryllidaceae — Ворсоби-
на, Солнцева, 1990). В большинстве случаев синергидный зародыш развивается
только до нескольких клеток, затем дегенерирует. Апогаметические зародыши, как
правило, меньших размеров, чем зиготические (например, в семействах
Papaveraceae — Sachar, 1955; Trilliaceae — Наумова, Яковлев, 1975).
Предпосылкой для образования зародышей из антипод является
дифференциация антиподального аппарата по типу яйцевого (например, у некоторых видов
семейств Asteraceae, Liliaceae, Ulmaceae) (Плющ, 1992; Pajak, 1998).
И синергидная, и особенно, антиподная апогаметия у цветковых растений
встречается редко. Синергидная апогаметия отмечена в 28 семействах 17 порядков
двудольных и 10 семействах 5 порядков однодольных растений (см.
«Сравнительная эмбриология цветковых растений», 1981 — 1990). Антиподная апогаметия
отмечена только у ряда семейств, причем наиболее достоверные сведения имеются по
сем. Asteraceae (виды рода Rudbeckia — Battaglia, 1955; Солнцева, 1973) и,
очевидно, АШасеае (Модилевский, 1925,1931). Зачастую увеличение числа антипод
или их деление в процессе развития зародышевого мешка расценивается как
образование антиподных зародышей. Приведенные данные о встречаемости апогаме-
тии у цветковых растений в настоящее время кажутся несколько завышенными
(Solntzeva, 1995; Солнцева, 1998).
Предложено различать апогаметию реализованную (реальную), когда
зародыш синергидного или антиподного происхождения достигает зрелости, и
нереализованную (потенциальную), когда такой зародыш развивается до двух —
нескольких клеток и отмирает (Камелина, 1994а; Kamelina, 1995). Реализованная
апогаметия является одной из причин полиэмбрионии. Такие семена содержат
наряду с зиготическим синергидный или антиподный зародыши (АШасеае,
Asteraceae, Liliaceae, Orchidaceae). В большинстве же случаев наблюдается
нереализованная апогаметия.
Апогаметия может сочетаться с другими формами апомиксиса — гемигамией,
партеногенезом, нуцеллярной и интегументальной эмбрионией. В последнем
случае идентифицировать апогаметические зародыши крайне затруднительно.
Партеногенез в сочетании с синергидной апогаметией — явление наиболее
распространенное, которое можно наблюдать даже в аберрантных семязачатках (например, у
видов сем. Paeoniaceae — Шамров, 1997 а).
Не все авторы классификаций апомиксиса согласны рассматривать апогаметию
как самостоятельный тип апомиксиса (Nogler, 1984; см. Классификация
апомиксиса), или вообще исключают возможность полиэмбрионии с антиподной
апогаметией у цветковых растений (Lakshmanan, Ambegaokar, 1984). Однако, обнару-
Рис. 13. Апогаметия.
1 — микропилярная часть зародышевого мешка Syrenia сапа (Brassicaceae) во время
оплодотворения: интактная синергида сохраняет жизнеспособность; 2 — проэмбрио из зиготы и из синергиды у
этого же вида; 3-5 — образование ародышей из зиготы и синергиды у Trillium camschatcense
(Trilliaceae); 6 — четырехклеточный проэмбрио из зиготы и ценоцитный зародыш из синергиды у
Argyropsis Candida (Amaryllidaceae); 7-8 — зиготический и синергидный проэмбрио у Cymnadenia
conopsea и Orchis militans (Orchidaceae);
Рис. 13 (продолжение).
9 — зигота и двуклеточиый зародыш у Tetradiclis tenella (Tetradklidaceae); 10,11 — синергидный и зиготиче-
ский проэмбрио у Tamanx encoides (Tamaricaceae) (10) и зрелое семя у этого вида (11) с двумя зародышами;
12, 13 — зиготический и антиподный зародыши, выделенные из созревающего семени Rudbeckia lac'miala
(Asteraceae); аз — зародыш, развивающийся из антиподы, п з — половой зародыш.
1-2 — по: Беляева, Родионова, 1983; 3-5 — по: Наумова, Яковлев, 1975; 6 — по: Ворсобииа, Солнцева,
1990; 7-8 - по: Савина, Поддубная-Арнольди, 1990; 9 - по: Камелина, 19946; 10, И - по: Johri, Как, 1954;
12,13 — по: Солнцева, 1973 (с измен.).
Семенное размножение
169
женный у Rudbeckia laciniata сформированный двусемядольный антиподный
зародыш в созревающем семени свидетельствует о наличии реализованной антиподной
апогаметии у этого вида (Солнцева, 1973).
В противовес оппонентам, Czapik (1998) приводит убедительные
доказательства в пользу самостоятельности этого типа апомиксиса, отмечая, что основное
отличие апогаметии от партеногенеза заключается в происхождении инициальной
клетки проэмбрио. В партеногенезе таковой всегда является яйцеклетка, а при
апогаметии — синергида или антипода, но не яйцеклетка. Более того, обращается
внимание на половую форму апогаметии, которая ранее не учитывалась, поскольку не
вписывалась в строгие рамки апомиксиса. К ней относятся случаи, когда проэмбрио
формируется из гаплоидной апогаметической клетки после ее оплодотворения.
Примером может служить Tamarix ericoides (Tamaricaceae), у которого из одной и
даже двух оплодотворенных синергид развиваются дополнительные зародыши,
иногда достигающие зрелости (Sharma, 1939; Johri, Как, 1954), т. е. наблюдается
реализованная синергидная апогаметия.
В исследованиях апогаметии есть ряд важных для эмбриологии и апомиксиса
проблем (Czapik, 1997, 1998). Это касается не только терминологии, но и ранней
идентификации клеток в зародышевом мешке, их дифференциации,
специализации, и возможности дедифференциации, а также факторов, влияющих на тотипо-
тентность клеток зародышевого мешка, которые, к сожалению, до сих пор
неизвестны. Рис. 13.
Беляева, Родионова, 1983; Ворсобина, Солнцева, 1990; Камелина, 1994а, б; Модилевский, 1925,
1931; Наумова, Яковлев, 1975; Плющ, 1992; Поддубная-Арнольди, 1940, 1964, 1976; Савина,
Поддубная-Арнольди, 1990; Солнцева, 1973,1998,1999; Хохлов, 1958; Шамров, 1997; Вагу de,
1878; Battaglia, 1955; Czapik, 1997, 1998; Ernst, 1918; Fagerlind, 1940; Farmer, Digby, 1907;
Gustafsson, 1946-1947; Hartmann, 1909; Johri, Как, 1954; Kamelina, 1995; Lakshmanan,
Ambegaokar, 1984; Nogler, 1984; Renner, 1916; Sachar, 1955; Sharma, 1939; Solntzeva, 1996;
Webber, 1940; Winkler, 1908,1920,1934.
КЛАССИФИКАЦИЯ АПОМИКСИСА
Первая классификация апомиксиса была предложена Winkler (1908,1920). Он
включил в апомиксис наряду с партеногенезом и апогамией адвентивную эм-
брионию, вивипарию и вегетативное размножение почками, луковицами,
корневищами и пр. Согласно его концепции, апомикты — это вторично
бесполые формы, по тем или иным причинам утратившие половое размножение, в
отличие от амиктов — первично бесполых примитивных форм организмов, у которых
отсутствует половая дифференциация и оплодотворение.
Позднее было предложено несколько десятков классификаций типов
апомиксиса. Почти каждый из авторов стремился разработать свой оригинальный
принцип классификации и в той или иной степени обновить терминологию. Последнее
породило известную путаницу, так как одни и те же формы апомиксиса
обозначались разными терминами. Кроме того, многим классификациям свойственна
излишняя детализация, затрудняющая понимание и без того непростого явления.
см. Апогаметия.
170
Системы репродукции
Даже в определении самого понятия «апомиксис» среди исследователей не
было единодушия. Одни понимали его так же широко, как Winkler (Fagerlind,
1940; Gustafsson, 1946-1947; Модилевский, 1948; Петров, 1964,1979), другие
ограничивали его содержание только формами семенного размножения (Ernst,
1918; Поддубная-Арнольди, 1964; Хохлов, 1967; Asker, 1981), или относили к
апомиксису только его гаметофитные формы, исключая адвентивную эмбрионию
(Battaglia, 1963; Batygina, 1990; Shishkinskaya, 1991; Терехин, 1996).
Некоторые авторы (Asker, 1980,1981; Грант, 1984; Nogler, 1984, Batygina, 1989; Баты-
гина, 1993, 1994, 1998) предпочитают использовать наряду с термином
«апомиксис» его синоним «агамоспермия», как правило, разделяя последнюю на
гаметофитный апомиксис и адвентивную эмбрионию.
Не рассматривая ранние классификации, в основе которых, в большинстве
случаев, лежала концепция Winkler, отметим только, что уже в схеме Ernst
(1918) впервые из апомиксиса исключено вегетативное размножение и выделены
два типа апомиксиса: индуцированный и автономный.
Широкой популярностью пользовалась классификация Gustafsson (1946-1947)
(Схема 1). Основное ее достоинство — простота. Вслед за Winkler, Gustafsson
считал все формы апомиксиса вторичными по отношению к половому размножению.
Разные типы генеративного (т.е. гаметофитного) апомиксиса согласно его схеме,
возникают в результате комбинирования различных способов формирования женского
гаметофита (диплоспория или апоспория) с разными способами образования
зародыша (партеногенез или апогаметия).
Классификация Gustafsson послужила отправным пунктом для создания
многих последующих систем классификации. В качестве примера приведем
известную схему Петрова (1964, 1979) (Схема 2), в которой «отдельные моменты
систем классификации апомиксиса Maheshwari и Fagerlind». В ней выделены
нерегулярный (гаплоидный) и регулярный (диплоидный) апомиксис и впервые
включен способ образования эндосперма: псевдогамия и автономный
апомиксис, т.е. сделан ряд важных добавлений к схеме Gustafsson. Однако в
классификации заметен существенный недостаток: в один ряд в ней поставлены явления
разного порядка, например, способ образования зародышевого мешка —
диплоспория и апоспория — и способ образования зародыша — адвентивная эмбриония.
Классификация Поддубной-Арнольди (1964,1976) была, по всей видимости,
наиболее популярна среди отечественных исследователей, особенно эмбриологов, которые
предпочитали использовать именно ее терминологию. Автор выделяет следующие типы
апомиксиса: партеногенез, апогаметию, апоспорию, нуцеллярную и интегументальную
эмбрионию, подразделяя первые два на редуцированную и нередуцированную формы.
Апоспория, в свою очередь, подразделяется на соматическую апоспорию (эвапоспорию)
и генеративную (синоним диплоспории). Воздавая должное простоте и доступности
классификации и терминологии Поддубной-Арнольди, следует отметить, однако, что в
одном случае в качестве самостоятельного типа апомиксиса выделен способ
формирования гаметофита (апоспория), а во всех других — способы формирования зародыша, в то
время как регулярный апомиксис является результатом их сочетания.
Самая оригинальная и выдержанная в едином ключе классификация
апомиксиса, на наш взгляд, разработана Хохловым (1967) (Схема 3). Автор считал
апомиксис результатом изменений, происходящих на разных этапах полового
размножения. Он выделил четыре элемента гаметофитного апомиксиса:
Схема 1. Классификация типов апомиксиса Gustafsson (1946-1947)
Амиксис
,г
Амфимиксис
f
♦
Генеративный
апомиксис
Диплоспория
1
Партеногенез
!'
Апомиксис
♦
Агамоспермия
«
♦
L*
поспорил
^'
Апогаметия
1
'
♦
Вегетативное
размножение
Спорофитный
апомиксис
и
Адвентивная
эмбриония
172
Системы репродукции
Схема 2. Оригинальная классификация апомиксиса Петрова (1964)
Нерегулярный
апомнксис
Агамоспермия
Гаплоидный
партеногенез
Гаплоидная
апогамия
Л
Апомнксис
Регулярный
апомнксис
Псевдогамия
Диплоспории
"Т
Апоспория
Адвентивная
эмбрионня
Автономный
апомнксис
л
Диплоспории
Вегетативное
размножение
х
Апоспория
Адентивная
эмбриония
1) апоспория — развитие нередуцированного зародышевого мешка из археспо-
риальной клетки или из производных от нее клеток;
2) апоархеспория — развитие нередуцированного зародышевого мешка из
соматической клетки нуцеллуса;
3) апозиготия — развитие зародыша из неоплодотворенной яйцеклетки;
4) апогаметия — развитие зародыша без оплодотворения из синергиды или
антиподы.
Комбинирование их друг с другом или с элементами полового размножения:
спорней (развитие зародышевого мешка из редуцированной мегаспоры) и зиготи-
ей (развитие зародыша из оплодотворенной яйцеклетки), приводит к появлению
уравновешенных (диплоидных) или неуравновешенных (гаплоидных) форм га-
метофитного апомиксиса. Адвентивная эмбриония впервые им названа «апогаме-
тофитной» формой апомиксиса, так как зародыши в этом случае развиваются не из
элементов зародышевого мешка, а из соматических клеток семязачатка.
Взаимоотношения элементов апомиксиса в системе семенного размножения растений
изображено автором в виде решетки, внутри которой нашлось место практически для
всех известных в природе форм апомиксиса.
Хохлов (1970) сделал попытку унифицировать терминологию путем
добавления к названию элементов приставки «апо-». Однако, двойное наименование форм
апомиксиса сделало предложенную терминологию достаточно сложной для
восприятия. Кроме того, взамен старых терминов автор ввел ряд новых (вместо
партеногенеза — апозиготию, вместо соматической апоспории — апоархеспорию), а
термин «апоспория» использовал в непривычном смысле как синоним
генеративной апоспории, или диплоспории. Эти терминологические сложности стали камнем
преткновения на пути широкого признания этой оригинальной классификации.
Схема 3. Классификация типов апомиксиса Хохлова (1967)
Гаметофит
CD-
Гамета
Спорогенез
ДрхеспорийЛ ,
Семяпочка.
Опподатдорение
Зигата
в
_ ЗародЬ/ш
V/ спорофита
А — типичный цикл развития зародыша при половом процессе: споровая зиготия (жирные стрелки) и
элементы бесполосемяниости ( тонкие стрелки), Б — классификация форм бесполосемянности
(незачерчениые значки, обозначающие морфобиологические фазы, характеризуют гаплоидное состояние;
зачерченные наполовину — диплоидное состояние; полностью зачерченные — триплоидное состояние;
крестиками обозначены морфобиологические фазы, выпавшие из цикла развития).
174
Системы репродукции
Наиболее созвучной современным представлениям об апомиксисе является
классификация, предложенная Battaglia (1963). Он впервые исключил из системы
апомиксиса не только вегетативное размножение, но и адвентивную эмбрионию,
что привело в дальнейшем к использованию термина «апомиксис» только по
отношению к его гаметофитным формам.
Последовательность элементов в системе Battaglia строго соответствует
естественному ходу событий, протекающих в генеративных органах: сначала следует
способ образования женского гаметофита, а затем способ образования зародыша
(Схема 4). В классификацию впервые введены такие явления, как андрогенез и
семигамия. Однако целесообразность включения семигамии вызывает сомнения
из-за ее не вполне определенного статуса: многие считают это явление отклонением
от нормального полового процесса.
Что касается исключения из апомиксиса адвентивной эмбрионии, то, как
известно, еще Winkler (1920) относил ее к вегетативному размножению. В последнее время
на проблему взаимоотношения адвентивной эмбрионии и апомиксиса обратили
внимание исследователи, работающие в области культуры in vitro (Maheshwari,
Схема 4. Классификация типов апомиксиса Battaglia (1963)
енез
спорог
н
гаметоф!
Гетероф.
Эуспория Анеуспория
Редуци
синкариогенез
юванный
гаметофит
1
Апомиксис
Г
Партеногенез
Псевдогамия
Андрогенез
Ч
г
Зародыш
редуцированный
аза
Гениальная Соматическая
апоспори
Нередуци{
я апоспория
/
юванный
гаметофит
Партеногенез
Псевдогамия
Семигамия
Андрогенез
1
i
Зародыш
нередуцированный
Гомофаза
^\
эиологиз
:ая эмб
s
эжение (спороф
!
ное
офит
Спор
ожени»
sн ое размн
к
а
Семенное размножение 175
Rangaswamy, 1958; Батыгина и др., 1978; Rangaswamy, 1980; Batygina, 1984,1990,
1999; Wit ms et al., 1983; Batygina, Zakharova, 1998). Авторы считают, что эмбриои-
догенез, наблюдающийся в культуре in vitro, с морфо-функциональных позиций
аналогичен процессу образования адвентивных зародышей. В связи с этим некоторые
авторы относят адвентивную эмбрионию (нуцеллярную, интегументальную и кли-
важную) к эмбриоидогенному типу вегетативного размножения (Batygina, 1990;
Батыгина 1991,1992,1997).
Классификация Battaglia позже была расширена и детализирована Солнцевой
(1970,1997). Но, как уже отмечалось выше, излишняя детализация только
препятствует созданию единой и доступной системы классификации апомиксиса.
Принципиально новый взгляд на проблему классификации дала попытка Вага и
Ghiorgita (1974), которые применили к ее решению нетрадиционный системный
подход. По мнению авторов, основное различие между половым и апомиктичным
размножением лежит на уровне системной организации соответствующих форм
растений и определяется их информационным содержанием. При половом
размножении суммируется информация двух индивидуальных систем, что приводит к
появлению у потомства новых качеств. В случае апомиксиса, от предков к потомкам
идет один информационный поток без вклада другой системы, благодаря чему
сохраняется исходное (родительское) информационное содержание.
Использование авторами системно-информационного подхода привело к
тому, что они объединили в одну группу все бесполые, по их мнению, формы
размножения — и вторичные (апомикты), и первичные (амикты) — и полностью
оторвали апомиксис от другого компонента системы семенного размножения —
амфимиксиса.
Такая точка зрения противоречила постепенно складывающемуся
представлению о тесном взаимодействии апомиксиса и амфимиксиса в рамках единой системы
семенного размножения. Хотя характер генетического контроля апомиксиса до сих
пор окончательно не установлен, большинство исследователей, начиная с Thomas
(1940), считают его проявление результатом мутаций, затрагивающих процессы
споро- и гаметогенеза у половых форм (Powers, 1945; Gustafsson, 1946-1947;
Nygren, 1954; Петров, 1964, 1979; Хохлов, 1967; Asker, 1980, 1994; Savidan,
1982,1992; Nogler, 1984; Mogie, 1988; Kindigeretal., 1994; Teryokhin, 1994).
Высказывается мнение, что процессы, приводящие к апомиксису, должны быть
связаны или непосредственно взаимодействовать с системой генетического контроля,
действующей при половом размножении, с целью сохранения последовательности
событий, которые связывают образование мегагаметофита и начало эмбриогенеза
(Murrey, 1992). Сейчас в самом разгаре работы по трансгрессии генов апомиксиса
от Tripsacum к Zea (Savidan, Berthaud, 1994; Savidan et al., 1994). Локализацию
этих генов связывают с определенным участком 16 хромосомы трипсакума
(Kindigeretal., 1994). В случае их успешного завершения можно ожидать
существенного прорыва в области генетического контроля апомиксиса.
Следует отметить еще один аспект современных представлений об
апомиксисе. До недавнего времени апомиксис традиционно противопоставлялся
амфимиксису, как бесполое размножение половому. Но сейчас, в основном, благодаря
работам генетиков, наметилась тенденция к объединению обоих способов
размножения в рамках общей системы репродукции (Nogler, 1984). Предполагаемая
общность механизмов генетического контроля апомиксиса и амфимиксиса, осу-
176
Системы репродукции
ществление обоих процессов на одной и той же структурной базе (половые
органы, гаметофиты, гаметы) позволяют рассматривать их не как альтернативные, а
как взаимодополняющие друг друга способы размножения, находящиеся в
состоянии баланса (Nogler, 1984). Учитывая то, что половой процесс у растений не
может быть сведен только к акту оплодотворения яйцеклетки, а все остальные его
события (то, что обозначено эмбриологами термином «множественное
оплодотворение») имеют место как у половых, так и у апомиктичных форм, есть все
основания считать апомиксис таким же полноправным компонентом системы
полового размножения, как и амфимиксис (Куприянов, 1989; Shishkinskaya, 1991).
Это, в первую очередь, относится к псевдогамным апомиктам, где для развития
эндосперма необходимо оплодотворение центральной клетки. У автономных апо-
миктов в образовании потомства принимает участие только один пол, но и у них
может формироваться определенный процент фертильной пыльцы, которая
оплодотворяет яйцеклетки их половых сородичей (Петров, 1964). Лишь у очень
ограниченной группы облигатных апомиктов (сомнительно, есть ли они вообще?)
должна наблюдаться полная редукция мужской генеративной сферы. Но в этом
случае правильнее говорить об однополовости или унипарентальном
размножении (Терехин, 1994).
Следует привести высказывание Поддубной-Арнольди по поводу термина «бес-
полосеменное размножение», предложенного Хохловым в качестве синонима
термина «апомиксис». Она указала на то, что «хотя образование зародыша, эндосперма и
семян здесь не связано с оплодотворением, пол у апомиктично размножающихся
растений выражен достаточно хорошо» (Поддубная-Арнольди, 1976: с. 358).
Взгляд на апомиксис как на бесполое размножение Куприянов (1989) считал
следствием отождествления амфимиксиса с половым процессом. На самом же
деле, понятие «половой процесс», как указывает автор, значительно шире
амфимиксиса, и«акт амфимиксиса не является самодовлеющей сущностью полового
размножения», а есть лишь один из его элементов, наряду с другими, в том числе и
апомиксисом. Автор дает следующее определение полового размножения,
основными параметрами которого он считает амфимиксис и апомиксис: «половыми у
многоклеточных организмов являются такие системы размножения, при которых
особи в ряду поколений проходят фазу единственной клетки»(с.14).
Разделяя мнение о половой сущности апомиксиса (Инге-Вечтомов, 1989;
Куприянов, 1989), мы в качестве аргумента используем вышеуказанные
генетический и структурный критерии, т.е. общность системы генетического контроля и
структурно-функциональной базы (Shishkinskaya, 1991). Согласно нашему
представлению о месте апомиксиса в системе семенного размножения главным
элементом апомиксиса является партеногенез, так как его присутствие обязательно для
проявления апомиксиса (Схема 5). С ним обычно сочетается один из трех разных
типов формирования зародышевого мешка:
диплоспория* — развитие гаметофита из нередуцированной мегаспоры,
апоспория — из материнской клетки мегаспор, апоархеспория — из
соматической клетки семязачатка. Иногда для проявления диплоидного апомиксиса
достаточно одного партеногенеза, как в случае спонтанного удвоения хромосом
в гаплоидной яйцеклетке, например, у пшениц (Канделаки, 1970). В схеме от-
Использование и трактовка этих терминов не согласуется с общепринятыми взглядами (ред. —
см.также Nogler, 1984; Апомиксис; Апоспория; Диплоспория).
Семенное размножение
177
сутствует апогаметия, что объясняется тем, что мы рассматриваем ее, как
частный случай партеногенеза. Прежде чем дать начало развитию зародыша, си-
нергида или антипода встают на необычный для них путь дифференциации1
(трансдетерминации) и становятся «яйцеклеткоподобными». Именно та-
кие«переродившиеся»клетки берут на себя функцию дополнительных
яйцеклеток и дают начало добавочным зародышам (Narayanaswamy, 1940; Weimarck,
1967; Sinder et al., 1980; Thirumaran, Lakshmanan, 1982; Shishkinskaya, 1992,
1995). Они с определенной, но очень низкой частотой, встречаются у многих
склонных к апомиксису видов. Апогаметия не является самостоятельным
способом размножения, она сопутствует, как правило, партеногенезу и является
одной из причин полиэмбрионии.
В заключение можно сказать, что, пытаясь создать всеобъемлющую систему
классификации апомиксиса, мы, по сути дела, изобретаем велосипед, так как
аналогичная ситуация имела место в случае амфимиксиса. Здесь основной элемент
— оплодотворение сочетается с тремя другими элементами системы полового
размножения — моноспорией, биспорией и тетраспорией, которые
олицетворяют три разных типа развития женского гаметофита половых видов. Тем не
менее, классификации типов развития зародышевых мешков вполне достаточно для
характеристики всех вариантов осуществления полового процесса. Почему же не
Схема 5. Система семенного размножения покрытосемянных
Тип размножения
Способ размножения
Способ образования
гаметофита
Способ образования
зародыша
Способ образования
эндосперма
Существует и другой тип формирования яйцеклеткоподобных синергид и антипод, когда
эти клетки непосредственно (без дифференциации) становятся на путь партеногенеза
(ред. — Герасимова-Навашина, Батыгина, 1958; Батыгина, 1987).
Схема 6. Классификация типов развития зародышевых мешков.
МКМ
О
Ф
В
В
в
I деление
мейоза
©
О
©
®
®
11 деление
мейоза
©
©
©
©
©
-О
в
1-вын
митоз
©
2-ой
митоз
©
е
¥
^
3-ий
митоз
Зрелый
ЗМ
Тип
развития
©
Polygonum-
тип
Allium-
тип
Adoxa-
тип
Allium-
nutans-Tiin
Taraxacum-
тип
Ixeris-
тип
Antennaria-
тип
Erogrostis-
тип
Роа-
тип
Bouteloa-
тип
Chloris-
Panicum-
тип
Andropogon-
тип
Heteropogon-
тип
Paspalum-
з м — зародышевый мешок, м к м — материнская клетка мегаспор, + - повторение соответствующей стадии
развития зародышевого мешка нормального типа,
► — пропуск стадии развития,
■ апоспорические элементы^
элементов иа разных стадиях развития зародышевого мешка, начиная с м к м
археспориальной клетки.
— дегенерация генеративных
^^| — дегенерация
* В таблице приведены только три основных типа развития редуцированных зародышевых мешков: моноспорический
(Polygonum — тип), биспорический (Allium — тип) и тетраспорический (Adoxa — тип).
Семенное размножение
179
использовать такой подход и при описании апомиксиса? Рядом авторов уже
сделаны попытки классифицировать типы развития зародышевых мешков апомик-
тичных видов (Battaglia, 1963, 1983; Хохлов, 1967; Solntzeva, 1990; Asker,
Jerling, 1992; Koltunov, 1993; Crane, 1995; Солнцева, 1997; Терехин, 1997). За
исключением недавно предложенной интегративной классификации Crane
(1995), в которой автор отказывается от традиционного разделения апомиксиса
на два основных типа (диплоспорию и апоспорию), все остальные отличаются
друг от друга только количеством выделенных типов и степенью детализации.
Взяв за основу таблицу Хохлова (1970) и несколько расширив ее, мы составили
классификацию, которая характеризует все разнообразие проявления
апомиксиса у растений (Схема 6). В ней нашла отражение сложившаяся в эмбриологии
концепция, что Polygonum-тип развития женского гаметофита олицетворяет
исходную последовательность событий при формировании зародышевого мешка,
которая в ходе эволюции могла служить основой для возникновения как
редуцированных, так и нередуцированных мегагаметофитов. При всем многообразии
типов развития зародышевых мешков половых видов общим для них является
сохранение мейоза для производства редуцированных гамет (изменяться может
•только конечная фаза деления — цитокинез). При образовании же диплоспори-
ческих и апоспорических зародышевых мешков основная роль принадлежит мей-
мутациям, приводящим либо к выпадению мейоза, либо к замене его другими
типами деления и, как следствие, к формированию нередуцированных гамет. Что
касается апоархеспории, то она, возможно, является результатом изменения
уровня экспрессии генов, запускающих развитие в семязачатке редуцированного
зародышевого мешка. Можно предположить, что их возросшая экспрессия
стимулирует к образованию гаметофита вслед за материнской клеткой макроспор
соседние соматические клетки.
Следует отметить, что у апомиктичных видов в пределах одного типа развития
конечный результат (т.е. структура мегагаметофита) может быть различным из-за
аномалий, возникающих на завершающей стадии формирования зародышевого
мешка и затрагивающих, в частности, процессы дифференциации и поляризации
его элементов. Нестабильность структуры зрелых женских гаметофитов апомик-
тов является характерной особенностью, отличающей их на популяционном уровне
от половых видов.
Мы надеемся, что такой подход избавит исследователей от бесплодных
усилий выработать приемлемую для всех классификацию апомиксиса на фоне
отсутствия единства в определении сущности этого явления и его места в системе
семенного размножения. Оно может быть достигнуто только после того, как
будет точно установлен механизм генетического (или эпигенетического) контроля
разных форм апомиксиса).
Батыгина и др., 1978; Батыгина, 1993, 1994; Грант, 1984; Канделаки, 1970; Куприянов, 1989;
Модилевский, 1948; Петров, 1964, 1979; Поддубная-Арнольди, 1964, 1976; Солнцева, 1970,
1997; Терехин, 1994, 1997; Хохлов, 1967, 1970; Asker, 1980, 1981, 1994; Asker, Jerling, 1992;
Вага, Ghiorgita, 1974; Battaglia, 1963, 1983; Batygina, 1984, 1989, 1990; Batygina, Zakharova,
1998; Crane, 1995; Ernst, 1918; Fagerlind, 1940; Gustafsson, 1946-1947; Kindiger et al., 1994;
Koltunov, 1993; Maheshwari, 1963; Maheshwari, Rangaswamy, 1958; Mogie, 1988; Murrey, 1992;
Narayanaswamy, 1940; Nogler, 1984; Nygren, 1954; Powers, 1945; Rangaswamy, 1980; Savidan,
1982,1992; Savidan, Berthaud, 1994; Savidan et al., 1944; Shishkinskaya, 1991,1992,1995; Sinder
180
Системы репродукции
et al., 1980; Solntzeva, 1990; Thirumaran, Lakshmann, 1982; Thomas, 1940; Weimarck, 1967;
Wilms et al., 1983; Winkler, 1908,1920.
ВЗАИМООТНОШЕНИЯ ЗАРОДЫША И ЭНДОСПЕРМА
ПРИ АПОМИКСИСЕ
Накопленная к настоящему времени информация указывает на многогранную
роль эндосперма при апомиксисе. Это следует учитывать при экспериментальном
получении, генетическом анализе, селекции и практическом использовании апо-
миктичных форм. Технология работы с апомиктами может меняться в зависимости
от того: (1) определяют ли одни и те же факторы автономное развитие зародыша и
эндосперма или же они специфичны для каждого из них; (2) может ли
партеногенез быть индуцирован развивающимся эндоспермом; (3) связаны или нет между
собой способность к псевдогамии и способность к автономному эндоспермогенезу;
(4) сходны или различны закономерности эндоспермогенеза при редуцированном
и нередуцированном апомиксисе; (5) могут ли какие-то особенности эндосперма
вести к гибели зародыша; (6) какова оптимальная геномная структура эндосперма;
(7) влияет ли эндосперм на какие-либо признаки зародыша и развивающегося из'
него спорофита; (8) имеет ли адаптационное и эволюционное значение способ
репродукции не только зародыша, но и эндосперма; (9) каковы особенности
развития эндосперма в культуре in vitro, широко используемой в биоинженерии.
Развитие эндосперма при разных формах апомиксиса имеет свои
специфические особенности.
Редуцированный апомиксис (гаплоидия). Возникновение матроклинных
гаплоидов (редуцированных апомиктов) при скрещиваниях зависит как от
отцовской, так и от материнской формы. В первом случае оно связано с аномалиями спер-
миев, ведущими к одинарному оплодотворению и, соответственно, к индукции
партеногенеза; во втором обусловлено ядерными и/или цитоплазматическими
факторами материнских форм (Тырнов, 1976). На основе этих и других фактов
была обоснована концепция о наследуемых и индуцированных формах гаплоидии у
разных видов (Tyrnov, 1992; Тырнов, 1994). Каждая из них характеризуется своей
спецификой развития зародыша и эндосперма (Тырнов, Еналеева, 1983; Еналеева,
Тырнов, 1994; Еналеева и др., 1997; Enaleeva, Tyrnov, 1997).
Индукции редуцированного апомиксиса сопутствует развитие эндосперма до
начала развития зародыша. Число ядер эндосперма может быть небольшим (около
8), что свидетельствует о том, что гаплоиндукция не связана с трофической
функцией эндосперма, а является, скорее всего, результатом воздействия каких-то
физических или химических факторов. В пользу гипотезы влияния«химических
стимулов» свидетельствует то, что эндосперм, начиная с ранней стадии развития,
вырабатывает гормоны и другие вещества, которые влияют на рост и морфогенез
зародыша (Vijaraghavan, Prabhakar, 1984), а также индуцирует морфогенетиче-
ские процессы в культуре in vitro при добавлении в питательную среду (Худяк,
1963; Джори, Рао, 1990). Кроме того, предполагается, что ранний эмбриогенез
может быть связан с осмотическим градиентом, возникающим вследствие
быстрого роста эндосперма (Vijayaraghavan, Prabhakar, 1984).
Редуцированный апомиксис, по крайней мере, у некоторых культур, связан
исключительно с псевдогамией. У исследованных нами свыше 20000 матроклинных
Семенное размножение
181
гаплоидов кукурузы эндосперм был гибридного происхождения (Тырнов, Завали-
шина, 1972; Tyrnov, 1998). Обоснована вероятность развития гибридного
эндосперма при возникновении гаплоидов у картофеля (Montelongo-Escobedo, 1969;
Лаптев, 1984). Гибридный эндосперм сопутствовал также гаплоидному и
диплоидному андрогенезу (Тырнов, 1986).
Несколько иная картина наблюдается при наследуемой форме редуцированного
апомиксиса. В неопыленных завязях кукурузы развитие зародыша вплоть до
глобулярной стадии может идти без развития эндосперма (Тырнов, Еналеева, 1983;
Еналеева, Тырнов, 1994; Enaleeva, Tyrnov, 19971), и поэтому «факторы
морфогенеза», вероятно, уже изначально присущи клеткам женского гаметофита. Во многих
зародышевых мешках (свыше 82%) обнаружено автономное развитие
эндосперма. Оно могло сочетаться с автономным эмбриогенезом. Первые 1-2 деления
эндосперма обычно проходили нормально, однако, последующее развитие было
аномальным. При отсутствии опыления ни в одном случае не было нормального
развития эндосперма. При поздних сроках фиксации отмечалась дегенерация
автономного эндосперма. Следовательно, на начальных этапах морфогенеза в
неопыленных завязях наблюдается автономный редуцированный апомиксис, но из-за
отсутствия нормально развитого эндосперма он до конца не реализуется.
Выполненное семя с гаплоидным зародышем возникает только при псевдогамии. Вместе с
тем, сама возможность автономного эндоспермогенеза имеет важное значение.
Достаточно высока вероятность, что эта автономность может быть результатом
плейотропного влияния тех же факторов, которые вызывают партеногенез,
поскольку оба признака передаются потомству как сцепленные (Tyrnov, 1997,1998).
Это может значительно упростить дальнейшую работу по созданию автономных
апомиктичных форм с автономным апомиксисом, не требующих опыления вообще.
Приведенные данные, возможно, касаются не только редуцированного
апомиксиса. Заключение об автономном характере апомиксиса часто базируется только на
цитоэмбриологическом анализе первых этапов развития зародыша и эндосперма.
Поэтому, учитывая описанный выше феномен автономного эндоспермогенеза при
редуцированном апомиксисе, необходима перепроверка аналогичных выводов и в
отношении нередуцированных апомиктов. Между редуцированным и
нередуцированным апомиксисом, вероятно, может существовать тесная связь. Например, у
земляники, для которой свойственен нередуцированный апомиксис наблюдали
редуцированную псевдогамию (Колотева, Жуков, 1994). У дигаплоидов сахарной
свеклы отмечена высокая частота (свыше 85%) нередуцированного партеногенеза
(Ширяева и др., 1989).
Нередуцированный апомиксис. При нем наблюдаются те же особенности
морфогенеза, что и при редуцированном. Так у многих псевдогамных апомиктов
(виды родов Hierochloe, Hypericum, Pennisetum, Panicum, Rubus,
Ranunculus) развитию зародыша обычно предшествует развитие эндосперма (Nogler,
1984).У псевдогамного биотипа курчавки (Atraphaxis frutescens) партеногене-
тическое развитие яйцеклетки начинается на 8-ядерной стадии эндосперма
(Ситников, 1986).
У других псевдогамных апомиктов (виды родов Botriochloa, Parthenium,
Роа, Potentilla, Tripsacum) эмбриогенез начинается до эндоспермогенеза, и
это может происходить еще до проникновения в зародышевые мешки
пыльцевых трубок (Nogler, 1984; Шишкинская и др., 1994). Такое явление опре-
182
Системы репродукции
деляют как«преждевременную эмбрионию». Партеногенетические
зародыши при этом могут достигать 100-200 клеточной стадии (например, у апо-
миктичных биотипов Potentilla). Однако затем они дегенерируют, если не
образуется эндосперм.
У некоторых видов при псевдогамии наблюдали как преждевременную, так и
нормальную эмбрионию (роды Paspalum, Potentilla). Однако такое варьирование
может быть результатом влияния внешних факторов. Так, в наших опытах с
кукурузой задержка опыления с 1-2 дней до 7-10 увеличивала частоту редуцированного
апомиксиса с 3,8% до 71,6%. Не исключено, что возраст неопыленных завязей
будет влиять на «нормальность» или «преждевременность» эмбриогенеза также и
у нередуцированных апомиктов.
У автономных апомиктов, так же как и у псевдогамных, может иметь место
преждевременная эмбриония (Hieracium, Taraxacum), или же деление яйцеклетки
начинается после начала развития эндосперма (Crepis, Cortaderia) (См. обзоры:
Поддубная-Арнольди, 1976; Nogler, 1984; Czapik, 1991). У Taraxacum officinale и
некоторых видов Pilosella (Блюднева и др., 1994; Кашин, Чернышева, 1997)
наблюдали все варианты автономного развития: только партеногенез, только эндос-
пермогенез и, наконец, партеногенез + эндоспермогенез. Темпы развития
эндосперма также могли быть различными. У сахарной свеклы при изоляции соцветий
наблюдали зародыши с эндоспермом, а также эндосперм без зародыша (Малец-
кий, Малецкая, 1996).
Обычно видам одного рода свойственен или автономный, или псевдогамный
апомиксис, но, вместе с тем, отмечена встречаемость и обоих типов у мятлика,
яблони (Nogler, 1984), поташника каспийского (Гусейнова, Курбанов, 1994). Вапо-
миктичных популяциях видов родов Festuca и Роа, по крайней мере на ранних
стадиях развития, возможны различные варианты эмбрио- и эндоспермогенеза:
зародыш половой — эндосперм апомиктичный; зародыш апомиктичный — эндосперм
половой; зародыш апомиктичный — эндосперм апомиктичный (Shishkinskaya,
1995). Способность к разным способам размножения выявлена даже в пределах
одного клона триплоидной малины: при весеннем цветении наблюдалась
псевдогамия, при осеннем — автономное развитие эндосперма (Дорогова, 1994). У
земляники без опыления автономный эндоспермогенез обычно не наблюдался. Однако,
при использовании частично инактивированной пыльцы, отмечены случаи
проникновения в яйцеклетку двух спермиев, и при этом наблюдались ядра эндосперма.
Такое явление определено как стимулятивно-автономное развитие эндосперма
(Сухарева, Батурин, 1994).
Плоидность эндосперма. При амфимиксисе у диплоидов плоидность
эндосперма, по крайней мере, при первых его делениях равна Зп; у четных полиплоидов она
кратна 3. Часть клеток эндосперма может приобретать иную плоидность вследствие
эндополиплоидии (Иоффе, 1971; Vijaraghavan, Prabhakar, 1984; Д'Амато, 1990).
При апомиксисе, такие явления, как выпадение мейоза, автономность,
псевдогамия, слияние или неслияние полярных ядер, могут существенно изменять
плоидность эндосперма. При амфимиксисе ее изменение ведет к значительным
аномалиям или к полной остановке развития эндосперма (что, естественно, влечет за собой
гибель зародыша). Эту особенность пытались объяснить с разных позиций:
нарушением соотношения геномов 2:3:2 между зародышем, эндоспермом и
материнскими тканями; несоответствием между объемами цитоплазмы и числом геномов;
Семенное размножение 183
разной«генетической ценностью» материнского и отцовского геномов эндосперма;
нарушением генного баланса в эндосперме; геномным импринтингом в эндосперме
(Nishiyama, Yabuno, 1978; Ehlenfeldt, Hanneman, 1988; Haig, Westoby, 1991).
Считают, что последнее имеет непосредственное отношение к апомиксису.
Геномный импринтинг — это явление различной экспрессии гена в
зависимости от того, получен ли он от матери или от отца. Это делает процесс развития
семени зависимым от соотношения материнских и отцовских геномов в эндосперме. В
норме оно равно 2:1. В необходимости отцовского генома для развития эндосперма
авторы видят причину широкого распространения псевдогамии, но вместе с тем
затрудняются объяснить с этих позиций автономный апомиксис, когда эндосперм
возникает без участия отцовского генома (Haig, Westoby, 1991). Имеется точка
зрения (на основе анализа плоидности эндосперма апомиктичных видов рода
Tripsacum), что эволюция апоспорового апомиксиса ограничена видами с
небольшими требованиями импринтинга или без них (Grimanelli et al., 1997).
Несмотря на существующую возможность, развитие автономного эндосперма
при гаплоидии у кукурузы никогда не шло до конца. Причина этого может быть
связана с неоптимальным уровнем плоидности эндосперма — п или 2n (Tyrnov,
1998). Имеются данные, что при псевдогамном редуцированном апомиксисе у
кукурузы эндосперм, вероятнее всего, триплоиден (Chase, 1969). При
редуцированном апомиксисе у тетраплоидного картофеля дигаплоидным зародышам
соответствует гексаплоидный эндосперм (Peloquin et al., 1995), то есть имеющий
плоидность кратную 3. Не исключено, что на базе редуцированного апомиксиса, изменив
плоидность эндосперма, например, экспериментально создав триплоиды или гекса-
плоиды, можно будет получать автономные нередуцированные апомикты. В
пользу этого говорит то, что последние у ряда видов — триплоиды.
При нередуцированном апомиксисе теоретически возможны следующие
варианты плоидности эндосперма при его автономном развитии из полярных ядер или
центрального ядра: 2х (4х); Зх (6х); 4х (8х) и т.д. Соответствие теоретически
ожидаемому наблюдалось в ряде случаев, по крайней мере, на ранних стадиях
развития эндосперма; позже плоидность части клеток, как и при амфимиксисе, могла
увеличиться вследствие эндополиплоидии. При псевдогамии плоидность
эндосперма может меняться в зависимости от плоидности и числа мужских гамет,
принявших участие в оплодотворении. Не исключено изменение плоидности
эндосперма и у автономных апомиктов, так как в некоторых случаях их полярные ядра также
могут быть оплодотворены (Nogler, 1984). При скрещивании растений разной
плоидности могут возникать нечетные полиплоиды (Зх, 5х, 7х и т.д.), и при их
переходе на апомиктичное размножение возрастает разнообразие плоидности
эндосперма. Представляют интерес скрещивания амфимиктов 2х х 4х и 4х х 2х, дающие
эндосперм с плоидностью 4х и 5х соответственно и как бы моделирующие
ситуацию при нередуцированном апомиксисе, когда слияние полярных ядер приводит к
образованию центрального ядра с плоидностью 4х, а его оплодотворение
редуцированной пыльцой при псевдогамии — 5х. Как показывают результаты
исследований (Тырнов, 1987), тетраплоидный эндосперм, как правило, не развивается, а
пентаплоидный эндосперм имеет разную степень полноценности. Дефектность
эндосперма, вероятно, зависит не только от уровня плоидности. При опылении тетра-
плоидов кукурузы разными диплоидами, особенно гибридами, мы наблюдали
разную степень развития эндосперма — от тонких пленок до половины размеров ти-
184
Системы репродукции
пичных зерновок (Тырнов, 1987). Это указывает на возможность усиления путем
отбора тенденций к формированию полноценного эндосперма при нетипичной пло-
идности. Данная проблема заслуживает специальных исследований, поскольку
вместо ожидаемого гетерозиса при апомиксисе, можно получить падение
урожайности за счет дефектности эндосперма.
Существуют и другие механизмы регуляции плоидности эндосперма.
Установлено, что к делению способны и полярные ядра и центральное ядро. Следовательно,
слияние ядер — необязательное условие митотической активности эндосперма
(Nogler, 1984). У камчатских видов мятлика развитие могло происходить после
оплодотворения одного из двух неслившихся полярных ядер (Шишкинская и др.,
1994). У апомиктичной псевдогамной линии риса обнаружены клетки эндосперма с
плоидностью Зх, 5х и Зх+2х. Предполагается, что последние произошли в
результате того, что одно полярное ядро было оплодотворено, а второе делилось без
оплодотворения (Cai et al., 1995). Кроме того, при псевдогамии может оплодотворяться
только одно полярное ядро; неоплодотворенное дегенерирует. Это можно
рассматривать, как один из механизмов снижения плоидности (Nogler, 1984; Дорогова, 1994),
вплоть до оптимального уровня или поддержания типичного соотношения геномов в
эндосперме — 2-х материнских и одного отцовского (Haig, Westoby, 1991).
Эволюционные аспекты. Считается, что отсутствие оплодотворения может
вести к различным негативным эволюционным последствиям (См. Проблемы
эволюционной значимости апомиксиса). Поэтому процесс апомиктизации, казалось
бы, в первую очередь должен затрагивать не зародыш, а эндосперм, который
выполняет кратковременные функции и не влияет на дальнейшую эволюционную судьбу
потомков. Однако, явление, когда зародыш половой, а эндосперм автономный в
природе не распространено, хотя отдельные случаи этого наблюдали при отдаленной
гибридизации (Худяк, 1963) и у некоторых апомиктов (Shishkinskaya, 1995). В чем
причина такой кажущейся «нелогичности» эволюции? Есть точка зрения, что
тройное слияние и развитие эндосперма служит барьером для случайной гибридизации,
механизмом биологической изоляции (Nishiyama, Yabuno, 1978).
Полагаем, что одна из возможных функций эндосперма связана с
сохранением стабильности полового способа размножения (Тырнов, 1987; Tyrnov,
1998). Частоты спонтанного развития зародыша без оплодотворения, видимо,
лежат в пределах 0,1 — 0,001%. Учитывая огромное число семян,
производимых в природе, даже при таких относительно небольших частотах, общее
количество возникающих апомиктичных растений могло бы достигать значительных
величин. Развитие зародыша без оплодотворения является феноменом,
постоянно сопутствующим половому способу размножения растений и создающим
реальную опасность его вытеснения апомиксисом. Следовательно, должны
быть какие-то механизмы стабилизации системы размножения, один из
которых может быть основан на взаимодействии зародыша и эндосперма. Апомик-
тичный эндосперм, как правило, имеет геномную структуру, не позволяющую
ему нормально развиваться. Недоразвитие эндосперма ведет к гибели
зародыша, а, следовательно, к элиминации форм с тенденцией к апомиксису.
С другой стороны, считается, что сочетание апомиктичного и амфимиктичного
способов размножения могут давать значительные эволюционные и
адаптационные преимущества. Утрата пыльцы привела бы к существованию только
автономных апомиктов. Наличие пыльцы при псевдогамии оставляет открытым канал воз-
Селенное размножение 185
врата к половому способу размножения и возникновению новых апомиктов при
расщеплении. В этом может заключаться одна из причин распространения
псевдогамии и, соответственно, сохранения половой природы эндосперма.
Не исключена и другая роль псевдогамии. Наблюдалось явление, которое
можно определить как «псевдогамный гетерозис» (Haskel, 1960; Schmidt, 1964);
отмечена зависимость покоя семян апомиктов и скорости их прорастания от мужского
родителя (Nogler, 1984). Поэтому можно допустить влияние эндосперма на очень
важные признаки уже сформировавшегося зародыша, а в итоге и особи.
Эндоспермальная эмбриония. Не исключено, что при апомиксисе
способностью к эмбриогенезу обладают разные клетки зародышевого мешка. У псевдогам-
ного апомикта Brachiaria setigera отмечены случаи, которые трактуют, как
возникновение зародыша из яйцеклетки, синергиды и эндосперма (Muniyamma, 1977).
Периферические клетки зрелого эндосперма вели себя как меристематические и
образовывали глобулярные или веретенообразные клеточные массы. Они были
соединены с оставшейся частью эндосперма структурой, подобной суспензору. У
этого объекта обнаружены триплоидные проростки. Косвенно триплоидность может
свидетельствовать об их происхождении из эндосперма. Однако, они могли
возникнуть и при оплодотворении нередуцированных женских гамет гаплоидным
спермием, и поэтому нужны дополнительные эксперименты для доказательства
происхождения зародыша из эндосперма (Джори, Амбегаокар, 1990).
Необычные случаи «эндоспермальной» эмбрионии обнаружены у сахарной
свеклы (Ширяева, 1986; Ярмолюк и др., 1994). В ткани эндосперма авторы
наблюдали картину, которую они трактуют, как развитие апомиктичного зародыша.
Сначала в развитом эндосперме формировались крупные, округлые инициальные
клетки-сомациты. Они после нескольких делений превращались в округлые или
неправильной формы зародыши без подвесков, которые располагались в центре
зародышевого мешка или почти в халазальной части. Отмечены случаи, когда вокруг
такого зародыша формировался свой эндосперм. Дальнейшая судьба таких
зародышей пока не установлена.
Развитие in vitro. Показано, что у партеногенетических линий кукурузы
развитие зародыша, вплоть до формирования растения-регенеранта, может идти даже
на безгормональных средах. Может развиваться также эндосперм, но это обычно
является фактором, препятствующим развитию зародыша (Алаторцева, Тырнов,
1994; Алаторцева, 1994; Alatortseva, Tyrnov, 1997). Этот факт следует учитывать
при разработке методов получения регенерантов в культуре завязей и семяпочек не
только апомиктичных, но и обычных половых форм, так как in vitro может
развиваться и зародыш и эндосперм независимо от способов размножения.
Таким образом, все имеющиеся факты однозначно говорят о том, что
взаимоотношения зародыша и эндосперма, независимо от способа размножения, является
важнейшими элементами системы репродукции растений.
Алаторцева, 1994; Алаторцева, Тырнов, 1994; Блюднева и др., 1994; Гусейнова, Курбанов, 1994;
Д'Амато, 1990; Джори, Амбегаокар, 1990; Джори, Рао, 1990; Дорогова, 1994; Еналеева,
Тырнов, 1994; Еналеева и др., 1997; Иоффе, 1971; Кашин, Чернышева, 1997; Колотева, Жуков, 1994;
Лаптев, 1984; Малецкий, Малецкая, 1996; Поддубная-Арнольди, 1976; Ситников, 1986;
Сухарева, Батурин, 1994; Тырнов, 1976, 1986, 1987, 1994; Тырнов, Еналеева, 1983; Тырнов, Завали-
шина, 1972; Худяк, 1963; Ширяева, 1986; Ширяева и др., 1989; Шишкинская и др., 1994;
Ярмолюк и др., 1994; Alatortseva, Tyrnov, 1997; Cai et al., 1995; Chase, 1969; Czapik, 1991;
186
Системы репродукции
Ehlenfeldt, Hanneman, 1988; Enaleeva, Tyrnov, 1997; Grimanelli et al., 1997; Haig, Westoby, 1991;
Haskell, 1960; Montelongo-Escobedo, Rowe, 1969; Muniyamma, 1977; Nishiyama, Yabuno, 1978;
Nogler, 1984; Peloquin et al., 1995; Schimdt, 1964; Shishkinskaya, 1995; Tyrnov, 1992,1997, 1998;
Vijayaraghavan, Prabhakar, 1984.
УЛЬТРАСТРУКТУРНЫЕ АСПЕКТЫ АПОМИКСИСА
Ультраструктурные аспекты апоспории. Ультраструктура семязачатка изучена
на ограниченном числе апомиктичных видов цветковых растений (Abeln et al.,
1984; Chapman, Busri, 1994; Vielle et al., 1995).
Формирование в нуцеллусе инициальных клеток апоспорических зародышевых
мешков было исследовано на примере Panicum maximum (Naumova, Willemse,
1995). Структурные различия между клетками нуцеллуса начинают обнаруживаться
после завершения мейоза и образования мегаспор (см. также Апоспория). В
непосредственной близости от тетрады, которая часто вскоре после образования начинает.
проявлять признаки дегенерации и гибнет, отдельные клетки нуцеллуса — будущие
инициальные клетки апоспорических зародышевых мешков, увеличиваются в
размерах, приобретают сферическую форму, их ядро и ядрышко становятся более
крупными. На первых этапах дифференциации инициальные клетки морфологически близки
к мегаспороциту, однако в дальнейшем их функциональная активность значительно
возрастает. В ядрышке, преобладает гранулярный компонент, свидетельствующий об
активном синтезе РНК. В нуклеоплазме наблюдается множество электроноплотных
образований, которые возможно представляют собой скопления молекул рибосо-
мальной РНК, транспортируемой из ядрышка в цитоплазму. Протопласт
инициальных клеток богат рибосомами и полисомами, ГЭР (последний часто находится в
непосредственной близости от ядерной оболочки и контактирует с ней),
выполняющими ведущую роль в синтезе белков. Многочисленны везикулы, транспортирующие
продукты жизнедеятельности клетки. Вакуоли средних размеров, располагаются
более или менее равномерно по всему объему клетки. Митохондрии многочисленны и
имеют хорошо развитую систему крист, что может свидетельствовать об активности
окислительно-восстановительных процессов в клетке, а, следовательно, и о ее
высоком энергетическом потенциале. Пластиды представлены лейкопластами, однако
накопления крахмала в них не происходит. Вполне вероятно, что синтезируемый
крахмал интенсивно расходуется клеткой. Оболочка апоспорической инициальной клетки
постепенно утолщается (подобное было обнаружено у Роа pratensis — Abeln et al.,
1984) и утрачивает плазмодесмы, с помощью которых ранее осуществлялся тесный
контакт с соседними клетками нуцеллуса. Утрата плазмодесм способствует большей
избирательности в поступлении в инициальную клетку метаболитов и
информационных сигналов, обеспечивая большую ее обособленность по сравнению с другими
клетками нуцеллуса. Сокращение клеточных контактов посредством утраты
плазмодесм является также характерной чертой мегаспороцитов, мегаспор и других клеток,
развитие которых не связано с апомиксисом.
Дальнейшие изменения в процессе формирования апоспорического
зародышевого мешка сопровождаются еще большим увеличением размеров и
функциональной активности клетки. Одноядерный апоспорический зародышевый мешок
имеет две крупные вакуоли у полюсов и ядро — в центре. Толщина клеточной
Семенное размножение
187
оболочки увеличивается приблизительно в семь раз по сравнению с
первоначальной. Плазмодесмы полностью исчезают, а клетки нуцеллуса, непосредственно
прилежащие к зародышевому мешку, дегенерируют. Таким образом,
апоспорический одноядерный зародышевый мешок, как и зародышевый мешок,
развивающийся после мейоза из мегаспоры тетрады, изолирован от других
жизнеспособных клеток нуцеллуса.
Апоспорический зародышевый мешок Panicum maximum развивается по
Panicum-типу. Аномалии отмечены не были. Сформированный зародышевый
мешок является четырехъядерным, его яйцевой аппарат состоит в большинстве
случаев из трех клеток (яйцеклетки и двух синергид), реже — из двух (яйцеклетки и си-
нергиды). Различия в числе клеток яйцевого аппарата, вероятно, обусловлены
спецификой положения ядер в ценоците до начала образования клеточных стенок.
Центральная клетка имеет, соответственно, одно или два полярных ядра, антиподы
отсутствуют. Каких-либо существенных различий в ультраструктурной
организации яйцеклетки и синергид апоспорического зародышевого мешка Panicum-типа у
P. maximum и зародышевого мешка Polygonum-типа обнаружено не было
(Naumova, Wilmse, 1995). Аналогичные данные были получены при исследовании
Brachiaria brizantha (Claudia et al., 1998). В халазальной зоне зародышевого
мешка Panicum-типа у гибрида в роде Pennisetum выявлено формирование выростов
клеточной стенки, которые отсутствовали у зародышевого мешка Polygonum-типа
одного из родителей (Chapman, Busri, 1994). У Pennisetum ciliare образование
клеточной стенки вокруг яйцеклетки апоспорического зародышевого мешка, из
которой затем развивался партеногенетический зародыш, наблюдалось за несколько
часов до проникновения пыльцевой трубки. Обнаруженный факт был истолкован
как препятствие к оплодотворению (Vielle et al., 1995).
Ультраструктурные аспекты диплоспории. Процесс дифференциации,
ведущий к образованию диплоспорического зародышевого мешка, может быть условно
подразделен на несколько стадий: археспориальной клетки, материнской
клетки диплоспорического зародышевого мешка, одноядерного и
сформированного диплоспорического зародышевого мешка. Каждая из этих стадий имеет
определенную морфологическую и функциональную характеристики.
Археспориальная клетка изодиаметрическая, со слабо выраженной
вакуолизацией (например, у Роа nemoralis и P. palustris — Osadchiy, Naumova, 1996;
Naumova et al., 1999). Ядро этой клетки крупное, сферическое со слабо
выраженной хроматизацией. Ядерная оболочка имеет немногочисленные поры, контактов с
эндоплазматическим ретикулумом (ЭР) не обнаружено. Ядрышко крупное с
многочисленными «вакуолями». Клетка обеднена рибосомами, полисомы также редки.
Пластиды и митохондрии имеют слабо развитые внутренние мембранные системы.
ЭР развит слабо, диктиосомы единичны и слабо функционально активны. Вакуоли
мелкие. Обнаружены лизирующие участки цитоплазмы, ограниченные двумя или
более мембранами. Клеточная оболочка довольно тонкая и содержит плазмодесмы,
которых несколько больше в халазальной части по сравнению с микропилярной.
Отмеченные признаки ультраструктурной организации археспориальной клетки у
видов Роа свидетельствуют о ее слабо выраженной функциональной активности и,
возможно, о частичной замене цитоплазмы в результате лизиса ее отдельных
участков. Аналогичную ультраструктурную организацию имеют археспориальные
клетки, претерпевающие мейоз, у других цветковых.
188 Системы репродукции
Материнская клетка диплоспорического зародышевого мешка по сравнению с
археспориальной клеткой характеризуется преобладанием длины над шириной,
усилением вакуолизации. Ее ядро остается крупным, приобретает неправильную
форму. Ядерная оболочка образует многочисленные протуберанцы и инвагинации,
ядерные поры становятся многочисленными. Хроматизация ядра остается слабой.
Ядрышко значительно увеличивается в размерах. Иногда в ядре, вблизи ядерной
оболочки наблюдаются скопления хроматина, напоминающие по форме
прикрепительные диски, которые обычно появляются в ядрах мегаспороцитов на концах
хромосом в профазе I мейоза. Наблюдается значительное увеличение количества
рибосом и полисом. ЭР также становится более развитым и концентрируется в
непосредственной близости от ядра, что дает возможность предполагать наличие его
контактов с ядерной оболочкой. Возрастает число и функциональная активность
диктиосом. Морфологическое состояние пластид и митохондрий практически
остается неизменным. Участки лизирующей цитоплазмы, окруженные мультимембран-
ными структурами, более не обнаруживаются. Клеточная оболочка утолщается,
плазмодесмы сохраняются только в халазальной ее части, но вопрос о том,
являются ли они функционирующими, остается неясным. В целом весь комплекс
указанных признаков (увеличение размеров ядрышка, возрастание количества рибосом и
полисом в цитоплазме, увеличение количества мембран ЭР и пузырьков
диктиосом, интенсивная вакуолизация клетки) свидетельствует о наличии в материнской
клетке диплоспорического зародышевого мешка интенсивных обменных процессов
между ядром и цитоплазмой, связанных с синтезом и транспортом
предшественников рибосом в ядре и белков в цитоплазме при участии рибосом, полисом, ЭР,
диктиосом и мембранных систем. Таким образом, несмотря на отсутствие при диплос-
пории нормального мейоза, структурно-функциональные процессы, происходящие
в цитоплазме, аналогичны тем, которые характерны для цитоплазмы
мегаспороцитов и мегаспор при нормальном мейозе (Dickinson, 1981; Schulz, Jensen, 1981; van
Went, Willemse, 1984; Embryology of Angiosperms, 1984). К отличительным
признакам материнской клетки диплоспорического зародышевого мешка следует
отнести отсутствие отложений каллозы на этой и последующих стадиях развития.
Такие же данные были получены при светооптических исследованиях
диплоспорических видов из родов Elymus и Tnpsacum (Crane, Carman, 1987; Carman et al., 1991;
Leblancetal., 1995).
При переходе от материнской клетки диплоспорического зародышевого мешка
к одноядерному зародышевому мешку продолжается удлинение клетки,
усиливается вакуолизация. Ядро продолжает сохранять неправильную форму. В ядерной
оболочке наблюдается множество протуберанцев и пор. Ядрышко — также
неправильной формы. Часто в ядре может присутствовать несколько ядрышек.
Рибосомы и полисомы весьма обильны во всех частях клетки. ЭР развит очень сильно, его
многочисленные цистерны ветвятся и пронизывают весь цитозоль клетки.
Контакты ЭР с ядерной оболочкой являются обычными. Диктиосомы становятся
многочисленными и проявляют высокую функциональную активность. Отдельные
профили ЭР, выполняя, очевидно, секреторную функцию, захватывают участки
цитоплазмы, приводя к ее лизису. Значительно увеличивается число и размеры пластид
и митохондрий, при этом происходит интенсивное развитие внутренних
мембранных систем. Клеточная оболочка продолжает неравномерно утолщаться,
плазмодесмы не обнаружены. Все эти показатели свидетельствуют о возросшем синтезе и
Семенное размножение
189
более активном транспорте белков. Возрастает на этой стадии также общий
энергетический потенциал клетки за счет активизации митохондрий и пластид. Утрата
плазмодесм приводит к большей изоляции одноядерного диплоспорического
зародышевого мешка от окружающих клеток нуцеллуса, обеспечивая избирательность
в поступлении веществ. Следует подчеркнуть, что указанные признаки характерны
для одноядерных зародышевых мешков как диплоспорических, так и возникших
после мейоза.
Ультраструктурные данные о сформированных диплоспорических
зародышевых мешках отсутствуют.
Ультраструктурные аспекты партеногенеза. Диплоидный партеногенез
широко распространен среди цветковых растений и, особенно, в сем. Роасеае
(Brachiaria, Panicum, Poa, Paspalum, Pennisetum, Tnpsacum) с частотой
встречаемости до 20 % и более (Savidan, 1982; Naumova et al., 1993; Naumova et al., 1995;
Martinez et al., 1994; Naumova, Wagenvoort, 1997). Гаплоидный партеногенез
спорадически встречается у представителей разных родов цветковых: Datura,
Nicotiana, Triticum, Oryza, Hordeum, Brassica, Crepis, Solarium, Zea, Gossipium и
др. (Kimber, Riley, 1963). Частота встречаемости особей, характеризующихся
наличием партеногенеза, обычно очень низка и в редких случаях превышает 1%.
Гаплоидный партеногенез может быть индуцирован экспериментально в результате
воздействия различных факторов, в качестве которых могут выступать задержка
или отсутствие опыления, гормональные или другие биологически активные
вещества, физические факторы (температура, радиационные воздействия и др.) (Asker,
Jerling, 1992). При этом наблюдается очень высокий процент образования
гаплоидных зародышей. Так, в случае с аллоплазматическими линиями Triticum aestivum
он превышает 90% (Matzk et. al, 1995).
Ультраструктурные исследования как гаплоидного так и диплоидного
партеногенеза весьма ограничены и касаются лишь немногих злаков (Hordeum —
Mogensen, 1982; Pennisetum и Panicum — Chapman, Busri, 1994; Naumova,
Willemse, 1995; Vielle et al., 1995). У Helianthus annuus изучены начальные этапы
партеногенеза, индуцированного условиями культуры in vitro (Hua Yan et al.,
1989). Сравнение тонкого строения яйцеклетки до помещения неопыленных
семязачатков в культуру и через пять дней культивирования, когда уже стали
проявляться признаки активации яйцеклетки к вступлению в партеногенез, обнаружило
сходство процессов дифференциации в условиях in vivo и в культуре in vitro. На
основании этих данных выявлены ультраструктурные преобразования яйцеклетки в
процессе ее подготовки к партеногенезу.
Обнаружено, что у аллоплазматической партеногенетической линии Triticum
aestivum яйцеклетка является уже высоко функционально активной за три дня до
опыления, когда цветок еще закрыт (Naumova, Matzk, 1997). По уровню
активности эта клетка может быть сопоставима с зиготой.
Морфологическими критериями начала активации яйцеклетки при
партеногенезе являются увеличение размеров яйцеклетки, ее ядра и ядрышка, изменение
формы и тонкого строения последних, а также структуры протопласта в целом.
Яйцеклетка, оставаясь грушевидной, увеличивается в размерах приблизительно в 2-2,5
раза, главным образом, за счет ее растяжения и увеличения степени вакуолизации
(образование крупной базальной вакуоли и множества более мелких,
располагающихся по всему объему клетки). В аналогичных пропорциях изменяются размеры
Рис. 14. Ультраструктурные аспекты апомиксиса.
1-7 — ультраструктурные аспекты развития апоспорического зародышевого мешка Panicum-типа у
Рапкит maximum: 1 — инициальные клетки апоспорических зародышевых мешков,
расположенные вблизи дегенерирующих мегаспор, 2, 3 — фрагменты инициальной клетки апоспорического
зародышевого мешка: гранулярный эндоплазматнческни ретикулум активен, расширенные профили
его концентрируются вблизи ядерной мембраны и присутствуют во всех других частях клетки,
митохондрии и полисомы многочисленны;
Рис. 14 (продолжение).
4 — два апоспорических зародышевых мешка, один из которых сформирован (Panicum-тнп), другой,
одноядерный, прилегает к халазалыюй его части, 5 — одноядерный апоспорический зародышевый мешок (увелич.),
6 — яйцеклетка и синергида апоспорического зародышевого мешка, 7 — фрагмент границы между яйцеклеткой
и центральной клеткой сформированного апоспорического зародышевого мешка, видна плазмалемма,
клеточная оболочка отсутствует; а з м — апоспорический зародышевый мешок, а и — инициальная клетка
апоспорического зародышевого мешка, д м — дегенерирующие продукты мейоза, м — митохондрии, пл — плазмалемма,
с — синергида, и к ~ центральная клетка, я р — эндоплазматнческни ретикулум, я — яйцеклетка, яд — ядро;
1,6 - х 5000, 273,7 - х 32000, 4 - х 400, 5-х 2500.
1-3, 7 — Наумова, ориг.; 4-6 — Naumova, Willemse, 1995.
192
Системы репродукции
ядра и ядрышка, возможно также появление дополнительного ядрышка. В
ядрышках преобладает гранулярный компонент, активно продуцирующий рибосомаль-
ную РНК для рибосомальных субъединиц, которые находятся в нуклеоплазме и
особенно хорошо видны вблизи ядерной оболочки. В цитоплазме в этот период
интенсивно возрастает число свободных рибосом и формируется множество полисом.
Увеличивается также число рибосом, функционирующих на мембранах ЭР и
ядерной оболочке. Ядерная оболочка характеризуется наличием множества ядерных
пор. Люмены гранулярного эндоплазматического ретикулума (ГЭР) часто
контактируют с наружной ядерной мембраной. Эти факты могут служить
доказательством активных обменных процессов между ядром и цитоплазмой. ГЭР представлен
многочисленными цистернами, различающимися по длине и ширине; часты
контакты их с аппаратом Гольджи, который продуцирует многочисленные везикулы,
поступающие в цитозоль и направляющиеся далее к вакуолям или к эндоплазматиче-
ским мембранам. Митохондрии многочисленны и более или менее равномерно
распределены по клетке; их внутренняя мембранная система умеренно развита.
Пластиды также многочисленны, представлены амилопластами. Кроме крахмала,
в качестве запасных веществ в яйцеклетке присутствуют липиды. Следует
отметить, что весьма сходную ультраструктурную характеристику имеет зигота многих
покрытосеменных (Плющ, 1992).
Оболочка партеногенетической яйцеклетки в период цветения неполная, т.е. в ее
халазальной области имеется лишь плазмалемма. У некоторых апомиктичных
представителей рода Pennisetum обнаружены выросты клеточной стенки
диплоидной яйцеклетки, что отличает ее от обычной гаплоидной яйцеклетки амфимиктич-
ных представителей этого рода (Chapman, Bursi, 1994). У P. ciliare отмечено
наличие клеточной оболочки вокруг диплоидной яйцеклетки за несколько часов до
проникновения спермия в зародышевый мешок (Vielle et al., 1995).
Таким образом морфологические преобразования партеногенетической
яйцеклетки, а именно, увеличение размеров клетки, ядра, ядрышек, и количества
последних, как и преобразования в строении клеточной оболочки, аналогичны тем,
которые характерны для зиготы.
Активация партеногенетической яйцеклетки, происходящая под влиянием
неизвестных нам стимулов, связана с интенсификацией синтеза белков. Рис. 14.
Жиров, 1967, 1969; Плющ, 1992; Abeln et al., 1984; Asker, Jerling, 1992; Carman et al., 1991;
Chapman, Busri, 1994; Claudia et al., 1998; Crane, Carman, 1987; Dichinson, 1981; Izmailow, 1986;
Hua Yan et al., 1989; Kimber, Riley, 1963; Leblanc et al., 1995; Martinez et al., 1994; Matzk et al.,
1995; Mogensen, 1982; Naumova et al., 1993, 1995, 1999; Naumova, Matzk, 1997; Naumova,
Wagenvoort, 1997; Naumova, Willemse, 1995; Osadchiy, Naumova, 1996; Savidan, 1982; Schulz,
Jensen, 1981; Vielle et al., 1995; van Went, Willemse, 1984.
ПРОСТРАНСТВЕННАЯ И ВРЕМЕННАЯ ОРГАНИЗАЦИЯ
МЕГАСПОРО- И МЕТАГАМЕТ0ФИТ0ГЕНЕЗА
У АМФИМИКТИЧНЫХ И АПОМИКТИЧНЫХ РАСТЕНИИ
Апомиксис принято считать феноменом вторичного происхождения
сравнительно с амфимиксисом. Логично предположить, что система регуляции
онтогенеза апомиктического зародышевого мешка наследовала большую часть
механизмов от аналогичной системы у амфимиктов. Кроме того, как известно, апо-
Семенное размножение
193
микты в той или иной мере сохраняют способность к амфимиксису. У некоторых
видов образование апомиктических и амфимиктических зародышевых мешков
можно наблюдать в одном семязачатке.
Анализируя процессы опыления, оплодотворения и начала эмбриогенеза у
Alchemilla pentaphylla, Strasburger (1905) обратил внимание на то, что при партено-
генетическом развитии яйцеклетка имеет очень непродолжительный период покоя. К
такому же мнению пришел и Gustafsson (1947), рассмотрев широкий круг видов. Он
высказал предположение о зависимости амфимиктического или апомиктического
развития яйцеклетки от степени синхронизации ее митотического цикла со скоростью
роста пыльцевой трубки. Согласно Rhoades и Dempsey (1966), аномалии в мейозе,
вплоть до его выпадения, обусловлены десинхронизацией его временной структуры.
Как известно, тетрада мегаспор и зародышевый мешок возникают в определенном
месте и в определенное время. Зародышевый мешок, формирующийся в более
позднее время и в ином месте, скорее всего имеет апоспорическое происхождение (как,
например, Botriochloa ishaemum — Москова, 1976).
Немногочисленные факты и предположения, подобные приведенным,
позволили высказать гипотезу о том, что специфика апомиксиса, возможно, связана с
пространственно-временными особенностями протекания микро- и мегагаметофи-
тогенеза у апомиктов (Гусаковская, Ермаков, 1986). Ныне к такому выводу
приходит все большее число исследователей.
С целью проверки предложенной нами гипотезы был проведен сравнительный
морфометрический и цитохимический анализ мегагаметофитогенеза у двух
половых (Crepis capillaris, Haplopappus gracilis) и двух апомиктических (Rudbeckia
laciniata, Taraxacum officinale) видов цветковых, различающихся по
эмбриологическим и кариологическим характеристикам (Гусаковская, Ермаков. 1988).
Мегаспоро- и мегагаметофитогенез условно можно рассматривать как
процесс развития одной репродуктивной клетки, проходящей последовательно во
времени ряд морфологически идентифицируемых стадий: 1) нуцеллярной клетки;
2) археспориальной клетки; 3) мегаспороцита перед мейозом (обособление его от
окружающих нуцеллярных клеток, заложение первичного слоя интегументально-
го тапетума); 4) мейоцита (мегаспороцита, вступившего в профазу первого
деления мейоза); 5) клетки диады; 6) клетки тетрады; 7) функциональной
мегаспоры. Размеры амфимиктической и апомиктической репродуктивных клеток и их
ядра меняются сходным образом. На стадии мейоцита они максимальны, на
стадии диады — минимальны. На стадии мегаспоры они снова достигают максимума
(Схемы 1 и 2).
Наряду с отмеченным сходством в характере роста репродуктивной клетки и ее
ядра у амфимиктов и апомиктов обнаруживается и различие, особенно в переходе
археспориальная клетка=>мегаспороцит. При амфимиксисе размер клетки и ее
ядро увеличивается в этом переходе примерно в 1,5 раза, тогда как размер апомик-
сисе — почти не меняется.
Этот факт заслуживает особого внимания. По мнению многих
исследователей, полярность зародышевого мешка определяется уже на стадии
археспориальной клетки. Возможно, это не единственная характеристика зародышевого
мешка, детерминируемая на данной стадии. Не исключено, что здесь
определяется ряд характеристик зародышевого мешка и его онтогенетических
предшественников.
Схема 1. Изменение размера репродуктивной клетки
по оси абсцисс : 1 — нуцеллярная, 2 — археспориальная, 3 — мегаспороцит,
5 — клетка диады, 6 — клетка тетрады, 7 — мегаспора; по оси ординат: разме
условных единицах. ♦ — С. caoillaris. Ш — Н. gracilis. А — Т. officinale, х —
— нуцеллярная, 2 — археспориальная, 3 — мегаспороцит, 4 — мейоцит,
1, 6 — клетка тетрады, 7 — мегаспора; по оси ординат: размер клетки (С) в
х. ♦ — С. capillaris, Ш — Н. gracilis, А — Т. officinale, х — R. laciniata
Схема 2. Изменение размера ядра репродуктивной клетки
по оси абсцисс : 1 — нуцеллярная, 2 — археспориальная, 3 — мегаспороцит, 4 — мейоцит,
5 — клетка диады, 6 — клетка тетрады, 7 — мегаспора; по оси ординат: размер ядра (N) в
условных единицах. ♦ — С. capillaris, Ш — Н. gracilis, А — Т. officinale, х — R. laciniata
Семенное размножение 195
Для объяснения наблюдаемых различий между амфимиктами и апомиктами
напрашиваются два простых предположения. Либо апомиктическая репродуктивная
клетка имеет сравнительно краткую продолжительность перехода археспориальная
клетка^ мегаспороцит и не успевает за это время вырасти в той же пропорции, что и
амфимиктическая. Либо в переходе археспориальная клетка^ мегаспороцит рост
апомиктической репродуктивной клетки по каким-то причинам задерживается или
тормозится. Какова бы ни была причина этой задержки, с нею, вероятно, связано то,
что в переходах археспориальная клетка^мегаспороцит^мейоцит апомиктическая
репродуктивная клетка и ее ядро увеличиваются в 2 раза, а амфимиктическая
репродуктивная клетка и ее ядро — в 3 раза. Возможно, эти различия свидетельствуют об
отсутствии у первой клетки к началу мейоза пула веществ, достаточного для
обеспечения двух делений мейоза. Имеющегося пула хватает лишь на одно деление.
Это предположение косвенно подтверждается результатами измерения
размера ядрышка в ядре репродуктивной клетки (Схема 3). В переходе нуцеллярная
клетка=*>археспориальная клетка ядрышко увеличивается, но у апомиктов — в
1,5-2,0 раза, а у амфимиктов — в 2,5-3,0 раза. В следующем переходе
археспориальная клетка=>мегаспороцит ядрышко у амфимиктов продолжает
увеличиваться, тогда как у апомиктов оно не меняется или даже уменьшается. Подобная
«противофазность» изменений размера ядрышка имеет место и в последующих
двух переходах мегаспороцит=>мейоцит=>диада, хотя и не выражена столь ярко.
Разный характер изменений размера ядрышка репродуктивной клетки
свидетельствует, вероятно, о неодинаковой интенсивности синтеза белков в
репродуктивной клетке в предмейотической интерфазе у амфимиктов и апомиктов. При
Схема 3. Изменение размера ядрышка в репродуктивной клетке
12
10
8
6
4
2
0
12 3 4 5 6 7
по оси абсцисс: 1 — нуцеллярная, 2 — археспориальная, 3 — мегаспороцит, 4 — мейоцит,
5 — клетка диады, 6 — клетка тетрады, 7 — мегаспора; по оси ординат: размер ядрышка (NL) в
условных единицах.^ — С. capillaris, Ш — Н. gracilis. А — Т. officinale, х — R. laciniata
196
Системы репродукции
этом общая картина изменений остается, в сущности, той же. Создается
впечатление, что в проявлении активности белок-синтезирующей системы апомиктическая
репродуктивная клетка как бы регулярно запаздывет или опережает амфимиктиче-
скую. Неясно, однако, чем обусловлены отмеченная противофазность в указанных
переходах и большее сходство исследуемых амфимиктов и апомиктов, отраженное
в схемах 1 и 2, по сравнению со схемой 3.
Сходство графиков изменения размеров самой репродуктивной клетки и ядра
указывает на наличие корреляции между этими двумя характеристиками. В связи с
этим, естественно встает вопрос о морфометрической модели мейоза. Не располагая
моделями подобного типа, мы обратились к моделям клеточного цикла, представляя
мейоз в виде двух последовательных, быстро сменяющих друг друга циклов.
Согласно одной из распространенных моделей клеточного цикла, у клеток в
стационарно растущих культурах продолжительность (Т) цикла связана со
средним размером (С) клетки в интерфазе равенством С'Т = const, где const зависит
от типа клеток. Это, по-видимому, простейшая модель связи морфометрических и
хронометрических характеристик клетки и клеточного цикла. СТ-модель вряд ли
может помочь выявить аналогичные связи характеристик репродуктивной клетки
и хронометрических характеристик происходящего с ней мейоза. Более
предпочтительной, в этом смысле, является, на наш взгляд, модель Hertwig (1908),
согласно которой, в клеточном цикле сначала рост клетки опережает рост ядра, при
этом отношение N/C снижается. Затем рост ядра опережает рост клетки,
отношение N /С увеличивается. Когда N/C достигает исходного значения,
характерного для клеток данного типа, клетка делится. Модель Хертвига неявно
предполагает, что к началу деления размер клетки и ее ядра вдвое превышают исходные
размеры. Таким образом, в начале и в конце цикла равенство отношений N/С
имеет вид N/C=2N/2C. Однако исходного значения N /С в конце цикла клетка
может достичь и при других значениях N и С. Если это имеет место, то,
возможно, клетка в ходе цикла дифференцируется. В модели Хертвига, следовательно,
изменение морфометрических характеристик клетки в ходе клеточного цикла
можно рассматривать как вероятный признак ее дифференциации.
Мы уже обращали внимание на то, что в переходах археспориальная клет-
ка=>мегаспороцит=Ф-мейоцит репродуктивная клетка и ее ядро у амфимиктов
увеличиваются примерно в три раза, тогда как у апомиктов — вдвое. Равенство
N/C в начале и в конце предмеиотическои интерфазы у первых имеет вид
N/C=3N/3C, а у вторых - N/C=2N/2C.
Как показано в ряде работ (например, Craigie, Cavalier-Smith, 1982), число
сравнительно быстро следующих друг за другом делений растительной клетки
зависит от ее размера. Моделирование двух делений мейоза подобными митотиче-
скими делениями возвращает нас к уже высказанному предположению о том, что
недостаточный рост апомиктической репродуктивной клетки в предмеиотическои
интерфазе не обеспечивает накопления пула веществ, необходимого для двух
последовательных делений. Возможно, для продолжения развития эта клетка
обязана иметь размер, не меньший некоторого минимума. Блокировка ее второго
деления осуществляется системой контроля морфометрических отношений,
действующей на уровне клетки.
По мнению Craigie и Cavalier-Smith (1982), наблюдавшиеся ими
закономерности митотических делений можно объяснить лишь в том случае, если допустить, что
Селенное размножение
197
после каждого деления дочерние клетки корректируют свой объем и делятся в
следующем цикле лишь при условии превышения объемом некоторого минимума,
характерного для клеток данного типа. Существование критического размера клетки,
по достижению которого в ней запускаются ключевые процессы, определяющие
дальнейшее течение клеточного цикла, ранее предполагал Fantes (1980).
Одной из возможных причин, ограничивающих способность репродуктивной
клетки корректировать морфометрические характеристики в ходе мейоза, является
лимит времени. При амфимиксисе основные события мегагаметофитогенеза,
очевидно, должны быть достаточно жестко скоррелированы во времени с основными
событиями микрогаметофитогенеза. При апомиксисе эти корреляции в той или
иной мере нарушаются, например, у Taraxacum officinale к моменту опыления в
завязи часто можно наблюдать уже развивающийся партеногенетически зародыш.
Вряд ли это означает, что репродуктивная система у этого вида свободна в выборе
оптимального момента индукции партеногенеза и, в частности, момента индукции
апомиктического мегагаметофитогенеза. В репродуктивном процессе, возможно,
как ни в каком другом процессе онтогенеза растения проявляется диктат известного
принципа: «out of time, out of chance».
В развитие упомянутой выше идеи Gustafsson (1947), можно предположить, что
генезис апомиксиса связан с дихогамией! — разнесением во времени двух моментов:
прогнозируемого растительным организмом момента опыления (и, следовательно,
прогнозируемого момента готовности к оплодотворению микрогаметофита) и
момента готовности к оплодотворению мегагаметофита. Дихогамия является, вероятно,
одним из наиболее архаичных и примитивных механизмов обеспечения аллогамии.
Напомним, что дихогамия встречается чаще в форме протандрии и реже в форме прото-
гинии, причем протогиничный временной сдвиг в подавляющем большинстве случаев
существенно меньше протандричного временного сдвига. Феномен дихогамии,
таким образом, имеет явно выраженную асимметрию по отношению к микро- и мегага-
метофитогенезу, что, вероятно, является не случайным. И сам феномен, и отмеченная
его асимметрия имеют место не только среди цветковых, но также среди других
высших и низших растений, для которых характерна анизогамия или анизоспория.
Все вышесказанное говорит о необходимости анализа отношения N/C в
репродуктивной клетке как характеристики, не сводимой к средним значениям N и С.
Данные об изменении ядерно-клеточного отношения (Схема 4) свидетельствуют
прежде всего о совпадении значений N/C на соответствующих стадиях развития
репродуктивной клетки у исследуемых амфимиктических и апомиктических видов.
Изменение отношения N/C в переходах археспориальная клетка^мегаспороцит
=*>мейоцит, т.е. в предмеиотическои интерфазе, согласуется с моделью Хертвига.
Если осреднить Хертвиговские колебания N /С, относящиеся к одному
клеточному циклу, для амфимиктов получается следующая картина.
Все средние значения N /С (кроме значения на стадии мегаспоры) оказываются
лежащими в узком диапазоне 0.36 — 0.39. Приведенные оценки ошибок средних
значений (3) свидетельствуют, вероятно, о жесткости удержания средних значений
системой регуляции онтогенеза зародышевого мешка, что, в свою очередь,
свидетельствует о важности этих значений.
Указанные совпадения средних значений N/C и их жесткий контроль не
составляют специфики амфимиктического мегагаметофитогенеза у исследуемых видов.
См. подробнее Дихогамия.
198
Системы репродукции
Для апомиктических видов получается сходная, в этом смысле, картина, хотя сами
средние значения оказываются несколько иными.
Другой вопрос, насколько общей является обнаруживающаяся в них
закономерность. Возможно, она имеет место лишь для некоторых Asteraceae, к которым
принадлежат исследуемые нами виды. Что же касается жесткого контроля морфомет-
рических отношений в репродуктивной клетке в процессе мегагаметофитогенеза,
то, как нам кажется, он универсален и обусловлен механизмами регуляции
онтогенеза зародышевого мешка, общими для амфимиктов и апомиктов.
Морфометрические характеристики репродуктивной клетки, по крайней мере
на некоторых стадиях ее развития, вероятно, могут быть использованы в
дополнение к традиционным эмбриологическим признакам, используемым в
систематических и филогенетических построениях. К такому выводу исследователи пришли
достаточно давно. Имея в виду работы Smith (1973,1975) по определению морфо-
метрических характеристик зародышевых мешков в роде Cornus.Herr (1984: 686)
пишет: «Among the various kinds of investigation, those directed to the female
gametophyte perhaps have the greatest potential value in taxonomic considerations». He
исключено, что морфологические и хронологические характеристики
онтогенетических предшественников зародышевого мешка, а также связи этих характеристик
могут помочь если не решить, то, по крайней мере, значительно прояснить ряд
проблем систематики и филогении.
Здесь уместно вернуться к дихогамии, как к возможному контексту
возникновения апомиксиса, и сказать о том, что временному разделению микро- и
мегагаметофитогенеза соответствует их пространственное разделение, проявляющееся у
растений в разных формах. У животных это пространственное разделение
выражено в предельной форме, благодаря способности к движению. Растения подобной
Схема 4. Изменение ядерно-клеточного отношения в репродуктивной клетке
Об"
0.5
0.4
0.3
0.2
0.1 •
0
12 3 4 5 6 7
по оси абсцисс: 1 — нуцеллярная, 2 — археспориальная, 3 — мегаспороцит, 4 — мейоцит,
5 — клетка диады, 6 — клетка тетрады, 7 — мегаспора; по оси ординат: отношение площади ядра к
площади клетки (N/C). ♦ — С. capillaris, Ж — Н. gracilis, А — Т. officinale, х — R. laciniata
Семенное размножение
199
способностью не обладают. Связь временного и пространственного аспектов гаме-
тогенеза у растений и животных носит разный характер. Поэтому аналогии,
например, между партеногенезом у растений и животных при анализе проблемы
апомиксиса могут иметь достаточно ограниченный характер.
Репродуктивный процесс у цветковых с рассматриваемой точки зрения
почти не изучен по причине очевидных трудностей, о которых свидетельствуют уже
упомянутые работы Smith (1973,1975). Соответствующие данные о морфомет-
рических характеристиках зародышевых мешков получены здесь по весьма
бедной статистике (3-5 измерений). Аналогичный анализ онтогенетических
предшественников зародышевого мешка сопряжен с еще большими трудностями. О
трудностях иного рода свидетельствует сравнительно небольшое число работ,
использующих точные количественные методы анализа репродуктивного
процесса у цветковых.
Возвращаясь к полученным нами данным, обратим внимание на близость
средних значений N/C у всех четырех исследуемых видов на стадии мегаспоры: 0.28 ±
0.04 (С. capillaris), 0.28 ± 0.02 (Н. gracilis), 0.31 ± 0.01 (Т. officinale), 0.32 ±
0.02 (R. laciniata). Эта близость свидетельствует, возможно, о том, что
достижение репродуктивной клеткой определенных значений морфометрических
характеристик на стадии мегаспоры является необходимым условием
продолжения ее развития. Выше мы сказали об особом положении археспориальной
клетки в ряду онтогенетических предшественников зародышевого мешка. Без
сомнения это относится также и к функциональной мегаспоре.
Напомним, что полученные нами данные об отношении N /С в
репродуктивной клетке определены по площадям, а не по объемам. Чтобы оценить отношение
объемов, необходимо полученное отношение возвести в степень 3/2.
Проделывая эту процедуру, мы приходим к оценке N/C—1/2 для мегаспоры. По объему
ядро мегаспоры у всех четырех исследуемых видов оказывается вдвое меньше
объема самой мегаспоры.
Нуцеллярная клетка С. capillaris и Н. gracilis имеет N/C=0,36, у Т. officinale и
R. laciniata — iV/C=0,49. Напротив, на стадии археспориальной клетки значения
N/C достаточно близки у всех четырех исследуемых видов. У археспориальной
клетки, как и у мегаспоры, объем ядра оказывается примерно вдвое меньшим
объема самой клетки. Если предположить, что такое соотношение есть обязательное
условие продолжения развития репродуктивной клетки, то снижение N /С у
апомиктов с 0,49 до 0,33 при дифференциации нуцеллярной клетки в археспориальную
примет вынужденный характер. После снижения система контроля
морфометрических отношений в апомиктической репродуктивной клетке удерживает N/С почти
в тех же пределах, какие свойственны и амфимиктической репродуктивной клетке.
Дальнейшее является лишь следствием событий, происходящих в переходе
нуцеллярная клетка=*>археспориальная клетка. Что касается последующего развития
репродуктивной клетки в амфимиктический или апомиктический зародышевый
мешок, оно происходит, вероятно, в значительной мере по одной программе, с
использованием одних и тех же механизмов.
Если гены апомиксиса проявляют себя в особенностях
пространственно-временной организации предмейотической интерфазы, то становится
понятной трудность обнаружения их экспрессии на тех уровнях, где ее обычно пытаются
искать.
200
Системы репродукции
По нашим предположениям, выделенные морфологически стадии развития
репродуктивной клетки у изученных растений совмещаются с общепринятыми
стадиями предмейотической интерфазы следующим образом:
G!=>S=>G2
нуцеллярная клетка => археспориальная клетка^ мегаспороцит => мейоцит
Результаты определения содержания нуклеиновых кислот в репродуктивной
клетке не подтверждают прямо такое совмещение (Схема 5). Следует заметить,
однако, что при использованном методе выявляется прежде всего рибосомальная
РНК, которая может составлять до 90 % от содержания всех нуклеиновых кислот
в клетке. Представленные данные свидетельствуют в пользу предположения о том,
что специфика апомиктического мегагаметофитогенеза в значительной мере
определяется в переходе от нуцеллярной клетки к археспориальной, а может быть и
раньше. Обращает на себя внимание повышение интенсивности накопления
нуклеиновых кислот в репродуктивной клетке у амфимиктов, начиная со стадии
археспориальной клетки. Апомиктическая репродуктивная клетка продолжает
накапливать нуклеиновые кислоты с той же интенсивностью. Это говорит, как будто, в
пользу сравнительной задержки роста апомиктической репродуктивной клетки.
Согласно Darzynkiewicz et al. (1981), скорость прохождения клеточного цикла и
отдельных его фаз коррелирует с числом рибосом.
Строго говоря, необходимо различать клеточный цикл и цикл деления
клетки. Последний предполагает обязательное наличие митоза, и потому его
называют митотическим циклом, или циклом деления. Вместе с тем, как из-
Схема 5. Изменение содержания нуклеиновых кислот в репродуктивной клетке
(масштабировано содержанием в нуцеллярной клетке)
4 ■
3.5-
3-
2.5
2 ■
1.5-
1
0.5-
0 -
1 2 3 4-5 6 7
по оси абсцисс : 1 — нуцеллярная, 2 — археспориальная, 3 — мегаспороцит, 4 — мейоцит, 5 — клетка
диады, 6 — клетка тетрады, 7 — мегаспора; по оси ординат: содержание нуклеиновых кислот в
относительных единицах, ф — С. capillaris, Ш — Н. gracilis, А — Т. officinale, х — R. laciniata
К( ]
Л^
^л=%
\ i
[ V ^
^хя
Селенное размножение
201
вестно, при дифференцировке клетка может проходить все стадии клеточного
цикла, не делясь, т.е. не претерпевая митоза. Такую последовательность
событий можно назвать циклом дифференцировки и включить последний в
общее название «клеточный цикл». Согласно современным представлениям, оба
цикла связаны двумя «точками» перехода — R R2 (the points of resting phase,
см. Епифанова и др., 1983), расположенными во второй половине фаз G и G2
соответственно. В точках R , R происходит задержка продвижения клетки по
циклу. Не исключено, что в этих локальных фазах задержки в
предмейотической интерфазе репродуктивной клетки осуществляется контроль морфомет-
рических характеристик, их возможная коррекция и принятие решения
относительно дальнейшего пути развития.
Гусаковская, Ермаков, 1986; 1988; Епифанова и др., 1983; Москова, 1976; Craigie, Cavalier-Smith,
1982; Darzynkiewicz et al., 1981; Fantes, 1980; Gustafsson, 1947; Herr, 1984; Hertwig, 1908;
Rhoades, Dempsey, 1966; Smith, 1973,1975; Strasburger, 1905.
ЭКСПЕРИМЕНТАЛЬНАЯ ИНДУКЦИЯ АПОМИКСИСА
IN SITU, IN VIVO И IN VITRO
Проблема экспериментальной индукции апомиксиса еще слабо разработана.
Особенно это касается дипло- и апоспории. Значительно большее внимание уделялось
индукции партеногенеза in vivo и in vitro у половых форм. Но и здесь результативность
исследований явно отстает от достижений в области индукции партеногенеза у
животных, где механизм и факторы активации яйцеклетки более или менее известны.
Имеется несколько сообщений по индуцированию у цветковых растений дипло-
и апоспории. Так, у Nicotiana tabacum в культуре незрелых завязей in vitro при
высокой температуре (37° С) происходит развитие нередуцированных мегаспор и в
дальнейшем зародышевых мешков, чего не наблюдалось при нормальной и низких
температурах (Лобанова, 1991). Это может указывать на то, что и в естественных
условиях высокая температура может увеличивать вероятность развития археспо-
риальных клеток по пути формирования нередуцированных мегаспор. Воздействие
колхицином на незрелые завязи Cucumis sativus in uiuo приводило к образованию
апоспорических и диплоспорических зародышевых мешков (Дзевалтовский, 1971,
1973). При обработке зрелых соцветий Zea mays in vivo растворами ИУК и ее
синтетическими аналогами, а также грамицидином А и С, кумарином, глутатионом,
диметилсульфоксидом (ДМСО) и некоторыми солями кальция наблюдали
формирование из клеток нуцеллуса структур, подобных инициальным апоспоровым
клеткам и апоспорическим зародышевым мешкам (Kashin, 1992; Кашин, 1993).
Успешная индукция партеногенеза получена с помощью облученной и чужеродной
пыльцы (Dore, Marie, 1993).
Но для понимания механизмов переключения на апомиктичный путь развития
наиболее информативны, вероятно, эксперименты по химической индукции
партеногенеза in vivo. В основном, правда, в них использованы формы, имеющие
генетическую склонность к апомиксису. У таких форм при обработке растворами
некоторых веществ наблюдалось увеличение выхода'апомиктичных семян по сравнению с
контролем в несколько раз. Для обработки использовались различные ауксины
(Арендт, 1960; Бритиков, 1975; Самородов, Голубинский, 1983; Романова и др.,
202
Системы репродукции
1983), кинетин (Арендт, Казас, 1978; Самородов и др., 1985), гибберелловая
кислота (Самородов, Голубинский, 1983), натриевая соль АТФ, гидролизат
казеина, аргинин, пролин (Бритиков, 1975) и т.д.
У форм, не имеющих генетической склонности к апомиксису, образование парте-
ногенетических семян вызывали: 2,4-Д (у Solarium tuberosum — Iwanada,1983),
ДМСО, колхицин и гидролизат малеиновой кислоты в парных сочетаниях (Zea
mays — Zhao, Gu, 1984), колхицин в сочетании с ДМСО (Gossypium hirsutum —
Zhou Shi-Qi et al., 1991), ДМСО (Ribes nigrum, Lycopersicon esculentum — Bep-
мель, Соловова, 1973; Cucumis sativus — Попов, 1978), брассинолид (Arabidopsis
thaliana, Brassica juncea и Tradescantia paludosa — Kitany, 1994). На уровне
активации мегагамет при обработке соцветий Zea mays были эффективны кинетин,
6-БАП, рутин, грамицидин С и Д, холекальциферол, рибофлавин, папаин, кумарин,
глутатион, НАДФ, ДМСО, этанол и некоторые соли кальция (Кашин, 1993).
Ауксины (ИУК, НУК, 2,4-Д) и гибберелловая кислота не проявляли активности.
С помощью культуры in vitro неоплодотворенных завязей и семязачатков были
получены партеногенетические зародыши, которые были способны развиваться в
растения (Hordeum vulgare — San Noeum, 1976; Oryza sativa — Asselin de Beauville, 1980;
Gerbera jamesonii — Sitbon, 1981; Nicotiana tabacum — Zhu, Wu, 1981; Triticum
aestivum — Zhu et al., 1981; Beta vulgaris — Hosemans, Bossoutrot, 1983; Zea mays —
Truong-Andre, Demarly, 1984; Allium сера — Campion, Alloni, 1990).
Однако специальные эксперименты по изучению физиологии активации
мегагамет и раннего развития партеногенетических зародышей в культуре
неоплодотворенных завязей ставятся редко. Тем не менее речь уже может идти о выявлении
некоторых закономерностей. Показано, что для активации мегагамет в культуре
неоплодотворенных завязей Panicum miliaceum необходимо 2-5-кратное
превышение в среде уровня цитокининов над ауксинами, в то время, как для
дальнейшей пролиферации — 5-10-кратное превышение уровня ауксинов над цитоки-
нинами (Кашин и др., 1999). Именно по этой причине, вероятно, для выявления
псевдогамных форм у злаков эффективна обработка соцветий водным раствором
ауксинов на стадии открытого цветка, которая приводит к развитию щуплых
зерновок со сформированным зародышем, но без эндосперма (Matzk, 1991). При этом
ауксины действуют не на яйцеклетки, а на недифференцированные зародыши,
определяя их дифференциацию, которая у псевдогамных форм происходит только
после образования эндосперма. Это указывает на участие именно ауксинов в
дифференцирующем действии эндосперма на ранний эмбриогенез.
У Triticum aestivum в культуре неоплодотворенных завязей партеногенез и апога-
метия индуцировались только относительно высокими концентрациями кинетина. В
то же время нуцеллярная и интегументальная эмбриония индуцировалась при равном
соотношении суммарной концентрации ауксинов и кинетина в среде независимо от
того, какие ауксины брались и в каком сочетании (Zhu et al., 1981; Мухамбеджанов и
др., 1991а,б). В тех случаях, когда в качестве ауксинов испытывали ИУК или НУК,
успешная индукция гиногенеза in vitro имела место либо при отсутствии в среде
ауксинов (Свирчевская, Бормотов, 1994; Bohanes et al., 1995), либо при превышении
концентрации цитокининов над ауксинами (Yang, Zhou, 1982; Павлова, 1987;
Бутара, Русина, 1988), либо при примерно равном их содержании (Doctrinal, 1990;
Campion et al., 1992). При культивировании in vitro неопыленных початков Zea mays
семена с партеногенетическими зародышами также образовывались при высоком
Семенное размножение
203
уровне кинетина в среде (2 мг/л) (Huang, Gu, 1995). С помощью иммунофермент-
ного анализа обнаружено резкое увеличение (в три раза) уровня цитокининов
(зеатин-рибозида) в завязях Triticum aestivum в период между опылением и
оплодотворением в условиях in situ (Ермаков и др., 1997).
Таким образом, можно предполагать, что именно цитокинины являются
лимитирующим фактором активации мегагамет у цветковых растений, а более
глубинный механизм этого процесса, вероятно, так же как и при активации яйцеклетки у
животных, связан с резким изменением кальциевого баланса в цитозоле мегагамет
(Kashin, 1992; Кашин, 1993; Кашин и др., 1999).
Арендт, 1960; Арендт, Казас, 1978; Бритиков, 1975; Бугара, Русина, 1988; Вермель, Соловова,
1973; Дзевалтовский, 1971, 1973; Ермаков и др., 1997; Кашин, 1993; Кашин и др., 1999;
Лобанова, 1991; Мухамбеджанов и др., 1991а,б; Павлова, 1987; Попов, 1978; Романова и др., 1983;
Самородов, Голубинский, 1983; Самородов и др., 1985; Свирчевская, Бормотов, 1994; Asselin
de Beauville, 1980; Bohanes et al., 1995; Campion, Alloni, 1990; Campion et al., 1992; Doctrinal,
1990; Dore, Marie, 1993; Hosemans, Bossoutrot, 1983; Huang Guozhong, Gu Ming-guang, 1995;
Iwanada, 1983; Kashin, 1992; Kitany, 1994; Matzk, 1991; San Noeum, 1976; Sitbon, 1981;
Truong-Andre, Demarly, 1984; Yang, Zhou, 1982; Zhao, Gu, 1984; Zhu, Wu, 1981; Zhu et al.,
1981; Zhou Shi-Qi et al., 1991.
ПРИКЛАДНЫЕ АСПЕКТЫ ГАМЕТОФИТНОГО АПОМИКСИСА
Возможность практического использования апомиксиса обсуждалась
неоднократно и отражена в ряде обзоров (Хохлов, 1971; Петров, 1979; Nogler, 1984;
Jefferson, 1994; Calzada et al., 1996).
Ряд особенностей апомиксиса — выпадение мейоза, отсутствие оплодотворения,
нерасщепляемость гетерозигот, возникновение гаплоидных спорофитов — ведет к
важным селекционным, биотехнологическим и экономическим последствиям.
Нередуцированные и редуцированные формы апомиксиса имеют
принципиально различное прикладное значение.
Нередуцированный партеногенез. Одной из главных перспектив
практического использования нередуцированного партеногенеза является закрепление гетерозиса
у гибридов в силу отсутствия у апомиктов расщепления в последующих поколениях.
У ряда культур массовое получение гибридных семян вообще затруднительно из-за
особенностей строения их цветка. Кроме того, открытость цветков, необходимая для
получения гибридов, может вести к заражению грибами и другим заболеваниям.
Поэтому гибриды многих культур (в частности такие важнейшие как пшеница, ячмень,
просо, люцерна, соя и др.) практически не используются или используются в очень
ограниченном объеме, а следовательно не добирается 20-100% потенциального урожая.
Проблема закрепления гетерозиса актуальна и для других уникальных
свойств гибридов — устойчивость к различным факторам, длина
вегетационного периода, фотопериодизм и др. Известно, что у отдаленных гибридов мейоз
идет неправильно. Обычно это ведет к стерильности. Вместе с тем,
принципиальный запрет на существование многих гибридных комбинаций видимо
отсутствует, в пользу чего говорит восстановление фертильности при аллополиплои-
дии. Поэтому, допустимо предположение, что вследствие выпадения мейоза,
можно будет получать пока неизвестные уникальные плодовитые межвидовые
204
Системы репродукции
3
гибриды и гибриды между таксонами более высокого порядка. Поэтому
желательно вовлечение апомиктичных форм в работе по соматической гибридизации
на основе слияния протопластов.
Известно, что многие неблагоприятные факторы (жара, засуха, дожди)
отрицательно влияют на пыльцу и ход опыления. Для ряда растений (бобовые, гречиха и
др.) потери урожая могут быть вызваны недостатком насекомых — переносчиков
пыльцы или их уничтожением при химических обработках. В этих случаях в силу
отсутствия оплодотворения апомиксис может существенно повысить их семенную
продуктивность.
Апомиксис целесообразно использовать также при выращивании ряда
клубненосных растений, у которых значительная часть продукции,
потребляемой в пищу, используется как посевной материал. Например, замена у
картофеля клубней на семена могла бы дать значительный экономический
эффект. Использование семян обычного картофеля невозможно, потому что он
сложный полиплоид, и половая репродукция сразу привела бы к расщеплению
с потерей сортовых качеств. При апомиксисе семена сохраняют ту же
генетическую структуру, что и клубни.
Одновременно при размножении семенами решается и другая проблема.
Известно, что при длительном вегетативном размножении наблюдается явление
так называемого «старения клонов», заражение вирусами и другими болезнями.
Это касается древесных, кустарниковых культур и того же картофеля. Чтобы
решить эту проблему используют сложные и дорогостоящие технологии микро-
клонального размножения на основе методов культуры тканей. Однако при
размножении семенами необходимость в них отпадает, поскольку
«оздоровление» идет автоматически.
У некоторых видов наиболее продуктивными являются несбалансированные
полиплоиды. В частности, у сахарной свеклы наибольший урожай корней с высокой
сахаристостью наблюдается у триплоидных форм. Семеноводство триплоидов
(основанное на скрещивании диплоидных и тетраплоидных форм) очень трудоемко и
дорогостояще. Поэтому закрепление триплоидного уровня на основе апомиксиса
заслуживает специальных исследований, тем более что у этой культуры апомиксис
регистрировался неоднократно.
С помощью апомиксиса можно предотвратить обмен генами между
культивируемыми и дикими видами. Данная проблема стоит при производстве гибридного
сорго на основе ЦМС. При этом возникают нежелательные вредные гибриды от
переопыления пыльцой дикого сородича-сорняка.
В последнее время возникла новая проблема в связи с получением трансгенных
растений. Высказываются опасения, что не исключены крайне нежелательные
последствия «генетического засорения» экосистем. С одной стороны, используемые
гены (например, устойчивости к гербицидам) могут приобрести сорняки. С другой
стороны, некоторые виды, приобретя новые свойства (например, устойчивость к
вредным насекомым), могут вытеснить другие виды ценоза. Поэтому желательно,
чтобы трансгенные растения были автономными апомиктами и не имели пыльцы
(как источника передачи генов другим видам).
Вместе с тем необходимо помнить, что данные по длительному поддержанию
сортов, линий или гибридов на апомиктичном уровне пока отсутствуют. Не
исключается — усиление мутационной изменчивости, накопление леталей, избыточная
Семенное размножение
205
гетерозиготность, анеуплоидия, переход к униплоидному состоянию и др. Эти
проблемы должны быть проработаны, чтобы не столкнуться с нежелательными
эффектами или знать как их преодолеть.
Редуцированный партеногенез. Пути практического использования
гаплоидных растений, возникших в результате редуцированного партеногенеза достаточно
разнообразны (Хохлов и др., 1976; Лаптев, 1984; Сидоров, 1990; Тырнов, 1986,
1998). Приведем главные из них с кратким изложением принципов или методов, на
которых они базируются.
1. Создание константных форм (гомозиготных линий). Обычно эта задача
решается путем самоопыления в 5-10 и более поколениях. Путем
экспериментального удвоения числа хромосом у гаплоидов эта задача решается в первом
поколении.
2. Получение анеуплоидов и транслокаций. Методы основаны на специфике мей-
оза у гаплоидов. Хромосомы у них расходятся беспорядочно к полюсам. Это
ведет к возникновению гамет с недостатком хромосом и моносомиков при
дальнейшем опылении нормальной пыльцой. К возникновению транслокаций
может вести частая конъюгация негомологичных хромосом, причиной которой
считается наличие гомологичных участков в разных хромосомах.
3. Повышение эффективности работ по отбору, клеточной и генетической
инженерии; создание мутантов и тест-объектов. Методы основаны на том, что у
гаплоидов (особенно у моноплоидов) проявляется действие всех мутаций, как
доминантных, так и рецессивных.
4. Преодоление несовместимости. Ряд полиплоидных культур имеют диплоидных
диких сородичей, обычно являющихся носителями многих ценных признаков.
Использование дигаплоидов облегчает скрещивание с этими диплоидными
видами вследствие выравнивания чисел хромосом и сближения
физиолого-биохимических характеристик, зависимых от уровня плоидности. В случае наличия
аллелей несовместимости вероятность скрещивания повышается из-за
уменьшения их числа у гаплоидов.
5. Селекция и генетический анализ комплекса признаков. Вероятность сочетания
разных групп сцепления для гаплоидов, диплоидов и тетраплоидов определяется
формулами (1/2), (1/4), и (1/36) в степени п, где п — число хромосом (генов).
Использование гаплоидов резко уменьшает число растений, необходимых при
отборе по комплексу несцепленных генов. Например, при использовании
гаплоидов одну гомозиготу по 5-ти генам можно получить среди 32 растений — (1/2) в
степени 5. При использовании тетраплоидов в аналогичном случае потребуется
свыше 60 млн растений — (1/36) в степени 5.
6. Ускоренное создание аллоплазматических линий. Традиционный метод бэк-
кроссов длителен (несколько поколений) и не всегда позволяет создавать
абсолютно точные аналоги. В некоторых случаях у гибридов женские гаметы
могут нормально возникать и функционировать только при наличии
отдельных хромосом исходной материнской формы. Поэтому даже при длительных
бэккросах их трудно или даже невозможно заместить хромосомами отцовской
формы. Материнские признаки могут также сохраняться за счет кроссингове-
ра. Использование андрогенеза (мужского партеногенеза) позволяет
избежать эти недостатки и получать нужные линии, в том числе с ЦМС уже в
первом поколении.
206
Системы репродукции
7. Создание нередуцированных апомиктов. Редуцированный партеногенез может
быть наследуемым (обусловленным генотипом материнского родителя) и нена-
следуемым (индуцированным). Наследуемые формы представляют интерес
для дальнейшего синтеза нередуцированных апомиктов на основе объединения
признаков партеногенеза, нередукции и нормального развития эндосперма
(Тырнов, Еналеева, 1983; Тырнов, 1994; Tyrnov, 1997).
Изложенное касается в основном проблем практической селекции. Однако
наряду с этим гаплоиды могут использоваться для решения теоретических задач. К
ним относятся: геномный анализ и эволюция геномов, генетика и морфология мейо-
за, генетика количественных признаков и доза генов, определение функциональной
диплоидизации полиплоидов, контроль гомо- и гетерозиготности, генетический
груз и его элиминация, гетерозис.
Лаптев, 1984; Петров, 1979; Сидоров, 1990; Тырнов, 1986,1994,1998; Тырнов, Еналеева, 1983;
Хохлов, 1971; Хохлов и др., 1976; Calzada et al., 1996; Enaleeva, Tyrnov, 1997; Jefferson, 1994;
Nogler, 1984; Tyrnov, 1997.
РОД ALCHEM1LLA L. (СЕМ. ROSACEAE) — КЛАССИЧЕСКИЙ ОБЪЕКТ
ДЛЯ ИЗУЧЕНИЯ ФАКУЛЬТАТИВНОГО АПОМИКСИСА
Род Alchemilla L. (манжетка) насчитывает более 1000 видов,
распространенных в Евразии и Африке (Frohner, 1995). Отдельные его представители занесены
человеком в Австралию, Новую Зеландию и Северную Америку.
Классические труды Murbeck (1901, 1902) и Strasburger (1905) положили
начало исследованиям воспроизведения манжеток. К настоящему времени
эмбриологически изучено в разной степени не более 100. видов (Hjelmquist, 1956;
Rutishauser, 1967; Мандрик, 1976, 1980; Глазунова, 1977, 1987; Izmailow, 1984,
1986, 1994; Chapik, 1994). Большинство видов Alchemilla — факультативные
апомикты, и только некоторые — амфимикты. Виды манжетки, особенно факуль-
тативно-апомиктические, характеризуются поливариантностью путей мегаспоро-
генеза, мегагаметофитогенеза.
Эти особенности позволяют рассматривать род Alchemilla в качестве модели
для выяснения роли дублирующих структур в обеспечении надежности семенной
репродукции по стратегии исследования, разработанной Батыгиной (1994).
Манжетка стала одним из объектов для широкого изучения свойств агамных
комплексов и выяснения эволюционных преобразований видов в условиях ограничения
полового процесса (Грант, 1984).
В семязачатках Alchemilla, как и у других розоцветных (Fragaria, Potentilla),
закладывается многоклеточный археспорий, который после ряда митотических
делений формирует спорогенный комплекс (Солнцева, 1965; Rutishauser, 1967). В
соответствии с разработанным способом обозначения топографии такого
комплекса (Rutishauser, 1967), описано строение и прослежены преобразования его клеток
на примере манжеток (Глазунова, 1977, 1983, 1987).
Клетки спорогенного комплекса располагаются в виде продольных рядов:
центральный, по бокам два латеральных и два париетальных. Снизу вверх в рядах
различают первичный, вторичный и последующий мегаспороциты. В центральном
первичном мегаспороците чаще всего наблюдается.мейоз, но может проходить и
Семенное размножение
207
анэумейоз (нарушенный мейоз). Латеральный и париетальный первичные
мегаспороциты претерпевают анэумейоз. В результате мейоза образуется тетрада
редуцированных мегаспор, а анэумейоза — диада нередуцированных мегаспор. В одном
■ и том же соцветии возможно осуществление всех выше перечисленных путей ме-
гаспорогенеза. Жизнеспособные мегаспоры преобразуются в материнские клетки
редуцированных или нередуцированных зародышевых мешков. В случае
дегенерации мегаспороцитов центрального продольного ряда (или их производных) в
материнскую клетку зародышевого мешка могут преобразовываться производные от
деления мегаспороцитов латеральных рядов. Анэумейоз мегаспороцитов приводит
к диплоспории. Митоз соматических клеток нуцеллуса может привести к
появлению нередуцированных апоспор — апоспории. Редуцированный зародышевый
мешок из мегаспоры развивается по Polygonum-типу. Нередуцированные
зародышевые мешки развиваются по Taraxacum-типу, но без слияния полярных ядер. Из
апоспор нередуцированные зародышевые мешки развиваются по Hieracium-типу
(Глазунова, 1984). На основании имеющихся данных виды рода Alchemilla можно
разделить на три группы: эуспоровые (амфимиктические), диплоспоровые и
апоспоровые (факультативно-апомиктические).
Развитие пыльника и формирование мужского гаметофита у отдельных видов
идет нормально. После симультанного образования тетраэдрических тетрад
микроспор формируются пыльцевые зерна, имеющие фертильность 90-95%. Пыльцевые
зерна двухклеточные, продолговато-сфероидальные, меридионально-трехборозд-
но-оровые; контур их гладкий, текстурный рисунок сетчатый, экзина двухслойная.
У большинства же видов наблюдаются нарушения в микроспорогенезе и
функционировании тапетума, что приводит к стерильности пыльцы ( иногда до 100 %),
появлению аномальных пыльцевых зерен, недоразвитию пыльников, при этом
стерильность пыльцы меняется по годам (Глазунова, 1983). Как отмечал Strasburger
(1905), пыльники раскрываются только в том случае, если в них преобладают
нормальные пыльцевые зерна.
Пыльца обнаружена на рыльце плодолистиков раскрытых цветков.
Агентами переноса являются насекомые и вода. В бутонах непосредственно перед
раскрыванием пыльца на рыльцах не обнаружена. Однако, в зародышевых мешках
таких бутонов присутствуют либо неоплодотворенные яйцеклетки Либо
двухклеточные проэмбрио (партеногенез) при неразрушенных синергидах и неслив-
шихся полярных ядрах.
У видов амфимиктов описано двойное оплодотворение с последующим
нормальным развитием семени. У видов факультативных апомиктов случаи
двойного оплодотворения редки. Чаще у них наблюдается партеногенетическое
образование зародыша при псевдогамии: 2-7-клеточный появившийся в бутоне
зародыш будет развиваться в случае оплодотворения полярных ядер в
раскрытом цветке. У некоторых видов обнаружено автономное развитие зародыша и
эндосперма.
В дополнение к половому и партеногенетическому способам образования
зародыша у отдельных видов отмечены случаи апогаметии (A. acutiloba) и ложной полиэм-
брионии (A. baltica). При дегенерации спорогенного комплекса можно обнаружить в
халазальной части семязачатка и в основании интегумента адвентивные зародыши
(нуцеллярная и интегументальная эмбриония). В одном и том же соцветии
образуются зародыши разной плоидности (полового и соматического происхождения).
208
Системы репродукции
Рассмотрим конкретные особенности разных видов манжетки, начиная от
настоящих амфимиктов и переходя к диплоспоровым, а затем и апоспоровым
факультативным апомиктам. Как пример вида амфимикта можно привести А.
pentaphyllea из Центральных и Южных Альп. Центральный мегаспороцит
многоклеточного спорогенного комплекса после мейоза образует четыре гаплоидные
мегаспоры. Развитие единственного зародышевого мешка идет по
Polygonum-типу. Зародыш и эндосперм возникают в результате двойного
оплодотворения. У четырех других альпийских видов (A. fissimima, A. trullata, A.
sabauda и A. pentaphylloides) в норме образуется половой зародыш. Однако
отмечены также зародышевые мешки, характерные для апогаметии, и
дегенерирующие семязачатки (Strasburger, 1905).
Для восточноевропейских видов, объединяемых под названием Alchem'dla.
vulgaris L. s.l., свойственна диплоспория в сочетании с апоспорией, хотя иногда
встречается и эуспория. Все эти пути мегаспорогенеза обнаружены у A. sarmatica и
подробно исследованы у A. filicaulis и A. glaucescens (Плиско,1970; Глазунова,
1984,1987). У двух последних видов в цветках на рыльцах регулярно можно
обнаружить довольно много пыльцевых зерен как нормального, так и аномального
строения. Развитие мужских генеративных структур у этих двух видов идет
по-разному. У A. glaucescens все годы наблюдений сохранялась 100 %-ная
стерильность пыльцы из-за дегенерации микроспор (Глазунова, 1981). У A. filicaulis
мейоз в микроспороцитах обычно проходит правильно или с редкими нарушениями
(Глазунова, 1983). Фертильность пыльцы у этого вида в разные годы меняется от
86 до 48%. В раскрывающихся пыльниках преобладают пыльцевые зерна
нормального строения. Недоразвитие пыльников и пыльцы у восточноевропейских
манжеток отмечалось и ранее (Юзепчук, 1941).
Редкие картины двойного оплодотворения обнаружены на препаратах опыленных
цветков A. baltica, A. glaucescens и A. heptagona. После этого проходит нормальное
развитие зародыша и эндосперма. Но чаще у перечисленных видов, а также у А.
acutiloba и A. filicaulis наблюдали партеногенетическое образование зародыша при
псевдогамии. Автономный партеногенез в отсутствие псевдогамии отмечен у А.
sarmatica (Плиско, 1970).
Таким образом, изученные манжетки группы видов A. vulgaris L. s.l.
характеризуются значительной вариабельностью эмбриологических процессов, но
чаще у них можно обнаружить диплоспорию с нередуцированным
партеногенезом. Эти виды нельзя считать облигатными апомиктами, так как у них
созревает много фертильной пыльцы, а также реализуются (хотя и редко) эуспория и
половой процесс.
Для сравнения приведем данные разных авторов по развитию женской
сферы видов, встречающихся за пределами восточной Европы. Для африканских
видов A. johnstonii и A. argyrophylla описана дегенерация центрального мегас-
пороцита после нарушенного мейоза (Hjelmquist, 1956). Зародышевые мешки
возникают из клеток — продуктов деления латеральных и париетальных мегас-
пороцитов. У европейских видов A. speciosa и A. alpina наблюдали в
центральном и латеральных мегаспороцитах нарушенный мейоз с образованием диад
(Strasburger, 1905). Здесь же обнаружено появление апоспоровых
зародышевых мешков из халазальных клеток нуцеллуса. Такие же процессы образования
зародышевых мешков описаны у A. monticola a A. subcrenata (Мандрик, 1976,
Семенное размножение
209
1980). Т аким образом, сочетание диплоспории и апоспории свойственно
многим видам манжетток.
Лишь в немногих работах приведены количественные данные о соотношении
разных типов образования зародышевых мешков в пределах одного вида. В этом
плане интересны сведения о среднеевропейских видах секций Calicinae и
Coriaceae (Izmailow, 1984, 1986). У них также выявлены диплоспория и
апоспория. Так, у A. incisa в 90% семязачатков встречаются апоспорические
зародышевые мешки, в 8% семязачатков — оба типа зародышевых мешков, в 2% — дип-
лоспорические. Образование зародыша и эндосперма у изученных видов этих
двух секций происходит без участия спермиев (автономно) и обозначено как
нередуцированный партеногенез. Признаков опыления или оплодотворения не
обнаружено. Пыльники содержат дегенерирующую пыльцу. Развитие зародыша
идет по Geum-типу (Soueges, 1923). Отмечено, что в 35 % семязачатков
развитие зародыша и эндосперма шло синхронно. В 39 % случаев развитие зародыша
начиналось раньше эндосперма, в 26 % — эндосперм начинал развиваться раньше
зародыша. В итоге, можно охарактеризовать апомиксис у изученных видов
секций Calicinae и Coriaceae как нередуцированный партеногенез на базе апоспории
в сочетании с более редкой диплоспорией.
Сравнение изученных видов манжетки по способам образования зародыша
позволяет выявить переход от видов с регулярным обновлением генетической
информации (мейоз, половой процесс, гамоспермия) к видам с преобладанием семян с
матроклинным наследованием (агамоспермия — частично диплоспория,
апоспория и, как следствие, нередуцированный партеногенез, а также адвентивная эм-
бриония); при некоторых случаях диплоспории предполагается возможность
изменения генетической информации (Rutishauser, 1967). Реализацию разных путей
образования семян в пределах вида мы трактуем как способ повышения
надежности семеношения.
Если раньше виды манжетки считались облигатными апомиктами (Юзепчук,
1941) , то современные цитоэмбриологические данные свидетельствуют о наличии
у них факультативного апомиксиса, который является преобладающим. Это
заключение основано на следующих фактах:
1. наличие половых и агамных видов, способных скрещиваться;
2. осуществление амфимиксиса и апомиксиса на базе единой структурной
организации семязачатка и спорогенного комплекса;
3. осуществление нормального и нарушенного мейоза при мегаспорогенезе;
4. развитие в соцветии мужских и женских гаметофитов с редуцированным и
нередуцированным числом хромосом;
5. осуществление двойного оплодотворения и его отсутствие или выпадение
одного из звеньев (сингамия);
6. реализация запасных способов образования зародыша в случае дегенерации
спорогенного комплекса (апоспория — нередуцированный партеногенез,
адвентивная и нуцеллярная эмбриония);
7. обеспечение надежности семеношения вида за счет тотипотентности клеток
семязачатка и лабильности эмбриональных процессов;
8. поддержание целостности системы скрещивания вида путем осуществления
мейоза и полового процесса. Рис. 15.
Рис. 15. Развитие эмбриональных структур у апомиктичных
представителей рода Alchemilla.
1-7 — формирование спорогенного комплекса у A. filicaulis (1-4, 6) и yA.glaucescens (5, 7);
;<Ч5
йдаяй^
ШМ1
^й 1М
4-3JH
а з ju
V- 'А*
тм
Ш
Рис. 15 (продолжение).
8-9 — зародышевые мешки: диплоспорические, апоспорические и нормального типа, развивающиеся
одновременно у A.glaucescens (8) и зрелый зародышевый мешок нормального строения у A.filicaulis (9);
Рис. 15 (продолжение).
10-24 — микроспорогенез и развитие пыльцевого зерна в норме yA.fdicaulis, пыльцевые зерна
разных размеров (22-24);
214
Системы репродукции
Батыгина, 1994; Глазунова, 1977, 1981, 1983, 1984, 1987; Глазунова, Пермяков, 1980; Грант,
1984; Демченко, 1967, 1974; Мандрик, 1976, 1980; Плиско, 1970; Солнцева, 1965; Юзепчук,
1941; Czapik, 1994; Frohner, 1995; Hjelmquist, 1956; Izmailow, 1984,1986,1994, Miirbeck, 1901,
1902; Rutishauser, 1967; Soueges, 1923; Strasburger, 1905.
ПРОБЛЕМА ЭВОЛЮЦИОННОЙ ЗНАЧИМОСТИ АПОМИКСИСА
Эволюционная роль апомиксиса — одна из важных проблем
репродуктивной биологии, которая неизменно пользуется повышенным вниманием
исследователей. Первая оценка апомиксиса, высказанная Darlington (1937) и Stebbins
(1941), была скорее негативной, ибо апомиксис считался аномалией, а
возможность прогрессивной эволюции апомиктичных форм полностью отрицалась.
Апомиксис рассматривался как механизм, позволяющий виду пережить
неблагоприятный период жизни, когда внешние условия препятствуют
осуществлению полового процесса.
Такая точка зрения в историческом ракурсе не была случайной. Начиная с работ
Менделя, половой процесс рассматривался как венец эволюции системы
размножения растений, значение которого обусловлено, в первую очередь, наличием
механизмов, обеспечивающих генетическую рекомбинацию, т.е. мейоза и
оплодотворения. Именно они создают тот запас наследственной изменчивости, который
необходим для осуществления эволюционного процесса (Шмальгаузен, 1940; Smith,
1971; Айала, 1984, 1988). При этом рекомбинационный эффект выражен тем
сильнее, чем генетически разнороднее вступающие в скрещивание компоненты.
Апомикты, утратившие мейоз и связанную с ним генетическую рекомбинацию,
были объявлены неконкурентоспособными по сравнению с половыми формами и
бесперспективными в эволюционном плане (Комаров, 1940; Stebbins, 1941;
Gustafsson, 1946-1947; Козо-Полянский, 1948; Баранов, 1960). Особенно
категорично высказался Stebbins (1941), который назвал апомиктичные виды
«эволюционными тупиками» и «закрытыми системами», неизбежно обреченными на
вымирание. Близкой точки зрения придерживались и другие известные ученые. В
частности, по мнению Дубинина (1984) особи апомиктичной популяции
представляют собой как бы многочисленные слепки с одного генотипа, они лишены
эволюционной пластичности и при смене условий неизбежно уступают место
половым видам. «Апомиксис, связанный с утратой полового размножения — эта плата
за частную приспособленность» — пишет автор (Общая генетика, 1984, стр.
396). В связи с потерей апомиктами эволюционного потенциала он считает эту
плату слишком большой.
Несомненно, что распространению такого взгляда на эволюционную роль
апомиксиса в значительной мере способствовала недостаточная изученность этого
явления и, в первую очередь, степени его распространения в различных группах
растений и взаимоотношений апомиктов с «сексуальными сородичами».
Абсолютно противоположная оценка эволюционного значения апомиксиса
была высказана Хохловым (1946). Он считал апомиксис закономерной ступенью
эволюции системы размножения покрытосемянных, отражением присущей ей
тенденции к редукции гаметофита. В подтверждение идеи позитивной эволюционной
роли апомиксиса (Хохлов, 1967; Хохлов, Малышева, 1970) приведен целый пере-
Семенное размножение 215
чень признаков биологического прогресса апомиктичных видов: широкое
распространение апомиксиса у покрытосемянных, приуроченность его к молодым и
прогрессивным систематическим группам, широкие географические ареалы и высокая
численность особей апомиктичных видов в природе, чрезвычайная
таксономическая дифференциация и колоссальный внутривидовой полиморфизм, высокая
семенная продуктивность и др. По некоторым из них апомикты значительно
превосходят соответствующие половые формы. Опираясь на данные молекулярной
генетики, он указал ряд потенциальных генетических механизмов, способных
компенсировать отсутствие у апомиктов мейотической рекомбинации (Хохлов,
1970). Хохлов выдвинул смелое предположение о том, что на определенном этапе
эволюции апомиктичные виды вытеснят половые, и на Земле наступит эра
апомиксиса. По мнению Петрова (1979), гипотеза Хохлова явилась закономерной
реакцией на недооценку эволюционной роли апомиксиса многими его современниками.
Начиная с 50-х годов эволюционное значение апомиксиса впервые ставится в
зависимость от сохранения им связи с половым процессом (Clausen, 1954; Wet de,
1965,1968,1971 a,b; Wet de, Harlan, 1963,1970 а, в; Wet de, Stalker, 1974; Nogler,
1984). Наибольшая эффективность приписывается системам размножения,
основанным на тесном взаимодействии апомиксиса и амфимиксиса. Для
подтверждения этой точки зрения авторы использовали данные, полученные при изучении
агамных комплексов — естественных сообществ, включающих разные биотипы
одного или нескольких близких видов (Babcock, Stebbins, 1938). В состав агамно-
го комплекса входят группы особей, имеющие разный уровень плоидности и
разные способы размножения (половой, факультативно и облигатно апомиктичный,
вегетативный). Между этими группами осуществляется постоянный обмен
генетической информацией. Апомиксису в таких комплексах отводится, в основном, роль
механизма, сохраняющего формы с нестабильной генетической конституцией
(гаплоиды, полиплоиды, анеуплоиды, гибриды). Основная нагрузка, по мнению
авторов, приходится на факультативные апомикты, которые осуществляют
необходимую для сохранения гетерозиготности и полиморфизма популяций связь с
половыми видами. Факультативные апомикты могут одновременно использовать оба
альтернативных способа семенного размножения: апомиктичный и половой. Это
делает систему размножения и самих апомиктов, и популяции в целом, динамичной,
гибкой, обеспечивая процветание агамных комплексов.
Агамных комплексов описано достаточно много (см. Грант, 1984). Анализ их
генетической структуры показал, что эволюционным потенциалом обладают те из
них, которые не являются панапомиктичными. Апомиксис вообще крайне редко
оказывается единственным способом размножения какой-либо систематической
группы: облигатные автономные апомикты, если они действительно существуют, в
чем сомневаются некоторые исследователи (см. Рубцова, 1989), являются скорее
исключением. Большинство же популяций апомиктов характеризуется
факультативным апомиксисом, чаще всего псевдогамного типа.
Следует отметить, что Wet de и Stalker (1974) отводят апомиксису более
скромную роль по сравнению с половым размножением, подчеркивая, что высоко
адаптированные агамные комплексы процветают потому, что они являются факультативно
половыми, а не потому, что они размножаются апомиктично. Ни апомиксис, ни
полиплоидия, по мнению авторов, не дают популяции каких-либо преимуществ, которых
не обеспечивала бы половая система размножения. Основная роль апомиксиса, с их
216
Системы репродукции
точки зрения, сводится к тому, что он помогает избежать стерильности
возникающим за счет рекомбинаций генетически несбалансированным генотипам. Важен не
сам по себе способ размножения, считают авторы, а достижение необходимого
баланса между механизмами, обеспечивающими сиюминутную выгоду (адаптацию) и
механизмами, создающими изменчивость. Слишком высокая изменчивость так же
вредна для популяции, как и слишком низкая. Баланс может быть достигнут за счет
одновременного использования разных способов размножения.
Более высокую оценку вклада апомиксиса в эволюционный процесс дают
Read и Bashaw (1969). По мнению авторов, даже короткий контакт между
половыми и апомиктичными формами с фертильной пыльцой может продуцировать
массу новых гибридов. При условии изоляции в природе возникающие апомик-
тичные формы, морфологически отличные от родителей, с течением времени
могут стать новыми видами.
Наиболее основательно эта проблема затронута в работах Петрова (1957,1964,
1979,1988), который считал, что в сочетании с половым размножением апомиксис
способен обеспечить длительное существование вида при изменении условий
окружающей среды и стать основой для прогрессивной эволюции. Исходя из гипотезы
существования ряда рецессивных генов, контролирующих разные элементы
апомиксиса, он утверждает, что накопление таких генов в составе генетического груза
популяций растений-перекрестников, переход их в гомозиготное состояние и затем
их сочетание при гибридизации приводят к появлению различных форм апомиктич-
ного размножения. Широкая и далеко идущая «миграция» этих генов в соседние
виды и роды приводит к появлению константных гетерозисных видов и
разновидностей, легко проникающих в ранее недоступные экологические ниши и
закрепляющихся в них (Петров, 1988).
На апомиксис, как важный фактор видообразования, указывали и другие авторы
(Doll, 1974; Urbanska-Worytkiewicz,1974; Глазунова, 1976; Dujardin, Hanna, 1987).
Даже облигатный апомиксис не обязательно становится эволюционным
тупиком (Петров, 1988). Сохранение облигатными апомиктами в той или иной степени
пыльцевой фертильности способствует их гибридизации, что впоследствии
заканчивается либо возвратом гибридов к половому размножению, либо стабилизацией
апомиксиса. Здесь можно добавить, что причиной возврата облигатных апомиктов
на половой путь воспроизводства может быть также анеуплоидия, как и в случае с
дисомией (Зп+2) у триплоидных одуванчиков (Sorensen, 1958) или переход на
более низкий уровень плоидности (Хохлов и др., 1976). Так же, как и сами апомик-
ты, «выщепляющиеся» из них половые формы могут представлять интерес с
эволюционной точки зрения. Gustafsson (1942) считал, что такая «производная
сексуальность очень важна для происхождения новых биотипов». На примере видов
Potentilla показано, что при возврате с апомиктичного на половой способ
размножения производится большое число новых биотипов, стабилизирующихся в
последующих поколениях (Muntzing A., Muntzing С, 1943).
Вышеизложенную точку зрения на эволюционную роль апомиксиса,
основным постулатом которой является признание необходимости взаимодействия
апомиксиса и амфимиксиса, в той или иной мере разделяет большинство
современных исследователей (Savidan, 1978, 1992; Asker, 1981, 1993; Nogler, 1984;
Shishkinskaya, 1991; Asker, Jerling, 1992; Jankun, 1993; Koltunov, 1993; Cai et al.,
1995; Batygina, 1999).
Семенное размножение
217
Совсем недавно в работе Кашина (1998) высказана гипотеза, несколько
усиливающая оценку апомиксиса в качестве одного из факторов эволюции.
Опираясь на данные популяционной генетики (Carson, 1982; Алтухов, 1989),
он считает, что половой процесс обеспечивает единство структуры вида и
создает мощные барьеры на пути возникновения надвидовой изменчивости.
Факультативный апомиксис, по мнению автора, снимает эти барьеры и ведет к
«взрыву» формообразовательных процессов сальтационного характера. При
достижении хромосомной сбалансированности возникшие апомиктичные формы
реверсируют к облигатно половому воспроизводству и, в конечном итоге,
трансформируются в «биологические виды».
Говоря об эволюционной роли апомиксиса нельзя не коснуться его
редуцированных форм (гаплоидии). Хохлов и соавторы (1976) рассматривали гаплоидию как
механизм деполиплоидизации полиплоидов, выдачи скрытой генетической
информации или возврата из «генетического плена» исходных видов. Например, у апо-
миктичных видов Род, Аиепа, Dactylis были выделены полигаплоиды, которые
напоминали другие виды или подвиды соответствующих родов. Кроме того, при
наличии у покрытосемянных вполне установленной связи способа размножения с
уровнем плоидности (половые виды — диплоиды, апомикты — полиплоиды),
возврат полиплоидов на диплоидный уровень обеспечивает агамному комплексу
необходимые преимущества полового размножения (гибридизация, рекомбинация,
избавление от леталей, отбор адаптивных и гетерозисных комбинаций). С другой
стороны, функционирование нередуцированных гамет ведет к повышению уровня
плоидности и восстановлению апомиктичного способа размножения.
Процесс деполиплоидизации может способствовать преодолению барьеров
нескрещиваемости, возникающих при сочетании форм с разными уровнями плоидности, за
счет выравнивания этих уровней или уменьшения числа генов несовместимости.
Существуют и другие возможности участия гаплоидов в эволюционном
процессе. В результате аномального течения мейоза у гаплоидов могут
формироваться гаметы с несбалансированными числами хромосом. Их оплодотворение ведет к
образованию анеуплоидного потомства, плодовитость которого может
обеспечить апомиктичное размножение. Кроме того, у гаплоидов нередко наблюдается
конъюгация негомологичных хромосом, что может стать причиной транслокаций
и, как следствие, кариотипической и геномной реорганизации (Тырнов, 1986а).
Известна еще одна форма редуцированного апомиксиса — андрогенез
(мужской партеногенез). В результате проникновения спермия в яйцеклетку и гибели ее
ядра возникают своеобразные «ядерно-цитоплазматические гибриды». Хорошо
известно, что цитоплазма может влиять на многие важные признаки, такие как
гетерозис, устойчивость к неблагоприятным факторам, нескрещиваемость,
стерильность, степень мутабильности и др. Поэтому смена плазмона может служить
фактором изменчивости и повышения адаптивного потенциала (Тырнов, 1986б).
Опираясь на данные, накопленные за последние десятилетия, можно
констатировать, что эволюционная роль апомиксиса многообразна и не ограничивается
сохранением и воспроизведением ценных генотипов. Факультативный апомиксис
расширяет границы геномной рекомбинации за счет вовлечения в половой процесс
нередуцированных гамет (Vielle, 1992; Martinez et al., 1994). При одновременном
использовании двух способов образования зародышей в семенах — апомиксиса и
амфимиксиса — растение производит потомство, обладающее разной генетиче-
218
Системы репродукции
ской конституцией и разными репродуктивными системами (Berthaud et al., 1995;
Noirot, 1995). Оно является более конкурентоспособным и, следовательно, будет
иметь больше шансов сохраниться и влиять на генофонд популяции. Если
сочетание апомиксиса с амфимиксисом реализуется у большого числа особей популяции,
то это приводит к увеличению информационных потоков (Campbell, 1995), к
возрастанию генетического полиморфизма популяции, к усилению роли синтезогене-
тических и сальтационных факторов эволюции (Кашин, 1998), т.е. такая система
размножения становится двигателем эволюционного процесса. Генетически
несбалансированные формы (гаплоиды, анеуплоиды, нечетные полиплоиды, гибридо-
генные производные), раз возникнув, могут стать основой для конструирования
новых стабильных генотипов. Эти новые формы, сохраняя за счет устойчивого апо-
миктичного размножения длительную репродуктивную изоляцию, могут с
течением времени трансформироваться в новые виды. Изменения, накопившиеся у них за
период изоляции, могут обеспечить сохранение ими видового статуса, даже при
условии смены способа размножения.
Таким образом, согласно современной оценке, апомиксис, вносит существенный
вклад в эволюцию растений, вполне сравнимый с тем, который обеспечивается
амфимиксисом. Взаимодействие апомиксиса и амфимиксиса в рамках одной системы
семенного размножения создает наиболее благоприятные условия для
прогрессивной эволюции видов.
Айала, 1984,1988; Алтухов, 1989; Баранов, 1960; Глазунова, 1976; Грант, 1984; Дубинин, 1984;
Завадский, 1966; Кашин, 1998; Козо-Полянский, 1948; Комаров, 1940; Петров, 1957, 1964,
1970,1979,1988; Поддубная-Арнольди, 1940,1976; Рубцова, 1989; Тырнов, 1986а, б; Хохлов,
1946, 1967, 1970; Хохлов, Малышева, 1970; Хохлов и др., 1976; Шмальгаузен, 1940; Asker,
1981; Asker, Jeriing, 1992; Babcock, Stebbins, 1938; Berthaud et al., 1995; Cai et al., 1995; Cambell,
1995; Carson, 1982; Clausen, 1954; Darlington, 1937; Doll, 1974; Dujardin, Hanna, 1987; Gustafsson,
1942,1947; Harlan, deWet, 1963; Junkun, 1993; Koltunov, 1993; Martinez etal., 1994; MuntzingA.,
Muntzing G., 1943; Nogler, 1984; Noirot, 1995; Read, Bashaw, 1969; Savidan, 1978, 1992;
Shishkinskaya, 1991; Smith, 1971; Sorensen, 1958; Stebbins, 1941; Urbanska-Worytkiewicz, 1974;
Vielle, 1992; Wet de, 1965,1968,1971 a, b; Wet de, Stalker, 1974.
THE EVOLUTION OF GAMETOPHYTIC APOMIXIS1
ЭВОЛЮЦИЯ ГАМЕТОФИТНОГО АПОМИКСИСА
Gametophytic apomixis (referred to as apomixis hereafter) is an anomaly wherein
sexual development in ovules fails, unreduced embryo sacs form, and unreduced eggs
develop into embryos without fertilization (parthenogenesis). In apomicts, the endosperm
may develop pseudogamously or autonomously, i.e. with or without fertilization of the
central cell. The evolutionary events responsible for the origins of these anomalies are
poorly understood. Unfortunately, as noted by Asker and Jeriing (1992), we have not
knowingly witnessed the birth, in nature, of a successful apomict. Observing such an
event, i.e. discovering a successful apomict and the immediate sexual parents from which it
arose, would permit a much more rapid elucidation of the critical events — be they
mutagenic or recombinational.
The author thanks Randy Bayer for helpful suggestions during the preparation of this paper
Семенное размножение
219
Two divergent hypotheses have been advanced in recent years to explain the
evolution and genetic regulation of apomixis. The first, and most popular of recent
years, claims apomixis arose by one to a few apomixis-specific mutations (Mogie,
1992; Grimanelli et al., 1999). Those endorsing this hypothesis point to, as evidence,
genetic analyses suggestive of simply inheritance. The second is the duplicate-gene
asynchrony hypothesis, which claims apomixis results from rare secondary contact
hybridizations in which specific combinations of rare ecotype-specific alleles induce
asynchronous (apomictic) development (Carman, 1997, 1999). According to this
hypothesis, apomixis may arise in diploid hybrids, interracial autopolyploids, and
allopolyploids.
Hypotheses for the origins of apomixis
The simple inheritance mutation hypothesis. This hypothesis is widely accepted
(Nogler, 1984, 1994; Mogie, 1992, 1994; Grimanelli et al., 1999; Sherwood, 1999).
Recent versions include naturally-occurring preconditions that are considered critical for
apomixis to evolve. Mogie (1992) suggested that a preexisting tendency for haploid
parthenogenesis could allow a single dominant meiotic mutation at one of many loci to
cause apomixis. Two or more mutations would be required in the absence of the
parthenogenesis precondition.
Another precondition is an absence of an endosperm balance number requirement. In
plants, a single reduced sperm nucleus (paternal, P) fuses with two fused but reduced
embryo sac nuclei (maternal, M) to initiate endosperm formation, and this 1P:2M genome
ratio is often essential for successful endosperm formation. Many apomicts comply with this
requirement in that a single reduced sperm nucleus fuses with a single unreduced maternal
nucleus (Haig, Westoby, 1991). Hence, the«unreduced state»of both eggs and
centrally-located nuclei in embryo sacs of apomicts may in some cases fulfill genomic
requirements for zygotes and central cells, respectively. However, two unreduced embryo
sac nuclei unite to form the central cell in apomictic Tripsacum dactyloides, which results in
a 1P:4M genomic ratio. Apparently this species does not have an endosperm balance
number requirement. According to the mutation hypothesis, the probability of apomixis
becoming stabilized should be higher in plants without a 1P:2M requirement when the
appropriate meiotic mutation(s) occur. Furthermore, the presence or absence of such
preconditions may explain why apomixis is generally restricted to certain families (Nogler,
1984; Norrmann et al., 1994; Grimanelli et al., 1999).
A shortcoming of the mutation hypothesis is that it does not readily explain facultative
expression wherein normal and fully functional sexual development occurs at varying
frequencies. To explain this, Mogie (1992) suggested that the mutant allele permits
facultative sexuality because it is heterozygous and only mostly dominant. Heterozygosity is
maintained because the wild type allele is required in somatic cells. Mogie further speculated
that the apomixis allele is dominant in generative cells and the wild-type allele is dominant in
vegetative cells because of a different «cellular» environment. This and similarly complex
explanations are required to explain inconsistent genetic analyses (ratios of sexual to
apomictic progeny) when apomicts are crossed to other apomicts or to different sexual
species (Carman, 1997).
The duplicate-gene asynchrony hypothesis. Tenets of the new hypothesis.
According to the duplicate-gene asynchrony hypothesis, apomixis is caused by
hybridization through which rare combinations of divergent genetic backgrounds (auto or
alloploid) are produced. The divergent genetic backgrounds contain specific
220
Системы репродукции
combinations of divergent alleles, possibly involving many loci, and these are responsible
for apomixis (Carman, 1997). Specific tenets of this hypothesis include:
— secondary contact hybridization among ecotypes differing in
environmentally-regulated schedules of floral development causes apomixis, and this may accompany
major climatic changes; apomixis may arise in diploids, interracial autopolyploids,
allopolyploids and paleopolyploids;
— apomixis requires cooperation between two asynchronously-expressed sets of floral
genes (Fig. 1); each set usually belongs to a separate ecotypically-divergent genome;
— the asynchronous expression that causes apomixis is controlled by rare ecotype-specific alleles
that regulate start times and durations of various phases of floral development (Fig. 1);
— polyploidy is prevalent in apomicts because it enhances i) parthenogenesis, it) male
fertility in allopolyploid and possibly interracial autopolyploid apomicts, and in) the
physical and functional partitioning of genomes in nuclei;
— loss-of-function mutations that improve fitness by eliminating maladaptive aspects of
asynchrony, may accumulate in natural populations of apomicts;
— mutations, deletions, chromosomal aberrations, and between-genome
recombinations may cause reversion to sexuality (monospory, bispory, tetraspory, or
other anomalous forms) by preventing, to varying degrees, the genomes from
competing in development.
Levels of genetic control. Figure 1 reveals several potential levels of regulation
for controlling the type of apomixis expressed (Fig. 2) and the frequency in which
sexual development occurs (facultativeness). For apomixis to occur, two schedules of
female development must be expressed asynchronously (Fig. 1). Thus, the first level of
control involves the timing in which floral development occurs during each schedule.
The respective«start times»are regulated by alleles that respond differentially to both
environmental and phenological maturity stimuli. This level of control (allelic variation
for flower initiation) is responsible for environmentally-induced variations in the degree
of facultativeness observed in some apomicts (discussed below).
The second level of control involves the rates at which the divergent
developmental programs advance through their various stages. For apomixis to
occur, the developing megaspore mother cell (MMC) must be immature and
unable to respond during the time in which the meiosis-inducing BI genes are
precociously expressed. Variations in this and the first level of control influence the
type of diplospory expressed, whether it be Antennaria-type (no signs of an initial
meiosis), Taraxacum-type (a disturbed meiotic prophase through a restitutional
first division), or some other type (Fig. 2; Carman, 1997). This level of control
also influences autonomous endosperm formation, which is associated with
Antennaria-type diplospory (Asker, Jerling, 1992; Fig. 2).
The third level of control involves variable expressivity of the two or more
asynchronously-expressed female developmental programs. Cross-genome gene
silencing is common in hybrids and polyploids (Soltis D., Soltis P., 1993), and if one
ovule development program is sufficiently suppressed, sexual development, encoded by
the second ovule development program, will ensue without interruption. This level of
control (genetic and epigenetic variation in expressivity) influences within-population
facultativeness, and is influenced by such things as ploidy level and the nutritional status of
the plant (see Asker, Jerling, 1992, for a review of within-population variation in
facultativeness).
Sexual ancestor 1:
Temporally advanced
Floral induction alleles
»г N г fii
X X/
of is» <*V
Megasporocyte formation
ED
Megasporogenesis ш
GS Bl
EH
as
Embryo sac formation щ
О CI
о
Sexual ancestor 2:
Temporally delayed
; Apomictic derivative:
i Intermediate phenotype
Precocious
parthenogenesis common
Autonomous endosperm / л'
formation somewhat common
Floral induction alleles
Megasporocyte formation
Embryo sac formation
Fig. 1. The duplicate-gene asynchrony hypothesis.Three columns of floral development are portrayed. The
left and right columns represent sexual species differing in timing of development with regard to environmental
and phenological maturity stimuli (genetic background). The middle column represents the intermediate
phenotype (apomixis), which is observed when hybrids or amphiploids are derived from two
ecotypically-divergent ancestors. Columns of horizontal lines represent gene cassettes controlling development.
Two criteria cause apomixis. First, two sets of genes, encoding floral induction through early embryony (left and
right columns), must be asynchronously expressed. The divergent floral induction alleles inherited from the
ecologically-divergent ancestors cause asynchrony. Second, cooperation between genes, belonging to the divergent
schedules of development, must occur as diagramed. The megasporocyte (MMC) develops from vegetative
tissues and reflects an "intermediate phenotype" between the "out-of-sink" floral schedules of the ancestors.
Megasporogenesis genes from the advanced schedule (multiple arrows by B,) are expressed too early and fail to
induce a complete meiosis from the immature MMC (see Fig 2). However, the accumulation of signals from B,
induces C, and C2, which cause embryo sacs to form from MMC (diplospory) or from adjacent nucellar cells
(apospory, compare with Table 1-S). The accumulation of signals from B, may prevent further expression of
megasporogenesis signals (see text). Precociously-expressed embryo sac, embryony, and endosperm inducing
signals (multiple arrows) in apomicts are responsible for precocious embryo sac development, parthenogenesis, and
autonomous endosperm development, respectively.
Antennaria -type
diplospory
Tataxacum -type
diplospory
Normal sexual
development
/ Time frame in
which mciosis
may be aborted
(callosic cell walls
generally absent)
©
Precocious embryo
formation common >
Autonomous endosperm
formation somewhat common
Cell walls r^
w/o calloseLJ
'' Time frame in which ^
mciosis may be aborted ^|_J
v (callosic cell walls rare) /
/>i
Cell walls K, >£
with callosc4
- -?!Ьадея
"-fmb,
r!°0'o
«cs
- M
^^,cs
Pollination/fertilization-
Autonomous endosperm
formation rare
Embryo v
Endosperm —-*■■£■
Hieracium-type
apospory
g Time frame in
$ which aposporous ч
w initials form (callosic *. ,-.
"о wall deposits of meiocytc^1 [T®]
о often abnormal) / ^
Cell of
ovule wall-
Precocious embryo/'
formation common
Autonomous endosperm
formation rare
Fig. 2. Normal sexual development in ovules of flowering plants plus two forms of diplosporous and one
form of aposporous apomixis. The three diagramed forms of apomixis begin with asexual uninucleate embryo sac
formation. The position along the megasporogenesis line to which the apomictic uninucleate embryo sacs most
closely correspond represents the average stage of sexual development in which the respective anomalies are hrst
detectable cytologically. The dotted lines radiating from the uninucleate embryo sacs represent the range in which
the anomalies are first detected cytologically. Apomictic embryo sac formation is most precocious in
Antennaria-type diplospory, and it effectively eliminates megasporogenesis. In Taraxacum-type diplospory, the
precocious expression of embryo sac formation occurs slightly later and disrupts the initial stages of meios.s. borne
aspects of both an ongoing meiosis and an ongoing embryo sac formation occur simultaneously in 1 araxacum-type
megaspore mother cells, e.g. the first cell division of meiosis occurs but the nuclear division is restitutionally mitotic,
not meiotic. In Hieracium-type apospory, the superpositioning of both meiosis and embryo sac formation is often
complete, i.e. meiosis often proceeds normally from the megaspore mother cell at the same time embryo sac
formation is occurring in an adjacent nucellar cell of the ovule wall. The aposporous embryo sacs, which usually
develop first, digest the products of meiosis.
Семенное размножение
223
A fourth level of control appears to be responsible for bispory, tetraspory, polyembryony,
several unusual forms of apomixis, and several other anomalies of female development
(Carman, 1997). These more bizarre anomalies generally occur in paleopolyploid diploids,
i.e. diploidized polyploids containing physically or epigenetically-fragmented (silenced)
genomes, or polyploids containing paleopolyploid genomes (Carman, 1997). They
combine aspects of two asynchronously-expressed pathways and/or switch between
asynchronously-expressed programs such that certain developmental phases are repeated
(one or more times) or deleted(Fig. 3). These complex but consistent forms of
development are proba bly caused by specific deletions or mutations, chromosomal
aberrations, and/or epigenetic forms of genome silencing (Carman, 1997). In contrast,
development, though asynchronous, is more normal in common forms of apomixis (Fig. 1),
which tend to occur in neopolyploids (polyploids containing complete genomes).
Other levels of control involve preexisting conditions of the progenitor species that
increase viability of the apomict once asynchrony is established. The presence of multiple
archegonia, which means the MMC may originate from one of several«archegoniaI»cells,
is one of these. In most species, a single cell develops a high level of developmental
competency for MMC formation. However, in species with multiple archegonia, each
archegonial cell is competent of forming a MMC, and most aposporous apomicts occur in
such taxa (Asker, Jerling, 1992).
Floral tissues in general express multiple developmental competencies. Ovary, ovule,
embryo sac, and embryo formation are readily induced from floral cells and tissues in vitro
but not from adjacent nonfloral tissues (Carman, 1990). Consequently, species exhibiting
high levels of competency in nucellar cells (such as those with multiple archegonia) are more
likely to express apospory when the required asynchrony, as diagramed in Figure 1, is
present. According to the duplicate-gene asynchrony hypothesis, preexisting tendencies for
parthenogenesis, which often occur in polyploids (Randolph, Fischer, 1939; Bierzychudek,
1985), and a preexisting absence of an endosperm balance number requirement increase
the likelihood of apomixis becoming stabilized in hybrids where the progenitors express
appropriately-divergent schedules of female development.
Mutant or wild-type alleles? The following sections discuss the origins of
apomixis with regard to paleoclimatology, phytogeography, genome evolution, Mendelian
analyses, physiological genetics, and polyploid evolution. Emphasis is placed on how well
observations in these disciplines are explained by the mutation hypothesis versus the
duplicate-gene asynchrony hypothesis.
Phytogeography, paleoclimatology, and the origins of apomixis
Phytogeography and the apomixis birth rate. Nearly all apomicts are polyploids
with restricted distributions and centers of diversity within the mid latitudes (Asker,
Jerling, 1992). Stebbins (1971) believed these observations are evidence that most
apomicts are of recent origin (Pleistocenic). Such conclusions are also based on
taxonomic complexity, fossil records (or the lack thereof), ploidy relationships where
higher ploidy levels generally indicate more recent origin (Stebbins, 1971; Gentry, 1986;
Asker, Jerling, 1992), and rates of molecular divergence (Crawford, 1989). Youthful
apomicts with distributions contained within a broader range of sexual progenitor species,
such as occurs in Bouteloua (Grant, 1971), Hieracium, and others (Asker, Jerling,
1992), probably arose during or shortly after the end of the last glacial retreat, which
occurred between 20 ky and 8 ky before present (BP). In contrast, apomicts with
Polygonum-type 8-nucleate monospory (mixis)
Q
Taraxacum-type 8-nucleate diplospory (apomixis)
0®
Antennaria-type 8-nucleate diplospory (apomixis)
Hieracium-type 8-nucleate apospory (apomixis)
Allium-type 8-nucleate bispory (mixis)
Adoxa-type 8-nucleate tetraspory (mixis)
™
Fig 3 Normal and anomalous forms of ovule development. The left, middle, and right lines represent meiosis,
embryo sac formation, and embryo and endosperm formation, respectively. Where lines overlap portions of two
developmental processes occur simultaneously. Where a line is truncated, the respective process is replaced by another.
Apomixis usually occurs in polyploids containing two or more complete genomes. Bispory and tetraspory usually occur
in paleopolyploids containing two or more fragmented paleopolyploid genomes. Thus, two essentially complete ovule
development pathways may be required for meiosis to transform into embryo sac formation followed by parthenogenesis
(apomixis). In contrast, some genes for meiosis and some genes for embryo sac formation are expressed simultaneously
in bispory and tetraspory, which are sexual. This fragmented expression reflects the fragmented nature of the gene
cassettes in paleopolyploid genomes. Mutations are not required to explain these anomohes: all are readily explained by
substitution-of-function phenomena involving gene cassettes derived from complete genomes (apomicts) or multiple
fragments of genomes (some apomicts, but mostly bisporic and tetrasporic species).
Семенное размножение
225
broader distributions (within larger regions of continents) that tend to fill and transgress
those of their putative sexual progenitors, e.g. apomicts in Crepis, Dicanthium,
Eupatorium, Parthenium, Rubus, Townsendia (Asker, Jerling, 1992), and Antennaria
(Bayer, 1996), may have evolved during earlier glacial periods.
Geologic evidence suggests that as many as 26 major glacial periods occurred during
the past 3 My (see Frakes et al., 1992, for a review). During these periods, the east west
and north south distributions of recently-evolved plants (including apomicts), which are
capable of overwintering glacial cycles in lower elevation or lower latitude refugia, are often
expanded. Such expansions accompany the cyclical shifting of climates associated with
the advance and retreat of continental ice. For example, during the retreat of the
Wisconsin ice in North America, plant associations in the northern great plains of the US
shifted, within a few thousand years, from a boreal spruce forest, which was extant at the
glacial maxima, to the expansive grasslands of today (Wells, 1970). During this
transition, species that had recently evolved in the southern Rocky Mountain cordillera,
possibly including the apomict Antennaria foggii (Chmielewski, 1994), migrated across
the forested«great plains»and became established in the mountains of eastern North
America (Miller, Thompson, 1979; Webb, 1988). Such climate-induced vegetative
shifts permitted new species, which evolved primarily as a result of secondary contact
hybridization during earlier glacial events (from 100,000 to 3 My BP), to migrate across
continents. Hence, apomicts with a very restricted distribution are probably of very recent
origin, while those of a more regional to continental distribution may have evolved during
previous glacial cycles. Youthful apomicts in this latter category include continental
endemics within Crataegus (Dickinson et al., 1996), Amelanchier, Cotoneaster, Malus,
Sorbus (Campbell, Dickinson, 1990), Taraxacum (Richards, 1973), Erigeron (Huber,
Leuchtmann, 1992), Antennaria (Bayer, 1996), Calamagrostis (Nygren, 1946), and
Poa (Kellogg, 1990).
Also important to the phytogeographic expansion of apomicts is their capacity for
occasional hybridization with related sexual and apomictic species or ecotypes. Such
events produce apomictic hybrid swarms (agamic complexes) with expanded ecological
plasticities (Stebbins, Major, 1965; Bierzychudek, 1985; Stebbins, 1985; Kellogg,
1990; Soltis D., Soltis P., 1993; Murray, 1995; Bayer, 1996; Ellerstrand et al., 1996).
A well documented example of expanded phytoecological capacity is found in the
Antennaria rosea agamic complex. The facultative apomict A rosea, which occurs almost
exclusively as a dioecious female, has differentially assimilated, at various locations from
close to the arctic circle to the US Mexican border, many unique ecological tolerances
and morphologies of at least eight sexual diploids (personal observations, Bayer et al.,
1991; Bayer, 1996). This has occurred through i) classical sexual introgression (n + n)
and ii) B[n hybridization wherein unreduced eggs of A rosea (almost always $) are
fertilized by reduced sperm from a related sexual species, and this results in progeny of
increased ploidy (2n+n). Both mechanisms increase the ecological capacity of the
progeny, which are usually apomictic.
Some tropical apomicts in the subfamily Panicoideae (Panicum, Pennisetum,
Setaria, etc.) have multi-continental distributions suggestive of a more ancient origin
(Asker, Jerling, 1992). The mechanism of apomixis in many of these grasses is more
derived, e.g. 4-nucleate embryo sacs form. In contrast, unreduced 8-nucleate embryo
sacs are more primitive (much closer to normal sexual reproduction) and typically occur in
recently evolved apomicts (Reddy, 1977).
226
Системы репродукции
The birth dates of the more ancient apomicts may also be correlated with climatic
deteriorations. A major cool period occurred during the Eocene, about 45 to 55 My BP
(Fig. 4). Angiosperms prior to this time had experienced only warm tropical to warm
desert climates, i.e. cool nights and cold winters had not previously occurred during the
age of angiosperms, even at the poles, which had supported, prior to this time, only
tropical and subtropical species (Frakes et al., 1992). With the onset of the Eocene cool
period, high latitude species, adapted to tropical climates and long days, migrated to lower
latitudes where they probably hybridized with related species or ecotypes, which were
adapted to tropical climates but short days. Ancient apomicts may have evolved during
these periods of secondary contact hybridization among species or ecotypes that had
previously been adapted to different latitudes.
N
Latitude
80
60
40
20
0
20
40
60
80
I
J Ice and tundra
У/////Л Mixed coniferous
ESSSa Broadleaved
deciduous
kxxxi Broadleaved
evergreen
3 Paratropical
rainforest
ШШ1 Tropical
rainforest
70 60 55 45 40 20 10 5
Millions of years before present
Fig. 4. Global climate deterioration and the evolution of modern angiospermous families. From 135 to 70 My
BP, the global climate was mostly tropical and only tropical angiosperms existed. Modern temperate-climate families
began evolving at about 60 My BP, which parallels the deterioration of the climate. A mid Eocene cool period occurred
at about 45 My BP, after which the climate warmed. From 40 to 5 My BP, the climate cooled, and many more
temperate-climate angiosperms evolved (summarized from Webb, 1988; Frakes et al., 1992).
Most apomicts evolved within 2% of the life span of angiosperms.
Plant-migration/apomixis-birth-date associations are most evident for youthful apomicts
(< 3 My old), which constitute the majority (Asker, Jerling, 1992). This 3 My time period
represents less than 2 % of the entire duration of angiosperm evolution (140+ My) and less
than 4 % of the evolutionary duration of modern angiospermous families (about 65 My, see
Taylor, Hickey, 1996; Stewart, Rothwell, 1993). Thus, unless apomicts are evolutionary
dead ends (Darlington, 1939), conditions during the Pleistocene greatly accelerated the
birth rate. The evolution of many new apomicts in 33 well-differentiated families during less
than 4 % of the duration of modern angiospermous families is strong evidence against
mutation-based hypotheses for the evolution of apomixis.
It may be argued that apomixis is, as Darlington (1939) suggested, an evolutionary
dead end, that the apomixis birth rate has been constant during most of the 140+ My of
Семенное размножение
111
angiosperm evolution (due to constant rates of mutation), and that the vast majority of
apomicts went extinct during the climatic shifts of the Pleistocene. However, this is not
supported by current theory. As noted above, the geographic ranges of apomicts tend to
expand rapidly throughout the range of their sexual progenitor species (Bierzychudek,
1985; Murray, 1995; Bayer, 1996), which, during the Pleistocene, should have
included mid and lower latitude areas where plants adapted to higher latitudes grew
during periods of glacial maxima. Hence, if the apomixis birth rate were constant, the vast
majority of apomicts should be of ancient origin with intercontinental distributions.
Multiple convergences of divergent ecotypes occurred during the
pleistocene. The quest to understand the Pleistocenic proliferation of apomicts
logically starts with an analysis of the climates during which sexual and apomictic
angiosperms evolved. The earliest confirmed angiospermous fossils are found in strata
from 140 My BP, i.e. during the Valanginian age of the early Cretaceous (Taylor,
Hickey, 1996). From then until the early Paleocene (about 65 My BP), temperate
climates did not exist on earth, i.e. the vegetation from the north to south poles
consisted of tropical rainforest to warm desert species (Fig. 4). Nevertheless, the
fossil record from the early Cenozoic (60 My to 65 My BP) contains representatives
from many extant angiospermous families, which had become well differentiated by
this time (Taylor, 1990). Except for an acute Eocene cool period (45 to 55 My BP,
Fig. 4), the cooling of the earths climate was gradual from 60 My to 20 My BP
wherein many angiospermous genera and species representative of modern temperate
floras evolved. A more rapid deterioration of global climate occurred from 20 My to 3
My BP and culminated in the first of approximately 26 ice ages. The most severe of
these occurred during the Pleistocene, which started 1.6 My BP and ended 10 ky BP
(Frakes et al., 1992; Stewart, Rothwell, 1993). The late Pliocenic and Pleistocenic
glaciations consisted of eight major glacial/interglacial cycles, which occurred at
about 100 ky intervals during the past 800 ky, and numerous minor glacial cycles that
occurred from about 3 My BP until about 800 ky BP (Frakes et al., 1992).
The cyclical climatic deteriorations and ameliorations of the Pleistocene caused
frequent large scale plant migrations. During each cycle, many mid to high latitude
ecotypes migrated to lower latitudes where they«overwintered»with lower latitude
ecotypes for thousands to tens of thousands of years (Fig. 5). Much secondary contact
hybridization occurred during these cycles (Stebbins, 1971,1985; Bartlein, 1988; Soltis
D., Soltis P., 1993) in both the northern and southern hemispheres (Fig. 5), e.g. Chile
and Argentina south of 40° С latitude and the south island of New Zealand were
glaciated during the most recent glacial cycles (see Huntley, Webb, 1988, for reviews).
A critical variable influencing the locations in which high frequency secondary contact
hybridization occurred during the ice ages was a general lack of temperature depression at
the tropics during glacial maxima. If temperatures in the tropics had been depressed to the
same extent as those in high latitudes, then both high and middle latitude species and
ecotypes would have migrated to lower latitudes, many tropical species would have
become extinct, and high frequency secondary contact hybridization would have been
minimized. But paleoclimatological evidence indicates that this did not occur. Mean
annual temperatures near the equatorial tropics during peak glacial periods were
depressed by only 3 ° to 4 °C (Huntley, Webb, 1988; Villagran, 1990). Thus, during
glacial maxima, thermal gradients starting at the mid latitude continental ice sheets (40 °
to 50 north and south latitude) and ending at the largely unaffected tropics (20° to 25 °
north and south latitude) were extremely steep (Fig. 5). Within this zone (about 20 to
50 ° latitude), high latitude ecotypes converged with mid latitude ecotypes, and frequent
secondary contact hybridization and polyploidization, involving related ecotypes and
species, occurred.
During glacial maxima, mid to higher latitude alpine and tundra ecotypes migrated to
refugial areas in the mid latitude mountains adjacent to low elevation valleys that
supported subtropical to temperate ecotypes (Fig. 5). Zones of high frequency
secondary contact hybridization and polyploidization occurred in these areas along
altitudinal gradients, e.g. numerous neoendemics in the Sierra Nevada mountains of
California formed in this manner (Stebbins, Major, 1965). Palynological studies of lakes
and bogs document a rapid northward migration of forbs, shrubs, and trees that followed
the retreat of continental ice at the end of the last ice age (Webb, 1988). The rapidity in
which revegetation occurred suggests that the ecotypes involved remained adapted
(genetically-fixed) to high latitudes during their various overwintering periods.
Most major glacial advances were dissected many times by minor interglacial periods
that lasted for only a few thousand years (Frakes et al., 1992). Thus, it is possible that 80
to 100 major climate-induced large-scale migrations of plant associations (Fig. 5)
occurred during the past 3 My. As described below, these geologically-frequent and
cyclical convergences of latitudinally-divergent but related ecotypes greatly increased the
frequency of polyploid formation. Furthermore, they occurred in the locations and during
the times in which most apomicts evolved, and they constitute the only natural history
phenomena directly linked with the explosion of new apomicts during the Pleistocene. It is
unclear how such events could have caused apomixis-specific mutations.
CE
3 Polar Ice
3 Herb tundra
r^rxi Shrubland
c*i*ya Woodland
iws4 Mixed Conifers
яшл BL deciduous
ювяяяя BL evergreen
irrrrrm Paratropical
Г777Л Tropical
Stages of continental glaciation
Fig. 5. General effects of continental glaciation on plant migration. Cosmopolitan plants are those with broad
latitudinal distributions and include many of the putative sexual progenitors of apomicts. About 26 glacial cycles
occurred during the past 3 My (see text). Most included periods in which the ice receded for several thousand years
after which it advanced again. These cyclical shiftings of climates and plants caused an unprecedented amount of
secondary contact hybridization between previously isolated and distinct ecotypes of the same or closely related species.
Семенное размножение
229
Genomes, phytogenies, and the origins of apomixis.
Apomixis occurs in at least 126 angiospermous genera (Carman, 1997), which is
0.94 % of those recognized by the Kew Botanical Gardens (Brummitt, 1992).
Eighty-four of these (67 %) belong to Asteraceae, Poaceae, or Rosaceae. Apomixis
occurs quite infrequently in an additional 30 families, and it has not been reported in the
remaining 430 families (Carman, 1995,1997).The.<4steraceae, Rosaceae, and Poaceae
are among the largest families of angiosperms and are perhaps the most cosmopolitan, i.e.
their individual members tend to have broad latitudinal distributions.
Apomixis is only one of several somewhat common anomalies of female development in
angiosperms. Such anomalies are frequently categorized as i) asexual, such as gametophytic
apomixis, polyembryony, and other more unusual forms of vegetative propagation, and ii)
sexual, such as bispory, tetraspory, abnormal premeiotic chromosomal condensations, and
the sequential formation of megasporangia (Davis, 1966; John et al., 1992; Carman,
1997). It is tempting to think of apomictic mechanisms as representing major developmental
deviations from the norm and polysporic mechanisms, where sexual reduction occurs (Fig.
3), as less deviant. This is an incorrect anthropomorphism. While apomixis effectively
eliminates meiosis, embryo sac development is usually much more normal in apomicts
(Chapman, Busri, 1994; Naumova, Willemse, 1995) than in polysporic species (Johri et
al., 1992; Carman, 1997). Furthermore, apomicts tend to contain stable genomes with low
base numbers and few stabilized base numbers per genus. In contrast, polysporic species
tend to contain unstable, highly derived, paleopolyploid (diploidized) genomes with high
base numbers and multiple stabilized base numbers per genus.
Apomictic Normal Polyembryonic Polysporic
Reproductive category
Fig. 6. Bar graph depicting i) the mean (SE) number of different chromosome base numbers per genus (bases
per genus) for genera known to occur in each given reproductive category (apomictic, normal, polyembryonic,
and polysporic), and ii) the mean (SE) chromosome base number of genera known to occur in each category. A
subsample of 72 sexual monosporic genera was selected at random and used for the "normal" category.
"Polyembryonic" has reference to bisporic and tetrasporic genera combined. Bars not represented by the same letter
are significantly different according to Tukeys Multiple Comparison Test. Genera with chromosome base numbers<10
usually contain primary genomes. Genera with base numbers >10 usually contain derived paleopolyploid genomes.
Paleopolyploidy is also suspected when a genus is represented by multiple base numbers (Goldblatt, 1980). This
figure indicates that most apomicts contain primary genomes and most polysporic species contain paleopolyploid
genomes (modified from Carman, 1997).
230
Системы репродукции
The statistically significant distinction in base numbers between apomicts (9.6 ± 0.4
SE) and polysporic species (15.7 ± 0.6) (Fig. 6) suggests that i) relatively complete
sets of duplicate genes encoding female development promote the expression of apomixis,
and ii) incomplete sets of duplicate genes promote the expression of polyspory and related
anomalies, which occur among paleopolyploids. It is unclear how mutations could be
associated with these major genomic distinctions. In contrast, an asynchronous expression
of incompletely-duplicated sets of developmental genes may explain all of these anomalies
(18 or more different types of polyspory — Johri et al., 1992; polyembryony, and
others — Carman, 1997). The tendency for apomicts to contain primary genomes and
polysporic species to contain paleopolyploid genomes is only a tendency. Many apomicts
clearly contain paleopolyploid genomes, including some warm season grasses such as
Tripsacum (x=18), Panicum (x=9,10), Brachiaria (x=7,8,9), Lamprothyrsus
(x=12), Paspalum (x=6,10), Pennisetum (x=7,8,9), most of the apomicts in the
Rosaceae (x=17), and many apomicts in the Asteraceae (Carman, 1997). It is also clear
that gametophytic apomixis occurs in nature at the diploid level in some of these
paleopolyploid apomicts, e.g. Sorbus eximia (Jankun, Kovanda, 1988), Trifolium
echinatum, T. uniolea, and T. utriculosum (Visser, Spies, 1994), Arabis holboellii
(Roy, 1995), and Allium tuberosum (Kojima, Nagato, 1997). Furthermore,
nonfunctional aposporous embryo sacs occur sporadically in several species of diploid
Paspalum (Quarin, 1986; Norrmann et al., 1989). Duplicate cassettes of genes for
appropriate female developmental pathways may exist in these paleopolyploid apomicts,
possibly even on the same chromosome(s), and such duplications may in some cases be
responsible for the stabilization of apomixis at the diploid level.
Apomixis may occasionally be a stepping stone to bispory and tetraspory. Thirty of 33
families containing apomicts also contain polysporic or polyembryonic species. The
expected number, according to the independent distribution model, is 17; and this
phylogenetic relationship is highly significant (Carman, 1997). Within families, apomicts
occur in primitive genera with low base numbers, and their developmental mechanisms also
tend to be primitive, i.e. they tend to diverge little from normal sexual reproduction. In
contrast, bispory, tetraspory, and polyembryony occur in related but derived genera
(significantly higher base numbers), and their developmental mechanisms also tend to be
derived, i.e. they tend to diverge greatly from normal sexual reproduction. From an analysis
of certain families, genera and species involved, Carman (1997) concluded that apomixis,
instead of being an evolutionary dead end, may occasionally serve as a reproductively-stable
evolutionary springboard for the evolution of normal and developmentally-novel (bisporic,
tetrasporic, etc) paleopolyploid sexual species and genera.
Genetic analyses and the origins of apomixis.
■Most genetic analyses of apomixis (see Table 1 for representative analyses) support
one or more of the following four basic conclusions:
a) a single locus (probably a chromosomal region containing many essential genes) is
associated with high frequency (near obligate) expression of apomixis;
b) other loci affect facultative expression of apomixis, and this genetic background
requirement has confounded some genetic analyses of apomixis;
c) some genetic backgrounds reduce or preclude the expression of apomixis even when a
known apomixis-conferring allele (or linkage group) appears to be present;
d) some genetic backgrounds induce the expression of apomixis even when a known
apomixis-conferring allele (or linkage group) appears to be absent.
S
о
a
я
6Л
a
a
M
0)
и
a
о
и
(Й
о
Я
и
a
о
и
<л
я
_о
-о
4)
я
3
в
о
In
CJ
f
*■•
К
J H
s
о
a
ч
m
X X
< <
и
m
III
t/i <
x x
ел т
! "3 "«
3 Я '
I s s
ил
111
t^ CO
о о
CO чЭ
Г- чЭ
« О
ю!е<
28
о о
о о
О 1-
СП <Ч
й?
2S
со о
с* ^ ■
С4 г-
111
< <
• X X
и и и и
<" <" < <
1Ш
111
llli
1Й1
ни
^ _ и
■3 2
~ &
8 О
Й* (М го -*-
т с/} с/} х^Н-ЕЕ
и
а"
<
S |
< .
X .§
•г. п.
н
1
,1
и
га"
<
98
i
Й5-М t
Hit I
о Д
Г1
■B'-S'
Table l(continuous)
Observed
segregation
Expected segregation
Cross1
Apo Sex Ratio Apo Sex
Sexual
ovules (%)
Notes/explanations
Conclusions
supported2
I. Penmsetum (4x aaaa x 6x Aaaaaa)
P. giaucum x squamuhtumn
J. Pennisetum (4x aaaa x 6x Aaaaaa)
P. giaucum x squa/nuhtumn
K. Tripsacum dactyhides1*
Zea mays (2x) x T. dactyhides (4x)
L. T. dactyhides x Z mays ВС lines
30 Мг+ВТг+Мгб-ТМб15
M. T. dactyhides*
2x (S) x 3x (A)
N. T. dactyhides"
2x (S) x 4x (A)
О. T. dactyhides x 2. л/лу/ ВС lines
20Mz+18TrIB
30Mz+9Tr(lincl)19
30Mz+9Tr (line 2)18
44, 47 & 51 chromosome lines20
P. Calamagrostis (sexual x sexual)21
С arundinacea (4x) x epigeios (8x)
162 235 0.87:1 185 212
5.124
One F| with Tetrasomic random chromatid А, В, С
.01 - .02 apomixis assortment model; a hemizygous
markers was apospory-specific genomic region
93% sexual (ASGR) was identified
.40 - .50
23 29
43
0.87:1
28
Data were obtained using a subset of more fertile
plants and arc not applicable for genetic analysis
0 to 16% From 1 to 5% of ovules in 10 of А, В, С, D
11 «sexual» Fis produced apo-
sporous sacs; ASGR was
probably not present in these
plants
Not Tetrasomic random chromatid A
reported assortment model; apomixis
linked to Trl 6 (distal Mz6L)
Not Apomixis linked to long arm of A
reported Tr16
0 -100% Percentage sexual embryo sacs in В
ovules decreased with an increase
in chromosome number
86 triploids from six families were scored for fertility (high = apomictic, low = sexual) and correlated with RFLP
markers. High fertility was linked to five Tripsacum linkage groups that correspond to three linkage groups in Zea
The Trl 6 chromosome + 17 other Tr chromosomes arc present
Trl 6 + 8 other Tr chromosomes
Trl 6 + a different set of 8 other Tr chromosomes
Mz6-Trl6 present + several other Tr chromosomes
Gcne(s) on Trl 6 represent only
0 - 3% one of several necessary linkage
9-15% groups, i.e. absence of certain Tr
85 - 90% chromosomes eliminates apo-
100% mixis regardless of Trl6
In an Fi (6x), 34% of functional embryo sacs
were diplosporous; but parthenogenesis was not
observed, only Bin hybrids. Apomixis does not
occur at any ploidy level in die parent spp
B,C
A
B,C
B,C
B.C
D
Table l(continuous)
Cross1
Notes/explanations
Conclusions
supported2
Q. Sanguisorba minor (sexual x sexual)22
ssp minor (4x) x ssp magnoui (4x)
ssp minor (4x) x ssp muricata (8x)
ssp mtiricata (8x) x ssp magnotii (4x)
All 4x & 6x Fis were fully functional aposporous
apomicts. Apospory is absent in parental ssp &
other ssp regardless of ploidy or environmental
treatments used in attempts to induce it
El. Raphatius sativus x Brassica
ohracaP2,
line 3048
Line 3050
Line 3051
Line 3053
Line 3054
Line 3057
Total
ovules
117
97
79
60
66
101
Aposporous
ovules (%)
70
61
57
58
36
66
Aposporous embryo
sacs/aposporous ovule
2.7
2.2
1.8
2.9
1.6
2.7
The listed lines are amphiploids (4x) obtained
from colchkine-doubled parents from many
diploid cultivars. An unreduced maternal
progeny was documented from these
Rrfbanobrassica lines.24 Apospory does not occur
elsewhere in the entire Brassicales order, i.e
apospory in these lines did not result from the
surfacing of a genetically suppressed apomixis-
specific allele.
S. Sorbis aria (2x) x tontrinalis (2.x)25 Both forms ofSorbis eximia (2x & 4x) are geographically-restricted neoendemics, and their parents are sexual diploids.
Diploid hybrid (S. eximia, 2x) At both ploidy levels, a primary group of archegonial cells form but fail to undergo meiosis. A 2nd group of
Amphiploid (S. eximia, 4x) archegonial cells form as the 1" group degenerate. Meiosis and aposporous embryo sac formation occur
simultaneously among cells of the 2nd group (compare with Fig 3.1). Apospory is fully functional at both ploidy levels.
T. Antennaria neglecta x p/antagimfo/ia26
Diploid hybrid (2x)
U. Intergeneric hybrids in the Triticeae
Hordet/m vulgare x Triticum turgiduiiP
H. vulgare x 7". aestivunP
T. aestivuml thymus racemosus/ /Tbinopyrum
Infrequent aposporous embryo sac formation was
documented in a hybrid between these two sexual diploid
species
Low frequency apomixis (unreduced embryo sac and egg formation followed by
parthenogenesis) occurs in various complex hybrids within the Triticeae (wheat and
its wild relatives). Embryological studies are needed to determine if
parthenogenesis occurs or if pollination occurs followed by chromosome
elimination.
B,D
'A = apomictic, S = sexual, CDS = colchicine doubled sexual, Mz = maize, Tr = Tripsacuw. 2sce text. 3I-Iarlan et al.(1964), 4Ta]iafcrro and Bashaw (1966),
5Sher\vood et al.(1994), *Burton and Forbes (1960),.7Savidan (1981), 8Savidan (1982), "Hanna et al.(1973), l0Lutts et.al.(1994), "Valle and Miles (1999),
12Ozias-Akins et al.(1998), l3Dujardin and Harma (1983), I4Leblanc et al.(1995), l5Kindiger et al.(1996), l6Shcrman et aL(1991), ,7Biakcy ct al.(1997), '«Sokolov
et al.(1998c), ,9Sokolov ct al.(1998a,b), ^Victor A. Sokolov, personnal communication, Sep, 1998 (44,47 and 51 chromosome segregants from the apomictic
Mz6-Trl6 translocation line that contain the translocation arc sexual), 2lNygren (1946), ^Nordborg (1967), ^Ellerstrum and Zagorcheva (1977), ^Ellerstrum
(1983), 25Jankun and Kovanda (1988), 26Stebbins (1932), 27Mujceb-Kazi (1981), 28Mujeeb-Kazi (1996).
234
Системы репродукции
Nonrecombining linkage groups are sometimes associated with apomixis. Many
genetic analyses are consistent with tetrasomic inheritance wherein a single dominant
allele «A» confers apomixis (Table 1-A,C,E,G,H,IJ,K). The duplicate-gene
asynchrony hypothesis predicts this outcome when i) genes from a second genome, which
causes asynchrony (Fig. 1), reside on a single chromosome and ii) the apomict must is an
allopolyploid or an interracial autopolyploid (segmental autoalloploid, see
Schultz-Schaeffer, 1980). Tetraploid apomicts meet the latter requirement by possessing
three homologous genomes and one genome homeologous to the others, e.g. TTT T'.
According to the duplicate-gene asynchrony hypothesis, such genomic configurations
should be common among apomicts (reviewed below).
In the configuration TTT T\ recombination between the divergent T and T'
chromosomes is infrequent. This may explain i) an absence of recombination in the
apomixis-conferring linkage group as found in Tripsacum (Grimanelli et al., 1998) and
Pennisetum (Ozias-Akins et al., 1998), and ii) hemizygosity within the
apomixis-conferring linkage group as found in Pennisetum (Ozias-Akins et al., 1998).
Homologous/homeologous chromosome sets in allotetraploids or segmental
autoalloploids of the TTT T' type assort as if all four genomes were homologous. During
meiosis, each of three homologous T chromosomes has an equal chance of forming a
nonrecombinant chromosomal association with its respective homeologous T'
chromosome. Hence, if a locus common to all four chromosomes of a three
homologous/one homeologous set contains alleles that are different from each other, then
all six pairwise combinations of the four different alleles will occur at random in the sexual
gametes. Grimanelli et al. (1998) observed such an assortment in a segregating maize
Tripsacum Fl population, and they cited it as evidence for a strict autotetraploid origin of
apomictic Tripsacum. However, lack of recombination in the apomixis-conferring linkage
group (probably a T= chromosome) argues against this conclusion. In contrast, it argues
in favor of an allotetraploid or a segmental autoallotetraploid (TTT T') origin, both of
which readily explain the observed random assortment of chromosomes.
The duplicate-gene asynchrony hypothesis predicts that most tetraploid apomicts are
allotetraploids or segmental autoallotetraploids of the type TTT T' (reviewed below).
This genomic configuration provides the simplest explanation for four genetic analysis
observations, two of which (the second and third) are rather peculiar: i) simple
inheritance, ii) lack of recombination in the apomixis-conferring linkage group, iii)
hemizygosity in the apomixis-conferring linkage group, and iv) autopolyploid-like
chromosomal segregation.
Other loci affect the frequency of sexual expression (facultativeness) in
apomicts. Many genetic analyses of apomixis confirm the existence of other loci that
reside on other chromosomes and strongly influence the sexual to apomictic embryo sac
ratio within individual plants. In genetic analyses where apomicts are crossed and
backcrossed with sexuals, it is not uncommon for the percentage of sexual embryo sacs in a
given plant to vary quantitatively from near 0% to above 90% (Table
1-E,G,H,I,J,N,0,R; note that in O, a difference of more than 70% facultativeness is
directly related to different sets of 8 Tripsacum chromosomes and that the elimination of
some Tripsacum chromosomes completely eliminates apomixis even though Trl6 is
present). Such studies lend themselves to analyses in which quantitative trait loci (QTL)
for facultativeness could be identified using molecular markers. Physiological studies of
apomixis (reviewed below) provide clues as to what these QTL control.
Семенное размножение 235
Genetic backgrounds reduce or preclude the expression of apomixis. There is
strong evidence that a major apomixis-conferring locus is present in the plant materials
referenced in Table 1-B,D,E,F,G,H,I,J,N,0 but that appropriate alleles at other loci
are required for a near obligate expression of apomixis. In fact, some studies
(B,F,M,N,0) indicate that the major locus is inoperative in the absence of appropriate
alleles at one or more different but critical loci.
Genetic backgrounds confer apomixis when«apomixis genes»are not present.
Ozias-Akins et al. (1998, Table 1-1) demonstrated the presence of an
«apospory-specific genomic region» (ASGR) in Pennisetum squamulatum that
cosegregated 100% with apomixis (generally high expression) in a segregating pearl
millet P. squamulatum F( population (162 apomicts: 235 sexuals). The authors
suggested that this fits a tetrasomic inheritance model with random assortment of
chromatids. However, P. squamulatum is an autoallohexaploid (Patil et al., 1961), not a
tetraploid, and recombination (crossing over between the centromere and the locus in
question), which was not observed for the chromosome containing the hemizygous
ASGR, is required for«random assortment of chromatids». Hence, other explanations
should be considered for this unusual segregation.
As suggested above for Tripsacum, the apomixis-conferring region (ASGR, in the
case of P. squamulatum) may reside on a divergent genome. Patil et al. (1961)
demonstrated that P. squamulatum is an autoallohexaploid probably of the type SSSS
S'S' or SSSSS S'. As for Tripsacum (TTT T'), the latter configuration explains
hemizygosity and an absence of recombination in the ASGR. The former configuration
also explains these phenomena provided the S' genome is homozygous for the critical
alleles. According to the duplicate-gene asynchrony hypothesis, this is expected, i.e.
alleles responsible for floral induction in the S' genome would be homozygous due to long
term selection in an environmentally divergent habitat prior to hybridization with related
plants containing the S genome. They could also be homozygous due to self pollination of
an ancestral triploid (SS S) in which unreduced and gametes were involved or by
chromosome doubling of the ancestral triploid.
Dujardin and Hanna (1983, Table 1-J) observed a similar apomict to sexual F
segregation ratio (6 apomicts: 11 sexuals, X NS) to that of Ozias-Akins et al. (1998)!
Percentage aposporous ovules in the six apomicts ranged from 63% to 93%. However,
more than 100 ovules of the 11 «sexual» segregants were analyzed, and the percentage
aposporous ovules in 10 of these averaged 2.6% (ranged from 1% to 5%). It is improbable
that all of these 10 segregants contained the ASGR (x 2=16.8, P < 0.001), yet aposporous
embryo sacs occasionally formed in each. Thus, it appears that certain genetic backgrounds
may cause apomixis in the absence of known apomixis-conferring linkage groups.
Sherwood (1994, Table 1-C) also obtained segregation patterns consistent with
tetrasomic inheritance and random assortment of chromatids. However, facultatively
apomictic plants were infrequently produced when sexual lines were selfed or crossed with
other sexual lines. This again suggests that appropriate recombinations of certain genetic
backgrounds, which lack major apomixis-conferring linkage groups, may induce apomixis.
There are now many reports of apomixis arising through hybridization of divergent
sexual germplasm. Stebbins (1932, Table 1-T) documented aposporous embryo sac
formation in a hybrid between diploid sexual Antennaria neglecta and diploid sexual A.
plantaginifolia. Likewise, Nordberg (1967, Table 1-Q) produced all combinations of
hybrids between two sexual tetraploid and one sexual octaploid Sanguisorba spp, and all of
236
Системы репродукции
the resulting tetraploid and hexaploid Fts were fertile aposporous apomicts. As stated by
Nordborg«only in hybrids has apospory been proved to give rise to embryos ... in
tetraploids [2n+0], involving pseudogamy, and in hexaploids, where it is sometimes
combined with sexual reproduction resulting in octaploids [2n+n]». Furthermore, Jankun
and Kovanda (1988, Table 1-S) documented fully functional high frequency apomixis
(apospory combined with diplospory) in both diploid and tetraploid Sorbus eximia, which
is a geographically-restricted hybrid derived from 5. aria and 5. torminalis, both of which
are sexual diploids. Nygren (1946, Table 1-P) observed apomictic embryo sacs (34% of
all well-formed sacs) in a hybrid between tetraploid sexual Calamagrostis arundinacea and
octaploid sexual C. epigeios, though unreduced eggs generally required fertilization for
embryo development [2n+n].
Low frequency apomixis has been reported in four intergeneric hybrids in the wheat grasses
(Mujeeb-Kazi, 1981,1996, Table 1-U; Bothmer et al., 1988; Li, Dong, 1993), and none
involved Elymus rectisetus, the only apomict in this tribe of grasses, or even other species of
Elymus. Similarly, high frequency unreduced male and female gametes were obtained in a
hybrid between sexual Triticum turgidum and sexual Aegilops longissima, which resulted in
high seed set from the F with double the chromosome number in the numerous F2s that were
produced (high frequency union of unreduced male and female gametes, 2n+2n). However,
parthenogenetic development from unreduced eggs was not observed (Pignone, 1993).
Finally, Ellerstrom and Zagorcheva (1977, Table 1-R) observed high frequency,
well formed, mature, and multiple aposporous embryo sacs in numerous lines obtained
from many different hybrid combinations involving artificial amphiploids of Raphanus
sativus and Brassica oleracea. Because many parental lines were involved, mutations are
not a reasonable explanation for this phenomenon.
The above examples taken together provide serious evidence for Ellerstrom and
Zagorcheva's conclusion: «In our opinion it seems therefore, more justified to conclude that
the formation of aposporic embryo-sacs ... is caused by physiological disturbances, as a
result of defective cooperation between the two parent genomes in the hybrid, rather than to
assume the presence of specific genes governing the formation of such embryo-sacs».
An impartial analysis of the many fortuitously-produced apomicts of hybrid origin
described above undermines the simple inheritance autonomous-gene paradigm that
has reigned among plant breeders for 40 years, but not necessarily among plant
biologists (see relevant opinions of Kellogg, 1990; Campbell et al., 1991; Asker,
Jerling, 1992; Bayer, 1996).
Physiological genetics and the origins of apomixis
Asynchronous signals modify cell cycles. Heterokaryon studies with yeast shed light
on molecular mechanisms that might cause apomixis. When yeast cells in Gl are fused
with yeast cells in S-phase, signals from the S-phase nuclei cause chromosomes in
adjacent Gl nuclei to replicate precociously. The degree of precocity and the rates of
replication increase with an increased S:G1 nuclear ratio in the heterokaryon. Likewise,
when yeast cells in interphase are fused with mitotic cells, signals from the mitotic nuclei
cause adjacent interphase nuclei (regardless of stage) to skip the intervening stages and
abnormally assume the chromosomal activities of the mitotic nuclei (see Lewin, 1994, for
a review). Apomixis may occur in an analogous manner (Fig. 1).
Sudden changes in environment can confuse cell cycles in plants in a manner similar to
asynchronous nuclei in yeast heterokaryons. When certain photoperiodically-sensitive
Семенное размножение
237
plants are grown in nonconducive photoperiods, or are moved from flowering-conducive
to nonconducive photoperiods, signals are produced that cause meiosis to abort (Nielson,
1942; Madsen, 1947; Moss, Heslop-Harrison, 1968). Other floral anomalies may also
occur, e.g. young floral buds may revert to vegetative growth (Krishnamoorthy, Nanda,
1968), maize tassels (Moss, Heslop-Harrison, 1968) and wheat stamens (Fisher,
1972) may become femininized, and wheat ovaries may transform into inflorescences
(Fisher, 1972). Like apomixis, the degree to which these anomalies occur is controlled by
a few major genes and many modifier genes (Thomas, Vince-Prue, 1997). These
photoperiod-induced anomalies are consistent with the GPT (genotype photoperiod
temperature) model of floral development (Yan, Wallace, 1998), which may also explain
inconsistencies in the apomixis physiology literature. The GPT model (Yan, Wallace,
1995,1996,1998) assumes i) flowering is preemptive in the absence of suppression, ii)
photoperiod genes, which suppress flowering, are expressed during nonconducive
photoperiods, and in) genetic variation for floral suppression is substantial.
Based on the GPT model, interracial tetraploids may be envisioned in which the
timing of suppression of floral development varies with genome (Fig. 1). Intermediate
ovular phenotypes would then develop in which the precocious genome would produce,
during belated apomeiotic prophases, end-of-meiosis check-point signals and embryo sac
formation signals. Meiosis would then be skipped in a manner similar to the skipping of
mitotic stages in yeast heterokaryons. Alternatively, embryo sac formation signals might,
because of lengthy exposures to nonsuppression, surpass threshold levels within nucelli
resulting in the formation of aposporous embryo sacs (Fig. 1).
Photothermal genes may regulate apomixis. Plants are often partitioned into: i) short
day plants (SDP), ii) long day plants (LDP), Hi) dual day length plants (DDLP), in
which characteristics of both SDP and LDP are combined (long-short-day plants,
short-long-day plants, and probably intermediate day length plants and ambiphotoperiodic
plants), and iv) day neutral plants (DNP). Differences in vernalization requirements
further partition these photoperiod response categories (Thomas, Vince-Prue, 1997).
Essentially all plants fit into one or more of these categories.
A reasonably current list of species in which photoperiod responses have been studied
was compiled by Thomas and Vince-Prue (1997). Plants targeted for such studies are
generally those with distinct, easily-recognized photoperiod responses. The list represents
287 angiospermous genera, of which 32 (11.2%) contain apomicts (Table 2; 16% of
SDP genera, 9% of LDP genera, 20% of DDLP genera (as defined above), and 11%
of DNP genera). In contrast, only 1% of all angiospermous genera are known to contain
apomicts (Carman, 1997). Hence, the percentage genera containing apomicts in
Thomas and Vince-Prue's list, which is heavily weight with plants exhibiting strong
photoperiod responses, is 11-fold higher than would be expected if apomixis were to occur
independent of strong photothermal requirements. Furthermore, an AOV indicated that
genera containing apomicts (Table 2) were represented within the list by significantly (P
< 0.02) more photoperiod categories (SDP, LDP, DDLP, DNP) per genus (1.7 ±
0.2 SE) than genera not containing apomicts (1.3 ± 0.05 SE). These findings implicate
photothermal genes in the evolution of apomixis and in its regulation.
Apomixis and facultativeness are probably polygenic threshold traits.Many
polygenic traits are dimorphic, i.e. they are regulated by an environmentally sensitive
«switch point» that is positioned along a normally distributed polygenic variable called the
«liability». Different «morphs» occur depending on whether the liability threshold is
238
Системы репродукции
Table 2: Photoperiodic response categories for genera listed in Thomas and Vince-Prue's (1997)
Appendix I (photoperiodic classification of plants) and which also contain aposporic or
diplosporic species; SDP, short day plants; LDP, long day plants; DDLP, dual daylength plants,
i.e. long-short-day plants, short-long-day plants, intermediate day plants, ambiphotoperiodic plants;
DNP, day neutral plants.
Genus
Bouteloua
Allium
Setaria
Poa
Paspalum
Solidago
Cucumis
Ranunculus
Raphanobrassica
Bidens
Bothriochloa
Brachiaria
Helianthus
Hyparrhenia
l^uffa
Panicum
Pennisetum
Rubus
Sorghum
Beta
Centaurea
Chondrilla
Cichorium
Hieraceum
Umonium
Rudbeckia
Aster
Coreopsis
Saccharum
Ma/us
Ornithogalum
Pyrus
SDP
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
X
LDP
X
X
X
X
X
X
X
X
X
X
X
X
DDLP
X
X
X
X
X
X
X
X
DNP
X
X
X
X
X
X
X
X
X
Семенное размножение
239
surpassed or not (Roff, 1994; Falconer, Mackay, 1996; Roth et al., 1997), and the
liability factor (risk factor for alternative morph development) often consists of multiple
and unknown components. By combining elements of the duplicate-gene asynchrony
hypothesis (Fig. 1; Carman, 1997) with elements of the GPT (Yan, Wallace, 1998)
and threshold (Falconer, Mackay, 1996) models, the expression of apomixis in hybrids
of sexual parents (detailed above) and the environment-induced variations in
facultativeness (detailed below) are largely explained (Fig. 7).
о
с
о
1»
о
to
(Л
Ф
о.
о.
(Л
о
Genome cone.
A (invariable)
В (lower limit)
В (mean)
В (upper limit)
Sexual threshold:
(ovules develop
sexually when
levels of В genome
suppressors fall
within this window)
Buds Meiosis Anthesis Seed
Floral initiation and development
Fig. 7. The multiple-photoperiod-response (MPR) component of the liability variable. The MPR model
combines the duplicate-gene asynchrony model of apomictic development (Fig 1) with the GPT model of floral
development (Yan, Wallace, 1998) and the threshold model of quantitative genetics (Falconer, Mackay, 1996). The
y-axis represents the polygenic floral suppressor component of the threshold trait liability factor. The latter probably
consists of many components, but the floral suppressors may be the most important (see text). Floral development
ensues as suppressor levels decrease, which occurs asynchronously (between genomes) resulting in an intermediate
phenotype, i.e. the bud, meiosis, and anthesis stages (verticle lines) represent compromises between the precociously
expressed A genome and the delayed В genome (Fig. 1). The diagram represents the simplest case scenario, assuming
a single location (environment) for plant growth, an invariable rate of degradation of suppressors for genome A (as in
DNP), and a normally distributed and variable degredation rate for genome В (as in LDP and SDP). Under these
conditions, ovules develop sexually when the degradation rates for genome В approach that of genome A throughout the
period from floral bud through MMC formation (sexual threshold window). In contrast, apomixis occurs when
differences in degredation rates between genomes exceed the sexual threshold window (as diagramed, the majority of
ovules would develop apomictically). The diagram may be enhanced by i) assuming that the floral suppressor
degredation rate for genome A is also variable and normally distributed, ii) assuming that the normally distributed floral
suppressor degredation rates for genomes A and В may vary with photoperiod and other environmental factors, i.e. they
may shift right or left causing more or less sexual development, iii) floral suppressor degredation rates for both genomes
A and В are polygenic traits, iv) limited recombination occurs between genomes A and В because of divergent genome
composition (see text), and v) other factors, in addition to floral suppressors, contribute to the overall liability factor.
The enhanced model explains variations in facultative expression among apomicts (Tables 3, 4) as well as tendencies
towards apomixis and completely-viable apomixis in hybrids obtained from sexual parents (Table 1).
240
Системы репродукции
The multiple-photoperiod-response (MPR) component of the liability
variable. The MPR component of the liability variable for apomixis expression (Fig. 7)
assumes that f) the rates of degradation of floral suppressors for two genomes, A and B,
are normally distributed and may be variable, and ii) the floral suppressor degradation
rates for genomes A and В may respond either similarly or differently to changes in
environment. Under these conditions, facultativeness should, for at least some apomicts,
shift when plants are grown in different photoperiods or when they are moved from one
photoperiod to another during growth.
In examples A through E (Table 3), sexual development is favored when reproduction
occurs during long days. This response is predicted by the MPR model (Fig. 7) provided
that genomes A and В were day-neutral and long-day-selected, respectively, prior to
hybridization and polyploidization. Accordingly, long days would enforce an accelerated
degradation of genome-B-specific floral suppressors narrowing the gap between the В and
A genome degradation curves. Consequently, more ovules would develop within the sexual
threshold window (Fig. 7). In contrast, short days would broaden the gap between
genomes A and В and increase the frequency of apomictic ovules. This scenario is
consistent with apomixis birth dates within geologically-cool periods wherein high latitude
(long-day) ecotypes migrated to lower latitudes and hybridized with lower latitude
(day-neutral) ecotypes of the same or closely related species.
Example G (Table 3) involves a unique diploid cytotype in which tendencies to form
aposporous embryo sacs, which are enviable, are favored when reproduction occurs during
long days. This response is predicted by the MPR model provided the unique diploid
contains both day-neutral and short-day alleles. Accordingly, long days would broaden the
floral suppressor degradation gap (Fig. 7) allowing for some aposporous embryo sac
development. The plant material of example F (Table 3) is a hybrid between the plant
Table 3: Relationships between photoperiod and percentage aposporous ovules.
Taxa
A. Dicanthium
aristatum
B. Dicanthium
aristatum
C. Dicanthium
intermedium
D. Themeda australis
E. Paspalum
cromyorrhi^pn {Ax)
F. P. crotrr/orrhi^pn
{Ax hybrid)
G. P. cromyorrhispn
(2x diploid)
Photoperiod
(day: night)
8:16 (40 d)-16:8
8:16
16:8
13:11
14:10
12:12
24:0
8:16
14:10
12:12
14:10
13:11
12:12
14:10'
13:11
12:12
Ovules with
apomictic
embryo sacs (%)
47
79
55
90
22
63
14
85
78
95
63
46
43
15
7
5
References
Knox, Heslop-
Harrison, 1963
Knox, 1967
Saran, DeWet, 1976
Evans, Knox, 1969
Quarin, 1986
Quarin, 1986
Quarin, 1986
Семенное размножение
241
materials of E and G, and the results suggest that additional sexual threshold windows may
have been established by combining day-neutral, long-day, and short-day genomes, i.e. an
overall reduction in apomixis frequency was observed in this hybrid (Table 3).
The apomict Poa pratensis is a short-long-day plant (Thomas, Vince-Prue, 1997),
i.e. short days generally enhance floral bud formation and long days enhance floral
development. Hence, both short-day and long-day ecotypes were undoubtedly involved
in its origin. Accordingly, the frequency of apomictic development should be high under
both long and short photoperiods, i.e. both conditions should enforce a broad
between-genome gap in schedules of floral suppressor degradation (Fig. 7). In contrast,
the gap should be narrower at intermediate photoperiods allowing for infrequent sexual
development. This tendency has been observed. Plants grown at five locations, which
provided 15.5, 15.5, 15.0, 14.5 h (long days), and 12.5 h (short days) of daylight,
respectively, generally had higher frequencies of apomixis than plants grown at two other
locations that provided intermediate day lengths (13.5 and 14 h) (Hovin et al., 1976).
However, the differences may be inconsistent with other studies (Mazzucato et al.,
1996), suggesting that other environmental components of the liability variable
(discussed below) may also play important roles in determining facultativeness in Poa.
Exposure to a gradually-changing photoperiod, as occurs in nature, may be necessary in
some taxa to induce appropriate photoperiod responses. For example, field grown
Hyparrhenia hirta (N17) had significantly fewer aposporous embryo sacs than plants of the
same line grown at constant 8,12 and 16 h photoperiods (McWilliam et al., 1970; Table
4-A). However, no differences between field and phytotron-grown plants were observed in
another line (Table 4-B), and, while phytotron photoperiods had little effect in two lines,
significant effects were observed in a third line (Table 4-A,B,C). In other examples, the
percentage of ovules containing apomictic embryo sacs increased when Calamagrostis
purpurea (diplosporous; Nygren, 1946) and Pennisetum ciliare (aposporous; Hussey et
al., 1991) ovules were sampled at progressively later dates throughout the summer. In the
latter study, the apomicticsexual ratios for the three collection period categories listed in
Table 4-D are significantly different (chi square = 43.937, 2 df, P - 0.001). In contrast,
the apomictic:sexual ovule ratios for P. ciliare plants grown at constant 8, 12, and 16 h
photoperiods did not differ (Table 4-E). Collectively, these results suggest that factors
other than photoperiod are important to facultativeness (Hussey et al., 1991) and/or
exposure of plants to gradual changes in photoperiod are important to facultativeness.
Multiple phenotypes may be defined by multiple thresholds. It should be noted that morphs
other than apomictic or sexual are often expressed. For example, a third morph, sterility, was
evident for H. hirta (N64) (Table 4-C). Sterile embryo sac percentages were 34%, 31%, and
16% for the 8,12 and 16 h photoperiods, respectively. It is possible that the gap between the A
and В genome degradation curves (Fig. 7) was largely incompatible with either sexual or
apomictic development at the 8 and 12 h photoperiods. Similar and consistent abnormality
categories were reported for Eragrostis curvula, in which short days increased the frequency of
sterile embryo sacs at the expense of apomictic embryo sacs (Brix, 1977), for interspecific
Pennisetum hybrids, in which certain F( genetic recombinations resulted in high frequency sterile
embryo sacs (Dujardin, Hanna, 1983), for Triticum Elymus hybrids, in which favorable
growing conditions decreased the frequency of abnormal diplosporous embryo sac development
(Peel et al., 1997), and for Taraxacum palustre, in which 2n+0 embryos tend to form in the
spring and 2n+n embryos (Вш embryos) tend to form in the autumn (Malecka, 1973). All of
these anomalies appear to be regulated to a greater or lesser extent by photoperiod.
242
Системы репродукции
Circumscribing the threshold response liability variable. Associations of apomicts with
genera known to have strong photoperiod responses (Table 2), tendencies of apomictic genera
to express multiple photoperiod categories (Table 2), and tendencies for facultativeness to be
influenced by photoperiod (Tables 3,4) suggest that photothermal genes are important
components of the liability variable. However, other variables may be equally important. For
example, differential genome silencing, which may eliminate asynchrony, may be under
genetic control as suggested by interspecific hybrids that differentially resemble one parent
more than the other. Likewise, polyploidy enhances the development of distinct genome
domains within nuclei (Leitch et al., 1990), and this may have a polygenic component.
Finally, Stebbins (J. Ledyard Stebbins, personal communication, 1997) suggested that
asynchrony might be greatest when plants develop rapidly, i.e. under favorable temperature,
water and nutritional conditions, and these effects (environmental growth optima) may vary
polygenically. The contributions of the potentially many loci important to apomixis might best
be described by breeding and photothermal studies in which QTL are identified for various
temporal and spacial embryological variables.
Attempts to identify QTL important to apomixis are underway by Ann Blakey
(1997) in Tripsacum and Rick Noyes (Indiana University, personal communication,
1998) in Erigeron. These approaches represent radical and pioneering departures from
the simple inheritance paradigm, which may have impeded genetic analysis research of
apomixis for much of the 20 century. However, it is clear from studies reviewed above
that many QTL for apomixis are masked by nonrecombinant hemizygous chromosomes.
Model research systems should, if possible, avoid such genomic backgrounds.
Table 4: Relationships between photoperiod and percentage apomictic embryo sacs.
Taxa
A. Hyparrhenia
hirta (N17)
B. Hyparrhenia
hirta (N43)
C. Hyparrhenia
hirta (N64)
D. Pennisetu/n
ciliare
(Texas field)
E. Vennisetum
ciliare
(phytotron)
Photoperiod
(day:night)
8:16
12:12
16:8
(field)
8:16
12:12
16:8
(field)
8:16
12:12
16:8
Sampled: May 15
May 31 -Aug 15
Aug 31 - Sep 31
8:16
12:12
16:8
Aposporous
Embryo sacs (%)
97
94
100
78
87
96
88
91
6.9
22.9
47.9
90.6
94.7
98.8
93.6
95.0
94.4
References
McWilliam et al.,
1970
McWilliam et al.,
1970
McWilliam et al.,
1970
Hussey et al.,
1991
Hussey et al.,
1991
Семенное размножение
243
Polyploidy and the origins of apomixis
Polyploid origins. It is now apparent that many if not most polyploid taxa have multiple
origins, and this concept is supported by molecular evidence (Soltis D., Soltis P., 1993). It
is also apparent that many apomicts, including some within Antennaria (Bayer, 1987;
1996), Amelanchier and Crataegus (Campbell, Dickinson, 1990), and many grass
genera (Kellogg, 1990), also have multiple hybrid origins. This latter observation is
incongruous with the simple inheritance mutation hypothesis, i.e. specific meiotic mutations
would have had to occur repeatedly among related but genetically-divergent hybrids.
Upon observing the infrequent to frequent formation of 2n gametes in many taxa,
Harlan and De Wet (1975) proposed three mechanisms of polyploid origin: i) fertilization
involving one (unilateral) or two (bilateral) 2n gametes, which results in autopolyploidy
(Class I polyploidy), ii) unilateral or bilateral fertilization in which the 2n gamete(s) are
produced within an interracial or interspecific diploid hybrid, which results in allopolyploidy
(Class II polyploidy), and iiz) interracial or interspecific diploid hybrids that undergo
somatic doubling (Class III polyploidy). Though difficult to prove, it is generally believed
that most polyploids belong to Class I or Class II (Bretagnolle, Thompson, 1995). At the
diploid level, unilateral polyploidization, resulting in triploids, is often compromised by the
endosperm balance number problem (4M:1P or 2M:2P), though in the vast majority of
cases, this problem does not prevent the formation of at least some triploid progeny
(Bretagnolle, Thompson, 1995). It is also believed that most polyploids originated during
the climatic shifts of the Pleistocene (Stebbins, 1971, 1985; Ehrendorfer, 1980;
Bierzychudek, 1985; Bretagnolle, Thompson, 1995; Murray, 1995).
Origins of apomixis. The duplicate-gene asynchrony hypothesis is consistent with
polyploid theory. It implies that frequencies of unreduced gametes are higher in hybrids
(interracial or interspecific) whose parents encode schedules of floral development that
differ in a specific manner (Fig. 7). According to this hypothesis, such hybrids are
potential precursors of polyploid apomicts.
Events leading to stabilized apomixis, which are subsequent to the formation of the
initial hybrid, would depend on conditions within the secondary contact hybridization
zone.In such zones, the frequency of occurrence of one parent is usually much higher than
the other. Hence, most of the viable pollen, available for pollination of unreduced eggs
produced by the hybrid, would originate from the predominant parent. Triploids with a
2:1 genome ratio, e.g. TT T', would then be produced. Assuming some triploids also
produce unreduced eggs (show tendencies for apomixis), a second round of backcrossing,
in which the same predominant pollen producer again supplies the pollen, would result in
the 3:1 genomic ratio TTT T'. Such ratios are expected only when tendencies for
apomixis (unreduced egg formation) are expressed at the diploid and triploid levels. This
line of reasoning implies that 3:1 genomic configurations in tetraploid apomicts, which
explain hemizygosity and simple inheritance segregation ratios (Table 1), may be the rule
rather than the exception.
Most apomicts are outcrossing perennials, and annual apomicts are extremely rare
(Asker, Jerling, 1992). Mutation-based hypotheses fail to explain this observation. In
contrast, the backcrossing scenario described above depends on outcrossing and
perenniality. At the diploid hybrid, BCt triploid, and ВС tetraploid levels, perenniality
allows for numerous genetic recombinations (in pollen) to be tested. Each may provide a
genetic background that confers a different degree of viability and facultativeness (Fig. 1,
7), and only those genetic backgrounds that confer viability survive.
244
Системы репродукции
Outcrossing and perenniality are characteristic of families with high rates of natural
hybridization, and the Asteraceae, Poaceae, and Rosaceae frequently rank near the top
(Ellerstrand et al., 1996). These three families contain 75% of all apomictic genera
(Carman, 1997). In contrast, apomixis is seldom observed in families that rank low in
hybridization rate, such as the Brassicaceae, Solanaceae, and Apiaceae (Ellerstrand et
al., 1996; Carman, 1997). Again, while mutation-based hypotheses fail to explain these
associations, they are wholly consistent with the backcrossing origin described above.
However, some families exhibit high hybridization rates that contain few or no apomicts,
including the Scrophulariaceae, Salicaceae, Onagraceae and Cyperaceae (Ellerstrand et
al., 1996; Carman, 1997). These families may be deficient in the types of photothermal
response genes required to confer apomixis, i.e. they may not be sufficiently cosmopolitan.
Polyploid genome .evolution and the origins of anomalies related to apomixis.
Certain genetic changes may follow polyploidy, including i) gene silencing, ii) gene
diversification, and hi) genome diversification (Soltis D., Soltis P., 1993). With regard to
the latter, Song et al. (1995) documented the loss and/or gain of parental restriction
fragments and the gain of novel fragments in F2 to F5 progenies derived from
artificially-produced intergenomic amphiploid Brassica. They also observed meiotic
abnormalities suggestive of intergenomic (nonhomologous) recombinations, which
probably explain the RFLP anomalies. These genomic modifications occurred rapidly, and
they suggest such changes might occur in other taxa following natural polyploidization.
As noted above, polysporic species (Fig. 3) tend to contain unstable, highly derived,
paleopolyploid genomes with high base numbers and multiple stabilized base numbers
per genus. Nevertheless, these species are often closely related to apomicts, which tend to
have low and stable base numbers. The findings of Song et al. (1995) demonstrate
mechanisms of genome reorganization consistent with the hypothesized paleo-
polyploidization and duplicate-gene asynchrony origin of polyspory and related anomalies
(Carman, 1997). Hence, apomixis may occasionally serve as a reproductively stable
evolutionary springboard from which paleopolyploid genome reorganizations generate
reproductively normal and novel species and genera (Carman, 1997).
Apomixis genes: an evolution of ideas
Data, accumulated during the early 20 century, suggested apomixis is a
consequence of hybridization. Ernst (1918) articulated these data into a wide
hybridization hypothesis, which claimed apomixis is the result of interspecific
hybridization. However, it soon became clear that some apomicts were autopolyploid.
Furthermore, apomixis had not been observed in man made interspecific hybrids.
These findings invalidated Ernst's hypothesis, and, in the absence of a suitable
alternative, apomixis gene hypotheses developed.
The simple inheritance mutant-gene hypothesis has dominated the apomixis
genetics literature for most of the century (see Asker, Jerling, 1992; Carman, 1997, for
reviews). These hypotheses developed in two directions. First, it was suggested
apomixis gene(s) are recessive but require appropriate polyploid backgrounds for
expression. Hence, they remain unexpressed for long periods of time and surface when
conditions are appropriate (Nygren, 1946; Gustafsson, 1946, 1947a,b). Today,
apomixis genes are considered dominant, manipulatable, and the result of
apomixis-specific mutations (Mogie, 1992; Kindiger, Sokolov, 1997; Grimanelli et
al, 1998, 1999). However, as discussed throughout this chapter, these interpretations
Семенное размножение
245
summarily ignore results from many phytogeographic, phylogenetic, genomic,
physiologic, and evolutionary studies as well as some genetic studies.
Recent versions of the simple inheritance mutant-gene hypothesis include
preconditions, Such as tendencies for parthenogenesis and a nonexistent endosperm
balance number requirement (Mogie, 1992; Grimanelli et al., 1998; 1999). These
recent versions also include appropriate genetic backgrounds with polygenic qualities
(Ozias-Akins et al., 1998). Hence, the gap between these versions and the
duplicate-gene asynchrony hypothesis has been narrowed. The latter merely includes
some additional preconditions, such as i) multiple archegonia (for apospory), ii)
abundant photothermal gene variability, and in) a high natural polyploidization rate
(perenniality and outcrossing). However, two major differences remain. First, the
duplicate-gene asynchrony hypothesis asserts that apomixis is regulated by a genetic
background composed of duplicate female development genes that are independently
regulated by divergent regulatory genes (probably photothermal genes). Second, while
the regulatory genes responsible for apomixis may be few in number (provided an
appropriate duplicate-gene genetic background in present), they did not evolve as
apomixis-specific mutations and they will not confer apomixis in the absence of an
appropriate duplicate gene genetic background. Rather, they evolved as mutations that
confer a greater environmental plasticity to sexual taxa in marginal environments.
Asker, Jerling, 1992; Bartlein, 1988; Bayer, 1987, 1996; Bayer et al., 1991; Bierzychudek,
1985; Blakey et al., 1997; Bothmer et al., 1988; Bretagnolle, Thompson, 1995; Brix, 1977;
Brummitt, 1992; Burton, Forbes, 1960; Campbell, Dickinson, 1990; Campbell et al., 1991;
Carman, 1990, 1995, 1997, 1999; Chapman, Busri, 1994; Chmielewski, 1994; Crawford,
1989; Darlington, 1939; Dickinson et al., 1996; Dujardin, Hanna, 1983; Ehrendorfer, 1980;
Ellerstrand et al., 1996; Ellerstrom, 1983; Ellerstrom, Zagorcheva, 1977; Ernst, 1918;
Evans, Knox, 1969; Fisher, 1972; Falconer, Mackay, 1996; Frakes et al., 1992; Gentry,
1986; Goldblatt, 1980; Grant, 1971; Grimanelli et al., 1998,1999; Gustafsson, 1946, 1947 a,
b; Haig, Westoby, 1991; Hanna et al., 1973; Harlan, Wet de, 1975; Harlan et al., 1964;
Hovin et al., 1976; Huber, Leuchtmann, 1992; Huntley, Webb, 1988; Hussey et al., 1991;
Jankun, Kovanda, 1988; Kellogg, 1990; Kindiger, Sokolov, 1997; Kindiger et al., 1996;
Knox, 1967; Knox, Heslop-Ha rrison, 1963; Knox et al., 1991; Kojima, Nagato, 1997;
Krish namoorthy, Nanda, 1968; Leblanc et al., 1995; Leitch et al., 1990; Lewin, 1994; Li,
Dong, 1993; Lutts et al., 1994; Madsen, 1947; Malecka, 1973; Mazzucato et al., 1996;
McWilliam et al., 1970; Miller, Th ompson, 1979; Mogie, 1992; Moss, Heslop-Harrison,
1968; Mujeeb-Kazi, 1981, 1996; Murray, 1995; Naumova, Willemse, 1995; Nielsen, 1942;
Nogler, 1984, 1994; Nordborg, 1967; Norrmann et al., 1989, 1994; Nygren, 1946;
Ozias-Akins et al., 1998; Patil et al., 1961; Peel et al., 1997; Pignone, 1993; Quarin, 1986;
Randolph, Fischer, 1939; Reddy, 1977; Richards, 1973; Roff, 1994; Roff et al., 1997; Roy,
1995; Saran, De Wet, 1976; Savidan, 1981, 1982; Schultz-Schaeffer, 1980; Sherman et al.,
1991; Sherwood, 1999; Sherwood et al., 1994; Sokolov et al., 1998a,b,c; Soltis D., Soltis P.,
1993; Song et al., 1995; Stebbins, 1932, 1971, 1985; Stebbins, Major, 1965; Stewart,
Rothwell, 1993; Taliaferro, Bashaw, 1966; Taylor, 1990; Taylor, Hickey, 1996; Thomas,
Vince-Prue, 1997; Valle, Miles, 1999; Villagran, 1990; Visser, Spies, 1994; Webb, 1988;
Wells, 1970; Yan, Wallace, 1995,1996, 1998.
246
Системы репродукции
СЕМЕННОЕ РАЗМНОЖЕНИЕ
СЕМЯ И СЕМЕННОЕ РАЗМНОЖЕНИЕ
Своеобразные черты репродуктивной биологии цветковых растений во многом
обусловлены неподвижностью их взрослых особей. Одним из следствий этого
явилось формирование специальных образований (диаспор), которые обеспечивали
размножение и расселение видов (См. Диаспора). В течение многих миллионов
лет эволюции растительного мира универсальной диаспорой была спора
(водоросли и высшие споровые). Позднее эта функция перешла к семенам, что во многом
способствовало семенным растениям занять господствующее положение на суше.
Первые семена обнаружены в отложениях верхнего девона, т.е. около 370 млн.
лет назад. Они были найдены в Америке (штат Пенсильвания), а позднее в
северо-западной части Ирландии.
Семя1 — одна из структурных единиц воспроизведения, размножения и
рассеивания (диссеминации), которая содержит зачаток (или зачатки — зародыши
разных генотипов2) нового растения и обычно специализированную
запасающую ткань (эндосперм, перисперм и др.), заключенные в защитные покровы
(семенную кожуру).
Семена различаются по величине, форме, окраске, опушенности и т.д. (гетерос-
пермия). В семенах некоторых видов цветковых растений, наряду с половым
зародышем или его производными (в случае эмбриональной — монозиготиче-
ской кливажной эмбриоидогении), формируются зародыши из клеток гаметофи-
та (гаметофитный апомиксис) и/или материнского спорофита (нуцеллярная или
интегументальная эмбриоидогения).
Бесполый способ репродукции посредством соматического эмбриогенеза или
гаметофитного апомиксиса, осуществляемых в семени, существенно расширяет
генетическое разнообразие семян, которое приводит к формированию нового
поколения с разной наследственной основой (бипарентальное или унипарентальное
наследование). Это позволяет говорить о том, что при определении
гетерогенности популяции необходимо учитывать эмбриогенетические признаки, наряду с
другими признаками строения семени (например, скульптура поверхности),
имеющими важное таксономическое значение.
Семя осуществляет функции воспроизведения, размножения и расселения,
что стало возможным у семенных растений благодаря объединению в нем гамето-
фита и спорофита. Как генеративная диаспора семя — надежная система,
поскольку в нем имеются специальные защитные оболочки, запас питательных веществ
(главным образом, в эндосперме) и оно при прорастании сразу дает проросток.
Следует помнить, что среди нормально развитых семян в популяции образуются
аберрантные (отклоняющиеся от нормы).
"Наличие большого количества семян и/или Нескольких зародышей (возможно
разного происхождения) в одном семени является одной из необходимых предпосы-
Подробнее, см. Семя, Т.2.
Подробнее, см. Генетическая гетерогенность семян.
См. Эмбриоидогения, Т. 2; см. также Эмбриоидогения — новый тнп вегетативного
размножения.
Семенное размножение
247
лок семенного размножения растений. Семенное размножение растений приводит к
увеличению численности популяции вида. Поддержание оптимальной плотности
популяции за счет семенного размножения особей получило название «семенное
возобновление» (Левина, 1981). Оно определяется банком семян в почве,
численностью выживающих всходов, ювенильных и генеративных особей нового поколения.
По мнению автора, семенное возобновление является завершающим этапом
репродуктивной биологии вида и свидетельствует, в конечном счете, о биологической
результативности всех предшествующих ему репродуктивных процессов.
Среди различных факторов, регулирующих размножение и возобновление, особое
место занимают биоценотические. Им принадлежит ведущая роль на заключительных
и решающих этапах возобновления: появление и выживание семенного подроста.
Семенное возобновление — многоэтапный, многофакторный и
саморегулирующийся биоценотический процесс. Одним из механизмов саморегуляции служит так
называемое «сопротивление среды приросту популяции».
Труден и полон опасности путь от семязачатка до семени, но не менее опасен —
от прорастания семени до формирования новой особи.
Данилова, Кирпичников, 1985; Левина, 1981; Терехин, 1996; Batygina, 1999.
РЕПРОДУКТИВНОЕ УСИЛИЕ
Представление о необходимости затрат материально-энергетических ресурсов
на процесс размножения растений сложилось еще в классических ботанических
работах, но только к концу XX века оно оформилось как целостная биологическая
концепция. Ядро этой концепции составляет понятие о репродуктивной фитомассе,
под которой понимают совокупность всех структурных частей, обеспечивающих
репродукцию. Репродуктивная фитомасса подразделяется на: а) фитомассу
собственно диаспор — семян, спор или почек и б) фитомассу обеспечивающих структур,
куда входят такие части, как околоплодник, околоцветник, цветоносы и др.
При количественной оценке репродуктивной фитомассы возможны два
подхода. Во-первых, оценке подлежит количество репродуктивной фитомассы, которое
существенно варьирует в зависимости от вида растений и условий их
произрастания. Во-вторых, можно оценивать долю репродуктивной фитомассы в общей
фитомассе всего растения, которая оказывается важным показателем
ориентированности жизнедеятельности растения на процесс размножения и называется
репродуктивным усилием. Это понятие предложено Harper (cm Harper, Ogden, 1970). Как
количество репродуктивной фитомассы, так и репродуктивное усилие одинаково
характеризуют метаболическую цену репродукции, но с разных ее сторон.
Общее принципиальное понятие о репродуктивном усилии сформулировали
довольно просто: репродуктивное усилие — это доля материально-энергетических
ресурсов, направляемых на процесс репродукции. Гораздо сложнее
конкретизировать форму вычисления репродуктивного усилия и унифицировать методику его
определения. Да такая унификация и не целесообразна, так как разные способы
вычисления репродуктивного усилия раскрывают разные оттенки этого процесса.
Поскольку репродукцию, как правило, определяют как процесс формирования
структур, обеспечивающих размножение, то логично для нахождения
репродуктивного усилия использовать данные о полном комплексе таких структур, не
выделяя отдельно семена или споры. В таком подходе есть и биологическая логика —
248
Системы репродукции
производство диаспор невозможно без образования структур, поддерживающих их
формирование. Тем не менее, в ботанической литературе используют две
основные формы вычисления репродуктивного усилия (RE):
по фитомассе всей совокупности репродуктивных структур (WR) —
RE, = (WR/W) x 100
или по фитомассе семян (WSM)—RE 2 = (WSM / W) х 100,
где W — общая фитомасса растения.
Репродуктивное усилие оценивают также по фитомассе цветков (Wfi):
RE3 = (WF1/W)xl00.
В этом случае оно отражает потенциальную готовность растений к
репродукции, когда она действительно лимитируется ресурсами организма, тогда как расчет
репродуктивного усилия в фазу семеношения и плодоношения включает еще и
успех в опылении цветков, сохраняемости плодов и семян в процессе их созревания,
т.е. внешние по отношению к особям растений обстоятельства.
Во всех случаях репродуктивное усилие находят как долю от общей фитомассы
растения. Для сопоставимости получаемых данных следует учитывать динамику
вегетативной фитомассы растений в процессе онтогенеза. Она существенно отличается
у разных видов растений. Здесь возможны три основных варианта: 1) максимум
вегетативной фитомассы приходится на начало бутонизации, тогда как позже она резко
уменьшается за счет оттока органических веществ в органы размножения; 2) пик
биомассы наблюдается также к началу бутонизации, но в дальнейшем существенного
спада биомассы вегетативных органов не происходит; 3) нарастание фитомассы
вегетативных органов осуществляется параллельно с репродуктивным процессом и
достигает максимума к концу вегетационного сезона. С учетом этого для вычисления
репродуктивного усилия целесообразно использовать максимальное значение
фитомассы вегетативных органов, а не случайно взятую в тот или иной момент времени
величину. В современной ботанической литературе (Harper, Ogden, 1970; Howarth,
Williams, 1972; Goldman, Willson, 1986; Кр1чфалушш, Мезев-Кр1чфалушш, 1994)
тонкости вычисления величины репродуктивного усилия нередко упускаются и
поэтому приводимые разными исследователями данные могут быть несопоставимыми.
В отдельных работах оценку репродуктивного усилия проводят, основываясь на
энергетических эквивалентах фитомассы. Расчетные формулы при этом остаются
прежними, но вместо граммов веса используются калории или джоули. Есть даже
попытки выразить размер репродуктивного усилия через минеральных веществ,
углерода или высокомолекулярных органических веществ, перемещающихся в семена
(Calow, 1979; Reekie, Bazzaz, 1987). Но, как правило, такое усложнение подходов
и методов не дает дополнительной биологической или экологической информации.
Поскольку физиологически наиболее активной частью растений являются
листья, прибегают к оценке репродуктивного усилия как отношения репродуктивных
показателей к общей листовой площади растения (А):
RE4=(WSM/A)xl00.
Такой подход оправдан тем, что общая фитомасса особи у растений ряда
жизненных форм «перегружена» отмершими клетками и тканями, которые выполняют
несущую или защитную функцию и вносят в оценку репродукции ненужный
информационный шум.
Семенное размножение
249
Число производимых растением семян характеризует «репродуктивное
давление» данной популяции на местообитание. Поэтому в отдельных случаях
репродуктивное усилие вычисляют как отношение числа образуемых семян (N ) или
плодов к общей фитомассе:
RE 5 = (Nsm/W) x 100.
У монокарпиков репродукция однократна, поликарпики вступают в
репродуктивный цикл неоднократно. Поэтому репродуктивное усилие у многолетних
растений предлагается вычислять как отношение фитомассы органов репродукции к
годичному приросту общей фитомассы растения (Willson, 1983) или как сумму
репродуктивных усилий за ряд лет репродукции (Марков, Плещинская, 1987).
Величина репродуктивного усилия (при ее оценке как RE ) варьирует в
широких пределах: в среднем от долей процента до 51% (Bierzychudek, 1982). У
многолетних растений она лежит на уровне 5-25%, у однолетников — в среднем
20-40%, а у сельскохозяйственных растений как результат селекции достигает
45-60%. В отдельных случаях репродуктивное усилие может составлять 61-70% .
Репродуктивное усилие в отношении органов вегетативного размножения
колеблется в диапазоне 23-80% (Willson, 1983). Размер репродуктивного усилия имеет
решающее значение для культурных растений, поскольку у подавляющего
большинства видов и сортов повышение урожайности обеспечивается прежде всего
возрастанием оттока органических веществ в органы репродукции (плоды и семена) и
поэтому является главной целью селекции.
Концепция альтернативного распределения ресурсов при конкуренции со
стороны отдельных органов растения не нашла универсального подтверждения.
Отрицательной корреляции репродуктивного усилия с формированием органов
вегетативного размножения не отмечалось, хотя известно, что высокорослые растения всегда
вынуждены увеличивать аллокацию в нерепродуктивные структуры (Givnish, 1993).
Но в этом направлении необходим дальнейший сбор фактического материала.
Связь репродуктивного усилия со стратегией жизни и жизненной формой
растений не очень жесткая. Обычно репродуктивное усилие выше и стабильнее по годам
у однолетников и монокарпиков, т.е. у r-стратегов. Но известно немало случаев,
когда поликарпики и многолетники имели высокие значения репродуктивного
усилия (26-60%), а однолетники — низкие (3-11%). У самоопыляющихся растений
затраты на формирование пестичных цветков больше, чем на формирование
тычиночных, тогда как у облигатных перекрестников это отношение бывает обратным
(DoustJ.,DoustL.,1983).Ha величине репродуктивного усилия сказывается
генетический полиморфизм видов и поэтому разные популяции могут существенно
отличаться друг от друга по этому показателю.
Сфера интересов многих ученых лежала в установлении общих закономерностей
изменения репродуктивного усилия в зависимости от вида растений и условий
произрастания, но полученный фактический материал неоднозначен. В целом,
репродуктивное усилие является видовым признаком, генетически наиболее
устойчивым по сравнению с другими показателями репродукции. Тем не менее его
закономерные изменения по эколого-ценотическим градиентам существуют. Так, у
Amphycarpa bracteata при смене местообитаний репродуктивное усилие менялось
от 15 до 41% (Willson, 1983), у Thlaspi arvense - от 20,5 до 54,1% (Злобин,
1989). Установлена тенденция к уменьшению репродуктивного усилия при
переходе растения из открытых местообитаний в сомкнутые сообщества, при низком
250
Системы репродукции
обеспечении минеральными веществами и при снижении абсолютной высоты над
уровнем моря. Имеют место и другие эффекты (см. Таблицу).
Во многих случаях изменения величины репродуктивного усилия отражают
разную модель строения тела растения (Марков, 1990), а также разный тип
дифференциации особей по жизненному состоянию и размеру. Обычно оно больше у
крупных особей (Barbour et al., 1980; Samson, Werk, 1986; Борисова, Малышева,
1993; Prati, 1997), но бывает и наоборот. Наблюдалась и независимость
репродуктивного усилия от размера особи. У многолетников величину репродуктивного
усилия чаще всего определяет размер особи к моменту первой репродукции. С этим
связана обратная корреляция величины репродуктивного усилия с плотностью
популяции. Размер репродуктивного усилия отдельных рамет может снижаться с
возрастом (например, у Orthilia secunda — Панченко, 1999). Но общие
закономерности возрастных изменений репродуктивного усилия пока остаются мало
изученными (Дашко, 1997; Кишко, 1998).
В мире растений реализуется множество разных типов распределения ресурсов в
органы размножения (Charlesworth, Morgan, 1991), для описания которых
разработано немало моделей. В целом, репродуктивное усилие пластично, непосредственно
Таблица: Тенденции изменения величины репродуктивного усилия у растений
в зависимости от эколого-ценотическнх условий
Виды растений
Многолетники
Ambrosia trifida
Anemone nemorosa
Chamaesyce hirla
Calinsoga spp.
Polygonum
cascadence
Rumex acetosella
Scrophularia nodosa
Spergula atvensis
Taraxacum officinale
Tussilago farfara
Однолетники
Характер изменения величины
репродуктивного усилия
При стрессах репродуктивная аллокация*
направляется только в пестичные цветки
Максимальна в оптимальных ценотических
условиях
Снижается при экологических стрессах
Снижается при водных дефицитах
Возрастает в нарушенных местообитаниях
Снижается с увеличением сукцессионного
возраста местообитания
Уменьшается при снижении освещенности
Снижается при водных дефицитах
Возрастает в нарушенных местообитаниях
Увеличивается при возрастании плотности
популяции
Стабилизируется или даже возрастает
с ухудшением условий
Ссылки
Bazzaz, 1984
Canullo, 1988
Fenner, 1985
Rai, Tripathi, 1983
Hickman, 1975
Escarr, Thompson, 1991
Baalen et al., 1990
Trivedi, Tripathi, 1982
Southwood, 1976
Fenner, 1985
Злобин, 1982; Марков,
Плещинская, 1987
* Аллокация (англ. allocation) — распределение, отток.
Семенное размножение
251
отражает жизненное состояние особей и является важным, хотя и не единственным,
компонентом репродуктивного успеха у растений. Оно, в первую очередь, служит
индикатором готовности особей к осуществлению репродукции и их возможностей
по вкладу материально-энергетических ресурсов в репродуктивные органы. В
последние годы в концепцию репродуктивного усилия включают также некоторые
аспекты взаимодействия полов и разнокачественности единиц размножения.
Борисова, Малышева, 1993; Злобин, 1989; Марков, 1987; Марков, 1990; Baalen van et al., 1990;
Barbour et al., 1980; Bazzaz, 1984; Bierzychudek, 1982; Calow, 1979; Canullo, 1988; Charlsworth,
Morgan, 1991; Doust J., Doust L.,1983; Escarre, Thompson, 1991; Givnish, 1993; Harper, Ogden,
1970; Hickman, 1975; Prati, 1997; Rai, Tripathi, 1983; Reekie, Bazzaz, 1987; Samson, Weerk, 1986;
Southwood, 1976; Trivedi, Tripathi, 1982; Willson, 1983.
РЕПРОДУКТИВНЫЙ УСПЕХ
В современной биологической литературе неоднократно обсуждался вопрос о
приоритетной стратегии в жизни растений. По мнению одних исследователей
(Гробстайн, 1968) приоритет принадлежит стратегии выживания организма,
других (Вернадский, 1978; Левина, 1981) — стратегии репродукции. В сущности это
ложная альтернатива. Фактически у всех растений онтогенетический цикл
подразделяется на две главные фазы: вегетативного роста и размножения. На протяжении
первой фазы, когда растение не обладает способностью к размножению, все его
материальные и энергетические ресурсы направлены на формирование структурных
компонентов тела и выживание организма. С момента перехода растения в
репродуктивную фазу положение в корне меняется, и центральной стратегией
оказывается обеспечение репродукции. Так что, в целом, стратегия выживания и стратегия
репродукции последовательно сменяют друг друга. Эти соображения позволяют
подойти к понятию репродуктивного успеха растений как одного из важнейших
параметров, характеризующих их жизненное состояние на втором этапе онтогенеза, и
как показателя конечных достижений в борьбе за существование. Общее понятие о
репродуктивном успехе растений обсуждалось еще Darwin (1859). Но как
самостоятельный термин он стал использоваться только с развитием популяционной
биологии растений (Harper, 1977).
Понятие репродуктивного успеха имеет разное содержание в зависимости от
уровня организации биосистем. Репродуктивный успех на уровне жизни особей
связан с плодовитостью растения, т.е. с количеством и качеством производимых
растением диаспор (см. Диаспора). Мерой репродуктивного успеха в этом случае
являются общее число производимых семян, соотношения числа плодов и цветков
или числа семян и семязачатков.
Но еще Fisher (1930) при разработке концепции репродуктивной ценности
видов подчеркивал, что нельзя связывать репродуктивный успех с одним только
количеством производимых диаспор. Это важная, но не единственная составляющая
репродуктивного успеха. В процессе микроэволюции могут иметь значение
незаметные на первый взгляд изменения репродуктивных структур и процессов. Так,
например, у Raphanus raphanistrum цветки желтые, а у его гибридов с R. sativus —
белые или розовые. А так как опылители явно предпочитают желтые цветки, то
идет элиминация семенного потомства таких гибридов (Lee, Snow, 1998). Итогом
252
Системы репродукции
J
репродукции является появление нового поколения растений, и в этом смысле
численность всходов и их закрепление — это главный и конечный индикатор
репродуктивного успеха растений на популяционно-ценотическом уровне.
Другой аспект рассматриваемой проблемы связан с ее расчленением на
репродуктивный успех как таковой и предпосылки, делающие репродуктивный
успех возможным. Исходя из этого, составляющие репродуктивного успеха
оказываются многообразными и включают в себя: вклад ресурсов в
репродуктивные органы; сохранение баланса между развитием вегетативных и
репродуктивных структур как необходимого условия для поддержания
жизнеспособности растений вплоть до фазы дисперсии семян; цветение в период
времени, благоприятный для опыления; созревание семян в сроки, удобные для их
дисперсии; а также формирование диаспор такого размера и в таком
количестве, которые оптимальны для появления будущего потомства. Репродуктивный
успех популяций дополнительно сопряжен с возрастным и жизненным
состоянием особей популяции, а у однополых растений связан с соотношением
тычиночных и пестичных растений в популяции.
Для каждого этапа репродукции существуют свои основные параметры,
которые могут использоваться как компоненты общей оценки репродуктивного успеха
(Злобин, 1989).
1. Фаза бутонизации — количество бутонов.
2. Фаза цветения — количество репродуктивной фитомассы; число цветков;
репродуктивное усилие; общее число семязачатков.
3. Опыление и оплодотворение — фертильность пыльцы; количество пыльцы,
поступающей на рыльца; число оплодотворенных семязачатков.
4. Фаза семеношения — количество репродуктивной фитомассы,
сосредоточенной в диаспорах; число плодов и семян; всхожесть и жизнеспособность семян;
гетероспермия.
5. Фаза дисперсии семян — количество семян, вступающих в дисперсию; агенты
разноса и дальность разноса семян.
6. Покой семян — глубина покоя семян; возможность формирования почвенного
банка семян и его размер.
7. Фаза прорастания семян — количество семян, сохранившихся к началу
прорастания; количество семян, давших всходы.
8. Формирование всходов и проростков — количество всходов и проростков и их
пространственное размещение.
После вступления поликарпических растений в репродуктивное состояние
интенсивность репродукции в разные годы бывает неодинаковой. Поэтому о
репродуктивном успехе нельзя судить по однократным учетам и наблюдениям.
Новые идеи в понимании репродуктивного успеха (Urbansca, 1989) связаны с
количественной оценкой трех компонентов репродукции: а) репродуктивного
предложения, которое понимают как количество семязачатков и количество пыльцевых
зерен; б) эффективности репродукции, выраженной как отношение
жизнеспособных пыльцевых зерен к общему их числу или как отношение числа вызревших
семян к числу семязачатков; в) всхожести семян.
Все эти показатели могут рассматриваться как характеристика репродуктивного
успеха особей растений, и тогда они определяются в расчете на одну особь. Но они
же дают информацию о состоянии популяции и ее ценотических и экосистемных
Семенное размножение
253
связях. В таком случае каждый из вышеприведенных параметров вычисляется на
единицу площади популяционного поля или биоценоза.
Существует непростая связь уровня репродуктивного процесса с развитием
вегетативных органов растения, с общим размером его фитомассы. С одной стороны,
для репродукции необходим определенный размер растения, меньше которого
репродукция невозможна, а с другой стороны, по крайней мере, у многолетних
растений, в годы активной репродукции явно снижен прирост вегетативных органов
(например, у деревьев закладываются более узкие годичные кольца древесины).
Формулируя принцип критических порогов для образования растениями органов
репродукции, Yokoi (1989) выделил два основных условия перехода растений к
размножению: а) достижение определенного возраста и б) достижение
определенного размера особи. Детальное исследование этой проблемы показало, что у
однолетников переход к репродукции контролируется, прежде всего, возрастом особи, у
двулетников — размером особи, а у многолетних трав дополнительным фактором
перехода к репродукции выступает характер местообитания. В богатых
местообитаниях, имеющих высокоплодородные почвы, критическую роль для начала
репродукции играет исходный размер особи, а в бедных — размер особи к началу
цветения. Есть виды растений, которые цветут при любом размере особей, а есть виды, у
которых критическим для начала цветения является один размер особи, а для
плодоношения — другой. У многолетников значения репродуктивных показателей
меняются с возрастом, и обычно между размером особи и величиной семенной
продукции имеется положительная корреляция (Aarssen, Taylor, 1992), тогда как для
однолетников характерна обратная связь роста и репродукции. Следует учитывать,
что органогенез цветка и семеношение обусловлены не просто формальными
параметрами размера особей, но их жизненным состоянием (Злобин, 1981).
В фазы бутонизации и цветения репродуктивный успех определяется
количеством закладываемых цветков и их функционированием. Закладываемость цветков
отражает состояние особей, их готовность к репродукции и зависит от доступности
ресурсов в среде и размера репродуктивной аллокации, т.е. перемещения
метаболитов из вегетативных органов растений в репродуктивные. Цветки насекомоопыляе-
мых растений несут важную сигнальную функцию и обладают выраженной
адресностью по отношению к определенному опылителю или группы опылителей (Peisl,
1997). Должно иметь место соответствие требований растений к фотопериоду и
термопериоду. Цветков всегда больше по сравнению с количеством образующихся
плодов. Главные причины гибели цветков следующие: а) недостаточное опыление у
анемофильных и энтомофильных растений, б) нехватка ресурсов, в) генетические
дефекты, г) экологические стрессы и д) деятельность вредителей.
Число пыльцевых зерен, приходящихся на один семязачаток, в природных
условиях сильно варьирует: от 1-3 штук до нескольких миллионов. Крупные особи
продуцируют больше пыльцевых зерен в расчете на один цветок. Многочисленные
опыты с доопылением цветков показывают, что недостаток пыльцы является очень
важным фактором, который обычно недооценивается. По средним подсчетам у
трав из-за недостатка пыльцы завязывается только 55% семян, а у деревьев — 11
(Howe, Westly, 1986). Немалое значение в репродуктивном успехе энтомофилов
имеет и количество производимого в цветках нектара. Это мало изученный вопрос,
но известно, что максимальное количество насекомых-опылителей привлекают
цветки с большим количеством нектара (Willson, 1984). Имеют преимущества и
254
Системы репродукции
виды с выраженным гелиотропизмом цветков, повышающим их прогреваемость,
что особенно важно для лесной и тундровой зон. Потери пыльцы у энтомофильных
растений оказываются не меньше, чем у анемофильных. В целом, у анемофилов и
энтомофилов переопыление охватывает лишь небольшие группы совместно
произрастающих растений, на рыльцах чаще всего преобладает чужая пыльца, ингиби-
рующая прорастание собственной пыльцы, и часто встречается самоопыление
(Голубев, Волокитин, 1986; Жиляев, 1989).
Стратегия репродукции проявляет себя в изменениях числа производимых
диаспор и их размера. Как два крайних решения выступают производство
небольшого количества семян, но с крупным зародышем и большим запасом
питательных веществ или образование значительного числа, но мелких семян. Обычно эти
тактики связывают соответственно с К- и r-стратегиями, которые реализуют
растения при прохождении своих жизненных циклов (Pianka, 1970). По данным
Govindaraju (1984), изучившего 34 вида хвойных растений Северной Америки,
для видов-колонизаторов были характерны крупные семена, а для климаксовых
видов — мелкие. Но это далеко не общее правило, а скорее общепринятое
заблуждение. Так, безусловный климаксовый вид Sequoiadendron giganteum
производит в расчете на одну особь 10 семян в год (Fenner, 1985). Двулетнее растение с
четкой r-стратегией Capsella bursa-pastoris дает до 200 тысяч семян, тогда как
Plantago major, являющийся по Trivedi, Tripathi (1982) типичным К-стратегом,
производит их 224 тысячи. По данным Radosevich, Holt (1984), в группе
однолетних сорных растений семенная продуктивность в расчете на одну особь
варьирует от 40 семян (Xanthium strumarium) до 900 тысяч (Anagalis arvensis). В
пределах группы цветковых растений общий вес производимых семян обычно
положительно коррелирует с размером растения.
Вес семян меняется в очень широких пределах — от 10 г (Orchidaceae) до 27
кг (Lodoicea maldivica). Определяет его в большей степени не столько стратегия,
сколько размер материнского растения. По большим выборкам подсчитано, что
для деревьев в среднем характерны семена массой 328 мг, для кустарников — 69
мг, а для трав — 7 мг. Существует зависимость размера семян от условий
произрастания растений. Но в целом вес семян по сравнению с другими репродуктивными
параметрами наиболее устойчив и варьирует мало даже при произрастании
растений в стрессовых условиях. С другой стороны, между весом и числом
продуцируемых семян существует обратная зависимость: чем тяжелее отдельное семя, тем
меньше их образуется на растении (Kawano, 1985).
Как крупные, так и мелкие семена имеют свои экологические недостатки и
преимущества с точки зрения конечного репродуктивного успеха. У крупных семян
больше запас питательных веществ, хорошо развитый зародыш позволяет быстрее
наращивать фотосинтезирующую поверхность и в итоге проросток оказывается
более конкурентноспособным. Однако, крупные семена требуют для прорастания
больше воды и чаще оказываются поврежденными фитофагами. К тому же
крупные семена при дисперсии имеют тенденцию концентрироваться возле
материнской особи, что в дальнейшем повышает конкуренцию между всходами. В
тщательно проведенных исследованиях над Lupinus texensis показано, что растения,
выросшие из более крупных семян, выделялись более высокими репродуктивными
показателями (Schaal, 1984). В целом крупные семена для растения оказываются
более выгодными (хотя и не во всех ситуациях).
Семенное размножение
255
Интегральную оценку репродуктивного успеха дает количество жизнеспособных
семян, производимое растением. Оно сопряжено с репродуктивным усилием растений
и размером производимых семян. Имеющиеся количественные данные по реальным
амплитудам значений этих параметров и по степени корреляций между ними
позволяют построить теоретическую модель, дающую возможность судить о величине
репродуктивного давления на местообитания растений, занимающих разное место в
континууме г-К- стратегии. Видно, что выходы числа семян максимизируются при двух
ситуациях: а) при мелких семенах (основной максимум) и б) при крупных семенах.
Амплитуда возможных значений репродуктивного усилия в обеих ситуациях
оказывается сходной. Минимальное количество семян производится, независимо от размера
репродуктивного усилия, у растений с промежуточной величиной семян (Схема 1).
Естественно, что у растений, реализующих разную репродуктивную стратегию,
могут наблюдаться более или менее значительные отклонения от теоретической модели.
Так, у группы из 18 видов сорных и рудеральных растений, для которых имеются
необходимые материалы (данные Stevens, 1957; Salisbury, 1976 и собственные
наблюдения), максимум выхода семян достигается при мелких семенах в сочетании с высокими
значениями репродуктивного усилия и при крупных семенах (но этот максимум был
невысоким) в сочетании с низкими значениями репродуктивного усилия (Схема 2).
В пределах одной популяции, как можно видеть на примере Thlaspi arvense,
также наблюдается достаточно широкая амплитуда сочетаний трех
анализируемых показателей репродуктивного успеха. В данной популяции преобладали
особи с репродуктивным усилием в 22-60% и мелкими семенами. Каждая такая
особь давала 500-1000 семян (Схема 3).
Дисперсия семян как компонент репродуктивного успеха подчинена немногим
основным принципам: она должна обеспечивать действенность быстрого заселения
свободных участков территории и не допустить обострения конкуренции с
материнскими особями. Обычно семена распространяются на расстояние от
материнского растения по радиусу в 100 м и менее, хотя в отдельных случаях это расстояние
может достигать 500 км. У зоохоров дисперсия семян улучшается при плотном
расположении материнских растений (Manasse, Howe, 1983).
Репродуктивный успех обусловлен также структурной (Обручева, Антипова,
1997) и гормональной готовностью семян к прорастанию (Процко, 1994). Он
оказывается сопряженным и с уровнем генетической, матрикальной и экологической
разнокачественности семян. Семена многих видов растений нуждаются в периоде
органического покоя, который проходят в период пребывания в почве. По
завершении дисперсии семена могут оставаться на поверхности почвы и тогда
перемещаться под действием поверхностных вод или ветра. Часто семена постепенно
заглубляются в почву. В агро экосистемах массовое заглубление семян в почву происходит
при вспашках, дискованиях или культивациях.
По отношению к семенному банку у растений существует выраженный
континуум стратегий с подразделением на следующие основные варианты: а)
немедленное прорастание семян осенью без формирования почвенного банка (например,
Dadylis glomerata); б) создание почвенного банка только на одну зиму с весенним
прорастанием семян (Mercurialis perennis); в) формирование многолетнего
почвенного банка из небольшой части семян (Epilobium hirsutum); г) поступление в
почвенный банк большей части семян (Calluna vulgaris). Разнятся почвенные банки и
по типам растительных сообществ — в девственных лесах они небольшие, в зла-
Схема 1. Теоретическая модель, показывающая зависимость между числом
образующихся семян, репродуктивным усилием и массой семян
11000°°
I 700°°°
°°°°
00°°°
о
I
ь
Схема 2. Соотношение между числом семян, нх массой и репродуктивным усилием
у 18 видов сорных растений (по материалам Stevens, 1957; Salisbury, 1976 и собственным
наблюдениям)
2600°°
22°°°°
%
1
Семенное размножение
257
ковниках, напротив, значительные. Чем выше сукцессионный возраст
местообитания, тем меньше размер почвенного банка семян (Петров, 1989) Возможно, это
связано с тем, что семена всех однолетников и двулетников сохраняются в почве
гораздо лучше, чем семена многолетников (Thompson et al., 1998). По годам
семенной банк сильно варьирует, и его размер во многом определяют фитофаги.
После достижения семенем структурной и метаболической готовности к
прорастанию пусковым механизмом последнего является вода (Обручева, Антипова,
1997). При оптимальной температуре и хорошей обеспеченности кислородом
прорастание идет быстрее, но сами эти факторы в отличие от воды триггером
прорастания не являются. В фазу прорастания семена отличаются повышенной уязвимостью
по отношению к стрессовым факторам. По мнению Angevine, Chabot (1979),
имеются две основные тактики прорастания: а) избегание трудных для прорастания
условий, что обеспечивается адаптацией механизмов длительности периода покоя
семян и пусковых механизмов прорастания; б) повышение устойчивости всходов к
неблагоприятным факторам.
Гибель всходов и проростков оказывается максимальной по сравнению со всеми
другими фазами репродуктивного процесса. Здесь важны даже тонкие детали
положения семени на поверхности грунта (Peart, 1984). В отличие от чисто
дарвиновского представления, по мнению отдельных исследователей (Cook, 1979)
критическим фактором репродуктивного успеха является не плодовитость растений, а
способность семян давать устойчиво жизнеспособные всходы и проростки. Очень
метким является в этой связи замечание о том, что заключения об экологических
связях взрослых особей могут быть ложными, так как растения растут там, где
Схема 3. Соотношение между числом семян, их весом и репродуктивным усилием
в популяции Thlaspi arvense
258 Системы репродукции
смогли сохраниться и прорасти семена, закрепиться всходы, а не там, где
экологические условия оптимальны для взрослых растений (Sagar, Harper, 1961).
В целом репродуктивный успех является сочетанием большого числа факторов,
в которые входят состояние растения, реализуемая им репродуктивная стратегия и
многочисленные популяционные и экосистемные связи организма.
Заключительные фазы репродукции полностью оказываются под контролем популяционных и
ценотических факторов.
Голубев, Волокит™, 1986; Жиляев, 1989; Злобин, 1981, 1989; Обручева, Антипова, 1997;
Петров, 1989; Процко, 1994; Aarssen, Taylor, 1992; Angevine, Chabot, 1979; Cook, 1979; Fenner,
1985; Ficher, 1930; Govindaraju, 1984; Howe, Westly, 1986; Kawano, 1985; Klinkhamer et al., 1990;
Manasse, Howe, 1983; Peart, 1984; Pianka, 1970; Rodasevich, Holt, 1984; Sagar, Harper, 1961;
Salisbury, 1976; Sarukhan, 1984; Schaal, 1984; Stevens, 1957; Trivedi, Tripathi, 1982; Urbansca,
1989; Willson, 1984; Yokoi, 1989.
ПОТЕНЦИАЛЬНАЯ СЕМЕННАЯ ПРОДУКТИВНОСТЬ
Изучение репродукции цветковых растений в динамике привело к
необходимости подразделения семенной продуктивности на две категории: потенциальную и
реальную семенную продуктивность. Потенциальной семенной
продуктивностью называют максимально возможное количество семян, которое способно
производить растение, популяция или фитоценоз за определенный
промежуток времени при условии, что все заложенные в цветках семязачатки смогут
сформировать зрелые семена.
Понятие о потенциальной семенной продуктивности впервые введено
Некрасовой (1960) при изучении хвойных древесных пород и уточнено Стариковой (1963)
и Левиной (1981).
В прикладных работах потенциальная семенная продуктивность нередко
приравнивается к потенциальному урожаю и тогда выражается числом семян, которые
могут быть произведены на единицу площади, занимаемой популяцией или
фитоценозом. Так, в лесоведении потенциальный урожай оценивают по числу
заложенных семязачатков в генеративных органах растений, вступающих в репродукцию
(Злобин, 1968). В этом случае потенциальный урожай выражают в расчете на
единицу площади. Сходные подходы имеют место в агрономии и луговедении.
В биологических исследованиях оценки потенциальной семенной
продуктивности строятся на учете числа семязачатков или пестиков, если плоды односемянные.
Так, крупнейший специалист по карпологии и семеношению Левина (1984) для
регистрации потенциальной семенной продуктивности у Bromopsis inermis учитывала
число колосков на растении, принимая во внимание, что колос этого растения дает
только одну зерновку.
Величина потенциальной семенной продуктивности варьирует у разных растений.
Следует отметить, что когда плодолистиков в цветке много, то их число от цветка к
цветку меняется в достаточно широких пределах, а когда плодолистиков мало (1-5), их число,
как и число семязачатков в них, жестко контролируется генотипом (Хохряков, 1975).
Другой важный фактор, определяющий уровень потенциальной семенной
продуктивности, состоит в присущей растению стратегии распределения
органических веществ в генеративные органы. Такое перемещение органических
веществ в органы размножения тесно сопряжено как с общим репродуктивным
успехом растений и, в частности, с пестичным успехом, так и с величиной репродук-
Семенное размножение
259
тивного усилия. Широкое варьирование размера репродуктивной аллокации от
особи к особи в пределах одной популяции и от популяции к популяции в пределах
одного вида растения делает оценки потенциальной семенной продуктивности
очень важными для определения репродуктивного давления растений на среду
обитания (Goldman, Willson, 1986).
Исследования последнего десятилетия свидетельствуют также о том, что
потенциальная семенная продуктивность нелинейно связана с общим размером
растения (Klinkhamer et al., 1992). Однако имеются данные, что пестичный
репродуктивный успех у растений определяется количеством органических
веществ, которое растение может направить на формирование пестиков и
развитие плода и семян, и связан с этим признаком линейно. На размере
потенциальной семенной продуктивности может сказываться и степень участия особи в
вегетативном размножении.
У культурных растений в результате длительного селекционного процесса
увеличено количество закладываемых семязачатков, а за счет активизации оттока
органических веществ в плоды и семена по сравнению с дикорастущими предками
повышен их конечный размер. Однако целенаправленной селекции на
жизнеспособность семян не ведется и поэтому при прорастании семян культурных растений
полной мобилизации запасных питательных веществ на нужды проростка не
происходит. Иногда даже отсутствуют ферментные системы, необходимые для этого.
Поэтому у культурных растений нет сопряженности между запасом питательных
веществ в семенах и качеством семян как единиц размножения.
На размер потенциального урожая существенно влияет возраст растений. У по-
ликарпических растений, которые дают несколько семеношений в течение своей
жизни, молодые особи имеют меньшую семенную продуктивность, затем она
возрастает, а у стареющих особей вновь падает. Наибольший репродуктивный выход
имеют средневозрастные генеративные особи (Ившин, 1998). Для многолетних
травянистых растений характерны пропуски отдельных лет, когда их
потенциальная семенная продуктивность оказывается нулевой.
Самый высокий потенциальный урожай дают растения, произрастающие в
условиях эколого-ценотических оптимумов (Добрецова, Беговатова, 1974). Как
следствие величина потенциальной семенной продуктивности закономерно
меняется вдоль экологических и ценотических градиентов (Rusch, 1993; Ким, 1997). Но
многое здесь зависит от видовой принадлежности растений, типа градиента и
масштаба сменяемости ведущих экологических факторов на нем. Так, Комендар с
соавторами (1996) наблюдал у Leucojum aestivum в Закарпатье одинаковое число
закладываемых семязачатков в лесных и луговых сообществах, тогда как у L.
vernum при возрастании высоты над уровнем моря с 200 до 1200 м количество
закладываемых семязачатков уменьшалось на 29,4%.
В целом размер потенциальной семенной продуктивности контролируется
четырьмя группами факторов:
1) генетическими, которые определяют верхний предел возможной плодовитости
растения;
2) физиологическими, которые включают возрастное и жизненное состояние особей;
3) экологическими, в число которых входят ресурсы и условия среды обитания
растений;
260
Системы репродукции
4) ценотическими, охватывающими сферу сообитания растений со всеми живыми
организмами сообщества.
Добрецова, Беговатова, 1974; Злобин, 1968; Ким, 1997; Комендар и др., 1996; Левина, 1984;
Хохряков, 1975; Goldman, Willson,1986; Klinkhameret al., 1992; Rusch, 1993.
РЕАЛЬНАЯ СЕМЕННАЯ ПРОДУКТИВНОСТЬ
Реальной (фактической) семенной продуктивностью называют количество
полноценных семян, производимое растением в расчете на одну особь
(Левина, 1981). Полноценность семян включает в себя прежде всего их
жизнеспособность, проявляющуюся в способности семян прорастать и давать всходы. Она
включает в себя также вес семян (обычно в виде массы 1000 семян в граммах),
лабораторную и полевую (грунтовую) всхожесть и количество здоровых семян.
С понятием реальной семенной продуктивности тесно связаны урожайность
и урожай семян. Понятие фактической урожайности, рассматриваемое как
выход массы семян или плодов с единицы площади, известно еще со времен
Древней Греции и Древнего Рима. Под урожайностью обычно понимают количество
полезной продукции (семян или плодов в первую очередь), получаемой с
определенной площади (Словарь ботанических терминов, 1984). Понятие
«урожай» приравнивают к общей валовой продукции, получаемой на
сельскохозяйственных землях (Гродзинский и др., 1991). В соответствии с этим под урожаем
семян надо понимать их количество или, чаще, вес в расчете на единицу
площади. Однако в биологии предпочитают использовать термин «продуктивность»,
тогда как в прикладных сферах — агрономии, лесоводстве и луговодстве —
термин «урожайность».
Таким образом, реальная семенная продуктивность характеризует плодовитость
особей растений, а урожайность семян — плодовитость популяций.
Реальная семенная продуктивность зависит от вида растений, варьируя от
нескольких семян до десятков или сотен тысяч штук на одну особь. Основное
количество семян в популяции производится небольшим числом крупных особей
(Hutchings, 1986). Такие сверхплодовитые особи, реальная семенная
продуктивность которых превышает среднюю для популяции в 2,4 — 80,0 раз, играют
важную роль в поддержании устойчивого существования видов растений (Salisbury,
1976). Реальная семенная продуктивность у растений варьирует сильнее, чем
потенциальная. Так, у Narcissus angustifolius первый из этих показателей изменяется
в пределах 39-69%, а второй — 12-22% (Кричфалуший, Комендар, 1990).
Определение реальной семенной продуктивности по количеству или весу семян
не дает однозначных результатов. Биологический смысл этих показателей не
совпадает, линейной связи между ними нет. Известно немало случаев, когда число
семян под влиянием тех или иных факторов не изменяется, но вес их падает или,
напротив, возрастает. Бывают и противоположные ситуации. Обычно число семян,
производимых растением, варьирует больше, чем вес семян (Primack, 1978).
Для более полной характеристики репродуктивного процесса растений было
предложено использовать коэффициент продуктивности (К ), равный
отношению реальной семенной продуктивности к потенциальной и выраженный в
процентах (Левина, 1982). Для растений разных жизненных форм имеется своя
специфика подсчета реальной семенной продуктивности. Полезным может быть на-
Семенное размножение 261
хождение коэффициента семинификации (Вайнагий, 1990), который может
сильно варьировать. Число формирующихся семян зависит от большого числа
факторов, среди которых важное значение придается достаточности опыления.
Развитие оплодотворенных семязачатков в дальнейшем определяется
количеством ресурсов, которые материнская особь может направить на их формирование.
А оно в свою очередь зависит от жизненного состояния особей, что
подтверждают многие опыты по искусственной дефолиации материнских растений в период
созревания семян.
Мало изученным остается вопрос о том, связано ли количество семязачатков,
которое закладывается на материнском растении, с их созреванием. Отдельные
наблюдения показывают, что «величина кладки» — так называют этот признак в
общей экологии — существенно влияет на итоговое количество спелых семян и их
полноценность (Пианка, 1981). Экологические стрессы в фазу формирования
семян также могут значительно снижать реальную семенную продуктивность, тогда
как в благоприятных условиях она может быть ниже потенциальной лишь на доли
процента. Так, у представителей группы неморальных трав широколиственных
лесов под влиянием стрессов рекреации (главным образом вытаптывание с
уплотнением почвы) выход семян снижался в 3-5 раз (Баштавой, 1998). У пяти видов
семейства колокольчиковых, произрастающих в лесах, которые испытывают
антропогенные воздействия, коэффициент семенной продуктивности уменьшается от
40,6% до 4,4% (Боронников, 1998).
На размере реальной семенной продуктивности сказывается
продолжительность периода созревания семян. Он даже у растений сходной жизненной формы
варьирует в широких пределах. Так, по данным Radosevich и Holt (1984) у
однолетних сорняков срок созревания семян варьирует от 40 (Setaria viridis) до 180
(Chenopodium album) дней.
Заметный урон формирующимся семенам приносит деятельность
«едоков» семян — фитофагов. В годы массовых вспышек численности
вредителей, питающихся семенами, или в условиях жестких экологических стрессов
потенциальный урожай теряется практически весь. Соотношения между
размером реальной семенной продуктивности и динамикой численности
фитофагов очень непростые. Так называемые «семенные годы», когда
количество производимых семян резко возрастает, позволяют растениям успешно
возобновляться и сохранять свою позицию в сообществах, так как вспышки
численности фитофагов не успевают за такими неожиданными для них
подъемами количества их пищи. Тем не менее в общем репродуктивном цикле на
фазу семязачатки — зрелые семена приходится самый высокий процент
гибели (Cavers, 1983).
Способность растений в отдельные годы резко повышать реальную семенную
продуктивность почти универсальна: семенные годы известны и у деревьев, и у
многолетних трав. У древесных пород семенные годы лучше выражены при
движении на северо-восток лесной зоны Евроазиатского континента. В сомкнутых
лесонасаждениях они проявляются меньше, на их частоту влияют и почвен-
но-климатические условия. Особенно характерны семенные годы для дуба, ели и
бука, мало свойственны — для березы, ольхи и тополя.
В оценку реальной семенной продуктивности растений входит и качество
семян, включающее в себя способность семян прорастать и формировать жизне-
262
Системы репродукции
способные всходы. Понятие о качестве семян вообще очень емкое. Согласно
Овчарову и Кизиловой (1966), на уровне особи имеют место три основные
формы разнокачественности семян: а) генетическая, возникающая за счет
объединения генотипов мужских и женских гамет; б) матрикальная, связанная с
различиями в положении семян на материнском растении; в) экологическая,
которая возникает за счет взаимодействия развивающихся семян с условиями
внешней среды. Обобщив все виды различий между семенами, Левина (1981)
предложила для их описания термин «неоднородность семян» и подразделила
ее на шесть основных форм: 1) количественная, проявляющаяся в несходстве
семян по размеру; 2) структурная, включающая форму, окраску и другие
морфолого-анатомические особенности семян; 3) биофизическая; 4)
биохимическая; 5) физиологическая; 6) экологическая. Таким образом,
неоднородность семян может проявляться в самых разных формах даже на уровне
отдельной особи растений. Если учитывать варьирование этих признаков на уровне
популяций и видов растений, то спектр полиморфизма семян оказывается
исключительно широким (см. Генетическая гетерогенность семян).
Величина реальной семенной продуктивности в конечном счете определяет
успех размножения растений. На ее основе разрабатываются модели
репродуктивного процесса растений, которые показывают, что как генетические программы
онтогенеза, так и эколого-ценотические условия их реализации чрезвычайно поливари-
антны и пластичны.
Вайнагий, 1990; Гродзинский и др., 1991; Левина, 1981,1982; Овчаров, Кизилова, 1966; Пианка,
1981; Словарь ботанических терминов, 1984; Cavers, 1983; Hutchings, 1986; Primack, 1978;
Radosevich, Holt, 1984; Salisbury, 1976.
СЕМЕННАЯ ПРОДУКТИВНОСТЬ ВИДОВ РОДА
SYMPHYTUM L. (BORAGINACEAE)
Виды Symphytum (окопника), интродуцированные из природной флоры,
используются в народном хозяйстве как кормовые, медоносные, лекарственные,
пищевые и декоративные растения. К ценным свойствам окопника можно
отнести: высокие урожаи зеленой массы, длительность произрастания на одном мес-.
те, экологическую пластичность, устойчивость к стрессам (Астахов, 1970;
Медведев, 1970; Смольский, Чекалинская, 1970; Фролов, 1976,1982,1993;
Медведев, Сметанникова, 1981; Варламова и др., 1997). Однако введение его в
культуру сдерживается несколькими причинами: неодновременностью
созревания плодов, их осыпаемостью, а также низкой семенной продуктивностью.
Представители рода Symphytum являются перекрестноопыляющимися энтомо-
фильными растениями. В условиях Северо-Западного региона цветки посещают
шмели и медоносные пчелы, причем опыление осуществляют шмель садовый и
шмель малый земляной. Остальные посетители собирают нектар, прогрызая
основание трубки венчика, и не принимают участия в опылении.
Цветки окопника имеют энтомофильную организацию и механизмы,
препятствующие автогамии: яркая окраска венчиков (розовая, красная, фиолетовая,
голубая) с указателями нектара, воронковидная форма, наличие флоральных
нектарников, херкогамия, а также дихогамия в форме протандрии. Многочис-
Семенное размножение
263
ленные цветки собраны в соцветия, что делает их хорошо заметными для
опылителей. Репродуктивный побег окопника представляет собой объединенное
соцветие (синфлоресценцию), состоящее из системы соцветий разных уровней.
Основным типом соцветия является тирс— сложное соцветие с моноподиально
нарастающей главной осью и боковыми соцветиями цимоидного характера —
двойными завитками (Федоров, Артюшенко, 1979). Выделяют главный, или
центральный и боковые тирсы.
Плод окопника — ценобий, состоящий не из двух (по числу плодолистиков), а
из четырех односемянных эремов (Артюшенко, Федоров, 1986). Эремы не
вскрываются, и семя, не освобождаясь из перикарпия, опадает с растения.
Исследования образцов разного географического происхождения показали,
что среднее число цветков в завитках, число завитков в центральных и боковых
тирсах, а также число репродуктивных побегов меняется с возрастом и достигает
максимальных значений в период зрелого генеративного растения (4-8 лет), а
затем постепенно снижается (Найда, 1998). Изменчивость числа репродуктивных
побегов особенно проявляется в возрасте старого генеративного растения. В это
время у одних растений уже наблюдается партикуляция и частичное выпадение
куста, а другие еще не подверглись этому процессу и число побегов не
сократилось. Изученные виды характеризуются высоким потенциалом плодообразова-
ния и семенной продуктивности (Табл. 1).
Под влиянием многочисленных факторов реальная семенная продуктивность
всегда бывает ниже потенциальной (Табл. 2). Наблюдения показали, что в
завитке не раскрываются от 1 до 5 бутонов, а часть раскрывшихся цветков не дает
плоды. Кроме того, не все семязачатки в цветках оплодотворяются и формируют
семена. Разница между числом бутонов в завитке и числом образовавшихся
плодов может составлять 45-80%. Еще более значительный разрыв (у Symphytum
asperum до 95%) отмечен между числом семязачатков в бутонах, числом фер-
тильных семязачатков в раскрывшихся цветках, числом завязавшихся семян и
числом зрелых нормальных семян.
Из четырех семязачатков, формирующихся в гинецее цветка окопника,
оплодотворяются и развиваются в семена чаще всего один-три, реже — все. Причем, у образцов
S. carpaticum, S. officinale, S. x uplandicum (к-16) в ценобии, как правило, созревают
два-четыре эрема, у остальных образцов — один-два. Поэтому коэффициент продук-
Таблнца 1: Потенциальная продуктивность видов Symphytum L.
Вид (образец)
S. asperum (к-21)
S. carpaticum (к-129)
S. officinale (к-115)
5. tanaicen.se (к-17)
S. х uplandicum (к-16)
Потенциальное
плодообразоваиие*
437,3
418,2
446,9
246,1
258,1
Потенциальная семенная продуктивность**
на побег
1749,2
1672,8
1787,6
984,4
1032,4
на растение
57198,8
29274,0
19663,6
17522,3
28391,0
Среднее число цветков на один побег (объем выборки 30 побегов).
: Среднее число семязачатков.
264
Системы репродукции
Таблица 2: Реальная продуктивность видов Symphytum L.
Вид (образец)
5. asperum (к-21)
5. carpaticum (к-129)
5. officinale (к-115)
5. tanaicense (к-17)
S. х uplandicum (к-16)
Плодообразование,
/о
13,5
60,8
60,4
50,1
71,4
Реальная семенная
п родуктивиость
на побег*
42,7
366,3
330,7
199,8
292,2
на растение**
20,3
117,5
86,4
34,7
83,6
Коэффициент
продуктивности,
/0
2,4
21,9
18,5
20,3
28,3
** Средняя масса семян на одно растение (г).
тивности всегда ниже процента плодообразования и колеблется по видам от 2,4 до
28,3%. У молодого и старого генеративного растения эти показатели обычно ниже.
Сравнивая продуктивность соцветий, следует отметить, что коэффициент
продуктивности выше в центральных тирсах, однако в отдельные годы более
продуктивны боковые тирсы. По-видимому, это связано с метеорологическими
условиями, в которых происходит цветение.
Известно, что у образцов S. officinale и S. carpaticum побеги двух поколений за
вегетационный период проходят полный цикл развития, при этом уровень семенной
продуктивности может быть выше либо у первого, либо второго поколения побегов.
Так, у представителей S. officinale в 1986 г. коэффициент продуктивности побегов
1-го поколения составлял 20,9%, 2-го — 28,0%, а в 1991 г. — 20,4% и 15,8%,
соответственно.
Анализ семязачатков и плодов окопника на разных фазах развития позволил
установить некоторые причины снижения семенной продуктивности (Схема).
Формирующиеся семязачатки гетерогенны, как и у ряда других видов растений (Орел и
др., 1986, 1987). Их можно разделить на четыре группы.
1 группа — фертильные оплодотворенные семязачатки, развивающиеся в семена.
2 группа — фертильные оплодотворенные семязачатки, но дегенерирующие
вследствие нарушений эмбриогенеза и эндоспермогенеза, причем остановка в
развитии может происходить как на начальных, так и на поздних этапах.
3 группа — фертильные неоплод отворенные семязачатки, их количество может
достигать 57,4-69,6%. Нарушения процесса опыления и отсутствие
оплодотворения могут быть вызваны недостатком или полным отсутствием
шмелей-опылителей в связи с неблагоприятными погодными условиями. Их
отсутствие в период массового цветения в течение двух суток снижает семенную
продуктивность на 3,2-12,1%. Кроме того, имеется прямая линейная
зависимость между жизнеспособностью пыльцы и коэффициентом семенной
продуктивности. Значения коэффициента корреляции (г=0,9) и коэффициента
детерминации (d=0,81) показывают, что 81% изменений коэффициента
продуктивности обусловлен жизнеспособностью пыльцы, а 19 % — связаны с
другими факторами. Эта группа семязачатков является резервом для
повышения семенной продуктивности.
66,7%
69,6%
2,9 "/о*
12,3% 18,8% g^
59,2%
9,5%
63,0%
61,0%
2,2%
29,1% 11,8% -~-% 3'7% 15,7°?^^ ПЛ%
21-5 А 10,4%
Д
57,4%
2,5%
58,1%
15,6% ^^ 12,3%
4,0%
D-2
-3
Схема. Структура семейной продуктивности у видов Symphytum L.
А-В - S.officinale (образцы К-115, К-28, К-193); Г - S.carpaticum; Д - S.tanaicense; Е-Ж -
5. х uplandicum (образцы К-51, К-16); 3 - S.asperum (образец К-15); 1 — процент реальной
семенной продуктивности, 2 — процент семязачатков, дегенерировавших после оплодотворения,
3 — процент фертильных неоплодотворенных семязачатков, 4 — процент семязачатков,
дегенерировавших до оплодотворения.
266
Системы репродукции
4 группа — стерильные семязачатки, в которых зародышевые мешки
дегенерируют до опыления, их доля может колебаться от 8,2% до 100%. В стерильных
семязачатках обнаружена дегенерация археспориальных клеток, мегаспор,
образование зародышевых мешков меньших размеров, а также слабое развитие
нуцеллуса. Семена не образуются.
Наибольший процент оплодотворенных семязачатков наблюдается, как
правило, в непарном цветке и первых трех-четырех цветках завитка. Так, у
представителей S. officinale уровень семенной продуктивности непарных цветков составляет
63,9%, первого цветка — 43,3%, второго — 50%, третьего — 40%, десятого —
16,7, пятнадцатого — 6,7%, т.е. чем ближе к верхушке находится цветок в завитке,
тем ниже процент оплодотворенных семязачатков. В подавляющем большинстве
случаев оплодотворяются и дают нормальные семена семязачатки абаксиальных
плодолистиков. Так, у S. tanaicen.se в непарных цветках абаксиальные семязачатки
формируют 36,1% семян, а адаксиальные — 27,8 %, в первых цветках завитка —
соответственно, 23,3% и 20,0%, во вторых — 28,3% и 21,7%.
Созревание эремов в многоуровневом соцветии у представителей рода
Symphytum сильно растянуто во времени, порядок созревания акропетальный.
Первыми начинают созревать эремы в нижних завитках центральных тирсов, затем этот
процесс распространяется на боковые тирсы. Собирать созревшие эремы
необходимо до раскрывания чашечки.
Уровень потенциальной семенной продуктивности у Symphytum имеет
выраженную видоспецифичность. Существенное колебание реальной семенной
продуктивности в разные годы обусловлено в значительной степени возрастом
растений. Наибольшего уровня продуктивность достигает в период зрелого
генеративного растения. Семенная продуктивность зависит также от таких факторов, как:
стерильность пыльцы, аберрантные семязачатки, дефицит опылителей,
нарушение оплодотворения и эмбриогенеза, метеорологические условия и другие.
Благодаря высокому потенциалу плодовитости видов, даже при умеренном
коэффициенте продуктивности, в конечном счете, образуется большое количество
полноценных семян, что дает возможность организации практического семеноводства
видов Symphytum.
Артюшенко, Федоров, 1986; Астахов, 1970; Варламова и др., 1997; Медведев, 1970; Медведев,
Сметанникова, 1981; Найда, 1998; Орел и др., 1986,1987; Смольский, Чекалинская, 1970;
Федоров, Артюшенко, 1979; Фролов, 1976,1982,1993.
СЕМЕННАЯ ПРОДУКТИВНОСТЬ АПОМИКТОВ
Семенная продуктивность псевдогамных апомиктичных форм обычно
низкая и в значительной мере зависит от мужского родителя, прежде всего от
уровня его плоидности (Nogler, 1984). Так, например, у Fragaria ananassa она не
превышает 40% (Батурин, 1987).
У автономных апомиктов, к которым относится большинство
представителей сем. Asteraceae, положение иное. Такие формы чрезвычайно удобны для
исследования семенной продуктивности и степени выраженности апомиксиса, так
как у них возможно получение апомиктичных семян в условиях изоляции.
Семенное размножение
267
Для апомиктичных форм данного семейства из родов Pilosella и Taraxacum
характерна высокая завязываемость семян в изолированных соцветиях (58-98%).
При этом нечетные и четные апомиктичные полиплоиды по степени завязывае-
мости семян не различались. В целом по этому показателю апомиктичные виды
не уступали половым, а чаще превосходили их (Jenniskens et al., 1984; Gadella,
1987,1991; Mogie, Ford, 1988; Кашин, Чернышева, 1997; Кашин и др., 1999а).
Среди видов рода Taraxacum в зависимости от частоты завязываемости семян в
условиях самоопыления выделяют факультативно агамоспермные (20-80%),
половые (близкой к 0) и облигатно агамоспермные (свыше 80%) формы (Richards,
1970; Rousi et al., 1985). По другим данным частота завязываемости семян при
самоопылении даже на уровне 85-90% позволяет относить форму к факультативно ага-
моспермной (Jenniskens et al., 1984). Последняя точка зрения ближе к истине, так
как есть серьезные основания считать, что облигатно апомиктичных форм в природе
не существует. Вероятно, предложенные критерии оценки можно распространить на
все роды сем. Asteraceae, в которых встречается апомиксис.
Семенная продуктивность апомиктичных форм Asteraceae в условиях
беспыльцевого режима (при кастрации) и самоопыления (при изоляции) достоверно не
различается. Это свидетельствует в пользу их облигатной аллогамности (Табл.)
(Кашин, Чернышева, 1997). В экспериментах показано, что и их половые
сородичи, в частности, виды родов Taraxacum и Pilosella облигатно аллогамны (Jenniskens
et al., 1984; Gadella, 1987).
Таблица:
Завязываемость и всхожесть семяи в популяциях некоторых видов и естественных
гибридов Pilosella.
Виды и условный номер
популяций
P. officinarum (22а)
(33а)
P. praealta
P. echioides (22ф)
(33Ф)
P. vaillantii
Р. х officinarum-praealta
P. x officinarum-vaillantii
P. x praealta-vaillantii
P. x officinarum-echioides
P. x echioides-praealta
Завязываемость семяи ( /о) в условиях
самоопыления
65.74 ± 6.24
71.97 ± 4.33
60.80 ± 2.38
0.00**
0.00**
89.44 ± 4.16
72.42 ± 4.61
75.522 ± 7.23
47.92 ± 11.16
69.59 ± 5.36
кастрации
75.40 ± 7.28
62.50 ± 4.61
57.90 ± 3.74
0.00**
0.00**
77.90 ± 0.91
82.49 ± 3.56
72.08 ± 3.02
свободного
цветения
88.07 ± 5.02
71.05 ± 4.70
Всхожесть
О/ *
семяи, /о
31.81 ±3.62
39.50 ± 4.16
52.45 ± 2.64
22.08 ± 3.97
30.00 + 2.82
60.00 ± 2.72
46.81 ± 5.24
20.04 ± 3.16
54.19 ± 6.21
6.12 ±3.61
57.55 ± 4.15
* Для P. echioides — при свободном цветении, для прочих видов — при самоопылении.
** Апомиктичных семян нет, отмечено наличие невыполненных партенокарпических семянок
при среднем их числе в соцветии 41.7±4.8;
268
Системы репродукции
При сравнении семенной продуктивности у исследованных апомиктичных
форм Asteraceae в условиях беспыльцевого режима при самоопылении и при
свободном цветении выявлено, что в условиях свободного цветения завязываемость
семян может возрастать (Табл.) (Кашин, Чернышева, 1997). Это также
свидетельствует в пользу того, что формы относятся к факультативно агамоспермным.
В одних и тех же популяциях видов агамного комплекса Pilosella при наблюдении
в течение пяти лет в условиях изоляции соцветий отмечено широкое варьирование за-
вязываемости семян по годам в пределах от 21 до 100% (Кашин и др., 1999а). Это
может быть связано как с прямым отрицательным действием неблагоприятных
факторов внешней среды на завязываемость и развитие семян, так и с тем, что погодные
условия смещают равновесие у факультативно апомиктичных форм то в сторону га-
моспермии, то в сторону преимущественной агамоспермии. В пользу последней
возможности говорят факты зависимости степени выраженности апомиксиса и
сексуальности у многих факультативно апомиктичных форм от внешних условий среды
(Nygren, 1946; Sparvoli, 1960; Knox, 1967; de Wet, Harlan, 1970; Nogler, 1984).
При исследовании всхожести семян у различных видов и гибридных форм
Pilosella максимальная всхожесть (52-60%) отмечена у агамоспермных форм с
нечетным уровнем плоидности (2n=5x=45) (P. vaillantii, P. praealta). В то же
время у полового вида P. echioides в двух исследованных популяциях (22ф и ЗЗф)
она находилась в интервале 22-30%, а у растений апомиктичной формы Р.
officinarum (четного полиплоида — 2п=6х=54) — не превышала 40% (Табл.)
(Кашин и др., 1999а). У полового тетраплоидного и апомиктичного пентаплоид-
ного биотипов P. officinarum средний процент прорастания семян был примерно
на том же уровне (37%) (Gadella, 1987).У межвидовых естественных гибридов,
имеющих устойчивый морфотип и существующих в ранге микровида (Р. х
officinarum-vaillantii, P. x officinarum-praealta), частота образования семян была
высокой (93-100%), а их всхожесть была на уровне 39%. При этом они вели
себя как факультативные апомикты. Сходно вели себя и межвидовые
естественные гибриды, не имеющие устойчивого морфотипа (P. x vaillantii-praealta) и
обильно представленные в ценозе (семенная продуктивность на уровне 76%,
всхожесть семян — 54%). Характерно, что те и другие являются гибридами
между факультативно апомиктичными видами. В то же время гибриды между
половым и апомиктичным видами P. x officinarum-echioides, изредка встречающиеся
в пределах исследованных ценозов, имели завязываемость семян на уровне 59%,
но лишь единичные из них были всхожими. Гибриды между апомиктичным и
половым видами P. x praealta- echioides с устойчивым морфотипом, существующие в
ранге локальной микропопуляции, имели завязываемость семян на уровне 70% и
всхожесть семян — 58% (Кашин и др., 1999б). Семена гибридов между половым
(4х) и апомиктичным (5х) биотипами P. officinarum также характеризовались
низкой всхожестью (Gadella, 1987). Показано, что в популяциях апомиктичных
(апоспорических) и половых форм агамного комплекса Pilosella формируются
семена разных уровней плоидности (2х-6х).
Одной из наиболее вероятных причин образования семян с разной плоидностью в
популяциях и даже в потомстве отдельных особей является снижение плоидности за
счет партеногенетического развития зародышей в апоспорических зародышевых
мешках. При этом в силу того, что апомиктичные формы исследованного фрагмента
агамокомплекса в основном пентаплоиды, т.е. имели хромосомно несбалансирован-
Семен
ное размножение
269
ный геном, переход на более низкие уровни плоидности происходил у них не с
уменьшением числа хромосом вдвое, а чаще всего с уменьшением на 1х-2х через механизм
типа перманентной нечетной полиплоидное™, описанной, например у Rosa canina
(Tackholm, 1922; Darlington, 1937; Грант, 1984).
Интересно, что у половой формы P. echioides в силу хромосомной
сбалансированности генома реверсия на дигаплоидный уровень происходила чаще всего с
образованием строгих дигаплоидов (2х=18). Это является аргументом в' пользу того,
что геномная изменчивость в популяциях действительно связана прежде всего с
реверсией на дигаплоидный уровень, которая является следствием нестабильности
системы семенного воспроизводства.
Уровни плоидности семян в одних и тех же апомиктичных популяциях
варьируют по годам, находясь в существенной зависимости от внешних условий. Само их
одновременное присутствие в популяциях и в потомстве отдельных растений
оказывается возможным благодаря динамическому равновесию апо-амфимиктичных
систем семенного воспроизводства, причем в сложной взаимосвязи и комбинации
эуспории, апомейоза, партеногенеза и эмбриогенеза. Это связано с тем, что в
подавляющем большинстве случаев или всегда апомиксис встречается в природе не в
облигатном, а в факультативном выражении (Clausen, 1954; Skalinska, 1971;
Gadella, 1972; Asker, 1979; Nogler, 1984; Asker, Jerling, 1992), т.е. процесс «апо-
миктизации» формы, вероятнее всего, никогда не идет до конца. А это, в свою
очередь, порождает у них всю сложность сочетаний путей реализации семенного
воспроизводства. Рис. 16-18.
Рис. 16. Частота образования семянок в условиях самоопыления у растений
в популяциях видов Pilosella в различные годы генерации.
1 — P. echioides (ЗЗф); 2 — P. echinoides (22ф); 3 — P. officinarum (33а); 4 — P. officinarum (22а);
5 — P. vaillantii; 6 — P. praelata. У P. echinoides семянки партенокарпические.
По: Кашин, ориг.
P. x praealta-
echioides
P. x vaillantii-
praealta
P. echioides
ЗЗф
P. ecMoides
22ф
P. vaillantii
P. praealta
P. officinarum
33a
P. officinarum
22a
Щ
I I I I I
0 20 40 60 80 100
Частота встречаемости, %
■ 6x
■ 5x
H4x
□ 3x
Рис. 17. Частота встречаемости семян с зародышами разных уровней плоидиости
в популяциях различных видов Pilosella.
По: Кашин, ориг.
Pilosella officinarum (22a)
100
^ 90
g 80
70
I 6°
£ 50
м
5
I
«S
з- юн
40-
30-
20
1996i
1997 г
Pilosella officinarum (33a)
1998 г
Ш2Х
пз»
□ 4х
■ Зх
Вбх
1996i
1997i
Pilosella vaillantii
1996 г 1997 г 1998 г
Рис. 18. Динамика встречаемости семян с зародышами различных уровней плоидиости
в популяциях полового и апомиктичных видов Pilosella по годам
По: Кашин, ориг.
272
Системы репродукции
Батурин, 1987; Грант, 1984; Кашин, Чернышова, 1997; Кашин и др., 1999а, б; Asker, 1979; Asker,
Jcrling, 1992; Clausen, 1954; Darlington, 1937; De Wet, Harlan, 1970; Gadella, 1972, 1987, 1991;
Jenniskens et al., 1984; Knox, 1967; Mogie, Ford, 1988; Nogler, 1984; Nygren, 1946; Richards, 1970;
Roussi et al., 1985; Skalinska, 1971; Sparvoli, 1960; Tackholm, 1922.
АБЕРРАНТНЫЕ СЕМЯЗАЧАТКИ И СЕМЕНА: СТРОЕНИЕ
И ДИАГНОСТИКА
Аберрантные (лат. abberans — отклоняющийся) семязачатки и семена
характеризуются отклонениями в форме, строении и функциях, что приводит к частичной
дегенерации или полному их отмиранию. Синонимы: абортивные, аномальные,
стерильные семязачатки и семена.
Время появления аномалий, их характер и степень выраженности являются так-
соноспецифическими, при этом у разных растений деструкции подвержены
различные структуры. Аберрантные семязачатки отличаются от фертильных
меньшими размерами (например, у Oxalis magnified — Guth, Weller, 1986). Их
возникновение может быть связано с изменением соотношения размеров интегументов и
нуцеллуса — увеличением размеров интегументов и уменьшением — нуцеллуса
(Phytolacca americana — Mikesell, 1988), остановкой роста зародышевого мешка в
длину (Prunus avium — Tukey, 1933) и т. д.
Такие семязачатки могут быть диагностированы по изменению их
морфологического типа (с анатропного в норме — на ортотропный), наличию асимметричного
интегумента, который не полностью окружает нуцеллус, по отсутствию микропиле или
формированию слишком широкого микропиле (Rhododendron nutallii — Palser et al.,
1990). У мутантных растений вместо двух интегументов развивается единственная
структура, которая может быть лопастной и напоминать интегумент в ранней стадии
эволюционного становления (мутант fee/1 Arabidopsis ihaliana — Robinson-Beers et
al., 1992). Абортирование семязачатков может вызываться разрастанием нуцеллуса
и выходом его за пределы микропиле (Saxegotheca conspicua — Noren, 1908; Rosa
sp., Cerasus vulgaris — Савченко, 1959), дегенерацией фуникулуса (Pistacia vera —
Grundwag, Fahn, 1969; Bradley, Crane, 1975; Shuraki, Sedgley, 1996) или халазы
(Persea americana — Steyn et al., 1993). Обнаружены так называемые овулоиды,
состоящие только из клеток наружного и внутреннего интегументов (Eucalyptus
woodwardii — Sedgley, 1989) или интегумента и остатков халазы (виды Vaccinium —
Bell, 1957; Eaton, Jamont, 1966; Stushnoff, Palser, 1969; Анисимова, 1997). В
последнем случае в аберрантных семязачатках выявлены изменения во времени начала
дегенерации нуцеллуса. В фертильных семязачатках этот процесс происходит на
двух- или четырехъядерной стадии развития зародышевого мешка, тогда как в
аберрантных время дегенерации смещалось на 8-ядерную стадию и даже на период после
опыления. По мнению Hall et al. (1966), длительное сохранение нуцеллуса и
сопутствующие процессы преждевременной деструкции интегумента ответственны за
женскую стерильность у некоторых клонов Vaccinium angustifolium.
Аберрантные семязачатки Paeonia lactiflora еще до оплодотворения
характеризуются целым комплексом признаков-маркеров, таких как: увеличение числа слоев
и гипертрофия клеток интегументального тапетума и апикальной части внутреннего
интегумента, преждевременная дегенерация нуцеллуса в микропилярной и средней
Семенное размножение
273
частях семязачатка, преждевременное накопление танинов в клетках наружного
эпидермиса наружного интегумента, изменение строения клеток плацентарного
обтуратора (Шамров, 1995, 1997а). Разрастание интегументального тапетума,
проявляющееся в увеличении числа слоев характерно и для некоторых других видов
(например, Helianthus annuus — Савченко, 1959). В неоплодотворенных
семязачатках признаки деструкции тканей и клеток обнаруживаются сначала во
внутреннем интегументе и нуцеллусе вблизи проводящего пучка, при этом отмечается
преждевременная лигнификация клеточных оболочек гипостазы (Daphne
arbuscula — Erdelska, 1999). Затем в этот процесс включается наружный
интегумент, в котором имеется проводящий пучок, идущий из фуникулуса.
Очень часто аберрантные семязачатки и семена характеризуются процессами
деструкции, начиная с ранних стадий развития. Дегенерации могут подвергаться
мегаспороциты, мегаспоры и зародышевые мешки, при этом в последних
выявлены нарушения синтеза крахмала в центральной клетке (например, у Medicago и
Trifolium — Bingham, Hawkins-Pfeiffer, 1984; Орел и др., 1985; Огородникова,
1989; Зимницкая, 1992; Казачковская, 1992; Полюшкина, 1993). В
аберрантных семязачатках еще до оплодотворения отмечено недоразвитие зародышевых
мешков (Paeonia anomala — Яковлев, Иоффе, 1957,1965; Yakovlev, Yoffe, 1957),
отсутствие клеткообразования (в ряде случаев образуется два зародышевых
мешка) (Eucalyptus woodwardii — Sedgley, 1989), их дегенерация во время
цветения (Е. cinerea — Полунина, 1957, 1963). Клетки зародышевого мешка могут
полностью разрушаться еще до оплодотворения (Vitis vinifera — Якимов и др.,
1977). После оплодотворения деструкции подвергается зародыш (мутанты
Arabidopsis thaliana — Meinke, 1982) либо зародыш и/или эндосперм (виды
Vaccinium — Bell, 1957; Eaton, Jamont, 1966; Stushnoff, Palser, 1969; Анисимова,
1997). В аберрантных семязачатках Paeonia lactiflora зародышевые мешки, как
правило, дегенерируют до оплодотворения (Шамров, 1995,1997а). Реже
встречаются зародышевые мешки (вхождение пыльцевых трубок в них не
обнаружено), в которых отдельные клетки (яйцеклетка, синергиды) проявляют
способность к апомиксису (партеногенез, синергидная апогаметия).
Признаками, представляющими ценность для диагностики аберрантных
семязачатков и семян, могут быть не только отклонения в их строении, но и специфика
метаболизма в отдельных тканях. В таких семязачатках еще до оплодотворения клетки
халазы, интегументов, нуцеллуса и гипостазы приобретают мощные каллозные
оболочки, что приводит к изменению путей транспорта веществ в семязачатке. Задержка
лизиса клеток в апикальной части нуцеллуса препятствует проникновению пыльцевых
трубок в зародышевый мешок (Brassicaceae, Fabaceae, Poaceae, Rosaceae, Solanaceae
- Bingham, Hawkins-Pfeiffer, 1984; Орел и др., 1985; Briggs et al., 1987;
Огородникова, 1989; Vishnyakova, 1991; Зимницкая, 1992; Казачковская, 1992; Полюшкина,
1993). Предложены различные экспресс-тесты для выявления аберрантных
семязачатков: свечение каллозы (Fabaceae, Solanaceae и др. — Vishnyakova, 1991), реакции
на пектиновые вещества, кислые полисахариды, кислую фосфатазу в области
микропиле перед оплодотворением (Oenothera hookeri, О. mut. brevistylis, Capsella
bursa-pastoris, Sisymbrium loselii — Chudzik, Sniezko, 1997 a,b, 1999).
Аномалии в ходе развития семязачатка могут быть вызваны различными
причинами: морфогенетическими, генетическими, физиологическими, антэкологическими,
экологическими (см. Таблицу). Одна из них связана с положением семязачатков в
274
Системы репродукции
завязи. В этом случае оплодотворение первого семязачатка и начало развития семени
в многосемянных плодах приводит, возможно, к перераспределению в поступлении
питательных веществ. Как показало экспериментальное исследование поглощения
С —сахарозы в условиях in vitro и влияние гормонов на соцветия in situ,
недоразвитие семян в нижней части плода (у Pongamia pinnata он из 2-3-семянного становится
односемянным) связано с ингибирующим действием ростовых гормонов растения
после того, как произойдет оплодотворение верхних семязачатков (Arathi et al.,
1999). У представителей сем. Fabaceae абортированные семязачатки можно
обнаружить в различных частях завязи: в базальной части (Bawa, Webb, 1984), ближе к
столбику (Horovitz et al., 1976) или на концах завязи (Link, 1961). Подобное имеет
Таблица: Возможные причины образования аберрантных семязачатков
Факторы
Морфогснетнчсскис
- положение в завязи
Генетическне
- наличие летальных мутаций в мейозе
- апоптоз
Физыологнческне
- недостаток ресурсов для развития
всех заложившихся семязачатков
- блокирование транспорта веществ в
семязачаток
Антэкологические
- низкое качество пыльцы
- недостаточное количество пыльцы
-конкурентное развитие пыльцевых
трубок
- отсутствие опылителей
- отсутствие условий для опыления
- низкий уровень соотношения числа
пыльцевых зереи и семязачатков
Экологические
- неадекватность условий произрастания
(экологические стрессы)
- специфика отдельных периодов цветения
Ссылки
Horovitz et al.,1976; Bawa, Webb, 1984
Wiens et al. 1987; Charlesworth, 1989
Batygina, Shamrov, 1993; Батыгииа, Воронова, 1999
Janzen, 1977; Haig, Wesloby, 1988;
Zimmerman, Pyke, 1988; Vaughton, 1993;
Navarro, 1998
Pimienta, Polito, 1982; Ganeshaiah, Uma,
Shaanker, 1992
Marshall, Elslrand, 1988
Casper, Niesenbaum, 1993; Navarro, 1998
Lee, 1984; Josht et al., 1993; O'Donnell, Bawa, 1993
Mengesetal., 1986
Erdelska, 1999
Cruder., 1977
Tilton, 1980; Stephenson, 1981; Meinke, 1982;
Sheridan, Neuffer, 1982; Bingham, Hawkins-
Pfeiffer, 1984; Felker et al., 1985; Marsden,
Meinke, 1985; Hodgson, 1989
Stephenson, 1981; Navarro, 1998
Семенное размножение
275
место, вероятно, и у ряда других растений (например, у Quercus gambelii —
Mogensen, 1975; Челак, 1997 и Trapa natans - Титова, 1988; Titova et al., 1997).
По мнению Charlesworth (1989), в популяциях растений, особенно многолетних
и опыляющихся исключительно перекрестно, накапливается «генетический груз»
(рецессивные летальные мутации), что понижает общую жизнеспособность
популяции. При конкуренции между семязачатками и плодами отмирают прежде всего
семена с «вредными» мутациями, которые проявляются на ранних этапах
онтогенеза. Как отражение гибридного происхождения рассматриваются аномалии в
развитии генеративных органов, в том числе и семязачатков, у некоторых видов рода
Medicago (Орел и др., 1985), а также Paeonia majko (Жгенти, 1978) и P. lactiflora
(Шамров, 1995,1997а).
О влиянии антэкологических причин на образование аберрантных семязачатков
свидетельствуют эксперименты с Capsicum annuum. Они показали, что при
недостаточном количестве пыльцы во время цветения в плодах образуется значительное
число абортивных семязачатков и семян. При дополнительном опылении число
оплодотворяющихся семязачатков увеличивается, однако при этом происходит абор-
тирование других плодов, развивающихся вслед за первым. Поэтому для
получения большого числа плодов рекомендовано использовать для опыления меньшее
количество пыльцы, чем это требуется для завязывания имеющихся семязачатков
(Marcelis, Baan Horman-Eijer, 1977).
Наличие аберрантных семязачатков в завязи приводит к снижению реальной
семенной продуктивности. Семязачатки с отклонениями могут дегенерировать
полностью в процессе развития, либо сохраниться, трансформируясь в семена,
отличающиеся от нормальных по форме, размерам, окраске и внутреннему строению.
Эти структурные, а часто физиологические различия семян внутри одного плода
или на растении в целом являются основой гетероспермии (см. Гетероспермия;
Реальная семенная продуктивность).
Феномен образования аберрантных семязачатков и семян имеет всеобщий
характер и связан у некоторых растений с адаптацией к расселению. Такие
семязачатки и семена встречаются преимущественно в многосемянных плодах и часто
обнаруживаются у растений, плоды которых расселяются с помощью воды, ветра или
животных. При этом уменьшается вес плодов, а в ряде случаев, как например у
Eucalypttus woodwardii, абортируемые семязачатки и семена до конца не
разрушаются и вместе с нормальными семенами создают форму плода (Augspurger, Hogan,
1983; Sedgley, 1989; Ganeshaiah, Uma Shaanker, 1992). У видов Vicia размер плода
коррелирует с общим числом семязачатков в завязи и числом абортируемых семян.
Виды с мелкими плодами (V. hirsuta, V. pubescens) характеризуются небольшими
семенами и низкой абортированностью, тогда как у видов с крупными плодами (V.
lutea, V. sativa) наблюдается обратная зависимость (Ortega-Olivencia, Delesa,
1977). Появление абортивных семязачатков у ряда растений, связанное с
перераспределением питательных веществ из дегенерирующих семязачатков в
развивающиеся, рассматривается как один из элементов жизненной стратегии в крайних
условиях существования (Erdelska, 1999).
Изучение и диагностика возникновения аберрантных семязачатков и семян
имеют важное значение как в теоретическом плане, так и в практических целях. Это
направление исследований приобретает особую актуальность в связи с выявлением
механизмов воздействия внешних неблагоприятных факторов на репродуктивные
on
ит
Рис. 19. Аберрантные семязачатки и семена у Paeonia lactiflora.
1_4 — фертильный семязачаток перед оплодотворением (1 — схема, 2 — микропилярная и 3 — хала-
зальная части) и на стадии зиготы (4);
ит
ит
-л$Ш
Рис. 19 (продолжение).
5-7 — аберрантный семязачаток перед оплодотворением (5 — схема, 6 — микропилярная и 7 — ха-
лазальная части): почти полное разрушение клеток микропилярной и средней зон нуцеллуса,
разрастание клеток интегументального тапетума, преждевременное отложение танинов в клетках
наружной эпидермы наружного интегумента; 8-11 — строение клеток интегументального тапетума в
фертильном (8, 9) и аберрантном (10, И) семязачатках;
Рис. 19 (продолжение).
12 13 - микропилярная часть семязачатка с разросшимся нуцеллярным колпачком и формирующимся нуцел-
лярным зародышем; 14 - двуядерный партеногенетический зародыш и неразрушенные синергиды, 15> -
деление в сииергиде; 16 - трехклеточный партеногенетический зародыш и неразрушенные синергиды; 1/, 10 -
фрагменты зародышевого мешка: двуядерный партеногенетический зародыш, отсутствие синергид
(разрушились) полярные ядра в центральной клетке еще не объединились (17), антиподы (18); масштабная линеи^
1,5 - 0.3 ммГ2,3,17,18 - 0.05 мм, 4,6-8,10,12 - 0.1 мм, 9,11,14-16 - 0.02 мм, 13 - 0.03 мм; в и - внутренний
и'нтегумент,' г - гипостаза, ит- иитегументальный тапетум, кт- клетки с танинами, л он- латеральная
область нуцеллуса, ни- наружный интегумент, н к - нуцеллярный колпачок, on - оперкулум, пд - подиум,
пло- плацентарный обтуратор, пс - постамент, m с - таниносодержащий слой, энд - эндосперм.
По: Шамров, 1997а.
Семенное размножение
279
структуры и в аспекте общей проблемы сохранения биологического разнообразия.
Выявление признаков-маркеров и дальнейшая разработка экспресс-методов для
оценки развивающихся семязачатков, особенно к моменту оплодотворения,
остается одной из первостепенных задач при исследовании репродуктивной биологии
редких, исчезающих и хозяйственно-ценных видов растений. Рис. 19.
Анисимова, 1997; Батыгина, Воронова, 1999; Жгенти, 1978; Зимницкая, 1992; Казачковская,
1992; Огородникова, 1989; Орел и др., 1985; Полюшкина, 1993; Титова, 1988; Челак, 1998;
Шамров, 1995,1997а; Яковлев, Иоффе, 1957, 1965; Arathi et al., 1999; Augspurder, Hogan, 1983;
Batygina, Shamrov, 1993; Bawa, Webb, 1984; Bell, 1957; Bingham, Hawkins-Pfeiffer, 1987; Bradley,
Crane, 1975; Briggs et al., 1987; Casper, Niesenbaum, 1993; Cave et al., 1961; Charlesworth, 1989;
Chudzik, Sniezko, 1997 a,b, 1999; Cruden, 1977; Eaton, Jamont, 1966; Erdelska, 1999; Felker et al.,
1985; Ganeshaiah, Uma Shaanker, 1992; Guth, Weller, 1986; Haig, Westoby, 1988; Hall et al., 1966;
Hodson, 1989; Horobvitz et al., 1976; Joshi et al., 1993; Link, 1961; Marsden, Meinke, 1985; Marshall,
Ellstrand, 1988; Meinke, 1982; Menges et al., 1986; Mikesell, 1988; Mogensen, 1975; Navarro, 1998;
O'Donnell, Bawa, 1993; Ortega-Olivencia, Devesa, 1997; Palser et al., 1990; Pimienta Polito, 1982;
Robinson-Beers et al., 1992; Sedley, 1989; Sheridan, Neuffer, 1982; Shuraki, Sedley, 1996;
Stephenson, 1981; Steyn et al., 1993; Stushhoff, Palser, 1969; Titova et al., 1997; Vaughton, 1993;
Vishnyakova, 1991; Wiens et al., 1987; Yakovlev, Yoffe, 1957.
ГЕТЕРОСПЕРМИЯ (греч. heteros — иной, различный, другой и sperma — семя)
— наличие на одном растении семян, различающихся по размерам, весу, окраске,
морфологии, анатомическому строению, генетической характеристике,
биохимическому составу, характеру прорастания и другим признакам. Синонимы:
гетерогенность, неоднородность и разнокачественность семян.
Гетероспермия широко представлена в растительном мире и присуща как диким,
так и культурным формам. В определении самого понятия и в терминологии,
касающейся разных сторон гетероспермии, нет четкости и единого мнения (см. Вареник,
1955; Строка, 1962,1964, 1966; Овчаров, Кизилова, 1966; Бартков, 1972,1973;
Левина, 1981; Данилова, Кирпичников, 1985; Макрушин, 1989).
В одной из первых работ, посвященных анализу причин разнокачественности
семян, а также тканей и клеток растений, Тамберг (1947,1951) выделила три ее типа:
вегетативное (соматическое) расщепление, стадийная разнокачественность и
физиологическая разнокачественность. Развивая эти представления, Строна (1962,1964,
1966), Овчаров и Кизилова (1966), Кизилова (1974) предложили различать три
типа (авторы называли их категориями) разнокачественности семян —
генетическую, материнскую (матрикальную) и экологическую. В качестве самостоятельных
рассматривались также гравиморфный, энантиоморфный, сексуальный и магнито-
морфный типы (Сулима, 1970; Бартков, 1973). В классификации Макрушина
(1989) учитывались происхождение факторов влияния, характер изменчивости
различных признаков семян, а также область использования в практических целях. Он
выделил четыре категории гетероспермии — популяционную, фамилиальную
(семейственную), матрикальную и изолокусную (обусловлена спецификой
эмбриональных процессов в отдельных цветках соцветия). Каждая категория, кроме первой,
подразделяется на три типа (экологический, трофический и генотипический). В по-
пуляционной категории различается только экологический и трофический типы.
Результатом глубокого анализа факторов, влияющих на развитие семени и
приводящих к неоднородности семян, является классификация Левиной и ее коллег
(Войтенко и др., 1980; Левина, 1981), в основу которой положены следующие
280
Системы репродукции
признаки: количественные, структурные, биофизические, биохимические,
физиологические, экологические. Признаки неоднородности семян могут быть
выражены в разной степени, сочетаться самым различным образом и проявляться
на разных уровнях (в пределах одного плода, одной особи, популяции, вида).
В соответствии с вышеперечисленными признаками в классификации Левиной
(1981) выделены типы, подтипы и формы неоднородности семян, при этом для
каждой формы указаны уровни, на которых она проявляется (органый, организмен-
ный, популяционный, видовой). Автор различает два типа неоднородности семян:
наследственную (генотипическую) и ненаследственную (модификационную).
Наследственная неоднородность подразделена на два подтипа и четыре формы: 1
— фенотипически разнородные семена, сходные по генотипу (форма — гетерокар-
пическая); 2 — фенотипически разнородные семена, различные по генотипу
(формы — индивидуальная, межпопуляционная и географическая). Ненаследственная
гетероспермия включает лишь формы: матуральную1, топографическую,
возрастную, сезонную, разногодичную и экологическую.
Батыгина (1999; см. Генетическая гетерогенность семян) дополнила
классификацию Левиной (1981) генетическим признаком. Под генетической
гетерогенностью семян понимается наличие в семени зародышей разного генетического
происхождения: половой, гаметофитный, эмбриоид. Соотношение различных
зародышей в семени может быть неодинаковым. Другие авторы рассматривают
генетическую разнокачественность семян в более узком смысле, как разнообразие
гамет, участвующих в половом процессе (Тамберг, 1951; Строна, 1962,1964,1966;
Овчаров, Кизилова, 1966; Кизилова, 1974; Левина, 1981).
Гетероспермия проявляется прежде всего в величине семян, при этом могут
изменяться размеры семядолей и гипокотиля зародыша, эндосперма, масса семян
(сем. Apiaceae: Angelica, Daucus, Foeniculum, Heracleum, Peucedanum — Груш-
вицкий и др., 1963; Еременко, 1950, Любич, 1951; Макаро, Кондратьева, 1962,
1970; Некрасов,1969; Тамберг, 1951; Тюрина, 1971; Ткаченко, 1998; сем.
Anacardiaceae: Pistasia vera — Shuraki, Sedgley, 1996).
Вес семян может значительно варьировать в зависимости от места их
формирования на растении (АШасеае, Apiaceae, Araliaceae, Asteraceae, Brassicaceae,
Chenopodiaceae, Fabaceae, Malvaceae, Poaceae, Polygonaceae). Например, у
Gossypium hirsutum и С. barbadense абсолютный вес 1000 семян зависит от
местоположения коробочки в пределах куста, от их количества в коробочке, а следовательно,
условий питания. На нижних ярусах растения он всегда выше (эти семена обладают и
лучшей энергией прорастания и повышенной всхожестью) и изменяется в
зависимости от сроков посева. При ранних посевах и хорошей агротехнике абсолютный вес
семян выше, чем при сверхранних и поздних (Бажанова,1960; Соловьев, 1960).
В плодах некоторых представителей сем. Ericaceae (Vaccinium angustifolium —
Bell, 1957; V. myrtillus, V. uliginosum и V. vitis-idaea — Анисимова, 1997,1998;
Анисимова, Комалетдинова, ориг. данные), собранных в период диссеминации,
семена различаются по размерам, морфологии и анатомическому строению. Крупные
семена имеют, как правило, нормально развитый зародыш, эндосперм и семенную
кожуру; семена средних размеров обычно не содержат зародыш, а эндосперм либо
скудный, либо отсутствует; мелкие семена представлены в основном экзотестой,
Maturitas, лат. — спелость (разновременность созревания семян на особи).
Семенное размножение
281
иногда остатками средних слоев интегумента. Среди семян, за исключением
мелких, иногда встречались семена с недоразвитым зародышем.
Гетероспермия проявляется также в различной степени дифференциации
зародышей (от глобулярной до торпедовидной стадии) в зрелом семени, например, у
Helleborus, Ranunculaceae — Бутузова, 1997).
Комплекс признаков гетероспермии характерен для злаков. Так, у Triticum
aestivum величина и вес зерновок, биохимический состав, физиологические
показатели и другие зависят от места их формирования в колосе, что является одной из
причин неоднородности потомства (Пыльнев, Филатова, 1958; Паршакова, 1964,
1965; Батыгина, 1974, 1987). Растения, выросшие из наружных семян средней
зоны колоса, характеризовались интенсивным ростом, ранним наступлением всех
фаз развития, быстрым нарастанием листовой массы и большим урожаем.
Растения, полученные из внутренних зерен верхней и нижней части колоса развивались
медленнее и урожай был ниже (Рыжей, Завгородняя, 1959). Многие авторы
отмечали варьирование в содержании белка в семенах, взятых из разных зон колоса
(Рыжей, 1959; Речник, 1962; Stubert, et al.,1962). Зерновкам злаков присуща
энантиоморфная гетероспермия, обусловленная левой или правой симметрией или
диссимметрией зародыша и эндосперма (Сулима, 1970). У Hierochloe stepposum
более крупные семена формируются на верхних ярусах метелки, однако в
зависимости от местообитания и метеорологических условий крупные семена
формировались либо на втором и шестом ярусе, либо на четвертом и шестом. Кроме того, в
пределах одной метелки наряду с семенами, содержащими нормально развитый
зародыш, обнаружены семена с незавершенной дифференциацией корня в зародыше,
с несколькими зародышами и без зародыша (Шохина, 1971).
Гетероспермия может проявляться в особенностях диссеминации. Например, у
Salsola ruthenica (Chenopodiaceae) на растении образуются два типа семян:
осыпающиеся (с улиткообразно свернутым зеленым зародышем, заключенные в
пленчатый околоплодник с крылатками) и неосыпающиеся (со светло-желтым
зародышем, замкнутые в особые приспособления из разросшихся и отвердевших тканей
околоплодника). Последние составляют 0,4 % от общего числа семян, встречаются
в нижней части растения и не прорастают в течение четырех лет (Продан, 1956). У
Atriplex nitens на одном растении формируются три типа семян: одни — плоские,
крупные, коричневые с тонкой оболочкой, прорастающие в год их созревания;
другие — выпуклые, черные, с твердой оболочкой, прорастающие весной следующего
года; третьи — выпуклые, мелкие, черные, с очень твердой оболочкой,
прорастающие лишь весной третьего года и позже (Любич, 1951). На примере A.nitens и
Chenopodium album было показано, что полиморфизм семян может явиться одной
из причин, обусловливающих значительную морфобиологическую неоднородность
особей в пределах ценопопуляций (Серая, 1979).
Причины, приводящие к гетероспермии, многообразны и взаимосвязаны
(Тамберг, 1951; Строна, 1962, 1964; Сулима,1970; Бартков.1973; Овчаров,
Кизилова,1966; Левина, 1981; Макрушин,1989; и др.). Гетероспермия
обусловлена прежде всего различиями в строении репродуктивных органов и асин-
хронностью в их развитии в пределах цветка, соцветия, растения
(Еременко,1950 ; Куперман, 1950; Левина, 1965; Овчаров, Кизилова, 1966; Бебин и
др., 1969; Пошехонова.1971; Тюрина, 1971; Шохина, 1971; Батыгина, 1974,
Ткаченко, 1998). Неоднородность семян обусловливается не только асинхрон-
282
Системы репродукции
ностью фаз бутонизации, цветения, созревания на разных ярусах материнского
растения, но и метеорологическими условиями вегетационных периодов,
площадью листьев, облиственностью и уровнем фотосинтезирующей деятельности
листовой поверхности (Бебин и др., 1969).
Изучение структурно-функциональных основ гетероспермии имеет важное не
только теоретическое, но и практическое значение, особенно в семеноводстве, так
как неоднородные семена различаются по продуктивности. Познание механизмов
гетероспермии откроет новые возможности для улучшения хозяйственно ценных
качеств семян и увеличения продуктивности растений. С глубокой древности и до
настоящего времени одним из агротехнических приемов является отбор крупных
полноценных семян для улучшения посевных качеств семенного материала (Кос-
тычев, 1877; Черномаз, 1939; Мухин, 1941; Musil, 1961; Строна, 1964; Овчаров,
Кизилова, 1966; Bewley, Black, 1978; Halloran, Pennell, 1982; Макрушин, 1989).
Исследование жизнеспособности семян растений и определение их хозяйственной
годности неразрывно связано с необходимостью объективной оценки их
физиологических, посевных и технологических качеств (энергия прорастания, лабораторная
и полевая всхожесть, сила роста, начало и скорость прорастания). Для оценки
качества семян предлагается использовать также размеры проростков. Например, у
Lycopersicon esculentum проростки из семян первой кисти длиннее, чем проростки,
развившиеся из семян вышележащих кистей, при этом энергия прорастания и
всхожесть семян тем ниже, чем позже созрели семена (Орлов, 1982). Значение особей,
развивающихся из мелких семян, очень важно. Позднее прорастание, длительное
нахождение в виргинильном периоде развития позволяет виду переживать
неблагоприятные климатические условия (Ткаченко,1998). У представителей рода
Trifolium установлена связь между полиморфизмом семян, темпом роста
проростков и их активностью к регенерации, что, вероятно, имеет адаптивное значение при
восстановительных процессах (Бумагина, Исакова, 1998).
Макрушин (1989), подчеркивая значимость гетероспермии, предлагает
выделить специальную отрасль биологической науки — гетеросперматологию, которая
дает теоретическое обоснование способам получения исходного материала для
селекции и первичного семеноводства, выращивания посевного материала в условиях
оптимизированной технологии, а также сохранения и улучшения его качества после
уборки урожая. Гетеросперматология, по мнению автора, призвана решать
следующие задачи: 1 — изучение изменчивости семян; 2 — изучение причин,
обусловливающих различия семян по тем или иным признакам и свойствам; 3 — изучение
влияния разнокачественное™ семян на развитие и продуктивность растений; 4 —
разработка на основе результатов этих исследований тестерной системы прогноза
урожайных свойств семян с целью отбора биологически наиболее ценного
посевного материала и планирование приемов его улучшения в процессе выращивания и
послеуборочной обработки. Рис. 20.
Анисимова 1997,1998; Бажанова, 1960; Бартков, 1972,1973; Батыгина, 1974,1987,1999; Бебин и
др., 1969; Бумагина, Исакова, 1998; Бутузова, 1997; Вареник, 1955; Войтепко и др., 1980; Груш-
вицкий и др., 1963; Данилова, Кирпичников, 1985; Еременко,1950; Еременко, Пошехонова, 1971;
Кизилова, 1974; Костычев, 1877; Куперман, 1950; Левина, 1965, 1981; Любич, 1949, 1950, 1951;
Макаро, Кондратьева, 1962; Макрушин, 1989; Мухин, 1941; Некрасов, 1969; Овчаров, Кизилова,
1966; Орлов, 1982; Паршакова, 1964; Продан, 1956; Пыльнев, Филатова, 1958; Речник, 1962;
Рыжей, 1959; Рыжей, Завгородняя, 1959; Серая, 1979; Соловьев, 1960; Строна, 1962,1964,1966; Су-
Рис. 20. Гетероспермия.
1-14 — зрелые семена Vaccinium myrtillus L. из одного плода, различающиеся размерами, формой и
строением: 1-10 — внешний вид семян крупной (1-6), средней (7,8) и мелкой (9,10) фракций,
зона эндосперма с
густоплазменными клетками
зона эндосперма с вакуоли-
зированными клетками
зона лизиса клеток
эндосперма
1 —- дегенерирующий эндосперм
Рис. 20 (продолжение).
11-14 — строение семян на продольным срезе (схемат.): с зародышем и обильным эндоспермом
(И), с недоразвитым зародышем, но обильным эндоспермом (12), с недоразвитым зародышем и
скудным эндоспермом (13), семя представлено только семенной кожурой, зародыш и эндосперм
отсутствуют, видны остатки дегенерирующего зародышевого мешка (14).
/Т\
V
в.
лажность,
%
[—| 18,0-20,0
q 20,0-22,0
22,1-24,0
24,1-26,0
26,1-28,0
28,1-30,0
30,0-32,0
18
19
Рис. 20 (продолжение).
15-16 — строение семян на продольных срезах Daucus carota (сорт Ленинградская), взятых из
одного соплодия с очень мелким (15) и крупным (16) зародышами, 17 — схема расположения зерен с
различной влажностью в пределах одного початка Zea mays в фазе полной спелости, 18-19 —
симметричные (18а,19а) и диссимметричные, с левым (18б,19б) и правым (18в,19в) изгибами
зерновки Secale ce.re.ale. (18) и Triticum sp.(19). Масштабная линейка: 1-10 — 100 мк; з — зародыш, с к —
семенная кожура, энд — эндосперм.
1-14 — Анисимова, ориг; 15-16 — по: Грушвицкий и др., 1963; 17 — по: Полферову и др., 1955;
18-19 - по: Сулима, 1970.
286
Системы репродукции
лима, 1970; Тамберг, 1947, 1951; Ткаченко, 1998; Тюрина, 1971; Шохина, 1971; Черномаз, 1939;
Bewley, Black, 1978; Halloran, Pennell, 1982; Shuraki, Sedgley, 1996; Stuber et al., 1962.
БАНК СЕМЯН
В банк семян входят не только семена как таковые, но и другие диаспоры:
плоды, части плодов, редко соплодия. В природных условиях банк семян существует
на надземных органах растений и в почве. Созревшие семена иногда опадают с
побегов сразу, а иногда держатся годами («банк в кронах»). Так, у австралийского
кустарника Banksia hookeriana семена аккумулируются в кроне как минимум в
течение 25 лет и высвобождаются под влиянием различных факторов со скоростью
2-3% в год (Enright et al., 1996).
Основная часть банка семян in situ находится в почве. Запас семян в почве
существует практически во всех зонах: от Арктики до тропиков. Семена — особи
вида, находящиеся в латентном состоянии (в периоде первичного покоя), что
позволяет им довольно долго сохранять жизнеспособность в неблагоприятных
условиях. Распределение семян в почвах разного типа и на разных глубинах, в
различных климатических зонах и фитоценозах изучено довольно широко (Работнов,
1982,1990,1995; Петров, 1989). Работнов сформулировал географическую
(широтную) закономерность распределения численности жизнеспособных семян в
почве: от тундры (1000 -3000 шт. на 1 кв. м.) к зоне северной тайги наблюдается
резкое снижение запаса семян; к широколиственным лесам, луговым и настоящим
степям число семян в почве увеличивается (до 10 тыс. шт. на 1 кв. м.) и к
пустынным степям опять снижается. Запас семян в почве образуется в результате
обсеменения растений, входящих в состав ценоза в настоящее время и существовавших в
нем в прошлом, а также привнесения семян извне. Основная масса семян в почве
продуцирована травянистыми растениями. Способность накапливать большие
устойчивые запасы жизнеспособных семян в почве возникла у видов растений,
произрастающих в условиях неустойчивой среды, когда возможность семенного
размножения реализуется лишь иногда. В неблагоприятных условиях ценопопуляция
может из активного состояния перейти в покоящееся и состоять исключительно из
жизнеспособных семян, находящихся в почве.
В почве создаются условия, способствующие пребыванию семян в
анабиотическом состоянии: анаэробные условия, пониженные температуры (особенно в
Арктике), высокая кислотность, повышенное содержание СО и продукты
жизнедеятельности сапрофитов, разлагающих отмершие органы растений.
Способность семян долго сохраняться живыми в почве видоспецифична и
сформировалась в процессе становления каждого вида в определенных условиях.
Продолжительность жизни семян очень варьирует у разных видов: от одного года (и
даже меньше) у видов, сформировавшихся в условиях, устойчиво благоприятных
для прорастания семян и развития проростков, до десятков (и сотен) лет у видов,
характеризующихся жизненным циклом со сменой активного и криптивного (греч.
cryplos — скрытный) периодов жизни (Работнов, 1995). Длительность
сохранения жизни семян в почве связана с наличием у них состояния покоя.
Продолжительность жизни семян в почве определяется как по косвенным
данным, так и путем постановки специальных опытов. Так, Карпов (1969)
констатировал, что жизнеспособность семян осоки буреющей, полевицы тонкой, луговика дер-
Семенное размножение
287
нистого и малины сохранялась более 100 лет (под опадом в ельнике-черничнике).
Комарова (1984) обнаружила в Приморье в кедрово-широколиственном лесу
семена чистотела азиатского, сохранившие всхожесть свыше 200 лет ( возраст семян
определяли по истории фитоценозов). Овеснов (1963) в почве, залитой 5 лет водами
Пермского водохранилища, обнаружил на 1 кв. м 2900 шт. всхожих семян 34 видов
(злаков, бобовых, полевых сорняков и рудеральных растений). С помощью
радиоуглеродного метода установлена продолжительность жизни семян Nelumbo nucifera в
3075 и 1080 лет, Lupinus arcticus — около 1000 лет, Саппа compacta — 530-620
лет и др. (Roos, 1986). Harrington (1972) проанализировал мировую литературу и
собрал данные о продолжительности жизни семян в почве по 324 видам древесных,
кустарниковых и травянистых растений.
Для точного определения возраста семян ставились специальные опыты с
помещением их в почву в горшках, бутылках, сетках на разную глубину с периодическим
выкапыванием образцов (Бартон, 1964; Kivilaan, Bandurski, 1981.). При этом
выяснилось, что семена большей части культурных видов в почве погибают очень быстро
(после одного года). Семена дикорастущих растений ведут себя по-разному. У ряда
видов отмечено очень продолжительное сохранение жизнеспособности: Brassica
nigra, Polygonum hydropiper — 50 лет, Oenothera biennis, Rumex crispus — 80 лет,
Verbascum blattaria — 100 лет (всхожесть семян 42%) и т.д.
Обзор работ по сохранению в почве диаспор мохообразных и
папоротникообразных (Работнов, 1995) показал, что в почвенном банке сохраняется несколько
десятков видов мхов, даже в почве тундры (Аляска) обнаружены споры 6-7 видов
мхов. Особенно большое количество жизнеспособных спор папоротников многих
видов (10-20 тыс./кв. м) обнаружено в почвах кедрово-широколиственных лесов
Приморья.
Изучение почвенного банка семян имеет большое научное и практическое
значение: для получения полного представления о запасе жизнеспособных семян, о
стратегии жизни видов, о состоянии и организации фитоценозов (описание
фитоценоза неполно без перечня видов в почвенном банке семян). Без знания видового
запаса семян в почве трудно понять происходящие сукцессии (особенно демута-
ции). На землях сельскохозяйственного использования знание почвенного банка
семян помогает в борьбе с сорняками. Иногда сохранившиеся в почве семена могут
обеспечить восстановление популяции. Так, после осветления леса семена Calluna
vulgaris, находившиеся в почве 50 лет, дали всходы и послужили основанием для
восстановления сообщества (Willems, 1988).
Понятие о сохранении семян дикорастущих видов ex situ довольно широкое: это
и коллекции семян в музеях, институтах, хранилищах, на засушенных растениях в
гербариях; хранение семян в отделах семеноведения ботанических садов (чаще
всего в комнатных условиях) для целей обмена. В настоящее время понятие банка
семян дикорастущих видов растений связывается с помещением их в регулируемые
условия, обеспечивающие долговременное сохранение их жизнеспособности и
генетической полноценности. Организация банков природных генетических
ресурсов включена в Международную конвенцию по сохранению биологического
разнообразия, принятую большинством государств мира в 1992 г., и в Стратегию
ботанических садов по охране растений (1994).
Исследованием проблемы долговечности семян занимаются ученые и
практики уже не одно столетие. По длительности сохранения жизнеспособности се-
288
Системы репродукции
мян различают 3 группы видов (Ewart,1908): микробиотики (семена
сохраняют всхожесть не более 3 лет), мезобиотики(до 15 лет), макробиотики (свыше
15 лет). В сводке Harrington (1972) собраны результаты мировой практики по
изучению продолжительности жизни семян 116 видов микробиотиков, 740
видов мезобиотиков и макробиотиков при хранении в лабораторных условиях,
гербариях, хранилищах.
К группе микробиотиков относятся некоторые орхидные, семена которых
сохраняют всхожесть считанные часы, а также Tussilago farfara, виды родов Salix,
Populus, Aesculus, Quercus и др. (Бартон, 1964; Стенвуд, Бэсс, 1983; Chin,
1988). Семена микробиотиков, быстро погибающие из-за высыхания, называют
рекальцитрантными.
Семена большинства дикорастущих видов из группы мезобиотиков легко
теряют влагу после созревания (ортодоксальные). К макробиотикам еще Ewart
(1908) отнес 137 видов из 47 родов сем. Fabaceae, 15 видов из сем. Malvaceae, 14
видов из сем. Myrtaceae, отдельные виды из семейств Nymphaeaceae, Labiatae,
Polygonaceae, Tiliaceae, Geraniaceae и др. Определение жизнеспособности семян
из коллекций и гербариев, хранившихся в комнатных условиях и имеющих вполне
достоверную дату сбора (Бартон, 1964; Harrington, 1972; Ex situ..., 1993),
выявило семена — долгожители (70 90 и более лет) в родах Саппа, Astragalus,
Trifolium, Daphne и др.
Обычно жизнеспособность семян определяется по их всхожести (растения из
старых семян выращивают довольно редко). Примером такой работы может
служить оценка карпологической коллекции ВИР (Хорошайлов, Ефремова, 1985) с
возрастом семян от 40 до 162 лет: из 249 видов проросли семена 14 видов, но
только единичные особи цвели и дали семена.
Банки семян культурных растений начали создаваться в 70-х годах 20 века, к
настоящему времени их сеть охватывает 65 стран мира и постоянно создаются
новые (Тихонова, 1995). Генетические ресурсы культурных видов растений и их
сородичей практически уже собраны в банках зародышевой плазмы; там же начали
собирать и семена некоторых экономически важных дикорастущих видов:
лекарственных, пищевых, технических и др. Банки семян дикорастущих видов начали
создаваться в 80-х годах преимущественно в крупных ботанических садах: в
Англии (Королевский ботанический сад Кью), Швейцарии (Базель), Испании
(Мадрид), Ю. Африке (Кирстенбоше) и в др. Температурные режимы хранения
семян в них аналогичны таковым в банках семян культурных видов: низкие
положительные температуры (+5° С) и неглубокое замораживание до -20 С (Botanic
gardens...,1987). Эти режимы удлиняют жизнь семян по сравнению с
комнатными температурами, но к резкому замедлению метаболизма они не приводят.
Очень перспективным режимом долговременного хранения семян (особенно
микробиотиков) является глубокое замораживание их в жидком азоте (-196 С)
или в парах над ним (около -160 С) (Стенвуд, Бэсс, 1983; Тихонова, 1992а,
19926,1995, Ex situ ...,1993).
Бартон, 1964; Карпов, 1969; Комарова, 1984; Овеснов, 1963; Петров, 1989; Работнов, 1982,
1990, 1995; Стенвуд, Бэсс, 1983; Стратегия ботанических садов по охране растений, 1994;
Тихонова, 1992 а,б, 1995; Хорошайлов, Ефремова, 1985; Botanic gardens and the world conservation
strategy, 1987; Chin,1988; Enright et al., 1996; Ewart, 1908; Ex situ..., 1993; Harrington, 1972;
Kivilaan, Bandurski, 1981; Roos, 1986; Willems, 1988.
Семенное размножение 289
ПЛОД (лат. экв. fructus, carpus) — морфологическое образование, развивающееся
из завязи после оплодотворения семязачатков.
В формировании плодов часто принимают участие пестик в целом, а также экст-
ракарпеллятные структуры цветка (цветоложе, элементы околоцветника), иногда
преобразованные части соцветия. Плоды обеспечивают развитие и созревание
семян и их распространение либо путем рассеивания семян (плоды—диссеминато-
ры), либо принимая на себя функции диаспор (плоды—диаспорианты).
Морфологическая природа плодов. Ботаники до настоящего времени не
смогли придти к общему мнению о морфологической природе (гомологии) плодов.
Именно поэтому, как отметил Eames (1961), термин «плод» употребляется
довольно свободно: как для обозначения отдельных карпелей апокарпного гинецея
(иногда называемых «плодиками», например у Fragaria), так и для описания целых
соплодий (например, у Ananas). В этой связи возникает вопрос о возможном
различном происхождении плодов. В карпологической литературе отражены два
основных, по существу взаимоисключающих взгляда на морфологическую природу
плодов. По мнению одних исследователей (Eames, 1961; Левина, 1987; Spjut,
Thieret, 1989; Takhtajan, 1991) , плод формируется из цветка в результате
структурных и функциональных перестроек гинецея и часто включает измененные экстра-
карпеллятные органы цветка. Поэтому «плод должен рассматриваться как
производное цветка в целом, а не только гинецея, несмотря на то, что его основные части
образуются плодолистиками» (Takhtajan, 1991:199) Согласно взглядам других
ботаников, плод представляет собой измененную в процессе развития завязь (van der
Pijl, 1969; Raven et al., 1986; Терехин и др., 1993) или пестик (Тихомиров, 1989).
Как подчеркивал Тихомиров (1989), плод не является каким-то новым или особым
органом цветка, но всегда развивается из других органов, представляя собой
завершающий этап их развития. В этой связи представляет интерес точка зрения Spjut (1994),
который определяет плод прежде всего как функциональную «единицу» — «единицу
распространения» («dispersal unit»). По его мнению, плоды представляют собой сложную
структуру из зрелых семязачатков, прикрепленных к мегаспорофиллам различных стро-
билярных структур. Мегаспорофиллы могут быть открытыми, как в стробилах
(«простых шишках») цикадовых, или слившимися в «семязачаткоподобные» структуры в
«сложных шишках» хвойных, или же закрытыми в карпелях гинецея покрытосемянных.
Представления Spjut еще более расширяют «поле гомологии» плодов, распространяя
понятие «плод» на стробилы (шишки, «cone») голосемянных растений. Понятие
«морфологическая природа плодов» становится еще более неопределенным.
На наш взгляд, van der Pijl (1969) правильно ограничил эволюционно
первоначальную сущность плода как сомкнутой структуры, образованной одним (плоды,
развившиеся из апокарпного гинецея) или несколькими (синкарпные плоды)
плодолистиками. Все образования, включающие экстракарпеллятные структуры,
особенно плоды, развивающиеся из нижней завязи или с участием разросшегося
цветоложа, являются эволюционно вторичными, производными от плодов,
образованных перикарпом («pericarp fruits»).
Поэтому, говоря об онтогенетическом происхождении плода, мы одновременно
обсуждаем и вопрос их эволюционного происхождения. С этих позиций мы,
во-первых, неизбежно приходим к определению эволюционно первичного плода
(«pericarp fruit») как образования, представляющего собой завершающие этапы
290
Системы репродукции
развития завязи, а во-вторых, обсуждение гомологии плодов переходит на уровень
обсуждения гомологии завязи.
Завязь представляет собой новую структуру — замкнутую полость,
образованную одной или несколькими карпелями (van der Pijl, 1969:13). Стенка завязи (пе-
рикарп) несомненно гомологична мегаспорофиллу (или сросшимся мегаспорофил-
лам), но завязь в целом — эволюционное новообразование, свойственное только
цветковым растениям и обеспечивающее ангиоспермию.
Как известно, процесс эволюции происходит путем «проб и ошибок», что
можно иллюстрировать известным примером образования «плодоподобной
структуры» («шишкоягоды») у Juniperus. У этого растения мясистая структура, очень
похожая на ягодовидный или, скорее, костянковидный плод, формируется тремя
верхними срастающимися чешуями шишки, которые становятся единым мясистым
«перикарпом», содержащим 1-3 семени с твердой семенной кожурой — очевидная
адаптация к эндозоохории. Пример с Juniperus создает впечатление о возможных
неоднократных и успешных попытках эволюционного возникновения плодов как
адаптивных к распространению семян образований.
При определении плода как «зрелой завязи», многочисленные образования
в гинецее, состоящие из несросшихся одиночных «зрелых карпелей»
(например, у видов Geum или Ranunculus), логичнее рассматривать в качестве
своеобразных унигинециальных соплодиев, что и предложил Тихомиров (1989),
правда, использовав для этого уже занятый термин «антокарпий». При таком
подходе неизбежно возникает один существенный вопрос: правильно ли
противопоставлять цветок (антостробил, согласно Arber, Parkin, 1907 и Тахтаджян,
1964) соцветию? В этой связи интересно, что недавно Poslushny и Charlton
(1993) обсудили возможность интерпретации морфологической природы
цветка Alismatidae (Helobiae) в терминах соцветия, имея в виду происхождение
генеративных структур этих растений от предковых префлоральных образований,
подобных «соцветию». Не представляет ли собой «цветок» простейшую форму
соцветия? При таком подходе снимаются многие противоречия между «эванто-
вой» и «псевдантовой» теориями.
Классификация плодов. Длящиеся уже более двух веков попытки создания
приемлемой для научного сообщества морфологической классификации плодов
пока не увенчались успехом (Грудзинская, 1968; Левина, 1987; Тихомиров,
1989). Более того, Spjut и Thieret (1989), исследовавшие историю
классификации так называемых сложных («compound») и сборных («aggregate» или
«multiple») плодов, пришли к заключению, что классификация плодов до сих пор
находится в хаосе. Van der Pijl (1969) подверг существенной критике
современные морфологические и так называемые генетические классификации Winkler
(1939,1940), Baumann-Bodenheim (1954), Takhtajan (1959), Левиной (1961) и
др. По его мнению, такие системы основаны на несовместимых признаках: с
одной стороны в них используются основные, экологически нейтральные,
морфологические особенности плодолистиков (или их собраний), а с другой —
усовершенствования, обязанные «случайным» экологическим требованиям к вскрыванию,
консистенции и другим подобным свойствам плодов. При этом морфологические
системы плодов, называемые «генетическими», в действительности являются
«онтогенетическими». Пути развития описываются в них типологически на
основе монофилетической концепции филогении покрытосемянных.
Семенное размножение
291
Одна из основных причин неудачных попыток построения морфологических и
«генетических» классификаций плодов состояла в неадекватном реальным
эволюционным процессам замещении понятия «плода как зрелой завязи» понятием
«плода как зрелого гинецея». При этом даже те ботаники, которые придерживались
понятия «плод как зрелая завязь», начиная с Linnaeus (1751, цит. по Spjut, Thieret,
1989) и Gaertner (1788), в действительности в своих системах оперировали с
понятием «плод как зрелый гинецей» (De Candolle, 1819; Lindley, 1832). Это привело к
двусмысленности понятия «плод», что было закреплено в разных терминах: «плод»
как результат развития апокарпного или синкарпного гинецея в целом и «плодик»
как результат развития отдельной уникарпеллятной завязи в апокарпном гинецее
(Терехин и др., 1993). Понятие многочленного плода, введенное в отечественную
литературу Гоби (1921) вслед за французскими путешественниками, в отношении
собрания плодов, развившихся из апокарпного гинецея, представляет собой
очевидный биологический и экологический нонсенс, если рассматривать развитие и
функции такой биологической системы с позиций опыления, оплодотворения и
дисперсии составляющих ее репродуктивных единиц.
Учитывая приведенные выше критические замечания в отношении
существующих классификаций плодов (Van der Pijl, 1969,1982; Spjut, Thieret, 1989;
Тихомиров, 1989; Терехин и др., 1993), следует признать, тем не менее, что усилиями
нескольких поколений карпологов от Gaertner (1788) до Roth (1977) и Spjut (1994)
знания об основных категориях и типах плодов и их распространении среди
покрытосемянных значительно пополнены. Наиболее трудная проблема сегодня
заключается в том, чтобы выяснить реальные эволюционные взаимосвязи между
основными категориями плодов, а также «плодоподобных» образований (таких, как
например, у Ananas или Fragaria). Это возможно осуществить только принимая во
внимание роль экологических (точнее — этологических) факторов в адаптивной
морфологической эволюции плодов, в соответствии с представлениями van der Pijl
(1982). Очевидно, что многочисленные явления параллельной эволюции,
приводящие к различного рода конвергенциям, значительно затрудняют научный
прогресс в эволюционной карпологии.
Не менее важно правильно оценить возможные переходные формы между
разными категориями плодов и плодоподобных образований, где очевидны
эволюционные экологические тенденции, но «морфологические очевидности» не
укладываются в существующие представления. Необходим поиск новых подходов к
исследованию эволюции плодов.
В этой связи мы предложили некоторые принципы классификации, исходя из
того, что у представителей отдела Magnoliophyta имеются не два (плоды и
соплодия), а три типа образований, способствующих диссеминации:
плод (fructus) — преобразованная в процессе развития завязь;
унигинециальное образование, служащее для рассеивания или распространения
семян (dispersal unit); часто формирующееся с участием цветоложа и/или
околоцветника и функционирующее как отдельная целостная репродуктивная
единица («reproductive unit») в период после опыления и оплодотворения;
соплодие (infructescence) — уни- или полигинециальная агрегация плодов,
функционирующих и как целостное образование в процессе аттрактации
агентов дисперсии («compound unit») и дискретно в качестве
диссеминирующей структуры;
292 Системы репродукции
диаспорокарпий (diasporocarpium) — образование, развивающееся из
совокупности завязей одного или смежных цветков (уни- и полигинециальные
диаспорокарпий), служащее для распространения семян и функционирующее
дискретно (на основе отдельных пестиков) в период цветения и как целостная
единица в период плодоношения.
В предлагаемой схеме фруктификаций1 (Схема 1) диаспорокарпий
занимают «нишу» между плодами и соплодиями и представляют собой по своей
морфологической сущности уни- или полигинециальные высокоинтегрированные
соплодия.
Схема 1. Классификация генеративных структур покрытосемянных, адаптированных
к функции распространения семяи (Терехин и др., 1993)
Образования, служащие для распространения семян - фруктификаций
плоды диаспорокарпий (плодонии) соплодия
плоды-диссеминаторы \ унигинециальные \ унигинециальные
(рассеивающие семена) \
плоды-диаспоранты мультигинециальные мультигинециальные
(распространяющие
семена)
«Многочленные» апокарпные плоды, на наш взгляд, должны быть поэтому
разделены на унигинециальные соплодия и унигинециальные диаспорокарпий
(Схемы 2 и 3).
Фруктификация — в современной ботанике (и, особенно, в палеоботанике) фруктификациями
называют органы, осуществляющие семенное воспроизведение: как женские, так и мужские, и
обоеполые (за исключением пыльцы). Термин используется как для описания органов
голосемянных, так и покрытосемянных растений. К фруктификациям относят цветки и соцветия, плоды и
соплодия, стробилы, простые и сложные шишки и т.д. (Мейен, 1987, с. 264-265; Spjut, 1994, с. 5). В
связи с этим мы сочли возможным использовать термин «фруктификация» в качестве наиболее
общего названия для обозначения всякого рода структур (как у голосемянных, так и у
покрытосемянных растений), воспроизводящих семена или способствующих их распространению. Это особенно
важно в отношении тех случаев, когда подобного рода структуры трудно или невозможно
«уложить» в традиционное понятие плода.
Схема 2. Диаспорокарпий унигинециальные
Унигинециальные диаспорокарпий (плодонии)
с сухими плодами на мясистом
или губчатом плодоложе
с мясистыми плодами
на сухом плодоложе
плодоложе плодоложе плодоложе с ягодовидными
выпуклое плоское вогнутое плодами
(Fragaria) (Nelumbo) (кувшиновидный (Аппопа)
«перикарп» образован
кожистым гипантием)
(Rosa)
с костянковидными
плодами
(Rubus)
Схема 3. Диаспорокарпий полигинециальные
Из листовко-
видных плодов
(Banksia)
Мультигинециальные диаспорокарпий (плодонии)
из семянковидных
плодов
(Ambrosia,
Casuarina,
Xantium)
из коробчатых из ореховидных
плодов плодов
(Liquidambar) (Castanopsls,
Fagus)
на разросшейся
оси соцветия
с погруженными
завязями
(Arctocarpus,
Bdallophyton,
Madura,
Sarcophyte)
в вогнутой чаше
из редуцированных
сросшихся веточек
соцветия
сиконий (Ficus)
с непогруженными
завязями
сорозы;
(Laportea,
Moms)
294
Системы репродукции
и
Полагая, что изменения экологических функций являются направляющим
фактором морфологической эволюции плодов, мы сочли возможным, как уже
было отмечено выше, разделить все плоды (именно плоды и только плоды) на две
основные группы: плоды — диссеминаторы и плоды — диаспорианты (Терехин
и др., 1993). Эти группы плодов не соответствуют обычно принятому их делению
на «вскрывающиеся» и «невскрывающиеся». Естественно, что все плоды
вскрываются, и вопрос заключается в том, когда они вскрываются и каким образом.
Заключая, нельзя не напомнить замечательное высказывание van der Pijl
(1969) о том, что современная морфология представляет собой «фоссилизиро-
ванную» экологию прежних эпох. При том, конечно, условии, что изменения
экологических функций рассматриваются как этологические, т. е. изменения
поведения (Терехин, 1991).
Биологическое значение и экологическая роль плодов. Карпели,
сомкнутые или сросшиеся, одиночные или в собраниях, служат структурной
основой для образования плацентарных тканей, из клеток которых
инициируются семязачатки. После оплодотворения, снабжение семян питательными
веществами, их защита от внешних воздействий и повреждений, а также
подготовка к участию в диссеминации (созревание, иногда
сопровождающееся образованием специальных структур плода) переходят от стенки
завязи к перикарпу. Изменение трофических функций в связи, например, с
изменением числа семян в плоде, приводит в процессе эволюции и к
существенным структурным перестройкам плодов. Например, у орхидных функции
перикарпа и общая структура плода (особенно развитие плацентарных
образований) связаны с обеспечением развития многих тысяч пылевидных ане-
мохорных семян в одном плоде и с выполнением плодом функции триггера
эффективного рассеивания семян в воздушной среде. Сухие коробочки
орхидных — пример многочисленной группы анемохорных плодов-триггеров,
плодов, «рассеивающих» семена.
Довольно очевидно, что переход к односемянным эндозоохорным плодам
(например, у Prunus) т. е. плодам, которые непосредственно участвуют в
распространении, замещая некоторые функции семян, требует существенной перестройки
тканей и общей структуры перикарпа, его васкулярной системы и плацентарных
структур. Приведенные примеры выявляют четкую зависимость изменения структуры и
биологических функций плода от его экологических функций, т. е. от характера
участия плодов в процессах диссеминации.
В природе существует два основных способа участия плодов в распространении
семян (Терехин и др., 1993). В первом случае плоды-диссеминаторы инициируют
тем или иным образом начальную дисперсию семян. Обычно такие плоды — сухие
многосемянные коробочки (например, у Papaver, Pyrola), как бы «передают»
семена таким абиотическим агентам распространения, как ветер или вода. Во втором
случае, плоды-диаспорианты непосредственно осуществляют процесс дисперсии
семян, заключенных в плодах, привлекая для этой цели биотические агенты
(разные способы зоохории). В некоторых случаях (Cocos nucifera), распространение
односемянных плодов осуществляется водой (гидрохория), но это, по-видимому,
вторично-эволюционная адаптация.
Таким образом, анализ экологической роли плодов выявляет два основных
биологических процесса: 1) когда в роли генеративной диаспоры выступает семя, а
Семенное размножение
295
плод лишь способствует процессу диссеминации и 2) когда сам плод выступает в
роли генеративной диаспоры (Терехин и др., 1993).
Van der Pijl (1969), обсуждая происхождение и эволюцию плодов, отметил
(вслед за Corner, 1958), что главное в этих процессах состоит в переходе
функций семян к плодам и важно при этом проследить стадии и возможные варианты
таких замещений. Такой перенос функций мог, по-видимому, происходить в
процессе эволюции неоднократно.
Эволюция плодов. В современной карпологии, при определенном
разнообразии мнений, существуют два принципиально различных взгляда на проблему
эволюции плодов.
Представления Takhtajan (1991) об эволюции плодов следуют строго монофи-
летической концепции Hallier (1912) о филогенезе покрытосемянных. По его
справедливому замечанию классификация плодов должна основываться на
происхождении каждого типа плодов и категорий таких типов. По мнению Takhtajan (1991),
современные эволюционные классификации плодов (Egler, 1943; Каден, 1947,
1961; Тахтаджян, 1959,1964) еще не отражают все их многообразие и
эволюционные отношения всех типов, но главные типы плодов и основные направления их
эволюции уже известны.
Концепция эволюции плодов, предложенная Takhtajan (1991), включает
следующие основные положения.
— Первичная категория плодов покрытосемянных — апокарпная многолистовка со
спиральным расположением свободных многосемянных плодиков на оси цветка
(Magnolia, Caltha, Paeonia).
— Синкарпные плоды образуются из синкарпного гинецея или из срастающихся в
течение развития свободных плодолистиков.
—«Сухие» плоды являются первичными. Во многих «линиях» (ветвях)
покрытосемянных «сухие» типы плодов дают начало эндозоохорным «сочным»
(«мясистым») плодам.
— Переходной формой между апокарпной многосемянкой и типичным синкарп-
ным плодом является синкарпная многосемянка, которая при созревании
открывается в сутуральных областях верхних свободных частей плодиков.
— Коробочка — наиболее примитивный тип сухого синкарпного плода. Существует
три основных типа коробочек: септированная с осевой плацентацией (синкарпная
в узком смысле), однокамерная с париетальной плацентацией (паракарпная) и
однокамерная со свободной центральной плацентацией (лизикарпная).
— Особую группу составляют плоды, развивающиеся из нижней завязи.
Наиболее общим типом в этой группе является сухая септированная коробочка.
— Многие паракарпные или несептированнные коробочки с париетальной
плацентацией происходят из септированных плодов с осевой плацентацией. Однако в
некоторых архаичных таксонах паракарпные плоды происходят прямо из
апокарпных (Monodora и Isolona из сем. Annonaceae, Takhtajania из сем.
Winteraceae и сем. Canellaceae).
Необходимо отметить в этой связи, что приведенные выше положения
основываются, как это подчеркнул еще van der Pijl (1982), на определенной
морфологической концепции филогенеза покрытосемянных и не имеют карпологических или
экологических обоснований. Это, в частности, относится к представлению о том,
что эволюционно первичными были «сухие» плоды. Кроме того, предложенная
296
Системы репродукции
концепция тесно связана с представлением о морфологической природе плода как
производного гинецея в целом, что, как показано выше, не является единственно
приемлемым представлением.
Van der Pijl (1969) подошел к проблеме эволюции плодов с другой стороны,
исследуя этот вопрос с позиций экологических функций цветка, семени и плода. Он
рассматривает эволюцию плодов как «последнюю стадию» в эволюции органов дис-
семинации (генеративных диаспор) высших растений. Эволюция карпели
(замкнутого мегаспорангия), согласно van der Pijl, состоит в совершенствовании разделения
функций между «семенем» и «плодом» на стадиях ранней защиты мегаспорангия, ат-
трактации агентов распространения и поздней защиты зародыша (включая стадию
покоя). Основной процесс эволюционных преобразований состоит при этом в
постепенном замещении функций и структур «семени» функциями и структурами
«плода». Процесс передачи функций был постепенным и вариабельным. В этой связи, van
der Pijl подчеркивает, что некоторые из вариаций этого процесса, например, раннее
освобождение семян из плодов (точнее, может быть из не вполне «созревших»
завязей у некоторых Liliaceae (Mondoideae), Berberidaceae (Caulophyllum), Violaceae
(Decorsella, Gymnorinorea), представляют собой примеры покрытосемязачатково-
сти, но не покрытосемянности («angiovulate, not yet angiospermous»).
Главные заключения, к которым пришел van der Pijl (1969), являются
совершенно противоположными таковым Takhtajan (1959, 1991). По мнению van der
Pijl, примитивные плоды (карпели) были суккулентными и зоохорными.
«Высыхание» и специальные способы вскрывания плодов являются эволюционно
вторичными по отношению к их суккулентности. Согласно van der Pijl (1969),
происхождение «карпеллятных» структур было полифилетичным и конвергентным. Он
сомневается в возможности существования каких-либо общих тенденций в эволюции
плодов, считая вероятной их специализацию во всех направлениях, с частыми «про-
грессами» и «регрессами» и «конечной конвергенцией».
Эколого-морфологический, аналитический подход, развиваемый van der Pijl
(1969), был применен позднее к изучению эволюции эмбриональных и
генеративных структур паразитных цветковых растений (Терехин, 1977), а также к
изучению взаимосвязей между экологическими факторами и строением цветков как
механизмов опыления (Faegri, Pijl van der, 1980). Следуя идеям van der Pijl, мы
полагаем, что изучение эволюции плодов с учетом существования у покрытосемянных
более разнообразных, чем принято считать, морфологических образований (не
только собственно плодов («pericarp fruit»), но также «диаспорокарпиев», «униги-
нециальных соплодий» и т.д.), осуществляющих функции распространения семян,
будет способствовать дальнейшему прогрессу в разработке этой проблемы.
Гоби, 1921; Грудзинская, 1968; Каден, 1947, 1961, 1965; Левина, 1987; Рейвн и др., 1990; Тах-
таджян, 1964; Терехин, 1991; Терехин и др., 1993; Тихомиров, 1989; Boumann-Bodenheim, 1954;
Corner, 1958; De Candolle, 1819; Eames, 1961; Egler, 1943; Gaertner, 1788; Lindley, 1832;'Pijl van
der, 1969; Poslushny, Charlton, 1993; Roth, 1977; Spjut, 1994; Spjut, Thieret, 1989; Takhtajan, 1959,
1991; Winkler, 1939,1940.
ГЕТЕРОКАРПИЯ (греч. heteros — другой, различный, carpos — плод), или разно-
плодность — генетически обусловленное свойство вида формировать на одной
особи плоды различного морфолого-анатомического строения.
Семенное размножение
297
Это явление известно давно и ему посвящена обширная литература (Huth,
1890; Delpino, 1894; Zonary, 1939, 1966; Левина, 1957, 1981; Войтенко, 1968,
1974; Левина, Войтенко, 1975; Меликян, 1986).
Гетерокарпия присуща в основном одно- или малолетним растениям, а также
видам (или популяциям), произрастающим в крайних, жестких условиях
окружающей среды (полупустыни, пустыни, высокогорья и т. п.). Она встречается у
представителей многих цветковых растений, но больше всего сосредоточена в
семействах Asteraceae, Boraginaceae, Brassicaceae, Chenopodiaceae, Dipsacaceae, Fabaceae.
Свойственный каждому семейству или роду тип плода определяет и характер
варьирования генеративных диаспор у гетерокарпных видов.
Выделяют следующие типы и формы гетерокарпии (согласно классификации
Левиной, 1981, с некоторыми изменениями и дополнениями).
I тип. Гетерохолокарпия — различия между целыми плодами. Выделяют
следующие формы:
а) эквивалентная (одинаковое число семян в плодах) отмечена у растений,
образующих односемянные невскрывающиеся плоды (например, Asteraceae, Dipsacaceae);
б) неэквивалентная- (различное число семян в плодах) чаще встречается у
растений с многосемянными вскрывающимися плодами (Brassicaceae, Fabaceae).
II тип. Гетерофрагмокарпия — морфолого-анатомичнеские различия между
составными частями (члениками, мерикарпиями, эремами) многосемянных
дробных или членистых плодов. Она подразделяется на три подтипа:
1) гетероартрокарпия — различия между члениками плода (Brassicaceae,
Fabaceae), имеет две формы — эквивалентную и неэквивалентную;
2) гетеромерикарпия — различия между мерикарпиями плода (Apiaceae,
Hydrocotylaceae, Malvaceae и др.);
3) гетероэремокарпия — различия между эремами плодов ценобиев
(Boraginaceae и Lamiaceae).
Различия генеративных диаспор особенно разительны именно при
эквивалентной гетерохолокарпии, когда односемянные невскрывающиеся плоды могут резко
различаться по размерам, форме, анатомическому строению перикарпия, характеру
придатков, формирующихся на поверхности плода, и иным признакам.
Важной чертой гетерокарпии являются глубокие отличия и в строении семян,
заключенных в плодах, мерикарпиях, члениках или эремах. Семена гетерокарпных
плодов или их частей существенно различаются также по глубине покоя,
длительности и характеру прорастания. Тем самым гетерокарпия позволяет растениям
регулировать число и очередность прорастания потомков по годам, что имеет
исключительное значение для однолетников.
Как было установлено, разнотипные плоды занимают на растении строго
определенное положение (Левина, 1981; Войтенко, Опарина, 1987). Василевская
и Дорджиева (1982), изучив формирование семянок у Helianthus annum
(Asteraceae), подтвердили, что гетерокарпия является результатом влияния
различных условий питания на развивающиеся семянки в соцветии.
Анатомически гетерокарпия выражена в степени развития и в количестве слоев перикарпия
у семянок этого вида.
Одним из важных эволюционных приобретений гетерокарпных растений
является то, что их генеративные диаспоры различаются по дальности распространения.
Исследования гетерокарпных представителей семейств Chenopodiaceae,
298
Системы репродукции
Brassicaceae и Boraginaceae подтвердили, что они образуют диаспоры нескольких
видов: барохорные (опадающие в непосредственной близости от материнской
особи), эпизоохорные (цепляющиеся за меховой покров млекопитающих и перья птиц
специальными придатками) и анемохорные (распространяемые воздушными
потоками в радиусе нескольких метров). Это способствует значительному и
целенаправленному расширению ареалов гетерокарпных видов.
Следовательно, гетерокарпия позволяет растениям дифференцировать
важнейший в их жизненном цикле этап — диссеминацию — как по временным, так и по
пространственным показателям.
Довольно слабо изучены процессы прорастания и формирования взрослых
особей у видов, характеризующихся гетерокарпией. В этом отношении весьма
интересны исследования популяций Seidlitzia florida (Chenopodiaceae), которые
показали, что морфологически различные плоды этого вида формируют архитектурные
модели разных особей, отличающихся не только своей морфологией, но и временем
цветения и плодоношения Акопян (1983).
Таким образом, гетерокарпия представляет собой один из способов
адаптации при семенном размножении цветковых растений. Адаптивный характер ге-
терокарпии проявляется и в дифференциации гетероморфных диаспор по
дальности их распространения, времени и характеру прорастания их семян и
разнообразию архитектурных моделей зрелых особей, возникающих у гетерокарпных
видов. Тем самым создается более пластичная и устойчивая структура
популяций гетерокарпных видов.
Акопян, 1983; Василевская, Дорджиева, 1982; Войтенко, 1968, 1974; Войтенко, Опарина, 1987;
Левина, 1957, 1981; Левина, Войтенко, 1975; Меликян, 1986; Delpino, 1894; Huth, 1890; Zohary,
1939,1966.
Вегетативное размножение
299
ЧАСТЬ IV — ВЕГЕТАТИВНОЕ РАЗМНОЖЕНИЕ
ВЕГЕТАТИВНОЕ РАЗМНОЖЕНИЕ
Вегетативное размножение — это увеличение числа особей данного вида или
сорта посредством отделения жизнеспособных частей вегетативного тела растений
(почек, побегов, корней и т. д.). Во многих случаях вегетативное размножение
сопровождается регенерацией, т.е. восстановлением недостающих органов у
отделившихся частей растений: формированием корней на обламывающихся веточках
(например, у Salix fragilis), образованием придаточных почек на опавших листочках
(Cardamine pratensis) и т. п. Довольно часто при вегетативном размножении все
органы будущей особи формируются еще до отделения ее от материнской
(например, розеточные побеги с придаточными корнями на столонах — усах у Fragaria —
Серебрякова, 1978).
Потомство, возникшее в процессе вегетативного размножения, образует клоны
— совокупность генетически однородных особей, идентичных по генотипу
материнскому организму. Образование клонов, называемых в англоязычной литературе
генетами (англ. genet — Harper, 1977), широко распространено в природе у видов,
размножающихся преимущественно вегетативным путем, например, у Elodea,
Lemna, Convallaria, Aegopodium и др. Сорта многих культурных растений
(Solarium tuberosum, Fragaria, Rubus, Tulipa и др.) представляют собой клоны.
В последние десятилетия все шире используют методы клонального
микроразмножения растений в культуре in vitro, которые позволяют вырастить целое
растение из немногих и даже одной клетки. Этот метод дает возможность сто- и
тысячекратно ускорить темпы размножения растений и получать не зараженный
вирусными болезнями посадочный материал. Метод микроклонирования экономически
оправдан для выращивания особо ценных культурных, декоративных,
лекарственных и редких растений (Катаева, Бутенко, 1983; Бутенко, 1998).
От «вегетативного размножения» следует отличать понятия «вегетативное
возобновление» и «вегетативное разрастание» (Шалыт, 1960). Вегетативное
возобновление — это образование новых частей растений вместо отмерших или
поврежденных. Оно хорошо выражено в форме сезонной ритмики растений. Вегетативное
разрастание — это увеличение размеров особи у растений. Оно сопровождается
Существует иная точка зрения иа эти понятия (см. Воспроизведение, размножение и
возобновление растений).
300
Системы репродукции
увеличением числа составляющих растение структурных модулей (термин ввел
Harper, 1977), обладающих относительной автономностью, т.е. потенциально
способных к самостоятельному существованию. Примерами подобных модулей могут
служить розеточные побеги (Aegopodium podagraria), кустики (Vaccinium
myrtillus), кусты (Carex pilosa), укореняющиеся побеги (Asarum europaeum).
Вегетативное разрастание легко наблюдать у однолетних, двулетних и вегетативнопо-
движных многолетних трав, а также у деревьев и кустарников. Проследить за
вегетативным разрастанием у кустарничков и вегетативно подвижных травянистых
многолетников гораздо труднее, поскольку у этих жизненных форм значительная
часть побеговых систем скрыта в земле и без раскопок нельзя установить границы и
размеры особей. Процесс вегетативного разрастания часто приводит к партикуля-
ции растений, распадению их на части — партикулы (см. Партикуляция). Парти-
кулы обычно представляют собой структурные модули (или их системы),
перешедшие к автономному существованию, например, отделившиеся и укоренившиеся
побеги (Aegopodium podagraria, Vaccinium myrtillus), ползучие побеги (Lysimachia
nummularia) и т. д. В англоязычной ботанической литературе такие отделившиеся
части называют раметами (англ. ramet — Harper, 1977).
Если отделившиеся части жизнеспособны, партикуляция ведет к вегетативному
размножению, т.е. увеличению числа особей. Если же отделяющиеся части не
жизнеспособны и быстро отмирают, тогда в результате партикуляции образуется опад.
Сенянинова-Корчагина (1967) предложила называть «старческим распадом»
случаи, когда партикуляция происходит на заключительных этапах онтогенеза, т.е. у
сенильных растений, и не сопровождается омоложением отделившихся партикул.
Таким образом, вегетативное размножение отличается от старческого распада тем,
что возникающее потомство по возрастному уровню моложе или, по крайней мере,
идентично материнскому растению.
В естественных условиях эффективность вегетативного размножения
определяется возрастом (или возрастным состоянием) растений, приступающих к
вегетативному размножению, степенью омоложения вегетативного потомства,
удаленностью его от материнского растения, длительностью физиологических
контактов между ними. Смирнова (1974), используя все эти признаки,
выделила 4 типа вегетативного размножения: 1) сенильная партикуляция (по Работно-
ву, 1969), которая свойственна главным образом стержнекорневым
травянистым многолетникам; 2) зрелая партикуляция без омоложения или со слабым
омоложением вегетативного потомства и слабым вегетативным разрастанием
(дерновинные злаки, осоки, короткокорневищные травы, геоксильные
кустарники); 3) зрелая партикуляция с неглубоким омоложением и активным
разрастанием (длиннокорневищные травы, кустарнички); 4) прегенеративная
партикуляция, свойственная молодым, еще не способным к цветению растениям.
Прегенеративная партикуляция обычно сопровождается глубоким
омоложением потомства. У одних биоморф (корнеотпрысковые, столонообразующие) она
связана с интенсивным разрастанием и расселением, у других (луковичные,
клубнелуковичные) разрастание выражено слабо и вегетативное потомство
сосредотачивается вблизи материнских растений, образуя компактные клоны.
Первый тип вегетативного размножения не эффективен, поскольку партикулы
быстро отмирают. По существу этот вариант следует отнести к вегетативному
распаду. Второй тип мало эффективен, так как жизненное состояние партикул низкое,
Вегетативное размножение
301
хотя их жизнь может продолжаться несколько десятилетий. Третий и четвертый
типы вегетативного размножения высоко эффективны. Потомков образуется
много (20-50 на одно растение в год) и они отличаются высокой энергией роста. Виды,
обладающие этими типами вегетативного размножения (например, Elytrigia repens,
Aegopodium podagraria, Potamogeton sp.), способны к быстрому захвату
территорий и акваторий. Результативность вегетативного размножения определяется не
только биоморфологией растений и их внутриорганизменными корреляциями, но и
внешними условиями (Любарский, Полуянова, 1984). Предельная длительность
жизни, темпы роста и развития вегетативного потомства (рамет) сильно варьируют
у разных видов и, по-видимому, определены генетически. Раметы Aegopodium
podagraria и Carex pilosa живут, например, по 7-9 лет, a Galium odoratum и Stellaria
nemorum — всего один год (Смирнова, 1987).
Вегетативное размножение, происходящее без участия человека, называется
естественным. Оно бывает неспециализированным и специализированным
(Серебряков, 1952; Серебрякова, 1978 — см. Васильев и др., 1978).
Неспециализированное вегетативное размножение наблюдается при перегнивании ползучих (Trifolium
repens, Lysimachia nummularia) и полегающих (Veronica chamaedrys) побегов,
эпиогенных, т.е. возникающих надземно, корневищ (Asarum, Geum, Alchemilla).
Специализированное вегетативное размножение происходит с участием
специализированных и часто видоизмененных побегов: длинных тонких быстро
перегнивающих столонов, как надземных (Fragaria), так и подземных (Trientalis europaea), ги-
погеогенных, т. е. развивающихся подземно, корневищ (Pyrola, Convallaria),
разнообразных запасающих органов: клубней (картофель), клубнелуковиц
(гладиолус, шафран), луковиц (тюльпаны, луки), выводковых почек (например, у
Ficaria verna). Клубневые, луковичные и клубнелуковичные растения отличаются
быстрыми темпами отрастания (возобновления) надземных побегов, поскольку
используют для роста накопленные в запасающих органах питательные вещества.
Искусственное вегетативное размножение человек применяет для разведения
культурных растений. С практической точки зрения, этот способ размножения
имеет преимущества по сравнению с семенным, так как позволяет долго сохранять
семенные свойства. При искусственном вегетативном размножении хозяйственно
ценных растений остро встает вопрос о процессах старения и длительности жизни
клонов, поскольку от них зависит устойчивость и долговечность сортов.
Специально проведенные исследования показывают, что сроки жизни клонов ограничены,
вегетативное потомство постепенно стареет и утрачивает полезные с хозяйственной
точки зрения признаки. У гладиолусов, например, при обычном размножении
клубнелуковицами, потомство обнаруживает признаки старения и постепенно теряет
сортовые свойства на втором-третьем десятках лет жизни сорта. С помощью
культуры in vitro старение можно существенно замедлить и даже практически
приостановить, если регулярно обновлять культуру in vitro и отбирать медленно стареющие
особи (Андреева и др., 1990; Матюхин, 1994).
Часто искусственное вегетативное размножение основано на разных способах
естественного размножения. Человек лишь ускоряет отделение вегетативного
потомства, разрезая корневища (сансевьера, кливия, аспидистра), отделяя дочерние
клубни, луковицы, клубнелуковицы (картофель, тюльпан, чеснок, гладиолус),
укореняя отводки (прижатые к земле ветви, например, у крыжовника) и черенки, т. е.
отрезки вегетативных органов. Черенки могут быть представлены побегами (стеб-
302
Системы репродукции
левые черенки — например, у смородины, тополя, комнатной герани), корнями
(корневые черенки — малина, облепиха, вишня), листьями (листовые черенки —
бегония, сентполия, или узумбарская фиалка).
Культурные растения, например, яблоня, груша, у которых регенерация корней
затруднена и черенки не укореняются, размножают с помощью прививок
(Серебрякова, 1978 — см Васильев и др., 1978).
Андреева и др., 1990; Батыгина, 1993; Васильев и др., 1978; Катаева, Бутенко, 1983; Любарский,
Полуянова, 1984; Матюхин, 1994; Работнов, 1969; Сенянинова-Корчагина, 1967; Серебряков,
1952; Смирнова, 1974,1987; Хохлов, 1970; Шалыт, 1960; Harper, 1977.
САРМЕНТАЦИЯ (лат. sarmentum — лоза, отпрыск, ус, плеть) — образование
отпрысков из верхушечной, боковых и придаточных почек на столонах, корневищах,
корнях, которые после укоренения отделяются от материнской особи.
Впервые термин sarmentum приведен на русском языке Моисеевым (1798) как
отпрыск стебельный, который может быть надземным и подземным (Пленк,
1798). Специализированные структуры, обеспечивающие процесс сарментации,
обозначали по-разному: отрасль (soboles) (Смеловский, 1800), леторасль (Дви-
губский, 1811), лоза, батог, прут, ус (Мартынов, 1820), отпрыск (Декандоль,
1839), корневой усик (Кюри, 1861), отпрыск, воздушный корень (Волкенштейн,
1874). Наиболее удачными терминами, отражающими суть явления, согласно Пе-
тунникову (1898), следует считать ус и корневой отпрыск.
Термин «сарментацйя» используется в ботанической литературе для
обозначения одного из способов естественного вегетативного размножения (Левина,
1981). При сарментации осуществляется интенсивный захват территории и
достигается самая высокая степень выживаемости дочерних растений, которые
претерпевают при этом, как правило, резкое омоложение. По глубине омоложенно-
сти потомков такой способ вегетативного размножения в большинстве случаев
приближается к семенному.
Формирование специализированных органов вегетативного размножения побе-
говой (столоны, корневища) и корневой природы, из почек которых образуются
куртины надземных обособляющихся побегов, наиболее сильно выражено у
цветковых растений (Схема).
Надземные столоны — тонкие, лишенные запасающей функции,
недолговечные (существующие один, реже два вегетационных периода), моно- или симподи-
ально нарастающие плагиотропные побеги с удлиненными междоузлиями,
регулярно формирующие дочерние, рано отделяющиеся боковые розеточные побеги;
характерны для надземно-ползучих травянистых жизненных форм. Надземные
столоны могут нести зеленые листья (Ajuga reptans, Ranunculus repens) и наряду с
функцией вегетативного размножения участвуют в фотосинтезе. Их нередко
называют плетями. Более высокоспециализированные надземные столоны, имеющие
исключительно чешуевидные листья (например, у Fragaria vesca, Saxifraga
flagellaris, видов рода Halerpestes), обычно именуют флагеллами, или усами.
Высокая энергия вегетативного размножения достигается и посредством
подземных столонов разной степени специализации (с листьями срединной или
низовой формаций,) (Trientalis europaea, Ranunculus lapponicus. R. lingua). У
столонно-клубневых (Stachys palustris, Sagittaria sagittifolia, Circaea alpina, Ullucus
Схема. Сарментацйя
1 — разветвленный симподиально нарастающий надземный столон Fragaria vesca с двумя
предлистьями, терминальным укороченным розеточным побегом и двумя боковыми ответвлениями;
2 — взрослая вегетативная особь Ranunculus lingua с многочисленными пазушными дочерними
укореняющимися розетками на подземных столонах; 3 — луковички — детки на коротких столонах
Gagea commutata; 4 — многократно разветвленные надземные корневища Tussilago farfara,
образующие надземные побеги; 5 — 2-летнее растение Anemone dichotoma с корневыми
отпрысками и придаточными почками на корнях; 6 — почка, заложенная на феллогене главного
корня Rubus idaeus; 7,8 — разные стадии развития придаточных почек на горизонтальных корнях
Rubus hirtus, зачатки которых возникают в паренхиме широкой вторичной коры; б cm, — боковой
столон первого порядка, б ст2 — боковой столон второго порядка, в к — вторичная кора, к пб —
корневой побег, крн — корневище, л — луковичка, н пб — надземный побег, н cm — надземный
столон, пл, — предлист первый, плг — предлист второй, п cm — подземный столон, пр пч —
придаточная почка, р пб — розеточный побег, фл — феллоген.
1 — по: Troll, 1954; 2,5 — по: Барыкина, 1995; 3 — по: Игнатьева, Андреева, 1993; 4 —
по: Korsmo, 1930; 6-8 — по: Барыкина, 1964.
304
Системы репродукции
iuberosus) и столонно-луковичных форм (Allium angulosum, Gagea commutata,
Lilium canadense) развитие подземного столона завершается формированием
терминальных или боковых клубней или луковиц, соответственно. Столоны
появляются у особей семенного происхождения рано, на первом-втором году жизни
(Голубев, 1961; Барыкина, Пустовойтова, 1973), им свойственны высокая скорость
разрастания и относительно быстрые темпы развития.
Морфологически близкие к столонам длинные горизонтальные корневища
(ризомы) характерны преимущественно для травянистых многолетников
(Veronica longifolla, Convallaria majalis, Paris quadrifolia, Elytrigia repens,
Car ex pilosa), но встречаются они и у геоксильных кустарников (Paeonia
suffruticosa, Caragana frutex, Amygdalus nana) и кустарничков (Vaccinium
vitis-idaea, V. myrtillus). Способность к образованию клонов при постепенном
разрушении старых частей ветвящихся многолетних корневищ присуща и
некоторым споровым растениям (хвощи, папоротники). При этом дочерние особи
корневищных жизненных форм в отличие от столонообразующих и корнеот-
прысковых часто не испытывают существенного омоложения и находятся при
отделении в том же возрастном состоянии, что и материнское растение.
Размножение корневыми отпрысками, т. е. надземными олиственными
укореняющимися побегами, развивающимися из придаточных почек на корнях,
наблюдается у многих деревьев и кустарников (Robinia pseudo-acacia, Populus tremula,
Alnus incana, Rubus idaeus, Cerasus fruticosa, Prunus spinosa). Часто
встречаются корнеотпрысковые травянистые многолетники, многие из них — злостные
сорняки полей, лугов, огородов (Convolvulus arvensis, Linaria vulgaris, Sonchus
arvensis) (Пачоский, 1915; Мальцев, 1937; Котт, 1961). Особенно широко
распространено образование корневых отпрысков среди растений степей и
полупустынь (Казакевич, 1922), тундры и лесотундры (Шитт, 1952).
Rauh (1937) различает факультативные, регенеративные и облигатные
корневые побеги. Первые появляются лишь в условиях улучшенного питания и роста
растения. Регенеративное происхождение корневых отпрысков проявляется в том,
что они образуются только в результате поранения корней (Trifolium montanum).
Облигатные корневые побеги регулярно формируются в процессе индивидуального
развития растения. Так, у Anemone dichotoma, Cirsium arvense уже в однолетнем
возрасте сначала в базальной части главного корня, затем на боковых и
придаточных корнях в акропетальной последовательности закладываются многочисленные
придаточные почки, развивающиеся в отпрыски; у трех- пятилетних особей
формируется клон из 30-40 корнеотпрысковых парциалей.
Исключительный интерес представляют грушанковые (Pyrola rotundifolia,
Moneses uniflora, Orthilia secunda), в редуцированном зародыше которых
отсутствует зачаток побега, а проросток формируется как униполярное образование только
за счет слабого разрастания и ветвления «радикулы» (протосомы). Развитие про-
тосомы прекращается до внедрения гиф микоризного гриба, после которого из
протосомы формируется корневище с репродуктивными побегами.
Как показывают результаты исследований представителей разных семейств
(Beijerinck, 1886; Busgen, 1927; Ossenbeck, 1927; Кренке, 1928; Rauh, 1937;
Вегетативное размножение 305
Барыкина, 1954; Dore, 1955; Василевская, 1957; Кондратьева-Мельвиль,
1957), корневые почки возникают эндогенно, часто близ места отхождения от
материнского корня тонких сосущих боковых ответвлений. В образовании
почек могут участвовать самые разнообразные ткани, не утратившие меристема-
тического характера или способные к дедифференциации. Это—перицикл
(Linaria vulgaris, Cirsium arvense, Eleagnus argentea, Hippophae rhamnoides),
феллоген (Rumex acetosella, Ulmus pennato-ramosa, U. campestris, Rubus
idaeus), межпучковый камбий и паренхима лубяной части первичных и
вторичных сердцевинных лучей (Heliotropium arguzioides, Slum latifolium, Rhus
tifina, Prunus spinosa), паренхима мягкого луба (Malus silvestris), наружные
слои первичной (виды p. Bryophyllum) и вторичной (феллодермального
происхождения) коры (Robinia pseudo-acacia, Populus alba, Rubus hirtus).
Некоторые превентивные почки могут долгие годы сохраняться в живом состоянии в
форме так называемых «спящих почек». Адвентивные почки встречаются реже
превентивных и в большинстве случаев дифференцируются в каллюсных
наплывах пораненных корней (Shepherdia argentea, Elaeagnus angustifolia, Ulmus
laevis, Malus silvestris).
Сарментация как один из способов вегетативного размножения, часто
обеспечивает господствующее положение вида в растительной группировке, и имеет
огромное приспособительное значение (возобновление леса, восстановление
травяного покрова лугов, задернение подвижных песков и оврагов).
Барыкина, 1954; Барыкина, Пустовойтова, 1973; Василевская, 1957; Волкенштейн, 1874;
Голубев, 1961; Двигубский, 1811; Декандоль, 1839; Казакевич, 1922; Кондратьева-Мельвиль, 1957;
Котт, 1961; Кренке, 1928; Кюри, 1861; Левина, 1981; Мальцев, 1937; Мартынов, 1820;
Пачоский, 1915; Петунников, 1898; Пленк, 1798; Серебряков, 1952; Смеловский, 1800; Шитт, 1952;
Beijerinck, 1886; Busgen, 1927; Dore, 1955; Ossenbeck, 1927; Rauh, 1937.
306
Системы репродукции
ПАРТИКУЛЯЦИЯ (лат. particula — частица, доля) — продольное расчленение
растения, преимущественно его подземных органов (каудекса, вертикального
корневища, главного корня, стеблекорневых клубней) на отдельные живые части (пар-
тикулы), способные при отделении к самостоятельному существованию и
развитию.
Впервые это явление было описано Jost (1890), наблюдавшим продольное
расщепление корня и корневища у Aconitum lycodonum, Centiana crudata и других
растений. Термин ввел Высоцкий (1915), изучавший вегетативное размножение у
травянистых многолетников Среднерусской равнины.
Партикуляция происходит в природе у многих представителей семейств
Ranunculaceae, Papaveraceae, Fabaceae, Crassulaceae, Apiaceae, Gentianaceae,
Convolirilaceae, Plantaginaceae, Polygonaceae, Chenopodiaceae, Aste.race.ae. и др.,
различающихся экологией и жизненной формой. Среди них встречаются стержне-
корневые, кистекорневые, дерновинные, короткокорневищные и клубнеобразую-
щие многолетние травы, полукустарнички и полукустарники, кустарнички и
кустарники с симподиальным нарастанием побегов, подушковидные растения.
Особенно широко она распространена у растений степей и прерий (Шалыт, 1950,
1965; Голубев, 1962), плакорных полупустынь и жарких пустынь (Коровин, 1934;
Рачковская, 1957), горных полупустынь и пустынь (Райкова, 1930; Станюкович,
1949; Сабардина, 1951), у некоторых представителей альпийской флоры
(Daubenmire, 1941; Микеладзе, 1960; Барыкина и др., 1991). Значительно реже
она встречается у типичных лесных мезофитов. Партикуляция может быть полной
и неполной (частичной), явной и скрытой. В большинстве случаев способность к
ней представляет видовой признак.
В эволюционном отношении партикуляция у цветковых растений — явление
относительно позднее. У более примитивных таксонов высших растений ее,
по-видимому, нет (Шалыт, 1965).
Биологический смысл партикуляции до сих пор остается спорным.
Высказано несколько точек зрения, порой диаметрально противоположных
(Басаргин, Горовой, 1972). По мнению ряда авторов (Korsmo, 1930; Закржевский,
Коровин, 1935; Troll, 1935; Новиков, 1943; Прокофьев и др., 1954;
Черняева, 1960; Любарский, 1961; Восканян, 1973; Барыкина, 1995), партикуля-
цию, сопровождающуюся расщеплением материнской особи на несколько
дочерних, можно считать особой формой вегетативного размножения (см.
Вегетативное размножение). Однако оно не сопровождается значительным
расширением площади, занимаемой видом, и, как правило, не приводит к
заметному омоложению вегетативного потомства. Не играя существенной роли
в самоподдержании видовых популяций, партикуляция вместе с тем имеет
важное приспособительное значение. Она обеспечивает продление жизни
клона и сохранение за видом определенной территории (Голубев, 1962).
Наиболее эффективен этот способ размножения в условиях динамичного
субстрата. Для стержнекорневых Carum caucasicum. Taraxacum stevenii, Plantago
Вегетативное размножение
307
saxatilis и других альпийских растений партикуляция — основной вид
размножения, так как семенное размножение у них сильно отстает от вегетативного
(Микеладзе, 1960).
Другие исследователи (Jost, 1890; Высоцкий, 1915; Нечаева, 1949; Козлова,
1953; Гордеева, 1957; Казарян, Балагедян, 1960; Шалыт, 1965; Пошкурлат,
1975), исходя из морфологического анализа полукустарничков, стержне- и кис-
текорневых травянистых мезофитов, интерпретируют это явление,
обнаруживаемое обычно лишь с переходом растений в генеративный период развития, как
один из признаков их медленного отмирания, т.е. как чисто возрастное явление,
не имеющее существенного биологического значения. Иными словами это —
старческий распад растения.
Некоторые ботаники (Радкевич, Шубина, 1935; Василевская, 1950)
связывают партикуляцию у ряда ксероморфных кустарников и полукустарников
пустыни не с возрастом растения, а исключительно с жесткими климатическими
условиями. Чем резче, по мнению этих авторов, контрасты между весенним
периодом максимальных осадков и летней засухой, тем раньше в онтогенезе
начинается партикуляция и тем интенсивнее она протекает. Влияние на процесс
партикуляции резко континентального климата отмечено и для некоторых
травянистых растений. Так, в отрогах Тянь-Шаня, существуют целые урочища
кок-сагыза, где он размножается вегетативно, распадаясь на самостоятельные
особи (Кудряшова 1958).
Работнов (1969), отождествляя партикуляцию с вегетативным размножением,
подразделяет ее на три типа: нормальную — размножение растений
специализированными, «неразносными» органами вегетативного размножения;
травматическую — образование новых особей при отчленении (животными или человеком) от
материнской неспециализированных органов вегетативного размножения; сениль-
ную — распад особей при их старении на несколько самостоятельных растений
(собственно партикуляция). С этим согласны многие исследователи (Левина,
1981; Жмылев и др., 1993; см. также «Ценопопуляции растений», 1976, 1988).
Нухимовский (1973, с. 108), придерживаясь в целом такой же точки зрения,
предлагает более широкую трактовку партикуляции; он понимает под ней «всякое
разделение высшего растения на живые части», включая отделение семян и
спор — «семенная и споровая партикуляция». Вегетативное же размножение он
рассматривает как увеличение числа особей «посредством партикуляции без
использования спор и семян» (с. 111). Однако такой взгляд Нухимовского на
партикуляцию не нашел сторонников.
Партикуляция у разных видов в соответствии с их жизненными формами
происходит неодинаково, что было отчасти проиллюстрировано еще Высоцким
(1915). Она занимает разное место в жизненном цикле особи и имеет разные
структурные основы, которые обусловлены особенностями морфолого-анато-
мического строения осевых вегетативных органов и их преобразованием в
онтогенезе. Изменения в микроструктуре партикулирующих растений были
отмечены многими исследователями, начиная с Jost (1890). Структурную основу пар-
308
Системы репродукции
тикуляции у ряда травянистых мезофитов, а также симподиально нарастающих
пустынных кустарников, полукустарников и кустарничков составляет некроз
части тканей стебля и корня, связанный с естественным сезонным отмиранием
побегов и периодическим их возобновлением (Радкевич, Шубина, 1935).
Процесс отмирания распространяется по веточному следу вниз, переходит из
стебля, каудекса или корневища в корень, создавая структурную предпосылку его
расщепления. При этом живые ткани отделяются от мертвых слоями
перидермы. Партикуляция в данном случае представляет собой реакцию растения на
отмирание части его надземных органов, независимо от характера факторов
(биологических или экологических), которыми оно вызвано.
Однако партикуляция не всегда сопряжена с отмиранием веточных следов.
Так, Высоцкий связывал партикуляцию у стержнекорневых полукустарников с
неравномерным вторичным утолщением корня и корневища. Более детальное
описание анатомических изменений, предшествующих продольному
расщеплению подземных органов у растений разных экологических групп и жизненных
форм приводится в ряде работ (Tschirch, 1889; Pfeiffer, 1926; Руденская, 1941;
Булгаков, 1944; Барыкина и др., 1976, 1977; Михайловская, 1976). В них
отмечается характерная для травянистых форм ранняя (у высокогорных растений
на 2-3 году жизни) активизация латеральных меристем. В корневище
партикуляция начинается с обособления и разрастания вокруг групп трахеальных
элементов ксилемы (одного или одновременно двух-трех рядом расположенных
пучков) дуг васкулярного камбия до полного или почти полного их смыкания в
кольцо. В результате этого возникают многочисленные центры локального
вторичного утолщения.
Иногда, например, у некоторых видов p. Taraxacum, представителей сем.
Convolvulaceae (Де-Бари, 1880) с клубневидно утолщенными корнями, клубнеоб-
разующих видов Aconitum (Kumazawa, 1937) в зоне гипертрофированного роста
корня меристематическими становятся и группы тонкостенных паренхимных клеток,
находящихся в центральной части органа, а также в первичной (Aconitum) или во
вторичной флоэме (Taraxacum). Делясь, они образуют очаги мелкоклеточной ткани,
дифференцирующиеся в дополнительные проводящие пучки (амфикрибральные,
коллатеральные или неполные). В камбиальной зоне некоторых открытых пучков
могут закладываться зачатки боковых или придаточных корней. На поверхности
наметившихся партикул в результате деления клеток флоэмной и ксилемной паренхимы
дифференцируется феллоген, образующий феллему. Наружным признаком
атипичного утолщения служит слабо ребристая поверхность органа. Последующее
отмирание и лизис межпучковой паренхимы приводит к обособлению партикул (Схема).
Высокая активность латеральных меристем (феллогена и камбия), обусловливающая
партикуляцию, по-видимому, определяется, как отмечает Микеладзе (1960),
динамикой физиологически активных веществ, установление природы которых — задача
будущего.
В пучках обособившихся партикул на протяжении 2 и более лет (20-25 лет у
Anemone protracta — Барыкина, 1995) продолжается работа камбия, благодаря
Схема. Партикуляция
1 — 5-летнее имматурное растение Pulsatilla violacea с партикулирующими подземными органами;
2-4 — партикуляция у Aconitum orientate: 2 — отделяющийся участок многолетнего
партикулирующего вертикального корневища с развившимся боковым побегом и спящими почками,
3 — схема анатомического строения партикулирующего корневища, 4 — отделившаяся от него
однопучковая партикула; 5 — поперечное сечение однолетнего стебле-корневого клубня Aconitum
confertiflorum, обладающего скрытой партикуляцией и атипичным утолщением; б пб — боковой
побег, в кс — вторичная ксилема, в прд — внутренняя перидерма, в фл — вторичная флоэма, г к
— главный корень, зпк — зачаток придаточного корня, з с — закупоренные сосуды, к — камбий, к
пр — концентрический проводящий пучок, кр — корневище, л — лист, но — некротические очаги, н
пр — неполный проводящий пучок, н прд — наружная перидерма, пк — придаточный корень, пч —
почка.
По: Барыкина, ориг.
310
Системы репродукции
чему происходит увеличение и обновление сильно паренхиматизированной или
преимущественно вторичной флоэмы или ксилемы. По данным Руденской
(1941) и Булгакова (1944), в корневых партикулах кок-сагыза, возникающих
вследствие атипичного вторичного утолщения, усиливается образование
млечников, что значительно повышает каучуконосность корней и растения в целом.
Следовательно, в тех случаях, когда партикуляция подземных органов
начинается на ранних фазах онтогенеза и сопровождается интенсивным
предварительным формированием локальных очагов вторичного утолщения, ее,
по-видимому, надо рассматривать как одно из проявлений адаптивной
специализации растения. Она обеспечивает регулярное пополнение проводящих и
запасающих тканей многолетних подземных органов, их контрактильность, а при
полном отделении партикул побегового происхождения, имеющих резерв
спящих почек и обладающих корнеобразовательной способностью, — и
вегетативное размножение.
Однако многие стороны партикуляции — «одного из интереснейших
биологических явлений в растительном мире» (Радкевич, Шубина, 1935, с. 19) —
остаются до сих пор невыясненными.
Барыкина, 1995; Барыкина и др., 1991,1976,1977; Басаргин, Горовой, 1972; Булгаков, 1944;
Василевская, 1950; Восканян, 1973; Высоцкий, 1915; Голубев, 1962; Гордеева, 1957; Де-Бари, 1880;
Жмылев и др., 1993; Закржевский, Коровин, 1935; Казарян, Балагедян, 1960; Козлова, 1953;
Коровин, 1934; Кудряшова, 1958; Левина, 1981; Любарский, 1961; Микеладзе, 1960; Михайловская,
1976; Нечаева, 1949; Новиков, 1943; Нухимовский, 1973; Пошкурлат, 1975; Прокофьев и др.,
1954; Работиов, 1969; Райкова, 1930; Радкевич, Шубина, 1935; Рачковская, 1957; Руденская,
1941; Сабардина, 1951; Станюкович, 1949; Ценопопуляции растений, 1976,1988; Черняева, 1960;
Шалыт, 1950,1965; Daubenmire, 1941; Jost, 1890; Korsmo, 1930; Kumazawa, 1937; Pfeiffer, 1926;
Troll, 1935; Tschirch, 1889.
ПОЧКА (лат. экв. gemma) — монополярная структура, представленная
укороченным побегом или его частью. Почка состоит из оси с конусом нарастания (апекс
s.l.) и разновозрастными листьями, которые покрывают ось и друг друга, а иногда
и с зачатками пазушных почек, цветков и соцветий. Наружные (нижние) листья в
почке вследствие неравномерного роста возвышаются и загибаются над апексом.
Это свойство листьев в почке называют акровергенцией . В результате акровер-
генции внутри почки образуется темная, влажная камера, в которой располагается
апикальная меристема и проходят самые первые этапы морфогенеза побега и его
первоначальный рост. Таким образом, наружные покровы почки защищают
наиболее молодые и уязвимые участки зачаточного побега от неблагоприятных внешних
воздействий, в первую очередь от высыхания. Возникновение почек в ходе
эволюции рассматривают как важный ароморфоз, позволивший покрытосемянным
успешно освоить все разнообразие условий жизни в надземно-воздушной среде
обитания (Серебрякова, 1978 — см. Васильев и др., 1978).
Греч, akros — верхний, конечный и лат. vergens — обращенный, направленный.
Вегетативное размножение 311
Почки обеспечивают рост побегов в длину (нарастание) и их ветвление. Все
это в конечном счете ведет к увеличению фотосинтезирующей поверхности
растения. В почках закладываются и репродуктивные органы — цветки. Способность
почек долгое время находиться в состоянии ростового покоя дает возможность
растениям переживать неблагоприятные условия (длительная засуха, холодная
зима). По окончании неблагоприятного времени года возобновляется рост, почки
развертываются и из них вырастают новые побеги.
Почки могут выполнять и запасающие функции, при этом они часто
видоизменяются. Примером такой сильно метаморфизированной почки служит
кочан обычной культурной капусты. Запасающая функция также хорошо
выражена у зимующих почек некоторых водных и прибрежных растений,
например, стрелолиста, водокраса, телореза. Эти зимующие почки называют ги-
бернакулами , они служат для вегетативного размножения, перезимовки и
возобновления растений. Иногда почки, например выводковые почки у
Bryophyllum, Dentaria, Polygonum viviparum, специализируются как органы
вегетативного размножения, связанного с так называемым живорождением
(см. Вивипария; Выводковая почка).
Понятие «почка» используют в широком и узком смыслах. В широком смысле
почками называют как покоящиеся почки, так и верхушки растущих побегов (Troll,
1954; Серебрякова, 1971; Halle et al., 1978). В узком смысле почками считают
только те, которые находятся в состоянии относительного покоя (Федоров и др.,
1962; Romberger, 1963).
Классифицируют почки по разным признакам. По типу заложенных в почках
зачатков их делят на вегетативные, которые содержат метамеры вегетативных
побегов, генеративные (цветочные) с зачатками цветков и соцветий и
смешанные (вегетативно-генеративные) с зачатками репродуктивных и вегетативных
органов. Почку, содержащую зачаток одного цветка, называют бутоном
(Серебрякова, 1978 — см. Васильев и др., 1978).
По характеру защитных структур почки делят на закрытые, имеющие
специализированные почечные чешуи — листья низовой формации, или катафил-
лы (например, у Populus, Padus, Convallaria и др.) и открытые (голые),
лишенные почечных чешуи. Открытые почки могут быть окружены зачатками
фотосинтезирующих листьев (например, у Viburnum lantana, Myrtus
communis), прилистниками развитых срединных листьев (Ficus elastica, виды
родов Trifolium, Alhemilla), развертывающимися зелеными листьями
(подорожник, элодея и все растущие верхушки побегов). Таким образом,
морфологически открытые почки защищены разнообразными покровами.
По положению на растении различают верхушечные (терминальные),
боковые (пазушные), придаточные (адвентивные) почки. Верхушечные почки
образуются на верхушках побегов, боковые — в пазухах листьев. И те, и другие
закладываются в первичных апикальных меристемах. Иногда (например, у
липы) в процессе роста побега его верхушка отмирает и ее заменяет самая
верхняя пазушная почка, которая оказывается на конце побега и называется
конечной, или ложноверхушечной.
Лат. hibernaculum — зимнее помещение.
312
Системы репродукции
Пазушные почки возникают в виде меристематических бугорков экзогенно за
счет деления поверхностных клеток, обычно в пазухах третьего — пятого сверху
листовых зачатков. Как правило, в пазухе одного листа закладывается одна
пазушная почка, реже — несколько. В последнем случае формируются добавочные
почки, не имеющие собственных кроющих листьев. Добавочные почки возникают в
результате длительной деятельности пазушной меристемы и могут располагаться
вертикально друг над другом или горизонтально бок о бок. Вертикально
расположенные почки называют сериальными (жимолость, ежевика), горизонтально
расположенные — коллатеральными (чеснок, птицемлечник хвостатый).
Коллатеральные почки свойственны растениям с широкими основаниями листьев,
преимущественно однодольным.
У некоторых растений имеет место внутрипочечное ветвление, т.е. на
материнской почке первого порядка из пазушных примордиев развиваются дочерние почки
второго порядка, а на них — внучатые почки третьего порядка. Таким путем
образуются групповые почки, например, на клубнях Solanum tuberosum, побегах Acer
negundo, видов родов Prunus и Vitis (Костина, 1997). Групповые, т.е. ветвящиеся,
почки отличаются от дополнительных тем, что у них каждая почка находится в
пазухе собственного кроющего листа. По степени и темпам развития дочерние и
внучатые почки могут не отличаться от материнской и даже обгонять ее, как например
у видов рода Camellia (Михалевская и др., 1988), у которых цветки развиваются
из дочерних почек, а материнские остаются вегетативными.
Придаточные почки образуются не из первичных апикальных, а из вторичных
боковых и раневых меристем или в результате дедифференциации клеток (чаще па-
ренхимных) постоянных тканей. В отличие от пазушных придаточные почки
закладываются как экзогенно, так и эндогенно (т.е. во внутренних тканях) и образуются
на междоузлиях стебля, на листьях и корнях. По строению придаточные почки не
отличаются от верхушечных и пазушных и выполняют те же функции. Кроме того,
они обеспечивают вегетативное размножение у корнеотпрысковых растений
(осина, осот полевой, щавелек) и регенерацию побеговых систем при поломках,
рубке, скашивании и т.п.
По длительности периодов ростового покоя и видимого роста различают почки
регулярного возобновления (зимующие), спящие и постоянно растущие
(Серебрякова, 1978 — см. Васильев и др., 1978). Почки регулярного возобновления
— это верхушечные и пазушные почки, которые пребывают в состоянии ростового
покоя не более одного года. В умеренных широтах, весной после перезимовки, эти
почки развертываются и из них вырастают (возобновляются) новые побеги.
Спящие почки находятся в покоящемся состоянии несколько (иногда много)
лет. По происхождению они могут быть пазушными, придаточными и даже
верхушечными (у Pittosporum — Михалевская, неопубл. данные). В спящей почке
конус нарастания ежегодно вычленяет зачатки нескольких метамеров побега, при
этом часть наружных чешуи отмирает. В результате ось почки ежегодно
подрастает на 1-2 мм (иногда больше), чаще всего на толщину годичного кольца
древесины. Спящие почки часто ветвятся и образуют скопления на поверхности
стволов, ветвей, корней. Пробуждаются спящие почки при повреждении растений и
обеспечивают восстановление (регенерацию) побеговых систем, например
образование пневой поросли (Серебряков, 1952; Ляшенко, 1964; Kozlowski, 1971) и
вторичных крон (Смирнова, 1994).
Вегетативное размножение
313
Постоянно растущие почки — это открытые верхушечные почки ряда
тропических растений (традесканция, зебрина, кокосовая пальма и др.), а также некоторых
моноподиально нарастающих травянистых многолетников умеренных широт
(подорожник, вероника дубравная, гравилат, кислица обыкновенная), у которых
зимняя остановка роста вынуждена. В постоянно растущих почках листья обычно
закладываются и развертываются согласованно, так что число зачатков листьев
остается постоянным, например у традесканции оно всегда равно трем (Серебрякова,
1978 — см. Васильев и др., 1978).
Морфогенез почек включает несколько этапов. Обычно их выделяют четыре:
почечная инициаль, почечный примордий, незрелая и зрелая почка. Почечная иници-
аль (Шилова, 1967) представляет собой гладкий меристематический бугорок,
возникающий в результате антиклинальных и периклинальных делений поверхностных
клеток меристемы. На почечном примордий вычленяются первые метамеры
побега, т.е. закладываются листовые бугорки и узлы будущего стебля. На этапе примор-
дия гистогенез еще отсутствует и прокамбиальные тяжи не заметны (Hagemann,
1984). Незрелая почка включает разновозрастные метамеры, но обычно не
способна тронуться в рост и сформировать побег из-за малой емкости. Емкостью почки
называют число заложенных в ней метамеров от первых зачаточных до наружных,
вполне сформированных (Серебрякова, 1971). В незрелых почках уже хорошо
выражена акровергенция и начинается гистогенез: дифференцируются первичные ткани,
закладываются прокамбиальные тяжи. Зрелые почки имеют максимальную
емкость. В них сформированы все почечные чешуи (если почки закрытые) и во многих
случаях заложены все метамеры будущего побега. Зрелые почки обычно переходят к
активному росту (Серебрякова, 1959,1961, 1971).
Таким образом, почки постоянно меняют свою емкость и строение. Даже если
почка находится в состоянии так называемого ростового покоя, внутри нее может
происходить внутрипочечный рост, т. е. заложение новых метамеров и
репродуктивных органов. Внутрипочечный рост идет ритмично, поскольку вычленение
каждого нового метамера уменьшает объем апекса и требуется время для его
восстановления. Отрезок времени между вычленением на апексе двух последовательных
метамеров называют пластохроном (Askenasy, 1880). Длительность пластохронов у
разных видов, у одного и того же вида в разных условиях, и даже у одного и того же
побега в разные периоды его жизни, неодинакова. Например, в период активного
весенне-летнего роста побегов величина пластохрона у лещины, березы, дуба равна
2-3 суткам, у клена — 12 суткам, а у ели — всего 4,5 часа (Серебрякова, 1978 —
см. Васильев и др., 1978).
Ритмы внутрипочечного роста побегов многоступенчаты и выражаются не
только в пластохронах, но и в периодах и тактах роста. Период роста — это время
заложения порции метамеров, соответствующей одному или нескольким циклам и
равной знаменателю формулы листорасположения. При формуле 1/3 цикл
включает три зачатка, при 2/5- пять, при 3/8- восемь. Такт роста — временной интервал
между заложением повторяющихся (т.е. лежащих на одной ортостихе) листьев
разных циклов. Соответственно различают однотактные периоды, когда
закладывается один цикл метамеров, дву-, три- и многотактные, когда формируются
метамеры двух и более циклов (Шилова, 1988). Исследования Шиловой (1967, 1974,
1984, 1988) показали, что внутрипочечный и видимый рост побегов часто идут
асинхронно и различаются как по числу, так и по продолжительности периодов и
314
Системы репродукции
тактов. Например, у большинства тундровых растений внутрипочечный рост
намного продолжительнее видимого (соответственно 6-8 и 2-4 недели) и часто
складывается из нескольких периодов, в то время как видимый рост — только из
одного. Временная и структурная организация внутрипочечного роста — важная форма
адаптации растений к факторам внешней среды.
Строение и емкость почек меняется также по мере развития побега и его
перехода от вегетативной фазы к генеративной. Монокарпический (однократно
плодоносящий) побег начинает свое развитие из начальной (инициальной) почки, которая,
как правило, является пазушной вегетативной. На верхушке монокарпического
побега в период его вегетативного роста располагается промежуточная
(интермедиальная) почка. У растений с полициклическими побегами, например у грушанок,
рамишии, эта почка может несколько лет оставаться вегетативной. При переходе
монокарпического побега к цветению формируется завершающая (финальная)
верхушечная почка (генеративная, как у грушанок, или вегетативно-генеративная
почка, как у некоторых злаков — щучки, овсяницы овечьей). Начальная почка у
растений с моноциклическими побегами (копытень, хохлатки, ятрышники) может
быть и одновременно завершающей, если в ней заложены все части будущего
побега, включая цветки и соцветия (Серебрякова, 1983).
Зачатки листьев закладываются в почках в виде меристематических бугорков,
которые сначала разрастаются равномерно во все стороны, а потом в высоту. У
однодольных листовые примордии имеют вид серповидных валиков, которые
затем растут в ширину и охватывают конус нарастания по всей его окружности. Уже
на ранних фазах примордии расчленены на нижнюю и верхнюю части. Из нижней
формируется основание листа (у однодольных влагалище) и прилистники, из
верхней — пластинка листа и черешок. Прилистники появляются очень рано в
виде боковых выростов основания и быстро увеличивают свои размеры за счет
краевого роста (Серебряков, 1952). В почке прилистники часто крупнее
зачаточных пластинок и создают для них дополнительную защиту. Пластинки
формируются вначале благодаря росту в длину главной и основных боковых жилок, но
этот рост быстро прекращается и дальнейшее формирование пластинки идет
благодаря краевому (маргинальному) росту, а у однодольных — вставочному (ин-
теркалярному), который продолжается и во внепочечной фазе (Серебрякова,
1978 — см. Васильев и др., 1978). Форму упаковки листовых пластинок в почке
называют листосложением.
Различают следующие типы листосложения: плоское — листовая пластинка
выпрямлена (хвойные), сдвоенное — пластинка сложена пополам по средней
жилке (у липы), складчатое — пластинка сложена продольными складками в виде
гармошки (у ольхи, кленов), смятое или скомканное — складки и неровности идут в
разных направлениях (ревень), скрученное или трубчатое — пластинка свернута
по продольной оси в трубку (садовая вишня), завернутое — края пластинки
завернуты к ее верхней поверхности (тополь), отвернутое — края пластинки завернуты
к ее нижней поверхности, улиткообразно свернутое — лист свернут по продольной
оси от верхушки к основанию (папоротники) (Федоров и др., 1962).
Положение в почке листьев по отношению друг к другу называют почкосмы-
канием, которое может быть створчатым (края листьев соприкасаются),
черепитчатым (края листьев налегают друг на друга), объемлющим или
охватывающим (наружные листья обвертывают все остальные), полуобъемлющим или по-
Вегетативное размножение 315
луохватывающим, когда наружный лист наполовину охватывает вышележащий
(Федоров и др., 1962).
Почечные чешуи закрытых почек имеют у разных растений разную
морфологическую природу. Они могут представлять собой основания листьев (ландыш,
купена), прилистники (орешник, дуб, бук), целые листья (волчеягодник, черника).
Почки, находящиеся в пазухах почечных чешуи, называют чешуепазушными.
По степени сформированности побега в почке Серебряков (1947, 1952)
различал три группы растений: 1) побег заложен полностью, включая цветки и соцветия
(анемоны, хохлатка, чистяк); 2) заложена только вегетативная часть побега, а
цветки и соцветия формируются на внепочечной фазе его развития (липа, гравилат,
вероника-дубравка); 3) заложена лишь часть вегетативного побега (иван-чай,
золотая розга, дудник лесной). Позже первый вариант развития побега получил
название «преформация», а дополнительное заложение метамеров во время
внепочечной фазы развития — «неоформация» (Halle et al., 1978). Установлено, что в
преформированных почках закладываются не только все метамеры будущего
побега, но и часть почечных чешуи будущей верхушечной почки. В случае неоформации
на удлиненных побегах (например, у тополя) морфологически различимы ранние
листья, развившиеся из преформированных зачатков, и поздние листья, возникшие
из неоформированных примордиев (Crithfild, 1960, 1970, 1971; Kozlowski, 1971;
Macdonaldetal., 1984).
Разнообразие почек на одном растении, находящихся на разных фазах
морфогенеза и отличающихся по положению, размерам, строению и функциям, создает
основу высокой пластичности побегообразования и дает возможность растениям
оптимально адаптироваться к среде, меняя размеры и форму побеговых систем. Не
случайно одна из наиболее популярных классификаций жизненных форм растений
— система Raunkier (1934) — использует в качестве основного критерия
положение почек возобновления по отношению к поверхности почвы.
Васильев и др., 1978; Костина, 1997; Ляшенко, 1964; Михалевская и др., 1988; Серебряков,
1947,1952; Серебрякова, 1959,1961,1964,1971,1983; Смирнова, 1994; Федоров и др., 1962;
Шилова, 1967, 1974, 1984, 1988; Askenasy, 1880; Critchfild, 1960, 1970, 1971; Hagemann,
1984; Halle et al., 1978; Kozlowski, 1971; Macdonald et al., 1984; Raunkier, 1934; Romberger
1963; Troll, 1937,1954.
ВЫВОДКОВАЯ ПОЧКА — специализированный орган вегетативного
размножения и расселения цветковых растений. В процессе развития выводковой почки
происходит становление ее биполярности (закладка адвентивных корней) и
формирование нового индивидуума. Синонимы: пропагула, луковичка, клубенек.
Первоначально термин «выводковая почка» применялся для обозначения одно-
или многоклеточных образований, обеспечивающих вегетативное размножение у
слоевцовых растений (водоросли, печеночники) (Buch, 1911; Goebel, 1908;
Schuster, 1969). Структуры, выполняющие эту функцию, присущи также высшим
споровым растениям (мхи, хвощи, плауны, папоротники) и ряду цветковых
растений (Кернер, 1899, 1902; Левина, 1961; Васильев и др., 1978; Schuster, 1984).
Выводковые почки возникают на растении в большом числе, а потом опадают с
него подобно семенам или спорам; сходство усиливается тем, что растения,
формирующиеся из опавших почек, значительно омоложены и напоминают семенные
316
Системы репродукции
проростки или молодой гаметофит. Образование нового растения из выводковой
почки детерминировано.
В зависимости от места возникновения на растении выделяют листовые,
стеблевые и корневые выводковые почки. Место закладки и строение выводковых
почек таксоноспецифичны (Кернер, 1902; McVeigh, 1937; Культиасов, 1953;
Жуковский, 1964; Schuster, 1969; Haccius, Lakshmanan, 1969; Haccius, Hausner,
1975; Longton, Schuster, 1983).
Известно, что 446 видов цветковых растений способны образовывать почки
различного типа на листьях (Haccius, Hausner, 1975). У части видов эти почки
являются выводковыми (Схема 1). Листовые выводковые почки возникают из
клеток листа, обычно в районе жилок и развиваются как до отделения его от
стебля, так и после. Во многих случаях отделение листа является необходимым
условием для развития почки (Кернер, 1902; Sinnott, 1960). Выводковые почки на
листьях описаны для представителей различных семейств: Brassicaceae
(Cardamine silvatica, С. uliginosa, С. pratensis, Nasturtium officinale, Rorippa
palustris, Brassica oleraceae, Arabis pumila), Papaveraceae (Cheldonium majus),
Nymphaeaceae (Nymphaea guianensis), Gesneriaceae (Episcia bicolor, Chirita
scinensis), Pinguiculaceae (Pinguicula backeri), Araceae (Atherurus ternatus),
Liliaceae (Fritillaria, Ornithogalum, Allium, Cagea sinensis, Hyacinthus),
Amaryllidaceae (Curculigo), Crassulaceae (Rochea falcata, Echeveria),
Droseraceae (Drosera anglica) (Кернер, 1902; Goebel, 1908). Морфогенез
выводковых почек у указанных видов изучен фрагментарно.
Среди орхидных образование листовых выводковых почек отмечено
только у Hammarbya paludosa (Dickie, 1875; Кернер, 1902; Gustafsson, 1946;
Summerhayes, 1951; Taylor, 1967; Bragina et al., 1996; Batygina, Bragina,
1997). Выводковая почка у этого вида формируется экзогенно за счет
пролиферации клеток верхнего эпидермиса листа или прицветника. Выводковая
почка состоит из листа, охватывающего сплошным кольцом внутреннюю
часть пропагулы, несущую апекс побега с примордиями трех листьев.
Закладка адвентивного корня происходит после отделения выводковой почки
(Batygina, Bragina, 1997; см. Вивипария).
Ряд авторов относит к выводковым почкам придаточные почки, возникающие
по краям листьев у видов рода Kalancho'd (включая виды рода Bryophyllum)
(Левина, 1961; Васильев и др., 1978). Эти почки (пропагулы — Т.Б., Е.А.), находясь
на материнском растении, дают маленькие побеги с адвентивными корнями.
Пропагулы формируются на определенной стадии развития материнского листа из
заранее возникших в ходе его онтогенеза групп клеток (Berger, 1877; Yarbrough,
1932, 1934; Batygina, 1989, 1990). Эти группы клеток («dormant meristems»)
являются производными краевой меристемы листа и в течение длительного времени
сохраняют способность к дальнейшему развитию. В ходе своего онтогенеза пропа-
гула проходит стадии, сходные со стадиями развития соматического зародыша
(Batygina et al., 1996; см. Эмбриоидогения). Виды Kalanchoe различаются по
дифференциации и морфогенезу пропагул. Пропагула у К. laxiflora (= В.
crenatum) является неметаморфизированной почкой, у которой развиваются
адвентивные корни. Пропагула К. pinnata (= В. calycinum) представляет собой эм-
бриоид. УК. daigremontiana (= В. daigremontianum) пропагула является
переходной формой между неметаморфизированной почкой, у которой развиваются адвен-
Вегетативное размножение
317
тивные корни, и эмбриоидом. Пропагулы у многих видов Kalanchoe образуют
проростки, находясь еще на материнском растении (см. Вивипария).
Отмечен интересный случай появления почек (вероятно, выводковых) на
плодолистиках Crinum и Amaryllis (Кернер, 1902). При попадании в сырую землю из
них развивались новые растения.
Схема 1. Расположение выводковых почек на листе
ф - выводковая почка
Y/^ - нижняя сторона листовой пластинки
1 — по всей поверхности верхней стороны листовой пластинки (Drosera intermedia, D. rotundifolia,
Arabis pumila), 2 — вдоль главной жилки листовой пластинки (Hyacinthus pouzolsii), 3 — в
основании листовой пластинки (Pinellia tuberifera, Nymphaeae micrantha, N. guineensis, Cardamine
pratensis, C. mathioli), 4 — на черешке листа (Pinellia tuberifera), 5 — по краю листовой пластинки
(Kalanchoe daigremontiana, К. pinnata), 6 — по краю апикальной части листовой пластинки
(Hammarbya paludosa, Kalanchoe' tubiflora), 7 — на нижней стороне листовой пластинки на
небольшом удалении от края (Ceraptopteris thalictroides), 8 — на всей поверхности верхней и нижней
сторон листовой пластинки (Ornithogalum scilloides).
По: Брагина, ориг.
318
Системы репродукции
Образование стеблевых выводковых почек1 происходит на гипокотиле
(Anagallis phoenicea, Euphorbia peplus, E. helioscopia, Linaria vulgaris), в пазухах
листьев (Ranunculus ficaria, Dentaria, Lilium) или на соцветии (Allium, Poa,
Polygonum viviparum) (Схема 2). У Р. viviparum выводковые почки
(клубеньки) формируются в пазухе кроющих листьев соцветия. Главная масса выводковой
почки образована базальным междоузлием — гипоподием и частично за счет
утолщения оси верхних междоузлий. Терминальная почка клубенька, а за ней и
боковые пазушные почки начинают раскрываться, будучи еще на материнском
растении, образуя розетки из 2-3 зеленых листьев, достигающих иногда 10-12 мм
длины. В таком состоянии клубеньки опадают на землю и укореняются, образуя
новые растения (Серебряков, 1952; см. Вивипария).
Имеются данные по формированию выводковых почек (луковичек) в метелке у
вивипарной и полувивипарной форм Poa bulbosa (Пополина, 1960, 1962а, б; см.
Вивипария). Сформированная луковичка состоит из точки роста, окруженной
молодыми листьями, укороченного стебля (донца), примордиев адвентивных корней,
листоподобных образований (5-7 шт.), развивающихся вместо частей цветка, и
колосковых чешуи. В начале развития выводковой почки происходит формирование
Схема 2. Выводковые почки иа соцветии
• - выводковая почка
О - цветок
1 — выводковые почки в нижней части соцветия (Cagea arvensis), 2 — на всем протяжении
соцветия, чередуясь с цветками (Polygonum viviparum (a),Alliumsenescens,A. oleraceum (б)),
3 — соцветие несет только выводковые почки (Polygonum viviparum (a), Allium vineale (б),
Cagea liotardi (в)), 4 — выводковые почки на всем протяжении соцветия в пазухах
прицветников вместе с цветками (Lilium bilbiferum, L. tigrinum, L. lancifolium, Cagea
bulbifera, Sparaxis bulbifera, Dentaria bulbifera, Saxifraga bulbifera, S. cernua), 5 — выводковые
почки на всем протяжении соцветия в пазухах прицветников вместе с цветками и в пазухах
листьев (Dioscorea batatas, D. bulbifera, D. triphylla).
По: Брагина, ориг.
Выводковые почки папоротников имеют стеблевое происхождение, так как вайя представляет
собой филлокладий (Кернер, 1902). Среди 140 видов папоротников, способных к образованию
почек на вайях, имеются виды, у которых они возникают постоянно (Asplenium celtidifolium, A.
flagellifemm, A. bulbiferum, A. viviparum) (McVeigh, 1937). Формирование выводковых почек
происходит в разных частях вайи: на поверхности зеленых долек ваи (у вышеупомянутых видов), на
черешках отдельных лопастей ваи (Ceratopteris thalictroides), в развилке вайи (Gleichenia alpina)
или на верхушке вайи (A. cirrhatum, A. flagellifolium, A. rhachirhizon, A. edgeworthii).
Вегетативное размножение
319
примордиев колосковых чешуи, а затем наблюдается акропетальное заложение
примордиев листоподобных образованней. Колосковые чешуи и первая пара
листоподобных образований в период выбрасывания метелки выполняют
ассимиляционную и защитную функции. Вторая и третья пары листьев имеют пластинку,
выполняющую функцию ассимиляции, и влагалище, в тканях которого происходит
отложение запасных питательных веществ (крахмальные зерна и гемицеллюлоза). Во
влагалищной части листа значительно развита механическая ткань. В эпидермаль-
ных, субэпидермальных и паренхимных клетках влагалища происходит накопление
антоциана, служащего для защиты луковички в период покоя.
На оси выводковой луковички происходит образование адвентивных корней. В
процессе развития примордии корней проникают в паренхимную ткань чешуи и
остаются в ней до прорастания на ранней стадии дифференциации. Таким образом,
выводковая луковичка имеет все органы, необходимые для нормального развития
растения в начале его вегетации. Иногда в пазухе некоторых нижних чешуи в луковичке
образуется дочерняя почка, состоящая из 3-4 листьев (Пополина, 1960, 1962а).
Созревшая луковичка отделяется от материнского растения и, попав на землю, в
определенных условиях (низкая температура и достаточная влажность)
прорастает, давая самостоятельное растение. Первыми появляются корни, а затем листья.
Стеблевое происхождение имеют выводковые почки (гибернакулы) у
Sagittaria, Stratiotes и Hydrocharis. Осенью они отделяются от перегнивающих
материнских растений, перезимовывают в илу, а весной всплывают и дают новые
растения (Васильев и др., 1978).
Приведенные выше примеры свидетельствуют о полиморфизме выводковых
почек. Они представляют собой либо неметаморфизированную пазушную или
придаточную почку с адвентивным корнем, либо луковичку (см. Луковичка), либо
клубенек стеблевого или корневого происхождения (Васильев и др., 1978) (Схема
3). Выводковые почки также различаются по характеру взаимоотношения с мате-
Схема 3. Типы выводковых почек
1 — неметаморфизированная пазушная или придаточная почка с адвентивным корнем, 2 — выводковая
луковичка, 3 — клубенек стеблевого происхождения, 4 — клубенек корневого происхождения; ад к —
адвентивный корень, ось побега дана штриховкой, апекс побега — клеточкой.
По: Васильев и др., 1978.
Системы репродукции
ринским растением и по наличию у них периода покоя. Выводковые почки,
прорастающие на материнском растении, являются одной из структурных единиц при
живорождении (см. Вивипария).
Для определения пути морфогенеза (гемморизогенный или эмбриоидогенный),
по которому идет формирование выводковой почки, целесообразно сравнить ее с
«типичной» почкой и с соматическим зародышем (эмбриоидом). «Типичная»
почка является специализированной частью растения, которая развивается в новый
орган. Как известно, по положению почки бывают верхушечными
(терминальными) и боковыми (пазушными и адвентивными) (Esau, 1977; см. Почка).
Верхушечная почка главного побега по происхождению является почечкой
зародыша. За счет ее развития происходит неограниченный рост главного побега.
Верхушечной почкой заканчиваются также и боковые побеги, однако они не являются
непосредственными производными зародышевой почечки.
Пазушные почки регулярно возникают экзогенно, в виде меристематических
бугорков, в пазухах молодых листовых зачатков, близ верхушки материнского
побега. Меристема пазушной почки происходит в основном из апикальной
меристемы главного побега. Расположение пазушных почек точно соответствует
листорасположению (Esau, 1977).
Боковые почки, которые возникают из более или менее зрелых тканей вне связи
с апикальной меристемой, считаются адвентивными (придаточными) (Pristley,
Swingle, 1929; MacDaniels, 1953; Haccius, Lakshmaman, 1969; Haccius, Hausner,
1975). По своему происхождению они могут быть экзогенными или эндогенными
(Pristley, Swingle, 1929; Thompson, McLean, 1943-1944). Часто адвентивные
почки не имеют определенной правильности в расположении (Васильев и др., 1978).
Сходство между выводковой почкой и «типичной» почкой состоит в следующем:
в происхождении, положении на растении, строении (наличие апекса побега).
Различия между выводковой почкой и «типичной» почкой касаются
уровня организации (выводковая почка — индивидуум, а «типичная» почка
является частью организма; выводковая почка — биполярная структура, имеющая
апекс побега и корня; «типичная» почка является монополярной структурой,
имеющей только -апекс побега; формирование адвентивных корней у выводковой
почки детерминировано, а у «типичной» почки они образуются лишь в процессе
регенерации) и функции этих структур (выводковая почка обеспечивает
вегетативное размножение растения; «типичная» почка обычно служит для
обеспечения регулярного возобновления вегетативного тела растения и формирования
репродуктивных структур).
Известно, что морфогенез эмбриоидов, образующихся в естественных
условиях, очень различен (Batygina, Zakharova, 1997; Батыгина, 1999; Batygina, 1998;
см. Т. 2. Параллели в развитии полового и соматического зародышей).
Выводковая почка по происхождению, положению, строению и
функциям имеет большое сходство с эмбриоидом, развивающимся на
вегетативных органах.
Различия между выводковой почкой и эмбриоидом, развивающимся на
вегетативных органах касаются: путей морфогенеза (развитие выводковой почки
идет по пути гемморизогенеза и в нем отсутствуют стадии, характерные для эм-
бриоида — глобулярная, сердечковидная и торпедовидная) и времени
возникновения инициален адвентивных корней.
Вегетативное размножение
321
Вариабельный характер организации выводковых почек в значительной степени
объясняется экологией вида и различным заложением инициалей выводковых
почек (эндогенное или экзогенное).
Для растений, образующих выводковые почки, видовым (или родовым)
признаком является исключительно сильное омоложение, которое в гораздо меньшей
степени наблюдается и у пазушных побегов. Кроме того старение у таких растений
крайне замедленное. С этой точки зрения выводковые почки имеют что-то общее с
зародышами семян в ряде физиологических процессов (Кренке, 1950).
Вегетативное размножение посредством выводковых почек обеспечивает
растениям быстрое освоение локальных территорий. Выводковые почки успешно
разносятся, подобно семенам, различными агентами на большие расстояния (см.
Диаспора). Из выводковой почки образуется хорошо развитое растение, способное
сразу укорениться, что особенно важно в тех районах, где период благоприятный
для размножения короткий.
Способность многих растений образовывать выводковые почки широко
используется в сельском хозяйстве для получения нового омоложенного потомства
(Кернер, 1899,1902; Правдин, 1938; Кренке, 1950; Любарский, 1960; Шалыт, 1960;
Haccius, Hausner, 1975). Рис. 3.
Батыгина, 1999; Васильев и др., 1978; Жуковский, 1964; Кернер, 1899, 1902; Кренке, 1950;
Культиасов, 1953; Левина, 1961; Любарский, 1960; Пополина, 1960, 1962а, б; Правдин, 1938;
Серебряков, 1952; Шалыт, 1960; Batygina, 1989,1990,1998; Batygina, Bragina, 1997; Batygina et
al., 1996; Berge, 1877; Bragina et al., 1996; Buch, 1911; Champagnat, 1961; Dickie, 1875; Esau, 1977;
Goebel, 1908, 1912; Gustafsson, 1946; Haccius, Hausner, 1975; Haccius, Lakshmanan, 1969;
Longton, Schuster, 1983; MacDaniels, 1953; McVeigh, 1937; Pristley, Swingle, 1929; Schuster, 1969,
1984; Sinnott, 1960; Summerhayes, 1951; Taylor, 1967; Thompsom, 1943-44; Yarbrough, 1932,1934.
ЛУКОВИЦА (лат. экв. bulbus)— метаморфизированный побег (или его часть),
состоящий из укороченной оси — донца, на котором расположены запасающие
листовые органы (чешуи) и почки. В ткани донца формируются корни. Это
постоянный и многолетний орган, который служит для вегетативного
возобновления и размножения.
Луковица явилась результатом приспособления в ходе эволюции к
неблагоприятным условиям, связанным, главным образом, с жарким и сухим летом и холодной
зимой. Горные, пустынные и полупустынные регионы — основное местообитание
луковичных растений. Наличие запаса воды и питательных веществ в луковице
создает относительную независимость растения от различных факторов среды.
В мировой флоре насчитывается около 3000 видов луковичных растений,
относящихся к семействам однодольных — Liliaceae, Hyacinthaceae,
Melanthiaceae, Calochortaceae, Amaryllidaceae, Iridaceae, Alliaceae.
В зависимости от структуры монокарпического побега (однократно
плодоносящего) луковичного растения, луковица представляет собой либо укороченный
побег, либо его часть. У растений с розеточной структурой побега безлистный
цветонос-стрелка отмирает и в луковицу включается весь укороченный побег.
Луковицу растения с полурозеточной или безрозеточной структурой
монокарпического побега представляет лишь укороченная его часть, а олиственная цветоносная
часть побега отмирает после завершения вегетации.
322
Системы репродукции
Луковицы классифицируются по разным признакам.
По продолжительности возобновления луковицы могут быть ежегодно
возобновляющиеся (однолетние) или возобновляющиеся в течение нескольких лет
(многолетние). Первые представлены одним укороченным побегом (укороченной
частью побега), т.е. побегом одного года (Tulipa, Allium, Calochortus). Вторые —
состоят из нескольких (от 2 до 8) укороченных побегов (укороченных частей
побегов) разных лет. Такие многолетние луковицы представляют систему побегов
(Amaryllis, Lilium, Veltheimia).
Продолжительность возобновления многолетних луковиц определяется числом
укороченных побегов, ее слагающих. Луковица ежегодно нарастает изнутри за счет
формирования в почке возобновления нового укороченного побега (или его части),
а наружные чешуи и донце старого побега ежегодно отмирают. В результате число
укороченных побегов (или его частей), слагающих луковицу зрелого растения,
сохраняется постоянным.
Процесс отмирания чешуи и донца проходит, как правило, сопряженно. Но
нередко отмирание чешуи опережает отмирание донца. Оголенное донце приобретает
вид корневища и в течение рядале'Гможет функционировать, сохраняя живыми
корневую систему, пазушные ипридаточные (адвентивные) почки. В результате
формируется своеобразная биоморфа — «луковица на корневище», — где
луковица расположена на вершине корневища, представляющего донце побега прошлых
лет (Allium, Lloydia, Drimiopsis).
По способу нарастания луковицы подразделяются на моноподиальные и
симподиальные. У моноподиальных луковиц ежегодное нарастание
происходит за счет верхушечной (терминальной) почки, расположенной всегда на
донце и остающейся постоянно вегетативной. Цветоносные побеги формируются у
них из пазушных почек (Narcissus, Leucojum, Calanthus). У симподиальных
луковиц цветоносный побег развивается из верхушечной почки, а нарастание
идет за счет развития пазушной почки (Lilium, Erythronium, Fritillaria).
Многолетние луковицы, таким образом, представляют моноподиально или симподи-
ально сочлененную систему укороченных побегов (укороченных частей
побегов) разных лет (генераций).
По форме луковицы могут быть симметричные (равнобокие) и
асимметричные (скошенные). Их форму определяет направление роста оси укороченного
побега (Баранова, 1981). При ортотропном направлении роста формируются
равнобокие луковицы (Hyacinthus, Muscari, Eucomis), при плагиотропном или
косо-ортотропном — асимметричные (Tulipa, Erythronium, Cagea из подрода
Platyspermum).
Листовые органы луковицы метаморфизированы в чешуи. Луковичные чешуи
различаются по форме, морфологической природе» числу их в луковице,
продолжительности жизни и по функциям, которые они выполняют.
По форме луковичных чешуи луковицы подразделяются на черепитчатые, по-
лутуникатные и туникатные (Федоров и др., 1962). Черепитчатые луковицы
имеют узкие ланцетные чешуи, не соприкасающиеся краями друг с другом (Lilium,
Nomocharis, Schizobasis). Полутуникатные луковицы состоят из широких чешуи,
охватывающих луковицу на 1/2 или 2/3 и более ее окружности, но не сросшиеся
краями. У туникатных луковиц чешуи сросшиеся или краями, или друг с другом в
радиальном направлении (Tulipa, Brimeura, Erythronium).
Вегетативное размножение
323
Луковицы чаще сложены чешуями разной морфологической природы
(влагалища вегетирующих листьев, низовые листья, влагалищные и покровные чешуи).
Однако у некоторых растений луковицы составлены исключительно из
однотипных чешуи или из разросшихся влагалищ ассимилирующих листьев (Ornithogalum
caudatum, Albuca angolensis) или из специализированных запасающих низовых
листьев-чешуй (Lilium, Fritillaria, Nomocharis). В последнем случае
ассимилирующие листья у растений расположены на цветоносной части побега.
Ежегодно в почке возобновления в луковице формируется определенное число
будущих луковичных чешуи (от 1 до 25). Учитывая, что луковица в своем составе
имеет 1 -8 укороченных побегов (укороченных частей побегов) разных лет, общее
число чешуи в ней может достигать 150 и более. Число чешуи в луковице
определяет и ее размер. Наиболее крупные достигают 20-30 см в диаметре и весят до 3 кг
(Urginea maritima, Bowiea volubilis, Lilium kesselringianum), а самые мелкие (од-
ночешуйные) не превышают 0.8 см в диаметре (Litanthus, Cagea). Однако не
всегда эта зависимость прямая.
Луковичные чешуи несут функцию запасания и защиты. Основную
запасающую функцию выполняют или разросшиеся влагалища ассимилирующих листьев,
или специализированные запасающие листья, у которых зеленые пластинки
частично или полностью редуцированы.
Функцию защиты выполняют покровные и влагалищные чешуи луковицы.
Специализированные покровные чешуи луковиц у луковичных растений редки
(Tulipa, Notholirion). Их роль обычно выполняют засохшие наружные чешуи.
Влагалищные чешуи тонкие, пленчатые, окружают молодые листья, защищая их в
начале роста от повреждений. Они никогда не становятся запасающими и, выполнив
свою защитную функцию, засыхают.
В луковице наряду с почкой возобновления в пазухах чешуи закладываются
пазушные почки, из которых формируются луковички-детки — органы
вегетативного размножения. Ряд растений закладывают почки в пазухах верхних чешуи
луковицы вблизи почки возобновления. Их развитие и рост проходит
одновременно и в результате формируются 2-3 луковицы одинакового размера, связанные
единым донцем. Подобное ветвление луковиц характерно для Zigadenus, Ledebouria,
Barnardia, для ряда сортов Hyacinthus. Такие «парные луковицы» широко
распространены среди видов Allium. Большинство растений формируют почки в пазухах
нижних (наружных) чешуи луковицы. В пазухе одной чешуи иногда закладывается
до 10 и более почек. Расположены они коллатерально. Сформированные из них
луковички-детки вскоре отделяются от материнской луковицы и продолжают
самостоятельный рост и развитие (Ornithogalum umbellatum, Notholirion
thomsonianum, Chionodoxa luciliae). Нередко луковицы-детки формируются на
столонах, которые выносят их за пределы материнской луковицы.
На чешуях луковиц и листьях у некоторых растений развиваются адвентивные
(придаточные) почки (Fritillaria, Erythronium, Brimeura). Они формируются из
вторичной боковой или раневой меристемы. Жизнеспособность этих почек низка и
вскоре после заложения они отмирают. Однако в культуре in vitro они могут быть
использованы для микроклонального размножения.
Одним из важных вопросов биологии является установление
продолжительности жизни луковицы и самого луковичного растения. Как уже отмечалось,
луковица регулярно возобновляется за период от 1 года до 6-8- лет в зависимости от вида.
ал л
нл
Рис. 21. Луковица.
1-9 — розеточный (1-3), полурозеточный (4-6) и безрозеточный (7-9) типы побега луковичного
растения: 1,4,7 — общий вид; 2,5,8 — строение однолетней луковицы (ежегодно возобновляется),
3, 6, 9 — строение многолетней луковицы; ал л — ассимилирующие листья укороченного побега,
дни, — осевая часть укороченного побега (донце луковицы), нл — низовые запасающие листья
(чешуи), о ив — остатки цветоносных частей побегов, п — почка возобновления, cm — стрелка, цв —
цветоносная часть побега;
10
и
Рис. 21 (продолжение).
10-12 — луковицы на корневище Drimiopsis maculata (10), Zigadenus elegans (11), Thulbaghia violacea
(12); 13 — симметричная (равнобокая) луковица Scilla autumnalis; 14-17 — асимметричные
луковицы Lilium regale (14), L. washingtonianum (15), Tulipa fosteriana (16), Erythronium sibiricum (17);
Вегетативное размножение
327
Однако нельзя отождествлять период, за который луковица полностью
возобновляется с общей продолжительностью жизни луковичного растения. Процесс
возобновления луковицы может повторяться десятки раз в течение жизни растения.
Это свидетельствует о том, что продолжительность жизни луковичного растения
может составлять десятки лет. Известны, например, 50-летние особи Lilium
martagon и Stilla sibirica, 45-летние — Tulipa borszowii, 30-летние — Muscari
neglectum и Cagea lutea (Заливский, 1955; Бочанцева, 1956; Hellwig, 1957;
Головкин, 1973). По-видимому, и это не предел продолжительности жизни этих
растений. С другой стороны, известны луковичные растения (Lilium pumilum, L.
buschianum, L. callosum), у которых процесс старения (ослабление роста и
цветения, сокращение размеров органов, снижение интенсивности размножения)
проявляется уже на четвертый — пятый год жизни. Такие растения вскоре погибают.
Строение луковицы стабильно для вида и используется в качестве
диагностического признака. Наряду с этим, строение луковицы может характеризовать
достаточно крупные таксономические группы — роды, подроды, секции и др. (Fritillaria,
Cagea, Ornithogalium, Allium и др.).
Для большинства луковичных растений характерна высокая способность к
регенерации почти всех вегетативных органов: чешуи, листьев, цветоносных
побегов. Эта особенность луковичных растений широко используется в цветоводстве.
Рис. 21.
Баранова, 1981, 1995; Бочанцева, 1956, 1962; Головкин, 1973; Заливский, 1955; Серебряков,
1962; Федоров и др., 1962; Hellwig, 1957.
ЛУКОВИЧКА (лат. экв. bulbillus) — сильно метаморфизированная почка,
состоящая из запасающих низовых листьев, зачатков зеленых листьев и придаточных
корней. Это специализированный орган вегетативного размножения.
Луковички формируются на надземной (надземные луковички) и подземной
(луковички-детки) частях растения. Надземные луковички образуются из почек,
расположенных в пазухах зеленых листьев надземного побега (Lilium lancifolium,
L. bulbiferum, Gagea lutea, Calochortus luteus, Nomocharis mairei, Tulipa praestans,
T.kaufmanniana), или формируются в зоне соцветия при нарушении развития
цветков (Allium caesium, Cagea minima, Lilium regale, L. bulbuferum). Надземные
луковички образуются и из адвентивных почек. Почки формируются из вторичных
боковых или раневых меристем на стеблях и листьях (Brimeura amethystina, Scilla
ledieni, Fritillaria latifolia).
Надземные луковички окрашены в зеленый, бурый или буровато-черный цвет и
состоят из 2-5 низовых запасающих листьев и зачатков зеленых листьев и корней.
Размер луковичек составляет от 0,5 до 1,5 см в диаметре. У одних растений они
начинают прорастать непосредственно на материнском растении сразу после
формирования, без периода покоя — Tulipa subpraestans (Данилова, Силина, 1962), ряд
сортов Lilium (Баранова, 1973). У большинства растений луковички пребывают в
состоянии покоя до весны следующего года.
Луковички, сформированные на подземной части растения —
луковички-детки, — развиваются из почек, расположенных в пазухах луковичных чешуи
(Ornithogalum umbellatum, Tulipa kaufmanniana, T. bifloriformis, Muscari
Рис. 22. Луковичка.
1-3 — луковички на подземной части цветоносного побега у Lilium pseudotigrinum (1), в пазухах
листьев у L. lancifolium (2), в области соцветия у L. regale (3); 4-5 - луковички-детки на столонах
луковицы Brimeura amethystine. (4) и L. canadense (5).
По: Баранова, ориг.
Вегетативное размножение
329
armeniacum) или в подземной части надземного побега, в пазухах чешуевидных
листьев (Lilium willmottiae, Nomocharis saluenensis).
В пазухах луковичных чешуи у разных видов растений закладывается от 1 до 20
почек, из которых формируются луковички-детки. Расположены они коллатераль-
но. По мере отмирания чешуи луковички-детки оказываются на периферии
материнской луковицы, отделяются от нее и начинают самостоятельную жизнь
(Chionodoxa luciliae, Galtonia candicans, Allium subhirsutum). У некоторых видов
детки формируются на столонах, которые выносят их за пределы материнской
луковицы (ювенильные особи Tulipa praestans, Allium oreophilum, Notholirion
thomsonianum, Muscari aucheri, Fritillaria uva-vulpis и др.)- Вскоре столоны
засыхают, а детки продолжают рост и развитие. Таким путем осуществляется
вегетативная подвижность вида. Известны виды, у которых столоны прирастают к чешуе
луковицы (Ornithogalum caudatum). В этом случае луковичка-детка сохраняет связь
с материнским растением до полного отмирания луковичной чешуи.
Формирование луковичек-деток в подземной части надземного побега присуще
видам лишь двух родов — Lilium (L. regale, L. willmottiae, L. lancongense, L.
pensylvanicum) и Nomocharis (N. saluenense). У этих растений в подземной части
надземного побега развиваются придаточные корни, и здесь, в зоне корней, на
узлах побега из пазушных почек формируются луковички-детки.
Луковички-детки развиваются также из адвентивных почек на чешуях луковиц
Fritillaria meleagris, Brimeura amethystina, Hyacinthoides hispanica, Erythronium
sibiricum. Жизнеспособность этих почек достаточно низкая, и они часто отмирают
прежде, чем завершится формирование деток.
Луковички-детки обычно крупнее надземных луковичек. Они состоят из 3-6
(8) низовых запасающих листьев и зачатков зеленых листьев и корней. Детки
обычно белые или по окраске соответствуют чешуям материнской луковицы.
Прорастают детки после отделения от материнского растения и прохождения
периода покоя, который может продолжаться в течение нескольких лет (Gagea).
Однако известны примеры (Notholirion thomsonianum, Cardiocrinum)
прорастания деток непосредственно на материнском растении в луковице, сразу после их
формирования. Рис 22.
Баранова, 1973; Данилова, Силина, 1962.
ПРОТОКОРМ (греч. protos — первичный, первый, cormos — ствол, побег,
клубенек) — клубневидный проросток у орхидных и некоторых птеридофитов.
Синонимы: эмбриональный клубенек, проросток.
Термин «протокорм» был введен Treub (1890) вместо используемого ранее
термина «эмбриональный клубенек» (фр. «tubercule embryonaire») для описания
структуры клубневидной формы, с волосками на нижней стороне, формирующейся
при прорастании зародыша плауна (Схема). Автор не распространял его на
структуру, образующуюся при прорастании семян орхидных. Данный термин впервые
использован для обозначения проростка орхидных Balfour (1905 — цит. по The
Oxford English Die, 1989, V. 12).
Вероятно, в начале 20 века термин «протокорм» еще не получил широкого
применения при описании развития орхидных. Так, даже в работах выдающегося
французского ботаника Bernard за 1909 г. он еще не используется, а встречается термин «про-
Схема. Формирование проростка у Lycopodium cernuum
1 — зародыш, формирующийся в заростке на ранней стадии развития (схемат.), пунктиром
отмечена граница, разделяющая его верхнюю (из которой впоследствии разовьется семядоля и
эмбриональный клубенек — протокорм) и нижнюю (из которой образуется нога при
формировании проростка, остающаяся в заростке) части; 2,3 — проростки на стадии появления из
заростка, происходит дифференциация семядоли и эмбрионального клубенька, несущего волоски
(схемат.); 4-6 — проростки на стадии формирования листьев; 7 — проросток на стадии появления
первого корня; 8 — проросток с формирующимся на первом корне клубеньком (прк — 9); а —
архегоний, а — зародыш, к — корень, л, — лй— первый и последующие листья; н ч с — нижняя
часть стебля (нога), о ч — остатки чехлика, пр — протокорм, с — суспензор, сд — семядоля.
1 _ 3 - по: Treub, 1890 (с измен.), 4 - 9 - по: Treub, 1890.
Вегетативное размножение
331
росток» (фр. «la plantule»). Однако уже в 1916 году Bernard посвящает одну из глав
специально теории «протокорма» по Treub и указывает на правомерность
использования данного термина и в случае орхидей. Тем не менее, он подчеркивает, что
сходство в строении спорофита плаунов и проростка орхидей связано с явлением мико-
трофии, но появление такой структуры как протокорм в онтогенезе данных растений
является примером конвергенции, а не общности происхождения этих растений.
Более того, наличие протокорма у орхидей не следует рассматривать как доказательство
их древнего происхождения (Bernard, 1932).
Кроме обозначения проростка у орхидных и плаунов, термин «протокорм»
используется и в более широком смысле. Так, Jacques-Felix (1958, 1982) называет
протокормом собственно тело зародыша у всех покрытосемянных растений.
В настоящее время термин «протокорм» нашел широкое применение при
описании ранних этапов послесеменного развития орхидей (Veyret, 1965,1974;
Cribb, 1999). Согласно мнению большинства современных исследователей
протокорм орхидей — это проросток (Veyret, 1965, 1974; Батыгина,
Васильева, 1980,1983; Батыгина, Шевцова, 1985; Батыгина, Андронова, 1988,
Batygina, Andronova, 1991; Вахрамеева и др., 1991; Виноградова, Филин, 1993;
Куликов, 1995; Виноградова, 1996, 1999; Татаренко, 1996; Баталов, 1998).
Однако в современной литературе можно встретить и другое толкование
структуры, формирующейся при прорастания семян орхидей. Например, некоторые
исследователи называют ее зародышем (Терехин, 1977; МбНег, 1987 а,с,
1989). Таким образом, в настоящее время вопрос о том, что такое протокорм у
орхидных — проросток или зародыш — остается дискуссионным.
Противоречивыми также являются точки зрения о морфогенетической природе органов
протокорма и их интерпретация. Границы стадии протокорма в жизненном цикле
определяют по-разному (Вахрамеева и др., 1991; Виноградова, 1996,1999;
Татаренко, 1996; Баталов, 1998). Отсутствие единого мнения о емкости понятия
«протокорм» можно объяснить не только своеобразием строения протокорма,
но и трудностями в определении возрастных фаз орхидных — «проросток»,
«ювенильное растение» и т.д.
Как известно, эмбриогенез у большинства исследованных видов сем.
Orchidaceae заканчивается образованием недифференцированного на органы
зародыша. Прорастание зародыша протекает в несколько этапов. На первом
— зародыш набухает и.его объем существенно увеличивается. Семенная
кожура разрывается и из нее появляется протокорм. Форма протокорма орхидных
таксоноспецифична: обратнояйцевидная, овальная, удлиненная, дисковидная,
разветвленная, шиповатая, шаровидная, веретеновидная (Veyret, 1965, 1974;
Батыгина, Шевцова, 1985; Clements, 1995, цит. по Cribb, 1999; Виноградова,
1999). Обычно на ранней стадии развития протокорм у всех изученных видов
орхидей обладает радиальной симметрией (см. Эмбриогенез орхидных, Т. 2).
По мере формирования органов побега, он может сохранять симметричное
строение (Bletilla, Dactylorhiza) или же становиться асимметричным (Calypso
bulbosa). У некоторых видов протокорм приобретает дорзовентральное
строение (Phalaenopsis).
Апикальная часть протокорма, состоящая из мелких клеток, представляет собой
апекс побега. Базальная часть протокорма, функционирующая как «запасающий
орган», состоит из крупных паренхимных клеток.
332
Системы репродукции
На апикальном полюсе протокорма происходит дифференциация апекса побега
с образованием примордиев листьев. Обычно примордий листа на ранней стадии
развития имеет вид замкнутого (у Listera ovata) или незамкнутого (у Dactylorhiza
baltica) валика (Batygina, Andronova, 1991). По мере роста примордия у данных
видов происходит постепенное смещение отверстия, ограниченного краями валика,
в боковую позицию. Примордий приобретает форму конуса. В ряде случаев края
отверстия полностью смыкаются.
Трактовка первого листового органа у орхидных различна. Его называют или
семядолей (Burgeff, 1936; Терехин, 1977), или настоящим листом (Батыгина,
Васильева, 1983). По мнению Терехина и Никитичевой (1968), не только
первый, но и второй аппендикулярные органы, формирующиеся на протокорме
Thunia, являются семядолями.
До настоящего времени сам термин «семядоля» остается дискуссионным.
Большинство исследователей считают семядоли модифицированными листьями, которые
закладываются на эмбриональной стадии развития спорофита цветковых растений
(см. Батыгина, 1987). В связи с тем, что листовые органы у большинства
представителей орхидных появляются в постсеменном развитии, на стадии протокорма, их
нецелесообразно называть семядолей (семядолями) или листоподобными органами
(Батыгина, Андронова, 1988; Batygina, Andronova, 1991). Они представляют собой
настоящие листья проростка, а сам зародыш является бессемядольным.
У некоторых видов орхидных в апикальной части зародыша (на продольном
срезе) можно видеть «бугорок», получивший название семядоля» (Arundina
graminifolia - Rao, 1967; Nishimura 1991; Bktilla striata — Bernard, 1909;
Tohda, 1968; Nishimura, 1991; Dendrochilum glumaceum — Beer, 1863, цит. по
Nishimura, 1991; Epidendrum vitellinum, Polystachya microbambusa — Veyret,
1965,1974; Sobralia macrantha — Treub, 1879; Nishimura, 1991; Thunia alba —
Терехин, Никитичева, 1968; Терехин, 1977,1991,1997; Nishimura, 1991).
Развитие зародыша изучено детально лишь у некоторых из так называемых
«семядольных» видов. Недавно проведенное переисследование (с помощью
сканирующего электронного микроскопа) зародыша и протокорма у двух из них —
Bletilla striata (Batygina et al., 1994),Thunia alba (Andronova, Batygina, 1992)
показало, что в апикальной части зародыша формируется совершенно
различная по строению и природе структура, которая имела в литературе одно и тоже
название —«семядоля». Так, у Bletilla striata в апикальной части зародыша
образуется аппендикулярный орган в виде серповидного валика. Зародыш же
Thunia alba не имеет зачатка данного органа. При прорастании зародыша в
апикальной части протокорма формируется «бугорок», состоящий из
нескольких клеток. Данную структуру можно обнаружить только на ранней стадии
развития протокорма, в процессе делений клеток апикального домена она
постепенно исчезает. Формирование листового органа у Thunia alba происходит на
стадии протокорма и, так же как у бессемядольных видов — валиком
(Батыгина, Андронова, 1988; Batygina, Andronova, 1991; Andronova, Batygina, 1992;
Андронова 1997). Появление «бугорка» в осевой части прорастающего
зародыша Thunia, по-видимому, обусловлено особенностями ростовых процессов и
законами цитомеханики. Изучение архитектоники поверхностного слоя и
внутренних тканей зародыша зрелого семени выявило наличие крупных,
пирамидальной формы клеток в осевой зоне апикальной части зародыша, сохраняющих
Вегетативное размножение
333
свою форму и размеры при прорастании. Эти клетки вступают в митотический
цикл позже, чем другие клетки в апикальной и средней частях зародыша.
Из вышесказанного можно заключить, что сама по себе форма зародышей на
продольных срезах не может быть достоверным критерием при решении вопроса,
имеется ли у него семядоля, т.е. зачаток листоподобного органа, или нет. Данные по
развитию зародыша и проростка у Thunia alba отрицают наличие у него
аппендикулярного органа. Поэтому данный вид, вероятно, следует исключить из списка
«семядольных».
Зародыши и проростки Bletilla striata и Sobralia macrantha также можно
отнести к «бессемядольным», поскольку их аппендикулярные органы не являются
модифицированными (см. Акотилия, Т.2).
Меристема зародышевого корня в базальной части протокормов не
формируется. Корни у орхидных появляются после дифференциации органов побега и имеют
адвентивную природу (Veyret, 1965, 1974; St-Arnaud et al., 1992; Barabe et al.,
1993; Андронова, 1997; Andronova, 1997).
Рост проростка, заложение и развитие органов побега осуществляется за счет
питательных веществ, накапливающихся в базальном органе протокорма (Ricardo,
Alvarez, 1971; Raghavan, 1976; Batygina, Vasilyeva, 1983). Обычно данный орган
функционирует до того момента, пока на протокорме не появятся адвентивные
корни. Продолжительность его жизни варьирует у разных видов, а также в пределах
одного вида. Данные, полученные с применением метода культуры in vitro,
свидетельствуют о том, что «запасающий орган» протокорма дегенерирует сразу после
формирования первого корня (Angraecum maculatum — Veyret, 1965;
Dactylorhiza maculata — Batygina, Vasilyeva, 1983). В случае D. baltica у
некоторых протокормов базальная часть отмирает сразу после появления первого корня, у
других она сохраняется намного дольше, и ее можно наблюдать даже на стадии
проростка с несколькими развитыми корнями (Андронова, 1997).
Существуют две точки зрения относительно морфогенетической природы ба-
зального органа протокорма орхидных. Согласно мнению одних исследователей, он
представляет собой гипокотиль (Nishimura, 1991; Терехин, 1997; Clements, 1995,
цит. по Cribb, 1999). По версии других, базальный орган зародыша и протокорма
орхидей имеет корневую сущность, на которую указывает наличие эпидермальных
волосков (Bernard, 1909; Veyret, 1965, 1974).
У зародыша цветковых растений границу раздела между гипокотилем и корнем
определить сложно. У проростка она легко выявляется по наличию эпидермальных
волосков, которые обычно присущи корню, и, как правило, отсутствуют на гипоко-
тиле. Это связано с различиями в дифференциации покровной ткани (эпидермиса)
двух различных, характерных для большинства изученных цветковых растений,
органов проростка (Duckett et al., 1994). В отличие от них, при формировании
протокорма орхидей, эпидермис практически во всех районах его тела (за исключением
апекса побега) приобретает способность формировать эпидермальные волоски.
Таким образом, базальная и средняя части тела протокорма орхидных покрыты
волосками и представляют собой единый орган как по внешнему, так и по
внутреннему строению (паренхимная ткань).
Тип волосков, образующихся на протокорме и корне, одинаков: однорядный
(Coeloglossum, Dactylorhiza, Gymnadenia, Orchis), либо многорядный (Bletilla,
Dendrobium phalaenopsis, Phalaenopsis, Thunia).
334
Системы репродукции
У взрослых растений сем. Orchidaceae трихомы можно обнаружить не
только на корнях, но и на других органах, которые, в той или иной мере,
участвуют в образовании микоризы корнестеблевом тубероиде, на подземной части
побега ниже узла листа (Pridgeon, 1994). Таким образом, трихомы у
орхидных не могут служить признаком, указывающим на корневую природу органа,
как это считали некоторые авторы (Bernard, 1969; Veyret, 1965, 1974).
По-видимому,базальный орган зародыша и протокорма орхидей по своей
природе не является корнем, а гомологичен гипокотилю зародыша и
проростка у других цветковых растений (Терехин, 1977; Clements, 1995, цит. по
Cribb, 1999).
Воспроизведение и размножение у орхидных, как в естественных условиях, так
и в культуре in vitro, независимо от типа структуры (генеративная или
вегетативная) и способа воспроизведения (половой или бесполый), связано с
формированием протокормов и протокормоподобных структур (Шевцова и др. 1986; Батыгина,
1987). Авторы рассматривают появление стадии протокорма в онтогенезе
орхидных как необходимый этап при переходе от полового к бесполому способу
репродукции, характерный для такой высокоспециализированной группы цветковых
растений. Вегетативное размножение орхидных в асимбиотической культуре
может осуществляться либо в форме «почкования» протокормов, либо путем
закладки нескольких точек роста на одном протокорме, что можно рассматривать как
один из резервов системы репродукции у орхидных (Батыгина, Васильева, 1980;
Batygina, Vasilyeva, 1983; Батыгина, Шевцова, 1985).
Андронова, 1997; Баталов, 1998; Батыгина, 1987; Батыгина, Андронова, 1988; Батыгина,
Васильева, 1980; 1983; Батыгина, Шевцова, 1985; Вахрамеева, и др.,1991; Виноградова, 1996,
1999; Виноградова, Филин, 1993; Куликов, 1995; Татаренко, 1996; Терехнн, 1977; 1991, 1997;
Терехин, Никитичева, 1968; Титова, 1997; Шевцова, Батыгина, Лаврентьева, 1986; Andronova,
1997; Andronova, Batygina, 1992; Barabe et al., 1993; Batygina, Vasilyeva, 1983; Batygina,
Andronova, 1991; Batygina et al., 1994; Bernard, 1909; 1932; Burgeff, 1936; Cribb, 1999; Duckett et
al., 1994; Jacques-Felix, 1958; 1982; Мц11ег; 1987 a,c; 1989; Nishimura, 1991; Pridgeon, 1994;
Raghavan, 1976; Rao, 1967; Ricardo, Alvarez, 1971; St-Arnaud et al., 1992; Tohda, 1968; Treub,
1879,1890; Veyret, 1965,1974.
ЭМБРИОИДОГЕНИЯ - НОВЫЙ ТИП ВЕГЕТАТИВНОГО РАЗМНОЖЕНИЯ
Впервые понятие «эмбриоидогения» в качестве новой категории
вегетативного размножения было предложено нами; рассмотрена также роль этого явления в
системе репродукции цветковых растений (Batygina, 1987,1989a,b; 1990, 1991,
1992, 1996; Батыгина, 1993а, б, 1994) (Табл., Схема 1).
Эмбриоидогения (греч. embryon — зародыш; oidos — вид; genus —
происхождение) — один из двух типов гомофазной репродукции цветковых растений in
situ, in vivo и in vitro, элементарной структурной единицей которой является эм-
бриоид. Эмбриоид — зачаток индивидуума, образующийся асексуально in situ, in
vivo и in vitro. Синонимы: соматический зародыш, зародышеподобная структура,
адвентивный зародыш.
Тенденция к образованию соматических зародышей имеется на всех этапах
онтогенеза цветковых растений, начиная с зиготы. Эмбриоиды могут возникать в ес-
ж
<
X
CQ
S
I
CQ
ч
8.
"К
О
X
-£,
и
и
и
а ai
Ё 5
о?
S
X
е
о
S
а
О
И
и
i
J
I
о
о
4
*
ш
Ш
Е
Е а
«Я J?
■С -°
и*
в
еа
CQ
й!
^и
N
»Я
X
X
е
о
r«J
S
а
О
S
DC
£
X
ы
с_
о
S
а
ю
СП
§ S 2
X й; в-
'3 ^5
J
I
1
X
X
е
о
S
а
и
S
Оа
Схема 1.
Пути морфогенеза при образовании нового растительного организма
ТОТИПОТЕНТНАЯ КЛЕТКА
Эмбриогенез Эмбриоидогенез
Органогенез Гистогенез
гемморизогенез геммогенез ризогенез
РАСТЕНИЕ
половой зародыш w эмбриоид
1 — эмбриогенез, 2 — эмбриоидогенез, 3 — гемморизогенез.
Вегетативное размножение
337
тественных условиях на разных структурах и органах растений. Явление эмбриои-
догении наблюдается у растений, произрастающих в разных экологических зонах.
Основным тезисом концепции об эмбриоидогении является
универсальность морфогенеза эмбриоидов и половых зародышей, образующихся в
естественных условиях и в экспериментальных — в культуре in vitro (Batygina,
1996, 1998; Батыгина, Захарова, 1997; Batygina, Zakharova, 1997).
При выделении эмбриоидогении в особый тип репродукции и размножения
нами были использованы два критерия: онтогенетический (гомофазная
репродукция, не сопровождающаяся ни мейозом, ни процессом слияния гамет, т.е.
бесполый способ образования нового поколения (унипарентальное наследование) и
морфологический (биполярная организация структуры с апексами побега и корня и
новой полярной осью). В то время как при эмбриогении (гетерофазная
репродукция) образование новой особи происходит благодаря половому процессу, т.е. мейо-
зу и слиянию гамет (бипарентальное наследование).
Эмбриоид формируется экзогенно или эндогенно, обычно из одной
соматической клетки, реже из эмбрионального клеточного комплекса.
Для эмбриоида характерно образование собственной новой оси (по
отношению к материнскому организму), соединяющей полярно формирующиеся апексы
побега и корня. Как правило, он не имеет общей васкулярной системы с
материнским организмом (закрытый радикулярный полюс). Генезис эмбриоида, так же,
как его форма и размеры, таксоноспецифичны. Эмбриоиду присущи основные
признаки, которые установлены для половых зародышей (полярность,
клеточная и гистогенная дифференциация, автономность и др.). При прорастании
эмбриоида сразу же «рождается» новая особь (Batygina, 1989a,b; Батыгина, 1987,
1993), причем у некоторых видов отмечена кратковременная связь с материнским
организмом. Продолжительность контакта и стадия развития эмбриоида, на
которой этот контакт осуществляется, различны у разных видов растений.
Формы эмбриоидогении. В зависимости от происхождения и положения
соматических зародышей на материнском растении можно выделить две основные
формы эмбриоидогении: репродуктивную (флоральную) и вегетативную
(Схема 2).
Репродуктивная (флоральная) эмбриоидогения — образование
эмбриоидов в цветке и в семени. Она включает, в свою очередь, эмбриональную1 (моно-
зиготическую кливажную) — на базе зиготы или зародыша, и овулярную (интегу-
ментальную и нуцеллярную) — из клеток интегумента и нуцеллуса семязачатка.
Монозиготическая кливажная эмбриоидогения была обнаружена, например,
у представителей сем. Orchidaceae (Eulophia epidendrae — Swamy, 1943). В одном
зародышевом мешке могут образоваться несколько эмбриоидов, формирующихся
либо из зиготы, либо из соматических клеток полового зародыша (суспензора или
собственно зародыша) (Схема 3).
Кливажная эмбриоидогения встречается также у Loranthus (Loranthaceae),
Erythronium, Tulipa (Liliaceae), Limnocharis (Orchidaceae) (Ernst, 1918), Lobelia
(Lobeliaceae) (Crete, 1938), Papaveraceae (Ильина, 1968), Poaceae (Erdelska,
1996) и многих других видов цветковых. Это явление присуще как цветковым рас-
Введение понятий «эмбриональная» и «овулярная» позволяет сразу же определить не только
происхождение эмбриоидов (из соматических клеток зародыша или семязачатка), но и этапы
онтогенеза, на которых они образуются.
Эмбриогениый и эмбриоидогенный типы репродукции цветковых растений. Половой
и бесполый способы образования зародыша
Схема 2.
фолиарная
каули генная
ризогенная
ЭМБРИОГЕНИЯ
Q^ ^ Эмбриоиды различных поколений однодольных и двудольных
растений
Семя с половым зародышем и эмбриоидами различных
поколений
Стадии развития гаметофита
Клон материнского ^^ Новый дочерний ( ^ Клон дочернего
растения ^g? спорофит Ч^ растения
I!
ел
о>
3
У
от
со
$
3
Со
ОО
03
Ю
ОО
то g
х ~
я
>
а
ь °
с -а
то а
а
За я ><
s "< -,
р IP <
За
£•§:■§ 9
s о о
а > й
в я о
ТО о *Э
- Ч о
О Я
а
4 2
КС К> О
Я О
s > a
ге 2 я
с j s
5 я к
° к
s 2.-
2
S
о
о>
Е s
ТО О
я >
О о
^ Ья
0 о
а яс а
то ^<
Е ю IP
я > г
о> m >
1 g Ю
о> ю
™ "Я
•о »
ТО — л
я 5 ^
S о> то
о -о -м
Я 0>
о к
St Я
«. к
5 >
ТО i
5 Э
s о
>
J=> К
ТО CU
„So
то - Е о я
го 0> Ox я
о /-V-■ -о а
о я ч^ю
2_3а то ш ™
-—. о а оз w
о >■ в "о о>
о1 в> о "о
а > > О
СГ СГ СГ >
Sc g
а
о
- .. а
■i ч »
я о> ъ
о >
Sc S
„ а
5 х
S "о
• Я я
S 1"
л
ю
то
Я
~ S
то то
1*1
<< то
Ю За
то то
I о> £
2 w
s 3 »
КОЯ
к -о 3
iS " s
а ю»
к -о
кс о
За
Я
о
К 5
ТО "о
ш >
ТО
g> S
"" S к
ИЕ "S
1 К и
о\^ а
•о Сл а
о> -о
ш
■о - в
> -о "о
сг £ в>
с Q •"
a S
ге s;
> то
а п
а а
За
К
о о
а
о
2 в
8-8
° I1
3
. то
Е>
L>
^ ТО
га -3
S О
— S
•• о>
к
• л
-. то
о Л ю 5 и
о й о ^-~ >
И
ГГ о
^ о
■ -3
я
§•?
и
2 "о
5 к
а >
Q то
с» Я
За »
а ч
s a
х "О
g о
X
г
о
к
о
в>
За v-
X
ю ^.
о> Е "о S
g g » s ш S 5
•о ™ ш 5 - -
S ш S о о
§ | | ? И«
то > К ^
н о J> g
V И- Ч/ Я П 0> S
КС КС КС 0> Оч/2
Е
к
"• ■>
м»
1 01
а »
S о
о> х>
ю * а
ш а
о го
и я
х >
К то
Я -3
о> о
я
о
>
то
>
о
-3
ю
к _
то о
■•о lE
о то
л "а
я Е
Е то
- — К
01 01 W
" a я
то ч
■ a a о
^. > -о -о
ТО 01 О*
to a и а
к о *
О
В
s
0>
в
о
Х>
3
S
а>
г
а.
тэ
к
о
S
Ja
о
Я
S
я
V!
О
"D
X
К
>
Я
я
S
V
О
1
с
о
и
а
О,
а
S
1)
г
1)
и
и
S
S
аг
■а
&
о
а
в
а
г
г
я
а
U
о
а
в
1)
S
S
1)
В"
S
2
а
05
S
О
а
С
а
е
о
о
"3 Я
я g
i °-
1 я
(N1 «
у S
■ворени
полово
с- к
о в
О 3
О х
1 w
1 U
-^ S
5 ев
? 3
Й а.
а ff
с я
^S
с о
я й
Е- О
Я) <0
щ Я
со о
©• о
О V
Я- я
Б1
^^ 2
я 3
s а
et <о
я О
& 1
SS.<N
ОЧН1
9-1
(- •-
гно-кле
идермы
я
а
3
о
О.
я
я
о
о
О
я
О
Я
Я
Я
со
н
О
о
3
X
я
а
i
а
3
о
а
я
я
S
я
й
о
4)
а*
rs
5
s
о
о
S
я
я
et
О
о
1
4)
О
1)
О
3
а
я
1
S С (N
яг я>
О 4>
И S
1) я
Я! Я
ГОТЫ ДО
образов
S ,
я 1
СО я"
§ а
я 3
з ■*
о о
о, а
я я
я я
Р о
S °
и х
О f-i
я Я1
о й
Я »
Я 4)
1 £
Р я
- разви
— разв
00 ■>■
х-н
..
»я
1)
a
3
о
Q.
Я
Я
X
я
О
V
X
я
я
S
о
и
о
i
О
й
8
X
5
ь
9
я
а
я
а
3
а.
1
О
■^
г-^ СЛ ON
a
I
о
а
я
я
зя
о
о
5*
g
Я
s
о
1
я>
и
a
з-
О
а.
я
я
э5
о
CQ
о
<
о
с
1
">
с
ON
ON
т-
я"
X
£
3
со
из
о
с
Вегетативное размножение
341
тениям, так и голосеменным (Webber, 1940). Кливажная эмбриоидогения
обнаружена у Sequoia (Buchholz, 1939), Cupressus (Doak, 1937), Cryptomeria,
Chamaecyparis (Buchholz, 1932), Sciadopitys (Buchholz, 1931), Juniperus (Cook,
1939; Mathews, 1939) и Saxegothea (Doyle, Looby, 1939).
Особый вид кливажной эмбриоидогении наблюдается при развитии
зародыша у представителей рода Paeonia (Схема 4). Согласно концепции Яковлева,
половой зародыш на ценоцитно-клеточной стадии развития образует путем
«почкования» множество зародышеподобных структур, одна из которых преобразуется
в половой зародыш (Яковлев, 1951,1983; Яковлев, Иоффе, 1961). Согласно
нашей концепции, эти структуры представляют собой соматические зародыши,
возникающие из клеток эпидермиса полового зародыша. Это — одна из
форм монозиготической эмбриоидогении (Батыгина, 1987а,б, 1992; Batygina,
1989; Brukhin, Batygina, 1994). В зрелом семени в результате конкурентного
развития остается лишь один эмбриоид, остальные гибнут на разных стадиях их
развития. Дегенерирует и половой зародыш, на котором образуются соматические
зародыши, при этом его деструкция происходит у различных видов пиона на
разных стадиях развития семени. В этом случае происходит клонирование
организма на первых этапах его развития (зародыш) и в зрелом семени пиона мы
имеем, как правило, один соматический зародыш (эмбриоид),
представляющий собой клон полового зародыша, а не собственно половой зародыш, как
считали ранее (Яковлев, Иоффе, 1961; Яковлев, 1983). Это яркий пример
перехода от одного способа образования спорофита — полового (n+п), к
другому — бесполому (эмбриоидогенезу — 2п=2п). Таким образом, в процессе
эволюции представители этого таксона приобрели способность к гомофазной
репродукции (спорофит > спорофит) на очень ранних этапах онтогенеза,
благодаря чему происходит вегетативное размножение путем клонирования (унипарен-
тальное наследование). Таким образом, в развивающемся семени можно
наблюдать два типа последовательно образующихся, различающихся по
происхождению зародышей: полового, не дифференцированного на органы
зародыша, который прекращает свое развитие и уступает место формированию
другого, соматического зародыша, дифференцированного на все основные
органы (апексы побега и корня, семядоли). Следует подчеркнуть, что, несмотря на
то, что зрелые семена пиона содержат только соматические зародыши,
образующиеся из них растения в природных условиях развиваются без отклонений.
Некоторые экспериментальные данные, полученные по воздействию
различных факторов (радиация, морфактины и т.д.) на развитие полового зародыша (в
культуре in vitro) Eranthis и др. (Haccius, 1965, 1978) сходны с явлением,
описанным у пиона (Батыгина, 1992). По-видимому, именно стрессовые ситуации и
в природе индуцируют образование соматических зародышей на базе гибнущего
полового зародыша.
У одних таксонов (например, Paeonia) этот процесс оказался закрепленным в
ходе эволюции. У других (например, Er.anthis — Haccius, 1965, 1978)
реализация эмбриоидогенного пути морфогенеза происходит спорадически, только в
стрессовых ситуациях.
Нуцеллярная и интегументальная эмбриоидогения отмечена более чем у 250
видов растений (Webber, 1940; Maheshwari, 1950; Lakshmanan, Ambegaokar, 1984;
Naumova, 1992). Обширная информация имеется по нуцеллярной эмбриоидогении у
342
Системы репродукции
плодовых деревьев, таких как Citrus, Mangifera, Eugenia и др. Количество
многозародышевых семян может меняться от вида к виду. Так, у Citrus microcarpa семена
дают обычно 21 проросток, тогда как у С. unshiu — около 40.
Нуцеллярная и интегументальная эмбриоидогения наблюдается также у
некоторых видов орхидных (Nigritella nigra, Spiranthes cernua) на разных стадиях
развития семязачатка, часто еще до формирования зародышевого мешка (Afzelius,
1928; Swamy, 1948).
Эмбриоиды могут образовываться из соматических клеток нуцеллуса и интегу-
ментов различными способами и на разных этапах развития семязачатка (Моди-
левский, 1931; Button et al., 1974; Батыгина, Маметьева, 1979; Батыгина, Фрей-
берг, 1979; Batygina, 1991). Так, у Роа pratensis эмбриоиды образуются либо из
одной клетки («dormant meristem»)1 нуцеллуса, либо через эмбриональный
клеточный комплекс, формирующийся в результате пролиферации клеток
нуцеллуса (Схема 5). Независимо от способа образования эмбриоида, в зрелом семени
Роа pratensis при нуцеллярной и интегументальной эмбриоидогении мы имеем дело
с клоном материнского растения, представленным в виде соматических зародышей.
Однако у этого вида мятлика, наряду с агамоспермными семенами, встречаются
семена с половым и нуцеллярными зародышами.
Нуцеллярная эмбриоидогения привлекает внимание по разным причинам. Одна
из них — возможность получения растений, свободных от вирусов. Известно, что
при обычном вегетативном размножении черенки часто бывают, инфицированы
различными патогенами, тогда как нуцеллярные зародыши и проростки, выращен-
Схема 5. Два способа образования соматического зародыша Роа pratensis
А — из одной клетки, Б, В — из группы клеток эмбрионального комплекса; а — антиподы, з —
зародыш, нз — нуцеллярный зародыш, э — эндосперм, экк — эмбрионально-клеточный комплекс.
По: Батыгина, Фрейберг, 1979.
«Dormant meristem» (англ.) — меристема покоя, или ожидания.
Вегетативное размножение
343
ные из них, свободны от вирусов. Некоторые авторы объясняют это тем, что ну-
целлус и соседствующие с ним ткани не связаны между собой сосудистой системой.
Генетики и селекционеры используют высокую способность некоторых видов
растений {Mangifera, Citrus) образовывать нуцеллярные зародыши как основной
критерий отбора генотипов для скрещивания, обеспечивая тем самым
разнообразие в потомстве. Согласно данным многих авторов, из нуцеллярных эмбриоидов
развиваются «омоложенные» сеянцы, которые напоминают проростки,
возникшие из половых зародышей, Так, Maheshwary (1950) подчеркивает, что сеянцы
Citrus, образующиеся из вегетативных почек на спорофите, развиваются без
колючек, тогда как сеянцы из нуцеллярных зародышей развиваются в растения с
колючками, подобно сеянцам из зиготических зародышей. Клоны Citrus,
постоянно размножаемые вегетативно (черенками), в конце концов, становятся
ослабленными и стерильными. Примечательно, что садоводы обновляют клоны Citrus,
используя нуцеллярные сеянцы, развивающиеся лучше, чем растения,
получаемые из черенков.
Встречаются случаи, когда в одном семени образование эмбриоидов может
протекать параллельно эмбриогенезу (например, Citrus). Для эмбриоидов и
проростков, образующихся из них, мы используем понятие «клон». Следует отметить, что
у некоторых представителей цветковых (Citroideae, Orchidaceae и др.) в одном
семени могут образовываться два разных клона — два поколения: клон материнского
организма (за счет нуцеллярной и интегументальной эмбриоидогении) и клон
дочерней особи (за счет кливажной эмбриоидогении). Фолиарные, каулигенные и
ризогенные эмбриоиды и, соответственно, проростки представляют собой клон
материнского организма на более позднем этапе онтогенеза (по сравнению с монози-
готическими эмбриоидами).
В том случае, когда в одном семени имеются эмбриоиды разного
происхождения: материнского (овулярные) и нового дочернего (эмбриональные), в
популяции развиваются растения двух генотипов. Это является предпосылкой создания
гетерогенности семян, которая в совокупности с вегетативной эмбриоидогенией в
конечном счете, обусловливает генетическую гетерогенность популяции (см.
Генетическая гетерогенность семян).
Вегетативная эмбриоидогения — образование эмбриоидов на
вегетативных органах; включает фолиарную эмбриоидогению (на листе), каули-
генную эмбриоидогению (на стебле) и ризогенную (на корне).
Приуроченность формирования эмбриоидов к определенному вегетативному органу таксо-
носпецифична.
Фолиарная эмбриоидогения. Неполные данные, касающиеся морфогенеза
структур, возникающих на вегетативных органах, привели к тому, что до сих пор
нет единой терминологии для их обозначения. Так, например, структуры,
образующиеся на листе у разных видов p. Bryophyllum (Crassulaceae), называют
«почками» (Howe, 1931; Серебрякова, 1978), «зародышами» или «листовыми
зародышами» (Naylor, 1932; Yarbrough, 1932; Warden, 1968), «листовыми
псевдолуковичками» (Johonson, 1934; Resende, 1954), «эмбриоидами» (Batygina, 1987).
В пользу последнего термина свидетельствуют результаты исследования
Bryophyllum calycinum и В. daigremontianum (Bragina et al., 1995; Batygina et al.,
1996). У изученных видов листовые структуры формируются из меристемы,
названной Yarbrough (1932) «дормант меристемой». Эта зона у В. calycinum распо-
344
Системы репродукции
ложена в выемке листа, а у В. daigremontianum — в выступе выемки. Это
обуславливает эндогенное образование эмбриоидов. На раннем этапе развития листа
клетки меристематической зоны не контактируют с проводящей системой. Это,
вероятно, является одной из причин, по которой она остается дормант меристемой.
Контакт между ними устанавливаются на более позднем этапе развития листа,
после образования 7-10 слоев густоплазменных клеток в этой зоне.
Далее начинается формирование новых «листовых» структур (эмбриоидов).
Поскольку самые ранние этапы развития эмбриоидов из дормант меристемы не
идентифицированы (формируется ли он из одной или из нескольких клеток),
говорить о сходстве этих структур с половым зародышем можно лишь на более поздних
стадиях развития. Как известно, половой зародыш двудольного растения обычно
проходит глобулярную, сердечковидную, торпедовидную стадии и стадию
зрелости. В развитии листовых структур у двух видов Bryophyllum можно выделить
сходные стадии, однако «глобулярная» стадия по морфологии отличается от
классической глобулярной стадии полового зародыша. Формирование «семядолей» у
этих структур происходит так же как, у половых зародышей двудольных. Обычно,
у обоих видов одна из «семядолей» меньше другой на ранних этапах развития.
Потом они становятся практически одинакового размера, в них дифференцируется
проводящая система, накапливается крахмал. Между «семядолями» формируется
почечка с двумя примордиями листьев.
Для вегетативных структур В. daigremontianum и В. calycinum характерно
отсутствие апикальной меристемы главного корня, вместо которой формируется
система адвентивных корней. Заложение адвентивных корней у В. daigremontianum
наблюдается в области «гипокотиля» на стадии поздней торпеды (хорошо
развитые «семядоли» со сформированной проводящей системой и крахмалом в их
клетках и почечка с двумя примордиями листьев). Заложение адвентивных корней в
вегетативной структуре В. calycinum наблюдается на стадии, когда хорошо развиты
«семядоли», в них начинает формироваться проводящая система, но крахмал в
клетках еще отсутствует и почечка еще не дифференцирована. Адвентивные корни
связаны с проводящей системой листа.
В генезисе вегетативной структуры выявлены различия, касающиеся строения
ее базальной части, времени и места заложения адвентивных корней.
В дальнейшем корни прорывают ткани листа и выходят в просвет выемки.
Отделение проростков от листа происходит благодаря образованию отделительного
слоя клеток, часть которых заполнена танинами.
Вегетативные структуры могут находиться на материнском листе до стадии, когда
у них сформировано 6 пар листьев. Вегетативные структуры В. daigremantianum в
условиях высокой влажности на длинном дне могут продуцировать новые
вегетативные структуры на третьей паре листьев.
Сравнительно-морфологический и гистологический анализ вегетативных
структур у обоих видов Bryophyllum позволяет говорить о том, что эти структуры
следует рассматривать как соматические зародыши, а не почки. Аргументом
могут служить такие признаки, как: происхождение из дормант меристемы;
прохождение основных стадий развития, присущих половому зародышу (глобулярная,
сердечковидная, торпедовидная); наличие семядолей и хорошо развитой плюму-
лы; биполярность их развития. Спецификой таких фолиарных эмбриоидов
является образование адвентивных корней на базе дериватов дормант меристемы.
Вегетативное размножение
345
Кратковременная связь эмбриоида с проводящей системой листа еще не говорит
о том, что эта структура является почкой.
У другого представителя сем. Crassulaceae — Crassula multicava было описано
образование зародышеподобных структур из дериватов клеток эпидермиса листа
или черешка (т.е. экзогенно) (McVeigh, 1938). Эти биполярные структуры, как и
в случае В. daigremontiana и В. calycinum сохраняли в течение определенного
времени связь с материнским организмом.
Сравнительный анализ морфогенеза некоторых половых зародышей,
соматических структур на листьях, а также эмбриоидов, образующихся в культуре in vitro,
позволил нам считать, что для вегетативной структуры у разных видов
Bryophyllum и у С. multicava корректнее использовать понятие «эмбриоид», чем
остальные термины.
Таким образом, мы придерживаемся, точки зрения Naylor (1932), Yarbrough
(1932) и McVeigh (1938), которые предложили называть новые вегетативные
структуры, образующиеся на листьях, «листовыми зародышами», или
«зародышами», но не почками. Эти авторы не использовали термин «эмбриоид», который был
введен в позднее.
Многие исследователи сравнивают «листовые зародыши» с семенами
(Yarbrough, 1934; Серебрякова, 1978; Haccius, 1978). Рассеивание (дисперсия)
вегетативных диаспор на разные расстояния от материнского растения зависит от
способа их образования и характера развития. Проростки, образующиеся из таких
листовых зародышей, напоминают «перекати-поле».
Каулигенная эмбриоидогения впервые детально была описана у Ranunculus
sceleratus in situ и in vitro (Konar, Nataraja, 1965; Konar et al, 1972). Эмбриоид у
этого растения, как и у С. multicava, формируется экзогенно — за счет дериватов
клеток эпидермиса, его развитие протекает сходно с половым зародышем
(Onagrad-тип эмбриогенеза). Ни на одном этапе своего развития каулигенные эм-
бриоиды не связаны с проводящей системой материнского организма, в отличие от
фолиарных эмбриоидов Bryophyllum и Crassula.
Ризогенная эмбриоидогения. В литературе имеются только фрагментарные
данные, требующие дополнительных исследований.
Эмбриоидогения как тип размножения. Сравнительный анализ результатов
исследований формирования соматических зародышей в естественных условиях и в
культуре ткани позволил сформулировать представление об эмбриоидогенезе как
о процессе, в основе которого лежит бесполый способ образования нового
спорофита (т.е. без участия гамет и оплодотворения) и об эмбриоидогении как
об особом типе вегетативного размножения.
Это согласуется с мнением Winkler (1934); Battaglia (1963) и Grant (1981) о
том, что и адвентивная эмбриония и вивипария (гомофазная — Т.Б.) являются
формами вегетативного размножения.
Размножение в этом случае осуществляется либо самими эмбриоидами, либо
миниатюрными проростками, развивающимися на растении из эмбриоидов, либо
семенами, в которых формируются эмбриоиды.
Эмбриоидогения, представленная различными формами, имеет большее
адаптивное значение для цветковых, чем другой тип вегетативного размножения —
гемморизогенный. Эволюционное возникновение эмбриоидов, по-видимому, было
обусловлено такими их преимуществами, как более короткий и, следовательно, бо-
346
Системы репродукции
лее энергетически выгодный путь образования множественных зачатков новых
особей с унипарентальной наследственностью (наряду с половыми зародышами).
Очевидно, что образование разных вегетативных и генеративных диаспор,
особенно семян, содержащих зачатки спорофита нового дочернего полового поколения
(бипарентальное наследование) и «старого» материнского поколения (унипарен-
тальное наследование), т.е. образование агамополовых комплексов, существенно
расширяет возможности «борьбы за существование», в связи, с чем эти процессы и
были подхвачены естественным отбором и оказались центральным звеном в
сохранении биологического разнообразия растений. Другое преимущество эмбриоидо-
генного типа размножения заключается в том, что единицей размножения является
зачаток целого организма, образующийся в семени или на вегетативных органах, а
не часть организма (или его отдельные органы — почка, корень), как это имеет
место при гемморизогении. В последнем случае необходимы определенные условия и
время для регенерации части организма до целой особи. Полноценный биполярный
организм, формирующийся при эмбриоидогении, способен у некоторых видов
растений не только сразу укореняться, но и разноситься, подобно семенам, ветром,
водой на малые и большие расстояния.
Такие установленные формы эмбриоидогении, как овулярная (нуцеллярная, ин-
тегументальная), эмбриональная (монозиготическая, кливажная) и вегетативная
(фолиарная, каулигенная и ризогенная), являются лишь элементами одного общего
типа размножения — эмбриоидогенного. В основе вышеописанного явления лежит
исключительное свойство растительной клетки — ее тотипотентность. Роль
явления эмбриоидогении в эволюции окончательно не установлена в силу слабой
изученности различных ее форм.
В связи с вышесказанным, трудно согласиться с утверждением некоторых
авторов, которые приписывают особую роль отдельным формам эмбриоидогении в
системе репродукции цветковых растений. Это не совсем корректно, так как для
установления роли каждой формы эмбриоидогении она должна рассматриваться в
сравнительном плане во взаимосвязи с другими формами, а также с эмбриогенией,
гемморизогенией и гаметофитным апомиксисом.
Последующие оригинальные исследования различных аспектов
эмбриоидогении еще раз позволили убедиться в правильности выдвигаемой концепции
(Brukhin, Batygina, 1994; Batygina et al., 1996; Батыгина, Захарова, 1997;
Batygina, Bragina, 1997; Batygina, Zakharova, 1997; Batygina, 1998, 1999a,b;).
Обобщение оригинальных и литературных данных дало возможность
обнаружить определенный параллелизм в развитии полового и соматического зародышей,
который проявляется в сходстве основных закономерностей морфогенеза
(полярность, симметрия, способность к пролиферации); огромном полиморфизме тех и
других; наличии переходных форм и аномалий. Главное различие между половым и
соматическим зародышем заключается в их происхождении — гетерофазная и го-
мофазная репродукция, соответственно. Однако, независимо от происхождения и
условий развития (in situ или in vitro), оба типа зародышей — биполярные
структуры и представляют собой зачаток нового индивидуума (а не его часть, как в
случае почки). Их роль в системе репродукции также сходна: они являются
элементарными структурными единицами размножения — семенного и вегетативного.
Другим важным аспектом характеристики эмбриоидов как оригинальных
образований является также сравнение их развития с формированием почек.
Вегетативное размножение
347
Прежде всего, сходство между эмбриоидом и почкой заключается в способе
образования — гомофазная репродукция. Кроме того, и те и другие — элементарные
структурные единицы вегетативного размножения. Главное различие между этими
структурами состоит в том, что эмбриоид, как и половой зародыш, зачаток нового
индивидуума, биполярная структура (имеются семядоли, апекс побега и корня), а
почка — часть целого организма, монополярна, имеет только апекс побега и не
формирует семядоли и только в процессе ее развития она становится биполярной,
так как формирует корень.
Вероятно, в связи с выделением эмбриоидогении как новой категории
вегетативного размножения, следует кратко остановиться на истории открытия этого
явления. Со времени исследований Reinert (1958) и Stewart et al. (1958) зароды-
шеподобные структуры, обнаруженные в культуре in vitro Daucus carota, стали
предметом всестороннего изучения. Как удалось установить, сходные
образования встречаются не только в условиях эксперимента (in vitro), но и в условиях
естественного размножения растений (например, при монозиготической кливаж-
ной эмбрионии) (Batygina, 1978, 1987, 1989; Батыгина и др., 1978; Батыгина,
Бутенко, 1981).
Vasil и Hildebrandt (1966) в этой связи предложили использовать термин
«зародыш» только к структурам полового происхождения, а термин «эмбриоид» — к
структурам, подобным зародышу, но образующимся в процессе бесполой
(вегетативной) репродукции (например, «нуцеллярные» зародыши, фолиарные
зародыши) или возникающим в культуре in vitro. Haccius, Lakshmanan (1969), Haccius
(1971) впервые обсудили вопрос о критериях выделения понятии «эмбриоид». Они
пришли к заключению, что этот термин может быть применен ко всем
образованиям, включая «адвентивные» зародыши, для которых характерен закрытый ради-
кулярный полюс, расположенный напротив стеблевого, а также для зародышепо-
добных структур в культуре in vitro.
Haccius (1965 a,b), а также Vasil и Hildebrandt (1966) отметили сходство в
особенностях развития и строения эмбриоидов, полученных в культуре in vitro и
зародышей, возникающих в процессе нуцеллярной и интегументальной эмбрионии. С
другой стороны, Hassius и Lakshmanan (1969) впервые обсудили вопрос о сходстве
и различиях эмбриоидов и «почкообразных» структур в культуре in vitro. Позднее
Haccius (1971), а также Swarny и Krishnamurty (1981) обстоятельно рассмотрели
вопрос о морфологической природе эмбриоидов, и пришли к противоположным
заключениям. По мнению Haccius, несмотря на определенные различия в развитии
половых («зиготических») зародышей и эмбриоидов, к обеим этим структурам
применимо представление о «зародышевом» характере развития и организации.
Однако, как отмечает автор, эмбриоиды отличаются от половых зародышей многих
покрытосеменных замедленной дифференциацией и в этом отношении подобны
зародышам голосеменных растений, с так называемым «нерегулярным» способом
дифференциации.
Следует отметить, что Haccius и Hausner (1975) отмечали, что основным
критерием разграничения половых зародышей и эмбриоидов, с одной стороны, и
адвентивных (а также пазушных) почек, с другой, служит не различие в их
происхождении, а то, что эмбриоиды не являются частями растения (это самостоятельные
особи следующего поколения) и они не связаны с материнским организмом общей
васкулярной проводящей системой, Для них характерно образование новой оси, со-
348
Системы репродукции
единяющей полярно расположенные апексы побега и корня. Однако, это, в общем,
справедливое замечание, не всегда абсолютно, так, например, у Crassula multicava
наблюдается временное соединение нового биполярного спорофита с материнским
организмом. Кстати сказать, у млекопитающих, дочерний организм также обычно
временно связан пуповиной с материнским организмом.
Swamy и Krishnamurthy (1981) пришли к заключению, что эмбриоиды по
характеру развития более сходны с адвентивными почками и имеют мало общих черт с
«зиготическими» зародышами. В связи с этим Swamy и Krishnamurthy предлагали
либо отказаться от термина «эмбриоид», либо отчетливо подчеркнуть, что
эмбриоиды не имеют существенного сходства с половыми зародышами.
Вероятно, уместно будет отметить, что при становлении этой концепции
появился ряд суждений авторов, которые считали, что эмбриоиды никогда не
образуются в природе и искать их бессмысленно (Орел, Лодкина, 1987). Кроме того, эти
же авторы считали, что неправомочно сравнивать нуцеллярные и интегументаль-
ные зародыши с эмбриоидами, образующимися в культуре ткани. Этой точки
зрения в настоящее время придерживается и Naumova (1992). Основным доводом
этих авторов является «место возникновения» и «место развития» — для нуцел-
лярных и интегументальных зародышей это — зародышевый мешок, который
отсутствует в культуре in vitro. Однако трудно согласиться с этим. Во-первых,
наличие зародышевого мешка никак не сказывается на генетической природе
адвентивных зародышей, так как они уже «заданы» их спорофитным происхождением
(2п=2п). Кроме того, есть виды растений, у которых зародыши развиваются вне
зародышевого мешка (например, у представителей сем. Podostemaceae).
Предложенные нами онтогенетический и морфологический критерии
выделения эмбриоидогении позволяют рассматривать эмбриоиды как особый класс
«зачатков» новых индивидуумов, а эмбриоидогенез как особый, бесполый способ
образования нового индивидуума, который нельзя сводить ни к партеногенезу, ни к
андрогенезу, ни к апогаметии.
Как показал анализ литературы и оригинальных данных, отказаться от термина
«эмбриоид» невозможно, поскольку, соматические зародыши, образующиеся из
соматических клеток материнского и дочернего спорофита (кливажные,
нуцеллярные и интегументальные, фолиарные, каулигенные и ризогенные), имеют ряд
особенностей (например, способ их образования, отсутствие чередования поколений),
которые не позволяют объединять эту категорию образований ни с половым, ни с
гаметофитными зародышами.
Он является естественным и довольно распространенным способом
репродукции у разных видов растений в природных условиях.
Следовательно, эмбриоидогению нельзя отнести ни к одной из традиционных
категорий вегетативного размножения (партикуляции, сарментации и др.).
«Кливажные» соматические зародыши, так же как и нуцеллярные и
интегументальные представляют собой элементарные структурные единицы вегетативного
размножения. Тут мы как бы сталкиваемся со своего рода «омоложением»
процесса вегетативного размножения, своеобразной неотенией.
Особенностью такого оригинального эмбриоидогенного типа размножения (в
отличие от обычных форм вегетативного размножения — партикуляции,
сарментации и др.) являются те же признаки, которые присущи и семенам с зиготическими
зародышами: множественность зачатков новых индивидуумов и их способность к
Вегетативное размножение
349
близкой и дальней дисперсии. Кроме того, как указывалось выше, эмбриоидогения
существенно увеличивает диапазон гетерогенности семян. С учетом явлений поли-
эмбрионии и ее разных форм (монозиготической кливажной эмбриоидогении, га-
метофитного апомиксиса, нуцеллярной и интегументальной эмбрионии), полового
процесса, можно выделить 5 типов генетической гетерогенности семян (см.
Генетическая гетерогенность семян).
Однако, в отличие от обычных семян (только с половыми зародышами)
встречаются семена, в которых «рука об руку» протекают различные способы
образования нового индивидуума — половой и бесполый. При этом часто ни один из
способов репродукции не представлен в «чистом виде». Например, образованию
«однояйцевых близнецов» (двойни, тройни и т.д.) предшествует половой процесс. В
этом случае один способ образования нового индивидуума — половой, сменяется
на другой — бесполый.
Таким образом, в некоторых случаях перед тем, как образовались «агамосперм-
ные семена» в «чистом» в виде, т.е. содержащие только соматические зародыши,
семена в процессе своего развития были «агамополовыми», (в них могли быть
нуцеллярные, интегументальные соматические зародыши и гетерозигота, которая
впоследствии могла бы бесполым способом — путем клонирования (кливажная мо-
нозиготическая эмбриоидогения), дать «однояйцевые близнецы».
Все эти сложные многоступенчатые процессы, происходящие в семени,
обеспечивают возможность воспроизведения и размножения новых дочерних особей (или
нового поколения), имеющих разные генотипы — либо унипарентальное, либо би-
парентальное наследование (в случае образования полового зародыша).
Таким образом, разработка новой концепции «эмбриоидогении» позволило нам
дать нетрадиционный взгляд на систему репродукции цветковых растений.
Он заключается в уточнении традиционных и выделении новых понятий,
связанных с воспроизведением и размножением. Итак, существуют: два
способа образования нового индивидуума — половой и бесполый; три пути
морфогенеза при формировании индивидуума — эмбриогенез, эмбриоидогенез и гем-
моризогенез; две формы репродукции (воспроизведения) — гетерофазная (эм-
бриогения, гаметофитный апомиксис) и гомофазная (репродуктивная и
вегетативная эмбриоидогения; гемморизогения — партикуляция, сарментация
и вивипария); два типа размножения — семенное (гамоспермия, агамоспермия
и гамо-агамоспермия) и вегетативное (которое включает гемморизогенный и
эмбриоидогенный способ размножения).
В заключение следует отметить, что введение новой
высокоспециализированной формы вегетативного размножения — эмбриоидогении — позволило
объединить такие, ранее казавшиеся разрозненными явления, как монозиготическая
кливажная, нуцеллярная и интегументальная эмбриоидогения и «фолиарные
зародыши». Вопрос о месте этих явлений в системе репродукции и их эволюционной роли
многие десятилетия оставался дискуссионным.
Чтобы улучшить понимание роли эмбриоидогении в передаче и сохранении
генетической информации, в эволюции различных форм размножения, необходимо
продолжить исследования этих явлений с участием специалистов разных профилей.
Батыгина, 1987 а,б, 1992,1993 а,б, 1994; Батыгина, Бутенко, 1981; Батыгина, Захарова, 1997;
Батыгина, Маметьева, 1979; Батыгина, Фрейберг, 1979; Батыгина и др., 1978; Ильина, 1968;
Модилевский, 1931; Орел, Лодкина, 1987; Серебрякова, 1978; Яковлев, 1951, 1983; Яковлев,
350
Системы репродукции
Иоффе, 1961; Afzelius, 1928; Battaglia, 1963; Batygina, 1978, 1987, 1989 a,b, 1990, 1991, 1992,
1996,1998; Batygina, Bragina, 1997; Batygina, Zakharova, 1997; Batygina etal., 1996; Bragina, etal.,
1995; Brukhin, Batygina, 1994; Buchholz, 1931,1932,1939; Button et al., 1974; Cook, 1939; Crete,
1938; Doak, 1937; Doyle, Looby, 1939; Erdelska, 1996; Ernst, 1918; Grant, 1981; Haccius, 1965 a,b,
1971, 1978; Haccius, Hausner, 1975; Haccius, Lakshmanan, 1969; Howe, 1931; Johonson, 1934;
Konar, Nataraja, 1965; Konar et al., 1972; Lakshmanan, Ambergaokar, 1984; Maheshwari, 1950;
Mathews, 1939; McVeigh, 1938; Naumova, 1992; Naylor, 1932; Reinert, 1958; Resende, 1954;
Stewart et al., 1958; Swamy, 1943, 1948; Swamy, Krishnamurty, 1981; Vasil, Hildebrandt, 1966;
Warden, 1968; Webber, 1940; Winkler, 1934; Yarbrough, 1932,1934.
КОНЦЕПЦИЯ ФИТОМЕРА И ЭВОЛЮЦИЯ ВЫСШИХ РАСТЕНИЙ
Достаточно очевидно, что особи высших растений, в отличие от особей
высших животных (позвоночных и членистоногих), являются сложными, обычно не
имея постоянной формы и величины. Основные составные части их тела —
побеги, состоят из более или менее повторяющихся структур, получивших название
фитонов, или фитомеров по аналогии с метамерами животных (Gray, 1879).
Каждый фитомер состоит из листа с ниже расположенным междоузлием, основание
которого может иметь почку, расположенную в пазухе листа предыдущего фито-
мера (Серебрякова, 1971).
Часто фитомерам придается только онтогенетическое значение как единицам
роста и развития побегов, которые принимаются за единые целостные структуры
(Arber, 1950). Действительно, с позиций настоящего времени побеги большинства
высших растений выглядят именно такими, однако при филогенетическом подходе
к ним нетрудно убедиться в том, что фитомеры по своему происхождению
соответствуют стерилизованным особям, размножающимся путем почкования, подобно
некоторым колониальным животным (Рытова, 1984; Цвелев, 1993).
Наиболее примитивный фитомер папоротников представлен только одной
вайей, которая и фотосинтезирует, и несет на своей нижней поверхности
репродуктивные органы — спорангии, что имеет место у некоторых однолетних родов. Затем в
ходе эволюции произошло разделение функций: единственная вайя разделилась на
2 части, из которых одна стала фотосинтезировать, а другая — давать
репродуктивные органы — спорангии. Стадии этого процесса — разделения первично
бифункциональной вайи на две монофункциональные можно наблюдать в пределах
крайне оригинального порядка Ophioglossaks, возможно, дошедшего до нашего
времени остатка предков голосемянных (Kato, 1988).
Полимеризация стерилизованных фотосинтезирующих вай-фитомеров привела
к формированию очень характерного для многих папоротников розеточного побега,
в котором за многочисленными фотосинтезирующими вайями следуют вайи с
репродуктивными органами, вначале еще способные и к фотосинтезу, но в ходе
дальнейшей эволюции теряющие эту способность. Целесообразность такой
полимеризации вполне понятна: она позволяет накопить больше питательных веществ для
развития репродуктивных органов, что особенно важно в менее благоприятных
условиях обитания, а также открывает широкие возможности для эволюции в
направлении грандизации (увеличения общих размеров растения).
Розеточные побеги папоротников являются еще очень примитивными, так как
их стеблевые части, состоящие из оснований вай-фитомеров, очень коротки и слабо
Вегетативное размножение
351
интегрированы. Хохряков (1982) считает такие побеги «предпобегами», в отличие
от истинных побегов голосемянных и покрытосемянных растений, хотя различия
между ними, на наш взгляд, не так уж велики.
Уже у слабо интегрированных розеточных побегов папоротников проявляются
особенности типичного побега. Их основной частью является фитомер —
стерилизованная или спороносящая вайя. Сильно укороченные междоузлия осевой
части побега — стебля формируются за счет оснований черешков вай, в верхней
части которых эндогенно возникает почка — зачаток следующей вайи.
Примитивные побеги еще неспособны к удлинению междоузлий и имеют только
верхушечную (апикальную) меристему. Меристемы, деятельность которых ведет к
удлинению междоузлий и формированию боковых почек, появились в ходе
эволюции значительно позднее.
Следует отметить, что рост примитивного побега папоротников (как, впрочем, и
любого побега с очередными листьями) осуществляется симподиально. То
обстоятельство, что возникающая симподиально апикальная меристема побега развита
значительно сильнее, чем истинно верхушечная меристема зачатка, дающая начало
листовой части вайи, объясняется ограниченным ростом последней. Верхушечной в
любом побеге всегда становится та меристема, которая сильнее развита и
формирует большее количество органов, независимо от того, является она эволюционно
первичной или вторичной (Grassl, 1967).
В ходе дальнейшей эволюции побегов у голосемянных и покрытосемянных
листовая и стеблевая части вегетативных фитомеров все более дифференцируются друг
от друга, а стеблевые части всех фитомеров, напротив, все более интегрируются,
формируя все более высоко организованные побеги. Их междоузлия получают
возможность удлиняться, а еще позднее появляется и геммаксиллярность —
возможность образования пазушных почек и боковых ветвей из них.
Если у растений с примитивными побегами и только верхушечной меристемой
эволюция в направлении грандизации осуществлялась только за счет
формирования большого количества фитомеров и постепенного поднятия розеток над
поверхностью земли, что имеет место у древовидных папоротников, саговников и многих
пальм (пахикаульных деревьев), то после появления пазушных почек и удлиненных
междоузлий стала возможной и грандизация с формированием лептокаульных
деревьев и кустарников.
Каждый фитомер, слагающий побеги высших растений, является как бы двуос-
ным (Рытова, 1984). Одна из его осей, заканчивающаяся верхушкой вайи или
листа и имеющая ограниченный рост, может быть названа вегетативной, а другая,
основная, хотя и симподиально возникающая ось, является репродуктивной,
поскольку она направлена на формирование репродуктивных органов, но часто через
целый ряд полимеризированных вегетативных фитомеров.
Вегетативные фитомеры могут различным образом видоизменяться.
Листовые части их могут превращаться в чешуи — катафиллы, защищающие молодые
почки от внешних воздействий. У многих родов (например, Asparagus и Ruscus) в
результате ксерофилизации листовые части всех фитомеров превратились в
чешуи, а фотосинтезирующими стали их стеблевые части — междоузлия. У
некоторых представителей родов Juncus (например, /. effucus) и Schoenoplectus и
других однодольных листья розеток стали чешуевидными, а единственный сильно
удлиненный вегетативный фитомер имеет и функционально, и анатомически поч-
352
Системы репродукции
ти не различающиеся стеблевую и листовую части, которые можно отличить
лишь по положению явно бокового соцветия. У рясок (Lemnaceae) листовые
части всех фитомеров полностью редуцированы, а фотосинтезирующими органами
стали очень слабо интегрированные (размножающиеся почкованием и легко
отделяющиеся друг от друга) стеблевые части фитомеров — фронды. У
луковичных однодольных прикорневые фитомеры видоизменены в мясистые чешуи
луковиц, а стеблевые листья, вероятно, сформировались в ходе эволюции из
прицветников соцветий, лишенных цветков.
В ходе эволюции фитомеры получили способность полимеризироваться не
только в разных ярусах вдоль оси побегов, но и в одном и том же ярусе, следствием чего
является переход от более примитивного очередного листорасположения к
супротивному или мутовчатому. В этих случаях стеблевые части двух и более фитомеров
объединяются друг с другом, а их листовые части — филломы остаются
свободными. Такая одноярусная полимеризация имела место и у голосемянных растений, где
она также, по-видимому, является вторичной. Для однодольных растений
характерно очередное расположение фитомеров, и в этом отношении (как и по обычному
отсутствию пазушных почек у стеблевых листьев) они более примитивны, чем
двудольные, у которых число фитомеров в одном ярусе (узле) может доходить до 20 и
больше (Hippuris).
Фертильные, или репродуктивные фитомеры также способны различным
образом полимеризироваться и олигомеризироваться. Ими являются тычинки и
плодолистики покрытосемянных, формирующие репродуктивные побеги — цветки
различного строения, при которых часто имеются и более или менее видоизмененные
вегетативные фитомеры. Впрочем, и репродуктивные фитомеры способны
стерилизоваться и входить в состав околоцветника (например, у многих Ranunculaceae).
Рытова (1984), отмечая метамерное строение побегов высших растений, не без
оснований, находит у них много общего с некоторыми колониальными животными
и потому предлагает для фитомеров менее формальное название «фитоиды».
Однако, гомологизируя вегетативные фитомеры побега со стерилизованными особями,
нельзя не забывать о том, что в ходе длительной эволюции состоящий из
фитомеров побег стал вполне целостной структурой, и в настоящее время он никак не
может быть принят за простую колонию фитомеров. Пожалуй, лишь у упомянутых
выше рясок лишенные листовых частей фитомеры-фронды способны образовывать
очень похожие на почкующиеся колонии группы.
С появлением пазушной меристемы, пазушных почек и ветвления возникла эво-
люционно более молодая колониальность второго порядка, когда повторяющимися
структурами становятся состоящие из фитомеров побеги (Цвелев, 1993), так как
каждый боковой побег вполне гомологичен первичному побегу, формирующемуся
из. зародышевой почки (Рытова, Цвелев, 1982). В этом случае «особь»
какого-либо лептокаульного дерева (например, Quercus) оказывается очень
сложной системой, состоящей из повторяющихся структур разных порядков.
Последние предлагалось называть «модулями» (White, 1979), однако введение
техногенного термина в биологию вряд ли удачно, хотя принятие общего термина для
повторяющихся структур разных порядков очень полезно. Отметим, что разными
авторами в последнее время предлагались «комплементарные» модели строения
побегов (Гатцук, 1995; Кузнецова, 1995). Излагаемая в данной статье концепция
соответствует метамерной, или фитонной модели побега (Gray, 1879).
Вегетативное размножение
353
Выше уже отмечалась относительно большая примитивность вегетативных
органов однодольных по сравнению с двудольными. Вероятно, более
примитивной особенностью однодольных является и наличие у них только одной семядоли
в зародыше. Эта семядоля (у злаков — щиток) вместе с другими частями
зародыша составляет один фитомер, который можно назвать первичным. Как и
вегетативные фитомеры побегов, первичный фитомер образует почечку, дающую
начало первичному побегу. Формирование зародышевой почечки еще на
материнском растении — своего рода живорождение, вероятно, следует считать
вторичной особенностью, так как в семени голосемянных она отсутствует.
Отсюда более слабое развитие почечки у некоторых семейств покрытосемянных,
вероятно, следует считать примитивным признаком, унаследованным от
голосемянных предков. Отсутствие почечки и вообще очень слабая дифференциация
первичного фитомера — зародыша у сем. Orchidaceae, возможно, также являются
примитивными особенностями. Несмотря на очень высокую специализацию
цветков и микотрофность, орхидные, несомненно, являются одной из
древнейших групп покрытосемянных (о чем свидетельствует их современное
распространение), и вследствие мозаичной эволюции у них могли сохраниться очень
примитивные признаки.
Из фитомерной природы зародыша следует способность его, подобно фитоме-
рам побегов, к одноярусной полимеризации. Отсюда представляется очень
вероятной первичность, а не вторичность односемядольного зародыша по сравнению с
многосемядольным, в том числе двусемядольным зародышем (Grassl, 1967;
Цвелев, 1993,1997). С фитомерной природой семядолей хорошо согласуется и
способность их видоизменяться в фотосинтезирующие надземные органы, свойственная
преимущественно двудольным (вероятно, вторичная особенность). Даже в
настоящее время очень широко распространено представление о первичности
двусемядольного зародыша, из которого односемядольный зародыш выводится путем
«синкотилии» или «гетерокотилии», однако обе последних возможности мало
вероятны (Tillich, 1992). Обычное присутствие двух и более семядолей у
голосемянных было одним из доводов в пользу первичности двусемядольности, хотя
достаточно очевидно, что современные голосемянные не имеют никакого отношения к
предкам покрытосемянных.
При одноярусной полимеризации «листовой части» первичных фитомеров
наиболее выгодным в эволюционном отношении оказалась двусемядольность
зародыша, так как при этом почечка зародыша становится из боковой верхушечной и
защищенной с обеих сторон семядолями. Интересно, что у рясок слабо
дифференцированный зародыш — первичный фитомер, по-видимому, также лишен своей
верхней — «листовой» части, а вместо почечки на нем образуются 1-2 молодых
фронда, легко отделяющиеся от материнского фронда — зародыша (Ильина,
1990). Вполне вероятно, что первичному фитомеру наиболее соответствует проэм-
брио, а не дифференцированный зародыш.
Таким образом, концепция фитомера (фитона, или фитоида) позволяет
по-новому подойти к решению некоторых спорных вопросов эволюции и
филогении высших растений, а также к оценке примитивности или продвинутое™
отдельных признаков. Необходимо еще раз отметить, что в ходе длительной эволюции
побегов высших растений стеблевые части фитомеров — междоузлия все более
интегрируются вплоть до образования в результате грандизации толстых одревесне-
354
Системы репродукции
вающих стволов лептокаульных деревьев, а их листовые части — филломы все
более от них обособляются. Фитомеры способны к полимеризации не только в
разных ярусах, но и в одном ярусе — узле, результатом чего является супротивное или
мутовчатое листорасположение (вероятно, вторичная особенность).,Несомненно,
вторична также способность фитомеров к удлинению междоузлий и образованию
боковых почек — ветвлению. Зародыш семени, по-видимому, является первичным
фитомером, способным, подобно фитомерам побегов, давать боковые почки,
которые при полимеризации первичных фитомеров в одном ярусе становятся
верхушечными. Отсюда зародыши с двумя и более семядолями, как и зародыши с хорошо
развитой боковой почечкой, следует считать более продвинутыми по сравнению с
односемядольными зародышами.
Гатцук, 1995; Ильина, 1990; Кузнецова, 1995; Рытова, 1984; Рытова, Цвелев, 1982;
Серебрякова, 1971; Хохряков, 1982; Цвелев, 1993,1997; АгЬег, 1950; Grassl, 1967; Gray, 1879; Kato, 1988;
Tillich, 1992; White, 1979.
Молекулярно-генетические аспекты репродукции
355
ЧАСТЬ V — МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ АСПЕКТЫ
РЕПРОДУКЦИИ
ГЕНЕТИКА РАЗВИТИЯ ЦВЕТКА
Генетика развития является одной из современных областей исследования,
возникшей на стыке морфологии, физиологии, эмбриологии, генетики, молекулярной
биологии и генной инженерии. Растения оказались в поле зрения генетики развития
позже, чем животные. Поэтому для изучения развития растений были
заимствованы некоторые подходы и методы, разработанные для животных объектов.
Используются также и современные молекулярно-генетические методы, в том числе и
специфичные для растительных объектов.
Для того, чтобы получить исходный материал — мутанты по дифференцировке,
традиционно используют два пути. Первый путь предполагает выявление
природных форм, различающихся проявлением тех или иных морфогенетических
процессов. Второй предусматривает специальную мутагенную обработку нормальных
растений с последующим отбором мутантных форм, характеризующихся
измененным морфогенезом. Если у большинства животных органогенез охватывает
сравнительно небольшой отрезок времени, то у растений органогенез продолжается на
протяжении всей жизни. В отличие от животных, число органов растения слабо
детерминировано. Чтобы применить к растениям подходы, разработанные в генетике
развития животных, необходим модельный процесс, который жестко
детерминирован во времени и в пространстве. Перспективным в этом отношении является
изучение генетики развития цветка.
Это связано с тем, что, несмотря на относительно короткий период своего
развития, цветок содержит большое количество разнообразных структур. Кроме того,
огромное внимание, уделяемое дифференцировке различных органов цветка,
обусловлено тем, что в процессе их развития происходит чередование гаметофитного и
спорофитного поколений, характеризующее специфику жизненного цикла
цветковых растений.
Изучение генетического контроля развития цветка стало возможным в
результате широкомасштабных работ по получению и детальному изучению мутантов,
дефектных по различным этапам реализации генеративных программ.
В качестве модельных объектов широко используются Arabidopsis thaliana
(Brassicaceae) и Antirrhinum majus (Scrophulariaceae). Несмотря на таксо-
356
Системы репродукции .
номическую удаленность этих видов, общая схема генетического контроля
развития цветка оказалась у них сходной, а многие гены, вовлеченные в этот
контроль — гомологичными (Соеп 1991, 1992; Coen, Meyerowitz, 1991;
Weigel, Meyerowitz, 1993). В последние годы сходные результаты
накапливаются и для многих других видов двудольных и однодольных, что
свидетельствует о высокой эволюционной консервативности механизмов генетического
контроля развития цветка (Theissen et al., 2000).
Запуск программ цветения
Известно, что развитие цветка включает несколько стадий:
—формирование вегетативной апикальной меристемы побега,
—превращение вегетативной апикальной меристемы в генеративную (меристему
соцветия),
—формирование меристем отдельных цветков (флоральных меристем),
—закладка отдельных органов цветка.
Запуск программ цветения (флоральная индукция) обеспечивает превращение
вегетативной меристемы в генеративную (меристему соцветия) и регулируется
разнообразными факторами как экзогенной, так и эндогенной природы. К факторам
внешней среды, оказывающим существенное влияние на флоральную индукцию у
арабидопсиса, относятся длина светового дня и температура (Bernier et al., 1993).
Длинный световой день (более 14-16 часов) способствует раннему переходу к
цветению, в то время как короткий (8-10 часов) — задерживает флоральную
индукцию. Раннему цветению способствует и кратковременная обработка проростков
низкой температурой (вернализация). Получен целый ряд мутантов с измененной
реакцией на перечисленные факторы внешней среды. Некоторые из этих мутантов
(fca, fd, /е, fha, flc, fpa, ft, fve, fwa, fy и др.) нечувствительны к длинному
световому дню и низкой температуре, в то время как другие (е//1, е//2, е//3, em/1, em/2, spy,
tfl и др.), напротив, способны к быстрому зацветанию независимо от
продолжительности светового дня (Weigel, 1995).
Раннее цветение обеспечивается мутациями в генах ELF 1, 2, 3, EMF 1, 2, а
также TFL. К более позднему цветению приводят мутации в генах СО, FCA,
FD, FLA, FE. FPA, FRI, FT, FVE, FY, С/. LD, GAI (Табл. 1).
Для мутантов em/1 и em/2 (embryonic flower) характерно
формирование единственного цветка почти сразу после прорастания семян (Sung et
al., 1992). Судя по тому, что у этих мутантов пропущена почти вся
вегетативная стадия развития, нормальный продукт гена EMF необходим для
задержки генеративных программ, в результате чего растение успевает
пройти достаточно продолжительную вегетативную стадию. Мутации tfl\
(terminal flower) также приводят к резкому сокращению вегетативной
фазы и к более раннему формированию генеративной меристемы (Shannon,
Meeks-Wagner, 1991; Schultz, Haughn, 1993). Таким образом,
продолжительная вегетативная стадия развития обеспечивается у растений за счет
активного подавления генеративных программ. Внешние факторы
(длинный световой день и кратковременные воздействия низкой температурой),
по-видимому, способны ослаблять это подавление, тем самым способствуя
более раннему цветению.
Молекулярно-генетические аспекты репродукции 357
Таблица 1:
Гены Arabidopsis thallana, влияющие иа процесс перехода к цветению
Мутации
Функция генов
ГЕНЫ ПОЗДНЕГО ЦВЕТЕНИЯ
Минимальный ответ на фотопериод и вернализацию
constans (со), gigantea (gi),
carbohydrate accumulation mutant (caml), fha, Ihy
Более выраженный ответ на фотопериод и
минимальный ответ на вернализацию
fd, fe, ft, fwa
Ответ на фотопериод и вернализацию
fca, fpa, luminidependens (Id), fve, frigida (fri), flc
Условные мутации:
позднее цветение при неиндуктивном фотопериоде
gibberelic acid 1 (ga\), gibberelic acid insensitive (gai)
Условные мутации: позднее цветение при длинном дне
(при прерывании темновой фазы фотопериода или при
низкой интенсивности света) —
phytochrome A (phyA)
Вызывают переход к цветению в ответ
на индуктивный фотопериод
Вызывают переход к цветению в ответ
на индуктивный фотопериод
Регуляция автономных путей перехода
к цветению
Участие в синтезе или восприятии гиб-
береллина, необходимого для перехода
к цветению при коротком дне
Участие в «измерении» длины дня и
ночи
ГЕНЫ РАННЕГО ЦВЕТЕНИЯ
Выпадение вегетативной фазы
embryonic flower l (emf\)
embryonic flower 2 (emfl)
Независимые от фотопериода
early flowering 3 (elf3),
constitutive photomorphogenic 1 (cop\),
de-etiolated I (deft )
Более выраженный ответ путей на фотопериод
phytochrom В (phy В), spindly (spy),
terminal flouwer (tfl), early in short days 4 (els 4),
early flowering 1 (efl \), early flowering 2 (elf 2)
Более выраженный ответ путей на фотопериод
phytochrome В (phy В), spindly (spy),
terminal flower (tfl),
early in short days 4 (els4),
early flowering\ (elfl),
early flowering 2 (elfl)
Необходим для ювенильной фазы
вегетативного развития
Участие в «измерении» длины дня и
ночи, репрессия перехода к цветению
Репрессия автономных путей перехода
к цветению
Репрессия автономных путей
фотопереход перехода к цветению
Формирование меристемы цветка представляет собой очередное изменение
функционального типа меристемы. В данном случае меристема соцветия
преобразуется в меристему цветка (флоральную меристему). По сравнению с запуском
программ цветения, формирование флоральной меристемы в гораздо меньшей
степени зависит от факторов внешней среды и более жестко контролируется геноти-
358
Системы репродукции
пом растения. У арабидопсиса и львиного зева получен ряд мутантов, дефектных по
некоторым элементам образования меристемы цветка вплоть до ее полного
отсутствия. Генетический анализ этих мутантов позволил идентифицировать
конкретные гены, контролирующие формирование флоральной меристемы.
Мутанты Ify (leafy) (Схема 1) неспособны формировать нормальные
меристемы цветков, вместо которых закладываются вторичные меристемы соцветий
(Coen et al., 1990; Irish, Sussex, 1990). Следует отметить, что в норме вторичные
соцветия возникают у арабидопсиса только в самой нижней (наиболее рано
формирующейся) части соцветия. При этом у мутантов Ify образование флоральных
меристем оказывается сдвинутым на верхние (более поздно формирующиеся)
зоны соцветия, причем закладывающиеся цветки сохраняют целый ряд
признаков, присущих соцветию:
— развиваются прицветные листья, отсутствующие у цветков дикого типа, но
имеющиеся у соцветий;
— органы цветка располагаются в спиральной последовательности;
— расстояние между органами в цветке оказывается значительно большим, чем в
нормальных цветках.
Достаточно сходные проявления свойственны мутациям ар\ (apetala 1). Так, у
растений, гомозиготных по мутантной аллели apl-1 (Схема 2), образующиеся
цветки содержат вторичные цветочные меристемы, закладывающиеся в пазухах
чашелистиков. Внутри этих вторичных цветков могут аналогично развиваться
третичные цветочные меристемы. Таким образом, флоральные меристемы мутантов
Схема 1.
Схематическое изображение растений Arabidopsis thaliana дикого типа и мутаитных
по генам идентичности флоральной меристемы
12 3 4
1 — дикий тип, 2 — мутация leafy, 3 — двойной мутант leafy / apetala\, 4 — мутация terminal
floweA; стрелками обозначена меристема соцветия, светлыми кружками — нормальные цветки,
темными кружками — аномальные цветки.
По: Coen et al., 1990.
Схема2.
Цветки растений Arabidopsis thaliana I, мутантные по генам развития цветка
1 — дикий тип, 2 — 6 — мутантные цветки: 2 — apetalal, 3 — pestillata, 4 — agamous, 5 — superman,
6 — clavataX.
По: Weigel, Meyerowitz, 1994; Riechmann, Meyerowitz, 1997.
360
Системы репродукции
apl способны вновь образовывать флоральные меристемы, что говорит об их
функциональном сходстве с меристемами соцветий.
Судя по фенотипу двойных мутантов //у apl (полное превращение соцветий в
вегетативные побеги — (Схема 1), продукты соответствующих генов
контролируют некие параллельные, частично перекрывающиеся пути, ведущие к
формированию флоральной меристемы. Аналогичные результаты получены и для мутаций //о
(floricaula) и squa (squamosa) у львиного зева.
Гены LFY и API арабидопсиса, а также FLO и SQUA львиного зева были
клонированы и секвенированы (Coen et al., 1990; Mandel et al., 1992; Weigel et al.,
1992). Результаты молекулярно-генетического анализа показали, что гены FLO и
LFY кодируют гомологичные белки с пролин-богатыми участками, характерными
для транскрипционных факторов. Представления о том, что продукт гена LFY
является регулятором транскрипции, косвенно подтверждаются данными о
внутриядерной локализации этого белка (Weigel, Meyerowitz, 1993). Результаты анализа
генов АР1 и SQUA подтвердили их гомологичность друг другу, а также позволили
отнести их к широко известному у многих организмов семейству
транскрипционных факторов MADS. Кроме того, было показано, что все четыре гена экспресси-
руются на самых ранних стадиях развития флоральной меристемы, что согласуется
с предполагаемой ролью их продуктов в качестве факторов, определяющих
развитие меристемы цветка (Coen et al., 1990; Weigel et al., 1992).
В процесс формирования флоральной меристемы вносят свой вклад и другие
гены. Так, проявление мутаций АР\ резко усиливается в присутствии мутантных
аллелей гена CAL (CAULIFLOWER). При этом аллели cal не имеют
самостоятельного фенотипического проявления и никак не влияют на степень проявления
мутаций //у (Bowman et al., 1993). Усиление эффектов, вызванных мутантными
аллелями АР\ или //у может быть обусловлено мутациями в генах АР2 и CLV 1
(CLAVATA\), которые сами по себе также не оказывают заметного влияния на
формирование флоральной меристемы. Таким образом, у арабидопсиса в процессе
формирования меристемы цветка принимают участие не только гены LFY и АР 1,
кодирующие некие ключевые регуляторные молекулы, но и целый ряд других
генов, влияние которых становится заметным при отсутствии активности одного из
главных факторов.
В противоположность рассмотренным выше генам, кодирующим позитивные
регуляторы формирования флоральной меристемы, продукт гена TFL\, по-видимому,
подавляет превращение меристемы соцветия в меристемы цветков. Действительно,
мутанты по этому гену образуют небольшое соцветие всего с несколькими цветками,
заканчивающееся терминально расположенным цветком (Схема 1). При этом
вторичные меристемы соцветий, в норме закладывающиеся у растений дикого типа,
оказываются замещенными на меристемы отдельных цветков, а терминальный цветок
состоит из двух или трех неполных цветков. Первичная меристема соцветия
претерпевает у этих мутантов превращение в 2-3 близко расположенные флоральные
меристемы, в то время как в норме у этого вида первичная меристема соцветия
потенциально неограниченна в своем росте и никогда не преобразуется во флоральную.
Продукт гена TFL1, вероятно, является антагонистом продуктов генов LFY и АР\ и
способен подавлять их активность в первичной меристеме соцветия. В соответствии с
этим, проявление мутаций TFL1, по-видимому, связано с расширением зон
активности, свойственных генам LFY и АР\ (Weigel et al., 1992, Bowman et al., 1993).
Молекулярно-генетические аспекты репродукции 361
Формирование органов цветка
Флоральная меристема арабидопсиса, как и многих других видов цветковых
растений, формирует 4 типа органов, для которых характерно круговое
расположение в цветке. При этом взаимное расположение кругов, образованных органами
каждого типа, остается всегда неизменным: первый (внешний) круг занят
чашелистиками, второй — лепестками, третий — тычинками и, наконец, четвертый
(центральный) круг занят плодолистиками. Вместе с тем, получен ряд мутантных форм
с нарушенной последовательностью расположения этих кругов в цветке (Схема
2). Характерной особенностью таких мутантных форм были нарушения сразу в
двух соседних кругах.
Особый интерес среди всех перечисленных выше генов вызывают гомеозисные
геныу4Р1, АР2, АРЪ, PI (PISTILATA) я AG (ACAMOUS) (Табл. 2; Схема 2).
Мутации в этих генах приводят к замене одних структур цветка на другие (Bowman
etal., 1991; Coen, Meyerowitz, 1991; Meyerowitz etal., 1991). Так, у мутантов по
генам АР\ и АРЪ происходит замена чашелистиков на плодолистикоподобные
структуры, а лепестков — на тычинки, в результате чего расположение органов в
цветках у мутантов ар\/ар2 оказывается следующим: плодолистики — тычинки —
тычинки — плодолистики. Мутации в гене АРЪ вызывают превращение
лепестков в чашелистики, а тычинок — в плодолистики. К тому же эффекту приводят и
мутации в гене PL Поэтому цветки у мутантов арЪ и pi имеют следующее
расположение органов: чашелистики — чашелистики — плодолистики — плодолистики
(Bowman et al., 1989). В случае мутации в гене AG происходит превращение
тычинок в лепестки, а плодолистиков — в чашелистики. Кроме того, мутанты по гену
AG характеризуются недетерминированным развитием цветочной меристемы.
Поэтому цветок у мутантов ag содержит многократно повторяющиеся
последовательности органов: чашелистики — лепестки — лепестки — чашелистики.
Перечисленные выше данные были обобщены в рабочую гипотезу,
объясняющую взаимодействие гомеозисных генов цветка, которая получила название
«ABC» модели, или теории «войны кругов» (Coen, Meyerowitz, 1994; Схема 3).
Основные положения этой гипотезы:
1) в ходе своего развития меристема цветка подразделяется на 4 концентрических
участка, условно называемых «кругами» и нумеруемых с первого по четвертый
по направлению от периферии к центру цветка;
2) в различных кругах экспрессируются три типа активностей: активность А — в
I и II круге, активность В — во П и III круге и активность С — в III и IV круге;
при этом активности А и С являются антагонистами и взаимно подавляют
экспрессию друг друга;
3) судьба каждого отдельного зачатка в цветке определяется комбинацией
активностей, экспрессируемых в соответствующем круге; при этом активность А
приводит к появлению чашелистиков, взаимодействие активностей А и В — к
образованию лепестков, взаимодействие активностей В и С — к
формированию тычинок, а активность С — к возникновению плодолистиков.
В соответствии с этой схемой, дефектность по активности А приводит к тому,
что активность С начинает экспрессироваться во всех четырех кругах. Таким
образом, локализация активностей во флоральной меристеме будет следующей: С
ВС ВС С, что приводит к формированию цветка, содержащего: плодолистики —
Таблица 2:
Гомологичные гены Arabldopsis thaliana и Antirrhinum та jus, затрагивающие
процесс развития цветка
Гены
Arabidopsis
Antirrhinum
Продукты генов
Фенотипы мутантов
ГЕНЫ, КОНТРОЛИРУЮЩИЕ ИНИЦИАЦИЮ И РАЗМЕР ФЛОРАЛЬНОЙ
МЕРИСТЕМЫ
TFL1
LFY
API
CAL
UFO
CLV\
CLV2
CEN
FLO
SQUA
}
FIM
}
?
(см.Табл. 1)
фактор транскрипции?
домеи MADS
домен MADS
слабая гомология с
белками - регуляторами
траисмембраииая
киназа - рецептор
?
превращение генеративной
меристемы в флоральную,
терминальный цветок (сеп)
превращение цветков в
соцветия, для Ify — частично
apt — цветки внутри органов
первой мутовки; squa - вместо
цветков образуются соцветия
усиление фенотипа ар\
замена первых цветков
вторичными соцветиями;
изменение размеров и
количества органов цветка
увеличенные меристемы,
больше органов цветка
увеличенное количество
плодолистиков
ГЕНЫ, КОНТРОЛИРУЮЩИЕ ТИП ОРГАНОВ ЦВЕТКА
АР\
API
AG
АРЗ
PI
р
SUP
SQUA
?
PLENA
DEFA
GLO
SEP
}
домен MADS
домен АР2
домен MADS
домен MADS
домеи MADS
}
регулятор
транскрипции,белок с
цинковыми пальцами
ар\ — прицветники вместо
чашелистиков, измененные
лепестки; squa — измененные
органы внутренних мутовок
плодолистики вместо
чашелистиков, тычинки вместо
лепестков
лепестки вместо тычинок,
новые цветки вместо
плодолистиков
чашелистики вместо лепестков,
плодолистики вместо тычинок
похожи на арЪ и dej A
похож на defA
больше тычинок, меньше
плодолистиков
Схема 3. Модель ABC
В
А
С
ЧЛ Т П
Цветок дикого типа. Под влиянием А, В и С функций на меристеме цветка
закладываются чашелистики (¥), лепестки (Л), тычинки (Т) и плодолистики
(Я).
в
п т т п
Цветок при отсутствии активности А функции. При наличии активности
только В и С функций на флоральной меристеме закладываются только тычинки
(Т) и плодолистики (/7).
А
С
чч пп
Цветок при отсутствии активности В функции. При наличии активности
только А и С функций на флоральной меристеме закладываются только
чашелистики (¥) и плодолистики (П).
В
А
Ч Л Л Ч
Цветок при отсутствии активности С функции. При наличии активности
только В и А функций на флоральной меристеме закладываются только
чашелистики (Ч) и лепестки (Л).
364
Системы репродукции
тычинки — тычинки — плодолистики. Такой цветок полностью лишен лепестков
(англ. petals), что и отразилось в названии соответствующих генов: АР\ и АР2
— безлепестковый. Мутации, затрагивающие активность В, приводят к
следующему распределению активностей в меристеме цветка: А А С С. Согласно этой
схеме, в формирующихся цветках полностью отсутствуют лепестки и тычинки, а
вместо них имеются дополнительные круги чашелистиков и плодолистиков. Как
оказалось, такие растения, содержащие в своих цветках чашелистики —
чашелистики — плодолистики — плодолистики, могут возникать за счет мутации в двух
генах —АРЗ (безлепестковый) иР/ (многопестичный). Мутации, нарушающие
активность С, приводят к тому, что антагонистическая активность А (продукт
гена APT) присутствует во всех четырех кругах. Таким образом,
соответствующие мутанты характеризуются следующим типом флоральной меристемы: А АВ
АВ А (чашелистики — лепестки — лепестки — чашелистики). Подобные
мутанты полностью лишены собственно генеративных структур цветка (тычинок и
плодолистиков), что позволило назвать соответствующий ген AG (бесполый).
Следует отметить, что мутанты ag характеризуются недетерминированным
развитием флоральной меристемы, а потому содержат в своих цветках многократно
повторенные круги чашелистиков и лепестков.
Гипотеза «ABC» хорошо согласуется и с фенотипами множественных
мутантов. Так, двойным мутантам ар2 арЗ/pi (С С С С) свойственны цветки,
состоящие из одних плодолистиков. Недетерминированные цветки двойных
мутантов арЗ/pi ag (А А А А) содержат только чашелистики. Двойные мутанты
ар2 ag ( -В В -1) несут недетерминированные цветки, содержащие листоподоб-
ные образования, а также уродливые структуры, одновременно напоминающие
и лепестки, и тычинки. Наконец, тройные мутанты apl арЗ/pi ag (- -)
характеризуются превращением цветков в недетерминированные аналоги
вегетативных меристем со спиральным расположением типичных листоподобных
структур. Этот факт убедительно свидетельствует о том, что цветок
действительно представляет собой модифицированный побег.
Впоследствии модель ABC была несколько модифицирована с учетом новых
данных о генах идентичности органов цветка и о взаимодействии их продуктов.
Так, выявлен дополнительный компонент активности А, кодируемый геном АР\,
причем его экспрессия в кругах 3 и 4 негативно регулируется (подавляется) геном
AG (Mandel et al., 1992). В то же время сам ген AG негативно регулируется
продуктом гена АР2, который подавляет его экспрессию в кругах 1 и 2.
Фенотипы мутантов по генам АР2, АРЗ, PI и AG свидетельствуют о том, что
продукты этих генов принимают участие: в определении идентичности органов
цветка, в инициации зачатков органов цветка, в установлении детерминированного
типа развития флоральной меристемы.
Характерно, что активность генов идентичности органов цветка отчасти
регулируется с помощью генов LFYиАР\ (Weigel, Meyerowitz, 1993), которые зкспрес-
сируются не только при инициации флоральной меристемы, но и в течение развития
цветка (Mandel et al., 1992 Weigel, 1992). В частности, продукты генов LFY и
АР\ активируют экспрессию генов АРЗ и Р/ и регулируют характер экспрессии
гена AG Таким образом, процессы инициации флоральной меристемы и
установления идентичности органов цветка оказываются тесно связанными.
Функция отсутствует, т.е. органы цветка не формируются.
Молекулярно-генетические аспекты репродукции 365
Как уже было отмечено, продукт гена AG, по-видимому, является ключевой
молекулой, контролирующей развитие собственно репродуктивных органов цветка
(тычинок и плодолистиков). Вместе с тем, этот же продукт обеспечивает
детерминированный тип развития флоральной меристемы. Судя по тому, что у всех
известных мутантов ag наблюдается одновременное нарушение обеих функций,
соответствующие активные центры молекулы либо перекрываются, либо неспособны к
нормальному функционированию поодиночке. Вместе с тем, при трансформации
нормальных растений арабидопсиса антисмысловыми копиями гена AG,
подсоединенными к сильному конститутивному промотору 35S-CaMV, удалось получить
трансгенные растения трех типов: трансформанты I типа, полностью сходные с
мутантами ag; трансформанты II типа, образующие недетерминированные цветки с
частично измененными репродуктивными органами; трансформанты III типа,
формирующие недетерминарованные цветки с нормально развитыми тычинками и
плодолистиками. Такие цветки образуют внутри своей завязи новые круги тычинок и
плодолистиков, а потому были названы «матрешками».
Таким образом, разделение двух функций белка AG принципиально возможно
и требует определенного уровня его экспрессии. При таком уровне экспрессии
количество молекул AG, по-видимому, оказывается вполне достаточным для
нормального развития репродуктивных органов, но недостаточным для
детерминации флоральной меристемы. Конкретные гены, регулируемые белком AG,
остаются неизвестными.
Ген AG является одним из представителей целого семейства генов,
кодирующих /lG-подобные транскрипционные факторы. Эти гены получили название
AGL (от ACAMOUS-Mke) , в настоящее время у арабидопсиса описано более 20
AGL -генов. Среди них достаточно подробно охарактеризованы шесть генов.
Поскольку их транскрипция осуществляется в апикальной меристеме после ее диф-
ференцировки во флоральную, соответствующие белки, вероятно, также
являются компонентами регуляторного каскада. Действительно, ген AGL5 содержит в
своей промоторной области участок специфического узнавания для
MADS-белков и не экспрессируется у мутантов ag. Напротив, транскрипция
гена AGL6 у тех же мутантов оказывается повышенной. Таким образом, белок
гена AG способен прямо или косвенно влиять на транскрипцию других
MADS -генов. С другой стороны, экспрессия reHaAGL\4 осуществляется
задолго до начала транскрипции гена AG.
С некоторыми белками семейства AGL продукт гена AG, по-видимому, может
вступать в образование димеров. Такой вывод сделан на основании результатов,
полученных с использованием дрожжевой дигибридной системы. Оказалось, что
К-домен белка AG способен вступать в эффективное взаимодействие с
К-доменами продуктов генов AGL2, AGL4, AGL6 и .4GL9. Таким образом,
вполне вероятно, что белок AG в норме образует не только гомодимерные
комплексы, но и различные типы гетеродимеров.
Для успешной терминации флоральной меристемы необходима активность по
крайней мере нескольких генов (AG, FON, CLV и 5 UP), выявленных в результате
анализа мутантных форм арабидопсиса.
Гены CLAVATA, SUPERMAN и FLORAL ORGAN NUMBER регулируют
детерминированность флоральной меристемы, а также количество
закладывающихся в цветке зачатков органов.
366 Системы репродукции
Описано семейство генов CLAVATA (CLV\, CLV2 и CLV3), мутации в которых
обладают сходным фенотипическим проявлением (Leyser, Furner, 1992; Clark et al.,
1993,1995; Crone, Lord, 1993). Особенно полно проанализированы мутанты с
нарушениями в генах CLV1 и CLV3. Такие растения характеризуются увеличенными
размерами всех типов апикальных меристем побега: вегетативной, меристемы соцветия и
меристемы цветка. Увеличенная апикальная меристема содержит большее
количество активно делящихся недифференцированных клеток, что приводит к образованию
на ней большего количества цветков (в случае меристемы соцветия) или отдельных
органов цветка (в случае меристемы цветка). Мутантный фенотип clv\ (Схема 2)
проявляется в развитии дополнительных плодолистиков внутри завязи. Однако,
даже в случае наиболее четко проявляющихся мутантных аллелей (сМ-1 и сМ-4)
рост и развитие дополнительных плодолистиков ограничены и не приводят к разрыву
стенок завязи (Clark et al., 1993). Таким образом, по-видимому, мутации в генах
CLV приводят к увеличению числа органов цветка и замедленной терминации фло-
ральной меристемы за счет увеличенных размеров самой меристемы.
Другим механизмом увеличения числа органов цветка и установления
недетерминированного развития флоральной меристемы является пролонгация
активности меристемы, приводящая к продолжению функционирования меристемы после
формирования примордиев первых трех кругов органов цветка. По такому
принципу происходит увеличение количества органов цветка (тычинок и
плодолистиков) у растений, мутантных по гену FON (FLORAL ORGAN NUMBER)
(Huang, Ma, 1997).
Анализ двойных мутантов по генам CLV1 и FON показал, что эти гены
контролируют развитие флоральной меристемы, используя разные пути.
Действительно, двойные мутанты clv\ /onl и clv3 /onl характеризуются более
выраженными нарушениями в детерминированности флоральной меристемы и
увеличением числа органов цветка, чем одиночные мутанты по этим генам. Так, в цветках
двойных мутантов развивается значительно большее количество тычинок и
плодолистиков, чем в цветках одиночных мутантов по генам CLV\ или FON. В то же
время у двойных мутантов cZul-4 /onl-1 наблюдается гораздо более интенсивный
рост и развитие дополнительных плодолистиков внутри завязи, чем у одиночных
мутантов c/ul-4. В отдельных цветках внутренние плодолистики прорывают
стенку завязи и полностью развиваются в дополнительные пестики. У двойных
мутантов генотипа clv3-2 /onl-1 в некоторых наиболее поздних цветках клетки
флоральной меристемы продолжают делиться после образования органов цветка,
образуя внутри завязи не дополнительные плодолистики, а массу
недифференцированных клеток.
Таким образом, активность генов CLVX и FON необходима для успешной
терминации флоральной меристемы, причем эти гены используют
независимые пути контроля развития меристемы и различные механизмы ограничения
ее активности.
К генам, контролирующим количество органов в цветке, относится и ген SUP
(SUPERMAN) (Schultz et al., 1991; Bowman et at., 1992). Мутантный фенотип
sup (Схема 2) проявляется в формировании нескольких кругов тычинок,
количество которых варьирует от 8 до 26 (Bowman et al., 1992). Наиболее четко
проявляющиеся мутантные аллели, такие как sup-1, демонстрируют значительное
увеличение числа тычинок в цветке, сопровождающееся обычно потерей плодолистиков.
Молекулярно-генетические аспекты репродукции 367
Как показал анализ двойных мутантов sup арЗ и sup pi, продукт гена SUP
негативно регулирует экспрессию генов АРЗ и PI в четвертом круге органов цветка. В
соответствии с этим, мутантный фенотип связан с распространением экспрессии
генов АРЗ и PI, в норме экспрессирующихся только во втором и третьем круге, и на
четвертый круг. Ген SUP не определяет идентичность органов цветка во втором и
третьем круге, его активность важна на более поздних этапах для поддержания
границы между этими кругами (Sakai et al., 1995). В то же время образование на
флоральной меристеме нескольких дополнительных кругов, содержащих тычинки,
свидетельствует о недетерминированности флоральной меристемы у мутантных по
гену SUP растений.
Терминация флоральной меристемы может быть нарушена и в случае
возвращения меристемы к более ранней программе развития. Подобное явление связано
с нарушениями в поддержании идентичности флоральной меристемы, которое
требует активности по меньшей мере двух генов, выполняющих и другие важные
регуляторные функции (Okamuro et al., 1996). Такие выводы были сделаны на
основе анализа отдельных случаев реверсии флоральной меристемы, т.е. возврата
меристемы цветка к функционированию по типу вегетативной меристемы.
Подобные реверсии, приводящие к развитию вегетативного побега из цветка, можно
индуцировать путем манипуляций с фотопериодом у растений, мутантных по гену
AG, а также гетерозигот по гену LFY. Как было отмечено выше, ген AG
необходим для установления идентичности генеративных органов цветка и терминации
флоральной меристемы, в то время как ген LFY определяет идентичность
флоральной меристемы во время ее образования и регулирует активность некоторых
гомеозисных генов.
Таким образом, процесс терминации флоральной меристемы тесно связан с
другими событиями в развитии цветка и контролируется при активном участии целого
ряда полифункциональных генов.
Молекулярные механизмы развития цветка
Многие из рассмотренных выше генов принадлежат к консервативной группе
транскрипционных факторов, представленной в геномах не только растений, но и
других групп живых организмов.
Продукты генов АР2, АРЗ, PI и AG являются транскрипционными
факторами. Если белок АР2 представляет собой оригинальный тип транскрипционных
факторов, то продукты генов АРЗ, PI и AG содержат высококонсервативный
ДНК-связывающий MADS-домен. Этот 56-аминокислотный домен получил
свое название по первым буквам четырех генов, кодирующих транскрипционные
факторы с высоко гомологичными ДНК-связывающими доменами (Yanofsky et
al., 1990): МСМХ — дрожжевой ген, контролирующий копийность минихромо-
сом в клетке; AGAMOUS — гомеозисный ген арабидопсиса; DEFICIENS —
гомеозисный ген львиного зева, соответствующий гену АРЗ; SRF — ген
человека, кодирующий регуляторный фактор сыворотки.
Продукты MADS -генов (MADS-белки) не только содержат высоко
консервативный ДНК-связывающий домен, но и имеют сходный план строения. Каждый
из них включает в себя 5 доменов: N-концевой, MADS- (необходим для
специфического связывания с ДНК), (Yanofsky et al., 1990), I- (слабо консервативен,
обеспечивает димеризацию белка), К- (несет сходные с кератинами
последовательности, также отвечающие за димеризацию белка) (Ma et al., 1991; Jack et al., 1992) и
368
Системы репродукции
С-концевой (слабо консервативен, необходим для функционирования). Все
MADS-белки являются димерами. При этом, если продукты генов АР\ uAG
образуют исключительно гомодимеры, то белки АРЗ и PI функционируют только в
виде гетеродимерных комплексов. Именно поэтому мутации арЗ и pi обладают
сходным фенотипическим проявлением.
Имея высоко консервативный ДНК-связывающий домен, все MADS-белки
обладают способностью связываться олигонуклеотидным мотивом CC(A/T)6GG,
получившим название CArG-бокса (Pollock, Treisman, 1990; Wyne, Treisman, 1992).
Действительно, различные MADS-белки арабидопсиса успешно конкурируют друг
с другом in vitro за связывание с одними и теми же нуклеотидными
последовательностями (Riechmann, Meyerowitz, 1997). Вместе с тем, не вызывает сомнений, что
каждому типу MADS-белков свойственна вполне самостоятельная транскрипционная
активность. Для разрешения этого парадокса были созданы химерные конструкции,
в которых С-концевые части генов АР\, АРЗ, PI и AG (включая их I-, К- и
С-домены) были подсоединены к MADS-доменам генов SRF и MEF2 животных.
Несмотря на несколько различные ДНК-связывающие способности белков SRF и
MEF2, продукты обеих химерных конструкций оказались полными
функциональными аналогами нормальных белков API, АРЗ, PI и AG (Riechmann, Meyerowitz,
1997). Таким образом, специфичность действия MADS-белков определяется не
только их ДНК-связывающими доменами. Более того, показано, что продукты
генов АРЗ и PI, а также их гомологов из львиного зева (DEFA и GLO,
соответственно), не способны связываться с ДНК по отдельности, но, образовав гетеродимер,
успешно связываются с последовательностью-мишенью. Недавние молекулярные
исследования показали, что активная форма всех продуктов MADS-генов
представляет собой гомо- или гетеродимер, причем за димеризацию отвечает именно
MADS домен (Riechmann et al., 1996; Riechmann, Meyerowitz, 1997).
Итак, анализ разнообразных мутантов арабидопсиса, проявляющих те или
иные аномалии в развитии цветка, позволил выдвинуть гипотезу о каскадной
регуляции этого процесса на транскрипционном уровне (Схема 4). В частности
исследование гомеозисных мутантов арабидопсиса привело к созданию модели
«ABC». Аналогичные мутанты получены и у другого модельного объекта —
львиного зева (Antirrhinum majus), систематически весьма далекого от
крестоцветных. Этот факт свидетельствует о том, что генетический контроль развития
цветка, по-видимому, универсален (Соеп, 1991; 1992; Coen, Meyerowitz, 1991;
Weigel, Meyerowitz, 1993).
В результате исследований генетического контроля развития цветка стало
очевидным, что эти процессы контролируются большим количеством регуляторных
белков, составляющих очень сложную сеть, в которой различные элементы тесно
взаимодействуют друг с другом. Каждый элемент этой сети может контролировать
сразу несколько процессов. Многие гены, такие как TFL\ и АР\, участвуют в
более чем одном этапе развития цветка, из чего следует, что один и тот же регулятор-
ный белок на разных этапах развития способен взаимодействовать с различными
генами. В соответствии с этим, мутации, затрагивающие различные участки одного
и того же регуляторного гена, могут характеризоваться весьма разнообразным
проявлением. Таким образом, детальное изучение функций подобных генов
невозможно без вовлечения в анализ как можно более широкого круга мутаций,
затрагивающих различные аспекты развития цветка.
Схема 4
Гипотетическая схема каскадного взаимодействия белков, контролирующих процесс
, развития цветка
сигналы
кадастровые
гены
н
\ \ \ \ \
fELFH (СОРП (FY] (lDJ (C0J
X
CAL —► API *>ГАР2)оГи^
Гены позднего и
раннего цветения
Гены,
определяющие тип
меристемы
1
HJFOJ
AGL2
AGL4
AGLS
I
|~арГ] (ар?) г^рГ^рГ^ р~1
Гены -
посредники
Гены, определяющие
тип органов цветка
Гены поздних
этапов развития
Г~1 I J"
чашелистики лепестки тычинки карпелы
| |- MADS-белки
() - транскрипционные факторы других типов
(1 - белки с неизвестными функциями
Жирными квадратами обозначены MADS-белки, кружками - транскрипционные факторы
других типов, восьмиугольниками — белки с неизвестными функциями.
По: Okamuro et al., 1996.
370 Системы репродукции
Bowman et al., 1991 a,b, 1992,1993; Clark et al., 1993,1995,1996; Coen, 1991; Coen, Meyerowitz,
1991; Drews et al., 1991; Goto, Meyerowitz, 1994; Jack et al., 1992,1994; Krizek, Meyerowitz, 1996
a,b; Ma, 1994; Mokamuro et al., 1996; Riechmann et al., 1996 a,b; Riechmann, Meyerowitz, 1997;
Sakai et al., 1995; Sieburth et al., 1995; Theissen et al., 2000; Weigel, 1995; Weigel, Meyerowitz, 1993,
1994; Weigel et al., 1992; Williams et al., 1997; Yanofsky et al., 1990.
THE GENETIC ANALYSIS OF OVULE DEVELOPMENT1
ГЕНЕТИЧЕСКИЙ АНАЛИЗ РАЗВИТИЯ СЕМЯЗАЧАТКА
The ovule is a simply composed but highly differentiated structure. In contrast to the
tremendous knowledge about ovule morphology of a vast number of species (see, vol. 1),
little was known until recently about the genetic and molecular mechanisms controlling its
development. The situation has changed with the advent of Arabidopsis thaliana as a
model system to study plant development at the genetic and molecular level (Somerville,
Meyerowitz, 1994). The ontogenesis of the ovules of Arabidopsis has been studied
genetically and molecularly not simply for their own sake, but also because the ovules
serve as an excellent model system to study organogenesis in plants in general (Reiser,
Fischer, 1993; Angenent, Colombo, 1996; Gasser et al., 1998; Crossniklaus, Schneitz,
1998). This is accompanied by a growing interest in ovules in the context of flower
evolution (see review Endress, 1997). Thus, I will focus largely, though not entirely, on a
summary of our knowledge about the genetic and molecular control of Arabidopsis ovule
development.
Ontogenesis of the Arabidopsis ovule. In recent years a number of labs contributed
to the investigation of Arabidopsis ovule development at the cellular and sub-cellular level
(Webb, Gunning, 1990; Mansfield et al., 1991; Robinson-Beers et al. , 1992 ;
Modrusan et al., 1994; Schneitz et al., 1995; Christensen et al., 1997) and a convenient
staging system has been established (Schneitz et al., 1995).
Stage 1 defines the early initiation and outgrowth phase of ovule ontogenesis. About
40-60 ovules per gynoecium originate as finger-like protrusions along the placenta. At
early stage 2 the archesporial cell becomes visible as a subepidermally located enlarged
cell at the apex or nucellus. The archesporial cell directly gives rise to the megaspore
mother cell which will eventually undergo meiosis at the end of stage 2.
Gametophyte development takes place during stage 3 following the Polygonum-type
of embryo sac development (Willemse, van Went, 1984). Only the bottom-most of the
tetrad of megaspores will continue development and form the uninucleate embryo sac.
The others experience cell death. The uninucleate embryo sac undergoes three rounds of
mitotic divisions followed by cellularization. The mature embryo sac consists of the two
synergids and the egg cell at the micropylar end, the large binucleate central cell, and three
antipodal cells at the chalazal pole.
During early to mid-stage 2 an inner and an outer integuments are initiated from the
epidermal cell layer flanking part of the subnucellar region (chalaza). The integuments
eventually envelop the nucellus, leaving open only a small cleft, the micropyle, through
which the pollen tube enters during the fertilization process. The outer integument
I thank P. Endress, U. Schiefthaler and Marcella Trembley for critical reading of the manuscript.
Work in my lab is funded by the Swiss National Science Foundation and by the Kanton of Zurich.
Молекулярно-генетические аспекты репродукции
371
experiences asymmetric growth with the posterior (abaxial, see below) side undergoing
more extensive cell division and cell elongation. The ovule therefore will exhibit a
characteristic kink (anatropy) with the micropyle situated next to the developing funiculus
(Gifford, Foster, 1989). Within the funiculus the vascular strand develops, reaching
maturity at the end of stage 3.
In summary, the ovule of Arabidopsis thaliana is tenuinucellate and carries a
Polygonium-type embryo sac. It is bitegmic and campylotropic at fertilization. The
campylotropy changes to amphitropy during the early postfertilization phase.
Fundamental processes controlling ovule development. It has been reasoned, that
for ovule development to occur, several processes have to take place: initiation and
outgrowth, specification of identity, pattern formation and eventually morphogenesis
(Schneitz et al., 1995). One can formally regard them as independent processes.
However, they obviously also have to be coordinated in a spatial and temporal manner,
and they can take place a number of times. For example, cell fate decisions have to happen
repeatedly during integument development, megasporogenesis and megagametogenesis.
In this context it is worth mentioning that growth control is of particular importance in
plant organogenesis (Meyerowitz, 1997). As a rule, plant cells or cell populations do not
move relative to each other. Thus, the size, pattern and shape of the ovule will be largely
achieved through the regulation of the timing and spatial patterns of cell divisions and cell
shape changes. This is also reflected by the results of the genetic analysis.
Identity. Culture experiments in tobacco indicated that the commitment to ovular fate
undergoes sequential restrictions from first gynoecial to second ovular fate (Evans,
Malmberg, 1989) , and that commitment takes place after the primordia are detectable
but before morphological signs of nucellar and integument development emerge.
As it is the case for other floral organs (Coen, Meyerowitz, 1991; Ma, 1994; Weigel,
Meyerowitz, 1994) genes encoding MADS-domain transcription factors regulate ovule
fate (Angenent et al., 1995; Colombo et al., 1995). In Petunia, simultaneous
cosuppression of two probably redundant genes, floral binding protein 7 (FBP7) and
FBP11, results in carpelloid tissue in place of ovules (Angenent et al., 1995). Ectopic
expression of FBPW suffices to lead to the occurrence of ectopic ovules in certain regions
of the perianth (Colombo et al., 1995). It was also observed that ectopic expression of С
function activity (regulating carpel identity (Coen, Meyerowitz, 1991; Weigel,
Meyerowitz, 1994)) in tobacco can lead to the development of carpelloid tissue from the
placenta (Mandel et al., 1992). Taken together, these findings suggested the possibility
that genes like FBP1/11 regulate ovule fate by repressing carpel identity genes in the
ovule. However, the two С function genes of Petunia, FBP6 and pMADS3 (Angenent
et al., 1993; Tsuchimoto et al., 1993), are also expressed during wild-type ovule
development and seem not to be under the control of FBP1 /\\ (Angenent et al., 1995).
It was therefore suggested that the balance of С function and FBP1 /\\ activities is critical
(Angenent et al., 1995). In this context, one possibility includes competition between the
proteins (Angenent et al., 1995). On the other hand, MADS domain proteins form
dimers or heterodimers (Mueller, Nordheim, 1991; Schwarz-Sommer et al., 1992;
ТгцЬпег et al., 1992; Pellegrini et al., 1995; Shore, Sharrocks, 1995), and certain
heterodimeric combinations are unable to bind DNA in vitro (Riechmann et al., 1996).
Thus, the phenotype following overexpression of С function genes could be due to excess
amounts of С function factors simply titrating-out ovule identity factors like FBP1 and
FBP11 by forming non-functional heterodimers.
372
Системы репродукции
Several MADS box genes are expressed in the ovule (Ma et al., 1991; Rounsley et
al., 1995; Savidge et al., 1995), but true Arabidopsis orthologues of FPB7 and FBP11
have not yet been isolated. However, the floral homeotic geneAPETALA2 (AP2) may
contribute to the control of ovule fate because carpelloid outgrowths, in place of ovules,
occur in particular ap2 mutants (Modrusan et al., 1994). The API locus encodes
another putative transcription factor with two so-called AP2 domains (Jofuku et al.,
1994; Weigel, 1995).
The ovule is a modular structure (see below) and the identity of certain elements of
the ovule appears to be regulated separately. Evidence comes from the phenotype of
mutants defective in BEL\ function (Robinson-Beers et al., 1992; Modrusan et al.,
1994; Schneitz et al., 1997). The primary defect in bell mutants is restricted to the
chalaza. In be/1 mutants no inner integument develops and instead of the outer
integument a collar-like protrusion forms indicating that BEL\ controls outer
integument identity. The outgrowths can develop carpelloid features at very late stages
expressing the Arabidopsis С function gene AGAMOUS (AC) (Modrusan et al.,
1994; Ray et al., 1994). It was therefore suggested that BEL\ exerts a cadastral
function and prevents the misexpression of AC in the ovule (Modrusan et al., 1994;
Ray et al., 1994). However, the situation is again more complex. AG is expressed in the
ovule throughout its development. Its RNA expression pattern overlaps with the one of
BEL\ (Bowman et al., 1991a; Reiser et al., 1995), indicating that BEL\ is not a
transcriptional regulator of AG. The BEL\ locus encodes a putative homeodomain
transcription factor (Reiser et al., 1995). It is still possible that the BEL\ and AG
proteins interact, as do other MADS domain and homeodomain transcription factors
(Gehring et al., 1994; Shore, Sharrocks, 1995). It is, however, unclear whether AG
plays a role in ovule development after all, because ovules develop in ap2-2 ag double
mutants (Bowman et al., 1991b), and overexpression of AG does not lead to the
formation of carpels in place of ovules (Mizukami, Ma, 1992).
Initiation and outgrowth. In Arabidopsis the AINTEGUMENTA (ANT) gene
controls floral organ initiation, growth and shape in general (Elliott et al., 1996; Klucher
et al., 1996; Baker et al., 1997; Schneitz et al., 1997). The ANT locus encodes a
putative transcription factor with two domains that share homology with AP2 (Elliott et
al., 1996; Klucher et al., 1996). In ant mutants the number of ovules per carpel is
reduced by half and the ovules are separated by wider spaces. This indicates that ANT,
besides its other functions, is required for ovule primordium initiation and/or outgrowth.
The ovules that are produced form a nucellus, chalaza and funiculus but lack integuments
and an embryo sac. Because such a phenotype is produced even by putative null-alleles
(Elliott et al., 1996; Klucher et al., 1996), it suggests that partially redundant factors
regulate this process.
It has recently been shown that the HUELLENLOS (HLL) gene (Schneitz et al.,
1997) encodes such an ovule-specific redundant function (Schneitz et al., 1998). The
phenotype of hll mutants is restricted to the ovule and is not identical but very similar to
ant mutants. The analysis of hll ant double mutants reveals best a function of HLL in
ovule primordium outgrowth. The number of ovules in plants defective for HLL and
ANT activities is not obviously different from ant single mutants. However, the double
mutants bear ovules that are drastically reduced in their longitudinal axis. The effect is
restricted to the subnucellar region (see also below). It implies that within this domain
HLL and ANT control ovule primordium outgrowth in a partially redundant fashion.
Молекулярно-генетические аспекты репродукции
373
This is supported by in situ hybridization studies which indicate that HLL does not act
as a transcriptional regulator of ANT. It is possible that in the absence of HLL a
threshold level of required ANT activity is higher. Alternatively, the two proteins may
interact directly.
Pattern formation. Pattern formation controls the spatial arrangement of distinct
regions with different cell fates (i.e., pattern elements) within an organ or an entire
organism (Waddington, 1962, 1973; Wolpert, 1971).
One can discriminate several such elements, based on morphological criteria, along a
longitudinal or proximal-distal axis of the ovule (Schneitz et al., 1995). Distally, the
nucellus is characterized by the presence of a megaspore mother cell, and eventually a
tetrad and embryo sac. Centrally, the chalaza is recognized as the region which initiates
the two integuments at its flank. The funiculus, as the proximal element, harbors the
vascular strand. This linear arrangement of at least three distinct morphological units
along the P-D axis is obviously not unique to Arabidopsis but is a typical feature of a
generalized ovule (Esau, 1977; Bouman, 1984; Gifford, Foster, 1989). Therefore, it
was suggested that they actually correspond to distinct proximal-distal pattern elements
(Schneitz et al., 1995). These elements are recognizable by early to mid-stage 2, hence,
they must be laid down during stage 1. It is noteworthy that an implicit consequence of this
hypothesis is the concept of an ovule as a modular structure.
There is also an anterior-posterior (A-P) axis (adaxial-abaxial), perpendicular to
the P-D axis, as indicated by the mode of integument initiation and the unequal
distribution of growth along this axis within the ovule and the outer integument (Gaiser
et al., 1995; Baker et al., 1997). Furthermore, the vascular strand is placed more
anteriorely within the funiculus. Interestingly, all the ovules within a carpel are oriented
with their anterior side pointing towards the stigma, suggesting that the establishment of
the A-P axis requires cues from outside the ovule.
Progress on the identification of genes that directly function in the establishment of the
pattern elements has been scarce. However, indirect evidence for a pattern formation
process is accumulating. For example, the BEL\ expression pattern provides molecular
evidence for the existence of the central or chalazal element (Reiser et al., 1995). At late
stage 1 it becomes restricted to a band located at the center of the primordium. In
addition, the region-specific defects of many early-acting ovule genes argue in favor of the
presence of such a patterning process (Schneitz et al., 1997). The analysis of INNER
NO OUTER (INO) suggested the presence of a fourth element along the
proximal-distal axis (Baker et al., 1997). In ino mutants outer integument development
does not proceed beyond the initial subepidermal cell divisions and epidermal cell
enlargements. In addition, they occur at the anterior side as opposed to the normal
posterior side. Because of this polarity shift in the mutant, INO could perhaps play a
direct role in establishing the A-P polarity of this pattern element. In addition, mutations
in SUPERMAN (SUP) (Bowman et al., 1992; Sakai et al., 1995), also known as
FLOW (Schultz et al., 1991), specifically lead to a defect in the anterior domain of the
outer integument (Gaiser et al., 1995).
The polarity of pattern formation. As outlined above, the hll ant double mutant
specifically fails to form the subnucellar region. More specifically, the funiculus is
always absent, the chalaza is variably affected and the nucellus is always present. This
finding suggests a qualitative difference between these elements and supports the
modular concept of an ovule (Schneitz et al., 1998). Interestingly, the nucellus is
374
Системы репродукции
produced even in the absence of a funiculus and chalaza. This also indicates that the
nucellus forms as an independent element. Furthermore, pattern formation takes place
progressively, beginning at the distal end of the primordium. The nucellus is built first,
followed by the chalazal and funicular elements. If the orientation of the progression of
pattern formation were the opposite, then one would expect a funiculus to be leftover.
However, this is not the case.
What then regulates the formation of the nucellus? There is a separate process,
regulated by the NOZZLE (NZZ) gene, which controls the formation of the nucellus
(Schiefthaler, Redweik, Schneitz, unpubl. results).
Morphogenesis and cellular differentiation. A number of genes has been identified
that seem to regulate growth and morphogenesis in response to specification and pattern
formation. They primarily affect the integuments. Results indicate that at least two levels
of control exist; some genes are required for the initiation of the integuments, some for
subsequent steps of morphogenesis. With respect to the latter class of genes, analysis is
still in its infancy and generalizations cannot be made yet. However, a complex scenario of
multiple distinct steps controlling morphogenesis is suggested.
Several loci have an early central role in the initiation of the integuments. As already
discussed, HLL and ANT are partially redundant factors that control ovule primordium
outgrowth. They are also required for the initiation and/or growth of the integuments
(Elliott et al., 1996; Klucher et al., 1996; Baker et al., 1997; Schneitz et al., 1997) .In
addition, both are necessary for the formation of the outgrowths in bell mutants (Klucher
et al., 1996; Baker et al., 1997; Schneitz et al., 1998). It is therefore likely that both play
a general role in cell proliferation processes in the ovule.
Mutations in three genes lead to the absence of specific structures within the chalaza.
Besides the effects on the outer integument be/1 mutants lack an inner integument.
ABERRANT TESTA SHAPE (ATS) is responsible for the formation of the boundary
region between the two integuments (Leon-Kloosterziel et al., 1994) and INO directly
or indirectly for outer integument development (Baker et al., 1997; Schneitz et al.,
1997). The ino phenotype indicates that inner integument development is independent of
the presence of an outer integument. The existence of an inter-integumentary boundary
region seems essential for this independence, because ats ino double mutants do not
develop an inner integument (Baker et al., 1997).
Only one gene is known, UNICORN (UCN), that seems to have a suppressory role.
A small extra bump is formed in ovules of ucn mutants which could represent a partial
supernumerary integument (Schneitz et al., 1997).
A number of loci are involved in the control of morphogenesis of the integuments
themselves, where they regulate cell proliferation and/or cell shape (Robinson-Beers
et al., 1992; Gaiser et al., 1995; Schneitz et al., 1997). Mutations in these genes do
not result in the absence but rather in altered shapes and sizes of the integuments.
Loci such as STRUBBELIG (SUB), SHORT INTEGUMENTS 1 (SIN\),
BLASIG (BAG) or SUPERMAN (SUP) most likely act after, for example HLL,
ANT or INO. In some instances this is corroborated by double mutant analysis
(Baker et al., 1997). The defects may be quite specific, either with respect to the
location, or, the process which is affected. For.example, in the case of sup mutants
only cell proliferation in the anterior domain of the outer integument is enhanced
leading to cup-shaped integuments (Gaiser et al., 1995). SIN\ specifically controls
cell shape (Robinson-Beers et al., 1992; Lang et al., 1994), and sinl mutants carry
Молекулярно-генетические аспекты репродукции 375
ovules with drastically reduced integuments. The defects in SUB or BAG affect both
cell proliferation and cell shape (Schneitz et al., 1997).
As might be expected for genes with a general function in morphogenesis, members of
the this class usually exhibit pleiotropic activities. A role for the zinc-finger putative
transcription factor SUP in the control of cell proliferation is also assumed for its early
function in floral organ specification (Bowman et al., 1992; Sakai et al., 1995). SIN\
does not only appear to regulate cell shape in the ovule, but has a number of different
functions as well (Ray et al., 1996a,b) including a possible role in cell to cell
communication. In the case of bag or sub mutants the entire plant is shorter and bushier
(Schneitz et al., 1997). This again suggests similar functions for the two genes
throughout post-germination development.
Gametogenesis. Compared to other areas of ovule development, little is known about
megasporogenesis or megagametogenesis at the functional level.
As outlined above, megasporogenesis takes place in the nucellus (sporangium). A
number of cells exist within the first subepidermal, or Ц, (Satina, Blakeslee, 1941; Satina,
1945), cell layer. However, in most angiosperms only one of these cells will give rise to an
archesporial cell, which then directly differentiates into the megaspore mother cell
(Gifford, Foster, 1989). This cell will undergo meiosis and eventually generate the
embryo sac. The first step of megasporogenesis thus consists of the singling out of the
megaspore mother cell within a hypodermal cell population. A maize gene, MAC\, was
recently identified which appears to control this process (Sheridan et al., 1996). In
MAC\ mutants, several hypodermal cells in the first subepidermal cell layer will develop
into megaspore mother cells, which will also undergo meiosis. The MAC! locus is
therefore likely to be a component of an inhibitory system, which suppresses the switch to
the meiotic fate in all other L2 cells except the developing megaspore mother cell. An
interesting aspect is that apparently most, if not all L, cells have the capacity to enter the
meiotic pathway (Sheridan et al., 1996).
A number of mutants in other species has also been characterized to some degree
including mutants defective in meiosis or cytokinesis (Hanna, Powell, 1974; Kennell,
Horner, 1985; Benavante et al., 1989; Golubovskaya et al., 1992). A large number of
mutations causing male and female sterility has recently been isolated in Arabidopsis
(Schneitz et al., 1997). They also seem to be specific to spore formation, because the
developmental block in all of them takes place at or before the appearance of the
uninucleate embryo sac.
What about the female gametophyte? A large number of genes is apparently involved in its
development (Patterson, 1994; Vollbrecht, Hake, 1995). In contrast, there are very few
reports on specific female gametophytic mutants in the literature. In Arabidopsis, one mutant,
g/, has been described (Redei, 1965) which carries a doublet of embryo sacs. A second
female gametophytic mutation, lethal ovulel, is known from maize (Nelson, Clary, 1952). It
disrupts the nuclear division cycle during embryo sac development (Sheridan, Huang, 1997).
An important question concerns the relative contribution of the gametophytic and
sporophytic genomes to embryo sac development. There is genetic evidence that embryo
sac ontogenesis is controlled by a combination of female gametophytically as well as
sporophytically active genes. The integuments play a key role (Reiser, Fischer, 1993),
but, regardless of the integuments, the sporophytic genome has an effect on gametophyte
development. This is indicated by, for example the indeterminate gametophyte (ig)
mutant of maize (Kermicle, 1971; Lin, 1978; Huang, Sheridan, 1996), the macl mutant
Fig. 23. The genetic analysis of ovule development.
Рис. 23. Генетический анализ развития семязачатка.
1 - Wild-type ovule development m Arabidopsis thaliana: A-C. Optical sections through whole-mount ovules on a different stages of its development (St.l—II,
St.2—V and St.4—V). The corresponding stages are indicated. D. Scanning electron micrograph of an ovule at the same stage as in С. Е. Highly schematized view
of the two main axes of polarity. A distal (D), central (C) and proximal (P) element are laid down during stage St.l — II. They will develop into the nucellus,
chalaza and funiculus, respectively. Note the anterior location of the developing vascular strand in the funiculus.
Fig. 23 (continued).
2 - scanning electron micrographs of mature (St.4-V) ovules of several different ovule mutants. A. ant. No integuments develop beyond some enlarged epidermal
cells in the region of the outer integument. B. ant hll double mutant. Note the variably shortened extension of the ovules. The short stubs carry a megaspore mother
cell, indicating that they are nucelli. The tissue that sometimes appears beneath the nucellus (like in the ovule in the center) can express ВЕЫ, showing that it
possesses chalazal properties. C. sub. The arrow indicates the protrusions that develop from the distal end the outer integument in this mutant. D. bag. Many
enlarged, bulbous cells are visible (arrow). No structured integuments. Abbreviations: ap - antipodal cells, cc - central cell, ch — chalaza, ec- egg cell, et —
endothelium, /и — funiculus, ii - inner integument, nu — nucellus, oi - outer integument, oir — outer integumentary ridge, syn — synergid, tet — tetrad, vs - vascular
strablnd. Scale bars, 20 mm.
After Schneitz et al., 1998.
378
Системы репродукции
(Sheridan et al., 1996), and the embryo sac-defective (emd) class of mutants in
Arabidopsis (Schneitz et al., 1997).
Outlook. The last couple of years have witnessed a remarkable increase in our
understanding of the molecular and genetic basis of ovule development. While much work
has still to be done, a solid framework for further studies is now built. Much of the
functional analysis has been carried out in Arabidopsis, but impressive results have also
been obtained from studies of several other species, in particular Zea and Petunia. Taking
into account the increased interest of plant systematists in ovules as well, we may hopefully
be able to discern the fundamental properties of ovule development, shared by even
remotely related species, in the not so distant future. Fig. 23.
Angenent, Colombo, 1996; Angenent et al., 1993, 1995; Baker et al., 1997; Benavante et al., 1989;
Bouman, 1984; Bowman et al., 199la,b, 1992; Christensen et al., 1997; Coen, Meyerowitz, 1991;
Colombo et al., 1995; Elliott et al., 1996; Endress, 1997; Esau, 1977; Evans, Malmberg, 1989; Gasser
et al., 1995; Gaiser et al., 1998; Gehring et al., 1994; Gifford, Foster, 1989; Golubovskaya et al., 1992;
Grossniklaus, Schneitz, 1998; Hanna, Powell, 1974; Huang, Sheridan, 1996; Jofuku et al., 1994;
Kennell, Horner, 1985; Kermicle, 1971; Klucher et al., 1996; Lang et al., 1994; Leon-Kloosterziel et al.,
1994; Lin, 1978; Ma, 1994; Ma et al., 1991; Mandel et al., 1992; Mansfield et al., 1991; Meyerowitz,
1997; Mizukami, Ma, 1992; Mordusan et al., 1994; Mueller, Nordheim, 1991; Nelson, Clary, 1952;
Patterson, 1994; Pellegrini et al., 1995; Ray et al., 1994,1996 a,b; Redei, 1965; Reiser, Fischer, 1993;
Reiser et al., 1995; Riechmann et al., 1996; Robinson-Beers et al., 1992; Rounsley et al., 1995; Sakai et
al., 1995; Satina, 1945; Satina, Blakeslee, 1941; Savidge et al., 1995; Schneitz et al., 1995, 1997,1998;
Schultz et al., 1991; Schwarz-Sommer et al., 1992; Sheridan et al., 1996; Sheridan, Huang, 1997; Shore,
Sharrocks, 1995; Somerville, Meyerowitz, 1994; Trobner et al., 1992; Tsuchimoto et al., 1993;
Vollbrecht, Hake, 1995; Waddington, 1962, 1973; Webb, Gunning, 1990; Weigel, 1995; Weigel,
Meyerowitz, 1994; Willemse; van Went, 1984; Wolpert, 1971.
ГАМЕТОФИТНЫЕ МУТАЦИИ
Гаметофитные мутации — условно выделенная группа мутаций,
затрагивающих признаки микро- и/или мегагаметофита. К этой группе также следует
относить мутации, проявляющиеся на стадиях спорогенеза, поскольку, как
правило, они приводят к структурным или геномным изменениям гаметофита.
Гаметофитные мутации подобно прочим мутациям могут быть спонтанными или
индуцированными, моно- или полигенными, доминантными или рецессивными.
Спецификой гаметофитных признаков является то, что они могут контролироваться
генотипом как материнского спорофита, так и гаметофита. В последнем случае
понятие доминантности и рецессивности неприменимо к диплоидам, поскольку
вследствие мейоза генотип гаметофита представлен одинарным набором генов.
Степень изученности гаметофитных мутаций далеко не одинакова. Фенотипи-
ческий эффект некоторых из них достаточно четко идентифицирован, им
присвоены генетические символы, а в ряде работ приводятся данные о хромосомной
локализации генов. В других же случаях лишь констатируется достоверный или
предположительный характер наследственной природы фенотипического изменения
гаметофита или предшествующих ему структур.
Мутации, проявляющиеся на стадии спороцита. Зарегистрированы
мутации, при которых вследствие нарушения предмейотических митозов формируются
спороциты с измененными числами хромосом или с увеличенным числом ядер. К
Молекулярно-генетические аспекты репродукции
379
этому классу также относятся мутации, вызывающие образование дополнительных
спороцитов, способных в дальнейшем преобразовываться в зародышевые мешки.
В частности, у Nigella sativa описана индуцированная мутация, вызывающая
нарушения предмейотических митозов в пыльниках. Это приводит к хромосомной моза-
ичности в микроспороцитах и как следствие — нарушению протекания мейоза и
формированию стерильной пыльцы (Datta, Biswas, 1985). У Hordeum vulgare
индуцирована мутация, вызывающая образование многоядерных микроспороцитов в
пыльниках верхушечных частей колоса. Дальнейшее развитие (спорогенез и
образование пыльцевых зерен) проходило на основе ценоцитных или, в случае слияния
ядер, полиплоидных клеток. Мейотические аномалии, обусловленные этим
состоянием ядер, приводили к полной стерильности пыльцы (Sethi et al., 1983). У Zea
mays описано образование многоядерных микро- и мегаспороцитов (мутация
рат\), дальнейшее развитие которых протекало с аномалиями и завершалось
мужской и женской стерильностью (Голубовская и др., 1994, Voronova, Batygina,
1997; Воронова, 1998, 1999). Другая мутация у Zea mays (lar-487= mac 1)
характеризуется наличием множественного археспория в семязачатках — до 25
мегаспороцитов асинхронно развивались в моно- и биспорические зародышевые
мешки. Конечной стадии достигали 1-2 зародышевых мешка (Golubovskaya et al.,
1993,1995; Батыгина и др., 1994, Sheridan et al., 1996; Voronova, Batygina, 1997;
Батыгина, Воронова, 1999; Воронова, 1999). У мутантной линии АС-1 Sorghum
bicolor зарегистрирована способность клеток нуцеллуса, расположенных рядом со
спороцитом или производными от него структурами, развиваться в
дифференцированные либо ценоцитные зародышевые мешки (Enaleeva et al., 1994). Апоспория,
свойственная некоторым апомиктичным видам и проявляющаяся в наследственно
обусловленной тенденции к индукции клеток к гаметофитогенезу (Ноглер, 1990),
также относится к этому классу мутаций.
Мутации, проявляющиеся на стадии спорогенеза. Известно большое число
мутаций, вызывающих изменения в цитокинезе и поведении хромосом на разных
стадиях мейоза. Часто эти мутации носят название мейотических (меймутаций). У
ряда видов (Zea mays, Secale cereale, Pisum sativum, Oryza sativa) хорошо
изучено большое число меймутаций и на их основе составлены генетические коллекции
(Gottschalk, Kaul, 1974; Голубовская, 1975; Kitada et al., 1983; Соснихина и др.,
1994). У многих других видов индуцированы единичные мутации, аналогичные
зарегистрированным у вышеназванных объектов.
В зависимости от характера проявления выделены группы мутаций,
вызывающих: отсутствие мейоза, выпадение первого или второго деления мейоза,
слипание хромосом, нарушения конъюгации хромосом (асинаптические и де-
синаптические), веретена деления, цитокинеза и мейотического цикла
(Gottschalk, Kaul, 1974, 1980а, Ь; Голубовская, 1975; Kaul, Murthy, 1985;
Соснихина и др., 1994).
Наиболее часто регистрируемым эффектом большинства меймутаций
является блокирование или аномальное развитие постмейотических структур и в
конечном итоге — дегенерация гаметофита (Gottschalk, Kaul, 1974; Голубовская,
1975; Kaul, Murthy, 1985).
Другим возможным проявлением меймутаций является изменение плоидности
гамет, в частности, возникновение нередуцированных гамет. Эти мутации
представляют особый интерес, во-первых, потому, что широко используются для по-
380
Системы репродукции
лучения «мейотических» полиплоидов, во-вторых — с ними связано явление ди-
плоспории у апомиктов. Установлено, что отсутствие редукции может быть
обусловлено меймутациями, приводящими к образованию реституционных ядер во
время первого или второго деления, а также мутациями, вызывающими
выпадение второго деления мейоза. При этом от способа возникновения
нередуцированных гамет зависит их генетическая характеристика. В том случае, если первое
деление осуществляется по типу реституционного, образуются диплоидные
гетерозиготные споры, а затем гаметы, генетически идентичные спорофиту. Это
наблюдается при некоторых формах апомиксиса. В случае кроссинговера
возможны отклонения от генотипа родительской формы. Выпадение второго
деления или формирование реституционных ядер во время второго мейотического
деления ведет к образованию преимущественно гомозиготных диплоидных гамет
(Hermsen, 1984; Werner, Peloquin, 1987).
Еще один механизм формирования реституционных ядер у видов с
симультанным типом цитокинеза основан на параллельной или триполярной конфигурации
веретен в анафазе 2, приводящей к образованию соответственно диад и триад
микроспор. Обе споры диады — диплоидные, в триаде — одна спора диплоидная.
Образованные таким путем нередуцированные гаметы в генетическом отношении
эквивалентны гаметам, возникающим в результате первого реституционного
деления. Мутации (ps, rp), вызывающие нарушение ориентации веретен деления,
описаны для Beta vulgaris (Малюта, 1980), Trifolium pratense (Parrott, Smith, 1984),
Medicago sativa (Vorsa, Bingham, 1979), Solanum tuberosum (Conicella et al.,
1996), Lotus tenuis (Rim, Beuselinck, 1996) и др.
К образованию реституционных ядер во время первого деления мейоза в микро- и
в мегаспорогенезе также могут приводить синаптические мутации (Hermsen, 1984).
Мутации, вызывающие выпадение второго мейотического деления и
приводящие к образованию гомозиготных нередуцированных гамет, зарегистрированы у
ряда видов. Среди них мутация tri у Hordeum vulgare (Finch, Bennet, 1979) и
мутация el у Zea mays, затрагивающие лишь мегаспорогенез (Rhodes, Dempsey, 1966).
У Datura stramonium мутация dy, вызывающая выпадение второго мейотического
деления, одинаково проявляется в микро- и мегаспорогенезе и ее последствием
является формирование зародышевых мешков и пыльцевых зерен типичного
строения, но с удвоенным числом хромосом в ядрах (Satina, Blakeslee, 1935). У Solanum
tuberosum выделены клоны с выпадением второго мейотического деления при
формировании мегаспор (Stelly, Peloquin, 1986).
Возникновение 2п-, а в ряде случаев 4п-гамет, может быть обусловлено
мутациями, вызывающими нарушения цитокинеза после первого и/или второго
делений мейоза. В частности, такие мутации (msl и ms4) выделены у Glycine max. При
выпадении цитокинеза формируются ценоцитные микроспоры, из которых
развиваются способные к прорастанию гигантские пыльцевые зерна (Graybosch, Palmer,
1985; Chen et al., 1987). У mslmsl -растении выпадение цитокинеза проявляется
также в женской генеративной сфере. Установлено, что ядра в ценомегаспорах
могут сливаться, и в дальнейшем из таких спор развиваются диплоидные
зародышевые мешки, которые иногда могут содержать увеличенное число элементов.
Образование в семязачатках мутантов диплоидных зародышевых мешков или
зародышевых мешков с дополнительными элементами является причиной появления в их
потомстве полиплоидов, гаплоидов, близнецов (Chen et al., 1985; Cutter, Bingham,
Молекулярно-генетические аспекты репродукции
381
1977; Kennel, Horner, 1985). Сходные мутации выделены у Medicago sativa (jp)
(McCoy, Smith, 1983; Pfeifer, Bingham, 1983; Mariani et al., 1993; Calderini,
Mariani, 1995), Zea mays (va) (Beadl, 1931), Kniphofia (Moffett, 1939). Однако в
двух последних случаях мутация проявлялась лишь в микроспорогенезе.
Одним из возможных генетических последствий меймутаций, наряду с
формированием нередуцированных или тетраплоидных гамет, является анеуплоидия.
Показано, что анеуплоиды могут возникать в потомстве синаптических мутантов как
результат неравного распределения хромосом в мейотических делениях (Uchino,
Tanaka, 1995). У мутантов с нарушениями в образовании синаптонемного
комплекса установлены отклонения в строении зародышевых мешков. В частности, у аси-
наптического мутанта Glycine max зародышевые мешки были уменьшенного
размера с нетипичной структурой ядер и клеток и в дальнейшем дегенерировали
(Benaventeetal., 1989).
Мутации, проявляющиеся на стадии микрогаметофитогенеза.
Идентифицирован ряд мутаций, затрагивающих развитие пыльцевого зерна от стадии
тетрады микроспор до образования спермиев в зрелом пыльцевом зерне. Наиболее
известные из них вызывают остановку развития на стадии одноядерных микроспор и
последующую их дегенерацию. Часто эти мутации (ms, rf) проявляются у растений
с определенным типом стерильной цитоплазмы (S). Такой тип мужской
стерильности носит название ядерно-цитоплазматической (ЦМС). Блокирование развития
пыльцы в этом случае обычно происходит вследствие нарушения
функционирования тапетального слоя пыльника, хотя не исключаются дополнительные причины
(Gottschalk, Kaul,1974; Френкель, Галун, 1982). Фенотипически сходное
проявление мужской стерильности, но без участия S-цитоплазмы (генная мужская
стерильность) обнаружено у разных видов. Обычно эти мутации обозначаются
символом ms. У Zea mays и Lycopersicon esculentum выявлено около 40 таких генов, у
Hordeum vulgare — 19 (Резникова, 1984). Такие мутации можно получать после
воздействия различными мутагенными факторами (Крупное, 1973).
Поскольку у диплоидов после завершения мейоза ядра микроспор содержат
одинарный набор хромосом, экспрессия мутантных генов происходит при гемизи-
готном состоянии генотипа, и, следовательно, все мутации (даже рецессивные)
могут быть выявлены. К числу мутаций Zea mays, контролируемых гаметофитным
геномом, относятся: мутация vox, вызывающая образование восковидного типа
крахмала в пыльцевых зернах (Nelson, 1962), мутация алкоголь-дегидрогеназы
(Adh) (Freeling, 1977), мутация gaMSA, экспрессирующаяся во время или сразу
после первого митоза в микроспоре и блокирующая последующее развитие
пыльцевого зерна (Sarigorla et al., 1996). Установлено, что размер и способность к
прорастанию пыльцевых зерен, рост пыльцевых трубок и их метаболические
характеристики также имеют гаметофитную регуляцию (Johnson et al., 1976). У ряда видов
установлена серия аллелей S, ответственных за гаметофитную или
гаметофитно-спорофитную несовместимость (Lewis, 1954). У некоторых линий
Solanum phureja обнаружена мутация, препятствующая делению генеративной
клетки в пыльцевой трубке, что ведет к одинарному оплодотворению и гаплоидии
(Montelongo-Escobedo, Rowe, 1969).
Мутационной изменчивостью, по-видимому, объясняется диморфизм пыльцевых
зерен по числу пор. В частности, у разных генотипов Nicotiana tabacum обнаружены
трех- и четырехпоровые пыльцевые зерна (Till-Bottraud et al., 1995). Появляющиеся
382
Системы репродукции
при химическом мутагенезе пыльцевые зерна тетраэдрической формы (как результат
слияния нескольких микроспор) yAnethum graveolens также обусловлены, вероятно,
соответствующим генетическим изменением (Raghuvanshi, Joshi, 1965).
У кукурузы получена линия ЗМС-8 с мутацией, вызывающей
функциональную дефектность (пока неизвестной природы) одного или обоих спермиев
пыльцевой трубки, препятствующую нормальному осуществлению двойного
оплодотворения. Вследствие этого в зародышевом мешке может осуществляться одинарное
оплодотворение (яйцеклетки или центральной клетки). Во втором случае нормально
развивающийся эндосперм стимулирует партеногенез гаплоидной яйцеклетки
(Тырнов, Завалишина, 1984; Еналеева и др., 1997).
Мутации, проявляющиеся на стадии мегагаметофитогенеза. К этой
группе относится мутация рат2 у кукурузы, вызывающая цитокинез после
каждого митотического деления мегаспоры, в результате чего вместо восьмиядер-
ного ценоцита формируются гаплоидные одноядерные клетки. В мужской
генеративной сфере мутация рат2 проявляется в множественных нарушениях мейо-
за (Голубовская и др., 1994).
Выделена также мутация ig у кукурузы, проявляющаяся в формировании
зародышевых мешков аномального строения. Среди них большую группу составляют
зародышевые мешки с увеличенным числом элементов (Lin, 1978,1981).
Показано, что причиной появления многоклеточных зародышевых мешков являются
дополнительные митозы на ценоцитной стадии, которые, в свою очередь,
обусловлены нарушениями цитоскелета (Huang, Sheridan, 1996; Еналеева и др., 1998).
Плейотропным эффектом мутации ig является мужская стерильность, полиэмбрио-
ния и возникновение гаплоидов, преимущественно андрогенных (Kermicle, 1971).
Несколько мутаций, проявляющихся в изменении числа элементов в
зародышевых мешках, выделено у Nicotiana tabacum. В частности, одна из них (линия
БГ-141.4) характеризуется формированием дифференцированных моно- или
биполярных зародышевых мешков с уменьшенным числом ядер и клеток (Enaleeva,
1992, 1997). Частота появления таких зародышевых мешков у разных растении
линии варьирует от 0 до 72%. У линии М-2 в нескольких поколениях проявляется
признак увеличенного числа клеток в зародышевом мешке за счет дополнительных
митозов. Частота многоядерных зародышевых мешков у разных растений
варьирует в широких пределах и может составлять более 70%. Две другие линии М-3 и
М-4 отличаются высокой частотой (до 90%) ценоцитных малоядерных
зародышевых мешков (Enaleeva, 1992).
Мутация 161 у Zea mays вызывает блокаду развития на одно-, двух и четырехъ-
ядерной стадиях развития, при этом в некоторых случаях ядра становятся
значительно увеличенными в размерах (Sheridan, Huang, 1997). Сходные мутации
зарегистрированы у Arabidopsis thaliana. Показано, что мутации g/, g/al, gfa, feml,
/em3 блокируют развитие мегагаметофита на одноядерной стадии (Christensen et
al., 1997; Drews etal., 1998); мутации hdd и prf — на двух- и четырехъядерной
стадиях (Springer et al., 1995; Moore et al., 1998).
У Trichosanth.es lobata обнаружены два типа зародышевых мешков: мелкие
(60x20 мкм) и крупные (100x30 мкм). Оба типа встречались в одних и тех же
завязях и даже на одной и той же стороне Т-образной плаценты (Datham, 1974).
К мутациям, проявляющимся на стадии дифференцированного зрелого
зародышевого мешка, относятся мутации преждевременного деления яйцеклетки до опло-
Молекулярно-генетические аспекты репродукции 383
дотворения. Они обнаружены у линии RA91 Linum usitatissimum (Huyghe, 1987;
Secor, Russell, 1988) и линии AT-1 Zea mays (Тырнов, Еналеева, 1983; Еналеева,
Тырнов, 1994). Обе мутантные линии характеризуются высокой частотой полиэм-
брионии типа 2п-п. Это объясняется тем, что клетки, образованные после первого
(у льна) и после второго (у кукурузы) деления яйцеклетки, иногда могут
функционировать в качестве самостоятельных яйцеклеток, способных к оплодотворению
или партеногенетическому развитию. Частота цитологического проявления этого
признака у льна составляла от 8 до 74%, у кукурузы — от 17,1 до 82,6%. Линия
АТ-1 кукурузы характеризуется автономным образованием эндосперма
(0-59,4%), развитие которого прекращается на ранних стадиях.
У Arabidopsis thaliana индуцированы мутации fie, /isl, /is2 и /is3, вызывающие
автономное развитие эндосперма в отсутствие оплодотворения (Ohad et al., 1996;
Chaudhury et al., 1997; Feldman et al., 1997). У этого же вида обнаружены мутации
g/a2, g/a3 и g/a7, препятствующие слиянию полярных ядер (Feldman et al., 1997;
Drews etal., 1998).
Изменчивость гаметофитных признаков, обусловленная хромосомными,
геномными и цитоплазматическими мутациями. Анеуплоидия вызывает
изменения в вегетативных и генеративных структурах. В частности, у анеуплоидов
Beta vulgaris отмечалось блокирование развития зародышевых мешков на ранних
стадиях, а также нарушение в числе митозов, полярности (Зайковская, Ярмо-
люк, 1968; Ярмолюк, 1972). У Zea mays в случае отсутствия второй или шестой
хромосомы развитие микрогаметофита останавливается на стадии первого митоза
микроспоры; при отсутствии любой другой хромосомы (кроме пятой) развитие
прекращается до начала этой стадии (Zhao, Weber, 1989). У моносомика и
двойного моносомика Brassica carinata снижалась фертильность пыльцы на 17% и
53%, соответственно (Serla, Raut, 1987). Отсутствие хромосомы 7А или 7Dv
Triticum turgidum var. durum препятствовало нормальному осуществлению мегас-
порогенеза (Joppa et al., 1987).
Присутствие в геноме В-хромосом неоднозначно влияет на развитие гаметофи-
тов. Как правило, при увеличении их количества возрастает процент стерильной
пыльцы и снижается женская фертильность. При единичных добавочных
хромосомах у некоторых видов фертильность не только не уменьшается, но может
возрастать (Мошкович, 1979). У диплоидных и тетраплоидных форм Impatiens
balsamina присутствие В-хромосом способствовало более быстрому росту
пыльцевых трубок (Mahajan, Raghuvanshi, 1983). У Aster novae-angliae В-хромосомы
вызывали выпадение цитокинеза в мегаспорогенезе, образование зародышевых
мешков с увеличенным числом ядер, развитие апоспорических зародышевых мешков,
проникновение пыльцевых трубок через халазу (Kluska, 1986).
Для полиплоидов характерно увеличение размеров зрелых гаметофитов
(Satoshi, 1980; Wafai, Koul, 1984) и снижение фертильности (Бормотов, 1972).
Последнее связано преимущественно с образованием мультивалентов в профазе1
мейоза и последующим формированием несбалансированных по числу хромосом
гамет. При развитии женского гаметофита отмечаются нарушения полярности,
числа митотических делений, дифференциации. Аномальные зародышевые мешки,
как правило, дегенерируют (Дзевалтовский, 1969; Molchova, 1970; Чеченова,
1977). Степень дефектности гаметофитов у разных полиплоидов варьирует в
широких пределах, и уровень мужской и женской стерильности у одних и тех же поли-
384
Системы репродукции
плоидных растений часто различается (Kutty, Kumar, 1983). У Petunia hybrida и
Pyrus communis, характеризующихся самонесовместимостью, при переходе на
полиплоидный уровень появлялась способность к завязыванию семян при
самоопылении (Lewis, 1954). У гаплоидов в связи с отсутствием гомологов мейоз проходит
с большими нарушениями, что приводит почти к полной мужской и женской
стерильности. Поскольку мейотические нарушения являются причиной формирования
спор с несбалансированными по числу хромосом генотипами, типы структурных
аномалий в зародышевых мешках (в случае их образования) сходны с выше
описанными для анеуплоидов и полиплоидов (Звержанская, 1974).
Цитоплазматические мутации спорофита также могут существенно изменять
проявление гаметофитных признаков. В частности, помимо уже упомянутого
эффекта ЦМС, отмечалось: изменение в отложении каллозы в оболочках микроспо-
роцитов (Petunia hybrida); образование аномальных тетрад микроспор (Triticale);
дробление ядрышек в микроспорах (Zea mays); возникновение двухпоровой и
очень мелкой пыльцы; неспособность к образованию пыльцевых трубок внешне
нормальными пыльцевыми зернами (Nicotiana tabacum); индукция партеногенеза
и полиэмбрионии; избирательность оплодотворения (Triticum); образование
нередуцированных мегагамет (Beta vulgaris); способность к морфогенезу микроспор в
культуре пыльников in vitro (Triticum и Triticale) (Крупное, 1973; Френкель,
Галун, 1982; Давиденко, 1984; Орлов, 1995).
Батыгина, Воронова, 1999; Воронова, 1998,1999; Голубовская, 1975; Дзевалтовский, 1969; Ена-
леева и др., 1998; Еналеева, Тырнов, 1994; Зайковская, Ярмолюк, 1968; Звержанская, 1974;
Крупнов, 1973; Мошкович, 1979; Ноглер, 1990; Соснихина и др., 1994; Тырнов, Еналеева, 1983;
Френкель, Галун, 1982; Чеченова, 1977; Ярмолюк, 1972; Benavente et al., 1989; Calderini, Mariani,
1995; Chen et al., 1987; Cutter, Bingham, 1977; Enaleeva, 1992,1997; Enaleeva et al., 1994; Finch,
Bennet, 1979; Golubovskaya et al., 1993, 1995; Gottschalk, Kaul, 1974, 1980a, 6; Hermsen, 1984;
Huang, Sheridan, 1996; Huyghe, 1987; Johnson et al., 1976; Kaul, Murthy, 1985; Kennel, Horner,
1985; Kitada et al., 1983; Lin, 1978,1981; Mariani et al., 1993; McCoy, Smith, 1983; Moffett, 1939;
Pfeifer, Bingham, 1983; Rhodes, Dempsey, 1966; Satina, Blakeslee, 1935; Secor, Russel, 1988;
Sheridan et al., 1996; Voronova, Batygina, 1997; Wafai, Koul, 1984; Zhao, Weber, 1989.
МОДИФИКАЦИОННАЯ ИЗМЕНЧИВОСТЬ ГАМЕТОФИТА
Модификационная изменчивость гаметофита — это ненаследуемые
изменения его признаков, обусловленные факторами внешней среды. Структура
гаметофита определяется в ходе споро- и гаметогенеза, поэтому при анализе его
модификаций следует учитывать эти процессы.
В основе нарушений спорогенеза, гаметофитогенеза и структурно-функциональной
организации зрелых гаметофитов лежат модификационные изменения многих
цитологических процессов, таких как карио- и цитокинез, поляризация, рост клеток,
вакуолизация и т.д. Эти нарушения приводят к стерильности или служат предпосылкой
некоторых генетических явлений — возникновения нередуцированных гамет, гаплоидии,
полиплоидии, анеуплоидии, полиэмбрионии, апомиксиса.
К числу внешних факторов, влияющих на развитие гаметофитов, относятся
температура, свет, влажность, химические вещества, различные излучения,
гравитация, магнитные и электромагнитные поля. Различные воздействия (прежде всего
Молекулярно-генетические аспекты репродукции 385
температурные) широко используется для преодоления самонесовместимости,
восстановления фертильности у форм с цитоплазматической мужской стерильностью
и гибридов, повышения завязываемости семян при отдаленных скрещиваниях.
Поскольку развитие гаметофита есть поступательный процесс, при котором
последующее событие обусловлено состоянием предыдущих структур, характер мо-
дификационных изменений зрелого гаметофита — пыльцевого зерна или
зародышевого мешка — определяется не только конкретным стрессовым фактором и его
дозой, но и стадией развития гаметофита в момент воздействия и
продолжительностью этого воздействия. Наиболее точное представление об индуцированных
модификациях позволяют получить эксперименты, проводимые в условиях
фитотрона и in vitro, при которых могут контролироваться конкретные факторы и
учитываться их дозовый эффект. Менее информативны в этом отношении данные,
полученные на основе исследований влияния неблагоприятных экологических
условий на генеративную сферу растений в природных популяциях. .
Модификационная изменчивость спорогенеза. На разных объектах
показано, что экстремальные температуры (повышенные и пониженные) могут изменять
течение мейоза, вызывая полное его подавление, выпадение первого или второго
мейотического деления, нарушения цитокинеза и распределения хромосом. В
частности, полное подавление мейоза при микроспорогенезе возможно у Triticum
aestivum при термошоке 33°С (Bodanese-Zamettini et al., 1979). Выпадение мейоза
и непосредственное превращение материнских клеток мегаспор в одноядерный га-
метофит индуцируется высокой температурой у Nicotiana tabacum (Лобанова, 1992;
Lobanova, Enaleeva, 1995). У Ulmus laevis при температуре 30°С происходит
замена мейоза митотическими делениями материнской клетки мегаспор с образованием
ряда-из 3 — 6 одноядерных клеток, которые затем дегенерируют (Hjelmqvist,
Grazi, 1965). При действии низких и высоких температур на мейоз может также
происходить полное или частичное выпадение второго мейотического деления, что
ведет к образованию диады или триады микроспор (Барская, Балина, 1970;
Karihaloo, 1991) и мегаспор (Лобанова, 1992). У Solatium phureja,
характеризующегося высокой частотой образования диплоидной пыльцы, низкотемпературный
стресс резко повышает процент ее формирования из диад за счет разрушения
фрагментов веретена во время второго мейотического деления (Mettale, 1983).
Формирование мужских 2п-гамет под действием температуры может быть обусловлено и
другими причинами: выпадением первого или второго деления мейоза и
формированием диад, попарным слиянием двух дочерних гаплоидных ядер в ходе второго
деления (Лутков, 1937). Показано, что у одних видов образование 2п-гамет
индуцировалось повышенными температурами (> 30°С), а у других видов этот эффект
достигался при пониженных температурах (< 5°С) (Hermsen, 1984). Частота
формирования 2п-мегагамет у одного из гибридных клонов картофеля,
выращиваемых в разных условиях, различалась более чем в два раза (Werner, Peloquin, 1987).
Возможность индукции диплоидных и даже тетраплоидных пыльцевых зерен
температурой отмечалась во многих ранних работах (Belling, 1925; Michaelis, 1926;
Sakamura, Stow, 1926).
Нарушение цитокинеза под воздействием внешних условий обычно выражается в
подавлении заложения клеточных перегородок после первого и/или второго деления
мейоза. В результате формируются двух-, трех- и четырехъядерные споры как в ме-
гаспорогенезе (Hjelmqvist, Grazi, 1964,1965; Dharamadhaj, Prakash, 1978; Лобано-
386
Системы репродукции
ва, 1992), так и в микроспорогенезе (Поддубная-Арнольди и др., 1934; Барская,
Балина, 1970). Но в некоторых случаях экстремальные условия провоцируют
образование клеточных перегородок у видов с тетраспорическим типом развития
зародышевого мешка. Так, у Tulipa при цветении в засушливые и жаркие периоды вместо
четырехъядерной мегаспоры формируется триада мегаспор в результате заложения
клеточной перегородки после первого деления мейоза и после второго деления в
верхней клетке диады (Беляева, 1977). Следствием нарушения цитокинеза при мегаспо-
рогенезе является изменение споричности зародышевого мешка. Как правило, она
увеличивается при повышенных температурах (Hjelmqvist, Grazi, 1964, 1965;
Dharamadhaj, Prakash, 1978). Например, у Nicotiana tabacum высокая температура
индуцирует развитие би-, три- и тетраспорических зародышевых мешков вместо мо-
носпорических (Лобанова, 1992). Имеются указания на увеличение споричности и
при пониженных температурах (Sokolowska-Kylczycka, 1988).
Факторы внешней среды могут модифицировать также генетически
обусловленную тенденцию к формированию нередуцированных женских гамет у апомик-
тичных видов. В частности, установлено, что изменение светового и
температурного режимов увеличивает или уменьшает степень проявления апомиксиса за счет
изменения частоты образования диплоспорических и апоспорических
зародышевых мешков (Nogler, 1984).
На поведение хромосом в мейозе значительное влияние оказывают:
рентгеновские лучи (Делоне, 1960; Даниелян, 1973), низкие и высокие температуры (Bleier,
1930; Альтергот и др., 1978; Bodanese-Zanettini et al., 1979; Гавриленко, 1984;
Елисеев, Гвасалия, 1988; Karihaloo, 1991), освещенность (Веселова, 1977),
дефицит или избыток почвенной влаги и минерального питания (Завадская, 1959; Ба-
тыгина и др., 1966; Троицкая, Батыгина, 1970; Сказкин, 1971; Зуева, 1973;
Caetanopereira et al., 1995), обработка соляной кислотой (Константинов, 1970) и
хлороформом (Лутков, 1937), условия космического полета (Kuang et al., 1995).
Хромосомные нарушения проявляются в образовании унивалентов и мультивален-
тов, увеличении или снижении частоты хиазм, разнообразных анафазных аббера-
циях, слипании хромосом, деструкции ядер, образовании параллельных или муль-
типолярных веретен, цитомиксисе и т.д.
Нарушения в распределении хромосом в мейозе являются причиной
образования монад, диад разных размеров, триад, неправильных тетрад, полиад, а
также формирования микроядер в спорах (Поддубная-Арнольди и др., 1934;
Барская, Балина,1970; Остапенко, Колючая, 1983), что, в свою очередь,
приводит к формированию аномальной пыльцы с несбалансированным геномом или
полной их дегенерации.
Модификационная изменчивость микрогаметофитогенеза. Процесс
формирования микрогаметофита от стадии микроспоры до спермиогенеза в
значительной степени подвержен модифицирующему влиянию внешних факторов.
Возникающие в этот период нарушения карио- и цитокинеза (равное первое
деление микроспоры, дополнительные деления ядер и клеток) могут
накладываться на мейотические. В случае серьезных структурно-функциональных
изменений обычно происходит дегенерация микроспор на разных стадиях
развития. Активация митотических делений, результатом которой является
формирование многоядерной пыльцы или многоспермиевости в пыльцевом
зерне зарегистрирована у Olea europaea при повышении температуры. Образова-
Молекулярно-генетические аспекты репродукции
387
ние многоядерной пыльцы также связано с подавлением заложения клеточных
перегородок начиная с двуядерной стадии (Шолохова, Никифоров, 1973).
Подобные нарушения зарегистрированы при гамма-облучении у Gossypium
hirsutum и Capsicum annuum (Руми и др., 1973; Илиева, Молхова, 1979), при
низкой температуре у Scorzonera tau-saghyz (Поддубная-Арнольди и др.,
1934). У Triticum aestivum повышенные температуры индуцировали
формирование пыльцевых зерен с двумя вегетативными и двумя генеративными ядрами
(Альтергот и др., 1978).
Возможность образования аномальных пыльцевых зерен широко применяется
для получения гаплоидов с помощью культуры in vitro (Батыгина, 1987).
Факторами, вызывающими аномальное развитие являются: температура и фотопериод во
время роста донорных растений (Rashid, 1983; Sunderland, 1983), предобработка
пыльников на стадии микроспор низкими или высокими температурами
(Sunderland, Huang, 1985; Li et al., 1988; Lazar et al., 1990), условия
культивирования, т. е. состав питательной среды, температура, свет, концентрация СО
(Резникова, 1984; Chen et al., 1984; Heberle-Bors, 1985; Shimada, 1989).
При воздействии стрессовых факторов на зрелую двуклеточную пыльцу может
нарушаться процесс спермиогенеза в пыльцевых трубках. В частности, при
рентгеновском облучении наблюдались митозы генеративных ядер с множественными
отклонениями, приводящими к формированию спермиев неравной величины и/или с
микроядрами, блокирование деления генеративного ядра (Vassileva-Dryanovska,
1966; Руми и др., 1973; Юдакова, Еналеева, 1994). Аномальные митозы
генеративных ядер с образованием микроядер зарегистрированы также после
воздействия холодом (Mo, Yang, 1992), оксимочевиной (Khan, Ma, 1974). Кроме того,
после холодовой обработки пыльцы наблюдались равные или неравные амитотиче-
ские деления (Mo, Yang, 1992). Подавление митозов происходит при повышенных
температурах (Балина, 1974). Остановка в развитии одно- и двуядерной пыльцы
может быть вызвана изменением фотопериода (Жукова, 1938).
Имеются сообщения, что под влиянием высокой температуры пыльцевые зерна
могут приобретать сходство с зародышевым мешком (см. Развитие
зародышевых мешков в пыльнике, Т. 1).
Модификационная изменчивость мегагаметофитогенеза. Все ключевые
процессы развития мегагаметофита, включая инициацию функциональной
мегаспоры, митотические деления, поляризацию, цитокинез и клеточную
дифференциацию, подвержены внешним воздействиям. При этом так же, как и при
микрогаметофитогенезе, возникающие модификации могут накладываться на
мейотические нарушения.
В зависимости от условий внешней среды материнской клеткой зародышевого
мешка может стать любая мегаспора из сформировавшейся тетрады или
одновременно две, три и даже четыре. Тенденция к развитию нескольких зародышевых
мешков в одном семязачатке реализуется не всегда, дополнительные мегаспоры
могут дегенерировать на разных стадиях развития (Лобанова, 1992). Развитие
зародышевых мешков из нескольких мегаспор может быть индуцировано температурой
(Dharamadhaj, Prakash, 1978), солевым стрессом (Gounaris et al., 1991).
Чувствительной к внешним условиям является и стадия ценоцита. Число
митозов варьирует в зависимости от температуры. Например, у ряда видов с тетраспо-
рическими зародышевыми мешками при повышении температуры происходит за-
388
Системы репродукции
мена Adoxa-типа на Drusa- или Chrysanthemum cinerariaefolium-типы
(Hjelmqvist, Grazi, 1964, 1965). Митотическая активность ядер в гаметогенезе у
Nicotiana tabacum стимулируется высокими температурами (35-40°С) и
угнетается низкими (10-13°С); при этом формируются зародышевые мешки
соответственно с большим (9-48) и малым (1-7) числом ядер (Еналеева, Лобанова, 1987;
Lobanova, Enaleeva, 1992, 1995). При 40°С наблюдались амитотические деления
ядер. Развитие аномальных зародышевых мешков с различным количеством ядер и
клеток при экстремальных температурах зарегистрировано у Scorzonera tau-saghyz
(Поддубная-Арнольди и др., 1934) и Tulipa (Беляева, 1977).
Цитокинез в зародышевом мешке также зависит от температуры. Например, у
Nicotiana tabacum при температурах 40°С и 10°С преобладали ценоцитые, а при
37°С и 13°С — сформированные зародышевые мешки (Лобанова, 1992).
К числу факторов, вызывающих изменения размеров, формы и темпов развития
зародышевых мешков, относятся: температура (Беляева, 1977; Ormrod et al., 1967;
Saini et al., 1983), недостаток воды в почве (Сказкин, 1971), спектральный состав
света (Устинова, 1973), фотопериод (Knox, Heslop-Harrison, 1963), солевой
стресс (Gounaris et al., 1991), рентгеновское облучение (Даниелян,1973; Руми и
др., 1973; Еналеева и др., 1978), постоянное магнитное поле (Козлов, Козлова,
1978), условия космического полета (Kuang et al., 1995), дефицит влаги и
минеральное питание (Зуева, 1973), обработка колхицином (Marciniak, 1967),
комплексные изменения факторов окружающей среды в природных популяциях (Чер-
ник, 1992; Geushova, 1992; Pfahler et al., 1996).
Влияние внешних факторов на уже сформировавшиеся зародышевые мешки
проявляется в изменении размеров, строения и вакуолизации клеток, положения
ядер, состояния полярных ядер и нитчатого аппарата (Чеботарь, 1965;
Герасимова-Навашина и др. 1968; Лобанова, 1992). В ряде случаев в клетках
зрелых зародышевых мешков могут быть индуцированы деления. Так, у Zea
mays при высокой температуре происходит увеличение числа ядер в клетках
антипод (Чеботарь, 1965), а у одной из линий Linum usitatissimum,
характеризующейся автономным делением яйцеклетки с образованием двух яйцеклеток,
повышение температуры с 16 до 28°С увеличивает частоту этих событий с 31% до
52% (Huyghe, 1987). Значительный интерес представляет возможность
индуцированного формирования дополнительных яйцеклеток из дополнительных ядер
в аномальных многоядерных зародышевых мешках или за счет
перераспределения ядер и уменьшения числа антиподальных клеток и синергид (Чеботарь, 1965;
Варшанина, 1987; Lobanova, Enaleeva, 1995). Такие модификации зародышевых
мешков могут быть причиной полиэмбрионии (Варшанина, 1987).
Многочисленные работы по индукции яйцеклетки к партеногенезу различными факторами
внешней среды in vivo обобщены в ряде обзоров (Kimber, Riley, 1963; Тырнов,
1976; Лаптев, 1984; Кашин, Куприянов, 1993).
У Zea mays и Panicum miliaceum происходит апомиктичное развитие
зародыша и эндосперма при обработке завязей различными химическими соединениями
(Кашин, Куприянов, 1993). Фактором, индуцирующим партеногенетическое
развитие яйцеклетки, может быть задержка опыления (Eenik, 1973; Тырнов,
Еналеева, 1983). Возможность индуцировать деления в клетках зрелых
зародышевых мешков показана в работах по культивированию неоплодотворенных
завязей и семязачатков (Yang, Zhon, 1982; Wu, Cheng, 1982; Tian, Yang, 1983). В
Молекулярно-генетические аспекты репродукции
389
этом случае индуцирующими факторами являются состав питательной среды,
температура и свет.
Альтергот и др., 1978; Балина, 1974; Батыгина, 1987; Батыгина и др., 1966; Веселова, 1977; Гав-
риленко, 1984; Герасимова-Навашина и др., 1968; Делоне, 1960; Жукова, 1938; Завадская, 1959;
Зуева, 1973; Кашин, Куприянов, 1993; Константинов, 1970; Лаптев, 1984; Лобанова, 1992;
Лутков, 1937; Поддубная-Арнольди и др., 1934; Сказкин, 1971; Троицкая, Батыгина, 1970; Тырнов,
1976; Устинова, 1973; Чеботарь, 1965; Черник, 1992; Шолохова, Никифоров, 1973; Юдакова,
Еналеева, 1994; Bleier, 1930; Caetanopereira et al., 1995; Chen et al., 1984; Dharamadhaj, Prakash,
1978; Heberle-Bors, 1985; Hermsen, 1984; Hjelmqvist, Grazi, 1964,1965; Huyghe, 1987; Karihaloo,
1991; Khan, Ma, 1974; Kimber, Riley, 1963; Knox, Heslop-Harrison, 1963; Kuang et al., 1995; Lazar
et al., 1990; Li et al., 1988; Lobanova, Enaleeva, 1992, 1995; Marciniak, 1967; Mettale, 1983;
Michaelis, 1926; Mo, Yang, 1992; Nogler, 1984; Pfahler et al., 1996; Rashid, 1983; Shimada, 1989;
Sunderland, 1983; Tian, Yang,1983; Vassileva-Dryanovska, 1966.
ЭМБРИОГЕНЕТИКА РАСТЕНИЙ
Важное значение эмбриологии для решения ряда фундаментальных и
прикладных проблем современной биологии хорошо известно. Вместе с тем, возможности
управления развитием, синтез форм с желаемыми признаками связаны с
использованием генетических методов и закономерностей, Поэтому неоднократно
отмечалась необходимость объединения данных эмбриологии и генетики (Вавилов, 1935;
Кольцов, 1935; Хохлов, 1968; Токин, 1986; Батыгина, 1987).
Эта специфичная и сложная во всех отношениях проблема может быть решена
только путем развития самостоятельного направления — эмбриогенетики
растений (Тырнов, 1986). Почему именно эмбриогенетика, а не «генетическая
эмбриология» или «эмбриологическая генетика» или просто «генетика эмбриологических
признаков»? Суть заключается не в краткости и емкости термина (что сам по себе
немаловажно), а в интегрированности (а не простой суммации) двух наук и их
взаимовлиянии друг на друга.
Под эмбриогенетикой мы понимаем дисциплину, предметами изучения которой
должны быть:
а) механизмы генетической детерминации н регуляции эмбриологических
признаков, процессов и явлений;
б) генетические последствия, обусловленные морфо-функциональными
особенностями генеративных и репродуктивных органов н структур;
в) возможности и пути использования клеток и структур генеративных и
репродуктивных органов для генетической инженерии.
Схема генетического анализа эмбриологических признаков сходна с таковой
для многих других структур спорофита, но имеется и своя специфика,
заключающаяся в следующем:
— разный характер контроля ряда эмбриологических признаков (гаметофитный,
спорофитный);
— гемизиготность гамет у диплоидов (с проявлением всех рецессивов) и ее
отсутствие у полиплоидов;
— разная степень плоидности компонентов женского гаметофита: яйцеклетки,
центральной клетки, а также зиготы-зародыша и эндосперма;
390
Системы репродукции
— материнская или гибридная природа генеративных структур и элементов
семени;
— передача отдельных признаков через мужской и женский гаметофиты или
только через один из них;
— разновременность возникновения ряда признаков (например, разные сроки
деления генеративной клетки, разное время созревания яйцеклеток в различных
частях соцветия, разное время слияния полярных ядер и др.);
— наличие структур типа «клетка в клетке».
В качестве предмета для генетического изучения важное значение имеют такие
эмбриональные процессы, как рост пыльцевых трубок, деление ядра генеративной
клетки, слияние полярных ядер, оплодотворение, целлюляризация эндосперма,
дегенерация антипод и др.
Поскольку для разных процессов характерна значительная изменчивость во
времени, то для выявления генетической обусловленности всего пути развития и его
последовательных этапов еще предстоит большая работа по установлению границ,
в пределах которых какие-то состояния можно было бы характеризовать как
элементарные дискретные признаки, доступные для генетического анализа.
К явлениям, подлежащим генетическому анализу можно отнести апомиксис, га-
плоидию, полиэмбрионию, несовместимость и др. Их реализация, как правило,
связана с полигенным контролем, но иногда в основе явлений может лежать
мутация одного гена (например, гена IG, вызывающего андрогенез у кукурузы).
Выделение явлений в отдельный предмет генетического анализа целесообразно также
потому, что для многих из них характерна эквифинальность (т.е. достижение
одного и того же результата разными путями). Например, гаплоидия может быть
результатом партеногенеза, гиногенеза, гемигамии (семигамии), элиминации
хромосом, репродукционного митоза и др. Конечный итог этого — возникновение
спорофита с «гаметическим» числом хромосом. Иногда один и тот же процесс
потенциально может приводить к разным результатам. Например, диплоспория,
может вести к апомиксису и/или полиплоидии.
Вопрос о генетических последствиях эмбриологических процессов обусловлен
тем, что они, будучи сами генетически предопределенными, могут порождать ряд
новых генетических явлений с иными закономерностями и возможностям (в том
числе эволюционно и селекционно-значимыми) или существенно влиять на
какие-то другие генетические признаки. Так, у некоторых видов установлено
сохранение или исчезновение митохондрий и пластид в мужском гаметофите,
вследствие чего возникает возможность одно- или двуродительского наследования цито-
плазматических признаков. Гиногенез ведет к внесению без кариогамии ядерного и
цитоплазматического материала от отцовской формы в гаплоидную яйцеклетку.
Нетипичный мейоз у гаплоидов приводит к транслокациям и анеуплоидии. В
культуре эндосперма in vitro могут возникать триплоиды.
В эмбриогенетической инженерии можно выделить два направления:
1) использование генетической инженерии для конструирования форм с
желаемыми эмбриологическими признаками;
2) использование эмбриональных структур (гаметофитов, половых клеток,
зиготы, проэмбрио, эмбриоидов и др.) для генетического конструирования и
передачи других (неэмбриологических) признаков.
Молекулярно-генетические аспекты репродукции 391
Привлекательность эмбриогенетической инженерии определяется
следующим. После различных манипуляций на клеточном уровне в большинстве
случаев необходимо получение растений-регенерантов. Это легче достигается при
использовании в качестве эксплантов различных эмбриональных структур.
Кроме того, для целей экспериментального мутагенеза и клеточной селекции
целесообразно использовать гаплоидные клетки. Известны попытки введения
ДНК (генов) в пыльцу или передача через облученную пыльцу отдельных
генов отцовской формы. С помощью ведения чужеродного генетического
материла в эмбриоиды и клетки эмбриогенного каллуса были получены трансгенные
растения кукурузы, рапса (Кучук, 1997). Интересны и практически значимы
результаты гаметной селекции, основанной на использовании пыльцы,
подвергнутой действию различных факторов (высокой и низкой температур, токсинов,
гербицидов, тяжелых металлов, солей, озона и др.) (Кильчевский, Хотылева,
1997; Специфика генной экспрессии в пыльце, Т. 1; Экспрессия генов в
эмбриогенезе, Т. 2, а также Гаметофитные мутации; Модификационная
изменчивость гаметофита; Генетика развития цветка).
Цели и ожидаемые результаты исследований в рассматриваемом плане
достаточно разнообразны.
1. Создание коллекции эмбриомутантов. Без решения этого вопроса
использование генетических методов практически невозможно.
2. Выявление генетической основы сходных признаков у разных таксонов.
Такая информация необходима для решения многих эволюционных,
филогенетических проблем. Она позволит оценивать перспективы
«взаимозаменяемости» генов разных видов методами обычной селекции или молекулярной
биологии, правильности выбора доноров соответствующих генов.
3. Управление путями морфогенеза, их модификация и
перепрограммирование. Наиболее актуальными длительное время будут оставаться вопросы,
связанные с культурой in vitro, взаимопревращением в цикле
«растение-клетка-растение», «гаметофит-спорофит». Это не исключает
необходимости исследований закономерностей развития in vitro, например,
превращение соматических клеток в зародыш при адвентивной эмбрионии,
гаплоидйзация, отсутствие редукции и др.
4. Временная модификация эмбриологических признаков. Она позволит
решить проблему экспериментальной индукции многих важных явлений,
например, стерильности или восстановления фертильности температурным
фактором, морфогенеза in uiuo и in vitro, полиплоидизации и др.
5. Создание организмов с заданными, наследственно закрепленными
эмбриологическими признаками и реконструкция систем размножения.
Сюда относятся: устранение самонесовместимости, замена двудомности на
однодомность, переход на апомиктический способ размножения, усиление регене-
рационного потенциала in vitro и др.
6. Управление рядом явлений, имеющих важное общебиологическое и
прикладное значение. К ним относятся андрогенез, репродуктивная изоляция,
эмбриогения и др.
7. Разработка принципиально новых методов селекции на основе эмбрноге-
нетических подходов.
392
Системы репродукции
Предметом изучения, несомненно, должна быть также модификационная
изменчивость, поскольку необходимо выявление факторов, влияющих на экспрессию
генов и позволяющих компенсировать их некоторые дефекты. Компенсационные
эффекты позволяют выявлять физиолого-биохимические и молекулярные
механизмы действия гена. На основе модификаций возможно достижение желаемых
результатов без изменения генетической основы.
Объекты исследования должны удовлетворять следующим требованиям. Они
должны входить в число классических генетических объектов, быть удобными для
эмбриологических исследований, давать более одного семенного поколения в год,
легко размножаться вегетативно и в культуре in vitro, быть истинными диплоидами
с относительно небольшим числом хорошо идентифицируемых хромосом, все или
большинство, из которых отвечают за хорошо выраженные маркерные признаки.
. Последнее облегчит будущие работы по локализации генов, контролирующих
репродуктивную сферу. Объекты должны быть удобными для проведения различных
биотехнологических и генноинженерных операций. Такими объектами, хотя и не
абсолютно идеальными, могут быть: из однодольных — кукуруза и ячмень, из
двудольных — томат и петуния. В последнее время все шире в работу вовлекается ара-
бидопсис, благодаря короткому циклу размножения, небольшому числу хромосом
(п=5) и возможности развития in vitro в строго контролируемых условиях (Smith,
1990; Ohadetal., 1996). Это не исключает работу с другими видами как объектами
частной эмбриогенетики или носителями уникальных признаков.
Кильчевский, Хотылева, 1997; Кольцов, 1935; Кучук, 1997; Суханов, Тырнов, 1986; Токин,
1987; Тырнов, 1986; Хохлов, 1968; Ohad et al., 1996; Smith, 1990; Tyrnov, 1992.
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ АПОМИКСИСА
Проблема генетического контроля апомиксиса у цветковых уже давно
привлекает к себе серьезное внимание. В первую очередь, это отражает
фундаментальный интерес, проявляемый в настоящее время к всестороннему изучению
молекулярно-генетических механизмов развития растений. С другой стороны,
возможность генетического конструирования апомиктических форм может иметь
существенное практическое значение, например, для широкомасштабного
воспроизведения гибридов F . Вместе с тем, конкретные данные о генетическом
контроле апомиксиса до сих пор остаются весьма фрагментарными, что, прежде
всего, отражает чрезвычайную сложность и недостаточную исследованность самого
явления апомиксиса.
В настоящее время вопрос об участии генотипа в определении признака
«способность к апомиксису» не вызывает сомнений. Такой вывод основан на
существовании многочисленных апомиктических форм, с той или иной частотой
воспроизводящих данный признак в ряду поколений. При этом особого
внимания заслуживает тот факт, что в потомстве всех исследованных апомиктических
форм, независимо от их систематической принадлежности, наблюдается выще-
пление как способных к апомиксису, так и нормальных особей (Hanna et al.,
1973; Nogler, 1994). Судя по этим данным, все апомиктические растения,
по-видимому, характеризуются определенной степенью гетерозиготности,
причем способность к апомиксису соответствует доминантному проявлению при-
Молекулярно-генетические аспекты репродукции
393
знака, в то время, как нормальный тип размножения — рецессивному. В пользу
последнего вывода свидетельствует и тот факт, что самоопыление нормальных
растений в подавляющем большинстве случаев приводит к стабильному
воспроизведению только себе подобных.
Широкая распространенность апомиксиса среди покрытосемянных
(Carman, 1995; см. также Эволюция гаметофитного апомиксиса), а также
весьма сходный (в плане доминирования) тип его наследования в различных
таксономических группах позволяют предполагать наличие достаточно общей,
а потому относительно простой схемы генетического контроля данного
признака. Между тем, многочисленные попытки провести соответствующий
генетический анализ пока не привели к каким-либо существенным успехам. Подобная
ситуация связана с целым рядом проблем, затрудняющих строгий генетический
анализ способности к апомиксису.
Одна из таких проблем заключается в сложности учета самого исследуемого
признака. Дело в том, что даже у ярко выраженных апомиктических особей как
правило не наблюдается полной приостановки полового способа размножения
(Valle, Miles, 1999). В соответствии с этим, в качестве исходных форм,
вовлекаемых в скрещивание с нормальными растениями, часто используются особи,
проявляющие достаточно высокую, но все же не 100 %-ную частоту апомиксиса. В
гибридных потомствах, полученных от такого рода скрещиваний, обычно наблюдается
выщепление широкого спектра сегрегантов, характеризующихся весьма различной
частотой апомиктического способа размножения (Shermanet al., 1991; Lutts et al.,
1994; Valle, Miles, 1999). При этом в подобных расщеплениях достаточно сложно
вычленить какие-либо фенотипические классы, четко различающиеся между собой
по исследуемому признаку. Таким образом, признак «способность к апомиксису»,
по-видимому, является не качественным, а количественным, а потому достаточно
сложен для генетического анализа.
Попытки расчленить анализируемые гибридные потомства на два качественно
различающихся класса (полностью неспособные к апомиктическому
размножению и проявляющиеся хотя бы какой-нибудь, пусть даже и низкой частотой
апомиксиса) также наталкиваются на существенные сложности. В первую очередь,
эти сложности связаны с необходимостью правильно идентифицировать
растения, проявляющие низкую частоту апомиксиса. Между тем, традиционные
методы выявления апомиктических растений основаны либо на цитоэмбриологиче-
ском исследовании конкретной особи, либо на анализе ее индивидуального
потомства (Негг, 1982; Savidan, 1982; Nogler, 1984; Crane, Carman, 1987; Asker,
Jerling, 1992). Подобные методы весьма трудоемки, а потому вряд ли могут
обеспечить достаточно глубокий анализ каждого сегреганта из исследуемой выборки.
В соответствии с этим, определенная (возможно, весьма значительная) часть
сегрегантов, характеризующихся низкой частотой апомиксиса, может быть
ошибочно отнесена к классу растений, полностью неспособных к апомиктическому
способу размножения, что, в свою очередь, приведет к искажению реального
расщепления (Nogler, 1989).
В последнее время серьезные надежды связывают с появлением новых
экспресс-методов идентификации нормальных и апомиктических особей
(Ozias-Akins et al., 1994; Grimanelli et al., 1995). Подобные методы могут
существенно упростить параллельное тестирование большого количества сегрегантов, что
сделает возможным более строгий анализ исследуемого признака.
394
Системы репродукции
Еще одна проблема, затрудняющая генетический анализ способности к апомик-
сису, состоит в значительном разнообразии механизмов составляющих его
процессов. Действительно, в основе апомиксиса могут лежать явления апоспории,
партеногенеза, а также широкого спектра других процессов, в том числе диплоспории
(Crane, 1989; Naumova, 1990; Solntseva, 1990; Willemse, Naumova, 1992; см.
также Апомиксис; Апоспория; Диплоспории, Партеногенез). Нельзя исключить,
что каждый из них может иметь в той или иной степени независимый генетический
контроль. Поэтому одно из непременных условий, необходимых для успешного
генетического анализа исследуемого признака, заключается в выявлении и
использовании форм, контрастно различающихся по способности только к апоспории,
только к партеногенезу и т.д.
Наконец, сложность работы с апомиктическими особями связана с
полиплоидной природой подавляющего большинства из них. Действительно,
практически все природные или искусственно полученные апомикты являются либо алло-
полиплоидами, либо отдаленными (межвидовыми или межродовыми)
гибридами. В соответствии с этим, генетический анализ исследуемого признака
традиционно основан на (Savidan, 1990):
— внутривидовых скрещиваниях между нормальными (половыми) диплоидами и
апомиктическими полиплоидами;
— внутривидовых скрещиваниях между нормальными и апомиктическими
полиплоидами одинаковой степени плоидности;
— отдаленных (межвидовых или межродовых) скрещиваниях между нормаль
ными и апомиктическими формами.
Каждый из этих подходов имеет свои недостатки. Так, при скрещивании
особей, характеризующихся различной степенью плоидности (как правило, 2n x 4п),
получаемые гибриды F обычно непригодны для дальнейшего генетического
анализа в силу своей стерильности. Подобные осложнения не возникают в том случае,
если скрещиваемые особи обладают одинаковым уровнем плоидности. При этом,
однако, наследование изучаемого признака должно реализовываться на
соответствующем полиплоидном уровне, что может существенно затруднять генетический
анализ. В свою очередь, расщепления, полученные на основе отдаленной
гибридизации, могут быть значительно искажены в силу несбалансированности
наследственного аппарата родительских форм. Наконец, общей проблемой, свойственной
всем трем перечисленным подходам, является очевидная невыровненность
генетического фона у вовлекаемых в скрещивание растений. Таким образом,
использование традиционных методов генетического анализа по отношению к признаку
«способность к апомиксису» в большинстве случаев может дать только весьма
приблизительные результаты.
Несмотря на сложность перечисленных проблем, для ряда объектов удалось
получить довольно большой объем данных, позволяющих сделать некоторые выводы
о генетическом контроле способности к апомиксису. К числу таких объектов, в
первую очередь, относятся Ranunculus auricomis, Panicum maximum, Tripsacum
dactyloides и Pennisetum squamulatum.
Для Ranunculus auricomis (2n = 16) известны тетраплоидные формы (4п =
32), способные к апоспории и в дальнейшем к партеногенезу (Nogler, 1984, 1989,
1995). Судя по результатам генетического анализа, способность к апоспории
характеризуется у этого вида доминантным наследованием и, по-видимому, контро-
Молекулярно-генетические аспекты репродукции
395
лируется одним единственным геном A (Nogler, 1995). Следует отметить, что
нормальные (половые) особи R. auricomis гомозиготны по рецессивной аллели дикого
типа (а а ), в то время как все апоспорические тетраплоиды являются гетерозиго-
тами А а а а или А А а а . Отсутствие гомозиготных апоспорических растений,
по-видимому, связано с плейотропным проявлением аллели А-, приводящим к
рецессивному летальному эффекту. Таким образом, гаметы, не содержащие ни одной
аллели дикого типа, должны характеризоваться полной нежизнеспособностью.
Подобная схема хорошо согласуется с тем фактом, что все апоспорические
растения R. auricomis являются исключительно полиплоидами.
В то время, как одной аллели А- вполне достаточно для развития
апоспорических зародышевых мешков, частота их возникновения у конкретной особи R.
auricomis может существенно варьировать в зависимости от ряда факторов. К
числу такого рода факторов относятся доза доминантной аллели, а также время
запуска апоспорических программ (данный параметр контролируется независимо от гена
А). В соответствии с этим, отдельные растения, несущие аллель А-, но
характеризующиеся слишком поздней индукцией апоспории, могут быть ошибочно отнесены
в разряд нормальных.
Подавляющее большинство апоспорических растений R. auricomis
одновременно проявляют способность и к партеногенезу. Между тем, в ходе
многочисленных возвратных скрещиваний удалось получить единичную трисомную
особь (2п + 1 = 17), проявляющую высокую степень апоспории, но
практически не способную к партеногенезу. Как показал дальнейший анализ этой особи,
ее партеногенетический потенциал был не утрачен, а лишь существенно
подавлен. Таким образом, в генетическом контроле способности к партеногенезу
принимает участие не только ген А, но и некие модификаторы, природа которых
остается неизвестной (Nogler, 1989).
Сходные исследования проведены для злака Panicum maximum, в
систематическом плане сильно удаленного от Ranunculaceae. Как показал детальный цитогене-
тический анализ, у этого вида нормальные (половые) растения также являются
чистолинейными диплоидными формами, в то время как все апомиктические особи
представлены тетраплоидами. В гибридных потомствах, полученных при
скрещивании таких растений между собой, по исследуемому признаку наблюдается четкое
моногенное расщепление 1:1. Судя по этим данным, нормальный тип размножения
и способность к апомиксису обусловлены у P. maximum генотипами аа и Аааа,
соответственно (Savidan, 1981). Кроме того, у данного вида (как и в случае
Ranunculus auricomis) наблюдается строгая корреляция между способностью к
апоспории и партеногенезу, что можно рассматривать в качестве дополнительного
свидетельства об общности генетического контроля этих форм апомиксиса.
В последнее время в изучении генетического контроля апомиксиса успешно
используется еще один злак, Tripsacum dactyloides, также встречающийся в
диплоидной и тетраплоидной формах. Являясь ближайшим родственником рода Zea, Т.
dactyloides успешно гибридизуется с неспособной к апомиксису кукурузой, а
потому представляет большой интерес как для фундаментальных исследований, так и
для сугубо практических целей. Среди гибридных потомков F, полученных при
скрещивании апомиктических особей Т. dactyloides с кукурузой, наблюдается
четкое расщепление 1:1, которое хорошо согласуется с моногенной схемой,
предложенной для R. auricomis и P. maximum (Leblanc et al., 1995). Данное гибридное по-
396
Системы репродукции
томство было проанализировано методом RFLP для выявления молекулярных
маркеров, проявляющих тесное совместное наследование со способностью к
апоспории. Для решения этой задачи использовали серию геномных и кДНК-зондов
кукурузы, обладающих перекрестной специфичностью по отношению к отдельным
хромосомам Т. dadyloides. В результате проведенного анализа удалось
продемонстрировать сцепление исследуемого признака с 4 RFLP-маркерами (частота
рекомбинации составляет около 15%) и тем самым впервые осуществить его
картирование (Grimanelli et al., 1995, 1998).
Успешное молекулярное маркирование хромосом было параллельно осуществлено
как на диплоидных (нормальных), так и на тетраплоидных (апомиктических)
формах Т. dadyloides. При этом все 4 RFLP-маркера, проявляющие наибольшую
степень сцепления с исследуемым признаком, характеризуются различным типом
совместного наследования на диплоидном и тетраплоидном уровне. Так, если на фоне
диплоидности рассматриваемые молекулярные маркеры успешно рекомбинируют
друг с другом, то на тетраплоидном уровне они проявляют гораздо более тесное
сцепление. Подобные результаты позволяют высказать предположение о том, что
способность к апоспории у Т. dadyloides тесно связана не только с плоидностью, но и с
подавлением рекомбинации на протяженном участке одной из хромосом (Grimanelli
et al., 1998). При этом весь соответствующий участок, имеющий весьма
значительные размеры и вероятно включающий в себя большое количество различных генов,
должен наследоваться как один генетический фактор. Данная схема может с успехом
объяснить выявленное у целого ряда видов моногенное наследование столь сложного
признака, как способность к апомиктическому способу размножения. Кроме того,
подобная модель хорошо согласуется с представлениями о совместном генетическом
контроле апоспории и партеногенеза. Тесная таксономическая близость Tripsacum
dadyloides к столь хорошо разработанному модельному объекту генетики растений,
как Zea mays, позволяет надеяться на возможность успешного изучения
молекулярно-генетических основ апомиксиса уже в ближайшем будущем.
Как уже было отмечено, способность к апомиктическому способу размножению
обычно наследуется по доминантному типу. В соответствии с фундаментальной
генетической идеологией, это свидетельствует о регуляторном характере нарушений,
ведущих к реализации программы апомиксиса. Действительно, доминантное
проявление мутации как правило указывает на то, что соответствующий молекулярный
продукт выходит из-под негативного контроля со стороны регуляторных систем
организма, но сохраняет при этом свою функциональную активность. Таким образом,
вполне вероятно, что непосредственной причиной апомиксиса является взаимная
несогласованность отдельных процессов, задействованных в формировании
женских генеративных структур.
Подобная ситуация может сложиться под действием различных факторов. С
одной стороны, причиной такой несогласованности могут служить единичные
(или множественные сцепленные) мутации, затрагивающие структуру
регуляторных компонентов генеративного развития. Именно эта интерпретация лежит
в основе традиционно рассматриваемой схемы, предполагающей участие му-
тантной аллели А~ в определении способности к апомиксису (Savidan, 1981;
Mogie, 1992; Leblanc et al., 1995; Nogler, 1995). С другой стороны,
непосредственной причиной апомиксиса, по-видимому, может служить совместная
реализация двух несколько различных (а потому несогласованных во времени)
Молекулярно-генетические аспекты репродукции
397
программ генеративного развития у многих межрасовых, межвидовых или
межродовых гибридов (Carman, 1997,1999). С таким предположением хорошо
согласуется не только доминантный характер способности к апомиктическому
размножению, но и аллополиплоидная природа большинства исследованных
апомиктов. При этом многие способные к апомиксису гибриды получены при
скрещивании исключительно половых гибридных форм (Stebbins, 1932;
Nygren, 1946; Nordberg, 1967; Jankun, Kovanda, 1988).
Особого внимания заслуживают результаты, полученные при изучении
апомиксиса у автоаллогексаплоидного злака Pennisetum squamulatum. У этого
вида, как и у Tripsacum dadyloides, удалось картировать участок генома,
определяющий способность растения к апоспории (Ozias-Akins et al., 1998).
Данный участок, получивший обозначение ASGR (apospory-specific genomic
region), присутствует у P. squamulatum в гемизиготном состоянии, а потому не
может рассматриваться в качестве мутантной аллели, обладающей
доминантным проявлением. В соответствии с этим, локус ASGR, по-видимому, является
компонентом одного из гомеологичных геномов, исходно участвовавших в
образовании аллополиплоидного гибрида.
Итак, подавляющее большинство апомиктов имеет полиплоидную природу.
Полученные к настоящему времени результаты, свидетельствуют о сходных
закономерностях наследования апомиксиса даже в систематически удаленных группах
растений. Способность к апомиксису наследуется по доминантному типу.
Ключевую роль при этом играет либо один основной ген, либо один полигенный локус, в
пределах которого значительно подавлена рекомбинация. Механизмы апомиктиче-
ского способа размножения пока остаются неизвестными.
Asker, Jerling, 1992; Carman, 1995, 1997, 1999; Crane, 1989; Crane, Carman, 1987;
Grimanelli, Leblanc, 1995; Grimanelli et al., 1998; Hanna et al., 1973; Herr, 1982; Jankun,
Kovanda, 1988; Leblanc et al., 1995; Lutts et al., 1994; Mogie, 1992; Naumova, 1990; Nogler,
1984, 1989, 1994, 1995; Nordberg, 1967; Nygren, 1946; Ozias-Akins et al., 1994, 1998;
Savidan, 1981,1982,1990; Sherman et al., 1991; Solntseva, 1989; Stebbins, 1932; Valle, Miles,
1999; Willemse, Naumova, 1992.
ГЕНЕТИЧЕСКАЯ ГЕТЕРОГЕННОСТЬ СЕМЯН
Как известно, семена цветковых растений различаются по ряду признаков:
морфологических, биохимических, физиологических, генетических (Табл.)
(см. Семя, Т.2).
Одним из важнейших признаков семян является генетическая
гетерогенность, обусловленная, главным образом, различным происхождением
зародыша (зародышей).
Гетерогенность семян у растений необходимо рассматривать не только с
позиции индивидуальной изменчивости, но и с учетом соотношения различных типов
размножения и форм репродукции в жизненном цикле.
Генетически разнокачественные семена обычно фенотипически неразличимы.
Однако в некоторых случаях, особенно когда родительские формы хорошо
различаются по фенотипу (ксении и метаксении у кукурузы), генотипическая и феноти-
пическая гетерогенность семян явственно видна.
398
Системы репродукции
Генетическая гетерогенность семян у цветковых растений — далеко не новая
проблема. Достаточно вспомнить, что Мендель не смог подтвердить в опытах с
Hieracium тот характер расщепления (3:1), который был им выявлен в
эксперименте с Pisum sativum. Позже эмбриологи установили факт образования в семенах
Hieracium зародышей без оплодотворения (апомиксис).
В основе генетической гетерогенности семян лежат различные явления, а
именно: эмбриогения, эмбриоидогения (овулярная и эмбриональная) и гаметофитный
апомиксис (см. подробнее Эмбриоидогения — новый тип вегетативного
размножения; Апомиксис).
Семена обычно содержат половые зародыши (гамоспермия),
образующиеся в результате полового процесса (мейоз и слияние гамет (п+п)).
Этот механизм — главный источник рекомбинации генов,
обуславливающий наследственную изменчивость.
Однако новое поколение растений может развиваться нз семян, в которых
зародыш образуется без оплодотворения — так называемая агамоспермия. В
связи с этим при агамоспермных жизненных циклах в нескольких поколениях
сохраняется относительно постоянное число хромосом.
Существуют несколько типов агамоспермии в зависимости от способа
образования зародышей: на базе гаметофита (партеногенез, апогаметия и т.д.), на
Таблица:
Признаки неоднородности семян (по: Левина, 1981, с измен, и дополн.).
I. Количественные
И. Структурные
III. Биофизические
IV. Биохимические
V. Физиологические
VI. Экологические
VII. Генетические
Размеры, абсолютный вес
1. Морфологические: форма, характер симметрии, окраска, скульптура
поверхности. Наличие и характер придатков, степень развития
зародыша, его положение и форма.
2. Анатомические: гистология спермодермы, особенности эндосперма —
размеры и форма клеток, размеры крахмальных зерен и т. д.
3. Эмбриологические: тип зародышевого мешка, тип семязачатка, тип
эмбриогенеза и т. д.
Электрические и радиоактивные свойства семян
Состав белков, аминокислот, витаминов и др., состав и активность
ферментов, степень влажности, наличие или отсутствие ингибиторов
прорастания
Проницаемость покровов семени, глубина покоя, физиология
прорастания, длительность жизнеспособности
Различные требования и устойчивость к факторам прорастания
(водному, температурному и световому режимам, аэрации почвы, химическому
составу почвенного раствора и т. п.)
Наличие различных форм агамоспермии на базе гаметофитного апомик-
сиса (партеногенез, апогаметия), на базе спорофитного апомиксиса (ну-
целлярная, интегументальная и монозиготическая кливажная эмбриония)
Молекулярно-генетические аспекты репродукции
399
базе материнского спорофита (овулярная — нуцеллярная и интегументальная
эмбриоидогения) и дочернего спорофита (эмбриональная — монозиготическая
кливажная эмбриоидогения).
Феномен монозиготической кливажной эмбриоидогении многими биологами
не рассматривается в системе семенной репродукции и не включается в схему
способов агамоспермии, т.е. вообще не учитывается возможность образования
агамоспермных семян за счет монозиготической эмбриоидогении (Battaglia,
1963; Grant, 1981; Nogler, 1984). Вероятно, слабая изученность этого
процесса у цветковых растений является основной причиной игнорирования данного
феномена. Кроме того, некоторые авторы (Lakshmanan, Ambegaokar, 1984)
относят образование дополнительных зародышей из проэмбрио и его частей к
половой полиэмбрионии. Однако, как нами было показано, это явление
представляет собой наглядный пример клонирования нового спорофита на раннем этапе
его развития, т.е. один из способов вегетативного размножения (Батыгина,
1992,1993). Поэтому мы сочли необходимым включить в агамоспермию
феномен монозиготической кливажной эмбриоидогении.
Таким образом, в семенах многих видов цветковых растений, наряду с новым,
дочерним половым зародышем или его производными (в случае монозиготической
кливажной эмбриоидогении), формируются зародыши материнского
происхождения (нуцеллярные и интегументальные, а также от различных форм гаметофитного
апомиксиса). Все это обуславливает формирование новых поколений с разной
наследственностью (унипарентальное или бипарентальное наследование1).
В одном семени могут образовываться генетически разные клоны2: клон
материнского организма (на базе нуцеллярной и интегументальной эмбриоидогении
(2п=2п) и гаметофитного апомиксиса (п, 2п, Зп и более)) и клон новой, дочерней
особн (на базе монозиготической кливажной эмбриоидогении, приводящей к
появлению «однояйцевых близнецов» — двойни, тройни и т.д.)3.
Как известно, в природе встречаются двойни, тройни и т.д., в которых зародыши
различаются по происхождению и генотипу: гаплоид-гаплоидные двойни (например,
у Orchis maculata — Hagerup, 1947; Cossypium barbadense — Beasley, 1940;
Sesbania acukaia — Haque, 1946); гаплоид-диплоидные двойни (Lilium martagon и
L. henryi — Cooper, 1943); диплоид-диплоидные (Asparagus officinalis — Randall,
Rick, 1945) и диплоид-триплоидные двойни у Triticum — \amamoto, 1936,
диплоид-диплоид-диплоидная тройня (Sagittaria graminea — Johri, 1936),
гаплоид-диплоид-гаплоидная тройня (Azadiracta indica — Nair, Kanta, 1961).
Исходя из генетической разнокачественности, обусловленной происхождением
зародышей, типом наследования, можно выделить несколько типов семян:
1 — семена с половым (зиготическим) зародышем (n+n=2n); бипарентальное
наследование;
2 — семена с гемигамным химерным зародышем; бипарентальное наследование;
Унипарентальное — однородительское и бипарентальное — двуродительское наследование..
Клон (греч. clone — отпрыск, ветвь) — совокупность клеток или особей, происходящих от
общего предка путем бесполого размножения. Считается, что клон состоит из генетически
однородных клеток. Генетическая однородность относительна вследствие возникновения спонтанных
мутаций (Биологический энциклопедический словарь, 1965).
Двойни, тройни и т.д. могут быть различной генетики: «однояйцевые» (из одной зиготы) и
«разнояйцевые» (из зиготы, синергиды и т.д.).
400
Системы репродукции
3 — семена с партеногенетическим зародышем; унипарентальное (материнское
или отцовское) наследование:
а) семена, содержащие диплоидные зародыши — нередуцированный
партеногенез,
б) семена, содержащие гаплоидные зародыши — редуцированный партеногенез,
в).семена, содержащие гаплоидные зародыши — редуцированный андрогенез;
4 — семена с соматическим зародышем (эмбриоидом); унипарентальное
наследование:
а) семена, содержащие нуцеллярные зародыши,
б) семена, содержащие интегументальные зародыши.
в) семена, содержащие монозиготические зародыши;
5 — семена, содержащие половой (зиготический), партеногенетические
зародыши и эмбриоиды в различных сочетаниях. Развитие зародышей в
таких гетерогенных семенах и образование проростков происходит на
конкурентной основе.
В отлнчие от «нормальных» семян, содержащих только зиготические
зародыши, в гетерогенных семенах «бок о бок» протекают различные процессы
образования нового индивидуума (половой н бесполый). При этом часто ни
один из репродуктивных процессов не представлен «в чистом виде». Например,
образованию «однояйцевых близнецов» (двойни, тройни и т.д.) предшествует
половой процесс, который затем сменяется на бесполый (переключение
программы развития). Все эти сложные многоступенчатые процессы, происходящие в
семени, обеспечивают возможность воспроизведения и размножения новых
поколений, имеющих разные генотипы.
В статье не рассматриваются случаи генетической гетерогенности гибридных
семян и семян, в которых половые зародыши и эмбриоиды могут образоваться из
разных зародышевых мешков или завязей. Эти аспекты гетерогенности семян
обсуждаются в ряде работ (Asker, 1979; Lakshmanan, Ambegaokar, 1984; Nogler, 1984).
Таким образом, в семени теоретически могут сформироваться несколько
типов зачатков организмов с различной наследственностью и способных дать
новые поколения растений. При этом некоторые из них, а именно — половой
зародыш и партеногенетические зародыши (Taraxacum- и Ixeris-типы развития
зародышевого мешка) несут в себе значительные источники изменчивости для
новых популяций. Другие апомиктичные зародыши, образующиеся при
апоспории и некоторых формах диплоспории (Antennaria- и Allium-типы развития
зародышевого мешка), являются хранителями материнского генотипа и
неспособны (или слабо способны) к воспроизведению генетического
разнообразия. В этом смысле они соответствуют вегетативному размножению, но,
однако, они заключены в семени.
Такие эмбриоиды, участвующие в вегетативном размножении путем
клонирования старого материнского или нового дочернего спорофита в семени, снижают
уровень генетической изменчивости в семенах, но являются в то же время их составной
частью и, поэтому, имеют возможности семенного распространения по принципу
«там и тогда», в отличие от классических форм вегетативного размножения,
обеспечивающих воспроизведение и размножение «здесь и теперь», как остроумно
отметила Левина (1981), обсуждая некоторые аспекты репродуктивной биологии
цветковых растений.
Молекулярно-генетические аспекты репродукции
401
Полнэмбриония и генетическая гетерогенность семян.Образование в одном
семени нескольких дополнительных зародышей наряду с зиготическим принято
называть «полиэмбрионией» (Maheshwari, 1950) (Схема 1). Несмотря на то, что
после открытия этого феномена Левенгуком в 1719 году прошло более 250 лет,
продолжает оставаться дискуссионным вопрос об объеме термина «полнэмбриония»
(Johansen, 1950; Maheshwari, Sachar, 1963; Lakshmanan, Ambegaokar, 1984). В этой
статье явление полиэмбрионии обсуждается в связи с тем, что процессы, лежащие в
его основе, создают условия для сочетания разных генотипов в одном семени, что еще
более усиливает генетическую гетерогенность семян. Необходимость уточнения
понятия «полиэмбрионня» вызвана также тем, что эмбриоиды могут образовываться
не только в семени, но и на вегетативных органах цветкового растения.
Все соматические зародыши, независимо от их происхождения и места
образования (на репродуктивных или на вегетативных органах) так же, как и
зародыши, образующиеся из клеток одного или более гаметофитов в одной и той же
завязи, являются адвентивными по отношению к зиготическому зародышу
(зародышам). В связи с этим термин «адвентивная эмбриония» следует употреблять в
более широком смысле, а не сужать его до нуцеллярной и интегументальной
эмбрионии, как это делают многие авторы, или только до нуцеллярной (Grant,
1981; Nogler, 1984). Поэтому я полагаю, что общая категория «полнэмбриония»
заключает в себе формирование всех половых и партеногенетических (гаметофит-
ных) зародышей и эмбриоидов в семени и на вегетативных органах в любых
возможных комбинациях.
Их образование может быть вызвано гибридизацией, опылением, физическими,
химическими и другими факторами. Развитие дополнительных зародышей может
быть автономным, спорадическим, индуцированным.
В настоящее время не известно, каковы морфофизиологические и
генетические причины полиэмбрионии. По-видимому, одной из причин является
нарушение организации зародыша и окружающих его структур, что
способствует переходу к полиэмбрионии. У слабо интегрированных зародышей
некоторых животных, возможно, вырабатывается иной способ регуляции деления
клеток, как защита от неблагоприятных условий среды. Как показано на некоторых
беспозвоночных животных, в этих случаях происходит переход к
соматическому эмбриогенезу (Токин, 1987). Некоторые авторы считают, что нарушаются
нормальные физиологические связи между частями зародыша, что, вероятно,
приводит, как мы полагаем, к нарушению аллометрии. Очень важным является
то, что при дезинтеграции частей зародыша или самого зародыша, часто
происходит отмирание его отдельных клеток (апоптоз), тогда как в других клетках
начинаются процессы дедифференциации и пролиферации, которые приводят к
полиэмбрионии (Токин, 1987).
Некоторые авторы рассматривают полиэмбрионию как рецессивный признак,
контролируемый группой генов (Kappert, 1939; Maheshwari, 1950). Другая
гипотеза объясняет появление семян с несколькими зародышами с цитологических
позиций (Rhoedes, 1961): должен быть определенный хромосомный баланс между
зародышем, эндоспермом и материнскими тканями (2:3:2). Такое соотношение
определяет «формулу успеха» развития дополнительных зародышей в семени.
Способность растительного организма образовывать эмбриоиды на всех этапах
его развития на различных органах (вегетативных и генеративных) при сохранении
способности к половому воспроизведению повышает пластичность и толерантность
Схема 1. Полиэмбриоиия у цветковых растений
1-4 — Ardisia polytoca: 1 — внешний вид семени, видны 7 зародышей; 2, 3 — положение зародышей в
семени, 4 — два семени из одного плода, вид сверху; 5-8 — прорастающие семена Hemenocallis
mexicana, зародыши выходят в различных местах семени (8 — семядоли изогнутые); 9-13,
16-19 — Euonimus latifolius: 9-11 — 3 зародыша в одном семени, два из которых, меньшего размера,
лежат между семядолями крупного зародыша (11 — их размеры и положение показаны пунктиром), 12,
13 — семя с двумя зародышами, 16, 17 — два проростка из одного семени, 18, 19 — три проростка из
одного семени (19 — семенная кожура удалена); 14, 15 — Amygdalis communis, два зародыша в одном
семени, при этом маленький зародыш лежит между семядолями крупного зародыша с неравными
семядолями.
По: Braun, 1859.
Молекулярно-генетические аспекты репродукции
403
систем репродукции. Тем самым создаются предпосылки формирования
гетерогенных (в возрастном и генетическом плане) популяций (Схема 2).
Экологическая и эволюционная роль гетерогенности семян. При
рассмотрении всех указанных форм эмбриоидогении и гаметофитного апомиксиса с точки
зрения их географического и климатического распространения, можно выявить
некоторые тенденции. Явление адвентивной полиэмбрионии (нуцеллярной и интегу-
ментальной эмбриоидогении) встречается в тропических и субтропических
условиях, тогда как гаметофитный апомиксис чаще встречается у растений северных
регионов с более холодным климатом (Grant, 1981). Бесполые диплоиды
встречаются чаще в группах с нуцеллярной и интегументальной эмбрионией (мно-
Схема 2. Способы образования индивидуума у цветковых растений, определяющие
характер состава популяции
эмбриогенез
эмбриоидогеиез
партеногенез
аидрогеиез
апогаметия
гемигамия
Клон F,
9)
гкг-ж---ья
Клон F,
• / •
^£г
Клон F,
ГОМОФАЗНАЯ РЕПРОДУКЦИЯ (СПОРОФИТ
-►СПОРОФИТ)
Р (частая точка) — родительский организм; F, (редкая точка) — первое поколение; F2 (редкая
точка) — второе поколение); белым обозначены зиготы и зиготический зародыш 1 и 2 поколений;
черным — соматические зародыши (эмбриоидогенный тип репродукции), белые стрелки —
формирование 1 поколения от зиготы до формирования репродуктивной сферы (семязачаток,
семя); черная стрелка — развитие 2 поколения в семязачатке—семени на организме 1 поколения.
Слева указаны возможные способы образования нового индивидуума 1 и 2 поколений.
404
Системы репродукции
гие виды Citrus), чем в группах с гаметофитным апомиксисом (Gustafsson,
19464947; Stebbins, 1950).
Влияние климатических факторов на полиэмбрионию установлено и для
некоторых голосемянных. Так, у северных аутохтонных популяций сосны
обыкновенной многозародышевые семена могут образовываться под влиянием низких
температур (Шимак, 1973).
Особенности развития семян (зародыши разного происхождения, запас
питательных веществ и прочные покровы, период покоя и др.), способствуют
созданию банка живых семян в почве. Это, в свою очередь, обеспечивает во многом го-
меостаз вида, популяции, ценоза. По образному выражению Левиной (1981),
запас семян в почве является по существу, «эмбриональной популяцией» вида и его
«долгосрочным резервом».
Теоретически можно полагать, что только за счет кливажной эмбриоидогении и
вивипарии (см. Вивипария) в течение одного сезона можно наблюдать
генетически однородную, но разновозрастную популяцию (Схема 2). В то же время за счет
нуцеллярных и интегументальных эмбриоидов, являющихся производными той же
зиготы, что и эмбриоиды, образующиеся при кливажной эмбриоидогении и
вивипарии, в течение нескольких сезонов, а иногда даже лет сохраняется родительский
генотип в популяции. При этом следует отметить, что в одном и том же семени,
наряду с нуцеллярными и интегументальными эмбриоидами, может образоваться
новая зигота, дающая в популяции генетически новое потомство. Нельзя забывать о
разных формах гаметофитного апомиксиса (партеногенез, апогаметия, гемигамия,
андрогенез), которые также усиливают генетическую гетерогенность семян. Таким
образом, наличие в одном семени половых зародышей и эмбриоидов разного
происхождения создает большую генетическую гетерогенность семян, т.е.
гетерогенность «эмбриональной популяции». Это явление встречается в природе
относительно часто, хотя многие исследователи, занимающиеся изучением семян и
сеянцев, его обычно игнорируют.
Степень преобразования генетического материала при различных типах
репродукции в процессе смены поколений постепенно уменьшается в следующем
направлении: гамоспермия (при перекрестном опылении) => гамоспермия (при
самоопылении) => агамоспермия (в случае гаметофитного апомиксиса) => ага-
моспермия (монозиготическая, нуцеллярная и интегументальная эмбриоидоге-
ния) => аспермия (в случае гемморизогении, фолиарной, каулигенной и ризоген-
ной эмбриоидогении). В этом ряду постепенно ослабевает значимость мейотиче-
ских преобразований и происходит замена семенной репродукции на
вегетативную. Процесс смены форм репродукции и соотношение типов и
способов репродукции в одном жизненном цикле, вероятно, связаны с изменениями ус*
ловий обитания растений. Меньшие преобразования генетического материала
(например, при апомиксисе) не расширяют адаптивные возможности организма,
в отличие от генерации в перекрестноопыляемых популяциях (гамоспермия). Все
вышерассмотренные тенденции могут реализоваться одновременно и
закрепляться в потомстве. Примером может служить репродукция посредством семян и
плодов, содержащих одновременно зачатки индивидуумов с принципиально
различной наследственностью — половые и соматические зародыши.
Значительный интерес представляют и полностью агамоспермные системы
размножения, при которых в семенах могут воспроизводиться спорофиты с разной
материнской наследственностью, а именно, разного происхождения: эмбриоиды —
Молекулярно-генетические аспекты репродукции
405
монозиготические, нуцеллярные, интегументальные и гаметофитные зародыши
(партеногенез, андрогенез, гемигамия и апогаметия).
Изучение агамо-половых комплексов представляет большой интерес с
теоретической точки зрения, так как дает основания для объективной оценки агамос-
пермии как особой формы семенного размножения и ее роли в микроэволюции.
Кроме того, эти исследования очень важны как основа цитогенетического
изучения апомиксиса в целях селекции. Семейства с агамоспермными видами
занимают самые различные места в филогенетической системе. Вероятно, это
проявление параллелизма в эволюции, столь широко известное у цветковых по многим
морфологическим признакам.
Генетическая неоднородность семян создается даже при автогамии благодаря
мейозу, что приводит к появлению семенного потомства, генетически отличающегося
от материнской особи, чего никогда не бывает в клоне при вегетативном
размножении. В перекрестноопыляющихся популяциях (при аллогамии) создается высокий
уровень гетерозиготности и большой «маневренный фонд» рецессивных генов.
Эта очень важная проблема остается еще мало изученной, хотя познание
генетической разнокачественности семян и популяций представляет интерес, как для
разработки теории репродукции, так и для практики (создание новых видов, сортов
растений и т.п.). Несомненно, эта проблема имеет прямое отношение к общей
проблеме сохранения биологического разнообразия на нашей планете.
Многовариантность способов репродукции в одном жизненном цикле у
цветковых растений, несомненно, имеет адаптивное значение, обеспечивая выживание
вида в норме и при стрессе. Системы репродукции у растений следует
рассматривать не только на аутэкологическом, но и на популяционном и экосистемном
уровнях, учитывая при этом эволюционный аспект. В связи с этим при разработке
экологических проблем репродуктивной биологии, популяционной эмбриологии,
генетики и селекции следует применять как морфологические, эмбриологические, так и
генетические и общебиологические критерии (Табл.).
Дальнейшая разработка представлений о многообразии способов
воспроизведения и размножения цветковых растений (в частности, о полиэмбрионии,
апомиксисе, генетической гетерогенности семян и т.д.) будет способствовать прогрессу в
изучении систем репродукции и расширению использования этих явлений в
интересах человечества.
Батыгина, 1992, 1993, 1999; Левина, 1981; Токин, 1987; Шимак, 1973; Asker, 1979; Battaglia,
1963; Batygina, 1999; Beasley, 1940; Cooper, 1943; Hagerup, 1947; Haque, 1946; Grant, 1981;
Gustafsson, 1946-1947; Johansen, 1950; Johri, 1936; Kappert, 1939; Lakshmanan, Ambegaokar, 1984;
Maheshwari, 1950; Maheshwari, Sachar, 1963; Nair, Kanta, 1961; Nogler, 1984; Randal, Rick, 1945;
Rhoedes, 1961; Stebbins, 1950; Yamamoto, 1936.
406
Системы репродукции
ЧАСТЬ VI — ПОПУЛЯЦИОННЫЕ И ЭКОЛОГИЧЕСКИЕ
АСПЕКТЫ РЕПРОДУКЦИИ
ФИТОЦЕНОЗ (греч. phyton — растение, koinos — общий) — участок
растительности, характеризующийся относительной однородностью строения,
флористического состава и условий абиотической среды (Шенников, 1964). Фитоценоз
является одним из основных объектов геоботаники (фитоценологии).
Существующие разные определения фитоценоза отличаются друг от друга лишь
по форме. В определениях представителей старшего поколения европейских
геоботаников главное внимание было обращено на гомогенность и определенность
строения и флористического состава (Kylin, 1926; Braun-Blanquet, 1951). Однако еще
Сукачев (1935) указывал, кроме того, на взаимозависимость растении в
фитоценозе. Ellenberg (1956,1968) подчеркивал обусловленность растительного
сообщества конкуренцией между растениями. Ниценко (1953, 1963) совершенно верно
отмечал, что в определении Сукачева нет четких критериев необходимой степени
однородности, что оно объясняет отличие фитоценоза от нефитоценоза, но не отличие
одного фитоценоза от другого.
Недостаток определения фитоценоза, сложившегося в классической
геоботанике, заключается в том, что в него было введено сразу два критерия:
обусловленность взаимоотношениями растений и гомогенность состава и строения, причем ни
тот, ни другой не были определены достаточно четко.
Взаимоотношения между растениями не обусловливают пространственной
однородности фитоценоза и его границ, не связывают фитоценоз в единую
материальную систему. Каждое растение в результате своей жизнедеятельности изменяет
среду вокруг себя, создавая фитогенное поле (Уранов, 1965), но площадь его
обычно невелика, лишь ненамного превышая площадь кроны и корневой системы. В
пределах фитоценоза, занимающего площадь в сотни квадратных метров или
гектары, не существует воздействия каждой особи на каждую. Пространственная
однородность факторов абиотической среды может способствовать образованию
пространственно однородного фитоценоза, но только тогда, когда весь однородный
по условиям среды участок (экотоп) имеет совершенно одинаковую историю
заселения и развития растительности. В противном случае на одном экотопе могут
находиться разные фитоценозы, представляющие разные стадии развития
растительности. Неравномерное снабжение диаспорами (семенами, спорами) разных частей
одного экотопа также приводит к заметным различиям растительности.
Популяционные и экологические аспекты репродукции 407
Если рассматривать фитоценоз как совокупность растений, находящихся во
взаимодействии друг с другом, то в этом случае оказывается невозможным
проводить границы между ними, так как на границах фитоценозов взаимодействия
между растениями не менее сильные, чем внутри их. Что касается изменений характера
взаимодействия растений на границах, то об этом до сих пор практически ничего не
известно. Ипатов (1966), анализируя сложившееся определение фитоценоза,
пришел к выводу, что этому определению более строго соответствует ценоячейка
(совокупность непосредственно взаимодействующих растений), а фитоценоз в
обычном понимании является скорее единицей районирования.
Норин (1968,1974) считал наличие взаимосвязей между растениями
основным признаком фитоценоза. Для отнесения какого-либо контура
растительности к фитоценозам он полагал необходимым наличие в них эдификатора (вида,
оказывающего сильное воздействие на среду и благодаря этому на все
остальные виды сообщества) или эдификаторной синузии, под контролем которой
находится вся площадь группировки. Фактически, он считает фитоценозами
лишь лесные группировки, где имеется достаточно сомкнутый древесный ярус,
и сообщества моховых болот. Эта точка зрения логично вытекает из
определения фитоценоза Сукачева и его последователей, но Норин придал слишком
большое значение силе взаимовлияния растений, в результате чего сильно сузил
понятие фитоценоза.
Состав и соотношения видов на каждом участке определяются как условиями
среды, так и взаимоотношениями между растениями. Известно, что в любом более
или менее сомкнутом растительном покрове, по крайней мере в подземной сфере,
взаимоотношения между растениями оказываются существенными для
определения их обилия и жизненности, но до сих пор отсутствуют надежные методы
количественной оценки их роли. Исходя из того, что взаимодействуют между собой лишь
соседние растения, а однородные участки растительности могут занимать
значительную площадь, не следует связывать основную единицу территориального
расчленения растительности с силой и характером взаимодействий между растениями.
Фитоценоз в общем случае — не система взаимодействующих растений, а
контур, характеризующийся определенным сходством растительности в разных его
частях (Василевич, 1983). Сходное по смыслу определение дали Ипатов и Кири-
кова (1997: с. 214): «Фитоценоз — участок растительного покрова, состав и
строение которого распределены по территории в соответствии с определенным
законом». Упоминание об определенном сходстве, определенном законе нужно для
того, чтобы можно было.создать какие-то правила, позволяющие проводить
границы между соседними фитоценозами.
Фитоценозы не являются наименьшей единицей пространственного
расчленения растительности. Нередко внутри фитоценозов встречаются участки,
сильно отличающиеся друг от друга по флористическому составу и
соотношениям разных видов. Такие участки получили название микрогруппировок, или
микроценозов. Основная причина появления микрогруппировок — средооб-
разующее воздействие определенного вида (одной особи или группы особей). В
лесных фитоценозах, где влияние деревьев на среду достаточно хорошо
выражено, микрогруппировки встречаются довольно часто. Они свойственны тем
сообществам, где древесный ярус разрежен или состоит из деревьев разных
пород, благодаря чему и создается неоднородность среды. Часто такие микро-
408 Системы репродукции
группировки занимают подкроновые пространства отдельных деревьев или
охватывают площадь, занятую небольшой группой подроста.
В травяных сообществах при отсутствии достаточно сильных эдификаторов
микрогруппировки — не частое явление. Пестрота травостоя, которая нередко
бросается в глаза, создается в основном за счет вегетативного разрастания (см.
Вегетативное размножение) особей отдельных видов или их более частой
встречаемости в более благоприятных условиях среды. Большую роль в создании пестроты
фитоценозов играет локальная неполночленность, т.е. связанная со случайными
обстоятельствами неравномерность в снабжении разных участков фитоценоза пропа-
гулами и в прорастании и выживаемости всходов.
Работнов (1972) выделяет следующие типы мозаичности фитоценоза: 1)
эпизодическая, обусловленная случайностями в распределении зачатков, 2) экотопи-
ческая, 3) фитогенная, обусловленная воздействием одного вида на другие, 4)
клоновая, 5) зоогенная, 6) антропогенная. В качестве микрогруппировки
следует рассматривать только такое сочетание обилий видов, которое является
достаточно закономерным, повторяющимся и имеет достаточно большие отличия от других
микрогруппировок.
Многие фитоценозы не включают в себя микрогруппировки, а являются
однородными в пространстве, гомотонными. Кроме того, необходимо различать
пространственно-гомогенные и клинальные фитоценозы (Василевич, 1967).
Пространственно-гомогенные фитоценозы характеризуются тем, что в любом
направлении в пределах такого фитоценоза растительность не меняется, и
сходство любых площадок не зависит от расстояния между ними на местности.
Основной фактор, определяющий существование пространственно-гомогенных
фитоценозов — пространственная однородность условий абиотической среды.
Клинальные фитоценозы характеризуются тем, что в их пределах происходит
плавное изменение растительности, без каких-либо скачков: численность одних
видов снижается, других растет, но какую-либо обоснованную границу между
разными частями такого фитоценоза провести нельзя. Если клинальный фитоценоз имеет
достаточно большую протяженность и высокую скорость изменения параметров,
то крайние его участки могут сильно отличаться по флористическому составу и
количественному соотношению видов. В ряде случаев такие крайние участки могут
быть отнесены даже к разным ассоциациям. Клинальные фитоценозы встречаются
главным образом на склонах, даже очень пологих, где происходят медленные и
плавные изменения абиотической среды.
Многие геоботаники считают, что классификация растительности — это
классификация фитоценозов. Наличие клинальных фитоценозов делает эту точку
зрения несостоятельной. В действительности, все классификации основываются на
описаниях площадок определенного размера, которые в общем случае
представляют лишь часть фитоценоза. Основное требование к этим площадкам — они
должны быть не менее площади выявления, т.е. они должны включать достаточно
большое число видов, а усредненные характеристики обилия видов на них должны
давать достаточно точную картину состояния растительности, сглаживая очень
сильное случайное варьирование растительности.
Василевич, 1967, 1983; Ипатов, 1966; Ипатов, Кирикова, 1997; Ниценко, 1953, 1963; Норин,
1968, 1974; Работнов, 1972; Сукачев, 1935; Уранов, 1965; Шенников, 1964; Braun-Blanquet
1951; Ellenberg, 1956,1968; Kylin, 1926.
Популяционные и экологические аспекты репродукции
409
ЭКОЛОГИЧЕСКАЯ НИША — положение вида в экосистеме, определяемое его
отношениями к факторам среды, другим видам и потребляемым ресурсам.
Впервые этот термин употребил американский орнитолог Grinnell (1917). Он
описал экологическую нишу калифорнийского пересмешника, охарактеризовав его
пищу и способ ее добывания, места для укрытия и гнездования, его связь с
климатическими факторами и растительными сообществами. Автор не проводил
различий между экологической нишей вида и экологической амплитудой , что и явилось
источником путаницы, продолжающейся до сих пор.
Гораздо более определенны высказывания Elton (1927), который определил
экологическую нишу как место животного в биотической среде, его отношение к
пище и врагам. Он считал, что ниши — это просто подразделения таких
понятий, как «хищники», «травоядные», «насекомоядные» и т.д., и показал, что в
разных сообществах одну и ту же нишу могут занимать разные виды. До
недавнего времени геоботаники мало пользовались этим понятием, и только в
последние два десятилетия концепция экологической ниши стала рабочим
инструментом в теоретических построениях, объясняющих структуру и
функционирование растительных сообществ.
. Наиболее развернутое определение экологической ниши дал Hutchinson
(1957). При этом он использовал понятие экологического пространства, в котором
каждая ось представляет какой-либо экологический фактор, оказывающий
воздействие на данный вид. Максимальные и минимальные значения факторов, при
которых вид может существовать, определяют объем экологического пространства, в
котором возможно существование вида — его экологическую нишу. Это
определение очень популярно у экологов, но оно внутренне противоречиво.
Принцип конкурентного исключения (Gause, 1934), согласно которому виды,
занимающие в сообществе одну и ту же экологическую нишу, вступают в
напряженные конкурентные отношения друг с другом, и в результате один вид вытесняет
другой, считается одним из основных законов организации биоценозов.
Включение в экологическую нишу всех существенных для организма факторов
привело к тому, что многие стали понимать ее как синоним «экологической
амплитуды» (Savage, 1958). В связи с этим было предложено различать следующие
понятия: 1) функциональная ннша, которая определяется позициями вида в
данном сообществе, потребляемыми видом ресурсами, разделение по которым может
снизить или исключить конкуренцию между видами, произрастающими в одном
сообществе; 2) пространственная ниша, или ниша местообитаний, отражающая
распределение вида по градиентам условий среды и сообществ; 3) ниша как
объединение обоих этих понятий (Whittaker, 1972; Whittaker et al., 1973).
Набор факторов, включаемых в функциональную нишу, весьма широк. Это —
не только пища, но и убежище, субстрат, положение в ярусах сообщества, сезонная
и суточная ритмика активности, контроль хищниками, конкуренция, аллохимиче-
ские отношения и т.д.
Odum (1971) не дал развернутого определения экологической ниши, но оставил
блестящий афоризм. Он писал, что местообитание — это адрес вида, а
экологическая ниша — его профессия.
Т.е. амплитудой факторов абиотической среды, в которой встречается данный вид.
410
Системы репродукции
Наиболее логичной является концепция экологической ниши Elton (1927). Рас
ширение этого понятия с включением в него экологической амплитуды делает его
слишком неопределенным. В экологическую нишу следует включать не все
действующие на организм факторы, а лишь те, которые определяют место вида в системе
межвидовых отношений внутри сообщества.
Дифференциация экологических ниш видов приводит к устранению
конкуренции между ними только в том случае, когда происходит разделение ниш по
всем ресурсам. У автотрофных растений она может осуществляться по
следующим ресурсам: 1) солнечная радиация (свет) как источник энергии для
фотосинтеза, 2) вода, 3) элементы минерального питания (макро- и
микроэлементы). Все они необходимы каждому виду растений, хотя и в разном количестве.
Дифференциация по каждому из этих ресурсов в принципе возможна, но только
в весьма ограниченных пределах.
Растения под пологом ели используют свет, который прошел сквозь крону
деревьев. Здесь нет конкуренции за свет, так как растения нижних ярусов не в
состоянии перехватить свет у деревьев ели, а тот свет, который прошел через кроны,
ели не нужен. В этом случае правильнее говорить о приспособлении, а не о
конкуренции (Ипатов, 1970). Но такое разделение по фактору света является далеко не
полным, если иметь в виду не отдельное растение, а популяции в целом.
По крайней мере, в первые фазы своего развития каждый вид находится в
зависимости от всех остальных видов в отношении светового режима. Следовательно,
как бы ни отличались виды растений по высоте расположения своих фотосинтези-
рующих органов и по потребностям в свете, это не может исключить конкуренцию
между ними за свет.
Вода — несколько более сложный фактор, чем свет, так как она может
поступать в сообщество сверху в виде осадков, снизу с грунтовыми водами и со стороны
за счет поверхностного или внутрипочвенного стока. Возможно существование
сообществ с двумя независимыми группами видов по отношению к водному питанию
— фреатофитов, использующих глубоко расположенные грунтовые воды, и ом-
брофитов, получающих воду за счет атмосферных осадков. Если влага осадков не
смыкается с грунтовыми водами, что нередко имеет место в аридных областях, то
разделение экологических ниш видов по этому фактору может быть полным. Но
всходы появляются на поверхности почвы и вначале имеют слабо развитую
корневую систему. Фреатофиты не с первых дней своей жизни становятся таковыми.
Всходы фреатофитов по существу омброфиты, и, следовательно, конкуренция за
влагу осадков между фреато- и омброфитами не исключается.
Что касается минерального питания, то в этом случае ситуация еще более
сложная, так как число элементов питания, необходимых каждому растению,
достаточно велико. Но все же растения не отличаются существенно по тому набору
элементов, которые им нужны для жизни. Различия между видами по этим параметрам в
основном количественные, поэтому нельзя сказать, что хотя бы некоторые из
видов, растущих вместе на одном ограниченном по площади участке, имеют
независимые источники минерального питания.
Таким образом, полное расхождение экологических ниш автотрофных
растений внутри сообщества невозможно ни по одному ресурсу.
В пределах сообщества нередко возникает мозаичность, обусловленная средо-
образующим воздействием самих растений. Такая фитогенная мозаичность приво-
Популяционные и экологические аспекты репродукции
411
дит к размещению части видов по разным микрогруппировкам. Она обычно ясно
выражена лишь в тех сообществах, где имеется сильный эдификатор, но где он не
образует сомкнутого полога или же в сомкнутом пологе чередуются особи
нескольких видов-эдификаторов. Фитогенная мозаичность может привести к разделению
экологических ниш некоторых видов сообщества. Произрастая в разных
микрогруппировках, такие виды, естественно, не могут конкурировать друг с другом.
Надежное разделение экологических ниш растений возможно лишь тогда,
когда они разграничены во времени или в пространстве. Эффективное число
параметров экологической ниши может быть сведено к трем: место, время, пища
(Pianka, 1974). Отсутствие пищевой специализации у растений дает им
возможность расходиться по разным нишам лишь по первым двум параметрам.
Геоботаники по-разному оценивали дифференциацию экологических ниш у
растений. Одни авторы (Работнов, 1950; Шенников, 1964) считали, что каждой си-
нузии в ценозе свойственна особая экологическая ниша. Позднее Работнов (1973)
стал считать, что в сложившихся фитоценозах столько экологических ниш, сколько
видов растений. Правда, он отмечал, что экологические ниши видов растений
полностью или частично перекрываются.
Whittaker (1972) считал, что все виды растении отличаются не
взаимоисключающими нишами, а лишь различным положением их центров. Он рассматривал
следующие факторы дифференциации растений по экологическим нишам в Сонор-
ской пустыне (Whittaker, 1975): 1) дифференциация по высоте, на которой
развивается основная масса листвы, 2) дифференциация по сезонам, 3) различное
решение водной проблемы.
Этих факторов явно недостаточно для полного или частичного разделения
экологических ниш всех видов сообщества. Что же касается дифференциации
растений по сезонам, то, действительно, существуют разные временные сину-
зии, отличающиеся периодом активности растений, т.е. потребляющие ресурсы
в разные сезоны. Примером такой синузии могут служить весенние эфемеры и
эфемероиды в пустынях и широколиственных лесах, которые вегетируют в то
время, когда основная доля летневегетирующих видов находится в состоянии
покоя. Есть все основания считать, что весенняя синузия представляет особую
экологическую нишу, но в большинстве случаев она занята не одним видом, а
довольно значительным их числом.
Несмотря на очень сильное перекрывание, а во многих случаях почти полное
тождество экологических ниш у ряда видов растений, существуют многовидовые
сообщества, состоящие из нескольких десятков видов. Такие сообщества нередко
устойчивы. Это находится, на первый взгляд, в прямом противоречии с принципом
конкурентного исключения. Но все дело в том, что существует ряд обстоятельств,
которые мешают действию этого принципа, т.е. полному вытеснению одного вида
другим. Прежде всего, при постоянно варьирующих условиях среды направление
конкуренции меняется, что обеспечивает сосуществование видов. Вследствие
неподвижного образа жизни растения могут распространить свое влияние лишь на
ограниченную площадь вокруг себя (фитогенное поле). В течение жизни растение
может вытеснить соседей лишь из фитогенного поля, которое ненамного больше
площади кроны и корневой системы.
Конкурентное исключение может проходить успешно и быстро лишь тогда, когда
один из конкурирующих видов имеет заметные преимущества перед другими. Но в
412
Системы репродукции
процессе видообразования, идущего независимо в разных таксонах, возникло
большое число видов с примерно равной конкурентоспособностью, в связи с чем и
невозможно конкурентное исключение одним видом ряда других (Василевич, 1979).
Сейчас все большее число геоботаников склоняется к тому, чтобы считать
ресурсные ниши растений мало дифференцированными. В этом существенное
отличие растений от животных, у которых наблюдается очень сильная дифференциация
экологических ниш.
Животные сильно специализированы по кормам: одни из них являются
растительноядными и питаются определенными видами растений, другие — хищники,
но поедающие лишь некоторые виды растительноядных животных, третьи — са-
протрофы, питающиеся мертвыми остатками животных или растений. Кроме того,
животные отличаются по времени суточной и сезонной активности, по местам, в
которых они переживают неблагоприятные для них сезоны года или размножаются.
Животным свойственна высокая специализация по тем ресурсам, которые они
потребляют, хотя далеко не все они являются монофагами, т.е. питающимися только
одним каким-то видом.
Когда говорят о дифференциации экологических ниш у растений, то чаще
всего понимают под этим дифференциацию ниш местообитаний, но
несовпадение этих ниш (точнее, экологических амплитуд) уже следует из принципа
экологической индивидуальности видов, который был сформулирован Рамен-
ским (1925) и Gleason (1926).
Слабая дифференциация ресурсных ниш у растений приводит к тому, что более
или менее напряженные конкурентные отношения возникают между большей
частью видов, произрастающих вместе в одном растительном сообществе.
Василевич, 1979; Ипатов, 1970; Работнов, 1950,1973; Раменский, 1925; Шенников, 1964; Elton,
1927; Gause, 1934; Gleason, 1926; Grinnell, 1917; Hutchinson, 1957; Odum, 1971; Pianka, 1974;
Savage, 1958; Whittaker, 1972,1973,1975.
ПОПУЛЯЦИЯ (лат. populus — множество) — совокупность особей одного вида, в
пределах которой осуществляется более или менее свободный обмен генами,
вследствие чего особи одной популяции оказываются генетически относительно
сходными. Это — минимальная самовоспроизводящаяся группа особей одного
вида, имеющая достаточно большую численность, на протяжении эволюционно
длительного времени населяющая определенное пространство и на протяжении
большого числа поколений в высокой степени изолированная от аналогичных групп
особей (Яблоков, 1987).
У растений обмен генами происходит за счет перекрестного опыления. В
популяциях самоопыляющихся амфимиктических растений и апомиктов он идет менее
интенсивно, но этого достаточно, чтобы поддерживать высокое генетическое
разнообразие в таких популяциях.
Пространственные границы популяций, как правило, очерчены весьма слабо, и
выделение каких-либо естественных популяций, внутри которых идет интенсивный
обмен генами и в то же время изолированных от соседних популяций, довольно
затруднительно. Специалисты по популяционной генетике считают, что достаточно
незначительного обмена генами, чтобы генетическая структура двух популяций
Популяционные и экологические аспекты репродукции
413
растений оказалась практически идентичной. К тому же мы очень мало знаем о
том, на какое расстояние переносятся пыльца и диаспоры (семена, споры)
большинства видов, а это основные факторы, способствующие генному обмену и
определению пространственных размеров популяций.
Работы последних лет по генетической структуре популяций растений,
выявляемой при помощи анализа варьирования аллозимов, показали, что большая часть
внутривидового генетического варьирования сосредоточена внутри популяций, но,
тем не менее, популяции, даже далеко удаленные друг от друга, мало отличаются по
генетической структуре (Berg, Hamrick, 1994; Lin et al., 1994; Ponoy et al., 1994;
Godt, Hamrick, 1995; Hofmann, Geburek, 1995; Konnert, 1995; Pedrola-Monfort,
Caujape-Castells, 1995; Demesure et al., 1996; Elena-Rossello, Cabrera, 1996; Silin,
Goncharenko, 1996; Cronberg et al., 1997; Wang, Nagasaka, 1997). Генетические
различия между популяциями обычно не связаны с географическим расстоянием
между ними (Akiyama, 1994; Konnert, 1995; Tuskan et al., 1996). Однако в ряде
работ было показано, что имеются определенные географические тренды в
различиях между популяциями (Семериков и др. 1993; Санников и др., 1997;
Muller-Stark, 1995; Zanetto, Kremer, 1995; Tani et al., 1996).
В практических исследованиях популяций обычно исходят не из генетической
изолированности или генетического своеобразия популяции, а из более или менее
изолированной совокупности особей одного вида. В связи с этим в геоботанике воз- ■
никло понятие о ценопопуляции как совокупности особей одного вида в
пределах фитоценоза (Петровский, 1961). Это понятие стало широко использоваться,
но, естественно, возник вопрос о соотношении его с понятием популяции.
В своей основополагающей работе по популяциям растений Работнов (1950,
с. 466) определил популяцию как «...совокупность особей одного вида,
произрастающих в определенном ценозе. Любой вид, если он встречается в
нескольких ценозах, представлен в них особыми популяциями». Этим было положено
начало воззрению на то, что границы популяций совпадают с границами
фитоценоза. Эту точку зрения разделяли Лавренко (1959), Шмальгаузен (1964),
Дажо (1975). Позднее некоторые геоботаники начали считать, что
ценопопуляции чаще всего представляют лишь часть конкретной популяции (Рысин,
Казанцева, 1975; Ценопопуляции растений (основные понятия и структура),
1976). Но Работнов (1992) остается на прежней точке зрения и считает, что
каждый вид в конкретном ценозе представлен особой популяцией, которую
следует считать фитоценотической.
В общебиологической сводке по популяциям (Тимофеев-Ресовский и др., 1973,
с. 75) утверждается, что «...границы биогеоценоза (экосистемы,
пространственные размеры которой совпадают с фитоценозом) являются в то же время
границами соответствующих популяций большинства видов, образующих данный
биогеоценоз». По мнению многих авторов, границы биогеоценоза совпадают с границами
фитоценоза, но Тимофеев-Ресовский считал, что биогеоценоз может быть по
площади и менее фитоценоза, а в ряде случаев, у видов животных и растений с мелкими
размерами особей границы популяций размещаются внутри биогеоценоза. Нужно
учитывать, что довольно часто фитоценозы имеют сравнительно небольшие
размеры: в травяной растительности — десятки квадратных метров, а в древесной (в
лесах) — несколько сотен. Вряд ли популяции многих видов животных и растений
могут уместиться на такой небольшой территории.
414
Системы репродукции
Точка зрения о том, что границы популяций совпадают с границами фитоцено-
зов, противоречит принципу непрерывности растительного покрова. Согласно
этим представлениям, мы должны были бы наблюдать почти всегда очень резкие
границы между фитоценозами. Часть видов данного фитоценоза, очевидно,
должна отсутствовать в соседних фитоценозах, что обеспечит относительную
пространственную изоляцию популяций, а у другой части видов на границах фи-
тоценозов должны возникать какие-то барьеры, обеспечивающие относительную
биологическую изоляцию, например, существенный сдвиг в сроках цветения.
Такие барьеры бывают (Falinska, 1974; Петрова, Санников, 1996), но,
по-видимому, далеко не у всех видов и далеко не во всех случаях. Обычно на
границе фитоценозов, которые к тому же нередко бывают весьма размытые,
происходит изменение обилия лишь части видов сообщества, несколько меняется и
флористический состав. Но изменения обилия или жизненности — еще не
доказательство наличия границы между популяциями.
Второе обстоятельство, которое не позволяет согласиться с совпадением границ
популяций и фитоценозов — повторяемость более или менее сходных фитоценозов
в пределах ограниченной территории. Пыльца и диаспоры могут легко
переноситься из одного фитоценоза в другой, обеспечивая этим панмиксию в пределах
значительного числа фитоценозов, где произрастает данный вид. Только в том случае,
когда фитоценоз очень сильно удален от других, где растет рассматриваемый вид,
его популяция совпадает по размерам с единственным фитоценозом. Но такие
случаи представляют собой скорее исключение, чем правило.
Кроме того, популяция — совокупность особей, населяющая определенное
пространство в течение жизни большого числа поколений. Однако значительная часть
фитоценозов преобразуется весьма быстро, по крайней мере, так обстоит дело в эпоху
интенсивного воздействия человека на природу. Значительная часть видов никогда не
встречается в коренных (климаксовых) сообществах, а свойственна различным фито-
ценозам, находящимся в процессе сукцессионных смен. Сукцессия (термин
предложен Clements, 1916) — направленные изменения растительности, начинающиеся на
местах, где растительность была уничтожена в результате каких-то природных или
антропогенных воздействий, и заканчивающиеся формированием устойчивых коренных
сообществ. На первых стадиях сукцессии господствуют эксплеренты (по Раменско-
му, 1935), или виды-беглецы («fugitive species», Whittaker, 1975), быстро
захватывающие свободную территорию, но не способные долго ее удерживать. Сукцессии, как
правило, идут настолько быстро, что каждый такой вид существует на данном месте в
течение одного или немногих поколений. Популяции таких видов охватывают большие
территории, в пределах которых быстро возникают и также быстро исчезают
отдельные кратковременные группировки особей, называемые поселениями (Шварц,, 1969),
или демами (Тимофеев-Ресовский и др., 1973). Сукцессии интенсивно протекают
лишь тогда, когда обнаженные местообитания (первичные и вторичные) находятся в
пределах популяционных ареалов многих видов местной конкретной флоры. Иначе
нельзя объяснить быстрое появление сомкнутых древостоев березы или осины на
вырубках, а сосны — на гарях. Но стоит только целиком уничтожить популяцию, как
этот процесс прекращается или сильно замедляется.
Очень бурная по сравнению с темпами эволюционных процессов динамика
растительности привела к тому, что популяции многих видов существуют как
совокупности поселений, каждое из которых весьма кратковременно, но за счет переноса
Популяционные и экологические аспекты репродукции 415
пыльцы и диаспор из одного поселения в другое, а также банка семян, сохраняется
целостность и непрерывность популяции во времени. Такого рода популяции в
последнее время стали называть метапопуляциями (Husband, Barrett, 1996).
Дажо, 1975; Лавренко, 1959; Петрова, Санников, 1996; Петровский, 1961; Работнов, 1950,1992;
Раменский, 1935; Рысин, Казанцева, 1975; Санников и др., 1997; Семериков и др., 1993;
Тимофеев-Ресовский, 1961; Тимофеев-Ресовский и др., 1973; Ценопопуляции растений
(основные понятия и структура), 1976; Шварц, 1969; Шмальгаузен, 1964; Яблоков, 1987; Akiyama,
1994; Berg, Hamrick, 1994; Clements, 1916; Cronberg et al., 1997; Demesure et al., 1996;
Elena-Rossello, Cabrera, 1996; Falinska, 1974; Godt, Hamrick, 1995; Hoffmann, Gebureck, 1995;
Husband, Barrett, 1996; Konnert, 1995; Lin et al., 1994; Muller-Stark, 1995; Pedrola-Monfort,
Caujape-Castells, 1995; Ponoy et al., 1994; Silin, Goncharenko, 1996; Tani et al., 1996; Tuskan et al.,
1996; Wang, Nagasaka, 1997; Whittaker, 1975; Zanetto, Kremer, 1995.
ЖИЗНЕННАЯ ФОРМА — внешний облик, или габитус1 растения, включающий
его надземные и подземные органы и возникающий в гармонии с условиями среды.
Синоним: биоморфа (греч. bios — жизнь, morpha — форма). Учение о жизненных
формах растений называют биоморфологией (Хохряков, 1975; Юрцев, 1976;
Жмелев и др., 1993).
Термин «жизненная форма» (нем. Lebensform) предложил Warming (1884).
Применительно к растениям это понятие используется в двух значениях: 1) как
конвергентное сходство габитуса представителей разных систематических групп,
возникших под влиянием одинаковых условий жизни (классификационный
подход); 2) как совокупность приспособительных свойств конкретного организма в
каждый момент его индивидуальной жизни (индивидуалистический подход).
Классификационный подход первым применил Humboldt (1806),
выделивший 16 (позднее 19) «основных форм» растений по сходству внешних, т.е. габиту-
альных, морфологических признаков. Сочетание определенных «основных форм»
характеризует физиономичность растительного покрова в разных климатических
областях Земли.
В учении о жизненных формах растений классификационный подход долгое
время был единственным. Он широко использовался (и сейчас используется) в
географических, ботанико-географических, геоботанических и систематических работах.
С начала XX века жизненные формы растений стали рассматривать в аспекте
эволюционных преобразований, что нашло отражение в современных трактовках
этого понятия. Так, Серебряков (1962,1964) считал, что жизненная форма
исторически возникает как выражение приспособленности к данным поч-
венно-климатических условиям. Серебрякова (1972) подчеркивала, что
жизненная форма связана с ритмом развития и приспособленностью к современным и
прошлым условиям существования. В начале XX столетия сформировалась
гипотеза о происхождении травянистых биоморф покрытосемянных от древесных,
которая базировалась на данных филогенетической систематики (Hallier, 1905),
сравнительной морфологии и анатомии растений (Eames, 1911; Baily, Sinnot,
1914; Sinnot, 1916; Jeffrey, 1917).
Таким образом, согласно классификационному подходу, жизненная форма —
это облик взрослого растения, живущего в типичном для вида месте обитания.
Habitus, лат. — внешний облик.
416
Системы репродукции
Жизненные формы вырабатывались в процессе длительной эволюции и
закреплены наследственно. Однако под воздействием внешних факторов (особенно
неблагоприятных) они могут меняться, обнаруживая определенный диапазон
изменчивости, своеобразную норму реакции. Например, Tilia cordata в центральных частях
ареала в широколиственных и смешанных лесах Европы представляет собой
одноствольное дерево. В этих же районах на вырубках она может образовывать кусто-
видную пневую поросль. У северных границ ареала в таежной зоне этот вид
приобретает облик низкорослого куртинообразующего многоствольного дерева, а в горах
у верхней границы леса — стланника (Чистякова, 1988; Восточноевропейские
широколиственные леса, 1994).
Индивидуалистический подход к анализу жизненных форм был осознан
намного позже, чем классификационный. Основателем этого подхода является
Warming (1884). Под жизненной формой он понимал форму, в которой
вегетативное тело растения находится в гармонии с внешней средой в течение всей его
жизни, от семени до отмирания. Хотя изменения габитуса любого организма в
течение его индивидуальной жизни очевидны, эти идеи долгое время не находили
понимания. Лишь в 50-60-х годах нашего столетия Серебряковым (1962), его
учениками и последователями было доказано, что растения в ходе онтогенеза меняют
жизненную форму. Эти онтогенетические изменения биоморф были названы
«фазами морфогенеза» (Шафранова, 1967; Гатцук и др., 1974; Жмелев и др., 1993).
На конкретных примерах были описаны сменяющие друг друга в онтогенезе
жизненные формы разных таксонов (Хохряков, 1975, 1978, 1981; Серебрякова,
1980). Для их обозначений предложен термин онтобиоморфа (Мазуренко, 1986;
Жмелев и др., 1993).
В настоящее время оба подхода (классификационный и индивидуалистический)
развиваются в тесной взаимосвязи, особенно в работах, касающихся вопросов
морфологической эволюции и биоморфологической классификации растений
(Серебряков, 1962, 1964, 1968; Серебрякова, 1971, 1972, 1974, 1983; Хохряков, 1975,
1978, 1981; Мазуренко, 1986).
Классификации биоморф основаны на признаках строения преимущественно
вегетативных органов и отражают параллельные и конвергентные пути
экологической эволюции. Как и любые экологические классификации, они многочисленны и
зависят от подходов и целей исследований.
Одна из наиболее популярных классификаций предложена датским
ботаником Raunkiaer (1905-1934). В основе ее лежит чрезвычайно важный для
растений приспособительный признак — положение почек возобновления по
отношению к субстрату и способ их защиты в неблагоприятный для роста (холодный
или сухой) период года. По этому признаку выделено пять крупных
подразделений жизненных форм.
1) Фанерофиты (греч. phaneros — открытый, явный, phyton — растение): почки
располагаются высоко над землей, т. е. находятся в воздушной среде. Это —
деревья, кустарники, деревянистые лианы, эпифиты, т. е. растения, живущие на
ветвях и стволах деревьев.
2) Хамефиты (греч. chamae — низкий, на земле): почки находятся невысоко (не
выше 20-30 см) над поверхностью почвы и зимой защищены снеговым
покровом. Сюда входят кустарнички, полукустарники и полукустарнички,
стелющиеся многолетние травы, растения-подушки.
Популяционные и экологические аспекты репродукции 417
3) Криптофиты (греч. cryptos — скрытый): почки скрыты или в глубине почвы
(геофиты — греч. geo — земля; это луковичные, клубнелуковичные, многие
корневищные растения), или в торфе и грунте водоемов (гелофиты — греч.
gelos — болото, т. е. болотные растения), или в толще воды (гидрофиты — греч.
hydor — влага, т. е. водные растения).
4) Гемикриптофиты (греч. gemi — полу): почки размещаются на поверхности
почвы или в ее самых верхних слоях и защищены мертвым растительным опа-
дом (лесной подстилкой, луговой ветошью). К гемикриптофитам относится
преобладающее большинство травянистых многолетников умеренной зоны.
5) Терофиты (греч. thews — лето) — однолетники, целиком отмирающие к концу
вегетационного сезона. На следующий год они возобновляются из семян,
которые сохраняются в почве или на ее поверхности.
Эти подразделения жизненных форм Raunkiaer делил на более мелкие по
разным признакам: размерам растений, характеру почечных покровов, длительности
жизни листьев и т.д. На основе его классификации составлены биологические
спектры флор (соотношение видов разных жизненных форм) для различных
природных зон и районов Земли. Оказалось, что в каждой климатической зоне
господствуют определенные жизненные формы: фанерофиты — в областях с влажным
тропическим климатом, гемикриптофиты — в умеренном поясе, терофиты — в
жарких пустынях с периодическими сезонами дождей.
Детальная эколого-морфологическая классификация жизненных форм
покрытосемянных и хвойных разработана Серебряковым (1962,1964, 1968). В ней
использованы названия биоморф, широко употребляемые в быту: деревья,
кустарники, кустарнички, травянистые растения. Классификация учитывает в первую
очередь внешний вид растений, тесно связанный с длительностью жизни и характером
смен скелетных осей. Скелетной осью называют многолетнюю побеговую систему,
имеющую часто форму стволика с кроной и развивающуюся из почек в приземной
или подземной частях растения (Серебряков и др., 1954; Жмелев и др., 1993).
Классификация Серебрякова иерархична и включает 6-8 биоморфологических
классификационных единиц разного ранга от самых крупных (отделы и типы) до
мелких (подгруппы и собственно биоморфы). Выделены четыре отдела:
древесные и полудревесные растения, наземные и водные травы. Древесные
растения обладают многолетними одревесневающими надземными скелетными осями с
почками возобновления, находящимися в воздухе (фанеро- и хамефиты, по
Raunkiaer). У полудревесных побеги частично многолетние деревянистые,
частично однолетние травянистые. Верхние, обычно небольшие по протяженности части
побегов ежегодно отмирают, а нижние с почками возобновления входят в состав
скелетных осей, имеющих высоту 5-20 см и более (хамефиты). Травянистые
растения отличаются от древесных и полудревесных тем, что их прямостоячие
надземные побеги всегда однолетние (точнее, односезонные), а скелетные многолетние
части, несущие почки возобновления, всегда подземные (геофиты) или приземные,
т. е. скрыты в подстилке (гемикриптофиты). Однолетние травы вообще не имеют
почек возобновления (Серебрякова, 1988).
Отдел древесных растений включает 3 типа биоморф: деревья, кустарники и
кустарнички. Деревья имеют хорошо выраженный главный ствол (реже
несколько стволов), который сохраняется в течение всей жизни растения. У кустарников
множество сменяющих друг друга стволиков, срок жизни которых ограничен и
418
Системы репродукции
варьирует от 2 (Rubus idaeus) до 40-60 (Caragana arborescens) лет. Кустарнички
— это низкорослые, высотой 20-50 см древесные растения (хамефиты),
наземные побеги которых формируют многочисленные сравнительно
недолговечные (5-10 лет) кустики, связанные под землей длинными корневищами.
Полудревесные растения включают два типа биоморф: относительно высокие
полукустарники, скелетные оси которых имеют высоту 20 и более см (например,
Artemisia sp. div.) и более низкорослые (скелетные оси не выше 20 см)
полукустарнички (Thymus, Lavanda, Salvia).
Типы древесных биоморф, т.е. деревья, кустарники и кустарнички,
подразделяют на классы, подклассы, секции и группы биоморф в зависимости от
строения и формы крон, стволов, корневых систем, длительности жизни
листьев и других признаков.
Отдел наземные травянистые растения Серебряков делит на два типа бно-
морф: травянистые поликарпики, т. е. многолетние, в течение своей жизни
многократно плодоносящие растения (преобладающее большинство видов умеренной
зоны) и монокарпнческие травы, т. е. растения, плодоносящие лишь один раз за
всю свою жизнь и после обсеменения полностью отмирающие. К монокарпикам
относятся все однолетние и двулетние травы, а также некоторые многолетние
(например, Carum carvi). Монокарпики известны не только у травянистых, но и у
древесных растений. Так, например, пальма тени — Corypha umbraculifera (Arecaceae) —
живет 40-70 лет, но цветет лишь один раз и после созревания плодов отмирает.
Классификация биоморф наземных поликарпических трав включает
несколько классов, подклассов и групп по таким признакам как: строение
корневой системы (стержне- и кистекорневые), наличие метаморфизированных
органов (корневищные, столонообразующие, луковичные и т.д.), способ
вегетативного размножения (корнеотпрысковые, длиннокорневищные), характер
кущения (плотно- и рыхлодерновинные) и т. д.
Биоморфы монокарпических трав Серебряков (1962) разделил на 4 класса:
«обычные» (с ассимилирующими побегами несуккулентного типа), суккулентные,
лианоидные, полупаразитные и паразитные. Классификация биоморф водных трав
в системе Серебрякова вообще не разработана.
К понятию «жизненная форма» Серебряков (1962, 1964, 1968) подходил с
эволюционных позиций, что нашло отражение в его классификации. Основной, так
называемый редукционный ряд биоморф демонстрирует главное направление
эволюции жизненных форм покрытосемянных: от деревьев к кустарникам,
кустарничкам, полудревесным растениям, многолетним и однолетним травам.
Выделены также ряды биоморф, возникших в экстремальных условиях среды
(например, у суккулентов, стланников, растений-подушек), а также под воздействием
фитоценотического отбора (лианы).
В последние десятилетия все большее внимание исследователей привлекают
биология и биоморфология одно- и малолетних растений (Harper, 1977; Begon et
al., 1986; Марков, 1986,1990,1992).
Дело в том, что эта группа, отнесенная Серебряковым к одному типу биоморф —
монокарпическим травам, играет все более возрастающую роль в современном
растительном покрове, который повсеместно нарушен под влиянием антропогенных
факторов. Малолетние и однолетние травы оказались весьма неоднородными как
по продолжительности жизни, которая колеблется от 1,5-2 лет у зимующих (ози-
Популяционные и экологические аспекты репродукции
419
мых) растений до нескольких недель у эфемеров, так и по структуре вегетативных
органов. Побеги этих растений бывают розеточными, полурозеточными, безрозе-
точными (удлиненными), прямостоячими, полегающими, вьющимися; корневые
системы могут быть стержневыми и мочковатыми.
Жизненные формы растений изучают также с позиций фитоценотического
анализа. В этом случае под жизненной формой понимают форму их
сосуществования со своими соседями и окружающей средой (Тихомиров, 1963). Разработано
несколько классификаций биоморф растений, основанных на фитоценотически
значимых признаках. Одна из первых принадлежит Высоцкому (1915), который
разделил степные травы на группы в зависимости от строения подземных органов и
степени вегетативной подвижности. Он выделял стержнекорневые, плотнодерно-
винные, корневищные и луковичные растения. Первые две группы он называл
«сиднями», подчеркивая, что их особи практически не перемещаются по площади
ценоза. Оригинальна система биоморф Зозулина (1961,1976), учитывающая
способности растений к регенерации после уничтожения их надземных частей, а также
к удержанию и расширению площади обитания в сообществе.
В фитоценологии и особенно в популяционной биологии растений широко
используется система биоморф, отражающая структуру фитогенных полей растений.
В ее основу положена концепция Уранова (1965) о фитогенном поле, как
пространстве, параметры которого преобразованы жизнедеятельностью растения. Степень
изменения основных показателей (освещенность, сила ветра, состав опада и т. д.)
характеризует напряженность фитогенного поля.
С учетом величины напряженности фитогенного поля выделены моно-, поли- и
ацентрические биоморфы (Ценопопуляции растений, 1976; Шорина, 1981;
Смирнова, 1987; Паленова, 1993; Восточноевропейские широколиственные леса, 1994;
Жукова, 1995).
Моноцентрические биоморфы вегетативно неподвижны и имеют лишь один
центр воздействия на среду. Это — деревья, стержнекорневые, плотнодерновинные
травянистые многолетники, однолетние травы. Полицентрические биоморфы
вегетативно подвижны и обладают несколькими центрами активного воздействия на
растительное сообщество. Это — кустарнички, многие кустарники, корнеотпрысковые,
длиннокорневищные, столонообразующие растения. Их надземные части
представлены относительно удаленными друг от друга с помощью коммуникационных
органов кустиками, отпрысками и побегами, которые и создают центры высокого
напряжения фитогенного поля. У ацентрических биоморф надземные части представлены
летнезелеными листьями и эфемерными генеративными побегами, а подземные —
густой сетью переплетающихся корневищ (например, у Trifolium repens). Эти
биоморфы не имеют центров длительной фитоценотической активности, и их фитоген-
ные поля характеризуются относительно равномерной напряженностью.
Таким образом, классификационная система биоморф растений отражает
принципы множественности и комплементарности классификаций, принятые в
современной экологии.
Жизненные формы растений следует отличать от экологических групп,
которые отражают приспособленность растений лишь к отдельным экологическим
факторам, а не ко всему комплексу условий среды. Выделяют экологические
группы в зависимости от: условий увлажнения — ксеро-, мезо-, гигро-, гидро- и гида-
тофиты, освещенности — гелио- и сциофиты, минерального питания — олнго-,
420
Системы репродукции
мезо- и эвтрофные растения. Одна и та же жизненная форма может относиться к
разным экологическим группам. Так, например, среди деревьев встречаются
гелио- (светолюбивые) и сциофиты (теневыносливые), и, наоборот, одна
экологическая группа может включать разные жизненные формы, например,
экологическая группа эвтрофных растений, т. е. требующих усиленного минерального
питания, представлена и деревьями (Alnus glutinosa), и кустарниками (Rubus idaeus),
и травами (Urtica dioica).
Высоцкий, 1915; Гатцук и др., 1974; Жмелев и др., 1993; Зозулин, 1961,1976; Мазуренко, 1986;
Марков, 1990; Серебряков, 1962,1964,1968; Серебрякова, 1971,1980,1983; Тихомиров, 1963;
Уранов, 1965; Хохряков, 1975,1981; Чистякова, 1988; Шафранова, 1967; Шорина, 1981; Юрцев,
1976; Baily, Sinnot, 1914; Begon et al., 1986; Eames, 1911; Hallier, 1905; Harper, 1977; Humboldt,
1806; Jeffrey, 1917; Raunkiaer, 1905,1934; Sinnot, 1916; Warming, 1884.
ДИАСПОРА (греч. dia — приставка со значением сквозного движения, spora —
сеяние, посев, потомок) — единица распространения, представляющая собой часть
растения (или целое растение) различной морфологической природы, естественно
отделяющуюся от материнского растения. Синонимы: диссеминула , зачаток2,
пропагула3.
Термин «диаспора» впервые был предложен Sernarder (1927). Он определял
диаспору как структуру, которая содержит зачаток (зачатки) нового организма и
служит для размножения и распространения растений. Диаспоры,
непосредственно отделяющиеся от материнского организма, согласно автору, являются
первичными. В процессе распространения они могут распадаться на вторичные
диаспоры. Sernarder описал все морфологическое разнообразие первичных диаспор у
цветковых растений и разделил их на две группы: генеративные и вегетативные и
несколько типов. Позднее van der Pijl (1969,1982), взяв их за основу, предложил
свою классификацию диаспор: А — споры (у низших растений), Б — гаплонты4,
В — новые диплонтьг в оболочках (генеративные диаспоры), Г — вегетативные
части старых днплонтов.
В отличие от классификации Sernarder, в ней нет подразделения диаспор на
первичные и вторичные, и не рассматриваются в качестве диаспор системы веток
с плодами или соплодиями. Кроме того, van der Pijl включает в классификацию
диаспор семя голосемянных растений и учитывает количество завязей, из
которых состоит плод.
Генеративные диаспоры. Van der Pijl разделяет генеративные диаспоры на 7
типов: 1) «голый» зародыш; 2) собственно семя (голосемянные и некоторые
покрытосемянные растения); 3) семена, освобождающиеся из
растрескивающихся плодов (с ложным ариллусом или без него); 4) плоды (простые — из одной за-
Термин введен Clements (1904).
Термин заимствован Хитрово (1908) из лекций Навашина.
Пропагула (лат. propago — отводок, потомок) — почка или побег, способные развиться во
взрослое растение (Henderson, 1953); общий термин для обозначения органов и частей, служащих
для вегетативного размножения (Кирпичников, Забинкова, 1977).
Гаплонт (греч. haploos — одиночный, простой и on — существо) — организм, у которого все
клетки содержат гаплоидный набор хромосом, а диплоидна только зигота.
Диплонт (греч. diploos — двойной и on — существо) — организм, все клетки которого, кроме
гамет диплоидны (БЭС, 1989).
| Популяционные и экологические аспекты репродукции 421
вязи или сборные — из многих завязей в одном цветке); 5) ложные плоды (из
одной завязи + другие части); 6) множественные, или сборные плоды из соцветий
(синкарпий); 7) семена, находящиеся на целом растении или на его части
(например, перекати-поле).
По мнению Левиной (1981), можно выделить только два морфологических
типа генеративных диаспор: 1 — голое семя, 2 — семя, окруженное
околоплодником (односемянный плод или плодик, мерикарпий, членик, эрем, косточка,
соплодие). Такое разделение диаспор является наиболее обобщенным и акцентирует
внимание на семени как единице дисперсии.
Мы предлагаем проводить разделение генеративных диаспор с учетом того,
какая морфологическая единица отделяется от материнского растения. Диаспоры при
таком рассмотрении можно отнести к 6 типам: соплодие (например, у Tilia, Morus,
Ficus, Loncera alpigena, Arctium), плод (например, у Betula, Ribes, Querqus,
Corylus, Fragaria), часть плода (например, у Acer, Cynoglossum, Rhaphanus),
семя (большинство цветковых растений), зародыш (Inga feuillei, Enhalus
acoroides) или проросток (Rhizophora, Bruguiera, Kandelia, Ceriops).
На одной особи могут формироваться разные по морфологии и внутреннему
строению плоды (см. Гетерокарпия) и семена (см. Гетероспермия), которые в
ряде случаев содержат зародыши разного происхождения (см. Генетическая
гетерогенность семян).
Вегетативные диаспоры. К категории вегетативных диаспор относятся
диаспоры, образующиеся как при гемморизогенном типе вегетативного
размножения (структурной единицей является почка) (Sernarder, 1927;
Серебряков, 1952; Левина, 1961,1981), так и при эмбриоидогенном (структурной
единицей является эмбрноид-проросток) (Батыгина, 1987, 1993; Batygina, 1989)
(см. Вегетативное размножение; Эмбриоидогения — новый тип
вегетативного размножения).
В зависимости от органа растения, на котором они образуются, различают
корневые, стеблевые и листовые диаспоры (Sernarder, 1927; Батыгина, 1987;
Batygina, 1989; Batygina et al., 1996). По длине оси побега различают
выделяющиеся (Saxifraga flagellaris) и невыделяющиеся (Scirpus alpinus) диаспоры. По
положению к поверхности почвы — надземные {Fragaria vesca) и подземные
(Epilobium palustre) диаспоры (Sernarder, 1927).
По морфологической природе среди вегетативных диаспор выделяют
корневище (или его часть) (Agropyrum repens, Asarum europaeum, Carex hyperborea,
Cypripedium calceolus, Ceum urbanum, Pulmonaria obscura, Tussilago farfara и
др.), клубень (Chaerophyllum bulbosum, Corydalis solida. Ranunculus bulbosa,
Sedum maximum, Solanum tuberosum, Trientalis europaea и др.), луковицу (Allium,
Crocus, Lilium, Tulipa; см. также Луковица; Луковичка), различные переходные
формы между ними (Adoxa moschatellia, Allium montanum, A. angulosum,
Dentaria digitata, Epilobium palustre, Lathraea squamaria и др.) (Серебряков, 1952;
Любарский, 1960), эмбриоид (или возникший из него проросток) (например,
Ranunculus sceleratus), почку (например, Tomieia menziesii) и переходную форму
между эмбриоидом и почкой (Bryophyllum daigremontianum = Kalancho'i
daigremontiana) (Батыгина, 1987; Batygina, 1989). В ряде случаев при
гемморизогенном типе вегетативного размножения диаспоры по своему внешнему виду и
строению сходны с остальными частями материнского растения (например, побеги
422
Системы репродукции
Elodea, Lemna, Opuntia, Sempewivum). Эти побеги отделяются от растения,
разносятся (водой или ветром), а затем укореняются.
К вегетативным диаспорам относятся также выводковые почки
—специализированные органы растения, служащие для вегетативного размножения и
расселения (см. Выводковая почка). Они могут быть метаморфизированными
(например, клубеньки и луковички) (см. Луковичка) и неметаморфизированными.
В зависимости от того, на какой стадии развития в момент отделения от
материнского растения находится диаспора, предложено различать покоящиеся и
проросшие диаспоры (Левина, 1981).
Почти все цветковые растения способны образовывать вегетативные
диаспоры. У одних эта способность проявляется постоянно, у других — только при
повреждении растения или изменении внешних условий (Работнов, 1974; см. также
Партикуляция ).
Следует отметить, что существуют единицы дисперсии, представляющие собой
растение или его части, несущие плоды или соплодия. Такие диаспоры занимают
промежуточное положение между вегетативными и генеративными диаспорами.
При распространении таких диаспор вегетативная часть может либо укорениться,
либо погибнуть.
В отдельных случаях диаспора одного вида растения может включать в себя
диаспоры другого вида и в дальнейшем развиваться совместно с ними (например,
семена орхидных, содержащие гифы грибов) (Sernarder, 1927).
Морфология и анатомия диаспор тесна связана со способом их распространения
(Linne, 1743, 1751; Hildebrand, 1873; Sernarder, 1901, 1906, 1927; Ильинский,
1945; Левина, 1960, 1981; van der PijI, 1969,1982; Stebbins, 1971). Процесс
распространения диаспор получил название диссемннации1, или дисперсии.
Способы диссемннации. Распространение диаспор может происходить без
участия каких-либо агентов (автохория) (Clements, 1904) или с участием внешних
агентов (аллохория) (Sernarder, 1901). Автохория включает барохорию
(самопроизвольное опадение зрелых диаспор) и автомеханохорию (активное
разбрасывание семян при вскрывании плодов).
В зависимости от агента диссеминации различают следующие способы
аллохории.
Анемохория — перенос диаспор воздушными течениями (Dammer, 1892;
Massart, 1898). Парящие диаспоры обладают небольшой массой и/или
парашютными приспособлениями. Планирующие диаспоры снабжены крыловидными
придатками. Все диаспоры, распространяемые ветром, имеют обтекаемую форму.
После опадения они могут переноситься по поверхности почвы, воды или по снежному
насту. Диаспоры, распространяемые ветром, характерны для следующих групп
растений (Левина, 1981): 1) древесные анемохоры (за исключением видов сем.
Salicaceae) (диаспоры с крыловидными выростами, приспособленные к планирую-
Linne (1751) назвал диссеминацией процесс рассеивания семян. В англоязычной литературе
при описании рассеивания и распространения семян, плодов, вегетативных зачатков растений,
пыльцы, спор используются термины «dispersal», «dispersion», «dissemination» (A Glossary of
Botanic Terms, 1916; A dictionary of scientific terms, 1953; Taxonomic Terminology of the Higher
Plants, 1954). Термин «dispersal» был предложен Praeger (1923) для обозначении активного
(динамического) процесса транспортирования диаспор, тогда как пассивное (статическое) состояние
называется «distribution». Van der Pijl (1969,1982) предложил использовать термин «dissemination»
только для семян.
Рис. 24. Диаспора.
1-34 - генеративные диаспоры: соплодие (1,2), плод (3-21), часть плода (22,23), семя (24-34): 1 - соплодие 7iSa cordate с летучкой
(анемохория), 2 -соплодие Moras alba, отдельный плодик заключен в сочный околоцветник (костянковидый плод, тип
распространения - зоохория), 3 - плод Erodium cicularium, 4 - rwonAegilops geniculate, плотно окруженный колосковой чешуей с остью, покрытой
щетинками, которые могут менять упругость при изменении влажности воздуха и почвы, за счет этого плод может передвигаться на
небольшие расстояния (3,4- механохория), 5 - плод Tragopogon dubius с пучком волосков на верхушке длинного носика плода, 6 - плод
Valeriana officinalis с перистым хохолком, 7,7а - плод Verikardia oculata и его продольный срез (7а), 8 - соплодие и отдельные плоды
Сеит montenum, 9 - плод Ulmus carpinifolia с одним крылом, 10 - плод Belula pendula с двумя крыльями, 11 - плод Scabiosa rotate с
крыловидной летучкой в виде диска, образованного разросшейся наружной чашечкой, 12 - плод Rumex longifolius с крыловидными
выростами, 15 - плод Salsola australis с пленчатым околоцветником, 14,14а,б - побег Anlhyllis vulncraria с цветками и плодами (14),
отдельный плод с чашечкой (14а), продольный разрез через чашечку, внутри, которой видеи боб (14б), 15,15а - плоды и соплодия (15)
Tnfcjium tomenlosum и продольный разрез через чашечку, в которой видно семя (15а), 16 - плоды и ветка с двумя соплодиями у Ostrya
carpinifolia, 17 - плоды Medicago sculellate (5-17 - анемохория), 18 - плод Ceralocephala falcate, прицепка является видоизмененным
столбиком, 19 - плод Cahum aparine, прицепки являются выростами околоплодника, 20 - плод Setaria vertidllate с кроющими
щетинками, 21 — плоды Medicago agrestis (18-21 — зоохория),
Рис. 24 (продолжение).
22 — один из четырех эремов, составляющих плод (ценобий) Cynoglossum diuaricatum, 23 — эрем С. officinale с шиповатым
краем, 24 — семя Lilium regale (тип распространения — автохория), 25 — семяАкотНга тасюсатра с крылом, 26 —
крылатое семя Malthiola incana, 27 — семя Saux ledermannii с пучком волосков у основания, 28 — семя Strophanlhus sarmenlosus с
пучком волосков на щетинковидном носике, 29 — семя Cochlospermum refigiosum с волосками по всей его поверхности
(25-29 — тип распространения — анемохория), 30-34 — семена с ариллусом и ариллоидом: Haveliopsis flexilis (30), Reseda
lulea (31), Sarawakodendron filameniosum (32), Casearia rugulosa (33), Bhesa pariculala (семя полностью окружено
ариллусом) (34) (30-34 — тип распространения — зоохория); 35 — проросток Kandeua rheeda как диаспора; 36-56 —
вегетативные диаспоры: клубень TMadiantha dubia (36), 37 — строение сформированной луковицы ТиКра ргаесох на продольном
срезе, в пазухе 4-й (верхней) луковичной чешуи видна дочерняя луковица (почка возобновления),
ПЧ
41а
Рис. 24 (продолжение).
38-40 — развитие выводковой почки на листе Tolmieia menziesii и формирование нового растения,
материнский лист отмирает (39а — листьея почки), 41а,б — выводковые почки иа побегах и (42)
проросшие у Gagea persica.
Рис. 24 (продолжение).
43-46 — выводковые почки, развивающиеся в пазухах листьев и на соцветии у Sedum dasyphyllum
на разных стадиях развития, 47 — новое растение Cardamine uliginosa в основании пластинки листа
материнского растения, 48, 49 — выводковые почки (клубеньки) в пазухах листьев (48) и
отдельный клубенек (49 — увелич.) у Ficaria ranuncules,
Рис. 24 (продолжение).
50 — выводковые почки в виде розетковидного побега, развивающиеся вместо цветков у Saxifraga
nivalis, 51-55 — выводковые почки на побеге (51), группа почек и цветков (52) и прорастание почки
(53-55) у 5. сегпиа; 56 — побеги Kltinia articulata как вегетативные диаспоры; 57,58 — растение
Plantago cretica как диаспора, ад к — адвентивные корни, в п — выводковая почка, к — корни,
л Ч]—л ч4 — луковичные чешуи, п — плоды, пч - почка, прд — предлист побега, прд, — предлист
дочерней луковицы, uje n — цветоносный побег.
1, 3-6, 9-13,18,19, 22, 23 — по: Артюшенко, Федоров, 1986; 2 — по: Жуковский, 1964; 7, 7а,
8,14-17, 20, 21,36, 38-58 - по: Кернер, 1902; 24-34 - по: Артюшенко, 1990; 35 - по: Schimper,
1898; 37 — по: Серебряков, 1952.
428
Системы репродукции
щему полету); 2) болотные и прибрежные, степные и сорные виды (плоды и семена
с хохолками-парашютами); 3) анемохоры сфагновых болот и травяного яруса
хвойных лесов (диаспоры в виде мелких пылеватых семян); 4) растения песчаных
пустынь (диаспоры типа воздушного шара или воздушной турбины).
Гидрохория — распространение диаспор с помощью воды (Dammer, 1892;
Massart, 1898). Такие диаспоры не смачиваются водой, приобретают плавучие
свойства и сохраняют жизнеспособность при длительном нахождении в воде.
Зоохория — распространение диаспор животными (Dammer, 1892; Massart,
1898; Sernarder, 1906; Левина, 1981): эндозоохория (распространение семян,
проходящих неповрежденными через пищеварительный тракт животного)
характерна для обитателей лесов, сфагновых болот и тундр, обладающих диаспорами в
виде сочных плодов; эпизоохория (пассивный разнос диаспор на теле животного)
отмечена у рудеральных растений, факультативно-сорных видов и растений
пустынь; синзоохория (активное распространение диаспор, связанное с запасанием
корма животными) отмечена у основных лесообразующих пород (Quercus, Fagus,
Pinus sibirica).
Антропохория — распространение диаспор с помощью человека (Heintze,
1932).
Распространение подземных вегетативных диаспор может происходить также
при смещении почвенных слоев (камнепады, оползни).
Способ диссеминации зависит не только от строения диаспор, но и от
морфологии и экологии всей особи, на которой они образуются (форма роста, высота,
морфология соцветия, положение диаспор на растении, время их созревания и др.)
(Левина, 1981). Одинакового типа диаспоры могут распространяться разными
способами в зависимости от характера биотопа. Иногда одни и те же диаспоры
последовательно распространяются двумя агентами и более (van der Pijl, 1969).
Общим свойством диаспор является парусность как механизм, обеспечивающий
пассивное перемещение диаспор (Хитрово, 1908).
Возникновение в ходе эволюции различных типов диаспор у цветковых
растений обеспечило им господствующее положение среди других растений и широкое
распространение. Рис. 24.
Артюшенко, 1990; Артюшенко, Федоров, 1986; Батыгина, 1987,1993; Ильинский, 1945; Кернер,
1902; Левина, 1960, 1961, 1981; Работнов, 1974; Реймерс, 1991; Серебряков, 1952; Хитрово,
1908; Batygina, 1989; Batygina et al., 1996; Clements, 1904; Dammer, 1892; Heintze, 1932;
Hildebrand, 1873; Linne, 1751, 1774; Massart, 1898; Praeger, 1923; Pijl van der, 1969, 1982;
Sernarder, 1901,1906,1927; Stebbins, 1971.
ПОПУЛЯЦИОННОЕ И ЦЕНОТИЧЕСКОЕ РЕГУЛИРОВАНИЕ
РЕПРОДУКЦИИ
Специфической особенностью репродукции у растений является ее
обусловленность процессами, идущими на уровне не только отдельных
особей, но и популяций, фитоценозов, экосистем. Концепция репродукции
как процесса, связанного с высокими уровнями организации биосистем,
доказывается многими фактами. В частности, для всех перекрестников
необходимы соседи по популяции как поставщики пыльцы и агенты по ее транспорти-
Популяционные и экологические аспекты репродукции
429
ровке. Автохоры сравнительно немногочисленны, и дисперсию семян также
можно считать зависимой от соседей по биоценозу. Сохраняемость
репродуктивных органов связана с пищевой деятельностью разнообразных фитофагов.
Понятия «потенциальная и реальная семенная продуктивность» отражают
разрыв, который имеется между числом закладываемых семязачатков и
числом производимых семян. Этот разрыв в основном итог работы популяцион-
ных и ценотических механизмов. Репродуктивный процесс регулируется
разнообразными популяционными и ценотическими факторами, степень
изученности которых неодинакова (Табл. 1).
Основную информацию о роли популяционных и ценотических связей растений в
репродукционном процессе дают различные количественные параметры (Табл. 2).
Популяционное регулирование. Среди факторов контроля репродукции
на первое место во многих случаях выдвигается «достаточность» опыления,
которая сопряжена с рядом структурных особенностей популяций растений.
Из-за нехватки пыльцы только 2,5% семязачатков развиваются в зрелые
семена (Fenner, 1985).
Основным условием поставки к цветкам полноценной пыльцы является
одновременность цветения всех особей популяции. Влияет и конкуренция за
опылителей. Известно, что более крупные цветки и крупные особи больше привлекают
Таблица 1:
Основные факторы, контролирующие репродукцию растений на уровне популяций
и сообществ
Факторы
Популяцнонный уровень
| размер популяции
| Тип пространственного размещения особей
Степень изоляции популяции
Плотность
Дифференциация особей в популяции
— по возрастному состоянию
— по виталитетному состоянию
Ценотическин уровень
Доступность ресурсов и наличие условий,
необходимых для репродукции
Уровень межвидовой конкуренции
Положение в пищевых цепях экосистемы
Наличие микроместообитаний, способствующих
сохранению и прорастанию семян
Антропогенные нагрузки на сообщество
Степень изученности
+
++
+
+++
+++
++
+++
+++
+
++
+++
Примечание: +++ хорошая изученность, ++ удовлетворительная изученность, + слабая
изученность.
430
Системы репродукции
опылителей. Поэтому избыточность цветения в популяционном смысле не является
вредной или ошибочной. Она обеспечивает опыление большего количества цветков
и повышает выход семян. Кроме того, такой «пустоцвет» выступает как
производитель пыльцы. Годы обильного цветения («семенные годы»), которые отмечены
для многих деревьев, кустарников и даже трав, очень полезны, так как в эти годы
фитофаги оставляют неповрежденными большее количество цветков и семян.
Играет роль и пространственная структура популяции: при повышенной
плотности популяции и малых расстояниях дисперсии семян создаются предпосылки
для переопыления близкородственных растений, что снижает жизнеспособность
потомства (Wiilson, 1984). Но, с другой стороны, произрастание растений
группами, которое возникает при так называемом контагиозном пространственном
размещении особей в популяциях, в период цветения существенно увеличивает плодоза-
вязываемость, как это показано на примере многих видов растений (Krannitz,
Maun, 1991). Это, возможно, связано не только с визуальной
привлекательностью, но и с более высокой концентрацией пахучих веществ, на которые
ориентируются многие насекомые-опылители (Robacker et al., 1988).
Для продукции семян важна структура популяции (Злобин, 1989, 1996).
Известно, что особи популяции неравноценны по выходу семян. Репродуктивное
давление популяции на ценоз обусловлено долей в ней генеративных особей и их
состоянием. Крупные особи дают много семян, но в популяциях их обычно мало. Мелкие
особи имеют меньшую семенную продуктивность, но за счет своей высокой численности
производят основное количество семян. Правда, такие семена могут быть
перегруженными генетическими дефектами и менее жизнеспособными. Известно, что
старые особи производят семена низкого качества. Роль отдельных особей в
производстве общего количества семян популяцией остается мало исследованной.
При повышении плотности популяции доля органических веществ,
поступающих из листьев в органы репродукции уменьшается, и семенная продукция заметно
снижается (Snaydon, 1984; Zimmerman, Weis, 1984). В популяциях небольшого
размера это нередко является следствием простой нехватки пыльцы (Agren, 1996),
тем более, что у травянистых растений по данным Жиляева (1996) основная часть
пыльцы распространяется по радиусу на расстояние не более 3-5 м от растения —
Таблица 2:
Основные репродуктивные показатели фнтопопуляций
Параметры
Пестичный репродуктивный успех
Тычиночный репродуктивный успех
Плодозавязываемость
Репродуктивное давление популяции
Семенная продукция популяции
Размещение семян по популяционно-
му полю
Почвенный банк семян
Единицы измерения и показатели
Число пестиков на единицу площади
Число тычинок на единицу площади
Доля оплодотворенных семязачатков от общего
их числа
Общее число семян, производимых популяцией
Число семян на единицу площади
Индексы неравномерности размещения
Число жизнеспособных семян в почвенном банке
Популяционные и экологические аспекты репродукции
431
донора пыльцы, а у клоновых растений в основном в пределах одного клона. У
некоторых видов при этом увеличивается опадание цветков, у других — уменьшается
размер соцветий, а у третьих — нарушается плодозавязывание. Согласно так
называемому правилу Олли (Лекявичюс, 1986), существуют две группы растений,
различающихся характером реагирования на популяционную плотность: первая —:
обратная зависимость размножения от плотности популяции, вторая — пик
размножения приходится на промежуточную плотность. Часто в местах с высокой
плотностью популяции иерархия особей по размеру семенной продуктивности
бывает наиболее выраженной.
Дисперсия семян, как бы она ни осуществлялась, ведет к их концентрации
вблизи материнских растений. Здесь репродуктивное давление видовой популяции
максимально. Но во многих случаях отмечено ингибирующее действие полога
материнских растений на прорастание семян и появление всходов (Rai, Tripathi, 1985).
Таким образом, особенности организации популяций сказываются на ряде
важных фаз репродуктивного процесса, выступая как механизмы контроля количества
и качества производимых диаспор.
Ценотическое регулирование. В ценотическом регулировании репродукции
имеют место как взаимное благоприятствование, так и конкуренция , которые в
совокупности воздействуют на все фазы этого процесса (Silvertown, 1982).
Основные механизмы ценотического регулирования репродукции связаны с
уровнем диффузной конкуренции в фитоценозе и локальным соседством особей,
вступающих в репродуктивный цикл. Эти эффекты проявляются в изменениях
жизненного состояния особей, которое четко коррелирует с репродукцией
растений. Отдельные формы конкуренции в их действии на репродукцию пока мало
изучены. В общем родительская стратегия цветковых растений ориентирована на
защиту репродукции от стрессовых факторов (Lloyd, 1979) и сама по себе является
результатом длительного эволюционного процесса.
В условиях многовидовых сообществ часто обостряется конкуренция за
опылителей и экосистемные связи такого типа оказываются очень важными
(Faegri, Pijl van der, 1980; Багдасарова, Длусский, 1989). Для успешного
опыления энтомофильных растений необходима синхронизация цветения с
деятельностью опылителей. Обычно густые одновидовые заросли растений
привлекают больше опылителей и, таким образом, контагиозный тип
размещения особей оказывается выгодным и для энтомофилов и для анемофилов и
должен поддерживаться отбором (Klinkhamer, Jong, 1990). Лучшие шансы на
опыление имеют более крупные особи, несущие большее количество цветков
(Pleasants, Zimmerman, 1990).
На фазу пребывания семян в почве и прорастание приходится пик их
смертности. Потеря жизнеспособности в период пребывания семян в почве и их
прорастания вызывается главным образом почвенными фитофагами, патогенными
грибами и резкими изменениями в режимах влажности и температуры почвы. Аллело-
патические эффекты пока остаются дискуссионными, но в отношении ряда видов
растений они доказаны, хотя критической роли явно не играют.
Концепция безопасного местообитания (Harper, 1977) и ниш возобновления
(Gmbb, 1977) определяет, что для последних фаз репродукции территория ценоза
неравноценна. Возобновление идет в зонах, где имеются стимулы для прерывания
периода покоя семян и оптимальные условия для их прорастания, а также сущест-
432
Системы репродукции
вуют доступные ресурсы, необходимые для роста всходов. Такие
микроместообитания и называют либо безопасными, либо нишами возобновления. Экосистемные
связи в этом отношении очень многообразны. Opuntia engelmannii и Prosopis
glandulosa увеличивают отток ресурсов из репродуктивной сферы в вегетативную
при избыточном увлажнении (Windberg, 1997). Семена многих видов прорастают
и всходы приживаются только в местах нарушений растительного покрова. Но есть
виды, которые лучше возобновляются под пологом материнских особей (например,
Calluna vulgaris) или под покровительством растений-нянек (Злобин, 1993 а, б). У
Amaranthus retroflexus показана прямая зависимость прорастания семян от размера
прогалины (Fenner, 1985).
На репродукцию влияет также сукцессионный статус сообщества. В
сериальных сообществах пик репродукции сопряжен с периодом доминирования
вида. В климаксовых сообществах он удерживается на промежуточном уровне.
Многие виды антропогенных нагрузок на сообщества, которые имеют
тенденцию к быстрому возрастанию, оказываются крайне неблагоприятными для
репродукционного процесса, прежде всего потому, что нарушают систему
межвидовых связей в экосистемах, угнетая одни группы организмов и создавая
благоприятные условия для развития других. Выявлены разносторонние
воздействия радиоактивного загрязнения экосистем на репродукцию растений (Корот-
кова, 1999). Сказываются и обычные техногенные и сельскохозяйственные
загрязнения. Так, Стволинская (2000) показала, что в условиях загрязнения,
вызываемого автотранспортом, у Taraxacum officinale сохраняется статус
генеративных особей, но в семенах в два раза увеличивается количество уродств
зародышей, что снижает их жизнеспособность. Однако у Pinus sylvestris
техногенное загрязнение не меняет качества семян, хотя и отрицательно сказывается
на размере шишек (Мазепа, 1995).
В целом, результаты репродукции как популяционно-ценотического процесса
определяются его синхронностью в пределах данной видовой популяции и
соотношением с сезонной динамикой развития других видов сообщества.
Заключительные этапы репродукции менее детерминированы состоянием особей растений в
сравнении с начальными этапами и больше подвержены воздействию
стохастических факторов. В итоге репродуктивный процесс оказывается «рыхлым явлением»,
содержание которого детерминировано как мощными прямодействующими
факторами, так и случайными. Роль последних в определенных ситуациях оказывается
решающей для репродуктивного процесса.
Багдасарова, Длусский, 1989; Злобин, 1989, 1993, а,б, 1996; Лекявичюс, 1986; Faegri, Pijl van
der, 1980; Fenner, 1985; Grubb, 1977; Harper, 1977; Klinkhamer, Jong de. 1990; Krannitz, Maun,
1991; Lloyd, 1979; Pleasants, Zimmerman, 1990; Rai, Tripathi, 1985; Robacker et al., 1988;
Silveitown, 1982; Snaydon, 1984; Willson, 1984; Zimmerman, Weis, 1984.
ПОПУЛЯЦИОННЫЙ И ЦЕНОТИЧЕСКИЙ АСПЕКТЫ ИЗУЧЕНИЯ
РЕПРОДУКЦИИ РАСТЕНИЙ В УСЛОВИЯХ АРКТИКИ
Репродукция растений — сложный миогофакторный, многоэтапный
процесс, охватывающий разные уровни организации жизни: клетку,
особь, вид, популяцию, ценоз и целую природную зону (Левина, 1981;
Популяционные и экологические аспекты репродукции 433
Fenner, 1985; Старшова, 1993; Khodachek, 1997; Ходачек, 1998). Каждый
уровень требует постановки своих задач и применения особых методов
исследования. Популяционные и ценотические аспекты репродукции
изучаются внутри таких дисциплин, как геоботаника, фитоценология, популяцион-
ная биология, ботаническая география (Zimmerman, Weis, 1984; Злобин,
1989; Злобин, Чумакова, 1989; Schat et al., 1989; Khodachek, 1993, 1995,
1997; Ходачек, 1994, 1998). Главные проблемы в этой области
исследований: роль репродукции растений в создании стабильных популяций, фитоце-
нозов и устойчивого растительного покрова, в формирований жизненных
стратегий, образовании банков семян и в конечном итоге сохранении
биологического разнообразия.
В последнее время особенно остро стоит проблема сохранения
растительного покрова в Арктике в связи с глобальными изменениями климата, а
также с усиливающимся антропогенным воздействием. Одним из важных
аспектов проблемы является стабильность популяций и устойчивость
растительного покрова, тесно связанные с жизненными стратегиями его
компонентов.
Существуют различные определения понятия «жизненная стратегия». Ра-
ботнов (1975) жизненную стратегию понимает как совокупность коадапта-
ций, определяющих место ценопопуляций в конкретных биоценозах. В более
поздних работах жизненная стратегия вида определяется как генетически
обусловленный и экоценотически реализуемый тип долгосрочного адаптивного
поведения видовой популяции (Grime, 1979; Stearns, 1980; Смирнова, 1987).
Иными словами, жизненная стратегия — это выявление механизмов,
сформировавшихся в процессе адаптации вида к условиям среды, что находит
отражение в особенностях его поведения в ценозе.
Согласно широко известной теории г/К отбора (McArthur, Wilson, 1967;
Pianka, 1970) и классификации жизненных стратегий Раменского-Грайма (Ра-
менский,1938; Grime, 1979), арктические растения относят к крайним
К-стратегам (Eriksen et al., 1993; Molau, 1993) или ультра-патиентам, согласно
теории Раменского (Юрцев,1986). Считается, что типичные К- и г-стратеги
(стресс-толеранты и рудералы, соответственно, согласно теории Grime, 1979)
отличаются, в основном, особенностями репродукции (Pianka, 1970). Многие
арктические виды, по-видимому, обладают чертами как г-, так и К-стратегов.
Предложенные нами показатели репродуктивного процесса арктических
растений могут быть включены в число критериев для определения типа жизненной
стратегии.
Растительный покров в Арктике формируется в экстремальных условиях
среды, в которых его устойчивость особенно тесно связана с репродукцией
составляющих его компонентов. Результаты получены автором в разных подзонах на
полуострове Таймыр (в южных, типичных и арктических тундрах) и в
высокоарктических тундрах Северной Земли (полярных пустынях, по терминологии
Александровой, 1977). В каждом из районов в течение трех лет в зональных и
некоторых интразональных сообществах изучались: сезонное развитие растений,
биология цветения и плодоношения у наиболее распространенных видов, способы
опыления, семенная продуктивность, банки семян, особенности прорастания семян
и развития проростков (Табл. 1).
434 Системы репродукции
Таблица 1:
Показатели семенной репродукции растений Западного Таймыра
Виды *
Hierochloe pauciflora
Alopecurus alp'mus
Arctagrostis latifolia
Trisetum sibiricum
Rupr. subsp.litorale
Koeleria asiatica
Poa arctka
P. alplgena
P. glauca
Dupontia jisheri
Festuca cryophila
Eriophorum medium
Carex chordorrhiza
C. stems
C. ensifolia (Turcz. ex
Gorodk.) V. Krecz.
subsp. arctisibirica Jurtz.
Juncus biglumis
Luzula confusa
L. nivalis
Lloydia serotina
Salix polaris
S. arctica
S: reptans
S. pulchra
S. lanata
Betula nana
Claytonia joanneana
Cerastium maximum
Melandrium apeialum
Minuartia macrocarpa
M. arctica
Caltha arctica
Ranunculus nivalis
R. borealis
Papaver pulvinatum
Eutrema edwardsii
Erysimum pallasii
Parrya nudicaulis
Draba pilosa
Семенная продуктивность
потенциальная
6-8
42-52
36-54
108-124
124-147
7-23
21-23
13-16
5
21-37
59
10-19
65-197
35-49
90-114
48-90
32-60
51
25-186
180-1008
48-160
400-1535
2310
38-90
23-30
496-792
220
28-34
33-38
421
24
12-72
1400-1500
27-33
372-576
19-110
20-41
условно-реальная
1-5
0-7
0-24
94
8-19
0-11
4-18
-
1.6
3.2
0-13
5-12
11-130
12-30
26-62
30-83
16-33
0-33
5-15
0-107
0-138
0-140
-
27-87
20
10-200
160
18-22
10-20
-
20
40-93
192-276
14-24
100-516
9-10
10-36
реальная
0-5
0-7
0-4
82
4-18
0-4
0-8
-
1.6
2.5
0.5-7
0-12
1-18
0-2
0-62
25-79
4-27
0-28
2-12
0-51
0-74
0-72
-
12-65
15
0-16
НО
17-18
6-15
-
14
0-29
0-216
11-23
0-320
2-9
6-35
Отношение числа плодов
к числу цветков на одном
генеративном побеге ( /о)
12-68
0-18
0-20
0-74
6-18
0-67
0-40
0-74
31
0-26
22
50-80
16-59
34-75
33-66
83-93
57-100
100
0-81
0-79
52-93
0-93
-
76-97
-
59-67
100
100
-
100
100
100
100
80-100
0-61
100
Популяционные и экологические аспекты репродукции
435
Таблица 1 (продолжение)
D. oblongata
D. micropetala
D. macrocarpa
D. fladnizensis
Saxifraga pulnctata
S. nivalis
S. hieracifolia
S. hirculus
Potentilla stipularis
Dryas punctata
Astragalus subpolaris
Oxytropis adamsiana
0. middendorffii
Hedysarum arcticum
Pachypleurum alpinum
Cassiope tetragona
Androsace bungeana
A. septentrionalis
Armeria arctica
Polemonium boreale
Myosotis asiatica
Eritrichium villosum
Pedicularis verticillata
P. sudetica
P. hirsuta
P. oederi
Tripleurospermum
phaeocephalum
Arnica iljinii
Senecio atripurpureus
18
34
10
33
513-1100
88
944-2700
600
84-168
5-54
7-15
85-220
150-2100
15-26
226-316
116-220
20-30
80-100
42
90-120
44-96
37
676-768
565
240-415
660-800
550
60-65
136
15
30
7.5
32
80-433
50-340
102-836
45-80
6-90
0-45
2-15
0-63
700
0-8
24-127
0-85
0-3
24-52
29
20-89
3-24
0
0-10
187
0-17
78-91
490
60-65
124
15
23
7.0
30
53-30
0-210
93-710
28-73
0-62
0-330
0-20
0-41
270
0-2
0-31
0-85
0-1
22-52
22
22-71
0-10
0
50-92
160
20-86
0-56
-
0-58
54
100
100
88
100
40-96
-
0-100
70
100
100
44
0-62
83
0-47
15-71
0-90
0-45
98-100
60
17-64
11-84
_
8-88
73-91
77-98
.
90
100
92
* Виды расположены по системе Engler (1924,1964), принятой в сводке «Арктическая флора СССР» (1960-1987).
Наиболее специфичными чертами репродукции арктических растений
являются: формирование цветочных почек в сезон, предшествующий цветению;
способность растений цвести при очень низких температурах воздуха (в полярных
пустынях цветки не погибают даже при -6 С); широкое распространение различных
форм самоопыления (включая клейстогамию, гейтоногамию), апомиксиса, парте-
нокарпии; созревание семян в зимнее время и в течение следующего летнего сезона
и т.д. Все это в совокупности приводит к успешному возобновлению и создает
возможности для выживания цветковых растений даже на крайнем пределе их
распространения (в арктических тундрах и полярных пустынях).
Потенциальная семенная продуктивность в значительной степени
определяется генетической программой вида: типом гинецея, числом семязачатков в
завязи и числом цветков на генеративном побеге (Ходачек, 1974, 1978). На
436
Системы репродукции
реальную семенную продуктивность, величина которой определяет
возобновление вида в фитоценозе, влияет весь комплекс биотических и абиотических
факторов среды. Она является скорее биоценологической, чем биологической
характеристикой вида (см. Потенциальная семенная продуктивность;
Реальная семенная продуктивность).
Кроме потенциальной и реальной семенной продуктивности целесообразно
выделить промежуточное понятие «условно-реальная семенная
продуктивность» (Ходачек, 1970, 1974, 1978), включающая все семена, независимо от
их качества — недозрелые, недоразвитые, поврежденные насекомыми и
грибами. Если потенциальная продуктивность является лишь теоретической верхней
границей семенной продуктивности, которую растения почти никогда не
достигают (за редким исключением), то условно-реальная семенная продуктивность
характеризует степень реализации потенциальной способности вида к
образованию семян. Сопоставление этой величины с потенциальной семенной
продуктивностью показывает, какая часть семязачатков развивается в семена. Она
находится в непосредственной зависимости от факторов опыления, питания и
биологических особенностей вида, влияющих на оплодотворение (количество и
качество пыльцы, скорость роста пыльцевых трубок, состояние рыльца в
момент опыления и др.). Изучение условно-реальной семенной продуктивности в
разные годы и в разных экологических и фитоценотических условиях дает
возможность установить максимальное количество семязачатков, развивающихся
в семена у каждого вида. Эти максимальные значения и соотношения с
потенциальной семенной продуктивностью можно считать биологической
характеристикой вида, так как каждый вид имеет ограниченные возможности
оплодотворения. Величина условно-реальной семенной продуктивности отражает роль
вида в фитоценозе, показывает его место среди компонентов ценоза,
характеризует жизненность вида. Она является той количественной характеристикой,
которая наряду с объемом фитомассы, интенсивностью фотосинтеза и другими
биохимическими и физиологическими показателями определяет эдификаторное
значение вида. Если пренебречь этой величиной и учитывать только реальную
семенную продуктивность, то представление о характере плодоношения вида,
возможностях его репродукции и способах размножения может оказаться
неточным или даже ошибочным. В случае несозревания семян в год наблюдения
или сильного их поражения можно сделать неверный вывод о неспособности
данного вида к семенному размножению, хотя в других погодных условиях он
образует зрелые, полноценные, неповрежденные семена. Кроме того, именно
величина условно-реальной семенной репродукции отражает влияние фактора
опыления на семенную репродукцию. Её соотношение с потенциальной
семенной продуктивностью показывает, при каком способе опыления наибольшее
количество семязачатков развивается в семена.
Для оценки результата репродукции важными показателями, с нашей точки
зрения, являются не только абсолютные, но и относительные величины. Мы
предлагаем использовать следующие коэффициенты: Cs— коэффициент семяобра-
зоваиия (отношение условно-реальной семенной продуктивности к
потенциальной), который показывает, какая часть семязачатков развивается в семена.;
Сг — коэффициент созревания (отношение реальной семенной
продуктивности к условно-реальной) отражает, какая часть из образовавшихся семян со-
Популяционные и экологические аспекты репродукции
437
зревает; Cv — коэффициент жизнеспособности, который показывает
жизнеспособную часть среди созревших семян (Khodachek, 1993, 1995,1997;
Ходачек, 1994,1998).
Для общей оценки семенной репродукции нами предложен интегральный
показатель — генеративная активность вида ( R ):
R= No/N х d х Cs x Cr x Cv,
где N — продолжительность наблюдений (в годах); No — число периодов
плодоношения (в годах); d — число генеративных побегов на м2; Cs, Cr, Cv
— коэффициенты.
Этот показатель (выведен математически) включает все основные
характеристики репродуктивного процесса (Табл. 2). В частности, отношение No/N
характеризует регулярность процесса плодоношения; Cs — коэффициент семяобразова-
ния — отражает суммарный результат всех стадий формирования семени,
выражение d х Cs характеризует успех семеношения популяции; Сг и Cv — качественные
характеристики семян, как результат влияния биотических и абиотических
факторов на семенную репродукцию.
Показатель R, характеризуя процесс семенной репродукции в целом, отражает
определенную тенденцию вида в отношении семенного размножения, показывает
генетические возможности его репродукции и их реализацию в определенных
эколого-ценотических условиях. Этот показатель может быть использован для
сравнения семенной репродукции разных видов, популяций, ценозов в пределах
одной природной (растительно-климатической) зоны, для сравнительной оценки
репродуктивного процесса у видов с широким географическим ареалом в разных
его частях, у растений разных растительно-климатических зон. Он может служить
также критерием для отнесения данного вида к определенному типу жизненных
стратегий — например, к К- или r-стратегам.Среди арктических видов наиболее
высокие показатели R (7- 15) отмечены у Dryas punctata, Cassiope tetragona,
Potentilla stipularis, Hierochloe pauciflora, Cerastium maximum, Papaver
pulvinatum, Polemonium boreale, Myosotis asiatica, Arnica iljinii, несколько ниже R
(1-6) — у многих злаков (Роа arctica, P. alpigena, Trisetum sibiricum subsp.
litoralis), видов родов Carex, Salix, Oxytropis. Низкую генеративную активность
(R < 1) имеют Juncus biglumis, Luzula nivalis, Salix pulchra, Minuartia arctica,
Androsace septentrionalis, Parrya nudicaulis, виды рода Draba.
Устойчивость растительного покрова в Арктике зависит также от вегетативной
подвижности его компонентов. Жизненная стратегия вида (поведение его в
ценозе), в значительной степени, определяется соотношением вегетативного и
семенного размножения. По этому показателю среди растений Арктики можно выделить
следующие группы.
1. Генеративно-лабильные виды (или пластичные). К этой группе относятся
виды с быстрой реакцией генеративных органов на изменение климатических
условий, благодаря специальным механизмам (автогамия, гейтоногамия,
клейстогамия, апомиксис, партенокарпия, вторичное цветение, переход от
дихогамии к гомогамии, к вивипарии и т.д.). Они вегетативно малоподвижные или
неподвижные, размножаются, в основном, семенами (Saxifraga hieracifolia,
Salix arctica, Minuartia macrocarpa, Juncus biglumis, Draba micropetala,
Pedicularis hirsuta, P. oederi, виды рода Luzula).
438 Системы репродукции
2. Вегетативно-мобильные виды — вегетативно-подвижные растения,
размножающиеся, в основном, вегетативным путем (большинство злаков, осок,
некоторые ивы, пушицы, а также такие виды, как Pyrola grandiflora, Ramischia
obtusata, Stellaria ciliatosepala и др.).
Таблица 2: Генеративная активность (R) некоторых растении Западного Таймыра
Виды
Hierochloe' pauciflora
Trisetum sibiricum subsp. litorale
Poa alpigena
P. arctica
Carex chordorrhiza
C. ensifolia subsp. arctisibirica
juncus biglumis
Luzula nivalis
Salix arctica
S. reptans
S. pulchra
Cerastium maximum
Minuartia arctica
Papaver pulvinatum
Erysimum pallasii
Draba pilosa
D. micropetala
D. macrocarpa
Parrya nudicaulis
Polentilla stipularis
Dryas punctata
Oxytropis adamsiana
0. middendorffii
Cassiope tetragona
Androsace septentrionalis
Polemonium boreale
Myosotis asiatica
Arnica iljinii(Maguire)
Cs
0.4
0.8
0.4
0.4
0.6
0.5
0.4
0.5
0.1
0.7
0.1
0.2
0.4
0.2
0.6
0.7
0.9
0.8
0.1
0.5
0.7
0.2
0.2
0.2
0.4
0.6
0.5
1.0
Cr
0.8
0.9
0.4
0.4
1.0
0.5
0.7
0.6
0.5
0.5
0.5
0.8
0.7
0.8
0.5
0.8
0.8
0.9
0.6
0.6
0.7
0.7
0.4
1.0
1.0
0.8
0.5
0.9
Cv
0.5
0.7
0.6
0.6
0.1
0.1
0.5
0.5
0.7
0.6
0.6
1.04
0.4
1.0
0.8
0.2
0.2
0.2
0.2
0.9
1.0 !
1.0
1.0
1.0
1.0
1.0
1.0
0.7
a
144
5.0
10.0
10.0
32.0
27.0
0.2
0.2
18.0
0.2
0.4
5.0
0.1
45.0
0.2
0.05
0.05
0.05
-
25.0
* 30.0
20.0
20.0
65.0
1.7
17.0
30.0
20.0
No/N
2/3
1
1
1
1
1
1
1
1
1
2/3
1
1
1
1/3
2/3
■ 2/3
2/3
2/3
1
1
1
1
1
1/3
1
1
1
R
15.0
2.5
1.6
1.6
1.9
1.0
0.03
0.03
1.0
1.9
0.01
7.2
0.01
7.2
0.02
0.01
0.01
0.01
0.01
7.9
14.7
2.8
1.6
13.0
0.2
8.2
7.5
12.6
Популяционные и экологические аспекты репродукции
439
3. Стабильные виды — растения, у которых сочетаются оба типа размножения
(Betula nana, Carex ensifolia subsp arctisibirica, С. stans, Cassiope tetragona,
Cerastium maximum, Draba pilosa, Dryas punctata, Hierochloe' pauciflora, Salix
reptans и др.).
Наибольшей толерантностью в условиях Арктики обладают растения с
высокой генеративной активностью, способные размножаться и вегетативным путем;
они имеют в почве значительный запас семян, которые могут прорастать в широком
диапазоне условий (Ходачек, 1985, 1993 а, б). Генеративная активность и
вегетативная подвижность видов обеспечивает стабильность популяций, так как первая
способствует обновлению генофонда, а вторая — пространственному
распространению вида и закреплению его в растительном покрове.
Александрова, 1977; Злобин, 1993; Злобин, Чумакова, 1989; Левина, 1981; Работнов, 1975; Ра-
менский, 1938; Ходачек, 1970,1974,1978,1985,1993а, б, 1994,1998; Юрцев, 1986; Eriksen et
al.. 1993; Grime, 1979; Khodachek, 1993, 1995, 1997; McArthur, Wilson, 1967; Molau, 1993;
Pianka, 1970; Schat et al. 1989; Stearns,1980; Yurtesv, 1986; Zimmerman, Weis, 1984.
СИСТЕМА РЕПРОДУКЦИИ НА ПРИМЕРЕ СИНУЗИЙ ТРАВ
В ЛИСТВЕННЫХ ЛЕСАХ
Система репродукции растений — один из ведущих факторов популяци-
онной стратегии вида (Salisbury, 1942; Шик, 1953; Вайнагий, 1974; Harper,
1977; Grime, 1979; Смирнова, 1987; Ценопопуляции растений (очерки популяци-
онной биологии), 1988). Известно, что у семенных растений она включает
семенное и вегетативное размножение. Значимость семенного и вегетативного
размножения в жизни популяций наиболее четко выступает при сравнении совместно
существующих групп видов. В европейских лиственных лесах такими группами
являются синузии эфемероидов и дубравного широкотравья (Серебряков, 1948,
1949; Шик, 1953; Смирнова, 1987).
Детальный анализ различных способов вегетативного размножения показал,
что, помимо общих репродуктивных параметров (продуктивность и биомасса
диаспор), растения, размножающиеся вегетативным путем, имеют специфические
характеристики. С учетом таких показателей, как время начала размножения в
онтогенезе и глубина омоложения дочернего потомства, вегетативное размножение
можно разделить на три типа (Смирнова, 1987). Размножение первого типа (се-
нильная, или старческая партикуляция, по Работнову, 1969; см. также Партику-
ляция) происходит в постгенеративный период, не сопровождается омоложением
потомства и его расселением. В этом случае длительное существование вида в
сообществе невозможно без семенного размножения. Так, например, если у видов
Corydalis solida, Scilla sibirica (эфемероиды), Lathyrus vernus, Ranunculus
cassubicus (широкотравье) не развивается жизнеспособное семенное потомство, то
через 10-15 лет их ценопопуляции переходят в критическое состояние или
полностью выпадают из ценоза.
Вегетативное размножение второго типа (нормальная партикуляция, по
Работнову, 1969) начинается в генеративном периоде и сопровождается неглубоким
омоложением потомства. Оно позволяет видам десятилетиями удерживать
позиции в ценозе, пока не наступят благоприятные условия для плодоношения и
прорастания семян. Этот тип размножения характерен для большинства видов обеих
440
Системы репродукции
синузий (Aegopodium podagraria, Asarum europaeum, Dentaria quinquefolia,
Galium odoralum, Polygonatum multiflorum и др.), которые сильно отличаются
по вегетативной подвижности: от нескольких см до нескольких десятков см в год.
Вегетативно наиболее подвижные виды имеют больше шансов длительно
сохраняться в сообществе.
Третий тип вегетативного размножения (ювенильная партикуляция)
осуществляется глубокоомоложенными диаспорами в начале (виды рода Gagea) или в
середине (Dentaria bulbifera, Ficaria verna) онтогенеза. Образующиеся вегетативные
диаспоры биологически равноценны семенам и часто заменяют их. При этом виды
могут длительно существовать в сообществах, не размножаясь семенами.
Анализ системы репродукции в пределах каждой из синузий выявляет
значимость того или иного типа размножения в устойчивом существовании вида в
сообществе. При анализе эфемероидов обнаружено, что виды родов Corydallis,
Erythronium, Scilla, у которых вегетативное размножение не развито вследствие
отсутствия условий для регулярного семенного размножения, выпадают из состава
сообществ в течение 1-2-х десятилетий. Виды родов Gagea, Ficaria и Dentaria
bulbifera, имеющие глубокоомоложенные, свободно отделяющиеся вегетативные
диаспоры, способны десятилетиями существовать в сообществах, возобновляясь
только вегетативным путем. Allium ursinum, A. victorialis, виды рода Anemonoides,
Dentaria quinquefolia, Tulipa biebersteiniana, характеризующиеся нормальной пар-
тикуляцией, но незначительным вегетативным разрастанием, для устойчивого
поддержания популяций и освоения вновь образующихся местообитаний требуют
периодического семенного размножения.
Среди дубравного широкотравья, как и среди эфемероидов, довольно большая
группа видов способна устойчиво существовать в сообществах только при условии
регулярного семенного размножения. Это — одно-малолетние монокарпики
(Alliaria petiolata, Geranium robertianum, Torilis japonica) или виды, у которых
вегетативное размножение отсутствует или представлено старческой партикуляцией
(Carex sylvatica, Festuca gigantea, Geum urbanum, Lathyrus vemus, Melica nutans,
Ranunculus cassubicus и др.). Виды, у которых имеются глубокоомоложенные,
свободно отделяющиеся вегетативные диаспоры, в этой синузий отсутствуют;
существует лишь один вид с глубокоомоложенными вегетативными зачатками —
корнеотпрысковая Viola mirabilis. Это — интересный пример сочетания
нормальной партикуляции при незначительном вегетативном разрастании (размножение
осуществляется при разделении коротких корневищ) и сарментации (размножение
осуществляется при отделении корневых отпрысков). Семенное размножение у
этого вида эпизодическое.
Самая большая группа включает виды, где нормальная партикуляция и
значительная вегетативная подвижность гарантируют возможность длительного
(десятилетиями) поддержания популяций только вегетативным путем {Aegopodium
podagraria, Carexpilosa, Convallaria majalis, Galeobdolon luteum, Galium odoratum,
Glechoma hirsuta, Mercurialis perennis, Stellaria holostea, Stachys sylvatica, Urtica
dioica). Семенное размножение у перечисленных видов также происходит
эпизодически и является резервным способом повышения устойчивости популяции.
Промежуточное положение между этими двумя группами видов занимают:
Asarum europaeum, Carex digitata, Paris quadrifolia, Polygonatum multiflorum,
Pulmonaria obscura, которые, хотя и обладают нормальной партикуляцией, но не-
я
ё
я
н
к
А
И
Я
а
н
о
о
а
s
В
о
и
о
S
и
л
а
1
зК
S
S
V
Б
я
а
и
о
Ч
S
О
а
V
Е
V
е-
№
S
Ч
о
а
в
V
а
м
А
S
V
&
S
и
М
А
а
V
S
я
а
я
в
А
а
о
н
о
Масса
продук-
я
X
а
%
енцн
Поп
ножения
S
я
а.
§
9
гелы
s
4
нач
1
а
09
етная
В"
О
X
9
Вид pacrei
L_
семян
a
ол-в
а
S3
ивно
н
У*Ч
годь
N^
У*Ч
з
5
J,
ния,
азмно
а.
а
нннца i
ВС
V
1 (мг) |
год) |
и
ч
X
ь
а
о
Б
и
я
S
ч
9
пуляцн
о
Б
[еиа
Е
V
и
V
3
9
атнв
очкн
С в
вег
2
е
ативн
Е
V
т
г
о
X
X
V
сем
о
ь
она
9
вегетат
о
О
9
9
семе!
1 7-7.5 |
-400 |
200
—
1-2
«*~v
0-50
•ч-
л
т—"
о
in
d
•ч-
Л
У—S
(N
ч-н
•п
^
2-3
w
1 4-5
[ета
а
'ium ursinum
X
0.7-0.9
100
60-
2-3
.—n.
ts.
1
сЛ
<*~*
»30-40
СЛ
'<■*-'
§
»30-
*—ч
tv.
СЛ
*А
^-ч
3-6
4-6
ета
S
я
а
emonoides
unculoides
^ г
| 2.4-3.6 |
•250
о
ел
2-3
1-2
-
о
т—"
с^.
CN
ч—'
d
vO
ел
ета
s
й
rydalis cava
3
| 1.5-1.6 |
-300
3
:о-30
CN
О
ел
Л
Л
OQ
Л
Л
л
У—ч
СЛ
CN
СЛ
CN
у^
2-4
1 2"4
ета
X
и
■aria vema
.а
| 1.2-1.5 |
■240 |
о
in
у—
0-20
ч-н
•"-^
*Ф
»
г)<
л
л
.00
Л
л
л
.*-*.
CN
,л
ч-н
«""^
2-4
^
2-4
ета
X
gea lulea
в
| 1.5-2.5 |
-3500
2000
CN
.*-s
(N
m
(N
СЛ
CN
^^
О
[ета
а
а
"С
1
gopodium poda
•и
| 0.8-1.0 |
-300
200
5-20
<--ч
in
СЛ
л
л
л
.*—ч
СЛ
(N
л
л
л
*~\
(N
т-<
^f
СЛ
/—N
2-3
^^
| 5-6
:ета
г
1
1
1
X
| 2.0-3.0 |
-500 |
200
нет
нет
г—"
нет
ета
X
iaria peiiolaia
\All
| 3.5-4.5 |
100
50-
еч
ч—*
/—V
»п
ел
С?
in
>40
^^
1П
сЛ
N»^
-50
| >40
s-^
in
СЛ
in
>^N
2-4
4-7
ета
г
я
а
arum europaeum
X
| 2.5-3.0 |
100
50-
10-40
ГЧ
^—s
ч-н
/Г
Л
Л
y—s
ч-н
^mS
Л
л
л
•«•"•
2-4
^"^
1П
(N
ета
Е
а
1
Е
3
3
| 15.0-20.0 |
-200 |
о
о
1-2
*-\
CN
^
ел
»п
Я
in
ч-"*
eN
■п
ел
ета
а:
К
thyrus vemus
j
| 10.0-15.0 |
200
50-
V
V
^■^
о
CN
»n
О
30-
л
л
~
о
eN
m
•**s
о
■*-
| »30-
о
in
in
d
ot?
о
in
ета
о.
Е
=
/i//oi
lygonatum mul
-£
| 3.0-3.5 |
150
50-
ч-н
V
V
у—\
(N
ч-н
СЛ
(N
(N
00
in
Ч-ч
ч-н
in
СЛ
ета
X
и
о>
Ыси
nunculus cassu
ОС
| 1.5-2.0 |
-350
200
0-20
т—'
eN
X
Л
Л
.—ч
ч-н
*—•
л
л
л
-^*>.
N—^
2-4
■Ф
р.
ета
s
я
а
"
chys sylvatica
1 Sta
| 1.5-2.5 |
-300
о
о
нет
нет
,-■
X
Т—
ета
s
К
rilis japonica
$
442
Системы репродукции
значительная вегетативная подвижность (как и у соответствующей группы
эфемероидов) требует для устойчивого поддержания популяций периодического
семенного размножения.
Существенными параметрами системы репродукции, определяющими «успех»
видов в завоевании новых микроместообитаний, являются потенциальная
вегетативная и семенная продуктивность, длительность процессов размножения в
онтогенезе и масса семян (Табл.). В синузии эфемероидов Ficaria verna и виды рода
Gagea имеют высокую продуктивность семян и вегетативных диаспор, виды родов
Allium и Corydalis, при сходном уровне семенной продуктивности, имеют меньшую
вегетативную продуктивность, а виды рода Anemonoides — и значительно
меньшую семенную продуктивность. Подобное разнообразие в соотношении семенной
и вегетативной продуктивности существует и в синузии дубравного широкотравья
(см. Табл.). Максимальная длительность семенного и/или вегетативного
размножения в онтогенезе отмечена у видов, обладающих ювенильной партикуляцией
(Ajuga genevensis, Ficaria verna, Gagea lutea, Galeobdolon luteum, Galium
odoratum, Stachys sylvatica и др.). Эти особенности системы репродукции в
значительной степени определяют положение видов в сообществах.
Вайнагий, 1974; Работнов, 1969; Серебряков, 1948,1949; Смирнова, 1987; Ценопопуляции
растений (очеркипопуляционнойбиологии), 1988; Шик, 1953; Grime, 1979; Halper, 1977; Salisbury, 1942.
ПОЛИВАРИАНТНОСТЬ СПОСОБОВ ЕСТЕСТВЕННОГО ВЕГЕТАТИВНОГО
РАЗМНОЖЕНИЯ И РАССЕЛЕНИЯ (НА ПРИМЕРЕ СЕМ. RANUNCULACEAE)
В эволюции лютиковых четко прослеживается тенденция к усилению
вегетативной подвижности многолетних растений, возникновению разнообразных
специализированных органов вегетативного размножения (Барыкина, 1975,1995а).
Адаптивная роль этих образований особенно ярко проявляется в условиях пониженного
или на какое-то время полностью подавленного семенного размножения. По
образному выражению Левиной (1981, с. 12), вегетативное размножение —
«важнейший резерв существования вида».
Лютиковым присущи почти все известные у покрытосемянных способы
естественного вегетативного размножения, включая сарментацию, партикуляцию,
вегетативную диаспорию, но преобладает первая.
В простейшем случае вегетативное размножение осуществляется без
формирования специальных органов посредством фрагментации лежачих или ползучих мо-
нокарпических побегов, свойственных травянистым поликарпикам (например,
видам рода Ranunculus), а также свисающих и укореняющихся в узлах при
соприкосновении с влажной почвой лианоидных побегов кустарников типа Clematis
brevicaudata. У наземно-ползучих форм (R. flammula, R. reptans),
произрастающих на подвижном влажном субстрате, из пазушных почек зоны торможения
цветоносных побегов образуются боковые ортотропные укореняющиеся розеточные
побеги (Troll, 1964). Перезимовав, они дают новые растения, повторяющие цикл
развития материнского. Размножение путем обособления отдельных участков,
погружающихся в конце вегетационного сезона на дно водоема, полегающих и
укореняющихся генеративных побегов характерно для водных лютиков (R. circinatus), a
также прибрежно-водной Caltha palustris. Налицо смена функций монокарпиче-
Популяционные и экологические аспекты репродукции
443
ского побега: после цветения и плодоношения часть его метамеров участвует в
вегетативном размножении и расселении растения.
В подавляющем большинстве случаев вегетативная подвижность растения
связана с развитием специализированных структур, в основном, побегового
происхождения. Они отличаются рядом биоморфологических признаков,
обусловленных разными функциональными нагрузками, характером роста,
возобновления, продолжительностью существования. У столонообразующих вегетативных
малолетников (Высоцкий, 1915), приуроченных к влажным и избыточно
увлажненным местообитаниям с рыхлой почвой, увеличение числа особей
осуществляется посредством сарментации. Формируются преимущественно надземные пла-
гиотропные с ассимилирующими листьями недолговечные плети, или столоны.
Они отходят от розеточной зоны возобновления ортотропного полурозеточного
материнского побега и регулярно развивают в узлах силлептические
укореняющиеся розеточные побеги. Растения Ranunculus repens, выросшие из семян, уже
со второго года могут начать размножаться при помощи столонов (Голубев, 1961;
Барыкина, Пустовойтова, 1973). Верхушка столона в конце сезона становится
ортотропной и заканчивает развитие формированием терминальной розетки. Все
розеточные побеги осенью обособляются. С помощью более
специализированных надземных столонов, несущих листья только низовой формации и,
следовательно, не участвующих в фотосинтезе, происходит быстрый захват площади и
расселение дочерних особей у видов рода Halerpestes.
Высокая вегетативная продуктивность Ranunculus lapponicus и R. lingua
достигается посредством развития интенсивно ветвящихся хрупких подземных
столонов с ассимилирующими (R. lapponicus) или чешуевидными (R. lingua)
листьями. По мере роста столоны образуют многочисленные розеточные боковые
побеги, быстро прерывающие связь с материнским. Придаточные корни, рано
закладывающиеся в основании розеток, обеспечивают переход последних к
самостоятельному существованию. Высокая скорость вегетативного размножения
увеличивает общую продолжительность большого жизненного цикла особи
семенного происхождения, хотя сами парциальные образования недолговечны и
существуют от 1 до 4 лет.
Удлиненные метаморфизированные плагиотропные побеги у наземно-ползучих
и подземно-столонных форм травянистых поликарпиков, несмотря на разные
способы формирования, обусловливают сходную стратегию быстрого и активного
захвата новых площадей обитания при кратковременном их удерживании и
значительную скорость перемещения.
Дальнейшая специализация органов размножения у лютиковых связана с
редукцией столонов, сопровождающейся клубневидным разрастанием их терминальных почек.
Относительно короткими (одно-двухметамерными) подземными столонами,
заканчивающимися ортотропно ориентированными почками возобновления с утолщенной
осью и пучками придаточных корней в их основании, размножаются столонообразую-
щие формы Ranunculus (Барыкина, Черняковская, 1986), столонно-клубневые
формы Delphinium, Aconitum (Барыкина и др., 1977).
У клубневых вегетативных малолетников (виды родов Aconitum, Delphinium)
обычно в генеративном возрастном периоде происходит факультативное
вегетативное размножение. Оно достигается одновременным раскрытием на многолетнем
материнском клубне нескольких быстро укореняющихся спящих почек, или почек
444
Системы репродукции
возобновления, гипоподий и мезоподий которых часто столоновидно
вытягиваются, а последующие укороченные междоузлия разрастаются в толщину, формируя
стеблевые и стебле-корневые дочерние клубни. Со временем они обособляются,
давая начало новым особям. В течение большого жизненного цикла образуется
несколько поколений вегетативного потомства. Клубни существуют у разных видов
1-2 и более лет. Вегетативная «оседлость» (согласно терминологии Любарского,
1967) клубневых форм при слабо выраженном вегетативном размножении
позволяет удерживать длительное время одно и то же место в сообществе.
Наиболее широко у представителей семейства распространено вегетативное
размножение посредством корневищ. У короткокорневищных видов родов Actaea,
Enemion, Ranunculus и др. вегетативная подвижность относительно слабая,
увеличение числа особей осуществляется в результате одновременного развития 2-4
анизотропных укореняющихся, впоследствии обособляющихся метаморфизированных
побегов возобновления. Им свойственен медленный захват территории
вегетативным путем — дочерние особи остаются в непосредственной близости друг от друга.
У длиннокорневищных травянистых и кустарниковых, преимущественно
лесных видов родов Anemone, Clematis, Coptis, Thalictrum разветвленные гипогеоген-
ные (изначально подземного происхождения) корневища (ксилоризомы) время от
времени образуют многочисленные укореняющиеся надземные побеги, которые в
дальнейшем в результате отмирания более старых связующих участков корневищ
обособляются в самостоятельные особи. В эту группу также входят виды с
отчетливо выраженным диморфизмом корневищ, несущих разные функции: вертикальные
укороченные эпигеогенные (надземно рожденные) корневища с пучками
придаточных корней, выступающие в качестве своеобразных «центров закрепления»
(Смирнова, 1974), и развивающиеся из их базальных пазушных почек
горизонтальные «коммуникационные» гипогеогенные корневища, служащие для быстрого
и интенсивного захвата новых участков в пределах населенной видом территории.
Появление в ходе онтогенеза гипогеогенных корневищ на основе эпигеогенных
существенно изменяет жизненную стратегию растения; надставочныи характер этого
новообразования усиливает вегетативную подвижность. Вегетативное
размножение у длиннокорневищных растений начинается нередко в конце виргинильного
периода и сопровождается лишь частичным неглубоким омоложением потомства.
Общая продолжительность большого жизненного цикла длиннокорневищных
видов составляет 70-150 и более лет (Работнов, 1946,1950; Серебряков, 1952).
Корнеотпрысковые формы известны у относительно небольшого числа
видов из трех родов: Anemone, Clematis (Чубатова, 1989), Delphinium (Зиман,
1985). Все они облигатнокорнеотпрысковые растения. Зачатки придаточных
почек у A. dichotoma и A. sylvestris отчетливо заметны в двулетнем возрасте
сначала на главном, боковых, а затем и тонких поверхностных горизонтальных
придаточных корнях. Они закладываются в камбиальной зоне обычно рядом с
отмирающими всасывающими боковыми корнями; скопление здесь продуктов
распада корня и приток питательных веществ благоприятствуют формированию
очагов меристемы. У генеративных (4-5-летних) особей A. dichotoma уже
насчитывается до 30, а у Clematis glauca — до 50 корневых отпрысков, от только
что начавших рост до цветущих. По глубине омоложения и быстроте перехода к
репродукции корневые отпрыски не отличаются от ювенильных или имматур-
ных растений семенного происхождения. Достигнув взрослого вегетативного
Популяционные и экологические аспекты репродукции 445
состояния, корневые отпрыски образуют придаточные почки на собственных
стеблеродных горизонтальных корнях, что приводит к неопределенно долгому
существованию клона. В то же время корневые отпрыски, имея корневую
систему, обладают, подобно парциальным побегам длиннокорневищных форм,
высокой физиологической автономностью, которая по мере их развития все более
возрастает, пока, наконец, не прекращаются связи с материнским растением.
Высокая вегетативная продуктивность у корнеотпрысковых видов
сопровождается сильным подавлением семенного размножения.
Заслуживает особого внимания наличие у некоторых лютиковых таких
специализированных диаспор побегового происхождения, как легко
отделяющиеся клубневидные пазушные почки на корневище Anemone flaccida
(Потапова, 1988) и более сложной морфологической структуры клубни,
формирующиеся в аксиллярных комплексах розеточных и «стеблевых» листьев
фотофильного монокарпического побега Ficaria verna (Цырина, 1930;
Metcalfe, 1938), названные нами почко-корневыми клубнями (Барыкина, Гу-
ленкова, 1990; Барыкина, 19956). В основе их развития, как и подземных
клубней у видов Aconitum, лежит один и тот же механизм. Он проявляется в
раннем укоренении почек возобновления и последующем разрастании корня
как основного хранилища питательных веществ. Следует отметить, что у F.
verna клубней появляется значительно больше, чем ежегодно
развертывающихся листьев. Это обусловлено внутрипочечным ветвлением, приводящим к
формированию в пазухе кроющего листа множественных почек разного
порядка. У этого вида чистяка клубни формируются регулярно, зрелые же пло-
дики появляются лишь спорадически; проростки и всходы встречаются только
на хорошо освещенных и влажных местах обитания.
Развитие метаморфизированных вегетативных зачатков типа выводковых
почек (вегетативная диаспория) обеспечивает не только быстрое размножение А.
flaccida и F. verna в пределах данного ценоза (где они в силу эфемерности не
являются сильными конкурентами для других видов), но и часто активное внедрение в
соседние ценозы. При этом отмечается глубокое омоложение вегетативного
потомства, начинающего цикл развития с вегетативной фазы.
В качестве своеобразной формы вегетативного размножения у высокогорных
видов родов Aconitum, Anemone, Delphinium, Paraquilegia, Pulsatilla
(Барыкина, Гуланян, 1874; Барыкина и др., 1976, 1991; Барыкина, Потапова, 1994;
Барыкина, 1995) выступает обособление корневищных или побеговых партикул,
формирование которых начинается с ранних фаз онтогенеза и сопровождается
атипичным вторичным утолщением (Kumazawa, 1937; Tamura, 1964; Барыкина и
др., 1977). У Anemone fasciculata, A. protracta, A. speciosa, зацветающих по
достижению 18-20 лет (Работнов, 1950), уже у 3-4-летних имматурных растений
внешне обнаруживаются первые признаки партикуляции. Наличие на партикулах
побегового происхождения резерва спящих почек, способность к корнеобразова-
нию, а зачастую и функционирование уже довольно хорошо развитой корневой
системы определяют при полном отделении партикул в условиях динамичного
субстрата слабо выраженное вегетативное размножение. Партикуляция не
приводит к достаточно резкому омоложению дочерних особей, но вместе с тем
способствует продлению жизни клона.
Выявленное многообразие способов вегетативного размножения в
пределах сем. Ranunculaceae демонстрирует широкий спектр адаптации видов к ус-
446
Системы репродукции
ловиям обитания, разную стратегию захвата ими нового жизненного
пространства (стратегия «стайера» и «спринтера», по Юрцеву, 1986), разные
скорости передвижения, особенности клонирования с учетом омоложения
вегетативного потомства.
Сходные специализированные органы вегетативного размножения в разных
таксонах — результат конвергентной эволюции. Способы вегетативного
размножения, как правило, видоспецифичны. Каждый вид характеризуется одним
способом размножения, лишь в единичных случаях формируются разные
специализированные структуры. Например, вегетативную подвижность обеспечивают наряду с
корневищами или стелющиеся побеги, или надземные столоны, или корневые
отпрыски. Такая дивариантность способов вегетативного размножения у особей
одного вида, сменяющих друг друга или сосуществующих одновременно, можно
рассматривать как один из механизмов, выработанных в ходе эволюционных
преобразований семейства, обеспечивающих самоподдержание популяции особенно в
меняющихся условиях среды.
Большое разнообразие способов вегетативного размножения и
расселения наряду с другими биоморфологическими особенностями позволило
лютиковым освоить резко различающиеся между собой экологические ниши и
обеспечило их существенную роль в растительном покрове в современную
геологическую эпоху.
Барыкина, 1975,1995а; Барыкина, Гуланян, 1974; Барыкина и др., 1976,1977,1991; Барыкина,
Гуленкова, 1991; Барыкина, Потапова, 1994; Барыкина, Пустовойтова, 1973; Барыкина, Чер-
няковская, 1992; Высоцкий, 1915; Голубев, 1961; Зиман, 1985; Левина; 1981; Любарский, 1967;
Потапова, 1988; Работнов, 1946,1950; Серебряков, 1952; Смирнова, 1974; Цырина, 1930; Чу-
батова, 1989; Юрцев, 1986; Kumazawa, 1937; Metcalfe, 1938; Tamura, 1964; Troll, 1964.
ОНТОГЕНЕЗ ВИДОВ РОДА FERULA L. (APIACEAE)
Вопросам цветения, прорастания семян и морфологии проростков видов рода
Ferula придается большое значение (Васильченко, 1941; Федоров и др., 1962;
Голубев, 1965; Мелибаев, 1977; Рахманкулов, Мелибаев, 1981; Богдасарова, 1990).
Род Ferula представлен как моно-, так и поликарпиками. Изучен онтогенез и
возрастные состояния 14 западно-тяньшанских видов рода Ferula в границах их ареала
(монокарпики — F. diversivittata, F. kuhistanica, F. samarkandica, F. ugamica; поли-
карпики — F. akitschkensis, F. ferganensis, F. karatavica, F. lapidosa, F. leucographa,
F. pallida, F. penninervis, F. prangifolia, F. tenuisecta, F. tschimganica) (Николаева,
1948; Федоров и др., 1962; Голубев, 1965; Рахманкулов, Мелибаев, 1981).
Латентный период длится от 6 месяцев (Маркова, Медведева, 1968) до 2-4
лет (Момотов и др., 1989). Виргинильный (прегеиеративный) период у моно-
карпиков длится 8-10 лет, а у поликарпиков 4-7 лет.
Для представителей сем. Apiaceae в природе характерна низкая всхожесть семян,
медленное прорастание и глубокий покой. В лабораторных условиях при температуре
0 -+4°С процент прорастания свежесобранных семян увеличивался до 70 — у моно-
карпических видов и до 76% — у поликарпических. После 8 лет хранения всхожесть
составляла 17-42% у монокарпиков и 43-75% — у поликарпиков. Относительно
длительная жизнеспособность семян говорит о больших потенциальных
возможностях видов Ferula в борьбе за выживаемость в условиях аридной зоны Средней Азии.
Популяционные и экологические аспекты репродукции
447
Грунтовая всхожесть семян у монокарпиков составляла в среднем 74%, у
поликарпиков — 64%. Ее величина варьировала у разных видов (40 — 86%) и семян
одного вида, собранных в различных точках ареала.
Для всех видов характерно эпигеальное прорастание. Первым появляется
корешок, который быстро углубляется в почву, затем — гипокотиль. Он, выпрямляясь,
выносит над поверхностью почвы две или три (в 0,3% случаев) семядоли.
Пластинки семядолей листовидные, узколинейные, цельнокрайные, часто голые. Через 30
дней после появления всходов средняя длина семядоли 18.0 мм, ширина — 2.9 у
монокарпиков и 17—1.9 у поликарпиков (соотношение этих величин: 6 :1 и 9 :1,
соответственно). Средняя продолжительность их жизни составляет 42-48 дней.
Для всех видов характерен умеренный темп роста корня; через 30 дней после
прорастания корень проникает в почву на глубину почти равную длине семядоли.
Ювенильное состояние. После развертывания у проростков 2-3 листьев
семядоли засыхают, и растение становится ювенильным. Первый лист появляется в конце
марта, начале апреля, средняя продолжительность его жизни у монокарпиков 46,5
дня, у поликарпиков — 48,5. Второй лист появляется на 24-30 день, и
продолжительность его жизни в среднем составляет 56 дней. В 75% случаев отмечено
появление третьего листа, продолжительность жизни которого 45-55 дней. Размер листьев
за сезон увеличивается у монокарпиков в 3 раза, у поликарпиков — в 5 раз.
Имматурное состояние у видов рода Ferula отсутствует, так как они не
образуют вегетативных побегов (Работнов, 1983; Жукова, 1988).
Переход от виргинильного периода к генеративному, в зависимости от места
произрастания, происходит у монокарпиков через 8-10 мес, а у поликарпиков —
через 4-7. В это время у них отрастают только розеточные листья и удлиняется
корень, а затем формируется генеративный побег.
Генеративный период у монокарпиков составляет несколько месяцев, а у
поликарпиков — 8-14 лет.
Монокарпики Ferula являются классическим примером растений с медленным
темпом прегенеративного развития, т.е. ежегодно бурно растут только розеточные
листья и утолщается корень. Затем, через 8-10 лет формируется генеративный
побег, прирост которого составляет до 20 см в сутки и развиваются генеративные
органы; через 25-30 дней, в зависимости от метеорологических условий года,
растения зацветают (Рахманкулов, Мелибаев, 1981; Момотов и др., 1989; Богдасарова,
1990). Рост репродуктивного побега происходит за счет удлинения междоузлий:
первое растет в среднем 20-30 дней, второе — 15-20, а третье — 13-16. В год
вступления особей в генеративное состояние (март—апрель) влагалища стеблевых
листьев плотно прикрывают соцветия, образуя «зеленый бутон», который по мере
роста побега увеличивается за счет разрыхления интенсивно растущих зонтиков и
зонтичков, распрямления и роста самих влагалищ, строение которых является
надежным диагностическим признаком вида. Они различаются по форме, размерам,
консистенции, опушению и способу прикрепления к стеблю.
После полного формирования соцветия наступает фаза бутонизации, затем
цветения. Цветки распускаются акропетально. Для них характерен дневной тип
цветения. Механизм раскрытия цветков разных половых форм однотипный, но имеются
некоторые различия в биологии их цветения. Обоеполые цветки, расположенные
на центральных зонтиках паракладиев, раскрываются с 6 до 22 ч. Пик цветения у
монокарпиков приходится на 8-10 ч., а у поликарпиков — на 7-10.
см 5 •
4
3
2
1
О
1 i
2
3
4
5
Дни
'f*ftttft fJMH *АЛ
15
25
JVSSHff'SA*'
CM 5
4
3
2
1
0
1
2
3
4
5
10 ¥ 15 W 25
Рис. 25. Онтогенез видов рода Ferula.
1,2 — прорастание семян и развитие проростков у F. ruhistanica (1) и F. /em«sec/a (2);
см Годы вегетации
1 2
Рис. 25 (продолжение).
3,4 — строение подземных органов монокарпика F. ruhistanica (3) и поликарпика F. tenuisecta (4) в
различные периоды онтогенеза: а — виргинильныи, б — генеративный, в — сенильныи периоды.
По: Рахманкулов, ориг.
450
Системы репродукции
Продолжительность цветения обоеполых цветков составляет у монокарпиков
6-9, а у поликарпиков — 6-13 дней. Максимум раскрытия обоеполых цветков у
монокарпиков зафиксирован на 2-3 день, у поликарпиков — на 1-2.
Распускание цветков в пределах зонтиков и зонтичков в целом происходит в
строгой последовательности, которая выявлена и у других представителей
зонтичных. В пределах соцветия продолжительность цветения различна, но
выявлена общая закономерность: на нижних паракладиях цветение длится дольше,
чем на верхних.
Семенная продуктивность вида зависит от количества генеративных побегов па-
ракладиев, зонтиков, зонтичков, а также от соотношения обоеполых и мужских
цветков на одной особи. Что касается непосредственно обоеполых цветков, то их вдвое
меньше у поликарпиков. Мужских цветков почти в пять раз больше у монокарпиков,
чем у поликарпиков, соотношение мужских цветков к женским составляет,
соответственно, 1:3 и 1:2. Коэффициент семенной продуктивности у них примерно одинаков.
Сенильный (постгенеративный период) у монокарпиков отсутствует. У
поликарпиков он начинается через 6-8 лет вегетации. Одним из признаков старения
особи является отмирание тканей в базальнои части центрального цилиндра стержневого
корня, что приводит к образованию дупел, глубина которых уже через 4-6 лет после
цветения достигает 10 см. Чем дольше особь цветет, тем больше образуется дупел на
стеблекорне и тем глубже они его расчленяют, однако обособления партикул не было
обнаружено ни у одного из изученных видов. Другим признаком сенильного периода
является формирование только вегетативных укороченных побегов (в течение
последующих 3-6 лет), после чего особь отмирает. Следовательно, чем больше
укороченных вегетативных побегов и больше дупел на корне, тем старше особь.
Таким образом, онтогенез видов Ferula (как монокарпиков, так и
поликарпиков), характеризуется отсутствием имматурного периода развития. У монокарпи-
ческих видов наиболее протяженным является прегенеративный период,
генеративный же, к которому приурочено единственное цветение и плодоношение,
относительно короток. Сенильного периода нет, так как сразу после плодоношения
растение отмирает. Рис. 25.
Богдасарова, 1990; Васильченко, 1941; Голубев, 1965; Жукова, 1988; Маркова, Медведева, 1968;
Мелибаев, 1977; Момотов и др., 1989; Николаева, 1948; Работнов, 1983; Рахманкулов, Мелиба-
ев, 1981; Федоров и др., 1962.
t>
Эмбриологические основы репродуктивных стратегий
451
ЧАСТЬ VII — ЭМБРИОЛОГИЧЕСКИЕ ОСНОВЫ
РЕПРОДУКТИВНЫХ СТРАТЕГИЙ
АДАПТИВНЫЕ ВОЗМОЖНОСТИ И РЕПРОДУКТИВНАЯ СТРАТЕГИЯ
ВОДНООРЕХОВЫХ (TRAPACEAE)
Семейство Тгарасеае представлено единственным родом Тгара (водяной
орех), включающим множество форм недостаточно ясного систематического
ранга. Водяной орех — редкий вымирающий реликт третичного периода,
являющийся в то же время ценным пищевым и кормовым растением. Согласно
Козо-Полянскому (1931), реликтовые виды являются «живыми ископаемыми»,
наглядно отражающими отдельные этапы и всю историю становления флоры того
или иного региона земного шара. В современную эпоху реликты часто
оказываются в совсем иных, по сравнению с прежними, условиях существования.
Поэтому познание пределов пластичности и толерантности их систем репродукции,
выявление жизненных стратегий при освоении различных экологических ниш
представляют несомненный интерес с общебиологической точки зрения и требуют
разработки подходов к их изучению.
В связи с вопросами систематики водноореховых, восстановления численности
и охраны, а также перспективой введения в культуру неоднократно подчеркивалась
необходимость детального изучения биологии, экологии, особенностей
репродукции их различных форм (Васильев, 1960; Редкие и исчезающие виды..., 1981;
Самарина и др., 1988; Красная книга РСФСР, 1988; Титова, Батыгина, 1997).
Род Тгара характеризуется обширным, хотя и разорванным ареалом в Евразии и
Африке (отдельные расы занесены в Северную Америку и Австралию). Его
представители произрастают в самых различных климатических условиях — от
тропиков и субтропиков до умеренных широт. Они входят в состав разнообразных
растительных сообществ, образуя ассоциации с различными видами других водных мак-
рофитов (Ceratophyllaceae, Nymphaeaceae, Potamogetonaceae, Najadaceae,
Hydrocharitaceae и др.), и окружены не менее разнообразной наземной
растительностью — от темнохвойной тайги, степей и лесостепей северного полушария до
тропических лесов южного полушария. Водяной орех обитает в пресноводных, как
правило стоячих или слабо проточных, теплых, хорошо прогреваемых водоемах
(озерах, старицах, прудах, речных заводях и т.п.) эвтрофного типа с илистыми или
песчаными грунтами на глубине от 0,5 до 3—4 м и нейтральными или слабокислы-
452
Системы репродукции
ми (рН 6-8) мягкими водами с несколько повышенным содержанием железа
(Apinis, 1940; Васильев, 1960; Шилов, Михайлова, 1970; Дубына, 1982).
Однако в ряде случаев его произрастание было отмечено в озерах дистрофного типа
(Мартыненко, Каим, 1977), а также в холодных озерах с интенсивным грунтовым
питанием (Шилов, Михайлова, 1970).
Жизненные формы. Представители рода являются водными
укореняющимися травами и относятся к группе гидатофитов (по классификации Уранова, 1974).
Верхняя, плавающая генеративная часть побега утолщена и несет розетку
ромбических листьев с длинными черешками и большими пузыревидными вздутиями на
них, формирующимися по мере развития плодов и поддерживающими растение на
поверхности воды. Подводная, вегетативная часть побега (0,5—4 м в длину, в
зависимости от глубины водоема) имеет длинные междоузлия и рано опадающие
подводные листья; от каждого междоузлия отходят длинные, рассеченные на доли
фотосинтезирующие органы, природа которых дискуссионна (метаморфозирован-
ные придаточные корни — Флеров, 1925; Zitek, 1955; Тимонин, 1984;
видоизмененные прилистники — Васильев, 1978). Закрепление растения в донном
субстрате осуществляется с помощью системы адвентивных корней, образующихся в
области длинного гипокотиля и нижних узлов стебля.
Для некоторых видов водяного ореха отмечено образование наземных форм,
которые настолько отличались по морфологическим признакам от водных (наличие
округлых вместо ромбических пластинок розеточных листьев, укороченных
черешков без пузыревидных вздутий, отсутствие подводных листьев и ассимилирующих
прилистников (корней) в их узлах), что их можно было принять за разные виды
(Чернов, 1939; Смирнова-Гараева, 1972; Дубына, 1982). По сведениям Дубыны
(1982), наземные формы Т. natans из верховьев и устья Днепра, Дуная и Южного
Буга (Украина) способны к цветению, но не образуют плодов. Однако наземные
формы, обнаруженные в долине реки Суйфун (Дальний Восток) (гербарные
образцы Комарова — цит. по: Васильев, 1960) и Сундрицкой заводи Окского
заповедника (Чернов, 1939), имели вполне сформированные плоды.
Способность водяного ореха (Т. europaea, T. longicarpa и Т. brevicarpa) к
прорастанию и дальнейшему развитию в воздушной среде была также показана
экспериментально (Jankowic, Blazencic, 1968). При этом растения существенно
отличались от контрольных (выращенных из плодов в воде) как по физиологии развития
(ускоренное прохождение фаз онтогенеза), так и морфолого-анатомическим
характеристикам (морфологическая карликовость, появление признаков наземных
растений в анатомической структуре стебля и листьев).
Принято считать, что водяной орех является однолетним растением (Тахтад-
жян, 1966; Cook, 1987; Agarwal, Mohan Ram, 1995). Однако имеются указания
на то, что в определенных условиях он может быть многолетним (Pailleux, Bois,
1888; Halacsy, 1901; Gams, 1925; Флеров, 1902,1925,1926). Согласно
Васильеву (1960), водяной орех по своей природе является потенциально многолетним
растением, о чем свидетельствует продолжительность его цветения и
плодоношения, заканчивающихся в умеренных широтах «насильственно» с наступающими
холодами. Это предположение подтверждается особенностями развития
растений Т. astrachanica и Т. europaea, интродуцированных из районов обитания в
дельте Волги (Астраханский Гос. заповедник) в условия, обеспечивающие более
продолжительную вегетацию (Ташкентский Ботанический сад, Узбекистан). Та-
Эмбриологические основы репродуктивных стратегий
453
кие растения характеризовались сменой циклов роста и развития побегов (их
вторичным ростом, цветением и плодоношением), а также более выраженной
способностью к вегетативному размножению (Мурдахаев, 1975).
Таким образом, в условиях умеренных широт водяной орех является
однолетним монокарпиком, а в субтропическом и тропическом поясах возможно
существование многолетних (более примитивных) видов с растянутым или
неоднократным плодоношением.
Вегетативное размножение водяного ореха представлено некоторыми слабо
специализированными формами. Его стебель может неоднократно ветвиться на
разных стадиях онтогенеза за счет образования боковых побегов в пазухах
листьев, в результате чего в течение вегетационного сезона на нем образуется
несколько розеток листьев различного возраста. Так, еще в процессе эмбриогенеза в
зародыше помимо главного побега в пазухах семядолей закладываются боковые
почки, из которых формируются боковые побеги, способные дать начало новым
растениям (Raimann, 1893; Васильев, 1960). Характерно, что развитие боковых
побегов в семядольных узлах происходит только на небольшой глубине (не более
2,5 м), в противном случ/ае оно прекращается и побеги отмирают (Мурдахаев,
1975; Титова, ориг. данные).
Образование боковых розеток наблюдается и позднее — как на вегетативной,
так и генеративной части главного побега, причем ветвление может быть весьма
обильным. Например, у Т. astrachanica обнаружен экземпляр длиной 8,6 м с 26
большими розетками листьев (Картина, Трофимов, 1951). В ряде случаев
происходит отделение боковых розеток от основного стебля в результате механического
повреждения или старения (отмирание базальной части стебля) особи (Gibelli,
Ferrero, 1891; Васильев, 1960; Мурдахаев, 1975), то есть происходит деление
одного экземпляра на несколько с образованием самостоятельных дочерних
растений, способных укореняться с помощью адвентивных корней или свободно
плавающих на поверхности воды (травматическая и сенильная партикуляция, по Ра-
ботнову, 1950 — см. Партикуляция).
Способность водяного ореха к образованию боковых побегов используется для
его искусственного вегетативного размножения. Например, в Китае молодые
боковые побеги проростков Т. bicornis с несколькими листьями отделяют от растения и
переносят на другое место для укоренения (Fu Ka-shui, 1954).
Следует отметить, что удельный вес вегетативного размножения в системе
репродукции водноореховых все же невысок. Согласно некоторым авторам (Cook,
1987), у Тгара вообще отсутствует естественное вегетативное размножение
вследствие сильно выраженного апикального доминирования. Это обусловило
необходимость разработки способов искусственного размножения водяного ореха в
культуре in vitro (Agrawal, Mohan Ram, 1995).
Семенное размножение. Единицей диссеминации водяного ореха является
плод — односемянный костянкообразный, с характерными рогами,
заканчивающимися длинными, острыми шипами-гарпунчиками. Массивный перикарп
состоит из зеленого травянистого наружного околоплодника (экзокарпа) и
черно-коричневого одревесневшего внутреннего околоплодника (эндокарпа).
Плоды необычайно вариабельны по форме и скульптуре поверхности, что
может быть обусловлено эколого—географическими причинами, специализацией
к распространению определенными видами животных (Васильев, 1960; Цве-
454
Системы репродукции
лев, 1964), а также гибридизационными процессами между отдельными
видами. Последнее подтверждается данными эмбриологии и биометрического
анализа плодов (Staszkiewicz, Wojcicki, 1979; Титова, 1988).
Семя, сплющенное в форме сердечка, заполняет всю полость плода. Зародыш,
возникающий в результате полового процесса, ложноодносемядольный, состоит из
массивной семядоли, длинного гипокотиля, главной зародышевой почечки с
зачатками нескольких листьев, прикрытой особым чешуевидным органом (второй
рудиментарной семядолей); в пазухах семядоли и чешуевидного органа закладываются
боковые почечки; главный корень редуцирован. Семенная кожура, образованная
производными обоих интегументов, тонкая кожистая, светло-коричневого цвета
(подробнее см. Колесова (Титова), 1996; Титова, 2000).
Помимо полового способа репродукции у Тгара возможен и бесполый. Так, у
Т. natans var. japonica экспериментально показана возможность апомиксиса,
однако его форма не установлена (Kadono, Schneider, 1986). У Т. astrachanica
наблюдалось образование зиготоподобных яйцеклеток при отсутствии пыльцевых трубок в
зародышевом мешке, что дает основание предполагать наличие у данного вида
партеногенеза (Титова, 1988).
Семенная продуктивность и факторы, определяющие ее уровень
Генетические факторы. Потенциально плоды Тгара являются двусемянными,
поскольку на ранних стадиях развития в полунижней двугнездной завязи
закладывается два семязачатка (по одному в каждом гнезде). Однако после
оплодотворения один из них всегда дегенерирует, независимо от того, произошло в нем
оплодотворение или нет. При этом вероятность дегенерации правого и левого, по
отношению к оси растения, семязачатков примерно одинакова. Из 461 исследованных
завязей Т. astrachanica в 161 наблюдалась дегенерация правого семязачатка, в
172—левого (в остальных 128 неоплодотворенных завязях дегенерировали оба
семязачатка) (Титова, 1988). Таким образом, детерминированная гибель одного из
семязачатков в завязи всегда приводит к снижению реальной семенной
продуктивности у Тгара в два раза по сравнению с потенциальной семенной продуктивностью.
Однако в единичных случаях у некоторых видов (Т. longicarpa — Jankowic,
Blazencic, 1961, 1973; Т. manshurica — Титова, ориг. данные) обнаружено
развитие обоих семязачатков и формирование двусемянных плодов.
Климатические и ценотические факторы. Урожайность водяного ореха
увеличивается при продвижении видов с севера на юг и находится в тесной
зависимости от продолжительности вегетационного периода, а также средних его
температур и интенсивности солнечного освещения (Васильев, 1960). Так, средняя
продуктивность водяного ореха в Сундрицкой заводи Окского заповедника составила
2,1 плода на розетку (Чернов, 1939), на оз. Ворохобы Псковской области — 2,8
(Белавская, Серафимович, 1977), на северо-западе Харьковской области — 5-6
орехов на растение (Черная, 1988). В еще более южных районах (в дельте Волги),
она заметно выше — 5-18 (Михайлова, 1940). Число плодов зависит также от
состояния самого растения: слаборазвитые экземпляры с 1-2 розетками несли 4-12
плодов, среднеразвитые — по 18-25, но бывает до 100 и более плодов на растение
(например, у Т. astrachanica — Вуколов, 1932; Каршина, Трофимов, 1951).
К числу факторов, лимитирующих успех репродукции водяного ореха, относят
частые летние паводки, вызывающие значительные нарушения в развитии расте-
Эмбриологические основы репродуктивных стратегий 455
ний и даже гибель популяции (Сорокин, 1988); ингибирующее действие других
членов сообщества (кувшинок, ряски, элодеи), а также прибрежных растений,
затеняющих их (рогоза, аира, тростника, камыша, лотоса и др.) (Коржинский, 1887;
Selling, 1940; Васильев, 1960; Белавская, Серафимович, 1977; Elakowich, Woofen,
1991). Существуют, однако, обратные данные — о высокой
конкурентоспособности водяного ореха и мирном сосуществовании его с упомянутыми растениями
(Wenner, 1939, 1940; Шилов, Михайлова, 1970).
Сведения различных авторов об урожайности водяного ореха даже из одного и
того же района довольно противоречивы и, по мнению Васильева (1960), связаны
скорее с несовершенством методики учета урожая, а не с его колебаниями в
пределах популяции или особи. Специальных исследований по соотношению
потенциальной и реальной семенной продуктивности водноореховых в зависимости от
различных экологических факторов почти не проводилось.
Анализ потенциальной (ПСП) и реальной (РСП) семенной продуктивности Т.
natans в условиях северной границы ареала (Псковская обл., оз. Ворохобы) с
использованием специально разработанной методики показал, что при
незначительном варьировании величины ПСП, показатели РСП и, соответственно, процент
семинификации существенно колебались по годам, и, в целом, были заметно ниже
таковых ПСП (Титова, Батыгина, 1997) (Табл. и Схема). Повышение РСП в
отдельные годы было, по-видимому, обусловлено благоприятными погодными
условиями (относительно высокие среднемесячные летние температуры,
незначительное количество осадков и др.). Более низкие средние температуры, частые
обильные дожди, особенно в период массового цветения растений, приводили к
резкому интеркалярному росту междоузлий, в том числе в генеративной части
побегов, отмиранию или задержке развития уже заложившихся цветочных почек и
образования новых, следствием чего являлось снижение завязываемости плодов.
Таким образом, избыточный уровень осадков, вызывающий обильные паводки,
действительно является одним из лимитирующих факторов репродукции Тгара,
особенно в Северо-Западном регионе России с его влажным морским климатом.
Таблица:
Потенциальная (ПСП) н реальная (РСП) семенная продуктивность Тгара natans L.
в разных ассоциациях на оз. Ворохобы, Псковская обл. *
Ассоциация
Тгара natans purum
Т. Natans + N. Candida
Годы
исследований
1990
1991
1992
1990
1991
1992
п
24
100
100
64
100
ПСП
95,76
82,34
99,40
64,24
62,70
РСП
0,46
5,65
7,49
2,41
5,82
Коэффициент
семниифнкацни
0,48
6,82
7,53
3,75
9,28
* Величину ПСП и РСП (в расчете на особь) определяли по числу следов от плодоножек
фертильных и стерильных плодов на генеративной части побега в конце вегетационного сезона,
после опадения их с материнского растения; следы от плодоножек полноценных, фертильных
плодов резко отличаются от стерильных по более выпуклой формой и крупным размером (см.
схему); цифры представляют средние значения.
456
Системы репродукции
Характерно, что в ассоциации Т. natans + Nymphaea Candida показатели ПСП
и особенно РСП были существенно ниже по сравнению с таковыми в ассоциации
Т. natans purum (Табл.). Снижение этих показателей происходило на фоне
подавления общего развития растений, формирования их боковых розеток, недоразвития
бутонов и т.д.
Антэкологические факторы. Цветки водяного ореха мелкие, одиночные,
белого цвета, обоеполые, актиноморфные, 4гчленные, развиваются в пазухах
листьев. Андроцей состоит из 4 тычинок, пыльники 4-гнездные, латрорзные, в бутоне
расположены примерно на одном уровне со столбиком, несколько наклонно к нему.
Гинецей образован двумя плодолистиками, завязь полунижняя, длинный столбик
закрытого типа, головчатое рыльце покрыто слегка удлиненными сосочкообразны-
ми клетками, выделяющими на поверхность секрет мукополисахаридной природы.
Основной способ опыления—самоопыление, которое обеспечивается
механизмом раскрытия цветка и движения пыльников относительно поверхности
рыльца (Gibelli, Buscaglioni, 1891; Михайлова, 1940; Ram, 1956; Kadono,
Schneider, 1986; Гревцова и др., 19876). Оно возможно в виде контактной и
неконтактной автофилии (Титова, 1988). Тот же механизм лежит и в основе
экологической клейстогамии, весьма характерной для Тгара: в пасмурную погоду, а
также в период завершения вегетационного сезона, полного раскрытия цветков часто
не происходит, однако опыление и оплодотворение могут осуществляться. У Т.
astrachanica отмечалась возможность истиной клейстогамии—прорастание
пыльцы прямо в пыльниках, еще до раскрытия бутонов, хотя случаев достижения
пыльцевыми трубками зародышевого мешка и процесса оплодотворения
наблюдать не удалось (Титова, 1988).
Схема. Генеративная часть побега Тгара после опадения с материнского растения
с различающимися по форме н величине следами плодоножек
с ф п — следы от фертильных плодов, сел- следы от стерильных плодов.
Эмбриологические основы репродуктивных стратегий 457
Перекрестное опыление насекомыми у Тгара носит случайный характер (М и-
хайлова, 1940; Васильев, I960; Kadono, Schneider, 1986). При этом возможны
как гейтоногамия, так и ксеногамия, поскольку нередко наблюдается
одновременное цветение цветков на нескольких розетках одного и того же растения, а также
двух цветков на одной розетке.
О важной роли перекрестного опыления у Тгара в историческом прошлом,
по-видимому, свидетельствует наличие в нижней части завязи околопестичного
диска, в области которого обнаружено присутствие нектара (Ohtaki, Joshido,
1980). Ram (1956), Kadono и Schneider (1986), наблюдавшие прорастание
пыльцевых зерен на поверхности диска, предположили, что он выделяет особый секрет,
способствующий прорастанию пыльцы на рыльце. Клетки диска содержат
большое количество крахмала, который быстро исчезает после оплодотворения
(Титова, 1988). Этот факт свидетельствует о том, что помимо возможной роли диска в
качестве источника питательных веществ для осуществления процесса
оплодотворения, несомненна его функция привлечения листогрызущих насекомых, нередко
выгрызающих сердцевину-завязей.
Несмотря на то, что механизм самоопыления у Тгара обеспечивает попадание
пыльцы на рыльце даже в случаях отсутствия агентов опыления или нераскрытия
цветков при неблагоприятных условиях, оплодотворение происходит далеко не
всегда и в завязях образуется большое число аберрантных семязачатков. Успех
оплодотворения во многом зависит от наличия оптимальных климатических условий для
его прохождения, от качества пыльцы и семязачатков, их соотношения и других
факторов (см. Популяциониые аспекты детерминации пола; Популяционный и
ценотический аспекты изучения репродукции растений в условиях Арктики;
Аберрантные семязачатки и семена: классификация и диагностика).
Оптимальными условиями для цветения Тгара являются температура воды не
ниже 18-20°С и высокая освещенность (Михайлова, 1940; Васильев, 1960;
Kadono, Schneider, 1986; Титова, 1988). Это обуславливает время выхода цветков
на поверхность воды в дневные часы суток (И — 12 и 17 — 18 час,
соответственно). Весьма интересна суточная ритмика цветения Т. natans в Псковской обл., у
которой выход цветков на поверхность воды и цветение могут осуществляться в
течение большого интервала времени — от 11 до 23 час. (Титова, Батыгина, 1997).
Последнее, несомненно, связано с увеличением продолжительности светового дня в
условиях северных широт и, по-видимому, способствует увеличению завязываемо-
сти плодов, особенно в период массового цветения растений. Именно в вечерние
часы, по-видимому, достигается наиболее благоприятное сочетание условий для
процессов опыления и оплодотворения — «спокойная вода» и ее хороший прогрев
при наличии достаточной освещенности. В условиях северной границы ареала этот
фактор может рассматриваться как частичная компенсация сокращения времени
для вызревания плодов при непродолжительном вегетационном периоде. У
Т. natans var. japonica также были обнаружены отдельные экземпляры, цветение
которых длилось до 23 час. и не показывало очевидной связи с уровнем
освещенности, однако природа этого явления в условиях Дальневосточного региона не вполне
понятна (Kadono, Schneider, 1986).
Специальных исследований качества образующейся пыльцы и зародышевых
мешков у различных типов Тгара не проводилось. Однако у ряда видов (Т.
astrachanica, Т. manshurica) обнаружено большое число аномалий в развитии
458
Системы репродукции
пыльцевых зерен и зародышевых мешков (см. ниже), которые могут приводить к
изменению их нормального соотношения, и соответственно, снижению реальной
семенной продуктивности.
Специфика прохождения эмбриональных процессов. Эмбриологическая
характеристика различных видов и форм водноореховых достаточно однотипна
(Gibelli, Ferrero, 1891,1895; Ram, 1956; Davis, 1966; Corner, 1976; Trela-Sawicka,
1978; Поддубная-Арнольди, 1982; Батыгина, Колесова, 1985; Гревцова и др.,
1987 а,б; Титова, 1988,1997 а, 2000; Колесова, 1996; Titova et al., 1997;
Захарова, 1998). Пыльники — четырехгнездные, зрелые пыльцевые зерна двухклеточ-
ные. Семязачаток — анатропный, крассинуцеллятный, битегмальный, археспорий
чаще одноклеточный, тетрады или триады мегаспор, как правило, линейные,
реже — изобилатеральные и Т-образные. Зародышевый мешок —
модифицированного Polygonum-типа, оплодотворение порогамное, эндосперм представлен
единственной клеткой с рано дегенерирующим гипертрофированным ядром.
Эмбриогенез Solanad-(T. bispinosa) или Onagrad-(T. astrachanica, Т. manshurica)
типа. Некоторые различия в характере эмбриональных процессов обнаружены на
популяционном и видовом уровнях.
Существенное влияние на уровень реальной семенной продуктивности водно-
ореховых могут оказывать различные аномалии в развитии эмбриональных
структур, такие как: образование тетрад аномального строения (Т. bispinosa —
Ram, 1956), высокий процент нарушений мейоза в микро- и мегаспороцитах и
формирования пыльцевых зерен и зародышевых мешков, что приводило к
образованию большого числа стерильных пыльцы и семязачатков (Т. astrachanica —
Титова, 1988; Т. manshurica — Титова, Захарова, ориг. данные). Отмечены
также существенные нарушения во внешней морфологии пыльцевых зерен
(характере борозд и гребней, числе апертур и др. — Т. astrachanica, Т. natans — Титова,
1988; Т. conocarpa, T. szaferi — Piorecki, 1980). Причинами таких нарушений
могут быть высокий уровень загрязненности водоемов, интрогрессивная
гибридизация между различными видами и др.
У некоторых видов и их отдельных популяций наблюдается тенденция к
образованию в семязачатке так называемых дублирующих структур (см. Батыгина,
1994). Так, у Т. bispinosa (Ram, 1956), Т. europaea, T. conocarpa (Гревцова и др.,
1987 б) и Т. astrachanica (Титова, 1988) отмечено спорадическое образование
множественного археспория и дополнительных зародышевых мешков. У
Т. manshurica (о-в Путятин, Дальний Восток) этот признак является достаточно
стабильным (Титова, Захарова, ориг. данные), при этом часть клеток археспория
развивается в мегаспороциты, которые вступают в мейоз и затем образуют
дополнительные зародышевые мешки, в которых иногда может происходить
оплодотворение и развитие нескольких зародышей в одном семязачатке (полиэмбрио-
ния). У Т. natans (оз. Ворохобы, Псковская обл.) типичным является
образование гомополярных тетрад мегаспор и потенция к одновременному развитию
нескольких мегаспор. Однако, это практически не оказывало влияния на уровень
реальной семенной продуктивности в данной популяции, так как такие мегаспоры
прекращали свое развитие на ранних стадиях и, как правило, не развивались в
дополнительные зародышевые мешки, способные к оплодотворению. Отмеченная
особенность развития, по-видимому, связана со становлением микропилярного
пути транспорта метаболитов в семязачатке Тгара и, соответственно, зародыше-
Эмбриологические основы репродуктивных стратегий
459
вого мешка Oenothera-типа в линии эволюции Lythraceae-Trapaceae-Onagraceae
(Titova et al., 1997).
Диссеминация. При созревании плода на его границе с плодоножкой
образуется отделительный слой, плод падает на илистое дно водоема, где происходит
разрушение наружного околоплодника, и впадает в состояние покоя, длящееся в
умеренных широтах до весны. Иногда, как это отмечено для Канского округа
Сибири, наблюдается дозревание плодов на дне водоема, поскольку орехи
формируются здесь поздно осенью, когда озера покрываются льдом (Васильев, 1947). У
некоторых видов Тгара отделение плода происходит вместе с плодоножкой; в
этом случае благодаря пузыревидным вздутиям на последней плоды плавают на
поверхности воды и могут распространяться течением на значительные
расстояния (Федченко, 1925; Русанов, 1957; Мурдахаев, 1975 и др.).
Вопрос о способах диссеминации водноореховых окончательно не решен.
Одни авторы полагают, что для них характерна гидрохория (Танфильев, 1890).
Другие считают, что диссеминация осуществляется путем зоохории, при этом в
качестве агентов распространения плодов рассматривают крупных рыб
(Ascherson, 1884), птиц (Nathorst, 1884) и мелких животных (Васильев, 1960;
Сенянинова-Корчагина, 1961). По мнению Цвелева (1964), такая особенность
строения плода водяного ореха как наличие зазубренных гарпунчиков на концах
его рогов, является приспособлением к распространению с помощью крупных
животных (зубров, лосей, буйволов), исчезновение которых в умеренной части
Евразии явилось основной причиной вымирания видов Тгара в этой зоне.
Прорастание. Водяной орех относится к группе рекальцитрантов: при
температуре хранения ниже 8-10°С и высыхании плоды быстро (в среднем через
10-12дней) теряют всхожесть (Мурзаев, 1935; Троицкий, 1947; Михайлова, 1940;
Agarwal, Mohan Ram, 1995). Однако имеются сведения о способности его плодов к
прорастанию, хотя и очень медленному (за 4 года — 61%), после их сухого
хранения в течение 6 месяцев (Седельников, 1907; Николаева и др., 1985).
Необходимым условием для прорастания являются скарификация, холодная стратификация
(Kinzel, 1913; Николаева и др., 1985), а также температура не ниже 12°С
(Троицкий, 1947; Васильев, 1960; Михайлова, 1940).
Согласно данным, полученным в основном в лабораторных условиях, водноорехо-
вые характерзуются довольно высокой всхожестью плодов. Так, лабораторная
всхожесть плодов Т. astrachanica (из Астрах. Гос. Зап-ка), хранившихся во влажных
условиях в течение 7 месяцев, составляла 75-90%, иногда — 100%, в зависимости от
года (Михайлова, 1940), Т. natans (из Псковской обл.) — 54-78% (Титова, ориг.
данные). При этом большая часть плодов прорастала в течение 10-12 дней, что
свидетельствует о высокой энергии их прорастания. Возможно, последнее является
компенсацией относительно низкого уровня реальной семенной продуктивности у
водноореховых. Характерно, что определенный процент плодов (например, 2-3% у Т.
natans с оз. Ворохобы) никогда не прорастает в первый год после диссеминации, хотя
их способность к прорастанию сохраняется и реализуется в течение последующих
нескольких лет (Fisher-Sigwart, 1901; Васильев, 1960; Сорокин, 1988; Титова,
Батыгина, 1997). Такая особенность плодов Тгара, свойственная и многим другим видам
цветковых, играет важную роль в создании банка жизнеспособных семян в почве и
для переживания растениями неблагоприятных условий. Для водяного ореха,
являющегося однолетним растением и размножающегося преимущественно с помощью се-
б пч
Рис. 26. Адаптивные возможности и репродуктивная стратегия
водноореховых.
1-2 — образование боковых побегов в пазухах семядолей проростка (1) и листьев взрослого
растения Тгара (2);
Рис. 26 (продолжение).
3-4 — внешний вид односемянного плода (без наружного околоплодника) (3) и семени (4);
5 — строение плода на продольном разрезе в плоскости верхних (5а) и нижних (5б) рогов (схемат.);
6 — двугнездная завязь Т. astrachanica с одним семязачатком в каждом гнезде; 7-8 — образование
двух проростков из одного двусемянного плода у Т. longicarpa;
Рис. 26 (продолжение).
9-16 — стадии цветения (I-IV) и механизм движения частей периантия и пыльников относительно поверхности
рыльца в цветке T.natans, способствующий автогамии: I — выход цветка («сомкнутого бутона») на поверхность
воды и раскрытие долей чашечки (9), пыльники не вскрыты и расположены ниже уровня головчатого рыльца, нижняя
часть которого находится в контакте с верхушками одного из них за счет характерного изгиба столбика (13-14),
железистая поверхность рыльца уже восприимчива к пыльце; II — начало раскрытия лепестков цветка («рыхлый бутон»)
(10), выпрямление столбика, одновременный рост тычиночных нитей в длину и начало вскрывания пыльников,
которые скользят щелью по поверхности рыльца (15); III - полное раскрытие лепестков (И), пыльники располагаются
выше уровня рыльца и сохраняют контакт с ним (16) или несколько отходят от него в стороны; IV — увядание и
погружение цветка в воду за счет изгиба цветоножки вниз (12), лепестки прижимают тычинки к рыльцу, которое
постепенно утрачивает способность к восприятию пыльцы; 17 — одновременное раскрытие двух цветков на одной розетке
T.natans (стадия "рыхлого бутона"), обусловливающее возможность ксеногамии;
Рис. 26 (продолжение).
18-20 — строение околопестичного диска T.natans: 18а — общий вид пестика с головчатым
рыльцем, характерным изгибом столбика и околопестичным диском в основании, 18б — часть
околопестичного диска с выростами, на концах которых находятся гидатоды, 18в — вырост с гидатодой
(увел.); 19-20 — клетки околопестичного диска, содержащие крахмал до оплодотворения (19),
после оплодотворения он исчезает (20);
21
22
Рис. 26 (продолжение).
21-22 - микроспорогенез (21а-д), микрогаметофитогеиез (21е-ж), мегаспорогенез (22а-д),
развитие зародышевого мешка (22е-м), эндосперма и зародыша (22н-с) у представителей рода Тгара в
норме (схемат.);
Рис. 26 (продолжение).
23-28 — внешний вид нормального (23) и аномальных (24-28) пыльцевых зерен Т. natans;
Рис. 26 (продолжение).
29-38 — аномалии микроспорогенеза и развития пыльцевого зерна у Т. astrachanica: неравномерное
расхождение хромосом в мейозе I (29), образование многополюсных веретен деления в мейозе I
(30) и микроядер (31,33), дегенерация одной из микроспор тетрады (32), формирование трехкле-
точных пыльцевых зерен со спермиями нормального (34) и аномального (с фрагментированными
ядрами — 35, 36) строения, преждевременное прорастание пыльцы в пыльниках (37,38);
Рис. 26 (продолжение).
39-42 — аномалии мегаспорогенеза и развития зародышевого мешка у Т. astrachanica: 39 —
неравномерное расхождение хромосом в ходе первого митотического деления в халазальной мегаспоре,
40 — формирование 4-клеточного 7-ядерного зародышевого мешка, 41-42 — 4-ядерные
зародышевые мешки с ядрами аномального строения;
Рис. 26 (продолжение).
43-45 — образование дублирующих структур в семязачатке: множественный археспорий у Т. manshurica (43),
гомополярные тетрады мегаспор у Т. natans (44, 45); 46 - полиэмбриония у Т. manshurica, 13-16 —
стереоскопическая микроскопия, 18а-в, 23-38 - СЭМ, 19-20, 45,46 - СМ (19-20 - ШИК -реакция). Масштабная
линейка; 18а - 1000 мкм, 18б - 100 мкм, 18в, 23-27а,28а - 10 мкм, 27б,28б - 1 мкм; б пч - боковая почечка,
вчп — вегетативная часть побега, гк — гипокотиль, г пч — главная почечка, гчп — генеративная часть побега,
л — микропиле, пзк — придаточные зародышевые корни, сд — семядоля, с к — семенная кожура, ч о —
чешуевидный орган (редуцированная семядоля), ч сд — черешок семядоли, эк+мз — экзокарп и мезокарп
(наружный околоплодник), эн — эндокарп (внутренний околоплодник).
1,6 - по; Колесова (Титова), 1996; 2 - по Miiencher, 1944 с измен.; 3 - по: Jankovic, Bla encic, 1973;
4-5 - по: Gibelli, Ferrero, 1891; 7-8 - no: JankoviJ, Bla encic, 1961; 9-18, 21-28 - по: Титова, Батыгина, 1997;
19-20, 43,46 - Титова, Захарова, ориг.; 29-42, 52 - по: Титова, 1988; 44-45 - по: Titova et al., 1997.
Эмбриологические основы репродуктивных стратегий
469
мян, она имеет особое значение, так как обеспечивает возобновление популяции в
случаях катастрофических нарушений созревания семян под воздействием крайне
неблагоприятных факторов. К числу последних, наиболее губительных для этого
вида, относятся: массовое уничтожение плодов человеком, животными, птицами,
низкие температуры вегетационного периода, препятствующие их своевременному
созреванию, сильные летние паводки и др.
Прорастание условно можно отнести к гипогеальному типу, хотя при этом в
семени остается лишь одна, большая семядоля; другая, рудиментарная, выходит
вместе с гипокотилем и почечкой наружу и защищает последнюю при прохождении
сквозь толщу ила (Raimann, 1893; Gibelli, Buscaglioni, 1894; Nakano, 1913; Gams,
1925; Михайлова, 1940; Титова, 1996 и др.). Эволюционное становление столь
необычного способа прорастания и тесно связанных с ним особого типа невскрываю-
щегося плода и ложной односемядольности зародыша, несомненно, является
следствием адаптации этого растения к условиям водного образа жизни.
Таким образом, для водноореховых характерна способность как к семенному,
так и вегетативному размножению. Семенное размножение, по-видимому,
является основным и может осуществляться посредством гамоспермии (большинство
видов) и агамоспермии (отдельные виды) (см. Воспроизведение, размножение
и возобновление; Апомиксис). Вегетативное размножение (сенильная и
травматическая партикуляция) более свойственно видам, произрастающим в теплых
южных широтах. Удивительная пластичность организации вегетативной и
генеративной сферы водяного ореха (образование многолетних и однолетних, водных и
наземных форм, различия в суточной ритмике цветения, формирование
дублирующих структур и разнообразие способов размножения) обеспечили высокую
надежность их систем репродукции. Это дало водноореховым возможность легко
приспосабливаться к самым различным условиям обитания и сохраниться до
наших дней. Рис. 26.
Батыгина, Колесова, 1985; Белавская, Серафимович, 1977; Васильев, 1960; Вуколов, 1932; Гревцо-
ва и др., 1987 а,б; Дубына, 1982; Захарова, 1998; Картина, Трофимов, 1951; Колесова (Титова),
1996; Мартыненко, Каим, 1977; Михайлова, 1940; Мурдахаев, 1975; Русанов, 1957; Самарина и
др., 1988; Седельников, 1907; Сенянинова-Корчагина, 1961; Смирнова-Гараева, 1972; Сорокин,
1988; Танфильев, 1890; Титова, 1988, 1997 а, 2000; Титова, Батыгина, 1997; Троицкий,1947;
Флеров, 1925, 1926; Цвелев, 1964; Черная, 1988; Чернов, 1939; Шилов, Михайлова, 1970;
Agarwal, Mohan Ram, 1995; Cook, 1987; Fisher-Sigwart, 1901; Fu Ka-shui, 1954; Gams, 1925; Gibelli,
Buscaglioni, 1893, 1894; Gibelli, Ferrero, 1891, 1895; Jankowic, Blacencic, 1961, 1965-66, 1973;
Kadono, Schneider, 1986; Ohtaki, Joshido, 1980; Piorecki, 1980; Ram, 1956; Selling, 1940; Staszkiewicz,
Wojcicki, 1979; Titova et al., 1997; Trela-Sawicka, 1978; Wenner, 1939, 1940.
РЕПРОДУКТИВНАЯ СТРАТЕГИЯ РОГОЛИСТНИКОВЫХ
(CERATOPHYLLACEAE)
Представители монотипного сем. Ceratophyllaceae являются водными
растениями, полностью погруженными в воду (гидатофиты, по Уранову, 1974). Они
встречаются в пресных водоемах всего земного шара и обычно растут в неглубоких
старицах или вдоль берегов мелких прудов и озер, образуя сообщества вместе с
Butomus umbellatus, Myriophyllum spicatum, Phragmites australis, Potamogeton
470
Системы репродукции
Z2
pectinatus, Sagittaria sagittifolia, Typha angustifolia (Дубина и др., 1985).
Наибольшее распространение имеет Ceratophyllum demersum — растение-космополит.
Виды семейства Ceratophyllaceae являются важнейшими компонентами водных
биоценозов (Каден, 1953а; Гаевская, 1966), одним из биологических средств,
препятствующих зарастанию водоемов (Коган, Чиннова, 1972), способны
накапливать радионуклиды (Чеботина, Любимова, 1981), а также могут служить
индикаторами постгляциальных отложений и вторых припойменных террас (Зоз, 1931).
Роголистниковые характеризуются рядом особенностей репродуктивной
биологии. Это многолетние однодомные травы без корней, закрепляющиеся в донном
субстрате с помощью нижних мутовок листьев («своеобразных ризоидов»). У них
раздельнополые цветки, членистые стебли и мутовчатые листья, разделенные на
линейные доли, при этом устьица отсутствуют, а ксилема редуцирована.
Размножаются роголистники как семенами, так и вегетативно.
В связи с высокой специализацией, обусловленной водным образом жизни,
и практической значимостью этих растений большой интерес представляет
изучение их репродуктивной стратегии, и, в первую очередь, экологии опыления,
плодоношения, прорастания семян и соотношения разных типов размножения в
жизненном цикле.
Несмотря на то, что виды Ceratophyllum имеют довольно обширные ареалы,
цветут и плодоносят они лишь в отдельных экотопах1. Большинство
исследователей объясняют крайне редкое цветение и плодоношение этих растений
требовательностью к высокой температуре (АгЬег, 1920; Muenscher, 1940; Каден,
19536; Wood, 1959). Кроме того, цветение наблюдается лишь у растений,
произрастающих в стоячей воде (Muenscher, 1940) и закрепленных в донном субстрате
(Meissner, 1954).
Семенное размножение. Процесс размножения растений связан с
энергетическими затратами на репродукцию, необходимыми для производства диаспор
(плодов, семян, проростков) (см. Репродуктивное усилие; Репродуктивный успех).
У изученных видов роголистника число мужских и женских цветков на растении в
период цветения обычно одинаково: 10-12 в начале цветения и 25-30 в период
массового цветения. В мужском цветке формируется обычно 15 сидячих тычинок
(Шамров, 1981; Wilmot-Dear, 1985). В завязи развивается один ортотропный,
крассинуцеллятный и унитегмальный семязачаток (Батыгина и др., 1982;
Шамров, 19976). Зрелый плод — односемянный орешек. Основную часть семени
занимает крупный, хорошо дифференцированный зародыш с зеленой почечкой (см.
Хлорофиллоносность зародыша как признак для классификации цветковых
растений, Т. 2), состоящей из 12-14 мутовок зачатков листьев. Число и форма
последних в каждом узле почечки являются таксоноспецифическими (Шамров,
1982; Les, 1985; Шамров, Батыгина, 1988). Эндосперм и интегумент
представлены в виде пленки. Защитную функцию семени выполняют толстостенные клетки
эпидермиса нуцеллуса (на микропилярном полюсе имеется эпистаза) и
сохраняющиеся слои клеток халазы, подиума и гипостазы (Шамров, 19976). Хотя
потенциальная семенная продуктивность высокая, число зрелых плодов на одном растении
невелико и варьирует в зависимости от условий произрастания. Так, оно составляет
4-5 у Ceratophyllum pentacanthum (Ленинградская обл. — пруды Павловского
парка) и С. demersum (Харьковская обл. — старица р. Уды, около пос. Песочин),
Экотоп (греч. oikos — дом и topos — место) — местообитание (Миркин и др., 1989).
Эмбриологические основы репродуктивных стратегий
471
5-6 — у С. submersum и 13-17 — у С. demersum и С. pentacanthum (Воронежская
обл. — Хоперский заповедник).
Недостаточная завязываемость семян может быть обусловлена рядом причин.
Одна из них — наличие стерильных пыльцевых зерен (20% у С. pentacanthum и
15% — у С. submersum), при этом среди них отмечены крупные аномальные,
похожие по строению на зародышевые мешки (иногда до 30-35% у С. pentacanthum)
(Шамров, 1983а).
Другой причиной является несовершенный способ переноса пыльцы. Для
видов Ceratophyllum характерно самоопыление, причем преимущественно в пределах
моноклональных популяций, что подтверждается низким уровнем генетического
разнообразия, гетерозиготности и способности к внутри- и межвидовым
скрещиваниям (Les, 1991). В пыльнике к моменту опыления формируются воздушные
полости. Тычинки со зрелой пыльцой отрываются от цветоложа цветка и всплывают
на поверхность воды. В таком взвешенном состоянии они находятся от 6 до 24 час,
после чего пыльники вскрываются. Места вскрывания всегда обращены вглубь
воды. Поскольку в стенке пыльника фиброзные утолщения отсутствуют, вскрыва-
ние осуществляется, по-видимому, за счет разности в натяжении между сухой
верхней и влажной нижней поверхностями тычинки. Высвободившаяся пыльца
попадает непосредственно в воду, медленно опускается на рыльце, имеющее вид
желобка, и затем попадает в канал столбика (Шамров, 1983б; Wilmot- Dear, 1985;
Endress, 1994). Следует отметить, что поверхность рыльца, за исключением
апикальной зоны, способна воспринимать пыльцу, начиная со стадии двуядерного
зародышевого мешка до первых стадий эмбриогенеза. В том случае, когда на стебле
находятся несколько женских цветков, готовых к опылению, они располагаются
относительно друг друга в разных плоскостях, тем самым, увеличивая вероятность
опыления (Шамров, 1983а).
На опыление влияет также и специфика конкретного экотопа — скорость
течения воды в момент вскрывания пыльников и густота произрастания трав.
Опылению способствуют стоячая вода и скученность растений в данном месте
обитания. Таким образом, отсутствие строгих опылителей и
нецеленаправленный перенос пыльцы водой на рыльца, «несовершенство» аппарата,
воспринимающего пыльцу, в совокупности с отмеченными особенностями в развитии
пыльника приводят к тому, что часть женских цветков оказывается неопылен-
ной и постепенно дегенерирует.
Факт редкого плодоношения может быть связан и с отсутствием оптимальных
условий для прорастания пыльцы. В эксперименте пыльцевые зерна почти не
прорастали при температуре 18°С и пыльцевые трубки начинали формироваться
только при 22-25°С (Шамров, 1983а).
Экологические факторы обусловливают также различие в числе плодов между
видами и отдельными популяциями. В Хоперском заповеднике, где роголистники
образуют довольно большие скопления и закреплены, как правило, в донном субстрате,
для их мест обитания во время цветения характерны стоячая вода с температурой
22°С и достаточная освещенность в течение дня. Экотопы С. pentacanthum в
Ленинградской и С. demersum в Харьковской областях с более растянутым периодом
цветения характеризуются меньшей освещенностью и прогреваемостью воды к моменту
цветения. Разные виды, по-видимому, требуют различных оптимальных условий для
цветения и опыления. Так, в прудах Павловского парка (Ленинградская обл.) растет
472
Системы репродукции
С. demersum, у которого цветение и плодоношение не наблюдается. Однако эти же
условия обитания позволяют цвести и плодоносить С. pentacanthum.
Главным и конечным индикатором репродуктивного успеха на уровне популяций
является численность проростков и их закрепление в ценозе (Злобин, 1989). У
роголистниковых развитие проростков в природе трудно обнаружить в связи с тем,
что прорастание происходит на дне водоема в толще ила (Strasburger, 1902; Arber,
1920; Muenscher, 1940; Каден, 19536; Seghal, Mohan Ram, 1981). Следует учесть
и тот факт, что плоды, как и вегетативные части растений, используются в качестве
корма водоплавающими птицами, рыбами и некоторыми моллюсками. В связи с
этим до стадии проростков, по-видимому, доходит лишь незначительное
количество формирующихся семян.
В экспериментальных условиях основная масса семян прорастает через 3-4 месяца
после созревания. Зрелые плоды отрываются от материнского растения и падают на
дно. Шипы на поверхности плодов позволяют им закрепляться как якорем в илистом
субстрате. Прорастание гипогеальное и начинается с расщепления плода по
брюшному шву на две половинки. Зародыш выходит через щель наружу своим нижним
концом (зародышевый корень слабо дифференцирован, имеется гипокотиль-корневая
ось). Затем появляются семядоли и почечка. Верхушки семядолей долго остаются
внутри плода. После их окончательного выхода наружу проросток способен
закрепляться в субстрате с помощью семядолей, верхушки которых крючкообразно загнуты в
стороны. Хорошо сформированный зеленый проросток роголистниковых уже с первых
этапов способен к дальнейшему самостоятельному развитию.
Вегетативное размножение. В местообитаниях, где условия для цветения и
опыления неблагоприятные (быстрое течение воды, большая глубина,
недостаточная прогреваемость водоемов), роголистниковые размножаются только
вегетативно. В этом случае, образуется мало цветков или они вообще не формируются, а
на стебле имеется много вегетативных почек. Вегетативное размножение
осуществляется посредством образования неспециализированных органов — «гибернакул»
(см. Почка; Партикуляция). При этом стебель «дробится» на кусочки с 1-2
мутовками листьев, , в пазухах которых находятся одна или несколько вегетативных
почек (Seghal, Mohan Ram, 1981). Такие части стеблей перезимовывают и дают на
следующий год новые растения.
Роголистниковые могут возобновляться, сочетая семенное и вегетативное
размножение. Так, в экотопах Харьковской области (С. tanaiticum — Виленский,
Лавренко, 1926; Зоз, 1931; Цвелев, гербарные сборы, 1966 и С. pentacanthum —
Шамров, 1980) наблюдается плодоношение, сопровождающееся образованием
гибернакул. Эти особенности биологии размножения роголистниковых позволяют
им пережить неблагоприятное время под коркой из подсохших растений и ила,
образующейся вследствие пересыхания водоема.
Таким образом, репродуктивная стратегия роголистниковых включает
реализацию двух путей развития:
1 — сочетание полового и бесполого (гемморизогенного) способов
репродукции и, соответственно, семенного и вегетативного типов размножения;
2 — только бесполый (гемморизогенный) способ репродукции и вегетативный
тип размножения.
Выбор той иной системы репродукции в зависимости от экологических
факторов (освещенность, температура воды к моменту цветения, скорость ее течения и
•а ==
а =? а
с
<3
Typh
Е
оо
<3
у»-
1
Sagi
3
Е
Bute
mogc
Pota
ophi
Cera
£
l
rma
q;
•g
и
Q.
q;
s-
■c
а
5
Рис. 27. Репродуктивная стратегия роголистниковых.
1 — эколого-ценотический профиль водной растительности, включающей виды Ceratophyllum;
2-5 — внешний вид растений С. tanaiticum (2) и С. demersum (5; 3, 4 — отдельные листья);
0,2 мм
1 '
Рис. 27 (продолжение).
6 — поперечный срез мужского цветка С. demersum; 7, 8 — общий вид тычинки (7) и строение
пыльника перед вскрыванием (8) у С. pentacanthum;
Рис. 27 (продолжение).
9-11 — строение плодолистика в период формирования и созревания зародышевого мешка у
С. pentacanthum; 12 — строение рыльца и столбика у С. demersum (а-е — последовательные
поперечные срезы);
Рис. 27 (продолжение).
13-18 — прорастание пыльцы и рост пыльцевых трубок на искусственной питательной среде у
С. pentacanthum; 19-23 — аномальные пыльцевые зерна (19 — 22) и вхождение пыльцевой трубки
в семязачаток у С. pentacanthum (23); 24 — двойное оплодотворение у С. submersum;
Рис. 27 (продолжение).
25-28 — внешний вид плодов у С. demersum (25), С. submersum (26), С. tanaiticum (27),
С. pentacanthum (28); 29 — продольный срез плода С. demersum;
Рис. 27 (продолжение).
30, 31 - женский (30) и мужской (31) цветки у С. demersum; 32, 33 - проростки С. demersum (32)
и С. submersum (33); г — гипостаза, зм — зародышевый мешок, и — интегумент, к — канал, н — ну-
целлус, пп — проводящий пучок, пч — почечка, р — рыльце, сд — семядоли, х — халаза, энд —
эндосперм.
1,2- по: Дубина и др., 1985; 3-5 - по: Wilmot-Dear, 1985; 6, 28, 32, 33 - по: Шамров, 1982;
7 - по: Шамров, 1981; 8-24 - по: Шамров, 1983а; 25-27, 29 - по: Шамров, Батыгина, 1988; 30,
31 - по: Шамров, 1980.
Эмбриологические основы репродуктивных стратегий
479
др.) и механизмов популяционно-ценотического регулирования позволяет
поддерживать состояние популяций роголистника на относительно устойчивом уровне.
Рис. 27.
Батыгина и др., 1982; Виленский, Лавренко, 1926; Гаевская, 1966; Дубина и др., 1985; Злобин,
1989; Зоз, 1931; Каден, 1953а, б; Коган, Чиннова, 1972; Уранов, 1974; Чеботина, Любимова,
1981; Шамров, 1980, 1981, 1982, 1983а, б, 19976; Шамров, Батыгина, 1988; АгЬег, 1920;
Endress, 1994; Les, 1985, 1991; Meissner, 1954; Muenscher, 1940; Seghal, Mohan Ram, 1981;
Strasburger, 1902; Wilmot-Dear, 1985; Wood, 1959.
РЕПРОДУКТИВНАЯ СТРАТЕГИЯ ЛОТОСОВЫХ (NELUMBONACEAE)
Монотипное семейство Nelumbonaceae представлено двумя очень близкими
видами: Nelumbo nucifera Gaertn. (лотос орехоносный) и N. lutea Willd. (лотос
желтый). Это очень древние растения, в ископаемом состоянии известные из
верхнемеловых отложений (в Гренландии, Южной Франции), миоцена в
Европе, третичных отложений Северной Америки (Чугунова-Сахарова, 1924; Сни-
гиревская, 1964).
В настоящее время лотос распространен главным образом в тропических и
субтропических областях Центральной и Северной Америки (N. lutea), Южной и
Юго-восточной Азии (N. nucifera), встречается также в умеренных широтах—в
Дельте Волги, Закавказье, на Дальнем Востоке (N. nucifera), в долине реки Тен-
неси (N. lutea). Местообитание приурочено к мелководным заливам взморья,
прибрежным полосам рек и небольшим озерцам, где он обычно растет совместно с
другими гидромакрофитами — Ceratophyllum, Trapa, Potamogeton, Butomus, Lemna и
др. (Палибин, 1904; Комаров, 1926; Sohmer, Sefton, 1978). Растения лотоса могут
произрастать в условиях различного гидрологического режима (при слабом и
сильном течении воды, на разной глубине — 0,5-2,2 м и т.д.).
Характер местообитания свидетельствует о высокой требовательности лотоса к
кислороду, питательным веществам, NaCl (Чугунова-Сахарова, 1924). Значение
этих факторов было подтверждено экспериментально, как и способность растений
выносить значительные колебания рН — от 4,5 до 9,0 (Meyer, 1930). Наблюдения
за поведением различных форм N. nucifera в экологических условиях,
отличающихся значением рН почвы, уровнем воды, освещенности и температурой,
позволили выделить три экотипа этого вида: глубоководный, мелководный и
оранжерейный (бассейновый) (Zhao Jiarong, 1985).
Лотосовые имеют большое практическое значение. С давних пор они служат
украшением естественных и искусственных водоемов, их разводят почти во всех
ботанических садах. Как пищевое и лекарственное растение лотос используется
в основном в странах Востока (Индия, Китай). Недавно выведены сорта N.
nucifera, перспективные для использования при очистке сточных вод (Sun
Xiangning et al., 1987; Tang Pei-hua et al., 1990). Вместе с другими водными
растениями и микроорганизмами они способны удалять из обрабатываемых вод
более 70% различных поллютантов (тяжелые металлы, органические
компоненты загрязнения).
Наряду с широким культивированием и использованием лотоса, в некоторых
случаях применяют методы контроля и ограничения роста растений (обрезка ли-
480
Системы репродукции
стьев, обработка гербицидами) (Hall, Penfound, 1944). Это связано с тем, что в
местах произрастания лотоса создаются благоприятные условия для развития
малярийных москитов.
Сочетание ценных свойств лотоса для научных, практических и
образовательных целей подчеркивает необходимость охраны и искусственного разведения
этого редкого растения как памятника природы (в нашей стране лотос занесен в
Красную книгу).
Представители лотосовых—крупные многолетние земноводные травы
(гидрофиты, по Уранову, 1974) с длинным корневищем, в узлах которого закладываются
листья, цветки и адвентивные корни. Корни вместе с сильно ветвящимся
корневищем удерживают растение в донном субстрате. Различают два типа корневищ:
тонкие (6-8 мм), располагающиеся в верхних слоях почвы, и толстые (8-20 мм) — в
более глубоких слоях; корневище образует сложную подземную сеть, общей
длиной до 72 км на площади 0,4 га (N. lutea — Hall, Penfound, 1944). Листья также
двух типов: подводные, чешуевидные (катафиллы) и надводные—плавающие и
воздушные, щитовидные. Nelumbo обладает уникальным типом филлотаксиса:
вдоль корневища располагаются триады листовых структур—два катафилла,
которые лишены зеленой окраски, и один щитовидный лист (Esau, Kosakai, 1975).
Листья обладают признаками ксероморфности (толстая кутикула, восковой налет,
шипики на черешке) и одновременно признаками гидрофитов (обилие
воздухоносных полостей во всех органах) (Снигиревская, 1964; Chen Wei-Pei, Zhang Simei,
1988). Цветки крупные, одиночные, обоеполые, с сильно разросшимся
цветоложем, на длинной цветоножке, покрытой мелкими шипами. В клубнях, корневище и
семенах содержится в изобилии крахмал.
Выделяют три фазы развития растения лотоса: проросток, ювенильный побег и
«ежегодный побег» (= генеративный побег) (Wang Hsi-Ching, 1956).
Семенное размножение. Плод лотосовых—погруженный многоорешек
(Снигиревская, 1964; Тахтаджян, 1966; Левина, 1967). В его образовании
принимает участие расширенное обратноконическое цветоложе. Отдельные плодики —
одревесневшие односемянные нераскрывающиеся орешки. Их число в плоде
колеблется от 8 до 25-30 у N. nudfera (Снигиревская, 1964; Collinson, 1980; Титова,
1988; Vasilyeva, 1990) и от 12 до 25 у N. lutea (Pearl, 1906; Hall, Penfound, 1944).
Плодики имеют очень твердый, каменистый перикарпий, состоящий из экзо-, мезо-
и эндокарпия (Wettstein, 1888; Wigand, Dennert, 1888; Ohga, 1923, 1926-1927;
Fenton, 1929; Снигиревская, 1964; Колесова (Титова), Батыгина, 1988).
Семя — овальное, плотно облекаемое перикарпием; семенная кожура имеет
вид сухой тонкой пленки коричневого цвета, включающей спрессованные
остатки обоих интегументов. Остатки эндосперма также в виде тонкой сухой
пленки, облегающей почечку зародыша. Зародыш крупный, удлиненной
формы, занимает почти всю полость семени, дифференцирован на 2 массивные
«семядоли», почечку зеленого цвета, короткий гипокотиль и сильно
редуцированный главный зародышевый корень. В апексе зародышевого корня имеется
общий образовательный центр, дерматоген отсутствует, граница между
периблемой и чехликом неотчетлива. В ходе эмбриогенеза он обрастает
складками базальной части тела зародыша (своеобразная колеориза), последний при
прорастании не развивается и заменяется системой адвентивных корней,
закладывающихся в основании черешков листьев почечки.
Эмбриологические основы репродуктивных стратегий
481
Морфологическая природа ряда структур и органов зародыша и проростка
Nelumbo дискуссионна. Зародыш Nelumbo интерпретируется как двусемядольный
(Schaffner, 1904; Gupta, Ahuja, 1967, 1969; Ito, 1982; Батыгина и др., 1983; Yan
Su-zhen, 1986; Лодкина, 1988; Снигиревская, 1993), либо как односемядольный
(Lyon, 1901, 1905; York, 1904; Haines, Lye, 1975; Титова, 1988; Titova, Batygina,
1996). При этом два массивных органа, называемых семядолями, рассматривались
как: лопасти единственной семядоли (Lyon, 1901,1905), истинные семядоли,
срастающиеся однако в своем основании (Haines, Lye, 1975; Titova, Batygina, 1996)
или закладывающиеся неодновременно, в соответствии с очередным
расположением (Лодкина, 1988). Согласно Lyon (1901) и Titova, Batygina (1996), по способу
заложения семядолей зародыш Nelumbo является односемядольным, поскольку
при этом в нем происходит формирование единственного примордия,
«раздваивающегося» в процессе дальнейшего развития. Однако интерпретация авторами
такого способа заложения семядолей является прямо противоположной —
результат схизокотилии первоначально единственной семядоли (Lyon, 1901) и частичной
унимаргинальной синкотилии двух исходных семядолей (Titova, Batygina, 1996;
Titova, 1997, см. также Синкотилия, Т. 2). Оригинальная точка зрения на
морфологическую природу семядолей у Nelumbo как модификацию ланцетных филломов
предложена Снигиревской (1993 — см. ниже).
Почечка зародыша лотоса имеет необычное строение: помимо зачатков 4
очередно расположенных щитовидных листьев в ней присутствуют особые
чешуевидные органы, образующиеся при втором, третьем и четвертом
щитовидных листьях и охватывающие апекс побега (Wigand, Dennert, 1888; Lyon, 1901;
Wang et al., 1956, 1966; Снигиревская, 1964, 1993; Gupta, Ahuja, 1967;
Титова, 1988). Большинство авторов рассматривают чешуевидный орган в
зародыше Nelumbo как разновидность прилистников (Trecul, 1854 а,Ь;
Gwynne-Waughan, 1897; Lyon, 1901; Wang Hsi-ching, Jii-Bing-sheng, 1966;
Chen Wei-Pei, Zhang Si-mei, 1988; Титова, 1988) или особый тип развития
влагалищного основания листа (Gupta, Ahuja, 1967). Согласно этим авторам
чешуевидный орган формируется из адаксиальной меристемы в базальной части
листового примордия, является его производным и располагается в той же
плоскости, что и лист, т.е. в соответствии с очередным расположением. Таким
образом, он имеет то же происхождение, что и прилистники щитовидных листьев,
образующиеся на корневище. Снигиревская (1993) рассматривает природу
чешуевидного органа в почечке зародыша с точки зрения листового диморфизма и
уникального типа филлотаксиса, свойственных побегу лотоса во взрослом
состоянии, и считает его ланцетовидным листом (катафиллом). Согласно этому
автору, в отличие от настоящего щитовидного листа с лучисто-краевым
жилкованием и без широкого влагалища, чешуевидный лист характеризуется
наличием ясно выраженного влагалища и параллельным жилкованием, т.е. тип
первичного взаимного расположения на стебле проростка щитовидных, а также
ланцетных листьев и семядолей является супротивно-перекрестным. Сходство в
развитии чешуевидного листа и семядолей в зародыше (особенности
жилкования, влагалищный тип основания и др.), а также расположение их на оси в одной
плоскости, привели автора к выводу о единой морфологической природе этих
органов и интерпретации семядолей Nelumbo как модифицированных
ланцетных филломов. Очевидно, этот важный вопрос требует дальнейшего изучения.
482
Системы репродукции
Семенная продуктивность лотосовых колеблется в зависимости от вида и
места произрастания. Так, среднее число плодиков в плоде у N. nucifera в условиях
Астраханского Государственного заповедника (АГЗ) (Дельта Волги) составляет
15-17 шт. (Чугунова-Сахарова, 1924; Доброхотова, 1938; Титова, Васильева,
ориг. данные). При этом половина плодов содержали один или несколько
плодиков. За пределами АГЗ (в ильмене Тюльпан) среднее число плодиков в плоде было
несколько ниже (12 шт.). N. nucifera, произрастающий на оз. Ханка (в устье р.
Лефу, залив Малый Ханкайчик), характеризуется высоким уровнем как
потенциальной (до 49 плодолистиков на одну завязь), так и реальной (до 35 плодиков в
плоде) семенной продуктивности (Титова, ориг. данные).
Снижение реальной семенной продуктивности может быть вызвано
различными факторами — климатическими, антэкологическими, генетическими и др.
Наблюдения за развитием растений Nelumbo в разных местах произрастания
(N. nucifera в Каспийско-Волжском районе — Чугунова-Сахарова, 1924; N. lutea
в долине реки Теннеси — Hall, Penfound; 1944) показали, что на процессы
цветения и плодоношения отрицательное воздействие оказывают продолжительные
засухи, наводнения, штормовые ветры. Хотя по некоторым данным (Доброхотова,
1938), лотос хорошо переносит временное пересыхание: процент созревших орехов
был выше, чем в других местах, сократился лишь период цветения.
Одной из наиболее распространенных причин снижения завязываемости
семян у лотосовых является нарушение процесса опыления и оплодотворения
вследствие отсутствия агентов опыления, изменения нормального соотношения
пыльцы и семязачатков и т.д.
Для Nelumbo характерно преимущественно перекрестное опыление,
осуществляющееся, главным образом, с помощью насекомых; цветки обоих видов протоги-
ничны, продолжительность их цветения колеблется в зависимости от условий от 3
до 5 дней (Miyake, 1898; Чугунова-Сахарова, 1924; Доброхотова, 1938; Сниги-
ревская, 1964; Sohmer, Sefton, 1978; Schneider, Buchanan, 1980; Титова, 1988). В
первый день цветения цветки лишь слегка приоткрываются ранним утром и вновь
закрываются к полудню; пыльники не вскрыты, но рыльца способны к восприятию
пыльцы — возможно опыление пыльцой лишь других цветков (ксеногамия и гейто-
ногамия). На второй день происходит полное раскрытие цветка, вскрывание
пыльников; рыльца лишь некоторое время (только в утренние часы) сохраняют
восприимчивость к пыльце, после чего быстро засыхают. Благодаря этому самоопыление
(автогамия) возможно лишь в очень короткий период (N. pentapetala (=N. lutea) —
Schneider, Buchanan, 1890; N. nucifera — Титова, 1988). Вследствие того, что
лотос весьма активно размножается вегетативно, и большие заросли его часто
являются клоном одной особи, у этого растения, очевидно, преобладает идиогамный тип
опыления (по классификации Левиной (1981)) в форме гейтоно- и автогамии.
Эмбриональные процессы у обоих видов протекают достаточно
единообразно: пыльники четырехгнездные, зрелые пыльцевые зерна двуклеточные,
семязачаток анатропный, крассинуцеллятный, битегмальный, археспорий одноклеточный,
зародышевый мешок Polygonum-типа, эндосперм целлюлярный, эмбриогенез
Asterad-типа (Lyon, 1901, 1905; York, 1904; Khanna, 1965; Gupta, Ahuja, 1967,
1969; Gupta, Ahluwalia, 1976; Батыгина и др., 1982, 1983; Ito, 1982; Jan Su-zhen,
1986; Батыгина, Колесова, 1988; Титова, 1988; Titova, Batygina, 1996). Однако
для некоторых популяций отмечены аномалии в микро- и мегаспорогенезе, разви-
Эмбриологические основы репродуктивных стратегий
483
тии зародыша и эндосперма, приводящие к ухудшению качества пыльцы,
формированию абортивных семязачатков и неполноценных плодов. Например, у N.
nucifera, произрастающего в АГЗ, часто наблюдались дегенерация микроспороци-
тов (отдельных клеток или их тяжей) и микроспор, связанная с утратой их контакта
с поверхностью тапетума или нарушениями развития последнего, а также
образование многоядерных пыльцевых зерен и др.
В ряде случаев происходило выпадение процесса сингамии вследствие задержки
одного из спермиев в синергиде, и в результате — образование семян с эндоспермом,
но без зародыша. Характерной аномалией является нарушение в развитии
семядольного аппарата зародыша — усиление степени срастания семядолей, образование
односемядольных зародышей. Число таких аномальных зародышей составляло
примерно 4% от общего числа исследованных (Титова, 1988; Vasilyeva, 1990). По
данным Снигиревской (1993), при срастании семядолей по всей длине наблюдается
недоразвитие зеленой почечки; такой зародыш не способен к прорастанию.
В некоторых популяциях обнаружены отклонения, которые потенциально могут
оказывать влияние на повышение уровня семенной продуктивности лотосовых.
Особый интерес в этом отношении представляет тот факт, что у N. nucifera из
разных мест произрастания (Дельта Волги, Дальний Восток, Индия) обнаружено
явление нераспадения тетрад микроспор на отдельные микроспоры (Khanna, 1965;
Куприянова, 1976; Куприянова, Алешина, 1978; Kuprianova, 1979; Титова, 1988;
Батыгина и др., 1991; Titova et al., 1993). Особенно высокий процент нераспав-
шихся тетрад характерен для N. nucifera с оз. Ханка (Титова, ориг. данные).
Наличие пыльцы в тетрадах способствует повышению эффективности опыления и,
следовательно, уровня семенной продуктивности. У N. nucifera из АГЗ и оз. Ханка
тетрады микроспор преимущественно тетраэдрические, реже — изобилатеральные
и накрестлежащие, у N. nucifera из Индии отмечено преобладание тетрад изобила-
терального типа. В отличие от одиночных трехбороздных микроспор, микроспоры,
соединенные в тетрады, часто имеют лишь одну круговую борозду, расположенную
экваториально. У N. nucifera с оз. Ханка также встречаются и одиночные
пыльцевые зерна с единственной круговой или несколько иного строения бороздой. Такие
пыльцевые зерна весьма сходны по строению с однобороздными пыльцевыми
зернами нимфейных растений (Nymphaeales s.s.), возможно имеющих отдаленное
родство с лотосовыми (Тахтаджян, 1980; Снигиревская, 1993). Это может дать
ключ к пониманию механизма возникновения однобороздной пыльцы из трехбо-
роздной (см. Куприянова, 1978).
В некоторых популяциях обнаружена тенденция к образованию в
семязачатках дублирующих структур (см. Батыгина, 1994). Например, у N. nucifera из
АГЗ наряду с одноклеточным археспорием часто (около 30% изученного числа
семязачатков) встречается образование множественного археспория (до 2-3 ар-
хеспориальных клеток), однако дополнительные археспориальные клетки в
большинстве случаев развиваются только до стадии мейоза, дегенерируя, как
правило, до его начала (Титова, 1988). У N. nucifera из Индии (Khanna, 1965) и N.
lutea из Северной Америки (York, 1904) отмечено образование дополнительных
зародышевых мешков, достигающих стадии оплодотворения. В некоторых пло-
диках лотоса, произрастающего в АГЗ, обнаружены дополнительные зародыши
(эмбриоиды), расположенные между семядолями более крупного полового
зародыша (Снигиревская, ориг. данные).
484
Системы репродукции
Диссеминация и прорастание. Созревание плодов N. nucifera в условиях
Дельты Волги происходит в конце августа-сентябре. По мере созревания плодиков
цветоложе высыхает, плодоножка увядает, вследствие чего цветоложе из
вертикального положения опускается «вниз головой». В результате этого плодики
отделяются от тканей цветоложа и падают в воду. Орешки уносятся течением далеко от
мест произрастания, нередко давая начало новым зарослям. Большую роль в
качестве агентов распространения играют также кабаны и крупные птицы — гуси,
лебеди и др. (Доброхотова, 1938).
Прорастание плодиков у обоих видов Nelumbo происходит сходным образом
(Доброхотова,. 1938; Hall, Penfound, 1944; Снигиревская, 1964; Шафранов,
1968). Оно осуществляется только в том случае, если в плодиках не начался
процесс высыхания перикарпия. Последний приводит к тому, что перикарпий
становится крайне твердым и не проницаемым для света, воздуха и воды ( Ohga,
1926-1927; Fenton, 1929; Toyoda, 1958,1960). Зародыш впадает в состояние
вынужденного покоя, который может длиться чрезвычайно долго — сотни и тысячи
лет (Ohga, 1923,1926-1927; Libby, 1951; Криштофович, 1957; Янишевский,
Первухина, 1961). Так, что плоды древнего лотоса, найденные в доисторическом
торфяном пласте в Северном Китае, где они пролежали более 1000 лет, сохранили
способность к прорастанию (Ohga, 1926-1927). Причин столь длительной
жизнеспособности семян лотоса может быть несколько: особенности строения зародыша,
большой запас питательных веществ, в т.ч. низкомолекулярных белков в крупных
семядолях, хорошо развитая зеленая почечка, способная быстро тронуться в рост
при благоприятных условиях, водо- и воздухонепроницаемый твердый перикарпий.
Но главная из причин, вероятно, заключается в специфике гормонального статуса
— отсутствие в зрелых плодиках ингибитора прорастания (АБК) и цитокининов
(Morozova, Vasilyeva, 1992; Морозова, Васильева, 1993).
Плодики с невысохшим перикарпием опускаются на дно водоема, однако, уже
через несколько часов, снова всплывают на поверхность воды и разносятся ее
течением. Всплывание плодиков, по-видимому, связано с выделением ими большого
количества газов — водорода и др., которые, как установлено экспериментально,
интенсивно выделяются при прорастании (Toyoda, 1958). Выделяющиеся газы,
по-видимому, заполняют пустоты, имеющиеся внутри плодика. По данным Hall,
Penfound (1944), 90% плодиков всплывает на поверхность рыльцем вниз. Такое
положение плавающих плодиков поддерживается благодаря наличию небольшой
полости, расположенной в нижней части плодика — между семенем и плодовой
оболочкой. Этой полости также отводится важная роль в распространении
плодиков водой и обеспечении их плавучести (Ohga, 1926-1927; Hall, Penfound, 1944;
Снигиревская, 1964; Титова, 1988).
Большой интерес в этой же связи представляет функция особого органа
(структуры) в перикарпии плодика Nelumbo — так называемого «протуберанца», или
«дыхальца», расположенного в его верхней части вблизи рыльца с его внешней,
абаксиальной стороны. По мнению Ohga (1926-1927), полость этого органа
служит резервуаром для запасания кислорода воздуха, необходимого для прорастания
плода в анаэробных условиях на дне водоема. Снигиревская (1964) полагает, что
он обеспечивает также поступление воды внутрь него при прорастании,
представляя собой «бугорок в перикарпии с отверстием, ведущим в его полость». Однако
такие особенности развития как наличие многослойных эпидермиса и палисадного
Эмбриологические основы репродуктивных стратегий
485
слоя, клеточные стенки которого пропитаны суберином, плотное расположение их
клеток, отсутствие в эпидермисе устьиц (Ohga, 1926-1929; Fenton, 1929; Титова,
1988; Колесова, Батыгина, 1988), говорят скорее об изолированности полости
«дыхальца» от внешней среды и его возможной функции «поплавка»,
обеспечивающего плавучесть плодиков во время диссеминации и при прорастании
(возможность заполнения газами).
Через некоторое время после всплывания (12 час. у N. lutea — Hall, Penfound,
1944) плодики вновь опускаются на дно, где постепенно прорастают.
Прорастание гипогеальное, происходит своеобразным способом: ни
семядоли, ни гипокотиль с зародышевым корнем не выходят из покровов; наружу
появляется лишь эпикотиль через щель, образующуюся в результате
продольного разрыва плодовой оболочки (Wigand, Dennert, 1888; Турдиев, 1960;
Снигиревская, 1964; Haines, Lye, 1975; Ito, 1982). Интересно, что этот разрыв
часто происходит вблизи «дыхальца», что дает основание предполагать роль
последнего в механизме вскрывания плода при прорастании. В этой связи,
возможно, найдет свое объяснение факт образования большого количества друз
кристаллов оксалата кальция в клетках, выстилающих полость «дыхальца».
Разрыв плодовой оболочки происходит через 5-6 дней, выход эпикотиля —
через 10-12 дней. Прорастание ускоряется при высоких (20-30°С) и замедляется
при низких (ниже 15°С) температурах.
Проросток имеет прямой (ортотропный), «зигзагообразный» побег с
четырьмя плавающими щитовидными листьями (с короткими междоузлиями
между ними) и адвентивными корнями в каждом узле, закладывающимися еще в
эмбриональный период. В течение месяца на поверхность воды
последовательно выходят листья. Плодик с молодым растением вновь поднимается на
поверхность, так как становится легче за счет израсходованного крахмала в семядолях.
Молодые проростки некоторое время плавают на поверхности воды, а затем,
попадая на более мелкие места, укореняются, обеспечивая, таким образом,
распространение.
Согласно Wang Hsi-Ching (1956), переход от прорастания к ювенильному
растению очень быстрый. Междоузлие, несущее вегетативную почку, значительно
удлиняется, становится горизонтальным и формируется плагиотропное корневище.
Следующие междоузлия такие же длинные. С дорзальной стороны каждого узла
на корневище формируются листья, с вентральной — адвентивные корни. При
наступлении холодного сезона последние два или три междоузлия корневища юве-
нильного растения образуют зимующий клубень с верхушечной почкой, которая
разовьется следующей весной.
Годичное растение лотоса по своей морфологии сходно с ювенильным, за
исключением того, что его вегетативные органы крупнее, и, помимо вегетативных,
оно образует также смешанные (т.е. вегетативные и цветочные) почки.
Корневище годичного растения сильно ветвится, образуя систему побегов. Строение
корневища несет признаки, четко указывающие на приспособленность к
земноводному образу жизни (чередование узлов и междоузлий, формирование смешанных
почек и клубней). Зимующие почки годичного побега — все смешанные.
Следует отметить, что данные в отношении продолжительности фаз онтогенеза,
времени заложения смешанных почек у Nelumbo несколько противоречивы
(Meyer, 1930; Hall, Penfound, 1944; Chen Wei-Pei, Zhang Si-mei, 1989).
486
Системы репродукции
В том случае, если плодовая оболочка успеет высохнуть до попадания плодика в
воду, процесс прорастания возможен лишь при ее повреждении (экзогенный, или
физический тип покоя — Николаева и др., 1985). В искусственных условиях оно
осуществляется, как правило, посредством механической (надпиливанием ее
вдоль) или химической обработки плодиков конц. Н SO (Ohga, 1923,1926-1927;
Meyer, 1930; Hall, Penfound, 1944; Шафранов, 1958; Toyoda, 1958).
Повреждение плодовой оболочки приводит к выпадению фазы всплывания плода на
поверхность воды и ускорению процесса прорастания (до 1-2 дней). В естественных
условиях прорастает лишь очень небольшой процент плодиков, причем факторы и
агенты, осуществляющие разрушение плодовой оболочки, практически не изучены
(Hall, Penfound, 1944).
Вегетативное размножение в естественных условиях. Вследствие
упомянутых выше факторов реализация семенного размножения Nelumbo в естественных
условиях достаточно осложнена и возобновление осуществляется
преимущественно вегетативно (гемморизогения), через образование перезимовывающих
клубней (Heritage, 1895; Meyer, 1930; Доброхотова, 1938; Снигиревская, 1964).
Неблагоприятными факторами для вегетативного размножения лотоса являются те
же, что и для семенного — засухи, наводнения, сильные ветры. В частности, в
засушливые годы у N. nucifera в Каспийско-Волжском районе наблюдалось
пересыхание корневой системы, вследствие чего к осени не происходило формирование
клубней (Чугунова-Сахарова, 1924); наводнения и засухи более двух недель
вызывали гибель большей части корневищ N. lutea в долине реки Теннеси (Hall,
Penfound, 1944).
Искусственное вегетативное размножение. В оранжереях ботанических
садов лотос размножают обычно отрезком корневища с верхушечной почкой,
который берут весной, стараясь не нарушить корневую систему (Фомин, 1905;
Доброхотова, 1938). В первый год посадки клубней N. nucifera цветения, как правило, не
бывает. При культивировании N. lutea клубни обычно образуют цветущее растение
в течение одного сезона, в то время как для проростков из семян для этого
требуется 2-4 года (Meyer, 1930). Использование черенкования корневищ в горшечной и
кадочной культурах способствует увеличению периода цветения (Deng Huiqin et
al., 1990). Растения, выращенные в бассейнах, показывали нормальное развитие,
сходное с таковым в природных условиях. Характер роста и развития
эмбриональных структур, динамика растворимых углеводов в них на ранних стадиях
формирования семени, тип аномалий (семена без зародыша, но с эндоспермом, семядоля с
одной лопастью и срединным положением апекса побега и др.) оказались
сходными у растений N. nucifera, растущих в естественных условиях и в оранжерейной
культуре (Титова, 1988; Vasilyeva, 1990). Однако при культивировании в
оранжерее наблюдалась тенденция к увеличению семенной продуктивности (12-31 плодик
на одно цветоложе, по сравнению с 8-22 в естественных условиях произрастания).
Искусственное семенное размножение представляет особый интерес для
селекции сортов лотоса, пригодных для выращивания его как комнатного растения
(Zhao Jiarong, 1988). В результате перекрестного опыления и искусственного
кроссбридинга были получены 12 новых китайских сортов N. nucifera, растения
которых были более низкорослые (8-20 см по сравнению с родительскими
формами — 10-130 см), имели цветы необычной формы и окраски и могли расти в
кадочной культуре. В Китае широко распространена горшечная и кадочная культу-
Рис. 28. Развитие генеративных и вегетативных органов
Nelumbo nucifera.
1-3 — внешний вид плода (1), плодика (2) и семени с вентральной (За) и дорзальной (Зб) сторон;
4 — строение плодика на продольном разрезе; 5-6 — строение дыхальца на поперечном разрезе
плодика на стадии сформированного семязачатка (5а, 5б) и зрелого семени (6);
Рис. 28 (продолжение).
7-10 — развитие почечки зародыша: 7 — заложение апекса побега, 8 — заложение примордия
первого листа, 9а — формирование второго листа супротивно первому (первый лист без чешуевидного
органа), 9б — фрагмент основания второго листа (увел.), иллюстрирующий происхождение
чешуевидного органа в результате конгенитального срастания прилистников с адаксиальнои стороны на
ранней стадии развития, 10а-б — общий вид чешуевидного органа в основании второго листа
почечки зрелого зародыша с адаксиальнои (10а) и абаксиальной (10б) сторон, 10в — апекс побега с
зачатком третьего и примордием четвертого листьев, находящийся внутри чешуевидного органа,
изображенного на рис. 10а,б (в основании третьего листа также развивается чешуевидный орган);
Рис. 28 (продолжение).
11-16 - последовательные стадии развития проростка (11-15) и расположение листовых органов на
его оси (16а,б);
Рис. 28 (продолжение).
17-19 — формирование ювенильного растения;
Рис. 28 (продолжение).
20 — общий вид взрослого («годичного») растения с боковыми побегами, цветками и плодами;
Рис. 28 (продолжение).
21-22 — расположение листьев у взрослого растения: 21 — участок корневища с клубнем на стадии
формирования бокового побега из пазухи листа с двумя щитовидными листьями и двумя катафилла-
ми, 22 — тот же побег иа более поздней стадии — с развивающимся третьим листом (междоузлие
между вторым и третьим листьями еще не удлинилось, направление дальнейшего роста указано
стрелкой;
Рис. 28 (продолжение).
23-24 — стадии цветения и механизм движения пыльников относительно поверхности рыльца:
23а — полураскрытый цветок («рыхлый бутон»), пыльники не вскрыты, прилегают к цветоложу и
находятся ниже уровня рылец (23б), которые уже способны к восприятию пыльцы (возможность
ксено- и гейтоногамии), 24а — полностью раскрытый цветок, отхождение пыльников в стороны от
цветоложа и их вскрывание (24б), поверхность рылец восприимчива к пыльце только в утренние
часы (возможность ксено- и гейтоногамии, а также неконтактной автогамии);
Рис. 28 (продолжение).
25-33 — развитие пыльника и пыльцевого зерна в норме: 25-27 — строение гнезд пыльника на
стадии микроспороцитов в профазе I мейоза (25) и тетрад микроспор (26, 27) на поперечном (25, 26)
и продольном (27) срезах, 28-33 — фрагменты стенки гнезда пыльника на стадии спорогениых
клеток (28), микроспороцитов в профазе I мейоза (29), тетрад микроспор (30), незрелых (31) и
зрелых (32) двуклеточиых пыльцевых зереи и в момент вскрываиия (33), микроспороциты в
наружном слое, а также тетрады микроспор, находящиеся в контакте с клетками тапетума, развиваются в
основном нормально (28-30), тетрады микроспор расположены в одни слой по поверхности
тапетума (27-30), несущей на более поздних стадиях орбикулы (31-33);
Рис. 28 (продолжение).
34-40 — аномалии в развитии пыльника и пыльцевых зерен: дегенерация клеток тапетума со стороны
связника (34), тетрад микроспор и отдельных микроспор в тетрадах, главным образом, лишенных
контакта с поверхностью тапетума (35, 36, см. также дет. 27) и пыльцевых зерен (39, 40), отсутствие
распада тетрад на отдельные микроспоры (37, 40 — ср. с распавшейся тетрадой на дет. 38);
Рис. 28 (продолжение).
41 - 48 — образование аномальных однобороздных пыльцевых зерен у N. nucifera с оз. Ханка: 41 —
пыльцевые зерна, видно большое число нераспавшихся тетрад, 42-44 — нераспавшиеся тетрады тетраэдрического
(42, 44) и изобилатерального (43) типа с нормальными трехбороздными (42,43) и аномальными одноборозд-
ными (44) пыльцевыми зернами, 45-48 — одиночные пыльцевые зерна с единственной круговой бороздой,
сходные с пыльцевыми зернами нимфейных растений, 49 а-в — схема, иллюстрирующая возможный механизм
образования однобороздных пыльцевых зерен из трехбороздных путем слияния двух борозд в одну и редукции
третьей: а — общий вид тетраэдрическои тетрады с тремя пыльцевыми зернами, снабженными одной круговой
бороздой, б — типичное трехбороздное пыльцевое зерно, в — пыльцевое зерно с неполностью слившимися
двумя бороздами и третьей свободной бороздой;
Рис. 28 (продолжение).
50-56 — развитие зародышевых мешков на базе одиночного (50-52) и множественного (53-56)
археспория; 57-58 — строение нормального (57) и аномального, с нарушением делений ядер и
клеток (58) зрелых зародышевых мешков;
дз
Рис. 28 (продолжение).
59-60 - аномальные односемядольные зародыши; 61 - дополнительный зародыш, лежащий между
семядолями полового зародыша (одна из нихудалена). 7-10, 41-48 59-60 - СЭМ, 25-401 - СМ, 61 -
стереоскопическая микроскопия. Масштабная линейка: 7-10, 41, 60-100 мкм, 16а - 5 мм, 21-22 - 1см, 42-48 - 10 мкм,
59 - 1000 мкм 61-1 мм; а п - апекс побега, бп- боковой побег, б пч - боковая почка, в п - вегетативная
почка г з к - главный зародышевый корень, д - дыхальце, дз- дополнительный зародыш, дкт-
дегенерирующие клетки тапетума, дм — дегенерирующие микроспоры, д п 3 - дегенерирующие пыльцевые зерна,
до - друзы кристаллов оксалата кальция, к - катафиллы (ланцетные листья), кл - клубень, кщ - корневище,
ко - канал рыльца, л' л2 ... — первый, второй и т.д. щитовидные листья, мд - междоузлие, о - орбикулы,
п - перикарпий, пр - прилистники, пч - почечка, пд- полость дыхальца, пзк- придаточные зародышевые
корни, ппл- полость плодика, о - рыльце, с - семядоля, с к - семенная кожура, т - нераспавшаяся тетрада,
у п - узлы проростка, у ю р - узлы ювенильного растения ч о - чешуевидный орган, э - эндосперм
1 2 4-6 11-15 - по: Колесова (Титова), Батыгина, 1988; За-б, 166 - по: Снигиревская 1964; 7-10,
59-60 - по: Titova, Batygina, 1996; 16а, 23-48 - Титова, ориг; 17-20 -по: Wang Hsi-ching, 1956; 21-22 -
по: Esau, Kosakai, 1975; 49 - по: Kuprianova, 1979; 50-55, 57-58 - по: Титова, 1988; 56 - по: Khanna, 1965;
61 — Снигиревская, ориг.
Эмбриологические основы репродуктивных стратегий
499
ра лотоса, развита его селекция, разработана нумерическая классификация 70
сортов лотоса, в том числе гибрида N. nucifera x lutea (Zhong Yang, Zhang
Xiaoyan, 1987). В ходе изучения морфологических и биологических признаков
различных форм лотоса, культивируемых в Китае, был обнаружен ряд важных
корреляций (Chang Sing-yen, Wang Chi-Chou, 1966). Например, процент завя-
зываемости семян оказался тем ниже, чем выше была степень сдвоенности
цветка. Такие культивары иногда были полностью стерильны, при этом урожай и
качество съедобных корневищ были также низкие. Напротив, у менее цветоносных
форм чем ниже была степень сдвоенности цветка, тем выше был урожай и
качество съедобного корневища. Высокая семенная продуктивность различных форм
лотоса обычно скоррелирована с низким декоративным качеством цветка и
пищевой ценностью корневища. Однако некоторые сорта, полученные китайскими
селекционерами, имеют как высокое орнаментальное качество и пищевые
достоинства, так и достаточный урожай семян.
Перспективным методом для сохранения и размножения лотоса является также
эмбриокультура (Ta-Chu Liu, 1948; Васильева, Батыгина, 1981; Batygina,
Vasilyeva, 1987; Не Zican, Liu Shijita, 1987).
Искусственное культивирование лотоса помимо практических целей, вносит
определенный вклад в познание механизмов репродукции, позволяя проследить
динамику эмбриональных процессов в контролируемых условиях и выявить
корреляции в развитии эмбриональных структур.
Суммируя все вышесказанное, можно сделать следующее заключение.
Репродуктивная стратегия лотосовых характеризуется комплексом таких признаков,
как: способность к самоопылению, длительная жизнеспособность семян, большая
энергия и высокая скорость роста, способность к быстрому освоению больших
территорий, устойчивость к некоторым видам загрязнений. Она включает
одновременную реализацию полового и бесполого (гемморизогенного) способов
репродукции и, соответственно, семенного и вегетативного размножения. Однако
на отдельных этапах онтогенеза может доминировать та или другая программа
генеративного развития. При этом, отмечена жесткая корреляция между развитием
органов полового и бесполого воспроизведения. Только те узлы на корневище, где
не закладывается цветочная почка, становятся сильно утолщенными и образуют
органы вегетативного размножения, т.е. клубни (Wang Hsi-Ching, 1956).
Половая репродукция зависит в значительной степени от переноса пыльцы
насекомыми и, поскольку большая часть популяции лотоса является клоновой,
межпопуляционные скрещивания способствуют сокращению периода
формирования семян (Sohmer, 1977). И, если вегетативное размножение способствует
сохранению и возобновлению данной популяции лотоса в определенном
местообитании, то семенное размножение имеет большее преимущество в стратегическом
плане, способствуя освоению новых территорий и созданию банка долгоживущих
семян. Рис. 28.
Батыгина и др., 1982,1983, 1991; Васильева, Батыгина, 1981; Доброхотова, 1938; Колесова
(Титова), Батыгина, 1988; Куприянова, 1978; Лодкина, 1988; Палибин, 1904; Снигиревская, 1964,
1993; Титова, 1988; Турдиев, 1960; Чугунова-Сахарова, 1924; Шафранов, 1958; Chang Sing-yen,
Wang Chi-chou, 1966; Chen Wei-Pei, Zhang Si-mei, 1988, 1989; Collinson, 1980; Deng Huiqin et
al., 1990; Esau, Kosakai, 1975; Fenton, 1929; Gupta, Ahluwalia, 1976; Gupta, Ahuja, 1967, 1969;
Gwynne-Waughan, 1897; Hains, Lye, 1975; Hall, Penfound, 1944; Heritage, 1895; He Zican, Liu
500
Системы репродукции
Shijita, 1987; Ito, 1982; Jones, 1988; Khanna, 1965; Lyon 1901, 1905; Meyer, 1930; Morozova,
Vasilyeva, 1992; Ohga, 1926-1927; Schneider, Buchanan, 1980; Shaffner, 1904; Sohmer, 1977;
Sohmer, Sefton, 1978; Tang Pei-hua et al., 1990; Titova, Batygina, 1996; Titova et al., 1993; Toyoda,
1958, 1960; Trecul, 1854a, b; Vasilyeva, 1990; Wang Hsi-Ching, 1956; Wang Hsi-ching, Jii
Bing-sheng, 1966; Wettstein, 1888; Wigand, Dennert, 1888; Yan Su-zhen, 1986; York, 1904; Zhong
Yang, Zhang Xiaoyan, 1987.
СЕМЕННОЕ И ВЕГЕТАТИВНОЕ РАЗМНОЖЕНИЕ
yVACCINIUM MYRTILLUS L. (ERICACEAE)
Vaccinium myrtillus (черника обыкновенная) относится к группе ползучих и
вегетативно подвижных кустарничков (Серебряков, 1962). Этот вид является
доминантой травяно-кустарничкового яруса целого ряда растительных сообществ
лесной зоны: светло- и темнохвойных, атакже мелколиственных лесов (Быков, 1965).
V. myrtillus — ценнейшее пищевое и лекарственное растение.
Для черники характерно как семенное, так и вегетативное размножение.
Биология семенного размножения исследована недостаточно полно, а имеющиеся
сведения нередко противоречивы (Бережний, 1957; Шабарова, 1968; Каверзнева,
1973; Краснов, 1978; Алексеева, 1990).
С момента заложения цветков до полного созревания плодов у черники
проходит около 14 месяцев, т.е. развитие репродуктивных органов охватывает два
вегетационных периода. В первый вегетационный период происходит заложение
цветков в почках возобновления, а во второй — цветение, оплодотворение,
формирование и созревание плодов (Схема 1). Сроки заложения и скорость формирования
почек возобновления в значительной степени зависят от метеорологических
условий вегетационного периода (Тяк, 1984).
Численность генеративных особей черники в разных фитоценозах варьирует. В
Карпатах, например, она составляет: в ельнике черничном — 1,3, в черничнике зе-
леномоховом — 196,7, черничнике голубичном — 62,4 шт. на м . Фактически
цветущих особей во всех популяциях обычно меньше, так как часть их находится во
временно нецветущем состоянии (Смирнова, 1976; Жиляев, 1989).
В сосновых фитоценозах Ленинградской обл. на 1 парциальном кусте
образуется 8,7±1,5 цветков, 6,5±0,7 плодов и свыше 350 шт. семян (Мазная, ориг.
данные). Развитие репродуктивных структур происходит асинхронно. В цветке
развивается обычно 10 тычинок, в каждой содержится 2500 до 4600 пыльцевых зерен.
Пыльник вскрывается апикальной порой. Зрелые пыльцевые зерна двуклеточные,
сохраняются в тетрадах. Количество жизнеспособной пыльцы варьирует от 0,38%
до 50,9%. Многочисленные семязачатки (86-95 в одной завязи) развиваются на
сутурально-угловых плацентах пятигнездной завязи (Анисимова, 1997; Anisimova,
Shamrov, 1999). Сформированный семязачаток ана-кампилотропный, тенуину-
целлятный, унитегмальный.
Развитие репродуктивных структур характеризуется наличием аномалий. Они
проявляются прежде всего в дегенерации пыльцевых зерен, зародышевых мешков,
элементов яйцевого аппарата, зародышей и эндосперма на разных стадиях
развития, в нарушении клеткообразования при формировании эндосперма. В отдельных
случаях отмечено образование дополнительных (синергидных) зародышей
(Анисимова, 1997,1998).
Схема 1. Развитие годичного побега (1 - 6) и формирование почки
возобновления смешанного типа следующего года вегетации (1а — 6а)
у Vaccinium myrtillus
1 — начало роста годичного побега, 1а — заложение первой пары чешуи в почке возобновления, 2 —
стадия бутонизации, 2а — формирование второй пары чешуи, 3 — стадия цветения, За —
образование первого листового зачатка, 4 - стадия плодоношения, 4а — заложение меристематического
бугорка побега следующего года вегетации, 5 — стадия созревания плодов, 5а — заложение новых
листовых и цветковых зачатков, 6 — опадение листьев и плодов, 6а — завершение формирования почки
возобновления следующего года вегетации; б — бутои, з л — зачатки листьев, з и, — зачатки
цветков, зч— зачатки чешуи, л — лист, п — плод, и, — цветок, ч — чешуи.
По: Тяк,1984, с изм.
502
Системы репродукции
Черника — облигатное энтомофильное растение, опыление которого
осуществляется шмелями. Порядок посещения опылителями цветков черники в
исследованных Карпатских популяциях строгий и определяется численностью цветущих
особей, расстоянием между ними, аггрегированностью, порядком зацветания в
пределах генеративного побега (Жиляев, 1989). В первую очередь опыляются соседние
цветки одного побега, затем цветки соседних особей и т.д. Подобный характер
опыления способствует появлению инбредных линий и образованию субпопуляций
в пределах всей совокупности особей вида в том или ином сообществе. В случае,
если система существует в течение многих поколений, локальная панмиксия
приводит к образованию гомозиготных массивов. В некоторых случаях (3-5% цветков)
отмечена автогамия.
В плодах черники, собранных в период диссеминации, обнаруживаются
неоднородные семена, которые по морфологическим, количественным (размерам) и
качественным (форме, степени развития зародыша и эндосперма) признакам можно
разделить ни три фракции: крупные, средние, мелкие. Семена крупной фракции
(от 1,2-1,8 х 0,5-0,9 мм) заостренно-овальные или линзовидные. Они содержат
обильный эндосперм и прямой либо слегка изогнутый цилиндрической формы
зародыш, который занимает около 3/4 длины семени. Зародыш дифференцирован
на две короткие семядоли, слабо развитую почечку, гипокотиль и зародышевый
корешок. Семенная кожура представлена наружным эпидермисом (радиальные и
внутренние тангентальные стенки клеток которого неравномерно утолщены и
имеют поры) и уплотненными клетками паренхимы. В единичных случаях,
обнаружены семена с недоразвитым зародышем. Семена средней фракции (0,6-1,1 х 0,3-0,5
мм) овальные, овально-заостренные, линзовидные, уплощенные, слегка
изогнутые, иногда со складками; лишены зародыша, эндосперм скудный, либо
отсутствует. Семена мелкой фракции (0,2-0,6 х 0,1-0,2 мм) продолговатые, уплощенные,
часто сохраняют форму семязачатка, в них нет зародыша и эндосперма. Они
представлены экзотестой и иногда остатками средних слоев интегумента и халазы (Чер-
няковская, 1992; Анисимова, 1997,1998). Для Северо-Западного региона России
(Мурманская, Ленинградская обл., Карелия) количество крупных, средних и
мелких семян в плоде составляет, соответственно: 74,0 : 24,1:1,9 (Мурманская обл.);
30,4 : 44,7 : 24,9 (Ленинградская обл.); 56,8 : 43,2 (Карелия) (Мазная, Лянгузо-
ва, 1995, 1997; Лянгузова и др., 1999).
Известно, что на формирование семян влияют многие факторы, в том числе и
условия произрастания (см. Реальная семенная продуктивность; Репродуктивный
успех; Популяционное и ценотическое регулирование репродукции). Возможно, с
этим связано значительное варьирование в одном плоде числа сформировавшихся
семян и их массы. Так, в сосновых фитоценозах Северо-Запада России количество семян
в одной ягоде варьирует от 17 до 112 шт. (Мазная, Лянгузова, 1995,1997; Анисимова,
1997; Лянгузова и др., 1999), в Западной Сибири — от 8 до 50 шт. (Тимошок,
Паршина. 1990) и на Украинском Полесье — от 18 до 72 шт. (Кондратюк, Шабарова,
1968). Масса 1000 семян в сосновых фитоценозах Северо-Запада России составляет
200-288 мг (Мазная, Лянгузова, 1995,1997; Лянгузова и др., 1999).
Семенная продуктивность одного парциального куста черники в Западной
Сибири в зависимости от типа фитоценоза и высоты местности над уровнем моря
составляет: потенциальная — 67-574 и реальная — 47-189 шт. семян (Тимошок,
Паршина, 1990).
Эмбриологические основы репродуктивных стратегий
503
Очевидно, что семена средней и мелкой фракций нежизнеспособны, что важно
учитывать при оценке качества семян. Об этом свидетельствуют результаты
исследований. Из семян, сформировавшихся в одной ягоде, прорастает не более 16%
(Мазная, ориг. данные). Лабораторная всхожесть семян разных репродукций и
собранных в разных частях ареала черники варьирует от 32 до 96% (Бережной,
1957; Шабарова, 1968; Краснов, 1978; Алексеева, 1990; Мазная, Лянгузова,
1995,1997; Тимошок, 1998; Лянгузова и др., 1999). Однако грунтовая всхожесть
семян не превышает 30%, семена прорастают медленно и первые всходы
появляются на 15-19 день опыта (Козирацкий, 1975; Мазная, Лянгузова, 1995). После
9-месячной стратификации грунтовая всхожесть семян черники может достигать
80% (Стацкявичене, Буктус, 1983).
Потенциальные возможности черники к эффективному семенному
размножению в природе реализуются не в полной мере. Причины этого могут быть
связаны с быстрой потерей их жизнеспособности, вызванной высокой
активностью почвенных микроорганизмов (Каменецкая, 1969; Карпов, 1960;
Левина, 1981; Петров, 1989; Komulainen et al., 1994). Кроме того, проростки
быстро погибают в мохово-лишайниковом ярусе, так как всходы черники
очень мелкие и для их успешного развития требуются особые условия
(постоянная влажность почвы, непрямое солнечное освещение, наличие микоризы,
отсутствие конкуренции и т.д.). Наиболее благоприятные условия для их
произрастания существуют в местах с нарушенным моховым покровом (на старых
кострищах, на возвышениях, по старым лесным дорогам и т.д.) и на старых
истлевших пнях и колодах (Авдошенко, 1948; Солоневич, 1956). В этих
местах отмечаются повышенная влажность почвы и наименьшая корневая
конкуренция, а также более богатый минеральный состав почв, создающийся за
счет разложения древесины или стока минерально обогащенных осадков по
стволам деревьев, мощного слоя подстилки и лучшей аэрации субстрата, более
высокой температуры почвы в корнеобитаемом слое. Попадание семян на эти
участки происходит благодаря птицам и животным, для которых плоды
черники являются основной кормовой базой (Раус, 1973). При этом, возраст
семенных особей черники различен, что свидетельствует о неоднократном
заносе семян на эти участки (Тимошок, 1998). Всходы черники обычно
встречаются группами, редко одиночно, причем, чем моложе особи, тем большими
группами они произрастают (Авдошенко, 1948).
Наиболее детальное описание морфогенеза черники от прорастания семян до
формирования клонов приведено в работах Серебрякова с соавторами
(Серебряков, Чернышева, 1955; Серебряков, 1962). Семена черники прорастают надземно
(Авдошенко, 1949). Сеянцы в первые годы растут медленно и в пятилетнем
возрасте достигают 5-8 см высоты. К 8-10 годам жизни сеянца черники образуется
миниатюрный, карликовый вечнозеленый кустарничек, так называемый
первичный (материнский) куст (Схема 2). Дальнейший рост куста черники
сопровождается образованием не только ассимилирующих побегов, но и длинных подземных
ползучих побегов. Эти побеги формируются из спящих почек, расположенных в ба-
зальной части главной оси, и побегов второго порядка первичного куста,
прикрытых к этому времени лесной подстилкой или моховым покровом. Вначале эти
побеги растут горизонтально, удаляясь в разные стороны по радиусам от первичного
куста, достигая 30-40 см длины в рыхлой лесной подстилке. Затем их верхушка
а п.
cm
tf.« 5
Рис. 29. Формирование цветка и строение генеративных структур
Vaccinium myrtillus L.
1-4 — развитие апикальной почки смешанного типа, 5 — общий вид цветка, 6 — общий вид цветка
без венчика,
7 — строение цветка на продольном срезе, 8 - поперечный срез цветка на уровне тычинок, 9 —
поперечный срез верхней части завязи, 10 — фрагмент стенки зрелого пыльника на поперечном срезе,
видны зрелые пыльцевые зерна, сохраняющиеся в тетрадах, И — продольный срез семязачатка на
стадии зрелого зародышевого мешка. Масштабная линейка: 1-9 — 0,3 мм, 10-11 — 0,03 мм; an —
апикальная почка, б — бутон, г — гипостаза, з — завязь, з м — зародышевый мешок, ап- зачаток
побега, зи, — зачаток цветка, ит — интегументальный тапетум, п з — пыльцевые зерна, с —
семязачатки, cm — столбик, т - тычинки.
1-11 — Анисимова, ориг.
Эмбриологические основы репродуктивных стратегий 507
приобретает ортотропное направление, выходит на поверхность почвы и
продолжает рост как ассимилирующий побег. В результате ветвления этого побега
образуется парциальный куст, который является частью материнского растения,
отличалась от последнего несколько большими размерами. Постепенно формируется
система парциальных кустов с материнским первичным кустом в центре, в
результате чего образуется клон (Серебряков, Чернышева, 1955).
Интенсивный рост подземных ползучих побегов обеспечивает быстрое
вегетативное разрастание клонов в радиальных направлениях. О быстроте разрастания
клонов черники можно судить, например по тому, что в ельниках Московской
области куртины достигают в диаметре 5-8 м и состоят из нескольких сотен
парциальных кустов. По мнению Злобина (1961) и Гедых (1979), в молодых клонах
черники все они способны к вегетативному разрастанию. Однако по мере
разрастания клонов эта способность у более старых парциальных кустов уменьшается.
Определение общей продолжительности жизни клонов практически невозможно
из-за трудности определения их границ, взаимопроникновения клонов друг в
друга и отмирания материнского куста. Продолжительность жизни клона
предположительно может составлять 100 и более лет (Авдошенко, 1949; Серебряков,
1962). С отмиранием системы главного корня, а затем и всего материнского
куста, происходит распадение клонов черники на отдельные части (партикулы), что
позволяет считать чернику вегетативно подвижным растением (см. Партикуля-
ция; Вегетативное размножение). Существует и другое мнение относительно
размножения черники. Так, по мнению Тимошок (1998), V. myrtillus вегетативно
не размножается. Согласно автору, это обусловлено тем, что черника
произрастает колониями, при этом парциальные кусты не отделяются и существуют в их
системе в течение всей жизни.
Таким образом система репродукции у черники включает как вегетативное, так
и семенное размножение. Однако данные о соотношении этих типов
противоречивы (Kuiala, 1928; Синская, Щенкова, 1928; Авдошенко, 1948; Солоневич, 1956;
Мазуренко, 1982; Деева, 1988; Тимошок, 1998). Рис. 20, 29.
Авдошенко, 1948,1949; Алексеева, 1990; Анисимова, 1997,1998; Бережний, 1957; Быков, 1965;
Гедых, 1979; Деева, 1988; Жиляев, 1989; Злобин, 1961; Каверзнева, 1963; Каменецкая, 1969;
Карпов, 1960; Кондратюк, Шабарова, 1968, 1986; Козирацкий, 1975; Краснов, 1978; Левина,
1981; Лянгузова и др.. 1999; Мазная, Лянгузова, 1995,1997; Мазуренко, 1982; Николаева и др.,
1985; Петров, 1989; Раус, 1973; Сенянинова-Корчагина, 1967; Серебряков, 1962; Серебряков,
Чернышева, 1955; Синская, Щенкова, 1928; Солоневич, 1956; Стачкявичене, Буткус, 1983;
Тимошок, 1998; Тимошок, Паршина, 1990; Тяк, 1984,1987; Черняковская, 1992; Шабарова, 1968;
Anisimova, Shamrov, 1999; Grevillius, Kirchner, 1923; Komulainen, 1994; Kuiala, 1928.
РЕПРОДУКТИВНАЯ СТРАТЕГИЯ ЖИВОРОДЯЩИХ РАСТЕНИЙ
Как известно, каждый вид обладает своеобразной системой репродукции,
которая в силу своих потенциальных возможностей обеспечивает воспроизведение и
размножение вида. Каждая система репродукции имеет определенную
пластичность и толерантность. Успех воспроизведения и размножения, как и любой другой
биологический процесс, зависит в определенной степени от экологической
обстановки. В пределах одного и того же свойственного виду фитоценоза под влиянием
508
Системы репродукции
метеорологических или биотических факторов могут меняться способы
размножения, календарные сроки или ритм размножения, а также качественные и
количественные показатели продуктивности вида. Эти изменения происходят на уровне
отдельных особей, так и популяции (Левина, 1981).
Воспроизведение и размножение растений, в частности живородящих,
происходит посредством образования разнообразных генеративных и вегетативных
диаспор (см. Диаспора). Для живородящих растений характерно семенное или
вегетативное размножение, либо их сочетание.
Многим мангровым (Rhizophora, Ceriops, Kandelia, Bruguiera) свойственна
облигатная генеративная вивипария, т.е. размножение с помощью проростков,
возникших на базе генеративной диаспоры, содержащей половой зародыш (см.
Вивипария). Вегетативное размножение этих видов не отмечено.
В условиях стресса (например, резкое изменение влажности воздуха)
некоторые растения из сем. Cucurbitaceae проявляют способность к факультативной
криптовивипарии.
Наибольшее многообразие систем репродукции встречается у растений,
которым свойственна вегетативная вивипария — гемморизогенная или эм-
бриоидогенная.
Так, виды рода Festuca высокогорных широт размножаются только
посредством гемморизогенной вивипарии (Fernald, 1933; Scholander, 1934). Однако на
южной окраине ареала для вивипарных овсяниц характерно сочетание семенного
и вегетативного размножения (Turesson, 1926-1931; Wycherley, 1953; Сипливин-
ский, 1973). Количество растений F. vivipara, у которых отмечена вивипария, и
степень модификации колосков варьируют в зависимости от группы растений, их
местообитания и сезонных условий (Salvesen, 1986). Растения также
различаются по числу фертильных цветков, при этом тетраплоиды из береговой популяции
продуцируют их больше, чем из альпийской популяции (Salvesen, 1986). В
соцветиях у гибрида F. rubra x vivipara часть колосков регулярно трансформируется в
воздушные луковички, остальные цветки в соцветии оказываются стерильны
(Elven, 1978, 1980; Salvesen, 1986).
В системе репродукции Роа bulbosa, P. alpigena и P. sublanata успешно
сочетаются разные способы образования нового индивидуума: посредством семян,
выводковых почек в соцветии и луковиц в основании стебля. Количество полноценных семян
у P. alpigena и P. sublanata сопоставимо с таковым у семенных форм, а всхожесть
даже выше нормы. P. alpigena и P. sublanata, произрастающие в разных
местообитаниях, различаются по количеству и качеству производимых ими вегетативных
диаспор. Так, P. alpigena образует множество мелких, быстро теряющих всхожесть
диаспор, которые успешно занимают небольшие свободные пространства в массе
сомкнутой злаковой синузии и не разносятся на значительные расстояния. Напротив,
крупные, долго сохраняющие жизнеспособность пропагулы P. sublanata способны
далеко переноситься вдоль берега Обской губы (Сарапульцев, 1998).
Некоторые формы живородящих злаков способны, обычно в самом конце
вегетационного периода, произвести несколько фертильных метелок (F. vivipara)
(Hunger, 1887; Schuster, 1910; Exo, 1916).
Как известно, система семенного размножения у цветковых включает
механизмы, участвующие в образовании инициальных клеток половых и соматических
зародышей, формировании семян и плодов, которые могут порознь или в комплексе
Эмбриологические основы репродуктивных стратегий
509
друг с другом поддерживать существование популяций вида в достаточно большом
ряду поколений (Левина, 1981; Куприянов, 1989; Batygina, 1998; Батыгина,
1999). Согласно Куприянову (1989), основными параметрами семенного
размножения являются те механизмы или элементы системы репродукции, которые
влияют на генетическую структуру популяций вида. У вивипарных представителей рода
Allium выявлены частичные нарушения в прохождении мейоза как при микро-, так
и мегаспорогенезе, обусловливающие в дальнейшем значительную степень
стерильности у этих видов (Устинова, 1944). По мнению автора, причиной этих
аномалий является развитие бульбочек (выводковых почек — Т. Б., Е. А.) в соцветии,
удаление которых стимулирует образование нормальных цветков. Таким образом,
у луков существуют все переходы от соцветий, состоящих только из цветков (А.
decipiens, A. aflatunense) к соцветиям, состоящим из цветков и бульбочек (А.
senescens, A. oleraceum) или только из бульбочек (A. proliferum). В зависимости
от способности к бульбообразованию и степени семенной стерильности Устинова
разделяет вивипарные луки на 3 группы: 1 — число цветочных почек в соцветии
равно или несколько меньше числа бульбочек, фертильность семян — 0.5-1.5%
(A. coeruleum, A. oleraceum); 2 — в соцветии преобладают бульбочки, семена
стерильны (A. carinatum, A. scorodoprasum); 3 — в соцветии обычно только
бульбочки и очень редко цветки, семена стерильны (A. proliferum).
Вариации в соотношении количества семян и вегетативных диаспор
(клубеньков) отмечены также и у двудольных, в частности, у Polygonum viviparum.
Цитологическое исследование растений P. viviparum, взятых из пяти разных точек
ареала, показало, что в Исландии это — гептаплоид, на Фаройских островах — октап-
лоид, а в-Гренландии, Англии и бывшей Чехословакии наблюдается 9-плоидная
вариация (Engell, 1973). Растения отличались по общей длине колоса, по размеру
той части колоса; на которой цветки были замещены клубеньками, и по морфологии
поддерживающих клубеньки листьев. Клубеньки из пяти местообитаний
различались по размеру и цвету, (см. Выводковая почка). Среди растений P. viviparum из
12 местообитаний на территории центральной Норвегии большинство имело
преобладающую тенденцию к замещению цветков клубеньками (Law et al., 1983).
Для ряда живородящих растений характерно образование проростков на листе
или в пазухе листа (Cardamine, Nymphaea, Kalanchoe, Hammarbya paludosa) (см.
Вивипария; Выводковая почка). Живородящие растения в зависимости от
внешних условий (длина дня, температура, влажность и др.), генотипа и возраста
способны продуцировать либо семена, либо вегетативные проростки, либо
одновременно оба типа диаспор. Причем в отличие от растений, для которых характерна
флоральная гемморизогенная вивипария, формирование вегетативных проростков
на листьях и в их пазухах практически не связано с развитием соцветия. Это дает
определенную автономность при формировании выводковых почек, а,
следовательно, большую пластичность при образовании новых растений.
В условиях стресса (например, резкое повышение влажности воздуха)
растения, способные к факультативной гемморизогенной вивипарии, могут
оставить дополнительное потомство (Cymbopogon — Dutt, Bradu, 1973;
Naveenetal.,1977).
Популяции живородящих растений гетерогенны по генотипу и возрастному
составу благодаря сочетанию различных способов размножения и времени
появления потомства.
510
Системы репродукции
Батыгина, 1999; Куприянов, 1989; Левина, 1981; Сарапульцев, 1998; Сипливинский, 1973;
Устинова, 1944; Balygina, 1998; Dutt, Bradu, 1973; Elven, 1978,1980; Engcll, 1973; Exo, 1916; Fernalcl,
1933; HQnger, 1887; Law et al., 1983; Naveen et al., 1977; Salvesen, 1986; Scholander, 1934; Schuster,
1910; Turesson, 1926-1931; Wycherley, 1953.
РЕПРОДУКТИВНАЯ СТРАТЕГИЯ ОРХИДНЫХ УМЕРЕННОЙ ЗОНЫ
Орхидные умеренной зоны представляют собой весьма разнородную группу в
систематическом и биоморфологическом отношениях и, очевидно, проникли в
умеренные широты в разное время и различными путями. В соответствии с этим их
адаптации к обитанию в умеренном климате достаточно разнообразны и наряду с
микотрофным образом жизни, общим для всех представителей сем. Orchidaceae,
определяют особенности систем репродукции.
Среди орхидных умеренной зоны северного полушария наиболее
многочисленны три группы, различающиеся, прежде всего по строению подземных или
наземных запасающих органов. К группе корневищных геофитов относятся
представители родов Cypripedium, Cephalanthera, Epipactis, Listera, Neottia. Для
группы корнеклубневых геофитов характерны запасающие органы в виде корне-
клубней (стеблекорневых тубероидов, по терминологии Dressier, 1981). К ним
относятся подтриба Gymnadeniinae (Coeloglossum, Dactylorhiza, Gymnadenia,
Platanlhera и др.) с веретеновидными или пальчатыми корнеклубнями,
распространенная в более влажных северных и горных областях умеренной зоны, и
подтриба Orchidinae (Anacamptis, Himantoglossum, Ophrys, Orchis, Serapias и
др.) с шаровидными или яйцевидными корнеклубнями — более
специализированная группа, адаптированная к условиям средиземноморского климата с
засушливым летом и мягкой зимой. Большая часть эволюционной истории этих
первично-наземных групп орхидных связана с умеренными широтами, и адаптации
к умеренному климату наложили отчетливый отпечаток на все стороны биологии их
представителей. Третью крупную группу среди орхидных умеренной зоны
составляют вторично-наземные гемикриптофиты с запасающими органами в виде
наземных (располагающихся в слое мха и рыхлой лесной подстилки) туберидиев, или
псевдобульб (представители подсем. Epidendroideae и Vandoideae). Виды этой
группы, произрастающие в местообитаниях с сильно развитым моховым покровом
(бриофилы), близкородственны тропическим эпифитам. Последняя группа
наиболее многочисленна во флоре областей с влажным океаническим климатом
(Восточная Азия, восток Северной Америки), а в Европе и Сибири представлена
немногими видами (из родов Calypso, Hammarbya, Liparis, Malaxis).
Системы репродукции у разных групп орхидных умеренной зоны имеют ряд
существенных отличий. У примитивных корневищных геофитов (Cypripedioideae
и Neottieae-Limodorinae) наиболее ярко выражены черты патнентной (по
терминологии Раменского, 1938), или стресс-толерантной (по Grime, 1979) жизненной
стратегии — устойчивость к неблагоприятным абиотическим факторам среды,
большая продолжительность жизни, низкие темпы семенного возобновления и др.
(Заугольнова и др., 1992). Вегетативное размножение путем ветвления корневищ
взрослых растений с последующим обособлением партикул — нормальная парти-
куляция (Ценопопуляции растений (очерки популяционной биологии), 1988) —
Эмбриологические основы репродуктивных стратегий
511
является преобладающим способом самоподдержания их популяций. При этом
урожай семян в их популяциях, зависящий, главным образом, от численности и
активности опылителей, может быть как стабильно низким (Cypripedium guttatum),
так и довольно высоким (С. macranthon, виды Epipactis). Однако и в последнем
случае их семенное возобновление имеет низкую эффективность, что
компенсируется большой продолжительностью жизни клонов (так, у Cypripedium calceolus
возраст клонов может достигать 200 лет — Kull, 1988) и их способностью к
значительному разрастанию. Основной причиной низкой эффективности семенной
репродукции является затрудненное прорастание семян, обусловленное, главным
образом, наличием структурных адаптации. В семенах видов этой группы кутинизи-
рованный внутренний слой семенной кожуры плотно прилегает к зародышу и
препятствует поступлению воды к нему (Lucke, 1981,1982а,b; Waes van, Debergh,
1986). Кроме того, в семенах представителей данной группы установлено наличие
абсцизовой кислоты, которая, как известно, является ингибитором прорастания
(Kinderen van der, 1987). По-видимому, семена Cypripedium и Neottieae, по
сравнению с семенами других орхидных, сохраняют жизнеспособность в почве более
продолжительное время. Наличие мицелия у совместимого микосимбионта не
является достаточным условием прорастания семян для видов этой группы (Куликов,
Филиппов, 1998). Возможно, прорастание стимулируется воздействием несим-
биотической почвенной микрофлоры или физических факторов (изменения
окислительно-восстановительного потенциала среды и др. — Weinert, 1990).
Поскольку сочетание условий, благоприятствующих прорастанию, встречается редко,
процент прорастающих семян обычно незначителен. Проростки сильно микотроф-
ны и развиваются сравнительно медленно (например, у Cypripedium первые
надземные органы формируются обычно на 3-4-м году жизни). Степень микотрофно-
сти взрослых растений может колебаться от высокой (Cephalanthera rubra) до
незначительной (Epipactis palustris).
У корнеклубневых геофитов трибы Orchideae преобладает патиентная
жизненная стратегия. Однако им свойствен и ряд черт, характерных для эксплерен-
тов, а именно: сравнительно небольшая продолжительность жизни, высокая
степень динамичности прегенеративной фракции в составе популяций в связи с
флуктуациями возобновления, высокая семенная продуктивность, слабо
выраженный период старения (Заугольнова и др., 1992). Вегетативное размножение
не играет существенной роли в самоподдержании популяций видов этой группы
(за редкими исключениями — Herminium monorchis, Platanthera hologlottis),
которое, таким образом, полностью зависит от семенного возобновления. У
большинства Orchideae семенная продуктивность из года в год поддерживается на
высоком уровне. У видов подтрибы Gymnadeniinae, адаптированных к условиям
относительно влажного климата, семена не имеют покоя (Куликов, Филиппов,
1998) и прорастают, очевидно, сразу же после попадания в почву. Только
небольшая часть проросших семян вступает в контакт с мицелием совместимого
микосимбионта и, таким образом, находит благоприятные условия для дальнейшего
развития. Однако численность протокормов видов этой группы в почвах их
местообитаний все-таки многократно превышает количество ювенильных, а тем
более взрослых растений в составе их популяций, что свидетельствует об отмирании
большей части проростков еще на подземной стадии развития (МбНег, 1987а;
Баталов, 1997). В связи с отсутствием приспособлений для предотвращения
512
Системы репродукции
преждевременного прорастания и непродолжительностью сохранения семенами
жизнеспособности (обычно не более 1 года) виды подтрибы Gymnadeniinae,
очевидно, неспособны к образованию даже кратковременного запаса семян в почве.
Для представителей этой группы характерны довольно значительные колебания
доли ювенильных растений в составе популяций — волны возобновления (Вах-
рамеева и др., 1987), причиной которых, видимо, является чередование
благоприятных и неблагоприятных периодов для выживания протокормов в почве.
Представители подтрибы Orchidinae, многие из которых по сезонному
ритму развития приближаются к эфемероидам, успевают отцвести и рассеять
семена до начала летней засухи. Их семена обладают покоем (хотя и менее
глубоким, чем у корневищных орхидных), что позволяет им избегать
преждевременного прорастания в период с недостаточной влагообеспеченностью.
Воспроизведение у представителей этой подтрибы особенно сильно зависит
от степени пересыхания верхних слоев почвы в летний период, являющегося
причиной отмирания большинства образующихся протокормов и резких
флуктуации возобновления (Moller, 1987а, Ь, с). Темпы развития проростков,
видимо, более высоки, чем считалось ранее, и в условиях средиземноморского
климата продолжительность подземного этапа развития не превышает 1 года
(Moller, 1987a,b). Степень микотрофности представителей трибы Orchideae
на ранних этапах онтогенеза высока и в большинстве случаев сохраняется
значительной в течение всей жизни растения. Однако колебания ее в пределах
этой группы довольно значительны — от высокой микотрофности
(Neottianthe cucullata и Orchis ustulata) до практически полной автотрофно-
сти во взрослом состоянии (Dactylorhiza incarnata).
В популяциях северных вторично-наземных гемикриптофитов подсем.
Epidendroideae семенное и вегетативное размножение могут быть представлены
примерно в одинаковой степени (например, у Calypso bulbosa — Куликов,
1997), либо семенное размножение преобладает (Malaxis monophyllos).
Семенная продуктивность обычно высока, хотя может ограничиваться
активностью фитофагов (как у Calypso bulbosa). Семена видов подсем. Epidendroideae
не имеют структурных особенностей, ограничивающих прорастание, и
обладают слабовыраженным покоем (Куликов, Филиппов, 1998). Жизнеспособность
семян сохраняется непродолжительное время (менее 1 года), поэтому виды этой
группы неспособны к формированию запаса семян в почве.
Продолжительность подземной фазы их онтогенеза, по-видимому, невелика. В пользу этого
свидетельствует отсутствие признаков сезонной периодичности роста в
строении подземных протокормов у С. bulbosa (Виноградова, Филин, 1993), а также
высокие темпы развития проростков этого вида в асимбиотической культуре
(формирование первичного побега с зеленым листом и туберидием за 9-10 мес.)
(Куликов, Филиппов, 1998). Способность протокормов представителей трибы
Malaxideae к позеленению на свету свидетельствует о возможности
прорастания на поверхности субстрата, хотя в природе их семена, вероятно, прорастают
в толще мохового покрова, где сохраняются условия равномерного увлажнения.
Степень микотрофности на стадии протокорма у С. bulbosa, видимо,
значительна, а у видов трибы Malaxideae, подобно большинству тропических форм с хло-
рофиллоносными протокормами, облигатно микотрофная фаза развития весьма
непродолжительна.
Эмбриологические основы репродуктивных стратегий
513
Для семенного возобновления корнеклубневых геофитов трибы Orchideae
благоприятны или даже необходимы нарушенные местообитания, создающие
свободное пространство для семенного потомства и ограничивающие конкуренцию со
стороны более активных компонентов фитоценозов. Вторично-наземные гемикрипто-
фиты подсем. Epidendroideae, в отличие от корнеклубневых геофитов, не имеют
столь выраженных черт эксплерентной жизненной стратегии, они приурочены
обычно к более стабильным фитоценозам и не требуют нарушений растительного
покрова для успешного семенного возобновления. Вследствие крайне низкой
конкурентоспособности они всегда произрастают на участках, не имеющих сомкнутого
травяного яруса из-за сильного развития мохового покрова, с которым тесно
связаны на протяжении всего жизненного цикла.
Таким образом, системы репродукции основных групп орхидных умеренной
зоны существенно различаются по ряду признаков (соотношение типов
размножения, темпы онтогенеза и др.) и характеру адаптации к сезонному климату (наличие
покоя семян, сезонная периодичность роста проростков), что определяет их
жизненную стратегию. Наиболее выражены эти адаптации у представителей
первично-наземных групп, филогенетически тесно связанных с умеренной зоной,
тогда как вторично-наземные формы по характеру репродуктивной стратегии
сравнительно мало отличаются от тропических эпифитных орхидных, численно
преобладающих в составе семейства.
Баталов, 1998; Вахрамсева и др., 1987; Виноградова, Филин, 1993; Заугольнова и др., 1992;
Куликов, 1997; Куликов, Филиппов, 1998; Раменский, 1938; Ценопопуляции растений (очерки по-
пуляционной биологии), 1988; Dressier, 1981; Grime, 1979; Kinderen van der, 1987; Kull, 1988;
Lucke, 1981,1982a,b; Moller, 1987a, b, c; Waes van, Debergh, 1986; Weinert, 1990.
ПРОБЛЕМЫ И ПЕРСПЕКТИВЫ СЕМЕННОГО РАЗМНОЖЕНИЯ IN VITRO
ОРХИДНЫХ УМЕРЕННОЙ ЗОНЫ
Представители сем. Orchidaceae издавна привлекают внимание
исследователей в связи с проблемой сохранения и размножения редких, исчезающих
видов. Для размножения орхидных умеренной зоны, которое в естественных
условиях лимитируется различными биогенными (наличие специфического
гриба) и абиогенными факторами, широко используется асимбиотическое и
симбиотическое культивирование in vitro незрелых и зрелых семян (и
зародышей). Главными проблемами в исследовании семенного размножения орхидных
умеренной зоны являются морфогенез зародыша и проростка in situ и в
культуре in vitro, репатриация и реинтродукция полученных растений в места
естественного произрастания.
Асимбиотическое культивирование незрелых семян. Процент
прорастающих семян орхидных умеренной зоны при асимбиотическом культивировании
значительно варьирует в пределах вида (Arditti, 1982). Как правило, лучше
прорастают семена, извлеченные из незрелых плодов (Burgeff, 1936; Fast, 1978, 1982;
Linden, 1980; Batygina, Vasilyeva, 1981,1983; Arditti, 1982; ). В связи с этим было
сделано предположение, что стадия развития семени и зародыша в момент
посева может быть определяющим фактором для получения максимальной доли
прорастающих семян in vitro.
514
Системы репродукции
Данное предположение было проверено при посеве семян представителей
рода Dactylorhiza (D. baltica, D. maculata, D. flavescens, D. incarnata),
изолированных в разные сроки после начала цветения (25-60 дней), на
модифицированную среду Knudson с регуляторами роста и без них (Табл. 1) (Андронова, 1986,
1988). Было показано, что доля прорастающих семян, посеянных через 25 дней
после начала цветения на среду, содержащую цитокинин и ауксин, была очень
низка. При этом семена прорастали неравномерно: наряду с мелкими и
немногочисленными довольно крупными протокормами можно было наблюдать и массу
непроросших семян.
Максимальный процент прорастания (100 % или немного ниже) был
отмечен при посеве семян Dactylorhiza baltica, D. maculata и D. flavescens на
стадии 40 — 45 дней после начала цветения на среду, содержащую регуляторы
роста. Семена прорастали одновременно, и протокормы развивались
примерно с одинаковой скоростью. Проросшие семена D. incarnata составляли лишь
50 % от общего количества посаженных.
Зрелые семена из вскрывшихся плодов (60 дней после начала цветения) D.
baltica и D. flavescens имели очень низкий процент прорастания, а у D. incarnata не
прорастали совсем.
Цитоморфологический и гистохимический анализ структур семени
D. baltica на стадии 40-45 дней после начала цветения (прекращение делений
клеток в зародыше и начало накопления запасных питательных веществ в них,
полная дегенерация клеток внутреннего интегумента и начало дегенерации
клеток наружного интегумента) свидетельствует о переходе семени к
созреванию (Андронова, 1988). По мере созревания семени (45 — 60 дней после на-
Таблица 1:
Процент прорастания семян некоторых видов рода Dactylorhiza в зависимости от стадии
их развития в момент посева в асимбиотической культуре in vitro на модифицированной
среде Кнудсона (ОС — основная среда и ОС + горм. — с добавлением кииетина
(0,5 мг/л), индолилуксусиой кислоты (1 мг/л) и аденина
(0,5 мг/л)) (по: Андронова, 1988).
Вид
D. baltica
D. flavescens
D. incarnata
D. maculata
Среда
ОС
ОС+горм.
ОС
ОС+горм.
ОС
ОС+горм.
ОС
ОС+горм.
д
20
0
4
30
3
5
ни после начала цветения
35
0
60
40
4
100
30
100
45
10
50
100
50
5
33
0
75
0
30
60
2
2
0
10
0
0
0*
56*
* Семена изолировали из зеленых плодов.
Эмбриологические основы репродуктивных стратегий
515
чала цветения) формируется механизм торможения прорастания, что
является причиной снижения способности семян к прорастанию в
асимбиотической культуре.
Кроме представителей рода Dactylorhiza способность семян на разных стадиях
созревания к асимбиотическому прорастанию in vitro была исследована у видов,
представляющих основные систематические группы внетропических орхидных
(Куликов, Филиппов, 1998). Было показано, что оптимальная для посева стадия
развития семени у Calypso bulbosa соответствует 35-40 дням после опыления, у
Liparis loeselii — 45-50, у Cypripedium calceolus - 30-35, у С. macranthon
35-50 (по данным для Северо-Запада России — 45-50, для Среднего Урала
35-40), у Orchis militaris — 20-25, у Listera ovata — до 20 дня после опыления.
Эти данные свидетельствуют о видоспецифическом характере зависимости
прорастания от стадии развития зародыша и структур семени.
В ходе проведенного исследования была выявлена корреляция между
способностью к прорастанию и состоянием клеток интегументов (особенно
внутреннего), а именно, семена были способны к прорастанию до тех пор,
пока клетки интегументов оставались живыми (по крайней мере частично).
Например, у Cypripedium calceolus в период 35-40 дней после опыления клетки
обоих интегументов полностью отмирают, семенная кожура приобретает
темно-бурую окраску, а способность семян к прорастанию in vitro полностью
утрачивается. У С. macranthon отдельные клетки внутреннего интегумента
остаются живыми до 50-55 дней после опыления, и в них хорошо
просматриваются ядра. Семена данного вида отчасти сохраняют способность к прорастанию in
vitro до поздних стадий созревания (Куликов, Филиппов, 1998).
В целом, орхидные умеренной зоны приобретают способность к
асимбиотическому прорастанию in vitro на более ранних стадиях своего развития, чем
представители тропических и субтропических групп данного семейства. Наилучший
результат в случае Listera ovata был получен при посеве семян на стадии трехклеточ-
ного зародыша. У Dactylorhiza baltica и D. maculata семя приобретает способность
к прорастанию через 7 дней после оплодотворения (т.е. через 25 дней после
опыления). По сравнению с вышеуказанными видами в случае Bletilla striata семена
способны прорастать только через 60 дней после оплодотворения (т.е. через 90 дней
после опыления). Развитие протокормов в асимбиотической культуре, наоборот,
происходит медленнее у Dactylorhiza (побег с зелеными листьями формируется в
течение 3—6 месяцев), чем у Bletilla (уже через 20 дней после прорастания
образуется проросток с листьями).
Результаты проведенных исследований позволяют заключить, что асимбиоти-
ческое культивирование in vitro незрелых семян на определенной,
специфичной для данного вида стадии развития является эффективным способом
получения проростков для большинства изученных видов, особенно обладающих
наиболее затрудненным прорастанием семян (виды родов Cypripedium и
Orchis, Epipactis palustris, Listera ovata, Dactylorhiza incarnata) (Куликов, 1991,
1995; Куликов, Филиппов, 1991, 1998; Филиппов, 1997; Pauw, Remphrey,' 1992!
Wagner, Hansel, 1994). Однако для отдельных видов — Cephalanthera longifolia,
Epipactis helleborine, E. atrorubens, Neottia nidus-avis, Hammarbya paludosa,
Epipogium aphyllum, Corallorhiza trifida — метод асимбиотического
культивирования незрелых семян in vitro не дал положительных результатов, что, возможно,
516
Системы репродукции
связано с недостаточными знаниями о репродуктивной биологии, типе покоя семян
и трофических потребностях развивающихся проростков данных видов.
Асимбиотическое культивирование зрелых семян. Как уже отмечалось
выше, одной из главных проблем размножения орхидных умеренной зоны
является то, что семена теряют способность к прорастанию в асимбнотической
культуре in vitro по мере созревания. Семена, изолированные на стадии вскры-
вания плода, обычно не прорастают. Возможны два механизма торможения
прорастания зрелых семян орхидных: 1) накопление ингибиторов прорастания,
например абсцизовой кислоты (Waes van, Debergh, 1986 a,b; Kinderen van der, 1987;
Semenova et al., 1992); 2) непроницаемость покровов семени (Burgeff, 1936;
Veyret, 1974; Lucke, 1981, 1982a,b).
Для снятия физиологического механизма торможения прорастания используют
длительное вымачивание семян в воде или стерильном питательном растворе
(Капо, 1968; Fast, 1982) либо длительную стратификацию семян при низких
положительных температурах после посева на среду (Borriss, Albrecht, 1969; Ballard,
1987; Semenova et al., 1992; Куликов, 1995; Филиппов, 1997). Такими способами
удается стимулировать прорастание у некоторых видов (Epipactis palustris,
Cypripedium reginae), в то время как для других они не дают положительных
результатов (Linden, 1980; Lucke, 1981; Waes van, Debergh, 1986 a,b; Riether,
1990). Поэтому правомерно предположение, что механизм торможения
прорастания в ряде случаев определяется не только ингибиторами прорастания, а может
иметь более сложную природу.
Одним из надежных способов стимулирования прорастания покоящихся семян
орхидных считается длительная их обработка раствором гипохлорита кальция или
натрия, одновременно стерилизующим семена и повышающим проницаемость
покровов семени (Linden, 1980; Lucke, 1982b; Waes van, Debergh, 1986 a,b; Riether,
1990). Однако прорастание Cypripedium calceolus и С. macranthon оказалось
возможным лишь при сочетании длительной предпосевной обработки зрелых семян
гипохлоритом (до полного отбеливания семенной кожуры) с последующей
холодной стратификацией высаженных на питательную среду семян. Это подтверждает
предположение, что такие семена обладают комбинированным покоем —
физическим, связанным с водонепроницаемостью покровов, и физиологическим,
связанным с физиологическим механизмом торможения прорастания.
Другими перспективными методами, приводящими к увеличению доли
прорастающих зрелых семян, являются: 1) механическая изоляция зародышей из семян и
2) предпосевная обработка семян гидролитическими ферментами, разрушающими
покровы семени (Андронова, 1986, 1988; Linden, 1992).
Так, у Dactylorhiza baltica изолирование зародышей из зрелых семян (на стадии
вскрывания плода) с помощью препаровальных игл обычно приводило к
увеличению процента прорастания зародышей в 10-15 раз по сравнению с интактными
зрелыми семенами. Однако зародыши D. incarnata, изолированные таким способом,
не прорастали (Табл. 2).
Обработка зрелых семян перед посевом цитазой стимулировала прорастание в 2
раза у D. baltica и способствовало появлению единичных протокормов у D.
incarnata (Табл. 3). Эти данные косвенно подтверждают наличие особой оболочки
вокруг зародыша зрелого семени D. incarnata (Lucke, 1981,1982b). Она
сохраняется при механическом изолировании зародыша и разрушается только под воздей-
Эмбриологические основы репродуктивных стратегий
517
ствием ферментов (Андронова, 1986,1988). По-видимому, данная оболочка
препятствует поступлению воды в клетки зародыша и является причиной
непрорастания семян и изолированных неферментативным способом зародышей. Это
предположение согласуется с результатами по длительному (4-5 недель)
вымачиванию зрелых семян D. incarnata, которое также приводило к их прорастанию
(Куликов, 1995; Филиппов, 1997).
Таблица 2:
Прорастание семян и зародышей, изолированных через 60 дней после начала цветения,
у некоторых видов рода Dactylorhiza в асимбнотической культуре in vitro
(по: Андронова, 1988)
Вид
D. baltica
зародыши
семена
D. incarnata
зародыши
семена
Среда
ОС
количество
посаженных (шт.)
63
237
60
60
количество
проросших (шт.)
12
5
0
0
%
20
2
0
0
ОС+торм.
количество
посаженных (шт.)
72
331
60
60
количество
проросших (шт.)
22
7
0
0
%
30
7.
0
0
Таблица 3:
Прорастание зрелых семян и зародышей Dactylorhiza baltica и D. incarnata
в асимбнотической культуре in vitro на модифицированной безгормональиой среде
Киудсона (семена после сбора и до посадки хранились 2 мес. при 8° С)
(по: Андронова, 1988)
Вид
D. baltica
зародыши
семена
семена, обработанные
цитазой
D. incarnata
зародыши
семена
семена, обработанные
цитазой
Количество посаженных
(шт.)
20
120
210
25
300
260
Количество проросших
(шт.)
1
13
44
0
1
13
%
5*
10
21
0
0
5
*Данные могут быть занижены в результате травмирования зародышей при изоляции из
семенной оболочки
518 Системы репродукции
Таким образом, для выведения семян орхидных из покоя наиболее
эффективно сочетание обработок, повышающих проницаемость их покровов и
устраняющих физиологический механизм торможения прорастания. Однако тот
факт, что такие обработки не позволили стимулировать прорастание зрелых семян
Cephalanthera longifolia, С. rubra, Epipactis helleborine, E. atrorubens, показывает,
что мы еще мало знаем о механизме покоя семян орхидных умеренной зоны.
В результате изучения асимбиотического прорастания in vitro зрелых семян
более 30 видов орхидных флоры России (Куликов, Филиппов, 1998) было показано,
что способность к прорастанию существенно различается у разных
систематических групп орхидных. Все представители примитивных корневищных орхидных —
подсем. Cypripedioideae и трибы Neottieae, а также подтрибы Orchidinae (Orchis,
Ophrys) — группы, исходно адаптированной к условиям средиземноморского лет-
незасушливого климата — характеризуются затрудненным прорастанием.
Напротив, зрелые семена распространенных преимущественно в более влажных районах
Северного полушария представителей подтрибы Gymnadeniinae (за исключением
Dactylorhiza incarnate.) можно отнести к более или менее легко прорастающим.
Также легко прорастают зрелые семена Coodyera repens — вечнозеленого
представителя преимущественно тропической группы (Spiranthoideae — Erythrodeae), a
семена вторично-наземных представителей подсем. Epidendroideae (Calypso
bulbosa, Liparis loeselii и др.) оказываются способными к прорастанию, но более
ослабленному и замедленному по сравнению с незрелыми семенами. Отсутствие
прорастания как зрелых, так и незрелых семян холомикотрофных бесхлорофилль-
ных видов (Epipogium aphyllum, Corallorrhiza trifida, Neottia nidus-avis),
вероятно, связано с неоптимальным составом питательных сред (Куликов, 1995).
Влияние экзогенных регуляторов роста на прорастание семян в асимбиоти-
ческой культуре in vitro. Литературные и собственные данные свидетельствуют
о том, что прорастание семян орхидных умеренной зоны в асимбиотической
культуре в значительной степени определяется наличием регуляторов роста в питательной
среде. Использование сред без регуляторов роста часто оказывается
неэффективным (Табл.1). Особенно важно это учитывать при культивировании незрелых
семян. Однако, влияние регуляторов роста на прорастание in vitro семян разных
групп орхидных существенно различается. У видов рода Dactylorhiza, семена
которых не обладают глубоким покоем, наличие регуляторов роста в среде не
увеличивает долю зрелых прорастающих семян, а более высокие концентрации регуляторов
роста (например, кинетин в концентрации 4 мг/л) вызывают ее заметное снижение
(в 2-5 раз) (Схемы 1, 2). В то же время регуляторы роста способствуют
значительному ускорению развития проростков Dactylorhiza в асимбиотической
культуре. Напротив, семена Cypripedium calceolus и С. macranthon неспособны
прорастать на среде без регуляторов роста (процент прорастания равен 0), тогда как
добавление ауксина или цитокинина в питательную среду в концентрации 0,5 — 2
мг/л существенно стимулировало прорастание семян (в разных вариантах опыта
20 — 76 %) (Схемы 3,4). Добавление в питательную среду только цитокинина
способствовало более значительному возрастанию доли прорастающих семян по
сравнению с вариантом питательной среды, содержащей только ауксин. Однако
рост значительного большинства образующихся протокормов останавливался на
ранней стадии, и для получения наибольшей доли активно растущих проростков
требовалось одновременное наличие ауксина и цитокинина в составе среды.
Схема 1. Прорастание семян Dactylorhiza maculata в асимбиотической культуре in uitro
на модифицированной питательной среде Харвейса с различным содержанием ауксина
и цитокинина (по: Филиппов, 1997)
ДОЛЯ
проросших
семян, %
ИУК, мг/л
4.0
кинетин, мг/л
Схема 2. Прорастание семян Dactylorhiza fuchsii в асимбиотической культуре in vitro
иа модифицированной питательной среде Харвейса с различным содержанием ауксииа
и цитокинина (по: Филиппов, 1997)
У^~~~~~]
ДОЛЯ
проросших
семян, %
1.0 кинетин, мг/л
Схема 3. Прорастание семяи Cypripcdium calceolus в асимбиотической культуре in vitro
иа модифицированной питательной среде Харвейса с различным содержанием ауксина
и цитокинииа (по: Куликов, 1995)
ДОЛЯ
проросших
семян, %
80-f
70+
60-1
50-
40-
30-
20
10
НУК, мг/л
кинетин, мг/л
Схема 4. Прорастание семяи Cypripcdium macranthon в асимбиотической культуре in vitro
иа модифицированной питательной среде Харвейса с различным содержанием ауксина
и цитокинииа (по: Куликов, 1995)
ДОЛЯ
проросших
семян, %
70 -S
бо y
50 Y
40-К
30-Г
20Г
ю|
ом
^т_
Вр?
/^ 1"
0^
0.5
НУК, мг/л
1.0
1.0
0.5
кинетин, мг/л
Эмбриологические основы репродуктивных стратегий 521
Подводя итог многолетним экспериментам по культивированию семян и
проростков орхидных умеренной зоны, можно заключить, что зависимость процессов
прорастания семян и развития проростков от концентраций регуляторов роста в
питательных средах и их соотношения видоспецифична. Для одних видов
прорастание семян стимулируется фитогормонами, а у других — нет или даже ингибируется.
Однако их отсутствие в питательной среде приводит к замедленному развитию
проростков большинства изученных видов орхидных умеренной зоны. Только
применение экзогенных ауксинов и цитокининов позволяет достигнуть
скорости роста асимбиотических проростков, сравнимой с наблюдаемой в симбио-
тической культуре (Harvais, Hadley, 1967; Hadley, Harvais, 1968; Borriss, Voigt,
1986). Велика вероятность того, что в природных условиях поставщиками
экзогенных регуляторов роста, необходимых для развития проростков, являются симбио-
тические грибы (Hadley, 1970; Stoutamire, 1974).
Симбиотическое культивирование семян in vitro. Первые исследователи по-
слесеменного развития орхидных считали, что заражение микоризным грибом
является необходимым условием прорастания семян в природе (Bernard, 1909;
Burgeff, 1936). Подобных взглядов придерживаются и некоторые другие авторы
(Warcup, 1973; Clements, Ellyard, 1979; Filipello Marchisio et al., 1985; Clements,
1988). Однако имеются серьезные основания для того, чтобы считать два
процесса — прорастание семени и установление симбиотическнх
взаимоотношений — независимыми друг от друга. Известно, что у некоторых видов орхидных
процессы, происходящие на начальных стадиях прорастания — поглощение воды,
увеличение размеров зародыша и использование запасных питательных веществ —
белков и жиров — могут протекать без заражения грибом, на питательных средах,
не содержащих Сахаров, или просто в дистиллированной воде (Eiberg, 1969;
Stoutamire, 1974; Fast, 1978, 1982; Hadley, 1982; Smreciu, Currah, 1989). Однако
при этом рост протокормов останавливается на ранней стадии их развития, а
возобновление его происходит только после проникновения в клетки протокорма
совместимого микосимбионта. Кроме того, у тех видов орхидных, у которых внутренний
слой семенной кожуры состоит из кутина, прорастание семян вообще не может
стимулироваться симбиотическими грибами из-за неспособности последних
расщеплять кутин (Lucke, 1981). С другой стороны, несимбиотическая почвенная
микрофлора может стимулировать прорастание покоящихся семян за счет выделения
ферментов, фитогормонов или изменения физико-химических показателей среды
(в частности, окислительно-восстановительного потенциала) (Weinert, 1990).
Обычно достаточно легко удается получить симбиотическое прорастание in vitro
зрелых семян Dactylorhiza maculata, D. fuchsii, Neottianthe cucullata, Platanthera
bifolia, Gymnadenia conopsea, Coeloglossum viride, Coodyera repens, Malaxis
monophyllos. Из видов, зрелые семена которых не прорастают в асимбиотической
культуре, симбиотическое прорастание было получено лишь у Dactylorhiza incarnata
и в единичных случаях у Epipactis palustris. Прорастание семян видов рода
Cypripedium и трибы Neottieae не удавалось получить ни с их собственными эндофи-
тами (хотя некоторые из них стимулировали рост протокормов Cypripedium,
предварительно выращенных в асимбиотической культуре), ни с активными микосимбион-
тами легкопрорастающих видов. При этом отдельные грибы, полученные из видов с
затрудненным прорастанием зрелых семян (Cypripedium calceolus, С. macranthon),
были способны стимулировать прорастание и рост проростков легкопрорастающих
522
Системы репродукции
видов (Neottianthe cucullata). Таким образом, грибы, со значительной долей
вероятности являющиеся природными симбионтами орхидных с затрудненным
прорастанием, оказались неспособны стимулировать прорастание их покоящихся семян.
Степень специфичности микоризного симбиоза у орхидных колеблется в
чрезвычайно широких пределах (Curtis, 1939; Harley, 1959; Harvais, Hadley,
1967; Dijk, 1988). Хотя обнаружен ряд примеров высокоспецифичного симбиоза
(Warcup, 1973; Ramsay et al., 1986), в целом специфичность наблюдается обычно не
на видовом уровне, а на уровне более крупных систематических групп (Clements et
al., 1986). Среди исследованных нами видов довольно высокая степень
специфичности симбиоза была отмечена у Coodyera repens, Platanthera bifolia, Coeloglossum
viride, прорастание семян и развитие проростков которых стимулировались главным
образом их собственными эндофитами или однотипными с ними по облику грибами,
выделенными из других видов. Neottianthe cucullata и Dactylorhiza incarnata в
природе, по-видимому, также обладают высокоспецифичным симбиозом, но in vitro
прорастание их семян и рост проростков могут стимулироваться и грибами, полученными
из других видов орхидных и внешне совершенно несходными с их природными
симбионтами. Наконец, Dactylorhiza maculata имеет наименьшую среди изученных
видов симбиотическую специфичность: обильное прорастание семян и успешное
развитие проростков этого вида были получены с весьма разнообразными по облику
грибами, выделенными из 10 разных видов орхидных. Состав природных симбионтов
D. maculata в различных местообитаниях также довольно разнообразен.
Доля прорастающих семян и скорость роста проростков в симбиотической
культуре значительно варьируют у разных видов. Прн использовании
наиболее активных грибных нзолятов скорость развития проростков может в
несколько раз превышать таковую в асимбиотической культуре.
Например, симбиотические проростки Neottianthe cucullata и Gymnadenia
odoratissima уже через 2 мес. после посева имели развернутые зеленые листья
и корни и начинали образовывать побеги возобновления, на которых вскоре
формировались корнеклубни. В асимбиотической культуре in vitro проростки
данных видов развивались до той же стадии значительно медленнее (6-12
мес). Растения, высаженные в природу, зацветали на 3-4-й год после посева
семян (Zakharova, Batygina, 1996).
Морфогенез проростков в культуре in vitro и в естественных условиях
произрастания. Несмотря на то, что морфогенез проростков внетропических видов
орхидных изучается с середины прошлого века (Irmisch, 1853), особенности
развития многих представителей этой группы в природных местообитаниях до сих пор
исследованы явно недостаточно (Moller, 1987b). Метод асимбиотического
культивирования проростков in vitro позволяет существенно облегчить изучение ранних
стадий онтогенеза орхидных умеренной зоны, но вопрос о соответствии процессов
морфогенеза в асимбиотической культуре и в природных условиях продолжает
оставаться дискуссионным.
Обычно считается, что различия между проростками орхидных,
развивающимися in vitro и in vivo, касаются лишь незначительных деталей, например формы и
степени утолщения протокормов (Veyret, 1974). Однако существенные различия
между условиями роста в природе и асимбиотической культуре могут вызывать
возникновение in vitro форм послесеменного развития, резко отличающихся от
наблюдаемых в природе (Moller, 1987а; Куликов, 1995; Филиппов, 1997).
Эмбриологические основы репродуктивных стратегий
523
У асимбиотических проростков Cypripedium может наблюдаться
формирование вторичных протокормоподобных структур, образование нескольких точек
роста на одном протокорме, формирование каллуса, что нехарактерно для
проростков, обнаруживаемых в природных местообитаниях. На более поздних стадиях
развития асимбиотические проростки Cypripedium и Listera ovata отличаются от
наблюдаемых в природе существенным увеличением числа и размеров
придаточных корней, развивающихся на первичном побеге до перехода его к
формированию надземных ассимилирующих листьев, а также склонностью осей первичных
побегов к ветвлению.
У асимбиотических проростков Calypso bulbosa быстро формируется побег с
единственным зеленым листом и туберидием, а уже после этого начинается
разрастание базальнои части протокорма, приводящее к формированию коралловидной
структуры. В природных условиях, наоборот, коралловидное разрастание
(ветвление, согласно Виноградовой, Филину, 1993) протокорма предшествует развитию
надземного побега.
У представителей трибы Orchideae на ранних стадиях развития in vitro нередко
встречается сильное вытягивание протокормов в длину, не наблюдаемое в
природных условиях. На более поздних этапах развития асимбиотические проростки
отличаются от наблюдаемых в природе (а также в симбиотической культуре)
увеличением числа и размеров придаточных корней на первичном побеге, задержкой
развертывания ассимилирующих листьев, торможением или полным отсутствием
дифференциации побегов возобновления с формирующимися на них корнеклубня-
ми. Вместо этого часть придаточных корней, развившихся на первичном побеге,
утолщается и приобретает облик запасающих органов. Таким образом,
особенностью асимбиотических проростков видов трибы Orchideae является более
длительный моноподиальный рост первичного побега и задержка или полное отсутствие
перехода к симподиальному росту. Эти особенности морфогенеза могут быть
связаны с влиянием экзогенных регуляторов роста, входящих в состав питательных
сред, и неоптимальным температурным режимом культивирования.
Для большинства исследованных видов орхидных умеренной зоны (за
исключением представителей подсем. Spiranthoideae — Spiranthes amoena и вечнозеленой
Coodyera repens) характерна четкая сезонная периодичность роста in vitro, однако
совпадения ритма развития проростков в условиях in vitro с наблюдаемым в
природных местообитаниях не обнаруживается. Проростки Cypripedium и ряда
представителей трибы Orchideae, развивающиеся in vitro, после образования почки с
зачатками надземных ассимилирующих листьев впадают в покой. После
содержания в течение 3-4 мес. при пониженной температуре (2-5°С) проростки
развертывают зеленые листья и образуют на первичных побегах почки возобновления, из
которых после второго периода покоя развиваются побеги следующей генерации и,
таким образом, происходит переход к симподиальному росту. Иногда рост побегов
удается стимулировать без периода охлаждения путем пересадки на свежую среду,
но в дальнейшем такие проростки не переходят к нормальному чередованию
периодов роста и покоя. У ряда видов (Calypso bulbosa, Liparis loeselii, Malaxis
monophyllos) для прохождения покоя проросткам не требуется охлаждение, и их
рост сохраняет нормальную периодичность при постоянной комнатной
температуре. Таким образом, для представителей первично-наземных групп орхидных,
эволюционная история которых наиболее тесно связана с умеренной зоной, характерна
524
Системы репродукции
потребность в низких температурах для прохождения покоя, тогда как
представители преимущественно тропических групп сохраняют сезонный ритм роста при
высоких температурах или обладают непрерывным ростом (Goodyera repens).
В настоящее время накоплен большой фактический материал по изучению
развития протокормов орхидных умеренной зоны in vitro (см. Эмбриогенез
орхидных, Т. 2; Протокорм). Однако, подробные данные по морфогенезу проростков в
естественных условиях, начиная от прорастания семян и до формирования юве-
нильных растений, до сих пор единичны. Тем не менее имеющиеся результаты, хотя
и немногочисленные, указывают на сходство в морфологии протокормов,
формирующихся in situ и в культуре in vitro, на ранних (Batygina, Andronova, 2000) и
существенные различия на более поздних стадиях развития. В связи с этим,
очевидно, что для понимания процесса развития проростков в природных условиях
нельзя опираться только на изучение морфогенеза проростков в культуре in
vitro. С другой стороны, не имеется достоверных сведений о том, что и в
природных условиях развитие проростков одного и того же вида протекает абсолютно
одинаково и не зависит от погодных условий либо от географического местоположения
популяции.
Андронова, 1986, 1988; Виноградова, Филин, 1993; Куликов, 1991, 1995; Куликов, Филиппов,
1991, 1998; Филиппов, 1997; Arditti, 1982; Ballard, 1987; Batygina, Andronova, 2000; Bernard,
1909; Borriss, Albrecht, 1969; Borriss, Voigt, 1986; Burgeff, 1936; Clements, 1988; Clements, Ellyard,
1979; Clements et al., 1986; Curtis, 1939; Dijk, 1988; Eiberg, 1969; Fast, 1978, 1982; Filipello
Marchisio et al., 1985; Hadley, 1970, 1982; Harley, 1959; Harvais, Hadley, 1967; Hadley, Harvais,
1968; Irmisch, 1853; Kano, 1968; Kinderen van der, 1987; Linden, 1980,1992; Lucke, 1981,1982 a,b;
Moller, 1987 a,b; Pauw, Remphrey, 1992; Ramsay et al., 1986; Riethcr, 1990; Semenova et al., 1992;
Smiresiu, Currah, 1989; Stoutamire, 1974; Veyret, 1974; Waes van, Debergh, 1986 a,b; Wagner,
Hansel, 1994; Warcup, 1973; Weinert, 1990; Zakharova, Batygina, 1996.
СОСТОЯНИЕ ПОПУЛЯЦИЙ CYMNADENIA CONOPSEA (L.) R. BR.
(ORCHIDACEAE) В РАЗЛИЧНЫХ ФИТОЦЕНОЗАХ
Кокушник комарниковый (Gymnadenia conopsea) — одна из наиболее
распространенных северных орхидей в Европе, встречающаяся также в Японии и
Китае. Это многолетнее травянистое растение, относящееся к группе корнеклуб-
невых орхидей с пальчатораздельными корнеклубнями (Серебряков, 1952; Вах-
рамеева и др., 1993). Ежегодно побеговая система обновляется за счет
образования почки возобновления и молодого корнеклубня, при этом прошлогодние побег
и корнеклубень отмирают. Таким образом, кокушник относится к вегетативным
однолетникам (Высоцкий, 1915). Для обозначения подземных структур корне-
клубневых орхидей употребляется термин «стеблекорневой тубероид» (Dressier,
1981; Татаренко, 1996, 1997).
В изучении онтогенеза и выделении возрастных состояний орхидных существует
ряд дискуссионных проблем, связанных прежде всего с методикой исследований и
терминологией. В фитоценологии разработана и широко применяется универсальная
классификация периодов онтогенеза высших растений, согласно которой различают
четыре группы (периода) возрастных состояний: 1) латентный (период покоящихся
семян); 2) виргинильный (от прорастания семени до первого цветения); 3) генера-
Эмбриологические основы репродуктивных стратегий
525
тивный (период семенного размножения); 4) сенильный (старческий) (Работнов,
1946, 1950 а,б, 1964; Уранов, 1967,1975; Ценопопуляции растений, 1976).
Одним из наиболее сложных вопросов при изучении ранних этапов онтогенеза
орхидных является трактовка структур, формирующихся при прорастании семян.
Прежде всего, дискуссионным остается понимание таких терминов, как
«проросток» и «протокорм» (см. Протокорм). Одни авторы эти термины разделяют и
рассматривают проросток как фазу развития между протокормом и ювенильным
растением (Гапоненко, 1992; Блинова, 1995). Другие под проростком орхидных
понимают структуру, появляющуюся при прорастании семян и существующую
вплоть до того момента, когда в ней заложится апекс надземного побега (Вахрамее-
ва, Денисова, 1993 а,б; Татаренко, 1996; Баталов, 1998).
Необходимым условием изучения онтогенеза орхидных является
использование таких методик, которые не наносят ущерб популяциям этих редких
растений. В связи с этим возрастные состояния орхидей оценивают по морфометри-
ческим и морфологическим признакам надземной части растений, например, по
числу и размерам фотосинтезирующих листьев, количеству жилок,
присутствию соцветия и некоторым другим (Вахрамеева, Денисова, 1983а,б; Блинова,
1995; Татаренко, 1996). Исследование подземных органов возможно лишь в
исключительных случаях.
У корнеклубневых орхидей достаточно трудно выделить группу имматурных
растений, для ее определения используют помимо вышеперечисленных
характеристик число придаточных корней, а также число лопастей и размеры корнеклубня.
Еще одной их особенностью является объединение в группу взрослых
вегетативных растений как виргинильных, так и «отдыхающих» генеративных особей.
Группу генеративных растений нельзя разделить на молодые, средневозрастные и
старые особи. Невозможно выделить и сенильное состояние, так как отмирание
растения происходит после очередного цветения либо после пребывания в нецветущем
состоянии 1-2 года.
К настоящему времени онтогенез кокушника комарникового в естественных
условиях изучен довольно подробно, за исключением латентного периода и периода
прорастания (Ziegenspeck, 1936; Вахрамеева, Виноградова и др., 1993; Блинова,
1995; Баталов, 1998).
Семена С conopsea мелкие — 0,2x0,7 мм (Fuller, 1978). В среднем в коробочке
содержится приблизительно 1100-1300 семян (Баталов, 1998). Способность зрелых
семян прорастать на искусственных питательных средах,сразу после посева
(Куликов, 1995; Куликов, Филиппов, 1998; см. также Репродуктивная стратегия
орхидных умеренной зоны) позволяет предположить, что семена данного вида могут
начать прорастание сразу после высыпания их из плода и попадания в почвенный
субстрат при наличии оптимальных условий. Прорастание семян и первые этапы
развития протокормов, по-видимому, не отличается от таковых у других бореальных
корнеклубневых орхидей (например, Dactylorhiza — Виноградова, 1999).
Протокормы кокушника встречаются на глубине 2-4 см, на границе слабо
разложившейся подстилки (дерновины) и гумусового горизонта или чуть ниже.
Обнаружены три группы протокормов: рг{ — беловатые, почти шаровидной формы,
около 1 мм, с едва заметной почкой; рг7 — более крупные, удлиненно-кубаревидной
формы, длиной около 2,5 мм, в самой широкой части до 2 мм в диаметре, у
основания почки заметен первый чешуевидный лист; рт — на втором междоузлии первич-
526
Системы репродукции
ного побега (длина его достигает 3 мм) развивается первый придаточный корень. В
пазухе второго чешуевидного листа заложена почка, несущая зачаток надземного
побега с первым фотосинтезирующим листом и корнеклубнем. Можно
предположить, что каждая из описанных групп протокормов — рг, рг?, рг — соответствует
первому, второму и третьему году их развития от начала прорастания семян.
Отсюда следует, что длительность холомикотрофного периода у С conopsea в данных
эколого-фитоценотических условиях составляет, по-видимому, три года .
После стадии проростка растение вступает в ювенильное возрастное
состояние, что происходит, вероятно, на четвертый год его развития. Ювенильные
растения отличаются от проростков прежде всего тем, что переходят к автотрофному
способу питания. Первый зеленый лист линейно-ланцетный, 5-7,8 см длиной,
0,4-0,7 см шириной с 2-4 жилками. Корнеклубень веретеновидный, 0,5-0,8 см
длиной, до 0,5 см шириной, придаточных корней 1-2. При переходе проростка в
ювенильную стадию моноподиальное нарастание меняется на симподиальное,
которое сохраняется в течение всей дальнейшей жизни растения. Ювенильная
стадия, по нашим наблюдениям, длится обычно один-два года.
Имматурные особи обладают двумя, реже тремя линейно-ланцетными
листьями 7-9 см длиной, 0,7-0,9 см шириной. Количество жилок увеличивается до 5-7.
Корнеклубень двух-, трехлопастной. Его высота слегка превышает ширину.
Придаточных корней 2-3. В этом состоянии растение пребывает 2-3 года.
Экземпляры взрослых вегетативных особей имеют три-шесть узко-ланцетных
листа 9-12 см длиной, 0,9-1,4 см шириной с 8-11 жилками. Корнеклубень
трех-пяти-лопастный. Придаточных корней 4-6. Обычно между завершением им-
матурной стадии и первым цветением проходит 2-3 года. Для С conopsea
характерны частые перерывы в цветении, поэтому значительную часть взрослых
вегетативных растений составляют «отдыхающие» генеративные экземпляры.
Генеративные особи имеют полурозеточные побеги, несущие четыре-шесть
нормально развитых фотосинтезирующих листьев с 10-15 жилками, а также
несколько (2-6) верховых листьев, внешне сходных с прицветными, но не несущих в
своих пазухах цветков. Соцветие — довольно густой колос цилиндрической формы
6-16 см длиной, из 15-76 цветков. Подземные органы во многом сходны с
таковыми взрослых вегетативных растений: число корневых окончаний и придаточных
корней 5-7. В благоприятных условиях длительность генеративной стадии может
превышать 10 лет, в то время как при постоянном вытаптывании и сборе букетов
она значительно сокращается (иногда до 4-6 лет). Отмирание особи происходит
обычно после очередного цветения.
Проведенные наблюдения позволяют предположить, что длительность
онтогенеза С conopsea в благоприятных условиях составляет не менее 25-30 лет.
Были изучены ценопопуляции кокушника в различных фитоценотических
условиях. На материковых суходольных лугах исследовали влияние выпаса различной
интенсивности и сенокошения, в сосняках разнотравных — рубок. Самая высокая
плотность (до 19 особей на 1 м ) отмечена в ценопопуляции на трясун-
ково-разнотравном лугу. Этот луг не используется для выпаса или сенокошения,
возможна небольшая рекреационная нагрузка осенью во время сбора грибов,
существенно не влияющая на состояние ценопопуляции. В возрастном спектре преобла-
Возможио, что рг,и р., г— это протокормы первого года жизни, тогда подземный период жизни
может составлять 2 года (ред.)
Эмбриологические основы репродуктивных стратегий
527
дают генеративные особи (46-61%). Ювенильные и имматурные составляют от 20
до 30%. За период с 1991 по 1998 гг. плотность ценопопуляции оставалась
стабильно высокой.
В сосняке разнотравном и сосняке разнотравном с осиной плотность
ценопопуляции намного меньше (3,5-3,8 особей на 1 м в первом ценозе, 2,5-3,0 особей —
во втором). В возрастном спектре преобладают взрослые вегетативные особи
(30-42% и 36-50%, соответственно), генеративные составляют не более 39% в
сосняке разнотравном и 32% в сосняке с осиной. Количество возрастно незрелых
растений нестабильно в обоих сообществах и сильно меняется по годам, что
свидетельствует о нерегулярном семенном возобновлении этих ценопопуляции,
по-видимому, из-за отсутствия надежных опылителей.
На вырубке сосняка, наоборот, плотность ценопопуляции выше (5,4-6,3 особей
на 1 м ). Доминируют генеративные особи (32-36%) при высокой суммарной доле
ювенильных и имматурных растений (31-40%). Стабильная плотность и
постоянство возрастного спектра свидетельствуют о способности С conopsea поселяться
во вторичных местообитаниях.
Ценопопуляция на сенокосном душистоколосково-трясунково-разнотравном
лугу сохраняет высокую плотность (8,8-9,4 особей на 1 м ). Возрастной спектр
стабилен. Доминируют генеративные особи (35-42 %). Численность
ювенильных растений меняется от 9 до 18%, но группа возрастно незрелых растений
стабильна. Сенокошение проходит в период плодоношения С conopsea, что
обеспечивает семенное возобновление ценопопуляции. каление надземных частей
побегов других растений увеличивает освещенность, и это благоприятно отражается
на способности к фотосинтезу молодых растений кокушника, практически не
повреждающихся при скашивании.
Ценопопуляция на ползучеклеверово-разнотравном лугу, периодически
используемом для перегона крупного рогатого скота («выпас малой интенсивности»), за
период наблюдений несколько снизила свою плотность (с 10,2 до 8,5 особей на 1 м ). В
возрастных спектрах доминируют генеративные растения (32-35%). Ювенильные и
имматурные растения в общей сложности составляют около 40%. Очевидно, во
время выгона скота повреждаются более крупные растения, а некоторое (несильное)
уплотнение почвы, вероятно, способствует активизации грибов-симбионтов. В то же
время при вытаптывании смертность молодых его растений выше, чем на невыпасае-
мых участках. Таким образом, в условиях слабого выпаса, не вызывающего
заметного изменения в составе фитоценоза и не приводящего к сильному уплотнению почвы,
ценопопуляции С conopsea могут сохраняться.
В условиях «интенсивного выпаса» (ежедневный выпас в течение большей
части лета) на кульбабово-разнотравном лугу происходит оезкое снижение
плотности ценопопуляции С conopsea (до 2,4 особей на 1 м ). В возрастном
спектре преобладают взрослые вегетативные особи. Возрастные спектры
нестабильны. Доля ювенильных и имматурных растений колеблется от 40 до
20%, вследствие высокой элиминации особей этих групп. Семенное
возобновление затруднено из-за низкой доли генеративных растений и неблагоприятных
условий для прорастания семян и приживаемости всходов (сильное уплотнение
почвы, постоянное вытаптывание).
Таким образом, на суходольных лугах при отсутствии антропогенных
нагрузок или их слабой интенсивности ценопопуляции С conopsea сохраняют ста-
528
Системы репродукции
бильную плотность и устойчивые возрастные спектры. Скашивание угодий во
время плодоношения кокушника не отражается отрицательно на семенном
возобновлении и уровне жизненности ценопопуляций. Интенсивный выпас
однозначно нарушает устойчивое состояние ценопопуляций: снижается плотность,
соотношение возрастных групп заметно варьирует по годам, увеличивается
элиминация особей (особенно прегенеративных стадий), сокращается
длительность генеративного периода.
Вырубки, приводящие к увеличению освещенности, положительно
сказываются на состоянии лесных ценопопуляций С conopsea, что проявляется в
увеличении плотности, активизации семенного возобновления и стабилизации
соотношения возрастных групп.
Любую ценопопуляцию орхидных можно представить в виде трех
взаимосвязанных группировок: семян, протокормов-микоризомов и автотрофных особей.
Особый интерес представляет рассмотрение роли ранних (холомикосимбиотроф-
ных) стадий онтогенеза в функционировании популяций орхидных. В связи с этим
на однородном участке трясунково-разнотравного материкового суходольного луга
была заложена пробная площадь 45 м и проведен учет автотрофных особей всех
возрастных состояний. Генеративные особи были закартированы в масштабе 1:25.
После этого случайным образом были выбраны 12 модельных генеративных
растений, которые стали центрами учетных площадок радиусом 25 см каждая. Таким
образом, общая поверхность учетных площадок составила чуть менее 2,5 м или
приблизительно 12% от всей пробной площади (Баталов, 1998).
В пределах каждой площадки выделяли пять зон по удаленности от
центрального генеративного растения: А (круг радиусом 5 см), Б (концентр,
ограниченный радиусами 5 и 10 см), В (от 10 до 15 см), Г(15-20 см), Д (20-25 см).
Соответствующие концентры подрезали по окружности острым ножом на
глубину 4-5 см, затем делили их на сектора так, чтобы длина дуги наружной
окружности была около 5 (или чуть более) см. Полученные пробы почвы
вырезали ножом и рассматривали их содержимое на фоне темной бумаги, используя
при необходимости ручную лупу. Просмотр проб проводили от центра к
периферии. Исследованные пробы возвращали на прежнее место, слегка уплотняя
почву. Обнаруженные протокормы картировали на схемах в масштабе 1 : 3, в
соответствии с их возрастом.
Основная часть протокормов возникает в непосредственной близости от
генеративных особей (в радиусе до 10 см). Сравнение плотности
протокормов рг с урожаем семян на 1 м показывает, что всхожесть семян очень
низкая (тысячные доли %).
Количество протокормов (prt + pr2 + рг}), по крайней мере, в два раза
превышает численность автотрофных особей. В возрастном спектре гемипопуляции
протокормов преобладает первая морфологическая группа. Соотношение численности рг;
: рг : рг -49,3 : 29,9 : 20,8 свидетельствует о высоком проценте гибели
протокормов. Кроме того, около половины проростков рг} гибнет при переходе к автотроф-
ному типу питания, в результате чего численность ювенильных растений составляет
42-50% от численности протокормов третьей группы.
Полученные данные свидетельствуют о необходимости дальнейших
исследований и разработки методик, позволяющих объективно и с минимальным ущербом
для популяций оценивать состояние дикорастущих видов орхидных. Рис. 30.
160
140 г
120
1004:
80
60
40
20
0
;X;X\^vX;X
* * ■
5 10 15 20 25
Расстояние от генеративного растения, см 2
Рис. 30. Состояние популяций Gymnadenia conopsea (Orchidaceae)
в различных фитоценозах.
1 — строение протокормов (рг;, рг2. рг}) ювенильных (;'), имматурных (im), взрослых
вегетативных (d d), генеративных (g) растений и цветка; 2 — количество протокормов в расчете на м на
различном удалении от генеративных растений (пунктирной линией обозначена средняя плотность
протокормов);
3.5 —|
2
1.5 4—
■jflHHH
1
I
1
1995 1996 1997 1998 8
=i
Ш
И
1993 19» 1997 1996
Рис. 30 (продолжение).
3-9 — количество растений па м на трясунково-разнотравпом лугу, не подвергающемуся
выкашиванию и вытаптыванию (3), на ползучеклеверово-разнотравном лугу (выпас малой интенсивности)
(4), на кульбабово-разнотравном лугу (интенсивный выпас) (5), на сенокосном душистоколос-
ково-разнотравном лугу (6), на вырубке сосняка (7), в сосняке разнотравном (8), в сосняке
разнотравном с осиной (9);
Рис. 30 (продолжение).
10-15 — морфометрические показатели растений, семенная продуктивность и урожай семян в
различных местообитаниях: на трясунково-разнотравпом лугу (А), на
ползучеклеверово-разнотравном лугу (Б), на кульбабово-разнотравном лугу (В), на вырубке сосняка (Д), в сосняке
разнотравном (Е): 10 — высота генеративного побега, 11 — длина соцветия, 12 — число цветков в соцветии,
13 — число семян в плоде, 14 — урожай семян в расчете на генеративный побег, 15 — урожай семян в
расчете на м ; вп- верхушечная почка, в ч л — второй чешуевидный лист, к к — корисклубень, пк-
придаточный корень, пп — пазушная почка, пчл — первый чешуевидный лист, т п — первичное
тело протокорма.
1-16 — Баталов, ориг.
532
Системы репродукции
Баталов, 1998; Блинова, 1995; Вахрамеева и др., 1993; Вахрамеева, Денисова, 1983а, б;
Высоцкий, 1915; Гапоненко, 1992; Куликов, 1995; Работнов, 1946, 1950а, б, 1964; Серебряков, 1952;
Татаренко, 1996,1997; Уранов, 1967,1975; Ценопопуляции растений, 1976; Dressier, 1981; Fuller,
1978; Ziegenspeck, 1936.
ВЛИЯНИЕ УСЛОВИЙ ЗАГРЯЗНЕНИЯ ОКРУЖАЮЩЕЙ СРЕДЫ
НА РЕПРОДУКЦИЮ РАСТЕНИЙ
Проблема защиты окружающей среды от загрязнений становится все более
актуальной. Определенные успехи достигнуты в изучении влияния внешних
факторов на биоту на разных уровнях ее организации — от ультраструктуры клеток до
экосистем в целом. Однако исследования реакций репродуктивных структур и
процессов на разнообразные загрязнения еще не получили достаточного развития.
Репродукцию растений можно представить в виде упрощенной схемы: цветок —
семя — проросток — ювенильное растение — взрослое растение. Репродуктивный
успех обусловлен целым рядом факторов: внутренними (биологическими,
проявляющимися на разных уровнях биоорганизации: организменном, популяционном и
т.д.) и внешними (экологическими). Особое место среди внешних факторов,
играющих критическую роль в регуляции репродуктивных процессов, занимают тип
загрязнения (кислый, щелочной, смешанный), концентрация загрязнителей и
продолжительность воздействия, а также форма их соединений (газообразные,
жидкие, твердые; доступные или недоступные для растений).
Как известно, цветок со всеми его элементами является наиболее уязвимым к
неблагоприятным факторам окружающей среды (Batygina, 1996). Атмосферное
загрязнение (SO , NO , HF, О и др.) и кислые дожди воздействуют как на развитие самого
цветка (размер, окраска, форма, число цветков), так и его отдельных элементов.
Например, оно влияет на размер, форму и химический состав пыльцы, количество и форму
апертур, скульптуру пыльцевого зерна, прорастание пыльцы и рост пыльцевой трубки,
причем in vitro наблюдается более значительный эффект по сравнению с ситуацией in
uiuo (Wolters, Martens, 1987; Глазунова, 1991; Rout, Varshney, 1996; Danielsson et al.,
1996; Бессонова и др., 1997; Дзюба, 1997). Сравнение чувствительности пыльцы
различных древесных растений к подкислению среды показало, что пыльца
лиственных деревьев (например, Acer saccharum и Betula allghaniensis) более чувствительна к
рН по сравнению с хвойными (Сох, 1983,1988).
Экспериментально доказано, что в присутствии тяжелых металлов относительный
успех опыления (% прорастания пыльцы и рост пыльцевых трубок) снижается
(Searcy, Mulcahy, 1985а, б; Сох, 1988). Обнаружена связь между количеством
аберраций в мейозе, стерильностью пыльцы, изменением ее размеров и накоплением
тяжелых металлов в цветочных почках, что позволяет рекомендовать пыльцу ряда растений
(например, Armeniaca vulgaris, Betula pendula, Impatiens balsamina, Lathyrus odoratus,
Tanacetum vulgare и др.) для биоиндикации загрязнения среды тяжелыми металлами
(Бессонова, 1994; Веселова др., 1996; Бессонова и др., 1997). Следует иметь в виду,
что на нарушения, вызванные окружающей средой, накладываются естественные
отклонения в развитии и строении пыльника и пыльцевого зерна.
Отрывочные сведения о воздействии загрязнения окружающей среды на
формирование и созревание плодов и семян не дают возможности в полном объеме вы-
Эмбриологические основы репродуктивных стратегий
533
явить влияние этого фактора на потенциальную и реальную семенную
продуктивность. В качестве примера можно привести данные Pare (1997) о нарушении
развития семени паразитного растения Striga gesneriodes под действием обработки
гербицидами. Оказалось, что наиболее чувствительными для обработки являются
прогамная фаза оплодотворения и ранний эмбриогенез. Обзор данных о снижении
числа, веса, размера семян и плодов под воздействием газообразных загрязнителей
и кислотных дождей сделан Wolters и Martens (1987). Некоторое снижение этих
показателей в условиях урбанизированной среды было отмечено Ткаченко и
Коробовой (1995). В то же время анализ массы семян и семенной продуктивности 16
видов травянистых растений, входящих в состав луговых сообществ, опушек и полян,
не выявил каких-либо ощутимых сдвигов этих показателей за 3 года, прошедших с
момента аварии на Чернобыльской АЭС (Попова и др., 1992). Варьирование
таких показателей, как число семян в одной ягоде и масса 1000 семян, у
представителей родов Vaccinium (V. myrtillus, V. vitis-idaea, V. uliginosum) и Empetrum (E.
hermaphroditum) в условиях загрязнения окружающей среды выбросами
металлургических комбинатов обусловлено межпопуляционной изменчивостью и не
связано с уровнем загрязнения среды (Лянгузова, Мазная, 1996; Мазная, Лянгузова,
1997; Лянгузова и др., 1998). Таким образом, необходимы дальнейшие
исследования семенной продуктивности растений в условиях различных типов загрязнения
окружающей среды для выявления чувствительных и устойчивых видов к этому
экологическому фактору.
Семенное размножение растений невозможно без успешного прорастания семян.
Выделить прямое воздействие загрязнения окружающей среды на этот процесс не
всегда удается. Так, например, лабораторная всхожесть семян растений, произраставших в
окрестностях металлургических предприятий, различалась в зависимости от
систематического положения растений. Семена Vaccinium myrtillus, V. vitis-idaea,
V. uliginosum, Arctostaphylos uva-ursi, Chamaenerion angustifolium имели высокую
всхожесть, достоверно не отличающуюся от контроля (Лянгузова, Мазная, 1996;
Мазная, Лянгузова, 1997; Лянгузова, 1998; Лянгузова и др., 1998). Всхожесть
Empetrum hermaphroditum и Solidago lapponica была значительно ниже по сравнению с
контролем, а семена Eriophorum polystachion совсем не прорастали (Лянгузова,
Мазная, 1996; Мазная, Лянгузова, 1997; Лянгузова, 1998). Аналогичные данные
получены по всхожести семян рудеральных и тривиальных видов растений, произрастающих
в условиях урбанизированной среды. Лабораторная всхожесть семян Anthemis
tinctoria, Capsella bursa-pastoris, Arctium tomentosum, Chamomilla suaveolens,
Leucanthemum vulgare, Melilotus albus, M. officinalis, Polygonum aviculare, Veronica
nemorosa, собранных в черте г. Санкт-Петербурга, была ниже по сравнению с
семенами из природных популяций. Всхожесть семян Plantago major и Rumex confertus из
городских и природных местообитаний не различалась, а у образца Tripleurospermum
inodorum, собранного в 15-20 м от бензоколонки, всхожесть была наибольшей из всех
исследуемых образцов этого вида (Ткаченко, Коробова, 1995). Прорастание семян
Acacia Senegal, Haloxylon recurvum, Prosopis juliflora стимулировалось в загрязненной
воде и при их проращивании на экстрактах из загрязненных почв, в то время как
лабораторная всхожесть семян Suaeda monoica резко снижалась в этих условиях (Iqbal,
Qadir, 1973). Отмечено, что виды с надземным прорастанием в целом обладают
большей чувствительностью к загрязнению окружающей среды по сравнению с растениями
с подземным прорастанием семян (Smith, 1981).
534
Системы репродукции
Различия в реакции репродуктивной сферы растений на загрязнение
окружающей среды могут быть связаны не только с их видовыми особенностями, но и с
формированием устойчивых популяций. В экспериментальных условиях показано, что
потомство популяций Bromopsis inermis, произраставших на промплощадках
металлургических и коксохимических производств, более устойчиво к повышенному
содержанию двуокиси серы в атмосфере и меди и цинка в почве (Коршиков, Михе-
енко, 1992). Формирование металлоустойчивых популяций в условиях
естественного обогащения почв тяжелыми металлами выявлено у Aster alpinus, Salvia
stepposa и др. (Растения в экстремальных условиях минерального питания, 1983;
Устойчивость к тяжелым металлам дикорастущих видов, 1991). Изучение процесса
естественного самозарастания золоотвалов тепловых электростанций Урала
показало, что ценопопуляции пионерных видов сем. Chenopodiaceae (Chenopodium
album, Atriplex nitens) характеризуются значительным разнообразием особей по
жизненному состоянию, что, по-видимому, является следствием полиморфизма
формирующихся в этих условиях семян (Серая, 1979).
В растениях существует несколько защитных систем, препятствующих
поступлению в них токсических веществ: почва-корень, корень-лист,
растение-репродуктивные органы (см. Растения в экстремальных условиях
минерального питания, 1983; Лесные экосистемы и атмосферное загрязнение, 1990).
Подтверждением этой гипотезы может служить тот факт, что содержание тяжелых
Таблица:
Содержание Ni и Си (мг/кг сухого вещества) в перегнойио-аккумулятивном горизонте
подзолистых почв (вытяжка 1 N HCI), листьях и семенах ягодных кустарничков
на разном удалении от комбината «Североникель» (Мурманская обл.)
(по: Лянгузова, Мазная, 1996)
Вид
Vaccinium uliginosum
листья
семена
V. myrtillus
листья
семена
V. vitis-idaea
листья текущего года
семена
Empetrum hermaphrodiium
листья
семена
Расстояние от источника загрязнения, км
65
контроль
Ni
2,5
3,1
5,0
2,5
2,3
3,0
6,6
1,7
Си
5,3
2,1
6,4
12,0
6,7
1,1
7,5
5,8
30
Ni
15,1
5,1
22,0
6,4
14,0
7,2
14,5
2,9
Си
8,0
4,8
—
11,0
6,8
1,2
10,5
4,6
15
Ni
86,0
9,2
92,0
11,0
42,0
16,0
53,0
7,1
Си
31,5
10
29,5
15,0
13,5
3,6
34,4
9,2
Эмбриологические основы репродуктивных стратегий 535
металлов в семенах как культурных, так и дикорастущих видов значительно ниже,
чем в других органах растений. В качестве примера приведены данные о
содержании никеля и меди в семенах и листьях некоторых ягодных кустарничков при
разном уровне загрязнения почв этими.металлами (Табл.). Таким образом, одной из
возможных причин устойчивости генеративной сферы растений к действию
тяжелых металлов может быть ограничение поступления загрязнителей в
репродуктивные органы, в частности, в семена.
Бессонова, 1994; Бессонова, Лыженко, 1991; Бессонова и др., 1997; Веселова и др., 1996;
Глазунова, 1991; Дзюба, 1997; Коршиков и др., 1990; Лянгузова, 1998; Лянгузова и др., 1998;
Лянгузова, Мазная, 1996; Мазная, Лянгузова, 1997; Попов и др., 1992; Растения в экстремальных
условиях минерального питания, 1983; Серая, 1979; Ткаченко, Коробова, 1995; Устойчивость к
тяжелым металлам дикорастущих видов, 1991; Batygina, 1996; Сох, 1983, 1988; Danielsson et al.,
1996; Iqbal. Qadir, 1973; Pare, 1997; Searcy, Mulcahy, 1985 а,в; Smith, 1981; Wolters, Martens,
1987.
Литература 537
ЛИТЕРАТУРА
Авдошеико А. К. Семенное размножение брусничных // ДАН СССР. Новая серия. 1948.
60(5): 897-899.
Авдошенко А. К. Биология северных брусничных // Учеи. зап. Ленинград, гос. пед. ии-та.
1949. 82:181-217.
Аверьянов Л. В. Основные пути морфологической эволюции в семействе Orchidaceae // Бот.
жури. 1991. 76(7): 921-935.
Айала Ф. Введение в популяциоиную и эволюционную генетику. М.: Мир, 1984: 1-230.
Айала Ф. Современная генетика. М.: Мир, 1988: 1-335.
Акопян Ж. А. Биология Seidlitzia florida (Chenopodiaceae) // Бот. журн. 1983. 68(6): 788-794.
Алаторцева Т. А. Культура завязей кукурузы в связи с апомиксисом: Дисс.... канд. биол. наук.
Саратов, 1994.
Алаторцева Т. А., Тырнов В. С. Сравнительное изучение развития иеоплодотворенных завязей
апо- и амфимиктичных линий кукурузы in vitro // Тр. Межд. симп. "Апомиксис у растений:
состояние проблемы и перспективы исследований." Саратов, 1994: 8-9.
Александрова В. Д. Геоботаиическое районирование Арктики и Антарктики (Комаровские
чтения, XXIX). Л.: Наука, 1977:1-187.
Алексеева X. А. Биология прорастания семян черники обыкновенной // Брусничные в СССР.
Ресурсы, интродукция, селекция. Новосибирск: Наука, 1990: 8-9.
Алиханян С. И. Общая генетика. М.: Высшая школа, 1985: 1-445.
Алтухов Ю. П. Генетические процессы в популяциях. М.: Наука, 1989: 1-328.
АльтерготВ. Ф., МордковичС. С, Фадеева Л. Г. Тепловые нарушения развития мужского га-
метофита у яровой пшеницы // Физиол. и биохим. культ, растений. 1978.10(5): 451-455.
Англо-русский биологический словарь. М.: Русский язык, 1976:1-732.
Андреева И. И., Катаева Н. В., Матюхии Д. Л. Клоиальное микроразмиожение гладиолуса
гибридного, позволяющее моделировать процессы старения // Изв. ТСХА. 1990. 4: 98-104.
Андронова Е. В. Эмбриогенез и постсемениое развитие орхидных (на примере Dactylorhiza
baltica, D. incamata, Thunia marshalliana, Bletilla striata): Дисс.... каид. биол. наук. Л., 1988:1-225.
Андронова Е. В. Эмбриогенез орхидных / / Эмбриология цветковых растений. Терминология и
концепции / Ред. БатыгинаТ. Б. СПб.: Мир и семья, 1997.1: 544—556.
Андронова О. В. Культивуваиия in vitro иасшия i зародгав роду Dactylorhiza Nevski
(Orchidaceae) // Укр. ботаи. журн. 1986. 43(6): 79-81.
Анисимова Г. М. Гетерогенность семян у Vaccinium myrtillus (Ericaceae) // Тр. межд. конф. по
анатомии и морфологии растений. СПб, 1997: 8—9
Анисимова Г. М. Эмбриология черники (Vaccinium myrtillus, Ericaceae) в условиях
промышленного загрязнения // Тез. докл. Н(Х) съезда РБО "Проблемы ботаники на рубеже XX-XXI
веков". СПб, 1998.1: 98.
538 Системы репродукции
Антонова В. И. Различия раздельнополых особей вороники черной в онтогенезе // Биология,
экология и взаимоотношения ценопопуляций растений. Матер. Конф. к 80-летию со дня рождения
А. А. Уранова, 1981. М.: 1982: 56-59.
Антонова В. И. Онтогенез и структура популяций вороники черной (Empetrum nigrum L.): Ав-
тореф. дис.... канд. биол. наук. М. 1988:1-22.
Антонова Л. А. Антэкология растений широколиственного леса // Экология опыления. Меж-
вуз. сб. иауч. трудов. 1976. 2: 30-63.
Арендт Н. К. Влияние химических стимуляторов на образование плодов у инжира // Тр. Гос.
Никитск. бот. сада. 1960. 32: 43-48.
Арендт Н. К., Казас А. Н. Индуцированный апомиксис у инжира // Апомиксис и цитоэм-
бриология растений. Саратов: Изд-во Сарат. ун-та, 1978. 4: 10-11.
Артюшенко 3. Т. Атлас по описательной морфологии высших растений. Семя. Л.: Наука,
1990: 1-204.
Артюшеико 3. Т., Федоров А. А. Атлас по описательной морфологии высших растений. Плод.
Л.: Наука, 1986:1-392.
Астахов И. И. Окопник. Л.: Лениздат, 1970: 1-16.
Багдасарова Т. В., Длусский Г. М. Конкуренция за опылителей и пространственная
репродуктивная изоляция у растений с широким спектром опылителей // Проблемы взаимодействия
человека и биосферы. М., 1989: 85-87.
Бажаиова А. П. Отбор семяи в пределах куста хлопчатника (Gossypium barbadense L.) и
значение его для повышения урожайности // Изв. АН Туркм.ССР, Сер. биол. науки. 1960. 5: 19-25.
Балина Н. В. Действие повышенной температуры на генеративные клетки // Физиол. раст.
1974. 21(3): 630-635.
Банникова В. П., Хведынич О. А Основы эмбриологии растений. Киев: Наукова думка, 1982:1-164.
Баранов П. А. Выступление в прениях по докладу С. С. Хохлова // Проблемы филогении и
филогенеза. Хроника V совещ. по физиол. раст. в 1958 г. Л., 1960: 27.
Баранова М. В. О формировании цветков в стеблевых луковичках Lilium // Бот. жури. 1973.
58(6): 890-893.
Баранова М. В. О связи структуры луковиц с экологическими условиями // Жизненные
формы: структура, спектры и эволюция. М.: Наука, 1981: 76-89.
Баранова М. В. Структура системы побегов и ее формирование у Lloydia serotina (Liliaceae) //
Бот. журн. 1995. 80(11): 17-27.
Барская Е. И., Балииа Н. В. Репродуктивный процесс у растений в связи с
засухоустойчивостью // Физиол. и биохим. культ, растений. 1970. 2(4): 416-419.
Бартков Б. И. Транспорт ассимилятов как одна из причин формирования материнской
разнокачественное™ семян у зернобобовых растений // Тез. докл. симп. "Физиолого-биохимические
проблемы семеноведения и семеноводства". Иркутск, 1972: 64-66.
Бартков Б. И. О гетероспермии (разнокачественности семяи) // Биохимические исследования
иа советском Дальнем Востоке. Тр. биол.-почв. ин-та. Новая серия. 1973. 13(116): 61-67.
Бартон Л. Хранение семян и их долговечность. М.:Колос, 1964:1-240.
Барыкина Р. П. Образование корневых отпрысков у некоторых деревьев и кустарников,
используемых в степном лесоразведении для скрепления почвы: Дисс.... канд. биол. наук. М., 1954:1-238.
Барыкина Р. П. Формирование куста у малины и ежевики в связи с их вегетативным
размножением // Бюлл. МОИП. Отд. биол. 1964. 69(2): 96-110.
Барыкина Р. П. Трансформация жизненных форм в семействах Ranunculaceae и Berberidaceae
// Тр. XII Межд. ботаи. конгресса. Л., 1975. 1: 243.
Барыкина Р. П. Поливариантность способов естественного вегетативного размножения и
расселения в семействе Ranunculaceae // Бюлл. МОИП. Отд. биол. 1995а. 100(1): 53-64.
Барыкина Р. П. Чистяк весенний // Биологическая флора Московской обл. М.: Аргус, 19956.10:75-82.
Барыкина Р. П., Гуланян Т. А. Морфолого-анатомическое исследование Pulsatilla violacea Rupr. и
P. aurea (N. Busch) Juz. в онтогенезе // Веста. МГУ. Сер. Биология и почвоведение. 1974. (6): 31-45.
Литература 539
Барыкина Р. П., Гуланян Т. А., Чубатова Н. В. Морфолого-анатомическое исследование
некоторых представителей рода Aconitum секции Lycoctonum DC. в онтогенезе // Бюлл. МОИП.
Отд. биол. 1976. 81(1): 99-116.
Барыкина Р. П., Гуланян Т. А., Чубатова Н. В. Морфолого-анатомическое исследование
некоторых представителей рода Aconitum секций Aconitum и Anthora DC. в онтогенезе // Бюлл.
МОИП. Отд. биол. 1977. 82(1): 132-148.
Барыкина Р. П., Гуленкова М. А. Метаморфоз и его значение в жизни растений // Бюлл.
МОИП. Отд. биол. 1990. 95(5): 103-111.
Барыкина Н. П., Потапова Н. Ф. Биоморфологический анализ видов рода Anemone флоры
бывшего СССР в ходе онтогенеза // Бюлл. МОИП. Отд. биол. 1994. 99(5): 124-137.
Барыкина Р. П., Пустовойтова В.И. Морфолого-анатомическое исследование Ranunculus
repens L. и R. reptans L. в процессе их индивидуального развития // Вестн. МГУ. Сер. Биология и
почвоведение. 1973. (6): 28-39.
Барыкина Р. П., Черняковская Е. Ф. Сравнительный биолого-морфологический анализ
Ranunculus illyricus и R. pedatus // Биол. науки. 1986. 5: 67-71.
Барыкина Р. П., Чубатова Н. В., Алгадаева Г. О. Структурная адаптация подушковидиых
растений к условиям высокогорья на примере Paraquilegia grandiflora (Ranunculaceae) // Вести.
МГУ Сер. 16. Биология. 1991.1: 47-54.
Басаргин Д. Д., Горовой П. Г. Некоторые черты биоморфологии борщевика Мелендорфа — к
вопросу о партикуляции // Бюлл. ГБС АН СССР. 1972. 85: 50-56.
Баталов А. Е. Биоморфология, экология популяций и вопросы охраны орхидей Архангельской
области: Автореф. дисс. ... канд. биол. иаук. М., 1998:1-16.
Баталов А. Е. Биоморфология, экология популяций и вопросы охраны орхидей Архангельской
области: Дисс.... канд. биол. иаук. М., 1998:1-266.
Батурин С. О. Сравнительное изучение фертильности апомиктичного клона крупноплодной
земляники сорта Мици Штиндлер и его исходной формы // Проблемы апомиксиса и отдалённой
гибридизации. Новосибирск: Наука, 1987:192-199.
Батыгина Т. Б. Эмбриология пшеницы. Л.: Колос, 1974: 1-206.
Батыгина Т. Б. Хлебное зерно. Л.: Наука, 1987а: 1-103.
Батыгина Т. Б. Новое представление о бесполом размножении и его классификации у
цветковых растений (в свете экспериментальных даииых) // V Всес. Школа по теоретической
морфологии растений. Научн. докл. Львов, 19876: 92-97.
Батыгина Т. Б. Эмбриологические основы пластичности и адаптивные возможности систем
репродукции цветковых растений // Биологическое разнообразие: подходы к изучению и
сохранению / Ред. Юрцев Б. А. СПб: Изд-во ЗИН РАН, 1992: 201-212.
Батыгина Г. Б. Некоторые аспекты морфогенетической полярности в онтогенезе растений //
Тез. докл. III Съезда ВОФР. СПб, 1993а: 258.
Батыгина Т. Б. Эмбриоидогения — новая категория способов размножения цветковых
растений // Проблемы репродуктивной биологии семенных растений. Тр. БИН РАН / Ред. Терехин Э.
С. СПб, 19936. 8:15-25.
Батыгина Т. Б. Апомиксис, агамоспермия и вивипария и их роль в системе репродукции
цветковых растений // Тр. Межд. симп. "Апомиксис у растений: состояние проблемы и перспективы
исследований". Саратов: Изд-во СГУ, 1994а: 16-18.
Батыгина Т. Б. Развитие зародышевых мешков в пыльнике // Эмбриология цветковых
растений. Терминология и концепции. Т.1. Генеративные органы цветка / Ред. Батыгина Т. Б. СПб:
Мир и семья, 19946.1:118-120.
Батыгина Т. Б. Семязачаток и семя с позиции надежности биологических систем // Эмбриология
цветковых растений. Терминология и концепции / Ред. Батыгина Т. Б. СПб: Мир и семья, 1994в. 1:263-267.
Батыгина Т. Б. Эмбриоидогения // Эмбриология цветковых растений. Терминология и
концепции / Ред. Батыгина Т. Б. СПб: Мир и семья-95,1997. 2:628-634.
Батыгина Т. Б. Генетическая гетерогенность семян // Физиол. раст. 1999. 46(3): 438-453.
540
Системы репродукции
Батыгина Т. Б., Андронова Е. В. Есть ли семядоля у орхидных? // ДАН СССР. 1988. 30 (4):
1017-1019.
Батыгина Т. Б., Бутенко Р. Г. Морфогенетические потенции зародыша покрытосеменных растений
(на примере представителей рода Paeonia, сем. Paeoniaceae) // Бот. жури. 1981. 66 (11): 1531-1547.
Батыгина Т. Б., Васильева В. Е. Система воспроизведения у орхидных // Тез. докл. Всес.
симп. "Охрана и культивирование орхидей". Таллин, 1980:107—110.
Батыгина Т. Б., Васильева В. Е. Развитие зародыша и проростка некоторых орхидных // Тез.
II Всес. совещ. "Охрана и культивирование орхидей". Киев, 1983: 73-75.
Батыгина Т. Б., Воронова О. Н. Проявление апоптоза на ранних этапах развития семязачатка у
мутанта кукурузы mac 1// ДАН. 1999. 367(3): 426-429.
Батыгина Т. Б., Захарова А. А. Параллели в развитии полового и соматического зародышей //
Эмбриология цветковых растений. Терминология и концепции / Ред. Батыгина Т. Б. СПб: Мир и
семья-95,1997. 2: 635-648.
Батыгина Т. Б., Колесова Г. Е. Семейство Тгарасеае // Сравнительная эмбриология
цветковых растений. Brunelliaceae-Tremandraceae. Л.: Наука, 1985:110-114.
Батыгина Т. Б., Колесова Г. Е., Васильева В. Е. Эмбриология нимфейных и лотосовых. III.
Эмбриогенез Nelumbo nucifera Gaertn. // Бот. журн. 1983. 68(3): 311-326.
Батыгина Т. Б., МаметьеваТ. Б. К эмбриологии рода Роа L. // Актуальные вопросы
эмбриологии покрытосеменных растений / Ред. Яковлев М. С. Л.: Наука, 1979: 89-95.
Батыгина Т. Б., Маметьева Т. Б., Васильева В. Е. Проблемы морфогенеза in vivo и in vitro //
Бот. журн. 1978. 63(1): 87-111.
Батыгина Т. Б., Титова Г. Е., Шамров И. И. Сравнительная эмбриология нимфейиых
(Nymphaeales S. L.) в связи с вопросами их филогеии и систематики // Матер. VIII Москов.
совещ. по филогении растенй. М: Наука, 1991:11-14.
Батыгина Т. Б., Троицкая Е. А., Алимова Г. К. Некоторые данные о развитии мужского
спорангия пшеницы при отсутствии бора // Бот. жури. 1966. 51(12): 1751-1754.
Батыгина Т. Б., Фрейберг Т. Е. Полиэмбриония у Роа pratensis L. (Роасеае) // Бот. журн.
1979. 64(6): 793-804.
БатыгинаТ. Б., Шамров И. И., Голубовская И. Н., Sheridan W. F. Значение генетических
исследований для эмбриологии // Генетика. 1994. 30:13.
Батыгина Т. Б., Шамров И. И., Колесова Г. Е. Эмбриология иимфейиых и лотосовых. II.
Развитие женских эмбриональных структур // Бот. журн. 1982. 67(9): 1179-1183.
Батыгина Т. Б., Шевцова Г. Г. Метаморфоз в онтогенезе орхидных (иа примере Cymbidium
hybridum, Orchidaceae) // Бот. жури. 1985. 70 (12): 1614-1621.
Баштавой Н. Г. Устойчивость популяций неморальных трав и тактика защиты в зонах урбанизации
// Жизнь популяций в гетерогенной среде. Йошкар-Ола: Периодика Марий Эл, 1998. 2:154-155.
Бебии СИ., Сииха Р., Талис В. К. Разиокачественность семян у зернобобовых культур в
зависимости от метеорологических факторов и местоположения плодов //Докл. ТСХА. 1969.152: 65-69.
Бекетов А. Н. О протерандрии зонтичных //Тр. СПб Общ. естествоисп. Отд. ботаники. 1889.20.
Беклемишев В. Н. Пространственная и функциональная структура популяций // Бюлл.
МОИП. Отд. биол. 1960. 65(2): 42-48
Белавская А. П., Серафимович, Н. Б. Заросли водяного ореха Trapa natans L. s.l. сем. Тгарасеае
иа озере Ворохобы Псковской области // Бот. журн. 1977. 62(7): 998-1002.
Белоусова Н. И., Фокииа Е. С. Случаи аидрогенеза в потомстве кукурузо-трипсакумиых
гибридов // Генетические основы апомиксиса и селекции растений. Новосибирск: Наука, 1984:20-25.
Белявская К. Н. К биологии живородящей гречихи // Уч. зап. Лен. гос. педагог, ин-та им. М.
Н. Покровского. 1949. 5(2): 93-95.
Беляева Л. Е., Родионова Г. Б. Семейство Brassicaceae // Сравнительная эмбриология
цветковых растений. Phytolaccaceae — Thymelaeaceae / Ред. Яковлев М. С. Л.: Наука, 1983:154-164.
Беляева Н. С. Развитие зародышевого мешка и оплодотворение у покрытосеменных (на
примере представителей флоры Туркмении): Автореф. дис. ... докт. биол. наук. Л., 1977: 1-35.
Берг Р. Л. Стандартизирующий отбор в эволюции цветка // Бот. жури. 1956.41(3): 318-334.
Литература
541
Берг Р. Л. Дальнейшие исследования по стабилизирующему отбору в эволюции цветка // Бот.
журн. 1958. 43(1): 12-27.
Бережний I. В. Про всхожкть насшня рослин з чагарникових угрупувань карпатських полонии
// Доповвд та noBi домления. Льв1в, 1957. 3(7): 53.
Бессонова В. П. Состояние пыльцы как показатель загрязнения среды тяжелыми металлами //
Экология. 1994. 4: 45-50.
Бессонова В. П., Лыженко И. И. Влияние загрязнения среды на прорастание и
физиологическое состояние пыльцы некоторых древесных растений // Бот. журн. 1991. 76(3): 422-426.
Бессонова В. П., Фендюр Л. М., Пересыпкина Т. Н. Влияние загрязнения окружающей среды
на мужскую фертильность декоративных цветочных растений // Бот. журн. 1997. 82(5): 38-45.
Биологический энциклопедический словарь / Ред. Гиляров М. С. М.: Советская
энциклопедия, 1986:1-831; 1989:1-864.
Блинова И. В. Эколого-биологические особенности некоторых представителей семейства
Orchidaceae Мурманской области: Дисс. ... канд. биол. наук. М., 1995:1-215.
Блюднева Е. А., Чернышева М. П., Кашин А. С. Эмбриологическое изучение популяции
Taraxacum officinale L. // Тр. Межд. симп. "Апомиксис у растений: состояние проблемы и
перспективы исследований." Саратов, 1994: 19-21.
Бобров Е. Г. Об интрогрессивной гибридизации и ее значении в эволюции растений // Бот.
журн. 1980. 65(8): 1065-1070.
Богдасарова М. X. Биология цветения и цитоэмбриология некоторых видов Ferula L.
Узбекистана: Автореф. дис. ... канд. биол. наук. Ташкент, 1990:1-22.
Борисова И. В., Малышева Г. С. Биолого-морфологические признаки растений,
определяющие время их цветения // Ботан. журн. 1993. 78(7): 63-71.
Бормотов В. Е. Аутополиплоидия и фертильность // Полиплоидия и селекция / Ред. Турбин
Н. В. Минск: Наука и техника, 1972: 36-45.
Боронников С. В. Влияние антропогенного фактора на семенную продуктивность колокольчиковых
// Жизнь популяций в гетерогенной среде. Йошкар-Ола: Периодика Марий Эл, 1998. 2:151-152.
Бочанцева 3. П. Онтогенез тюльпанов // Тр. Бот. сада АН УзССР. 1956. 5: 71-108.
Бочанцева 3. П. Тюльпаны. Ташкент: Изд-во АН УзССР, 1962:1-407.
Бритиков Е. А. Биологическая роль пролина. М.: Наука, 1975:1-88.
Бутара А. М., Русина Л. В. Культура неоплодотворённых завязей и семяпочек in vitro как
способ получения гаплоидных растений // Физиол. и биохим. культ, растений. 1988. 20(5): 419-430.
Булгаков С. В. Измененная анатомическая структура корня кок-сагыза и ее биологическое
значение // ДАН СССР. 1944. 45(1): 37-41.
БумагинаС. И., Исакова Н. М. Влияние полиморфизма семян на темпы роста проростков и
регенеративную активность видов клевера // Тез. докл. II (X) съезда РБО "Проблемы ботаники на
рубеже XX-XXI веков". СПб, 1998. 1:104.
Бутузова О. Г. Условия прорастания семян видов рода Helleborus L. (Ranunculaceae) // Тез.
докл. VI молодежи, конф. ботаников в Санкт-Петербурге. СПб, 1997: 44.
Быков Б. А. Доминанты растительного покрова Советского Союза. Алма-Ата, 1965. 3:1-462.
Вайнагий И. В. О методике изучения семенной продуктивности // Бот. журн. 1974.59(6): 826-831.
Вайнагий И. В. Методика определения семенной продуктивности представителей семейства
лютиковых // Бюлл. ГБС АН СССР. 1990. (15): 86-90.
Варламова К., Приходько Е., Приходько Ю. Модель полевого кормопроизводства с
привлечением нетрадиционных кормовых культур // Матер, симп. "Новые и нетрадиционные растения и
перспективы их практического использования". Пущино. 1997. 5: 604-606.
Варшанина Т. П. Некоторые данные о зависимости полиэмбрионии и гаплоидии от
метеорологических факторов // Проблемы размножения цветковых (прикладные аспекты). Тез. докл. сов.
по цветению, опылению и семенной продуктивности растений. Пермь, 1987: 76-77.
ВасилевичВ. И. К методике анализа границ фитоценозов // Бюлл. МОИП. Отд. биол., 1967.
72(3): 85-93.
542
Системы репродукции
Василевич В. И. Почему существуют многовидовые растительные сообщества // Бот. журн.
1979. 64(3): 341-350.
Василевич В. И. Очерки теоретической фитоценологии. Л.: Наука. Ленингр. отд-ние. 1983:1-248.
Василевская В. К. Изучение онтогенеза как один из методов экологической анатомии //
Проблемы ботаники. 1950.1: 264-281.
Василевская В. К. Анатомия образования почек на корнях древесных растений // Веста. ЛГУ.
Сер. биол. 1957. 3(1): 5-21.
Василевская В. К., Дорджиева В. К. Формирование проводящей системы в цветке Helianthus
annuus (Asteraceae) // Бот. журн. 1982. 6(4): 520-526.
Васильев А. Е., Воронин Н. С Еленевский А. Г., Серебрякова Т. И. Ботаника. Анатомия и
морфология растений. М.: Просвещение, 1978: 1-478.
Васильев В. Н. Водяной орех и перспективы его культуры в СССР. М.- Л.: Изд. АН СССР.
1960:1-100.
Васильев В. Н. О природе подводных органов у представителей рода Trapa L. // Бот. журн.
1978. 63(10): 1515-1518.
Васильева В. Е., Батыгина Т. Б. Культивирование in vitro зародышей и семяпочек лотоса,
изолированных на разных стадиях развития // Физиол. раст. 1981. 28(2): 319-327.
Васильченко И. Т. О филогенетическом значении морфологии прорастания у зонтичных
(Umbelliferae) // Сов. ботаника. 1941. 3: 30-40.
Вахрамеева М. Г., Виноградова И. О., Татаренко И. В., Цепляева О. В. Кокушник комарнико-
вый // Биологическая флора Московской области. М.: Изд-во МГУ, 1993. 9(1): 51-64.
Вахрамеева М. Г., Денисова Л. В. Любка двулистная — Platanthera bifolia (L.) Rich. //
Диагнозы и ключи возрастных состояний луговых растений. М.: Изд-во МГПИ, 1983а: 16-18.
Вахрамеева М. Г., Денисова Л. В. Ятрышник (пальчатокоренник) пятнистый — Dactylorhiza
maculata Soo и ятрышник Фукса — D. fuchsii Soo // Диагнозы и ключи возрастных состояний
луговых растений. М.: Изд-во МГПИ, 19836:12-15.
Вахрамеева М. Г., Денисова Л. В., Никитина С. В. Особенности структуры ценопопуляций
видов семейства орхидных / / Популяционная экология растений. Матер, конф., посвящ. 85-летию со
дня рожд. А. А. Уранова. М.: Наука, 1987:147-153.
Вахрамеева М. Г., Денисова Л. В., Никитина С. В., Самсонов С. К. Орхидеи нашей страны.
М.: Наука, 1991:1-224.
Верещагина В. А. Экология цветения и опыления Oxalis acetosella L. // Бот. журн. 1965.
50(8): 1078-1091.
Верещагина В. А. Антэкология растений темнохвойной тайги: Автореф. дис. ... канд. биол.
наук. Пермь, 1966: 1-18.
Верещагина В. А. Гинодиэция, клейстогамия и гетеростилия у покрытосеменных
(морфологические и эмбриологические аспекты): Автореф. дис. ... докт. биол. наук. Л., 1980а: 1-36.
Верещагина В. А. Эмбриология некоторых клейстогамных фиалок // Бот. журн. 19806. 65(8):
1147-1156.
Верещагина В. А., Маланина Л. М. О гинодиэции душицы обыкновенной (Origanun vulgare
L.) // Науч. докл. высш. школы. Биол. науки. 1974. 6: 51-57.
Верещагина В. А., Новоселова Л. В. Репродуктивная биология Medicago lupulina (Fabaceae)
// Бот. журн. 1997. 82(1): 30-39.
Верещагина В. А., Новоселова Л. В. Бутонная клейстогамия у однолетних видов люцерны
Medicago (Fabaceae) // Тез. докл. Н(Х) съезда РБО "Проблемы ботаники на рубеже XX-XXI
веков". СПб, 1998.1:106-107.
Вермель Е. М., Соловова К. П. Получение искусственного партеногенеза у цветковых
растений и некоторые проблемы селекции // Онтогенез. 1973. 4(3): 240-248.
Вернадский В. И. Живое вещество. М.: Наука, 1978:1-358.
Веселова Т. Д. Нарушения в развитии генеративных органов томатов в связи с недостатком
света // Вестн. МГУ. Биология. 1977. 4:38-43.
Литература
543
Веселова Т. Д., Гревцова Н. А., Джалилова X. X., Ильина Г. М., Троицкая Т. А. О возможности
выявления видов-индикаторов загрязнения окружающей среды на основании анализа состояния
мужской генеративной сферы у цветковых растений // Бюл. МОИП. Отд. биол. 1996.101(4): 69-72.
Викторов Д. П. Краткий словарь ботанических терминов. М.-Л.: Наука, 1964: 1-177.
Виленский Д. Г., Лавренко Е. М. Условия обитания в Харьковской губернии Ceratophyllum
tanaiticum Sapjeg. // Дневн. Всес. съезда ботаников в Москве, М. 1926: 47.
Виноградова Т. Н. Ранние стадии развития тайника сердцевидного в природных условиях //
Бюлл. МОИП. Отд. биол. 1966.101(4): 82-91.
Виноградова Т. Н. Морфология и биология некоторых бореальных орхидных (Orchidaceae
Juss.) на ранних стадиях их развития: Автореф. дисс. ... канд. биол. наук. М. 1999а: 1-22.
Виноградова Т. Н. Варианты развития первого побега надземных орхидных в естественных
условиях // Мат. Межд. конф. "Охорона i культивування орхидей". Киев, Наукова думка, 19996:41-42.
Виноградова Т. Н., Филин В. Р. О жизненной форме, протокормах и корневищах Calypso
bulbosa (L.) Oakes (Orchidaceae) // Бюлл. МОИП. Отд. биол. 1993. 98(2): 61-73.
Вишнякова М. А. Самонесовместимость: структурно-функциональные аспекты //
Эмбриология цветковых растений. Терминология и концепции. / Ред. Батыгина Т. Б. СПб: Мир и семья-95,
1997. 2: 113-120.
Войтенко В. Ф. Формы гетерокарпии в семействе Brassicaceae и их эволюционная оценка //
Бот. журн. 1968.53(10): 1428-1439.
Войтенко В. Ф. Основные черты дисперсии гетерокарпных крестоцветных // Вопросы
биологии семенного размножения. Ульяновск: Изд-во УГПИ, 1974: 87-90.
Войтенко В. Ф., Еременко Л. Л., Левина Р. Е., Смирнов И. А., Смирнова Н. Г. Качество
семян в связи с условиями их формирования // Методические указания по семеноведению интроду-
центов. М.: Наука, 1980: 27-37.
Войтенко В. Ф., Опарина С. Н. Анатомический анализ гетерокарпии в семействе Boraginaceae
// Бот. журн. 1987. 72(5): 569-580.
Волкенштейн П. Словарь главнейших терминов, употребляемых при описании растений. СПб:
Изд. Безобразов и К , 1874: 1-27.
Волкович В. Б. Соотношение полов и особенности роста разнополых особей Antennaria dioica L.
// Бот. журн. 1972.57(10): 1278-1286.
Воронова О. Н. Особенности развития женской репродуктивной сферы у мутанта кукурузы рот 1 / /
Проблемы ботаники на рубеже XX-XXI веков. Тезисы докл. II/XI съезда РБО. СПб, 1998.1:108.
Воронова О. Н. Морфогенетические потенции семязачатка Zea mays L.: Дисс. ... канд. биол.
наук. СПб, 1999:1-168.
Ворсобина Л. И., Солнцева М. П. Семейство Amaryllidaceae // Сравнительная эмбриология
цветковых растений. Однодольные. Butomaceae-Lemnaceae / Ред. БатыгинаТ. Б., Яковлев М. С.
Л.: Наука, 1990: 87-96.
Восканян В. Е. О партикуляции некоторых стержнекорневых растений альпийских ковров горы
Арагац // Биол. журн. Армении. 1973. 26(8): 11-16.
Восточно-европейские широколиственные леса / Ред. Смирнова О. В. М.: Наука, 1994:1-362.
Вуколов СМ. Используем заросли водяного ореха // Колхозн. сады и огор. 1932. 42(12): 9-10.
Высоцкий Г. Н. Ергеня, культурно-фитологический очерк // Тр. Бюро по прикл. ботан. СПб.,
1915. 8(10-11): 1113-1443.
Гавриленко Г. А. Влияние температуры на кроссинговер у томатов // Цитология и генетика.
1984.18(5): 347-352.
Гаевская Н. С. Роль высших растений в питании животных пресных водоемов. М.: Наука,
1966:1-327.
Гандилян П. А. Живорождение у пшеницы // Морфогенез растений. М.: Изд-во МГУ, 1961.
1: 308-311.
Гапоненко Н. Б. Биологические особенности видов рода Orchis L. флоры Украины в связи с
охраной ex situ: Дисс. ... канд. биол. наук. Киев, 1992: 1-197.
544
Системы репродукции
Гатцук Л. Е. Комплементарные модели побега и их синтез // Бот. жури. 1995. 80(6): 1-10.
Гатцук Л. Е., Дервиз-Соколова Т. Г., Иванова И. В., Шафранова Л. М. Пути перехода от
кустарниковых форм к травянистым в некоторых таксонах покрытосеменных // Проблемы филогении
высших растений / Ред. Благовещенский А. В., Старостин Б. А., Алексеев Е. Б. М.: Наука, 1974:16-36.
Гедых В. Б. Развитие зарослей черники и ее урожай // Растит, ресурсы. 1979.15(1): 10-19.
Генкель П. А. К экологии растений мангров // Физиология древесных растений. М.: Изд-во
АН СССР, 1962: 223-232.
Генкель П. А. К познанию вивипарии в растительном мире / / Журн. общ. биол. 1979.40(1): 60-66.
Генкель П. А., Фан И-сунь. О физиологическом значении вивипарии у растений мангров //
Acta Bot. Sinica. 1958. 7(2): 51-70.
Геодакян В. А. Роль полов в передаче и преобразовании генетической информации //
Проблемы передачи информации. 1965.1(1): 105-112.
Геодакян В. А. Количество пыльцы как регулятор эволюционной пластичности
перекрёстноопыляющихся растений // ДАН СССР. 1977. 234(6): 1460-1463.
Геодакян В. А. Количество пыльцы как передатчик экологической информации и регулятор
эволюционной пластичности растений // Журн. общ. биол. 1978. 39(5): 743-753.
Геодакян В. А., Кособутский В. И. Регуляция соотношения полов механизмом обратной связи
// ДАН СССР. 1967.137(4): 938-941.
Герасимова-Навашина Е. Н., Капил Р. Н., Коробова С. Н., Савина Г. И. Процесс двойного
оплодотворения при пониженных температурах // Бот. журн. 1968. 53(5): 614-627.
Гершензон С. М. Основы современной генетики. Киев: Наукова думка, 1983:1-557.
Гиляров М. С. Эволюция постэмбрионального развития и типы личинок насекомых // Зоол.
журн. 1957. 35(11): 1683-1689.
Глазунова К. П. Проблема вида у апомиктичных покрытосеменных растений на примере рода
Alchemilla L. // Матер. 5-го Моск. совещ. по филогении раст. М.: Наука, 1976: 36-38.
Глазунова К. П. О возможности применения теории агамно-полового комплекса к систематике
покрытосеменных растений ( на примере рода Alchemilla L.) // Бюлл. МОИП. Отд. биол. 1977. 82(5): 129-139.
Глазунова К. П. Микроспорогенез Alchemilla glaucescens Wallr. // Вестн. Моск. ун-та. Сер.
биол., почв. 1981. 4: 31-35.
Глазунова К. П. Микроспорогенез и микрогаметофитогенез у Alchemilla filicaulis Buser. //
Биол. науки. 1983. 7: 79-83.
Глазунова К. П. Апомиксис у восточноевропейских представителей рода Alchemilla L.: Авто-
реф. дис ... канд. биол. наук. М., 1984:1-17.
Глазунова К. П. Образование зародышевых мешков у агамных видов манжетки (Alchemilla L.)
// Бюлл. МОИП. Отд. биол. 1987. 92(5): 96-110.
Глазунова К. П. Популяционный подход к изучению реакций растений на комплексное
воздействие естественного и антропогенного факторов / / Общебиологические аспекты филогении
растений / Ред. Тихомиров В. Н. М.: Наука, 1991: 35-38.
Глазунова К. П., Пермяков А. И. Об особенностях пыльцы некоторых видов рода Alchemilla L.
в связи с апомиксисом // Биол. науки. 1980. 5: 54-59.
Гоби X. Я. Генетическая классификация плодов семенных растений // Зап. Лаб. по
семеноведению при ГБС РСФСР. 1921. 4(4): 5-30.
Гойман Э. Инфекционные болезни растений. М.: Сельхозгиз, 1954:1-348.
Головкин Б. Н. Переселение травянистых многолетников на Полярный север. Л.: Наука, 1973:1-264.
Голубев В. Н. К морфолого — генетической характеристике ползучих растений // Бюлл.
МОИП. Отд. биол. 1961. 66(4): 53-65.
Голубев В. Н. Основы биоморфологии травянистых растений Центральной лесостепи // Тр.
Центр. — Черноземн. Гос. заповедника им. В. В. Алехина. Воронеж: Изд-во Воронеж, ун-та.
1962. 7:1-510.
Голубев В. Н. Эколого-биологические особенности травянистых растений и растительных
сообществ лесостепей. М. 1965:1-286.
Литература
545
Голубев В. Н., Волокитин Ю. С. Основные принципы и закономерности динамической
экологии опыления цветковых растений // Сб. научн. тр. Никит, бот. сада. 1986. 98: 7-28.
Голубовская И. Н. Генетический контроль поведения хромосом в мейозе // Цитология и
генетика мейоза / Ред. Хвостовая В. В., Богданова Ю. Ф. М.: Наука, 1975: 312-338.
Голубовская И. Н., Авалкина Н. А, Перемыслова Е. Э. Гены paml и рат2, контролирующие
цитокинез на разных этапах онтогенеза половых клеток кукурузы // Генетика. 1994. 30(10): 1392-1399.
Гордеева Т. К. К биологии полыни черной Artemisia pauciflora Web. // Тр. БИН им. В. Л.
Комарова АН СССР. Сер. 3. Геоботаника. 1957. 2: 88-117.
Гостев А. А. Мужская стерильность у шалфея мускатного // Тр. ВНИИЭМК. 1971.3:23-26.
Грант В. Видообразование у растений. М: Мир, 1984:1-528.
Гревцова Н. А., Назарова В. Ю., Тихомиров В. Н. К эмбриологии рода Trapa L.
Сравнительно-эмбриологическое исследование мужской генеративной сферы Trapa europaea Fler. и
Trapa conocarpa (Aresch.) Fler. // Научн. докл. высш. школы. Биол. науки. 1987а. 5: 74-81.
Гревцова Н. А., Назарова В. Ю., Тихомиров В. Н. К эмбриологии рода Trapa L.
Сравнительно-эмбриологическое исследование женской генеративной сферы Trapa europaea Her. и
Trapa conocarpa (Aresch.) Fler. // Научн. докл. высш. школы. Биол. науки. 19876. 7: 89-93.
Гринфельд Э. К. Происхождение антофилии у насекомых. Л.: Изд-во ЛГУ, 1962:1-186.
Гринфельд Э. К. Происхождение и развитие антофилии у насекомых. А: Изд-во АТУ, 1978:1-208.
Гробстайн К. Стратегия жизни. М.: Мир, 1968:1-144.
Гродзинский А. М., Злобин Ю. А., Миркин Б. М., Наумова Л. Г. Словарь-справочник по аг-
рофитоценологии и луговедению. Киев: Наукова думка, 1991:1-136.
Гроссет Г. Э. Модификационная изменчивость Seseli peucedanoides (Bieb.) K.-Pol. и половой
полиморфизм растений этого вида и Heracleum sibiricum L. / / Бюлл. МОИП. Отд. биол. 1974.79(6): 57-77.
Грудзинская И. А. Системы классификации и номенклатуры плодов в свете их применения в
ботанических руководствах // Бюлл. МОИП. Отд. биол. 1968. 73(3): 78-85.
Грушвицкий И. В., Агнева Е. Я., Кузина Е. Ф. О разнокачественное™ зрелых семян моркови
по величине зародыша // Бот. журн. 1963. 48(10): 1484-1489.
Гуляев Г. В., Мальченко В. В. Словарь терминов по генетике, цитологии, селекции и
семеноводству. М.: Россельхозиздат, 1975:1-214.
Гусаковская М. А., Ермаков И. П. Цитофизиологический анализ развития зародышевого мешка у
амфимиктов и апомиктов // Гаметогенез, оплодотворение и эмбриогенез семенных растений,
папоротников и мхов. Тез. докл. IX Всес. сов. по эмбриологии растений. Кишинев: Штиинца, 1986: 88-89.
Гусаковская М. А, Ермаков И. П. Рост репродуктивных клеток в семяпочке у половых и апомиктиче-
ских видов сложноцветных // Клеточный цикл растений в онтогенезе. Киев: Наукова думка, 1988:158-171.
Гусейнова Н. А., Курбанов Э. А. Апомиксис у некоторых видов Маревых // Тр. Межд. симп.
"Апомиксис у растений: состояние проблемы и перспективы исследований." Саратов, 1994: 45-47.
Давиденко О. Т. Нехромосомные мутации. Минск: Наука и техника. 1984:1-164.
Дажо Р. Основы экологии. М: Мир, 1975:1-415.
Д'Амато Ф. Значение полиплоидизации органов и тканей репродуктивной системы //
Эмбриология растений : использование в генетике, селекции и биотехнологии. М.: Агропромиздат,
1990. 2: 343-427.
Даниелян А. X. Изучение процессов микро- и макроспорогенеза, микро- и макрогаметогенеза у
облученных растений табака // Половой процесс и эмбриогенез растений. Матер. IV Всес. симп.
М.: 1973: 62-63.
Данилова М. Ф., Кирпичников М. Э. Словарь терминов // Анатомия семян. А: Наука, 1985.1:8-31.
Данилова М. Ф., Силина 3. М. Формообразование у тюльпанов (Tulipa L.) в связи с
активизацией пазушных меристем // Тр. БИН АН СССР, 1962. 5(7): 176-224.
Дашко Р.Д. Досл1дження репродуктивно1 бюлоги видов роду Muscari Mill, на Закарпатп //
Охорона довк1лля: сучасш дооидження в екологн i мжобюлогп. Ужгород: 1997:103-107.
Двигубский И. А. Начальные основания естественной истории растений, заключающие
терминологию растений, лучшие их системы, физиологию и патологию, историю, описание растений упот-
репродукции
ребительнейших, с кратким показанием их пользы в экономии, врачебной науке и пр. Ч. 1. М.:
Изд — во Моск. ун-та, 1811:1-360.
Де-Бари А. Сравнительная анатомия вегетативных органов явнобрачных и
папоротникообразных растений. Вып. 2. СПб: Общественная польза, 1880: 1-699.
Деева Н. М. Структура ценопопуляций черники в редкостойных лесах Полярного Урала //
Экология популяций: Тез. докл. Всесоюз. совещ., Новосибирск, 1988. М., 1988: 208-211.
Декандоль А. Введение к изучению ботаники, или начальный курс этой науки. М.: Изд-во
Моск. ун-та, 1839. 1: 1-541.
Делоне Л. Н. Чувствительность разных фаз митоза к ионизирующим излучениям // Итоги
науки. 3. Ионизирующие излучения и наследственность (биологические науки) / Ред. Дубинин Н.
П. М.: Изд-во АН СССР, 1960:104-123.
Демченко Н. И. Палинологические данные к систематике и филогении розоцветных: Автореф.
дис.... канд. биол. наук. 1967:1-18.
Демченко Н. И. Палинологическое обоснование самостоятельности подтрибы Alchemillineae
семейство Rosaceae // Сб. науч. тр. каф. ботаники Одесского с.-х. ин-та. Одесса, 1974. 2: 75-76.
Демьянова Е. И. Антэкология маревых каменистой и солончаковой пустыни Юго-восточного
Казахстана: Автореф. дис.... канд. биол. наук. Пермь, 1970:1-18.
Демьянова Е. И. К антэкологическому и цитоэмбриологическому изучению гинодиэции у
Dianthus versicolor Fisch. / / Экология опыления. Межвуз. сб. науч. тр. Пермс. ун-та. 1978:38-50.
Демьянова Е. И. К изучению гинодиэции в роде Dianthus (Caryophyllaceae) // Бот. журн.
1981а. 66(1): 65-71.
Демьянова Е. И. Об особенностях распространения гинодиэции в семействе губоцветных //
Науч. докл. высш. школы. Биол. науки. 19816. 9: 69-73.
Демьянова Е. И. Фертильность пыльцы у гинодиэцичных растений лесостепного Зауралья / /
Экология опыления растений. Пермь: изд-во Пермс. ун-та. 1982. 6: 93-106.
Демьянова Е. И. Распространение гинодиэции у цветковых растений // Бот. журн. 1985.
70(10): 1289-1301.
Демьянова Е. И. Половая структура популяций гинодиэцичных и двудольных растений // По-
пуляциониая экология растений. Матер. Конф. к 85-летию со дня рождения А. А. Уранова, 1986.
М., 1987: 6-10.
Демьянова Е. И. К изучению половой структуры популяций гинодиэцичных и двудомных
растений // Тез. докл. Всес. совещ. "Экология популяций". Новосибирск, 1988.1:17-19.
Демьянова Е. И. Половой полиморфизм цветковых растений: Автореф. дис. ... докт. биол.
наук, М., 1990а: 1-35.
Демьянова Е. И. Половой полиморфизм цветковых растений. Дисс. ... докт. биол. наук. М.,
19906:1-347.
Демьянова Е. И. Некоторые итоги и проблемы изучения полового полиморфизма у
покрытосеменных// Тез. симп. "Проблемы репродуктивной биологии семенных растений". Пермь, 1996:9-10.
Демьянова Е. И. Половая структура природных популяций сексуально-полиморфных растений
Предуралья // Вести. Пермс. ун-та. Биология, 1997. 3: 9-19.
Демьянова Е. И., Покатаева Н. В. Некоторые данные о гинодиэции у Dianthus acicularis Fisch.
(Caryophyllaceae) // Бот. журн. 1977. 62(10): 1469-1479.
Демьянова Е. И., Пономарев А. Н. Половая структура природных популяций гинодиэцичных
и двудомных растений лесостепи Зауралья // Бот. журн. 1979. 64(7): 1017-1024.
Демьянова Е. И., Титова А. В. Морфология и размеры цветков разных половых типов у
гинодиэцичных растений // Экология опыления. Межвуз. сб. науч. тр. Пермск. ун-та. 1981: 3-20.
Джапаридзе Л. И. Пол у растений. Тбилиси: Мецниереба, 1963.1:1-307; 1965. 2:1-302.
Джори Б. М., Амбегаокар К. Б. Эмбриология: вчера и сегодня // Эмбриология растений:
использование в генетике, селекции и биотехнологии. М.: Агропромиздат, 1990.1: 9-65.
Джори Б. М., Рао П. С. Экспериментальная эмбриология // Эмбриология растений:
использование в генетике, селекции и биотехнологии. М.: Агропромиздат, 1990. 2: 343-427.
Литература
547
Дзсвалтовский А. К. Особенности развития женского гаметофита у триплоидной формы арбуза
Асахи Ямато // Цитология и генетика. 1969. 3(1): 7-16.
Дзевалтовский А. К. Некоторые особенности развития женского гаметофита у огурца (Cucumis
sativus L.), обусловленные воздействием колхицина // Цитология и генетика. 1971. 5(1): 23-28.
Дзевалтовский А. К. Естественная и стимулятивная апоспория у представителей семейства
тыквенных // Проблемы апомиксиса у растений и животных. Новосибирск: Наука, 1973: 96-105.
Дзюба О. Ф. Состояние репродуктивной сферы Angelica sylvestris в условиях Ленинградской
области в текущем столетии // Тр. межд. конф. по анатомии и морфологии растений. СПб, 1997: 245-246.
Добрецова Т. Н., Беговатова Н. А. Влияние фитоценотической среды на семенную
продуктивность мари белой (Chenopodium album L.) и некоторые особенности биологии ее семян // Вопросы
биологии семенного размножения / Ред. Левина Р. Е. Ульяновск: Изд-во УГПИ, 1974:152-158.
Доброхотова К. В. Материалы к изучению Nelumbo caspica Fisch. (Schipcz.) в дельте Волги //
Тр. Астраханского Гос. Заповедника, 1938. 2: 289-307.
Дорогова Н. В. Особенности апомиксиса у триплоидной малины R. idaeus сорта Прогресс //Тр. Межд.
симп. "Апомиксис у растений: состояние проблемы и перспективы исследований." Саратов, 1994: 51-53.
Дубина Д. В., Чорна Г. А., Боримська Е. В. Ceratophyllum tanaiticum Sapjeg. на УкраШ // Укр.
Бот. журн. 1985. 42(1): 56-61.
Дубинин Н. П. Общая генетика. М.: Наука, 1984:1-396; 1986:1-559.
Дубына Д. В. 1982. Распространение, экология и ценология Trapa natans (Trapaceae) на
Украине // Бот. журн. 1982. 67(5): 659-667.
Елисеев В. А., Гвасалия Г. Б. Влияние температурного фактора на прохождение мейоза у юно-
сов // Науч.-техн. бюлл. ВНИИ растениевод. 1988.178: 33-37.
Елумеев Э. А. Цветение и плодоношение свободиоягодника (элеутерококка)
колючего — Eleutherococcus senticosus (Rupr. et Maxim.) Maxim.: Автореф. дисс.... канд. биол. наук. Л, 1970:1-18.
Еналеева Н. X. Возможности и перспективы ферментативной мацерации в эмбриологических
исследованиях покрытосеменных растений: Дисс.... канд. биол. наук. Саратов, 1979.
Еналеева Н. X., Лобанова Л. П. Индукция структурных изменений макрогаметофита табака
температурой / / "Гаметная и зиготная селекция растений". Матер. Республ. коиф. 1986. Кишинев:
Штиинца, 1987:154-158.
Еналеева Н. X., Отькало О. В., Тырнов В. С. Фенотипическое проявление мутации ig в мегага-
метофите кукурузы линии Зародышевый маркер // Генетика. 1998. 34(2): 259-265.
Еналеева Н. X., Тырнов В. С. Апомиксис у растений: состояние проблемы и перспективы
исследований / / Тр. Межд. симп. "Апомиксис у растений: состояние проблемы и перспективы
исследований". Саратов, 1994а: 57-59.
Еналеева Н. X., Тырнов В. С. Цитологическое проявление элементов апомиксиса у линии
кукурузы АТ-1 и ее гибридов // Тр. Межд. симп. "Апомиксис у растений: состояние проблемы и
перспективы исследований." Саратов, 19946: 57-59.
Еналеева Н. X., Тырнов В. С, Душаева Н. А. Цитоэмбриологическое изучение зародышевых
мешков табака и стручкового перца после рентгеновского облучения // Тез. докл. VII Всес. симп.
по эмбриологии растений. Киев: Наукова думка, 1978. 2:18-19.
Еналеева Н. X., Тырнов В. С, Селиванова Л. П., Завалишина А. Н. Одинарное
оплодотворение и проблема гаплоиндукции у кукурузы // Докл. РАН. 1997. 353(3): 405-407.
Епифанова О. И., Терских В. В., Полуновский В. А. Покоящиеся клетки. М.: Наука, 1983:1-176.
Еременко Л. Л. О разнокачественности цветков и семян в зонтике моркови // Агробиология.
1950. 6:123,-127.
Еременко Л. Л., Пошехонова 3. Я. Формирование семян садовой фиалки в связи с
местоположением на растении // Качество семян в связи с условиями их формирования при интродукции.
Новосибирск: Наука, 1971: 47-60.
Ермаков И. П., Гусаковская М. А., Баринова Ю. В., Блинцов А. Н. Изменение содержания
эндогенных цитокининов в завязях Triticum aestivum на ранних этапах эмбриогенеза / / Тр. Межд.
конф. по анатомии и морфологии растений. СПб, 1997: 351-352.
548
Системы репродукции
Жакоб Ф., Вольман Э. Пол и генетика бактерий. М.: Иностр. лит-ра, 1962:1-395.
Жгенти Л. П. Апомиксис у видов рода Paeonia // Вести. Груз. бот. общ-ва АН ГССР. 1978. 7:
113-126.
Жиляев Г. Г. Формирование популяционных границ энтомофильных растений в связи с
опылением // Журн. общ. биол. 1989.50(5): 646-654.
Жиляев Г. Г. Распространение пыльцы в популяциях травянистых растений // Ботан. журн.
1996. 81(3): 53-59.
Жинкина Н. А. Сравнительная эмбриология представителей семейства Campanulaceae: Дисс.
... канд. биол.наук. Л., 1995:1-120.
Жиров Е. Г. Цитоэмбриологическое изучение наследования диплоспории у Роа pratensis //
Цитология и генетика культурных растений / Ред. Петров Д. Ф. Новосибирск: Мир, 1967:184-201.
Жиров Е. Г. Некоторые генетические аспекты апомиксиса у мятлика // Изв. Сиб. отд. АН
СССР. Сер. Биол. Науки. 1969.1 (5): 76-85.
Жиров Е. Г., Шевцова Л. С. Влияние акрифлавина на проявление фактора, контролирующего
диплоспорию у Роа palustris L. // Генетика. 1970. 6 (10): 33-37.
Жмелев П. Ю., Алексеев Ю. Е., Карпухина Е. А. Основные термины и понятия современной
биоморфологии растений. М.: Изд. МГУ, 1993:1-147.
Жукова Г. С. Световые условия развития пыльцы у ячменя / / ДАН СССР. 1938.19(4): 299-302.
Жукова Л. А. Некоторые аспекты изучения онтогенеза семенных растений / / Вопросы
онтогенеза растений. Межвуз. сб. Йошкар-Ола: Изд-во МарГУ. 1988: 3-14.
Жукова Л. А. Популяционная жизнь луговых растений. Йошкар-Ола: Гос. ком. РФ по высш.
образованию, 1995:1-222.
Жуковский П. М. Ботаника. М.: Высшая школа, 1964:1-667.
Жуковский П. М. Гетерозис растений и филогенетическая стерильность как эволюционное
явление в природе // Генетика. 1967. 3(5): 33-44.
Заблуда Г. В. Влияние условий роста и развития на морфогенез и продуктивность хлебных
злаков // Агробиология. 1948.1: 78-91.
Завадская И. Г. О причинах возникновения стерильной пыльцы у ячменя при недостатке воды
в почве и некоторых возможностях их устранения // Учен. зап. ЛГПИ. 1959.192:139-151.
Завадский К. М. Проблема вида у апомиктичных растений // Совещ. по пробл. апомиксиса.
Саратов, 1966:17-21.
Зайковская И. Э., Ярмолюк Г. И. Гаметогенез и развитие семян у триплоидных растений
сахарной свеклы // Докл. ВАСХНИЛ. 1968. 7(1): 19-22.
Закржевский Б. С, Коровин Е. П. Экологические особенности главнейших растений
Бетпак-Дала // Тр. Среднеаз. Гос. ун-та. Сер. 8-6. Ботаника. Ташкент. 1935. 23:1-74.
ЗаливскийИ.Л. Селекция и интродукция лилий в Ленинграде // Бюлл. ГБС, 1955.23:14-25.
Заугольнова Л. Б., Никитина С. В., Денисова Л. В. Типы функционирования популяций
редких видов растений // Бюлл. МОИП. Отд. биол. 1992. 97(3): 80-91.
Захарова А. А. Эмбриология Trapa manshurica (Trapaceae) // Тез. докл. П(Х) съезда РБО
"Проблемы ботаники на рубеже XX-XXI веков". СПб, 1998:119-120.
Звержанская Л. С. Мейоз и формирование мужского и женского гаметофитов у гаплоидов //
Гаплоидия у покрытосеменных растений. Ч. II. Саратов: Изд-во СГУ, 1974: 7-42.
Зиман С. Н. Морфология и филогения семейства лютиковых. Киев: Наук, думка, 1985:1-248.
Зимницкая С. А. Эмбриологические особенности Trifolium trichocephalum Bieb. и Trifolium
pannonicum Jacq. при интродукции на Среднем Урале в связи с низкой семенной продуктивностью.
Автореф. дисс.... канд. биол. наук, СПб. 1992:1-20.
Злобин Ю. А. К познанию строения клонов Vaccinium myrtillus L. // Бот. журн. 1961. 46(3):
311-322.
Злобин Ю. А. Семенное размножение хвойных древесных пород как биоценотический процесс
// Вопросы биологии семенного размножения / Ред. Левина Р. Е. Ульяновск: Изд-во УГПИ,
1968:193-205.
Литература _ 549
Злобин Ю. А. Об уровнях жизнеспособности растений / / Журн. общ. биол. 1981.42(4): 492-505.
Злобин Ю. А. Репродукция у цветковых растений: уровень особей и уровень популяций //
Биол. науки. 1989. (7): 77-89.
Злобин Ю. А. Мутуализм и комменсализм у растений // Бюлл. МОИП. Отд. биол. 1993а.
99(1): 57-63.
Злобин Ю. А. Популяционное и ценотическое регулирование репродукции у цветковых
растений // Проблемы репродуктивной биологии семенных растений / Ред. Терехин Э. С. СПб:
Изд-во БИН РАН, 19936: 8-13.
Злобин Ю. А. Структура фитопопуляций // Успехи совр. биологии. 1996. 116(2): 133-146.
Злобин Ю. А., Чумакова Е. А. Рост и репродукция у эфемероидов широколиственного леса
при разных уровнях рекреационных нагрузок / / Бот. журн. 1989. 74(3): 432-439.
Зоз И.Г. О Ceratophyllum tanaiticum Sapjegin // Изв. Бот. сада АН СССР, 1931.30(3-4): 403-413.
Зозулин Г. М. Система жизненных форм высших растений // Бот. журн. 1961. 46(1): 3-20.
Зозулин Г. М. Схема основных направлений и путей эволюции жизненых форм семенных
растений // Бот. журн. 1968. 53(2): 223-233.
Зозулин Г. М. Аспекты учения о жизненных формах в биосферном плане // Проблемы
экологической морфологии растений / Ред. Серебрякова Т. И. М.: Наука, 1976: 45-54.
Зуева Г. В. Аномалии в развитии женского гаметофита пшенично-ржаных амфидиплоидов //
"Половой процесс и эмбриогенез растений". Матер. Всес. симп. М., 1973: 81-82.
Иванов А. И. Люцерна. М.: Колос, 1980:1-349.
Ившин Н. В. Изменчивость числа семязачатков в коробочке в экологически различных
популяциях Plantago major L. // Экология. 1998. 6: 435-440.
Игнатьева И. П., Андреева И. И. Метаморфозы вегетативных органов покрытосеменных. М.:
Изд-во МСХА, 1993. 2:1-170.
Илиева И., Молхова Е. Влияние гама-облъчманято върху микрогаметогенеза, прорастването
на прашец и ранния ембриогенез при тепера // Генет. и селекция (НРБ). 1979.129(4): 242-252.
Ильина Г. М. Сравнительно-эмбриологическое исследование семейства маковых (Papaveraceae Juss.)
в связи с положением его в системе покрытосеменных: Автореф. дисс.... канд. биол. наук. М., 1968:1-24.
Ильина Г. М. Сем. Zemnaceae // Сравнительная эмбриология цветковых растений.
Однодольные. Butomaceae-Lemnaceae. Л.: Наука, 1990: 279-286.
Ильинский А. П. Расселение растений (основные понятия и термины) // Природа. 1945.5:45-55.
Иоффе М. Д. Полиплоидия в эндосперме цветковых растений // Проблемы эмбриологии.
Киев: Наукова думка, 1971:170-196.
Ипатов В. С. О понятии фитоценоз и элементарной ячейке общественной жизни растений //
Вестн. ЛГУ. Сер. Биол. 1966. 3: 56-62.
Ипатов В. С. Некоторые вопросы теории организации растительного покрова // Бот. журн.
1970.55(2): 184-195.
Ипатов В. С, Кирикова Л. А. Фитоценология. СПб: Изд-во СПбГУ, 1997:1-316.
Каверзнева Ю. Г. О семенном размножении черники // Рубки и восстановление
хозяйственно-ценных хвойных пород в южно-таежной подзоне Европ. части РСФСР. Сб. научн.
тр. ЛОС. М., 1973: 252-263.
Каден Н. Н. К вопросу о ложных плодах // Вестн. МГУ. 1947.18: 23.
Каден Н. Н. Плоды и семена среднерусских роголистниковых // Бюлл. МОИП. Отд. биол.
1953а. 38(3): 82-85.
Каден Н. Н. Роголистники Европейской части СССР // Бюлл. МОИП. Отд. биол. 19536.
38(3): 86-89.
Каден Н. Н. О некоторых основных вопросах классификации, типологии и номенклатуры
плодов // Бот. журн. 1961. 46(4): 496-504.
Казакевич Л. И. Материалы к биологии растений Юго-Востока России. 1. Главнейшие типы
вегетативного возобновления и размножения травянистых многолетников // Бюлл. Отд. приклад,
ботан. Саратовск. обл. с.-х. опытной станции. 1922. (18): 1-21.
550
Системы репродукции
Казарян В. О., Балагедян Н. В. Партикуляция — основная причина старения и отмирания
многолетних стержнекорневых трав // Изд. Арм. ССР. 1960.13(9): 17-27.
Казарян В. О., Геворкян И. А. К вопросу о гормональной регуляции листа каланхое в ходе
формирования выводковых почек // Биол. журн. Армении. 1985. 38(2): 99-104.
Казачковская Е. Б. Морфологическое проявление женской стерильности у люцерны // Ргос. XI
Intern. Symp."Embryology and seed reproduction", Leningrad, 1990. St.Petersburg: Nauka, 1992:256-257.
Кайгородова М. С. Антэкология растений тундр Полярного Урала: Автореф. дис.... канд. биол.
наук. Пермь. 1972: 1-19.
Кайгородова М. С. Антэкология растений тундр Полярного Урала // Экология опыления.
Межвуз. сб. научн. трудов. 1976. 2: 3-29.
Камелина О. П. Семейство Ворсянковые (Dipsacaceae) // Жизнь растений. Порядок
Ворсянковые (Dipsacales) / Ред. Тахтаджян А. Л. М.: Просвещение, 1981. 5 (2): 383-385.
Камелина О. П. О синергидной апогаметии в роде Tetradiclis Stev. // Тр. Межд. симп. "Апо-
миксис у растений: состояние проблемы и перспективы исследований". Саратов, 1994а: 69-70.
Камелина О. П. Эмбриология и систематическое положение рода Tetradiclis (Tetradiclidaceae)
// Бот. журн. 19946. 79(5): 11-27.
Каменецкая И. В. Почвенный запас семян сосны и основных травяно-кустарничковых
растений в сосняках черничных // Сосновые боры подзоны южной тайги и пути ведения в них лесного
хозяйства. М.: Наука, 1969: 252-263.
Канделаки Г. В. Отдаленная гибридизация и явление псевдогамии // Апомиксис и селекция.
М.: Наука, 1970:171-182.
Карпов В. Г. О видовом составе живых семян и запасе их в почве ельника-черничника // Тр.
МОИП. 1960. 3:131-140.
Карпов В. Г. Экспериментальная фитоценология темнохвойной тайги. Л.: Наука, 1969:1-335.
Каршина Л. Е., Трофимов М. М. О возможности культуры чилима в дельте р. Волги // Бюлл.
МОИП. Отд. биол. 1951. 56(1): 94-96.
Катаева Н. В., Бутенко Р. Г. Клональное микроразмножение растений. М.: Наука, 1983:1-97.
Кашин А. С. Структурно-функциональные аспекты эволюции систем семенного размножения
у покрытосеменных // Апомиксис в эволюции цветковых растений / Ред. Кашин А. С,
Куприянов П. Г. Саратов: Изд-во СГУ, 1993: 85-155.
Кашин А. С. Половое размножение, агамоспермия и видообразование у цветковых // Журн.
общ. биол. 1998.59(2). 171-191.
Кашин А. С, Блюднева Е. А., Силкин М. А. Активация мегагамет и регуляция эмбриогенеза в
культуре in vitro неоплодотворённых завязей проса посевного // Физиол. раст. 2000а. (в печати).
Кашин А. С, Киреев Е. А., Чернышева М. П., Титовец В. В. Потенциал формообразования
агамного комплекса Pilosella. 2. Естественные межвидовые гибриды // Бот. журн. 20006. (в печати).
Кашин А. С, Куприянов П. Г. Апомиксис в эволюции цветковых растений. Саратов: Изд-во
СГУ, 1993:1-196.
Кашин А. С, Сенников А. Н, Чернышева М. П., Отькало О. В., Титовец В. В. Потенциал
формообразования агамного комплекса Pilosella. 1. Базовые таксономические виды / / Бот. журн. 1999.84(4): 25-38.
Кашин А. С, Чернышева М. П. Частота апомиксиса в популяциях некоторых видов Taraxacum
и Hieracium // Бот. журн. 1997. 82(9): 14-24.
Кернер А. фон Марилаун. Жизнь растений / Ред. Бородин И.П. СПб: Просвещение, 1899.1:
1-773; 1902. 2:1-841.
Кизилова Е. Г. Разнокачественность семян и ее агрономическое значение. Киев: Урожай, 1974:1-216.
Кильчевский А. В., Хотылева Л. В. Экологическая селекция растений. Минск: Тэхналопя,
1997:1-372.
Ким Г. Ю. Онтогенез, структура и жизненность ценопопуляций Calamagrostis langsdorffii
(Link.) Trin. на пойменных лугах Нижнего Амура // Растительные ресурсы. 1997. 33(4): 1-16.
Кишко К.М. Особливосп бюморфологии, репродуктивно1 бюлогп та йм1чного складу Gentiana
asclepiadea L. в Закарпатп // Науковий вкник Чершвецькогоушверситету, 1998. 2(4): 114-120.
Литература
551
Коган Ш. И., Чиннова Г. А. О взаимотношениях Ceratophyllum demersum с некоторыми
сине-зелеными водорослями // Гидробиол. журн. 1972. 8(5): 21-27.
Кожин А. Е. Вопросы выражения пола и многообразие сексуальных типов у цветковых
растений // Журн. общ. биологии. 1941. 2(3): 355-374.
Козирацкий Л. А. Вщвореняя i рацюнальне використання недеревно1 рослинност1 Aide. Кшв,
1975:1-88.
Козлов Г. С, Козлова М. Э. Влияние постоянного магнитного поля на генеративные органы
табака // Апомикис и цитоэмбриология / Ред. Тырнов В. С. Саратов: Изд-во СГУ, 1978: 58-59.
Козлова Н. И. Анатомо-экологическая характеристика полукустарничков Восточного Крыма
// Бот. журн. 1953.38(4): 497-512.
Козо-Полянский Б. М. В стране живых ископаемых. М.: Гос. учебно-педагогич. изд. 1931:1-184.
Козо-Полянский Б. М. Закон Найт-Дарвина и механизмы цветков // Тр. Воронежск. ун-та,
1946.14(1): 48-50.
Козо-Полянский Б. М. X. К. Шпренгель и современная ботаническая наука // Природа.
1947а. 1: 89-91.
Козо-Полянский Б. М. К антэкологии белозора (ParnassiapalustrisL.). В защиту дарвинизма в
экологии цветка // Бот. журн. 19476. 30(1): 15-22.
Козо-Полянский Б. М. К вопросу о филогенетическом значении апомиксиса // Бот. журн.
1948. 33(1): 123-127.
Козо-Полянский Б. М. Происхождение цветка и типа цветковых растений / / Бюлл. МОИП.
Отд. биол., 1950. 55(4): 41-50.
Козо-Полянский Б. М. Против идеализма в морфологии растений / / Бот. журн. 1951.36(2): 115-128.
Колесова Г. Е. Семейство Тгарасеае // Сравнительная анатомия семян. СПб: Мир и семья,
1996. 5: 242-259.
Колесова Г. Е., Батыгина Т. Б. Семейство Nelumbonaceae // Сравнительная анатомия семян.
Л: Наука, 1988. 2:157-162.
Колотева Н. И., Жуков О. С. Цитоэмбрилогическое исследование земляники в связи с апомик-
сисом // Тр. Межд. симп. "Апомиксис у растений: состояние проблемы и перспективы
исследований." Саратов, 1994: 81-83.
Кольцов Н. К. Роль гена в физиологии развития // Биол. журн. 1935. 4(5): 753-774.
Комарницкий Н.А., Кудряшов Л.В., Уранов А.А. Ботаника. Систематика растений. М.:
Просвещение, 1975:1-608.
Комаров В. Л. Учение о виде у растений (страница из истории биологии). М.-Л.: Изд-во АН
СССР. 1940:1-212.
Комарова Т. А. Развитие Chelidonium asiaticum (Papaveraceae) при восстановлении
кедрово-широколиственных лесов Южного Сихотэ-Алиня после пожара // Бот. журн. 1984.
69(8): 1052-1062.
Комендар В. И., Сабадош В. И., Шуйская Н. В., Пекар Я. М. Особенности семенной
продуктивности некоторых видов геоэфемероидов в Закарпатье // Ботаника и микология на пути в третье
тысячелетие / Ред. Вассер С. П. Киев, 1996: 152-160.
Кондратьева-Мельвиль Е. А. Образование корневых отпрысков у некоторых травянистых
двудольных // Вестн. ЛГУ. Сер. биол. 1957. 3(1): 22-37.
Кондратюк Е. Н., Шабарова С. И. К характеристике плодов и семян некоторых вересковых //
Бюлл. ГБС. 1968. 70: 93-95.
Константинов А. В. Нарушения мейоза у некоторых растений при действии соляной кислотой
// Генетика и цитология / Ред. Турбин Н. В. Минск: Изд-во БГУ, 1970:191-192.
Кордгом Е. Л. Цитоэмбриология семейства зонтичных. Киев: Наукова думка, 1967:1-174.
Кордгом Е. Л., Глущенко Г. И. Цитоэмбриологические аспекты проблемы пола
покрытосеменных. Киев: Наук, думка, 1976:1-198.
Коржинский С. И. Материалы к географии, морфологии и биологии Aldrovanda vesiculosa L.
// Тр. Общ. естествоисп. природы при Импер. Казанском унив. 1887. 27(1): 1-98.
552
Системы репродукции
Коржинский Я. В. Способы и эффективность рассеивания семян и динамика популяций
растений в горных лесах Карпат / / Проблемы охраны генофонда и управления экосистемами в
заповедниках зоны. М.: Наука, 1986:107-109.
Коровин Е. П. Растительность Средней Авии и Южного Казахстана. М. — Ташкент: Саогиз,
1934:1-480.
Короткова Е. 3. Влияние богатства почвы и влажности условий местопроизрастания на процесс
накопления 137Cs надземной фитомассой дикорастущих ягодных растений Украинского Полесья
// Тез. межд. научн. конф. молодых ученых "Лес. Наука. Молодежь". Гомель, 1999: 31-33.
Коршиков 1.1., Михеенко I. П., Котов В. С, Чернишова Л. В. Стшкшть потомства Bromopsis
inermis (Leys.) Holub (Poaceae) з техногенних екототв до арчистого газу i важних метал1в // Укр.
бот. журн. 1992. 49(6): 59-62.
Костина М. В. Строение и ритм развития систем годичных побегов у древесных представителей
розоцветных (подсемейства Spiraeoideae и Prunoideae): Автореф. дис канд. биол. наук. М., 1997:1-26.
КостычевП. А. Влияние качества семян на урожай// Сельск. хоз-во и лесовод. 1877.152:11-18.
Костычев С. П. Физиология растений. М.-Л.: Сельхозгиз, 1937.1:1-547.
Котт С. А. Сорные растения и борьба с ними. 3-е изд. М.: Сельхозгиз, 1961: 1-365.
Красная книга РСФСР. Растения: Семейство Рогульниковые (Водяные орехи, Водноорехо-
вые) Trapaceae. M.: Росагропромиздат. 1988: 431-432.
Краснов В. П. Всхожесть и энергия прорастания семян черники в Полесье (Житомирская
область) // Растит, ресурсы. 1978.14(4): 526-529.
Кренке Н. П. Хирургия растений. М.: Новая деревня, 1928: 1-653.
Кренке Н. П. Регенерация растений / Ред. Баранов П. А. М.-Л.: Изд-во АН СССР, 1950:1-675.
Кричфалуций В. В., Комендар В. И. Биоэкология редких видов растений. Львов: Свит, 1990:1-160.
Кр1чфалушш В. В., Мезев-Кр1чфалушш Г. М. Популяцшна бюлопя рослин. Ужгород: Изд-во
Ужгородск. Державн. ун-та, 1994:1-80.
Криштофович А. Н. Палеоботаника. Л.: Наука, 1957:1-340.
Крупное В. А. Генная и цитоплазматическая мужская стерильность растений. М.: Колос, 1973:1-279.
Кудряшова О. И. О партикуляции у травянистых многолетников // Физиология растений.
1958. 5(1): 77-80.
Кузнецова М. С. Антэкология некоторых основных компонентов ракомитриевой тундры
Полярного Урала // Уч. зап. Пермск. ун-та. Биология. 1970. 206: 47-57.
Кузнецова Т. В. К истории развития представлений о плане строения побега сосудистых
растений и месте филлома в нем // Бот. журн. 1995. 80(7): 1-12.
Куликов П. В. Асимбиотическое семенное размножение редких орхидных Урала // Проблемы
рационального использования, воспроизводства и экологического мониторинга лесов (Инф.
материалы). Свердловск: УрО АН СССР, 1991: 83 - 85.
Куликов П. В. Экология и репродуктивные особенности редких орхидных Урала: Дисс.... канд.
биол. наук. Екатеринбург, 1995:1—487.
Куликов П. В. Биологические особенности, воспроизведение и динамика популяции Calypso bulbosa
(L.) Oakes (Orchidaceae) на Среднем Урале // Бюлл. МОИП. Отд. биол. 1997.102(5): 61-67.
Куликов П. В., Филиппов Е. Г. Прорастание семян и развитие проростков in vitro у некоторых
орхидных умеренной зоны // Экология и интродукция растений на Урале. Свердловск: УрО АН
СССР, 1991: 39 - 43.
Куликов П. В., Филиппов Е. Г. О методах размножения орхидных умеренной зоны в культуре
in vitro // Бюлл. ГБС. 1998.176:125-131.
Культиасов М.С. Ботаника. М.: Сов. наука, 1953:1-588.
Куперман Ф. М. О неравномерности в развитии зачаточного колоса у злаков // Докл.
ВАСХНИЛ. 1950. 3: 33-38.
Куприянов П. Г. Диагностика систем семенного размножения в популяциях цветковых
растений. Саратов: Изд-во СГУ, 1989:1-160.
Литература
553
Куприянова Л. А. Пыльца Nelumbo caspica (DC) Fisch. и строение ее тетрад / / Палинология в
СССР. М.: Наука, 1976: 22-24.
Куприянова Л. А., Алешина Л. А. Пыльца и споры растений флоры Европейской части
СССР. Л.: Наука, 1978:1-183.
Кучук Н. Н. Генетическая инженерия высших растений. Киев: Наукова думка, 1997: 1-152.
Кюри [Без иниц.]. Руководство к определению растений легким и точным способом с помощью
собственного исследования. М.: Изд. Григорьев, 1861:1-437.
Лавренко Е. М. Основные закономерности растительных сообществ и пути их изучения / /
Полевая геоботаника. М.-Л.: Изд-во АН СССР, 1959.1:13-75.
Лакшманан К. К., Амбегаокар К. Б. Полиэмбриония // Эмбриология растений:
использование в генетике, селекции, биотехнологии. М.: Агропромиздат, 1990. 2: 5-38.
Лаптев Ю. П. Гетероплоидия в селекции растений. М.: Колос, 1984:1-248.
Лебедев В. П. Половая структура ценопопуляций щавеля малого (Rumex acetosella L.) //
Биол. науки. 1989.10: 77-82.
Левина Р. Е. Способы распространения плодов и семян. М.: Изд-во МГУ, 1957:1-90.
Левина Р. Е. К методике изучения распространения семян и плодов (диссеминация) //
Полевая геоботаника. М.-Л.: Изд-во АН СССР, 1960. 2:143-162.
Левина Р. Е. Многообразие и эволюция форм размножения растений. М.: Учпедгиз, 1961:1-80.
Левина Р. Е. Биология семенного размножения как научная проблема // Вопросы биологии
семенного размножения. Саратов: Приволжское книжн. изд-во, 1965. 20(5): 4-16.
Левина Р. Е. Дифференциация пола у растений // Экология опыления. Пермь: Изд-во Пермс.
ун-та, 1979. 4: 62-67.
Левина Р. Е. Репродуктивная биология семенных растений. Обзор проблемы. М.: Наука, 1981:1-96.
Левина Р. Е. Семенная продуктивность райграса высокого в культуре // Растительные
ресурсы, 1982.18(1): 33-40.
Левина Р. Е. Семенная продуктивность Bromopsis inermis (Poaceae) // Ботан. журн. 1984.
69(1): 55-61.
Левина Р. Е. Морфология и экология плодов. Л., 1987:1-260.
Левина Р. Е., Войтенко В. Ф. Гетерокарпия, или разноплодие // Природа. 1975. 5: 87-95.
Лекявичюс Э. Элементы общей теории адаптации. Вильнюс: Мокслас, 1986:1-273.
Леме Ж. Основы биогеографии. М.: Прогресс, 1976:1-309.
Лесные экосистемы и атмосферное загрязнение / Ред. Алексеев В. А. Л.: Наука, 1990:1-198.
Лобанова Л. П. Модификационная изменчивость макрогаметофитогенеза табака,
индуцированная температурой: Дисс. ... канд. биол. наук. Саратов, 1992:1-207.
Лобашов М. Е., Ватти К. В., Тихомирова М. М. Генетика с основами селекции. М.:
Просвещение, 1979:1-304.
Лодкина М. М. Эволюционные отношения однодольных и двудольных по данным изучения
зародыша и проростков // Бот. журн. 1988. 73(5): 617-630.
Лутков А. Н. Об экспериментальном получении полиплоидных гамет под влиянием низкой
температуры и хлороформа / / Тр. по прикладн. ботанике, генетике и селекции. 1937. Сер. 11(7): 127-148.
Лыкова Е. И. Клейстогамия у Girgensohnia oppositiflora (Pall.) Fenzl. и Halimocnemis villosa Kar.
et Юг.// Учен. зап. Перм. ун-та. 1964.114: 93-96.
Львова И. Н. Пол у растений. М.: Изд-во МГУ, 1963:1-55.
Любарский Е. Л. Об органах вегетативного возобновления и размножения высших растений / /
Бот. журн. 1960. 45(7): 1067-1069.
Любарский Е. Л. Об эволюции вегетативного возобновления и размножения у травянистых по-
ликарпиков // Бот. журн. 1961. 46(7): 959-968.
Любарский Е. Л. Экология вегетативного размножения высших растений. Казань: Изд-во
КГУ, 1967:1-180.
Любарский Е. Л., Полуянова В. И. Структура ценопопуляций вегетативно подвижных
растений. Казань: Изд-во КГУ, 1984:1-138.
554
Системы репродукции
Любич Ф. П. Формирование пола у конопли в зависимости от местоположения плодов в
соцветии // Агробиология. 1950.1:153-155.
Любич Ф. П. Разнокачественность плодов и семян у растений и ее значение в жизни вида //
Агробиология. 1951. 5: 21-27.
Лянгузова И. В. Качество и жизнеспособность семян некоторых травянистых растений в
условиях промышленного загрязнения // Тез. докл. 3-й Межд. конф. по устойчивому развитию
"Проблемы индустриальных регионов: менеджмент и экология". Запорожье, 1998: 92-93.
Лянгузова И. В., Комалетдииова Э. М., Мазная Е. А. Оценка потенциальных возможностей
некоторых видов p. Vaccinium к семенному размножению в условиях промышленного загрязнения
// Тез. докл. 3-й Межд. конф. по устойчивому развитию "Проблемы индустриальных регионов:
менеджмент и экология". Запорожье, 1998. 93-95.
Лянгузова И. В., Мазная Е. А. Влияние атмосферного загрязнения на репродуктивную
способность дикорастущих ягодных кустарничков сосновых лесов Кольского полуострова // Растит,
ресурсы. 1996. 32(4): 14-21.
Лянгузова И. В., Мазная Е. А., Комалетдииова Э. М. Оценка качества семян некоторых
ягодных кустарничков северо- и южнотаежных сосновых лесов // Биологическое разнообразие.
Интродукция растений. Матер. II Межд. конф. СПб, 1999: 358-360.
Ляшенко Н. И. Биология спящих почек. М.-Л.: Наука, 1964:1-87.
Магешвари П. Эмбриология покрытосеменных. М.: Ин. лит-ра, 1954:1-439.
Мазепа В. Г. Влияние техногенного загрязнения атмосферы на репродуктивные особенности
Pinus sylvestris L. // Укр. ботан. журн. 1995. 52(5): 654-658.
Мазная Е. А., Лянгузова И. В. Репродуктивная способность Vaccinium myrtillus L. в условиях
атмосферного загрязнения (Кольский полуостров) // Растит, ресурсы. 1995. 31(2): 16-26.
Мазная Е. А., Лянгузова И. В. О репродуктивной способности ягодных кустарничков сосновых
лесов северной Карелии в условиях атмосферного загрязнения // Растит, ресурсы. 1997. 33(2): 45—50.
Мазная Е. А., Лянгузова И. В. Биология прорастания семян некоторых видов рода Vaccinium
L. // Растит, ресурсы. 1999. 35(1): 53-60.
Мазуренко М. Т. Вересковые кустарнички Дальнего Востока. Структура и морфогенез. М.:
Наука, 1982:1-182.
Мазуренко М. Т. Биоморфологические адаптации растений Крайнего Севера. М.: Наука,
1986:1-208.
Макаро И. Л., Кондратьева А. В. Повышение продуктивности семян овощных культур. М.:
Сельхозиздат, 1962:1-199.
Макаро И. Л., Кондратьева А. В. Физиология семян овощных культур // Физиология
сельскохозяйственных растений. Физиология овощных бахчевых культур / Ред. Рубин Б. А. М.:
Изд-во МГУ, 1970. 8: 5-53.
Макрушин Н. М. Основы гетеросперматологии. М.: Агропромиздат, 1989: 1-288.
Малецкий С. И., Малецкая Е. И. Самофертильность и агамоспермия у сахарной свеклы (Beta
vulgaris L.) // Генетика. 1996. 32(12): 1643-1650.
Малиновский К. А. Популяционная биология растений: ее цель, задачи и методы // Укр. бот.
журн. 1986. 43(4): 318-331.
Мальцев А. И. Атлас важнейших видов сорных растений СССР. Л.: Сельхозгиз, 1937.1:1-167.
Малюта Э. Н. Мейотическая мутация, приводящая у диплоидной сахарной свеклы к
образованию нередуцированных гамет // Индуцированный мутагенез и апомиксис / Ред. Петрова Д. Ф.
Новосибирск: Наука, 1980:102-108.
Мандрик В. Ю. Ембрюлогичне досл1дження деякихвид1в роду Alchemilla L. // Укр. бот. журн.
1976.33(5): 476 — 480.
Мандрик В. Ю. Форма апомиксиса у представителей семейства Rosaceae / / Бюлл. ГБС. 1980.
116: 86-93.
Марков М. В. Популяционная биология растений (учебно-методическое пособие). Казань:
Изд-во КГУ, 1986:1-108.
Литература
555
Марков М. В. Популяционная биология розеточных и полурозеточных малолетних растений.
Казань: Изд-во КГУ, 1990:1-186.
Марков М. В. Структура и популяционная биология малолетних растений центра Русской
равнины: Автореф: Дисс.... докт. биол. наук. М., 1992:1-35.
Марков М. В., Плещинская Е. Н. Репродуктивное усилие у растений // Журн. общ. биол.
1987. 48(1): 77-83.
Маркова Л. П., Медведева Л. И. Материалы к изучению подземных органов некоторых ферул
из подрода Peucedanoides (Boiss) Korov. // Растения семейства зонтичных — источник
биологически активных веществ. Л.: Наука, 1968:149-173.
Мартыненко В. П., Каим Л. Г. Водяной орех Trapa natans L. в Белорусском Поозерье // Бот.
иссл. Белорус, отд. ВБО. 1977.19:146-149.
Мартынов И. Техно-ботанический словарь на латинском и российском языках. СПб: Изд-во
Российской Акад., 1820:1-682.
Матюхин Д. Л. Возрастные изменения в клонах гладиолуса гибридного, полученных in vitro:
Автореф.... дис. канд. биол. наук. М. 1994:1-18.
Медведев П. Ф. Малораспространенные кормовые культуры. Л.: Колос, 1970: 1-160.
Медведев П. Ф., Сметанникова Л. И. Кормовые растения Европейской части СССР.
Справочник. А: Колос, 1981: 208-213.
Мелибаев С. К биологии прорастания семян некоторых видов рода Ferula L. // Дикорастущие
лекарственные растения и их ресурсы. Ташкент: ФАН, 1977: 43-47.
Меликян А. П. Опыление цветковых растений // Итоги науки и техники. ВИНИТИ. Сер.
Ботаника. 1991. 12: t-50.
Меликян А. П., Тихомиров В. Н. Цветок // Эмбриология цветковых растений. Терминология
и концепции / Ред. Батыгина Т. Б. СПб: Мир и семья, 1994. 1: 29-34.
Меце О., Кнут П. Жизнь и строение цветка. СПб: Брокгауз-Ефрон, 1911:1-199.
Микеладзе Р. М. К познанию альпийских ковров // Проблемы ботаники. М.-Л., 1960.5:170-181.
Минина Е. Г. Смещение пола у растений воздействием факторов внешней среды. М.: Изд-во
АН СССР, 1952:1-198.
Минина Е. Г. Значение смещения пола у растений для селекции (о связях гетерозиса и
полиплоидии с сексуализацией) // Журн. общ. биологии. 1965. 26(4): 416-427.
Миркин Б. М., Розенберг Г. С, Наумова Л. Г. Словарь понятий и терминов современной
фитоценологии. М.: Наука, 1989:1-223.
Мирошниченко Е. Некоторые биологические особенности Роа (к методам определения апомик-
тичных форм) // Цитология и селекция культурных растений. 1964. 2: 49-58.
Мирошниченко Е. Факультативный псевдогамный апомиксис и кариологический полиморфизм
в роде Роа // Апомиксис у растений и животных. Новосибирск: Наука, 1978. 35: 224-236.
Михайлова Л. Н. К экологии и биологии чилима (Trapa L.) в дельте Волги // Тр. Астрах, гос.
заповеди. 1940. 3: 85-113.
Михайловская И. С. Особенности анатомической структуры геофильного органа борца
высокого Aconitum excelsum Rchb. // Бюлл. МОИП. Отд. биол. 1976. 81(6): 95-111.
Михалевская О. Б., Шарашидзе Н. М., Брегвадзе М. А., Джибути Л. Т. Динамика развития побегов и
почек у Camellia japonica и С. sasanqua в Батумском ботаническом саду // Бот. журн. 1988.73(9): 823-829.
Модилевский Я. С. До вивчения пол1ембрюнп у Allium odorum L. // BicH. Кшвс. ботан. саду.
1925. 2: 9-20.
Модилевский Я. С. Про утворения зародмв у Allium odorum L. // BicH. Кшвс. ботан. саду.
1931. (12-13): 27-48.
Модилевский Я. С. Апомиксис у покритонасшних рослин / / Бот. журн. АН УССР. 1948.5(2): 5-21.
Молчан И. М. Половые типы растений и теория несовместимости / / Изв. ТСХА. 1974.3:67-81.
Момотов И. Ф., Патудина В. М., Беркович Б. В. Онтогенез и кормовые качества травянистых
многолетников, пригодных для фитомелиорации пустынных пастбищ // Проблемы освоения
пустынь. Ашхабад: Ылым, 1989. 4: 46-53.
556
Системы репродукции
Монюшко В. А. Половые формы цветковых растений и закономерности в их географии и
происхождении // Тр. по прикл. бот., генет. и селекц. 1937.1(2): 107-152.
Морозова Н. М., Васильева В. Е. К вопросу о длительной жизнеспособности семян Nelumbo
nucifera (Nelumbonaceae) // Бот. журн. 1993. 78(8): 47-50.
Морщихина С. С. Семейство ризофоровые (Rhizophoraceae) // Жизнь растений / Ред. Тах-
таджян А. Л. М.: Просвещение, 1981. 5(2): 231-233.
Москова Р. Д. Апомиксис у Bothriochloa ischaemum L. // Апомиксис и его использование в
селекции. М.: Колос, 1976: 101-117.
Мошкович А. М. Добавочные хромосомы покрытосеменных растений. Кишинев: Штиинца,
1979:1-164.
Мурдахаев Ю. М. Биологические особенности видов рода Trapa L., интродуцированных
Ботаническим садом АН УзССР в Ташкент // Интродукция и акклиматизация растений. 1975. 12: 55-59.
Мурзаев М. А. Сбор и заготовка дикорастущих орехов. М.-Л.: КОИЗ 1935:1-97.
Мухамбеджанов С. К., Азимова Е. Д., Колумбаева С. К., Ереженов А. Е., Рахимбаев И. Р.
Культивирование неоплодотворённых завязей пшеницы // Матер. Всес. науч. конф. по с-х. био-
технол. Целиноград, 1991а: 62-63.
Мухамбеджанов С. К., Ереженов А. Е., Рахимбаев И. Р. Нуцеллярная и интегументальная эмбрио-
ния в культуре неоплодотворённых завязей пшеницы // Изв. Каз. ССР. Сер. биол. 19916. 2: 84-85.
Мухин А. Д. Различия в продуктивности семенного потомства с разных частей колоса / /
Яровизация. 1941. 3:104-106.
Назаров В. В. Репродуктивная биология орхидных Крыма: Дисс.... канд. биол. наук. СПб, 1995:1-294.
Найда Н. М. Биология семенного размножения окопника (Symphytum L.) в условиях
Северо-Запада Нечерноземной зоны РФ: Дисс.... докт. биол. наук. СПб, 1998:1-452.
Нарматов Б. Биология цветения и цитоэмбриология однолетних эспарцетов: Автореф. дис. ...
канд. биол. наук. Ташкент, 1988:1-20.
Наумова Т. Н., Яковлев М. С. Развитие эмбриональных структур Trillium camschatense
Ker-Gawl. после опыления // Бот. журн. 1975. 60(5): 627-635.
Некрасов В. И. Оценка качества семян отдельных экземпляров Acanthopanax sessiliflorum и
Maackia amurensis // Бюлл. ГБС. 1969. 74: 82-86.
Некрасова Т. П. К вопросу о динамике урожаев у пихты сибирской / / Тр. по лесному
хозяйству Сибирского биол. ин-та СО АН СССР. 1960. 5.
Нечаева Н. Т. Материалы к биологии полыни Artemisia herba alba Asso // Бот. журн. 1949.
34(1): 95-99.
Никитичева 3. И., Яковлев М. С. Семейство Rhizophoraceae // Сравнительная эмбриология
цветковых растений. Brunelliaceae-Tremandraceae / Ред. Яковлев М. С. Л.: Наука, 1985:120-125.
Николаева М. Г. К биологии прорастания некоторых видов Ferula L. // Эксперимент,
ботаника. М.-Л., 1948. 6: 218-228.
Николаева М. Г., Разумова М. В., Гладкова В. Н. Справочник по проращиванию покоящихся
семян. Л.: Изд-во Наука, 1985:1-347.
Ниценко А. А. Понятие о фитоценозе в современной советской геоботанике / / Вестн. ЛГУ.
Сер. Биол., геогр. и геол. 1953.1: 61-71.
Ниценко А. А. О некоторых спорных вопросах теории геоботаники // Бот. журн. 1963. 48(4):
486-501.
Новиков Г. Н. О формах размножения пустынных полукустарничков // Сов. Ботаника. 1943.
(2): 30-37.
Новожилова Н. Н. Цветение и опыление высокогорных растений Восточного Памира:
Автореф. дис. ... канд. биол. наук. Томск, 1984:1-16.
Новоселова Л. В. Репродуктивная биология однолетних видов люцерны: Автореф. дис.... канд.
биол. наук. Пермь, 1996а: 1-19.
Новоселова Л. В. Особенности репродуктивной биологии однолетних видов Medicago / /
Проблемы репродуктивной биологии растений: Тез. докл. симп. Пермь: Перм. ун-т, 1996б: 20-21.
Литература
557
Новоселова Л. В. Развитие пыльцевых зерен и фертильность пыльцы у однолетних видов
Medicago L. // Вест. Перм. ун-та. Пермь, 1997. 3: 46-49.
Новоселова Л. В. Бутонная клейстогамия у некоторых однолетних видов рода Medicago
(Fabaceae) // Бот. журн. 1998. 83(11): 82-87.
Ноглер Г. А. Гаметофитный апомиксис // Эмбриология растений / Ред. Джори В. М. М.: Аг-
ропромиздат, 1990. 2: 39-91.
Норин Б. Н. О некоторых понятиях фитоценологии и геоботаники // Бот. журн. 1968. 53(9):
1268-1274.
Норин Б. Н. Некоторые проблемы изучения взаимоотношений лесных и тундровых экосистем
// Бот. журн. 1974. 59(9): 1254-1268.
Нухимовский Е. Л. О соотношении понятия "партикуляция" и "вегетативное размножение" //
Бюлл. МОИП. Отд. биол. 1973. 78(5): 107-120.
Обручева Н. В., Антипова О.В. Физиология инициации прорастания семян // Физиол. раст.
1997. 44(2): 287-302.
Овеснов А. М. Всхожие семена в почве, затопленной водами Пермского водохранилища //
Материалы по биологии и гидробиологии волжских водохранилищ. М.-Л.: Изд-во АН СССР, 1963:10-12.
Овчаров К. Е., Кизилова Е. Г. Разнокачественность семян и продуктивность растений. М.:
Колос, 1966:1-160.
Огородникова В. Ф. Морфология семяпочек и зародышевых мешков клевера лугового
(Trifolium pratense) // Цитология и анатомия культурных растений, 1989.124:14-18.
Орел Л. И., Константинова Л. Н., Казачковская Е. Б. Морфологические признаки фертиль-
ности и стерильности семяпочек и зародышевых мешков люцерны / / Бюлл. ВИР. 1987.170:5-9.
Орел Л. И., Константинова Л. Н., Огородникова В. Ф., Вишнякова М. А., Дзюбенко Н. И.,
Иванов А. И., Казачковская Е. Б. Отбор растений люцерны с высокой плодовитостью завязей //
Методические указания / Дорофеев В. Ф. Л., 1985:1-35.
Орел Л. И., Константинова Л. Н., Огородникова В. Ф., Дзюбенко Н. И. Фертильность
семяпочек люцерны и методы ее оценки / / Тр. по приклад, ботан., генет. и селекц. Л., 1986. 99:10-17.
Орел Л. И., Лодкина М. М. Рецензия на статью: Т. Б. Батыгина. Новое представление о
бесполом размножении и его классификация у цветковых (в свете экспериментальных данных). — В
кн.: V Всес. школа по теоретической морфологии растений. (15-18 сент. 1987 г.): Науч. доклады.
Львов, 1987, с. 96 // Бот. журн. 1988. 73(9): 1363-1367.
Орлов В. В. Взаимосвязь кривой распределения показателей качества семян с их
биологическими характеристиками // Биометрический анализ в биологии. М., 1982: 62-66.
Орлов П. А. Взаимодействие генома и плазмона в дифференцировке тканей и развитии
растений (на примере пшеницы): Дисс ... докт. биол. наук. Минск. 1995:1-248.
Остапенко Е. К., Колючая Г. С. Влияние пониженных температур на развитие пыльцевых
зерен у пшеницы Артемовка // Проблемы гаметогенеза, оплодотворения и эмбриогенеза. Матер.
VIII Всес. совещ. по эмбриол. растений (Ташкент, 12-13 октября 1982). Ташкент: Фан, 1983:106.
Павлова М. К. Культура неоплодотворённых завязей и семяпочек: возможности и перспективы
// Сельскохозяйственная биология. 1987.1: 27-33.
Паленова М. М. Особенности популяционной жизни некоторых наземноползучих трав:
Автореф. дисс.... канд. биол. наук. М., 1993:1-16.
Палибин И. В. Несколько слов о лотосе (Nelumbo nucifera Gaertn.) и его экологическом
значении // Изв. Имп. СПб Бот. Сада. 1904. 4(3): 60-66.
Панченко СМ. Особенности популяций Orthilia secunda на северо-востоке Украины //
Экология. Материалы 4-й Мытищенской конф. молодых ученых, 1999: 28-29.
Паршакова А. Л. К вопросу о разнокачественности семян в пределах одного соцветия
чистосортного растения в связи с проблемой взаимоотношений между растениями в чистых посевах //
Взаимоотношения растений в растительном сообществе. Казань: Изд-во КГУ, 1964: 30-38.
Паршакова А. Л. Разнокачественность зерновок в колосе пшеницы // Вопросы биологии
семенного размножения. Саратов: Приволжское книжн. изд-во, 1965. 20(5): 138-157.
558
Системы репродукции
Пачоский И. Отчет по исследованию сорно — полевой растительности в Херсонской губернии
в 1914 г. // Тр. бюро по прикл. ботан. 1915. 8(6): 816-820.
Первухина Н. В. Проблемы морфологии и биологии цветка. Л.: Наука, 1970:1-168.
Первухина Н. В. Околоцветник покрытосеменных. Л.: Наука, 1979:1-110.
Першина Л. А. Отдаленная гибридизация ячменя (генетические и биотехнологические
аспекты): Дисс.... докт.биол. наук. Новосибирск, 1995.
Петров В. В. Банк семян в почвах лесных фитоценозов европейской части СССР. М.: Изд.
МГУ, 1989:1-176.
Петров Д. Ф. Значение апомиксиса для закрепления гетерозиса // ДАН СССР. 1957.112(5): 954-957.
Петров Д. Ф. Генетически регулируемый апомиксис. Новосибирск.: Наука, 1964:1-187.
Петров Д. Ф. Генетически регулируемый апомиксис как способ закрепления гетерозиса и его
значение для селекции // Апомиксис и селекция. М.: Наука, 1970: 21-33.
Петров Д. Ф. Генетические основы апомиксиса. Новосибирск: Наука, 1979:1-276.
Петров Д. Ф. Апомиксис в природе и опыте / Ред. Юдин Б. Ф. Новосибирск: Наука, 1988:1-214.
Петров Ю.Е. Размножение и циклы развития водорослей //Жизнь растений. М.:
Просвещение. 1977. Т.З. С. 38-42.
Петрова И. В., Санников С. Н. Изоляция и дифференциация популяций сосны обыкновенной.
Екатеринбург, 1996:1-160.
Петровский В. В. Синузии как формы совместного существования растений // Бот. журн.
1961. 46(11): 1615-1626.
Петунников А. Свод ботанических терминов, встречающихся в русской ботанической
литературе. М.: Изд. Кушнеров и К°, 1898:1-133.
Пианка Э. Эволюционная экология. М.: Мир, 1981:1-400.
Письяукова В. В. Элементы морфологической эволюции растений. Учебное пособие. Л.:
ЛГПИ, 1980:1-74.
Пленк И. Я. Начальные основания ботанического словоизъяснения и брачной системы
растений. Перевод с латинского Сидора Моисеева. СПб: Изд-во АН, 1798:1-183.
Плиско М. А. Эмбриологическое изучение апомиксиса у представителей Rosaceae и Compositae
// Апомиксис и селекция / Ред. Хохлов С. С. и др. М.: Наука, 1970:134-141.
Плиско М. А. Семейство Rhizophoraceae // Сравнительная анатомия семян / Ред. Тахтаджян
А. Л. СПб: Мир и семья-95,1996.5:134-150.
Плющ Т. А. Ультраструктура зародышевого мешка покрытосеменных. Киев: Наук, думка, 1992.1-146.
Поддубная-Арнольди В. А. Современное состояние вопроса о бесполом размножении у
покрытосемянных растений // Бот. журн. 1940. 25(1): 75-91.
Поддубная-Арнольди В. А. Общая эмбриология покрытосеменных растений. М.: Наука,
1964а: 1-482.
Поддубная-Арнольди В. А. Сравнительно-эмбриологическое исследование представителей
семейства орхидных // Бюлл. ГБС. 19646.54: 51-62.
Поддубная-Арнольди В. А. Цитоэмбриология покрытосеменных растений. М.: Наука, 1976:1-507.
Поддубная-Арнольди В. А., Селезнева В. А. Орхидеи и их культура. М.: Наука, 1957:1-176.
Поддубная-Арнольди В. А., Стешина Н., Сосновец А. Материал к биологии цветения и
размножения Scorzonera tau-saghyz Lipsh. et Bosse // Бот. журн. 1934.19(4): 338-364.
Полунина Н. Н. Сравнительное изучение эмбриологии и биологии цветения некоторых видов
эвкалипта // ДАН СССР, 1957.115(4): 819-821.
Полунина Н. Н. Сравнительно-эмбриологическое исследование некоторых представителей
семейства миртовых // Бюлл. ГБС. 1963. 49: 82-90.
Полюшкина Е. Н. Развитие и строение семяпочки, зародышевого мешка фертильных и
стерильных цветков сои: Автореф. дис.... канд. биол. наук. Ашгабат, 1993:1-20.
Поляков П. П. Систематика и происхождение сложноцветных. Алма-Ата: Наука, 1967:1-334.
Пономарев А. Н. Экология цветения и опыления злаков и люцерны // Бот. журн. 1954. 39(5):
705-720.
Литература 559
Пономарев А. Н. О протерандрии зонтичных // ДАН СССР, 1960а. 135(3): 750-752.
Пономарев А. Н. Экология цветения и опыления злаков // Биол. науки. 19606. (1): 80-86.
Пономарев А. Н. Клейстогамия у ковылей // Бот. журн. 1961а. 46(9): 1229-1235.
Пономарев А. Н. О протерандрии зонтичных // Учен. зап. Перм. ун-та. 19616.18(3): 27-31.
Пономарев А. Н. Цветение и опыление злаков // Учен. зап. Перм. ун-та. 1964.114:115-179.
Пономарев А. Н. Некоторые итоги и задачи изучения антэкологии растений разнотравно-ковыльных
степей // Вопросы антэкологии. Мат. симп. по антэкологии. Пермь, 1969а: 67.
Пономарев А. Н. Предмет и некоторые аспекты антэкологии // Вопросы антэкологии. Л.,
19696: 43-45.
Пономарев А. Н. О постановке и направлениях антэкологических исследований // Учен. зап.
Перм. ун-та. 1970. 206: 3-10.
Пономарев А. Н., Верещагина В. А. Антэкологический очерк темнохвойного леса // Проблемы
биогеоценологии, геоботаники и бот. географии / Ред. Тихомирова Б. А. Л.: Наука, 1973:196-207.
Пономарев А. Н., Демьянова Е. И. К изучению гинодиэции у растений // Бот. журн. 1975.60(1): 3-15.
Пономарев А. Н., Демьянова Е. И. К антэкологии некоторых степных растений лесостепного
Зауралья // Экология опыления. Межвуз. сб. науч. трудов. Пермь, 1978: 23-30.
Пономарев А. Н., Демьянова Е. И. Опыление // Жизнь растений. М.: Просвещение, 1980.
5(1): 55-77.
Пономарев А. Н.. Лыкова Е. И. Клейстогамия у маревых // ДАН СССР. 1960. 35(5):
1262-1265.
Попов В. В. Изучение индуцированного апомиксиса у тыквенных культур // Апомиксис и
цитоэмбриология растений. Саратов: Изд-во СГУ, 1978. 4: 99-100.
Попов М. Г. Географо-морфологический метод систематики и гибридизационные процессы в
природе // Тр. Бюро по прикл. ботанике, генетике и селекции. 1927.17(1): 221-290.
Попов М. Г. Система покрытосемянных растений в связи с проблемой их эволюции // Бот.
журн. 1954. 39(6): 867-881.
Попов М. Г. К вопросу о происхождении покрытосемянных // Бот. журн. 1956. 41(5): 768-769.
Попов О. Н., Таскаев А. И., Фролова Н. П. Генетическая стабильность и изменчивость семян в
популяциях травянистых фитоценозов в районе аварии на Чернобыльской АЭС. СПб: Наука, 1992:1-142.
Пополина Т. Г. Морфологические особенности формирования органов плодоношения у Роа
bulbosa L. // Бот. журн. 1960. 45(7): 1032-1039.
Пополина Т. Г. Анатомо-морфологические особенности мятлика луговичного (Роа bulbosa L.)
семенной и живородящей форм // Тр. БИН АН СССР. Серия VII. 1962а. 5:166-175.
Пополина Т. Г. Анатомо-морфологические и эмбриологические исследования мятлика
луговичного в связи со способами размножения: Азтореф. дисс.... канд. биол. наук. Душанбе, 1962б: 1-19.
Потапова Н. Ф. Биолого-морфологическое исследование видов рода Anemone L. флоры
СССР: Дисс. ... канд. биол. наук. М. 1988: 1-258.
Пошкурлат А. П. Большой жизненный цикл горицвета весеннего // Растительные ресурсы.
1975.11(4): 483-517.
Правдин Л.Ф. Вегетативное размножение растений (теория и практика) / Ред. Любименко В.
Н., М.-Л.: Огиз-Сельхозгиз, 1938:1-232.
Продан Т. К. Разнокачественность семян курая и их морфологические особенности //
Агробиология. 1956. 5:151-152.
Прокофьев А. А., Кудряшова О. И., Глазунова Е. М. Биологическое значение сократительной
деятельности корней // Физиол. раст. 1954.1(2): 109-121.
Процко Р. Ф. Фитогормоны: направления современных исследований // Укр. ботан. журн. 1994.
51(6): 109-117.
Пыльнев В., Филатова Л. Разнокачественность семян яровой пшеницы в зависимости от
положения в колосе // Сб. студ. н.-иссл. работ Тимирязевск. с-х академии. 1958. 8: 32-39.
Работнов Т. А. Длительность виргинильного периода жизни травянистых растений // Успехи
соврем, биологии. 1946а. 51(2): 91-98.
560
Системы репродукции
Работнов Т. А. Опыт определения возраста у травянистых растений // Бот. журн. 19466.
31(5): 24.
Работнов Т. А. Вопросы изучения состава популяций для целей фитоценологии // Проблемы
ботаники. М.: Изд-во АН СССР, 1950а: 466-483.
Работнов Т. А. Жизненный цикл многолетних травянистых растений в луговых ценозах / / Тр.
БИН АН СССР. Сер. 3. Геоботаника. 19506. 6: 7-207.
Работнов Т. А. Определение возрастного состава популяций видов в сообществе / / Полевая
геоботаника. М.-Л.: Наука, 1964:132-145.
Работнов Т. А. Итоги изучения семенного размножения растений на лугах в СССР // Бот.
журн. 1969а. 54(6): 817-833.
Работнов Т. А. Некоторые вопросы изучения ценотических популяций // Бюлл. МОИП.
Отд. биол. 19696. 74(1): 141-149.
Работнов Т. А. Мозаичность луговых фитоценозов // Бюлл. МОИП. Отд. биол. 1972.
77(4): 104-117.
Работнов Т. А. Факторы устойчивости наземных фитоценозов // Бюлл. МОИП. Отд. биол.
1973. 4: 67-76.
Работнов Т. А. Луговедение. М.: Изд-во МГУ, 1974:1-384.
Работнов Т. А. Изучение ценотических популяций растений в целях выяснения "стратегии
жизни" видов растений // Бюлл. МОИП. Отд. биол. 1975. 80(2): 5.
Работнов Т. А. Жизнеспособные семена в почвах природных биогеоценозов СССР //
Теоретические и прикладные аспекты биогеографии. М: Наука, 1982: 35-59.
Работнов Т. А. Фитоценология. М: Изд-во МГУ, 1983:125-139.
Работнов Т. А. Некоторые вопросы изучения жизнеспособных диаспор растений в почвах
природных биогеоценозов // Бюлл. МОИП. Отд. биол. 1990. 95(3): 53-62.
Работнов Т. А. Фитоценология. М: Изд-во МГУ, 1992:1-351.
Работнов Т. А. Некоторые вопросы изучения диаспор растений в почвах природных
фитоценозов // Бюлл. МОИП. Отд. биол. 1995.100(5): 69-76.
Радкевич О. Н., Шубина Л. Н. Морфологические основы явления партикуляции у ксерофитов
пустыни Бетпак-Дала // Тр. Среднеаз. ун-та. Сер 8б. Ботаника. 1935. 25: 3-20.
Разевит В. А. Лотос, Nelumbo nucifera Gaertner в Восточном Закавказье // Аквариум и
комнатные растения. М.: Тип-ия Русск. Т-ва, 1911:1-8.
Райкова И. А. Растительные ландшафты Памира // Тр. Среднеаз. Гос. ун — та. Сер. 8б.
Ботаника. 1930.12:1-24.
Раменский Л. Г. Основные закономерности растительного покрова и их изучение. Воронеж,
1925:1-27.
Раменский Л. Г. О принципиальных установках, основных понятиях и терминах
производственной типологии земель, геоботаники и экологии // Сов. Ботаника. 1935. 4: 25-42.
Раменский Л. Г. Введение в комплексное почвенно-геоботаническое исследование земель. М.:
Сельхозгиз, 1938: 1-620.
Растения в экстремальных условиях минерального питания / Ред. Школьник М. Я.,
Алексеева-Попова Н. В. Л.: Наука, 1983:1-176.
Раус Л. К. Дикорастущие ягодники в питании некоторых зверей и птиц // Охота, пушнина,
дичь. Киров, 1973. 40-41: 7-10.
Рахманкулов У., Мелибаев С. Некоторые биологические особенности среднеазиатских видов
рода Ferula L. // Биологические особенности и распространение перспективных лекарственных
растений. Ташкент: ФАН, 1981: 31-61.
Рачковская Е. И. К биологии пустынных полукустарничков // Тр. БИН АН СССР. Сер. 3.
Геоботаника. 1957.11: 5-87.
Редкие и исчезающие виды флоры СССР, нуждающиеся в охране / Ред. Тахтаджян А. Л. Л.:
Наука. 1981:1-171.
Резникова С. А. Цитология и физиология развивающегося пыльника. М.: Наука, 1984:1-272.
Литература
561
Рейвн П., Эверт Р., Айкхорн С. Современная ботаника. М.: Мир, 1990. Т. 1. С. 152-154.
Реймерс Н. Ф. Популярный биологический словарь / Ред. Яблоков А. В. М.: Наука, 1991:1-537.
Ригер Р., Михаэлис А. Генетический и цитогенетический словарь. М.: Колос, 1967:1-607.
Рожановский С. Ю. Анатомическое строение выводковых луковичек Роа bulbosa L. var vivipara
// ДАН УзССР. 1961. 2: 56-59.
Розанова М. А. Проблема пола у высших растений // Теоретические основы селекции
растений. М.-Л.: Сельхозиздат, 1935:145-162.
Романова Г. С, Кольцова А. С, Мосолкова И. М. Индуцированный апомиксис у луковичных
на примере тюльпана // Сб. науч. тр. Никитск. бот. сада. 1983. 91:102-113.
Рубцова 3. М. Эволюционное значение апомиксиса. Л.: Наука, 1989:1-153.
Руденская Б. Я. Изменение строения корня кок-сагыза в связи с его укрупнением // ДАН
СССР. 1941. 45(1): 956-958.
Руми В. А., Власова Н. А., Скокова А. А. Действие и последствие радиации в онтогенезе
генеративной сферы хлопчатника // Эмбриология покрытосемянных растений / Ред. Коварский А. Е.
Кишинев: Штиинца, 1973: 107-118.
Русанов Ф. Н. О некоторых водных растениях Дальневосточного Приморья // Бюлл. ГБС
АН СССР. 1957. 27:118-119.
Руцкий И. А. Экология опыления Asclepias cornuti Dec: 1. О формах опыления A. cornuti Dec.
// Тр. Воронеж, гос. ун-та. 1937. 9(1): 180-199.
Руцкий И. А. Экологическая характеристика опылительной энтомофилии у цветков Asclepias
cornuti Dec. // Тр. Воронеж, гос. ун-та. 1938. 10(2).
Руцкий И. А. Экология цветка ваточника (Опыт стационарного изучения антэкологии вида)
// Тр. Бот. сада им. проф. Б. М. Козо-Полянского. Воронеж, 1967. 3: 1-192.
Руцкий И. А. Краткий очерк развития антэкологии. Воронеж: Воронеж, ун-т, 1980:1-130.
Рыбин В. А. Самостерильность и самофертильность растений как фактор в селекции. М.-Л.:
Гос. изд-во с.-х. совхозной и колхозной лит-ры, 1935: 463-494.
Рыжей И. Н., Завгородняя Е. П. Породные качества семян яровой пшеницы в зависимости от
места образования их в колосе // Бюлл. Киргизск. н.-и. ин-та земледелия. 1959. 4: 38-45.
Рыжков В. Л. Генетика пола. Харьков: Госиздат, 1936:1-250.
Рыжков В. Л. Некоторые проблемы генетики пола // Генетика. 1966. 2(2): 3-15.
Рысин Л. П., Казанцева Т. Н. Метод ценопопуляционного анализа в геоботанических
исследованиях // Бот. журн. 1975. 60(2): 199-209.
Рытова Н. Г. Пазушная меристема и ее производные у видов рода Cleistogenes (Poaceae) по
данным СЭМ (колониальный и оргаиизменный уровни организации тела растения) // Бот.
журн. 1984. 69(2): 170-179.
Рытова Н. Г., Цвелев Н. Н. О гомологии зародышевой и боковых почек у злаков (Роасеае) и
природе односемядольности // Бюлл. МОИП. Отд. биол. 1982. 87(1): 78-85.
Сабардина Г. С. Высокогорные пустыни южной части Центрального Тянь-Шаня // Уч. зап.
Ленингр. ун-та. Сер. биол. Геоботаника. 1951. 30(143): 128-175.
Савина Г. И., Поддубная-Арнольди В. А. Семейство Orchidaceae // Сравнительная эмбриология
цветковых растений. Однодольные / Ред. Батыгина Т. Б., Яковлев М. С. Л.: Наука, 1990:172-179.
Савченко М.И. Об отклонениях в развитии семяпочки некоторых покрытосеменных растений
// Бот. жури. 1959. 44(6): 786-804.
Самарина Б. Ф., Горянцева О. В., Гущина Е. Г., Тихомиров В. Н. Распространение и охрана
водоемов с водяным орехом в Рязанской области // Тез. докл. II Всес. конф. по высш. водн. и
прибрежно-водн. раст. Борок, 1988: 44-45.
Самородов В. Н., Голубинский И. Н. Апомиксис и партенокарпия в роде Pyrus (Rosaceae) и
возможности их гормональной регуляции // Тез. докл. VII съезда ВБО (Донецк, 1983). Л., 1983: 267-268.
Самородов В. Н., Кривенцов В. И., Ядров А. А., Шолохова В. А., Казас А- Н. Стимулятор
апомиксиса цветковых растений. А.С. N 1323048 // Бюлл. изобр. 1985. (26).
562
Системы репродукции
Санников С. Н., Семериков В. Л., Петрова И. В., Филиппова Т. В. Генетическая
дифференциация популяций сосны обыкновенной в Карпатах и на Русской равнине // Экология. 1997.3:163-167.
Сарапульцев И. Е. Популяционная структура псевдовивипарных арктических злаков (Роа alpigena
(Blytt) Lindm. и P. sublanata Reverd.): Автореф. дисс.... канд. биол. наук. Екатеренбург, 1998:1-26.
Сладков А. Н. О размножении растений // Биол. науки. 1986. 4: 62-76.
СвирчевскаяА. М., БормотовВ. Е. Характерная особенность регенерации при гиногенезе у
сахарной свёклы // ДАН Беларуссии. 1994. 38(6): 57-59.
Седельников A. Trapa natans L. в Семипалатинской области / / Зап. Западно-Сиб. отдела Им-
пер. Русск. геогр. общ. Материалы к флоре Киргизского края. 33(1). 1907:1-11.
Семериков В. Л., Подогас А. В., ШурхалА. В. Структура изменчивости аллозивных локусов в
популяциях сосны обыкновенной // Экология. 1993. 1:18-25.
Сенянинова-Корчагина М. В. Ископаемый водяной орех (Trapa L.) как индикатор
палеогеографических условий на Карельском перешейке. Л.: Изд-во ЛГУ, 1961:1-188.
Сенянинова-Корчагина М. В. Геофилия и ее значение в сложении растительного сообщества (о
целостности организма высших растений) // Уч. зап. ЛГУ. Сер. географ, наук. 1967.327(19): 7-96.
Серая Г. П. Полиморфизм семян и жизненность растений мари белой и лебеды лоснящейся при
выращивании на каменноугольной золе // Растения и промышленная среда / Ред. Чибрик Т. С.
Свердловск: Уральский рабочий. 1979: 68-72.
Серебряков И. Г. О ритме сезонного развития растений подмосковных лесов // Вестник МГУ.
1947. (6): 75-108.
Серебряков И. Г. Структура и ритм в жизни цветковых растений. 4.1. / / Бюлл. МОИП. Отд.
биол. 1948. 53(2): 49-66.
Серебряков И. Г. Структура и ритм в жизни цветковых растений. 4.2. / / Бюлл. МОИП. Отд.
биол. 1949.54(1): 47-62.
Серебряков И. Г. Морфология вегетативных органов высших растений. М.: Сов. наука,
1952:1-392.
Серебряков И. Г. Экологическая морфология растений. М.: Высшая школа, 1962:1-378.
Серебряков И. Г. Жизненные формы высших растений и их изучение. Полевая геоботаника.
М.-Л.: Изд-во АН СССР, 1964.3:146-205.
Серебряков И. Г. Эволюция жизненных форм растений в отдельных таксонах
покрытосеменных// Рефер. докл. Всес. межвуз. конф. по морфологии растений. М.: Изд-во МГУ, 1968:14-16.
Серебряков И. Г., Доманская Н. П., Родман Л. О морфогенезе жизненной формы кустарника
на примере орешника // Бюлл. МОИП. Отд. биол. 1954. 59(2): 57-70.
Серебряков И. Г., Чернышева М. Б. О морфогенезе жизненной формы кустарничка у черники,
брусники и голубики и др. болотных Ericaceae // Бюлл. МОИП. Отд. биол. 1955. 60(2): 65—77.
Серебрякова Т. И. О некоторых морфологических закономерностях побегообразования у
овсяницы луговой / / Бюлл. МОИП. Отд. биол. 1959. 64(3): 83-97.
Серебрякова Т. И. Некоторые закономерности формирования почек и побегов у луговых злаков
// Бюлл. МОИП. Отд. биол. 1961. 66(4): 42-51.
Серебрякова Т. И. Формирование куста и клона у костра безостого (Bromus inermis) // Бот.
журн. 1964. 49(1): 39-51.
Серебрякова Т. И. Морфогенез побегов и эволюция жизненных форм злаков. М.: Наука,
1971:1-360.
Серебрякова Т. И. Учение о жизненных формах растений на современном этапе / / Итоги науки
и техники. Ботаника. М.: ВИНИТИ, 1972.1: 84-169.
Серебрякова Т. И. Эволюционные отношения жизненных форм в некоторых секциях рода Роа
L. // Проблемы филогении высших растений / Ред. Благовещенский А. В., Старостин Б. А.,
Алексеев Е. Б. М.: Наука, 1974:116-152.
Серебрякова Т. И. Еще раз о понятии "жизненная форма" у растений / / Бюлл. МОИП. Отд.
биол. 1980. 85(6): 75-86.
Серебрякова Т. И. О некоторых модусах морфологической эволюции цветковых растений //
Журн. общей биол. 1983а. 44(5): 579-593.
Литература
563
Серебрякова Т. И. Почка как этап развития побега // Тез. докл. УП делег. съезда ВБО
(Донецк, 1983). Л., 19836: 232-233.
Серебрякова Т. И. Экологичекие группы и жизненные формы растений // Ботаника.
Морфология и анатомия растений / Ред. Васильев А. Е. и. др. М. : Просвещение, 1988: 431-461.
Сидорский А. Г. Эволюция половой организации цветковых растений. Н.Новгород:
Волго-Вят. кн. изд-во, 1991:1-210.
Сидорский А. Г. Особенности структуры соцветий Sagittaria sagittifolia (Alismataceae) в
популяциях рек Сура и Алатырь (Среднее Поволжье) // Бот. журн. 1994. 79(12): 34-39.
Сидоров В. А. Биотехнология растений. Клеточная селекция. Киев: Наукова думка, 1990:1-280.
Симонова О. Н. О формах цветков заманихи высокой // Бюлл. ГБС. 1980. 117: 69-74.
Синская Е. Н., Щенкова М. В. К вопросу о полиморфизме некоторых видов Vaccinium // Тр.
по прикл. ботан., генет. и селекц, 1928.18(4): 185-222.
Сипливинский В. Н. Вивипарные овсянницы (Festuca L.) внеарктической Сибири // Новости
систематики высших растений, 1973.10:11-19.
Ситников А. П. Псевдогамия у Atraphaxis frutescens (сем. Polygonaceae) в условиях ТАССР//
Гаметогенез, оплодотворение и эмбриогенез семенных растений, папортников и мхов. Кишинев:
Штиинца, 1986:167-168.
Сказкин Ф. Д. Критический период у растений по отношению к недостатку воды в почве. Л.:
Наука, 1971:1-120.
Словарь ботанических терминов / Ред. Дудка И. А. Киев: Наукова думка, 1984: 1-306.
Смеловский Т. Философия ботаники, изъясняющая первые оной основания сочинений Карла
Линнея. СПб: Изд-во Акад. Наук, 1800:1-195.
Смирнова О. В. Особенности вегетативного размножения травянистых растений дубрав в связи
с вопросами самоподдержания популяций / / Возрастной состав популяций цветковых растений в
связи с их онтогенезом. М.: МГПИ, 1974: 168-195.
Смирнова О. В. Объем счетной единицы при изучении ценопопуляций растений различных
биоморф // Ценопопуляций растений. М.: Мир, 1976:14-44.
Смирнова О. В. Структура травяного покрова широколиственных лесов. М.: Наука, 1987:1-205.
Смирнова О. В. Восточноевропейские широколиственные леса. М.: Наука, 1994:1-363.
Смирнова-Гараева Н. В. Водяной орех на Днестре // Охрана природы. 1972. 9:126-130.
Снигиревская Н. С. Материалы к морфологии и систематике рода Nelumbo Adans / / Тр. БИН
АН СССР. 1964.1(13): 104-172.
Снигиревская Н. С. Листовой диморфизм и природа семядолей у Nelumbo (Nelumbonaceae)
//Бот. журн. 1992. 77(12): 1-6.
Солнцева М. П. К биологии цветения и эмбриологии ковылей / / Тр. БИН АН СССР. 1965а.
3(17): 135-150.
Солнцева М. П. О развитии многоклеточного археспория у земляники. // Морфология цветка и
репродуктивный процесс у покрытосеменных растений / Ред. Яковлев М. С. М.-А, 1965б: 189-204.
Солнцева М. П. Эмбриологическая классификация апомиксиса покрытосеменных / / Генетика.
1969. 5 (8): 20-30.
Солнцева М. П. Основы эмбриологической классификации покрытосеменных // Апомиксис и
селекция. М.: Наука, 1970: 87-100.
Солнцева М. П. Типы развития зародышевого мешка и морфология зародыша Rudbeckia
laciniata L. // Эмбриология покрытосеменных растений. Кишинев: Штиинца, 1973: 47-57.
Солнцева М. П. Что же такое апомиксис у цветковых растений? / / Бот. журн. 1991. 76(6): 801-808.
Солнцева М. П. Об использовании двойных названий при характеристике апомиктичных
растений // Бот. журн. 1997. 82(10): 49-58.
Солнцева М. П. Проблемы апогаметии / / Тез. докл. II (X) Съезда РБО. "Проблемы
ботаники на рубеже XX-XXI веков". СПб. 1998. 1: 132-133.
Солнцева М. П. Проблемы апогаметии // Бот. журн. 1999. 84(8): 1-23.
Соловьев В. А. Об индивидуальной солеустойчивости и формообразовательных процессах у
томатов // Физиол. раст. 1960. 7(2): 222-225.
564
Системы репродукции
Соловьев В. П. О разнокачественное™ семян хлопчатника // Узб. биол. журн. 1960. 3:16-21.
Солоневич Н. Г. Материалы к эколого-биологической характеристике болотных трав и
кустарничков // Растительность Крайнего Севера СССР и ее освоение. М., 1956. 2: 307-498.
Сорокин А. С. Распространение рогульника плавающего в Калининской области // Тез. докл.
II Всес. конф. по высш. води, и прибрежно-водн. раст. Борок, 1988: 50-51.
Соснихина С. П., Федотова Ю. С, Смирнов В. Г., Михайлова Е. И., Богданов Ю. Ф.
Изучение генетического контроля мейоза у ржи // Генетика. 1994. 30(8): 1043-1056.
Станюкович К. В. Растительный покров Восточного Памира // Зап. Всесоюз. геогр.
общества. Нов. сер. М., 1949.10:1-159.
Старикова В. В. Методика изучения семенной продуктивности растений на примере эспарцета
// Бот. журн. 1963. 48(5): 696-699.
Старшова Н. П. Частичная андростерильность популяций некоторых представителей семейства
Caryophyllaceae // Бот. журн. 1966. 81(1): 64-74.
Старшова Н. П. Вклад Р. Е. Левиной в разработку проблемы репродуктивной биологии
семенных растений // Бюл. МОИП. Отд. биол. 1989. 94(3): 113-117.
Старшова Н. П. Программно-методические подходы к исследованию половой
дифференциации (на примере Silene borysthenica (Grim.) Waltems) // Проблемы репродуктивной биологии
семенных растений. Тр. БИН РАН. СПб, 1993. 8: 64-75.
Старшова Н. П., Баранникова Н. Н. Половая дифференциация ценопопуляций Dianthus
stenocalyx (Caryophyllaceae) как составная часть системы семенного размножения // Бот. журн.
1998. 88(3): 79-90.
Стачкявичене Э. И., Буткус В. Ф. Семенное размножение черники // Ресурсы дикорастущих
плодово-ягодных растений, их рациональное использование и организация плантационного
выращивания хозяйствеино-ценных видов в свете решения Продовольственной программы СССР //
Тез. докл. Гомель, 1983: 36-38.
Стволинская Н. В. Жизнеспособность Taraxacum officinale Wigg. в популяциях города Москвы
в связи с антропогенным загрязнением // Экология, 2000. 2: 147-150.
Стенвуд Ф. С, Бэсс Л. Н. Сохранение зародышевой плазмы путем глубокого охлаждения
семян // Холодостойкость растений / Ред. Самыгин Г. А. М.: Колос, 1983: 280-287.
Стратегия ботанических садов по охране растений. М., 1994:1-61.
Строганов Б. П., Иваницкая Е. Ф., Чернядева И. П. Влияние высоких концентраций солей на
растения // Физиол. раст. 1956. 3(4): 319-327.
Строна И. Г. К вопросу о разнокачественное™ семян и методах их оценки // Тр. Укр. н.-и.
ин.-та растен., селек. и ген. 1962. 7: 68-76.
Строна И. Г. Разнокачественность семян полевых культур и ее значение в семеноводческой
практике // Биологические основы повышения качества семян сельскохозяйственных культур. М.:
Наука, 1964: 21-25.
Строна И. Г. Общее семеноведение полевых культур. М.: Колос, 1966: 1-464.
Сукачев В. Н. Терминология основных понятий фитоценологии // Сов. Бот. 1935. 5: 11-21.
Сулима Ю. Г. Биосимметрические и биоритмические явления и признаки у
сельскохозяйственных растений. Кишинев: АН Молд.ССР, 1970: 1-148.
Суриков И. М. Генетика внутривидовой несовместимости мужского гаметофита и пестика у
цветковых растений // Успехи совр. генетики. М.: Наука, 1972. 4:119-169.
Суханов В. М., Тырнов В. С. Эмбриогенетические аспекты аидрогенеза in vitro // Гаметогенез,
оплодотворение и эмбриогенез семенных растений, папоротников и мхов. Кишинев: Штиинца, 1986:239.
Сухарева Н. Б., Батурин С. О. Цитоэмбрилогические основы апомиктического размножения
земляник // Тр. Межд. симп. "Апомиксис у растений: состояние проблемы и перспективы
исследований." Саратов, 1994:15-137.
Сэджер Р. Гены вне хромосом // Молекулы и клетки. М.: Мир, 1966:129-144.
Тамберг Т. Г. Влияние местоположения семян на растении на их посевные и породные качества
// Тез. дис. канд. биол. наук, ЛГУ. 1947: 1-2.
Литература
565
Тамберг Т. Г. Влияние местоположения семян на растении на их посевные и породные качества
// Уч. зап. ЛГУ. Сер. биол. наук. 1951.139 (26): 231-249.
Таифильев Г. И. К вопросу о вымирании Trapa natans // Вестн. естествозн. СПб, 1890,1:1-7.
Татаренко И. В. Орхидные России: жизненные формы, биология, вопросы охраны. М.: Аргус,
1996: 1-207.
Татаренко И. В. Орхидные со стеблекорневыми тубероидами //Тр. Межд. конф. по анатомии
и морфологии растений. 1997. СПб: Диада, 1997:131-132.
Тахтаджян А. Л. Основы эволюционной морфологии покрытосеменных. М.-Л., 1964: 1-236.
Тахтаджян А. Л. Развитие мужского и женского гаметофита. //Жизнь растений. М.:
Просвещение, 1980. 5 (1) 53.
Тахтаджян А. Л. Систематика и филогения цветковых растений. М.-Л.: Наука, 1966: 88-90.
Тахтаджян А. Л. Семейство колокольчиковые (Campanulaceae) // Жизнь растений / Ред.
Тахтаджян А. Л. М.: Просвещение, 1981. 5(2): 447-459.
Терехин Э. С. Метаморфоз в онтогенезе покрытосеменных растений — паразитов // ДАН
СССР. 1968.178(4): 957-959.
Терехин Э. С. О возможности использования понятия "поведение" в изучении эволюции
растений // Бот. журн. 1972. 57(1): 75-89.
Терехин Э. С. Паразитные цветковые растения. Эволюция онтогенеза и образ жизни. Л.:
Наука, 1977:1-219.
Терехин Э. С. Семейства: Hydrocharitaceae, Potamogetonaceae, Ruppiaceae, Zannichelliaceae,
Zosteraceae, Najadaceae / / Сравнительная анатомия семян. Л.: Наука, 1985.1:38-43, 51-57,59-63.
Терехин Э. С. Репродуктивная биология сорных заразиховых. Л.: Наука, 1988а: 1-143.
Терехин Э. С. Семейства Hachetteaceae, Sarcophytaceae, Latraeophillaceae, Lophophytaceae,
Balanophoraceae // Сравнительная анатомия семян. Л.: Наука, 19886. 2: 120-132.
Терехин Э. С. Проблемы эволюции онтогенеза семенных растений (39 Комаровские чтения)
// Тр. БИН РАН. 1991. 2:1-68.
Терехин Э. С. Место и роль агамоспермии в системе семенного воспроизводства // Тр. Межд. симп.
"Апомиксис у растений: состояние проблемы и перспективы исследований". Саратов, 1994:138-140.
Терехин Э. С. Семя и семенное размножение. СПб: Мир и семья-95,1996: 1-376.
Терехин Э. С. Редуцированные и нередуцироваиные зародыши // Эмбриология цветковых
растений. Терминология и концепции. Т. 2. Семя / Ред. Батыгина Т. Б. СПб: Мир и семья-95,
1997: 449-461.
Терехин Э. С, Шибакина Г. В., Серафимович Н. Б. Эколого — морфологическая
классификация плодов и подобных плодам образований (в связи с особенностями процессов репродукции) //
Проблемы репродуктивной биологии семенных растений. Тр. БИН РАН. СПб, 1993. 8: 76-100.
Терминология роста и раввития высших растений / Ред. Чайлахян М. X. М., Наука, 1983:1-96.
Тимонин А. К. О природе гребневидных органов чилима (Trapa natans L. s. 1., Trapaceae) //
Научн. докл. высш. школы. Биол. науки. 1984. 3: 63-65.
Тимофеев-Ресовский Н. В. О некоторых принципах классификации биохорологических единиц
// Тр. ин-та биологии УФ АН СССР. 1961. 27: 23-28.
Тимофеев-Ресовский Н. В., Яблоков А. В., Глотов Н. В. Очерк учения о популяции. М: Наука,
1973:1-277.
Тимошок Е. Е. Экология брусничных в Западной Сибири. Экология регионального
природопользования. Томск, 1998: 1-46.
Тимошок Е. Е., Паршина Н. В. Семенная продуктивность Vaccinium myrtillus L. (Кузнецкий
Алатау) // Растит, ресурсы. 1990. 26(3): 314-327.
Титова Г. Е. Эмбриология некоторых водных растений (Nelumbo nucitera Gaertn., Cabomba
caroliniana A. Gray, Trapa astrachanica (Fler.) Winter.): Автореф. дисс. ... канд. биол. наук. Л.:
БИН, 1988а: 1-18.
Титова Г. Е. Эмбриология некоторых водных растений (Nelumbo nucifera Gaertn., Cabomba
caroliniana A.Gray, Trapa astrachanica (Fler.) Winter.): Дисс. ... канд. биол. наук. Л. 19886: 1-188.
566
Системы репродукции
Титова Г. Е. Псевдомонокотилия // Эмбриология цветковых растений. Терминология и
концепции / Ред. Батыгина Т. Б. СПб: Мир и семья-95, 1997а. 2: 382-383.
Титова Г. Е. Акотилия / / Эмбриология цветковых растений. Терминология и концепции / Ред.
Батыгина Т. Б. СПб: Мир и семья-95,19976. 2: 404-407.
Титова Г. Е. О природе псевдомонокотилии у цветковых растений // Бот. журн. 2000. 85(6).
Титова Г. Е., Батыгина Т. Б. Репродуктивная биология Trapa natans L. (Trapaceae) в условиях
северо-запада России в связи с перспективой его использования как пищевого и кормового растения
// Матер. 2-го Межд. симп. "Новые и нетрадиционные растения и перспективы их практического
использования". Пущино, 1997: 499-501.
Тихменев Е. А., Левковский В. П. К антэкологии злаков арктической тундры острова Врангеля
// Бот. журн. 1973. 58(10): 1474-1484.
Тихомиров Б. А. Очерки по биологии растений Арктики. М.-Л.: Изд. АН СССР, 1963:1-154.
Тихомиров В. Н. О плодах и соплодиях // Бюлл. МОИП. Отд. биол. 1989. 94(3): 59-65.
Тихонова В. Л. Ресурсы внутривидовой изменчивости дикорастущих травянистых растений, их
изучение, сохранение и использование (на примере охраняемых и лекарственных видов): Дисс. ...
докт. биол. иаук. М., 1992а: 1-471.
Тихонова В. Л. Долговременное хранение семян дикорастущих видов растений. Банки: сбор
материала, документация, методики, режим. Пущино, 19926:1-21.
Тихонова В. Л. Сохранение генофонда растений в банках зародышевой плазмы // Генетические
коллекции растений. Вып. 3. / Ред. Коваль С. Ф. Новосибирск, 1995: 37-68.
Ткаченко К. Г. Гетероспермия и онтогенез // Тез. докл. II (X) съезда РБО "Проблемы
ботаники на рубеже XX-XXI веков". СПб, 1998. 2:330.
Ткаченко К. Г., Коробова М. М. Влияние урбанизированной среды на качество семян
некоторых видов растений // Матер, иаучн. конф. "Биологическое разнообразие. Интродукция
растений". СПб, 1995: 223.
Токин Б. П. Общая эмбриология. М.: Высшая школа, 1987:1-478.
Троицкая Е. А., Батыгина Т. Б. Влияние недостатка бора иа формирование вегетативных и
генеративных органов // Тр. БИН АН СССР. 1970. 4(20): 22-38.
Троицкий Н. А. О водяном орехе Trapa natans L. и возможностях использования его в качестве
пищевого материала // Изв. Крымск. пед. инст. им. М.В. Фрунзе. Симферополь. 1947.22:121-129.
Турдиев С. Ю. Некоторые особенности прорастания семян и формирования проростков ним-
фейиых // Тр. Алма-Атинск. Бот. сада, 1960. 5:164-178.
Тырнов В. С. Генетические закономерности возникновения гаплоидов // Гаплоидия и селекция
/ Ред. Крупнов В. А. М.: Наука, 1976а: 121-131.
Тырнов В. С. Эмбриологические механизмы возникновения гаплоидии // Гаплоидия и
селекция. М.: Наука, 19766: 66-76.
Тыриов В. С. Возможные эволюционно-генетические последствия гаплоидии у растений //
Современные проблемы филогении растений. М.: Наука, 1986а.: 45-46.
Тырнов В. С. Андрогенез in vivo у растений / / Биология развития и управление
наследственностью. М.: Наука, 19866.: 138-164.
Тырнов В. С. Эмбриогенетика растений: проблемы и перспективы // Гаметогенез,
оплодотворение и эмбриогенез семенных растений, папоротников и мхов. Кишинев: Штиинца, 1986в.: 31.
Тырнов В. С. Эндосперм как фактор, ограничивающий отбор гамет на апомиксис // Гаметная и
зиготная селекция растений. Кишинев: Штиинца, 1987:112-115.
Тырнов В. С. Гаплоидия и апомиксис // Тр. Межд. симп. "Апомиксис у растений: состояние
проблемы и перспективы исследований." Саратов, 1994:141-142.
Тырнов В. С. Гаплоидия у растений: научное и прикладное значение. М.: Наука, 1998: 1-53.
Тырнов В. С, Еналеева Н. X. Автономное развитие зародыша и эндосперма у кукурузы //
ДАН СССР. 1983. 272(3): 722-725.
Тырнов В. С, Завалишина А. Н. Встречаемость гаплоидов кукурузы среди зерновок,
различающихся по величине // Докл. ВАСХНИЛ. 1972. 6:15-17.
Литература
567
Тырнов В. С, Завалишина А. Н. Индукция высокой частоты возникновения матроклинных
гаплоидов у кукурузы // ДАН СССР. 1984. 276(3): 735-738.
Тюрина Е. В. О формировании семян некоторых видов горичника // Качество семян в связи с
условиями их формирования при интродукции. Новосибирск: Наука, 1971а: 30-39.
Тюрина Е. В. Сибирские представители рода Peucedanum L. и перспективы их интродукции //
Растительные богатства Сибири. Новосибирск: Наука, 19716: 59-71.
Тюрина Е. В. Протерандрия у представителей рода Peucedanum L. // Комплексное изучение
полезных растений Сибири. Новосибирск: Наука, 1974: 68-74.
Тюрина Е. В. Гинодиэция и семенная продуктивность у Peucedanum vaginatum Ledeb.
(Apiaceae) // Проблемы размножения цветковых (прикладные аспекты): Тёз. докл. совещ. по
цветению, опылению и семенной продуктивности растений. Пермь, 1987: 95-96.
Тяк Г. В. Формирование почек и плодоношение Vaccinium myrtillus (Vacciniaceae) // Бот.
журн. 1984. 69(2): 240-244.
Тяк Г. В. Рост и развитие корневищ Vaccinium myrtillus L. // Раст. ресурсы. 1987. 23(1): 46-51.
Уильяме У. Генетические основы и селекция растений. М.: Колос, 1968: 1-447.
Уранов А. А. Фитогенноеполе // Проблемы современной ботаники. М.-Л.: Наука, 1965.2:251-254.
Уранов А. А. Онтогенез и возрастной состав популяций (вместо предисловия) // Онтогенез и
возрастной состав цветковых растений. М.: Наука, 1967: 3-17.
Уранов А. А. Растение и среда // Жизнь растений. М.: Просвещение, 1974. 1: 58-98.
Уранов А. А. Возрастной спектр фитоценотических популяций как функция времени и
энергетических волновых процессов // Биол. науки. 1975. 2: 7-34.
Устинова Е. И. Сравнительное эмбриологическое исследование нормальных и вивипарных
видов лука // Бот. журн. 1944. 29(5): 232-239.
Устинова Е. И. Развитие репродуктивных органов в женских соцветиях кукурузы при разном
световом режиме // Эмбриология покрытосемянных растений / Ред. Коварский А. Е. Кишинев:
Штиинца, 1973:119-127.
Устойчивость к тяжелым металлам дикорастущих видов / Ред. Алексеева-Попова Н. В. Л.:
Наука, 1991:1-214.
Фегри К. Л., Пейл ваи дер. Основы экологии опыления. М.: Мир, 1982: 1-377.
Федоров А. А., Артюшеико 3. Т. Атлас по описательной морфологии высших растений.
Соцветие. Л.: Наука, 1979:1-294.
Федоров Ал. А., Кирпичников М. 3., Артюшенко 3. Т. Атлас по описательной морфологии
высших растений. Стебель и корень. М.-Л.: Изд-во АН СССР. 1962:1-353.
Федченко Б. А. Биология водных растений, как предмет изучения в школе. М.-Л.: Госиздат.
1925:1-132.
Филиппов Е. Г. Внутривидовая изменчивость и экология видов рода Dactylorhiza Neck, ex
Nevski (сем. Orchidaceae) на Урале: Дисс. ... канд. биол. наук. Екатеринбург. 1997:1-180.
Флеров А. Ф. Trapa natans L. во Владимирской губернии // Тр. Бот. сада Юрьевск. унив.
1902. 3(4): 244-250.
Флеров А. Ф. Систематика и ботаническая география рода Trapa L. // Изв. ГБС СССР. Л.,
1925. 24:13-45.
Флеров А. Ф. Обзор видов рода Trapa и их распространение // Изв. Донск. политехи, инст. в
Новочеркасске. Новочеркасск. 1926.10(Прилож. 1): 3-47.
Фомин А. Цветение лотоса (Nelumbo nucifera Gartn) в бассейне Кавказского отдела в
Тифлисском Ботаническом саду // Вестн. Тифл. Бот. сада. 1905.1: 35-36.
Франк Р. Апомиксис и полиплоидия // Сельхозбиология. 1988. 4: 99-109.
Френкель Р., Галун Э. Механизмы опыления, размножение и селекция растений. М.: Колос,
1982:1-384.
Фролов Ю. М. Семенная продуктивность окопника шершавого // Рост, развитие и
урожайность растений в условиях северо-востока европейской части РСФСР. Вологда, 1976. 4: 1-68.
Фролов Ю. М. Окопник в условиях Севера. Л.: Наука, 1982:1-151.
568
Системы репродукции
Фролов Ю. М. Каталог коллекции живых растений ботанического сада. Кормовые растения.
Ин-т биологии Коми НЦ УрО РАН. Сыктывкар, 1993. 3:1-28.
Хитрово В. Н. О парусности зачатков некоторых растений. Киев: Тип. Импер. Ун-та св.
Владимира, 1908: 1-24.
Хованская Н. В. Некоторые особенности вегетативного размножения Kalanchoe daigremontiana
(Hamet de la Bathie) Jacobs. // Бот. журн. 1970. 54(6): 924-928.
Ходачек Е. А. Семенная продуктивность и урожай семян растений в тундрах Западного
Таймыра // Бот. журн. 1970. 55(7): 995-1009.
Ходачек Е. А. Семенная продуктивность арктических растений в фитоценозах Западного
Таймыра. Л.: 1974:1-24.
Ходачек Е. А. Семенная продуктивность растений Западного Таймыра / / Структура и
функции биогеоценозов Таймырской тундры / Ред. Томилин Б. А. Л.: Наука, 1978: 166-198.
Ходачек Е. А. Запас семян в почвах тундр Таймыра и полярных пустынь Северной Земли //
Бот. журн. 1985. 70(7): 896-908.
Ходачек Е. А. Особенности прорастания семян арктических растений (Западный Таймыр) //
Бот. журн. 1993а. 78(2): 15-27.
Ходачек Е. А. Прорастание семян арктических растений // Проблемы репродуктивной
биологии семенных растений / Ред. Терехин Э. С. СПб: Изд-во РАН, 19936:126-134.
Ходачек Е. А. Роль репродукции растений в проблеме рекультивации растительного покрова
Крайнего Севера // Освоение Севера и проблема рекультивации. Сыктывкар, 1994: 313-317.
Ходачек Е. А. Роль репродукции в формировании устойчивого растительного покрова в
Арктике // Тез. докл. II (X) Съезда РБО "Проблемы ботаники на рубеже XX-XXI веков". СПб,
1998: 320-321.
Хорошайлов Н. Г., Ефремова Г. И. Всхожесть старовозрастных семян сорных растений //
Бюлл. ВИР. 1985.152: 39-42.
Хохлов С. С. Бесполосеменные растения. Исторические предпосылки и эволюционные
перспективы // Уч. зап. Саратовск. гос. ун-та. Саратов, 1946.1: 3-75.
Хохлов С. С. Классификация апомиксиса у покрытосеменных // ДАН СССР. 1958. 119(4):
812-815.
Хохлов С. С. Апомиксис: классификация и распространение у покрытосеменных растений //
Успехи совр. генетики. 1967.1: 43-105.
Хохлов С. С. Генетические функции полового процесса и проблема апомиксиса // 2-ое совещ.
по пробл. апомиксиса у растений и животных. Новосибирск: Наука, СО, 1968а: 67-69.
Хохлов С. С. Происхождение гинодиэцичных видов в свете исследований эволюции цветка при
апомиксисе // Апомиксис и цитоэмбриология растений. Саратов: Изд-во СГУ, 19686: 3-30.
Хохлов С. С. Эволюционно-генетические проблемы апомиксиса у покрытосеменных растений
// Апомиксис и селекция. М.: Наука, 1970: 7-21.
Хохлов С. С. Апомиксис как основа разработки принципиально новых методов селекции //
Симп. по апомиксису растений. Тбилиси: Мецииереба, 1971: 42-44.
Хохлов С. С, Зайцева М. И., Куприянов П. Г. Выявление апомиктичных форм во флоре
цветковых растений СССР / Ред. Хохлов С. С. Саратов: Изд-во СГУ, 1978:1-224.
Хохлов С. С, Малышева Н. А. Распространение и формы апомиксиса у злаков // Апомиксис
и селекция. М.: Наука, 1970: 7-55.
Хохлов С. С, Тырнов В. С, Гришина Е. В. и др. Гаплоидия и селекция. М.: Наука, 1976:1-221.
Хохряков А. П. Закономерности эволюции растений. Новосибирск: Наука, 1975: 1-202.
Хохряков А. П. Эмбрионизация в эволюции растений // Журн. общ. биол. 1978. 39(5):
671-684.
Хохряков А. П. Эволюция биоморф растений. М.: Наука, 1981:1-168.
Хохряков А. П. Уровни полимеризации в эволюции растений // Изв. АН СССР. Сер. биол.
1982. 5: 722-737.
Худяк М. И. Эндосперм покрытосеменных растений. Киев: Изд-во АН УССР, 1963:1-184.
Литература
569
Цвелев Н. Н. О способе распространения водяного ореха Trapa L. в прошлом и вымирании его в
историческое время // Бот. журн. 1964. 49(9): 1338-1340.
Цвелев Н. Н. О значении гибридизационных процессов в эволюции злаков (Роасеае) / /
История флоры и растительности Евразии. Л.: Наука, 1972: 5-16.
Цвелев Н. Н. О возможности деспециализации путем гибридогенеза на примере эволюции
трибы Triticeae семейства злаков (Роасеае) // Журн. общ. биол. 1975. 36(1): 90-99.
Цвелев Н. Н. Семейство вербеновые (Verbenaceae) // Жизнь растений / Ред. Тахтаджян А.
Л. М.: Просвещение, 1981. 5(2): 400-404.
Цвелев Н. Н. Гибридизация как один из факторов увеличения биологического разнообразия и
геномный критерий родов у высших растений // Матер, конф. БИН РАН и ЗИН РАН "
Биологическое разнообразие: подходы к изучению и сохранению" (Ленинград, 1990). СПб, 1992:193-201.
Цвелев Н. Н. О геномном критерии родов у высших растений // Бот. журн. 1991. 76(5):
669-675.
Цвелев Н. Н. Эволюция фитомера у высших растений // Бюлл. МОИП. Отд. биол. 1993.
98(2): 53-60.
Цвелев Н. Н. Фитомеры и профиллы как составные части побегов сосудистых растений //
Бюлл. МОИП. Отд. биол. 1997.102(5): 54-57.
Ценопопуляции растений (основные понятия и структура) / Ред. Уранов А. А., Серебрякова Т.
И. М.: Наука, 1976: 1-216.
Ценопопуляции растений (очерки популяционной биологии) / Ред. Серебрякова Т. И.,
Соколова Т. Г. М.: Наука, 1988:1-184.
Цырина Т. С. О природе пазушных клубеньков Ranunculus ficaria L. // Зап. Крым, о-ва есте-
ствоиспыт. и любит, природы. 1930. 12: 5-15.
Чайлахян М. X. Восприимчивость цветковых к паразитам и пол растений // ДАН СССР.
1947. 61(3): 321-332.
Чайлахян М. X. Регуляция цветения высших растений. М.: Наука, 1988:1-560.
Чайлахян М. X., Мартинович Л. Н., Кочанков В. Г. О химической регуляции роста и
формирования генеративных органов у двудольных растений // ДАН СССР. 1969. 189(3): 662-665.
Чайлахян М. X., Хрянин В. Н. Гормональная регуляция проявления пола // Бот. журн. 1980.
65(2): 153-171.
Чайлахян М. X., Хрянин В. Н. Пол растений и его гормональная регуляция. М.: Наука, 1982:1-172.
Чайлахян М. X., Янина Л. И., Фролова И. А. Цветение побегов, образовавшихся из эпифит-
ных почек бриофиллума на укорененных листьях // ДАН СССР, 1969.189(5): 1139-1141.
Чеботарь А. А. К вопросу об экспериментальной эмбриологии кукурузы // Генетика, селекция и
семеноводство кукурузы / Ред. Коварский А. Е. Кишинев: Картя Молдовеняскэ, 1965.1:169-181.
Чеботина М. Я., Любимова С. А. Зависимость сорбции радионуклидов пресноводными
растениями от рН среды // Гидробиол. журн. 1981.17(5): 101-105.
Челак В. Р. Особенности опыления, оплодотворения и формирования семян у дуба в связи с
плодоношением в дубравах Молдовы // Тез. докл. II (X) съезда РБО "Проблемы ботаники на
рубеже XX-XXI веков". СПб, 1998.1:139-140.
Черная Г. А. Водяной орех (Trapa natans L.) в Харьковской области // Тез. докл. II Всес.
конф. по высш. водн. и прибрежно-водн. раст. Борок, 1988: 57.
Черник В. Ф. Особенности формирования эмбриологических структур как проявление
приспособления растений к неблагоприятным условиям произрастания // ДАН Беларуси. 1992. 36(7-8): 646-651.
Чернов В. Н. К распространению водяного ореха (Trapa natans L.) на территории Окского гос.
заповедника // Научно-метод. зап. комитета по заповедникам. Изд-во комитета по заповедникам.
1939. 3:193-196.
Черномаз П. А. Продуктивность семян в зависимости от сроков образования их на
материнском растении // Докл. ВАСХНИЛ. 1939.13: 3-8.
Черняева А. М. Морфологические и биологические особенности корневой системы Polygonum
weyrichii Fr. Schm. // Бот. жури. 1960. 45(11): 1672-1677.
570
Системы репродукции
Черняковская Е. Ф. Семейство Ericaceae // Сравнительная анатомия семян / Ред. Тахтаджян
А. Л. СПб: Наука, 1992. 4: 25-35.
Чеченова Т. Н. Аномалии макрогаметогенеза у полиплоидов // Экспериментальная генетика
растений / Ред. Зосимович В. П. Киев: Наукова думка, 1977: 53-59.
Чистякова А. А. Жизненные формы и их спектры как показатели состояния вида в ценозе (на
примере широколиственных деревьев) // Бюлл. МОИП. Отд. биол. 1988. 93(6): 93-105.
Чубатова Н. В. Онтоморфогенез и характер вегетативного размножения Clematis glauca Willd.
// Бюлл. МОИП. Отд. биол. 1989. 94(6): 32-38.
Чугунова-Сахарова Н. Л. Некоторые результаты исследования лотоса (Nelumbo nucifera) в
Каспийско-Волжском районе // Русск. Гидробиол. журн. 1924. 3(8-10): 173-199.
Шабарова С. I. Про вар1абш>нють плод1в та можливкть насшневого поновлення вид1в з родини
брусничных, поширених на Укранському Полка // Укр. бот. журн. 1968. 25(3): 55-58.
Шалыт М. С. Подземная часть некоторых луговых, степных и пустынных растений и фитоце-
иозов. 1. Травянистые и полукустарничковые растения и фитоценозы лесной (луга) и степной зон
// Тр. БИН АН СССР. Сер. 3. Геоботаника. 1950. 6: 205-447.
Шалыт М. С. Вегетативное размножение и возобновление высших растений и методы его
изучения // Полевая геоботаника / Ред. Лавренко Е. М., Корчагин А. А. М.-Л.: Изд-во АН
СССР. 1960. 2:164-205.
Шалыт М. С. Партикуляция у высших растений // Проблемы совр. ботаники. М.-Л.: Наука,
1965. 2:117-122.
Шамров И. И. Некоторые данные по антэкологии Ceratophyllum // Бот. журн. 1980. 65(5):
703-706.
Шамров И. И. Особенности строения пыльника у Ceratophyllum demersum и C.pentacanthum
(Ceratophyllaceae) // Бот. журн, 1981. 66(10): 1464-1473.
Шамров И. И. Эмбриология сем. Ceratophyllaceae (роголистниковые) в связи с его
систематическим положением: Дисс.... канд. биол. наук. Л, 1982:1-206.
Шамров И. И. Антэкологическое исследование трех видов Ceratophyllum (Ceratophyllaceae)
// Бот. журн. 1983а. 68(10): 1357-1366.
Шамров И. И. Строение пыльника и некоторые особенности микроспорогенеза и развития
пыльцевого зерна у представителей рода Ceratophyllum (Ceratophyllaceae) // Бот. жури. 19836.
68(12): 1662-1667.
Шамров И. И. Аберрантность семязачатков у Paeonia lactiflora: диагностика и возможные причины
// Матер, научн. конф. "Биологическое разнообразие. Интродукция растений". СПб, 1995: 61-62.
Шамров И. И. Развитие семязачатка и семени у Ceratophyllum demersum (Ceratophyllaceae) //
Бот. журн. 1997а. 82(10): 1-13.
Шамров И. И. Развитие семязачатка и семени у Paeonia lactiflora (Paeoniaceae) // Бот. журн.
19976. 82(6): 24-46.
Шамров И. И., Батыгина Т. Б. Семейство Ceratophyllaceae // Сравнительная анатомия семян
/ Ред. Тахтаджян А. Л. Л.: Наука, 1988. 2:153-156.
Шамров И. И., Никитичева 3. И. Морфогенез семяпочки и семени у Gymnadenia conopsea
(Orchidaceae): структурное и гистохимическое исследование // Бот. журн. 1992. 77(4): 45—60.
Шамурин В. Ф. Вопросы опыления у растений (обзор работ О. Хагерупа) // Бот. журн. 1956.
41(9): 1380-1384.
Шамурин В. Ф. О суточном ритме и экологии цветения некоторых арктических растений //
Бот. жури. 1958а. 43(8): 1183-1191.
Шамурин В. Ф. Суточная ритмика и экология цветения некоторых степных растений // Бот.
журн. 19586. 43(4): 548-557.
Шамурин В. Ф. Сезонный ритм развития и экология цветения и опыления арктических
растений на севере Якутии: Автореф. дис. ... канд. биол. наук. Л., 1960:1-18.
Шамурин В. Ф. К антэкологии растений Арктики // Вопросы антэкологии. Матер, симп. по
антэкологии. Пермь. 1969:1-383.
Литература
571
Шафранов П. А. О некоторых биоморфологических особенностях лотоса орехоносного
(Nelumbium nuciferum Gartn.) в связи с его интродукцией // Бюлл. ГБС. 1958. 30: 16-21.
Шафранова Л. М. О некоторых возможных путях перехода от кустарников к травам на
примере Potentilla L. // Научн. докл. высш. школы. Биол. науки. 1967. 6: 70-76.
Шварц С. С. Эволюционная экология животных // Тр. ин-та экол. живот, и раст. УФ АН
СССР. 1969. 65:1-198.
Шевцова Г. Г., Батыгина Т. Б., Лаврентьева А. Н. Некоторые аспекты системы воспроизведения
орхидных на примере Cymbidium hybridum (Orchidaceae) // Бот. журн. 1986. 71(11): 1457—1467.
Шелковников А. Б. Nelumbo nucifera Gaertn. на разливах Аракса на Мугани // Изв.
Кавказом Музея, 1909. 4:157-172.
Шенников А. П. Введение в геоботанику. Л: Изд-во ЛГУ, 1964:1-447.
Шереметьев С. Н. О приспособительном значении полового диморфизма цвтковых растений
// Бот. журн. 1983.'б8(5): 561-571.
Шик М. М. Сезонное развитие травяного покрова дубравы // Учеи. зап. МГПИ. 1953. 73(2):
159-250.
Шилов М. П., Михайлова Т. Н. Экологические и фитоценотические особенности водяного
ореха (Trapa natans L.) в пойменных водоемах Владимирской области // Экология. 1970.5:53-59.
Шилова Н. В. Приспособления вечнозеленых кустарников к условиям Севера. Л.: Наука,
1967:1-63.
Шилова Н. В. Рост листьев некоторых видов Saxifraga L. // Бот. журн. 1974.59(8): 1116-1128.
Шилова Н. В. О заложении и росте побегов микрофильных кустарничков в горных тундрах
восточной Камчатки // Бот. журн. 1984. 69(2): 158-169.
Шилова Н. В. Ритмы роста и пути структурной адаптации тундровых растений. Л.: Наука,
1988:1-212.
Шимак М. Полиэмбриония семян сосны обыкновенной (Pinus silvestris) в арктических районах
// Половая репродукция хвойных. Матер. I Всес. Симпоз. Новосибирск: Наука, 1973 1: 83-95.
Ширяева Э. И. Особенности эмбриогенеза при апомиксисе сахарной свеклы // Гаметогенез,
оплодотворение и эмбриогенез семенных растений, папортников и мхов. Кишинев: Штиинца, 1986: 205.
Ширяева Э. И., Ярмолюк Г. И., Кулик А. Т., Червякова В. В. Апомиксис у самоопыленных
линий сахарной свеклы и использование его в селекции на гетерозис // Цитология и генетика.
1989. 23(3): 39-43.
Шитт П. Г. Биологические основы агротехники плодоводства. М.: Сельхозгиз, 1952:1-360.
Шишкинская Н. А., Савина Т. А., Синегубова Ю. В. Апомиксис у мятликов Камчатки // Тр.
Межд. симп. "Апомиксис у растений: состояние проблемы и перспективы исследований." Саратов,
1994:157-159.
Шмальгаузен И. И. Пути и закономерности эволюционного процесса. М., 1940:1-231.
Шмальгаузен И. И. Факторы эволюции (теория стабилизирующего отбора), М.-Л.: АН
СССР, 1946: 1-396.
Шмальгаузен И. И. Кибернетические вопросы биологии. Новосибирск: Наука, 1964: 1-224.
Шмальгаузен И. И. Факторы эволюции (теория стабилизирующего отбора). М.-Л.: Наука,
1968: 1-415.
Шолохова В. А., Никифоров Ю. Л. Влияние высоких температур на развитие пыльцевых
зерен маслины // Цитогенетические и цитоэмбриологические методы в селекции плодовых и ягодных
культур / Ред. Колесников В. А., Щербаков В. К. М.: Колос, 1973: 91-98.
Шорина Н. И. Жизненный цикл безвременника великолепного (Colchicum speciosum Stev.) в
лесном и субальпийском поясах Западного Закавказья / / Онтогенез и возрастной состав
популяций цветковых растений. М.: Наука, 1967: 70-79.
Шорина Н. И. Строение зарослей папоротника орляка в связи с его морфологией //
Жизненные формы: Структура, спектры, эволюция / Ред. Серебрякова Т. И. М.: Наука, 1981: 213-232.
Шорина Н. И. Экологическая морфология и популяционная биология представителей
подкласса Polypodiidae: Автореф. дисс. ... докт. биол. наук. М., 1994:1-34.
572
Системы репродукции
Шохина Н. К. Семенная продуктивность и качество семян зубровки степной // Качество
семян в связи с условиями их формирования при интродукции. Новосибирск: Наука, 1971: 39-46.
Шульц Г. Э. Случай экспериментальной вивипарии у злака // Бот. журн. 1939.25(3): 197-208.
Юдакова О. И., Еналеева Н. X. Цитоэмбриологические предпосылки гаплоидии у томатов и
перспективы их реализации при опылении облученной пыльцой // Апомиксис у растений:
состояние проблемы и перспективы исследований. Тр. Межд. симп. Саратов, 1994: 163-165.
Юзепчук С. В. Alchimilla L. — Манжетка // Флора СССР. М.-Л.: Изд-во АН СССР,
1941.10: 289-410.
Юрцев Б. А. Жизненные формы — один из узловых объектов ботаники // Проблемы
экологической морфологии растений / Ред. Серебрякова Т. И. М.: Наука, 1976: 9-44.
Юрцев Б. А. Продукционные стратегии и жизненные формы растений // Жизненные формы в
экологии и систематике растений: Межвуз. сб. науч. тр. М.: Изд-во МГПИ, 1986:9-23.
Яблоков А. В. Популяционная биология. М: Наука, 1987:1-303.
Яковлев М. С. О единстве эмбриогенеза покрытосеменных и голосеменных растений // Тр.
БИН АН СССР. Сер. VII. 1951. 2: 231-242.
Яковлев М. С. Семейство Paeoniaceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983: 70-77.
Яковлев М. С, Иоффе М. Д. Особенности эмбриогенеза рода Paeonia // Бот. журн. 1957.
42(10): 1491-1502.
Яковлев М. С, Иоффе М. Д. Дальнейшее изучение нового типа эмбриогенеза
покрытосеменных // Бот. журн. 1961. 46(10): 1402-1421.
Яковлев М.С., Иоффе М. Д. Эмбриология некоторых представителей рода Paeonia //
Морфология цветка и репродуктивный процесс у покрытосеменных растении. М.-Л., 1965:140-176.
Янишевский Д. Е., Первухина Н. В. Увеличение продолжительности жизни быстро теряющих
всхожесть семян (предварительные опыты) // Сов. бот. 1941. 3.
Ярмолюк Г. И. Явление анеуплоидии у полиплоидной сахарной свеклы // Полиплоидия и
селекция / Ред. Турбин Н. В. Минск, 1972: 212-218.
Ярмолюк Г. И., Белгородская С. П., Балкин И. Я. Апомиксис у сахарной свеклы //Тр.
Межд. симп. "Апомиксис у растений: состояние проблемы и перспективы исследований." Саратов,
1994:166-168.
A Dictionary of Scientific Terms / Ed. Henderson I. F. Edinburg: Oliver and Boyd, 1953: 1- 506.
A Glossary of Botanical Terms / Ed. Jackson B. D. London: Duckworth and Co, 1916:1-427.
Aarssen L. W., Taylor D. R. Fecundity allocation in herbaceous plants // Oikos. 1992.65(2): 225-232.
Abeln Y. S., Wilms H. J., van Wrjk A. J. P.. Initiation of asexual seed production in Kentucky Blue-
grass (Poa pratensis L.) // Proc. 8th Int. Symp. Sexual Reproduction in Seed Plants, Ferns and Mosses.
Wageningen, the Netherlands. 1984:160-164.
Ackerly D. D., Jasienski M. Size-dependent variation of gender in high density stands of the
monoecious annual, Ambrosia artemisifolia (Asteraceae) // Oecologia. 1990. 82(4): 474-477.
Afzelius K. Die Embryobildung bei Nigritella nigra // Svensk. Bot. Tidskr. 1928. 22(1-2): 82-91.
Agarwal A., Mohan Ram H. Y. In vitro germination and micropropagation of water chestnut (Trapa
sp.) // Aquatic Botany. 1995. 99: 1-12.
Agren J. Population size, pollinator limitation, and seed set in the self-incompatible herb Lythrum
salicaria // Ecology. 1996. 77(6): 1779-1790.
Agren L., Kullenberg В., Sensenbaugh T Congruences in pilosity between three species of Ophrys (Orchidaceae)
and their Hymenopteran pollinators // Nova Acta Reg. Soc. Scientarium Upsaliensis, 1984. 3:15-25
Akiyama H. Allozyme variability within and among populations of the epiphytic moss Leucodon
(Leucodontiaceae) // Amer. J. Bot. 1994. 81(10): 1280-1287.
Литература
573
Alatortseva T. A., Tyrnov V. S. Possibilities of diagnosis of parthenogenesis by culture in vitro of
unpollinated ovaries // Maize Gen. Coop. NL. 1997. 71: 75.
Allard R. W., Jain S. K., Workman P. L. The genetics of inbreeding populations // Advan. Genet.
1968. 14: 55-131.
Anderson E. Origin of the Angiosperms // Nature. 1934. 133(3360): 462.
Anderson E. Introgressive hybridization. N.-Y.: J.Wiley, 1949: 1-109.
Anderson G. J., Stebbins G. L. Dioecy versus gametophytic self - incompatibility: a test // Amer.
Naturalist. 1985.124(3): 423-428.
Anderson W. P. Cryptic self-fertilization in the Malpighiaceae // Science. 1980.207(4433): 892-893.
Andronova E. V. On the morhological and physiological polarity of embryo: an opinion and facts //
Bull. Polish Acad. Sci. Biol. Sci. 1997. 45(2-4): 217-223.
Andronova E. V., Batygina T.B. Uniformity of initiation of the first leaf during germination of the
orchids (on example of the Thunia marshalliana Rchb.f.) // Proc. XI Int. Symp. "Embryology and seed
reproduction". Leningrad, 1990. SPb, 1992: 37-38.
Angenent G. C, Colombo L. Molecular control of ovule development // Trends PI. Sci. 1996.1:228-232.
Angenent G. C, Franken J., Busscher M., Colombo L., van Tunen A. J. Petal and stamen formation
in Petunia is regulated by the homeotic gene fbpl // Plant J. 1993. 3: 101-112.
Angenent G. C, Franken J., Busscher M., van Dijken A., van Went J. L., Dons H. J. M., van Tunen A. J.
A novel class of MADS box genes is involved in ovule development in Petunia // PI. Cell. 1995. 7:1569-1582.
Angevine M. V., Chabot B. F. Seed germination syndromes in higher plants // Topics in Plant
Population Biology / Ed. Solbrig О. Т. et al. N.-Y.: Columbia Univ. Press, 1979: 188-206.
Anisimova G. M., Shamrov 1.1. Ovule and seed development in Vaccinium myrtillus (Ericaceae) //
Acta Bot. Cracov. 1999. 41[suppl. 1]: 30.
Apinis Arv. Untersuchungen iiber die Okologie der Trapa L., I Teil. Systematische Zugehorigkeit,
Geschichte, Standortsverhaltnisse und die Verbreitung der Pflanze in Lettland, II Teil. Bedingungen der
Keimung und Entwicklung der Pflanze // Acta Hort. Bot. Univ. Latviensis (Riga). 1940.13 (1-3): 7-83.
Arathi H.S., Ganeshaiah K.N., Uma Shaanker R., Hegde S.G. Seed abortion in Pongamia pinnata
(Fabaceae) // Amer. J. Bot. 1999. 86(5): 659-662.
Arbeloa A., Herrero M. The significance of the obturator in the control of pollen tube entry into the
ovary in peach (Prunus persica) // Ann. Bot. 1987: 60(6): 681-685.
Arber A. Water plants. A study of aquatic angiosperms. Cambridge: Univ. Press, 1920: 1-436.
Arber A. The natural philosophy of plant form. Cambridge: Univ. Press, 1950: 1-246.
Arditti J. Orchid seed germination and seedling culture - a manual: Introduction, general outline,
tropical orchids (epiphytic and terrestrial), and North American terrestrial orchids // Orchid biology - reviews
and perspectives / Ed. Arditti J. Ithaca, N.-Y.: Cornell Univ. Press, 1982. 2: 243-293.
Argus G. W. An experimental study of hybridization and pollination in Salix (willow) // Canad. J.
Bot. 1974. 52(7): 1613-1619.
Arime J. P. Plant strategies and vegetation processes. Chichester: John Wiley & Sons, 1979:1-222.
Armstrong J. A. Biotic pollination mechanisms in the Australian flora - a review // New Zealand J.
Bot. 1979.17(4): 467-508.
Aronne G., Wilcock С. С Reproductive characteristics and breeding system of shrubs of the
Mediterranean region // Functional Ecology. 1994. 8: 69-76.
Aronne G., Wilcock C. C, Pizzolongo, P. Pollination biology and sexual differentiation of Osyris
alba (Santalaceae) in the Mediterranean region // PI. Syst. Evol. 1993. 188: 1-16.
574
Системы репродукции
Arroyo М. Т. К. Chiasma frequency evidence on the evolution of autogamy in Limnanthes floccosab
(Limnanthaceae) // Evolution. 1973. 27(4): 679-688.
Ascherson P. I., Jaeggi J. Die Wassernuss, Trapa natans L. und der Tribulus der Alten // Bot.
Centralbl. 1884.17: 242-249.
Askenasy E. Uber eine neue Methode urn die Verteilung der Wachstumintensitat in wachsenden
Teilen zu bestimmen // Vorh. naturwiss. - med. Vereins Heidelberg. 1880. 2: 70-153.
Asker S. E. Pseudogamy, hybridization, and evolution in Potentilla // Hereditas. 1977. 87:179-184.
Asker S. E. Progress in apomixis research // Hereditas. 1979. 66(2): 231-240.
Asker S. E. Gametophytic apomixis: elements and genetic regulation // Hereditas. 1980. 93: 277-293.
Asker S. E. Viewpoints on apomictic and sexual reproduction in angiosperms // Acta Soc. Bot.
Polon. 1981. 50(1-2): 195-200.
Asker S. E. Genetics of apomixis mechanisms // Apomixis: Exploiting hybrid vigor in rice. Manila,
1994: 39-42.
Asker S. E., Jerling L. Apomixis in plants. Boca Raton: CRC Press, 1992: 1-298.
Asselin de Beauville M. Obtention d'haploides in vitro a partir d'ovaires non fecondes de Riz, Oryza
sativa L. // С R. Acad. Sci. (Paris). 1980. 290(6): 489-492.
Assienan В., Noirot M. Isozyme polymorphism and organization of the agamic complexes of the
Maximae (Panicum maximum Jacq., P. infestum Anders, and P. trichocladum K.Schum.) in Tanzania
// Theor. Appl. Genet. 1995. 91: 672-680.
Augspurger C. K., Hogan K. P. Wind dispersal of fruits with variable seed number in a tropical tree
(Lonchocarpus pentaphyllus: Leguminosae) // Amer. J. Bot. 1983. 70(7): 1031-1037.
Axell S. Om anordningarna for fanerogama vaxternas befruktning. Diss. ... fil. fak. i. Upsala.
Stockholm: I. Haeggstrom, 1869: 1-116.
Baalen J. van, Andel J. van, Janssen D. W., Nelissen H. J. Reproductive allocation in plants
Scrophularia nodosa grown at various levels of irradiance and soil fertility // Acta Bot. Need. 1990.
39(2): 183-196.
Babcock E. В., Stebbins G. L. The American species of Crepis. Washington: Publ. Corn. Inst.,
1938: 1-199.
Baily J. W., Sinnot E. W. Investigations on the phylogeny of the Angiosperms // Bot. Gaz.
(Chicago). 1914. 58(1): 36-60.
Baker H. G. Dimorphism and monomorphism in the Plumbaginaceae. II. Pollen and stigmata in the
genus Limonium // Ann. Bot. (II). 1953a. 17(67): 433-445.
Baker H. G. Dimorphism and monomorphism in the Plumbaginaceae. III. Correlation of geographical
distribution patterns with dimorphism and monomorphism in Limonium // Ann. Bot. (II). 1953b. 17(68): 615-627.
Baker H. G. Self-compatibility and establishment after «long-distance» dispersal // Evolution. 1955.
9(3): 347-348.
Baker H. G. Expression of sex in flowering plants // Nature. 1957. 180(4596): 614-615.
Baker H. G. Reproductive methods as factors in speciation in flowering plants // Cold Spring Harbor
Symp. Quant. Biol. 1959. 24: 177-191.
Baker H. G. The adaptation of flowering plants to nocturnal and crepuscular pollinators // Quart.
Rev. Biol. 1961. 36(1): 64-73.
Baker H. G. Heterostyly in Connaraceae with special reference to Byrsocarpus coccineus // Bot.
Gaz. 1962.123(3): 206-211.
Baker H. G. Evolutionary mechanisms in pollination biology / / Science. 1963.139(3558): 877-883.
Литература
575
Baker H. G. Evolution, functioning and breakdown of the heteromorphic incompatibility systems, I:
The Plumbaginaceae // Evolution. 1966. 20(3): 349-368.
Baker H. G. Support for Baker's law - as a rule // Evolution. 1967a. 21(4): 853-856.
Baker H. G. The evolution of weedy taxa in the Eupatorium microstemon species aggregate // Taxon.
1967b. 16(4): 293-300.
Baker H. G. The evolution of weeds // Ann. Rev. Ecol. Syst. 1974. 5(1): 1-24.
Baker H. G. Anthecology. Testament, New Testament, Apocrypha // New Zealand J. Bot. 1979.
17(4): 431-440.
Baker H. G. Some functions of dioecy in seed plants //Amer. Naturalist. 1984.124(2): 149-158.
Baker S. C, Robinson-Beers K., Villanueva J. M., Gaiser J. C, Gasser С S. Interactions among
genes regulating ovule development in Arabidopsis thaliana // Genetics. 1997. 145: 1109-1124.
Ballard W. W. Sterile propagation of Cypripedium reginae from seeds // Amer. Orchid Soc. Bull.
1987. 56(9): 935-946.
Bara I. I., Ghiorghita G. I. Apomixis content and classification criteria // Ann. Biol. 1974.
13(11-12): 579-585.
Barabe D., Saint-Arnaud M., Lauzer D. Sur la nature des protocormes d'Orchidees (Orchidaceae)
// С R. Acad. Sci. 1993. Ser III, 316:139-144.
Barber H. N. Hybridization and the evolution of plants // Taxon. 1970. 19(2): 154-161.
Barbour M. G., Burk J. H., Pitts W. D. Terrestrial Plant Ecology. Menlo Park, Calif.: The
Benjamin Cummings Publ., 1980: 1-640.
Barrett S. C. H., Helenurm, K. The reproductive biology of boreal forest herbs. II. Phenology of
Flowering and Fruiting // Canad. J. Bot. 1987. 65: 2047-2056.
Bartlein P. J. Late-tertiary and quaternary paleoenvironments // Vegetation History / Eds. Huntley
В., Webb T. III. Kluwer Acad. Publ., 1988: 113-154.
Bary A. de. Uber apogame Fame und die Erscheinung der Apogamie im Allgemeinen // Bot. Zbl.
1878. 36: 449-487.
Bateman A. J. Self-incompatibility systems in angiosperms. 1. Theory // Heredity. 1952.6(3): 285-310.
Battaglia E. Unusual cytological features in the apomictic Rudbeckia sullivantii Boyton et Beadle //
Caryologia. 1955. 8(5): 1-32.
Battaglia E. Apomixis // Recent Advances in the Embryology of Angiosperms / Ed. Maheshwari P.
Delhi: Univ. Delhi, 1963: 221-264.
Battaglia E. Embryological questions: 5. Discussion on the concepts of spore, sporogenesis and
apospory in relation to the female gametophyte of angiosperms // Ann. Bot. 1983. 41: 1-25.
Batygina T. B. Embryology of wheat // Proc. Indian Natl. Sci. Acad., B. 1978a. 44: 13-29.
Batygina Т. В. Embryological processes at distant hybridization in Gramineae family // Proc. Indian
Natl. Sci. Acad., B. 1978b. 44: 30-42.
Batygina Т. В. Problems of morphogenesis in situ, in vivo and in vitro // Proc. Int. Symp. "Plant tissue
and cell culture application to crop improvement". Olomouc, Chechoslovakia, 1984. Prague, 1984: 43-56.
Batygina Т. В. New concept of asexual reproduction in flowering plants // Abstr. XIV Int. Bot.
Congress. Berlin, 1987: 5.
Batygina T. B. New approach to the system of reproduction in flowering plants / / Apomixis Newslet.
1989a. 1: 52-55.
Batygina Т. В. A new approach to the systems of reproduction in flowering plants //
Phytomorphology. 1989b. 39(3-4): 311-325.
576
Системы репродукции
Batygina Т. В. New concept of asexual reproduction in flowering plants // Some aspects and actual
orientation in Plant Embryology, "Dedicatory volume to Prof. A. Lebegue" / Eds. Pare J., Bugnicourt
M. Amiens: Univ. Picardie, 1989c: 28-44.
Batygina Т. В. Embryoidogenic type of reproduction in flowering plants // Apomixis Newslet. 1990.
2: 58-66.
Batygina Т. В. Nucellar embryoidogeny in Poa pratensis (Poaceae) // Pol. Bot. Stud. 1991a. 2:121-125.
Batygina T/ B. New hypothesis about the initials and genesis of embryoids (somatic embryos) and a
position of embryoidogeny in the reproduction system // Apomixis Newslet. 1991b. 3: 19-24.
Batygina Т. В. Position of the phenomenon of embryoidogeny in the system of flowering plants
reproduction // Proc. XI Int. Symp. "Embryology and seed reproduction" Leningrad, 1990. SPb, 1992a: 6-10.
Batygina T. B. Relation between embryoidogeny (somatic embryogeny) and apomixis // Abstr.
XIII Eucarpia Cong. Angers. 1992b: 333-334.
Batygina Т. В. Adaptive abilities of reproductive systems of flowering plants // Abstr. Int. Conf. on
Plants & Environmental Pollution. Lucknow, India. 1996a: 68.
Batygina Т. В. Parallel development of somatic and sexual embryos // Abstr. 14 Int. Congr. Sex.
Plant Reprod. Lome, Australia, 1996b: 4.
Batygina T. B. Morphogenesis of somatic embryos developing in natural conditions // Biologija.
1998. 3: 61-64.
Batygina Т. В., Andronova E. V. Is there a cotyledon in the Orchidaceae? An Opinion // Resent
Advances in Plant Biology / Eds. Malik С P., Abrol Y. P. Delhi: APN Publ. Corp., 1991: 369-374.
Batygina Т. В., Andronova E. V. What is the orchid protocorm? An opinion // Advances in Botany
/ Eds. Mukerji K. G., Chamola B. P., Sharma A. K., New Delhi: APH Publ. Corp., 2000 (in press).
Batygina Т. В., Andronova E. V., Kartseva L.A. Morphogenesis of the embryo and seedling of
flowering plants (an example of orchids) // Proc. 13 Int. Cong. Electron Microscopy, Paris, 1994. 3B:
1039-1040.
Batygina Т. В., Bragina E. A. Embryology and reproductive biology of Hammarbya paludosa (L.)
Kuntze (Orchidaceae) // Bull. Polish Acad. Sci. Biol. Sci. 1997. 45(2-4): 107-118.
Batygina Т. В., Bragina E. A., Titova G.E. Morphogenesis of propagules in viviparous species
Bryophyllum daigremontianum and B.calycinum // Acta Soc. Bot. Polon. 1996. 65(1-2): 127-133.
Batygina Т. В., Vasilyeva V. E. System of reproduction of Orchidaceae (on example of Dactylorhiza
maculata (L.) Soo // Proc. VII Int. Symp. "Fertilization and Embryogenesis in ovulated plants", High
Tatra (Rackova dolina), 1982. Czechoslovakia, Bratislava, 1983: 27—33.
Batygina Т. В., Zakharova A. A. Polymorphism in sexual and somatic embryos // Bull. Pol. Acad.
Sci. 1997. 45(2-4): 235-255.
Baumann-Bodenheim M. G. Prinzipien eines Fruchtsystems der Angiospermen // Ber. Schweiz.
Bot. Ges. 1954. 64: 94-112.
Bawa K. S. Evolution of dioecy in flowering plants // Ann. Rev. Ecol. Syst. 1980a. 11(1): 15-39.
Bawa K. S., Crisp J. E. Wind-polhnation in the understory of a rain forest in Costa Rica //J. Ecol.
1980b. 68: 871-876.
Bawa K. S. The evolution of dioecy - concluding remarks // Ann. Missouri Bot. Gard. 1984.
71(1): 294-296.
Bawa K. S., Webb C. J. Flower, fruit and seed abortion in tropical forest trees: implications for the
evolution of paternal and maternal reproductive patterns // Amer. J. Bot. 1984. 71(5): 736-751.
Литература
577
Bayer R. J. Evolution and phylogenetic relationships of the Antennaria (Asteraceae: Inuleae)
polyploid agamic complexes // Biol. Zentrabl. 1987. 106(6): 683-698.
Bayer R. J. Evolution of polyploid agamic complexes with examples from Antennaria (Asteraceae) //
Opera Bot. 1996.132:53-65.
Bayer R. J., Purdy B. G., Lebedyk D. G. Niche differentiation among eight sexual species of
Antennaria Gaertner (Asteraceae: Inuleae) and A. rosea, their allopolyploid derivative / / Evol. Trends
Plants. 1991. 5(2): 109-123.
Bazzaz F. A. Demographic consequences of plant physiological traits: some case studies //
Perspectives on Plant Population Ecology / Eds. Dirzo R., Sarukhan J. Sunderland: Sinauer Ass. Inc. Publ.,
1984: 324-346.
BeadlG. W. A gene in Zea mays for failure of cytokinesis during meiosis // Cytologia. 1931. 3(2):
142-145.
Beasley J. O. The production of polyploids in Gossypium // J. Heredity. 1940. 31(1): 39-48.
Begon M., Harper J. L., Townsend C. R. Ecology. Individuals, population and communities. Oxford
a. o.: Blackwell Scient. Publ., 1986: 1-876.
Beijerinck M. W. Beobachtungen und Betrachtungen iiber Wurzelknospen und Nebenwurzeln //
Natuur. Verhandl. der Koninkl. Akad. Amsterdam. 1886. 25:11-118.
Belhassen E., Beltran M., Couvet D., Dommee В., Gouyon P.-H., Olivieri J., Bell G. On the
function of flowers // Proc. Roy. Soc. London. 1985. 224(1235): 223-265.
Bell H. P. The development of the blueberry seed // Canad. J. Bot. 1957. 35(2): 139-193.
Belling J. The origin of chromosomal mutations in U vularia //Journ. Genet. 1925.15(7): 245-266.
Benavente R. S., Skorupska H., Palmer R. G., Shoemaker R. C. Embryo sac development in the cv KS
male-sterile, female sterile line of soybean (Glycine max) // Amer. J. Bot. 1989. 76(12): 1759-1768.
Bennet M. D., Finch R. A., Barelay I. R. The time rate and mechanizm of chromosome elimination
in Hordeum hybryds // Chromosoma. 1976. 5(2): 175-200.
Berg С. С Systematics and phylogeny of the Urticales // Evolution, systematics, and fossil history of
the Hamamelidae. Higher Hamamelidae / Eds. Crane P. R., Blackmore S. Oxford: Clarendon Press,
1989. 2:193-220.
Berg E. E., Hamrick J. L. Spatial and genetic structure of two sandhills oaks: Quercus laevis and
Quercus margaretta (Fagaceae) // Amer. J. Bot. 1994. 81(1): 7-14.
Berger H. Beitrage zur Entwicklungsgeschichte von Bryophyllum calycinum. Zurich: Druck und
Verlag von Caesar Schmidt, 1877: 1-111.
Bernard N. L'evolution dans la symbiose: les orchidees et leurs champignons commensaux // Ann.
Sci. Nat. Bot. 1909. 9:1-196.
Bernard N. L'evolution des plantes // Libraire Felix Alcan. Paris, 1932: 271-293.
Bernardello L., Galetto L., Rodriguez I. G. Reproductive biology, variability of nectar features and
pollination of Combretum fruticosum (Combretaceae) in Argentina // Bot. J. Linn. Soc. 1994.114(3): 293-308.
Berry P. E., Calvo R. N. Wind pollination, self-incompatibility, and altitudinal shifts in pollination
systems in the high Andean genus Espeletia (Asteraceae) // Amer. J. Bot. 1989. 76(11): 1602-1614.
Berthaud J., Barre M., Savidan I. The diversity of agamic genus Tripsacum in Mexico // Harnessing
Apomixis. A new Frontier in Plant Science. Texas, USA. 1995: 36.
Bertin R. The ecology of sex expression in red buckeye // Ecology. 1982. 63(2): 445-456.
Bertin R., Newman С. М. Dichogamy in Angiosperms // Bot. Rev. 1993. 59(2): 112-152.
578
Системы репродукции
Bewley I. D., Black M. Physiology and biochemistry of seed in relation to germination. Berlin:
Springer Verlag, 1978. 1:1-306.
Bierzychudek P. Life history and demography of shade-tolerant temperate forest herbs: a review //
New Phytol. 1982. 90(4): 757-776.
Bierzychudek P. Patterns in plant parthenogenesis // Experientia. 1985. 41: 1255-1264.
Bierzychudek P., Eckhart V. Spatial segregation of the sexes of dioecious plants // Amer. Naturalist.
1988.132(1): 34-43.
Bingham E. Т., Hawkins-Pfeiffer J. Female sterility in alfalfa due to recessive trait retarding
integument development // Heredity. 1984. 75(3): 231-233.
Birky C. W. Jr. Evolution and population genetics of organelle genes: mechanisms and models //
Evolution at the Molecular Level / Eds. Selander R. S. et al. Sinauer Ass. Inc. Publ. Sunderland, 1991:112-134.
Birky C. W. Jr. Relaxed and Stringent genomes: why cytoplasmic genes don't obey Mendel's laws //
Heredity. 1994. 85: 355-365.
Blakey С A., Dewald С L., Goldman S. L. Co-segregation of DNA markers with Tripsacum fertility
// Maydica. 1997. 42: 363-369.
Bleier H. Experimentell-cytologische Untersuchungen. I. Einfluss abnormaler Temperatur auf die
Reduktionsteilung // Zeitschr. Zellforsch. microskopische Anatomie. 1930. 11(1): 218-236.
Bodanese-Zanettini M. H., de Moraes F. M. H., Salzano F. M. Cytogenetic studies in two brazilian wheat
cultivars under natural and controlled temperature conditions // Rev. Brasil. Biol. 1979. 39(3): 551-557.
Bohanes В., Jakse M., Ihan A., Javornik B. Studies of gynogenesis in onion (Allium сера L.).
Induction procedures and genetic analysis of regenerants // PI. Sci. 1995. 104(2): 215-224.
Bolick M. R. The pollen surface in wind-pollination with emphasis on the Compositae // PI. Syst.
Evol. 1990. (Suppl.) 5: 39-51.
Bond W. J. Do mutualisms matter? Assessing the impact of pollinator and disperser disruption on
plant extinction // Phil. Trans. Royal Soc. London, series B. Biol. Sci. 1994. 344: 83-90.
Borriss H., Albrecht L. Rationelle Samenvermehrung und Anzucht europaischer Erdorchideen //
Gartenwelt. 1969. 69: 511-514.
Borriss H., Voigt T. Symbiotische und asymbiotische Samenkeimung von Orchis mascula - Ein
Beitrag zum Problem der Spezihtat der Mykorrhizapilze // Die Orchidee. 1986. 37(5): 222-226.
Botanic gardens and the world conservation strategy / Ed. Bramwell D. London: Acad. Press. 1987:1-367.
Bothmer R. von, Bengtsson M., Flink J., Linde-Laursen I. Complex interspecific hybridization in barley
(Hordeum vulgare L.) and the possible occurrence of apomixis // Theor. Appl. Gen. 1988. 76: 681-690.
Bouman F. The ovule // Embryology of Angiosperms / Ed. Johri В. М. N.-Y.: Springer Verlag,
1984:123-157.
Bowman J. L., Alvarez J., Weigel D., Meyerowitz, E. M., Smyth D. R. Control of flower development
in Arabidopsis thaliana by APETALA1 and interacting genes // Development. 1993. 119: 721-743.
Bowman J. L., Drews G. N., Meyerowitz E. M. Expression of the Arabidopsis floral homeotic gene
AGAMOUS is restricted to specific cell types late in flower development // PI. Cell. 1991. 3: 749-758.
Bowman J. L., Sakai H., Jack Т., Weigel D., Mayer U., Meyerowitz E. M. SUPERMAN, a
regulator of floral homeotic genes in Arabidopsis // Development. 1992. 114: 599-615.
Bowman J. L., Smyth D. R., Meyerowitz E. M. Genetic interactions among floral homeotic genes of
Arabidopsis // Development. 1991. 112:1-20.
Bowman R. N. Experimental non-stigmatic pollinations in Clarkia unguiculata Lindl. (Onagraceae)
// Amer. J. Bot. 1984. 71(10): 1338-1346.
Литература 579
Braak J. P., Kho I. O. Some observations on the floral biology of the carrot (Daucus carota L.) //
Euphytica. 1958. 7(2): 131-139.
Bradley M. V., Crane J. C. Abnormalities in seed development in Pistacia vera L. //J. Amer. Soc.
Hon. Sci. 1975.100: 461-464.
Bragina E. A., Batygina Т. В. The embryology and reproductive biology of Hammarbia paludosa
(L.) Ktze. (Orchidaceae) // Abstr. VIII Conference of Plant Embryologists. Gdansk, 1997: 26.
Bragina E.A., Nazarov V.V., Batygina T.B. Reproductive systems of Hammarbia paludosa
(Orchidaceae) // Abstr. Conf. "Reproductive Biology'96". London, 1996: 29.
Bragina E. A., Titova G. E., Batygina Т. В. The models of the formation of new sporophyte in genus
Bryophyllum (Crassulaceae) // Abstr. VII Conf. of Plant Embryologists of Czech Republic, Slovakia
and Poland. Lublin, 1995: 8.
Braun A. Uber Polyembryonie und Keimung von Caelebogyne. Berlin: Akad. Wissenschaft., 1859:109-263.
Braun-Blanquet J. Pflanzensoziologie. Wien: Springer-Verlag, 1951: 1-631.
Bretagnolle F., Thompson J. D. Gametes with the somatic chromosome number: mechanisms of their
formation and role in the evolution of autopolyploid plants // New Phytol. 1995. 129: 1-22.
Briggs С L., Westoby M., Selkirk P. M., Oldfield R. J. Embryology of early abortion due to limited
material resources in Pisum sativum L. // Ann. Bot. 1987. 59(5): 611-619.
British Flowering Plants / Ed. Jackson A. K. London: Ward, Lock and Co. Ltd., 1939: 1-667.
Brix K. The influence of the daylength on the relationship of sexual and asexual embryo sacs in
Eragrostis curvula (Schrad.) Nees. // Proc. 6'1' Congr. South African Genet. Soc. Pretoria, 1977.
Brockmann J., Bocquet G. Okologische Einflusse auf die Geschlechtsverteilung bei Silene vulgaris
(Moench) Garcke (Caryophyllaceae) // Ber. Deutsch. Bot. Ges. 1978. 91(2): 217-230.
Brown W. L., Wilson E. O. Character displacement // Systematic. Zool. 1956. 5: 49-64.
Brukhin V. V., Batygina T. B. Embryo culture and somatic embryogenesis in culture of Paeonia
anomala // Phytomorphology. 1994. 44(3-4): 151-157.
Brummitt R. K. Vascular plant families and genera. Whitstable, Kent: Roy. Bot. Gardens, Kew,
Whitstable Litho. Ltd., 1992: 1-804.
Brunet J., Charlesworth D. Floral sex allocation in sequentially blooming plants // Evolution. 1995.
49(1): 70-79.
Buchholz J. T. The suspensor of Sciadopitys // Bot. Gaz. 1931. 92(3): 243-262.
Buchholz J. T. The embryology of Chamaecyparis obtusa // Amer. J. Bot. 1932a. 19(3): 230-238.
Buchholz J. T. The suspensor of Cryptomeria japonica // Bot. Gaz. 1932b. 93(2): 221-226.
Buchholz J. T. The morphology and embryology of Sequoia gigantea // Amer. J. Bot. 1939.26(2): 93-101.
Biich H. Uber die Blattorgane der Lebermoose. Helsingfors, 1911: 1-77.
Bullock S. H. Breeding systems in the plants of a tropical deciduous forest // Biotropica. 1985.17:187-301.
Burgeff H. Samenkeimung der Orchideen und Entwicklung ihrer Keimpflanzen. Jena: G. Fischer
Verlag, 1936:1-312.
Burrows С J. Studies in Pimelea. 1. The breeding systems // Trans. Roy. Soc. New Zealand. 1960.
88(1). 29-45.
Burson B. L. Phylogenetics of apomictic Paspalum dilatum // Proc. XVI Int. Grass Congr. Nice,
France, 1989: 413-414.
Burson J. L. Cytological mechanisms of apospory and diplospory // Apomixis: Exploiting Hybrid
Vigor in Rice / Ed. Khush G. S. Los Banos, Philippines, 1994: 35-38.
580
Системы репродукции
Burton G. W., Forbes I. The genetics and manipulation of obligate apomixis in common bahia grass
(Paspalum notatum Flugge) // Proc. 8lhInt. Grassl. Congr. (Reading, 1960). Reading, 1961: 66-71.
Busgen M. Bau und Leben unserer Waldbaume. Jena: G. Fischer, 1927: 1-426.
Button J., Kochba J., Borman C. H. Fine structure of an embryoid development from embryogenic
ovular callus of "Shamouti" orange (Citrus sinensis Osb.) // J. Exp. Bot. 1974. 25(85): 446-457.
Caetanopereira C. M., Pagliarini M. S., Brasil E. M., Martins E. N. Influence of aluminium in
causing chromosome stickiness in maize microsporocytes // Maydica. 1995. 40(4): 325-330.
Cai D., Wang R. R.-C, Carman S. G. The promotive role of gametophytic apomixis in evolution //
Harnessing Apomixis. A new Frontier in Plant Science. Texas, USA, 1995: 40.
Calderini O., Mariani A. Megagametophyte organization in diploid alfalfa meiotic mutants producing
4n pollen and 2n eggs // Theor. Appl. Genet. 1995. 90(1): 135-141.
Callaghan T. V. A comparison of the growth of tundra plant species at several widely separted sites / /
Merlewood Research and Development Paper. 1973. 53: 1-38.
Calow P. The cost of reproduction - a physiological approach // Biol. Rev. 1979. 54(1): 23-40.
Calzada J.-P. V., Crane C. F., Stelly D. M. Apomixis: the asexual revolution // Science. 1996.
274:1322-1323.
Campbell C. S. Cleistogamy in Andropogon L. (Gramineae) // Amer. J. Bot. 1982. 69(10):
1625-1635.
Campbell C. S. Interspecific genes flow in Amelanthier agamic complex // Harnessing Apomixis. A
new Frointier in Plant Science. Texas, USA, 1995: 11.
Campbell C. S., Dickinson T. A. Apomixis, patterns of morphological variation, and species concepts
in subfam. Maloideae (Rosaceae) // Syst. Bot. 1990. 15(1): 124-135.
Campbell C. S., Greene C. W., Dickinson T. A. Reproductive biology in subfam. Maloideae
(Rosaceae) // Syst. Bot. 1991. 16: 333-349.
Campbell D. R. Inflorescence size: test of the male function hypothesis // Amer. J. Bot. 1989.
76(5): 730-738.
Campion В., Alloni C. Induction of haploid plants in onion (Allium сера L.) by in vitro culture of
unpollinated ovules // PI. Cell. Tissue Organ Cult. 1990. 20(1): 1-6.
Campion В., Assimonty M. Т., Vicini E., Schiavi M. Advances in haploid plant induction in onion
(Allium сера L.) through in vitro gynogenesis // PI. Sci. 1992. 86(1): 97-104.
Canullo R. Densita, ritmo stagionale e potenziale generativo di popolazioni di Anemone nemorosa L.
presso il bacino di Gubbio // Webbia. 1988. 42(1): 77-99.
Carey G. Further investigations on the embryology of viviparous seeds // Proc. Linn. Soc. N. S. W.
1934. 59(5/6): 392-410.
Carey G. Further investigations on the embryology of viviparous seeds // Sydney Univ. Reprints.
1935. Ser. 2 (Bot.). 2(2): 392-410.
Carlquist S. The biota of long-distanse dispersal. 4. Genetic systems in the floras of oceanic islands / /
Evolution. 1966. 20(4): 433-455.
Carman J. G. Embryogenic cells in plant tissue cultures: occurrence and behavior / / Vitro Cell Devel.
Biol. 1990. 26: 746-753.
Carman J. G. Gametophytic angiosperm apomicts and the occurrence of polyspory and polyembryony
among their relatives // Apomixis Newslet. 1995. 8: 39-53.
Carman J. G. Asynchronous expression of duplicate genes in angiosperms may cause apomixis,
bispory, tetraspory, and polyembryony // Biol. J. Linn. Soc, 1997. 61(1): 51-94.
Литература
581
Carman J. G. The gene effect: genome collisions and apomixis // Advances in Apomixis Research /
Eds. Savidan Y., Carman J. G. Rome: FAO, CIMMYT, ORSTOM, 1999.
Carman J. G., Crane C. F., Riera-Lizarazu O. Comparative histology of cell walls during meiotic and
apomictic megasporogenesis in two hexaploid Australian Elymus species // Crop. Sci. 1991. 31: 1527-1532.
Carman J. G., Hutch S. L. Aposporous apomixis in Schizachyrium (Poaceae: Andropogoneae) //
Crop. Sci. 1982. 22:1252-1255.
Carson H. L. Speciation as a major reorganization of polygenic balances // Mechanisms of
Speciation. Liss., 1982: 411-433.
Casper В. В., Niesenbaum R. A. Pollen versus resource limitation of seed production: A
reconsideration // Curr. Sci. (India). 1993. 65(3): 210-214.
Catarino F. M. Some effects of kinetin on growth breaking of dormancy and senescence in
Bryophyllum // Port. Acta. Biol. Ser. A. 1965. 9(1-2): 211-248.
Catling P. M. Autogamy in Eastern Canadian Orchidaceae: a review of current knowledge and some
new observation // Natur. Can. 1983, 110(1): 37-53.
Cave M. S., Arnott H. J., Cook S. A. Embryogeny in the California peonies, with reference to their
taxonomic position // Amer. J. Bot. 1961. 48(5): 397-404.
Cavers P. B. Seed demography // Canad. J. Bot. 1983. 61(12): 3578-3590.
Champagnat M. Recherches de morphologie descriptive et experimentale sur le genre Linaria. Paris:
Masson, 1961:1-170.
Chang Sing-yen, Wang Chi-chou. A preliminary investigation on the morphological and biological
characteristics of lotus varieties // Acta Hort. Sin. 1966. 5(2): 89-100.
Chapman G. P., Busri N. Apomixis in Pennisetum: an ultrastructural study // Int. J. Plant Sci.
1994.155(5): 492-497.
Chapman V. J. Respiration studies of mangrove seedlings. I. Material and some preliminary
experiments // Bull. Marine Sci. Gulf Caribbean. 1962. 12(1): 137-167.
Charlesworth D. Why do plants produce so many more ovules than seeds? // Nature. 1989.
338(6210): 21-22.
Charlesworth D., Charlesworth B. The evolution and breakdown of S-allele systems // Heredity.
1979. 43: 41-55.
Charlsworth D., Morgan M. T. Allocation of resources to sex functions in flowering plants // Phil.
Trans. Royal Soc. L. Ser. B. 1991. 332(1262): 91-102.
Chase M. W., Soltis D. E., Olmstead R. G. et al. Phylogenetics of seed plants: an analysis of
nucleotide sequences from the plastid gene rbcL // Ann. Miss. Bot. Garden. 1993. 80: 528-580.
Chase S. S. Monoploids and monoploid derivatives of maize (Zeamays L.) // Bot. Rev. 1969.
35(2): 117-167.
Chaudhury A. M., Ming L., Miller C, Craig S., Dennis E. S., Peacock W. J. Fertilization-independent
seed development in Arabidopsis taliana // Proc. Natl. Acad. Sci. USA, 1997. 94(4): 4223-4228.
Chen C. C, Kasha K. J., Marsolais A. Segmentation patterns and mechanisms of genome
multiplication in cultured microspores of barley // Canad. J. Genet. Cytol. 1984. 26(4): 475-483.
Chen L. F., Albertsen M. C, Palmer R. G. Pollen and coenocytic microspore germination in
male-fertile and male-sterile msl soybean // Euphytica. 1987. 36(1): 333-343.
Chen L. F., Heer H. E., Palmer R. G. The frequency of polyembryonic seedlings and polyploids from
msl soybean // Theor. Appl. Genet. 1985. 69(3): 271-277.
582
Системы репродукции
Chen L. Z., Kozono Т. Cytology and quantitative analysis of aposporous embryo sac development in
guineagrass (Panicum maximum Jacq.) // Cytologia 1994a. 59: 259-260.
Chen L. Z., Kozono T. Cytological evidence of seed-forming embyo development in polyembryonic ovules
of facultatively apomictic guineagrass (Panicum maximum Jacq.) // Cytologia. 1994b. 59(3): 351-359.
Chen W., Zhang S. A study on ecological anatomy in Nelumbo nucifera Gaertn. // Acta Ecol. Sin.
1988. 8(3): 277-282.
Chen W., Zhang S. The structure, elongation and thickening of rhizome in Nelumbo nucifera Gaertn.
// Acta Bot. Sin. 1989. 31(3): 191-197.
Chin H. F. Recalcitrant seeds. A status report. Rome: Int. Board for PL Genet. Res. 1988: 1-28.
Chmielewski J. G. Evaluation of the taxonomic status of Antennaria brunnescens, and Antennaria
foggii (Asteraceae: Inuleae) // Canad. J. Bot. 1994. 72(12): 1775-1777.
Christensen C. A., King E. J., Jordan J. R., Drews G. N. Megagametogenesis in Arabidopsis wild
type and the Gf mutant // Sexual PI. Reprod. 1997. 10(1): 49-64.
Chudzik В., Sniezko R. Micropyle of the crassinucellar ovules mature for fertilization in Oenothera, Capsella
bursa-pastoris and Sisymbrium loeselii // Abstr. VIII Conf. PI. Embryol. Poland, Gdansk, 1997a: 29.
Chudzik В., Sniezko R. Testing the fertility in ovules of Oenothera hookeri, Oe. Brevistylis — female
sterile form, Capsella bursa-pastoris and Sisymbrium loeselii by induction of callose fluorescence // Bull.
Pol. Acad. Sci., Biol. Sci. 1997b. 45(2-4): 283-288.
Chudzik В., Sniezko R. Histochemical features signaling receptivity of ovules of Oenothera hookeri de
Vries and Oe. mut. brevistylis // Acta Biol. Cracov. Ser. Bot. 1999. 41:119-129.
Church A. H. Types of Floral Mechanism. Oxford: Clarendon Press, 1908: 1-211.
Clapham A. R., Tutin T. G. and Warburgh E. F. Flora of the British Isles. Cambridge: Cambridge
Univ. Press, 1962: 1-1269.
Clark S. E., Jacobsen S. E., Levin J. Z., Meyerowitz E. M. The CLAVATA and SHOOT
MERISTEMLESS loci competitively regulate meristem activity in Arabidopsis // Development. 1996.
122:1567-1575.
Clark S. E., Running M. P., Meyerowitz E. M. CLAVATA I, a regulator of meristem and flower
development in Arabidopsis // Development. 1993. 119: 397-418.
Clark S. E., Running, M. P., Meyerowitz E. M. CLAVATA 3 is a specific regulator of shoot and
floral meristem development affecting the same processes as CLAVATA I // Development. 1995. 121:
2057-2067.
Clark S. E., Williams, R. W., Meyerowitz E. M. The CLAVATA I gene encodes a putative recep-
tor-kinase that controls shoot and floral meristem size in Arabidopsis // Cell. 1997. 89: 575-585.
Claudia A., Araujo G., Santana E. F., Carneiro V. Т. С Female gametophyte development of
apomictic Brachiaria brizantha: morphological analysis / / Abstr. XV Congr. on Sexual Plant Reprod.
Wageningen, The Netherlands, 1998: 67.
Clausen J. Partial apomixis as an equilibrium system in evolution // Caryologia. 1954.6(1-3): 469-479.
Clay K. The differential establishment of seedlings from chasmogamous and cleistogamous flowers in
natural populations of the grass Danthonia spicata (L.) Beauv. // Oecologia. 1983. 57(1-2): 183-188.
Clements F. E. The development and structure of vegetation // Univ. Nebraska. Bot. Survey
Nebraska, VII, Studies in the vegetation of state, III, 1904: 1-176.
Clements M. A. Orchid mycorrhizal associations // Lindleyana. 1988. 3(2): 73-86.
Clements M. A., Ellyard R. K. The symbiotic germination of Australian terrestrial orchids // Amer.
Orchid Soc. Bull. 1979. 48(11): 810-816.
Clements M. A., Muir H., Cribb P. J. A preliminary report on the symbiotic germination of
European terrestrial orchids // Kew Bull. 1986. 41(2): 437-445.
Литература
583
Clifford H. T. Insect pollination of Plantago lanceolata L. // Nature. 1962. 193(4811): 196.
Coen E. S. The role of homeotic genes in flower development and evolution / / Ann. Rev. PI. Physiol.
PL Mol. Biol. 1991. 42: 241-279.
Coen E. S., Meyerowitz E. M. The war of the whorls: genetic interactions controlling flower
development // Nature. 1991. 353: 31-37.
Colliuson M. E. Recent and tertiary seeds of the Nymphaeaceae sensu lato with a revision of Brasenia
ovula (Brong.) Reid and Chandler // Ann. Bot. 1980. 46(5): 603-632.
Colombo L., Franken J., Koetje E., van Went J., Dons H. J. M., Angenent G. O, van Tunen A. J.
The petunia MADS box gene FBP11 determines ovule identity // PI. Cell. 1995. 7: 1859-1868.
Conicella C, Genualdo G., Errico A., Frusciante L., Monti L. M. Meiotic restitution mechanisms
and 2n pollen formation in a Solanum tuberosum dihaploid and in dihaploid x wild species hybrids //
Plant Breeding. 1996. 115(3): 157-161.
Conn J. S., Blum U. Sex ratio of Rumex hastatulus: the effect of environmental factors and certation
// Evolution. 1981a. 35(6): 1108-1116.
Conn J. S., Blum U. Differentiation between the sexes of Rumex hastatulus in net energy allocation,
flowering and height // Bull. Torrey Bot. Club. 1981b. 108(4): 446-455.
Connor H. E. Breeding systems in New Zealand grasses. 6. Control of gynodioecism in Cortaderia
richardii (Endl.) Zotov. // New Zealand J. Bot. 1965. 3(2): 233-242.
Cook C. D. K. Vegetative growth and genetic mobility in some aquatic weeds // Differentiation
Patterns in Higher Plants / Ed. Urbanska К. М. London: Acad. Press, 1987: 217-225.
Cook M. T. The embryology of Rhizophora mangle L. // Bull. Torrey Bot. Club. 1907.34(6): 271-277.
Cook P. L. A new type of embryogeny in the conifers // Amer. J. Bot. 1939. 26(3): 138-143.
Cook R. E. Patterns of juvenile mortality and recruitment in plants // Topics in Plant Population
Biology. / Ed. Solbrig О. Т. et al. N.-Y.: Columbia Univ. Press, 1979: 207-231.
Cooper D. C. Haploid-diploid twin embryos in Lilium and Nicotiana // Amer. J. Bot. 1943.30(6): 408-413.
Corff J. le., Agren J., Schemske D. W. Floral display, polinator discrimination, and female
reproductive success in two monoecious Begonia species // Ecology. 1998. 79: 1610-1619
Come K. C, Burr F. A., Burr B. Molecular analysis of the maize anthocyanin regulatory locus cl //
Proc. Natl. Acad. Sci. USA, 1986. 83: 9631-9635.
Corner E. J. H. Transference of function // J. Linn. Soc. London, 1958. 56: 33-40.
Correns C. Bestimmung, Vererbung und Verteilung des Geschlechtes bei den hoheren Pflanzen //
Handb. Vererbung. Wissenschaft. Berlin: Gebr. Borntraeger, 1928. II(Part S): 1-138.
Cox R. M. Sensitivity of forest plant reproduction to long range transported air pollutants: in vitro
sensitivity of pollen to simulated acid rain // New Phytol. 1983. 95(2): 269-276.
Cox R. M. Sensitivity of pollen from various coniferous and broadleaved trees to combinations of
acidity and trace metals // New Phytol. 1988. 109(2): 193-201.
Craigie R., Cavalier- Smith T. Cell volume and the control of the Chlamydomonas cell cycle / / J. Cell
Sci. 1982. 54(2): 173-191.
Crane C. F. A proposed classification of apomictic mechanisms in flowering plants // Apomixis
Newslet. 1989. 1: 11-20.
Crane C. F. Integrative classification of sexual and apomictic gametophytes in high plants // Abstr.
Int. Symp. on apomixis. USA. 1995: 45.
Crane C. F., Carman J. G. Mechanisms of apomixis in Elymus rectisetum from eastern Australia and
New Zeland // Amer. J. Bot., 1987. 74(41): 477-496.
584
Системы репродукции
Crawford D. J. Enzyme electrophoresis and plant systematics // Isozymes in Plant Biology / Eds.
Soltis D. E., Soltis P. S. Portland, Discorides, 1989:146.
Crepet W. L. The role of insect pollination in the evolution of the angiosperms // Pollination biology
/ Ed. Real L. Orlando: Acad. Press, 1983: 29-50.
Crete P. La polycmbryonie chczle Lobelia syphiliyica L. // Bull. Soc. Bot. France. 1938.85(7/8): 580-538.
Cribb P. J. Morphology // Genera Orchidacearum. General Introduction, Apostasioideae,
Cypripedioideae / Eds. Pridgeao A. M. et al. N.-Y.: Oxford Univ. Press, 1999. 1: 13-23.
Critchfild W. B. Leaf dimorphism in Populus trichocarpa // Amer. J. Bot. 1960. 47(8): 699-711.
Critchfild W. B. Shoot growth and heterophylly in Ginkgo biloba // Bot. Gaz. 1970.131(2): 150-162.
Critchfild W. B. Soot growth and heterophylly in Acer // J. Arnoldi Arboretum. 1971.52(2): 240-266.
Cronberg N., Molau U., Sonesson M. Genetic variation in the clonal bryophyte Hylocomium
splendens at hierarchical geographical scales in Scandinavia // Heredity. 1997. 78(3): 293-301.
Cronquist A. An Integrated System of Classification of Flowering Plants // N.-Y: Columbia Univ.
Press, 1981: 1-1262.
Cropper S. C, Calder D. M. The floral biology of Thelymitra epipactoides (Orchidaceae) and the
implications of pollination by deceit on the survival of this rare orchid // PI. Syst. Evol. 1990.170(1/2): 11-28.
Crowe L. K. The evolution of outbreeding in plants. 1. The Angiosperms // Heredity. 1964.19(3): 435-457.
Cruden R. W. Fecundity as a function of nectar production and pollen-ovule ratios // Variation,
Breeding and Conservation of Tropical Forest Trees / Ed. Burley J. N.-Y: Acad. Press, 1976a: 171-178.
Cruden R. W. Intraspecific variation in pollen-ovule ratios and nectar secretion - preliminary evidence
of ecotypic adaptation // Ann. Missouri Bot. Gard. 1976b. 63(2): 277-289.
Cruden R. W. Pollen-ovule ratios: a conservative indicator of breeding systems in flowering plants //
Evolution. 1977. 31(1): 32-46.
Cruz R., Miles W., Roca J. W., Crus-G-de-la, Ramirez H., De-la-Cruz-G. Apomixis and sexuality
in Brachiaria. 1. Biochemical and cytoembryological studies // Proc. XVI Int. Grassland Congr. Nice,
France, 1989: 417-418.
Curtis E. J. C, Cantlon J. E. Studies of the germination process in Melampyrum limare // Amer. J.
Bot. 1965. 52(6): 552-555.
Curtis J. T. The relation of specifity of orchid mycorrhizal fungi to the problem of symbiosis // Amer.
J. Bot. 1939. 26(5): 390-399.
Cutter G. L., Bingham E. T. Effect of soybean male-sterile gene ms on organization and function of
the female gametophyte // Crop. Sci. 1977.17(7): 760-764.
Czapik R. Some research problems of the endosperm in Angiospermae / / Polish Bot. Stud. 1991.2:109-120.
Czapik R. Studies on embryology and reproduction of angiosperms - an introductory note // Polish
Bot. Stud. 1994. 8: 3-5.
Czapik R. Embryological aspects of apomixis in the family Rosaceae // Acta Soc. Bot. Polon. 1996a.
65(1-2):188.
Czapik R. Problems of apomictic reproduction in the families Compositae and Rosaceae // Folia
Geobot. Phytotax. 1996b. 31(3):381-387.
Czapik R. Theoretical aspects of apogamety in angiosperms // Bull. Pol. Acad. Sci., Biol. Sci. 1997.
45(2-4): 57-64.
Czapik R. Apogamety and its critique // Apomixis Newslet. 1998. 10: 1-2.
Daehler С. С Variation in self-fertility and the reproductive advantage of self-fertility for an invading
plant (Spartina alterniflora) // Evolutionary Ecology. 1998. 12: 553-568.
Литература
585
Dafni A. Mimicry and deception in pollination // Ann. Rev. Ecol. Syst. 1984. 15: 259-278.
Dafni A. Pollination in Orchis and related genera: evolution from reward to deception // Orchid
biology: Reviews and perspectives / Ed. Arditti J. London: Cornell Univ. Press, 1987. 4: 79-104.
Dafni A. Pollination Ecology: a practical approach. Oxford: Univ. Press, 1992: 1-250.
Dafni A., Dukas R. Insect and wind pollination in Urginea maritima (Liliaceae) // PI. Syst. Evol.
1986.154:1-10.
Dammer U. Die Verbrcitungsausriistungen der Polygonaceen // Biol. Centralblatt. 1892.12(9-10): 257-261.
Danielsson H., Gelang J., Pheijal H. Growth, flower development and ozone sensitivity in Phleum
genotypes of different geographic origin in Scandinavia // Abstr. Int. Conf. Plants & Environmental
Pollution. Lucknow, India, 1996: 11.
Darlington С D. What is a hybrid? // J. Heredity. 1937a. 28(9): 308.
Darlington С D. Recent Advances in Cytology. London: Churchill, 1937b: 1-671.
Darlington С D. The Evolution of Genetic Systems. Cambridge: Cambridge Univ. Press, 1939:1-149.
Darlington С D. Evolution of Genetic Systems. Edinburgh: Oliver & Boyd. 1958: 1-265.
Darwin Ch. On the origin of species by means of natural selection, or the preservation of favoured races
in the struggle for life. London: J. Murrey: 1859.
Darwin Ch. The Effects of Cross and Self Fertilisation in the Vegetable Kingdom. London: J. Murray,
1876:1-482.
Darwin Ch. The Different Forms of Flowers on Plants on the Same Species. London: J. Murray,
1877: 1-352.
Darzynkiewicz Z., Evenson D., Staino-Coico L., Sharpless Т., Melamed M. Duration of the G, and
S-phase of individual cells in populations correlates with their RNA-content // Acta Pathol. Microbiol.
Scand. 1981. 89(274) (Suppl): 336-340.
Datham A. S. R. Occurrence of dimorphic embryo sacs in Trichosanthes lobata Roxb // Curr. Sci.
India. 1974. 43(3): 91-92.
Datta A. K., Biswas A. K. Meiotic instability in the microsporocytes of an aberrant plant isolated from
the mutant progeny of Nigella sativa L. // Cytologia. 1985. 50(4): 649-654.
Daubenmire R. Phenological and other characteristics of tropical semi-deciduous forest in
north-western Costa Rica // J. Ecol. 1972. 60(1): 147-170.
Daubenmire R. F. Some ecologic features of the subterranean organs of alpine plants // Ecology.
1941. 22(4): 370-378.
Daumann E. Tier, - Wind - und Wasserbliitigkeit in der tschechoslowakischen Flora. II.
Dicotyledonen. III. Angiospermen zusammenfassend // Preslia. 1972a. 44(1): 28-36.
Daumann E. Die Braune Haselwurz (Asarum europaeum L.), ein obligatcr Selbstbestauber //
Preslia. 1972b. 44(1): 24-27.
Daumann E., Synek F. Tier, - Wind - und Wasserbliitigkeit in der tschechoslowakischen Flora. I.
Monocotyledonen // Osterr. Bot Zeitung. 1968 (1969). 115(4-5): 427-433.
Davies O. S. Chromosome elimination in interspecific hybrids // Heredity. 1974. 32(2): 267-270.
Davis G. L. Systematic embryology of the angiosperms. N.-Y. (a. o.): Wiley, 1966:1-528.
Davis J. H. The ecology and geologic role of mangroves in Florida // Pap. Tortugas Labor. 1940.
32: 303-412.
Day Т., Aarssen L. W. A time commitment for size-dependent gender allocation // Evolution.
1997. 51(3): 988-993.
De Candolle A. P. Theorie elementaire de la botanique en exposition des principes de la classification
naturelle et de l'art de decrire et d'etudier les vegetaux. Paris: Chez. Deterville, 1819: 1-566.
586
Системы репродукции
De Wet J. M. J., Harlan J. R. Apomixis, polyploidy and speciation in Dichanthium // Evolution.
1970. 24(2): 270-277.
Delph L. F. Sex-ratio variation in the gynodioecious shrub Hebe strictissima (Scrophulariaceae) //
Evolution. 1990. 44(1): 134-142.
Delpino F. Studi apparecchi d. fecond. nelle piante autocarpee. 1867: 1-36.
Delpino F. Einteilung der Pflanzen nach dem Mechanismus der dichogamischen Befruchtung und
Bemerkungen iiberdie Befruchtungsvorgange bei Wasserpflanzen // Bot. Zeit. 1871. 29: 443-467.
Delpino F. Eterocarpia ed eteromericarpia nelle Angiospermae // Mem. R. Accad. Sci. Inst.
Bologna. 1894. 4:1-44.
Demesure В., Comps В., Petit R. J. Chloroplast DNA phylogeography of the common beech (Fagus
sylvatica) in Europe // Evolution (USA). 1996. 50(6): 2515-2520.
Deng H., Huang G., Gui J. A study on the lotus propagation by cutting rhizome // J. Wuhan Bot.
Res. 1990. 8(3): 292-296.
Dewey D. R. The origin of Agropyron smithii // Amer. J. Bot. 1975. 62(5): 524-530.
Dewey D. R. Genomic and phylogenetic relationships among North American perennial Triticeae
grasses // Grasses and Grasslands: Systematics and Ecology / Ed. Estes J. R. Oklahoma: Univ.
Oklahoma Press, 1982: 51-58.
Dewey D. R. The genomic system of classification as a guide to intergeneric hybridization with
perennial Triticeae // Gene Manipulation in Plant Improvement. 16th Stadler Genetic Symp. / Ed. Gustafson
J. P. N.-Y., London, 1984: 209-279.
Dharamadhaj P., Prakash N. Development of the anther and ovule in Capsicum // Austral. J. Bot.
1978. 26(3): 433-439.
Dick M. W. Sexual reproduction: nuclear cycles and life-histories with particular reference to lower
eukaryotes // Biol. J. Linn. Soc. 1987. 30(12): 181-192.
Dickie G. Note on buds developed on leaves of Malaxis //J. Linn. Soc. Bot. London. 1875.14:1-3.
Dickinson H. G. Cytoplasmic differentiation during microsporogenesis in higher plants // Acta Soc.
Bot. Polon. 1981. 50 (1-2): 3-12.
Dickinson T. A., Belaoussoff S., Love R. M., Muniyamma M. North American black-fruited
hawthorns. I. Variation in floral construction, breeding system correlates, and their possible evolutionary
significance in Crataegus sect. Douglasii Loudon // Folia Geobot. Phytotax. 1996. 31(3): 355-371.
Dijk E. Mykorrhizen der Orchideen. 1 // Die Orchidee. 1988a. 39(1): 38-41.
Doak С. С Morphology of Cupressus arizonica: gametophytes and embryogeny // Bot. Gaz. 1937.
98(3/4): 808-815.
Doctrinal M. Gynogenese de la betterave sucriere influence de quelques facteurs sur le renddement en
embrons // Bull. Soc. Bot. Fr. Actual, bot. 1990. 137(3-4): 144.
Doll R. Die apomiktische Art und ihre Beziehung zur Evolution // Widerspiegelung Binnenstruktur
und Dinamik Art in Bot. Berlin, 1974: 161-173.
Dommee В., Assouad M. W., Valdeyron G. Natural selection and gynodioecy in Thymus vulgaris L.
// Bot. J. Linn. Soc. 1978. 77(1): 17-28.
Dooner H. K. Coordinate genetic regulation of flavonoid biosynthetic enzymes in maize // Mol. Gen.
Genet. 1983a. 189(1): 136-141.
Dooner H. K. Gene-enzyme relationships in anthocyanin biosynthesis in maize // Maize for
Biological Research / Ed. Sheridan W. F. Charlottsville: PI. Mol. Biol Ass. 1983b: 123-128.
Dooner H. K. Viviparous-1 mutation in maize conditions pleiotropic enzyme deficiencies in the
aleurone // PI. Physiol. 1985. 77(2): 486-488.
Литература
587
Dooner H. K., Nelson O. E. Interaction among C, R and Vp in the control of the Bz
glucosyltransferase during endosperm development in maize // Genetics. 1979. 91(2): 309-315.
Dore C, Marie F. Production of gynogenetic plants of onion (Allium сера L.) after crossing with
irradiated pollen // PI. Breeding. 1993.111(2): 142-147.
Dore J. Studies in the regeneration of horseradish // Ann. Bot. N. S. 1955. 19 (73): 127-137.
Dostal R. Fotoperiodicke pokusy s Circaea intermedia a Bryophyllum crenatum // Vestnik Kralovske
Ceske Spolecnosti nauk, Roc. 1944 An. 1946: 1-24.
Dostal R. Growth correlations in Bryophyllum leaves and exogenous growth regulations // Biol.
Plantarum. 1970. 12(2): 125-133.
Doust J. L. Floral sex ratios in andromonoecious Umbelliferae // New Phytol. 1980. 85 (12): 265-273.
Doust J. L., Cavers P. B. Sex and gender dynamics in Juck-in-the pulpit, Arisaema triphyllum
(Araceae) // Ecology. 1982. 63(3): 797-808.
Doust J. L., Doust L. L. Paternal strategy: gender and maternity in higher plants // BioSci. 1983.
33(3): 180-186.
Doyle J., Looby W. J. Embryogeny in Saxegothea and its relation to other podocarps // Sci. Proc.
Roy. Dublin Soc. 1939. 22(11): 127-147.
Dressier R. L. The Orchids: Natural history and classification. Cambridge (MA) & London:
Harvard Univ. Press, 1981: 1-332.
Drews G. N.. Bowman J. L., Meyerowitz E. M. Negative regulation of the Arabidopsis homeotic
gene AGAMOUS by the APETALA 2 product // Cell. 1991. 65: 991-1002.
Drews G. N.. Lee D., Christensen C.A. Genetic analysis of female gametophyte development and
function // PL Cell, 1998.10(1): 5-17.
Duckett C. M., Oparka K. J., Prior D. A., Roberts K. Dye - coupling in the root epidermis of
Arabidopsis is progressively reduced during development // Development. 1994.120: 3247-3255.
Dujardin M., Hanna W. W. Apomictic and sexual pearl millet. X Pennisetum squamulatum hybrids
// J. Heredity. 1983. 74: 277-279.
Dujardin M., Hanna W. W. Cytotaxonomy and evolutionary significance of two offtype millet plants
// J. Heredity. 1987. 78(1): 21-23.
Dulberger R., Smith M. В., Bawa K. S. The stigmatic orifice in Cassia, Senna and Chamaecrista
(Caesalpiniaceae): morphological variation, function during pollination, and possible adaptive significance
// Amer. J. Bot. 1994. 81(11): 1390-1396.
Dutt A. K., Bradu B. L. Proliferation in Cymbopogon and its role in plant propogation // Proc. Ind.
Acad. Sci. 1973. 77(5B): 181-185.
Eames A. J. On the origin of the herbaceous type in the angiosperms //Ann. Bot. 1911.25: 241-224.
Eames A. J. Morphology of the Angiosperms. N.-Y.: McGraw Hill Book Сотр., 1961: 1-518.
Eaton G. W., Jamont A. M. Megagametogenesis in Vaccinium corymbosum L. // Canad. J. Bot.
1966. 44(5): 712-714.
Ecology and Evolution of Plant Reproduction / Ed. Wyatt R. N.-Y: Chapman & Hall. 1992:1-397.
Eenik A. H. Matromorphy in Brassica oleracea L. III. The influence of temperature, delayed prickle
pollination and growth regulators on the number of matromorphic seeds formed // Euphytica. 1973.
23(3): 711-718.
Egler F. E. The fructus and the fruit // Chronica Bot. 1943. 7: 391-395.
Ehlenfeldt M. K., Hanneman R. E. Jr. Genetic control of Endosperm Balance Number (EBN):
three additive loci in a threshold-like system // Theor. Appl. Genet. 1988. 75: 825-832.
588
Системы репродукции
Ehrendorfer F. Polyploidy and distribution // Polyploidy / Ed. Lewis W. H. N.-Y.: Plenum Press,
1980: 45-60.
Eisikowitch D. The role of dark flowers in the pollination of certain Umbelliferae / / J. Natur. History.
1980.14: 737-742.
Elena-Rossello J. A., Cabrera E. Isozyme variation in natural populations of cork oak (Quercus suber
L.) // Silv. Genet. 1996. 45(4): 229-235.
Eleuterius L. N., McDaniel S. Observations on the flowers of Juncus roemerianus // Castanea.
1974. 39(1): 103-108.
Ellenberg H. Aufgaben und Methoden der Vegctationskunde // Einfuhrung in die Phytologie.
Stuttgart. 1956. 4(1): 3-136.
Ellenberg H. Wege der Geobotanikzum Verstandis der Pflanzendecke // Naturwiss. 1968.55(10): 462-470.
Ellerstrom S. Apomictic progeny from Raphanobrassica // Hereditas. 1983. 99: 315.
Ellerstrom S., Zagorcheva L. Sterility and apomictic embryo sac formation in Raphanobrassica //
Hereditas. 1977. 87:107.
Elliott R. C, Betzner A. S., Huttner E., Oakes M. P., Tucker W. Q. J., Gerentes D., Perez P.,
Smyth D. R. AINTEGUMENTA, an APETALA2-like gene of Arabidopsis with pleiotropic roles in
ovule development and floral organ growth // PI. Cell. 1996. 8: 155-168.
Ellstrand N. C, Marshall D. L. Patterns of multiple paternity in populations of Raphanus sativus //
Evolution. 1986. 40(4): 836-842.
Ellstrand N. C, Whitkus R., Riesenberg L. H. Distribution of spontaneous plant hybrids // Proc.
Natl. Acad. Sci. 1996. 93: 5090-5093.
Elton C. Animal Ecology. London: Sidwick & Jackson, 1927: 1-264.
Embryology of Angiosperms / Ed. Johri В. М. Berlin: Springer-Verlag, 1984: 1-602.
Enaleeva N. Kh. Experimental production of gametophyte mutants // Proc. XI Int. Symp.
«Embryology and seed reproduction.» Leningrad, 1990. SPb, 1992: 143-144.
Enaleeva N. Kh. A tobacco mutant with a reduced cell number in embryo sacs. 1. Expression of the
mutation in plants of different generations at the mature gametophyte stage // Sexual PI. Reprod. 1997.
10(6): 300-304.
Enaleeva N. Kh., Elkonin L. A., Belyaeva E. V. Embryological manifestation of apomixis in
Sorghum line derived from tissue culture // Apomixis Newslet. 1994. 7: 30-33.
Enaleeva N. Kh., Tyrnov V. S. Cytological manifestation of apomixis in AT-1 plants of corn //
Maize Genet. Coop. NL. 1997. 71: 71-75.
Endress P. K. Diversity and Evolutionary Biology of Tropical Flowers. Cambridge: Cambridge Univ.
Press, 1994a: 1-511.
Endress P. K. Evolutionary aspects of the floral structure in Ceratophyllum / / PI. Syst. Evol. 1994b.
8:175-183.
Endress P. K. Evolutionary biology of flowers: prospects for the next century // Evolution and
diversification of Land Plants / Eds. Iwatsuki K., Raven P. H. Tokyo: Springer-Verlag, 1997: 99-119.
Engell K. A preliminary morphological, cytological, and embryological investigation in Polygonum
viviparum // Bot. Tidsskr. 1973. 67(4): 305-316.
Engell K. Morphology and cytology of Polygonum viviparum in Europe. I. The Faroe Islands // Bot.
Tidsskr. 1978. 72(2-3): 113-118.
Enright N.J., Lamont B.B., Marsula R. Canopy seed bank dynamics and optimum fire regime for the
highly serotinous shrub, Banksia hookeriana //J. Ecol. 1996. 84(1): 9-17.
Erdelska O. Polyembryony in maize - histological analysis // Polish J. Bot. 1996. 65(1-2): 123-124.
Erdelska O. Successive tissue degeneration in unfertilized ovules of Daphe arbuscula // Acta Biol.
Cracov, Ser. Bot., 1999. 41:163-167.
Литература
589
Eriksen В., Molau U., Svensson M. Reproductive strategies in two arctic Pedicularis species
(Scrophulariaceae) // Ecography. 1993. 16:154-166.
Eriksson O. Seedling dynamics and life histories in clonal plants // Oikos. 1989. 55: 231-238.
Eriksson O. Evolution of seed dispersal and recruitment in clonal plants // Oikos. 1992. 63:439-448.
Ernst A. Bastardierung als Ursache der Apogamie im Pflanzenreich. Eine Hypothese zur
experimentellen Vererbungus-und Abstammungslehre. Jena: G. Fischer, 1918:1-666.
Esau K. Anatomy of Seed Plants. N.-Y.: John Wiley & Sons, 1977: 1-550.
Esau K., Kosakai H. Leaf arrangement in Nelumbo: a reexamination of a unique phyllotaxy //
Phytomorphology. 1975. 25(1): 100-112.
Escarre J., Houssard C, Briane J. P. Evolution. Le rapport des sexes de populations de Rumex
acetosella le long d'une succession postculturale // Canad. J. Bot. 1987. 65(12): 2668-2675.
Escarre J., Thompson J. D. The effects of successional habitat variation and time of flowering on seed
production in Rumex acetosella // J. Ecol. 1991. 79(4): 1099-1112.
Evans L. Т., Knox R. B. Environmental control of reproduction in Themeda australis // Aust. J.
Bot. 1969.17(3): 375-389.
Evans P. Т., Malmberg R. L. Alternative pathways of tobacco placental development: time of
commitment and analysis of a mutant // Dev. Biol. 1989. 136: 273-283.
Evolution des taux de femelles dans populations naturelles de thym, Thymus vulgaris L. Deux
hypotheses alternatives confirmees // С R. Acad. Sci. Ser.3. 1990. 310(9): 371-375.
Ewart A. J. On the longevity of seeds // Proc. Roy. Soc. Vict. 1908. 21(1): 1-210.
Ex situ Storage of Seeds, Pollen and in vitro Cultures of Perennial Woody Plant Species / Ed. Wang
B. S. P., Charest P. J., Downie B. Rome: FAO, 1993:1-83.
Exo A. Poa alpina und die Erscheinung der Viviparie bei ihr. Diss. Univ. Bonn. 1916: 1-55.
Faegri K, Pijl L. van der. The Principles of Pollination Ecology. Toronto a.o.: Pergamon Press, 1966:1-248.
Faegri K, Pijl L. van der. The Principles of Pollination Ecology. Oxford a.o.: Pergamon Press, 1971:1-291.
Faegri K, Pijl L. van derThe Principles of Pollination ecology. Oxford a.o.: Pergamon Press, 1980:1-244.
Fagerlind F. Die Terminologie der Apomixis-Prozesse // Hereditas. 1940. 26(1): 1-22.
Fagerlind F. Die Samenbildung und die Zytologie bei agamospermischen und sexuellen Arten von
Elatostema und einigen nahestehenden Gattungen nebst Beleuchtung einiger damit zusammenhangender
Probleme // K. Sven. Vetenskapsakad. Handl. 1944. 21(4): 1-130.
Falconer D. S., Mackay F. C. Introduction to Quantitative Genetics. Harlow, England: Longman
Group Ltd, 1996: 1-464.
Falinska K. Reakcja populacji roslinnych na zroznicowanie ekosystemow oraz ukladow ekotonowych
// Wiad. Ekologiczne. 1974. 20(4): 356-376.
Fan R. W., Zhou J., Huang J. Q. The controlled pollination and seed-setting rate of Liriodendron
chinense (Hemsl.) Sarg. // Chinese J. Bot. 1995. 7(1): 24-29.
Fantes P. A. Cell division control. Why clocks are inadequate // Eur. J. Cell Biol. 1980. 22(1): 492.
Farmer J. В., Digby L. Studies in apospory and apogamy in ferns // Ann. Bot. 1907. 21(82): 161-200.
Fast G. Uber das Keimverhalten europaischer Erdorchideen bei asymbiotischer Aussaat // Die
Orchidee. 1978. 29(6): 270-274.
Fast G. Orchid seed germination and seedling culture - a manual: European terrestrial orchids
(symbiotic and asymbiotic methods) // Orchid biology - reviews and perspectives / Ed. Arditti J. Ithaca,
N.-Y.: Cornell Univ. Press, 1982. 2: 309-326.
Feldman K.A., Coury D.A., Christianson M.L. Exceptional segregation of a selectable marker
(KanR) in Arabidopsis indentifies genes important for gametophytic growth and development //
Genetics, 1997.147(12): 1411-1422.
590
Системы репродукции
Felkcr F. С, Peterson D. M., Nelson О. Е. Anatomy of immature grains of eight maternal effect
shrunken endosperm barley mutants // Amer. J. Bot. 1985. 72(21): 248-256.
Fenner M. Seed Ecology. London - N.-Y.: Chapman & Hall, 1985: 1-151.
Fenton M. S. A microchemical study of the fruit coat of Nelumbo lutea // Amer. J. Bot. 1929.16(5): 259-276.
Femald M. L. Recent discoveries in the Newfoundland flora. Boston, 1933: 1-403.
Filipello Marchisio V., Berta G., Fontana A., Marzetti Mannina F. Endophytes of wild orchids
native to Italy: their morphology, caryology, ultrastructure and cytochemical characterization // New
Phytol. 1985.100: 623-641.
Finch R. A., Bennet M. D. Action of triploid inducer (tri) on meiosis in barley (Hordeum vulgare L.)
// Heredity. 1979. 43(1): 87-93.
Fincham J. R. S. Genetics. Bristol: John Wright & Sons, 1983.
Finkelstein R. R., Somerville C. R. Three classes of abscisic acid (ABC)-insensitive mutations of
Arabidopsis define genes that control overlapping subsets of ABA responses // PI. Physiol. 1990.
94(4): 1172-1179.
Fischer-Sigwart H. Trapa natans L. bei Zofingen // Ber. schweiz. Bot. Ges. (Bern), 1901.11:15-22.
Fisher J. E. The transformation of stamens to ovaries and of ovaries to inflorescences in Triticum
aestivum L. under short-day treatment // Bot. Gaz. 1972. 133(1): 78-85.
Fisher R. A. The General Theory of Natural Selection. Oxford: Clarendon Press, 1930: 1-272.
Florcs S., Schemske D. W. Dioecy and monoecy in the flora of Puerto Rico and the Virgin Islands:
ecological correlates // Biotropica. 1984. 16(2): 132-139.
Ford H. A., Paton D. С Forde N. Birds as pollinators of Australian plants // New Zealand J. Bot.
1979.17(4): 509-519.
Frakes L. A., Francis J. E., Syktus J. I. Climate Modes of the Phanerozoic. Cambridge: Cambridge
Univ. Press. 1992:1-274.
Franchi G. G., Pacini E. Types of pollination and seed dispersal in Mediterranean plants // Giorn.
Bot. Ital. 1996.130: 579-585.
Fredrikson M., Carlsson K., Franksson O. Confocal scanning laser microscopy, a new technique used in
an embryological study of Dactylorhiza maculata (Orchidaceae) // Nord. J. Bot. 1988. 8(4): 369-374.
Freeling M. Spontaneous forward mutation versus reversion frequencies for maize ADH 1 in pollen //
Nature. 1977. 267(5607): 154-156.
Freeman D. C, Harper К. Т., Charnov E. L. Sex change in plants: old and new observations and new
hypotheses // Occologia. 1980. 47(2): 222-232.
Freeman D. C, McArthur E. D. The relative influences of mortality, nonflowering, and sex change on
the sex ratios six Atriplex species // Bot. Gas. 1984. 145(3): 385-394.
Freeman D. C, McArthur E. D., Harper К. Т. The adaptive significance of sexual lability in plants
using Atriplex canescens as a principal example // Ann. Missouri Bot. Card. 1984. 71(1): 266-277.
Frohner S. Alchemilla L. // Hegi G. Illustrierte Flora von Mitteleuropa.-2. Aufl. - Berlin -Wien:
Blackwelle, 1995. 4(2 B): 13-241.
Fryxell P. A. Mode of reproduction of higher plants // Bot. Rev. 1957. 23(3): 135-233.
Fu Ka-shui. A preliminary study on "Ling" Trapa bicornis Osbeck and its cultivation in Canton and
its vicinity // Acta Bot. Sin. 1954. 3(1): 77-79.
Fuller F. S. Malaxis, Hammarbya, Liparis. Wittenberg - Lutherstadt: A. Ziemsen Verlag, 1966:1-52.
Fuller F. Platanthera, Gymnadenia, Leucorchis, Neottianthe // Die Orchideen Deutschlands.
Wittenberg — Lutherstadt: A. Ziemsen Verlag, 1978. 8: 1-64.
Funk V. A. Phylogenetic patterns and hybridization / / Ann. Missouri Bot. Card. 1985. 72(4): 681-715.
Gadclla T. W. J. Biosystematic studies in Hieracium pilosella L. and some related species of the
subgenus Pilosella // Bot. Not. 1972. 25(4): 361-369.
Gadella T. W. J. Sexual tetraploid and apomictic pentaploid populations of Hieracium pilosella
(Compositae) // PI. Syst. Evol. 1987.157(3-4): 219-245.
Литература
591
Gadella T. W. J. Reproduction, variation and interspecific hybridization in three species of Hieracium
section Pilozellina (Compositae) // Polish Bot. Stud. 1991. 2: 85-103.
Gaertncr J. De Fructibus et Seminibus Plantarum. Leipzig: Acad. Carolinae, 1788. 1: 1-384.
Gaiser J. C, Robinson-Beers K., Gasser C. S. The Arabidopsis SUPERMAN gene mediates
asymmetric growth of the outer integument of ovules // PI. Cell. 1995. 7: 333-345.
Gams H. Hydrocaryaceae // G. Hegi. Illustrierte Flora von Mitteleuropa. Munchen, 1925.5(1): 1-674.
Ganders F. R. The biology of heterostyly // New Zealand J. Bot. 1979. 17(4): 607-635.
Ganeshaiah K. N., Uma Shaanker R. Frequency distribution of seed number per fruit in plants: a
consequence of the self-organizing process? // Curr. Sci. (India). 1992. 62(4): 359-365.
Garcia M. В., Antor R. J. Sex ratio and sexual dimorphism in the dioecious Borderea pyrenaica
(Dioscoreaceae) // Oecologia. 1995. 101(1): 59-67.
Gasser C. S., Broadhvest J., Hauser B. A. Genetic analysis of ovule development // Ann. Rev. PI.
Physiol. PI. Mol. Biol. 1998. 49:1-24.
Gates R. R. Taxonomy and genetics of Oenothera // Monogr. Biol. 1958. 7: 1-115.
Gause G. F. The Struggle for Existence. Baltimore: Williams & Wilkins. 1934: 1-163.
Gehring W., Affolter M., Burglin T. Homeodomain proteins // Ann. Rev. Biochem. 1994. 63:487-526.
Genetic control of self-incompatibility and reproductive development in flowering plants / Eds.
Williams E. G. et al. Dordrecht, 1994:1-540.
Gentry A. H. Endemism in tropical versus temperate plant communities // Conservation Biology /
Ed. Soule. Sunderland: Sinauer Ass. Inc. 1986: 153-181.
Geushova Т. М. Observation on the reaction of embryo structures of Angiospermae in nature on
changes of ecological conditions // Proc. XI Int. Symp. "Embryology and Seed Reproduction."
Leningrad, 1990. SPb, 1992:174-175.
Gibbs P. E., Milne C, Vargas Carrillo. Correlation between the breeding system and recombination
index in five species of Senecio // New Phytol. 1975. 75(3): 619-626.
Gibelli G., Buscaglioni L. L'impollinazione nei fiori della Trapa natans L. u T. verbanensis De Nrs.
Ossevazioni ed esperienze del Socio / / Rendicouti della R. accademia dei Lincei, Roma. 1893.2(9): 227-236.
Gibelli G., Buscaglioni L. Die Bestaubung in den Bluten der Trapa natans L. und der Trapa
verbanensis De Nrs. // Archives italiennes de Biologie. 1894. 21: 62-73.
Gibelli G., Ferrero E. Ricerche di anatomia e morphologia intorno alio sviluppo dell'ovolo e del seme
della Trapa natans L. // Malpighia (Genova), 1891. 5(4-5): 156-218.
Gibelli G., Ferrero E. Ricerche di anatomia e morphologia intorno alio sviluppo del fiore e del frutto
della Trapa natans L. // Malpighia (Genova), 1895. 9(9-10): 1-61.
GiffordE. M., Foster A. S. Morphology and Evolution of Vascular Plants. N.-Y: W. H. Freeman
& Co., 1989.
Gilbert F. S., Haines N., Dickson K. Empty flowers // Functional Ecology. 1991. 5: 29-39.
Gilbert F. S., Opitz J. M., Ruff K. A. Resynthesizing evolutionary and developmental biology //
Devel. Biology. 1996.173(2): 357-372.
Givnish T.I. Allometry and the ecology of plant structure // 15th Intern. Bot. Congr. Yokogama, 1993:306.
Gleason H. A. The individualistic concept of the plant association // Bull. Torrey Bot. Club. 1926.
53(1): 7-26.
Godfrey M. J. The fertilisation of Ophrys apifera // J. Bot. 1921. 59: 285-287.
Godt M. J. M., Hamrick J. L. Allozyme variation in two Great Smoky Mountain endemics: Glyceria
nubigena and Rugelia nudicaulis //J. Heredity. 1995. 86(3): 194-198.
Goebel K. Pflanzenbiologischen Schilderung. I Teil insbesondere der Archegoniaten und
Samenpflanzen. N. G. Marburg: Elwert, 1889 - 1901: 1-239.
Goebel K. Organographie der Pflanzen. Jena: G. Fischer, 1898.1:1-838.
592
Системы репродукции
Goebel К. Die Kleistogamen Bliiten und die Anpassungstheorien // Biol. Zentrabl. 1904. 24:
673-697; 737-753; 769-787.
Goebel K. Einleitung in die experimentelle Morphologie der Pflanzen. Leipzig, Berlin: B. G.
Teubner, 1908:1-208.
Goebel K. Bliitenbildung und Sprossgestaltung (Anthokladien und lnfloreszenzen) 2.
Erganzungsband zur Organographie der Pflanzen. Jena: G. Fischer, 1931: 1-242.
Goebel K. Organographie der Pflanzen insbesondere der Archegoniaten und Samenpflanzen. Jena:
G. Fischer, 1933. 3:1379-2078.
Goldblatt P. Polyploidy in angiosperms: monocotyledons // Polyploidy / Ed. Lewis W. H. N.-Y.:
Plenum Press, 1980: 219-239.
Goldman D. A., Willson M. F. Sex allocation in functionally hermaphroditic plants: a review and
critique // Bot. Rev. 1986. 52(2): 157-194.
Goldschmidt R. Die Merogonie der Oenotherabastarde und die doppeltreziproken Bastarde von de
Vries // Archiv f. Zellforsch. 1912. 9: 331-344.
Golubovskaya I. N., Avalkina N. A., Sheridan W. Effects of several meiotic mutants on female meio-
sisin maize // Dev. Genet. 1992.13: 411-424.
Golubovskaya I. N.. Avalkina N. A., Auger D., Sheridan W. F. The mutational analysis of plant mei-
osis // Int. Conf. "Harnessing apomixis. A new frontier in plant science". Hilton hotel College Station,
Texas, USA, 1995: 24.
Golubovskaya I. N., Grebennikova Z. K., Avalkina N. A., Sheridan W. F. The role of ameioitic 1 gene
in the initiation of meiosis and in subsequent meiotic events in maize // Genetics. 1993. 135: 1151-1166.
Gomez J. M., Zamora R. Wind pollination in high-mountain populations of Hormathophylla spinosa
(Cruciferae) // Amer. J. Bot. 1996. 83(5): 580-585.
Gonzalez M. V., Cocque M., Herrero M. Papillar integrity as an indicator of stigmatic receptivity in
kiwifruit (Actinidia deliciosa) // J. Exp. Bot. 1995. 46: 263-269.
Gorczynski T. Badania histo-cytologiczne nad kwiatami klcistomicznemi u Lamium amplexicaule,
Oxalis acetosella i Viola odorata // Acta Soc. Bot. Pol. 1929. 6: 248-295.
Goto K., Meyerowitz E. M. Function and regulation of the Arabidopsis Horal homeotic gene
PISTILLATA // Genes Devel. 1994. 8:1548-1560.
Gottschalk W., Kaul M. L. H. The genetic control of microsporogenesis in higher plants // Nucleus.
1974.17(3): 133-166.
Gottschalk W., Kaul M. L. H. Asinapsis and desinapsis in flowering plants. I. Asinapsis // Nucleus.
1980a. 23(1-2): 1-15.
Gottschalk W., Kaul M. L. H. Asinapsis and desinapsis in flowering plants. II. Desinapsis //
Nucleus. 1980b. 23(1-2): 97-120.
GouldS. J., VrbaE. S. Exaptation -a missing term in the science of form // Paleobiology. 1982. 8:4-15.
Gounaris E. K., Sherwood R. Т., Gounaris I., Hamilton R. H., Gustine D. L. Inorganic salts modify
embryo sac development in sexual and aposporous Cenchrus ciliaris // Sexual PI. Reprod. 1991.4(3): 188-192.
Govier R. N., Harper J. L. Hemiparasitic weeds // 7'1' Brit. Weed. Contr. Conf. London, 1965:577-582.
Govindaraju D. R. Mode of colonization and pattern of life history in some North American conifers
// Oikos. 1984. 43(3): 271-276.
Grant V. Pollination systems as isolating mechanisms in angiosperms // Evolution. 1949.3(3): 82-97.
Grant V. Plant Speciation. Columbia: Univ. Press, 1971: 1-435.
Grant V. Plant Speciation. N.-Y.: Columbia Univ. Press, 1981: 1-528.
Grassl С. О. Phylogenetic concepts and archetype of the Magnoliophytes //Taxon. 1967.16(2): 353-368.
Литература
593
Gray A. The Botanical Text-Book. Pt. 1. Structural Botany or Organography on the Basis of
Morphology. N.-Y. - Chicago: Ivison, Blakeman, Taylor & Co. 1879: 1-442.
Graybosch R. A., Palmer R. G. Male sterility in soybean (Glycine max). II. Phenotypic expression of
the ms4 mutant // Amer. J. Bot. 1985. 72(11): 1751-1764.
Grimanelli D., Hernandes M., Perotti E., Savidan Y. Dosage effects in the endosperm of
diplosporous apomictic Tripsacum (Poaceae) // Sexual PI. Reprod. 1997. 10: 279 - 282.
Grimanelli D., Leblanc O., Espinosa E., Perotti E., Gonzalez-de-Leon D., Savidan Y Mapping
diplosporous apomixis in tetraploidTripsacum: one gene or several genes? // Heredity. 1998. 80(1): 33-39.
Grimanelli D., Leblanc O., Gonzalez-de-Leon D., Savidan Y. Mapping apomixis in tetraploid
Tripsacum, preliminary results // Apomixis Newslett. 1995. 8: 37-39.
Grimanelli D., Ozias-Akins P., Tohme J., Gonzalez-de-Leon D. Molecular genetics in apomixis
research // Adv. Apomixis Res. / Ed. Savidan Y., Carman J. G. FAO: Rome, 1999.
Grime J. P. Plant strategies and vegetation processes. 1979(12): 1-222.
Grinnell J. The niche-relationships of the California thrasher // Auk. 1917. 34(2): 428-433.
Groom M. J. Allele effects limit population viability of an annual plant// Amer. Naturalist. 1998.
151: 487-496.
Grossniklaus U., Schneitz K. The molecular and genetic basis of ovule and megagametophyte
development // Seminars in Cell and Developmental Biology / Eds. Lindsey K., Jiirgens G. 1998. 9: 227-238.
Grubb P. J. The maintenance of species-richness in plant communities: the importance of the
regeneration niche // Biol. Rev. Cambridge Phil. Soc. 1977. 52:107-145.
Grundwag M., Fahn A. The relation of embryology to the low seed set in Pistacia vera
(Anacardiaceae) // Phytomorphology. 1969. 19(3): 225-235.
Guiraudat J., Hauge B. M., Valan C, Smalle J., Parcy F., Goodman H. M. Isolation of the
Arabidopsis ABI3 gene by positional cloning // PI. Cell. 1992. 4(10): 1251-1261.
Gunning B. E. S., Pate J. S. "Transfer cells". Plant cells with wall ingrowths, specialised in relation to short
distance transport of solutes — their occurrence, structure, and development // Protoplasma. 1969.68(1-2): 107-133.
Guppy H. B. Observations of a Naturalist in the Pacific between 1896 and 1899. London. 1906.
Gupta S., Ahluwalia R. The anther and ovule of Nelumbo nucifera. A reinvestigation // J. Indian
Bot. Soc. 1979. 58(2): 177-182.
Gupta S., Ahuja R. Is Nelumbo a monocot? // Naturwiss. 1967. 18: 498.
Gupta S., Ahuja R. Embryology and systematic position of Nelumbo nucifera // Seminar on
morphology, anatomy and embryology of land plants. Dehli, 1969: 63-64.
Gustafsson A. The interrelation of meiosis and mitosis. 1. The mechanism of agamospermy //
Hereditas. 1939. 25(3): 289-322.
Gustafsson A. The origin and properties of the European blackberry flora // Hereditas. 1942.
28(3-4): 249-273.
Gustafsson A. Apomixis in higher plants. I. The mechanism of apomixis // Lunds Univ. Arsskr. N.
F. 1946. 42(3): 1-67.
Gustafsson A. Apomixis in higher plants. II. The causal aspect of apomixis // Lunds Univ. Arsskr.
N. F. 1947a. 43(2): 69-179.
Gustafsson A. Apomixis in higher plants. III. Biotype and species formation // Lunds Univ. Arsskr.
N.F. 1947b. 43(2): 181-370.
Guth C. J., Weller S. G. Pollination, fertilization and ovule abortion in Oxalis magnifica // Amer. J.
Bot. 1986. 73(2): 246-253.
594
Системы репродукции
Gwynne-Waughan D. Т. On some points in the morphology and anatomy of the Nymphaeaceae //
Trans. Linn. Soc. London. 1897. 7: 287-299.
Haacke W. Gestaltung und Vererbung. Eine EntwicklungsmechanikderOrganismen. Leipzig, 1893a.
Haacke W. Die Trager der Vererbung // Biol. Centralblatt. 1893b. 13: 525-542.
Haberlandt G. Uber der Ernahrung der Keimlinge und die Bedeutung des Endosperm bei viviparen
Mangrovenpflanzen // Ann. Jarb. Bot. Buitenzorg, 1895. 12: 91-115.
Haberlandt G. Eine botanische Tropenreise. Leipzig: W. Engelmann, 1898: 1-296.
Haccius B. Weitere Untersuchungen iiber Somatogenese aus den Suspensorenzellen von Eranthis
hiemalis Embryonen // Planta. 1965a. 64(3): 219-224.
Haccius B. Haben "Gewebekulturen - Embryonen" einen Suspensor? // Ber. Deutsch. Bot. Ges.
1965b. 78(11): 11-21.
Haccius B. Zur derzeitigen Situation der Angiospermen Embryologie // Bot. Jahrb. Syst. 1971.
91(2/3): 309-329.
Haccius В., Hausner G. Adventivknopsen und nicht zygotische Embryonen - Grundlagen und
Anwendung // Planta Med., Suppl. 1975: 35-41.
Haccius В., Lakshmanan K. K. Adventiv-Embryonen-Embryoide-Adventiv-Knopsen. Ein Beitrag
zur Klarung der Begriffe // Osterr. Bot. Z. 1969.116(1-5): 145-158.
Hackel E. Uber Kleistogamie bei Grasern // Osterr. Bot. Zeit. 1906.56: 81-88; 143-154; 180-186.
Hadley G. The interaction of kinetin, auxin and other factors in the development of north temperate
orchids // New Phytol. 1970. 69(4): 549-555.
Hadley G. Orchid mycorrhiza // Orchid biology - reviews and perspectives / Ed. Arditti J. Ithaca,
N.-Y.: Cornell Univ. Press, 1982. 2: 83-118.
Hadley G., Harvais G. The effects of certain growth substances on asymbiotic germination and
development of Orchis purpurella // New Phytol. 1968. 67(3): 441-445.
Hagemann W. Die Bauplan der Pflanzen eine vergleichender Darstellung ihrer Konstruction.
Heidelberg: Univ. Press. 1984:1-464.
Hagerup E., Hagerup O. Thrips pollination in Erica tetralix // New Phytol. 1953. 52(1): 1-7.
HagerupO. On pollination in the extremely hot air at Timbuctu // Dan. Bot. Arc. 1932. 8(1): 1-20.
Hagerup O. The spontaneous formation of haploid, polyploid and aneuploid embryos in some orchids
// Det. Kgl. Danske Vidensk. Selskab. Biol. Medd. 1947. 20(9): 1-22.
Hagerup O. Thrips-pollination in Calluna // Dan. Biol. Medd. 1950. 18(4): 1-8.
Hagerup O. Pollination in the Faroes — in spite of rain and poverty in insects // Det. Kgl. Danske
Vidensk. Selskab. Biol. Medd. 1951.18(15): 1-78.
Hagerup O. Autogamy in some Drooping Bicornes flowers // Bot. Tidsskr. 1954. 51: 103-106.
Haig D., Westoby M. On limits to seed production // Amer. Naturalist. 1988. 131(5): 757-759.
Haig D., Westoby M. Genomic imprinting in endosperm: its effect on seed development in crosses
between species, and its implications for the evolution of apomixis // Phil. Trans. R. Soc. Lond. B.
1991. 333: 1-13.
Haines R. W., Lye K. A. Seedlings of Nymphaeaceae // Bot. J. Linn. Soc. 1975. 70: 255-265.
Halacsy E. de. Conspectus Florae Graecae. Lipsiae: G. Engelmann, 1901. 1: 1-825.
Hall T. F., Penfound W. T. The biology of the American lotus, Nelumbo lutea (Willd.) Pers. //
Amer. Midi. Naturalist. 1944. 31(3): 744-758.
Halle F., Oldemann R. A. A., Tomlinson P. B. Tropical Trees and Forests. An Architectural
Analysis. Berlin, Heidelberg, N.-Y., 1978:1-441.
Литература
595
Hallier H. Ein zweiter Entwurf des naturlichen (phylogenetishen) System der Blutenpflanzen // Ber.
Deutsch. Bot. Ges. 1905. 23(2): 85-91.
Hallier H. L'origine et le systeme phyletique des Angiosperms exposes a l'aide de leur arbre
genealogique // Arch. Need. 1912. 2(1): 146-234.
Halloran G., Pennell A. Grain size and seedling growth of wheat at different ploidy levels // Ann.
Bot. 1982. 9(1): 103-113.
Hamann U. Beitrag zur Embryologie der Centrolepidaceae mit Bemerkungen iiber den Bau der Bliiten und
Bliitenstande und die systematische Stellung der Familie // Ber. Deutsch. Bot. Ges. 1962. 75(5): 153-171.
Hamann U. Neue Untersuchungen zur Embryologie und Systematik der Centrolepidaceae // Bot.
Jahrb. Syst. 1975. 96:154-191.
Hambler D. Some taxonomic investigations on the genus Rhinanthus // Watsonia. 1958.4(3): 101-116.
Handbook of Experimental Pollination Biology / Eds. Little C. E., Jones R. J. N.-Y.: Van Nostrand.
1983: 1-558.
Hanna W. W., Burton G. W. Cytogenetics and breeding behavior of an apomictic triploid in
bahiagrass // J. Heredity. 1986. 77: 457-459.
Hanna W. W., Gupta P. K., Tsuchiya T. Apomixis in crop plants- cytogenetic basis and role in plant
breeding // Chromosome engineering in plants: genetics, breedings, evolution. Part A. / Ed. Gupta P.
K. Amsterdam, Netherlands: Elsevier Sci. Publ., 1991: 229-242.
Hanna W. W., Powell J. B. Radiation-induced female-sterile mutant in pearl millet // J. Heredity.
1974. 65(4): 247-249.
Hanna W. W., Powell J. В., Millot J. C, Burton G. W. Cytology of obligate sexual plants in
Panicum maximum Jacq. and their use in controlled hybrids // Crop. Sci. 1973. 13: 695-697.
Haque A. Haploid-haploid polyembryony in Sesbania aculeata Pers. // Curr sci. (Bangalore).
1946.15: 287.
Harlan J. R., Brooks M. H., BorgaonkarD. S., de Wet J. M.J. Nature and inheritance of apomixis in
Bothriochloa and Dichanthium // Bot. Gaz. 1964. 125(1): 41-46.
Harlan J. R, Wet J. M. J. de. Role of apomixis in evolution of the Bothriochloa-Dichanthium complex
//Crop Sci. 1963. 3:314-316.
Harlan J. R., Wet J. M. J. de. On O. Winge and a prayer: the origins of polyploidy // Bot. Rev.
1975. 41: 361-390.
Harley J. L. The biology of mycorrhiza. Aberdeen: Aberdeen Univ. Press, 1959: 1-240.
Harmer R. Vegetative proliferation and vivipary in Scottish grasses // Trans. Bot. Edinb. 1984.
44(3): 261-268.
Harper J. L. Population Biology of Plants. London - N.-Y: Acad, press. 1977: 1-892.
Harper J. L., Ogden J. The reproductive strategy of higher plants. I. The concept of strategy with
special reference to Senccio vulgaris L. // J. Ecol. 1970. 58(3): 681-698.
Harrington J. F. Seed storage and longevity // Seed biology / Ed. Kozlowski Т. Т. N.-Y.: Acad.
Press, 1972.1(3): 145-245.
Hartmann M. Autogamie bei Protisten und ihre Bedeutung fur das Befruchtungsproblem // Arch.
Protistenkunde. 1909.14(2): 264-334.
Harvais G., Hadley G. The relation between host and endophyte in orchid mycorrhiza // New
Phytol. 1967. 66(2): 205-215.
Haskell G. Role of the male parent in crosses involving apomictics Rubus species // Heredity. 1960.
14(1-2): 101-113.
596
Системы репродукции
Hattori Т., Vasil V., Rosenkrans L., Hannah L. C, McCarty D. R., Vasil I. K. The Viviparous-1
gene and adscisic acid activate the CI regulatory gene for anthocyanin biosynthesis during seed maturation
in maize // Genes Dev. 1992. 6: 609-618.
He Zican, Liu Shijita. A study on callus induction and regeneration of plantlet from embryo culture of
lotus // Acta Hydrobiol. Sin. 1987.11(3): 278-281.
Heberle-Bors E. In vitro haploid formation from pollen: a critical review // Theor. Appl. Genet.
1985. 71(3): 361-374.
Heinricher E. Die Aufzucht und Kultur der parasitischen Samenflanzen. Jena, 1910: 1-53.
Heinricher E. Zur Physiologie der Schmarotzenden Rhinantheen, besonders der halbparasitischer //
Naturwiss. 1917. 5(8): 113-119.
Heintze A. Handbuch der Verbreitungsokologie der Pflanzen. Stockholm: Selbstverlag, 1932.1: 266.
Heiser С. В. Natural hybridization with particular reference to introgression // Bot. Rev. 1949.
15(10): 645-687.
Hellwig Z. Byliny w parku i ogrodzie. Warszawa. 1957: 1-152.
Hepner A., Boulter M. E. Pollen tube growth and fertilization efficiency in Salpiglossis sinuata:
implications for the involvement of chemiotropic factors // Ann. Bot. 1987. 60(5): 595-601.
Heritage B. Preliminary notes on Nelumbo lutea // Bull. Torrey Bot. Club. 1895. 22(6): 266-271.
Hermsen J. G. Th. Mechanisms and genetic implications of 2n-gamete formation // Iowa State J.
Res. 1984. 58(3): 421-434.
Herr J. M. An analysis of methods for permanently mounting ovules cleared in four-and-a-half type
clearing fluids // Stain Tech. 1982. 57: 161-169.
Herr J. M. Embryology and Taxonomy // Embryology of Angiosperms / Ed. Johri В. М. Berlin,
N.-Y.: Springer, 1984: 647-696.
Hertwig R. Uber neue Probleme der Zellenlehre // Arch. Zellf. 1908. 1(1): 1-32.
Heslop-Harrison J. New Concepts in Flowering-Plant Taxonomy. London: Heinemann, 1953:1-29.
Heslop-Harrison J. The sexuality of flower // New Biology. 1957a. 23: 9-28.
Heslop- Harrison J. The experimental modification of sex expression in flowering plants / / Biol. Rew.
1957b. 32(1): 38-90.
Heslop-Harrison J. Forty years of genecology // Adv. Ecolog. Res. 1964. 2: 159-247.
Heslop-Harrison J. Sexuality in angiosperms // Plant Physiology - A Treatise / Ed. Steward F. C.
N.-Y.: Acad. Press. 1972. 6c: 133-289.
Heslop-Harrison J. An interpretation of the hydrodynamics of pollen // Amer. J. Bot., 1979. 66(6):
737-743.
Heslop-Harrison J. Self-incompatibility: phenomenology and physiology // Proc. R. Soc. Lond., B.
1983. 218: 371-395.
Heslop-Harrison J. Pollen germination and pollen tube growth // Int. Rev. Cytol. 1987.107:1-78.
Heslop-Harrison J. The angiosperm stigma // Sexual Plant Reproduction / Eds. Cresti M., Tiezzi
A. Berlin a. o.: Springer Verlag, 1992: 59-68.
Heslop-Harrison Y., Heslop-Harrison J., Reger B. J. The pollen-stigma interaction in the grasses. 7.
Pollen-tube guidance and the regulation of tube number in Zea mays L. // Acta Bot. Need. 1985. 34(2):
193-211.
Heslop-Harrison Y., Shivanna K. R. The receptive surface of the angiosperm stigma // Ann. Bot.
1977. 41(176): 1233-1258.
Литература
597
Hesse M. Entwicklungsgeschichte und Ultrastruktur von Pollenkitt und Exine bei nahe verwandten
entomophilen and anemophilen Angiospermensippen: Ranunculaceae, Hamamelidaceae, Platanaceae und
Fagaceae // PI. Syst. Evol. 1978.130(1/2): 13-42.
Hesse M. Entwicklungsgeschichte und Ultrastruktur von Pollenkitt and Exine bei nahe verwandten
entomo- und anemophilen Angiospermen: Polygonaceae // Flora. 1979a. 168(6): 558-577.
Hesse M. Entwicklungsgeschichte und Ultrastruktur von Pollenkitt and Exine bei nahe verwandten entomo-
und anemophilen Angiospermen: Salicaceae, Tiliaceae und Ericaceae // Hora. 1979b. 168(6): 540-557.
Hesse M. Entwicklungsgeschichte und Ultrastruktur von Pollenkitt and Exine bei nahe verwandten
entomophilen and anemophilen Sippen der Oleaceae, Scrophulariaceae, Plantaginaceae und Asteraceae
// PI. Syst. Evol. 1979c. 132(1/2): 107-139.
Hickman J. C. Environmental unpredictability and plastic energy allocation strategies in the annual
Polygonum cascadence (Polygonaceae) // J. Ecology. 1975. 63(2): 689-701.
Hildebrand F. Die Verbreitungsmittel der Planzen. Leipzig: Verl. von W. Engelmann, 1873:1-162.
Hill A., Nantel A., Rock. C. D., QuatranoR. S. A conserved domain of the Viviparous-1 gene
product enhances the DNA binding activity of the bZIP protein EmBP-1 and other transcription factors //J.
Biol. Chem. 1996. 271: 3366-3374.
Hill J., Lord E. M. Dynamics of pollen tube growth in the wild radish Raphanus raphanistrum
(Brassicaceae). Order of fertilization // Evolution. 1986. 40(6): 1328-1334.
Hjelmquist H. The embryology of some South African Alchemilla species // Bot. Not. 1956.
109(1): 21-32.
Hjelmqvist H., Grazi F. Studies on variation in embryo sac development // Bot. Not. 1964. 7(2): 141-166.
Hjelmqvist H., Grazi F. Studies on variation in embryo sac development. Second Part // Bot. Not.
1965.118(4): 329-360.
Hodgson J. G. Are families of flowering plants ecologically specialized? // Plants Today. 1989.2(4): 132-138.
Hoecker U., Vasil I. K., McCarty D. R. Integrated control of seed maturation and germination
programs by activator and repressor functions of Viviparous-1 of maize // Genes. Dev. 1995. 9: 2459-2469.
Hoekstra F. A. Respiration and vitality of bi- and trinucleate pollen / / Incompatibility. 1973. 3: 52-54.
Hoekstra F. A., Bruinsma J. Reduced independence of the male gametophyte in angiosperm evolution
// Ann. Bot. 1978. 42(179): 759-762.
Hoffmann Ch., Gebureck Th. Allozyme variation of indigenous Douglas fir (Pseudotsuga menziesii)
populations and their descendants in Germany // Silv. Genet. 1995. 44(5-6): 222-225.
Hofmeister W. Vergleichende Untersuchungen der Keimung, Entfaltung und Fruchtbildung der hoherer
Kryptogamen und der Samenbildung der Coniferen. Leipzig: Verlag von Friedrich Hofmeister, 1851: 1-179.
Hopping M. E., Jerram E. M. Pollination of kiwifruit (Actinidia chinensis Planch.): stigma-style
structure and pollen tube growth // New Zealand J. Bot. 1979. 17(3): 233-240.
Horovitz A. Is the hermaphrodite flowering plant equisexual? // Amer. J. Bot. 1978. 65(4): 485-486.
Horovitz A., Meiri L., Beiles A. Effects of ovule position in fabaceous flowers on seed set and
outcrossing rates // Bot. Gaz. 1976.137(3): 250-254.
Hosemans D., Bossoutrot D. Induction of haploid plants from in vitro culture of unpollinated beet
ovules (Beta vulgaris L.) // Z. Pflanzenzuchtg. 1983. 91(1): 74-77.
Hovin H. W., Berg С. С, Bashaw E. C, Buckner R. C, Dewey D. R., Dunn G. M., Hoveland С
S., Rincker C. M., Wood G. M. Effects of geographic origin and seed production environment on
apomixis in Kentucky bluegrass // Crop. Sci. 1976. 16: 635-638.
598
Системы репродукции
Howarth S. E., Williams J. T. Chrysanthemum segetum // J. Ecol. 1972. 60(2): 473-584.
Howe H. F., Westly L. C. Ecology of pollination and seed dispersal // Plant Ecology / Ed. Crawley
M. J. Oxford: Blackwell Sci. Publ.. 1986: 185-216.
Howe M. D. A morphological study of the leaf notches of Bryophyllum calycinum // Amer. J. Bot.
1931.18(5): 387-390.
Huang B.-Q., Sheridan W. F. Embryo sac development in the maize indeterminate gametophytel
mutant: abnormal nuclear behavior and defective microtubule organization // PI. Cell. 1996. 8(8): 1391-1407.
Huang Guozhong, Gu Ming-guang. Получение in vitro партеногенетических семян из
неопылённых початков кукурузы // Acta Genet. Sin. 1995. 22(3): 230-238 (кит).
Huber W., Leuchtmann A. Genetic differentiation of the Erigeron species (Asteraceae) in the Alps: a
case of unusual allozymic uniformity // PI. Syst. Evol. 1992. 183(1/2): 1-16.
Humboldt A. Ideen zur einer Physionomik der Gewachse. Tubingen. J. G. Gotta, 1806:1-28.
Hunger E. Uber einige viviparie Pflanzen und die Erscheinung der Apogamie bei denselben.
Dissertation. Rostock. 1887.
Husband B. C, Barrett S. C. H. A metapopulation perspective in plant population biology // J.
Ecol. 1996. 84(3): 461-469.
Hussey M. A., Bashaw E. C, Hignight K. W., DahmerM. L. Influence of photoperiod on the
frequency of sexual embryo sacs in facultative apomictic buffelgrass // Euphytica. 1991. 54(2): 141-145.
Hutchings M. H. The structure of plant populations // PI. Ecology /Ed. Crawley M. J.
Oxford-London, 1986: 97-136.
Hutchinson G. E. Concluding remarks // Cold Spring Harbor Symp. Quant. Biol. 1957.22:415-427.
Huth E. Uber geokarpe, amphikarpe und heterokarpe Pflanzen. Berlin: Samml. Naturwiss., 1890. 3:1-32.
Huyghe C. La polyembryonie haploide-diploide chez le lin (Linum usitatissimum L.). Etude
cytologique et physiologique // Agronomie. 1987. 7(8): 567-573.
Iqbal M. Z., Qadir S. A. Effect of industrial pollution on seed germination // Pakistan J. Bot. 1973.
5(2): 155-158.
Irmisch T. Beitrage zur Morphologie und Biologie der Orchideen. Leipzig, 1853: 1-82.
Ito M. On the embryos and the seedlings of the Nymphaeaceae // Acta Phytotax. Geobot. 1982.33:143-148.
Iversen J. Blutenbiologischc Studien. I. Dimorphie und Monomorphie bie Armeria // K. Danske.
Vidensk. Selsk. Biol. Medd. 1940.15: 8.
Iwanada M, Chemical induction of aposporous apomictic seed production // Proc. Int. Congr. Res.
for the Potato in the vier 2000, CIP, Lima. Peru, 1983: 104-105.
Izmailow R. Cyto-embryological studies on Alchemilla L. (series Calicinae Buser). 1.
Microsporangium and microsporogenesis // Acta Biol. Cracov. Ser. Bot. 1984. 26: 1-17.
Izmailow R. Cyto-embryological studies on Alchemilla L. (series Calicinae Buser). II. Apomictic
processes in ovules // Acta Biol. Cracov. Ser. Bot. 1986. 27: 39-61.
Izmailow R. Embryo and endosperm relations at early stages of their development in Alchemilla
subsect. Heliodrosium (Rosaceae) // Polish Bot. Stud. 1994. 8: 61-67.
Jack Т., Brockman L. L., Meyerowitz E. M. The homeotic gene APETALA 3 of Arabidopsis
thaliana encodes a MADS box and is expressed in petals and stamens // Cell. 1992. 68: 683-697.
Jack Т., Fox G. L., Meyerowitz E. M. Arabidopsis homeotic gene APETALA 3 ectopic expression:
transcriptional and posttranscriptional regulation determine floral organ identity // Cell. 1994. 76:703-716.
Jackson A. K. British Flowering Plants. London: Ward, Lock & Co. Ltd, 1939: 1-667.
Jacobsen H. В., Martens H. Influence of temperature and ageing of ovules and pollen on reproductive
success in Trifolium repens L. // Ann. Bot. 1994. 74(5): 493-501.
Литература
599
Jacques—Felix H. Sur une interpretation nouvelle de Pcmbryon des Graminees. Consequences
terminologiques et rapports avec les autres types d'embryoncs / / Сотр. Rend. Hebd. Sea. Acad. Sci.
1958. 246(1): 150-153.
Jacques—Felix H. Les Monocotyledones n'ont pas de cotyledon // Adansonia. 1982. 1-2: 3—40.
Jain S. K. Male sterility in flowering plants // Bibliographia Genetica. 1959. 18: 101-166.
James C. D., Hoffman M. Т., Lightfoot D. C, Forbes G. S., Walter, W. G. Pollination ecology of
Yucca elata // Oecologia. 1993. 93: 512—517.
Janaki Ammal E. K., Gupta B. K. The role vivipary in genus Cymbopogon // Curr. Sci. 1969.
38(22): 576.
Jankowic M., Blazencic J. Uber die Erscheinung zweisamiger Fruchte und zweifachariger Keimung bei
der Art Trapa longicarpa M. Jank. // Glasn. bot. zavodu i baste univ. Beogradu. 1961. 1(3): 213-226.
Jankowic M., Blazencic J. Anatomske i morfoloske karakteristike vegetativnih organa Trapa L. gajene
uporedo u vodenoj i vasdusnoj sredini pod eksperimentalnim uslovima // Glasn. bot. zavodu i baste univ.
Beogradu. 1965-1966. 3[nov.ser.](l-4): 5-28.
Jankowic M., Blazencic J. Uporedna studija structure endocarpa plodova razlicitin vrsta roda Trapa L.
i njen ekoloski snacaj // Glasn. bot. zavodu i baste univ. Beogradu. 1973. 8(1-4): 84-116.
Jankun A. Evolutionary significance of apomixis in Sorbus intermedia (Rosaceae) // Fragm. Flor.
Geobot. 1993. 36: 627.
Jankun A., Kovanda M. Apomixis at the diploid level in Sorbus exima (embryological studies in
Sorbus 3) // Preslia, Praha. 1988. 60:193-213.
Janzen D. H. Developmental demography of Bauhinia pauletia Pers. (Leguminosae) seeds and ovules
// Brenesia. 1977. 12/13:105-111.
Jassem B. Apomixis in the genus Beta // Apomixis Newslett. 1990. 2: 7-23.
Jefferson R. Apomixis: a social revolution for agriculture? // Biotechnology Development Monitor.
1994. 19: 1-16.
Jeffrey E. C. The Anatomy of Woody Plants. Chicago: Univ. Chicago Press, 1917: 1-478.
JenkinT. J. Notes on vivipary in Festucaovina// Rep. Bot. Soc. Exchange Club. 1922. 6:418-432.
Jenniskens M. - J. P. J., Wetzels P., Sterk A. A. Aspects of the flowering ecology of taxa of Taraxacum
(sect. Taraxacum) // Bot. Jahrb. Syst. 1984. 104(3): 369-400.
Jensen C. J. Monoploid production by chromosome elimination // Appl. Fundam. Aspects Plant
Cell, Tissue and Organ Culture. Berlin, 1977: 299-340.
Joel D. M., Losner-Goshen D. Early host-parasite interactions: models and observations of host root
penetration // Biology and Management of Orobanche, R. T. J., The Netherlands, 1994: 237-247.
Jofuku K. D., den Boer B. G. W., Van Montagu M., Okamuro J. K. Control of Arabidopsis flower
and seed development by the homeotic gene APETALA2 // PI. Cell. 1994. 6: 1211-1225.
Johansen D. A. Plant Embryology. Waltham, M. A: Chronica Botanica, 1950: 1-305.
John В., Lewis K. P. Chromosome hierarchy: An untroduction to the biology of the chromosome.
Oxford: Clarendon Press, 1975: 1-171.
Johnson M. A. The origin of the pseudo-bulbils Kalanchoe daigremontiana // Bull. Torrey Bot.
Club. 1934. 61: 355-366.
Johnson M. C, Mulcahy D. L., Galinat W. C. Male gametophyte in maize: influences of the
gametophytic genotype // Theor. Appl. Genet. 1976. 48(6): 299-303.
Johri B. M. Studies in the family Alismaceae. IV. Alisma plantago L., Alisma plantago-aquatica L.
and Saggitaria graminea Mich. // Proc. Indian Acad. Sci. Sect. B. 1936. 4(2): 128-138.
Johri В. М., Ambegaokar К. В., Srivastava P. S. Comparative Embryology of Angiosperms. Berlin
a.o.: Springer-Verlag, 1992. 1: 1-614, 2: 615-1221.
Johri В. М., KakD. The embryology of TamarixL. // Phytomorphology. 1954. 4(1/2): 230-247.
Jona R. Corylus // Handbook of Flowering / Ed. Halcvy A. H. Boca Raton, 1985. 2: 333-340.
600 Системы репродукции
Jones J. A. Overcoming delayd germination of Nelumbo lutea // Bot. Gaz. 1928. 85(3): 341-343.
Jongedijk E. The pattern of megasporogenesis and megagametogenesis in diploid Solanum species hybrids;
its relevance to the origin of 2n-eggs and the induction of apomixis // Euphytica. 1985. 34(3): 599-611.
Jongedijk E. Desynapsis and 2n-megaspore formation in diploid potato: potentials and limitations for
breeding and for the induction of diplosporic apomixis / Ph. D. thesis, Wageningen, 1991: 1-110.
Joppa L. R., Williams N. D., Maan S. S. The chromosomal location of a gene (msg) effecting
megasporogenesis in durum wheat // Genome. 1987. 29(4): 578-581.
Joshi A. C. A suggested explanation of the prevalence of vivipary on the sea-shore //J. Ecology.
1933. 21: 209-212.
Joshi N. V., Uma Shankar, Ganeshaiah. The «neighbour effect» and its role in shaping the positional
pattern of seed development in fruits: an illustration from the pods of Erythrina suberosa // Curr. Sci.
(India). 1993. 65(3): 234-238.
Jost L. Die Zerkliiftungen einiger Rhisome und Wurzeln // Bot. Ztg. 1890. 48(32): 501-512.
Juel O. Parthenogenesis bei Antennaria alpina (L.) Br. // Bot. Centralbl. 1898. 74: 269-372.
Juncosa A. M. Developmental morphology of the embryo and seedling of Rhizophora mangle L.
(Rhizophoraceae) // Amer. J. Bot. 1982. 69(10): 1599-1611.
Juncosa A. M., Webster B. D. Development of chasmogamous, aerial cleistogamous and
subterranean cleistogamous flowers in Amphicarpaea bracteata L. // Amer. J. Bot. 1989. 76(6): 67-68.
Kalin Arroyo M. T. Breeding systems and pollination biology in Leguminosae // Adv. Legume Syst.
Roy. Bot. Gardens, Kew. 1981.1: 723-769.
Kamelina O. P. Synergid apogamety in the genus Tetradiclis Stev. (Tetradiclidaceae) and occurrence
of this phenomenon in flowering plants // Apomixis Newslett. 1995. 8: 32-33.
Капо К. Acceleration of the germination of so-called «hard-to-germinate» orchid seeds // Amer.
Orchid Soc. Bull. 1968. 37(8): 690-698.
Kappert H. von. Erbliche Polyembryonie bei Linum usitatissimum // Biol. Zentralbl. 1939.
53(5/6): 276-307.
Karihaloo J. L. Desynapsis due to temperature stress in three species of Solanum L. // Cytologia.
1991. 56(4): 603-611.
Karron J. D. The pollination ecology of co-occurring geographically restricted and widespread species
of Astragalus (Fabaceae) // Amer. J. Bot. 1988. 75(7): 1114-1119.
Karron J. D. Patterns of genetic variation and breeding systems in rare plant species // Genetics and
Conservation of Rare Plants / Eds. Falk D. A., Holsinger К. Е. Oxford: Univ. Press, 1991: 87-98.
Karsten G. Uber die Mangrove Vegetation im Malayischen Archipel // Bibliotheca botanica. 1891.22:1-63.
Kashin A. S. Physiological aspects of apomixis in angiosperms // Apomixis Newsletter. 1992.4:19-24.
Kato M. The phylogenetic relationship of Ophioglossaceae // Taxon. 1988. 37(2): 381-386.
Kaul M. L. I., Murthy T. G. K. Mutant genes affecting higher plant meiosis // Theor. Appl. Genet.
1985. 70(4): 449-466.
Kawano S. Life history characteristic of temperate woodland plants in Japan // The Population
Structure of Vegetation / Ed. J. Whte. Dordrecht: Dr. W. Junk Publ., 1985: 515-549.
Kay Q. O., Stevens D. P. The frequency, distribution and reproductive biology of dioecious species in
the native flora of Britain and Ireland // Bot. J. Linn. Soc. 1986. 92(1): 39-64.
Kearns C. A., Inouye D. W. Techniques for Pollination Biologists. Colorado: Univ. Press, 1993:1-583
Kellogg E. A. Variation and species limits in agamospermous grasses // Syst. Bot. 1990.15(1): 112-123.
Kennell J. C, Horner H. T. Influence of the soybean male sterility gene (msl) on the development of
the female gametophyte // Canad. J. Genet. Cytol. 1985a. 27(2): 200-209.
Литература
601
Kennell J. C, Horner H. T. Megasporogenesis and megagametogenesis in soybean, Glycine max //
Amer. J. Bot. 1985b. 72(10): 1553-1564.
Kermicle J. L. Pleiotropic effects on seed development of the indeterminate gametophyte gene in maize
//Amer. J. Bot. 1971. 58(1): 1-7.
Kerner von Marilaun A. Pflanzenleben. Leipzig-Wien: Verlag Bibliogr. Instituts, 1896. 1: 1-766;
1898. 2:1-778.
Khan S. A. R. Pollination and fruit formation in litchi (Nephelium litchi) // Agr. J. India. 1929.24:183-187.
Khan S. H., Ma N. H. Hydroxyurea enhanced chromatid aberrations in Tradescantia pollen tubes
and seasonal variation of aberration rates // Mutat. Res. 1974. 25(1): 33-38.
Khanna P. Morphological and embryological studies in Nymphaeaceae. II. Brasenia schreberi Gmel.
and Nelumbo nucifera Gaertn. // Austral. J. Bot. 1965.13(3): 379-387.
Khodachek E. A. Reproductive strategies of plants in Arctic Environment // Abstr. Int. Conf.
"Global Change and Arctic Terrestrial Ecosystems", Oppdal. Norway, 1993: 60.
Khodachek E. A. Reproductive strategies of plants in environments of the Arctic // Ecosystems
Research Report 10. Global Change and Arctic Terrestrial Ecosystems. Directorate-General Science,
Research and Development ECSC-EC-EAEC. Brussels, Luxembourg, 1995: 69-79.
Khodachek E. A. Seed reproduction in arctic environments // Opera botanica. 1997.132:129-135.
Kimber G., Riley R. Haploid angiosperms // Bot. Rev. 1963. 29(4): 480-531.
Kinderen G. van der. Abscisic acid in terrestrial orchid seeds: a possible impact on their germination
// Lindleyana. 1987. 2(2): 84-87.
Kindiger В., Bai D., Sokolov V. Assignment of a gene (8) conferring apomixis in Tripsacum to a
chromosome arm: cytological andrnolecularevidence // Genome. 1994. 39: 1133-1141.
Kindiger В., Dewald С Genome accumulation in eastern gamagrass, Tripsacum dactyloides (L.) L.
(Poaceae) // Genetica. 1994. 92: 197-201.
Kindiger В., Sokolov V. Progress in the development of apomictic maize. // Trends Agron. 1997.1:75-94.
Kindiger В., Sokolov V., Dewald C. A comparison of apomictic reproduction in eastern gamagrass
(Tripsacum dactyloides (L.) L. and maize-Tripsacum hybrids) // Genetica. 1996. 97: 103-110.
Kindiger В., Sokolov V., Khatypova I. V. Evaluation of apomictic reproduction in a set of 39
chromosome Maize-Tripsacum backcross hybrids // Crop Sci. 1996. 36: 1108-1113.
Kinzel W. Frost und Licht als beeinflussende Krafte bei der Samenkeimung mit besonderer
Berucksichtigung der Entwicklund (Nachveife, Keimdauer etc.) und anderer biologishen Eigentumlichkeiten
der Samen aus den verschiedenen Pflanzenfamilien. Stuttgart: Verlagsbuchhandl, 1913:1-170.
Kipp-Goller T. Uber Bau und Entwicklung der viviparen Mangrovenkeimlinge // Z. Bot. 1940.
35(1): 1-40.
Kitada K., Kurata N., Satoh H., Omura T. Genetic control of meiosis in rice, Oryza sativa L. I.
Classification of meiotic mutants induced by MNU and their cytogenetical characteristics // Jap. J.
Genet. 1983. 58(3): 231-240.
Kitany Y. Induction of parthenogenetic haploid plants with Brassinolide // Japanese J. Genet. 1994.
69(1): 35-40.
Kivilaan A., Bandurski R. S. The one hundred-year period for Dr. Beal's seed viability experiment //
Amer. J. Bot. 1981. 68(9): 1290-1292.
Klinkhamer P. G. L., Jong T. J. de. Effects of plant size, plant density and sex differential nectar reward on
pollinator visitation in the protandrous Echium vulgare (Boraginaceae) // Oikos. 1990. 57(3): 399-405.
Klinkhamer P. G. L. Jong T. de, Meelis E. How to test for proportionality in the reproductivity in the
reproductive efforts of plants // Amer. Naturalist. 1990. 135(2): 291-300.
Klinkhamer P. G. L., Jong T. de, Meijden Ed. van der. Size-dependent reproductive output in plants
// Abstr. XV Int. Bot. Congr. Yocohama, Japan, 1993: 278.
602
Системы репродукции
Klinkhamer P. G. L., MeelisE., JongT. J. de, Weiner J. On the analysis of size-dependent
reproductive output in plants // Functional Ecology. 1992. (6): 308-316.
Klucher K. M, Chow H., Reiser L., Fischer R. L. The AINTEGUMENTA gene of Arabidopsis
required for ovule and female gametophyte development is related to the floral homeotic gene
APETALA2 // PI. Cell. 1996. 8:137-153.
Kluska T. Cyto-embryological studies on Aster novae-angliae L. // Acta Biol. Cracov. Ser. Bot.
1986. 28(1): 1-29.
Knobloch J. W. Intergeneric hybridization in flowering plants // Taxon. 1972. 21(1): 97-103.
Knox R. B. Apomixis: seasonal and population differences in a grass // Science. 1967.
157(3786): 325-326.
Knox R. В., Heslop-Harrison J. Experimental control of aposporous apomixis in a grass of the
Andropogoneae // Bot. Not. 1963.116(1): 127-141.
Knox R. В., Kenrick J., Jobson S., Dumas C. Reproduction function in the mimosoid legume Acacia
retinoides: ultrastructural and cytochemical of stigma receptivity // Austr. J. Bot. 1989. 37(2): 103-124.
Knuth P. Handbuch der Bliitenbiologie. Leipzig: Verlag von W. Engelmann, 1898a. 1:1-400;
1898b. 2(1): 1-696; 1899. 2(2): 1-705; 1904. 3(1): 1-570; 1905. 3(2): 1-598.
Knuth P. Handbook of Flower Pollination. Oxford: Univ. Press, 1906. 1: 1-382; 1908. 2: 1-703;
1909. 3:1-644.
Koeman-Kwak M. The pollination of Pedicularis palustris by nectar thieves (short-tongued
bumblebees) // Acta Bot. Need. 1973. 22(6): 608-615.
Kojima A., Nagato J. Diplosporous embryo sac formation and the degree of diplospory in Allium
tuberosum // Sexual PI. Reprod. 1992a. 5(1): 72-78.
Kojima A., Nagato J. Pseudogamous embryogenesis and the degree of parthenogenesis in Allium
tuberosum // Sexual PI. Reprod. 1992b. 5(1): 79-85.
Kojima A., Nagato J. Discovery of highly apomictic and highly amphimictic dihaploids in Allium
tuberosum // Sexual PI. Reprod. 1997.10(1): 8-12.
Koltunov A. M. Apomixis: embryo sacs and embryos formed without pollination or fertilization in
ovules // PI. Cell. 1993. 5:1425-1437.
Komulainen M., Vieno M., Yarmishko V. Т., Daletskaya T. V., Maznaya E. A. Seedling
establishment from seeds and seed banks in forests under long-term pollution stress: a potential for vegetation
recovery // Canad. J. Bot. 1994. 72(2): 143-149.
Konar R. N., Nataraja K. Experimental studies in Ranunculus sceleratus L. Development of embryos
from the stem epidermis // Phytomorphology. 1965. 15(2): 132-137.
Konar R. N., Thomas E., Street H. E. The diversity of morphogenesis in suspension cultures of
Atropa belladonna // Ann. Bot. 1972a. 36(145): 249-258.
Konar R. N., Thomas E., Street H. E. Origin and structure of embryoids arising from epidermal cells
of the stem of Ranunculus sceleratus L. // J. Cell Sci. 1972b. 11: 77-93.
Konnert M. Investigations on the genetic variation of beech (Fagus sylvatica L.) in Bavaria // Silv.
Genet. 1995. 44(5-6): 346-351.
Koornneef M. Genetic aspects of abscisic acid / / A Genetic Approach to Plant Biochemistry / Eds.
Blonstein A. D., King P. J. Vienna: Springer, 1986: 35-54.
Koornneef M., Hanhart C. J., Hilhorst H. W. M., Karssen С. М. In vitro inhibition of seed
development and reserve protein accumulation in recombinants of abscisic acid biosynthesis and responsiveness
mutants in Arabidopsis thaliana // PI. Physiol. 1989. 90(2): 463-469.
Koornneef M., Reuling G., Karssen С. М. The isolation and characterization of abscisic
acid-insensitive mutants of Arabidopsis thaliana // Physiol. Plantarum. 1984. 61(2): 377-383.
Литература
603
Korpelainen H. Patterns of phenotypic variation and sexual size dimorphism in Rumex acetosa and R.
acetosella // Bot. Helv. 1992.102(1): 109-120.
Korsmo E. Unkrauter im Ackerbau der Neuzeit. Biologische und praktische Untersuchungen. Berlin:
J. Springer, 1930:1-580.
Kozlowski Т. Т. Growth and development of trees. N.-Y. - London: Acad. Press, 1971: 1-443.
Krannitz, P. G., Maun M. A. An experimental study of floral display size and reproductive success in
Viburnum opulus: importance of grouping // Canad. J. Bot. 1991. 69(2): 394-399.
Kreitner G. L., Sorenzen E. L. Stigma development and the stigmatic cuticle of Medicago scutellata
// Canad. J. Bot. 1985. 63(4): 813-818.
Krishnamoorthy H. N., Nanda К. К. Floral bud reversion in Impatiens balsamina under
non-inductive photoperiods // Planta. 1968. 80(1): 43-51.
Krizek, B. A., Meyerowitz E. M. The Arabidopsis homeotic genes APETALA 3 and PISTILLATA
are sufficient to provide the В class organ identity function // Development. 1996a. 122:11-22.
Krizek B. A., Meyerowitz E. M. Mapping the protein regions responsible for the functional
specificities of the Arabidopsis MADS domain organ-identity proteins // Proc. Natl. Acad. Sci. USA.
1996b. 93: 4063-4070.
Kuang A. K., Musgrave M. E., Matthews S. W., Cummins D. В., Tucker S. C. Pollen and ovule
development in Arabidopsis thaliana under spaceflight conditions // Amer. J. Bot. 1995. 82(5): 585-595.
Kubicki B. The mechanismus of sex determination in flowering plants // Genetica Polonica. 1972.
13(1): 53-66.
Kugler H. Einfiihrung in die Bliitenokologie. Stuttgart: G. Fischer Verlag, 1955: 1-278.
Kugler H. Bliitenokologie. Stuttgart: G. Fischer Verlag, 1970:,1-345.
Kuhn M. Einige Bemerkungen iiber Vandellia und den Bliitendimorphismus // Bot. Zeitung. 1867.
25: 65-67.
Kuiala V. Untersuchungen iiber die Waldvegetation in Sud- und Mittelfinland // Commun. fust.
Forest. Fenn. 1928.10:141-154.
Kuijt J. The Biology of Parasitic Flowering Plants. Berkeley, Los Angeles: Univ. California Press,
1969:1-246.
Kull T. Identification of clones in Cypripedium calceolus (Orchidaceae) // Изв. АН ЭССР. Сер.
биол. 1988. 37(3): 195-199.
Kullenberg В. New observations on the pollination of Ophrys L. (Orchidaceae) // Zoon. Suppl.
1973.1: 9-14.
Kumazawa M. Developmental history of the abnormal structure in the geophilous organ of Aconitum
// Bot. Mag. Tokyo. 1937. 51(612): 914-925.
Kunin W. E. Density and reproductive success in wild populations of Diplotaxis erucoides
(Brassicaceae) // Oecologia. 1992. 91:129-133.
Kuprianova L. A. On the possibility of the development of tricolpate pollen from monosulcate //
Grana. 1979. 18(1): 1-4.
Kusano S. Experimental studies on the embryonal development in an Angiosperms //J. Col. Agr.
Tokyo Imp. Univ. 1915. 6: 7-120.
Kutty M. V. C, Kumar H. Studies on induced tetraploid in four diverse cultivars of pea (Pisum
sativum L.) // Cytologia. 1983. 48(1): 51-58.
Kylin H. Uber Begriffsbildung und Statistik in der Pflanzensoziologie // Bot. Not. 1926: 81-180.
604
Системы репродукции
Lakshmanan К. К., Ambegaokar К. В. Polyembryony // Embryology of Angiosperms / Ed. Johri
В. М. Berlin a. o.: Springer-Verlag, 1984: 448-475.
Lang J. D., Ray S., Ray A. Sinl, a mutation affecting female fertility in Arabidopsis, interacts with
modi, its recessive modifier // Genetics. 1994. 137:1101-1110.
Lau T.-C, Stephenson A. G. Effects of soil nitrogen on pollen production, pollen grain size, and
pollen performance in Cucurbita pepo (Cucurbitaceae) // Amer. J. Bot. 1993. 80(7): 763-768.
Laurie D. A., O'Donoughue L. S., Bennett M. D. Wheat x maize and other wide sexual hybrid: their
potential for genetic manipulation and crop inprovement // Gene - Manipulation in Plant Improvement.
N.-Y.: Plenum Press, 1990.11: 95-126.
Laverty T. M., Plowright R. C. Fruit and seed set in Mayapple (Podophyllum peltatum): influence of
intraspecific factors and local enhancement near Pedicularis canadensis // Canad. J. Bot. 1988.66(1): 173-178.
Law R., Cook R. E. D., Manlove R. J. The ecology of flower and bulbil production in Polygonum
viviparum // Nord. J. Bot. 1983. 3(5): 559-565.
Lazar M. D., Schaeffer G. W., Baenziger P. S. The effects of interactions of culture environment with
genotype on wheat (Triticum aestivum) anther culture response // PI. Cell Repts. 1990. 8(9): 525- 529.
Lee T. N., Snow A. A. Pollinator preferences and the persistance of crop genes in wild radish
populations (Raphanus raphanistrum) // Amer. J. Bot. 1998. 85(3): 333-339.
Leblanc O., Grimanelly D., Gonzalez-de-Leon D., Savidan Y. Detection of the apomictic mode of
reproduction in mize-Tripsacum hybrids using maize RFLP markers // Theor. Appl. Genet. 1995a.
90:1198-1203.
Leblanc O., Peel M. D., Carman J. G., Savidan Y Megasporogenesis and megagametogenesis in
several Tripsacum species (Poaceae) // Amer J. Bot. 1995b. 82 (1): 57-63.
Lee T. D. Patterns of fruit maturation: a gametophyte competition hypothesis // Amer. Naturalist.
1984.123(3): 427-432.
Lehnhardt В., Nitzsche W. Loss of apomixis in Arabis holboellii Hornem when regenerated in tissue
culture // Angew Bot. 1988. 62: 225.
Leitch A. R., Mosgoller W., SchwarzacherT., Bennett M. D., Heslop-Harrison J. S. Genomic in
situ hybridization to sectioned nuclei shows chromosome domains in grass hybrids //J. Cell Sci. 1990.
95: 335-341.
Leon-Kloosterziel K. M., Keijzer C. J., Koornneef M. A seed shape mutant of Arabidopsis that is
affected in integument development // PI. Cell. 1994. 6: 385-392.
Leppik E. Dichromena ciliata, a noteworthy entomophilous plant among Cyperaceae // Amer. J. Bot.
1955. 42: 455-458.
Les D. H. The taxonomic significance of plumule morphology in Ceratophyllum (Ceratophyllaceae)
// Syst. Bot. 1985.10(3): 338-346.
Les D. H. Genetic diversity in the monoecious hydrophyle Ceratophyllum (Ceratophyllaceae) //
Amer. J. Bot. 1991. 78(8): 1070-1082.
Levin D. A. The breeding system of Lithospermum carolinense: adaptation and counteradaption //
Amer. Naturalist. 1968.102: 42-443.
Levin D. A. Plant density, cleistogamy and self-fertilization in natural populations of Lithospermum
caroliniense // Amer. J. Bot. 1972a. 59(4): 71-77.
Levin D. A. Competition for pollinator service: a stimulus for the development of autogamy //
Evolution. 1972b. 26(4): 668-669.
Литература
605
Levin D. A., Berube D. E. Phlox and Colias: the efficiency of the pollinator system // Evolution.
1973. 26: 242-250.
Lewin В., Genes V. N.-Y: Oxford Univ. Press, 1994:1-1272.
Lewis D. The evolution of sex flowering plants // Biol. Rev. of the Cambridge Philosoph. Soc. 1942.
17(1): 46-67.
Lewis D. Incompatibility in flowering plants // Biol. Rev. 1949. 24(4): 472-496.
Lewis D. Comparative incompatibility in angiosperms and fungi // Advan. Genet., New-York. 1954.
6(3): 235-285.
Lewis D. Genetic versatility in incompatibility in plants // New Zealand J. Bot. 1979.17(4): 637-644.
Lewis D., Crowe L. K. The genetics and evolution of gynodioecy // Evolution. 1956.10(2): 115-125.
Li H., Qureshi J. A., Kartha К. К. The influence of different temperature treatments on anther culture
response of spring wheat (Triticum aestivum L.) // PI. Sci. 1988. 57(1): 55-61.
Li L. H., Dong Y. S. A self-fertile trigeneric hybrid, Triticum aestivum x Agropyron michnoi x Secale
cereale // Theor. Appl. Genet., 1993. 87: 361-368.
Lin B.-Y Structural modifications of the female gametophyte associated with the indeterminate
gametophyte (ig) mutant in maize // Canad. J. Genet. Cytol. 1978. 20(2): 249-257.
Lin B.-Y Megagametogenetic alterations associated with the indeterminate gametophyte (ig)
mutation in maize // Rev. Brasil. Biol. 1981. 41(3): 557-563.
Lin T.-P., Lee T.-J., Yang L.-F., Cung Y.-L., Yang J.-C. Comparison of the allozyme diversity in
several populations of Chamaecyparis formosensis and Chamaecyparis taiwanensis // Canad. J. Forest
Res. 1994. 24(10): 2128-2134.
Linden B. Aseptic germination of seeds of northern terrestrial orchids // Ann. Bot. Fenn. 1980.
17(2): 174-182.
Linden B. Two new methods for pretreatment of seeds of Northern orchids to improve germination in
axenic culture // Ann. Bot. Fenn. 1992. 29(4): 305-313.
Linder H. P. Key innovations and the evolution of wind pollination // Reproductive Biology / Eds.
Owens S. Т., Rudall P. J., Kew: Royal Botanic Gardens, 1998:123-135.
Linder H. P., Ferguson I. K. On the pollen morphology and phylogeny of the Restionales and Poales
// Grana. 1985. 24: 65-76.
Linder H. P., Kellogg E. A. Phylogenetic patterns in the commelinid clade // Monocotyledons: sys-
tematics and evolution / Eds. Rudall P. J. et al. Kew: Royal Botanic Gardens, 1995: 473-496.
Lindley J. An introduction to botany. London: Longman, Rees a.o., 1832:1-558.
Linhart Y. В., Feinsinger P. Plant-hummingbird interaction effect of island size and degree of special*
ization on pollination // J. Ecology. 1980. 68: 745-760.
Link A. J. The morphological development of the fruit of Pisum sativum var. Alaska //
Phytomorphology. 1961.11(1): 79-84.
Linne C. Systema Nature. Lugduni Batavorum. 1735:1-13.
Linne C. Flora Lapponica. Amstelaedami, 1737:1-372.
Linne C. Philosophia botanica. Stockholmiae: apud. Godofr. Kiesewetter, 1751:1-362.
Linne C. Flora Svecica, ed II. Stockholmiae, 1755:1-464.
Linne C. Oratio de telluris habitabilis incremento. Leiden: Lungduni Batavorum, 1774:1-104.
Linneaus C. van. Systema naturae, sive regna tria naturae systematice, proposita per classes, ordines,
geners & species. Lugdon: Batavorum, apid Theodorum Haak: J. Wilhelmi de Groot, 1735: 1-54.
Linnert G. Cytologische Grundlagen fur Sterilitatserscheinungen in der Gattung Salvia // Ziichter,
1955. 25(7/9): 237-241.
Linnert G. Kerngesteuerte Gynodiozie der Salvia nemorosa // Zeitschrift Vererbungslehre. 1958.
89(7): 36-51.
606
Системы репродукции
Lisci M., Cardinali G., Pacini E. Pollen dispersal and role of pollenkitt in Mercurialis annua L.
(Euphorbiaceae) // Йога. 1996.191: 385-391.
Lisci M., Tanda C, Pacini E. Pollination ecophysiology of Mercurialis annua L. (Euphorbiaceae), an
anemophilous species flowering all year round // Ann. Bot. 1994. 74: 125-135.
Lloyd D. G. Breeding systems in Cotula L. (Compositae, Anthemidae). 1. The array of monoclinous
and diclinous systems // New Phytol. 1972a. 71(6): 1181-1194.
Lloyd D. G. Breeding systems in Cotula L. (Compositae, Anthemidae). II. Monoecious populations
// New Phytol. 1972b. 71(6): 1195-1202.
Lloyd D. G. Parental strategies of angiosperms // New Zealand J. Bot. 1979.17(4): 595-606.
Lloyd D. G. The distributions of gender in four angiosperm species illustrating two evolutionary
pathways to dioecy // Evolution. 1980a. 34(1): 123-134.
Lloyd D. G. Sexual strategies of plants. I. An hypothesis of serial adjustment of maternal investment
during one reproductive session // New Phytol. 1980b. 86(1): 69-79.
Lloyd D. G. Sexual strategies in plants. III. A quantitative method for describing the gender of plants
// New Zeal. J. Bot. 1980c. 18(1): 103-108.
Lloyd D. G., Bawa K. S. Modification of the gender of seed plants in varying conditions // Evol.
Biol. N.-Y.: London, 1984.17: 255-338.
Lobanova L. P., Enaleeva N. Ch. Modification variability of tobacco macrogametophyte, induced by
temperature // Proc. XI Int. Symp. "Embryology and Seed Reproduction". Leningrad, 1990. SPb, 1992: 326-327.
Lobanova L. P., Enaleeva N. Ch. On temperature inducing of cytoembryological prerequisites of
apomixis and their realization possibility // Apomixis Newstlet. 1995. 8:19-20.
Loewing F. W. Phisiological sex characters in plants // Bot. Rev. 1938. 4(11): 38.
Longly B. Tetrades irregulieres, developpements apomeiotiques et aposporie dans les ovules de
Cichorium intybus L. (Chicoree de Bruxelles) // Canad. J. Bot. 1984. 62: 635-646.
Longton R. E., Schuster R. M. Reproductive biology // New manual of bryology / Ed. Schuster R.
M. Nichinan, Miyazaki: The Hattori Botanical Laboratory, 1983. 1: 386-462.
Lord E. M. Cleistogamy: a tool for the study of floral morphogenesis, function and evolution // Bot.
Rev. 1981. 47(4): 421-449.
Lorenzo E. Sobre la inflorescencia, morfologia floral у embriologia de Janusia guaranitica
(Malpigiaceae) // Kurtziana. 1981.14: 101-124.
Lotsy J. P. Evolution by means hybridization. The Hague: Martinus Nijhoff. 1916: 1-250.
Love A. Generic evolution of the wheatgrasses // Biol. Zentralbl. 1982.101(3): 199-212.
Love A. Conspectus of the Triticeae // Feddes Repert. 1984. 95(7-8): 425-521.
Lubbers E. L., Arthur L., Hanna W. W., Ozias-Akins P. Molecular markers shared by diverse
apomictic Pennisetum species // Theor. Appl. Genet. 1994. 89 (5): 636-642.
Lucke E. Samenstruktur und Samenkeimung europischer Orchideen nach Veyret sowie weitere
Untersuchungen. 1. Teil // Die Orchidee. 1981. 32(5): 182-188. 2. Teil // Die Orchidee. 1982a.
33(1): 8-16. 3. Teil // Die Orchidee. 1982b. 33(3): 108-115.
Lutts S., Ndikumana J., Louant B. P. Male and female sporogenesis and gametogenesis in apomictic
Brachiaria brizantha, Brachiaria decumbens and Fl hybrids with sexual colchicine induced tetraploid
Brachiaria ruziziensis // Euphytica. 1994. 78(1-2): 19-25.
Lyon H. L. Observation on the embryogeny of Nelumbo // Minnesota Bot. Stud. 1901. 2(5): 643-655.
Lyon H. L. The cotyledon of the angiosperms // Amer. Nat. 1905. 39:13-14.
Литература
607
Ma H. The unfolding drama of flower development: recent results from genetic and molecular analyses
// Genes Dev. 1994. 8: 745-756.
Ma H.. Yanofsky M. F., Meyerowitz E. M. AGL1-ALG6, an Arabidopsis gene family with
similarity to floral homeotic and transcription factor genes // Genes Dev. 1991. 5: 484-495.
MacArthur R. H., Wilson E. O. The theory of Island biogeography. Princeton: Princeton Univ.
Press, 1967:1-203.
Maccklintock B. Controlling elements and gene // Cold Spring Harbor Symp. Quant. Biol. 1956.21:197.
MacDaniels L. H. Anatomical basis of so-called adventitions buds in apple, N.-Y: Ithaca, 1953:1-22.
Macdonald A. D., Mothersill D. H., Caesar J. C. Shoot development in Betula papyrifera. Ill Lond
shoot organogenesis // Canad. J. Bot. 1984. 62(3): 437-445.
Madge M. Spermatogenesis and fertilization in the cleistogamous flower of Viola odorata var. praecox
hort. // Ann. Bot. 1929. 43: 545-577.
Madsen G. C. Influence of photoperiod on microsporogenesis in Cosmos sulphureus cav. var.
Klondike // Bot. Gaz. 1947.109:120-132.
Mahajan S., Raghuvanshi S. S. Effect of В chromosomes on pollen tube growth in diploid and
tetraploid Impatiens balsamina L. // Proc. Indian Nat. Sci. Acad. 1983. 49(4): 354-358.
Maheshwari J. K. Cleistogamy in angiosperms // Proc. Summer School Botany, Daryeeling, Juni
1960. New Dehli, 1962:145-155.
Maheshwari P. An Introduction to the Embryology of Angiosperms. N.-Y.: McGraw-Hill Book
Company, 1950:1-453.
Maheshwari P., Rangaswamy N. S. Polyembryony and in vitro cultures of embryos of Citrus and
Mangifera // Indian J. Hort. 1958. 15: 275-282.
Maheshwari P., Sachar R. C. Polyembryony // Recent Advances in the Embryology of
Angiosperms / Ed. Maheshwari P. Delhi: Univ. Delhi, 1963: 265-296.
Maire R. devolution nucleaire chez les Endophyllum //J. Bot. 1990a. 14: 80-97, 369-382.
Maire R. L'evolution nucleaire chez les Uredinees // Compt. Rendus Congres Intern. Botanique
Expos. Univ. Paris. 1900b(1901): 135-150.
Malecka J. Problems of the mode of reproduction in microspecies of Taraxacum section Palustria
Dahlstedt. // Acta Biol. Crac. Ser. Bot. 1973.16:37.
Manasse R. S., Howe H. F. Competition for dispersal agents among tropical trees: influence of
neighbors // Oekologia. 1983. 59(2-3): 185-190.
Mandak B. Seed heteromorphism and life cycle of plants: a literature review // Preslia, Praha. 1997.
69:129-159.aa
Mandel M. A., Bowman J. L., Kempin S. A., Ma H., Meyerowitz E. M., Yanofsky M. F.
Manipulation of flower structure in transgenic tobacco // Cell. 1992. 71:133-143.
Mansfield S. G., Briarty L. G., Erni S. Early embryogenesis in Arabidopsis thaliana. I. The mature
embryo sac // Canad. J. Bot. 1991. 69: 447-460.
Marcelis L. F. M., Baan Hofman-Eijer L. R. Effects of seed number on competition and dominance
among fruits in Caspicum annuum L. // Ann. Bot. 1997. 79(6): 687-693.
Marciniak K. Colchicine induced changes in the development of the lily embryo sac / / Bull. Soc. Sci.
et Lettres. Lodz. 1967.18(3): 1-4.
Mariani A., Tavoletti S., Veronesi F. Abnormal macrosporogenesis in five alfalfa (Medicago sativa)
mutants producing 4n pollen // Theor. Appl. Genet. 1993. 85(6-7): 873-881.
608
Системы репродукции
Marsden M. P. E., Meinke D. W. Abnormal development of the suspensor in an embryo-lethal
mutant of Arabidopsis thaliana // Amer. J. Bot. 1985. 72(11): 1801-1812.
Marshall D. L., Ellstrand N. C. Effective mate choice in wild radish: evidence for selective seed
abortion and its mechanism // Amer. Naturalist. 1988.131(5): 739-756.
Martinez E. J., Espinoza F., Quarin C. L. BIH-progeny (2n+n) from apomictic Paspalum notatum
obtained through early pollination // Heredity. 1994. 85(4): 295-297.
Martinez-Palle E., Herrero M. The ponticulus: a structure bridging pollen tube access to the ovule in
Pistacia vera // Sexual PI. Reprod. 1995. 8: 217-222.
MascarenhasJ. P. Molecular mechanisms of pollen tube growth and differentiation // PI. Cell. 1993.
5:1303-1314.
Massart J. La dissimination des plantes alpines // Bull. Soc. Roy. Bot. Belg. 1898. 37(39).
Mathews A. C. The morphological and cytological development of the sporophylls and seed of
Juniperus virginiana L. // J. Elisha Mitchell Sci. Soc. 1939. 55(1): 7-62.
Matten L. C, Lacey W. S., Edwards D. Discovery of one of the oldest gymnosperm floras containing
cupulate seeds // Phytologia. 1975. 32(4): 299-303.
Mattsson O., Knox R. В., Heslop-Harrison J., Heslop-Harrison Y. Protein pellicle of the stigmatic
papillae as a probable recognition site in incompatibility reactions // Nature. 1974. 247: 298-300.
Matzk F. A novel approach to differentiated embryos in the absence of endosperm // Sexual PI.
Reprod. 1991. 4: 88-94.
Matzk F., Meyer H.-M., Baumlein, H., Balzer H.-J. A novel approach to the analysis of the initiation
of embryo development in Gramineae // Sexual PI. Reprod. 1995. 8: 266-272.
Mayers A. M., Lord E. M. Comparative flower development in the cleistogamous species Viola
odorata. I A growth rate study // Amer. J. Bot. 1983a. 70(10): 1548-1555.
Mayers A. M., Lord E. M. Comparative flower development in the cleistogamous species Viola
odorata. II An organography study // Amer. J. Bot. 1983b. 70(10): 1556-1563.
Mazzucato A., Barcaccia G., Pezzotti M„ Falcinelli M. Biochemical and molecular markers for investigating
the mode of reproduction in the facultative apomict Poa pratensis L. // Sexual PI. Reprod. 1995 (8): 133-138.
Mazzucato A., Falcinelli M., Fabio V. Evolution and adaptedness in a facultatively apomicitic grass,
Poa pratensis L. // Euphytica. 1996. 92:13-19.
Mazzucato A, Falcinelli M., Veronesi F. Evolution and adaptedness in a facultatively apomictic grass, Poa
pratensis L. // Adaptation in Plant Breeding / Ed. Tigeratedt P. M. A. Kluwer Acad. Publ., 199?: 13-19.
McCarty D. R. The role of VP1 in regulation of seed maturation in maize // Biochem. Soc. Trans.
1992. 20(1): 89-92.
McCarty D. R. Genetic control and integration of maturation and germination pathways in seed
development // Ann. Rev. Plant Physiol. Plant Mol. Biol. 1995. 46: 71-93.
McCarty D. R., Carson C. B. The molecular genetics of seed maturation in maize // Physiol. PI.
1990. 81: 267-272.
McCarty D. R. Carson С. В., Lazar M., Simonds S. C. Transposable element-induced mutations of
the viviparous-1 gene in maize // Dev. Genet. 1989a. 10: 473-481.
McCarty D. R., Carson С. В., Stinard P. S., Robertson D. S. Molecular analysis of viviparous-1: an
abscisic acid-insensitive mutant of maize // PI. Cell. 1989b. 1(5): 523-532.
McCarty D. R., Hattori Т., Carson С. В., Vasil V., Lazar M., Vasil I. K. The Viviparous-1
developmental gene of maize encodes a novel transcriptional activator // Cell. 1991. 66: 895-905.
McComb J. A. The sex forms of species in the floral of the south-west of Western Australia //
Austral. J. Bot. 1966. 14(3): 303-316.
Литература
609
McCoy T. J., Smith L. I. Genetics, cytology, and crossing behavior of an alfalfa (Medicago sativa)
mutant resulting in failure of the postmeiotic cytokinesis // Canad. J. Genet. Cytol. 1983. 25(4): 390-397.
McKone M. J., Tonkyn D. W. Intrapopulation gender variation in common ragweed (Asteraceae:
Ambrosia artemisifolia L.) a monoecious annual herb // Oecologia. 1986. 70(1): 63-67.
McVeigh J. Regeneration in Crassula multicava // Amer. J. Bot. 1938. 25: 7-11.
McWilliam J. R., Shanker K., Knox R. B. Effects of temperature and photoperiod on growth and
reproductive development in Hyparrhenia hirta // Aust. J. Agric. Res. 1970. 21: 557-569.
Meagher T. R. Sexual dimorphism and ecological differentiation of male and female plants // Ann.
Missouri Bot. Gard. 1984. 71(1): 254-264.
Meagher T. R. Analysis of paternity within a natural population of Chamaelirium luteum. 1.
Identification of most-likely parents // Amer. Naturalist. 1986.128:199-215.
Meeuse A. D. J. Angiosperms past and present // Advances Front. PI. Sci. 1965. 11:1-228.
Meeuse A. D. J., De Meijer A. H., Mohr O. W. P., Wellinga S. M. Entomophily in the dioecious
gymnosperm Ephedra aphylla Forsk. (=E. alte C. A. Mey.), with some notes on Ephedra campylopoda C.
A. Mey. III. Further anthecological studies and relative importance of entomophily // Israel J. Bot. 1990.
39:113-123.
Mei Sun, Wong K.C., Joe S.Y. Lee. Reproductive biology and population genetic structure of Kandelia
candel (Rhizophoraceae), a viviparous mangrove species // Amer. J. Bot. 1998, 85(11): 1631-1637.
Meinke D. W. Embryo-lethal mutants of Arabidopsis thaliana: evidence for gametophytic expression
of the mutant genes // Theor. Appl. Genet. 1982. 63: 381-386.
Meinke D. W. A homoeotic mutant of Arabidopsis thaliana with leafy cotyledon // Science. 1992.
258:1647-1650.
Meinke D. W., Franzmann L. H., Nickle T. C, Yeung ,E. C. Leafy cotyledon mutants of
Arabidopsis // PI. Cell. 1994. 6(8): 1049-1064.,
Meissner P. G. A note on Ceratophyllum demersum and C. echinatum in Wercerster country,
Massachusetts // Rhodora. 1954. 56(671): 257-258.
Melampy M. N., Hayworth A. M. Seed production and pollen vectors in several nectarless plants //
Evolution. 1980. 34:1144-1154.
Menges E. S., Waller D. M., Gawler S. C. Seed set and seed predation in Pedicularis furbishiae, a
rare endemic of the St. John River, Maine // Amer. J. Bot. 1986. 73(8): 1168-1177.
Metcalfe C. R. The morphology and mode of development of the axillary tubercles and root tubers of
Ranunculus ficaria // Ann. Bot. 1938 2(5): 145-157.
Mettale N. A. Environmental induction of high freguency 2n pollen formation in diploid Solanum //
Canad. J. Genet. Cytol. 1983. 25(6): 609-615.
Meyer W. C. Dormancy and growth studies of the American lotus, Nelumbo lutea // PI. Physiol.
1930. 5(2): 225-234.
Meyerowitz E. M. Genetic control of cell division patterns in developing plants // Cell. 1997.88:299-308.
MichaelisP. Uberden Einflussder Kalte auf die Reduktionsteilung von Epilobium // Planta. 1926.
1(5): 569-582.
Midgley J. Pollen dispersal distances for a conifer canopy species in the Knysna forest / / South Afric.
J. Bot. 1989. 55: 662-663.
Mikesell J. Comparative development of viable and aborted ovules in Phytolacca americana L.
(Phytolaccaceae) // Bot. Gaz. 1988.149(2): 196-202.
Miki-Irosige H., Hoek I. H. S., Nakamura S. Secretions from the pistil of Lilium longiflorum //
Amer. J. Bot. 1987. 74:1709-1715.
610 Системы репродукции
Miller N. G., Thompson G. G. Boreal and western north American plants in the late Pleistocene of
Vermont //J. Arnold Arboretum. 1979. 60:167-218.
Mitchell R. Adaptive significance of Ipomopsis aggregate nectar production: observation and
experiment in the field // Evolution. 1993. 47(1): 25-35.
Miyake K. Some physiological observations on Nelumbo nucifera Gaertn. // Bot. Mag. Tokyo.
1898.12: 85-101,112-117.
Mizukami Y., Ma H. Ectopic expression of the floral homeotic gene AGAMOUS in transgenic
Arabidopsis plants alters floral organ identity // Cell. 1992. 71:119-131.
Mo Y., Yang H. Mitosis and amitosis of the nucleous of generative cell in pollen tubes of Zephyranthes
Candida (Lindl.) Herb. // Acta Bot. Sin. 1992. 34(7): 485-490.
Modrusan Z., Reiser L., Feldmann K. A., Fischer R. L., Haughn G. W. Homeotic transformation
of ovules into carpel-like structures in Arabidopsis // PI. Cell. 1994. 6: 333-349.
Moffett A. A. Studies on the formation of multinuclear giant pollen grains in Kniphofia //J. Genet.
1939. 25(3): 315-337.
Mogensen H. L. Ovule abortion in Quercus (Fagaceae) // Amer. J. Bot., 1975. 62(2): 160-165.
Mogensen H. L. Double fertilization in barley and cytological explanation for haploid embryo
formation, embryoless caryopses, and ovule abortion // Carlsberg Res. Commun. 1982. 47: 313-354.
Mogie M. Automixis: its distribution and status // Biol. J. Linn. Soc. 1986. 28(3): 321-329.
Mogie M. A model for the evolution and control of generative apomixis // Biol. J. Linn. Soc. 1988.
35:127-153.
Mogie M. The evolution of asexual reproducton in plants. London: Chaman & Hall, 1992:1-276.
Mogie M., Ford H. Sexual and asexuel Taraxacum species // Biol. J. Linn. Soc. 1988. 35(2): 155-168.
Mokamuro J. K.., den Boer B. G. W., Lotys-Prass C, Szeto W., Jofuku K. D. Flowers into shoot:
photo and hormonal control of a meristem identity switch in Arabidopsis // Proc. Natl. Acad. Sci. USA,
1996. 93:13831-13836.
Molau U. Relationships between flowering phenology and life history strategies in tundra plants //
Arctic and alpine research. 1993. 25(4): 391-402.
Molchova E. Zytoembryologische Untersuchungen verschiedener polyploider Formen von Capsicum
L. // Tagungsber. Dtsch. Acad. Landwirtschaftwiss. Berlin. 1970.101: 81-91.
Moldenke A. R. Niche specialisation and species diversity along a Californian transect // Oecologia.
1975. 21: 219-242.
Moller O. Die subterrane Innovation und der Wachstumszyklus einiger Erdorchideen // Die
Orchidee. 1987a. 38(1): 13-22.
Moller O. Zur Notwendigkeit einer Renaissance der Erdorchideenkunde // Die Orchidee. 1987b.
38(2): 71-76.
Moller O. Vom Samenkorn bis zur ersten echten Knolle: Das Protokormstadium von Orchis mascula
// Die Orchidee. 1987c. 38(6): 297-302.
Moller O. Die samenkeimung das Protocormstadium und der Aufwuchs der O. militaris // Die
Orchidees. 1989. 40: 29-32.
Montelongo-Escobedo H., Rowe R. Haploid induction in potato: cytological basis for the pollinator
effects // Euphytica. 1969.18(1): 116-123.
Moss G. I., Heslop-Harrison J. Photoperiod and pollen sterility in maize // Ann. Bot. 1968.32:833-846.
Mueller C. G. F., Nordheim A. A protein domain conserved between yeast MCMl and human SRF
directs ternary complex formation // EMBO J. 1991.10: 4219-4229.
Muenscher W. С Fruits and seedlings of Ceratophyllum // Amer. J. Bot. 1940. 27(4): 231-233.
Литература
611
Mujeeb-Kazi A. Apomictic progeny derived from intergeneric Hordeum-Triticum hybrids //J.
Heredity. 1981. 72: 284-285.
Mujeeb-Kazi A. Apomixis in trigeneric hybrids of Triticum aestivum x Leymus racemosus x
Thinopyrum elongatum // Cytologia. 1996. 61: 15-18.
Mulcahy D. L., Caporello D. Pollen flow within a tristylous species: Lythrum salicaria // Amer. J.
Bot. 1970. 57:1027-1030.
Muller H. The Fertilisation of Flowers. London: Thompson, 1883:1-669.
Miiller A. J., Heidecker U. Lebensfahige und letale fusca-Mutanten bei Arabidopsis thaliana //
Arabidopsis Inf. Serv. 1968. 5: 54-55.
Muller H. Alpenblumen, ihre Befruchtung durch Insecten und ihre Anpassungen an dieselben.
Leipzig: W. Engelmann, 1881: 1-611.
Muller-Stark G. Genetic variation in high elevated populations of Norway spruce (Picea abies) in
Switzerland // Silv. Genet. 1995. 44(5-6): -356-362.
Muniyamma M. Triploid embryos from endosperm in vivo // Ann. Bot. 1977. 41: 1077-1079.
Munro S. L., Linder H. P. The embryology and systematic relationships of Prionium serratum
(Juncaceae: Juncales) // Amer. J. Bot. 1997. 84: 850-860.
Munro S. L., Linder H. P. The phylogenetic position of Prionium (Juncaceae) within the order
Juncales based on morphological and rbcL sequence data // Syst. Bot. 1998. 23: 43-55.
Muntzing A., Muntzing G. Spontaneus changes in chromosome number in apomictic Potentilla
collina // Hereditas. 1943. 29: 451-460.
Murbeck S. Parthenogenetische Embryobildung in der Gattung Alchemilla // Lunds Univ. Arsskr.
1901. Afd.2. 36(7): 1-41.
Murbeck S. Uber Anomalien im Baue des Nucellus und Embryosackes bei parthenogenetischen
Arten der Gattung Alchemilla // Lunds Univ. Arsskr. 1902. Afd.2. 38(2): 1-10.
Murrey A. W. Creative bloks: cell cycles checkpoints and feedback controls // Nature. 1992. 339:
599-604.
Murray D. F. Causes of arctic plant diversity: origin and evolution / / Ecol. Stud. 1995.113: 21-32.
Musil A. F. Testing seeds for purity and origin // The yearbook of agriculture. Seeds / Ed. Stefferud
A. Washington: Unit. St. Dept. Agricult., 1961: 417-433.
Nair N. C, Kanta K. Studies in Meliaceae 4. Floral morphology and embryology of Azadirachta in-
dica A. Juss.: A reinvestigation // J. Indian Bot. Soc. 1961. 40: 382-396.
Nakagawa H. Embryo sac analysis and crossing procedure for breeding apomictic guineagrass
(Panicum maximum Jacq.) // JARQ (Jap. Trap. Agric. Res. Centre). 1990. 24 (2): 163-168.
Nakagawa H. Cytological study and breeding of some tropical grasses // Bull. Hiroshima Prefect.
Agric. Res. Centre. 1993 (58): 148.
Nakagawa H., Hanna W. W. Induced sexual tetraploids for breeding guineagrass (Panicum
maximum Jacq.) // J. Jap. Soc. Grassland Sci. 1992. 38(2): 152-159.
NakanoH. Beitrage zur Kenntnis der Variationene von Trapa in Japan // Bot.Jahr. 1913.50(40): 440.
Nambara E., Naito S., McCourt P. A mutant of Arabidopsis which is defective in seed development
and storage protein accumulation is a new abi3 allele // Plant J. 1992. 2: 435-441.
Narayanaswamy M. S. Megasporogenesis and the origin of triploid in Saccharum // Ind. J. Agr. Sci.
1940.10(4): 534-551.
Nathorst A. G. Ueber Trapa natans L., hauptsachlich mit Rucksicht auf ihr Vorkommen in Schweden
// Bot. Centralbl. 1884.18(2): 275-278.
Naumova T. Apomixis and amphimixis in angiosperms: classification // Apomixis Newslet. 1990.2: 33-38.
612
Системы репродукции
Naumova Т. N. Apomixis in Angiosperms. Nucellar and integumentary embryony. London, Tokyo,
Boca Raton: Ann. Arbor., 1992: 1-144.
Naumova T. N. Apomixis in Angiosperms: Nucellar and integumentary embryony. Boca Raton: C.
R. С Press, 1993:1-144.
Naumova T. N. Apomixis in tropical fodder crops: cytological and functional aspects // Euphytica.
1997. 96: 93-99.
Naumova T. N., Bock Th. S. M. de, Wagenvoort M. Apomixis and sexuality in Brachiaria
decumbens accessions // Apomixis Newslet. 8: 28-31.
Naumova T. N., Nijs A. P. M. den, Willemse M. Т. М. Quantitative analysis of aposporous
parthenogenesis in Poa pratensis genotypes // Acta Bot. Neerl. 1993. 42(3): 299-312.
Naumova T. N., Matzk F. Differences in the initiation of the zygotic and parthenogenetic pathway in
Salmon lines of wheat: ultrastructural studies // Sexual PI. Reprod. 1997:121-130.
Naumova T. N.. Osadtchiy J. V., Sharma V. K., Dijkhuis P., Ramulu K. S. Apomixis in plants: structural
and functional aspects of diplospory in Poa nemoralis and Poa palustris // Protoplasma. 1999. 208:186-195.
Naumova T. N., Wagenvoort M. Apomixis and sexuality in diploid and tetraploid accessions of
Brachiaria decumbens // Sexual PI. Reprod. 1999.12: 43-52.
Naumova T. N., Willemse M. Т. М. Ultrastructural characteristics of apospory in Panicum
maximum // Sexual PI. Reprod. 1995. 8:197-204.
Navarro L. Effect of pollen limitation, additional nutriens, flower position and flowering phenology on
fruit and seed production in Salvia verbenaca (Lamiaceae) // Nordic J. Bot. 1998. 18(4): 441-446.
Naveen J., Hamalata I., Gupta В. К. Vivipary in Java citronella grass // Indian Forest. 1977.
103(12): 822-823.
Naylor E. E. The morphology of regeneration in Bryophyllum calycinum // Amer. J. Bot. 1932.
19(1): 32-40.
Neiland M. R. M., Wilcock С. С Reproductive ecology of European orchids // Proc. 14th World
Orchid Conf. British Orchid Society, HMSO. Edinburgh, 1994:138-147.
Neiland M. R. M., Wilcock С. С Maximisation of reproductive success in European orchids under
conditions of infrequent pollination // Protoplasma. 1995.187(1): 39-48.
Neiland M. R. M., Wilcock С. С Fruit set, nectar reward and rarity in the Orchidaceae // Amer. J.
Bot. 1998a. 85(12): 1657-1671.
Neiland M. R. M., Wilcock С. С Effects of pollinator behaviour on pollination of nectarless orchids:
floral mimicry and interspecific hybridisation // 2nd Monocot Symposium, Sydney, 1998b.
Neill S. J., Horgan R., Parry A. D. The carotenoid and abscisic acid content of viviparous kernels and
seedlings of Zea mays L. // Planta. 1986.169(1): 87-96.
Neill S. J., Horgan R., Rees A. F. Seed development and vivipary in Zea mays L. // Planta. 1987.
171(3): 358-364.
Nelson О. Е. The waxy locus in maize. 1. Intralocus recombination frequency estimates by pollen and
by conventional analysis // Genetics. 1962. 47(6): 737-742.
Nelson O. E., Clary G. R. Genie control of semi-sterility in maize //J. Hered. 1952. 43: 205-210.
Nepi M., Pacini E. Effect of pistil age on pollen tube growth, fruit development and seed set in
Cucurbita pepo L. Under revision.
Nepi M., Pacini E. Pollination, pollen viability and pistil receptivity in Cucurbita pepo // Ann. Bot.
1993. 72: 526-536.
Nettancourt D. de. Incompatibility in Angiosperms. N.-Y.: Springer Verlag, 1977:1-230.
Литература
613
Nickrent D. L., Musselman L. J. Autogamy in the American strain of witchweed, Striga asiatica
(Scrophulariaceae) // Brittonia. 1979. 31(2): 253-256.
Nielsen C. S. Effects of photoperiod on microsporogenesis in Biloxi soybean // Bot. Gaz. 1942.
104: 99-106.
Nilsson L. A. Mimesis of bellflower (Campanula) by the red helleborine Cephalanthera rubra //
Nature. 1983. 305: 799-800.
Nishimura G. Comparative morphology of cotyledonous orchid seedlings // Lindleyana. 1991.
6(3): 140-146.
Nishiyama I., Yabuno T. Causal relationships between the polar nuclei in double fertilisation and
interspecific cross-incompatibility in Avena // Cytologia. 1978. 43: 453-466.
Nogler G. A. Gametophytic apomixis // Embryology of Angiosperms / Ed. Johri В. М. Berlin:
Springer-Verlag, 1984: 476-518.
Nogler G. A. Cytogenetics of parthenogenesis - first results on Ranunculus auricomus // Apomixis
Newslet. 1989.1: 44-47.
Nogler G. A. Genetics of gametophytic apomixis - a historical sketch // Polish Bot. Stud. 1994.8:5-11.
Nogler G. A. Genetics of apomixis in Ranunculus auricomis. VI Epilogue // Botanica Helvetica.
1995.105:111-115.
Noirot M. Allelic ratios and sterility in the agamic complex of the Maximae (Panicoideae):
evolutionary role of the residual sexuality // J. Evol. Biol. 1993. 6: 91-101.
Nordberg G. Embryological studies in the Sanguisorba minor complex (Rosaceae) // Bot. Not.
1967.120:109-119.
Noren С. О. Zur Kenntnis der Entwicklung von Saxegotheca conspicna Lindl. // Svensk Bot.
Tidskr. 2:101-122.
Norrmann G. A., Bovo O. A., Quarin C. L. Post-zygotic seed abortion in sexual diploid X apomictic
tetraploid intraspecific Paspalum crosses // Aust. J. Bot. 1994. 42(4): 449-456.
Norrmann G. A., Quarin C. L., Burson B. L. Cytogenetics and reproductive behavior of different
chromosome races in six Paspalum species // J. Heredity. 1989. 80: 24-28.
Novosyelova L. V. The peculiarities of florescence and pollination of the annual species of Medicago
L. // Abstr. XV Int. Congr. on Sexual PI. Reprod., Wageningen, 1998: 97.
Nygren A. The genesis of some Scandinavian species of Calamagrostis // Hereditas. 1946.32:131-262.
Nygren A. Apomixis in Angiosperms // Bot. Rev. 1954. 20(10): 577-649.
O'Donnel M. E., Bawa K. S. Gamete selection and patterns of ovule and seed abortion // Curr. Sci.
(India). 1993. 65(3): 214-219.
Odum E. P. Fundamentals of ecology. Philadelphia: W. B. Saunders Co, 1971: 1-547.
Ogburia M. N., Adachi T. Histological analysis of embryo sac formation and detection of meiotic
diplospory in cassava (Manihot esculenta Crantz) // Euhytica. 1996. 88 (1): 9-16.
Ohad N., Margossian L., Hsu Y.-C, Williams C, Repetti P., Fischer R. L. A mutation that allows
endosperm development without fertilization // Proc. Natl. Acad. Sci. USA, 1996. 5: 5319-5324.
Ohga J. On the longevity of fruits of Nelumbo nucifera // Bot. Mag. Tokyo. 1923. 37(439): 87-95.
Ohga J. On the structure of some ancient but still viable fruits of Indian lotus, with special reference to
their prolonged dormancy // Jap. J. Bot. 1927. 3:1-20.
Ohtaki S., Joshido T. Illustrated Japanese Water Plants. Tokyo: Hokuryo-kan, 1980: 1-132.
Ormrod D. P., Woolley C. I., Eaton G. W., Stobbe E. H. Effect of temperature on embryo sac
development in Phaseolus vulgaris // Canad. J. Bot. 1967. 45(6): 948-950.
614
Системы репродукции
Ornduff R. The origin of dioecism from heterostyly in Nymphoides (Menyanthaceae) // Evolution.
1966. 20:309-314.
Ornduff R. Reproductive biology in relation to systematics // Taxon. 1969.18(2): 121-133.
Ornduff R. Incompatibility and the pollen economy of Jepsonia parryi // Amer. J. Bot. 1970. 57(9):
1036-1041.
Ortega-Olivencia A., Devesa J. A. Seed set and germination in some wild species of Vicia from SW
Europe (Spain) // Nord. J. Bot. 1997.17(6): 639-648.
Osadchiy J. V., Naumova T. N. Diplospory in Poa nemoralis and P. palustris: ultrastructural aspects
// Apomixis Newslet. 1996. 9: 6-9.
Ossenbeck C. Kritische und experimentelle Untersuchungen an Bryophyllum // Flora. 1927. 122:
342-387.
Ottaviano E., Mulcahy D. L. Genetics of angiosperm pollen // Advan. Genet. 1989. 26: 1-64.
Owen R. On parthenogenesis or the successive production of procreating individuals from a single
ovum. London. 1849.
Owens S. J., Prychid C, Cox A. V. Structure and development of the stigma, style and ovary of Caesalpinia
pulcherrima (L.) Sw., post-anthesis, pre- and post-pollination // Bot. J. Linn. Soc. 1995.118: 275-288.
The Oxford English Dictionary. Oxford: Clarendon Press, 1989.12:1-695.
Ozias-Akins P., Lubbers E. L., Arthur L., Hanna W. W. Molecular markers for apomixis in
Pennisetum // Apomixis: Exploiting hybrid vigor in rice / Ed. Krush. Manila, IRRI, 1994: 51-53.
Ozias-Akins P., Lubbers E. L., Arthur L., Hanna W. W., Witcombe J. R. Molecular markers
linked with apomixis: evolutionary and breeding implications // Proc. of an ODA Plant Sciences
Research Programme Conference, 1993. "Use of Molecular Markers in Sorghum and Pearl millet breeding
for developing countries." Norwich, UK, 1994: 90-95
Ozias-Akins P., Roche D., Hanna W. W. Tight clustering and hemizygosity of apomixis-linked
molecular markers in Pennisetum squamulatum implies genetic control of apospory by a divergent locus that
may have no allelic form in sexual genotypes // Proc. Natl. Acad. Sci. USA. 1998. 95.
Pacini E. Harmomegathic characters of Pteridophyta spores and Spermatophyta pollen // PL Syst.
Evol. [SuppL]. 1990. 5: 53-69.
Pacini E. Transport mechanisms of pollen - a short review // Sexual PL Reprod. / Eds. Cresti M.,
Tiezzi A. Berlin a. o.: Springer Verlag, 1992: 69-79.
Pacini E., Franchi G. G. Fasi fiorali e germinazione extrastigmatica del polline di Arum italicum Mill.
// Giom. Bot. Ital. 1981.115: 364.
Pacini E., Franchi G. G. Reproduction in Mediterranean plants // Webbia. 1984. 38: 93-103.
Pacini E., Franchi G. G. Pollen dispersal unit, gynoecium and pollination // Reprod. Biol. / Eds.
Owens S. J., Rudall P. J. Kew, 1997:183-195.
Pacini E., Franchi G. G., Lisci M., Nepi M. Pollen viability related to type of pollination in six
angiosperm species // Ann. Bot. 1997. 80: 83-87.
Pailleux A., Bois D. Les plantes aquatiques alimentaires. Paris, au siege de la societe. 1888:1-31.
Paiva R., Kriz A. L. Effect of abscisic acid on embryo-specific gene expression during normal and
precocious germintion in normal and viviparous maize (Zea mays) embryos // Planta. 1994.192: 332-339.
Pajak M. Antipodal egg and apogamety in Rudbeckia L. // Apomixis Newslet. 1998.10:12.
Palser B. F., Rouse J. L., Williams E. G. Aberrant ovules and megagametophytes in Rhododendron
nuttalii (Ericaceae) // Bot. Gaz. 1990.151(1): 73-87.
Pande G. K.., Pakrash M. A., Hassam M. A. Floral biology of barley (Hordeum vulgare L.) //
Indian. J. Agr. Sci. 1972. 48: 697-703.
Литература
615
Pare J. Embryogenesis of Striga hermonthica (Del.) Benth. (Scrophulariaceae), action of herbicides
and other factors: an overview // Эмбриология цветковых растений. Терминология и концепции /
Ред. Батыгина Т. Б. СПб.: Мир и семья-95,1997. 2: 575-578.
Parcy F., Valon С, Kohara A., Misera S., Giraudat J. The abscisic acid-insensitives3, fusca3, and
leaf cotyledonl loci act in concert to control multiple aspects of Arabidopsis seed developmet // PL Cell.
1997. 9(8): 1265-1277.
Parrott W. A., Smith R. R. Production of 2n pollen in red clover // Crop. Sci. 1984. 24(3): 469-472.
Parsons P. A. Evolution of sex in flowering plants of south Australia // Nature. 1958. 181(4624):
1673-1674.
Patil B. D., Hardas M. W., Joshi A. B. Auto-alloploid nature of Pennisetum squamulatum Fresen.
// Nature. 1961.189: 419-420.
Patterson E. B. Translocations as genetic markers // The Maize Handbook / Eds. Freeling M.,
Walbot V. N.-Y.: Springer, 1994. 361-363.
Pauw de M. A., Remphrey W. R. In vitro germination of three Cypripedium species in relation to time
of seed collection, media, and cold treatment // Canad. J. Bot. 1992. 71: 879-885.
Paz-Ares J. Ghosal D., Wienand U., Peterson P. A., Saedler H. The regulatory locus cl of Zea
mays encodes a protein with homology to myb proto-oncogene products and with structural similarities to
transcriptional activators // EMBO J. 1987. 6: 3553-3558.
Pearl R. Variation in the number of seeds of the lotus // Amer. Nat. 40: 757-768.
Peart M, H. The effects of morphology, orientation and position of grass diaspores on seedling survival
// J. Ecol. 1984. 72(2): 437-453.
Pedrola-Monfort J., Caujape-Castells J. Genetic structure and spatial distribution of a narrow endemic
plant: Androcymbium europaeum (Colchicaceae) // Bot. Macaronesica. 1995. 21: 85-94.
Peel M. D., Carman J. G., Zhi Wu Liu, Wang R.-C. Meiotic anomalies in hybrids between wheat
and apomictic Elymus rectisetus (nees in Lehm.) A. Love & Connor // Crop. Sci. 1997. 37:717-723.
Peisl P. Ubersichtarticle. Die Signalfunktionen von Bluten // Bot. helv. 1997.107(1): 3-28.
Pellegrini L., Tan S., Richmond T. J. Structure of serum response factor core bound to DNA //
Nature. 1995. 376: 490-498.
Pellmyr O. The pollination ecology of two nectarless Cimicifuga spp. (Ranunculaceae) in North
America // Nord. J. Bot. 1986. 6: 713-723.
Peloquin S. J., Ortiz R., Gabert A. C. Nature of «pollinator effect» in potato haploid production //
Abstr. Inter. Conf. "Harnessing apomixis. A new frontier in plant science." Texas, USA, 1995: 68.
Petanidou Т., Vokou D. Pollination and pollen energetics in Mediterranean ecosystems // Amer. J.
Bot. 1990. 77: 986-992.
Petersen P. M. Variation of the population structure of Polygonum viviparum L. In relation to certain
environmental conditions // Meddr. Gronland Biosci. 1981. 4:1-19.
Pfahler P. L., Pereira M. J., Barnet R. D. Genetic and environmental variation in anther, pollen and
pistil dimensions in sesame // Sexual PI. Reprod. 1996. 9(4): 228-252.
Pfeifer T. W., Bingham E. T. Abnormal meiosis in alfalfa, Medicago sativa: cytology of 2n egg and
4n pollen formation // Canad. J. Genet. Cytol. 1983. 25(2): 107-112.
Pfeiffer H. H. Das abnorme Dickenwachstum // Handb. Pflanzenanatomie von K. Linsbauer. Abt.
2. Berlin: Borntraeger, 1926. 2(9): 1-272.
Philbrick С. Т., Anderson G. J. Implications of pollen/ovule ratios and pollen size for the reproductive
biology of Potamogeton and autogamy in aquatic angiosperms // Syst. Bot. 1987.12(1): 98-105.
616
Системы репродукции
Pianka E. R. On r- and K-selection // Amer. Naturalist. 1970.104(940): 592-597.
Pianka E. R. Evolutionary ecology. N.-Y.: Harper and Row. 1974: 1-356.
Pignone D. Non-reductional meiosis in a Triticum turgidum x Aegilops longissima hybrid and in
backcrosses of its amphidiploid with T. turgidum (Poaceae) // PI. Sys. Evol. 1993.187: 127-134.
Pijl L. van der Principles of dispersal in higher plants. Berlin a.o.: Springer-Verlag, 1969: 1-154.
Pijl L. van der. Principles of dispersal in highter plants, 2d ed., Berlin, N.-Y.: Springer-Verlag, 1972.
Pijl L. van der. Principles of dispersial in higher plants. Berlin a.o.: Springer, 1982: 1-215.
Pimienta E., Polito V. S. Ovule abortion in «Nonpareil» almond (Prunus dulcis [Mill.] D.
A.Webb) // Amer. J. Bot. 1982. 69(6): 913-920.
Piorecki J. Kotewkaorzech wodny (Trapa L.) wPolsce // Biblioteka Przemyska. Przemysl. 1980.13:1-159.
Plack A. Sexual dimorphism in Labiatae // Nature. 1957.180(4596): 1218-1219.
Plant Reproductive Biology, patterns and strategies / Eds. Lovett Doust J., Lovett Doust L. Oxford:
Univ. Press, 1988: 1-344.
Pleasants J. M., Zimmerman M. The effect of inflorescence size on pollinator visitation of Delphinium
nelsonii and Aconitum columbianum // Collect. Bot. 1990. 19: 21-39.
Pohl F. Beziehungen zwischen Pollenbeschaffenheit, Bestaubungsart und Fruchtknotenbau //
Beihefte Botan. Centralblatt. 1929a. 66: 247-285.
Pohl F. Kittstoffreste auf der Pollenoberflache windbliitiger Pflanzen // Beihefte Botan. Centralblatt.
1929b. 66: 286-305.
Pollination Biology / Ed. Real L. Orlando: Academic Press, Inc., 1983:1-338.
Polunin N. Circumpolar Arctic Flora. Oxford: Clarendon Press, 1959: 1-514.
Ponoy В., Hong Y.-P., Woods J., Jaquish В., Carlson J. E. Chloroplast DNA diversity of
Douglas-fir in British Columbia // Canad. J. Forest Res. 1994. 24(9): 1824-1834.
Posluszny U., Charlton W. A. Evolution of the helobial flower // Aquatic Bot. 1993. 44: 303-324.
Powers L. Fertilization without reduction in guayule (Parthenium argentatum Gray) and a hypothesis
as to evolution of apomixis and polyploidy // Genetics. 1945. 30: 323-346.
Praeger R. L. Dispersal and distribution // J. Ecol. 1923.11:114-123.
Prati D. Trade-off between vegetative and sexual reproduction in the clonal plant Ranunculus reptans
// 6th Congr. Eur. Soc. Evol. Biol. Arnhem, 1997. Without page numbers.
Preston R. E. Pollen-ovule ratios in the Cruciferae // Amer. J. Bot. 1986. 73(12): 1732-1740.
Pridgeon A. M. Multicellular trichomes in tribe Diurideae (Orchidaceae): systematic and biological
significance // Kew Bull. 1994. 49: 569-579.
Priestley J. H., Swingle C. F. Vegetative propagation from the standpoint of plant anatomy //U.S.
Dept. Agr. Tech. Bui. 1929.151: 34-56.
Primack R. B. Regulation of seed yield in Plantago // J. Ecol. 1978. 66(3): 835-847.
Proctor M. Insect pollination syndromes in an evolutionry context // The pollination of flowers by
insects / Ed. Richards A. J. London: Academic Press, 1978: 105-116.
Proctor M., Yeo P. The pollination of flowers. London: Collins, 1973:1-418.
Proctor M., Yeo P., Lack A. The natural history of pollination // The New Naturalist, London:
Harper Collins, 1996:1-479.
Руке G. H. What does it cost a plant to produce floral nectar? // Nature. 1991. 350: 88-89.
Quarin C. L. Seasonal changes in the incidence of apomixis of diploid, triploid, and tetraploid plant of
Paspalum cromyorrhizon // Euphytica. 1986. 35: 512-522.
Литература 617
Radosevich S. P., Holt J. S. Weed Ecology: Implications for Vegetation Management. N.-Y: A.
Wiley Intersci. Publ., 1984: 1-265.
Raghavan V. Experimental embryogenesis in vascular plants. London a.o.: Acad. Press, 1976:1—603.
Raghuvanshi S. S., Joshi Sh. Artificial induction of pollen variability in Anethum and Pimpinella //
Naturwiss. 1965. 52(13): 397-398.
Rai J. P., Tripathi R. S. Population regulation in Galinsoga ciliata and G. parviflora // Weed Res.
1983. 23(3): 151-163.
Rai J. P., Tripathi R. S. Effects of established populations of two annual weeds on their newly emerged
seedling cohort // Proc. Indian Acad. Sci. 1985.15(2): 79-86.
Raimann R. Hydrocaryaceae // Die naturlichen Pflanzenfamilien / Eds Engler A., Prantl K.
Leipzig, 1898. 3(7): 223-226.
Ram M. Floral morphology and embryology of Trapa bispinosa with a discussion on the systematic
position of the genus // Phytomorphology. 1956. 6(3-4): 312-323.
Ramsay R. R., Dixon K. W., Sivasithamparam K. Patterns of infection and endophytes associated
with West Australian orchids // Lindleyana. 1986.1(4): 203-214.
Randall T. E., Rick С M. A cytogenetic study of polyembryony in Asparagus officinalis L. // Amer.
J. Bot. 1945. 9: 560-569.
Randolph L. F., Fischer H. E. The occurrence of parthenogenetic diploids in tetraploid maize //
Proc. Natl. Acad. Sci. USA, 1939. 25:161-164.
Rao A. N. Flower and seed development in Arundina graminifolia // Phytomorphology. 1967.17:291-300.
Rapp K. About the sex ratio and sex differentiation in cloud-berry (Rubus chamaemorus L.) // Jord
ogMyr. 1987. 11(1): 1-11.
Raquin С Induction of haploid plants by in vitro culture of Petunia ovaries pollinated with irradiated
pollen // Z. Pflanzenzucht. 1985. 94:166-169.
Rashid A. Pollen dimorphism in relation to pollen plant formation // Physiol. Plant. 1983.58(4): 544-548.
Rathcke B. Flowering phenologies in a shrub community; competition and constraints // J. Ecology.
1988. 76: 975-994.
Rauh W. Die Bildung von Hypocotyl und Wurzelsprossen und ihre Bedeutung fur die Wuchsformen
der Pflanzen // Nova Acta Leop. 1937. 4(24): 395-553.
Raunkiaer C. Types biologiques pour la geographie botanique // Dan. vid. selsk. forhandl. 1905. 5:
345-347.
Raunkiaer C. The life forms of plants and statistical plant geography. Oxford: Oxford Univ. Press,
1934:1-632.
Raven P. H., Evert P. F., Eichhorn S. E. Biology of Plants. N.-Y: Worth Publ. Inc., 1987:1-775.
Ray A., Lang J. D., Golden Т., Ray S. SHORT INTEGUMENT (SIN1), a gene required for
ovule development in Arabidopsis, also controls flowering time // Development. 1996.122: 2631-2638.
Ray A., Robinson - Beers K., Ray S., Baker S. C, Lang J. D„ PreussD., Milligan S. B.,GasserC.
S. Arabidopsis floral homeotic gene BELL (BELl) controls ovule development through negative
regulation of AGAMOUS gene (AG) // Proc. Natl. Acad. Sci. USA. 1994. 91: 5761-5765.
Ray S., Golden Т., Ray A. Maternal effects of the short integument mutation on embryo development
in Arabidopsis // Dev. Biol. 1996.180: 365-369.
Read J. C. Bashaw E. C. Cytotaxonomic relationships and the role of apomixis in speciation in
Buffelgrass and Birdwoodgrass // Crop Sci. 1969. 6: 805-806.
618
Системы репродукции
Reader R. J. Competitive relationships of some bog ericads for major insect pollinators // Canad. J.
Bot. 1975. 53(13): 1300-1305.
Reddy P. S. Evolution of apomictic mechanisms in Gramineae - a concept // Phytomorphology.
1977. 27: 45-50.
Redei G. P. Non-mendelian megagametogenesis in Arabidopsis // Genetics. 1965. 51: 857-872.
Reekie E. G., Bazzaz F. A. Reproductive effort in plants. 2. Does carbon reflect the allocation of other
resources? // Amer. Naturalist. 1987. 129(6): 897-906.
Reeves L. M., Reeves T. Life history and reproduction of Malaxis paludosa in Minnesota // Amer.
Orchid. Soc. Bull. 1984. 53:1280-1291.
Reeves P. A., Olmstead R. G. Evolution of novel morphological and reproductive traits in a clade
containing Antirrhinum majus (Scrophulariaceae) // Amer. J. Bot. 1998. 85:1047-1056.
Regal P. J. Pollination by wind and animals: ecology of geographical patterns // Ann. Rev. Ecol.
Syst. 1982.13: 497-524.
Reinert J. Untersuchungen iiberdie Morphogenese an Gewebekulturen // Ber. Deutsch. Bot. Ges.
1958. 71(1): 15.
Reiser L., Fischer R. L. The ovule and the embryo sac // PI. Cell. 1993. 5:1291-1301.
Reiser L., Modrusan Z., L. M., Samach A., Ohad N.. Haughn G. W., Fischer R. L. The BELLI
gene encodes a homeodomain protein involved in pattern formation in the Arabidopsis ovule primordium
// Cell. 1995. 83: 735-742.
RennerO. ZurTerminologiedespflanzlichenGenerationswechsels // Biol. Zbl. 1916. 36: 337-374.
Sakai A. K.., Weller S. G., Chen Mei-Ling, Chou Shian-Yean, Tasanont Chrichan. Evolution of
gynodioResende F. Variabilidade feno-e genotipicamente determinada na fisiologia do desenvolvimento
dos pseudo-bolbilhos (Bryophyllum) // Bol. Soc Port. Ci. Nat. 1954. 20(1): 78.
Rhoades M. M. The cytoplasmic inheritance of male sterility in Zea mays //J. Genet. 1933.27:71-93.
Rhoades M. M. Unusual events in seed development // USDA Year Book, 1961: 75-79.
Rhoades M. M., Dempsey E. Induction of chromosome doubling at meiosis by the elongate gene in
maize // Genetics. 1966. 54(2): 505-522.
Ricardo M. J., Alvarez M. R. Ultrastructural changes associated with utilization of metabolite reserves
and trichome differentiation in the protocorm of Vanda // Amer. J. Bot. 1971. 58(3): 229—238.
Richards A. J. Eutriploid facultative agamospermy in Taraxacum // New Phytol. 1970. 69: 761-774.
Richards A. J. The origin of Taraxacum agamospecies // Biol. J. Linnean Soc. 1973. 66: 189-211.
Richards A. J. Plant Breeding Systems. London: George Allen and Unwin, 1986:1-529.
Riechmann J. L., Krizek B. A., Meyerowitz E. M. Dimerization specificity of Arabidopsis MADS
domain homeotic proteins APETALA1, APETALA3, PISTILLATA, and AGAMOUS // Proc.
Natl. Acad. Sci. USA. 1996. 93: 4793-4798.
Riechmann J. L., Meyerowitz E. M. Determination of floral organ identity by Arabidopsis MADS
domain homeotic proteins API, AP3, PI, and AG is independent of their DNA-binding specificity //
Molec. Biol. Cell. 1997. 8:1243-1259.
Riechmann J.-L., Krizek B. A., Meyerowitz E. M. Dimerization specificity of Arabidopsis MADS
domain homeotic proteins APETALA1, APETALA 3, PISTILLATA and AGAMOUS // Proc.
Natl. Acad. Sci. USA. 1996. 93: 4793-4798.
Riechmann J.-L., Wang M., Meyerowitz E. M. DNA-binding properties of Arabidopsis MADS
domain homeotic proteins APETALA 1, APETALA 3, PISTILLATA, and AGAMOUS // Nucl.
Acids Res. 1996. 24: 3134-3141.
Литература
619
Rieger R., Michaelis A., Green M. M. Glossary of Genetics. Classical and Molecular. New Delhi
a.o.: Narosa Publ. House, 1993:1-551.
Riether W. Keimverhalten terrestrischer Orchideen gemaBigter Klimate // Die Orchidee. 1990.
41(3): 100-109.
Rim Y. W., Beuselinck P. R. Cytology of 2N pollen formation and pollen morphology in diploid
Lotus tenuis (Fabaceae) // Amer. J. Bot. 1996. 83(8): 1057-1062.
Robacker D. C, Meeuse B. J. D., Erikson E. H. Floral aroma. How far will plants go to attract
pollinators? // BioSci. 1988. 38(6): 390-398.
Robbins L., Travis J. Examining the relationship between functional gender and gender specialization
in hermaphroditis plants //Amer. Naturalist. 1986. 128(3): 409-415.
Robertson C. The structure of flowers and the mode of pollination of the primitive angiosperms // Bot.
Gaz. 1904. 37(14): 294 -298.
Robertson D. S. The genetics of vivipary in maize // Genetics. 1955. 40: 705-760.
Robichaud C. S., Sussex I. M. The response of viviparous-1 and wildtype embryos of Zea mays to
culture in the presence of abscisic acid // J. PI. Physiol. 1986.126: 235-242.
Robichaud C. S., Wong J., Sussex I. M. Control of in vitro growth of viviparous embryo mutants of
maize by abscisic acid // Dev. Genet. 1980.1: 325-330.
Robinson-Beers K., Pruit R. E., Gasser C. S. Ovule development in wild-type Arabidopsis and two
female sterile mutants // PI. Cell. 1992. 4:1237-1249.
Robyns W. Over viviparie en biotecnose bij planten // Meded. Kon. Vlaamse. Acad. Wetensch.
Lett. Schone Kusten Belgie. 1971. 33: 3-14.
Rock C. D., Quatrano R. S. The role of hormones during seed development // Plant Hormones /
Ed. Davies P. J. Dordrecht, The Nethrlands: Kluwer Academic Publ., 1995: 671-697.
Rodasevich S. R., Holt J. S. Weed Ecology. N.-Y: A.Wiley Intersci. Publ., 1984:1-265.
Roff D. A. The evolution of dimorphic traits: Predicting the genetic correlation between environments
// Genetics. 1994.136: 395-401.
Roff D. A., Stirling G., Fairbairn D. J. The evolution of threshold traits: A quantitative genetic
analysis of the physiological and life-history correlates of wing dimorphism in the sand cricket // Evolution.
1997. 51:1910-1919.
Romberger J. A. Meristems, growth, and development in woody plants // Tech. Bull. 1963.
(1293): 1-214.
Roos E. E. Precepts of successful seeds storage // Physiology of seed deterioration. Spec. Pub.11 /
Eds. Donald M. B. et al. Wisconsin, USA: Crop Science Society of America, 1986: 1-25.
Ross M. D. Evolution of dioecy from gynodioecy // Evolution. 1970. 24(4): 827-828.
Ross M. S., La Roi G. H. Above ground biomass allocation by four understorey vascular plant species
in central Alberta jack pine, Pinus banksiana, forests // Canad. Field Naturalist. 1990. 104: 394-402.
Roth J. Fruits of Angiosperms // Encyclopedia of Plant Anatomy / Eds. Zimmerman W. et al.
Berlin, Stuttgart: Gebriider Borntraeger, 1977: 1-675.
Rounsley S. D., Ditta G. S., Yanofsky M. F. Diverse roles for MADS box genes in Arabidopsis
development // PI. Cell. 1995. 7:1259-1269.
Rousi A., Huttunen H., Hyrkas-Lyytikainen K. Chromosome and reproductive behavior of Finnish
Taraxacum agamospecies // Nord. J. Bot. 1985. 5(2): 127-141.
Roy B. A. The breeding systems of six species of Arabis (Brassicaceae) // Amer. J. Bot. 1995.82:869-877.
620
Системы репродукции
Rusch G. The role of regeneration by seed in the dynamics of limestone grassland communities //
Acta Univ. Uppsaliensis. Uppsala. 1993. (427): 1-21.
Rutishauser A. Fortpflanzungsmodus und Meiose apomiktischer Bliitenpflanzen. //
Protoplasmatologia. Handbuch der Protopiasmaforschung. Wien - N.-Y.: Springer Verlag, 1967. 6:1-245.
Rutishauser A. Embryologie und Fortpflanzungsbiologie der Angiospermen. Berlin a.o.:
Springer-Verlag, 1969:104-121.
Rutishauser R., Ronse Decraene L. P., Smets E., Mendonza-Heuer I. Theligonum cynocrambe:
developmental morphology of a peculiar rubiaceous herb // PI. Syst. Evol. 1998. 210:1-24.
Sachar R. The embryology of Argemone mexicana L. - A reinvestigation // Phytomorphology. 1955.
5: 200-218.
Sagar G. R., Harper J. L. Controlled interference with natural populations of Plantago lanceolata, P.
major and P. media // Weed Res. 1961.1: 163-176.
Saini H. S., Sedgley M., Aspinall D. Effect of heat stress during floral development on pollen tube growth
and ovary anatomy in wheat (Triticum aestivum L.) // Austral. J. Plant Physiol. 1983.10(2): 137-144.
Sakai A. K. Sex ratio of red maple (Acer rubrum) populations in northern lower Michigan // Amer.
J. Bot. 1989. 76(6)[suppl.]: 122.
Sakai A. K.., Weller S. G. Ecological aspects of sex expression in subdioecious Schiedea globosa
(Caryophyllaceae) // Amer. J. Bot. 1991. 78(9): 1280-1288.
Sakai A. K.., Weller S. G., Chen Mei-Ling, Chou Shain-Yean, Tasanont Chrichan. Evolution of
gynodioecy and maitenance of females: the role of inbreeding depression, outerossing rates and resourse
allocation in Schiedea adamantis (Caryophyllaceae) // Evolution. 1997. 51(3): 724-736.
Sakai H., Medrano L. J., Meyerowitz E. M. Role of SUPERMAN in maintaining Arabidopsis
floral whorl boundaries // Nature. 1995. 378:199-203.
Sakamura Т., Stow I. Uber die experimentell veranlasste Entstehung von keimfahigen Pollenkornern
mit abweichenden Chromosomenzahlen // Jap. J. Bot. 1926. 3(2): 111-137.
Salisbury E. Exceptional fruitfulness and its biological significance // Proc. Roy. Soc. L. Biol. Sci.
1976. B193(1113): 455-460.
Salisbury E. J. The reproductive capacity of plant. Studies in quantitative biology (XI). London: Gr.
Bell, 1942:1-244.
Salvesen Per H. Festuca vivipara in Southern Norway, infraspecific differentiation and systematic
affinities // Univ. Ups., Symb. Bot. Ups. 1986. 27(2): 155-167.
Samson D. A., Weerk K. S. Size-dependent effects in the analysis of reproductive effort in plants //
Amer. Naturalist. 1986.127(5): 667-680.
San Noeum L. H. Haploides d'Hordeum vulgare L. par culture in vitro d'ovaires non fecondes //
Ann. Amelior Plant. 1976. 26: 751-754.
Saran S., De Wet J. M. J. Environmental control of reproduction in Dichanthium intermedium //J.
Cytol. Genet. 1976.11: 22-28.
Sarigorla M., Ferrario S., Villa M., Pe M. E. GaMS-1: A gametophytic male sterile mutant in maize
// Sexual PI. Reprod. 1996. 9(4): 216-220.
Satina S. Periclinal chimeras in Datura in relation to the development and structure of the ovule //
Amer. J. Bot. 1945. 32: 72-81.
Satina S., Blakeslee A. F. Cytological effects of a gene in Datura which causes dyad formation in
sporogenesis // Bot. Gaz. 1935. 96(6): 531-532.
Satina S., Blakeslee A. F. Periclinal chimeras in Datura stramonium in relation to development of leaf
and flower // Amer. J. Bot. 1941. 28: 862-871.
Литература
621
Satoshi Y. Identification of ploid level by pollen characters in Primula sieboldii E. Morren // Japan. J.
Breed. 1980. 30(4): 393-400.
Savage J. M. The concept of ecological niche, with reference to the theory of natural coexistence //
Evolution. 1958.12(1): 111-112.
Savidan I. L'apomixie gametophytique chez les craminces et son utilization en ameloration des plantes
// Ann. amelior. plant. 1978. 28(1): 1-9.
Savidan Y. Genetics and utilization of apomixis for the improvement of Guineagrass (Panicum
maximum Jacq.) // Proc XIV Int. Grassl. Congr., Lexington, KY, 1981: 182-184.
Savidan Y. Embryological analysis of facultative apomixis in Panicum maximum Jacq. // Crop Sci.
1982a. 22: 467-469.
Savidan Y. H. Nature et heredite de l'apomixie chez Panicum maximum Jacq. // Travaux et
documents d L'ORSTOM. 1982b. 153: 3-159.
Savidan Y. Apomixis and its use in plant breeding. The genetic control of apomixis // Apomixis
Newslet. 1990. 2: 24-26.
Savidan Y Apomixis and agamic complexes: from theory to practice (Fr) // Species Complexes,
Gene Flows and Plant Genetic Resources, Proc. Int. Coll., Paris: Bureau des Ressources Genetiques
Publ., 1992a: 291-300.
Savidan Y. Progress in research on apomixis and its transfer to major grain crops // Reproductive
biology and Plant Breeding. Berlin: Springer-Verlag, 1992b: 269-279.
Savidan Y, Berthaud J. Maize x Tripsacum hybridization and the potential for apomixis transfer for
maize improvement // Biotechn. Agricult. Foresty. 1994. 25: 69-83.
Savidan Y., Leblank O., Berthaud J. Transferring apomixis to maize // Exploiting hybrid vigor in
rice. IRRI Manila. 1994: 23-29.
Savidge В., Rounsley S. D., Yanofsky M. Temporal relationship between the transcription of two
Arabidopsis MADS box genes and the floral organ identity genes // PI. Cell. 1995. 7: 721-733.
Scariot A. O., Lleras E. Reproductive biology of the palm Acrocomia aculeata in Central Brazil //
Biotropica. 1991. 23:12-22.
Schaal B. A. Life-history variation, natural selection, and maternal effects in plant population //
Perspectives on plant population ecology / Eds. Dirzo R., Sarukhan J. Sunderland: Sinauer Ass. Inc. Publ.,
1984:188-206
Schat H., Ouborg J., De Wit R. Life hystory and plant architecture: size-dependent reproductive
allocation in annual and biennial Centaurum species // Acta Bot. Neerl. 1989. 38(2): 183-201.
Schemske D. W. Evolution of reproductive characteristics in Impatiens (Balsaminaceae): the
significance of cleistogamy and chasmogamy // Ecology. 1978. 59(3): 596-613.
Schemske D. W. Floral ecology and hummingbird pollination of Combretum farinosum in Costa Rica
// Biotropica. 1980.12(3): 169-181.
Schimper A. F. W. Pflanzen-Geographie auf physiologischer Grundlage. Jena: G. Fischer, 1898:1-876.
Schlessman M. A. Size, gender, and sex change in dwarf ginseng, Panax trifolium (Araliaceae) //
Oecologia. 1991. 87(4): 588-595.
Schlising R. A., Turpin, R. A. Hummingbird dispersal of Delphinium cardinale pollen treated with
radioactive iodine // Amer. J. Bot. 1971. 58: 401-406.
Schmidt H. Beitrage zur Zuchtung apomiktischer Apfelunterlagen 1. Zytogenetische und
embryologishe Untersuchungen // Z. Pflanzenzucht. 1964. 52: 27-102.
Schmiicker Th. Hohere Parasiten // Handbuch Pflanzenphysiol. 1959. 2: 480-517.
622
Системы репродукции
Schneider С. К. Illustriertes Handworterbuch der Botanik. Leipzig: Wilhelm Engelmann, 1905:1-496.
Schneider E. L. Notes on the floral biology of Nymphaea elegans (Nymphaeaceae) in Texas //
Aquatic Bot. 1982.12:197-200.
Schneider E. L., Buchanan J. D. Morphological studies of the Nymphaeaceae. XI. The floral biology
of Nelumbo pentapetala // Amer. J. Bot. 1980. 67(2): 182-193.
Schneitz К.., С Baker S. C, Gasser C. S., Redweik A. Pattern formation and growth during floral
organogenesis: HUELLENLOS and AINTEGUMENTA are required for the formation of the
proximal region of the ovule primordium in Arabidopsis thaliana // Development. 1998.125: 2555-2563.
Schneitz K., Hiilskamp M., Kopczak S. D., Pruitt R. E. Dissection of sexual organ ontogenesis: a
genetic analysis of ovule development in Arabidopsis thaliana // Development. 1997.124:1367-1376.
Schneitz K.., Hiilskamp M., Pruitt R. E. Wild-type ovule development in Arabidopsis thaliana: a light
microscope study of cleared whole-mount tissue // Plant J. 1995. 7: 731-749.
Scholander P. F. Vascular plants from northern Svalbard, with remarks on the vegetation in Nort-East
land. Oslo: J. Dybwad, 1934: 1-153.
Schoper J. В., Lambert R. J., Vasilas B. L., Westgate M. E. Plant factors controlling seed set in
maize // PI. Physiol. 1987. 83:121-125.
Schroter C. Das Pflanzenleben der Alpen. Zurich, 1908: 1-806.
Schultz E. A., Pickett F. В., Haughn G. W. The FLO10 gene product regulates the expression
domain of homeotic genes AP3 and PI in Arabidopsis flowers // PI. Cell. 1991. 3:1221-1237.
Schultz-Schaeffer J. Cytogenetics. N.-Y.: Springer Verlag, 1980:1-446.
Schuster J. Uber die Morphologie der Grasblute // Flora. 1910.100: 213-226.
Schuster R. M. Vegetaive and asexual reproduction; regeneration // The Hepaticae and
Anthocerotae of North America East of the Hundredth Meridian. N.-Y, London: Columbia University
Press, 1969: 513-533.
Schuster R. M. Asexual reproductive devices // New manual of bryology / Ed. Schuster R. M.
Nichinan, Miyazaki: The Hattori Botanical Laboratory, 1984. 2: 844-851.
Schwarz-Sommer Z., Hue I., Huijser P., Flor P. J., Hansen R., Tetens F., Lonnig W.-E., Saedler
H., Sommer H. Characterization of the Antirrhinum floral homeotic MADS-box gene deficiens: evidence
for DNA binding and autoregulation of its persistent expression throughout flower development //
EMBOJ. 1992.11:251-263.
Searcy К. В., Mulcahy D. L. Pollen selection and the gametophytic expression of metal tolerance in
Silene dioica (Caryophyllaceae) and Mimulus guttatus (Scrophulariaceae) // Amer. J. Bot. 1985a.
72(11): 1700-1706.
Searcy К. В., Mulcahy D. L. Pollen tube competition and selection for metal tolerance in Silene dioica
(Caryophyllaceae) and Mimulus guttatus (Scrophulariaceae) // Amer. J. Bot. 1985b. 72(11): 1695-1699.
Sears E. R. Genetics and farming // Oearbook, USA. W. 1947: 245-255.
Secor D. L., Russel S. Megagametophyte organization in a polyembryonic line of Linum
usitatissimum // Amer. J. Bot. 1988. 75(1): 114-122.
Sedgley M. Ultrastructure and hystochemistry of the watermelon stigma //J. Cell Sci. 1981.48:137-146.
Sedgley M. Ovule and seed development in Eucalyptus woodwardii Maiden (Symphyomyrtus) //
Bot. Gaz. 1989.150(3): 271-280.
Sedgley M., Blesing M. A., Vithanage H. I. M. V. A developmental study of the structure and
pollen receptivity of the Macadamia pistil in relation to protandry and self-incompatibility // Bot. Gaz.
1985.146: 6-14.
Литература
623
Seghal A., Mohan Ram H. Y. Comparative developmental morphology of two populations of
Ceratophyllum L. (Ceratophyllaceae) and their taxonomy // Bot. J. Linn. Soc. 1981. 82(3): 343-356.
Selling O. H. Till kannedomen om Trapa natans L. i Borjesjon // Forh. Geol. Foren. Stockholm
Forhandlingar. 1940. 62(4): 335-360.
Serla N., Raut R. N. Monosomies in Brassica carinata // Curr. Sci. 1987. 56(14): 717-718.
Sernarder R. Zur Verbreitungsbiologie der Skandinavischen Pflanzenwelt. Berlin: R. Friedlander and
Sohn, Upsala: Lundequistska Bokhandeln, 1901: 1-459.
Sernarder R. Entwurf einer Monographic der europaischen Myrmekochoren. Uppsala: Sven. Vet.
Akad. Handl., 1906. 41(7): 43-108.
Sernarder R. Zur Morphologie und Biologie der Diasporen // Nova Acta Reg. Soc. Sci. Upsal.,
Vol. Exstra ordin. Edit. 1927:1-104.
Semenova A. V, Makoveychuk A. Yu., Kislin E. N., Guseva M. V. Seed germination of boreal terrestrial
orchids // Proc. XI Int. Symp. «Embryology and seed reproduction», Leningrad, 1990. SPb, 1992:489-490.
Sethi G. S., Kalia V., Negi M. Cytogenetics of coenocytism in barley (Hordeum vulgare L.) //
Cytologia. 1983. 48(3): 511-517.
Shaffner J. H. Some morphological peculiarities of the Nymphaeaceae and Helobiae // Ohio Nat.
1904. 4: 83-92.
Shamrov I. I. Seed and vegetative reproduction interrelation during adaptogenesis to water life in
Ceratophyllum // Abstr. Vlth Intern. Ecolog. Congr. Manchester, UK, 1996: 430.
Shanthamma C. Apomixis in Cenchrus glaucus Mudaliar et Sundaraj // Proc. Indian Acad Sci.
(Plant Sci.). 1982. 91 (1): 25-35.
Sharma Y. M. L. Gametogenesis and embryology of Tamarix .ericoides Rottl. // Ann. Bot. N. S.
1939. 3(11): 861-870.
Sheridan W. F., Avalkina N. A., Shamrov 1.1., Batygina Т. В., Golubovskaya I.N. The macl gene:
controlling the commitment to the meiotic pathway in maize // Genetics. 1996:142: 1009-1020.
Sheridan W. F., Huang B.-Q. Nuclear behavior is defective in the maize (Zea mays L.) lethal ovule2
female gametophyte // Plant J. 1997.11(12): 1029-1041.
Sheridan W. F., Neuffer M. G. Maize development mutants, embryos unable to form leaf primordia
// J. Heredity. 1982. 73: 318-329.
Sherman R. A., Voigt P. W., Burson B. L., Dewald C. L. Apomixis in diploid x triploid Tripsacum
dactyloides hybrids // Genome. 1991. 34: 528-532.
Sherwood R. A. Genetic analysis of apomixis // Advances in Apomixis Research / Eds. Savidan Y,
Carman J. G. FAO, Rome, 1999.
Sherwood R. T. Nuclear DNA amount during sporogenesis and gametogenesis in sexual and
aposporous buffelgrass // Sexual PI. Reprod. 1995. 8: 85-90.
Sherwood R. Т., Berg C. C, Young B. A. Inheritance of apospory in buffelegrass // Crop Sci. 1994.
34(6): 1490-1494.
Shimada T. Microspore development during in vitro anther culture of wheat // Wheat Inf. Serv.
1989. 69: 46-48.
Shishkinskaya N. A. Non-traditional view on apomixis // Apomixis Newslet. 1991. 3: 34-36.
Shishkinskaya N. A. Apomixis in seed reproduction system of weed cereals //. Proc. XI Int. Symp.
"Embryology and Seed Reproduction." Leningrad, 1990. SPb, 1992. 507-508.
Shishkinskaya N. A. Some results of apomixis investigation in cereals // Apomixis Newslet. 1995.8:21-23.
624 Системы репродукции
Shivanna К. R., Heslop-Harrison Y, Heslop-Harrison J. The pollen-stigma interaction: bud
pollination in the Cruciferae // Acta Bot. Neerl. 1978. 27: 107-119.
Shivanna K. R., Sastri D. C. Stigma-surface esterase activity and stigma receptivity in some taxa
characterized by wet stigmas // Ann. Bot. 1981. 47: 53-64.
Shore P., Sharrocks A. D. The MADS-box family of transcription factors // Eur. J. Biochem.
1995. 229:1-13.
Shulz J. H., Jensen W. A. Pre-fertilization ovule development in Capsella: ultrastructural and
ultracytochemical localization of acid phosphatase in the meiocyte // Protoplasma. 1981. 107: 27-45.
Shuraki Y. D., Sedgley M. Fruit development of Pistacia vera (Anacardiaceae) in relation to embryo
abortion and abnormalities at maturity // Austr. J. Bot. 1996. 44(1): 35-45.
Sieburth L. E.f Running M. P., Meyerowitz E. M. Genetic separation of third and fourth whorl
functions of AGAMOUS // PI. Cell. 1995. 7:1249-1258.
Silin A. E., Goncharenko G. G. Allozyme variation in natural populations of Eurasian pines. IV.
Population structure and genetic variation in geographically related and isolated populations of Pinus nigra
Arnold on the Crimean Peninsula // Silv. Genet. 1996. 45(2-3): 67-75.
Silvertown J. W. Introduction to Plant Population Ecology. London: Longman, 1982: 1-209.
Simmonds N. W. The breeding system of Chenopodium quinoa. 1. Male sterility // Heredity. 1971.
27(1): 73-82.
Sinder A. N. R., Swamy B. G. L.f Arekal G. D. Synergid embryo in Pennisetum squamulatum //
Curr. Sci. 1980. 5(23): 914-915.
Singh S., Walles B. Ultrastructural differentiation of the ovarian transmitting tissue in Lilium regale //
Ann. Bot. 1995. 75: 455-462.
Singh V. P., Ramanujam S. Expression of andromonoecy in coriander, Coriandrum sativum L. //
Euphytica. 1973. 22:181-188.
Sinnot E. W. Evolution of herbs // Science. 1916. 44(1131): 291-298.
Sinnott E.W. Plant morphogenesis. N.-Y. a.o: McGaraw-Hill, 1960:1-550.
Sitbon M. Production of gaploid Gerbera jamesonii plants by in vitro culture of unvertilized ovules / /
Agronomic 1981. 1: 807-812.
Skalinska M. A new case of unlike reciprocal hybrids in Aquilegia // Rep. Fifth Int. Bot. Congr.
1931: 250.
Skalinska M. Experimental and embryological studies in Hieracium aurantiacum L. // Acta Biol.
Crac. Ser. Bot. 1971.14(2): 139-152.
SkriverK,, MundyJ. Gene expression in response to abscisic acid and osmtic stress // PL Cell. 1990.
2: 503-512.
Slaby K., Sebanek J. Content of endogenous cytokinins in intact and transversally cut leaf blandes of
Bryophyllum crenatum // PI. Growth Regul. 1984. 2(2): 111-116.
Small E. Pollen-ovule patterns in tribe Trifolieae (Leguminosae) / / Plant Syst. Evol. 1988.160:195-205.
Small E.,JompheM. A synopsis of the genus Medicago (Leguminosae) // Canad. J. Bot. 1989. 67:
3260-3294.
Smith E. B. Pollen competition and relatedness in Haplopappus section Isopappus (Compositae) //
Amer. J. Bot. 1970. 57: 874-881.
Smith J. M. What use in sex? //J. Theor. Biol. 1971. 30: 319-335.
Smith J. Regulation of the cell cycle in animal cells // Biochem. Soc. Trans. 1973.1(5): 1078-1081.
Smith J. A quantitative analysis of the megagametophyte of five species of Cornus L. / / Amer. J. Bot.
1975. 62(4): 387-394.
Литература 625
Smith R. Arabidopsis thaliana: a model plant for studying the molecular basis of morphogenesis //
Aust. J. PI. Physiol. 1990.178: 323-331.
Smith W. H. Air pollution and forests. Interactions between air contaminants and forest ecosystems.
N.-Y: Springer-Verlag, 1981:1-379.
Smreciu E. A., Currah R. S. Symbiotic germination of seeds of terrestrial orchids of North America
and Europe // Lindleyana. 1989. 4(1): 6-15.
Snaydon R. W. Plant demography in an agricultural context // Perspectives on Plant Population
Ecology / Eds. Dirzo R., Sarukhan J. Sunderland, Massachusetts: Sinauer Ass. Inc. Publ., 1984: 389-407.
Sohmer S. H. Aspects of the biology of Nelumbo pentapetala (Walter.) Fernald. the american lotus on
the upper Missisippi // Wis. Acad. Sci. 1977. 65: 258-273.
Sohmer S. H., Sefton D. F. The reproductive biology of Nelumbo pentapetala (Nelumbonaceae) on the
upper Mississippi river. II. The insects associated with the transfer of pollen // Brittonia. 1978. 30(3): 355-364.
Sokolov V. A., Kindiger В., Khatypova V. I. Apomictically reproducing 39-chromosome
maize-Tripsacum hybrids // Russian J. Genet. 1998a. 34: 399-405.
Sokolov V. A., Kindiger В., Khatypova V. I. Investigation of apomictic maize-Tripsacum hybrids //
Russian J. Genet. 1998b. 34: 392-398.
Sokolov V. A., Lukina L. A., Khatypova I. V. Perspectives of developing apomixis in maize //
Maize Genet. Coop Newsl. 1998c. 72: 67-68.
Sokolowska-Kulczycka A. Poszukiwanie przyczyn zmi ennosci rozwojowej gametofitow zenskich u
Angiospermae // Wiad. Bot. 1988. 32(2): 81-93.
Solbrig О. Т. On the relative advances of cross- and self-fertilization // Ann. Missouri Bot. Card.
1976. 63(2): 262-276.
Solbrig О. Т., Rollins R. C. The evolution of autogamy in species of the mustard genus Leavenworthia
// Evolution (USA). 1977. 31(2): 265-281.
Solntzeva M. P. Classification of embryo sacs of apomictic plants, including the structural basis of
heterogeneity among embryo-sac nuclei // Apomixis Newslet. 1989.1: 4-10.
Solntzeva M. P. What, then, is apomixis in flowering plants? // Apomixis Newslet. 1990. 2: 28-32.
Solntzeva M.P. Letters // Apomixis Newslet. 1995. 8: 55-57.
Soltis D. E., Soltis P. S. Molecular data and the dynamic nature of polyploidy / / Crit. Rev. PL Sci.
1993.12: 242-273.
Somerville C. R., Meyerowitz E. M. Introduction // Arabidopsis / Eds. Meyerowitz E. M.,
Somerville C. R. Cold Spring Harbor: Cold Spring Harbor Laboratory Press, 1994:1-6.
Song K., Lu P., Tang K, Osborn Т. С Rapid genome change in synthetic polyploids of Brassica and
its implications for polyploid evolution // Proc. Natl. Acad. Sci. USA. 1995. 92: 7719-7723.
Sorensen Th. Sexual chromosome-aberrants in triploid apomictic Taraxacum // Bot. Tidsskr. 1958.
54(1): 1-22.
Soueges R. Developpement de Temryon chez le Geum urbanum L. // Bull. Soc. Bot. France. 1923.
70: 645-660.
Southwood T. R. Bionomic strategies and population parameters / / Theoretical Ecology / Ed. Nay
R. M. Oxford: Blackwell Sci. Publ., 1976: 26-48.
Sparvoli E. Osservacioni cito-embryologiche in Eupatorium riparium Reg. II. Megasporogenesi e
svilippo del gametofito femminile // Ann. di Bot. (Rome). 1960. 26: 481-504.
Spears E. E. Island and mainland pollination ecology of Centrosema virgianum and Opuntia stricta / /
J. Ecology 1987. 75: 351-362.
Spjut R. W. Systematic Treatment of Fruit types // Mem. N.-Y. Bot. Card. 1994. 70: 1-181.
626 Системы репродукции
Spjut R. W., Thieret J. W. Confusion between multiple and aggregate fruits / / Bot. Rev. 53(1): 53-72.
SpomeK. R. A new approach to the problem of the primitive flower// NewPhytol. 1949. 48(2): 259.
Sprengel C. K. Das entdeckte Geheimnis der Natur im Bau und in der Befruchtung der Blumen.
Leipzig: Wilhelm Engelmann, 1793. / Reprinted in 1894.1:1-184; 2:1-172; 3:1-178; 4:1-7.
St-Arnauld M.f Lauzer D., Barabe D. In vitro germination and early growth of seedlings of Cypri-
pedium acaule (Orchidaceae) // Lindleyana, 1992. 7(1): 22-27.
Stanton M. L., Preston R. E. A qualitative model for evaluating the effects of flower attractiveness on
male and female fitness in plants // Amer. J. Bot. 1988. 75(4): 540-544.
Stanton M. L., Snow A., Handel S. N. Floral evolution: attractiveness to pollinators increases male
fitness // Science. 1986. 232(4758): 1625-1627.
Staszkiewicz J., Wojcicki J. I. Biometrical analysis of Trapa L. nuts from Poland // Fragmenta
Floristica et Geobotanica. 1979. 25: 33-59.
Stearns S. C. A new view of life-history evolution // Oikos. 1980. 35: 266-281.
Stebbins G. L. Cytology in Antennaria. I. Normal species // Bot. Gaz. 1932. 94:134-151.
Stebbins G. L. Apomixis in the angiosperms // Bot. Rev. 1941. 7(10): 507-542.
Stebbins G. L. Variation and evolution in plants. N.-Y.: Columb. Univ. Press, 1950:1-643.
Stebbins G. L. Variation and evolution in plants. N.-Y.: Columb. Univ. Press, 1951:1-382.
Stebbins G. L. Cytogenetics and evolution of the grass family // Amer. J. Bot. 1956.43(10): 890-905.
Stebbins G. L. Self-fertilization and population variability in the higher plants // Amer. Naturalist.
1957. 91(861): 337-354.
Stebbins G. L. The role of hybridization in evolution // Proc. Amer. Philos. Soc. 1959.103(2): 231-251.
Stebbins G. L., Major J. Endemism and speciation in the California flora // Ecol. Monog. 1965.35:1-35.
Stebbins G. L. The significance of hybridization for plant taxonomy and evolution // Taxon. 1969.
18(1): 26-35.
Stebbins G. L. Adaptive radiation of reproductive characteristics in Angiosperms. II Seeds and
seedlings // Ann. Rev. Ecol. Syst. 1971a. 2: 237-260.
Stebbins G. L. Chromosomal Evolution in Higher Plants. London: Arnold Press, 1971b.: 1-216.
Stebbins G. L. Polyploidy, hybridization, and the invasion of new habitats // Ann. Missouri Bot.
Card. 1985. 72(4): 824-832.
Steiner К. Е. Has Ixianthes (Scrophulariaceae) lost its special bee? // PL Syst. Evol. 1993.185: 7-16.
Stelleman P. The possible role of insect visits in pollination of reputedly anemophilous plants,
exemplified by Plantago lanceolata, and syrphid flies // The pollination of flowers by insects / Ed. Richards A. J.
London: Acad. Press, 1978: 41-46.
Stelly D. M., Peloquin S. I. Formation of 2n megagametophytes in diploid tuber-bearing solanums //
Amer. J. Bot. 1986. 73(9): 1351-1363.
Stephenson A. G. Flower and fruit abortion: proximate causes and ultimate functions // Ann. Rev.
Ecol. Syst. 1981.12: 253-279.
Stephenson A. G. Proteins associated with self-incompatibility in Campanula rapunculoides //
Abstr. XV th Int. Congr. on Sexual PL Reprod. Wageningen, 1998: 50.
Stephenson A. G., Winsor J. A, Schlichting C. D. Evidence for non-random fertilization in the common
zucchini, Cucurbita pepo / Sexual reproduction in higher plant / Eds. Cresti M. et al. Berlin, 1988:333-338.
Stevens O. A. Weights of seeds and numbers per plant // Weeds. 1957. 5(1): 46-55.
Stewart F. C, Mapes M. O., Mears K. Growth and organized development of cultured cells. II.
Organization in cultures grown from freely suspended cells // Amer. J. Bot. 1958. 45(10).
'Литература 627
Stewart W. N., Rothwell G. W. Paleobotany and the evolution of plants. Cambridge: Cambridge
Univ. Press, 1993:1-521.
Steyn E. M. A., Robbertse P. J., Smith D. An anatomical study of ovary-to-cuke development in
consistently low-producing trees of the «Fuerte» avocado (Persea americana Mill.) with special reference
to seed abortion // Sexual PI. Reprod. 1993. 6(1): 87-97.
Stone J. L., Thompson J., Dent-Acosta S. J. Assessment of pollen viability in hand-pollination
experiments: a review // Amer. J. Bot. 1995. 82:1186-1197.
Stout A. B. The flower behavior of avocados // Mem. N.Y. Bot. Card., 1926. 7:145-203.
Stoutamire W. P. Terrestrial orchid seedlings // The orchids: scientific studies / Ed. Withner С L.
N.-Y: Wiley-Intersci., 1974:101-128.
Strasburger E. Ein Beitrag zur Kenntnis von Ceratophyllum submersum und phylogenetische
Erorterungen // Jahrb. Wiss. Bot. 1902. 37(3): 477-526.
Strasburger Ed. Die Apogamie der Eualchemillen und allgemeine Gesichtuspunkte die sich aus ihr
ergeben // Jahrb. Wiss. Bot. 1905. 4(1): 88-164.
Stushhoff C, Palser B. F. Embryology of five Vaccinium taxa including diploid, tetraploid, and
hexaploid species or cultivares // Phytomorphology. 1969.19(4): 312-331.
Summerhayes V. S. Wild orchids of Britain. London: Collins, 1951:1-366.
Sun M., Ganders F. R. Female frequencies in gynodioecious populations correlated with selfing rates
in hermaphrodites // Amer. J. Bot. 1986. 73(11): 1645-1648.
Sun X., Shi K., Yuan Y. Absorption and accumulation of heavy metal pollutants in the lotus, Nelumbo
nucifera Gaertn. // Acta Hydrobil. Sin. 1987.11(3): 281-283.
Sunderland N. The concept of morphogenic competence with reference to anther and pollen culture / /
PL Cell Cult. Crop Improv. Proc. Int. Symp. N.-Y - London, 1983:125-139.
Sunderland N., Huang B. Barley anther culture - the switch of programme and albinism //
Hereditas. 1985. Suppl. 3(1): 27-40.
Susman R. W., Raven P. H. Pollination by lemurs and marsupials: an archaic coevolutionary system
// Science. 1978. 200: 731-736.
Sutherland S. Floral sex ratios, fruit-set, and resource allocation in plants // Ecology. 1986a. 67(4):
991-1001.
Sutherland S. Patterns of fruit-set: what controls fruit-flower ratios in plants? // Evolution. 1986b.
40(1): 117-128.
Sutherland S., Delph L. F. On the importance of male fitness in plants: patterns of fruit-set //
Ecology. 1984. 65(4): 1093-1104.
Swamy B. G. L. Gametogenesis and embryogeny of Eulophea epidendrae Fischer // Proc. Natl.
Inst. Sci. India. 1943. 9: 59-65.
Swamy B. G. L. Agamospermy in Spiranthes cernua // Lloydia. 1948.11(3): 149-162.
Swamy B. G. L., Krishnamurty K. V. On embryos and embryoids // Proc. Indian Acad. Sci. 1981.
96: 401-414.
SwansonS. D., SohmerS. H. The biology of Podophyllum peltatumL. (Berberidaceae), the may
apple. II. The transfer of pollen and success of sexual reproduction // Bull. Torrey Bot. Club. 1976 103:
223-226.
Ta-Chu L. Cultivation of excised plumules of Nelumbo speciosum in vitro // Bot. Bull. Acad. Sin.
1948. 2(3): 207-210.
628 Системы репродукции
Takcholm G, Zytologische Studien uber die Gattungen Rosa // Acta Horti Bergiani (Uppsala).
1922. 7: 97-381.
Takhtajan A. L. Die Evolution der Angiospermen. Jena: Fisher, 1959:1-344.
Takhtajan A. L. Outline of the classification of flowering plants (Magnoliophyta) // Bot. Rev. 1980.
46(3): 225-359.
Takhtajan A. L. Evolutionary trends in flowering plants. N.-Y.: Columbia Univ. Press, 1991:1-235.
Takhtajan A. Diversity and classification of flowering plants, N.-Y: Columbia Univ. Press, 1997:1-643.
Taliaferro C. M., Bashaw E. C. Inheritance and control of obligate apomixis in breeding buffelgrass,
Pennisetum ciliare // Crop Sci. 1966. 6: 473-476.
Tammisola J. Fruit set and equivalence classes of incompatibility in natural populations of arctic
bramble (Rubus arcticus L.) in Finland // Hereditas. 1982. 97: 331.
Tamura M. Morphology, ecology and phylogeny of Ranunculaceae // Sci. Rep. Osaka Univ. 1964.
13(1): 25-38.
Tan B. C, Schwartz S. H., Zeevaart Jan A., McCarty D. R. Genetic control of abscisic biosynthesis
in maize // Proc. Natl. Acad. Sci. USA. 1997. 94(94): 12235-12240.
Tang P., Sun J., Shen J. A primary study on two pollution-resisting cultivars of Nelumbo nucifera //
Bot. Res. 1990. 5:115-120.
Tani N., Tomaru N., Araki M., Ohba K. Genetic diversity and differentiation in populations of
Japanese stone pine (Pinus pumila) in Japan // Canad. J. Forest Res. 1996. 26(8): 1454-1462.
Taxanomic terminology of the higher plants / Ed. Featherly H.I. Ames, Iowa: The Iowa State College
Press, 1954:1-166.
Taylor R. L. The foliar embryos of Malaxis paludosa // Canad. J. Bot. 1967. 45(9):1553-1556.
Taylor D. W. Paleobiogeographic relationships of angiosperms from the Cretaceous and early Tertiary
of the North American area // Bot. Rev. 1990. 56: 279-417.
Taylor D. W., Hickey L. J. Flowering Plant Origin, Evolution and Phylogeny. N.-Y: Chapman &
Hall, 1996:1-403.
Teryokhin E. S. Apomixis in Potamogeton obtusifolius Mert. et Koch (Potamogetonaceae) //
Apomixis Newslet. 1994. 7: 38-41.
Teryokhin E. Weed broomrapes: systematics, ontogenesis, biology, evolution. Germany:
Aufstieg-Verlag, 1997:1-182.
Theissen G., Becker A., Di Rosa A., Kanno A., Kim J. Т., Munster Th., Winter K.-U., Saedler H.
A short history of MADS-box genes in plants // PI. Mol. Biol. 2000. 42:115-149.
Thirumaran K., Lakshmanan К. К. Synergid embryo in Dioscorea composita Hemsl. // Curr. Sci.
1982. 57(8): 428-429.
Thomann E. В., Sollinger J., White C, Rivin C. J. Accumulation of group 3 late embryogenesis
abundant proteins in Zea mays embryos. Roles of abscisic acid and the Viviparous-1 gene product // PI.
Physiol. 1992. 99: 607-614.
Thomas В., Vince-Prue D. Photoperiodism in Plants. N.-Y.: McGraw-Hill, 1997:1-428.
Thomas P. T. Reproductive versality in Rubus. II. The chromosomes and development.// J. Gen.
1940. 40:119-128.
Thompson J., McLean. Towards a modern physiological interpretation of flowering // Proc. Linn.
Soc, London. 1943-44.156: 46-48.
Thompson K., Bakker J. P., Bekker R. M., Hodgson J. G. Ecological correlation of seed persistence
in the soil in the north-west European flora //J. Ecol. 86(1): 163-169.
Литература 629
Thomson J. D., Thomson B. A. Pollen preservation and viability schedules in animal-pollinated
plants: consequences for reproductive success // Ecology and Evolution of Plant Reproduction / Ed.
Wyatt R. N.-Y. - London: Chapman & Hall, 1992:1-24.
Tian H., Yang H. Synergid apogamy and egg cell anomalous division in cultured ovaries of Oryza
sativa L. // Acta Bot. Sin. 1983. 25(5): 403-408.
Till-Bottraud I., Mignot A., Depaepe R., Dajoz I. Pollen heteromorphism in Nicotiana tabacum
(Solanaceae) // Amer. J. Bot. 1995. 82(8): 1040-1048.
Tillich H.-J. Bauprinzipien und Evolutionslinien bei monocotylen Keimpflanzen // Bot. Jahrb. Syst.
1992.114(1): 91-132.
Tilton V. R. Aberrant ovules in Angiosperms: A review of selected examples and new observations on
Omithogalum caudatum (Liliaceae) // Proc. Iowa Acad. Sci. 1980. 87: 23-28.
Titova G. E., Batygina Т. В. Is the embryo of Nymphaealean plants (Nymphaeales s. 1.) a
dicotyledonous? // Phytomorphology. 1996. 46(2): 171-190.
Titova G. E., Zakharova A. A., Shamrov I. I. Ovule and seed development in Тара natans L.
(Trapaceae) in connection with the specific of embryo sac structure, absence of endosperm and
pseudomonocotyledony // Bull. Polish Acad. Sci., Biol. Sci. 1997. 45 (2-4): 81-92.
Titova G. E., Shamrov 1.1., Batygina Т. В. Comparative embryology of Nymphaeales s. 1. in relation
to phylogeny and taxonomy // Abstr. XV Bot. Congr. Japan, 1993: 235.
Toyoda K. On the maturing stage of the fruit of lotus and its germination / / J. Jap. Bot. 1958.33(3): 85-91.
Tbyoda K. Hydrogen evolution in seeds of Nelumbo nucifera and other angiosperms // Bot. Mag.
Tokyo. 1960. 80(945): 118-122.
Travis J. Components of reproductive success in the herbaceaous perennial Amianthium
muscaetoxicum // Ecology and Evolution of Plant Reproduction / Ed. Wyatt R. N.-Y.: Chapman &
Hall, 1992: 255-280.
Trecul A. Vegetation du Nelumbium codophyllum et disposition anomale de ses Fenilles et de ses
Stipules // Ann. Sci. Nat. Bot. 1854a. 1: 291-298.
Trecul A. Disposition des Stipules et des Fenilles du Nelumbium codophyllum et Vegetation singuliere
de cette Plante // Bull. Soc. Bot. France. 1854b. 1:18-22, 60-63.
Trela-Sawicka Z. Embryology studies Trapa natans L. // Acta Biol. Crac, Ser. Bot. 1978. 21-22
(2): 101-108.
Treub M. Etudes sur les Lycopodiacees VI. L'embryon et la plantule du Lycopodium cernuum L. //
Ann. Jard. Bot. Buitenzorg, 1890. 8:1-37.
Trivedi S., Tripathi R. S. The effects of soil structure and moisture on reproductive strategies of
Spergula arvensis L. and Plantago major L. // Weed Res. 1982. 22(1): 41-49.
Trobner W., Ramirez L., Motte P., Hue I., Huijser P., Lonnig W.-E., Saedler H.,
Schwarz-Sommer Z. GLOBOSA: a homeotic gene which interacts with DEFICIENS in the control of
Antirrhinum floral organogenesis // EMBO J. 1992.11: 4693-4704.
Troll W. Vergleichende Morphologie der hoheren Pflanzen. Vegetationsorgane. Berlin: Verlag von
Gebriider Borntraeger, 1935.1:1-172.
Troll W. Vergleichende Morphologie der hoheren Pflanzen. Berlin: Verlag von Gebriider Borntraeger,
1937: 288-304, 499-511.
Troll W. Praktische Einfuhrung in die Pflanzenmorphologie. Erster Teil. Jena: G. Ficher, 1954.1:1-258.
Troll W. Die Infloreszenzen. Jena. G. Fischer, 1964.1:1-615.
630 Системы репродукции
Truong-Andre L, Demarly Y. Obtaining plants by in vitro culture of unfertilized maize ovaries (Zea mays
L.) and preliminary studies on the progeny of a gynogenetic plant / / Z. Pflanzenzuchtg, 1984.92:309-320.
Tschirch A. Angewandte Pflanzenanatomie. Grundriss der Anatomic Leipzig, 1889.1:1-548.
Tsuchimoto S., Krol A. R. van der, Chua N.-H. Ectopic expression of pMADS3 in transgenic
petunia phenocopies the petunia blind mutant // PI. Cell. 1993. 5: 843-853.
Tubeuf C. V. Monographic der Mistel. Munchen-Berlin, 1923:1-832.
Tukey H.B. Embryo abortion in early-ripening varieties of Prunus avium // Bot. Gaz., 1933. 94(3):
433-468.
Turcotte E. L., Feaster C. V. The origin of 2n and n sectors of chimeral Pimacotton plants / / Crop
Sci. 1973.13(1): 11-13.
Turcotte E. L., Feaster C. V. Method of producing haploids semigametic production of cotton hap-
loids // Haploid in Higher Plants / Ed. Kasha K. J. Guelph., 1974: 53-64.
Turesson G. Studien iiber Festuca ovina L. I. Normalgeschlechtliche, halb- und ganzvivipare Typen
nordischer Herkunft // Hereditas. 1926. 8:161-206.
Turesson G. Studien iiber Festuca ovina L. II. Chromosomenzahl und Viviparie // Hereditas. 1930.
13:177-184.
Turesson G. Studien iiber Festuca ovina L. III. Weitere Beitrage zur Kenntnis der
Chromosomenzahlen viviparer Formen // Hereditas. 1931.15(1): 13-16.
Tuskan G. A., Fransis K. E., Russ S. L., Romme W. H., Turner M. G. RAPD markers reveal
diversity within and among clonal and seedling stands of aspen in Yellowstone National Park, U.S.A. //
Canad. J. Forest Res. 1996. 26(12): 2088-2098.
Tyrnov V. S. Embryogenetic regularities of haploidy in plants // Proc. XI Int. Symp. "Embryology
and seed reproduction." Leningrad, USSR. 1990. SPb, 1992: 576-577.
Tyrnov V. S. Producing of parthenogenetic forms in maize // Maize Genet. Coop. NL. 1997. 71:73-74.
Tyrnov V. S. Apomixis and endosperm development // Maize Genet. Coop. NL. 1998. 72: 73-74.
Uchino A., Tanaka K. Occurrence of aneuploid progenies from an asynaptic amphydiploid of Scilla
scilloides (Lindley) Druce. 2. Mechanism of reproduction of the various aneuploid progenies //J. PL
Research. 1995.108(1090): 185-194.
Uphof C. Th. Cleistogamic flowers // Bot. Rev. 1938. 4(1): 21-49.
Urbansca K. Reproductive effort or reproductive offer? A revised approach to reproductive strategies
of flowering plants // Bot. Helv. 1989. 99(1): 49-63.
Urbanska-Worytkiewicz K. L'agamospermie, systeme de reproduction important dans la speciation
des angiospermes // Bull. Soc. Bot. France. 1974 (1975). 121(9): 329-346.
Valle С. В. D., Miles J. W. Breeding of apomictic species // Advances in Apomictic Research /
Eds. Savidan Y., Carman J. G. Rome: FAO, CIMMIT, ORSTOM, Rome, 1999.
Valle do С. В., Savidan Y.H., Jank L. Apomixis and sexuality in Brachiaria decumbens Stapf. //
Proc. XVI Intern. Grass Congr. Nice, France. 1989: 407-408.
Vardar Y, Acarer P. Auxin in relation to the development of epiphyllous buds in Bryophyllum //
Phyton. 1957. 8(2): .109-119.
Vasil I. K., Hildebrandt A. C. Variations of morphogenetic behaviour in plant tissue cultures. II.
Petroselinum hortense // Amer. J. Bot. 1966.. 25: 7-11.
Vasil V., Marcotte W. R., Jr, Rosenkrans L., Cocciolone S. M., Vasil I. K., Quatrano R. S., McCarty
D. R. Overlap of Viviparous 1 (VPl) and abscisic acid response elements in the Em promoter: G-Box
elements are sufficient but not necessary for VPl transactivation // PL Cell. 1995. 7(10): 1511-1518.
Литература . 631
Vasilyeva V. E. Comparison of the early stages of lotus seed development in situ and in vivo // Proc.
XI Int. Symp. "Embryology and seed reproduction*': Leningrad, 1990. SPb, 1992: 590-591.
Vassileva-Dryanovska O. A. Fertilization with irradiated pollen in Tradescantia // Rad. Bot. 1966.
6(5): 469-479.
Vaughton G. Nonrandom patterns of fruit set in Banksia spinulosa (Proteaceae) : interovary
competition within and among inflorescens // Int. J. PL Sci. 1993.154(2): 306-313.
Vegetation History / Eds. Huntley В., Webb T. Ill Dordrecht etc.: Kluwer Acad. PubL, 1988:1-803.
Veyret Y Embryogenie comparee et blastogenie chez les Orchidaceae—Monandrae //
O.R.S.T.O.M. Paris. 1965:1-106.
Veyret Y. Development of the embryo and young seedling stages of orchids / / The Orchid Scientific
Studies / Ed. Withner C. L. N.-Y. a.o.: Acad. Press, 1974: 223-265.
Vielle J.-Ph., Burson B. L., Bashaw E. C, Hussey M. A. Early fertilization events in the sexual and
aposporous egg apparatus of Pennisetum ciliare (L.) Link. // Plant J. 1995. 8(2): 309-316.
Vielle J.-Ph. Fertilization in aposporous grasses: a small tribute to Pablo Neruda // Apomixis
Newslet. 1992. 6: 7-9.
Vijayaraghavan M. R., Prabhakar K. The endosperm / / Embryology of Angiosperms / Ed; Johri В.
M. Berlin a. o.: Springer-Verlag, 1984: 319-376.
Villagran C. Glacial climates and their effects on the history of the vegetation of Chile: A synthesis
based on palynological evidence from Isla de Chiloe // Rev. Paleobot. Palynol. 1990. 65:17-24.
Vishnyakova M. A. Callose as an indicator of sterile ovules // Phytomorphology. 1991.41(3-4): 245-252.
Visser N. С Spies J. J. Cytogenetic studies in the genus Tribolium (Poaceae: Danthonieae). II. A
report on embryo sac development, with special reference to the occurrence of apomixis in diploid specimens
// S. Afr. J. Bot. 1994. 60: 22-26.
Vbgel S. Uber den Blutendimorphismums einiger sudefrikanischer Pflanzen // Osterr. Bot. Z. 1955.
102: 486-500.
Vbllbrecht E., Hake S. Deficiency analysis of female gametogenesis in maize / / Dev. Genet. 1995.16:44-63.
Voronova O. N., Batygina T. B. Ovule of Zea mays mutants and apoptosis // Bull. Polish Acad. Sc.
1997. 45(2): 75-80.
Vorsa N., Bingham E. T. Cytology of 2n pollen formation in diploid alfalfa, Medicago sativa //
Canad. J. Genet. Cytol. 1979. 21(6): 525-530.
Vroege P. W., Stelleman P. Insect and wind pollination in Salix repens L. and Salix caprea L. //
Israel J. Bot. 1990. 39:125-132.
Vuilleumier B. S. The origin and evolutionary development of heterostyly in the angiosperms //
Evolution. 1967. 21(6): 219-226.
Waddington С. Н. New patterns in genetics and development. N.-Y: Columbia University Press, 1962.
Waddington С. Н. The morphogenesis of patterns in Drosophila // Developmental Systems: Insects
/ Eds. Counce S. J., Waddington С. Н. London, N.-Y.: Acad. Press, 1973. 2: 499-535.
Waes J. M. van, Debergh P. C. Adaptation of tetrazolium method for testing the seed viability and scanning
electron microscope study of some Western European orchids // Physiol. Plantar. 1986a. 66(4): 435-442.
Waes J. M. van, Debergh P. C. In vitro germination of some Western European orchids // Physiol.
PL 1986b. 67(2): 253-261.
Wafai B. A., Koul A. K. Impact of polyploidy on the gametophytes, ovules and seeds in some
himalayan tulips // Phytomorphology. 1984. 34(1-4): 64-69.
Wagner W. H. Hybridization, taxonomy and evolution // Modern methods in plant taxonomy.
London - N.-Y.: Acad. Press, 1968:113-138.
632 Системы репродукции
Wagner J., Hansel A. In vitro seed germination of Cypripedium calceolus L. At various embryogenic
stages // Angev. Bot. 1994. 68: 5-9.
Waller D. W. The relative costs of self- and cross fertilized seeds in Impatiens capensis
(Balsaminaceae) // Amer. J. Bot. 1979. 66(2): 313-320.
Walt van der I. D., Littlejohn G. M. Stigma receptivity of two Protea cultivars in relation to the
development of hybridization techniques // S. Afr. J. Bot. 1996. 62: 258-262.
Walter H., Steiner M. Die Okologie der Ost-Afiikanischen Mangroven // Zeit. Bot. 1936.30(3): 65-193.
Wang H.-Ch. A preliminary report on the morphological studies of the vegetative body and the
organization of the bud of Nelumbo nucifera Gaertn. // Acta Bot. Sin. 1956. 5(4): 425-437.
Wang H.-Ch., Yti B.-Sh. The structure of the plumule of Nelumbo nucifera Gaertn. and the nature of
its scale // Acta Bot. Sin. 1966.14(2): 126-133.
Wang Z. M., Nagasaka K. Allozyme variation in natural populations of Picea glehnii in Hokkaido,
Japan // Heredity. 1997. 78(5): 470-475.
Warcup J. H. Symbiotic germination of some Australian terrestrial orchids // New Phytol. 1973.
72(3): 387-392.
Warden J. Cytological observation of first phases of induced leaf-plantlet development in Bryophyllum
crenatum. Their relation to gene activation // Rev. Biol. 1968. 6: 357.
Warden J. Leaf-embryo dormancy in Bryophyllum crenatum under short-day condition. Blocking of the
factors controlling cell division and morphogenesis // Port. Acta Biol. Serie A. 1969/1970.11(3-4): 319-338.
Warming E. Tropische Fragmente. II. Rhisophora Mangle L. // Bot. Jahrb. Syst. Pflanzengesch.
Pflanzengeogr. / Ed. Engler A. Leipzig: Wilhelm Engelmann, 1883. 4: 519-548.
Warming E. Ober perenne Gewachse // Bot. Centralbl. 1884.18(19): 16-22.
Webb С J. Breeding systems and the evolution of dioecy in New Zealand apioid Umbelliferae //
Evolution. 1979. 33: 662-672.
+
Webb M. C, Gunning В. Е. S. Embryo sac development in Arabidopsis thaliana. I.
Megasporogenesis, including the microtubular cytoskeleton // Sexual PI. Reprod. 1990. 3: 244-256.
Webb M. C, Williams E. G. The pollen tube pathway in the pistil of Lycopersicum peruvianum //
Ann. Bot. 1988. 61: 415-423.
Webb T. Eastern North America // Vegetation History / Eds. Huntley В., Webb III T. Kluwer
Acad. PubL, 1988: 385-414.
Webber J. M. Polyembryony // Bot. Rev. 1940. 6(11): 575-599.
Weigel D. The APETALA2 domain is related to a novel type of DNA binding domain // PI. Cell.
1995a. 7: 388-389.
Weigel D. The genetics of flower development: from floral induction to ovule morphogenesis // Ann.
Rev Genetics. 1995b. 29:19-39.
Weigel D., Alvarez J., Smyth D. R., Yanofsky M. F., Meyerowitz E. M. LEAFY controls floral
meristem identity in Arabidopsis // Cell. 1992. 69: 843-859.
Weigel D., Meyerowitz E. M. Activation of floral horaeotic genes in Arabidopsis // Science. 1993.
261:1723-1726.
Weigel D., Meyerowitz E. M. The ABCs of floral homeotic genes // Cell. 1994. 78: 203-209.
Weimarck G. Apomixis in Hierochloa monticola (Gramineae) // Bot. Not. 1967.120(4): 448-455.
Weinert M. Keimungsfurdernde Faktoren bei schwerkeimenden europaischen Orchideen. I.
Bodenpilze und Agarbedeckung // Die Orchidee. 1990. 41(4): 127-133.
Weins D. Mimicry in plants // Evolution. Biology. 1978.11: 365-403.
Литература 633
Weismann A. Aufsatze iiber Yererbung und verwandte biologische Fragen. Jena: G. Fischer, 1892:1-848.
Wells P. V. Postglacial vegetational history of the great plains // Science. 1970.157:1574-1582.
Wenner С G. Borjesjon-en vaxtpaleontologisk studie av en fornsjo med Trapa natans // Forh. Geol.
Foren. 1939-1940. 61(4): 429-462.
Went J. L. van, Willemse M. T. M. Fertilization // Embryology of Angiosperms / Ed. Johri В. М.
Berlin: Springer-Verlag, 1984: 273-317.
Werner J. E., Peloquin S. J. Frequency and mechanisms of 2n egg formation in haploid Solanum
tuberosum - wild species Fl hybrids // Amer. Potato J. 1987. 64(12): 641-654.
Westergaard M. The mechanism of sex determination in dioecious flowering plants / / Advan. Genet.
1958. 9:217-281.
Wet J. M.J. de. Diploid races of tetraploid Dichanthium speies // Amer. Nat. 1965. 99:167-172.
Wet J. M. J. de. Diploid-tetraploid-haploid cycles and the origin of variability in Dichanthium
agamospecies // Evolution. 1968. 22: 304-307.
Wet J. M. J. de. Polyploidy and evolution in plants // Taxon. 1971a. 20: 29-35.
Wet J. M. J. de. Reversible tetraploidy as an evolutionary mechanizm // Evolution. 1971b. 25:545-548.
Wet J. M. J. de, Harlan J. R. Morphology of compilospecies Bothriochloa intermedia // Amer. J.
Bot. 1963. 53: 9-98.
Wet J. M. J. de, Harlan J. R. Apomixis, polyploidy and speciation in Dichanthium // Evolution.
1970a. 24(2): 270-277.
Wet J. M. J. de, Harlan J. R. Bothriochloa intermedia - a taxonomic dilemma // Taxon. 1970b. 19:
339-340.
Wet J. M. J de, Stalker H. T. Gametophytic apomixis and evolution in plants // Taxon. 1974.
23(5/6): 689-697.
Wettstein R. Beobachtungen iiber den Bau und die Keimung des Samen von Nelumbo nucifera
Gaertn. // Verh. Zool.-bot. Ges. 1888. 38: 41-48.
White J. The plant as a metapopulation // Ann. Rev. Ecol. Syst. 1979.10:109-145.
Whitehead D. R. Wind pollination in the angiosperms: evolutionary and environmental considerations
// Evolution. 1969. 23: 28-35.
Whitehead D. R. Wind pollination: some ecological and evolutionary perspectives / / Pollination
Biology / Ed. Real L. Ontario: Acad. Press, Inc., 1983: 97-107.
Whitlow C. Mass production of Calopogon tuberosus // Proc. Conf. North American native
terrestrial orchids. Propagation and production. Washington. USA, 1996: 5—11.
Whittaker R. H. Evolution and measurement of species diversity // Taxon. 1972. 21(2-3): 213-251.
Whittaker R. H. Communities and ecosystems. N.-Y: MacMillan Co.t 1975:1-385.
Whittaker R. H., Levin S. A., Root R. B. Niche, habitat and ecotope // Amer. Naturalist. 1973.
107(995): 321-338.
Widen В., Widen M. Pollen limitation and distance-dependent fecundity of the clonal gynodioecious
herb Glechoma hederacea (Lamiaceae) // Oecologia. 1990. 83:191-196.
Widen M. Sexual reproduction in a clonal, gynodioecious herb Glechoma hederacea // Oikos. 1992.
63: 430-438.
+
Wiens D., Calvin С L., Wilson C. A., Davern С I., Frank D., Seavey S. R. Reproductive success,
spontaneous embryo abortion and genetic load in flowering plants // Oecologia. 1987. 71(5): 501-509.
Wigand A., Dennert E. Nelumbium speciosum Willd. // Biblioth. Bot. 1888.11: 1-68.
i
4_
634 ; Системы репродукции
Wilcock С. С. The pollination of flowers by insects by A. J. Richards. Book review // J. Ecology.
1980. 68: 326-327.
Wilcock С. С Botanical santuaries for Scotland's flora // Transact. Bot. Soc. Edinburgh. 1990.45:509-517.
Wilcock C. C, Jennings S. B. Partner limitation and restoration of sexual reproduction in the clonal
dwarf shrub Linnaea borealis L. (Caprifoliaceae) // Protoplasma. 1999. 208: 76-86.
Wilcock С. С, Neiland M. R. M. Reproductive characters as priority indicators for rare plant
conservation // Proc. Second Europ. Conf. on the Conservation of Wild Plants / Eds. Synge H., Akeroyd J.,
Oslo: Swedish Treatened Plants Unit and Plantlife, 1998: 221-230.
Wilken D. H. The balance between chasmogamy and cleistogamy in Collomia grandiflora
(Polemoniaceae) // Amer. J. Bot. 1982. 69(8): 1326-1333.
Willems J. H. Soil seed bank and regeneration of a Calluna vulgaris community after forest clearing / /
Acta Bot. Neerl. 1988. 37(2): 313-320.
Willemse M. T. M., Naumova T. Apomictic genes and seed plant development // Apomixis
Newslet. 1992. 5:19-32.
Willemse M. T. M., Went J. L. van. The female gametophyte // Embryology of Angiosperms / Ed.
Johri В. М. N.-Y: Springer Verlag, 1984:159-196.
Williams R. W., Wilson J. M., Meyerowitz E. M. A possible role for kinase-associated protein
phosphatase in the Arabidopsis CLAVATA 1 signaling pathway // Proc. Natl. Acad. Sci. USA.
1997. 94:10467-10472.
Willson M. F. Sexual selection in plants // Amer. Naturalist. 1979.113(6): 777-790.
Willson M. F. Sexual selection and dicliny in angiosperms / / Amer. Naturalist. 1982.119(4): 579-583.
Willson M. F. Plant reproductive ecology. N.-Y: J. Willey & Sons, 1983:1-282.
Willson M. F. Mating patterns in plants / / Perspectives on plant population ecology / Eds. Dirzo R.,
Sarukhan J. Sunderland: Sinauer Ass. Inc. Publ, 1984: 261-276.
+
Willson M. F. Sexual selection, sexual dimorphism and plant phylogeny // Evol. Ecol. 1991.5(1): 69-87.
Wilmot-Dear С M. Ceratophyllaceae // Flora of tropical East Afrika / Ed. Polhill R. M. Boston:
A. A. Balkema, 1985:1-5.
Wilms H. J. Pollen tube penetration and fertilization in spinach // Acta Bot. Neerl. 1981.30:101-122.
Wilms H. J., Went J. I. van, Cresti M., Ciampolins F. Structural aspects of female sterility in Citrus
limon // Acta Bot. Neerl. 1983. 32: 87-96.
Windberg L. A. Annual fruit production of Opuntia engelmannii and Prosopis glandulosa in southern
Texas // Texas J. Sci. 1997. 49(1): 65-72.
Winkler H. Uber Parthenogenesis und Apogamie im Pflanzenreiche. Jena: G. Fischer, 1908a:l-166.
Winkler H. Parthenogenesis und Apogamie im Pflanzenreiche // Progr. Rei. Bot. 1908b. 2(3): 293-454.
Wmkler H. Verbreitung und Ursache der Parthenogenesis im Pflanzen- und Tierreiche. Jena: G.
Fischer. 1920:1-232.
Winkler H. Fortpflanzung der Gewachse. VII. Apomixis // Handworterbuch der Naturwissenschaft.
Jena, 1934. 4: 451-461.
Winkler H. Versuch eines "naturalichen" Systems der Fruchte // Beitz. Biol. Pflanzen. 1939.1:201-220.
Winkler H. Zur Einigen und Weiterfuhrung in der Frage des Fruchtsystems / / Beitz. Biol. Pflanzen.
1940. 2: 92-130.
Wodehouse R. P. Pollen grains. N.-Y: McGraw-Hill, 1935:1-574.
Wolpert L. Positional information and pattern formation // Current Topics. Developmental Biology /
Eds. Moscona A. A., Monroy A. N.-Y: Acad. Press, 1971. 6:183-224.
Литература 635
Wolters J. H. В., Martens M. J. M. Effects of air pollutants on pollen / / Bot. Rev. 1987.53(3): 372-414.
Wood С. Е. The genera of the Nymphaeaceae and Ceratophyllaceae in the Southeastern United
States // J. Arnold Arboretum. 1959. 40(1): 94-112.
Wu B. J., Cheng K. Cytological and embiyological studies on haploid plant production from cultured
unpollinated ovaries of Nicotiana tabacum L. // Acta Bot. Sin. 1982. 24(2): 125-129.
Wu-ShuBiao, Shang-YongJin, Han-XueMei, Wang-JingXue, Zhang-FuYao, Wei-YaoMing,
Wu-S. В., Shang-Y. J., Han-X. M.( Wang-J. X., Zhang F. Y, Wei-Y. M. Embiyological study on
apomixis in a sorghum line SSA-1 // Acta Bot. Sin. 1994. 36 (11): 833-937.
Wyatt R. Ecology and Evolution of Plant Reproduction. N.-Y: Chapman & Hall, 1992:1-397.
Wycherley P. R. Proliferation of spikelets of British grasses // Watsonia. 1953.3(1953-1956): 413-456.
Yakovlev M. S., Yoffe M. D. On some peculiar features in the embryogeny of Paeonia //
Phytomorphology. 1957. 7(1): 74-82.
Yamamoto Y Uber das Varkommen von triploiden Pflanzen bei Mehrlings-Keimlingen von Triticum
vulgare Vill. // Cytologia. 1936. 7(3): 431-436.
Yamashita T. Uber die Pollenbildung bie Halodule pinifolia und H. uninervis // Beitr. Biol. Pfl.
1976. 52: 217-226.
Yampolsky C, Yampolsky H. Distribution of sex in the phanerogamic flora // Bibliotheca Genetica.
Leipzig. 1922. 3:1-62.
Yan H., Yang H.-Y., Jensen W. A. An electron microscope study on in vitro parthenogenesis in
sunflower // Sexual PL Reprod. 1989. 2(3): 154-166.
Yan W., Wallace D. H. A model of photoperiod-temperature interaction effects on plant development
// Crit. Rev. Plant Sci. 1995.15: 63-96.
Yan W., Wallace D. H. A physio logical-genetic model of photoperiod-temperature interactions in
photoperiodism, vernalization, and male sterility of plants // Hort. Rev. 1996.17: 73-123.
Yan W., Wallace D. H. Simulation and prediction of plant phenology for five crops based on
photoperiod-temperature interaction // Ann. Bot; 1998. 81: 705-716.
Yan S.-Zh. The development of embryo and endosperm of Nelumbo nucifera Gaertn. // Acta Bot.
Sin. 1986. 28(4): 359-360.
Yang H., Zhon C. In vitro induction of haploid plants from unpollinated ovaries and ovules // Theor.
Appl. Genet. 1982. 63(2): 97-104.
t
Yannetti R. Arethusa bulbosa life cycle, propagation and production // Proc. Conf. North American
native terrestrial orchids. Propagation and production. Washington, USA, 1996: 27-43
Ymofeky M. F., Ma H., Bowman J. L., Drews G. N., Feldmann K. A., Meyerowitz E. M. The protein
encoded by the Arabidopsis homeotic gene agamous resembles transcription factors / / Nature. 1990.346:35-39.
Yarbrough J. A. Anatomical and developmental studies of the foliar embryos of Bryophyllum
calycinum // Amer. J. Bot. 1932.19(6): 443-453.
Yarbrough J. A. History of leaf development in Bryophyllum calycinum/ / Amer. J. Bot. 1934. 21(8):
467-482.
Yazgan M. Studies on the effect of auxin-kinetin on the epiphyllos budding in Bryophyllum
daigremontianum Berg. // Publ. Ser. Sci. Fac. Inst, of botany. Bornova-Izmir. 1970. 2:1-39.
Yokoi Y An analysis of age- and size-dependent flowering: a critical-production model // Ecol. Res.
1989. 4(3): 387-397.
York H. H. The embryo sac and embryo of Nelumbo // Ohio Nat. 1904. 4:167-176.
Zacharova A. A., Batygina Т. В. Embryoculture for preservation of northern orchids // Abst. Int.
Conf. on Reproductive biology. Royal Bot. Gardens, Kew, 1996: 61.
636 Системы репродукции
Zanetto A., Kremer A. Geographical structure of gene diversity in Quercus petraea (Matt.) Libl. I.
Monolocus pattern of variation // Heredity. 1995. 75(5): 506-517.
Zavada M. S. Comparative morphology of monocot pollen and evolutionary trends of apertures and
wall structures // Bot. Rev. 1983. 49: 331-379.
Zhao J. Observations on the ecological character of lotus //J. Wuhan Bot. Res. 1985.3(3): 267-271
Zhao J. A preliminary study on the breeding of new chinese bowl lotus cultivars //J. Wuhan Bot.
Res. 1988. 6(2): 145-150.
Zhao Z., Gu M. Production of diploid pure lines of maize through parthenogenesis induced by
chemicals // Acta Genet. Sin. 1984.11(1): 39-46.
Zhao Z.-Y., Weber D. F. Male gametophyte development in monosomies of maize // Genome.
1989. 32(1): 155-164.
Zhong Y., Zhang X. Study on numerical classification of the cultivars of lotus / / J. Wuhan Bot. Res.
1987. 5(1): 49-58.
Zhou Shi-Qi, Qian De-Qi, Cao Xiu- Yun. Induction of parthenogenesis and chromosome behavior in
plants of parthenogenetic origin in cotton (Gossypium hirsutum) // Genome. 1991. 34(2): 255-260.
Zhou X. M., Madrmootoo C. A., MacKenzie A. F., Smith D. L. Effects of stem-injected sucrose
on photosynthesis and productivity of water stressed corn plants //J. Agron. Crop Sci. 1997.179: 91-99.
Zhou-Zhi Qin, Li-Yu Nong. Studies on the apomixis in Malus Mill: a literature review // Acta
Hort. Sin. 1995. 22(4): 341-347.
Zhu Z. C, Wu H. S. Induction of haploid plantlets from unpollinated ovaries of Nicotiana tabacum
L. cultured in vitro // Acta Genet. Sin. 1981. 8: 63-65.
Zhu Z. C, Wu H. S., An Q. K., Liu Z. Y. Induction of haploid plantlets from unpollinated ovaries of
Triticum aestivum cultured in vitro // Acta Genet. Sin. 1981. 8: 386-390.
Ziegenspeck H. Orchidaceae // Lebensgeschichte Bliitenpflanzen Mitteleuropas. 1936.
l(4):-l-740.
Zimmermann J. K. Ecological aspects of labile gender expression in a population of the Panamanian
orchid Catasetum vividiflavum // Amer. J. Bot. 1989. 76(6), suppl.: 133.
Zimmerman J. K.., Weis J. M. Factors attecting suvivorship, growth, and fruit production in a beach
population of Xanthium strumarium // Canad. J. Bot. 1984. 62(10): 2122-2127.
Zimmerman M., Руке G. H. Reproduction "in Polemonium : assessing the factors limiting seed set //
Amer. Naturalist. 1988.131(5): 723-738.
Zimmerman W. Die introgressive Hybridization als wichtige Phase der pflanzlichen Phylogenie //
Forschungen u. Fortschritte. 1966. 40(2): 33-37.
Zinselmeier C, Westgate M. E., Jones, R. J. Kernel set at low water potential does not vary with
source-sink ratio in maize // Crop Sci. 1995. 35:158-163.
Zitek R. V. Die Wassernuss hat "Keimen" // Orion. 1955.10 (21-22).
Zohary M. Karpobiologische Beitrage aus der orientalischen Flora // Bot. Notis. 1939. 4.
Zohary M. Flora Palestina.Yerusalim, 1966. lptl/2.
t
Предметный указатель 637
предметный указатель
Аберрантные семязачатки и семена 272
Автогамия 112,170,181
Агамоспермия 145, 170, 398
Адвентивная эмбриония (см. Эмбриондогения) 143, 144,170,173
Аллогамия 115
Амфимиксис 142
Антэкология 72, 456
экология опыления 72
экология цветка 72 >
Апогаметия 159, 165
Апогамия (см. Апогаметия) 165
Апомиксис гаметофитный 142,143,145,170, 398
нерегулярный 143,170
регулярный 144,170
эволюционный 214, 218
Апоспория 143,146,172,176,186
Банк семян 286
Вивипария 39, 50,144, 508
— вегетативная 40, 44
генеративная 40, 42
Возобновление 35, 247
Воспроизведение 35, 246
Гаметофит 378
модификации 384
мутации 378
Гамоспермия 398
Гейтоногамия 115
Гемигамия (= семигамия) 161,174
Генетика развития 355
— семязачатка 370
цветка 355
Тетерогенность семян 279, 280, 397
638 Системы репродукции
Гетерокарпия 296
Гетероспермия 279
Гетеростилия 82
диморфная 82
— триморфная 82
Гибридизация 137
Гинодиэция78
Диаспора 246, 420
вегетативная 420, 421
— генеративная 420
Диплоспория 143, 151, 176,187
Диссеминация 246, 420, 459, 484
Дихогамия 84
протандрия 84
— протогиния 84
Диэция 74
андродиэция 74
— гинодиэция 74, 78
Жизненная форма 415, 452
гемикриптофиты 417
криптофиты 417
терофиты 417
фанерофиты 416
— хамефиты 416
Жизненный цикл 69
Клейстогамия 96, 99
Ксеногамия 116
Луковица 321
Луковичка 327
Метаморфоз 62
Моноэция 75
андромоноэция 77
гиномоноэция 76
— тримоноэция 77
Партеногенез 143,158,174,189
андрогенез 160, 174
гиногенез 160
Партикуляция 306, 442
нормальная 306
сенильная 306
— травматическая 306
Плод 289
Пол 88
фенотипический 92
функциональный 92
— детерминация пола 88
Полиэмбриония 401
Предметный указатель 639
Половой полиморфизм 73, 89
двудомные растения 73, 74
гермафродитные растения 73, 74
однодомные растения 73, 74
полигамные, или многодомные растения 73, 74
трехдомные растения 74
Популяция 412, 524
Почка 310
адвентивная 311
боковая 311
вегетативная 311
верхушечная 311
выводковая 45, 50, 311, 315
генеративная 311
гибернакула 311, 472
придаточная 311
Протокорм 329, 524, 525
Псевдогамия 170,181
Размножение 35, 246, 500
вегетативное 299, 442, 453, 472, 486, 500
семенное 246, 453, 470, 480, 500, 513
Репродукция 21, 35, 406, 428, 432, 439, 532
гетерофазная 36
гомофазная 36
регулирование репродукции 428
популяционное 429, 432
ценотическое 431, 432
репродуктивные стратегии 451, 469, 479, 507, 510
репродуктивное усилие 247
репродуктивный успех 251
системы репродукции 451, 479, 507, 510
Сарментация 302
Семенная продуктивность 258, 260, 262, 266, 455, 482, 503
потенциальная 258, 455, 482
реальная 260, 455, 482
Семя 246, 272, 279, 454, 470, 480, 502, 525
Синузия 439
Способы переноса пыльцы 93
Фитомер 350
Фитоценоз 406
Хазмогамия 96
Эволюция цветковых растений 107, 137, 350
Экологическая ниша 409
Экологическая эмбриология 24
Эмбриогенетика 389
Эмбриоид 334
Эмбриоидогения 146,175, 334, 398
российская академия наук
Ботанический институт им. В. Л. Комарова,
Россия, 197376 СПб., ул. Профессора Попова, д. 2.
Директор, член-корреспондент РАН, профессор
ЛЕВ ЮСТИНИАНОВИЧ БУДАНЦЕВ
т. (812) 234-12-37
факс (812) 234-45-12
E-mail: binadmin@OK3277.spb.edu
Отдел эмбриологии и репродуктивной биологии.
Заведующая, заслуженный деятель науки РФ,
профессор, доктор биологических наук
БАТЫГИНА ТАТЬЯНА БОРИСОВНА
т. (812) 234-52-14
российский фонд
фундаментальных исследований
(изд. грант № 00-04-62013)
АНО НПО «МИР И СЕМЬЯ», «ИНТЕРЛАЙН»
СПб., В. О., ул. Уральская, д. 17,
т/ф (812) 320-68-59,350-17-74,350-27-21 (доб. 244, 455),
E-mail: mis95@mail.ru, interline@mail.ru
Оригинал-макет и диапозитивы изготовлены в АНО НПО «Мир и семья», «Интерлайн»
СПб., В. О., ул. Уральская, д. 17, т. (812) 320-68-59, 350-17-74, 350-27-21 (доб. 244)
Лицензия ЛП № 000422 от 27 авг. 1999 г.
Г
Компьютерная верстка: Юлия Борисова, Андрей Янишевский
Компьютерный набор: Брагина Е.А., Голубева Т. Н„ Евдокимова Е. £., Буту зова О. Г.
Редактор: Васильева В. Е.
Обработка иллюстраций: Андрей Янишевский, Юлия Борисова
Ответственный за изготовление оригинал-макета: Кулаков А. О.
Налоговая льгота — общероссийский классификатор продукции ОК-00-93, том 2;
953000 — книги, брошюры. Федеральный закон 188 — ФЗ от 30.11.1995 г.
Федеральный закон 191 — ФЗ от 01.12.1995 г.
Сдано в набор 06.10.1999. Подписано к печати 10.01.2000.
Формат 70x100/16, объем печ. л. 40,5. Бумага офсетная.
Печать офсетная. Гарнитура академическая. Тираж 500 экз.
Заказ №283.
Отпечатано с готовых диапозитивов в ГИПП «Искусство России».
198099, Санкт-Петербург, ул. Промышленная, д. 38, к. 2.