Текст
л ■
ТЕ*МИ *ЛОГ Я
И КОН ЦЕП Ц И
t
^.W
j»
Э%-
, &£
'Ш:
\ - - ■
\'г
Г*
".-,
а-
у
^
V *
7
L
-
1
<_
. J .
V-
л
Ч.~
■
-.
? "i
■ X
&:
■*.-
1 i
1: -
i
^
г
х
■;'' *
,
*-
ЪУ
;-
■«_'
МИР СЕМЬЯ"
СПБ, 199
ЭМБРИОЛОГИЯ ЦВЕТКОВЫХ РАСТЕНИИ
ТЕРМИНОЛОГИЯ И КОНЦЕПЦИИ
В 3-х томах
ГЕНЕРАТИВНЫЕ ОРГАНЫ ЦВЕТКА
Том 1
ТАТЬЯНА БОРИСОВНА БАТЫГИНА
Редактор
«МИР И СЕМЬЯ»
САНКТ-ПЕТЕРБУРГ
1994
EMBRYOLOGY OF FLOWERING PLANTS
TERMINOLOGY AND CONCEPTS
Three volume edition
GENERATIVE ORGANS OF FLOWER
Volume 1
TATYANA B. BATYGINA
Editor
kWORLD AND FAMILY»
ST.PETERSBURG
1994
РОССИЙСКАЯ АКАДЕМИЯ НАУК
Ботанический институт им. В.Л.Комарова
ОТДЕЛ ЭМБРИОЛОГИИ
И РЕПРОДУКТИВНОЙ БИОЛОГИИ
РОССИЙСКИЙ ФОНД
ФУНДАМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
Рецензенты
Э. С. ТЕРЕХИН, И. П. ЕРМАКОВ
Редакционная коллегия
Г. К. АЛИМОВА, Т. Б. БАТЫГИНА (редактор), В. Е. ВАСИЛЬЕВА,
Г. Я. ЖУКОВА (секретарь), О. П. КАМЕЛИНА,
3. И. НИКИТИЧЕВА, И. И. ШАМРОВ
О
RUSSIAN ACADEMY OF SCIENCES
V. L. Komarov Botanical institute
DEPARTMENT OF EMBRYOLOGY
AND REPRODUCTIVE BIOLOGY
RUSSIAN FOUNDATION
FOR FUNDAMENTAL RESEARCHES
Reviewers
E. S. TERYOKHIN, I. P. ERMAKOV
Editorial board
G. K. ALIMOVA, Т. В. BATYGINA {editor), O. P. KAMELINA,
Z. I. NIKITICHEVA, I. I. SHAMROV, V. E, VASILYEVA,
G. YA. ZHUKOVA (secretary)
УДК 581.3
ЭМБРИОЛОГИЯ ЦВЕТКОВЫХ РАСТЕНИЙ. ТЕРМИНОЛОГИЯ И КОНЦЕПЦИИ.
Т. I. Генеративные органы цветка (ред. Т.Б. Батыгина).
В книге, представляющей собой 1-й том 3-томного издания, излагаются современные
представления о строении и развитии пыльника и семязачатка. Она содержит текст н иллюстрации в виде
рисунков, графиков, схем, микрофотографий (СМ, ТЭМ, СЭМ). Текст включает авторские трактовки
основных терминов и понятий, используемых в современной ботанической литературе при описании
всех структурных элементов пыльника и семязачатка, а также ряд необходимых общебиологических
терминов. Приводится семантика терминов, принципы классификации основных эмбриональных
структур, отражены вопросы гомологизации, структурно-функциональные аспекты. Делается
попытка привлечения данных ультраструктурной, экологической, популяционной эмбриологии для
уточнения понятий.
Издание носит монографический и энциклопедический характер. Предназначено для
эмбриологов, систематиков, физиологов, генетиков, селекционеров и ботаников широкого профиля.
Рассчитано на научных работников, аспирантов и студентов-биологов. Библ. 1734 назв. Илл. более 1000 рис.
Публикация поддержана Российским Фондом фундаментальных исследований (№
издательского гранта 94-04-11460).
Авторы:
Г.К. Алимова, Т.Б. Батыгина, A.M. Бугара, А.Е. Васильев, В.Е. Васильева, Н.И. Габараева,
L„ \«алаДзе> Е.Н. Герасимова-Навашина, И.Н. Голубовская, М.Ф. Данилова, Н.А. Жинкина,
„ „ ™укова- 0П Амелина, Г.А. Комар, В.А. Коннова, Е.Л. Кордюм, И.А. Корчагина,
Круглова, А.П. Меликян, З.И. Никитичева, В.Ф. Огородникова, И.Н. Орлова, В.П. Печени-
M.R. Vijayaraghavan, M.T.M. Willemse.
The book, representing the first volume of a three-volume edition, is devoted to current notions of
structure and development of anther and ovule. The first volume contains textual material and graphic material
such as drawings, charts, diagrams, microphotos and electron micrographs. There are authors' explanations
of both general biology terms and basic terms and concepts used in the modern botanical literature for defining
the structural elements of anther and ovule. The authors describe the term semantics, main classification
principles of the development types of such structures as nucellus, embryo sac, anther wall, etc. The homology
of basic embryonal structures and structural, functional and evolutionary aspects are also included The
authors try to invoke the ultrastructural, ecological and population embryology data to verify the conceots
based on the classical embryology.
This is a monographic and encyclopaedic edition. It will be of interest to embryologists, taxonomists
physiologists geneticists, plant-breeders and botanists. The book is intended both for scientists and for
students. Its bibliography consists of about 1734 references. The text is provided with more than 1000
illustrations.
The book is supported by the Russian Foundation for Fundamental Researches (grant N 94-04-11460).
Authors:
л лО^',ЛИш0Уа' TB- B^yS"13- J- Bednara, N.N. Bhandari, F. Bouman, A.M. Bugara, B. Chaudhrv
A.A. Chebotaru, P. Chitralekha, M.F. Danilova, G. El-Ghazaly, O. Erdelska, N.I.Gabarayeva
H.N. Gerassimova-Navashina, I.N. Golubovskaya, G.E. Gvaladze, D.A. Hamilton, O.A. Khvedynich
ip JlT и °^оКх?Ть' VA- Konnova, I.A. Korchagina, E.L. Kordyum, N.N. Kruglova!
J.P. Mascarenhas, A.R. Melikyan, H.L. Mogensen, Z.I. Nikiticheva, V.F. Ogorodnikova, I N Orlova
V.P Pechenitsyn V.A Poddubnaya-Arnoldi, O.B. Proskurina, B. Rodkiewicz, I.D. Romanov,'
S.D. Russell, R. Shah, I.I. Shamrov, S.V. Shevchenko, V.K. Simonenko, E.S. Teryokhin, V.N. Tikhomirov
£'v ^IT' V Уа8ПУеуа- AE- Vassilyev, M.R. Vijayaraghavan, M.T.M. Willemse, N.A. Zhinkina
ij.Ya. Zhukova. '
СОДЕРЖАНИЕ
ПРЕДИСЛОВИЕ . 13
БЛАГОДАРНОСТИ 17
ВВЕДЕНИЕ 19
ЧАСТЬ I — ЦВЕТОК
ОБЩЕЕ ПРЕДСТАВЛЕНИЕ
Цветок (А. 77. Меликян, В. Н. Тихомиров) 29
Андроцей {А. 77. Меликян) , 34
Тычинка (Г. Б. Батыгина) 35
Гинецей {И. А. Корчагина) 37
Плодолистик {И. А. Корчагина) 37
Плацента {И. А. Корчагина) 38
ЧАСТЬ II — ПЫЛЬНИК
ОБЩЕЕ ПРЕДСТАВЛЕНИЕ
Пыльник (О. 77. Камелина) 39
Микроспорангий (О. 77. Камелина) 40
Эпидермис (О. 77. Камелина) 41
Связник (О. 77. Камелина) 41
СТЕНКА МИКРОСПОРАНГИЯ
Стенка микроспорангия (Т. Б. Батыгина) 42
Париетальный слой (О. 77. Камелина) 44
Эндотеций (О. 77. Камелина) 44
Средний слой (О. 77. Камелина) 45
Фиброзные утолщения {О. 77. Камелина) 46
Тапетум {О. 77. Камелина) 46
Тапетум и орбикулы (тельца Убиша) (G. El-Ghazaly) 47
Тапетальная мембрана {В. Ф. Огородникова) 49
Спорополленин (77. И. Габараева) 50
Тапетум: ультраструктурные аспекты (А. А. Чеботарь) 52
Новый подход к классификации типов тапетума (О. 77. Камелина) 56
Новый подход к классификации типов формирования стенки
микроспорангия (Э. С. Терехин, Т. Б. Батыгина, И. И. Шамров) . 60
МИКРОСПОРОГЕНЕЗ
Микроспорогенез {В. Rodkiewicz, J. Bednara) 67
Археспорий {С. В. Шевченко) 68
Спорогенная ткань {С. В. Шевченко) 69
Микроспороцит (С. В. Шевченко) 69
Мейоз (И. Н. Голубовская) 70
6
Цитохимия мейоза (А. М. Бугара) 76
Тетрада микроспор (Г. К. Алимова) 79
Иммунофлуоресценция цитоскелета в ходе микроспорогенеза
(В. Rodkiewicz, J. Bednara) 81
МИКРОСПОРА
Микроспора (Г. К. Алимова) 82
Цитохимия микроспор (А. М. Бугара) 83
Ультраструктурные аспекты развития микроспор (агрегаты
эндоплазматического ретикулума) Ш. И. Габараева) 84
ПЫЛЬЦЕВОЕ ЗЕРНО
Пыльцевое зерно (мужской гаметофит) (Г. К. Алимова) 86
Оболочка пыльцевого зерна (G. El-Ghazaly) 88
Генеративная клетка (Г. К. Алимова) 90
Ультраструктура генеративной клетки (Н. L. Mogensen) 91
Вегетативная клетка (Г. К. Алимова) 92
Ультраструктура вегетативной клетки (Н- L. Mogensen) 93
Спермий (Г. Я. Жукова) 94
Диморфизм спермиев Щ. L. Mogensen) 95
Цитохимия пыльцевого зерна (А. М. Бугара) 96
Движение ядра и клеток в развивающемся пыльцевом зерне
(Т. Б. Батыгина, Н. Н. Круглова) 99
Морфофункциональный статус гаметогенеза {А. А. Чеботарь) 101
Поллиний (Г. К. Алимова) 102
Эволюция мужского гаметофита (Е. Н. Герасимова-Навашина) . 104
Специфика генной экспрессии в пыльце (D. A. Hamilton, J. P. Mas-
carenhas) • 109
ПЫЛЬНИК: ГИСТОХИМИЧЕСКИЕ И УЛЬТРАСТРУКТУРНЫЕ
АСПЕКТЫ (М. R. Vijayarghavan, Bharti Chaudry, Rajesh Shah) 112
ЦИТОМИКСИС (Я H. Орлова) 115
ПИТОПЛАЗМАТИЧЕСКАЯ МУЖСКАЯ СТЕРИЛЬНОСТЬ
{В. К. Симоненко) 117
РАЗВИТИЕ ЗАРОДЫШЕВЫХ МЕШКОВ В ПЫЛЬНИКЕ (Т. Б.
Батыгина) 118
ПЫЛЬНИК КАК МОДЕЛЬ ДЛЯ ИЗУЧЕНИЯ МОРФОГЕНЕТИЧЕ-
СКИХ ПОТЕНЦИЙ И ПУТЕЙ МОРФОГЕНЕЗА (Г. Б. Батыгина) 120
ЧАСТЬ III — СЕМЯЗАЧАТОК
ОБЩЕЕ ПРЕДСТАВЛЕНИЕ
Семязачаток (Я А. Корчагина) 122
Структура и функции кампилотропного семязачатка
(F. Воитап) 131
Примордий семязачатка (Я. И. Шамров) 13?
МЕГАСПОРАНГИЙ
Нуцеллус (мегаспорангий) (3. И. Никитичева) 134
Эпидермис нуцеллуса (3. Я Никитичева) 139
Париетальная ткань нуцеллуса (3. И. Никитичева) 141
Мегаспорогенез {В. Rodkiewicz, J. Bednara) 142
Археспорий (3. И. Никитичева, И. И. Шамров) 143
Спорогенная клетка {3. И. Никитичева) 145
Мегаспороцит {В. Rodkiewicz, J. Bednara) 146
Тетрада мегаспор {В. А. Поддубная-Арнолъди) 147
Классификация типов мегаспорангия (Е. Л. Кордюм) 147
ИНТЕГУМЕНТЫ
Интегумент (Я. Я Шамров) 150
Эпидермис (Я Я Шамров) 153
Интегументальный тапетум (3. И. Никитичева, Я Я Шамров) \5А
Паренхима интегумента (Я. Я Шамров) 156
Микропиле (О. Б, Проскурина) 157
Оперкулум (Я Я Шамров) 158
Микропиляриый воротничок (Я Я. Шамров) 158
ДРУГИЕ СПЕЦИАЛИЗИРОВАННЫЕ СТРУКТУРЫ
СЕМЯЗАЧАТКА
Ариллус (Г. А. Комар) 159
Обтуратор (Я Я Шамров) 161
Халаза (Я Я Шамров) 163
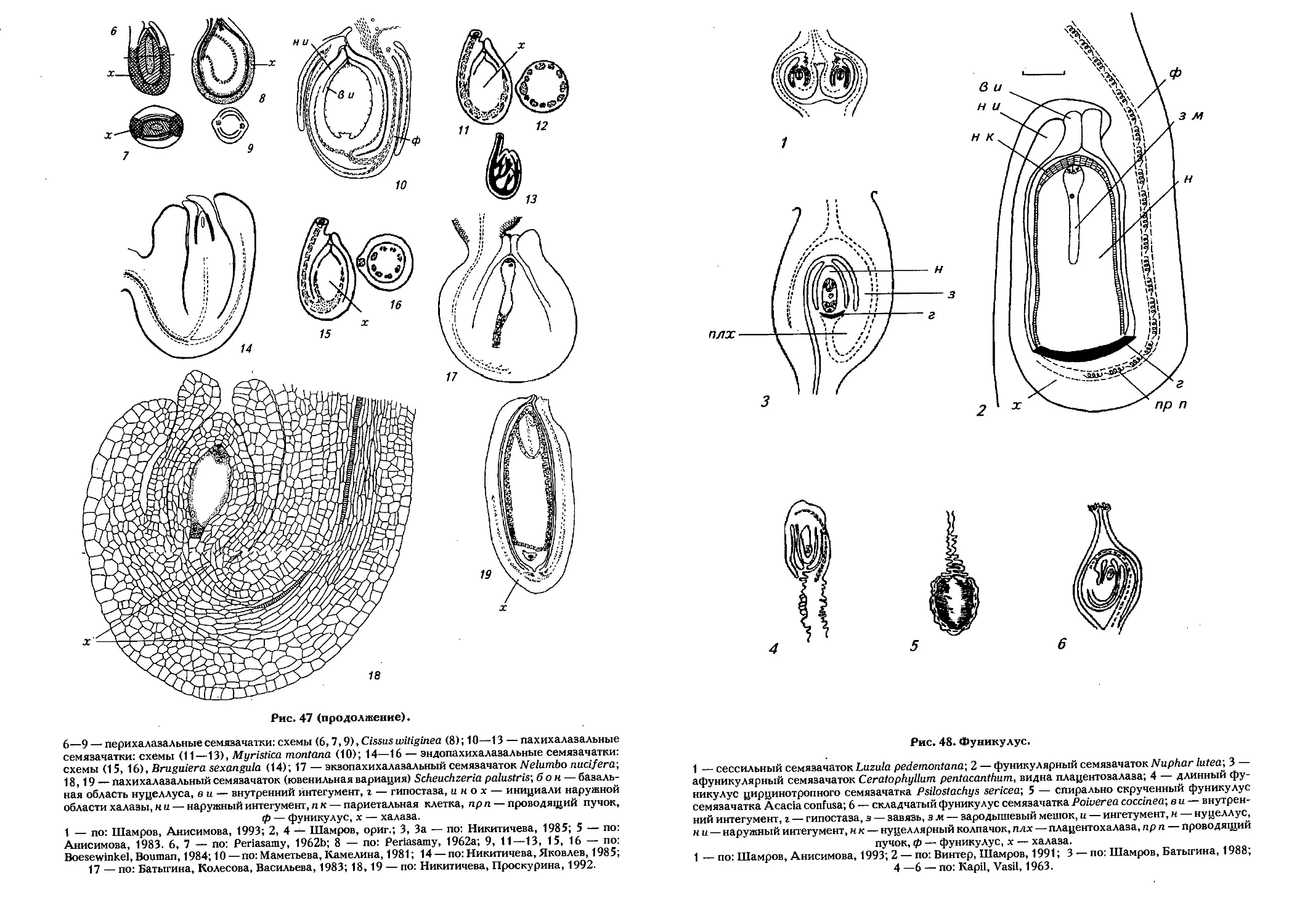
Фуникулус (Я. Я. Шамров) 165
Новый подход к трактовке структур базальной области
семязачатка (Т. Б. Батыгина, Я Я Шамров) 166
Гипостаза {Т. Б. Батыгина, И. И. Шамров) 168
Подиум (Я. Я Шамров) 169
Постамент (Я. Я Шамров) 171
ЗАРОДЫШЕВЫЙ МЕШОК
Зародышевый мешок (женский гаметофит): происхождение и
развитие {Е. Н. Герасимова-Навашина) 172
Зародышевый мешок: сформированный и зрелый (Т. Б.
Батыгина) 188
Яйцеклетка (Г. Я. Жукова) , 188
Синергида {Т. Б. Батыгина, Г. Я. Жукова) 192
Центральная клетка зародышевого мешка (Г. Я. Жукова) 195
Полярные ядра (Г. Я. Жукова, Т. Б. Батыгина, Г. Е. Гваладзе) .. 197
Антиподы (Г. Я. Жукова, Т. Б. Батыгина) 199
Ультраструктурные аспекты развития зародышевого мешка
(Scott D. Russell) 202
Цитокинез в зародышевом мешке (N. N. Bhandari, P. Chitralekhd) 207
Фрагмопласт (А. Е. Васильев) 208
Цитохимия зародышевого мешка (О. А. Хведынич) 209
Прижизненные исследования зародышевого мешка (О. Erdelska) 211
ТИПЫ РАЗВИТИЯ ЗАРОДЫШЕВОГО МЕШКА
Принципы классификации типов развития зародышевого мешка
(Я. Д. Романов) 213
8
ХАРАКТЕРИСТИКА РАЗЛИЧНЫХ ТИПОВ РАЗВИТИЯ
ЗАРОДЫШЕВОГО МЕШКА
Polygonum-тип (Г Е, Гваладзе, Г ,Е. Титова) 216
Oenothera-тип {Т. Б. Батыгина, В. Е. Васильева) 218
Allium-тип (Н. А. /Кинкина, Г. Е. Гваладзе) 222
Podostemum-тип (9. С. Терехин) 223
Balsamita-тип {3. И. Никипгичева) 225
Drusa-тип (В. П. Печеницын) 225
Fritillaria-тип (В. П. Печеницын) 226
Plumbagella-тип (Н. А. Жинкина) 227
Adoxa-тип {В. П. Печеницын) 227
Tulipa-tetraphylla {В. П. Печеницын) 228
Eriostemones-тип {В. П. Печеницын) 228
Penaea-тип {О. П Камелина, В. Коннова) 229
Plumbago-тип {Н.А.Жинкина) 230
Peperomia-тип (,3. И. Никипгичева, Г Е. Гваладзе) 231
Дискуссионные типы развития зародышевого мешка: 233
Schisandra-тип {Т. Б. Батыгина) 233
Gunnera-тип (З. И. Никипгичева) 233
Chrysanthemum-тип (И. И. Шамров) 233
Эволюция типов развития зародышевого мешка (В. П. Печеницын) 234
Иерархическая классификация зародышевых мешков (Э. С. Тере-
шн) 239
Эволюция женского гаметофита (Э. С. Терехин) 248
ТРАНСПОРТ ВЕЩЕСТВ В СЕМЯЗАЧАТКЕ
Проводящая система семязачатка {М. Ф. Данилова) 255
Питательные вещества и транспорт в семязачатке (М. Т. М.
Wllkmse) 256
Питательные вещества и транспорт в семязачатке {И. И. Шамров) 258
Структурные аспекты поступления веществ в зародышевый
мешок (О. Erdelska) 261
СЕМЯЗАЧАТОК И СЕМЯ С ПОЗИЦИИ НАДЕЖНОСТИ
БИОЛОГИЧЕСКИХ СИСТЕМ (Т. Б. Батыгина) 263
ЛИТЕРАТУРА 267
ИЛЛЮСТРАЦИИ 321
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ 507
НА ВКЛЕЙКАХ: КЛАССИКИ И АВТОРЫ ТОМА
CONTENTS
PREFACE 13
ACKNOWLEDGEMENTS .....................'..'.'.'.'.'.'.'.'.'.'.'.'.'.'.'..'. 17
INTRODUCTION 19
PART ONE — FLOWER
GENERAL NOTION
Flower (A. P. Melikjan, V. N. Tikhomirov) 29
Androecium (A. P. Melikjan) 34
Stamen (Г. В. Batygina) 35
Gynoecium (/. A. Korchagina) 37
Carpel (/. A. Korchagina) 37
Placenta (/. A. Korchagina) 38
PART TWO — ANTHER
GENERAL NOTION
Anther {O. P. Kamelina) 39
Microsporangium (O. P. Kamelina) 40
Epidermis «9. P. Kamelina) 41
Connective (O. P. Kamelina) 41
MICROSPORANGIUM WALL
Microsporangium wall (Г. В. Batygina) 42
Parietal layer (O. P. Kamelina) 44
Endothecium (O. P. Kamelina) 44
Middle layer (O. P. Kamelina) 45
Fibrous thickenings {O. P. Kamelina) 46
Tapetum Ю. P. Kamelina) 46
Tapetum and orbicules (Ubisch bodies) (G. El-Ghazaly) 47
Tapetal membrane (V. F. Ogorodnlkova) 49
Sporopollenin (N. I. Gabarajeva) 50
Tapetum: ultrastructural aspects (A. A. Chebotaru) 52
A new approach to the classification of tapetum types (o. P.
Kamelina) 56
A new approach to the classification of types of microsporangium
wall development (E. S. Teryokhln, Т. В. Batygina, I. I. Shamrov) . 60
MICROSPOROGENESIS
Microsporogenesis (B. Rodklewlcz, J. Bednara) 67
Archesporium (5. V. Shevchenko) 68
Sporogenous tissue (S. V. Shevchenko) 69
Microsporocyte (S. V. Shevchenko) 69
10
Meiosis (/. N. Gohtbovskaya) 70
Cytochemistry of meiosis (A M. Bugara) 76
Tetrad of microspores (С. К. Alimova) 79
Immunofluorescence of cytoskeleton during microsporogenesis
(B, Rodkiewicz, J. Bednara) 81
MICROSPORE
Microspore (G. K. Alimova) 82
Cytochemistry of microspores (А M. Bugara) 83
Ultrastructural aspects of microspore development (aggregates of
endoplasmic reticulum) (N. I. Gabarajeva) 84
POLLEN GRAIN
Pollen grain (male gametophyte) (G. К. Alimova) 86
Pollen wall (G. El-Ghazaly) 88
Generative cell (G. K. Alimova) 90
Ultrastructure of generative cell (G. L. Mogensen) 91
Vegetative cell (G. K. Alimova) 92
Ultrastructure of vegetative cell (G. L. Mogensen) 93
Sperm (G. Ya. Zhukova) 94
Dimorphism of sperms (G. L. Mogensen) 95
Cytochemistry of pollen grain (A. M. Bugara) 96
Nucleus and cell movement in developing pollen grain (Т. В.
Batygina, N. N. Kruglova) 99
Morphofunctional status of gametogenesis (A A. Chebotaru) 101
Pollinium (G. K. Alimova) 102
Male gametophyte evolution (#. N. Gerassimova-Navashina) 104
A compendium of genes expressed specifically in pollen that have
been cloned and characterized (D.A. Hamilton, J. P. Mascarenhas) 109
ANTHER: HISTOCHEMICAL AND ULTRASTRUCTURAL ASPECTS
(M. R. Vijayaraghavan, Bharti Chaudhry and Rajesh Shah) 112
CYTOMIXIS (/. N. Orlova) 115
CYTOPLASMIC MALE STERILITY (V. K. Simonenko) 117
DEVELOPMENT OF EMBRYO SACS IN ANTHER (Т. В. Batygina) ... 118
ANTHER AS A MODEL FOR STUDYING MORPHOGENETIC
POTENCIES AND PATHWAYS (Г. В. Batygina) 120
PART THREE — OVULE
GENERAL NOTION
Ovule (/. A. Korchagina) 122
Structure and functions of campylotropous ovule (F. Bouman) ... 131
Ovular primordium (/. /. Shamrov) 132
MEGASPORANGIUM
Nucellus (megasporangium) (Z. /. Nikiticheva) 134
Nucellar epidermis (Z. /. Nikiticheva) 139
Parietal tissue of nucellus (Z. /. Nikiticheva) 141
Megasporogenesis {B. Rodkiewicz, J. Bednara) 142
Archesporium (Z. I. Nikiticheva, I. I. Shamrov) 143
Sporogenic cell (Z. /. Nikiticheva) 145
Megasporocyte (B. Rodkiewicz, J. Bednara) 146
Tetrad of megaspores (У. A. Poddubnaya-ArnoldO 147
Classification of megasporangium types {E. L. Kordyum) 147
INTEGUMENTS
Integument (/. /. Shamrov) 150
Integumental epidermis (/. /. Shamrov) 153
Integumentary tapetum (Z. /. Nikiticheva, I. I. Shamrov) 154
Integumental parenchyma (/. /. Shamrov) 156
Micropyle {O. B. Proskurina) 157
Operculum (/. /. Shamrov) 158
Mycropyllar collar (/. /. Shamrov) 158
OTHER SPECIALIZED STRUCTURES OF OVULE
Arillus (G.A. Komar) 159
Obturator (/./. Shamrov) 161
Chalaza (/./. Shamrov) 163
Funiculus (/./. Shamrov) 165
A new interpretation of structures in ovule basal region (Т. В.
Batygina, I. I. Shamrov) 166
Hypostase (T. B. Batygina, I. I. Chamrov) 168
Podium (/./. Shamrov) 169
Postament (/./. Shamrov) 171
EMBRYO SAC
Embryo sac (megagametophyte): origin and development {H. N.
Gerassimova-Navashina) 172
Embryo sac — formed and mature (7\ B. Batygina) 188
Egg cell (G. Ya. Zhukova) 188
Synergid (Г. В. Batygina, G. Ya. Zhukova) 192
Central cell of the embryo sac (G. Ya. Zhukova) 195
Polar nuclei (G. Ya. Zhukova, T. B. Batygina, G. E. Gvaladze) 197
Antipodals (G. Ya. Zhukova, T. B. Batygina) 199
Fine structure of megagametophyte development (S. D. Russell) . 202
Cellularization of free-nuclear female gametophyte (N. N. Bhan-
dari, P. Chitralekha) 206
Phragmoplast {A. E. Vassilyev) 208
Cytochemistry of embryo sac (0. A. Khvedynich) 209
Observation of living embryo sac (O. Erdelska) 211
TYPES OF EMBRYO SAC DEVELOPMENT
Classification principles of types of embryo sac development (I. D.
Romanov) 213
DESCRIPTION OF VARIOUS TYPES OF EMBRYO
SAC DEVELOPMENT
Polygonum-type (G. E. Gvaladze, G. E. Titova) 216
Oenothera-type (Г. B. Batygina, V. E. Vasilyeva) 218
Allium-type (N. A. Zhinkina, G. E. Gvaladze) .' 222
Podostemum-type {E. S. Teryokhin) 223
12
Balsamita-type (Z. /. Nikiticheva) 225
Drusa-type (V. P. Pechenitsyn) 225
Fritillaria-type (V. P. Pechenitsyn) 226
Plumbagella-type (N. A. Zhinkina) 227
Adoxa-type (V. P. Pechenitsyn) 227
Tulipa-tetraphylla-type (V. P. Pechenitsyn) 228
Eriostemones-type (V. P. Pechenitsyn) -228
Penaea-type {O. P. Kamelina, V. Konnova) 229
Plumbago-type (N. A. Zhinkina) 230
Peperomia-type (Z. /. Nikiticheva, G. E. Gvaladze) 231
Questionable types of embryo sac development: 233
Schisandra-type (Т. В. Batygina) 233
Gunnera-type (Z. /. Nikiticheva) 233
Chrysanthemum-type (/. /. Shamrov) 233
Evolution of types of embryo sac development {V. P. Pechenitsyn) 234
Hierarchic classification of embryo sacs (E. S. Teryokhin) 239
Evolution of female gametophyte {E. S. Teryokhin) 248
TRANSPORT OF SUBSTANCES IN THE OVULE
Vascular system of the ovule (Л/. F. Danylova) 255
Nutrient supply and transport in the ovule (Л/. Т. М. Willemse) 256
Metabolite transport in developing ovule (/. /. Shamrov) 258
Structural aspects of embryo sac nutrition (0. Erdelska) 261
OVULE AND SEED FROM THE ANGLE OF RELIABILITY OF 263
BIOLOGICAL SYSTEMS (Г. Batygina)
REFERENCES 267
ILLUSTRATIONS 321
INDEX 507
INSETS: CLASSICS & CONTRIBUTORS OF THE VOLUME
Объясняйте значение слов и вы избавите мир
от половины заблуждений.
Р. Декарт
Дифференицаи/гя терминов — это не просто
игра словами, но совершенно необходимое
условие, чтобы разобраться в природе вещей.
Л. Ван дер Пейл
ПРЕДИСЛОВИЕ
Основная задача публикуемого 3-томного издания — обобщение классических
и современных представлений о строении и развитии репродуктивных органов
цветка, о процессах формирования семени. При работе над изданием широко
использованы материалы 5-томной сводки «Сравнительная эмбриология цветковых
растений» (1981, 1983,1985, 1987, 1990), которая содержит богатый материал для
теоретических обобщений, для анализа распространения признаков (или их
уникальности) и эволюционных преобразований структур, что открывает широкие
возможности для пересмотра прежних и создания новых классификаций, для
разработки новых концепций.
Работа над 5-томной сводкой «Сравнительная эмбриология цветковых
растений» показала, что в литературе существуют разногласия по многим вопросам
терминологии. Ряд теоретических проблем требует своего переосмысления.
Ощущается потребность в типизации целого ряда структур, классификация которых
ранее не была разработана. В связи с этим представляется актуальным
рассмотреть теоретические и терминологические вопросы эмбриологии, исходя из
анализа классического наследия и результатов новейших исследований.
При написании настоящей работы авторы использовали монографии
крупнейших ботаников и эмбриологов, в том числе: F. Netolitzky «Anatomie der
Angiospermen-Samen» (1926), К. Schnarf «Embryologie der Angiospermen.
Archegoniaten» (1929) и «Vergleichende Embryologie der Angiospermen» (1931), P.
Maheshwari «An Introduction to the Embryology of Angiosperms» (1950), А. Л. Tax-
таджян «Основы эволюционной морфологии покрытосеменных» (1964), В. А. Под-
дубная-Арнольди «Общая эмбриология покрытосеменных растений» (1964) и
«Цитоэмбриология покрытосеменных растений. Основы и перспективы» (1976),
G. Davis «Systematic Embryology of the Angiosperms» (1966), E. Corner «The seeds
of dicotyledons» (1976), «Embryology of Angiosperms» (1984) под ред. В. М. Johri.
Большую помощь в нашей работе оказал оригинальный труд П. А. Баранова
«История эмбриологии растений» (1955), который обобщил основные этапы развития
эмбриологии и показал значение работ отечественных эмбриологов для развития
мировой науки. Корректировка отдельных терминов и понятий проводились в
соответствии с «Латино-русским словарем для ботаников» Н. Н. Забинковой и М. Э.
Кирпичникова (1957), «Русско-латинским словарем для ботаников» М. Э. Кир-
пичникова и Н. Н. Забинковой (1977), а также другими словарями и
справочниками. Авторы статей использовали также периодическую литературу, включая
работы 90-х годов, опубликованные в журналах и материалах международных
симпозиумов.
Настоящее издание является оригинальной попыткой совместить принцип
терминологического словаря с монографическим описанием отдельных
структур и процессов. В то же время в настоящей работе расширены
традиционные границы эмбриологии. В нее включены вопросы покоя и прорастания
семени, экологические аспекты репродукции растений и ряд других вопро-
14
сов. Издание состоит из 3 томов. I том («Генеративные органы цветка»)
содержит три части: Цветок, Пыльник, Семязачаток. II том («Семя») состоит
из шести основных частей: Оплодотворение, Эндосперм, Перисперм,
Зародыш, Семенная кожура, Проросток. III том посвящен «Системам
репродукции».
В отличие от традиционной структуры словаря, «терминологические» статьи в
книге расположены не в алфавитном порядке, а по тематическому принципу в
целях создания целостной картины событий, происходящих в репродуктивных
органах цветка. Предметный указатель названий статей-терминов дается в конце
книги.
Текст включает ряд обобщающих концептуальных статей и терминологических
понятийных статей, посвященных отдельным структурам и процессам. В них
содержатся определение термина, его семантика и история вопроса, краткие данные
по генезису и функциям различных эмбриональных структур, основные
общепризнанные классификации генеративных структур и процессов их развития.
Например, описание развития стенки микроспорангия рассматривается в
соответствии с принятой классификацией G. Davis (1966), при описании типов развития
зародышевых мешков использованы принципы выделения и названия типов,
согласно классификации И. Д. Романова (1971, 1981). В то же время в книге
предлагается ряд новых или видоизмененных классификаций, учитывающих
современные данные, выдвигаются новые теоретические концепции, приводятся
современные представления об эволюционных преобразованиях генеративных
структур. Характеристика структур подтверждается примерами их наличия и
распространения среди цветковых растений, основанными на анализе материалов
5-томной сводки «Сравнительная эмбриология цветковых растений» (1981, 1983,
1985, 1987, 1990). Работы зарубежных авторов представлены без значительных
редакционных правок. В монографию включены также тексты из работ
исследователей-классиков с некоторыми изменениями, которые сохранили актуальность
до настоящего времени. Это статьи Е. Н. Герасимовой-Навашиной (1951, 1954,
1958), посвященные эволюции мужского и женского гаметофитов, И. Д. Романова
(1981) о принципах классификации зародышевого мешка и В. А. Поддубной-Ар-
нольди (1976) — тетрады мегаспор.
Названия концептуальных статей, а также разделов и ряда подразделов
выделены отдельной строкой, а названия терминологических статей напечатаны в
начале строки без абзаца. Из-за необходимости краткого изложения приводится
минимум ссылок на авторов, главным образом, в связи с приоритетностью открытий
и терминологии, уникальностью обнаруженного признака. Ссылка на авторов
отсутствует в тех случаях, когда высказывается общепринятое мнение или
описываемый признак широко распространен. Ссылки на использованную литературу
даны в конце каждой статьи (с указанием автора и года издания), а полные
библиографические данные представлены в общем списке литературы в конце тома.
Каждая статья снабжена иллюстративным материалом в виде рисунков,
микрофотографий, схем, графиков. Номер рисунка указывается в конце каждой статьи.
З.И. Никитичева
Explain the meanings of the words, and you will
deliver the world from a half of errors.
R. Descartes
This differentiation in terms is not a mere play
on words, but is necessary for the correct insight into
themature of things.
L. Van der Pijl
PREFACE
The principal aim of the present edition (in three volumes) is to make a
generalization of classical and up-to-date conceptions concerning generative organs in
flower, their structure, development and seed-formation processes. When working at
this publication an exhaustive use was made of the 5-volume book «Comparative
Embryology of Flowering Plants» (1981, 1983, 1985, 1987, 1990). The book contains
ample material to be employed in theoretical generalizations, when analyzing the
distribution of features (or their uniqueness) and evolutionary transformations of
structures. This offers vast possibilities for a revision of former classifications and for
the creation of new classifications and new concepts.
The work at the above-mentioned book disclosed a great disagreement in scientific
literature on many problems of terminology. A number of theoretical conceptions need
re-examination, while a lot of structures require typification as their classification was
not elaborated earlier. There is, therefore, an urgent need to scrutinize these theoretical
and terminological problems of embryology taking into account classical inheritance
and results of recent studies.
In preparation of the present edition the authors made use of the following
monographs and books by prominent botanists and embryologists: F. Netolitzky,
«Anatomie der Angiospermen-Samen» (1926); K. Schnarf, «Embryologie der
Angiospermen. Archegoniaten» (1929) and «Vergleichende Embryologie der
Angiospermen» (1931); P. Maheshwari, «An Introduction to the Embryology of
Angiosperms» (1950); A. L. Takhtajan, «Foundations of Evolutionary Morphology of
Angiosperms» (1964); V. A. Poddubnaja-Arnoldi, «General Embryology of
Angiosperms» (1964) and «Cytoembryology of Angiospermous Plants. Principles and
Perspectives» (1976); G. L. Davis, «Systematic Embryology of the Angiosperms»
(1966); E. Corner, «The Seeds of Dicotyledons» (1976); В. М. Johri (ed.), «Embryology
of Angiosperms» (1984). P. A. Baranov's original work «The History of Plant
Embryology» (1955), was particularly helpful for the authors. In the book main stages
in the history of embryology are generalized, emphasizing the importance of the studies
by Russian embryologists for world science. Formulations of separate terms and
concepts were made with the reference to the Latin-Russian Dictionary for Botanists by
N. N. Zabinkova and M.E. Kirpichnikov (1957), Russian-latin Dictionary by M. E.
Kirpichnikov and N.N. Zabinkova (1977) and other dictionaries and manuals. The
authors of the articles also made use of scientific periodicals including journals and
papers of international symposia published in 1990's.
The present publication is an original endeavour to combine the terminological
dictionary principle with the monographical description of separate structures and
processes. At the same time the traditional scope of embryology is enlarged. The
problems of seed dormancy and germination, ecological aspects of plant reproduction
and a number of other issues are also included.
16
The publication comprises three volumes. Volume 1 is divided into three parts:
Flower, Anther, Ovule. Volume 2, entitled «The Seed», comprises six principal parts:
Fertilization, Endosperm, Perisperm, Embryo, Seed Coat, Seedling. Volume 3 is
dedicated to reproduction systems.
In contrast to the traditional dictionary structure, terminological entries are
arranged not in the alphabetical order, but according to the thematic principle. The
purpose of this arrangement is to represent in their integrity all the events taking place
in the generative organs of the flower.
The text consists of a number of generalizing conceptual articles and terminological
concept entries dealing with separate structures and processes. In each entry the
definition of the term is given, its semantics and historical background are clarified,
information on the genesis and functions of different embryonal structures and
generally recognized classifications of generative structures and their development are
provided for example, microsporangium wall development is treated in conformity with
the accepted classification suggested by G. Davis (1966); a guiding principles and names
of types according to I. D. Romanov's classification (1971, 1981) are used in the
description of embryo sac development types.
At the same time a number of new or modified classifications, new theoretical
conceptions are suggested in the book, all of which are based on up-to-date information;
modern notions about evolutionary transformations of generative structures are also
dealt with.
The occurrence and distribution of the structures characterized are illustrated by
examples in flowering plants that are from the above-mentioned 5-volume book
«Comparative Embryology of Flowering Plants».
Works by foreign authors are given without much editing. The articles of classical
researchers, that remain up-to-date, are also presented in the book, though with some
reductions. These are the articles by H. N. Gerassimova-Navashina (1951, 1954, 1958)
where evolution of the male and female gametophytes is dealt with, articles by I. D.
Romanov (1981) on the principles of the embryo sac classification and by V. A.
Poddubnaja-Arnoldi (1976) on megaspore tetrads.
The titles of conceptual articles as well as of sections and subsections appear in
separate lines, while the titles of terminological entries are printed without spacing at
the beginning of the line.
The number of references had to be minimized, because of space limitations; the
references made are, for the most part, connected with the priority of discoveries and
terms, with the uniqueness of the feature discovered. No reference is made when a
current opinion is expressed or the feature described has a wide distribution. Short
references are given at the end of each article (the author's name and the date of
publication) while complete bibliographical data are placed at the end of the volume. Every
article or entry is provided with illustrative material, such as drawings,
microphotographs (LM, ТЕМ, SEM), schemes or diagrams, the illustration number
being indicated at the end of each article.
Z. I. Nikiticheva
X.
ГЕРАСИМОВА-НАВАШИНА Е. Н.
GERASSIMOVA-NAVASHINA E. N.
(1905—1993)
МАГЕШВАРИ П.
MAHESHWARI Р.
(1904—1966)
ПОДДУБНАЯ-АРНОЛЬДИ В. А.
PODDUBNAYA-ARNOLDI V. А.
(1902—1985)
РОМАНОВ И. Д.
ROMANOV I. D.
(1906—1980)
НАВАШИН С. Г.
NAVASHIN S. G.
(1857—1930)
СТРАСБУРГЕР Е.
STRASBURGER Е.
(1841—1912)
ФАМИНЦИН А. С.
FAMINTSYN A. S.
(1835—1918)
«Г^ к
V Л *
^ /с4ьыЯ-/*^—^
ШНАРФ К.
SCHNARF К.
(1879—1942)
17
БЛАГОДАРНОСТИ
Выражаю свою искреннюю благодарность всему авторскому коллективу и
особенно признательна коллегам из разных стран мира, откликнувшимся на
предложение участвовать в этой монографии: N. N. Bhandari, B. Chaudhry, P.
Chitralekha, R. Shah, M. R. Vijayaraghavan (Индия); F. Bouman, М. Т. М. Willemse
(Голландия); В. Rodkiewicz, J. Bednara (Польша); О. Erdelska (Словакия); G. Е1-
Ghazaly (Швеция); D. A. Hamilton, J. Mascarenhas, H. L. Mogensen, D. Scott Russell
(США); а также из стран СНГ: Е. Л. Кордюм, О. А. Хведынич, А. М. Бугара, В.
К. Симоненко (Украина); Г. Е. Гваладзе (Грузия).
Особую благодарность хотела бы выразить сотрудникам Отдела эмбриологии
и репродуктивной биологии В. Е. Васильевой, И. И. Шамрову, а также кураторам
3. И. Никитичевой, О. П. Камелиной и Г. К. Алимовой за их многостороннюю
помощь в подготовке этого издания. Признательна секретарям издания Г. Я.
Жуковой и О. Б. Проскуриной. Сердечно благодарна Н. А. Шинкиной, Л. В. Паньковой
за прекрасные репродукции многих рисунков и Л. М. Ротен- фельд — за
безукоризненное выполнение фотографий, а также Г. Е. Титовой, Е. А. Брагиной,
Н. П. Сторожук, Н. О. Босмановой и Ю. Е. Толкачевой за техническую помощь при
оформлении рукописи.
Сердечно благодарна М. Э. Кирпичникову за неоценимые консультации по
терминологическим вопросам.
Очень признательна чл.-корр. РАН Р. В. Камелину за содействие в издании
этой книги.
Я благодарна также сотрудникам издательства «Мир и Семья»
Н.В.Емельяновой и И.Г.Константиновой за доброжелательное отношение, эффективное и
энергичное сотрудничество.
Монография смогла увидеть свет благодаря финансовой поддержке
Российского Фонда фундаментальных исследований.
Т. Б. Батыгина
2 Генеративные органы цветка.
18
ACKNOWLEDGEMENTS
As the editor of this volume, I would like to express my gratitude to the team of
contributing authors. I am especially thankful to colleagues from different countries of
the world who accepted our proposal to participate in the preparation of this book,
namely, N. N. Bhandari, B. Chaudhry, P. Chitralekha, R. Shah, M. R. Vijayaraghavan
(India); F. Bouman, M. T. M. Willemse (Netherlands); B. Rodkiewicz, J. Bednara
(Poland); O. Erdelska (Slovakia); G. El-Ghazaly (Sweden); D. A. Hamilton, J.
Mascarenhas, H. L. Mogensen, D. Scott Russell (USA); also to our colleagues from CIS
countries: E. L. Kordyum, O. A. Khvedynich; A. M. Bugara, V. K. Simonenko
(Ukraine); G. E. Gvaladze (Georgia).
My special thanks are due to the research workers of the Embryology and
Reproductive Biology Department: V. E. Vasilyeva, I. I. Shamrov, as well as to the
curators Z. I. Nikiticheva, O. P. Kamelina and G. K. Alimova for their great help in the
preparation of the present edition. I am also grateful to the Edition Secretaries G. Ya.
Zhukova and O. B. Proskurina; to N. A. Zhinkina and L. V. Pankova for beautiful
illustrations; to L. M. Rotenfeld for excellent photography; to G. E. Titova, E. A.
Bragina, N. P. Storozhuk, N. O. Bosmanova and Yu. E. Tolkacheva for their valuable
technical assistance.
My heartfelt gratitude is due to professor M. E. Kirpichnikov for his valuable
consultations on terminology questions.
I am thankful to R. V. Kamelin, corresponding member of Russian Academy of
Sciences for his assistance in publication of the book.
My appreciation is due to workers of „World and Family" for their benevolence and
effective collaboration.
The financial support from the Russian Foundation for Fundamental
Researches, without which the book would not have been printed, is gratefully
acknowledged.
TATYANA BATYGINA
19
ВВЕДЕНИЕ
Эмбриология растений — наука о закономерностях зарождения и
первых этапов развития растительного организма — переживает полосу
расцвета, обусловленного общим прогрессом в естествознании. Эмбриологи
растений изучают сегодня не только процесс развития зародыша и семени в целом, но
и сложные процессы морфогенеза, происходящие при бесполом размножении,
различные аномалии, при половой репродукции. В последнее время эмбриология
из чисто морфологической науки все больше становится морфофизиологической и
экологоморфологической. Выявление морфогенетических и морфофизиологиче-
ских корреляций, определяющих нормальный ход развития зародыша и
проростка, невозможно без изучения меняющихся в процессе онтогенеза
взаимоотношений растения и среды.
Современная эмбриология ставит своей задачей управление развитием
организмов. Успехи в ее осуществлении возможны лишь при тесном сотрудничестве
эмбриологов с цитологами, физиологами, генетиками, экологами и
селекционерами. Эмбриологическая информация становится все более необходимой
для теоретических и экспериментальных исследований, касающихся
вопросов репродукции. Такие открытия XX века, как экспериментальная гап-
лоидия, парасексуальная гибридизация, выращивание растений из соматических
клеток, имеют общебиологическое значение. Они не могут, однако, быть в полной
мере использованы без разработки эмбриологических аспектов этих явлений.
Кроме того, и сама эмбриология растений располагает сегодня целым рядом
фундаментальных открытий в области репродукции, имеющих широкий выход в
практику (цитоплазматическая мужская стерильность - ЦМС, явления апомикси-
са и ряд других).
На стыке эмбриологии, антэкологии, карпологии, генетики, физиологии и
селекции сформировалось одно из новых, быстро развивающихся направлений —
репродуктивная биология. Разработка теоретических основ полового и
бесполого воспроизведения является составной частью репродуктивной
биологии. Последняя включает изучение различных взаимосвязанных этапов
онтогенеза: органогенез цветка, цветение, опыление, оплодотворение, эмбриогенез,
созревание семян, диссеминацию, прорастание семян и семенное воспроизведение
популяции. Все они так или иначе связаны с эмбриологией в широком смысле
слова.
Главное — разработка проблем амфимиксиса и апомиксиса, закономерностей
эмбриогенеза, явлений несовместимости и самосовместимости, выявление
закономерностей потенциальной и реальной семенной продуктивности, а следовательно,
и урожайности.
Развитие репродуктивной биологии важно в связи с интродукцией и
репатриацией редких, исчезающих и хозяйственно-ценных растений. К этому
направлению примыкают цитоэмбриологические исследования по изучению влияния
загрязнителей на репродуктивные структуры (антэкология), что связано с
проблемой охраны окружающей среды. Эти исследования в последнее время — в век
экологического стресса — приобретают все большее значение, так как
репродуктивные структуры больше всего подвержены влиянию неблагоприятных факторов
среды.
г*
20
Особый интерес представляет изучение явлений апомиксиса во всей их широте.
Вопросы, связанные с изучением партеногенеза, апоспории, диплоспории, поли-
эмбрионии нуждаются сейчас в более активном исследовании, особенно в связи с
запросами практики. Такие типы агамоспермии, как вивипария и адвентивная эм-
бриония, которые вероятно можно рассматривать как переходные формы между
семенным и вегетативным размножением, заслуживают особого внимания
эмбриологов.
Выявление закономерностей эволюции онтогенеза в связи с
вопросами филогении и систематики продолжает оставаться одним из
основных направлений в современной эмбриологии. Эмбриологические
признаки, в силу их относительного консерватизма, представляют собой
дополнительный материал для развития и уточнения наших представлений о
систематическом положении ряда порядков, семейств, родов и даже видов.
Одной из актуальных задач является исследование слабо изученных
таксонов, что необходимо для уточнения критериев эволюционной и
систематической значимости признаков.
Новые данные, накопленные в описательной и экспериментальной биологии,
морфологии, репродуктивной биологии и биологии развития, должны сыграть
свою роль в активизации работ в области эволюционной эмбриологии. Этой же
задаче служит и выход в свет в последнее время ряда монографий, освещающих
различные аспекты описательной и сравнительной эмбриологии (Поддуб-
ная-Арнольди, 1976, 1982; Johri, ed., 1984; Johri et al., 1992; «Сравнительная
эмбриология цветковых растений», 1981—1990; и др.), а также более глубокий
анализ работ основоположников эмбриологии растений (В. Гофмейстера, А. С. Фа-
минцына, А. Т. Болотова, Р. Суэжа, К. Шнарфа, И. Н. Горожанкина, Н. И.
Железнова, В. И. Беляева, С. Г. Навашина, Д. Джогансена, П. Магешвари, Е. Н.
Герасимовой-Навашиной, В. А. Поддубной-Арнольди, И. Д. Романова, М. С.
Яковлева и ряда других).
В 5-томной монографической сводке «Сравнительная эмбриология
цветковых растений» приведены характеристики семейств по системе А. Л. Tax-
таджяна (1980). Она подготовлена эмбриологами Ботанического института
им. В. Л. Комарова РАН (С.-Петербург) и в ней подводятся итоги
исследований в области описательной эмбриологии с начала XIX столетия до
наших дней. В работе развернута широкая панорама развития и
дифференциации эмбриональных структур у двудольных (I—IV тома) и однодольных
(V том) растений во всем их многообразии. Монография служит
руководством для дальнейших работ в области репродуктивной биологии, поскольку
содержит обобщенные данные о процессах полового и бесполого
размножения, включая апомиксис, у хозяйственно-ценных, редких и исчезающих
видов растений.
Это издание создало основы для углубления исследований в различных
областях эмбриологии семенных растений и в то же время показало необходимость
совершенствования имеющихся классификаций эмбриональных структур и
процессов у цветковых растений и их типизации. В последние годы российскими учеными
создан ряд новых классификаций: способов и типов репродукции у
покрытосеменных, типов развития зародышевого мешка и зародыша, пыльника тапетума,
апомиксиса. Была разработана оригинальная концепция системы репродукции
цветковых растении и выделен новый тип бесполого размножения — эмбриоидоген-
ный.
С накоплением новых данных повышаются объективность классификаций и их
соответствие реальным эволюционным процессам. Это способствует более
активному участию эмбриологов в разработке проблем систематики и филогении цвет-
21
ковых растений. Однако теоретические основы классификации эмбриональных
структур все еще разработаны недостаточно. Усиление систематической и
филогенетической значимости этих классификаций тесно связано с прогрессом наших
янаний о процессах эволюции растений, ее движущих факторах (экологических,
генетических и др.) и способах эволюционных преобразований онтогенеза
растений. Отсюда вытекает необходимость всестороннего углубленного внимания к
эмбриональным структурам, наиболее полно отображающим особенности эволюции
онтогенеза, а также необходимость обсуждения этих проблем и новых
классификаций на предстоящих конференциях и симпозиумах (с участием не только
эмбриологов, но и систематиков).
За сравнительно короткий период развития эмбриология растений стала
разветвленной областью биологии.
В эволюционной эмбриологии зародился новый подход к изучению проблем
эволюционной адаптации растений — эколого-морфологический. На примере
паразитных растений, установлено, что в основе эволюционных преобразований
их репродуктивных структур лежат такие общебиологические явления, как
метаморфоз, неотения, редукция. В этом аспекте рассмотрены гипотезы о возможных
механизмах эволюционного становления односемядольности зародыша в рамках
существующих гипотез о гетерохронии и синкотилии.
Экологическая эмбриология — важнейшее направление в исследованиях
раннего онтогенеза и выявлении в нем критических периодов. Познание
пластичности и толерантности систем репродукции также является предметом
исследования экологической эмбриологии. В связи с этим важное значение имеет изучение
эмбриональных структур (семязачатка, зародыша и др.) с позиции выявления
резервов и надежности биологических систем.
Это направление смыкается с популяциоиной эмбриологией, в задачу
которой входит изучение вариабельности морфогенеза и фенотипа в популяции
(изучение вариаций жизненного цикла и многообразия систем репродукции).
Иммунологическое направление в эмбриологии призвано сыграть
значительную роль в решении вопросов, связанных с проблемой совместимости и
несовместимости при гибридизации.
В последнее время все более ярко проявляется тенденция к синтезу
эмбриологических и генетических данных — генетической эмбриологии. Еще
Н. К. Кольцов (1935) писал, что «.. .только объединение этих двух наук
(экспериментальной эмбриологии и генетики — Т.Б.) между собой, а также с цитологией и
биохимией создаст единую науку, которая может разрешить общебиологические
проблемы». Все проблемы, связанные с морфогенезом: проблемы
дифференциации, специализации, оценки признаков, определение понятий «ген и признак»,
«генотип и фенотип», в той или иной степени касаются эмбриологии и генетики.
Это направление уже сформировалось в Саратовском университете.
В последнее время бурно стала развиваться экспериментальная
эмбриология, которая в отличие от описательной позволяет ответить на вопрос, не только
как, но и почему, складывается так или иначе сложный морфопроцесс
эмбрионального развития.
Известный крупнейший эмбриолог растений P. Maheshwari предсказывал еще
в 1950 г., что будущее эмбриологии несомненно принадлежит экспериментальному
направлению. Основным стимулом развития экспериментального направления в
эмбриологии растений являются, в первую очередь, запросы практической
селекции: выяснение причин стерильности и череззерницы и их преодоление;
использование адвентивных зародышей и др.
Моделью для изучения механизмов дифференциации и молекулярно-генети-
ческих закономерностей морфогенеза эмбриональных структур особенно в по-
22
следнее время, стали регенераты, полученные с помощью культуры
растительных клеток, тканей, органов и зародышей (эмбриокультура). Получены
интересные данные относительно влияния различных абиотических факторов на
морфогенез, рассмотрены возможные способы образования эмбриоидов и т. п. Успех эм-
бриокультуры зависит от правильно выбранной стадии развития генеративных
структур, используемых в культуре in vitro, от состояния донорских растений.
Актуальной становится разработка теоретических основ культивирования
in vitro как вегетативных, так и генеративных структур (завязь, пыльник,
семязачаток, зародыш, эндосперм, зародышевый мешок, спермий и др.). Сочетание
экспериментального подхода со знанием деталей генезиса эмбриональных
структур, позволяет предсказать пути морфогенеза регенерантов, оптимальную стадию
развития зародыша для эмбриокультуры и т. п. Это направление смыкается с
клеточной инженерией и биотехнологией.
При создании генетико-селекционных программ и разработке эффективных
биотехнологий все большее значение придается эмбриологическим данным, по
которым можно судить о том, как протекают процессы, приводящие к образованию
нормальных семян, и о причинах аномалий, сопровождающих ход эмбриональных
процессов.
В результате разработанного эмбриологами Ботанического института РАН
(С.-Петербург) системного подхода применительно к генеративным структурам,
используемым в культуре in vitro, выдвинуты отдельные теоретические
положения (например, автономность зародыша, критические стадии в развитии
генеративных структур и др.), которые применяются в селекционной работе. С учетом
этих знаний получены новые формы растений.
Становятся более очевидными перспективы развития прикладной
эмбриологии. Среди проблем можно выделить:
— экологические проблемы, связанные с разработкой подходов и методов
получения нормальных семян редких и хозяйственно-ценных растений;
сохранение биологического разнообразия — создание банка генетического материала
(семян, зародышей, половых клеток); выявление уровня пластичности и
толерантности систем репродукции и соотношения различных способов размножения у
разных таксонов при воздействии повреждающих факторов;
— биотехнологические проблемы, связанные с созданием эффективных
технологий для массового тиражирования новых форм и сортов, а также редких и
исчезающих видов растений на базе эмбриоидогенеза (соматического
эмбриогенеза) и гемморизогенеза (органогенеза);
— сельскохозяйственные проблемы — повышение реальной
продуктивности, создание новых форм и сортов с применением методов отдаленной и парасек-
суальной гибридизации, преодоление нескрещиваемости и т. д.
Прогресс эмбриологии тесно связан с использованием современных методов
(электронной микроскопии, ауторадиографии, радиоактивных изотопов,
моделирования, микрохирургии), что открывает новые перспективы исследования на
различных уровнях организации (молекулярном, клеточном, тканевом,
органном, организменном и популяционном).
Применение флюоресценции, в том числе иммунофлюоресценции,
фазового контраста, электронной (ТЭМ, СЭМ) и интерференционной контрастной
оптики Nomarski, а также методов современной клеточной биологии —
иммуноцитохимии, цейтраферной съемки, «vidio-image processing» — уже
позволило получить ряд уникальных данных по тонкой структуре и функциям
репродуктивных органов и тканей. Выявлен диморфизм спермиев,
возможность энзиматического изолирования генеративной клетки и спермиев,
зародышевого мешка, а также отдельных клеток женского гаметофита. Исполь-
23
зование эндоэнзимных маркеров позволило выявить специфические
особенности мейоза.
Количественные исследования мРНК в пыльцевом зерне и спермиях уже
позволили получить новые данные об их тонкой структуре. Идентифицирована
мРНК в зрелом пыльнике и выявлены специфические гены, контролирующие
микроспорогенез.
Достижения эмбриологической науки за последние десятилетия поставили
эмбриологов перед необходимостью написания нового обобщающего труда.
Предпринята попытка рассмотреть генезис отдельных эмбриональных структур с позиции
системного подхода, а также по возможности наиболее полно и в современной
интерпретации осветить вопрос о репродукции цветковых растений.
Следует отметить, что последние международные конгрессы и симпозиумы по
эмбриологии растений (Италия, 1988; СССР, 1990; США, 1992; Австрия, 1994), в
которых участвовали не только эмбриологи растений, но и генетики, физиологи,
цитологи, биотехнологи, еще раз подтвердили своевременность публикации
данного издания. Биологи разных специальностей остро нуждаются в обобщении
эмбриологических данных и особенно в единой терминологии.
Все выше сказанное позволило коллективу авторов приступить к подготовке
настоящего трехтомного издания «Эмбриология цветковых растений.
Терминология и концепции». В 1 -м томе этого издания принимают участие
эмбриологи и морфологи Ботанического института им. В. Л. Комарова РАН, а также
коллеги из стран СНГ (Украина, Грузия) и других стран мира (США, Голландия,
Польша, Словакия, Индия, Швеция). В этом издании более полно, чем в одной из
последних монографий по эмбриологии растений (John, ed., 1984; Johri et al.,
1992), будут представлены результаты исследований, гипотезы и концепции
отечественных эмбриологов.
Столь большому авторскому коллективу практически невозможно написать в
едином стиле все главы. Поэтому редактор ставил своей целью выдержать единый
смысловой план книги и избежать излишнего повторения материала в разных
разделах. Отдельные разделы помимо изложения объективных данных
отражают, конечно, и взгляды их авторов на описываемые структуры и процессы. Это
придает их работам в отдельных случаях дискуссионный характер. Но как раз
дискуссии и отражают существо науки. В этом смысле издание будет полезно в
качестве основы для нового этапа синтеза эмбриологических знаний. Авторский
коллектив надеется, что монография будет полезной научным работникам:
эмбриологам, анатомам, систематикам, генетикам, физиологам, цитологам и
экологам, специалистам в области молекулярной биологии, биотехнологам,
растениеводам и селекционерам, а также студентам и преподавателям биологии высших
учебных заведений и средних школ и всем, интересующимся биологией. Выход
трехтомной монографии по эмбриологии растений по замыслу авторов должен
показать, насколько велика роль современной эмбриологии в решении
общебиологических проблем, особенно в век экологического стресса.
Думаю, что выход в свет монографии послужит стимулом для дальнейших
теоретических и экспериментальных исследований в эмбриологии растений. Мы
будем рады получить советы и замечания, которые учтем при написании следующих
томов.
Татьяна Батыгина
24
INTRODUCTION
Embryology of plants, as a science studying the regularities of the origin
and earliest developmental stages of the plant organism, is at present at its
heyday, which can be explained by the general progress in natural sciences. Plant
embryologists are nowadays investigating not only the embryo and seed development
taken in its integrity, but also sophisticated processes of morphogenesis involved in
asexual reproduction as well as various anomalous phenomena occurring in sexual
reproduction. Embrylogy, instead of being a purely morphological branch of science, is
nowadays acquiring the features of morpho-physiological and ecologo-morphological
science. Morpho-genetic and morpho-physiological correlations, which determine the
normal development of the embryo and seedling, cannot be detected without
investigation of interrelationships between the plant and its environment which change
during ontogenesis.
The objective of modern embryology is to be able to control the development of
organisms. This aim can be realized only on condition that there is a close collaboration
of embryologists with experts in cytology, physiology, genetics, ecology and breeders.
Embryological information is increasingly getting indispensable in theoretical and
experimental studies of reproduction problems. Such discoveries made in the 20th
century as experimental haploidy, parasexual hybridization, plant propagation from
somatic cells are all of great general biological significance. They cannot, however, be
used to full advantage without further elaboration of the embryological aspects of these
phenomena. Embryology of plants, in addition, possesses a great number of
fundamental discoveries in the domain of reproduction that have a considerable
practical importance, e.g., cytoplasmic male sterility (CMS), the apomixis phenomenon,
etc.
At the crossing of embryology, anthecology, carpology, genetics, physiology and
plant breeding a new and rapidly progressing branch of science, reproductive
biology has emerged. Creation of theoretical foundations for sexual and
asexual reproduction phenomena is an integral part of reproductive biology. It
embraces studies of various interrelated stages of ontogenesis: flower organogenesis,
flowering, pollination, fertilization, embryogenesis, seed ripening, dissemination, seed
germination and seed reproduction in the population. All of these are in this or that
way connected with embryology in the broad sense.
The principal purpose is to research the problems of amphimixis and apomixis, the
laws of embryogenesis, the phenomena of incompatibility and self-compatibility, as well
as to elucidate the laws of potential and real seed productivity and, consequently, those
of crop yield.
The development of reproductive biology is especially important for the introduction
and repatriation of rare and vanishing plants as well as of plants that are of great value for
agriculture. Within the scope of this branch of science are also cytoembryological studies
concerned with the influence of pollutants on reproductive structures (anthecology).
Such studies are the environmental protection programme. The importance of this kind of
investigations has considerably grown of late, in the age of ecological stresses, because it is
reproductive structures that are affected to a highest degree by unfavourable
environmental factors.
Of special interest are apomixis phenomena requiring full-scale studies.
Parthenogenesis, apospory, diplospory, polyembrybny need nowadays more intensive
25
investigations to satisfy practical demands. Such types of agamospermy as vivipary and
adventive embryony, i. е., possible transitional forms between seed and vegetative
propagation, require special attention of embryologists.
The search for laws of ontogenesis evolution in connection with the
problems of phylogeny and systematics has remained one of the main directions to
follow in modern embryology. Embryological features, being relatively conservative,
may be employed to supplement and specify our concepts concerning systematic positions
occupied by a number of orders, families, genera and even species. One of the urgent tasks
in the investigation of poorly studied taxa, that is indispensible in specifying the criteria of
evolutionary and systematic importance of embryological features.
New data accumulated by descriptive and experimental biology, morphology,
reproductive and developmental biology should stimulate studies of evolutionary
embryology. A number of recently published monographs should also contribute to this
stimulation, namely, those dedicated to various aspects of descriptive and
comparative embryology (Poddubnaja-Arnoldi, 1976, 1982; Johri, ed., 1984; Johri
etal., 1992; «Comparative Embryology of Flowering Plants», 1981—1990 (in Russian);
etc.) or representing a profound analysis of the works of the founders of plant
embryology, namely W. Hofmeister, A. S. Famintzyn, A. T. Bolotov, R. Soueges, K.
Schnarf, J. Goroschankin, N. Zheleznov, W. I. Belyaev, S. G. Navashin, D. A. Johansen,
P. Maheshwari, H.N. Gerassimova-Navashina, V. A. Poddubnaja-Arnoldi, I.D.
Romanov, M. S. Yakovlev, and others.
In the 5-volume book «Comparative Embryology of Flowering Plants» families are
characterized according to A. L. Takhtajan's system (1980). The book was compiled by
the embryologists of the Komarov Botanical Institute (Russian Academy of Sciences, St.
Petersburg). Summarized in the book are the results of research in descriptive
embryology that has been made from the beginning of the XIX century up to the present
day. The publication represents a wide panorama of the development and differentiation
of embryonal structures in dicotyledonous plants (Volumes I to IV) and
monocotyledonous plants (Volume V) embracing all the forms in their multiplicity. The
book is intended as a manual and guide for future work in reproductive biology, since it
contains generalized data on the processes of sexual and asexual reproduction (including
apomixis) in economic plants, rare and vanishing plant species.
The book formed a foundation for detailed investigations in various fields of the
embryology of seed plants and, at the same time, it demonstrated the necessity to refine
the existing classifications of the embryonal structures and processes in flowering plants
along with their typification. In recent years a number of new classifications have been
worked out by Russian scientists: that of the modes and types of reproduction in
angiosperms, of types of the embryo sac and embryo development, of the anther, of
tapetum, and of apomixis. An original conception has been elaborated concerning the
reproduction system of flowering plants and a new type of asexual reproduction —
embryoidogenic — has been recognized.
Classifications achieve a higher degree of objectivity and closer correspondence to
actual evolutionary processes with the accumulation of new data. This enables the
embryologists to take an increasingly active part in the work at the problems of
systematics and phylogeny of flowering plants. However, theoretical foundations of
classification of embryonal structures have been elaborated insufficiently. The
significance of the these classifications in systematics and phylogeny can be increased
through the progress in our understanding of the evolutionary events taking place in
plants, evolution factors (ecological, genetic, etc.), and of the ways of evolutionary
transformations in plant ontogenesis. Embryonal structures, therefore, require special
attention as they embody, most comprehensively, the peculiarities in the evolution of
ontogenesis. All these problems and new classifications necessitate discussions at
26
scientific conferences and symposia with the participation of embryologists and
taxonomists.
During a comparatively short period of its development, embryology of plants has
become a ramified field of biology.
In evolutionary embryology a new approach has been suggested to the study of the
problems of evolutionary adaptation in plants — an ecologp-morphological
approach. While investigating parasitic plants it was ascertained that underlying the
evolutionary transformations of their reproductive structures are such general
biological phenomena as metamorphosis, neoteny, reduction. In view of this aspect, but
within the framework of heterochrony and syncotyly hypotheses, some new hypotheses
were considered on the possible mechanisms of evolution of monocotyledonous emryo.
Ecological embryology is the most important direction in the studies of early
ontogenesis detecting critical phases in it. Plasticity and tolerance of reproduction
systems are also the subject of ecological embryology. Of particular importance is the
investigation of embryonal structures (ovule, embryo, etc.) on the basis of reliability of
biological systems.
This direction merges with population embryology aimed at studying
morphogenetic and phenotypic variability in a population (studying variation in life
cycle and diversity of reproduction systems).
Immunological direction in embryology is to play an essential role solving the
problems of compatibility and incompatibility in hybridization.
Recently the tendency has been observed towards the synthesis of embryological
and genetic data, i. е., towards genetic embryology. It was N. K. Koltsov (1935) who
wrote «Only unification of these two branches of science (experimental embryology and
genetics- Т. В.), as well as their cooperation with cytology and biochemistry, are to create
an indivisible science capable of solving the problems of general biology». Within the
scope of embryology and genetics are all the problems connected with morphogenesis:
differentiation, specialization, evaluation of characters, definition of such concepts as
«gene and character», «genotype and phenotype». This trend has emerged at the Saratov
University (Russia).
A rapid development of experimental embryology can also be observed
nowadays. In contrast to descriptive embryology this branch of science not only
elucidates the patterns of complex morpho-process of the embryonal
development, but also discloses the reasons why the process has this or that
particular trend.
The outstanding plant embryologist P. Maheshwari, in 1950, predicted a promising
future for experimental embryology. The demands of practical breeding serve as the
main stimulus for the ■ development of the experimental direction in embryology of
plants, e.g., finding out the causes of sterility and grain gene deficiency with their
subsequent correction; use of adventive embryos, etc.
Regenerants obtained from cultures of plant cells, tissues, organs and
embryos (embryoculture) have recently become a model studying mechanisms of
differentiation and molecular-genetic regularities in morphogenesis of embryonal
structures. Some interesting results were obtained on the effects of various
abiotic factors on morphogenesis, possible ways of the embryoid formation were
proposed, and so on. The success of an embryoculture depends on the correct
choice of the developmental stage of the generative structure to be used in vitro
culture, as well as on the state of donor plants. Of vital importance is an
elaboration of theoretical basis for in vitro cultivation of vegetative and
generative structures (ovary, anther, ovule, embryo, endosperm, embryo sac,
sperm, etc.). The experimental approach, combined with a detailed knowledge
of the genesis of reproductive structures, allows one to predict the
27
morphogenetic pathways of regenerants, to determine the optimal developmental
stage of the embryo to be used for embryoculture, etc. This direction contacts
with cell engineering and biotechnology.
The embryological data are increasingly growing in importance for genetic and
breeding programmes and effective methods in biotechnology, providing information
on the processes resulting in normal seed formation as well as the causes of anomalies
arising in the course of embryonal processes.
A system approach to generative structures used for in vitro cultures was elaborated
by the embryologists of the Botanical Institute (Russian Academy of Sciences,
St.Petersburg). It enabled them to arrive at some theoretical conceptions, in particular,
such as the autonomy of the embryo, critical stages in the development of generative
structures. These concepts are applied in breeding work, resulting in the production of
new forms of plants.
At present, prospects of applied embryology can be clearly seen. Among the
problems to be addressed, the following ones should be mentioned.
— Ecological problems: the elaboration of special methods to obtain normal seeds
of rare plants and of economic ones; Conservation of biological diversity, i. е., it is vital
to establish a bank of genetic material (seeds, embryos, gametes); estimating the degree
of plasticity and tolerance of reproductive systems, and the relationship between
different modes of reproduction in various taxa of plants exposed to injurious factors.
— Biotechnological problems: development of effective methods for mass
replication of new forms and varieties as well as of rare and vanishing plant species.
This can be done on the basis of embryoidogenesis (somatic embryogenesis) and
hemmorhizogenesis (organogenesis).
— Agricultural problems: increasing real productivity; creation of new forms and
varieties by applying distant and parasexual hybridization; overcoming cross-
incompatibility barriers, etc.
Progress in embryology is to a great extent dependent on application of modern
methods of electron microscopy, autoradiography, radioactive labelling, modelling,
micro-surgery, etc. These methods open new vistas for research at different levels of
organization: molecular, cellular, that of the tissue, organ, organism and population.
Unique data on fine structure and functions of generative organs and tissues have
been obtained with the aid of such methods as fluorescence (including
immunofluorescence), phase contrast, electronic optics (ТЕМ, SEM), Nomarski
interference and contrast optics as well as by applying the methods of modern cell
biology, i.e., those of immunocytochemistry, video-image processing. Some other
discoveries should be mentioned: sperm dimorphism, feasibility of enzymatic isolation
of such structures as generative cells and sperms, reproductive cells, embryo sac, also
of individual cells of the female gametophyte. Utilization of endoenzyme markers
enabled the researchers to elucidate specific features of meiosis.
Quantitative mRNA studies in pollen grains and sperms provided new data on their
fine structure. mRNA was identified in mature anther, so were specific genes controlling
microsporogenesis.
Major advances in embryology that have been made in recent decades call for a new
comprehensive survey, such as that offered, it is hoped, by the present book. An
endeavour has been made to adopt the system approach when treating the genesis of
particular embryonal structures; reproduction of flowering plants is viewed from a
modern perspective.
It should be mentioned that latest international congresses and symposia dedicated
to embryology of plants (Italy, 1988; USSR, 1990; USA, 1992; Austria, 1994) once
again reaffirmed the need for such publication. Taking part in the symposia were not
only plant embryologists, but also experts in genetics, physiology, cytology,
28
biotechnology. Biologists of different specialities are in extreme need of generalized
embryological data and especially of unified terminology.
All the above prompted the team of authors to undertake the preparation of the
present 3-volume edition «Embryology of Flowering Plants. Terminology and
Concepts». Participating in the edition are experts in embryology and morphology of
the Komarov Botanical Institute (Russian Academy of Sciences), colleagues from CIS
(Ukraine and Georgia) and other countries of the world: the USA, Netherlands, Poland,.
Slovakia, India, Sweden. The results of investigations, hypotheses and conceptions by
Russian embryologists will be presented in a more comprehensive way than in any of
the latest monographs on plant embryology (Johri, ed., 1984; Johri et al., 1992).
It is hardly possible for a large team of authors to observe a single standard of style
throughout the book. It was the Editor's task, therefore, to adhere to the same semantic
pattern and avoid unnecessary reiterations of material in different sections. Particular
articles, along with the objective presentation of the material, unavoidably reflect the
author's own view of the structures and processes described. This makes some of the
articles open to discussion. But disputes are essential in science. In this respect the
publication will be useful as a basis for a new stage of the synthesis in embryological science.
The team of authors would like to express their hopes that the book will be useful to
research workers, experts in embryology, anatomy, taxonomy, genetics, physiology,
cytology and ecology; to specialists in molecular biology, biotechnology, plant-growing
and breeding. It may also be of great use to biology students and lecturers of colleges
and universities, and to all thoses interested in biology. This 3-volume book on the
embryology of plants, should hopefully demonstrate the great role played by modern
embryology in solving general biological problems in the age of ecological stresses.
I do believe that when the book is published it will serve to further theoretical and
experimental research in plant embryology. Any criticisms and useful suggestions are
welcome and will be taken into account in future work.
Цветок
29
ЧАСТЬ I — ЦВЕТОК
ОБЩЕЕ ПРЕДСТАВЛЕНИЕ
ЦВЕТОК — важнейшая репродуктивная структура покрытосеменных, в которой
происходит микро- и мегаспорогенез, микро- и мегагаметогенез, опыление и
оплодотворение, развитие зародыша и в конечном счете — образование семян и плодов.
Его рассматривают чаще всего как метаморфизированный, одноосный,
укороченный побег с ограниченным ростом, выполняющий репродуктивную функцию.
Цветки необычайно разнообразны по строению, окраске и размерам,
варьирующим от нескольких мм до одного метра и более в диаметре
(например, у раффлезии).
Цветок заканчивает собой стебель, главный или боковой. Часть стебля под
цветком, лишенная обычно листьев, называется цветоножкой. Цветоножки у
разных растений различны по размерам и играют большую роль при формировании
разнообразных соцветий (зонтиков, щитков, кистей и др.). Иногда цветоножка
укорочена, едва выражена или даже отсутствует; в последнем случае цветки
называют сидячими.
Цветоножка переходит в ось цветка, или цветоложе. Цветоложе обычно шире
цветоножки и характеризуется слабо выраженными междоузлиями. На узлах
цветоложа располагаются все части цветка, как стерильные (чашелистики и
лепестки) , так и спороносные (тычинки и плодолистики). Цветоложе может иметь
различную форму — удлиненную, уплощенную, выпуклую. В некоторых группах
покрытосеменных цветоложе при созревании плодов сильно меняет размеры,
окраску и является аттрактантом для биотических агентов, распространяющих
плоды (например, у земляники, шиповника и др.).
Чашелистики и лепестки составляют вместе околоцветник, стерильную часть
цветка. Чашелистики обычно служат для защиты внутренних частей цветка,
особенно до его распускания (в бутоне), а если они зеленые, то и дополнительными
органами фотосинтеза. Иногда чашелистики становятся лепестковидными и
принимают на себя функцию лепестков, привлекая внимание биотических агентов,
производящих перекрестное опыление (например, у дельфиниума, борца,
купальницы из лютиковых). Чашелистики могут служить также для защиты
развивающихся плодов, могут участвовать в формировании структуры плодов,
способствовать их распространению. Благодаря многообразию биологических функций,
выполняемых чашелистиками, они подвергаются разнообразным видоизменениям.
Чашелистики имеют листовую природу. Они, по-видимому, произошли из
верховых вегетативных листьев. Переходы от верховых листьев к чашелистикам
хорошо выражены у представителей ряда семейств (например, у пионовых,
каликантовых, диллениевых и др.).
Лепестки, образующие венчик цветка, играют обычно иную роль, чем
чашелистики. На ранних стадиях развития цветка они также имеют функцию защиты
внутренних частей цветка, а в дальнейшем, в раскрытом цветке, их основная
функция — привлечение опылителей и содействие успешному перекрестному
30
Генеративные органы цветка
опылению. Происхождение лепестков у разных групп цветковых различно. В
подавляющем большинстве случаев лепестки происходят из тычинок, которые
стерилизовались. Особенно выражена тычиночная природа лепестков у
представителей таких семейств, как лютиковые, маковые, нимфейные, розоцветные, а также
у многих других. Однако не у всех представителей покрытосеменных лепестки
имеют тычиночное происхождение; у ряда, в основном архаических, семейств,
таких как магнолиевые, пионовые, винтеровые, лимонниковые, они, также как и
чашелистики, имеют листовое происхождение. Поэтому в настоящее время в цветках
принято различать андропеталы — лепестки, возникшие из тычинок, и брактео-
петалы — лепестки, являющиеся производными прицветных листьев (брактей).
Размеры, форма и окраска венчика отличаются большим разнообразием и
связаны с биологией опыления. Лепестки часто срастаются краями, образуя
спайнолепестный венчик. Такой венчик возникает из свободнолепестного независимо в
разных линиях эволюции покрытосеменных растений. Когда в цветке имеются
как чашечка, так и венчик, то околоцветник называют двойным. В тех случаях,
когда либо лепестки отсутствуют, либо нет ясно выраженных различий между
чашелистиками и лепестками, околоцветник называется простым. Простой
околоцветник бывает венчиковидным, если его листочки ярко окрашены, либо чашеч-
ковидным, если он невзрачный, окрашенный в зеленоватые тона.
Удобно различать несколько типов цветков в зависимости от наличия
околоцветника и его строения:
ахламидный — цветок без околоцветника, голый (предполагается его
первичная беспокровность); в некоторых случаях функции околоцветника могут
выполнять верхушечные вегетативные листья;
гаплохламидный — цветок, с первично недифференцированным простым
околоцветником, листочки которого расположены по спирали или циклами —
мутовками; листочки околоцветника могут быть брактеоидными (чашечковидными)
или петалоидными (лепестковидными);
диплохламидный — цветок, в котором внутренние стерильные филломы
отличаются от наружных (т.е. имеется чашечка и венчик);
апохламндный — голый цветок, но не первично беспокровный, а такой, в
котором несомненно произошла редукция околоцветника, приведшая к его
исчезновению; если вследствие редукции цветок утратил чашелистики, его можно назвать
апосепальным, а если в процессе эволюции исчезли лепестки — апопетальным.
Внутрь от околоцветника расположены тычинки, а в центре — плодолистики.
Совокупность тычинок в цветках называется андроцеем, а совокупность
плодолистиков — гинецеем.
В некоторых специализированных цветках тычинки становятся
стерильными, изменяют форму и превращаются в так называемые стаминодии (см.
ТЫЧИНКА).
Внутреннюю часть цветка занимают плодолистики. Морфологически и
функционально плодолистики соответствуют мегаспорофиллам. У ряда архаических
покрытосеменных сохранился довольно примитивный тип плодолистика
(например, у родов дегенерия и тасманния). Он состоит из короткой ножки и сложенной
вдоль средней жилки пластинки, края которой не замкнуты, они не только не
срастаются, но фактически едва соприкасаются. Сближенные края плодолистика
представляют собой примитивную рыльцевую поверхность, покрытую
многочисленными железистыми волосками. Срастание этих сближенных краев у таких
типов плодолистиков происходит после опыления, при формировании плода. У
подавляющего большинства покрытосеменных плодолистики в процессе эволюции
срослись краями и сформировали пестики. В пестике выделяются рыльце,
улавливающее и удерживающее пыльцевые зерна, столбик (стилодий), который при-
Цветок
31
поднимает рыльце над завязью и представляет собой тракт, по которому растет
пыльцевая трубка, и завязь, где формируются семязачатки, в которых образуется
женский гаметофит, или зародышевый мешок.
Пестик мультифункционален, причем его функции строго меняются в
онтогенезе. На самых ранних этапах развития он защищает развивающиеся
семязачатки от неблагоприятных условий среды, пестик представляет собой влажную
камеру, в которой формируются семязачатки, а стенки его на этом этапе также и фо-
тосинтезируют. Рыльце, которое в дальнейшем улавливает и удерживает на своей
поверхности пыльцевые зерна, представляет собой селектор, отбирающий и
стимулирующий прорастание пыльцы своего вида. В семязачатках,
располагающихся внутри завязи пестика, происходит оплодотворение яйцеклетки, формируется
зигота, зародыш, в дальнейшем они превращаются в семена, обычно хорошо
защищенные плодолистиком, который к моменту созревания семян превращается в
плод и способствует их дальнейшему распространению.
Наиболее архаичные покрытосеменные характеризуются цветками, в
которых плодолистики (пестики) свободные, они обычно присутствуют в
большом числе и располагаются спирально (например, гинецей магнолии,
лютика). Такой гинецей называется апокарпным; число плодолистиков при этом
может быть очень различно — от многих до одного (мономерный гинецей).
В процессе эволюции гинецея плодолистики могут срастаться между собой,
и из апокарпного гинецея возникает ценокарпный. Обычно различают три
типа ценокарпного гинецея: синкарпный, паракарпный и лизикарп-
ный. Во всех этих типах отдельные стилодий могут оставаться свободными
или срастаются, образуя общий столбик. Если плодолистики свободны и
каждый из них образует отдельный пестик, то верхняя удлиненная часть
пестика, несущая рыльце, называется стилодием. Если плодолистики
срослись, то верхушки их могут все же оставаться свободными, и тогда пестик
имеет несколько свободных стилодиев, если же стилодий срастаются, то
образуется столбик.
Во многих линиях эволюции покрытосеменных независимо и параллельно
произошло срастание ценокарпного гинецея с окружающими его частями цветка, и в
результате возникла так называемая нижняя завязь. Конструктивно нижняя
завязь более экономична: при относительно меньшей затрате «строительного
материала» обеспечивается более эффективная защита семязачатков и семян,
увеличивается полиморфизм типов плодов и расширяются возможности
распространения плодов и семян.
Части цветка закладываются на цветоложе в виде меристематических бугорков
(примордиев), обычно в строгой последовательности — от периферии к центру,
т.е. сначала бугорки чашелистиков, затем лепестков, тычинок и, наконец,
плодолистиков. Но нередко эта последовательность частично нарушается; более того,
известны даже крупные таксоны, у представителей которых заложение элементов
андроцея (при многочисленных тычинках) идет центробежно, т.е. от центра к
периферии, и т.д.
Исходным в эволюционном плане было, по-видимому, спиральное, или
ациклическое, расположение частей цветка на цветоложе. В настоящее время у
покрытосеменных преобладают круговые, или циклические цветки, когда части цветка
образуют отчетливые циклы, мутовки, или круги (например, 5 чашелистиков в
одном круге, 5 лепестков в следующем, 10 тычинок в двух кругах и пестик из 5
плодолистиков). Чаще других встречаются пятикруговые, четырехкруговые
(особенно в тех случаях, когда выпадает один круг тычинок) и трехкруговые цветки,
но возможно и сокращение, и увеличение числа кругов. Наконец, известны и ге-
мициклические цветки, в которых наружные филломы (весь околоцветник или
32 Генеративные органы цветка.
только чашечка) располагаются кругами, а внутренние (тычинки и пестики) —
по спирали.
В циклических цветках обычно соблюдается правило чередования кругов, т.е.
члены каждого последующего круга не противолежат членам соседних кругов, а
чередуются с ними. Иногда это правило нарушается: так, если в цветке, например,
два круга тычинок, то наружные могут противолежать лепесткам, а не
чашелистикам — явление так называемой обдиплостемонии.
Цветки бывают обоеполые (с андроцеем и гинецеем) и однополые (только с
андроцеем или только с гинецеем). При этом однополые цветки могут находиться
на одном растении, как у дуба, березы, кукурузы, когда растение называется
однодомным, либо они развиваются на разных растениях, как у тополя, облепихи и
конопли — растения называются двудомными. В случае же когда на одном
растении встречаются как обоеполые, так и однополые цветки, как у многих
сложноцветных и тыквенных, то их называют полигамными. В настоящее время
считается, что однополые цветки возникли в процессе эволюции из обоеполых, а у
однополых цветков двудомность — явление более позднее, чем однополость.
Один из очень важных признаков цветка — тип его симметрии, которая
определяется в первую очередь расположением листочков околоцветника. Если через
поперечное сечение цветка можно провести несколько плоскостей симметрии, т.е.
если он имеет радиальную симметрию, то такой цветок называют актиноморфным
(правильным). Актиноморфные цветки свойственны большинству
покрытосеменных.
В процессе специализации, связанной в первую очередь с биологией опыления,
во многих линиях эволюции из актиноморфных возникли зигоморфные
(неправильные) цветки. В отличие от актиноморфных зигоморфные цветки могут быть
разделены в медианной плоскости на две одинаковые половины только в одном
направлении (например, цветок фиалки или гороха). Кроме радиально-симмет-
ричных (т.е. актиноморфных) и зигоморфных цветков встречаются также
асимметричные, в которых невозможно провести ни одной плоскости симметрии и
разделить их на две равные (симметричные) половины (например, цветок канны).
Таким образом, следует отметить, что цветки различных покрытосеменных
имеют очень разное и зачастую сложное строение, поэтому описание их и
сравнение друг с другом, что важно в первую очередь для целей систематики, нередко
затруднительно и во всяком случае очень трудоемко. Для более быстрого и легкого
ознакомления со строением цветков с середины прошлого столетия ученые стали
пользоваться диаграммами и формулами. Диаграммой в ботанике называется
изображение проекции частей цветка на горизонтальную плоскость, причем
различные части цветка обозначаются различными знаками. Практически наиболее
точный метод построения диаграммы — это сечение зрелого бутона вместе с
кроющим листом и прицветниками (если они есть) и точное изображение полученной
картины. Диаграмма дает возможность судить о числе частей цветка, их взаимных
отношениях, расположении, типе симметрии цветка и т.д.
Более сжато, хотя и менее наглядно, общий план строения цветка может быть
передан в виде формулы. При использовании принятых для этой цели символов
и цифр в формуле также можно отразить тип симметрии, спиральное или
циклическое расположение частей цветка, число элементов, их срастание, увеличение
путем расщепления, положение завязи и другие признаки.
Возникновение цветка в эволюции растений было ароморфозом большого
биологического значения. Цветок позволил покрытосеменным использовать
множество биотических и абиотических агентов для процесса перекрестного опыления и
тем самым дал им значительные преимущества в решении проблем репродукции
по сравнению с другими отделами высших растений. Большинство современных
Цветок
ЪЪ
ученых считают, что первоначальными агентами, производящими опыление
покрытосеменных растений, были насекомые.
Важным условием возникновения энтомофилии послужила обоеполость
репродуктивных органов цветковых растений. В обоеполых цветках насекомые,
использовавшие первоначально пыльцу в качестве пищи, перелетая с цветка на цветок
неизбежно производили перекрестное опыление, тогда как при раздельнополых
репродуктивных органах (например, у современных голосеменных) роль
насекомых как опылителей весьма невелика.
По мнению ряда ученых, связь насекомых с репродуктивными органами
растений возникла давно, в триасе или даже в перми. Насекомые еще тогда
обнаружили питательную ценность пыльцы и поллинофагия, вероятно, возникла
независимо в разных отрядах насекомых, начавших систематически питаться пыльцой
различных групп высших растений. Тем самым, ко времени появления цветковых
растений в природе уже существовали различные группы насекомых-поллинофа-
гов среди прямокрылых, жуков, сетчатокрылых и др., которые стали посещать
цветки и использовать пыльцу в качестве пищи. По-видимому, именно опыление
цветков различными группами насекомых на разных этапах эволюции
покрытосеменных стимулировало большое разнообразие их морфологии. В процессе
дальнейшей сопряженной эволюции покрытосеменных и насекомых в результате
стабилизирующего отбора возникают удивительные, хитроумные устройства в
структуре цветков, способствующие посещению их строго определенными
группами насекомых. В цветках кроме пыльцы появляются разнообразные аттрактанты,
в первую очередь нектар, пищевые тельца, масла, их начинают посещать птицы,
летучие мыши и другие мелкие позвоночные. Аттрактанты, вырабатываемые
цветками покрытосеменных, ученые делят на две группы — первичные и
вторичные. К первичным аттрактантам относятся те, ради которых животные посещают
цветки, это в первую очередь источники пищи, а именно пыльца, нектар, пищевые
тельца, масла и др. Ко вторичным аттрактантам относят то, что привлекает
внимание агентов опыления, а именно — аромат, визуальные приманки (венчик и
др.), жилище и т.д. Использование покрытосеменными большой армии
биотических агентов привело к возникновению во многих их группах сложных механизмов
опыления. Однако далеко не все покрытосеменные используют животных в
качестве опылителей, некоторые цветковые, либо изначально, либо потеряв
биотические агенты, используют в качестве опылителей ветер и воду. Цветки у таких
растений имеют внешне более простое строение, околоцветник, как правило, простой,
невзрачный, его листочки не препятствуют попаданию на пестик пыльцевых
зерен, которые двигаются с потоками воздуха. У тычинок часто удлиняется
тычиночная нить, своеобразные модификации претерпевают столбик, рыльце и т. д.
Особенно сильно у анемофильных и гидрофильных растений изменяется оболочка
пыльцевых зерен, благодаря чему пыльца легко распространяется не только
потоками воздуха, но и в толще воды. У растений, использующих абиотические
агенты опыления, четко выражены сезонные, фенологические и суточные ритмы
цветения.
В отношении происхождения цветка существует несколько основных точек
зрения. Чаще всего его рассматривают как метаморфизированный, укороченный
побег с ограниченным ростом, приспособленный для выполнения специфических
функций (эвантовая, или стробилярная теория). При этом предполагают, что
цветок произошел из стробила (шишки) тех или иных голосеменных, в частности бен-
неттитовых или саговниковых. Однако в настоящее время считается более
вероятным, что как цветок покрытосеменных, так и стробилы голосеменных имеют
лишь общее происхождение от репродуктивных побегов еще лишенных стробилов
полностью вымерших семенных папоротников. Другие ученые считают, что в про-
3 Генаративные органы цветка.
34 Генеративные органы цветка
цессе эволюции цветок возник не из простого побега, а из целой системы побегов
и, следовательно, скорее гомологичен соцветию («псевданций»), хотя конкретные
' морфологические решения здесь очень разнообразны (псевдантовая теория).
Существует также и теломная теория, трактующая цветок как модификацию теломов
первичных высших растений. Наконец, ряд ученых считают, что необычайный
полиморфизм цветков покрытосеменных не позволяет свести их к одному-единст-
венному, исходному прототипу и, следовательно, цветки в разных таксонах вовсе
не обязательно строго гомологичны.
Как бы то ни было, на практике цветок в подавляющем большинстве случаев,
действительно, удобнее всего уподобить простому, укороченному побегу,
имеющему осевую часть (цветоложе, тор) и листоподобные филломы —
стерильные (околоцветник) и фертильные (тычинки и пестики).
Оценка примитивности или, наоборот, эволюционной продвинутости
признаков цветка покрытосеменных зависит, конечно, от взглядов на происхождение
этой группы. Исходя из господствующих представлений на этот счет большинство
исследователей считают примитивными признаками выпуклое или коническое
цветоложе, спиральное расположение частей цветка, множественность и
неопределенность его частей, актиноморфность, отсутствие срастаний, листоподобные
тычинки без четко дифференцированной тычиночной нити и обычно с
выраженным надсвязником, апокарпный гинецей, незамкнутые до конца плодолистики,
низбегающие рыльца и т. д. С другой стороны, альтернативные особенности —
плоское или точечное цветоложе, фиксированное число циклически
расположенных частей, спайнолепестность, ценокарпия и т.п. рассматриваются как эволюци-
онно продвинутые признаки.
Таким образом, возникновение цветка и его производного — плода позволило
покрытосеменным использовать множество биотических и абиотических
компонентов биосферы для обеспечения процессов опыления и расселения, что дало им
значительные преимущества по сравнению с другими группами растений и
явилось важной причиной их победы в борьбе за существование. Рис. 1.
Голенкин, 1937; Гринфельд, 1978; Имс, 1964; Курсанов и др., 1940; Первухина, 1970; Тахтаджян,
1964; Фегри, Ван дер Пэйл, 1982.
'АНДРОЦЕЙ (греч. апег, род. andros — мужчина, oikos — дом) — совокупность
тычинок (микроспорофиллов) в цветке. Термин предложен в 1826 г. De Candolle.
Число и форма тычинок в цветках варьируют, что в первую очередь связано со
способом опыления.
В цветках тычинки располагаются строго закономерно. У сравнительно более
архаичных семейств они располагаются еще в спиральном порядке, их, как
правило, много, и число их неопределенное. У подавляющего же большинства
покрытосеменных тычинки в цветках расположены циклически или мутовчато, число их
строго определенное, обычно небольшое.
Тычинки могут срастаться, причем срастаются либо тычиночные нити
(например, у бобовых), либо пыльники (например, у сложноцветных). Редко
срастание заходит так далеко, что даже теряются границы пыльников
(например, у некоторых тыквенных). Нити тычинок иногда срастаются в
отдельные пучки, как у зверобойных, либо в окружающие завязь трубки, как
у мальвовых. Тычинки могут срастаться и с околоцветником, особенно с
венчиком, на большем или меньшем протяжении; часто происходит также
срастание тычинок со столбиком пестика (например, гиностемий у
орхидных). Все срастания тычинок возникли в эволюции в результате
стабилизирующего отбора под влиянием различных способов опыления и являются
обычно чрезвычайно постоянными.
Цветок
35
Как отмечено было раньше, в процессе эволюции покрытосеменных число
тычинок в цветках уменьшается и становится строго определенным, однако в
некоторых линиях эволюции число тычинок вновь возрастает, что характерно,
например, для кактусовых и некоторых розоцветных. Это увеличение числа тычинок
связано с биологией опыления и обычно характерно для цветков, лишенных
нектара, где аттрактантом для биотических агентов, производящих перекрестное
опыление, являются пыльцевые зерна.
Голенкин, 1937; Имс, 1964; Тахтаджян, 1964; De Candolle, 1826.
ТЫЧИНКА — генеративный орган цветка, представляющий собой
преобразованный в процессе эволюции микроспорофилл (лат. microsporophyllum).
Тычинка у большинства цветковых растений состоит из проксимальной
стерильной части — тычиночной нити и дистальной фертильной части —
пыльника. Тычиночная нить варьирует по форме, размерам и времени ее
существования. Обычно это провизорный орган, но иногда, становясь деревянистой, тычинки
сохраняются при плоде (например, у Kingia). На тычиночной нити иногда
образуются придатки различного происхождения и с разными функциями. Чаще всего
Возникновение этих приспособлений обусловлено тем или иным способом
опыления. У большинства видов цветковых в тычинке имеется проводящий пучок.
Обычно пучок проходит через всю тычиночную нить и заканчивается либо в ткани
связника, либо у основания пыльника. У некоторых растений проводящий пучок в
тычинке частично или полностью редуцирован.
Пыльник состоит из одного или нескольких мнкроспорангиев, в полости
которых развивается пыльца. Связник — стерильная ткань, соединяет
микроспорангии в единое целое — пыльник. Связник может выступать над
микроспорангиями, образуя разной формы и величины придатки. У большинства видов
цветковых (95%) в связнике имеется один проводящий пучок, у злаков вокруг
проводящего пучка дифференцируются клетки обкладки (Батыгина, 1974).
Форма, размеры и степень дифференциации связника в значительной степени
определяют форму пыльника.
Тычиночная нить, связник и его дистальные придатки представляют собой
части микроспорофилла, поэтому морфологически не совсем точно говорить, что
пыльник «прикрепляется» к тычинке. Выделено несколько типов тычинок на
основании характера соединения пыльника с тычиночной нитью (вросшие,
качающиеся и т.д.), которые учитываются систематиками.
У отдельных примитивных представителей семейств Magnoliaceae,
Degeneriaceae и др. тычинка представляет собой пластинчатый микроспорофилл
с тремя жилками, в толще которого дифференцируются и формируются
микроспорангии. У этих видов (например, у Degeneria vitiensis) тычинка не разделена на
тычиночную нить и пыльник. У некоторых видов (например, у представителей
рода Juglans) в процессе эволюции произошла редукция тычиночной нити, в
результате чего появились сидячие тычинки. Однако сидячие тычинки могут являться
следствием и ряда других причин.
Число микроспорангиев и их положение в микроспорофилле различно у
разных таксонов. Изменение расположения микроспорангиев частично
прослеживается в их генезисе, но обычно ход этих изменений проследить
трудно, т. к. они являются результатом длительных эволюционных
преобразований (адаптации к способам рассеивания пыльцы). Установлены две формы
расположения микроспорангиев на спорофилле: абаксиальное и адакси-
альное. Кроме того, положение микроспорангиев в пыльнике определяется
также характером вскрывания пыльника: экстрорзным, интрорзным,
латрорзным и их различными вариациями. Все эти признаки используются
3*
36
Генеративные органы цветка
систематиками и имеют большое значение для понимания эволюции
микроспорангиев и микроспорофилла в целом.
У большинства цветковых растений пыльник тетраспорангиатный, т. е.
содержит 4 микроспорангия, расположенных попарно. Однако у многих видов из
семейств Adoxaceae, Malvaceae, Phyllidraceae и др. он биспорангиатный.
Встречаются семейства (Araceae, Asclepiadaceae, Asteraceae, Moringaceae, и др.), у
которых в одном и том же цветке обнаружены би- и тетраспорангиатные
пыльники. Существуют пыльники, содержащие восемь и более микроспорангиев.
Пыльник или его половину называют синангием (Eames, 1961), а сросшиеся
в единую структуру тычинки или пыльники — синандрием (Тахтаджян, 1980).
Полость, в которой образуется пыльца, называют различными терминами:
микроспорангий, гнездо пыльника, пыльцевой мешок, пыльцевая камера и тека
(Eames, 1961). Большинство из этих терминов морфологически не точны, так как
подчас не отражают сути структуры. У некоторых видов в процессе созревания
как тетра-, так и биспорангиатного пыльника число микроспорангиев как бы
«уменьшается» до одного, так как они «сливаются» в результате дегенерации
перегородок между соседними микроспорангиями. Такое уменьшение числа
микроспорангиев может быть вызвано и другими причинами, в том числе и
недоразвитием. К сожалению, Davis (1966) придает этим вторичным модификациям
диагностическое значение и ошибочно трактует тетраспорангиатные пыльники с
разрушившимися перегородками как двугнездные, а биспорангиатные — как од-
ногнездные. Поэтому, например, термин «одногнездный пыльник» может иметь
совершенно разный морфологический смысл. В связи с этим, термин «гнездо
пыльника», так часто используемый в русской литературе, а многими
исследователями не совсем корректно приравненный к термину «микроспорангий», лучше
не использовать. Это замечание относится и к термину «тека», который, как
считает Eames (1961), следует избегать по той же причине. Достаточно сказать, что у
некоторых представителей семейства Cucurbitaceae и в роде Callitriche все 4
микроспорангия соединяются в одну «теку».
У отдельных видов в латрорзных зрелых пыльниках, не происходит слияния
микроспорангиев, так как они расположены изолированно по углам спорофилла,
и «тека» представляет собой один спорангий, а пыльник оказывается «четырех-
тековым» (Eames, 1961). В русской литературе, бытует термин «тека» и
используется обычно для обозначения двух латеральных микроспорангиев одной пары
(дорзального и вентрального) в тетраспорангиатном пыльнике.
У некоторых представителей семейств Nymphaeaceae, Calycanthaceae и
Magnoliaceae часть тычинок становятся стерильными и, в этом случае, они
называются стаминодиями (лат. stamen — тычинка, греч. oidos — вид). Стаминодии
разнообразны по форме и размерам и часто представляют собой переходные
формы между тычинкой и лепестком.
Стаминодиями называются также и редуцированные тычинки, которые иногда
представлены в пестичных цветках. У некоторых видов они функционируют как
нектарники (например, у Coptis). Стаминодии имеют проводящую систему,
характерную для тычинок, но в редуцированных тычинках (например, у некоторых
представителей семейства Scrophulariaceae) тычинки либо совсем не имеют
проводящего пучка, либо лишь его остатки присутствуют в цветоложе.
В процессе эволюции у некоторых групп растений происходила редукция
отдельных частей тычинки: тычиночной нити, связника, числа микроспорангиев,
числа слоев стенки микроспорангия, числа пыльцевых зерен. Так, например,
ткань связника в пластинчатых спорофиллах обычно массивная, а в таком
специализированном семействе, как Роасеае, она представлена только группой клеток.
Одновременно может редуцироваться как число микроспорангиев, так и дисталь-
Цветок
37
ный отросток связника — у паразитного растения Arceuthobium (Viscaceae) в
пыльнике сохраняется лишь один почковидный микроспорангий Рис. 2, 3.
Баранов, 1955; Батыгина, 1974, 1987; Винтер, Батыгина, 1988; Резникова, 1984; Тахтаджян, 1980;
Bhandari, 1984; Davis, 1966; Eames, 1961; Esau, 1977.
ГИНЕЦЕЙ (греч. gyne — женщина, oikos — дом, жилище) — совокупность
плодолистиков (мегаспорофиллов) в цветке покрытосеменных. В цветке имеется один
или несколько плодолистиков, которые могут быть свободными, т. е. не сросшимися
друг с другом (апокарпный гинецей — греч. аро- один и karpos — плод) или
сросшимися в единое целое (синкарпный гинецей — греч. syn — вместе).
По отношению к гинецею используется также давно укоренившийся термин
«пестик». Последним обозначают либо каждый плодолистик в апокарпном
гинецее (простой пестик), либо весь синкарпный гинецей (сложный пестик).
Некоторые ботаники (например, Eames, 1961) предлагают устранить термин «пестик»;
однако в том смысле, в котором он был определен выше, он и сейчас остается
полезным. Рис. 4.
ПЛОДОЛИСТИК представляет собой листоподобную структуру, сложенную в
апокарпном гинецее кондупликатно, т. е. по главной жилке таким образом, что
адаксиальная поверхность оказывается внутри полости, а его края более или менее
плотно сближаются, смыкаются или срастаются. Предполагают, что для
определенных таксонов характерен тот или иной тип сложения плодолистиков (Eames,
1961). У многих таксонов при формировании пестика прямые, не завернутые края
плодолистиков складываются и образуется краевая зона. Вероятно, что в процессе
эволюции гинецея подобного типа произошло сокращение ширины этой зоны. У
другого типа апокарпного гинецея края плодолистиков сначала заворачиваются
внутрь и лишь позже складываются или срастаются своими абаксиальными
поверхностями, при этом краевые проводящие пучки плодолистиков оказываются
инвертированными. В зрелом состоянии плодолистик с редуцированной краевой
зоной часто бывает трудно отличить от плодолистика с завернутыми внутрь краями.
Объединение плодолистиков в синкарпном гинецее осуществляется тремя
основными путями: соседние плодолистики, сомкнутые или сросшиеся по первому
(с незавернутыми краями), либо по второму (с завернутыми краями) типу,
срастаются своими уплощенными боковыми, абаксиальными сторонами друг с
другом, а иногда еще прирастают к столбиковидному карпофору, в результате чего
образуется двугнездный или многогнездный гинецей (ценокарпный — греч.
koinos —общий). У третьего типа синкарпного гинецея первично или вторично
несложенные плодолистики в полностью или частично развернутом состоянии
срастаются своими краями друг с другом, в результате чего образуется
одногнездный, так называемый паракарпный гинецей (лат. parallelicus —
параллельный) . Эти основные способы объединения плодолистиков могут видоизменяться в
результате вторичных модификаций. Пример такой модификации можно найти у
представителей сем. Brassicaceae, Boraginaceae, Lamiaceae, у которых гнезда
гинецея, сформированного из двух сросшихся плодолистиков, оказываются
разделенными пополам ложной перегородкой, образовавшейся из выростов плацент у
краев плодолистиков. Наконец, перегородки в ценокарпном гинецее,
разделяющие завязь на гнезда, могут разрушаться, в результате чего образуется
одногнездный гинецей из двух—нескольких плодолистиков — лизикарпный
гинецей (лат. lysis — разрушение, растворение).
Плодолистик апокарпного гинецея более продвинутых таксонов
дифференцируется на нижнюю, расширенную, фертильную часть — завязь, в полости
которой образуются семязачатки, и верхнюю суженную, стерильную — стилодий. У
38 Генеративные органы цветка
наиболее примитивных таксонов стилодии отсутствуют. Образование синкарпного
гинецея характеризуется в первую очередь срастанием фертильных частей
плодолистиков (завязей), а у более подвинутых таксонов и стилодиев, в результате
чего формируется столбик.
У более примитивных таксонов вдоль краев плодолистиков, а у более
продвинутых — в стилодиях или в столбике, дифференцируется своеобразная
секреторная ткань, выделяющая слизь и сахаристую жидкость, служащие для
улавливания пыльцы и дальнейшего ее прорастания. Эти участки плодолистиков были
названы рыльцами. В зависимости от формы и местоположения различают шовное
(«рыльцевой гребень»), низбегающее, верхушечное (головчатое, шаровидное,
овальное, сферическое, вогнутое, цилиндрическое, перистое, лопастное,
кистевидное и т. д.) рыльца. У некоторых примитивных таксонов формируется так
называемое «внутреннее рыльце», иногда почти целиком выстилающее полость
завязи (Eames, 1961). Если столбик или стилодии под верхушечным рыльцем
редуцируется, то рыльце называется сидячим. Рис. 4.
ПЛАЦЕНТА (лат. placenta — лепешка) — место заложения и прикрепления
семязачатка к плодолистику. Плацента может представлять собой довольно
крупный вырост, иногда почти заполняющий просвет в полости завязи.
По мнению многих авторов, наиболее примитивна ламинальная, (диффузная,
поверхностная) плацентация, при которой семязачатки разбросаны по всей
внутренней поверхности плодолистика (например, у Butomaceae, Limnocharitaceae).
У большинства цветковых плаценты субмаргинальные или сутуральные. В таком
случае каждый плодолистик имеет две плаценты, тянущиеся близко от его краев.
Иногда говорят о шовной, маргинальной плаценте, с существованием которой,
однако, согласны не все авторы (Eames, 1961; Тахтаджян, 1964; и др.).
Положение и тип плаценты зависит от способа объединения плодолистиков и
типа гинецея (Puri, 1951). В апокарпном гинецее плацентация чаще всего
субмаргинальная и сутуральная (околошовные), в ценокарпном —
центрально-угловая (или центрально-сутуральная), в лизикарпном — колончатая (или
центральная), а в паракарпном — париетальная (или постенная, пристенная). В
одногнездной завязи плацента может находиться у самого ее основания, и
плацентация в этом случае называется базальной. Существуют также таксоны, у
которых ткани плаценты и халазы образуют единую структуру — плацентохалазу
(подробнее см. ФУНИКУЛУС). Рис. 4.
Тахтаджян, 1964; Eames, 1961; Puri, 1951.
Пыльник
39
ЧАСТЬ II — ПЫЛЬНИК
ОБЩЕЕ ПРЕДСТАВЛЕНИЕ
ПЫЛЬНИК — фертильная часть тычинки, в микроспорангиях которой
осуществляется микроспорогенез, образуются и созревают пыльцевые зерна. Первые
морфологические описания пыльника и пыльцы относятся к концу XVII века (Grew,
1682г., Camerarius, 1694г.). В начале XVIII века. Linnaeus дал определение всех
частей тычинки и пыльника, и эта терминология стала общепринятой. Пыльник
(по Линнею — anthera от греч. anthos — цветок) состоит из микроспорангиев,
попарно объединенных в теки с помощью стерильной ткани — связника. Пыльник
многих растений имеет надсвязник и другие стерильные придатки, что особенно
характерно для примитивных цветковых (Magnoliaceae, Degeneriaceae,
Calycanthaceae, Hamamelidaceae). Пыльники варьируют по форме и размерам.
Различны также положение их в цветке, способ прикрепления к тычиночной нити,
способ вскрывания. Чаще всего пыльник содержит 4 микроспорангия, однако число
их может варьировать. Микроспорангии в пыльнике располагаются в большинстве
случаев симметрично, иногда ассиметрично, только на адаксиальной
(Magnoliaceae) или на абаксиальной (Winteraceae, Degeneriaceae, Calycanthaceae)
стороне пыльника. Проводящая система пыльника представлена одним или
несколькими проводящими пучками, следующими из тычиночной нити в связник,
иногда разветвляющимися в теки (Escalloniaceae) (Камелина, 1984а).
В развитии пыльника наблюдаются 3 периода: премейотический, мейотиче-
ский и постмейотический (Резникова, 1984). Премейотический период
характеризуется усиленной митотической активностью, в результате которой формируются
стенка пыльника и спорогенная ткань, т. е. происходит образование
микроспорангиев. Завершается он с прекращением делений в спорогенной ткани и с переходом
спорогенных клеток в микроспороциты. В мейотический период происходит
дифференциация слоев стенки микроспорангиев и мейоз в микроспороцитах, в
результате чего образуются тетрады гаплоидных микроспор. В постмейотический
период развиваются и созревают пыльцевые зерна на фоне соответствующих
изменений в стенке микроспорангиев.
В зрелом пыльнике, содержащем зрелые пыльцевые зерна, отсутствует локу-
лярная жидкость и сохраняются только те слои стенки, которые участвуют во
вскрытии пыльника.
Раскрываются пыльники чаще всего продольной щелью, иногда клапанами
(Berberidaceae), порами (Ericaceae) и другими способами. У многих видов вскры-
вание пыльника происходит с предварительным разрушением перегородки в тёке
между микроспорангиями, в результате которого полости двух микроспорангиев
объединяются, а затем вскрываются одной щелью. В месте вскрывания теки у
некоторых видов образуются валики из увеличенных клеток эпидермиса и эндоте-
ция (стомиум) (Liliaceae, Bignoniaceae и др.), замыкающиеся несколькими
мелкими клетками, которые и разрываются. Но чаще встречаются пыльники без сто-
миума с мелкими замыкающими клетками эпидермиса и эндотеция, причем в этих
40 Генеративные органы цветка
клетках не образуются фиброзные утолщения. У ряда видов микроспорангии в
пыльниках остаются обособленными до самого вскрытия (Dipsacaceae,
Morinaceae, Valerianaceae и др.).
Эволюционное преобразование пыльника цветковых растений шло в
направлении уменьшения размеров связника и числа сосудистых пучков в нем, числа слоев
в стенке микроспорангия, изменения положения микроспорангиев и других
признаков. Рис. 5.
Камелина, 19816; Поддубная-Арнольди, 1976; Резникова, 1984; Тахтаджян, 1964, 1987; Bhandari,
1984; Carniel, 1963; Coulter, Chamberlain, 1915; Eames, 1961.
МИКРОСПОРАНГИЙ (греч. micros — малый, spora — семя, angeion —
вместилище) — спорогенная часть пыльника. В микроспорангии происходит развитие
микроспор и пыльцевых зерен. Синонимы: гнездо пыльника, пыльцевой мешок.
В типичном случае на ранних этапах развития примордий пыльника
представлен меристемой, окруженной эпидермисом, в дальнейшем
выделяются 4 бугорка, в каждом из которых одна или несколько субэпидермальных
клеток становятся археспориальными. Последовательные периклинальные
деления археспориальной клетки и ее производных приводят к формированию
стенки микроспорангия и спорогенной ткани. Со стороны связника из
активной меристемы пыльника, прилегающей к спорогенной ткани,
формируется внутренняя часть тапетума, а у отдельных видов и остальные слои,
идентичные слоям стенки микроспорангия.
Развитие четырех микроспорангиев в пыльнике характерно для большинства
цветковых растений. Однако, у отдельных видов число микроспорангиев в
пыльнике может быть меньшим — один (Diapensiaceae), два (Moringaceae,
Marantaceae, некоторые Monimiaceae), три (Daphniphyllaceae — наряду с
четырьмя) или большим — восемь (Zannichelliaceae, Cymodoceaceae, наряду с
четырьмя) , и даже до 50 (Mimosaceae). Изменение числа микроспорангиев
объясняется различными причинами: редукцией части пыльника или трансформацией ее
в стерильный придаток (Cannaceae, Marantaceae), слиянием одной пары
микроспорангиев на раннем этапе развития пыльника, что встречается спорадически
(Daphniphyllaceae, Nitrariaceae), расщеплением тычинки (Adoxaceae), или
срастанием примордиев пыльников на ранних этапах, а также закладкой
дополнительных перегородок внутри микроспорангия. В отдельных семействах пыльники
образуют синандрии, которые несут множество микроспорангиев (Myristicaceae,
Aristolochiaceae).
Микроспорангии одного пыльника могут быть равной величины или разной,
когда микроспорангии, расположенные на абаксиальной стороне пыльника
меньше адаксиальных (Eupomatiaceae, Ceratophyllaceae, Berderidaceae, Nandina-
ceae). Форма микроспорангия варьирует от овальной, округлой до
подковообразной (у видов с выдающимися внутрь гнезда выростами связника — Lamiaceae,
Bignoniaceae, некоторые Campanulaceae). Различны микроспорангии и по
величине; на ранних стадиях в них могут быть разными число слоев спорогенной ткани
и величина микроспороцитов, а на поздних — число и величина пыльцевых
зерен.
В микроспорангиях одного пыльника стадии микроспорогенеза и развития
пыльцевого зерна проходят обычно синхронно, но иногда асинхронно. Так, в сем.
Peganaceae в одном и том же микроспорангии можно наблюдать все стадии мейоза
— от интерфазы мейоза 1 (в основании пыльника), последовательно к верхушке
пыльника — до телофазы (Kapil, Ahluwalia, 1963). Асинхронность в развитии
обнаруживается и в разных микроспорангиях одного пыльника (Bignoniaceae,
Zygophyllaceae) (Камелина, 1985г; Камелина и др., 1990). У многих растений в
Пыльник
41
постмейотический период микроспорангии заполняются локулярной жидкостью,
окружающей микроспоры, которая исчезает в процессе созревания и
дегидратации пыльника.
Камелина, 19816, 1985г; Камелина, Тучина, 1982; Камелина и др., 1990; Магешвари, 1954;
Поддубная-Арнольди, 1976; Bhandari, 1984; Davis, 1966; Eames, 1961.
ЭПИДЕРМИС (греч. epi — на, сверху и derma — кожа) — покровная ткань,
окружающая весь пыльник. Синонимы: экзотеций.
На ранних стадиях развития пыльника клетки эпидермиса стенки
микроспорангиев и связника не отличаются, имеют вид меристемы, их характерной
особенностью является только антиклинальное направление делений. Но по мере
дифференциации слоев стенки эти различия проявляются в изменении величины и
формы клеток и ядер, в наличии запасных веществ, в плотности цитоплазмы, в
сохранности самих клеток.
Клетки эпидермиса стенки микроспорангия в процессе развития изменяются
по величине, конфигурации, состоянию органелл и другим параметрам. В
подавляющем большинстве случаев эпидермис в зрелом пыльнике сохраняется, но
иногда сминается или слущивается (Nitrariaceae, Tetradiclidaceae). У некоторых
растений, чаще всего когда пыльник вскрывается порой или другим способом, а
не продольной щелью, стенка зрелого пыльника представлена только
эпидермисом (Bignoniaceae). В отдельных случаях в эпидермисе образуются тонкие
фиброзные утолщения (Empetraceae). Эпидермис в стенке микроспорангия покрыт
кутикулой, которая бывает различной толщины (очень толстая у Peganum
harmald) и конфигурации (например, звездчатая шипиковатая у Coriariaceae,
гребневидная у Morinaceae). Кутикула на наружной тангентальной оболочке у
некоторых видов появляется очень рано, еще до мейоза (Elaeagnaceae,
Brexiaceae). В клетках эпидермиса на ранних стадиях часто имеется крахмал
(Valerianaceae, Dipsacaceae), у некоторых видов накапливаются танины
(Brexiaceae, Cyrillaceae, Myristicaceae, присутствуют кристаллы оксалата
кальция (роды Ixerba, Malacocarpus), хлоропласты (Zannichelliaceae, Ruppiaceae). У
отдельных видов на эпидермисе образуются волоски (Calycanthaceae) и
специфические структуры в виде острых шипов, способствующие вскрытию пыльника
(Incarvillea), трихомы (пельтатные железки у Stachys trinervis, Lamiaceae).
Иногда в эпидермисе присутствуют устьица (Geraniaceae). Рис. 6.
Камелина, 1985а, 1987а, 19876,1988; Резникова, 1984; Bhandari, 1984; Kapil, Ahluwalia, 1963; Konnova,
1992.
СВЯЗНИК — стерильная часть пыльника, связующая микроспорангии и
являющаяся продолжением тычиночной нити.
Структура связника, число слоев в нем и его форма различны. У некоторых
видов связник очень массивный (Magnoliaceae, Eupomatiaceae, Degeneriaceae,
Trapaceae, Brexiaceae), у многих видов связник не массивен, а иногда
представлен всего несколькими слоями (Tetradiclidaceae). У некоторых водных растений
между клетками связника имеются воздушные полости (Zannichelliaceae). В
отдельных случаях в связнике образуются многоклеточные выросты — плацентои-
ды, врастающие в каждый микроспорангий (Eames, 1961) и обуславливающие его
подковообразную форму (Lamiaceae, Verbenaceae, Bignoniaceae, некоторые
Campanulaceae). Выросты эти могут быть и от перегородки между
микроспорангиями (Lamiaceae, Verbenaceae). В клетках связника накапливается крахмал
(Nandinaceae, Bignoniaceae), танины (Escalloniaceae, Brexiaceae, Marantaceae),
кристаллы оксалата кальция (Peganaceae). У некоторых растений в связнике
отмечены специфические клетки-вместилища, в которых накапливаются различ-
42 Генеративные органы цветка
ные вещества — жиры (Pittosporaceae), слизь полисахаридной природы
(Nitrariaceae).
На поздних стадиях развития пыльника у некоторых видов слой клеток
связника, примыкающий к гнезду, дифференцируется по типу эндотеция, и в его
клетках образуются фиброзные утолщения (Datiscaceae, Parnassiaceae,
Tamaricaceae, Escalloniaceae и др.). Фиброзные утолщения в связнике можно
наблюдать также в клетках его субэпидермиса (Daphniphyllaceae, Mqgnoliaceae,
Cneoraceae, Peganaceae и др.), плацентоидах (некоторые Campanulaceae) и в
глубжележащих слоях связника (Brexiaceae, Morinaceae). В центре связника
проходит проводящий пучок или пучки (многочисленные у Ostrowskia magnifica,
Campanulaceae).
Связник является полифункциональной структурой, выполняя механическую,
запасающую роль и участвуя в транспорте веществ из тычиночной нити и
материнского растения в микроспорангии.
Жинкина, Камелина, 1985; Камелина, 1981 в, 1983г, 1984а; Камелина, Жинкина, 1989; Фрейберг, 1983,
1985а, 19856; Eames, 1961.
СТЕНКА МИКРОСПОРАНГИЯ
СТЕНКА МИКРОСПОРАНГИЯ — слои клеток микроспорангия, окружающие
спорогенную ткань.
Вопрос о возникновении и развитии стенки микроспорангия является одним
из наиболее сложных в эмбриологии.
Warming (1873) ввел понятие о центробежном характере развития стенки
микроспорангия покрытосеменных растений. При этом типе тапетум (если он
происходит из париетального слоя) является первичным продуктом развития
париетального слоя. Напротив, при центростремительном развитии стенки
микроспорангия тапетум является конечным продуктом дифференциации
париетального слоя (Carniel, 1961). Когда мы говорим о центробежном и
центростремительном развитии париетального слоя, то имеем в виду вектор, проходящий
от центра микроспорангия к его краю, либо, наоборот, от края к его центру. В
результате сложных морфогенетических преобразований в пыльнике стенка
микроспорангия у большинства таксонов формируется различным способом (Терехин и
др., 1993).
Следует различать сформированную стенку микроспорангия,
характеризующуюся конечным числом слоев, специфичным для каждого таксона, и
стенку зрелого микроспорангия — в момент вскрывания. При
созревании пыльника идет процесс дальнейшей дифференциации и специализации
клеток всех слоев стенки микроспорангия, совпадающий обычно с мейоти-
ческим периодом и формированием пыльцы. Сформированная стенка
микроспорангия у большинства покрытосеменных состоит из эпидермиса (см.
ЭПИДЕРМИС), эндотеция, среднего слоя и тапетума. У примитивных
таксонов она более толстая, чем у более продвинутых. Увеличение
массивности стенки микроспорангия происходит обычно либо за счет увеличения
числа средних слоев (Magnoliaceae, Degeneriaceae, Ranunculaceae), либо за
счет увеличения числа слоев тапетума (Magnoliaceae, Trochodendraceae,
Schisandraceae и др.). У отдельных представителей Rubiaceae, Oleaceae и
др. тапетум многослоен лишь со стороны связника. У представителей
Magnoliaceae, Schisandraceae эндотеций неравномерно-двуслойный, у
Scrophulariaceae (Chelone glabra) он представлен двумя-шестью слоями. От-
Пыльник
43
мечена, однако, также многослойность эндотеция у отдельных примитивных
семейств (Bhandari, 1971; см. Сравн. эмбр. цветковых растений, 1981—1990).
В процессе эволюции у многих видов растений происходило уменьшение
числа как самих микроспорангиев (Arceuthobium pusilum), так и его
различных слоев.
Несмотря на значительные достижения в изучении генезиса микроспорангиев
покрытосеменных, остаются дискуссионными некоторые вопросы, относящиеся к
ранним стадиям их развития и имеющие принципиальное значение для
выяснения механизма формирования микроспорангиев. Актуальность проблемы состоит
в том, что, как правильно отметил Bhandari (1984), исследования первых этапов
развития микроспорангия малочисленны. Однако данные, собранные в
«Сравнительной эмбриологии цветковых растений» (1981—1990), и некоторые
исследования отечественных эмбриологов (Батыгина и др., 1963; Сладков, Гревцова, 1988;
Терехин и др., 1993; и др.) позволяют поставить и обсудить ряд вопросов,
относящихся к сфере морфогенетической регуляции развития пыльника как органа.
Одним из таких важных вопросов является происхождение некоторых слоев
стенки микроспорангия, особенно со стороны связника.
Долгое время исследователи были убеждены, что стенка микроспорангия
формируется только с его внешней стороны (Warming, 1873; Schnarf, 1929, 1931; и др.).
В связи с этим и в последующий период исследований стенки микроспоран^ия
основное внимание было уделено ее формированию только с внешней стороны,
противолежащей связнику. С начала 60-х годов исследователи стали уделять внимание
формированию стенки микроспорангия, как с наружной стороны, так и со стороны
связника. Carniel (1961) первый обратил внимание на то, что у Zea mays стенка
микроспорангия окружает спорогенную ткань со всех сторон, тапетум является
производным париетального слоя, правда, автор не акцентирует внимание на
происхождении последнего. Батыгина с соавторами (1963), Батыгина (1974, 1987)
пришли, однако, к выводу, что у Triticum тапетум также является производным
париетального слоя, однако он имеет двойственное происхождение: часть
его, со стороны связника, дифференцируется из клеток меристемы, тогда как с
наружной стороны клетки париетального слоя являются производными
клеток археспория. Однако, возможны два пути (по крайней мере) образования
тапетума со стороны связника: либо из меристемы пыльника, прилегающей к
связнику, либо из меристемы, входящей в состав самого микроспорангия.
Periasamy и Swamy (1966) высказали предположение о двойственном
происхождении тапетума в микроспорангии у цветковых. При этом они имели в виду,
что со стороны связника тапетум всегда формируется из меристемы
последнего, а не из париетального слоя. Этой точки зрения придерживаются и
сейчас некоторые исследователи (Камелина, 1981а-г, 1991). В дальнейшем для
ряда таксонов цветковых растений это предположение было подтверждено
исследованиями, касающимися происхождения тапетума (Vijayaraghavan, Ratnaparkhi,
1973; Никитичева, 1987; Сравн. эмбр. цветковых растений, 1981—1990).
Действительно, по крайней мере, у части таксонов цветковых растений можно
констатировать двойственное происхождение некоторых слоев стенки микроспорангия или
ее инициалей, хотя пути ее морфогенеза различны у представителей разных
таксонов. Однако нельзя исключать и другой путь формирования тапетума —
из париетальной ткани, как это было ранее показано для Zea mays и Triticum
(Carniel, 1961; Батыгина и др., 1963) и подтверждено для Triticale (Bhandari,
Khosla, 1982). Авторы с документальной убедительностью показали, что тапетум
в микроспорангии у перечисленных злаков формируется исключительно из
париетальной ткани, окружая концентрическим слоем спорогенную
ткань.
44
Генеративные органы цветка
Ввиду отсутствия детальных исследований первых этапов развития
микроспорангия остается дискуссионным вопрос о природе париетального слоя и других
слоев стенки микроспорангия. Достаточно напомнить, что в некоторых случаях при
многоклеточном археспории была показана возможность формирования
париетального слоя во всех его частях из археспориальной ткани (Shreve, 1906; Holmgren,
1913; Батыгина и др., 1963). В то же время, сведения о дифференциации тапетума из
спорогенной ткани (Maheshwari, 1950; Bhandari, 1971,1984; Lakshmanan, Poornima,
1988) нуждаются в уточнении.
Таким образом, сегодня вопрос о генезисе стенки микроспорангия нельзя
признать окончательно решенным, хотя он, возможно, является ключевым
для понимания уровня, характера и механизмов регуляции формирования
микроспорангия. Рис. 7.
Батыгина, 1974, 1987; Батыгина и др., 1963, Батыгина, Шамров, 1981а; Гревцова, Сладков, 1983;
Камелина, 1981а-г, 1991; Никитичева, 1987; Сладков, Гревцова, 1988; Терехин и др., 1993; Bhandari,
1971, 1984; Bhandari, Khosla, 1982; Carniel, 1961; Holmgren, 1913; Lakshmanan, Poornima, 1988;
Maheshwari, 1950; Periasamy, Swamy, 1966; Schnarf, 1929, 1931; Shreve, 1906; Vijayaraghavan,
Ratnaparkhi, 1973; Warming, 1873.
ПАРИЕТАЛЬНЫЙ СЛОЙ (лат. paries — стенка) — слой стенки
микроспорангия, возникающий в результате периклинального деления археспориальных
клеток и являющийся инициальным для других слоев. Термин введен Nageli (1842г.)
при описании тканей молодого пыльника; париетальными были названы все слои
стенки. Различают первичный и вторичный париетальные слои. Первый
образуется из археспориальной клетки (клеток), его клетки делятся периклинально.В
зависимости от типа формирования стенки микроспорангия, производными
первичного париетального слоя могут быть тапетум и вторичный париетальный слой
(при центробежном типе), эндотеций и вторичный париетальный слой (при
центростремительном типе) или два вторичных париетальных слоя (при основном типе)
(Davis, 1966). Периклинальное (~ные) деление клеток вторичного (-ных)
париетального слоя приводит к образованию эндотеция и среднего слоя (центробежный
тип), тапетума и среднего слоя (центростремительный тип) или всех слоев стенки:
эндотеция, 2 средних слоев и тапетума (основной тип). Клетки париетальных слоев
характеризуются признаками меристемы.
Камелина, 19816; Сладков, Гревцова, 1991; Davis, 1966.
ЭНДОТЕЦИЙ (греч. endon- внутри и theke- вместилище) — наружный слой
стенки микроспорангия, расположенный под эпидермисом. Название введено
Purkinje (1830 г.) для определения всех слоев стенки вскрывающегося пыльника,
лежащих под эпидермисом. Эндотеций является производным первичного или
вторичного париетальных слоев. В связи с этим время его дифференциации
различно: раньше в первом и позже во втором случае. В молодом пыльнике клетки
эндотеция мало отличаются от клеток эпидермиса и клеток среднего слоя. В мейо-
тический период у одних, а чаще в постмейотический период у других растений
клетки эндотеция значительно увеличиваются, а со стадии первого митоза в
пыльцевом зерне в оболочках эндотеция на антиклинальных и внутренних тангенталь-
ных клеточных стенках развиваются так называемые фиброзные
утолщения (пояски), которые ориентированы, в основном, перпендикулярно
эпидермальному слою. В некоторых случаях фиброзные утолщения не образуются,
а радиальные и внутренняя тангентальная стенки оболочки значительно
утолщаются (Nandinaceae), или утолщаются все оболочки сетчатыми перфорациями
(некоторые Magnoliaceae). В отдельных случаях оболочки клеток эндотеция не
утолщаются, и фиброзных поясков в них не образуется (Empetraceae, Epacridaceae).
Пыльник
45
Это наблюдается и у некоторых водных (Zannichelliaceae, Cabombaceae,
Ceratophyllaceae) и клейстогамных растений.
В клетках эндотеция на ранних стадиях присутствует крахмал, иногда в
них накапливаются танины (Elaeqgnaceae, Ebenaceae, Brexiaceae). У
большинства растений эндотеций в стенке зрелого пыльника сохраняется и
участвует во вскрывании пыльника. В отдельных случаях (Incarvillea)
эндотеций с фиброзными утолщениями сохраняется только в районе стомиума.
Как правило, эндотеций в стенке пыльника бывает однослойным, иногда
нерегулярно-двуслойным (Marantd) или многослойным. Рис. 8.
Камелина, 1988,1990а, 19906; Камелина, Проскурина, 1987; Камелина и др., 1990; Никитичева, 1983;
Bhandari, 1984; Johri et al., 1992.
СРЕДНИЙ СЛОЙ (назван по расположению между тапетумом и эндотецием;
Coulter, 1898 г.) — является производным первичного и (или) вторичного
париетальных слоев. Количество средних слоев в стенке микроспорангия варьирует от 1
(или в редких случаях он вообще отсутствует) до 5—7 (Nandinaceae, Marantaceae).
Увеличение числа средних слоев происходит за счет дополнительных перикли-
нальных делений, часто неупорядоченных, в образовавшемся одном или двух
средних слоях.
На ранних стадиях клетки среднего слоя не отличаются от клеток
эпидермиса и эндотеция, часто содержат крахмал. В мейотический период
наблюдается уплощение клеток и ядер среднего слоя с последующим их
разрушением и лизисом в постмейотический период или с частичным
увеличением и разрастанием клеток после деструкции тапетума.
Во многих случаях, когда средний слой является единственным, он
эфемерен, с началом мейоза постепенно дегенерирует и разрушается до начала
лизиса тапетума (Dipsacaceae, Valerianaceae). В других случаях он
функционирует и после лизиса тапетума, вплоть до созревания пыльцевых зерен
(Роасеае). Когда средних слоев много, они существуют продолжительное
время, постепенно разрушаясь в центростремительном направлении
(Daphniphyllaceae, Nandinaceae). Когда в стенке пыльника присутствуют 2—
3 средних слоя, их развитие иногда протекает различно. Примыкающий к
тапетуму средний слой (или слои) разрушается, а примыкающий к эндоте-
цию — сохраняется и в зрелом пыльнике. Причем, в сохраняющихся
клетках среднего слоя образуются фиброзные пояски (утолщения), которые чаще
всего отличаются конфигурацией от таковых в эндотеций (Daphniphyllaceae,
Datiscaceae, Morinaceae и др.), а иногда одинаковы с ними (Escalloniaceae,
Winteraceae). В отдельных случаях в стенке зрелого пыльника средний слой
сохраняется, но оболочки его не имеют фиброзных утощений (Actinidiaceae,
Davidiaceae, Peganaceae). Два средних слоя в пыльниках Beta vulgaris
отличаются по ультраструктуре клеток: в наружном слое в них более развит
пластидный аппарат, а во внутреннем — эндоплазматический ретикулум, в
них же повышенная плотность рибосом и меньшая степень вакуолизации
(Голубева, 1989). В клетках сохраняющихся средних слоев иногда
накапливаются танины (Brexiaceae, Myrsinaceae). В сем. Агасеае средний слой,
примыкающий к тапетуму, участвует в создании периплазмодия (Pacini,
Juniper, 1983). Многочисленные средние слои в пыльниках сем. Marantaceae
секретируют в полость гнезда слизь полисахаридной природы (Камелина,
1990а, 19906). В средних слоях отмечалось наличие каротина и липидных
гранул (Liliaceae) (Резникова, 1984).
Таким образом, функции среднего слоя различны: запасающая (депо
крахмала и других питательных веществ), транспорта ассимилятов, секре-
46
Генеративные органы цветка
торная (в т. ч. участие в образовании полленкита), механическая, связанная
со вскрыванием стенки пыльника. Рис. 9.
Батыгина, 1974, 1987; Голубева, 1989; Камелина, 1980, 19816, 1981в, 19836, 1985г, 1990а, 19906;
Резникова, 1984; Фрейберг, 1985; Bhandari, 1984; Davis, 1966; Keijzer, Willemse, 1988a, 1988в; Pacini,
Juniper, 1983.
ФИБРОЗНЫЕ (=волокнистые) (лат. fibra — волокно) УТОЛЩЕНИЯ —
специфические утолщения оболочек клеток различных тканей пыльника. Они
встречаются в эндотеции (у большинства растений), в остающихся средних слоях зрелого
пыльника (Datiscaceae, Morinaceae, Zygophyllaceae), в субэпидермисе связника
(Daphniphyllaceae, Magnoliaceae), в тканях связника (Brexiaceae, Winteraceae), в
выростах связника (плацентоидах) (Ostrowskia), очень редко — в эпидермисе
пыльника (Empetraceae). Фиброзные утолщения образуются в
дифференцированных клетках, как правило, на стадии предшествующей или во время первого митоза
в пыльцевом зерне. При их образовании значительно утолщается внутренняя
тангентальная оболочка клетки (что особенно характерно для эндотеция), от нее
отходят фиброзные пояски по радиальным обоочкам, заканчиваясь у верхней
тангенталыюй, а иногда и охватывая ее. В химический состав фиброзных
утолщений входит dL -целлюлоза (De Fossard, 1969), пектин и лигнин. В поляризованном
свете отмечается их интенсивное свечение.
Фиброзные утолщения отличаются по толщине поясков, их расположению и
конфигурации. Несмотря на то, что Eames (1961) учел значительное число
структурных вариаций, полной типизации разнообразия фиброзных утолщений не
существует. Для отдельных семейств, таких как Araceae (French, 1985a, 1985в,
1986); Asteraceae (Dormer, 1962; Vincent, Getliffe, 1988); Poaceae, Restionaceae
(Manning, Under, 1990); Orchidaceae (Feudenstein, 1991) приводится более дробная
типизация фиброзных утолщений эндотеция, имеющих, по мнению авторов,
систематическое значение.
Основная функция фиброзных утолщений — участие во вскрывании
пыльника. При дегидратации клеток они действуют как пружина,
разворачивающая стенки тек пыльника (пояски эндотеция и среднего слоя).
Очевидно, фиброзные пояски тканей связника и плацентоида при вскрытии
пыльника срабатывают как механизм, выталкивающий пыльцу за пределы
пыльника. Рис. 10.
Камелина, 1980,1988,1990а, 19906; Камелина, Жинкина, 1989; Фрейберг, 1981,1985; De Fossard, 1969;
Dormer, 1962; Eames, 1961; Feudenstein, 1991; French, 1985a, 1985b, 1986; Manning, Linder, 1990; Noel,
1983; Vincent, Getliffe, 1988.
ТАПЕТУМ (греч. tapes — выстилающий слой, ковер) — полифункциональная
ткань, непосредственно прилегающая к спорогенной ткани пыльника и
обеспечивающая прохождение мейоза, нормальное развитие микроспор и созревание
пыльцевых зерен. Синоним: выстилающий слой.
Происхождение тапетума может быть различным: в стенке
микроспорангия он является производным париетального (первичного или вторичного)
слоя, со стороны связника — дифференцируется из клеток активной
меристемы, прилегающей к археспорию. У некоторых злаков весь тапетум
образуется из париетального слоя (Carniel, 1961; Батыгина и др., 1963; Bhandari,
Khosla, 1982), и тогда идет речь о двойственном происхождении последнего
(Батыгина, 1974). Тапетум бывает гомоморфным или гетероморфным, когда
его внутренняя часть многослойна, или представлена крупными, папилло-
видными клетками (Larniaceae, Bignoniaceae и др.). В некоторых случаях
тапетум образует временные перегородки между спорогенными клетками
Пыльник 47
(септы, или трабекулы) (Gentianaceae, Balsaminaceae). Клетки тапетума
могут быть одно-, дву- и многоядерными. Рис. 11.
Батыгина, 1974; Батыгина и др., 1963; Bhandari, Khosla, 1982; Carniel, 1961.
ТАПЕТУМ И ОРБИКУЛЫ (ТЕЛЬЦА УБИША)
Тапетальные клетки образуют четко выраженный слой, окружающий споро-
генную ткань микроспорангия в пыльнике.
Характерные черты тапетальных клеток:
1. Крупные размеры и эфемерность. 2. Цитоплазма богата рибосомами и
активными органеллами. 3. Клетки могут быть многоядерными или
полиплоидными. 4. В клетках происходят неупорядоченные митотические деления и слияния
ядер. 5. В них наблюдаются ускоренные и интенсивные процессы,
заканчивающиеся дегенерацией цитоплазмы.
Различают два основных типа тапетума:
1. Железистый (секреторный) тип тапетума, клетки которого сохраняют
свое первоначальное положение и впоследствии разрушаются.
2. Амебоидный тип (проникающий, или периплазмодиальный):
протопласты клеток тапетальной ткани проникают между микроспороцитами и
развивающимися пыльцевыми зернами, где они сливаются и образуют тапетальный
периплазмодий. В некоторых случаях тапетальные клетки повторно вступают в
период гиперсекреции, продолжающийся почти до полного созревания пыльцевых
зерен. Так, например, у Nymphaea наблюдается два четких периода, в течение
которых тапетальные клетки проникают в полость гнезда пыльника (Rowley et al.,
1990). Каждый из периодов завершается возвращением тапетальных клеток в
исходное положение и образованием ими палисадного слоя внутри гнезда пыльника.
По мере появления новых данных разграничение между типами тапетальной
ткани становится все менее четким. Различия в структуре тапетума объясняются,
по-видимому, приспособлениями к размеру и форме пыльцевых зерен, способу их
распространения, полленкиту и другим факторам (Pacini, 1990).
Функции тапетума. Главной функцией тапетальной ткани/Является
снабжение образующихся микроспор питательными веществами. Кроме того, клетки
тапетума могут принимать участие в следующих процессах:
1. Секреция фермента каллазы для растворения каллозных оболочек тетрад
(Stieglitz, 1977).
2. Секреция полисахаридов внутрь гнезда пыльника на стадии распада тетрад
на отдельные микроспоры и дальнейшее их поглощение развивающимися
микроспорами (Pacini, Franchi, 1983).
3. Образование предшественников экзины, согласно экспериментальным
данным, могут быть представлены фенолами или р-кумаровой кислотой (Schulze
Osthoff, Wiermann, 1987; Wehling et al., 1989). В образованиизкзины наряду с та-
петальными клетками участвует также и мужской гаметофит.
4. Тапетальные клетки проявляют и другие формы активности, что,
по-видимому, приводит к формированию различных структур, характерных для
некоторых семейств. Например, у Onagraceae клетки тапетума играют определенную
роль в образовании тонких гибких волокон, известных под названием висциновых
(клейких) нитей, являющихся продолжением внешнего слоя экзины (Hesse, 1984).
Тапетум у представителей семейства Compositae (Asteraceae)o6pa.3yeT
устойчивую к ацетолизу мембрану с внешней стороны спорогенной ткани (Heslop-
Harrison, 1969). Эта мембрана известна как «culture sac», или перитапетальная
мембрана (Shivanna, Johri, 1985).
48
Генеративные органы цветка
5. Образование орбикул (телец Убиша).
6. Образование полленкита, который представляет собой гидрофобный слой,
состоящий в основном из липидов и каротиноидов (Pacini, Casadoro, 1981; Rowley,
El-Ghazaly, 1992). Полленкит обычно откладывается на поверхности экзины и
способствует связыванию пыльцевых зерен между собой, очевидно, для более
эффективного опыления насекомыми.
7. Образование трифины, представляющей собой смесь гидрофобных и
гидрофильных соединений. Трифина откладывается обычно на поверхности пыльцы и
вероятно способствует защите пыльцевых зерен, а также опылению насекомыми
(Dickinson, Lewis, 1973).
Орбикулы. Впервые орбикулы были обнаружены Rosanoff (1865) вблизи
тапетума, при этом по составу они были сходны с экзиной пыльцевых зерен. Данные
об их строении, полученные с помощью светового микроскопа, были
опубликованы Schnarf (1923) и Ubisch (1927). Schnarf (1923), по-видимому, был первым, кто
описал эти экзиноподобные тельца у Lilium martagon. Kosmath (1927) предложил
называть эти тельца «гранулами Убиша», исходя из того вклада, который был
сделан Убишем в изучение их характерных свойств. Heslop-Harrison (1962)
использовал термин «бляшки» для описания таких телец; Erdtman с соавторами
(1961) предложили термин «орбикулы». Орбикулы являются слишком мелкими
структурами для исследования только с помощью светового микроскопа. С
появлением электронной микроскопии они были легко повторно идентифицированы,
и стало возможным изучение их развития и строения.
Орбикулы обычно представляют собой сфероидальные структуры,
обнаруживаемые в пыльниках многих покрытосеменных растений, как
однодольных, так и двудольных, а также голосеменных. Форма орбикул может быть
различной в зависимости от вида. Они могут быть палочкообразными,
овальными, треугольными с округленными углами, а также в форме
бублика или в виде пластинок с волнообразным или зубчатым краем и т.п.
Орбикулы часто сливаются в крупные агрегаты, как, например, у Oxalis
pes-caprae. Морфологические различия орбикул могут иметь значение для
систематики (Raj, El-Ghazaly, 1987; El-Ghazaly, 1989).
Оболочка орбикул, по всей видимости, состоит из спорополленина — вещества,
отличающегося большой прочностью. Рисунок поверхности орбикул и экзины
может иметь поразительное сходство (El-Ghazaly, Jensen, 1986a).
Что касается роли орбикул, то разные исследователи приписывают им
различные функции. Среди них, например, называют транспортную функцию по
доставке спорополленина; функцию гидрофобного слоя, выстилающего гнезда
пыльника, за счет чего обеспечивается свободное отделение пыльцевых зерен; их
функции могут быть также связаны с рассеиванием пыльцы (подробнее см. Echlin,
1971а; Pacini et al., 1985).
Формирование орбикул начинается в цитоплазме тапетальных клеток с
образования мелких сферических телец (про-орбикул) диаметром приблизительно 0,1
мкм. Происхождение про-орбикул, по-видимому, связано с ЭР клеток тапетума.
На стадии спорогенной ткани в цитоплазме клеток тапетума появляются
многочисленные про-орбикулы, ограниченные мембраной. Мембрана про-орбикул
сливается с плазмалеммой клеток тапетума, и образующиеся орбикулы проходят
сквозь плазмалемму, располагаясь на ее поверхности; спорополленин начинает
аккумулироваться на поверхности про-орбикул вплоть до образования оболочки.
Орбикулы, очевидно, остаются прикрепленными к плазмалемме клеток тапетума.
Они располагаются на тангентальных наружных и внутренних и радиальных
сторонах тапетальных клеток (El-Ghazaly, Jensen, 1986a; Hesse, 1986; Rowley, Walles,
1987). Рис. 12.
Пыльник
49
Dickinson, Lewis, 1973; Echlin, 1971a; El-Ghazaly, 1989; El-Ghazaly, Jensen, 1986a; Erdtman etal., 1961;
Heslop-Harrison, 1962, 1969; Hesse, 1984, 1986; Kosmath, 1927; Pacini, 1990; Pacini, Casadoro, 1981;
Pacini, Franchi, 1983; Pacini etal., 1985; Raj, El-Ghazaly, 1987; Rosanoff, 1865; Rowley, El-Ghazaly, 1992;
Rowley et al., 1990; Rowley, Walles, 1987; Shivanna, Johri, 1985; Schnarf, 1923; Schulze, Osthoff, Wiermann,
1987; Stieglitz, 1977; Ubisch, 1927; Wehlingetal., 1989.
ТАПЕТАЛЬНАЯ МЕМБРАНА — структура, окружающая целиком каждую
клетку тапетума секреторного типа. Термин впервые использован Banerjee (1967)
для.обозначения ацетолизоустойчивой мембраны, формирующейся у злаков на
поверхности стенок клеток тапетума со стороны гнезда пыльника. Синонимы:
тапетальная пленка (Романов, 1970в), орбикулярная стенка (Christensen et al,
1972), пелликула (Cousin, 1979).
Кроме тапетальной мембраны, окружающей каждую клетку тапетума (Огород-
никова, 1976, 1986, 1990; Голубева, 1983), обнаружена ацетолизоустойчивая
мембрана, которая ограничивает все клетки тапетума со стороны среднего слоя. Она
была названа экстратапетальной мембраной (Heslop-Harrison, 1969), перитапе-
тальной мембраной (Dickinson, 1970), перитапетальной пленкой (Резникова,
1984). Тапетальная и экстратапетальная мембраны образуются в посттетрадный
период, одновременно с экзиной пыльцевых зерен. Строение этих мембран с
поверхности и на поперечных срезах пыльников, ацетолизированных в
концентрированной серной кислоте, исследовали под электронным микроскопом. Структура
экстратапетальной мембраны с поверхности выглядит электронно-прозрачным
слоем с глобулами спорополленина, на поперечных срезах — электронно-плотной
линией, заходящей на радиальные стенки двух соседних клеток и образующей V-
образную ламеллу (Walles, Rowley, 1979). В структуре тапетальной мембраны
отмечены различия, зависящие от ее топографии. В связи с этим введены
обозначения стенок клетки тапетума: внутренняя тангентальная, наружная тангентальная
и радиальные. Внутренняя тангентальная — это стенка клетки, обращенная в
полость гнезда пыльника, наружная тангентальная — в сторону клеток среднего
слоя, радиальные — в сторону соседних клеток тапетума. У растений с
секреторным тапетумом условно можно выделить 4 типа строения тапетальной мембраны.
I. Pinaceae-тип. Структура мембраны довольно однородна на всех стенках
клетки. Она представлена фибриллярным материалом, в который на внутренней
тангентальной стенке включены орбикулы. Такая структура мембраны
обнаружена у представителей семейств Pinaceae, Schisandraceae, Simmondsiaceae,
Moraceae, Chenopodiaceae, AUiaceae, Ruscaceae.
II. Rosaceae-тип. Этот тип тапетальной мембраны отличается от предыдущего
отсутствием орбикул в фибриллярном материале и выявлен у представителей
семейств: Rosaceae, Fabaceae, Linaceae, Polygonaceae.
III. Solanaceae-тип. Структура тапетальной мембраны представлена сетчатым
переплетением тяжей, окружающим каждую клетку целиком. К мембране на
внутренней тангентальной стенке прикрепляются орбикулы. Такая структура
мембраны наблюдалась у представителей Solanaceae.
IV. Роасеае-тип. Наблюдаются различия в структуре мембраны в зависимости
от ее положения. Тапетальная мембрана внутренних тангентальных стенок
состоит из трех компонентов: продырявленного слоя, сетчатого переплетения тяжей и
орбикул. Тапетальная мембрана радиальных стенок по структуре в целом
соответствует мембране на внутренней тангентальной стенке. Разница в их строении
заключается в том, что орбикулы располагаются приблизительно на 1 /3
поверхности радиальных стенок, ближе к полости гнезда пыльника. Тапетальная
мембрана радиальных стенок заходит частично на наружную тангентальную стенку,
огибая наружные углы клетки. Мембрана наружных тангентальных стенок пред-
4 Генеративные органы цветка.
50
Генеративные органы цветка
ставлена фибриллярным материалом. Такая сложная и оригинальная структура
тапетальной мембраны характерна для представителей семейства Роасеае.
К настоящему времени структура тапетальной мембраны исследована светооп-
тическим и электронно-микроскопическим методами у представителей 30
семейств с секреторным тапетумом.
У растений с амебоидным типом тапетума (Asteraceae и Caprifoliaceae и
др.) формируется только экстратапетальная мембрана в виде электронно-цро-
зрачного слоя с глобулами спорополленина (Heslop-Harrison, Dickinson, 1969).
Анализ химической природы экстратапетальной и тапетальной мембран, как
и экзины пыльцевого зерна, показывает, что она состоит их ацетолизоустойчивого
материала, относящегося к классу спорополленинов. Функциональное значение
экстратапетальной мембраны до сих пор неясно. Предполагают, что она образует
мешок (culture sac) для сохранения пыльцевых зерен (Heslop-Harrison, Dickinson,
1969). У злаков тапетальная мембрана на внутренних тангентальных стенках,
вероятно, обеспечивает однослойное расположение пыльцевых зерен в гнезде
пыльника в результате «прилипания» шипиков экзины к шипикам орбикул (Романов,
1970в). Существует мнение, что орбикулы способствуют высыпанию зрелой
пыльцы из пыльника, в связи с тем, что зрелая пыльца легко отскакивает от их несма-
чиваемой поверхности (Heslop-Harrison, Dickinson, 1969). Структура компонентов
тапетальной мембраны, как и структура экзины пыльцевого зерна,
характеризуется постоянством и может быть использована как диагностический признак в
систематике. Форма, величина и количество орбикул на единицу поверхности
мембраны специфичны для таксона на уровне рода. Рис. 13.
Голубева, 1983; Огородникова, 1976, 1986, 1990; Резникова, 1984; Романов, 1970в; Banerjee, 1967;
Christensenetal., 1972; Cousin, 1979; Dickinson, 1970; Heslop-Harrison, Dickinson, 1969; Walles, Rowley,
1979.
СПОРОПОЛЛЕНИН — биополимер, содержащийся в экзине пыльцевого зерна;
экзоспории спор, в продуктах секреции тапетума, а также в клетках некоторых
грибов и водорослей на определенных стадиях их жизненного цикла. Термин
введен Zetzsche (Zetzsche et al., 1937).
Спорополленин устойчив к химическим и физическим воздействиям, слабо
растворим лишь в 2-аминоэтаноле и хромовой кислоте. До сих пор точно не
установлены химический состав спорополленина, его предшественники и место их
синтеза (Southworth, 1990). В первом сообщении указывалось, что спорополленин
является окисленным углеводородом, имеющим химический состав между
СздНшОго и С9оН15о03з (Zetzsche et al., 1937). Brooks и Shaw (1968, 1978) считали,
что спорополленин образуется путем окислительной кополимеризации каротино-
идов и каротиноидных эфиров: авторы обнаружили стократное увеличение
количества каротиноидов при образовании зигоспор у гриба Mucor mucedo, а также
включение Н3 - ^-каротина в спорополленин некоторых грибов и С14-
каротиноидов — в пыльцу Lilium и Cucurbita. Однако, позднее выявлено, что ингибирование
каротиноидного биосинтеза мало влияло на формирование спорополлениновой
оболочки пыльцы Cucurbita pepo (Prahl et al., 1985). Спектроскопический анализ
химически устойчивого материала наружной клеточной стенки водоросли
Botryococcus braunii показал, что этот материал явно некаротиноидной природы
(Berkaloff et al., 1983; Largeau et al., 1984). Более того, в развивающихся
микроспорах тюльпана во фракции спорополленина был обнаружен фенилаланин (Prahl
et al., 1986), который,, как считают авторы, участвует в биосинтезе
спорополленина как непосредственный предшественник фенолов; не исключено, что в биосинтез
спорополленина вовлечен терпеноидный метаболизм. Применялась также С'3
ядерная магнитно-резонансная спектроскопия для анализа спорополлениновых
Пыльник 51
образцов, выделенных из пыльцы растений самых разных
филетических рангов (Guilford et al., 1988). Обнаружено,
что спорополленин — не одно-единственное вещество, а
состоит из смеси сходных полимеров XHemsley et al., 1992),
происходящих от таких насыщенных предшественников,
как жирные кислоты. Электронно-цитохимическое
исследование развивающихся микроспор Liriodendron chinensis с
применением ферментов до и после фиксации позволило ЦООС/
получить доказательство в пользу предположения, что
предшественниками спорополленина могут быть липороте-
иды (Габараева, 1990; Gabarayeva, 1991). После выделения р _ кумариновая кислота
спорополленина из пыльцы Pinus mugo и анализа его в
масс-спектрометре обнаружилось, что в спектре
доминируют пики, характерные для р-кумариновой кислоты (Wehling et al., 1989). При
химическом разрушении спорополленина с использованием АЦ3 р-кумариновая
кислота также являлась основным компонентом его деградации и было сделано
предположение, что р-кумариновая кислота является истинной структурной
единицей спорополленинового скелета (Wehling etal., 1989; Wiermann, Gubatz, 1992).
Таким образом, самые разные химические вещества рассматриваются
различными авторами как возможные предшественники спорополленина. Это
естественно в ситуации, когда (1) сама структура спорополленина до конца не установлена
(2) понятие «предшественник» допускает широкую интерпретацию, при которой
может подразумеваться целый ряд веществ, подключающихся к биосинтезу на его
разных инициальных ступенях. Следствием неясности химического состава
спорополленина и его предшественников является то, что до сих пор не найдено их
специфических метчиков. Правда, недавно возникла надежда получить такой
метчик (Southworth et ah, 1988). Как отмечают авторы, единственный путь
идентифицировать вещество, не определяя его химическую структуру — это
использовать его как антиген, получить на него специфические антитела и применить им-
муноцитохимические методы, чтобы определить и охарактеризовать место
синтеза этого вещества. Развивая эту остроумную идею, Southworth et al. (1988)
разработала методику очистки экзин и цитоплазмы с целью получения антител
на спорополленин. Предварительные результаты показали, однако, что все
химические экстракции, которые удаляют неспорополлениновые компоненты
пыльцевых зерен, уменьшают связывание антител с пыльцевыми зернами, указывая на
то, что часть антител связывалась ранее с протеиновыми или другими
компонентами экзин (Southworth at al., 1988). Для получения высокоспецифичного
метчика-антитела на спорополленин необходимо иметь абсолютно очищенный от
примесей спорополленин, и притом в нативном состоянии. Однако, данные Rowley с
соавторами (Rowley, Prijanto, 1977; Rowley, Dahl, Sengupta, 1981; Rowley, 1990) о
структуре экзины, которые показывают экзину как элементы гликокаликса,
«замурованные» в спорополленин, оставляют мало надежды на саму возможность
получения чистого (без примесей) спорополленина. Что касается намерения
определить с помощью антител место синтеза спорополленина, то это
представляется маловероятным, поскольку его предшественники в цитоплазме имеют совсем
другой химический состав, и антитела не должны на них реагировать. Известно,
что никаких следов спорополленина внутри клеток найти не удалось, и клетка
выделяет лишь вещество — предшественник спорополленина, которое полимеризу-
ется уже на поверхности микроспоры. Считается более или менее установленным,
что у большинства растений в течение тетрадного периода предшественники
спорополленина синтезируются самой микроспорой, а в посттетрадном — в основном
тапетумом. Относительно места их синтеза в различных органеллах клетки суще-
4*
52
Генеративные органы цветка
ствуют различные мнения. Однако в последнее время все больше авторов отдают
предпочтение в этом отношении цистернам эндоплазматического ретикулума
(ЭР). Высказано предположение, что синтез предшественников спорополленина
осуществляется короткими трубчатыми цистернами агранулярного ЭР (АЭР)
микроспор (Dunbar, 1973; Gabara, 1974; Dickinson, 1976; Габараева, 1991).
Интересно, что в терпеноидогенных клетках многих видов растений (и животных) было
показано участие АЭР в синтезе и транспорте липидов, терпенов, стероидов
(Васильев, 1977) — веществ тех же групп, к которым предположительно относятся
предшественники спорополленина. Другие необычные формы ЭР —
агрегированные, так называемый кольчужный ЭР и «зебра»-ЭР — участвуют, по всей
вероятности, в синтезе предшественников спорополленина у представителей сем.
Magnoliaceae (Габараева, 1990; Gabarayeva, 1991). Весьма важно отметить
возможные функции спорополленина экзины. Кроме нескольких широко известных
(механическая защита пыльцы после высыпания, защита от высыхания, УФ-лу-
чей, радиации, контроль за гармомегатностью, запасание белков, узнавания и
самонесовместимости) , предполагаются и другие функции. Дело в том, что кароти-
ноиды содержат свободные радикалы и конъюгированные двойные связи, что
обуславливает антиоксидантную активность этих веществ. На этом основании
высказано предположение, что тонкий каротиноидо-содержащий слой или слой
другого химического состава, обладающий множеством конъюгированных двойных
связей, может дезактивировать различные химические вещества и подавлять
отдельные реакции, предохраняя протопласт от окисления (Kronestedt-Robards,
Rowley, 1989). Итак, возможно, защитная функция экзины, проявляющаяся в
ходе развития пыльцевого зерна, обусловлена тем, что содержащийся в ней антиок-
сидант обнаруживает свою активность при низком парциальном давлении
кислорода внутри пыльника (до цветения). При высоком содержании кислорода (после
высыпания пыльцы из полости пыльника) он, наоборот, показывает высокий
уровень автоокисления (Burton, Ingold, 1984).
Васильев, 1977; Габараева, 1990, 1991; Berkaloff et al., 1983; Brooks, Shaw, 1968, 1978; Burton, Ingold,
1984; Dickinson, 1976; Dunbar, 1973; Gabara, 1974; Gabarayeva, 1991; Guilford et al., 1988; Hemsley et al.,
1992; Kronestedt-Robards, Rowley, 1989; Largeau et al., 1984; Prahl et al., 1985, 1986; Rowley, Prijanto,
1977; Rowley J. R., Dahl, Sengupta, Rowley J S., 1981; Southworth, 1988, 1990; Southworth et al., 1988;
Wehlinget al., 1989; Wiermann, Gubatz, 1992; Zetzsche et al., 1937.
ТАПЕТУМ. УЛЬТРАСТРУКТУРНЫЕ АСПЕКТЫ.
Ультраструктура тапетума изучена на примере различных представителей
цветковых: Paeonia tenuifolia (Marquardt et al., 1968), Zea mays (Чеботарь, 1969,
1972), Lilium longiflorum (Heslop-Harrison, Dickinson, 1969), Mahonia aquifolium
(Roland-Heydacker, 1979), Disporum smilacinum (Takahashi, Sohma, 1979),
Primula obconica (Stevens, Murray, 1981), Ziziphora bibersteiniana и Thymus
caramarjamicus (Курбанов, 1981), Lilium henryi (Hrich, 1983), Austrobaileya
maculata (Zavada, 1984), Secale cereale, Triticum aestivum, Avena satiua (Огород-
никова, 1986; El-Ghazaly, Jensen, 1985), Michelia fuscata (Габараева, 1986),
Tillandsia pallidoflavens, Tilia platyphyllos (Hesse, Hess, 1993). Полный обзор этих
работ сделал Bhandari (1984). Еще Ubisch (1927), Kosmath (1927) и др. обратили
внимание, что на поверхности клеток секреторного тапетума образуются темно-
окрашенные тела, состоящие из спорополленина. Позже Brooks и Shaw (1968)
высказали мысль, что предшественником спорополленина в пыльниках lilium henryi
являются каротиноиды и что экзина образуется в результате окислительной
полимеризации каротиноидов и стероидосодержащих веществ. Основные каротиноид-
ные пигменты, участвующие в образовании спорополленина у различных видов
Lilium'. о(-каротин-5, 6-эпоксид, ^-каротин, виолаксантин, антераксантин и др.,
Пыльник
53
образуются в конце фазы тапетальной активности. Нет единого мнения
относительно происхождения спорополленина экзины. Высказано предположение
(Echlin, 1971), что синтез предшественников спорополленина происходит как в
цитоплазме пыльцевого зерна, так и в цитоплазме клеток тапетума. О
существовании связи между предшественниками спорополленина и энзимообразованием
говорят наблюдения Valda (1981), показавшего, что при разрушении тапетума у
Primula obconica эстераза и липидные компоненты откладываются на экзине
развивающихся пыльцевых зерен.
Исследователи придерживаются единого мнения о том, что тапетум
микроспорангия цветковых растений играет важную роль в образовании нуклеиновых
кислот, белков, углеводов, полисахаридов, кислой фосфатазы (растворитель
целлюлозной оболочки тетрады микроспор), а также в синтезе предшественников
спорополленина, идущего на образование ацетолизоустойчивой экзины, спородермы,
синтеза предшественников тапетальных «зерен», названных тельцами Убиша, по
имени исследователя, впервые описавшего их (Ubisch, 1927), тапетодермы, пол-
ленкита, трифины и др.
Амебоидный (периплазмодиальный) тапетум исследован на примере
Тradescantia bracteata (Mepham, Lane, 1969), Helianthus annuus (Horner, 1977),
Mahonia aquifolium (Roland-Heydacker, 1979) и др. Тапетальные клетки
традесканции богаты пластидами, митохондриями, рибосомами, большими полисаха-
ридными образованиями и электронноплотными телами с гранулярным
содержимым. В периплазмодии обнаружены рафиды, не связанные с мембранными
структурами (Bhandari, 1984). В тапетуме Helianthus annuus выявлены стилоподобные
кристаллы. Как было показано, многочисленные пузырьки Гольджи участвуют в
образовании мультивезикулярных тел. Подобные образования выявлены и в
секреторном тапетуме Zea mays (Чеботарь, 1972), Ipomea purpurea и Helleborus
foetidus (Bhandari, 1984).
В ходе микроспорогенеза тапетум подвергается дефинитивной деструкции: к
моменту образования тетрад микроспор его клеточные оболочки растворяются, а
протопласты со всеми органеллами внедряются между ними. В массе излившегося
периплазмодия пластиды, как и другие клеточные органеллы, претерпевают ре-
дифференциацию. Об этом свидетельствует реорганизация их структуры. В
цитоплазме вновь появляются диктиосомы, гранулярный ЭР, микротрубочки,
происходит образование электроннопрозрачных везикул, содержащих гидролитические
ферменты. Последние, сливаясь с каллозной оболочкой тетрад микроспор,
ускоряют ее распад.
В ходе резорбции клеток усиливается их вакуолизация, цитоплазма остается
электронноплотной, в пластидах растет число пластоглобул. Параллельно с
деструктивными процессами, идущими в тапетуме, компоненты трифины — полиса-
харидные гранулы, уплощенные липидные глобулы и другие фрагменты
цитоплазмы откладываются в виде поверхностного слоя на экзине (Bhandari, 1984).
Секреторный (железистый) тапетум наиболее часто встречается у цветковых
растений и электронномикроскопически изучен у большого числа видов: Роа
annua, виды Silene и Cannabis, Lilium longiflorum, Allium сера, Beta vulgaris, Citrus
lemon, Sorghum bicolor, Capsicum annuum, Antirrhinum majus, Gentiana acaulis,
Pelargonium zonale, Kalanchoe obtusa, Lycopersicum peruvianum, Lens culinare (все
виды цит. по Bhandari, 1984), Zea mays (Чеботарь, 1969, 1972), Primula obconica
(Stevens, Murray, 1981), Austrobaleja maculata (Zavada, 1984), Secale cereale,
Triticum aestivum, Avena sativa (Огородникова, 1986) и др. Клетки секреторного
тапетума одно-двух-четырех- и многоядерные, связанные между собой
многочисленными плазмодесмами, которые прослеживаются также и между тапетумом и
клетками промежуточного слоя и микроспороцитами (на ранних фазах развития).
54
Генеративные органы цветка
В двуядерных клетках тапетума Zea mays (Чеботарь, 1972) обнаружены крупные
пучки микротрубочек, расположенные вдоль радиальной стенки клетки.
Подобные образования обнаружены и у Avena, Olea и Helleborus (Bhandari, 1984). Роль
и происхождение этих структур неизвестны. Не потеряли интерес сообщения
Cooper (1952),.Takats (1962), показавших, что в цитоплазме тапетальных клеток
синтезируются ДНК, РНК и белки. Причем основной .синтез падает на период
мейоза. Однако этот вопрос не получил окончательного разрешения. До конца не
выяснен и вопрос о том, в какой форме из клеток тапетума поступают к микроспо-
роцитам питательные вещества. Takats (1962) полагает, что нуклеиновые
кислоты, образующиеся в тапетальном слое, попадая в микроспороциты, деполимери-
зуются и ресинтезируются. Цитофотометрические исследования {Taylor, 1959,
Moss, Heslop-Harrison, 1967 — цит. по Резниковой, 1984) выявили независимость
биосинтеза основных макромолекулярных соединений в развивающихся микро-
спороцитах, микроспорах, пыльцевых зернах и тапетуме кукурузы. Авторами
высказано предположение, что накопление РНК и белков в клетках тапетума
связано с формированием этой ткани и выполнением ею определенных
специфических функций. Однако вряд ли можно согласиться с этим.
Изучение тапетогенеза' у Zea mays позволило выделить следующие фазы
(Ф): Ф1 — дифференциация тапетума; Ф2 — деление ядер, их полиплои-
дизация; ФЗ — усиление физиолого-биохимической активности, увеличение
количества нуклеопротеидов, аминокислот, витаминов, активизация органелл
(пластид, митохондрий, аппарата Гольджи, ЭР и др.), синхронное
взаимодействие с метаболическими процессами, протекающими в материнских
клетках микроспор и клетках других слоев стенки микроспорангия; Ф4 —
наступление литической волны, начало так называемой деструкции тапетума
и развертывание морфо-физиологических изменений в материнских клетках
микроспор, секреции предшественников спорополленина и спорополленинооб-
разование; Ф5 — «периплазмоидизация» клеток тапетума, реорганизация
структуры органелл. Попытаемся дать краткую характеристику того, что
происходит в тапетогенезе на субмикроскопическом уровне.
Установлено, что начало растворения каллозы, окружающей тетрады
микроспор, совпадает с началом растворения пектоцеллюлозных оболочек тапетальных
клеток. Плазмодесменные связи между клетками тапетума Zea mays (Чеботарь,
1972) расширяются настолько, что свободно преодолеваются митохондриями. К
одноядерной фазе микроспор тапетальные клетки лишены оболочек, их
протопласт ограничен лишь плазмалеммой. После растворения оболочек клеток
«периплазмодий» перемещается в пространство между пыльцевыми зернами, достигая
иногда центра микроспорангия. В таких «периплазмодиальных» образованиях
можно наблюдать хлоропласты, амилопласты, активизацию деятельности
аппарата Гольджи, митохондрий и ЭР (Чеботарь, 1969а, б). Однако этот период
непродолжителен. Что же происходит с цитоплазмой клеток тапетума и ее органелл в
4-ой фазе тапетогенеза?
Основное вещество цитоплазмы клеток тапетума электронноплотное,
насыщено органеллами. Значительная часть протопласта занята крупными, плотно
прижатыми друг к другу ядрами. В отличие от клеток других слоев стенки пыльника
(эндотеция, эпидермиса) клетки тапетума Zea mays на протяжении Ф4—Ф5
лишены крупных вакуолей. Незначительное количество мелких вакуолей
приурочено к завершению деления ядер (тапетума), разбросано главным образом по
периферии клеток.
Тапетогенез, или генезис тапетума — это совокупность морфо-физиологических изменений от
начала образования тапетума до его гистолиза (А.Ч.)
Пыльник
55
Резорбция органелл, деструктивные процессы в целом протекают в
присутствии вакуолей. Обратную картину наблюдаем в клетках эндотеция и эпидермиса.
Обращает внимание сравнительно высокая плотность основного вещества
цитоплазмы клеток тапетума. Преобладающие компоненты цитоплазмы: рибосомы,
свободные (в полисомах) и прикрепленные, а также гранулярный ЭР. К
наступлению деструктивной волны многочисленные слабо дифференцированные
митохондрии и пластиды претерпевают характерные структурные изменения. В
протопласте появляются миелиновые структуры. Плазмалемма хорошо
прослеживается по всему периметру клетки, содержит множество пиноцитозных инвагинаций,
иногда переходящих в своеобразные внутриплазматические проходы на
наружной, обращенной к микроспорам, поверхности клеток.
Ядра тапетальных клеток довольно крупные, содержат одно или несколько
ядрышек и многочисленные хроматиновые структуры. Они отличаются высокой
активностью (полного исчезновения хроматиновых структур не наступает).
Описанное состояние хорошо прослеживается на протяжении всего тапетогенеза. При
фиксации по Паладе и контрастировании уранилацетатом и тетраокисью свинца
хроматиновые структуры в тапетуме Zea mays выявляются довольно четко
(Чеботарь, 1969в,1972).
Кариолимфа тапетальных ядер электронно прозрачная, содержит электрон-
ноплотные фибрилярные образования, многочисленные гетерохроматиновые
участки, напоминающие по своей ультраструктуре ядрышко, но более
крупнозернистые. В литературе много суждений о роли полиплоидизации клеток тапетума, а
следовательно, о повышении содержания нуклеиновых кислот в последних,
однако никто не описывал достоверно слияния таких ядер. Ультраструктурное
исследование указывает лишь на сильное их сближение.
Пластиды (лейко-, амило-, хлоро- и хромопласты) слабо дифференцированы.
Развитые хлоропласты, подобные тем, которые наблюдаются в клетках
эндотеция, в тапетуме не выявлены. На стадии микроспор пластиды различаются
структурой внутренней мембранной системы.
Характерной особенностью пластид, вступающих в фазу активной
дезинтеграции, является расслаивание матрикса, приводящее к полному
разрушению (лизису) органелл. Наблюдается исчезновение мембранных структур и
появление одной или множества осмиофильных глобул, расположенных
группами. В целом пластиды клеток тапетума претерпевают тот же процесс
облитерации, что и другие клеточные органеллы. Пластиды
высвободившегося «периплазмодия» претерпевают, наряду с реактивацией других
органелл, своеобразную реорганизацию и формируют внутреннюю мембранную
систему.
Митохондрии многочисленны, равномерно распределены по всему
протопласту, в основном сферические, реже удлиненные, неравномерной толщины,
крупных размеров (магномитохондрии) с плотным матриксом и
многочисленными длинными кристами. Местами митохондрии окутаны каналами ЭР.
В периплазмодии митохондрии, как наиболее долго сохраняющие морфофи-
зиологическую активность, первоначально становятся более электронноплот-
ными, обнаруживая даже признаки фрагментации по периферии органелл.
Однако с усилением литической волны митохондрии теряют электронную
плотность, кристы в центре матрикса исчезают, наблюдается лишь
небольшое их число близ оболочки органелл.
Аппарат Гольджи в начале тапетогенеза активно отделяет многочисленные
везикулы, образующие мультивезикулярные тела, которые перемещаются к плаз-
малемме. Аппарат Гольджи представлен многочисленными вытянутыми диктио-
сомами, терминальные цистерны, которые принимают мешкообразный вид, содер-
56
Генеративные органы цветка
жат электронноплотное вещество. В фазе — 1 (дифференциация клеток тапетума)
аппарат Гольджи высоко активен; в фазе — 3—4 тапетогенеза диктиосомы
достигают максимальной длины, их число 3—4, они менее активны и сохраняются до
полного лизиса «периплазмодия».
ЭР гранулярной формы сильно развит. Многочисленные каналы ЭР образуют
участки эргастоплазмы, окружают ядра, пластиды и митохондрии, местами ана-
стомозируют. Активность ЭР и диктиосом связана с транспортом
предшественников спорополленина, равно как и с обеспечением питательными веществами
развивающихся микроспор. Было замечено, что в фазе гистолиза тапетальных клеток
гранулярный ЭР становится агранулярным.
Рибосомы на протяжении всего тапетогенеза многочисленны, прикреплены к
мембранам ЭР, образуя непрерывные полисомные ряды (из 4—8 единиц), или
свободны.
Ретроспективный анализ тапетогенеза показывает, что тапетум обладает
наиболее мощным метаболическим потенциалом по сравнению с другими
слоями стенки микроспорангия. Он приспособлен к использованию
промежуточных и конечных продуктов клеточного метаболизма других слоев стенки
эпидермиса, эндотеция и промежуточного слоя (у Zea mays эпидермальные
клетки богаты хромопластами и липидными образованиями, а эндотеций
имеет сильно развитую фотосинтетическую систему) (Чеботарь, 1970). Элек-
тронномикроскопические исследования ультраструктуры тапетума
показывают, что стенка пыльника по своей специализации, интегрированное™ и роли
в развитии и дифференциации гаплоидных структур, представляет
уникальное спорофитное образование.
Габараева, 1986; Курбанов, 1981; Огородников, 1986; Резникова, 1984; Чеботарь, 1969а, б, в, 1970,
1972; Bhandari, 1984; Brooks, Shaw, 1986; Cooper, 1952; Echlin, 1971; El-Ghazaly, Jensen, 1985; Heslop-
Harrison, Dickinson, 1969; Hesse, Hess, 1993; Horner, 1977; Hrich, 1983; Kosmath, 1927; Marquardtetal.,
1968; Mepham, Lane, 1969; Moss, Heslop-Harrison, 1967; Roland-Heydacker, 1979; Stevens, Murray, 1981;
Takahashi, Sohma, 1979; Takats, 1962; Taylor, 1959; Ubisch, 1927; Valda, 1981; Zavada, 1984.
НОВЫЙ ПОДХОД К КЛАССИФИКАЦИИ ТИПОВ ТАПЕТУМА
Принципы классификации типов тапетума основываются на структурных
особенностях этой ткани. Чаще всего, начиная с предложенной Goebel (1905)
типологии, различают два типа тапетума: секреторный (синонимы:
железистый, клеточный, париетальный) и амебоидный (синонимы:
периплазмодиальный, инвазйвный). В последний тип включают и случаи образования
периплазмодия, в котором, вслед за Tischler (1915), выделяют два вида —
настоящий и ложный (синонимы: типичный и нетипичный) —
периплазмодии, причем, критерии для их определения у авторов различны (Tischler,
1915; Wunderlich, 1954; Carniel, 1963; Davis, 1966; Поддубная-Арнольди,
1976). Claussen (1927) выделил 4 подтипа периплазмодия.
В современных классификациях отмечается большее разнообразие форм и
структурно-функциональных особенностей тапетума (Pacini et al, 1985; Pacini,
1990; Pacini, Franchi, 1991), при этом учитываются все периоды его развития в
связи с генезисом пыльника (Камелина, 1978, 19816, 1988, 1991).
Приняв за основу не только структурные, но и временные факторы
отличий в развитии тапетума, указанные Carniel (1963), Камелина (1978)
вводит в классификацию тапетума понятие «реорганизация тапетума»,
которая имеет место у ряда таксонов в постмейотический период. Предложено
также различать амебоидный и периплазмодиальный тапетумы, равно
как «ложный» и «настоящий» периплазмодии, оставив за последним статус
одного из основных типов. Во избежание путаницы в терминологии «лож-
Пыльник 57
ный» периплазмодий предлагается называть синцитием и рассматривать
его как форму реорганизации клеточного тапетума.
Электронно-микроскопические исследования подтверждают эти построения (Pacini, Juniper, 1983;
Pacini, Keijzer, 1989).
Таким образом, основными типами тапетума у цветковых растений
являются клеточный (секреторный) и периплазмодиальный. В первом
типе наблюдается клеточный тапетум без реорганизации и с реорганизацией
(4 формы), происходящей после стадии тетрад микроспор (в
постмейотический период развития пыльника) с образованием синцития, амебоидного
тапетума, окаймляющего симпласта н тапетальной ткаии. Несколько
вариаций развития отмечено и в периплазмодиальном типе (Камелина,
1991).
Клеточный тапетум — характеризуется клеточной структурой и
пристенным положением на всем протяжении существования ( за
исключением тех случаев, когда имеет место реорганизация тапетума).
Первичная оболочка сохраняется в клетках тапетума до стадии тетрад
микроспор, после чего вслед за ее растворением происходит образование вторичной
оболочки, содержащей спорополленин, и во многих случаях с орбикулами на
внутренней тангентальной и радиальных сторонах каждой клетки. Лизис
содержимого клеток происходит постепенно, в зрелом пыльнике сохраняется
лишь спорополлениновая тапетальная пленка с орбикулами.
Этот тип тапетума (клеточный, без реорганизации) отмечен у 229 семейств
двудольных и у 38 семейств однодольных растений.
Периплазмодиальный тапетум (греч.peri — вокруг,plasma —
жидкая или гелеобразная часть клетки, eidos — форма) — настоящий
периплазмодий, по Carniel, 1963) — характеризуется формированием ценоцит-
иой структуры на ранних стадиях в течение премейотического и
мейотического периодов развития пыльника. Растворение оболочек
клеток тапетума происходит сразу же после образования тапетального слоя.
Причем, в отличие от клеточного тапетума, в периплазмодиальном не
появляются плазмодесмы между клетками тапетума и микроспороцитами, а в
оболочках отсутствует целлюлоза (отмечен только пектин) (Albertini et al.,
1987). В одних случаях слияние цитоплазмы и образование периплазмодия
происходит одновременно с заполнением им микроспорангия на стадии мик-
роспороцитов (Ruppia — вариация). В других случаях — цитоплазма
отдельных протопластов сливается в однородную массу в пристенном слое, окружая
комплекс микроспороцитов с последующим проникновением в полость
микроспорангия на стадии тетрад микроспор (Potamogeton — вариация) или в
момент распада тетрад на отдельные микроспоры (Zannichellia —
вариация) . Ядра тапетума делятся в пристенном слое отдельных протопластов или
в общей массе цитоплазмы, распределяясь в дальнейшем по всему
периплазмодию. Микроспороциты, тетрады микроспор и микроспоры развиваются в
непосредственном контакте с плазмалеммой общего протопласта
периплазмодия. Содержащая спорополленин мембрана присутствует только на
внешней, прилегающей к тканям пыльника стороне протопласта периплазмодия.
Этот тип тапетума отмечен в 21 семействе однодольных растений.
Реорганизация тапетума — структурно-функциональная перестройка
клеточного тапетума, происходящая в начале постмейотического периода
развития пыльника. Генетически закрепленный признак, общий для многих
видов. Нарушение процесса реорганизации приводит к стерилизации
пыльцы. Реорганизация тапетума отмечена в 20 семействах двудольных
растений.
Пыльник
59
Синцитий (греч. syn- вместе и kytos- клетка) (=ложный периплазмодий, по
Carniel, 1963) — форма реорганизации клеточного тапетума.
Характеризуется растворением оболочек тапетума в начале постмейотического периода
развития пыльника, внедрением протопластов тапетума в полость
микроспорангия и дальнейшим слиянием их цитоплазмы. Однородная масса
периплазмодия заполняет все пространство между микроспорами на стадии их
вакуолизации.
Эта форма реорганизации тапетума отмечена в семействах Winteraceae,
Malvaceae, Rubiaceae, Caprifoliaceae, Valerianaceae, Asteraceae и др.
Амебоидный тапетум (=несинцитиальный инвазивный, по Pacini,
Franchi, 1991) — форма реорганизации клеточного тапетума.
Характеризуется растворением оболочек клеток тапетума в начале постмейотического
периода развития пыльника и внедрением протопластов тапетума в полость
микроспорангия между микроспорами. При этом плазмалемма каждого
протопласта сохраняется, цитоплазма их не смешивается, и всегда остаются
заметными границы между отдельными протопластами. Эта форма
реорганизации тапетума встречается у отдельных представителей семейств
Lauraceae, Papaveraceae, Rubiaceae, Asteraceae.
Окаймляющий симпласт (греч. syn — вместе и plastos — образованный,
вылепленный) — форма реорганизации клеточного тапетума.
Характеризуется растворением оболочек клеток тапетума в начале постмейотического
периода развития пыльника с последующим слиянием цитоплазмы
отдельных протопластов и образованием многоядерного протопласта в пристенном
слое, без внедрения его в полость микроспорангия. Описан в сем.
Berberidaceae (Budell, 1964).
Тапетальная ткань — форма реорганизации клеточного тапетума.
Характеризуется растворением оболочек клеток тапетума в начале
постмейотического периода развития пыльника с последующим внедрением
протопластов в полость микроспорангия и заполнением ими пространства между
микроспорами. Между протопластами образуются вторичные целлюлозные
оболочки, и на стадии вакуолизированных микроспор тапетум снова
становится клеточным. Спорополленин в оболочках тапетальной ткани и орбику-
лы не обнаружены. Лизис клеток происходит постепенно, причем оболочки
лизируют в последнюю очередь. В зрелом пыльнике тапетальная ткань не
сохраняется. Эта форма реорганизации клеточного тапетума описана в сем.
Dipsacaceae (Камелина, Яковлев, 1976; Камелина, 1980, 19876).
В качестве отдельных форм клеточного тапетума (называемого авторами
париетальным) предлагается рассматривать тапетум, оболочки клеток которого
сохраняются на всем протяжении развития, что характерно для некоторых видов с
пыльцой, собранной в полиады и массулы (Mimosaceae, Asclepiadaceae,
Orchidaceae), и тапетум злаков в связи с особенностями взаимоотношения
тапетум — микроспора (Pacini, Franchi, 1991).
При определении типа тапетума следует рассматривать его в развитии,
отмечать наличие или отсутствие реорганизации и учитывать следующие
критерии: его структуру щ и во время мейоза (для определения основного
типа) и на стадии вакуолизированных микроспор (для определения формы
реорганизации), степень и место слияния цитоплазмы протопластов (для
определения формы реорганизации). Характеризуя тапетум, необходимо
также учитывать количество ядер в клетках (одноядерный и многоядерный),
наличие тапетальной пленки с орбикулами или только экстратапетальной
мембраны, однородность и гетероморфность и другие морфологические
особенности.
60
Генеративные органы цветка
Цитология, ультраструктура, а также функции тапетума прекрасно освещены
в современных обзорах (Bhandari, 1984; Pacini et al., 1985; Albertini et al., 1987;
Pacini, 1990; Pacini, Ffanchi, 1991). Рис. 11,14.
Камелина, 1978, 1980, 19816, 1988, 1991; Albertini etal., 1987; Bhandari, 1984; Carniel, 1963; Chapman,
1987; Claussen, 1927; Davis, 1966; Goebel, 1905; Pacini et al., 1985; Pacini, 1990; Pacini, Franchi, 1991;
Wunderlich, 1954.
НОВЫЙ ПОДХОД К КЛАССИФИКАЦИИ ТИПОВ ФОРМИРОВАНИЯ
СТЕНКИ МИКРОСПОРАНГИЯ
Классификация типов формирования стенки микроспорангия
покрытосеменных была впервые предложена 30 лет назад (Батыгина и др., 1963). Эта
классификация была основана на оригинальных данных, полученных при исследовании
развития стенки микроспорангия в семействах Роасеае и Ericaceae, а также на
выявленной Warming (1873) центробежной последовательности и описанной
Carniel (1961) центростремительной последовательности в развитии стенки
микроспорангия. Описания центростремительной последовательности образования
клеточных слоев стенки микроспорангия были известны из литературы и раньше,
но в отличие от остальных только Carniel интерпретировал это развитие у Zea
mays L. как центростремительный морфогенетический процесс. Термин «стенка
микроспорангия» в данной работе мы употребляем для описания дистальной
(противоположной связнику) части покрова микроспорангия, где и проявляются в
полной мере описываемые закономерности.
В предложенную Батыгиной с соавт. (1963) классификацию были включены
данные о формировании стенки микроспорангия из париетального слоя, и об
образовании тапетума из краевых клеток вторичного археспория. Davis (1966),
предложив свой вариант классификации, основанной на поведении вторичных
париетальных слоев, выделила 4 типа развития стенки микроспорангия. К уже известным
двум типам — «центробежному» («двудольному» по: Davis, 1966; Solanaceae по:
Батыгина и др., 1963) и «центростремительному» («однодольному», по: Davis, 1966;
«Umbelliferae», по: Батыгина и др., 1963) она добавила два новых типа: «основной»
и «редуцированный». В связи с тем, что у большинства изученных таксонов
цветковых растений стенка микроспорангия образуется из первичного париетального
слоя, а вопрос о возможности формирования тапетума из клеток вторичного
археспория остается дискуссионным, мы в настоящей работе рассматриваем только
способы формирования стенки микроспорангия из первичного париетального слоя.
Согласно данным, приведенным в «Сравнительной эмбриологии цветковых
растений» (1981—1990) развитие стенки микроспорангия изучено у 150 семейств из
400 описанных в системе Тахтаджяна (1980). Центробежный (двудольный) тип
развития описан в 67 семействах двудольных растений и в 2 семействах
однодольных, центростремительный (однодольный) тип — в 23 семействах двудольных и 26
семействах однодольных растений. Основной тип описан в 27 семействах
двудольных растений и редуцированный тип — в 2 семействах однодольных.
Фактический материал, обобщенный в «Сравнительной эмбриологии
цветковых растений», позволил провести новый, более полный анализ имеющихся
данных с целью уточнения критериев, лежащих в основе классификации способов
развития стенки микроспорангия у покрытосеменных.
Следует отметить, что попытки корректировки данных о развитии стенки
микроспорангия уже предпринимались, главным образом с целью уточнения
терминологии (Батыгина, Шамров, 1981а; Гревцова, Сладков, 1983; Сладков, Гревцова,
1988). Не имея возможности вести полемику по всем вопросам обсуждаемой темы,
Пыльник
61
мы рассмотрим лишь главные из них, имеющие, с нашей точки зрения,
принципиальный характер.
В процессе развития в стенке микроспорангия образуются (не считая
эпидермиса, общего для пыльника в целом) три типа тканей.
Эндотеций — механическая, однослойная или многослойная ткань,
способствующая вскрыванию тек пыльника, присутствующая в зрелых пыльниках
не у всех таксонов (т. е. ткань факультативная). Обычно целлюлозные
пояски утолщений клеточных оболочек (фиброзные утолщения),
характеризующие в большинстве случаев этот тип ткани, формируются в клетках субэпи-
дермального слоя стенки микроспорангия. В связи сэтим, субэпидермальный
слой исследователи, как правило, называют эндотецием уже во время его
образования, что не во всех случаях соответствует дальнейшему назначению
этого слоя. Следует отметить, что образование утолщений оболочек в клетках
субэпидермального слоя происходит значительно позже его
дифференциации (обычно во время образования микроспор).
У значительного числа видов фиброзные утолщения в клетках стенки
микроспорангия вообще не образуются1. Они не образуются в пыльниках, теки которых
вскрываются порами, как, например, у представителей семейств Melastomataceae,
Ericaceae, Alangiaceae, Asclepiadaceae, Solanaceae, Scrophulariaceae (Солнцева,
1983, 1985; Якобсон, Терехин, 1983; Алимова, 1987; Наумова, 1987; Жукова, Под-
дубная-Арнольди, 1987; Никитичева, 1987). Они не образуются и у ряда таксонов
водных растений (Батыгина, Шамров, 1981 б), именно у тех, для которых
характерно подводное опыление (гипогидрофилия): представители семейств Ceratophylla-
ceae, Elatinaceae, Cymodoceaceae, Najadaceae и некоторых других (Батыгина,
Шамров, 1981а, б; Соколовская, 1983; Камелина, 1990; Терехин, 1990). Отсюда
видно, что ткань эндотеция имеет адаптивное значение по отношению к способам
опыления.
Фиброзные утолщения в оболочках клеток субэпидермального слоя
отсутствуют и тогда, когда функцию вскрывания тек принимает на себя эпидермис
(экзотеций). Подобные примеры описаны в семействах Ranunculaceae (Anemone,
Aquilegia), Polygonaceae (Oxyris) (Соколовская, 1981; Солнцева, 1983) и
некоторых других.
В случаях, когда фиброзные утолщения образуются не только в клетках
субэпидермального слоя, но и в клетках глубже лежащих слоев, логичнее
говорить о многослойной ткани эндотеция, а не о фиброзных утолщениях в
клетках средних слоев. Многослойный эндотеций описан у представителей
семейств Cannaceae, Cela-straceae, Rosaceae (Мандрик, Петрус, 1985;
Наумова, 1987а; Шевченко, 1990 и др.
Иногда однородные (фиброзные или иные по форме) утолщения образуются
как в клетках субэпидермального слоя, так и в эпидермисе (Arceuthobium из сем.
Viscaceae) или в клетках эпидермы, субэпидермального слоя или глубже лежащих
слоев, что описано, например, у Aeginetia из сем. Orobanchaceae, в семействах
Rafflesiaceae, Roridulaceae, Saxifragaceae (Терехин, Анисимова, 1981; Коробова,
1985; Камелина, 1985а; Терехин, 1987а, 19876).
Из приведенных примеров видно, что ткань эндотеция может иметь различное
происхождение и ее образование непосредственно не связано с дифференциацией
того или иного слоя в стенке микроспорангия. В связи с этим мы предлагаем на-
Сведения, касающиеся характеристики стенки микроспорангия у таксонов, включенных в
издание «Сравнительная эмбриология цветковых растений», здесь и далее приводятся по этому
изданию. Сведения о работах авторов оригинальных исследований можно найти в литературных
источниках, приведенных в вышеназванном издании.
62
Генеративные органы цветка
зывать все слои клеток, находящиеся между эпидермисом и тапетумом
сформированной стенки микроспорангия, средними, образующими ткань средних
слоев. В ходе дальнейшей специализации наружный слой (или слои) превращается
в эндотеций, а внутренний (или внутренние) — в трофическую ткань.
Трофическая ткань — однослойная или многослойная, провизорная
факультативная ткань, служащая источником питательных веществ для споро-
генной ткани. Об ее факультативности свидетельствует отсутствие
трофической ткани в стенке микроспорангия у некоторых представителей семейств
Lemnaceae, Najadaceae, Zannichelliaceae (Ильина, 1990; Камелина, Тере-
хин, 1990; Терехин, 1990). В случае многослойной трофической ткани и
многослойного же эндотеция разграничить эти ткани можно только после
появления в клетках эндотеция специфических утолщений или после начала
облитерации в клетках трофической ткани.
Тапетум — однослойная или многослойная ткань, провизорная, облигатно
присутствующая в стенке микроспорангия. Она выполняет в
микроспорангии три основные функции: питания микроспор, формирования экзины, а
также синтеза и высвобождения материала, используемого при отложении
трифины и «полленкита» (Bhandari, 1984). Отличительной особенностью
тапетальной ткани является ранняя специализация ее клеток, происходящая
вскоре после их дифференциации. Увеличение числа слоев тапетума в
пыльниках представителей некоторых семейств происходит, по-видимому, после
специализации тапетума как ткани (Камелина, 1985; Терехин, 19876).
Специфика образования основных тканей стенки микроспорангия позволяет
различать при ее формировании три вида морфогенетических процессов.
Дифференцирующие деления — периклинальные деления,
инициирующие разные по назначению ткани. Дифференцирующими являются,
например: деления археспориальных клеток, дающие спорогенную и
первичную париетальную ткань; деления клеток первичного или вторичного
париетального слоя, приводящие к инициации тапетума. Деления, ведущие к
увеличению числа клеток или числа средних слоев, в строгом смысле
дифференцирующимися не являются, так как образование эндотеция и
трофической ткани происходит на заключительных стадиях развития
микроспорангия. Эффект ложной диференцировки создается лишь в случае типовой
модели стенки микроспорангия: три слоя — три ткани.
Формирующие (образующие, по: Ивановская, 1983) деления —
периклинальные или антиклинальные деления, умножающие число клеток или
клеточных слоев той или иной ткани. Формирующими являются, например,
деления, ведущие к умножению числа клеток и клеточных слоев тапетума и
средних слоев как предшественников образования эндотеция и трофической
ткани.
Тканевая специализация. В отличие от предыдущих
морфогенетических процессов этот процесс не связан с делением клеток. Однородные
изменения, происходящие в отдельных клетках и распространяющиеся на
близлежащие, приводят к образованию специализированной ткани, что видно на примере
формирования фиброзных утолщений по мере обособления эндотеция.
В основе предложенных классификаций типов (способов) развития
стенки микроспорангия лежит критерий направленной
последовательности дифференцирующих делений, ведущих к инициации тапетума,
выявленный уже в работах Warming (1873), Carniel (1961) и использован-
Провизорными называются временные структуры, исчезающие, в отличие от дефинитивных, в
процессе развития.
Пыльник
63
иый в классификации Батыгиной с соавт. (1963), позже принятый Davis
(1966) в отношении двудольного и однодольного типов. Наиболее
отчетливо эта направленность дифференцирующих делений проявляется в типовых
моделях стенки микроспорангия: три клеточных слоя — три ткани (тапетум, средний
слой, субэпидермальный слой, называемый эндотецием). Направленность
дифференцирующих делений четко проявляется в последовательности образования
слоев: тапетум — производное первичного париетального слоя при центробежной
последовательности; тапетум — производное вторичного (внутреннего)
париетального слоя при центростремительной последовательности. Таким образом,
основным критерием типа развития стенки микроспорангия является
онтогенетическое время инициации тапетума.
В связи с этим, необходимо, чтобы критерий, лежащий в основе выделения
типов, получил отражение в их названиях — центробежный и центростремительный.
Это тем более целесообразно, что соответствие между типами классификации и
таксонами разных уровней далеко не всегда соблюдается.
Выдвинутый Davis (1966) критерий поведения вторичных париетальных слоев
для определения типовой принадлежности, на наш взгляд, неприменим, хотя бы
потому, что принадлежность к центробежному типу определяется уже в результате
периклинальных делений первичного париетального слоя. По вышеизложенным
причинам, а также потому, что обсуждаемая нами классификация относится к
способам формирования стенки микроспорангия из париетального слоя, следует
отказаться и от предложенных нами ранее (Батыгина и др., 1963) названий типов,
основанных на их первоописаниях в таксонах (Solanaceae и Umbelliferae — типы,
соответственно) .
С нашей точки зрения (Терехин и др., 1993), типовое разнообразие способов
формирования стенки микроспорангия покрытосеменных из париетального слоя
ограничивается двумя упомянутыми выше типами (см. схему). Davis (1966), по-
видимому, не имела оснований для выделения основного типа в качестве
оригинального, сопоставимого, по изложенным выше критериям, с центробежным и
центростремительным типами. И в центростремительном, и в основном типах
развития тапетум является производным вторичного (внутреннего) париетального
слоя. Все это позволяет оставить за основным типом лишь статус одной из
вариаций центростремительного типа. Эту вариацию можно назвать «компликатной»
(англ. complicated— усложненный). В типовой (3-слойной) вариации
центростремительного типа субэпидермальный средний слой инициируется в результате
периклинальных делений клеток первичного париетального слоя, тогда как в
компликатной вариации — в результате неоднократных периклинальных делений
вторичного (наружного) париетального слоя. Таким образом, в многослойных
моделях конечный субэпидермальный средний слой может быть производным любой
генерации периклинальных делений предшествующих субэпидермальных слоев.
Все эти вариации развития соответствуют критерию центростремительного типа.
При этом наружный париетальный слой, в сущности, не относится к категории
париетальных слоев, так как его деления не являются дифференцирующими.
Исходя из вышесказанных соображений, нельзя признать типовой статус и за
редуцированным типом. Он представляет собой, в сущности, одну из вариаций
развития центробежного типа, сокращенную до двух слоев — «редуцированную».
Тапетум в этом случае также является производным первичного париетального слоя.
О принадлежности редуцированной вариации развития к центробежному типу
свидетельствуют данные об образовании у ряда видов семейств Lemnaceae и
Zannichelliaceae среднего слоя в полном соответствии с центробежным типом
формирования стенки микроспорангия {Caldwell, 1899; Лодкина, 1971; Ильина, 1990;
Камелина, Терехин, 1990).
64
Генеративные органы цветка
Из изложенного следует, что иерархическая классификация, основанная
на выделении двух типов (центробежного и центростремительного) с
несколькими вариациями в каждом из них адекватно отражает
разнообразие эволюционных преобразований стенки микроспорангия.
Особое место среди вариаций способов образования многослойной стенки
микроспорангия центростремительного типа занимает вариация, описанная в сем.
Nymphaeaceae (Батыгина, Шамров, 1981 б). При этом способе развития тапетум
является производным третичного (внутреннего) париетального слоя. Эту вариацию
можно назвать «пролонгированной» (англ. prolonged—длительный), так как в ней
находит свое наиболее полное выражение именно центростремительная тенденция
в последовательности дифференцирующих делений, приводящих к образованию
тапетума. Формально этот способ развития как бы выходит за границу критерия
центростремительного типа. Поэтому в критерий центростремительного типа
необходимо, вероятно, внести дополнение: тапетум — производное вторичного
париетального слоя или его последующих дериватов (в отличие от центробежного типа,
где тапетум прилегает к внутренней границе стенки микроспорангия уже при
делении первичного париетального слоя).
Таким образом, иерархическая классификация типов формирования стенки
микроспорангия может быть представлена в следующем виде:
ЦЕНТРОБЕЖНЫЙ ТИП
Компликатная вариация
Первичный
париетальный
слой
Средний слой
Наружный
средний слой
Тапетум
Внутренний
средний слой
Типовая вариация
Первичный
париетальный
слой
Средний
слой
Тапетум
Наружный
(субэпидермальный)
средни й слой
Внутренний
средний слой
Редуцированная вариация
Первичный
париетальный слой
Субэпидермальный
средний слой
Тапетум
* Точками показана возможность формирующих делений и образования новых слоев.
Пыльник
65
Первичный
париетальный
слой
ЦЕНТРОСТРЕМИТЕЛЬНЫЙ ТИП
Пролонгированная вариация
Наружный
(субэпидермальный)
средний слой
Вторичный
париетальный
слой
Средний слой
Третичный
париетальный
слой
Внутренний
средний
слой
Тапетум
Компликатная вариация
Первичный
париетальный
слой
Средний слой
Средний слой
Средний слой
Вторичный
париетальный
слой
Средний слой
Тапетум
Типовая вариация
Первичный
париетальный
слой
Наружный
(субэпидермальный)
средний слой
Вторичный
париетальный
слой
Внутренний
средний слой
Тапетум
Приведенные выше материалы свидетельствуют о необходимости внесения
некоторых изменений в терминологию описания развития стенки микроспорангия.
В принципе, следует стремиться к сохранению устоявшихся терминов. Поэтому
вероятно нельзя согласиться, например, с предложением Сладкова и Гревцовой
(1988) заменить термин «археспорий» термином «инициальные (субэпидермаль-
ные) клетки». История фитоэмбриологии свидетельствует, что термином
«археспорий» при описании стенки микроспорангия всегда называются клетки,
имеющие двойственную судьбу (Schnarf, 1929; Goebel, 1932; Maheshwari, 1950). Сужать
понятие археспория до обозначения ранних стадий спорогенной ткани, что, в сущ-
5 Генеративные органы цветка.
fa Генеративные органы цветка
ности, предлагают Сладков и Гревцова, на наш взгляд, не совсем корректно.
Целесообразно, по-видимому, сохранить термины «первичный париетальный слой»
и «вторичный париетальный слой», ввести термины «третичный париетальный
слой», «трофическая ткань» и «ткань средних слоев».
В заключение рассмотрим возможные аспекты эволюционной
(филогенетической) интерпретации способов и вариаций развития стенки микроспорангия
покрытосеменных и возможность применения упорядоченных данных в этой области для
систематики. Необходимо учитывать прежде всего то обстоятельство, что
развитие стенки микроспораигия к настоящему времени изучено у
представителей менее половины семейств, составляющих систему цветковых
растений. Как и большинство других эмбриологических признаков, способы
формирования стенки микроспорангия, в противоположность утверждениям Davis (1966),
не всегда являются таксоноспецифическими на уровне семейств, порядков и т. д.
В некоторых крупных систематических группах у изученных таксонов
прослеживается сходный способ образования стенки микроспорангия. Так, например,
центробежный тип развития описан в порядках Ebenales, Gentianales, Dipsacales,
Polemoniales, центростремительный тип — в порядках Commelinales, Liliales. С
другой стороны, в ряде семейств описаны как центробежный, так и
центростремительный типы (к последнему относим и основной тип). Такими семействами
являются Capparaceae, Brassicaceae, Sterculiaceae, Euphorbiaceae, Rosaceae,
Zygophyllaceae, Apiaceae, Verbenaceae, Solanaceae (Батыгина, Колесова, 1983;
Беляева, Родионова, 1983; Родионова, 1983; Савина, 1983; Камелина, 19856; Манд-
рик, Петрус, 1985; Гревцова, 1987; Жукова, Лоддубная-Арнольди, 1987; Фрей-
берг, 1987).
В семействах Lemnaceae и Zannichelliaceae описаны типовая и редуцированная
вариации центробежного типа (Ильина, 1990; Камелина, Терехин, 1990).
Общее распространение способов (типов) развития стенки микроспорангия
среди покрытосеменных растений позволяет сделать вывод о несовпадении хода
эволюционных преобразований стенки микроспорангия и хода филогении
цветковых. Присутствие разных типов развития в одном таксоне (например, семействе)
свидетельствует о возможности параллельных эволюционных преобразований
структур стенки микроспорангия.
Вопрос о конкретных направлениях эволюционных преобразований стенки
микроспорангия остается не вполне ясным. Как мы показали выше,
редуцированная вариация «центробежного» типа является в некоторых случаях завершающей
стадией адаптации стенки микроспорангия к подводному опылению. В то же
время, остается не вполне понятным сходное направление редуцированных
изменений в семействе Lemnaceae, у представителей которого опыление происходит в
воздушной среде.
Сложным является и вопрос о модусах эволюционных преобразований стенки
микроспорангия. Общее увеличение или уменьшение числа слоев стенки
происходит, по-видимому, за счет изменения числа конечных периклинальных делений.
В то же время, редуцированная вариация обнаруживает тесную взаимосвязь с
онтогенетическим временем дифференциации тапетума.
Несовпадение эволюционных преобразований стенки микроспорангия и
филогенетического развития цветковых свидетельствует об относительном значении
этих данных для систематики. Общий уровень изученности формирования стенки
микроспорангия покрытосеменных остается недостаточным, что требует усиления
сравнительно-эмбриологических исследований структур стенки микроспорангия.
Алимова, 1987; Батыгина и др., 1963; Батыгина, Колесова, 1983; Батыгина, Шамров, 1981а, 19816;
Беляева, Родионова, 1983; Гревцова, 1987; Гревцова, Сладков, 1983; Жукова, Поддубная-Арнольди,
1987; Ивановская, 1983; Ильина, 1990; Камелина, 1985а, 19856; Камелина, Терехин, 1990; Коробова,
Пыльник
67
1985; Лодкина, 1971; Мандрик, Петрус, 1985; Наумова, 1987; Никитичева, 1987; Родионова, 1983;
Савина, 1983; Сладков, Гревцова, 1988; Соколовская, 1981, 1983; Солнцева, 1983, 1985; Тахтадшян,
1980; Терехин, 1983, 1987а, 19876, 1990; Терехин, Анисимова, 1981; Терехин и др., 1993; Шевченко,
1990; Bhandari, 1984; Caldwell, 1899; Carniel, 1961; Davis, 1966; Maheshwari, 1950; Schnarf, 1929;
Warming, 1873.
МИКРОСПОРОГЕНЕЗ
МИКРОСПОРОГЕНЕЗ — процесс формирования микроспор путем мейотическо-
го деления микроспороцитов, развивающихся внутри гнезд пыльника.
Материнские клетки микроспор (микроспороциты) возникают из клеток спорогенной ткани.
Они характеризуются плотной цитоплазмой и крупными ядрами и, вступая в
мейоз, теряют плазмодесменные связи с тапетумом. Далее пекто-целлюлозные
оболочки микроспороцитов подвергаются гидролизу и замещаются новыми, кал-
лозными оболочками. В ходе этого процесса плазмодесмы между микроспороцита-
ми исчезают, но микроспороциты соединены между собой широкими (1—2 мм)
тяжами цитоплазмы, проникающими через цитомиктические каналы в каллозных
оболочках. Наиболее выражены каналы на стадиях зиготены и пахитены. Через
них осуществляется межклеточный транспорт и создается возможность обмена
макромолекулами и даже цитоплазматическими органеллами. Как следствие
этого, физиологически активные вещества могут распространяться очень быстро во
все микроспороциты гнезда. Это, по-видимому, способствует определенной
синхронизации развития клеток и прохождения фаз мейотического деления (Bell, 1989;
Bhandari, 1984).
В ранней профазе I микроспороциты изолируются утолщенными каллоз-
ными оболочками с ограниченной проницаемостью. Полагают, что
микроспороциты не подвергаются воздействию со стороны сопряженных систем
родительского растения и поэтому могут осуществлять свое мейотическое
развитие (Dickinson, 1982).
Митохондрии и пластиды микроспороцита дедифференцируются и их строение
упрощается. Цистерны ЭР1 закручиваются в кольцевидные образования и
изолируют участки цитоплазмы в виде многослойных включений аналогично тому, что
имеет место в мегаспороцитах. Одновременно с изменением формы ЭР
наблюдается и снижение содержания цитоплазматической, рибосомальной и
информационной РНК. Эти изменения могут свидетельствовать, по крайней мере, о
частичной деструкции специфических информационных молекул и о подготовке основы,
на которой могут транслироваться транскрипты м-РНКазы, специфичные для га-
метофитной фазы; однако генная информация о спорофитной несовместимости
сохраняется и проявляется в прорастающих пыльцевых зернах. Влияние цитоплаз-
матических изменений, однако, интерпретируется по-разному (Bell, 1989; Souvre
<:t al., 1987; Dickinson, Li, 1988).
Ядерная оболочка и ядрышки очень активны в профазе I. Ядерная оболочка
образует внутриядерные везикулы, которые очевидно влияют на расположение
хромосом. Ядрышко выделяет многочисленные микроядрышки, которые в
последующей анафазе I, по-видимому, остаются в цитоплазме как нуклеолоиды (Souvre
etal., 1987).
Первое мейотическое деление приводит к формированию диады. Затем обра-
иуется тетрада микроспор обычно тетраэдральная. Тетрада и микроспоры внутри
нее окружены сплошными, обычно толстыми каллозными оболочками (Kapil,
Tiwari, 1978). У очень немногих растений (например, из сем. Сурегасеае) три по-
ЭР — эндоплазматический ретикулум.
68 Генеративные органы цветка
стмейотических ядра дегенерируют, и в дальнейшем формируется единственная
микроспора.
Известны два основных способа цитокинеза в микроспороцитах:
симультанный (у большинства двудольных) и сукцессивный (у большинства
однодольных) '
Сукцессивный цитокинез. Деления ядер в мейозе I и II сразу же
сопровождаются формированием фрагмопласта и каллозной клеточной пластинки.
Симультанный цитокинез. После мейоза I клеточная пластинка не образуется
и два ядра диады располагаются в общей цитоплазме. Мейоз II сопровождается
одновременным цитокинезом между четырьмя пост-мейотическими ядрами и
образованием внутренней каллозной оболочки тетрады.
У многих растений с симультанным цитокинезом отмечаются
определенные закономерности в расположении цитоплазматических органелл в ходе
микроспорогенеза (Nymphaea, Impatiens, Orchis). Пластиды и митохондрии
располагаются в экваториальной плоскости первого мейотического деления,
разделяя таким образом диаду на две одноядерные зоны. У отдельных
растений в результате недостаточной активности цитокинетического аппарата
формируется неполная каллозная клеточная пластинка внутри скопления
органелл (у Nymphaea). В течение интеркинеза фрагмопласт и неполная
клеточная пластинка разрушаются, но агрегация органелл в форме диска
сохраняется до завершения мейоза. Затем он изменяет свою форму и
разделяет четыре постмейотических ядра. С образованием перегородок между
микроспорами агрегация органелл исчезает.
У отдельных растений (род Malva) отмечены некоторые особенности в
образовании комплекса органелл. В поздней профазе I пластиды и митохондрии
концентрируются в виде слоя вокруг ядра. По завершении мейоза каждое ядро снова
оказывается окруженным органеллами. Затем между такими ядрами одновременно
формируются перегородки. Комплексы органелл предположительно играют роль
клеточных пластинок, предотвращая объединение ядер и веретен в ходе
формирования тетрад микроспор (Rodkiewicz, Duda, 1988).
После стадии тетрад каллозные оболочки микроспор начинают быстро
растворяться, но прежде чем разъединиться, каждая микроспора покрывается новой
оболочкой, примэкзиной, таким образом вступая в период интенсивной генной
транскрипции (Mascarenhas, 1989). Рис. 15.
Bell, 1989; Bhandari, 1984; Dickinson, 1982; Dickinson, Li, 1988; Kapil, Tiwari, 1978; Mascarenhas, 1989;
Rodkiewicz, Duda, 1988; Souvreet al., 1987.
АРХЕСПОРИЙ (греч. arche — начало, spore — спора) — группа клеток субэпи-
дермального слоя лопасти пыльника, из которых формируются спорогенная ткань
и слои стенки микроспорангия.
Впервые он был описан Warming (1873) в его классической работе
«Untersuchungen uber pollenbildende Phyllome und Kaulome» как «инициальные
(материнские) клетки пыльцы». Инициальными клетками становятся либо
клетки эпидермального слоя, либо производные его внутренних рядов после перикли-
нальных делений.
Goebel (1880) предложил назвать описанные Warming (1873) «инициальные
клетки спорообразующей ткани» (как для микро-, так и мегаспорангиев) более
кратко — «археспорий».
В литературе более широко используются термины «симультанный» и «сукцессивный» типы
образования тетрад микроспор (ред.)
Пыльник
69
Позднее Schnarf (1929), обобщив литературные данные, подчеркивал, что
клетки археспория отличаются от окружающих более плотной цитоплазмой и
крупным ядром с ядрышком.
В настоящее время существуют разные мнения относительно формирования
археспория. Большинство исследователей считают, что археспориальные клетки
дифференцируются в субэпидермальном слое лопасти пыльника (Maheshwari,
1950; Fagerlind, 1961; Батыгина и др., 1963; Коробова, 1971; Поддубная-Арноль-
ди, 1976; Кордюм, 1978; Батыгина, 1974, 1987; Шамров, 19816; Lakshmanan,
Poornima, 1988). Другие авторы (Гревцова, Джалилова, 1992) утверждают, что
эти клетки происходят от деления исходных субэпидермальных клеток, третьи
(Лодкйна, 1971) считают, что «...понятие „археспорий" весьма условное,
говорящее лишь о месте в зачатке органа, где сохранились очаги флоральной
меристемы». Рис. 16.
Батыгина, 1974, 1984, Батыгина и др., 1963; Гревцова, Джалилова, 1992; Кордюм, 1978; Коробова,
1971; Лодкйна, 1971; Поддубная-Арнольди, 1976; Реймерс, 1991; Шамров, 19816; Fagerlind, 1961;
Goebel, 1880; Lakshmanan, Poornima, 1988; Maheshwari, 1950; Milyaeva, Lazarova, 1992; Periasamy,
Thangavel, 1988; Schnarf, 1929; Warming, 1873.
СПОРОГЕННАЯ ТКАНЬ — ткань, формирующаяся в результате периклиналь-
ных делений археспориальных клеток. Термин ввел Goebel (1880). Первое
подробное описание ткани дал Schnarf (1929), который обнаружил, что ее клетки
значительно отличаются от окружающих клеток своими размерами и размерами ядер,
более плотной цитоплазмой.
Структура спорогенной ткани у разных видов различна. В одних случаях
клетки располагаются одним продольным рядом, в других — несколькими рядами.
Спорогенные клетки интенсивно делятся и после завершения митозов
преобразуются в микроспороциты. В процессе делений объем ядер спорогенных клеток
сильно увеличен, однако объем самих клеток меняется незначительно. Как следствие
этого увеличение объема ядра приводит к сильному изменению соотношения
размеров ядра и клетки и изменению физико-химических условий в ядре, что не
может не влиять на метаболизм клетки (Резникова, 1975, 1984; Reznickova, 1979).
Клетки спорогенной ткани содержат значительное количество РНК и очень мало
углеводов (Vijayalakshmi, Lakshmanan, 1988). Рис. 17.
Камелина, 19816; Резникова, 1975,1984; Goebel, 1880; Reznickova, 1979; Schnarf, 1929; Vijayalakshmi,
lakshmanan, 1988.
МИКРОСПОРОЦИТ — спорогенная клетка, вступающая в мейоз после
прекращения в ней митозов. Синонимы: материнская клетка микроспор, мейоцит.
Микроспороциты отличаются от клеток окружающих тканей более густой
цитоплазмой, большими размерами и крупными ядрами (Магешвари, 1954;
Батыгина и др., 1963; Чеботарь, 1972; Поддубная-Арнольди, 1976). Перед мейозом
микроспороциты значительно увеличиваются в размерах. В премейотической
интерфазе в ядрах микроспороцитов осуществляется репликация ДНК (Taylor, 1953,
1959; Plant, 1953; Moss, Heslop-Harrison, 1967; Резникова, Островерхое, 1970) и
подавляется синтез гистонов (Bogdanov et al., 1973; Bogdanov, Strokov, 1976;
Строков, 1977). Конденсированный хроматин ядра микроспороцитов занимает
периферическое положение — вблизи ядерной мембраны. Цитоплазма содержит
рибосомы, хорошо дифференцированные пластиды, митохондрии и короткие
цистерны эндоплазматической сети (Bhandari, Sharma, 1988).
В начале мейоза вокруг микроспороцитов начинает откладываться каллоза
(Sato Joshihiko, 1988; Blackmore, Burnes, 1988; Rodriguez-Garcia, Alche, 1992),
причем синтез каллозы начинается перед лептотеной, а наибольшее ее количество .
70 Генеративные органы цветка
образуется в пахитене. Толщина каллозной оболочки может быть различной
(Echlin, Godwin, 1968; Biddle, 1979) и коррелирует со стадией мейоза (Waterkeyn,
1981; Rodriguez-Garcia, Alche, 1992). Возможно образование многослойной
каллозной стенки (Waterkeyn, 1981; Skvarla, Larson, 1966).
Каллоза представляет собой полисахарид, состоящий из в р-\ ,3-глюканов
(Rowley, 1959; Heslop-Harrison, 1968; Waterkeyn, 1981). В случае формирования
сложной пыльцы или поллиниев, по мнению некоторых авторов (Vijayaraghavan,
Shukla, 1977), каллозная оболочка не образуется. Тогда как другие авторы (Zee,
Siu, 1990), отмечают отсутствие каллозы только внутри тетрады между
микроспорами. Откладывается каллоза между плазменной мембраной и первичной
целлюлозной стенкой, образуя, в конечном итоге, сплошной слой. Для злаков
характерно отсутствие каллозы на стороне микроспороцитов, обращенной к тапетуму, и
образование массивной каллозной оболочки в виде гребня, выступающего внутрь
микроспорангия, на противоположной стороне клеток (Романов, 1966, 1970; Баты-
гина, 1974). В образовании каллозы принимают участие диктиосомы (Heslop-
Harrison, 1966), эндоплазматический ретикулум (Skvarla, Larson, 1966) и липиды
(Willemse, 1971). В конце мейоза каллозная оболочка растворяется, что связано с
изменением величины рН и активизацией каллазы (Izhar, Frankel, 1971).
В функции каллозы входит механическая и химическая изоляция
микроспор друг от друга в период их формирования и от окружающих
соматических тканей (Waterkeyn, 1981; Heslop-Harrison, 1964; Heslop-Harrison,
Mackenzie, 1967). Предполагается, что каллозная стенка играет важную роль
в детерминации строения поверхности первичной экзины (Larson, Lewis,
1963; Waterkeyn, 1970; Ford, 1971).
У многих покрытосеменных растений отмечено наличие плазмодесм,
связывающих микроспороциты, и цитоплазматических мостиков,
пронизывающих каллозные стенки соседних микроспороцитов. Плазмодесмы могут
превращаться в широкие цитомиктические каналы, через которые проходят
различные компоненты цитоплазмы и даже пластиды (Pacini, Cresti, 1978).
Обмен растворенными в цитоплазме веществами через плазмодесмы
обеспечивает синхронность прохождения ранних стадий развития микроспороцитов
(Heslop-Harrison, 1966). Рис. 18.
Батыгина, 1974; Батыгина и др., 1963; Камелина, 19816; Магешвари, 1954; Резникова, Островерхое,
1970; Поддубная-Арнольди, 1976; Романов, 1966, 1970; Строков, 1977; Чеботарь, 1972; Bhandari,
Sharma, Nadltu, 1988; Biddle, 1979; Blackmore, Burnes, 1988; Bogdanov et al., 1973; Bogdanov, Strokov,
1976; Echlin, Godwin, 1968; Ford, 1971; Heslop-Harrison, 1964, 1966a, 1966Ь,1968в; Heslop-Harrison,
Mackenzie, 1967; Izhar, Frankel, 1971; Larson, Lewis, 1963; Moses, Taylor, 1955; Moss, Heslop-Harrison,
1967; Pacini, Cresti, 1978; Plant, 1953; Rodriguez-Garcia, Alche, 1992; Rowley, 1959; Sato Joshihiko, 1988;
Skvarla, Larson, 1966; Strokov et al., 1973; Taylor, 1953, 1958, 1959; Vijayaraghavan, Shukla, 1977;
Waterkeyn, 1981; Waterkeyn, Bietait, 1969; Willemse, 1971; Zee, Siu, 1990.
МЕЙОЗ
МЕЙОЗ (греч. meiosis — уменьшение) был открыт в 1884 г. Ван-Бенеденом при
цитологическом изучении развития червя Parascaris equorum. Мейоз занимает
центральное место в цикле полового размножения эукариот при чередовании
диплоидной и гаплоидной фаз. Это особый тип деления клетки, при котором
весь набор хромосом уменьшается ровно вдвое. Из каждой клетки с
диплоидным набором хромосом в ходе мейоза образуются четыре гаплоидные половые
клетки. Свойство уменьшать число хромосом вдвое, составляет
биологическую суть мейоза и гарантирует сохранение постоянства диплоидного
числа хромосом при смене поколений.
Пыльник
71
Отличительные цитологические особенности мейоза и митоза
В диплоидном организме каждая хромосома (кроме половых у гетерогаметного
пола) представлена двумя копиями по одной от каждого родителя. Эти пары
хромосом называют гомологичными. И в митоз, и в мейоз пары гомологичных
хромосом вступают в редуплицированном состоянии. Каждый из гомологов
представлен двумя сестринскими хроматидами, соединенными вместе.
Основные отличия мейоза и митоза заключены в их предназначении. В митозе
исходная клетка делится на две себе подобные. Обе дочерние клетки наследуют
по одной копии каждого из гомологов, сохраняя диплоидное число хромосом,
диплоидное количество ДНК и свою генетическую идентичность материнской клетке.
Чтобы это осуществилось, каждое митотическое деление ядра сопровождается
разделением редуплицированных сестринских хроматид. Сестринские хроматиды
располагаются в экваториальной плоскости веретена таким образом, что их кине-
тохорные нити направлены к противоположным полюсам, что позволяет в
анафазе митоза им правильно распределиться между двумя полюсами.
Основной результат мейоза — редукция числа хромосом вдвое. Это
осуществляется благодаря двум событиям, специфичным для мейоза: конъюгации
гомологичных хромосом и одному разделению центромер на два деления ядра в мейозе.
Конъюгация гомологичных хромосом осуществляется в профазе I мейоза с
участием синаптонемного комплекса (СК). Конъюгирующие гомологичные
хромосомы (биваленты) выстраиваются в экваториальной плоскости веретена так, что
центромеры гомологов ориентированы к противоположным полюсам. При этом
сестринские хроматиды каждого из гомологов своими кинетохорными нитями
соединены с одним из полюсов. Такая особенность ориентации центромер приводит
к тому, что в анафазе I мейоза каждая дочерняя клетка наследует обе копии
одного из гомологов. Дочерние клетки будучи диплоидными по количеству ДНК,
уменьшают число центромер вдвое. Эти клетки отличаются от исходной
материнской и друг от друга по происхождению наследуемых хромосом за счет
перетасовки хромосом отцовской и материнской линии (количество разных вариантов
наследования составляет 2", где п равно гаплоидному числу хромосом) и за счет
кроссинговера в пределах пар гомологов.
Образование гаплоидных гамет завершается во втором делении мейоза,
которое происходит без репликации. Хромосомы выстраиваются на экваторе вновь
строящегося веретена и сестринские хроматиды отходят к противоположным
полюсам как в митозе.
Типичная картина мейоза и некоторые особенности
метаболизма нуклеиновых кислот и белков
Различают два деления мейоза, каждое из которых состоит из стадий,
последовательно сменяющих друг друга. Первое деление включает интерфазу, профазу
I, метафазу I, анафазу I, телофазу I. Второе деление начинается с короткой стадии
интеркинеза, далее следуют друг за другом профаза II, метафаза II, анафаза II,
телофаза И.
Иитерфаза. В S-фазе премейотической интерфазы происходит синтез
ДНК. Эта стадия значительно продолжительнее таковой в митозе, и в этот
период реплицируется основная масса ДНК (99,7%), остальная часть ДНК,
составляющая 0,3%, реплицируется в профазе I. Тип синтеза ДНК в
премейотической интерфазе назван задержанным типом. В профазу I вступают
клетки с редуплицированными хромосомами, каждая хромосома
представлена двумя хроматидами.
Профаза I. Самая важная стадия мейоза. Продолжительность профазы
составляет около 90% времени всего мейотического цикла и у разных
72 Генеративные органы цветка
объектов длится от нескольких суток до десятков лет. В профазе I выделяют
пять стадий: лептотену, зиготену, пахитену, диплотену, диакинез.
Лептотена. На этой стадии хромосомы представлены тонкими нитями,
переплетенными в клубок. Каждая хромосома своими концами прикрепляется к
ядерной мембране с помощью прикрепительного диска. Вдоль каждой хромосомы
строится боковой осевой элемент, который на стадии синапсиса гомологов составит
один из боковых элементов синаптонемного комплекса. Число хромосом в лепто-
тене соответствует диплоидному набору, но общее количество ДНК и число хро-
матид — тетраплоидному.
Выделен лептотенный белок (L-белок, Л-белок), синтезирующийся только в
мейотической клетке. Он не связан с ядерной мембраной и его мол. масса 73000
дальтон. В отсутствие ионов Mg2~ белок представлен мономерной формой. Он ин-
гибирует синтез зиготенной ДНК в нормальном и ахиазматическом (лишенном
конъюгации и кроссинговера) генотипах. Это означает, что функция Л-белка не
связана ни с конъюгацией, ни с кроссинговером. Он не влияет и на синтез общей
ДНК ядра в мейотической и соматической клетках не влияет. Считают, что с Л-
белком связана необратимая детерминация вступления клетки в мейоз после S-
фазы.
Зиготена. Начало синапсиса гомологичных хромосом отличает эту стадию
мейоза от предшествующей. Точки инициации конъюгации гомологов
располагаются на ядерной мембране. Концы гомологичных хромосом каким-то образом
узнают эти точки на ядерной мембране и от них синапсис распространяется по всей
длине хромосомы. В местах синапсиса гомологичных хромосом формируется
белковая структура СК, состоящая из двух боковых и одного центрального элемента.
Пахитена. На этой стадии наступает завершение конъюгации гомологов. Пару
хромосом, образовавшуюся в результате синапсиса в профазе I называют
бивалентом. СК сформирован по всей длине хромосомы, в центральном элементе СК
на этой стадии различают рекомбинационные узелки, с которыми связывают
процесс кроссинговера. В пахитене осуществляется обмен участками между
несестринскими хроматидами, т, е. кроссинговер.
На этих двух стадиях профазы I появляются пики синтеза определенных
фракций ДНК и энзиматической активности специфических ферментов, участвующих
в осуществлении важнейших цитогенетических процессов конъюгации
гомологичных хромосом и кроссинговера.
В зиготене синтезируется зиготенная ДНК (zyg-ДНК, зиг-ДНК).
Характер ее репликации полуконсервативный. Зиг-ДНК обогащена G-C
парами оснований, что определяет ее более высокую плавучую плотность 1,712 г/см3.
Для сравнения общая ДНК ядра содержит 40% G-C пар оснований и ее плавучая
плотность — 1,700 г/см3. Зиг-ДНК состоит в основном из уникальных
последовательностей, каждая из которых содержит 5—10 тысяч пар нуклеотидов (т.п.н.) и
равномерно распределена по длине всех хромосом. Поведение зиг-ДНК в мейозе
необычно. Это касается не только задержки ее репликации до стадии зиготены.
Синтез ее не завершается и на этой стадии, небольшие пробелы остаются на
концах вновь синтезированных нитей вплоть до анафазы I. Репликация зиг-ДНК ин-
гибируется Л-белком, он же защищает пробелы зиг-ДНК от вырезания S-I нукле-
азой. Функцию зиг-ДНК связывают с процессом конъюгации и рекомбинации.
Пахитенная ДНК (pach-ДНК, пах-ДНК) выделена в пахитене мейоза.
Характер ее репликации репаративный. В пах-ДНК выделяют две фракции: 30% ее
составляют умеренно повторяющиеся последовательности длиной 5—7 т.п.н.,
остальная часть состоит из коротких умеренных повторов порядка 200 пар
нуклеотидов, повторенных в геноме 700—2000 раз. Пробелы пах-ДНК тут же
устраняются репаративным синтезом.
Пыльник
73
Оказалось, что в пах-ДНК локализуются сайты, подверженные однонитевым
разрывам под воздействием специфической эндонуклеазы с оптимальным
значением рН 5,2. Доступность пахитенной ДНК для однонитевых разрывов
регулируется группой небольших молекул ядерной РНК (psn-PHK — pachytene small
nuclear), длина которых составляет 125 пар нуклеотидов, и в транскрипции
которых принимает участие РНК-полимераза III. Эти молекулы РНК синтезируются
только при условии осуществления истинной конъюгации гомологичных
хромосом. Выделение фракции psn-PHK позволило расшифровать молекулярную
организацию участков пах-ДНК, претерпевающих репаративный синтез. Сайтами
разрезания-репарации оказались последовательности ДНК комплементарные
psn-PHK. Функцию пах-ДНК связывают с процессом кроссинговера,
осуществление которого требует репаративного синтеза ДНК.
Специфическая эндонуклеаза действует на двухнитевую ДНК, вызывая одно-
нитевые разрывы, что подтверждается появлением свободных 3 Р — 5 ОН концов.
На этих стадиях профазы I мейоза выделены белки, способствующие реассо-
циации однонитчатых ДНК. Они относятся к группе ДНК-связывающих белков.
Двум белкам приписывают важную роль в процессе кроссинговера. U-белок
{unwinding) активен в присутствии АТФ. Пик активности совпадает с зиготеной-
пахитеной. Обладает двумя важными свойствами. Одно из них — связывание или
удержание дуплексной ДНК, другое свойство — расплетение двухнитчатой ДНК.
R-белок (reanneling) обеспечивает реассоциацию ДНК. Он существует в клетке
только в комплексе с липидами. По своим молекулярным свойствам R-белок
сходен с белком, кодируемым геном 32 у фага Т4, и играющим важнейшую роль в
процессе генетической рекомбинации. Для активации R-белка необходима
истинная гомологичная конъюгация.
В мейотических клетках лилии, мыши, человека обнаружены и другие
ферменты — экзонуклеазы, полинуклеотидкиназы, лигазы.
Таким образом, в мейотической профазе активируется множество ферментных
систем, регулирующих готовность клетки к мейозу, конъюгацию гомологичных
хромосом, кроссинговер и др.
Диплотена. На этой стадии теряется тесный контакт между конъюгирующими
гомологами, т. к. синаптонемный комплекс распадается. Хромосомы
раздвигаются и каждая гомологичная хромосома бивалента обретает свою индивидуальность.
Но гомологи остаются связанными одной или несколькими хиазмами, т. е. в
местах, где произошел кроссинговер. У объектов (саранчовых), удобных для
наблюдения диплотены, отчетливо видно, что в образовании хиазм участвуют только
две из четырех хроматид бивалентной хромосомы.
В ооцитах (развивающихся яйцеклетках) диплотена может растянуться на
месяцы и годы, т. к. на этой стадии оогенеза хромосомы спирализуются и
синтезируют РНК, обеспечивая яйцеклетку резервными веществами. В некоторых
случаях диплотенные хромосомы особенно активно синтезируют РНК. Такие
хромосомы — типа ламповых щеток — находят, например, у насекомых, амфибий и
человека.
Диакинез. Хромосомы на этой стадии еще более укорачиваются, отделяются
от ядерной мембраны, полностью разрушается СК, и прекращается синтез РНК.
Стадией диакинеза завершается профаза I мейоза со всеми сложными цитогене-
тическими событиями и начинается подготовка к расхождению гомологичных
хромосом.
Метафаза I. На этой стадии исчезает ядрышко и ядерная оболочка,
завершается построение веретена. Биваленты в метафазной пластинке
ориентированы так, что центромеры гомологов направлены к противоположным
полюсам (см. выше). Гомологичные хромосомы удерживаются вместе за счет
74 Генеративные органы цветка
хиазм. В метафазе I происходит подготовка хромосом к их правильному
расхождению в дочерние клетки.
Анафаза I. В этой стадии начинается движение гомологичных хромосом к
противоположным полюсам. Молекулярные и физические механизмы анафазного
движения пока не выяснены. Ясно одно, что в анафазе I происходит разделение
хиазм, и гомологи, освободившись друг от друга, приобретают способность к
движению. Хромосома в анафазе I представлена двумя хроматидами,
удерживающимися вместе только в области центромера (за ними сохранился термин диада).
Центромерные области первыми достигают полюсов, к каждому из полюсов
отходит полный гаплоидный набор хромосом, в котором представлено по одному
удвоенному гомологу от каждого бивалента.
Телофаза I. Хромосомы на этой стадии теряют свои очертания под
микроскопом, восстанавливается ядерная мембрана и после деления клетки (цитокинеза)
формируются две дочерние клетки. На этом первое деление мейоза завершается.
Таким образом, при первом делении мейоза каждая дочерняя клетка наследует
две копии одного из двух гомологов и поэтому содержит диплоидное количество
ДНК. Однако от обычных диплоидных клеток они отличаются в двух отношениях:
1) обе копии ДНК каждой хромосомы происходят лишь от одной из двух
гомологичных хромосом, имевшихся в исходной материнской клетке, 2) эти две копии
клетка получает в виде тесно связанных сестринских хроматид, составляющих
одну хромосому. Количество ДНК от тетраплоидного (4с), которым обладает
клетка, вступающая в мейоз, редуцируется до диплоидного (2с) (с — количество ДНК,
приходящееся на гаплоидный набор). Таково состояние дочерних клеток перед
вторым делением мейоза.
Второе деление мейоза наступает после короткого периода покоя — интер-
кинеза и протекает по типу митоза. Поскольку в период покоя не происходит
синтеза ДНК, создается впечатление, что хромосомы из одного деления быстро
входят во второе. Профаза II у всех организмов короткая, в профазе II и метафазе II
хромосомы, как и в анафазе I, представлены двумя хроматидами, соединенными
в области центромеры. Ядерная оболочка разрушается как только формируется
новое веретено. После этого, быстро сменяя друг друга, проходят метафаза II,
анафаза II, телофаза П. Как и в митозе, кинетохорные нити сестринских хроматид
направлены к противоположным полюсам. В метафазной пластинке сестринские
хроматиды удер?киваются вплоть до того момента, когда их центромеры
расходятся к противоположным полюсам в анафазе И. В телофазе II формируются ядерные
оболочки вокруг каждого из четырех гаплоидных ядер, проходит цитокинез, и
мейоз на этом завершается.
Итак, единственный акт синтеза ДНК в премейотической интерфазе,
конъюгация гомологичных хромосом, кроссинговер и одно деление центромер на два
последовательных деления мейоза — вот цепь событий, обеспечивающих переход от
(2п)- к (1п)-набору хромосом, образование четырех гаплоидных клеток из одной
диплоидной, вступившей в мейоз, и огромное генетическое разнообразие половых
клеток.
Такова типичная картина мейоза и по такой схеме он протекает у большинства
видов растений и животных.
Типы мейоза
Помимо классического двухступенчатого типа мейоза, описанного выше, в
природе встречаются и другие типы. Одноступенчатый тип мейоза наиболее
интересен в этом отношении. Впервые этот тип описан у жгутиконосцев Кливлендом.
Суть его сводится к выпадению I деления мейоза, связанного с конъюгацией, крос-
синговером и хиазмообразованием. Одноступенчатый мейоз описан у споровиков,
Пыльник
75
некоторых видов раковинных корненожек и других простейших (подробнее см.
обзор, Райков, 1975).
Отдельного рассмотрения заслуживает мейоз у организмов с нелокализо-
ванной центромерой (тип ожиги и кокцид). От классического типа он
отличается тем, что первое деление мейоза является полностью эквационным. Это
обеспечивается тем, что гомологичные хромосомы в диплотене-метафазе I мейоза
располагаются тандемно, в результате чего коориентация бивалентов не
осуществляется, а осуществляется автоориентация. В профазе II вновь
осуществляются конъюгация гомологов (см. Цитология и генетика мейоза, 1975).
Асимметричный цитокинез. Процесс созревания яйцеклетки в оогенезе
различных объектов показателен. (Из всего сложного процесса формирования
яйцеклетки рассматриваем только два деления мейоза). Основное отличие мейоза
заключается в том, что в оогенезе из одной дилоидной клетки с редуплицированным
(4с) содержанием ДНК формируется единственная гаплоидная яйцеклетка,
крупная по размерам и богатая питательными веществами. Это достигается двумя
особенностями мейоза при оогенезе: 1) обратимой задержкой мейоза на стадии
профазы I; 2) несимметричным делением цитоплазмы после каждого деления мейоза.
Остановка мейоза на стадии диплотены от нескольких дней до нескольких
десятков лет необходима для формирования яйцевой оболочки, играющей важную
роль в процессе оплодотворения. Спаренные хромосомы при этом принимают вид
«ламповых щеток», свойственных хромосомам, активно синтезирующим РНК.
В результате асимметричного деления цитоплазмы продукты первого мейоти-
ческого деления — ооциты второго порядка — резко различаются по величине при
равном содержании ДНК и количестве хромосом. Один из них представляет собой
маленькое полярное тельце, другой — крупную клетку, которая продолжает
развитие.
Второе деление вновь завершается асимметричным цитокинезом, в результате
которого формируется зрелая яйцеклетка крупных размеров, и второе полярное
тельце. Обе клетки гаплоидны по содержанию ДНК и набору одиночных
хромосом. Первое и второе полярные тельца деградируют.
Гаплоидные самцы медоносной пчелы — трутни могут формировать спермин с
гаплоидным числом хромосом только благодаря тому, что у них эволюционно
закрепился аномальный мейоз, связанный с блокадой расхождения хромосом к
полюсам. В результате в первом делении мейоза все унивалентные хромосомы
остаются в центре клетки. Асимметричный цитокинез отделяет небольшую часть
цитоплазмы без хромосом, формируя одну большую клетку с исходным гаплоидным
набором хромосом и маленькую клетку без хромосом с небольшим количеством
цитоплазмы. Второе деление мейоза протекает как обычный митоз, но
асимметричный цитокинез образует две гаплоидные клетки разного размера. Только
крупная клетка превращается в жизнеспособный спермий. По той же схеме
протекает мейоз у самцов осы.
Ахиазматический мейоз протекает без образования хиазм (распространен
у гетерогаметных полов бабочек, двукрылых, богомолов). У одной группы особей
с таким типом мейоза (например, самки тутового шелкопряда (Bombyx mori L.)
имеется нормально развитый, но не исчезающий в диплотене СК, который,
видоизменившись, остается в клетке вплоть до метафазы I; кроссинговер отсутствует,
хиазм нет. У другой группы особей (типичные представители — самцы Drosophila
melanogaster) образование СК блокировано полностью, кроссинговер и хиазмы
отсутствуют. Таким образом, в ахиазматическом мейозе этих двух групп цитоге-
нетический эффект сходен (нет кроссинговера и хиазм), но генетические
механизмы блокады этих процессов, по-видимому, различны: в первой группе блокада
может быть осуществлена генами, воздействующими непосредственно на систему ре-
7£ Генеративные органы цветка
комбинации (типа гена mei9 у дрозофилы), в другой — асинаптическими генами,
блокирующими формирование СК.
Среди апомиктических видов растений встречаются различные формы
перехода от типичного мейоза к митозу. Изменение касается 1-го деления мейоза и
проявляется в различной степени нарушения конъюгации гомологичных хромосом и
в блокаде кроссинговера.
У некоторых видов партеногенетически размножающихся животных (Caras$ius
auratus gibelio, Daphnia pulex), гаплоидных самцов Перепончатокрылых и
Простейших первое деление мейоза может полностью выпадать (одноступенчатый
мейоз), у других оно частично нарушается, при этом блокируется кроссинговер и
нарушается расхождение гомологов (например, у Poeciliapsis Cx). Рис. 19.
Альберте и др., 1987; Голубковская, 1985; Жученко, Король, 1985; Кушев, 1971; Райков, 1975;
Цитология и генетика мейоза, 1975; Hotta, Stern, 1971,1981, 1984; John, Lewis, 1965; Moses, 1956; Rhoades,
1951; Stern, Hotta, 1973.
ЦИТОХИМИЯ МЕЙОЗА
Мейоз — один из наиболее интегральных биологических процессов,
представляющий собой особый тип деления дифференцирующихся клеток. В ходе этого
процесса происходят два основных события, определяющие его специфику —
редукция числа хромосом и рекомбинация генетического материала. Таким
образом, дифференциация мейотических клеток характеризуется прежде всего
преобразованием ядерных структур, что отчетливо проявляется в изменении
морфологии и поведения хромосом.
Цитохимические методы сыграли весьма существенную роль на первых этапах
исследования биохимической организации мейотических клеток. Существенным
достижением явилось установление факта завершения основного синтеза ДНК в
течение S-периода премеиотической интерфазы и обнаружение явления
задержанного удвоения гистонового компонента хромосом по сравнению с удвоением
количества ДНК (Moss, Heslop-Harrison, 1967; Резникова, Островерхое, 1970;
Антропова, 1971).
Для сегодняшнего этапа развития науки характерно широкое применение в
исследованиях мейоза идей и методов молекулярной биологии. Именно благодаря
исследованиям на молекулярном уровне, начавшимся около 30 лет назад, удалось
существенно продвинуться в изучении биохимии мейоза, выявить новые факты и
закономерности. Назовем хотя бы некоторые из них.
1. Репликация ДНК в S-периоде премеиотической интерфазы осуществляется
по полуконсервативному типу. Однако в премейотическом S-периоде наблюдается
уменьшение числа точек инициации репликации и увеличение длины репликонов.
Это приводит к тому, что премейотический S-период более продолжителен, чем в
цикле митоза (Taylor, 1965; Stern, Hotta, 1973).
2. В премейотическом S-периоде наблюдается задержка репликации фракции
уникальных последовательностей нуклеотидов, получившей название зиг-ДНК.
Удалось показать, что небольшая часть хромосомной ДНК (0,3% генома) не
реплицируется в S-периоде и этот процесс задерживается до зиготены (Hotta et al.,
1966). Функция зиг-ДНК весьма специфична и состоит в обеспечении первичного
локус- специфического контакта гомологичных хромосом во время их
конъюгации. Исследования последних лет позволили выявить специфический мейотиче-
ский белок (L-белок), проявляющий функцию ингибитора репликации зиг-ДНК.
Этот белок не оказывает своего ингибирующего действия по отношению к основной
части ДНК и проявляет свой эффект только в предзиготенном интервале, исчезая
при репликации зиг-ДНК (Hotta et al., 1984).
Пыльник
77
3. Во время пахитены происходит сепаративный синтез ДНК (пах-ДНК),
составляющей 0,1 % генома. Этот сепаративный синтез лежит в основе
кроссинговера. Пах-ДНК состоит из повторяющихся последовательностей нуклеотидов и
синтез ее происходит в тех участках хромосом, которые ранее уже были реплициро-
ваны. Следовательно, синтез пах-ДНК не приводит к появлению дополнительного
количества ДНК, а только к замене уже существующих частей молекулы. (Hotta
etal., 1966; Hotta, Stern, 1971).
4. В обеспечении молекулярных механизмов кроссинговера принимают участие
по крайней мере три специфических для мейоза фермента. Под действием
специфической эндонуклеазы в сегментах пах-ДНК образуются однонитчатые
разрывы, которые оказываются местом действия U-белка, проявляющего активность
только в присутствии АТФ и способствующего расплетанию нескольких сотен пар
оснований ДНК. После действия U-белка происходит реассоциация полинуклео-
тидных цепочек в гетеродуплексы с помощью R-белка. Сегменты пах-ДНК, в
которых происходит репаративный синтез, распределены с интервалами внутри
50% генома и являются сайтами разрезания-репарации в пахитене (Stern, 1985).
Цитохимические методы в силу своей специфики пока не позволяют решать
вопросы, доступные методам биохимии и молекулярной биологии. Однако
возможности цитохимии в исследовании мейоза остаются в значительной степени не
реализованными. Цитохимический подход в ряде случаев может дать полезную
информацию о метаболическом состоянии клеток в мейозе и тем самым существенно
дополнить результаты, полученные на основе методов молекулярной биологии.
Использование цитохимических методов позволяет выявить ранние изменения
в метаболизме клеток, предшествующие их вступлению на мейотический путь
развития. На рисунке 20 представлены результаты цитофотометрического анализа
доступности ДНК кислотному гидролизу (окраска по Фельгену) в клетках спороген-
ной ткани лилии (Lilium candidum) на стадиях начала и окончания митозов. В обоих
случаях гидролизные кривые имеют один максимум, однако для стадии окончания
митозов этот максимум сдвинут к более короткому сроку гидролиза. Таким
образом, ДНК клеточных ядер на стадии окончания митозов менее устойчива к
действию кислотного гидролиза, что свидетельствует о повышении уровня деконденса-
ции хроматина в клетках спорогенной ткани, совпадающее по времени с
завершением пролиферативной активности.
Результаты цитохимического анализа РНК и общих белков, выявляемых галло-
цианин-хромовыми квасцами и нафтоловым желтым, также свидетельствует о
заметных сдвигах в метаболизме клеток спорогенной ткани в процессе
дифференциации. На стадии окончания митозов наблюдается заметное увеличение содержания
указанных макромолекулярных соединений как в ядре, так и в цитоплазме.
Как уже было отмечено, основной синтез ДНК в цикле мейоза завершается в
S-периоде премеиотической интерфазы. В ядрах микроспороцитов лилии на
стадии поздней премеиотической интерфазы (G-период) цитохимический анализ
показал содержание ДНК, соответствующее 4С. Показатели содержания ДНК для
отдельных стадий профазы I и метафазы I сохраняются на том же уровне, а в
ядрах образующихся тетрад количество ДНК становится равным 1С.
Цитохимическое определение гистонов показало, что в отличие от ДНК их
количество в течение премеиотической интерфазы не удваивается. В поздней
премеиотической интерфазе содержание гистонов, выявляемых при окраске прочным
зеленым, соответствует приблизительно ЗС. Уровень, соответствующий 4С,
обнаруживается только в диплотене-диакинезе. Таким образом, если в цикле митоза
удвоение содержания ДНК и гистона идет параллельно и заканчивается в
S-периоде, то в премеиотической интерфазе происходит отставание синтеза гистонов от
синтеза ДНК, наблюдаемое также на протяжении большей части профазы I.
78
Генеративные органы цветка
Имеющиеся на сегодняшний день результаты биохимических исследований
подтверждают данные, полученные с помощью цитохимических методов. При
этом удалось подтвердить не только факт подавления синтеза гистонов в премей-
отической интерфазе, но и выявить динамику его отдельных фракций в профазе I
деления мейоза (Bogdanov, Strokov, 1976). Фракции Н2а, Н2, НЗ и Н4 были
отнесены к раносинтезирующимся, а фракция Н1 — к позднесинтезирующейся.
Наряду с этими фракциями в микроспороцитах лилии была обнаружена
специфическая фракция — НМ (гистон мейоза), относящаяся к группе раносинтезирующих-
ся гистонов (Sheridan, Stern, 1967).
Особый интерес представляет исследование особенностей структурного
состояния хроматина в премейотической интерфазе и в профазе I. Эта задача также может
быть решена цитохимическими методами. На рисунке 20 представлены кривые,
отражающие чувствительность ДНК к воздействию кислотным гидролизом в ядрах
микроспороцитов лилии. Не останавливаясь подробно на описании гидролизных
кривых, отметим два важных следствия, вытекающие из полученных результатов.
Во-первых, в поздней премейотической интерфазе наблюдается увеличение де-
конденсации хроматина и его переход в более гетерогенное состояние. Во-вторых,
в ходе прохождения отдельных стадий профазы I мейоза максимальный уровень
деконденсации хромосом выявляется в зиготене и пахитене. К концу профазы
наблюдается нарастание конденсации, достигающей максимального значения в мета-
фазе I.
Из полученных результатов логически напрашивается вывод о взаимосвязи
между повышенной деконденсацией хромосом в зиготене-пахитене и
задержанным синтезом гистонов. Этот факт согласуется с выдвинутым ранее положением
о том, что в результате задержанного синтеза гистона поддерживается
определенный уровень деконденсации хромосом, создающий благоприятные условия для
конъюгации и кроссинговера (Bogdanov, Strokov, 1976). Вместе с тем этот
определенный уровень деконденсации способствует сохранению высокой
метаболической активности микроспороцитов в профазе I, обеспечивая синтез РНК и белков,
как для самого мейоза, так и для молодых микроспор (Резникова, 1984).
Имеющиеся на сегодняшний день результаты цитохимических исследований
свидетельствуют о том, что значительное увеличение содержания РНК и общих
белков приходится на премейотическую интерфазу (Moss, Heslop-Harrison, 1967;
Резникова, 1984). Синтез указанных макромолекулярных соединений
продолжается на протяжении всей профазы I, однако интенсивность этого синтеза у разных
видов растений может иметь временные отличия.
Отличительная особенность синтеза РНК в профазе I мейоза состоит в том, что
синтезируется в основном хромосомная РНК. Так, цитохимическое исследование
микроспороцитов лилии не выявило заметного снижения в содержании ядерной
РНК (окраска галлоцианин-хромовые квасцы) даже тогда, когда ядрышко
существенно уменьшилось в объеме, что сопровождалось довольно резким снижением
в нем количества РНК. Результаты, полученные с помощью электронной
цитохимии показали, что РНК, синтезированная в течение профазы I, обнаруживалась
в ассоциации с периферической частью хромосом и в межхромосомном
пространстве (Porter et al., 1982).
Изложенные факты свидетельствуют о том, что в основе дифференциров-
ки мейотических клеток лежат события молекулярного уровня. Вероятно,
первые видимые проявления перестройки внутриклеточного метаболизма
обнаруживаются уже в спорогенной ткани. Возможно, что накопление общих
белков в клетках можно рассматривать как один из факторов,
способствующих замедлению темпов клеточного деления, а затем и прекращению
митозов. Известно, например, что клетки, достигшие определенного уровня
Пыльник
79
содержания общих белков, не вступают в митоз даже при стимулированной
пролиферации (Магакян и др., 1987).
Прохождение клетками премейотической интерфазы и профазы I
характеризуется изменением в структуре хроматина и хромосом, увеличением
содержания РНК и белка. Длительность мейотической профазы I с
характерной структурой хромосом детерминирована, вероятно, еще в
премейотической интерфазе и связана с задержкой синтеза гистонового компонента.
Рис. 20.
Антропова, 1971; Магакян и др., 1987; Резникова, 1970; Резникова, Островерхое, 1970; Bogdanov,
Strokov, 1976; Hotta et al., 1966,1984; Hotta, Stern, 1971; Moss, Heslop-Harisson, 1967; Porter et al., 1982;
Sheridan, Stern, 1967; Stern, 1985; Stern, Hotta, 1973; Taylor, 1965.
ТЕТРАДА МИКРОСПОР (греч. tetra — четыре, micros — малый, spora —
спора, семя) — структура, образованная четырьмя гаплоидными клетками,
возникшими в процессе обоих делений мейоза микроспороцита .
Образование тетрад и их распад на отдельные микроспоры у цветковых
растений был впервые описан Nageli (1842). Hofmeister (1861, 1867), на основе времени
и способа заложения перегородок, выделил два типа образования тетрад:
сукцессивный, или сукцеданный (лат. successivus, succedaneus —
последовательный) и симультанный (лат. simultaneus — одновременный). При сукцессив-
ном типе каждое деление мейоза сопровождается образованием клеточных
перегородок. Фрагмопласт закладывается в телофазе гетеротипического деления
(мейоза I) в центре микроспороцита и растет центробежно, разделяя клетку на две
равные клетки. Подобным способом происходит деление клеток диады после го-
меотипического деления (мейоза II), которое завершается образованием четырех
клеток. При симультанном типе образования тетрад после мейоза I цитокинез
отсутствует. Четыре клетки микроспор возникают одновременно после мейоза II
путем заложения борозд в виде впячиваний оболочки микроспороцита от периферии
клетки к центру и перешнуровывания протопласта микроспороцита на четыре
клетки. При симультанном типе образования тетрад у представителей ряда
семейств (Cucurbitaceae, Plumbaginaceae, Fabaceae) в разделении микроспороцита
на микроспоры важную роль играют вакуоли, которые, сливаясь, разделяют
протопласт микроспороцита на отдельные микроспоры.
Описан третий тип образования тетрад — промежуточный, когда после
мейоза I наблюдается заложение борозды по периферии микроспороцита, но к концу
интерфазы II рост борозды приостанавливается и возобновляется после мейоза II,
и в то же время происходит заложение и рост второй борозды, завершающийся
образованием четырех клеток. Промежуточный тип образования тетрад ближе к
симультанному типу.
В последнее время с учетом накопившегося противоречивого материала была
предложена более развернутая классификация типов образования тетрад
(Sampson, 1969), в которой выделяются три основные типа цитокинеза:
1. Сукцессивный — перегородки развиваются от центра к периферии в конце
мейоза I и II (Zea mays и многие другие растения).
2. Симультанный — борозды закладываются от периферии к центру в конце
мейоза II (Nicotiana и многие другие растения); различают три разновидности
этого процесса:
а) гетеротипическая борозда закладывается в конце мейоза I, в то время как
гомеотипическая — в конце мейоза II; процесс перешнуровывания протопласта
заканчивается образованием тетрады (Magnolia kobus) (Stoudt, 1960),
б) гетеротипическое заложение борозды, завершающееся образованием диады,
предшествует гомеотипическому (Magnolia liliiflord) (Hayashi, 1960),
80
Генеративные органы цветка
в) формируется незавершенная клеточная перегородка (Zygoginum) или не-
долгоживущий ее предшественник (Pseudoivintera, Magnolia).
3. Симультанный — клеточные перегородки формируются от центра к
периферии в конце мейоза II (Helleborus — Waterkeyn, 1962; Illiciwn, Schisandra,
Kadsura — Hayashi, 1960; Kapil, Jalan, 1964). Для данного типа деления
характерны явление «реконструкции» фрагмопласта и появление вторичных веретен в
конце мейоза II (Laurelia) (Sampson, 1969).
Таким образом, цитокинез при образовании тетрад осуществляется путем
образования клеточной пластинки или бороздования. Согласно современным
электронно-микроскопическим данным активное участие в обоих случаях принимает
пузырьково-микротрубочковый комплекс цитоплазмы (vesicle-microtubular
complex) (Кордюм, 1978; Went van, Cresti, 1988b). Одновременно с образованием
перегородок происходит отложение каллозы вокруг микроспор.
Тип образования тетрад микроспор многими исследователями
рассматривается как систематический признак. Симультанный тип образования тетрад
характерен для двудольных цветковых растений, а сукцессивный — для однодольных.
Хотя возможны исключения. Так, среди двудольных в семействах Myristicaceae,
Monimiaceae, Lauraceae, Asclepiadaceae встречается только сукцессивный тип, а
в семействах Annonaceae, Aristolochiaceae, Ceratophyllaceae, Cabombaceae,
Berberidaceae, Ranunculaceae, Staphyleaceae, Plantaginaceae встречаются оба
типа. Среди однодольных в семействах Phormiaceae, Juncaceae, Cyperaceae —
только симультанный, а в Butomaceae, Aponogetonaceae, liliaceae, Iridaceae,
Taccaceae — оба типа.
Промежуточный тип описан у представителей двудольных (сем. Magnoliaceae,
Annonaceae, Winteraceae, Nelumbonaceae, Plantaginaceae).
Дискуссионным остается вопрос, какой из типов образования тетрад является
эволюционно более продвинутым. Одни авторы (Goebel, 1923; Schnarf, 1931;
Сладков, 1962, 1970) полагают, что симультанный тип более примитивен, так как он
существует не только у цветковых, но также и у архегониальных растений
(голосеменных, плаунообразных, клинолистных, папоротникообразных и мхов).
Другие авторы (Schurhoff, 1926; Тахтаджян, 1948, 1964, и др.), напротив, считают
сукцессивный тип более примитивным, так как образование свободных ядер они
рассматривают как явление более прогрессивное. По мнению третьих (Tackholm,
Soderberg, 1918), развитие одного типа образования тетрад из другого в разных
ветвях системы могло идти различно: в одних ветвях более примитивным мог быть
один тип, в других — другой.
Образовавшиеся в результате мейоза тетрады различаются по форме и
взаимному расположению клеток, что зависит от способа тетрадообразования и формы
микроспороцита. Описано 6 типов образования тетрад: тетраэдральный, изобила-
теральный, крестообразный, ромбический, Т-образный, линейный (Boehm, 1931;
Maheshwari, 1950).
Согласно ранее высказанному мнению (Schnarf, 1920), нашедшему
подтверждение в работах других авторов (Сладков, 1989, Rangaswamy, Janaki
Subramanyan, 1990; Сладков, Гревцова, 1991) при симультанном типе цитокинеза
образуются только тетраэдральные тетрады. При сукцессивном типе образуются
все типы тетрад микроспор, кроме тетраэдральных (Сладков, 1989). По мнению
Сладкова (1989) источником ошибок многих исследователей в определении типа
тетрад, вероятно, является то, что они определяют тип тетрад по
сформировавшимся, но еще не распавшимся микроспорам, форма которых не соответствует
форме только что образовавшихся после мейоза клеток, и не связывают взаимное
расположение микроспор с положением самих тетрад. Рис. 21.
Кордюм, 1978; Коробова, 1981; Поддубная-Арнольди, 1971; Сладков, 1962, 1970, 1989; Сладков,
Гревцова, 1991; Тахтаджян, 1948, 1964; Bhandari, 1984; Boehm, 1931; Goebel, 1923; Hofmeister, 1861,
Пыльник
81
1867; Maheshwari, 1950; Nageli, 1842; Rangaswamy, Janaki Subramanyan, 1990; Sampson, 1969; Schnarf,
1929, 1931; Tackholm, Soderberg, 1918; Went van, Cresti, 1988b.
ИММУНОФЛУОРЕСЦЕНЦИЯ ЦИТОСКЕЛЕТА
В ХОДЕ МИКРОСПОРОГЕНЕЗА
Сведения об организации цитоскелета в ходе микроспорогенеза были
расширены благодаря применению методов непрямой иммунофлуоресценции и иммуно-
цитохимии с использованием коллоидного золота (Gunning, Hardham, 1982). С
помощью этих методов была установлена локализация цитоскелетных белков при
микро- и мегаспорогенезе.
Иммунофлуоресцентный метод. Препараты клеток обрабатываются сначала
антителом к определенному цитоскелетному белку. После того как антитело
связывается с белком, препараты обрабатываются иммуноглобулином, который в
свою очередь присоединяется к первому антителу. Иммуноглобулин метят
маркером, обычно флуорохромом (FITC, родамин) или коллоидным золотом. Маркеры
указывают местоположение цитоскелетных белков в клетках.
Распределение элементов цитоскелета изменяется в ходе микроспорогенеза.
Микротрубочки образуют несколько групп: цитоплазматическую сеть, веретено
первого и второго мейотических делений и фрагмопласты телофазы I и II
(Lammeren van et al., 1985). Обращает на себя внимание отсутствие нрепрофазного
тяжа микротрубочек, который в митотически делящихся клетках предопределяет
положение клеточных пластинок, образующихся после телофазы (Hogan, 1987;
Traasetal., 1989).
В микроспороцитах на стадии ранней профазы I цитоплазматические
микротрубочки располагаются беспорядочно. В диплотене новые микротрубочки
возникают у ядерной оболочки, образуя плотный перинуклеарный слой. Позднее в
профазе I микротрубочки появляются на бивалентных хромосомах, пучки их
присоединяются к кинетохорам. По-видимому, эти микротрубочки вместе с перинук-
леарными принимают участие в образовании веретена (Brown, Lemmon, 1991),
которое в анафазе превращается в систему полярных микротрубочек и
флуоресцирующих кинетохорных пучков. В поздней телофазе I и ранней интерфазе
микротрубочки, возникающие, очевидно, вблизи ядерных оболочек, а также часть
микротрубочек веретена, образуют фрагмопласт, достигающий поверхности
сестринских ядер. Такая структура фрагмопласта, по-видимому, характерна для
мейотических клеток, тогда как в митотических клетках фрагмопласты менее
развиты и не достигают поверхности ядер.
В экваториальной плоскости фрагмопластов телофазы I наблюдается
образование клеточной пластинки или агрегация органелл. Образование клеточной
пластинки типично для сукцессивного цитокинеза, скопление органелл — для
симультанного. При обоих типах исчезают фрагмопласты в интерфазе, а к профазе
II вновь образуются перинуклеарные и кинетохорные микротрубочки.
У растений с сукцессивным цитокинезом веретена второго мейотического
деления и фрагмопласты сливаются и функционируют независимо друг от друга в
обеих клетках диады. У растений с симультанным цитокинезом образуется два
веретена и после второго мейотического деления два бочонковидных фрагмопласта
возникают между двумя парами сестринских ядер. Затем микротрубочки
связывают несестринские ядра и принимают участие в образовании вторичных
фрагмопластов. Цитокинез осуществляется тетраполярной системой фрагмопластов, и
ценоцитный микроспороцит делится одновременно с образованием тетрады.
Актиновые микрофиламенты были выявлены как компоненты цитоплазмати-
ческой сети микротрубочек, веретен и фрагмопластов (Lammeren van et al., 1989).
6 Генеративные органы цветка.
82
Генеративные органы цветка
Они, по-видимому, также окружают веретено плотной сетью, которая выходит в
цитоплазму.
Организация микротрубочек при мегаспорогенезе моноспорического типа
сходна с таковой при микроспорогенезе (Willemse, van Lammeren, 1988; Webb,
Gunning, 1990b). Рис. 15.
Brown, Lemmon, 1991; Gunning, Hardham, 1982; Hogan, 1987; Lammeren van et al., 1985, 1989; Traas et
al., 1989; Webb, Gunning, 1990b; Willemse, van Lammeren, 1988.
МИКРОСПОРА
МИКРОСПОРА (греч. micros — малый, spora — спора, семя) — первая клетка
гаметофитной генерации, образующаяся в микроспорангии в результате двух
мейотических делений микроспороцита.
Термин «микроспора» часто ошибочно используют в качестве синонима
термина «пыльцевое зерно». Согласно Schnarf (1929) и Maheshwari (1950), микроспора
и пыльцевое зерно — это разные стадии гаметофитной генерации. Первое
описание микроспор было дано Nageli (1842). После завершения мейоза в микроспоро-
ците формируется тетрада микроспор, окруженных каллозной оболочкой.
Особенности поверхности микроспор и положение апертур в них обнаруживаются уже на
стадии тетрады в процессе синтеза примэкзины. Синтез элементов примэкзины в
тетраде осуществляется протопластом каждой отдельной микроспоры. Примэкзи-
ну образуют пектоцеллюлозные микрофибриллы, которые располагаются между
плазмалеммой и каллозной оболочкой микроспоры. При ферментативном
разрушении каллозы происходит отложение на поверхности микроспоры спорополле-
нина, синтезированного клетками тапетума, что приводит к формированию экзи-
ны. На стадии микроспоры синтезируется и внутренний слой оболочки будущего
пыльцевого зерна — интина, важной функцией которой является формирование
стенки, выстилающей апертуру. У ряда родов цветковых (Pseudowintera, Victoria,
Philydrum, Luzula, Typha и др.) микроспоры остаются в тетрадах и продолжают
свое развитие, образуя сложные пыльцевые образования.
Продолжительность развития микроспор вариабельна: от нескольких часов и
дней — у тропических и субтропических растений до несколько месяцев у многих
арктических растений. Разработано несколько классификаций фаз развития
микроспор (Романов, 1970; Батыгина, 1974; Vithanage, Knox, 1980; Willemse,
Reznickova, 1980).
Высвободившиеся из тетрады микроспоры имеют плотную невакуолизирован-
ную цитоплазму и ядро с одним или несколькими ядрышками, расположенное в
центре клетки. Обычно наблюдается заметный рост микроспор,
сопровождающийся оводнением и вакуолизацией цитоплазмы. Затем начинается процесс авто-
фагии цитоплазмы, за которым следует формирование новой цитоплазмы и
рибосом, В результате амилогенеза пропластиды дифференцируются в амилопласты,
содержащие крахмал (Pacini, 1990). В ходе образования интины и формирования
апертур крахмал гидролизуется. Последующий амилогенез и вакуолизация новой
цитоплазмы имеют место после I митоза в пыльцевом зерне.
В период вакуолизации наблюдается интенсивное увеличение объема
микроспоры. Так, у злаков диаметр микроспоры увеличивается более чем в два раза,
достигая 3/4 размера зрелого пыльцевого зерна. Происходит смещение ядра из
центрального положения в пристенное, что часто связывают с образованием большой
центральной вакуоли (Poaceae, Campanulaceae, Juglandaceae, Saxifragaceae).
Иногда (Hawortia, Juncus, luzula, Ruppia) вакуоль не наблюдается, но ядро все же
оказывается в пристенном положении. По отношению к апертуре положение ядра в
Пыльник
83
микроспоре перед митозом строго постоянно для каждого вида растений. Это
обусловлено, вероятно, наличием в микроспоре химических и физических градиентов,
которые определяются архитектоникой и полярностью ее протопласта и
обнаруживаются еще при образовании тетрады микроспор (Geitler, 1935; Maheshwari, 1950;
Герасимова-Навашина, 1951; Vazart, 1958; Батыгина, 1962; Романов, 1970).
Полярность микроспор особенно заметно проявляется у злаков и выражается
в положении ядра микроспоры относительно поры. Пора микроспоры обращена к
тапетуму. Перед митозом ядро микроспоры находится на максимальном
расстоянии от поры, тогда как на стадиях вакуолизации и роста микроспоры оно может
занимать разное положение по отношению к поре (Батыгина, 1962, 1974, 1987;
Kihara, Hori, 1966; Романов, 1966, 1970).
В процессе роста и формирования микроспоры заметно увеличивается объем ее
цитоплазмы, ядра и ядрышек, меняется характер вакуолизации цитоплазмы.
Состояние цитоплазматических органелл тесно связано с процессами, имеющими
место в ходе развития микроспор (Went van, Cresti, 1989). Особенно сильным
изменениям подвержены популяции рибосом, цитоплазматический матрикс и эндо-
мембранная система. Число и распределение рибосом тесно связано с
аккумуляцией нуклеолоидов в цитоплазме. Во время формирования примэкзины, экзины и
интины меняется конфигурация ЭР, диктиосом, число и величина пузырьков.
Обилие гладкого ЭР и диктиосом может быть тесно связано с сильным ростом
микроспор и вакуолизацией их цитоплазмы. Микроспора завершает свое развитие,
вступая в дифференцирующий митоз, в результате которого образуются две
клетки мужского гаметофита: вегетативная и генеративная.
Батыгина, 1962,1974,1987; Герасимова-Навашина, 1951; Поддубная-Арнольди, 1976; Романов, 1966,
1970а,б; Geitler, 1935; Kihara, Hori, 1966; Knox, 1984a; Maheshwari, 1950; Nageli, 1842; Pacini, 1990;
Schnarf, 1929; Vazart, 1958; Vithanage, Knox, 1980; Went van, Cresti, 1989; Willemse, Reznickova, 1980.
ЦИТОХИМИЯ МИКРОСПОРЫ
Процесс развития микроспор является наиболее длительным этапом при
формировании пыльцевого зерна цветковых растений. В ходе развития микроспоры
сильно увеличиваются в объеме. С помощью цитохимических и биохимических
методов удалось показать, что в развивающихся микроспорах наблюдается
увеличение содержания ДНК, РНК и белков (Bryan, 1951; Ogur et al, 1951; Taylor, 1958;
Woodard, 1958, и др.). Более поздние цитохимические исследования ранее не
изученных видов, в основном подтвердили установленные закономерности.
На примере лилии (Lilium candidum), шалфея (Salvia sclarea), лаванды
(Lavandula angustifolia) и кориандра (Coriandrum sativum) показано увеличение
содержания ДНК в ядрах микроспор. В поздней интерфазе накануне митоза (G2-
период) содержание ДНК соответствует 2С. Характер количественных изменений
гистона в основном сходен с характером количественных изменений ДНК.
Несмотря на то, что в микроспорах лилии, шалфея и лаванды обнаруживается некоторое
отставание увеличения содержания гистона от увеличения содержания ДНК, в
поздней интерфазе накануне митоза содержание гистона находится на уровне 2С.
Процесс развития микроспор характеризуется не только количественными
изменениями ДНК и гистона, но и изменениями в структурном состоянии хроматина
ядра. Анализ чувствительности ДНК к кислотному гидролизу позволяет оценить
направление изменений физико-химического состояния хроматина ядер
развивающихся микроспор лилии. Результаты цитохимических исследований позволяют
сделать заключение, что развитие микроспор сопровождается изменением физико-
химического состояния хроматина, увеличением количества ДНК, выявляемой
при относительно коротком времени гидролиза. Данный факт свидетельствует о
б*
84
Генеративные органы цветка
том, что в развивающихся микроспорах лилии наблюдается тенденция к деконден-
сации хроматина и возрастанию его метаболической активности, достигающей
максимума накануне митоза.
Полученные результаты дают возможность оценить уровень метаболической
активности хроматина в различные периоды интерфазы. По-видимому,
метаболическая активность хроматина относительно снижена в течение большей части G1-
периода. Повышение уровня метаболической активности наблюдается, очевидно,
перед началом и во время синтетического периода. Дальнейший рост
метаболической активности обнаруживается в С2-периоде перед митозом микроспоры.
Имеющиеся в настощее время результаты цитохимических, а также
биохимических исследований свидетельствуют о том, что синтез РНК в микроспорах
осуществляется на протяжении всей интерфазы. При этом синтез РНК происходит с
максимальной интенсивностью после завершения процесса репликации ДНК
(Steffensen, 1966). Синтезирующаяся в течение развития микроспор РНК
относится преимущественно к рибосомальному типу. (Peddada, Mascarenhas, 1975).
Содержание РНК в ядрышке, хроматине ядра и цитоплазме развивающихся
микроспор изменяется определенным образом. Об этом свидетельствуют
результаты цитохимического исследования РНК в процессе развития микроспор лилии. В
первой половине интерфазы содержание РНК увеличивается как в цитоплазме, так
и в хроматине ядра и в ядрышке. Перед вступлением микроспор в S-период
количество РНК в ядрышке снижается, но возрастает в хроматине ядра и цитоплазме. С
началом S-периода обнаруживается тенденция к снижению количества РНК в
хроматине ядра и увеличению ее содержания в ядрышке и цитоплазме.
Представленные результаты свидетельствуют о довольно сложной взаимосвязи процесса
синтеза РНК и, вероятно, транспорта синтезированной РНК из ядра в цитоплазму.
Вместе с тем они показывают, что суммарное содержание РНК (в целом на клетку)
увеличивается по мере развития микроспор, достигая максимального уровня
накануне митоза.
Установленные закономерности обнаруживаются и у других видов растений.
Так, в процессе развития микроспор шалфея, лаванды и кориандра наблюдается
увеличение содержания РНК как в ядре, так и в цитоплазме.
Характер изменения содержания общих белков в развивающихся микроспорах
обычно во многом сходен с характером изменения РНК (Moss, Heslop-Harrison,
1967). Например, в процессе развития микроспор лилии обнаруживается
увеличение содержания общих белков в ядре и цитоплазме.
Таким образом, развитие микроспор характеризуется некоторыми
особенностями процесса синтеза ДНК, РНК, ядерных и цитоплазматических белков. При этом,
вероятно, интенсивность синтетических процессов в микроспорах невысокая,
поскольку развитие микроспор сильно растянуто во времени. Исключение
составляют поздние стадии, характеризующиеся более активным внутриклеточным
метаболизмом, о чем свидетельствует усиление деконденсации хроматина и увеличение
содержания РНК. Рис. 22.
Bryan, 1951; Moss, Heslop-Harrison, 1967; Oguretal., 1951; Peddada, Mascarenhas, 1975; Steffensen, 1966;
Taylor, 1958; Taylor, McMaster, 1954; Woodard, 1958.
УЛЬТРАСТРУКТУРНЫЕ АСПЕКТЫ РАЗВИТИЯ МИКРОСПОР.
АГРЕГАТЫ ЭНДОПЛАЗМАТИЧЕСКОГО РЕТИКУЛУМА
Агрегаты эндоплазматического ретикулума (ЭР) представляют собой
объемные структуры весьма своеобразного строения. Они занимают столь
значительную часть цитоплазмы клетки, что могут быть заметны даже при
наблюдении в световом микроскопе. Их можно условно разделить на два типа.
Пыльник
85
Первый тип — агрегаты так называемого кольчужного типа (фр.
aggregates en cotte de mallles, англ. chain-mail aggregates), или «кольчуги»,
описанные Eyme (1967) в клетках нектарников Diplotaxis и Ficaria. Eyme (1967)
предполагает, что кольчуги аккумулируют липопротеиды. Именно этот термин,
предложенный Eyme, представляется наиболее удачным для обозначения этих
необычных агрегатов ЭР, имеющих на срезах параллельные синусоидальные (в
одной плоскости среза) или сцепленные кольцевые (в другой плоскости среза)
профили. Синонимы: квазикристаллические решетки (Wooding, 1967),
лабиринты (Behnke, 1968), рассматриваемые как запас мембран в клетке;
изогнуто-спиральные агрегаты ЭР {convoluted ER — Esau, Hoefert, 1980), встречающиеся при
дезорганизационных процессах в клетке; кроме того, их присутствие считают
признаком специфической цитоплазматической дифференциации, связанной с
основной функцией клетки (Esau, Charvat, 1975), отмечая наличие в цистернах этих
агрегатов кислых фосфатаз и АТФ-аз. Источником автолитических ферментов
считает их и Evert (1984). Кольчуги, обнаруженные в развивающихся
микроспорах — искривленный ЭР {contorted ER — Hoefert, 1969а) — у видов рода Beta
прямо связаны с ядерной оболочкой и, по мнению автора, участвуют в переносе
веществ от ядра к плазмалемме. Такие же образования отмечены в период
интенсивного роста интины у Tradescantia bracteata (Mepham, Lane, 1970); авторы
считают, что агрегаты ЭР участвуют в быстром переносе веществ для построения
интины к плазмалемме. Эти и подобные им агрегаты ЭР отмечены в развивающихся
элементах флоэмы (Телепова, 1985).
Кольчужные агрегаты ЭР постоянно присутствуют в цитоплазме микроспор
Micheliafuscata и Manglietia tenuipes (Magnoliaceae) на протяжении почти всего
периода их развития (Габараева, 1986, 1987; Gabarayeva, 1991). За время с начала
тетрадного периода до середины посттетрадного агрегаты претерпевают ряд
изменений, однако во время развития примэкзины неизменно наблюдается контакт
кольчуг с плазмалеммой посредством цистерн ЭР, несущих рибосомы и
являющихся прямыми ответвлениями гладких цистерн кольчуг. Заполненность внутрици-
стернального пространства кольчуг аморфным, умеренно электронно-плотным
веществом и постоянная ассоциация с развивающейся примэкзиной позволяет
предположить синтетическую функцию этих образований; во всяком случае, их участие
в основной функции клетки — построении сложной оболочки пыльцевого зерна —
несомненна. Учитывая, что агранулярный эндоплазматический ретикулум
участвует в синтезе и транспорте терпенов, стероидов, липидов (Васильев, 1977), и что в
примэкзиновый матрикс Micheliafuscata и Manglietia tenuipes вначале
откладывается умеренно электронно-плотное вещество, вероятнее всего — липидное, а затем
на этом субстрате полимеризуется спорополленин, являющийся терпеноидным
веществом, можно предполагать, что именно эти вещества (липиды, терпеноиды)
синтезируются и переносятся к плазмалемме микроспор кольчугами (Габараева,
1990; Gabarayeva, 1991).
Второй тип агрегатов ЭР еще более своеобразен; они пронизывают всю
цитоплазму развивающихся микроспор Liriodendron chinensis (Габараева, 1990;
Gabarayeva, 1991). Эти агрегаты составлены из пачек длинных, лежащих
параллельно друг другу трубчатых цистерн. Число цистерн в агрегатах обычно нечетное
и колеблется от 3-х до 13-ти. Центральная цистерна всегда содержит темное осмио-
фильное вещество; в многоцистерновых агрегатах темные цистерны обычно
чередуются с электронно-прозрачными, что и послужило причиной их наименования
«зебра»—агрегатами {zebra-aggregates—Gabarayeva, 1991). Эти крупные
агрегаты образуют волнообразные изгибы в цитоплазме, ветвятся или замыкаются в
кольца. Отчетливо прослеживается ассоциация концов осмиофильных цистерн с
липидными глобулами, постоянно лежащими рядом в цитоплазме. Наружные
86
Генеративные органы цветка
электронно-прозрачные цистерны агрегатов несут рибосомы, а концы
периферически расположенных агрегатов подходят к плазмалемме. Учитывая стадии
развития микроспор Liriodendron chinensis, на которых встречаются зебра-агрегаты,
контакт цистерн агрегатов с плазмалеммой и происходящую в это время особенно
активную аккумуляцию спорополленина в экзине, естественно было предположить
участие этих структур в синтезе предшественников спорополленина;
предположение о липопротеиновой природе синтезируемых веществ как одного из звеньев в
цепи предшественников этого биополимера подтвердилось
электронно-цитохимической ферментативной реакцией с проназой (Габараева, 1990). Структуры, отчасти
похожие на описанные (спаренные цистерны ЭР с осмиофильным веществом между
ними и рибосомами на наружных поверхностях) наблюдал Fleurat-Lessard (1986) в
паренхимных клетках Mimosa pudica. Он считает, что они участвуют в синтезе
белков, возможно — контрактильных. Агрегированные цистерны ЭР найдены в
раковых клетках (Schaf f et al., 1972; цит. по: Fleurat-Lessard, 1986). Подобные структуры
описаны также в инцистирующихся зооспорах гриба Pythium aphanidermatum
(Grove, Bracker, 1978), их функция авторами не обсуждается. Следует обратить
внимание на встречаемость этого типа агрегированного ЭР у таких различных
организмов как высшие растения, грибы и раковые клетки животных. Возможно, такие
агрегаты ЭР являются цитологически общезначимыми; они появляются там и
тогда, где необходим интенсивный синтез каких-либо сложных протеидов, а для
прохождения синтеза требуется пространственная разобщенность исходных
компонентов (протеинов и простетических групп). Рис. 23.
Васильев, 1977; Габараева, 1986,1987, 1990;Телепова, 1985; Behnke, 1968; Esau, Charvat, 1975; Eyme,
1967; Fleurat-Lessard, 1986; Gabarayeva, 1991; Hoefert, 1969a; Mepham, Lane, 1970.
ПЫЛЬЦЕВОЕ ЗЕРНО
ПЫЛЬЦЕВОЕ ЗЕРНО (лат. pollen — пыльца и granum — зерно) —
многоклеточная структура, образующаяся за счет одного или двух митотических делений
в микроспоре, в результате чего возникает мужской гаметофит. Синоним: мужской
гаметофит'.
Микроспора «прорастает», образуя пыльцевое зерно, состоящее из двух или
трех клеток: вегетативной и генеративной (двуклеточное) или вегетативной
клетки и двух спермиев (трехклеточное). Различают три типа развития пыльцевых
зерен: «нормальный» тип, Т'riglochin-Tvm. и Juncus-rvm (Имс, 1964). При
нормальном типе, характерном для большинства цветковых растений, микроспоры сильно
увеличиваются в объеме перед делением. В случае Triglochin-rvma сначала
происходит деление и лишь затем увеличиваются размеры. Этот тип развития
пыльцевых зерен наблюдается у ряда однодольных (Najas, Triglochin, Ruppia, Lilaea,
Aponogeton). Juncus-rvm ограничен представителями Juncaceae и Сурегасеае и, по
мнению Имса (1964), не четко отличается от других типов. Однако, имеющиеся
данные свидетельствуют, что у Juncaceae (Анисимова, 1987) микроспора и
пыльцевое зерно практически не отличаются по размерам.
Первое деление в микроспоре определяют как неравный, или
дифференцирующий митоз, в результате которого формируются две различные в морфологическом
и физиологическом отношении клетки: вегетативная и генеративная.
Характерной особенностью первого деления является положение и направление веретена
деления, которое постоянно для каждого вида растений и определяется строго фик-
Некоторые исследователи распространяют понятие «мужской гаметофит» и на пыльцевую
трубку.
Пыльник
87
сированным положением ядра микроспоры в пристенном слое у определенной
стенки микроспоры (наружной, внутренней, радиальной по положению в тетраде)
(Geitler, 1935; Герасимова-Навашина, 1951). Веретено деления проходит
параллельно длинной оси пыльцевого зерна (правило Гофмейстера-Гертвига) и
перпендикулярно стенке пыльцевого зерна, к которой прилегает ядро. Веретено деления
часто бывает асимметричным (Geitler, 1935; Герасимова-Навашина, 1951), что
обусловлено положением ядра в пыльцевом зерне. Степень асимметрии веретена, в
свою очередь, определяет различное поведение хромосом в поздней анафазе и тело-
фазе (Geitler, 1935; Герасимова-Навашина, 1951). Наличие, однако,
асимметричного веретена не всегда является обязательным условием для неравного деления,
так как и при симметричной фигуре деления (Asclepias, Anthericum, Adoxa,
Sambucus, Cuscuta, Uvularia и др.) также формируются неравные клетки (Geitler,
1935; Maheshwari, 1950). '
Образовавшиеся генеративная и вегетативная клетки отделены друг от друга
плазмалеммами, плазмодесмы отсутствуют (van Aelst, van Went, 1991). Отмечено
временное присутствие каллозы вокруг генеративной клетки у ряда растений
(Hyacinthus orientalis, Tradescantia bracteata, Impatiens balsamina), а также у
представителей рода Triticum и Chlorophytum (Gorska-Brylass, 1967; Романов,
1970; Резникова, 1984).
Второе митотическое деление, происходящее в генеративной клетке, приводит
к образованию двух мужских гамет (спермиев). Генеративная клетка или
образовавшиеся спермин располагаются в цитоплазме вегетативной клетки, последняя
по мере созревания пыльцы обогащается окислительными ферментами,
витаминами, физиологически активными и запасными веществами.
Пыльцевые зерна по составу запасных веществ можно подразделить на жиросо-
держащие (Juglandaceae, Eupomatiaceae, Frankeniaceae, Stachyuracae, Lauraceae,
Salicaceae, Pittosporaceae, Polygonaceae) и крахмалоносные (АШасеае,
Aizoaceae, Betulaceae, Butomaceae, Moraceae, Trapaceae и др.). У ряда семейств в
пыльцевых зернах накапливаются крахмал, липиды и белки (Brassicaceae,
Grossulariaceae, Sonneratiaceae, Ruppiaceae).
Оболочка пыльцевого зерна состоит из экзины (снаружи) и интины. На
поверхности экзины наблюдаются борозды, поры, щели и колпы, достигающие интины,
объединяемые общим названием «апертура» и представляющие собой места
прорастания пыльцевых трубок. Пыльцевые зерна очень разнообразны по структуре
экзины, числу и форме апертур.
Пыльца обычно имеет округлую, эллипсоидальную или вытянутую форму, но
может быть лопастной или многоугольной. Отклонением от обычной формы
пыльцы является нитевидная пыльца (Cymodoceaceae, Zosteraceae) и серповидная
{Ruppiaceae).
Обычно пыльцевые зерна одиночные, реже они образуют сложные соединения в
виде диад (Scheuchzeriaceae), тетрад (Empetraceae, Epacridaceae, Juncaceae,
Droseraceae, Philydraceae, Typhaceae, Velloriaceae, Sapindaceae), полиад
(Mimosaceae) и поллиниев (Asclepiadaceae, Orchidaceae).
Пыльцевые зерна, как уже отмечалось, могут быть двуклеточными или трех-
клеточными. В классе двудольных двуклеточные пыльцевые зерна характерны
для 195 семейств, трехклеточные — для 98 семейств. В классе однодольных
двуклеточные пыльцевые зерна встречаются в 41 семействе, трехклеточные — в 28.
Оба типа пыльцевых зерен отмечены в порядках на разных уровнях
филогенетической системы цветковых растений (Камелина, 1991). Рис. 24.
Герасимова-Навашина, 1951; Имс, 1964; Камелина , 1991; Поддубная-Арнольди, 1976; Резникова,
1984; Романов, 1970а-в; Aelst van, van Went, 1991; Geitler, 1935; Gorska-Brylass, 1967; Knox, 1984a;
Maheshwari, 1950.
88
Генеративные органы цветка
ОБОЛОЧКА ПЫЛЬЦЕВОГО ЗЕРНА
Оболочка пыльцевого зерна состоит из экзины и интины — внутреннего пол-
исахаридного слоя. Экзина, как известно, состоит в основном из спорополленина
— высокоустойчивого полимера каротиноидов и их эфиров (Brooks, Shaw, 1978).
Однако в недавнее время, с помощью метода ,3С, основанного на
ядерно-магнитном резонансе и обладающего высокой разрешающей способностью, было
установлено, что спорополленин — это не одно вещество, а комплекс родственных
биополимеров — производных высоконасыщенных предшественников, таких, как
жирные кислоты (Guilford et al., 1988). Было показано, что фенолы являются
неотъемлемым компонентом экзины (Schulze, Osthoff, Wiermann, 1987). Высказано
предположение, что р-кумаровая кислота является подлинной структурной
единицей скелета экзины (спорополленина) (Wehling et al., 1989).
Экзина состоит из нескольких слоев:
Экзина
Экзина
ин;ина- • '№>ш№Ш№шттш№. у™.*?.
Схема стратиграфии стенки пыльцевого зерна у большинства покрытосеменных растений согласно
Erdtman (правая сторона) и Faegri (левая сторона).
1. Тектум (лат. tectum, мн.ч. tecta) — частично или полностью покрывающий
слой. Он может быть перфорирован микропорами или микроканалами (тектатная
пыльца). Тектатные пыльцевые зерна могут быть: а) пертектатными, в том
случае, если тектум сплошной, (например, Triticum aestivum), б) субтектатными в
том случае, если тектум прерывистый (например, Erucaria crassifolia).
Пыльцевые зерна без явного тектума являются интектатными (например, Franklandia
triaristata, Proteaceae — Erdtman, 1969).
Тектум может быть гладким или иметь выросты различного рода.
2. Столбик (лат. baculum, мн.ч. bacula) обычно располагается между тектумом
и нэкзиной в виде палочек или палочкообразных элементов. Столбики
различаются по высоте и толщине, могут быть прямыми или ветвящимися. Тектум и
столбики образуют слой, называемый сэкзиной (Erdtman, 1969).
3. Нэкзина по-видимому, является более однородной по структуре, чем сэк-
зина. Верхняя (проксимальная) часть нэкзины имеет свойство окрашиваться
подобно сэкзине. Верхняя часть нэкзины получила название нэкзина-1. Сэкзина
вместе с нэкзиной-1 образуют слой экзина-1.
4. Нэкзина-2, или эндэкзина: по своим свойствам окрашиваться она
отличается от нэкзины-1. Кроме того, она не обладает такой сложной структурой, как
нэкзина-1. Нэкзина-2 может иногда быть единственным компонентом нэкзины; в
других случаях она очень редуцирована или вовсе отсутствует.
Имеются различные терминологии для обозначения слоев экзины. Наиболее
распространенными являются термины, введенные Erdtman и Faegri.
Пыльник
89
Интина состоит из менее разнородных слоев. Она содержит толстый полисаха-
ридный слой, часто с радиально-ориентированными трубочками и обычно
имеющий утолщение под апертурами. В некоторых случаях интина состоит более, чем
из одного слоя. Слои могут различаться морфологически и по химическому
составу (Heslop-Harrison, 1979a,b; Kress, Stone, 1982; см. также: Knox, р.207,
Embryology of Angiosperms, 1984a).
Развитие оболочки пыльцы
Пыльцевые зерна образуются в пыльниках из спорогенной ткани в процессе
митотического деления, в результате которого формируются материнские клетки
пыльцы — микроспороциты. После мейотического деления образуются тетрады
гаплоидных микроспор. Тетрады затем покрываются каллозной оболочкой и
располагаются в гнезде вплотную к тапетуму. Каллоза jS-1, 3-полиглюкан)
выявляется вокруг материнских клеток микроспор на начальной стадии мейоза. Она
образует слой между плазмалеммой и оболочкой микроспороцита. Добавочная
каллоза образуется после второго мейотического деления и изолирует молодые
микроспоры (Heslop-Harrison, 1968). Снаружи от плазмалеммы микроспор
появляется фибриллярный материал, который постепенно накапливается. Был сделан
вывод, что покров плазмалеммы (примэкзина) содержит рецепторы аккумуляции
предшественников спорополленина и полимеризации (primexine, Heslop-Harrison,
1963; glycocalax, Rowley, Dahl, 1977). Каллозная оболочка тетрад начинает
разрушаться, и молодые микроспоры высвобождаются из тетрад в гнездо пыльника.
Вскоре после высвобождения микроспор начинается образование вакуолей в их
цитоплазме. У Triticum aestivum размер вакуоли возрастает по мере увеличения
объема пыльцевых зерен (El-Ghazaly, Jensen, I986a,b). В процессе дальнейшего
развития диаметр вакуолизированных микроспор становится вдвое больше, чем
толщина их оболочки.
Толщина оболочки микроспор постепенно возрастает при переходе от
состояния свободных молодых микроспор к вакуолизированным микроспорам.
Появление большой вакуоли в цитоплазме молодых пыльцевых зерен, как предполагают,
ведет к тому, что создается давление на оболочку развивающихся пыльцевых
зерен. В результате этого давления слои оболочки спрессовываются. В некоторых
случаях (например, у злаков) рудиментарная эндэкзина прижимается к
проксимальной поверхности подстилающего слоя и перестает быть различимой (El-
Ghazaly, Jensen, 1986a). Образование внутреннего слоя нэкзины (нэкзина-2, или
эндэкзина), а также интины может происходить в период вакуолизации,
например, у видов Vicia(Audran, Willemse, 1982), Lilium (Heslop-Harrison, Dickinson,
1969). Образование нэкзины-1 (подстилающего слоя) и нэкзины-2 (эндэкзины)
обычно происходит в процессе образования ламелл на плазмалемме. Эти ламеллы
образуют поверхность для отложения спорополленина. «Интина, как правило,
закладывается после экзины» (Erdtman, 1969).
Образование интины может быть связано с плазмалеммой, как, например, у
Triticum aestivum (El-Ghazaly, Jensen, 1986,b). Иногда в процессе синтеза интины
особенно часто наблюдаются диктиосомы, например, у Ranunculaceae (Roland,
1971), в то время как в других случаях особенно многочисленны профили ЭР и
полисомы, например, у Cosmos (Knox, Heslop-Harrison, 1970).
У многих видов изучены ультраструктурные аспекты пыльцевой оболочки.
Так, например, у Artemisia vulgaris (Rowley et al., 1981) данные по субструктуре
экзины получены с использованием методов частичного окисления. Они
предложили модель гликокаликса, состоящего из единиц-комплексов (тафтов). Тафт
состоит из поверхностной спиральной субъединицы, оплетающей несколько
аксиальных спиральных субъединиц. Тафт является как бы скелетом столбика и
расположен перпендикулярно плазмалемме. Рис. 25.
90
Генеративные органы цветка
Audran, Willemse, 1982; Brooks, Shaw, 1978; El-Ghazaly, Jensen, 1986a; El-Ghazaly, Jensen, 1986b;
Erdtman, 1969; Guilford et al., 1988; Heslop-Harrison, 1963, 1979a, b; Heslop-Harrison, Dickinson, 1969;
Knox, 1984a; Knox, Heslop-Harrison, 1970; Kress, Stone, 1982; Roland, 1971; Rowley, Dahl, 1977; Rowley
et al., 1981; Schulze, Osthoff, Wiermann, 1987; Wehling et al., 1989.
ГЕНЕРАТИВНАЯ КЛЕТКА (лат. genero — производить, порождать) —
меньшая клетка двуклеточного пыльцевого зерна, возникающая в результате
дифференцирующего митоза, и образующая при последующем делении два спермия.
Синонимы: антеридиальная, сперматогенная, спермиогенная клетка. Первое
описание двух неравных «ядер» (клеток, Г.А.) в пыльцевом зерне было дано Nageli
(1842). Strasburger (1884) определил их функции и дал название меньшей
клетке — «генеративная».
Генеративная клетка первоначально плотно прилегает к оболочке пыльцевого
зерна. Ее положение таксоноспецифично и является систематическим признаком.
Оно обусловлено архитектоникой пыльцевого зерна, полярностью протопласта
микроспоры и определяется еще в тетраде (Geitler, 1935; Герасимова-Навашина,
1951а; В. Vazart, 1958; Романов, 1970а,б). Первоначально генеративная клетка
имеет линзовидную форму. Согласно электронно-микроскопическим данным
генеративная и вегетативная клетки отделены друг от друга только собственными
плазмалеммами (J. Vazart, 1969, 1971). Gorska-Brylass (1967) описала для
генеративной клетки образование временной каллозной оболочки у 2 видов
Chlorophytum, Hyacinthus orientalis, Tradescantia bracleata и Impatiens balsamiria,
которая, вероятно, выполняет определенную роль в дифференциации
генеративной клетки. В результате неравного митоза генеративная клетка становится ма-
лоцитоплазменной, однако содержит обычный набор клеточных органелл, за
исключением пластид (без крахмала), которые могут отсутствовать у ряда
растений. Митохондрии генеративной клетки мельче митохондрий вегетативной
клетки, имеют хорошо развитую внутреннюю мембранную систему. Отмечаются
немногочисленные диктиосомы с пузырьками Гольджи, цистерны гранулярного
ЭР, свободные рибосомы, сферосомы, липидные глобулы и мелкие вакуоли. В
периферических районах цитоплазмы расположены микротрубочки, упакованные в
пачки и ориентированные параллельно длинной оси клетки (Aelst van, van Went,
1991). Ядерная оболочка генеративной клетки имеет поры.
При резорбции фрагмопласта в цитоплазме генеративной клетки снижается
содержание РНК, затем в ходе дифференциации происходит интенсивный синтез
РНК и увеличение ее содержания в цитоплазме и ядре при одновременном
снижении содержания в ядрышке (Волховских, 1965). Ядро генеративной клетки
сравнительно быстро удваивает содержание ДНК по сравнению с вегетативным ядром,
тогда как увеличение содержания гистонов происходит более медленными
темпами (Резникова, 1984). Цитоплазма генеративной клетки в отличие от вегетативной
не имеет запасных веществ, в частности, крахмала.
Важным этапом в развитии генеративной клетки является ее отхождение от
оболочки пыльцевого зерна и перемещение в направлении ядра вегетативной
клетки (Батыгина, 1962, 1974, 1987; Kichara, Hori, 1966; Романов, 1970а,б; Schlag,
Hesse, 1922). Отделение генеративной клетки от стенки пыльцевого зерна
начинается с потери ею линзовидной формы. Центральная часть генеративной клетки
вместе с ядром выпячивается внутрь вегетативной клетки, что сопровождается
отходом цитоплазмы из районов, граничащих со стенкой пыльцевого зерна, быстро
уменьшается поверхность контакта между генеративной клеткой и интиной
пыльцевого зерна вплоть до полного отделения. Генеративная клетка приобретает
округлую или радиально вытянутую форму. Вскоре после отделения генеративной
клетки наблюдается ее перемещение по направлению к ядру вегетативной клетки,
Пыльник
91
в результате чего она располагается в непосредственной близости от ядра. В ходе
своего дальнейшего развития генеративная клетка видоизменяется и отходит от
ядра вегетативной клетки. Чаще генеративная клетка приобретает
веретенообразную, эллиптическую, иногда серпообразную форму. У некоторых растений
{Allium, Cuscuta, Ottelia, Tradescantia, Paeonia) генеративная клетка очень
длинная и ее длина может равняться длине или ширине пыльцевого зерна. У Calathea
она в три раза превышает диаметр пыльцевого зерна. У Erythronium генеративная
клетка имеет амебообразную форму. В случае образования трехклеточного
пыльцевого зерна наблюдается деление генеративной клетки. Весь процесс деления:
расположение хромосом и образование веретена ничем не отличается от
нормального митоза. Разделение клетки происходит либо перетяжкой, либо заложением
клеточной пластинки. Возможны случаи, когда в некоторых пыльцевых зернах
закладывается хорошо выраженная клеточная пластинка, которая вскоре
исчезает, и окончательное разделение спермиев происходит в результате образования
перетяжки, возникающей вскоре после этого. В других пыльцевых зернах
клеточная пластинка, возникнув, продолжает существовать, а развитие перетяжки
задерживается, хотя начало ее образования заметно с одной из сторон. В этом случае
генеративная клетка разделяется клеточной пластинкой до того, как образуется
перетяжка. В ходе деления генеративной клетки наблюдается перемещение ее
органелл в периферические районы цитоплазмы. В районе веретена наблюдаются
микротрубочки, отдельные цистерны гранулярного ЭР и много свободных
рибосом. В поздней телофазе пузырьки диктиосом и микротрубочки располагаются в
районе будущей клеточной пластинки, принимая участие в ее образовании
(Charzynska et al., 1988). Рис. 24.
Батыгина, 1962, 1974, 1987; Волховских, 1965; Герасимова-Навашина, 1951а, 1958; Имс, 1964; Под-
дубная-Арнольди, 1976; Резникова, 1984; Романов, 1970; Aelst van, van Went, 1991; Charzynska et al.,
1988; Charzynska, Lewandowska, 1990; Geitler, 1935; Gorska-Brylass, 1967; Kichara, Hori, 1966;
Maheshwari, 1950; Nageli, 1842; Schlag, Hesse, 1992; Strasburger,1884; Vazart В., 1958; Vazart J., 1969,
1971.
УЛЬТРАСТРУКТУРА ГЕНЕРАТИВНОЙ КЛЕТКИ
Генеративная клетка является объектом электронно-микроскопических
исследований с шестидесятых годов настоящего столетия. Она может быть овальной,
серповидной или веретеновидной формы. У многих видов между плазмалеммой
генеративной клетки и смежной внутренней плазмалеммой окружающей ее
вегетативной клетки наблюдается отчетливая клеточная оболочка. Она, по-видимому,
содержит целлюлозу и пектиновые вещества (Maruyama et al., 1965; Jensen et al.,
1974; Nakamura, Miki-Hirosige, 1985; Cresti et al., 1987), а на ранних стадиях
развития, возможно, каллозу (Gorska-Brylass, 1967). У некоторых видов
генеративная клетка лишена клеточной оболочки, о чем свидетельствует отсутствие
какого-либо пространства между плазмалеммой генеративной клетки и внутренней
плазмалеммой вегетативной клетки (Jensen et al., 1974; De Mason, Sekhar, 1988).
В цитоплазме генеративной клетки обнаружены ЭР, рибосомы, диктиосомы,
многочисленные вакуоли, микротрубочки, митохондрии и, у некоторых видов,
пластиды (Sassen, 1964; Larson, 1965; Lombardo, Gerola, 1968; Sanger, Jackson, 1971;
Jensen et al., 1974; Knoth et al., 1980; Russell, Mislan, 1986; De Mason, Sekhar, 1988;
Schroder, Oldenburg, 1990; Zhuetal., 1990, 1991). Наличие пластид в генеративных
клетках однако не гарантирует их наследования, т.к. они могут дегенерировать в
генеративной клетке, быть исключены из спермиев, из зиготы или перенесены в
суспензор в ходе развития зародыша (Clauhs, Grun, 1977; Mogensen, Rusche, 1985;
92
Генеративные органы цветка
Mogensen, 1988; Sears, 1980; Hagemann, Schroder, 1989; Schroder, Oldenburg, 1990).
Отсутствие пластид в генеративной клетке служит основой строго материнской
пластидной наследственности (Smith, 1989).
Ядро генеративной клетки повторяет ее форму и, как будет показано в статье,
посвященной вегетативной клетке, число пор в оболочке ядра генеративной
клетки обычно намного меньше, чем в оболочке ядра вегетативной клетки (Mepham,
Lane, 1969; La Fountain J., La Fountain K., 1973; Shi et al., 1991). Рис. 26.
Clauhs, Grim, 1977; Cresti etal., 1987; DeMason, Sekhar, 1988; Gorska-Brylass, 1967; Hagemann, Schroder,
1989; Jensen et al., 1974; Knoth et al., 1980; La Fountain J, La Fountain K., 1973; Larson, 1965; Lombardo,
Gerola, 1968; Maruyama et al., 1965; Mepham, Lane, 1969; Mogensen, 1988; Mogensen, Rusche, 1985;
Nakamura, Miki-Hirosige, 1985; Russell, Mislan, 1986; Sanger, Jackson, 1971; Sassen, 1964; Schroder,
Oldenburg, 1990; Sears, 1980; Shi et al., 1991; Smith, 1989; Zhuet al., 1990a, 1991.
ВЕГЕТАТИВНАЯ КЛЕТКА (лат. vegeto — возбуждать, произрастать) —
большая клетка пыльцевого зерна, дающая при его прорастании пыльцевую трубку.
Синонимы: клетка пыльцевой трубки, сифоногенная клетка. Strasburger (1884)
впервые определил ее функции и дал название.
Вегетативная клетка образуется в результате дифференцирующего митоза и
занимает большую часть объема пыльцевого зерна. Ее ядро сразу же после митоза
лежит вблизи генеративной клетки и не отличается по размерам от ядра
последней. Постепенно ядро вегетативной клетки заметно увеличивается в объеме и
начинает перемещаться к противоположному концу пыльцевого зерна. Движению
ядер в развивающемся пыльцевом зерне было уделено большое внимание,
детально было исследовано на пыльце злаков (Батыгина, 1962, 1974, 1987; Kichara, Hori,
1966; Романов, 1970). Движение ядра вегетативной клетки совершается вдоль ее
стенки.вероятно, вместе с окружающей его цитоплазмой, так что вся масса
цитоплазмы, находившаяся около генеративной клетки, перемещается на
противоположный конец пыльцевого зерна, а центральную часть его занимает вакуоль.
Согласно Батыгиной (1962), ядро вегетативной клетки в ходе развития пыльцы
злаков совершает два перемещения: первое движение происходит в район поры,
второе — в центр клетки. Размеры вегетативного ядра и его ядрышек сильно
увеличиваются. Форма вегетативного ядра у большинства видов цветковых растений
остается неизменно шаровидной, тогда как у отдельных видов оно заметно меняет
свою конфигурацию, принимает амебообразную форму или сильно вытягивается,
становится нитевидным, или распадается на отдельные фрагменты (Maheshwari,
1950; Герасимова-Навашина, 1951; Полякова, 1961, 1963; Батыгина, 1962, 1987;
Волховских, 1965). Вегетативному ядру приписывается большая метаболическая
активность. Ядерная оболочка имеет большое количество неравномерно
разбросанных пор.
Синтез ДНК в вегетативном ядре не совпадает по времени с таковым в
генеративном ядре й происходит намного позднее, чаще уже перед
созреванием пыльцевого зерна (Резникова, 1984). Содержание гистонов в
вегетативном ядре остается неизменным до репликации ДНК, при этом в гистонах
преобладает фракция аргинина. По содержанию общих белков вегетативное
ядро богаче генеративного ядра, причем белки характеризуются большей
кислотностью. Вегетативное ядро участвует в синтезе РНК и белков в
цитоплазме. Отмечены корреляции между величиной ядрышка и степенью
пиронинофилии цитоплазмы в вегетативной клетке (Полякова, Подставек,
1960; Полякова, 1962). Вегетативное ядро, вероятно, играет определенную
роль и в процессе деления генеративной клетки и в образовании спермиев
(Герасимова-Навашина, 1951; Полякова, 1960, 1961, 1962). Перед делением
генеративной клетки оно располагается вблизи делящейся клетки.
Пыльник
93
Вегетативное ядро в силу своей метаболической активности участвует в
образовании и росте пыльцевой трубки, хотя в ряде случаев оно перед образованием
пыльцевой трубки распадается на фрагменты или при образовании пыльцевой
трубки не выходит из пыльцевого зерна (Maheshwari, 1950; Поддубная-Арнольди,
1976).
Для вегетативной клетки характерно самое низкое ядерно-плазменное
отношение на всем протяжении ее существования ЩИшп candidum) (Резникова, 1984). В
вегетативной клетке наблюдается интенсивный синтез цитоплазмы, так что ко
времени образования спермиев в пыльцевом зерне или чаще ко времени
созревания пыльцевого зерна исчезает вакуоль вегетативной клетки. Перед созреванием
пыльцы цитоплазма вегетативной клетки сильно обезвоживается.
Вегетативная клетка является запасающей клеткой с высокой метаболической
активностью, содержащей большое количество резервных энергетических
субстанций в виде липидов, крахмала, белков, необходимых для интенсивного роста
клетки и синтеза стенки во время прорастания и роста пыльцевой трубки.
Ультраструктурное строение цитоплазмы вегетативной клетки подтверждает
ее роль как запасающей клетки и клетки, образующей пыльцевую трубку
(Charzynska et al., 1989; Aelst van, Went van, 1991). В цитоплазме зрелой
вегетативной клетки наблюдаются многочисленные митохондрии с хорошо развитыми
кристами, рибосомы, мелкие пузырьки. Сферосомы, диктиосомы, большие
пузырьки встречаются в относительно малом количестве. Цистерны гранулярного
ЭР упакованы в пачки или присутствуют в виде отдельных единиц или пар,
связанных со сферосомами и пластидами. Связанные цистерны ЭР характерны для
зрелых пыльцевых зерен. При прорастании пыльцы цистерны рассеиваются по
цитоплазме. Связи, образуемые цистернами ЭР со сферосомами и пластидами,
являются свидетельством отложения липидов, крахмала. Полирибосомные зоны в
цитоплазме являются местами активного синтеза протеидов, необходимых для
прорастания пыльцы. Соотношение числа мелких пузырьков и присутствие
цистерн гранулярного ЭР, упакованного в пачки, может быть показателем
продолжительности времени, необходимого пыльце для прорастания. Большое число
мелких пузырьков и малое число цистерн ЭР характерно для пыльцы, прорастающей
в течение нескольких минут. Рис. 24.
Батыгина, 1962, 1974, 1987; Волховских, 1965; Герасимова-Навашина, 1951; Поддубная-Арнольди,
1976; Полякова, Подставек, 1960; Полякова, 1961,1963; Резникова, 1984; Романов, 1970а,б; Aelst van,
van Went, 1991; Charzynska et al., 1988; Kichara, Hori, 1966; Knox, 1984; Maheshwari, 1950; Strasburger,
1884.
УЛЬТРАСТРУКТУРА ВЕГЕТАТИВНОЙ КЛЕТКИ
Ультраструктура вегетативной клетки изучена достаточно полно. При
созревании пыльцевого зерна (в период цветения) в ее протопласте еще не наблюдается
крупной центральной вакуоли (Knox, 1984а). Она обычно содержит полный набор
всех основных цитоплазматических компонентов, развитых в той или иной
степени: ЭР, рибосомы, диктиосомы, митохондрии, пластиды (часто с крупными
крахмальными зернами), пузырьки, мелкие вакуоли, липидные капли, белковые
тела, микротрубочки, микрофиламенты и плотную гиалоплазму (Larson, 1965;
Sanger, Jackson, 1971; Jensen et al., 1974; Mogensen, 1986; De Mason, Sekhar, 1988;
Tiwari, 1988). У некоторых видов, в особенности у злаков, значительная часть
цитоплазмы вегетативной клетки заполнена крахмальными зернами и пузырьками,
содержащими предшественники компонентов клеточной оболочки пыльцевой
трубки (Mogensen, Lady man, 1989). В одном пыльцевом зерне риса может
насчитываться свыше миллиона таких пузырьков, занимающих до 30% объема вегета-
94
Генеративные органы цветка
тивной клетки (Heslop-Harrison J., Heslop-Harrison Y., 1982). Эти пузырьки,
независимо от того, сформированы ли они до или после прорастания пыльцы,
являются производными диктиосом и содержат прежде всего пектиновые вещества и
белок. Они играют существенную роль в росте пыльцевой трубки, т.к. их
содержимое включается в клеточную стенку кончика пыльцевой трубки в процессе ее
удлинения, а их мембраны встраиваются в плазмалемму пыльцевой трубки.
Ядро вегетативной клетки обычно более округлой формы (хотя часто бывает и
лопастным), чем ядро генеративной клетки или спермиев; оно и красится слабее.
Обычно оно тесно связано со спермиями, даже охватывая их отчасти и образуя
комплекс, называемый «male germ unit» (Dumas et al., 1984; Mogensen, 1992).
Частота пор ядерной оболочки в вегетативной клетке также более высокая, чем у
ядер генеративной клетки или спермиев (Mepham, Lane, 1969; La Fountain J., La
Fountain K., 1973; Shi et al., 1991). В ядре вегетативной клетки, как полагают, идет
и более активный синтез РНК (Mascarenhas, 1975). Рис. 26.
Brewbaker, 1967; DeMason, Sekhar, 1988; Dumaset al., 1984a; Heslop-Harrisony J., Heslop-Harrisony Y.,
1982; Jensen et al., 1974; Knox, 1984a; Larson, 1965; La Fountain J., La Fountain K., 1973; Mascarenhas,
1975; Mepham, Lane, 1969; Mogensen, 1986, 1992; Mogensen, Ladyman, 1989; Sanger, Jackson, 1971; Shi
etal., 1991;Tiwari, 1988.
СПЕРМИЙ (греч. sperma — семя) — мужская половая клетка, или мужская
гамета. Спермин образуются в результате деления генеративной клетки либо еще
в пыльцевом зерне, либо, после его прорастания, в пыльцевой трубке. Спермин
содержат гаплоидный набор хромосом и характеризуются чрезвычайно
измененными ядерно-цитоплазматическими отношениями. Цитоплазма спермиев
распределена тонким слоем вдоль латеральных сторон ядра и сосредоточена по полюсам
клетки. Хроматин ядра находится в конденсированном состоянии. Ядра мужских
гамет, как правило, лишены ядрышек, хотя известны случаи их наличия (виды
Triticum — Батыгина, 1962, 1987; Plumbago zeylanica — Russell, 1983; Matthiola
bicornis — Тарасенко и др., 1988). У ряда видов ядрышко наблюдается лишь в ядре
незрелых спермиев, в процессе дальнейшего развития оно исчезает (Татинцева,
1973, 1975, 1988). Цитоплазма спермия содержит обычный набор клеточных орга-
нелл — митохондрии с многочисленными кристами, диктиосомы в ассоциации с
пузырьками Гольджи, цистерны ЭР (большей частью гранулярного типа),
рибосомы, липидные капли, микротела и микротрубочки; у отдельных видов отсутствуют
пластиды. Основная роль микротрубочек в протопласте спермиев, как
предполагают, заключается в регуляции формы мужских гамет (Went van, Willemse, 1984).
Размер и форма вакуолей спермия варьируют. Вопрос о структуре пластидома
мужских гамет принадлежит к числу интереснейших и мало разработанных
проблем современной эмбриологии. Существенные различия в структуре мужских и
женских гамет цветковых растений, включая структуру пластидома, стали
результатом их дивергентной эволюции. В отличие от яйцеклетки, в спермиях произошло
значительное сокращение числа пластид, уменьшение их размеров и упрощение
ультраструктуры. Согласно концепции о нескольких типах распределения пластид
в ходе развития пыльцевого зерна и спермиогенеза цветковых растений, спермин
у ряда видов апластидны (Hagemann, 1981; Hagemann, Schroder, 1989, и др.).
Однако, наряду с представлениями о постепенном в историческом аспекте
«физическом исключении» пластид мужских гамет из пластидома растений,
разрабатывается гипотеза «изменения органелл». Она выдвинута на основании данных
генетики (Vaughn, 1981) для объяснения механизмов пластидной наследственности у
высших растений (подробнее см. Жукова, 1993).
Одной из отличительных черт мужских гамет является то, что в ходе
спермиогенеза эти клетки постепенно освобождаются от клеточных оболочек (перед син-
Пыльник
95
гамией и тройным слиянием их протопласт ограничен лишь плазмалеммой).
Спермин, образующиеся в результате деления генеративной (=спермиогенной, по
терминологии Герасимовой-Навашиной, 1951а) клетки, остаются связанными
друг с другом на всем пути их продвижения по пыльцевой трубке к месту контакта
с яйцеклеткой и центральной клеткой. У одних видов спермин связаны общей
клеточной стенкой, у других — связь спермиев осуществляется посредством
выпячиваний их протопластов. Пара спермиев в свою очередь ассоциирована с
вегетативным ядром. Эта ассоциация может быть различной. Связь спермиев
обеспечивается либо посредством одинарного длинного отростка, охватывающего лопастное
вегетативное ядро, либо при помощи нескольких выпячиваний. При этом у одних
видов с вегетативным ядром связан только один из пары спермиев, у других —
оба спермия. Такой комплекс из пары спермиев и вегетативного ядра получил
название «male germ unit». У Helleborus foetidus, однако, подобного комплекса
обнаружить не удалось (Heslop-Harrison et al., 1986). Показано, что у Calanthe vestita,
например, связь между спермиями сохраняется после выхода их из пыльцевой
трубки. Сохранение этой связи предполагают и у Nicotiana rustica, но не только
в период излияния содержимого пыльцевой трубки в синергиду, айв месте
расхождения мужских гамет к яйцеклетке и к центральной клетке. Эта связь,
возможно, обеспечивает одновременный контакт обоих спермиев с женскими гаметами,
что может предотвратить оплодотворение одной из этих клеток двумя спермиями
(Плющ, 1992). Согласно С.Г. Навашину, оба спермия в одной и той же пыльцевой
трубке являются зеркально-подобными (энантиоморфными). У некоторых
представителей Hliaceae, Amaryllidaceae и Tamaricaceae спермин одной пары
различаются размерами, количеством цитоплазмы и объемом ядер (Беляева, 1973).
Разница в размерах спермиев пыльцевого зерна отмечена также и у отдельных
представителей Asteraceae. При этом более крупный спермий всегда
располагается ближе к вегетативному ядру (Barnes, Blackmore, 1987). Имеются некоторые
данные о диморфизме спермиев и у злаков (Batygina, 1974).
На ультраструктурном уровне диморфизм спермиев отмечен как в пыльцевой
трубке, так и в пыльцевом зерне (Russell, 1984; Dumas et al., 1985; Ни, 1990;
Mogensen, 1990b; Southworth, 1990b; Tarasenko, 1990; Zhu etal., 1990b). Спермин
одной пары могут различаться не только формой, размерами, но и содержанием
органелл. Так у спермиев пыльцевого зерна Plumbago zeylanica обнаружены
различия в числе митохондрий, пластид и микротел (Russell, 1984). Не выявлено
гетероморфизма у спермиев пыльцевого зерна Hordeum vulgare (Mogensen, Rusche,
1985), а также пары спермиев пыльцевой трубки Populus deltoides (Rougier et al.,
1991). В отличие от голосеменных у цветковых растений функционируют оба
спермия, осуществляя двойное оплодотворение. Рис. 7(19), 27, 30.
Банникова, 1975; Банникова и др., 1985; Батыгина, 1961, 1962, 1974, 1987; Беляева, 1973; Герасимо-
ва-Навашина, 1951а, 1971; Жукова, 1993; Кордюм, 1978; Коробова, 1959, 1979; Магешвари, 1954;
Навашин, 1911; Навашин, Финн, 1912; Плющ, 1989а, 1992; Поддубная-Арнольди, 1976; Тарасенко и
др., 1988; Татинцева, 1973, 1975, 1988; Тахтадшян, 1978; Финн, 1941; Чеботарь, 1969в, 1972; Barnes,
Blackmore, 1987; Batygina, 1974; Dumas et al., 1985; Gerassimova, 1933; Hagemann, 1981; Hagemann,
Schroder, 1989; Heslop-Harrison et al., 1986; Hoefert, 1969a,b; Hu, 1990; Jensen, Fisher, 1968a,b;
Mogensen, 1990b; Mogensen, Rusche, 1985; Richter-Landmann, 1959; Rougier et al., 1991; Russell, 1983,
1984, 1991; Russell, Cass, 1981; Southworth, 1990b; Steffen, Landmann, 1958; Tarasenko, 1990; Vaughn,
1981; Went van, Willemse, 1984; Whatley, 1982; Zhuet al., 1990b.
ДИМОРФИЗМ СПЕРМИЕВ. Делая обзор литературы по морфологии мужских
гамет, Maheshwari (1950) ссылается на сообщение о том, что ядра спермиев одного
и того же зародышевого мешка в момент их слияния с ядром яйцеклетки и
полярными ядрами различаются своими размерами и формой. В одних случаях ядро
меньшего спермия сливается с ядром яйцеклетки, а в других — с полярными
96
Генеративные органы цветка
ядрами. Поскольку эти наблюдения проводились после сингамии' (слияния гамет),
вполне вероятно, что они справедливы только по отношению к ядрам, а не к
спермиям в целом. Только у одного вида (Vinca minor) Maheshwari (1950)
действительно отметил случай, когда спермин были неравными; один спермий крупнее
другого (Finn, 1928). Maheshwari допускает возможность «незначительных
различий в размере и форме между двумя мужскими гаметами»; однако он приходит к
заключению, что это может быть результатом различий в плоскостях срезов или
несинхронности трансформации мужских ядер в ходе кариогамии (слияния ядер).
Современные исследования структуры спермиев ведутся с помощью таких
технических средств, которые не оставляют никаких сомнений в существовании
неравенства спермиев в паре. Russell (1984) был первым, кто применил технику
реконструкции трехмерной структуры клетки по серийным ультратонким срезам с
помощью компьютера для изучения структуры спермиев. Он обнаружил, что у
Plumbago zeylanica спермий трехклеточного пыльцевого зерна значительно
отличаются друг от друга по своим размерам, форме и составу органелл. Russell назвал
эти клетки «диморфными», указывая на наличие двух форм. С тех пор диморфизм
спермиев продемонстрирован на нескольких видах (см. обзоры Ни, 1990; Roeckel
et al., 1990; Russell, 1991; Mogensen, 1990a, 1992). Была введена дополнительная
терминология для обозначения цитоплазматических различий («цитоплазма-
тическая гетероспермия») и ядерных различий («ядерная гетероспер-
мия») между спермиями, принадлежащими паре (Russell, 1991). Как синоним
термина «диморфизм спермиев» используется также термин «гетероморфизм
спермиев» (Ни, 1990).
Несмотря на то, что диморфизм спермиев более широко распространен, чем
предполагалось ранее, он не обязателен. Применение техники серийных
ультратонких срезов и компьютерных реконструкций показали, что у некоторых видов,
таких как ячмень (Mogensen, Rusche, 1985), петуния (Wagner, Mogensen, 1988) и
люцерна (Zhu et al., 1992), спермий каждой пары «изоморфны» (одинаковы по
форме). В обзорах Ни (1990) и Russell (1991) приводятся списки исследованных до
настоящего времени видов, которые характеризуются диморфными или
изоморфными спермиями. Рис. 28.
Finn, 1928; Ни, 1990; Maheshwari, 1950; Mogensen, 1990a, 1992; Mogensen, Rusche, 1985; Roeckel et al.,
1990; Russell, 1984, 1991; Wagner, Mogensen, 1988; Zhu et al., 1992.
ЦИТОХИМИЯ ПЫЛЬЦЕВОГО ЗЕРНА
Первые удачные попытки использования цитохимических методов для
исследования биохимии и метаболизма клеток развивающегося пыльцевого зерна
относятся к 50-м годам текущего столетия. Уже тогда были получены результаты,
которые показали, что генеративная и вегетативная клетки различаются по
содержанию нуклеиновых кислот и белков и эти различия во многом определяют
специфику метаболического состояния пыльцевого зерна (Swift, 1950; Bryan, 1951;
Woodard, 1958). В дальнейшем, по мере совершенствования методики,
количественная цитохимия становится одной из ведущих в исследовании биохимической
организации пыльцевого зерна цветковых растений.
Цитохимические исследования позволили выявить особенности
количественных изменений ДНК в клетках развивающегося пыльцевого зерна. Удалось
показать, что у всех изученных видов генеративная и вегетативная клетки сразу после
неравного митоза получают равные количества ДНК, соответствующие 1 С. В ходе
По Maheshwari (1950), термин «сингамия» означает слияние спермия с яйцеклеткой.
Пыльник
97
дальнейшего развития наблюдается репликация ДНК в ядре генеративной
клетки, при этом для большинства видов отмечалось относительно раннее вступление
генеративной клетки в S-период. Образующиеся спермий имели гаплоидный
уровень ДНК (1С), однако у некоторых видов в ядрах спермиев происходит
дальнейший рост содержания ДНК, обусловливающий их пребывание в S-периоде, или
приводящий к удвоению ее количества.
Вопрос о количественных изменениях ДНК в ядре вегетативной клетки
развивающегося пыльцевого зерна и на сегодняшний день не решен однозначно. У
одних видов синтез ДНК в ядре вегетативной клетки не был обнаружен, у других
наличие такого синтеза подтверждено экспериментально (Банникова и др., 1985;
Gorska-Brylass, 1986).
Попытаемся проследить некоторые из описанных закономерностей на
конкретных примерах. Для цитохимического выявления ДНК в пыльцевых зернах лилии
(Lilium candidum) и кориандра (Coriandrum sativum) использовалась окраска
препаратов по Фельгену, а в пыльцевых зернах шалфея {Salvia sclarea) и лаванды
{Lavandula angustifolia) — окраска оливомицином. У всех изучаемых видов
растений обнаруживается репликация ДНК в ядре генеративной клетки. У видов с трех-
клеточной пыльцой (шалфей, лаванда, кориандр) деление генеративной клетки
приводит к образованию спермиев. В пыльцевых зернах шалфея и лаванды
спермин сразу после своего образования содержат количество ДНК, превышающее 1 С,
что, вероятно, связано с сильным укорочением или даже выпадением периода G1
и быстрым вступлением в S-период. В зрелых пыльцевых зернах, в день
раскрытия пыльника, содержание ДНК в спермиях находится на уровне 2С. Синтез ДНК
в спермиях пыльцевого зерна кориандра не обнаруживается и ее содержание
сохраняется на уровне 1 С.
Характер количественных изменений ДНК в ядре вегетативной клетки имеет
некоторые видовые особенности. У лилии синтез ДНК в ядре вегетативной клетки
смещен к конечным этапам развития и приводит практически к удвоению ее
содержания. В пыльцевых зернах шалфея и лаванды синтез ДНК в ядре
вегетативной клетки не обнаруживается. У кориандра вступление вегетативной клетки в
S-период наблюдается уже на ранних стадиях развития пыльцевого зерна. В
зрелом трехклеточном пыльцевом зерне содержание ДНК в ядре вегетативной клетки
на уровне 1,7С. Факт незавершенного синтеза ДНК в вегетативной клетке
пыльцевого зерна представляется особенно интересным. Дополнительные
исследования показали, что увеличение содержания ДНК до 1,7С есть результат
неравномерного синтеза в пределах популяции пыльцевых зерен. Большая часть этой
популяции содержит в ядре вегетативной клетки зрелого пыльцевого зерна 1С ДНК,
а меньшая — 2С. Установленный факт не является новым, однако представляет
несомненный интерес, поскольку до настоящего времени был экспериментально
показан только для одного вида Hippeastrum belladonna (Pipkin, Larson, 1973).
Уже в относительно ранних цитохимических исследованиях была предпринята
попытка дать характеристику не только количественных изменений ДНК в
клетках пыльцевого зерна, но и гистонов — основных белков, связанных с ДНК в
составе хроматина (Rasch, Woodard, 1959; Jalouzot, 1969). Эти исследования
выявили различную степень окрашивания ядерных гистонов генеративной и
вегетативной клеток и стимулировали дальнейшие исследования этих белков не только
цитохимическими, но и биохимическими методами. Удалось показать, что
генеративные ядра содержат лизин- и аргинин-богатые гистоны, тогда как вегетативные
— только аргинин-богатые гистоны (Sheridan, 1973). Особый интерес
представляет обнаружение в пыльцевых зернах добавочной фракции, так называемого мей-
отического гистона — НМ. Эта фракция синтезируется в профазе I мейоза, а после
неравного митоза сохраняется в генеративном ядре. Биохимические исследования
7 Генеративные органы цветка.
gg Генеративные органы цветка
последних лет показали, что ядра генеративной и вегетативной клеток
пыльцевого зерна содержат пять основных фракций гистонов: Hi, Н2А, Н2В, НЗ и Н4.
Однако в вегетативных ядрах, характеризующихся диффузным состоянием
хроматина, содержится меньше белка фракций HI и НЗ, а белка фракции Н4 — больше
(Таймлаидр., 1984).
Динамика количественных изменений гистона в ядрах генеративной и
вегетативной клеток пыльцевого зерна сходна с динамикой содержания ДНК. Обэтом
наглядно свидетельствуют результаты цитохимического анализа гистона
(окраска прочным зеленым) в ядрах обеих клеток в процессе развития пыльцевого
зерна лилии. В отличие от гистона, содержание негистоновых белков хроматина,
выявляемых также с помощью прочного зеленого, постепенно снижается как в ядре
генеративной, так и вегетативной клеток. Не останавливаясь подробно на
функциональной роли этих белков отметим, что снижение их содержания в клетках
развивающегося пыльцевого зерна может приводить к усилению связи ДНК — ги-
стон и оказывать влияние на метаболическую активность хроматина.
В процессе развития пыльцевого зерна происходит синтез РНК и общих белков.
Высокий уровень содержания РНК в ядре и цитоплазме вегетативной клетки, а
также в ядре генеративной обнаруживается уже в молодом двуклеточном
пыльцевом зерне (Woodard, 1958; Jalouzot, 1969; Резникова, 1984; Хведынич, Петрик,
1986). В ходе дальнейшего развития количество РНК в цитоплазме обеих клеток
увеличивается, при этом в цитоплазме вегетативной клетки наблюдается
активизация ее синтеза накануне раскрывания пыльника. Результаты количественного
анализа РНК в генеративной и вегетативной клетках развивающегося пыльцевого
зерна лилии (окраска комплексом галлоцианин — хромовые квасцы) показала,
что уже на начальных стадиях развития пыльцевого зерна обнаруживается более
высокий уровень РНК в ядрышке вегетативной клетки. В ходе дальнейшего
развития содержание РНК в ядрышках обеих клеток постепенно возрастает, а затем
понижается. Количество РНК в хроматине ядра также обнаруживает тенденцию к
возрастанию вплоть до конечных стадий развития. И только в день раскрывания
пыльника содержание РНК в хроматине ядра генеративной клетки резко падает.
Количество РНК в цитоплазме генеративной и вегетативной клеток
увеличивается на начальных стадиях развития двуклеточного пыльцевого зерна. В ходе
дальнейшего развития ее содержание в цитоплазме генеративной клетки остается
на определенном уровне, в то время как в цитоплазме вегетативной клетки
количество РНК продолжает увеличиваться. При этом на протяжении всего процесса
развития пыльцевого зерна лилии содержание РНК в цитоплазме вегетативной
клетки существенно превосходит ее содержание в цитоплазме генеративной.
Вопрос о функциональной активности клеток пыльцевого зерна в литературе
поднимается сравнительно давно. Считают, что генеративная клетка в силу своей
специфической роли в его развитии сохраняет способность к синтезу нуклеиновых
кислот и белков, в то время как вегетативная отличается пониженным
метаболизмом (Волховских, 1965). Другие исследователи характеризуют вегетативную
клетку как метаболически активную, сходную по своему физиологическому
состоянию с клетками меристематического типа (Jalouzot, 1969). Вместе с тем, на наш
взгляд, не правомерно ставить вопрос о том, какая из клеток пыльцевого зерна
более функционально активна. Каждой из клеток пыльцевого зерна свойственно
совершенно особое метаболическое состояние. Так, например, у лилии
сопоставление функциональной активности вегетативной клетки, длительное время
сохраняющей гаплоидный уровень ДНК, с генеративной, относительно быстро
вступающей в S-период и имеющей затем вдвое большее количество ДНК,
представляется задачей не такой простой, как это может показаться на первый взгляд.
Высокая функциональная активность вегетативной клетки проявляется в увели-
Пыльник
99
ченном объеме ядра, повышенном содержании РНК в ядре и цитоплазме. При этом
ядро вегетативной клетки на единицу ДНК содержит больше негистоновых
белков. Метаболизм генеративной клетки поддерживается на уровне, необходимом
для осуществления процесса репликации на начальных стадиях развития
пыльцевого зерна, а также для осуществления последующего митоза, приводящего к
образованию спермиев во время роста пыльцевой трубки. Рис. 29.
Банникова и др., 1985; Волховских, 1965; Резникова, 1984; Таймла и др., 1984; Хведынич, Петрик,
1986; Bryan, 1951; Gorska-Brylassetal., 1986; Jalouzot, 1969; Pipkin, Larson, 1973; Rash, Woodard, 1959;
Sheridan, 1973; Swift, 1950; Woodard, 1958.
ДВИЖЕНИЕ ЯДРА И КЛЕТОК
В РАЗВИВАЮЩЕМСЯ ПЫЛЬЦЕВОМ ЗЕРНЕ
При изучении процесса развития пыльцевых зерен цветковых растений,
исследователи сталкиваются с интересным явлением — движением ядра в микроспоре,
клеток и ядра в пыльцевом зерне. Особый интерес представляет феномен
перемещения генеративной клетки в вегетативной клетке пыльцевого зерна. Злаки в этом
отношении заслуживают специального внимания в силу ряда особенностей
развития и строения пыльника, микроспор и пыльцевых зерен. Характерная форма мик-
роспороцитов (близкая к эллипсоиду) определяет тангентальную ориентацию
веретен при обоих делениях, которая, в свою очередь, приводит к однослойному
расположению всех микроспор и пыльцевых зерен, обращенных порами в сторону
тапетума. В микроспороцитах, клетках диад и тетрад в виде гребней образуются
утолщенные каллозные оболочки, направленные в полость микроспорангия.
(Drahowzal, 1936; Carniel, 1961; Романов, 1970а,б; Батыгина, 1974).
Известно, что на определенном этапе развития микроспоры (фаза слабоваку-
олизированной микроспоры) ее ядро перемещается из центра клетки к клеточной
оболочке, располагаясь против поры прорастания (Батыгина, 1962а,б, 1987;
Kichara, Hon, 1966; Романов, 1966). За этим следует процесс вакуолизации
микроспоры. После дифференцирующего деления микроспоры (фаза сильновакуоли-
зированной микроспоры), ведущего к образованию двуклеточного пыльцевого
зерна, ядро вегетативной клетки перемещается по направлению к апертуре во
«внешний» район пыльцевого зерна. В конце концов оно оказывается
расположенным под порой прорастания и в непосредственной близости от нее.
В развитии пыльцевого зерна наступает фаза девакуолизации, во время
которой происходит дальнейшее перемещение генеративной клетки и вегетативного
ядра. Фаза движения генеративной клетки в район поры, где в этот момент
находится ядро вегетативной клетки, начинается с ее округления и «отделения» от
оболочки пыльцевого зерна. Затем по мере усиления синтеза цитоплазмы в
вегетативной клетке, вакуоль постепенно уменьшается, хотя полностью не исчезает.
Далее наступает новая фаза в развитии пыльцевого зерна, во время которой вновь
происходит удлинение генеративной клетки. Последняя отходит от вегетативного
ядра, все еще располагаясь в широком пристенном слое цитоплазмы вегетативной
клетки. Постепенно ядро вегетативной клетки, как и сама генеративная клетка,
перемещается глубже — внутрь протоплазмы вегетативной клетки. Движение
клеток и ядер, согласно Романову (1970а,б), совершается пассивно.
В период деления генеративной клетки и образования двух спермиев-клеток,
происходит уменьшение окрашиваемое™ ядра вегетативной клетки, постепенно
исчезают его сильно вакуолизированные ядрышки, само ядро становится
лопастным. В это же время происходят изменения положения спермиев, а также их
формы и строения. Форма спермиев с момента их образования в пыльцевом зерне до
попадания в пыльцевую трубку и в зародышевый мешок значительно изменяется.
т
100 Генеративные органы цветка
Имеются некоторые данные о диморфизме спермиев у злаков (Батыгина, 1974;
Mogensen, Rusche, 1985). Ко времени образования зрелого пыльцевого зерна,
спермин и ядро вегетативной клетки чаще всего располагаются рядом, но
положение их в пыльцевом зерне по отношению к поре может быть различно. Зрелое
пыльцевое зерно злаков, в частности пшеницы, трехклеточное, имеет два
вытянутых в длину спермия, с ясно различимыми концами: одним тупым, другим
заостренным (Батыгина, 1961, 1962а,б; Chu, Ни, 1981). Таким образом, в процессе
развития пыльцевого зерна ядро вегетативной клетки, генеративная клетка и
спермин неоднократно меняют свое положение по отношению к поре.
Отметим ряд специфических особенностей в развитии пыльцевого зерна
злаков, возможно, имеющих отношение к перемещению в нем ядер и
клеток. К ним можно отнести: разнообразное положение фигуры деления в
микроспоре (обычно фигуры деления в микроспоре располагаются
асимметрично), неодновременное образование клеточной стенки между генеративной
и вегетативной клетками, состоящей, главным образом, из каллозы, и
кратковременность ее существования, которая, вероятно, приводит к тому, что
генеративная клетка окружена двумя плазмалеммами — своей и плазмалем-
мой вегетативной клетки. Сходное развитие микроспоры и пыльцевых зерен
в настоящее время, наблюдается у всех изученных в эмбриологическом
отношении злаков. Поэтому это явление можно считать закономерным и
характерным для всего сем. Роасеае.
Движение ядер в процессе жизнедеятельности клеток характерно не только для
развивающихся микроспор и пыльцевых зерен. Общеизвестно движение ядра
вегетативной клетки и клеток-спермиев при росте пыльцевых трубок. Хорошо
известны перемещения ядер к противоположным полюсам зародышевого мешка
покрытосеменных (например, Polygonum-тип развития) на разных стадиях его
развития, а в зрелом зародышевом мешке — смещение ядер синергид в базальный
район этих клеток, ядра яйцеклетки — в апикальный ее район. Закономерное
перемещение ядер также отмечается в мегаспороцитах и при формировании
женского гаметофита у представителей различных таксонов, имеющих и другие типы
развития зародышевого мешка. Интересны перемещения ядер в эндосперме у
Neottia nidus-avis, в гаусториальных клетках эндосперма Latraea squamaria, в
зародыше Pyrola rotundifolia (Терехин и др., 1971). Показано перемещение ядра
при развитии клеток эпидермиса гипокотиля льна: на определенном этапе
развития ядро «покидает» пристенное положение, характерное для клеток эпидермиса
в покоящемся состоянии, и перемещается в центр клетки (Навашин, Макушенко,
1956). Изучено перемещение ядра в онтогенезе устьичной клетки Tradescantia
virginiana (Tarkowska et al., 1987). Движение ядер характерно и для клеток
животных организмов. Так, смещение ядер отчетливо наблюдается в клетках,
продуцирующих эмаль формирующегося зуба: вначале ядро расположено вблизи
поверхности клетки, а когда в клетках появляется эмаль, происходит смещение ядра
вглубь цитоплазмы (Алов и др., 1969). Можно было бы привести еще множество
примеров. Таким образом, перемещение ядер, также как и клеток в ходе
жизнедеятельности клеток следует рассматривать как общебиологическое явление.
Движение и перемещение гамет и органелл предположительно является одной
из функций цитоскелета клетки (микротрубочек и микрофиламентов) (Heslop-
Harrison, 1987; Heslop-Harrison J., Heslop-Harrison Y., 1989; Pierson et al., 1989).
Фибриллярный аппарат выявлен в цитоплазме генеративной клетки Haemanthus
katherinae (Sanger, Jackson, 1971), Petunia hybrida (Cresti et al., 1976) и ряда
других растений (Tiezzi et al., 1988). Присутствие миозина и кинезина обнаружено в
цитоплазме вегетативной клетки табака (Moscatelli et al., 1988). Однако в целом
этот интереснейший вопрос пока еще остается открытым. Рис. 30.
Пыльник
101
Алов и др., 1969; Батыгина, 1961, 1962а,б, 1974, 1987; Навашин, Макушенко, 1956; Романов, 1966,
1970а,б; Терехин и др., 1971; Carniel, 1961; Chu, Hu, 1981; Cresti et al., 1976; Ни Shi-yi et al., 1981;
Drahowzal, 1936; Heslop-Harrison, 1987; Heslop-Harrison J., Heslop-Harrison Y., 1989; Kichara, Hori,
1966; Mogensen, Rusche, 1985; Moscatelli et al., 1988; Pierson et al., 1989; Russell, Huang, 1994; Sanger,
Jackson, 1971; Tarkowska etal., 1987; Tiezzi et al., 1988.
МОРФОФУНКЦИОНАЛЬНЫЙ СТАТУС ГАМЕТОГЕНЕЗА
МОРФОФУНКЦИОНАЛЬНЫЙ СТАТУС ГАМЕТОГЕНЕЗА —
совокупность морфофункциональных и филогенетических закономерностей обособления
мужского и женского гаметофитов цветковых растений, начиная с инициации и
кончая дифференциацией гамет (Чеботарь, 1983; Chebotaru, 1985). Морфофунк-
циональный статус раскрывает наследственно закрепленные проявления
структуры и функции, на которых зиждется гаметная селективность, эмбриональная
детерминация, адаптация и устойчивость популяций. На основании светооптиче-
ских и электронномикроскопических исследований гаметогенеза было сделано
заключение об особом, принципиальном значении взаимосвязей в системе:
материнский организм — спорогенная ткань — половые клетки — зигота — зародыш —
семя (Чеботарь, 1960, 1972, 1983; Chebotaru, 1968, 1978, 1985).
Основными принципами морфофункционального статуса гаметогенеза
являются:
а — принцип отсеивания (аббревиации) археспориальных, спорогенных и
гаметных образований, названных нами генетически неполноценными. Появление
и деструкция последних прослеживается на всем пути мейотического и
последующих делений гаплоструктур в макроспорогенезе, микроспорогенезе, гаметогенезе,
зиготогенезе и эмбриогенезе, где наряду с гаметообразованием закономерно
отсеиваются сестринские или латеральные новообразования. В гаметогенезе гибридного
потомства имеет место и постоянное выбрасывание (рассеивание) в цитоплазму
хроматинового (ядерного) материала. Аббревиация (термин Северцева, 1939)
гаплоструктур происходит с большой точностью из поколения в поколение, синхронно
с процессом образования полноценных гамет. Принцип аббревиации
прослеживается у абсолютного большинства эукариот и выступает не как трофическая
неизбежность дифференциации и сексуализации, но как своеобразное эволюционное
«решето» естественного отбора на «клеточном», предгаметном и гаметном уровнях.
В данном процессе просматривается генетически закрепленный путь
детерминации и элиминации отработанных «шлаков» (в понимании Гольдшмита, 1923).
Таким образом, принцип аббревиации генетически неполноценных образований
показывает, что определенная часть структур, сформировавшихся в результате мей-
оза и последующих делений гаплоидных клеток, разными путями закономерно
элиминирует, исчезая в сложной трофической цепи. Гаметогенез, являющийся
этапом онтогенеза, мы рассматриваем как своеобразное эволюционное «решето».
б — принцип эквипотенциальности гаметных образований (экви-оди-
наковый, равнозначный), прослеживаемый на примере прямых и обратных внут-
рипопуляционных, внутри- и межвидовых скрещиваний. Генетическая равнопо-
тенциальность мужских и женских гамет, на которую указывают многие авторы
(Мюнтцинг, 1967; Инге-Вечтомов, 1989 и др.), подтверждается
эмбриологическими исследованиями и работами в области биотехнологии (Бутенко, 1970; Batygina,
1992). Имеющиеся структурные отличия относятся главным образом к ядерно-
плазменным соотношениям, морфофизиологическому состоянию пластидома и
хондриома (Чеботарь, 1972, 1985; Бхандари, 1990).
Эквипотенциальность мужских и женских гамет как основных носителей груза
генотипической специфичности, закладывается в гаметогенезе и реализуется в
•j 02 Генеративные органы цветка
процессе оплодотворения и эмбриогенеза. При этом надежно обеспечивается
преемственность поколений за счет постоянных мейотических рекомбинаций,
канализируемых панмиксией.
в — принцип энантиоморфизма в гаметогенезе, описанный на примере
мужских гамет, носит также общебиологический характер и обеспечивает
избирательную взаимоассимиляцию гамет в ходе сингамии. Допустив энантиоморфность
природы сестринских спермиев клеток, С. Г. Навашин (1951а) обосновал темта-
мым механику биологической активности и избирательного самодвижения
мужских гамет в ходе оплодотворения. Энантиоморфные различия допускаются и в
отношении женских гамет к сестринским структурам (яйцеклетка — полярное ядро
центральной клетки зародышевого мешка), хотя различия еще больше
проявляются в процессе постмейотической дифференциации. Здесь особая роль отведена ци-
топлазматическому компоненту. С точки зрения выдвигаемого принципа можно
полагать, что стратегия сингамии как общебиологического явления основывается на
энантиоморфном синергизме, т. е. на взаимоассимиляции зеркальноподобных
образований. Синергизм поддерживает морфогенетический гомеостаз, который
канализирует адаптивную изменчивость спорогаметофитов в фило- и онтогенезе.
Самым главным в морфофизиологическом статусе гаметогенеза является
реально действующий отбор на предгаметном и гаметном уровнях, который состоит
не в замещении аллели, а в дифференциации и формировании эквипотенциальной
реакции (Шишкин, 1984), т. е. подборе адаптивных половых клеток,
вписывающихся в амплитуду изменчивости генотипа, за пределами которою гаметы либо
элиминируют, либо дают абортивные зародыши.
Морфофункциональный статус показывает также, что половые клетки
возникают как элементы целостной системы. Определение морфофункционального статуса
гаметогенеза позволяет проследить истоки биоэкологической целесообразности,
адаптивной нормы реакции в понимании Шмальгаузена (1940) и других важных
закономерностей полового воспроизводства. В гаметогенезе прослеживается закон
гомологичных рядов в наследственной изменчивости Н. И. Вавилова.
В целом гаметогенез высших растений следует рассматривать как
своеобразный, не до конца познанный «ботанический алфавит», которым написан
эволюционный путь биологического прошлого нашей планеты. Если горные
образования напоминают о прошлом нашей планеты окаменелым молчанием, то цветковые
растения это делают своим постоянным онтогенетическим обновлением.
Возникшие однажды в геологическом прошлом на диплоидном спорофите гаметы
повторяют в бесчисленных поколениях себе подобных посредством гаметогенеза.
Бутенко, 1970; Бхандари, 1990; Гольдшмидт, 1923; Инге-Вечтомов, 1989; Навашин, 1951; Поддубная-
Арнольди, 1982; Сабинин, 1963; Северцов, 1939; Чеботарь, 1960, 1972; 1983; Шишкин, 1984; Шмаль-
гаузен, 1940; Batygina, 1992; Chebotaru, 1968,1978,1985; Willemse, 1972.
ПОЛЛИНИЙ (лат. pollinium — пыльцевой комочек) — совокупность пыльцевых
зерен, объединенных общей оболочкой, либо особым клейким веществом.
Синонимы: массула1, сложная пыльца.
У цветковых растений встречаются пыльцевые образования от простых — в
виде диад (Scheuchzeriaceae), тетрад (Empetraceae, Epacridaceae, Juncaceae,
Droseraceae, Philydraceae, Typhaceae, Velloziaceae, Sapindaceae), полиад
(Mimosaceae) до более сложных — в виде поллиниев. Поллинии обнаружены
только в двух семействах цветковых: у подавляющего большинства однотычинко-
' Под термином массула понимаются также микроспоры разноспоровых папоротников,
объединенных в небольшие комочки (Куприянова, Алешина, 1967). У некоторых архидных
поллинии разделены на массулы (Dressier, 1993).
Пыльник
103
вых орхидей (сем. Orchidaceae подсем. Orchidoideae) и у представителей ластов-
невых {Asclepiadaceae). •
Число поллиниев в пыльнике может варьировать от 2 до 8. Поллинии
различаются по форме (шаровидные, яйцевидные, обратнояйцевидные, эллиптические,
продолговатые, вальковатые, сплющенные, подковообразные, цилиндрические,
клиновидные, широкотреугольные, цельные, расчлененные), по консистенции
(гранулированные, мучнистые, восковые или твердые). Эти признаки имеют
систематическую значимость.
На поллиниях образуются особые структуры из клейкого вещества (эластовис-
цина), обеспечивающие слипание поллиниев и служащие приспособлениями для
их переноса насекомыми при опылении. У орхидных эти структуры представлены
ножкой (каудикулой) и прилипальцем (висцидием). Такой поллиний,
снабженный приспособлениями для переноса насекомыми, часто называют поллинарием.
У ластовневых структуры, обеспечивающие перенос поллиниев представлены
транслятором, состоящим из зажимного срединного тельца или «корпускулы»,
от которой отходит пара ножек, прикрепляющихся к поллиниям правого и левого
гнезд двух соседних пыльников. Транслятор может нести 2—4 поллиния, если все
гнезда пыльника развиты.
Клейкое вещество, участвующее в образовании поллиниев и названное эласто-
висцином, сходно по своему химическому составу, времени и месту синтеза и
функции с полленкитом (Schill, Wolter, 1986). Эластовисцин, как и полленкит,
является продуктом секреции клеток тапетума. У ряда орхидных в тапетальном слое
имеются отдельные группы клеток с толстыми трахеидальными утолщениями.
Они специализированы на синтезе эластовисцина в местах формирования ранее
описанных особых структур на поллиниях (Wolter et al., 1988).
Формирование поллиниев в пыльниках орхидных может наблюдаться на очень
ранних стадиях. Так, у Peristylus spiranth.es четко различимы образования,
состоящие из нескольких спорогенных клеток, окруженные более толстой общей
оболочкой (Zee, Siu, 1990). Перед мейозом эти образования, состоящие уже из
микроспороцитов, окружены толстой каллозной оболочкой. Каллоза обнаруживается
и за плазмалеммой каждого микроспороцита. Для каждого поллиния характерна
строгая синхронность клеточных делений, что осуществляется благодаря хорошо
развитым цитоплазматическим связям между его клетками. Такие связи
отсутствуют между поллиниями одного и того же пыльника. При образовании тетрад
отложения каллозы на поверхностях плазмалемм микроспор не происходит,
отдельные цитоплазматические связи наблюдаются между микроспорами.
Сформированные поллинии у большинства исследованных представителей
имеют бесструктурную оболочку, которая, согласно данным сканирующей
электронной микроскопии, значительно толще стенок пыльцевых зерен, входящих в
поллиний. Пыльцевые зерна в поллиниях потеряли способность образовывать
собственную экзину, что связано с подавлением отложения каллозы либо вокруг
микроспороцитов и между микроспорами в тетраде {Asclepiadaceae), либо вокруг
внутренних тетрад и между микроспорами (Orchidaceae). В тех случаях, когда
наблюдается отложение каллозы вокруг микроспороцитов в поллиниях происходит
образование экзины. Так, у Peristylus spiranthes в поллинии описано
формирование экзины трех типов, различающихся по степени сложности структуры (Zee,
Siu, 1990). Экзина первого типа, представляющая собой внешнюю оболочку
наружных тетрад, состоит из тектума, бакул и нэкзины. Экзина второго типа,
наблюдаемая на внутренних стенках тетрад, имеет слабо развитые тектум и бакулы
и более тонкую нэкзину. Экзина третьего типа, встречающаяся на стенках
пыльцевых зерен внутри тетрад, развита еще слабее и состоит только из мелких сфе-
!рических тел. У орхидных образование интины в пыльцевых зернах происходит
104 Генеративные органы цветка
несколько иным путем, чем у других покрытосеменных. Интина орхидей
двуслойная: наружный слой, обозначенный как эктоинтина, более темный, внутренний,
эндоинтина, более светлый.
Оболочка поллиния у ластовневых анатомически и морфологически
дифференцирована (Galil, Zeroni, 1969; Sreedivi, Namboodiri, 1982). Она состоит из веществ
спорополлениновой природы, ацетолизоустойчива, за исключением участка, где
происходит прорастание пыльцевых трубок, именуемого бороздой прорастания.
Положение борозды прорастания четко определено для каждого из 14 родов
ластовневых. У ряда родов (Huernia, Gerapegia) борозда прорастания различима на
необработанных, непроросших поллиниях. Она представлена мембраной с
перфорациями, имеющими различные размеры, форму и положение, которая после ацетолиза
выявляется в виде узкого прерывистого щелевидного отверстия, размеры которого
варьируют от 40 мкм (Stapelia) до 500 мкм (Calotropis). Рост пыльцевых трубок в
поллинии наблюдается в направлении зон проницаемости. Такой зоной
проницаемости является сама борозда прорастания или любое искусственно образованное
отверстие в стенке поллиния.
Соединение пыльцевых зерен в поллинии у цветковых растений считается
продвинутым признаком, проявлением неотении в развитии пыльцы, которое
можно интерпретировать как большую экономию материала и времени
(Favre-Duchartre, 1984). При этом происходит выпадение отдельных стадий
в развитии пыльцы, таких как подавление отложения каллозы, образования
экзины и пор в пыльцевых зернах. В поллиниях число нефункционирующих
пыльцевых зерен невелико. Рис. 31. *
Favre-Duchartre, 1984; Galil, Zeroni, 1969; Linkens, Suren, 1969; Pacini, 1990; Schill, Wolter, 1986;
Sreedevi, Namboodiri, 1982; Vijayaraghavan, Shukla, 1976, 1977; Wolter et al., 1988; Zee, Siu, 1990;
Dressier, 1993.
ЭВОЛЮЦИЯ МУЖСКОГО ГАМЕТОФИТА
Вопрос о природе мужского гаметофита покрытосеменных продолжает
оставаться дискуссионным. Проросшая микроспора покрытосеменного — пыльцевое
зерно с его двумя делениями более сходно по своему внешнему виду с пыльцевыми
зернами предшествующих форм (папоротникообразных, голосеменных) с их
тремя—пятью делениями, и поэтому гомологизация здесь на первый взгляд кажется
более простой и ясной, и можно было бы думать, что в современной морфологии
уже существует общепринятое мнение насчет природы мужского гаметофита.
Однако это не так.
Так из двух клеток мужского гаметофита Мейер (1953) считает большую за
антеридий, а Модилевский (1953), наоборот, меньшую клетку считает антеридиаль-
ной. В то же время Battaglia (1951) все пыльцевое зерно до образования в нем спер-
миев считает за сильно редуцированный антеридий; американские авторы
(например, Chamberlain, 1935) вовсе не усматривают элементов антеридия в
пыльцевом зерне. Таким образом, в литературе до сих пор отсутствует
необходимая ясность в этом вопросе.
Для понимания природы пыльцевого зерна покрытосеменных в первую очередь
необходим подход с позиций теории развития на цитологической основе.
Чрезвычайно интересны детали процесса образования спермиогенной («генеративной»)
клетки покрытосеменных; при сопоставлении их с соответствующими деталями
процесса образования проталлиальных клеток хвойных, можно уяснить себе ряд
моментов, существенных для понимания превращения микроспоры в пыльцевое
зерно.
У покрытосеменных, как известно (Geitler, 1935; Герасимова-Навашина,
1951а, б), благодаря сильной вакуолизации микроспоры к моменту ее прораста-
Пыльник
105
ния, которая совпадает с распадом в это время тапетального слоя в пыльнике (и,
возможно, является источником накопления большого количества клеточного
сока), первое деление проходит в пристенном слое протопласта; это обстоятельство
обусловливает дифференциальное деление, т. е. образуется двухклеточный гаме-
тофит, состоящий из маленькой пристенной и большой, сильно вакуолизирован-
ной, клеток. Вскоре в большой клетке начинается синтез новой цитоплазмы,
вакуоль в ней заполняется цитоплазмой, а малая клетка, будучи окружена лишь
кожистым слоем, как бы «подмываясь» цитоплазмой большой клетки, включается
в нее, образуя вместе с ней общую систему пыльцевого зерна. В дальнейшем эти
две клетки гаметофита как бы разделяют между собой необходимые для
оплодотворения функции: меньшая становится спермиогенной и, делясь еще раз, дает два
спермия, а большая переходит на путь синтеза веществ, необходимых для роста
и развития в дальнейшем пыльцевой трубки, т. е. становится сифоногенной
клеткой. Надо отметить, что у покрытосеменных к моменту первого деления в
пыльцевом зерне уже сформированы оболочки пыльцевого зерна (экзина и интина). У
голосеменных, например у Larix dahurica (Герасимова-Навашина, 1954а, б), к
моменту первого деления в пыльцевом зерне создаются условия, сходные с
существующими у покрытосеменных; тут же происходит распад тапетального слоя, в
связи с чем микроспора сильно вакуолизируется; протопласт вместе с фигурой
деления смещается в одну сторону, в силу чего и происходит отделение к стенке, как
и у покрытосеменных, маленькой линзовидной клеточки. Однако дальнейшая
судьба ее иная. В это время в пыльцевом зерне происходит образование
внутреннего целлюлозного слоя, который и отделяет эту клетку от всей системы
пыльцевого зерна. Будучи, таким образом, выключенной из системы пыльцевого зерна,
и не получив достаточного количества собственной цитоплазмы, эта клетка
гаметофита — первая проталлиальная — гибнет.
Такая же участь постигает и вторую клетку, образовавшуюся в сходных
условиях, в результате второго деления в гаметофите. Она также выключается из общей
системы пыльцевого зерна и, за неимением достаточного количества собственной
цитоплазмы для поддержания жизнедеятельности, также вскоре гибнет.
Лишь к моменту третьего деления гаметофита в нем создаются условия,
которые обеспечивают вновь образовавшейся клетке — антеридиальной —
возможность дальнейшего развития. Пыльцевое зерно становится теперь менее вакуоли-
зированным, так как в пыльнике создаются условия для синтеза цитоплазмы —
роста пыльцевого зерна; к этому моменту обычно заканчивается образование
целлюлозных оболочек, и поэтому вновь образовавшаяся клетка не выключается из
системы пыльцевого зерна, а продолжает свое развитие. Эта антеридиальная
клетка делится еще раз, находясь уже посередине пыльцевого зерна, и дает нож-
ковую (или базальную) и спермиогенную клетки. Апикальная клетка после
отделения антеридиальной становится клеткой, дающей пыльцевую трубку
(сифоногенной) .
Таким образом, определение условия обмена веществ и обстановка развития
определяют дальнейшую судьбу (дифференцировку) клетки; что это так, видно из
некоторых случаев аномалий.
Так, если ветки Larix da/шпса/которая, как известно, готовится к цветению в
конце зимы, т. е. при очень низких температурах, внести в помещение и, через
некоторое время зафиксировать, то в развитии микроспор обнаружится очень
много аномалий, анализ которых помогает вскрыть причины нормальной дифферен-
цировки.
Достаточно сместиться во времени друг относительно друга всего двум
факторам развития, а именно вакуолизации и началу образования целлюлозных
оболочек, как результаты станут иными.
I
о
о
1
I
3
I
^
w.
я а
< ,
S от
S н
с <и
Si
w ^
СИ а*
I!
!I
II
3?
s^
QJ QJ
Л) qj Qj QJ
alp
ii
II
SI
ш 5
6«
s
<u
о
X,
и
н
S
X
и
д
•Н-
0>
от
от
е
К
Пыльник . г.-;
™ J ' ПРИ обРазовании проталлиальной клетки синтез оболочек уже
закончится, то она не выключится из системы пыльцевого зерна и не погибнеТ
Ьсли при своем первом и втором делениях пыльцевое зерно будет менее ваку
олизировано, то проталлиальные клетки получат большее ^ли^ествГцГтоплав
ПхгГДа ВП°ЛНе ДОС™точное не только для существования, но и дГя деления
nv ™ Д ЯСН°' ЧТ° ГИбеЛЬ пР°таллиальных клеток обусловлена не какими-либо
их имманентными свойствами, а лишь теми условиями, в которые ониТпадают
в ходе развития данного пыльника. Жизнедеятельность клетки ^усло^ена толТ
1^ЖХ5ЕГклетка'конечно'не несет в себе — Ж S£
покрытосеменных образуются две одинаковые клетки, или два одинаковых ядоа
и возникает нефункционирующая в дальнейшем система одинаковых ядра
хаким образом, анализируя ход развития, мы видим, что у покрытосеменных
первая же клетка гаметофита получает способность стать спермиогйной Те н"-
лийГиРаНЬ^' Ч6М У голосеменны*> образуется антеридиаль^ГЛетка (антери
дни), и, наоборот, у голосеменных первые клетки гаметофита (проталлиальные
Z^'^ZZ'T^ °Т ПрИВХадяш»х обстоятельств обусл^Гх ходом
развития пыльника. Поэтому спермиогенную клетку покрытосеменных можно го-
ГболТеХВчемТумЬоКОпС °ДИ* ™ ДВУ* П6РВЫХ КЛ6™ Софита голосеменнь1х
и оолее ни с чем. Умозрительные же попытки формальной гомологизапии только
мешают нам понять природу пыльцевого зернаТ и поэтому eci££3^S
приходят в столкновение с действительностью. естественно, что они
Необходимо высказать еще некоторые соображения в связи с обсуждением ппи
роды пыльцевого зерна покрытосеменных, исходя из сравнения хадГоаТви?ия
пыльцевого зерна у различных групп растений, начиная ?SSL^.K££S
Фа^ГрйвитиГпГГГ v • Ш ПредСТаВЛ6?-й ™е coJ^hSjSSSS
<разы развития пыльцы у представителей Cycadales, Coniferales Gnetale^ и
rtvnnToxT- НеТ необхо^мости «писывать здесь процесс у каждой и? этих
групп в отдельности, так как он протекает у них в своей основе сходным обоЛом
ниеГп^Г0' Д°СТатОЧНО известен- В ^стве примера orpSSSSSS
"И1развития пыльцевого зерна у Pinus, которое наиболее полно и напоминает
только что рассмотренный нами процесс у Larix напоминает
Зежде всего необходимо сказать, что в терминологии здесь до сих пор нет еля-
согласно некоторым авторам.). При втором делении верхушечная клетка обо^зо'
вавшегося двухклеточного гаметофита отделяет вторую Jpa^La^.^
сегмебнтТнеоЛяИ™^!е KAe™' об°азУюЧ««*я в виде маленьких линзовидных
nf^!HI ' развиваются Дальше и разрушаются, а верхушечная клетка поетео-
певает еще одно деление - третье по счету. В дальнейшем она уже больше не Sin?
ся, а берет на себя ряд новых функций, вырастая позднее в пыльпевуюТоубк^ш"
108 Генеративные органы цветка
(«generative cell» Чемберлена) и обозначена ант. Этот термин вполне соответствует
существу дела: данная клетка является инициалью антеридия, так как при своем
делении (являющемся по счету четвертым при развитии гаметофита) образует
зачаточный антеридий, состоящий из ножковой клетки (нк) («базальная клетка»,
«Stielzelle», «Fusszelle», «Stalk cell») и из спермиогенной клетки (ск)
(«Spermatogenous cell», «Body cell»). Ножковая клетка это, по существу, все, что
осталось у «Pinus» от антеридия как органа; что касается спермиогенной клетки,..то
это уже материнская клетка мужских гамет (спермиев), которые образуются в
результате деления, являющегося пятым по счету и последним в ходе развития у
«Pinus».
В литературе существует взгляд, согласно которому верхушечную клетку
непосредственно перед делением, производящим антеридиальную клетку, считают
за «инициаль антеридия» («anteridial initial»). Согласно этому взгляду, было бы
логично зрелое пыльцевое зерно считать за антеридий, чего, однако, не делается,
очевидно, ввиду отмеченной в литературе (Coulter, 1909) трудности гомологиза-
ции клеток, составляющих пыльцевое зерно.
На основании этого взгляда (см. схему), у некоторых Coniferales (Taxodiaceae,
Cupressaceae и Taxaceae), у Gnetum и Angiospermae за инициаль антеридия
приходится принимать уже микроспору, что и делают отдельные авторы
(Chamberlain, 1935), распространяя это и на «Angiospermae», но это вряд ли
правильно, так как является совершенно искусственным объединением двух
различных морфологических понятии. Однако подобное построение до сих пор
пользуется популярностью (см. Battaglia, 1951), и, конечно, вызвано тем, что образование
спермиев не могут представить себе без антеридия, но последнего, как можно
видеть при беспристрастном анализе, в действительности нет не только у
покрытосеменных, но уже и у некоторых голосеменных (например, Wehvitschia).
Если мы посмотрим далее на приведенную схему, то на ней хорошо видно, что
эволюция мужского гаметофита идет разными путями в различных группах
семенных растений, обнаруживая резко выраженную гетерохронию. В одних происходит
сокращение проталлиальных клеток при сохранении антеридиальной клетки (а
следовательно, и зачаточного антеридия, состоящего из ножковой и спермиогенной
клеток). Так, например, у Cycadales имеется только одна проталлиальная клетка,
но развивается зачаточный антеридий; у Taxodiaceae, Cupressaceae, Taxaceae уже
вовсе нет проталлиальных клеток, но все еще есть зачаточный антеридий. Сходное
с последней группой положение и у Gnetum. Напротив, у Wehvitschia сохранилась
одна проталлиальная клетка, но уже не развивается антеридий, а образуется
непосредственно спермиогенная клетка, т. е. антеридий как орган перестал
существовать. Таким образом, Taxodiaceae, Cupressaceae, Taxaceae и Gnetum
приближаются к покрытосеменным в одном отношении (исчезновение проталлиальных
клеток) , a Wehvitschia — в другом отношении (отсутствие антеридия).
Последний член филогенетического ряда — покрытосеменные — претерпел
высшую степень сокращения развития мужского гаметофита: здесь нет ни
проталлиальных клеток, ни зачаточного антеридия, а, как мы видели, образуется в
результате первого же деления микроспоры спермиогенная клетка, которую,
однако, нет достаточных оснований гомологизировать со спермиогенной клеткой
нижестоящих групп, так как она возникает непосредственно в результате
деления микроспоры, а не отделяется особой антеридиальной клеткой.
У покрытосеменных, таким образом, акселерация достигает высшей степени в
результате более раннего образования спермиев в процессе развития гаметофита. В
силу этого покрытосеменными утрачены те более поздние стадии развития, на
которых у нижестоящих групп еще образовывался зачаточный антеридий.
Положение, следовательно, принципиально сходное с тем, которое существует в женской
Пыльник
109
сфере, где уже одна из семи клеток женского гаметофита непосредственно
преобразуется в яйцеклетку, тогда как например, у Pinus после образования 2048 клеток
женского гаметофита возникает только инициаль архегония, которой предстоит
еще после трех делений дать яйцеклетку. Поэтому, по-моему, совершенно
неправилен тот вывод, к которому приходит Battaglia (1951), а именно, что мужской гамето-
фит покрытосеменных якобы «более консервативен», чем женский, так как имеет
антеридий, хотя и редуцированный, в то время как архегония уже не существует. В
действительности же мужской гаметофит в своем упрощении зашел столь же
далеко, как и женский, если не дальше. Антеридий, как и архегоний, несомненно давно
перестал образовываться у покрытосеменных
Детальный цитологический анализ развития пыльцевого зерна,
представленный выше, свидетельствует о правильности такого вывода: процесс образования
спермиогенной клетки покрытосеменных принципиально сходен с процессом
образования проталлиальных клеток у голосеменных; значительно меньше его
сходство с образованием антеридиальной клетки, и уже вовсе отличен он от
образования спермиогенной клетки голосеменных, производимой не прямо
верхушечной клеткой, а получающейся в результате деления антеридиальной клетки. Мне
представляется, что спермиогенная клетка покрытосеменных не может быть го-
мологизирована ни с чем, кроме клетки гаметофита.
Что касается другой клетки пыльцевого зерна покрытосеменных, т. е. сифоно-
генной, то та роль, которую играет развивающаяся из нее пыльцевая трубка,
получающая совершенно особое значение у покрытосеменных, характеризует
высший этап развития мужского гаметофита, когда он сам становится участником
полового акта, образуя вместе со спермиями единую оплодотворяющую систему
(Герасимова-Навашина, 1951а, б, 1952, 1954а, б) и обеспечивая в результате
процесса опыления развитие, наряду с семенем, и плода — этого новоприобретения
покрытосеменных.
Герасимова-Навашина, 1951а, б, 1952, 1954а, б; Мейер, 1953; Модилевский, 1953; Battaglia, 1951;
Chamberlain, 1935; Coulter, 1909; Geitler, 1935.
СПЕЦИФИКА ГЕННОЙ ЭКСПРЕССИИ В ПЫЛЬЦЕ
Пыльца представляет собой крайне редуцированный зрелый мужской
гаметофит цветковых растений. Функция пыльцы состоит в том, чтобы способствовать
переносу ее спермиев к женскому гаметофиту для осуществления оплодотворения.
Несмотря на то, что зрелая пыльца всего лишь трехклеточная, эволюционно она
является потомком более сложных многоклеточных гаметофитов. Поэтому
неудивительно, что в ходе развития и прорастания пыльцы проявляется действие большого
числа генов, что вряд ли можно было ожидать, исходя из ее кажущейся простоты.
Ботаники приступили к изучению действия генов пыльцы с целью получения
большей информации относительно природы и регуляции генетической программы
пыльцы. На основе исследований такого рода должны быть сделаны выводы о
способах управления генами пыльцы для нужд сельского хозяйства, биотехнологии и
даже медицины; эти исследования приведут нас к более точному пониманию
экспрессии генов у гаплоидов.
Типы и последовательность экспрессии генов в пыльце. Как было
сказано выше, количество различных мРНК, экспрессируемых в пыльце, оказывается
гораздо большим, чем можно было бы ожидать для такого, казалось бы, простого
организма. Было подсчитано, что общее число генов, экспрессируемых в зрелой
пыльце разных видов растений, составляет порядка 20—24 тыс. (см. обзор —
Mascarenhas, 1990), т. е. около 60 % генов, экспрессируемых в побеге —
морфологически более сложном образовании. Понятно, что большинство генов, экспрессируе-
110
Генеративные органы цветка
мых в пыльце, проявляется и в других тканях растения, и только некоторая их
часть остается специфичной для пыльцы. Процент генов, специфичных для
пыльцы, составляет, согласно подсчетам, 10—20% (Mascarenhas, 1990). В недавнее
время, однако, было высказано предположение, что многие из специфичных
пыльцевых мРНК содержатся в относительно малых количествах и поэтому трудны для
обнаружения (Hodge et al., 1992. Относительное содержание таких мРНК,
установленное этими авторами в результате экспериментов, приближается к
30%.
Исследования по определению разности мРНК при экспрессии генов в пыльце
дают некоторые указания относительно последовательности экспрессии. В общем,
по этому признаку гены пыльцы можно разделить на два класса: гены, экспресси-
руемые с самого начала развития, но экспрессия которых понижается по мере
созревания, и гены, экспрессия которых начинается после митоза в микроспорах,
причем накопление мРНК происходит по мере созревания. Это явное упрощение,
ибо недавно было охарактеризовано несколько генов с экспрессией
промежуточного характера (Hodge et al., 1992; Roberts et al., 1993). Однако большинство
специфических генов пыльцы, которые удалось изолировать, принадлежат к классу
«поздних», поскольку они могут быть изолированы у зрелой пыльцы, которую легче
получить в достаточном количестве, чем незрелую пыльцу. Гены этого класса,
вероятно, участвуют в процессах созревания, прорастания, а также роста
пыльцевых трубок.
Специфичные гены пыльцы. В таблице представлен список всех
специфичных пыльцевых генов, данные о которых опубликованы к настоящему времени;
гены были клонированы и, частично охарактеризованы.
Имеется еще некоторое число генов (такие, как ADH1, BetVII, профилин, Cat-1,
ЕРБРсинтетаза и пр.), которые проявляются в пыльце, но не являются
специфичными для пыльцы. Такие гены не были включены в список, также как и гены, экс-
прессируемые в пыльниках или в тапетуме. Большинство этих генов были
выделены с помощью стандартных методов отбора (скрининга), избирательных по
отношению к РНК, уровень которой в пыльце гораздо выше, чем в других тканях. В
результате большинство из них находятся, вероятно, среди наиболее экспрессиру-
емых, и потому наиболее легко обнаруживаются. Следует отметить, что те белки,
которым приписывают функцию ферментативной активности, в действительности
не были проверены на эту активность; скорее всего, эта функция была за ними
закреплена на основании изучения аминокислотной последовательности у белков,
гомологичных известным белкам.
Большинство генов, приведенных в таблице, имеют отношение к ферментам,
способствующим распаду стенки, а также к белкам, связанным с цитоскелетом,
которые, возможно, способствуют прорастанию пыльцевой трубки в пестике.
Интересно отметить, что многие из белков пыльцы, вызывающие аллергическую
реакцию у человека, обладают определенными функциями, например, пектатлиаза,
профилин, кальмодулин и т. д.
Таким образом, в ходе развития микрогаметофита у покрытосеменных
действует комплексная генетическая программа с экспрессированием двух основных
классов генов. Гены «раннего класса», вероятно, экспрессируются на стадии незрелых
микроспор, в то время как гены «позднего класса» — в период созревания и
прорастания пыльцы и роста пыльцевой трубки. Это подтверждается наблюдением, в
результате которого было идентифицировано несколько специфических пыльцевых
клонов «позднего класса», чьи последовательности аналогичны таковым у
ферментов, связанных с синтезом и распадом клеточных стенок в процессе роста
пыльцевой трубки (Wing et al., 1989). Эти «поздние гены» представляют основную массу
генов пыльцы, которые были клонированы и охарактеризованы.
Пыльник
111
В настоящее время проводится большая исследовательская работа по изучению
промоторных элементов генов пыльцы, а последующая характеристика генов,
ответственных за ключевые регуляторные процессы в пыльце, даст возможность
понять природу экспрессии генов гаплоидов и ее связь с экспрессией у диплоидного
растения. Открытия в молекулярной биологии пыльцы укажут пути их
практического применения в селекции растений, биотехнологии и для разработки их
научных основ.
Таблица: Специфичные гены пыльцы
Ген
Zm58
lat56,lat59
G10
Amb a 1.4-4
Amb a II
LolpI
Lolplb
KGB family
(Poa p IX)
P2 family
PG1
W2247
Bp19
Bp10
NTP303
chiA
TUA1
SF3
13
Zm13
lat52
Tpo44,
Tpo70
Bp4 (A,B,C)
различные
Вид
Кукуруза
Томат
Табак
Томат
Амброзия
Плевел
(Райграс)
Мятлик
луговой
Энотера
Кукуруза
Кукуруза
Рапс
Рапс
Табак
Петуния
Арабидопсис
Подсолнечник
Рапс
Кукурува
Томат
Традесканция
Рапс
Рапс
Предполагаемая функция
Пектатлиаза (гомология с lat56, lat59,
G10, Amb a I, ID*
Пектатлиаза (гомология с Zm58, G10,
Amb a I, ID*
Пектатлиаза 9гомология с Zm58,
lat56, lal59, Ambal, ID*
Аллергены, пектатлиаза (гомология
Zm58,lat56, lat59,G10)*
Аллергены
Аллергены
Полигалактуроназа
Полигалактуроназа (гомология с W2247)
Полигалактуроназа (гомология с PG1)
П ектинэстераза
Аскорбатоксидаза
Аскорбатоксидаза
CHI гены
Альфа-тубулин
Белок, связывающий ДНК
(цинк-содержащий)
Олеозин
Неизвестна (гомология с lat52)
Неизвестна (гомология с Zml 3, возможно
гомология с ингибитором трипсина Кунца)
Неизвестна
Неизвестна
Неизвестна
Ссылки
Hodge R.etal. 1992
WingR. A.etal. 1989
Rogers H. J. etal. 1992
RafnarT. etal. 1991,
Rogers B. L. et al. 1991
Singh M. B. etal. 1991
Silvanovich A. et al. 1991
Brown S. M. &
CrowchM. L., 1990
NiorgenM. F. etal. 1991
Allen R. J. &
Lonsdale D. M. 1993
Albani D. et al. 1991
AlbaniD. etal. 1992
Weterings K. et al. 1992
Van Tunen A. J. et al. 1990
Carpenther J. L. et al. 1992
BaltzR. etal. 1992
Roberts M. R.etal. 1991
Hamilton D. A. et al. 1989
TwellD. etal. 1989
StinsonJ. R.etal. 1987
Albani D. et al. 1990
Mascarenhas, 1990
* Эти гены также гомологичны гену 9612, который экспрессируется в столбиках табака и томата
(Budelieretal., 1990).
Albani et al., 1990, 1991, 1992; Allen, Lonsdale, 1993; Baltzet al., 1992; Brown, Crouch, 1990; Budelier,
1990; Carpenter et al., 1992; Hamilton et al., 1989; Hanson et al., 1989; Hodge et al., 1992; Mascarenhas,
1990; Niogret etal., 1991; Rafnar etal., 1991; Roberts etal., 1991,1993; Rogers etal., 1991,1992; Silvanovich
et al., 1991; Singh et al., 1991; Stinson et al., 1987; Twell et al., 1989; Tunen van et al., 1990; Weterings et al.,
1992; Wing etal., 1989.
112
Генеративные органы цветка
ПЫЛЬНИК: ГИСТОХИМИЧЕСКИЕ
И УЛЬТРАСТРУКТУРНЫЕ АСПЕКТЫ
Пыльник представляет собой систему специализированных гетерогенных
клеток и предназначен для защиты, питания и рассеивания пыльцы. В настоящее
время становится возможным осмыслить большой объем поступающей
информации по различным аспектам развития пыльника в связи с широким
распространением цито- и гистохимических исследований, использующих ТЭМ и СЭМ с
высокой разрешающей способностью. К сожалению, большая часть исследований
касается развития монад, в то время как очень мало информации о более сложном
процессе развития полиад.
Гистохимия дает возможность идентифицировать и определить локализацию
специфических веществ в клетках и тканях, определить место их синтеза,
накопления и транспорта в исследуемых тканях, что ведет к пониманию выполняемых
ими функций. На каждом этапе дифференциации, происходящей в течение
репродуктивного цикла на уровне клетки, ткани или органа, отмечается активность
либо метаболита (метаболитов), либо фермента (ферментов), что указывает на
направление дальнейшего развития. Гистохимические исследования также
способствуют пониманию роли слоев стенки пыльника в развитии пыльцы.
Доминирующим процессом в примордии пыльника является цитокинез,
продолжающийся до дифференциации различных тканей. Археспорий и его
производное — спорогенная ткань обычно отличаются большой концентрацией РНК и
белков. В настоящее время имеются сведения о том, что высокое содержание
нуклеиновых кислот и белков необходимо для осуществления процесса
дифференциации у ряда биологических систем. Спорогенная ткань метаболически очень
активна, ее формирование является важной стадией в развитии пыльника,
поскольку именно в этой ткани имеет место дифференциация материнских клеток
пыльцы. Спорогенные клетки вступают в стадию роста, дифференциации и
специализации, что завершается формированием пыльцевых зерен. У Sesbania
speciosa ядрышко в мейоците приобретает серповидную форму и, перемещаясь к
периферии, образует колпачок (Vijayaraghavan et al., 1991). Возможно, что такой
поляризованный ядрышковый колпачок представляет собой дополнительное
приспособление, инициирующее мейоз. У Prosopis juliflora целлюлозная стенка
материнской клетки сохраняется вокруг тетрад и дает интенсивную ШИК-реакцию
(Chaudhry, Bharti, 1992). У отдельных микроспор тетрады обнаруживаются при-
мэкзина и апертуры, дающие ШИК-положительную реакцию. Во время
вакуолизации в цитоплазме микроспоры ядро движется по направлению к периферии.
Затем происходит асимметричное митотическое деление, в результате которого
образуется крупная вегетативная клетка и небольшая,плоская генеративная
клетка. В период цветения генеративная клетка приобретает веретенообразную
форму, у нее образуется ШИК-положительная тонкая стенка, и она погружается
в цитоплазму вегетативной клетки. Генеративная клетка затем делится с
образованием двух вытянутых спермиев, в которых интенсивно окрашивается белок.
Пыльцевые зерна высыпаются на трехклеточной стадии, они трехбороздные
(tricolporate), со складчатой поверхностью экзины.
Сложная пыльца встречается в 52 семействах цветковых растений (Gunet, Le
Tomas, 1973). У Albizzia lebbek пыльцевые зерна высыпаются в виде полиад;
каждая полиада представляет собой сложное образование из 16 зерен (Shah Rajesh,
1992). Одиночная спорогенная клетка делится дважды с образованием четырех
микроспороцитов. Сплошная каллозная оболочка защищает каждую из полиад.
Однако между мейоцитами каллозная оболочка является прерывистой, указывая
тем самым на присутствие цитомиктических каналов. Наличие этих цитоплазма-
Пыльник
113
тических связей свидетельствует об установлении сцеплений между соседними
микроспорами после растворения каллозной оболочки. Мейоз, имеющий место в
каждой из материнских клеток пыльцы, приводит к образованию четырех
тетраэдральных тетрад. На последующих стадиях они слипаются и образуют 16-кле-
точную полиаду. Экзина является двуслойной, причем сэкзина покрывает только
поверхность полиады, в то время как нэкзина и интина обволакивают каждое
зерно. В полиадах обнаруживается несколько ШИК-положительных пор,
расположенных на поверхности; другие поры встречаются в углах пыльцевых зерен.
Полиады — акалимматные там, где пыльцевые зерна не объединены сплошным
слоем сэкзины. Акалимматные полиады наблюдаются также у Acacia spp. (Kenrick,
Knox, 1979) и у многих представителей трибы Ingeae (Mimosoideae: Leguminosae)
(Niezgoda et al., 1983).
Рассматривая образование монад и полиад, нельзя не учитывать значение слов,
из которых состоит стенка пыльника. Стенка состоит из эпидермы, эндотеция,
средних слоев и тапетума, который функционирует как местный энергетический
резервуар для источника энергии, расположенного вблизи от спорогенной ткани и
материнских клеток пыльцы. Они участвуют в дифференциации мужского гамето-
фита. Полагают, что различные метаболиты, накапливаемые в стенке пыльника,
используются в развитии пыльцы. То, что слои стенки пыльника осуществляют
функцию питания, доказывается повсеместным присутствием плазмодесм между
этими слоями, тапетумом и спорогенной тканью. По мере того, как микроспороциты
подвергаются дальнейшей дифференциации, в эндотеции образуются радиальные
утолщения, средние слои истоньчаются и в конце концов дегенерируют, а тапетум
становится четко выраженным и специализированным слоем.
У Prosopis pliflora утолщения в эндотеции выявляются в виде хорошо
развитых, ШИК-положительных волокон; они возникают вдоль внутренних тангенти-
альных стенок, простираются вверх, и заканчиваются около внешних тангенти-
альных стенок. Эти утолщения более выражены на стадии вакуолизации
микроспор: они являются частью механизма вскрывания пыльника. Целлюлозная
природа утолщений подтверждается интенсивной ШИК-реакцией. На
электронно-микроскопических снимках отчетливо видна волоконная структура этих
утолщений. Клетки, составляющие средние слои, вакуолизированные, прямоугольные
и характеризуются интенсивно окрашиваемыми цитоплазмой и ядром. В течение
мейоза в мейоците внутренний средний слой (тот, что примыкает к тапетуму)
подвергается дегенерации и исчезает. Внешний средний слой, однако, сохраняется до
наступления двуклеточной стадии в пыльцевых зернах, т. е. приблизительно до
середины срока созревания. Повышение и понижение количества крахмала в
клетках средних слоев и эндотеция свидетельствуют о том, что продукты
расщепления крахмала являются одним из основных источников питания
развивающихся микроспор и пыльцы. При электронно-микроскопическом исследовании
средних слоев обнаруживается множество хлоропластов с ярко выраженными тилако-
идами и крахмальными зернами. В стенке гнезда пыльника лилии
обнаруживаются 4—5 средних слоев, крахмал в которых выполняет важную
функцию в качестве источника питания (Reznickova, Willemse, 1980).
Внутренняя поверхность гнезда, обеспечивающая спорофитно-гаметофитные
взаимоотношения в пыльниках покрытосеменных, состоит из тапетума — слоя
ткани, морфология которого широко варьирует в зависимости от таксона: от
секреторного эпителия до инвазивного плазмодия. Согласно последним сообщениям,
после периода тетрад секреторный тапетум может преобразоваться в амебоидный
тапетум (1), псевдо-периплазмодий (2) или может происходить перегруппировка
тапетальных клеток с сохранением четких клеточных границ, так что
заполняется, в основном, пространство в гнездах между микроспорами (3). Pacini и Franchi
8 Генеративные органы цветка.
114
Генеративные органы цветка
(Pacini 1990; Pacini, Franchi, 1991) представили обзоры, охватывающие обычные
типы тапетума, встречающиеся во многих главных группах сосудистых растений.
Имеется несколько таксонов, у которых, по сообщениям, обнаружен инвазивный,
но несинцитиальный тапетум: Carina indica L. хС. spec. (Tiwari, Gunning, 1986a,
1986Ь) и Cichorium intylus (Pacini, Keijer, 1989).
Особенности развития и расположения тапетума в системе слоев, образующих
стенку пыльника, свидетельствуют о том, что тапетум является тканью,
обладающей большой физиологической значимостью, поскольку все питательные
вещества, поступающие в спорогенные клетки, микроспоры, пыльцевые зерна
проходят через эту ткань или синтезируются в ней. У Prosopis juliflora тапетум
секреторного типа (Chaudhry, Bharti, 1992). Во время мейоза, происходящего в
микроспороцитах, между смежными тапетальными клетками выявляются
отчетливо выступающие межклеточные связи. Тапетальные клетки насыщены РНК и
белком, что связано с присутствием в цитоплазме большого количества слоев
ГЭР1. На стадии образования тетрад внутренние тангентальные и радиальные
стенки тапетума подвергаются деструкции. Цитоплазма клеток тапетума
становится более электронно-плотной и везикулярной, она содержит многочисленные
профили ГЭР, митохондрии и рибосомы. Одновременно с этими изменениями в
тапетуме, начинается формирование структурных элементов стенки пыльцевого
зерна на поверхности микроспор, в то время когда они еще заключены в толстую
каллозную оболочку. Вместе с образованием пробакул на поверхности микроспор
в тапетуме происходит образование про-орбикул, быстро покрывающихся споро-
полленином и преобразующихся в орбикулы. На поверхности клеток тапетума
формируются выпячивания в местах появления про-орбикул: профили ГЭР с
расширяющимися концами тесно связаны с образованием орбикул. Первые
отложения спорополленина в виде отдельных частиц появляются на ядре про-орбикул;
по мере поступления материала они разрастаются и сливаются, образуя слой. По
мере увеличения толщины слоя спорополленина происходит слияние смежных
телец и образование сложных орбикул. Про-орбикулы на стадии тетрад микроспор
и даже после накопления спорополленина связаны с ГЭР, что указывает на его
участие в синтезе про-орбикул. То, что про-орбикулы являются производными ЭР
было отмечено также у Anemarrhena asphodeloides (Chen et al., 1988) и lilium
henryi (Herich, Lux, 1985). Синтезированный тапетумом спорополленин
конденсируется на ядрах про-орбикул и инициалях экзины. Микроспоры, после
высвобождения из тетрад, вступают в прямой контакт со спорополленином,
производным тапетума. Происходит быстрое отложение спорополленина внутри и снаружи
структурированной экзины и инфраструктура стенки, сформированная в тетраде,
становится более организованной. В ходе вакуолизации микроспор тапетум все
более дезорганизуется, цитоплазма его клеток подвергается деструкции, в то время
как в самих микроспорах происходит образование оболочки пыльцы (оболочки
будущих пыльцевых зерен; ред.) путем отложения спорополленина на эндэкзине и
формирования целлюлозной интины. При цветении (пылении) тапетум
полностью лизируется, остается только тапетальная мембрана, покрытая как
одиночными, так и сложными орбикулами. У Albizzia lebbek множество орбикул
выстилает внутреннюю тангентальную стенку тапетума, образуя мешковидную
структуру, что способствует более эффективному рассеиванию полиад. Благодаря
контакту с орбикулами экзина пыльцевых зерен приобретает округлую
поверхность.
Железки на пыльниках. Железки широко распространены у растений. Они
чрезвычайно разнообразны по своему местоположению, организации и составу
ГЭР — гранулярный эндоплазматический ретикулум (Ред.)
Пыльник
115
секрета. Однако железки пыльников, являющиеся придатками связников, редки:
они обнаружены у Myrtaceae (Beardsell et al., 1989) и Violaceae (Fahn, 1979). У
Prosopis juliflora каждый пыльник снабжен железкой, которая расположена над
гнездами пыльника в виде придатка связника (Chaudhry Bharti, Vijayaraghavan,
1992). Железка состоит из тонкой многоклеточной ножки и широкой, также
многоклеточной, сферической головки, состоящей из секреторных клеток.
Секреторные клетки головки характеризуются плотной цитоплазмой; они насыщены как
внутриклеточным полисахаридным секретом, так и включениями белковой
природы. По данным гистохимии вещества, откладывающиеся первоначально в
пузырьках железки, накапливаются затем на ее поверхности. В активной и зрелой
железке секреторные клетки лизируются, и за счет дегенерации протопластов
(голокринная секреция) секретируют белково-углеводный эксудат, который
через отверстия в кутикуле выделяется на поверхность железки. Гетерогенный
эксудат, который обволакивает поверхность железки, служит в качестве источника
питания для множества различных насекомых-опылителей, в особенности для
Thysanoptera и Hemiptera. Частым посетителем выступает Oxyrhachis tarendus из
Membracidae. Это насекомое часто можно наблюдать на железке пыльника или на
других частях цветка. Его также находили в клетках железки как бы пойманным
в ловушку, вероятно, во время поглощения пищи. Предполагают, что наряду со
значительным количеством пыльцы и нектара, производимым этим растением,
дополнительным источником питания для насекомых служит белково-углеводный
эксудат железки. Привлеченное цветком насекомое, поедая эксудат на
поверхности железки, покрывается пыльцой и может оказаться невольным переносчиком
пыльцы при посещении разных соцветий одного и того же дерева или же соцветий
различных деревьев, осуществляя тем самым перекрестное опыление той или
иной популяции. Секрет связывает пыльцевые зерна, служит источником питания
для насекомых-опылителей и тем самым способствует распространению пыльцы.
Это явление может оказывать существенное воздействие на поведение
потенциальных опылителей. Рис. 32.
Beardsell et al., 1989; Chaudhry Bharti, 1992; Chaudhry Bharti, Vijayaraghavan, 1992; Chen et al., 1988;
Fahn, 1979; Guinet, LeThomas, 1973; Herich, Lux, 1985; Kenrick, Knox, 1979; Niezgodaetal., 1983; Pacini,
1990; Pacini, Franchi, 1991; Pacini, Keijzer, 1989; Reznickova, Willemse, 1980; Shah Rajesh, 1992; Tiwari,
Gunning, 1986a, 1986b; Vijayaraghavan, Seth Neeru, 1991.
ЦИТОМИКСИС
ЦИТОМИКСИС (греч. cytos — клетка, mixis — смешение) — перемещение
части цитоплазмы с ядром или с частью ядра из одной клетки в соседнюю (или в
несколько соседних); происходит как в соматических, так и в спорогенных тканях.
Впервые цитомиксис наблюдал Gates (1911), который определил это явление
как процесс переноса хроматина ядра из клетки-донора в цитоплазму
клетки-реципиента.
Разные авторы определяли цитомиксис как: перенос из клетки в клетку
бесструктурного хроматина; обмен клеток цитоплазмой; передвижение из клетки в
клетку целых интерфазных ядер или их частей вместе с цитоплазмой; миграцию
цитоплазмы с хроматином ядра любой стадии спирализации; слияние
протопластов соседних спорогенных клеток; миграцию между спороцитами цитоплазмы с
отдельными хромосомами, фрагментами хромосом или хромосомными
ассоциациями.
Цитомиксис может быть индуцирован экспериментально при повреждении ар-
хеспориальной ткани (Левитский, 1928; Tarkowska, 1973), вирусными болезнями
8*
116
Генеративные органы цветка
(Смирнов, 1954), экстремальными погодными условиями (Медведева, Базавлук,
1951).
Наиболее широко цитомиксис распространен у растений с нарушенным гоме-
остазом: у гибридов, мутантов, инцухтированных линий, регенерантов.
С точки зрения цитогенетических последствий наиболее интересен цитомиксис
в спорогенных клетках. Частота встречаемости цитомиксиса — широко
варьирующий признак. В спорогенной ткани гибридов злаков она максимальна в лептоне-
ме и пахинеме. В поздней профазе и метафазе частота его низка. Один микрбспо-
роцит мог быть одновременно и донором, и реципиентом. Массовая миграция
хромосом из микроспороцитов в межклеточное пространство вызывает полную
стерилизацию спорогенных клеток.
Обязательная предпосылка миграции протопластов — нарушение целостности
клеточных стенок с образованием цитомиктических каналов (Heslop-Harrison,
1966b). Наиболее вероятны цитомиктические каналы в местах, где нет мощных
отложений каллозы и протопласты соседних мейоцитов соприкасаются наиболее
тесно.
Не обнаружено преемственности между цитомиктическими каналами и плаз-
модесмами. Не сопоставимы их площади поперечного сечения (Heslop-Harrison,
1966b).
Последствия цитомиксиса усложняют картины мейоза. Идентифицируется
мигрировавший хроматин по следующим признакам: он всегда находится в
цитоплазме клетки-реципиента и никогда не включается в ее ядро; он всегда остается
в той фазе спирализации, в которой мигрировал. Таким образом, в
клетке-реципиенте оказываются хромосомы различной степени спирализации.
Мигрировавший хроматин может иметь вид гомогенных капель различной величины и
плотности. Он может быть представлен бивалентами, унивалентами или фрагментами
метафазных хромосом.
Дискуссионным является вопрос об отношении цитомиксиса к анеуплоидии.
Для увеличения набора хромосом мейоцита-реципиента необходимо соблюдение
следующих условий: хромосомы должны быть неповрежденными и включенными
в митотический аппарат клетки-реципиента. Иначе сверхкомплектный хроматин
будет элиминирован. По сведениям многих авторов, в том числе подтвержденным
электронно-микроскопическим исследованиям, хромосомы в процессе миграции
сильно повреждаются (Welling, 1956; Tarkowska, 1973; Романов, Орлова, 1971).
Чужой хроматин обычно отторгается клеткой-реципиентом путем заложения
клеточных перегородок с образованием мелких аномальных клеток-спутниц. При
этом и клетки-доноры, и клетки-реципиенты дегенерируют. У миндаля и персика
цитомиксис вызывал массовую стерильность пыльцы (Soodan, Wafal, 1987).
Вероятность возникновения мейоцитов с увеличенным в результате
цитомиксиса числом хромосом едва ли может быть значительной, так как зависит от
совпадения целого ряда обстоятельств. Несомненно, что клетки-доноры хроматина,
утратившие большую часть набора хромосом, не способны к дальнейшему
развитию. О степени жизнеспособности мейоцитов, лишившихся небольшой части ядра
нет данных.
Явление цитомиксиса ошибочно объяснялось некоторыми авторами
существованием цитоплазматического градиента в микроспороцитах гибридов,
различиями в темпах деления ядер исходных родительских форм.
Некоторые современные авторы неверно интерпретировали картины
последствий цитомиксиса вслед за Bleier (1930), который принял микроспороциты с
хромосомами различной степени спирализации за доказательство обособления
геномов родительских видов у гибридов злаков. Так, Шкутина и Хвостова (1966)
объяснили наличие в одном мейоците хромосом различной степени спирализации
Пыльник
117
разобщением хромосом исходных видов. В доказательство своей гипотезы авторы
приводят картины, где, кроме нормально спирализованных, находятся
хромосомы в стадии профазы. Авторы считают, что это крайнее выражение
несогласованного функционирования геномов пшеницы ржи, т. е. профазоподобными
представлены хромосомы ржи, отставшие по степени спирализации от хромосом пшеницы.
В цитогенетическом аспекте важно знать, принадлежат ли менее спирализо-
ванные хромосомы ядру микроспороцита и каковы числа хромосом в собственных
ядрах этих мейоцитов. Согласно представлениям вышеупомянутых авторов, в
мейоците гексаплоидного тритикале в виде более спирализованных должны быть
28 хромосом (=14 бивалентов) пшеницы и в виде профазоподобных — 14 (=7
бивалентов) хромосом ржи. На самом деле ядро мейоцита представлено 21-м
одинаково спирализованным бивалентом из хромосом пшеницы и ржи, а менее спира-
лизованные хромосомы, так же, как и сгустки хроматина, были сверхкомплектны.
Они попали в мейоцит-реципиент в результате цитомиксиса.
Следует подчеркнуть, что цитомиксис никогда не происходит одновременно и
регулярно во всех клетках спорогенных комплексов. Проявления его в высшей
степени спорадичны. Эти особенности подтверждают, что цитомиксис —
нарушение нормального процесса микроспорогенеза и что генетическая
несбалансированность является если не основной причиной цитомиксиса, то фактором,
значительно увеличивающим его частоту. Нарушение гомеостаза представляет собой
фон для максимально отрицательной реакции на любые неблагоприятные
воздействия, какими являются и механическое повреждение пыльника, и экстремальные
внешние воздействия, и гибридность.
Представления некоторых авторов о цитомиксисе как о регулярном явлении,
увеличивающем генетическую изменчивость в природе и эксперименте (Шнайдер,
1988), кажутся нам малоубедительными. Таким образом, цитомиксис —
нарушение процесса клеточной репродукции, более или менее часто сопутствующее мик-
роспорогенезу растений. Наиболее существенные последствия цитомиксиса
состоят в частичной стерильности спорогенных комплексов пыльников, в особенности
у гибридов. Рис. 33.
Левитский, 1928; Медведева, Базавлук, 1951; Романов, Орлова, 1971; Смирнова, 1954; Шкутина,
Хвостова, 1966; Шнайдер, 1988; Blejer, 1930; Gates, 1911; Heslop-Harrison, 1966b; Soodan, Wafai, 1987;
Tarkowska, 1973; Welling, 1965.
ЦИТОПЛАЗМАТИЧЕСКАЯ
МУЖСКАЯ СТЕРИЛЬНОСТЬ (ЦМС)
ЦИТОПЛАЗМАТИЧЕСКАЯ МУЖСКАЯ СТЕРИЛЬНОСТЬ (ЦМС) —
мужская стерильность, возникающая в результате взаимодействия
специфической S-цитоплазмы и рецессивных генов rf rf в гомозиготном состоянии (Kaul,
1988). Впервые это явление как контабесценция (атрофия) пыльников было
описано в 1904 Корренсом у чабера садового (Satureja hortensis). Lasers и Lersten
(1972) сообщили о наличии признака ЦМС у 140 видов, 47 родов и 20 семейств
покрытосеменных, Kaul (1988) приводит сведения для 288 видов, у которых
обнаружен этот тип мужской стерильности.
ЦМС характеризуется нормальным, без нарушений, протеканием мейоза.
Аномалии в развитии чаще всего появляются в постмейотический период, на
стадии тетрад или вскоре после выхода микроспор из тетрад, в процессе развития
микроспоры в пыльцевое зерно — мужской гаметофит (Орел, 1968, Симоненко,
1982). В некоторых случаях развитие продолжается до двух- и трехклеточной
стадий пыльцевого зерна.
118 Генеративные органы цветка
Аномальные процессы выражаются в прогрессирующей вакуолизации
протопласта микроспоры, аномальном развитии митохондрий, пластид и споро дермы, в
которой не развивается интина.
Характерным признаком пыльников растений являются не только аномалии в
развитии спорогенной ткани, но и нарушение нормального функционирования и
аномальное развитие тапетума, который, по-видимому, является местом
первичного проявления генетических факторов ЦМС (Flawell, 1974). Это выражается либо
в преждевременной дегенерации и лизисе тапетума, или, чаще всего, в длительном
его сохранении, или активном разрастании уже после образования микроспор.
Для пыльников растений с ЦМС характерна гипертрофия клеток тапетального
слоя, преобразование секреторного тапетума в ложный пристенный интратапе-
тальный плазмодий после разрушения радиальных стенок клеток тапетума, и
аномальное развитие орбикул, или полное их отсутствие (Shivanna, Johri, 1985).
На микрофотографиях представлены два варианта аномального развития
тапетума пыльника кукурузы: при техасском типе ЦМС с локальным образованием
ложного плазмодия и при «С»-типе ЦМС, где каждая тапетальная клетка
гипертрофирована, имеет утолщенную оболочку, сильно вакуолизирована, сохраняется до
полной дегенерации молодых микроспор.
Принципиальная роль тапетума в развитии признака стерильности пыльцы
показана также методами молекулярной биологии. Трансгенные растения табака
и рапса, содержащие ТА29-РНКазный доминантный ген, специфично экспресси-
рующийся в тапетуме, проявляют полную абортивность пыльцы и, в результате,
полную мужскую стерильность. Предполагается, что перенос этого гена в другие
растения может быть использован в практических целях для массового получения
гибридных семян (Mariami et al., 1990).
Генетические особенности признака ЦМС наиболее полно изучены у кукурузы.
Jones (1950, Jones et al., 1957) ввел понятие плазмогены и хромогены. Им было
сделано заключение, что стерильность пыльцы у кукурузы возникает в
результате взаимодействия особой цитоплазмы, в которой возникла наследственная
мутация, и наследуемых по менделевской схеме рецессивных ядерных факторов.
Доминантное состояние этих факторов при той же стерилизующей цитоплазме
приводит к восстановлению фертильности пыльцы. У стерильного аналога линии
кукурузы восстановление фертильности пыльцы обусловлено наличием двух
доминантных аллелей RflRf2, все известные закрепители стерильности имеют
генотип rf I rf I Rf2Rf2, в стерильная линия обладает двумя парами рецессивных
аллелей rf1rf1rf2rf2 и S-цитоплазмой (Duvick, 1959). Аналогичные генетические
закономерности наблюдаются и у других видов и родов (Edwardson, 1970).
Предполагают, что цитоплазматическими детерминантами ЦМС у ряда
растений являются митохондрии (Peterson et al., 1975, Barrat, Flawell, 1975), однако есть
данные о детерминации этого признака пластидами (Ahokas, 1978).
ЦМС широко используется в селекционной практике кукурузы, сорго,
подсолнечника, сахарной свеклы и других культур для массового получения гибридных
семян первого поколения. Рис. 34.
Орел, 1968,1972; Симоненко, 1982; Ahokas, 1978; Barrat, Flawell, 1975; Duvick, 1959; Edwardson, 1970;
Flawell, 1974; Jones, 1950; Jones et al., 1957; Kaul, 1988; Lasers, Lersten, 1972; Mariami et al., 1990; Peterson
et al., 1975; Shivanna, Johri, 1985.
РАЗВИТИЕ ЗАРОДЫШЕВЫХ МЕШКОВ В ПЫЛЬНИКЕ
Изменение сексуализации — образование «зародышевых мешков» в
пыльцевых зернах впервые было обнаружено Nemec (1898) у Hyacinthus orientalis и в
дальнейшем было названо феноменом Немеца {«Nemec phenomenon»). Позднее
Пыльник
119
(DeMol, 1923; Stow, 1930, 1934; Naithani, 1937) были получены сходные картины,
но уже после специальной обработки луковиц различных сортов Hyacinthus, в
которых пыльники находились, главным образом, на стадии мейоза. Феномен
Немеца был также обнаружен у Ornithogalum nutans и Leptomeria billardieri (Geitler,
1941; Ram, 1959b).
Особого внимания заслуживают данные об образовании «зародышевых
мешков» в пыльнике Heuchera micrantha, полученные в экспериментальных условиях
(Vijayaraghavan, Ratnaparkhi, 1977). В этой же работе рассмотрены возможные
варианты поведения микроспор, находящихся в тетрадах, изолированных
микроспор, а также обсуждаются вопросы, связанные с генезисом таких «зародышевых
мешков». Авторами установлено, что образование «зародышевых мешков» может
происходить по Polygonum-, Plumbago- и Penaea-типам, хотя в них часто не
обнаруживается заложение перегородок.
У злаков {Hordeum vulgare и Triticum aestivum) также были обнаружены
зрелые пыльцевые зерна с нормально развитым 7-клеточным зародышевым мешком
(три клетки яйцевого аппарата, три антиподы и центральная клетка с двумя
полярными ядрами) (Батыгина, 1987).
Имеются данные Davis (1968), свидетельствующие о возможном образовании
«зародышевых мешков» из отдельных тапетальных клеток пыльника у Calotis
lappulacea (Asteraceae). Описывая это явление, Davis отметила морфологическую
и структурную вариабельность этих структур, а также увеличение их числа в
пыльниках, подвергшихся различным воздействиям.
Несмотря на то, что взгляды на происхождение «пыльцевых
зародышевых мешков» противоречивы, тем не менее анализ данных позволяет
предполагать, что они могут образовываться четырьмя морфогенетическими
путями: в результате деления микроспороцита, микроспоры, вегетативной или
генеративной клеток. Вероятно, можно уже считать установленным, что этим
«зародышевым мешкам» должны предшествовать ценоцитные структуры и в
зависимости от числа делений и характера распределения ядер в них могут
образовываться «зародышевые мешки» либо Polygonum-, либо Plumbago- или
Penaea-типов. Не все ценоцитные структуры, образующиеся при развитии
пыльника преобразуются в «зародышевые мешки», т. к. для этого
необходимы определенные факторы, обусловливающие организацию морфогенети-
ческой оси полярности в так называемом пыльцевом зерне.
Большинство авторов, обнаруживших феномен Немеца у разных
представителей Liliaceae, Santalaceae, Saxifragaceae, Роасеае, отмечает, что пыльники, в
которых образуются «зародышевые мешки», различаются характером развития
каждого спорангия (его стенки и спорогенного комплекса) .Так, иногда в трех
микроспорангиях одного пыльника Heuchera micrantha микроспоры полностью
дегенерируют, а в четвертом развивается «embryo sac like structure» (Vijayaraghavan,
Ratnaparkhi, 1977). Отмечен в этом случае и разный характер дифференциации
тапетума (образование «клеток палисадной формы») в разных микроспорангиях
одного и того же пыльника, т.е. вероятно, существует определенная корреляция
между образованием «зародышевых мешков» и строением стенки
микроспорангия, в котором они развиваются. Экспериментально подтверждено, что имеется
прямая связь между развитием тапетума и характером развития микроспор и
пыльцевых зерен (Zenkteler, 1962; Hayward, Manthriratna, 1972; и др.).
Исследователи, изучавшие это явление, единодушно пришли к выводу, что образование
«зародышевых мешков» обычно связано со значительным (до 90%) разрушением
пыльцевых зерен. В связи с этим было выдвинуто предположение о наличии в
пыльнике специфичного некрогормона, индуцирующего развитие «зародышевых
мешков» (Haberlandt, 1921; Stow, 1934, 1940).
120.
Генеративные органы цветка
Сравнительное морфофизиологическое исследование пыльцевых зерен, в
которых развивались «зародышевые мешки», и нормальных зародышевых мешков
Hyacinthus выявило их большое сходство. Подтверждением их нормальной
«женской потенции» является, по мнению Stow, тот факт, что в культуре in vitro
пыльцевые трубки нормальной пыльцы оплодотворяют такие «зародышевые мешки».
Увеличение в них числа ядер после оплодотворения автор трактует как процесс
образования ядер эндосперма. К сожалению, образуются ли при этом зигота, а
затем и зародыш — неизвестно.
Продолжает оставаться дискуссионным вопрос о том, окружены ли экзиной со
всех сторон такие «пыльцевые зерна» с «женской потенцией», как это обнаружено
у Heuchera, или она образуется лишь на одном конце «зародышевого мешка».
Противоречивые суждения имеются также о полюсе, где обнаруживается экзина.
Одни авторы считают, что она локализована там, где формируется яйцевой
аппарат (Geitler, 1941), другие — там, где антиподы (Stow, 1930; Naithani, 1937). При
дальнейшем развитии «зародышевых мешков» происходит разрыв экзины.
Остается неясным, каковы причины индукции таких «зародышевых мешков»
в пыльнике. Geitler утверждал, что это явление находится под генетическим
контролем. Naithani, объясняя это явление также с позиции законов Менделя, все же
считал, что изменения в пыльце происходят под воздействием темпертуры. Не
нашла полного подтверждения и гипотеза о некрогормонах.
Герасимова-Навашина (1958) полагала, что нарушение обмена веществ в
пыльниках под влиянием температурного воздействия обеспечивает разрастание
микроспоры и возможность возникновения дополнительных делений в ней. При
развитии зародышевого мешка из микроспор имеет место не внешнее сходство с
развитием зародышевого мешка из мегаспор, как считает Герасимова-Навашина,
а принципиальное тождество обоих процессов, как результат одинакового
проявления основных законов клеточного развития в сходных условиях. Поэтому
приписывать микроспоре какие-либо «мужские» и «женские» потенции, как это
делает Stow (1934), не совсем корректно, т.к. у любой эмбриональной клетки лишь одна
«потенция» — развиваться и, делиться в соответствующих условиях. Если
изменяются условия, то неизбежно изменяется и характер развития, что наблюдается
при формировании различных типов зародышевых мешков (подробнее см.
«Развитие и происхождение зародышевого мешка»).
Все эти данные приобрели новое звучание при открытии другого явления —
получения гаплоидных растений из микроспор и пыльцевых зерен (Батыгина,
1987). Рис.35.
Батыгина, 1987; Герасимова-Навашина, 1958; Davis, 1968; De Mol, 1923; Geitler, 1941; Haberlandt,
1921; Hayward, Manthriratna, 1972; Naithani, 1937; Nemec, 1898; Ram, 1959b; Stow, 1930, 1934, 1940;
Vijayaraghavan, Ratnaparkhi, 1977; Zenkteler, 1962.
ПЫЛЬНИК КАК МОДЕЛЬ
ДЛЯ ИЗУЧЕНИЯ МОРФОГЕНЕТИЧЕСКИХ ПОТЕНЦИЙ
И ПУТЕЙ МОРФОГЕНЕЗА
В настоящее время тычинки, особенно пыльники, являются структурами,
наиболее часто используемыми в экспериментальной эмбриологии, прежде всего для
получения гаплоидов. Именно по пыльникам накоплен большой фактический
материал, позволяющий уже сегодня частично управлять процессами морфогенеза
в искусственных условиях. Это позволяет ставить вопрос об использовании
пыльника как наиболее изученной из эмбриональных структур в качестве модели для
экспериментального изучения основных закономерностей и путей морфогенеза
растений. Этому способствует и то, что, в сущности, в морфогенезе пыльника на-
Пыльник
121
ходят отражение основные морфогенетические процессы растений в целом
(например, чередование поколений).
Более глубокое и целенаправленное изучение пыльника как модели позволит
быстрее подобрать способы управления морфогенезем сначала в искусственных,
а затем и в естественных условиях обитания растений.
Для более полного представления о пыльнике как модельной системе
необходима прежде всего разработка методических основ его изучения: унификация
терминологии стадий развития, постановка основных проблем, затрагиваемых в
исследованиях, унифицированное изучение путей морфогенеза пыльника в
культуре in vitro у различных видов покрытосеменных, сопряженное изучение всех
структур тычинки и женской репродуктивной сферы растений. Несмотря на то,
что пыльник является сложной интегрированной системой, с методической точки
зрения пыльник, несомненно, более простая модель по сравнению с семязачатком
для исследования морфогенеза in situ, in vivo и in vitro, поскольку при изучении
пыльника легче выявить и моделировать отдельные морфологические процессы и
их корреляции (Батыгина, 1983; Резникова, 1984; и др.).
В связи с этим, вероятно, следует разработать определенную стратегию
исследования. 1. Исследование тычинки у растений в условиях in situ с учетом биологии
развития всего растения и особенно антэкологии. 2. Изучение тычинки у видов,
контрастирующих по способу опыления (например, хазмогамия, клейстогамия).
3. Изучение тычинки in situ и in vivo в динамике, в сочетании с изучением
кинетики биохимических процессов. 4. Сопоставление фактов, полученных при
изучении развития тычинки в естественных условиях, с материалом, полученным при
ее культивировании in vitro. 5. Моделирование условий для каждого этапа
развития пыльника с учетом данных, полученных в результате комплексных морфоби-
охимических исследований.
Все вышесказанное позволит вскрыть критические периоды в развитии
тычинки, обусловливающие специфическое развитие отдельных ее структур. Это даст
возможность управлять процессом развития пыльника in situ, in vivo и in vitro.
Кроме того, введение определенных триггеров и индукторов в среду при
культивировании пыльников на различных этапах их развития у разных видов
покрытосеменных позволит выявить морфогенетические потенции различных клеток
пыльника, а также пути морфогенеза в культуре in vitro: эмбриоидогенез,
органогенез и гистогенез.
Батыгина, 1974, 1983, 1987; Резникова, 1984; Bhandari, 1984; Davis, 1966; Eames, 1961; Esau, 1977.
122
Генеративные органы цветка
ЧАСТЬ III — СЕМЯЗАЧАТОК
ОБЩЕЕ ПРЕДСТАВЛЕНИЕ
СЕМЯЗАЧАТОК — орган семенного растения, формирующийся на плаценте, в
котором происходит мегаспорогенез, формирование женского гаметофита и
процесс оплодотворения и из которого в результате сложных преобразований
образуется семя. Семязачаток представляет собой защищенный стерильными покровами
видоизмененный мегаспорангий семенных растений. Синоним: семяпочка.
Еще Goethe (1790) в своих работах употреблял термин «Samenknospe» (нем.) и
рассматривал эту структуру как метаморфизированную почку, видя в нуцеллусе
верхушку стебля, а в интегументах — видоизмененную последнюю пару листьев.
Некоторые ботаники не делали принципиального различия между семяпочкой и
вегетативной почкой, связывая ее природу с осью-стеблем (Schleiden, 1843,
Schacht, 1854; Payer, 1857; Braun, 1860). Позже употребление термина
«семяпочка» (англ. «seedbud») стало традиционным, хотя многие морфологи уже
отказались от рассмотрения этого образования как почки.
С середины 19 века параллельно с термином «семяпочка» стали использовать
и термин «семязачаток» (англ. ovule и нем. Samenanlage),
Дискутируется написание термина «семяпочка» и «семязачаток». Тахтаджян
(1964) предложил писать эти термины через «е», так как по правилам русского
языка соединительной буквой в составных словах является «е». В настоящее
время через «я» пишут скорее по традиции.
Семязачаток состоит из центрального тела — нуцеллуса (устаревшее
название — ядро семязачатка), окруженного одним или двумя защитными покровами
— интегументами и прикрепленного к плаценте семяножкой — фуникулю-
сом.1 Часть семязачатка, прилегающая к фуникулюсу, где происходит слияние
фуникулюса с нуцеллусом и интегументами, называют халазой (Esau, 1977). На
противоположном полюсе семязачатка (микропилярном) свободные концы инте-
гумента или интегументов вытягиваются в более или менее длинную трубку —
микропиле, или микропилярный канал. Микропиле соединяет нуцеллус с
внешней средой. У «голосеменных» растений, кроме араукариевых, через
микропиле к яйцевому аппарату проникает пыльца, а у цветковых — пыльцевая
трубка; при прорастании семени через него выходит зародышевый корень.
Большинство исследователей сходятся во мнении, что нуцеллус гомологичен мегаспоран-
гию разноспоровых папоротниковидных. Заметная уже у высших споровых
тенденция к стерилизации археспориальных клеток в мегаспорангий при
переходе к разноспоровости, достигает у семенных своего апогея. Как правило, у них
стерилизуется почти все материнские клетки мегаспор, кроме одной,
отличающейся клиновидной формой, гигантскими размерами, крупным светлоокрашива-
ющимся ядром (отчего она напоминает инициальную клетку апикальной
меристемы высших споровых растений). В результате мейоза она дает тетраду мегаспор,
- фуникулус (ред.)
Семязачаток
123
погруженную в нуцеллус. Таким образом, в отличие от споровых растений, у
семенных не происходит высыпания спор из мегаспорангия, и развитие не только
женского гаметофита, но и начальные фазы образования нового спорофита,
протекают внутри мегаспорангия. Впервые эту точку зрения высказал Hofmeister
(1851).
Семязачаток семенных растений, в том числе и многих покрытосеменных,
массивный, крассинуцеллятный, его нуцеллус развивается по эуспорангиатному
типу, из многих клеток плаценты, эпидермальных в группе «голосеменных» и эпи-
дермальных и субэпидермальных — у цветковых (Schnarf, 1929; Allen, 1946, 1947;
Тахтаджян, 1954). На основании этого сделано предположение, что семенные
растения произошли от древнейших эуспорангиатных разнообразных
папоротниковидных. Из цветковых наиболее массивным нуцеллусом обладают двудольные од-
нопокровные из Hamamelidae, а также примитивные таксоны двудольных
{Rosaceae, Ranunculaceae и др.) и однодольные. У них на верхушке нуцеллуса
обычно формируется массивная ткань — нуцеллярный колпачок, иногда
вдающийся в основание микропиле. В этом проявляется отличие цветковых от группы
«голосеменных», особенно от их наиболее примитивных представителей, у
которых мегаспорангий, наоборот, как бы раскрывается, что выражается в
образовании пыльцевой камеры — углубления на верхушке нуцеллуса — образующейся
на месте лизиса его клеток. Раскрывание нуцеллуса можно рассматривать как
свойство, унаследованное от предковых споровых растений. В микропилярном
канале выделяется секреторная жидкость, которая втягивает пыльцу в пыльцевую
камеру, где она и прорастает.
У наиболее высокоорганизованных покрытосеменных семязачаток тенуину-
целлятный, с очень маленьким, тонким нуцеллусом, состоящим из 1 —2 слоев
клеток, формирующимся из одной, нескольких субэпидермальных и эпидермальных
клеток плаценты, наподобие спорангиев лептоспорангиатных папоротников.
У ряда представителей подклассов Dilleniidae, Rosidae, Caryophyllidae
верхушка нуцеллуса сильно разрастается и образует клювовидный вырост,
внедряющийся в микропиле, а иногда даже выступающий над семязачатком. Если он
прилегает к обтуратору, то этим облегчается путь пыльцевой трубки (Gris, 1858; Baillon,
1884; Cooper, Brink, 1945; Martens, 1957; Савченко, 1959, 1960, 1973; Favre-
Duchartre, 1963). Клювовидный вырост напоминает вырост над семязачатком,
служащий для улавливания пыльцы у Araucariaceae, Saxegothaea, Cedrus и
некоторых других голосеменных. Наличие клювовидного выроста у цветковых
может свидетельствовать о сохранении у них потенциальной возможности
улавливать пыльцу, что подтверждается опытами Maheshwari, Kapil (1963), Савченко
(1973). Martens (1957) рассматривал эту структуру как патологическое
образование. Для понимания функции клювовидного выроста интересны случаи его
образования у Betulaceae, у которых в период опыления завязь еще не сформирована,
семязачатки открыты и, поэтому, можно говорить о своеобразной «голосемянно-
сти». Возможно, что клювовидный вырост есть проявление анахронизма
(Савченко, 1960, 1973).
По типу нуцеллуса и числу интегументов выделяют пять типов семязачатков:
крассинуцеллятный с одним или двумя интегументами, тенуинуцеллятный с
одним или двумя интегументами и, наконец, «голый» (без интегумента) и с
редуцированным нуцеллусом (Schnarf, 1929).
В примордии семязачатка у некоторых таксонов формируется одна археспори-
альная клетка и мегаспороцит, из которого и образуются мегаспоры. У ряда
таксонов фертильными оказывается большое число клеток, составляющих спороген-
ную ткань (Casuarinaceae, Betulaceae, Fagaceae, Ranunculaceae, а также
некоторые Rosaceae, Asteraceae и др.). Обычно многоклеточный археспорий считается
124
Генеративные органы цветка
более примитивным; его наличие у эволюциошго продвинутых таксонов может
быть либо проявлением гетеробатмии, либо вторичным явлением. В результате
мейоза возникают споры. Чаще всего женский гаметофит формируется только из
одной споры, обычно расположенной ближе к халазе, т. е. к источнику питания,
хотя потенциально любая из спор тетрады может прорасти. Остальные споры
тетрады, как правило, редуцируются на той или иной фазе развития.
В результате прорастания мегаспоры формируется женский гаметофит. В
разных отделах семенных растений развитие женского гаметофита имеет
специфические черты. У большинства он моноспорический, формируется из единственной
мегаспоры, которая при этом очень сильно разрастается за счет потребления
окружающих клеток нуцеллуса. У «голосеменных» вначале в споре происходит
многократное деление ядер с образованием 260 и более ядер, располагающихся в
пристенной цитоплазме вокруг крупной центральной вакуоли. Позже нуклеарная
фаза сменяется целлюлярной. Клетки формируются в центростремительном
направлении, а позднее разрушаются под воздействием проэмбрио в
центробежном направлении. На микропилярном полюсе многоклеточного заростка
образуются архегонии — один (Тоггеуа), два (большинство таксонов «голосеменных»)
или более (Cupressaceae), до 200 (Widdingtonia). У Cupressaceae архегонии
образуют группу, отделенную от заростка специальной оболочкой. При наличии
большого количества архегониев у цикадовых, они располагаются по всей поверхности
заростка. Архегонии обычно погружены полностью в ткань гаметофита, стенка
архегония поэтому сильно редуцирована, у многих таксонов укорачивается шейка
(у Cycadopsida, например, она состоит всего из двух клеток). Наконец, в отделе
Gnetophyta у рода Gnetum и Wehvitschia архегонии в классическом понимании
вообще не формируются.
У цветковых архегонии отсутствуют, число делений ядра мегаспоры сильно
сокращено, многоклеточный заросток не образуется. Из мегаспоры формируется
зародышевый мешок. Обычный восьмиядерный зародышевый мешок
Polygonum-типа развития обнаружен у 80% изученных цветковых. Выделяют и другие типы
зародышевых мешков.
В литературе высказывалось много гипотез о природе зародышевого мешка.
Большинство авторов рассматривает его как сильно измененный и
редуцированный женский гаметофит, состоящий всего из 7 клеток и 8 ядер, с ранним
проявлением тенденции к половому слиянию. Одной из наиболее интересных является
гипотеза Porsch (1907), позволяющая перекинуть мост через пропасть,
разделяющую цветковые и остальные семенные растения. Porsch считал, что зародышевый
мешок цветковых представляет собой результат дальнейшей редукции заростка
семенных растений. Здесь достиг своей кульминации принцип экономии
материала и ускорения темпов развития, проходящий красной нитью в эволюции высших
растений. В то время, как громоздкие, многоклеточные заростки других
семенных растений развиваются крайне медленно, иногда не один год, у
цветковых его образование происходит сравнительно быстрее и сократилось
до трех ядерных делений. Такая крайняя экономия материала достигается
благодаря тому, что развитие гаметофита и затем спорофита происходит в мегас-
порангии, заключенном внутри завязи, и обеспечивается питанием
непосредственно от материнского спорофита. У покрытосеменных редукция захватила и
архегонии, который изменился и упростился. Он полностью утратил свои стенки
(эта тенденция наблюдается и у некоторых других семенных растений), и от них
остались, как считал Porsch, только яйцеклетка, брюшная канальцевая клетка,
дающая вегетативное ядро, и две шейковые канальцевые клетки,
превращающиеся в синергиды, не утратившие функции проведения пыльцевой трубки. Второй
архегонии превратился в антиподальный аппарат. Две брюшные канальцевые
Семязачаток
125
клетки обоих архегониев, сливаясь, образуют вегетативное ядро зародышевого
мешка. Их природа как клеток сестринских по отношению к яйцеклетке,
проявляется в их тенденции к слиянию, к половому процессу. Постепенная редукция
архегониев и ускорение прохождения половой стадии наблюдается еще у
папоротниковидных и «голосеменных», особенно в отделе Gnetophyta. О возможности
проявления их половой тенденции могут свидетельствовать и случаи оплодотворения
одной из антипод у покрытосеменных и брюшной канальцевой клетки у хвойных.
Одним из ускоряющих развитие факторов является, возможно, свет, который,
проходя через светопрозрачные плодолистики, более нежные, чем чешуи
стробилов других семенных растений, могли способствовать более быстрому созреванию
половых элементов. Экспериментальные исследования доказали прямую
зависимость цветения от света (Голенкин, 1927; Сенянинова-Корчагина, 1959).
Интегумент, или покров семязачатка, у большинства семенных растений, в
том числе у большинства сростнолепестных и ряда свободнолепестных
двудольных покрытосеменных и некоторых однодольных — единственный. У
подавляющего же большинства свободнолепестных двудольных и однодольных два интегу-
мента, причем чаще наружный развит сильнее.
Некоторые авторы трактуют ариллусы и ариллоиды как третий интегумент,
появляющийся в результате расщепления наружного интегумента. Иногда
считают третий интегумент образованием sui generis. Вопрос о его происхождении и
гомологии остается дискуссионным (см. Савченко, 1973). Наконец, Corner (1949a) у
трех родов семейства Аппопасеае ткань разросшейся халазы между наружным и
внутренним интегументами, участвующую в формировании семенной кожуры,
описал как четвертый интегумент, принимая ариллус, разрастающийся после
оплодотворения и становящийся мякотью плода, за третий интегумент. Но эта точка
зрения не находит поддержки у многих морфологов (напр. Савченко, 1973; и др.).
У большинства семенных растений интегумент срастается с нуцеллусом, а
свободным он остается, в лучшем случае, на микропилярном конце (Eames, 1961) и
лишь у семенных папоротников и у большинства относительно примитивных
цветковых (Cleome, Julianiania, Casuarina, Juglans, Myrica) оба интегумента явно
свободны и не срастаются ни друг с другом, ни с нуцеллусом. У представителей ряда
таксонов можно проследить весь процесс срастания. Так, у ряда представителей
Rosaceae, Fabaceae, Myristicaceae, Ochnaceae, Capparaceae, Ranunculaceae,
Fagaceae и у многих однодольных свободные интегументы плотно прилегают друг
у другу, не срастаясь, а у ряда родов Ranunculaceae, Fabales, Palmales и
некоторых других можно проследить все ступени до полного срастания, когда границ
между интегументами не видно. При отсутствии срастания интегументов с
нуцеллусом последний может иметь свою ножку, приподнимающую его над интегумен-
том. Это можно рассматривать как примитивный признак.
Из фактов срастания интегументов можно сделать заключение, что простой
интегумент у некоторых цветковых возник из двойного вторично, конгенитально, в
результате срастания. При этом в разных семействах тенденция к слиянию
интегументов проявлялась независимо и гетерохронно (Coulter, Chamberlain, 1903;
Maheshwari, 1950; Eames, 1961; Поддубная-Арнольди, 1964; Тахтаджян, 1964;
Савченко, 1973; и др.). Сросшийся интегумент более массивный. Причиной такого
слияния может быть проявление общей для всех органов цветковых эволюционной
тенденции к срастанию либо, по мнению Joshi (A.Joshi, 1939; G. Joshi, 1960) они
могли срастись в результате давления стенки завязи на семязачатки.
Возможно, следует признать, что и для большинства «голосеменных»
характерен двойной интегумент, если рассматривать купулу у семенных папоротников
как наружный интегумент. Тогда можно предположить, что в отделе Cycadophyta
единственный массивный покров семязачатка, соответствует только купуле, а
126
Генеративные органы цветка
внутренний интегумент нацело срастается с нуцеллусом и образует его наружные
слои. В отделе Gnetophyta снаружи интегумента имеется второй, наружный
покров. У Ginkgophyta единственный массивный покров семязачатка, видимо,
состоит из двух сросшихся (как у многих цветковых), и лишь в отделе Pinophyta
интегумент действительно единственный, поскольку семязачатки большинства
представителей укрыты в шишках. У подокарповых, тиссовых и головчатотиссовых,
не имеющих таких шишек, снаружи образуется эпиматий — видоизмененная
семенная чешуя.
Интегумент играет, в первую очередь, защитную функцию в семязачатке,
защищая нуцеллус от неблагоприятных воздействии. В семени из него формируется
семенная кожура. Кроме того, в семязачатке он играет трофическую функцию,
частично секреторную.
Вопрос о природе интегумента у семенных растений до сих пор остается
загадкой для ученых. Было высказано много гипотез, но ни одна из них не может
полностью удовлетворить. Например, считали интегумент простым выростом
споролистика, видоизмененным индузиумом папоротниковидных, новообразованием,
видоизмененным листом. Сейчас большинство ученых придерживаются синанги-
альной гипотезы его происхождения, выдвинутой Benson (1904). Согласно этой
гипотезе, семязачатки произошли из плоского соруса, из небольшого количества
спорангиев, причем один спорангий, расположенный в середине, остается фер-
тильным, а окружающие его периферические спорангии полностью
стерилизовались, срослись и превратились в интегумент. Доказательством этой гипотезы
может служить строение семязачатков наиболее древних семенных папоротников с
их камерным интегументом, камеры которого вверху заканчивались свободными
отростками, соответствующими верхушкам спорангиев.
Переходя к собственно покрытосеменным, следует сказать, что в трактовке
происхождения покровов их семязачатков так же еще много спорного.
Действительно, по-видимому, покровы семязачатков цветковых унаследованы ими от
Lyginopteridophyta. Если это так, то можно предположить, что хотя бы один из
покровов их семязачатков мог образоваться из покрова семенных папоротников (из
стерилизовавшихся и сросшихся спорангиев). Некоторые авторы считают, что
хотя бы один из покровов является новообразованием. В последнее время
исследователи все больше склоняются к мнению, что оба покрова унаследованы от
семенных папоротников, нуцеллус которых защищен двумя покровами — интегументом
и купулой, из которых внутренний — результат стерилизации и преобразования
спорангиев, а наружный, возможно, образовался из спорофилла или его частей.
На наш взгляд, правомерно сделать и еще одно предположение. Возможно, что
у некоторых таксонов цветковых оба интегумента синангиальной природы,
образовавшиеся в результате слияния и стерилизации спорангиев, располагавшихся
в сорусе двумя кругами, вокруг центрального спорангия. Из внутреннего круга
спорангиев образовался внутренний интегумент, а из периферического —
наружный. По-видимому, интегументы разных таксонов покрытосеменных не всегда
гомологичны.
У цветковых морфологические особенности семязачатка и семяножки, их
форма и взаимное расположение, а также положение семязачатка в полости завязи,
в первую очередь ориентация микропиле, являются устойчивыми
таксономическими и систематическими признаками. Многочисленные исследования показали,
что эти признаки отражают определенные биологические особенности таксонов,
направление их эволюции.
Так, например, о роли направления микропиле в завязи писал еще Goebel
(1933). Как известно, в эволюции завязи в целом и семязачатка в частности,
столкнулось несколько основных тенденций. Выработались структуры, с одной сторо-
Семязачаток
127
ны, наиболее пригодные для защиты гаметофита и зародыша от неблагоприятных
внешних воздействий, в первую очередь от высыхания, облучения, перегрева, а с
другой — для облегчения опыления, оплодотворения, диссеминации и
прорастания. При этом в разных таксонах одна и та же задача могла решаться по-разному.
И одного и того же результата растения могли достигнуть, развиваясь
различными путями (Корчагина, 1969).
Один из наиболее важных признаков семязачатка является ориентация
микропиле. В зависимости от этого затрудняется или облегчается оплодотворение,
удлиняется или укорачивается путь пыльцевой трубки, облегчается или
затрудняется поступление в семя, к зародышу воды, необходимой для начала ростовых
процессов. Иногда ориентация микропиле влияет также на прорастание
зародыша, на положение кончика корня в плоде, причем причину того или другого
расположения микропиле в каждом конкретном случае следует устанавливать,
исходя из биологических особенностей растения. Отсюда тип семязачатка и его
ориентация в завязи являются важным показателем биологических особенностей
растения и, в комплексе с другими признаками, способны пролить свет на
возможное направление эволюции данной группы растений и на достигнутый
эволюционный уровень.
Первую попытку классифицировать типы семязачатка, встречающиеся у
покрытосеменных, сделал основатель французской школы анатомов-ботаников
Mirbel (1829). Изучая развитие семязачатка у ряда семейств, он пришел к выводу,
что прямой семязачаток, названный им ортотропным, или атропным, является
исходным типом и встречается у Juglandaceae, Polygonaceae, Urticaceae.
Наиболее распространенным считал обращенный семязачаток, названный им анатроп-
ным. Кроме этих двух типов, описаны еще два: изогнутый, или кампилотропный,
и двухсторонне изогнутый, или амфитропный. Первый из них обнаружен у
Cruciferae и Caryophyllaceae, а второй — у Chenopodiaceae. С тех пор, при
классификации семязачатков покрытосеменных растений в качестве основных
признаков принимались форма семязачатка и фуникулюса, расположение оси нуцел-
луса и микропиле по отношению к плаценте и фуникулюсу. (Warming, 1878, 1913;
Козо-Полянский, 1922; Sahni, 1925; Netolitzky, 1926; Голенкин, 1927; Goebel, 1933;
Maheshwari, 1950; Eames, 1961). На этом основании было установлено пять
основных классических типов семязачатков (Goebel, 1933).
1. Ортотропный, или атропный — прямой семязачаток (лат. ouulum
orthotropum). Микропиле находится на одной оси с рубчиком и фуникулюсом.
Таким образом, семязачаток расположен перпендикулярно к плаценте, а халаза и
микропиле противолежат друг другу. Такой семязачаток был также назван
радиальным или симметричным. У этого типа фуникулус обычно короткий, а иногда
он отсутствует. Такой семязачаток характерен для представителей семейств
двудольных, относящихся к порядкам Centrospermae, Polygonales, Juglandales,
Piperales, Enantioblastae. Среди однодольных он встречается у некоторых
Najadaceae, Commelinaceae, Restionaceae, Araceae и Smilacaceae.
2. Анатропный — обращенный семязачаток (лат. ouulum anatгорит),
повернутый на 180° так, что микропиле, обращенное к плаценте, и рубчик
расположены параллельно, а халаза и микропиле противолежат друг другу. Полная
обращенность нуцеллуса вызывается своеобразным неравномерным ростом
фуникулюса, который в процессе развития изгибается под халазой. Верхняя часть
интегумента, формирующая микропиле, часто бывает приросшей к фуникулюсу.
В большинстве случаев, наружный интегумент со стороны фуникулюса не
развивается. Это самый распространенный тип семязачатка среди покрытосеменных,
особенно характерный для более примитивных порядков и семейств из подклассов
Magnoliidae, Alismatidae.
128
Генеративные органы цветка
3. Гемитропный — полуповернутый семязачаток (лат. ouulum
hemitropum). Нуцеллус с интегументами повернут только на 90° по отношению к
плаценте и фуникулусу, а микропиле и халаза противолежат друг другу.
Занимает промежуточное положение между ортотропным и анатропным
семязачатками и характерен для представителей семейств Primulaceae, Scrophulariaceae и др.
4. Кампилотропный — односторонне изогнутый семязачаток (лат.
ovulum campylotropuni). Характеризуется односторонним разрастанием нуцел-
луса и интегументов. Изгибание нуцеллуса приближает микропиле к
плаценте, которое располагается почти на одном уровне с халазой. Этот тип
семязачатков характерен для некоторых представителей пор. Caryophyllales
и семейства Саррагасеае.
5. Амфитропный — двухсторонне изогнутый семязачаток (лат. ouulum
amphytropum). Семязачаток перегибается таким образом, что нуцеллус в
продольном разрезе имеет подковообразную форму. Микропиле и халаза расположены
почти на одном уровне. Изгиб нуцеллуса сопровождается образованием близ
брюшной стороны выроста паренхимной ткани, которая врастает в нуцеллус. Этот
участок ткани образуется из клеток нуцеллуса либо интегументов. В клетках этой
ткани накапливаются питательные вещества. Семязачаток этого типа характерен
для представителей надпор. LLlianae, nop. Caryophyllales, семейств Alismataceae,
Brassicaceae, Fabaceae..
Четыре последних типа семязачатков (анатропный, гемитропный,
кампилотропный, амфитропный) были названы Goebel (1933) также дорсовентральными,
или асимметричными.
Описанная выше классификация, вошедшая в учебники и пособия по ботанике,
не отражает однако все существующее разнообразие морфогенетических типов
семязачатков и их переходных форм.
Появилась необходимость включения других признаков или построения
классификации на совершенно иных принципах. Так, например, в классификациях
Тахтаджяна (1964), Eames (1961) выделяются типы семязачатков и по
характеру их расположения в завязи (эпитропный, апотропный, плеврот-
ропный). Все чаще появляются классификации, учитывающие большее
количество признаков, например, ход проводящих тяжей в семяножке, закономерности
онтогенеза семязачатка. Это обусловлено в первую очередь, видимо, увеличением
количества детально изученных растений, среди которых встречаются такие, у
которых семязачатки имеют более сложную форму, более разнообразное
расположение в завязи, что не укладываются в рамки прежних классификаций. Это вызывает
насущную необходимость расширить «набор» типов, пересмотреть уже
существующие понятия и определения и уточнить их, поскольку в одни и те же понятия разные
авторы часто вкладывают различный смысл (например, понятие
«кампилотропный» у Mirbel, Warming и Bocquet) и, наоборот, одни и те же типы семязачатки
называют по-разному.
В разработку уже имеющихся классификаций большой вклад внес Bocquet
(1959b), который принимал во внимание не только взаимное расположение
семязачатка и семяножки с ее проводящей системой, но, по преимуществу, и признаки
самой семяножки. На этом основании Bocquet выделяет две серии типов
семязачатков, сочетая такой признак, как «прямая» или «согнутая» на дисталь-
ном конце семяножка («орто-» или «ана» — группа) с общепризнанными
признаками семязачатков, как бы вынося признак семяножки за скобки. Он выделяет
следующие семязачатки: 1. с «орто» (прямой) семяножкой (фуникулярным тя-
жем): ортотропный, орто-кампилотропный, орто-амфитропный и 2. с
«ана» (вверх повернутой, загнутой) семяножкой (фуникулярным тяжем) —
анатропный, ана-кампилотропный, ана-амфитропный. Одновременно
Семязачаток
129
Bocquet различает семязачатки в зависимости от их положения по
отношению к верхушке завязи, выделяя эпитропные и апотропные.
Критически рассматривая классификацию Bocquet, следует отметить, что
принцип, положенный в ее основу, действительно весьма важен. Однако она
(классификация) , как признает и сам Bocquet, далеко не исчерпывает всего
разнообразия семязачатков, не во всем выдержана, и определения понятий, данные Bocquet,
иногда сужают возможность их приложения. Например, вряд ли ему следовало
оговаривать, при совершенно правильном разделении семязачатков на
эпитропные и апотропные, что они принимают такое положение за счет изгиба дисталь-
ного конца семяножки вверх или вниз. Ведь это может произойти и по другим
причинам (изгибание семязачатка, семяножки и других участков и т. д.).
Сходный подход к классификации типов семязачатков по форме семязачатка
и семяножки можно встретить в работах Савченко и Петровой (1963), Савченко и
Комар (1965), Савченко (1973).
Наряду с формой семяножки, ряд авторов считает положение семязачатка в
завязи важным признаком для выделения типов, разделяя семязачатки на
прямостоячие (расположенные на дне завязи, с микропиле, направленным вверх),
повислые (свешивающиеся сверху, с микропиле, направленным вниз) и
горизонтальные или боковые (расположенные на боковых стенках или на центральном
семяносце). Судя по имеющимся в литературе определениям, в этих случаях речь
идет о семязачатках с прямыми семяножками. Но остается неясным, к какому
типу отнести семязачатки с изогнутыми семяножками, например анатропные?
Недостатком этих классификаций является то, что в них объединяются вместе
признаки различной категории (положение в завязи, характер семяножки и т. д.)
В связи с классификацией морфологических типов семязачатков интерес
представляет работа Sterling (1963). Тип семязачатка она определяет не только по
форме семязачатка и семяножки, но обращает также большое внимание на положение
семязачатка в полости завязи. Интересен принцип ее подхода к классификации
тем, что она не объединяет разные признаки в одно понятие, а делит семязачатки
по разным признакам на группы. Для установления, к какому типу относится
данный семязачаток, Sterling вначале определяет отдельно по каждому признаку
принадлежность семязачатка к тем или иным группам. И уже затем
устанавливает тип на основании сочетания названий этих нескольких групп. Характеризуя
семязачатки рода Prinsepia, например, она учитывает положение обтуратора,
семяножки и семязачатка и ход проводящих тяжей. На этом основании она
противопоставляет семязачатки прямостоячие или приподымающиеся (лат. erect)
семязачаткам свисающим (лат. pendent) и плевротропным (лат. pleurotropus),
используя известную терминологию Lindley (1836, 1853).
В зависимости от изгиба семяножки вдоль дорсальной или
вентральной стороны плодолистика (это определяет их положение в полости завязи),
Sterling выделяет семязачатки восходящие, подымающиеся (лат.
ascendent, ascendens) и нисходящие (лат. descendens). В первом случае
семяножка подымается вдоль стороны семязачатка к дорсальной поверхности
плодолистика, а во втором — спускается вдоль вентральной его стороны. Учитывая, что
семязачаток может быть при этом ориентирован по-разному, Sterling выделяет в
зависимости от направления микропиле (вверх или вниз по отношению к
верхнему концу завязи) семязачатки, соответственно, эпитропные и апотропные как
среди приподнятых или прямостоячих (erect—epitropic; erect — apotropic), так и
среди висячих (pendent — epitropic; pendent — apotropic) и т. д. Отсюда тип
семязачатка Sterling характеризует с учетом по крайней мере четырех признаков.
Таким образом, градация типов семязачатков по их расположению в завязи,
предложенная Sterling, является более гибкой, отражающей большее разнообра-
9 Генеративные органы цветка.
130 Генеративные органы цветка
зие форм. При этом отражается, например, то, что для положения семязачатка
значение приобретает не только одностороннее разрастание интегумента в хала-
зальной части, что способствует повороту семязачатка, но и изгиб верхнего конца
семяножки, а в других случаях и нижнего ее конца. Так, в связи с двусторонним
изгибанием семяножка может принять S-образную форму.
Сходный подход к классификации типов семязачатков предложен
нами (Корчагина, 1969). Она оформлена в виде таблицы, где перечислены основные
признаки семязачатков, имеющие большое биологическое и
морфологическое значение, и необходимые, как минимум, для выделения групп
типов: ориентировка микропиле по отношению к основанию стилодийно-
го канала, положение семязачатка по отношению к месту его
прикрепления к плаценте, взаиморасположение семязачатка и семяножки,
величина угла прикрепления семяножек (у семяножковых) или (у бессемянож-
ковых) к плаценте, форма (характер продольной оси) семязачатка,
наличие или отсутствие семяножки, наличие определенных
разрастаний тканей интегумента, нуцеллуса или семяножки. Таким образом,
пользуясь идеей, предложенной Bocquet, Sterling, Савченко и Комар, предлагаем
выделять тип семязачатка отдельно по каждому признаку, при этом название типа
образуется из сочетания названий всех этих групп. Такой подход позволяет, в случае
необходимости ввести в характеристику типа дополнительные признаки.
Недостатком такого подхода является громоздкость названия и постепенное и
бесконечное увеличение количества таких терминов, зато таким путем можно
охарактеризовать тип любого семязачатка.
Тип семязачатка имеет филогенетическое значение. Исходным типом
семязачатка одни морфологи считают ортотропный, или атропныи, другие — анатропныи
семязачаток. Дискуссия по этому вопросу продолжается и сейчас. Возникновение
различного рода модификаций основных типов определялось, очевидно, строением
завязи, числом семязачатков, типом плацентации, степенью развития
проводниковой ткани и др. Все эти условия , конечно, имели большое значение и в
видоизменении исходной формы семязачатка, существовавшего у предков семенных растений.
Есть основание предполагать, что видимо, ортотропный семязачаток может быть
примитивным, но может быть и вторичным. Например, согласно наблюдениям
автора в сем. Betulaceae (род Duschekia) можно наблюдать переход от анатропного
семязачатка в выпрямленный, от которого в результате редукции основания
плаценты мог образоваться базальный семязачаток типа Juglandaceae (Корчагина, 1965).
Таким образом, в результате изучения морфологических типов семязачатков
многими исследователями была сделана попытка установить те признаки в
строении семязачатка, которые позволили бы более точно классифицировать и свести
все типы в определенную схему. Однако, до сих пор нет совершенной
классификации, отражающей все многообразие существующих типов и переходных форм
семязачатка среди покрытосеменных.
Семязачаток в конечной фазе своего развития является зрелым органом,
способным к выполнению свойственной ему функции. После оплодотворения
происходит развитие зародыша и эндосперма, сопровождающееся изменениями всех
структур семязачатка, характерными для развивающегося семени. Поскольку в
ходе индивидуального развития форма семязачатка и фуникулюса сильно
изменяется, то характеристику типов семязачатка необходимо составлять на стадии
зрелого зародышевого мешка, так как до этой фазы семязачаток еще не сформирован
полностью, а после оплодотворения он уже не семязачаток, а молодое семя. Рис. 36.
Голенкин, 1927; Козо-Полянский, 1922; Корчагина, 1965,1969; Поддубная-Арнольди, 1964;
Савченко, 1959, 1960, 1973; Савченко, Комар, 1965; Савченко, Петрова, 1963; Сенянинова-Корчагина, 1959;
Тахтадшян, 1954, 1964; Allen, 1946, 1947; Baillon, 1884; Benson, 1904; Bocquet, 1959b; Braun, 1860;
Семязачаток
131
Cooper, Brink, 1945; Corner, 1949; Coulter, Chamberlain, 1903; Eames, 1961; Esau, 1977; Favre-Duchartre,
1963; Goebel, 1933; Goethe, 1790; Gris, 1858; Hofmeister, 1851; Joshi A., 1939; Joshi P., 1960; Lindley,
1836,1853; Maheshwari, 1950; Maheshwari, Kapil, 1963; Martens, 1957; Mirbel, 1829; Payer, 1857; Porsch,
1907; Sahni, 1925; Schacht, 1854; Schleiden, 1943; Schnarf, 1929; Sterling, 1963; Warming, 1878, 1913.
СТРУКТУРА И ФУНКЦИИ
КАМПИЛОТРОПНОГО СЕМЯЗАЧАТКА
Впервые классификацию семязачатков покрытосеменных по их форме дал
Mirbel (1830). Он выделил ортотропный, кампилотропный и анатропныи
семязачатки, которые в качестве трех главных типов использовались в большинстве
справочников и учебников конца 19-го и начала 20-го столетия. Эта
классификация была проиллюстрирована в книге «Die naturlichen Pflanzenfamilien»
(«Естественные семейства растений») (Engler, Prant, 1889) и впоследствии включена в ряд
монографий (Coulter, Chamberlain, 1903; Wettsten, 1911).
Вопросом о классификации семязачатков занимался Goebel (1923), указавший
на различия в развитии семязачатков у Leguminosae и Cruciferae, а также
Caryophyllaceae. Он ввел термин «амфитропия» для семязачатков, у которых
зародышевый мешок или зародыш изогнуты в средней части и приобретает более
или менее подковообразную форму. Термин кампилотропия относился к
семязачаткам с более слабым и односторонним изгибом. Engler (1926) в своем втором
издании согласен с точкой зрения Goebel. Несмотря на широкое распространение
понятий «кампилотропного» и «амфитропного» типов, при практическом их
использовании возникают значительные трудности.
Bocquet (1959) пытался решить проблему, предложив более детальную
классификацию. Он четко показал, что кампилотропия и амфитропия представляют
собой независимые процессы по отношению к анатропии. Выделяя основные серии
орто-, теми- и анатропии, он различал 6 различных типов семязачатков с
изогнутым зародышевым мешком. Кроме того, он описал характерное для амфитропных
семязачатков структуру образованную массой клеток под сводом нуцеллуса. Эту
структуру Bocquet назвал центральным телом.
Однако это не решило практических задач, связанных с классификацией
семязачатков с изогнутыми зародышевыми мешками. Сравнительный
систематический анализ данных, представленных в более поздних руководствах (Davis, 1966;
Corner, 1976; Cronquist, 1981), свидетельствует о многих противоречивых фактах
в характеристике семейств, имеющих семязачатки с изогнутым зародышевым
мешком. Это относится к сем. Acanthaceae, Cneoraceae, Crossomataceae,
Dilleniaceae, Menispermaceae, Oleaceae, Portulacaceae и др. Литературные
данные и наши собственные наблюдения четко показывают, что структура
семязачатков сильно варьирует. Изгиб семязачатка в кампилотропное положение
начинается на разных стадиях развития семязачатка. Центральное тело, над которым
происходит изгибание зародышевого мешка, может иметь различное
происхождение и положение. В его формировании могут участвовать эндосперм, нуцеллус или
халаза, внутренний интегумент, рафе, фуникулус или даже плацента. Рост
осуществляется за счет клеточного деления, растяжения и резорбции нуцеллярной
ткани зародышевым мешком. Кампилотропия имеет полифилетическое
происхождение, широко распространена среди покрытосеменных и встречается в более,
чем 65 семействах, относящихся к различным надпорядкам как двудольных, так
и однодольных. Наиболее изучены в этом отношении пор. Caryophyllales,
Capparales и Fabales. Во многих случаях кампилотропия ограничивается уровнем
семейства, рода или даже вида. Для некоторых семейств, например,
Caryophyllaceae, Papilionaceae и Myrtaceae характерны кампилотропные
семязачатки разной формы. Существует фундаментальное различие в функциях между
9*
132 Генеративные органы цветка
анатропией и ортотропией, с одной стороны, и кампилотропией, с другой. Анат-
ропный семязачаток широко распространен среди покрытосеменных. Согласно
Davis (1966), 204 из 315 семейств имеют анатропные семязачатки. Наиболее
вероятно, что анатропия является исходным типом семязачатка покрытосеменных.
Вследствие анатропного изгиба микропиле перемещается к плаценте, тем самым
укорачивая путь прохождения пыльцевой трубки. Ортотропия найдена в 20
семействах покрытосеменных и часто связана с наличием в завязи единственного
прямого семязачатка, при этом микропиле направлено или даже контактирует с
проводящей тканью столбика (например, Polygonaceae, Myricaceae, Juglandaceae и
Zosteraceae).
Главная функция кампилотропии относится не к семязачатку, а к семени.
Исследователи, занимающиеся вопросами экологии семян, показали, что существует
корреляция между продолжительностью жизни, внешним обликом, местом
обитания и размером семени. Размер семени и число семян сказывается на
распространении , прорастании семян и формировании проростка. Благодаря кампилотропии
в семени заключен зародыш, который в 2 раза длиннее самого семени. Длинные
зародыши имеют более длинные корни, гипокотиль и (или) семядоли и, вероятно,
больше возможностей для формирования проростков.
В заключение, констатируя полифилетичность происхождения и
морфологическое разнообразие кампилотропии, можно полагать, что нет никакого серьезного
основания для выделения категорий кампилотропии и амфитропии.
Кампилотропия — признак семени, часто проявляющийся уже на стадии
семязачатка. Функционально кампилотропию следует сравнивать с «упаковкой»
зародыша, т. е. со способом увеличения размера или поверхности зародыша или его
частей, а не с анатропией или ортотропией.
Bocquet, 1959; Bouman, Boesewinkel, 1991; Davis, 1966; Corner, 1976; Cronquist, 1981; Coulter,
Chamberlain, 1903; Engler, 1926; Engler, Prantl, 1889; Goebel, 1923; Mirbel, 1830; Wettstein, 1911.
ПРИМОРДИЙ СЕМЯЗАЧАТКА (лат. primordium — зачаток, бугорок) — не
дифференцированный на структуры семязачаток на ранних стадиях развития.
Морфология примордия семязачатка, имеющего вид полушаровидного
образования, была описана Mirbel (1829).
Впервые на основе теории гистогенов, предложенной Hanstein (1868), его
гистогенез был прослежен у представителей сем. Piperaceae (Schmitz, 1872). Рядом
авторов (Guttenberg, 1960; Fagerlind, 1961, и др.) примордий семязачатка
рассматривался с точки зрения теории туники-корпуса, предложенной Schmidt (1924).
Исходя из особенностей заложения на плаценте, выделены 2 группы примордиев
семязачатков (Кордюм, 1967, 1968, 1978, см. стр. 148). В группе Б примордий
семязачатка формируется в результате преимущественно периклинальных делений
клеток субэпидермального слоя плаценты и состоит из однослойной туники и
корпуса; в группе А периклинальные деления происходят в нижележащих слоях
плаценты и примордий семязачатка состоит из двуслойной туники и корпуса. Bouman
(1984) предложил подразделить примордий семязачатков на 3-зонные (группа А,
по Кордюм) и 2-зонные (группа Б, по Кордюм). В более поздних работах
(Venturelli, Bouman, 1986; Grootjen, Bouman, 1988, и др.) для описания примордия
используются термины «туника» и «корпус».
Уже первыми исследователями было обнаружено, что возникновение
примордия семязачатка осуществляется за счет периклинальных делений клеток субэпи-
дермальных слоев плаценты (Schmitz, 1972; Strasburger, 1872; Warming, 1874).
Warming (1878) установил 3 пути возникновения примордиев семязачатков: за счет
делений клеток субэпидермиса (1), за счет нижележащего слоя (2), путем
одновременных делений клеток субэпидермального и третьего слоев (3). Он не придавал
Семязачаток
133
этим различиям решающего значения в образовании примордия семязачатка, так
как у ряда растений обнаруживаются различные комбинации указанных путей.
В большинстве имеющихся работ генезис примордия семязачатка не прослежен,
а лишь отмечаются особенности делений клеток в различных слоях плаценты.
При формировании семязачатков, характеризующихся отсутствием халазаль-
ной зоны нуцеллуса (как правило, это типичные тенуинуцеллятные семязачатки),
периклинальные деления клеток происходят в третьем слое плаценты. Лишь в этом
случае можно говорить о том, что эпидермальный и субэпидермальный слои
являются едиными для плаценты и примордия семязачатка. Для значительного числа
таксонов цветковых растений наибольшее формирующее значение, вероятно,
имеют периклинальные деления субэпидермального слоя плаценты, за счет которых
образуется основная часть семязачатка (нуцеллус, наружная область халазы и
фуникулуса, иногда интегумент). За счет периклинальных делений клеток
нижележащих слоев плаценты образуются ткани, обеспечивающие контакт семязачатка с
плацентой. Таким образом, в результате периклинальных делений клеток
субэпидермального и нижележащих слоев плаценты происходит «сдвиг» слоев примордия
семязачатка по отношению к исходным слоям плаценты. Наружные производные,
возникающие при делении субэпидермальных клеток плаценты, образуют
археспорий, инициали латеральной области нуцеллуса и наружной области халазы и
фуникулуса, а внутренние — вместе с производными третьего и нижележащих
слоев плаценты формируют продольные ряды клеток. Возникают примордий
семязачатков, состоящие у большинства цветковых растений из эпидермального,
субэпидермального и одного—нескольких продольных рядов клеток.
Как было показано ранее для апекса побега, теория туники-корпуса
способствует пониманию расположения и роста клеток в самой апикальной меристеме.
Вклад меристемы в дифференциацию тканей и структур становится понятным на
основе концепции цито-гистологической зональности, предложенной для
характеристики апекса побега (Foster, 1938; Popham, Chan, 1952; Василевская, Кондрать-
ева-Мельвиль, 1958; Gifford, Corson, 1971; Mignotte et al., 1989; и др.). Согласно
этой концепции в сформированном примордий семязачатка можно выделить
следующие зоны: периферическую (эпидермальный слой), апикальную (зона
дифференцирующихся археспориальных клеток в субэпидермальном слое),
латеральную (клетки субэпидермального слоя ниже уровня археспориальных
клеток) , базальную (продольные ряды клеток под субэпидермисом) и переходную
(она дифференцируется в центробежном направлении и проходит через
базальную и латеральную зоны до периферической). В строении апикальной,
латеральной и базальной зон обнаруживаются различия. Обычно на уровне переходной
зоны одновременно с ее дифференциацией или чуть позже возникают интегументы,
выше этого уровня дифференцируется нуцеллус, а ниже — халаза и фуникулус.
Каждая зона примордия дает определенную область семязачатка, степень
выраженности которой варьирует у разных таксонов, что приводит в конечном итоге к
различным типам семязачатков. Из периферической зоны образуются эпидермис
нуцеллуса, халазы и фуникулуса, часто интегументы. На базе апикальной зоны
формируется мегаспороцит или мегаспороцит и париетальная ткань. Латеральная
зона дает начало латеральной области нуцеллуса и наружной области халазы и
фуникулуса, а базальная зона — базальной (осевой) области нуцеллуса и прокам-
биальным тяжам клеток в халазе и фуникулусе. Переходная зона образует
собственно гипостазу семязачатка. Рис. 37.
Батыгина, 1974; Василевская, Кондратьева-Мельвиль, 1958; Кордюм, 1967, 1968, 1978; Навашин, .
1951е; Шамров, 1990г; Шамров, Винтер, 1991; Шамров, Никитичева, 1992; Anisimova, Shamrov, 1992a,
1992b; Bouman, 1984; Fagerlind, 1961; Foster, 1938; Gifford, Corson, 1971; Grootjen, Bouman, 1988;
Guttenberg, 1960; Hanstein, 1868; Mignotte, Vallade, Bugnon, 1989; Mirbel, 1829; Popham, Chan, 1952;
134
Генеративные органы цветка
Schmidt, 1924; Schmitz, 1872; Shamrov, 1991, 1992а, 1992b; Strasburger, 1872; Venturelli, Bouman, 1986;
Warming, 1874,1878; Zhinkina, Shamrov, 1992.
МЕГАСПОРАНГИЙ
НУЦЕЛЛУС (лат. nucellus) — основная структура семязачатка, в которой
закладываются и развиваются спорогенные клетки и женский гаметофит. Синонимы:
мегаспорангий, макроспорангий. Наличие центрального тела, или ядра и
покровов в семязачатке установил Brown (1826b). Термин «нуцеллус» (фр. nucelle) для
центральной части семязачатка впервые употребил Mirbel (1829). Hofmeister
(1851) убедительно показал, что нуцеллус семязачатка покрытосеменных
гомологичен мегаспорангию других высших растений. Это представление поддержали
крупнейшие ботаники (Warming, 1878; Schnarf, 1929; Тахтаджян, 1964, 1980; и
др.). Элементы генезиса нуцеллуса на примере большого числа видов впервые дал
Warming (1878) в основополагающей работе «De I'ovule».
Нуцеллус развивается из апикальной части примордия семязачатка.
Инициальные клеточные слои примордия: туники (эпидермис и субэпидермис) и
корпуса при дальнейшем его развитии формируют определенные ткани нуцеллуса.
Морфологическое обособление нуцеллуса происходит с момента заложения инте-
гумента в его основании, соединенном с халазой. На вершине нуцеллуса в субэпи-
дермальном слое одна или несколько клеток преобразуются в археспорий. С
этого момента нуцеллус становится гетерогенной структурой, состоящей из спороген-
ных клеток и из соматической ткани, которая рассматривается как стенка
мегаспорангия. У цветковых по сравнению с голосеменными, спорогенная ткань и
стенка мегаспорангия подверглись значительной редукции.
Археспориальная клетка непосредственно (без деления) или после отделения
кроющей (париетальной) клетки преобразуется в материнскую клетку
мегаспор — мегаспороцит. Последний, путем мейоза, формирует мегаспоры,
прорастающие в женский гаметофит, называемый у цветковых растений
зародышевым мешком. Число мегаспороцитов в нуцеллусе может варьировать от
одного до нескольких десятков. Если археспорий не отделяет париетальную клетку, то
мегаспороцит находится непосредственно под эпидермисом. Если париетальная
клетка отделяется, она может делиться (антиклинально и периклинально),
формируя стерильную париетальную ткань. Увеличение объема нуцеллуса
происходит наиболее интенсивно в период мегаспорогенеза и первых этапов мегагаме-
тогенеза в основном за счет деления субэпидермального и глубже лежащих
клеточных слоев. Различия в митотической активности первичных слоев нуцеллуса
приводят к большой вариабельности в размерах, форме и пропорциях его частей
у представителей разных групп цветковых. Стерильная часть нуцеллуса,
окружающая мегаспороцит, может быть многослойной или однослойной, со всеми
переходами между промежуточными вариантами, ее существование в семязачатке
может быть кратковременным или длительным.
Форма нуцеллуса при его сохранении в зрелом семязачатке варьирует. В ана-
и ортотропных семязачатках нуцеллус прямой, цилиндрический (Sedum,
Houttuynid), шаровидный (Magnolia, Peperomia) или конусовидный (Polygonum,
Nelumbo). В кампилотропных семязачатках или производных от него типах
нуцеллус может быть в разной степени изогнутым (Portulaca, Allium). В
современных сравнительных исследованиях нуцеллус часто подразделяется на три зоны
(условно): микропилярную (апикальную) зону, расположенную над мегаспороци-
том или зародышевым мешком; латеральную (среднюю) зону, окружающую с
боков мегаспороцит или зародышевый мешок; халазальную (базальную) зону,
находящуюся ниже уровня мёгаспороцита и зародышевого мешка. Степень развития
Семязачаток
135
отдельных зон нуцеллуса варьирует. У одних таксонов развиты все три зоны
(Casuarinaceae, Haloragaceae), у других — преимущественное развитие получает
одна из них. Например, массивная микропилярная зона может сочетаться со
слаборазвитой или неразвитой халазальной (Ulmaceae, Polygalaceae) и, наоборот,
массивная халазальная — со слабо развитой микропилярной (Brassicaceae,
Crassulaceae, Saururaceae). У ряда таксонов образуется многослойная массивная
латеральная часть (Magnoliaceae, Poaceae, Liliaceae, Nelumbonaceae). У
представителей некоторых семейств апикальная зона нуцеллуса разрастается, образуя
клювовидный вырост, внедряющийся в микропиле (Euphorbiaceae, Rosaceae,
Trapaceae, Cucurbitaceae и др.). Типизация нуцеллуса, охватывающая все
многообразие его строения и поведения, до сих пор детально не разработана
(классифицированы лишь отдельные его элементы, например, археспорий). По степени
развития нуцеллуса Van Tieghem (1898) разделил семязачатки на два типа: крас-
синуцеллятные — с массивным многослойным нуцеллусом и тенуинуцеллят-
ные — с небольшим 1 —2-слойным нуцеллусом. Эти типы утвердились в
литературе, хотя они не имеют четких разграничений, и между ними существуют
разнообразные переходные формы (Schnarf, 1929; Eames, 1961; Кордюм, 1978; Bouman,
1984; и др.). Предлагалось также дополнительно учитывать период существования
нуцеллуса, число клеток археспория, наличие париетальных клеток, способность
клеток эпидермиса к периклинальным делениям, уровень заложения интегумента
и ряд других признаков (Tieghem van, 1901b; Asplund, 1920; Dahlgren, 1927a;
Schnarf, 1929; Maheshwari, 1950; Кордюм, 1978; Bouman, 1984; и др.). Davis (1966)
предложила использовать наличие или отсутствие париетальных клеток как
единственный критерий для разделения красен- и тенуинуцеллятных семязачатков. В
дополнение к 2 основным типам ею выделен «псевдокрассинуцеллятный» тип,
включающий нуцеллус без париетальной ткани, но с многослойным эпидермисом
в апикальной его части. На наш взгляд, предложенный ею подход к типизации
сложной структуры нуцеллуса является односторонним, так как принимает во
внимание строение только апикальной части нуцеллуса и противоречит
первоначальному пониманию его основных типов. Предложенная Кордюм (1978) сложная
классификация мегаспорангиев (см. стр. 145), учитывающая, главным
образом, участие слоев плаценты в их формировании и особенности археспория,
ограничена ранней стадией развития (периодом мегаспорогенеза) и поэтому не
является достаточно полной.
Поскольку утвердившиеся в литературе термины «крассинуцеллятный» и «те-
нуинуцеллятный» относятся к семязачатку, их использование в качестве
определения к нуцеллусу лингвистически не правомочно. Для наиболее полной
характеристики нуцеллуса предлагаем при сохранении его классических типов
учитывать дополнительные признаки, характеризующие особенности его строения и
развития.
I тип нуцеллуса. В крассинуцеллятных семязачатках нуцеллус можно
определить как толстостенный, массивный (nucellus crassus). Характеризуется
многослойной тканью стенки, сформированной эпидермисом и производными
субэпидермиса, образованными в результате его периклинальных делений. Содержит от
одной до нескольких спорогенных клеток, сохраняется в оплодотворенном
семязачатке в течение определенного периода эмбриогенеза. II тип. В
тенуинуцеллятных семязачатках нуцеллус тонкостенный, слаборазвитый (nucellus tenuis).
Характеризуется редукцией ткани стенки до одного или двух клеточных слоев —
эпидермиса и субэпидермиса, утратившего способность к периклинальным
делениям. Содержит обычно одну спорогенную клетку. Мегаспороцит и зародышевый
мешок, в случае их слабого роста, окружены с боков клетками производящего их
субэпидермального слоя, однако при интенсивном их росте — они выходят из гра-
136 Генеративные органы цветка
ниц субэпидермиса и оказываются окруженными только эпидермисом.
Тонкостенный нуцеллус разрушается в период мегагаметогенеза, в оплодотворенном
семязачатке не сохраняется.
К типовым характеристикам предлагаются дополнительные признаки,
относящиеся к различным аспектам развития нуцеллуса. А. Степень развития зон
нуцеллуса (микропилярной, латеральной, халазальной): значительная,
средняя, слабая, или полная их редукция. Б. Степень тканевой дифференциации:
наличие или отсутствие париетальной ткани, многослойного эпидермиса,
латеральной паренхимы, гипостазы, постамента и др. тканей). В.
Продолжительность существования нуцеллуса относительно стадий развития
репродуктивных структур: мегаспорогенеза, гаметогенеза, эмбриогенеза. Например, нуцеллус
Myriophyllum — массивного типа, с хорошо развитыми тремя зонами; в
микропилярной зоне дифференцируется нуцеллярный колпачок и париетальная ткань, в
халазальной зоне — проводящий тяж из удлиненных клеток; нуцеллус начинает
дегенерировать после стадии глобулярного проэмбрио. Нуцеллус Lathraea —
тонкостенного типа, халазальная зона не развита; дегенерирует на стадии 2—4-ядер-
ного зародышевого мешка.
Строение нуцеллуса изучено у большого числа видов на светооптическом
уровне и у небольшого числа видов на электронно-микроскопическом уровне.
Ультраструктурные исследования выявили меристематический характер клеток
растущего нуцеллуса, связь соседних клеток через плазмодесмы, а также специфику
развития разных типов нуцеллуса. Массивный нуцеллус, как правило,
гистологически дифференцирован: в нем выделяется эпидермис и паренхимная ткань.
У большинства цветковых эпидермис однослойный, т.к. его клетки делятся только
антиклинально. У некоторых видов они могут делиться периклинально, образуя
многослойный нуцеллярный колпачок (Polygalaceae,- Haloragaceae,
Asparagaceae и др.). Поверхность эпидермиса покрыта слоем кутикулы. В
процессе развития нуцеллус может дифференцироваться на ткани, различающиеся по
толщине клеточных стенок, составу органелл и характеру вакуолизации
цитоплазмы (Jensen, 1956c; De Boer-de Jeu, 1978; Noher de Halac, 1980; Wilms, 1980;
Плиско, 1980, 1982; Folsom, Cass, 1988; и др.). Однако, большая вариабельность в
строении тканей и отсутствие единой терминологии для их обозначения
затрудняют сравнительный анализ.
В микропилярной зоне нуцеллуса формируется париетальная ткань,
производная первичного археспория: она варьирует по числу слоев (от одного до 20 и
более) и у некоторых видов становится гетероморфной {Alcea rosea, Плиско,
1980). У представителей многих семейств (Hamamelidaceae, Malvaceae,
Chenopodiaceae, Sonneratiaceae и др.) формируется «тяж» из удлиненных клеток,
проходящих от микропиле до яйцевого аппарата, который служит для проведения
пыльцевой трубки.
В развитой халазальной зоне нуцеллуса некоторых таксонов
дифференцируется центральный тяж из удлиненных клеток (Saururaceae, Droseraceae) или в
отдельных случаях из трахеидоподобных клеток (Casuarinacae, Euphorbiaceae). У
Capsella (Schulz, Jensen, 1971) и Spinacia (Wilms, 1980) в халазальной зоне
выявлено два типа тканей: ближайшая к антиподам ткань состоит из толстостенных
клеток у первого рода и тонкостенных — у второго, содержащих в цитоплазме
хорошо развитый ЭР, большое число митохондрий и диктиосом и незначительное
число пластид с крахмалом и липидных капель. Клетки этой части нуцеллуса
постепенно сдавливаются и разрушаются растущим зародышевым мешком, в то
время как клетки основания нуцеллуса начинают активно делиться и формируют
«халазальную пролиферирующую ткань» в период раннего эмбриогенеза. В
халазальной зоне нуцеллуса у многих видов формируется морфологически отчетливо
Семязачаток
137
выраженная ткань, называемая гипостазой. У некоторых таксонов в период
развития зародышевого мешка может формироваться постамент в виде осевой части
основания нуцеллуса и подиум — в виде чашеобразного остатка основания
нуцеллуса.
В многослойной латеральной зоне нуцеллуса у ряда видов (Oenothera, Spinacia,
Alcea) происходит структурная дифференциация клеточных слоев на внутренние
и периферические (Noher de Halac, 1980; Wilms, 1980; Плиско, 1980,1982).
Предполагают, что преобразования, происходящие во внутренних слоях, связаны с их
более ранней дегенерацией. Однако, у Glycine max (Folsom, Cass, 1988) внутренняя
ткань нуцеллуса выделяется, начиная со стадии мегаспороцита, благодаря
утолщенным оболочкам, обилию рибосом в цитоплазме, многочисленным плазмодес-
менным связям клеток друг с другом и с ценоцитным гаметофитом. Эта ткань не
имеет сходства с дегенерирующими внутренними слоями других видов.
Дегенерация разных типов нуцеллуса существенно различается.
Многослойный нуцеллус, как правило, дегенерирует после оплодотворения на разных
стадиях развития зародыша (Papaveraceae, Polygalaceae, Malvaceae, Linaceae).
Обычно дегенерация начинается с внутренних клеточных слоев латеральной
зоны, прилегающих к зародышевому мешку (Alcea). Клетки микропилярной и
халазальной зоны нуцеллуса могут сохраняться значительно дольше, чем
латеральной (Sedum, Colhicum и др.). Показано, что начало дегенерации клеток нуцеллуса,
смежных с мегаспороцитом и молодым зародышевым мешком, может происходить
одновременно с активизацией клеточных делений в периферических слоях
нуцеллуса (Norstog, 1974; Tilton, Lersten, 1981; Willemse, De Boer-De Jeu, 1981).
Отмечено образование зоны лизиса, охватывающей несколько слоев нуцеллуса по
периферии развивающегося зародышевого мешка (Norstog, 1974; Плиско, 1981; и
др.). Дегенерации клеток нуцеллуса у Oenothera (Noher de Halac, 1980) и Alcea
(Плиско, 1982) предшествует аккумуляция в них запасных веществ (липидов,
полисахаридов, белков). Высказано предположение, что дегенерация нуцеллуса
происходит двумя путями (Плиско, 1982): 1) путем автолиза цитоплазмы и
скопления клеточных оболочек около стенки зародышевого мешка (Aquilegia, Alcea);
2) без автолиза цитоплазмы с исчезновением типичной клеточной оболочки
(Helianthus, Calendula, Hordeum, Oenothera). Предполагается, что у ряда
исследованных растений в автолизе цитоплазмы участвуют автофагические вакуоли,
лизосомы, мультивезикулярные тела, а также ЭР.
Тонкостенный нуцеллус (из 1—2 слоев клеток вокруг мегаспороцита) имеет,
как правило, короткий период развития. Его клетки бедны органеллами, не
содержат запасных веществ, дегенерируют обычно еще в неоплодотворенном
семязачатке, во время развития зародышевого мешка (большинство Sympetalae), хотя
известны некоторые исключения. Например, однослойный нуцеллус сохраняется
в зрелом семязачатке Sambucus и Gymnadenia. Разрушение нуцеллуса чаще всего
начинается с микропилярной зоны, затем оно захватывает среднюю зону, а
позднее — халазальную, остатки которой могут некоторое время сохраняться и после
оплодотворения, вокруг антипод. У отдельных таксонов (Impatiens, Reseda)
возможно утолщение оболочек в отмирающих клетках эпидермиса микропилярной
зоны, которые служат своеобразной запасающей тканью.
В нуцеллусе неоплодотворенного семязачатка могут накапливаться запасные
вещества в виде крахмала (Caryophyllaceae, Eupomatiaceae и др.), а также в
небольшом количестве липидные капли и белковые тела. У некоторых таксонов
(Piperaceae, Caryophyllaceae) нуцеллус является запасающей тканью для
прорастающего зародыша и сохраняется в зрелом семени в виде перисперма. Как
интенсивно растущий орган, нуцеллус содержит физиологически активные вещества
(аскорбиновую кислоту, SH-группы, гетероауксин). У разных видов растений от-
138 Генеративные органы цветка
мечены различия в составе веществ и их распределении в разных тканях нуцел-
луса. Например, у Lilium нуцеллус богат аскорбиновой кислотой, у Delphinium и
Cypripedium она не обнаружена; у Lilium гетероауксин выявлен во всем нуцеллусе,
а у Rosa только в халазальной зоне нуцеллуса Щингер, 1958). Гистохимические
исследования крассинуцеллятного семязачтка Nelumbo nucifera выявили
специализированные ткани в нуцеллусе, различающиеся по строению клеток и
концентрации нуклеиновых кислот (Vasilyeva et al., 1988). Наиболее высокая
концентрация НК отмечена в халазальной зоне нуцеллуса, более низкая — в
периферических слоях клеток микропилярной части нуцеллуса, самая низкая — в слоях
клеток, примыкающих к зародышевому мешку. Сведения о строении клеток
нуцеллуса у разных видов обобщены D'Amato (1984): у некоторых видов клетки
нуцеллуса диплоидные {Campanula), у большинства видов в них происходит эндо-
редупликация хромосом, уровень плоидности может варьировать (у Pedicularis —
8 п, у Cucumis — 16 п, у Daphne — 32 п, у Тгара — 256 п).
У некоторых таксонов клетки нуцеллуса оказываются способными к
формированию нуцеллярных зародышей, которые могут возникать во всех зонах
нуцеллуса (Euphorbiaceae, Роасеаё) или чаще в микропилярной зоне (Вихасеае,
Cactaceae, Anacardiaceae и др.), и затем врастать в зародышевый мешок.
Своеобразное поведение халазальной зоны нуцеллуса отмечено у
представителей Podostemaceae, у которых в результате локального разрушения клеток
нуцеллуса под развивающимся зародышевым мешком образуется ценоцитный ну-
целлярный плазмодий, выполняющий функции эндосперма (Mukkada, 1962).
Основной функцией нуцеллуса является формирование мегаспор и обеспечение
определенного периода развития женского гаметофита. О выполнении нуцеллу-
сом трофической и транспортной функции свидетельствуют пронизанные плазмо-
десмами клетки нуцеллуса, составляющие единый симпласт, наличие
специализированных структур между проводящим пучком в халазе и зародышевым
мешком (осевые ряды клеток, подиум, постамент, гипостаза, прокамбиальный тяж).
Транспортную функцию нуцеллуса подтверждает динамика Сахаров (Willemse,
Franssen-Verheijen, 1983). Экспериментально подтверждено, что вещества из
сосудистого пучка поступают в нуцеллус:у Zephyranthes изотопы С14 быстро
аккумулировались в слоях нуцеллуса, окружающих зародышевый мешок (Сое, 1954). В
настоящее время установлено, что зародышевый мешок в своем развитии
использует питательные вещества как из интактного, так и из разрушающегося
нуцеллуса.
Кроме того, массивный в микропилярной зоне нуцеллус выполняет функцию
проведения пыльцевой трубки и, возможно, обеспечивает ее рост. Есть
предположение о защитной роли нуцеллуса с толстостенными клетками (Чабан, Яковлев,
1974).
В разных таксонах развитие нуцеллуса имеет свои особенности, что
объясняется тесным взаимодействием между нуцеллусом и другими структурами
семязачатка: зародышевым мешком, интегументом, халазой и др. Поведение нуцеллуса,
очевидно, связано с особенностями развития и питания зародышевого мешка.
Например, ранняя дегенерация нуцеллуса коррелирует с формированием в интегу-
менте эндотелия, контактирующего с зародышевым мешком и эндоспермом.
Нуцеллус может замещать эндосперм в процессе развития зародыша
{Podostemaceae) или выполнять запасающую функцию в зрелом семени там, где
эндосперм развит слабо (Piperaceae).
Эволюционные преобразования нуцеллуса, как признано всеми
исследователями (см. Schnarf, 1929; и др.), происходили в направлении его редукции от
массивного центрального тела, в глубине которого развиваются множественные спо-
рогенные клетки, до небольшого бугорка, в котором единственный мегаспороцит
Семязачаток 139
развивается под покровом одного эпидермального слоя стенки. Редукция споро-
генной и соматической тканей могли не совпадать во времени, причем большую
роль в эволюции мегаспорангия могли иметь процессы стерилизации (Кордюм,
1978). Примеры прогрессивной редукции нуцеллуса можно найти не только у
представителей родственных семейств, но даже в пределах одного семейства
(Ranunculaceae, Caryophyllaceae, Liliaceae, Asparagaceae и др.), где отмечены как
крассинуцеллятные, так и тенуинуцеллятные семязачатки. Наиболее известным
примером постепенной редукции стерильной ткани нуцеллуса до нескольких
клеток эпидермиса являются представители семейства Apocynaceae (Guignard, 1917)
и Rubiaceae (Fagerlind, 1937). У них наблюдается эволюционный ряд от
морфологически выраженного нуцеллуса в виде центральной части семязачатка, до
нескольких клеток эпидермиса над мегаспороцитом, погруженным в халазальную
ткань семязачатка. Еще более глубокая редукция нуцеллуса, связанная с общей
редукцией семязачатка, наблюдается у представителей
высокоспециализированных семейств — Loranthaceae, Balanophoraceae, Viscaceae (Eames, 1961; Терехин,
1987a, 19876; и др.). Формирование мегаспор и женского гаметофита у них
происходит в глубине недифференцированной ткани плаценты или в тканях основания
завязи.
Строение нуцеллуса является константным систематическим признаком вида
и, часто, таксонов более высокого ранга, и рассматривается как показатель
эволюционного уровня морфогенетической организации семязачатка. В настоящее
время в ряде работ рассмотрено распределение типов нуцеллуса в системе
цветковых (Dahlgren, 1975, 1980; Камелина, 1991; и др.). Хорошо развитый
толстостенный нуцеллус характерен для большинства однодольных растений и части
двудольных, стоящих в основании системы цветковых; тонкостенный и рано
дегенерирующий нуцеллус — для более эволюционно продвинутых таксонов (Schnaf,
1929; Тахтаджян, 1964; и др.). Рис. 38.
Батыгина, 1974, 1987; Камелина, 1991; Кордюм, 1978; Никитичева, 1992; Плиско, 19716, 1980, 1982;
Поддубная-Арнольди, 1964,1976; Савченко, 1973; Тахтаджян, 1964; Терехин, 1987а, 19876; Терехин,
Яковлев, 1967; Цингер, 1958; Чабан, Яковлев, 1974; Шамров, 1990; Asplund, 1920; Bouman, 1984;
Brown, 1826b, Bruun, Olesen, 1988; Сое, 1954; Coulter, Chamberlain, 1903; D'Amato, 1984;
K.V.O.Dahlgren, 1927a; R.Dahlgren, 1975, 1980; Davis, 1966; De Boer-de Jeu, 1978; Eames, 1961; Ellis
Raymon, Chaffey, 1987; Fagerlind, 1937; Folsom, Cass, 1988; Fougere-Rifot, 1988; Goebel, 1933; Guignard,
1917; Hofmeister, 1861; Home, 1914; Jensen, 1965c; Maheshwari, 1950; Mirbel, 1829; Mukkada, 1962;
Netolitzky, 1926; Nikiticheva, 1992; Noher de Hadac, 1980; Norstog, 1974; Philipson, 1978; Rodkiewicz,
Bednara, 1976; Schnarf, 1929,1931;Schulz, Jensen, 1971,1986; Shamrov, 1992a; Vasilyevaetal., 1988; van
Tieghem, 1898, 1901b, Tilton, 1980a; Tilton, Lersten, 1981; Warming, 1878; Willemse, Bednara, 1979;
Willemse, De Boer-de-Jeu, 1981; Willemse, Franssen-Verheijen, 1983; Wilms, 1980.
ЭПИДЕРМИС НУЦЕЛЛУСА (греч. epi — на и derma — кожа + нуцеллус) —
поверхностный слой клеток нуцеллуса. Иногда это единственный слой стенки
мегаспорангия, окружающий материнскую клетку мегаспор (Orobanchaceae,
Orchidaceae, Acanthaceae). Снаружи эпидермис нуцеллуса покрыт слоем
кутикулы. Клетки эпидермиса связаны между собой и с клетками внутренних слоев
плазмодесмами. В случае однослойной стенки нуцеллуса плазмодесмы
обнаружены только на радиальных клеточных стенках, например, у Calendula (Плиско,
1982). Обычно клетки эпидермиса нуцеллуса делятся только антиклинально. У
ряда таксонов в микропилярной зоне они могут делиться периклинально. Такие
деления на ранней стадии развития семязачатка наблюдал Warming (1878) у
Aristolochia и Ficus, СТ. Навашин (1951) у Betula. Позднее периклинальные
деления эпидермальных клеток были отмечены у представителей многих семейств
(Aceraceae, Lauraceae, Rosaceae и др.). В эпидермисе латеральной зоны нуцеллуса
периклинальные деления встречаются реже, они обнаружены у некоторых видов
140
Генеративные органы цветка
из сем. Portulacaceae (Батыгина, 1983в), Maranthaceae (Камелина, 1990а, б),
Haemodoraceae (Алимова, 1990).
Ткань в апикальной части нуцеллуса, состоящая из нескольких слоев,
производных эпидермиса, имеющая вид колпачка над париетальной тканью или над
микропилярной частью зародышевого мешка, получила название нуцелляриого
колпачка. Такое понимание этого термина поддерживается большинством
современных исследователей (см. Davis, 1966; Bouman, 1984; «Сравнительная
эмбриология цветковых растений», 1981, 1983, 1985, 1987, 1990). Однако термин «нуцел-
лярный колпачок» употребляется и для обозначения всей апикальной части
нуцеллуса над зародышевым мешком (Eames, 1961; Савченко, 1973), особенно в тех
случаях, когда трудно проследить генезис эпидермальной и париетальной тканей.
Нуцеллярный колпачок может состоять из двух и более слоев. Степень его
развития является видоспецифическим признаком. Многослойный колпачок отмечен у
представителей семейств Caryophyllaceae, Calycanthaceae, Phytolaccaceae,
Rosaceae и др. Из нуцелляриого колпачка может формироваться эпистаза (van
Tieghem, 1901) — ткань с утолщенными оболочками, сохраняющаяся в зрелом
семени (Potamogetonaceae, Ranunculaceae).
В начале роста нуцеллуса эпидермис обычно имеет признаки меристемы и не
отличается от внутренней ткани. В процессе подготовки семязачатка к
оплодотворению и после его осуществления эпидермальные клетки нуцеллуса могут
заметно изменяться по форме, объему, характеру цитоплазмы, строению клеточных
оболочек. Чаще всего происходит растяжение эпидермальных клеток параллельно
поверхности нуцеллуса. Например, у Oryza sativa клетки эпидермиса
шестигранные, сильно вытягиваются по окружности развивающейся зерновки, их
антиклинальные стенки имеют ребристые утолщения (Ellis et al., 1987). Реже
эпидермальные клетки бывают вытянуты в радиальном направлении, перпендикулярно
поверхности нуцеллуса, что наблюдалось у Begonia (Анисимова, 19836) и Droseта
(Терехин, 1985). Эпидермис может приобретать вид секреторного слоя из
густоплазменных клеток, напоминающего интегументальный тапетум (Рараиег и
Roemeria из сем. Рараиегасеае — Ильина, 1981; Scilla из сем. Liliaceae —
Савченко, Комар, 1965; Melo и Cucumis из сем. Cucurbitaceae — Дзевалтовский, согласно
илл., 1983). Наибольшим изменениям подвергаются эпидермальные клетки
нуцеллуса в микропилярной его части. У некоторых растений несколько клеток на
вершине нуцеллуса сильно вытягиваются в направлении микропиле и
приобретают более плотную цитоплазму. Эта особенность отмечена у представителей
семейств Agavaceae (Tilton, Mogensen, 1979), Portulacaceae (Батыгина, 1983в),
Cactaceae (Наумова, 1983), Haloragaceae (Никитичева, 19856), Maranthaceae
(Камелина, 1990а) и др. и, вероятно, связана с проведением пыльцевой трубки.
Специфические изменения клеток эпидермиса в микропилярной зоне
нуцеллуса наблюдались в период оплодотворения у представителей сем. Piperaceae:
наружная клеточная стенка приобретает извилистый контур, увеличивая
поверхность их соприкосновения со смежными клетками интегумента (Никитичева и др.,
1981). В микропилярной части эпидермиса нуцеллуса у Reseda (Чабан, Яковлев,
1974) происходит утолщение клеточных стенок за счет отложения слизи, начиная
со стадии мегаспорогенеза. В цитоплазме клеток отмечены обильные диктиосомы,
хорошо развитый гранулярный ЭР и многочисленные вакуоли. К моменту
оплодотворения цитоплазма эпидермальных клеток полностью резорбируется и
замещается слизистыми веществами. В эпидермальном (и единственном) слое
нуцеллуса у Impatiens в период развития зародышевого мешка происходит сильное
утолщение клеточных стенок, сопровождающееся сжатием цитоплазмы (De Boer-
de-Jeu, 1978). Толстостенные клетки эпидермиса нуцеллуса, по предположению
выше указанных исследователей, возможно, участвуют в защите зародышевого
Семязачаток 141
мешка от давления со стороны пыльцевой трубки. Они могут также служить
дополнительным резервом питательных веществ.
Продолжительность существования эпидермального слоя нуцеллуса
различается у таксонов с разными типами семязачатка. В тенуинуцеллятных
семязачатках эпидермис, как единственный слой, дегенерирует еще до оплодотворения
(Orobanchaceae, Scrophulariaceae и др.). Встречаются, однако, и исключения.
Так, у Gymnadenia (Шамров, Никитичева, 1992) и Sambucus (Камелина и др.,
1987) он сохраняется и в зрелом семязачатке, в то время как для большинства
видов Orchidaceae и Caprifoliaceae характерна ранняя дегенерация
эпидермального слоя. В крассинуцеллятных семязачатках эпидермис обычно разрушается
после дегенерации внутренних тканей на разных стадиях развития семени.
Известны случаи, когда при разрушении большей части нуцеллуса может длительно
сохраняться микропилярная часть его эпидермиса над развивающимся
зародышем: это отмечено у некоторых видов Crassulaceae (Никитичева, 1985),
Resedaceae (Чабан, 1983), Berberidaceae (Капинос, Каграманова, 1966) и др. У
Ceratophylhim сохраняющийся в семени эпидермис нуцеллуса образует плотный
слой вокруг зародыша и, возможно, выполняет функцию покровов семени
(Шамров, Батыгина, 1988). Рис. 38.
Батыгина, 198Зв; Камелина, 1990а, б; Навашин, 1951; Никитичева и др., 1981; Плиско, 1982; Савченко,
1973; Чабан, Яковлев, 1974; Шамров, Батыгина, 1988, De Boer-de-Jeu, 1978; Ellis et al., 1987; Tilton,
1980a, Tilton, Mogensen, 1979; Warming, 1878.
ПАРИЕТАЛЬНАЯ ТКАНЬ НУЦЕЛЛУСА (лат. parietalis — париетальный,
постенный) — ткань в микропилярной зоне нуцеллуса, находящаяся под
эпидермисом и возникающая из париетальной (кроющей) клетки — производной
археспория. Париетальная клетка отделяется при периклинальном делении археспори-
альной клетки и может, в свою очередь, сформировать более или менее массивную
ткань в результате периклинальных и антиклинальных делений. С наличием
париетальной ткани большинство исследователей связывают определение красси-
нуцеллятного типа семязачатка (Asplund, 1920; Davis, 1966; и др.). Однако, эта
точка зрения является дискуссионной.
Наиболее интенсивный период формирования париетальной ткани обычно
совпадает с процессом мегаспорогенеза и развития зародышевого мешка
(Juncaginaceae, Polygalaceae, Smilacaceae). Наблюдается большое разнообразие в
числе слоев сформированной париетальной ткани у цветковых растений. Наличие
и степень развития париетальной ткани являются довольно устойчивым
таксономическим признаком.
Многослойная париетальная ткань (около 10 и более слоев) характерна для
многих семейств из порядков Magnoliates, Laurales, Casuarinales, Caryophyllales,
Paeoniales, Violates, Fagates и др. Массивная париетальная ткань может быть
дифференцирована на несколько структурно различающихся слоев клеток. Так,
между микропиле и яйцевым аппаратом может формироваться специализированная
«проводниковая ткань», состоящая из удлиненных клеток и служащая для
проведения пыльцевой трубки. Она соседствует с клетками паренхимного типа, что
показано на Alcea rosea (Плиско, 1980), Spinacia oleracea (Wilms, 1980) и других
видах.
В некоторых семействах присутствие париетальных клеток в нуцеллусе
нестабильно (Liliaceae, Alliaceae, Phormiaceae, Asparagaceae и др.): у одних видов они
формируются, у других — нет. Вероятно, в этих случаях нуцеллус находится в
состоянии эволюционной прогрессирующей редукции. У ряда видов париетальная
клетка отделяется, но вскоре разрушается (Houttuynia cordata, Никитичева,
1981а; Calathea louisae, Камелина, 19906). В таксонах с тенуинуцеллятными се-
142
Генеративные органы цветка
мязачатками археспорий не отделяет париетальную клетку (например, семейства
группы Sympetalae).
Общепринятым является представление о том, что эволюционные
преобразования нуцеллуса, в том числе и его париетальной ткани, происходили в направлении
постепенной редукции. Нуцеллус с многослойной париетальной тканью
рассматривается как более примитивный тип по сравнению с нуцеллусом, в котором
париетальная ткань редуцирована до одной клетки или отсутствует (Netolizky, 1926;
Schnarf, 1929; К. Dahlgren, 1928; Кордюм, 1978; и др.). Сравнительный анализ
структуры нуцеллуса представителей различных семейств цветковых растений
подтверждает это представление. Так, в семействах, стоящих на высоком
эволюционном уровне развития, париетальная ткань в нуцеллусе, как правило, отсутствует
(R. Dahlgren, 1980). Рис. 38.
Кордюм, 1978; Плиско, 1980; Савченко, 1973; Вошпап, 1984; К. Dahlgren, 1928; R. Dahlgren, 1980; Davis,
1966; Eames, 1961; Mukherjee, 1973; Schnarf, 1929; Warming, 1878; Wilms, 1980.
МЕГАСПОРОГЕНЕЗ — процесс, во время которого мегаспороциты проходят
мейоз, давая начало мегаспорам. Существует три типа мегаспорогенеза: моноспо-
рический, биспорический и тетраспорический.
Моноспорическое развитие характерно для большинства
покрытосеменных. Мегаспороцит после первого мейотического деления делится на две
клетки, называемые диадой, а после второго мейотического деления
образуются четыре мегаспоры. Одна из этих мегаспор, функциональная,
способна развиваться в зародышевый мешок. Три других — дегенерирующие
мегаспоры, подвергаются гидролизу и, вероятно, утилизируются
развивающейся функциональной мегаспорой. Функциональной мегаспорой может
становиться либо халазальная, либо микропилярная клетка тетрады: халазаль-
ное расположение характерно для Polygonum-типа развития зародышевого
мешка, микропилярное — для Oenothera-типа.
Бнспорическое развитие. Первое мейотическое деление приводит к
образованию диады, но после второго мейотического деления механизм цитокинеза
блокируется и клетки диады становятся двуядерными. Халазальная двуядерная
мегаспора является функциональной при Allium-типе развития зародышевого
мешка, микропилярная — при Endymion-типе.
Тетраспорическое развитие. Механизм цитокинеза в мегаспороците не
функционирует, вследствие чего мейоз приводит к образованию одной 4-ядерной
мегаспоры (ценомегаспоры), как у Lilium, Fritillaria, Plumbago и т. д.
Во время профазы I мейоза цитоплазма и клеточная стенка мегаспороцита
претерпевают структурные и биохимические изменения. Митохондрии и пластиды
дедифференцируются и становятся почти не различимыми, за исключением
видов, у которых пластиды в мегаспороцитах содержат крахмальные зерна
{Oenothera, Epipactis, Iris). Некоторые процессы, проходящие в профазе I
мегаспороцита, сходны с процессами, которые описаны в микроспорогенезе: ядерная
оболочка растягивается и образует везикулы, в ядрышке возникают нуклеоиды,
которые появляются в цитоплазме после метафазы I.
Изменения, происходящие в цитоплазме мегаспороцита, наиболее полно
изучены у Lilium. Отмечено значительное увеличение ЭР, совпадающее с ростом
мегаспороцита, который достигает примерно 200 мм в длину и 50 мм в ширину (это
один из самых больших мегаспороцитов у покрытосеменных). Цистерны ЭР
расположены пачками вблизи ядра, но позднее (в профазе I) они
перераспределяются в кольца, изолирующие участки цитоплазмы. Изолированные компартменты
цитоплазмы, по-видимому, защищены от сильного внешнего гидролитического
воздействия. Однако, гидролитические энзимы также присутствуют в кольцевид-
Семязачаток
143
ных цистернах (Rodkiewicz, Mikulska, 1965; Dickinson, Heslop-Harrison, 1977;
Fougere-Rifot, 1987; Kapil, Bhatnagar, 1981).
Распределение органелл. Пластиды и митохондрии в мегаспороците на
стадии ранней профазы I у орхидных сосредоточены в микропилярной зоне, а в
поздней профазе I равномерно распределены по всей цитоплазме, тогда как у
некоторых растений они сконцентрированы в халазальной зоне. Это приводит к
неравномерному делению мегаспороцита и образованию в дальнейшем халазальной
функциональной мегаспоры.
Пластиды в мегаспороцитах представителей сем. Onagraceae до мейоза аггре-
гированы в микропилярной и халазальной зонах, тогда как другие органеллы
распределены по всей цитоплазме. Во время мейотических делений пластиды
остаются в тех же зонах и оказываются соответственно в микропилярной и
халазальной мегаспорах линейной тетрады. Эти две мегаспоры у некоторых
Onagraceae способны развиваться в зародышевые мешки (Rodkiewicz, Bednara,
1986).
Оболочка мегаспороцита. Начиная с ранней профазы I новый компонент —
полисахарид каллоза — откладывается по всей стенке мегаспороцита моноспори-
ческого или биспорического типа развития. На стадии средней профазы I у
Oenothera каллоза исчезает в халазальной зоне мегаспороцитов. Каллозный слой
в халазальной стенке мегаспороцита у орхидных (Polygonum-тип зародышевого
мешка) становится перфорированным (ситоподобным). После первого и второго
мейотических делений мегаспороциты разделяются каллозными перегородками,
которые изолируют дегенерирующие мегаспоры (Rodkiewicz, Bednara, 1986).
Существует мнение, что у некоторых видов каллозная флуоресценция
отсутствует на полутонких препаратах мегаспороцитов. Однако, слабая флуоресценция
обнаруживается при обработке давленых препаратов этих мегаспороцитов
анилиновым синим реактивом на каллозу.
Согласно некоторым экспериментальным данным, каллозные оболочки не
проницаемы для молекул среднего и большого размера, следовательно,
мегаспороциты в профазе I и дегенерирующие мегаспоры изолируются от каких-то
факторов, присутствующих в ткани нуцеллуса. Изоляция усиливается также из-за
отсутствия или очень малого количества плазмодесм в боковых стенках
мегаспороцитов. Плазмодесмы очень многочисленны только на том полюсе мегаспороцита,
где развивается функциональная мегаспора (Bell, 1989). Имеется явное
соответствие между местом исчезновения каллозы в профазе I мегаспороцита и положением
функциональной мегаспоры в тетраде. Кроме того, эта часть стенки пронизана
плазмодесмами, а у некоторых растений формируется лабиринт оболочки.
Мегаспороциты и тетрады мегаспор являются сильно поляризованными системами, в
которых положение функциональных мегаспор детерминировано уже на ранних
стадиях развития (Willemse, Bednara, 1979; Rodkiewicz, Bednara, 1986). Рис. 39.
Bell, 1989; Bouman, 1984; Dickinson, Heslop-Harrison, 1977; Fougere-Pifot, 1987b; Kapil, 1981;
Maheshwari, 1950; Rodkiewicz, Bednara, 1986; Rodkiewicz, Mikulska, 1965; Willemse, Bednara, 1979.
АРХЕСПОРИЙ (греч. arche — начало и spore — спора) — клетка или несколько
клеток субэпидермального слоя апикальной области зачатка мегаспорангия
(нуцеллуса), производящая спорогенную и париетальную (кроющую) клетки или
дифференцирующаяся непосредственно в спорогенную клетку (мегаспороцит),
дающую начало спорам.
Археспорий формируется как в семязачатке (женский археспорий), так и в
пыльнике (мужской археспорий) и имеет много сходных черт в развитии. Впервые
он был описан Warming как «инициальные (материнские) клетки пыльцы»
(Warming, 1873), и как «инициальные (материнские) клетки зародышевого меш-
144
Генеративные органы цветка
ка» (Warming, 1878). «Инициальными клетками» становятся либо клетки субэпи-
дермального слоя, либо его внутренние производные после периклинальных
делений.
Goebel (1880) предложил назвать описанные Warming «инициальные клетки
спорообразующей ткани» спорангиев высших растений более кратко —
«археспорий». Первоначально он понимал его как «гиподермальную клетку, которая
отделяет тапетальную клетку», что следует из описания развития спорангия,
например, у лептоспорангиатных папоротников. Однако точного определения термина
он не дал, что явилось в дальнейшем причиной неоднозначного толкования
понятия «археспорий» как самим автором (Goebel, 1898—1901), так и другими
исследователями.
Schnarf (1929) полагал, что субэпидермальные клетки можно считать археспо-
риальными, когда они выделяются среди окружающих клеток и становятся
исходными клетками для развития зародышевого мешка. Очевидно, что в этом случае
под археспорием понимаются клетки субэпидермального слоя, которые
непосредственно трансформируются в материнские клетки мегаспор. В то же время
предложенное им описание типов археспория однозначно трактует археспорий как
субэпидермальные инициальные клетки, дающие начало спорогенному
комплексу (из 1 или нескольких клеток) и стерильной ткани стенки мегаспорангия
(кроющим клеткам) (I, II, III, IV — типы археспория).
Dahlgren (1928) различал первичные археспориальные клетки, которые
располагаются в субэпидермальном слое раннего семязачатка и преобразуются сразу
в материнские клетки зародышевого мешка, и вторичные археспориальные
клетки, которые образуются после отделения кроющих клеток клетками
субэпидермиса. Некоторые исследователи (Сладков, Гревцова, 1988, 1989) считают, что
субэпидермальные клетки в апикальной части нуцеллуса следует обозначать как
«инициальные клетки стенки спорангия и археспория», а термин «археспорий»
употреблять лишь для обозначения клеток, дающих начало только спорам.
Неоднозначное понимание термина «археспорий» могло возникнуть при
отсутствии полных данных о генезисе и сравнении различных стадий его развития.
Однако, определить археспорий (одноклеточный или многоклеточный) можно
только на первых этапах его развития, так как в дальнейшем в некоторых таксонах
(Casuarinaceae, Rosaceae, Ceratophyllaceae и др.) спорогенные клетки могут
делиться митотически.
От окружающих клеток нуцеллуса археспориальные клетки могут отличаться
более крупными размерами клеток и ядер, плотной цитоплазмой,
гистохимическими и ультраструктурными характеристиками. В цитоплазме археспориальной
клетки многих растений обнаружен высокий уровень содержания РНК и белков
(Петровская, 1955; Власова, Серебрякова, 1963; Panchaksharappa, Syamasundar,
1975; Bhandari et al., 1980; Shamrov, 1991; и др.). У некоторых растений
(Cypripedium insigne — Поддубная-Арнольди, 1959; Gentiana cruciata — Шамров,
1990г) в ней выявляются низкий уровень РНК и белков, но большое количество
крахмала. Ультраструктурные исследования (различные виды Dendrobium —
Israel, Sagawa, 1964) показали, что по сравнению с окружающими клетками в
цитоплазме археспориальной клетки увеличивается содержание митохондрий,
пластид и ЭР, появляются многочисленные липидные капли; постепенно исчезают
плазмодесмы. В любом случае они начинают удлиняться либо при
непосредственном превращении археспориальных клеток в спорогенные клетки, либо при
переходе к дифференцирующему периклинальному делению на париетальную и спо-
рогенную клетки. Второй способ характерен для большинства примитивных
семейств с массивным нуцеллусом, в котором спорогенные клетки оказываются под
париетальными клетками в глубине нуцеллуса. Первый способ связан с редук-
Семязачаток
145
цией (отсутствием) периклинальных делений и непосредственным
преобразованием субэпидермальной археспориальной клетки в спорогенную и в дальнейшем
в мегаспороцит. Он является более коротким путем развития мегаспороцита и
характерен для высокоспециализированных семейств с тенуинуцеллятным
семязачатком. В случае дифференциации нескольких археспориальных клеток,
возникшие спорогенные клетки могут далее делиться, благодаря чему увеличивается
число клеток одного типа ткани — спорогенной, клетки которой
трансформируются в мегаспороциты.
Классификация типов археспория впервые предложена Schnarf (1929): в
основу положено число его клеток и возможность их периклинальных делений на
кроющую и спорогенную. Им выделены 6 типов археспория. ВI, II и VI-типах
дифференцируется большое число археспориальных клеток: различие между типами
заключается в наличии дифференцирующих делений на спорогенные и кроющие (I,
II) или отсутствии таковых (VI). Единственная археспориальная клетка (III, IV,
V-типы) может отделять кроющую клетку (III, IV) или непосредственно
трансформироваться в мегаспороцит (V). Отмечены переходные состояния,
характеризующиеся заложением нескольких археспориальных клеток, но дальнейшим
развитием только центральной.
Во всех поздних классификациях (Поддубная-Арнольди, 1964, 1976; Кордюм,
1978; Камелина, 1991) использованы принципы, предложенные Schnarf и
расширено число примеров. Классификация археспория Сладкова и Гревцовой (1989)
основывается не на стадии археспория (в понимании Schnarf), а на стадии споро-
генных клеток перед их преобразованием в мегаспороциты.
Таким образом, анализируя имеющуюся литературу, считаем возможным
выделить два основных типа женского археспория: многоклеточный (Casuarinales,
Myricales, Paeoniales и др.) и одноклеточный (Ericales, Orchidales, Scrophulariales
и др.) Основной характеристикой как многоклеточного, так и одноклеточного
археспория является возможность дифференцирующего деления на париетальную и
спорогенную клетки. Каждый тип подразделяется на два подтипа: подтип А —
археспориальная клетка делится на париетальную и спорогенную клетки, подтип Б —
археспориальная клетка без дифференцирующего деления преобразуется в
мегаспороцит. Дальнейшие деления этих клеток, приводящие к увеличению их числа,
мы не считаем необходимым включать в классификацию археспория.
Основные положение относительно эволюции археспория были высказаны
Schnarf (1929, 1931) и подтверждены дальнейшими исследованиями (Maheshwari,
1950; Поддубная-Арнольди, 1964, 1976; Кордюм, 1968, 1978; и др.). Эволюция
археспория происходила в направлении редукции двумя разными путями и их
сочетанием: путем уменьшения числа археспориальных клеток и путем сокращения
числа делений производных археспория (кроющих и спорогенных) в период
развития от археспориальной клетки до материнской клетки мегаспор. Рис. 37.
Власова, Серебрякова, 1963; Камелина, 1991; Кордюм, 1968,1978; Петровская, 1955;
Поддубная-Арнольди, 1959, 1964, 1976; Сладков, Гревцова, 1988, 1989; Шамров, 1990г; Bhandari, 1980; Dahlgren,
1928; Goebel, 1880; 1898—1901; Israel, Sagawa, 1964; Maheshwari, 1950; Panchaksharappa, Syamasundar,
1975; Schnarf, 1929; 1931; Shamrov, 1991; Warming, 1873,1878.
СПОРОГЕННАЯ КЛЕТКА — инициальная клетка, производящая споры.
Формируется на ранней стадии развития семязачатка из субэпидермальной
археспориальной клетки двумя путями: либо в результате ее преобразований без деления,
либо после дифференцирующего деления на стерильную кроющую клетку и
спорогенную клетку.
Если археспорий характеризуется как меристематическая клетка, а
мегаспороцит — высокоспециализированная клетка с определенным состоянием ее обо-
10 Генеративные органы цветка.
146
Генеративные органы цветка
лочки, цитоплазмы и ядра, вступающего в мейоз, то спорогенной, на наш взгляд,
можно назвать клетку на любом этапе превращения археспориальной клетки в ме-
гаспороцит. Возможно, по этой причине в литературе отсутствуют четкие
морфологические критерии спорогенной клетки и слабо изучена ее структура. Спороген-
ные клетки могут делиться, образуя многоклеточную спорогенную ткань, однако
этот процесс трудно отделить от заложения многоклеточного археспория. В случае
заложения нескольких археспориальных клеток каждая из них или только часть
может становиться на путь развития спорогенной клетки. Многоклеточная споро-
генная ткань может быть представлена одним слоем клеток (Рараиегасеае,
Rubiaceae и др.) или несколькими слоями (Casuarinaceae, Lorantkaceae,
Paeoniaceae и др.). Точные данные о происхождении этих слоев отсутствуют.
Развитие спорогенной клетки в мегаспороцит сопровождается определенными
морфологическими изменениями. Клетка начинает выделяться от меристематических
клеток нуцеллуса большим размером, плотной цитоплазмой, крупным ядром,
более утолщенной оболочкой, потерей плазмодесм и подготовкой ядра к мейозу.
Строение мегаспороцита — конечной стадии развития спорогенной клетки,
хорошо изучено разными методами исследования. Некоторые исследователи не
делают терминологических различий между археспориальной, спорогенной и
материнской клеткой мегаспор (мегаспороцитом). Вероятно, это не противоречит
истине в том случае, когда археспорий преобразуется в спорогенную клетку, а
последняя в мегаспороцит без деления.
Единственная спорогенная клетка обычно развивается в однослойном нуцел-
лусе (семейства группы Sympetalae), но нередко и в многослойном нуцеллусе
(Haloragaceae, Scheuchzeriaceae, Cynomoriaceae и др.). Развитие двух и более
спорогенных клеток характерно для семязачатков с массивным многослойным ну-
целлусом (Caryophyllaceae, Paeoniaceae и др.).
Поддубная-Арнольди, 1964, 1976; De Boer-de-Jeu, 1978; Israel, Sagawa, 1964; Maheshwari, 1950;
Schnarf, 1929.
МЕГАСПОРОЦИТ — клетка спорофита, преобразующаяся после мейоза в
мегаспору, дающую начало женскому гаметофиту (зародышевому мешку). Синоним:
материнская клетка мегаспор. У диплоспорических апомиктов, однако,
зародышевый мешок развивается непосредственно из мегаспороцита, в котором механизм
мейоза подавлен.
Мегаспороцит образуется из археспориальной клетки, дифференцирующейся в
субэпидермальном слое нуцеллуса семязачатка. Археспориальные клетки
увеличиваются в размерах, удлиняясь вдоль оси микропиле-халаза. У одних видов они
вступают в мейоз и становятся мегаспороцитами. У других видов археспорий
сначала подвергается асимметрическому митозу, в результате которого наружу
отделяется маленькая — кроющая клетка, а внутрь большая клетка — мегаспороцит.
Мегаспороцит развивается в семязачатке, характеризующимся полярностью,
и сам обычно проявляет определенные свойства поляризации: удлиненная форма;
ядро, обычно смещенное к микропилярному полюсу; часто неравномерное
распределение органелл в цитоплазме и каллозы в стенке мегаспороцита. Необходимые
условия для индукции и осуществления мейоза имеются только в микропилярной
зоне нуцеллуса. Хотя природа мейотических индукторов все еще не известна,
механизм индукции является стабильным и хорошо сбалансированным, так как у
большинства видов только одна нуцеллярная клетка способна к мейозу. У
некоторых видов дифференцируется многоклеточная археспориальная ткань. В мейоз
вступает несколько мегаспороцитов, что может привести к образованию
нескольких тетрад мегаспор (Bouman, 1984; Fougere-Rifot, 1987b). Рис. 39.
Bouman, 1984; Fougere-Rifot, 1987b.
Семязачаток
147
ТЕТРАДА МЕГАСПОР (греч. tetra — четыре, megas — большой, spora —
спора, семя) — структура, образованная четырьмя гаплоидными клетками,
возникшими в процессе обоих делений мейоза мегаспороцита.
Из клеток археспория возникают материнские клетки мегаспор. Материнская
клетка мегаспор покрытосеменных, как и у разноспоровых плаунообразных,
папоротникообразных и голосеменных, претерпевает два последующих деления
мейоза, в результате чего, аналогично образованию тетрады микроспор,
появляется тетрада мегаспор с гаплоидным набором хромосом.
Мейоз при образовании мегаспор обычно происходит несколько позднее, чем
при образовании микроспор, но протекает он сходно с последним.
Образование перегородок между мегаспорами происходит последовательно.
Типы расположения тетрад: 1) линейный, 2) Т-образный, 3) обращенный
Т-образный, 4) квадратный, 5) тетраэдрический. При мегаспорогенезе, как и при микро-
спорогенезе, образуются каллозные оболочки, функции которых аналогичны (см.
Каллоза). Характерной особенностью мегаспоры, как и любой другой клетки, в том
числе и клетки археспория, является ее полярность, основанная на
разнокачественное™ цитоплазмы и ядра в верхней и нижней частях. Следствием полярности
клеток археспория и мегаспор является и полярность зародышевого мешка.
У большинства цветковых растений (в случае развития зародышевого мешка
по Polygonum-типу) возникают четыре клетки мегаспор, из которых нижняя
увеличивается в размерах и превращается в зародышевый мешок, а три верхние
отмирают.
Наряду с этим типом образования мегаспор имеются и другие: образование
трех, двух или только одной мегаспоры. В последнем случае материнская клетка
мегаспор непосредственно становится материнской клеткой зародышевого мешка.
Хотя обычно зародышевый мешок образуется из нижней мегаспоры, но иногда он
развивается из верхней или из срединных мегаспор. У всех Onagraceae и
некоторых Asteraceae зародышевый мешок возникает из верхней мегаспоры. Очень
редко, но все же наблюдаются такие случаи, когда зародышевый мешок образуется
из срединных мегаспор, как например, у Limnocharis emarginata, Aralia
racemosa и Colchicum autumnale. Развивающаяся дальше мегаспора с самого
начала своего возникновения отличается от неразвивающихся своими более
крупными размерами. Впоследствии эта разница еще более увеличивается благодаря
интенсивному росту ее за счет последних. Иногда развивающихся мегаспор
больше одной. У Phellodendron amurense наблюдалось прорастание всех мегаспор
тетрады, однако и в этом случае полностью развивается обычно лишь одна
мегаспора; один из развивающихся зародышевых мешков вытесняет все остальные,
которые дегенерируют на разных, но главным образом, на ранних стадиях развития
(Старшова, Солнцева, 1973).
Поддубная-Арнольди, 1976; Старшова, Солнцева, 1973; Яковлев, 1981: Bouman, 1984; Davis, 1966;
Johri, 1963; Kuran, 1972; Rembert, 1971; Rodkiewicz, 1970, 1978; Rodkiewicz, Bednara, 1976; Willemse,
1981; Willemse, de Boer-de Jeu, 1981.
КЛАССИФИКАЦИЯ ТИПОВ МЕГАСПОРАНГИЯ
МЕГАСПОРАНГИЙ (jpe4.megas — большой, spora — спора и angeion — сосуд,
вместилище) — орган бесполого размножения, в котором образуются мегаспоры.
У семенных растений многоклеточный мегаспорангий (нуцеллус) эуспорангиат-
ного типа гомологичен спорангиям других высших растений, окружен интегумен-
том или интегументами и расположен в центральной части формирующегося
семязачатка. Синонимы: макроспорангий.
10*
148
Генеративные органы цветка
Изучение дифференциации семязачатков у представителей различных
семейств покрытосеменных показало, что особенности строения мегаспорангия
связаны с количеством центральных клеток субэпидермиса (второго слоя туники),
количеством дифференцирующихся археспориальных клеток, интенсивностью
делений вегетативных, а в ряде случаев и спорогенных клеток субэпидермиса,
временем и местом возникновения интегументов, а также характером изгиба
семязачатка в целом. На основании этих особенностей предложена классификация
типов мегаспорангия (Кордюм, 1968, 1978). Группа А. Бугорок семязачатка
возникает на плаценте в результате антиклинальных (преимущественно) делений
клеток двух периферических слоев плаценты — эпидермального и субэпидер-
мального — и периклинальных и антиклинальных делений клеток глубжележа-
щих слоев. Таким образом, недифференцированный семязачаток состоит из
клеток двух слоев туники и клеток корпуса. Группа Б. Бугорок семязачтка возникает
на плаценте в результате антиклинальных делений клеток эпидермального слоя
плаценты и периклинальных делений клеток субэпидёрмального слоя.
Недифференцированный семязачаток образован клетками, производными одного
наружного слоя плаценты (туники) и субэпидёрмального слоя.
В группе А выделяется 5 типов. I тип — Casuarina. Несколько центральных
клеток второго слоя туники дифференцируются в первичные археспориальные
клетки, которые в результате периклинальных делений образуют париетальные
(кроющие) клетки, расположенные под эпидермисом, и вторичные
археспориальные клетки. Повторные периклинальные (и антиклинальные) деления
происходят и в соматических клетках, производных второго слоя туники, и в
париетальных клетках. Вторичные археспориальные клетки после 1—2-периклинальных
делений переходят к мейозу, т. е. становятся материнскими клетками мегаспор.
Периклинальные деления в эпидермисе, дающие начало интегументу,
начинаются ниже апикальных клеток корпуса (виды семейств Casuarinaceae, Corylaceae,
Hippocastanaceae, Lauraceae, Paeoniaceae, Rhamnaceae, Rosaceae и др.). В
зависимости от уровня заложения интегумента мегаспорангий содержит различное
количество клеток корпуса. II тип — Malabaila. Несколько центральных клеток
второго слоя туники дифференцируются в первичные археспориальные клетки,
которые непосредственно становятся материнскими клетками мегаспор.
Периклинальные деления в эпидермисе, дающие начало интегументу,
начинаются ниже апикальных клеток корпуса (виды Apiaceae, Brassicaceae, Rubiaceae). Ill
тип — Ribes. Только одна из центральных клеток второго слоя туники
дифференцируется в первичную археспориальную клетку; в результате ее периклинального
деления образуется париетальная и вторичная археспориальная клетка, которая
становится материнской клеткой мегаспор. Периклинальные (и антиклинальные)
деления происходят в соматических клетках — производных второго слоя туники,
и в париетальной клетке. Периклинальные деления в эпидермисе, дающие начало
интегументу, начинаются обычно на уровне апикальных клеток корпуса или
несколько ниже (виды семейств Magnoliaceae, Saxifragacae, Betulaceae,
Polygonaceae, Plumbaginaceae, Liliaceae, Amaryllidaceae, Chenopodiaceae,
Fabaceae, Myrtaceae, Portulacaceae, Caryophyllaceae, Urticaceae, Capparidaceae,
Zingiberaceae и др.). IV тип — Anisum. Только одна из центральных клеток
второго слоя туники дифференцируется в первичную археспориальную клетку,
которая без деления преобразуется в мегаспороцит. Периклинально делятся только
соматические клетки второго слоя туники. Деления в эпидермисе, дающие начало
интегументу, происходят на уровне апикальных клеток корпуса или первичной
археспориальной клетки (виды семейств Actinidiaceae, Ranunculaceae,
Papaveraceae, Apiaceae, Solanaceae, Boraginaceae, Gentianaceae, Poaceae,
Alismataceae, Hydrocharitaceae). V тип — Helianthus. Асимметрия семязачатка
Семязачаток
149
выражена на ранних этапах его дифференциации. Периклинально делятся все
центральные клетки второго слоя туники. Повторные деления происходят только
в одной паре клеток, причем, базальные клетки этой пары делятся в различных
направлениях, а апикальная, если делится — только периклинально, в
результате чего образуется ряд клеток, верхняя клетка которого становится материнской
клеткой мегаспор. Периклинальные деления клеток эпидермиса, дающие начало
интегументу, происходят на уровне апикальных клеток корпуса. В результате
этого формируется нуцеллус, состоящий из небольшого числа клеток эпидермиса и
клеток, производных второго слоя туники. Материнская клетка мегаспор только
в основании окружена клетками, производными второго слоя туники, в остальной
части — клетками эпидермиса (ряд видов семейств Asteraceae, Poaceae). VI—VII
типы относятся к группе Б. VI тип — Achillea. Недифференцированный
семязачаток состоит из однослойной туники и 3—5 слоев клеток, производных
субэпидёрмального слоя плаценты. Один-два ряда клеток верхушки семязачатка,
расположенных под эпидермисом, дифференцируются в археспориальные клетки,
которые непосредственно становятся материнскими клетками мегаспор.
Периклинальные деления в клетках эпидермиса, дающие начало интегументу, идут на
уровне основания археспориальных клеток или несколько ниже. Нуцеллус
формируется преимущественно из клеток эпидермиса и археспориальных клеток,
которые непосредственно становятся материнскими клетками мегаспор (ряд видов
семейства Asteraceae). VII тип — Antennaria. Недифференцированный
семязачаток состоит из однослойной туники и трех-четырех слоев клеток, производных
субэпидёрмального слоя плаценты. Верхушечная клетка центрального ряда
дифференцируется в археспориальную клетку, которая непосредственно становится
материнской клеткой мегаспор. Периклинальные деления клеток эпидермиса,
дающих начало интегументу, происходят на уровне основания археспориальной
клетки (виды семейства Asteraceae). VIII тип — Himantoglossum.
Недифференцированный семязачаток состоит из однослойной туники и одного ряда клеток,
производных субэпидёрмального слоя плаценты. Верхняя клетка субэпидермиса
дифференцируется в археспориальную клетку. Периклинальные деления в
клетках эпидермиса, дающие начало интегументу, происходят на уровне основания
археспориальной клетки или несколько ниже. Археспориальная клетка,
окруженная только эпидермисом, непосредственно становится материнской клеткой
мегаспор (виды семейства Orchidaceae).
Наличие тесных корреляций между развитием мегаспорангия и уровнем
заложения интегументов является одной из причин разнообразия мегаспорангиев
покрытосеменных растений по сравнению с голосеменными, у которых интегумент
на ранних этапах формирования семязачатка всегда свободен от мегаспорангия.
Поскольку деление семязачатков на крассинуцеллятные, тенуинуцеллятные (van
Tieghem, 1898) не отражает многих особенностей их строения, целесообразно
давать более общую характеристику мегаспорангия покрытосеменных, не
ограничиваясь указанием на наличие или отсутствие париетальных клеток, и обязательно
включая характеристику археспория (одноклеточного или многоклеточного). При
этом повысится таксономическая ценность характеристики мегаспорангия.
Для определения типа мегаспорангия необходимо изучать его формирование с
самых ранних этапов, вплоть до стадии тетрады мегаспор и образования
одноядерного зародышевого мешка. В дальнейшем уже более четко выступают
особенности морфологии семязачатка, связанные со специализацией и формированием
женского гаметофита. В строении же собственно мегаспорангиев более отражено
направление прогрессивной эволюции, чем специализации. Об этом
свидетельствует и факт, что тот или иной тип мегаспорангия не зависит от основных типов
семязачатка (атропный, гемитропный, кампилотропный, амфитропный). Так, III
150
Генеративные органы цветка
тип мегаспорангия описан у видов с различными типами семязачатков (атроп-
ный — у Urticaceae, анатропный — у Magnoliaceae, кампилотропный — у
Caryophyllaceae, амфитропный — у Chenopodiaceae, гемитропный — у
Primulaceae). Таким образом, особенности строения мегаспорангаев относятся к
числу надежных таксономических признаков. В качестве исходного,
примитивного типа мегаспорангия рассматривают крупный с многослойной стенкой,
содержащей париетальную ткань, и многоклеточным археспорием (I тип). В мегаспоран-
гиях этого типа обычно имеются и клетки корпуса. Дифференциация археспори-
альных клеток сходна с таковой в микроспорангиях: (несколько центральных
клеток второго слоя туники приобретают черты первичных археспориальных
клеток, которые в результате периклинальных делений образуют париетальные и
вторичные археспориальные клетки, способные к одному или нескольким мито-
тическим делениям). Эволюция мегаспорангия шла в направлении редукции как
соматической, так и спорогенной его частей, причем оба направления в редукции
мегаспорангия могли не совпадать во времени. Большую роль в эволюции
мегаспорангия, по-видимому, играли процессы стерилизации. Один и тот же более
подвинутый в эволюционном отношении тип мегаспорангия мог возникнуть из
различных более примитивных типов. В качестве наиболее продвинутых типов мегас-
IV тип - Anisum
Подтипы - Scopolia,
Vincetoxicum
VIII тип - Himantoglossum
II тип - Malobaila ^. ■—
Подтип - Asperula „, тм . Ribes
VII тип - Antennaria
V тип - Helianthus
VI тип - Achillea
I тип - Casuarina
порангиев рассматриваются IV, VII и VIII типы, характеризующиеся однослойной
стенкой, одноклеточным археспорием и отсутствием париетальных клеток. Эти
типы мегаспорангиев описаны большей частью в семействах, имеющих ряд
признаков прогрессивной организации. Рис. 40.
Кордюм, 1968,1978;Поддубная-Арнольди, 1964,1976;Bouman, 1984; Schnarf, 1929; Tieghem van, 1898.
ИНТЕГУМЕНТЫ
ИНТЕГУМЕНТ (фр. in — не и tegument — оболочка) — структура семязачатка,
окружающая мегаспорангий (=нуцеллус). Синоним: покров. Интегумент был
описан в семени впервые под названием «наружная мембрана» (Grew, 1672; Malpighi,
1675). Более подробные исследования строения семязачатка (Brown, 1818, 1826b,
1834) позволили выделить в нем две «мембраны», или «оболочки» (фр. tegument).
Было высказано предположение, что истинной мембраной является только внут-
Семяэачаток
151
ренняя. Наружная мембрана является дополнительной и как бы «покрывает»
развивающийся семязачаток; ей и было дано название «интегумент». В дальнейшем
(Schleiden, 1837) термином «интегумент» стали обозначать обе мембраны
семязачатка, выделяя наружный и внутренний интегументы.
Семязачатки цветковых растений различаются по числу интегументов: битег-
мальные (двупокровные) — почти у всех однодольных и многих двудольных,
унитегмальные (однопокровные) — преимущественно у спайнолепестных из
двудольных и атегмальные (беспокровные) — у некоторых паразитных
растений (например, Misodendraceae и некоторые Olacaceae). Среди цветковых
растений битегмальные семязачатки обнаружены в 237 семействах, а унитегмальные
— в 114 (Камелина, 1991). Интегумент (или интегументы) могут быть развиты в
разной степени. Крайняя степень его редукции до инициальных клеток
характерна для ряда паразитных растений (например, Santalaceae — Ram, 1959a,b; Raj,
1970; некоторые Gentianaceae — Figdor, 1897; Bouman, Louis, 1989). Полное
отсутствие интегумента наблюдается только в недифференцированном семязачатке. У
некоторых цветковых растений было описано три интегумента и даже четыре.
Третьим интегументом некоторые исследователи (Gaertner, 1788; Warming, 1878;
Corner, 1954; и др.) считают ариллус, а четвертым — средний интегумент,
описанный у Annonaceae (Corner, 1949a). Большинство авторов (Schweiger, 1905;
Александров, 1954; Имс, 1964; Комар, 1973; и др.) ариллус рассматривают не в
качестве новообразования, а как специализацию отдельных структур уже
сформированного семязачатка.
Внутренний интегумент (лат. internus — внутренний + интегумент) —
проксимальный по отношению к нуцеллусу покров в битегмальных семязачатках. У
однодольных он, как правило, 2—3-слойный. Однако у ряда двудольных
внутренний интегумент может состоять из большего числа слоев клеток: 4—5
(Burseraceae, Stachyuraceae) или 7—10 (Neuradaceae). Его клетки могут
становиться инициальными клетками соматических зародышей (эмбриодов)
(Orchidaceae, Ochnaceae, Celastraceae — Afzelius, 1928; Chiarugi, Francini, 1930;
Copeland, 1966; Наумова, 1970, 1983). В процессе развития у одних таксонов
(Polygonaceae, Zingiberaceae) внутренний интегумент разрушается полностью, у
других (Amaranthaceae, Berberidaceae) он образует тегмен семени.
Наружный интегумент (лат. externus — наружный + интегумент) — дис-
тальный по отношению к нуцеллусу покров в битегмальных семязачатках. Его
толщина варьирует: от 2 (Papaveraceae, Saururaceae, некоторые Liliaceae) до 20—
25 слоев (Paeoniaceae, некоторые Nymphaeaceae). У представителей почти 80
семейств двудольных и однодольных растений (Bouman, 1984) в нем
дифференцируется проводящий пучок: простой (Hemerocallidaceae, Magnoliaceae) или
разветвленный (Connaraceae, Meliaceae), доходящий до уровня микропиле
(Савченко, Комар, 1965; Boesewinkel, Bouman, 1984). В процессе созревания
семени наружный интегумент у большинства видов преобразуется в тесту.
По мере роста интегумент постепенно окружает нуцеллус. На верхушке
семязачатка свободные края интегумента формируют канал для прохождения
пыльцевой трубки в зародышевый мешок — микропиле. Обычно микропиле
образовано внутренним интегументом. Иногда в его формировании участвуют оба
интегумента: внутренний образует эндостом, а наружный — экзостом. В
обращениях семязачатках, как правило, происходит конгенитальное срастание
части интегумента с фуникулусом с образованием рафе.
Интегументы могут дать начало различным структурам: обтуратору (оба
интегумента) , оперкулуму (внутренний интегумент), ариллоиду (наружный
интегумент) , интегументальному тапетуму (внутренний или единственный
интегументы). В интегументе (единственном или наружном) может дифференциро-
152
Генеративные органы цветка
ваться один и более проводящих пучков (см. ПРОВОДЯЩАЯ СИСТЕМА
СЕМЯЗАЧАТКА).
В битегмальных семязачатках первым, как правило, развивается внутренний
интегумент. У отдельных таксонов сначала возникает наружный интегумент
(Euphorbiaceae) либо наблюдается одновременная дифференциация обоих инте-
гументов Ципсасеаё). Интегументы закладываются в виде валиков, что уже видно
из первых иллюстраций Mirbel (1829) по генезису семязачатка, и обычно
возникают за счет периклинальных делений эпидермальных либо субэпидермальных
инициалий примордия семязачатка (Warming, 1878). В области формирующегося
интегумента выявляется зона (обычно 1 —2-слойная) активно делящихся клеток,
отличающихся от окружающих клеток крупными размерами и часто большими
ядрами. В исключительных случаях (например, Ceratophyllaceae — Шамров,
ориг.) эти деления происходят как в эпидермальном, так и субэпидермальном
слоях. У некоторых таксонов (Brassicaceae — Roth, 1957; Iiliaceae — Bouman, 1971;
Orchidaceae — Шамров, Никитичева, 1992) интегумент может быть образован
только наружными производными эпидермальных инициалей, тогда как обычно
в построении интегумента участвуют все производные инициалей. Внутренний
интегумент почти всегда имеет эпидермальное (Warming, 1878; Bouman, 1974; и др.),
а наружный, так же как и единственный, либо эпидермальное происхождение
(Netolitzky, 1926; Шамров, 1990г; Шамров, Анисимова, 1993), либо субэпидер-
мальное (Warming, 1878; Pechoutre, 1902; Bouman, 1974; и др.). Характер
заложения интегумента может служить таксономическим признаком (Bouman, 1984).
В многослойных интегументах различают эпидермис и паренхиму. Обычно
образование многослойного интегумента происходит за счет периклинальных
делений клеток среднего слоя (или средних слоев). В некоторых случаях в этом
участвуют также периклинальные деления клеток эпидермиса с наружной
(Cucurbitaceae) либо внутренней (Magnoliaceae) стороны, либо с обеих сторон
одновременно (Paeoniaceae). Семязачатки с многослойными интегументами
описаны как у примитивных, так и у более высокоорганизованных таксонов. Так,
многим примитивным таксонам (Calycanihaceae, Magnoliaceae, Myristicaceae)
присущи многослойные, а более продвинутым таксонам (Didieraceae, Caryophyllaceae)
— 2—3-слойные интегументы. С другой стороны, ряд таксонов в основании
системы цветковых растений (Aristolochiaceae, Papaveraceae, Saururaceae)
характеризуются 2—3-слойными интегументами, а таксоны более высокого уровня
системы (Elaeagnaceae, Rhamnaceae, группа спайнолепестных растений) имеют
многослойные интегументы. Единственный интегумент, как правило, более
массивный, чем интегументы в битегмальных семязачатках.
Вопрос о филогенетической значимости многослойности интегумента остается
дискуссионным. Этот признак рассматривается одними авторами как исходный
(Bouman, 1974; Boesewinkel, 1981; Goldberg, 1986), а другими — как вторичный
(Netolitzky, 1926; Савченко, 1973). Эволюционное становление интегумента,
вероятно, следует рассматривать в связи с сопряженно развивающимися другими
структурами семязачатка, а также с особенностями строения семенной кожуры,
способом диссеминации и прорастания.
Число интегументов в семязачатке является характерным таксономическим
признаком вида, рода и часто — семейства. В некоторых семействах (Fagaceae,
Monimiaceae, Piperaceae, Rosaceae) встречаются виды как с одним, так и с двумя
интегументами. Наличие в семязачатке двух интегументов считается
примитивным признаком. Эволюционный переход от би- к унитегмальности происходил,
вероятно, многократно и гетерохронно в самых разных ветвях системы
покрытосеменных (Имс, 1964; Тахтаджян, 1948, 1964; Bouman, 1984). Предполагают
(Coulter, Chamberlain, 1903; Тахтаджян, 1948, 1964; Bouman, 1974; Bouman, Callis,
Семязачаток
153
1977; Bouman, Schrier, 1979; Bouman, 1984; и др.) три пути перехода к
унитегмальности. 1) Утрата одного из интегументов в результате задержки или полного
подавления его развития (некоторые Hydnoraceae, Piperaceae, Rafflesiaceae,
Rutaceae). 2) Конгенитальное срастание зачатков двух интегументов в одну
общую структуру, при этом оба интегумента имеют одинаковое происхождение
(Anacardiaceae, Balsaminaceae). 3) Элиминация зачатка внутреннего
интегумента эпидермального происхождения в тех семязачатках, где наружный интегумент
имеет субэпидермальное происхождение (некоторые Ranunculaceae). Возможен
еще один путь становления единственного интегумента семязачатка — сближение
инициалей двух интегументов различного происхождения, в результате чего
апикальная часть интегумента формируется за счет эпидермальных инициалей, а его
средняя и базальная части — за счет субэпидермальных инициалей
(Ceratophyllaceae — Шамров, ориг. данные).
Защитная функция является основной функцией как интегумента, так и его
производного — семенной кожуры. Кроме того, в интегументе накапливаются
различные вещества (крахмал, белки, липиды), в связи с чем он участвует в питании
зародышевого мешка, а после оплодотворения — в питании развивающегося
зародыша.
Вопросы происхождения и гомологии интегумента до сих пор широко
дискутируются. Наибольшей поддержкой пользуется синангиальная гипотеза (Benson,
1904; Benson, Welsford, 1909) и ее теломный вариант (Козо-Полянский, 1948; Кре-
четович, 1952; Walton, 1953; Meeuse, 1963; и др.). Согласно этой гипотезе,
семязачаток рассматривается как синангий, или синтелом. Интегумент представляет
собой трансформированный периферический стерильный мегаспорангий, или
телом, окружающий центральный мегаспорангий, который сохранил свою
первоначальную функцию и преобразовался в нуцеллус. Существует иная точка зрения,
согласно которой из двух покровов семязачатка лишь внутренний является
настоящим интегументом, соответствующим единственному интегументу
голосеменных; наружный интегумент покрытосеменных имеет не спорангиальное, а
листовое происхождение. Предполагают, что он произошел из купулы — особого
покрова ^ окружающего семязачаток семенных папоротников, вероятных предков
цветковых растений (Stopes, 1905; Walton, 1953; Тахтаджян, 1964, 1980; Stebbins,
1974; Красилов, 1989; и др.). Рис. 41.
Александров, 1954; Имс, 1964; Камелина, 1991; Козо-Полянский, 1948; Комар, 1973; Красилов, 1989;
Кречетович, 1952; Наумова, 1970, 1983; Савченко, 1973; Савченко, Комар, 1965; Сладкое, Гревцова,
1989; Тахтаджян, 1948,1964,1980; Шамров, 1990г; Шамров, Анисимова, 1993; Шамров, Никитичева,
1992; Эзау, 1980; Afzelius, 1928; Benson, 1904; Benson, Welsford, 1909; Boesewinkel, 1981; Boesewinkel,
Bouman, 1984; Bouman, 1971, 1974, 1984; Bouman, Callis, 1977; Bouman, Louis, 1989; Bouman, Schrier,
1979; Brown, 1818, 1826, 1834; Chiarugi, Francini, 1930; Copeland, 1966; Corner, 1949a, 1954, 1976;
Coulter, Chamberlain, 1903; Figdor, 1897; Gaertner, 1788; Goldberg, 1986; Grew, 1672; Malpighi, 1675;
Meeuse, 1963; Mirbel, 1829; Netolitzky, 1926; Pechoutre, 1902; Raj, 1970; Ram, 1959а,в; Roth, 1957;
Schleiden, 1837; Schweiger, 1905; Stebbins, 1974; Stopes, 1905; Walton, 1953; Warming, 1878.
ЭПИДЕРМИС ИНТЕГУМЕНТА (греч. epi- на и derma- кожа + интегумент) —
поверхностный слой клеток интегумента семязачатка. Клетки эпидермиса на
ранних стадиях развития семязачатка, как правило, небольших размеров, изодиамет-
рические, тонкостенные, с ядром, располагающимся в центре. У ряда таксонов
(Plantaginaceae, Polemoniaceae) сильное увеличение размеров клеток эпидермиса
происходит после оплодотворения (у Plantaginaceae в 60—80 раз). Оно
сопровождается утончением клеточных оболочек (Hyde, 1970) либо выпрямлением их
наружных и радиальных стенок (Жукова, 1987), а также увеличением размеров ядра
и ядрышка и изменением в распределении органелл. Согласно ультраструктурным
исследованиям они характеризуются признаками меристематических клеток: на-
154
Генеративные органы цветка
личие вакуолей, плотной гиалоплазмы с многочисленными рибосомами и слабое
развитие ЭР (Васильев, Плиско, 1971а; Плиско, 1971а). К стадии образования
зародышевого мешка клетки эпидермиса увеличиваются в размерах, вакуолизи-
руются, при этом ядро смещается к наружной тангентальной стенке. Их
радиальные стенки пронизаны плазмодесмами, более многочисленными в наружном инте-
гументе. Специализация клеток эпидермиса сопровождается исчезновением плаз-
модесм на внутренних тангентальных стенках (Mogensen, 1973; Wilms, 1980;
Belyaeva, 1983; и др.). По мере развития клетки эпидермиса с наружной стороны
интегумента часто приобретают утолщения оболочек и могут вытягиваться в тан-
гентальном (Begoniaceae, Datiscaceae, Gentianaceae) либо радиальном
(Grossulariaceae, Solanaceae) направлении, принимая вид столбчатой ткани. У
большинства растений они сохраняются и входят в состав семенной кожуры. В
наружном интегументе (Amaryllidaceae, Liliaceae и др.) имеются устьица
(Петрова, 1977).
Клетки эпидермиса интегумента (или интегументов) покрыты кутикулярной
пленкой. При тесном соприкосновении интегументов друг с другом или с нуцел-
лусом кутикулярные пленки могут сближаться, образуя неоднородную по
строению кутикулу, сохраняющуюся обычно в зрелом семени. В клетках эпидермиса
могут накапливаться различные вещества: крахмал, танины, кристаллы оксалата
кальция. У некоторых таксонов клетки эпидермиса с наружной стороны
(единственного у Plantaginaceae, наружного у Juncaceae) на конечных стадиях развития
семени заполняются слизистыми веществами полисахаридной природы. Процесс
выделения секрета сопровождается исчезновением крахмала и постепенной
дегенерацией протопласта (Hyde, 1970; Шамров, ориг. данные). Рис. 41.
Васильев, Плиско, 1971; Жукова, 1987; Петрова, 1977; Плиско, 1971а; Савченко, 1973; Савченко,
Комар, 1965; Шамров, 1990г; Belyaeva, 1983; Hyde, 1970; Mogensen, 1973; Netolitzky, 1926; Wilms, 1980.
ИНТЕГУМЕНТАЛЬНЫЙ ТАПЕТУМ (лат. tapetum integumentale — тапетум,
выстилающий слой интегумента) — часть эпидермальной ткани интегумента со
стороны зародышевого мешка. Термин был введен Palm (1915). Синонимы:
эндотелий, эпителий, эндодермис. Наибольшее распространение из синонимов в
современной литературе получил термин эндотелий, введенный Schwere (1896).
Интегументальный тапетум формируется, как правило, в тенуинуцеллятных
семязачатках: обычно унитегмальных (большинство Sympetalae), реже битегмаль-
ных (из внутреннего интегумента, например, Primulaceae, некоторые Linaceae).
Он обнаружен также в крассинцеллятных семязачатках с эфемерным нуцеллусом:
унитегмальных (Alangiaceae, Davidiaceae, Griselliniaceae) или битегмальных
(например, некоторые linaceae). Формирование интегументального тапетума
характерно для многих семейств двудольных растений, среди однодольных он
обнаружен только в 7 семействах (Лгасеае, Агесасеае и др.).
Эндотелий имеет ряд общих и специфических для каждого таксона черт. Он
формируется в результате преобразований эпидермиса интегумента в клетки
секреторного типа со стороны нуцеллуса (позднее контактирует с зародышевым мешком) и
представляет собой слой секреторных клеток. В редких случаях, когда эпидермис
интегумента рано разрушается, эндотелий может формироваться из субэпидер-
мального слоя (например, у Melampyrum из сем. Scrophulariaceae) (Arekal, 1963;
Никитичем, 1979а).
Дифференциация эндотелия происходит в период интенсивного роста
интегумента: обычно на стадии мегаспорогенеза выявляется упорядоченность и
однотипность его клеток. Их форма, сначала изодиаметрическая, в процессе развития
меняется относительно продольной оси зародышевого мешка: у большинства
таксонов клетки вытягиваются перпендикулярно, у некоторых (Asteraceae,
Семязачаток 155
Gentianaceae и др.) — параллельно; иногда клетки интегументального тапетума
сохраняют изодиаметрическую форму (Lathraea из сем. Scrophlariaceae). У
некоторых видов клетки однослойного эндотелия в процессе его развития становятся
неоднородными: группа мелких клеток чередуется с более крупными клетками,
что может приводить в дальнейшем к руминации эндосперма (виды трибы
Verbasceae из сем. Scrophulariaceae).
По ультраструктурным признакам выделены три стадии развития
интегументального тапетума (на примере Calendula officinalis — Васильев, Плиско, 1971а). В
период развития зародышевого мешка клетки эндотелия имеют палисадную
форму, содержат мелкие вакуоли и обладают признаками меристематических
клеток (слабое развитие эндоплазматического ретикулума, высокая плотность
гиалоплазмы, обилие свободных рибосом) (1 -ая стадия). В период зрелого
зародышевого мешка клетки эндотелия несколько уплощаются вдоль его поверхности и
характеризуются признаками дифференцирующихся клеток (исчезновение
типичных вакуолей, уплотнение гиалоплазмы, развитие обильного гранулярного ЭР,
активного аппарата Гольджи и обилие рибосом) (2-ая стадия). Во время
эмбриогенеза эндотелий характеризуется растяжением его клеток в тангентальном
направлении, сильной их вакуолизацией и приобретением черт строения, обычных
для дифференцированных паренхимных клеток (3-я стадия). Сходные
структурные изменения в клетках эндотелия в ходе развития зародышевого мешка описаны
также для других видов (Newcomb, 1973a,b; Жукова, 1987; Went van, 1989; и др.).
Обычно эндотелий однослойный, но у некоторых представителей семейств
Asteraceae, Оrobanchaceae и Gentianaceae он многослойный (Schnarf, 1929; Tiagi,
1965; Шамров, 1990г).
Наблюдаются вариации в протяженности интегументального тапетума вдоль
зародышевого мешка у представителей разных семейств, и в пределах одного
семейства {Ericaceae, Gesneriaceae, Asteraceae, Scrophulariaceae и др.): он может
быть развит по всей длине зародышевого мешка или только на определенном его
уровне, окружая центральную или халазальную, реже микропилярную его часть.
Вероятно эти особенности эндотелия скоррелированы со строением эндосперма и
его гаусториев (Никитичева, 19796).
Клетки эндотелия, как правило, одноядерные, лишь у отдельных таксонов
{Asteraceae, Balanitaceae, Solanaceae) они двуядерные или многоядерные; ядра
могут быть полиплодными. Высокая плоидность ядер в клетках эндотелия
отмечена у Pedicularis palustris (Steffen, 1955). Как показали ультраструктурные
исследования, клетки интегументального тапетума связаны между собой
многочисленными плазмодесмами, пронизывающими радиальные стенки и, таким образом, весь
слой эндотелия образует единый симпласт (Vazart В., Vazart J., 1965; Васильев,
Плиско, 1971; Жукова, 1987; Went van, 1989 и др.). В тангентальных стенках со
стороны интегументальной паренхимы плазмодесм меньше, а со стороны
зародышевого мешка они не обнаружены. На поверхности клеток эндотелия, т.е. между инте-
гументом и зародышевым мешком, образуется слой кутикулы, первоначально
сплошной, а ко времени созревания зародышевого мешка — прерывистый. В
процессе развития семени тангентальные и радиальные стенки клеток эндотелия могут
приобретать вторичные утолщения разного состава. Обычно наиболее утолщены
тангентальные стенки, граничащие с зародышевым мешком, которые у Impatiens
walleriana (Went van, 1989) пропитаны электронно-плотным веществом, возможно,
спорополленином. У Nymphoides humboldianum (Батыгина, Колесова, 1987) более
утолщенными являются радиальные стенки клеток. У некоторых растений (Vicia,
Lathyrus из сем. Fabaceae) клетки эндотелия характеризуются признаками
передаточных клеток, о чем свидетельствует наличие выростов тангентальных
клеточных стенок (Gunning, Pate, 1974). Обнаружено, что у Petunia kybrida (Esser, 1963)
156
Генеративные органы цветка
опыление стимулирует отложение в оболочках клеток интегументального тапетума
каллозы, которая исчезает после оплодотворения. У Impatiens каллоза
сопровождает процесс дегенерации клеток эндотелия и выявляется в виде слоя,
покрывающего эндосперм (Went van, 1989).
У многих видов сем. Solanaceae при несовместимых скрещиваниях происходит
пролиферация клеток эндотелия, что приводит в дальнейшем к гибели гибридных
зародышей (соматопластическая стерильность) (Satina et al., 1950; Rappaportet
al., 1950).
Гистохимическими исследованиями выявлены в клетках эндотелия углеводы
(часто в виде крахмала), липиды, а также физиологически-активные вещества:
аскорбиновая кислота и некоторые ферменты (эстераза, пероксидаза) (Цингер,
1958; Went van, 1989; Шамров, 1990г; и др.).
На основании комплексных морфологических, ультраструктурных и
гистохимических исследований интегументального тапетума установлено, что эта ткань
имеет высокую физиологическую активность и, вероятно, является
полифункциональной. Согласно гипотезе о секреторной функции интегументального тапетума,
его клетки вырабатывают гидролитические ферменты, которые разрушают и
«переваривают» клетки паренхимы интегумента (Guignard, 1893; Goebel, 1933;
Цингер, 1958; и др.). Продукты гидролиза, как считает большинство исследователей,
поступают в зародышевый мешок. О путях их транспорта высказаны различные
точки зрения (Netolitzky, 1926; Schnarf, 1929; Цингер, 1958; Vazart W., Vazart J.,
1965; Newcomb, 1973a,6; Bhat, Vijayaraghavan, 1980 и др.) (см. ТРАНСПОРТ
ВЕЩЕСТВ В СЕМЯЗАЧАТКЕ). Одни авторы предполагают, что вещества
поступают в зародышевый мешок непосредственно из интегументального тапетума,
другими авторами эндотелий рассматривается как барьер, препятствующий для
прямого транспорта веществ. Метаболизированные вещества поступают по эндотелию
в халазальную область семязачатка, а оттуда — через специализированные ткани
— в зародышевый мешок. Высказано также мнение, что эндотелий определяет ал-
лометрический рост зародышевого мешка и интегумента (Васильев, Плиско, 1971;
Kapil, Tiwari, 1978). Но, вероятно, это не специфическая его функция, т.к.
подобный рост происходит и в семязачатках, где эндотелий отсутствует. Кроме того, у
Impatiens показано, что эндотелий развивается независимо от зародышевого
мешка (Went van, 1989).
В тех случаях, когда эндотелий или его остатки в виде тангентальных стенок
клеток сохраняется в созревающем семени (некоторые виды Нпасеае,
Scrophutariaceae, Solanaceae и др.), он, вероятно, выполняет защитную функцию
по отношению к эндосперму и зародышу, а, возможно, и другие функции в
процессе прорастания.
Эволюционные преобразования эндотелия тесно связаны с преобразованием
всего семязачатка и, в частности, с редукцией нуцеллуса. Его специализация в
интегументе отражает более высокий уровень организации семязачатков
цветковых растений. Рис. 42.
Жукова, 1987; Никитичем, 1979а,б; Васильев, Плиско, 1971а; Цингер, 1958; Шамров, 1990г; Bhat,
Vijayaraghavan, 1980; Bouman, 1984; Esser, 1963; Gunning, Pate, 1974; Jonnson, 1879—1880; Kapil, Tiwari,
1978; Netolitzky, 1926; Newcomb, 1973a,b; Schnarf, 1929; Schwere, 1896; Tiagi, 1965; Went van, 1989;
Vazart В., Vazart J., 1965.
ПАРЕНХИМА ИНТЕГУМЕНТА (греч. par- равный, enchyma- налитое + инте-
гумент) — паренхимная ткань, лежащая под эпидермисом многослойного
интегумента. Она может иметь в своем составе от 1 до 20 и более слоев: 1—2 слоя у
представителей семейств Gesneriaceae (Алимова, Яковлев, 1982), Спеогасеае (Ка-
мелина, 1985д), 4—7 — у Staphyleaceae (Алимова, 1985), Шасеае (Никитичева,
Семязачаток
157
1985в), 10 и более слоев — у Bignoniaceae (Фрейберг, 19876), Gentianaceae
(Шамров, 1988), Nelumbonaceae (Батыгина, 1981 в). Согласно ультраструктурным
исследованиям клетки интегументальной паренхимы, как и всего интегумента в
целом, на ранних стадиях развития характеризуются признаками меристематиче-
ских клеток. В период формирования зародышевого мешка происходит
специализация этих клеток, накапливаются полисахариды, белки, липиды (Цингер, 1958;
Mogensen, 1973; Newcomb, 1973a, b; Wilms, 1980; Went van, 1989; Шамров, 1990г;
и др.). У некоторых таксонов (Asteraceae, Valerianaceae) клетки внутренних слоев,
примыкающих к эндотелию, синтезируют и секретируют слизистые вещества, что
сопровождается активизацией аппарата Гольджи, вакуолизацией цитоплазмы,
исчезновением крахмала и постепенной дегенерацией протопласта (Васильев,
Плиско, 1971 а; Камелина, Жукова, 1987). Клетки интегументальной паренхимы могут
отличаться ультраструктурой от клеток эпидермиса: например, у представителей
сем. Polemoniaceae хлоропласты в 2—3 раза крупнее, содержат крахмал и имеют
более развитую систему тилакоидов (Жукова, 1987). У некоторых растений
(например, Heliophila amplexicaulis из сем. Brassicaceae — Родионова, 1972, 1992) в
интегументальной паренхиме отмечено образование крупных многоядерных
клеток , выполняющих трофическую функцию. У многих таксонов, в процессе развития
семени, клетки интегументальной паренхимы частично или полностью
разрушаются. Рис 50.
Алимова, 1985; Алимова, Яковлев, 1982; Батыгина, 1981в; Васильев, Плиско, 1971а; Жукова, 1987;
Камелина, 1985д; Камелина, Жукова, 1987; Никитичева, 1985в; Родионова, 1972, 1992; Фрейберг,
19876; Цингер, 1958; Шамров, 1988, 1990г; Mogensen, 1973; Newcomb, 1973a, b; Went van, 1989; Wilms,
1980.
МИКРОПИЛЕ (греч. micros- малый, мелкий, pyle- ворота, вход) — канал,
образованный сомкнутым у верхушки нуцеллуса интегументом (или интегументами) и
обеспечивающий проникновение пыльцевой трубки в зародышевый мешок при
порогамии. Синонимы: пыльцевход, семявход. Термин «микропиле» введен Turpin
(1806), хотя первое его описание сделано Grew (1672).
У унитегмальных семязачатков микропиле образуется единственным
интегументом. У битегмальных семязачатков оно может быть образовано обоими
интегументами {Malvaceae, Grossulariaceae, Moraceae) либо наружным интегументом
(Salicaceae и др.). Часть микропиле битегмального семязачатка, сформированная
внутренним интегументом, называется эндостом, наружным — экзостом (греч.
stoma- рот, endon- внутри, ехо- снаружи); эти термины ввел Mirbel (1829). Микро-
пилярный канал может быть коротким или длинным. Микропиле, образованное
обоими интегументами, может быть прямым (Ruppiaceae, Centrolepidaceae,
Musaceae и др.) или зигзагообразным (Hamamelidaceae, Papaveraceae,
Berberidaceae и др.). Иногда верхняя часть интегумента разрастается и образует
складки или закручивается, в результате чего микропиле представляет собой
длинный извилистый канал (Malpigia, Cissus). У некоторых растений микропиле
не образуется вследствие недоразвития интегументов (Torenia, Philadelphia) или в
результате полного срастания их краев (Alchemilla, Ficus). Для некоторых
цветковых характерно проникновение зародышевого мешка в микропилярный канал
(Flacourtiaceae, Loranthaceae), или образование клювовидного выроста нуцелляр-
ной ткани (Euphorbiaceae), что препятствует смыканию краев интегументов и
формированию типичного микропилярного канала. Образовавшееся таким образом
широкое отверстие было названо Baillon (1885) «акропиле».
Клетки, выстилающие микропиле, обычно обладают густой цитоплазмой и
сравнительно крупными ядрами Шпит). Они могут быть покрыты волосками
(ряд видов Asteraceae), сосочками или, как у Begonia, Nehimbo и др., имеют глад-
158
Генеративные органы цветка
кую поверхность, часто покрытую восковыми отложениями. Клетки,
выстилающие микропиле, активно секретируют, способствуя проведению пыльцевой трубки
к зародышевому мешку.
Обеспечивая проникновение пыльцевых трубок к нуцеллусу и зародышевому
мешку, микропиле, в то же время, является последним барьером,
ограничивающим их количество (в ряду рыльце-завязь-микропиле). У многих растений
клетки, выстилающие микропиле, сразу после прохождения пыльцевой трубки
заполняются танинами. Рис. 43.
Поддубная-Арнольди, 1964; Савченко, 1973; Baillon, 1885; Boesewinkel, Bouman, 1984; Bor, Kapil, 1976;
Bouman, 1984; Brown, 1834; Fritsche, 1935; Gartner, 1788—1807; Grew, 1672; Mirbel, 1829; Turpin, 1806.
ОПЕРКУЛУМ (лат. operculum- крышечка) — структура в виде крышечки,
образующаяся из клеток апикальной части внутреннего интегумента. Термин
предложен Hegelmaier (1868), хотя описание оперкулума было сделано ранее (Gaertner,
1788—1798).
Вопросы генезиса оперкулума долго обсуждались в литературе. Было высказано
предположение, что он образуется частично внутренним и частично наружным ин-
тегументами (Caldwell, 1899). Детальные исследования оперкулума у
представителей сем. Lemnaceae, проведенные S. Maheshwari (1954, 1956), подтвердили точку
зрения Hegelmaier, что оперкулум является специализированной тканью
внутреннего интегумента. В такой трактовке термин «оперкулум» был использован в книге
«Сравнительная эмбриология цветковых растении» (Яковлев, 1981). Вероятно,
следует отказаться от его широкого толкования, когда под названием
«зародышевая, или семенная крышечка» (эмбриотега, эмбриостега) рассматриваются
структуры различного происхождения, расположенные в виде крышечки над корневым
полюсом зародыша (Boesewinkel, Bouman, 1984; Данилова, Кирпичников, 1985; и
др.).
Оперкулум обнаружен как у однодольных (Lemnaceae, Liliaceae, Zosteraceae
и др.), так и двудольных (Haloragaceae, Nymphaeaceae, Репаеасеае и др.),
причем, у однодольных (например, в пор. Zingiberales) он часто формируется
одновременно с микропилярным воротничком.
Оперкулум начинает формироваться во время развития зародышевого мешка и
его образованию предшествует, как правило, увеличение числа слоев клеток в
апикальной части внутреннего интегумента. В дальнейшем клетки эпидермиса с
наружной (Costaceae — Panchaksharappa, 1962; Lemnaceae — Kapil, Vasil, 1963) либо
с внутренней стороны (Liliaceae — Шамров, ориг.) сильно увеличиваются в
размерах, особенно в радиальном направлении. В оперкулум трансформируется вся
апикальная часть внутреннего интегумента (Lemnaceae — Kapil, Vasil, 1963; и др.) или
только ее отдельные слои (Zosteraceae — Терехин, Шибакина, 1985), при этом
оболочки клеток утолщаются, нижележащие клетки интегумента постепенно
сдавливаются и лигнифицируются. Максимального развития оперкулум достигает в
зрелом семени, обеспечивая защиту микропилярного района семени и способствуя
прорастанию. Рис. 50.
Данилова, Кирпичников, 1985; Савченко, 1973; Терехин, Шибакина, 1985; Яковлев, 1981; Boesewinkel,
Bouman, 1984; Caldwell, 1899; Gaertner, 1788—1798; Hegelmaier, 1868; Kapil, Vasil, 1963; S. Maheshwari,
1954, 1956; Panchaksharappa, 1962.
МИКРОПИЛЯРНЫЙ ВОРОТНИЧОК (лат. collare- воротничок +
микропиле) — кольцевидная структура в апикальной части наружного интегумента.
Термин ввел Humphrey (18%). Микропилярный воротничок обнаружен только у
однодольных растений, относящихся к порядкам Commelinales и Zingiberales. Он
дифференцируется в семязачатке перед оплодотворением. Периклинальные деления
Семязачаток
159
клеток и локальное увеличение числа слоев паренхимы наружного интегумента
приводят к образованию кольцевидной структуры, определяющей своеобразную
форму микропилярного конца семязачатка и семени. В области микропилярного
воротничка внутренний интегумент и нуцеллус формируют складки (Mauritzon,
1936; Chikkannaiah, 1962; Grootjen, Bouman, 1981; Grootjen, 1983; Камелина,
19906).
Микропилярный воротничок сохраняется в зрелом семени, при этом
внутренний слой его клеток может окремневать. Развиваясь часто вместе с оперкулумом,
он образует массивную механическую ткань семенной кожуры, обеспечивая
дополнительную защиту микропилярного района семени и облегчая процесс
прорастания (Boesewinkel, Bouman, 1984). Рис. 41.
Камелина, 19906; Boesewinkel, Bouman, 1984; Chikkannaiah, 1962; Grootjen, 1983; Grootjen, Bouman,
1981; Humphrey, 1896; Mauritzon, 1936.
ДРУГИЕ СПЕЦИАЛИЗИРОВАННЫЕ
СТРУКТУРЫ СЕМЯЗАЧАТКА
АРИЛЛУС (лат. arilhis — кровелька) — семенной придаток в виде
специализированных образований различного происхождения, развитие которых начинается
в семязачатке и продолжается в семени. Синоним: присемянник. В зрелом семени
ариллусы представлены сочными, часто окрашенными образованиями,
служащими дополнительными приспособлениями для распространения семян.
Термин «ариллус» предложил Linnaeus (1751) для мешковидной оболочки
вокруг семени, затем значение этого термина несколько трансформировалось по мере
получения новых данных. Так Gaertner (1788—1807) определил ариллус как
дополнительную оболочку семени фуникулярного происхождения. Далее Richard
(1808) установил, что ариллус возникает в области рубчика семязачатка и
окончательно развивается только после оплодотворения. Наконец, Planchon (1845) в своем
фундаментальном труде разделил ариллусы на истинные (выросты на фунику-
лусе у основания семязачатка) и ложные (различные разрастания наружного
интегумента, названные ариллоидами (лат. arilloid). Planchon также ввел понятие
строфиоли (различные выросты вдоль рафе). Эти термины обсуждаются до
настоящего времени, так как обозначаемые ими структурные образования имеют
таксономическое значение. Истинный ариллус развивается из тканей фуникулуса в
области рубчика над обтуратором. Он закладывается в семязачатке на стадии 2—4-
ядерного зародышевого мешка и в дальнейшем не срастается с семенной кожурой.
Истинный ариллус, в какой-то мере подобно обтуратору, закрывает микропиле в
анатропных семязачатках. Ариллоиды (ложные ариллусы) и их разновидности,
(строфиоли и карункулы) никогда не закрывают микропиле, так как
закладываются обычно от края экзостома или являются выростами других областей
наружного интегумента (Gaertner, 1788—1807; Richard, 1808; Planchon, 1845; Pfeiffer, 1891;
Ван-Тигем, 1901; Pijl, 1955,1957; Тахтаджян, 1964; Комар, 1965а,б; и др.).
Несколько иначе к этой проблеме подошел Baillon (1876). Он предложил
сохранить единый термин «ариллус» (объединяющий истинный и ложный ариллусы),
добавляя к нему определение его местоположения. Он также предложил ввести
понятие «общий» и «частный» ариллус, т. е. локализованный в той или иной
области (рафе, халазы, семяножки, микропиле): например, ариллус фуникулярный
(Nymphaea), ариллус микропилярный (Euphorbia, Polygala и т. д.). Определение
Baillon (1876) было поддержано многими его современниками (Pfeiffer, 1891;
Schweiger, 1905). Но последующие исследователи, в частности Netolitzky (1926),
не могли не заметить, что Baillon слишком расширил понятие ариллуса, необос-
160
Генеративные органы цветка
нованно перенося его на волосковые образования и летучки. Об этой его ошибке
писал и Goebel (1933).
После работ Planchon (1845) и Baillon (1876) наиболее обстоятельной была
работа об ариллусах Pfeiffer (1891), который хотя и симпатизировал идеям Baillon
и критиковал Planchon, считал необходимым учитывать при определении
ариллуса его местоположение и связь с семенем, считая, что истинный ариллус
срастается с семенной кожурой только в месте своего возникновения. Pfeiffer (189J)
выступал против трактовки ариллуса как третьего интегумента, довольно
распространенной в то время, учитывая, что ариллус появляется на уже нормально
развитом и оплодотворенном семязачатке. Сторонником Pfeiffer в этом вопросе был
Schweiger (1905), написавший монографию о развитии карункул и обтураторов у
Euphorbiaceae и подчеркивающий, что каранкула (микропилярный ариллоид) по
своей природе абсолютно не сходна с третьим интегумёнтом.
Maheshwari (1950) приводит пример новообразования ариллуса как
третьего интегумента у Ulmus americana путем расщепления наружного
интегумента. В литературе также описан очень интересный случай образования
* четырех интегументов у некоторых Аппопасеае: два обычных интегумента,
один ариллус (сильно развитая часть наружного интегумента) и средний
интегумент — новообразование между внутренним и наружным
интегумёнтом (Corner, 1949a, b). Против интерпретации ариллуса как третьего
интегумента выступает Earns (1961), который считает ариллус частью обычного
интегумента, результатом его специализации, связанной с распространением
семян животными. Вопрос об ариллусе как о третьем интегументе все же
остается открытым, так как все противники этой точки зрения обычно
имели дело с ариллоидом, т. е. выростом наружного интегумента.
Были попытки рассмотреть природу ариллуса в эволюционном аспекте. Так,
Corner (1949b, 1953, 1954а, b) в своей теории Дуриана (от названия плода индо-
малайского дерева Durio zibethinus из семейства Bombacaceae) связывает наличие
ариллуса с эволюцией плода. Он обращает внимание, что истинный ариллус редко
встречается среди травянистых растений и чаще обнаруживается у тропических
деревьев (наблюдение, которое в настоящее время нуждается в коррективах).
Corner делает вывод, что плоды, имеющие ариллусы, являются примитивными.
У продвинутых форм, особенно с нижней завязью, они редки. Corner высказывает
предположение, что ариллус у древних растений, распространяемых животными,
был третьим мясистым интегумёнтом, который в процессе эволюции
редуцировался, а его рудимент у современных растений представлен в виде различных
образований. Здесь мы отметим, что небольшие ариллоиды, по Corner, являются
признаком более высокой специализации и продвинутое™. Теория Дуриана очень
интересна и заслуживает особого обсуждения. Она привлекла в свое время внимание
многих исследователей. Наиболее серьезным ее противником надо считать Pijl
(1955, 1957), отметившего, что Corner не учитывает экологические факторы,
игнорирует те случаи, где ариллус развивается de novo, не критически подходит к
анализу собранного материала, в некоторых случаях принимал ариллоиды за
ариллусы. Сам Pijl четко отграничивает ариллусы от ариллоидов. Он, в
противоположность Corner, считает недифференцированную плотную саркотесту
примитивным признаком и исходным образованием для более специализированных
структур — ариллоидов. Ариллоид, по его мнению, — это неполная,
редуцированная саркотеста, более экологически приспособленная к распространению
семян животными. Отсюда же можно проследить эволюционный переход от сарко-
тесты к ариллоидам разного типа и местоположения и, наконец, как высший этап
эволюции, к ариллусу. В то же время Pijl не отрицает возможности независимого
происхождения ариллуса в некоторых случаях. Pijl не абсолютизирует свою точку
Семязачаток
161
зрения, считая, что не у всех групп растений приспособление к зоохории шло
через возникновение саркотесты и ариллиодов. Есть и другие пути развития.
Кроме того, в последнее время исследователи (и в частности Corner, 1976, в
противовес ранее развиваемой теории) обратили внимание на то, что встречаются
образования, имеющие смешанный характер — комбинация микропилярного
ариллоида с истинным ариллусом. Их называют ариллодиями (лат. arillodium) —
одним из ранних терминов Planchon (1845). С моей точки зрения, смешанные
образования — ариллодии, на которые раньше мало обращали внимание,
встречаются довольно часто.
Несмотря на разногласия в представлении о ложном и истинном ариллусах
таксономическое и эволюционное значение этого признака нельзя не учитывать.
Отмечены случаи образования у целых семейств только строфиолей или только
карункул (например, у Euphorbiaceae) (Тахтаджян, 1964; Pijl, 1969; Corner, 1976;
Kapil, Вог, Bouman, 1980; Boesewinkel, Bouman, 1984). Рис. 44.
Ван-Тигем, 1901; Имс, 1964; Комар, 1965 а, б; Тахтаджян, 1964; Baillon, 1876; Boesewinkel, Bouman,
1984; Corner, 1949a, b, 1953,1954a, b, 1976; Earns, 1961; Gaertner, 1788—1807; Goebel, 1933; Kapil et al.,
1980; Linnaeus, 1751; Maheshwari, 1950; Netolitzky, 1926; Pijl, 1955, 1957,1969; Pfeiffer, 1891; Planchon,
1845; Richard, 1808, Schweiger, 1905.
ОБТУРАТОР (лат. obturator — затычка, пробка) — ткань секреторного типа,
представленная эпидермальными удлиненными клетками завязи или
семязачатка, которые растут в направлении микропиле и часто закрывают вход в него.
Термин предложил Baillon (1858), но описание обтуратора под названием
«проводниковая ткань» было сделано ранее (Brongiart, 1827).
Классификация типов обтуратора была предложена Савченко (1973). В
зависимости от того, на какой структуре дифференцируется обтуратор, автор
выделяет следующие типы обтураторов: фуникулярный, интегументальный,
плацентарный и плодолистиковый. Веселова (1989, 1991) предложила различать
еще нуцеллярный и септальный обтураторы. По нашему мнению, термин
«плодолистиковый обтуратор» не совсем точно отражает происхождение
обтуратора. Поскольку в этом случае обтуратор возникает из эпидермальных клеток
стенки завязи, то его следует называть париетальным (лат parietis — стенка).
Анализ имеющихся данных позволил нам придти к заключению, что, в
зависимости от происхождения, следует, вероятно, различать два основных типа
обтураторов: 1) овулярные (лат. ovuhun — семязачаток) обтураторы,
формирующиеся из клеток семязачатка; 2) овариумные (лат. ovarium — завязь) —
обтураторы, формирующиеся из клеток завязи. В зависимости от положения обтураторов
в семязачатке или завязи выделяются вариации: в овулярном типе — интегу-
ментальный, фуникулярный и нуцеллярный, в овариумном типе —
плацентарный, париетальный и септальный обтураторы. Существуют также
обтураторы промежуточного, овулярно-овариумного, типа, которые формируются
из клеток как семязачатка, так и завязи.
Из овулярных обтураторов наиболее распространен фуникулярный обтуратор.
Он формируется в основании фуникулуса преимущественно анатропных
семязачатков (Molluginaceae — Narayana, Jain, 1962; Liliaceae — Савченко, Комар,
1965). Интегументальный обтуратор образуется в результате разрастания
верхнего края обычно внутреннего интегумента, который может врастать в канал
столбика (Агасеае — Fagerlind, 1944b; Poaceae — Савченко, Петрова, 1963), реже —
наружного интегумента (Nymphaeaceae — Винтер, 1987). Нуцеллярный
обтуратор формируется из апикальных клеток эпидермы нуцеллуса и в виде
многослойной клювовидной структуры может выходить за пределы микропиле, контактируя
с обтураторами овариумного типа (Nyctaginaceae — Bhargava, 1932; Rosaceae —
11 Генеративные органы цветка.
152 Генеративные органы цветка
Савченко, 1959; Euphorbiaceae — Вог, Kapil, 1976; Polygonaceae — Солнцева,
1983; Trapaceae — Батыгина, Колесова, 1985; Caryophyllaceae — Веселова, 1989).
Овариумные обтураторы обнаружены у сравнительно небольшого числа
таксонов. Париетальный обтуратор образуется чаще всего у основания столбика
(Rosaceae — Arbeola, Herrero, 1987), но иногда и в базальной части завязи
(Tkymelaeaceae — Fuchs, 1938). Плацентарный обтуратор возникает из клеток
плаценты, граничащих с клетками семязачатка (ПИасеае — Berg, 1962; АШасеае
— Шамров, 19906). Септальный обтуратор формируется из клеток перегородок
завязи синкарпнрго гинецея (Caryophyllaceae — Веселова, 1991).
Тип обтуратора связан с особенностями строения фуникулуса. В фуникуляр-
ных семязачатках обтуратор обычно развивается из клеток фуникулуса реже,
фуникулуса и интегумента (Victoria amazonica из сем. Nymphaeaceae — Винтер,
1987; Шамров, Винтер, 1991). В сессильных и фуникулярных семязачатках со
слабо выраженным фуникулусом обтураторы являются производными плаценты
(Juncaceae, Paeoniaceae — Шамров, Анисимова, 1993; Шамров, ориг.) либо
плаценты и фуникулуса (Gagea stipitata из сем. liliaceae — Shamrov, 1992b).
Обтураторы имеют эпидермальное происхождение и состоят из сравнительно
крупных клеток с утолщенными наружными стенками, плотной цитоплазмой и
большим ядром с несколькими ядрышками. Они обладают признаками
передаточных клеток (Johnson et al., 1975; Peterson et al., 1979; Singh, Walles, 1992; Walles,
1992, и др.) и являются, подобно клеткам рыльца и канала столбика,
разновидностью проводниковой ткани (Tilton, Horner, 1980; Tilton et al., 1984; Clifford,
Owens, 1990). В них синтезируются и могут выделяться на поверхность капли
жира, Сахаров и слизистые вещества (Schweiger, 1905; Савченко, 1973; Arbeola,
Herrero, 1987; Шамров, Анисимова, 1993; и др.).
Интегументальные, нуцеллярные, фуникулярные и париетальные обтураторы
обычно возникают в период формирования зародышевого мешка и достигают
полного развития к моменту проникновения пыльцевой трубки в полость завязи
(Bhargava, 1932; Савченко, Комар, 1965; Савченко, 1973; Винтер, 1987; Шамров,
Винтер, 1991; и др.). Время дифференциации плацентарных обтураторов
варьирует: у одних таксонов (liliaceae — Шамров, ориг.) они начинают выделяться на
стадии примордия семязачатка, у других (Euphorbiaceae — Maheshwari, Johri, 1941;
АШасеае — Шамров, 19906; Juncaceae — Шамров, Анисимова, 1993) — на стадии
2-ядерного зародышевого мешка. Считается, что рост пыльцевой трубки
происходит по поверхности обтуратора, клетки которого выделяют секрет, однако
пусковые механизмы этого процесса мало изучены. Для Prunus persica из сем. Rosaceae
установлено, что на продуцирование секрета не влияет опыление, а рост пыльцевой
трубки начинается после исчезновения из клеток париетального обтуратора
запасного крахмала (Arbeola, Herrero, 1987). Обычно обтураторы после оплодотворения
разрушаются, но иногда плацентарный обтуратор сохраняется в зрелом семени
(Luzula pedemontana из сем. Juncaceae — Шамров, Анисимова, 1993).
Накопление различных пластических веществ в клетках обтуратора,
характеризующихся признаками передаточных клеток, а также их своеобразный рост в
направлении микропиле, свидетельствуют о функции обтуратора как секретиру-
ющего образования, обеспечивающего питание, рост и проникновение пыльцевой
трубки в зародышевый мешок (Maheshwari, 1950; Савченко, 1973; Johnson et al.,
1979; Tilton, Horner, 1980; Tilton et al., 1984; и др.). Рис. 45.
Батыгина, Колесова, 1985; Веселова, 1989,1991; Винтер, 1987; Савченко, 1959; 1973; Савченко, Комар,
1965; Савченко, Петрова, 1963; Солнцева, 1983; Шамров, 19906; Шамров, Анисимова, 1993; Шамров,
Винтер, 1991; Arbeola, Herrero, 1987; Bhargava, 1932; Baillon, 1858; Berg, 1962; Bor, Kapil, 1976;
Brongiart, 1827; Clifford, Owens, 1990; Fagerlind, 1944a; Fuchs, 1938; Johnson et al., 1975; Maheshwari,
1950; Maheshwari, Johri, 1941; Narayana, Jain, 1962; Peterson et al., 1979; Schweiger, 1905; Shamrov,
1992b; Singh, Walles, 1992; Tilton, Horner, 1980; Tilton et al., 1984; Walles, 1992.
Семязачаток
163
ХАЛАЗА (греч. chalaza — узелок) — базальная область семязачатка, в которой
объединяются в одну структуру основания нуцеллуса, фуникулуса. Термин
предложил Treviranus (1805).
Халаза не резко отграничена от других частей семязачатка. В качестве
условной границы халазы можно рассматривать либо место окончания кутикулы
(Netolitzky, 1926), либо уровень объединения эпидермальных слоев (Цингер,
1958). Полагаем, что в качестве одного из критериев можно использовать
положение гипостазы в семязачатке.
Особенности развития и строения халазы варьируют в зависимости от
морфологического типа семязачатка. Первая классификация типов халазы была
предложена Periasamy (1962b), в основу которой положены два критерия: 1.
соотношение халазы с другими структурами семязачатка, 2. доля участия халазы в
построении семенной кожуры. В соответствии с этим различают следующие типы
халазы: 1) нормальная халаза — составляет сравнительно небольшую часть
семязачатка и семени и принимает незначительное участие в построении семенной
кожуры, 2) массивная халаза, или пахихалаза, по Corner (1976) — составляет
большую часть семени и возникает за счет интеркалярного роста по всем
направлениям после оплодотворения; образует большую часть семенной кожуры, 3) пе-
рихалаза (термин предложил Corner, 1949а) — составляет значительную часть
семени и образуется за счет интеркалярного роста в рафальной и антирафальной
областях; составляет значительную часть семенной кожуры.
Нами предлагается классификация типов халазы с выделением в ней
вариаций. В основу предлагаемой классификации положены следующие
критерии: 1. положение в дифференцирующемся примордии семязачатка и
относительные размеры халазы по сравнению с другими структурами
сформированного семязачатка. 2. особенности ее васкуляризации, 3. степень
участия халазы в построении семенной кожуры. Выделяются 3 типа халазы:
1) пахихалаза (греч. pachys — массивный), 2) типикохалаза (греч.
typicus — типичный; синоним: нормальная халаза, по Periasamy, 1962b); 3)
лептохалаза (греч. leptos — тонкий; термин предложен нами).
Пахихалаза обнаружена в семязачатках небольшого числа таксонов,
занимающих различные уровни системы цветковых растений. На основании
принципа пространственно-временной координации в развитии структур
семязачатка следует различать 3 вариации пахихалазы: 1) типовая, 2) юве-
нильная (лат. juvenilis — молодой), 3) матурная (лат. maturus — зрелый).
В семязачатках с типовой вариацией пахихалазы заложение интегумента
приурочено к самой апикальной части дифференцирующегося примордия
семязачатка. Это приводит к тому, что халаза с самого начала занимает
большую часть семязачатка по сравнению с нуцеллусом и интегументом.
Окончательно пахихалаза формируется в зрелом семени (Тropaeolaceae —
Tiwari et al., 1977; Rhizophoraceae — Никитичем, Яковлев, 1985; Cannaceae
— Grootjen, Bouman, 1988).
В семязачатках с ювенильной вариацией пахихалаза начинает
развиваться как и в случае типовой вариации. Однако в дальнейшем еще до
оплодотворения (Ceratophyllaceae — Шамров, ориг.) или сразу же после
оплодотворения (Scheuchzeriaceae — Никитичем, Проскурина, 1992) более
массивной становится микропилярная часть семени и относительные размеры
халазы уменьшаются. Такая специфика развития халазы была обнаружена
у Santalum album (Shamrov et al., 1992) и, вероятно, присуща многим видам
пор. Santalales с дифференцированными семязачатками (Fagerlind, 1947;
Agarwal, 1963; Raj, 1970, и др.).
11*
j 54 Генеративные органы цветка
В случае матурной вариации массивность халазы создается после
оплодотворения за счет интеркалярного роста ниже места прикрепления обоих интегумен-
тов (некоторые Myristicaceae — Periasamy, 1962a; Nair, 1972; Heel, 1982;
Lauraceae — Corner, 1976). У одних таксонов (некоторые Myristicaceae — Heel,
1982; Corner, 1983; Rhizophoraceae — Никитичева, Яковлев, 1985) пролиферация
клеток халазы происходит только в основании внутреннего интегумента (эндопа-
хихалаза, термин предложен Boesewinkel, Bouman, 1984), у других
(Nelumbonaceae — Батыгина и др., 1983) — в основании наружного интегумента
(экзопахихалаза — термин предложен нами).
В пахихалазальных семязачатках зародышевый мешок начинает
развиваться в окружении тканей нуцеллуса, а возникающий затем зародыш
продолжает свое развитие в окружении тканей халазы. Фуникулярный
проводящий пучок, как правило, образует сеть постхалазальных пучков, часть из
которых продолжается в интегументы (Маметьева, Камелина, 1981;
Boesewinkel, Bouman, 1984). В зрелом семени производные пахихалазы
составляют основную часть семенной кожуры.
Типикохалаза обнаружена в семязачатках большинства цветковых
растений. На основании особенностей развития можно выделить 2 вариации
типикохалазы: типовая (характерна для многих таксонов) и перихалазаль-
ная (греч. peri — вокруг, около). В семязачатках с типовой вариацией
положение интегумента, позволяющее судить о топографии нуцеллуса и
халазы в дифференцирующемся примордии семязачатка варьирует: в
формирующихся тенуинуцеллятных семязачатках (Bignoniaceae, Gentianaceae,
Scrophulariaceae) интегумент возникает почти в апикальной части примордия
на уровне археспориальной клетки, а в крассинуцеллятных семязачатках
(Grossulariaceae, Magnoliaceae, Nymphaeaceae) — значительно ниже уровня
археспориальных клеток. Однако всегда нуцеллус и интегумент (крассину-
целлятные семязачатки) или только интегумент (тенинуцеллятные
семязачатки) занимает большую половину сформированного семязачатка и
развивающегося семени. В халазе, как правило, воронкообразно заканчиваются
элементы ксилемы и флоэмы фуникулярного проводящего пучка
(Boesewinkel, Bouman, 1984). Производные типовой вариации типикохалазы
принимают незначительное участие в образовании семенной кожуры.
В случае перихалазальной вариации происходит однонаправленный рост
халазы в области рафе и антирафе, в результате чего радиальная симметрия
семязачатка и семени сменяется билатеральной симметрией (Аппопасеае,
Monimiaceae — Corner, 1949a, 1976; Periasamy, Swamy, 1961; Vitaceae и некоторые
Lauraceae — Periasamy, 1962a,b). Для семязачатков с перихалазой характерно
ответвление постхалазального пучка в интегумент от фуникулярного проводящего
пучка (Bouman, 1984). Однако такая особенность строения проводящей системы
присуща и ряду таксонов с типовой вариацией типикохалазы (Campanulaceae,
Cucurbitaceae, Paeoniaceae). Хотя степень участия перихалазы в образовании
семенной кожуры увеличивается по сравнению с типовой вариацией типикохалазы,
все же на большом своем протяжении семенная кожура формируется за счет
клеток интегумента.
Лептохалаза характерна для тенуинуцеллятных семязачатков ряда таксонов
верхнего уровня системы цветковых растений (Begoniaceae, Gesneriaceae,
Orchidaceae и др.). Она представлена небольшой группой клеток,
разрушающихся в процессе развития семени. Производные лептохалазы практически не
участвуют в построении семенной кожуры. Прокамбиальные клетки, обычно
формирующиеся в фуникулусе, в халазе отсутствуют.
Семязачаток
165
Первые стадии развития халазы изучены еще недостаточно. По нашим
данным, слои, участвующие в образовании определенных областей халазы, можно
выявить на самых ранних стадиях развития семязачатка. В субэпидермальном
слое семязачатка с типикохалазой под формирующимся интегументом
(наружным интегументом в битегмальных семязачатках) происходят периклинальные
деления клеток, за счет которых образуется наружная область халазы. В анатроп-
ных семязачатках (Campanulaceae, Gentianaceae, Nymphaeaceae)
периклинальные деления обнаруживаются только с дорзальной стороны, а в ортотропных
(Barclayaceae — Винтер, 1987) — с обеих сторон семязачатка. Клетки осевого
ряда примордия семязачатка ниже формирующейся гипостазы трансформируются
во внутреннюю область халазы, в которой дифференцируется проводящий пучок.
Положение халазы в семязачатке, а также одна из характерных особенностей
ее строения (в ней обычно оканчивается проводящий пучок семязачатка)
позволяют предположить, что халаза является своеобразным «депо» для метаболитов,
поступающих как из проводящего пучка, так и из смежных с халазой областей
семязачатка. Другая ее функция — защитная — наиболее характерна для
пахихалазальных семян, у которых семенная кожура образована преимущественно
производными халазы.
Вопрос об эволюционных преобразованиях халазы в семязачатке
цветковых растений до сих пор слабо разработан. Можно предположить, что
исходным типом семязачатка является семязачаток с типикохалазой. Исходя
из представлений Тахтаджяна (1964, 1980) и Терехина (1977, 1991) о
модусах эволюционных преобразований органов и тканей, возникновение
семязачатков с лептохалазой можно рассматривать как отражение одного из
основных направлений эволюции структур — от крупных, массивных до
мелких, немногослойных семязачатков, что выражается в уменьшении
размеров структуры. Появление пахихалазальных семязачатков и семян,
отмеченное как среди примитивных, так и продвинутых таксонов, происходило,
вероятно, многократно и является результатом адаптивной эволюции,
связанной с особенностями диссеминации и прорастания. Рис. 46, 47.
Винтер, 1987; Маметьева, Камелина, 1981; Никитичева, 1990; Никитичева, Проскурина, 1992;
Никитичева, Яковлев, 1985; Тахтаджян, 1964, 1980; Терехин, 1977, 1991; Цингер, 1958; Шамров, 19906;
Шамров, Винтер, 1991; Шамров, Никитичева, 1992; Agarwal, 1963; Boesewinkel, Bouman, 1984; Bouman,
1984; Corner, 1949a, 1976, 1983; Grootjen, Bouman, 1988; Fagerlind, 1947; Heel, 1982; Nair, 1972;
Netolitzky, 1926; Periasamy, 1962a,b; Periasamy, Swamy, 1961; Raj, 1970; Shamrov, 1992a,b; Shamrov et
al., 1992; Tiwari et al., 1977; Treviranus, 1805; Wisselingh, 1924.
ФУНИКУЛУС (лат. funiculus — канатик) — структура, с помощью которой
семязачаток прикрепляется к плаценте; в фуникулусе дифференцируется проводящая
система, по которой в ткани семязачатка и развивающегося семени поступают из
завязи органические и минеральные вещества. Синоним: семяножка. Термин был
предложен Mirbel (1829).
В зависимости от наличия или отсутствия семяножки выделены 2 типа
семязачатков (Корчагина, 1969): семяножковый и бессемяножковый, или сидячий
(семязачаток практически лишен семяножки; имеет широкое основание, ткань которого
непосредственно переходит в ткань плаценты, образуя плацентохалазу). Нами
предлагается иная трактовка сидячих семязачатков и классификация
семязачатков по строению и степени развития фуникулуса, которая включает 3 типа. В
зависимости от степени развития фуникулуса семязачатки можно подразделить на
фуникулярные (семязачаток с фуникулусом), афуннкулярные (фуникулус
как структура отсутствует) и сессильные (лат. sessilis — сидячий, или
прикрепленный основанием к чему-либо; семязачаток прикрепляется к плаценте базаль-
ной частью рафе).
155 Генеративные органы цветка
В фуникулярных семязачатках фуникулус может быть длинным или
коротким, прямым или изогнутым, закрученным или складчатым, что в
значительной степени определяет морфологический тип семязачатка и его положение в
завязи (Maheshwari, 1950; Корчагина, 1969; Савченко, 1973; Данилова,
Кирпичников, 1985, и др.). Фуникулус хорошо выражен в семязачатках, занимающих
боковое положение в завязи (например, Nympkaeaceae — Батыгина, 1981а;
Винтер, Шамров, 1991; особенно у Nuphar lutea, семязачаток которой является гипер-
тропным — Винтер, 1987). Длинным фуникулусом часто обладают висячие
семязачатки (Amarantkaceae — Kajale, 1937; Brassicaceae, Capparaceae — Родионова,
1972, 1983). В цирцинотропных семязачатках длинный фуникулус сильно
закручен (Cactaceae — Archibald, 1939; Phimbaginaceae — Коробова, 1983). У
некоторых растений он может способствовать выбрасыванию семян из плода (Fabaceae
— La Rue, 1954; Magnoliaceae — Earle, 1938).
В сессильных семязачатках, как правило, обращенных (анатропных, кам-
пилотропных и амфитропных), в процессе развития происходит конгенитальное
срастание фуникулуса с интегументом и образуется рафе. В этом случае
собственно фуникулус морфологически не выражен и семязачатки прикрепляются базаль-
ной частью рафе к сильно разросшемуся плацентарному выросту (Campanulaceae,
Juncaceae, Paeoniaceae). У некоторых растений (Cactaceae) описано разветвление
фуникулуса (Buxbaum, 1953; Kapil, Vasil, 1963), что, вероятно, является
своеобразным плацентарным выростом, а не базальной ветвящейся частью фуникулуса.
В афуникулярных семязачатках фуникулус редуцирован полностью, а
плацента с халазой формируют единую структуру — плацентохалазу (Роасеае —
Александров и др., 1944; Батыгина, 1974; Melanthesa rhamnoides из сем.
Euphorbiaceae — Singh, 1968; Ceratophyllaceae — Шамров, 1981; Santalum album
из сем. Santalaceae — Shamrov et al., 1992).
На фуникулусе могут развиваться различного рода волоски. Из его тканей
могут формироваться обтуратор и ариллус. Рис. 48.
Александров и др., 1944; Батыгина, 1974; Винтер, 1987; Винтер, Шамров, 1991; Данилова,
Кирпичников, 1985; Коробова, 1983; Родионова, 1972, 1983; Савченко, Комар, 1965; Шамров, 1981; Archibald,
1939; Buxbaum, 1953; Earle, 1938; Kajale, 1937; Kapil, Vasil, 1963; La Rue, 1954; Maheshwari, 1950;
Shamrov et al., 1992; Singh, 1968.
НОВЫЙ ПОДХОД К ТРАКТОВКЕ СТРУКТУР
БАЗАЛЬНОЙ ОБЛАСТИ СЕМЯЗАЧАТКА
В семязачатке цветковых растений формируется ряд специализированных
структур (гипостаза, подиум, постамент), генезис, положение и функция
которых являются предметом широкого обсуждения. Толкование понятий
«гипостаза», «подиум» и «постамент» весьма неоднозначное, а порою и
противоречивое.
История рассматриваемых понятий начинается с представлений Van Tieghem
(1901b, 1903). Им был предложен термин «гипостаза» для обозначения ткани,
представленной в виде диска, чаши или колонки под зародышевым мешком,
состоящей из клеток с лигнифицированными оболочками и служащей, по его
мнению, барьером для роста зародышевого мешка в направлении основания
семязачатка. При введении термина им не были учтены тип развития нуцеллуса (красси-
и тенуинуцеллятные семязачатки), стадия развития зародышевого мешка (до
оплодотворения — сформированный, зрелый; после оплодотворения — в период
формирования зародыша, эндосперма, перисперма и т. д.).
Dahlgren (1940) ввел термин «подиум» и подтвердил необходимость выделения
термина «постамент», впервые использованного Westermaier (1890). Согласно их
Семязачаток
167
точке зрения, постамент — колонка клеток под антиподами зародышевого мешка,
а подиум — долго сохраняющийся остаток нуцеллуса чашевидной формы.
Dahlgren и ряд других авторов (Mauritzon, 1933a; Maheshwari, 1950; Савченко,
1973; Поддубная-Арнольди, 1976; и др.) считали, что гипостаза, подиум и
постамент в процессе развития могут трансформироваться друг в друга, что привело к
неоднозначному толкованию и смешению этих понятий.
Со времени введения терминов «гипостаза», «подиум» и «постамент»
накопилось много сведений по строению и развитию семязачатков. Изучение
рассматриваемых структур с самых ранних стадий развития семязачатка позволило нам
дать несколько иную их трактовку. Гипостаза, подиум и постамент развиваются
как единое образование с самых ранних этапов развития семязачатка. В
формирующемся примордии семязачатка, кроме эпидермального и субэпидермального
слоев, выделяются один или несколько рядов клеток, ориентированных
параллельно его продольной оси. Клетки этих продольных рядов имеют двойственное
происхождение: в апикальной части возникают за счет периклинальных делений
клеток субэпидермиса плаценты, а в средней и нижней частях — за счет
периклинальных делений клеток третьего и глубжележащих слоев. Они активно
делятся, сначала преимущественно поперечно, и представляют в совокупности
меристему базальной зоны.
Продольные (осевые) ряды клеток под спорогенными и гаметофитными
структурами наблюдали и ранее (Warming, 1878; Heusser, 1915; Schnarf,
1929; Навашин, 1951 е; и др.). Однако, формирование продольных рядов
клеток не рассматривали в связи с функционированием этих структур.
Результаты наших исследований (Батыгина, 1974, 1987; Шамров, 1990г;
Шамров, Никитичева, 1992; Шамров, Анисимова, 1993; Tobe, Batygina, в печати,
и др.) свидетельствуют о том, что продольные ряды, образованные
таблитчатыми или удлиненными клетками выполняют наиболее важную роль в
семязачатке — проведение питательных веществ к спорогенным и гамето-
фитным структурам из проводящей системой плаценты и завязи с самых
ранних этапах развития семязачатка.
Продольные ряды клеток примордия семязачатка могут давать различные
специализированные структуры. В крассинуцеллятных семязачатках из клеток
проксимального (по отношению к археспориальной клетке) района возникает
постамент, из клеток дистального района — проводящий пучок, из клеток среднего
района — подиум и гипостаза (центральная область). В тенуинуцеллятных
семязачатках формируются только гипостаза и проводящий пучок: гипостаза
(центральная область) — из клеток проксимального района, а проводящий пучок
— из клеток дистального района. В связи с двойственным происхождением клеток
подиума и гипостазы, их латеральные области образуются из клеток меристемы
латеральной зоны примордия семязачатка. Время инициации гипостазы, подиума
и постамента, продолжительность существования и особенности их строения
варьируют у разных таксонов, тесно связаны с другими сопряженно развивающимися
структурами семязачатка и семени и обусловлены спецификой мегаспорогенеза,
развития зародышевого мешка, зародыша и эндосперма.
Таким образом, в понятие «гипостаза» различные авторы вкладывают
разный смысл. С нашей точки зрения, его следует рассматривать как термин
в широком смысле слова, включающий в себя «собственно гипостазу»,
подиум и постамент. Однако все эти структуры, хотя и выполняют сходную
функцию, различаются особенностями генезиса. Рис. 49.
Батыгина, 1974, 1987; Навашин, 1951е; Поддубная-Арнольди, 1976; Савченко, 1973; Шамров, 1990 г;
Шамров, Анисимова, 1993; Шамров, Никитичева, 1992; Dahlgren, 1940; Heusser, 1915; Maheshwari,
1950; Mauritzon, 1933a; Schnarf, 1929; Tieghem Van, 1901b, 1903; Warming, 1878.
168
Генеративные органы цветка
ГИПОСТАЗА (греч. hypo- под, внизу и stasis- остановка) — ткань,
дифференцирующаяся в основании нуцеллуса и интегументов. Она присуща семязачаткам
большинства цветковых растений. В тенуинуцеллятных семязачатках
(Gentianaceae, Lamiaceae) гипостаза располагается непосредственно под
зародышевым мешком, в крассинуцеллятных (Ceratophyllaceae, Elaeagnaceae,
Nymphaeaceae, Resedaceae) между гипостазой и зародышевым мешком имеется
ткань нуцеллуса, которая может разрушаться в процессе развития семени, в
результате чего гипостаза оказывается под эндоспермом.
Гипостаза инициируется на уровне формирующегося интегумента
(внутреннего в битегмальных семязачатках) почти одновременно с его заложением. Иногда
она выделяется раньше других структур семязачатка (Juncaceae).
Дифференциация гипостазы происходит в центробежном направлении. Она может быть
представлена группой клеток, имеющей форму диска, или реже 1 —3 клетками
(некоторые Orchidaceae, вероятно, Orobanchaceae). Вначале эти клетки изодиаметри-
ческие, тонкостенные, густоплазменные, с крупными ядрами, содержащими
несколько ядрышек. У некоторых растений клетки гипостазы являются 2-ядер-
ными, при этом ядра могут сливаться (Campanulaceae, Liliaceae,
Scrophulariaceae). В сформированной гипостазе клетки становятся таблитчатыми
и вакуолизированными.
Характер клеток гипостазы варьирует у разных видов. Так, например, в
гипостазе у Anethum graveolens выделяются два типа секреторных клеток:
периферические клетки с большим ядром и срединные, имеющие тонкие стенки и небольшие
ядра (Szujko-Lacza, 1978). Однако, у Retzia capensis периферические радиально-
удлиненные клетки гипостазы имеют лигнифицированные утолщенные стенки, в
то время, как ее центральная часть состоит из тонкостенных клеток (Engell, 1987).
Стенки клеток различаются по строению. У Delphinium camptocarpum клетки
гипостазы имеют толстые слоистые стенки без плазмодесм (Беляева, 1983), в то
время, как у некоторых видов сем. Solanaceae отмечены многочисленные
протуберанцы клеточной стенки (Ермаков, Горяева, 1982). Стенки клеток гипостазы могут
одревесневать (Polygonaceae, Rosaceae, Malvaceae, Amaryllidaceae, Urticaceae и
др.) или опробковевать {Liliaceae, Ulmaceae, Geraniaceae и др.). Утолщение
клеточных стенок гипостазы может идти за счет каллозы, кутина, суберина и
лигнина (Netolitzky, 1926, Савченко, 1973). Ее клетки часто заполнены таниноподобны-
ми веществами (Bouman, 1984). У Allium odorum клетки гипостазы являются
густоплазменными и приобретают черты сходства с эпидермой некоторых гидатод
(Haberlandt, 1923, 1925). Особенностью гипостазы на поздних стадиях развития у
некоторых представителей цветковых является образование воздушных
полостей, за счет анастомозов ее отдельных клеток (Maheshwari, 1950), а также схи-
зогенных вместилищ, заполненных различными веществами, в том числе и
дубильными. У некоторых видов (например, у Scilla sibirica) клетки гипостазы
выделяют вещества неизвестного состава, которые веерообразно расходятся
(Герасимова-Навашина, Батыгина, 1958; Савченко, Комар, 1965).
В клетках гипостазы (в зависимости от вида растений и стадии развития) могут
накапливаться различные вещества: крахмал, белки, жиры, танины и др.
Например, у Agave — углеводы, белки и жиры, у Ornithogahim — только углеводы (Tilton,
1980в), у Gentiana cruciata — декстрины, крахмал и белки (Шамров, 1990 г).
Можно полагать, что продолжительность существования гипостазы скоррели-
рована с особенностями развития нуцеллуса, интегументов и зародышевого
мешка, при этом выявляется тенденция к ее сокращению у таксонов, более
продвинутых в эволюционном отношении. Так, у спайнолепестных с тенуинуцеллятными
унитегмальными семязачатками ее, обычно тонкостенные, клетки дегенерируют
Семязачаток
169
на первых стадиях эмбриогенеза. У таксонов, характеризующихся крассинуцел-
лятными семязачатками, гипостаза более массивная, часто имеет вид чаши и ее
клетки с утолщенными оболочками либо разрушаются на поздних стадиях
развития зародыша, либо сохраняются в зрелом семени (Cephalotaceae,
Ceratophyllaceae, Juncaceae).
Особый интерес представляют морфогенетические корреляции между
наличием гипостазы и типом эндосперма, выявленные как в крассинуцеллятных, так и
тенуинуцеллятных семязачатках разных семейств (Johri, Seghal, 1963; Szujko-
Lacza, 1978, и др.). Обнаружено, что у некоторых видов продолжительность
существования гипостазы более длительная при целлюлярном эндосперме, чем при
нуклеарном.
Гипостаза мультифункциональна. Расположение около проводящего пучка,
строение клеток по типу секреторных, а также накопление в них различных
веществ позволили большинству авторов рассматривать гипостазу как ткань (англ.
«glandular tissue», «nutritive apparatus»), связанную с секрецией энзимов и
регуляторов роста (Hakansson, 1923; Paliwall, 1950; Adatia, Shah, 1952; Szujko-Lacza,
1978; Tilton, 1980; Boesewinkel, Bouman, 1984; и др.).
Кроме того, местоположение гипостазы около проводящего пучка и сохранение
ее у некоторых видов растений в зрелом семени позволяет говорить также и о
функции гипостазы, связанной с сохранением и поддержанием определенного водного
баланса в покоящихся зрелых семенах в течение длительного периода покоя в
жаркие, сухие сезоны (Goebel, 1933; Tilton, 1980; Engell, 1987; и др.). Некоторые
исследователи считают, что гипостаза выполняет еще и механическую и
защитную функции, в частности, как барьер, препятствующий разрастанию
зародышевого мешка, зародыша и эндосперма (Eames, 1961; Venkateswarlu, Prakasa Rao,
1972; Engell, 1987; и др.). Например, у Retzia capensis периферические,
концентрированно расположенные слои толстостенных клеток гипостазы препятствуют
проникновению агрессивного халазального гаустория эндосперма в нижнюю часть
семязачатка (Engell, 1987).
Отмечена еще одна функция гипостазы — гаусториальная: гипостаза вместе с
паренхимной тканью халазы и антиподами образует гаусториальный аппарат
(Цингер, 1958).
Однако, основной функцией гипостазы у большинства изученных
представителей, вероятно, является трофическая, и ее специализированные клетки
(независимо от их формы и строения оболочки) осуществляют транспорт метаболитов к
спорогенным и гаметофитным структурам. Рис. 46, 47; 49—51.
Батыгина, 1974,1987; Беляева, 1983; Герасимова-Навашина, Батыгина, 1958; Ермаков, Горяева, 1982;
Петрова, 1977; Поддубная-Арнольди, 1976; Савченко, 1973; Савченко, Комар, 1965; Цингер, 1958;
Цингер, Поддубная-Арнольди, 1959; Шамров, 1990а; Adatia, Shah, 1952; Boesenwinkel, Bouman, 1984;
Bouman, 1984; Brown, Mogensen, 1972; Eames, 1961; Engell, 1987; Goebel, 1933; Haberlandt, 1923, 1925;
Hakansson, 1923; Johri, Seghal, 1963; Maheshwari, 1950; Netolizky, 1926; Paliwall, 1950; Shamrov, 1992a;
Szujko-Lacza, 1978; Tilton, 1980b; Tieghem Van, 1901b; 1903; Venkatenswarlu, Prakasa Rao, 1972.
ПОДИУМ (греч. podion — основание) — структура чашевидной формы,
возникающая в базальной зоне нуцеллуса.
Термином «подиум», введенным K.Dahlgren (1940), обозначают долго
сохраняющийся остаток халазальной (базальной) зоны нуцеллуса. В зависимости от
особенностей преобразования этой зоны нуцеллуса различают колонковидный
и бокаловидный подиумы. Колонковидный подиум (термин предложен Тере-
хиным, 1990) формируется преимущественно в семязачатках со слабо
дифференцированными и рано разрушающимися микропилярной и средней зонами
нуцеллуса (Alangiaceae, Liliaceae, Zosteraceae). В него трансформируется вся хала-
зальная зона нуцеллуса (Dahlgren, 1940; Комар, 1982; Алимова, 1987а; Shamrov,
170
Генеративные органы цветка
1992Ь; и др.), которая сначала имеет вид колонки, а затем, после деструкции
части своих клеток, постепенно приобретает форму чаши. На первых стадиях
развития колонковидный подиум образован тонкостенными клетками разной формы
с плотной цитоплазмой. Его поведение в ходе созревания семени варьирует:
постепенная дегенерация клеток в том месте, где они контактируют с зародышевым
мешком или эндоспермом, приводит либо к полному исчезновению колонковидно-
го подиума до оплодотворения (Rhizophoraceae) или после оплодотворения
(Campanulaceae, Lecythidaceae, некоторые Styracaceae), либо к сохранению его
базальной части в зрелом семени (некоторые Liliaceae, Zosteraceae), при этом
клетки становятся толстостенными.
Бокаловидный подиум (термин предложен нами) формируется в красси-
нуцеллятных семязачатках с длительно существующей латеральной областью
нуцеллуса после оплодотворения. Он дифференцируется в форме бокала в
халазальной зоне нуцеллуса на ранних стадиях развития семязачатка. В
сформированном семязачатке его верхняя граница находится на уровне
антипод зародышевого мешка. Клетки бокаловидного подиума имеют
двойственное происхождение и возникают в результате периклинальных делений:
латеральные области — преимущественно за счет субэпидермальных клеток,
а центральная область — за счет части клеток среднего района зоны
базальной меристемы примордия семязачатка. Между подиумом и
зародышевым мешком находится паренхимная ткань нуцеллуса, которая
разрушается в процессе развития семени, а подиум постепенно приходит в контакт
с эндоспермом. Строение и время дифференциации бокаловидного подиума
скоррелированы со степенью массивности крассинуцеллятного семязачатка.У
Ceratophyllaceae, например, подиум начинает формироваться на стадии спо-
рогенной клетки и в сформированном семязачатке состоит из 8—12-слоев
клеток. В менее массивном семязачатке Juncaceae дифференциация подиума
начинается либо на ранних стадиях мегаспорогенеза (Luzula), либо на
поздних фазах развития зародышевого мешка (Juncus), при этом подиум
является 3—5-слойным. Обычно подиум состоит из нескольких слоев
таблитчатых клеток с плотной цитоплазмой. Его клетки изначально тонкостенные, а
в дальнейшем чаще всего они становятся толстостенными. Полностью или
частично подиум сохраняется в виде чаши в зрелом семени
(Ceratophyllaceae, Grossulariaceae, Juncaceae, вероятно, Cyperaceae,
Degeneriaceae).
Бокаловидный подиум, начинающий развиваться с самых ранних стадий
формирования семязачатка и хорошо отличающийся от других структур нуцеллуса,
мы предлагаем рассматривать в качестве истинного подиума. В отличие от него,
колонковидный подиум (эта структура сочетает в себе признаки постамента и
подиума и ее, вероятно, можно называть постаменто-подиумом — Shamrov, 1992а)
представляет собой всю сохраняющуюся халазальную зону нуцеллуса,
напоминая по форме бокаловидный подиум на поздних стадиях развития семени.
В клетках подиума обнаружены белки, декстрины, танины. На основании
результатов структурного и гистохимического исследования можно предположить,
что подиум выполняет функцию проведения метаболитов, поступающих в него из
проводящего пучка через гипостазу. Его центральная часть обеспечивает
питательными веществами зародышевый мешок, а более массивная латеральная часть
— латеральную, долго сохраняющуюся после оплодотворения, область
нуцеллуса. В зрелом семени он, вероятно, играет защитную роль. Рис. 49—51.
Алимова, 1987а; Анисимова, 1985; Батыгина, 1984а; Данилова, Кирпичников, 1985; Комар, 1982;
Никитичева, 1983; Никитичева, Яковлев, 1985; Петрова, 1977; Терехин, 1990; Шамров, Анисимова,
1993; Anisimova, Shamrov, 1992a,b; Bouman, 1984; Dahlgren, 1939a, 1940; Shamrov, 1992a,b.
Семязачаток
171
ПОСТАМЕНТ (лат. postament-колонка) — ткань нуцеллярного происхождения,
располагающаяся в виде колонки под спорогенными или гаметофитными
структурами. Синонимы: колонка, пьедестал, подставка для антипод.
По термином «постамент», употребленным впервые Westermaier (1890),
понималась колонка из удлиненных клеток под антиподальным концам зародышевого
мешка. Клетки колонки отличаются от окружающих клеток более густой
цитоплазмой и более интенсивно окрашивающимися оболочками. По его мнению,
основная функция постамента — трофическая. Dahlgren (1939а, 1940) расширил
содержание термина и полагал, что постамент присутствует как на стадии
зародышевого мешка, так и на различных стадиях развития семени. Им было высказано
предположение о двух способах возникновения постамента: 1) «врастание» ткани
под антиподами в полость зародышевого мешка, 2) преобразование гипостазы,
располагающейся в виде колонки под зародышевым мешком и представленной
клетками с утолщенными оболочками. Различные авторы поддерживают либо
первое положение (Комар, 1965а; Савченко, 1973; и др.), либо второе (Palm, 1915;
Schnarf, 1929; Mauritzon, 1933а; Поддубная-Арнольди, 1976; Фрейберг, Камели-
на, 1981; и др.).
Согласно нашим представлениям, в постамент трансформируются верхние
клетки продольных рядов примордия семязачатка, располагающиеся под архес-
пориальной клеткой. В сформированном семязачатке постамент представляет
собой осевую часть халазальной зоны нуцеллуса. У злаков эта структура была
описана как «своеобразная гипостаза» (Батыгина, 1974, 1987).
Таким образом, постамент формируется в семязачатках с
дифференцированной халазальной зоной нуцеллуса, которая может быть немногослойной (Araceae,
Orchidaceae, Ranunculaceae) или состоять из довольно значительного числа слоев
(Costaceae, Grossulariaceae, Zingiberaceae). Постамент образован удлиненными
или таблитчатыми клетками в виде рядов, доходящих до гипостазы и часто
напоминающих по строению прокамбиальные клетки (Mucke, 1908; Joshi,
Venkateswarlu, 1935; Камелина, Проскурина, 1987; Алимова, 1990; Шамров,
Никитичева, 1992; и др.). Клетки постамента, например, у Quercus gambelii
(Fagaceae), содержат ядро удлиненной формы, большое количество митохондрий,
свободных рибосом и хорошо развитый ЭР и связаны между собой
немногочисленными плазмодесмами. По периферии этих клеток плазмалемма формирует
инвагинации различных размеров (Mogensen, 1973).
Продолжительность существования постамента варьирует у разных растений
и скоррелирована с особенностями развития и функционирования других
структур нуцеллуса. Чаще всего колонка клеток в халазальной зоне нуцеллуса
полностью разрушается вскоре после оплодотворения. У некоторых таксонов
(Taccaceae — Hakansson, 1921; Poaceae — Батыгина, 1974, 1987; Asparagaceae —
Сатарова, 1990) разрушение клеток колонки происходит еще до оплодотворения
и сопровождается постепенным их замещением растущим зародышевым мешком,
в результате чего обеспечивается более тесный контакт с проводящей системой
семязачатка и завязи. У представителей ряда семейств (Calycanthaceae —
Камелина, 1981 г) на месте разрушающихся клеток осевой области базальной зоны
нуцеллуса формируется лизигенная полость над гипостазой.
При длительном существовании постамента происходит постепенное
разрушение латеральных слоев, а затем и эпидермального слоя в халазальной зоне
нуцеллуса и замещение их в ходе развития халазальным гаусторием центральной
клетки зародышевого мешка (позже эндосперма) (Araceae — Mucke, 1908; Buell,
1938; Geissolomataceae — Stephens, 1909; Pontederiaceae — Ono, 1928; Fagaceae—
Brown, Mogensen, 1972; Mogensen, 1973; Grossulariaceae — Шамров, ориг.). У од-
172 Генеративные органы цветка
них таксонов (Araceae, Costaceae, Geissolomataceae, Zingiberaceae) он состоит из
одревесневших клеток и сохраняется в зрелом семени. Одревеснение клеточных
стенок может начинаться еще в периоды мегаспорогенеза и развития
зародышевого мешка {Costaceae — Panchaksharappa, 1962; Magnoliaceae — Фрейберг, Ка-
мелина, 1981; Sterculiaceae — Venkata Rao, 1953; Zingiberaceae —
Panchaksharappa, 1966; Gurudeva, Somashekar, 1985; и др.).
Исходя из строения клеток и расположения их в виде рядов, а также динамики
накопления в них белков, крахмала, декстринов и других веществ, можно
полагать, что основная функция постамента связана с транспортом метаболитов,
поступающих из гипостазы в спорогенные, а позже — гаметофитные структуры.
Другой функцией является механическая, если постамент сохраняется в зрелом
семени. Рис. 49, 51.
Алимова, 1990; Батыгина, 1974,1984а, 1987; Камелина, 1981г; Камелииа, Проскурина, 1987; Комар,
1965а; Поддубная-Арнольди, 1976; Савченко, 1973; Сатарова, 1990; Фрейберг, Камелина, 1981; Шам-
ров, Никитичева, 1992; Brown, Mogensen, 1972; Buell, 1938; Dahlgren, 1939a, 1940; Gurudeva,
Somashekar, 1985; Hakansson, 1921; Joshi, Venkateswarlu, 1935; Mauritzon, 1933a; Mogensen, 1973;
Mucke, 1908; Ono, 1928; Palm, 1915; Panchaksharappa, 1962,1966;Schnarf, 1929;Shamrov, 1992a; Tilton,
1980b; Venkata Rao, 1953; Westermaier, 1890.
ЗАРОДЫШЕВЫЙ МЕШОК
ЗАРОДЫШЕВЫЙ МЕШОК (ЖЕНСКИЙ ГАМЕТОФИТ):
ПРОИСХОЖДЕНИЕ И РАЗВИТИЕ'
Общепризнано, что одно из основных отличий покрытосеменных от
нижестоящих групп состоит в наличии у них своеобразного зародышевого мешка и двойного
оплодотворения. На основании чрезвычайного сходства в строении зародышевых
мешков у подавляющего большинства покрытосеменных (так называемый
нормальный тип) и всеобщности двойного оплодотворения считается несомненным,
что зародышевый мешок именно этого наиболее распространенного типа и
двойное оплодотворение могли возникнуть лишь однажды в историческом развитии
(Schnarf, 1929, 1936; Поддубная-Арнольди, 1930, 1951; Maheshwari, 1937, 1948,
1950; Романов, 1944, и др.). Систематики видят в этом неотразимый аргумент в
пользу строго монофилетического происхождения покрытосеменных растений
(Гроссгейм, 1945; Жуковский, 1949; Буш, 1944, и др.). Что касается иных, особых,
типов зародышевых мешков, встречающихся у меньшинства представителей
покрытосеменных, то они считаются производными от нормального типа,
принимаемого за первоначально возникший, примитивный (Schnarf, 1929; Романов, 1944;
Поддубная-Арнольди, 1930, 1951; Maheshwari, 1937, 1948, 1950). Только
отдельные эмбриологи допускают возможность самостоятельного возникновения
некоторых других типов зародышевых мешков, но недостаточно убедительно это
аргументируют (Joshi, 1938; Модилевский, 1953).
Проблема происхождения покрытосеменных неразрывно связана с проблемой
происхождения зародышевого мешка и с производной от нее проблемой
происхождения двойного оплодотворения, т. е. решение основного вопроса филогении
покрытосеменных было по существу отдано эмбриологии. Естественно, что для
решения этого центрального вопроса искали в структуре зародышевого мешка
покрытосеменных гомологии со структурой женского заростка и архегония
голосеменных. Как известно, однако, установить такую гомологию оказалось
невозможно. Временным успехом пользовалась лишь архегониальная теория Порша
1 Текст печатается из работы Е.Н. Герасимовой-Навашиной (1954а, б) с разрешения автора с
сокращениями и изменениями.
Семязачаток
173
(Porsch, 1907), рассматривавшая зародышевый мешок как два архегония и
видевшая в случаях «оплодотворения» брюшного канальцевого ядра у голосеменных
прообраз двойного оплодотворения. Эта теория потеряла под собой реальные
основания, особенно после открытия ди- и тетраспорических зародышевых мешков
(Fagerlind, 1941; 1944а; Романов, 1944; Maheshwari, 1948). Как мы увидим ниже,
в теории Порша было рациональное зерно в той ее части, которая относится к
происхождению двойного оплодотворения; к сожалению, это не приняли во внимание
и, целиком отбросив теорию Порша, тем самым создали трудность для понимания
всей проблемы в целом.
В последнее время эмбриологи склоняются к точке зрения, развившейся из
первоначальных представлений (Hofmeister, 1867; Strasburger, 1900 и др.);
наиболее полно она развита И.Д. Романовым (1944). Согласно этой точке зрения,
зародышевый мешок возник в результате сильного сокращения хода развития
женского гаметофита. Сокращение это, резко выраженное уже у голосеменных, достигло
у покрытосеменных своего предела. В то время как у голосеменных женский га-
метофит переходит от свободноядерной (ценоцитной) фазы развития к клеткооб-
разованию и к выделению женских половых клеток после одиннадцатого деления
(хвойные), а у высших их представителей (оболочкосеменные) даже после
девятого или восьмого делений, у покрытосеменных клеткообразование (организация
клеток) в женском гаметофите достигается уже после трех делений (нормальный
тип), а у ди- (тип АШит)и тетраспорических (тип Adoxa) зародышевых мешков,
соответственно, даже после двух и одного деления. У высших оболочкосеменных
(Gnetum, Wehvitschia) архегониев уже совсем не образуется, а оплодотворяются
отдельные клетки заростка, расположенные близ микропиле и рассматриваемые
как задержанные в развитии архегонии (Fagerlind, 1941) или как их инициали
(Chamberlain, 1935). Тем более не достигает той стадии, когда может образоваться
архегонии, зародышевый мешок покрытосеменных (Coulter, 1909).
Описанные отношения схематически поясняет рис. 52. Горизонтальный ряд А
изображает макроспорогенез1 и ход развития женского гаметофита у хвойных
(Coni/erales, no Ferguson, 1904).
Спорогенная клетка в результате первого и второго делений (мейотические
деления) образует четыре обособленные макроспоры, три из которых гибнут, а
четвертая, обычно халазальная, «прорастает» и дает начало гаметофиту (заростку).
Развитие гаметофита включает 11 клеточных делений и идет вплоть до последнего
деления по способу свободного образования ядер, т. е. все ядра остаются лежать в
общей цитоплазме, не разделяясь перегородками. Таким образом, молодой гаме-
тофит (зародышевый мешок) является ценоцитом. Только после одиннадцатого
деления (когда число ядер достигает 2м = 2048) наступает клеткообразование.
Центральное положение вакуоли и более или менее округлая форма ценоцита
определяют париетальное (постенное) расположение ядер, равномерно
распределяющихся в цитоплазме. При продолжающихся делениях рост зародышевого мешка
постепенно затухает и к 11—12 делению соотношение между числом ядер и
количеством цитоплазмы достигает такой величины, когда ядра оказываются
лежащими друг от друга на расстояниях, достаточно близких, чтобы между ними могло
наступить образование перегородок. Макрогаметофит от свободноядерной
(ценоцитной) фазы переходит к клеточной. Одновременно с этим прекращаются и
деления, а на верхнем конце зародышевого мешка начинают выделяться инициали
архегониев, из которых в результате трех делений (иногда больше) формируются
архегонии, состоящие из шейковых канальцевых клеток (ш), брюшного
канальцевого ядра (б) (как правило, вскоре погибающего) и яйцеклетки (я). В ходе оп-
Синоним термина «мегаспорогенез»
174
Генеративные органы цветка
лодотворения пыльцевая трубка вносит в яйцеклетку архегония свое содержимое
с двумя спермиями.
В следующем горизонтальном ряду Б изображен ход макроспорогенеза и
развития гаметофита у Gnetum, где архегониев уже не образуется. Согласно данным
Fagerlind (1941), макроспорогенез у Gnetum не сопровождается образованием
перегородок. Все 4 ядра макроспор, возникшие в результате мейотических делений
спорогенной клетки, остаются лежать в общей цитоплазме; образуется с самого
начала ценоцит («ценомакроспора», Б, 11), и он как целое дает начало гаметофиту
тетраспорического происхождения. Общий ход развития гаметофита у Gnetum и в
дальнейшем сходен с таковым у Coniferales (развитие большой вакуоли,
равномерное, постенное распределение в цитоплазме синхронно делящихся ядер при
общем росте ценоцита) (ряд Б, 1 —8). Однако темп делений здесь не так сильно
отстает от темпа роста зародышевого мешка, и поэтому раньше происходит
переход от свободноядерного состояния к клеточному и к выделению на верхнем конце
зародышевого мешка клеток, способных оплодотворяться (рис. 52, Б, 8). Как
видно из рисунка, число делений при развитии гаметофита у Gnetum сокращено на
три (по сравнению с хвойными). Это сокращение происходит, во-первых, за счет
возникновения тетраспоричности и, во-вторых, за счет фактического уменьшения
числа делений в гаметофите на одно. В результате происходит в общей сложности
10 делений (считая от спорогенной клетки), дающих 210 = 1024 ядра. Таким
образом, у Gnetum дело до образования архегониев и не доходит, т. к. способными к
оплодотворению становятся уже клетки, сравнимые, самое большее, с инициаля-
ми архегониев (по Фагерлинду — «задержанные в своем развитии архегонии»);
но и это сравнение не правомочно, так как гаметофит здесь развивается не из
споры, а из четырехъядерного ценоцита («ценомакроспоры»), соответствующего всем
четырем спорам.
Закономерность этого процесса вполне понятна, если учесть, что у высших
растений вместе с сокращением заростка происходит и сокращение развития
архегониев. Уже у хвойных архегонии крайне упрощен, у некоторых из них перестает
образовываться брюшная канальцевая клетка, от которой сохраняется лишь одно
ядро, тоже дегенерирующее, так что к моменту оплодотворения остается лишь
одна яйцеклетка.
Таким образом, архегониев, как таковых, с самого начала уже нет в женском
гаметофите Gnetum (нет их также и у Welwitschia), и совершенно бесперспективно
искать хотя бы «следы» их в зародышевом мешке (женском гаметофите)
покрытосеменных, с еще более сокращенным ходом развития.
Третий горизонтальный ряд рисунка показывает ход развития зародышевого
мешка нормального типа у покрытосеменных: макроспорогенез протекает
совершенно сходно с хвойными, сходным же образом начинает прорастать и
макроспора. Отличие покрытосеменных от хвойных состоит главным образом в том, что у
первых в развивающемся зародышевом мешке гораздо более быстрыми темпами
идет размножение ядер при относительно медленном росте молодого гаметофита.
Вскоре, уже после третьего деления, в гаметофите покрытосеменных митозы
прекращаются и между ядрами формируются клеточные перегородки: гаметофит от
свободноядерной (ценоцитной) фазы переходит к клеточной. На вершине его
дифференцируется оплодотворяемая клетка — яйцеклетка. Яйцеклетку
покрытосеменных можно, следовательно, гомологизировать, самое большее, с инициальной
клеткой архегония (Fagerlind, 1941), а это уже далеко от истинной гомологизации.
Эта общая тенденция сокращения развития женского гаметофита сохраняется
и внутри группы покрытосеменных (рис. Г—Д). В двух особых линиях развития
зародышевых мешков (тип Allium и тип Adoxa), соответственно би- и тетраспо-
рических, еще сильнее сократился онтогенез гаметофита (соответственно до двух
Семязачаток
175
и одного деления). Сокращение идет за счет включения макроспорогенеза в
формирование зародышевого мешка подобно тому, как это имеет место у Gnetum.
Развитие этих типов зародышевых мешков еще яснее показывает всю бесплодность
попыток усмотреть в элементах зародышевого мешка покрытосеменных родство с
архегониями или с их элементами. Здесь эта «гомология» совершенно иллюзорна
уже по одному тому, что приходится гомологизировать элементы, происшедшие
из двух и четырех макроспор, с элементами, происшедшими из одной
макроспоры, а это явно абсурдно морфологически (см. Романов, 1944; Fagerlind, 1944a;
Maheshwari, 1948; Модилевский, 1953, и др.).
Таким образом, можно допустить, что у покрытосеменных одна из клеток
заростка берет на себя функцию яйцеклетки. Все прочие клетки зародышевого
мешка надо также, конечно, рассматривать как клетки женского заростка
(гаметофита) (Strasburger, 1900). Это относится и к синергидам, и к антиподам, и, наконец,
к центральной клетке зародышевого мешка с ее полярными ядрами, получающей
после оплодотворения способность вновь делиться, образуя вторичный эндосперм.
Поэтому вторичный эндосперм' покрытосеменных не следует рассматривать как
нечто принципиально новое. Как по происхождению, так и по функции он
является заростком, но его функция улучшается гибридностыо и связанной с ней поли-
плоидностью. Это совершенно ясно было выражено еще С.Г. Навашиным (1898:
цит. по Навашин, 1951а), который подчеркивал, что вторичный эндосперм
сохраняет функцию первичного эндосперма голосеменных, будучи сходен с ним также
и по характеру своего развития, но в то же время приобретает он сходство и с
зародышем благодаря включению в его образование полового процесса.
Вторичный эндосперм покрытосеменных поэтому не тождествен зародышу, но
не является и прежним заростком; исторически он произошел, конечно, от
заростка, но несет в себе все преимущества, даваемые половым способом образования
(Brink, Cooper, 1940, 1947; Модилевский, 1950).
Итак, очевидно, что зародышевый мешок покрытосеменных образовался в
результате сильного сокращения единого процесса развития женского гаметофита,
сокращения, отмечавшегося еще Coulter (1909). Оно, надо полагать, было вызвано
изменением в условиях существования, повлиявшим на весь ход обмена веществ
у предков покрытосеменных. Только упуская это из виду, в различиях между
женскими гаметофитами голо- и покрытосеменных могли видеть «пропасть» или
«разрыв», разделяющие эти группы (Кузнецов, 1936; Поддубная-Арнольди, 1930,
1951, и др.). В действительности же никакой «пропасти» здесь нет: «разрыв»
между женскими гаметофитами голосеменных и покрытосеменных кажется столь
большим только в том случае, если не основываться на изучении реальных
закономерностей развития гаметофита.
Сокращение развития гаметофита покрытосеменных рассматривается И.Д.
Романовым (1944) как аналог неотении, т. е. в данном случае как раннее
образование гамет при выпадении конечных стадий развития гаметофита (выпадения
образования архегония и нескольких предшествующих ему клеточных поколений).
К этой же точке зрения примыкает А.Л. Тахтаджян (1948, 1950), хотя и в менее
последовательной форме, так как допускает еще у покрытосеменных «следы»
архегониев.
С нашей точки зрения правильнее говорить просто об ускорении развития
(«акселерация» по Северцову, 1939); термином же «неотения» издавна
обозначаются лишь особые случаи акселерации у животных (половая зрелость,
наступающая у личинок).
1 Имеется в виду эндосперм покрытосеменных, образующийся после оплодотворения
центральной клетки зародышевого мешка (Ред.)
176
Генеративные органы цветка
Если общее направление развития женского гаметофита покрытосеменных,
как мы видели, достаточно ясно, то все же остается трудность для понимания
окончательной конструкции зародышевого мешка, на первый взгляд не
имеющей ничего общего с соответствующей фазой развития (третье деление
гаметофита) у голосеменных, у которых в это время постенное расположение свободных
ядер. До сих пор особенно смущает образование всегда одинаковых «четверок»
ядер, «конструктивных групп», «синангиев» у обоих полюсов зародышевого
мешка. Эта одинаковость строения обоих полюсов зародышевого мешка
покрытосеменных, сходство с двумя архегониями, послужило, как уже указано, основой
теории Порша (Porch, 1907) и дальнейшего ее развития (Nilsson, 1941; Schnarf,
1942). Однако, уже из вышесказанного очевидно, что понять природу
зародышевого мешка можно лишь на основе анализа его развития. Романов (1944) и
Fagerlind (1944a) стремились рассматривать все многообразие строения
зародышевых мешков с точки зрения «механизма» их развития, рассматривая
определенные частные закономерности как основу образования специфической
структуры зародышевого мешка. Так, Романов к этим закономерностям относит
поляризацию зародышевого мешка, синхронность ядерных делений в нем, депрессию
одного из концов зародышевого мешка. Fagerlind выводил ряд гипотетических
заключений, касающихся механизма образования и развития изученных им
зародышевых мешков, излагая их в ряде пунктов, причем последние носили скорее
описательный характер.
Возможно, однако, и другое понимание этого вопроса. Отказываясь от
формальных гомологии структур зародышевого мешка со структурами
зрелых гаметофитов нижестоящих форм, я предполагаю рассмотреть
зародышевый мешок нормального типа не только на основе улавливания каких-либо
особых, ему одному свойственных закономерностей, а исходя из основных
и наиболее общих закономерностей жизненного цикла клетки и ее
элементов. Такой подход дает возможность не только лучше понять развитие и
возникновение зародышевого мешка нормального типа, но помогает
разрешить ряд трудных вопросов развития других, «аномальных» типов
зародышевых мешков. Мало того, если в основу анализа положить общие
закономерности клеточной жизнедеятельности, главным образом закономерности
клеточного деления, то становится понятным не только возникновение
строения зародышевого мешка, но и двойное оплодотворение как итог все того
же процесса сокращения развития женского гаметофита.
Перед тем, как рассмотреть развитие зародышевого мешка на указанной
основе, напомним те основные закономерности, действующие в любой эмбриональной
клетке (Hofmeister, 1867; Sachs, 1878, 1882; Hertwig, 1894; Gerasimoff, 1890;
Вильсон, 1925; M.C. Навашин, 1947; Герасимова-Навашина, 1951а, 19516), которые в
данном случае особенно важны для нас.
1. Ядро, а следовательно и фигура митоза, стремятся расположиться в
определенном «динамическом центре» клетки (что вызывается, по всей вероятности,
отталкиванием от оболочек протопласта). Положение этого центра часто совпадает
с геометрическим центром клетки; если клетка асимметрично вакуолизирована
(например, молодое одноядерное зерно — микроспора), то ядро располагается в
центре максимального скопления цитоплазмы.
2. Ось фигуры митоза располагается по более длинной оси поляризованного
протопласта, а деление, следовательно, стремится разделить продолговатую
клетку поперек (типично для меристем органов, растущих в длину, например, для
верхушечной меристемы корня).
3. Каждая новая плоскость деления стремится пересечь предыдущую под
прямым углом (типично для микроспорогенеза).
Семязачаток
177
4. Расходящиеся при делении сопроизводные ядра взаимно отталкиваются; это
митотическое отталкивание прекращается образованием перегородок
(обособлением клеток) или достаточно сильным развитием вакуоли между ядрами. Только
тогда вступает в силу правило 1 (т. е. ядра стремятся занять динамические центры
своих протопластов) (пример: спермиогенез у покрытосеменных).
5. В дву- и многоядерных клетках (ценоцитах) ядра делятся синхронно.
Взаимное отталкивание сохраняется между всеми ядрами, а не только между сопро-
изводными (правило 4); поэтому все ядра максимально удаляются друг от друга,
чем определяется характер их распределения. В силу этого в двуядерном ценоците
ядра оказываются у противоположных полюсов (пример: первое мейотическое
деление в материнской клетке пыльцы); в четырехъядерном (в силу поворота
деления, правило 3) — по вершинам тетраэдра или по углам квадрата (пример: второе
мейотическое деление в материнской клетке пыльцы); в многоядерных ценоцитах
ядра распределяются совершенно равномерно в сплошной массе цитоплазмы или
в ее постенном слое, если ценоцит сильно вакуолизирован (пример: первичный
эндосперм голосеменных, вторичный нуклеарный эндосперм покрытосеменных).
6. Клеткообразование в ценоцитах после митозов происходит лишь при
определенном «насыщении» цитоплазмы ядрами, или, иначе говоря, по достижении
известной густоты их расположения. Взаимодействие ядер вызывает образование
между ними фрагмопластов, в которых образуются клеточные пластинки. При
очень большом расстоянии между ядрами или при наличии между ними большой
вакуоли это взаимодействие не устанавливается, перегородка не образуется, и
ядра остаются в общей цитоплазме.
7. После полного прекращения процессов, связанных с делением в ценоците,
ядра перестают влиять друг на друга (например, взаимно отталкиваться), и, если
нет к тому препятствий в виде обособления клеток, то они, согласно правилу 1,
стремятся к общему динамическому центру.
Проявление перечисленных закономерностей видоизменяется конкретной
обстановкой, складывающейся в результате дифференциации клеток и тканей
(вакуолизация, изменение формы, направление давления, одностороннее
поступление веществ и пр.). Так, в ткани, состоящей из сомкнутых клеток, и в сильно
вытянутых клетках может не проявляться правило 3; сильное развитие вакуоли
препятствует образованию перегородки после деления и пр. Дело усложняется
еще и тем, что эти факторы часто взаимодействуют между собой в различных
сочетаниях. Однако среди них всегда можно выявить решающий, ведущий,
определяющий тот или иной результат. Это будет для нас особенно важно при
рассмотрении различных типов развития зародышевых мешков.
Если мы теперь обратимся к общеизвестной картине развития зародышевого
мешка нормального типа, то сразу увидим, что в этом развитии ведущую роль
играют перечисленные выше основные клеточные закономерности. В этом смысле в
зародышевом мешке нет ничего специфического, что можно было бы
истолковать как унаследованную конструкцию, возникшую однажды в
истории у единственного предка. Ядро макроспоры делится на два ядра,
расходящихся, как при всяком делении, к полюсам поляризованной клетки (правила
1 и 2); второе и третье деления совершенно синхронны и взаимно
перпендикулярны (правила 3 и 5), в силу чего у полюсов неизбежно образуются «загадочные»
четверки ядер. Ядра в каждой четверке, взаимно отталкиваясь (правило 4),
непременно расположатся при этом так, что три из них упрутся в «свод» ценоцита,
а четвертое окажется обращенным к середине последнего, занятой к этому
времени разросшейся вакуолью. Этот момент совпадает с «насыщением» ядрами
(правило 6) полярных скоплений цитоплазмы, в которых и происходит вставление
перегородок между ядрами, т. е. формирование яйцевого аппарата и антипод. Силь-
12 Генеративные органы цветка.
178
Генеративные органы цветка
ная вакуолизация и разрастание зародышевого мешка препятствует вставлению
перегородки между двумя четвертыми ядрами каждой тетрады ядер, что ведет к
образованию большой центральной клетки с двумя полярными ядрами. Вскоре в
ней образуется один динамический центр, куда и сходятся полярные ядра
(правила 1 и 7).
Таким образом, развитие зародышевого мешка нормального типа есть процесс,
который единственно и может произойти при данных условиях роста клетки.
Любая эмбриональная клетка, помещенная в соответствующие условия, будет
неизбежно проходить именно такой путь развития, определяемый всеобщими
законами клеточной жизни, а не зависящий всецело от каких-либо специфических
законов, свойственных только макроспоре; такие специфические закономерности
могут, лишь до некоторой степени видоизменить это развитие.
Факт апоспорического развития зародышевых мешков у многих апомиктов
(например, у ряда видов сложноцветных) является, на наш взгляд, неотразимым
доказательством правильности именно такой точки зрения. Как известно, у апо-
миктических растений зародышевый мешок «нормального типа» образуется не из
споры, а непосредственно из материнской клетки спор, которая, несмотря на то,
что не проходит специфического пути, приводящего к образованию споры как
начальной клетки гаметофита, тем не менее дает зародышевый мешок. Трудно
объяснить это чем-либо иным, кроме как проявлением общих закономерностей
клеточного развития в соответствующих условиях.
Ярчайшим подтверждением сказанного являются также некоторые особые
случаи и прежде всего давно известное поразительное явление развития молодых
пыльцевых зерен (микроспор) при необычно высокой температуре в
образования, совершенно сходные с зародышевым мешком (Nemec, 1898; Stow, 1930, и др.).
Исходя из вышесказанного, принципиально вполне возможно представить себе
происхождение нормального зародышевого мешка покрытосеменных от
зародышевого мешка какой-либо нижестоящей группы растений, сходной даже с
современными голосеменными. С нашей точки зрения очевидно, что различие в ходе
развития гаметофита голо- и покрытосеменных зависит от причины самого общего
характера, а именно, от изменения всего хода обмена веществ, которое у предков
покрытосеменных не могло быть вызвано ничем иным, кроме общей перемены в
условиях существования.
Как уже было сказано выше (правило 6), клеткообразование, т. е.
окончательное формирование зародышевого мешка, зависит от определенного соотношения
между темпом размножения ядер и накоплением в ценоците цитоплазмы. У
покрытосеменных размножение ядер происходит несравненно быстрее, чем у
голосеменных, и поэтому гораздо раньше достигается указанное соотношение. У
голосеменных же, как известно, развитие зародышевого мешка продолжается в
течение очень долгого времени, поскольку темп ядерных делений при развитии
женского гаметофита чрезвычайно медленный. Так, согласно данным Ferguson
(1904), у сосны на первых фазах происходит в среднем одно ядерное деление в
месяц при очень сильном росте ценоцита и соответственном накоплении
цитоплазмы. Другая особенность покрытосеменных заключается в том, что молодой
зародышевый мешок очень рано начинает расти в длину, отчего его протопласт
фактически разделяется вакуолей надвое; в силу этого и образуются полярные
группы ядер, а затем и клеток. Таким образом, от изменения начальной формы
зародышевого мешка в комбинации с быстрым прохождением его развития
зависит окончательное расположение образующихся в нем ядер, а следовательно,
соответственным образом изменяется и окончательное клеточное строение
зародышевого мешка. Совершенно иное положение у голосеменных, например у хвойных,
где зародышевый мешок сохраняет более или менее округлую форму, неизбеж-
Семязачаток
179
ным результатом чего (в комбинации с указанным медленным развитием)
является равномерное распределение ядер в постенном слое цитоплазмы (согласно
правилу 5). Поэтому при всем своем кажущемся различии, восьмиядерные фазы
развития гаметофитов в той или другой группе являются на самом деле лишь
различным выражением, в разных условиях, одного и того же основного
процесса. В одном случае получается полярная конструкция зародышевого мешка
покрытосеменного, в другом — равномерное распределение ядер в постенном слое
цитоплазмы. Это различие, однако, не есть выражение наличия какого-либо
специфического плана.организации, а, как мы видели, является результатом
действия факторов самого общего характера. К этому моменту мы еще вернемся при
рассмотрении развития тетраспорического зародышевого мешка типа Peperomia,
свободноядерные фазы развития которого гораздо сильнее напоминают первые
стадии развития зародышевого мешка голосеменных именно благодаря
изначальной округлой форме макроспороцита; там выдвигаемый нами принцип
зависимости распределения ядер от формы клетки получит дальнейшее подтверждение.
Из вышесказанного ясно, что особенности развития зародышевого мешка
покрытосеменных следует скорее объяснять общими изменениями обмена веществ,
а не приобретением каких-либо специфических наследственных изменений
строения, которые могли возникнуть лишь однажды и обеспечили появление
первичного зародышевого мешка нормального типа как образования sui generis.
Рассмотренные нами данные делают гораздо более вероятным противоположное
представление, именно, что уже у всех голосеменных имелись вполне достаточные
предпосылки для развития в дальнейшем зародышевого мешка
покрытосеменных; поэтому возникновение этого последнего могло быть неоднократным, от
нескольких дивергировавших предков, имевших, однако, для этого предпосылки в
виде относительно сходных структур, из которых он мог возникать (явление
параллелизма, в данном случае, по отношению к возникновению у цветковых
растений зародышевого мешка нормального типа).
Эти выводы наилучшим образом подтверждаются и при рассмотрении других
типов зародышевых мешков покрытосеменных, на которых можно показать, что
в основе их развития также лежат те же общие закономерности клеточного
развития; проявление последних лишь видоизменяется под влиянием специфических
особенностей онтогенеза генеративных органов того или иного вида растения. Но
среди подобных факторов всегда есть решающий, определяющий ход онтогенеза
зародышевого мешка; выявление этого ведущего фактора в большинстве случаев
необходимо для правильного понимания природы и происхождения изучаемого
типа зародышевого мешка. Разные типы — это результат особенностей развития.
Однако эти особенности не касаются самого главного, т. е. принципов развития,
тех глубинных процессов, на основе которых и протекает развитие. Принципы
клеточного развития везде одни и те же, и у голосеменных, и даже у нижестоящих
групп, но они видоизменяются привходящими обстоятельствами, возникающими
в ходе онтогенеза гаметофита на той или другой его фазе.
Вернемся к рассмотрению би- и тетраспорических зародышевых мешков,
имеющих в готовом виде «нормальное» строение (тип Allium и тип Adoxa — рис. 52,
Г и Д). Как уже отмечалось, их особенность состоит в том, что они развиваются
соответственно из двух и четырех макроспор, образующих ценоциты, и
представляют высшие ступени сокращения развития женского гаметофита. Эти типы
являются дальнейшим подтверждением нашей точки зрения, трактующей строение
зародышевого мешка нормального типа не как наследственную «конструкцию»,
осуществляемую через развитие макроспоры определенного происхождения,
например из получающегося непосредственно в результате одного или обоих мей-
отических делений без обособления макроспор. Совершенно очевидно, что исход-
12*
180
Генеративные органы цветка
ные двуядерные ценоциты моно-, би- и тетраспорического зародышевых мешков
(рис. 52 — В, I, Г, II и Д, I) не гомологичны между собой, однако, окончательный
результат развития во всех трех случаях совершенно сходен, т. е. представляет
зародышевый мешок нормальной конструкции («конвергентное развитие» по Мо-
дилевскому, 1953; «унаследованная конструкция конечных фаз» по Романову,
1944). Нам кажется, что наша точка зрения позволяет дать наиболее естественное
объяснение — принять, что ценоцит независимо от своего происхождения
развивается сходным образом при наличии сходных условий на основе одних и тех же
общих внутренних закономерностей. Все сказанное нами выше о развитии
зародышевого мешка нормального типа поэтому целиком приложимо и к этим типам
и, в свою очередь подтверждается ими.
Из этого следует очень важный дальнейший вывод. Нет оснований
полагать, что би- и тетраспорические зародышевые мешки должны были всегда
исторически происходить от нормального типа, считающегося исходным.
Напротив, есть основания допустить возможность независимого возникновения
би- и тетраспории у предков покрытосеменных. Лучшим подтверждением
этой мысли может служить наличие тетраспории у Gnetum, на которое мы
уже указывали выше.
В пределах каждого из естественных трех крупных подразделений (моно-, би- и
тетраспорических) зародышевых мешков различают то или иное число типов в
зависимости от того, какие признаки строения и развития считают существенными.
Поэтому различные авторы устанавливают различное число типов зародышевых
мешков. Как мы видели, большинство авторов согласно в том, что зародышевый
мешок обязан своим возникновением появлению у какого-то единственного предка
покрытосеменных некоторых особых закономерностей развития женского гамето-
фита, в силу действия которых образовался зародышевый мешок нормального
типа, давший впоследствии все прочие типы. Однако, дальнейший анализ развития
различных зародышевых мешков, помимо уже рассмотренных нами, показывает,
что нет никаких оснований и в этом случае допускать какие-либо специфические
закономерности (фиксированное число делений, особая полярность и пр.), так как все
различные формы организации зародышевых мешков являются лишь
различными выражениями одних и тех же общих закономерностей в зависимости от
специфических условий их осуществления. Условия же эти складываются всякий раз в ходе
онтогенеза, свойственного тому или другому виду растения.
Рассмотрим сначала зародышевый мешок так называемого типа Oenothera,
являющегося особым типом внутри моноспорической группы. Он, как известно,
характеризуется тем, что состоит только из четырех клеток (вместо семи), т. е. из
яйцевого аппарата и центральной клетки, содержащей лишь одно полярное ядро.
Этот как бы половинный состав зародышевого мешка является следствием того,
что при его развитии происходит всего два деления вместо обычных трех. Другая
его особенность состоит в том, что он развивается из микропилярной макроспоры
в отличие от нормального типа, где развитие зародышевого мешка, как известно,
происходит типично из халазальной макроспоры.
Подходя формально к истолкованию этого типа, допускают, что предки
.Onagraceae (где этот тип только и известен) помимо и независимо от
наследственной фиксации выживания микропилярной макроспоры (вместо халазальной)
должны были приобрести еще следующие три специфические особенности развития
зародышевого мешка.
1. Отхождение ядра макроспоры к ее микропилярному концу, где после его
деления и образуется яйцевой аппарат («возникновение униполярности»).
2. Локализация вакуоли в халазальном конце макроспоры.
3. Сокращение числа делений с трех до двух.
Семязачаток
181
Между тем, с нашей точки зрения достаточно вместо допущения возникновения
четырех наследственно фиксированных особенностей сделать лишь одно вполне
естественное предположение, чтобы при учете общих закономерностей клеточного
развития, объяснить особенности зародышевого мешка Oenothera в их
органической связи друг с другом. Достаточно допустить, что у Onagraceae установился
особый порядок поступления веществ в макроспору, чтобы все указанные
особенности развития их зародышевого мешка стали понятны.
В самом деле, если развитие в тетраде только одной из микроспор зависит, в
первую очередь, от того, что она с самого начала получает лучшее питание, то,
очевидно, надо предположить, что источник питания находится с той стороны, где
лежит развивающаяся макроспора. У растений с нормальным ходом развития мо-
носпорического зародышевого мешка ток питательных веществ должен идти,
следовательно, от халазы, что обычно и принимается. У растений с развитием типа
Oenothera он должен иметь обратное направление, вследствие чего и развивается
макроспора, ближайшая к микропиле. Можно себе представить, например, при
ускорении спорообразования по отношению к формированию проводящей системы
семяпочки, не успевающей еще достигнуть уровня халазы к моменту головности
тетрады макроспор. Но, кроме ассимилятов, приносимых в семяпочку проводящей
системой, несомненно важное значение имеют те пластические вещества, которые
макроспора получает от дезинтегрирующих соседних клеток, и, в первую очередь,
от поглощаемых ею продуктов дезинтеграции остальных трех макроспор (Нава-
шин, Герасимова-Навашина, Яковлев, 1952). При нормальном типе развития
источник этих веществ находится со стороны, противоположной источнику
ассимилятов, притекающих через халазу. При развитии же типа Oenothera оба эти
источника веществ оказываются с одной стороны, так как во время дезинтеграции
трех макроспор, надо полагать, уже устанавливается поступление ассимилянтов
из халазы. Такое одностороннее поступление веществ в макроспору, уже
успевшую сильно вырасти к тому времени, не может не вызвать асимметрии ее обмена
веществ, наглядно выражающейся в данном случае в одностороннем образовании
вакуоли с халазального конца и в миграции главной части цитоплазмы с ядром к
противоположному, микропилярному концу. Ядро макроспоры оказывается там,
очевидно, в тех же условиях, в каких при нормальном типе развития находится
одно из двух сопроизводных ядер, получившихся после первого деления в
макроспоре; поэтому вполне естественно, что там происходят те же процессы, что и в
микропилярном конце нормального зародышевого мешка, т. е. два
последовательных деления, завершающихся образованием яйцевого аппарата и одного
полярного ядра центральной клетки (здесь, конечно, «центральная» только по
названию) . Таким образом, происходит сокращение числа делений на одно в силу того,
что в типе Oenothera первое по счету деление физиологически соответствует
второму по счету делению нормального типа, а второе — третьему; деление же,
физиологически эквивалентное первому делению нормального типа, вовсе не
может осуществиться.
Таким образом, на примере зародышевого мешка Oenothera мы видим, что,
несмотря на всю его кажущуюся специфику, сущность его отличия от нормального
типа может быть сведена к действию такого общего фактора, как отношение
темпов развития семяпочки и макроспор, сказывающееся на порядке поступления
веществ.
Наибольшее число типов зародышевых мешков, как известно, сосредоточено в
тетраспорической группе, где вследствие образования исходного четырехъядер-
ного ценоцита с самого начала имеется наибольшее разнообразие возможностей
развития. Однако, при анализе развития этих типов можно видеть, что в основе
особенностей каждого из них лежит, как и везде, один ведущий фактор общего
182
Генеративные органы цветка
характера. Прежде всего необходимо отметить те случаи, где решающим
фактором является форма исходной клетки.
Так, если сравнить округлый зародышевый мешок типа Peperomia с сильно
вытянутым зародышевым мешком типа Pyrethrum то, принимая во внимание общие
закономерности клеточного развития, можно сразу сказать, что именно форма
исходного ценоцита была решающим фактором в определении этих тетраспориче-
ских типов.
В случае зародышевого мешка Peperomia округлая форма макроспороцита
определяет способ распределения ядер, а именно, они располагаются в нем
равномерно по периферии, в результате чего вместо двух полярных клеточных групп
на стенках зародышевого мешка обособляются более или менее равномерно
расположенные клетки. Оставшиеся свободные ядра («полярные») собираются в
динамическом центре округлого зародышевого мешка.
Если мы обратимся к зародышевому мешку типа Pyrethrum, то здесь тоже уже
по одной форме ценоцита можем предсказать поведение ядер: быстрый рост
ценоцита в длину не дает возможности ядрам во втором делении менять плоскость
последнего, вследствии чего ядра располагаются цепочкой вдоль ценоцита; поворот
происходит в третьем делении, как только в разрастающемся ценоците это
позволят пространственные отношения.
Эти примеры показывают с полной ясностью, какую важную роль в
определении типа развития играет характер развития семяпочки1, так как последний
непосредственно определяет форму исходной клетки (ценоцита) зародышевого
мешка: так, семяпочка Peperomia характеризуется радиально-симметричным ростом,
а у Pyrethrum — продольным. Нет сомнения, что громадное значение должны
иметь и такие общие факторы, как характер плацентации, строение завязи, а
может быть, и всего цветка, не говоря уже о соотношении между развитием системы
снабжения семяпочки и ритмом развития макроспоры (ср. выше). Эти важные
обстоятельства, к сожалению, совершенно не принимались во внимание при
установлении типов зародышевых мешков, где последние не только представляются
вне связи с характером семяпочки, но и к тому же и изображаются совершенно
произвольно в виде овалов или даже кружочков.
Если мы вкратце рассмотрим еще некоторые другие тетраспорические типы,
на первый взгляд обладающие чрезвычайным своеобразием, то увидим, что в
действительности оно является не более, чем проявлением все тех же общих
закономерностей, вступающих в действие в различных сочетаниях друг с другом, в тех
или иных условиях, в свою очередь создаваемых общим ходом онтогенеза органа
и даже всего организма.
Прежде всего остановимся на типе Fritillaria, привлекающем всеобщее
внимание особенностями своего развития. Некоторые эмбриологи (Joshi, 1938)
опирались на него как на доказательство полифилетического происхождения
покрытосеменных. Этот тип характеризуется, как известно, главным образом
асимметричным распределением ядер в четырехъядерном ценоците. Вместо нормального
распределения по два ядра у каждого из концов (распределение 2+2), как у
знакомого нам типа Adoxa (т. е. тетраспорического типа с нормальным
окончательным строением), здесь ядра располагаются так, что у микропилярного конца
остается лишь одно из них, а три остальные оказываются в халазальном конце
(распределение 1+3). Эти три ядра обнаруживают, кроме того, аномальное поведение:
при наступающем делении они сливаются в одно ядро, так что первоначальный
четырехъядерныи ценоцит снова становится двухъядерным, причем халазальное
ядро получает триплоидный состав («эффект Бамбачиони», Bambacioni, Mezzetti,
Синоним термина «семязачаток».
Семязачаток
183
1931). После этого деления ценоцит вторично становится четырехъядерным, и,
наконец, в результате наступающего последнего деления, достигается
окончательное восьмиядерное состояние. Описанная особенность поведения халазальных
ядер получает, однако, различное выражение у различных видов растений,
обладающих зародышевым мешком типа Fritillaria, в зависимости от того, что деление
ядер в халазальном конце в той или иной степени подавляется. Это подавление
может идти вплоть до того, что три слившихся халазальных ядра оказываются
вовсе неспособными к дальнейшему делению и в результате получаются
зародышевые мешки с уменьшенным числом ядер (7, 6 и 5; Романов, 1939). Это явление
нарушения хода деления ядер в халазальном конце зародышевого мешка
получило название «депрессии» (Романов, 1936, 19396).
Однако, все основные особенности развития типа Fritillaria, а именно
«миграция» трех ядер в халазальный конец, их слияние между собой и подавление
деления в халазальном конце, в действительности могут быть сведены к единому
процессу подавления [функциональной активности ] халазального конца
зародышевого мешка, начальным проявлением которого является своеобразное
асимметрическое распределение ядер «1+3».
Расположение ядер в своей основе имеет динамическую природу и поэтому
всякое изменение условий, сказывающееся на взаимном отталкивании ядер,
должно сказаться и на рапределении последних.
Исходя из рассмотренных общефизиологических закономерностей,
своеобразное распределение ядер «1+3» в ценоците типа Fritillaria, по моему мнению, всего
естественнее объяснить тем, что активность двух нижних ядер начинает рано
подавляться и поэтому в то время как два верхних ядра, отталкиваясь друг от друга
на максимальное расстояние, раздвигаются, ядра нижней пары не препятствуют
своим отталкиванием движению нижнего ядра из верхней пары. В результате
нижнее ядро из микропилярной пары уходит далеко к халазальному концу, образуя
вместе с двумя халазальными ядрами тесную группу, чем и достигается
характерная конфигурация ядер «1+3».
Следующая фаза этой депрессии проявляется в объединении трех делящихся
ядер в халазальном конце, что затем и приводит к образованию «вторично-четы-
рехъядерного» ценоцита. Дальнейший ход событий в халазальном конце
зародышевого мешка и характер окончательного строения зародышевого мешка, как уже
сказано, зависит от степени и характера той же депрессии, начало которой, по
нашему мнению, надо отнести еще к фазе четырехъядерного ценоцита, т. е. к
самому началу развития зародышевого мешка. Между тем, до сих пор начало
проявления этого подавления активности халазального конца относили к гораздо
более позднему моменту, т. е. к периоду последнего деления, от степени подавления
которого зависит окончательное число ядер зародышевого мешка («депрессия» по
Романову; «отказ ядер делиться» по Фагерлинду).
Дальнейшая особенность типа Fritillaria состоит в том, что при его нормальном
развитии происходит одно добавочное деление по сравнению с «нормальным» тет-
распорическим типом (типом Adoxa). В результате того, что в микропилярном
конце первичного четырехъядерного ценоцита остается лишь одно ядро (в силу
распределения «1+3»), там, очевидно, создаются условия, сравнимые с
предыдущей фазой развития, т. е. с двуядерным ценоцитом; поэтому свободно
осуществляются два деления, в обычном случае происходящие в микропилярном конце и
образующие микропилярную тетраду ядер, а далее — яйцевой аппарат с верхним
полярным ядром. Иначе говоря, пользуясь формулировкой, примененной нами
при рассмотрении развития типа Oenothera, второе по счету деление в макроспо-
роците типа Fritillaria физиологически эквивалентно первому по счету
делению в типе Adoxa, а третье — второму.
184
Генеративные органы цветка
Подтверждением сказанному может служить развитие зародышевого мешка у
Tulipa tetraphylla, описанное как особый тип (Романов, 1938) и представляющее в
известном отношении противоположность типу Fritillaria, так как здесь, на четы-
рехъядерной стадии, достигается обратное распределение ядер: «3+1» вместо
«1+3». Решающую роль в данном случае играет, очевидно, форма четырехъядер-
ного ценоцита, халазальная часть которого здесь вытянута в продольном
направлении, а микропилярная сильно расширена. Эта особенность, кроме того,
комбинируется в ходе развития со слабой депрессией. Поэтому халазальная пара ядер
ориентируется по продольной оси ценоцита, а микропилярная — в
перпендикулярном направлении, что является неизбежным выражением основных правил
деления в этих условиях. Отталкиваясь от сопроизводного ему ядра, верхнее ядро
халазальной пары поднимается кверху, приближаясь к микропилярной паре
ядер, которым, благодаря их поперечному расположению, разойтись некуда.
Наступающее затем продольное растяжение ценоцита вследствие развития вакуоли
еще более усиливает выражение распределения «3+1». Поскольку микропиляр-
ный конец еще на четырехъядерной фазе оказывается уже относительно
насыщенным ядрами, число делений сокращается по сравнению с типом Fritillaria на одно,
в чем тип Tulipa tetraphylla сходен с типом Adoxa, отличаясь от последнего лишь
окончательным строением, что надо отнести просто за счет исходной формы
ценоцита.
Таким образом, рассмотренные нами три характерных тетраспорических типа
зародышевых мешков представляют собою в сущности результат вариаций одного
и того же основного процесса развития четырехъядерного ценоцита. Варьирование
процесса вызвано влиянием факторов самого общего характера, а именно —
формой ценоцита и неодинаковостью физиологического состояния микропилярного и
халазального концов, зависящей, как мы предполагаем, от характера
поступления веществ. Все дело лишь в том, в какой комбинации и в какой момент эти
факторы действуют. Поэтому естественно, что все эти типы (как и ряд других,
встречаются в кругу близко родственных форм, и нет ничего удивительного, что иногда
характер развития зародышевого мешка этих типов варьирует в пределах одного
вида и даже особи (Романов, 1936, 1938, 19396, 1944).
Рассматривая ход развития зародышевого мешка типа Fritillaria мы
установили, что необходимо допустить очень рано наступающую там физиологическую
неравноценность халазального и микропилярного концов молодого зародышевого
мешка, которая, по нашему мнению, в первом своем проявлении ответственна за
специфическое распределение ядер «1+3», а потом — и за все последующее. Ни*
кажется, что объяснение этому явлению можно искать единственно лишь в
неодинаковом снабжении халазального и микропилярного концов развивающегося
зародышевого мешка, т. е. в том же общем факторе, который несомненно
ответственен и за подавление трех макроспор при моноспорическом развитии. Если так, то
в депрессии, происходящей в тетраспорических зародышевых мешках, можно
видеть следы их вторичного происхождения от моноспорических типов. В пользу
такого предположения говорит и широкая распространенность начального
распределения ядер «1+3», известного в ряде тетраспорических зародышевых мешков
помимо типа Fritillaria (типы: Drusa, Anthemis, Plumbagella, по Романову).
В связи с этим может встать вопрос, почему при возникновении тетраспории
подавление развития стали испытывать халазальные макроспоры, а не микропи-
лярные, как у большинства исходных моноспорических типов? Ответ на этот
вопрос может быть лишь один: тетраспорические типы с подавлением
микропилярного конца не могли удержаться, так как подобный ход развития несовместим с
образованием функционального яйцевого аппарата, а сохранились отбором лишь
варианты с подавлением халазального конца. Самая же возможность такого «об-
Семязачаток
185
ращения» процесса у моноспорических предков тетраспорических типов
неопровержимо доказывается примером типа Oenothera. К тому же, в недавнее время
стали известны нормальные зародышевые мешки, развивающиеся, как правило,
из микропилярной микроспоры (Fagerlind, 1944a, 1944b).
Нами почти не затронут важнейший вопрос о причине относительного
постоянства числа делений при развитии зародышевых мешков (вставший почти с
момента открытия последних). Без этого постоянства числа делений (особенно в микро-
пилярном конце зародышевого мешка) не мог бы возникнуть весь «ансамбль
явлений», характеризующий оплодотворение у покрытосеменных. Это постоянство
кажется настолько необъяснимым, что даже и те эмбриологи, которые близко
подходят к тому, чтобы обобщать факторы развития зародышевых мешков на основе
закономерностей клеточного развития (Романов, 1944; Fagerlind, 1944а), в
нерешительности останавливаются перед своеобразием организации зародышевого
мешка, в котором видят некий эталон или план, свойственный только женской
сфере покрытосеменных. Фагерлинд допускает даже идеалистические
формулировки, говоря о некой «цели», к которой стремится развитие зародышевого мешка.
Достижение этой наследственно фиксированной цели, по Фагерлинду, может лишь
отдаляться или приближаться факторами развития, но пока цель не достигнута
(имеется в виду образование яйцевого аппарата и ядра эндосперма), деления в
зародышевом мешке «должны» продолжаться.
Объяснение этой, на первый взгляд действительно загадочной определенности,
следует искать, по моему мнению, не в допущении наличия унаследованного
«порядка» развития, а опять-таки в анализе действия самых общих клеточных
закономерностей, т. е. в цитологическом подходе.
Известно, что во время прохождения клеткой деления синтез протоплазмы
практически останавливается. Именно поэтому при быстро следующих друг за
другом делениях "как, например, при спорогенезе или на первых стадиях
развития зародыша, клетки мельчают, не успевая в промежутке между двумя
делениями вырастать до прежнего размера. В эмбриональных тканях (меристема)
устанавливается определенный ритм делений и ритм неразрывно связанного с ним
синтеза новой протоплазмы, происходящего в промежутках между делениями, а
следовательно, устанавливается постоянство среднего размера клеток. Вместе с
тем устанавливается и более или менее определенное соотношение между массой
ядра и массой цитоплазмы, известное как «ядерно-плазменное отношение»; в
сущности, употребляя выше выражение «насыщение цитоплазмы ядрами», мы
имели в виду то же самое. Те же взаимоотношения в принципе должны
существовать, конечно, и в ценоцитах, возникающих при повторных делениях клеточных
ядер без обособления клеток. Но при темпе ядерного деления, превышающем
некоторую «норму», синтез протоплазмы будет неизбежно отставать,
ядерно-плазменное отношение будет сдвигаться в пользу ядер и деления рано или поздно
прекратятся; очевидно, что при прочих равных условиях они прекратятся тем скорее,
чем быстрее темп деления. Таким образом, число повторных делений при
образовании ценоцита, а, следовательно, и окончательное число ядер в нем, должно быть
обусловлено, с одной стороны, запасом пластических веществ в исходной клетке,
а с другой — темпом делений, от которого в свою очередь зависит количество
новых пластических веществ, успевающих синтезироваться в промежутках между
делениями. Что же касается протоплазмы, или, выражаясь осторожнее,
пластических веществ, необходимых для того, чтобы клетка могла делиться, то их запас в
каждой клетке, несомненно, не бывает большим. В подавляющем большинстве
эмбриональных клеток, т. е. в меристемах, этого запаса, по-видимому, как раз
хватает на одно деление, иначе происходили бы повторные деления в сестринских
клетках без их роста в промежутках, его, однако, не наблюдается. В тех же особых
186
Генеративные органы цветка
случаях, когда происходят повторные деления, быстро следующие друг за
другом, этот запас веществ, очевидно, бывает большим, и он предварительно
накапливается клеткой в силу особых условий ее развития, характеризующихся,
по-видимому, прежде всего задержкой деления.
Такой клеткой, повторно делящейся без «передышки», в течение которой могло
бы происходить возобновление запаса, является, как известно, материнская
клетка, претерпевающая два мейотических деления. Особенно наглядно видно это на
материнских клетках пыльцы, проделывающих два быстро следующих друг за
другом деления без всякого периода роста между ними. Почему, спрашивается,
микроспороцит осуществляет два и только два, деления? В высшей степени
невероятно предположение, что деления останавливаются на втором потому, что
начинает действовать какой-то тормозящий фактор, внешний по отношению к спо-
роцитам. Собственно говоря, такое предположение даже вовсе исключено, что ясно
на примере крупных пыльников, где деления идут «волной»: на одном конце
может идти еще второе мейотическое деление, в то время как на другом конце идет
уже второе. Пришлось бы, следовательно, допустить, что предполагаемый
внешний фактор останавливает второе деление, не мешая первому, а это совершенно
невероятно. Поэтому всего естественнее предполагать, что материнская клетка
обладает собственным «запасом», которого хватает лишь на два деления, и этот
запас накоплен ею в предшествовавший мейозу период, когда клетка долго растет
не делясь (так называемый период роста). В принципе то же самое относится,
конечно, и к макроспорогенезу.
Каждая из четырех макроспор, получившихся в результате обоих
мейотических делений, должна опять претерпеть рост, без которого невозможно
дальнейшее деление, т. е. начало формирования гаметофита. Весьма
вероятно, что макроспора, которой предстоят обычные митозы, при своем росте
накапливает такой запас, какой приобретает обычная меристема клетки, т.
е. достаточны лишь для одного деления. Естественно возникает вопрос,
почему же макроспора (при нормальном типе развития) делится не один
раз, а два раза подряд?
На этот вопрос, нам кажется, можно дать следующий гипотетический ответ
(конечно, мы заранее отказываемся от другой возможности — допущения наличия
определенного «плана» или «цели»). Всего образуется четыре макроспоры,
которые, разделившись каждая по одному разу, в общей сложности дали бы,
разумеется, восемь клеток. Иными словами, в своей совокупности они, очевидно,
обладают запасом, необходимым и достаточным для прохождения всех делений,
образующих нормальный зародышевый мешок. И если вспомним, что развитие
моноспорического нормального зародышевого мешка сопровождается
поглощением одной макроспорой трех остальных, то вполне возможно допустить, что при
этом поглощении запас пластических веществ всех четырех макроспор
сосредоточивается лишь в одной из них, откуда с неизбежностью вытекает возможность для
нее именно трех делений, не более и не менее.
В самом деле, мы исходим из того, что для осуществления клеточного деления
необходимо накопление веществ в определенном количестве. Поэтому, поскольку
при делении происходит удвоение элементов клетки, вполне законно считать, что
для осуществления деления необходимо наличие веществ в двойном количестве по
сравнению с тем, которое имеется в каждой из сестринских клеток после деления.
Таким образом, если численно выразить относительный запас готовой к делению
клетки через два, то содержание каждой из сестринских клеток мы, очевидно,
должны приравнять к единице. Если функциональная (выживающая) макроспора
в самом деле поглощает необходимые пластические вещества трех остальных
равных ей макроспор тетрады, то она должна нести в себе учетверенный запас,
Семязачаток
187
который, согласно нашему условию, выразится числом восемь. Поскольку, по
нашему допущению, при делении запас веществ уменьшается вдвое, это содержание
макроспоры окажется исчерпанным после трех непрерывно следующих друг за
другом делений, дающих молодой восьмиядерный зародышевый мешок, который
можно рассматривать как восемь еще не обособившихся клеток-правнучек
исходной макроспоры.
Это предположение прекрасно подтверждается развитием тетраспорического
зародышевого мешка нормальной конструкции (тип Adoxa) (рис. 52, Д), где
происходит лишь одно деление в четырехъядерном ценоците, представляющем собою
не что иное, как объединенные четыре макроспоры. Следовательно, согласно
нашей гипотезе, моноспорический тип развития по существу отличается от
тетраспорического лишь тем, что единственное деление, доступное каждой из четырех
макроспор, у него как бы вмещается в одну макроспору и потому
«фракционировано» во времени, тогда как при тетраспорическом типе развития оно совершается
сразу, в один прием (рис. 52, В и Д). Если же исходить из допущения
унаследованного «плана», согласно которому при нормальном моноспорическом типе
развития деления «останавливаются» на третьем делении, то придется для
тетраспорического типа допустить свой особый «план», при котором остановка происходит
на первом делении.
В случае биспорического типа (тип Allium, рис. 52, Г), согласно нашей
гипотезе, двуядерный (биспорический) ценоцит, поглотив другую пару
макроспор, должен получить вследствие этого возможность разделиться именно
два раза вместо одного (как при тетраспорическом развитии). Иначе,
очевидно, пришлось бы допустить, что здесь возник еще новый «план»
развития, именно, остановка делений на втором, в отличие от моноспорического
и тетраспорического «планов», где остановка возникла, соответственно, на
третьем и первом делениях.
Таким образом, из нашего предположения вытекает, что все своеобразие
женского гаметофита покрытосеменных и здесь сводится лишь к крайнему
ускорению темпов клеточного деления по сравнению с голосеменными,
ускорение при котором деления в макроспоре не оставляют времени на синтез
веществ, необходимых для клеточного деления. У голосеменных же, при их
крайне медленном темпе деления в макроспорах, последние в этом
отношении ведут себя в сущности очень сходно с обычными клетками меристемы,
т. е. в промежутках между делениями успевают каждый раз синтезировать
новые пластические вещества, что и позволяет у них совершаться большому
числу делений.
Итак, резюмируя, можно сказать, что подобно тому как нормальный тип
зародышевого мешка мог возникнуть неоднократно в определенный период
эволюции, так и другие типы могли возникать повторно, притом независимо
от нормального типа. Тем не менее, приходя к заключению о возможности
и вероятности многократного и независимого возникновения зародышевых
мешков, мы отнюдь не отрицаем того, во многих случаях доказанного
факта, что зародышевые мешки различных типов могли происходить один из
другого и в первую очередь из нормального типа, что привело к
общеизвестному широкому параллелизму. Рис. 52.
Буш, 1944; Вильсон, 1925; Герасимова-Навашина, 1951а, 1954а, 6; Гроссгейм, 1945; Жуковский, 1949;
Кузнецов, 1936; Модилевский, 1950, 1953; М.С. Навашин, 1947; С.Г. Навашин, 1900, 1951; Навашин,
Герасимова-Навашина, Яковлев, 1952; Поддубная-Арнольди, 1930,1951; Романов, 1936,1938,19396,
1944; Северцов, 1939; Тахтаджян, 1948, 1950; Bambacioni, Mezzetti, 1931; Brink, Cooper, 1940, 1947;
Chamberlain, 1935; Coulter, 1909; Fagerlind, 1941, 1944a, b; Ferguson, 1904; Gerasimoff, 1890; Hertwig,
1894; Hofmeister, 1867; Joshi, 1938; Maheshwari, 1937, 1948, 1950; Nemec, 1898; Nilsson, 1941; Schnarf,
1929, 1936; Stow, 1930; Strasburger, 1900.
188
Генеративные органы цветка
ЗАРОДЫШЕВЫЙ МЕШОК: СФОРМИРОВАННЫЙ И ЗРЕЛЫЙ
В связи с отсутствием в эмбриологической литературе разграничения понятий
«сформированный зародышевый мешок» и «зрелый зародышевый мешок», были
предложены следующие их определения (Батыгина и др., 1982).
Сформированный зародышевый мешок — тот, в котором завершено клеткообразование. Он
характеризуется, обычно, специфическим для каждого таксона числом и
расположением клеток. На этой стадии, как показали эксперименты, зародышевый мешок
еще не готов к оплодотворению (Батыгина, 1974). Зрелый зародышевый
мешок — тот, в котором произошла дифференциация и завершилась специализация
его элементов, имеющих характерные признаки в каждом таксоне; зародышевый
мешок готов к оплодотворению. Длительность прохождения каждой стадии
развития зародышевого мешка различна: от нескольких часов до нескольких дней и
детерминирована у представителей разных таксонов.
В связи с рассмотренными понятиями, следует, вероятно, остановиться на
терминах «слабо дифференцированный» и «недифференцированный» яйцевой
аппарат, появившихся как при светооптических, так и электронномикроскопических
исследованиях. К сожалению, в литературе отсутствуют характеристики,
позволяющие разграничить эти понятия. Отмечается, правда, что при их определении
необходимо учитывать такие морфологические признаки, как полярность,
топография, форма, размер, наличие или отсутствие в синергидах нитчатого аппарата
(Герасимова-Навашина, 1962; Петрова, 1977; Плющ, 1992 и др.). Однако, все эти
признаки характеризуют зрелый зародышевый мешок, в котором прошли
дифференциация и специализация. Отсутствие нитчатого аппарата и других признаков
у многих таксонов никак не могут свидетельствовать о том, что яйцевой аппарат
«слабо дифференцирован» или «недифференцирован». Сходство в строении всех
трех клеток яйцевого аппарата, например, у Lilium не дает права
охарактеризовать его как «слабо дифференцированный», а яйцевой аппарат у Ulmus считать
одновременно «дифференцированным» (по одним признакам) и «слабо
дифференцированным» (по другим) (Плющ, 1992). В зрелом зародышевом мешке все
половые элементы, в том числе, и все клетки яйцевого аппарата, дифференцированы,
но степень дифференциации может быть различна. Говорить о
недифференцированном и слабо дифференцированном яйцевом аппарате, в точном понимании
термина «дифференциация», не совсем корректно. Даже условное использование
таких терминов в классификации яйцевого аппарата (Плющ, 1992), с нашей точки
зрения, не правомочно, так как не отражает сути явления.
Батыгина, 1974; Батыгина и др., 1982; Герасимова-Навашина, 1962; Плющ, 1992.
ЯЙЦЕКЛЕТКА—женская гамета растительного организма, из которой в
результате оплодотворения развивается зародыш (новая особь). Наличие инициальной
клетки зародыша в зародышевом мешке впервые установил Brongniart (1827),
назвавший ее зародышевым пузырьком (фр. vesicule embryonnaire), а в 1858 г.
немецкий ботаник Hartig впервые назвал его яйцом.
Яйцеклетка представляет собой одну из клеток трехклеточного яйцевого
аппарата, располагающегося в микропилярном районе зародышевого мешка. У
некоторых видов с Plumbago- и Plumbagella-типами развития зародышевых мешков
обычно в районе микропиле наблюдается только одна клетка — яйцеклетка (Plumbago
capensis, P. zeylanica, Plumbagella micrantha). Известны случаи увеличения числа
клеток в яйцевом аппарате. Так, например, у Crepis capillaris и Ochna serrulata в
нем насчитывается до пяти клеток, из них две или три — яйцеклетки (Gerassimova,
1933). Наличие 5—7 клеток в яйцевом аппарате постоянно наблюдается в зароды-
Семязачаток
189
шевых мешках типов Tulipa tetraphylla и Т. eriostemones (Романов, 1939, 1945,
1971а).
Яйцеклетка у цветковых растений относительно крупная, обычно больше си-
нергид (Elaeagnaceae, Gentianaceae, Loranthaceae, Malvaceae, Rhamnaceae,
Rosaceae и др.), имеет чаще всего грушевидную форму. Яйцевой аппарат может
составлять меньшую часть зародышевого мешка (Paeoniaceae, Portulacaceae и
др.) либо более его трети или даже половину (Aizoaceae, Cactaceae, Clusiaceae,
Nyctaginaceae). Яйцеклетка зрелого зародышевого мешка характеризуется
морфологической полярностью. Наиболее наглядным ее показателем служит
взаиморасположение ядра и крупной «центральной» вакуоли. Ядро обычно расположено
на халазальном полюсе клетки, вакуоль — на микропилярном полюсе.
Полярность, как и дифференциация клеток яйцевого аппарата, проявляется в процессе
созревания зародышевого мешка. Первоначально все три клетки яйцевого
аппарата обнаруживают некоторое структурное сходство (Guignard, 1882; Романов,
19366; и др.). У Gossypium, например, оно выражается в одинаковом положении
ядер и вакуолей во всех трех клетках незрелого яйцевого аппарата (вакуоли
занимают халазальную часть клетки, а ядро расположено над нею); при этом
яйцеклетка значительно меньше синергид. В дальнейшем происходит увеличение
размеров яйцеклетки, главным образом, по-видимому, за счет увеличения вакуоли
(Романов, 19366). Описан целый ряд отклонений от типичной полярности
яйцевого аппарата. Положение ядра в яйцеклетке Plantago lanceolata варьирует: оно
может быть центральным или апикальным (Vannereau, 1978). Не всегда
обнаруживается характерная для клеток яйцевого аппарата ориентировка ядер и вакуолей
и у представителей семейства Papaveraceae (Ильина, 1981). У Samadera indica
(Simaroubaceae) полярность этой клетки, как правило, типичная; в отдельных
зародышевых мешках, однако, отмечено необычное расположение ядра и вакуоли,
что рассматривают как результат нарушения процесса дифференциации клеток
(Солнцева, 1985). Описаны яйцевые аппараты, в которых все три клетки
дифференцированы по типу синергид (Eryngium planum, Osmorhiza aristata — Гревцова,
1987) или по типу яйцеклетки (Sambucus — Камелина и др., 1987). Не исключено,
что отдельные из приведенных примеров атипичной полярности клеток яйцевого
аппарата у отдельных видов являются не таксоноспецифическими признаками, а
показателями незрелости зародышевого мешка. Ультраструктурная
характеристика яйцевых аппаратов отклоняющихся типов структурной организации дана в
работах Плющ (1991, 1992).
Протопласт яйцеклетки содержит полный набор клеточных органелл. Ядро
яйцеклетки, как правило, крупнее ядер синергид (исключение составляют,
например, представители семейства Resedaceae, у которых размер ядра яйцеклетки
меньше ядер синергид (Чабан, 1983).
Исходя из сравнительного анализа ультраструктуры пластид яйцеклетки по
данным литературы и собственных исследований, можно заключить, что
пластиды яйцеклетки цветковых растений представлены лейкопластами (у
подавляющего большинства исследованных видов это амилопласты). Хлоропласты в
яйцеклетке цветковых растений не обнаружены не только у лейко-, но и хлороэмбрио-
фитов. Этим она отличается от яйцеклетки многих водорослей и некоторых
высших растений (Жукова, 1983, 1993). Пластиды концентрируются главным
образом вокруг ядра яйцеклетки. Форма пластид амебоидная. Исключительно
глубокие инвагинации характерны для лейкопластов яйцеклетки Aconitum napellus
(Жукова, Соколовская, 1983). Внутренняя мембранная система пластид
яйцеклетки исследованных видов развита слабо. В их строме встречаются лишь отдельные
тилакоиды. Для пластид яйцеклетки Capsella bursa-pastoris (Jensen, 1968),
Epipactis atrorubens (Savina, Zhukova, 1983) и Aconitum napellus характерен пери-
190
Генеративные органы цветка
ферический пластидный ретикулум. Строма пластид очень плотная; у многих
видов, тем не менее, в ней отмечено наличие пластоглобул и рибосом. Из-за слабой
внутренней дифференциации пластиды яйцеклетки цветковых растений стали
рассматривать как одну из форм пропластид — эопласты (Thomson, Whatley,
1980). Вместе с тем, установлено, что пластиды яйцеклетки цветковых растений
накапливают запасные углеводы в виде крахмала. Лишь у отдельных видов
крахмал в пластидах яйцеклетки не обнаружен: Crepis capillaris (Герасимова-Наваши-
на, Гуляев, 1973), Cytinus hypocistis (Ponzi, Pizzolongo, 1976), Aconitum napellus
(Жукова, Соколовская, 1983), Agave parryi (Tilton, Mogensen, 1979), Ornithogalum
caudatum (Tilton, 1981) и Nicotiana rustica (Плющ, 1989в). К числу возможных
таксоноспецифических черт ультраструктуры пластид яйцеклетки наряду с
отсутствием амилогенеза, следует отнести: формирование концентрических
мембранных образований (Aconitum napellus — Жукова, ориг.); ассоциации пластид с
мембранами ЭР (Epidendrum scutella — Cocucci, Jensen, 1969); отложение в строме
пластид вещества неизвестной природы в виде нескольких сферических телец
(Gossypium hirsutum — Jensen, 1968); накопление значительных количеств
пластоглобул (Lycopersicon esculentum — Ермаков, Горяева, 1982).
Для протопласта яйцеклетки цветковых растений большинства видов
характерна крупная вакуоль. У некоторых видов эта вакуоль занимает большую часть ее
объема, например, у Alcea rosea (Жукова, ориг.), Gossypium hirsutum (Jensen, 1964,
1965b, 1968), Capsella bursa-pastoris (Schulz, Jensen, 1968b, Hibiscus costatus, H.
furcellatus (Ashley, 1972), Ornithogalum caudatum (Tilton, 1981). Наряду с крупной
вакуолью наблюдаются более мелкие вакуоли. У одних видов они располагаются
ближе к халазальному полюсу протопласта (Capsella bursa-pastoris, Plumbago
zeylanica), у других — к микропилярному (Linum catharticum). У отдельных видов
крупной вакуоли не обнаружено (Diboll, Larson, 1966; Иоффе 1968; Cocucci, Jensen,
1969; Чабан, 1975; Maze, Lin, 1975). Отсутствие центральной вакуоли
рассматривают как особенность структуры яйцеклетки исследованных видов. Эти данные,
однако, могут быть результатом исследования зародышевых мешков в незрелом
состоянии (см. выше). Какое из этих предположений ближе к истине, покажут
дальнейшие исследования.
Клеточная оболочка яйцеклетки неравномерной толщины. В микропилярном
районе она утолщена, однако почти полностью лишена выростов, характерных для
других клеток зародышевого мешка. Исключение составляет яйцеклетка Plumbago
zeylanica и P. capensis, у которой на микропилярном полюсе наблюдается
структура, подобная нитчатому аппарату (Cass, 1972a, b; Cass, Karas, 1974). У
подавляющего большинства исследованных видов на халазальном полюсе яйцеклетки
готового к оплодотворению зародышевого мешка полисахаридная оболочка
отсутствует. Оболочка яйцеклетки становится неполной в процессе ее дифференциации.
Первоначально, после завершения цитокинеза в ценоцитном зародышевом мешке,
все три клетки яйцевого аппарата полностью окружены оболочками. В ходе
созревания зародышевого мешка и подготовки его к оплодотворению халазальная часть
их клеточных оболочек исчезает. Это показано уже на ряде объектов (Cass, 1981;
Fougere-Rifot, 1981; Wilms, 1981;Savina, Zhukova, 1983; Гвилава, 1987; и др.).
Таким образом, отсутствие клеточных оболочек на халазальном полюсе клеток
яйцевого аппарата может служить одним из показателей зрелости зародышевого
мешка. По мнению Cass (1981), избирательная утрата части клеточных оболочек
является приспособлением для более эффективной трансмиссии гамет и, возможно, для
«узнавания» через специфичные мембранные контакты. У некоторых растений
клетки яйцевого аппарата полностью лишены клеточных оболочек (Potamogeton
— Wiegand, 1900; Peperomia blanda — Плющ, 1983, 1988; Gagea lutea — Плющ,
1992). После плазмогамии яйцеклетка полностью окружена клеточной оболочкой,
Семязачаток
191
что препятствует дальнейшему проникновению в нее спермиев и обеспечивает ей
относительную метаболическую изоляцию от окружающих клеток и тканей.
Сравнительные морфологические исследования с применением световой и электронной
микроскопии выявили довольно значительные вариации в структуре яйцеклетки
различных видов цветковых растений. К числу общих черт структурной
организации яйцеклетки следует отнести следующие: наибольшим развитием обладают
хондриом, пластидом, свободные рибосомы и вакуом; такие органеллы как ЭР и
аппарат Гольджи развиты очень слабо; клеточная оболочка на халазальном полюсе
клетки отсутствует (Васильев, Плиско, 19716; Jensen, 1972; Кордюм, 1978; Tilton,
1981; Жукова, 1983,1984; Willemse, van Went, 1984; Плющ, 1991; 1992; идр.).
Яйцеклетка цветковых растений рассматривается как
высокоспециализированная клетка (Герасимова-Навашина, 1971; Батыгина, 1987)'. Сравнительный
анализ ее ультраструктуры подтверждает правомерность такого рассмотрения. К
числу показателей ее высокой специализации относится своеобразное сочетание
таких структурных признаков, как наличие амилопластов, свойственных
главным образом запасающим тканям (лейкопласты без крахмала лишь у отдельных
видов), концентрация их преимущественно вокруг ядра, сильное развитие хонд-
риома и вакуома, слабое развитие ЭР и аппарата Гольджи, обилие рибосом
(преимущественно в форме моносом), избирательная утрата части клеточной оболочки
(Жукова, 1983, 1984). Яйцеклетка находится в тесном взаимодействии с
материнским организмом. Так, например, аккумуляция в ней крахмала свидетельствует
об активизации не только биосинтетических процессов, управляемых амилосин-
тетазой, но и процессов, обеспечивающих приток в эту клетку моносахаров.
Косвенными показателями активизации транспорта веществ в яйцеклетку являются
не только синтез крахмала (а также запасных липидов и белков), но и присутствие
плазмодесм в оболочке яйцеклетки и развитие вакуома, способного к
аккумуляции неорганических соединений, а также растворимых Сахаров, аминокислот,
органических кислот и других метаболитов, т. е. к созданию фонда субстратов для
многочисленных процессов синтеза (Жукова, 1983). Последние обеспечивают
процессы роста яйцеклетки в ходе подготовки ее к оплодотворению (в том числе, рост
растяжением), процессы дезинтеграции клеточной оболочки на ее апикальном
полюсе (не исключено участие в них ферментов), увеличение объема пластидома и
хондриома. В ходе дифференциации яйцеклетки, таким образом, создаются не
только ее полярность, но и высокий энергетический потенциал, а также временное
резервирование запасных веществ (крахмала амилопластов, липидных
включений) и, возможно, растворимых метаболитов в вакуоме. Специализация
яйцеклетки делает ее способной к выполнению таких специфических функций, как
восприятие спермия, объединение с ним и подготовка к деланию, т. е. к переходу
нового организма от одноклеточной стадии своего существования к многоклеточной.
Рис. 53.
Банникова и др., 1985; Баранов, 1955; Батыгина, 1974,1987; Васильев, Плиско, 19716; Гвилава, 1987;
Герасимова-Навашина, 1971; Герасимова-Навашина, Гуляев, 1973; Ермаков, Горяева, 1982; Жукова,
1983, 1984, 1993; Жукова, Соколовская, 1978, 1983; Ильина, 1981; Иоффе, 1968; Камалова, Жукова,
Руми, 1983; Камелина, Жукова, 1987; Камелина и др., 1987; Кордюм, 1978; Кордюм и др., 1980;
Магешвари, 1954; Модилевский, 1953; Наумова, 1990; Плиско, 19716; Плющ, 19886,1989в, 1991,1992;
Поддубная-Арнольди, 1976; Романов, 19366, 1939, 1945, 1971а; Солнцева, 1985; Тахтаджян, 1978;
Чабан, 1975,1983; Яковлев, 1983; Ashley, 1972; Brongniart, 1827; Cass, 1972a, b, 1981; Cass, Karas, 1974;
Cocucci, Jensen, 1969; Dahlgren, 1927b, 1939b; Deschamps, 1969; Diboll, Larson, 1966; Dong, Yang
Hong-yuan, 1989; Erdelska, 1981; Fougere-Rifot, 1981;Gerassimova, 1933; Hartig, 1858; Hofmeister, 1849;
Jensen, 1964, 1965b, 1968, 1972; Johri, Bhatnagar, 1973; Kapil, 1974; Kapil, Bhatnagar, 1981; Maze, Lin,
1975; Newcomb, 1973a; Ponzi, Pizzolongo, 1976; Russell, 1993; Savina, Zhukova, 1983; Schulz, Jensen,
По мнению некоторых авторов яйцеклетка является неспециализированной паренхимной
клеткой (Russell, 1993).
192
Генеративные органы цветка
1968b; Sumner, van Caeseele, 1989; Thomson, Whatley, 1980; Tilton, 1981; Tilton, Mogensen, 1979;
Vannereau, 1978; Vazart В., Vazart J., 1966; Vazart J., 1969; Wardlaw, 1955; Went van, 1970b; Wiegand,
1900; Wilms, 1981; Willemse, van Went, 1984;
СИНЕРГИДА (греч. syn — вместе, ergon — работа) — клетка-спутница
яйцеклетки. Термин ввел Schacht (1857). Эти клетки (обычно их две) вместе с яйцеклеткой
образуют в зародышевом мешке единый комплекс — яйцевой аппарат. У видов, с
Plumbago- и Plumbagella-типами развития зародышевого мешка синергиды
отсутствуют.
Синергиды различных таксонов довольно разнообразны по своей величине,
форме, строению и жизнеспособности. Они обычно меньше яйцеклетки, однако у
отдельных таксонов — крупнее ее, либо одинакового с ней размера (различать
клетки яйцевого аппарата в таком случае можно лишь по их положению в
зародышевом мешке). У некоторых видов, в частности, у видов Allium, синергиды
разной величины. Одна из них при этом может достигать гигантских размеров, либо
претерпевать ряд делений. Синергиды бывают воронковидные, например, у
Crepis tectorum (Герасимова-Навашина, 1957), с зубовидными выростами, как у
Triticum aestivum, (Батыгина, 1962), с широким основанием (Anacardiaceae,
Davidiaceae, Valerianaceae и др.) или с сильно вытянутыми и зауженными
терминальными концами (Asteraceae, Calyceraceae, Solanaceae и др.). У ряда видов
Allium (Haberlandt, 1922; Модилевский, 1925), у Eucalyptus cinerea (Полунина,
1959) они часто похожи на яйцеклетку. У некоторых видов синергиды, особенно в
своей базальной части, настолько удлиняются, что их концы проникают довольно
глубоко в микропиле и даже в ткани семязачатка. Наличие синергид с гаустори-
альными выростами является характерным признаком отдельных таксонов
цветковых растений (например, ряда триб семейства Asteraceae, отдельных родов
семейства Роасеае). Самые длинные и узкие синергидные гаустории, которые
врастают в завязь и достигают столбика, пронизывая его на 1/3, описаны у
Quinchamalium chinense из Santalaceae (Johri, Agarwal, 1965).
Синергиды обладают ярко выраженной полярностью, которая прослеживается
как в структуре клеточной оболочки (см. ниже), так и в организации их
протопласта. Типичным для этих клеток является базальное расположение ядра (в
непосредственной близости от нитчатого аппарата) и апикальное — вакуоли. Такое
расположение сохраняется и после оплодотворения (Epipactis atrorubens,
Valeriana officinalis и др.). Противоположное расположение этих органелл
отмечено у представителей Anacardiaceae, Apiaceae, Combretaceae, Myrtaceae. Ядра
синергид лопастные по форме (округлые — в синергидах незрелого зародышевого
мешка), меньше ядра яйцеклетки, но могут быть одинакового с ним размера
(Lecythidaceae) или крупнее его (Convolvulaceae, Resedaceae). Синергиды обычно
одноядерные, но иногда, как у Anthemis alpina, Carya illinoensis и Dictamnus albus,
они двуядерные или даже, как у Santalum album, — трехъядерные. Ядро, как
правило, гаплоидное. У некоторых видов в синергидах обнаружены гигантские
полиплоидные ядра и политенные хромосомы. У исследованных представителей
семейства Tropaeolaceae отмечено деление ядер синергид, при этом митозы
остаются незавершенными (Walker, 1947; Батыгина, 19856). Пластидом синергид
представлен лейкопластами со слабовыраженной внутренней мембранной
системой. Многие таксоны характеризуются наличием амилопластов, но с
незначительным содержанием крахмала {Alcea rosea — ориг. данные; Proboscidea
louisianica — Mogensen, 1978; Valeriana officinalis — Камелина, Жукова, 1987 и
др.). Не обнаружен крахмал в синергидах Zea mays (Diboll, Larson, 1966),
Epidendrum scutella(Cocucci, Jensen, 1969), Petunia hybrida (Went van, 1970),
Hordeum vulgare (Cass, Jensen, 1970), Aquilegia formosa (Vijayaraghavan et al.,
1972), Agave parryi (Tilton, Mogensen, 1979). Отмечена ассоциация пластид с ЭР
Семязачаток
193
(Е. scutella). Пластиды распределены по всему протопласту. Митохондрии,
напротив, концентрируются преимущественно близ нитчатого аппарата. Вакуом
представлен одной крупной или множеством мелких вакуолей в апикальной части
синергид. Рибосомы обычно многочисленны. Диктиосомы выглядят умеренно
активными, локализуются, главным образом, в районе нитчатого аппарата. ЭР описан
как в гранулярной, так и в агранулярной формах. Благодаря активности аппарата
Гольджи и ЭР протопласт синергид имеет альвеолярный вид. Синергиды, как
правило, выделяются наибольшей плотностью гиалоплазмы и накоплением в
процессе развития осмиофильных включений в вакуолях, межмембранном пространстве
ЭР, оболочек митохондрий, пластид и ядра. У большинства видов клеточная
оболочка неполная. Она постепенно утоныпается по направлению к халазальному
полюсу клетки, исчезая в конце концов. Апикальная часть синергид оказывается
ограниченной только плазмалеммой. Известны виды, у которых в зрелом
зародышевом мешке полисахаридные клеточные оболочки яйцевого аппарата
полностью отсутствуют — клетки окружены одними плазмалеммами (виды
Potamogeton — Wiegand, 1900; Peperomia blanda, Gagea lutea — Плющ, 19886). В
базальной части синергид у большинства растений дифференцируется нитчатый
аппарат. Первым описал эту своеобразную модификацию клеточной оболочки
Schacht (1857) при исследовании зародышевых мешков Campanula, Watsonia и
Zea; он же дал ему это название. Одновременно нитчатый аппарат описал
Hofmeister (1857) у Crocus. Ультраструктура нитчатого аппарата впервые была
описана Jensen [1963 (1964) ] у хлопчатника спустя 100 лет, а его развитие в
деталях было прослежено van der Pluijm (1964) на примере Torenia fournieri. Это;
образование представляет собой систему извилистых, сильно разветвленных вы-1
ростов клеточной оболочки на микропилярном полюсе синергиды. Такие выросты
увеличивают поверхность плазмалеммы, придавая синергиде свойства
передаточной клетки, осуществляющей короткодистантный транспорт веществ. Известны
виды и со слабо выраженным нитчатым аппаратом (Valeriana officinalis).
Установлена большая вариабельность как тонкой организации нитчатого аппарата,
так и его химического состава (Went van, Linskens, 1967; Vijayaraghavan et al.,
1988; и др.). У Jasione montana на микропилярном полюсе синергид обнаружены
значительные отложения кутина в клеточной оболочке (Berger, Erdelska, 1973).
Предложены первые классификации типов нитчатого аппарата (Went van,
Linskens, 1967; Cocucci, 1981; Vassilyev, Lobkov, 1990). Встречаются, однако, виды
без нитчатого аппарата. К ним относятся Petunia hybrida (Went van, 1970a),
Helianthus annuus (Newcomb, 1973a), Calendula officinalis (Плиско, 1977а), Adoxa
moschatellina, Crepis tectorum, Gagea lutea, Lilium regale, L. candidum, Peperomia
blanda, Rudbeckia hirta (Плющ, 1992) и др. У отдельных видов выявлено
специфическое утолщение клеточной оболочки в микропилярной области в виде слоя
слизистых веществ (полисахаридов или белков), различимое только под
электронным микроскопом (Vassilyev, Lobkov, 1990).
Структура синергид чрезвычайно лабильна. Наряду с изменениями,
происходящими в процессе дифференцировки и специализации клеток яйцевого аппарата
(увеличение размеров, изменение формы ядра, вакуолизация протопласта,
формирование нитчатого аппарата, исчезновение апикальной части клеточной
оболочки синергид), наблюдается так называемая дегенерация синергид. У
большинства исследованных видов отмечена дегенерация одной из них. У отдельных видов
могут дегенерировать обе синергиды: у некоторых видов Triticum (Батыгина,
1974), у Spinacia oleracea (Wilms, 1981), Hordeum vulgare (Mogensen, 1984),
Triticum aestivum (You, Jensen, 1985), Brassica campestris (Went van, Cresti,
1988a), Peperomia blanda (Плющ, 1992). У Galanthus nivalis выявлена
ультраструктурная дифференциация синергид зрелого зародышевого мешка по количе-
13 Генеративные органы цветка.
194 Генеративные органы цветка
ству актиновых микрофиламентов. Дегенерация, наблюдаемая после опыления,
отмечена в синергиде, насыщенной актином (Bednara et al., 1994). На ряде видов
показано, что пыльцевая трубка входит в ту синергиду, которая проявляет черты
дегенерации (Jensen, Fisher, 1968a; Schulz, Jensen, 1968b; Cocucci, Jensen, 1969;
Cass, Jensen, 1970; Mogensen, 1972, 1978; Maze, Lin, 1975; Mogensen, Suthar, 1979;
и др.). Время дегенерации варьирует: у одних видов она наблюдается перед
вхождением пыльцевой трубки, у других — после ее вхождения в синергиду.
Инициацию этого процесса большинство исследователей связывают с опылением,
стимулирующим трансформацию одной из синергид (редко обеих) в воспринимающую.
У Panicum sp., однако, структурные изменения в синергидах, подобные апоптозу,
отмечены вне связи с опылением, в процессе созревания пестика. Они протекают
в обеих сестринских синергидах, но асинхронно и сопровождаются секрецией
кальция из этих клеток. Кальций, секретированный из синергид, первоначально
аккумулируется в апопласте, между нитчатыми аппаратами и в оболочке
зародышевого мешка. Затем происходит перемещение кальция в сторону микропиле и
далее вдоль наружного интегумента семязачатка (Chaubal, Reger, 1994). Синерги-
ды обычно эфемерны и вскоре после оплодотворения дегенерируют. Известны
примеры сохранения после оплодотворения и продолжительного существования
обеих синергид или одной из них (Arecaceae, Limnanthaceae, Loranthaceae,
Malvaceae, Orchidaceae, Papaveraceae, Parnassiaceae, Valerianaceae). У
отдельных таксонов при этом наблюдается увеличение размеров сохраняющейся сине-
ргиды (Berberidaceae, Bixaceae, Liliaceae, Saxifragaceae). Особенно долго
сохраняется гигантская синергида, характерная для луков. У Allium nutans гигантская
синергида исчезает лишь после образования многоклеточного зародыша (Стожа-
рова, 1973). Ядро у такой синергиды очень крупное, возникающее в результате
эндомитоза.
Синергиды являются полифункциональными клетками. Основная их роль
состоит в привлечении пыльцевых трубок к зародышевому мешку и в обеспечении
высвобождения их содержимого и точного попадания спермиев к женским гаметам.
Механизмы этих процессов остаются предметом дискуссии. Согласно одной из
точек зрения, синергиды осуществляют синтез и секрецию хемотропно-активных по
отношению к пыльцевым трубкам веществ (Pluijm van der, 1964; Jensen, 1965a;
Went van, Linskens, 1967; Fougere-Rifot, 1975, 1987a; Плиско, 1977а, б; Плющ,
1988a, 1992; и др.). По мнению других авторов, свойством привлечения
пыльцевых трубок обладает не зародышевый мешок, а семязачаток. В микропилярном
районе нуцеллуса перед вхождением пыльцевых трубок у исследованных
мальвовых отмечено «растворение» клеток, намечающее путь их продвижения к
зародышевому мешку. Такая трансформация клеток нуцеллуса может начаться еще в
период нахождения пыльцевых трубок в столбике (Jensen, 1969; Chandra, Bhatnagar,
1975). Имеются данные и об отсутствии влияния семязачатков на рост пыльцевых
трубок (Stosser, 1986). По данным электронной микроскопии наряду с признаками
секреторной активности синергиды обладают также свойствами передаточных
клеток. Это послужило основанием для рассмотрения синергид как
полифункциональных клеток. Они участвуют в обеспечении роста зародышевого мешка в
сторону микропиле (Плющ, 1992). Синергиды осуществляют также абсорбцию,
запасание и транспорт веществ из нуцеллуса и/или интегументов в зародышевый
мешок, способствуя питанию яйцеклетки, центральной клетки, зиготы, эндосперма
и зародыша. С помощью электронной микроскопии установлено, что пыльцевая
трубка обычно входит в зародышевый мешок через нитчатый аппарат
воспринимающей синергиды, где ее рост приостанавливается (у видов без нитчатого
аппарата вхождение пыльцевой трубки не локализовано). В семействах Anacardiaceae
(Александровский, Наумова, 1985), Apiaceae (Кордюм, 1967), Betulaceae (Кор-
Семязачаток
195
чагина, 1981), Gentianaceae (Maheshwari D., Lakshminarayana, 1977),
Hypericaceae (Bugnicourt, 1969), Nyctaginaceae {Kajale, 1938), Poaceae (Батыги-
на, Маметьева, 1979), Zygophyllaceae (Kapil, Ahluwalia, 1963; Masand, 1963),
Amaryllidaceae (Ворсобина, Солнцева, 1990) описано образование синергидных
зародышей. Рис 54.
Александровский, Наумова, 1985; Банникова, Плющ, 1982; Баранов, 1955; Батыгина, 1962, 1974,
1985а, б, 1987; Батыгина, Маметьева, 1979; Беляева, 1987; Гваладзе, 1960, 1962, 1974, 1976; Гераси-
мова-Навашина, 1947, 1957; Герасимова-Навашина, Батыгина, 1958; Герасимова-Навашина,
Коробова, 1959', Глущенко, 1958; Гревцова, 1987; Жукова, 1984; Камелина, Жукова, 1987;
Коробова-Семенченко, 1976; Магешвари, 1954; НавашинС.Г., 1910; Плиско, 1977а, б; Плющ, 1988а,
б, 1989в, 1992; Поддубная-Арнольди, 1976; Полунина, 1959; Стожарова, 1973; Стожарова, Поддуб-
ная-Арнольди, 1977; Фрейберг, 1985; Хведынич, 1991; Шевченко, Камелина, 1987; Эзау, 1980;
Bednara etal., 1994; Berger, Erdelska, 1973; Brouland, 1975; Broulandetal., 1976; Bugnicourt, 1969; Cass,
1981; Cass, Jensen, 1970; Chandra, Bhatnagar, 1975; Chao, 1971; Chaubal, Reger, 1994; Cocucci, 1981;
Cocucci, Jensen, 1969; Dahlgren, 1924, 1928, 1938; Davis, 1966; Fagerlind, 1939a, b; Fougere-Rifot, 1975,
1981,1987a, 1989; Godineau, 1969; Hofmeister, 1849,1857; Ishikawa, 1918; Jensen, 1963 (1964), 1965a, b,
c, 1968,1969,1972; Jensen, Fisher, 1968a; Johri, Agarwal, 1965; Kapil, Ahluwalia, 1963; Kapil, Bhatnagar,
1981; Kirkwood, 1905; Linskens, 1969; Maheshwari D., Lakshminarayana, 1977; Masand, 1963; Maze, Lin,
1975; Mogensen, 1972,1978,1984; Mogensen, Suthar, 1979; Philipson, 1977,1981; Philipson, Connor, 1984;
Pluijm van der, 1964; Russell, Mao, 1990; Savina, Zhukova, 1983; Schacht, 1857; Schulz, Jensen, 1968b;
Stenar, 1932; St5sser, 1986; Strasburger, 1884; Tilton, 1981; Tilton, Mogensen, 1979; Vassilyev, Lobkov,
1990; Vazart В., Vasart J., 1966; Vasart J., 1971; Vijayaraghavan et al., 1972; Vijayaraghavan, NeeruSeth,
Alka Jain, 1988; Vijayaraghavan, Bhat, 1983 (1984); Walker, 1947, Weber, 1929; Went van, 1970a; Went
van, Cresti, 1988a; Went van, Linskens, 1967; Wiegand, 1900; Willemse, van Went, 1984; You, Jensen, 1985.
ЦЕНТРАЛЬНАЯ КЛЕТКА зародышевого мешка — клетка, получившая
название по своему местоположению в зародышевом мешке. Синонимы: зачаток
эндосперма, материнская клетка эндосперма. Она занимает, как правило,
наибольшую часть зародышевого мешка, в центре, между яйцевым аппаратом и
антиподами (или нуцеллусом). Эта клетка, подобно яйцеклетке, сливается с одним из
пары спермиев — клеток, доставляемых пыльцевой трубкой в зародышевый мешок
во время двойного оплодотворения. В результате этого процесса она
трансформируется в первичную клетку эндосперма, дающую начало эндосперму семени.
Центральная клетка обычно крупнее остальных клеток зародышевого мешка
(Davidiaceae, Paeoniaceae, Trochodendraceae, и многие др.), реже — равна им
или несколько меньше (Аросупасеае, Asclepiadaceae, Caprifoliaceae, Cynomo-
riaceae, Dipsacaceae, Valerianaceae и др.). Их форма варьирует у разных
таксонов. Встречаются сильно вытянутые клетки, у которых длина во много раз
превышает ширину (Magnoliaceae, Malvaceae, Nelumbonaceae, Trochodendraceae),
расширенные в микропилярной части и трубковидные на халазальном полюсе
Шпасеае, Malvaceae), овальные (Araliaceae, Gentianaceae, Limnanthaceae, Moni-
miaceae), удлиненно-овальные {Elaeagnaceae, Rafflesiaceae), изодиаметрические
(Primulaceae, Ranunculaceae, Valerianaceae). В зародышевых мешках отдельных
представителей семейств Caryophyllaceae, Chenopodiaceae, Papaveraceae
наблюдаются изогнутые центральные клетки. У представителей семейства
Alismataceae, например, у Alisma natans эта клетка приобретает U-образную
форму. В процессе созревания зародышевого мешка и подготовки его к
оплодотворению центральная клетка многих таксонов значительно увеличивается в
объеме. Это происходит преимущественно за счет усиления ее роста в длину у одних
видов в направлении халазы (Veltheimia viridiflora — Hofmeister, 1859; Beta
vulgaris — Оксиюк, 1927; Marcgravia purpurea — Swamy, 1948a; Carallia
lancaefolia — Никитичева, Яковлев, 1985 и др.), у других — в противоположную
сторону с выходом зародышевого мешка в микропиле и даже за его пределы
(Phaseolus vulgaris — Weinstein, 1926; виды Torenia — Krishna Iyengar, 1941 и
др.). У отдельных таксонов наблюдается образование ответвлений центральной
13*
\ 95 Генеративные органы цветка
клетки за счет ее локального латерального роста (Olax stricta — Agarwal, 1963 и
др.).
Центральная клетка содержит два, реже одно или несколько ядер, которые
называются полярными. Одним из наиболее существенных структурных
преобразований, претерпеваемых этой клеткой в ходе дифференцировки клеток
зародышевого мешка, является образование так называемого вторичного ядра центральной
клетки — продукта слияния двух (изредка более) полярных ядер (см.
ПОЛЯРНЫЕ ЯДРА).
Пластидом центральной клетки у подавляющего большинства исследованных
видов представлен крупными лейкопластами (чаще амилопластами). Большие
запасы крахмала перед оплодотворением отмечены в центральной клетке Arachis,
Tilia, Penstemon, Acacia, Nicotiana, Calendula. В пластидах Cossypium, Capsella,
Spinacia, Valeriana крахмал наблюдается, но в меньшем количестве, чем в
яйцеклетке. Не обнаружен крахмал в пластидах центральной клетки Helianthus
(Newcomb, 1973a), Linum (Vazart В., Vazart J., 1966), Aconitum (Жукова,
Соколовская, 1983) и Alcea (Жукова, ориг.). В центральной клетке зародышевого мешка
крестоцветных (Jensen, 1972; Schulz, Jensen, 1973; Sumner, 1989; Mansfield et al.,
1991) и резедовых (Чабан, Яковлев, 1974; Чабан, 1979) обнаружены хлоропласты.
Центральная клетка является единственной клеткой зародышевого мешка, в
которой достоверно установлено наличие хлоропластов у указанных таксонов
(Жукова, 1984). Митохондрии, как правило, обильны, высоко дифференцированы.
Центральная клетка сильно вакуолизирована; ее вакуом представлен главным
образом крупными вакуолями, располагающимися в центральной части клетки.
Большая часть ее цитоплазмы сосредоточена в районах расположения яйцевого
аппарата и антипод, а остальная часть оттеснена вакуолями к периферии клетки,
где она образует тонкий постенный слой вдоль латеральной стенки зародышевого
мешка. Центральной клетке свойственно экстенсивное развитие ЭР,
преимущественно гранулярной формы. Особенно высокая плотность мембран ЭР отмечена
близ яйцевого аппарата. Параллельные профили ЭР обильны также близ антипод
и вдоль выростов клеточной оболочки. Диктиосомы, как правило,
сконцентрированы в периферической зоне клетки, около ее оболочки. Их активность,
по-видимому, скорее всего связана с биосинтезом вещества быстро растущей клеточной
стенки и ее выростов (у Aquilegia vulgaris — Fougere-Rifot, 1978, на границе
центральной клетки с синергидами и нуцеллусом). Цитоплазма центральной клетки
богата рибосомами в форме как моно-, так и полисом. Исключение составляет
зародышевый мешок Aconitum napellus, в центральной клетке которого свободных
рибосом не обнаружено, отмечены лишь прикрепленные.
Центральная клетка, как и все другие клетки зародышевого мешка, отчетливо
поляризована. Подобно клеткам яйцевого аппарата она окружена клеточной
оболочкой лишь частично. Последняя отсутствует на микропилярном полюсе клетки,
в месте контакта с яйцевым аппаратом. Стенка центральной клетки, пограничная с
антиподами, содержит плазмодесмы и у большинства видов, таких, как Stipa elmeri
(Maze, Lin, 1975), Aquilegia vulgaris (Rifot, 1973), Aconitum napellus (Жукова,
ориг.), снабжена выростами стенки. У Eschscholtzia californica в ходе созревания
зародышевого мешка отмечены случаи полного исчезновения и этой стенки
(Fougere-Rifot, 1981). Латеральная стенка центральной клетки, на границе с
клетками нуцеллуса или интегументов, обычно утолщена. Она снабжена хорошо
развитыми выростами стенки. У одних видов протуберанцами унизана микропилярная
часть латеральной стенки (Crepis capillaris — Godineau, 1971; Stellaria media —
Newcomb, Fowke, 1973; Plantago lanceolata Vannereau, 1978; Spinacia oleracea —
Wilms, 1981), у других — халазальная (Linum usitatissimum — Vazart, 1971). У
Gossypium hirsutum (Schulz, Jensen, 1977) и Aquilegia vulgaris (Fougere-Rifot, 1978)
Семязачаток
197
такие выросты имеет большая часть латеральной стенки центральной клетки. У
Capsella bursa-pastoris (Schulz, Jensen, 1971), Helianthus annuus (Newcomb, Steeves,
1971), Euphorbia helioscopa (Gori, 1977) пальцеобразные выросты стенки
наблюдаются как на микропилярном, так и на халазальном полюсах центральной клетки. В
зрелом зародышевом мешке Stellaria лабиринт оболочки наблюдается в микропи-
лярной части центральной клетки, тогда как в сформированном зародышевом
мешке мелкие выросты отмечены вдоль всей стенки центральной клетки на границе ее
с нуцеллусом (Kudlicka et al., 1981). У ряда видов (Plantago lanceolata —
Vannereau, 1978; Valeriana officinalis — Камелина, Жукова, 1987; Nicotiana rus-
tica — Плющ, 1992) образование выростов отмечено и на границе центральной
клетки с синергидами. В центральной клетке зрелого зародышевого мешка Capsella
bursa-pastoris выростов клеточной оболочки не наблюдается. Они образуются
после оплодотворения в раннем эмбриогенезе (Schulz, Jensen, 1973).
Центральная клетка имеет максимальную площадь контакта с окружающим
нуцеллусом и/или интегументами. Предполагают ее активное участие в
абсорбции, проведении и секреции метаболитов. Она служит местом запасания
резервных питательных веществ — крахмала, липидов (особенно большие запасы липи-
дов отмечены у Sonneratia caseolaris — Камелина, 1985в), и, возможно, белков.
Ею осуществляется секреция некоторых энзимов, экспортируемых,
предположительно, для лизиса окружающих тканей — нуцеллуса и интегументов. В этой
клетке, таким образом, одновременно протекают: интенсивный синтез
конституционных и запасных веществ и катаболические процессы. И все это связано с ее
основной биологической ролью материнской клетки эндосперма. Рис 55.
Банникова, Плющ, 1990; Батыгина, 1974; Герасимова-Навашина, Гуляев, 1973; Жукова, 1983, 1984;
1993; Жукова, Соколовская, 1983; Иоффе, 1968; Камелина, 1985в; Магешвари, 1954; Модилевский,
1928; Никитичева, 1985в; Никитичева, Анисимова, 1987; Никитичева, Яковлев, 1985; Оксиюк, 1927;
Остапенко, Хведынич, 1987; Плиско, 19716; Плющ, 1989в; Поддубная-Арнольди, 1976; Романов,
1960а; Савина, 1985; Терехин, Анисимова, 1987; Чабан, 1979; Чабан, Яковлев, 1974; Шевченко,
Камелина, 1987; Agarwal, 1963; Cass, 1981; Cooper, 1933;; D'Alascio-Deschamps, 1973; Fougere-Rifot,
1978, 1981;Garcia, 1962;Godineau, 1971; Hofmeister, 1859; Jensen, 1963 (1964), 1965b, 1968,1972; Juel,
1887; Kapil, Bhatnagar, 1981, 1983/1984; Kudlicka et al., 1981; Mauritzon, 1933a; Mogensen, 1982; Maze,
Lin, 1975; Narang, 1953; Newcomb, 1973a; Newcomb, Fowke, 1973; Newcomb, Steeves, 1971; Rifot, 1973;
Schnarf, 1929;Schulz, Jensen, 1973,1977;Singh, 1961;Sumner, 1989;Swamy, 1948a;Swamy, Bailey, 1949;
Vannereau, 1978; Vazart, 1971; Vazart В., Vazart J., 1966; Vijayaraghavan, Neeru Seth, Alka Jain, 1988;
Weinstein, 1926; Went van, 1970; Wilms, 1981; You, Jensen, 1985.
ПОЛЯРНЫЕ ЯДРА (греч. polos- ось, полюс) — ядра центральной клетки
зародышевого мешка цветковых растений (материнской клетки эндосперма). Термин
«полярные ядра» предложил A.Fischer (1880), который различал «верхнее
полярное ядро» (нем. «oberer Polkern»), «нижнее полярное ядро» («unterer Polkern») и
продукт их слияния — «центральное ядро» («Centralkern»). Guignard использовал
термины — полярные ядра и вторичное ядро зародышевого мешка (1881).
Позднее эти термины получили общее признание. У большинства видов два полярных
ядра — микропилярное (верхнее) и халазальное (нижнее). Они обособляются от
полярных групп ядер ценоцитного зародышевого мешка при переходе его к клет-
кообразованию в процессе формирования яйцевого аппарата и антипод. В
большинстве случаев эти ядра одинаковы по размеру и строению, поэтому после их
сближения трудно отличить микропилярное ядро от халазального. Если ядра
различаются по величине, то обычно более крупным является микропилярное ядро,
иногда — халазальное (зародышевый мешок Fritillaria-типа развития). На
основании сравнительных исследований видов с Polygonum-, Oenothera-, Allium- и
1 — более точным является термин «вторичное ядро центральной клетки зародышевого мешка»
(прим.авторов).
198
Генеративные органы цветка
Fritillaria-типами развития зародышевых мешков выдвинута гипотеза о
стимулирующей роли халазального полярного ядра во втором звене двойного
оплодотворения (Гваладзе, 1976). По мнению автора, это ядро способствует
преимущественному развитию эндосперма по сравнению с зародышем на начальных этапах
развития семени.
В зависимости от типа развития женского гаметофита количество полярных
ядер в его центральной клетке может варьировать, в отличие от яйцеклетки,
которая, как правило, содержит одно ядро. Иногда она содержит лишь одно — микропи-
лярное полярное ядро (например, в зародышевых мешках Oenothera- и Tulipa
eriostemones-типов развития (по классификации Романова, 1971а). Центральная
клетка чаще всего является диплоидной, реже гаплоидной (см. выше) или
полиплоидной, что связано с типом развития зародышевого мешка. Так, например, в
зародышевых мешках Penaea-типа развития при образовании вторичного ядра
сливаются четыре ядра. У видов Peperomia (с Peperomia-типом развития зародышевого
мешка) ядра, находящиеся в центральной клетке (у PMspidula — 14, у P.pellucida
— 8, у других видов от 4 до 8) вступают в контакт и образуют полиплоидный
комплекс, соответствующий вторичному ядру. Окончательное слияние этих ядер
происходит после контакта со спермием. В апомиктичных зародышевых мешках число
полярных ядер может варьировать и значительно возрастать.
У отдельных таксонов, в частности, в пределах рода Allium, отмечена
вариабельность и такого признака как сходство полярных ядер по размерам и строению.
У A.schoenoprasum, A.cepa и A.sativum оба полярных ядра неотличимы друг от
друга как по форме, так и по величине. Перед оплодотворением эти ядра
сближаются. В этот период у них нет строго определенного местоположения. Они
наблюдаются как в микропилярном конце зародышевого мешка в непосредственной близости
от яйцевого аппарата, так и в центральной, реже халазальной, частях
зародышевого мешка. Незадолго до оплодотворения они сливаются, образуя вторичное ядро
центральной клетки, или же только вступают в контакт друг с другом. У
A.atroviolaceum и A.rotundum, напротив, полярные ядра различаются не только по
размерам, но и по состоянию хроматина. Микропилярное полярное ядро в 2—3 раза
превосходит по размерам халазальное, содержит несколько ядрышек и, как
правило, Фельген-отрицательное. Меньшее же халазальное полярное ядро, в
противоположность микропилярному, Фельген-положительное (Гваладзе, 1962, 1966, 1973).
Подобное же явление описано ранее у представителей рода Gagea (Романов, 1961).
Время объединения полярных ядер варьирует у различных таксонов: они могут
сливаться до, во время и после оплодотворения. Так, например, у Capsella bursa-
pastoris (Schulz, Jensen, 1968в, 1973), Helianthus annuus (Newcornb, 1973a) и Stipa
elmeri (Maze, Lin, 1975) объединение полярных ядер завершается перед
оплодотворением. У хлопчатника (Jensen, 1964; Schulz, Jensen, 1977) и ячменя (Mogensen,
1982) их объединение начинается перед опылением, а завершается только после
приближения к ним ядра спермия. В процессе оплодотворения окончательно
сливаются полярные ядра у шпината (Wilms, 1981). Такие растения составляют
меньшинство среди исследованных цветковых растений. У некоторых видов этот
признак относительно не стабилен. У пшеницы, например, полярные ядра до
оплодотворения обычно сближены, но не слиты. Их объединение начинается после
контакта одного из них с ядром спермия. Есть основания предполагать
возможность слияния полярных ядер в отдельных семязачатках еще до оплодотворения.
При объединении полярных ядер у пшеницы часто видны фрагменты
цитоплазмы, захваченной ими при сближении (Батыгина, 1974). Аналогичное явление
было описано при слиянии полярных ядер у Impatiens glandulifera (Steffen, 1951) и
у Arachis hypogaea (Герасимова-Навашина, 1954). Наличие цитоплазматических
«захватов» у Triticum aestivum может служить показателем того, что объединение
Семязачаток
199
полярных ядер началось, но еще полностью не завершилось, так как при полном
слиянии участки захваченной цитоплазмы уже не видны.
Электронно-микроскопические исследования у злаков подтвердили эти данные (Mogensen, 1982). На
ультраструктурном уровне слияние полярных ядер впервые было описано Jensen
(1964) у хлопчатника. Слияние ядер начинается с образования эвагинаций их
ядерными оболочками и последующего контакта между ними в нескольких точках
вдоль зоны сближения ядер. Сначала контактируют и сливаются наружные
ядерные мембраны, а затем следуют контакты и слияние внутренних мембран.
Последнее ведет к формированию ряда узких мостов между ядрами, которые
постепенно расширяются и сливаются друг с другом. Небольшие участки цитоплазмы
оказываются зажатыми между этими мостами. Нуклеоплазма обоих ядер
объединяется, завершая их слияние. Исследование процесса объединения полярных ядер
у Adoxa moschatellina позволило высказать предположение о формировании
локальных разрывов в эвагинациях оболочек сливающихся полярных ядер. Общая
целостность оболочки при этом не нарушается. Объединение оболочек ядер
происходит в участках разрывов (Банникова, Плющ, 1990). После объединения ядер
сливаются и ядрышки, что служит показателем завершения объединения на
уровне хроматина. В полярных ядрах Т.aestivum через некоторое время после их
слияния часто появляется довольно много дополнительных ядрышек, число которых
достигает 20 и более; они сильно отличаются по своим размерам и окраске от
ядрышек, выделенных спермием. Аналогичные ядрышки встречаются иногда и в
неоплодотворенных полярных ядрах (Батыгина, 1974). Не объединяются
полярные ядра в зрелых зародышевых мешках представителей Alangiaceae,
Coriariaceae, Gentianaceae, Loasaceae, Nitrariaceae, Rhamnaceae и др.
Полярные ядра и вторичное ядро центральной клетки — это самые крупные
ядра зародышевого мешка. Не составляет исключения и гаплоидное ядро
центральной клетки у онагровых, диаметр которого достигает 25 мкм. Обычно
полярные ядра содержат небольшое количество гетерохроматина и имеют крупное
ядрышко, содержащее несколько ядрышковых вакуолей. Ядерная оболочка глубоко
инвагинирована и во многих местах связана с цистернами гранулярного ЭР; ядро
лопастное. У одних видов вторичное ядро (или полярные ядра в контакте)
располагается вблизи яйцеклетки и отделено от халазального полюса клетки крупной
вакуолью, у других видов вторичное ядро располагается в центральной части
зародышевого мешка и связано с яйцевым аппаратом хорошо выраженным тяжем
цитоплазмы. Расположение вторичного ядра у халазального конца встречается
значительно реже и характерно для растений, характеризующихся гелобиальным
типом развития эндосперма. Известны случаи такого расположения вторичного
ядра и у видов с целлюлярным эндоспермом. Рис. 56.
См. литературу к статье «Центральная клетка», а также: Банникова, Плющ, 1990; Батыгина, 1974;
Гваладзе, 1960, 1962, 1966, 1973, 1976; Герасимова-Навашина, 1954; Романов, 1961, 1971а; Battaglia,
1987а; Fischer, 1880; Guignard, 1881; Jensen, 1973; Mogensen, 1982; Schulz, Jensen, 1968b; 1973; Willemse,
van Went, 1984.
АНТИПОДЫ (греч. anti- против; pous- нога) — группа клеток, обычно из трех,
составляющая халазальную, изредка халазально-латеральную часть зрелого
зародышевого мешка. Эти клетки впервые охарактеризовал Hofmeister (1849) при
описании наиболее типичной организации зародышевого мешка, назвав их
«gestreckten Zellen». В последующих статьях они определены как «Gegenfussler»,
«Gegenfusslerzellen», «Gegenfusslerinnen». Термин «антиподы» введен в
ботаническую литературу при переводе на английский язык немецкого термина
«Gegenfussler der Keimblaschen» (Henfrey, 1853). Наличие трех антипод
характерно для зародышевых мешков Polygonum-, Allium-, Adoxa- и некоторых других
200 Генеративные органы цветка
типов развития, т.е. наблюдается у подавляющего большинства (свыше 80%)
эмбриологически исследованных видов цветковых растений. В зародышевых
мешках Drusa-типа развития эта группа состоит из 8 клеток, а при Plumbagella-типе
наблюдается лишь одна антипода (триплоидная). У некоторых таксонов при
формировании антиподального комплекса не происходит цитокинеза и халазальный
полюс зародышевого мешка остается свободноядерным. При Oenothera-типе
развития зародышевого мешка антиподы вообще не образуются.
Продолжительность жизнедеятельности и структура этих образований
отличаются исключительным разнообразием. Это отмечено как в пределах семейств
(Amaryllidaceae, Arecaceae, Gentianaceae, Ranunculaceae и др.), так и у
отдельных видов (виды Parnassia и др.). Полиморфизм антипод обусловлен наличием
нескольких типов развития зародышевого мешка, а также неоднотипностью всей
системы взаимодействия элементов семязачатка у разных таксонов.
Расположение клеток в трехклеточном антиподальном комплексе может быть
Т-образным, линейным (вдоль или поперек халазально-микропилярной оси),
гроздевидным и т.д. Разнообразна и форма клеток антипод, что может
наблюдаться даже в пределах одного антиподального аппарата. У отдельных видов антиподы
морфологически сходны с яйцевым аппаратом, например, у Allium paniculatum
(Модилевский, 1928а), видов Rudbeckia (Maheshwari, Srinivasan, 1944; Battaglia,
1947; Мовсесян, 1968; Солнцева, 1971, 1987), у отдельных представителей
Asclepiadaceae (см. Davis, 1966), видов Sambucus (Тучина, 1985). На примере
Scilla sibirica показано, что такая структура антипод сохраняется и после
оплодотворения (Герасимова-Навашина, Батыгина, 1958).
Антиподы чаще всего являются эфемерными структурами. Их дезинтеграция,
по данным многих исследователей, происходит еще в процессе подготовки
зародышевого мешка к оплодотворению либо вскоре после его осуществления. Вместе
с этим у многих таксонов цветковых растений установлена способность антипод не
только заметно увеличиваться в размерах и/или в числе с образованием
многоклеточной ткани, но и сохраняться длительное время в процессе развития семени.
К числу таких таксонов относятся многие представители Arecaceae,
Berberidaceae, Nelumbonaceae, Papaveraceae, Poaceae, Ranunculaceae, Rubiaceae
и др. Так, у Sasa paniculata (Poaceae) число антипод возрастает до 300 клеток
(Yamaura, 1933). В этом же семействе, однако, известны и исключения: в
зародышевом мешке Echinochloa frumentacea и Panicum miliare наблюдается только три
антиподы (Anton, Cocucci, 1984). Расположение клеток в многоклеточном
антиподальном комплексе у представителей Nelumbonaceae и Gentianaceae отличается
большим своеобразием. У многих Alangiaceae, Asteraceae, Betulaceae,
Morinaceae, Poaceae деление каждой из трех исходных клеток антипод приводит
к образованию зародышеподобных структур. Их генезис подробно прослежен на
примере 4 видов Stipa. Показано, что митотическая активность антиподальных
зародышеподобных структур постепенно снижается, обособленность трех
клеточных групп утрачивается, клеточный комплекс вытягивается вдоль стенки
зародышевого мешка и постепенно дегенерирует (Яковлев, Солнцева, 1965). Отмечен,
однако, случай формирования антиподального зародыша, достигшего зрелости
(Rudbeckia laciniata — Солнцева, 1987). Процессы разрастания антипод и/или
увеличение их числа у многих таксонов продолжаются и после оплодотворения.
Так, у Aconitum napellus три разросшиеся антиподы могут сохраняться вплоть до
созревания семени (Osterwalder, 1898). Известны примеры подобной же
жизнеспособности антипод и в семействе Cynomoriaceae (Терехин и др., 1975).
Антиподы обычно одноядерные, первоначально с гаплоидным набором
хромосом (у видов с Fritillaria- и Plumbagella-типами развития зародышевых мешков —
с триплоидным). В процессе дифференциации зародышевых мешков, однако, у
Семязачаток 201
многих цветковых растений происходит увеличение числа ядер, которое может
достигать 60. По данным электронной микроскопии у некоторых видов Linum
внутренние клеточные стенки в антиподальном комплексе являются неполными
(Vazart J., 1968). У Oryza sativa при амитотических делениях ядер антипод
образование этих стенок происходит путем «свободного» роста (Dong, Yang, 1989).
Ядра антипод отдельных видов подвергаются и процессам эндоредупликации;
выявлены гигантские эндополиплоидные ядра и политенные хромосомы (Tschermak-
Woess, 1956; Turala, 1966; Петрова и др., 1985; Ishioka, Sato, 1990). Процесс
увеличения уровня плоидности ядер происходит и в многоядерных клетках
антипод за счет слияния отдельных ядер, приводящего ко вторичному уменьшению их
числа и образованию крупных ядер неправильной формы. Известны примеры
гетерогенности антиподальных комплексов по плоидности их ядер (Sato, 1990; и
др.). У некоторых сортов кукурузы, напротив, сохраняющиеся антиподы
представляют собой массивную гаплоидную ткань (Randolph, 1936).
Антиподы зрелого зародышевого мешка характеризуются четко выраженной
морфологической полярностью, а также исключительно большой насыщенностью
органеллами, в первую очередь, пластидами (включая амилопласты с мелкими
крахмальными зернами) и митохондриями, а также рибосомами и гранулярным
ЭР. Хлоропласты в антиподах не обнаружены. Полярность относительно микро-
пилярно-халазальной оси зародышевого мешка создается за счет различий в
составе и структуре клеточных органелл, в вакуолизации цитоплазмы, в строении
клеточной оболочки (Жукова, Соколовская, 1977). Наряду с указанными чертами,
которые характеризуют антиподы почти всех изученных объектов и
существенным образом отличают их от других элементов зародышевого мешка, обнаружены
и некоторые различия. Почти у всех исследованных видов отмечается наличие
гранулярного ЭР, у одних это обильный ЭР в виде эргастоплазмы или
концентрических кругов вокруг небольших вакуолей, например, у Linum usitatissimum,
Helianthus annuus, Aquilegia vulgaris, Stipa elmeri, Aconitum napellus, а у других
это длинные профили ЭР, располагающиеся вблизи плазмалеммы: Epidendrum
scutella, Linum catharticum, Zea mays. Заметный полиморфизм наблюдается и в
структуре пластид антипод. Клетки антипод, в отличие от клеток яйцевого
аппарата, снабжены полными клеточными оболочками (известны, правда, и
отдельные исключения). Антиподы организованы по типу передаточных клеток.
Клеточные оболочки в различных зонах антипод отличаются большой
неоднородностью по толщине, электронно-оптической плотности и химическому составу, а
также по топографии, размерам и форме протуберанцев клеточных стенок, по
наличию или отсутствию плазмодесм.
У отдельных видов установлена способность антипод к образованию гаустори-
ев. К ним относятся представители Rubiaceae (см. Магешвари, 1954; Поддубная-
Арнольди, 1976), Aristolochiaceae (Терехин, Анисимова, 1981), Asteraceae
(Солнцева, 1987), Sedumfabaria (Никитичева, 1985а).
Антиподы являются полифункциональными структурами. Основная их
функция заключается в избирательном поглощении и направленном транспорте
питательных веществ и метаболитов из материнского организма через халазальный
район семязачатка в зародышевый мешок. По-видимому, в связи с этим они, как
правило, дифференцируются первыми в зародышевом мешке и у отдельных
таксонов даже превосходят по величине (или по числу) клетки яйцевого аппарата.
Антиподы служат не только центрами абсорбции питательных веществ, но и их
преобразования. Структура ядра (и, в особенности, его ядрышка), обилие
рибосом, экстенсивный гранулярный ЭР и его ассоциации с вакуолями в антиподах
позволяют предположить преобладание процессов, связанных с белковым
обменом. Не исключена при этом и секреторная активность антипод. Антиподы многих
202 Генеративные органы цветка
видов способны накапливать запасные белки и липиды, потребляемые после
оплодотворения. Это говорит об их запасающей функции для развивающегося
эндосперма и зародыша семени. Крахмал, однако, в пластидах антипод встречается
редко; отмечен у Epidendrum scutella, Linum usitatissimum, Ornithogalum caudatum,
Valeriana officinalis, Zea mays. Интересной особенностью антипод зародышевого
мешка цветковых растений является сочетание в них признаков
специализированных и меристематических клеток (Жукова, 1984). Рис. 57.
Александров, Александрова, 1946; Батыгина, 1974; Батыгина и др., 1983; Герасимова-Навашина,
1957; Герасимова-Навашина, Батыгина, 1958; Жукова, 1984; Жукова, Соколовская, 1977; Ильина,
1981; Камелина, 1980, 1985а, 1987в; Камелина, Яковлев, 1974; Корчагина, 1981; Магешвари, 1954;
Мовсесян, 1968; Модилевский, 1928а; Никитичева, 1985а; Петроваи др., 1985; Поддубная-Арнольди,
1976; Романов, 19366; Солнцева, 1971, 1987; Тахтаджян, 1980; Терехин, Анисимова, 1981; Терехин и
др., 1975; Тучина, 1985; Шамров, 1988; Эзау, 1980; Яковлев, Солнцева, 1965; Afzelius, 1924; Anton,
Cocucci, 1984; Balicka-Iwanowska, 1899; Battaglia, 1947, 1987a; Berger, Erdelska, 1973; Bhandari,
Bhargava, 1983; Bhatnagar, Johri, 1972; Bohdanowicz, Turala-Szybowska, 1985,1987; Chamberlain, 1895;
Chikkannaran, Mahalingappa, 1975; Davis, 1966; Diboll, 1968; Dong, Yang, 1989; Ekdahl, 1941; Engell, 1992;
Fagerlind, 1944a; Fougere-Rifot, 1981; Guerin, 1903; Guignard, 1881; Haberland, 1925; Henfrey, 1853;
Huss, 1906; Ikeda, 1902; Ishioka, Sato, 1990; Kapil, Bhatnagar, 1978; Lotscher, 1905; Maheshwari,
Srinivasan, 1944; Mauritzon, 1933a; Maze, Lin, 1975; Mottier, 1895; Nagl, 1976; Newcomb, 1973a;
Osterwalder, 1898; Rifot, 1973; Rodkiewicz, Mikulska, 1967; Schnarf, 1929; Schulz, Jensen, 1971; Sehgal,
1980; Shattuck, 1905; Stolt, 1921; Taskholm, 1916; Tian H„ Yang H., 1991; Tilton, Lersten, 1981 b; Tretjakow,
1895; Turala, 1966; Turala-Szybowska, Wolanska, 1990; Vazart J., 1968; Venkata Rao, 1959;
Vijayaraghavan, Neeru Seth, Alka Jain, 1988; Westermaier, 1890; Westerwalder, 1898; Willemse, Kapil,
1981; Willemse, van Went, 1984; Wilms, 1981; Yamaura, 1933.
УЛЬТРАСТРУКТУРНЫЕ АСПЕКТЫ РАЗВИТИЯ
ЗАРОДЫШЕВОГО МЕШКА
В ходе формирования зародышевого мешка (= женского гаметофита, или = ме-
гагаметофита) четко выделяются две фазы: мегаспорогенез, в результате
которого после двух делений мейоза формируются и созревают мегаспоры, и мегага-
метогенез, который начинается с митотического свободноядерного деления
продуктов мейоза (т. е. мегаспор), проходит фазу целлюляризации и завершается
созреванием мегагаметофита. В настоящем обзоре дана лишь общая
характеристика развития зародышевого мешка; более подробную информацию по
отдельным вопросам организации мегагаметофита можно почерпнуть из других
источников (Kapil, Bhatnagar, 1981; Rodkiewicz, 1978; Willemse, van Went, 1984).
Несмотря на большое число публикаций в этой области, далеко не все типы развития
зародышевого мешка описаны на ультраструктурном уровне (Maheshwari, 1950).
Мегаспорогенез. Процесс мегаспорогенеза начинается с образования одно-
или многоклеточного археспория в спорофитной ткани материнского организма.
Клетки археспория характеризуются более крупными размерами по сравнению с
окружающими клетками, наличием ядрышек в ядрах и мелких вакуолей; по
данным электронной микроскопии, это не поляризованные клетки, насыщенные слабо
дифференцированными органеллами (Eyme, 1965; Kapil, Bhatnagar, 1981). Лишь
одна из этих клеток переходит к дальнейшему развитию. Она при этом либо
претерпевает митотическое деление перед мейозом, либо непосредственно становится ме-
гаспороцитом (= материнской клеткой мегаспор) (Maheshwari, 1950). Достоверно
определить мегаспороцит иногда удается лишь после его вступления в мейоз. В
случае деления археспориальной клетки одна из дочерних клеток — внутренняя
(обращенная к халазе), становится мегаспороцитом в то время как вторая —
«наружная» (обращенная к микропиле), или париетальная, путем митотических делений
ее производных образует слои клеток — париетальную (вегетативную) ткань. Мей-
отическое деление ядра мегаспороцита и переход от спорофитной к гаметофитной
генерации сопровождаются глубокими цитоплазматическими преобразованиями в
Семязачаток
203
этой клетке. Тонкая структура протопласта мегаспороцита в момент инициации
мейоза подобна таковой у меристематических клеток (Dickinson, Heslop-Harrison,
1977;Eyme, 1965; Kapil, Bhatnagar, 1981; Schulz, Jensen, 1981). Митохондрии и про-
пластиды слабо дифференцированы. Рибосомы, как и ЭР, обильны. Отмечена
полярность в распределении органелл в пределах этой клетки. У разных видов она
выражена по-разному. Так, например, в роде Myosurus большинство органелл
сосредоточено в месте образования будущей функционирующей мегаспоры
(Woodcock, Bell, 1968). У большинства растений, однако, полярность клетки
выражена слабо (Medina et al., 1981; Rodkiewicz, 1978; Russell, 1979; Schulz, Jensen, 1981,
1986). Клеточная оболочка мегаспороцита несколько толще оболочек окружающих
клеток и во многих случаях представляется специализированной (Kapil,
Bhatnagar, 1981). У растений, в образовании мегагаметофита которых участвует
только одно из ядер, образовавшихся в результате мейоза (= моноспорический тип
развития зародышевого мешка), или два из них (= биспорический тип развития), в
составе обычных компонентов клеточной оболочки есть основания ожидать
наличие каллозы (а-1,3 полиглюкана). Это легко установить с помощью 0,005%
анилинового синего в 0,1 М р-ре КН2Р04 при рН 8,2. В топографии каллозы отмечена
специфичность, связанная с типом развития зародышевого мешка. При моноспориче-
ском и биспорическом типах развития (Rodkiewicz, 1970), даже если полярность
мегаспороцита противоположна полярности, свойственной нормальному
(Polygonum) типу развития, каллоза аккумулируется на абортивном полюсе
мегаспороцита, как, например, у рода Oenothera (Jalouzot, 1978). Однако, при
формировании зародышевого мешка тетраспорического типа развития каллоза в клеточной
оболочке отсутствует (Rodkiewicz, 1970). Плазмодесмы, как правило,
наблюдаются только в тех участках клеточной оболочки, которые не аккумулируют каллозу. В
тетраспорических зародышевых мешках они также наблюдаются главным образом
в халазальной клеточной стенке.
В ходе профазы I митохондрии и пропластиды претерпевают глубокие
структурные изменения и дифференциацию, становясь сходными по
внешнему виду. Это поставило цитологов перед новой проблемой: сохраняются ли
в ходе мейоза органеллы, несущие наследственный материал, и если они
дезинтегрируют, то происходит ли регенерация из других органелл или из
оболочки ядра (Dickinson, Heslop-Harrison, 1977). Ультраструктурные и
биохимические исследования показали наличие ДНК-содержащих органелл и
их сильную модификацию в ходе профазы. На этой фазе мейоза
уменьшается и плотность рибосом (Rodkiewicz, Mikulska, 1963, 1965а; Dickinson,
Heslop-Harrison, 1977; de Boer-de-Jeu, 1978; Rodkiewicz, 1978; Willemse,
Franssen-Verheijen, 1978; Russell, 1979; Schulz, Jensen, 1981; Willemse, van
Went, 1984). В цитоплазме часто обнаруживаются автофагоцитозные
вакуоли, производные ЭР, и провакуоли, которые иногда содержат мембраны или
органелло-подобные включения (Russell, 1979; Schulz, Jensen, 1981). В этих
вакуолях локализованы два относительно неспецифических энзима: кислая
фосфатаза (Schulz, Jensen, 1981; Willemse, Bednara, 1979) и эстераза
(Willemse, Bednara, 1979). Их наличие подтверждает предположение о том,
что отдельные клеточные компоненты деградируют в ходе этой
фазы,разрушаясь до предшественников.
Дедифференциация цитоплазмы достигает своего наивысшего предела к
середине мейоза I; те же самые тенденции наблюдаются и в ходе микроспорогенеза
(см. ПЫЛЬНИК), и, по-видимому, специфичны для тех же самых фаз мейоза
(Dickinson, Heslop-Harrison, 1977). Снижение уровня нуклеиновых кислот и
белков в микроспорогенезе тесно коррелирует с увеличением уровня
гидролитических энзимов. Ультраструктурные данные показали, что подобные изменения ве-
204
Генеративные органы цветка
роятны и в мегаспороците в ходе мейоза (Dickinson, Heslop-Harrison, 1977). У
разных видов покрытосеменных растений, по-видимому, эти особенности выражены
в разной степени. Наиболее отчетливо подобные изменения можно наблюдать в
развивающемся женском гаметофите Lilvum (Dickinson, Heslop-Harrison, 1977;
Rodkiewicz, Mikulska, 1963, 1965a, b), в котором участки концентрически
расположенных ламелл ЭР, по-видимому представляют собой резервуары сохраненной
цитоплазмы, изолированной от остальной гидролитически активной среды. У
растений с моноспорическим зародышевым мешком незначительно выраженная
аутофагоцитозная активность, по-видимому, приурочена к специальным компар-
тментам, цитоплазматические резервуары более редки, а элиминация рибосом
лишь частичная (De Boer-de-Jeu, 1978; Jalouzot, 1978; Medina, etal., 1981; Russell,
1979; Schulz, Jensen, 1981; Willemse, Bednara, 1979; Willemse, Franssen-Verheijen,
1978).
Продукты первого цикла деления мегаспороцита и редукционного деления его
ядра (= мейоз I) называются клетками диады мегаспор, а клетки, прошедшие оба
цикла ядерного деления (= мейоз I и мейоз II), являются мегаспорами. У растений
с моноспорическим или биспорическим типами развития женского гаметофита
абортирование одной из клеток диады или трех клеток тетрады мегаспор,
по-видимому, генетически запрограммировано. Нефункционирующие мегаспоры и
клетки диады часто характеризуются некоторой редукцией пластид; диктиосомы,
гранулярный ЭР и вакуоли, напротив, могут быть у них более обильными, чем в
функционирующей клетке (Willemse, 1981). Нефункционирующие мегаспоры
лишены плазмодесм (De Boer-de-Jeu, 1978; Jalouzot, 1978; Russell, 1979; Schulz,
Jensen, 1981, 1986; Willemse, 1981); продукты их дезинтеграции часто включаются
в состав богатой каллозной клеточной оболочки (Rodkiewicz, 1970; Russell, 1979;
Schulz, Jensen, 1986). Каллоза наблюдается на боковых и поперечных стенках
абортирующих мегаспор. В дегенерирующих клетках появляются плотные зоны
гидролитической активности, включающие пероксидазы и эстеразы (Willemse,
Bednara, 1979). Кислая и щелочная фосфатазы содержатся не только в этих
клетках, но часто и в функционирующей мегаспоре (Schulz, Jensen, 1986; Willemse,
Bednara, 1979). Дегенерирующие клетки первоначально подобны мегаспороциту,
но, в конечном итоге, из-за разрушения жизненно важных внутриклеточных
мембранных систем, в них наступает общий распад клеточного материала (Cass et al.,
1985; Schulz, Jensen, 1986). В конце концов утрачивается и плазмалемма и лити-
ческая активность становится основной (Cass et al., 1985; Russell, 1979; Schulz,
Jensen, 1986). Как можно предположить, продукты деградации этих
абортирующих клеток в конце концов резорбируются, как и продукты распада окружающих
клеток нуцеллуса (= вегетативная часть семязачатка заключенная в интегументы,
= мегаспорий) (Russell, 1979; Schulz, Jensen, 1986). Однако, в отличие от
дезинтегрирующих клеток нуцеллуса, дегенерирующие мегаспоры или клетки диады
абортируют быстро, еще до начала разрастания мегагаметофита (Rodkiewicz,
1978).
Функционирующая мегаспора (при всех способах развития зародышевого
мешка) характеризуется, по данным электронной микроскопии, редифференциа-
цией митохондрий и пластид, а также усилением синтетической активности, о чем
свидетельствует увеличение плотности рибосом и числа клеточных органелл, а
также рост самой клетки (De Boer-de-Jeu, 1978; Eyme, 1965; Russell, 1979; Schulz,
Jensen, 1986). В ней возможно также отложение запасных веществ (Willemse,
Franssen-Verheijen, 1978), включая липиды и крахмал (Willemse, Bednara, 1979).
У Capsella в функциональной мегаспоре отмечено образование множества мелких
выростов плазмалеммы, что может быть связано с поступлением в нее продуктов
клеточного содержимого абортирующих мегаспор (Schulz, Jensen, 1986). В содер-
Семязачаток
205
жащих каллозу клеточных стенках в этот период отмечено появление мелких
включений (Russell, 1979; Schulz, Jensen, 1986).
Мегагаметогенез. Мегаспорогенез завершается митотическим делением
ядра или ядер мегаспор. При моноспорическом типе развития зародышевого мешка
функционирующая мегаспора содержит одно ядро, в то время, как при биспори-
ческом и тетраспорическом типах развития мегаспора содержит 2 или 4 ядра,
соответственно. Эти различия в числе ядер означают следующее: чтобы достичь
полного комплекта ядер для моноспорических мегаспор тетрады потребуется 3 цикла
митотического деления, для биспорических мегаспор потребуется два цикла, а для
тетраспорических — достаточен только один цикл (Maheshwari, 1950).
При моноспорическом и биспорическом типах развития мегагаметофита
значительный процент цитоплазмы мегаспороцита расходуется на образование
абортивных клеток: при моноспорическом типе от 67 до 75% цитоплазмы
мегаспороцита может абортировать, а при биспорическом типе — 50%. Поскольку тетраспо-
рические зародышевые мешки сохраняют весь объем протопласта при вступлении
в мегагаметогенез, они представляются незавершившими подготовку к нему по
ряду показателей — по своему размеру и степени созревания цитоплазмы (De
Boer-de-Jeu, 1978).
В ходе мегагаметогенеза цитоплазма претерпевает ряд заметных изменений,
включающих формирование центральной вакуоли, репликации наследуемых
органелл, один или более циклов митотического деления и, наконец, целлюляриза-
цию мегагаметофита (Kapil, Bhatnagar, 1981; Willemse, 1981). Формирование
центральной вакуоли обычно начинается с образования мелких вакуолей de novo или
из ЭР, которые затем объединяются, образуя более крупную вакуоль,
характерную для центральной клетки зрелого зародышевого мешка (Kapil, Bhatnagar,
1981; Russell, 1979; Schulz, Jensen, 1986). В течение 4-ядерной стадии развития
мегагаметофита у Zea (Russell, 1979) митохондрии претерпевают дедифференциа-
цию и редифференциацию; это совпадает с затуханием интенсивной литической
активности центральной вакуоли и переходом от вегетативной к репродуктивной
дифференциации. В оболочках абортивных мегаспор легко выявляется каллоза,
которая наблюдается на протяжении всей двуядерной стадии развития
мегагаметофита.
Свободно-ядерные деления (= формирование ядер путем митотического
деления без одновременного формирования клеточной стенки) прекращаются по
достижении окончательного набора ядер. В большинстве случаев зрелый
зародышевый мешок содержит 8 ядер (и состоит из 7 клеток); это положение может меняться
при блокировке одного из звеньев процесса (= выпадении деления какой-либо
клетки, которое, по всей вероятности, происходит типичным для растительной
клетки образом) или при последующем увеличении числа клеток (Maheshwari,
1950). Многочисленными светооптическими исследованиями показано, что ядра
обеих синергид являются производными верхнего микропилярного ядра четы-
рехъядерного мегагаметофита, а ядро яйцеклетки и полярное ядро — нижнего
микропилярного ядра (Maheshwari, 1950). Это подтверждено и электронной
микроскопией (Cass, et al., 1985, 1986). Целлюляризация мегагаметофита в микропи-
лярном районе инициируется формированием отдельных фрагмопластов между
двумя парами сестринских ядер (Cass, et al., 1986). Клеточная пластинка,
возникающая между ядрами синергид, обеспечивает их разделение, в то время как
клеточная пластинка, возникающая между ядрами яйцеклетки и центральной
клетки, формирует халазальную стенку всех клеток яйцевого аппарата (= яйцеклетка
и 2 синергиды) и затем дает ответвления в направлении микропиле, завершающие
разделение яйцеклетки и синергид. Рост клеток яйцевого аппарата в дальнейшем
вызывает появление четковидных клеточных стенок; их локальная прерыви-
206
Генеративные органы цветка
стость на халазальном конце клеток (Cass et al., 1985, 1986) — структурная
модификация для проникновения спермия и слияния гамет у некоторых
покрытосеменных растений (Kapil, Bhatnagar, 1981). Развитие так называемых «крючков»
синергид, столь характерных для мегагаметофитов покрытосеменных растений,
является следствием разрастания основания синергид за пределы исходного
места прикрепления (Cass et al., 1986). В процессе созревания клетки яйцевого
аппарата приобретают цитоплазматическую организацию, соответствующую их
клеточному типу. Полярные ядра (= ядра центральной клетки) мигрируют в
определенную зону, где они вступают в контакт друг с другом, частично или полностью
сливаясь в соответствии с типом развития мегагаметофита (Maheshwari, 1950).
Антиподы, достигая зрелости, могут сохраняться и претерпевать дальнейшие
деления или дегенерировать, в зависимости от вида растения (Maheshwari, 1950).
Рис. 58.
Cass et al., 1985, 1986; De Boer-de-Jeu, 1978; Dickinson, Heslop-Harrison, 1977; Eyme, 1965; Jalouzot,
1978; Kapil, Bhatnagar, 1981; Maheshwari, 1950; Medina, 1981; Rodkiewicz, 1970, 1978; Rodkiewicz,
Mikulska, 1963, 1965a, b; Russell, 1979; Schulz, Jensen, 1981, 1986; Willemse, 1981; Willemse, Bednara,
1979; Willemse, Franssen-Verheijen, 1978; Willemse, van Went, 1984; Woodcock, Bell, 1968.
ЦИТОКИНЕЗ В ЗАРОДЫШЕВОМ МЕШКЕ
Начальная свободноядерная стадия всегда присутствует в ходе развития
зародышевого мешка при всех (моноспорических, биспорических и тетраспорических)
типах его развития. Процесс цитокинеза (целлюляризации) в свободноядерном
женском гаметофите приводит к образованию женской гаметы, или яйцеклетки.
Одним из менее изученных аспектов развития зародышевого мешка у
покрытосеменных растений является организация и дифференциация яйцеклетки и других
взаимосвязанных элементов зародышевого мешка. Хотя исследования в области
эмбриологии покрытосеменных растений длятся уже почти столетие, клеткообра-
зование в свободноядерном зародышевом мешке детально не изучено. Лишь
недавно появились публикации, в которых содержится информация о процессе
формирования клеточных оболочек в зародышевом мешке и его целлюляризации (см. Cass
et al., 1986; Bhandari, Chitralekha, 1989). Недостаточность наших знаний была
обусловлена 1) отсутствием ювелирной техники для выявления изначально
возникающих тонких перегородок и 2) быстрой скоростью процесса целлюляризации. Элек-
тронномикроскопические исследования с применением тонких и полутонких
срезов заключенного в смолы материала (Newcomb, 1973; Kapil, Bhatnagar, 1981)
возродили интерес к изучению этого важного аспекта. В прошлом десятилетии
подробные данные о процессе целлюляризации были получены у Hordeum vulgare
(Cass et al., 1985, 1986), Ranunculus sceleratus (Bhandari, Chitralekha, 1989) и у
Glycine max. (Folsom, Cass, 1990). Однако информация остается все еще
недостаточной и необходимы дальнейшие исследования большого числа видов прежде, чем
могут быть сделаны окончательные выводы о механизме образования клеточных
оболочек и последующем цитокинезе. Поэтому мы рассмотрим, главным образом,
характерные особенности различных механизмов цитокинеза в зародышевом мешке.
Процесс цитокинеза в зародышевом мешке был вначале изучен в восьмиядер-
ных семиклеточных зародышевых мешках. В этом случае восьмиядерной стадии
предшествует четырехъядерная стадия, в которой пары ядер располагаются на
каждом из двух (микропилярном и халазальном) полюсов мегагаметофита.
Четыре ядра делятся митотически, формируя восемь ядер — по четыре на каждом
полюсе. Клеточные оболочки формируются между четырьмя ядрами на каждом
полюсе, в результате чего в зародышевом мешке образуются две группы из трех
одноядерных клеток, разделенных крупной центральной клеткой, с двумя поляр-
Семязачаток
207
ными ядрами (семиклеточный зародышевый мешок). Три клетки на
микропилярном конце представляют собой яйцевой аппарат, тогда как три клетки на
халазальном конце — антиподальный комплекс. Bhandari и Chitralekha (1989)
считают, что 1) положение ядер и 2) плоскость ядерного деления в четырехъядерном
мегагаметофите обусловливают характер целлюляризации. В узкой халазальной
части ядра расположены одно над другим наклонно (относительно продольной оси
зародышевого мешка), тогда как в широкой микропилярной части два других
ядра размещены рядом в горизонтальной плоскости. Однако было отмечено
перемещение одного из двух микропилярных ядер в халазальном направлении (Folsom,
Cass, 1989). У Ranunculus sceleratus плоскости деления обоих ядер в каждой группе
взаимноперпендикулярны, но наклонны по отношению к длинной оси
зародышевого мешка. В результате этого распределение дочерних ядер на халазальном
конце идет по схеме 1+2+1 (Bhandari, Chitralekha, 1989). В широком микропилярном
конце ядра расположены по схеме 2+1 +1, но это выглядит как 3+1 вследствие
размещения ядер в тонком слое цитоплазмы.
Образование клеточных оболочек на обоих полюсах зародышевого мешка
происходит одновременно. Стенки возникают как клеточные пластинки с помощью
фрагмопластов в ходе последней стадии деления четырех ядер (Bhandari,
Chitralekha, 1989; Folsom, Cass, 1990). Ранее также отмечалось участие клеточных
пластинок в целлюляризации мегагаметофита (см. Cass et al., 1986; Bhandari,
Chitralekha, 1989; Folsom, Cass, 1990). Согласно другому мнению клеточные
оболочки формируются в восьмиядерном зародышевом мешке независимо от
ядерного деления и несколько позже его (Cass et al., 1985, 1986). Эти клеточные
пластинки тонкие, дисковидные.
Об образовании трех отдельных клеточных пластинок на каждом полюсе
мегагаметофита было сообщено в ряде работ (Cooper, 1935, 1941; Rees-Leonard, 1935;
Smith, 1942; Bhandari, Chitralekha, 1989). Folsom и Cass (1990), изучая положение и
ориентацию клеточных стенок в клеточном зародышевом мешке, также пришли к
выводу, что три клеточные пластинки действительно участвуют в
целлюляризации. Две из них формируются на основе первичных фрагмопластов, после ядерного
деления. Одна из трех пластинок (CPI, см. рис. 59) формируется перпендикулярно
продольной оси зародышевого мешка. По мере роста она достигает стенки
зародышевого мешка, сливается с нею и отделяет тем самым полярное ядро от остальных
(трех) ядер. Вторая клеточная пластинка (СРП, см. рис. 59) между второй парой
сестринских ядер закладывается наклонно по отношению к продольной оси
зародышевого мешка; затем она изгибается вокруг одного из ядер, тем самым отделяя его
от двух несестринских ядер. Третья клеточная пластинка (СРШ, см. рис. 59) (более
мелкая, чем две другие) возникает несколько позже параллельно продольной оси
гаметофита и располагается между двумя несестринскими ядрами. По мере
расширения эта пластинка вступает в контакт и затем объединяется с наклонной
клеточной пластинкой одной своей стороной, с клеточной пластинкой I стороной,
обращенной к центральной вакуоли, с оболочкой мегагаметофита остальной частью
края пластинки. Cooper (1935) и Smith (1942) считали, что эта клеточная пластинка
(СРШ) возникает на базе веретена, сохраняющегося после ядерного деления при
образовании четырехъядерного зародышевого мешка. Однако это заключение
требует подтверждения ультраструктурными исследованиями. Интересно отметить,
что оба полярных ядра располагаются на разных полюсах.
Согласно Cass с соавторами (1986), сначала формируются лишь две стенки:
вертикальная, сформированная между двумя синергидными ядрами, и
горизонтальная — между микропилярным полярным ядром и ядром яйцеклетки.
Горизонтальная стенка разветвляется на две, одна из которых продолжает расти
горизонтально, отделяя полярное ядро от ядер яйцевого аппарата. Другая ветвь рас-
208
Генеративные органы цветка
тет вертикально в направлении стенки зародышевого мешка между ядрами
яйцеклетки и синергид и сливается с вертикальной стенкой между синергидными
ядрами. Она отделяет яйцеклетку от синергид. Одна из двух вертикальных стенок
сильно извилиста.
Ультраструктурные исследования подтвердили, что эти клеточные пластинки
имеют четкообразный вид и, по-видимому, формируются и растут путем слияния
пузырьков — производных диктиосом. На растущих концах клеточных стенок
наблюдаются отдельные микротрубочки, связанные с пузырьками (Cass et al., 1986).
Однако нам (Bhandari, Chitralekha, неопубл. данные) не удалось обнаружить ни
активных диктиосом, ни их производных — пузырьков, ни микротрубочек около
растущих концов. С другой стороны, мы наблюдали большое количество цистерн
гранулярного ЭР вблизи клеточных пластинок. Поэтому мы полагаем, что эти
цистерны играют важную роль в росте пластинок. В клеточных пластинках
наблюдается электронноплотная центральная часть (срединная пластинка),
окруженная электроннопрозрачной частью (первичная клеточная оболочка).
Из трех клеток, сформировавшихся в микропилярной области зародышевого
мешка, одна клетка дифференцируется в женскую гамету или яйцеклетку, а две
другие — в синергиды. Вначале яйцеклетка и синергиды не различаются ни по
положению, ни по структуре. Различия проявляются между клетками позднее.
Однако, исходя из положения ядер и веретен, большинство ранних авторов и
современные (Cass et al., 1986; Folsom, Cass, 1990) присоединились к концепции,
предложенной Porsch (1907), согласно которой ядро яйцеклетки и микропилярное
полярное ядро являются сестринскими ядрами, как и ядра обеих синергид. При
исследовании R. sceleratus мы не получили никаких доказательств в пользу этой
концепции. Рис. 59.
Bhandari, Chitralekha, 1989; Cassetal., 1985,1986; Cooper, 1935,1941; Folsom, Cass, 1989, 1990;Kapil,
Bhatnagar, 1981: Newcomb, 1973; Porsch, 1907; Rees-Leonard, 1935; Smith, 1942.
ФРАГМОПЛАСТ (греч. phragma — перегородка; plastos — вылепленный) —
цитоскелетный компонент растений, возникающий при переходе клетки к
делению. Под световым микроскопом выглядит как бочонковидная или кольцевидная
структура из параллельных волокон, похожих на волокна веретена ядерного
деления, но более коротких, располагающаяся, как правило, между телофазными
ядрами. Как установлено в электронномикроскопических исследованиях,
фрагмопласт представляет собой два набора параллельных микротрубочек, своими
«плюс»-концами направленных к экваториальной межъядерной зоне, в которой
они заходят друг за друга. Часть микротрубочек фрагмопласта начинает полиме-
ризоваться в полярных зонах веретена ядерного деления еще в анафазе, остальные
образуются позднее в зонах около восстановившихся оболочек ядер. Фрагмопласт
чаще всего рассматривают как вновь образованную структуру, а не как
производное веретена деления. В состав фрагмопласта входят и расположенные коаксиально
с микротрубочками микрофиламенты. В экваториальную зону фрагмопласта
переносятся содержащие, главным образом, пектиновые вещества, секреторные
пузырьки Гольджи, продуцируемые диктиосомами. Эти пузырьки, сливаясь друг с
другом в одной (перпендикулярной микротрубочкам) плоскости, дают начало
перегородке между клетками — клеточной пластинке. Она имеет вид взвешенного
в центре фрагмопласта круга; мембрана пузырьков после их слияния друг с другом
образует новые плазмалеммы по обеим сторонам клеточной пластинки. Клеточная
пластинка разрастается центробежно за счет включения в ее край все новых
пузырьков. Микротрубочки фрагмопласта, как правило, сохраняются только в
зоне слияния пузырьков, длина их уменьшается; там, где слияние завершилось,
микротрубочки деполимеризуются. Поэтому фрагмопласт, имеющий в начале бо-
Семязачаток
209
чонковидную форму, в крупных клетках вскоре приобретает форму кольца,
располагающегося на периферии клеточной пластинки. Диаметр кольца прогрессивно
увеличивается за счет полимеризации все новых микротрубочек по мере
разрастания пластинки. Когда клеточная пластинка достигнет стенок материнской клетки,
все эти микротрубочки распадаются, фрагмопласт исчезает, цитокинез
заканчивается, на клеточную пластинку с обеих сторон откладывается первичная оболочка.
Фрагмопласт участвует в образовании клеточной пластинки и при обработке
агентами, ингибирующими полимеризацию микротрубочек, нормальный
цитокинез не происходит. Хотя механизм контроля отложения клеточной пластинки со
стороны фрагмопласта точно не выяснен, предполагают, что его микротрубочки
и/или микрофиламенты обеспечивают транспорт и агрегацию пузырьков в
экваториальной плоскости фрагмопласта.
У растений (большинство двудольных, немногие однодольные) с симультанным
типом образования тетрад микроспор (путем бороздования) после I деления мейоза
может формироваться рудиментарный или типичный, но эфемерный фрагмопласт
с зачаточной, вскоре исчезающей клеточной пластинкой или без нее, с зачаточной
бороздой (Magnolia, Lonicera, Phalaenopsis) или фрагмопласт вообще не
отмечается (Gasteria). После II деления мейоза сохраняющиеся между сестринскими ядрами
веретена («первичные веретена») вместе с отходящими от ядерной оболочки
новыми тяжами микротрубочек могут принимать форму типичных бочонковидных
фрагмопластов (Phalaenopsis) или же явных фрагмопластов не образуется
(Lonicera, Impatiens, Gasteria). Между несестринскими ядрами за счет
образующихся на ядерной оболочке микротрубочек могут формироваться вторичные фраг-
мопласты (веретена). Когда фрагмопласты достигнут стенок, начинается
центростремительный рост борозд деления. При этом клеточные пластинки не
появляются и роль фрагмопластов сводится к детерминации числа и ориентации борозд. У
некоторых растений (Тradescantia) без формирования фрагмопласта может
происходить и цитокинез генеративной клетки.
При целлюляризации зародышевого мешка фрагмопласты с клеточными
пластинками образуются между сестринскими ядрами, однако закладываются ли
фрагмопласты между несестринскими ядрам (вторичные), точно не установлено.
Возможно, что клеточные пластинки между ними образуются за счет роста
первичных фрагмопластов, которые загибаются соответствующим образом в
экваториальную зону между несестринскими ядрами. У растений с нуклеарным
эндоспермом (Arabidopsis) в телофазе деления первичного ядра эндосперма образование
фрагмопласта может не сопровождаться появлением клеточной пластинки, в
результате цитокинез не происходит. При клеткообразовании в нуклеарном
эндосперме фрагмопласты с клеточными пластинками образуются как между
сестринскими ядрами (первичные фрагмопласты), так и между несестринскими
(вторичные) . Фрагмопласты могут (например, у Triticum) закладываться независимо от
ядерных делений за счет радиально отходящих от оболочки ядер микротрубочек.
Baskin, Cande, 1990; Brown, Lemmon, 1992; Wick, 1991.
ЦИТОХИМИЯ ЗАРОДЫШЕВОГО МЕШКА
Цитохимические исследования зародышевых мешков начались в 50-х годах
нашего столетия (Steffen, 1951; Krupko, Denley, 1955). Методами качественной
цитохимии (реакция Фельгена, окраска метилгрюн-пиронином по Браше, окраска
прочным зеленым) преимущественно изучалась локализация ДНК в ядрах, РНК
и белков в цитоплазме.
В 70-х годах впервые были применены количественные методы исследования
зародышевых мешков: цитофотометрия при окраске препаратов по Фельгену (Аг-
14 Генеративные органы цветка.
210
Генеративные органы цветка
роскин, Папаян, 1977) и люминесцентный микроспектральный анализ (Сердюк,
Конарев, 1970) при окраске акридиновым оранжевым.
Первые данные по количественному содержанию ДНК; в ядрах зародышевых
мешков получены для видов Nicotiana tabacum, LLlium regale, Triticum aestivum,
Triticale, Galanthus nivalis (Банникова и др., 1985). С целью определения
соотношения продолжительности отдельных периодов интерфазы митотического цикла
исследовали ядра яйцеклеток зрелых зародышевых мешков и нижние микропи-
лярные ядра четырехъядерных зародышевых мешков, являющихся
предшественниками ядер яйцеклеток. Установлено, что синтез ДНК в ядрах зрелых
яйцеклеток не происходит, среднее количество ДНК соответствует 1С ДНК гаплоидного
ядра. При формировании яйцеклеток наиболее продолжительным является
период синтеза ДНК (55—64% ядер). Следующий по продолжительности — пресинте-
тический период (22—30% ядер), наименее продолжительный —
постсинтетический период (11 — 17 % ядер). Соотношение фаз митотического цикла в ходе мега-
гаметогенеза отличается от такового в ядрах соматических клеток и является,
вероятно, необходимым при формировании половых клеток (Гриф, Иванов, 1975).
Исследование физико-химического состояния хроматина ядер всех клеток
зародышевого мешка дает представление о структуре хроматина ядра и его
синтетической активности (Хведынич, 1989). Ядра яйцеклеток, как правило,
характеризуются более конденсированным хроматином по сравнению с ядрами других
клеток зародышевого мешка. Часть ДНК в них прочно связана в липопротеидных
комплексах. Однако доля конденсированного хроматина в ядрах яйцеклеток у
разных видов неодинакова, что проявляется в различной интенсивности окраски
по Фельгену. Ядра центральных клеток характеризуются, в основном, деконден-
сированным состоянием хроматина, в нем почти не обнаруживается прочно
связанная ДНК. В ядрах синергид и антипод у большинства видов хроматин тоже,
главным образом, диффузный. В антиподах злаков, однако, выявляется и
конденсированный хроматин, что, по-видимому, связано с политенизацией хромосом.
Таким образом, ядрам всех клеток зародышевого мешка свойственно
определенное структурное состояние хроматина, характерное для данного типа клеток.
Ядра зародышевого мешка различаются по функциональной активности.
Наименее активны ядра яйцеклеток: свободной РНК в хроматине мало,
преобладает РНК, связанная с белками и липидами, что свидетельствует о
незначительном ее синтезе. Синтетическая активность ядер центральной
клетки, судя по соотношению свободной и связанной РНК, у исследованных
видов несколько различается. Возможно, это связано с разной
продолжительностью существования зародышевых мешков. В ядрах синергид и антипод
выявляется много свободной РНК, что говорит о ее синтезе и высокой
функциональной активности ядер этих клеток.
От функциональной активности ядер зависит содержание белков в цитоплазме.
У подавляющего большинства видов цитоплазма зрелой яйцеклетки содержит
незначительное количество этих биополимеров, слабо пиронинофильна и умеренно
красится на белки. Содержание РНК и белков в цитоплазме центральной клетки
зародышевого мешка у разных видов варьирует. В цитоплазме синергид и антипод
концентрация РНК и белков выше, чем в цитоплазме яйцеклетки и центральной
клетки, о чем свидетельствует более сильная пиронинофилия и окрашиваемость
на белки.
Таким образом, результаты цитохимических исследований подтверждают, что
зародышевый мешок представляет собой сложную динамичную систему клеток,
функции которых четко распределены. Рис. 60.
Агроскин, Папаян, 1977; Банникова и др., 1985; Гриф, Иванов, 1975; Сердюк, Конарев, 1970;
Хведынич, 1989; Krupko, Denley, 1955; Steffen, 1951.
Семязачаток
211
ПРИЖИЗНЕННЫЕ ИССЛЕДОВАНИЯ
ЗАРОДЫШЕВОГО МЕШКА
Зародышевый мешок (женский гаметофит растений) в течение своего развития
окружен нуцеллусом и интегументами семязачатка. В отличие от мужского гаме-
тофита, исследование структуры и функции зародышевых мешков методически
более затруднено.
Изучение «живых» зародышевых мешков привлекает внимание по нескольким
причинам. Во-первых, идет речь о проверке и уточнении данных; полученных при
изучении постоянных препаратов на фиксированном материале. Во-вторых,
изучение этих зародышевых мешков позволяет определить и уточнить временные
параметры и последовательность процессов, происходящих в них до, во время и
после оплодотворения. Кроме того, в таких зародышевых мешках можно точно
определить нужную фазу развития для фиксации объекта и дальнейшего изучения
методом световой или электронной микроскопии (Сидорова, 1985).
Изолированные зародышевые мешки также используются для изучения цитоскелета (Bednara
etal., 1990).
В настоящее время особый интерес в изучении живых зародышевых мешков
представляет область клеточных манипуляций, связанных прежде всего с
контролируемым оплодотворением, с микроинъекцией генетически
трансформированных клеток спермиев, с включением чужеродной ДНК в отдельные элементы
зародышевого мешка, с индукцией некоторых типов апомиксиса и т.п. (Huang,
Russell, 1989; Cass, 1990; Kranz et al., 1991).
В прижизненных исследованиях зародышевого мешка важную роль играет
выбор объекта и методов изоляции и культивирования. При этом можно использовать
такие естественные свойства семязачатков, которые позволяют проводить
наблюдения без выделения зародышевых мешков. Имеется ввиду, например,
вырастание зародышевого мешка за пределы интегументов (Torenia, виды семейств
Loranthaceae, Santalaceae). Зародышевый мешок Torenia fournieri был
использован для изучения оплодотворения in vitro (Keijzer et al., 1988a, b).
Подходящим объектом для изучения зародышевого мешка являются также и
виды растений с маленькими тенуинуцелятными семязачатками, у которых
отсутствует, либо имеется только один прозрачный интегумент. Классическим
объектом, принадлежащим к этой группе видов, является Monotropa hypopitys,
зародышевый мешок который изучал в прошлом столетии Strasburger. Структуру и
функцию элементов живого зародышевого мешка орхидей (Calanthe veitchii,
Dendrobium nobile, Cypripedium insigne) перед и после оплодотворения изучала
Поддубная-Арнольди (1958, 1959 и т.д.), успешные работы которой послужили
примером для исследований других видов с применением новых методов. Для
исследований с помощью микрокинематографической съемки был использован вид
Jasione montana (Campanulaceae), у которого маленькие тенуинуцелятные
семязачатки с одним прозрачным интегументом. В результате исследования живого
зародышевого мешка у этого вида были получены данные о продолжительности
циклов сжатия ядрышковых вакуолей яйцеклетки, центральной клетки
зародышевого мешка и различных клеток зародыша и эндосперма после оплодотворения
(Erdelska, 1973). Контрактивный цикл длится от 7 минут до нескольких часов, в
зависимости от объема растущей вакуоли, а также от клеточной активности и
длительности митотического цикла. Микрокинематографически были
проанализированы первые фазы развития эндосперма целлюлярного типа, включая способ и
скорость роста клеточных оболочек в эндосперме, начиная со слияния спермия с
вторичным ядром зародышевого мешка. Было обнаружено, что
продолжительность клеточного цикла на начальных стадиях развития целлюлярного эндоспер-
14*
212
Генеративные органы цветка
ма Jasione montana составляет 5—8 часов при 25 °С. При этих условиях
образование клеточной стенки продолжалось 20—40 минут. При изучении развития
зародыша на основе прямых измерений линейной тетрады было определено, что
длительность митотического цикла дочерних клеток повышается в направлении к
апикальной клетки зародыша. В том же направлении снижается вакуолизация и
увеличивается меристематический характер отдельных клеток (Erdelska, 1983).
Для механической изоляции зародышевых мешков из семяпочек
целесообразно брать виды с большим зародышевым мешком и с прочной оболочкой
зародышевого мешка. Изоляция совершается иглами или микроманипулятором. На
изолированных полностью или частично зародышевых мешках подснежников
(Galanthus nivalis из семейства Amaryllidaceae) была измерена скорость движения
спермия в центральной клетке (3 мкм/мин) и дана характеристика отдельных фаз
слияния ядра спермия с центральным ядром зародышевого мешка при двойном
оплодотворении. Образование и длительность существования мужского ядрышка
во вторичном ядре при тройном слиянии занимает около 150 минут, а слияние
сформированных мужского и женского ядрышек занимает период около 10—15
минут при 25 °С. В зародышевом мешке этого типа были изучены и первые фазы
деления ядра в эндосперме нуклеарного типа, а также рост и деление зиготы
(Erdelska, 1983).
Значительным прогрессом в области изучения зародышевых мешков можно
считать введение метода энзиматической изоляции фиксированных и живых
зародышевых мешков. Для изоляции используется смесь энзимов, расщепляющих
компоненты клеточных оболочек (целлюлазы, пектиназы, мацеразы и т.п.). Для
энзиматической изоляции более подходящими являются виды с небольшими
семязачатками и зародышевыми мешками, которые лучше переносят
манипуляции, связанные с удалением окружающих тканей, с многочисленным
промыванием и т. д.
В числе исследователей, которые применяли метод энзиматического
изолирования зародышевых мешков, были Еналеева, Тырнов и Хохлов (1972).
Позже этот метод нашел широкое применение у китайских ученых, прежде
всего у Zhou и Yang (1985, и др.), которые усовершенствовали метод,
работая с видами Antirrhinum majus, Helianthus annuus и Nicotiana tabacum.
Их методика позволяет получать достаточное количество зародышевых
мешков для дальнейшего культивирования, изоляции женских гамет и для
других клеточных манипуляций. В последнее время значительно возросло число
лабораторий, в которых ведутся работы в этом направлении, а также и
число используемых объектов (Theunis et al., 1991).
Пока в прижизненных исследованиях интактных семязачатков
используются прежде всего среды, повышающие прозрачность интегументов
(минеральные масла, силиконовые жидкости и т. д.). В работе с энзиматически
изолированными зародышевыми мешками используются среды и условия,
подходящие для культивирования изолированных клеток или
протопластов.
Дальнейшее развитие метода прижизненного изучения зародышевых мешков
должно быть направлено прежде всего на разработку методик длительного
культивирования зародышевого мешка на всех стадиях развития. Этот метод имеет
большое значение для последующих работ, связанных с изоляцией отдельных
клеток или их протопластов. Рис. 61.
Еналеева и др., 1972; Сидорова, 1985; Поддубная-Арнольди, 1958,1959; Bednara et al., 1990; Cass, 1990;
Erdelska, 1973,1983; Huang, Russell, 1989; Keijzeret al., 1988a, b; Kranz, Lorz, 1991; Poddubnaja-Arnoldi,
1960; Theunis et al., 1991; Zhou, Yang, 1985.
Семязачаток
213
ТИПЫ РАЗВИТИЯ ЗАРОДЫШЕВОГО МЕШКА
ПРИНЦИПЫ КЛАССИФИКАЦИИ
ЗАРОДЫШЕВЫХ МЕШКОВ1
Зародышевый мешок цветковых растений представляет собой женский гамето-
фит. Характерными особенностями зародышевого мешка являются сильное
сокращение его развития по числу фаз и сильное упрощение строения зрелого
зародышевого мешка по сравнению с развитием и строением женского гаметофита
голосеменных. У большинства цветковых, как и у подавляющего большинства
голосеменных, происходит последовательное деление мегаспороцита при мейотиче-
ских делениях: при I (делении) мейоза образуется первая перегородка,
разделяющая мегаспороцит на 2 клетки (стадия диады), а при II (делении) мейоза
образуются вторые перегородки в клетках диады и из мегаспороцита образуются 4
клетки — тетрада мегаспор. Таким образом, мегаспорогенез, свойственный
большинству цветковых, характеризуется заложением перегородок при обоих мейоти-
ческих делениях и образованием обособленных спор. Последняя особенность
указывает на его примитивность у семенных растений. Каждая из 4 мегаспор тетрады
может развиться в зародышевый мешок, который по своему происхождению будет
моноспорическим. Обычно развивается нижняя халазальная мегаспора, а
остальные 3 оказываются лишними и отмирают.
Предпосылками развития зародышевых мешков, образуемых несколькими
мегаспорами, является подавление заложения перегородок при II (делении) мейоза
или при обоих мейотических делениях. В первом случае сначала образуется
диада, а после II (деления) мейоза обе клетки оказываются двуядерными ценоцита-
ми, т. е. содержащими по 2 мегаспориальных ядра. Каждый такой ценоцит
соответствует паре необособившихся мегаспор и поэтому развивающийся из него
зародышевый мешок биспорическим по своему происхождению. Во втором случае,
диады исчезают, весь мегаспороцит становится 4-споровым ценоцитом, а
развивающийся из него зародышевый мешок будет тетраспорическим.
После завершения мегаспорогенеза начинается новый этап развития, который,
с исторической точки зрения, является собственно развитием гаметофита. Однако,
этот этап четко отграничен лишь у моноспорических зародышевых мешков: здесь
завершение мейоза и образование тетрады мегаспор ясно свидетельствует и о
завершении мегаспорогенеза. Далее начинается развитие одной мегаспоры, которая
развивается как ценоцит, т. е. митотические деления ее ядер не сопровождаются
формированием клеточных перегородок. У биспорических зародышевых мешков
ценоцитная стадия завершается раньше — после I мейоза клетки диады уже
оказываются ценоцитами и, соответственно, отмирает лишь одна клетка диады. Наконец,
у тетраспорических зародышевых мешков начало ценоцитной стадии совмещено с
началом мейоза и никаких отмирающих элементов нет. Таким образом, число ядер,
с которыми зародышевый мешок вступает во второй этап своего развития, равно
числу образовавших его мегаспор, т. е. 1, 2 или 4. В этом и заключаются
возможности сокращения числа фаз развития зародышевого мешка, которые обусловлены
переходом от моно- к би- и тетраспории. Последующие деления ядер являются
митозами, которые, как правило, протекают синхронно, и, благодаря этому, развитие
в целом четко разделяется на фазы делений и фазы интеркинезов. Так как число
мейотических делений всегда равно 2 (развитие зародышевого мешка при апомик-
сисе здесь не рассматривается), то общее число фаз развития зародышевого мешка
Статья И.Д. Романова «Зародышевый мешок» перепечатана с небольшими изменениями и
сокращением текста из книги «Сравнительная эмбриология цветковых растений» (1981). Полный
список литературы приведен в работе автора 1971 г.
Семязачаток
215
определяется числом синхронных митозов, имеющих место в зародышевом мешке
после мегаспорогенеза. Изменение числа митозов явилось результатом эволюции
развития зародышевых мешков у цветковых. Общей особенностью конструкции
зрелых зародышевых мешков является наличие центральной клетки и
периферических, обычно «концевых» клеточных групп. Разные конструкции зародышевого
мешка обусловлены различиями в числе, расположении и составе этих групп. Если
имеется только одна группа, она всегда находится у микропилярного полюса
зародышевого мешка и является яйцевым аппаратом. Две группы, т. е. яйцевой аппарат
и антиподы, располагаются у микропилярного и халазального полюсов. Когда
имеется 4 группы и больше, то появляются латеральные, т. е. боковые группы.
Развитие полярных групп в зародышевом мешке завершается клеткообразова-
нием, которое происходит здесь обычным путем, т. е. путем образования фрагмоп-
ластов и клеточных пластинок, дающих начало перегородкам. В конце телофазы
последнего митоза, кроме уже образовавшихся первичных фрагмопластов,
образуются еще вторичные - между всеми соседними ядрами. Во всех фрагмопластах
появляются клеточные пластинки, которые, смыкаясь, образуют перегородки,
отделяющие клетки полярной группы как друг от друга, так и от образующейся в этот
момент центральной клетки. Так как перегородки возникают между всеми ядрами, то
каждая клетка будет иметь по одному ядру, а одно из ядер данной группы окажется
ядром центральной клетки, т. е. будет полярным ядром. Таким образом, при
образовании полярной группы, число клеток в ней оказывается на единицу меньше
числа ядер, образовавшихся у данного полюса при последнем митозе. Вследствие
удаленности полюсов друг от друга и наличия центральной вакуоли, центральная
клетка поделиться не может. По завершении клеткообразования клетки полярных
групп могут более или менее разрастаться и вклиниваться в центральную клетку.
Антиподы могут приобретать вид клеточной группы, прилегающей снизу к
центральной. Происходит дифференциация и специализация клеток в пределах
группы. Последняя дифференциация имеет особо важное значение в яйцевом аппарате.
Однако у некоторых цветковых известны недифференцированные яйцевые
аппараты.
Зародышевый мешок — типы развития. Понятие типа развития
зародышевого мешка определяется 3 следующими признаками: 1) числом мегаспор,
образующих зародышевый мешок, 2) числом митозов, происходящих после мейотиче-
ских делений, 3) поведением ядер, определяющим особенности конструкции
(организации зародышевого мешка). Под поведением ядер подразумевается, прежде
всего, их дефинитивное распределение (4+0, 1 +3, 2+2 и т. д.)', а также явления
вторичного перераспределения и слияния халазальных ядер, изменяющие конечный
результат дефинитивного распределения. Депрессию халазального конца
зародышевого мешка нерационально считать признаком типа развития, т. к. она обычно
изменчива в своем онтогенетическом проявлении. Она обусловливает
возникновение редуцированных форм в пределах различных типов. Общее число ядер в
зрелом зародышевом мешке также не следует считать признаком типа, поскольку оно
варьирует в зависимости от интенсивности проявления депрессии.
Названия разных типов зародышевых мешков повторяют наименования тех
таксонов (главным образом, родов), у которых эти типы были первоначально
обнаружены или наиболее точно описаны. Общепринятые принципы номенклатуры
типов зародышевых мешков отсутствуют. Однако, учитывая перечисленные при-
От ред. — имеется ввиду распределение ядер у полюсов зародышевого мешка: первая цифра
показывает число ядер у микропилярного полюса, вторая — у халазального полюса. При
характеристике типов вместо определений одно-, дву-, четырех- и многополюсный (Романов, 1981)
использованы термины уни-, би-, тетра- и полиполярный зародышевые мешки.
216
Генеративные органы цветка
знаки типа развития зародышевого мешка, можно различить 13 типов у
эмбриологически исследованных цветковых растений, размножающихся нормально
половым путем. Каждый из перечисленных типов представляет собой достаточно
стабильный онтогенез зародышевого мешка, свойственный данному таксону. В
качестве онтогенетических отклонений у данного вида могут появляться типы
зародышевых мешков, являющиеся нормой у других родственных видов, и
наблюдающиеся также только в виде отклонений. Многие из последних весьма интересны
как с онтогенетической, так и с филогенетической точек зрения.
Описанное множество разных типов развития зародышевых мешков, очевидно,
является результатом эволюции в пределах цветковых. Если принять, что
зародышевый мешок цветковых произошел от женского гаметофита голосеменных того
типа, который нам известен у Cycadales, Ginkgoales и Coniferales, то
примитивными признаками типа развития зародышевого мешка будут моноспоричность
и наибольшее число митозов. Сочетание этих признаков имеется только у
Polygonum-типа, следовательно, его следует считать примитивным типом. Тетрады
мегаспор упомянутых таксонов голосеменных обычно столь сходны с тетрадами
мегаспор цветковых, что их невозможно различить. Новой в онтогенезе и
характерной только для цветковых является конечная фаза его развития, т. е. зрелый
зародышевый мешок. Среди довольно значительного разнообразия конструкций этих
конечных фаз примитивной у цветковых будет та, которой завершается развитие
примитивного, т. е. Polygonum-типа зародышевого мешка.
ХАРАКТЕРИСТИКА РАЗЛИЧНЫХ ТИПОВ РАЗВИТИЯ
ЗАРОДЫШЕВОГО МЕШКА
Polygonum-тип
Зародышевый мешок Polygonum-типа развития — моноспорический,
трехмитозный, биполярный. Первые данные о строении зародышевого мешка
этого типа получены Hofmeister (1847). Однако полная картина его развития на
примере Polygonum divaricatum была описана в работе Strasburger (1877). Данный
тип зародышевого мешка является наиболее распространенным типом среди
покрытосеменных (более 80% видов), чем, вероятно, и объясняется то, что Palm
(1915) первоначально дал ему название «нормальный». Позднее Maheshwari
(1948) переименовал его в Polygonum-тип в соответствии с названием рода, у
которого он впервые был обнаружен.
В классическом варианте развития зародышевый мешок Polygonum-типа, как
правило, формируется из халазальной клетки тетрады микроспор. Однако в
некоторых семействах (Chenopodiaceae, Cucurbitaceae, Flacourtiaceae и другие)
известны случаи его развития из эпихалазальной, микропилярной или субмикропи-
лярной клеток тетрады. В процессе развития мегаспоры в зародышевый мешок,
ее объем и размер ядра значительно увеличиваются, количество органелл в
цитоплазме резко возрастает. В ее халазальной области происходит растворение
каллозной оболочки, которая, как правило, полностью окружает мегаспороцит и
его дочерние клетки в период мейоза (Rodkiewicz, 1970, 1978; Russell, 1979 и др.).
После первого митотического деления ядра мегаспоры образовавшиеся ядра
расходятся к противоположным полюсам двуядерного ценоцита, между ними
появляется крупная вакуоль. В результате следующих двух митотических делений
образуется 8-ядерный зародышевый мешок с четырьмя ядрами у каждого полюса,
после чего в нем происходит процесс цитокинеза. В микропилярной части
дифференцируется яйцевой аппарат, состоящий из яйцеклетки и двух синергид, в
халазальной части — три антиподы; центральная клетка содержит два полярных ядра,
Семязачаток
217
отошедшие от микропилярного и халазального полюсов (в силу чего они
называются микропилярным и халазальным ядрами соответственно).
Сформированный зародышевый мешок биполярный, семиклеточный,
8-ядерный.
В процессе созревания зародышевого мешка его клетки приобретают признаки
свойственной им специализации. Яйцевой аппарат обычно хорошо
дифференцирован. Яйцеклетка крупнее синергид, ее ядро расположено в апикальной части,
большая вакуоль — в базальной. Клетки синергид, как правило, имеют небольшие
ядра, расположенные в базальном конце клеток, и небольшие вакуоли — в
апикальном. Характерным признаком синергид у большинства представителей с
Polygonum-типом зародышевого мешка является наличие нитчатого аппарата в их
базальной части. Однако известны виды, в синергидах которых нитчатый аппарат
отсутствует (например, виды семейства Nelumbonaceae, Ceratophyllaceae). В
центральной клетке происходит сближение полярных ядер: они могут сливаться,
образуя вторичное ядро центральной клетки до оплодотворения (например, в сем.
Magnoliaceae, Myrlsticaceae, Iridaceae), либо в процессе оплодотворения
(например, в сем. Chloranthaceae, Calycanthaceae, Роасеаё).
Число клеток в зрелом зародышевом мешке может варьировать. В типичном
случае он семиклеточный, восьми-семиядерный. Изменение числа клеток может
происходить на ценоцитной стадии развития зародышевого мешка вследствие
выпадения одного или более делений в ходе его развития, а также слияния ядер
халазальной группы (например, у представителей семейств Orchidaceae,
Trapaceae). Результатом таких отклонений является уменьшение числа клеток
сформированного зародышевого мешка до четырех, пяти, шести клеток.
Изменения в числе клеток могут носить и вторичный характер, то есть осуществляться в
процессе созревания зародышевого мешка. Так, вследствие разрушения
сформированных антипод происходит уменьшение числа клеток зрелого зародышевого
мешка (например, в семействах Alismataceae, Menyanthaceae). И наоборот,
дополнительные деления клеток (ядер) антипод как до, так и после процесса
оплодотворения, приводят к вторичному увеличению числа клеток (и ядер) в
зародышевом мешке (Poaceae, Typhaceae и многих других).
Взяв за основу число митотических делений ядер, а также их поведение в ходе
развития зародышевого мешка, у представителей семейства Orchidaceae Abe
(1972а, b) предложил выделить четыре вариации (типа по Abe) развития.
Форма зародышевого мешка, его размеры, а также строение яйцевого аппарата
и антипод, при Polygonum-типе развития сильно варьируют и носят таксоноспе-
цифичный характер.
Сравнительный анализ структуры зародышевых мешков Polygonum-типа в
процессе их развития у разных видов растений на светооптическом и электронно-
микроскопическом уровнях не выявил каких-либо его специфических черт по
сравнению с другими типами (Jensen, 1973; Kapil, Bhatnager, 1981; Rodkiewicz,
Bednara, 1986; Willemse, Went, 1984; Fougere-Rifot, 1987b; Плющ, 1992).
Вопрос об эволюционных взаимоотношениях зародышевого мешка Polygonum-
типа с другими типами зародышевых мешков цветковых является дискуссионным.
Многие исследователи (Coulter, 1908; Palm, 1915; Chiarugi, 1927; Schnarf, 1919,
1936; Maheshwari, 1937; Романов, 1944, 1971a; Герасимова-Навашина, 1954а, б,
1971; Поддубная-Арнольди, 1964, 1976; Кордюм, 1978; Терехин, 1984, 1991;
Плющ, 1992 и др.) считают его исходным по отношению к другим типам
зародышевых мешков. Основными аргументами в поддержку этой точки зрения авторы
считают широкое распространение данного типа среди покрытосеменных растений и,
следовательно, его филогенетическую древность, а также образование в результате
мейоза обособленных спор в противоположность ценоспорам при би- и тетраспори-
218
Генеративные органы цветка
ческом типах развития, которое рассматривается ими как исторически первичное.
Ряд авторов (Campbell, 1901; Schurchoff, 1919; Fagerlind, 1944а; Смирнов, 1982) не
считают первичным моноспорический зародышевый мешок Polygonum-типа,
исходя из того, что данный тип зародышевого мешка не имеет гомологов среди гамето-
фитов голосеменных растений, тогда как тетраспорический зародышевый мешок
сближается с гаметофитом голосеменных растений, в частности Gnetum, гораздо
легче. Согласно еще одной точке зрения (Модилевский, 19286, 1953), все типы
зародышевых мешков покрытосеменных являются своеобразными и равноценными
вариантами общего предкового типа; восьмиядерный зародышевый мешок — не
примитивный, а наиболее распространенный и совершенный вариант среди
других. Рис. 52.
Герасимова-Навашина, 1954а,б, 1957, 1971; Кордюм, 1978; Модилевский, 19286, 1953; Плющ, 1992;
Поддубная-Арнольди, 1964, 1976; Романов, 1944; 1971а; Смирнов, 1982; Терехин, 1984, 1991; Abe,
1972а, b; Campbell, 1901; Chiarugi, 1927; Coulter, 1908; Fagerlind, 1944a; Fougere-Rifot, 1987b;
Hofmeister, 1847; Jensen, 1973; Kapil, Bhatnagar, 1981; Maheshwari, 1937,1948; Palm, 1915; Rodkiewicz,
1970, 1978; Rodkiewicz, Bednara, 1986; Russell, 1979;Schnarf, 1929,1936; Schurchoff, 1919; Strasburger,
1877; Willemse, van Went, 1984.
Oenothera-тип
Зародышевый мешок Oenothera-типа развития — моноспорический,
двумитозный, униполярный, впервые был обнаружен у представителей сем.
Onagraceae (Hofmeister, 1847, 1849). Детально его развитие было прослежено у
Oenothera lamarckiana (Geerts, 1908), О.biennis, Epilobium angustifolium,
E.dodonaei, Circaea lutetiana (Модилевский, 1909) и показано его
происхождение из микропилярной мегаспоры тетрады. Позднее Oenothera-тип
развития зародышевого мешка был описан у целого ряда видов этого семейства (Гаче-
чиладзе, 1981; Виэльунска-Войтась, 1984; Батыгина, 1985 и др.). Считалось, что
этот тип развития зародышевого мешка характерен только для ceM.Onagraceae
(Maheshwari, 1947), исключая род Тгара, у которого было описано развитие
зародышевого мешка Polygonum-типа (Maheshwari, 1947; Батыгина, Колесова,
1985) и который в результате длительной дискуссии между систематиками был
закреплен в ранге монотипного семейства Тгарасеае (Тахтаджян, 1966, 1980).
Сходный с Oenothera-типом характер развития зародышевого мешка был
обнаружен у Schisandra chinensis (Yoshida, 1962; Swamy, 1964), а также у S.grandiflora,
S.repanda (согласно иллюстрациям, представленным в работах Kapil, 1962; Kapil,
Jalan, 1964; Hayashi, 1963). Однако у изученных видов ceM.Schisandraceae
инициальной клеткой зародышевого мешка, как правило, становится халазальная, а не
микропилярцая мегаспора, как в ceM.Onagraceae. По видимому, из-за
эфемерности антипод авторы относили развитие зародышевого мешка у видов рода
Schisandra к Polygonum-типу (Hayashi, 1963; Kapil, Jalan, 1964; Davis, 1966) или к
модификации Polygonum -типа (Yoshida, 1962). Согласно Swamy (1964) в 50%
семязачатков у S.chinensis развитие зародышевого мешка шло по Oenothera-типу.
Вопрос о типе развития зародышевого мешка у видов Schisandra остается до
сих пор дискуссионным. В этой связи представляет интерес публикация Battaglia
(1986) «Embryological questions. Do new types of embryo sac occur in Schisandra?»,
содержащая сравнительный анализ работ, посвященных развитию зародышевого
мешка у различных видов Schisandra}. Автор, основываясь только лишь на
происхождении зародышевого мешка нз халазальной мегаспоры,
приходит к заключению о целесообразности выделения нового, Schisandra-
типа развития зародышевого мешка.
1 Battaglia, 1951; Yoshida, 1962; Kapil, 1962; Hayashi, 1963; Kapil, Jalan, 1964; Swamy, 1964; Davis,
1966; Bhandari, 1970.
Семязачаток
219
Однако большинство исследователей при определении типа развития
зародышевого мешка не придают решающего значения положению функциональной
мегаспоры в тетраде или триаде, а используют три главных признака (см. Романов,
1971, 1981):
1 — число мегаспор, образующих зародышевый мешок;
2 — число митозов, происходящих после мейотических делений;
3 — поведение ядер, определяющее конструкцию (организацию) зародышевого
мешка.
Кроме того, следует отметить, что у некоторых видов цветковых растений,
например, из ceM.Cucurbitaceae (Дзевалтовский, 1983), Flacourtiaceae (Алимова,
1983), независимо от типа развития зародышевого мешка любая из клеток триады
или тетрады мегаспор может стать функциональной.
Характер развития зародышевого мешка у некоторых представителей сем.
Onagraceae и Schisandraceae сходен по основным признакам (таблица). Поэтому,
с нашей точки зрения, предложение Battaglia о выделении особого Schisandra-типа
развития зародышевого мешка только по одному признаку (инициации
зародышевого мешка из халазальной мегаспоры) в настоящее время не является
достаточно убедительным.
Широкие сравнительно-эмбриологические исследования отдельных таксонов
Nymphaeales sensu lato в связи с их систематическим положением, объемом и
взаимосвязями выявили особый характер развития зародышевого мешка. Так,
впервые было установлено, что зародышевый мешок у Cabomba caroliniana в генезисе
униполярный и происходит из халазальной мегаспоры триады (Батыгина,
1981а; Батыгина и др., 1982). Эти особенности развития зародышевого мешка
позволили выделить его в Cabomba-подтип Polygonum-типа. Более детальные
исследования различных нимфейных {С.caroliniana, Nymphaea alba, Ngigantea,
Nuphar lutea, Victoria amazonica и Barclaya (Hydrostemma) longifolium
подтвердили происхождение зародышевого мешка из халазальной мегаспоры триады
(реже тетрады), его униполярность, а также установили двумитозность (Винтер,
1987; Титова, 1988, 1990; Винтер, Шамров, 1991а,б). По мнению Винтер (1987),
развитие зародышевого мешка у изученных ею видов нимфейных идет по
Oenothera-типу или Schisandra-типу, согласно классификациям Романова (1971)
и Battaglia (1986), соответственно. Как промежуточный тип между Oenothera- и
Polygonum-типами рассматривается развитие зародышевого мешка у Nymphaea
heudelotii (Miegroet van, Dujardin, 1992).
Дискуссионность вопроса, касающегося Oenothera-типа и Schisandra-типа
развития зародышевого мешка, а также результаты последних
эмбриологических исследований представителей различных таксонов, относящихся к
сем. Onagraceae, Schisandraceae, Cabombaceae, Nymphaeaceae и Barclayaceae
привели нас к необходимости вновь рассмотреть вопрос о ревизии Oenothera-
типа развития зародышевого мешка. Учитывая сходство в развитии
зародышевого мешка у этих таксонов по 3-м главным признакам, считаем
неправомерным выделять самостоятельный тип — Schisandra. В то же время,
такие отличительные признаки, как число образующихся мегаспор,
положение функциональной мегаспоры, различный характер специализации
элементов зародышевого мешка и, возможно, другие признаки позволяют уже
рассматривать его как подтип1.
1 Термин «подтип» правомерен и используется в ряде классификаций (см. Романов, 1971;
Поддубная-Арнольди, 1976; Терехин, 1991; и др.).
220
Генеративные органы цветка
Рассмотрим кратко основные черты развития зародышевого мешка у
представителей вышеуказанных таксонов, подтверждающие целесообразность
выделения в Oenothera-типе Schisandra-подтипа (таблица).
Таблица
Характеристика Oenothera-типа и Schisandra-подтипа развития
зародышевого мешка (ЗМ)
Главные признаки:
Число мегаспор, образующих ЗМ
Число митозов, происходящих после
мейотических делений
Поведение ядер, определяющее
конструкцию ЗМ
Второстепенные признаки:
Число образующихся мегаспор
Положение функциональной
мегаспоры
Морфология элементов ЗМ
Oenothera-тип
обычно
одна
два
4-Ю
тетрада
(реже триада)
микропилярное
(как правило)
синергиды
с нитчатым
аппаратом
Schisandra-подтип
обычно
одна
Два
4-Ю
триада
(реже тетрада)
халазальное
(как правило)
синергиды
без нитчатого
аппарата
(как правило)
Oenothera-тип
Общепризнано, что Oenothera-тип развития зародышевого мешка — моноспо-
рический, двумитозный, униполярный, присущ только представителям
ceM.Onagraceae (Maheshwari, 1950). Инициальной клеткой зародышевого
мешка, как правило, становится микропилярная клетка линейной, Т-образной
или косой тетрады мегаспор. У некоторых видов (Stenosiphon linifolium и Jussiaea
repens) описаны случаи отсутствия формирования клеточной стенки в
микропилярной клетке диады и развития триады мегаспор. В отдельных случаях
{E.hirsutum, O.odorata, Ograveolens, O.pycnocarpa, O.lamarckiana) наблюдалось
одновременное развитие микропилярной и халазальной мегаспор, в результате
чего образовывались иногда два зародышевых мешка (Hoeppener, Renner, 1929), а
также несинхронное функционирование всех четырех мегаспор, дающих начало
четырехъ- и двуядерным зародышевым мешкам (Subramanyam, Govindu, 1948).
Время дегенерации трех оставшихся мегаспор различно. У большинства видов
ceM.Onagraceae они часто сохраняются долго, вплоть до стадии сформированного
зародышевого мешка (например, у Ludwigia palustris, Виэльунска-Войтась, 1984).
Иногда признаки дегенерации отмечаются, когда микропилярная мегаспора еще не
приступила к делению, как например, у E.hirsutum (Гачечиладзе, 1981).
Детальные исследования первых этапов мегаспорогенеза у различных
представителей ceM.Onagraceae с применением флюоресцентной,
интерференционной и электронной микроскопии выявили специфическую полярность и
приуроченность плазмодесм к микропилярной зоне мегаспороцита (Jalouzot,
1971, 1978; Rodkiewicz et al., 1976). Характер отложения, время появления
и исчезновения каллозы в мегаспороците и отсутствие ее на апикальном
Семязачаток
221
конце микропилярной мегаспоры предопределяют функционирование только
микропилярной и дегенерацию трех остальных мегаспор (Kuran, 1972;
Bednara, Rodkiewicz, 1975; Sniezko, 1976; Rodkiewicz, Sniezko, 1978; Sniezko,
Harte, 1984; Виэльунска-Войтась, 1984). Авторы считают, что каллоза
играет существенную роль при образовании женского гаметофита. Выявлена
специфика строения, распределения и количества органелл в цитоплазме
мегаспороцита и мегаспор (Jalouzot, 1978; Rodkiewicz et al., 1976; Гвилава,
1987; Плющ, 1992). Например, у E.palustre функциональная микропилярная
мегаспора содержит наибольшее количество пластид и наименьшее — дик-
тиосом, по сравнению с другими мегаспорами (Bednara, Rodkiewicz, 1974).
Характерной особенностью развития зародышевого мешка по Oenothera-типу
является формирование большой вакуоли в халазальной части функционирующей
мегаспоры, при этом ядро перемещается из центральной части клетки в
апикальную. В результате двух митозов, протекающих обычно во
взаимоперпендикулярных направлениях, образуется четырехъядерный зародышевый мешок. В этот
период происходит усиленное разрастание зародышевого мешка как в микропиляр-
ном, так и в халазальном направлениях. Форма и размеры сформированного и
зрелого зародышевого мешка варьируют (Виэльунска-Войтась, 1984; Батыгина,
1985).
Процесс клеткообразования начинается в четырехъядерном зародышевом
мешке. В сформированном зародышевом мешке имеется трехклеточный яйцевой
аппарат, клетки которого вначале морфологически слабо различаются, и
центральная клетка. Положение полярного ядра по отношению к яйцевому аппарату
вариабельно.
В зрелом зародышевом мешке у представителей ceM.Onagraceae элементы
яйцевого аппарата достаточно крупные и специализированные. Яйцеклетка
располагается обычно ниже синергид, она может быть сильно вакуолизиро-
вана, особенно в апикальной ее части. Синергиды также вакуолизированы
и обычно в базальной части имеют характерные зубовидные выросты и
нитчатый аппарат.
Oenothera-тип Schisandra-подтип
Зародышевый мешок Oenothera-типа Schisandra-подтипа развития — моио-
спорический, двумитозный, униполярный, отличающийся от зародышевого
мешка основного Oenothera-типа тем, что он формируется, как правило, из
халазальной клетки триады, реже тетрады мегаспор.
К этому подтипу следует отнести развитие зародышевого мешка у
представителей ceM.Schisandraceae, СаЬотпЪасеае, Nymphaeaceae и Barclayaceae.
Особого внимания заслуживают случаи образования в одном цветке у
S.chinensis моноспорического (50%) и биспорического (50%) зародышевых
мешков (Swamy, 1964).
Несмотря на некоторые различия в мегаспорогенезе, развитие
зародышевого мешка у представителей сем. Onagraceae и семейств пор. Nymphaeales
sensu lato. принципиально сходно. Однако элементы яйцевого аппарата в
зрелом зародышевом мешке у изученных видов сем. Cabombaceae и
Nymphaeaceae менее специализированы и в синергидах часто отсутствует
нитчатый аппарат.
У некоторых видов кипрейных и нимфейных отмечались аномалии развития
зародышевых мешков:
1 _ Увеличение числа делений ядер зародышевого мешка. Например, у Anogra
pallida полярное ядро делится многократно, образуя до 140 ядер, а синергида
в некоторых случаях содержит до 20 ядер (Johansen, 1931).
222
Генеративные органы цветка
2 — Изменение полярности — образование биполярного зародышевого мешка
Polygonum-типа развития. Например, у L.octovalvis, E.nervosum, Nuphar
luteum (Батыгина, 19816; Винтер, Шамров, 1991а).
3 — Нарушение дифференциации отдельных элементов зародышевого мешка.
Например, у L.octovaluis яйцевой аппарат содержит одну яйцеклетку и одну си-
нергиду.
Мы полагаем, что все вышесказанное служит основанием для выделения
Schisandra-подтипа в Oenothera-типе развития зародышевого мешка, но не
самостоятельного Schisandra-типа (как предлагает Battaglia, 1986).
Существуют две точки зрения на происхождение зародышевого мешка
Oenothera-типа развития. Согласно гипотезе монофилетического происхождения
зародышевых мешков Oenothera-тип происходит из Polygonum-типа (Battaglia,
1986). В пользу этого свидетельствуют данные о случаях развития зародышевого
мешка по Polygonum-типу у представителей ceu.Onagraceae, Schisandraceae,
Nymphaeaceae.
По мнению Герасимовой-Навашиной (1954, 1958), развитие зародышевого
мешка протекает в соответствии с основными закономерностями, присущими
любой растительной клетке, и характер формирования зародышевого мешка того
или иного типа зависит от внешних условий. Исходя из этого, автор пришел к
заключению, что все типы развития зародышевых мешков, в том числе и Oenothera-
тип, могли возникать в процессе эволюции неоднократно и независимо друг от
друга (полифилетическое происхождение).
Обнаружение Oenothera-типа развития зародышевого мешка у таксонов
различных филогенетических уровней дополняет наши знания о распространении
этого типа среди покрытосеменных. Вероятно, более детальные сравнительные
исследования комплекса морфологических признаков на разных уровнях
организации приблизят нас к разгадке тайны о происхождении различных типов развития
зародышевых мешков. Рис. 62.
Алимова, 1983; Батыгина, 1981а,б, 1985; Батыгина, Колесова, 1985; Батыгина и др., 1982, 1991;
Винтер, 1987; Винтер, Шамров, 1991а,б; ВиЭльунска-Войтась, 1984; Гачечиладзе, 1981; Гвилава, 1987;
Герасимова-Навашина, 1954, 1958; Дзевалтовский, 1983; Модилевский (Modilewski), 1909; Плющ,
1992; Романов, 1971, 1981; Тахтаджян, 1966, 1980, 1987; Титова, 1988, 1990; Battaglia, 1951, 1986;
Bednara, Rodkiewicz, 1974,1975; Bhandari, 1970; Bouffordetal., 1990; Davis, 1966;Geerts, 1908; Hayashi,
1963; Hoeppener, Renner, 1929; Hofmeister, 1847,1849; Jalouzot, 1971,1978; Johansen, 1931; Kapil, 1962;
Kapil, Jalan, 1964; Kuran, 1972; Maheshwari, 1947, 1950; Miegroet van, Dujardin, 1992; Rodkiewicz,
Sniezko, 1978; Rodkiewicz et al., 1976; Sniezko, 1976; Sniezko, Harte, 1984; Subramanyam, Govindu, 1948;
Swamy, 1964; Yoshida, 1962.
Allium-тип
Зародышевый мешок Allium-типа развития — биспорический,
двумитозный, биполярный. Материнская клетка мегаспор делится,
образуя диаду клеток. Верхняя клетка диады отмирает, а нижняя становится
инициальной клеткой зародышевого мешка. После трех последовательных
митотических делений в ней образуется 8 ядер, располагающихся
равномерно на двух полюсах.
Впервые зародышевый мешок Allium-типа развития был описан у Allium
fistulosum (Strasburger, 1879). Впоследствии было установлено, что подобный
тип развития характерен для представителей всего рода Allium (Weber,
1929; Messeri, 1931; Устинова, 1944; Глущенко, 1958; Гваладзе, 1962;
Соколов, 1968 и др.).
Развитие зародышевого мешка по Allium-типу было описано также у
представителей семейства Alismataceae — Sagittaria guayanensis (Johri, 1936), Alisma
Семязачаток
223
plantago (Johri, 1936) и у некоторых представителей других семейств
(Amaryllidaceae, Balanophoraceae, Butomaceae, Datiscaceae, Liliaceae,
Orchidaceae, Viscaceae, Podostemaceae).
Сформированный зародышевый мешок семиклеточный, состоящий из
яйцеклетки, двух синергид, центральной клетки с двумя полярными ядрами (микропи-
лярным и халазальным) и трех антипод, обычно небольших, которые вскоре
после образования дегенерируют. Типичные зародышевые мешки Allium-типа —
восьмиядерные (Schaffner, 1896; Murthy, 1935), как, например, у Sagittaria
guayanensis (Johri, 1935) и S.sagittifolia (Никитичева, 1990). Яйцевой аппарат у
этих представителей трехклеточный, синергиды с заостренными концами и
нитчатым аппаратом.
В процессе созревания зародышевого мешка этого типа часто происходит
уменьшение числа антипод. В результате этого зрелый зародышевый мешок
Allium-типа, готовый к оплодотворению, оказывается четырехклеточным и
состоит из яйцеклетки, двух синергид и центральной клетки с двумя полярными
ядрами, антиподы отсутствуют. Изредка антиподы сохраняются и после
оплодотворения, имитируя яйцевой аппарат.
Allium-тип развития был описан у Agraphis patula (= Scilla hispanica) (Treub,
Mellink, 1880). Но позднее было установлено, что у видов Scilla (Hoare, 1934)
начало зародышевому мешку дает микропилярная клетка диады, а не халазальная,
что типично для Allium-типа.
Биспорический зародышевый мешок Allium-типа обычно выводят из моноспо-
рического (Поддубная-Арнольди, 1964; Плющ, 1992). Рис. 63.
Гваладзе, 1962; Глущенко, 1958; Камелина, 19836; Никитичева, 1990; Плющ, 1992;
Поддубная-Арнольди, 1964, 1976; Романов, 1971а; Соколов, 1968; Устинова, 1944; Шамров, 1990а,б; Ноаге, 1934;
Johri, 1936; Jones, Emsweller, 1936; Messeri, 1931; Murthy, 1935; Schaffner, 1896; Strasburger, 1879; Treub,
Mellink,1880
Podostemum-тип
Зародышевый мешок Podostemum1 (Apinagia) типа развития —
биспорический, одномитозный, униполярный (Романов, 1944).
Сомнения в реальном существовании Podostemum типа развития зародышевого
мешка нашли свое отражение в том, что он был исключен из некоторых
классификаций зародышевых мешков, в частности, из классификации,
предложенной Willemse и van Went (1984). Вопрос о типе зародышевого мешка
у представителей сем. Podostemaceae является предметом длительной и еще
не закончившейся дискуссии (Maheshwari, 1950; Battaglia, 1971, 1987;
Arekal, Nagendran, 1976; и др.). Обсуждаются, главным образом, три
проблемы: способ образования зародышевого мешка у подостемовых, реальность
Podostemum-типа и интерпретация структуры сформированного зародышевого
мешка. Зародышевые мешки всех изученных представителей сем.
Podostemaceae относятся к биспорической серии (биспорическому типу, по:
Терехин, 1991). У представителей семейства описаны два пути развития
зародышевого мешка. В первом случае, после деления ядра халазальной
клетки диады и их расхождения к полюсам, их судьба становится
различной. Нижнее (халазальное) ядро пикнотизируется и впоследствии полностью
лизируется. Иногда это ядро успевает один раз поделиться до начала
деструкции. Но и в этом случае, ко времени созревания зародышевого мешка
эти ядра обычно разрушаются (Razi, 1949; и др.). В редких случаях удается
Podostemon — тип (по Maheshwari, 1950)
224
Генеративные органы цветка
увидеть их остатки в халазальной клетке зрелого зародышевого мешка.
Микропилярное ядро дважды делится, после чего наступает период
цитокинеза. Характерная особенность — вариабельность в расположении 4-х клеток
сформированного зародышевого мешка. Чаще всего на микропилярном конце
располагаются друг подле друга две клетки, а ниже, одна под другой —
еще две. Иногда образуется инвертная структура — две халазальные клетки
лежат одна подле другой. В некоторых случаях клетки расположены в один
ряд, друг над другом. Иногда разные формы расположения клеток
встречаются в пределах одного вида, например, у Hydrobryopsis sessilis (Arecal,
Nagendran, 1975b). Таким образом, особенность описанного выше способа
формирования зародышевого мешка состоит, во-первых, в том, что в
процессе развития функционирует только одно (микропилярное) ядро из 2-х
ядер, образовавшихся при первом делении в халазальной клетке диады, а
во-вторых, в том, что в течение развития зародышевого мешка происходят
3 деления ядер. Сформированная структура зародышевого мешка всегда
4-клеточная. Этот способ развития Battaglia (1971) рассматривает по праву
приоритета в качестве Apinagia-типа. Он был впервые описан в ряде работ
Went (1908, 1910).
У некоторых представителей семейства, в частности, у Podostemum subulatus,
был описан иной способ развития зародышевого мешка (Magnus, 1913; Chiarugi,
1933; и др.). В этом случае ядро халазальной клетки диады делится дважды и
формируется та же 4-клеточная структура, но уже без дополнительных
(дегенерирующих в процессе развития) ядер. Именно этот тип развития был назван
Podostemum-типом и именно в отношении этого способа образования
зародышевого мешка чаще всего высказываются сомнения.
На основании анализа последних исследований и переисследований
развития зародышевого мешка у представителей сем. Podostemaceae,
проведенных, в основном, представителями индийской школы эмбриологов (Arekal
and Nagendran, 1975a, b, 1976, 1977а, b), итальянским эмбриологом Battaglia
(1987) было высказано обоснованное, на наш взгляд, предположение, что
для всех изученных представителей семейства характерен тот тип развития
зародышевого мешка, который был впервые описан у Apinagia с более или
менее ранним исчезновением дегенерирующих халазальных ядер. В связи с
этим приходится признать более приоритетным и корректным название
Apinagia-тип по сравнению с названием Podostemum-тип.
Весьма важной является дискуссия о правильной интерпретации структуры
зародышевого мешка у представителей Podostemaceae (см. Battaglia, 1987; Терехин,
1991) в связи с проблемами, касающимися закономерностей и направлений
эволюции женского гаметофита семенных растений. По нашему мнению, независимо
от расположения клеток, в зародышевом мешке представителей сем.
Podostemaceae присутствуют три структуры: синергиды (одна или две),
яйцеклетка и гаусториальная клетка (одна или две). Гаусториальная клетка является
по своему происхождению гомологом центральной клетки зародышевого мешка,
которая содержит лишь верхнее полярное ядро. Однако эта клетка аналогична
антиподам и выполняет их функцию. Такая интерпретация подтверждается двумя
соображениями. Во-первых, у подостемовых своеобразный «жидкий» перисперм,
расположенный под зародышевым мешком, ко времени начала развития
зародыша замещает отсутствие эндосперма. Во-вторых, как и в сем. Orchidaceae (у
Ophrys), отсутствие эндосперма приводит к тому, что «двойное» оплодотворение
становится одинарным. Эти изменения связаны, по-видимому, с особенностями
репродуктивной биологии этих высокоспециализированных водных растений. В
частности, с необходимостью очень быстрого и экономичного созревания семян в
Семязачаток
225
своеобразных условиях существования. Apinagia (=Podostemum) тип
зародышевого мешка нуждается в дополнительных, более детальных исследованиях. Рис. 64.
Терехин, 1991; Arekal, Nagendran, 1975a, b, 1976,1977а, b; Battaglia, 1971,1987; Chiarugi, 1933; Magnus,
1913; Maheshwari, 1950; Razi, 1949; Went, 1908,1910; Willemse, van Went, 1984.
Balsamita-тип
Зародышевый мешок Balsamita (=Anthemis) типа развития — тетрас-
порический (псевдомоноспорический, с дегенерацией трех ядер мегаспор),
трехмитозный, биполярный (Романов, 1944; Fagerlind, 1944a). Обнаружен
только у Balsamita vulgaris (^Chrysanthemum balsamita) из сем. Asteraceae.
Последовательность его развития описана Fagerlind (1939c) и Harling (1951). В ме-
гаспороците оба деления мейоза происходят без цитокинеза, образовавшиеся 4
ядра располагаются по формуле 1+3. Три ядра, сдвинутые к халазальному полюсу
клетки, вскоре переходят в пикнотическое состояние. На этой стадии ценоцитная
клетка формирует ответвление, растущее в направлении микропиле, в которое,
вероятно, переходит микропилярное (споровое) ядро. Оно увеличивается в объеме
и вступает в митоз. Два дочерних ядра удаляются друг от друга и разделяются
крупной вакуолью. После трех митозов на микропилярном и халазальном
полюсах зародышевого мешка образуются по 4 ядра. Таким образом, зародышевый
мешок возникает в результате 5 ядерных делений (двух мейотических и трех мито-
тических). Процесс клеткообразования завершается формированием 7-клеточно-
го зародышевого мешка с 3-клеточным яйцевым аппаратом. В центральной клетке
оба полярных ядра сливаются до оплодотворения. Антиподы представлены тремя
клетками: две из них, граничащие с центральной клеткой, могут становиться
многоядерными, халазальная антиподальная клетка имеет боковой вырост, содержит
одно ядро и остатки трех пикнотических споровых ядер. Fagerlind (1939с) нашел
сходство в развитии зародышевого мешка Ch. balsamita с описанным ранее у
Anthemis tinctoria (Holmgren, 1915). Однако, позднее было установлено, что у
Anthemis развитие зародышевого мешка 2-митозное (2-phasic) (Harling, 1950). По
утверждению Harling (1951), тетраспорическое, псевдомоноспорическое, 3-митоз-
ное (З-phasic) развитие зародышевого мешка пока что установлено только у
Chrysanthemum balsamita (=Balsamita vulgaris). Своеобразный способ развития
зародышевого мешка у этого вида большинством исследователей рассматривается
как особый тип тетраспорического гаметофита. Рис 65.
Поддубная-Арнольди, 1976; Романов, 1944, 1971а, 1981; Терехин, 1991; Fagerlind, 1939c, 1944а;
Harling, 1950, 1951; Holmgren, 1915.
Drusa-тип
Зародышевый мешок Drusa-типа развития — тетраспорический,
двумитозиый, униполярный (Maheshwari, 1948). Впервые описан у Drusa
oppositifolia (Hakansson, 1923). В результате мейоза образуется четырехспоровый
ценоцит. В интерфазе II—III делений, ядра мегаспор распределяются по схеме 1 +3
(одно ядро на микропилярном полюсе, три — на халазальном). В отличие от
Fritillaria-типа халазальные ядра не сближаются друг с другом. У Pyrethrum-фор-
мы ядра мегаспор распределяются по схеме 1+1+1+1, а окончательная
поляризация по схеме 2+6 наблюдается лишь в интерфазе III—IV делений.
III деление проходит синхронно, при этом фигуры делений трех халазальных
ядер находятся на значительном расстоянии друг от друга. В результате
образуется 8 ядер с распределением 2+6.
15 Генеративные органы цветка.
226
Генеративные органы цветка
В интерфазе III—IV делений обычно проявляется депрессия халазального
конца. При этом одно—три самых нижних ядра, будучи несколько мельче,
окрашиваются значительно интенсивнее остальных. IV деление у таких ядер происходит
аномально с ярко выраженным слипанием хромосом или агглютинацией
хроматина, а нередко они вообще не делятся. Аномальность митозов усиливается по
направлению к халазальному концу, что является проявлением так называемого ци-
топлазматического градиента (Романов, 1965а).
После IV деления образуется зародышевый мешок с четырьмя ядрами в мик-
ропилярном конце и 8—12 — в халазальном. Сформированный зародышевый
мешок состоит из трехклеточного яйцевого аппарата, центральной клетки с двумя
полярными ядрами и 7—11 клеток-антипод. Число последних может уменьшаться
вследствие образования двуядерных клеток (Pyrethrum-форма) или отсутствия
образования клеточных перегородок между 4—6 верхними ядрами (Tulipa).
Отклонения в развитии наблюдаются при поляризации ядер мегаспор и при III
делении и проявляются в слиянии двух или всех трех халазальных ядер
зародышевого мешка.
Drusa-тип развития зародышевого мешка характерен для родов Anthemis,
Crucianella, Majanthemum, Melampyrum, встречается у Bowlesia, Drusa,
Helichrysum, Tanacetum и наряду с другими типами — у Erigeron, Erythronium,
Rubia, Smilacina, Tamarix, Tulipa, Ulmis и др. Рис. 66.
Романов, 1965а, 1971а, 1981; Hbkansson, 1923; Maheshwari, 1948.
Fritillaria-тип
Зародышевый мешок Fritillaria-типа развития — тетраспорический,
двумитозный, биполярный. Впервые описан у Fritillaria persica (Bambacioni,
1928а). В результате мейоза образуется ценоцит с разнообразным расположением
четырех ядер мегаспор (четырехъядерный зародышевый мешок). В интерфазе II—
III делений ядра располагаются по схеме 1 +3. К началу III деления три халазальных
ядра сближаются друг с другом, что существенно отличает этот тип от Drusa-типа.
В профазу III деления все 4 ядра мегаспор вступают одновременно и в
дальнейшем фигуры деления трех нижних ядер объединяются (сливаются) в одну. В
результате образуется вторичный четырехядерный зародышевый мешок с двумя
гаплоидными ядрами в микропилярном конце и двумя триплоидными — в
халазальном. После IV деления формируется зародышевый мешок, состоящий из
клеток яйцевого аппарата (яйцеклетка, как правило, недифференцирована),
центральной клетки с двумя полярными ядрами и антипод. Ядра клеток яйцевого
аппарата и верхнее полярное ядро — диплоидные, в то время как ядра антипод и
нижнее полярное ядро — триплоидные.
Довольно часто наблюдается различная степень депрессии халазального конца,
которая характеризуется аномальными митозами с выпадением профазы либо
переходом из ранней профазы или интерфазы в метафазу с агглютинацией
хроматина. Степень депрессии усиливается при более раннем ее проявлении и по мере
приближения к халазальному концу. При сильной депрессии (Tulipa) антиподы
редуцированы до 2—1, а нижнее полярное ядро инактивировано. В крайних случаях —
у Clintonia-формы и Tulipa maximowiczii нижнее полярное ядро и антиподы
отсутствуют.
Отклонения в онтогенезе зародышевого мешка довольно редкие и наблюдаются
обычно при поляризации ядер мегаспор и слиянии халазальных ядер.
Fritillaria-тип развития зародышевого мешка характерен для большинства
родов подсем. Liliodeae, родов Gaillardia, Heckeria, Rudbeckia (половые формы),
Piper, Ratibida, встречается у Leptachis, Myricaria, Platystemon и, наряду с дру-
Семязачаток
227
гими, в основном, тетраспорическими типами, — у Armeria, Cornus, Erythronium,
Euphorbia, Limonium, Statica, Tamarix, Tulipa. Рис. 67.
Романов, 1971а, 1981; Bambacioni, 1928a; Maheshwari, 1937.
Plumbagella-тип
Зародышевый мешок Plumbagella-типа развития —
тетраспорический, одномитозный, биполярный. Такой тип зародышевого мешка впервые
был обнаружен у Phimbagella micranta (Fagerlind, 1938; Boys, 1939), а позднее у
Gagea capusii и у некоторых видов Tamarix. В материнской клетке мегаспор после
мейоза образуются четыре ядра, располагающиеся на двух полюсах: одно ядро
находится в ее микропилярной части, три остальных — в халазальной. Затем три
ядра в халазальном конце сливаются с образованием триплоидного ядра (феномен
Карано-Бамбичиони); таким образом, зародышевый мешок оказывается двуядер-
ным. В микропилярной его части находится одно гаплоидное ядро, а в
халазальной — одно триплоидное. Следующее деление приводит к образованию четырех
ядер: двух гаплоидных — в микропилярной части и двух триплоидных — в
халазальной части зародышевого мешка. На стадии вторичного четырехядерного
зародышевого мешка происходит процесс клеткообразования и формирования его
элементов. В микропилярном конце зародышевого мешка формируется
гаплоидная яйцеклетка, а в халазальном конце — единственная триплоидная антипода.
Два ядра (верхнее гаплоидное и нижнее триплоидное) становятся полярными
ядрами центральной клетки. Зрелый, готовый к оплодотворению зародышевый
мешок Plumbagella-типа состоит из яйцеклетки, центральной клетки с тетраплоид-
ным ядром (результат слияния гаплоидного и триплоидного полярных ядер) и
одной антиподы, обычно проявляющей признаки депрессии. Синергиды
отсутствуют.
Dahlgren (1916) считал Plumbagella-тип развития зародышевого мешка
наиболее продвинутым среди остальных типов, исходя из того, что при этом типе
развития образуется всего лишь четыре ядра. Boyes (1939) установил, что тип
развития зародышевого мешка у Phimbagella является сокращенным вариантом
развития зародышевого мешка Fritillaria-типа. Рис. 68.
Коробова, 1983; Плющ, 1992; Поддубная-Арнольди, 1964, 1976; Романов, 1971а; Bambicioni, 1928a;
Boyes, 1939; Carano, 1925; Dahlgren, 1916; Fagerlind, 1938; Maheshwari, 1950.
Adoxa-тип
Зародышевый мешок Adoxa-типа развития — тетраспорический,
одномитозный, биполярный (Романов, 1944). Впервые описан у Adoxa
moschatellina (Jonsson, 1879—1880). В результате мейоза образуется ценоцит с
четырьмя ядрами мегаспор. В интерфазе II—III делений ядра располагаются по
схеме 2+2. У видов Tulipa нередко халазальные ядра бывают несколько меньшего
размера и менее правильной формы, чем микропилярные. В таком состоянии
четырехъядерный зародышевый мешок Adoxa-типа бывает удивительно похож на
вторичный четырехъядерный зародышевый мешок Fritillaria-типа.
III деление проходит, как правило, синхронно. В ряде случаев отмечается
отставание самого нижнего и одного из микропилярных ядер, как исключение —
отставание верхнего и аномальное деление самого нижнего из халазальных ядер.
В результате III деления образуется зародышевый мешок с распределением ядер
4+4. Сформированный зародышевый мешок состоит из яйцевого аппарата, трех
антипод и центральной клетки с двумя полярными ядрами.
15»
228 Генеративные органы цветка
Характерная депрессия халазалыюго конца, проявляющаяся в том, что
ядра двух антипод мельче и сильнее хроматизированы, чем ядро антиподы,
которое является сестринским по отношению к нижнему полярному ядру. В
крайних случаях антиподы редуцированы до двух или дегенерируют еще до
оплодотворения.
Для достоверного выявления Adoxa-типа необходимо наблюдение всех стадий
развития. В качестве отклонений в этом типе отмечена значительная
вариабельность при распределении ядер мегаспор — от 4+0 до 0+4.
Adoxa-тип развития зародышевого мешка характерен для родов Adoxa,
Sambucus, обнаружен также у Hydnora, Nolina, Phyllocactus, Rhytidophyllum,
Sanicula и, наряду с другими типами, встречается почти у двух десятков родов,
среди которых Amaryllis, Erigeron, Limonium, Nerine, Tamarix, Tulipa, Solarium,
Ulmus. Рис. 69.
Романов, 1944, 1971a, 1981; Jonsson, 1879—1880; Maheshwari, 1948.
Tulipa tetraphylla-тип
Зародышевый мешок Tulipa tetraphylla-типа развития — тетраспо-
рический, одиомитозный, биполярный (Романов, 1944). Впервые описан у
Tulipa tetraphylla и Т. ostrovskiana (Романов, 1938). Единственная археспориаль-
ная клетка закладывается субэпидермально и непосредственно превращается в
мегаспороцит. Ядро мегаспороцита нередко располагается ближе к микропиляр-
ному концу. В мейозе I ахроматиновое веретено чаще всего ориентировано
наклонно по отношению к продольной оси мегаспороцита, реже параллельно ей. В дву-
ядерном ценоците нижнее ядро часто находится на значительном удалении от
халазалыюго конца. Мейоз II проходит строго синхронно. После I и II делений
отмечается образование клеточных пластинок между сестринскими ядрами.
В интерфазе II—III делений ядра расходятся по схеме 3+1, после чего
образуется центральная вакуоль. III деление проходит, как правило, синхронно. Иногда
наблюдается отставание халазалыюго ядра, и как исключение — его аномальное
деление. В результате III деления образуется зародышевый мешок с
распределением ядер 6+2.
В сформированном зародышевом мешке яйцевой аппарат состоит из пяти
морфологически сходных клеток, из которых одно—два располагаются выше других,
являясь, вероятно, синергидами. Вблизи от яйцевого аппарата располагается
верхнее полярное ядро. В халазальной части находятся единственная антипода и
инактивированное нижнее полярное ядро, уступающее в размере верхнему
полярному ядру. Ядро антиподы часто дегенерирует уже вскоре после своего
образования, но иногда сохраняется, будучи более хроматизированным по сравнению с
нижним полярным ядром. Часто наблюдаются отклонения в развитии, особенно
на стадии поляризации ядер мегаспор.
Tulipa tetraphylla-тип развития зародышевого мешка, наряду с Adoxa-типом,
характерен для Tulipa kolpakovskiana, Т. ostrovskiana и Т. tetraphylla (Печеницын,
1989). Он обнаружен также у Ulmis pumila (Walker, 1950). Рис. 70.
Романов, 1938, 1944, 1971а, 1981; Печеницын, 1989; Walker, 1950.
Eriostemones-тип
Зародышевый мешок Eriostemones-типа развития — тетраспориче-
ский, одиомитозный, монополяриый (Романов, 1944; Fagerlind, 1944a).
Впервые описан у Tulipa celsiana и Т. silvestris (Liliaceae) (Bambacioni-Mezzetti, 1931).
Единственная археспориальная клетка закладывается субэпидермально и пре-
Семязачаток
229
вращается непосредственно в мегаспороцит. Характерная особенность развития —
ранняя вакуолизация цитоплазмы, заметная уже в ранней профазе мейоза I. В
мейозе I ахроматиновое веретено ориентировано, как правило, поперечно по
отношению к продольной оси мегаспороцита. В двуядерном ценоците оба ядра
располагаются в микропилярном конце. Таким образом, распределение ядер
начинается уже в мейозе I (деления) и полностью заканчивается в интерфазе I—II
делений. II и III деления ядер синхронные. В телофазе II между дочерними ядрами
отмечается образование первичных и вторичных фрагмопластов.
Сформированный зародышевый мешок — восьмиклеточный: семь клеток яйцевого аппарата и
центральная клетка с полярным ядром, располагающимся в верхней части и
отличающимся более крупными размерами. В дальнейшем ядро центральной
клетки опускается вниз и располагается ближе к халазальному концу.
Клетки яйцевого аппарата обычно расположены в два ряда. Верхний ряд
состоит из двух клеток, ядра которых отличаются от остальных меньшей величиной
и являются более хроматизированными. Пять клеток второго ряда
морфологически не различаются между собой. Одна из них функционирует как яйцеклетка.
Нижнее полярное ядро и антиподы отсутствуют.
Eriostemones-тип развития зародышевого мешка — исключительно постоянный
тип, характерен только для видов Tulipa из подрода Eriostemones (Liliaceae). Рис.
71.
Романов, 1944, 1971а, 1981; Bambacioni-Mezzetti, 1931; Fagerlind, 1944a.
Репаеа-тип
Зародышевый мешок Penaea-типа развития — тетраспорический,
двумитозный, тетраполяриый (Романов, 1944; Fagerlind, 1944a). Впервые
описан у представителей родов Sarcocolla, Репаеа и Brachysiphon (Репаеасеае)
(Stephens, 1909) и у Euphorbia procera (Euphorbiaceae) (Modilewsky, 1909).
В результате мейоза образуется четырехспоровый ценоцит с ромбическим
расположением ядер: 1+1+1+1. Оба митоза происходят синхронно, в пристенном слое
цитоплазмы, образуя 16 ядер, расположенных по 4 на каждом из 4-х полюсов
клетки. В результате клеткообразования на всех полюсах зародышевого мешка
формируются одинаковые трехклеточные группы, а четыре свободных полярных
ядра сближаются в центре зародышевого мешка и затем объединяются.
Характерной особенностью дальнейшего развития зародышевого мешка является
одинаковая, по типу клеток яйцевого аппарата, дифференциация всех 3-клеточных групп.
Яйцеклетка в зрелом зародышевом мешке крупная, с ядром в апикальной части
и вакуолью в базальной части синергиды — с уплощенным основанием, с
нитчатым аппаратом, содержат вакуоль в апикальной части и ядро в базальной части
клетки. Точно так выглядят латеральные и халазальная группы, только иногда
их клетки меньших размеров.
Зрелый зародышевый мешок сферический, центральная клетка пронизана
тяжами цитоплазмы, в центре ее располагаются полярные ядра, сливающиеся до
или во время оплодотворения.
Такое строение зародышевого мешка позволило интерпретировать его как
комплекс из четырех униполярных зародышевых мешков, развивающихся из каждой
мегаспоры (Stenar, 1937), и говорить об отсутствии настоящих антипод (Tobe,
Raven, 1984). Однако, в дальнейшем, в качестве яйцевого аппарата функционирует
только микропилярная группа клеток: пыльцевая трубка входит в одну из сине-
ргид, из оплодотворенной яйцеклетки развивается зародыш. Положение
халазальной группы, связь этих клеток с гипостазой {Biebersteiniaceae) или с тяжем клеток
нуцеллуса, связанным с проводящим пучком семязачатка {Репаеасеае) позволяет
230 Генеративные органы цветка
предположить, что эти клетки выполняют функцию антипод, которые, однако,
довольно эфемерны. Эфемерны и синергидоподобные клетки латеральных групп, а
яйцеклеткоподобные и интактная синергида сохраняются продолжительное время,
вплоть до ранних стадий эндоспермогенеза, причем, оболочка их сильно
утолщается (Biebersteinia).
В строении зародышевого мешка наблюдается вариабельность: расположение
групп не всегда симметрично, число клеток и свободных ядер в зародышевом
мешке не всегда одинаково. Это особенно характерно для Acalypha indica (Maheshwari,
Johri, 1941; Kapil, 1960), что позволяет выделить в этом типе Acalypha indica-ва-
риацию, характеризующуюся образованием четырехклеточных групп на полюсах
зародышевого мешка и восьми свободных ядер в центральной клетке.
Penaea-тип развития зародышевого мешка характерен для всех изученных
родов сем. Репаеасеае, а также Malpighia (Malpighiaceae), Acalypha и Euphorbia
procera (Euphorbiaceae) и видов сем. Biebersteiniaceae. Рис. 72.
Камелина, Коннова, 1990,1992; Романов, 1944,1971а, 1981; Fagerlind, 1944a; Kapil, 1960; Maheshwari,
Johri, 1941; Modilewsky, 1909; Stenar, 1937; Stephens, 1909; Tobe, Raven, 1984.
Plumbago-тип
Зародышевый мешок Plumbago-типа развития — тетраспорический,
одиомитозный, тетраполяриый. Впервые описан у Plumbago capensis (Haupt,
1934). В материнской клетке мегаспор после двух делений мейоза, происходящих
без цитокинеза, образуются четыре ядра, расположенных по углам ромба. В
результате последующего митотического деления ядер образуется 8-ядерный
зародышевый мешок, на каждом из четырех полюсов которого имеется по два ядра.
На этой стадии в зародышевом мешке происходит цитокинез. Одно ядро микро-
пилярной пары становится ядром яйцеклетки; синергиды отсутствуют. Четыре
ядра из каждой пары, выполняющие роль полярных ядер, сливаясь, образуют
тетраплоидное ядро центральной клетки. Судьба остальных трех ядер различна:
они или дегенерируют, или становятся ядрами клеток, которые выполняют,
вероятно, функцию антипод.
Характерной особенностью видов с Plumbago-типом развития
зародышевого мешка является тенденция к дегенерации тех клеток и ядер, которые
не участвуют непосредственно в акте оплодотворения. В самом крайнем
случае, это ведет к тому, что вместо типичного тетраполярного 8-ядерного
зародышевого мешка Plumbago-типа ко времени оплодотворения могут
образоваться однополюсные 2-клеточные зародышевые мешки, состоящие только
из яйцеклетки и центральной клетки. У Plumbago capensis, P. zeylanica
(Cass, 1972a, b; Russell, 1980) в яйцеклетках обнаружен нитчатый аппарат.
По мнению авторов, описавших это явление, яйцеклетка в таких случаях
дополнительно принимает на себя функцию отсутствующих синергид.
Показано, что пыльцевая трубка не проникает внутрь такой яйцеклетки, а лишь
внедряется в ее нитчатый аппарат и далее растет в толще оболочки
яйцеклетки, изливая затем свое содержимое вместе со спермиями и вегетативным
ядром между яйцеклеткой и центральной клеткой.
Исследование на ультраструктурном уровне тетраспорических зародышевых
мешков ряда видов (Плющ, 1992) указывает на свойственные им признаки
локального автолиза цитоплазмы, наличие атипичной структуры яйцевого аппарата
и более медленное, чем в моноспорическом зародышевом мешке, протекание
кариогамии.
Семязачаток
231
Существуют вариации Plumbago-типа развития зародышевого мешка.
Например, нередко встречается однополюсный четырех-клеточный
зародышевый мешок (Plumbago europaeum). Наблюдаются также случаи нетипичного
расхождения ядер при формировании зародышевого мешка, запаздывание
или отсутствие делений у некоторых видов рода Plumbago (Haupt, 1934;
D'Amato, 1940b).
Plumbago-тип развития зародышевого мешка характерен для отдельных
представителей рода Plumbago: P. capensis, P. zeylanica, P. scandens, P. coccinea
(Dahlgren, 1937; Fagerlind, 1939), а также двух других родов семейства
Plumbaginaceae: Ceratostigma plumbaginioides, С. willmottiuna (D'Amato, 1940a) и
Vogelia (Mathur, Khan, 1941). Рис. 73.
Коробова, 1983; Плющ, 1990; Поддубная-Арнольди, 1976; Романов, 1971а; Cass, 1972a, b; Dahlgren,
1937; D'Amato, 1940a; Fagerlind, 1939; Haupt, 1934; Maheshwari, 1950, Mathur, Khan, 1941; Russell, 1980.
Peperomia-тип
Зародышевый мешок Peperomia-типа развития — тетраспорический,
двумитозный, монополяриый. Впервые был описан у Peperomia pellucida
(Campbell, 1899а, b, 1901). Картину своеобразного развития зародышевого мешка
Peperomia-типа дополнили исследования Brown (1908), Johnson (1914) и ряда
других авторов.
Мегаспороцит имеет грушевидную форму с несколько расширенной хала-
зальной частью, в которой располагается ядро. Оба деления мейоза
происходят без цитокинеза, вследствие чего клетка мегаспороцита становится
инициальной клеткой зародышевого мешка и все четыре ядра мегаспор
принимают участие в его формировании. Обычно одно ядро располагается
в микропилярной части клетки, три — в халазальной. На этой стадии
наблюдается рост ценоцитной клетки и образование в центре ее крупной
вакуоли. Далее после двух митотических делений образуются 16 ядер,
расположенных четырьмя группами в периферическом слое цитоплазмы, из них
четыре ядра имеют фиксированное положение у микропилярного полюса
зародышевого мешка, остальные расположены в халазальной его части.
В процессе целлюляризации в зародышевом мешке веретена второго
митотического деления ориентированы тангентально (Смирнов, 1982, 1983); из
каждой четырехъядерной группы потенциально могут сформироваться две
клетки и два свободных ядра, т. е. всего восемь пристенных (латеральных)
клеток и восьми-ядерная центральная клетка. Однако такое четкое
распределение ядер встречается редко. Для Peperomia-типа развития зародышевого
мешка характерна высокая вариабельность в числе ядер центральной клетки
и числе латеральных клеток.
Зрелый зародышевый мешок Peperomia-типа развития имеет характерную,
шаровидную форму, иногда с небольшим выступом на микропилярном конце, где
располагается яйцевой аппарат; халазальный полюс зародышевого мешка
морфологически не выражен.
Вопрос о строении яйцевого аппарата является дискуссионным. В
литературе утвердилось представление о типичности для рода Peperomia дву-
клеточного яйцевого аппарата, состоящего из яйцеклетки и одной синергиды
(Johnson, 1914; Магешвари, 1954; Романов, 1971а, 1981; Смирнов, 1982,
1983). С нашей точки зрения яйцевой аппарат, описанный Johnson (1914)
как двуклеточный, в действительности является зиготой и интактной сине-
ргидой, что очевидно из рисунка. Существует также мнение, что яйцевой
232
Генеративные органы цветка
аппарат Peperomia представлен только яйцеклеткой (Поддубная-Арнольди,
1976). У некоторых видов Peperomia отмечены как двуклеточные, так и
трехклеточные яйцевые аппараты (Fagerlind, 1939b, Murty, 1959). У ряда
видов (Peperomia blanda, P. obtusifolia) яйцевой аппарат всегда состоит из
трех слабодифференцированных клеток, не имеющих целлюлозной оболочки
(Никитичева, 19816; Никитичева, Яковлев, Плющ, 1981), что подтверждено
ультраструктурными исследованиями (Плющ, 1982, 1992).
Латеральные клетки, число которых варьирует (0—8), расположены без
определенного порядка по стенке зародышевого мешка. Большинством
исследователей они рассматриваются как гомологи антипод, участвующих в
транспорте питательных веществ из нуцеллуса в зародышевый мешок. Они
сохраняются в оплодотворенном зародышевом мешке на первых этапах
развития эндосперма и иногда делятся на две—четыре клетки. Центральная
клетка невелика по объему. Количество полярных ядер в ней варьирует от
7 до 13. Их слияние в зрелом зародышевом мешке обычно начинается
только после контакта со спермием. Первичное ядро эндосперма
полиплоидное, очень крупное, занимает значительную часть клетки.
Ультраструктурные исследования зародышевого мешка Peperomia blanda
выявили во всех его клетках низкую плотность распределения рибосом, чрезвычайно
слабое развитие ЭР и аппарата Гольджи, что свидетельствует о его пониженной
активности.
Вопрос о происхождении и эволюционном уровне зародышевого мешка
Peperomia-типа остается дискуссионным. Одни авторы (Campbell, ,1901;
Fagerlind, 1944a; Смирнов, 1982) сближают зародышевый мешок Peperomia
с гаметофитом рода Gnetum. Другие (Rutgers, 1923) представляют его как
совокупность четырех «простых» зародышевых мешков. Однако большинство
исследователей поддерживают представление о вторичном характере
преобразованной при становлении зародышевого мешка Peperomia-типа и его
происхождении из моноспорического Polygonum-типа (Coulter, 1908; Романов,
1945, 1971а; Герасимова-Навашина, 1954; Поддубная-Арнольди, 1976; Кор-
дюм, 1978; Терехин, 1984, 1991; Плющ, 1992). Тем не менее, трудно
представить, что зародышевый мешок типа Peperomia, развитие которого не
подчинено строгим закономерностям, берет начало от Polygonum-типа со
стабильным, упорядоченным процессом формирования (Гваладзе, 1973).
Кроме того, слабая дифференциация яйцевого аппарата, расположение
яйцеклетки непосредственно под микропиле считается менее совершенным в
смысле адаптации к оплодотворению, чем в зародышевых мешках
Polygonum-типа (Плющ, 1992). Не исключена возможность независимого
происхождения зародышевого мешка описываемого типа, как и других типов
(Герасимова-Навашина, 1958). Особенности зародышевого мешка Peperomia-
типа, обнаруженного в роде Peperomia, очевидно, в определенной мере
обусловлены характером взаимоотношений всех структур, сложившихся в
процессе развития семязачатка и семени (Герасимова-Навашина, 1958;
Никитичева и др., 1981; Смирнов, 1982), и, в частности, строением нуцеллуса
(слабая тканевая дифференциация нуцеллуса, сохранение в качестве
запасающей ткани в зрелом семени и отсутствие проводящего тяжа в его хала-
зальной части). Рис. 74.
Гваладзе, 1973,1978; Герасимова-Навашина, 1958; Кордюм, 1978; Никитичева, 1981а, б; Никитичева,
Яковлев, Плющ, 1981; Плющ, 1982, 1992; Поддубная-Арнольди, 1976; Романов, 1971а, 1981;
Смирнов, 1982,1983; Abele, 1924; Brown W.D., 1908; Campbell, 1899a, b, 1901; Fagerlind, 1939в, 1944а; Fisher,
1914; Johnson, 1900а,в, 1914; Maheshwari, 1950; Martinoli, 1948; Murty, 1959; Rutgers, 1923; Schurhoff,
1926.
Семязачаток
233
ДИСКУССИОННЫЕ ТИПЫ РАЗВИТИЯ ЗАРОДЫШЕВОГО МЕШКА:
Schisandra-тип
Зародышевый мешок Schisandra-типа развития — моноспорический,
двумитозный, униполярный. Впервые обнаружен и описан у Schisandra
chinensis (Schisandraceae) Yoschida (1962). Такой характер развития
зародышевого мешка присущ, вероятно, также S.grandiflora, S. repanda и Kadsura japonica
(согласно иллюстрациям, представленным в работах Kapil, 1962; Kapil, Jalan,
1964; Hayashi, 1963). Однако авторы по-разному классифицировали развитие
зародышевого мешка у видов рода Schisandra: как Polygonum-тип (Hayashi, 1963;
Kapil, Jalan, 1964), как модификация Polygonum-типа (Yoshida, 1962), как
Oenothera-тип (Swamy, 1964) или как Schisandra-тип (Battaglia, 1986). Вопрос о
выделении самостоятельного Schisandra-типа развития зародышевого мешка
остается до сих пор дискуссионным. С нашей точки зрения, имеется ряд веских
оснований, позволяющих рассматривать его только как подтип в Oenothera-типе
развития зародышевого мешка (подробнее см. Oenothera-тип).
Gunnera-тип
Зародышевый мешок Gunnera-типа развития — тетраспорический,
двумитозный, биполярный (Романов, 1944; Модилевский, 1953). Некоторые
исследователи выделяют Gunnera-подтип в рамках Penaea-типа (Mezzetti-
Bambacioni, 1949) или Gunnera-вариацию Peperomia-типа (Schnarf, 1936). По
таким критериям, как споричность, число митозов и число ядер, эту вариацию
можно отнести к описываемым типам, но она отличается по расположению ядер в
формирующемся мегагаметофите и конструкции зрелого зародышевого мешка, на
основании чего Gunnera-тип зародышевого мешка был выделен как
самостоятельный.
Развитие зародышевого мешка у Gunnera macrophylla (Ernst, 1908; Samuels,
1912) и у G. chilensis (Modilewsky, 1908) имеет свои особенности. Мейоз в
материнской клетке мегаспор проходит без цитокинеза, ядра в четырехядерном цено-
ците располагаются по углам тетраэдра. После этой стадии происходит
увеличение объема зародышевого мешка и перераспределение ядер, вступающих в митоз.
На восьмиядерной стадии два ядра располагаются на микропилярном полюсе,
шесть — на халазальном, на шестнадцатиядерной стадии соответственно 4 и 12
ядер, разделенные большой центральной вакуолью. Процесс клеткообразования
в зародышевом мешке завершается формированием трехклеточного яйцевого
аппарата, располагающегося на микропилярном полюсе, шестиклеточного антипо-
дального аппарата — на халазальном полюсе, и центральной клетки, содержащей
семь ядер. Возможно как одновременное слияние всех ядер, так и
последовательное слияние сначала шести халазальных, а затем объединение их с микропиляр-
ным полярным ядром. В современных классификациях зародышевых мешков
(Романов, 1971а, 1981; Терехин, 1991) Gunnera-тип как самостоятельный не
выделяется. Рис. 75.
Модилевский, 1953; Романов, 1944,1971а; Терехин, 1991; Ernst, 1908; Modilewsky, 1908; Samuels, 1912.
Chrysanthemum-тип
Зародышевый мешок Crysanthemum-типа развития —
тетраспорический, двумитозный, биполярный. Впервые описан у Chrysanthemum
cinerariaefolium из сем. Asteraceae (Martinoli, 1939). В результате мейоза обра-
234 Генеративные органы цветка
зуется четырехспоровый ценоцит, в котором ядра располагаются по схеме 1 +2+1.
В отличие от Fritillaria-типа объединяются не три халазальных, а только два
центральных ядра. После первого митоза формируются шесть ядер: по два
гаплоидных ядра на микропилярном и халазальном полюсах и два диплоидных ядра в
центре развивающегося зародышевого мешка. В результате следующего деления
возникает двенадцатиядерный зародышевый мешок. Процесс клеткообразования
завершается формированием одиннадцатиклеточного зародышевого мешка:
трехклеточный яйцевой аппарат (ядра гаплоидные), семь антипод (четыре
нижних — с гаплоидными ядрами, а три верхние — с диплоидными ядрами) и
центральная клетка с двумя ядрами (гаплоидным и диплоидным). У этого вида
зародышевый мешок может развиваться иначе — без объединения центральных ядер
в четырехспоровом ценоците с образованием 16 гаплоидных ядер (в результате
двух митозов), что соответствует Pyrethrum-форме Drusa-типа (Романов, 1971а).
У Gagea stipitata из сем. Liliaceae (Шамров, 1990а) зародышевый мешок
развивается по Chrysanthemum-типу (с отклонениями). Зародышевый мешок двуми-
тозный, однако второе деление претерпевают лишь производные верхнего мега-
спорангиального ядра, тогда как нижнее мегаспориальное ядро часто не делится.
Зрелый зародышевый мешок шести—семиклеточный: яйцеклетка, две синерги-
ды (ядра гаплоидные), две—три антиподы (одна с диплоидным, а другие с
гаплоидными ядрами) и двуядерная центральная клетка (ядра гаплоидное и
диплоидное).
Вопрос о статусе Chrysanthemum-типа развития зародышевых мешков
дискуссионен. Его выделяют в особый тип, положение которого не ясно (Maheshwari,
1950) либо рассматривают как тип, близкий к Fritillaria-типу (Martinoli, 1939,
1967; Fagerlind, 1944a; Battaglia, 1959). Некоторые авторы помещают его в
качестве либо подтипа в Fritillaria-тип (Mezzetti-Bambacioni, 1949), либо особой формы
в Drusa-тип, занимающей промежуточное положение между Drusa- и Fritillaria-ти-
пами (Романов, 1981). Рис. 76.
Романов, 1971а, 1981; Шамров, 1990а; Battaglia, 1959; Fagerlind, 1944a; Harling, 1951; Maheshwari, 1950;
Martinoli, 1939,1967; Mezzetti-Bambacioni, 1949.
ЭВОЛЮЦИЯ ТИПОВ РАЗВИТИЯ ЗАРОДЫШЕВОГО МЕШКА
Формирование того или иного типа зародышевого мешка определяется
действием трех основных программ, контролирующих число мегаспор, число постмей-
отических делений, особенности поведения ядер (дефинитивное распределение,
вторичное перераспределение, слияние халазальных ядер) (Герасимова-Наваши-
на, 1954а, б, 1958; Романов, 1944, 1971а, 1981). При обсуждении проблемы
эволюции зародышевого мешка покрытосеменных растений большинство
исследователей ограничивается установлением исходного типа развития зародышевого
мешка. Начиная с Schnarf (1931), почти общепризнанным является мнение о
наибольшей примитивности, исходное™ моноспорического Polygonum-типа, хотя
некоторые авторы считают таковым 16-ядерный тетраспорический зародышевый
мешок (Schurhoff, 1926; Fagerlind, 1944a; Модилевский, 1953; Sundara Rajan, 1976;
Смирнов, 1982).
В отношении постмейотических делений прогрессивным считается уменьшение
их числа в основном по аналогии с направлением эволюции от женского гамето-
фита голосеменных растений к зародышевому мешку покрытосеменных (Palm,
1915; Романов, 1957, 1981; Кордюм, 1971; Battaglia, 1989). Особенно категорично
отстаивал эту точку зрения Романов, который считал сокращение числа митозов
одним из главных направлений эволюции. Однако остается неясным адаптивное
значение сокращения периода развития зародышевого мешка покрытосеменных
Семязачаток
235
растений. Кроме того, показано (Печеницын, 1989), что митотические деления
происходят даже в заведомо нежизнеспособных ценоцитах, что говорит о
значительной автономности данной программы развития. По-видимому, в ходе
эволюции зародышевого мешка покрытосеменных растений эта программа не всегда
менялась однозначно.
Наиболее дискуссионным является вопрос о дефинитивном распределении
ядер и их дальнейшем поведении. Обсуждая причины распределения ядер, одни
исследователи (Maheshwari, 1948; Chiarugi, 1950; Романов, 1965а, б, 1970а;
Смирнов, 1982) развивали идеи о пассивном движении ядер, другие придерживаются
противоположной точки зрения — об их активном движении (Герасимова-Нава-
шина, 1954а, б, 1971; Терехин и др., 1971; Печеницын, 1989). Поддерживаемая
нами точка зрения Терехина с соавторами (1971) о расположении ядер в местах с
наиболее интенсивными метаболическими процессами подтверждается и данными
исследования ультраструктуры зародышевого мешка (Плющ, Банникова, 1989).
В эволюционном плане причины различий в дефинитивном распределении
ядер и их дальнейшем поведении почти не обсуждались. Логичным
представляется мнение Романова (1965а, б) о том, что в ходе эволюции депрессия халазаль-
ного полюса зародышевого мешка проявляется на все более ранних фазах
онтогенеза1. Выдвинутая же Battaglia (1989) схема, согласно которой эволюция
зародышевого мешка покрытосеменных растений шла в направлении уменьшения числа
ядер в микропилярном конце при клеткообразовании, на наш взгляд, довольно
искусственна, поскольку в нее явно не укладываются Eriostemones- и Tulipa
tetraphylla-типы развития зародышевого мешка, имеющие соответственно 7- и 5-
клеточный яйцевой аппарат.
Для решения вопроса о путях эволюционных преобразований
зародышевых мешков покрытосеменных растений большое значение имеет
сравнительное изучение представителей таксонов разного ранга (семейств, родов и
видов), характеризующихся наличием нескольких типов развития
зародышевого мешка, как, например, у Erythronium, Euphorbia, Limonium, Tamarix,
Tulipa, Ulmus, Delosperma cooperi и др. Подобные примеры позволяют
предположить, что разнообразие типов развития мегагаметофита в каждом
конкретном таксоне не случайно, а представляет собой этапы или ступени
единого эволюционного процесса.
Рассмотрим это положение на примере рода Tulipa. Романов приходит к выводу
о первичности Fritillaria-типа развития зародышевого мешка в роде Tulipa. Другие
известные у этого таксона типы развития зародышевого мешка (Adoxa-, Drusa-,
Tulipa tetraphylla-, Eriostemones-типы), по его мнению возникли от Fritillaria-типа
в ходе эволюционного становления рода.
Более подробное изучение видов Tulipa позволило нам разработать иную схему
взаимоотношений различных типов развития тетраспорических зародышевых
мешков (Печеницын, 1989). При этом мы полагали, что если вслед за
большинством эмбриологов принять моноспорический Polygonum-тип развития
зародышевого мешка за примитивный, исходный, то логично считать таковыми и особенности,
присущие этому типу: изобиполярность, отсутствие депрессии халазального
полюса или возможно позднее ее проявление, слияние полярных ядер или хотя бы
их контакт до оплодотворения.
1 От ред. — На основании ряда работ (Терехин, Яковлев, 1968; Терехин, 1977; Терехин,
Камелина, 1969, 1972; Терехин, 1991) становится очевидным, что депрессию халазального полюса
зародышевого мешка можно рассматривать как начальные стадии редукции его халазальных
структур, которая в полной мере проявляется в, таких таксонах, как Orchidaceae,
Pyroloideae-Monotropoideae, Balanophoraceae и др.
Семязачаток
237
Исходя из этого, в качестве исходного типа развития зародышевого мешка в
роде Tulipa нами определен Adoxa-тип, имеющий ряд особенностей развития,
сближающих его с исходным Polygonum-типом. К числу таких особенностей
относятся: изобиполярность, позднее проявление депрессии халазального полюса,
сближение полярных ядер до оплодотворения. Как явный атавизм отмечено
также временное образование клеточных пластинок после обоих мейотических
делений.
В результате дивергентной эволюции зародышевого мешка тюльпанов у одних
видов сформировалась его монополярность по схеме: Adoxa-тип — Tulipa
tetraphylla-тип — Eriostemones-тип, а у других — гетеробиполярность с
постепенным усилением степени депрессии халазального полюса по схеме: Adoxa-тип —
Drusa-тип — Fritillaria-тип. Усиление депрессии халазального полюса
зародышевого мешка сопровождалось все более ранним ее проявлением и, в конечном итоге,
привело к объединению трех халазальных ядер при III делении, столь
характерному для Fritillaria-типа развития.
Основным определяющим фактором эволюции зародышевого мешка
тюльпанов являлись аридизация и усиление континентальности климата Древнего
Средиземноморья — центра происхождения тюльпанов. В конечном итоге виды под-
рода Eriostemones стали характеризоваться микротермностью и Eriostemones-ти-
пом развития зародышевого мешка, тогда как виды подрода Leiostemones —
мезотермностью и, в основном, Fritillaria-типом. Первые распространились
значительно шире, заняв северные части ареала рода и области с умеренным
климатом, освоив экологические ниши с наиболее ранним цветением. Несомненно, что
процессу расселения способствовал и тот факт, что формирование зародышевых
мешков как Fritillaria-, так и особенно Eriostemones-типа развития в значительно
меньшей степени подвержено влиянию колебаний температуры по сравнению с
исходным Adoxa-типом.
Таким образом, наиболее эволюционно продвинутыми среди тетраспорических
зародышевых мешков Tulipa являются монополярный Eriostemones-тип и
Fritillaria-тип, характеризующийся гетеробиполярностью, наибольшей степенью
депрессии халазального полюса, сопровождающейся слиянием трех халазальных
ядер, а также отсутствием сближения полярных ядер до оплодотворения.
Приняв за основные направления эволюции зародышевых мешков увеличение
споричности, изменение изополярности в сторону монополярности или гетеробипо-
лярности, что в свою очередь сопровождается усилением депрессии халазального
полюса, можно представить следующую схему взаимосвязи их типов развития.
Исходным типом развития зародышевого мешка для каждого уровня
споричности является изобиполярный тип: среди моноспорических зародышевых
мешков — Polygonum-тип, среди биспорических — Allium-тип, среди
тетраспорических — Adoxa-тип. Взаимоотношения среди моно-(Oenothera-тип) и
биспорических (Apinagia-форма) зародышевых мешков вполне очевидны: развитие шло в
сторону формирования монополярности.
Значительно сложнее связи среди тетраспорических зародышевых мешков,
хотя и здесь четко видны оба направления эволюции — становление монополярности
(Adoxa-тип — Eriostemones-тип) и гетеробиполярности с усилением депрессии
халазального полюса (Adoxa-тип — Clintonia-форма). Chrysanthemum
cinerariaefolium-форму, характеризующуюся слиянием не всех халазальных
ядер, мы рассматриваем как этап эволюции от Drusa- к Fritillaria-типу, а
Clintonia-форму — продолжением эволюции Fritillaria-типа, сопровождающейся
дальнейшим усилением депрессии халазального полюса.
Если ветви Adoxa-тип — Eriostemones-тип и Adoxa-тип — Clintonia-форма
выглядят довольно естественными, то с группой тетраполярных зародышевых меш-
238
Генеративные органы цветка
ков дело обстоит сложнее. Некоторое представление о возможных путях их
эволюции могут дать факты наличия Penaea-типа, наряду с Adoxa- и другими тетраспо-
рическими типами, у limonium и Delosperma cooperi. Это дает основание
предположить, что Penaea-тип развития зародышевого мешка произошел от Adoxa-типа и
является как бы промежуточным в отношении распределения ядер мегаспор 2+2 и
1 +3. При удлинении зародышевого мешка и усилении депрессии халазального
полюса Penaea-тип мог перейти в Drusa-тип, при сохранении же округлой формы — в
Peperomia-тип. В случае формирования одноклеточного яйцевого аппарата
прослеживается направление Penaea-тип — Plumbago-тип — Plumbagella-тип,
которое, как и ветвь Adoxa-тип — Clintonia-форма, характеризуется становлением ге-
теробиполярности и усилением депрессии халазального полюса вплоть до слияния
ядер. Именно в связи с наличием одноклеточного яйцевого аппарата мы выводим
Plumbagella-тип из Plumbago-типа, а не считаем его редуцированной формой
Fritillaria-типа развития. Не совсем ясно положение Balsamita-типа. Однако можно
предположить, что этот тип развития произошел из Drusa-типа.
В пользу предложенной схемы взаимосвязей различных типов развития
зародышевого мешка говорят результаты анализа их распределения среди
семейств, насчитывающих 2 и более различных типа развития (всего таких
семейств свыше 50). Наибольшее распространение, как показал анализ 5-
томной сводки «Сравнительная эмбриология цветковых растений» (1981 —
1990), имеют типы развития в ветви Polygonum-тип — Fritillaria-тип, при
этом они располагаются в строго убывающей последовательности: Polygonum-
тип встречается в 51 семействе, Allium-тип — в 41, Adoxa-тип — в 18,
Drusa-тип — в 13 и Fritillaria-тип — в 8. Значительно реже встречаются
Penaea-тип — в 5 семействах и Peperomia-тип — в 4. Остальные типы
развития характерны для 1—3 семейств.
Определяющими факторами эволюции типов развития зародышевого мешка
служат изменение климата и усиление депрессии халазального полюса с
передвижением сроков ее проявления на все более ранние этапы развития. Последнее
отражает процесс «полной редукции халазального комплекса клеток как остатка
трофической ткани женского заростка» (Смирнов, 1982) и отчетливо видно в рядах
Allium — Apinagia, Adoxa — Clintonia и Adoxa — Plumbagella'.
Второе направление эволюции — становление монополярности — привело к
образованию Oenothera-, Podostemum- и Eriostemones-типов развития зародышевого
мешка
На всех уровнях споричности оба направления эволюции — усиление
депрессии халазального полюса и становление монополярности — приводят
к исключению нижнего полярного ядра из процесса двойного
оплодотворения. Адаптивное значение этого феномена заключается в ускорении
развития зародыша, поскольку в данном случае зигота приступает к делению
намного раньше, чем у видов с тройным слиянием (Гваладзе, 1976; Пече-
ницын, 1989), что рассматривается как явно прогрессивный признак
(Смирнов, 1982).
Батыгина, Колесова, 1983; Гваладзе, 1976; Герасимова-Навашина, 1954а, б, 1971; Ильина, Поддуб-
ная-Арнольди, 1983; Камелина, 1983г; Кордюм, 1971; Коробова, 1983; Модилевский, 1953; Печени-
цын, 1989; Плющ, 1987; Плющ, Банникова, 1989; Поддубная-Арнольди, 1981; Романов, 1957, 1965а,
б, 1971а, 1981; Смирнов, 1982; Терехин, Никитичева, Камелина, 1971; Шамров, 1990а; Battaglia, 1989;
Chiarugi, 1950; Fagerlind, 1948; Palm, 1915; Schurhoff, 1926; Strasburger, 1900; Sundara Rajan, 1976.
1 От ред. — В то же время в ряде работ (Strasburger, 1900; Смирнов, 1982; Терехин, 1991)
показано, что общей редукции женского гаметофита у цветковых не происходит, так как после
оплодотворения продолжается развитие гаметофита. Идет только избирательная редукция.
Семязачаток
239
ИЕРАРХИЧЕСКАЯ КЛАССИФИКАЦИЯ
ЗАРОДЫШЕВЫХ МЕШКОВ
Напомним, что термин «зародышевый мешок» охватывает период развития
женского гаметофита цветковых растений от его инициации до завершения
первичного цитокинеза. Сюда включают также период специализации
(«созревания») клеток зародышевого мешка.
Различия в морфогенетическом происхождении, способах образования и в
структурной организации зародышевых мешков создают естественную основу для
их классификации. Классификация зародышевых мешков необходима для
понимания эволюции женского гаметофита, а также для использования в
исследованиях по таксономии, систематике и филогении и в смежных прикладных науках
(например, в исследованиях апомиксиса).
Впервые классификация зародышевых мешков была предложена Пальмом
(Palm, 1915), а наиболее известные из современных классификаций — это
классификации Шнарфа (Schnarf, 1936), Магешвари (Maheshwari, 1950), Джори (Johri,
1963), Рутисхаузера (Rutishauser, 1969), Романова (1971а) и Амбегаокара
(Ambegaokar, 1984, по Willemse, van Went, 1984). Романов (1971 и 1944а) и
Магешвари (Maheshwari, 1950) предложили 3 основных критерия для выделения типов
зародышевых мешков: 1) число мегаспор, участвующих в образовании
зародышевого мешка, 2) число делений свободных ядер, участвующих в его развитии после
завершения мейоза и 3) поведение ядер, определяющее клеточную организацию
зародышевого мешка и характер его полярности. При этом не учитывается
вторичное увеличение числа ядер и клеток, происходящее иногда позднее первичного
цитокинеза.
Предложенные критерии, на наш взгляд, не отражают полностью особенности
и сложности формирования зародышевых мешков. Они требуют коррекции и
некоторых дополнений. В некоторых случаях (например, при описании
зародышевых мешков) невозможно говорить об участии того или иного числа мегаспор в
инициации и развитии зародышевого мешка. В действительности можно судить
лишь о числе ядер, как результате мейотических делений, участвующих в
инициации зародышевого мешка (см. Balsamita-вариация). Понятие мегаспоры, как
особой специализированной клетки, у покрытосеменных утрачивает здесь свой
прямой смысл. Но, поскольку во всех известных случаях мейоз завершается и
формируется именно гаметофит с гаплоидными ядрами, можно использовать понятие
и термины би- и тетраспоричности зародышевых мешков, имея в виду
высказанное выше замечание.
Недостаточная точность этого и других критериев, отмеченных выше,
приводит к тому, что мы едва ли обнаружим две оригинальные классификации,
содержащие одинаковый «набор типов» зародышевых мешков. Кроме того, морфогене-
тическая и эволюционная неравновесность отмеченных выше критериев
необходимо приводит нас к созданию иерархической классификации зародышевых
мешков. Попытка такой классификации представлена на таблице.
Наша классификация предполагает три ступени иерархии: типы, подтипы и
вариации. Уже сегодня очевидно, что многие вариации могут включать несколько
форм развития и организации, но, по-видимому, подробная разработка
классификации — дело будущего. Каждая ступень иерархии имеет свои критерии и прежде,
чем перейти к кратким комментариям типов, подтипов и вариаций, как основных
звеньев классификации, обсудим основания, необходимые и достаточные для их
выделения. Моно-, би- и тетраспорические женские гаметофиты характерны не
только для покрытосеменных, но также и для голосеменных растений. Несмотря
на относительную однородность первых (свободноядерных) стадий развития у го-
МЕГАСПОРОГЕНЕЗ
мейоз I мейоз
©
/Ф
V*/
е_
МЕГАГАМЕТОГЕНЕЗ
митоз I
митоз II митоз III
цито-
КЛАССИФИКАЦИЯ
тип подтип
моно
Polygonum
5 дел.:
(2)+3
ВАРИАЦИЯ
Polygonum
8 (3+2+3),.
биполярное;
депрессивные формы
щ
Ч
Balanophora
8 (3+2+3 или
1 трипл.),
биполярное; с
инверсией полярности,
депрессивные формы
Balsamita
8 (3+2+3),
биполярное;с
замещением и инверсией
полярности
мейоз I
мейоз II
митоз I
Oenothera
4 дел.:
(2)+2
Oenothera
4 (3+1),
униполярное
Apinagia
(=Podostemum)
4 (2+1+1),
биполярное; с замещением
а.
©
БИ-
Allium
4 дел.:
(2)+2
Allium
8 (3+2+3),
биполярное
Иерархическая классификация зародышевых мешков покрытосеменных. Обозначение:
и изменениями.
— реорганизация. По: Терехин, 1991, с дополнениями
мейоз
.мейоз II митоз! митоз II цитокинез
ТЕТРА-
Ререго-
mia
4 дел.:
(2)+2
Peperomia
16 (2+8+6),
мультиполярное
Репаеа
16 (3+4+9),
тетраполярное
а~
Drusa
16 (3+2+11),
биполярное
Chrysanthemum
cinerariaefolium I
10 (3+3+4),
биполярное
Chrysanthemum
cinerariaefolium
12 (3+2+7),
биполярное
Иерархическая классификация зародышевых мешков покрытосеменных (продолжение).
Семязачаток
243
лосеменных, среди них также известны биспорические женские гаметофиты у
Juniperus и тетраспорические у Gnetum и Wehvitschia. Эти факты имеют важное
эволюционное значение. Они свидетельствует о том, что после перехода к
семенному размножению и воспроизведению, некоторые функции мегаспор (такие,
например, как распространение и переживание неблагоприятных условий) были
утрачены в процессе эволюции, а функция инициации гаметофита оказалась
«размытой», т. е. распространенной на все стадии процесса мегаспорогенеза:
материнскую клетку мегаспор, клетки диад и, собственно, мегаспоры. В то же
время функции мейоза, как способа перевода ядер в гаплоидное состояние,
необходимо сохранились в связи с функциями полового воспроизведения и оказались во
многих случаях включенными в первые стадии развития женского гаметофита.
Заметим при этом, что переход к регулярному унипарентальному
воспроизведению, требующий сохранения диплоидного состояния ядер при экспрессии генов,
стимулирующих развитие гаметофита (в случаях наследуемого гаметофитного
апомиксиса) требует совершенно иных генетических адаптации и способов
сохранения диплоидного состояния ядер в гаметофите.
Очевидно, что такого рода изменения по своему эволюционному значению
важнее и шире, нежели, например, изменения числа делений свободных ядер в
процессе развития зародышевого мешка или распределения ядер перед цитокинезом.
Перенос внимания с клеток на ядра при определении типов зародышевого мешка
имеет, как мы увидим, существенное значение для их классификации. Но в любом
случае остается разделение зародышевых мешков на три типа моно-, би- и
тетраспорические (см. таблицу).
«Эндоспорическое» развитие зародышевых мешков в рамках ценоцитной
структуры (в сущности, многоядерной клетки), существенно влияет на характер
закономерностей их развития и особенности отклонений в развитии. Например,
развитие в рамках ценоцитной структуры допускает значительные перемещения
ядер и т. д.
При выделении подтипов, которые отражают особенности развития
зародышевых мешков, мы не сочли возможным использовать для их сравнения второй
критерий — число ядерных делений (митозов), происходящих после завершения
мейоза (Романов, Магешвари и др.). Этот критерий действует только в моноспориче-
ских зародышевых мешках, тогда как развитие би- и тетраспорических подобных
образований включает и мейотические деления. Более корректно считать число
делений от ядра инициальной клетки зародышевого мешка, разделяя в
необходимых случаях мейотические и митотические деления.
Кроме того, часто в процессе развития зародышевых мешков происходят мор-
фогенетические преобразования, не связанные с делениями ядер, но имеющие
существенное значение для дальнейших «шагов» развития. К таким
преобразованиям мы относим, во-первых, феномен Карано-Бамбачиони (слияние ядер,
результирующее повышение их плоидности), эффект замещения (когда деградирующие
ядра элиминируются в процессе развития и замещаются ядрами из другого их
клона) и процесс инверсии полярности зародышевого мешка (когда вследствие
своеобразных его разрастаний происходит замещение одного полюса другим)..
Перечисленные выше преобразования помогают точнее определить иерархический
ранг зародышевого мешка и его место в классификации. Однако главным
критерием определения подтипа является число ядерных делений, участвующих в его
развитии.
При равном числе ядерных делений вследствие разных причин (например,
эффекта Карано-Бамбачиони, иного типа слияния ядер, изменений ритмов ядерных
делений, характера цитокинеза) зрелый зародышевый мешок может содержать
различное число ядер и клеток. А закономерные перемещения и группировки
16*
244
Генеративные органы цветка
ядер создают оригинальную, устойчивую в рамках таксона, структурную
организацию сформированного зародышевого мешка. Именно эти критерии были
использованы нами при классификации вариаций зародышевых мешков. Все
отклонения в развитии, обусловленные иными причинами, можно рассматривать в
качестве некоторых форм или тератологических отклонений.
Конкретная организация зародышевого мешка и его способ развития
выражены в вариациях. Мы выделяем сегодня 17 таких вариаций. Кратко
прокомментируем их с учетом принадлежности к тому или иному типу и подтипу.
Моноспорический тип. Инициирующим развитие зародышевого мешка
ядром в этом типе является ядро одной из 4-х мегаспор. Развитие протекает в рамках
ценомегаспоры.
Polygonum-подтип характеризуется 3-мя митотическими делениями. Для
корректного сравнения с другими подтипами из иных типов необходима единая точка
отсчета. Такой общей точкой отсчета может быть только одноядерная материнская
клетка мегаспор. Поэтому, к числу митозов мы условно добавляем 2 мейотических
деления, которые не включаются в развитие зародышевого мешка Polygonum-
подтипа, но являются реальным морфогенетическим резервом, использованным
в процессе эволюции при создании других типов и большинства подтипов и
вариаций. Polygonum-подтип включает три вариации (см. табл.).
Polygonum-вариация. Первое иллюстрированное описание этой вариации было
сделано Страсбургером (Strasburger, 1879а) на примере Polygonum divaricatum.
Образуется в результате трех последовательных митотических делений ядер,
начиная от ядра жизнеспособной мегаспоры. Три остальные мегаспоры
разрушаются. В случае множественного археспория (Casuarinaceae, Rosaceae, Loranthaceae
и др.) конкурируют в развитии не разные мегаспоры одной тетрады, но
жизнеспособные (обычно, халазальные) мегаспоры разных тетрад. Обычно 8-ядерный,
изобиполя'рный зародышевый мешок имеет характерное распределение ядер:
3+2+3 (яйцевой аппарат с двумя синергидами, центральная двуядерная клетка и
3 антиподы). Наиболее вариабелен халазальный полюс. За счет выпадения
делений ядер и образования клеток сформированные зародышевые мешки Polygonum-
вариации часто содержат неполное их число. Это характерно для многих таксонов
из сем. орхидных, а также для микопаразитных представителей сем. вересковых,
например, Hypopithys monotгора и др. (Терехин, 1963).
Balanophora-вариация. Впервые подробно и с хорошими иллюстрациями была
описана Фагерлиндом (Fagerlind, 1945a) на примере Balanophora elongata и
Langsdorffia hypogaea. Зародышевый мешок развивается из микропилярной
мегаспоры тетрады. На двуядерной стадии гаметофита, у его халазального конца
образуется вырост, в который переходит нижнее ядро. Образовавшийся вырост
активно разрастается в микропилярном направлении и после 3-го митоза на этом
полюсе формируется яйцевой аппарат, ниже расположены два полярных ядра.
Поведение халазальных ядер крайне нестабильно. Хотя на халазальном полюсе
зародышевого мешка могут образоваться 4 ядра, антиподы видимо никогда не
образуются. Деления ядер на разных полюсах зародышевого мешка существенно не
синхронны у Balanophora thwaitesii. Часто образуются лишь 2 или даже 1 антипо-
дальное ядро, которое располагается в полости центральной клетки. Не редки
слияния халазальных ядер (Терехин, Яковлев, 1967). Все перечисленные
особенности развития зародышевого мешка Balanophora позволяют выделить ее
развитие в особую вариацию. Становление инверсии полярности зародышевого мешка
Balanophora связано, возможно, с тем, что у этого высокоспециализированного,
древнего паразитного растения развитие зародышевого мешка происходит
непосредственно в ткани миниатюрного пестика. Семязачаток, по-видимому, анатроп-
ный, в процессе эволюции полностью элиминирован. Инверсия зародышевого
Семязачаток
245
мешка — способ восстановления необходимого положения зародышевого мешка
для обеспечения эффективного оплодотворения.
Balsamita-вариация. Этот способ развития был впервые описан Фагерлиндом
(1939с) на примере Balsamita vulgaris. Магешвари (Maheshwari, 1950) отнес
пример с Balsamita в группу растений, не укладывающихся в классификацию, тогда
как Романов (1981) выделил тетраспорический Balsamita-тип. Своеобразие
развития зародышевого мешка Balsamita представлено двумя оригинальными
процессами. Инициальной клеткой зародышевого мешка является материнская клетка
мегаспор, что, по-видимому, и дало основание Романову поместить зародышевый
мешок Balsamita среди тетраспорических гаметофитов. Как видно на таблице, 4
ядра мегаспор располагаются в ценомегаспороците в соотношении 1 +3.
Жизнедеятельным остается только микропилярное ядро, остальные 3 ядра отмирают.
Таким образом, в развитии зародышевого мешка (на основе эффекта замещения)
участвует только одно из 4 ядер мегаспороцита. Мейотические деления не
участвуют в его развитии, которое происходит на основе 3 митозов одного из ядер
мегаспороцита. Кроме того, в процессе развития зародышевого мешка происходит
инверсия его полярности, подобная той, что была описана выше у Balanophora.
Эволюционные основания этой инверсии остаются неясными. Тем не менее
имеются, на наш взгляд, достаточные основания для определения способа развития
Balsamita в качестве оригинальной вариации Polygonum-подтипа моноспориче-
ского развития.
Oenothera-подтип. Моноспорический подтип развития Oenothera, в отличие от
развития подтипа Polygonum, завершается в результате 2 митозов.
Oenothera-вариация. Геертс (Geerts, 1908) установил, что у Oenothera
lamarckiana зародышевый мешок образуется обычно из микропилярной
мегаспоры тетрады и завершается в 2 митоза. Возникшие таким образом 4 ядра образуют
яйцеклетку, 2 синергиды и единственное полярное ядро. Таким образом,
зародышевый мешок Oenothera является униполярным образованием. С чем связано
отсутствие антиподального аппарата, неясно. До недавнего времени предполагали,
что эта вариация характерна лишь для таксонов сем. Onagraceae, однако в
последнее время Oenothera-вариация зародышевого мешка была обнаружена и у
некоторых таксонов из других семейств.
Apinagia (= Podostemum)-вариация. Магешвари (Maheshwari, 1950)
рассматривал весьма оригинальное развитие зародышевых мешков в сем.Podostemaceae в
качестве отклонений от биспорического Allium-типа зародышевого мешка.
Романов (1981) ввел развитие некоторых представителей сем. Podostemaceae в
качестве особого типа под условным названием Podostemon. Наибольший вклад в
расшифровку способов развития зародышевого мешка у представителей этого крайне
оригинального семейства водных растений внесли индийские исследователи
(Mukkada, 1962a, b; Arekal a. Nagendran, 1975a, b и др.) и известный итальянский
эмбриолог-аналитик Эмилио Батталья (Battaglia, 1971, 1987). Батталья тщательно
проанализировал все имеющиеся данные и пришел к выводу, что всем
представителям сем. Podostemaceae свойствен один оригинальный способ развития
зародышевого мешка, впервые описанный на примере Apinagia. Различия касаются
поведения ядер (дополнительные деления, быстрое или медленное их отмирание),
не участвующих в построении зародышевого мешка.
В зародышевый мешок развивается халазальная клетка диады, при этом в
каждой из клеток диады образуются по 2 ядра. Микропилярная клетка диады
вскоре полностью отмирает, а из 2 ядер халазальной клетки диады в развитии
зародышевого мешка участвует лишь одно микропилярное ядро. Халазальное ее
ядро постепенно отмирает или же этот процесс начинается после деления
халазального ядра, и тогда дегенерирующие ядра можно наблюдать и в сформирован-
246
Генеративные органы цветка
ном зародышевом мешке. Таким образом, в развитии зародышевого мешка
Apinagia-вариации проявляется эффект замещения. В результате 2 митозов мик-
ропилярного ядра халазальной клетки диады (что дает нам основание отнести
этот способ развития к моноспорическому типу) образуется 4-х ядерный, а затем
4-х клеточный зародышевый мешок.
Биспорический тип. Инициирующим развитие зародышевого мешка ядром
в этом типе является ядро халазальной клетки диады. В развитие зародышевого
мешка включается второе мейотическое деление.
Allium-подтип характеризуется тремя последовательными делениями ядер,
первое из которых является вторым мейотическим делением.
Allium-вариация. Впервые была описана Страсбургером (Strasburger, 1879a) на
примере Allium fistulosum. Зародышевый мешок развивается из халазальной
клетки диады в результате 3 последовательных делений (одно мейотическое деление, 2
митоза). Процесс реорганизации заключается в отмирании микропилярной клетки
диады. По распределению ядер, а затем и клеток зародышевого мешка
Allium-вариация вполне подобна таковой Polygonum: 7 клеток, 8 ядер (3+2+3), изобиполяр-
ный зародышевый мешок. Allium-вариация спорадически присутствует у таксонов
ряда семейств из разных систематических областей цветковых растений.
Тетраспорический тип. Инициирующим развитие зародышевого мешка
ядром является ядро мегаспороцита. В развитии участвуют все 4 ядра мегаспор и
оба мейотических деления.
Peperomia-подтип. Характеризуется 4-мя последовательными делениями ядер.
Вариации отличаются число ядер и клеток в зародышевых мешках и
особенностями их распределения.
Peperomia-вариация. Описана на примере Peperomia pellucida (Campbell,
1899а, Ь; Johnson, 1900). В процессе развития каждое из 4-х ядер ценомегаспоро-
цита делится дважды, образуя в совокупности 16 ядер, которые более или менее
равномерно распределяются в периферическом слое цитоплазмы зародышевого
мешка. Таким образом, его организацию можно определить как мультиполярную.
Характерная особенность — присутствие лишь одной синергиды. Основные
отклонения в развитии касаются числа ядер, участвующих в образовании первичного
ядра центральной клетки зародышевого мешка. Зародышевые мешки этой
вариации описаны также у некоторых видов Gunnera ( Halorrhagidaceae).
Penaea-вариация. Прямое развитие без преобразований весьма сходно с
таковым в Peperomia-вариации. Основные отличия в четко тетраполярной
организации сформированного зародышевого мешка и дифференциации 2-х синергид.
Впервые эта вариация была описана у трех родов: Penaea, Brachysiphon и
Sarcocolla (Stephens, 1909). В дальнейшем обнаружена у некоторых видов сем.
Malpigiaceae и Euphorbiaceae. Спорадически встречается в ряде других семейств.
Drusa-вариация. Шестнадцатиядерный зародышевый мешок был впервые
описан у Drusa oppositifolia (Hakansson, 1923). При этом способе развития после
завершения мейоза в ценомегаспороците 3 ядра мегаспор опускаются в его базаль-
ный конец. Такое размещение в результате 2-х последовательных митозов
переходит в соотношение 2+6, а затем 4+12. Микропилярные ядра образуют яйцевой
аппарат и верхнее полярное ядро, а 12 нижних ядер образуют 11 антипод и нижнее
полярное ядро. Общая организация зародышевого мешка: 3+2+11, гетеробиполяр-
ная. Вариация спорадически встречается и у некоторых других растений,
например, у видов Crucianella, Tanacetum, Ulmus и, что особенно интересно, например,
у Chrysanthemum parthenium. Это приближает нас к описанию двух следующих
вариаций.
Мартиноли (Martinoli, 1939) описал два вполне оригинальных способа
образования зародышевого мешка у одного и того же вида — Chrysanthemum
Семязачаток
247
cinerariaefolia. Магешвари (Maheshwari, 1950) отнес их к типам, не
укладывающимся в классификацию. Мы, вслед за Амбегаокаром (Ambegaokar, 1984, цит. по
Willemse, van Went, 1984) считаем возможным включить их в классификацию
зародышевых мешков в качестве 2 оригинальных вариаций.
Chrysanthemum cinerariaefolia I-вариация. После завершения мейоза в
ценомегаспороците ядра 4 мегаспор оказываются расположенными в одном вертикальном
ряду, при этом 2 крайние ядра расположены у полюсов, а 2 средних сближены в
центре мегаспороцита. Центральные ядра далее не делятся (но и не отмирают), а
впоследствии выполняют в зародышевом мешке роль полярных ядер. Микропилярное
ядро делится дважды и впоследствии его 4 производный образуют яйцевой аппарат
и верхнее полярное ядро (третье!). 4 халазальных ядра образуют 4 антиподы.
Chrysanthemum cinerariaefolia П-вариация. 2 центральных ядра (из
образовавшихся 4-х ядер ценомегаспороцита) сливаются, образуя диплоидное ядро. Затем
все ядра ценомегаспороцита последовательно и синхронно дважды делятся. Мик-
ропилярная четверка гаплоидных ядер образует яйцевой аппарат и верхнее
полярное ядро. Халазальная четверка гаплоидных ядер образует 4 клетки антипод.
Из центральной четверки диплоидных ядер одно функционирует в качестве
нижнего полярного ядра, а остальные три образуют дополнительные антиподальные
клетки. Число делений гаплоидных ядер на халазальном конце нестабильно: 1 или
2 их деления могут выпадать.
Таким образом, в этой вариации развития мы встречаемся с двумя
преобразованиями: эффектом слияния 2 ядер, с образованием диплоидного ядра и с
частичным замещением диплоидными клетками гаплоидных антипод.
Fritillaria-вариация. Бамбачиони (Bambacioni, 1928a, b) показал, что у
некоторых видов Fritillaria и Lilium образование 4 ядер мегаспор в ценомегаспороците
приводит к вторичной 4-х ядерной стадии. При расположении ядер мегаспор 1 +3,
халазальные ядра лежат близко друг к другу. При следующем делении три
веретена халазальных ядер сливаются, формируя в результате последующего деления 2
триплоидных ядра (эффект Карано-Бамбачиони). Микропилярное ядро остается
гаплоидным и делится. В результате следующего деления образуются 4
гаплоидных (на микропилярном полюсе) и 4 триплоидных ядра. В итоге сформированный
зародышевый мешок, после слияния полярных ядер состоит из гаплоидных клеток
яйцевого аппарата, тетраплоидного ядра центральной клетки и 3-х триплоидных
антипод. Такой способ развития был впоследствии описан у ряда видов Lilioidea и у
представителей некоторых других семейств, например, у Piper, Rudbeckia,
Erithronium, Cardiocrinum, Tamarix, Cornus, некоторых видов Tulipa и др.
Adoxa-подтип. Характеризуется 3-мя последовательными делениями ядер
мегаспороцита.
Adoxa-вариация. Впервые была описана у Adoxa moschatellina (Jonsson, 1879—
1880). Образуется в результате 1 митоза 4 ядер ценомегаспороцита. В результате
формируется семиклеточный, восьмиядерный (3+2+3), изобиполярный
зародышевый мешок. Описана позднее у Adoxa, Sambucus и некоторых видов Erithronium,
Tulipa и Ulmus. У Erithronium americana и некоторых видов Ulmus развитие
зародышевых мешков следует иногда Adoxa-вариации, а иногда Fritillaria-вариации.
Возможно, что Fritillaria-вариация является производной от таковой Adoxa.
Plumbago-вариация. Описана впервые у Plumbago capensis (Haupt, 1934).
Особенность вариации в распределении ядер после первого митоза в
ценомегаспороците. В сформированном зародышевом мешке одиночная яйцеклетка без
синергид. В центральной клетке 4 полярных ядра. Оставшиеся 3 ядра иногда образуют
у стенок зародышевого мешка яйцеклеткоподобные структуры, но обычно они
отмирают и в зрелом зародышевом мешке отсутствуют. Эта вариация ограничена
тремя родами сем. Plumbaginaceae.
248
Генеративные органы цветка
Plumbagella-вариация. Была впервые описана только у Plumbagella micrantha
(Fagerlind, 1938b). 4 ядра в мегаспороците располагаются по формуле 1+3. В
результате слияния 3 халазальных ядер образуется вторичная двуядерная стадия.
После единственного митоза образуется весьма оригинальная конструкция
зародышевого мешка (1+2+1): одиночная яйцеклетка, тетраплоидное ядро
центральной клетки и одна триплоидная антипода.
Tulipa tetraphylla-вариация. Была описана Романовым (1971) у одноименного
вида. В ценомегаспороците распределение ядер мегаспор по схеме: 3+1. После
одного митоза в зародышевом мешке образуется яйцевой аппарат с одной
яйцеклеткой и 4 синергидами; 2 полярных ядра и 1 антипода.
Eriostemones-вариация. Описана Романовым (1971) у видов секции
Eriostemon.es рода Tulipa. Развитие протекает сходно с таковым у Tulipa
tetraphylla. Однако, все 8 ядер оказываются в микропилярном конце
зародышевого мешка, где образуется яйцевой аппарат из яйцеклетки и 6 синергид. Одно из
ядер выполняет роль верхнего полярного ядра. Антиподы отсутствуют.
Анализ процессов мегаспорогенеза и мегагаметогенеза привел нас к
следующим заключениям.
В процессе эволюции женского гаметофита неоднократно и в разных частях
системы семенных, особенно, покрытосеменных растений происходили сложные
адаптивные преобразования, имевшие разное значение для судьбы самого семени
и различную степень распространения среди таксонов.
Различия в способах образования зародышевых мешков при единообразии их
конечной организации: 8 (3+2+3) свидетельствуют о существенном значении
изменений развития женского гаметофита для адаптивных эволюционных
преобразований семязачатков. Эта тема, к сожалению, слабо исследована эмбриологами.
В формировании зародышевых мешков разных типов, подтипов и вариаций
участвуют многообразные морфогенетические процессы, поэтому определять пути
развития женского гаметофита на основе немногих и определенных критериев,
очевидно, недостаточно.
И последнее, учитывая генетические аспекты проблемы, видно более
правильно ориентироваться (при определении места той или иной вариации в
классификации) на участии в развитии зародышевых мешков ядер мегаспор, ядер клеток
диады и ценомегаспороцита.
Романов, 1944, 1971а, 1981; Терехин, 1963, 1991; Терехин, Яковлев, 1967; Arekal, Nagendran, 1975a,
b; Bambacioni, 1928a, b; Battaglia, 1971; Campbell, 1899a, b; Fagerlind, 1938, 1939c, 1945a; Geerts, 1908;
Hakansson, 1923; Haupt, 1934; Jonsson, 1879—1880; Johnson, 1900; Johri, 1963; Maheshwari, 1950;
Martinoli, 1939; Mukkada, 1962a, b; Palm, 1915; Rutishauser, 1969; Strasburger, 1879a; Shnarf, 1936;
Stephens, 1909.
ЭВОЛЮЦИЯ ЖЕНСКОГО ГАМЕТОФИТА
После того как Strasburger (1884) открыл явление оплодотворения (сингамию)
у цветковых растений, Le Monnier (1887) высказал предположение, что слияние
полярных ядер в центральной клетке зародышевого мешка также является актом
оплодотворения, сравнимым с оплодотворением яйцеклетки. Он предложил
рассматривать эндосперм цветковых растений в качестве второго зародыша,
преобразованного в процессе эволюции в питательную ткань для зародыша,
развивающегося из зиготы. Для С.Г.Навашина (1899 — Цит. по: Навашин, 1951 а), который
открыл явление «тройного» слияния (слияния двух полярных ядер или
производного от них ядра центральной клетки с ядром второго спермия), было вполне
логично не только присоединиться к этой точке зрения, но и назвать функции обоих
спермиев единым термином «двойное оплодотворение» (Навашин, 1900).
Представление об эндосперме как «втором зародыше» бытует и до сих пор (Favre-
Семязачаток
249
Duchartre, 1984), но, (что важно!), с той поправкой, что антиподы принадлежат
соматической ткани гаметофита.
Для большинства исследователей, признающих феномен «двойного
оплодотворения», зародышевый мешок (женский гаметофит) покрытосемянных является не-
отеническим образованием, т. е. следствием общей редукции женского гаметофита
голосемянных растений (Романов, 1944,1971; Battaglia, 1951; Герасимова-Наваши-
на, 1958 и др.). Считая таким образом, что развитие женского гаметофита
цветковых растений заканчивается (как и у голосемянных!) формированием половых
структур, многие исследователи, которые не могли согласиться с идеей
«эндосперма как второго зародыша», отделяют эндосперм от женского гаметофита,
рассматривая его как новообразование (Schnarf, 1942; Swamy, 1974). У такого
представления есть две главные точки опоры: 1) эндосперм цветковых является как бы
продуктом оплодотворения и 2) в отличие от моноплоидного эндосперма (в сущности,
проталлия) голосемянных, эндосперм покрытосемянных «в норме» является трип-
лоидным образованием (в отличие от остальных структур зародышевого мешка).
С другой стороны, у?ке Strasburger (1900), проведя всесторонний анализ
проблемы, предположил, что «тройное слияние» не является настоящим
оплодотворением, а лишь стимулом к развитию эндосперма. Battaglia (1951), вслед за Maheshwari
(1950), обоснованно отвергая оба варианта «архегониалыюй» гипотезы Porsch
(1907) nSchurhoff (1919,1928), также предположил, что «тройное слияние»
является стимулом к митотической активности центральной клетки. Он, тем не менее, был
сторонником идеи об общей редукции эндосперма при эволюционном переходе к по-
крытосемянности и рассматривал эндосперм цветковых в качестве «вторичного»
эндосперма, а антиподы — в качестве остатков первичного эндосперма,
гомологичного эндосперму голосемянных.
Fagerlind (1941) наиболее точно и полно сформулировал основные положения
«гнетовой» гипотезы: 1) полярные ядра центральной клетки зародышевого мешка
покрытосемянных соответствуют последним остаткам «свободных» ядер Gnetum
и ранним стадиям развития гаметофитов других голосемянных; 2) центральная
вакуоль зародышевого мешка цветковых гомологична таковой у Gnetum и других
голосеменных; 3) яйцеклетка гомологична фертильным периферическим клеткам
Gnetum или «задержанным» в своем развитии архегониям, а антиподы
соответствуют «нижней» питательной ткани гаметофита Gnetum; 4) эндосперм цветковых
— это «задержанная» в своем развитии ткань гаметофита, дальнейшее развитие
которой стимулируется слиянием с мужской гаметой. Эти заключения не
означают, однако, что цветковые произошли от Gnetum, но обозначают направление
изменений в эволюции женского гаметофита при переходе к покрытосемянности.
Кажется удивительным, что, несмотря на все эти усилия, большинство
эмбриологов остаются приверженными идее «двойного» оплодотворения и эндосперма
как новообразования, не принадле?кащего собственно гаметофиту. Вероятно, в
связи с этим существует необходимость время от времени напоминать об уже
высказанных идеях и аргументах, приводить новые факты и дополнительные
аргументы, чтобы представления научного сообщества соответствовали истинным
результатам эволюционного процесса. Battaglia (1951), а затем Герасимова-Наваши-
на (1958) развили идеи Fagerlind (1941) о замещении яйцеклеток, образующихся
в архегониях голосемянных (за исключением Gnetum и Welivitschid) их
предшественниками, т. е. клетками, образующимися в микропилярной зоне гаметофита
покрытосеменных на ранних стадиях развития. Ошибка Battaglia (1951), на наш
взгляд, состояла в том, что, отмечая редукцию архегониальных структур, он
включал ее, тем не менее, в процесс общей редукции женского гаметофита.
Подводя некоторые итоги, можно выделить три основных заблуждения, которые
сегодня присущи большинству эмбриологов: 1) представление об общей редукции
250
Генеративные органы цветка
женского гематофита семенных растений в связи с переходом к покрытосемянно-
сти; 2) представление о том, что слияние ядра второго спермия с ядром (ядрами)
соматической центральной клетки является одним из актов «двойного»
оплодотворения, и 3) представление о том, что эндосперм цветковых представляет собой
«новообразование», не гомологичное проталлию (эндосперму) голосемянных или его
части.
Критически рассмотрим, прежде всего, последнее из этих заблуждений, что
поможет прояснить вопрос и о первых двух. Пожалуй, Смирнов (1982) первым
усомнился в том, что эволюция от голо- к покрытосемянным сопровождалась общей
редукцией женского гаметофита, в состав которого у цветковых он включает и
эндосперм как образование, «существенно гомологичное» проталлию голосемянных.
Он считает, что попытки рассматривать эндосперм цветковых в качестве «второго
зародыша» или «новообразования» принципиально изменяют «композицию»
(организацию) взаимодействующих структур в семени в процессе смены поколений,
что мало вероятно и в чем нет необходимости. Он выдвинул гипотезу перехода от
однофазового к двуфазовому развитию женского гаметофита в связи со
становлением покрытосемянности. Речь идет о том, что слабо эффективное оплодотворение
яйцеклеток у голосеменных, происходящее в архегониях, образующихся на
конечных стадиях развития женского гаметофита (и семени в целом), смещается у
цветковых на ранние стадии развития гаметофита и становится фактором,
способствующим развитию только фертильных семян.
По нашему мнению (Терехин, 1991), это было обусловлено избирательной ре^
продукцией половых (архегониальных) структур гаметофита и замещением их
онтогенетическими предшественниками.
В этой связи интересно рассмотреть изменение «композиции» гомологии в связи
с покрытосемянностью. Достаточно очевидно, что для голосеменных характерна
единообразная зональность женского гаметофита, связанная с его поляризацией
(поляризованная зональность). Полезно обсудить ее кратко на менее сложных
моделях «IVelwitschia» или «Gnetum». В микропилярной зоне гаметофита
формируются половые структуры (яйцеклетки); центральная часть занята запасающей
питательной тканью (трофофит, по Pearson, 1929), халазальная зона представляет
собой гаусториальный структурно-функциональный комплекс. Это достаточно
рациональная организация, учитывая пути подхода питательных веществ из
материнского растения, содной стороны, и путь спермиев к женскому гаметофиту, сдру-
гой. Это находит подтверждение во всех известных нам работах по развитию семян
у голосемянных растений и в наших наблюдениях развития семени у Thuja
occidentalis и Taxus baccata.
Становление такой организации происходит у голосемянных постепенно, в
течение развития гаметофита. У покрытосемянных с «нормальным» типом
зародышевого мешка подобная же «композиция» устанавливается быстро («одномоментно»)
и синхронно в процессе первичного клеткообразования. При этом яйцевой аппарат
(яйцеклетку и синергиды) мы относим к половому микропилярному комплексу,
центральную клетку рассматриваем в качестве инициального гомолога трофофита,
а антиподы на халазальном полюсе гаметофита — в качестве гаусториальных
структур. В процессе дальнейшего развития в халазальной части структуры
трофофита часто образуется новый гаусториальный комплекс, замещающий эфемерные
антиподы. Возможные отклонения, как-то: образование эндоспермальных гаусто-
риев в микропилярной части трофофита (например, у норичниковых) или гаусто-
риальная активность синергид, не нарушают общей принципиальной организации.
Доводы в пользу трофофита (эндосперма) цветковых как новообразования, в
связи с его плоидностью и «тройным слиянием» не представляются нам
убедительными. Battaglia (1951) уже рассматривал вопрос о плоидности вторичного яд-
Семязачаток
251
ра центральной клетки и пришел к выводу, что это не изменяет представления об
этой структуре женского гаметофита как соматической, а не половой.
Действительно, рассматривая зародышевые мешки с нередуцированными (диплоидными)
клетками в некоторых формах апомиксиса, мы не отрицаем их гомологичность
гаплоидным зародышевым мешкам того же типа. Почему же эту позицию нужно
менять в отношении эндосперма? Хотя в целом у покрытосемянных не
наблюдается общей редукции эндосперма (и, следовательно, женского гаметофита), в
отдельных таксонах паразитных покрытосемянных, специализированных на
максимальное производство семян в каждой завязи, происходит редукция эндосперма
и, в исключительных случаях, его полная элиминация. Мы кратко рассмотрим
некоторые из примеров, так как они, на наш взгляд, подтверждают приведенные
выше суждения о морфологической природе эндосперма цветковых
В пылевидных семенах представителей подсем. Pyroloideae сем. Ericaceae с
редуцированными зародышами клеточной эндосперм также слабо развит и степень
его развития связана со степенью редукции зародышей.Этот процесс часто
сопровождается редукцией халазальных структур зародышевого мешка (Терехин,
1977). Вместо трех антиподальных клеток формируются две клетки или даже
иногда одна с тремя пиктоническими ядрами. Таким образом, в связи со слабым
развитием эндосперма (трофофита) редуцируются и обеспечивающие его гаусториаль-
ные структуры. Сходная картина наблюдалась нами и у Balanophora thwaitesii
((Терехин, Яковлев, 1967). При этом пикнотизированные халазальные ядра часто
сливаются и остаются в общей с полярными ядрами клетке, которая
функционирует в качестве инициальной (центральной) клетки слабо развитого трофофита.
Значительно дальше заходит процесс редукции у высокоспециализированных
микропаразитных орхидных. У этих растений полностью отсутствует, вследствие
особенностей их биологии (Терехин, 1977), необходимость в эндосперме после
созревания семени. При сильнейшей редукции зародыша здесь наблюдается
крайние формы редукции эндосперма. Так у Neottia nidus-avis в центральной клетке
образуется всего 4 свободных ядра, тогда как предшественники антиподальных
ядер и клеток (включая халазальное полярное ядро) пикнотизируются еще на
стадии 4-х ядерного зародышевого мешка и исчезают ко времени первого или
второго деления «оплодотворенного» микропилярного ядра (Терехин, Камелина,
1969, 1972). Сходная картина наблюдается и у некоторых других
специализированных орхидей, например в роде Epipactis и др.
Еще дальше заходит процесс редукции у Habenaria linearifolia (Терехин,
Камелина, 1972). Хотя здесь и образуются три антиподальные клетки и оба
полярных ядра, после слияния ядра центральной клетки с ядром спермия, возникшее
ядро не делится, а, увеличившись в размерах, вскоре пикнотизируется. Таким
образом, стимулирующая роль второго спермия в развитии центральной клетки
утрачивается.
Сравним оба примера: у Neottia после слияния верхнего полярного ядра с
ядром второго спермия слабо развивается диплоидный ядерный эндосперм, а у
Habenaria, в этой же ситуации ядро центральной клетки не делится.
По-видимому, второй спермий обладает лишь сигнальной (триггерной), а не стимулирующей
митозы функцией, как считал Battaglia (1951). Вероятно, также, что уровень
плоидности ядра центральной клетки не имеет решающего значения в его развитии.
Следует заметить, что здесь мы описали крайне выраженные эволюционно
отработанные случаи угнетения развития трофофита.
Не затрагивая в этой статье явления гаметофитного апомиксиса (их значение
в эволюции женского гаметофита отчасти обсудил Battaglia в 1951), рассмотрим
еще два наиболее ярких примера, прямо относящихся к обсуждаемой нами теме.
У Ophrys insectifera (Савина, 1972) и, возможно, у Arundia speciosa, двух видов
252
Генеративные органы цветка
Phajus (Навашин, 1951) и 7"richosmasuavis (Баранов, 1917) редукцияхалазальной
и уже центральной части зародышевого мешка заходит столь далеко, что спермий,
попадая в центральную клетку (где могут обитать и халазальные ядра) не
сливается с полярными ядрами. Он остается обособленным до общей дегенерации ядер
центральной клетки. Но в этом состоянии центральная клетка (суперминитрофо-
фит) способна обеспечить развитие редуцированного зародыша питательными
веществами. Именно в этом случае зачаток эндосперма содержит гаплоидные ядра,
которые не сливаются, но вся структура функционирует в качестве гаплоидного
минипроталлия (точнее, в качестве соматической ткани проталлия после
образования половых структур). При этом общая динамическая «композиция»
(поляризованная зональность) здесь соблюдается.
Совокупность приведенных примеров достаточна на наш взгляд, для
выяснения гомологии структур женского гаметофита у покрыто- и голосемянных
растений. Они подтверждают представления Fagerlind (1941) с тем, однако,
дополнением, что центральная клетка зародышевого мешка гомологична центральной
области (трофофиту) голосемянных, а антиподы гомологичны базальной
гаусториальной зоне гаметофита голосемянных.
Приведем еще один пример, в котором диссонанс между эволюционным
происхождением структуры и ее изменяющейся функцией подчеркивает единство
«композиции» женских гаметофитов голо- и покрытосемянных растений. В Apinagia
(=Podostemum)-THne развития зародышевого мешка у представителей сем.
Podostemaceae (Battaglia, 1971, 1987) четко прослеживается та же тенденция к
редукции халазальных структур зародышевого мешка, что и на выше приведенных
примерах. Адаптация к очень своеобразному водному образу жизни в
быстротекущих водах с резкой сменой дождливых и сухих сезонов, привела к следующим
изменениям. Зародышевый мешок формируется за счет четырех микропилярных
ядер. Под основанием развивающегося зародышевого мешка образуется
своеобразный перисперм, представленный свободноядерной структурой (Arecal, Nagendran,
1975а, b). Обычно на микропилярном полюсе формируются две синергиды, под
ними — яйцеклетка и в основании клетка, гомологичная центральной, но
выполняющая антиподальную (гаусториальную) функцию (Терехин, 1991).
Оплодотворение — одинарное (функционирует только спермий, ядро которого сливается с
ядром яйцеклетки (Mukkada, 1969; Battaglia, 1971). Невозможность участия второго
спермия зародышевого мешка в оплодотворении подтверждается косвенно
частичным изменением числа и расположения структур зародышевого мешка: в
некоторых случаях образуется одна синергида, яйцеклетка и две базальные клетки.
Иногда нарушается и общая «композиция» расположения клеток зародышевого
мешка. Однако, неясно: это нормальное событие или искажение развития.
Этот пример, на наш взгляд, еще раз подчеркивает принципиальное сходство
организации женских гаметофитов цветковых и голосемянных растений.
По-видимому, подобные примеры, существенно сужающие хиазму между голо- и
покрытосемянными растениями в области семенного воспроизведения будут
умножаться, тогда как едва ли мы когда-нибудь увидим хотя бы один пример,
доказывающий «зародышевую» природу эндосперма или его особую роль, как
«новообразования».
Удивительно, насколько легко эмбриологи восприняли идею «двойного»
оплодотворения С.Г.Навашина (1898). Удивительно, что несколько поколений
исследователей в большинстве своем не подвергают ее критическому осмыслению.
Аргументы, приведенные Fagerlind (1941), Battaglia (1951), Смирновым (1982) и в
этой статье, в отношении гомологии основных структур женского гаметофита
цветковых и голосемянных растений, достаточно весомы и никто еще не пытался
(возможно, именно по этой причине) их столь же аргументированно оспорить. Следует
Семязачаток
253
отметить, что проникновение во все более интимные (тонкие) структуры женского
гаметофита с помощью все более совершенных технических средств не может, по-
видимому, дать ответы на обсуждаемые здесь вопросы. Эти ответы «лежат» в
другой исследовательской области — в сравнительной и экологической морфологии,
которая сегодня, в период увлечения «инструментальной» эмбриологией,
пользуется, к сожалению, все меньшим вниманием.
Приведенные в предыдущем разделе материалы свидетельствуют о
принципиальном соответствии организации женского гаметофита у голо- и
покрытосемянных растений (о сходстве «композиции», по Смирнову, или «поляризованной
зональности», как это было сказано выше и что, вероятно, точнее). Как справедливо
заметил Смирнов (1982), система онтогенеза, при которой эндосперм цветковых
принимается за второй зародыш (к чему логически неизбежно ведут все варианты
архегониальной гипотезы) требует коренной перестройки исторически
складывающихся отношений между женским гаметофитом, зародышем и материнским
спорофитом. При этом требуется, чтобы естественная метаболическая и морфогене-
тически преемственная взаимосвязь между зародышем и проталлием была
заменена взаимосвязью между зародышем и второй эндоспермоподобной структурой
дополнительного зародыша, с приобретением последним всех основных
признаков и свойств проталлия. В этом случае, кстати, невозможно представить себе
происхождения цветковых не только от голосемянных, но и от любой известной
группы высших или даже низших растений. Подчеркнем, что твердо установленная,
по нашему мнению, гомология эндосперма цветковых и трофофита (центральной
части эндосперма) голосемянных неопровержимо свидетельствует о том, что
центральная клетка зародышевого мешка является соматической, а не половой
структурой. Следовательно, оплодотворение у цветковых растений, как и во всех
других таксонах растительного мира, является одинарным и сводится к слиянию
ядра спермия с ядром яйцеклетки, т.е. к единичному (индивидуальному) акту
конъюгации мужской и женской половых клеток. Выше мы показали, что в
некоторых специализированных таксонах паразитных и водных растений сигнальная
(«триггерная», по Терехину, 1991) роль ядра второго спермия по отношению к
ядрам центральной соматической клетки может быть частично, а затем и полностью
утрачена. Для более полного представления о характере эволюционных
процессов, связанных с оплодотворением или, точнее, с функционированием
«дополнительных» спермиев, необходимо, по-видимому, провести анализ поведения
«дополнительных» спермиев в некоторых таксонах голосемянных растений.
Согласно современным сведениям, в большинстве случаев у голосемянных
растений второй спермий (или второе ядро спермия) не участвует в процессе
оплодотворения. Так, у Araucaria, Pinus и Podocarpus в рецептивную вакуоль яйцеклетки
попадают оба спермия, однако в оплодотворении участвует лишь один из них, тогда
как второй вскоре дегенерирует. В сем. Taxodiaceae, а также у Juniperus в
яйцеклетку обычно проникает больший из спермиев, тогда как другой остается в пыльцевой
трубке и также дегенерирует (Chamberlain, 1935; Кондратьева, Тихова, 1982).
Между тем у голосемянных известны случаи спонтанного и даже
закономерного участия второго спермия в процессах, связанных с оплодотворением. Favre-
Duchartre (1984) делит такого рода явления на две категории. Во-первых, это
случаи межархегониального оплодотворения, когда происходит проникновение обоих
спермиев (или сперматозоидов) из одной пыльцевой трубки в соседние архегонии.
Такие случаи описаны у Ginkgo и Callitris (Lotsy, 1899; Favre-Duchartre, 1956).
Во-вторых, это слияние ядра второго спермия с неполовыми ядрами того же
самого архегония. Такое спонтанное внутриархегониальное «двойное»
оплодотворение описано у Thuja, Abies, Pseudotsuga, Ephedra и Ginkgo (Land, 1907;
Hutchinson, 1915; Herzfeld, 1922, 1927; Khan, 1940, 1943; Mulay, 1941). Pearson
254
Генеративные органы цветка
(1929), Герасимова-Навашина (1958) и Friedman (1990) рассматривают такие
случаи в качестве прообраза «двойного» оплодотворения. В некоторых случаях эти
спонтанные явления приобретают биологический смысл в состязательности. Так,
у Cycadaceae и Ginkgo оба сперматозоида входят или, по крайней мере, пытаются
проникнуть в яйцеклетку (Swamy, 1948; Lee, 1955). У Gnetum оба спермия
проникают в терминальную область женского гаметофита и продвигаются к
ближайшему половому ядру (Swamy, 1973). Иногда ядра обоих спермиев сливаются с двумя
соседними половыми ядрами (Lotsy, 1899).
Сперматозоиды и спермин как бы продолжают, при этом, начавшийся ранее
процесс «состязания» мужских гаметофитов. Например, в пыльцевой камере
Ginkgo обычно прорастает несколько пыльцевых зерен, но как только
сперматозоиды высвобождаются из какой-либо пыльцевой трубки, другие пыльцевые
трубки начинают дегенерировать (Lee, 1955). Сходная картина конкурентного
поведения на этой стадии онтогенеза наблюдалась и у Welwitschia (Pearson, 1929).
Friedman (1990) пришел к выводу, что «двойное» оплодотворение у Ephedra
nevadensis является закономерным процессом, поскольку ядро второго спермия
регулярно сливается с брюшным канальцевым ядром (сестринским ядру
яйцеклетки). В этом последнем случае мы действительно наблюдаем явление, сходное
с «картиной» оплодотворения у цветковых, когда ядро второго спермия
закономерно сливается с неполовым ядром, в сущности, с ядром относящимся к
соматическим структурам полового органа.
Из этого, на наш взгляд, следует, что в процессе эволюционного развития
женского гаметофита голосемянных по модели Welwitschia (у которой, по-видимому,
нет строгой границы между половыми и соматическими клетками микропилярной
зоны гаметофита и оплодотворение происходит на клеточной стадии развития, а
ядра в первичных клетках, в том числе и половых, способны к слияниям) —
вполне возможен переход от спонтанного к закономерному функционированию обоих
спермиев, т. е. к «двойному» оплодотворению (на основе предшествующего
конкурентного поведения).
Таким образом, в некоторых «модельных» таксонах голосемянных мы
находим, по-отдельности, все основные слагающие «двойного» оплодотворения
цветковых: спонтанное слияние ядра второго спермия с соматическим (у ряда
таксонов) ; слияние ядер одной соматической клетки между собой в зоне, соседствующей
с половыми клетками (у Welwitschia), и переход первого из этих явлений в
закономерную форму {Ephedra canadensis).
Соединение этих элементов в единую систему у какого-то, неизвестного пока,
предкового для покрытосемянных таксона (или таксонов) и привело к известной
сегодня модели «двойного оплодотворения». Для этого, по-видимому, необходимо
было сочетание такого типа развития женского гаметофита, при котором,
одновременно с клеткообрзованием, происходила дифференциация половых (гаметы),
транзиторных (синергиды), трофических (центральная клетка) и гаусториаль-
ных (антиподы) структур. К этой модели «композиции» системы полового
воспроизведения у цветковых более всего близка модель «Welwitschia» которая,
однако, не отвечает всем вышеназванным условиям.
Среди цветковых таковым условиям более всего отвечают «композиции» семи
клеточных, восьмиядерных зародышевых мешков Polygonum- (моноспориче-
ский), Allium (биспорический)- или Adoxa (тетраспорический)-вариаций.
Учитывая широкое распространение среди покрытосемянных моноспорического типа
полового воспроизведения, возможно, именно этим обстоятельством (а не большой
древностью) можно объяснить и широкое распространение Polygonum-подтипа
зародышевого мешка у цветковых.
Семязачаток
255
Довольно многочисленные отклонения от «нормального» типа развития и
строения зародышевых мешков у цветковых растений требуют, по-видимому, более
широких и детальных исследований с целью выяснения их конкретно-адаптивного
онтогенетического или экологического смысла. Вероятно, только полное
освобождение от фетиша «двойного оплодотворения» и разного рода «близнецовых» и
«новообразовательных» гипотез позволит нам продвинуться вперед в выяснении
эволюционного смысла и значения фракционированного развития женского
гаметофита покрытосемянных, его ключевого звена — оплодотворения и проблемы
полового воспроизведения семенных растений в целом.
Баранов, 1917; Герасимова-Навашина, 1958; Кондратьева, Тихова, 1982; Навашин, 1951а; Поддуб-
ная-Арнольди, 1976; Романов, 1944, 1971а; Савина, 1972; Терехин, 1977, 1991; Терехин, Яковлев,
1967; Терехин, Камелина, 1969,1972; Arecal, Nagendran, 1975; Battaglia, 1951,1971,1987; Chamberlain,
1935; Fagerlind, 1941; Favre-Ducharlre, 1984; Friedman, 1990; Herzfeld, 1922, 1927; Hutchinson, 1915;
Khan, 1940, 1943; Land, 1907; Lee, 1955; Le Monnier, 1887; Lotsy, 1899; Maheshwari, 1950; Mukkada,
1969; Mulay, 1941; Navaschin, 1898; Pearson, 1929; Porsch, 1907; Schnarf, 1942; Schurhoff, 1919, 1928;
Strasburger, 1884, 1900; Swamy, 1948, 1973, 1974.
ТРАНСПОРТ ВЕЩЕСТВ В СЕМЯЗАЧАТКЕ
ПРОВОДЯЩАЯ СИСТЕМА СЕМЯЗАЧАТКА
Васкулярное снабжение семязачатка обеспечивается терминальными
ответвлениями проводящих пучков гинецея, проходящих через плаценту в фуникулус и
оканчивающихся у большинства покрытосеменных в халазе.
Окончания проводящих пучков могут быть в той или иной степени
разветвленными. Ответвления большей частью короткие и не выходят за пределы халазы, как
это имеет место у ряда представителей Euphorbiaceae (Landes, 1946), или они могут
иметь продолжение в интегументах или, реже всего, в нуцеллусе. Вхождение
проводящего пучка в нуцеллус описано, в частности, Kershaw (1909) для Myricagale.
Однако, на приведенном этим автором рисунке в центральной части нуцеллуса
изображено три ряда удлиненных в направлении оси нуцеллуса клеток, которые могут
быть уподоблены лишь прокамбиальным элементам и отличаются от
дифференцированных васкулярных элементов, входящих в состав интегументальных
проводящих пучков на той же стадии развития семязачатка. К сожалению данных о
дальнейшей судьбе прокамбиального тяжа нуцеллуса автор не приводит. Согласно
Fagerlind (1947) у Anacolosafrutescens и Strombosia zeylanica (Olacaceae)
проводящие пучки в нуцеллусе доходят непосредственно до основания зародышевого
мешка, окружая его базальную часть. У представителей семейств Asclepiadaceae,
Capparidaceae, Resedaceae, Casuarinaceae, Liliaceae, Thymelaeaceae, Olacaceae
обнаружены так называемые нуцеллярные трахеиды, рассеянные в нуцеллусе и не
имеющие непосредственной связи с проводящими пучками (Johri, Kapil, 1953;
Gupta, Rajeswari, 1977). Согласно Landes (1946) появление васкулярных элементов
в нуцеллусе связано с гипертрофированным ростом халазальной ткани. В целом
наличие сосудистых элементов в нуцеллусе известно для видов, относящихся к 17
семействам. При этом вопрос о присутствии васкулярной ткани в нуцеллусе не
может считаться решенным. В литературе высказывались обоснованные сомнения в
том, относятся ли отдельные трахеидоподобные клетки, встречающиеся в
нуцеллусе, действительно к системе проводящей ткани или просто являются клетками с
сетчатыми утолщениями стенок (Bouman, 1984).
Присутствие дифференцированных проводящих пучков в интегументах
констатировано для большого числа представителей покрытосеменных. По
сообщению Bouman (1984), проводящие пучки в наружном интегументе обнаружены по
меньшей мере у 80 семейств (Annonaceae, Cucurbitaceae, Euphorbiaceae,
Leguminosae, Magnoliaceae, Myristicaceae, Rosaceae, Sterculiaceae, Vitaceae). Xa-
256 Генеративные органы цветка
рактер васкуляризации варьирует от простого пучка в антирафе до густой сети
мелких пучков по всему интегументу (Kuhn, 1928).
Во внутреннем интегументе васкулярные пучки описаны у представителей
семейств Dipterocarpaceae, Elaeocarpaceae, Euphorbiaceae, Myristicaceae (Corner,
1976).
В обоих интегументах проводящие пучки наблюдали у Aleutrites, Dalechampia,
Cremophyllum.
Наибольшего развития проводящая система семязачатков достигает у
представителей некоторых групп пальм (Агесасеае). Так, у Hyphaene indica, по данным
Mahabale и Chennaveeraian (1957) массивный интегумент на 2/3 своей длины
пронизан 16—18 проводящими пучками. Вместе с тем именно на примере пальм мо?кет
быть показано, что густая сеть васкулярных пучков в покровах семязачатка и
семени может быть в значительной степени отнесена не к интегументам, а к
разросшейся халазе. У Hyphaene indica, по-видимому, формируются пахихалазальные
семязачатки (и семена), у которых значительная часть покровов создается за счет
разросшейся халазы вместе со всей системой разветвленных в ней пучков.
У Polymoniaceae, Diapensiaceae, Podostemonaceae, некоторых видов сем.
Solanaceae, многих видов сем. Campanulaceae проводящий пучок не достигает
халазы, а иногда отсутствует даже в фуникулусе. Полная редукция проводящей
системы характерна для семейств Pyrolaceae, Orchidaceae, Orobanchaceae,
Crassulaceae, Loganiaceae, Loasaceae (Савченко, 1973).
Относительно общей структуры и цитологического состава проводящих пучков
в литературе сравнительно мало данных. В фуникулусе и рафе пучок большей
частью коллатеральный, в интегументах и нуцеллусе его структура может
изменяться на амфикрибральную или амфивазальную.
Проводящие пучки состоят обычно из немногочисленных трахеид и еще
меньшего числа элементов флоэмы.
Учитывая, что у большинства семязачатков покрытосеменных проводящие
пучки заканчиваются в халазе, следует признать, что функция специализированной
васкулярной ткани ограничивается в основном подведением воды и пластических
веществ к семязачатку. Перераспределение элементов питания и метаболически
активных веществ в пределах самого семязачатка осуществляется, по-видимому,
за счет других транспортных систем (см. следующие статьи этого раздела). При
этом халазальной зоне семязачатка принадлежит особая роль.
Характер проводящей системы семязачатка в ряде случаев может иметь
таксономическое значение. Это бесспорно, например, для пальм (Uhl, Moore, 1971), а
также для ряда других семейств. Что касается филогенетического значения самого
присутствия элементов проводящей системы в семязачатках покрытосеменных, в
частности, в интегументах и нуцеллусе, то мнения по этому вопросу весьма
противоречивы. Бесспорен тот факт, что из всех частей растений семязачатки имеют
самую слабую васкуляризацию и в общем плане этот признак может считаться эво-
люционно продвинутым. Рис. 77.
Данилова Савченко, 1985; Савченко, 1973; Савченко, Комар, 1965; Fagerlind, 1947; Bouman, 1984;
Corner,1976; Gupta, Rajeswari, 1977; Johri, Kapil, 1953; Kapil, Vasil, 1963; Kershaw, 1909; Kuhn, 1928;
Landes, 1946; Mahabale, Chennaveeraian, 1957; Uhl, Moore, 1971.
ПИТАТЕЛЬНЫЕ ВЕЩЕСТВА И ТРАНСПОРТ
В СЕМЯЗАЧАТКЕ
Обеспечение питательными веществами и транспорт в семязачатке
осуществляется в соответствии с 2-мя его функциями: развитие зародышевого мешка и
семенной кожуры. Данных о составе и путях транспорта питательных веществ к раз-
Семязачаток
257
вивающемуся зародышевому мешку и семенной кожуре очень мало. Однако
некоторые заключения можно сделать на основании морфологических и
физиологических параметров процесса дифференциации тканей семязачатка.
Семязачаток на ранних стадиях непосредственно связан с плацентой. В
фуникулусе и халазе формируется ткань из удлиненных клеток,
дифференцирующихся в первичную ксилему и элементы флоэмы. Этот проваскулярный тяж часто
заканчивается в халазальной части нуцеллуса. Степень развития васкулярной
ткани вариабельна: она может отсутствовать у растений с мелкими семязачатками,
либо может быть сильно развитой, образуя ветвления в интегументы.
Дифференциация сосудистой системы может завершаться у некоторых таксонов и после
оплодотворения в процессе формирования семени.
В начале развития семязачатка, когда все его клетки меристематические,
транспорт осуществляется как симпластически (через плазмодесмы), так и апопласти-
чески (вдоль молодых клеточных стенок). В этот период не происходит,
по-видимому, значительных изменений в снабжении и транспорте питательных веществ. В
семязачатке крассинуцелятного типа, как известно, клетки могут делиться в
продольном направлении параллельно главной оси семязачатка. В результате
образуются ряды клеток с предпочтительным плазмодесменным контактом в
продольном направлении. Первые признаки изменений в транспортной системе
обнаруживаются во время мейоза и изоляции мейотических клеток посредством каллоз-
ной оболочки. Увеличивается масса цитоплазмы с органеллами и формируется
толстая клеточная оболочка в результате дополнительного поступления
питательных веществ. Во время развития линейной тетрады некоторые нуцеллярные клетки
начинают растягиваться. Начало развития функциональной мегаспоры
сопровождается дегенерацией и исчезновением каллозных стенок. De Boer-de Jeu (1978)
считает, что продукты дегенерирующих мегаспор реутилизируются в качестве
питательных веществ для функциональной мегаспоры. Мегаспора содержит
различные запасные вещества — липиды, крахмал и, вероятно, белки. В результате
образования каллозной оболочки создается не только временное молекулярное сито, но
также происходит изменение в апопластическом обмене и запасание углеводов,
необходимых для питательного обеспечения функциональной мегаспоры.
В некоторых семязачатках на стадии диады или тетрады начинает развиваться
гипостаза. Существует большое разнообразие в дифференциации и строении
гипостазы. В некоторых случаях оно проявляется в высокой активности группы клеток
вблизи халазального конца функциональной мегаспоры. Активность клеток
определяется реакцией на пероксидазу, кислую и щелочную фосфатазы (Willemse,
Bednara, 1979). Стенки клеток гипостазы показывают сильную флуоресценцию
благодаря фенольным соединениям и дают реакцию на лигнин и суберин. Эта
особенность показывает изменения апопластного транспорта к развивающемуся ме-
гаспороциту и от него. В этой зоне поступление питательных веществ через клетки
гипостазы осуществляется, главным образом, по симпласту и пропитывание
клеточных стенок фенольными соединениями препятствует апопластическому
транспорту от сильно вакуолизированного ценоцита и позднее от зародышевого мешка.
Особая функция гипостазы, связанная, как полагают Boesewinkel и Bouman (1984)
с секрецией гормонов или других цитоплазматических продуктов, может быть
обусловлена исключительно симпластическим транспортом в этой системе.
Очень мало сведений имеется о происхождении и функции эпистазы. Все они
указывают на присутствие лигнин- или суберин-подобных веществ в оболочках и,
возможно, блокирование апопластного транспорта в микропиле.
Развитие функциональной мегаспоры до ценоцита с двумя ядрами начинается с
образования вакуолей и затем слияния их в одну большую центральную вакуоль.
Этот процесс означает поглощение воды из окружающей ткани нуцеллуса. Запас-
17 Генеративные органы цветка.
258 Генеративные органы цветка
ные вещества, присутствующие в функциональной мегаспоре, потребляются во
время развития ценоцита от дву- до восьмиядерной стадии. Гидролиз крахмала
может вызвать повышение осмотического давления в ценоците. С помощью флуорох-
ромов было продемонстрировано поглощение (веществ), главным образом, вокруг
развивающегося ценоцита и позднее зародышевого мешка (Mogensen, 1981).
Вокруг растущего ценоцита, особенно в микропилярной зоне, происходит разрушение
клеток нуцеллуса, в результате чего обеспечивается не только пространство, но и
питание для роста ценоцита и, позднее, зародышевого мешка. У некоторых
растений весь нуцеллус исчезает в верхней части и с латеральных сторон зародышевого
мешка. В таком случае формируется специальная ткань интегумента, снабжающая
питанием зародышевый мешок — интегументальный тапетум.
В зрелом зародышевом мешке можно наблюдать преобразование стенок как в
синергидах, так и в центральной клетке в характерные передаточные структуры с
лабиринтом оболочки. Антиподальные клетки в основании зародышевого мешка
также могут иметь такие структуры. Этим компартментам приписывается функция
транспорта на короткие расстояния через оболочку, которая может усиливаться
после оплодотворения (Johri, Ambegaokar, 1984). Наряду с «передаточными»
стенками возникают трубчатые клеточные выросты в направлении окружающих тканей,
которые функционируют как гаустории, осуществляя, поглощение питательных
веществ. У некоторых растений эти гаустории присутствуют уже в мегаспоре, у
других гаусторий образуется в верхней части ценоцита или в синергидах. В базальной
части также могут быть гаустории, происходящие из сохраняющихся антиподаль-
ных клеток. Антиподальные клетки рассматриваются как клетки, участвующие в
снабжении питанием зародышевого мешка. В случае ранней дегенерации их
участие очень кратковременное. Запасные вещества, такие как крахмал и иногда ли-
пиды, могут присутствовать в центральной клетке зародышевого мешка.
В семязачатке Gasteria имеются два кольца глюкозосодержащих клеток: одно
— вокруг верхушки зародышевого мешка, а другое — в базальной части вблизи
халазы. В этих зонах накапливаются растворимые углеводы, а в верхней части
откладываются также крахмал. Накопление крахмала происходит и в
центральной клетке. Такая зональность в распределении некоторых питательных веществ
указывает на существование сложной системы снабжения зародышевого мешка
питательными веществами.
Ткань нуцеллуса окружена внутренним и наружным интегументами. Эти ткани
растут в продольном направлении за счет клеточных делений и затем за счет
растяжения. После приобретения окончательной формы зародышевого мешка
дальнейшее развитие внутреннего и наружного интегументов временно
приостанавливается, при этом в них могут появляться межклеточные пространства. Они могут
заполняться газом, что свидетельствует о его транспорте в этих тканях.
Транспорт питательных веществ в семязачатке претерпевает изменения после
оплодотворения, когда образуются зародыш и эндосперм.
Boesewinkel, Bouman, 1984; De Boer-de Jeu, 1978; Johri, Ambegaokar, 1984; Mogensen, 1981; Willemse,
Bednara, 1979.
ТРАНСПОРТ МЕТАБОЛИТОВ
В РАЗВИВАЮЩЕМСЯ СЕМЯЗАЧАТКЕ
Транспорт метаболитов включает поступление веществ по
проводящей системе из плаценты в репродуктивные и соматические ткани
семязачатка, а также их перераспределение в процессе развития через
систему специализированных тканей (гипостазу, подиум, постамент,
интегументальный тапетум, гаустории).
Семязачаток
259
Пространственно-временная координация процессов роста, дифференциации и
метаболизма в семязачатке обеспечивается на разных уровнях организации тремя
типами транспорта, как и в растении в целом (Курсанов, 1976; Лютге, Хигинбо-
там, 1984): 1) между тканями семязачатка и плацентой — дальний транспорт, 2)
между клетками различных тканей — средний, или коротко-дистантный, 3)
между органеллами каждой клетки — ближний, или внутриклеточный.
Дальний транспорт осуществляется посредством флоэмы и ксилемы. По фуни-
кулярному проводящему пучку, оканчивающемуся у большинства растений в ха-
лазе, реже продолжающемуся в интегументы (Campanulaceae, Magnoliaceae,
Paeoniaceae), осуществляется трофическая связь семязачатка с плацентой. У ряда
высокоспециализированных таксонов эта связь обеспечивается средним типом
транспорта либо по тяжам прокамбиальных клеток (Buddiejaceae, Caprifoliaceae,
Gentianaceae), либо по системе клеток всех тканей фуникулуса (Gesneriaceae,
Orchidaceae). В этом случае пластические вещества из плацентарных проводящих
пучков симпластически перемещаются в структуры семязачатка. В
сформированном семязачатке коротко-дистантный транспорт метаболитов характерен прежде
всего для нуцеллуса, халазы, интегументальной паренхимы, тонкие клеточные
стенки которых пронизаны многочисленными плазмодесмами. В эпидермисе
интегументов плазмодесмы имеются только на радиальных стенках клеток, вследствие
чего движение веществ идет послойно (Mogensen, 1973; Wilms, 1980; Belyaeva, 1983;
и др.). Ближний транспорт осуществляется в каждой клетке семязачатка
посредством клеточных органелл.
В семязачатках вещества поступают преимущественно из цветоложа, стенки
завязи и плаценты. Они выявляются прежде всего в халазе, поскольку здесь у
многих таксонов оканчивается проводящий пучок, а затем перемещаются в
различные репродуктивные и соматические ткани семязачатка. Метаболиты могут
накапливаться в течение определенного времени в нуцеллусе и интегументах, а в
дальнейшем снова поступать в халазу (Buell, 1952; Сое, 1954; Mogensen, 1973;
Bhandari et al., 1980, 1985; Tilton, Lersten, 1981a,в; и др.). В семязачатках с инте-
гументальным тапетумом клетки синтезируют различные физиологически
активные вещества, которые могут поступать непосредственно в халазу. Кроме того,
под действием гидролитических ферментов (амилазы, протеазы), секретируемых
клетками интегументального тапетума, может происходить разрушение смежных
клеток инте- гументальной паренхимы, после чего продукты гидролиза
перемещаются также в халазу (Цингер, 1958; Newcomb, 1973a,b; Went Van, 1989; Шам-
ров, 1990г; и др.).
Передвижение веществ из халазы к развивающимся спорогенным и гаметофит-
ным структурам осуществляется посредством различных специализированных
тканей, среди которых важная роль принадлежит гипостазе (Lonay, 1922; Цингер,
1958; Батыгина, 1974, 1984а; Malik, Vermani, 1975; Tilton, 1980в, Шамров, 1990г;
Shamrov, 1992а; и др.). Положение гипостазы в основании нуцеллуса и
интегументов и ее контакт с проводящей системой семязачатка свидетельствует о том, что
она, вероятно, является своеобразным распределителем питательных веществ в
семязачатке, обеспечивая ими как репродуктивные структуры, так и нуцеллус и
интегументы. В типичных тенуинуцеллятных семязачатках гипостаза
непосредственно граничит с зародышевым мешком. В семязачатках крассинуцеллятного
и промежуточного типа в зародышевый мешок вещества поступают из гипостазы
либо через центральную часть подиума (Ceratophyllaceae, Juncaceae — Shamrov,
1992а), либо через постамент (Fagaceae, Grossulariaceae, некоторые
представители Orchidaceae — Mogensen, 1973; Шамров, Никитичева, 1992). В семязачатках
некоторых растений различные структуры (синергиды, антиподы, эндосперм,
суспензор и др.) формируют гаустории, клетки которых имеют гипертрофирован-
17*
260
Генеративные органы цветка
ные ядра и плотную цитоплазму; они поглощают питательные вещества из
соседних тканей и снабжают ими развивающийся зародышевый мешок, а позднее —
эндосперм и зародыш.
В клетках зародышевого мешка формируются выросты стенок, которые
увеличивают поверхность плазмалеммы и играют важную роль в трансмембранном
переносе веществ, выполняя функцию абсорбции и секреции (Vijayaraghavan et al.,
1988a,b; и др.). Время появления выростов на стенках клеток зародышевого
мешка коррелирует либо с началом уменьшения запасных веществ из окружающих
клеток нуцеллуса или интегумента, либо с дегенерацией этих клеток (Schulz,
Jensen, 1968a, 1969, 1977; Fougere-Rifot, 1978; Kudlicka et al., 1981; Tilton et al.,
1984; Vijajaraghavan et al., 1988a,b; и др.).
Сведения о составе и количестве транспортируемых веществ фрагментарны и
характеризуют либо отдельные ткани, либо отдельные стадии развития
семязачатка (Buell, 1952; Mogensen, 1973; Malik, Vermani, 1975; Bhat, Vijayaraghavan,
1980; Kallarackal, Bhatnagar, 1981; Bhandari et al., 1980, 1985; Васильева и др.,
1984; и др.).
Данные, касающиеся путей транспорта метаболитов в развивающемся
семязачатке, крайне малочисленны, но тем не менее показывают специфику,
обусловленную особенностями его строения. Результаты гистохимического исследования
свидетельствуют о том, что во время дифференциации археспориальнои клетки в
плаценте имеются предшественники нуклеиновых кислот, белков и
полисахаридов, которые вероятно, поступают во все ткани примордия семязачатка (Шамров,
1990г; Anisimova, Shamrov, 1992a; Shamrov, 1992a).
До образования тяжей прокамбиальных клеток (например, в крассинуцеллят-
ном семязачатке Luzula pedemontana на стадии сформированного мегаспороцита, а
в тенуинуцеллятном семязачатке у Gentiana cruciata — после завершения мегаспо-
рогенеза) метаболиты продолжают поступать во все формирующиеся структуры и
накапливаются в них в больших количествах. В крассинуцеллятном семязачатке в
период мегаспорогенеза как ранее накопленные, так и вновь поступающие
вещества в основном расходуются, что, вероятно, связано с процессами роста и
интенсивными делениями клеток в местах формирования структур семязачатка,
отложением каллозы в мегаспороците и формирующихся мегаспорах. Однако с началом
развития зародышевого мешка, когда формируются подиум и проводящий пучок с
элементами флоэмы и ксилемы, метаболиты вновь накапливаются в соматических
тканях семязачатка.
В тенуинуцеллятном семязачатке G.cruciata с началом образования
зародышевого мешка, когда разрушается нуцеллус и формируются тяжи прокамбиальных
клеток и интегументальный тапетум, происходит перераспределение в
поступлении метаболитов: как по прокамбиальным клеткам из плаценты, так и из
большинства соматических тканей семязачатка вещества перемещаются в развивающийся
зародышевый мешок, о чем свидетельствует увеличение в нем количества
крахмала и белков. В крассинуцеллятном семязачатке L.pedemontana эта особенность
выявляется только после оплодотворения: к стадии раннего глобулярного зародыша
вещества начинают поступать преимущественно в зародыш и эндосперм.
В крассинуцеллятном семязачатке Gasteria verrucosa слабый поток
растворимых Сахаров во все ткани семязачатка во время мегаспорогенеза сменяется их
направленным интенсивным потоком в нуцеллус и зародышевый мешок (Willemse,
Franssen-Verhejen, 1983). У Spinacia oleracea перед оплодотворением,
по-видимому, перестают транспортироваться в зародышевый мешок сахара вследствие
сильного разрастания халазальной части нуцеллуса (Wilms, 1980).
Высказано предположение, что в тенуинуцеллятном семязачатке с
развивающимся зародышевым мешком N-метаболиты поступают в него преимущественно
Семязачаток
261
по эпидермису семязачатка, интегументальному тапетуму и гипостазе, а С-мета-
болиты — преимущественно по клеткам прокамбиального тяжа и гипостазы
(Шамров, 1990г). Возможно о таком же поступлении метаболитов в семязачаток
свидетельствует перемещение флуорохрома из фуникулуса как в халазальную,
так и в микропилярную части сформированного семязачатка у некоторых
растений (Mogensen, 1981; Zhang Zhen-jue, Zheng Guo-ji, 1988). В крассинуцеллятном
семязачатке, с хорошо дифференцированной проводящей системой, метаболиты
из плаценты поступают в зародышевый мешок и окружающие ткани, главным
образом, по проводящему пучку через систему специализированных тканей.
Согласно представлениям Батыгиной (1984а), в завязи и семязачатке
существует несколько путей транспорта веществ, которые могут меняться в процессе
развития и осуществляться различными структурами. На основании изучения
Nelumbo nucifera и Triticum aestivum (Батыгина, неопубл. данные) и анализа
имеющейся литературы сделано предположение, что существует по крайней мере три
пути транспорта: апикальный, базальный и латеральный. На разных стадиях
развития один из путей транспорта может доминировать, а у некоторых растений
отсутствовать совсем. Все это в значительной степени определяет ход спорогенеза
и тип развития зародышевого мешка.
Транспорт ассимилятов в направлении потребляющих тканей (меристемы,
запасающие ткани) обеспечивается в растении системой аттрагирующих зон (Penot,
1965, 1966; Курсанов, 1976). На ранних стадиях развития, когда
дифференцируются структуры семязачатка, такой аттрагирующей зоной, вероятно, является
весь семязачаток, затем — зародышевый мешок, а после оплодотворения —
эндосперм, зародыш, при этом последние могут действовать одновременно, если
эндосперм не потребляется растущим зародышем. Рис. 78.
Батыгина, 1974,1984а; Васильева и др., 1984; Курсанов, 1976;Лютге,Хигинботам, 1984; Цингер, 1958;
Шамров, 1990 г; Шамров, Никитичева, 1992; Anisimova, Shamrov, 1992a; Belyaeva, 1983,1992; Bhandari
et al., 1980, 1985; Bhat, Vijayaraghavan, 1980; Buell, 1952; Сое, 1954; Folsom, Cass, 1986; Fougere-Rifot,
1978; Jalouzot, 1983; Johri, 1962, 1992; Kallarackal, Bhatnagar, 1981; Kudlicka et al., 1981; Lonay, 1922;
Masand, Kapil, 1966; Malik, Vermani, 1975; Mogensen, 1973, 1981; Newcomb, 1973a,b; Penot, 1965, 1966;
Sohulz, Jensen, 1968a, 1969, 1977; Shamrov, 1992a; Subramanyam, 1949, 1953, 1960; Tilton, 1980b; Tilton
et al., 1984; Tilton, Lersten, 1981а,в; Went Van, 1989; Vijayaraghavan et al., 1988a,1988b; Willemse,
Franssen-Verhejen, 1983; Wilms, 1980; Zhang Zhen-jue, Zhang Guo-ji, 1988.
СТРУКТУРНЫЕ АСПЕКТЫ ПОСТУПЛЕНИЯ ВЕЩЕСТВ
В ЗАРОДЫШЕВЫЙ МЕШОК
В зародышевом мешке покрытосеменных растений происходят ключевые
процессы полового размножения: в нем развивается и оплодотворяется женская
половая клетка и из образовавшейся в результате оплодотворения зиготы развивается
зародыш. Зародышевый мешок и позже развивающийся в нем зародыш действует
как потребитель метаболитов (sink), что подтверждается некоторыми
структурными и функциональными показателями, например, осмотическим градиентом,
повышающимся в направлении к зародышу (Ryczkowski, 1962; Yeung, Brown, 1982).
Процессы, происходящие в зародышевом мешке, требуют первоочередной
доставки питательных веществ и специальной защиты от неблагоприятных
физических и химических воздействий среды, что обеспечивается специальными
структурными приспособлениями. Зародышевый мешок не связан непосредственно с
проводящим пучком семязачатка. В принципе, все метаболиты, поступающие в
зародышевый мешок из проводящей системы, должны пройти через клетки
материнского спорофита — нуцеллус, интегумент и т. д. или после оплодотворения —
через ткани формирующейся семенной кожуры и эндосперм (Murray, 1987).
262
Генеративные органы цветка
Необходимость в питании и защите зародышевого мешка обусловила развитие
структур, как общих, так и специфических для отдельных таксонов. К
структурам, характерным для зародышевых мешков большинства видов, принадлежат:
а) плазмодесмы; б) изоляционные слои (кутикулярные, каллозные,
субериновые); в) структуры, обеспечивающие передаточную функцию.
Хотя у функциональной мегаспоры временно может сохраняться плазмодес-
менная связь с нуцеллусом, в зрелом семязачатке плазмодесмы соединяют в один
симпласт только клетки одной генерации, т. е. клетки гаметофита и клетки
спорофита (Сагг, 1976). Между клетками гаметофита и тканью спорофита часто
развиваются «изоляционные» слои на наружной стенке зародышевого мешка или на
внутренней стенке клеток нуцеллуса или интегумента. Изоляционные слои
возникают уже перед оплодотворением и могут частично или полностью разрушаться
после оплодотворения, во время развития зародыша.
Спорофит и гаметофит в семязачатке связаны апопластически посредством
структур, обеспечивающих транспорт на короткие расстояния. В местах наиболее
активного обмена веществ часто развиваются передаточные структуры,
увеличивающие поверхность и облегчающие транспорт. Они могут возникнуть на стенке
зародышевого мешка, антипод, синергид, суспензора, поверхностного слоя
эндосперма и т. д. (Berger, Erdelska, 1973; Tilton et al., 1984).
Перед оплодотворением главное направление питательных веществ в
зародышевый мешок осуществляется через халазальную область семязачатка, от
окончания проводящего пучка через клетки нуцеллуса и интегументов. Движению
веществ в этом направлении не препятствуют изоляционные слои, но помогают
передаточные структуры. После оплодотворения в зародышевые мешки многих
растений начинают поступать вещества, которые временно отложились в покровах
семени или плода. Большинство этих веществ попадает в покровные ткани из
материнского растения через проводящую систему, меньшая их часть может быть
продуктом фотосинтетической активности самих покровных тканей (Caley et al.,
1990). В результате генетически запрограммированной деградации содержимое
клеток покровов поступает в зародышевый мешок. Деградации подвергается и ну-
целлус, чаще всего еще до оплодотворения. Таким образом, после оплодотворения
кроме халазального пути в зародышевый мешок могут поступать продукты
распада некоторых тканей семязачатка, причем непосредственно через стенку
зародышевого мешка, в тех местах, где в результате роста нарушается изоляционный
слой. Так, например, в зародышевом мешке Jasione montana после
оплодотворения разрушается изоляционный слой мешка в субмикропилярной области,
которая значительно расширяется. В этой области на стенке зародышевого мешка
развиваются передаточные структуры, соединяющие зародышевый мешок с
клетками интегументального тапетума (Berger, Erdelska, 1973).
Вещества, поступающие из проводящего пучка, временно откладываются в
покровных тканях (Ryczkowski, 1986). Система временного отложения питательных
веществ возникает не только в отношении «спорофит — гаметофит», но и в
отношении «эндосперм — зародыш», причем, лишь у тех видов, у которых питание
зародыша на определенных стадиях эмбриогенеза зависит от эндосперма.
Преобладающий путь питания зародыша через суспензор на первых стадиях
эмбриогенеза связан с возникновением новых или расширением существующих путей
поступления питательных веществ в микропилярную область зародышевого мешка
и развитием специальных структур на стенках клеток суспензора, суспензорных
или эндоспермальных гаусториев.
Гаустории принадлежат к структурам, которые являются таксоноспецифичны-
ми. Они часто имеют вид сильно увеличенных клеток с полиплоидным ядром и
характерным набором органелл для выполнения секреторных функций. У гаусто-
Семязачаток
263
риальных клеток могут быть простые или разветвленные выросты,
увеличивающие поверхность и способствующие абсорбции веществ из окружающих тканей.
К специфическим структурам, облегчающим поступление веществ в
зародышевый мешок, принадлежит и гипостаза со стороны халазальной области и эпистаза
со стороны микропилярной области зародышевого мешка (Subramanyam, 1960).
У некоторых видов увеличивается число антипод в результате многократных
делений. Полиантиподальные зародышевые мешки характерны, например, для
семейства Роасеае. Предполагается, что антиподальный аппарат участвует в
процессе поступления веществ в зародышевый мешок через халазальную область.
Подобную функцию в микропилярной области может выполнять и интактная
синергида, которая после оплодотворения у некоторых видов не дегенерирует, а
продолжает функционировать (Maze, Lin, 1975).
Специальные структуры, регулирующие вхождение веществ в семязачаток, в
том числе и в зародышевый мешок, представляют те клетки и слои, которые как
полагают, отвечают за прекращение поступления воды и веществ в зрелое семя. К
ним, например, принадле?кат пигментный слой в основание зерновки кукурузы.
Семязачаток покрытосеменных растений, а после оплодотворения семя, в
онтогенетическом плане, представляет формацию, в которой имеются ткани, при-
надле?кащие материнскому спорофиту (нуцеллус, интегументы), гаметофиту
(зародышевый мешок) и дочернему спорофиту (зародыш, эндосперм). Для их
взаимодействия необходимо образование специфических изоляционных и
коммуникационных структур, которые обеспечивают, с одной стороны, специфику
генетических программ отдельных генераций клеток и, с другой стороны, их
метаболическую связь. Изучение мутантов с аберрантными семязачатками показывает,
например, что нарушения в развитии зародышевого мешка связаны с нарушениями
в развитии интегументов (Robinson-Beers et al., 1992).
Таким образом, изоляция спорофита и гаметофита обеспечивается отсутствием
симпластической связи и присутствием изоляционных слоев. Метаболическая
связь осуществляется апопластически посредством структур, которые облегчают
транспорт на короткие расстояния (например, передаточные структуры) из
областей окончания проводящих пучков или из областей временного отложения
питательных веществ. Рис. 79.
Berger, Erdelska, 1973; Caley, et al., 1990; Carr, 1976; Maze, Lin, 1975; Murray, 1987; Robinson-Beers et
al., 1992; Ryczkowski, 1962; Ryczkowskietal., 1986; Subramanyam, 1960; Tiltonetal., 1984; Yeung, Brown,
1982.
СЕМЯЗАЧАТОК И СЕМЯ С ПОЗИЦИИ НАДЕЖНОСТИ
БИОЛОГИЧЕСКИХ СИСТЕМ
Завязь — семязачаток — зародышевый мешок (в дальнейшем плод — семя —
зародыш) — динамичная интегрированная система, тесно связанная с развитием
всего растительного организма и характеризующаяся непрерывно меняющимся
состоянием своей целостности. Каждый этап ее развития характеризуется
определенными морфогенетическими и морфофизиологическими корреляциями,
которые обуславливают нормальное протекание спорогенеза, мегагаметогенеза и, в
свою очередь, определяются генетикой данного организма и таксона в целом.
Структурно-функциональные изменения этой сложной репродуктивной системы
могут затрагивать разные уровни (организменный, органный, тканевой,
клеточный, молекулярный) и проявляться на разных этапах развития структур.
Для успешного изучения такой динамичной системы с функциональными
связями, как завязь, семязачаток и семя, перспективен системный подход. В
настоящее время разрабатываются различные аспекты системного подхода в биологии
264
Генеративные органы цветка
(Лищитович, 1974; Гродзинский, 1977, 1983; Батыгин, 1977, 1986; Урманцев,
1979; Батыгина, 1983, 1984а,б; Васильева, Батыгина, 1981; Батыгина, Васильева,
1983, и др.). При формулировании системного подхода к проблеме
дифференциации семязачатка необходимо учитывать следующие моменты:
1. Семязачаток — система, состоящая из определенных структурных
элементов (нуцеллус, интегумент, зародышевый мешок и др.), между которыми
существуют строго определенные морфогенетические и морфофизиологические
корреляции.
2. Дифференциация семязачатка в системе «семязачаток — окружающая
среда» (как правило, среда — ткани материнского растения).
3. Организация семязачатка и семени с позиции надежности биологических
систем.
В связи с этим разработана следующая стратегия исследования:
1. выбор в качестве модельных объектов видов растений,
контрастирующих по эмбриологическим признакам, особенностям экологии,
прорастания и занимающих различное положение в системе цветковых
растений;
2. изучение структур семязачатка и семени в динамике и взаимосвязи с
окружающими тканями завязи (и плода); сопоставление стадий и темпов
развития структур с процессами споро-, гаметофито- и эмбриогенеза;
3. сравнение кинетики морфогенетнческих и физиолого-биохимиче-
ских процессов в семязачатке и завязи (и в семени и плоде);
4. сравнение закономерностей дифференциации семязачатка и
семени в условиях in situ, in vivo и in vitro;
Предложенный «блок изучения» позволяет выявить морфогенетические и
морфофизиологические корреляции,обуславливающие пространственную и
временную координацию различных структур и процессов, и установить критические
периоды (Vasilyeva et al., 1987). Поскольку организация семязачатка и семени носит
адаптивный характер и меняется в ходе их развития и созревания, необходимо
особое внимание уделить идентификации факторов, определяющих их строение.
Так, например, характер строения семязачатка на ранних этапах развития,
вероятно, определяется, в основном, характером и способом опыления и
оплодотворения, а на более поздних — типом развития зародыша и спецификой его
прорастания и т. п. (Батыгина, 1984а,б).
Одним из важнейших аспектов изучения организации семязачатка
является выяснение биологического значения множества дублирующих
структур (археспориальных, спорогенных клеток, тетрад мегаспор, апоспориче-
ских и диплоспорических зародышевых мешков) в одном семязачатке и их
роли в семенной репродукции. В связи с этим представляет интерес
рассмотрение семязачатка и семени с позиции нового направления в науке — надежности
биологических систем.
При изучении генезиса семязачатка и семени следует исходить из следующих
посылок. Все клетки тотипотентны, но время и степень проявления этого
свойства различны. Тотипотентность обусловливает в семязачатке и
семени непрерывность морфогенеза и многовариантность способов
(половой, бесполый, апомиксис) и форм (например, живорождение — вивипария)
репродукции, а также путей морфогенеза. Тотипотентность может
сопровождаться поливариантностью (неоднозначностью матричных процессов) и
гетерогенностью клеток (Инге-Вечтомов, 1977).
В процессе эволюции в репродуктивной системе каждого таксона сложилась своя
специфика «резервов» и «отказов». Это проявляется в разном характере и степени
олигомеризации. «Работа» дублирующих механизмов обычно связана с «конкурен-
Семязачаток
265
тностью» и системой «отказов» (проявление аномалий — аберраций, деструкции и
т.п.) на разных уровнях биоиерархии. Например, поклеточный отбор,
проявляющийся в дегенерации большей части спорогенных клеток, способствует
поддержанию генетической и физиологической чистоты яйцеклетки и в конечном итоге
генетической чистоты потомства. Следовательно, гибель спорогенных клеток,
происходящая на низком уровне биоиерархической системы, свидетельствует о сохранении
и проявлении высокой степени надежности биосистемы. Система «скрытых»
репродуктивных резервов (изменение сексуализации пыльцы1 и др.) имеется на ранних
этапах развития цветка, а также на других этапах онтогенеза. Таксоноспецифич-
ность этих резервов легко обнаруживается в культуре ткани (каулифлория,
образование тычинок и пыльцевых гнезд на лепестках, на завязи и др.).
Характер первых этапов развития семязачатка (апоспория, диплоспория, «до-
рмант меристема»), в основном, определяет разнообразие резервов (партеногенез,
нуцеллярная и интегументальная эмбриоидогения и др.) и, следовательно,
гетерогенность семян. Это — резервы, позволяющие сработать системе отказов на
отдельных этапах развития семени, но не допустить полного отказа в системе семенной
репродукции при нарушении полового процесса (мейоза и оплодотворения), которое
могло бы привести систему семязачаток — семя к гибели.
Наиболее ярко описанные выше явления могут быть иллюстрированы путем
сравнительного анализа представителей разных таксонов, контрастирующих по
эмбриологическим признакам (типу семязачатка, строению нуцеллуса,
зародышевого мешка и т. д.).
Например, система резервов в крассинуцеллятном семязачатке пеона (Paeonia
anomala, P.lactiflora) проявляется в множественности археспоральных клеток
(4—5), мегаспороцитов (16—20), тетрад мегаспор (5—7), формирующихся
зародышевых мешков (3—4), а в развивающемся семени и в нуцеллярной эмбриоидо-
гении (Яковлев, Иоффе, 1965; Batygina, Shamrov, 1993). Кроме того, у пеона
обнаружено интересное явление — «клонирование». Смысл его заключается в том,
что на ценоцитно-клеточной стадии полового проэмбрио закладываются до 25—27
соматических зародышей. Из них в результате конкурентного развития в зрелом
семени, как правило, остается лишь один эмбриоид (а не половой зародыш!)
(Batygina, 1988, 1989, 1993). Таким образом, интегрированная система
семязачаток — семя пеона имеет различные резервы на разных уровнях биоиерархии,
обеспечивая надежность систем репродукции пеона.
Другой тип резервов наблюдается у мятликов. Так, в крассинуцеллятном
семязачатке мятлика (Роа pratensis) система резервов представлена «дормант
меристемой», которая реализуется в образовании различных типов зародышевого
мешка (редуцированные, апо- и диплоспорические), а в дальнейшем в
партеногенезе, апогаметии, различных формах нуцеллярной эмбриоидогении (Батыгина,
Маметьева, 1979; Batygina, 1991). Нуцеллярные эмбриоды в семязачатке мятлика
различа- ются по происхождению. Одни формируются, вероятно, из дормант
меристемы, другие — из клеток пролиферирующего нуцеллуса (Батыгина, Фрей-
берг, 1979).
В семязачатке кукурузы (Zea mys), как и у видов Роа, формируется, обычно,
одна археспориальная клетка, а в дальнейшем один зародышевый мешок и один
зародыш (см. Maheshwari, 1950; Чеботарь, 1972; Коробова, 1982; Van Lammern, 1987).
В этом случае система наде?кности проявляется в метамерности структур: многопо-
чатковость, большое количество семязачатков в початке и др. Однако, в
экспериментальных условиях система репродукции у мутанта кукурузы 1аг-487
оказывается несбалансированной в результате мутации гена в рецессивном гомозиготном
См. Развитие «зародышевых мешков» в пыльнике.
266 Генеративные органы цветка
состоянии. Это проявляется в наличии большого числа дублирующих структур (ар-
хеспориальных и спорогенных клеток, тетрад мегаспор, редуцированных и дип-
лоспорических зародышевых мешков (Батыгина и др., 1994; Sheridan,
Golubovskaya, Batygina, Shamrov, in press).
Таким образом, экспериментальные данные свидетельствуют о возможной
реверсии и появлении ряда специфических анцестральных черт в строении
семязачатка, характерных для таксонов, расположенных в основании системы
цветковых растений. Интересно отметить, что множество дублирующих структур
характерно для крассинуцеллятных семязачатков ряда примитивных таксонов
{Fagaceae, Casuarinaceae, Lauraceae и др.).
Система резервов у тропических орхидных проявляется в образовании нуцел-
лярных и интегументальных эмбриоидов на ранних стадиях развития
семязачатка, в апогаметии и разнотипной монозиготической полиэмбриоидогении (Afzelius,
1928; Swamy, 1943, 1948). Апоспория и диплоспория отсутствуют, а метамерия
выражается в большом числе тенуинуцеллятных семязачатков. У бореальных
орхидных система резервов реализуется, главным образом, в образовании большого
числа протокормов из одного зародыша во время прорастания (Batygina, Vasilyeva,
1983; Батыгина, Шевцова, 1985), а также в вивипарии (живорождении) (Кернер,
1901).
Высокая степень тотипотентности клеток семязачатка и семени орхидных,
проявляющаяся в разновременной дифференциации и функционировании резервов
как бы «страхует» развитие специфически организованного редуцированного тену-
инуцеллятного семязачатка орхидных. Веер различных форм и способов
репродукции реализуется в различных путях морфогенеза: эмбриогенезе,
эмбриондогенезе и гемморизогенезе (Батыгина и др., 1978; Batygina, 1987,
1989). Они обеспечивают не только надежность систем репродукции, но и широкий
ареал распространения орхидных растений. Сходная ситуация, как было отмечено
выше, характерна и для Poapratensis, где выявлены различные типы апомиксиса.
Специфика генезиса и организации семязачатка цветковых позволяет
прогнозировать время дифференциации и функционирования дублирующих структур в
случае отсутствия или нарушения полового процесса. Семязачаток и семя —
саморегулирующаяся система
, обеспечивающая гомеостаз и репродуктивную стратегию вида.
Таким образом, надежность систем репродукции (семенной и вегетативной)
обеспечивается системой резервов и отказов, проявляющейся на разных уровнях
биоиерархии. Все они предстают как звенья одной цепи в системе репродукции
цветковых, обеспечивая пластичность и толерантность (адаптацию) не только
семени как этапа онтогенеза,но и самого растения и популяции в целом.
Управлять отдельными этапами онтогенеза можно лишь в том случае, если
рассматривать все вышеуказанные явления, происходящие в семязачатке — семени,
в их взаимосвязи и определяя при этом значение каждого из них для
продуктивности популяции, вида. Рис. 80.
Батыгин, 1977, 1986; Батыгина, 1983а, 1984а,б; Батыгина, Васильева, 1983; Батыгина, Маметьева,
1979; Батыгина, фрейберг, 1979; Батыгина, Шевцова, 1985; Батыгина и др., 1978; Васильева,
Батыгина, 1981; Гродзинский, 1977, 1983; Кернер, 1901; Коробова, 1982; Лищитович, 1974; Урманцев, 1979;
Чеботарь, 1972; Яковлев, Иоффе, 1965; Afzelius, 1928; Batygina, 1987, 1988, 1989, 1991, 1993; Batygina,
Shamrov, 1993; Batygina, Vasilyeva, 1983; Vasilyevaet al., 1987; Lammeren van, 1987, Swamy, 1943, 1948c.
Литература
267
ЛИТЕРАТУРА
Авдулов И. П. Неправильность митоза у пырейных гибридов // Тр. Саратов,
сельскохозяйственной опытной станции. М.-Л., 1937. С. 99—108.
Агроскин Л. С., Папаян Г. В. Цитофотометрия. Л.: Наука, 1977. 295 с.
Александров В. Г. Анатомия растений. М.: Сов. наука, 1954. 499 с.
Александров В. Г., Александрова О. Г. Об антиподах и зародышевом мешке // Ботан. журн. 1946.
Т. 31, №6. С. 10—24.
Александров В. Г., Александрова О. Г., Яковлев М. С. О характерных чертах морфологии плода
злаков типа маиса (Zea mays L. ) // Сов. Ботаника. 1944. № 6. С. 63—75.
Александров В. Г., Савченко М. И. Об особенностях истории развития плода и семени в семействе
Сложноцветных // Тр. БИН им. Bf Л. Комарова АН СССР. Морфология и анатомия растений. Сер.
VII. 1957. Вып. 2. С. 5—98.
Александровский Е. С, Наумова Т. Н. Семейство Anacardiaceae // Сравнительная эмбриология
цветковых растений. Brunelliaceae-Tremandraceae. Л.: Наука, 1985. С. 166—173.
Алимова Г. К. Семейство Flacourtiaceae // Сравнительная эмбриология цветковых растений.
Phytolacaceae-Thymelaeaceae. Л.: Наука, 1983. С. 99—103.
Алимова Г. К. Семейство Staphylleaceae // Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandraceae. Л.: Наука, 1985. С. 176—178.
Алимова Г. К. Семейство Alangiaceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 15—18.
Алимова Г. К. Семейство Alstroemeriaceae // Сравнительная эмбриология цветковых растений //
Butomaceae-Lemnaceae. Л.: Наука, 1990а. С. 74—76.
Алимова Г. К. Семейство Haemodoraceae // Сравнительная эмбриология цветковых растений.
Butomaceae-Lemnaceae. Л.: Наука, 1990 б. С. 134—138.
Алимова Г. К., Яковлев М. С. К эмбриологии Streptocarpus rexii (Gesneriaceae) // Ботан. журн.
1982. Т. 67, № 4. С. 470—479.
Алов И. А., Брауде А. И., Аспиз М. Е. Основы функциональной морфологии клетки. М.:
Медицина, 1969. 343 с.
Альберте Б., Брей Д., Льюис Дж., Рэфф М., Роберте К., Уотсон Дж. Молекулярная биология
клетки. М.: Мир, 1987. Т. 4. 197 с.
Андропова Е. Н. Цитофотометрия ДНК и гистонов в митозе и мейозе у животных и растений:
Автореф. дис. ... канд. биол. наук. Л., 1971. 23 с.
Анисимова Г. М. Развитие семени у Orobanche cumana и О. alsatica (Orobanchaceae) // Ботан.
журн. 1983а. Т. 63, № 4. С. 473—482.
Анисимова Г. М. Семейство Begoniaceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 19836. С. 144—148.
Анисимова Г. М. Семейство Lecythidaceae // Сравнительная эмбриология цветковых растений.
Brunellaceae-Tremandraceae. Л.: Наука, 1985. С. 125—129.
Анисимова Г. М. Семейство Juncaceae // Сравнительная эмбриология цветковых растений.
Butomaceae-Lemnaceae. Л.: Наука, 1990. С. 183—187.
Ашурметов А. А., Саидов Д. К., Норматов Б. А. Микроспорогенез и развитие мужского гамето-
фита у видов рода Glycyrrhiza L. // Доклады АН Уз. ССР. 1979. № 7. С. 68—69.
Банникова В. П. Цитоэмбриология межвидовой несовместимости у растений. Киев: Наук, думка,
1975. 284 с.
Банникова В. П., Плющ Т. А. Ультраструктура яйцевого аппарата зародышевого мешка
покрытосеменных растений // Укр. ботан. журн. 1982. Т. 39, № 6. С. 81—87.
Банникова В. П., Плющ Т. А. Слияние ядер гамет и полярных ядер у цветковых растений //
Цитология и генетика. 1990. Т. 24, № 1. С. 62—64.
Банникова В. П., Хведынич О. А. Основы эмбриологии растений. Киев: Наук, думка, 1982. 163 с.
Банникова В. П., Хведынич О. А., Шпилевая С. П. и др. Половые клетки и оплодотворение у
покрытосеменных и водорослей. Киев:'Наук, думка, 1985. 220 с.
Баранов П. А. Материалы по Эмбриологии Orchidaceae // Журн. Русск. Ботан. об-ва. 1917. Т. 2.
С. 22—27.
Баранов П. А. История эмбриологии растений. М.-Л.: Изд-во АН СССР, 1955. 439 с.
Батыгина Т. Б. Изменение мужских гамет в ходе оплодотворения у пшеницы // Докл. АН СССР.
1961. Т. 137, № 1. С. 220—223.
Батыгина Т. Б. Микроспорогенез и развитие пыльцевого зерна у пшеницы // Докл. АН СССР.
1962а. Т. 142, № 5. С. 1205—1208.
268
Генеративные органы цветка
Батыгина Т. Б. Процесс оплодотворения у пшеницы // Тр. БИН им. В. Л. Комарова АН СССР. Сер.
VII. 19626. Вып. 5. С. 260—293.
Батыгина Т. Б. Эмбриология пшеницы. Л. : Колос, 1974. 206 с.
Батыгина Т. Б. Сем. Cabombaceae // Сравнительная эмбриология цветковых растений.
Winteraceae-Juglandaceae. Л.: Наука, 1981а. С. 101—105.
Батыгина Т. Б. Сем. Nymphaeaceae // Сравнительная эмбриология цветковых растений.
Winteraceae-Juglandaceae. Л.: Наука, 19816. С. 105—110.
Батыгина Т. Б. Семейство Nelumbonaceae // Сравнительная Эмбриология цветковых растений.
Winteraceae-Juglandaceae. Л.: Наука, 1981в. С. 116—120.
Батыгина Т. Б. Пыльник как модель изучения морфогенетических потенций и путей морфогенеза
// Тез. докл. Всесоюз. симпоз. «Развитие мужской генеративной сферы растений. (Морфофизиологи-
ческие аспекты)». Симферополь, 1983а. С. 9—10.
Батыгина Т. Б. Системный подход к проблеме дифференциации зародыша покрытосеменных
растений // Материалы VIII Всесоюз. совещ. по эмбриологии растений «Проблемы гаметогенеза,
оплодотворения и эмбриогенеза», Ташкент, 1982. Ташкент, 19836. С. 25—26.
Батыгина Т. Б. Семейство Portulacaceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983в. С. 26—32.
Батыгина Т. Б. Завязь и семяпочка — сложная интегрированная система (сопряженность развития
структур и некоторые аспекты транспорта веществ в генеративных структурах) // Материалы
Всесоюз. симпоз. «Морфофункциональные аспекты развития женских генеративных структур семенных
растений». Телави, 1984а. С. 6—8.
Батыгина Т. Б. О необходимости совершенствования существующих классификаций типов
семяпочек покрытосеменных // Тез. I Всесоюз. конф. по анатомии растений. Л., 19846. С. 18—19.
Батыгина Т. Б. Семейство Onagraceae // Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandraceae. Л.: Наука, 1985а. С. 104—110.
Батыгина Т. Б. Семейство Tropaeolaceae // Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandraceae. Л.: Наука, 19856. С. 215—219.
Батыгина Т. Б. Хлебное зерно. (Атлас). Л.: Наука, 1987. 102 с.
Батыгина Т. Б. Морфогенетические резервы репродуктивных структур (тотипотентность и
детерминированность) // Тез. III Съезда ВОФР. С.-Петербург, 1993. Т. 1. С. 65.
Батыгина Т. Б., Васильева В. Е. Целесообразность системного подхода к проблеме
дифференциации зародыша покрытосеменных растений // Онтогенез. 1983. Т. 14, № 3. С. 304—311.
Батыгина Т. Б., Колесова Г. Е. Семейство Euphorbiaceae // Сравнительная эмбриология
цветковых растений. Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. С. 267—277.
Батыгина Т. Б., Колесова Г. Е. Семейство Тгарасеае // Сравнительная эмбриология цветковых
растений. Brunelliaceae-Tremandraceae. Л.: Наука, 1985. С. 110—116.
Батыгина Т. Б., Колесова Г. Е. Семейство Menyanthaceae // Сравнительная эмбриология
цветковых растений. Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 145—153.
Батыгина Т. Б., Колесова Г. Е., Васильева В. Е. Эмбриология нимфейных и лотосовых. III.
Эмбриогенез Nelumbo nucifera Gaertn. // Ботан. журн. 1983. Т. 68, № 3. С. 311 —326.
Батыгина Т. Б., Колесова Г. Е., Драгунова Е. В. Семейство Rhamnaceae // Сравнительная
эмбриология цветковых растений. Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 94—98.
Батыгина Т. Б., Маметьева Т. Б. Тотипотентность клеток растительного организма в системе
надежности воспроизведения покрытосеменных // Материалы Моск. совещ. по филогении растений.
М.: Наука, 1976. С. 15—16.
Батыгина Т. Б., Маметьева Т. Б. К эмбриологии рода Роа L. // Актуальные вопросы эмбриологии
покрытосеменных растений. Л.: Наука, 1979. С. 89—95.
Батыгина Т. Б., Терехин Э. С, Алимова Г. К., Яковлев М. С. Генезис мужских спорангиев
Gramineae и Ericaceae // Ботан. журн. 1963. Т. 48, N° 8. С. 1108—1120.
Батыгина Т. Б., Титова Г. Е., Шамров И. И. Сравнительная эмбриология нимфейных (Nymphaeales
s. 1. ) в связи с вопросами их филогении и систематики // Тез. докл. VIII Моск. совещ. «Филогения
и систематика растений». М.: Наука, 1991. С. 11—14.
Батыгина Т. Б., Фрейберг Т. Е. Полиэмбриония у Роа pratensis // Ботан. журн. 1979. Т. 64, № 6.
С. 793—804.
Батыгина Т. Б., Шамров И. И. Эмбриология нимфейных и лотосовых. I. Развитие пыльника //
Ботан. журн. 1981а. Т. 66, № 12. С. 1696—1709.
Батыгина Т. Б., Шамров И. И. Семейство Ceratophyllaceae // Сравнительная эмбриология
цветковых растений. Winteraceae-Juglandaceae. Л.: Наука, 19816. С. 110—115.
Батыгина Т. Е., Шамров И. И., Колесова Г. Е. Эмбриология нимфейных и лотосовых. II. Развитие
женских эмбриональных структур // Ботан. журн. 1982. Т. 67, № 9. С. 1179—1195.
БатыгинаТ. Б., Шамров И. И. Эмбриология нимфейных и лотосовых. Строение пыльцевого зерна.
Некоторые особенности сопряженного развития пыльцевого зерна и стенки пыльника // Ботан. журн.
1983. Т. 68, № 9. С. 1177—1183.
Батыгина Т. Б., Шевцова Г. Г. Метаморфоз в онтогенезе орхидных (на примере Cymbidium
hybridum, Orchidaceae) // Ботан. журн. 1985. Т. 70, № 12. С. 1614—1621.
Литература
269
Белинцев Б. И., Белоусов Л. В., Зарайский А. Г. Модель эпителиальных морфогенезов на основе
упругих сил и контактной поляризации клеток // Онтогенез. 1985. Т. 16, № 1. С. 5—14.
Беляева Л. Е., Родионова Г. Б. Семейство Brassicaceae // Сравнительная эмбриология цветковых
растений. Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. Т. 2. С. 154—164.
Беляева Н. С. О различиях спермиев одной пары у некоторых покрытосеменных // Половой
процесс и эмбриогенез растений: Материалы Всесоюз. симпоз. М., 1973. С. 17—18.
Беляева Н. С. Разнокачественность спермиев у некоторых покрытосеменных и ее роль в процессе
двойного оплодотворения // Изв. АН Туркм. ССР. Сер. биол. 1975. № 3. С. 3—8.
Беляева Н. С. Строение и развитие женского гаметофита покрытосеменных после клеткообразо-
вания // Изв. АН Туркм. ССР. Сер. биол. 1987. № 6. С. 3—10.
Биологический энциклопедический словарь / Под ред. М. С. Гилярова. Изд. 2-е. М.: Сов.
энциклопедия, 1989. 864 с.
Волховских 3. В. Динамика нуклеиновых кислот при формировании генеративной и вегетативной
клеток пыльцевого зерна лилии // Цитология. 1965. Т. 7, № 6. С. 745—748.
Бутенко Р. Г. Тотипотентность растительной клетки и культура ткани // Культура изолированных
органов, тканей и клеток растений. М.: Наука, 1970. С. 84—92.
Буш И. А. Курс систематики высших растений. М.: ГУИЗ, 1944. 583 с.
Бхандари Н. И. Микроспорангий // Эмбриология растений. Ред. Б. М. Джори. М.: Агоопоомиз-
дат, 1990. С. 66-146.
Ван-Тигем П. Общая ботаника. Морфология, анатомия и физиология растений. М., 1901
703 с.
Василевская В. К., Кондратьева-Мельвиль Е. А. О некоторых вопросах строения верхушки
вегетативного побега // Проблемы ботаники. М.-Л., 1958. Вып. 3. С. 288—298.
Васильев А. Е. Функциональная морфология секреторных клеток растений. Л.: Наука,
1977. 208 с.
Васильев А. Е., Плиско М. А. Электронномикроскопическое исследование интегументального та-
петума и смежных тканей семязачатка у Calendula officinalis L. // Ботан. журн. 1971а. Т. 56, № 3. С
335—346.
Васильев А. Е., Плиско М. А. Ультраструктура зародышевого мешка покрытосеменных //
Материалы V Всесоюз. совещ. по эмбриол. растений. Кишинев, 19716. С. 29—30.
Васильева В. Е., Батыгина Т. Б. Культивирование in vitro зародышей и семяпочек лотоса,
изолированных на разных стадиях развития // Физиология растений. 1981. Т. 28, № 2
С. 319—327.
Васильева В. Е., Колесова Г. Е., Чочия К. А., Батыгина Т. Б. Морфофизиологические корреляции
в развитии семяпочки лотоса // Материалы. Всесоюз. симпоз. «Морфофункциональные аспекты
развития женских генеративных структур семенных растений». Телави, 1984. С. 11.
Веселова Т. Д. Эмбриологическое исследование Lychnis coronaria (L.) Desv. (Caryophyllaceae) //
Деп. ВИНИТИ, № 2003—В 89. М., 1989. 16 с.
Веселова Т. Д. О морфологической природе обтуратора у гвоздичных // Биол. науки. 1991. № 2
С. 93—103.
Вейсман А. Д. Греческо-русский словарь // СПб., 1882.
Вильсон Э. Б. Клетка. М.-Л.: Биомедгиз, 1925. 1372 с.
Вильсон Э. Б. Клетка и ее роль в развитии наследственности. М.-Л.: Изд-во АН СССР, 1940. Т
1—2. 1062 с.
Винтер А. Н. Эмбриология рода Hydrastemma (Barclaya) в связи с его систематическим
положением: Дисс. ... канд. биол. наук. БИН. Л., 1987. 285 с.
Винтер А. Н., Батыгина Т. Б. Семейство Barclayaceae // Сравнительная анатомия семян. Л.:
Наука, 1988. С. 147—152.
Винтер А. Н., Шамров И. И. Развитие семяпочки и зародышевого мешка у Nuphar lutea
(Nymphaeaeceae) // Ботан. журн. 1991а, Т. 76, № 3. С. 378—390.
Винтер А. Н., Шамров И. И. Мегаспорогенез и развитие зародышевого мешка у представителей
родов Nymphaea и Victoria (Nymphaeaceae) // Ботан. журн. 19916. Т. 76, № 12. С. 1716—1728.
Виэльунска-Войтась О. Эмбриология некоторых представителей семейства Onagraceae: Автореф.
дисс. ... канд. биол. наук. Л., 1984. 15 с.
Власова Н. А., Серебрякова Л. Е. К вопросу о локализации нуклеиновых кислот с темпами
развития зародышевого мешка у хлопчатника // Узб. биол. журн. 1963. Т. 17, № 1. С. 27—33.
Ворсобина Л. И., Солнцева М. П. Семейство Amaryllidaceae // Сравнительная эмбриология
цветковых растений. Butomaceae-Lemnaceae. Л.: Наука, 1990. С. 87^96.
Габараева Н. И. Развитие экзины у Mihelia fuscata (Magnoliaceae) в связи с изменениями цитоп-
лазматических органелл микроспор и тапетума // Ботан. журн. 1986. Т. 71, № 3. С. 311 —322.
Габараева Н. И. Ультраструктура и развитие ламелл эндэкзины у Manglietia tenuipes
(Magnoliaceae) в связи с вопросом о наличии ламелл эндэкзины у примитивных покрытосеменных //
Ботан. журн. 1987. Т. 72, № 10. С. 1310—1317.
Габараева Н. И. О месте синтеза предшественников спорополленина в развивающихся пыльцевых
зернах представителей семейства Magnoliaceae // Ботан. журн. 1990. Т. 75, № 6. С. 783—791.
270
Генеративные органы цветка
Габараева Н. И. Ультраструктура и развитие экзины и орбикул у Magnolia delavayi (Magnoliaceae)
в тетрадном и начале посттетрадного периодах // Ботан. журн. 1991. Т. 76, № 1. С. 10—19.
Гачечиладзе М. И. Эмбриология некоторых видов семейства онагровых: Дисс. ... канд. биол. наук.
Тбилиси, 1981. 130 с.
Гваладзе Г. Е. Эмбриология Allium schoenoprasum L. // Сообщ. АН Груз. ССР. 1960. Т. 25, № 3.
С. 327—334.
Гваладзе Г. Е. Развитие генеративных органов и эмбриогенез у некоторых видов рода Allium: Ав-
тореф. дисс. ... канд. биол. наук. Тбилиси, 1962. 28 с.
Гваладзе Г. Е. К изучению полярных ядер покрытосеменных // Сообщ. АН Груз. ССР. 1966. Т. 68,
№3.
Гваладзе Г. Е. Сравнительно-эмбриологическое исследование зародышевых мешков типов
Polygonum, Oenothera, Allium, Fritillaria у некоторых растений: Автореф. дисс. ... докт. биол. наук.
Тбилиси, 1973. 54 с.
Гваладзе Г. Е. Синергиды у некоторых видов рода Gagea // Сообщ. АН Груз. ССР. 1974. Т. 74,
№2. С. 421—423.
Гваладзе Г. Е. Халазальное полярное ядро центральной клетки зародышевого мешка
покрытосеменных. Тбилиси: Мецниереба, 1976. 120 с.
Гваладзе Г. Е. Зародышевый мешок типа Peperomia // Тез. докл. VII Всесоюз. симпоз. по
эмбриологии растений. Киев, 1978. Вып. 3. С. 14—15.
Гвилава М. Н. Субмикроскопическая характеристика зрелого зародышевого мешка Epilobium
hirsutum // Изв. АН ГССР. Сер. биол. 1985. Т. 11, № 3. С. 168—172.
Гвилава М. Н. Ультраструктура зародышевого мешка Chamerion angustifolium (L.) Holub
(Onagraceae) до оплодотворения // Укр. ботан. журн. 1986. Т. 43, № 4. С. 48—50.
Гвилава М. Н. Развитие зародышевого мешка у видов семейства Onagraceae: Автореф. дисс. ...
канд. биол. наук. Тбилиси, 1987. 18 с.
Герасимов И. И. Некоторые замечания о функции клеточного ядра // Русские классики морфол.
раст.. Гос. изд., 1923. С. 123—129.
Герасимова-Навашина Е. Н. Митотическая гипотеза двойного оплодотворения // Докл. АН
СССР. 1947. Т. 57, № 4. С. 395—398.
Герасимова-Навашина Е. Н. Пыльцевое зерно, гаметы и половой процесс у покрытосеменных
растений // Тр. БИН им. В. Л. Комарова АН СССР. Сер. VII. 1951а. Вып. 2. С. 294—355.
Герасимова-Навашина Е. Н. Пыльцевое зерно, гаметы и половой процесс у покрытосеменных
растений // Тез. докл. делегат, совещ. ВБО. М.-Л. 19516. Вып. 4. С. 28—33.
Герасимова-Навашина Е. М. К цитолого-эмбриологическому пониманию процесса опыления //
Тр. БИН им. В. Л. Комарова АН СССР. Сер. VIII. 1952. Вып. 3. С. 165—211.
Герасимова-Навашина Е. М. Развитие зародышевого мешка и вопрос о происхождении
покрытосеменных // ДАН СССР. 1954а. Т. 95, № 4. С. 877—881.
Герасимова-Навашина Е. Н. Развитие зародышевого мешка, двойное оплодотворение и вопрос о
происхождении покрытосеменных // Ботан. журн. 19546. Т. 39, № 5. С. 655—681.
Герасимова-Навашина Е. Н. Двойное оплодотворение покрытосеменных, его природа и
происхождение: Автореф. дисс. ... д-ра биол. наук. Л., 1955. 42 с.
Герасимова-Навашина Е. Н. Оплодотворение как онтогенетический процесс // Ботан. журн. 1957.
Т. 42, № 11. С. 1654—1673.
Герасимова-Навашина Е. Н. О гаметофите и об основных чертах развития и функционирования
воспроизводящих элементов у покрытосеменных растений // Проблемы ботаники. 1958. Вып. 3. С.
125—167.
Герасимова-Навашина Е. Н. Цитологические данные о стимуле к развитию клеток зародышевого
мешка (растений) // Тр. БИН. им. В. Л. Комарова АН СССР. Сер. VII. 1962. Вып. 5. С. 238—249.
Герасимова-Навашина Е. Н. Двойное оплодотворение покрытосеменных и некоторые
теоретические аспекты // Проблемы эмбриологии. Киев: Наук, думка, 1971. С. 113—152.
Герасимова-Навашина Е. Н., Батыгина Т. Б. Процесс оплодотворения у Scilla sibirica Andr. //
Ботан. журн. 1958. Т. 43, № 7. С. 959—988.
Герасимова-Навашина Е. Н., Гуляев В. А. Некоторые данные об ультраструктуре клеток
зародышевого мешка Crepis capillaris (L.) Wallr. после опыления // Бюл. Гл. ботан. сада АН СССР. 1973.
№ 89. С. 14—20.
Герасимова-Навашина Е. Н., Коробова С. Н. О роли синергид в процессе оплодотворения // Бюл.
МОИП. Отд. биол. 1959. Т. 61, вып. 5. С. 69—76.
Гладкова В. Н. Порядок орхидные (Orchidales) сем. Орхидные (Orchidaceae) // Жизнь растений.
М.: Просвещение, 1982. Т. 6. С. 248—275.
Глущенко Г. И. Цитоэмбриологическое исследование Allium сера L.: Автореф. дисс. ... канд.
биол. наук. М., 1958. 22 с.
Голенкин М. И. Победители в борьбе за существование. Исследование причин и условий
завоевания земли покрытосеменными растениями в середине мелового периода // Тр. Бот. ин-та
Ассоциации н.-и. ин-тов при Ф. М. фак. 1-го Моск. гос. ун-та. М., 1927. 101 с.
Голенкин М. И. Курс высших растений. М.-Л.: Биомедгиз, 1937. 598 с.
Литература
271
Голубева Е. А. Формирование ацетолизоустойчивых оболочек пыльцевых зерен и клеток тапету-
ма пыльников Beta vulgaris // Тр. по прикладной ботанике, генетике и селекции. Л., 1983. Т. 74. С.
56—64.
Голубева Е. А. Ультраструктура и функция средних слоев стенки пыльника сахарной свеклы //
Сборник научных трудов по прикладной ботанике, генетике и селекции ВНИИ растениеводства. Л.,
1989. Т. 124. С. 78—82.
Голубовская И. Н. Экспериментальное исследование генного контроля мейоза у кукурузы //
Теоретические основы селекции. Ред. Д. ф. Петров. Новосибирск: Наука, 1985. С. 119—134.
Голубовская И. Н. Хромосомы кукурузы // Генетика культурных растений: кукуруза, рис, просо,
овес, Л.: ВО «Агропромиздат», Ленинградское отд. 1988. С. 7—9.
Голышкин Л. Б. Цитологическое исследование микроспорогенеза и образование пыльцы видов
лука // Тр. по прикл. ботанике, генетике и селекции. Л., 1977. Т. 60, Вып. 2. С. 39—41.
Гольдшмидт Р. Механизм и физиология определения пола. М.; Пг.: Гос. изд-во, 1923. 294 с.
Грант В. Видообразование у растений. М.: Мир, 1984. 528 с.
Гревцова Н. А. Семейство Apiaceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 35—44.
Гревцова Н. А., Джалилова X. X. Строение стенки микроспорангия рода Lupinus L. // Proc. XI
Intern. Symp. «Embryology and seed reproduction», 3—7 July, 1990, Leningrad. St.-Petersburg, 1992.
P. 191—192.
Гревцова Н. А., Сладкое А. Н. О возможности унификации терминов при описании развития
стенки микроспорангия // Биол. науки. 1983. № 3. С. 83—87.
Гринфельд Э. К. Происхождение и развитие антофилии у насекомых. Л.: Изд-во ЛГУ, 1978. 206 с.
Гриф В. Г., Иванов В. Б. Временные параметры митотического цикла у цветковых растений //
Цитология. 1975. Т. 17, № 6. С. 694—717.
Гроссгейм А. А. К вопросу о графическом изображении систем цветковых растений // Сов.
ботаника. 1945. Т. 13, № 3. С. 3—27.
Данилова М. Ф., Кирпичников М. Э. Словарь терминов // Сравнительная анатомия семян. Л. :
Наука, 1985. Т. 1. С. 8—32.
Данилова М. Ф., Савченко М. И. Семейство Агесасеае // Сравнительная анатомия семян. Л.:
Наука, 1985. Т. 1.С. 236—253.
Дзевалтовский А. К. Семейство Cucurbitaceae // Сравнительная эмбриология цветковых
растений. Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. С. 127—138.
Еналеева И. X., Тырнов В. С, Хохлов С. С. Выделение зародышевых мешков покрытосеменных
растений путем мацерации тканей // Цитология и генетика. 1972. Т. 6. № 5. С. 439—441.
Ермаков И. П., ГоряеваО. В. Ультраструктура клеток семяпочки у некоторых представителей
семейства пасленовых. М., 1982а. Деп. МГУ, № 1851—82. Редкол. журн. «Вест. МГУ», сер. 16, биология.
Ермаков И. П., Горяева О. В. Изменения в структуре клеток семяпочки Lycopersicon esculentum
Mill., сопровождающие активацию зародышевого мешка перед оплодотворением // Вестник МГУ.
Сер. биол., 19826. 11 с.
Жинкина Н. А., Камелина О. П. Семейство Pittosporaceae // Сравнительная эмбриология
цветковых растений. Brunelliaceae-Tremandraceae. Л.: Наука, 1985. С. 20—24.
Жукова Г. Я. Ультраструктурные и функциональные особенности яйцеклетки цветковых //
Проблемы гаметогенеза, оплодотворения и эмбриогенеза. Материалы VIII Всесоюз. совещ. по
эмбриологии растений. Ташкент, 1983. С. 30—31.
Жукова Г. Я. Ультраструктура клеток зрелого зародышевого мешка цветковых (черты сходства
и различия) // Материалы Всесоюз. симпоз. Телави, 1984. С. 22—23.
Жукова Г. Я. Семейство Polemoniaceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 206—209.
Жукова Г. Я. Пластиды гамет и зародыша цветковых растений // Ботан. журн. 1993. Т. 78, № 4.
С. 18—35.
Жукова Г. Я., Поддубная-Арнольди В. А. Семейство Solanaceae // Сравнительная эмбриология
цветковых растений. Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 241—248.
Жукова Г. Я., Соколовская Т. Б. Ультраструктура антипод зародышевого мешка Aconitum napellus
L. (Ranunculaceae) перед оплодотворением // Ботан. журн. 1977. Т. 62, № 11. С. 1600—1611.
Жукова Г. Я., Соколовская Т. Б. О некоторых ультраструктурных особенностях зародышевого
мешка Aconitum napellus L. // Тез. докл. VI делегат, съезда ВБО. Л., 1978. С. 77—78.
Жукова Г. Я., Соколовская Т. Б. О некоторых чертах ультраструктуры зародышевого мешка
Aconitum napellus L. // Проблемы гаметогенеза, оплодотворения и эмбриогенеза. Материалы VIII
Всесоюз. совещ. по эмбриологии растений. Ташкент, 1983. С. 67—68.
Жукова Г. Я., Тучина Н. Г. Семейство Агесасеае // Сравнительная эмбриология цветковых
растений. Butomaceae-Lemnaceae. Л.: Наука, 1990. С. 255—266.
Жуковский П. М. Ботаника. М.: Сов. наука, 1949. 552 с.
Жуковский П. М., Медведев Ж. Внепластидные каротиноиды и спорогенез // ДАН СССР. 1949.
Т. 94, № 1. С. 141—144.
Жученко А. А., Король А. Б. Рекомбинация в эволюции и селекции. М.: Наука, 1985. 400 с.
272 Генеративные органы цветка
Зуева Г. В. Особенности формирования мужского гаметофита пшенично-ржаного амфидиплоида
// Индукция цветения и морфогенез монокарпических побегов травянистых поликарпических
растений. Свердловск, 1975. С. 76—81.
Ивановская Е. В. Цитоэмбриологическое исследование дифференциации клеток растений. М. :
Изд-воМГУ, 1983. 152 с.
Ильина Г. М. Семейство Papaveraceae // Сравнительная эмбриология цветковых растений.
Winteraceae-Juglandaceae. Л.: Наука, 1981. С. 142—150.
Ильина Г. М. Семейство Lemnaceae // Сравнительная эмбриология цветковых растений.
Butomaceae-Lemnaceae. Л.: Наука, 1990. С. 279—288.
Ильина Г. ML, Поддубная-Арнольди В. А. Семейство Aizoaceae // Сравнительная эмбриология
цветковых растений. Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. С. 16—19.
Имс А. Морфология цветковых растений. ML: Мир, 1964. 497 с.
Инге-Вечтомов С. Г. Генетика с основами селекции. М.: Высшая школа, 1989. 592 с.
Иоффе М. Д. Развитие зародыша и эндосперма у пшеницы, конских бобов и редиса // Тр. БИН
им. В. Л. Комарова АН СССР. Сер. VII. 1957. Вып. 4. С. 211—269.
Иоффе М. Д. К эмбриологии Trochodendron aralioides Sieb. et Zucc. (Развитие пыльцы и
зародышевого мешка) // Тр. БИН им. В. Л. Комарова АН СССР. Сер. VII. 1962. Вып. 5. С. 250—259.
Иоффе М. Д. Процесс оплодотворения у Anemone nemorosa L. и A. ranunculoides L. // Ботан.
журн. 1968. Т. 53, № 7. С. 891—905.
Исаева В. С, Преснов Е. В. Пространственная организация клеток и морфогенез //
Теоретические и математические аспекты морфогенеза. М., 1987. С. 48—71.
Камалова Г. В., Жукова Г. Я., Руми В. А. Семейство Malvaceae // Сравнительная эмбриология
цветковых растений. Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. С. 260—266.
Камелина О. П. Тапетум у ворсянковых (Dipsacaceae) и классификация типов тапетума у
покрытосеменных // Тез. докл. VI Делегат, съезда ВБО. Л., 1978. С. 78—79.
Камелина О. П. Сравнительная эмбриология семейства Dipsacaceae и Morinaceae. Л.: Наука, 1980.
102с.
Камелина О. П. К эмбриологии малоизученных таксонов. 1. Некоторые данные по эмбриологии
семейства Eupomatiaceae // Ботан. журн., 1981а. Т. 66, № 6. С. 854—859.
Камелина О. П. Пыльник // Сравнительная эмбриология цветковых растений. Winteraceae-
Juglandaceae. Л.: Наука, 19816. С. 18—21.
Камелина О. П. Семейство Daphniphyllaceae // Сравнительная эмбриология цветковых растений.
Winteraceae-Juglandaceae. Л.: Наука, 1981в. С. 172—176.
Камелина О. П. Семейство Calycanthaceae // Сравнительная эмбриология цветковых растений.
Winteraceae-Juglandaceae. Л.: Наука, 1981г. С. 69—74.
Камелина О. П. Семейство Phytolaccaceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983а. С. 7—13.
Камелина О. П. Семейство Datiscaceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 19836. С. 139—144.
Камелина О. П. Семейство Stachyuraceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983в. С. 106—110.
Камелина О. П. Семейство Tamaricaceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983 г. С. 179—185.
Камелина О. П. К эмбриологии рода Escallonia L. (Escalloniaceae) // Ботан. журн. 1984а. Т. 69,
№ 10. С 1304—1316.
Камелина О. П. Развитие пыльника и пыльцевого зерна у Daphniphyllum macropodum
(Daphniphyllaceae) // Ботан. журн. 19846. Т. 69, № 3. С. 376—383.
Камелина О. П. Семейство Nitrariaceae // Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandraceae. Л.: Наука, 1985а. С. 152—156.
Камелина О. П. Семейство Coriariaceae// Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandraceae. Л.: Наука, 19856. С. 173—175.
Камелина О. П. Семейство Sonneratiaceae // Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandraceae. Л.: Наука, 1985в. С. 88—93.
Камелина О. П. Семейство Zygophyllaceae // Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandraceae. Л.: Наука, 1985 г. С. 145—152.
Камелина О. П. Семейство Спеогасеае // Сравнительная эмбриология цветковых растений.
Brunellaceae-Tremandraceae. Л.: Наука, 1985д. С. 138—141.
Камелина О. П. Семейство Morinaceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 1987а. С. 177—184.
Камелина О. П. Семейство Dipsacaceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 19876. С. 184—192.
Камелина О. П. Эмбриология рода Brexia в связи с его систематическим положением // Ботан.
журн. 1988. Т. 73, № 3. С. 355—366.
Камелина О. П. Семейство Marantaceae // Сравнительная эмбриология цветковых растений. Л. :
Наука, 1990а. С. 247—254.
Литература
21 г
Камелина О. П. Развитие мужских и женских эмбриональных структур в семействе Marantaceae //
Ботан. журн. 19906. Т. 75, № 4. С. 480—493.
Камелина О. П. Семейство Cymodoceaceae// Сравнительная эмбриология цветковых растений.
Butomaceae-Lemnaceae. Л.: Наука, 1990в. С. 52—54.
Камелина О. П. Сравнительно-эмбриологический анализ как метод филогенетической
систематики цветковых растений: Дисс. ... доктора биол. наук. Ташкент, 1991. 80 с.
Камелина О. П., Дзевалтовский А. К. Семейство Lamiaceae // Сравнительная эмбриология
цветковых растений. Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 225—236.
Камелина О. П., Жинкина.Н. А. К эмбриологии Ostrowskia magnifica (Campanulaceae). Развитие
мужских эмбриональных структур // Ботан. журн. 1989. Т. 74, № 9. С. 1293—1301.
Камелина О. П., Жукова Г. Я. Семейство Valerianaceae // Сравнительная эмбриология цветковых
растений. Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 171—177.
Камелина О. П., Коннова В. А. Эмбриологические признаки рода Biebersteinia Steph. в связи с его
систематическим положением // Докл. АН Тадж. ССР. 1990. Т. 33, № 3. С. 193—195.
Камелина О. П., Малдыбекова К. С. Развитие пыльника и пыльцевого зерна у Valeriana phu
(Valerianaceae) // Ботан. журн. 1980. Т. 65, № 5. С. 640—646.
Камелина О. П., Проскурина О. Б. К эмбриологии Stegnosperma halimifolium (Stegnospermataceae).
Распределение эмбриологических признаков в порядке Caryophyllales // Бот. журн. 1985. Т. 70, № 6.
С. 721—730.
Камелина О. П., Проскурина О. Б. Семейство Elaeagnaceae // Сравнительная эмбриология
цветковых растений. Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 105—110.
Камелина О. П., Терехин Э. С. Семейство Zannichelliaceae //Сравнительная эмбриология
цветковых растений. Butomaceae-Lemnaceae Л.: Наука, 1990. С. 44—50.
Камелина О. П., Тучина Н. Г. К эмбриологии малоизученных таксонов. II. Развитие
пыльника и пыльцевого зерна у Nandina domestica Thunb. (Berberidaceae) // Ботан. журн. 1982.
Т. 67, № 11. С. 1459—1468.
Камелина О. П., Тучина Н. Г., Вишнякова М. Н. Семейство Caprifoliaceae // Сравнительная
эмбриология цветковых растений. Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 159—168.
Камелина О. П., Хоролсурен Ш., Проскурина О. Б. К эмбриологии представителей флоры МНР —
Incarvillea potaninii (Bignoniaceae) и Sphaerophysa salsula (Fabaceae) // Ботан. журн. 1990. Т. 75, № 9. С.
1248—1261.
Камелина О. П., Яковлев М. С. Развитие зародышевого мешка в роде Morina L. // Ботан. журн.
1974. Т. 59, № 11. С. 1609—1617.
Камелина О. П., Яковлев М. С. Развитие пыльника и микрогаметогенез у представителей сем.
Dipsacaceae и Morinaceae // Ботан. журн. 1976. Т. 61, № 7. С. 932—945.
Камелина О. П., Яковлева Г. В. Мегаспорогенез и развитие зародышевого мешка у Dianthus
caryophyllus L. (Caryophyllaceae). // Ботан. журн. 1982. Т. 67, № 1. С. 80—87.
Кантор Т. С. К эмбриологии культурного льна // Бюлл. Гл. ботан. сада АН СССР. 1957. Вып. 29.
С. 48—60.
Кантор Т. С- Сравнительно-эмбриологические исследования культурного и некоторых диких
видов льна // Эмбриологические исследования покрытосеменных. Тр. Гл. ботан. сада АН СССР. 1959.
Т. 6. С. 170—190.
Капинос Г. Е., Каграманова Ф. В. К биологии цветения и цитоэмбриологии Leontice L. // Изв.
АН Аз. ССР. Сер. биол. наук. 1966. № 1. С. 10—16.
Карташева Н. Н. Строение и функция нектарников цветка двудольных. Томск: Изд-во Томск,
унта, 1965. 195 с.
Кернер А. Жизнь растений. С.-П. 1901. Т. 1. 773 с.
Козо-Полянский Б. М. Введение в филогенетическую систематику высших растений. Воронеж:
Природа и культура, 1922. 167 е.
Козо-Полянский Б. М. К модернизации системы растительного мира // Тр. Воронеж. Гос. Ун-та.
1948. Т. 15. С. 76—129.
Кольцов Н. К. Роль гена в физиологии развития // Биол. журн. 1935. Т. IV, № 5. С.
753—774.
Комар Г. А. О структуре ариллуса некоторых представителей сем. крыжовниковых
(Grossulariaceae) // Морфология цветка и репродуктивный процесс у покрытосеменных растений М.-
Л.: Наука, 1965а. С. 114—130.
Комар Г. А. Ариллусы, их природа, строение и функции. // Ботан. журн. 19656. Т. 50, № 5. С.
715—724.
Комар Г. А. О типе семяпочки некоторых представителей подсемейства Asphodeloideae
(Liliaceae) // Ботан. журн. 1982. Т. 67, № 7. С 800—805.
Комар Г. А. Семейство Liliaceae//Сравнительная анатомия семян. Л.: Наука, 1985. Т. 1. С. 71—76.
Комар Г. А., Савченко М. И. Морфология семяпочки покрытосеменных растений. Л.: Наука,
1973. С. 55—64.
Кондратьева В. П., Тихова М. А. Женский гаметофит. Оплодотворение // Репродуктивные
структуры голосеменных. Л.: Наука, 1982. С. 72—83.
18 Генеративные органы цветка.
274
Генеративные органы цветка
Конычева В. И., Кадырова Р. У. Семейство Chenopodiaceae // Сравнительная эмбриология
цветковых растений. Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. С. 49—52.
Кордюм Е. Л. Цитоэмбриология семейства зонтичных. Киев: Наукова думка, 1967. 176 с.
Кордюм Е. Л. Особенности раннего онтогенеза семяпочки с различным типом археспория у ряда
представителей покрытосеменных // Цитология и генетика. 1968. Т. 2, № 5. С. 415—428.
Кордюм Е. Л. Значение эмбриологии для решения вопросов систематики и филогении
покрытосеменных растений // Проблемы эмбриологии. Киев: Наукова думка, 1971. С. 196—216.
Кордюм Е. Л. Особенности дифференциации и филогенетическое значение женского
археспория покрытосеменных // Эмбриология покрытосеменных растений. Кишинев: Штиинца,
1973. С. 24—33.
Кордюм Е. Л. Эволюционная цитоэмбриология покрытосеменных растений. Киев: Наукова
думка, 1978. 219 с.
Кордюм Е. Л., Недуха Е.М., Сидоренко П. П. Структурно-функциональная характеристика
растительной клетки в процессах дифференцировки и дедифференцировки. Киев: Наукова думка, 1980.
112с.
Коробова С. Н. О ходе оплодотворения у кукурузы (Zea mays L. ) // Докл. АН СССР. 1959. Т.
127, №4. С. 921—923.
Коробова С. Н. Сравнительное изучение тычиночных и пестичных цветков кукурузы // V Всес.
совещ. по эмбриологии растений. Кишинев, 1971. С. 86—87.
Коробова С. Н. Движение спермиев в пыльцевой трубке покрытосеменных растений // Ботан.
журн. 1977. Т. 62, № 11. С. 1585—1589.
Коробова С. Н. Движение спермиев покрытосеменных растений в пыльцевой трубке и в
зародышевом мешке // Актуальные вопросы эмбриологии покрытосеменных. Л.: Наука, 1979. С. 5—19.
Коробова С. Н. Семейство Plumbaginaceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. С. 59—64.
Коробова С. Н. Семейство Saxifragaceae // Сравнительная эмбриология цветковых растений.
Brunnelliaceae-Tremandraceae. Л.: Наука, 1985. С. 26—29.
Коробова-Семенченко Л. В. К эмбриологии семейства Saxifragaceae. VI. Микропилярные
гаустории и ранние стадии развития зародыша у Chrysosplenitim alternifolium L. // Вестн. Моск. Гос. Ун-та.
Сер. 16, Биология, 1976. № 5. С. 92—94.
Корчагина И. А. Типы семязачатков у березовых и возможное направление их эволюции // Тез.
докл. Моск. межвуз. конф. по морфологии растений. М., 1965. С. 159—160.
Корчагина И. А. Попытка классификации морфологических типов семязачатков
покрытосеменных // Ботан. журн. 1969. Т. 54, № 10. С. 1513—1530.
Корчагина И. А. Семейство Betulaceae // Сравнительная эмбриология цветковых растений.
Winteraceae-Zuglandaceae. Л.: Наука, 1981. С. 201—210.
Кострюкова К. Ю. К биологическому пониманию развития пыльцевого зерна // Агробиология.
1948. №2. С. 51— 61.
Кострюкова К. Ю. К вопросу о разнокачественное™ спермиев-клеток, происходящих из одной
пыльцевой трубки // Ботан. журн. 1951. Т. 8. № 3. С. 17—21.
Кострюкова К. Ю. Разнокачественность спермиев в двойном оплодотворении // Материалы Все-
союз. симпоз. по эмбриологии растений. Киев, 1968. С. 107—111.
Кострюкова К. Ю., Бенецкая Г. К. Подтверждает ли дальнейшее развитие эмбриологии учение
С. Г. Навашина о самостоятельной подвижности мужских гамет покрытосеменных // Изв. АН
АрмССР. 1958. Т. 11. №9.
Кострюкова К. Ю., Чернояров М. В. Спостережения над прорастаниям пилку Clivia miniata Hort.
in vitro // Сборник памяти акад. А. Ф. Фомина. Киев, 1938.
Красилов В. А. Происхождение и ранняя эволюция цветковых растений. М. : Наука, 1989. 263 с.
Кречетович Л. М. Вопросы эволюции растительного мира. М. : МОИП, 1952. 351 с.
Круглова Н. Н. Эмбриология двукисточника тростникового Phalaroides arndinacea (L. ) Rausch. :
Автореф. дисс. ... канд. биол. наук Л., 1985. 21 с.
Круглова Н. Н. Движение ядер в микроспорах и клеток в пыльцевых зернах злаков как
диагностический признак аномалий процесса микроспорогенеза // Тез. докл. науч. конф. «Изучение,
охрана и рациональное использование природных ресурсов». Уфа, 1989. С. 87.
Крылова В. В. Биология макроспорогенеза и семяобразования культурных видов фасоли //
Биология оплодотворения и гетерозис культурных растений. Кишинев, 1963. Вып. 2. С. 79—1 53.
Кузнецов Н. И. Введение в систематику цветковых растений. Л.: ОГИЗ, 1936. 456 с.
Куприянова Л. А., Алешина Л. А. Палинологическая терминология покрытосеменных растений.
Л.: Наука, 1967. 84 с.
Курбанов Э. А. Сравнительное исследование ультраструктуры микроспорогенеза зизифоры и
чабреца // Изв. АН Аз. ССР, Сер. биол. науки. 1981. № 4. С. 6—11.
Курсанов А. Л. Транспорт ассимилятов в растениях. М: Наука, 1976. 676 с.
Курсанов Л. И., Крашенинников Ф. И., Комарницкий Н. А., Курсанов А. Л. Курс ботаники для
высших педагогических учебных заведений и университетов. М.: Гос. Учебно-Пед. Изд-во Нарком-
проса РСФСР, 1940. Т. 1. 419 с.
Литература
21Ъ
Кушев В. В. Механизмы генетической рекомбинации. Л.: Наука, 1971. 247 с.
Левигс-кий Г. А. Экспериментально вызванное перемещение хромосом из одной клетки в другую
// Журн.'рус. бот. об-ва. 1928. Т. 13, № 1—2. С. 19—25.
Литвак А. И. Люминесцентная микроскопия в исследовании опыления и роста пыльцевых трубок
в пестике // Генетика и селекция в Молдавии. Кишинев, 1971.
Литвак А. И., Колесников С. М. Использование микрофотосъемки в изучении процессов развития
мужского гаметофита покрытосеменных растений // Биология оплодотворения и гетерозиса
культурных растений. Кишинев, 1965.
Лищитович Л. И. Введение в понятие онтогенетической цепи // Системный подход в биологии
растений. Киев, 1974. С. 23-32.
Лодкина М. М. Формирование пыльцевых мешков у двух видов ряски // Материалы V Всесоюз.
совещ. по эмбриологии раст. Кишинев, 1971. С. 102.
Лунева М. 3., Бутенко Р. Г., Поддубная-Арнольди В. А. Культура тканей — этап в гибридизации
травянистых и древесных форм Nicotiana // Цитология и генетика. 1972. Т. 6, № 4. С. 291—297.
Лютге У., Хигинботам Н. Передвижение веществ в растениях. М.: Колос, 1984. 408 с.
Магакян Ю. А., Наджарян Н. У., Колтухчева Н. А. Содержание суммарного белка в.клетках как
фактор регуляции их пролиферации // Цитология. 1987. Т. 29, № 4. С. 465—471.
Магешвари П. Эмбриология покрытосеменных. М.: Иност. лит., 1954. 439 с.
Маметьева Т. Б., КамелинаО. П. Семейство Myristicaceae // Сравнительная эмбриология
цветковых растений. Winteraceae-Juglandaceae. Л.: Наука, 1981. С. 47—50.
Мандрик В. Ю., Петрус Ю. Ю. Семейство Rosaceae // Сравнительная эмбриология цветковых
растений. Brunelliaceae-Tremandraceae. Л.: Наука, 1985. С. 55—64.
Медведева Г., Базавлук В. К вопросу о стерильности ветвистой пшеницы // Докл. АН СССР.
1951. Т. 77, №6. С. 1099—1102.
Меликян А. П. Гистогенез спермодермы у Brasenia schreberi Gmel. и Nymphaea capensis Thunb. //
Вестн. ЛГУ, Сер. биол., 1964. Вып. 2, № 9. С 121—125.
Мейер К. Н. Эволюция мужского гаметофита покрытосеменных растений. // Бюлл. Московского
общества испытателей природы. 1953. Т. 58, Отд. биол. Вып. 5. С. 55—61.
Миляева Э. Л. К вопросу о цитомиксисе в процессе микроспорогенеза // Бюл. Гл. ботан. сада
АН СССР. 1965. Вып. 59. С. 53—58.
Мовсесян С. Н. Сравнительное цитоэмбриологическое исследование некоторых видов рудбекий //
Материалы Всесоюз. симпоз. по эмбриологии растений. Киев, 1968. С. 138—140.
Модилевский Я. С. До вивчения пол1ембрюни у Allium odorum L. // BicH. Khjb. ботан. саду. 1925.
Bun. 2. С. 9—20.
Модилевский Я. С. Дальнейшие исследования по эмбриологии и цитологии видов Allium // BicH.
К'1'в. бот. саду. 1928а. № 7/8. С. 57—64.
Модилевский Я. С. Женский гаметофит у Angiospermae // Укр. ботан. журн. 19286. № 5. С. 5—40.
Модилевский Я. С. Про утворения зародк1в Allium odorum L. II BiCH. Кшв. ботан. саду. 1931. Вип.
12—13. С. 27—48.
Модилевский Я. С. Современное состояние вопроса об эндосперме у покрытосеменных растений
в связи с формированием зародыша, семени и плода // Изв. АН СССР, сер. биол., 1950. С.
Модилевский Я. С. Эмбриология покрытосеменных растений. Киев, 1953. 224 с.
Модилевский Я. С. Окснюк П. Ф., Худяк М. И. и др. Цитоэмбриология основных хлебных злаков.
Киев: Изд-во АН УССР, 1958. 336 с.
Навашин М. С. О ядрах меристематической ткани, возникающей при регенерации у растений //
Рефераты н.-и. работ за 1945 г. Отд. биол. наук АН СССР, 1947. С. 262—263.
Навашин М. С. Пыльцевая трубка покрытосеменных как полярно-дифференцированная система
// Материалы Всесоюз. симпоз. по эмбриологии растений. Киев, 1968. С. 141—146.
Навашин М. С, Макушенко Л. М. О начальных фазах регенерации в связи с вопросом о генезисе
растительной клетки // Тр. совещ. по эмбриологии «Проблемы современной эмбриологии». Л., 1956.
С 356.
Навашин М. С., Макушенко Л. М., Волховских 3. В. Морфологическое исследование пыльцевой
трубки // Тез. координац. совещ. по проблеме «Узловые вопросы цитологии». Л.,-1959. С. 17.
Навашин С. Г. Об оплодотворении у сложноцветных и орхидных. (Предварительное сообщение)
// Известия Имп. Акад. наук. 1900. Т. 13, № 3. С. 335—340.
Навашин С. Г. О самостоятельной подвижности мужских половых ядер у некоторых
покрытосеменных растений // Зап. Киевск. об-ва естествоисп. 1910. Т. 20, Вып. 4. С. 321—336.
Навашин С. Г. Результаты пересмотра процессов оплодотворения у Lilium martagon и Fritillaria
tenella // Избр. труды. М.-Л.: Изд-во АН СССР, 1951а. Т. 1. С. 188—192.
Навашин С. Г. Об оплодотворении у сложноцветных и орхидей // Избр. труды. М.-Л.: Изд-во АН
СССР, 19516. Т. 1. С. 225—229.
Навашин С. Г. О процессах оплодотворения у некоторых двудольных // Избр. труды М.-Л.: Изд.
АН СССР, 1951 в. Т. 1. С. 230—235.
Навашин С. Г. Опыт структурного изображения свойств половых клеток // Избр. труды. М.-Л.:
Изд-во АН СССР, 1951г. Т. 1. С. 326—361.
18*
276
Генеративные органы цветка
Навашин С. Г. Подробности об образовании мужских половых ядер у Lilium martagon // Зап. Киев,
об-ва естествоиспытателей. 1911. Т. 21, Вып. 4. С. 119—151 (см. Избр. труды. М.-Л. 1951 д. Т. 1. С.
247—270.
Навашин С. Г. Об обыкновенной березе и о морфологическом значении халазогамии // Избр.
труды. М.-Л.: Изд-во АН СССР. 1951е. Т. 1. С. 123—167.
Навашин С. Г., Финн В. В. К истории развития халазогамных Juglans nigra и Juglans regia // Зап.
Киев, об-ва естествоиспытателей. 1912. Т. 22, Вып. 3—4. С. 1—85.
Наумова Т. Н. Полиэмбриония у Euonymus macroptera Rupr. и Е. planipes (Koehne) Koehne //
Ботан. журн. 1970. Т. 55, № 9. С. 1270—1280.
Наумова Т. Н. К эмбриологии представителей семейства Buxaceae // Ботан. журн., 1981. Т. 66,
№8. С. 1135—1145.
Наумова Т. Н. Семейство Ochnaceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. С. 78—83.
Наумова Т. Н. Семейство Celastraceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 1987а. С. 49—54.
Наумова Т. Н. Семейство Asclepiadaceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 19876. С. 132—137.
Наумова Т. Н. Семейство Trilliaceae // Сравнительная эмбриология цветковых растений.
Butomaceae-Lemnaceae. Л.: Наука, 1990. С. 151—159.
Никитичева 3. И. О взаимосвязях в развитии эндосперма и тканей семязачатка у видов семейств
Scrophulariaceae и Orobanchaceae // Ботан. журн. 1979а. Т. 64, № 11. С. 1567—1580.
Никитичева 3. И. Развитие зародыша, эндосперма и семени у паразитных представителей
семейства Scrophulariaceae // Актуальные вопросы эмбриологии покрытосеменных. Л.: Наука, 19796.
С. 130—157.
Никитичева 3. И. Семейство Saururaceae // Сравнительная эмбриология цветковых растений.
Winteraceae-Juglandaceae. Л.: Наука, 1981а. С. 81—84.
Никитичева 3. И. Семейство Piperaceae // Сравнительная эмбриология цветковых растений.
Winteraceae-Juglandaceae. Л.: Наука, 19816. С. 84—90.
Никитичева 3. И. Семейство ЕЬепасеае // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983а. С. 229—233.
Никитичева 3. И. Семейство Styraceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae Л.: Наука, 19836. С. 221—225.
Никитичева 3. И. Семейство Crassulaceae // Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandraceae. Л.: Наука, 1985а. С. 29—34.
Никитичева 3. И. Семейство Haloragaceae // Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandraceae. Л.: Наука, 19856. С. 116—120.
Никитичева 3. И. Семейство Linaceae // Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandraceae. Л.: Наука, 1985в. С. 196—201.
Никитичева 3. И. Семейство Polygalaceae '// Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandraceae. Л.: Наука, 1985г. С. 225—230.
Никитичева 3. И. Семейство Scrophulariaceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Lemnaceae. Л.: Наука, 1987. С. 251—259.
Никитичева 3. И. Семейство Scheuchzeriaceae // Сравнительная эмбриология цветковых
растений. Butomaceae-Lemnaceae. Л.: Наука, 1990. С. 26—28.
Никитичева 3. И., Анисимова Г. М. Семейство Loranthaceae // Сравнительная эмбриология
цветковых растений. Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 74—83.
Никитичева 3. И., Проскурина О. Б. Семейство Convolvulaceae // Сравнительная эмбриология
цветковых растений. Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 196—200.
Никитичева 3. И., Проскурина О. Б. Семейство Juncaginaceae // Сравнительная эмбриология
цветковых растений. Butomaceae-Lemnaceae. Л.: Наука, 1990. С. 28—34.
Никитичева 3. И., Проскурина О. Б. Эмбриология Scheuchzeria palustris (Scheuchzeriaceae) //
Ботан. журн. 1992. Т. 77, № 1. С. 3—18.
Никитичева 3. И., Яковлев М. С. Семейство Rhizophoraceae // Сравнительная эмбриология
цветковых растений. Brunelliaceae-Tremandraceae. Л.: Наука, 1985. С. 120—125.
Никитичева 3. И., Яковлев М. С, Плющ Т. А. Развитие семяпочки, зародышевого мешка,
зародыша и эндосперма у некоторых видов рода Peperomia (Piperaceae) // Ботан. журн. 1981. Т. 66, №
10. С. 1388—1397.
Огородникова В. Ф. Ультраструктура тапетальной пленки некоторых культурных растений // Тр.
по прикл. ботанике, генетике и селекции. 1976а. Т. 58. С. 124—129.
Ультраструктура тапетальных пленок пыльников Triticum activum L., Secale cereale L. и Avena
sativa L. // Тез. докл. X Всесобзн. конф. по электрон, микроскопии. Ташкент, 19766. Т. 2. С. 380—382.
Огородникова В. Ф. Генезис и ультраструктура спорополлениновой оболочки клеток тапетума
злаков // Ботан. журн. 1986. Т. 71, № 10. С. 1366—1371.
Огородникова В. Ф. Динамика ультраструктуры клеточных органелл тапетума Triticum aestivum
(Poaceae) // Ботан. журн. 1990. Т. 75, № 2. С. 186—192.
Литература
277
Окаюк П. Ф. Ембрюлопя цукрового буряка // Вюн. Ки1в ботан. саду. 1927, № 5/6. С.
145—164.
Оксиюк П. Ф. Сравнительное цитолого-эмбриологическое исследование семейства Resedaceae
(Reseda и Astrocarpus). // Журн. И-та ботаники АН УССР. 1937. № 12 (20). С. 1—40.
Орел Л. И. Цитоэмбриологическое изучение цитоплазматической мужской стерильности лука //
Тр. по прикл. ботанике, генетике и селекции. 1968. Т. 40, № 1. С. 163—176.
Орел Л. И. Цитология мужской цитоплазматической стерильности кукурузы и других
культурных растений. Л.: Наука, 1972. 84 с.
Орлова И. Н. Цитомиксис и его последствия в микроспорогенезе тетраплоидных Triticale //
Генетика. 1971. Т. VII, № 12.
Остапенко Е. К., Хведынич О. А. Цитохимическое исследование зародышевых мешков Galanthus
nivalis (Amaryllidaceae) // Ботан. журн. 1987. Т. 72, № 3, С. 291—298.
Паламарчук И. А. Развитие женского гаметофита у кремнистого сорта кукурузы // Науч. докл.
высш. школы. Биол. науки, 1958. № 4. С. 118—123.
Первухина И. В. Проблемы морфологии и биологии цветка. Л.: Наука, 1970. 169 с.
Петров Д. Ф. Генетически регулируемый апомиксис. Новосибирск: Наука, 1964. 188 с.
Петрова Т. Ф. Изменение основных частей семяпочки при развитии семени у некоторых
представителей Liliaceae // Ботан. журн. 1967. Т. 52, № 8. С. 1187—1193.
Петрова Т. Ф. Цитоэмбриология лилейных. Подсемейство Lilioideae. M.: Наука, 1977. 213 с.
Петрова Т. Ф., Соловьянова О. Б., Ченцова Ю. С. Ультраструктура гигантских хромосом в
антиподах ячменя // Цитология. 1985. Т. 27, № 5. С. 499—503.
Петровская Т. П. Динамика нуклеиновых кислот при репродуктивных процессах орхидей
Calanthe veitchii // Бюлл. Гл. ботан. сада. 1955. Вып. 22. С. 67—74.
Печеницын В. П. Морфология и эмбриология видов Tulipa: Автореф. дисс. ... докт. биол. наук.
Л., 1989.48 с.
Плиско М. А. Электронномикроскопическое исследование интегументального тапетума и
смежных тканей семязачатка у Calendula officinalis L.: Автореф. дисс. ... канд. биол. наук. Л., 1971 а. 22 с.
Плиско М. А. Электронномикроскопические исследования особенностей мегагаметогенеза у
Calendula officinalis L. // Ботан. журн. 19716. Т. 56, N° 5. С. 582—298.
Плиско М. А. Ультраструктура синергид у Calendula officinalis L. в начальный период развития (до
вхождения пыльцевой трубки в зародышевый мешок) //Ботан. журн. 1977а. Т. 62, № 2. С. 161—172.
Плиско М. А. Ультраструктура синергид в семязачатках Calendula officinalis (Asteraceae) после
вхождения пыльцевой трубки в зародышевый мешок//Ботан. журн. 19776. Т. 62, № 11. С. 1612—1619.
Плиско М. А. Ультраструктура нуцеллуса у Alcea rosea (Malvaceae) // Ботан. журн. 1980. Т. 65,
№ 6. С. 775—786.
Плиско М. А. Некоторые особенности дегенерации клеток нуцеллуса // Ботан. журн. 1982. Т. 67,
№ 11. С. 1469—1478.
Плиско М. А. Семейство Zingiberaceae // Сравнительная анатомия семян. Л., 1985. Т. 1. С. 217—
222.
Плиско М. А., Комар Г. А. Структура семяпочки покрытосеменных // Атлас ультраструктуры
растительных тканей. Петрозаводск, 1980. С. 431—447.
Плющ Т. А. Ультраструктура зародышевого мешка Peperomia blanda (Piperaceae) // Укр. ботан.
журн. 1982. Т. 39, № 4. С. 88—91.
Плющ Т. А. Субмикроскопическая характеристика репродуктивных структур семязачатка
Peperomia blanda (Piperaceae): Авторефер. дисс. ... канд. биол. наук. Л., 1983. 14 с.
Плющ Т. А. Ультраструктура клеток зародышевых мешков Lilium regale и L. candidum (Liliaceae)
до оплодотворения // Ботан. журн. 1987. Т. 72, № 5. С. 651—657. ■
Плющ Т. А. К вопросу о функциях синергид покрытосеменных // Ботан. журн. 1988а. Т. 73',
№8. С. 1140—1146.
Плющ Т. А. Оболочки клеток яйцевого аппарата покрытосеменных // Тез. докл. VI Всесоюз. сим-
поз. «Ультраструктура растений». Киев, 19886. С. 60.
Плющ Т. А. Электронно-микроскопическое наблюдение спермиев в зародышевом мешке Calanthe
vestita (Orchidaceae) и Nicotiana rustica (Solanaceae) // Ботан. журн. 1989а. Т. 74, № 3. С. 325—328.
Плющ Т. А. Ультраструктура зародышевого мешка Rudbeckia hirta (Asteraceae) // Ботан. журн.
19896. Т. 74, № 7. С. 932—940.
Плющ Т. А. Ультраструктура зародышевого мешка Allium-типа у Scilla sibirica (Liliaceae) и
Nicotiana rustica (Solanaceae) // Ботан. журн. 1989в. Т. 74, № 11. С. 1598—1602.
Плющ Т. А. Зародышевый мешок и оплодотворение у покрытосеменных (ультраструктурные
аспекты): Автореф. дисс. ... докт. биол. наук. Л., 1990. 33 с.
Плющ Т. А. К вопросу об ультраструктуре яйцевого аппарата покрытосеменных // Ботан. журн.
1991. Т. 76, № 8. С. 1049—1055.
Плющ Т. А. Ультраструктура зародышевого мешка покрытосеменных. Киев: Наук, думка, 1992.
146 с.
Плющ Т. А., Банникова В. П. Ультраструктура зародышевого мешка и оплодотворение у Adoxa
moschatellina (Adoxaceae) // Ботан. журн. 1989. Т. 74, № 1. С. 59—65.
278
Генеративные органы цветка
Поддубная-Арнольди В. А. Эмбриологический метод в систематике покрытосеменных растений
// Изв. Ассоц. НИИ физ.-мат. I МГУ. 1930. Т. 3, № 1-А.
Поддубная-Арнольди В. А. Значение эмбриологических исследований высших растений для
систематики // Успехи совр. биологии. 1951. Т. 32, Вып. 3. С. 352—392.
Поддубная-Арнольди В. А. Исследование процесса оплодотворения у некоторых
покрытосеменных растений на живом материале // Ботан. журн. 1958. Т. 43, № 2. С. 178—193.
Поддубная-Арнольди В. А. Исследование эмбриональных процессов у некоторых орхидей на
живом материале // Тр. Гл. ботан. сада. 1959. Т. 6. С. 49—89.
Поддубная-Арнольди В. А. Общая эмбриология покрытосеменных растений. ML: Наука, 1964.
482 с.
Поддубная-Арнольди В. А. Микроспорогенез и мужской гаметофит покрытосеменных растений //
Проблемы эмбриологии. Киев: Наук, думка, 1971. С. 26—72.
Поддубная-Арнольди В. А. Цитоэмбриология покрытосеменных растений. Основы и
перспективы. М.: Наука, 1976. 507 с.
Поддубная-Арнольди В. А. Семейство Ulmaceae // Сравнительная эмбриология цветковых
растений. Winteraceae-Juglandaceae. Л.: Наука, 1981. С. 186—187.
Поддубная-Арнольди В. А. Характеристика семейств покрытосеменных растений по цитоэмбри-
ологическим признакам. М.: Наука, 1982. 253 с.
Полунина Н. Н. Биология цветения и эмбриология некоторых представителей семейства
миртовых: Автореф. дисс. ... канд. биол. наук. М., 1958а.
Полунина Н. Н. К биологии цветения и эмбриологии Евгении миртолистной // Бюл. Гл. ботан.
сада АН СССР, 19586. Вып. 30. С. 59—65.
Полунина Н. Н. Биология цветения и эмбриология эвкалипта // Тр. Гл. ботан. сада АН СССР.
1959. Вып. 6. С. 191—210.
Полунина Н. Н. Микрофотосъемка при изучении пыльцы некоторых растений // Морфогенез
растений. М., 1961. Т. 2. С. 459—462.
Полунина Н. Н., Свешников А. И. Микрофотосъемка при изучении пыльцы и пыльцевых трубок
некоторых амариллисовых // Докл. АН ССР. 1959. Т. 127. № 1. С. 217—219.
Полякова Т. Ф. К вопросу о роли вегетативного ядра в развитии мужского гаметофита //
Цитология. 1961. Т. 3, № 3. С. 254—265.
Полякова Т. Ф. Изучение вегетативного ядра в пыльцевом зерне у Echinops sphaerocephalus //
Цитология. 1963. Т. 5, № 1. С. 52—60.
Полякова Т. Ф., Подставек С. Е. О поведении вегетативного ядра у растений с двухъядерным и
трехъядерным типом пыльцевых зерен // Докл. АН СССР. 1960. Т. 133, № 6. С. 1433—1436.
Презент И. И. Биологическое значение двойного оплодотворения // Агробиология. 1948. № 5. С.
45—57.
Проскурина О. Б. Эмбриология семейства Elaeagnaceae: Автореф. дисс. ... канд. биол. наук. Л.,
1990. 18 с.
Райков И. Б. Проблема происхождения и эволюции мейоза // Цитология и генетика мейоза. М.
: Наука, 1975. С. 344—371.
Резникова С. А. Закономерности клеточной дифференциации при микроспоро- и гаметогенезе
(на примере Lilium candidum L.): Автореф. дисс. ... докт. биол. наук. М., 1975. 46 с.
Резникова С. А. Пыльник как интегрированная система // Тез. докл. Всесоюз. симпоз. «Развитие
мужской генеративной сферы растений (морфофизиологические аспекты)». Симферополь, 1983. С.
69—70.
Резникова С. А. Цитология и физиология развивающегося пыльника. М.: Наука, 1984. 266 с.
Резникова С. А., Бугара А. М., Ерохина А. И. Цитохимическое исследование ДНК и гистонов в
тканях пыльника лилии в ходе микроспоро- и гаметогенеза // Онтогенез. 1979. Т. 10, № 3. С. 277—284.
Резникова С. А., Виллемсе М. Т. М. Электронно-микроскопическое и гистохимическое
исследование тканей развивающегося пыльника лилии в связи с метаболизмом запасных питательных
веществ // Физиология растений. 1981. Т. 28, Вып. С. 1181—1189.
Резникова С. А., Дикинсон X. Г. Клеточные механизмы катаболизма запасных липидов в тапе-
туме лилии // Докл. АН СССР. 1981. Т. 256, № 5. С. 1278—1280.
Резникова С. А., Островерхов В. О. Цитофотометрическое исследование содержания ДНК в
процессе микроспорогенеза у Lilium candidum L. // Докл. АНСССР. 1970. Т. 194, № 3. С. 695—697.
Реймерс Н. Ф. Популярный биологический словарь. М.: Наука, 1991. 536 с.
Ригер Р., Михаэлис А. Генетический и цитогенетический словарь. М.: Колос, 1967. 607 с.
Родионова Г. Б. Развитие семяпочки и интегументов у Heliophila amplexicaulis L. II Ботан. журн.
1972. Т. 57, №9. С. 1153—1161.
Родионова Г. Б. Семейство Саррагасеае // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. С. 150—154.
Родионова Г. Б. Семейство Brassicaceae // Сравнительная анатомия семян. СПб: Наука, 1992. Т.
4. С. 191—201.
Родкевич Б., Беднара И., Снежко Р. Поляризация клеток в мегаспорогенезе у Onagraceae //
Ботан. журн. 1976. Т. 61, № 7. С. 905—909.
Литература
279
Романов И. Д. Развитие зародышевого мешка в роде Gossypium // Вопросы цитологии,
эмбриологии и анатомии хлопчатника. Ташкент, 1936. С. 17—35.
Романов И. Д. Новая форма зародышевого мешка Adoxa-типа у Т. tetraphylla и Т. ostrovskiana //
Докл. АНСССР. 1938. Т. 19, № 1—2. С. 113—115.
Романов И. Д. Две новые формы зародышевого мешка в роде Tulipa // Докл. АН СССР. 1939. Т.
22. С. 140—142.
Романов И. Д. Эволюция зародышевых мешков цветковых растений. Дисс. ... докт. биол. наук.
Ташкент, 1944. 415 с.
Романов И. Д. Эволюция зародышевого мешка в группе Tulipeae семейства Liliaceae // Бюлл.
среднеаз. гос. ун-та. 1945. Вып. 23. С. 118—119.
Романов И. Д. Опыт причинного анализа форм тетрад макроспор // Тез. докл. совещ.
эмбриологов. Л. 1955. С. 111—112.
Романов И. Д. Зародышевый мешок в роде Tulipa// Докл. АНСССР. 1957. Т. 115, № 5. С. 1025—
1027.
Романов И. Д. Параллелизм в эволюции зародышевого мешка покрытосеменных. // Вопросы
эволюции, биогеографии, генетики и селекции. М.-Л., 1960а. С. 217—223.
Романов И. Д. Развитие семяпочек и зародышевого мешка у хлопчатника (Gossypium) //
Хлопчатник. III. Строение и развитие хлопчатника. Ташкент, 19606. С. 326—355.
Романов И. Д. Эволюция онтогенеза зародышевого мешка покрытосеменных // Всесоюз. совещ.
эмбриологов. Тезисы докладов. М., 1960в. С. 145—146.
Романов И. Д. Происхождение особой структуры ядер эндосперма у Gagea // Докл. АН СССР.
1961. Т. 141, № 4. С. 984—986.
Романов И. Д. Аномальные мейозы и цитоплазматический градиент в зародышевых мешках
некоторых цветковых растений. I. Виды Rhinopetalum и Erythronium sibiricum // Цитология. 1963. Т. 5,
№ 6. С. 623—629.
Романов И. Д. Аномальные митозы и цитоплазматический градиент в зародышевых мешках
некоторых растений. II. Виды Tulipa // Цитология. 1965а. Т. 7, № 1. С. 23—32.
Романов И. Д. Опыт анализа некоторых особенностей развития зародышевого мешка Fritilaria-ти-
па. // Ботан. журн. 19656. Т. 50, № 9. С. 1276—1287.
Романов И. Д. Эмбриологические исследования и систематика // Проблемы ботаники. М.-Л.,
1965в. С. 79—80.
Романов И. Д. Специфические особенности развития пыльцы злаков // Докл. АН СССР. 1966. Т.
169, № 2. С. 456—459.
Романов И. Д. Специфические особенности развития пыльцы злаков и их таксономическое
значение // Рефераты докл. Всесоюз. межвуз. конф. по морфологии растений. М., 1968. С. 245—247.
Романов И. Д. Особенности развития пыльцы злаков и значение их для некоторых генетических
исследований // Генетика. 1970а. Т. 6, № 10. С. 11—25.
Романов И. Д. Развитие пыльцы пшеницы по наблюдениям на живом материале // Бюлл. ВИР
им. Н. И. Вавилова. 19706. Вып. 15. С. 38—45.
Романов И. Д. Специфические особенности развития пыльцы злаков и значение их для некоторых
генетических исследований // Генетика. 1970в. Т. 6, № 6. С. 11—23.
Романов И. Д. Типы развития зародышевого мешка покрытосеменных растений // Проблемы
эмбриологии. Киев: Наукова думка, 1971а. С. 72—112.
Романов И. Д. Движение ядер при развитии зародышевого мешка у Solanum viraultorum (Bitt. )
Card, et Haukes // Ботан. журн. 19716. Т. 55, № 11. С. 1563—1668.
Романов И. Д. Зародышевый мешок // Сравнительная эмбриология цветковых растений.
Winteraceae-Juglandaceae. Л.: Наука, 1981. С. 11—16.
Романов И. Д., Грабовская С. Р. Механизм прикрепления пыльцевых зерен у злаков к стенке гнезд
пыльников // Тр. по прикл. ботанике, генетике и селекции. ВНИИ растениеводства. 1973. Т. 50, №
1.С. 285—293.
Романов И. Д., Орлова И. Н. Цитомиксис и его последствия в микроспороцитах Triticale //
Генетика. 1971. Т. 7, № 12. С. 5—13.
Сабинин Д. А. Физиология развития растений. М.: Изд-во АН СССР, 1963. 196 с.
Савина Г. И. Процесс оплодотворения у Ophrys insectifera // Ботан. журн. 1972. Т. 57, № 3. С.
389—392.
Савина Г. И. Семейство Sterculiaceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. С. 248—251.
Савина Г. И. Семейство Hydrangeaceae // Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandraceae. Л.: Наука, 1985. С. 14—18.
Савина Г. И. Семейство Proteaceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 113—115.
Савина Г. И., Поддубная-Арнольди В. А. Семейство Orchidaceae // Сравнительная эмбриология
цветковых растений. Butomaceae-Lemnaceae. Л.: Наука, 1990. С. 172—179.
Савченко М. И. Об отклонениях в развитии семяпочки некоторых покрытосеменных растений //
Ботан. журн. 1959. Т. 44, № 6. С. 786—804.
280
Генеративные органы цветка
Савченко М. И. Аномалии в строении семяпочек покрытосеменных растений // Докл. АН СССР.
1960. Т. 130, № 5. С. 1154—1157.
Савченко М. И. Морфология семяпочки покрытосеменных растений. Л.: Наука, 1973. 190 с.
Савченко М. И., Комар Г. А. Морфология семяпочек некоторых однодольных // Морфология
цветка и репродуктивный процесс у покрытосеменных растений. М.-Л., 1965. С. 74—113.
Савченко М. И., Петрова Л. Р. Морфология семяпочки ячменя Hordeum vulgare L. и некоторые
особенности ее развития // Ботан. журн. 1963. Т. 48, № 11. С. 1623—1638.
Сатарова Т. Н. Семейство Asparagaceae // Сравнительная эмбриология цветковых растений.
Butomaceae-Lemnaceae. Л.: Наука, 1990. С. 114—124.
Северцов А. Н. Морфологические закономерности эволюции. М.-Л.: Изд-во АН СССР, 1939.601 с.
Сенянинова-Корчагина М. В. О победе цветковых с позиции гелиогеофизики. Л.: Изд-во ЛГУ,
1959. 132 с.
Сердюк Л. С., Конарев В. Г. Флуоресцентный анализ структурного состояния ДНК в ядре //
Клеточное ядро и его ультраструктура. М.: Наука, 1970. С. 235—238.
Сидорова Н. В. Особенности ультраструктуры изолированных зародышевых мешков табака //
Докл. Акад. наук Укр. ССР. «Б», 1985. Т. 12. С. 63—66.
Симоненко В. К. Мужской гаметофит кукурузы и особенности его развития // Изв. АН МолдССР.
Сер. биол. и с.-х. наук. 1965. № 9. С. 32—36.
Симоненко В. К. Развитие пыльника и микроспор в фертильных и ЦМС-линиях подсолнечника //
Цитология и генетика. 1982. Т. 16, № 5, С. 34—41.
Сладкое А. Н. Полярные оси спор и расположение ядер при мейозе и тетрадах разных типов у
папоротникообразных // Докл. АН СССР. 1962. Т. 146, № 1. С. 225—229.
Сладков А. Н. Типы тетрад, гексад и спор // Вестн. МГУ. Сер. 6. Биология, почвоведение. 1970.
№2. С. 82—91.
Сладков А. Н. О типах тетрад микроспор покрытосеменных растений // Бюлл. МОИП. Отд. биол.
1989. Т. 94, Вып. 6, С. 48—52.
Сладков А. Н., Гревцова Н. А. О формировании стенки микроспорангия покрытосеменных. //
Бюлл. МОИП. Отд. биол. 1988. Т. 93, Вып. 4. С. 69—74.
Сладков А. Н., Гревцова Н. А. О формировании стенки мегаспорангия покрытосеменных //
Бюлл. МОИП. Отд. биол. 1989. Т. 4, Вып. 3. С. 75—79.
Сладков А. Н., Гревцова Н. А. Введение в эмбриологию покрытосеменных. М.: Изд-во МГУ, 1991.
96 с.
Смирнов А. Г. Женский гаметофит покрытосеменных и его эволюция. Казань: Изд-во Казан
унта, 1982. 120 с.
Смирнов А. Г. Некоторые результаты изучения эмбриологии Peperomia Langsdorffii // Материалы
VIII Всесоюз. совещ. по эмбриологии растений. Ташкент, 1983. С. 124—125.
Смирнова В. А. О передвижении ядер при мозаичных заболеваниях некоторых однодольных //
Бюлл. МОИП. Отд. биол. 1954. Т. 59, Вып. 5. С. 71—76.
Соколов И. Д. Развитие зародышевого мешка репчатого лука (Allium сера L.) // Изв. АН ТССР.
1968. Сер. биол. наук. № 1. С. 87—89.
Соколовская Т. Б. Семейство Ranunculaceae // Сравнительная Эмбриология цветковых растений.
Winteraceae-Juglandaceae Л.: Наука, 1981. С. 130—138.
Соколовская Т. Б. Семейство Elatinaceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. С. 96—98.
Солнцева М. П. О поведении ядер половых клеток и образовании мозаичного зародыша при се-
мигамии у Rudbeckia laciniata L. // Докл. АН СССР. 1971. Т. 197, № 1. С. 234—237.
Солнцева М. П. Семейство Polygonaceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. С. 53—58.
Солнцева М. П. Семейство Melastomataceae // Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandraceae. Л.: Наука, 1985. С. 94—96.
Солнцева М. П. Семейство Asteraceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 318—331.
Сравнительная анатомия семян. Л. : Наука, 1985. Т. 1. 315 с; 1988. Т. 2. 256 м.; 1991. Т. 3. 252 с;
1992. Т. 4. 448 с.
Сравнительная эмбриология цветковых растений. Л.: Наука, 1981. 264 с; 1983. 363 с; 1985. 285
с; 1987. 391 с; 1990. 332 с.
Старшова Н. П., Солнцева М. П. К характеристике зародышевого мешка Phellodendrom amurense
Rupr. II Ботан. журн. 1973. Т. 58, № 11. С. 1644—1654.
Стожарова И. А. О роли синергид в процессе оплодотворения у Allium nutans L. // Половой
процесс и эмбриогенез растений. М., 1973. С. 221—222.
Стожарова И. А., Поддубная-Арнольди В. А. Роль синергид при оплодотворении, эмбрио-
и эндоспермогенезе у Allium nutans L. // Бюлл. Гл. ботан. сада АН СССР. 1977. Вып. 105.
С. 70—78.
Строков А. А. Исследование гистонов в микроспорогенезе у лилии: Автореф. дисс ... канд. биол.
наук. М., 1977.
Литература
281
Таймла Э. А., Ермаков И. П., Тукеева М. И., Карпова Л. В. Электрофоретический анализ ядерных
гистонов мужского гаметофита Tradescantia paludosa Anders et Woodson // Вестн. Моск. Гос. Ун-та.
Сер. 16, Биология, 1984. № 3. С. 47—53.
Тарасенко Л. В., Банникова В. П. Ультраструктура трехклеточного пыльцевого зерна тритикале //
Укр. ботан. журн. 1986. Т. 43, № 1. С. 71 —73.
Тарасенко Л. В., Банникова В. П., Сытник К. М. Взаимосвязь клеток в пыльцевых зернах ржи и
маттиолы // Докл. АН УССР. 1988. Б, № 3. С. 81—84.
Татинцева С. С. О «специфических» клетках в тычинках сорго // Бот. журн. 1967. Т. 52,
№ 5. С. 690—695.
Татинцева С. С. О спермиогенезе некоторых покрытосеменных // Материалы Всесоюз. симпоз.
«Половой процесс и эмбриогенез растений». М., 1973. С. 228—229.
Татинцева С. С. Образование и развитие спермиев у некоторых покрытосеменных. I. Роасеае
(Gramineae); II. Asteraceae (Compositae) //Ботан. журн. 1975. Т. 60, № 12. С. 1707—1720.
Татинцева С. С. Образование и развитие спермиев у некоторых покрытосеменных. III.
Boraginaceae. IV. Najadaceae // Изв. АН Турк. ССР. Сер. биол. науки. 1988. № 1. С. 3—9.
Тахтаджян А. Л. Соотношение и фитогенез у высших растений // Тр. Ереван. Ун-та. 1943. Т. 22.
С. 71—176.
Тахтаджян А. Л. Морфологическая эволюция покрытосеменных. М.: МОИП, 1948. 301 с.
Тахтаджян А. Л. Теория филэмбриогенеза А. Н. Северцева и эволюционная морфология
растений // Проблемы ботаники. Изд. АН СССР. 1950. Вып. 1. С. 222—231.
Тахтаджян А. Л. Основы эволюционной морфологии покрытосеменных. М.-Л.: Наука, 1964. 236 с.
Тахтаджян А. Л. Система и филогения цветковых растений // М.-Л., Наука, 1966, 610 с.
Тахтаджян А. Л. Гаметофит, гаметангии и оплодотворение // Жизнь растений. Введение. Москва:
Просвещение, 1978. Т. 4. С. 32.
Тахтаджян А. Л. Семязачаток // Жизнь растений. М., 1980. Т. 5, ч. 1. С. 49—53.
Тахтаджян А. Л. Система магнолиофитов. Л.: Наука, 1987. 439 с.
Тахтаджян А. Л., Меликян А. М. Сравнительно-анатомическое изучение семенной оболочки
Leontice, Gymnospermium, Caulophyllum и близких родов в связи с их систематикой // Ботан. журн.
1972. Т. 57, № 10. С. 1271—1278.
Телепова М. Н. Ультраструктура клеток флоэмы в корне Hordeum vulgare L. Автореф. дисс. ...
канд. биол. наук. Л., 1985. 15 с.
Терехин Э. С. Развитие семяпочки и женского гаметофита у Pyroleae и Monotropeae // Ботан.
журн. 1963. Т. 48, № 3. С. 406—414.
Терехин Э. С. Паразитные цветковые растения. Эволюция онтогенеза и образ жизни // Л. : Наука,
Лен. отд., 1977. 219 с
Терехин Э. С. Некоторые черты эволюции женских семенных растений // Материалы Всесоюз.
симпоз. «Морфофункциональные аспекты развития женских генеративных структур семенных
растений». Телави, 1984. 58 с.
Терехин Э. С. Семейство Droseraceae II Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandiaceae. Л.: Наука, 1985. С. 48—51.
Терехин Э. С. Семейство Viscaceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 1987а. С. 82—86.
Терехин Э. С. Семейство Balanophoraceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 19876. С. 89—93.
Терехин Э. С. Семейство Orobanchaceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 1987в. С. 268—272.
Терехин Э. С. Семейство Najadaceae // Сравнительная эмбриология цветковых растений.
Butomaceae-Lemnaceae. Л.: Наука, 1990а. С. 54—56.
Терехин Э. С. Семейство Zosteraceae // Сравнительная эмбриология цветковых растений.
Butomaceae-Lemnaceae. Л.: Наука, 19906. С. 52—54.
Терехин Э. С. Проблемы онтогенеза семенных растений // Тр. БИН им. В. Л. Комарова АН СССР.
1991. Вып. 2. 68 с.
Терехин Э. С., Анисимова Г. М. Семейство Rafflesiaceae // Сравнительная эмбриология цветковых
растений. Winteraceae-Juglandaceae Л.: Наука, 1981. С. 96—100.
Терехин Э. С, Анисимова Г. М. Семейство Santalaceae // Сравнительная эмбриология цветковых
растений. Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 66—71.
Терехин Э. С, Батыгина Т. Б., Шамров И. И. Классификация типов стенки микроспорангия у
покрытосеменных. Терминология и концепции // Ботан. журн. 1993. Т. 78, № 6. С. 16—24.
Терехин Э. С, Камелина О. П. Эндосперм Orchidaceae (к вопросу о редукции) // Ботан. журн.
1969. Т. 54, № 5. С. 657—669.
Терехин Э. С, Камелина О. П. Эндосперм Habernaria linearifolia Maxim, и Neottia nidus-avis (L. )
Rich, (квопросу об эволюции эндосперма у орхидных) //Ботан. журн. 1972. Т. 57, № 11.С. 1373—1383.
Терехин Э. С, Никитичева 3. И., Камелина О. П. О перемещении ядер в эндосперме, зародыше
и при макроспорогенезе у некоторых покрытосеменных растений // V Всесоюз. совещ. по
эмбриологии растений. Кишинев, 1971. С. 176—178.
282
Генеративные органы цветка
Терехин Э. С, Шибакина Г. В. Семейство Zosteraceae // Сравнительная анатомия семян. Л.:
Наука, 1985. Т. 1.С. 59—62.
Терехин Э. С, Яковлев М. С. Эмбриология Balanophoraceae // Ботан. журн. 1967. Т. 52, № 6. С.
745—758.
Терехин Э. С, Яковлев М. С. Зародыш покрытосеменных как адаптивная эволюирующая система
// Реферат, докл. Всесоюз. межвузовского совещ. по физиологии растений. М. 1968. С. 282—283.
Терехин Э. С, Яковлев М. С, Никитичева 3. И. Развитие микроспорангия, пыльцевых зерен,
семяпочки и зародышевого мешка у Cynomorium songaricum Rupr. (Cynomoriaceae) // Ботан. журн. 1975.
Т. 60, №2. С. 153—162.
Титова Г. Е. Эмбриология некоторых водных растений (Nelumbo nucifera Gaertn., Cabomba
caroliniana A.Gray.Trapaastrachanica (Fler.) Winter: Автореф. дисс.... канд. биол. наук. Л. 1988а. 18с.
Титова Г. Е. Эмбриология некоторых водных растений (Nelumbo nucifera Gaertn, Cabomba
caroliniana A. Gray, Trapa astrachanica (Fler. ) Winter) // Дисс. ... канд. биол. наук. Л.: БИН, 19886.
239 с.
Тодерич К. Н. Семейство Asteraceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 318—331.
Транковский Д. А. Спермогенез и оплодотворение у росянки (Drosera) // Бюл. МОИП. Отд. биол.
1938. Т. 47. С. 104—112.
Тучина Н. Г. Развитие мужских и женских эмбриональных структур у Sambucus coreana (Nakai)
Кот. et Alis. и Sambucus racemosa L. // Tp. 7 Конф. молодых ученых БИН АН СССР, Ленинград,
апр. 1984. Л., 1985. С. 96—109.
Урманцев Ю. А. Системный подход к проблеме устойчивости растений (на примере исследования
зависимости содержания пигментов в листьях фасоли от одновременного действия на нее засухи и
засоления) // Физиология растений. 1979. Т. 26, № 4. С. 762—777.
Устинова Е. И. Сравнительно-эмбриологическое исследование нормальных и вивипарных видов
лука // Ботан. журн. 1944. Т. 29, № 5. С. 232—239.
Фегри К., Л. Ван дер Пэйл. Основы экологии опыления. ML: Мир, 1982. 379 с.
Федоров А. А., Артюшенко 3. Т. Атлас по описательной морфологии высших растений. Л., 1975.
350 с.
Федотова Т. А. Семейство Paeoniaceae // Сравнительная анатомия семян. Л.: Наука, 1988. Т. 2.
С. 195—207.
Финн В. В. Спорные вопросы развития мужского гаметофита покрытосеменных // Науков зап.
Ки'1'в. держ. ун-та. 1935. № 1. С. 25—47.
Финн В. В. Мужские гаметы у покрытосеменных растений // ДАН СССР. 1941. Т. 30. С. 454—456.
Фрейберг Т. Е. Семейство Winteraceae // Сравнительная эмбриология цветковых растений.
Winteraceae-Juglandaceae. Л.: Наука, 1981. С. 26—30.
Фрейберг Т. Е. Семейство Parnassiaceae // Сравнительная эмбриология цветковых растений.
Brunelliaceae-Tremandraceae. Л.: Наука, 1985. С. 43—48.
Фрейберг Т. Е. Семейство Verbenaceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 1987а. С. 219—225.
Фрейберг Т. Е. Семейство Bignoniaceae // Сравнительная эмбриология цветковых растений.
Davidiaceae-Asteraceae. Л.: Наука, 19876. С. 259—264.
Фрейберг Т. Е. Семейство Commelinaceae // Сравнительная эмбриология цветковых растений.
Butomaceae-Lemnaceae. Л.: Наука, 1990. С. 198—204.
Фрейберг Т. Е., Камелина О. П. Семейство Magnoliaceae // Сравнительная эмбриология цветковых
растений. Winteraceae-Juglandaceae. Л.: Наука, 1981. С. 36—41.
Фролова Л. В., Шамина 3. В. Цитогенетическая характеристика культуры тканей растений из
семейства бобовых // Цитология и генетика. 1974. Т. 8, № 5. С. 413—418.
Хведынич О. А. Функционирование ядер в клетках зародышевых мешков разных видов
покрытосеменных // Ботан. журн. 1989. Т. 74, № 11. С. 1603—1611.
Хведынич О. А. Оплодотворение у Galanthus nivalis (Amaryllidaceae) // Ботан. журн. 1991. Т. 76,
№1.С. 83—88.
Хведынич О. А., Кравец Е. А. Оплодотворение синергид у видов рода Lilium (Liliaceae) // Ботан.
журн. 1991. Т. 76, № 2. С. 236—240.
Хведынич О. А., Петрик С. А. Динамика накопления РНК в пыльцевых зернах // Ботан. журн.
1986. Т. 71, № 1.С. 47—51.
Цвелев Н. Н. Семейство ластовневые (Asclepiadaceae) // Жизнь растений. Л.: Наука, 1981. Т. 5,
ч. 2. С. 362—365.
Цингер Н. В. Семя, его развитие и физиологические свойства. М.: Изд-во АН СССР, 1958. 285 с.
Цингер Н. В., Петровская-Баранова Т. П. Оболочка пыльцевого зерна — живая физиологически
активная структура // ДАН СССР. 1961. Т. 138. С. 466—469.
Цингер И. В., Поддубная-Арнольди В. А. Применение гистохимической методики к изучению
эмбриональных процессов у орхидных // Тр. Гл. ботан. сада АН СССР. 1959. Т. 6. С. 90—169.
Цитология и генетика мейоза (Ред. В. В. Хвостова, 10. Ф. Богданов). М.: Наука, 1975.
432 с.
Литература
283
Чабан И. А. Эмбриогенез и эндоспермогенез Reseda lutea L. и Chelidonium majus L. по данным
световой и электронной микроскопии: Автореф. дисс. ... канд. биол. наук. Л., 1975. 26 с.
Чабан И. А. Электронномикроскопическое исследование эндосперма у Reseda lutea L. //
Актуальные вопросы эмбриологии покрытосеменных. 1979. Л.: Наука. С. 58—69.
Чабан И. А. Семейство Resedaceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. С. 164—172.
Чабан И. А., Яковлев М. С. Эмбриология Reseda lutea L. I. Мегаспорогенез и развитие
зародышевого мешка // Ботан. журн. 1974. Т. 59, № 1. С. 24—37.
Чеботарь А. А. О макроспорогенезе и развитии зародышевого мешка кукурузы (Макроспорогенез
— основа раннего онтогенеза) // Тр. Ин-та биологии МФ АН СССР. Кишинев: Штиинца, 1960. Т. 1.
С. 49—74.
Чеботарь А. А. Развитие и ультраструктура пластид злаковых // Хлоропласты и митохондрии.
М.: Наука, 1969а. С. 122—145.
Чеботарь А. А. Ультраструктура мужского и женского гаметофитов, пыльцевой трубки и вопрос
двойного оплодотворения растений // Изв. АН МССР. 19696. № 3. С. 87—90.
Чеботарь А. А. Дополнительные наблюдения над ультраструктурой пыльцевого зерна // ДАН
СССР. 1969в. Т. 184, № 2. С. 449—451.
Чеботарь А. А. Цитоэмбриологическое и электронно-микроскопическое исследование кукурузы
(Zea mays L. ): Автореф. дисс. ... д-ра биол. наук. Кишинев. 1970. С. 1—60.
Чеботарь А. А. Эмбриология кукурузы. Кишинев: Штиинца, 1972. 384 с.
Чеботарь А. А. О морфо-функциональном статусе высших растений // Тез. докл. Всесоюз. сим-
поз. по эмбриологии. Симферополь, 1983.
Чеботарь А. А., Лудникова Л. А., Азема Т. Ф., Архипенко М. Г. Эмбриология плодово-ягодных,
технических и стимулирующих возделываемых растений. Кишинев: Штиинца, 1987. С. 1—204.
Чеботарь А. А., Чеботарь Т. И. Структура митохондрий растительной клетки // Хлоропласты и
митохондрии. М.: Наука, 1969. С. 289—300.
Чеботарь А. А., Челак А. М., Мошкович А. М., Архипенко М. Г. Эмбриология зерновых, бобовых
и овощебахчевых возделываемых растений. Кишинев: Штиинца, 1987. С. 1—226.
Чиампорова М., Ахалкаци М. Ш., Гваладзе Г. Е. Ультраструктура стерильных тканей семяпочки
Galanthus nivalis (Amaryllidaceae) // Ботан. журн. 1988. Т. 12, № 73. С. 1722—1730.
Шамров И. И. Эмбриология семейства Ceratophyllaceae (роголистниковые) в связи с его
систематическим положением: Автореф. дисс. ... канд. биол. наук. Л., 1981а. 20 с.
Шамров И. И. Особенности развития пыльника у Ceratophyllum demersum и С. pentacanthum
(Ceratophyllaceae) // Ботан. журн. 19816. Т. 66, № 10. С. 1464—1473.
Шамров И. И. Развитие семяпочки и особенности строения зародышевого мешка у
представителей семейства Gentianaceae // Ботан. журн. 1988. Т. 73, № 2. С. 213—222.
Шамров И. И. Семейство Liliaceae // Сравнительная эмбриология цветковых растений.
Butomaceae-Lemnaceae. Л.: Наука, 1990а. С. 63—74.
Шамров И. И. Семейство АШасеае // Сравнительная эмбриология цветковых растений.
Butomaceae-Lemnaceae. Л.: Наука, 19906. С. 76—83.
Шамров И. И. Семейство Hemerocallidaceae // Сравнительная эмбриология цветковых растений.
Butomaceae-Lemnaceae. Л.: Наука, 1990в. С. 83—87.
Шамров И. И. Семяпочка Gentiana cruciata (Gentianaceae): структурно-функциональные аспекты
развития // Ботан. журн. 1990 г. Т. 75, № 10. С. 1363—1379.
Шамров И. И., Анисимова Г. М. Морфогенез семяпочки Luzula pedemontana (Juncaceae):
структурно-гистологическое исследование // Ботан. журн. 1993. Т. 78, № 4. С. 47—59.
Шамров И. И., Батыгина Т. Б. Семейство Ceratophyllaceae // Сравнительная анатомия семян. Л.:
Наука, 1988. Т. 2. С. 153—156.
Шамров И. И., Винтер А. Н. Развитие семяпочки у представителей родов Nymphaea и Victoria
(Nymphaeaceae) // Ботан. жури. 1991. Т. 76, № 8. С. 1073—1083.
Шамров И. И., Никитичева 3. И. Морфогенез семяпочки и семени у Gymnadenia conopsea
(Orchidaceae): структурное и гистохимическое исследование // Ботан. журн. 1992. Т. 77, № 4. С. 45—
60.
Шевченко С. В. Семейство Саппасеае // Сравнительная эмбриология цветковых растений.
Butomaceae-Lemnaceae. Л.: Наука, 1990. С. 245—247.
Шевченко С. В., Камелина О. П. Семейство Davidiaceae // Сравнительная эмбриология цветковых
растений. Davidiaceae-Asteraceae. Л.: Наука, 1987. С. 7—12.
Шевченко С. В., Камелина О. П. К эмбриологии Davidia involucrata (Davidiaceae) // Ботан. журн.
1988. Т. 73, № 2. С. 203—213.
Шишкин И. А. Индивидуальное развитие и естественный отбор // Онтогенез. 1984. Т. 15, № 2.
С. 4—18.
Шкутина Ф. М., Козловская В. Ф. Цитомиксис в мейозе у некоторых гибридных форм злаков под-
трибы Triticinae // Генетика. 1974. Т. 10, № 5. С. 5—12.
Шкутина Ф. М., Хвостова В. В. Цитологический анализ пшенично-ржаных амфидиплоидов //
Экспериментальная полиплоидия в селекции растений. М., 1966. С. 261.
284
Генеративные органы цветка
Шмальгаузен И. И. Изменчивость и смена адаптивных норм в процессе эволюции // Журн. общей
биологии. ML: Наука, 1940. Т. 1, № 4.
Шнайдер Т. М. Особенности мейоза у отдаленных гибридов пшеницы, полученных с участием
мутанта ph // Цитология и генетика. 1988. Т. 22, № 3. С. 18—22.
Эзау К. Анатомия растений // М.: Мир, 1980. Т. 1, 2. 558 с.
Эмбриология растений: использование в генетике, селекции, биотехнологии / Ред. Б. М. Джори.
ML: Агропромиздат, 1990. Т 1. 509 с; Т. 2. 461 с.
Якобсон Л. Я., Литвинчик И. С, Лангенфельд В. Т. Развитие мужского гаметофита у Viburnum
L. // Бюл. Гл. ботан. сада АН СССР. 1984. Вып. 131. С. 105—108.
Якобсон Л. Я., Терехин Э. С. Семейство Ericaceae // Сравнительная эмбриология цветковых
растений. Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. С. 202—209.
Яковлев М. С. Эмбриогенез и его значение для филогении растений // XIII Комаровские чтения.
М.-Л.: Изд-во АН СССР, 1960. 40 с.
Яковлев М. С. Гаметогенез, зародышевый мешок и пыльцевое зерно (к проблеме происхождения
Angiospermae) // Ботан. журн. 1974. Т. 59, № 12. С. 1721—1727.
Яковлев М. С. Словарь основных терминов // Сравнительная эмбриология цветковых растений.
Winteraceae-Juglandaceae. Л.: Наука, 1981. С. 7—25.
Яковлев М. С. Семейство Paeoniaceae // Сравнительная эмбриология цветковых растений.
Phytolaccaceae-Thymelaeaceae. Л.: Наука, 1983. С. 70—77.
Яковлев М. С, Иоффе М. Д. Эмбриология некоторых представителей рода Paeonia // Морфология
цветка и репродуктивный процесс у покрытосеменных растений. М.-Л.: Наука (Тр. Бот. ин-та АН
СССР), 1965. С. 140—176.
Яковлев М. С, Солнцева М. П. Некоторые вопросы морфологии цветка и эмбриологии ковылей
// Морфология цветка и репродуктивный процесс у покрытосеменных растений. М.-Л.: Наука (Тр.
Бот. ин-та АН СССР), 1965. С. 61—73.
Abe К. Contribution to the embryology of the family Orchidaceae. VI. Development of the embryo sac
in 15 species of orchids // Sci. Repts. Tohoku Univ. Ser. IV (Biol.). 1972a. Vol. 36, № 3. P. 135—178.
Abe K. Contribution to the embryology of the family Orchidaceae. VILA comparative study of the orchid
embryo sac // Ibid. 1972b. Vol. 36, № 3. P. 179—201.
Abele K. Untersuchungen an Gametophyten von Peperomia incana // Bot. Arch. 1924. Bd7. S. 321 —324.
Adatia R. D., Shah G. L. A contribution to the life history of Coriandrum sativum L. // J. Univ. Bombay.
1952. Ser. B. Vol. 20. P. 34—46.
Aelst A. C. van, van Went J. L. The ultrastructure of mature Papaver dubium L. pollen grains // Acta
bot. need. 1991. Vol. 40, № 4. P. 319—328.
Afzelius K. Embryologische und zytologische Studien inSenecio und verwandten Gattungen // Acta horti
berg. 1924. Bd 8, № 7. S. 123—219.
Afzelius K. Die Embryobildung bei Nigritella nigra // Sven. bot. tidskr. 1928. Bd 22, H 1 —2. S. 82—91.
Agarwal S. Morphological and embryological studies in the family Olacaceae — I. Olax L. //
Phytomorphology. 1963. Vol. 12, № 2. P. 185—196.
Ahokas H. Cytoplasmic male sterility in barley. 2. Physiology and anther cytology of msml // Hereditas.
1978. Vol. 89, Ns 1. P. 7—21.
D'Alascio-Deschamps R. Organisation du sac embryonnaire du Linum catharticum L., espece recoltee en
station naturelle; etude ultrastructurale// Bull.Soc. bot. France. 1973. T. 120, № 5—6. P. 189—195.
Albani D., Altosaar I., Arnison P. G., Fabijanski S. F. A gene showing sequence similarity to pectin
esterase is specifically expressed in developing pollen of Brassica napus. Sequences in its 5' flanking region
are conserved in other pollen-specific promoters // Plant Mol. Bol. 1991. Vol. 16, P. 501—513.
Albani D., Robert L. S., Donaldson P. A., Altosaar I., Arnison P. G., Fabijanski S. F. Characterization
of a pollen-specific gene family from Brassica napus which is activated during early microspore development
// Plant Mol. Biol. 1990. Vol. 15. P. 605—622.
Albani D., Sardana R., Robert L. S., Altosaar I., Arnison P. G., Fabijanski S. F. A Brassica napus gene
family which shows sequence similarity to ascorbate oxidase is expressed in developing pollen. Molecular
characterization and analysis of promoter activity in transgenic tobacco plants // Plant J. 1992. Vol. 2. P. 331—342.
Albertini L., Souvre A., Audran J. С Le tapis de l'anthere et ses relations avec les microsporocytes et
les grains de pollen // Rev. Cytol. Biol, veget. Bot. 1987. Vol. 10, fasc, 3—4. P. 211—242.
Allen G. S. Embryogeny and development of the apical meristems of Pseudotsuga. I. Fertilization and
early embryogeny. // Amer. J. Bot. 1946. Vol. 33, № 8. P. 666— 677.
Allen G. S. Embryogeny and development of the apical meristems of Pseudotsuga. II. Late embryogeny
// Amer. J. Bot. 1947. Vol. 34, № 2. P. 73—80.
Allen R. J., Lonsdale D. M. Molecular characterization of one of the maize polygalacturonase gene family
members which are expressed during late pollen development // Plant J. 1993. Vol. 3. P. 261—271.
Allsopp A. Regeneration and polarity in the Marchantiales // Phytomorphology. 1967. Vol. 17, № 1—4
P. 264—370.
Литература
285
Anisimova G. M., Shamrov I. I. Ovule development and structure peculiarities in Luzula pedemontana
(Juncaceae) // Proc. XI Intern. Symp. «Embryology and seed reproduction». Leningrad, USSR, 1990. St.
Petersburg. 1992a. P. 45—46.
Anisimova G. M., Shamrov I. I. The ovule development in Juncus filiformis (Juncaceae) // Abstr. XII
Intern. Congr. Columbus, Ohio, USA, 1992b. P. 2.
Anton A. M., Cocucci A. E. The grass megagametophyte and its possible phylogenetic implications //
Plant Syst. and Evol. 1984. Vol. 146, № 1—2. P. 117—121.
Arbeloa A., Herrero M. The significance of the obturator in the control of pollen tube entry into the
ovary in peach (Prunus persica) // Ann. Bot. 1987. Vol. 60, № 6. P. 681—685.
Archibald E. E. The development of the ovule and seed of jointed cactus (Opuntia aurantiaca Lindley)
// South Afr. J. Sci. 1939. Vol. 36, № 2. P. 195—211.
Arekal G. D. Embryological studies in Canadian representatives of the tribe Rhinantheae,
Scrophulariaceae // Can. J. Bot. 1963. Vol. 41, № 2. P. 267—303.
Arekal G. D., Nagendran С R. Is there a Podostemum type of embryo sac in the genus Farmeria? //
Caryologia. 1975a. Vol. 28, № 2. P. 229—235.
Arekal G. D., Nagendran С R. Embryo sac of Hydrobryopsis sessilis (Podostemaceae) — origin,
organization and significance // Bot. Notis. 1975b. Bd 128, № 3. P. 332—338.
Arekal G. D., Nagendran С R. A new type of embryo sac organization in angiosperms // Curr. Sci.
(India). 1976. Vol. 45, № 20. P. 717—719.
Arekal G. D., Nagendran С R. Female gametophyte of Zeylanidium (Podostemaceae) — a clarification
// Phytomorphology. 1977a. Vol. 27. P. 123—129.
Arekal G. D., Nagendran С R. The female gametophyte in two Indian genera of Tristichoideae
(Podostemaceae) — a reinvestigation // Proc. Indian Acad. Sci. B. 1977b. Vol. 86. P. 287—294.
Ashley T. Zygote shrinkage and subsequent development in some Hibiscus hybrids // Planta (Berl.).
1972. Bd 108, № 4. S. 303—317.
Asplund E. Studien iiber die Entwicklungsgeschichte der Bluten einiger Valerianaceen // Kgl. Sven.
Vetenskapsakad. handl. 1920. Bd 61, № 3. S. 3—66.
Audran J. C, Willemse M. Т. М. Wall development and its autofluorescence of sterile and fertile Vicia
faba L. pollen // Protoplasma. Wien. 1982. Bd 110, № 2. S. 106—110.
Baillon H. E. Etude general du groupe des Euphorbiacees // Paris: Librairie de V. Masson. 1858. 684 p.
Baillon H. E. Sur l'origine du macis de la Muscade et des arilles en general // Adansonia. 1876. T. 11.
Baillon H. E. Recherches sur les ovaires acropiles Premier Memoire // Bull. Congr. Intern, botanique et
d'horticulture. St. Petersburg, 1885. P. 59—63.
Balicka-Iwanowska G. P. Contribution a l'etude du sac embryonnaire chez certains Gamopetales //
Flora. 1899. Bd 86. S. 47—71.
Baltz R., Domon C, Pillay D. T. N., Steinmetz A. Characterization of a pollen-specific cDNA from
sunflower encoding a zinc finger protein // Plant J. 1992. Vol. 2, P. 713—721.
Bambacioni V. Ricerche sulla ecologia e sulla embryologia di Fritillaria persica L. // Ann. Bot. 1928a.
T. 18, № 1. P. 7—37.
Bambacioni V. Contributo alia embriologia di Lilium candidum L. // С r. Acad. Lincei. 1928b. T. 8, №
6. P. 612—618.
Bambacioni-Mezzetti V. Nuove ricerche suH'embriologia delle Giliaceae // Ann. Bot. 1931. T. 19, P.
365—382.
Banerjee U. С Ultrastructure of tapetal membranes in grasses // Grana palynol. 1967. Vol. 7, № 1—2.
P. 365—377.
Barnes S. H., Blackmore S. Preliminary observations on the formation of the male germ Unit in Catananche
caerulea L. (Compositae: Lactuceae) // Protoplasma. 1987. Vol. 138, №2—3. P. 187—189.
Barrat D. H. P., Flawell R. B. Alterations in mitochondria associated with cytoplasmic and
nuclear genes concerned with male sterility in maize // Theor. and Appl. Genet. 1975. Vol. 45,
№ 7. P. 315—321.
Baskin T. I., Cande W. Z. The structure and function of the mitotic spindle in flowering plants // Annu.
Rev. Plant Physiol. 1990. Vol. 41. P. 277—315.
Battaglia E. Ricerche cariologiche ed embriologiche sul genere Rudbeckia. 9. Le anomalie del gametofito
femminie cellularizzato di R. laciniata // Nuovo Gior. Bot. Ital. 1947. Vol. 54, P. 377—405.
Battaglia E. The male and female gametophytes of angiosperms — an interpretation // Phytomorphology.
1951. Vol. 1, №1—2. P. 87—116.
Battaglia E. New types of embryo sac development in Scilla autumnalis // 9th Intern. Bot. Congr. 1959.
Vol. 2. P. 23—24.
Battaglia E. The embryo sac of Podostemaceae — an interpretation // Caryologia. 1971. Vol. 24. P.
403—420.
Battaglia E. The evolution of the female gametophyte of angiosperms: an interpretative key
(Embryological Questions 14) // Ann. Bot. 1980. Vol. 47. P. 7—144.
Battaglia E. Embryological questions: 4. Gynogonium versus Archegonium and the generalization of the
prefixes andro-and gyno-in plant reproduction. Appendix: Bischoff T. G. (1835) «De Hepaticis...» //Ann.
Bot. 1982. Vol. 40. P. 1—48.
286
Генеративные органы цветка
Battaglia E. Embryological questions: 5. Discussion of the spore, sporogenesis and apospory in relation
to the female gametophyte of angiosperms // Ann. Bot. 1983. Vol. 41. P. 1—25.
Battaglia E. Meiosis and Mitosis: a terminological criticism // Ann. Bot. 1985. Vol. 43. P. 101—140.
Battaglia E. Embryological questions: 7. Do new types of embryo sac occur in Schisandra // Ann. Bot.
1986. Vol.44, P. 69—92.
Battaglia E. Embryological questions: 10. Have the expressions «polar nuclei» and «secondary nucleus»
been rightly established? Appendix: Hofmeister W. (1847) «Untersuchungen ... bei ... Oenothereen» // Atti
Soc. Tosc. Sci. Not., Mem., Ser. B. 1987a. Vol. 94. P. 127—150.
Battaglia E. Embryological questions: 11. Has the debated case of Podostemaceae been resolved? // Ann
Bot. 1987b. Vol. 45. P. 37—64.
Battaglia E. The evolution of the female gametophyte of angiosperms: an interpretative key.
(Embryological questions: 14) // Ann. Bot. 1989. Vol. 47. P. 7—144.
Battaglia E. Embryological questions: 15. Does the case spore-nucleus = egg-nucleus occur in angiosperm
female gametophytes? // Ann. Bot. 1990. Vol. 48. P. 7—48.
Batygina T. B. Fertilization process of cereals. // Fertilization process in higher plants (Linskens H. F.
ed.). Amsterdam. 1974. P. 205—220.
Batygina T. B. New concept of asexual reproduction in flowering plants // Abstr. XIV Bot. Congr., West
Berlin. 1987. P. 25.
Batygina Т. В. Some aspects of reproductive biology: asexual reproduction in flowering plants and genetic
heterogeneity of seeds // Proc. Intern. Symp. «Sexual reproduction in higher plants». Italy. 1988. P. 443—447.
Batygina Т. В. Position of the phenomenon of embryoidogeny in the system of flowering plants reproduction
// Proc. XI Intern. Symp. «Embryology and seed reproduction». Leningrad, USSR, 1990. St. Petersburg:
Nauka, 1992. P. 6—10.
Batygina Т. В., Shamrov I. I. Ovule and seed structure in Poa, Paeonia and orchids from the point of
reliability // Abstr. XV Intern. Bot. Congr. Yokohama, Japan, 1993. P. 96.
Batygina Т. В., Vasilyeva V. E. System of reproduction of Orchidaceae (on example of Dactylorhyza
maculata L. Soo.) // Proc. VII Intern. Symp. «Fertilization and embryogenesis in ovulated plants». High Tatra
(Rackovadolina), 14—17 June, 1982. Czechoslovakia, Bratislava. 1983. P. 27—33.
Beardsell D. V., Williams E. G., Knox R. B. The structure and histochemistry of the nectary and anther
secretory tissue of the flowers of Thryptomene calucina (Lindl.) Stapf (Myrtaceae) // Austral. J. Bot. 1989.
Vol. 37. P. 65—80.
Bednara J., Erdelska O., van Lammeren A., Willemse M. Т. М. The embryo sac cytosceleton of Galanthus
nivalis L. plant — before and after fertilization // Frontiers in sexual plant reproduction research. International
association: Abstr. 13th Intern. Congr. on Sex. Plant Reproduction, Vienna, Austria, July 10—14, 1994.
Vienna.
Bednara J., Kuras M., Rodkiewicz B. Ultrastructural changes during megasporogenesis in Epipactis
(Orchidaceae). // Acta Soc. Bot. pol. 1981. Vol. 50, № 1—2. P. 127—130.
Bednara J., Rodkiewicz B. Megasporocyte and megaspore ultrastructure in Epilobium // Bull. Acad
Polon. Sci., Ser. sci. biol. 1974. Vol. 22, № 12. R. 847—850.
Bednara J., Rodkiewicz B. Cell polarization in female gametophyte development in Epilobium
(Onagraceae) // Ann. med. soc. Pol. Acad. sci. 1975. Vol. 20, № 2. P. 56—58.
Bednara J., Willemse M. T. M., Lammeren A. A. M. van. Organization of the actin cytoskeleton during
megasporogenesis in Gasteria verrucosa visualised with fluorescent labelled phaloidin // Acta bot. neer. 1990
Vol. 39, № 1. P. 43—48.
Behnke H. Zur Aufbau gitterartiger Membranstrukturen in Seibelementplasma von Dioscorea //
Protoplasma. 1968. Bd 66, № 3. S. 287—310.
Bell P. R. The alternation of generations // Adv. Bot. Res. 1989. Vol 16, № P. 55—93.
Belyaeva N. S. Ultrastructure of chalazal end cells of ovule of Delphinium before fertilization // Proc.
VII Intern. Symp. «Fertilization and embryogenesis in ovulated plants», High Tatra (Rackova dolina),
Czechoslovakia, 1982. Bratislava, 1983. P. 189—194.
Belyaeva N. S. An ultrastructural-physiological approach to. the question of feeding the female
gametophyte of Angiospermae // Abstr. XI Symp. «Embryology and seed reproduction». Leningrad, USSR,
1990. P. 19.
Benson M. Telangium scotti, a new species of Telangium (Calymmatotheca) showing structure// Ann.
Bot. 1904. Vol. 18, № 79. P. 161—177.
Benson M., Welsford E. J. The morphology of the ovule and female flower of Juglans regia and a few
allied genera // Ann. Bot. 1909. Vol. 23, № 92. P. 623—633.
Berg R. J. Morphology and taxonomic position of Medeola, Liliaceae // Skr. Norske vid.-akad. Oslo.
1962. № 3. S. 1—55.
Berger C, Erdelska O. Ultrastructural aspects of the embryo sac of Jasione montana L.: cell walls //
Caryologia. 1973. Vol. 25 (Suppl.). P. 109—120.
Berkaloff C, Casadevall E., LargeauC, Metzger P., Peracca S., Virilet J. The resistent polymer of the walls
of the hydrocarbon-rich alga Botryococcus braunii // Phytochemistry, 1983. Vol. 22, № 2. P. 389—397.
Bhandari N. N. Schisandraceae // Proc. Symp. of Angiosperms. Bull. Indian Nat. Sci. Acad. 1970. Vol.
41. P. 42—44.
Литература 287
Bhandari N. N. Embryology of the Magnoliales and comments on their relationships // J. Arnold
Arboretum. 1971. Vol. 52, № 1. P. 1—39.
Bhandari N. N. Embryology of the Magnoliales and comments on their relationships //J. Arnold
Arboretum. 1971. Vol. 52, № 2. P. 285—304.
Bhandari N. N. Microsporangium // Embryology of Angiosperms / Ed. B. M. Johri. Berlin etc. 1984. P.
53—121. c r it ту ■
Bhandari N. N., Bhargava M. Wall ingrowthes in the antipodal cell in Papaver sommferum L. // Beitr.
Biol. Pflanz. 1983. Bd 58, №. 1. S. 53—58. .
Bhandari N. N., Bhargava A., Sachdeva A. The mature ovule of Papaver somniferum — A histochemical
study // Phytomorphology. 1985. Vol. 35, № 1,2. P. 111 — 119.
Bhandari N. N., Chitralekha P. Cellularization of the female gametophytes in the Ranunculus sceleratus
Linn. //Can. J. Bot. 1989. Vol. 67. P. 1325—1330.
Bhandari N. N.. Khosla R. Development and histochemistry of anther in Triticale cv. Tri-1. I. Some new
aspects in early ontogeny // Phytomorphology. 1982. Vol. 32, № 1. P. 18—27.
Bhandari N. N., Kishori R., Natesh S. Ontogeny, cytology and histochemistry of anther tapetum in relation
to pollen development in Nigella damascena //Phytomorphology. 1976. Vol. 26, № 1. P. 46—59.
Bhandari N. N. Sharma Madhu. Histochemical and ultrastructural studies during anther development in
Solanum nigrum Linn. II. Distribution of organelles in the meiocytes during microsporogenesis //
Phytomorphology. 1988. Vol. 38, № 1. P. 1—8.
Bhandari N. N.. Soman P., Bhargava M. Histochemical studies on the female gametophyte of Argemone
mexicana L. // Cytologia. 1980. Vol. 45, № 1-2. P. 281-291.
Bhandari N. N.. Venkataraman R. Embryology of Drimys winteri // J. Arnold Arboretum. 1968. Vol.
49, № 4. P. 509—524.
Bhargava H. R. Contribution to the morphology of Boerhaavia repanda // J. Indian Bot. Soc. 1932. Vol.
11, №4. P. 303—326. ...
Bhat U., Vijayaraghavan M. R. Distribution of insoluble polysaccharides in Linum usitatissimum-zygote
to seedling//Cytologia. 1980. Vol. 45, №. 1-2. P. 65-75.
Bhatnagar S. P., Johri B. M. Development of angiosperm seeds // Seed Biology. 197Z. Vol. 1.
P. 77—150.
Bhojwani S. S., Bhatnagar S. P. The Embryology of Angiosperms. 2nd ed. Delhi etc.: Vikas publ. house
PVT Ltd. 1975. 264 p. (n„ „ ,
Biddle J. A. Anther and pollen development in garden pea and cultivated lentil // Can. J. Bot. 1979. Vol.
57, № 18. P. 1883—1901. ,_ j u J. . .
Bishop С J., McGown L. J. The role of the vegetative nucleus in pollen tube growth and in the division
of the generative nucleus in Tradescantia paludosa // Amer. J. Bot. 1953. Vol. 40, № 6. P. 658—659.
Blackmore S., Burnes S. H. Pollen ontogeny in Catananthe coerulea (Compositae: Lactucea). 1.
Premeiotic phase to establishment of tetrads // Ann. Bot. 1988. Vol. 62, № 2. P. 605—614.
Bleier H. Untersuchungen iiber das Verhalten der verschiedenen Kernkomponenten bei der
Reductionteilung von Bastarden Lierre, typ. J. Van In u Cie, Louvain A. Hystpruyst // Cellule. 1930. Bd
15, № 1.S. 83—144. „ ^ „ ч ..
Bocquet G. The structure of the placental column in the genus Melandrium (Caryophyllaceae) //
Phytomorphology. 1959a. Vol. 9, № 3. P. 217—221.
Bocquet G. The campylotropous ovule // Ibid P. 222—227.
Boehm K. Embryologische Untersuchungen an Zingiberaceae // Planta. 1931. Bd 14, № 2. S. 411—440.
Boesewinkel F. D. Development of ovule and seed coat in the Rutales-Geraniales assembly. 1981. Ph. D.
Boesewinkel F. D. Ovule and seed structure in Datiscaceae // Acta bot. neerl. 1984. Vol. 33, № 4. P.
419 429.
Boesewinkel F. D., Bouman F. The seed structure // Embryology of Angiosperms / Ed. В. М. Johri.
Berlin etc. Springer Verlag 1984. 602 p.
Bogdanov Yu. F., Strokov A. A., Reznickova S. A. Histone synthesis during meiotic prophase in LUium
// Chromosoma. 1973. Vol. 43. P. 237—245.
Bogdanov Yu. F., Strokov A. A. Peculiarities of histone synthesis in meiosis and relation to chromosome
structure and behaviour // Biol. Zbl. 1976. Bd 95, № 3. S. 335—342.
Bohdanowicz J., Turala-Szybowska K. Ultrastructure of endopolyploid antipodals in Aconitum vulnana
Rchb. I. Antipodals in the mature embryo sac // Protoplasma. 1985. Vol. 127, № 3. P. 163—170.
Bohdanowicz J., Turala-Szybowska K. Ultrastructure of endopolyploid antipodals in Aconitum
vulnaria Rchb. II. Antipodals in the period of free nuclear endosperm // Protoplasma. 1987. Vol.
140, № 1. P. 13—21. ^ , д „ ¥ , •
Bor J., Kapil R. N. Anatropy and ontogeny of the bitegmic ovule in Chrozopnora A. H. L. Jussieu
(Euphorbiaceae) // Acta bot. neerl. 1976. Vol. 25, № 6. P. 385—400.
Boufford D. E., Crisoi J. V., Tobe H., Hoch P. С A cladistic analysis of Circaea (Onagraceae) //
Cladistics. 1990. Vol. 6. P. 171—182.
Bouman F. The application of integumentary studies to taxonomic and phylogenetic problems // Ber.
Dtsch. bot. Ges. 1971. Bd 74, H 3—4. S. 169—177.
288
Генеративные органы цветка
Bouman F. Developmental studies of the ovule, integuments, and seed in some angiosperms // Univ. van
Amsterdam. Naarden, Boek en Offsetdrukk. Los. 1974. 180p.
Bouman F. The ovule // Embryology of angiosperms / Ed. B. M. Johri. Springer Verlag. 1984. P. 123—
157.
Bouman F., Boesewinkel F. D. The campylotropous ovules and seeds, their structure and functions //
Bot. Jahrb. Syst. 1991. Bd 113, N 2/3. S. 255—270.
Bouman F., Callis J. I. M. Integumentary shifting — a third way to unitegmy // Ber. Dtsch. bot. Ges.
1977. Bd 90, № 1—2. S. 15—28.
Bouman F., Louis A. Seed structure in Voyria primuloides Baker (Gentianaceae): taxonomic and
ecological implication // Dedicatory vol. to prof. A. Lebeque «Some aspects and actual orientations in planl
embryology», 1989. Universite de Picardie, Amiens, France. P. 261—270.
Bouman F., Schrier S. Ovule ontogeny and seed coat development in Gentiana with a discussion on the
evolutionary origin of the single integument // Acta bot. neerl. 1979. Vol. 28, № 6. P. 467—478.
Boyes J. W. Development of embryo sac of Plumbagella micranta // Amer. J. Bot. 1939. Vol. 26, № 6.
P. 539—547.
Braun A. Uber Polyembryonie und Keimung von Coelobogyne. Ein Nachtrag zu der Abhandlung iiber
Parthenogenesis der Pflanzen // Abh. Kong. Akad. Wiss. Berlin, phys. Abt. 1860. S. 107—263.
Brewbaker J. L. The distribution and phylogenetic significance of binucleate and trinucleate pollen grains
in the angiosperms // Amer. J. Bot. 1967. Vol. 54, № 9. P. 1069—1083.
Brink R. A., Cooper D. C. Double fertilization and development of the seed in angiosperms // Bot. Gaz.
1940. Vol. 102, № 1. P. 1—25.
Brink R. A., Cooper D. С The endosperm in seed development //Bot. Rev. 1947. Vol. 13, №8. P. 423—
477.
Brink R. A., Cooper D. С The endosperm in seed development // Bot. Rev. 1947. Vol. 13, № 9. P.
479—541.
Brongniart A. Memoire sur la generation et le developpement de l'embryon dans les vegetaux
phanerogames // Ann. sci. nat. bot. 1827. V. 12; P. 225—296.
Brooks J., Shaw G. Chemical structure of the exine of pollen walls and a new function for carotenoids in
nature // Nature. 1968. Vol. 219, P. 532—533.
Brooks J., Shaw G.Sporopollenin: a review of its chemistry, palaeochemistry, and geochemistry //Grana.
1978. Vol. 17, P. 91—97.
Brouland M. Recherches sur la structure du sac embryonnaire et sur les phenomenes de fecondation chez
la Clematis recta L. // Botaniste. 1975. T. 57, № 1—6. P. 5—14.
Brouland M., Guerven C, Le Cog C. Etude cytologique qualitative et quantitative de la reproduction de
la Delphinium ajacis L. // Rev. cytol. et biol. veg. 1976. T. 39, № 1—2. P. 121—138.
Brown R. On some remarkable deviations from the usual structure of seeds and fruits // Trans. Linn. Soc.
London. 1818. Vol. 12. P. 143—151.
Brown R. Character and description of Kingia // Voyages of.discovery / Ed. P. King. London. 1826a.
P. 534—565.
Brown R. Sur la structure de 1'ovule anterieurement a l'impregnation dans les plantes phanerogames et
sur la fleur femelle des Cycadees et des Coniferees // Ann. sci. natur. Bot. 1826b. T. 7. P. 211 —244.
Brown R. Vermischte botanische Schriften. Nurnberg: Leonard Schrag, 1834. Bd 5. 478 S.
Brown R. C, Lemmon В. Е. Microtubules associated with simultaneous cytokinesis of coenocytic
microsporocytes // Amer. J. Bot. 1988. Vol. 75. P. 1848—1856.
Brown R. C, Lemmon В. Е. Minispindles and cytoplasmic domains in microsporogenesis of orchids //
Protoplasma, 1989. Vol. 148, № 1—2/3. P. 26—32.
Brown R. C, Lemmon В. Е. Pollen development in orchids 1. Cytoskeleton and the control of division
plane in irregular patterns of cytokinesis // Protoplasma. 1991. Vol. 136, P. 9—18.
Brown R. C, Lemmon В. Е. Control of division plane in normal and griseofulvintreated microsporocytes
of Magnolia // J. Cell Sci. 1992. Vol. 103, Pt 4. P. 1011—1038.
Brown R. C, Mogensen H. L. Late ovule and early embryo development in Quercus gambelii // Amer.
J. Bot. 1972. Vol. 59, № 4. P. 311 —316.
Brown S. M., Crouch M. L. Characterization of a gene family abundantly expressed in Oenothera organensis
pollen that shows sequence similarity to polygalacturonase // Plant and Cell Physiol. 1990. Vol. 2, P. 263—274.
Brown W. D. The nature of the embryo sac of Peperomia // Bot. Gaz. 1908. Vol. 46, № 8. P. 445-460.
Brumfield R. T. Asymmetrical spindle in the first microspore division of certain angiosperms // Amer. J.
Bot. 1941. Vol. 28, № 3. P. 713—721.
Bruun L., Olesen P. A structural investigation of the ovule in sugar beet, Beta vulgaris L.: the mature
embryo sac and micropylar nucellus // Nord. J. Bot. 1989. Vol. 9. № 1. P. 81—87.
Bryan J. H. D. DNA — protein relations during microsporogenesis of Tradescantia // Cromosoma. 1951.
Vol. 4, № 4. P. 369—392.
Budelier K. A., Smith A. G., Gasser С S. Regulation of a stylar transmitting tissue-specific gene in wild-
type and transgenic tomato and tobacco // Mol. Gen. Genet. 1990. Vol. 224, P. 183—192.
Budell B. Untersuchungen der Antherenentwicklung einiger Blutenpflanzen // Ztschr. Bot. 1964. Bd 52,
H. I.S. 1—28.
Литература
289
Buell M. F. Seed and seedling of Acorus calamus // Bot. Gaz. 1935. Vol. 96, № 4. P. 758—765.
Buell M. F. Embryology of Acorus calamus // Bot. Gaz. 1938. Vol. 99, № 3. P. 556—568.
Buell M. F. Developmental morphology in Dianthus. II. Starch accumulation in ovule and seed // Amer.
J. Bot. 1952. Vol. 39, №. 7. P. 458—467.
Bugnicourt M. Polyembryonie chez l'Hypericum tetrapterum Fries (-Hypericum acutum Moench.) //
Bull. Soc. Bot. France. 1969. T. 116, № 9. P. 495—504.
Burgess G. Cell shape and mitotic spindle formation in the generative cell of Endymion non-scriptus //
Planta. 1970. Bd 95, H. 4. S. 201—207.
Burton G. W., Ingold K. U. J3-carotine: an unusual type of lipid antioxidant // Science. 1984. Vol. 224.
P. 569—573.
Buxbaum F. Morphology of Cacti. Sect. 2. Flower. California, Pasadena: Abbey Garden press, 1953. P.
88—170.
Caldwell O. W. On the live history of Lemna minor // Bot. Gaz. 1899. Vol. 27, № 1. P. 37—66.
Caley C. Y., Duffus С M., Jeffcoat B. Photosynthesis in the pericarp of developing wheat grains // J.
Exp. Bot. 1990. Vol. 224. P. 303—307.
Camerarius R. J. De sequ plantarum epistola // Tabingae. 1749. P. 83—148.
Campbell D. H. A peculiar embryo sac in Peperomia pellucida. // Ann. Bot. 1899a, Vol. 13,
№ 52. P. 626.
Campbell D. H. Die Entwicklung des Embryosackes von Peperomia pellucida Kunth. // Ber. dtsch. bot.
Ges. 1899b. Bd 17, H. 10, S. 452—456.
Campbell D. H. The embryo sac of Peperomia // Ann. Bot. 1901. Vol. 15, № 57. P. 103—118.
Campbell D. H. Recent investigation upon the embryo sac of angiosperms // Amer. Natur. 1903. Vol.
36. P. 7—12.
Carniel K. Das Antherentapetum von Zea mays // Oster. bot. ztschr. 1961. Bd 108, № 1. S. 89—96.
Carniel K. Das Antherentapetum // Oster. bot. ztschr. 1963. Bd 110, № 2—3. S. 145—176.
Carpenter J. L., Planse S. E., Snustad D. P., Silflow С Preferential expression of an a-tubulin gene of
Arabidopsis in pollen // Plant Cell Physiol. 1992. Vol. 4. P. 557—571.
Carr D. J. Plasmodesmata in growth and development // In: Intercellular communication in plants: studies
on plasmodesmata / Eds. D. E. S. Gunning, A. W. Robards. Berlin e. a. Springer. 1976.
Cass D. D. Occurrence and development of a filiform apparatus in the egg of Plumbago capensis // Amer.
J. Bot. 1972a. Vol. 59, № 3. P. 279—283.
CassD. D. infrastructure of theegg of Plumbago zeylanica// Amer. J. Bot. 1972b. Vol. 59, №6. P. 648.
Cass D. D. Structural relationships among central cell and egg apparatus cells of barley as related to
transmission of male gametes // Acta Soc. bot. pol. 1981. Vol. 50, № 1—2. P. 177—180.
Cass D. D. Studies of isolated embryo sacs and sperm cells of maize and winter wheat // Amer. J. Bot.
1990. Vol. 77, Suppl. P. 5—6.
Cass D. D., Jensen W. A. Fertilization in barley // Amer. J. Bot. 1970. Vol. 57, № 1. P. 62—70.
Cass D. D., Karas J. Ultrastructural organization of the egg of Plumbago zeylanica // Protoplasma. 1974.
Vol. 81, № 1. P. 49—62.
Cass D. D., Peteya D. J., Robertson B. L. Megagametophyte development in Hordeum vulgare. 1. Early
megagametogenesis and nature of cell wall formation //Can. J. Bot. 1985. Vol. 63, № 12. P. 2164—2171.
Cass D. D., Peteya D. J., Robertson B. L. Megagametophyte development in Hordeum Vulgare. 2. Late
stages of wall development and morphological aspects of megagametophyte cell differentiation //Can. J. Bot.
1986. Vol. 64, № 10. P. 2327—2336.
Cavallini A., Cionini P. G. Nuclear DNA content in differentiated tissues of sunflower // Protoplasma.
1986. Vol. 130, № 2—3. P. 91—97.
Cave M. S. Embryological characters of taxonomic significance//Lilloa. 1962. Vol. 31. P. 171—181.
Chamberlain С J. Contributions to the embryology of Aster novaeangliae // Bot. Gaz. 1895.
Vol. 20. P. 205—212.
Chamberlain С J. Gymnosperms. Structure and Evolution // Chicago. III. Unit, of Chicago press, 1935.
XII. 484 p.
Chandra S., Bhatnagar S. P. Pollination and nucellus in Abelmoschus esculentus // Biol, plant. (Praha).
1975. T. 17, №2. P. 154—155.
Cliao Ch. Y. A periodic acid — Schiff's substance related to the directional growth of pollen tube into
embryo sac in Paspalum ovules // Amer. J. Bot. 1971. Vol. 58, № 7. P. 649—654.
Chapman G. P. The tapetum // Intern. Rev. Cytol. 1987. Vol. 107. P. 111 — 125.
Charzyriska M., Ciampolini F., Cresti M. Generative cell division and sperm cell formation in barley //
Sex. Plant Reprod. 1988. Vol. 1. P. 240—247.
Charzynska M., Lewandowska E. Generative cell division and sperm cell association in the pollen grain
of Sambucus nigra // Ann. Bot. 1990. Vol. 65, № 6. P. 685—689.
Charzynska M., Murgia M., Cresti M. Ultrastructure of the vegetative cell of Brassica napus pollen with
particular reference to microbodies // Protoplasma, 1989. Vol. 152, № 2/3. P. 22—28.
Chaubal R., Reger B. J. Secretion of calcium by pearl millet synergids // Frontiers in sexual plant
reproduction research: Abstr. book 13th Internat. congress on Sex. Plant Reproduction, Vienna, Austria,
July 10—14, 1994. Vienna: University of Vienna, 1994. P. 23.
19 Генеративные органы цветка.
290
Генеративные органы цветка
Chaudhry Bharti. Histochemical and ultrastructural aspects of anther, pollen and seed development in
Prosopis juliblora (Swartz) DC. with a note on insect infestation of seeds // Ph. D. Thesis, Univ. Delhi, Delhi,
1992.
Chaudhry Bharti, Vijayaraghavan M. R. Structure and function of the anther gland in Prosopis juliblora
(Leguminosae, Mimosoideae): A histochemical analysis // Phyton. 1992. Vol. 32. P. 1—7.
Chebotaru A. A. Electron microscopy investigation, ontogeny and the question of new formation of
organelles // Abstr. XII Intern. Congr. genet. Japan, Tokyo, 1968. P. 11.
Chebotaru A. A. Some characteristics of vegetative, generative and sperm cell cytoplasm of maize (Zea
mays ssp. sackharata Sturt.) // Bull. Soc. Bot. France, Actualites botaniques, France, Reims, 1978. № 1—2.
P. 155—160.
Chebotaru A. A. The morpho-functional status of higher plants gametogenesis // Proc. Intern. Symp.
sexual reproduction. Wageningen, Netherlands, 1985.
Chen Z.-K., Wang F.-H., Zhou F. On the origin, development and ultrastructure of the orbicules
and pollenkitt in the tapetum of Anemarrhena asphodeloides (Liliaceae) // Grana. 1988. Vol. 27.
P. 273—282.
Chiarugi A. In gametofito feminee della Angiospermae nei suovo varitipi di construcione e di sviluppo.
// Nuovo Giorn. Bot. Ital. N. S. 1927. Vol. 34, № 5.
Chiarugi A. Lo sviluppo del gametofito femmineo della Weddelina squamulosa // С. г. Acad. Lincei,
Roma. 1933. Vol. 17. P. 1095—1100.
Chiarugi A. La poliploidia della genrazione aploide femminile delle fanerogame // Caryologia. 1950. Vol.
3, №2. P. 149—155.
Chiarugi A., Franchini E. Apomissia in Ochna serulata walp. // Nuovo Gior. Bot. Ital. 1930. Vol. 37, №
LP. 1—250.
Chikukkannaiah P. S. Embryological studies in Commelinaceae // Plant embryology. Symp. CSIR. New
Delhi, 1962. P. 23—36.
Chikkanaiah P. S., Mahalingappa M. S. Antipodal collar in some members of Gramineae // Curr. Sci.
(India). 1975. Vol. 44, № 1. P. 22—23.
Christensen J. E., Horner H. Т., Lersten N. R. Pollen wall and tapetal orbicular wall development in
Sorghum bicolor // Amer. J. Bot. 1972. Vol. 59, № 1. P. 43—58.
Chu H., Hu Z. Male gametophyte development in monosomies of wheat // Genome. 1981. Vol. 32, № 1.
P. 155—164.
Clauhs R. P., Grun P. Changes in plastid and mitochondrion content during maturation of generative cells
of Solanum (Solanaceae) // Amer. J. Bot. 1977. Vol. 64, № 4. P. 377—383.
Claussen P. Uber das Verhalten des Antherentapetum bei einiger Monocotylen und Ranales // Bot. Arch.
1927. Bd 18. S. 1—27.
Clifford S. C, Orvens S. J. The stigma, style and ovarian transmitting tract in the Oncidiinae
(Orchidaceae): morphology, developmental anatomy and histochemistry // Bot. Gaz. 1990. Vol. 151 N° 4
P. 440—451.
Cocucci A. E. Aspectos ultrastructurales de la fertilization en angiospermas // Kurtziana. 1981 T 14.
P. 41—62.
Cocucci A. E., Jensen W. A. Orchid embryology: the mature megagametophyte of Epidendrum scutella
// Kurtziana. 1969. Vol. 5. P. 23—28.
Сое G. E. Distribution of carbon 14 in ovules of Zephyranthes drummondii // Bot. Gaz. 1954. Vol. 11 5,
№ 4. P. 342—346.
Cooper D. С Macrosporogenesis and embryology of Melilotus // Bot. Gaz. 1933. Vol. 95. P. 143—155.
Cooper D. С Macrosporogenesis and development of the embryo sac of Lilium henryi // Bot. Gaz 1935.
Vol. 97, № 1. P. 346—355.
Cooper D. С Macrosporogenesis and embryo sac development in Euchlaena mexicana and Zea mays //
J. Agr. Res. 1937a. Vol. 55. P. 539—551.
Cooper D. C. Macrosporogenesis and embryology of Medicago // J. Aer. Res. 1937b. Vol. 57 № 7. P.
539-551.
Cooper D. C. Development of megagametophyte in Erythronium albidum// Bot. Gaz. 1939. Vol. 100, №
4. P. 862—867.
Cooper D. С Macrosporogenesis and the development of the seed of Phryma leptostachya // Amer. J.
Bot. 1941. Vol. 28. № 9. P. 755—761.
Cooper D. С The transfer of desoxyribose nucleic acid from the tapetum to the microsporocytes at the
onset of meiosis // Amer. Natur. 1952. № 86. P. 219—230.
Cooper D. C, Brink R. A. Seed collapse following matings between diploid and tetraploid races
Lycopersicon pimpinellifolium // Genetics. 1945. Vol. 30, № 4, P. 376—401.
Copeland H. F. The morphology and embryology of Euonymus japonica // Phytomorphology. 1966. Vol.
16, №3. P. 326—333.
Corner E. J. H. The Annonaceous seed and its four integuments // New Phytologist. 1949a. Vol 48 №
3. P. 333—364.
Corner E. J. H. The durian theory of the origin: the modern tree // Ann. Bot. N. S. 1949b. Vol. 13, №
52. P. 367—414.
Литература
291
Corner E. J. H. The durian theory extended. I. // Phytomorphology. 1953. Vol. 3, № 4. P.
465—476.
Corner E. J. H. The durian theory extended. II. The arillate fruit and the compound leaf //
Phytomorphology. 1954a. Vol. 4, № 1—2. P. 152—165.
Corner E. J. H. The durian theory extended III. Pachycauly and megaspermy conclusion //
Phytomorphology. 1954b. Vol. 4, № 3—4. P. 263—274.
Corner E. J. H. The seeds of dicotyledons. Cambridge etc. 1976. Vol. 1. 311 p.
Corner E. J. H. The seeds of dicotyledons. Cambridge etc. 1976. Vol. 2. 552p.
Corner E. J. H. The myristicaceous seed // Blumea. 1983. Vol. 28, № 2. P. 330—340.
Coulter J. M. Contribution to the life history of Ranunculus // Bot. Gaz. 1898. Vol. 25. P. 73—88.
Coulter J. M. Relation of megaspores to embryo sacs in Angiosperms // Bot. Gaz. 1908. Vol.
45. P. 361—366.
Coulter J. M. Evolutionary tendencies among Gymnosperms // Bot. Gaz. 1909. Vol. 41.
Coulter J. M., Chamberlain С J. Morphology of Angiosperms. Chicago. 1903. 471 p.
Coulter J. M., Chamberlain С J. Morphology of Angiosperms (Pt II). New-York. 1915. 348 p.
Cousin M. T. Tapetum and pollen grain of Vinca rosea, Apocynaceae // Grana. 1979. Vol. 18, № 2. P.
115—128.
Cresti A., Gori P., Pacini E. Sexual reproduction in higher plants. Berlin Springer-Verlag, 1988.
Cresti M., Lancelle S. A., Hepler P. K. Structure of the generative cell wall complex after freeze
substitution in pollen tubes of Nicotianaand Impatiens // J. Cell Sci. 1987. Vol. 88, P. 373—378.
Cresti M., Murgia M., Theunis С. Н. Microtubule organization in sperm cells in the pollen tubes of Brassica
oleracea L. // Protoplasma. 1990. Vol. 154, P. 151—156.
Cresti M., Pacini E., Ciampolini F., Sarfatti G. Germination and early tube development in vitro of
Lycopersicum peruvianum pollen: ultrastructural features // Planta. 1977. Bd 136, S. 239—247.
Cresti M., van Went J. L., Willemse M. Т. М., Pacini E. Fibrous masses and cell and nucleus movement
in the pollen tube of Petunia hybrida // Acta bot. need. 1976. Vol. 25, № 5. P. 381—383.
Cronquist A. An integrated system of classification of flowering plants. New-York: Columbia Univ. Press.
1981. XVIII. 1262 p.
Dahlgren K. V. O. Zytologische und embryologische Studien liber die Reichen Primulales und
Plumbaginales // Kgl. sven. Vetenskapsakad, handl. 1916. Bd 56, H. 4. S. 1—80.
Dahlgren K. V. O. Studien uber die Endospermbildung der Kompositen // Sven. bot. tidskr. 1924. Bd 18.
S. 117—203.
Dahlgren K. V. O. Die Morphologie des Nuzellus mit besonderer Berucksichtigung der deckzellosen
Tipen. //Jahrb. Wiss. Bot. 1927a. Bd 67, H. 2. S. 374—426.
Dahlgren K. V. O. Ueber das Vorkommen von Starke in den Embryosacken der Angiospermen // Ber.
dtsch. bot. Ges. 1927b. Bd 45. S. 374—384.
Dahlgren K. V. O. Hakenformige Leistenbildungen bei Synergiden // Ber. dtsch. bot. Ges. 1928. Bd 46.
5. 434—443.
Dahlgren K. V. O. Die Entwicklung des Embryosacken bei Plumbago zeylanica // Bot. notis. 1937. H.
6. P. 487—498.
Dahlgren K. V. O. Hakenbildungen bei Synergiden, Zweite Mitteilung // Sven. bot. tidskr. 1938. Bd 52.
S. 221—237.
Dahlgren K. V. O. Endosperm und Embryobildung bei Zostera marina //Bot. notis. 1939a. H. 4. S. 607 —
615.
Dahlgren K. V. O. Sur la presence d'amidon dans le sac embryonnaire chez les angiospermes // Bot.
notis. 1939b. H. 1.S. 221—231.
Dahlgren K. V. O. Postamentbildungen in den Embryosacken der Angiospermen // Bot. notis. 1940. H.
4. S. 347—369.
Dahlgren R. The distribution of characters within an angiosperm system. I. Some embryological
characters // Bot. notis. 1975. H. 128. S. 181—197.
Dahlgren R. A revised system of classification of the angiosperms // Bot. J. Linn. Soc. 1980. Vol. 80, №
2. P. 91—124.
D'Amato F. Embryologia di Ulmus campestris L. // Nuovo Gior. Bot. Ital. N. S. 1940a. Vol. 47, № 2. P.
247—263.
D'Amato F. Contribution all'embriologia delle Plumbaginaceae // Nuovo Gior. Bot. Ital. N. S. 1940b.
Vol. 47, № 2. P. 349—382.
D'Amato F. Apomissia in Statice oleaefolia Scop. var. confusa Godr. // Nuovo Gior. Bot. Ital. 1940c.
Vol. 47, № 2. P. 504—505.
D'Amato F. Role of polyploidy in reproductive organs and tissues // Embryology of Angiosperms / Ed.
В. М. Johri. Berlin a. o.: Springer-Verlag. 1984. P. 519—566.
Dashek W. V., Rosen W. G. Electron microscopical localisation of chemical components in the grown
zone of lily pollen tubes // Protoplasma. 1966. Vol. 61, P. 192—203.
Davis G. L. Systematic embryology of angiosperms. New-York 1966. 528 p.
Davis G. L. Apomixis and abnormal anther development in Calotis lappulacea Benth. (Compositae) //
Austral. J. Bot. 1968. Vol. 16. № 1. P. 1—17.
19*
292
Генеративные органы цветка
De Boer-de Jeu M. J. Megasporogenesis. A comparative study of the ultrastructural aspects of
megasporogenesis in Lilium, Allium and Impatiens // Meded. Landbouwhogesch. Wageningen. 1978.
№ 16. P. 128.
De Fossard R. A. Development and histochemistry of the endothecium tn the anthers of in vitro grown
Chenopodium rubrum L. // Bot. Gaz. 1969. Vol. 130, № 1. P. 10—22.
De Mason D. A., Sekhar K. N. C. The breeding system in the date (Phoenix dactylifera L.) and its
recognition by early cultivators // Adv. Econ. Bot. 1988. Vol. 6, P. 20—35.
De Mol W. E. Duplication of generative nuclei by means of physiological stimuli and its significance //
Genetica. 1923. Vol. 5, P. 225—272.
Deschamps R. Premiers stages du developpement de l'embryon et de Palbumen du Lin: etude au
microscope electronique // Rev. Cytol. Biol. Veg. 1969. Vol. 32, № 3—4. P. 379—390.
Diboll A. G. Fine structural development of the megagametophyte of Zea mays following fertilization //
Amer. J. Bot. 1968. Vol. 55, № 7. P. 797—806.
Diboll A. G., Larson D. A. An electron microscopic study of mature megagametophyte in Zea mays //
Amer. J. Bot. 1966. Vol. 53, № 4. P. 391—402.
Dickinson H. G. The fine structure of a peritapetal membrane investing the microsporangium of Pinus
banksiana // New Phytologist. 1970. Vol. 69. № 4. P. 1065—1068.
Dickinson H. G. The deposition of acetolysis resistant polymers during the formation of pollen // Pollen
Spores. 1976. Vol. 18, № 3. P. 321—334.
Dickinson H. G. The development of pollen // Rev. Cytol. Biol. Veg. 1982. Vol. 5, P. 5—19.
Dickinson H. G., Heslop-Harrison J. Ribosomes, membranes and organelles during meiosis in angiosperms
// Phil. Trans. Roy. Soc. London B. 1977. Vol. 277. P. 327—342.
Dickinson H. G., Lewis D. The formation of the tryphine coating the pollen grains of Raphanus
and its properties relating to the selfincompatibility system // Proc. Roy. Soc. London B. 1973.
Vol. 184. P. 149—165.
Dickinson H. G., Li F. L. Organelle behaviour during higher plant gametogenesis // Soc. Exp. Biol. Ser.
1988. Vol. 5. P. 131—148,
Dong J., Yang Hong-yuan. [ Ultrastructure of embryo sac in Oryza sativa L. ] // Acta bot. sin. 1989.
Vol. 31, №2. P. 81—88.
Dormer K. J. The fibrous layer in the anthers of Compositae // New Phytologist. 1962. Vol. 61, № 2. P.
150—153.
Drahowzal G. Ein Beitrage zur Morphologie und Entwicklungsgeschichte der Pollenkorner // Osterr.
Bot. Ztschr. 1936. Bd 85, H. 4. S. 241—269.
Dressier R. L. Phylogeny and classification of the orchid family. Portland, Oregon: Dioscorides Press.
1993. 314 p.
Dumas C, Knox R. В., MsConchie С A., Russel S. D. Emerging physiological concepts in fertilization
// What's New in Plant Physiology. 1984. Vol. 15. P. 17—20.
Dumas C, Knox R. В., Gaube T. The spatial association of the sperm cells and vegetative nucleus in the
pollen grain of Brassica // Protoplasma. 1985. Vol. 124, № 3. P. 168—174.
Dunbar A. Pollen development in Eleocharis palustris group (Cyperaceae). I. Ultrastructure and
ontogeny // Bot. notis. 1973. Bd 126, H 2. S. 197—254.
Duvick D. N. The use of cytoplasmic male sterility in hybrid production // Econ. Bot. 1959. Vol. 13, №
3. P. 167—195.
Eames A. J. Morphology of the Angiosperms. New-York: Mc-Grawhill. 1961. 518 p.
Earle T. T. Embryology of certain Ranales // Bot. Gaz. 1938. Vol. 100, № 2. P. 257—275.
Echlin P. The role of the tapetum during microsporogenesis of angiosperms // Pollen: development and
physiology. / Ed. J. Heslop-Harrison, Butterworths. London. 1971a. P. 52—53.
Echlin P. Poduction of sporopollenin by the tapetum // Sporopollenin. Proc. Symp., London, 1970.
London — New York. 1971 b. P. 220—247.
Echlin P., Godwin H. The ultrastructure and ontogeny of pollen in Helleborus foetidus L. II. Pollen grain
development through the callose special wall stage // J. Cell Sci. 1968. Vol. 3. P. 161 —174.
Edwardson J. R. Cytoplasmic male sterility // Bot. Rev. 1970. Vol. 36, № 4. P. 341—420.
Ekdahl I. Die Entwicklung von Embryosack und Embryo bei Ulmus glabra Huds. // Sven. bot. tidskr.
1941. Bd 35, № 2. S. 143—156.
El-Ghazaly G. Pollen and orbicule morphology of some Euphorbia species // Grana. 1989. Vol. 28, P.
234—259.
El-Ghazaly G., Jensen W. Studies of the development of wheat (Triticum aestivum) pollen III. Formation
of microchannels in the exine // Pollen et spores. 1985. Vol. 27, № 1. P. 5—14.
El—Ghazaly G., Jensen W. Studies of the development of wheat (Triticum aestivum) pollen. I. Formation
of the pollen wall and Ubisch bodies // Grana. 1986a. Vol. 25, . P. 1—29.
El-Ghazaly G., Jensen W. Studies of the development of wheat (Triticum aestivum) pollen: formation of
the pollen aperture // Can. J. Bot. 1986b. Vol. 64, № 2. P. 3141—3154.
Ellis Raymon J., Chaffey Nigel Y. Structural differentiation of the nucellar epidermis in the caryopsis of
rice (Oryza sativa) // Ann. Bot. 1987. Vol. 60, № 6. P. 671—675.
Embryology of Angiosperms / Ed. В. М. John. Berlin; Springer-Verlag. 1984. 602 p.
Литература
293
Engell K. Embryology and taxonomic position of Retziacapensis (Retziaceae) // Nord. J. Bot. 1987. Vol.
7, № 2. P. 117—124.
Engell K. The antipodal cells in the embryo sac of Hordeum vulgare // Proc. XI Intern. Symp.
«Embryology and seed reproduction». Leningrad, July 3—7, 1990. St. Petersburg. 1992. P. 147—148.
Engell K., Petersen G. B. Integumentary and endothelial cells of Bellis perennis. Morphology and
histochemistry in relation to the developing embryo sac // Bot. tidskr. 1977. Bd 71, № 3—4. S. 237—244.
Engler A., Plantl K. Die naturlichen Pflanzenfamilien. Leipzig, 1889. XII. T. 3. Abt. 1. 289 S.
Erdelska O. Nucleolarvakuolen in den Zellen des Embryosackes von Jasione montana L. // Protoplasma.
1973. Vol. 76, №. P. 123—127.
Erdelska O. Pre-fertilization development of ovule of Jasione montana L. // Phytomorphology. 1975.
Vol. 25, № 1. P. 76—81.
Erdelska O. Embryologia krytosemennych rastlin. Bratislava: Veda, 1981. 199 p.
Erdelska O. Microcinematographical investigation of the female gametophyte, ferilization and endosperm
development // Proc. 7th Intern. Symp. «Fertilization and embryogenesis in ovulated plants», High Tatra
(Rackova dolina), Czechoslovakia, 1982. Bratislava. 1983. P. 49—54.
Erdtman G. Handbook of palynology. Copenhagen: Munksgaard. 1969.
Erdtman G., Berglung В., Praglovgki J. An introduction to a Scandinavian pollen flora // Grana palynol.
1961. Vol. 2(3). P. 3—92.
Ernst A. Zur Phylogenie des Embryosackes der Angiospermen // Ber. dtsch. bot. Ges. 1908. Bd 26a. S.
419—438.
Esau K. Anatomy of seed plants. New-York: e. a.: J. Wiley and sons. 1977. 550 p.
Esau K., Charvat I. D. An ultrastructural study of acid phosphatase localization in cells of Phaseolus
vulgaris phloem by the use of the azo dyo method // Tissue and Cell. 1975. Vol. 7, № 4. P. 619—630.
Esau K., Hoefert L. L. Endoplasmic reticulum and its relation to microtubulus in sieve elements of
sugarbeet and spinach // J. Ultrastr. Res. 1980. Vol. 71, № 3. P. 249—257.
Eschrich W, Electronenmikroskopische Untersuchungen an Pollenmutterzellen-Callose. IV. Mitt, iiber
Callose // Protoplasma 1962. Bd 55. № 2. S. 419—422.
Esser K. Bildung und Abbau von Kallose in den Samenanlagen der Petunia hybrida // Ztschr. Bot. 1963.
Bd 51, H. I.S. 32—51.
Evert R. F. Comparative structure of phloem // Contemporary problems on plant anatomy. New-York.
1984. P. 145—234.
Eyme J. Recherches cytologiques sur le gametophyte femelle de Helleborus foetidus L. ef H. niger L. //
Botaniste. 1961. Vol. 44, P. 255—289.
Eyme J. Recherhes sur la constitution cytoplasmique de l'archespore et du sac embryonnaire de Lilium
candidum L. // Botaniste. 1965. Vol. 48, № 1—6. P. 99—155.
Eyme J. Nouvelles observation sur I'infrastructure de tissus nectarignes floraux // Botaniste. 1967. Vol.
50, № 1—6. P. 169—183..
Fagerlind F, Embryologische, zytologische und bestaubung experimentelle Studien in der Familie
Rubiaceae nebst Bemerkungen uber einige Polyploiditatsprobleme // Acta Horti berg. 1937. Bd 11, H. 9. S.
195—470.
Fagerlind F. Embryosack von Plumbagella und Plumbago // Arkiv. for Bot. 1938, Bd 29, Ser. B. S. 1 —8.
Fagerlind F. Der Embryosack von Plumbagella und Plumbago // Ark. bot. 1939a. Bd 29, H. 1. S. 1—8.
Fagerlind F. Die Entwicklung des Embryosackes bei Peperomia pellucida Kunth. // Ark. bot. 1939b. Bd
29A, H. 17. S. 1—15.
Fagerlind F. Drei Beispiele des Fritillaria-typus // Sven. bot. tidskr. 1939c. Bd 33, H. 2. S. 188—204.
Fagerlind F. Kritische und revidierende Untersuchungen iiber das Vorkommen des Adoxa- («Lilium»)
Types // Acta horti berg. 1939d. Bd 13, H. 1. S. 1—49.
Fagerlind F. Stempelbau und Embryosackentwicklung bei einigen Pandanaceen // Ann. Jard. Bot.
Buitenz. 1940. Bd 49. S. 55—78.
Fagerlind F. Der Bau der Samenarilage und des Macrogametophyten bei Quisqualis indica // Bot. notis.
1941a. Bd2. S. 217—222.
Fagerlind F. Bau und Entwicklung der Gnetum-Gametophyten. // K. Sven. Vetenskapsakad. handl.
1941b. Ser. 3. Bd 19. S. 1—55.
Fagerlind F. Der tetrasporische Angiospermen-Embryosack und dessen Bedeutung fur das
Verstandnis der Entwicklungsmechanik und Phylogenie des Emryosackes // Ark. Bot. 1944a. Bd
31A, H. 11. S. 1—71.
Fagerlind F. Die Samenbildung und die Zytologie bei agamospermischen und sexuellen Arten von
Elatostema und einigen nahestehenden Gattungen nebst Beleuchtung einiger damit Zusammenhangens
Probleme // Kgl. sven. Vetenskapsakad. handl. 1944b. Bd 21, H. 4. S. 1—130.
Fagerlind F. Blute und Blutenstand der Gattung Balanophora // Bot. Notis. 1945. H. 4. S. 330—350.
Fagerlind F. Gynoeceum — morphologische und embryologische studien in der familie Olacaceae // Bot.
Notis. 1947. S. 207—230.
Fagerlind F. The initiation and early development of the sporangium in vascular plants // Sven. bot. tidskr.
1961. Bd 55, H.2. S. 299—312.
Fahn A. Secretory tissues in plants. London: Acad. Press, 1979.
294
Генеративные органы цветка
Fang J., Zhang Sh. Dimorphism of tapetum and its histochemistry in Capsicum annuum L. // Acta bot.
sinica. 1988. Vol. 30, № 4. P. 352—356.
Faroog M., BilquistS. Studies in the Lentibulariacae. 7. The embryogeny in Utricularia scandens // Beitr.
Biol. Pflanz. 1966. Bd 42. S. 127—131.
Favre-Duchartre M. A propos des nucellus des plantes a ovules // Ann. Sci. Univ. Reims et ARERS,
1963. Vol. 1—2.
Favre-Duchartre M. Homology and Phylogeny // Embryology of Angiosperms. Berlin a. o., 1984. P. 679—
734.
Ferguson M. C. Contribution to the life history of Pinus, with special reference to sporogenesis, the
development of the gametophytes, and fertilization // Proc. Wash. Acad. Sci., 1904. Vol. 6.
Feudenstein J. V. A systematic study of endothecial thickenings in the Orchidaceae // Amer. J. Bot.
1991. Vol. 78, №6. P. 766—781.
Figdor W. Uber Cotylanthera Bl. // Ann. Jard. Bot. Buitenzorg., 1897. Bd 14. S. 213—240.
Finn W. W. Spermazellen bei Vinca minor und V. herbacea // Ber. dtsch. bot. Ges. 1928. Bd 46. H. 4.
S. 235—236
Fischer A. Zur Kenntnis Embryosakentwicklung einiger Angiospermen //Jen. Zeit f. Nat. 1880. Bd 14. S.
9—132.
Fisher G. C. Seed development in the genus Peperomia. // Bull. Torrey Bot. Club. 1914. Vol. 41, № 3.
P. 137—156, № 4. P. 221 —241.
Flawell R. A model for the mechanism of cytoplasmic male sterility in plants with special reference to
maize // Plant Sci. Lett. 1974. Vol. 3, P. 259—263.
Fleurat-Lessard G. Specialized formation of endoplasmic reticulum in parenchyma cells of Mimosa pudica
L. // Protoplasma. 1986. Vol. 130, № 1. P. 1—4.
Foard D. E., Haber A. N., Fishman T. N. Initiation of lateral root primordia without completion
of mitosis and without cytokinesis in uniseriate pericycle // Amer. J. Bot. 1965. Vol. 52, № 6.
P. 580—590.
Folsom M. W., Cass D. D. Changes in transfer cell distribution in the ovule of soybean after fertilization
// Can. J. Bot. 1986. Vol. 64, № 5. P. 965—972.
Folsom M. W., Cass D. D. The characteristics and fate of the soybean inner nucellus // Acta bot. neerl.
1988. Vol. 37, № 3. P. 387—393.
Folsom M. W., Cass D. D. Embryo sac development in Soybean: ultrastructure of megasporangenesis and
early megagametogenesis //' Can. J. Bot. 1989. Vol. 67. P. 2841—2849.
Folsom M. W., Cass D. D. Embryo sac development in soybean: cellularization and egg apparatus
expansion // Can. J. Bot. 1990. Vol. 68. P. 2135—2147.
Ford J. H. Ultrastructural und chemical studies of pollen wall development in the Epacridaceae //
Sporopollenin / Eds. J. Brooks, P. R. Grant, M. Muir, P. van Gijzel, G. Shaw. London: Acad. Press, 1971.
Ford J. H. Monad pollen development: the initiation of cytoplasmic polarity // Cytologia. 1972. Vol. 6,
№ 1. P. 64—81.
Foster A. S. Structure and growth of the shoot apex in Ginkgo biloba // Bull. Torrey Bot. Club. 1938.
Vol. 65. P. 531—556.
Fougere-Rifot M. L'edification de l'appareil filiforme et 1'evolution cytoplasmique des synergides du sac
embryonnaire d'Aquilegia vulgaris // С r. Acad. Sci. 1975. T. 280D, № 21. P. 2445—2447.
Fougere-Rifot M. La cellule centrale du sac embryonnaire d'Aquilegia vulgaris L.: des noyaux polaires
aux noyaux d'albumen leiteux // Bull. Soc. bot. France. Actual. Bot. 1978. T. 125, № 1—2. P. 207—213.
Fougere-Rifot M. Intercellular relations and wall structures in mature embryo sacs of four species of
angiosperms // Acta Soc. bot. pol. 1981. Vol. 50, № 1—2. P. 131—138.
Fougere-Rifot M. L'evolution du sac embryonnaire des Ranunculacees: les synergides d'Aquilegia
vulgaris L. etl'apparationd'une secretion tardive// Rev. Cytol. Biol. veg. Bot., 1987a. T. 10, № 1. P. 33—46.
Fougere-Rifot M. Macrosporo- et macrogametogeneses, fecondation, embryogenese et albuminogenese
// Bull. Soc. bot. France, Actual. Bot., 1987b. T. 134, № 1. P. 113—168.
Fougere-Rifot M. La lyse des cellules nucellaires de l'ovule d'Aquilegia vulgaris L. // Ann. sci. Univ.
Reims et ARERS, 1988. № 23. P. 140—151.
Fougere-Rifot M. L'evolution du reticulum endoplasmique des synergides d'Aquilegia vulgaris L. // Ann.
sci. natur. Bot. et biol. veget., 1989. T. 10, № 2. S. 49—62.
Franke W. W., Herth W., Van der Wonde W. J., Morr D. J. Tubular and filamentous structures in pollen
tubes: possible involvement as guide elements in protoplasmic streaming and vectorial migration of secretory
vesicles // Planta. 1972. Vol. 105, № 4. S. 317—341.
French I. C. Patterns of endothecial wall thickenings in Araceae: subfamilies Pothoidaceae and
Monsteroidaceae // Amer. J. Bot. 1985a. Vol. 72. P. 472—486.
French I. C. Patterns of endothecial wall thickenings in Araceae: subfamilies Calloidaceae, Lasioidaceae
and Philodendroidaceae // Bot. Gaz. 1985b. Vol. 146. P. 521—533.
French I. C. Patterns of endothecial thickenings in Araceae: subfamilies Colocasiodaceae, Aroidaceae
and Pistioidaceae // Bot. Gaz. 1986. Vol. 147. P. 166—179.
Frideman W. E. Double fertilization in Ephedra, a nonflowering seed plant: its bearing on the origin of
Angiosperms // Science. 1990. Vol. 247. P. 951—954.
Литература
295
Fritsche J. Uber die Entwicklung des Pflanzeneies in seinen fruhesten Zustanden und iiber die Bildung
der Haute derselben // Arch. Naturgesch. (Wiegmann). 1935. Bd 2. S. 229—332.
Fuchs Т. С E. Beitrage zur Embryologie der Thymelaeaceae // Osterr. bot. Ztschr. 1938. Bd 87. H. 1.
S. 1—41.
Gabara B. A possible role for the endoplasmic reticulum in exine formation // Grana. 1974. Vol. 14, №
1. P. 16—22.
Gabarayeva N.I. Patterns of development in primitive angiosperm pollen // Pollen and Spores: Pattern
of diversification /1991. Vol. 44, № 4. P. 257—268.
Gaertner J. De fructibus et seminibus plantarum. Stuttgart; Leipzig, 1788—1807. Vol. 1—3.
Galil J., Zeroni M. On the organization of the pollinium in Asclepias curassavica // Bot. Gaz. 1969. Vol.
130, № 1. P. 1—4.
Garsia V. Embryological studies in the Loasaceae: development of endosperm in Blumenbachia hieronymi
Urb. // Phytomorphology. 1962. Vol. 12, № 3. P. 307—312.
Gates R. R. Pollen formation in Oenothera gigas // Ann. Bot. 1911. Vol. 25. P. 909—940.
Geerts G. M. Beitrag zur Kenntnis der zytologischen Entwicklung von Oenothera lamarckiana // Ber.
dtsch. bot. Ges. 1908. Bd 26a. S. 608—614.
Geitler L. Beobachtungen die erste Teilung in Pollenkorn der Angiospermen // Planta. 1935. Bd. 24. H
3. S. 361—386.
Geitler L. Embryosacke aus Pollenkornern bei Ornithogalum // Ber. dtsch. bot. Ges. 1941. Bd 59, H 9.
S. 419—423.
Gerasimoff I. Einige Bemerkungen uber die Function des Zellkern. Moscow. 1890. Gr. 8. 7 p.
Gerassimova E. N. Fertilization in Crepis capillaris // Cellule. 1933. Vol. 42, № 1. P. 103—148.
Gerassimova-Navashina H. Fertilization and events leading up to fertilization and their bearing on the
origin of Angiosperms // Phytomorphology. 1961. Vol. 11. P. 139—146.
Gifford E. M., Corson G. E. I. The shoot apex in seed plants // Bot. Rev. 1971. Vol. 37,
№ 2. P. 143—229.
Gildenhuys P. J., Brix K. Apomixis in Pennisetum dubium // S. Afr. J. agric. Sci. 1959. Vol.
2. P. 231—245.
Godineau J.-C. Ultrastructure des synergides chez quelques composees // Rev. cytol. biol. veg. 1969. T.
32, № 3—4. P. 209—218.
Godineau J.-C. Ultrastructure du sac embryonnaire de Crepis tectorum L.: Etat apres la cellularisation
et la fusion des noyaux polaires // Ann. Sci. Univ. Reims et ARERS. 1971. T. 9, f. 1. P. 78—88.
Goebel K. Beitrage zur vergleichenden Entwicklungsgeschichte der Sporangien // Bot. Ztg. 1880. Bd
38, № 32. S. 545—553.
Goebel K. Organography of Plants. London: Oxford Univ. Press, 1905. Vol. 2.
Goebel K. Organographie der Pflanzen, insbesondere der Archegoniaten und Samenpflanzen. Jena: G.
Fischer, 1923. T. 3, IX. 581 S.
Goebel K. Organographie der Pflanzen, insbesondere der Archegoniaten und Samenpflanzen. 1932. T.
3. S. 1380—1445.
Goebel K. Organographie der Pflanzen. Jena: G. Fischer, 1933. № 10. S. 1379—2078.
Goldberg A. Classification, evolution and phylogeny of the family of dicotyledons // Smithsonian Contrib.
Bot. 1986. № 58. 205 p.
Goodwin В. С What are the causes of morphogenesis? // Biol. Essays. 1985. Vol. 3, № 1. P. 32—47.
Gori P., Sarfatti G., Cresti M. Development of spherical organelles from the endoplasmic reticulum in the
nucellus of some Euphorbia species // Planta. 1971. Vol. 99, № 2. P. 133—143.
Gorska-Brylass A. Transitory callose envelope surrounding the generative cell in pollen grains // Acta
Soc. bot. pol. 1967. Vol. 36, № 2. P. 419—422.
Gorska-Brylass A., Bednarska E., Swierzowicz I. At which morphological maturation stage of pollen
grain takes place DNA replication // Acta Univ. N. Copernice. Biol. 1986. № 28. P. 13—19.
Gottschalk W. Meiotische und prameiotische Abregulierung // Gas. Bot. 1960. Bd 48, H. 2. S. 104—125.
Green J. W. A revised terminology for spore-containing parts of anthers // New Phytol. 1980. Vol. 84.
P. 401—406.
Grew N. The anatomy of the vegetable begun. With a general account of vegetatibn founded thereor.
London: Print. Spencer Hickman. 1672. 1978 p.
Gris A. Note sur quelques cas de monstruosit (et specialement) sur la rose verte. Paris. 1858.
Grootjen С J. Development of ovule and seed in Maranthaceae // Acta bot. neer. 1983. Vol. 32, №
1—2. P. 69—86.
Grootjen С J., Bouman F. Development of ovule and seed in Costus cuspidatus (Zingiberaceae) with
special reference to the operculum // Bot. J. Linn. Soc. 1981. Vol. 83, № 1. P. 27—39.
Grootjen C. J., Bouman F. Seed structure in Cannaceae: taxonomic and ecological implications // Ann.
Bot. 1988. Vol. 61, № 3. P. 363—371.
Grove S. N., Bracker С. Е. Protoplasmic changes during zoospore encystment and cyst germination in
Pythium aphanidermatum // Exp. mycol. 1978. Vol. 2, № 1. P. 51—98.
Guerin P. Sur le sac embryonnaire et en particulier les antipodes des Gentianes // J. Bot. 1903. T. 17.
P. 101—108.
296
Генеративные органы цветка
Guha S., Maheshwari S. С. In vitro production of embryos from anthers of Datura // Nature. 1964. Vol.
204. P. 497.
Guignard L. Sur l'origine du sac embryonnaire et le role des antipodes // Bull. Soc. bot. France. 1881.
Vol.28. P. 197—201.
Guignard L. Recherches sur le sac embryonnaire des phanerogames angiosperms // Ann. sci. natur. Bot.
1882. Vol. 13, №6. P. 136—199.
Guignard L. Etudes sur le phenomenes morphologiques de la fecondation // Bull. Soc. bot. France. 1889.
Vol. 36. P. 100—146.
Guignard L. Nouvelles tudes sur la fecondation // Ann. sci. natur. Bot. 1891. Vol. 14, № 7. P. 163—296.
Guignard L. Recherches sur le developpement de la graine et en particulier de tegument seminal // J.
Bot. 1893. Vol. 16. P. 301—368.
Guignard L. Les centres cinetiques chez les vegetaux // Ann. sci. natur. Bot. 1898. Vol. 6, № 8. P.
177—220.
Guignard L. L'appareil sexuel et la double fecondation dans les Tulipes // Ann. sci. natur. Bot. 1900.
Vol. 11, № 7. P. 365—387.
Guignard L. L'ovule chez les Apocynacees et Asclepiadacees // Mem. Acad. Sci. Inst. Fr. 1917. T. 55.
P. 1—34.
Guilford W. J., Schneider D. M., Labovitz J., Opella S. J. High resolution solid state 13c NMR
spectroscopy of sporopollenins from different plant taxa // Plant Physiol. 1988. Vol. 86, № 1. P.
134—136.
Guinet Ph., Le Thomas A. Interpretation de la repartition dissymetrique des couches de l'exine dans les
pollens composes: consequences relatives a la notion d'aperhue // С r. Acad. sci. D. 1973. Vol. 276. P.
1545—1548.
Gunning B. E. S., Hardham A. R. Microtubules // Annu. Rev. Plant Physiol. 1982. Vol. 33. P. 651 —698.
Gunning B. E. S., Pate J. S. Transfer cells // Dynamic aspects of plant ultrastructure / Ed. A. W. Robards.
London: McGraw-Hill Book Co., 1974. P. 441—480.
Guo G., Chen M.-Ch. Ultrastructure of anther wall in Stevia rebaudiana Bertoni //Acta biol. exp. sinica.
1989. Vol. 22, № 3. P. 269—277.
GuptaS. С Umbelliferae. // Bull. Ind. Nat. Sci. Acad. 1970. Vol. 41. P. 233—238.
Gupta S. C, Nanda Kanan. Ontogeny and histochemistry of dimorphic tapetum in Tecoma stans anthers
// Bull. Soc. bot. France. 1978. Vol. 125, № 1—2. P. 129—131.
GuptaS. C, Rajeswari V. M. Nucellar tracheids in ovules of Luffacylindrica // Ann. Bot. 1977. Vol. 41,
№ 175. P. 1005—1007.
Gurudeva M. R., Somashekar R. K. Development of embryo sac in Paracautleya bhatii R. M. Smith.,
Zingiberaceae // Curr. Sci. (India). 1985. Vol. 54, № 19. P. 1009—1010.
Guttenberg H. Grundzuge der Histogenese hoherer Pflanzen. I. Die Angiospermen. Berlin-Nikolassee:
Borntraeger. 1960. 315 s.
Gvaladze G. E., Akhalkatsi M. Sh. Is the Polygonum-type embryo sac initial? // Abstr. XI Intern. Symp.
«Embryology and seed reproduction». Leningrad, USSR. 1990. St. Petersburg, 1992. P. 57.
Haberlandt G. Physiologische Pflanzenanatomie. Leipzig: Engelmann. 1909. XVIII. 650 S.
Haberlandt G. Wundhormone als Erreger von Zellteilungen // Beitr Allgem Bot. 1921. Bd 2. S. 1 —53.
Haberlandt G. Die Vorstufen und Ursachen der Adventivembryonie // Sitzungsber. Preuss. Acad. Wiss.
1922. Bd 25. S. 386—406.
Haberlandt G. Zur Embryologie von Allium odorum // Ber. dtsch. bot. Ges. 1923. Bd 41. S. 174—179.
Haberlandt G. Zur Embryologie und Cytologie von Allium odorum // Ber. dtsch. bot. Ges. 1925. Bd 43.
S. 559—564.
Hagemann R. Unequal plastid distribution during the development of the male gametophyte of
angiosperms // Acta Soc. bot. Pol. 1981. Vol. 50, № 1—2. P. 321—327.
Hagemann R., Schroder M.B. The cytological basis of the plastid inheritance in angiosperms //
Protoplasma. 1989. Vol. 152, № 1. P. 57—64.
Hagerup O. The morphology and biology of the Corylus fruit // Kl. Danske. Vidensk. Selsk. Biol. Medd.
1942. Bd 17, № 6. P. 1—32.
Hakansson A. Beitrage zur Entwicklungsgeschichte der Taccaceen // Bot. notis. 1921. S. 189—268.
Hakansson A. Studien iiber die Entwicklungsgeschichte der Umbelliferen. // Acta Univ. Lund. 1923.
Adv.2. Bd 1,№ 7. S. 1—120.
Hamilton D. A., Bashe D. M., Stison J. P., Mascarenhas J. P. Characterization of pollen-specific genomic
clone from maize. // Sex. Plant Reprod. 1989. Vol. 2, № 4. P. 208—212.
Hammond B. L. Development of Podostemon ceratophyllum // Bull. Torrey bot. CI. 1937. Vol. 64. P.
17—36.
Hanson D. D., Hamilton D. A., Travis J. L., Bashe D. M., Mascarenhas J. P. Characterization of pollen-
specific cDNA clone from Zea mays and its expression // Plant Cell. 1989. Vol. 1. P. 173—179.
Hanstein J. Die Scheitelzellgruppe im Vegetationspunkt der Phanerogamen // Festsch. Niederrhein. Ges.
Natur. und Heilkunde. 1868. S. 109—134.
Harling G. Embryological studies in the Compositae. 1. Anthemideae-Anthemedinae // Acta horti berg.
1950. Bd. 15. S. 135—168.
Литература
297
Harling G. Embryological studies in the Compositae — Part II. Anthemideae — Chrysantheminae //
Acta horti berg. 1951. Bd 16, № 1. S. 1—56.
Hartig Th. Entwicklungsgeschichte des Pflanzenkeims, dessen Stoffbildung und Stoffwandlung wiihrend
der Vorgange des Reifens und des Keimens fur Pflanzenbau // Leipzig: Forstnersche Buchhandl. 1858.164 S.
Haupt A. W. Ovule and embryo sac of Plumbago capensis// Bot. Gaz. 1934. Vol. 95, № 3. P. 649—659.
Hayashi Y. The embryology of the Magnoliaceae (sens, lat.) II. Megasporogenesis, female gametophyte
and embryogeny of Schisandra repanda Radlkofer and Kadsura Japonica Dunal // Sci. Reps Tohoku Univ.
Ser. 4 (Biol.). 1963. Vol. 29, № 3—4. P. 403—411.
Hayashi Y. The comparative embryology of the Magnoliaceae (s.l.) in relation to the systematic
consideration of the family // Sci. Reps Tohoku Univ. Ser. 4 (Biol.). 1965. Vol. 31. P. 29—44.
Hayward M. D., Manthriratna M. A. P. P. Pollen development and variation in the genus
Lolium. 1. Pollen size and tapetal relationships in male-fertiles and male-steriles // Z. Pflanzenzuchtg.
1972. Bd 67. S. 131—144.
Hegelmaier F. Die Lemnaceen. Eine monographische Untersuchune. Lepzie: W. Engelmann, 1868. VI
169 [1] S.
Hell W. A. van. Note on the structure of developing seeds of Kneva and Horsfieldia (Myristicaceae) //
Blumea. 1982. Vol. 28, № 1. P. 53—60.
Hemsley A. R., Chaloner W. G., Scott A. C, Barric P. J. Composition of sporopollenin in fossial and
living spore systematics // Abstr. 8th Intern. Palynol. Congr. Aix-en-Provence, 1992. P. 62.
Henfrey A. The phenomenon of rejuvenescence in nature ... by dr. A. Braun; transl. by A. Henfrey.
1853. R. Society. London.
Herich R., Lux A. Lytic activity of Ubisch bodies (orbicles) // Cytologia. 1985. Vol. 50. P. 563—569.
Herr J. M., Jr. A new clearing squash technique for the study of ovule development in angiosperms //
Amer. J. Bot. 1971. Vol. 58, № 8. P. 785—790.
Herr J. M., Jr. An analysis of methods for permanently mounting ovules cleared in four-and-a-half type
clearing fluids // Stain Technol. 1982. Vol. 57. P. 161—169.
Herr J. M., Jr. The removal of phlobaphenes for improved clearing of sections and whole structures //
Amer. J. Bot. 1985. Vol. 72, P. 817.
Hertwig O. Zoologica, XVIII, 1884.
Hertwig O. Zeit und Streitfragen der Biologie. Heft 1. Praformation oder Epigenese? Grundzuge einer
Entwicklungs-theorie der Organismen. Jena: G. Fischer. 1894. IV. 143 S.
Herzfeld S. Ephedra campylopoda Mey. Morphologie der weiblischen Blute und Befruchtunesvorgane
//Denkschr. Acad. Wiss. 1922. Bd 98. S. 243—268.
Herzfeld S. Beitrage zur Kenntnis von Ginkgo // Jahrb. Wiss. Bot. 1927 Bd 66. S. 814—862.
Heslop-Harrison J. Origin of exine // Nature. 1962. Vol. 195. P. 1069—1071.
Heslop-Harrison J. An ultrastructural study of pollen wall ontogeny in Silene pendula // Grana Palynol
1963. Vol. 4, № 1. P. 7—24.
Heslop-Harrison J. Cell walls, cell membranes, and protoplasmic connections during meiosis and pollen
development // Pollen physiology and fertilization / Ed. H. F. Linskens. Amsterdam: North-Holland. 1964. P
39—47.
Heslop-Harrison J. Cytoplasmic continuities during spore formation in flowering plants // Endeavour
1966a. Vol. 25, № 95. P. 65—72.
Heslop-Harrison J. Cytoplasmic connections between angiosperm meiocytes // Ann. Bot 1966b. Vol
30, № 118. P. 221—230.
Heslop-Harrison J. Anther carotenoids and the synthesis of sporopollenin // Nature. 1968a. Vol. 220
№5167. P. 605.
Heslop-Harrison J. Wall development within the microspore tetrad of Lilium longiflorum // Can. J Bot
1968b. vol.46, № 10. P. 1185—1192.
Heslop-Harrison J. An acetolysis-resistant membrane investing tapetum and sporogenous tissue in the
anthers of certain Compositae // Can. J. Bot. 1969. Vol. 47. P. 541—542.
Heslop-Harrison J. Sporopollenin in the biological context // Sporopollenin / Ed. J. Brooks, P. R Grant
M. Muir, P. van Gijzel, G. Shaw. London. 1971. P. 1—30.
Heslop-Harrison J. Aspects of the structure, cytochemistry and germination of the pollen of rye (Secale
cereale L.) // Ann. Bot. 1979a. Suppl. 1. Vol. 44, P. 1—47.
Heslop-Harrison J. Pollen walls as adaptive systems // Ann. Miss. Bot. Gard., 1979b. Vol 66 № 4 P
813—829.
Heslop-Harrison J. Compartmentation in anther development and pollen-wall morphogenesis // Proc.
Intern. Symp. «Cell compartmental and metabolic channeling». Jena, 1980. P. 471—484.
Heslop-Harrison J. Pollen germination and pollen tube growth // Intern, review of cytology. Pollen:
Cytology and development / Eds. K. L. Giles, J. Prakash. London, 1987. P. 1—78.
Heslop-Harrison J., Dickinson H. G. Time relationships of sporopollenin synthesis associated with
tapetum and microspore in Lilium // Planta. 1969. Vol. 84, № 3. P. 199—214.
Heslop-Harrison J., Heslop-Harrison Y. The growth of the grass pollen tube. 1. Characteristics of the
polysaccharide particles («P-particles») associated with apical growth // Protoplasma. 1982. Vol 112 №
1/2. P. 71—80.
298
Генеративные органы цветка
Heslop-Harrison J., Heslop-Harrison Y. Actomyosin and movement of the vegetative nucleus of the
angiosperm pollen tube: association with theactin cytoskeleton // J. Cell Sci. 1989. Vol. 93, P. 229—308.
Heslop-Harrison J., Heslop-Harrison J. S., Heslop-Harrison Y. The compartment of the vegetative
nucleus and generative cell in the pollen and pollen tubes of Helleborus foetidus L. // Ann. Bot. 1986. Vol.
58, № 1. P. 1—12.
Heslop-Harrison J., Heslop-Harrison Y., Cresti M., Tiezzi A., Moscatelli A. Cytoskeleton elements, cell
shaping and movement in the angiosperm pollen tube // J. Cell Sci. 1988. Vol. 91, P. 49—60.
Heslop-Harrison J., Mackenzie A. Autoradiography of soluble (l4C) thymidine derivatives during meiosis
and microsporogenesis in Lilium anthers // J. Cell Sci. 1967. Vol. 2. P. 387—400.
Heslop-Harrison Y. Stigma adaptations and control of pollen-tube number in the grasses // Abstr. Intern.
Symp. on Angiosperm Pollen and Ovules. Basic and applied aspects. Villa Olmo, Como, Italy, June 23—27,
1991, P. 25.
Hesse M. An exine architecture model for viscin threads // Grana. 1984. Vol. 23, P. 69—75.
Hesse M. Orbicules and the ectexine are homologous sporopollenin concretions in Spermatophyta // Plant
Syst. and Evol. 1986. Vol. 153, № 1/2. P. 37—48.
Hesse M., Hess M. W. Recent trends in tapetum research. A cytological and methodological review //
PI. Syst. Evol. 1993. Vol. 7. P. 127—145.
Heusser K. Die Entwicklung der generativen Organe von Himantoglossum hircinum // Beih. bot.
Centralbl. 1915. Abt. 1. Bd 32. S. 218—277.
Hoare G. Gametogenesis and fertilization in Scilla nonscripta // Cellule. 1934. T. 42. P. 269—292.
Hodge R., Paul W., Draper J., Scott R. Cold-plaque screening: a simple technique for the isolation of low
abundance, differentially expressed transcripts from conventional cDNA libraries // Plant J. 1992. Vol. 2, P.
257—260.
Hoefert L. L. infrastructure of Beta pollen. I. Cytoplasmic constituents // Amer. J. Bot. 1969a. Vol. 56,
№ 4. P. 363—368.
Hoefert L. L. Fine structure of sperm cells in pollen grains of Beta // Protoplasma. 1969b. Vol. 68, №
1—2. P. 237—240.
Hoekstra F. A., Bruinsma J. Respiration and vitality of binucleate and trinucleate pollen // Physiol. Plant.
1975. Vol.34, P. 221—225.
Hoeppener E., Renner O. Genetische und zytologische Oenothereen-Studien. // Bot. Abh. Goebel. 1929.
Bd 1, H. 15. S. 1—66.
Hofmeister W. Untersuchungen des Vorganges bei der Befruchtung der Oenothereen // Bot. Ztschr.
1847. Bd 5. S. 785—792.
Hofmeister W. Die Entstehung des Embryo der Phanerogamen. Eine Reihe microscopischer
UriTersuchungen. Leipzig, 1849. 89 S.
Hofmeister W. Vergleichende Untersuchungen der Keimung, Entfaltung und Fruchtbildung der hoherer
Kryptogamen und Samenbildung der Coniferen. Leipzig, 1851. 179 S.
Hofmeister W. Beitrage zur Kenntnis der Gefasskryptogamen, 1 —2 // Abh. math.-phys. Kl. sachs. Gesel.
Wissensch. 1852—1857. Bd 4. S. 123—179. Bd 5. S. 603—682.
Hofmeister W. Neuere Beobachtungen uber die Embryobildung der Phanerogamen // Jahrb. Wiss. Bot.
1858. Bd 1.S. 82—190.
Hofmeister W. Neue Beitrage zur Kenntnis der Embryobildung der Phanerogamen. II. Monocotyledonen.
Leipzig. 1859. Bd 7 (вып. 2). S. 629—760.
Hofmeister W. Lehre von der Pflanzenzelle. Leipzig, 1867.
Hogan D. J. Microtubule patterns during meiosis in two higher plant species // Protoplasma. 1987. Vol.
138. P. 126—136.
Holmgren I. Zur Entwicklungsgeschichte von Butomus umbellata // Sven. bot. tidskr. 1913. Bd 7. S. 58 —
77.
Holmgren I. Die Entwicklung des Embryosackes bei Anthemis tinctoria // Sven. bot. tdsk. 1915. Vol. 9.
S. 171—183.
Horner H. T. A comparative light- and electronmicroscopic study of microsporogenesis in
male-fertile and cytoplasmic male-sterile sunflower (Helianthus annuus) // Amer. J. Bot. 1977. Vol.
64, № 56. P. 745—759.
Hotta V., Ito M., Stern H. Synthesis of DNA during meiosis // Proc. Nat. Acad. Sci. 1966. Vol. 54,№
4. P. 1184—1191.
Hotta V., Stern H. A DNA — binding protein in meiotic cells of Lilium // Develop. Biol. 1971. Vol. 26.
P. 87—89.
Hotta V., Stern H. Small nuclear RNA molecules that regulate nuclease accessibility on specific chromatin
region of meiotic cell // Cell. 1981. Vol. 27, № 1. P. 309—319.
Hotta V., Stern H. The organizing of DNA segments undergoing repair synthesis during pachytene //
Chromosoma. 1984. Vol. 90, № 3. P. 243—253.
Hotta V., Tabata S., Stern H. Replication and nicking of zygotene DNA sequences. Control by meiosis
specific protein // Chromosoma. 1984. Vol. 90, № 3. P. 243—253.
Howe T.D. The female gametophyte of three species of Grindelia and of Prionopsis ciliata (Compositae)
// Amer. J. Bot. 1975. Vol. 62, № 3. P. 273—279.
Литература
299
Hrich R. Study of specific programmes of cytodifferentiation and degradation of tapetal cells // Acta
fac. rerum natur. Univ. Comen. Physiol, plant. 1983. Vol. 19. P. 1—7.
Hu S. Y. Male germ unit and sperm heteromorphism: the current status // Acta bot. Sinica. 1990. Vol.
32, № 2. P. 230—240.
Hu S., Zhu C, Xu L. Ultrastructure of male gametophyte in wheat. II. 'Formation and development of
sperm cell // Acta bot. sin. 1981. Vol. 23, № 2. P. 85—91.
Huang B. Q., Russell S. D. Isolation of fixed and viable eggs, central cells and embryo sacs from ovules
of Plumbago zeylanica // Plant Physiology. 1989. Vol. 90, P. 9—12.
Humphrey J. E. The development of the seed in the Scitamineae // Ann. Bot. 1896. Vol. 10,
№ 37. P. 1—40.
Huss H. A. Beitrage zur Morphologie und Physiologie der Antipoden // Beih. Bot. Centrabl. 1906. Bd
20, Abt. 1,2. S. 77—174.
Hutchinson A. N. Fertilization in Abies // Bot. Gaz. 1915. Bd 60. S. 457—472.
Huynh K.-L. Un phenomene de polaritepen connu dans l'anthere des Graminees et des Cyperacees: la
position constante du pore germinatie du pollen // Bull. Soc. bot. Suisse. 1975. Vol. 85, № 1. P. 18—24.
Hyde В. В. Mucilage-producing cells in the seed coat of Plantago ovata: developmental fine structure //
Amer. J. Bot. 1970. Vol. 57, № 210. P. 1197—1206.
Ikeda T. Studies in the physiological functions of antipodals and. the phenomena of fertilization in
Liliaceae. I. Tricyrtis hirta // Bull. Coll. Agr. Tokyo Imp. Univ. 1902. Vol. 5. P. 41—72.
Ishikawa M. Studies on the embryo sac and fertilization in Oenothera // Ann. Bot. 1918. Vol. 32. P. 279—
317.
Ishioka K., Sato S. Polyploidy of the nuclear DNA contents of the antipodal cells of Hemerocallis
middendorfii var. esculenta // Sci. Perts. Hirosaki Univ. 1990. Vol. 37,№ 2. P. 128—131.
Israel H. W., Sagawa J. Post-pollination ovule development in Dendrobium orchids. II. Fine structure of
the nucellar and archesporial phases // Caryologia. 1964. Vol. 17, № 2. P. 301—306.
Iver R. D., Raina S. K. The early ontogeny of embryoids and callus from pollen and subsequent
organogenesis in anther cultures of Datura metel and rice // Planta. 1972. Vol. 104. P. 146—156.
Iwanami Y. Physiological studies of pollen // J. Yokohama Municip. Univ. 1959. Vol. 116. P.
1—137.
Izhar S., Frankel R. Mechanism of male sterility in Petunia: the relationship between pH, callose activity in
the anthers and the breakdown of the microsporogenesis // Theor. and Appl. Genet. 1971. Vol. 41. P. 104—
108.
Jaffe L. A., Weisenseel M. N., Jaffe L. F. Calcium accumulations within the growing tips of pollen tubes
// J. Cell Biol. 1975. Vol. 67. P. 488—492.
Jalouzot M.-F. Aspects ultrastructuraux de la megasporogenese d'Oenothera lamarkiana en rapport avec
les depots callosiques observes // Ann. Univ. ARERS. 1971. T. 9, № 1. P. 36—46.
Jalouzot M.-F. Differentiation des elements de la tetrad femelle chez Oenothera erythrosepala // Bull.
Soc. bot. France. Actual. Bot. 1978. T. 125, № 1—2. P. 167—170.
Jalouzot M.-F. Ultrastructural aspects of the ovule of Colchicum autumnale (Liliaceae) // Proc. VII
Intern. Cytoembr. Symp. «Embryogenesis in ovulated plants». High Tatra (Rackova dolina), 1982. Bratislava,
1983. P. 183—187.
Jalouzot R. Differentiation nucleaire et cytoplasmique du grain de pollen de Lilium candidum // Exp. Cell
Res. 1969. Vol. 55, № 1. P. 1—8.
Jensen W. A. Cell development during plant embryogenesis // Meristems and differentiation. Brookhaven
Symposia in Biology. 1963 (1964). № 16. P. 179—202.
Jensen W. A. The ultrastructure and histochemistry of the synergids of cotton. // Amer. J. Bot. 1965a.
Vol. 52, № 3. P. 238—256.
Jensen W. A. The ultrastructure and composition of egg and central cell of cotton //Amer. J. Bot. 1965b.
Vol. 52, №8. P. 781—797.
Jensen W. A. The composition and ultrastructure of the nucellus in cotton // J. Ultrastruct. Res. 1965c.
Vol. 13, № 1—2. P. 112—128.
Jensen W. A. Cotton embryogenesis: the zygote // Planta. 1968. Bd 79, H. 4. S. 346—366.
Jensen W. A. Cotton embryogenesis: pollen tube development in the nucellus // Can. J. Bot. 1969. Vol.
47, № 3. P. 383—386.
Jensen W. A. The embryo sac and fertilization in Angiosperms // Univ. Hawaii, Harold L. Lyon
Arboretum lecture. 1972. № 3. P. 2—31.
Jensen W. A. Fertilization of flowering plants // Bioscience. 1973. Vol. 23, № 1. P. 21—27.
Jensen W. A., Ashton M., Heckard L. R. Ultrastructural studies of the pollen of subtribe Castilleiinae,
family Scrophulariaceae // Bot. Gaz. 1974. Vol. 135. P. 210—218.
Jensen W. A., Fisher D. B. Cotton embryogenesis: double fertilization // Phytomorphology. 1967 (1968).
Vol. 17, № 1—4. P. 261—269.
Jensen W. A., Fisher D. B. Cotton embryogenesis: the entrance and discharge of the pollen tube in the
embryo sac // Planta. 1968a. Bd 78, H. 2. S. 158—183.
Jensen W. A., Fisher D. B. Cotton embryogenesis: the sperm // Protoplasma. 1968b. Vol. 65, № 3. P.
277—286.
300
Генеративные органы цветка
Johansen D. A. The hypostase and seed sterility in the Onagraceae // Madrono. 1928. Vol. 1, № 10. P.
165—167.
Johansen D. A. Studies on the morphology of the Onagraceae. 6. Anogra pallida // Amer. J. Bot. 1931.
Vol. 18, № 10. P. 854—864.
John В., Lewis K. R. The meiotic systems // Protoplasmatologia. 1965. Vol. 4, № 6.
Johnson D. S. On the endosperm and embryo of Peperomia pellucida // Bot. Gaz. 1900b. Vol. 30, № 1.
P. 1—11.
Johnson D. S. Studies of the development of the Piperaceae. 2. The structure and seed development of
Peperomia hispidula // Amer. J. Bot. 1914. Vol. 1, № 7. P. 323—339; № 8. P. 357—397.
Johnson L. E. В., Wilcoxson R. D., Frosheirser F. J. Transfer cells in tissues of the reproductive system
of alfalfa // Can. J. Bot. 1975. Vol. 53. P. 952—956.
Johri B. M. Studies in the family Alismaceae III. Sagittaria quayanensis H.B.K. and S.latifolia Willd. //
Proc. Indian Acad. Sci. Sect. B. 1935. Vol. 2, № 1. P. 33—48.
Johri В. М. Studies in the family Alismaceae. IV Alisma plantago L., A. plantago-aquatica L. and
Sagittaria graminea Mich. // Proc. Indian Acad. Sci. Sect. B. 1936, № 2. Vol. 4. P. 128—138.
Johri B. M. Nutrition of the embryo sac // Proc. Summer School of Bot. -Darjeeling, 1960 / Eds P.
Maheshwari, B. M. Johri, J. K. Vasil. 1962. P. 106—118.
Johri В. М. Female gametophyte // Recent advances in the embryology of angiosperms. Intl Soc Plant
Morphologists, Univ. Delhi, ed. P. Maheshwari, 1963. P. 69—103.
Johri В. М. Nutrition of the anther, ovule and seed // Proc. XI Intern. Symp. «Embryology and seed
reproduction», Leningrad, 1990. St. Petersburg, 1992. P. 11—12.
Johri В. М., Agarwal S. Morhology and embryological studies in the family Santalacaceae. VIII.
Quinchamalium chinense Lam. // Phytomorphology. 1965. Vol. 15, № 4. P. 360—372.
Johri B. M., Ambegaokar K. B. Embryology: then and now // In: Embryology of Angiosperms / Ed. B.
M. Johri, Berlin a. o., 1984. P. 28.
Johri B. M., Ambegaokar K., Srivastava P. S. Comparative embryology of Angiosperms // Berlin a. o.:
Springer-Verlag, Vol. 1,2. 1992. 1221 p.
Johri В. М., Bhatnagar S. P. Some histochemical and ultrastructural aspects of the female gametophyte
and fertilization in Angiosperms // Caryologia. 1973. Vol. 25, № 1. P. 9—25.
Johri B. M., Kapil R. N. Contribution to the morphology and life history of Acalypha indica L. //
Phytomorphology. 1953. Vol. 3, № 3. P. 137—151.
Johri B. M., Seghal С. В. Growth of Anethum graveolens L. // Plant Tissue and Organ Culture / Eds P.
Maheshwari, N. S. Ranga Swamy. A Symposium, 1963. P. 245—256.
Johnson D. S. On the endosperm and embryo of Peperomia pellucida // Bot. gaz. 1900. Vol. 30, N 1.
P. 1—11.
Jones D. The interrelation of plasmogenes and chromosomes in pollen production in maize // Genetics.
1950. Vol. 35, № 5. P. 101—104.
Jones D., Stinson H., Khoo U. Pollen restoring genes // Con. Agr. Exp. Stat. Bull. 1957. №
610. P. 1—43.
Jones H. A., Emsweller S. L. Development of the flower and macrogametophyte of Allium сера //
Hilgardia. 1936. Vol. 10. P. 415—454.
Jonsson B. Om embryosackens utveckling hos Angiosperma // Lunds univ. arsberatt., 1879—1880. Vol.
16. S. 1—86.
Joshi A. C. Systematic distribution of the Fritillaria-type of embryo sac and the mono- or polyphyletic
origin of Angiosperms // Chronica Bot. 1938. Vol. 4, № 6. P. 507—508.
Joshi A. C. Morphology of Tinospora cordifolia with some observation on the origin of the single
integument, nature of synergidae, and affinitees of the Menispermaceae // Amer. J. Bot. 1939. Vol. 26, №
26. P. 433—439.
Joshi A. C, Pantulu J. V. A morphological and cytological study of Polianthes tuberosa // J.Indian Bot.
Soc. 1941. Vol. 20. P. 37—71.
Joshi A. C, Venkateswarlu J. Embryological studies in the Lythraceae. I. Lawsonia inermis // Proc.
Indian Acad. Sci. B. 1935. Vol. 2, № 4. P. 481—493.
Joshi P. С Morphological and embryological studies in the family Santalacaceae. V. Osyris wightiana
Wall. // Phytomorphology. 1960. Vol. 10, № 3. P. 239—248.
Juel H. O. Beitr'age zur Anatomie der Marcgraviaceen // Kgl. sven vetenskapsakad. handl. 1887. Bd 12;
S. 1—28.
Juel H. O. Untersuchungen iiber die Auflosung der Tapetenzellen in den Pollensacken der Angiospermen
// Jahrb. Wiss. Bot. 1915. Bd 56. S. 337—364.
Jurica H. S. A morphological study of the Umbelliferae // Bot. Gaz. 1922. Vol. 74. P. 292—307.
Kajale L. B. Embryology of Achyranthes aspera Linn // Proc. Indian Acad. Sci. 1937. Vol. 5, № 5. P.
195—205.
Kajale L. B. Embryo and seed development in the Nyctaginaceae. 1. Studies in the genus Boerhaavia //
J. Indian Bot. Soc. 1938. Vol. 17, № 4. P. 243—254.
Kallarackal I. Ontogenetical and cytochemical studies on the ovule of Liuaria bipartita. Ph. D. Thesis,
Univ. Delhi, 1976.
Литература
301
Kallarackal I., Bhatnagar S. P. Cytochemical studies on the integument and integumentary tapetum in
Linaria bipartita (Vent.) Will. // Caryologia. 1981. Vol. 34, № 4. P. 447—455.
Kamelina O. P. The types of tapetum in Angiosperms // Ann. Sci. Univ. Reims. 1988. № 23.
P. 71—73.
Kamelina O. P. Distribution of embryological features in the orders of Magnoliophyta classes // Proc. XI
Intern. Symp. «Embryology and seed reproduction». Leningrad, USSR, 1990. St. Petersburg, 1992. P. 242—
243.
Kamelina O. P., Konnova V. The embryo sac of Biebersteinia multifida, peculiarities of development //
Proc. XI Intern. Symp. «Embryology and seed reproduction». Leningrad, USSR, 1990. St. Petersburg, 1992. P.
244—245.
Kamra O. P. Chromatin extrusion and cytomixis in pollen mother cells of Hordeum // Hereditas. 1960.
Vol. 46, № 3—4. P. 592—600.
Kapil R. N. Embryology of Acalypha Linn // Phytomorphology. 1960. Vol. 10, № 2. P. 174—184.
Kapil R. N. Some recent examples of the value of embryology in relation to taxonomy // Bull. Bot. Surv.
India. 1962. Vol. 4, № 1—4. P. 57—66.
Kapil R. N. Contemporary spectacle in angiosperm embryology // Acta Bot. Ind. 1974. Vol. 2, № 2. P.
79—106.
Kapil R. N., Ahluwalia K. Embryology of Peganum harmala Linn. // Phytomorphology. 1963. Vol. 13,
№ 2. P. 127—140.
Kapil R. N., Bhandari N. N. Morphology and embryology of Magnolia Dill, ex Linn. // Proc. Nat. Inst.
Sci. India. 1964. Vol. 30, № 5. P. 245—262.
Kapil R. N., Bhatnagar A. K. The antipodes // Phyta. 1978. № 1. P. 54—75.
Kapil R. N., Bhatnagar A. K. Ultrastructure and biology of female gametophyte in flowering plants //
Intern. Rev. Cytol., 1981. Vol. 69, № 3/4. P. 291—341.
Kapil R. N., Bhatnagar A. K. Central cell: pre- and postfertilization parameters // Phytomorphology.
1983 (1984). Vol.33, № 1/4. P. 157—167.
Kapil R. N., Bor J., Bouman F. Seed appendages in Angiosperms // Bot. Jahrb. Syst. 1980. Bd 101, H.
4. S. 555—574.
Kapil R. N., Jalan S. Schisandra Michaux — its embryology and systematic position // Bot. notis. 1964.
Bd 117, № 3. S. 285—306.
Kapil R. N., Tiwari S. С The integumentary tapetum // Bot. Rev. 1978a. Vol. 44, № 4. P. 457—490.
Kapil R. N., Tiwari S. С Plant embryological investigations and fluorescence microscopy; an assessment
of integration // Intern. Rev. Cytol. 1978b. Vol. 53. P. 291—331.
Kapil R. N., Vasil I. K. Ovule. Recent advances in the embryology of Angiosperms. Ed. P.Maheshwari.
Delhi, 1963. P. 41—67.
Katterman G. Ein Beitrag zur Frage der Dualitet der Bestandteile des Bastardkernes // Planta. 1933. Bd
18. P. 751—785.
Kaul M. L. H. Male Sterility in Higher Plants. Berlin; Heidelberg: Springer Verlag, 1988. 1005 p.
Kausik S. B. The life history of Lobelia trigona Roxb. with special reference to the nutrition of the embryo
sac. // Proc. Indian Acad. Sci. B. 1935. Vol. 2, № 4. P. 410—418.
Keijzer С J., Reinders M. C, Leferinkten Kloster H. B. A micromanipulation method for artificial
fertilication in Torenia. // Sexual reproduction in higher plants / Eds M. Cresti, P. Gori, E. Pacini. Berlin:
Springer. 1988. P. 119—124.
Keijzer C. J., Willemse M. Т. М. Tissue interactions in the developing locule of Gasteria verrucosa during
microgametogenesis // Acta bot. neerl. 1988a. Vol. 37, № 4. P. 475—491.
Keijzer С J. Willemse M. Т. М. Tissue interactions in the developing locule of Gasteria verrucosa during
microsporogenesis // Acta bot. neerl. 1988b. Vol. 37, № 4. P. 493—508.
Kenrick J., Knox R. B. Pollen development and cytochemistry in some Australian species of Acacia //
Austral. J. Bot., 1979. Vol. 27. P. 413—427.
Kershaw E. M. The structure and development of the ovule of Myrica gale // Ann. Bot., 1909. Vol 23,
№91. P. 353—362.
Khan R. A note on double fertilization in Ephedra foliata // Curr. Sci. (Bangalore), 1940. Vol. 9, P.
323—324.
Khan R. Contributions to the morphology of Ephedra foliata Boiss. 11. Fertilization and Embryogeny //
Proc. Nat. Acad. Sci. Ind., 1943. Vol. 13, P. 357—375.
Khanna P. Morphological and embryological studies in Nymphaeaceae. III. Victoria cruziana D'orb and
Nymphaea stellata Willg. // Bot. Mag. Tokyo, 1967. Vol. 80, № 950. P. 309—312.
Kihara H., Hori T. The behavior of nuclei in germinating pollen grain of wheat, rice and maize // Zuchter,
1966. Bd. 36, H. 4, S. 145—150.
Kihara H., Lilienfeld F. Kerneinwanderung und Bildung Syndiploider Pollenmutterzellen bei dem F1-
Bastard. Triticum Aegilopoides x Aegilops Squarrosa // Jap. J.Genetics, 1934. Vol. 10. P. 1—28.
. Kirkwood J. E. The comparative embryology of the Cucurbitacae // Bull. N. Y. Bot. Gard., 1905. Vol.
3. P. 313—402.
Knoth R., Wriacher M., Vetter J. Phytoferritin — accumulating plastids in the male generative cell of
Pelargonium hortorum Bailey // Ztschr. Pflanzenphysiol., 1980. Bd 98. S. 365—370.
302
Генеративные органы цветка
Knox R. В. The pollen grain // Embryology of Angiosperms / Ed. B. M.Johri. Berlin a. o.: Springer,
1984a. Vol. 1. P. 197—271.
Knox R. B. Pollen — pistil interactions // Enc. Plant Physiol. N. Ser., 1984b. Vol. 17. P. 508—608.
Knox R. В., Heslop-Harrison J. Pollen wall proteins: localization and enzymatic activity // J. Cell Sci.
1970. Vol. 6. P. 1—27.
Koernicke M. Der heutige Stand der pflanzlichen Zellforschung // Ber. dtsch. bot. Ges., 1903. H. 1. Bd
XXI. S. 66—134.
Konnova V. A. Anther and pollen grain development in Biebersteiniaceae and Geraniaceae // Abstr.
XII Intern. Congress on Sexual Plant Reproduction. Ohio, USA. 1992. P. 34.
Korobova S. N. On the development of the specific cells during micro- and macrosporangium formation
in Zea mays. // Ann. Univ. A.R.E.R.S, 1971. Vol. 9. P. 58—61.
Korobova S. N. On the behaviour of sperms in the process of fertilization in higher plants // Fertilization
in Higher Plants. Amsterdam, 1974.
Kosmath L. Studien uber das Antheren tapetum // Osterr. bot. Ztschr., 1927. Bd 76. H. 3. S. 235—241.
Kowal T. The morphological and anatomical features of the seeds of the genus Amaranthus L. and keys
for their determination // Monogr. bot. (Warszawa), 1954. P. 162—187.
Kranz E., Bautor J., Lorz H. In vitro fertilization of single, isolated gametes of maize mediated by
electrofusion // Sex. Plant Reproduction, 1991. Vol. 4. P. 12—16.
Kress W. J., Stone D. E. Nature of the sporoderm in monocotyledons, with special reference to the pollen
grain of Cannaand Heliconia // Grana, 1982. Vol. 21. P. 129—148.
Krishna Iyengar C. V. Development of the embryo sac and endosperm-haustoria in Torenia cordifolia
Roxb. and T.hirsuta Benth // Proc. Natl. Inst. Sci. India, 1941. Vol. 7. P. 61—71.
Kronestedt-Robards E. C, Rowley J. R. Pollen grain development and tapetal changes in Strelitzia
reginae (Strelitziaceae) // Amer. J. Bot., 1989. Vol. 76, № 6. P. 856—870.
Krupko S., Denley A. Deoxyribonucleic acid deficiency in the mature egg nuclei of Alcea davyana in
South Africa // Nature, 1955. Vol. 177, № 2. P. 192.
Kudlicka K., Kuras M., Rodkiewicz B. Embryo sac development in Stellaria media. // Acta Soc. bot.
pol. 1981. Vol. 50, № 1—2. P. 143—146.
Kuhn G. Beitrage zur Kenntnis der intraseminalen Leitbundel bei den Angiospermen // Bot. Jahrb. Syst.,
1928. Bd61.S. 325—385.
Kuran H. Callose localizaion in the walls of megasporocytes and megaspores in the course of development
of monospore embryo sacs // Acta Soc. bot. pol., 1972. Vol. 41, № 4, P. 519—534.
La Cour L. F. Nuclear Differentiation in the pollen grain // Heredity, 1949. Vol. 3, № 3, p. 319—337.
La Fountain Jr. J. R., La Fountain K. L. Comparison of density of nuclear pores on vegetative and
generative nuclei in pollen of Tradescantia // Exp. Cell. Res. 1973. Vol. 78. P. 472—476.
Lakshmanan K. K. Preliminary note an the embryology of Diplanthera univervis Aschers. // Curr. Sci.,
1968.Vol. 37, № 18. P. 534—535.
Lakshmanan K. K., Poornima S. Microsporogenesis in Rhizophora lamarckii Montr. // Curr. Sci. India,
1988. Vol. 57, № 19.
Lammeren A. A. M. van. Structure and function of the microtubular cytoskeleton during endosperm
development in wheat: an immunofluorescence study // Protoplasma, 1988. Vol. 146. P. 18—27.
Lammeren A. M. van, Bednara J., Willemse M. Т. М. Organization of the active cytoskeleton during
pollen development in Gasteria verrucosa (Mill) H.Duval visualized with rhodamin-phalloidin // Planta, 1989.
Bd 178, N4. P. 531—539.
Lammeren A. M. van, Keijzer С J., Willemse M. Т. М., Kieft H. Structure and function of the
microtubular cytoskeleton during pollen development in Gasteria verrucosa (Mill.) H. Duval // Planta, 1985.
Bd 185. N 1. P. 1—11.
Lampton R. N. Floral morphology in Asimina tritoba Dunal. I. Development of ovule and embryo sac //
Bull. Torrey Bot. Club., 1957. Vol. 84, № 3. P. 151—156.
Land W. J. Fertilization and embryogeny in Ephedra trifurcata // Bot. Gaz. 1946. Vol. 44. P.
273—292.
Landes M. Seed development in Acalypha rhomboidea and some other Euphorbiaceae // Amer. J. Bot.,
1946. Vol. 33, № 6. P. 562—568.
Largeau C, Casadevall K., Kadouri A., Metzger P. Formation of Botryococcus-derived kerogens —
Comprarative study of immature torbanites and of the extant alga Botryococcus braunii // Org. Geochem.,
1984. Vol. 6. P. 327—332.
Larson D. A. Fine-structural changes in the cytoplasm of germinating pollen // Amer. J. Bot. 1965. Vol.
52, №2. P. 139—154.
Larson D. A., Lewis С W. Pollen wall development in Parkinsonia aculeata // Grana palynol., 1963.
Vol. 3, №3. P. 21—27.
La Rue С D. The extraordinary funiculus of Acacia confusa Merril. // Rhodora, 1954. Vol. 56, № 670.
P. 229—231.
Laser K. D., Lersten N. R. Anatomy and cytology of microsporogenesis in cytoplasmic male sterile
angiosperms // Bot. Rev., 1972. Vol. 38, № 3. P. 325—454.
Lee С L. Fertilization in Ginkgo biloba // Bot. Gaz., 1955. Vol. 117. P. 79—100.
Литература
303
Levan A. Cenocyte formation in the pollen mother cells of haploid Phleum pratense // Hereditas, 1941.
Bd 27, H. 3—4. S. 243—252.
Lindley J. A natural systems of botany. London, 1836.
Lindley J. The vegetative kingdom. London: Bradbury, Evans, 1853. 908 p.
Linnaeus С Philosophia botanica Stockholmiae. Apud. Godofr. Kiesewetter, 1751. 362 p.
Linskens H. F. Fertilization mechanisms in higher plants // Fertilization: comparative morphology,
biochemistry and immunology. Acad. Press., 1969. № 4. P. 2.
Linskens H. F., Heinen W. Cutinase — Nachweise in Pollen // Z. Bot., 1962. Bd. 50, № 4. S. 338—347.
Linskens H. F., Suren M. L. Die Entwicklung des Pollinium von Asclepias curassavica // Ber. dtsch. bot.
Ges., 1969. Bd 82, H. 7—8. S. 527—534.
Lombardo G., Gerola F. M. Cytoplasmic inheritance and infrastructure of the male generative cell of
higher plants // Planta, 1968. Bd 82. S. 105—110.
Lonay H. Contribution a Petude des relations entre la structure des differentes parties de l'ovule et la
nutrition generate de celui-ci avant et apres la fecondation // Bull. Class. Sci. Acad. Royl. Belg., 1922. Ser.
5. T. 8,№ 1. P. 24—45. _
Lotscher P. K. von. Uber den Bau und Funktion der Antipoden in der Angiospermen-Samenanlage //
Flora, 1905. Bd 94, № 2. S. 213—262.
Lotsy J. P. Contribution to the life-history of the genus Gnetum // Ann. Jard.Bot. Buitenzorg, Leiden.
1899, Ser. 11, T. 1. P. 2—11.
Magnus W. Die atypische Embryosackentwicklung der Podostemaceen // Flora, 1913, Bd. 105. H.5, S.
275—336.
Mahabale T. S., Chennaveeraiah M. S. Studies on Hyphaene indica Весе. I. Morphology //
Phytomorphology, 1957. Vol. 7, № 2. P. 184—194.
Maheshwari D. H., Lakshminarayana K. Embryological studies in Gentianaceae // J. Ind. Bot. Soc,
1977, Vol. 56, № 2, p. 182—188.
Maheshwari P. A critical review of the types of embryo sacs in angiosperms // New Phytologist, 1937.
Vol. 36,№ 5. P. 359—416.
Maheshwari P. Tetranucleate embryo sacs in angiosperms // Lloydia, 1947. Vol. 10, № 1, p. 1—18.
Maheshwari P. The angiosperm embryo sac // Bot. Rev., 1948. Vol. 14, № 1. P. 1 —56.
Maheshwari P. The male gametophyte of angiosperms // Bot. Rev., 1949. Vol. 15, № 1. P. 1—75.
Maheshwari P. An introduction to the embryology of angiosperms. New York: McGraw-Hill,
1950. 453 p.
Maheshwari P., Chopra R. N. The structure and development of the ovule and seed of Opuntia dillenii
Haw // Phytomorphology, 1955. Vol. 5, № 1. P. 112—122.
Maheshwari P., Johri B. M. The embryo sac of Acalypha indica L. // Beih. Bot. Centbl., 1941. Bd. 61 A.
S. 125—136.
Maheshwari P., Kapil R. N. Fifty years of science in India // Progress of Botany. Indian science congress
association. Calcutta, 1963. 178 p.
Maheshwari P., Srinivasan A. R. A contribution to the embryology of Rudbeckia bicolor Nutt // New
Phytol., 1944. Vol. 43. P. 135—142.
Maheshwari S.' С The embryology of Wolffia // Phytomorphology, 1954, Vol. 4, № 4, p.
355—365.
Maheshwari S. С The endosperm and embryo of Lemna and systematic position of the Lemnaceae //
Phytomorphology, 1956. Vol. 6, № 1, p. 51—55.
Malik C. P., Vermani S. Physiology of sexual reproduction. I. A histochemical study of the embryo sac
development in Zephyranthes rosea and Lagenaria vulgaris // Acta histochem., 1975. Vol. 53, № . P. 244—
280.
Malpighi M. Anatome plantarum. London: J. Martyn, 1675. 82 p.
Manning J. C, Linder H.. P. Cladistic analysis of patterns of endothecial thickening in the
Poales/Restionales // Amer. J. Bot., 1990, Vol. 77, № 2. P. 196—210.
Mansfield S. G., Briarty L. G., Erni S. Early embryogenesis in Arabidopsis thaliana. I. The mature embryo
sac // Can. J. Bot., 1991. Vol. 69, № 3, p. 447—460.
Marengo N. The relation of the cytoplasmic inclusions during sporogenesis in Onoclea sensibilis // Amer.
J. Bot., 1949, Vol. 36, № 5, p. 281—293.
Mariami C, De Beuckeller M., Truettner J., Leemons J., Goldberg R. Induction of male sterility in plants
by a chimeric ribonuclease gene // Nature, 1990. Vol. 347, № 6295. P. 737—741.
Marquardt H., Barth O. M., Rahden U. von. Zytophotometrische und elektronenmikroskopische
Beobachtungen uber die Tapetumzellen in den Antheren von Paeonia tenuifolia // Protoplasma. 1968. Bd
65, № 4. S. 407—421.
Marshall H. G., Schwidt J. W. A study of the meiotic stability of certain Agrotricum hybrids // Agron.
J., 1954. Vol. 46, №8. P. 383.
Martens P. Bee nucellaire micropyly et paroi megasporale chez Encephalartos Poggei Asch. // Cellule,
1957. T. 58, №2. P. 151—168.
Martinoli G. O. Contributo all'embriologia delle Asteracee. I—III // N.G.Bot. Ital., 1939. Vol. 46, № 2.
P. 259—298.
304
Генеративные органы цветка
Martinoli G. О. Embriologia della Peperomia maculosa Hook. // N. G. Bot. Ital., 1948. Vol. 55, P. 235—
250.
Martinoli G. O. Position and significance of the Pyrethrum cinerariaefolium (Chrysanthemum
cinerariaefolium) type among the tetrasporic types of female gametophyte // Phytomorphology, 1967. Vol.
17, № 1—4. P. 207—210.
Maruyama K., Gay H., Kayfmann B. P. The nature of wall between generative and vegetative nuclei in
the pollen grain of Tradescantia paludosa // Amer J. Bot., 1965. Vol. 52, № 6. P. 605—610.
Masand P. Embryology of Zygophyllum fabago L. //Phytomorphology, 1963. Vol. 13,№ 3. P. 293—302.
Masand P., Kapil R. N. Nutrition of the embryo sac and embryo — a morphological approach. //
Phytomorphology 1966. Vol. 16, № 2. P. 158—175.
Mascarenhas J. P. The biochemistry of angiosperm pollen development // Bot. Rev. 1975. Vol. 41. № 3.
P. 259—314.
Mascarenhas J. P. The male gametophyte of flowering plants // Plant Cell., 1989. Vol. 1. P. 657—664.
Mascarenhas J. P. Gene activity during pollen development // Annu. Rev. Plant Physiol. Plant Mol. Biol.
1990. Vol.41. P. 317—338.
Mathur K. L., Khan R. The development of the embryo sac in Vogelia indica Lamk. // Proc. Indian
Acad. Sci., Sect. В., 1941. Vol. 13. № 6. P. 360—368.
Matsuda Т., Kawahara H., Chonan N. Histo-cytological researches on translocation and ripening in rice
ovary. 1. Histological changes and transfer pathways in the developing ovary. // Jap. J. Crop Sci., 1979.
Vol.48, P. 155—162.
Mauritzon J. Studien uber die Embryologie der Familien Crassulaceae und Saxifragaceae // Diss. Lund.,
1933a. 152 S.
Mauritzon J. Uber die Embryologie der Turneraceae und Frankeniaceae // Bot. notis., 1933b. H. 1—6
S. 543—554.
Mauritzon J. Zur Embryologie von Peumus boldus // Archiv. Bot. syst., fitoeeoer., eenet., 1935. Vol. 11,
N 1, p. 317—327.
Mauritzon J. Samenbau und Embryologie einer Scitamineen // Acta Univ. Lund, 1936. Bd 31,
N 9. S. 1—31.
Mauritzon J. Contribution to the embryology of the orders Rosales and Myrtales // Lund univ. arsskr. N.
F. Avd. 3, 1939. Vol. 35, N 2. P. 1—121.
Maze J., Lin S. С A study of the mature megagametophyte of Stipa elmeri // Can. J. Bot., 1975. Vol.
53, N 24. P. 2958—2977.
Medina F. J., Risueno M. C, Rodriguez-Garcia M. J. Evolution of female meiosis in Pisum sativum //
Planta, 1981. Vol. 151. P. 215—228.
Meeuse A. D. From ovule to ovary: A contribution to the phylogeny of the megasporangium // Acta
biotheor., 1963. Vol. 16, N 2. P. 127—182.
Meeuse A. D. Megasporangium, nucellus, ovule and presemen: their nomenclature and homology // Acta
bot. neel., 1974. Vol. 23, N 4. P. 439—503.
Melchers G., Labib G. Die Bedeutung haploider hoherer Pflanzen fur Pflanzenphysiologie und
Pflanzenzuchtung. Die durch anrherenkultur erzeugten Haploiden, ein neuer Durchbruch fiir die
Pflanzenzuchtung // Ber. Dtsch. bot. Ges., 1970. Bd 83, H. 3—4. S. 129—150.
Mepham R. H., Lane G. R. Nucleopores and polyribosome formation // Nature. 1969. Vol. 221. P. 288 —
289.
Mepham R. H., Lane G. R. Observation on the fine structure of developing microspores of Tradescantia
bracteata // Protoplasma, 1970. Vol. 70. P. 1—20.
Messere A. Ricerche embriologiche e cariologiche sopra i generi Allium e Nothoscordon // N. G. bot
Ital. 1931. T. 38, № 3. P. 409—441.
Mezzetti-Bambacioni V. Sull'embriologia della Fritillaria messanensis Raf. e sull'opportunita di distinguere
unaserie Fritillaria net tipo Euphorbia dulcus // Ann. Bot. 1949. V. 23. P., 116—138.
Miegroet Van Fr., Dujardin M. Cytologie et histologie de la reproduction chez le Nymphaea heudelotii
// Canad. J. Bot. 1992. Vol. 70, № 10. P. 1991—1996.
Mignotte J., Vallade J., Bugnon F. Apex caulinaires vegetatifs a promeristeme supere ou infere: Quelques
variantes principales chez les plantes Vasculaires // Bull. Soc. bot. France. Lett. Bot. 1989. T. 136 № 3 P
213—224.
Miki-Hirosige H., Nakamura S. Process of metabolism during pollen-tube wall formation // J. Electron.
Microsc. 1982. Vol. 31. № 1. P. 51—62.
Mikulska E., Rodkiewicz B. Fine structure of four-nucleate stages and the central cell of Lilium regale
embryo sac // Flora. Abt. A. 1967a. Bd 157, № 5. S. 365—372.
Mikulska E., Rodkiewicz B. Ultrastructure of the maturating embryo sac of Lilium regale // Acta bot
Soc. pol. 1967b. Vol. 36, № 3, P. 555-566.
Miller E. E. Development of the pestillate and fertilization in Zea mays // J. Aer. Res. 1919. Vol 18, №
5. P. 225—286.
Milyaeva E. L., Lazarova N. M. Ultrastructural peculiarities of two types of reproductive meristems //
Proc. XI Intern, symp «Embryology and seed reproduction», Leningrad, July, 3—7, 1990. St. Petersburg:
Nauka, 1992. P. 363—364.
Литература
305
Mirbel C. F. B. Nouvelles recherches sur la structure et les developpements de l'ovule vegetale. // Ann.
Sci. Nat. Bot. 1829. T. 17. P. 302—318.
Mirbel S. F. B. Additions aux nouvelles recherches sur la structure et les developpements de l'ovule //
Mem. Acad. Sci. Inst. France. 1830. Vol. 9. P. 629—684.
Modilewski J. S. Zur Embryobildung von Gunnera chilensis // Ber. Dtsch. bot. Ges. 1908. Bd 26. S.
550—556.
Modilewski J. S. Zur Embryobildung von einiger Onagraceae // Ber. Dtsch. bot. Ges. 1909. Bd 27. S.
287-291.
Mogensen H. L. Fine structure and composition of the egg apparatus before and after fertilization in
Quercus gambelii: the functional ovule // Amer. J. Bot. 1972. Vol. 59, N. 9. P. 931—941.
Mogensen H. L. Some histochemical, ultrastructural, and nutritional aspects of the ovule of Quercus
cambelii // Amer. J. Bot. 1973. Vol. 60. № 1, № P. 48—54.
Mogensen H. L. Synergids of Proboscidea lousianica (Martineaceae) before fertilization //
Phytomorphology. 1978. Vol. 28, № 1. P. 114—122.
Mogensen H. L. Translocation of uranin within the living ovules of selected species// Amer. J. Bot. 1981.
Vol. 68. № 2. P. 195—199.
Mogensen H. L. Double fertilization in barley and the cytological explanation for haploid embryo
formation, embryoless caryopses and ovule abortion // Carlsberg Res. Commun. 1982. Vol. 47. P.
313—354.
Mogensen H. L. Quantitative observations on the pattern of synergid degeneration in barley // Amer. J.
Bot. 1984. Vol. 71. P. 1448—1451.
Mogensen H. L. Juxtaposition of the generative cell and vegetative nucleus in the mature pollen grain of
amaryllis (Hippeastrum vitatum) // Protoplasma. 1986. Vol. 134. P. 67—72.
Mogensen H. L. Exclusion of male mitochondria and plastids during syngamy in barley as a basis for
maternal inheritance // Proc. Natl. Acad. Sci. USA. 1988. Vol. 85. P. 2594—2597.
Mogensen H. L. Fertilization and early embryogenesis // Reproductive Versatility in the Grasses / Ed.
G. P. Chapman. Cambridge, 1990a. P. 76—99.
Mogensen H. L. Ultrastructure of male sex cells and fertilization in flowering plants // Amer. J. Bot.
1990b. Vol. 77, № 6, Suppl. P. 6.
Mogensen H. L. The male germ unit: concept, composition, and significance // Sexual Reproduction in
Flowering Plants / Ed. S. D. Russell, С Dumas. Int. Rev. Cytol. San Diego: Acad. Press, 1992.
Mogensen H. L., Ladyman A. R. A structural study on the mode of action of СНА Chemical Hybridizing
Agent in wheat // Sexual Plant Reprod. 1989. Vol. 2. P. 173—183.
Mogensen H. L., Rusche M. L. Quantitative ultrastructural analysis of barley sperm. I. Occurrence and
mechanism of cytoplasm and organelle reduction and the question of sperm dimorphism // Protoplasma. 1985.
Vol. 128, № 1. P. 1—13.
Mogensen H. L., Suthar H. K. Ultrastructure of the egg apparatus of Nicotiana tabacum (Solanaceae)
before and after fertilization // Bot. Gaz. 1979. Vol. 140, № 2. P. 168—179.
Monnier G. Sur la valeur morphological de l'albumen chez les Angiosperms // Journ. Bot. (Paris). 1887.
Vol. 1, P. 140—142.
Moscatelli A., Tiezzi A., Vigniani R., Cai G., Bartalesi A., Cresti M. Presence of kinesin in tobacco pollen
tube // Sexual reproduction in higher plants / Ed. M. Cresti, O. Gori, E. Pacini. Berlin, Heidelberg: Springer,
1988. P. 205—209.
Moses M. J. Chromosomal structure in crayfish spermatocytes // J. Biophys. a. Biochem. Cytol. 1956.
Vol. 2. P. 215—217.
Moses M. J., Taylor J. H. Desoxypentose nucleic acid synthesis during microsporogenesis in Tradescantia
// Exp. Cell. Res. 1955. Vol. 9.
Moskova R. D. An election microscopic study of nucellus cells of Bothriochloa ischaemum L. //
Caryologia. 1975. Vol. 28, № 3. P. 295—300.
Moss G. J., Heslop-Harrison J. A cytochemical study of DNA, RNA and protein in the developing maize
anther. II. Observations // Ann. Bot. 1967. Vol. 31, N 4. P. 555—572.
Mottier D. M. Contributions to the embryology of the Ranunculaceae // Bot. Gaz. 1895. Vol. 20. P.
241—248,296—304.
Mottier D. M. Uber das Verhalten der Kerne bei der Entwicklung des Embryosacken und die Vorgange
bei Befruchtung // Jahrb. wiss. Bot. 1897. Bd 31. S. 125—158.
Mu X. -J., Wang F. —H., Wang W. —L. Development and histochemical observations of tapetum and
peritapetal membrane in anther of Pulsatilla chinesis // Acta bot. sinica. 1988. Vol. 30, № 1. P. 6—13.
Miicke M. Uber den Bau und die Entwicklung der Friichte und uber die Herkunft von Acorus calamus
L. // Bot. Zeitung. 1908. Bd. 66, Abt. 1. S. 1—23.
Mukkada A. J. Morphological and embryological studies on some indian Podostemaceae: Theses D. Ph.
Diss. Univ. Delhi, 1962a. 72 p.
Mukkada A. J. Some observations on the embryology of Dicraea stylosa Wight. // Plant embryology.
Symp. CSIR. New Dehli. 1962b. P. 139—145.
Mukkada A.J. Some aspects of the morphology, embryology and biology of Ternida zeylanica (Carduer)
Tulasne // New Phytol. 1969. Vol. 68. P. 1145—1153.
20 Генеративные органы цветка.
306
Генеративные органы цветка
Mulay В. N. A study of the pistillata plants of Ephedra foliata Boiss. found at Drigh Road near Karashi
in Sind // Proc. Indian Sci. Congr. 1941. Vol. 28. P. 158.
Muntzing A. ,MPrakkenR. Chromosomal abberations in rye populations //Hereditas. 1941. Vol.27. P. 273.
Murbeck S. Uber Organization, Biologie und Beziehungen der Neuradeceen // Lunds Univ. Arsberatt.
N. F. Avd. 2. 1916. Bd 12, H. 6. S. 1—28.
Murray D. R. Nutritive role of seed — coats in developing legume seeds // Amer. J. Bot. 1987. Vol. 74.
P. 1122—1137.
Murthy S. K. N. A reply to the post-script of the paper on «Studies in the family Alismataceae. 1.
Limnophyton obtusifolium Mig», by B. M. Johri // J. cl. Bot. Soc. 1935. Vol. 14, № 4. P. 351.
Murty Y. S. Studies in the order Piperales. III. A contribution to the study of floral morphology of some
species of Peperomia. // J. Indian Bot. Soc. 1959. Vol. 38, № 1. P. 120—139.
Nageli K. Zur Entwicklungsgeschichte des Pollens bei den Phanerogamen. Zurich, 1842. 36 S.
Nagl W. Early embryogenesis in Tropaeolum majus L.: ultrastructure of embryo-suspensor // Biochem.
und Physiol. Pflanzen. 1976. Bd 170, № 3. S. 253—260.
Nair N. С Development of the ovule in a species of Cissus // Nature (Engl.) 1965. Vol. 208, № 5008 P.
402.
Nair N. С Floral morphology and embryology of Myristica malabarica Lamk. with a discussion on certain
aspects of the systematics of Myristicaceae // Adv. PI. Morph. 1972. P. 264—277.
Naithani S. P. Chromosome studies in Hyacinthus orientalis L. III. Reversal of sexual state in the anthers
of H. orientalis L. var. yellow Hammer // Ann. Bot. 1937. Vol. 1. P. 369—377.
Nakamura S., Miki-Hirosige H. Fine structural study on the formation of the generative cell wall and intine-
3 layer in a growing pollen grain of Lilium longiflorum // Amer. J. Bot. 1985. Vol. 72, № 3. P. 365—375.
Nakazawa S. Cell polarity as the «Logos» of morphogenesis // Cytologia, 1989. Vol. 54, № 2. P. 293—
298.
Nanda K., Gupta S. Malfunctioning tapetum and callose wall behaviour in Allium сера microsporangia
// Beitr. Biol. Pflanzen. 1974. Bd 50. H. 6. S. 465—472.
Nanda K., Gupta S. С Studies in the Bignoniaceae. II. Ontogeny of dimorphic anther tapetum in Tecoma
// Amer. J. Bot. 1978. № 4. P. 400—405.
Narang N. The life history of Stackhousia linariaefolia with a discussion on its systematic position //
Phytomorphology. 1953. Vol. 3, № 4. P. 485—493.
Narayan K. N. Apomixis in some species of Pennisetum and in Panicum anditotale // Plant Embryology
/ Ed. P. Maheshwari. CSIR, New Delhi, 1962. P. 55—61.
Narayana H. S., Jain K. A contribution to the embryology of Limeum indicum // Lloydia. 1962. Vol. 25,
№2. P. 100—108.
Nast С G., Bailey I. W. Morphology and relationships of Trochodendron and Tetracetron. II.
Inflorescense, flower and fruit // J. Arnold Arboretum. 1945. Vol. 36, № 3. P. 267—276.
Navaschin S. G. Resultate einer Revision der Befruchtungesvorgange bei Lilium Martagon und Fritillaria
Tenella // Bull. Acad. Sci. St. Petersburg. 1898. Bd 9. S. 377—382.
Nemec B. Uber den Pollen der petaloiden Antheren von Hyacinthus orientalis L. // Rozpr. Cs. Akad.
Prag. 1898. №7. P. 17—23.
Netolitzky F. Die Anatomie der Angiospermen-Samen // Berlin: Verl. von. Gebr. Borntraeger, 1926.
364 s.
Newcomb W. The development of the embryo sac of sunflower Helianthus annuus before fertilization //
Can. J. Bot. 1973a. Vol. 51, № 5. P. 863—878.
Newcomb W. The development of the embryo sac of sunflower Helianthus annuus after fertilization //
Can. J. Bot. 1973b. Vol. 51, № 5. P. 879-890.
Newcomb W., Fowke L. C. The fine structure of the change from the free:—nuclear to cellular condition
in the endosperm of chickweed Stellaria media // Bot. Gaz. 1973. Vol. 134, № 3. P. 236—241.
Newcomb W., Steeves T. A. Helianthus annuus embryogenesis: embryo sac wall projection before and
after fertilization. // Bot. Gaz. 1971. Vol. 132, № 4. P. 367—371.
Newman I. V. Studies in the Australian acacias. 4. The life history of Acacia baileyana F. V. M. Part 2.
Gametophytes, fertilization, seed production and germination and general conclusion // Proc. Linn. Soc. N.
S. W. 1935. Vol. 2. P. 237—351.
Niezgoda С J., Feuer S. M., Nevling L. I. Pollen ultrastructure of tribe Ingeae (Mimosoideae:
Leguminosae) // Amer. J. Bot. 1983. Vol. 70, № 5. P. 650—667.
Nikiticheva Z. I. Embryological features of some Piperales // Acta Soc. bot. pol. 1981. Vol. 50. № 1—2.
P. 329—332.
Nikiticheva Z. I. Dynamics of seed structure development in Angiosperms // Proc. XI Intern. Symp.
«Embryology and seed reproduction». Leningrad, USSR, 1990. St. Petersburg, 1992. P. 401—402.
Nilsson H. Die Homologie des Angiospermen Embryosackes // Bot. notiser. 1941. H. 1. P. 50—58.
Niogret M. -F., Dubald M., Mandaron P., Mache R. Characterization of pollen polygalacturonase encoded
by several cDNA clones in maize // Plant Mol. Biol. 1991. Vol. 17. P. 1155—1164.
Nitsch J. P., Nitsch С Haploid plants from pollen grains // Science. 1969. Vol. 63. P. 85—87.
Noel A. R. A. The endothecium — a neglected criterion in taxonomy and phylogeny // Bothalia. 1983.
Vol. 14. P. 833—838.
Литература
307
Noher de Halac J. Fine structure of nucellar cells during development of the embryo sac in Oenothera
biennis L. // Ann. Bot. 1980. Vol. 45, № 5. P. 515—521.
Norstog K. Nucellus during early embryogeny in barley: fine structure // Bot. Gaz. 1974. Vol. 135, №
2. P. 97—103.
Ogorodnikova V. F. Sporopollenin membrane in tapetum of the anthers // Abstr. XI Intern, symp.
«Embryology and seed reproduction», Leningrad, 1990. P. 116.
Ogur M., Erickson R. O., Rosen G. V. Nucleic acids in relation to cell division in Lilium longiflorum //
Exp. Cell Res. 1951. Vol. 2, № 1. P. 73—89.
Ono T. Embryologische Studien an einiger Pontederiaceen // Sci. Repr. Tohoku Univ. Ser. 4. 1928. Vol.
3. P. 405—415.
Oryol L. I. Polarity of microspore and movement of nuclei and of generative cell in Zea mays // Rev.
Cytol. Biol. Veg. 1969. T. 32, Fasc. 1—2. P. 37—42.
Osterwalder A. Beitrage zur Embryologie von Aconitum napellus L. // Flora, 1898. Bd 85, H. 3. S.
254—292.
Pace L. The gametophytes of Calopogon // Bot. Gaz. 1909. Vol. 48. 126 p.
Pacini E. Tapetum and microspore function // Microspores: Evolution and Ontogeny / Eds. S. Blackmore,
R. B. Knox. London: Acad. Press, 1990. P. 213—237.
Pacini E., Casadoro G. Tapetum plastids of Olea europea // Protoplasma. 1981. Vol. 106. № 3—4. P.
289—297.
Pacini E., Cresti M. Ultrastructural characteristics of tapetum and microspore mother cells in
Lycopersicum peruvianum during meiotic prophase // Soc. Bot. Fr. Actual. Bot. 1978. Vol. 125.
Pacini E., Franchi G. G. Pollen grain development in Smilax aspera L. and possible functions of the loculus
// Biology and Implications for Plant Breeding / Eds. D. L. Mulcahy, E. Ottaviano. New York, 1983. P.
183—190.
Pacini E., Franchi G. G. Diversification and evolution of the tapetum // Pollen and spores / Eds. S.
Blackmore, S. H. Barnes. Oxford, 1991. Spec. Vol. 44. P. 301—316.
Pacini E., Franchi G. G., Hesse M. The tapetum: its form, function and possible phylogeny in
Embryophyta // Plant Syst. a. Evol. 1985. Vol. 149. P. 155—185.
Pacini E., Juniper В. Е. The ultrastructure of the formation and development of the amoeboid tapetum
in Arum italicum Miller // Protoplasma. 1983. Vol. 117. P. 116—129.
Pacini E., Keijzer С J. Ontogeny of intruding non periplasmodial tapetum in the wild chicory (Cichorium
intybus: Compositae) // Plant Syst. a. Evol. 1989. Vol. 167. P. 149—164.
Pacini E., Simoncioli C, Cresti M. Ultrastructure of nucellus and endosperm of Diplotaxis eruciodes during
embryogenesis // Caryologia. 1975. Vol. 28, № 4. P. 525—538.
Paliwall R. L. Life of Coriandrum sativum L. // Proc. 37th Indian Sci. Cong. (Poona) 1950.
Pt. III. P. 47.
Palm B. Studien liber Konstruktionstypen und Entwicklungswege des Embryosackes der Angiospermen:
Diss. Stockholm, 1915.
Panchaksharappa M. G. Embryological studies in some members of the Zingiberaceae // Plant
embryology. A symposium. New Dehli, 1962. P. 224—238.
Panchaksharappa M. G. Embryological studies in some members of the Zingiberaceae. II. Elettaria
cardamonum, Hitchenia caulina and Zingiber macrastachyum // Phytomorphology. 1966. Vol. 16, № 4. P.
412—417.
Panchaksharappa M. G., Hedge R. R. Distribution of insoluble polysaccharides in the ovule of Cicer
arietinum L. // Curr. Sci. 1972. Vol. 41, № 19. P. 719—720.
Panchakscharappa M. G., Syamasundar J. A cytological study of ovule development in Dipcadi montanum
Dalz. // Cytologia. 1975. Vol. 40, № 2. P. 141—149.
Pandey K. K. Theory and practice of induced androgenesis // New Phytol. 1973. Vol. 72. P.
1129—1140.
Parkin J. The durian theory — a criticism // Phytomorphology. 1953. Vol. 3, № 1—2.
Pearson H. H. Gnetales. New York. 1929. 194 S.
Pechoutre F. Contribution l'etude du developpment de Povule et de la graine des Rosacees // Ann. Sci.
Nat. Bot. Sr. 8. 1902. Vol. 16. № 1—2. P. 1—158.
Peddada L., Mascarenhas J. P. The synthesis of 5 S ribosomal RNA during pollen development //
Develop. Growth. Diff. 1975. Vol. 17, № 1. P. 1—8.
Penot M. Etude du role des appels moleculaires dans la circulation liberienne // Theses Fac. Sci. Univ.
Strasbourg. 1965. P. 1—49.
Penot M. Etude de la migration orientee du С dans le liber de Tradescantia viridis // С. г. Acad. Sci.
Paris 1966. Vol. 266, P. 874—877.
Periasamy K. Studies on seeds with ruminate endosperm. I. Morphology of ruminating tissue in Myristica
fragrans // J. Univ. Madras. B. 1961. Vol. 31. P. 53—58.
Periasamy K. Studies on seeds with ruminate endosperm. II. Development of rumination in the Vitaceae
// Proc. Indian Acad. Sci. B. 1962a. Vol. 56, № 1. P. 13—26.
Periasamy K. The ruminate endosperm: development and types of rumination // Plant embryology. A
symposium. New Dehli, 1962b. P. 62—74.
20*
308
Генеративные органы цветка
Periasamy К., Amalathas J. Absence of callose and tetrad in the microsporogenesis of Pandanus
odoratissimus with well-formed pollen exine // Ann. Bot. 1991. Vol. 67, № 1. P. 29—33.
Periasamy K., Swamy B. G. L. Studies in the Annonaceae. II. The development of ovule and seed in
Cananga odorata and Milmiusa wightiana // J. Indian Bot. Soc. 1961. Vol. 40, № 2. P. 206—216.
Periasamy K., Swamy B. G. L. Morphology of anther tapetum of Angiosperms // Curr. Sci. 1966. Vol.
35, № 17. P. 427—431.
Periasamy K., Thangavel S. Anther development in Xylopia nigricans // Proc. Indian Acad. Sci. Plant.
Sci. 1988. Vol. 98, № 4. P. 251—255.
Persival J. Cytological studies of some hybrids of Aegilops sp., wheats and of some hybrids between
different species of Aegilops // J. Genet. 1930. Vol. 22. P. 201—278.
Peterson P. A., Flawell R. В., Barrat D. H. P. Altered mitochondrial membrane activities associated with
cytoplasmically inherited disease sensitivity in maize // Theor. a. Appl. Genet. 1975. Vol.45. P. 309—314.
Peterson R. L., Scott M. G., Miller S. L. Some aspects of carpel structure in Caltha palustris L.
(Ranunculaceae) // Amer. J. Bot. 1979. Vol. 66. P. 334—342.
Pfeiffer A. Die Arillargebilde der Pflanzensamen. // Bot. Jahrb. Syst. Pflanzengesch. u. Pflanzengeogr.
1891. Bd 13.
Pfeiffer W. M. The morphology of Leitneria floridana // Bot. Gaz. 1912. Vol. 53, № 3. P. 189—203.
Philipson M. N. Haustorial synergids in Cortaderia (Gramineae) // N. Z. J. Bot. 1977. Vol. 15, N 4. P.
777—779.
Philipson M. N. Nucellar degeneration in Cortaderia (Gramineae). // Protoplasma. 1978. Vol 95, № 4.
P. 361—369.
Philipson M. N. The haustorial synergids of Cortaderia (Gramineae) at maturity // Acta Soc. bot. pol.
1981. Vol. 50, № 1—2. P. 151—160.
Philipson M. N., Connon H. E. Haustorial synergids in danthoniad grasses // Bot. Gaz. 1984. Vol. 145,
№ 1. P. 78—82.
Pierson E. S., Kengen H. M. P., Derksen J. Microtubules and actin filaments co-localize in pollen tubes
of Nicotiana tabacum L. and Lilium longiflorum Thunb. // Protoplasma 1989. Vol. 150. P. 75—77.
Pijl L. van der. Sarcotesta, aril, pulpa and the evolution of the Angiosperm fruit. // Proc. Konikl. Neder.
Akad. Wetensch., ser. С 1955. Vol 58, N. 2—3. P. 154—161.
Pijl L. van der. On the arilloides of Nephelium, Euphorbia, Litchi and Aesculus and the seed of
Sapindaceae. // Gen. Acta. Bot. Neer. 1957. Vol. 6, № 5. P. 618—641.
Pijl L. van der. Principles of dispersal in higher plants. Berlin etc.: Springer-Verlag, 1969. 154 p.
Pipkin J. L., Larson D. A. Changing patterns of nucleic acids, basic and acidic proteins in generative and
vegetative nuclei during pollen germination and pollen tube growth in Hippeastrum belladonna // Exp. Cell
Res. 1973. Vol. 79, № 1. P. 28—42.
Planchon J. E. Developpement et caracteres des vrais et des faux arilles // Ann. Sci. Nat. Bot. 1845. Vol.
3. P. 275—312.
Plaut W. S. DNA synthesis in microsporocytes in Lilium henry // Hereditas. 1953. Bd 39. S. 438—444.
Pluijm J. E. van der. An electron microscopic investigation of the filiform apparatus in the embryo sac of
Torenia fourniori // Pollen physiology and fertilization /Ed. H. F. Linskens. Amsterdam, 1964. P. 8—16.
Poddubnaja-Arnoldi V. A. Study of the fertilization in living material of some angiosperms //
Phytomorphology. 1960. Vol. 10. № 2. P. 185—198.
Ponzi R., Pizzolongo P. Cytinus hypocistis L. embryogenesis: ultrastructural aspects of megasporogenesis
and megagametogenesis // J. Submicr. Cytol. 1976. Vol. 8, № 4. P. 327—336.
Popham R. A., Chan A. P. Zonation in the vegetative stem tip-of Chrysantemum morifolium Bailey //
Amer. J. Bot. 1952. Vol. 37, № 6. P. 476—482.
Porsch O. Versuch einer phylogenetischen Erklarung des Embryosackes und der dopelten Befruchtung
der Angiospermen. Jena, 1907. 49 p.
Porter T. R. Development of the megagametophyte and embryo of Allium mutabile // Bot. Gaz. 1936.
Vol. 98. P. 317—327.
Porter E. K., Bird J. M., Dickinson H. G. Nucleic acid synthesis in microsporocytes of Lilium sv. cinabar:
events in the nucleus // J. Cell Sci. 1982. Vol. 57, № 3. P. 229—246.
Prahl A. -K., Rittscher M., Wiermann R. New aspects of sporopollenin biosynthesis // Biotechnology
and ecology of pollen / Ed. D. H. Malcahy. New York: Springer-Verlag, 1986. P. 313—318.
Prahl A. -K., Springstubbe H., Grumbach K., Wiermann R. Studies on sporopollenin biosynthesis: the
effect of inhibitors of carotenoid biosynthesis on spoporopollenin accumulation // Z. Naturforsch. 1985. Bd 40.
S. 621—626.
Price S. Cytological studies in Saccharum and allied genera. I. Syncytes in certain clones of Saccharum
and Erianhus // Cytologia. 1956. Vol. 21, № 1. P. 21.
Puri V. The role of floral anatomy in the solution of morphological problems // Bot. Rev. 1951. Vol. 17.
P. 471—553.
Purkinje J. E. De cellulis antherarum fibrosis nee non de granorum pollinarium formis commentatio
phytotomica. Bratislaviae. 1830.
Rafnar Т., Griffith I. J., Kuo M., Bond J. F., Rogers B. L., Klapper D. G. Clonning of Amb a I (antigen
E), the major allergen family of short ragweed pollen // J. Biol. Chem. 1991. Vol. 266. P. 1229—1236.
Литература
309
Raghavan V. Experimental embryogenesis in vascular plants. London etc.: Acad. Press. 1976. 603 p.
Raj B. Morphological and embryological studies in the family Santalaceae — Buckleya lanceolata Sieb.
et Zucc. // Beitr. Biol. Pflanz. 1970. Bd 46, H. 2. S. 193—207.
Raj В., El-Ghazaly G. Morphology and taxonomic application of orbicules (Ubisch bodies) in
Chloranthaceae // Pollen et spores. 1987. Vol. 29. P. 151—166.
Ram M. Morphological and embryological studies in the family Santalaceae. III. Leptomeria R. Br. //
Phytomorphology. 1959a. Vol. 9, № 1. P. 20—33.
Ram M. Occurence of embryo sac-like structures in the microsporangia of Leptomeria billardierii R. Br.
// Nature. 1959b. Vol. 184. P. 914—915.
Randolph L. F. Developmental morphology of the caryopsis in maize // J. Agr. Res. 1936. Vol. 53, №
12. P. 881—916.
Rangaswamy N. S., Janaki Subramanyan. Computer graphics to infer microspore tetrad configurations //
Proc. XI Intern. Symp. «Embryology and seed reproduction», Leningrad, USSR, 1990. St. Petersburg, 1992. P.
451—452.
Rao S. A. M. Studies in the Malpighiaceae. II. Structure and development of the ovules and embryo sac of
Malpighiacoccifera Linn, and Tristellateiaaustralis // Proc. Nat. Inst. Sci. India, B. 1941. Vol. 7. P. 393—404.
Rappaport J., Satina S., Blakeslee A. F. Extracts of ovular tumors and their inhibition of embryo growth
in Datura // Amer. J. Bot. 1950. Vol. 37, №8. P. 586-595.
Rash E., Woodard J. W. Basic proteins of plant nuclei during normal and pathological cell growth // J.
Biophys. Biochem. Cytol. 1959. Vol. 8, № 3. P. 263—276.
Razi B. A. Embryological studies of two members of the Podostemaceae // Bot. Gaz. 1949. Vol. 111. №
1. P. 211—218.
Rees H.Genotypic control of chromosome behaviour in rye. I. Inbred lines//J. Hered. 1955.№ 9. P. 93.
Rees-Leonard O. L. Macrosporogenesis and development of the macrogametophyte of Solanum tuberosum
// Bot. Gaz. 1935. Vol. 96. P. 734—750.
Reinert J., Bajaj Y. R. S., Heberle E. Induction of haploid tobacco plants from isolated pollen //
Protoplasma. 1975. Vol. 84. P. 191—196.
Rembert DH. Jr. Phylogenetic significance of megaspore tetrad patterns in Leguminales //
Phytomorphology, 1971. Vol. 21. № 1. P. 1 —9.
Reznickova S. A. Biochemical and ultrastructural features of meiotic cells // Nucleus (India), 1979. Vol.
22. P. 50—66.
Reznickova S. A., Aelst A. C. van, Willemse M. Т. М. Investigation of exine and orbicule formation in
the Lilium anther by scanning electron microscopy // Acta. bot. neerl. 1980. Vol. 29, № 2/3. P. 157—164.
Reznickova S. A., Willemse M. Т. М. Formation of pollen in the anther of Lilium. II. The function of the
surrounding tissues in the formation of pollen and pollen wall // Acta. bot. neerl. 1980. Vol. 29, № 2/3. P. 141 —
156.
Rhoades M. M. Meiosis // The Cell. New York, London: Acad. Press, 1951. Vol. 3. P. 1—75.
Richard L. С. М. Demonstrations botaniques ou analyse du fruit considere en generale. Paris,
1808. 111 p.
Richter-Landmann W. Der Befruchtungsvorgang bei Impatiens glandulifera Royle unter
Berucksichtigung der Plasmatischen Organelle von Spermazelle, Eizelle und Zygote // Planta, 1959. Bd 53,
H. 2. S. 162—177.
Rifot M. Evolution structural du pole chalazien du sac embryonnaire d'Aquilegia vulgaris en liaison avec
son activit trophique // Compt. Rend. Acad. Sci. 1973. Vol. 277, № 14. P. 1313—1316.
Roberts M. R., Hodge R., Ross J. H. E., Sorensen A., Murphy D. J., Draper J., Scott R. Characterization
of a new class of oleosins suggest a male gametophyte-specific lipid storage pathway // Plant J. 1993. Vol.
3. P. 629—636.
Roberts M. R., Robson F., Foster G. D., Draper J., Scott R. С A Brassica napus mRNA expressed
specifically in development microspores // Plant Mol. Biol. 1991. Vol. 17. P. 295—299.
Robinson-Beers K., Pruit R. E., Gasser Ch. Ovule development in wild-type Arabidopsis and two female
sterile mutants // Plant Cell. 1992. Vol. 4. P. 1237—1249.
Rodkiewicz B. Walls with callose in the megaspores and hypostase of ovules of Antirrhinum
majus observed in a fluorescence microscope // Bull. Acad. pol. sci. Ser. sci. biol. 1967. Vol. 15,
№ 5. P. 493—495.
Rodkiewicz B. Callose in cell walls during megasporogenesis in angiosperms // Planta. 1970. Bd 93. S. 39—
47.
Rodkiewicz B. Przebudowa cytoplasmy isolacia i polaryzacja w melocytach podczas megasporogenezy
u angiospermae (in Polish) (Cytoplasm restructuring isolation and polarization in meiocytes during
megasporogenesis in angiosperms) // Post. Biologii Komorki. 1978. Vol. 5. P. 135—154.
Rodkiewicz В., Bednara J. Cell wall ingrowths and callose distribution in megasporogenesis in some
Orchidaceae // Phytomorphology. 1976. Vol. 26, № 3. P. 276—281.
Rodkiewicz В., Bednara J. Development and ultrastructure of female gametophyte in angiosperms //
Post. Biologii Komorki. 1986. Vol. 13. P. 125—144. (Polish with English summary).
Rodkiewicz В., Duda E. Aggregations of organelles in meiotic cells of higher plants // Acta Soc. bot.
pol. 1988. Vol. 52. P. 637—659.
310
Генеративные органы цветка
Rodkiewicz В., Mikulska E. Electron microscope observations of cytoplasmic changes in developing
megasporocyte of Lilium candidum // Flora, 1964. Bd 154. Abt. A, H. 2. S. 384—387.
Rodkiewicz В., Mikulska E. Electron microscope observations of endoplasmic reticulum in Lilium
megasporocytes. // Flora. 1965a. Bd 155. Abt. A, H. 3. S. 341—346.
Rodkiewicz В., Mikulska E. The development of cytoplasmic structures in the embryo sac of Lilium
candidum as observed with the electron microscope // Planta. 1965b. Bd 67. H. 3. S. 297—304.
Rodkiewicz В., Mikulska E. The micropylar and antipodal cells of the Lilium regale embryo sac observed
with the electron microscope // Flora. A. 1967. Bd 158, Abt. A., H. 2. S. 181—188.
Rodkiewicz В., Sniezko R. Differentiation of functional megaspore in Onagraceae // Bull. Soc. Bot.
France. 1978. Vol. 125, № 1—2. P. 163—166.
Rodriguez-Garcia M. I., Alche I. D. Contribution to knowledge of the special callose wall during
microsporogenesis in Olea europaea L. // Proc. XI Int. symp. «Embryology and seed reproduction», 3—7
July, 1990, Leningrad. St. Petersburg, 1992. P. 463—464.
Roeckel P., Chaboud A., Matthys-Rochon E., Russel S. D., Dumas С Sperm cell structure,
development and organization // Microspores: Evolution and Ontogeny. San Diego: Acad. Press,
1990. P. 281—307.
Rogers B. L., Morgenstern J. P., Griffith I. J., Yu X. В., Counsell С M., Brauer A. W., King T. P., Graman
R. D.,KuoM-c. Complete sequence of the allergen Am a II //J. Immunol. 1991. Vol. 147. P. 2547—2552.
Rogers H. J., Harvey A., Lonsdale D. M. Isolation and characterization of a tobacco gene with homology
to pectate lyase which is specificaly expressed during microsporogenesis // Plant Mol. Biol. 1992. Vol. 20.
P. 403—502.
Roland F. Characterization and extraction of the polysaccharides of the intine and the generative cell
wall in the pollen grains of some Ranunculaceae // Grana. 1971. Vol. 11. P. 101—106.
Roland-Heydacker F. Aspect ultrastructuraux de l'ontogenie du pollen et du tapis shez Mahonia
aquifolium Nutt. Berberidaceae // Pollen et spores. 1979. Vol. 31, № 3. P. 259—278.
Rosanoff S. Zur Kenntnis des Baues und der Entwicklungsgeschichte des Pollens der Mimoseae // Jahrb.
Wiss. Bot. 1865. Bd 4. S. 441—450.
Rosenberg O. Uber die Pollenbildung von Zostera. Medd. Stockholms Hogsk. Bot. Inst. Uppsala. 1901.
S. 1—21.
Roth I. Die Histogenese der Integumente von Capsella bursa-pastoris und ihre morphologische Bedeutung
// Flora. 1957. Bd 145, H. 1—2. S. 212—235.
Rougier M., Inoud N., Said C, Russell S., Dumas С Male gametophyte development and formation of the
male germ unit in Populus deltoides following compatible pollination // Protoplasma. 1991. Vol. 162, № 2—3.
P. 140—150.
Rowley J. R. The fine structure of pollen wall in the Commelinaceae // Grana palynol. 1959. Vol. 2, №
1. P. 3-31.
Rowley J. R. The fundamental structure of the pollen exine // Plant Syst. a. Evol. 1990. Suppl. 5. P.
13—29.
Rowley J. R., Dahl A. O. Pollen development in Artemisia vulgaris with special reference to giucocalyx
material // Pollen et Spores. 1977. Vol. 19, P. 169—284.
Rowley J. R., Dahl A. O., Rowley J. S. Substructure in exines of Artemisia vulgaris (Asteraceae) //
Rev. Palaeobot. a. Palynol. 1981. Vol. 35. P. 1—38.
Rowley J. R., Dahl A. O., Sengupta S., Rowley J. S. A model of exine substructure based on dissection
of pollen and spore exines // Palynology. 1981. Vol. 5. P. 107—152.
Rowley J. R., El-Ghazaly G. Lipid in wall and cytoplasm of Solidago pollen // Grana. 1992. Vol. 31. P.
273—283.
Rowley J. R., Gabarayeva N. I., Walles B. Tapetal cell modifications around microspores of Nymphaea //
Proc. XI Intern. Symp. «Embryology and seed reproduction». July 3—7, 1990, Leningrad. St. Petersburg,
1992. P. 467—468.
Rowley J. R., Prijanto B. Selective destribution of the exine of pollen grains // Geophytology. 1977. Vol.
7, N 1. P. 1—23.
Rowley J. R., Walles B. Origin and structure of Ubisch bodies in Pinus sylvestris // Acta Soc. bot. pol.
1987. Vol. 56, N 2. P. 215—227.
Russell S. D. Fine structure of megagametophyte development in Zea mays // Can. J. Bot. 1979. Vol. 57.
№10. P. 1093—1110.
Russell S. D. Participation of male cytoplasm during gamete fusion in Angiosperm, Plumbago zeylanica
// Science. 1980. Vol. 210. P. 200—201.
Russell S. D. Fertilization in Plumbago zeylanica: gametic fusion and fate of the male cytoplasm // Amer.
J. Bot. 1983. Vol. 70, № 3. P. 416—434.
Russel S. D. Ultrastructure of the sperm of Plumbago zeylanica. II. Quantitative cytology and three-
dimensional organization // Planta. 1984. Bd 162, H. 5. S. 385—391.
Russel S. D. Isolation and characterization of sperm cells in flowering plants // Ann. Rev. Plant Physiol,
a. Plant Mol. Biol. 1991. Vol. 42. P. 189—204.
Russell S. D. The egg cell: development and role in fertilization and early embryogenesis // Plant cell.
1993. Vol. 5, № 10. P. 1349—1359.
Литература
311
Russell S. D., Cass D. D. Ultrastructure of the sperm of Plumbago zeylanica. I. Cytology and association
with vegetative nucleus // Protoplasma. 1981. Vol. 107, № 1—2. P. 85—107.
Russell S. D., Huang B. Q. Gametes, cytoskeleton and fertilization in two flowering plant model systems
// Abstr. Book XHIth Jntern. Congr. on Sex. Plant Reprod. Vienna, 1984. P. 22.
Russell S. D., Mao Lian-Ju. Patterns of embryo sac organization, synergid degeneration and cotyledon
orientation in Lilium usitatissimum L. // Planta. 1990. Bd 182, H. 1. S. 52—57.
Russell S. D., Mislan T. W. Microtubule-organelle associations during generative cell polarization
in Plumbago zeylanica // Proc. 44th Ann. Meet. Electron Microsc. Soc. of Amer. 1986. P.
280—281.
Rutgers F. L. The female gametophyte of Angiosperms. //Ann. J. Bot. Buitenzorg. 1923a. Vol. 33, № 1. P.
1—5.
Rutgers F. L. Embryo sac and embryo of Moringa oleifera. // Ann. J. Bot. Buitenzorg. 1923в. Vol. 33,
№ 1. P. 6—66.
Rutishauser A. Embryologie und Fortflanzungsbiologie der Angiospermen // Berlin etc.: Springer-
Verlag. 1969.
Ryczkowski M. Changes in the osmotic value of the sap from embryos, the central vacuole and cellular
endosperm during development of the ovules // Bull. Acad. Pol. Sci. Ser. biol. sci. 1962. P. 375—380.
Ryczkowski M., Kowalska A., Reczynski W. Element concentrations in the sap surrounding the
developing embryo of Aesculus hybrida // J. Plant Phytol. 1986. Vol. 122. P. 367—472.
Sachs J. Uber die Anordnung der Zellen in jungsten Pflanzentheile // Verhandl. d. med. -phys. Gesellsch.
Wizburg, 1877. № 5. XI. 26 S.
Sachs J. Vorlesungen uber Pflanzenphysiologie. / Leipzig, 1882. 991 S.
Sahni B. The ontogeny of vascular plants and the theory of recapitulation // J. Indian Bot.
Soc. 1925. Vol. 4.
Sampson F. B. Cytokinesis in pollen mother cells of angiosperms, with emphasis on Laurelia nova-
zelandiae (Monimiaceae) // Cytologia. 1969. Vol. 34. P. 511—634.
Samuels J. A. Etudes sur le developpement du sac embryonnaire du Gunnera macrophylla Bl. // Arch.
Zellforsch. 1912. Bd 8, H. 1. S. 52—120.
Samuelson G. Studien ilber die Entwicklungsgeschichte einiger Bicornes-Typen // Svensk. bot. tidskr.
1913. Bd7, H. 3. S. 601—604.
Sanger J. M., Jackson W. T. Fine structure study of pollen development in Haemanthus katherinae Baker
// J. Cell Sci. 1971. Vol. 8. P. 303—315.
Santos A., Salema R. Plastids of tapetum of Cucurbita polymorpha Duch. // Cienc. biol. Mol. a. Cell Biol.
1988. Vol. 13, № 3—4. P. 123.
Sarvella P. Cytomixis and the loss of chromosomes in meiotic and somatic cells of Gossypium // Cytologia.
1958. Vol.23. P. 14.
Sassen M. M. Fine structure of Petunia pollen grain and pollen tube // Acta bot. neerl. 1964. Vol. 13. P.
175—181.
Satina S., Rappaport J., Blakeslee A. F. Ovular tumors connected with incompatible crosses in Datura
// Amer. J. Bot. 1950. Vol. 37. P. 576—586.
Sato Joshoniko. Pollen development of Aucuba japonica Thunb. // Sci. Repts. Yokohama Nat. Univ. Ser.
2. 1988. № 35.
Sato S. The nuclear DNA contens in the synergids and antipodal cells of the mature embryo sac of Allium
tuberosum // Sci. Repts. Hirosaki Univ. 1990. Vol. 37, № 2. P. 124-127.
Savina G. I., Zhukova G. Ya. Ultrastructural aspects of the embryo sac development in Epipactis
atrorubens (Hoffm.) Schult // Proc. 7th Intern. Cytoembryol. Symp., Fertilization and embryogenesis in
ovulated plants. High Tatra (Rackova dolina), June 14—17, 1982. Bratislava, 1983. P. 207—209.
Sax K. Effects of variations in temperature on nuclear and cell division in Tradescantia // Amer. J. Bot.
1937. Vol. 24, № 5. P. 218—225.
Sax K. Polarity and differentiation in microspore development // Amer. J. Bot. 1936. Vol. 23, № 9. P.
145—153.
Schacht H. Beitrage zur Anatomie und Physiologie der Gewachse. Berlin. 1854.
Schacht H. Ueber Pflanzen-Befruchtung // Jahrb. Wiss. Bot. 1857. Bd 1. S. 193—232.
Schaffner J. H. The embryo sac of Alisma plantago//Bot. Gaz. 1896. Vol. 21. P. 123—132.
Schaffner J. H. A contribution to the life history and cytology of Erythronium // Bot. Gaz. 1901. Vol.
31. № 5. P. 369—387.
Sehgal С. В., Gifford E. M. Developmental and histochemical studies of the ovules of Nicotiana rustica L.
// Bot. Gaz. 1979. Vol. 140. P. 180—188.
Schell R., Wolter M. On the presence of elastoviscin in all subfamilies of the Orchidaceae and the
homology to pollenkitt // Nord. J. Bot. 1986. Vol. 6, № 3. P. 321—324.
Scheridan W. F. Nonaqueous isolation of nuclei from lily pollen and examination of their histones // Z.
Pflanzenphysiol. 1973. Bd 68, H. 4. S. 450—459.
Scheridan W. F., Stern H. Histone of meiosis // Exp. Cell Res. 1967. Vol. 45, № 3. P. 323—335.
Schift H. The constancy of deoxyribose nucleic acid in plant nuclei // Proc. Nat. Acad. Sci. 1950. Vol.
36, № 5. P. 643—654.
312
Генеративные органы цветка
Schlag M., Hesse M. The formation of the generative cell in Polystachia pubescens (Orchidaceae) //
Sexual Plant Reprod. 1992. Vol. 5. P. 131—137.
Schleiden M. J. Einige Blicke auf die Entwicklungsgeschichte des vegetablischen Organismus bei den
Phanerogamen // Arch. Naturgesch. (Wiegmann). 1837. Jg. III. Bd 1. S. 289—320.
Schleiden M. J. Grundzuge der Wissenschaftlichen Botanik nebst einer methodologischen Einleitung als
Anleitung zum Studium der Pflanze // Morphologie. Organologia. 1843. Bd 2. S. 564.
Schmidt A. Histologische Studien an phanerogamen Vegetationspunkten // Bot. Arch. 1924. Bd 8, H.
1—2. S. 345—404.
Schmitz F. Die Bluten-Entwicklung der Piperaceen // Bot. Abh. 1872. Bd 2, H.J. 74 S.
Schnarf K. Kleine Beitrage zur Entwicklungsgeschichte der Angiospermen. VI. Uber das Verhalten des
Antherentapetums einiger Pflanzen // Osterr. bot. Z. 1923. Bd 72. S. 242—245.
Schnarf K. Embryologie der Angiospermen. Berlin: Gebr. Borntr'ager, 1929. 417 S.
Schnarf K. Vergleichende Embryologie der Angiospermen. Berlin: Gebr. Borntr'ager. 1931. 354 S.
Schnarf K. Embryologie der Gymnospermen. 1933. Berlin, Gebr. Borntr'ager.
Schnarf K. Contemporary understanding of embryo sac development among Angiosperms // Bot. Rev.
1936. Vol. 2, № 12. P. 565—585.
Schnarf R. Archegonium und Archegontheorie // Biol. Gen. Wien. 1942. Bd 16, H. 1—3, S. 198—224.
Schroder M. -В., Oldenburg H. Ultrastructural studies on plastids of generative and vegetative cells in
Liliaceae. 7. Plastid distribution during generative cell development in Tulbaghia violacea Harv // Flora.
1990. Bd 184. S. 131—136.
Schulz R., Jensen W. A. Capsella embryogenesis: the synergids before and after fertilization // Amer.
J. Bot. 1968a. Vol. 55, № 5. P. 542—552.
Schulz R., Jensen W. A. Capsella embryogenesis: the egg, zygote and young embryo // Amer. J. Bot.
1968b. Vol. 55, № 7. P. 807—819.
Schulz R., Jensen W. A. Capsella embryogenesis: the suspensor and the basal cell // Protoplasma. 1969.
Vol. 67. № 2—3. P. 139—163.
Schulz R., Jensen W. A. Capsella embryogenesis: the chalazal proliferating tissue. // J. Cell Sci. 1971.
Vol. 8. №2. P. 139—163.
Schulz R., Jensen W. A. Capsella embryogenesis: the central cell // J. Cell Sci. 1973. Vol. 12, № 3. P.
741—763.
Schulz R., Jensen W. A. Cotton embryogenesis: the early development of the free nuclear endosperm //
Amer. J. Bot. 1977. Vol. 64. № 4. P. 384—394.
Schulz R., Jensen W. A. Pre-fertilization ovule development in Capsella: ultrastructure and
ultracytochemical localization of acid phosphatase in the meiocyte// Protoplasma. 1981. Vol. 104. P. 27—45.
Schultz R., Jensen W. A. Pre-fertilization ovule development in Capsella; the dyad, tetrad, developing
megaspore, and two-nucleate megagametophyte // Can. J. Bot. 1986. Vol. 64. P. 875—884.
Schulze Osthoff K., Wiermann J. Phenols as intergrated compounds of sporopollenin from Pinus pollen
// J. Plant Physiol. 1987. Vol. 131. P. 5—15.
Schurhoff P. N. Zur Phylogenie des Angiospermen—Embryosackes // Ber. Dtsch. bot. Ges. 1919. Bd
37. S. 160—168.
Schurhoff P. N. Die Zytologie der Blutenpflanzen. Stuttgart: Enke Verlag, 1926. 8. XI. 792 S.
Schurhoff P. N. Uber Entwicklung des Eiapparates der Angiospermen // Ber. Dtsch. Bot. Gaz. 1928. Bd
46. S. 560—572.
Schweiger J. Beitrage zur Kenntnis der Samenentwicklung der Euphorbiaceen // Flora. 1905. Bd 94. S.
339—379.
Schwere S. Zur Entwicklungsgeschichte der Frucht von Taraxacum officinale Web. Ein Beitrage zur
Embryologie der Compositen // Flora. 1896. Bd 82, H. 1. S. 32—66.
Sears B. B. Elimination of plastids during spermatogenesis and fertilization in the plant kingdom // Plasmid.
1980. Vol. 4. P. 233—255.
Sehgal C. B. Ultrastructure of antipodal cells in Nicotiana rustica // Phytomorphology. 1980. Vol. 30, №
LP. 61—66.
Shah Rajesh. Light and electron microscopic studies on development of polyads and seeds with special
reference to seed infestation and destruction in Albizzia lebbek (L.) Benth // Thesis Ph. D. Univ. of Delhi, Delhi,
1992.
Shamrov I. I. The ovule of Swertia iberica (Gentianaceae): structural and functional aspects //
Phytomorphology, 1991. Vol. 41, № 3—4. P. 213—229.
Shamrov I. I. Structural and functional aspects of ovule development in some flowering plants // Proc. XI
Intern. Symp. «Embryology and seed reproduction», Leningrad, USSR, 1990. St. Petersburg, 1992a. P. 501 —
502.
Shamrov I. I. The ovule morphogenesis in Gagea stipitata (Liliaceae) // Abstr. XII Intern. Symp.
Columbus, USA. 1992b. P. 85.
Shamrov I. I., Anisimova G. M., Lakshmi Sita G., Batygina Т. В. The peculiarity of ovule development
and structure in Santalum album (Santalaceae) // Abstr. XII Intern. Congr. on Sexual Plant Reprod.
Columbus, Ohio, USA. 1992. P. 62.
Shattuck С H. A morphological study of Ulmus americana // Bot. Gaz. 1905. Vol. 20. P. 209—223.
Литература
313
Sheel K., Bhandari N. Ontogenetic and histochemical studies on the anther development of Carica papaya
// Phytomorphology. 1990. Vol. 40, № 1—2. P. 85—91.
Shi L., Mogensen H. L., Zhu Т., Smith S. E. Dynamics of nuclear pore density and distribution patterns
within developing pollen: implications for a functional relationship between the vegetative nucleus and the
generative cell //J. Cell Sci. 1991. Vol. 99. P. 115—120.
Shivanna K. R., Johri В. М. The Angiosperm pollen: structure and function. New Delhi: Wiley Eastern,
1985.
Shivanna K. R., Heslop-Harrison Y., Heslop-Harrison S. S. Inhibition of the pollen-tube in the self-
incompatibility response of grasses // Incompat News lett. 1978. Vol. 10. P. 5—7.
Shreve F. The development and anatomy of Sarracenia purpurea // Bot. Gaz. 1906. Vol. 42.
P. 107—126.
Silvanovich A., Astwood J., Zhang L., Kisil F., Sehon A., Mohapatra S., Hill R. Nucleotide sequence
analysis of the cDNA coding for Poa p IX isoallergens of Kentucky bluegrass pollen // J. Biol. Chem. 1991.
Vol.266. P. 1204—1210.
Singh B. Studies in the family Malpighiaceae. III. Development and structure of seed and fruit of Malpighia
glabra Linn. // Hort. Adv. 1961. Vol. 5. P. 145—155.
Singh D. Studies on endosperm and development of seed in Cucurbitaceae and some its related families
// Agra Univ. J. Res. Sci. 1961a. Vol. 10, pt 2. P. 117—123.
Singh D. Development of embryo in the Cucurbitaceae // J. Indian Bot. Soc. 1961b. Vol. 40.
P. 620—623.
Singh M. В., Hough Т., Theerakulpisut P., Avjioglu A., Davies S., Smith P. M., Taylor P., Simpson R.
J., Ward L. D., McCluskey J., Ruy R., Knox R. B. Isolation of cDNA encoding a newly identified major
allergenic protein of rye-grass pollen: intracellular tatring to the amyloplast // Proc. Nat. Acad. Sci. 1991.
Vol. 88. P. 1384—1488.
Singh R. P. Structure and development of seeds in Euphorbiaceae: Melanthesa rhamnoides Wt. // Beitr.
Biol Pflanzen. 1968. Bd 45, H. 1. S. 127—133.
Singh S., Walles B. The ovarian transmitting tissue in Lilium regale // Int. J. Plant Sci. 1992. Vol. 153,
№ 2. P. 205—211.
Sinito T. On the extrusion of nuclear substance in Iris japonica Thub. // Tokyo Bot. Mag. 1922. Vol. 36.
P. 99.
Sinnott E. W. Plant morphogenesis. New York etc.: McGraw-Will Book Сотр. Inc. 1960. 550 P.
Skvarla J. J., Larson J. A. Fine structural studies of Zea mays pollen. I. Cell membranes and exine
ontogeny // Amer. J. Bot. 1966. Vol. 53. P. 1112-1125.
Smith С M. Development of Dionaea muscipula. I. Flowers and seed // Bot. Gaz. 1929. Vol. 89. P. 507—
530.
Smith F. H. Megagametophyte of Clintonia // Bot. Gaz. 1943. Vol. 105. P. 263—267.
Smith F. H. Development of the gametophytes and fertilization in Camassia // Amer. J. Bot. 1976. Vol.
29. P. 657—663.
Smith S. E. Biparental inheritance of organelles and its implications in crop improvement // Plant Breed.
Rev. 1989. Vol. 9. P. 361—393.
Smith-White S. Polarized segregation in the pollen mother cells of a stable triploid // Heredity. 1948.
Vol. 2. Pt. 1. P. 119—129.
Smith-White S. Pollen development patterns in the Epacridaceae // Proc. Linn. Soc. 1959a. Vol. 84, №
1.Р. 321—323.
Smith-White S. Pollen tetrad segregation in Astrosoma pinifolium // Proc. Linn. Soc. N. S. W. 1959b.
Vol. 84, № 2. P. 259—278.
Sniezko R. Distribution of polysaccharides during megasporogenesis in Onagraceae // Ann. Univ. M.
Curie-Sklodowska. 1976. Vol. 31. P. 183—191.
Sniezko R., Harte C. Polarity and competition between megaspores in the ovule of Oenothera hybrids //
Plant Syst. Evol. 1984. Vol. 144, № 1. P. 83—97.
Soodan A. S., Wafai B. A. Spontaneous occurrence of cytomixis during microsporogenesis in almond
Prunus amygdalus Batsch. and peach P. persica Batsch. // Cytologia. 1987. Vol. 52, № 2. P. 361—364.
Soueges R. L'embryologie vegetable // Resume historigue (Paris). 1934. № 1. 57 P. № 2. 59 P.
Southworth D. Isolation of exine from gymnosperm pollen // Amer. J. Bot. 1988. Vol. 75, №
1. P. 15—21.
Southworth D. Exine biochemistry // Microspores: Evolution and Ontogeny / Eds. S. Blackmore, R. B.
Knox. London: Acad. Press, 1990a. P. 193—212.
Southworth D. Approaches to the study of flowering plant sperm cells // Amer. J. Bot. 1990b. Vol. 77,
№ 6. P. 7—8.
Southworth D., Singh M. В., Hough Т., Smart I. J., Taylor P., Knox R. B. Antibodies to pollen exines
//Planta. 1988. Bd 176. S. 482—487.
Souvre A., Albertini L., Aurdan J. C. Le grain du pollen des angiosperms // Bull. Soc. bot. Fr. 1987. T.
137. P. 87—112.
Sreedevi P., Namboodiri A. N. The germination of pollinium and the organization of germ furrow in some
members of Asclepiadaceae // Can. J. Bot. 1982. Vol. 60, № 2. P. 166—172.
314
Генеративные органы цветка
Stanley R. G., Linskens H. F. Pollen. Berlin etc.: Springer, 1974.
Stebbins G. L. Flowering plants. Evolution above the species level. Cambridge, Mass.: Belknap press of
Harvard Univ. press, 1974. 380 p.
Steffen K. Zur Kenntnis des Befruchtungsvorhanges bei Impatiens glandulifera Lindl. // Planta 1951
Bd 39, H. 3. S. 25—37.
Steffen K. Zytologische Untersuchungen an Pollenkorn und -schlauch. 1. Phasenkontrastoptische
Lebensuntersuchungen an Pollenschlauchen von Galanthus nivalis // Flora. 1953. Bd 140, № 1. S. 140—174.
Steffen K. Kern- und Nucleolenwachstum bei endomitotischer Polyploidisierung. Ein Beitrag zur
karyologischen Anatomie von Pedicularis palustris L. // Planta. 1955. Bd 45. S. 379—394.
Steffen K., Landmann W. Chondriosomen-, Sph'arosomen- und Proplastidenzahlen in Beziehung zu den
Differenzierungsvorgangen bei der Antherenentwicklung // Planta. 1958. Bd 51, № 1.
Steffensen D. M. Synthesis of ribosomal RNA during growth and division in Lilium // Exp. Cell Res. 1966.
Vol. 44, № 1. P. 1—12.
Stelly D. M., Peloquin S. J., Palmer R. G., Grane С F. Mayer's hemalum-methyl salicylate: a stain-
clearing technique for observations within whole ovules // Stain Technol. 1984. Vol. 59. P. 1 55—161.
Stenar H. Studien liber die Entwicklungsgeschichte von Nothoscordum fragrans Kunth. und N. striatum
Kunth. // Sven. bot. tidskr. 1932. Bd 26. S. 25—44.
Stenar H. Zur Embryosackentwicklung einiger Malpighiaceen // Bot. notis. 1937. S. 110—118.
Stephens E. L. The embryo sac and embryo of certain Penaeaceae // Ann. Bot. 1909. Vol. 23, № 91
P. 363—378.
Sterling С The affinities of Prinsepa (Rosaceae) // Amer. J. Bot. 1963. Vol. 50. № 7. P. 693—699.
Stern H. Initiation of meiosis in lily and mouse: some molecular considerations // Arch. Anat. Microsc
et morphol. exp. 1985. Vol. 74, № 1. P. 10—13.
Stern H., Hotta V. Biochemical control of meiosis // Ann. Rew. Genet. 1973. Vol. 7, № 1. P. 37—67.
Stevens Valda A. M., Murray B. G. Studies on heteromorphic selfincompatibility systems: the
cytochemistry and ultrastructure of the tapetum of Primula obconica //J. Cell Sci. 1981. Vol. 50. P. 419—431.
Stieglitz H. Role of beta-1,3 glucan in postmeiotic microspore release // Developmental Bioloey. 1977
Vol. 57. P. 87—97.
Stinson J. R., Eisenberg A. J., Willing R. P., Pe M. E., Hanson D. D., Mascarenhas J. P. Genes expressed
in the male gametophyte of flowering plants and their isolation // Plant Physiol. 1987. Vol. 83. P. 442—447.
Stolt K. A. H. Zur Embryologie der Gentianaceen und Menyanthaceen // Konel. Svenska Vet.-Akad
Handl. 1921. Bd61, № 14. S. 1—56.
Stopes M. On the double nature of the cycadean integument // Ann. Bot. 1905. Vol. 19. P. 561—566.
Stosser R. Uber die Anziehung der Pollenschlauche durch die Samenanlagen bei Fruchten // Aneew.
Bot. 1986. Bd 60, № 5—6. S. 421—426.
Stow I. Experimental studies on the formation of the embryo sac-like pollen in the anthers of Hyacinthus
orientalis // Cytologia. 1930. Vol. 1. P. 417—439.
Stow I. On the female tendencies of the embryo sac-like giant pollen grains of Hyacinthus orienthalis //
Cytologia. 1934. Vol. 5. P. 88—108.
Strasburger E. Die Coniferen und die Gnetaceen. Jena: Fischer, 1872. 135 S.
Strasburger E. Uber Befruchtung und Zellteilung. Jena: Fischer, 1877.
Strasburger E. Die Angiospermen und die Gymnospermen. Jena: Fischer, 1879a. 173 S.
Strasburger E. Neue Beobachtungen uber Zellbildung und Zellteilung // Bot. Z. 1879 b. Je. 37. S 265—
279,281—288.
Strasburger E. Neue Untersuchungen iiber den Befruchtungsvorgang bei den Phanerogamen als
Grundlage fUr eine Theorie der Zeugung. Jena, 1884. 176 S.
Strasburger E. Einige Bemerkungen zur Frage nach der doppelten Befruchtung bei Angiospermen // Bot
Zeitung. 1900a. Bd 58, Abt. 2, H. 19—20. S. 293—316.
Strasburger E. Lehrbuch der Botanic fur Hochschulen. 4. verbess. Aufl. Jena: Fischer, 1900b. 588 S.
Strokov A. A., Bogdanov Yu. F., Reznikova S. A. Quantitative study of histones of meiocytes. II.
Polyacrylamide gel electrophoresis of isolated histones from Lilium microsporocytes // Chromosoma. 1973.
Vol. 43. P. 247—260.
Stutz С Asynchronous meiotic chromosome rhythm as a cause of sterility in Triticale // Genetics. 1962.
Vol. 47, № 8. P. 988.
Subramanyam K. An embryological study of Lobelia pyramidalis Wall, with special reference to the
mechanism of nutrition of the embryo in the family Lobeliaceae // New Phytoloeist 1949 Vol. 48, № 3 P
365—373.
Subramanyam K. The nutritional mechanism of embryo sac and embryo in the families Campanulaceae,
Lobeliaceae and Stylidiaceae // J. Mysore Univ. 1953. N 13. P. 1—4.
Subramanyam K. Nutritional mechanism of the seed — 1. Nutritional mechanism of the embryo sac // J.
Madras Univ. 1960. Vol. 30B, № 1. P. 29—44.
Subramanyam K., Govindu H. С The development of the female gametophyte in Oenothera // J. Indian
Bot. Soc. 1948. Vol. 27. № 1. P. 25—30.
Sumner M. J. Development of the megagametophyte central cell of Brassica campestris: (Pap. ) Joint
Meet. Can. Bot. Assoc, Toronto, 6—10 Aug. 1989 // Amer. J. Bot. 1989. Vol. 76, № 6. Suppl. P. 60.
Литература
315
Sumner M. J., van Caeseele L. The ultrastructure and cytochemistry of the egg apparatus of Brassica
campestris // Can. J. Bot. 1989. Vol. 67, N 1. P. 177—190.
Sundara Rajan S. Is Polygonum type embryo sac really primitive? // Acta Bot. Indica. 1976.
№ 4. P. 89—92.
Sunderland N., Wicks F. M. Embryoid formation in pollen grains of Nicotiana tabacum // J. Exp. Bot.
1971. Vol.22. P. 213—221.
Swamy B. G. L. Embryology of Orchidaceae // Curr. Sci. (Bangalore). 1943. Vol. 12. P. 13—17.
Swamy B. G. L. A contribution to the embryology of the Marcgraviaceae // Amer. J. Bot. 1948a. Vol.
35, № 9. P. 628—633.
Swamy B. G. L. A contribution to the life history of Casuarina // Proc. Amer. Acad. Arts Sci. 1948b.
Vol. 77, № 1. P. 1—32.
Swamy B. G. L. Agamospermy in Spiranthes cernua // Lloydia. 1948c. Vol. 11, № 3. P. 149—162.
Swamy B. G. L. Contribution to the life history of a Cycas from Mysore (India) // Amer. J. Bot. 1948d.
Vol. 35. P. 77—87.
Swamy B. G. L. Embryological studies in Orchidaceae // Amer. Midi. Nat. 1949. Vol 41. № 1. P. 113—119.
Swamy B. G. L. Macrogametophytic ontogeny in Schisandra chinensis // J. Indian Bot. Soc. 1964. Vol.
43, № 3. P. 391—396.
Swamy B. G. L. Contribution to the monograph of Gnetum. 1. Fertilization and proembryo //
Phytomorphology. 1973. Vol. 23. P. 48—53.
Swamy B. G. L. On the presumed ancestry of the embryo sac // Phytomorphology. 1974. Vol. 24. P.
102—106.
Swamy B. G. L., Bailey J. W. The morphology and relationships of Cercidiphyllum // J. Arnold
Arboretum. 1949. Vol. 30, № 2. P. 187—210.
Swift H. The constancy of deoxyribose nucleic acid in plant nuclei // Proc. Nat. Acad. Sci. 1950. Vol.
36, № 5. P. 643—654.
Szujko-Lacza J. Hypostase, embryonic sac and endosperm in Anethum graveolens L., and in various
families // Acta biol. Acad. sci. hung. 1978. Vol. 29, № 3. P. 255—271.
Tackholm G. Zur Antipodenentwicklung der Kompositengattungen Cosmidium und Cosmos // Sven. bot.
tidskr. 1916. Bd 10, H. 3. S. 423—437.
Tackholm G., Soderberg E. Neue Beispiele der simultanen und sukzessiven Wandbildung in der
Pollenmutterzellen // Sven. bot. tidskr. 1918. Bd 12, H. 2. S. 189—201.
Takahashi M., Sohma K. Pollen wall formation and tapetum in Disporum smilacinum A. Iray (Liliaceae)
// Sci. Repts Tohoku Univ. 1970. Ser. 4, № 4. P. 37.
Takats S. T. An attempt to detect utilization of DNA breakdown products from the tapetum for DNA
synthesis in microspores of Lilium longiflorum // Amer. J. Bot. 1962. Vol. 49, № 7. P. 748—758.
Takhtajan A. L. Outline of the classification of flowering plants (Magnoliophyta) // Bot. Rev. 1980. Vol.
46, N 3. P. 225—359.
Tarasenko L. V. Ultrastructural analysis of the generative and sperm cells in the pollen of Matthiola bicornis
L. // Abstr. XI Intern, symp. «Embryology and seed reproduction», Leningrad, USSR, July 3—7,1990. P. 168.
Tarkowska J. Experimental analysis of the mechanism of cytomixis. I. Cytomixis in vegetative tissue //
Acta Soc. bot, pol. 1965. Vol. 34, № 1. P. 27—44.
Tarkowska J. Experimental analysis of mechanism of cytomixis. II. Cytomixis in the pollen mother cells
of the lily — Lilium candidum L. // Acta Soc. bot. pol. 1966. Vol. 35, № 1. P. 25—40.
Tarkowska J. The nature of cytomixis // Caryologia. 1973. Vol. 25. Suppl. P. 151—157.
Tarkowska J., Wazynska M., Jablonska A. Translocation on nuclei and reorientation of mitotic apparatus
in the ontogeny of stomata in Tradescantia virginiana L. // Acta Soc. bot. pol. 1987. Vol. 56, № 4. P. 599—
610. „
Taylor J. H. Autoradiographic detection of incorporation of P into chromosomes during meiosis and
mitosis // Exp. Cell. Res. 1953. Vol. 4. P. 164—173.
Taylor J. H. Incorporation of phosphorus-32 into nucleic acids and proteins during microgametogenesis
of Tulbaghia // Amer. J. Bot. 1958. Vol. 45, № 2. P. 123—131.
Taylor J. H. Autoradiographic studies of nucleic acids and proteins during meiosis in Lilium longiflorum
// Amer. J. Bot. 1959. Vol. 46, № 7, P. 477—484.
Taylor J. H. Distribution of tritium — labelled DNA among chromosome during meiosis //J. Cell Biol.
1965. Vol. 25, № 1. P. 57—67. „
Taylor J. H., McMaster R. D. Autoradiographic detection of incorporation of P into chromosome during
meiosis and mitosis // Exp. Cell Res. 1954. Vol. 4, № 1. P. 164—173.
Theunis С H., Piterson E. S., Cresti M. Isolation of male and female gametes in higher plants // Sex.
Plant Reprod. 1991. Vol. 4, № 3. P. 145—154.
Thomson W. W., Watley J. M. Development of nongreen plastids // Ann. Rev. Plant Physiol. 1980. Vol.
31. P. 375—394.
Tiagi B. Development of the seed and fruit of Melampyrum nemorosum L. and M. arvense L. // Can. J.
Bot. 1965. Vol. 43, № 12. P. 1511 —1521.
Tian Hui-qiao, Yang Hong-Yuan. Ultrastructural studies of partenogenesis and antipodal apogamy in
Allium tuberosum Roxb. // Acta Bot. Sin. 1991. Vol. 33, №11. P. 819—824 (in Chinese).
316
Генеративные органы цветка
Tieghem Ph. van. Sur la structure de la fleur des Nuytsia et Gaiadendron, comparee a celle des
Loranthacees parasites // Bull. Soc. bot. 1893. T. 40. P. 341—361.
Tieghem Ph. van. Structure des quelques ovules et parti qu'on peut pour amerliorer la classification // J.
Bot. France. 1898. T. 12. P. 197—220.
Tieghem Ph. van. Sur les dicotyledones du groupe des Homoxylees // J. Bot. France, 1900. T. 14, № 8.
P. 277—330.
Tieghem Ph. van. Epibeepharide genre nouveau de Luxembourgiacees // J. Bot. France. 1901a. T. 15,
№ 12. P. 389.
Tieghem Ph. van. L'hypostase, sa structure et son r8le constans, sa position et sa forme variables // Bull.
Mus. nat. Hist. Nat. natur. 1901b. T. 7, № 8. P. 412—418.
Tieghem Ph. van. L'hypostase dans le fruit et dans la graine // Bull. Mus. nat. Hist, natur.
1902. T. 8. P. 43.
Tieghem Ph. van. Sur l'hypostase // Ann. Sci. natur. Bot. Ser. 8. 1903. T. 17. P. 347—362.
Tiezzi A., Moscatelli A., Ciampolini F., Milanesi C, Murgia M., Cresti M. The cytoskeletal apparatus of
the generative cell in several angiosperm species // Sexual reproduction in higher plants / Eds. M. Cresti, P.
Gori, E. Pacini. Berlin, Heidelberg: Springer, 1988. P. 215—220.
Tilton V. R. The nucellar epidermis and micropyle of Ornithogalum caudatum (Liliaceae) with a review
of these structures in other taxa // Can. J. Bot. 1980a. Vol. 58, Ns 17. P. 1872—1884.
Tilton V. R. Hypostase development in Ornithogalum caudatum (Liliaceae) and notes on other types of
modifications in the chalaza of angiosperms ovules // Can. J. Bot. 1980b. Vol. 58, № 19. P. 2059—2066.
Tilton V. R. Ovule development in Ornithogalum caudatum (Liliaceae) with a review of selected papers on
angiosperm reproduction. IV. Egg apparatus structure and function // New Phytol. 1981. Vol. 88, № 3. P.
505—531.
Tilton V. R., Horner H. T. Stygma, style and obturaior of Ornithogalum caudatum (Liliaceae) and their
function in reproductive process // Amer. J. Bot. 1980. Vol. 67, № 7. P. 1113—1131.
Tilton V. R., Lersten N. R. Ovule development in Ornitologalum caudatum (Liliaceae) with a review of
the selected papers on angiosperms reproduction. I. Integuments, funiculus and vascular tissue // New Phytol.
1981a. Vol. 88, № 3. P. 439—457.
Tilton V. R., Lersten N. R. Ovule development in Ornithogalum caudatum (Liliaceae) with a review of
selected papers on angiosperm reproduction. III. Nucellus and megagametophyte // New Phytol. 1981b. Vol.
88, № 3. P. 477—504.
Tilton V. R., Mogensen H. L. Ultrastructural aspects of the ovule of Agave parryi before fertilization //
Phytomorphology. 1979. Vol. 29, № 3—4. P. 338—350.
Tilton V. R., Wilcox L. W., Palmer R. G., AlbertsenM. С Stigma, style and obturator of soy bean, Glycine
max (L.) Merr. (Leguminoseae) and their function in the reproductive process // Amer. J. Bot. 1984. Vol. 71.
№ 4. P. 676—686.
Tischler G. Die Periplasmodienbildung in den Antheren der Comubrigen Monocotylen. // Jahrb. Wiss.
Bot. 1915. Bd 55. S. 52—90.
Tischler G. Handbuch der Pflanzenanatomie. Berlin: Gebr. Borntraeger, 1921—22. Bd 2. 154 S.
Titova G. E. The development of the female generative structures in Cabomba caroliniana A. Gray
(Cabombaceae) // Abstr. XI Intern. Symp. «Embryology and seed reproduction», 1990. Leningrad: Nauka.
P. 210.
Tiwari S. С The cytoskeleton during pollen development in Tradescantia verbiniana: A study employing
chemical fixation, freeze substitution, immunofluorescence and colchicine administration // Can. J. Bot. 1988.
Vol. 67. P. 1244—1253.
Tiwari S. C, Bouman F., Kapil R. N. Ovule ontogeny in Tropaelum majus // Phytomorphology. 1977
(1978). Vol. 27, № 4. P. 350—358.
Tiwari S. C, Gunning В. Е. S. Development of tapetum and microspores in Canna L.: an example of an
invasive but non-syncytial tapetum // Ann. Bot. (USA). 1986a. Vol. 57, № 4. P. 557—563.
Tiwari S. C, Gunning В. Е. S. Development and cell surface of a non syncytial invasive tapetum in Canna:
ultrasrtuctural, freeze substitution, cytochemical and immunofluorescence study // Protoplasma. 1986b. Vol.
134. P. 1—16.
Tobe H., Raven P. H. The embryology and relationships of Penaeaceae (Myrtales) // Plant Syst. a. Evol.
1984. Vol. 146, № 3—4. P. 181—195.
Traas J. A., Burgain S., Dumas de Vaulx R. The organization of the cytoskeleton during meiosis in egg
plant (Solanum melongena L.) microtubules and F-actine are both necessary for coordinated meiotic division
// J. Cell Sci. 1989. Vol. 92. P. 541—550.
Tretjakow S. Die Beteilung der Antipoden in Fallen der Polyembryonie bei Allium odorum // Ber.
Deutsch. Bot. Ges. B. 1895. Bd 13, H. 1. S. 13—17.
Treub M., Mellink J. Notice sur le developpment du sac embryonnaire dans quelques angiosperms //
Arch. Neerl. Sci. 1880. T. 15. P. 452—457.
Treviranus G. R. Biologie oder Phylosophie der lebenden Natur // Gottingen : Johann Friedrich Rower,
1805. Bd 3.226 S.
Tschermak-Woess E. Notizen iiber die Riesenkerne und «Riesenchromosomen» in den Antipoden von
Aconitum // Chromosoma. 1956. Bd 8, H. 2. S. 113—134.
Литература
317
Tschirch A. Physiologishe Studien iiber die Samen, insbesondere die Saugorgane derselben // Ann. Jard.
Bot. Buitenzorg. 1891. Bd 9. S. 143—183.
Tunen A. J. van, Mur L. A., Brouns G. S., Rienstra J.-D., Koes R. E., Mol J. N. M. Pollen- and anther-
specific promoters from Petunia: tandem promoter regulation of the chiA gene // Plant Cell. 1990. Vol. 2.
P. 393—401.
Turala K. Strukturen endopolyploider Kerne in Bereich der Samenanlage einiger Monocotylen // Osterr.
bot. Z. 1966. Bd 113. S. 529—541.
Turala-Szybowska J., Wolanska J. Two mechanisms of polyploidization of the antipodals in Aquilegia
vulgaris L. // Acta biol. crac. Ser. bot. 1990. Vol. 31. P. 63—74.
Turpin P. Memoire sur l'organe par lequel le fluide fecondant peut s'entroduire dans l'ovule des vegetaux
// Ann. Muss. Hist. Nat. 1806. T. 7. P. 199—211.
Twell D., Wing R., Yamaguchi J., McCormick S. Isolation and expression of an anther-specific gene from
tomato // Mol. a. Gen. Genet. 1989. Vol. 247. P. 240—245.
Ubisch G. von. Zur Entwicklungsgeschichte der Antheren // Planta. 1927. Bd 3. S. 490—495.
Uhl N. W., Moore H. E. The palm gynoecium // Amer. J. Bot. 1971. Vol. 58, № 10. P. 945—992.
Vannereau A. Etude ultrastructurale du complete micropylaire du sac embryonnaire adulte de Plantago
lanceolata L. // Bull. Soc. bot. France. 1978. T. 125, № 1—2. P. 201—205.
Vasil I. K. The new biology of pollen // Naturwissenschaften. 1973. Bd 60, H. 1. S. 247—253.
Vasil I. K., Nitsch С Experimental production on pollen haploids and their uses // Z. Pflanzenphysiol.
1975. Bd 76. S. 191—212.
Vassilyev A. E., Lobkov P. A. Filiform apparatus of synergids: structure and functions // Abstr. XI
Intern. Symp. «Embryology and seed reproduction», Leningrad, July 3—7, 1990. P. 129.
VasilyevaV. E., Titova G. E., ErmakovJ. P., MorozovaN.M.,ChochyaK. A. Time and space concordance
of the growth, differentiation and metabolism in the developing seed of Nelumbo nucifera Gaertn. // Sexual
Reproduction in higher Plants / Eds. M. Cresti, P. Gori, E. Pacini. Proc. 10th Intern. Symp. 30 May — 4 June,
1988. Univ. Siena, Siena, Italy. Berlin etc.: Springer Verlag, 1988. P. 487.
Vaughn К. С Organelle transmission in higher plants: organelle alteration vs. physical exclusion // J.
Hered. 1981. Vol. 72, №5. P. 335—337.
Vazart B. Befruchtung und Kernversehmelzung // Protoplasmatologia. Handbuch der
Protoplasmaforschung. Wien: Springer, 1958. Bd 7. S. 158.
Vazart B. Structure et evolution de la cellule generative du Lin, Linum usitatissimum, au cours
des premiers stades de la maturation du pollen // Rev. cytol. et biol. veg. 1969. T. 32. fasc. 1—2.
P. 101—114.
Vazart B. Premiere division haploide et formation de la cellule generatrice dans le pollen de tabac //
Ann. Univ. et ARERS. 1971. T. 9, № 1. P. 179—187.
Vazart В., Vazart J. Infrastructure de l'ovule du Lin, Linum usitatissimum L. I. L'assise jaquette on
endothelium // С r. Acad. Sci. Paris. 1965. T. 261, № 11. P. 2927—2930.
Vazart В., Vazart J. Infrastructure du sac embryonnaire du Lin (Linum usitatissimum L.) // Rev. Cytol.
Biol. Veg. 1966. T. 29, № 3—4. P. 251—266.
Vazart J. Ultrastructure de l'ovule du Lin, Linum usitatissimum L. Lecomplexe antipodial //C.'R. Acad.
Sci. Paris. 1968. T. 266, № 3. P. 211—213.
Vazart J. Organization et ultrastructure du sac embryonnaire du Lin (Linum usitatissimum L.) // Rev.
cytol. et Biol. Veg. 1969. T. 32, fasc. 3—4. P. 227—240.
Vazart J. Degenerescence d'une synergide et penetration du tube pollinique dans le sac embryonnaire de
Linum usitatissimum L. // Ann. Univ. et ARERS. 1971. T. 9, № 1. P. 89—97.
Vehling K., Niester Ch., Boon J. J., Willemse M. T. M., Wiermann R. p-Coumaric acid — a monoer in
the sporopollenin skeleton // Planta. 1989. Bd. 179. S. 376—380.
Venkata Rao С Contributions to the embryology of Sterculiaceae. V. // J. Indian Bot. Soc. 1953. Vol.
32, № 4. P. 208—238.
Venkata Rao С Contributions to the embryology of Palmae. II. Ceroxylineae // J. Indian Bot. Soc. 1959.
Vol. 38, № 1. P. 46—75.
Venkateswarlu, Prakasa Rao S. Embryological studies in some Combretaceae // Bot. notis. 1972. Bd 125,
H. 2. S. 161—179.
Ventura M. Osservazioni embriologiche su Arechavaletaria uruguayensis Speg. // Ann. Bot. (Roma).
1938. Vol. 21, № 3. P. 527—533.
Venturelli M., Bouman F. Embryology and seed development in Mayaca fluviatilis (Mayacaceae) // Acta
bot. neer. 1986. Vol. 35, № 4. P. 497—516.
Vijayalakshmi A., Lakshmanan К. К. Histochemistry of meiocytes, microspores, pollen and tapetum in
Haworthia fasciata Haw. // Nat. Acad. Sci. Lett. 1988. Vol. 11, № 1.
Vijayaraghavan M. R., Bhat Usha. Synergids before and after fertilization // Phytomorphology. 1983.
Vol. 33, № 1—4. P. 78—84.
Vijayaraghavan M. R., Jensen W. A., Ashton M. E. Synergids of Aquilegia formosa — their
histochemistry and ultrastructure // Phytomorphology. 1972. Vol. 22, № 2. P. 144—159.
Vijayaraghavan M. R., Kumra S., Sijata V. Ontogeny and histochemistry of anther wall in Saxifraga ciliata
L. // Proc. Indian Acad. Sci. 1987. Vol. 97, № 4. P. 301—307.
318 Генеративные органы цветка
Vijayaraghavan M. R., Misra Gayatri, Sujata Vefantam. Wandlabyrinthe in the embryo sac of Nigella
damascena Linn // Proc. Indian Acad. Sci. Plant Sci. 1988. Vol. 98, № 4. P. 261—268.
Vijayaraghavan M. R., Neeru Seth, Alka Jain. Ultrastructure and histochemistry of angiosperm embryo
sac — An overview // Proc. Indian Nat. Sci. Acad, part B. 1988. Vol. 54, № 1. P. 93—110.
Vijayaraghavan M. R., Ratnaparkhi S. Dual origin and dimorphism of the anther tapetum in Alectra
thomsoni Hook // Ann. Bot. 1973. Vol. 37. P. 355—359.
Vijayaraghavan M. R., Ratnaparkhi S. Pollen-embryo sacs in Heuchera micrantha Dougl. // Caryologia.
1977. Vol. 30, № 1. P. 105—119.
Vijayaraghavan M. R., Seth Neeru. Histochemical and ultrastructural studies on microspore mother cells
during meiotic prophase in Sesbania speciosa // Phytomorphology. 1991. Vol. 41. P. 231—239.
Vijayaraghavan M. R., Shukla A. K. The nature of covering around the aggregate of microspores in
Pergullaria daemia (Forsk) McC. et Blat. // Ann. Bot. 1976. Vol. 40, № 167. P. 417—421.
Vijayaraghavan M. R., Shukla A. K. Absence of callose around the microspore tetrad and poorly
development exine in Pergullaria daemia // Ann. Bot. 1977. Vol. 41, № 175. P. 923—926.
Vincent P. L. D., Getliffe F. M. The endothecium in Senecio (Asteraceae) // Bot. J. Linn. Soc. 1988.
Vol.97. P. 63—71.
Vithanage H. J. M. V., Knox R. B. Periodicity of pollen development and quantitative cytochemistry of
exine and intine enzymes in the grasses Lolium perenne and Phalaris tuberosa // Ann. Bot. 1980. Vol. 45,
№2. P. 131 — 142.
Wada B. Mitotic cell studies on in vivo observations XI. Various causes which prevent an elucidation of
mitosis // Cytologia. 1981. Vol. 46. P. 599—621.
Wagner V. Т., Mogensen H. L. The male germ unit in the pollen and pollen tubes of Petunia hybrida:
ultrastructural, quantitative and three-dimensional features // Protoplasma. 1988. Vol. 143. P. 101-110.
Walker R. J. Megasporogenesis and embryo development in Tropaeolum majus L. // Bull. Torrey Bot.
Club. 1947. Vol. 74. P. 240—249.
Walker R. J. Megasporogenesis and development of megagametophyte in Ulmus // Amer. J. Bot. 1950.
Vol. 37, № 1. P. 47—52.
Walles B. Ultrastructure of the ovarian transmitting tissue in Lilium regale // Proc. XI Intern. Symp.
«Embryology and seed reproduction», Leningrad, 1990. St. Petersburg. 1992. P. 607—608.
Walles R. I., Rowley J. R. Tapetal cells during pollen development in Pinus sylvestris // J. Ultrastruct.
Res. 1979. Vol. 1966, № 1. P. 95.
Walton J. Evolution of the ovule in pteridosperms // Adv. Sci. 1953. Vol. 10. P. 223—230.
Wardlaw С W. Embryogenesis in plants. London, New York, 1955. 391 p.
Warming E. Untersuchungen iiber pollenbildende Phyllome und Kaulome // Bot. Abh. Gebiet.
Morphologie und Physiologie. 1873. Bd 2, H. 2. S. 1—90.
Warming E. Bemerkungen iiber das Eichen // Bot. Zeitung. 1874. Bd. 32. S. 465—470.
Warming E. De l'ovule // Ann. sci. nat. Bot. Ser. 6. 1878. T. 5. P. 175—266.
Warming E. Observations sur la valeur systematique de l'ovule // Mindeskrift Yapetus Steenstrup,
Kjbenavn. 1913. T. 24. P. 1—45.
Waterkeyn L. Cytochemical localization and function of the 3-linked callose in the developing cotton
floor cell wall // Protoplasma. 1981. Vol. 106.
Waterkeyn L., Bietait A. On a possible function of the callosic special wall in Apomea purpurea (L.)
Roth. // Grana. 1969. Vol. 10. P. 13—20.
Weatherwax P. Structure and development of reproductive organs // Corn and Corn Improvement, New
York, 1955.
Webb M. C, Gunning В. Е. S. Embryo sac development in Arabidopsis thaliana. I. Megasporogenesis
including the microtubular cytoskeleton // Sex. Plant Reprod. 1990a. Vol. 3. P. 244—256.
Webb M. C., Gunning В. Е. S. Megasporogenesis in Arabidopsis thaliana, including the
microtubular cytoskeleton // XI Intern. Symp. «Embryology and seed reproduction»., Leningrad:
Nauka, 1990b. P. 211.
Webber E. Entwicklungsgeschichte Untersuchungen uber die Gattung Allium // Bot. Arch. 1929. Bd
25. S. 1—44.
Wehling K., Niester Ch., Boon J. J., Willemse M. T. M., Wiermann R. p-Coumaric acid — a monomer in
the sporopollenin skeleton // Planta. 1989. Bd 179. S. 376—380.
Weiling F. Light- und elektronmicroskopische Beobachtungen zum Problem der Cytomixis sowie ihren
moglichen Beziehung zur Potocytose Untersuchungen bei Cucurbita-Arten und Lycopersicum esculentum //
Planta. 1965. Bd 67, H. 2. S. 182.
Weimark K. A. Cytogenetic behaviour in octoploid Triticale. I. Meiosis, aneuploidy and fertility //
Hereditas. 1973. Vol. 74, № 1. P. 103—118.
Weinstein A. J. Cytological studies on Phaseolus vulgaris // Amer. J. Bot. 1926. Vol. 13. P.
248—263.
Weinziecher S. Beitrage zur Entwicklungsgeschichte von Xyris indica L. // Flora. 1914. Bd 106, H. 1.
S. 71—76.
Went F. A. F. C. The development of the ovule, embryo sac and egg in Podostemaceae // Rec. trav. bot.
neer. 1908. № 5. P. 1—16.
Литература 319
Went F. A. F. C. Intersuchungen iiber Podostemaceen // Verh. Kon. Akad. wetensch. Amsterdam: J.
Muller. 1910. 88 S.
Went J. L. van. The ultrastructure of the synergids of Petunia // Acta bot. neerl. 1970a. Vol. 19, № 2.
P. 121—132.
Went J. L. van. The ultrastructure of the egg and central cell of Petunia // Acta bot. neerl. 1970b. Vol.
19, № 3. P. 313—322.
Went J. L. van. Integumentary tapetum in Impatiens walleriana ovules // Some aspects and actual
orientations in plant embryology, Eds. J. Pare, M. Bugnicourt. Amiens: Cedex, France. Dedicatory volume
to prof. A. Lebeque. 1989. P. 271—279.
Went J. L. van, Cresti M. Pre-fertilization degeneration of both synergids in Brassica campestris ovules
// Sex. Plant Reprod. 1988 a. № 1. P. 208—216.
Went J. L. van, Cresti M. Cytokinesis in microspore mother cells of Impatiens sultani // Sex. Plant Reprod.
1988b. № 1. P. 228—233.
Went J. L. van, Cresti M. Cytoplasmic differentiation during tetrad formation and early microspore
development in Impatiens sultani // Protoplasma. 1989. Vol. 148. P. 1—7.
Went J. L. van, Linskens H. F. Die Entwicklung des sogenannten «Fadenapparates» im Embryosack von
Petunia hybrida // Genet. Breeding Res. 1967. Vol. 37, № 1. P. 51—56.
Went J. L. van, Willemse M. T. M. Fertilization // Embryology of Angiosperms // Ed. В. М. Johri. Berlin,
New York: Springer Verlag. 1984. P. 273—317.
Westermaier M. Zur Embryologie der Phanerogamen insbesondere iiber die sogenannten Antipoden //
Nova acta leopold. 1890. Bd 57, № 1. S. 1—30.
Westerwalder A. Historische Bemerkungen zur Lehre von der Bedeutung der Antipoden-Zellen // Ber.
dtsch. bot. Ges. 1898. Bd 16, H. 8.
Weterings K., Rejnen W., van Aarssen R., Kortstee A., Spijkers J., van Herpen M., Schrauwen J.,
Wullems G. Characterization of a pollen-specific cDNA from Nicotiana tabacum expressed during
microgametogenesis and germination//Plant Mol. Biol. 1992. Vol. 18. P. 1101—1111.
Wettstein R. R. Handbuch der Systematischen Botanik. Leipzig, Wien: Deuticke. 1911, VIII. 914S.
Whatley J. M. Ultrastructure of plastid inheritance: green algae to angiosperms // Biol. Rev. 1982. Vol.
57, № 4. P. 527—569.
Wick S. M. Spatial aspects of cytokinesis in plant cells // Curr. Opin. Cell Biol. 1991. Vol. 3, № 2. P.
253—260.
Wiegand K. M. Notes on the embryology of Potamogeton // Bot. Gaz. 1900. Vol. 30, № 1. P. 25—47.
Wiermann R., Gubatz S. Pollen wall and sporopolenin // Int. Rev. Cytol. 1992. Vol. 140. P. 35—72.
Wiger J. Embryological studies on the families Buxaceae, Meliaceae, Simaroubaceae and Burseraceae //
Diss. Lund. 1935. 130S.
Willemse M. Т. М. Morphological and quantitative changes in the population of cell organelles during
microsporogenesis of Pinus sylvestris L. I. Morphological changes from zygotene until prometaphase I // Acta
bot. neerl. 1971. Vol. 20, № 3. P. 261—274.
Willemse M. Т. М. Morphological and quantitative changes in the population of cell organelles
during microsporogenesis of Gasteria verrucosa // Acta bot. neerl. 1972. Vol. 21, № 1. P. 17—31.
Willemse M. Т. М. Polarity during megasporogenesis and megagametogenesis // Phytomorphology. 1981.
Vol. 31, № 1. P. 124—134.
Willemse M. Т. М., Bednara J. Polarity during megasporogenesis in Gasteria verrucosa //
Phytomorphology. 1979. Vol. 29, № 1. P. 156—165.
Willemse M. T. M., De Boer-De Jeu M. J. Megasporogenesis and early megagametogenesis // Acta Soc.
bot. pol 1981. Vol. 50, № 1—2. P. 111—120.
Willemse M. T. M. Franssen-Verheijen M. A. W. Cell organelles changes during megasporogenesis and
megagametogenesis in Gasteria verrucosa (Mill). Haw. // Bull. Soc. bot. France, Actualites Bot. 1978. T.
125. P. 187—191.
Willemse M. T. M., Franssen-Verheijen M. A. W. Ovular development // Proc. VII Intern. Cytoembr.
Symp. «Fertilization and embryogenesis in ovulated plants». High Tatra (Rackova dolina), 14—17 June, 1982.
Bratislava, 1983. P. 177-181.
Willemse M. Т. М., Kapil R. N. Antipodals of Gasteria verrucosa (Liliaceae), an ultrastructural study //
Acta Bot. neerl. 1981. Vol. 30, № 1—2. P. 25—32.
Willemse M. Т. М., Reznickova S. A. Formation of pollen in the anther of Lilium. Development of the
pollen wall // Acta bot. neerl. 1980. Vol. 29, №2—3. P. 127—140.
Willemse M. T. M., van Lammeren A. A. M. Structure and function of microtubular cytoskeleton during
megasporogenesis and embryo sac development in Gasteria verrucosa (Mill.) H. Duval. // Sex. Plant Reprod.
1988. Vol. 1. P. 745—782.
Willemse M. T. M., van Went J. L. The female gametophyte // The embryology of Angiosperms / Ed.
В. М. Johri. Berlin, New York: Springer, 1984. P. 159—196.
Wilms H. J. Development and composition of the spinach ovule // Acta bot. neerl. 1980. Vol. 29, № 4.
P. 243—260.
Wilms H. J. Ultrastructure of the developing embryo sac of spinach // Acta bot. neerl. 1981. Vol. 30,
№ 1—2. P. 75—99.
320
Генеративные органы цветка
Wing R. A., Yamaguchi J., Larabell S. К., Yrsin V. M., McCormic S. Molecular and genetic
characterization of two pollen-expressed genes that have sequence similarity to pectate lyases of the plant pathogen
Erwinia // Plant Mol. Biol. 1989. Vol. 14. P. 17—28.
Wisselingh S. van. Bijdragen tot de kennis van de Zaadhuid Zestiende bijdrage: over de Zaadhuid der
Ranunculaceae // Pharm. weekbl. 1924. Vol. 61. P. 1509—1531.
Wodehouse R. P. Pollen grains, their structure, identification and significance in science and medicine.
New York, London. 1935. 574 P.
Wolter M., Seuffert C, Schill R. The ontogeny of pollinia and elastoviscin in the anther of Doritis
pulcherrima (Orchidaceae) // Nord. J. Bot. 1988. Vol. 8, № 1. P. 77—88.
Woodard J. W. Intracellular amounts of nucleic acids and proteins during pollen grain growth in
Tradescantia // J. Biophys. Biochem. Cytol. 1958. Vol. 4, № 4. P. 383—389.
Woodcock С L. F., Bell P. R. Features of the ultrastructure of the female gametophyte of Myosurus
minimus // J. Ultrastruct. Res. 1968. Vol. 22. P. 546—563.
Wooding F. B. Endoplasmic reticulum aggregates of ordered structure // Planta. 1967. Bd 76, H. 2. S.
205—208.
Worsdell W. С The structure and morphology of the ovule. An historical sketch // Ann. Bot. 1904. Vol.
18, P. 57—86.
Wulff H. Die pollentenwicklung der Juncaceen // Jahrb. Wiss. Bot. 1937. Bd 87. H. 4. S. 533—556.
Wunderlich R. Uber das Antherentapetum mit besondere Berucksichtigung seiner Kernzahl // Oster.
bot. Ztschr. 1954. .Bd 101, № 1—2. S. 1—63.
Yamashita T. Ober'die Pollenbildung bei Halodule pinifolia und H. uninervis // Beitr. Biol. Pflanz. 1976.
Bd52, H. 1— 3. S. 217—226.
Yamaura A. Karyologische und embryologische Studien uber einige Bambusa-Arten (vorlaufige
Mitteilung) // Bot. Mag. Tokyo. 1933. Vol. 47. P. 551—555.
Yeung E. C, Brown D. С W. The osmotic environment of developing embryos of Phaseolus vulgaris //
Ztschr. Pflanzenphysiol. 1982. Bd 106. S. 149—156.
Yoschida O. Embryologische Studien uber Schisandra chinensis Bailey // J. Coll. Arts. Sci. Chiba Univ.
1962. Vol. 3, № 4. P. 459—462.
You R., Jensen W. A. Ultrastructural observations of the mature megagametophyte and the fertilization
in wheat (Triticum aestivum) // Can. J. Bot. 1985. Vol. 63, № 2. P. 163—178.
Zalokar M. Activation of ascidian eggs with lectins // Develop. Biol. 1980. Vol. 79, № 1. P.
232—237.
Zavada M. S. Pollen wall development of Austrohaileya maculata // Bot. Gaz. 1984. Vol. 145, № 1. P. 11 —
21.
ZeeS. Y.,Siu J. H. P. Studies on the ontogeny of the pollinium of a massulate orchid (Perstylus spiranthes)
// Rev. palaeobot. palynol. 1990. Vol. 64, № 1—4. P. 159—164.
Zenkteler M. Microsporogenesis and tapetal development in normal and malesterile carrots (Daucus
carota) // Ann. J. Bot. 1962. Vol. 49. P. 341—348.
Zenkteler M. In vitro culture — a useful method for obtaining haploid plants // Genet. Pol. 1971. Vol.
12. P. 267—273.
Zetzsche F., Kalt P., Liecht J., Ziegler E. Zur Konstitution des Lycopodium-Sporonins, des Tasmanins
und des Lange-Sporonins. XI. Mitteilung uber die Membran der Sporen und Pollen // J. Pract. Chem. 1937.
Vol. 148. P. 267—286.
Zhang Zhen-jue, Zheng Guo-ji. Translocation of uranin within the living ovules of Vanilla // Acta Bot.
Sin. 1988. Vol. 30, № 5. P. 490—493.
Zhinkina N. A., Shamrov I. I. The ovule development in the family Campanulaceae // Abstr. XII Intern.
Congr. Sexual Plant Reprod. Columbus. Ohio, USA. 1992. P. 83.
Zhou C, Yang H. Y. Observations on enzymatically isolated living and fixed embryo sacs in several
angiosperm species // Planta. 1985. Bd 165. S. 225—231.
Zhu Т., Mogensen H. L., Smith S. E. Generative cell composition and its relation to male plastid inheritance
patterns in Medicago sativa // Protoplasma. 1990a. Vol. 158. P. 66—72.
Zhu Т., Mogensen H. L., Smith S. E. Ultrastructural reconstruction and quantitative features of alfalfa
sperms // Amer. J. Bot. Suppl. 1990b. Vol. 77, № 6. P. 42.
Zhu Т., Mogensen H. L., Smith S. E. Quantitative cytology of the alfalfa generative cell and its relation
to male plastid inheritance patterns in three genotypes // Theor. Appl. Genet. 1991. Vol. 81. P. 21 —26.
Zhu Т., Mogensen H. L., Smith S. E. Heritable paternal cytoplasmic organelles in alfalfa sperm cells:
ultrastructural reconstruction and quantitative cytology // Eur. J. Cell Biol, (submitted). 1992.
Zschege С Mutationsauslosung durch chemikalien bei Weizen. IV. Cytogenetische Untersuchungen an
Mutanten // Z. Pflanzenzucht. 1963. Bd 49. S. 122.
ИЛЛЮСТРАЦИИ
I ТОМА
JPne. 1 Цветок,
1 — полный обоеполый цветок; 2 — цветок ШШ (в ПРОДОЛЬНОМ равмере со многими тычинками и
двумя пестиками /прочие удалецы/); % — отдельные части цветка (схемы);
л — лепестки, п — пестики, т — тычинки, цв — цветоложе, ч — чашелистики.
1—3 — по: Курсанови др., 194Q-
Рис. 3. Тычинка.
1 — стадии эволюции тычинок (микроспорофиллов) (а—е) от примитивного микроспорофилла
(Degeneria vitiensis) (а) до высокоспециализированного типа (е); 2 — изменение положения краев
тычинки (хх) и спорангиев от погруженных (а) до выступающих (е,ж,м,н)): А — изменения типа
вскрывания (а — интрорзное; д — латрорзное; е — экстрорзное; ж — интрорзное); Б — разнообразные
стадии, наблюдаемые у Magnolia viLiriodendron (з,и,к — Magnolia maingayi, M. nitida, M. grandiflora,
соответственно, вскрывание интрорзное, спорангии слегка выступающие; л — М. cambelli, вскрывание
латрорзное, спорангии выступающие; м — Liriodendron, вскрывание экстрорзное, спорангии
выступающие, изменение их положения сопровождается изменением положения наружных мельчайших
жилок; к— Magnolia acuminata, вскрывание латрорзно-интрорзное, спорангии выступающие).
Рис. 3 (продолжение).
3 — схема строения тычинки: А — продольные разрезы тычинок (можно наблюдать последовательное
освобождение половинок пыльника, ранее погруженных в ткань пластинки); Б — поперечные разрезы
пыльников (показывают развитие половинок пыльника пу^ем редукции боковых тканей и ткани
связника); 4 — поперечные разрезы пыльников (можно, наблюдать видоизменения в форме связника во
время цветения: А,Б — Irispumila, изменение обусловлено Дифференциальным ростом (А — молодой,
Б — зрелый пыльник); В,Г— Nymphaea colorata, изменение обусловлено ростом, подобным росту
камбия, характерно развитие гребня на связнике (В — молодой, Г — зрелый пйльник); 5 — стаминодии
у Hydrostemma longifolia (Barclayaceae).
1 — no: Тахтаджян, 1985; 2—4 — no: Eames, 1961, с изменениями; 5 — Батыгина, ориг.
17 18
Рис. 4. ГИНЕЦЕИ. ПЛОДОЛИСТИК. ПЛАЦЕНТА.
1 —9 — типы рылец; 1 — шовное рыльце апокарпного гинецея («рыльцевый гребень»); 2 — шовное при
сросшихся краях плодолистика; 3 — низбегающее; 4 — верхушечное; 5 — головчатое; 6 — сидячее
головчатое; 7 — три нитевидных; 8 — перистые; 9 — кистевидные. 10—18 — схема двух способов
смыкания краев плодолистика: 10—14 — способ складывания плодолистика вдоль, при котором края
плодолистика соприкасаются вентральными поверхностями, а проводящие пучки краев плодолистика
полуинвертированы: 10 — обширная краевая зона; 11 — редукция краевой зоны; 12—14 — этапы
срастания и слияния проводящего тяжа; 15—17 — способ свертывания, при котором половинки
пластинки плодолистика сближаются краями, а проводящие пучки инвертированы слабо: показаны
этапы сближения и срастания; 17—18 — способ свертывания, при котором половины пластинки
соприкасаются своими дорзальными поверхностями, пучки инвертированы, края свободные.
Рис. 4 (продолжение).
19—26 — основные типы гинецея и плацентации: 19 — предковая форма с раскрытыми мегаспоро-
филлами, с субмаргинальным положением семязачатков; 20—22 — апокарпный гинецей: 20, 21 — с
сутурально-угловой плацентацией; 22 — с ламинальнойплацентацией; 23,24 — ценокарпный гинецей
с сутурально-угловой плацентацией; 25 — лизикарпный гинецей с колончатой центральной
плацентацией; 26 — паракарпный гинецей с париетальной плацентацией; 20, 22, 23, 26 — плодолистики
сложены несвернутыми краями; 21, 24 — сложены предварительно вавернутыми краями; д п —
дорзальный проводящий пучок, к л — краевой проводящий пучок, р — рыльце, с — стилодий, сз —
семязачаток, ст. — столбик.
1—9, 19—26 — Корчагина, ориг.; 10—18 — по: Имс, 1964.
Рис. 5. Пыльиик, микроспорангий.
1,2 — пыльник Myristica macrothyrsa (Myristicaceae) с многочисленными микроспорангиями и
отдельный микроспорангий со сформированной стенкой; 3 — тетраспорангиатный пыльник Scabiosa bipinnata
(Dipsacaceae), сохраняющий индивидуальность каждого микроспорангия до самого вскрытия; 4, 5 —
тетраспорангиатный пыльник Phytolacca americana (Phytolaccaceae) с раздвинутыми теками;
перегородка между микроспорангиями в теках разрушается (5); 6, 7 — биспорангиатный пыльник Catathea
louisae и Ctenanthe lubbersiana (Marantaceae), перегородка между микроспорангиями разрушается;
8 — восьмиспорангиатный.пыльник Zannichellia pedunculata (ZannicheUiaceae) (1 —8 — поперечные
срезы); пл — плацентоид.
1, 2 — по: Маметьева, Камелина, 1981; 3 — по: Камелина, 1980; 4, 5 — по: Камелина, 1983а;
6,7 — по: Камелина, 1990; 8 — по: Камелина, Терехин, 1990.
к
Рис. 6. Эпидермис.
1 — фрагмент пыЛьника Coriaria myrtifolia (Coriariaceae), эпидермис со «звездчатой» кутикулой; 2 —
эпидермис с очеНЬ толстой кутикулой у Peganuifi harmala (PegaAaeeue)\ 3 — в зрвЛбм пыльнике
Nitraria komarooil (Nitrariaceae) эпидермис практически не сохраняется; 4 — фрагмент пыльника
Stachys trinervis (Lamiaceae) с пельтатными железками на эпидермисе, тапетум гетероморфный; 5 —
фрагмент пыльника Incarvillea potaninii (Bignoniaceae), эпидермис с трихомами) тапетум
Гетероморфный с орбикулами, клетки плацентоида с крахмалом; 6 — крупные клетки эпидермиса зрелого
пыльника Brexia madagascariensis (Brexiaceae) заполнены танинами, эндотецИи и сохраняющиеся
средние слои с фиброзными утолщениями, кутикула на эпидермисе мелко-зубчатого профиля; ж —
железка, к — кутикула, пл — плацентоид, тр — трихомы.
1 — по: Камелина, 19856; 2 — по: Kapil, Ahluwalia, 1963; 3 — по: Камелина, 1985а; 4 — по: Камелина,
Дзевалтовский, 1987; 5 — по: Камелина и др., 1990; 6 — по: Камелина, 1988.
Рис. 7. Стеика микроспорангия.
1 —19 — развитие ётенки микроспорангия в пыльнике Eleutherococcus senticosus (Araliaceae) (1 —9) и
Triticum aestivuni (Poaceae) (10—19) (на рис. 1—5 показана Дифференциация тапетума со стороне!
связника — из Меристемы микроспорангия, 10—14 — то же — из париетального Слоя, на рис. 5,15
представЛ6Н& бформированная стенка микроспорангия, 9,19 — стенка зрелого мйкроспорангия).
Рис. 7 (продолжение).
а — археспорий, вел — внутренний слой, н ел — наружный слой, п к — париетальная клетка, пел —
париетальный слой, епк — спорогенная клетка, сп тк — спорогенная ткань, ср ел — средний слой,
тп — тапетум, эн — эндотеций, эп — эпидермис (экзотеций).
1 —9 — по: Анисимова, 1987; 10—19 — по: Батыгина, 1987.
Рис. 8. Эндотеций.
1 — стенка зрелого пыльника с однослойным эндотецием у Calathea louisae и с двуслойным эндотецием
у Maranta leuconeura (Marantaceae) (2); 3—5 — тека зрелого пыльника Incarvillea potaninii
(Bignoniaceae), Эндотеций с фиброзными утолщениями присутствует только в районе стомиума (3,4),
Остальная часть стенки представлена эпидермисом и тапетальной пленкой с орбикулами под ним (5);
6 — эндотеций в стенке зрелого пыльника Zannichellia pedunadata (Zannichelliaceae) без фиброзных
утолщений (1 —6 — поперечные срезы); с — стомиум, эн — эндотеций, эп — эпидермис.
1, 2 — по: Камелина, 1990; 3—5 —по: Камелинаи др., 1990; 6 —по: Камелина, Терехин, 1990.
Рис. 9. Средний слой.
1,2 — один эфемерный средний слой в стенке микроспорангия Phytolacca americana (Phytolaccaceae);
3 — многочисленные средние слои у Nandina domestica (Nandinaceae), не сохраняющиеся в зрелом
пыльнике (4); 5 — сохраняющийся средний слой в зрелом пыльнике Stegnosperma halimifolium
(Stegnospermatacea'e), без сриброзных утолщений; 6 — два средних слоя в гнезде пыльника Datisca
cahnabina (Datiscaceae), внутренний разрушается, а наружный сохраняется, в его клетках образуются
фиброзные утолщения (7), отличающиеся от таковых в эндотеции; 8 — многочисленные средние слои
в стенке гнезда пыльника Ctenanthe lubbersiana (Marantaceae), выделяющие слизь в полость
микроспорангия (9) и разрушающиеся по мере созревания пыльника; ее — средний слой, тп с — тапеталь-
ный слой, эн — эндотеции, эп — эпидермис.
1,2 — по: Камелина, 1983а; 3,4 — по:Камелина, Тучина, 1982; 5 — по: Камелина, Проскурина, 1985;
6, 7 — по: Камелина, 19836; 8, 9 — по: Камелина, 1990.
Рис. 10. Фиброзные утолщения.
1 —7 — различные варианты расположения фиброзных слоев в пыльниках: в эндотеции, средних слоях
и тканях связника у Bubbia howeana (Winteraceae) (1) и Brexia madagascariensis (Brexiaceae) (5); в
эндотеции у Eupomatia laurina (Eupomatia laurina (Eupomatiaceae) (2) и Calycanthus fertilis
(Calycanthaceae) (3); в эндотеции и субэпидермисе связника Daphniphyllum macropodum
(Daphniphyllaceae) (4); в эндотеции и одном слое со стороны связника, прилегающем к полости
микроспорангия у Scabiosa bipinnata (Dipsacaceae); в эндотеции, плацентоидах, ткани связника у Ost-
rowskia magnifica (Campanulaceae) (7).
(1 —7 — поперечные срезы, фиброзные слои заштрихованы).
1 — по: Фрейберг, 1981; 2—4 — по: Камелина, 1981 а; 5 — по: Камелина, 1988; 6 — по: Камелина, 1980;
7 — по: Камелина, Жинкина, 1989.
Рис. 11. Тапетум (морфология).
1—4 — развитие гетероморфного тапетума у Escallonia rubra (Escalloniaceae), внутренняя часть
тапетума многослойная, вдающаяся в центре в спорогенную ткань, с двуядерными клетками (1—3)
или с полиплоидными ядрами в клетках (4); наружная — нерегулярно-двуслойная (4); 5 —
морфологически однородный тапетум у Datisca cannabina (Datiscaceae); 6 — тапетум с многоядерными
клетками и орбикулами у Brexia madagascariensis (Brextaceae); 7 — многослойный тапетум с двуядерными
клетками у Daphniphyllum macropodum (Daphniphyllaceae); 8,9 — трабекулы тапетального
происхождения в пыльниках Gentiana lutea (Gentianaceae).
Рис. 11 (продолжение).
(1 —7) — поперечные срезы; в га — внутренняя часть тапетума, к — кутикула, нт — наружная часть
тапетума, ее — средние слои, cm — спорогенная ткань, т — тапетум, тр — трабекулы, энд — эндо-
теций, эп — эпидермис.
1—4 — по: Камелина, 1984; 5 — по: Камелина, 19836; 6 — по: Камелина, 1988; 7 — по: Камелина,
1981в; 8, 9 — по: Шамров, 1987.
Рис. 12. Тапетум и орбикулы.
1 — поперечный срез пыльника Triticum aestiuum (ТЭМ), видна звездчатая структура каллозы и
спорогенные клетки, окруженные тапетумом (х 22000); 2А—D — орбикулы (тельца Убиша) различной
формы (СЭМ): 2А — от округло-треугольных до четковидных у Physopsis lachnostachya
(Chloranthaceae) (х 1500), 2В — пластинчатые с неровным краем у Euphorbia falcata (x 4500), 2С —
компактно размещенные параллельными рядами орбикулы у Euphorbia Ыиопае (х 4500), 2D —
шаровидные или кольцеобразные у Nymphaea (x 230).
Рис. 12 (продолжение).
Рис. 12 (продолжение).
3 — сложные скопления орбикул на стенке пыльцевого зерна Oxalis pes-caprae (СЭМ, х 10000).
Рис. 12 (продолжение).
4 — часть клетки тапетума на стадии поздней тетрады (ТЭМ), видны мелкие глобулярные тельца
(про-орбикулы) в углублениях плазмалеммы; глобулярные тельца без мембраны (стрелка) и с
мембраной (наконечник стрелки) в цитоплазме клеток тапетума (х 25000).
Рис. 12 (продолжение).
5 — фрагмент клетки тапетума (ТЭМ) с сердцевиной орбикулы, состоящей из множественных
структур, связанных с цистернами гранулярного ЭР (стрелки), видна поверхность гликокаликса тапеталь-
ных клеток (х 7000).
/
Рис. 12 (продолжение).
6 —• часть клетки тапетума ТгШсит aestiuum (ТЭМ) с орбикулярной оболочкой (стрелка) и орбикулами
(наконечник стрелки) (х 30000); ER — эндоплазматический ретикулум; G—гликокаликс; РО — про-
орбикулы; U — сердцевина орбикулы (тельца Убиша).
1 —3, 6 — El-Ghazaly, ориг.; 4 — по: El-Ghazaly, Jensen, 1986a; 5 — по: Rowley, Walles, 1987.
m At н
m At н
Рис. 13. Тапетальная мембрана.
1—16 — фрагменты спорополлениновой мембраны тапетальных клеток пыльников с поверхности
(1,3,5,8,9,11,13,15) и на поперечных срезах (2,4,6,7,10,12,14,16) после обработки концентрированной
серной кислотой:
Рис. 13 (продолжение).
Pinus syluestris (1,2), Beta vulgaris (3,4), Fragaria uesca (5,6), Medicago satiua (7,8), Solarium tuberosum
(9,10), Lycopersicon esculentum (11,12), Triticum aestiuum (13,14) и Helianthus anriuus (15,16).
-fry.
> m м н /
л
t» *-'-
4 ;..*
u
:^f
у}**
*■-.
V /n wf p .
л УЗ
« r
f»
^ /0
Рис. 13 (продолжение).
(Увеличение: 1,3,9,11,13,16 —x 15000; 2 —x7000; 4 —хЮООО; 5,8 —x3500; 6 — 4200; 7 —x1400;
10 —2500; 12 —x 11200: 14 —x 13800; 15 —x7500);
•Jl ) m ai в i
m m н
if»
^Шг
Э/Г? /If
эт м
щ<
i
14
Рис. 13 (продолжение).
m м в — тапетальная мембрана внутренней тангенталыюй стенки, тми — тапетальная мембрана
наружнойташенталыюйстенки, о — орбикула, тмр— тапетальная мембрана радиальной стенки,
э — экзина пыльцевого зерна, эт м — экстратапетальная мембрана.
1—4 — по: Голубева, 1983; 5—8 — по: Огородникова, 1990; 9—12 — по: Огородникова, 1976а; 13—
16 — по: Огородникова, 19766.
Рис. 14. Тапетум (формы реорганизации).
1 —3 — реорганизация клеточного тапетума в синцитий у Leycesteria formosa (Caprifoliaceae); 4—6 —
реорганизация клеточного тапетума втапетальную ткань вроде Scabiosa(Dipsacaceae); 2, 5
—амебоидная стадия развития тапетума (1 —6 — поперечные срезы).
1—3—.по: Камелинаидр., 1987; 4—6 — по: Камелина, 1987.
Рис. 15. Микроспорогенез и иммунофлюоресценция цитоскелета.
1 —8 — микроспорогенез у Nicotiana, флуоресценция рядов микротрубочек, обнаруженная с помощью
непрямого иммуноцитохимического метода: 1 — профаза 1, диплотена, сеть микротрубочек,
концентрирующаяся у ядра; 2 — метафаза 1, веретено, хромосомы в нефлюоресцирующеи экваториальной
плоскости; 3 — поздняя анафаза 1, система полярных микротрубочек и флюоресцирующие колпачки
кинетохорных пучков; 4 — телофаза 1, микротрубочки фрагмопласта; 5 — интеркинез, пучки
микротрубочек вокруг ядер, часть микротрубочек фрагмопласта все еще сохраняется в межъядерном
пространстве; 6 — метафаза II, веретена микротрубочек, одно на продольном, и другое на поперечном
срезах, фрагмопласт уже дегенерировал; 7 — телофаза 11, четырехполюсный вторичный фрагмоп-
ласт; 8, 9 — сукцессивный микроспорогенез: 8 — диада, 9 — тетрада микроспор изобилатерального
типа, менее обычная, чем тетраэдральная (рис. любезно предоставлен проф. J. Cebrat); 10 — тетрада,
флюоресценция каллозы; 11 — симультанный микроспорогенез, диада Nymphaea — экваториальное
скопление органелл; 12 — метафаза 1, микроспороцит Malva, агрегация органелл вокруг мейотиче-
ского аппарата; 13 — микроспороцит Malva после мейоза 1, агрегация органелл вокруг
интеркинетических ядер.
Рнс. 16. Археспорий.
1 —4 — дифференциация археспория в пыльниках Zizyphus jujuba (1), Linum perenne (2), Allium
caspium (3) и Helianthus annuus (4); a — археспорий.
1 — Шевченко, ориг.; 2 — no: Rao, 1966; 3 — по: Шамров, 19906; 4 — по: Joshi, Pantulu, 1941.
Рис. 17. Спорогенная ткань.
1—6 — формирование спорогенной ткани: у Allium caspium (1, 2), Scabiosa lucida (3), Ostrowskia
magnifica (4), Davidia involucrata (5) и Rhoeo discolor (6); пл — плацента, n n — первичный
париетальный слой, с — спорогенная ткань, э — эпидермис.
1,2 — по: Шамров, 19906; 3 — по: Камелина, 1987; 4 — по: Камелина, Жинкина, 1989; 5 — по:
Шевченко, Камелина, 1987; 6 — по:Фрейберг, 1990.
мсц
мсц
мсц
tin®? ■:■■ :■■■: |Л»::-..;> .>-. ^&я
SIX
ywc«
н т
мсц
пл
Рис. 18. Микроспороцит.
1—7 — микроспороциты на разных стадиях развития: у Campsis radicans (1), Linum perenne (2),
Gossypium hirsutum (3, 4), Reseda lutea (5), Pittosporum tobira (6) и Ostroivskia magnified (7); em —
внутренний тапетум, мсц — микроспороциты, нт — нарудшый тапетум, пл — плацента, се — средний
слой, э — эпидермис, эн — эндотеций.
1 — по:Фрейберг, 1987;2 — по: Rao, 1966; 3—4 — по: Камалова, Жукова, Руми, 1983; 5 —по: Чабан,
1983; 6 — по: Жинкина, Камелина, 1985; 7 — по: Камелина, Жинкина, 1989.
МЕИОЗ
МИТОЗ
Репликация ДНК Репликация ДН
Конъюгация
гомологичных
хромосом
Удвоившиеся хромосомы
располагаются на экваторе
веретена независимо
друг от друга
Пары удвоившихся
гомологичных хромосом
располагаются^ на
экваторе веретена
Первое деление
Второе.деление
Клеточное .
деление /Nv
Рис. 19. Мейоз.
1 — сравнение мейоза с обычным митозом (схема). Для простоты показана только одна пара
гомологичных хромосом. Спаривание гомологичных хромосом происходит только в мейозе; поскольку перед
спариванием каждая хромосома удваивается и состоит из двух сестринских хроматид, для
образования гаплоидных гамет необходимы два клеточных деления. Поэтому из любой диплоидной клетки,
вступающей в мейоз, образуются четыре гаплоидные клетки.
Центромера
Пара гомологичных
хромосом
Ядерная мембрана
Прикрепительный диск
Место, где начинает формироваться
синаитонемальный комплекс
Направление хода
синапсиса
Хроматин
Белковая нить
Рскомбипациопиый узелок
Боковые элементы
синаптонемиальною
100 нм
Дскондспсация
хроматина и
синтез РНК.
Концы хромосом
отделяются от
ядерной мембраны
Центромера
Видны
четыре хроматиды
Хиазма
Рис. 19 (продолжение).
2 (А,Б) — схемы, показывающие видимые изменения двух гомологичных хромосом на протяжении
мейоза. Представлен ход событий в клетках млекопитающих, хотя весьма сходную картину можно
наблюдать и в клетках многих других организмов. А. Пять стадий в профазе I мейоза;
Метафаза I
Рис. 19 (продолжение).
Б. остальные стадии мейоза. Пояснения в тексте.
Рис. 19 (продолжение).
3 — картина типичного мейоза у кукурузы (микрофотографии, увеличение 90x10, кроме стадий диад
и тетрад 20x10): а—д — профаза I, а) зиготена, б—в) пахитена, г) диплотена, четко видны 10
бивалентов с хиазмами, д) диакинез — видно 10 закрытых бивалентов и ядрышко; е — метафаза I, 10
бивалентов выстроились в экваториальной плоскости, на отдельных бивалентах видны кинетохорные
нити, направленные к полюсам; ж — анафаза I, по 10 хромосом отходят к каждому полюсу, каждая
хромосома состоит из двух хроматид, соединенных в области центромеры; з — стадия диад, общий
вид; и—к — прометафаза II, хромосомы в том же состоянии, что в анафазе I, особенно четко видно на
специально увеличенных хромосомах этой стадии (к); л — анафаза II, делятся центромеры
сестринских хроматид, особенно хорошо видно на рис. (м); н — стадия тетрад, о — общий вид конечной
стадии мейоза.
1, 2 — по: Альберте и др., 1987; 3 — по: Голубовская. 1988.
I
140
Ш
60
W
20
/
Л
\ V
\*
200
100
РНК
а- яЪро
т- цитоплазма
QSu,\uZ 6&лон
Л1/ 1Л2 Ml
^ Стадии днФФеренциАции
&РЕМ* ГНДРОЛЮА ,НШ1.
§ 600 '
J
; zoo
-зс/*^
гс/
1С
1 1 I
4С
—i 1 (
Л
\
\
1
\
[
Vc
UP Uli
С/ в, :
Стлдии MeiigSA
но-
ъ ■
«г НО-
s. -
s -
gJ«
be
В»:
1 :
А
/ ^
Г\
дйемя гидролиз а, мш.
Овьем ttmuiKA.Hm
4
&РЕМЯ rujIPOAHH . MKl
Калаче ства РНК,
Рис. 20. Цитохимия мейоза.
1 — гидролизные кривые для ядер клеток спорогенной ткани Lilium candidum на стадиях начала (1) и
окончания митозов (2); 2 -— содержание РНК и общего белка в ядре и цитоплазме клеток спорогенной
ткани на стадиях начала (МО и окончания митозов (М2); 3 — изменение содержания ДНК (1) и
гистона (2) в микроспороцитах Lilium candidum в процессе мейоза; 4 — гидролизные кривые для ядер
микроспороцитов Lilium candidum на стадиях ранней (1) и поздней премейотической интерфазы (2);
5 — гидролизные кривые для микроспороцитов Lilium candidum на стадиях зиготены (1), пахитены
(2), диакинеза (3) и метафазы 1 (4); 6 — кривые изменения объема ядрышка (1) и содержания РНК в
ядрышке (2) и в ядре (3) в процессе мейоза у Lilium candidum; Д — диплотена, ДК — диакинез,
ДП — диплотена поздняя, ДР — диплотена ранняя, 3 — зиготена, ИП — интерфаза поздняя, ИР —
интерфаза ранняя, Л — лептотена, М1 — метафаза I, M2 — метафаза II, П — пахитена, Т — тетрады.
1—5, 6 (2, 3) — Бугара, ориг.; 6 (1) — по: Резникова, 1984.
Рис. 21. Тетрады микроспор.
1 — типы микроспорогенеза: сукцессивный, симультанный и промежуточный; 2 — типы тетрад
микроспор: / — линейный, 2,3 — тетраэдрический, 4,5 — крестообразный, 6 — Т-образный, 7 —
ромбический, 8 — изобилатеральный.
Ж
Рис. 21 (продолжение).
3 — типы тетрад микроспор в разных положениях (схема): I, II — тетраэдрический, III —
крестообразный, IV — изобилатеральный; А — отдельные микроспоры; Б — микроспоры, полностью
проецирующиеся на препаратах одна на другую; В — направления поворотов тетрад по проходящим через
их центры вертикальной (а-б) и горизонтальной (в-г) осям. Тонкими линиями показаны контуры
клеток микроспор, образовавшихся сразу после мейоза.
Рис. 21 (продолжение).
4—19 — образование тетрад мкроспор: у Haloxylon aphyllum (4—9), у Plumbago europaeum (10—15),
у Reseda lutea (16—19), у Orobanche pallidiflora (20—22).
1—Камелина, ориг.; 2, 3 — по: Сладкова, Гревцова, 1991; 4—9 — по: Конычева, Кадырова, 1983;
10—15 — по: Коробова, 1983; 16—19 — по: Чабан, 1983; 20—22 — по: Терехин, 1987.
■^
1
-+-
Ж/ Oft »CJ
te****
ли
ю
60
«0
го
/-
' I
*
Ж
г \
\
. , , , _1
Стащи ра)Ышия
* J « S 6 Г 9 U
время гидролиза, мин.
Ъкт гидрилизл, мин.
та
g 800
§
5" бш
§
1 чао
S3
?
t то
■■
_
/
/
/
• /
Y-*^
\Z
А*
^*
ми кгкат т т
Стадш раъития
пи на hcs мен
Стадии рлз&мткя
на ясг «5 /к* ms лс»
Стлции рдзвитая
Рис. 22. Цитохимия микроспор.
1 — кривые изменения содержания ДНК (1) и гистона (2) в ядрах развивающихся микроспор Lilium
candidum (a), Sabia sclarea (б), Lavandula angustifolia (в) и Coriandrum sativum (г); 2 — гидролизные
кривые для ядер микроспор Lilium candidum на стадиях: микроспоры с тонкой оболочкой (1),
микроспоры с толстой оболочкой (2), микроспоры с пристенным расположением ядра (3); 3 — гидролизные
кривые для ядер микроспор Lilium candidum на стадиях: вакуолизированные микроспоры (1), зрелые
микроспоры (2), поздняя интерфаза микроспор (3); 4 — кривые изменения содержания РНК в
хроматине ядра (1), ядрышке (2) и цитоплазме (3) развивающихся микроспор Lilium candidum; 5 — кривые
изменения содержания РНК в ядре (1) и цитоплазме (2) развивающихся микроспор Sabia sclarea (a),
Lavandula angustijvlia (6) aCoriandrum sativum (в); 6 — кривые изменения содержания общего белка
в ядре (1) и цитоплазме (2) развивающихся микроспор Lilium candidum.
1а — по: Резникова и др., 1979; 16—г, 2—6 — Бугара, ориг.
Рис. 23. Ультраструктурные аспекты развития микроспор (агрегаты эндоплазматического
ретикулума).
1,2 — средняя стадия тетрадного периода развития микроспор Michelia fuscata. В цитоплазме
микроспор, окруженных каллозой, отчетливо видны кольчужные агрегаты эндоплазматического
ретикулума. Цистерны, несущие рибосомы, являются прямым продолжением цистерн кольчужного агрегата и
тянутся к плазмалемме (стрелки); 3, 4 — тетрадный период развития микроспор Michelia fuscata.
Кольчужные агрегаты ЭР в кортикальной цитоплазме развивающихся микроспор; 5—7 —
развивающиеся микроспоры Manglietia tenuipes: 5,7 — ранняя свободноспоровая стадия: 5 — два кольчужных
агрегата объединены цистернами гранулярного ЭР (стрелки), 7 — кольчужный агрегат с отходящими
от него цистернами гранулярного ЭР (стрелки); 6 — кольчужный ретикулум в цитоплазме микроспоры
в тетрадном периоде, его цистерны заполнены темным веществом; 8,9 — развивающиеся микроспоры
Liriodendron chinensis. Многочисленные «зебра» — агрегаты ЭР в цитоплазме микроспор, состоящие
из различного числа трубчатых цистерн (ограничены стрелками). Центральная цистерна всегда осми-
офильна, наружные цистерны электроннопрозрачны и несут рибосомы. Осмиофильные центральные
цистерны контактируют с липидными глобулами (двойные стрелки). Встречаются многоцистерновые
агрегаты (9, ограничен большими стрелками); 10—12 — микроспоры Liriodendron chinensis на стадии
построения интины. «Зебра» — агрегаты ограничены стрелками: 10 — «зебра»-агрегат, переходящий
в цистерну гранулярного ЭР, контактирует с плазмалеммой (стрелка) ,11 — стрелка указывает на
ветвящийся «зебра»-агрегат; 12 — наружные цистерны агрегатов несут рибосомы (стрелки); ар —
складка экзины в области апертуры, в — вакуоль, г в — везикулы Гольджи, д — диктиосома, и —
интина, к — каллоза, к р — кольчужный ЭР, 4 г — липидные глобулы, м — митохондрия, п —
плазмалемма, пл — пластида, пм — примэкзиновый матрикс, ц м — цитоплазма микроспоры, э — эк-
зина, я — ядро, я о — ядерная оболочка.
1, 3 — по: Габараева, 1986; 2, 6 — по: Габараева, 1990; 4, 8—12 — Габараева, ориг.;
5, 7 — по: Габараева, 1987.
U /И
V*
J; ,
ш
*;V"M* ******
£ ■> * Ж/ Щ' Щ№ *jffr T e *. . v
4* « ""-.
A.
* 1? * . § . ЙТ» *л
Рис. 23 (продолжение).
3
0,3 мкм
i 1
.• «•■
0,25 мим
?9*- -^
e*V# d6* •*;:#'
, 1 » 1^-*e»»
if
' *»
■*>
^
*-..*,
Рис. 23 (продолжение).
Us»"1*» «'
)<-'
t~
ȣ t*V
б
U'
x » 4,
'V£
yW
W
., С-*- 0,25 мкм^ ч- л- 1*Л"
^V .J,"1 fl"'1'- -"'у Ц М'^
Рис. 23 (продолжение).
V ~ *V* "." 'f "■- '*Ji • • it* *
Рис. 23 (продолжение).
/0 0,5 Л1км
« Hf
/fACAf
»
**. ^Ч?ч
Рис. 23 (продолжение).
Рис. 24. Пыльцевое зерно. Генеративная клетка. Вегетативная клетка.
1 —8 — формирование пыльцевого зерна у Galtonia candicans; 1 —4 — первое деление в пыльцевом
зерне. Характерное пристенное положение первичного ядра, вступающего в деление, вакуоль — в
центре, в цитоплазме — большое количество крахмальных зерен: 1 — профаза деления; 2 —
асимметрия веретена деления; 3 — ранняя телофаза, асимметрия дочерних ядер; 4 — поздняя телофаза,
асимметрия дочерних ядер, заложение клеточной пластинки; 5—8 — последовательные этапы
развития двуклеточного пыльцевого зерна: 5 — отделение генеративной клетки от вегетативной,
реконструкция дочерних ядер, сильное отставание генеративного ядра по сравнению с вегетативным; 6 —
момент вскоре после отделения генеративной клетки; 7 — начало отхождения генеративной клетки от
стенки пыльцевого зерна, видны остатки вакуоли; 8 — зрелое пыльцевое зерно; генеративная клетка
рриняла веретеновидную форму, отошла от стенки внутрь пыльцевого зерна, справа остатки вакуоли;
качественное различие цитоплазмы генеративной и вегетативной клеток. (Рисунки сделаны по
препаратам С.Г. Навашина);
13
14
:•-!
15 \
Рис. 24 (продолжение).
9—15 — различная форма пыльцевых зерен: шаровидная (9) у Paeonia anomala, эллипсоидная (10) у
Buniumpaucifolium, тетраэдрическая (11) у Lomatiumlongifolia, серповидная (12) у Ruppiabr achy pus,
нитевидная (13, 14) у Haelodule unineruis, (15) у Amphibolis antarctica;
Рнс. 24 (продолжение).
16—21 — различная форма генеративной клетки в зрелом пыльцевом зерне: веретеновидная (16) у
Viburnumopulus, (17—18) иChrisalidocarpuslucubensis, серповидная (19) у Liliumcandidum,
амебовидная (20) у Tradescantia uirginica, лентовидная (21) у Calathea louisae.
!_8 _ по: Герасимова-Навашина, 1951; 9 — по: Яковлев, 1983; 10 — по: Гревцова, 1987; 11 — по:
Савина, 1987; 12 —по: Камелина, 1990; 13—14 — по: Yamashita, 1976; 15 — по: Lakshmanan, 1968;
16 —по: Якобсон, 1984; 17—18—по: Жукова, Тучина, 1990; 19 —по: Резникова, 1984; 20— по: Под-
дубная-Арнольди, 1976; 21 — по: Камелина, 1990.
Рис. 25. Оболочка пыльцевого зерна.
1 — пертектатный тектум пыльцевого зерна Phragmites australis (СЭМ, х 7500); 2 — субтектатный
тектум пыльцевого зерна Erucaria crassifolia (СЭМ, х 2000); 3 — фрагмент пыльцевого зерна
Convolvulus microphyllus (СЭМ), видны тонкие прямые и толстые разветвленные бакулы (стрелки) (х
3000); 4 — экзина с микроканалами как в тектуме, так и в подстилающем слое, тонкая темная
рудиментарная эндэкзина (наконечники) и толстая интина с мембранным и фибриллярным
компонентами (х 40000); 5 — срединный срез пыльцевых зерен Triticum aestiuum, видна толстая интина особенно
близ апертуры (ТЭМ, х 300); 6 — толстый срез (около 150 нм) частично окисленной экзины, контр-
астированный напылением золотом после полного удаления Эпона и аралдита. Не радиальные
связывающие элементы на поверхности бакул, а отростки тектума более заметны, чем столбики. Отростки
тектума состоят из двух тяжей, а в бакуле видны два или более элементов. Линии от модели тяжей
(вставка) проходят в отростки тектума, которые могут быть образованы и не одним элементом и в
доказательство тому имеют столбики и связывающие элементы. Масштабная линейка — 1 нм; В —
бакулы, F — подстилающий слой, I — интина, Т — тектум.
1—6 — El-Ghazaly, ориг.
<m
Рис. 25 (продолжение).
и
S
S
и
й
■<
О
«*
о
а
в
1Л
!S
U
S
а.
Рнс. 25 (продолжение).
и
S
Я
и
й
<
О
«*
о
а,
в
1Л
!S
U
S
а,
Рис. 26. Ультраструктура генеративной и вегетативной клеток.
1 — часть вегетативной клетки пыльцевого зерна пшеницы с многочисленными везикулами,
содержащими предшественники вещества клеточной оболочки, митохондриями, пластидами с крахмалом,
кластерами рибосом (наконечники стрелок без наименований) и интинои стенки пыльцевого зерна
(ТЭМ); масштабная линейка — 1 мкм.
Рис. 26 (продолжение).
2 — цитоплазма вегетативной клетки, ядро вегетативной клетки, генеративная клетка и ядро
генеративной клетки у Hippeastrum uitatum (ТЭМ); масштабная линейка — 3 мкм.; GC — генеративная
клетка, GN — ядро генеративной клетки, In — интина оболочки пыльцевого зерна, М —
митохондрия, S — амилопласт, VC — вегетативная клетка, VN — ядро вегетативной клетки, WV — везикулы,
содержащие предшественники компонентов клеточной оболочки.
1 — по: Mogensen, Ladyman, 1989; 2 — по: Mogensen, 1986.
Рис. 27. Спермий.
1 —8 — деление генеративной клетки, образование спермиев в пыльцевом зерне Eminium alberti; 9,10
— пыльцевые зерна Campanula rapunailoides с рыльца пестика (9 — с делящейся генеративной
клеткой, 10 — трехклеточное пыльцевое зерно); 11—16 — спермиогенез в пыльцевой трубке С.
rapunailoides; 17—19 — спермиогенез в пыльцевых зернах Tulipa; 20—23 — двуклеточное пыльцевое
зерно и пыльцевые трубки, иллюстрирующие спермиогенез у Trillium camschatcense.
1—8 — по: Коробова, Жинкина, 1990, 9—16 — по: Коробова, Жинкина, 1987, 17—19 — по: Беляева,
1973, 20—23 — по: Наумова, 1990.
Рис. 28. Диморфизм спермиев.
1 — реконструкция спермиев Plumbago с применением компьютера; видны различия между спермиями
по форме и размерам, а также то, что они связаны между собой общей стенкой; 2 — вид двух спермиев
(рис. 1) изнутри вместе с вегетативным ядром; видны различия между спермиями в размере ядер, в
числе пластид и митохондрий и тесная связь выроста более крупного спермия с вегетативным ядром;
наконечники стрелок без обозначений указывают на общую клеточную стенку между спермиями; 3 —
стереоскопическая пара компьютерной реконструкции обоих спермиев по серийным ультратонким
срезам зрелого пыльцевого зерна ячменя; видно сходство спермиев по форме и размерам, а также то,
что они не связаны друг с другом, и что ни один из спермиев не связан с вегетативным ядром.
Масштабная линейка приблизительно 3 мкм; М — митохондрии, Р —пластиды, S —спермий, SC —
цитоплазма спермия, SN — ядро спермия, VN — ядро вегетативной клетки.
1, 2 — по: Russell, 1984; 3 — по: Mogensen, Rusche, 1985.
& 1С
1 1С
w in m i» nf at ti? nt из
5 .1 j
t^
>.
500
90
SO
ID
eo
cj so
§ ад
£ м
£ M
г to
nt пг аз т as nc
Стадии развитии
m пг пз m irs да П7 па пз
Стадии развития
VK40
»20
еово -
it гс
Ко/шчест&а ДНК,
классы илпидиогта, С
m пг m m as m пт па пз
CtaBUU PAJMTU3
СГАЩШ РЛ5Ы4ТИЯ
Рис. 29. Цитохимия пыльцевого зерна.
1 — кривые изменения ДНК в процессе развития
пыльцевых зерен Lilium candidum (a), Salvia
sclarea (б), Lavandula angustifolia (в) и
Coriandrum sativum (г) (1 —генеративная клетка,
2 — вегетативная клетка, 3 — спермин); 2 —
гистограмма распределения пыльцевых зерен
Coriandrum sativum по содержанию ДНК в ядре
вегетативной клетки в день раскрытия пыльника;
3 — кривые изменения содержания гистонов и
негистоновых белков в ядрах генеративной (1) и
вегетативной (2) клеток развивающегося
пыльцевого зерна Lilium candidum; 4 — кривые
изменения содержания РНК в хроматине ядра
вегетативной (1) и генеративной клеток (2) и в ядрышке
(3, 4) в процессе развития пыльцевого зерна
Lilium candidum; 5 — изменения содержания РНК
в цитоплазме генеративной (1) и вегетативной
клеток (2) развивающегося пыльцевого зерна
Lilium candidum.
<\>
«О
45
1
I
8
i
!
5
!
'///////г
S
а
и
О)
г
о
а
й,
S1
I
в
«
S
н
S
а
я
%
m
>>
s
4)
X
a
и
о
1
1
а
S
5
I
'5 3
g s
i |i
2 «
n s
О, щ
U О
и
«*
о
X
а
И
1
х 65
а чЗ
S s Я
8 8|
В & a
5 Я! I
i 2 '
a 8 <
2 3&
s at
в ll
о. я ©
О «S,
m
S
1
Рис. 30 (продолжение).
2—3 — у Triticum aestiuum, на фиксирозанном материале (2) и живом (3); 3: (1 — микроспора с невакуолизированной цитоплазмой; 2 — начало фазы
вакуолизации: образование мелких вакуолей; 3—4 — конец фазы вакуолизации; ядро расположено у внутреннего конца микроспоры, вакуоль — у внешнего;
микроспора в конце фазы роста; ядро находится у внутреннего конца пыльцевого зерна, напротив поры; 5—7 — пыльцевое зерно сразу же после завершения
1 митоза; ядро вегетативной клетки в своем первоначальном положении около генеративной клетки; 6 — каллоза в стенке генеративной клетки (под
УФ-светом); 8 — конец фазы движения ядра вегетативной клетки, расположенного около поры; 9, 10 — конец фазы движения генеративной клетки; в
цитоплазме вегетативной клетки — крахмальные зерна. На всех фотографиях хорошо видна пора с оперкулюмом; В — вакуоль, ВКл — вегетативная клетка,
ГКл — генеративная клетка, Д — диада микроспор, К — каллоза, Кр — крахмал, Оп — оперкулюм, П — пора, Сп — спермин, ТМ — тетрада микроспор,
ЦСп — цитоплазма спермиев, ЯВКл — ядро вегетативной клетки, ЯГКл — ядро генеративной клетки, ЯМ—ядро микроспоры, ЯСп — ядро спермиев,
ЯдВКл — ядрышко ядра вегетативной клетки.
1 — по: Батыгина, Таскаева, 1985; 2 — по: Батыгина, 1987; 3 — по: Романов, 1970; Орел, неопубл. данные.
Рис. 30 (продолжение).
и
s
s
и
й
<
О
«*
I
о
I
л
и
s
s
и
й
■<
О
«*
о
а
в
I
Рис. 31. Поллиний.
t 18 — поллинии у орхидных: 1—4 — число поллиниев в пыльнике: 1 — два, 2 — четыре, 3—4 —
восемь; 5—8 — число поллиниев, расположенных на ножке: 5 — один, 6 — два, 7 — четыре, 8 — восемь;
9—12 — поллинии, прикрепленные к липкой железке: 9—10 — объединенные, 11—12 — раздельные.
Ножка поллиния: 8 — длинная, 13 — короткая, 14 — толстая, 8 — тонкая, 15 — нитевидная, 16 —
прямая, 17 — изогнутая, 6 — четырехугольная, 12 — копьевидная, 9 — обратноконическая, 11 —
цельная. Липкая железка поллиния (прилипальце): 2 — плоская, 17 — узкая, 15 — яйцевидная, 13 —
обратнояйцевидная, 4 — эллиптическая, 9 — дисковидная, 10 — треугольная, 17 —
продолговато-четырехугольная. Форма поллиния: 2 — округлая, 4 — вальковатая, 18 — широкотреугольная.
Консистенция поллиния: 1,11,15 — гранулированная. 19 — поллинии у ластовневых.
Рис.31 (продолжение).
20,21 — пыльца в тетрадах у Victoria cruciana, у Drimus winteri. 22—34 — пыльца и сложные пыльцевые
образования у орхидных: 22—23 — непроросшие и проросшие одиночные пыльцевые зерна у
Cypripedium insigne, 24—32 — непроросшие и проросшие пыльцевые зерна, соединенные в тетрады у
Calanthe ueithii, 33—34 — непроросшие и проросшие пыльцевые зерна, соединенные в массулы у
Platantera bifolia. 35 — расположение трех типов экзин на поверхности пыльцевых зерен,
объединенных в массулы у Peristylus spiranthes (схема); ж — железка поллиния, н — ножка поллиния, п —
поллиний; Е — тетрада, А — массу ла, Т — тапетум; I — тип I экзины, II — тип II экзины, III — тип
III экзины.
1—18 — по: Федоров, Артюшенко, 1975; 19 — по: Цвелев, 1981; 20 — по: Khanna, 1967; 21 — по: Bhan-
dari, Vencataraman, 1968; 22—34 — по: Поддубная-Арнольди, 1976; 35 — по: Zee, Siu, 1990.
Рис. 32. Пыльник — гистохимические и ультраструктурные аспекты.
1 А—Н — Prosopis juliflora. Микрофотографии поперечных срезов пыльника: А — окраска пирони-
ном Y; В, С, F, Н — окраска Кумасси бриллиантовым синим; D, E, G — окраска периодной кислотой
и реактивом Шиффа (ШИК-реакция). А — четырехгнездный пыльник, видны спорогенные клетки с
цитоплазмой богатой РНК и пиронинофильными ядрышками (х 250); В — гнездо пыльника, стенка
гнезда дифференцирована на эпидерму, эндотеций, два средних слоя и вакуолизированный тапетум;
спорогенные клетки с крупными ядрами, цитоплазма насыщена ядерными белками (х 7 50); С — гнездо
пыльника на стадии материнских клеток микроспор, хорошо прослеживаются межклеточные связи в
тапетуме (стрелки) (х 600); D — фрагмент гнезда пыльника на стадии тетрад микроспор, видно
растворение оболочек клеток тапетума, каждая клетка тетрады имеет примэкзину, дающую ШИК-по-
ложительную реакцию, вокруг тетрад сохраняются целлюлозные оболочки материнских клеток, а
отдельные микроспоры имеют зачаточные апертуры (х 600); Е — гнезда пыльника, виден эндотеций
с хорошо развитыми U-образными, ШИК-положительными фиброзными утолщениями (х 300); F —
участок гнезда пыльника на ранней стадии созревания пыльцевого зерна, в результате митоза
сформирована маленькая генеративная клетка около стенки микроспоры, различимы три отчетливые
апертуры прорастания со слабо развитой экзиной (х 750); G — зрелые пыльцевые зерна на стадии цветения,
экзина слабо прокрашивается, интина же красится интенсивно, генеративная клетка веретеновидной
формы обладает тонкой, ШИК-положительной оболочкой и заключена в цитоплазму вегетативной
клетки (х 750); Н — генеративная клетка рано делится на две удлиненные клетки спермиев,
интенсивно прокрашивающиеся на общий белок, вегетативное ядро и пара спермиев тесно связаны (х 600);
са — каллоза, е — экзина, en — эндотеций, ер — эпидермис; gc — генеративная клетка, i — интина,
ml — средние слои, nunc — материнская клетка микроспор, рх — примэкзина, s1, s2 — спермин, sp
— спорогенная клетка, t — тетрада, tp — тапетум, vc — вегетативная клетка, vn — вегетативное ядро.
2 А—F: А, В — Sesbania speciosa; С—F — Prosopis juliflora; А — микрофотография участка
поперечного среза пыльника, окрашенного пиронином Y, показана слабо прокрашивающаяся цитоплазма и
пиронинофильные ядрышки ядер материнских клеток микроспор, виден темноокрашенный, в форме
полумесяца чехлик ядрышка (х 1000); В — фрагмент части материнской клетки микроспоры в ранней
профазе (стадия пахитены), чехлик ядрышка прижат к ядерной мембране (стрелка), в цитоплазме
клеток обнаруживаются профили гранулярного ЭР, рибосомы, плейоморфные митохондрии,
пластиды и везикулы (ТЭМ х 19025); С — фрагмент гнезда пыльника с частью среднего слоя, тапетума и
тетрадами микроспор, цитоплазма клеток тапетума электронноплотная, насыщена везикулами, про-
орбикулы пронизывают оболочки клеток тапетума и проникают в гнездо пыльника, где они
покрываются спорополленином и преобразуются в орбикулы (ТЭМ х 4350); D — увеличенный фрагмент клетки
тапетума снимка «О с про-орбикулами, непосредственно связанными со стопками цистерн ЭР (ТЭМ
х 39000); Е — периферический участок тетрады микроспор, пробакулы выглядят как небольшие,
квадратные или клинообразные блоки, отходящие от плазмалеммы микроспор (ТЭМ х 38750); F —
увеличенный участок снимка «О, обнаруживающий срастание дисков спорополленина вокруг про-
орбикул (ТЭМ х 18900); al — гнездо пыльника, са — каллоза, m — митохондрия, ml — средний слой,
mmc — материнская клетка микроспор, п — ядро, пи — ядрышко; о — орбикула, pb — пробакулы, pi
— пластида, ро — про-орбикула, гег — гранулярный эндоплазматический ретикулум, s — споропол-
ленин, tp — тапетум, ve — пузырек.
3 А—F: А—D — Prosopis juliflora; E, F — Albizzia lebbek; A — фрагменты клеток среднего слоя на
стадии тетрады микроспор, видны многочисленные хлоропласты с хорошо развитыми тилакоидами и
зернами крахмала (ТЭМ х 13250); В — эндотеций на стадии вакуолизированнои микроспоры,
обнаруживающий хорошо развитые U-образные утолщения с отчетливой фибриллярной структурой (ТЭМ х
4875); С — периферическая часть дегенерирующего тапетума со сложными орбикулами,
выстилающими гнезда пыльника на стадии одноядерных микроспор (ТЭМ х 22275); D — фрагмент
вакуолизированнои микроспоры, прилегающей к дегенерирующему тапетуму, цитоплазма микроспор
становится менее плотной и более вакуолизированнои, что сопровождается утолщением и комплексациеи
экзины, оболочка пыльцы дифференцирована на сэкзину (тектум и бакула) и нэкзину 1
(подстилающий слой), нэкзина 2 (эндэкзина) более электронноплотная, чем нэкзина 1, интина в поцессе
дифференциации (ТЭМ х 18900); Е — пыльник, вскрывающийся щелью с рассеивающимися полиадами
(СЭМ, х 550); F — часть полиады с пыльцевыми зернами, богатыми липидами, экзина двуслойная с
сэкзиной, приуроченной только к наружной поверхности полиады, в то время как нэкзина прикреплена
к слою интины и окружает каждое пыльцевое зерно, экзина обладает наружной округлой поверхностью
из-за постоянного контакта с орбикулами (ТЭМ, х 3800); Ьа — бакула, ch — хлоропласт, en —
эндотеций, end — эидэкзина, fo — подстилающий слой, ft — фиброзные утолщения, i — интина, ml —
средний слой, п — ядро, пе — нэкзина, о — орбикула, р — полиада, ро — про-орбикула, se — сэкзина,
sg — зерно крахмала, te — тектум, tp — тапетум.
4 — Albizzia lebbek, поперечные срезы пыльника: А, С, D, G — микрофотографии препаратов,
окрашенных на ШИК-реакцию; F — окраска реактивом Шиффа; В, Е, Н — микрофотографии
(флуоресцентная микроскопия); А — гнездо пыльника с двумя материнскими клетками пыльцы, слои стенки
пыльника: эпидерма, эндотеций, средний слой и тапетум (х 250); В — гнездо пыльника на стадии
четырех материнских клеток пыльцы, непрерывная каллозная оболочка окружает материнские клетки
пыльцы, светящаяся точка в центре обозначает место контакта оболочек материнских клеток (х 225);
С, D — гнезда пыльника с тетрадами микроспор, тетрады окружены каллозной оболочкой с цитомик-
тическими канальцами (стрелки) на внутренних стенках (С — х 500; D — х 600); Е — отдельные
пыльцевые зерна полиады отделены друг от друга отложениями каллозы, более тонкими кнаружи и
утолщенными между пыльцевыми зернами (х 600); F — полиада на одноядерной стадии с отчетливо
прокрашивающимися ядрами, тапетум лизирует орбикулы, производные тапетума, плотно покрывают
развивающиеся полиады (х 600); G — гнездо пыльника на двуядерной стадии полиад, в полиадах
несколько пор располагается снаружи, в то время как остальные расположены по углам, эндотеций
характеризуется ШИК-положительными фиброзными утолщениями (х 600); Н — гнездо пыльника с
покрытым экзиной пыльцевым зерном, флюоресцирующим благодаря наличию спорополленина,
внутренние тангентальные стенки клеток тапетума покрыты флюоресцирующими орбикулами,
образующими мешок вокруг полиад (х 600); al — гнездо пыльника, ар — апертура, са — каллоза, en —
эндотеций, ер — эпидермис, ех — экзина, ml — средние слои, п — ядро, о — орбикулы, рте —
материнские клетки пыльцы, se — сэкзина, td — тетрада, tp — тапетум.
5 А—Н — Prosopis juliflora, железки на пыльниках: А — СЭМ; В, D, F — микрофотографии
препаратов, окрашенных периодной кислотой с реактивом Шиффа; С, Е, G, Н — микрофотографии
препаратов, окрашенных Кумасси бриллиантовым синим. А — зрелый бутон, показаны пыльники с железками
(х 50); В — продольный срез молодого пыльника с апикальной железкой, железка является придатком
связника пыльника, располагается над гнездами пыльника, клетки железки связаны хорошо
развитыми прямоугольными эпидермальными клетками (х 250); С — зрелая железка пыльника с хорошо
прокрашивающимися секреторными клетками ее сферической головки, богатой белоксодержащими
включениями, эпидермальные клетки с плотной цитоплазмой, покрыты слоем кутикулы (х 250); D —
часть железки пыльника перед началом экстрацеллюлярной секреции, клетки головки железки
насыщены внутриклеточным полисахаридным секретом, эпидермальные клетки покрыты слоем кутикулы,
а секреторные клетки ваполнены гранулами полисахаридов (х 600); Е, F — части железок пыльника
в фазе секреции, видна дегенерация протопластов секреторных клеток, содержимое и эксудат которых
богаты белком; когда давление скапливающегося секрета достигает максимума, кутикула
отслаивается от оболочки эпидермальных клеток и эксудат выдавливается наружу екзозь мелкие поры в
кутикуле (стрелки) (х 480); G — то же самое; виден лизис секреторных клеток и выделение лизиро-
ванного содержимого вместе с гранулами (стрелки), дающими положительную реакцию на
полисахариды (х 480); Н — то же самое, с насекомым, пойманным железкой пыльника, вероятно, при поедании
корма (х 200); а — пыльник, си — кутикула, ер — эпидермис, ех — эксудат, g — железка, in —
насекомое, ре — лепесток, sc — секреторные клетки, st — черешок.
,%т4У) /fn-tf
Рис. 32, 1.
^^^''^•■'•^«^'ИЙИВмюи.,,,
Рис. 32, 2.
Ч&!ЗГ**«ЫЖ
Рис. 32, 3.
....*■ /%S
Рис. 32, 4.
fi
V ^ , ПТМ iff* И
Рис. 32, 5.
Рис. 33. Цитомиксис.
1 —8 — процесс миграции протопластов в спорогенных клетках пшенично-ржаных амфидиплоидных
гибридов и последствия цитомиксиса: лептонема (1), пахинема (2), метафаза (3, 4), профазные
хромосомы и капли хроматина в диакинезе (5), то же в пахинеме (6), микроклетки, обособившиеся
вокруг мигрировавшего хроматина и тетрада микроспор после утраты хроматина (7), то же в стадии
диад микроспор (8).
1—3 — по: Орлова, 1971; 5, 7 — по: Орлова, 1976 (см. Поддубная-Арнольди, 1976, стр. 126,127);
4, 6, 8 — Орлова, ориг.
Рис. 34. Цитоплазматическая мужская стерильность (ЦМС).
1 — микроспора кукурузы техасского типа ЦМС, вакуолизация протопласта; 2 — гипертрофия тапе-
тума в микроспорангиях кукурузы техасского типа ЦМС; 3 — микроспорангий кукурузы «С» типа
ЦМС, сильно вакуолизированные тапетальные клетки с утолщенными оболочками сжимают
дегенерирующие микроспоры.
1 —3 — Симоненко, ориг.
Рис. 35. Зародышевые мешки в пыльниках.
1 —23 — Развитие зародышевых мешков из пыльцевых зерен у Hyacinthus orientalis (1 —22) и Hordeum
vulgare (23): 1, 11 —15 — нормальные микроспоры и пыльцевое зерно; 2—6,16—21, 23 —
последовательные стадии формирования зародышевых мешков из микроспоры; 7—10 — формирование
зародышевых мешков отклоняющихся типов с различным характером распределения ядер (и клеток) по
полюсам (7, 8 — четырех-, 9 — восьми-, 10 — пятнадцатиядерные зародышевые мешки); 12—14,
22 — последовательные стадии процесса оплодотворения зародышевых мешков, полученных из
пыльцевых зерен, 24 — процесс микроспорогенеза и вариации в поведении Микроспоры у Heachera mic-
rantha (схематизировано).
1—10,15—21 —по: Stow, 1930, с изменен.; 23 —Батыгина, ориг.; 11—14 — по: Stow, 1933,
с изменен.; 24 — по: Vijayaraghavan, Ratnaparkhi, 1977.
Рис. 35 (продолжение).
■iW
22
Рис. 35 (продолжение).
CM
t
s
я
u
й
<
о
ч
о
а
в
ел
и
S
а,
° А Б В Г Д
Рис. 36. Типы семязачатков.
1 —6 — типы семязачатков: А — ортотропная серия: 1 — ортотропный; 2 — орто-кампилотропный; 3
— орто-амфитропный; Б — анатропная серия; 4 — анатропный; 5 — ана-кампилотропный; 6 —
ана-амфитропный; 7 — схема связей различных морфологических типов семязачатков: А —
ортотропный; Б — анатропный; В — гемитропный; Г — кампилотропный: а — орто-кампилотропный; б —
ана-кампилотропный; Д — амфитропный: в — орто-амфитропный; г — ана-амфитропный; д — гипер-
тропный; е — орто-цирцинотропный; ж — ана-цирцинотропный; 8 — типы семязачатков в зависимости
от положения в завязи: А, Б — эпитропный; В, Г — апотропный; Д — плевротропный; б в — базальный
вырост семязачатка, и — интегумент, м — микропиле, н — нуцеллус, ф п — фуникулярный
проводящий пучок, х — халаза.
1 —6 — по: Bocquet, 1959; 7 — по: Савченко, 1973.
и В и
и н и
с т
пр т
Рис. 37. Примордий семязачатка. Археспорий.
1 — типы заложения семязачатков (нижний ряд: А — трехзонные, Б, В — двухзонные) и
соответствующие типы семязачатков по строению нуцеллуса (верхний ряд: Г — крассинуцеллятные, Д—3 —
тенуинуцеллятные), видны эпидермальный (1), субэпидермальный (2) и третий (3) слои меристемы;
Рис. 37 (продолжение).
2—13 — организация примордия семязачатка и начало дифференциации в нем структур: у крассину-
целлятного семязачатка Paeonia lactiflora с многоклеточным археспорием (2—4); у крассинуцеллят-
ного семязачатка Nymphaea gigantea с одиоклеточным археспорием (5—9); у тенуинуцеллятного
семязачатка Gentiana cruciata с одноклеточным археспорием (10—13); а — археспорий, г — слой
клеток гипостазы, и в и — инициали внутреннего интегумента, иг — инициали гипостазы, uu —
инициали интегумента, и ни — инициали наружного интегумента, м — мегаспороцит, с к — спороген-
ная клетка, ст. — спорогенная ткань, пт. — париетальная ткань, пр т — прокамбиальный тяж.
1 — по: Вошпап, 1984, с изм.; 2—4 — Шамров, ориг.; 5—9 — по: Шамров, Винтер, 1991, с изм.;
10—13 — по: Шамров, 1990.
Рис. 38. Нуцеллус (мегаспорангий). Эпидермис нуцеллуса. Нуцелляриый колпачок.
Париетальная ткань нуцеллуса.
1 — схема первых этапов формирования толстостенного (А, Б, Б/) и тонкостенного (А, В, В/, В2)
нуцеллуса: периклинальные деления в субэпидермальном слое приводят к формированию
многослойной стенки, окружающей мегаспороцит (Б, Б/); при отсутствии периклинальных делений в
субэпидермальном слое (В) и разной интенсивности роста мегаспороцита и подлежащих клеток третьего слоя
формируется двухслойная (ВО или однослойная (В2) стенка;
п т
Рис. 38 (продолжение).
2—8 — формирование многослойного нуцеллуса у Triglochin palustre; видно периклинальное деление
в субэпидермальном слое, а также периклинальные деления париетальной клетки и эпидермиса в
апикальной зоне нуцеллуса;
Рис. 38 (продолжение).
9—12 — формирование париетальных слоев и их ранняя дегенерация у Smilacina stellata;
Рис. 38 (продолжение).
13—19 — формирование и дегенерация однослойного нуцеллуса у Lathraea squamaria; 20—22 —
формирование однослойной стенки нуцеллуса и сохранение ее в период мегаспорогенеза у Sambucus
racemosa (20) и S. coreana (21, 22);
н к
п т
Рис. 38 (продолжение).
23—29 — разная степень развития и дифференциации микропилярной, латеральной и халазальной
зон нуцеллуса в сформированном семязачатке: 23 — Myriophyllum spicatum; 24 — Houttuynia cordata;
25 — Poly gala major; 26 — Rhoeo discolor; 27 — Melo sativus;
э н
Рис. 38 (продолжение).
28 — Sonneratia caseolaris; 29 — Alcea rosea (схематизировано); 30—37 — примеры преобразования
клеток эпидермиса нуцеллуса: 30 — периклинальные деления апикальных клеток эпидермиса у Betula
verrucosa; 31 — удлинение апикальных клеток у Portulaca grandiflora;
Рис. 38 (продолжение).
32 — периклинальные деления эпидермальных клеток в латеральной зоне нуцеллуса у Calathea
louisae; 33, 34 — радиальное растяжение эпидермальных клеток нуцеллуса у Drosera rotundiflora;
35—37 — отложение слизи в эпидермальных клетках у Reseda lutea; 38 — микропилярная часть
семязачатка Peperomia pellucida: видны извилистость наружной стенки эпидермальных клеток
нуцеллуса и внутренней стенки интегументальных клеток, заполненных танинами; а — археспорий, и —
интегумент, л з н — латеральная зона нуцеллуса, м з н — микропилярная зона нуцеллуса, же —
мегаспороцит, н — нуцеллус, н к —нуцеллярный колпачок, пт — париетальная ткань, х зн —хала-
зальная зона нуцеллуса, зн — эпидермис нуцеллуса.
1—6, 13, 19 — Никитичева, ориг.; 7, 8 — по: Никитичева, Проскурина, 1990; 9—12 — по: Сатарова,
1990; 20—22 — по: Камелина и др., 1987 (рис. Н. Г. Тучиной); 23 — по: Никитичева, 1985; 24 — по:
Никитичева, 1981а; 25 — по: Никитичева, 1985г; 26 — по: Фрейберг, 1990; 27 — по: Дзевалтовский,
1983; 28 — по: Камелина, 1985в; 29 — по: Плиско, 1982; 30 — по: Навашин, 1951; 31 — по: Батыгина,
1983в; 32 — по: Камелина, 1990а; 33—34 — по: Терехин, 1985; 35—37 — по: Чабан, Яковлев, 1974;
38 — по: Никитичева, 19816.
Рис. 38 (продолжение).
39 — фрагмент клеток эпидермиса нуцеллуса с пальцеобразными выростами в интегумент у Poperomia
blanda (CM), 40 — микропилярная часть нуцеллуса Alcea rosea, видна дифференциация на различные
ткани, обозначенные цифрами 1—5, СМ (х 360); 41—44 — фрагменты клеток микропилярной части
нуцеллуса A. rosea из тканей, отмеченных на рис. 40 цифрами 1 (41, 42), 2 (43) и 5 (44), ТЭМ (41 —
х 44000), 42 — х 20400, 43 А — 43000,43 Б — х 12500, 43 В — х 28400,43 Г — х 28400,43 Д — х 16000,
44 А — х 25000, 44 Б — 27000, 44 В — х 36500, 44 Г — х 9400); 45 — фрагменты клеток однослойного
нуцеллуса (нк) Calendula officinalis, ТЭМ (А — живой клетки, х 18000, Б — дегенерирующей клетки,
х 25000); в — вакуоль, д — диктиосома, и — интегумент, ко — клеточная оболочка, л — лейкопласт,
лк — липидная капля, м — митохондрия, мл — мультивезикулярное тело, пг — пузырек Гольджи,
пэр — петлевидный ЭР, спп — секрет в периплазматическом пространстве, ст — сферическое тело;
тэр —трубчатый ЭР; tj — цитосома; ирр — цистерноидный ЭР, э н — эпидермис нуцеллуса, я — ядро;
яд — ядрышко.
39 — по: Никитичева и др., 1981; 40—44 — по: Плиско, 1980; 45 — по: Плиско, 1982.
X
/' «эр
t ,
ч .
773
1 I
-'" /V":.//
I'
/^ Г
* '
,*K-
vt.
<*s
r - • .-' % УГ &<
'/**• * - A rf^-z*: <* \) * *■ * *
^ * its / » » - Ti*(* e- >»^ /i. *
/V//7?
-//
Рис. 38 (продолжение).
К яд
Л, i
1 *Ч ^
;-j\
^Jf*4l
_х -^.<-Olj«S!s
,'.i >*
^4'
^*«ь^-
^^_
4>
Рис. 38 (продолжение).
Ч-'*Ш
t^ife^ ^
?s
Ж 'г* j
3*
h^43a
>rVf f» Ж> "% 0>% 4rirf <; - , ** jff. ' '
•a
-"S
Рис. 38 (продолжение).
2 fjd'.^ ~ -
/ 4* cffi~*\i*
1 * м>
'•КФ н
•«•#-.
? » »f» JD « КГ
W
■^v1
^
Щ
СП71
I
У7/Г
^/4S
44г
Рис. 38 (продолжение).
Л* * J . .
?4
/Л
J
'45a
Рис. 38 (продолжение).
Рис. 39. Мегаспороцит и мегаспорогенез.
1 — нуцеллус с мегаспороцитом на стадии профазы I, кроющая клетка делится антиклинально;
2—4 — мегаспорогенез у Oenothera, флуоресценция каллозных стенок после окрашивания
анилиновым синим: мегаспороцит (2); диада, в микропилярной зоне отсутствует каллоза (3); тетрада мегаспор,
отсутствует флюоресценция в микропилярной и боковых стенках функциональной мегаспоры (4);
5—7 — мегаспороциты у Epipactis (Orchidaceae), флуоресценция каллозных стенок: мегаспороцит (5),
диада (6), халазальная стенка мегаспороцита, каллоза перфорирована подобно ситу (7); 8 —нуцеллус
Epipactis, пластиды с крахмальными зернами (темные), сконцентрированные в микропилярной части
мегаспороцита; 9 — цитоплазматическая область мегаспороцита Liliam в профазе I, многослойные
цитоплазматические тела.
I
1
1
и
S
a,
l<»
s 2
is-
&
о
с
ю
4)
s
ь>
в
tit
о.
о
с
и
2
0>
S
3
с
3
А
о
S
и н и
Рис. 41. Интегументы.
1 — одновременное залошение внутреннего и наружного интегументов из эпидермальных клеток
примордия семязачатка Luzula pedemontana; 2,3 — формирование единственного интегумента за счет
эпидермальных и субэпидермальных инициален у Ceratophyllum demersum;
n m
и т
Рис. 41 (продолжение).
4,5 — формирование унитегмального семязачатка Gentiana cruciata; 6 — одна из стадий развития би-
тегмального семязачатка Cytinus ruber, наружный интегумент в зачаточном состоянии;
Рис. 41 (продолжение).
7 — битегмальный семязачаток Begonia manicata, оба интегумента образуют микропиле; 8 —
семязачаток Cananga odorata с наружным, внутренним и средним интегументами; 9 — микропилярный
воротничок у Triantia fugas; 10 — фрагмент наружного интегумента развивающегося семени
Grossularia downingiana; 11—14 — возможные пути перехода от би- к унитегмальности: редукция
наружного интегумента (11), редукция внутреннего интегумента (12), слияние интегументов (13),
элиминация интегумента (14); в и — внутренний интегумент, г — гипостаза, ибон —инициали
базальной области нуцеллуса, и ей — инициали внутреннего интегумента, ии — инициали
интегумента, илон — инициали латеральной области нуцеллуса, и ни — инициали наружного интегумента,
и п — интегументальная паренхима, и т — интегументальный тапетум, м в — микропилярный
воротничок, ни — наружный интегумент, пд — подиум, п к — париетальная клетка, пт — прокамби-
альный тяж, с к — спорогенная клетка, ф — фуникулус, х — халаза.
1 — по: Шамров, Анисимова, 1993; 2, 3 — Шамров, ориг.; 4, 5 — по: Шамров, 1990; 6 — по: Терехин,
Анисимова, 1981; 7 — по: Анисимова, 1983; 8 — по: Corner, 1949; 9 — по: Chikkannaiah, 1962; 10 — по:
Комар, 1965; 11 —14 — по: Bouman, 1984.
Рис. 42. Интегументальный тапетум.
1 —9 — развитие и строение интегументального тапетума: Halesia Carolina (1 —4, 4а, 5), Alniphyllum
fortunei (6) (Styracaceae), Nymphoides humboldiana (Menyantaceae) (7) и Calendula officinalis (8, 9)
(Asteraceae); 10—12 — схема ультраструктурной организации клеток интегументального тапетума у
Calendula officinalis на разных стадиях развития семязачатка: с четырехъядерным (10) и зрелым (11)
зародышевым мешком и в период раннего эмбриогенеза (12); 13—24 — интегументальный тапетум в
семязачатке перед оплодотворением (13—18) и на стадии глобулярного проэмбрио (19—24) у
Verbascum thapsus (13, 19), Melampyrum nemorosum (14, 20), Tozzia alpina (15, 21), Lathraea
squamaria (16, 22), Bartsia alpina (17, 23) и Cistanche flava (18, 24) из семейств Scrophulariaceae и
Orobanchaceae (5 — поперечный срез семязачатка, остальные — продольные срезы семязачатков);
г — гипостаза, и т. — интегументальный тапетум, мг — микропилярный гаусторий эндосперма, х г —
халазальный гаусторий эндосперма, э — эндосперм.
1 —4,6 — по: Никитичева, 1983, сизм.; 5 — Никитичева, Шамров, ориг.; 7 — по: Батыгина, Колесова,
1987;8—12 —по: Плиско, Васильев, 1971; 13—24 — по: Никитичева, 1979.
11'
10
?2
Рис. 42 (продолжение).
Рис. 42 (продолжение).
I
<•! *•&?•
ooqQqqoO a
-i Qq a « а в о
02м
м г
х г
Рис. 42 (продолжение).
Рис. 42 (продолжение).
25, 27 — фрагменты клеток интегументального тапетума на стадиях четырехъядерного зародышевого
мешка (25, см. схему 26) и торпедовидного зародыша (27, см. схему 28) Valeriana officinalis, крахмал
в интегументальном тапетуме не аккумулируется в отличие от интегументальной паренхимы (25), на
оболочках клеток интегументального тапетума, обращенных к зародышевому мешку, кутикула
(стрелка) еще наблюдается;
Рис. 42 (продолжение).
29, 30 — строение интегументального тапетума на стадии семязачатка с глобулярным зародышем
Tozzia alpina (29) и Lathraea squamaria (30); an — амилопласт, в — вакуоль, г.э.р. — гранулярный
эндоплазматическии ретикулум, и.т — интегументальный тапетум, к — кутикула, к.з — крахмальное
зерно, к.о — клеточная оболочка, л.к — липидная капля, лп — лейкопласт, лс — ломасома, м —
митохондрия, пл — плазмалемма, пд — плазмодесма, ан — эндосперм, я — ядро.
25—28 — по: Камелина, Жукова, 1987; 29—30 — по: Никитичева, 1979.
Рис. 43. Микропиле.
1 — микропиле унитегмального семязачатка Convolvulus scammonia (Convobulaceae); 2 — прямое
микропиле, образованное обоими интегументами у Nitraria schaberi (Nitrariaceae); 3 —
зигзагообразное микропиле Shepherdia argentea (Elaeagnaceae), образованное обоими интегументами; 4 —
микропиле, образованное внутренним интегументом (Diunthus caryophyllus, Caryophyllaceae); 5 —
микропиле, образованное наружным интегументом (Paliurus spina christl, Rhamnaceae); 6 — выход
зародышевого мешка в микропиле (Arechavaletaia uruguayensis, Flacourtiaceae); 7 — выход нуцеллярного клюва
в микропиле (Chrozophora obliqua, Euphorbiaceae); 8 — микропилярный воротничок в семязачатке со
зрелым зародышевым мешком у Calathea louisae (Maranthaceae) ;ви — внутренний интегумент, з м —
зародышевый мешок, м — микропиле, мв — микропилярный воротничок, ни — наружный интегумент,
нк — нуцеллярный клюв, эн — эндостом, эк — экзостом.
1 — по: Никитичева, Проскурина, 1987; 2 — по: Камелина, 1985, с измен.; 3 — по: Проскурина, 1990;
4 — по: Камелина, Яковлева, 1982, с измен.; 5 — по: Батыгина и др., 1987, с измен.; 6 — по: Ventura,
1938; 7 — по: Bor, Kapil, 1976; 8 — по: Камелина, 1990, с измен.
Рис. 44. Ариллус.
1 а, б, в — анатомическое строение ариллуса Ribes nigrum иа разных стадиях развития семязачатка и
семени; 2, 3 — Myristica fragrans: продольный срез семени с развивающимся ариллусом на стадии
многоклеточного проэмбрио (2) и общий вид семени с* ариллусом (3); 4 — развивающееся семя Асго-
trema arnottianum с ариллусом; 5,6 — развивающиеся семена с ариллоидом у Stachyurus praecox (5)
и Chelidonium та jus (6); 7 — почти зрелое семя Euphorbia pilosa с экзостомальным ариллоидом
(кару нкулой). (1,2,4—7 — продольные срезы семязачатка и семени); ар — ариллус, кар — карун-
кула.
1 — по: Комар, 1965а; 2 — по: Камелина, Маметьева, 1982; 3 — по: Velenovsky, 1913; 4 — по: Swamy,
Periasamy, 1955; 5, 7 — по: Corner, 1976; 6 — по: Crete, 1937.
Рис. 45. Обтуратор.
1 — фунику лярный и интегументальный (из наружного интегумента) обтураторы у Victoria amazonica;
2 — интегументальный обтуратор (из внутреннего интегумента) у Leukosyke capitellata; 3 — фунику-
лярный и плодолистиковый (-париетальный) обтураторы у Ruscus hypophyllum; 4, 5 — нуцеллярный
обтуратор у Bqerhavia re panda; 6 — плацентарный обтуратор у Allium caspium; г — гипостава, ц о —
интегументальный обтуратор, ко — нуцеллярный обтуратор, по — плацентарный обтуратор, пл о —
плодолистиковый обтуратор, прп — проводящий пучок, ф о — фунику лярный обтуратор.
1 — по:Шамров, Винтер, 1991; 2 — по: Fagerlind, 1941; 3 —по: Савченко, Комар, 1965; 4, 5 —по:
Bhargava, 1932; 6 — по: Шамров, 1990а.
ПАХИХАЛАЗА
Типовая вариация
Ювенильная вариация
Матурная вариация
Рис. 46. Типы халазы семязачатка цветковых растений (схематизировано).
Объяснение в тексте.
По: Шамров, ориг.
ТИПИКОХАЛАЗА
Типовая вариация
Перихалазальная вариация
ЛЕПТОХАЛАЗА
Рис. 46 (продолжение).
Рис. 47. Халаза. Гипостаза.
1 — начало формирования наружной области халазы у Luzula pedemontana; 2—4 — типикохалазаль-
ные семязачатки, в которых показано положение гипостазы: в основании нуцеллуса и интегументов у
Gagea stipitata (2), под зародышевым мешком у Poly gala major (3, За) uSwertiaiberica (4); 5 — лептоха-
лазальный семязачаток Orobanche cumana.
Рис. 47 (продолжение).
6—9 — перихалазальные семязачатки: схемы (6,7,9), Cissus witiginea (8); 10—13 — пахихалазальные
семязачатки: схемы (11—13), Myristica montana (10); 14—16 — эндопахихалазальные семязачатки:
схемы (15, 16), Bruguiera sexangula (14); 17 — экзопахихалазальный семязачаток Nelumbo nucifera;
18,19 — пахихалазальныйсемязачаток (ювенильнаявариация) Scheuchzeriapalustris; бон — базаль-
ная область нуцеллуса, ей — внутренний интегумент, г — гипостаза, uuox — инициали наружной
области халазы, ни — наружный интегумент, п к — париетальная клетка, прп — проводящий пучок,
ф — фуникулус, х — халаза.
1 — по: Шамров, Анисимова, 1993; 2, 4 — Шамров, ориг.; 3, За — по: Никитичева, 1985; 5 — по:
Анисимова, 1983. 6, 7 — по: Periasamy, 1962b; 8 — по: Periasamy, 1962a; 9, 11—13, 15, 16 — по:
Boesewinkel, Bouman, 1984; 10 — по: Маметьева, Камелина, 1981; 14 — по: Никитичева, Яковлев, 1985;
17 — по: Батыгина, Колесова, Васильева, 1983; 18,19 — по: Никитичева, Проскурина, 1992.
Рис. 48. Фуникулус.
1 — сессильный семязачаток Luzula pedemontana; 2 — фуникулярный семязачаток Nuphar lutea; 3 —
афуникулярный семязачаток Ceratophyllum pentacanthum, видна плацентозалаза; 4 — длинный
фуникулус цирцинотропного семязачатка Psilostachys sericea; 5 — спирально скрученный фуникулус
семязачатка Acacia confusa; 6 — складчатый фуникулус семязачатка Poiverea coccinea; ей —
внутренний интегумент, г — гипостаза, з — завязь, зм — зародышевый мешок, и — ингетумент, н — нуцеллус,
ни — наружный интегумент, нк — нуцеллярныи колпачок, плх — плацентохалаза, прп — проводящий
пучок, ф — фуникулус, х — халаза.
1 — по: Шамров, Анисимова, 1993; 2 — по: Винтер, Шамров, 1991; 3 — по: Шамров, Батыгина, 1988;
4 —6 — по: Kapil, Vasil, 1963.
Рис. 49. Специализированные структуры базальной области семязачатка:
гипостаза, подиум, постамент.
1 — оригинальная схема дифференциации постамента, подиума, гипостазы и проводящего пучка из
меристемы базальной зоны и их дальнейшее развитие в семязачатке крассинуцеллятного (левый ряд),
тенуинуцеллятного (правый ряд) и промежуточного (средний ряд) типов;
Рис. 49 (продолжение).
2—13 — формирование структур семязачатка: «гипостазы» (=постамента в нашем понимании) у
Мауаса fluviatilis (2—7), постамента у Geissoloma marginatum (8, 8а, 9), «гипостазы» (=постамента и,
возможно, собственно гипостазы, в нашем понимании) у Datisca cannabina (10), «гипостазы» (=поста-
мента и гипостазы в нашем понимании) у Brucea amarissima (11), гипостазы у Passerina filiformis (12)
и Antigonon leptopus (13); а к — археспориальная клетка, г — гипостаза, иг — инициали гипостазы,
ипд — инициали подиума, ипс — инициали постамента, пд — подиум, прп — проводящий пучок,
прт — прокамбиальные тяжи, пс — постамент, эп — эпидермис.
1 — Батыгина, Шамров, ориг.; 2—7 — по: Venturelli, Bouman, 1986; 8, 8а, 9 — по: Stephens, 1909; 10 —
по: Boesewinkel, 1984; 11 — по: Nair, Sukumaran, 1960; 12 — по: Guerin, 1916; 13 — по: Солнцева, 1983.
бпд
и б пд
и г
Рис. 50. Подиум. Гипостаза. Оперкулум.
1 —7 — формирование бокаловидного подиума у Ceratophyllum demersum (1 —4)
и Luzula pedemontana (5—7);
X К Э
ви
пр п
пр п
Рис. 50 (продолжение).
9 \
Рис. 50 (продолжение).
8,9 —колонковидный подиум у СагаШа lancaefolia; 10—12,12а, 13,13а, 136 —преобразование ба-
зальной зоны нуцеллуса в колонковидный подиум и формирование оперкулума у Gagea stipitata.
Рис. 50 (продолжение).
б пд — бокаловидный подиум, в и внутренний интегумент, г — гипостаза, и б пд — инициали
бокаловидного подиума, иг — инициали гипостазы, кпд — колонковидный подиум, л он —
латеральная область нуцеллуса, on — оперкулум, по — плацентарный обтуратор, прп — проводящий пучок,
пс — постамент, пт — париетальная ткань, ф — фуникулус, ф о — фуникулярный обтуратор, х —
халаза, хкэ — халазальная клетка эндосперма.
1—3,10—13,12а, 13а, 136 — Шамров, ориг.; 4 — по: Шамров, Батыгина, с изм., 1988; 5—7—по:
Шамров, Лнисимова, 1993; 8,9 — по: Никитичева, Яковлев, 1985.
ПС
Рис. 51. Постамент. Подиум. Гипостаза.
1 —3 — формирование постамента и гипостазы в тенуинуцеллятном семязачатке Gymnadenia conopsea;
4 — постамент в семязачатке промежуточного тпа ТгШсит aestivum; 5—8 — формирование постамента,
подиума и гипостазы в крассинуцеллятном семязачатке Ribes aureum;
Рис. 51 (продолжение).
9, ю — клетки гипостазы на стадии зрелого зародышевого мешка Lycopersicon esculentum, видны
протуберанцы клеточной оболочки; su — внутренний интегумент, в п — вентральный пучок, г —
гипостаза, иг — инициали гипостазы, и пс — инициали постамента, з — зародыш, ко — клеточная
оболочка, кло — клетки обкладки, ни — наружный интегумент, пд — подиум, пл — плазмалемма,
пр — протуберанцы, пс — постамент, ткл — таблитчатые клетки, пт — прокамбиальный тяж, э —
эндосперм, эпн — эпидермис нуцеллуса.
1 —3 — по: Шамров, Никитичева, 1992; 4 — по: Батыгина, 1974; 5—8 — Шамров, ориг.; 9,10 — по:
Ермаков, Горяева, 1982.
Рис. 52. ЗАРОДЫШЕВЫЙ МЕШОК (ЖЕНСКИЙ ГАМЕТОФИТ): ПРОИСХОЖДЕНИЕ
И РАЗВИТИЕ.
1 — Схема развития и начала формирования зародышевого мешка нормального типа: ядра, ближайшие
к наблюдателю, заштрихованы. С левой стороны рисунка показаны три взаимно перпендикулярные
плоскости деления (расхождения) ядер при развитии женского гаметофита. Макроспора А
прорастает, давая двуядерный ценоцит (молодой женский гаметофит) Б с вакуолью в средней части. В
результате второго деления, протекающего в плоскости, перпендикулярной плоскости первого деления,
возникает четырехъядерный ценотитный гаметофит В; ядра показаны в момент максимального
расхождения (В — тот же ценоцит, повернутый на 90°); при «квадратном расположении» В ; В — то же
при «тетраэдрическом» расположении. Г — верхняя (микропилярная) часть ценоцита после третьего
деления ядер во взаимно перпендикулярных плоскостях (Г — то же при повороте вправо на 90°). Ядра
располагаются по вершинам тетраэдра, что отвечает максимальному удалению их друг от друга. Д —
верхняя часть ценоцита в фазе клеткообразования (Д — то же при повороте на 90°); между всеми
ядрами образовались перегородки, в результате чего обособились яйцевой аппарат и северное
полярное ядро; две верхние клетки с сестринскими ядрами (на Д — проектирующиеся друг на друга, а на
Д — видимые в плане) представляют синергиды, третья — яйцеклетку, являющуюся на этой фазе
развития всегда наименьшей, во всех трех клетках яйцевого аппарата ядра отходят от стенок в их
центры. Е — общий вид только что сформировавшегося зародышевого мешка (Е — то же при повороте
вправо на 90°); наверху — микропилярный конец, видны три клетки яйцевого аппарата (в Е синергиды
и антиподы проектируются друг на друга), внизу — халазальный конец, видны три антиподы; оба
полярных ядра, оставшиеся в общей цитоплазме центральной клетки, позднее сблизятся в ее
динамическом центре.
2 — Схема последних фаз развития зародышевого мешка, показывающая происхождение ядер в
результате синхронных митозов и способ вставления перегородок между ними. Все изображено в
проекции на плоскость рисунка. Сестринские пары ядер показаны попарно одинаковым цветом:
А — телофаза последнего (3-го) митоза в женском гаметофите (веретена делений в каждой паре
взаимно перпендикулярны, середина ценоцита занята большой вакуолью); Б — более поздняя фаза
(между сформировавшимися ядрами, расположенными по вершинам тетраэдров, закладываются
клеточные пластинки как в первичных веретенах, соединяющих сестринские ядра, так и во вторичных,
возникающих между несопроизводными ядрами); В — только что сформировавшийся зародышевый
мешок (клетки обособились друг от друга — вверху яйцевой аппарат, внизу антиподы, в середине
центральная клетка с обоими свободными полярными ядрами и с большой вакуолью); Г — последняя
фаза развития зародышевого мешка (полярные ядра слились посредине центральной клетки,
образовав вторичное ядро).
3 — Фазы развития женского гаметофита у Crepis tectorum: 1 — двуядерный гаметофит; ядра
расположены в фокусах эллипсоидальной клетки, готовящейся ко второму делению. Центральная часть
занята большой вакуолью. Справа и слева видны остатки клеток нуцеллуса, поглощенных молодым
гаметофитом. Микропилярный конец нуцеллуса вместе с остатками трех макроспор уже поглощен
нацело. 2 — четырехъядерный гаметофит вскоре после завершения второго деления. Ядра сохраняют
расположение обоих веретен этого деления. Хорошо видно отталкивание ядер в результате их телофа-
тического расхождения: все четыре ядра, разошедшись до предела своими наружными сторонами,
плотно прилегают к границе протопласта и даже образуют выпячивания. Между каждой парой ядер
цитоплазма сохраняет еще явственные остатки первичных веретен. 3 — молодой гаметофит в метафазе
деления всех его четырех ядер (третье деление в гаметофите). Все ядра делятся синхронно;
расположение веретен близко к взаимной перпендикулярности. Веретена располагаются вдоль длинных осей
заключающих их участков цитоплазмы, на максимальных расстояниях друг от друга. 4 —
формирование из микропилярной «тетрады» яйцевого аппарата и северного полярного ядра. Только что
обособившиеся клетки: яйцеклетка, две синергиды и центральная клетка (видна верхняя ее часть). 5 —
халазальная тетрада, примерно та же стадия, что на предыдущем рисунке. Молодой антиподальный
аппарат из уже обособившихся клеток (перегородка, разделяющая две верхние клетки, лежит в
плоскости рисунка) и южное полярное ядро с частью центральной клетки. Сильная вакуолизация
нижней антиподы. При сравнении 1, 2, 3,4 видно измельчание ядер в результате двух
последовательных делений. 6—8 — сформировавшиеся зародышевые мешки (в профиль — 6, 8, анфас — 7);
разрастание всех клеток, отставание яйцеклетки. Движение полярных ядер в центр клетки зачатка
эндосперма; 9 — верхняя часть зрелого зародышевого мешка; синергиды прикрывают яйцеклетку и
снабжены сильно развитыми зубовидными выростами, расположенными в горловине центральной
клетки и вдающимися в мнкропиле, плотно его закрывая. Концы синергид с внутренней стороны
образуют воронковидные углубления; ядра синергид лежат симметрично у основания выступов на
уровне горловины центральной клетки. Женские ядра еще сильно хроматизированы.
4 — Схема, показывающая эволюционный процесс сокращения хода развития женского гаметофита:
А — Coniferales (Pinus); Б — Gnetum; В—Д — Angiospermae; В — моноспорический зародышевый
мешок нормального типа, Г — диспорический зародышевый мешок типа Allium, Д — тетраспориче-
ский зародышевый мешок типа Adoxa; I, II — мейотические деления, 1—11 — последовательные
деления при развитии гаметофита; б — брюшное канальцевое ядро, ш — шейковые канальцевые
клетки, я — яйцеклетка.
1,2,3 (1—5) —по: Герасимова-Навашина, 1958, с измен.; 3 (6—9) —по: Герасимова-Навашина, 1957,
с измен.; 4 — по: Герасимова-Навашина, 1954.
Рис. 52 (продолжение).
('
В
Л
Макроепоро
гемез
I §
о©!
0©6
/Ъзбитие ма/грогаикетерияга
{зародышевого -мешха)
/ г 3 4-7 6 я/о 1L
& хгк&
4
jfpxeee/mu
Рис. 52 (продолжение).
Рис. 53. Яйцеклетка.
1 — микропилярный район зародышевого мешка Alcea rosea до оплодотворения: а—в — три
последовательных среза яйцевого аппарата; г — двуклеточный проэмбрио и сохраняющаяся синергида; д —
амилопласт яйцеклетки (ее прастидный аппарат контрастирует с пластидомом центральной клетки —
ср. с рис. 55 (16, 17) «Центр, кл..»); е — фрагмент апикальной части яйцеклетки на границе с
центральной клеткой; клеточная оболочка между ними отсустствует, плазмалеммы обеих клеток
извилисты;
Н
"iWr*1*" ' „„Л
У ?" %4
4£ ~"йьг~
н а
i '
SP,
1*
I
« к
^ "* ^Цк
"л* .,>"" 'i;
ф]
У
у К
i
f'&£f~
Рис. 53 (продолжение).
2а, б — фрагменты базальной части синергиды A rosea; масштабная линейка — 1 мкм; ам —
амилопласт, в я — вторичное ядро центральной клетки, н — нуцеллус, на — нитчатый аппарат, п —'
проэмбрио, сн — синергида, сен — сохраняющаяся синергида, ц к — центральная клетка, я —
яйцеклетка.
1а — по: Камалова, Жукова, Руми, 1983; 16—е, 2 — Жукова, ориг.
go £5 x* °z°
Рис. 54. Синергида.
1 — микропилярная часть зародышевого мешка Scilla sibirica (A — анфас, Б — в профиль), стрелками
показано направление будущего расхождения спермиев; 2 — схема микропилярнои части
зародышевого мешка Linum usitatissimum, иллюстрирующая взаиморасположение синергид и яйцеклетки; 3 —
схемы микропилярнои части зародышевого мешка ТгШсит до оплодотворения (1, 1а), в момент
оплодотворения (2,2а) и на начальных стадиях Эмбриогенеза (3, За, 4,4а) в дорсовентральном (1 —4)
и билатеральном (1 а—4а) сечении;
Рис. 54 (продолжение).
4 — зрелый зародышевый мешок Parnassia; 5 — синергиды ТгШсит aestivum с зубовидными
выростами; б — синергиды с гаусториальными выростами у Ursinia anthemoides; 7 — синергиды Eucalyptus
cinerea, подобные яйцеклеткам; 8 — воронковидные синергиды Crepis tectorum; 9 — синергиды
Quinchamalium chinen.se с гаусториальными выростами, врастающими в завязь и достигающими
столбика, пронизывая его на 1 /3; 10 — сохраняющаяся синергида и четырехклеточный зародыш Argyrop-
sis Candida;
11 —18 — отдельные последовательные фазы формирования и деструкции гигантской сохраняющейся
синергиды Allium nutans; 19 — фрагмент зародышевого мешка Valeriana officinalis на стадии зиготы
и двуклеточного эндосперма, видна базальная часть сохраняющейся синергиды с запасным
крахмалом; клеточная оболочка микропилярной клетки двуклеточного эндосперма на границе с основанием
сохраняющейся синергиды снабжена выростами стенки; 20 — фрагмент апикальной части
сохраняющейся синергиды в зародышевом мешке Epipactis atrorubens на стадии многоклеточного проэмбрио и
ценоцитного эндосперма; верхушка синергиды имеет лопастевидные выросты, ее клеточная оболочка
прерывиста; обозначения те же, что и на рис. 53 и т — интегументальный тапетум, п я — полярные
ядра, с — синергиды, сп — спермин, эн — эндосперм, я — яйцеклетка, яр — ядро.
1 — по: Герасимова-Навашина, 1958; 2 — по: Vazart, 1971; 3 — по:Батыгина, 1974; 4 — по: Фрейберг,
1985; 5 — по: Батыгина, 1974; 6 — по: Видаяти, 1973; 7 — по: Полунина, 1958а, б; 8 — по:
Герасимова-Навашина, 1957; 9— по: Johri, Agarval, 1965; 10 — по: Ворсобина, Солнцева, 1990; 11—18 — по:
Стожарова, Поддубная-Арнольди, 1977; 19 — по: Камелина, Жукова, 1987; 20 — Жукова, ориг.
* J* a» • : ■> </.
X •
v •
Рис. 54 (продолжение).
Рис. 55. Центральная клетка.
1 —11 —• разнообразие формы центральной клетки зрелого зародышевого мешка цветковых растений
и соотношения ее размеров с размерами других элементов зародышевого мешка (Cercidiphyllum t
japonicum, Davidia invobicrata, Galanthus nivalis, Linum liburnicum, Malpighia glabra , Marcgravia
purpurea, Olax stricta, Paliurus spina christi, Philadelphus schrenkii, Sonneratia apetala, Stackhousia
linariae folia). Видны также варианты местоположения вторичного ядра центральной клетки (1,2,4,
6—8); расположение ядра в ее халазальной части наблюдается не только у видов с гелобиальным типом
развития эндосперма (7), но и с целлюлярным (6); варьирует и локализация полярных ядер, не
завершающих своего слияния перед оплодотворением и находящихся в контакте (3,5,9). Центральная
клетка Philadelphus schrenkii выделяется исключительно сильной вакуолизацией протопласта (8). Рис.
9 иллюстрирует один из вариантов увеличения размеров центральной клетки в процессе созревания
зародышевого мешка путем локального роста на ее халазальном полюсе, приводящего к смещению
антипод в латеральное положение. На рис. 10 приведен зародышевый мешок с центральной клеткой,
формирующей латеральный вырост. У большинства исследованных видов основным запасным
веществом центральной клетки является крахмал (4), у некоторых видов — запасные липиды (11); 12—15
— фрагменты продольных медианных срезов семязачатка Alcea rosea на стадии зрелого зародышевого
мешка (12—14) и схема семязачатка (15). Иллюстрируют центральную клетку сильно вытянутой
формы и соотношение ее размеров с размерами других клеток зародышевого мешка; 16,17 —
фрагменты протопласта центральной клетки A.rosea близ яйцевого аппарата; митохондрии амебоидной '
формы, аппарат Гольджи в состоянии гиперсекреции, пластиды без крахмала; стрелкой (/) отмечен
белковый кристалл пластиды (17); видны также трубочки пластиды, концентрически расположенные
тилакоиды; 18—20 — фрагменты протопласта центральной клетки зародышевого мешка Aconitum
napellus перед оплодотворением: 18,19 — лейкопласты амебоидной формы; 20 — участок цитоплазмы
околоядерной зоны; обозначения те же, что и на рис. 53; д — диктиосома, лп — лейкопласт, м —
митохондрия, я а — яйцевой аппарат, яр — ядро.
1 — по: Swamy, 1948; 2 — по: Narang, 1953; 3 — по: Singh, 1961; 4 — по: Шевченко, Камелина, 1987;
5 — по: Батыгина и др., 1987; 6 — по: Swamy, Bailey, 1949; 7 — по: Остапенко, Хведынич, 1987; 8 — по:
Савина, 1985; 9 — по: Никитичева, 1985; 10 — по: Agarwal, 1963; 11 — по: Камелина, 1985; 12—19 —
Жукова, ориг.; 20 — по: Жукова, Соколовская, 1977.
В зародышевом мешке Malpighia glabra полярные ядра еще не слились.
Рис. 55 (продолжение).
Рис. 55 (продолжение).
t . ч,
'i .
, Л/? :> .*
?1>
5* ^ W&$£r ^
44 t j«CA
1 - /\,
I >,
* f
\
Ф:
M
d
16
Рис. 55 (продолжение).
* - yr
л
Ф.
У7Л
4 *
^f
%
V^£„
г i
Рис. 55 (продолжение).
Рис. 56. Полярные ядра.
1 — микропилярный район вародышевого мешка Allium schoenoprasum, халазальное и микропилярное
полярные ядра одинакового строения; 2 — четыре полярных ядра в центральной клетке зародышевого
мешка Plumbago capensis, развивающегося по Plumbago-типу; 3 — зародышевый мешок Peperomia
rezediflora с нарушенным процессом клеткообразования, в центральной клетке 14 полярных ядер;
4 — гаплоидное микропилярное и триплоидное халазальное полярные ядра в контакте со спермием
Lilium caucasicum; 5 — зародышевый мешок Galanthus nivalis, центральная клетка со вторичным ядром;
6 а—л — последовательные фазы слияния полярных ядер центральной клетки зародышевого мешка
пшеницы в период объединения их со спермием, видно появление большого числа дополнительных
ядрышек в ядре первичной клетки эндосперма, сильно отличающихся по своим размерам и окраске от
ядрышек, выделенных спермием: а, б — спермин на границе двух полярных ядер, в, г, е, ж — спермин
объединяются с одним полярным ядром, д — спермий объединяется сразу с обоими полярными
ядрами, з — ядро первичной клетки эндосперма в интерфазе, и, к — профаза эндосперма, л — мета-
фаза эндосперма (а—д, з—к — Т. aestiuum, в, ж, л — Т. топососсит).
1—5 — по: Гваладзе, 1976; 6 — по: Батыгина, 1974.
Рис. 57. Антиподы.
\ _ готовый к оплодотворению зародышевый мешок Convolvulus scammonia; 2,3 — зародышевый
мешок Triticum (2 — профиль, 3 — анфас); 4,5 — наиболее распространенные варианты расположения
клеток в трехклеточном антиподальном комплексе зрелого зародышевого мешка (4 — ЕиротаПа
laurina, 5 — Royena lucida); 6 — антиподы, имитирующие яйцевой аппарат (зародышевый мешок Scilla
sibirica); такая структура антипод сохраняется и после оплодотворения;
Рис. 57 (продолжение).
7 — антиподы формирующегося зародышевого мешка Crepis tectorum в фазе деления; 8 — отдельные
последовательные фазы созревания зародышевого мешка Nelumbo nucifera (a—в) и момент его
оплодотворения (г), видно увеличение числа клеток антипод (до 8) и ядер в каждой из них (до 5); 9а —
зародышевый мешок Gentianella lingullata; один из редко встречающихся вариантов расположения
антипод в зародышевом мешке цветковых растений; 96 — схема продольного медианного среза
семязачатка того же вида;
Рис. 57 (продолжение).
10 — сохраняющиеся антиподы на одной из заключительных фаз развития семени Cynomorium
songaricum, 11 — некоторые моменты формирования зародышевого мешка Anemone nemorosa на
продольных срезах: а — антиподы одноядерные; 6 — антиподы двуядерные; в — антиподы четырехъ-
ядерные; г — вторично одноядерные антиподы в оплодотворяющемся зародышевом мешке; 12 —
зародышевые мешки Chamaerion dodonaei (a), Ludwigia palustris (б) Oenolhera-типа развития — без
антипод;
Рис. 57 (продолжение).
13 — зародышевый мешок Stipa, показан генезис зародышеподобных антиподальных комплексов
(а—д) (объяснение в тексте); 14 — схема организации халазального полюса зародышевого мешка
Aconitam napellus перед оплодотворением (третья антипода не изображена); 15—17 — фрагменты
цитоплазмы пузыревидной части антипод A.napellus, видны инвагинации лейкопластов (стрелка) и
формирование их оболочкой концентрических мембранных образований (двойная стрелка); 18,19 —
фрагменты халазального полюса зародышевого мешка Aconitam napellus на границе центральной
клетки с антиподами до (18) и после оплодотворения (19); 20 — фрагменты протопластов антипод
зрелого зародышевого мешка Epipactis atrorubens, видны лейкопласты (крахмал не обнаружен; 21,22
— сохраняющиеся антиподы Votervaxm officinalis после деления первичного ядра эндосперма (21, см.
таюке схему на рис. 22) и на стадии двуклеточного эндосперма (22); отмечено наличие мелких
крахмальных зерен в пластидах; обозначения те же, что и на рис. 53; д — диктиосома, кр —
крахмальное зерно, цк — центральная клетка, эп — экстрацеллюлярное пространство.
1 — по: Никитичева, Проскурина, 1987; 2,3 — по: Батыгина, 1974; 4— по: Камелина, 1981; 5 — по:
Никитичева, 1983; 6 — по: Герасимова-Навашина, Батыгина, 1958; 7 — по: Герасимова-Навашина,
1954; 8 — по: Батыгина и др., 1982; Титова, ориг.; 9 — по: Шамров, 1987; 10 — по: Терехин, 1987; 11
— по: Иоффе, 1968, с измен.; 12 — по: Батыгина, 1985; 13 — по: Яковлев, Солнцева, 1965, с измен.;
14—16 — по: Жукова, Соколовская, 1977; 17—20,22 — Жукова, ориг.; 21—по: Камелина, Жукова,
1987.
Рис. 57 (продолжение).
17
femiaaoMEB»! /V К J
J- ''&£•
. ■&.;. *- f«V^4,
""./
18
/5
Рис. 57 (продолжение).
«*• ^«f?»
^ V*JeR£?»&v * ** ^*^ %&*&?* & life'
ъя^-Ш*
Г ^
{,
%*^
20
~ "L/ fif « - L . ft4"* Л "->
?Л
".У Ч * к*
<»0
#Je*
>*Яви
'J..?
2;
Рис. 57 (продолжение).
Рис. 57 (продолжение).
Рис. 58. Ультраструктура мегагаметофита.
1 —3 — локализация каллозных клеточных оболочек в дегенерирующих мегаспорах и клетках диады
Zea mays; окраска обесцвеченным анилиновым синим; эпифлюоресцентный микроскоп (микропиляр-
ный полюс — вверху на всех рис.). Масштабная линейка 10 мкм. 1 — мегаспороцит; каллозная
оболочка обозначена стрелкой; 2 — триада мегаспор, видна каллозная стенка в дегенерирующих
мегаспорах и клетках диады (стрелки без указателя) и в функционирующей мегаспоре; 3 — двуядер-
ный мегагаметофит; видны остатки каллозных оболочек дегенерирующих меиотических клеток
(стрелки без указателя); 4—7 — развитие мегагаметофита Zea mays (ТЭМ). Масштабная линейка 5
мкм; 4 — мегаспороцит. Ядро перемещается к микропилярному полюсу в середине профазы I.
Большинство органелл, содержащих ДНК, локализовано в халазальной части по отношению к ядру; 5 —
функционирующая мегаспора. Вакуолизация начинается с образования мелких, рассеянных по всему
протопласту вакуолей. Ядро расположено в центре или смещено к халазальному полюсу клетки,
органеллы, содержащие ДНК, — в перинуклеарнойзоне; 6 — двуядерный мегагаметофит, видны две
дегенерирующие мегаспоры (стрелки), которые сохраняют положительную реакцию на каллозу (см.
3); центральная вакуоль образуется путем слияния мелких вакуолей. Цитоплазма двуядерного
зародышевого мешка более электронно-плотная, чем окружающих клеток; 7 — четырехъядерный
мегагаметофит и дегенерирующая мегаспора (стрелка); вакуоли сливаются и образуют компартменты,
обладающие, по-видимому, литической активностью; видны также отдельные халазальные и микро-
пилярные вакуоли; ES — мегагаметофит (= зародышевый мешок), FM — функционирующая
мегаспора.
1—7 — по: Russell, 1979.
Рис. 59. Цитокинез в зародышевом мешке.
1 — халазальный конец зародышевого мешка на стадии ранней телофазы третьего митотического деления; видны три сильно ШИК — положительные
клеточные пластинки. Между хроматиновыми массами двух делящихся ядер видны две клеточные пластинки (CPI и СРП), тогда как третья (СР III) более
тонкая и короткая локализована между ними и ориентирована перпендикулярно к ним (СМ); 2 — объемное изображение зародышевого мешка после
завершения цитокинева; 3 — реконструкция зародышевого мешка ячменя на ранней стадии формирования клеточных оболочек яйцевого аппарата; сегменты
клеточных стенок, заканчивающиеся короткими штрихами, объединяются со стенкой зародышевого мешка; сегменты без штрихов оканчиваются в
цитоплазме;
Рис. 59 (продолжение).
4, 5 —халазальная область семязачатка Ranunculus sceleratus (продольный срез, ТЭМ); 4 — видны три клеточные пластинки — CPI, СРП и СРШ; 5— около
клеточных пластинок видны многочисленные цистерны гранулярного ЭР. (4 — х8800; 5 — х 17500); Ап1, Ап2, АпЗ —антиподы, СС— центральная клетка,
СН — халазальная часть, СР — клеточная пластинка, CV — центральная вакуоль, Е — яйцеклетка или ядро яйцеклетки, ЕА1, ЕА2, ЕАЗ — клетки яйцевого
аппарата, Ml — микропилярная часть, Р, PN — полярное ядро, RER — гранулярный ЭР, S — синергида или ядро синергиды.
1,2 — по: Bhandari, Chitralekha, 1989; 3 — по: Cass et al., 1986; 4, 5 — Bhandari, ориг.
Динамика синтеза ДНК
в нижних микропилярных ядрах
четырехъядерных зародышевых мешков
2с
с
2с
с
22% ,
24%
i 2c
с;
и
Triticale
° Triticum aestivum
Galanthus nivalis
Lilium regale
Nicotiana tabacum
0.1
G,
0.5
S
0.9
a
Накопленные частоты, усл. ед.
Рис. 60. Цитохимия зародышевого мешка.
I — динамика синтеза ДНК в нижних микропилярных ядрах четырехъядерного зародышевого мешка
у разных видов; 2 — состояние хроматина в ядрах яйцеклеток зародышевых мешков: I — Triticale,
II — Lilium regale, III — Galanthus nivalis, IV — Nicotiana tabacum. A—Г — количество ДНК (отн. ед.);
а—д — количество РНК (отн. ед.): а, в, г — в ядрах Triticale, Lilium regale, Galanthus nivalis; б, д —
в ядрышках Triticale, Galanthus nivalis; 3 — состояние хроматина в ядрах центральных клеток
зародышевых мешков:
ДНК
РНК
ДНК
100 \-
Jb
РНК
100 -
jjl J J J] Ifl
'if " li"J 1
а б в
где
Рис. 60 (продолжение).
I — Triticale, II — Galanthus nivalis, III — Lilium regale. A—Г — количество ДНК (В — верхнее
полярное ядро, Г — нижнее полярное ядро Lilium regale); а—е — количество РНК: а, в — в ядрах
Triticale, Galanthus nivalis; б, г — в ядрышках Triticale, Galanthus nivalis; д — в верхнем полярном ядре;
е — в нижнем полярном ядре Lilium regale. 4 — состояние хроматина в ядрах синергид зародышевых
мешков: I — Triticale, II — Galanthus nivalis. III — Lilium regale. A—Г — количество ДНК (В —
синергида первая, Г — синергида вторая); а—е — количество РНК: а, в — в ядрах Triticale, Galanthus
nivalis; б, г — в ядрышках Triticale, Galanthus nivalis; д, е — в ядрах первой и второй синергид Lilium
regale. 5 — состояние хроматина в ядрах антипод зародышевых мешков:
РНК
ДНК
100 \г
iffL
111
ли
в
б в
I
г д
Рис. 60 (продолжение),
I — Nicotiana tabacum, II — Triticale, III — Galanthus nivalis. A—В — количество ДНК; а—д —
количество РНК: а, б, г — в ядрах Nicotiana tabacum, Triticale, Galanthus nivalis; в, д — в ядрышках
Triticale, Galanthus nivalis;
I — ДНКпосле обработки препаратов РНК-азой; 2 — свободная РНК, удаляемая РНК-азой; 3 — ДНК
или РНК, связанная с белками; 4 — ДНК или РНК, связанная с липидами. По оси ординат —
интенсивность свечения, (отн. ед.).
I — Хведынич, ориг.; 2—5 — по: Хведынич, 1989.
10 МКМ
Рис. 61. Прижизненные исследования зародышевого мешка.
1а — яйцевой аппарат зародышевого мешка Jasione montana (нефиксированный материал); 1 б —
часть зародышевого мешка Jasione montana перед оплодотворением с полярными ядрами в
центральной его части и яйцеклеткой в микропилярной; 2 а — частично изолированный зародышевый мешок
Galanthus nivalis во время оплодотворения; в халазальной его части кроме антипод видны вторичное
ядро центральной клетки и ядро спермия; 26 — зигота в частично изолированном зародышевом мешке
Galanthus nivalis.
ж* ;ws:.
Ш'* >:'i^ ^'% v^#F '^та>)^.:Д^Ж^^^/ №
gfhM*.', ^«s« :,....# /\ '■■'№■>• „•/ ' i," .<-F -I--'' ■"'и iifjr» ~-'--^\L ;.■■■*.■ f*,f7
If *^V," '^ ^/vt-H" \Ш#Ь'} ,;^-.;^^Ai|L*
^«;?/<:Ж
m
*
Ш
Рис. 61 (продолжение).
За — популяция изолированных зародышевых мешков Nicotiana tabacum, выделенных с помощью
ферментов (х 140); 3 в —изолированный зародышевый мешок с протопластами яйцеклетки, двух
синергид, центральной клетки и двух антипод (х 410).
1 а, 1 б — по: Erdelska — кадры из фильма С 1075/1973, IWF, Gottingen; 2 а, 2 б — по: Erdelska —
кадры из фильма С 1463/1982, IWF, Gbttingen; 3 а, 3 б — по: Sun Meng — xiang, Yang Hong-yuan, Zhou
Chang, Acta Bot. Sinica (в печати).
10
Рис. 62. Oenothera-тип развития зародышевого мешка.
1 —58 — развитие зародышевого мешка Oenothera-типа: по классическому варианту — у Chamaenerion
dodonaei (Onagraceae) (1—5) и Schisandra-подтипу — у Schisandrachinensis (Schisandraceae) (6—22),
Cabomba caroliniana (Cohombaceae) (23—33), Nuphar lutea (Nymphaeaceae) (34—46), Hydrostemma
longifolia (Barclayaceae) (47—58).
1 —5 — по: Батыгина, 1985; 6—10 — no: Yoshida, 1962; 11 —22 — no: Swamy, 1964; 23—33 — по: Баты-
гина, Шамров, Колесова (Титова), 1982; Титова, 1988; 34—58 — по: Винтер, 1987.
Рис. 62 (продолжение).
Рис. 62 (продолжение).
Рис. 62 (продолжение).
58
Рис. 62 (продолжение).
Рис. 63. Allium-тип развития зародышевого мешка.
1—6 — последовательные стадии развития зародышевого мешка Allium, schoenoprasum: диада (1);
деление нижней клетки диады (2);дву-, четырех-и восьмиядерная стадии развития зародышевого
мешка (3—5); сформированный зародышевый мешок (6).
1—6 — по: Гваладзе, 1976.
17 18 19 20
Рис. 65. Balsamita-тип развития зародышевого мешка.
1 —9 — последовательность развития зародышевого мешка по Balsamita-типу (схема);
10—20 — мегаспорогенез и развитие зародышевого мешка Balsamita vulgaris: мегаспорогенез (10—
12), ценоцитный тетраспорический мегаспороцит с тремя дегенерирующими халазальными ядрами
(13), развитие зародышевого мешка и формирование халазального выроста (14—18),
сформированный и зрелый зародышевый мешок (19—20) с трехклеточным яйцевым аппаратом, центральной
клеткой и тремя антиподами, две из них многоядерные, халазальная имеет вырост и содержит ядро и
три пикнотических споровых ядра.
1—9 — по: Романов, 1971; 10—20 — по: Fagerlind, 1939.
Рис. 66. Drusa- тип развития зародышевого мешка.
1 — мегаспороцит; 2 — двуядерный ценоцит; 3 — анафаза мейоза II; 4 — распределение ядер мегаспор
1+3; 5 — анафаза III деления; 6 — восьмиядерный зародышевый мешок с распределением ядер 2+6;
7 — метафаза IV деления; 8 — поздняя телофаза IV деления, усиление депрессии по направлению к
халазальному концу; 9 — нижнее полярное ядро и антиподы в сформированном зародышевом мешке;
(1,7,8 — Tulipa korolkooil; 2, 3, 5,6,9— Т. nitida; 4 — Т. wilsoniana).
1 —9 — Печеницын, ориг.
Рис. 67. Fritillaria- тип развития зародышевого мешка.
1 — профаза мейоза I; 2 — телофаза мейоза 1, образование клеточной пластинки; 3 — метафаза мейоза
И; 4 — первичный четырехъядерный зародышевый мешок; 5, 6 — распределение ядер мегаспор 1+3;
7 — метафаза III деления; 8 — вторичный четырехъядерный зародышевый мешок; 9 — поздняя
телофаза IV деления; (1,2,6 — Tulipaanadroma; 3, 5,7 —Т. aj'finis; 4,8 — Г. tschimganica; 9 —
Т. Julia).
1 —9 — Печеницын, ориг.
Рис. 68. Plumbagella-тип развития зародышевого мешка.
1 —6 — развитие зародышевого мешка Plumbagella micrantha: I — мегаспороцит с четырьмя ядрами
мегаспор; 2—4 — образование двух гаплоидных ядер в микропилярной части зародышевого мешка,
слияние трех ядер и последующее деление с образованием двух триплоидных ядер в халазальнои
части; 5 — сформированный зародышевый мешок с яйцеклеткой, центральной клеткой и антиподой;
6 — зрелый зародышевый мешок с яйцеклеткой и центральной клеткой.
1 —4 — по: Boyes, 1939; 5, 6 — по: Dahlgren, 1916.
Рис. 69- Adoxa- тип развития зародышевого мешка.
1 — мегаспороцит; 2 — двуядерный ценоцит; 3 — анафаза мейоза II; 4 — начало распределения ядер
мегаспор (2+2); 5 — профаза III деления; 6 — поздняя телофаза III деления; 7 — восьмиядерный
зародышевый мешок; 8,9 — халазальный конец сформированного зародышевого мешка; (1,4 — Tulipa
kolpakovskiana; 2, 3, 5—9 — Tulipa tetraphylla).
1 —9 — Печеницын, ориг.
Рис. 70. Tulipa tetraphylla- тип развития зародышевого мешка.
I 1 — профаза мейоза 1; 2 — метафаза мейоза 1; 3 — профаза мейоза II; 4 — анафаза мейоза II; 5 —
четырехъядерный зародышевый мешок; 6 — распределение ядер мегаспор 3+1; 7 — профаза Ш
деления; 8 — анафаза III деления; 9 — сформированный зародышевый мешок; (1, 4, 6, 8, 9 — Tulipa
kolpakovskiana; 2, 3, 5 — Т. tetraphylla; 7 — Т. ostroDskiana).
1 —9 — Печеницын, ориг.
Рис. 71. Eriostemones- тип развития зародышевого мешка.
1 —9 — развитие зародышевого мешка Tulipa neustrueuae: 1 — профаза мейоза 1,1 — начало
вакуолизации цитоплазмы; 2 — профаза мейоза I, в халазальной части видна большая вакуоль; 3 — метафаза
мейоза I; 4 — анафаза мейоза I; 5 — метафаза мейоза II; 6 — телофаза мейоза И; 7 — четырехъядерныи
зародышевый мешок; 8 — анафаза III деления; 9 — только что образовавшийся восьмиядерный
зародышевый мешок.
1 —9 — Печеницын, ориг.
Рис. 72. Penaea-тип развития зародышевого мешка.
1 —9 — развитие зародышевого мешка Biebersteinia multifida: 1 — мегаспороцит; 2 — мейоз 1;
3 — мейоз II; 4 — увеличенный четырехъядерныи ценоцит; 5, 6 — первое и второе митотическое
деление ядер; 7 — сформированный зародышевый мешок; 8 — дифференциация элементов зародыше-
!вого мешка; 9 —• зрелый зародышевый мешок;
1 —9 — Камелина, Коннова, ориг.
I
I
Рис. 73. Plumbago- тип развития зародышевого мешка.
1—7 — последовательные стадии развития зародышевого мешка Plumbago coccinea; 8, 9 — P.
europaeum: однополюсный четырехклеточныи зародышевый мешок, готовый к оплодотворению (8);
нетипичное (разбросанное) положение клеток яйцевого аппарата (9).
1—7 — по: Boyes, Battaglia, 1951; 8, 9 — по: Коробова, 1983.
Рис. 74. Peperomia- тип развития зародышевого мешка.
1 —5 — мегаспорогенез у видов Peperomia; 6—9 — восьми- и 16-ядерная стадии развития
зародышевого мешка; 10, 11 — зародышевый мешок в момент оплодотворения, видны контакт мужского и
женского ядер в яйцеклетке, две синергиды — разрушенная и интактная, и пристенные клетки
(антиподы), в центральной клетке группа полярных ядер и спермий в момент слияния; 12—14 —
развитие зародышевого мешка; 15,16 — сформированный зародышевый мешок с двух- и трех-клеточ-
ным яйцевым аппаратом; 17 — недифференцированный яйцевой аппарат Peperomia blanda (x 1500);
(1,9 — P. obtusifolia;2—8,10,11,17 — P. blanda; 12 —P. verticillata; 13 — P. magnoliaefolia; 14 —
P. rubrella; 15 — P. sp.; 16 — P. maculosa);
Рис. 74 (продолжение).
и — интегумент, м — мегаспороцит, н — нуцеллус, лк- пристенные клетки, с — синергида, эк —
эпидермис нуцеллуса, я — яйцеклетка.
1—11 —по: Никитичева, Яковлев, Плющ, 1981; 12—16 — по: Смирнов, 1982; 17 —по: Плющ, 1992.
Рис. 75. Gunnera- тип развития зародышевого мешка.
1—7 — мегаспорогенез (1—4) и развитие зародышевого мешка (5—7) Gunnera macro phylla; 8, 8а —
зрелый зародышевый мешок G. chilensis, содержащий трехклеточныи яйцевой аппарат, шестиклеточ-
ный антиподальныи комплекс и центральную клетку с семью ядрами.
1 —7 — по: Samuels, 1912; 8, 8а — по: Modilewsky, 1908.
^•jgj?' 4
Рис. 76. Chrysanthemum- тип развития зародышевого мешка.
1 —4 — развитие зародышевого мешка Chrysanthemum cinerariae folium; 5—12 — развитие
зародышевого мешка Gagea stipitata.
1—4 — по: Martinoli, 1939; 5—12 — по: Шамров, 1990а, сизм. и дополн.
Рис. 77. Проводящая система семязачатка.
1—7 — распределение проводящих пучков в семязачатках Scheuchzeria palustris (1), Rumex sp. (2),
Horsfieldia subglobosa var. brachiata (3), Cananga odorata (4a — продольный, 46 — поперечный срезы),
Myristica fragrans (5), Knema laurina (6), Magnolia stellata (7); в и — внутренний интегумент, г —
гипостаза, зар — зародыш, з м а — зона меристематической активности, н — нуцеллус, ни —
наружный интегумент, о — обтуратор, п — перикарпий, пд — подиум, пп — проводящий пучок,
псм — присемянник, ф — фуникулус, энд — эндосперм.
1 — по: Stenar, 1935; 2 — по: Netolitzky, 1926; 3, 5, 6 — по: Corner, 1976; 4а, 46 — по: Periasamy, Swamy,
1961; 7 — по: Kapil, Bhandari, 1964.
Рис. 78. Транспорт веществ в семязачатке.
1 —22 — возможные пути поступления веществ в семязачаток на разных стадиях развития: 1 —7 —
Centiana cruciata, 8—13 — Luzula pedemontana, 14—17 — Triticum aestivum, 18—22 — Nelumbo nuci-
fera. На рис. 1 —13 стрелкой обозначены пути передвижения преимущественно N-метаболитов,
пунктирной стрелкой — преимущественно С-метаболитрв, двойной стрелкой — N- и С-метаболитов
одновременно; г — гипостаза, з м — зародышевый мешок, инп — интегументальная паренхима, и т —
интегументальный тапетум, пд — подиум, пло — плацентарный обтуратор, прп — проводящий пучок,
itm — париетальная ткань, ф — фуникулус, х — халаза.
1 —7 — по: Шамров, 1990; 8—13 — по: Anisimova, Shamrov, 1992а; Шамров, ориг.; 14—22 — Батыгина,
ориг.
П т
ПЛ О
Рис. 78 (продолжение).
18
Рис. 78 (продолжение).
V
2
£
!r^V
/*"*
w7a i
>*?£"/
' 'Г За
w&
fe,
-\
<* "Г
Рис. 79. Структурные аспекты поступления веществ в зародышевый мешок.
1, 2 — передаточные структуры оболочки зародышевого мешка Jasione montana; (1-х 8000; 2-в его
субмикропилярной области, х 28000); За, б — зародышевый мешок Papaver somniferum: общий вид
(За) .передаточные структуры в антиподах (36, ШИК-реакция); а — антиподы.
1 —3 — Erdelcka, . ориг.
Рис. 80. Система резервов в развивающемся семени.
1—11 — Paeonia lactiflora : 1 — схема завязи (поперечный срез); 2—4 — семязачаток на стадиях
примордия (2), начала дифференциации структур (3) и образования спорогенной ткани (4); 5—7 —
фрагменты семязачатка на стадиях мегаспорогенеза и образования зародышевого мешка;
одновременное развитие нескольких мегаспороцитов, тетрад мегаспор, нормальных и, возможно, диплоспориче-
ских зародышевых мешков; 8—9 — семязачаток на стадии зрелого зародышевого мешка: общий вид
(8), яйцевой аппарат (9а), клетки интегументального тапетума и нуцеллуса (96); 10, 10а —
формирование нуцеллярного зародыша из клеток париетальной ткани; синергиды и яйцеклетка разрушаются,
нуцеллярныи колпачок образует клювовидную структуру, 11 — начальные стадии развития полового
зародыша (а—б) и образование нескольких соматических зародышей (эмбриоидов) на базе ценоцит-
но-клеточной структуры полового зародыша (в—д).
0.03 ММ
и т
Рис. 80 (продолжение).
г — гипостаза, з м — зародышевый мешок, иг — инициали гипостазы, и ей — инициали внутреннего
интегумента, и д з м — инициали диплоспорических зародышевых мешков, и н и — инициали
наружного интегумента, и пд — инициали подиума, ипс — инициали постамента, и т — интегумен-
тальный тапетум, м — мегаспороцит, н — нуцеллус, нк — нуцеллярныи колпачок, н к с — нуцеллярная
клювовидная структура, пд —- подиум, прп — проводящий пучок, прт — прокамбиальные тяжи
пс — постамент, п т — париетальная ткань, с к — спорогенная клетка, cm — спорогенная ткань.
1—10 — Щамров, ориг., 11 — Батыгина, ориг.
Н КС
п т
10
11
в
Рис. 80 (продолжение).
}
П редметный указатель
507
Агрегат эндоплазматического
ретикулума 84
Андроцей 30, 34
Антеридиальная клетка 90 (см.
Генеративная клетка)
Антиподы 199
Апертура 99
Ариллоид 151, 159
Ариллус 151, 159
Археспорий 43, 68, 143
— вторичный 144
— женский 143
— многоклеточный 145
— мужской 68
— одноклеточный 145
— первичный 144
Вегетативная клетка 86, 92, 93
Выстилающий слой (см. Тапе-
тум)
Гамета 86, 87, 94—96, 174, 188
— мужская (см. Спермий)
— женская (см. Яйцеклетка)
Гаметофит
— мужской 86, 104
— женский 134, 172,202
Гаусторий
— антиподы 201
— синергид 192
Генеративная клетка 86, 90, 91
Гинецей 30, 37
— апокарпный 37
— лизикарпный 37
— паракарпный 37
— синкарпный 37
— ценокарпный 37
Гипостаза 137, 166, 168
Гнездо пыльника (см.
Микроспорангий)
Диморфизм спермиев 95
Завязь 37
Зародышевый мешок 132, 155,
172,211
— зрелый 155, 188
— клеткообразование (см.
Цитокинез)
— сформированный 188
— типы 213—216, 234, 239—
248
— Adoxa 174, 179, 182—184,
199, 227
— Allium 174, 179, 187, 197,
199,222, 237,246, 254
— Balsamita 225
— Drusa 184, 200, 225
— Eriostemones 228
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
— Gunnera 233
— Fritillaria 182, 197, 200, 226
— Oenothera 180, 183, 197, 218
— Penaea 229
— Peperomia 198,231
— Plurabagella 184,188, 209, 227
— Plumbago 188, 230
— Podostemum 223, 252
— Polygonum 147,197,203, 217,
237
— Tulipa tetraphylla 189, 228
— Shisandra218, 233
Интегумент 122, 125, 150
— внутренний 151
— наружный 151
Интегументальный тапетум
151, 154
Интина 87, 88
Клетка пыльцевой трубки (см.
Вегетативная клетка)
Кроющая клетка (см.
Париетальная клетка) 134
Макроспора (см. Мегаспора)
Макроспорангий (см. Мегаспо-
рангий)
Материнская клетка мегаспор
(см. Мегаспороцит)
Массула (см. Поллиний)
Мегагаметогенез 202, 205
Мегагаметофит (см.
Зародышевый мешок)
Мегаспора 134, 147
Мегаспорангий 134, 135, 147
Мегаспорогенез 142, 202
Мегаспорофилл 37
Мегаспороцит 134, 143, 146
Мейоз70, 134
Микропиле 122, 151, 157
Микропилярный воротничок
158
Микроспора 79, 82—84
Микроспорогенез 67, 81
Микроспорангий 35, 40, 42
— расположение 35
— абаксиальное 35
— адаксиальное 35
Микроспорофилл 35
Микроспороцит 69
Нитчатый аппарат 188,193, 230
Нуцеллус 122, 134—136
Нуцеллярный клюв 123
Нуцеллярный колпачок 140
Оболочка пыльцевого зерна 88,
89
Обтуратор 151, 161
— интегументальный 161
— нуцеллярный 161
— овариумный 161
— овулярный 161
— париетальный 161
— плацентарный 161
— плодолистиковый 161
— септальный 161
— фуникулярный 161
Окаймляющий симпласт 59
Оперкулум 151, 158
Орбикулы (Тельца Убиша) 48
Орбикулярная пленка (см. Тп-
петальная мембрана) 49
Паренхима интегумента 156
Париетальная клетка 141
Париетальный слой стенки
микроспорангия 42—44
Париетальная ткань нуцеллуса
136, 141
Пелликула (см. Тапетальшиг
мембрана) 49
Перитапетальная мембрана
(см. Тапетальная мембрана)
Перитапетальная пленка (см.
Тапетальная мембрана)
Пестик 37
Плацента 38
Плацентация 38
— базальная 38
— колончатая 38
— ламинальная 38
— маргинальная 38
— париетальная 38
— субмаргинальная 38
— сутуральная 38
— центрально-угловая 38
— шовная 38
Плацентойд 41
Плацентохалаза 38, 166
Плодолистик 37
Подиум 137, 166, 169
Полнада 102
Полленкит 48
Поллинарий 103
Поллиний 102
Полярные ядра 197
Постамент 137, 166, 171
Постаменто-подиум 170
Примордий семязачатка 132
Пыльник 35, 39, 112, 118
— тетраспорангиатный 36
— биспорангиатный 35
— вскрывание 35
— интрорзное 35
508
Генеративные органы цветка
— латрорзное 35
— экстрорзное 35
Пыльца 35, 109
Пыльцевое зерно 86, 88, 96, 99,
178
Пыльцевая трубка 92
Пыльцевой мешок (см.
Микроспорангий)
Рафе 151
Рыльце 38
Связник 35, 41
Семязачаток 122
— амфитропный 128
— анатропный 127
— апотропный 128
— атегмальный 151
— атропный (ортотропный) 127
— афуникулярный 165, 166
— битегмальный 151
— восходящий 129
— гемитропный 128
— кампилотропный 128
— крассинуцеллятный 135
— плевротропный 128
— подымающийся 129
—- сессильный 165, 166
— тенуииуцеллятный 135
—г унитегмальный 151
— фуникулярный 165, 166
— цирцинотропный 166
—f эпитропный 128
Семяножка (см. Фуникулус)
Семяпочка (см. Семязачаток)
Симпласт 155, 257, 259
—» окаймляющий 57
Синангий 36
Синандрий 36
Синергида 192
Синцитий 57, 59
Сифоногенная клетка (см.
Вегетативная клетка)
Сложная пыльца (см. Полли-
НИИ)
Сдерматогенная клетка (см.
Генеративная клетка)
Спермий 86, 94
Спермиогенная клетка 88
Спорогенная клетка 145
Спорогенная ткань 69
— пыльника 43
— семязачатка 145
Спорополленин £0, 89
Средний слой стенки
микроспорангия 42, 45, 62
Стаминодий 36
Стенка микроспорангия 42
— сформированная стенка 42
— зрелого микроспорангия 42
— типы формирования 60
— основной 44, 60
— редуцированный 60
— центробежный 42, 60, 64
— центростремительный 44, 60,
65
Стилодий 37
Столбик 38
Стомиум (см. Эндотеций)
Тапетальная мембрана 49
Тапетальная пленка (см.
Тапетальная мембрана) 49
Тапетальная ткань 57, 59
Тапетум 42, 43, 46, 47, 52, 56
— типы 47, 56
— амебоидный 17, 50, 53, 56—
59
— клеточный 57
— периплазмодиальный 47, 56,
57
Тека (см. Микроспорангий)
Тетрада микроспор 79
— типы формирования 79
— промежуточный 79
— симультанный 79
— сукцессивный 79
— типы тетрад 80
— изобилатеральный 80
— крестообразный 80
— линейный 80
— ромбический 80
— тетраэдральный 80
— Т-образный 80
Тетрада мегаспор 147
\
Трабекулы 47
Трифина 48
Трофическая ткань 62
Тычинка 35
Тычиночная нить 35
Феномен Немеца 118
Фиброзные утолщения 44, 46
Фрагмопласт 208
Фуникулус 38, 122, 165
Халаза 122, 163
— типы
— лептохалаза 163, 164
— пахихалаза 163
— типикохалаза 163,164
Центральная клетка
зародышевого мешка 195
Цитокинез 75, 206
Цитомиксис 115
Цитоплазматическая мужская
стерильность 117
Экзина 88
— нэкзина 88
— нэкзина-2 = эндэкзина 88
— столбик 88
— сэкзина 88
— тектум 88
Экзостом 151, 157
Экзотеций (см. Эпидермис
пыльника) 41
Экстратапетальная мембрана
(см. Тапетальная мембрана)
Эндодермис (см. Интегумен-
тальный тапетум)
Эндостом 151, 157
Эндотелий (см. Интегумен-
тальный тапетум)
Эндотеций 42, 44, 61
Эпидермис нуцеллуса 136, 139
Эпидермис интегумента 153
Эпидермис пыльника 41, 42
Эпистаза 140
Эпителий (см. Интегументаль-
ный тапетум)
Яйцеклетка 174, 188
Male germ unit 95
АВТОРЫ I ТОМА
AUTHORS OF VOLUME I
" i. :
к
АЛИМОВА Г. К.
ALIMOVA G. К.
БАТЫГИНА Т. Б
BATYGINA Т. В.
БЕДНАРА Й.
BEDNARA J.
..Л
■»:■
\\V.
iVi'A1.1.'
■.■iVi1.'!1.
■■■- •:*:•'-
БУГАРА А. М.
BUGARA A. M.
БХАНДАРИ H. H.
BHANDARI N. N.
ВАСИЛЬЕВА В. Е.
VASILYEVA V. E.
ВИЛЛЕМСЕ М. Т. М.
WILLEMSEM. Т. М.
ВИДЖАЯРАГХАВАН M. P.
VUAYARAGHAVAN M. R.
ГАБАРАЕВА Н. И.
GABARAYEVAN.I.
■v^l
■■■
X
ГОЛУБОВСКАЯ И. Н
GOLUBOVSKAYA I. N
ДАНИЛОВА М. Ф
DANILOVA M. F.
ЖИНКИНА Н. А.
ZHINKINA N. А.
Ш^
КАМЕЛИНА О. П.
KAMELINAO. Р.
КОМАР Г. А.
KOMAR G. А.
КОРДЮМ Е. Л.
KORDYUM E. L.
КОРЧАГИНА И. А.
KORCHAGINAI. А.
КРУГЛОВА Н. Н.
KRUGLOVAN.N.
МЕЛИКЯН А. П.
MELIKJAN А. Р.
,У^iл.*.■^.-,ш,ШJr,rJ,.
/l'.'j^'.'.'l'l'.'A1
.■:-ZvZ-z-»_v:m-
i^'i'iV^A'i'i'i'i'i
^i'i'j'i'j'i'i'i'i'i'j'i
.V.V.^.V.'jVl
\\r»,b"b"h"J"J,_
\r»r»V»"."Jr»,«
ГЛ,.|.,|,Г|'.1.
ШшР
/.'.Vi'j'b
■Iй
#■■
IVZ
.7Л
МОГЕНСЕН X. Л.
MOGENSEN H. L.
НИКИТИЧЕВАЗ. И.
NIKITICHEVAZ. I.
ОГОРОДНИКОВА В. Ф.
OGORODNIKOVA V. F.
т&
S
mtf«frR-tt::-z->>:vz-
Ч^^'.'Л'.^/Л^ЧЧ'/Л^'.'Л'.'.'Л'.'.'/Л'.'.1.
||||.,."||.|.,л\г.т.,;;л^,.,л^,.,лг.,/л,.г. ■"■%"■'■
I _ ■ L J ■ ■ ■ ■ ■ L ■ ■ ■ ■ ■ ■ ■ ■ ■ ■ B-L-B ■ ■ ■ ■ J ■ ■ ■ ■ I I
,.r.,.,b"."."J\\,»,b"JW^Jr»Vb"JW^.".W»,.,.r»,»,«"
CflvK^OZOZiKvIvZ^vZOZ^i'IvZ^Z^Z'ZOrlv
Sm^'X-Z-.-X^v^VlV.^v.v.^w^.
Ш ■>:«-:■:■>:->:-:■:■:->:-:■:■:-:■
'I'l'.'j'j'^l'l'j'j'j'.'l'l'j'j'.V.'l'j'j'.'.'^l'j'j1.1^^!'.'
IV+^VZ^Z^^OZOZ^OZOi^OZV^NiOZOZ^^Vji.
■Л\г»,»,»,ь,."Л"»гЛ
!*>№>>:■»:■
J^,■,ь■г^гJгJ,.,ь,.■.г.^г.Vь^г■г■,■,ь,
.V.'i'.'j'jV.'^^i'j'.V.'rjW.1.^
X'Zv^vZvZ^".
.^'.W'j'j'.^W.-j-.-.
y/iVJi'i'ii'iVi"." ■
■AVi'iVi'iVi'i'iVi
iVi'i'j'jVi1
.v^.^w."
ОРЛОВА И. Н.
ORLOVAI.N.
ПЕЧЕНИЦЫН В. П.
PECHENITSYNV.P.
ПРОСКУРИНА О. Б
PROSKURINA О. В.
*як*
зшш
и,
ч|
РОДКЕВИЧ Б.
RODKIEWICZ В.
РАССЕЛЛ С. Д.
RUSSELL S. D.
СИМОНЕНКО В. К.
SIMONENKOV. К.
jV."
■ ■ г г ■
:*ttW*
11111
-Л'.'
j ■
?illllil|!ri:i
.VAr.
lilt
тштт
тМтМж
ft:*-
.■К it1 Л. >V ■" /*"-\ ■ ■" ■" и".
mm
ТЕРЕХИН Э. С.
TERYOKHYN E. S.
ТИТОВА Г. Е.
TITOVA G. E.
it
■■:■:
ТИХОМИРОВ В. Н.
TIKHOMIROV V. N.
ЧЕБОТАРЬ А. А.
CHEBOTARU A. A.
ШАМРОВ И. И.
SHAMROV 1.1.
ШЕВЧЕНКО С. В.
SHEVCHENKO S. V.
■jV.1
ЭЛЬ-ГАЗАЛИ Г.
EL-GHAZALYG.
ЭРДЕЛЬСКА О.
ERDELSKA О.
РОССИЙСКАЯ АКАДЕМИЯ НАУК
Ботанический институт им. В. Л. Комарова,
Россия, 197376 СПб., ул. проф. Попова,д. 2.
т.(812) 234-12-37
факс (812)234-45-12
E-mail—binran @ glas. ape. org
Отдел эмбриологии и репродуктивной биологии,
заслуженный деятель науки РФ,
профессор, доктор биологических наук
БАТЫГИНА ТАТЬЯНА БОРИСОВНА
т. (812) 234-84-20, 234-84-21, 234-54-10
РОССИЙСКИЙ ФОНД
ФУНДАМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
(изд. грант № 94-04-11460)
НПО «МИР И СЕМЬЯ»,
СПб., В.О. 6-я линия д. 49, кв. 11-12,
т/ф: (812)218-66-41
Оригинал-макет и диапозитивы изготовлены в НПО
«МИР И СЕМЬЯ».
СПб., В.О. 6-я линия д. 49, кв. 11-12, т/ф: (812) 218-66-41
Компьютерный набор: Ищенко Я. П., Легонькова И. В., Пеняева Е. О.
Компьютерная верстка: Константинова И. Г.
Редакторы: Васильева В. Е., Захаров А. М.
Иллюстрации: большинство иллюстраций являются оригинальными и
выполнены самими авторами.
Сдано в набор 05.06.94 г. Подписано к печати 25.12.94 г.
Формат 70x100/16, объем 32/64 печ,-л. Бумага офсетная № 1.
Печать офсетная. Гарнитура академическая. Тираж 1000 экз. Заказ 3300-
Отпечатано в Санкт-Петербургской типографии № 1 РАН
199034, СПб., В. О., 9 линия, д. 12
Издательская фирма «МИР И СЕМЬЯ» выпускает в 1994-1995 г. при поддер
жке РОССИЙСКОГО ФОНДА ФУНДАМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
следующие книги по систематике высших растений, подготовленные сотрудниками
Гербария Ботанического института им. В.Л. Комарова РАН:
1. Флора Восточной Европы, т. 9. Отв. редактор Н.Н. Цвелев.
Продолжение известной сводки «Флора европейской части СССР».
Включает обработки 32 семейств, в том числе Chenopodiaceae, Polygonaceae,
Euphorbiaceae, Trapaceae.
2. C.K. Черепанов. Сосудистые растения России и сопредельных стран.
Второе издание книги «Сосудистые растения СССР», вышедшей в 1981 г
3. Т.В. Егорова. Осоки России и сопредельных стран, ранее
входивших в состав СССР.
Полная монографическая обработка рода Сагех для территории
бывшего СССР.
Кроме того предлагаются уже опубликованные издания:
1. Растения Центральной Азии, вып. 10 (Araliaceae, UmbelUferae, Cornaceae)
Составитель В.М. Виноградова, отв. редактор серии В.И. Грубов.
2. Л.В. Аверьянов. Определитель орхидных (Orchidaceae Juss.) Вьетнама.
Распространение книг осуществляется фирмой «Мир и семья».
Заявки просьба направлять по адресу:
Санкт-Петербург, В.О. 6 линия, д. 49, кв. 12
(телефон: (812) 218-66-41; факс: (812) 218-66-41)
WORLD AND FAMILY Ltd. will publish in 1994-1995 the following books on
vascular plant taxonomy, prepared by the staff of the Herbarium of the Komarov
Botanical Institute of the Russian Academy of Sciences. All books are sponsored
by Russian Foundation for Fundamental Researches.
1. Flora Europae Orientalis, vol. 9. Editor of the series N.N. Tzvelev.
The next volume of the Flora Partis Europaeae URSS. With treatments of 30
families, including Chenopodiaceae, Polygonaceae, Euphorbiaceae, Trapaceae. In
Russian, with guide for non-Russian readers.
2. T.V. Egorova. The genus Carex in Russia and neighbouring countries.
Complete taxonomic revision of the genus Carex for the territory of the former
USSR. Keys for determination, taxonomic and evolutionary notes both in Russian
and English.
Besides already pubished books are available:
1. Plantae Asiae Centaralis, vol. 10. (Araliaceae, UmbelUferae, Cornaceae). Author
V.M. Vinogradova, editor of the series V.I. Grubov.
Keys for determination and taxonomic notes both in Russian and English.
2.Averyanov L.V. Key for Orchidaceae of Vietnam. In Russian.
To order these books, please send you requests to:
World and Family Ltd., Vassilyevski Ostrov, 6 linia, 49, apt 12,
St Petersburg, Russia
phone: (812) 218-66-41; fax: (812) 218-66-41
Издательство приносит извинения за опечатки, допущенные в книге
по техническим причинам:
в основном тексте
страница
6
10
17
20
35
39
40
47
50
51
75
87
90
102
104
106
111
»
112
113
114
118
131
135
139
181
203
204
222
»
239
240
246
265
»
»
строка
17 снизу
15,17,19 сверху
15 сверху
7 снизу
14 сверху
16 сверху
14 снизу
13 снизу
10 сверху
»
»
13 сверху
26 сверху
21 сверху
2 снизу
24 сверху
таблица
»
17 сверху
7 снизу
23 сверху
11 сверху
16 снизу
17 снизу
22 снизу
26 сверху
17 сверху
16 сверху
14 снизу
26 сверху
3 сверху
1 снизу
17 сверху
1 снизу
20 снизу
6 снизу
8 снизу
24 сверху
напечатано
Chaudry
О. L. Mogensen
Ротен-фельд
пыльника тапетума
деревянистой
ассиметрично
Berderidaceae
согласно
их
липоротеиды
дилоидной
Stachyuracae
bracleata
архидных
Linkens
Ephedras
9гомология
Carpenther J. L.
Gunet, Le Tomas
истоньчаются
Chaudhry, Bharti
в стерильная
Crossomataceae
см. стр. 145
Schnaf
головности
(o(-1,3-полиглюкана)
мегаспорий
галлозной
luteum
Johri, 1936
Романов (1971 и 1944а)
— реорганизация
Halorrhagidaceae
Van. Lammern
mys
a pxe сп оральных
следует читать
Chaudhry
Н. L. Mogensen
Ротенфельд
пыльника, тапетума
деревянистыми
асимметрично
Berberidaceae
которые, согласно
из
липопротеиды
диплоидной
Stachyuraceae
bracteata
орхидных
Linskens
Ephedra
(гомология
Carpenter J. L.
Guinet, Le Thomas
истончаются
Chaudhry Bharti
а стерильная
Crossosomataceae
см. стр. 148
Schnarf
готовности
(£-1,3-полиглюкана)
мегаспо ранг и й
каллоаои
lutea
Johri, 1935
Романов (1944, 1971а)
^L— реорганизация
Haloragaceae
Van Lammeren
mays
археспориальн ых
в подписях к рисункам
№ рисунка строка
1
15
21 (продол.2)
32
38 (продол.6)
» (продол.7)
40
44
48
51
52
57 (продол.З)
2 сверху
9 сверху
4 сверху
9 снизу
6 снизу
3 снизу
2 сверху
5 сверху
3 сверху
» »
8 сверху
10 сверху
напечатано
размере
телофаза 11
Сладкова
поцессе
13,19
цитосома
садии
ариллоидом
плацентозалаза
тпа
ценотитный
Valeriana
следует читать
разрезе
телофаза II
Сладков
процессе
13-19
цитосегресома
стадии
с ариллодием
плаценто-халаза
типа
ценоцитный
Valeriana