Автор: Батыгина Т.Б.
Теги: эмбриология растений общее растениеводство иллюстрации эмбриологические признаки характеристики репродукция цветковых растений
ISBN: 5-86429-018-1
Год: 1997
Текст
ЭМБРИ* «Г
ЦВ ТК« Ы
ACT И"
ТЕРМИНОЛОГИЯ
И КОНЦЕПЦИИ
МИР И СЕМЬЯ
СПб, 1997
ЭМБРИОЛОГИЯ ЦВЕТКОВЫХ РАСТЕНИИ
ТЕРМИНОЛОГИЯ И КОНЦЕПЦИИ
В 3-х томах
СЕМЯ
То
м
ТАТЬЯНА БОРИСОВНА БАТЫГИНА
Редактор
МИР И СЕМЬЯ-95
САНКТ-ПЕТЕРБУРГ
1997
EMBRYOLOGY OF FLOWERING PLANTS
TERMINOLOGY AND CONCEPTS
Three volume edition
SEED
Volume 2
TATYANA B. BATYGINA
Editor
WORLD AND FAMILY-95
ST. PETERSBURG
1997
РОССИЙСКАЯ АКАДЕМИЯ НАУК
Ботанический институт им. В. Л. Комарова
ОТДЕЛ ЭМБРИОЛОГИИ
И РЕПРОДУКТИВНОЙ БИОЛОГИИ
Российский Фонд
Фундаментальных Исследований
Рецензенты
Э. С. ТЕРЕХИН, И. П. ЕРМАКОВ
Редакционная коллегия
Е. В. АНДРОНОВА, Т. Б. БАТЫГИНА (редактор),
В. Е. ВАСИЛЬЕВА, Г. Я. ЖУКОВА, Л. М. ПОЗДОВА,
Г. Е. ТИТОВА, И. И. ШАМРОВ (секретарь)
О
RUSSIAN ACADEMY OF SCIENCES
V. L. Komarov Botanical Institute
DEPARTMENT OF EMBRYOLOGY
AND REPRODUCTIVE BIOLOGY
Russian Foundation
for Fundamental Researches
Reviewers
E. S. TERYOKHIN, I. P. ERMAKOV
Editorial board
E. V. ANDRONOVA, Т. В. BATYGINA (editor),
L. M. POZDOVA, I. I. SHAMROV (secretary),
G. E. TITOVA, V. E. VASILYEVA, G. YA. ZHUKOVA
ББК 41.8
УДК 581.3
ISBN 5-86429-018-1
ЭМБРИОЛОГИЯ ЦВЕТКОВЫХ РАСТЕНИЙ. ТЕРМИНОЛОГИЯ И КОНЦЕПЦИИ.
Т.2. СЕМЯ (ред. Т. Б. Батыгина).
2-й том 3-томного издания является юбилейным томом, посвященным 100-летию открытия
С. Г. Навашиным двойного оплодотворения у покрытосеменных растений. В книге излагаются
современные представления о строении семени, о процессах, участвующих в его формировании
(сингамия, тройное слияние и др.), а также о постсеменном развитии (покой и прорастание
семян) цветковых растений. Она содержит статьи авторов и иллюстрации в виде рисунков,
графиков, схем, микрофотографий (СМ, ТЭМ, СЭМ). Текст включает авторские трактовки
основных терминов и понятий, используемых в современной ботанической литературе при описании
структурных элементов семени, происходящих процессов, а также ряд необходимых
общебиологических терминов. Приводится семантика терминов, принципы классификации зародыша,
эндосперма, зрелого семени и др., отражены вопросы гомологизацни, структурно-функциональные н
кполюцнонныс аспекты. Авторы привлекают данные ультраструктурной, экологической и
экспериментальной эмбриологии для уточнения понятий.
Издание носит монографический и энциклопедический характер. Предназначено для
эмбриологов, систематиков, физиологов* генетиков, селекционеров и ботаников широкого профиля.
Рассчитано на научных сотрудников, аспирантов и студентов-бнологов. Бнбл. более 2500 назв. Илл. 2798.
Публикация поддержана Российским Фондом Фундаментальных Исследований (№
издательского гранта 95-04-28565).
Авторы:
Е. В. Андронова, Г. М. Анисимова, О. В. Антипова, Т. Б. Батыгина, Е. А. Брагина, В. Б. Брюхин,
В. Е. Васильева, М. А. Вишнякова, Т. Д. Вышенская, Е. Н. Герасимова-Навашина, |М. Ф. Данилова^
Н. А. Жинкина, Г. Я. Жукова, А. А. Захарова, О. П. Камелина, Л. В. Ковалева, С. Н. Коробова,
Л. Г. Красников, С. С. Медведев, Н. М. Морозова, С. Г. Навашин, Т. Н. Наумова, 3. И. Никитичева,
Н. В. Обручева, Т. А. Плющ, Л. М. Поздова, В. В. Полевой, М. В. Разумова, Т. С. Саламатова,
М. П. Солнцева, Э. С. Терехин, Г. Е. Титова, О. А. Хведынич, И. И. Шамров, С. М. Щипарев, М. Cresti,
О. Erdelska, W. E. Friedman, G. Jurgens, H. Kieft, A. A. M. van Lammeren, Y.-Q. Li, F. Ma, D. W. Meinke,
J. Pare, B. Rodkiewicz, S. D. Russell, J. H. N. Schel, E. Szczuka, W. L. H. van Veenendaal, J. L. van Went,
X. L. Ye, E. С Yeung, S. Y. Zee.
Volume 2 of three-volume Edition is a jubilee, dedicated to the discovery of double fertilization
in Angiospermae by S. G. Nawaschin. The book covers the up-to-date notions of seed structure,
processes resulting to its formation (syngamy, triple fusion etc.), as well as of postseminal development
(seed dormancy and germination). It contains the contributor's papers, illustrated with drawings,
charts, diagrams, microphotos and electron micrographs (LM, ТЕМ, SEM). There are authors'
explanations of both general biology terms and the basic terms and concepts used in the modern
botanic literature for describing the main structural elements of seed and the processes occurring in
it. The term semantics, classification principles of embryo, endosperm, mature seed etc. are emphasized.
The homology of basic seed elements and functional and evolutionary aspects in their development
are also included. To verify the concepts based on the classical embryology the current ultrastructural,
ecological and experimental embryology data are drawn.
This is a monographic and encyclopedic Edition. It will be of interest for embryologists, taxonomists,
physiologists, geneticists, plant-breeders and botanists. The book is intendend both for scientists and for
students. Its bibliography consists of more than 2500 sources. The text is provided with 2798 illustrations.
Edition is snpported by the Russian Fonndation for Fundamental Researches (Grant
№ 95-04-28565).
Authors:
E. V. Andronova. G. M. Anisimova, O. V. Antipova, T. B. Batygina, E. A. Bragina, V. B. Brukhin, M. Cresti,
IM. F. Danilova, IO. Erdelska, W. E. Friedman, E. N. Gerassimova-Navashina, G. Jurgens, O. P. Kamelina,
O. A. Khvedynich, H. Kieft, S. N. Korobova, L. V. Kovaleva, L. Q. Krasnikov, A. A. M. van Lammeren, Y.-Q Li,
F. Ma, S. S. Medvedev, D. W. Meinke, N. M. Morozova, T. N. Naumova, S. G. Nawaschin, Z. I. Nikiticheva,
N. V. Obrucheva, J. Pare, T. A. Plyushch, V. V. Polevoy, L. M. Pozdova, M. V. Razumova, B. Rodkiewicz,
S. D. Russell, T. S. Salamatova, J. H. N. Schel, I. I. Shamrov, M. P. Solntseva, S. M. Szcziparev, E. Szczuka,
E. S. Teryokhin, G. E. Titova, V. E. Vasilyeva, W. L. H. van Veenendaal, M. A. Vishnyakova, T. D. Vyshenskaya,
J. L. van Went, X. L. Ye, E. С Yeung, A. A. Zakharova, S. Y. Zee, N. A. Zhinkina, G. Ya. Zhukova.
СОДЕРЖАНИЕ
ПРЕДИСЛОВИЕ 13
БЛАГОДАРНОСТИ 21
СЕРГЕИ ГАВРИЛОВИЧ НАВАШИН. Автобиография 23
ЧАСТЬ I — ДВОЙНОЕ ОПЛОДОТВОРЕНИЕ
ИСТОРИЯ ОТКРЫТИЯ
Феномен двойного оплодотворения (Т. Б. Батыгина). ........ 31
Результаты пересмотра процессов оплодотворения у Lilium
martagon и Fritillaria tenella (С. Г. Навашин) 45
Об оплодотворении у сложноцветных и орхидных (С. Г.
Навашин) 50
О самостоятельной подвижности мужских половых ядер
у некоторых покрытосеменных растений (С. Г. Навашин) . . 56
Опыт структурного изображения свойств половых ядер
(С. Г. Навашин) ' 67
Лилейные — классический объект дли изучения опыления и
оплодотворения (Е. Н. Герасимова-Навашина, Т. Б. Батыгина) ... 86
ПРОГАМНАЯ ФАЗА ОПЛОДОТВОРЕНИЯ
Проводниковый тракт пестика (М. А. Вишнякова) 107
Самонесовместимость: структурно-функциональные
аспекты (М. А. Вишнякова) ИЗ
Пыльцевая трубка (С. П. Коробова, Л. В. Ковалева) 120
Образование и рост пыльцевой трубки (Л. В. Ковалева) 121
Деление генеративной клетки и формирование спермиев
(М. Cresti, Y.-Q. Li) 125
Мужская оплодотворяющая система (5. D. Russell) 127
Порогамия (Т. Н. Наумова) 136
Халазогамия (Т. Н. Наумова) 138
ОПЛОДОТВОРЕНИЕ
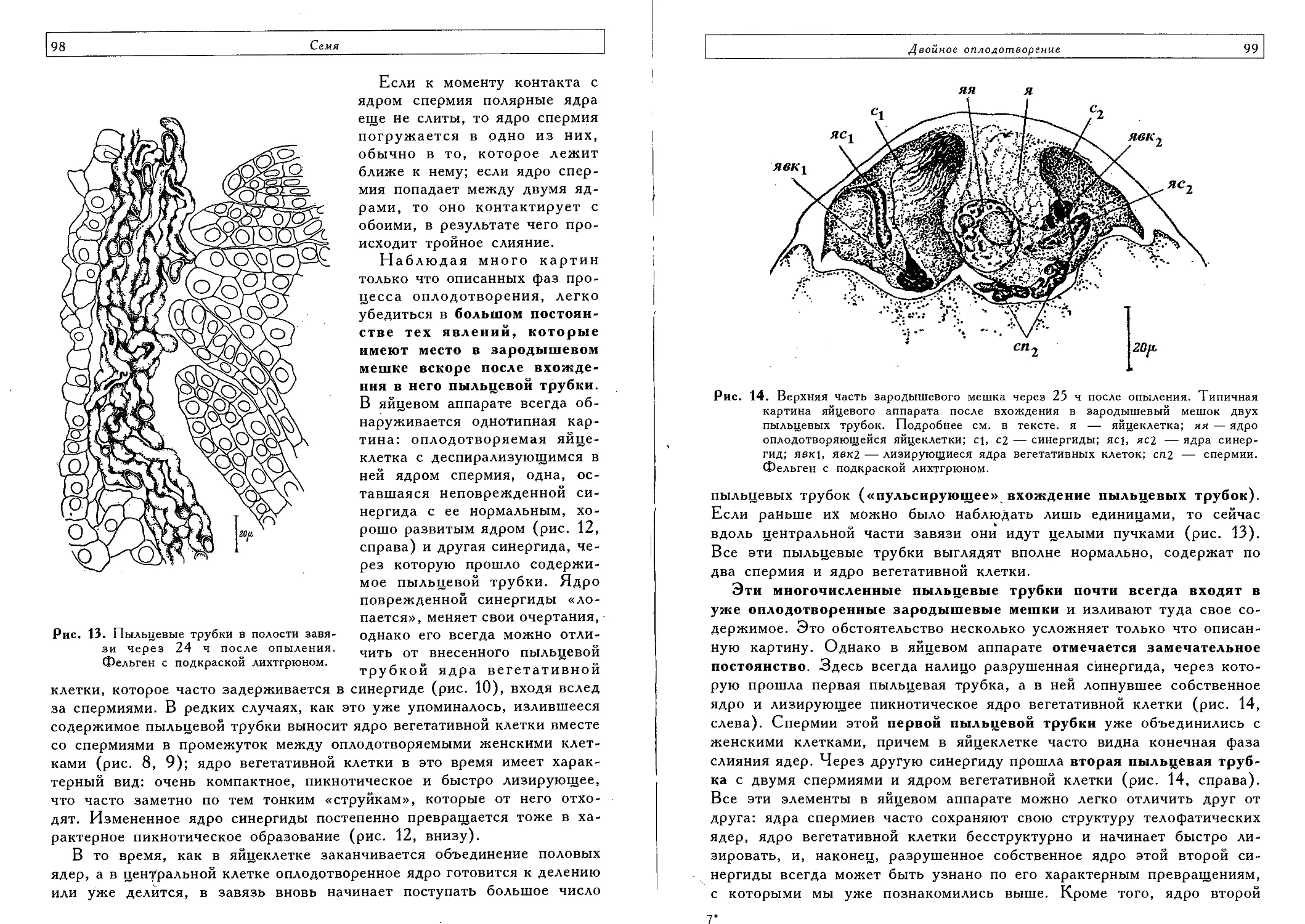
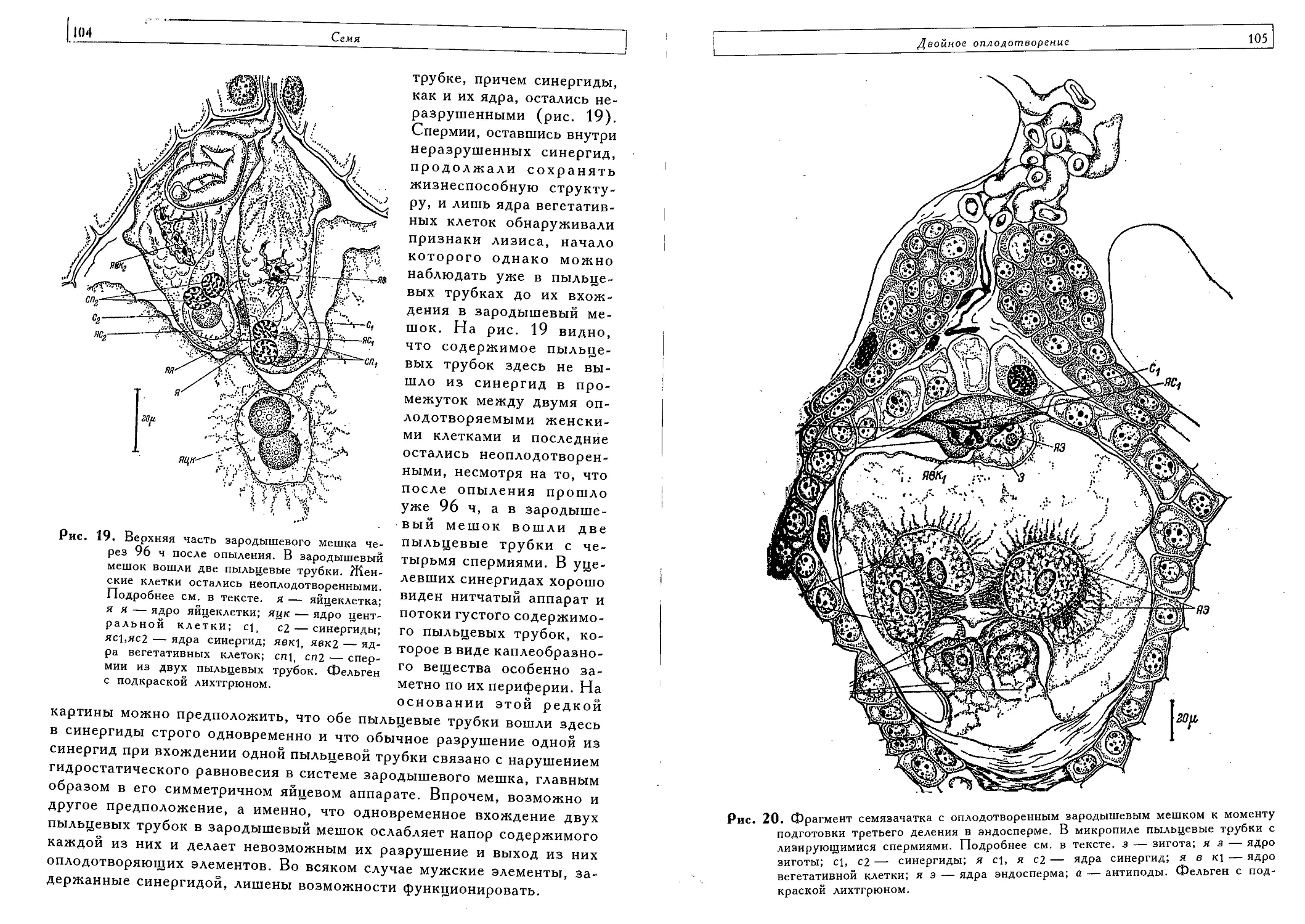
Двойное оплодотворение (Т. Б. Батыгина) 140
Типы двойного оплодотворения (Е. Н. Герасимова-Навашина) . . 140
Сингамия (Т. Б. Батыгина, В. Е. Васильева) 143
Тройное слияние (Т. Б. Батыгина, Е. А. Брагина) 161
Передача цитоплазмы при оплодотворении (5. D. Russell) 169
Процесс двойного оплодотворения и митотический цикл клетки
(митотическая гипотеза) (Е. Н. Герасимова-Навашина) 175
Типы двойного' оплодотворения в свете данных электронной
микроскопии (Т. А. Плющ) 182
Механизмы оплодотворения (5. D. Russell) 186
Цитохимия процесса оплодотворения (О. А. Хведынич) 193
Гемигамия (М. П. Солнцева) 197
Опыление и оплодотворение у злаков (Г. Б. Батыгина) 200
Оплодотворение in vitro (5. D. Russell) 210-
ЧАСТЬ II — ЭНДОСПЕРМ, ПЕРИСПЕРМ
Эндосперм (Г. Я. Жукова) 212
Типы развития эндосперма: 218
— Нуклеариый (Г. Я. Жукова) 218
— Целлюлярный (Я. И. Шамров) 227
— Гелобиальный (Я. И. Шамров) 236
Развитие эндосперма у Brassica napus L. (по данным световой
микроскопии) (А.А.М. van Lammeren, H. Kieft, F. Ma,
W. L. H. van Veenendaal) •. 240
Клеточная дифференциация в перикарпе и эндосперме
развивающейся зерновки кукурузы (Zea mays L.) (A. A. M. van
Lammeren, H. Kieft, J. H. N. Schel) 245
Микропилярный гаусторий у Impatiens walleriana Hook, ex Am.
(/. L. van Went ) 254
Эмбриогения семенных растений и эволюция эндосперма
(W. Е. Friedman) 256
О возможности выделения тубифлорального типа развития
эндосперма (О. П. Камелина) 281
Новый подход к типизации эндосперма в связи с проблемой его
эволюции (Я. Я. Шамров) 284
Перисперм (Я. Я. Шамров) 291
ЧАСТЬ III — ЗАРОДЫШ
ОБЩЕЕ ПРЕДСТАВЛЕНИЕ
Зародыш (Э. С. Терёхин) 294
Эмбриогения (Я. Я. Шамров) 297
СТАДИИ РАЗВИТИЯ И СТРУКТУРЫ ЗАРОДЫША •
Зигота (Т. Б. Батыгина, В. Е. Васильева) 307
Проэмбрио (Г. Е. Титова, И. И. Шамров) 321
Суспензор (3. И. Никитичева) 325
Ультраструктурные особенности суспензора (Г. Я. Жукова) 332
Функции суспензора (Е. С. Yeung, S. Y. Zee, X. L. Ye) 341
Протодерма (эмбриодерма) (Е. В. Андронова) 346
Гипофизис (Г. Е. Титова) 352
Эпифизис (Е. В. Андронова) 356
Зародышевый корень (\М. Ф. Данилова^) '. 358
Эпикотиль (Е. В. Андронова) 376
Семядоля (Т. Б. Батыгина ) 380
Вариации в развитии семядольного аппарата (Г. Е. Титова) 381
Дикотилия 381
Псевдодикотилия 382
Монокотилия 382
Псевдомонокотилия • • • 382
Синкотилия 383
Схизокотилия 396
Поликотилия 397
Акотилия 404
Гетерокотилия 407
Формирование оси в эмбриогенезе: гипотезы и факты (С. Jurgens) 412
Морфологическая классификация зародыша зрелого семени:
критический обзор основных систем (Т. Д. Вышенская) 418
О принципах создания экологической классификации зародышей
(Э. С. Терёхин, 3. И. Никитичева) 437
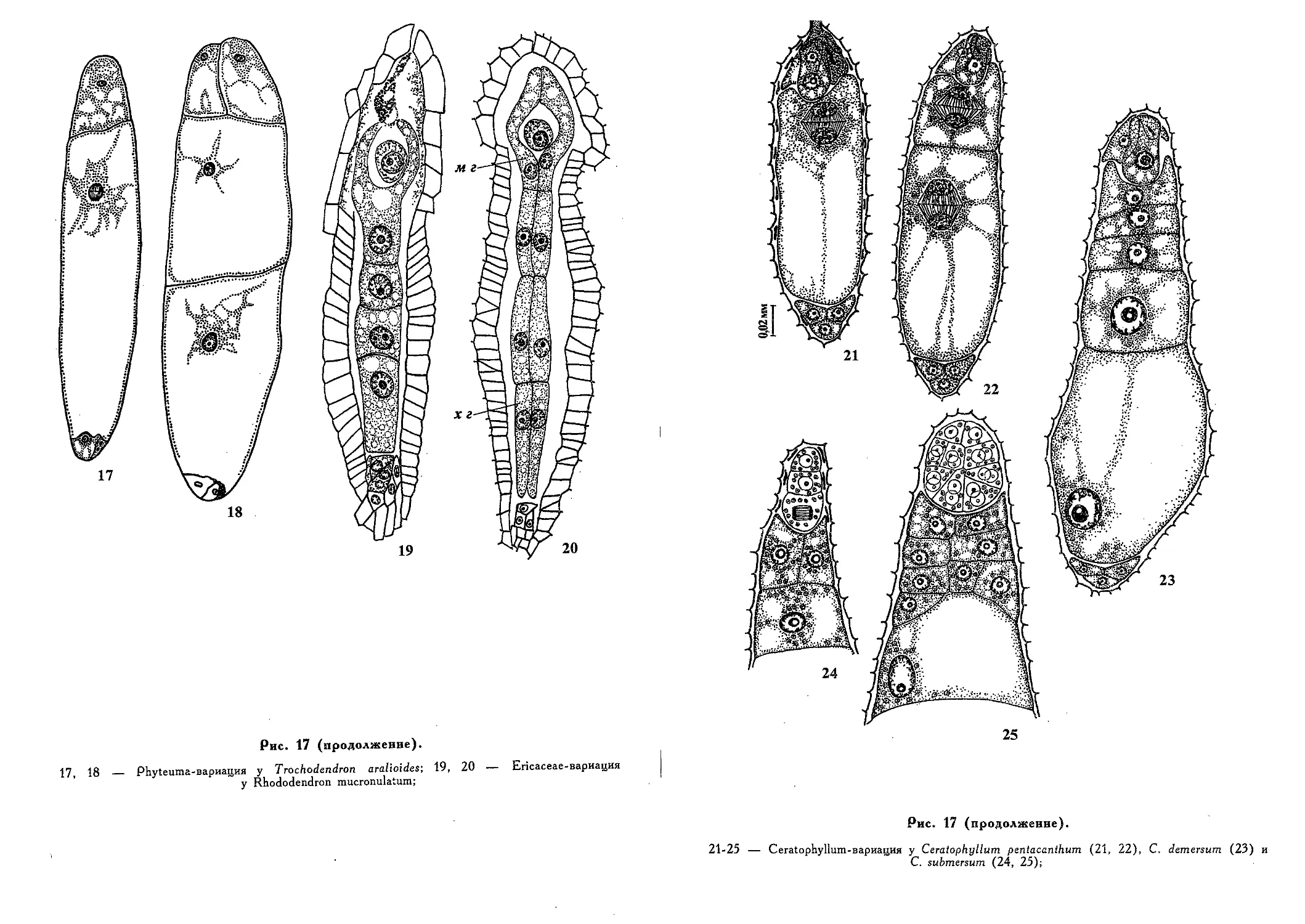
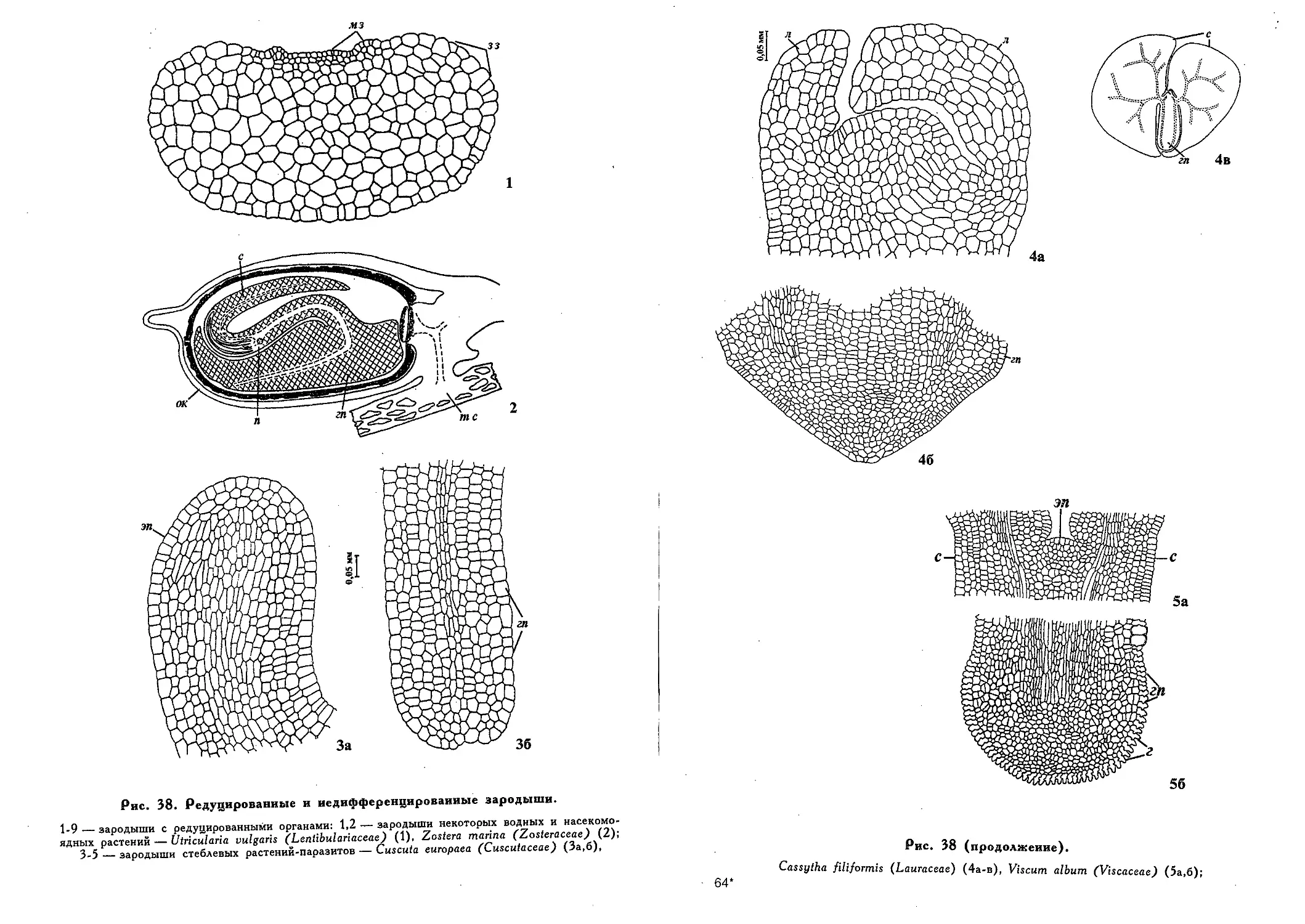
Редуцированные и недифференцированные зародыши (Э. С.
Терёхин) 449
Хлорофиллоносность зародыша как признак для классификации
цветковых растений (Г. Я. Жукова) 461
Новая концепция происхождения зародыша однодольных
(Т. Б. Батыгина, Л. Г. Красников) 470
ТИПЫ ЭМБРИОГЕНЕЗА
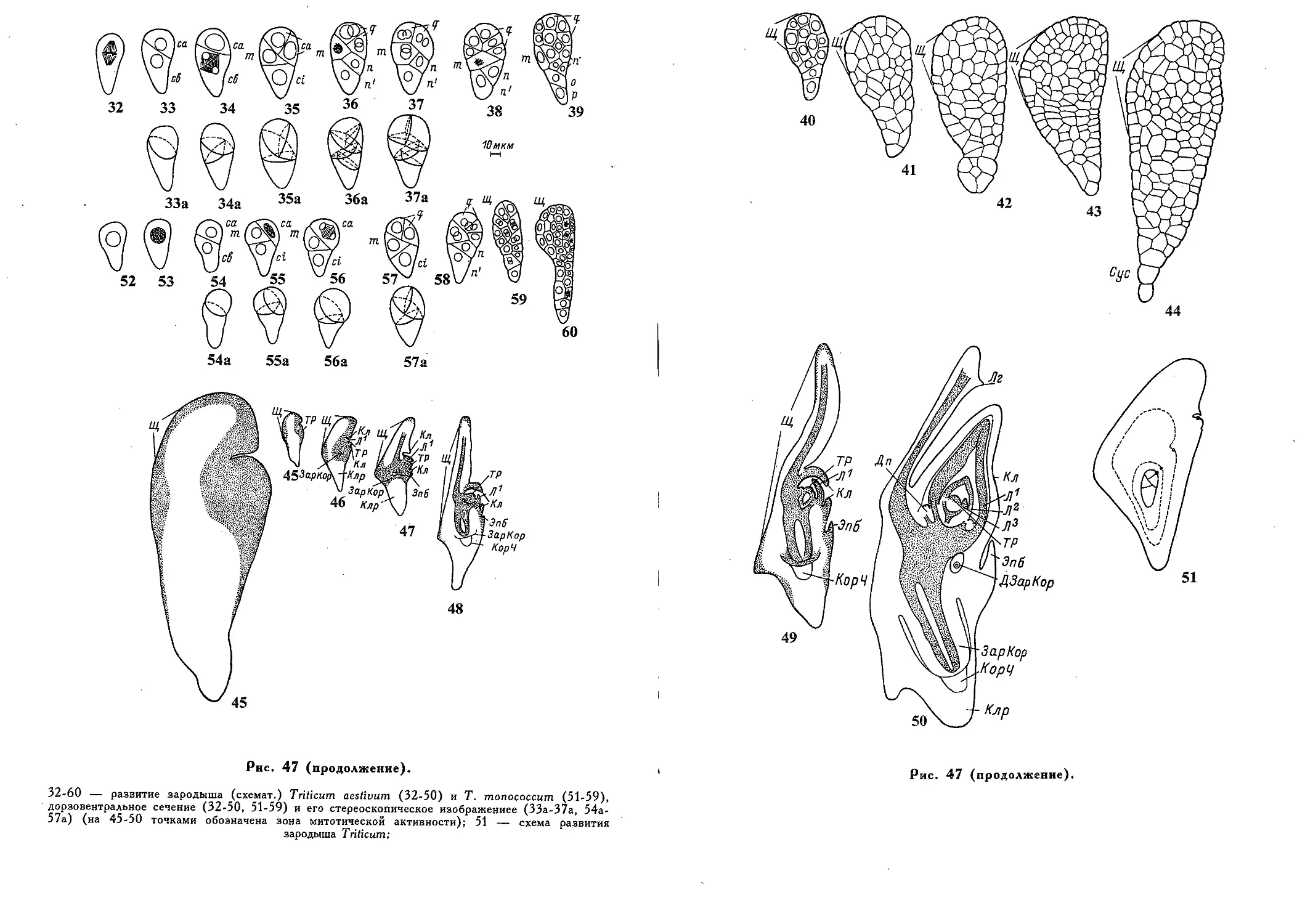
Принципы классификации типов эмбриогенеза (Я. Я. Шамров). . . 493
Типы эмбриогенеза 508
— Pi ре г ad (О. П. Камелина) 508
— Onagrad (Г. М. Анисимова ) 510
— Asterad (Г. Е. Титова) 512
— Solanad (H. А. Жинкина) 516
— Chenopodiad (H. А. Жинкина) 517
— Caryophyllad (H. А. Жинкина) 518
Новые типы эмбриогенеза 520
— Graminad (Т. Б. Батыгина) 520
— Paeoniad (Т. Б. Батыгина) 526
Эмбриогенез злаков (Т. Б. Батыгина) 528
Эмбриогенез пионовых (Т. Б. Батыгина, В. Б. Брюхин) 539
Эмбриогенез орхидных (Е. В. Андронова) 544
УЛЬТРАСТРУКТУРНЫЕ И ГИСТОХИМИЧЕСКИЕ АСПЕКТЫ
ЭМБРИОГЕНЕЗА
Ультраструктурные аспекты эмбриогенеза (Т. Н. Наумова) .... 557
Гистохимические и иммуногистохимические аспекты эмбриогенеза
(В. Б. Брюхин). 568
Кутикула развивающегося зародыша (В. Rodkiewicz, E. Szczuka) 573
8
Эмбриогенез Striga hermonthica (Del.) Benth. (Scrophulariaceae),
влияние гербицидов и других факторов (/. Pare) 575
ФИЗИОЛОГО-БИОХИМИЧЕСКИЕ И ГЕНЕТИЧЕСКИЕ
АСПЕКТЫ ЭМБРИОГЕНЕЗА
Автономность зародыша (В. Е. Васильева, Т. Б. Батыгина) 579
Прижизненные наблюдения зародыша (О. Erdelskd) 588
Перспективы генетического анализа эмбриогенеза (D. W. Meinke) . 593
Экспрессия генов в эмбриогенезе (Н: М. Морозова) 605
Полярность и эмбриогенез (С. С. Медведев) 617
ЭМБРИОИДОГЕНИЯ
Эмбриоид (Т. Б. Батыгина) 624
Эмбриоидогения (Т. Б. Батыгина) 628
Параллели в развитии полового и соматического зародышей
(Т. Б. Батыгина, А. А. Захарова) 635
ЧАСТЬ IV — СЕМЯ
Семя (\М. Ф. Ланилова~\) 649
Семенная кожура (\М. Ф. Данилова]) 650
ЧАСТЬ V — ПОКОЙ И ПРОРАСТАНИЕ СЕМЯН
Покой семян (Л. М. Поздова, М. В. Разумова) 656
Морфология и физиология прорастания семян (Н. В. Обручева,
О. В. Антипова) 667
Щиток и его роль при прорастании (С. М. Щипарев) 681
Гормональная регуляция роста и развития проростков (В. В.
Полевой, Т. С. Саламатова) 685
ЛИТЕРАТУРА 691
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ " 822
ИЛЛЮСТРАЦИИ 824
НА ВКЛЕЙКЕ: КЛАССИКИ МОРФОЛОГИИ И
ЭМБРИОЛОГИИ; АВТОРЫ ТОМА
CONTENTS
PREFACE 17
ACKNOWLEDGEMENTS 22
S. G. NAWASCHIN. Autobiography 23
PART I — DOUBLE FERTILIZATION
THE HISTORY OF THE DISCOVERY
The phenomenon of double fertilization (Т. В. Batygina) 31
Revision of the fertilization process in Lilium martagon and Fritillaria
tenella: results (5. С Nawaschin) 45
About fertilization in Asteraceae and Orchidaceae
(S. C. Nawaschin) 50
On the motility of male germ nuclei in some angiosperms
(5. С Nawaschin) 56
An experience of structural representation of germ nucleus properties
(5. С Nawaschin) 67
Liliaceae — a classical experimental model for studying pollination
and fertilization (E. iV. Cerassimova-N'avashiiia, Т. В. Batygina) 86
PROGAMIC PHASE OF DOUBLE FERTILIZATION
Transmitting tract in the pistil (M. A, Vishnyakova) 107
Self-incompatibility: structural and functional aspects
(M. A. Vishnyakova) ИЗ
Pollen tube (S. N. Korobova, L. V. Kovaleva) 120
Pollen tube formation and growth (L. V. Kovaleva) 121
Generative cell division and sperm cell formation (M. Gresti,
Y.-Q. Li) 125
Male germ unit (5. D. Russell) 127
Porogamy (7\ N. Naumova) 136
Chalazogamy (T. N. Naumova) 138
FERTILIZATION
Double fertilization (Т. В. Batygina) 140
Types of double fertilization (E.N. Gerassimova-Navashina) 140
Syngamy (T. B. Batygina, V. E. Vasilyeva) 143
Triple fusion (T. B. Batygina, E. A. Bragina) 161
Cytoplasmic transmission during fertilization (5. D. Russell) 169
Double fertilization and mitotic cycle of the cell (mitotic hypothesis)
(E.N .Gerassimova-Navashina) 175
Types of double fertilization in the light of electron microscopic
evidence (T.A.Plyushch) 182
10
Fertilization mechanisms (5. D. Russell) 186
Fertilization cytochemistry (O. A. Khvedynich) 193
Hemigamy (M. P. Solntseva) . 197
Pollination and fertilization in Gramineae (Т. В. Batygina) 200
In vitro fertilization (5. D. Russell) 210
PART II — ENDOSPERM, PERISPERM
Endosperm (G. Ya. Zhukova). 212
Types of endosperm development 218
— Nuclear (C. Ya. Zhukova) 218
— Cellular (/. /. Shamrov) 227
— Helobial (/. /. Shamrov) 236
Light microscopical study of endosperm formation in Brassica napus
L. (A. A. M. van Lammeren, H. Kieft, F. Ma,
W. L. H. van Veenendaal) 240
Cell differentiation in the pericarp and endosperm of developing
maize kernels (Zea mays L.) (A. A. M. van Lammeren, H. Kieft,
J. H. N. Schel) 245
The micropylar haustorium in Impatiens walleriana Hook, ex Am. (/.
L. van Went ) 254
The evolution of embryogeny in seed plants and the
developmental origin and early history of endosperm
(W. E. Friedman) 256
About possibility of separation of tubifloral type of endosperm
development (O. P. Kamelina) 281
A new approach to endosperm typification in relation to the problem
of its evolution (/. /. Shamrov) 284
Perisperm (/. /. Shamrov) 291
PART III — EMBRYO
GENERAL IDEA
Embryo (E. S. Teryokhin) 294
Embryogeny (/. /. Shamrov) 297
DEVELOPMENTAL STAGES AND STRUCTURES
OF THE EMBRYO
Zygote (T. B. Batygina, V. E. Vasilyeva) 307
Proembryo (G. E. Titova, I. I. Shamrov). 321
Suspensor (Z. /. Nikiticheva) 325
Ultrastructural features of suspensor (G. Ya. Zhukova) 332
Suspensor functions (E. C. Yeung, S. Y. Zee, X. L. Ye) 341
Protoderm (embryoderm) (E. V. Andronova) 346
Hypophysis (G. E. Titova) 352
Epiphysis (E.V.Andronova) 356
Radicle (\M.F.Danilova\) 358
Epicotyl (E.V.Andronova) 376
Cotyledon (Т. В. Batygina) 380
Variations in the cotyledon apparatus development (G. E. Titova) . 381
Dicotyly 381
Pseudodicotyly 382
Monocotyly 382
Pseudomonocotyly 382
Syncotyly 383
Schizocotyly 396
Polycotyly 397
Acotyly 404
Heterocotyly 407
Axis formation in plant embryogenesis: cues and clues (G. Jurgens) 412
Morphological classification of embryo in mature seed: critical review
of main systems (T. D. Vyshenskaya) 418
On the principles of ecological classification of embryos
(E. S. Teryokhin, Z. I. Nikiticheva) . . . 437
Reduced and undifferentiated ("underdeveloped") embryos
(E. S. Teryokhin) 449
Chlorophyll-bearing property of the embryo as a criterion
for classifying flowering plants (G. Ya. Zhukova) 461
Origin of the monocotyledonous embryo: a new concept (Т. В.
Batygina, L. G. Krasnikov) 470
TYPES OF EMBRYOGENESIS
Principles of classificaton of embryogenesis types
(/. /. Shamrov) 493
Types of embryogenesis 508
— Piperad (O. P. Kamelina) 508
— Onagrad (G. M. Anisimova) 510
— Asterad (G. E. Titova) 512
— Solanad (N. A. Zhinkina) 516
— Chenopodiad (iV. A. Zhinkina) 517
— Caryophyllad (iV. A. Zhinkina) 518
New types of embryogenesis 520
— Graminad (Т. В. Batygina) 520
— Paeoniad (Т. В. Batygina) 526
Embryogenesis in Gramineae (Т. В. Batygina) 528
Embryogenesis in Paeoniaceae (T. B. Batygina, V. B. Brukhin) . . . 539
Embryogenesis in Orchidaceae (E. V. Andronova) 544
ULTRASTRUCTURAL AND HISTOCHEMICAL ASPECTS
OF EMBRYOGENESIS
Ultrastructural aspects of embryogenesis (T. N. Naumova) 557
Histochemical and immunohistochemical aspects of
embryogenesis (V. B. Brukhin) 568
12
The cuticle of developing embryo (5. Rodkiewicz, E. Szczuka) .... 573
Embryogenesis of Striga hermonthica (Del.) Benth. (Scrophularia-
ceae), action of herbicides and other factors: an overview
(/. Pare) 575
PHYSIOLOGICAL-BIOCHEMICAL AND GENETIC ASPECTS
OF EMBRYOGENESIS
Autonomy of the embryo (V. E. Vasilyeva, Т. В. Batygina) 579
Observations on living embryo (O. Erdelska) 588
Perspectives on genetic analysis of plant embryogenesis
(D. W. Meinke) 593
Gene expression during embryogenesis (N. M. Morozova) 605
Polarity and embryogenesis (5. 5. Medvedev) 617
EMBRYOIDOGENY
Embryoid (Т. В. Batygina) 624
Embryoidogeny (Т. В. Batygina) 628
Parallelism in the development of somatic and sexual embryos
(T. 5. Batygina, A. A. Zakharova) 635
PART IV — SEED
Seed (\M. F.Danilova\) . 649
Seed coat (\M. t. Danilova\) 650
PART V — SEED DORMANCY AND GERMINATION
Seed dormancy (L. M. Pozdova, M. V. Razumova) 656
The morphology and physiology of seed germination (N. V. Obrucheva,
O. V. Antipova) 667
Scutellum and its role in germination (S. M. Szcziparev) 681
Hormonal regulation of seedling growth and development
(V. V. Polevoy, T. S. Salamatova) 685
REFERENCES 691
INDEX „ 822
ILLUSTRATIONS 824
INSETS: CLASSICS OF PLANT MORPHOLOGY
AND EMBRYOLOGY; CONTRIBUTORS OF THE
VOLUME
Предисловие
13
Посвящается 100-летию открытия
Сергеем Гавриловичем Навашиным
двойного оплодотворения
у покрытосеменных растений
Семена — источник жнзни, ее начало и конец,
результат прошлого урожая н залог будущего
О. Л. Фриман.
ПРЕДИСЛОВИЕ
Открытие Навашина дало толчок многочисленным исследованиям
оплодотворения не только у покрытосеменных, но и голосеменных растений.
Одна из талантливейших его учениц — Елена Николаевна Герасимова-
Навашина, разработала новые представления об этом процессе, в
частности, о типах оплодотворения. Ее исследования также стали
классическими. Традиции эмбриологической школы С. Г. Навашина и Е. Н.
Герасимовой-Навашиной продолжают развиваться в разных
лабораториях мира и, в первую очередь, в Отделе Эмбриологии и
Репродуктивной Биологии Ботанического института иМ. В. Л. Комарова
Российской Академии Наук. *,
Мы сочли приятным долгом включить в это издание краткую
автобиографию С. Г. Навашина, историю открытия двойного
оплодотворения, а также некоторые его работы, опубликованные в русских и
немецких журналах и ставшие библиографической редкостью. Эти
исследования и до настоящего времени не утратили своего значения,
поскольку в них детально описывается и иллюстрируется прекрасными
рисунками процесс двойного оплодотворения на классических объектах.
В последнее время очевидна тенденция к сближению эмбриологии с
генетикой, физиологией и биохимией. Прогресс в области
молекулярной биологии усилил эти взаимосвязи. Если раньше основным методом
генетики был гибридологический анализ, позволяющий регистрировать
те или иные альтернативные признаки, то в настоящее время внимание
генетиков все больше привлекают вопросы проявления генетических
признаков в процессе онтогенеза, закономерности кариогамии,
плазмогамии и цитокинеза, равно как гистогенеза и органогенеза. В центре
внимания многих генетиков стало изучение мутаций, проявляющихся на
критических этапах развития мужских и женских генеративных
структур и эмбриогенеза (например, нарушение асимметричного заложения
перегородки в зиготе), что позволяет выявлять механизмы генной
регуляции процессов развития и органогенеза. Найдены удачные
модельные объекты для исследования мутаций (Arabidopsis thaliana, Zea
mays).
14
Семя
К сожалению, специалисты в области изучения наследования
признаков не всегда учитывают фундаментальные достижения
эмбриологии. Однако именно классическая эмбриология в лице таких ученых,
как К. Schnarf, R. Soueges, D. A. Johansen, P. Maheshwari, В. М.
Johri, J. S. Mestre, J. L. Guignard, A. Lebegue, С. Г. Навашин, М. С.
Яковлев, E. H. Герасимова-Навашина и др., внесла значительный вклад в
понимание основных закономерностей зарождения и первых этапов
развития растительного организма.
В резолюции XV Международного Конгресса по половой
репродукции у цветковых растений (Австралия, 1996) была отмечена
актуальность усиления работ в области классической эмбриологии как
необходимого фундамента любого исследования по репродуктивной биологии.
В предлагаемой книге большое внимание уделено морфологическим
и функциональным аспектам процесса оплодотворения и эмбриогенеза,
которые составляют основное ядро семенного воспроизведения. Важно
отметить, что особый тип полового воспроизведения у цветковых
растений, неразрывно связанный с семенной репродукцией, позволил им
«завоевать» Землю и создать основу для развития и процветания
нашей цивилизации. Именно семена являются основным источником
питания для человечества, и поэтому невозможно переоценить
значение научного прогресса в их изучении.
Наряду с традиционными представлениями о развитии семени в
книге изложены оригинальные концепции по проблемам
происхождения, корреляций и эволюционных преобразований структур семени,
которые содержат данные не только по покрытосеменным, но и
голосеменным растениям.
Достижения в области экспериментальной эмбриологии, касающиеся
морфогенеза репродуктивных структур, в частности, развития
соматического зародыша, позволили обсудить новую категорию бесполого
размножения — эмбриоидогению.
В книге представлены также новые типы эмбриогенеза и эндоспер-
могенеза, классификации (и подходы) типов развития основных
структур семени, разработанные сотрудниками Ботанического института им.
В. А. Комарова РАН. Обобщены результаты исследований по
экологической эмбриологии, хлорофиллоносности зародыша, его
автономности и др.
Авторы ставили своей задачей обобщение классических и
современных экспериментальных данных о развитии генеративных органов
цветка, процессах формирования и прорастания семени, о системе семенной
репродукции в целом. Это особенно актуально в связи с
необходимостью сохранения редких и исчезающих видов растений, создания банка
семян и разработки новых биотехнологий для размножения ценных
форм и сортов.
Не менее важной является унификация эмбриологических терминов
и понятий, которая будет способствовать дальнейшему развитию
представлений о репродуктивных процессах, протекающих в ходе онтогенеза.
Предисловие
15
В 1994 г. вышел из печати первый том трехтомного издания
«Эмбриология цветковых растений. Терминология и концепции» —
«Генеративные органы цветка», который был посвящен общему строению
цветка и его основных генеративных органов — пыльника и семязачатка.
Настоящая книга является вторым томом этого издания. Она
состоит из 5 частей, в которых рассмотрены процессы развития всех
структур, участвующих в формировании семени. При этом авторами
учитывалась давно назревшая необходимость расширения границ
эмбриологии растений как науки, которая из описательной превращается
в каузальную дисциплину. Кроме традиционных разделов:
«Оплодотворение», «Зародыш» и «Эндосперм», в книгу включены разделы,
освещающие природу запасающей ткани — перисперма, строение
семенной кожуры, а также перспективы генетического анализа
эмбриогенеза, особенности постсемениого развития, включая покой и
прорастание семян.
При написании книги были использованы такие известные монографии,
как: F. Netolitzky, «Anatomie der Angiospermen-Samen» (1926);
К. Schnarf, «Embryologie der Angiospermen. Archegoniaten» (1929) и
«Vergleichende Embryologie der Angiospermen» (1931); R. Soueges, «Les
Lois du Developpement» (1937) и «Embryogenie et Classification»
(1939); D. A. Johansen, «Plant Embryology» (1950); P. Maheshwari,
«An Introduction to the Embryology of Angiosperms» (1950); П. А. Баранов,
«История эмбриологии растений» (1955); А. Л. Тахтаджян, «Основы
эволюционной морфологии покрытосеменных» (1964) и «Система Маг-
нолиофитов» (1987), A. L. Takhtaia'n, «Outline of the Classification of
Flowering Plants (Magnoliophyta)» (1980); В. А. Поддубная-Арнольди,
«Общая эмбриология покрытосеменных растений» (1964) и «Цитоэмб-
риология покрытосеменных растений. Основы и перспективы» (1976);
G. Davis, «Systematic Embryology of Angiosperms» (1966); Т. Б.
Батыгина, «Эмбриология пшеницы» (1974); Е. Corner, «The Seeds of
Dicotyledons» (1976); Э. С. Терёхин, «Паразитные цветковые растения.
Эволюция онтогенеза и образ жизни» (1977); V. Raghavan,
«Experimental Embryogenesis in Vascular Plants» (1976) и
«Embryogenesis in Angiosperms: A Developmental and Experimental Study»
(1986); K. Esau, «Anatomy of Seed Plants» (1977); «Embryology of
Angiosperms» (1984), под ред. В. М. Johri; «Сравнительная эмбриология
цветковых растений» (1981, 1983, 1985, 1987, 1990), под ред.
М. С. Яковлева и Т. Б. Батыгиной; М. F. Willson, «Plant Reproductive
Ecology» (1983); В. M. Johri, К. Ambegaokar, P. S. Srivastava,
«Comparative Embryology of Angiosperms» (1992) и др.
Уточнение семантики терминов проводилось в соответствии со
словарями: М. С. Cooke, «A Manual of Botanic Terms» ([1873?]);
В. D. Jackson, «A Glossary of Botanic Terms» (1916); H. H. 3a-
бинкова, М. Э. Кирпичников, «Латино-русский словарь для
ботаников» (1957); М. Э. Кирпичников, Н. Н. Забинкова, «Русско-
латинский словарь для ботаников» (1977); Биологический Энцикло-
16
Семя
педический словарь (1986, 1989); The Oxford English Dictionary
(1989) и др.
В публикуемом издании сочетаются принципы построения
энциклопедического словаря с монографическим описанием
эмбриональных структур и процессов. Однако в отличие от традиционной
структуры словарей, терминологические статьи в каждой из частей
книги расположены не в алфавитном порядке, а по тематическому
принципу в целях создания целостной картины о каждой из
основных структур семени. В конце книги дается предметный указатель.
Терминологические статьи составляют большую часть текстов. Они
содержат: определение и семантику термина, его историю, сведения о
происхождении, развитии, функциях и классификации описываемой
структуры. Освещаются вопросы эволюционных преобразований
эмбриональных структур и характер распространения эмбриологических
признаков среди цветковых растений.
Вторая группа статей объединяет концептуальные статьи,
посвященные наиболее сложным и дискуссионным вопросам эмбриологии
покрытосеменных. К ним относится и ряд текстов из работ отечественных
классиков эмбриологии растений, сохранивших свою актуальность и до
настоящего времени. Это статьи С. Г. Навашина и Е. Н. Герасимовой-
Навашиной.
Работы зарубежных авторов приведены на английском языке.
Случаи разночтения в терминах указаны в сносках.
Названия концептуальных статей, разделов и ряда подразделов
выделены жирным шрифтом и отдельной строкой, а названия
терминологических статей, также выделенные жирным шрифтом, напечатаны
в начале строки без абзаца.
В конце каждой статьи приведены основные литературные
источники (автор и год издания). Они отсутствуют в тех случаях, когда
высказывается общепринятое мнение или описывается широко
распространенный признак. Полные библиографические данные представлены
в конце книги.
Большинство терминологических и концептуальных статей снабжено
иллюстративными материалами в виде рисунков, микрофотографий
(СМ, ТЭМ, СЭМ), схем и графиков. Порядковый номер
иллюстрации указан в конце текста статьи. В книгу включены фотографии
классиков морфологии и эмбриологии, а также авторов, принимавших
участие в написании тома.
Батыгина Т. Б.
Никитичева 3. И.
Предисловие
17
То S. G. Nawaschin the discoverer
of double fertilization
in angiosperms (100 anniversary)
Seeds are the germ of life, a beginning and an end,
the fruit of yesterday's harvest and the promise
of tomorrow's.
O. L. Freeman
PREFACE
Nawaschin's discovery has become stimulus for numerous investigations
of fertilization not only in Angiospermae, but also in Gymnospermae. One
of his most talanted pupils — E. N. Gerassimova-Navashina, has
developed new notions about this process, specifically the idea of fertilization
types. Her investigations became classical also. Their embryological school
traditions nowadays are continued in different laboratories of the world
and, primarily, in the Department of Embryology and Reproductive,
Biology of Komarov Botanical Institute of the Russian Academy of
Sciences. \
We considered it to be our pleasartt duty to include in this edition the
short autobiography of S. G. Nawaschin, the history of double fertilization
discovery and some of his works, "published in Russian and German
journals, which are bibliographical rarities. These investigations have not
lost their significance up to our time, because they contain the detailed
descriptions of double fertilization process in classical objects.
In recent time the tendency of consolidation of embryology with
genetics, physiology and biochemistry is obvious. Progress in molecular
biology has strengthened these relationships. Earlier the main genetical
method was hybridological analysis, the one permitting to record these or
those alternative features, and nowadays the attention of geneticists is
more and more attracted to the questions of genetical feature expression
during ontogenesis, regularities of caryogamy, plasmogamy and cytokinesis,
as well as of histogenesis and organogenesis. For many geneticists of the
world the centre of attention became the study of mutations which affect the
first developmental stages of male and female generative structures and of
embryogenesis (for example, the disturbance of asymmetrical initiation of the
first wall in the zygote). This permits to reveal the action mechanism of
genes in the processes of development and organogenesis. The successful
models for studying mutations are found (Arabidopsis thaliana, Zea mays).
Unfortunately, the specialists in the area of studying features
inheritance do not consider enough the fundamental achievements of
embryology. However, it was the very classical embryology, with such repre-
IS Семя
sentatives as К. Schnarf, R. Soueges, D. A. Johansen, P. Maheshwari,
B. M. Johri, J. S. Mestre, J. L. Guignard, A. Lebegue, S. G. Nawaschin,
M. S. Yakovlev, E. N. Gerassimova-Navashina a.o., which has made
significant contribution in the understanding the main regularities of the
origin and early stages of individual development.
In the resolution of XV International Congress on sexual reproduction
in flowering plants (Australia, 1996) the necessity of intensification of the
works in the area of classical embryology, as a basis of any investigation
on reproductive biology, was noted.
In the book, presented to readers, the great attention is paid to the
morphological and functional aspects of fertilization process and
embryogenesis, the ones which are the main subjects of investigation for
the embryologists of St. Petersburg scientific school for many decades.
This is connected with the fact.
Besides, it is important that the very peculiar type of sexual reproduction
closely connected in flowering plants with seed reproduction, has permitted
the flowering plants «to conquer» the Earth and create the basis-for the
development and flourishing of our civilization. Just the seeds are the main
nutritive source for the mankind, and that is why it is impossible to
overevaluate the significance of scientific progress in their studying.
Together with the traditional ideas of seed development, the original
notions on the problems of origin, correlations and evolutionary
transformations of seed structures are presented in the book.The data are
drawn not only for angiospermous, but also for gymnospermous plants.
The new data in the area of experimental embryology, dealing with
morphogenesis of reproductive structures, specifically, the development of
somatic embryo, have permitted to discuss the new notion of asexual
reproduction — embryoidogeny.
The new classifications of the developmental types of main seed
structures, worked over mainly by the researchers of Botanical Institute, are
presented in tne book. Investigations on ecological embryology, embryo
chlorophyll-bearing, it's autonomy and others are generalized.
The new types of embryogenesis and endospermogenesis are also
described.
The task of the authors was the generalization of theoretical notions
at the basis of the classical and experimental data about the development
of flower generative organs, the process of seed formation and germination,
the system of seed reproduction as a whole. It is especially urgent with
the necessity to preserve the rare and vanishing plant species, to create a
seed bank and to elaborate a new biotechnologies for multiplication of
avaluable plant forms and varieties connected with the problems of seed
reproduction.
The unification of embryological terms and notions will promote the
further development of ideas about the reproductive processes occurring
during plant ontogenesis.
Предисловие
19
The first volume of the three-volume edition «Embryology of Flowering
Plants. Terminology and Concepts» was published in 1994. It was
devoted to the common flower structure and the structure of main generative
organs — the anther and ovule. The present book is the second volume
of this edition. It consists of five parts and reflects the processes, which
take part in the seed formation. The authors took into account the long
ago matured broadening of plant embryology borders, the science which
turns from descriptive into casual discipline. Becides the traditional
chapters — «Fertilization», «Embryo» and «Endosperm», — in the book
there are chapters, showing the nature of such storage tissue as peris-
perm, the testa structure, and also perspectives on genetic analysis
of plant embryogenesis the features of the postseminal development
including the seed dormancy and germination.
For preparing of the book we have used such well-known monographi-
es, as F. Netolitzky «Anatomie der Angiospermen-Samen» (1926);
K. Schnarf, «Embryologie der Angiospermen. Archegoniaten» (1929) and
«Vergleichende Embryologie der Angiospermen» (1931); R. Soueges,
«Les Lois du Developpement» (1937) and «Embryogenie et
Classification» (1939); P. Maheshwari, «An Introduction to the «Embryology
of Angiosperms» (1950); D. A. Johansen, «Plant Embryology» (1950);
P. A. Baranov, «The History of Plant Embryology» (1955);
A. L. Takhtajan, «Foundations of Evolutionary Morphology of
Angiosperms» (1964), «Outline of the Classification of Flowering Plants»
(1980) and «System Magnoliophyta» («1987); V. A. Poddubnaya-Arnol-
di, «General Embryology of Angiosperms» (1964) and «Cytoembryology
of Angiospermous Plants. Principles and Perspectives» (1976); G. Davis,
«Systematic Embryology of Angiosperms» (1966); Т. В. Batygina,
«Embryology of the Wheat» (1974); E. S. Teryokhin, «Parasytic
flowering plants. Evolution of Ontogenesis and Mode of Life» (1977);
E. Corner, «The Seeds of Dicotyledons» (1976); K. Esau, «Anatomy
of Seed Plants» (1977); В. М. Johri (ed.), «Embryology of
Angiosperms» (1984); M. S. Yakovlev, Т. В. Batygina (ed.), «Comparative
Embryology of Flowering Plants» (1981, 1983, 1985, 1987, 1990);
V. Raghavan, «Experimental Embryogenesis in Vascular Plants» (1976)
and «Embryogenesis in Angiosperms: A Developmental and Experimental
Study» (1986); M. F. Willson, «Plant Reproductive Ecology» (1983);
B. M. Johri, K. Ambegaokar, P. S. Srivastava «Comparative
Embryology of Angiosperms» (1992) and others.
For the closer definition of terms' meaning the following dictionaries
were used: M. C. Cooke, «A Manual of Botanic Terms» [1873?];
B. D. Jackson, «A Glossary of Botanic Terms» (1916); N. N. Zabinkova,
M. E. Kirpichnikov, «Latino-Russian Dictionary for Botanists» (1957);
M. E. Kirpichnikov, N. N. Zabinkova, «Latin-Russian Dictionary for
Botanists» (1977), Biological Encyclopedical Dictionary (1986, 1989);
The Oxford English Dictionary (1989) and others.
I
20
Семя
In this encyclopedical edition the principles of constructing the
dictionary with monographic description of embryonic structures and
processes are combined. However, unlike traditional dictionary
structure, the terminological articles in every part of the book are
disposed not in alphabetical order, but according to theme principle,
so as to create the integrated picture about every of main seed structures.
In the end of the book the subject index is given.
The terminological articles consist the main part of the text. These
articles include: the definition and semantics of the terms, their history,
the main data about origin, development, functions and classification of
described structure. In a number of cases the questions of evolutionary
transformations and the character of distribution of embryological features
among flowering plants are discussed.
The second group of articles combines conceptional articles, devoted
to the most complicated and being on discussion questions of angiosperm
embryology. To these is related also a number of texts from the works
by native plant embryology classics, which have preserved their acute
meaning up to our time. These are the articles by S. G. Nawaschin and
E. N. Gerassimova-Navashina. The studies of foreign authors, reflecting
the methodical and theoretical achievements of the last years are presented
in English. Some cases of difference between author's terms and terms
accepted in this edition, are marked in footnotes.
The titles of conceptional articles, chapters and number of subchapters
are marked by heavy type and separate line, while the titles of
terminological articles, which are also printed in bold type, are published in
the beginning of the line without indention.
In the end of every article the main short references are given (the
author's name and the date of publication). The reference is absent in the
cases when common opinion is given or broadly-spread feature is described.
The full bibliographical data used are placed at the end of the volume.
The majority of terminological and conceptional articles are supplied
with illustrations such as drawings, microfotographs (LM, ТЕМ, SEM),
schemes and graphs, the illustration number being indicated at the end of
the article. The book includes the photoes of morphological and
embryological science classics, and also of authors, who have taken part
in it's creation.
Tatyana B. Batygina
Zinaida I. Nikiticheva
Предисловие
21
БЛАГОДАРНОСТИ
Выражаю искреннюю благодарность всему авторскому коллективу и
особую признательность коллегам из разных стран мира,
откликнувшимся на предложение участвовать в этой монографии: М. Cresti, Y.-Q.
Li (Италия); S. D. Russell, W. E. Friedman, D. W. Meinke (США);
A. A. M. van Lammeren, W. L. H. van Veenendaal, J. H. N. Schel,
H. Kieft, F. Ma, J. L. van Went (Голландия); Е. С. Yeung (Канада),
S. Y. Zee (Гонконг), X. L. Ye (Китай); G. Jurgens (Германия); J.
Pare (Франция); В. Rodkiewicz, E. Szczuka (Польша); О. Erdelska
(Словакия); О. А. Хведынич (Украина).
Особую благодарность хотела бы выразить В. Е. Васильевой
(редактору), И. И. Шамрову (секретарю издания), а также Г. Е. Титовой,
Г. Я. Жуковой, Л. М. Поздовой, Е. В. Андроновой, Г. М. Анисимо-
вой, О. П. Камелиной и Т. Н. Наумовой за их многостороннюю
помощь в подготовке этого издания. Сердечно бл&годарна Н. А. Жинки-
ной, А. А. Захаровой за прекрасные, репродукции многих рисунков и
Л. М. Ротенфельд — за безукоризненное выполнение фотографий, а
также Е. А. Брагиной, О. Н. Вороновой, М. А. Берлиной, Я. В. Осад-
чему и Д. В. Суслову за техническую помощь при оформлении рукописи.
Очень признательна Г. К. Лахману и Е. В. Драгуновой за
неоценимую помощь при переводе отдельных материалов на английский
язык.
Я благодарна также сотрудникам издательства «Мир и семья-95»
за доброжелательное отношение, эффективное и плодотворное
сотрудничество.
Монография смогла увидеть свет благодаря финансовой поддержке
Российского Фонда Фундаментальных Исследований.
Т. Б. БАТЫГИНА
-'Л2~828
I 22
Семя
ACKNOWLEDGEMENTS
As the editor of this volume, I would like to express my gratitude to
the team of contributing authors. I am especially thankful to colleagues
from different countries of the world who accepted our proposal to
participate in the preparation of this book, namely: M. Cresti, Y.-Q. Li
(Italy); S. D. Russell, W. E. Friedman, D. W. Meinke (USA); A.
A. M. van Lammeren, W. L. H. van Veenendaal, J. H. N. Schel, H.
Kieft, F. Ma, J. L. van Went (Netherlands); E. С Yeung (Canada),
S. Y. Zee (Hong Kong), X. L. Ye (China); G. Jurgens (Germany);
J. Pare (France); B. Rodkiewicz, E. Szczuka (Poland); O. Erdelska
(Slovakia); O. A. Khvedynich (Ukraina).
My special thanks are due to V. E. Vasilyeva (ed.), I. I. Shamrov
(secretary), as well as to G. E. Titova, G. Ya. Zhukova, L. M.
Pozdova, E. V. Andronova, G. M. Anisimova, O. P. Kamelina and
T. N. Naumova for their great help in the preparation of the present
edition. I am also grateful to N. A. Zhinkina and A. A. Zakharova for
beautiful illustrations; to L. M. Rotenfeld for excellent photography; to
E. A. Bragina, O. N. Voronova, Ya. V. Osadtchiy, D. V. Souslov and
M. A. Berlina for their valuable technical assistance.
Very grateful to G. K. Lakhman and E. V. Dragunova for invaluable
help in the translation into English.
I am also sincerely grateful to the colleagues of Publishing House
«World and Family-95» for benevolence and effective collaboration.
The financial support from the Russian Foundation for Fundamental
Researches, without which the book would not have been printed, is gratefully
acknowledged.
TATYANA B. BATYGINA
КЛАССИКИ МОРФОЛОГИИ И ЭМБРИОЛОГИИ
и
АВТОРЫ 2 ТОМА
КЛАССИКИ МОРФОЛОГИИ И ЭМБРИОЛОГИИ
CLASSICS OF MORPHOLOGY AND EMBRYOLOGY
.■" л. *L. л
. 4b.
■»>■,.'■■:
АМИЧИ Д. Б.
AMICI G. В.
(1786-1864)
АРИСТОТЕЛЬ
ARISTOTEL
(384-322 до н.э.)
Ш
Ш
%.
. *$t*4u.
SSIirfW:
л-
АРНОЛЬДИ В.
ARNOLDI V. \
(1871-1924)
ii '. .',*£ ■ -1
. . :'":'S&," ■ :.
- .fJV". si»;:- . \$Ч
БАРАНОВ П. А.
BARANOV P. A.
(1892-1962)
Г ' ч
/Лиг
БЕКЕТОВ А. Н.
BEKETOV A. N.
(1825-1902)
БОРОДИН И. П.
BORODIN LP.
(1847-1930)
**
V'
ii*
ГАНШТЕИН И.
HANSTEINJ.
(1822-1880)
ГРЮ Н.
GREW N.
(1628-1711)
J№< "^""
■■i«4:S!#'*
*-J5j;35-.--
ДАРВИН Ч.
DARVIN Ch.
(1800-1882)
ДЖОРИ Б. IV
JOHRI В. М.
(род. 1909)
--* ■*,
КАМЕНСКИЙ Ф. М.
KAMIENSKI F. М.
(1851-1912)
КЕМЕРЕР Р.
CAMERARIUS R.
(1665-1721)
КЕЛЬРЕЙТЕР И
KOELREUTER J
(1733 —1£
КЭМПБЕЛЛ Д. Г
CAMPBELL D. Н.
(1859-1953)
k
ЛЕОНАРДО ДА ВИНЧИ
LEONARDO DA VINCHl
(1452-1519)
ЗХ.Т -"-'r';''f-
ЛИННЕЙ К.
LINNAEUS К.
(1707-1778)
7%, .-.■> ФА
РОЗАНОВ С. М.
ROSANOFF S. М.
(1840-1870)
СТРАСБУРГЕР Э.
STRASBURGER E.
(1844-1912)
СУЭЖ Р.
SOUEGES R.
(1876-1967)
':.|
ТРЕИБ М.
TREUB М.
(1851-1910)
mm
ФЕОФРАСТ
FEOFRAST
(370-286 до н. э.)
ЧИСТЯКОВ И. Д.
TSCHISTIAKOFF I. D.
(1843-1877)
:^M
ШЛЕИДЕН М. И.
SCHLEIDEN M.J.
(1804-1881)
/
ШНАРФ K.
SCHNARF K.
(1879-1947)
—}■
/
ТАХТАДЖЯН А. Л.
TAKHTAJAN A. L.
(род. 1910)
ЯКОВЛЕВ М. С.
YAKOVLEV M. S.
(род. 1902)
АВТОРЫ 2 ТОМА
AUTHORS OF VOLUME 2
£№&
Андронова Е. В.
Andronova E. V.
г
ж
Анисимова Г. М.
Anisimova G. М.
.:> "*
Батыгина Т. Б.
Batygina Т. В.
Брагина Е. А.
Bragina E. А.
10Щт
Брюхин В. Б.
Brukhin V. В.
Ван Ламмерен А. А. М.
Van Lammeren A. A. M.
Васильева В. Е.
Vasilyeva V. E.
щЛ
[й---- -W%B ,- - .У \ Л
Вишнякова М. А.
Vishnyakova M. A.
Вышенская Т. Д.
Vyshenskaya Т. D.
Гваладзе Г. Е.
Gvaladze G. E.
е Ч
Sti-
Герасимова-Навашина Е. Н.
Е. N. Gerassimova-Navashina
i.^r
v..
Данилова М. Ф.
Danilova M. F.
Zft
Ф
Жинкина Н. A.
Zhinkina N. A.
Захарова A. A.
Zakharova A. A.
Зи С. Е.
Zee S. Y.
Ие К. Л.
Ye X. L.
Йенг Э. К.
Yeung E. С.
Камелина О. П.
Kamelina О. Р.
Кифт X.
Kieft H.
Коробова С. Н.
Korobova S. N.
1» «J
Крести М.
Cresti M.
"./ЛИЙ,
- - 1ЛГ >** ■*:■*
Г
Медведев С. С.
Medvedev S. S.
Морозова Н. М.
Morozova N. М.
Наумова Т. Н.
Naumova Т. N.
Никитичева 3. И.
Nikiticheva Z. I.
Обручева Н. В.
Obrucheva N. V.
Паре Ж.
Pare J.
Поздова Л. М.
Pozdova L. М.
Разумова М. В.
Razumova M. V.
Расселл С. Д.
Russell S. D.
Родкевич Б.
Rodkiewicz В.
Л-
Савина Г. И.
Savina G. I.
Солнцева М. П.
Solntseva M. Р.
.Гяу^кр*
Терехин Э. С.
Teryokhin E. S.
Титова Г. Е.
Titova G. Е.
Шамров И. И.
Shamrov I. I.
Шел Дж. X. Н.
Schel J. H. N.
A.^fc
Щипарев С. М.
Szcziparev S. М.
V
Щука Е.
Szczuka E.
Эрдельска О.
Erdelska О.
СЕРГЕИ ГАВРИЛОВИЧ НАВАШИН
(1857-1930)
Предисловие
23
СЕРГЕЙ ГАВРИЛОВИЧ НАВАШИН1
Автобиография
Родился я в 1857 г. 2 декабря, в с. Царевщине Саратовской губ.
Вольского у. Отец мой, Гавриил Иванович Навашин, был главным
врачом в имениях, обнимавших большую округу. В с. Царевщине была
большая больница и аптека с аптекарским садом, которым заведовал
врач, т. е. мой отец, имевший в помощь фельдшера и аптекаря. Отец
имел медицинскую практику по всему уезду и делал нередко поездки.
Мать моя, Елизавета Алексеевна, была родом из Москвы, из
чиновнической семьи, духовного происхождения. Отец из дворян Калужской
губ., из семьи обедневшей, без поместья, уже несколько поколений
неизменно служившей на военной службе. Один из дядей отца,
полковник Михаил Навашин, убит при штурме Севастополя, на Малахо-
вом кургане. Брат отца, мой дядя, Андрей Навашин, также был
военным, участвовал в кампаниях, был ранен, имел пенсию и за женой
получил имение под Саратовом. Дяди по матери: один, Василий
Клиентов, был художник, портретист; другие двое, Виктор и Владимир,
были военными; Виктор убит в турецкую кампанию в 70-х годах при
геройской защите Горного Дубняка. Старшая сестра матери, тетка
моя, Анна Алексеевна, жила в нашей семье в помощь матери, ради
большой семьи: братьев и сестер нас было семь человек.
Отец, так же как и мать, состояния не имел, и семья жила на труды
отца, его врачебную практику и жалованье врача в Царевщине. Это
место, со смертью владельца имений, отцу пришлось оставить, и он
переехал с семьей в Саратов, где получил от своей тетки, Бизяевой, в
наследство небольшую усадьбу, на которой построил дом на ссуду из
«Строительной комиссии». Эту ссуду долго выплачивала мать, потому
что отец вскоре умер (1863), когда мне минуло 6 лет. Семья осталась
Печатается по книге: С. Г. Навашин. Избранные труды. М.—Л.: Изд.
АН СССР, 1951. Т. 1. С 13—20.
24
Семя
без средств, но обе женщины, мать и тетка, своим трудом, — открыв
маленькую школу для приготовления детей в учебные заведения, —
дали возможность всем детям получить образование. Старшие в семье
были мои сестры, учившиеся в Саратовском институте. Старшая сестра,
Александра, увеличила упомянутую школу и, выйдя замуж за учителя
гимназии И. И. Зелинского, вместе с ним открыла позже женскую
гимназию, которая Пользовалась в Саратове весьма хорошей репутацией.
Младшая сестра, Анна'," также трудилась по педагогической части и
была известна как образцовая народная учительница. Из братьев я был
старший. Второй — Николай — рано погиб, будучи еще гимназистом
(самоубийство как следствие меланхолии); после смерти матери, через
год после окончания мною гимназии. Мне и оставшемуся в живых
другому брату, Андрею, пришлось кончать образование на собственные
заработки, как водится, частными уроками, которые я, впрочем, начал
уже давать 14 лет отроду. Я поступил студентом в славившуюся тогда
Медико-хирургическую Академию (ныне Военно-медицинская) в
Ленинграде. Гимназию я прошел легко, благодаря хорошей подготовке дома
моей теткой. Поступил во 2 класс и до 4 учился старательно,
включительно до «наград». С 4 класса учился «на тройку» и окончил курс с
аттестатом сплошь из троек, только с одной четверкой по математике.
К счастью, это тогда не было еще помехой для поступления в высшее
учебное заведение. Экономия же сил в четырех старших классах, как
я уверен, сохранила мне свежесть памяти и сообразительность, вообще
способности для более серьезной работы.
Я имел, кроме того, много досуга на чтение и всяческое
любительство. С раннего возраста меня привлекало коллекционирование,
устройство самодельных физических аппаратов, химических аппаратов, а
летом поездки на лодке, рыбная ловля и охота с ружьем.
Руководителей в этих занятиях я не имел, что, может быть, осталось моим
уделом и позже, ибо я, ученый специалист, не принадлежу ни к чьей
школе и считаю до сих пор, что книга и собственный опыт — лучшие
учителя. В Медико-хирургической академии весьма интересовался
общими науками, из которых, впрочем, лишь одна анатомия была
представлена блестяще проф. Грубером и Ландцертом. Грубер произвел на
меня неизгладимое впечатление человека, отдавшегося всецело науке и
ушедшего ради нее «из мира». Ландцерт поражал художественным
изложением «сухого» предмета — описательной анатомии. Первым
годам в академии я обязан очень многим: студенчество было очень
многолюдно (на. моем курсе свыше 300 чел.), и потому некоторые
практические занятия были сделаны необязательными. Так, в
химической лаборатории работали лишь студенты-«любители», всего десятка
два. Со второго года я занимался, поэтому, химией по целым дням,
отрываясь лишь для препаровочной Грубера. Так дело пошло и
дальше, так что с 4 курса я почти не посещал клиник (кроме Боткинской
и Склифосовского), а занимался уже по органической химии в
лаборатории А. П. Бородина (он же известный композитор). Этот превос-
Предисловие
25
ходный человек привлекал к себе всех и впоследствии был другом
моей семьи. Он своим отношением ко мне дал мне понять, что
медицина не по мне. Я, сдав экзамен за 4 курса, вышел из академии и
поступил в Московский университет на 2 курс, сдав дополнительный
экзамен. Продолжал здесь занятия у проф. Марковникова, но не
особенно счастливо, несмотря на большое усердие. Весьма полезно
оказалось для меня то, что я, по своей опытности в анализе, был
старшим практикантом в помощь единственному лаборанту, милейшему
и незабвенному Освальду Карловичу Мюллеру; помогал советами
товарищам по аналитической химии. В это время самыми
привлекательными лекциями были курсы по физиологии растений К. А.
Тимирязева, также и его беседы со студентами в часы практических занятий.
Мы слышали от него множество рассказов о неурожайности в
Западной Европе, характеристики его учителей, каковы были Гофмейстер,
Бунзен, Клод Бернар и др. Нас было на курсе 12 чел., и Тимирязеву
легко было отметить меня как основательно знающего химию, по
которой я имел тогда и заработок для жизни в Москве: я был
ассистентом на лекциях по химии на тогдашних Высших женских курсах,
называвшихся обычно Лубянскими. Многим воспользовался я при этом
от проф. А. А. Колли, превосходного и очень требовательного
демонстратора опытов. Тимирязев поэтому наметил меня в ассистенты, и по
окончании курса я стал его помощником в университете и бывшей
Петровской академии. Несмотря на это, я быд совершенно без
подготовки по ботанике собственно. Пришлось очень много поработать,
чтобы получить необходимые сведения по анатомии растений и по
флоре, для занятий со студентами. «К тому времени я уже был женат
на одной из слушательниц тех же Лубянских курсов, Александре
Савельевне Сметаниной, подруге моей жизни по сей день. С нею были
мои первые ботанические экскурсии, положившие начало моему
знанию флоры, а также — повороту от химии к ботанике.
Ради проверки гербария, собранного за лето, я обращался к
тогдашнему лучшему знатоку флоры, математику-геометру В. Я. Цинге-
ру, который своим образом страстного любителя живой природы дал
мне направление в сторону биологии. Я до сих пор уверен, что
биологу необходимо изучать предмет, начиная с прямого знакомства хотя
бы с одной группой растений или животных. Наши физиологи, в
сущности, либо химики, либо физики, а не биологи, что, конечно,
зависит от состояния науки в данную эпоху, от ее потребностей. Как
бы то ни было, с химией для меня было покончено моим
«кандидатским рассуждением» «О конституции соляных растворов», — тема,
вскоре попавшая в руки великана, знаменитого Вант-Гоффа.
«Карьера» моя была этим определена, и я на всю жизнь остался доволен
тем, что не был «оставлен при университете», а попал прямо на
работу в качестве помощника хорошего учителя. В моей роли
Тимирязев оставил мне широкую самодеятельность. За время моей службы
в Петровской академии я сдал экзамен на магистра ботаники.
1/23-828
26
Семя
Я чрезвычайно обязан К. А. Тимирязеву за то, что он потребовал
от меня приступить к этому, оставив на время текущие лабораторные
занятия. На самом деле, пора было сделать этот официальный акт,
без которого продвинуться вперед тогда было невозможно. За два
года, как раз к моим 30 годам, я подготовился к экзамену и держал
его в Петербургском университете. Вновь изъявляю свою
признательность К. А. Тимирязеву за ту рекомендацию, которой он снабдил
меня моему главному экзаменатору, А. Н. Бекетову. Мой экзамен в
факультете свелся лишь на экзамен по химии (экзаменатор —
теперешний академик Д. П. Коновалов), тогда как оба другие
экзаменатора, Бекетов и Гоби, были удовлетворены представленными мною
конспектами и первыми моими научными статьями и докладами. Я,
получив «степень» магистранта, мог объявить приватдоцентский курс.
В Академии я читал в течение года курс патологии растений, а в
Университете — введение в систематику грибов.
Через год последовал знаменитый разгром Петровской академии и
уход Тимирязева из ее состава. Я получил предложение из Санкт-
Петербургского университета и перешел туда ассистентом по ботанике к
проф. Бородину. Там я возобновил также свой приватдоцентский курс по
патологии растений. Судьба свела меня здесь с тремя светлыми
личностями: И. П. Бородиным, А. Н. Бекетовым и М. С. Ворониным. С
последним у меня установилась тесная дружба, несмотря на большую
разницу в летах (мне было только за 30, а ему за 50), сначала на почве нашей
общей любви к исследованию грибов. Я работал с ним совместно и
признаю его своим учителем по исследованиям истории развития низших
существ. Ему же я был полезен знанием новейших приемов
микроскопической техники. С ним совместно была мною сделана работа над одним
интересным паразитом, и ему же я обязан темой для магистерской
диссертации — о болезни сережек березы, которую я вскоре (1894) и
«защитил» в буквальном смысле слова, потому что официальный
оппонент, проф. Гоби, был крайне восстановлен, по разным причинам против
меня. Попутно, изучая болезнь сережек березы, я проследил порядок
оплодотворения у нее и наткнулся на открытие, сделавшее мое имя
известным в Европе: на особенность прохождения пыльцевой трубки, так
называемую «халацогамию», только что перед этим открытую известным
М. Трейбом у экзотического семейства казуариновых. Трейб построил на
этом чрезвычайно замысловатую теорию положения этого семейства в
системе; мое же открытие разрушало построение Трейба и давало
интересные выводы касательно процесса эволюции оплодотворения вообще.
Отсюда мною была взята тема для диссертации на степень доктора
ботаники, которую я закончил за два года, а в 1896 г. защищал в
Одессе, уже будучи профессором Киевского университета. Особенности
оплодотворения у березы обратили мое внимание на сродственные
растения (лесной орешник, ольху), особенно на грецкий орех. Последний мне
пришлось изучать только в более теплом климате, в Киеве, куда, на
кафедру ботаники, я был назначен по защите своей магистерской диссер-
Предислоеие
27
тации (в 1894 г.). Уже в Киеве мной был закончен ряд исследований
по оплодотворению, приводивших меня к мысли, что вполне необходима
ревизия этого процесса у тех растений, которые корифеями нашей науки
(Шахтом, Гофмейстером, Страсбургером, Гиньяром) были поставлены
образцом общей схемы процесса. Еще в Петровской академии, под
впечатлением блестящих статей и красивых рисунков Гиньяра, я имел
желание видеть все своими глазами; но попытки мои были безуспешны, что
я объяснял высокой техникой работы Гиньяра и моим слабым искусством.
В Киеве, по защите докторской диссертации, я принялся за повторение
исследования Гиньяра по способам лучшим и убедился, что данные этого
ученого как раз зависели от его малого искусства и от его пылкой
фантазии, следовавшей слепо за открытиями в области зоологии, где дело
оказалось вскоре тоже не без греха. Картин Гиньяра не оказалось вовсе
на тех именно объектах, которые он брал; получилось также и не то, что
представляли себе упомянутые корифеи, а нечто вовсе неожиданное в
отношении образования белка семени, эндосперма: последний оказался
также результатом оплодотворения, т. е. как бы близнецом зародыша.
Этому исследованию я не мог, однако, отдать тогда достаточно времени,
так как принял предложение Трейба, посетившего меня в Киеве, приехать
к нему на Яву для занятий в знаменитом тропическом саду Бейтензорга.
Для этого имелась стипендия Академии Наук, основанная по ходатайству
Трейба. В тропиках я пробыл более полугода, где подтвердил свое
открытие на орхидных. Особой выгоды в научнЬм отношении я от этой
поездки не получил, если не считать за необходимость, чтобы натуралист
раз в жизни видел океан и тропики.- Вернувшись с Явы, я возобновил
свои исследования над оплодотворением, на сей раз у подсолнечника, т.
е. в семействе, далеко стоящем от исследованных впервые однодольных
(лилии и др.). Таким образом, явление, которое могло поначалу казаться
особенностью лишь некоторых однодольных, следовало принять за
признак, общий всему отделу покрытосеменных. Это составляло уже весьма
крупный вклад в науку, именно как данные для характеристики отдела
семенных растений, что и принято ныне всеми авторитетами ботаники.
Де-Фризом было указано тогда естественное объяснение загадочного
явления «ксений» у маиса на основании моего открытия.
Около описываемого времени, еще до поездки на Яву, я предпринял
исследование возбудителя рака у капусты («кила» капусты), 20 лет
раньше открытого и описанного Ворониным. Я разъяснил, при помощи
современных методов, цикл превращений паразита внутри клеток корня.
Работа, ввиду интереса к злокачественным опухолям вообще, была
встречена с большим вниманием в медицине. Берлинский клиницист,
известный Лейден, даже командировал ко мне своего ассистента —
ознакомиться с моими препаратами. На русском языке работа появилась в
«Русском архиве патологии, медицины, бактериологии и пр.»,
редактировавшемся Подвысоцким. Мое участие в ходе нашей науки было
оценено, впервые и одновременно, нашей Академией Наук, избравшей меня
своим членом-корреспондентом (1901), немецким Ботаническим обществом,
723*
28
Семя
почтившим меня таким же дипломом, и Венским зоолого-ботаническим
обществом, избравшим меня своим почетным членом. В 1904 г. я был
удостоен Академией Наук первой премии К. Ф. оэра за ряд
исследований по эмбриологии семенных растений. В Киеве я имел возможность
иметь учеников в своей лаборатории при Ботаническом саде. С самого
начала таким явился Н. В. Цингер, сын известного московского
математика, недавно безвременно умерший профессором в Харькове. Им
была сделана у" меня его магистерская диссертация по эмбриологии
конопли и хмеля, обратившая на себя внимание за границей. Дальнейшие
его труды были из иной области (видообразование, естественный отбор
у сорняков) и стяжали ему репутацию биолога, собственными
наблюдениями, а не рассуждениями, вносящего новые вклады в учение Дарвина
о значении отбора в эволюции видов. Свою докторскую диссертацию
о сорняках льна он защищал также в Киеве.
Другой мой ученик — Г. А. Левитский — цитолог и биометрик,
заявил себя в науке точным исследованием отношения хондриосом к
пластидам. Моими же учениками по Киеву являются: Финн,
Фаворский, Делоне, мой сын М. Навашин, все сделавшие значительные вклады
в современную цитологию и, так или иначе, принимающие участие в
строительстве русского учения и науки. Русская академическая жизнь,
особенно университетская, была сильно потрясена событиями 1905 —
1907 гг. Это подготовило участие профессуры в выборах в
Государственную Думу. Я, в числе некоторых других граждан Киева,
находившихся на государственной службе, подвергся «репрессиям». Для меня
они, впрочем, значения не имели: я был всего лишь лишен производства
в следующий чин, т. е. д. ст. сов., и очередных орденов, вплоть до
1917 г. В поселке Святошин под Киевом, где я жил, мне удалось еще
до 1905 г. открыть народное училище (двухклассное), благодаря
содействию земства, Министерства земледелия и весьма либерального
тогдашнего попечителя Учебного округа, моего товарища по науке,
бывшего проф. Беляева. Я был несколько лет почетным блюстителем этого
училища и построил для него дом на ничтожные средства, данные казной,
и лесной материал в виде «делянки» леса. С наступлением реакции я
принужден был оставить это дело.
Научные мои занятия я продолжал в это и последующее время и
устроил домашнюю лабораторию и питомник растений на усадьбе, где
жил с семьей в Святошине. Общее течение научной жизни заставило
меня отступить от эмбриологии и обратиться к изучению клетки, именно
сравнительному: клетки растительной и животной. За время от 1908
до 1914 г. я достиг достаточных познаний по литературе зоологической.
Связь с западноевропейскими учеными и научными учреждениями более
и более крепла: в 1907 г. я был избран почетным членом немецкого
Ботанического общества, в 1908 г. — одновременно с несколькими
русскими обществами естествоиспытателей — членом-корреспондентом
Баварской Академии наук, в 1911 г. — иностранным членом Лондонского
Линнеевского общества.
Предисловие
29
Темою систематического исследования стала для меня в последующее
время изменчивость строения ядра (специально, размеров хромосом и
их взаимных отношений) у индивидов одного и того же вида. Мною
было открыто, что по таким отличиям могут быть распознаваемы внутри
вида две расы: одна с ядром симметричного строения, другая — с ядром
асимметричным. В Святошине и в Ботаническом саду Киевского
университета мной были установлены обширные культуры двух лилейных для
выяснения генетических отношений этих рас. В 1912 г. основные факты
были опубликованы мной в изданиях Академии Наук, а в 1916 г. —
некоторые соображения по этому поводу теоретического свойства. С
началом войны совпало ухудшение моего здоровья, а в 1915 г. я принужден
был подвергнуться операции. Товарищи по университету, врачи
настаивали на переезде моем с семьей в более теплый климат. Я выбрал
местом жительства Тифлис как город, в котором есть крупные научные
учреждения, между ними обширный Ботанический сад. В 1915 г. осенью
я выехал в Тифлис, взяв с собой всю лабораторную обстановку (мою
собственную). Работа, однако, благодаря этому оказалась нарушенной.
Я с трудом нашел рабочее место на Тифлисской
химико-бактериологической станции, а позже кочевал с одного места на другое. Несмотря
на это, под моим руководством занимались, время от времени,
слушательницы Тифлисских высших женских курсов, а из Москвы ко мне
была командирована от Петровской с.-х. академии окончившая там курс
и заведовавшая микроскопической лабораторией Селекционной станции
А. Г. Николаева, ставшая одной из.моих лучших учениц, недавно
безвременно скончавшаяся.
В 1918 г. я был избран действительным членом Академии Наук, а
также орд. Чл. Академии наук в Упсале. Условия жизни в Тифлисе
становились более и более тяжелыми, прекратилась выслуженная мною
пенсия и пособие (на научные исследования). Средства к
существованию я имел лишь в плате за лекции в Грузинском университете и
Тифлисском политехникуме. Лекций приходилось читать до 16 часов в
неделю и лично вести практические занятия. Обзор моей деятельности
(научно-исследовательской), равно как моих учеников и сотрудников с
1914 по 1923 гг., был представлен мной в виде статьи около 2 печ.
листов, с таблицей рисунков, по предложению, полученному мной от
акад. Северцова и Лазарева, в январе 1923 г. (Этот обзор остался не
напечатанным). В 1923 г. весною я получил настойчивое предложение
занять место директора только что возникшего Института им.
Тимирязева и был таковым утвержден ГУС'ом. В институте я имею теперь
школу молодых натуралистов (почти исключительно женщины),
работающих коллективно под моим руководством в Отделении
экспериментальной эволюции, заведующим которого я состою.
0—828
9 марта 1926 г. Москва.
30
Семя
Двойное оплодотворение у Lilium martagon
(Рисунок С. Г. Навашина, 1898)
Двойное оплодотворение
31
ЧАСТЬ I — ДВОЙНОЕ ОПЛОДОТВОРЕНИЕ
ИСТОРИЯ ОТКРЫТИЯ
ФЕНОМЕН ДВОЙНОГО ОПЛОДОТВОРЕНИЯ1
В 1998 году исполняется 100 лет со времени сделанного Сергеем
Гавриловичем Навашиным крупнейшего открытия в биологии —
двойного оплодотворения.
Имя академика С. Г. Навашина (1857-1930 гг.) пользуется
широкой известностью, его работы признаны классическими. С. Г. Нава-
шин выделялся среди ученых самобытностью, ^независимостью научного
творчества. В отличие от общепринятого в годы его молодости
порядка, он не «совершенствовался» за границей, а развивал свои
дарования, оставаясь на родине. Сергей Гаврилович впервые выехал за
границу, будучи уже знаменитым ученым, и там с большим успехом
пропагандировал достижения русской науки, приобретая искренних
друзей среди зарубежных ученых.
Классические труды С. Г. Навашина стали библиографической
редкостью. В связи с этим в настоящее издание включено несколько его
основополагающих работ, посвященных процессу оплодотворения.
Публикация классических работ особенно важна для подготовки молодых
специалистов, поскольку в них с максимальной яркостью проявляются
все ценные качества С. Г. Навашина-исследователя: объективность,
точность наблюдения, проницательность, интуиция и
оригинальность.
Важным элементом научного творчества С. Г. Навашина является
исключительно тонкая передача открываемых им под микроскопом
картин с помощью художественно выполненных рисунков. Иллюстрации
его цитологических работ не только способствовали появлению
совершенно новой для того времени области ботаники — «тонкое строение
При написании данной статьи использованы материалы, опубликованные в книге
«С. Г. Навашин. Избранные труды» (1951),а также данные,любезно предоставленные
М. А. Гусаковской (Московский Государственный Университет).
32
Семя
элементов клеточного ядра», изображавшихся ранее в виде
бесформенных глыбок, но и по сей день считаются шедеврами по технике
исполнения (часто он давал их в акварели).
Как говорил С. Г. Навашин: «Рисунок — язык морфолога».
В настоящее время . наряду с новыми техническими возможностями
(ТЭМ, СЭМ, компьютерная реконструкция и т. д.) рисунок
продолжает оставаться необходимым и важным этапом в познании истины.
Особого внимания заслуживает работа, посвященная
оплодотворению — «Опыт структурного изображения свойств половых ядер»,
которая не потеряла свою ценность до наших дней, являясь примером
точности наблюдений и гениальной прозорливости. В данной работе
С. Г. Навашин выступает как замечательный морфолог, изучающий
детали структуры (клетки и ядра) для выявления функций.
Хотя со времени ее публикации прошло почти 75 лет, один из
важнейших вопросов, поставленных С. Г. Навашиным, до сих пор
привлекает внимание исследователей, а именно: о причинах направленного
движения спермиев к женским половым клеткам. Как пишет
С. Г. Навашин (1927, с. 327), продолжает оставаться загадочным
«...момент — разлучение обоих половых ядер, спермиев, лежащих
временно бок о бок и последующее стремление их в противоположных
направлениях: одного в яйцеклетку, другого — в протоплазму
зародышевого мешка, к обоим полярным ядрам последнего, в это время уже
сливающимся». Для решения этого вопроса он предложил оригинальную
гипотезу энантиоморфизма. С. Г. Навашин считал, что имеется зер-
кальноподобное расположение всех элементов в каждой паре спермиев
и женских клеток (ядро яйцеклетки и микропилярное полярное ядро
центральной клетки). После попадания спермия в зародышевый мешок
в последнем создается сложная система из четырех ядер («различно
настроенных тел»). В силу взаимодействия попарно настроенных ядер,
образуется своего рода градиент, определяющий направление движения
каждого ядра спермия к определенному ядру женской клетки.
Таким образом, гипотеза энантиоморфизма основана на
предположении, что в паре спермиев так же, как и в женских клетках
(яйцеклетке и центральной клетке), одно ядро является левым, другое
правым. Слияние происходит между соответствующими друг другу ядрами
(правое с правым, левое с левым). С. Г. Навашин впервые подошел
к важнейшей проблеме биологии — асимметрии цитоплазмы, обратив
внимание на физиолого-биохимические различия D-и L-форм.
Проблему асимметричности С. Г. Навашин рассматривал широко. Он писал:
«Подобно тому, как асимметричное строение молекулы или кристалла
находится в соотношении с оптической деятельностью данного тела,
так асимметрия гаплоидного ядра является условием специфичного,
половодеятельного состояния гаплоидных клеток, причем это состояние
должно проявляться в двух противоположных формах, подобно тому,
как проявляется оптическая деятельность в формах право- и левовра-
щающих тел одной химической природы». В настоящее время иссле-
Двойное оплодотворение
33
дователи придают большое значение асимметричным процессам как
у растений, так и у животных (асимметричный цитокинез),
происходящим в мейозе и в митозе (например, при делении микроспоры,
зиготы, клеток зародыша). Эти вопросы рассматриваются на
клеточном и субклеточном уровнях (см. Т. 1, Т. 2: Graminad-тип
эмбриогенеза; Ультраструктурные аспекты эмбриогенеза).
Кроме того, в этой работе С. Г. Навашин фактически впервые
говорит о диморфизме мужских и женских клеток, установленном
впоследствии и на ультраструктурном уровне (см. Т. 1: Спермий;
Диморфизм спермиев). Примечательно, что еще в 1898 г., когда главное
внимание С. Г. Навашина было привлечено к проблеме оплодотворения,
он делает доклад «Диморфизм ядер у Plasmodiophora brassicae» (Зап.
Киевск. Общ. Естествоисп., 1901, Т. XVII, вып. 1, с. 36).
Несмотря на то, что прошло так много лет после опубликования
этой работы, продолжают оставаться невыясненными механизмы,
обеспечивающие процесс двойного оплодотворения (см.
Механизмы оплодотворения). Можно только сожалеть, что эти работы
С. Г. Навашина не известны зарубежным исследователям, т. к. его
гипотеза энантиоморфизма и в настоящее время могла бы быть
полезной при изучении этой сложной проблемы.
Теория энантиоморфизма, как отмечает М. С. Навашин (1973), до
сих пор не потеряла своего значения, т. к. является не только
постулатом молекулярного уровня, но и точно отображена в
надмолекулярных структурах. М. С. Навашин показал, что свойство
энантиоморфизма присуще не только гаплоидным ядрам, но всем ядрам,
образующимся при клеточном делении. Таким образом, М. С.
Навашин не только подтвердил соображения С. Г. Навашина, но и показал
универсальность этого процесса, тем самым углубив наши знания о
природе клеточного деления.
Гипотеза «ядерного энантиоморфизма» в настоящее время может
быть рассмотрена как одна из гипотез, объясняющих механизм
двойного оплодотворения.
Открытие С. Г. Навашиным феномена двойного оплодотворения —
«...замечательное достижение отечественной науки, которое по своему
влиянию на дальнейшее развитие биологии можно сравнить лишь с
открытием законов наследственности и механизма мейоза» (Поддуб-
ная-Арнольди, 1976). Его значение настолько велико, что
представляется необходимым остановиться на истории этого открытия.
Величайший ботаник Hofmeister (1849) на основании изучения 38
видов из 19 родов покрытосеменных дал впервые целостную картину
полового процесса. В своем труде «Die Entstehung des Embryo der
Phanerogamen. Eine Reihe microscopischer Untersuchungen» он показал
на живом материале (Orchis и Gymnadenia) прорастание пыльцы на
рыльце и возможное участие пыльцевой трубки в оплодотворении
(рис. 1). Однако он остался на позициях, согласно которым «мужское
оплодотворяющее начало» поступает в яйцеклетку путем диффузии.
34
Семя
Рис. 1. 1-4 — строение зрелого мешка и вхождение в него пыльцевой трубки у
Orchis morio (1,2) и O.militaris (3,4); 5-7, 9 — развитие зародыша у
Gymnadenia odoratissima и О.morio (8) (по: Hofmeister, 1849).
Один из крупнейших ботаников того времени Karsten (1860)
понимал, что оплодотворяющее вещество (франц. «matiere fecondante»)
должно попасть в яйцеклетку, чтобы зародился зародыш, но также
продолжал объяснять процесс оплодотворения яйцеклетки через
диффузию «оплодотворяющего начала» — сначала через стенку трубки
в зародышевый мешок, а затем в яйцеклетку, где и должен
совершиться акт оплодотворения. Наличие акта оплодотворения он
логически доказывал тем, что если бы оплодотворение не совершалось, то
повсеместно в растительном мире царствовал бы партеногенез, чего
в действительности нет.
Horkel (1836), Schleiden (1837, 1839), Schacht (1850), являющиеся
ярыми поллинистами, считавшими, что зародыш возникает из кончика
пыльцевой трубки, своим авторитетом настолько убедили всех в своей
правоте, что Нидерландская Академия Наук присвоила Schacht
премию за выдающиеся исследования в области процесса оплодотворения.
Двойное оплодотворение
35
Рис. 2. Развитие зародыша из пыльцевой трубки Martynia lutea, п т — пыльцевая
трубка, з — зародыш (по: Schacht, 1850).
В подтверждение правильности своих воззрений Schacht привел
рисунки по развитию зародыша из пыльцевой трубки Martynia lutea
(рис. 2). Однако позднее, в 1856 г. поллинисты признали
ошибочность своих убеждений.
Горожанкин своими классическими работами по оплодотворению у
голосеменных впервые опроверг господствующее в то время мнение о
диффузном проникновении спермия в яйцеклетку. Он писал:
«...оплодотворение хвойных совершается не диффузным путем происходит
еще настоящая копуляция вторичного ядра яйцевого мешка со сперма-
генами» (1880, с. 161). При этом он отметил, что этот процесс
сходен с таковым у тайнобрачных.
36
Семя
В 1877 г. Strasburger впервые наиболее полно описал процесс
вхождения пыльцевой трубки через синергиду в зародышевый
мешок у Monotropa hypopitys, обнаружив, что одна из двух мужских
гамет, находящихся в пыльцевой трубке, входит в полость
зародышевого мешка, осуществляя функцию оплодотворения яйцеклетки. По
его мнению, второй спермий растворяется в пыльцевой трубке.
Несмотря на многолетние прежние его утверждения, что
«оплодотворяющее начало» лишь диффундирует через стенку пыльцевой трубки,
он все же первым в мире определил роль одного спермия, т. е.
фактически открыл сингамию — одинарное оплодотворение у
цветковых. Судьба второго спермия продолжала оставаться загадкой.
В 1886 г. L. Guignard, иллюстрируя этот процесс на примере
представителей сем. Cactaceae, отмечал иной путь вхождения пыльцевой
трубки в зародышевый мешок — пыльцевое содержимое входит
непосредственно в яйцеклетку (минуя синергиды).
Следует отметить, что классические исследования Горожанкина,
Strasburger и Guignard ознаменовали конец длительной, почти
двадцатилетней дискуссии с «поллинистами», утверждавшими, что зародыш
развивается из кончика пыльцевой трубки.
После открытия одинарного оплодотворения многие эмбриологи
мира занимались детальным исследованием различных аспектов
оплодотворения, в том числе и ростом пыльцевых трубок в пестике. Treub
(1891) открыл феномен халазогамии (см. Халазогамия). Работая
над проблемой халазогамии у Juglans regia, С. Г. Навашин (1895)
впервые установил наличие двух спермиев в зародышевом мешке,
представленных в виде растянутых спиралей.
24 августа (по старому стилю) 1898 года на X съезде русских
естествоиспытателей С. Г. Навашин сделал сообщение на тему
«Новые наблюдения над оплодотворением у Fritillaria tenella и Lilium
martagon». Впервые в мире С. Г. Навашин показал, что обе мужские
клетки проникают в протоплазму зародышевого мешка и имеют
почти червеобразную форму, причем тело их изгибается в различных
случаях «чрезвычайно прихотливо».
Далее мужские ядра отделяются друг от друга, причем одно проникает
в яйцеклетку, а другое «тесно прикладывается» к одному из неслившихся
еще полярных ядер, т. е., как подчеркивал С. Г. Навашин, к
сестринскому ядру яйцеклетки. С. Г. Навашин отмечал, что мужские ядра
продолжают сохранять свою червеобразную форму, а «несколько позже
полярное ядро, копулирующее с другим мужским ядром, направляется
навстречу другому полярному ядру, с которым и встречается в середине
зародышевого мешка». Только после значительного промежутка времени
наступает полное слияние всех ядер в профазе деления. «...Вся группа
ядер делится, как одно ядро». (См. Результаты пересмотра процессов
оплодотворения у Lilium martagon и Fritillaria tenella).
Это открытие (статья под названием «Resultate einer Revision
der Befruchtungsvorgange bei Lilium martagon und Fritillaria
Двойное оплодотворение
37
tenella») было вначале опубликовано на немецком языке в
Известиях Академии Наук (Bull, de Г Acad, des Sci. de St.-Petersbourg,
vol. 9, N. 4, November 1898, p. 377 — 382), а затем в
«Botanisches Centralblatt» (1899, Bd 77, N 2. S. 62), вышедшем
4 января 1899 г.
Таким образом, весь ученый мир узнал об открытии С. Г. Нава-
шиным двойного оплодотворения у покрытосеменных растений.
Крупнейшие русские ботаники — академики Фаминцын, Воронин,
Тимирязев, Беляев — высоко оценили открытие С. Г. Навашина.
В 1899 году вышла работа Guignard, который также описал двойное
оплодотворение у лилейных и позднее у других видов покрытосеменных
растений (1900, 1922). В своей работе «Sur les antherozoides et la double
copulation chez les vegetaux angiosperms», он, к сожалению, не ссылается
на открытие, сделанное С. Г. Навашиным в 1898 г., и ни словом не
упоминает о полученных последним данных. В этой работе, вышедшей
в апреле 1899 г., Guignard описывает явление двойного оплодотворения,
вразрез с прежними собственными исследованиями.
Встречающиеся до сих пор в зарубежной литературе указания на
независимое и одновременное открытие Guignard двойного
оплодотворения лишены потому всякого основания. Незаслуженной популярности
французского ботаника, вероятно, немало способствовал известный
немецкий ботаник Goebel, немедленно прореферировавший в своем журнале
«Flora» (1899, Bd 86, S. 235) указанную статью, но ни слова не
упомянувший об имевшихся задолго до Того трех публикациях С. Г.
Навашина, опубликованных на немецком и русском языках.
Следует отметить результаты исследований оплодотворения у
цветковых растений, выполненных В. М. Арнольди и французским
исследователем О. М. Mottier. Как совершенно справедливо пишет
известный русский ботаник П. А. Баранов в своей книге «История
эмбриологии» (1955): «История науки знает массу случаев, когда крупные
открытия упускались учеными в силу гипноза традиционных
представлений, воспринимавшихся как незыблемые истины. Ярким примером в
этом отношении является случай с крупным русским эмбриологом
В. М. Арнольди, получивший признание благодаря сообщению Финна
(1931). В. М. Арнольди первым увидел на препарате семяпочки
подснежника (Scilla sibirica) слияние мужских гамет с яйцеклеткой и с
ядром центральной клетки зародышевого мешка, т. е. двойное
оплодотворение у растений, но... он ие поверил своим глазам, посчитал
вторую мужскую гамету случайно занесенной в зародышевый мешок
и прошел мимо возможности сделать огромной важности открытие,
которое чгрез несколько лет после Арнольди сделал С. Г. Навашин,
обессмертив свое имя. То же самое повторилось и с Mottier, который видел
картину двойного оплодотворения за год (в 1897 г.) до открытия его
Навашиным, но счел это случайностью и не обратил на нее должного
внимания».
38
Семя
В одной из своих исторических работ «Пересмотр процессов
оплодотворения у Lilium martagon и Fritillaria tenella», напечатанной в
«Классиках естествознания» (книга 12, Госиздат, 1923), С. Г. Навашин
впервые дал оценку открытого им явления — двойного оплодотворения.
С. Г. Навашин с самого начала занял твердую позицию
относительно половой природы эндосперма. К своему открытию он пришел
через эмбриологические исследования разных видов. Начиная с этой
работы, он всецело посвятил себя изучению процесса оплодотворения.
Это нашло отражение в последующих статьях: «Об оплодотворении
у сложноцветных и орхидных» (1900), «Ueber die Befruchtungsvorgan-
ge bei einigen Dicotyledonen» (1900), «О самостоятельной
подвижности мужских половых ядер у некоторых покрытосеменных растений»
(1910) («Ueber das selbststandige Bewegungsvermogen der Spermakerne
bei einigen Angiospermen», 1909), «Подробности об образовании
мужских половых ядер у Lilium martagon» (1911) («Naheres iiber die
Bildung der Spermakerne bei Lilium martagon», 1910), «К истории
развития халацогамных Juglans nigra и Juglans regia» (1912) (совм. с
В. В. Финном) («Zur Entwicklungsgeschichte der Chalazagamen,
Juglans regia und Juglans nigra», 1913) и «Опыт структурного
изображения свойств половых ядер» (1926/1927).
В этих работах он впервые рассматривает следующие вопросы:
половая сущность слияния ядра спермия со вторичным ядром
центральной клетки, строение половых элементов в связи с их
функциями, движение спермиев в зародышевом мешке, наличие
цитоплазмы у мужских гамет и ее участие в оплодотворении. Многие
из перечисленных аспектов двойного оплодотворения продолжают
оставаться загадкой и в настоящее время.
В последние годы своей жизни, будучи директором Биологического
института им. К. А. Тимирязева и заведующим Отделением
экспериментальной эволюции (1923), С. Г. Навашин продолжает научную
деятельность, посвященную изучению цитологических аспектов процесса
оплодотворения. К сожалению, большая часть этих работ осталась
неопубликованной.
Двойное оплодотворение в настоящее время описано более чем у
300 видов цветковых, относящихся к различным семействам, включая
такие примитивные, как Casuarinaceae, Ceratophyllaceae, Ranuncula-
ceae, Fagaceae, Betulaceae, Ulmaceae, и подвинутые — Umbelliferae
(Apiaceae), Rubiaceae, Asteraceae и Orchidaceae. Данные о процессе
оплодотворения обобщены в ряде монографий и работ (Sax, 1918;
Schiirhoff, 1926; Dahlgren, 1927; Gerassimova, 1933; Schnarf, 1941;
Герасимова-Навашина, 1947-1990; Модилевский, 1949, 1953, 1963;
Поляков, 1950; Maheshwari, 1950; Steffen, 1963; Linskens, 1969).
Каково же биологическое значение феномена двойного
оплодотворения у покрытосеменных?
Следует отметить, что его оценка обычно связывается с оценкой
биологической сущности процесса оплодотворения в целом. Дарвин,
Двойное оплодотворение
39
открывший «великий закон природы», говорил о прогрессивном
значении появления полового процесса в истории органического мира,
рассматривая при этом перекрестное опыление как источник поднятия
жизнестойкости потомков и обогащения наследственности.
В России представления Дарвина о значении полового процесса
получили дальнейшее развитие. Известный русский
ученый-дарвинист — ботаник А. Н. Бекетов в преддверии открытия двойного
оплодотворения в своем учебнике «Ботаника» писал: «совокупление есть
собственно вид специализированного питания», отмечая при этом,
что «новая клеточка» одарена «высшей живучестью, а потому
способна разрастаться в новое растение лучше всякой другой клеточки
данного растения» (1883, с. 367).
Как же сам С. Г. Навашин оценивал свое открытие? Исследование
двойного оплодотворения у различных представителей однодольных
(Liliaceae, Orchidaceae) и двудольных (Asteraceae, Ranunculaceae,
Juglandaceae и др.), занимающих разные уровни филогенетического
древа цветковых, позволило С. Г. Навашину высказать положение об
универсальности этого процесса для всех покрытосеменных. Однако
С. Г. Навашин отметил специфику его протекания у некоторых видов
растений. В одной из своих работ «О процессе оплодотворения у
некоторых двудольных» С. Г. Навашин писал: «...При слиянии мужского
ядра с ядром эндосперма1 мы имеем дело с настоящим
оплодотворением, и этот факт может найти филогенетическое объяснение» (см.
Навашин, 1951, с. 232). В подтверждение половой природы
эндосперма он приводит экспериментальные данные, полученные De Vries
(1899) и Correns (1899), по опылению чужой пыльцой различных рас
Zea mays. Эти ученые, как считал С. Г. Навашин, своими блестящими
опытами показали, что «...свойства растения, дающего пыльцу,
передаются не только зародышу, но и эндосперму. Возникновение при этом
пары гибридных близнецов — гибридного зародыша и гибридного
эндосперма — названные ученые объясняют тем, что здесь имеется
настоящее оплодотворение центральной клетки зародышевого мешка»
(1900, с. 235).
Таким образом была более полно раскрыта сущность феномена
«Ксений» у цветковых растений, так долго интриговавшего многих ботаников
со дня его открытия (Focke, 1881). Это позволило С. Г. Навашину
считать, что «...исчезают все практические основания искать
различия между процессами при образовании зародыша и эндосперма.
Скорее всякое теоретически постулируемое различие между этими
процессами оказывается весьма проблематичным доказательством
полноты наших современных знаний об истинной природе
оплодотворения» (1900, с. 235).
С. Г. Навашин называл продукт слияния двух половых ядер — «ядром эндос
перма», а центральную клетку в этот момент — «клеткой зачатка эндосперма».
40
Семя
Однако вопрос о биологическом значении двух звеньев
оплодотворения (сингамии и тройного слияния) вызвал широкую дискуссию.
Guignard считал, что второе звено (оплодотворение клетки зачатка
эндосперма) в двойном оплодотворении является ложным
оплодотворением (une sorte de pseudo-fecondation) в отличие от истинного
оплодотворения (une fecondation vraie). Strasburger полагал, что слияние
ядра спермия со вторичным ядром центральной клетки является лишь
большим стимулом к развитию эндосперма, поэтому он назвал его
вегетативным оплодотворением («vegetative Befruchtung»), в отличие от
генеративного — оплодотворения яйцеклетки, которое имеет целью, по
его выражению, передачу наследственных свойств.
Сам С. Г. Навашин, признавая сингамию и тройное слияние половым
актом, тем не менее считал оплодотворение полярных ядер своего рода
полиэмбрионией, сходной с таковой у голосеменных. Продукт тройного
слияния он называл белковой зиготой, а образующийся из нее эндосперм
приравнивал к видоизмененному зародышу. Основная функция этого
«близнецового зародыша», по мнению С. Г. Навашина, —
трофическая, т. е. эндосперм, по существу, играет роль питательной ткани.
В общем сходное мнение было высказано и Strasburger. Позднее Sargant
(1900) рассматривала образование эндоспермального зародыша как
стимул к его активному росту, a Porsch (1907) — как «питательный
зародыш». Некоторые исследователи (Schurhoff, 1919) считают, что
эндосперм покрытосеменных подобен заростку так же, как и эндосперм
голосеменных.
Cooper и Brink (1947) подчеркивали физиологическое преимущество
триплоидного эндосперма, образование которого является как бы ком- '
пенсацией крайней редукции женского гаметофита. В этом аспекте
двойное оплодотворение рассматривается многими учеными мира. По мнению
Козо-Полянского (1949), появление гибридного эндосперма
покрытосеменных — одно из звеньев двойного оплодотворения, которое
значительно повысило жизнеспособность и адаптивные возможности
полового зародыша покрытосеменных. Это и явилось причиной широкого
распространения цветковых растений в современную геологическую
эпоху. Тахтаджян (1978), оценивая роль двойного оплодотворения, считал
его характерной особенностью цветковых, резко отличающей их от
остальных групп растений. Он рассматривал слияние одного из двух,
образующихся в мужском гаметофите спермиев с яйцеклеткой, как
собственно оплодотворение, а результат тройного слияния — первичное
ядро эндосперма как питательную ткань, характерную для цветковых
растений, и служащую для питания развивающегося из зиготы зародыша.
Известная талантливая русская исследовательница Цингер (1958)
считала, что двойное оплодотворение — половой процесс в обоих его
звеньях. Хотя физиологический механизм ядерных слияний при
образовании эндосперма — половой, но биологическое его значение —
трофическое, так как ядерные слияния повышают физиологическую
активность тканей, ускоряя подачу к ним питательных веществ.
Двойное оплодотворение
41
С. Г. Навашин дает следующую оценку двойного оплодотворения:
«Рядом со своим бесспорным значением в систематике, процесс
этот, — по существу физиологический, как это ни странно, в
физиологии игнорируется до сего времени почти совершенно. Мне
известны лишь немногие слабые попытки морфологов, в том числе и моя
собственная, подвергнуть физиологическому анализу самое
существеннейшее в этом своеобразном процессе, почти не имеющем себе
аналогий ни в других типах растительного царства, ни в царстве животных:
различие поведения мужских половых ядер, т. е. обоих спермиев,
перед слиянием с женскими ядрами.»
Однако Pearson (1929), Герасимова-Навашина (1958) и ряд других
исследователей сообщали, что у некоторых голосеменных (например,
у Abies balsamea, Ephedra fragilis, Thuja и др.) кроме яйцеклетки
архегония изредка оплодотворяется ядро брюшной канальцевой клетки.
Продукт слияния спермия с последней напоминает эндосперм
покрытосеменных.
Поддубная-Арнольди (1976) категорично высказывалась против
этой гипотезы, обосновывая свое убеждение тем, что ядро брюшной
канальцевой клетки не гомологично вторичному ядру центральной
клетки зародышевого мешка. Кроме того продукт слияния ядра
брюшной канальцевой клетки с ядром спермия у голосеменных
является диплоидным, а не триплоидным, как у большинства цветковых.
Герасимова-Навашина утверждала, что двойное оплодотворение
(как и зародышевый мешок) не представляет собой нового, присущего
лишь покрытосеменным явления, хак как в ег0 основе лежат общие
закономерности, присущие любой клетке (см. Процесс двойного
оплодотворения и митотический цикл клетки (митотическая
гипотеза)). Герасимова-Навашина выступала против представлений об
однократном и одноместном возникновении двойного оплодотворения. Она
рассматривала этот вопрос в связи с возникновением цветковых
растений, поддерживая теорию их полифилетического происхождения.
Смирнов (1982) и Терёхин (1991) выступили против уникальности
феномена двойного оплодотворения у цветковых. Смирнов считал, что
«...лишь в том случае, когда эндосперм цветковых рассматривается, как
«запоздавшая» в своем развитии ткань заростка, «композиция системы»
полового воспроизводства оказывается по существу изомерной таковой
у голосеменных и других высших растений». Его мнение сходно с
мнением Schurhoff (1919), высказывавшегося в пользу того, что эндосперм
у цветковых — не что иное, как ткань заростка.
Терёхин (1991) в своей работе «Проблемы эволюции онтогенеза
семенных растений» пришел к заключению, что «...центральная клетка
зародышевого мешка цветковых растений гомологична инициальным
структурам трофической (центральной) части проталлия голосеменных
растений, а антиподы — его гаусториальной (базальной) части.
Следовательно, центральная клетка зародышевого мешка не является второй
женской гаметой и не гомологична какой-либо иной половой структуре».
42
Семя
На основании этого Терёхин приходит к выводу, что оплодотворение
у цветковых растений по своей биологической сущности не является
двойным, а скорее оно одинарное с триггером, в роли которого выступает
второй спермий, т. е. фактически поддерживает точку зрения Strasbur-
ger, рассматривавшего акт второго оплодотворения как ростовой стимул.
Friedman (1990, 1993, 1994, 1995) показал, что двойное
оплодотворение не является уникальным и встречается не только у
цветковых, но и у голосеменных. Особенно ярко оно выражено у
представителей Cnetales {Ephedra, Cnetum и Welwitschid). Он считает,
что двойное оплодотворение у цветковых и у Ephedra — синапоморфное
(«synapomorphic — evolutionary homologous»). Согласно точке зрения
Friedman, эндосперм цветковых подобен таковому у голосеменных и
проходит через промежуточную стадию «diploid supernumerary embryos»,
образующуюся в результате второго звена двойного оплодотворения (см.
Эмбриогения семенных растений и эволюция эндосперма).
Все вышесказанное свидетельствует о том, что важнейший вопрос
о биологической роли двойного оплодотворения продолжает
оставаться дискуссионным. В первую очередь это относится ко второму
звену двойного оплодотворения — оплодотворению вторичного ядра
центральной клетки зародышевого мешка.
Можно соглашаться или не соглашаться с той или иной точкой зрения
о биологической роли двойного оплодотворения и его отдельных этапов,
но нельзя не признать, что само открытие С. Г. Навашиным феномена
«двойного оплодотворения» у покрытосеменных растений —
ключевой стадии в онтогенезе — позволило совершенно с иных позиций
рассмотреть происхождение покрытосеменных растений.
И. Н. Горожанкин и С. Г. Навашин создали Московскую,
Киевскую и Санкт-Петербургскую школы эмбриологов, обогатившие
мировую науку многими ценными сведениями; среди последователей
С. Г. Навашина — А. Г. Николаева, М. Гургенова, М. С.
Навашин, Е. Н. Герасимова-Навашина, В. А. Поддубная-Арнольди,
И. Д. Романов и многие другие. Особое внимание заслуживают
исследования Е. Н. Герасимовой-Навашиной, которая не только активно
развивала идеи С. Г. Навашина о двойном оплодотворении у
цветковых, но и сама получила много интересных фактов и выдвинула ряд
замечательных идей. В 1933 г. вышла ее фундаментальная работа о
процессе оплодотворения у Crepis, сразу получившая широкую
известность за рубежом. Впервые перед глазами исследователей
таинственный процесс оплодотворения у цветковых растений предстал в виде
наглядных, последовательно расположенных во времени картин,
демонстрирующих самые различные стороны этого процесса. Во многих
зарубежных монографиях и учебниках в разделе «Оплодотворение
у растений» опубликованы классические ювелирные рисунки
Елены Николаевны, которые еще раз доказывают, что рисунок —
инструмент познания. Венцом цикла работ Герасимовой-Навашиной
по оплодотворению у покрытосеменных стала ее знаменитая митотичес-
Двойное оплодотворение
43
кая гипотеза (см. Процесс двойного оплодотворения и митотический
цикл клетки (митотическая гипотеза)). В дополнение к двум
гипотезам С. Г. Навашина (активной подвижности спермия и энан-
тиоморфизма половых ядер) митотическая гипотеза двойного
оплодотворения остается и до настоящего времени одной из
интереснейших гипотез, претендующей на объяснение поведения спер-
миев в зародышевом мешке.
Сейчас кажется естественным, что Герасимова-Навашина, развивая
идеи С. Г. Навашина о биологической роли двойного оплодотворения
у цветковых растений, вышла в итоге на ряд кардинальных проблем
биологии: происхождение покрытосеменных, механизм двойного
оплодотворения и его устойчивость, онтогенез гамет и т. д. Но даже
и сейчас продолжает удивлять нетривиальная идея
Герасимовой-Навашиной о том, что причины всех особенностей двойного
оплодотворения следует искать в общих клеточных закономерностях.
Рассматривая процесс двойного оплодотворения у покрытосеменных
растений с точки зрения общих закономерностей, лежащих в основе
клеточного цикла, Е. Н. Герасимова-Навашина (1968, 1969, 1971,
1982, 1990) пришла к заключению, что у Crepis capillaris гаметы
контактируют в периоде G\ своего прерванного митотического цикла,
заканчивая последний в зиготе, где вступают в периоды S и Gi интерфазы.
В Петербурге в Ботаническом институте им. В. Л. Комарова
Академии Наук Елена Николаевна создала школу классической
эмбриологии и заложила основы по экспериментальному изучению процесса
оплодотворения у покрытосеменных (воздействие рентгеновских лучей,
температуры, отдаленная гибридизация и т. д.). Ее учениками с
гордостью могут назвать себя многие отечественные и зарубежные
специалисты: Г. К. Алимова, Т. Б. Батыгина, Н. В. Беляева, М. А. Гу-
саковская, И. П. Ермаков, С. Н. Коробова, С. А. Резникова,
Г. А. Савина, И. А. Стожарова, Э. С. Терёхин, О. А. Хведынич,
Т. А. Плющ, P. Kapil, N. N. Bhandari и другие. Многие из них
впервые детально (на световом уровне) изучили процесс
оплодотворения в широком смысле (sensu lato) на целом ряде покрытосеменных
(пшеница, кукуруза, арахис, пролеска, хлопчатник, лилейные,
орхидные, паразитные и др.), что дало много нового и интересного для
изучения поведения спермиев в пыльцевой трубке, пестике и
зародышевом мешке в норме и при экспериментальных воздействиях. Они
показали весь цикл изменений спермиев во время их движения к
зародышевому мешку и в процессе сингамии и тройного слияния.
Прошло сто лет со дня открытия «Великого закона природы» —
двойного оплодотворения у цветковых растений. Этот большой срок
еще раз показал, насколько сложен и многогранен процесс
оплодотворения у цветковых. Получено много новых интересных фактов благодаря
использованию различных методов исследования (цейтраферная съемка,
цитохимия, ТЭМ, СЭМ и др.), предложены новые гипотезы,
касающиеся различных аспектов двойного оплодотворения.
44
Семя
Применение электронной микроскопии позволило уточнить ряд
данных, полученных на светооптическом уровне, и дать новую трактовку
отдельным этапам процесса оплодотворения у некоторых таксонов. На
ультраструктурном уровне было впервые показано двойное
оплодотворение у цветковых, строение так называемого «нитчатого аппарата»,
выявлен диморфизм спермиев, их цитоскелет (наличие микротрубочек
и микрофиламентов), наличие цитоплазмы у спермиев в экстрацеллю-
лярном пространстве (щели) зародышевого мешка, подтверждена роль
синергид в оплодотворении. Кроме того рассмотрена кариогамия в
зародышевом мешке и показан ряд последовательных событий этого
процесса (Larson, 1965; Diboll, 1968; Jensen, Fisher, 1968; Schulz, Jensen,
1968; Гуляев, Герасимова-Навашина, 1968; Cass, Jensen, 1970; Went
van, 1970; Чеботарь, 1972; Jensen, 1973; Татинцева, 1975, 1984; Cass,
1981; Mogensen, 1982, 1988; Russell, 1983, 1985, 1986, 1993; Mogensen,
Rusche, 1985; Тарасенко, Банникова, 1986; Плющ, 1987, 1992; Russell
et al., 1990; Dumas et al., 1994).
В связи с изучением механизма двойного оплодотворения были
проведены экспериментальные исследования по выделению спермиев из
пыльцевых зерен и пыльцевых трубок и осуществлению оплодотворения
in vitro (Russell, 1986; Dupius et al., 1987; Matthys-Rochon et al., 1987;
Cass, Fabi, 1988; Wagner et al., 1989a, b; Mogensen et al., 1990; Dumas,
Mogensen, 1993; M6l et al., 1994; Kranz et al., 1994).
Однако следует сказать, что электронно-микроскопические
исследования внесли определенный вклад в познание различных аспектов
двойного оплодотворения. Тем не менее, отсутствуют, например,
детальные темпоральные исследования двойного оплодотворения у
представителей разных таксонов, контрастирующих по способу
образования спермиев (дву-и трехклеточные пыльцевые зерна), по
количеству цитоплазмы спермиев, по типу оплодотворения и т. п., также
отсутствует сравнительный анализ детальных данных, полученных при
световых и электронно-микроскопических исследованиях.
Большое значение имеет цитофотометрическое изучение
процесса оплодотворения. Первые данные в этом направлении получены с
помощью реакций Фельгена, Унна, Браше, что позволило
охарактеризовать состояние хроматина спермиев на протяжении всего их
сложного морфогенетического пути от попадания в зародышевый мешок до
кариогамии (Герасимова-Навашина, 1952, 1959, 1971; Кахидзе, 1954;
Vazart, 1958; Батыгина, 1959, 1960, 1962а, б, 1974; Коробова, 1959;
Фурсов, 1964; Банникова, Хведынич, 1982).
С помощью цейтраферной кинофотосъемки обнаружен ряд
интересных особенностей двойного оплодотворения, свидетельствующих, в
частности, об активном движении спермиев у Calanthus nivalis (Erdelska,
1978, 1983).
Можно только удивляться великой прозорливости и интуиции С. Г.
Навашина, который почти сто лет назад очертил круг проблем,
связанных с изучением открытого им явления, которые и в настоящее время
Двойное оплодотворение
45
продолжают быть актуальными: механизм двойного оплодотворения,
уникальность этого явления и его биологическая сущность.
Банникова, Хведынич, 1982; Баранов, 1955; Батыгина, 1959, 1962, 1974; Бекетов,
1883; Герасимова-Навашина, 1947а-д, 1952, 1955, 1958, 1959, 1968, 1969, 1971а-в,
1990; Горожанкин, 1880; Гуляев, Герасимова-Навашина, 1968; Кахидзе, 1954; Козо--
Полянский, 1949; Коробова, 1959; Модилевский, 1949, 1953, 1958, 1963; Навашин М.
С, 1973; Навашин С. Г., 1895а-в, 1898, 1900, 1901; 1909, 1910, 1911, 1926/1927,
1927, 1951; Навашин С. Г., Финн, 1912; Плющ, 1987, 1992; Поддубная-Арнольди,
1976; Поляков, 1970; Смирнов, 1982; Тарасенко, Банникова, 1986; Татинцева, 1975,
1984; Тахтаджян, 1978; Терёхин, 1991; Финн, 1931; Фурсов, 1964; Хведынич и др.,
1971; 1981; Цингер, 1958; Чеботарь, 1972; Cass, 1981; Cass, Fabi, 1988; Cass, Jensen,
1970; Cooper, Brink, 1947; Correns, 1899; Dahlgren, 1927; Diboll, 1968; Dumas,
Mogensen, 1993; Dupuis et al., 1987; Erdelska, 1978, 1983; Focke, 1881; Friedman, 1990,
1993, 1994, 1995; Gerassimova, 1933; Gerassimova-Navashina, 1982; Goebel, 1899; Guig-
nard, 1886, 1899a, b, 1900, 1922; Hofmeister, 1849; Horkel, 1836; Jensen, 1973; Jensen,
Fisher, 1968a, b; Karsten, 1860; Kranz, Lorz, 1994; Larson, 1965; Linskens, 1969; Ma-
heshwari, 1950; Matthys-Rochon et al., 1987; Mogensen, 1982, 1988; Mogensen, Rusche,
1985; Mogensen et al., 1990; M61 et al., 1994; Nawaschin, 1898a, b, 1900, 1909, 1910;
Nawaschin, Finn, 1913; Pearson, 1929; Porsch, 1907; Russell, 1983, 1985a, 1986, 1993;
Russell et al., 1990a, b; Sargant, 1990; Sax, 1918; Schacht, 1850; Schleiden, 1837, 1839;
Schnarf, 1941; Schulz, Jensen, 1968a, b; Schiirhoff, 1919, 1926; Steffen, 1963; Strasbur-
ger, 1877, 1880, 1884; Treub, 1891; Vazart, 1958; De Vries, 1899; Wagner et al., 1989a;
Went van, 1970a-c.
РЕЗУЛЬТАТЫ ПЕРЕСМОТРА ПРОЦЕССОВ ОПЛОДОТВОРЕНИЯ
У LILIUM MARTAGON И FRITILLARIA TENELLA *' 2
На Съезде русских естествоиспытателей и врачей* который
собирался в конце августа этого года в Киеве, я сделал доклад о моих
наблюдениях над оплодотворением у Lilium martagon и Fritillaria
tenella с демонстрацией многочисленных рисунков и препаратов.
Вследствие моего близкого отъезда на долгое время в Бейтензорг я не смог
Эта и три следующие статьи печатаются по книге С. Г. Навашина «Избранные
труды. М. — Л., Изд. АН СССР, 1951, т. 1» с сокращениями комментариев и
оригинальной транскрипцией фамилий цитируемых авторов.
Статья С. Г. Навашина (S. G. Nawaschin) впервые напечатана на немецком языке
в «Известиях» Академии Наук (Bull, de l'Acad. des Sci. de St.-Petersbourg, vol. 9,
N 4, Novembre 1898, pp. 377-382), под заглавием «Resultate einer Revision der
Befruchtungsvorgange bei Lilium martagon und Fritillaria tenella». На русском языке
впервые напечатана под заглавием «Пересмотр процесса оплодотворения у Lilium
martagon и Fritillaria tenella» в книге «Классики естествознания» (кн. 12, Госиздат,
1923) под редакцией В. М. Арнольди. Представляет первое полное сообщение
С. Г. Навашина об открытии им двойного оплодотворения.
46
Семя
закончить эту работу во всех подробностях; поэтому я хочу в
настоящем кратком сообщении опубликовать главные результаты моего
исследования, чтобы дать им более широкое распространение.
Я предпринял изучение оплодотворения у названных растений,
которым, как известно, за последние 8 лет было уделено с разных
сторон больше внимания, чем каким-либо другим объектам, с целью,
на основании собственного опыта в отношении этих многократно
изученных объектов, получить правильную ориентировку в
исследовании оплодотворения у «безлепестных». Временно я оставил мои
исследования этого процесса у грецкого ореха из-за исключительной
трудности объекта (мужские половые ядра1 здесь очень малы, а
семяпочки2 недостаточно хорошо фиксируются какими бы то ни было
обычными средствами) в надежде вернуться к нему позже с большим
успехом.
Я фиксировал маленькие кусочки завязи Fritillaria tenella из
здешнего ботанического сада и Lilium martagon, дико растущей в
окрестностях Киева, преимущественно флемминговской жидкостью.
После известной тройной флемминговской окраски приготовлялись
многочисленные препараты из серий срезов. Оба растения
многократно испытывались и в более позднее время года. Это испытание
показало, что семена Fritillaria вначале развиваются вполне
нормально, с образованием нормального зародыша и обильного
эндосперма, хотя потом и подвергаются по большей части дезорганизации,
причем их содержимое в той или иной мере резорбируется; напротив,
у Lilium martagon я находил во множестве коробочки с нормально
развитыми и зрелыми семенами. Оба растения были, таким образом,
вполне пригодны как материал для наблюдения нормального
оплодотворения, что выяснилось тотчас же и при исследовании
микроскопических препаратов. В полном согласии с данными известного
исследования Guignard над оплодотворением у Fritillaria meleagris и
Lilium martagon, как и с работой Overton (1891) над
оплодотворением у последнего растения, я мог установить на обоих выбранных
мною видах тот факт, что весь процесс оплодотворения продолжается
чрезвычайно долго, так что здесь имеется возможность особенно
ясно наблюдать отдельные его фазы.
Многие из моих результатов, которые кратко изложены ниже,
существенно отличаются от данных вышеупомянутых авторов.
1. Каждый раз, когда пыльцевая трубка наблюдалась в
соприкосновении с зародышевым мешком, оба мужские половые ядра также
наблюдались в содержимом зародышевого мешка. Мужские ядра
имеют почти цилиндрическую или длинноконическую форму, всегда чер-
Спермии (ред.)
Семязачатки (ред.)
Двойное оплодотворение
47
веобразно изогнуты и лежат оба в протоплазме зародышевого
мешка, сначала свободно и так близко друг от друга, что по большей
части представляются единым целым.
2. Мужские ядра затем отделяются друг от друга, причём одно
проникает к яйцеклетке, а другое тесно прикладывается к одному из
еще не слившихся в это время полярных ядер, именно к сестринскому
ядру яйцеклетки. При этом оба мужские ядра еще сохраняют свою
червеобразную форму.
Это поведение половых ядер Lilium martagon наблюдалось уже
Mottier (1898). Этот автор рассматривает данное явление как
ненормальное. По его наблюдениям «казалось», что находящееся в
яйцеклетке мужское ядро никогда не сливается с ядром яйцеклетки:
через 96 ч после опыления зародышевые мешки показывали
признаки дезорганизации, а испытание многих «зрелых» коробочек
показывало, что семена «созрели ненормально». Наблюдались
ли пыльцевые трубки в семяпочках, зародышевые мешки которых
имели признаки дезорганизации или, по крайней мере,
констатировались ли в соответствующих завязях, и действительно ли с
самого начала отсутствовали зародыши в более молодых
созревающих семенах, т. е. могло ли действительно иметь место
оплодотворение, но несмотря на возможность его оно не
происходило, из текста не видно. Вероятно, ' Mottier имел дело с
тем явлением, которое мне встретилось у Fritillaria tenella,
семена которой, как было упомянуто выше, в здешнем саду не
вызревают нормально, хотя и содержат в первый период
развития нормально возникающий зародыш. В действительности
оплодотворение как у Lilium martagon, так и у Fritillaria tenella
происходит постоянно и следующим образом.
3. В то время как мужское ядро ' которое собственно и должно
было бы называться генеративным, все более и более тесно прилегает
к ядру яйца , полярное ядро, копулирующее с другим мужским
ядром, направляется навстречу ко второму полярному ядру, с
которым и встречается в середине зародышевого мешка.
4. Все эти три ядра, которые теперь лежат близко друг от друга
в сгущенной протоплазме, остаются до профазы своего деления
обособленными и некоторое время легко отличимы друг от друга;
мужское ядро, которое тем временем потеряло свою червеобразную
форму, меньше, чем полярные ядра, но зато богаче хроматином; его
хроматиновый скелет грубее, чем у полярных ядер, которые отли-
«Щели» (ред.).
Ядро спермия (ред.).
Яйцеклетки (ред.).
48
Семя
чаются друг от друга по величине, причем нижнее «антиподальное
ядро» значительно больше, чем верхнее «яйцевое полярное ядро».
Состав этой группы ядер, как и особенности отдельных ее частей,
я наблюдал на большом числе оплодотворенных семяпочек, так что
нет никакого сомнения, что мы имели здесь дело с вполне
постоянным явлением; на каждом сколько-нибудь удавшемся срезе
этот факт к тому же необычайно легко констатировать, так что
подобный препарат я мог демонстрировать при 3-м объективе.
5. Только после прохождения профазы деления, которая во
всех трех ядрах совершается одновременно, ядра сливаются, причем
многочисленные хромосомы располагаются в одну общую
экваториальную пластинку; таким образом, вся группа ядер делится, как
одно ядро. За первым делением быстро следуют второе и третье.
6. Во время первых делений ядер эндосперма постепенно
изменяется вид копулирующего с ядром яйцеклетки генеративного ядра, и оба
ядра принимают, наконец, вид покоящегося клеточного ядра. Если
препарат был хорошо фиксирован, плоскость, разделяющая оба
копулирующие ядра, бывает хорошо различима, следовательно, во
время состояния покоя полного слияния ядер не наблюдается. Во
время профазы первого деления, которое в оплодотворенной
яйцеклетке наступает к моменту приготовления ядер эндосперма к третьему
делению, я уже не мог различить отдельных ядерных полостей в ядре
яйца.
По всем признакам, следовательно, слияние мужского ядра с
женским происходит не во время состояния покоя, как Mottier (1898)
указывает для Lilium candidum, а во время профазы деления как
Guignard впервые наблюдал у L. martagon.
7. Как выше уже было сказано, в семяпочках обоих изученных
растений развитие зародыша и эндосперма идет нормальным путем.
Только после того, как зародыш в семенах Fritillaria достигнет
трети своей нормальной величины, замечались признаки рассасывания
эндосперма и отмирания зародыша. Напротив, зрелые семена Lilium
martagon заключали нормальный зародыш.
Некоторые из здесь приведенных результатов вполне совпадают
с моими прежними сообщениями об оплодотворении у грецкого ореха;
в моей первой статье (Nawaschin, 1895) по этому вопросу сказано
следующее:
«Во многих случаях я находил половые ядра в разных местах
содержимого зародышевого мешка лежащими обыкновенно попарно в его
протоплазме». «Этот факт едва ли можно объяснить иначе, как
предположив, что половые ядра блуждают в протоплазме зародышевого мешка
до тех пор, пока одно из них не встретится с женским ядром и не
сольется с ним.» У Juglans я постоянно находил вместо развитого
яйцевого аппарата только свободные ядра в верхней части зародышевого
мешка, потому я и указал тогда на известную аналогию процесса у
грецкого ореха и у Gnetum (по данным Karsten, 1902). Позже я сделал
Двойное оплодотворение
49
более подробное сообщение по этому вопросу на основании моих
дальнейших исследований в СПб. обществе естествоиспытателей (Навашин,
1897), причем я главным образом обращал внимание на форму половых
ядер, их я находил всегда по два в протоплазме, окружающей
яйцеклетку , при этом под конец (после совершившегося оплодотворения,
наблюдая ядра, оставшиеся лишними после проникания одного из них
в яйцо) «в виде более или менее растянутых спиралей».
Такие факты, касающиеся столь различных по своему
систематическому положению растений, как виды Juglans, Fritillaria и Lilium,
показывают согласно, что есть случаи, когда пыльцевая трубка заставляет
переходить в зародышевый мешок не одно из своих половых ядер,
как принималось раньше, а оба своих генеративных ядра. Далее мне
кажется возможным сделать на основании формы этих ядер заключение,
что мужские ядра, пока они еще находятся в протоплазме
зародышевого мешка в свободном состоянии, имеют способность к
самостоятельному передвижению, которое можно сравнить с движением
извивающегося червя. Наконец, у Fritillaria и Lilium выясняется
изумительный факт, что совершенно нормально развивающийся эндосперм
возникает вследствие процесса, который начинается слиянием одного из
мужских ядер с сестринским ядром ядра яйцеклетки, т. е. с одним из
двух женских ядер. Этот процесс может быть поэтому назван с тем
же правом, как и оплодотворение яйца, половым актом. Здесь мы имеем,
следовательно, дело с некоторого рода полиэмбрионией, которая
является в виде образования пары различно развивающихся близнецов: в
то время как один из них развивается в высоко расчлененное высшее
растение, другой остается в виде талл*ома и в конце концов поглощается
первым.
При современном состоянии учения об оплодотворении у
покрытосеменных вышеизложенные факты могут рассматриваться только как
исключение из общего правила. Необходимо здесь, однако, заметить,
что в той же области учения об оплодотворении голосеменных совсем
еще недавно, на почве наблюдений Беляева на Taxus baccata, возникли
сначала сомнения в правильности прежнего понимания содержимого
пыльцевой трубки, а затем вскоре произошло и полное изменение
этого понимания «самым поразительным образом» (Strasburger, 1892).
Поэтому я хочу уже теперь высказать предположение, что открытые
мною факты у видов Liliaceae, которые всеми сделанными до сих пор
исследованиями были замечательным образом просмотрены, окажутся
существующими и у других покрытосеменных, изучение которых, как
известно, значительно труднее.
Это кажется мне тем правдоподобнее, что мое толкование процесса
оплодотворения у Lilium и Fritillaria как своего рода полиэмбрионии
При более удачной фиксации зародышевого мешка мне удалось, однако,установить
присутствие дифференцированной яйцеклетки.
4—828
50
Семя
имеет также и филогенетическое основание. Я хочу отметить здесь
замечательную аналогию всего явления с процессом оплодотворения у
Gnetum, у которого, по новейшим данным (Lotsy, 1898), мы имеем дело
с подобного рода полиэмбрионией. Здесь, как и там, оплодотворение
состоит в том, что каждая из пыльцевых трубок (у Gnetum, как и у
Juglans, в зародышевый мешок проникает от одной до нескольких
пыльцевых трубок) вводит оба свои генеративные ядра в зародышевый мешок
и каждое мужское ядро сливается с женским, так что каждой пыльцевой
трубке соответствует всегда пара продуктов копуляции. Таким образом
возникшие «зиготы» превращаются у Gnetum в проэмбрионы, в то время
как у Liliaceae одна из зигот превращается в «эндосперм». У Gnetum
немногие из оставшихся свободными ядер зародышевого мешка
окружаются протоплазмой и целлюлозной оболочкой, таким образом, по
мнению автора, возникает «рудиментарный эндосперм». По моему мнению,
это явление соответствует скорее образованию антипод у
покрытосеменных, чем эндосперма, который в своем возникновении имеет много
своеобразного. Из краткого сопоставления результатов исследования
Lotsy можно заключить, что род Gnetum занимает совсем обособленное
положение в семействе, причем в высшей степени вероятно, что он
представляет переход к покрытосеменным.
Если теоретическое значение вышеприведенных моих данных и
может быть подвергнуто сомнению, то, во всяком случае, моя работа
ясно показывает, что в данных, как будто бы совершенно точно
обоснованных, могут оказаться существенные пробелы.
Навашин, 1897; Karsten, 1902; Lotsy, 1898; Mottier, 1898; Nawaschin, 1895;
Overton, 1891; Strasburger, 1892.
ОБ ОПЛОДОТВОРЕНИИ У СЛОЖНОЦВЕТНЫХ И ОРХИДНЫХ Х
В своем первоначальном сообщении об оплодотворении у Lilium
martagon и Fritillaria tenella (Nawaschin, 1898b) я высказал
предположение, что открытое мною у этих растений «двойное
оплодотворение», а также строение и свойства мужских генеративных клеток
могут оказаться нормальными явлениями для покрытосеменных
вообще. Я считал себя вправе на такое предположение на основании
фактов, добытых мною относительно двух видов Juglans, у которых я
видел уже раньше (Навашин, 1895; Nawaschin, 1897), как и у
названных обоих Liliaceae, проникание в зародышевый мешок обеих
Статья С.Г. Навашина напечатана в «Известиях» Имп. Академии Наук (октябрь
1900 г., т. XIII, N 3, с. 335-340). В этой статье впервые появляется термин «двойное
оплодотворение», с этих пор навсегда укоренившийся в науке как определение одной
из характернейших биологических особенностей покрытосеменных растений.
Двойное оплодотворение
51
генеративных клеток и указал на особенности в форме последних,
делающие их сходными с сперматозоидами.
Мой отъезд в Бейтензорг помешал мне тотчас же подробно
изложить мои наблюдения над оплодотворением у Liliaceae; тем не
менее я наметил себе, в виду важности обнаруженных фактов, тогда
же дальнейшую задачу — распространить свои наблюдения на
большее число растений, чтобы выяснить прежде всего следующие два
обстоятельства:
1. Каким образом и не иначе ли, чем у Liliaceae, происходит
оплодотворение в семействах, наиболее отдаленных в системе от
Liliaceae.
2. Происходит ли слияние мужской генеративной клетки с ядром
зародышевого мешка и в тех случаях, когда эндосперма не
образуется.
Положительное решение первого вопроса позволило бы с большею
вероятностью обобщить факты, наблюдаемые у Liliaceae, на все
покрытосеменные. Что же касается второго пункта, то решение его
представлялось мне весьма важным в виду возможности различных
толкований факта слияния мужской генеративной клетки с ядром
зародышевого мешка. Мое предположение, что это слияние есть
слияние половое и что эндосперм происходит вследствие оплодотворения,
подобно зародышу, встретило иное определение этого явления со
стороны Guignard (1899b), подтвердившего фактическую сторону моего
исследования спустя всего пять месяцев после появления моего
сообщения. Ученый этот называет это4, пока загадочное явление «ложным
оплодотворением» (pseudo-fecondaAion), полагая, по-видимому, что мы
имеем уже вполне ясное представление о природе «настоящего»
оплодотворения у семенных растений.
Не разделяя этих мнений почтенного французского ученого, я
полагаю теперь только своевременным обратиться к детальному
изучению как «настоящего», так и «ненастоящего» оплодотворения, так
как мне удалось, как я думаю, излагаемыми ниже наблюдениями
поставить почти вне сомнения, что двойное оплодотворение пред-
. ставляет нормальное явление для всех покрытосеменных, как
однодольных, так и двудольных, а также, что слияние мужской
генеративной клетки с ядром зародышевого мешка не происходит в том
случае, когда не образуется эндосперма, и, следовательно, у
большинства растений, по результату своему, действительно вполне
аналогично оплодотворению.
Для своих исследований я избрал семейства Ranunculaceae и
Compositae как такие, которые представляют достаточный контраст и
между собою и с Liliaceae. Из Ranunculaceae Delphinium elatum,
изученный мною подробно, показал мне много интересного касательно стро-
Здесь и далее — с вторичным ядром центральной клетки (ред.).
4*
52
Семя
ения полового аппарата и мужских генеративных клеток, которые у этого
растения мне удалось, однако, наблюдать только перед выходом из
пыльцевой трубки в зародышевый мешок, а также после копуляции их с
ядрами яйца и зародышевого мешка1. Двойное оплодотворение и чер-
вевидная форма мужских генеративных клеток оказались присущими и
этому растению; но более полно и на лучших препаратах мне удалось
наблюдать то же самое у двух сложноцветных: Helianthus annuus и
Rudbeckia speciosa, почему я и ограничусь здесь изложением лишь
касающихся этих растений фактов.
Семяпочки обоих этих растений фиксируются чрезвычайно хорошо,
благодаря легкой проницаемости покрова, состоящего из почти
опорожненных тканей, и, наоборот, обилию содержимого самого
зародышевого мешка. Относительно развития и строения зародышевого
мешка у Helianthus я почти не имею ничего прибавить к исследованию
Merrell (1900) над другими видами сложноцветных (Silphium), не
исключая особенностей в строении антипод и прямого деления их ядер.
Ядро зародышевого мешка представляет в этом семействе продукт
полного слияния обоих полярных ядер, происходящего задолго до
оплодотворения, т. е. содержится так же, как у прочих изученных до
сих пор покрытосеменных, кроме Liliaceae. Это ядро у Helianthus
бедно хроматином и тесно соприкасается с яйцом, которое иногда
даже, несколько вдавлено в него. В момент опорожнения пыльцевой
трубки обе мужские клетки вступают в протоплазму зародышевого
мешка со стороны обеих синергид, из которых одна оказывается
измененною, после чего одна из мужских клеток проникает сбоку в
протоплазму яйца, а другая копулирует с ядром зародышевого мешка.
Обе мужские клетки имеют одну и ту же форму, напоминающую
сперматозоиды, и одинаковое строение: это — длинные нити,
несколько сплюснутые и расширенные в середине и по концам, чрезвычайно
богатые хроматином, представляющим плотную, губчатую массу. Это
строение в сущности таково же, каким я наблюдал его у червевидных
мужских клеток Liliaceae, где последние никогда не бывают
гомогенными или спирально полосатыми, как ошибочно утверждает Guignard
(1899b), но рыхло губчатыми, почти сетчатого строения, как
изобразил их впервые Mottier (1898). Таково же строение мужских клеток
и у Silphium по рисунку Merrell (1900), видевшего их, однако, только
внутри пыльцевых клеток. Первой наступает копуляция одной мужской
клетки с ядром зародышевого мешка, чем, может быть, и объясняется
более рано наступающее деление ядра эндосперма. Рис. 1,
представляемый мною здесь, дает понятие о строении и форме мужских
генеративных клеток у Helianthus и об их отношениях к яйцу и ядру
зародышевого мешка в момент оплодотворения.
Центральной клетки (ред.).
Двойное оплодотворение 53
Рис. 1, 2: 1 — продольный разрез зародышевого мешка Helianthus annuus, вверху
генеративные клетки (увелич.); 2 — зародышевый мешок Phajus blumei
после оплодотворения; ek — ядра зародышевого мешка (= полярные ядра,
вторичное ядро центральной клетки зародышевого мешка, ядро эндосперма —
ред.), ет — зародыш, ov — яйцо (яйцеклетка), ps — пыльцевая трубка, s,
si и S2 — синергиды, spl и sp2 — мужские генеративные клетки (=
спермин — ред.).
54
Семя
У Rudbeckia все части зародышевого мешка несравненно крупнее,
чем у Helianthus. В громадном яйце ее мне удалось дважды найти
мужскую генеративную клетку как раз в тот момент, когда она
приближается к ядру яйца, тогда как другая мужская клетка уже слилась
с ядром зародышевого мешка и видима в нем как более плотное
тельце, окруженное густою массою хроматина. Мужские генеративные
клетки этого растения также перекручены спирально, но гораздо
короче и толще, чем у Helianthus, и с более ясным, характерным,
губчатым строением хроматина.
Таким образом, загадочное явление «двойной копуляции» при
оплодотворении оказывается свойственным и таким отдаленным от Lilia-
сеае семействам, каковы Ranunculaceae и в особенности Compositae.
Можно, следовательно, признать это явление для всех
покрытосеменных как за нормальное или за правило, подлежащее разве очень
редким исключениям.
Одно из таких редких исключений, по-видимому, обнаружено
мною у Orchidaceae и является как нельзя более поучительным,
ввиду того что это семейство представляет, как известно, и другое
исключение из общего правила: у Orchidaceae вовсе не образуется
эндосперма.
Будучи в Бейтензорге, я изучал оплодотворение у трех видов из
этого семейства, именно у Phajus blumei, Phajus sp. и Arundia speciosa,
и нашел у всех них приблизительно одинаковые отношения после
оплодотворения, которые представлены мною на прилагаемом рис. 2.
Оба полярные ядра у этих растений не сливаются до
оплодотворения, вопреки показанию Strasburger (1884), изучившего
оплодотворение у европейских Orchidaceae. Эти ядра остаются не
слившимися, а лишь тесно прижатыми друг к другу и после
оплодотворения, во время которого к ним присоединяется третье ядро, как
я думаю, ядро мужской генеративной клетки. Во всех случаях и
на всех стадиях развития зародыша я находил в зародышевом мешке
постоянно одну и ту же группу из трех ядер, соответствующую
такой же группе у Liliaceae, причем вначале можно было отличать
мужское ядро от обоих полярных ядер, как это представляет левый
зародышевый мешок на рис. 2. Таким образом, мы имеем здесь
также двойную копуляцию, сочетание обеих мужских клеток,
одной — с яйцом, другой — с элементами эндосперма; но последнее
сочетание не ведет к полному слиянию, т. е. к оплодотворению,
три ядра остаются обособленными, и вследствие этого эндосперм не
образуется. Принимая во внимание этот исключительный факт наряду
с постоянным явлением слияния мужского ядра с ядром
зародышевого мешка у других растений, трудно усмотреть существенное
различие между образованием зародыша и эндосперма: и эндосперм,
как зародыш, является вслед за актом полового характера, после
оплодотворения центральной клетки зародышевого мешка, как можно
было бы назвать его протоплазму с срединным ядром.
Двойное оплодотворение
55
Нечто подобное найденному мною у упомянутых орхидных
наблюдал Strasburger (1884) у Orchis latifolia. Он замечает, что часто ядро
зародышевого мешка после оплодотворения состоит из нескольких
частей, которые, по его мнению, представляют свободные ядра антипод,
приставшие к ядру зародышевого мешка. Я полагаю, что
представленные мною рисунки достаточно ясно показывают истинный характер
явления и что мое толкование более вероятно.
Что в слиянии одной из мужских генеративных клеток с ядром
зародышевого мешка мы должны видеть акт оплодотворения не
только с морфологической точки зрения, но и с точки зрения
физиологической, т. е. передачу наследственных признаков со стороны
отца при посредстве генеративной клетки, показали недавно в своих
чрезвычайно интересных сообщениях de Vries (1899) и Correns
(1899). Как извещают эти ученые, им удалось при помощи опыления
пыльцой мучнистой разновидности маиса женских цветков маиса
сахарного получить «гибридный эндосперм» с явственными свойствами
с отцовской стороны, т. е. с мучнистым содержимым. Такое явление
едва ли нуждается теперь в ином более естественном объяснении,
кроме объяснения, предлагаемого авторами сообщений,
утверждающими, что свойства эндосперма появились здесь путем участия в
оплодотворении обеих мужских генеративных клеток, т. е. вследствие
оплодотворения первоначальной клетки эндосперма.
Таким образом, следует, по-видимому, признать, что, во-первых,
«двойное оплодотворение» представляет нормальное явление для
покрытосеменных; что, во-вторых, если и окажутся исключения из
общего правила, они найдут себе объяснение, вроде данного мною
для случая у Orchidaceae, и что, в-третьих, форма и строение
генеративных клеток у двудольных и однодольных одинаковы, причем
клетки эти весьма походят на сперматозоиды споровых растений.
Найти более осязательные доказательства способности к
самостоятельному движению мужских генеративных клеток, которое мне и
теперь представляется вне сомнения, проследить их развитие и изучить
детально механизм поступления их в половой аппарат, а также условия
слияния женской и мужской клеток — составляет задачу теперешних
моих исследований, о результатах которых я надеюсь известить в
скором времени.
Навашин, 1897; Correns, 1899; Guignard, 1899b; Merrell, 1900; Mottier, 1898;
Nawaschin, 1895, 1898b; Strasburger, 1884; Vries de, 1899.
О САМОСТОЯТЕЛЬНОЙ ПОДВИЖНОСТИ
МУЖСКИХ ПОЛОВЫХ ЯДЕР
У НЕКОТОРЫХ ПОКРЫТОСЕМЕННЫХ РАСТЕНИЙ 1
Настоящая статья содержит описание отдельных наблюдений,
сделанных мною в различное время при исследовании оплодотворения у
различных растений. Первоначально эти исследования имели целью
лишь доказать наличность «двойного оплодотворения» в нескольких
семействах двудольных и однодольных растений. Подобная цель
достигается сравнительно легко, именно, наблюдением самого слияния
мужских половых ядер с ядром яйцеклетки и ядром зародышевого
мешка на фиксированных препаратах. Таково содержание большинства
работ, посвященных другими авторами той же цели, например, целый
ряд работ Guignard (1899Ь, 1900, 1901а, Ь, с, 1902 и др.) над
представителями из различных семейств двудольных и однодольных.
Лишь Strasburger (1900) принадлежит попытка (не удавшаяся мне с
орхидными) увидеть на живом материале процесс достижения
мужскими половыми ядрами их места назначения и самое слияние их с
соответственными ядрами женского аппарата. В результате своих
наблюдений над живыми семяпочками Monotropa hypopitys автор пришел
к отрицанию какой-либо самостоятельности в передвижении мужских
половых ядер внутри зародышевого мешка и, наоборот, к убеждению
в существовании приспособления для буксирования этих ядер
протоплазмою, по крайней мере, одного из них к ядру зародышевого мешка.
У Monotropa hypopitys одно из мужских половых ядер, по Strasburger,
движется пассивно к вторичному ядру зародышевого мешка,
увлекаемое течением в толстом протоплазматическом тяже, идущем от
полового аппарата ко дну зародышевого мешка, где и лежит упомянутое
только что ядро. Это наблюдение Strasburger дало повод Koernicke
(1903) высказаться отрицательно касательно существовавших взглядов
на подвижность мужских половых ядер, а именно следующим образом:
«Из своеобразно извитой, даже штопоровидной формы генеративных
Статья С. Г. Навашина напечатана в «Записках» Киевского общества
естествоиспытателей (1910, т. 20, вып. 4, с. 321-336; отд. оттиск 1909 г.). Та же
работа в предыдущем году вышла на немецком языке под заглавием: «Ueber das selbst-
standige Bewegungsvermogen der Spermakerne bei einigen Angiospermen» (Oester. Bot.
Ztschr., Bd 59, 1909, N 12, pp. 457-467). В этой работе впервые опубликованы
рисунки картин двойного оплодотворения у Fritillaria ienella и Lilium martagon, по-
видимому, предназначавшиеся для задуманной полной работы о двойном оплодотворении,
так и не написанной С. Г. Навашиным. Один из этих рисунков широко использован
в учебниках и сводках. После помещенных в данной работе рисунков С. Г. Навашин
уже не иллюстрировал картин оплодотворения, хотя и возвращался к этой проблеме
позднее.
Двойное оплодотворение
57
ядер было выведено заключение касательно самостоятельной
подвижности их. Однако об этом, как и вообще о самостоятельном движении
ядер, не существует особенно подробных наблюдений. Возможно, что
изогнутые формы генеративных ядер, как и эллипсоидные или чечеви-
цеобразные ядра Monotropa hypopitys, у которой Strasburger наблюдал
двойное оплодотворение в живых семяпочках, передвигаются течениями
протоплазмы внутри зародышевого мешка к его полярным ядрам».
Итак, с одной стороны, многочисленные картины и описания
готовых «зигот», т. е. продукта копуляции мужских и женских ядер в
яйце и зародышевом мешке, с другой стороны, едва ли не
единственное наблюдение Strasburger касательно возникновения этих зигот, т. е.
способа, каким мужские половые ядра достигают женских. Такова в
коротких словах характеристика наших сведений об интересующем нас
здесь процессе, недостаточность которых тем более очевидна, что мы
до сих пор из них не знаем, каким образом и куда собственно
изливается содержимое пыльцевой трубки и каково значение наблюдаемого
при этом постоянно явления того загадочного изменения одной из
синергид, которое отмечается всеми под названием «помутнения» си-
нергиды, «участвующей» при оплодотворении. Изливается ли
содержимое пыльцевой трубки прямо в зародышевый мешок и в таком случае
в протоплазму его, или в промежуток между последней и половым
аппаратом, или же это содержимое проходит сквозь помутневшую
синергиду и лишь оттуда — к месту назначения? Сколько я могу
помнить, и то, и другое мнение приводилось вскользь лишь у немногих
авторов, по моему суждению, однако, без достаточных оснований.
Причина недостаточности этих сведений кроется, конечно, в самом
существе дела; явления, связанные с оплодотворением, все, за
исключением, быть может, самого слияния копулирующих ядер, должны
быть признаны совершенно мимолетными, так как они совершаются
каждый раз однажды и в крайне ограниченном пространстве. Уловить
момент каждого такого явления на фиксированном препарате есть дело
редкого случая, а следовательно, решить поставленную задачу во всех
деталях может помочь лишь исключительное счастье.
Не претендуя даже на сколько-нибудь приблизительное решение
вопроса о способе доставления мужских половых ядер в женский
половой аппарат во всех деталях этого вопроса, я тем не менее хотел
бы настоящею статьею заявить, что несколько раз был так счастлив,
что напал именно на «редкий препарат», в котором мог видеть
мужские половые ядра еще на их пути к женским. Такие редкие случаи
я' и хочу описать, предоставляя, конечно, читателю сделать из них
свой собственный вывод; скажу, однако, наперед, что мой вывод из
них сложился в определенное убеждение в том, что мужские половые
ядра должны быть непременно одарены самостоятельною
подвижностью для того, чтобы быть в состоянии пройти и тот короткий путь,
который остается им сделать внутри зародышевого мешка.
58 Семя
За этими немногими разъяснениями перехожу к изложению своих
наблюдений.
Зародышевый мешок у Fritillaria tenella в состоянии, близком к
оплодотворению (рис. 1 и 2), чрезвычайно ясно обнаруживает полную
независимость и обособленность как яйцевого аппарата, так и антипод
от протоплазмы зародышевого мешка — факт, неоднократно отмеченный
и другими наблюдателями (Mottier, 1904). Благодаря действию
реактивов и среды, в которую заключен препарат (ксилол, канадский
бальзам), содержимое зародышевого мешка несколько сокращается и
отступает от оболочки последнего. Протоплазма зародышевого мешка с
обоими готовыми слиться полярными ядрами явственно представляется
самостоятельною клеткою и заслуживает поэтому с полным правом особого
названия, которое указывало бы на назначение этой клетки. Я буду
называть ее далее клеткою зачатка эндосперма или, короче, зачатком
Рис. 1-7: 1 — Fritillaria tenella. Верхняя часть зародышевого мешка в продольном
разрезе. Почти готовый половой аппарат, часть вачатка эндосперма и в нем
верхнее полярное ядро. Клетки полового аппарата почти не отличаются друг от
друга. Вследствие сокращения протопластов между клетками явственно заметна
их первичная оболочка в виде тончайшей пленки. Между половым аппаратом и
зачатком эндосперма, по той же причине, образовался значительный
промежуток; 2 — Fritillaria tulipaefolia. Нижняя часть вародышевого мешка
приблизительно в той же стадии развития, как на предыдущем рисунке, в продольном
разрезе. Протоплазма зачатка эндосперма содержит нижнее полярное ядро и
явственно обособленна от группы антипод, из которых нижняя с
размножившимися ядрами; 3, 4 — Fritillaria tenella: 3 — верхняя часть зародышевого
мешка перед самым оплодотворением. На месте яйцеклетки (слева) в разрезе
лишь соответственный просвет; справа помутневшая синергида и содержимое
пыльцевой трубки с х-телами. В протоплазме зачатка эндосперма — оба
мужских половых ядра, почти перекрученные друг около друга; 4 — верхняя часть
зародышевого мешка в самом начале оплодотворения (копуляция половых ядер).
Мужские половые ядра разошлись; одно проникло в яйцеклетку и копулирует с
ядром последней, другое только что коснулось верхнего полярного ядра. Сквозь
яйцеклетку просвечивает ядро неизменной синергиды и одно из х-тел; 5 —
Lilium martagon. Верхняя часть зародышевого мешка перед оплодотворением.
Справа видна часть яйцеклетки с малым отрезком протоплазмы и ядра. Слева,
соответственно промежутку между половым аппаратом и зачатком вндосперма
(ср. деталь 1), находится излившаяся масса содержимого пыльцевой трубки с
частями обоих мужских половых ядер (срезы, попавшие в этот разрез) и
многочисленными кругловатыми, красными зернами. Направо ниже видна часть
верхнего полярного ядра; 6, 7 — Juglans nigra: 6 — фиксировано алкогольным
раствором сулемы с уксусной кислотой. Окрашено in toto сафранином и в
разрезах гематоксилином. Яйцеклетка в продольном сечении перед
оплодотворением. Изображена противоположная зрителю половина яйцеклетки; по ее
поверхности толстым слоем (внизу и справа слой виден в сечении) — излившееся
содержимое пыльцевой трубки; в нем видна проврачная, бесцветная, почти
бисквитообразная вакуоля или капля, содержащая в себе оба овальные мужские
половые ядра, сильно покрашенные гематоксилином. Внутри яйцеклетки — его
ядро как бы с бугристой поверхностью; 7 — обработка та же, что и в
предыдущем. Справа — часть яйцеклетки с протоплазмой и ядром; слева —
мутная масса, на краю которой — прозрачная вакуоля, наполовину перерезанная
бритвою (нижняя часть вскрыта, верхняя лишь просвечивает). В вакуоле — оба
мужских половых ядра яйцевидной формы, слегка изогнутые и ваостренные, в
различных положениях. Внизу — верхнее полярное ядро.
Двойное оплодотворение
59
60 Семя
эндосперма. Клетка эта представляется совершенно голым протопластом,
т. е., самое большее, с неявственно развитым кожистым слоем. Иначе
дело обстоит с клетками яйцевого аппарата и группы антипод. Как между
клетками яйцевого аппарата, так и между антиподами на наших рис. 1
и 2 совершенно явственно обозначаются первичные оболочки клеток —
факт, также вскользь указываемый в литературе, но, на мой взгляд,
недостаточно оцененный. Особенно ясно это на рис. 1 в яйцевом
аппарате, где, благодаря сокращению протопластов, местами видна
изолированная первичная оболочка между двумя соседними клетками.
Таковы, следовательно, условия для готовящихся совершиться
событий, после того как мужские половые ядра поступят в зародышевый
мешок; каждое из этой пары ядер должно направиться в соответственную
женскую клетку: одно — в яйцеклетку, другое — в зачаток эндосперма,
и проникнуть внутрь тела последних; но мы не видим решительно никаких
приспособлений или подготовленных для этого наперед путей, а ско-
Рис. 8-15 — Helianthus annuus (12-14 окрашены фуксином с йодной зеленью):
8 — верхняя часть зародышевого мешка перед оплодотворением.
Симметрично развитые синергиды, левая с ядром; нижняя часть яйцеклетки, также
с ядром. Протоплазма зачатка эндосперма явственно отстала от яйцеклетки.
Ядро зачатка эндосперма попало в разрезе лишь частью; 9 — препарат,
подобный предыдущему. Между яйцеклеткою и вторичным ядром зачатка
эндосперма в протоплазме последнего видно углубление, входящее и в ядро
зачатка эндосперма; 10 — а и с — два последовательных продольных
разреза из одной и той же серии, на которых видны те же части, что и в
предыдущих препаратах; Ь — сильно увеличенные ядра синергид; d — часть
препарата (с) при более сильном увеличении: сверху — дно яйцеклетки,
внизу — часть ядра зачатка эндосперма с углублением в нем. Как
показывает сравнение разрезов а и с, углубление, изображенное на предыдущем
рисунке, есть сечение срединной ямки (а не складки или бороздки) на
поверхности ядра; 11 — поперечные разрезы через один и тот же половой
аппарат после оплодотворения: а — на уровне выше положения ядер
синергид; Ь — на уровне этих ядер, с — на уровне основания яйцеклетки (место
ее прикрепления); d и е — еще ниже проведенные разрезы. Везде е
означает яйцеклетку, s] — неизмененную, s2 — помутневшую и спавшуюся синер-
гиду, end — эндосперм. В рис. Ь синергида s] содержит ядро; спавшаяся
синергида $2 сохранила, по-видимому, лишь ядрышко своего ядра; в рис. d
по периферии синергиды S2, а в рис. е под самым дном ее заметна обильная
зернистая масса, по-видимому, содержимое пыльцевой трубки; 12-14 сняты с
продольных разрезов зародышевых мешков, в которых оплодотворение
только что произошло: 12 — справа — яйцеклетка, слева — неизмененная
синергида, внизу — вторичное ядро зачатка эндосперма. Внутри ядра
яйцеклетки и в ядре зачатка эндосперма, в первом внизу, а в последнем наверху,
заметны части спиралью свернутой ленты мужского полового ядра. В ядре
зачатка эндосперма, кроме того, видно округлое, гомогенное тельце, как бы
завернутое в скрученную оболочку ядра; от тельца вправо, к спирали
мужского полового ядра, тянется скрученная складочка той же оболочки.
Хроматин ядра зачатка эндосперма собран в нижней трети ядра; 13 и 14 — видны
те же отношения, что и в предыдущем рисунке. На рис. 13 не изображено
мужское половое ядро в ядре зачатка эндосперма, потому что оно не попало
в этот разрез и находится в следующем; 15 — поперечный разрез через
половой аппарат на уровне прикрепления яйцеклетки (сверху). Обе
синергиды содержат сходные ядра и совершенно симметрично образованы.
Двойное оплодотворение
61
^d
sat— MfW*i-: жгожа
62
Семя
pee — находим препятствия в виде оболочки, окружающей яйцеклетку
и способной, конечно, оказать некоторое сопротивление проникающему
сквозь нее телу.
Обратимся к моменту, критическому для всего процесса, который
мне удалось наблюдать всего один раз между несколькими сотнями
препаратов зародышевого мешка такого классического объекта для
исследования оплодотворения, какова Lilium martagon.
Рис. 5 дает нам изображение верхней части зародышевого мешка
этого растения, очевидно, тотчас после поступления содержимого
пыльцевой трубки в зародышевый мешок (ср. подробное описание рис. 5).
Между яйцеклеткою и зачатком эндосперма содержится мутная, почти
неокрашенная, гомогенная масса излившегося содержимого пыльцевой
трубки вместе с тяжем и зернами ярко покрашенного сафранином, более
плотного вещества, природу которого определить ближе затруднительно.
Здесь же, между красными зернами, видны те части обоих мужских
половых ядер, которые попали в данный разрез. Сравнивая этот рисунок
с рис. 1, невольно приходишь к заключению, что масса, содержащая в
себе оба мужских половых ядра, изливается не куда-либо иначе, как в
промежуток между яйцевым аппаратом и зачатком эндосперма. Отсюда-
то, из совершенно индифферентного места, и предстоит обоим мужским
половым ядрам проникнуть: одному в яйцеклетку, другому в тело
зачатка эндосперма. Допустим пока, что мужские половые ядра содержатся
при этом вполне пассивно и что, наоборот, протоплазма соответственных
женских клеток является исключительным двигателем всех элементов,
участвующих в процессе. Очевидно, нам придется допустить, что
протоплазма зачатка эндосперма должна сама прежде проникнуть внутрь
массы, содержащей мужские половые ядра, для того чтобы оттуда
извлечь последние; но придется сделать при этом и дальнейшее
предположение, которое должно объяснить, почему названная протоплазма
извлекает из содержимого пыльцевой трубки только половые ядра, а зерна,
окружающие их, оставляет, как лишние в процессе, на месте? Этот
факт представляет нам рис. 3, снятый также с единственного в своем
роде, т. е. очень редкого препарата зародышевого мешка Fritillaria te-
nella. Оба мужских половых ядра находятся здесь в самом теле зачатка
эндосперма и лежат настолько тесно, что кажутся закрученными один
вокруг другого, как я описал это раньше, в своей первой статье о двойном
оплодотворении (Nawaschin, 1898b). Такое перемещение мужских
половых ядер из одной среды в другую, конечно, совершающееся и у
Lilium martagon, может быть объяснено едва ли чем иным, как их
собственным, самостоятельным движением, с одной стороны, и
некоторою вязкостью содержимого пыльцевой трубки, с другой: последнее
обстоятельство обусловливает то, что все зерна содержимого пыльцевой
трубки остаются на месте и лишь активные элементы его, т. е. половые
ядра, пробиваются наружу, попадая в протоплазму зачатка эндосперма.
Какого бы, однако, объяснения мы ни дали совершившемуся до сих
пор, дальнейшая доставка обоих мужских половых ядер и теперь еще
Двойное оплодотворение
63
не обеспечена. Естественным образом возникает теперь вопрос, каким
образом оба половых ядра покинут друг друга, для чего им необходимо
почти расплестись из общего свертка? Почему не оба они будут увлечены
течением протоплазмы в одну сторону, а, наоборот, поодиночке
отбуксированы один к яйцеклетке, другой к полярному ядру? Мало того,
исходя из представления о пассивности и неподвижности половых ядер,
следовало бы совершенно определенно предположить, что их присутствие
внутри протоплазмы зачатка эндосперма возбуждает противоположные
течения последней, быть может, подобие водоворота, которыми оба ядра
центробежно разводятся. Для такого предположения, однако, едва ли
нашлись бы основания, тем более, что таковые не объяснили бы нам
определенного направления течений, а следовательно и направления
движений обоих половых ядер, а также не устранили бы последнего
затруднения: объяснить механизм самого проникания одного из мужских
ядер в яйцеклетку. Чтобы проникнуть в яйцеклетку, одно из мужских
ядер должно пробить себе путь сквозь кожистый слой этой клетки,
само собою понятно, если и в этом случае не вмешается активно сама
протоплазма яйцеклетки. Последнему ни на чем не основанному
предположению противоречат все многочисленные изображения «двойного
оплодотворения», которые представляют протоплазму яйцеклетки и
протоплазму зачатка эндосперма в течение этой стадии процесса, так же
как и раньше, совершенно изолированными друг от друга, как это
передает и мой рис. 4 для Fritillaria tenella.
Таким образом, единственное предположение о самостоятельной
подвижности мужских половых ядер, \хорошо согласуемое с
изменчивостью формы последних, освобождает нас от необходимости сделать
целый ряд предположений, которые понадобились бы иначе, чтобы
объяснить доставление мужских половых ядер к месту их назначения
силами окружающей среды, т. е. протоплазмы.
Как я имел случай объяснить однажды, я намеревался, по
выяснении процесса оплодотворения у лилейных, возвратиться к изучению
этого процесса у видов Juglans (Nawaschin, 1898b). В настоящее
время мною закончено это исследование, и оно должно появиться в
печати в будущем году. Пока же я хочу воспользоваться лишь двумя
рисунками оттуда, достаточными, чтобы несколько иначе осветить
разобранный выше вопрос.
Рис. 6 представляет яйцеклетку Juglans nigra, разрезанную на
препарате пополам вдоль. Яйцеклетка содержит немного протоплазмы и
ядро с неявственным хроматином и ядрышком. С поверхности,
отвращенной от наблюдателя, яйцеклетка как бы облита слоем зернистой,
вакуолистои, густой массы, о толщине которой можно судить по нижнему
краю яйцеклетки, где этот слой перерезан. В этом слое содержится как
бы вакуоля значительной величины и овальной формы, заключающая,
по-видимому, каплю совершенно не красящегося гиалинового вещества,
а в ней — оба мужских половых ядра, сильно покрашенных
гематоксилином. Рис. 7 показывает такую же вакуолю у Juglans regia в сечении
64
Семя
и сбоку: часть ее вполне вскрыта бритвою и поэтому бесцветна, другая
же лишь просвечивает сквозь вещество, аналогичное веществу слоя,
лежащего по стенке яйцеклетки в описанном выше препарате.
Здесь, у обоих видов Juglans, мы встречаемся с обстоятельствами,
значительно отличающимися от изображенных нами у лилейных, — с
обстоятельствами, подробное изъяснение которых я дам в другом месте;
здесь же я укажу лишь, что изображенная на обоих рисунках одна и
та же стадия процесса оплодотворения, в противоположность такой же
стадии у многих известных мне растений, весьма длительна и поэтому
попадается весьма часто. Можно думать поэтому, что мужские половые
ядра у видов Juglans попадают в зародышевый мешок.еще не вполне
зрелыми в массе общей протоплазмы, оставшейся от их материнской
клетки и еще заметной в виде гиалиновой капли. Здесь они дозревают,
имея вначале почти округлую форму (рис. 6), позднее же становятся
удлиненно-яйцевидными, слегка изогнутыми (рис. 7) и напоминают
какие-то зооспоры или сперматозоиды, лишенные ресничек. В этом
состоянии, как мне кажется, половые ядра получают способность
двигаться, подобно многим зооспорам, движущимся еще внутри материнской
клетки; активными движениями они освобождаются из заключающей их
вакуоли и направляются каждое к соответственной женской клетке.
Такая аналогия кажется мне во всяком случае более правдоподобной сама
по себе и более отвечающей действительно наблюдаемым отношениям,
нежели предположение, которое и на этот раз делало бы протоплазму
женской клетки ответственной за всевозможные удобства на пути
мужских половых ядер к их месту назначения. Что мужские половые ядра
у Juglans лишены органов движения, т. е. ресничек, как можно думать
по моим препаратам, по моему мнению, не должно мешать такой
аналогии: во-первых, следует помнить, с каким вообще трудом
сохраняются реснички у зооспор при фиксировании их внутри клеток;
во-вторых, существуют случаи временного и мимолетного образования
ресничек зооспорами; поэтому, может быть, и у Juglans мужские
половые ядра лишь кажутся лишенными ресничек. Действительно,
они настолько малы, что и самое строение их выясняется с большим
трудом, и предстояло бы еще решить, состоят ли они целиком из
ядра, как это теперь принимается, по-видимому, всеми для
оплодотворяющих элементов у покрытосеменных растений (Koernike, 1903),
или же содержат в своем теле часть протоплазмы, необходимой по
нашим теперешним представлениям для движения вообще. Этого я
думаю коснуться в другой готовящейся к печати моей работе по
развитию мужских половых ядер у Lilium martagon.
С тех пор как я опубликовал свои исследования над оплодотворением
у сложноцветных (Nawaschin, 1900), я несколько лет продолжал
наблюдения над этим процессом у Helianthus annuus, желая выяснить
роль синергид при поступлении содержимого пыльцевой трубки в
зародышевый мешок. Пересмотрев множество своих препаратов, а также
тех, которые были изготовлены из моего материала моими учениками
Двойное оплодотворение
65
с целью практики микротома, я составил предлагаемые здесь рисунки,
дающие, как мне кажется, достойные внимания намеки касательно
интересующих нас здесь вопросов.
Зародышевый мешок Helianthus annuus и особенно яйцевой аппарат
устроены весьма определенно и постоянно. Я прошу читателя обратиться
к подробному объяснению рис. 8-10, изображающих продольное сечение
верхней части зародышего мешка этого растения, желая здесь отметить
лишь одно обстоятельство: постоянную наличность более или менее
глубокой впадины между яйцеклеткой и вторичным ядром зачатка
эндосперма (рис. 9 и 10, с, d). Эта впадина, судя по постоянству ее размера
и формы, едва ли может быть сведена на сокращение соответственных
элементов на препаратах; я склонен рассматривать ее как временное
помещение для принятия обоих мужских половых ядер вместе с частью
содержимого пыльцевой трубки. Действительно, как раз в этом месте
происходит внедрение одного из мужских половых ядер во вторичное
ядро зачатка эндосперма, как это показывает мой рисунок к только что
цитированной статье, а также рис. 12-14 настоящей статьи, о которых
речь будет еще ниже. Но проследим сначала те изменения, которые
постигают яйцевой аппарат в течение всего процесса оплодотворения,
чтобы иметь право судить о достоверности такой догадки.
На рис. 15 мы видим яйцевой аппарат до оплодотворения в
поперечном сечении. Как и на продольных разрезах, мы видим здесь обе
совершенно симметрично развитые синергиды, отчасти обнимающие
узкое основание яйцеклетки. На поперечных разрезах яйцевого
аппарата после оплодотворения (рис. 11, а-е) одна из синергид
оказывается значительно спавшеюся, мутною и содержащей внутри гомогенное
тельце, по-видимому, ядрышко разрушенного ядра (рис. 11, Ь), а по
своей периферии — обложенною зернистою массою (рис. 11, d),
собирающейся особенно на дне синергиды (рис.. 11, е). Мне думается,
что эту зернистую массу можно отождествить с менее обильною
зернистостью в соответствующем месте зародышевого мешка Lilium
martagon (красные зерна на рис. 5) и, следовательно, принять за
излившееся содержимое пыльцевой трубки.
Весь процесс поступления содержимого пыльцевой трубки в
зародышевый мешок у Helianthus annuus представляется мне на основании
всего мною виденного следующим образом: когда пыльцевая трубка
минует канал микропиле и ткань ядра семяпочки и достигнет своим
концом вершины зародышевого мешка, одна из синергид, находящихся
видимым образом в напряженном состоянии (давление внутри
типичной вакуоли внизу синергиды), внезапно лопается в своем остром
конце и изливает часть своего содержимого в канал микропиле.
Вследствие этого на месте одной синергиды оказывается полупустой мешок,
что в свою очередь должно иметь следствием внезапное понижение
гидростатического давления в этом пространстве. Это должно повлечь
за собою опорожнение пыльцевой трубки, причем через открывшийся
конец ее часть ее содержимого перельется в зародышевый мешок в
5-828
66
Семя
непосредственной близости с лопнувшей синергидой, покрыв
последнюю с поверхности более или менее толстым слоем (зернистость по
периферии). Отсюда уже оба мужских половых ядра пробиваются при
помощи активных движений во впадину между яйцеклеткой и ядром
зачатка эндосперма и только отсюда отправляются одно внутрь
яйцеклетки, другое во вторичное ядро зачатка эндосперма.
Форма мужских половых ядер у Helianthus annuus как нельзя более
благоприятствует толкованию в вышеприведенном смысле, т. е.
допущению самостоятельной способности их к передвижению (ср. выше
цитированную мою статью). Это штопорообразные нити или даже скорее
спирально скрученные ленты, которые, то скручиваясь, то распрямляясь,
должны вращаться и двигаться в то же время поступательно. Некоторое
косвенное доказательство их вращательного, сверлящего движения я
вижу в весьма постоянных и своеобразных картинах начала слияния одного
из них с весьма крупным вторичным ядром зачатка эндосперма. Рис. 12-
14 изображают один и тот же весьма редкий момент этого слияния:
остатки спирали обоих мужских половых ядер заметны и в ядре яйца,
и в ядре зачатка эндосперма (кроме рис. 13, где спираль не попала в
изображенный разрез); но, кроме частей хроматиновой спирали, каждый
раз в ядре зачатка эндосперма замечается еще округлое гомогенное
тельце, как бы связанное с упомянутой спиралью изогнутою тонкою
полоскою. Гомогенное тельце это легко отличается от ядрышка своею
неспособностью краситься: оно остается совершенно бесцветным при
разнообразных способах окраски; полоска же, тянущаяся от гомогенного
тельца к хроматиновой спирали мужского ядра, есть оптическое выражение
складки оболочки ядра зачатка эндосперма, втягиваемой и скручиваемой
мужским ядром при внедрении последнего в первое. Это легко
констатировать на препарате с помощью перемены установки микроскопа,
причем полоска характерным образом смещается взад и вперед, соответствуя
в каждый данный момент оптическому сечению наклонно помещенной
или вогнутой перепонки. Нетрудно, кроме того, убедиться, что эта
складка, как по окраске, так и по толщине, совершенно тождественна
со складочками, находящимися на поверхности ядра как раз над
гомогенным тельцем, и здесь уже видимым образом переходящим в оболочку
ядра. Я представляю себе, что мужское половое ядро сверлящим
движением углубляется в ядро зачатка эндосперма и не сразу прорывает
его оболочку, но впячивает ее перед собою и скручивает ее складками,
увлекая за собою часть какого-то полужидкого вещества, находившегося
во впадине ядра вместе с обоими мужскими ядрами: остаток этого
полужидкого вещества в виде округлой капли и есть «гомогенное тельце»,
видимое на препаратах. К сожалению, явление это, о сущности которого
довольно легко судить, глядя в микроскоп, трудно поддается
изображению на словах и на рисунке. Я прошу поэтому читателя помочь моему
объяснению опытом, положив на платок какое-нибудь округлое тело и
стараясь его провести сквозь платок при помощи вращательного
движения.
Двойное оплодотворение
67
Я слишком далек от того, чтобы придавать сообщенным в этой
статье фактам значение, достаточное для окончательного решения
вопроса: каким образом достигают мужские половые ядра
соответственных женских клеток? Но мне кажется, что изложенное способно
возбудить внимание наблюдателей к некоторым частностям столь
сложного процесса оплодотворения, остававшимся до сих пор в тени.
Кроме того, я убежден, что другим могут попасться как более удобные
объекты для исследования, так и различные средства для
фиксирования, которые при удачной комбинации, быть может, окажут лучшие
услуги, чем, правда, заслуженная флеммингова жидкость, которой я
почти исключительно пользовался. Конечно, наши сведенияо
частностях в процессе оплодотворения должны развернуться далеко за
теперешние рамки. В особенности же мне хотелось в этой статье указать
те довольно тонкие, но характерные отличия, которыми разнообразится
процесс оплодотворения у различных представителей
покрытосеменных. Сравнительное изучение процесса есть верный способ постижения
его существеннейших свойств.
Guignard, 1899b, 1900, 1901а, Ь, с, 1902; Koernicke, 1903; Mottier, 1904; Nawaschin,
1898b, 1900; Strasburger, 1900.
ОПЫТ СТРУКТУРНОГО ИЗОБРАЖЕНИЯ СВОЙСТВ
ПОЛОВЫХ ЯДЕР 1
V
Процесс оплодотворения у покрытосеменных обладает вполне
своеобразной формой, благодаря чему ему присвоено даже особое
наименование «двойного оплодотворения», по мнению многих, впрочем, не
соответствующее природе этого явления. Можно сказать, что значение
этого процесса до сих пор ограничивается значением признака
систематического. Действительно, двойное оплодотворение, установленное
теперь у представителей весьма многих семейств дву- и
односемядольных, едва ли не в качестве единственного вполне категорического
различия полагает естественную и резкую грань между голосеменными
и покрытосеменными; тогда как даже тот признак, который послужил
для наименования обоих этих подотделов, именно, устройство женского
цветочного органа, таков, что в истории нан!ей науки терпел
неоднократно небезосновательную критику.
Рядом со своим бесспорным значением в систематике процесс
этот, — по существу физиологический, — как это ни странно, в
физиологии игнорируется до сего времени почти совершенно. Мне
Статья С. Г. Навашина впервые напечатана в юбилейном сборнике, посвященном
И. П. Бородину (1927, с. 94—114).
5*
68
Семя
известны лишь немногие слабые попытки морфологов, в том числе
и моя собственная (Навашин, 1910), подвергнуть физиологическому
анализу самое существеннейшее в этом своеобразном процессе, почти
не имеющем себе аналогий ни в других типах растительного царства,
ни в царстве животных — различие поведения мужских половых
ядер, т. е. обоих спермиев, перед слиянием с женскими ядрами.
Между тем, казалось бы, как раз в зародышевом мешке
покрытосеменного растения половой акт совершается в необычайно
упрощенной обстановке, притом точно определенной и доступной анализу:
всего два женских ядра сливаются здесь с двумя же мужскими,
так что женской гамете не представляется выбора между множеством
гамет, как это бывает чаще всего у низших растений и у животных;
для этого выбора при двойном оплодотворении всегда налицо одна
пара ядер, спермиев1, т. е., как можно думать, ровно столько,
сколько «необходимо и достаточно» (по выражению математиков)
для условий нормальной функции всего аппарата.
До открытия двойного оплодотворения полагали, что в условиях
процесса кроется нечто несовершенное, так как один из спермиев
казался излишним, и думали видеть его так или иначе задержанным
перед входом в зародышевый мешок. Оказалось, наоборот, что он-
таки надобен, что без его участия не обходится развитие эндосперма.
По крайней мере, у гибридов на эндосперме сказывается резко
отцовское влияние, что не может быть, конечно, истолковано иначе,
как влиянием того спермия, который мы видим сливающимся со
вторичным ядром зародышевого мешка. Было обнаружено наконец,
что это слияние не есть простое «заглатывание» спермия женским
ядром, но слияние, вполне подобное половому слиянию ядер, ибо
было показано (Навашин, 1915), что число хромосом в продукте
слияния равно сумме таковых в привходящих трех ядрах: двух
женских, так называемых «полярных», и мужского ядра спермия.
Функция спермия при образовании эндосперма, следовательно, неотличима
от таковой при образовании зародыша, как с генетической, так и
с морфологической точки зрения. Итак, хотя по результату мы
должны считаться с крупными различиями между образованием
зародыша и эндосперма, однако едва ли можно сомневаться в том,
что по началу оба процесса существенно сходны: что оба спермия,
как истинные мужские половые ядра, направляются к
соответственным половым женским ядрам, следуя некоторым специфичным
импульсам.
За этой областью, доступною нам в разбираемом явлении, и лежит,
наконец, момент, разъяснение которого пока не поддается нашему
анализу. Мой личный опыт в этом отношении таков, что именно тогда,
Здесь и далее под термином «спермий» понимается лишь его ядро (ред.)
Двойное оплодотворение
69
когда удается наилучшим образом, в малейших деталях изучать
явление на микроскопических картинах, именно тогда его существеннейший
момент и является наиболее загадочным...
Этот момент — разлучение обоих половых ядер, спермиев,
лежащих временно бок о бок, и последующее стремление их в
противоположных направлениях: одного — в яйцеклетку, другого же —
в протоплазму зародышевого мешка, к обоим полярным ядрам
последнего, в это время уже сливающимся.
Наилучшие препараты, которые мне приходилось видеть и с
которых сняты подробнейшие рисунки, были получены в последние годы
одной из моих учениц Гургеновой, работа которой выйдет вскоре из
печати (Гургенова, 1928). Почти в кинематографической
последовательности на этих препаратах можно видеть, как вначале оба спермия
помещаются в промежутке между протоплазмой яйца и протоплазмой
зародышевого мешка вместе с большим числом гомогенных, сильно
красящихся глыбок, очевидно, — продуктом изменения содержимого
пыльцевой трубки; как затем оба спермия покидают это временное
пристанище, в котором, однако, остаются, как на фильтре, все
упомянутые глыбки или зерна; позже один спермий непосредственно
попадает в яйцо, тогда как другой можно наблюдать на нескольких этапах
его пути в направлении к полярным ядрам, как бы самостоятельно
пролагающим свой путь через протоплазму.
О самостоятельной подвижности спермиев в данном случае не
может, однако, быть и речи. В отличие от спермиев у лилейных, где эти
ядра имеют изменчивую, червевидную форму, в описываемом случае,
у Phelipaea ramosa, они не что иное как совершенно округлые,
покоящиеся (мелкозернистые) ядра без малейшего следа протоплазматичес-
кой оболочки. Последнее необычайно явно тогда, когда спермий
несколько вдается в вакуолю протоплазмы зародышевого мешка: при
этом край ядра, спермия, рисуется на совершенно прозрачном фоне
вакуоли, и не возможно было бы не заметить слоя его протоплазмы,
если бы она на самом деле была бы им сохранена. Спермий у
Phelipaea, очевидно, принадлежат к бесплазменным, т. е. подобны
известным мне по исследованию лилейных, чем, конечно, не
отвергается существование спермиев, одетых собственной плазмой (Finn,
1926). В протоплазме зародышевого мешка на пути этого спермия мы
не видим также ничего, кроме вакуоль (о значении которых ниже), в
особенности же ничего такого, что было бы подобно тому, что видел
в живом состоянии Strasburger у Monotropa hypopitys, и что дало
этому наблюдателю повод толковать перемещение спермиев как
результат действия потоков протоплазмы (Strasburger, 1900).
Естественно, в объяснение наблюдаемого процесса в целом, в
воображении рисуется нечто весьма сложное, что ведет (1) к освобождению
обоих спермиев из их заточения, (2) к отделению их от видимо мертвых
тел, т. е. глыбок и зерен, и (3), что самое главное и загадочное, —
к разлучению спермиев и направлению их по противоположным путям.
70
Семя
К тому, что мне было известно о двойном оплодотворении по
чужим исследованиям, я должен добавить здесь из новейшей
литературы данные Haberlandt (1921) и Wylie (1921), довольно запоздало
попавшие в мои руки. Маститый физиолог, упоминая о двойном
оплодотворении, указывает совершенно справедливо на крупные проблемы
в описании его, бросающиеся до сих пор в глаза в изложении
руководств ботаники. Превосходное описание американского натуралиста
дает совершенно новую, так отчетливо до сих пор невиданную картину
образования спермиев в виде полных клеток, настоящих гамет. Но
первый останавливает свое внимание на причине стимула деления
оплодотворенной яйцеклетки, а второй вовсе не касается того, что
представляется мне особо загадочным и важным: способа передвижения
спермиев. Дело остается, следовательно, до сих пор неподвинутым.
Для меня очевидно, что физиология в учении о направлении
самоподвижных клеток не содержит положений, которые могли бы служить
опорой при анализе данной комбинации отношений: для выяснения, что
за механизм, который распределяет в нашем случае неподвижные тела,
каковы оба спермия и мертвые зерна, отделяя те и другие в точности
друг от друга? Особенно дело затрудняется в дальнейшем тем, что с
морфологической точки зрения оба спермия представляются
тождественными дочерними ядрами одного и того же материнского ядра, т. е.
генеративной клетки пыльцевого зерна. То же самое следует принять
для ядер яйцеклетки и зародышевого мешка, по крайней мере, если
иметь в виду ближайшее к яйцу «северное полярное» ядро.
Раз мы становимся, однако, на динамическую точку зрения в
отношении анализируемого процесса, дело меняется: невольно мы
умозаключаем, что если нет видимой непосредственно разницы в
паре занимающих нас ядер, то не зависит ли их различная судьба
все-таки от обстоятельств, лежащих лишь в данный момент за сценой
действия или только что миновавших? Последнее естественнее, и я
остановился на нем: причина, по моему убеждению, лежит в
предшествующем делении генеративной клетки, которое дает спермиям
существенно неодинаковое, или, вернее, — «противоположное
настроение». Если мы, далее, представим себе то же самое касательно
обоих ядер, являющихся различной целью стремления обоих спермиев
и одинаково оказывающихся также сестринскими ядрами, то перед
нами выступит картина системы, состоящей из четырех тел, об
условиях равновесия которой позволительно рассуждать, исходя из
нашего допущения о различном настроении одинаковых по
происхождению ядер. Если мы при этом не забудем, что обе протоплазмы,
являющиеся ареной действия, будучи смежны, все же должны быть
различно настроены, каждая соответственно индукции со стороны
обоих различно настроенных ядер, то перед нами откроется
возможность сравнения данной природной системы с некоторыми
мертвыми моделями или системами, равновесие которых, конечно,
определить и анализировать легче.
Двойное оплодотворение
71
Я представляю себе, например, каплю тонкой эмульсии масла в
воде, рядом с другой каплей масла с мелко раздробленной в нем водою,
т. е. такую же эмульсию, но с обратным отношением фаз: в первом
случае dispersum масло и dispergens вода, во втором — жидкости
поменялись ролями. Вообразим, что обе капли касаются друг друга.
В обеих каплях должен идти процесс «отмешивания», собирания
взвешенной жидкости в более крупные капли, что, конечно, случится и на
поверхности соприкасания капель. Я полагаю, что должно здесь
случиться то же, что мы видим при отстаивании эмульсий вообще:
становящиеся крупнее капельки масла будут переходить, как в
отстаивающейся эмульсии, туда, где масло dispersum, а капельки воды —
туда, где вода dispergens. К сожалению, такая модель неосуществима
и не показательна, так как видимости обоюдной миграции капель
масла и воды мешает различие в удельном весе этих жидкостей, т. е.
влияние тяжести.
Разбирая далее условия, мыслимые в нашей задаче о механике
движения обоих спермиев, мы, конечно, покинем приведенное сравнение:
оно слишком грубо, и не физические данные в своей элементарности
могут обусловить, на самом деле, поведение живых элементов данной
системы. Нечто общее с воображаемым примером эмульсий оказывается
в зародышевом мешке лишь тогда, если мы примем, что пограничные
плазмы яйцеклетки и зародышевого мешка отличны и что в том же
роде отличны в своих свойствах сестринские ядра одной и той же пары.
Последнего условия, впрочем, уже достаточно, так как ведь им
определяется и первое: протоплазма находится неизбежно под влиянием
своего ядра, и, стало быть, две протоплазмы, коих ядра различны, должны
быть в некотором роде различны сами.
Представим себе теперь, что некий гормон X истекает из ядра
яйца, представим вновь довольно грубо, что он, в конечном
результате, разжижает цитоплазму яйца и что сходным гормоном
обладает один из спермиев, тогда как подобное же влияние на
протоплазму зародышевого мешка принадлежит гормону У северного
полярного ядра и другого спермия. Итак, я принимаю, что спермин
отличны друг от друга в одной и той же паре по своим гормонам;
а этого, в связи с допущенным отличием ядер соседних протоплазм,
как мне кажется, достаточно, чтобы решить нашу задачу. Явно,
что при таком условии протоплазма яйца окажется в одной из своих
частей под совокупным действием гормона своего ядра и спермия,
в части, ближайшей к этому спермию; здесь она будет,
предположительно, разжиженной, и спермий поступит туда, как засасывается
какое-нибудь тело в воронку водоворота, или, вернее, как потонуло
бы оно на размягченном пятне желатина. Соображение это
подтверждается тем, что реально можно видеть на описанном отчасти
выше уже пути второго спермия; все пространство между тем
местом, где вначале лежат оба спермия, и полярными ядрами
зародышевого мешка представляется сильно вакуолизированным. Таков вид
г72
Семя
этой полосы протоплазмы, конечно, на фиксированном препарате;
но, восстанавливая в воображении прижизненную картину, мы скорее
всего должны заключить лишь об избытке в этом месте «клеточного
сока», иначе — о разжижении.
Само собою, в нашем рассуждении гормоны X и У — лишь
символы, какими, может быть, они окажутся во многих случаях,
которые мы вообще претендуем толковать с подобающей точностью
биохимии; но, каково бы на самом деле ни было взаимодействие
мужских и женских ядер и отношение их к соответственным
протоплазмам, я полагаю, что своим изображением хода явления я
сделал приемлемым положение: причина, по которой один спермий
поступает в яйцо, а другой в смежную полость зародышевого мешка,
состоит в том, что спермин одной и той же пары не одинаковы,
так же как отличны друг от друга участвующие в процессе
женские ядра; и это несмотря на то, что и та, и другая пара
ядер суть ядра сестринские, т. е. происходят от деления одного
материнского ядра, каковое деление в морфологической науке принято
до сих пор считать вообще эквационным.
Этого рода соображения привели меня к тому, чтобы искать
возможность тонких, большею частью скрытых отличий в свойствах ядер,
происшедших таким делением, и в воображении рисовалась
возможность видеть это отличие не в составе ядра и характере его элементов,
каковые должны быть тождественны, а лишь во взаимном
расположении элементов, хромосом, в момент возникновения каждого из
дочерних ядер, т. е. в некотором «структурном» отличии ядер, в
своего рода изомерии, именно, стереоизомерии ядра.
Спешу здесь пойти навстречу вполне основательному возражению.
Мне скажут, конечно: какое значение может иметь расположение
хромосом в мета-, ана- и телофазе (где оно легко распознается),
там, где, как в покоящемся ядре, сами хромосомы вовсе не
приметны, где они, по мнению многих (а также и по моему),
распыляются на свои элементы? Я отвечу на это ссылкою на последующее,
где будет указано, что кристаллическая форма многих тел
обуславливает также и свойства растворов их, по гипотетическому
представлению, как бы форму молекул или комплексов таковых, т. е.
тех элементов, на которые кристалл распадается по растворении.
Покоящееся состояние ядра я приравниваю, следовательно, к
раствору хромосомной массы, к ее золю.
Опираясь в дальнейшем на аналогию, которую мне представляется
возможным провести между происхождением, строением и свойствами
половых ядер и соответственными отношениями энантиоморфных сте-
реоизомеров химических тел, я сделаю попытку представить некоторое
изображение поведения и состояний половых ядер; именно,
изображение, потому что объяснения не существует и в химии, науке опытной
и более точной, чем наша, для сходных отношений и состояний в области
определенных физических и химических явлений.
войног оплодотворение
Вместе с тем я коснусь весьма важного вопроса о точной
характеристике гаплоидного ядра (ix-ядра) и существенного различия его от
ядра диплоидного (2х-ядра). Как мы увидим, касательно этого до
последнего времени существуют некоторые предрассудки в нашей
науке. Если самый предмет моего рассуждения покажется многим
полуфантастическим (сближение сложноорганизованных тел, ядер, с
химическими телами в кристаллах или растворах), то, может быть,
касающееся природы и отличий ядер гаплоидных и диплоидных
примирит читателя с остальным содержанием статьи.
Двух великих ученых прошедшего века одинаково занимала
морфологическая проблема сущности или природы живых тел. Оба они пришли
к аналогиям, заимствованным из кристаллографии, т. е. морфологии тел
мертвой природы. Проблему, которую решить они оба имели в виду,
можно поэтому называть и структурной, и морфологической.
Одному из них, Негели, представлялся необычайным по своему
значению факт, что главнейшие элементы живого тела являются
телами анизотропными, т. е. двояко преломляющими свет. Эту
способность Негели приписывал кристаллическим индивидам, и отсюда
существенная черта его «мицеллярной теории», по которой «живая
материя» должна состоять из элементарных единиц, «мицелл»,
имеющих форму и строение кристалла.
Другой натуралист — не кто иной как бессмертный творец
микробиологии Пастер. Его идеи положили начало представлениям о
пространственном расположении четырех различных элементарных атомов
или радикалов, насыщающих четыре единицы сродства атома углерода.
Схема этого представления или соответственная модель —
асимметричный тетраэдр, центр которого занят атомом углерода, а по
вершинам неравных углов размещены различные атомы, или радикалы. К
этому представлению приводит сравнение свойств оптически
деятельных органических тел с асимметричным кристаллом кварца. То, что
составляет причину вращения плоскости поляризации в кристалле
кварца, по убеждению Пастера, должно принадлежать и молекулам
тех тел, которые не только в форме кристалла, но и в растворах
вращают плоскость поляризации; в первом случае это — асимметрия
кристалла, во втором — асимметрия самой молекулы.
Как Негели, так и Пастера, параллельно с специальным интересом
оптического эффекта, занимала более широкая задача: заглянуть в
сущность жизненных процессов. Особенно Пастеру казалось
надежным принимать при этом как точку опоры тот действительно
замечательный факт, что оптически деятельные органические вещества не
могли быть получены, по крайней мере непосредственно, синтезом в
лабораториях, но являются продуктом деятельности живой клетки.
Причина, почему и с успехами синтеза не могут быть получены до
сих пор непосредственно оптически деятельные тела, состоит в том,
что наши химические реакции создают всегда одновременно обе формы
оптически деятельного тела (J и /). Эти два оптических изомера компен-
74
Семя
сируют взаимно свое влияние на поляризованный свет, ибо они
сочетаются в пропорции их молекулярного веса, давая непрочное соединение,
оптически недеятельное (так называемое «рацемическое» сочетание).
Только природа, как утверждал Пастер, обладает средством создавать
оптически деятельные тела и при этом — порознь, то право-, то ле-
вовращающее.
В своем убеждении касательно своеобразия синтеза в условиях живой
природы Пастер шел, несомненно, слишком далеко, вплоть до иллюзий.
Его ученик и преемник Дюкло передает одну из них так: фабрикация
асимметричных тел вообще зависит в природе от асимметрии самой
фабрики в целом. Земля наша, конечно, шар; но шар этот симметричен
только когда мы его созерцаем как неподвижное тело; а так как этот
шар вертится всегда в одном направлении, то он разделяет свойства
всех асимметричных тел, ибо в зеркальном отражении своем он должен
нам казаться вертящимся в направлении, противоположном
действительному. Одинаково и солнечные лучи, падающие на зелень земли, кажутся
нам в зеркало падающими в направлении ином, чем истинные. Каждое
наше движение в том же смысле обращается зеркалом, что известно
каждому по опыту. Словом, вся картина живой природы несовместима
с ее зеркальным изображением. Оригинал живой природы и отражение
его «энантиоморфны», как выражаются не только морфологи и
кристаллографы, но и химики, говоря об асимметричных системах. Прототип
такой системы в простейшем виде — это тот тетраэдр с неравными
или разноименными углами, о котором уже сказано.
В асимметрии нашей природы в целом, по убеждению Пастера, и
должны лежать сложные условия того, что развитие жизни привело на
нашей земле к созданию асимметричных форм вообще, а в частности
тех асимметричных молекул органических тел, которым постоянно
присуща способность оптически деятельного кристалла.
Какова бы ни была наша оценка этой иллюзии Пастера, он вполне
справедливо отмечает обстоятельство, не всегда явное в нашем сознании,
что «все вещественные предметы, каковы бы они ни были,
рассматриваемые в отношении их форм, или повторения их идентичных частей,
подобны тем тетраэдрам (симметричному и асимметричному), которые
мы только что различили. Одни предметы, поставленные перед зеркалом,
дают изображение, совместимое с ними; изображение других не
совпадает с оригиналом, хотя воспроизводит точно все его детали. Прямая
лестница, стебель с супротивными листьями, куб, человеческое тело —
вот тела первой категории. Винтовая лестница, стебель с листьями по
спирали, кисть руки, неправильный тетраэдр — вот формы второй
группы. Эти последние не имеют плоскости симметрии» (Pasteur, 1860).
Таково простое и точное определение, по Пастеру, асимметричного
тела, фигуры или системы, конечно, включительно до молекулы. Я
решаюсь думать, что если бы Пастер мог знать в свое время о теперешних
фактах касательно строения и превращения клеточного ядра, то к
приведенной цитате добавил бы: из всех образований живой природы гап-
Двойное оплодотворение
75
лоидное клеточное ядро наиболее подобно (в критической фазе деления)
упомянутой напоследок форме — асимметричному тетраэдру, именно:
его плоскостной схеме или проекции. Если бы Пастер знал это
обстоятельство, он принял бы его, конечно, за окончательное подтверждение
своей идеи; особенно, при том освещении, которое делает гаплоидное
ядро системой первичной, отсюда лишь производным является
диплоидное ядро (см. ниже).
Пастер поставил в соотношение (не как прямую причину)
воображаемое строение асимметричной молекулы с оптическими свойствами
раствора соответственного тела. Асимметричное, как увидим,
гаплоидное ядро проявляет особенность своего строения в специфичном, особо
деятельном состоянии индуцируемой им клетки: половые клетки суть
непременно клетки гаплоидные. Понятия и слова пол, половой,
конечно, лишь покрывают, но не исчерпывают свойств гаплоидных клеток
и свойственного им ядра; тем более, что гаплоидные клетки могут
быть и не половыми. Разобраться в относящихся сюда понятиях
составляет задачу следующего отдела этой статьи; но уже здесь я
решаюсь выразить свое убеждение: подобно тому как асимметричное
строение молекулы, или кристалла, находится в соотношении с
оптической деятельностью данного тела, так асимметрия
гаплоидного ядра является условием специфичного, половодеятельного
состояния гаплоидных клеток, причем это состояние должно
проявляться в двух противоположных формах, подобно тому как
проявляется оптическая деятельность в формах право- и
левовращаю- щих тел одной химической природы.
Различие между ядрами клеток зародышевых или половых и ядрами
клеток соматических открыто зоологами при исследовании высших
животных, и позже эти понятия перенесены в ботанику, будучи обоснованы
на исследованиях более доступных в этом отношении также высших
растений. Так как тем и другим представителям царства живых существ
свойствен вполне единообразный принцип механизма превращения
соматических клеток и ядер в половые клетки и ядра — принцип механизма
редукционного деления («деление созревания» зоологов), то наиболее
распространенным еще пребывает первоначальный взгляд, выработанный
зоологами, что соматическое ядро есть образование первичное, которое
в силу особого процесса, редукции, сокращает число своих хромосом
вдвое, производя таким образом вторично дочерние и последующие
ядра с половинным числом хромосом. Под влиянием учений Негели и
Вейзмана создалось телеологическое представление, что будто бы это
уменьшение числа хромосом выработалось в силу простой необходимости
предотвращать накопление ядерного вещества («идиоплазмы» Негели)
в клетках последующих поколений. Так как наука неизбежно должна
принимать, что половому состоянию живых существ предшествовало
состояние бесполое, то из упомянутого взгляда следовало заключить, что
соматические ядра низших существ должны были быть сходны с
«первичными», т. е. соматическими ядрами высших животных и растений,
76
Семя
или быть диплоидными. На обычном языке современной цитологии
следовало бы сказать, что соматическое, диплоидное или 2х-ядро
свойственно первозданной клетке, а половое, гаплоидное или 7х-ядро есть
образование производное, результат процесса эволюции вообще и
эволюции пола в частности.
Эта сторона нашей теории освещена теперь наилучшим образом
ботаническими исследованиями, однако с совершенно противоположным
выводом. В истории происхождения полового процесса и самого пола
на первых этапах ее мы находим у простейших растений, несомненно,
первобытный порядок, состоящий в том, что половые клетки еще не
вполне выработаны и не обособлены от соматических, служащих для
бесполого размножения. Так, у многих зеленых водорослей клетки тела
могут образовать одинаково и споры (зооспоры), и половые клетки,
гаметы. Но и у них существует редукционное деление, только никак
не в виде средства предотвратить накопление элементов ядра и не перед
половым процессом, а как естественное последствие его, последствие
накопления ядерных элементов, т. е. каждый раз после того, как
соединяются половые клетки при оплодотворении. Численная редукция
хромосом происходит здесь в половом продукте, в зиготе, при ее
прорастании, состоящем в делении ее для образования спор. Зигота, не
развиваясь в новую особь, подобную материнской, тем не менее является
здесь полным гомологом той особи высших растений, которую мы
именуем теперь, согласно теории чередования поколений, спорофитом, или,
по числу хромосом, диплоидной 2х-генерацией или диплонтом.
Это проникло и в современную генетику, которая именует высоко
сложную и совершенную особь высшего растения, животного и человека
коротко зиготой, выставляя этим на вид «двойственную» природу этой
особи и ее происхождение слиянием двух гаплонтов-гамет с 7х-ядром.
Итак, мы принимаем, что первичное состояние организмов
знаменуется ядром гаплоидным,4 что диплонты появились вслед за гаплонтами,
после выработки полового процесса, который имел своим последствием
и редукционное деление. Последнее у существ, стоящих как бы на
рубеже между существами различной высоты организации, происходит,
как сказано, на первых шагах развития зиготы и подобно
«расторжению брака», заключенного как бы на короткое время между гаметами.
Брак здесь еще не выработан окончательно как вполне необходимый
в жизни институт: он краток и непрочен. Мы видим также, что у
таких существ размножение происходит успешнее не половым
способом, а при помощи спор, которые к тому же могут быть весьма
сходны с гаметами и так же, как последние, родясь от гаплоидной
особи, содержат гаплоидные ядра.
Последнее обстоятельство, уже указанное раньше, кажущимся
образом грозит всему нашему построению, клонящемуся к тому, что
половые функции обуславливаются гаплоидным ядром. Так можно думать,
однако, если не считаться с неизбежным историческим моментом
последовательности и постепенности эволюции: пол не явился сразу, но,
Двойное оплодотворение 77 !
наоборот, постепенными превращениями первично гаплоидные клетки,
элементы бесполого размножения или споры достигли ранга элементов
половых: все переходы между зооспорами и гаметами мы видим
именно у целого ряда низших водорослей и грибов.
В силу каких отличий гаметы таких существ, будучи по
происхождению тождественны со спорами, обладают взаимным стремлением
сочетаться между собой, иначе, почему они деятельны в половом
отношении — это вопрос мало освещенный физиологически до сих пор.
Мне рисуется все же возможность некоторой аналогии этого факта с
тем, что принято и дознано экспериментально в микробиологии и
названо там достижением и ослаблением вирулентности у микробов.
Известно, что патогенные микробы могут быть лишены своей
вирулентности проведением через ряд соответственных культур или через
подходящий для этого организм (вакцины). Если мы примем во
внимание, что большинство гаплонтов, низших водорослей, в течение
вегетационного периода дают однообразно поколение за поколением при
помощи спор, то нам представится возможным предположение, что и
здесь протопласты клеток из поколения в поколение, как в сериях
культур, ослабляются, теряя нечто вроде вирулентности в отношении
способности вегетативно расти или образовывать прорастающие споры.
Рядом с этим можно представить себе дело и так, что вирулентная в
половом отношении гамета погашает свою вирулентность в акте
полового слияния и что протопласты клеток приобретают вновь
способность к половому слиянию, проходя, некоторый «стаж», т. е. несколько
бесполых поколений, с вегетативно сильнейшими протопластами.
Иными словами, гамета есть та же спора, но с крайне ослабленной
способностью расти и одновременно с максимальной вирулентностью
по отношению к себе подобным, что сказывается в стремлении
сливаться попарно. Половое слияние, к тому же, в случае неодинаковых
по полу гамет не лишено сходства, быть может, с нападением микроба
(мужской гаметы на женскую гамету); с другой же стороны, с
явлением сопротивления или самозащиты от такого нападения (фагоцитоз
в микробиологии), — сходства в том, что крупная женская гамета
«поглощает» мелкую мужскую.
Уместно добавить также, что есть определенное сходство между
вирулентностью микробов и взаимным стремлением гамет в том
отношении, что равные гаметы (гомогамия), рожденные одною особью,
большею частью не тяготеют друг к другу; так же точно при «аутои-
нокуляции» микробы, воспитанные в теле особи, не вирулентны более
для этого тела.
Таким образом, приходится различать, видимо, основное условие
половой способности клеток — это гаплоидность ее ядра, и вторичные
условия, которые могут сделать потенциально половую клетку
неспособной к слиянию с себе подобной, как это мы видим на половых
клетках одной и той же особи у низших организмов, а также на том,
что у раздельнополых существ гаметы одного пола не сливаются меж-
78
Семя
ду собою. Я полагаю поэтому, что ядру присуще определить полов-
ность «in potentia», тогда как направляет, разрешает или стимулирует
половое слияние совокупность влияний окружающей протоплазмы.
Итак, мы можем утверждать, что хотя гаплоидная клетка может
быть и не половой, половая клетка должна быть непременно
гаплоидной, т. е. содержать число хромосом вообще вдвое меньше, чем
соматическая клетка той же особи (следовательно, не непременно 1х
хромосом, но и 2х, если мы имеем дело, например, с тетраплоидною
мутацией. Нас, впрочем, должны занимать здесь исключительно
половые клетки обычных диплонтов).
Приняв сказанное, мы становимся вновь перед обстоятельством,
требующим разъяснения.
В начале статьи было указано, что картина двойного оплодотворения
представляет отношения в возможно простой обстановке системы,
элементы которой налицо в наименьшем числе, но допускающем еще выбор.
Я полагаю, что именно лишь в такой обстановке возможно судить о
различиях гамет в отношении их окончательной способности к взаимному
стремлению или слиянию; это, конечно, потому, что в тех случаях, когда
мы рассматриваем отношения множества гамет различного пола или
даже, как это часто бывает, отношения множества мужских гамет к
единственному яйцу (Fucaceae), мы решительно неспособны установить, все
ли мужские гаметы приемлемы для данного яйца? Иначе, нет ли
существенных различий между множеством спермиев? Мы видим лишь
то, что один из спермиев сливается с данным яйцом. Таким образом,
наши сведения об отношениях гамет у низших не должны противоречить
нашему предположению, что оба спермия у покрытосеменных могут быть
друг от друга чем-то отличны.
Переходим, наконец, к выяснению возможности этого отличия, что
сводится на точную характеристику гаплоидного ядра вообще.
В силу происхождения зиготы слиянием двух клеток, ядра которых
содержат одно и то же число хромосом, число хромосом ее особей вида
(не гибридных и не отличающихся так называемыми «половыми»
хромосомами) является четным, что подтверждено бесчисленными
реальными наблюдениями. Но так же четным может быть число хромосом
гаплоидного ядра гамет, что мы знаем на достаточном числе примеров.
Характерным же свойством набора диплоидного ядра является лишь то
обстоятельство, которое вытекает из экспериментальной генетики как
целого, из ее главного постулата о неповторяемости факторов
наследуемых признаков. Эти факторы, или носители их, гены, в качестве
«элементарных квантумов» наследуемой материи от обоих производителей,
содержатся в ядре в наименьшем числе, т. е. по одному от каждого
производителя или, стало быть, в числе 2 в целом диплоидном ядре,
и по одному из пары одинаковых ген в одной хромосоме. Связь цитологии
с генетикой ведь и утверждается весьма правдоподобным
предположением, что четности и одинаковости попарно факторов генетики в точности
и визуально отвечает четность числа хромосом диплоидного ядра и оди-
Двойное оплодотворение
79
наковость хромосом попарно. Наоборот, как следует отсюда, хромосомы
гаплоидного ядра все, как по форме или величине, так и по содержанию
ген, являются телами, существенно, качественно неодинаковыми или
индивидуально различными, что и в этом случае легко обнаруживается
визуально у многих видов по форме хромосом.
Во многих случаях мы наблюдаем, что расположение хромосом
диплоидного и гаплоидного ядра имеет характер циклический, т. е. что
хромосомы лежат в пластинке метафазы кругом некоторого центра;
отсюда название этой стадии деления у зоологов — «звезда» (aster).
Поэтому законно сравнение этой системы с плоскостной схемой,
употребляемой для пояснений симметрии многогранников в
кристаллографии, т. е. с многоугольником. Можно представить диплоидное ядро
многоугольником, в котором углы попарно одинаковы, а гаплоидное
соответственное ядро — многоугольником с числом сторон вдвое
меньшим, в котором все углы будут различны. Таким образом, пластинка,
или звезда, всякого гаплоидного ядра будет в существенном сходна с
молекулой асимметричного строения, в которой кругом одного центра
(атома С) группируются различные атомы или радикалы; одним
словом, система такого ядра асимметрична.
Лишь значительное число хромосом, особенно при небольших
размерах всего ядра, может быть помехой определению индивидуальности
хромосом и, следовательно, определению визуально асимметрии всей
системы. Когда же число хромосом невелико, задача становится совсем
легкой и асимметрия ядерной пластинки столь же очевидной, как
асимметрия кисти руки, пальцы которой можно приравнять хромосомам.
Различие лишь в том, что ядерная пластинка не имеет тыльной и ладонной
поверхности (различие, что пальцы связаны пястью, не существенно),
но это различие временное, так как после долевого расщепления
хромосом и расхождения дочерних хромосом к полюсам мы получаем две
пластинки, или звезды (diaster), обладающие внутренней и наружной
поверхностями, иначе — ориентированные противоположно по
отношению к центру материнского ядра. Хромосомы обеих пластинок
оказываются при этом расположенными совершенно так же, как пальцы
первоначально сложенных ладонями рук, потом разведенных: глядя на
дочерние пластинки из центра ядра, мы убедились бы, что в одной
пластинке разноименные хромосомы А, В, С, D размещены по направлению
движения часовой стрелки, как пальцы левой руки (считая от большого),
а в другой пластинке те же А, В, С, D лежат в обратном порядке, как
пальцы правой руки. Одна пластинка может поэтому быть названа
правой, а другая левой. Иначе обе пластинки, как кисти рук, являются
взаимно своим зеркальным подобием: они энантиоморфны.
Последнее имеет следствием то, что клетка с гаплоидным набором
может быть наделена свойствами системы с определенной полярностью,
т. е. что она при повторении делений порождает каждый раз различные
элементы. Так, протопласт пыльцевого зерна делится явно
дифференциально, что проще всего видно на примере любого покрытосеменного,
!80
Семя
у которого после деления ядра микроспоры образуется две различные
клетки: большая вегетативная и малая генеративная. В зародышевом
мешке, очевидно, первое деление ядра также дифференциальное, так
как микропилярное ядро, делясь далее, дает ядра полового аппарата, а
противоположное служит началом антипод, т. е. аппарата вегетативного.
И в окончательных делениях ядер созревающего зародышевого мешка
нетрудно усмотреть ту же особенность: оба ядра верхнего конца его не
делятся эквационно, так как одно делится на будущие ядро яйцеклетки
и северное полярное ядро, а другое ядро своим делением полагает начало
обеим синергидам, которые содержатся неодинаково: одна созревает
раньше, мутится и разрушается, уступая свое место содержимому
пыльцевой трубки, другая же сохраняется гораздо дольше, но в половом
процессе никакого участия не принимает.
Мы вправе, думается мне, заключить отсюда, что и в генеративной
клетке деление ее гаплоидного ядра не эквационно по существу, но
дифференциально, т. е. что оба возникающие в ней ядра, одно правое,
другое левое, существенно не одинаковы: одно назначено или
приноровлено к слиянию с ядром яйца, другое же — к слиянию с северным
полярным ядром.
Таковы свойства и предположительно последствия этих свойств у
ядра гаплоидного. Совершенно иное мы должны приписать ядру
диплоидному, содержащему исключительно попарно одинаковые хромосомы.
В известном расположении такая система сходствовала бы во время
деления с парою уродливых рук, у которых средний палец был бы удвоен,
а за ним следовали бы не безымянный и мизинец, а повторились бы
указательный и большой пальцы. Такие кисти были бы симметричны,
и каждая перчатка для таких рук годилась бы для рук обеих, чего, как
известно, не может быть для перчаток с рук нормальных. Точно так
же в диплоидном ядре состава АА, ВВ, СС, DD, содержащем четыре
пары одинаковых (в каждой паре) хромосом, очевидно, может быть
достигнута симметрия расположением хромосом одной половины набора
(А, В, С, D) по направлению часовой стрелки, а другой — по
направлению противному, как представлено на фигуре:
A I A
В I В
С I С
D I D
которая, как видно, делится пополам плоскостью симметрии. Этот
восьмиугольник по раздвоении всех своих элементов в плоскости чертежа
дает фигуры не только тождественные, но совместимые при любом на-
Двойное оплодотворение
81
ложении, т. е. не энантиоморфные. Отраженный в зеркале, он останется
без изменения, равно как и тогда, когда мы посмотрим на него с обратной
стороны бумаги, на просвет. Иного свойства фигура получится, если
мы возьмем половинное число букв, и иначе, — если сольем
одинаковые буквы, получится четырехугольник:
D
А В
С
который не имеет плоскости симметрии, а отраженный в зеркале или
рассматриваемый на просвет окажется по расположению букв
обращенной фигурою, буквы которой будут следовать в обратном порядке, как
показывает фигура:
В
A D
С
Обе последние фигуры при простоем наложении не совместимы, что,
вместе с прочими свойствами, показывает их энантиоморфность.
Читателю остается теперь вообразить себе реальные условия деления
гаплоидного ядра с любым числом хромосом, чтобы видеть, что оба
дочерние ядра от такого деления действительно относятся друг к другу
так, как обе последние фигуры; nota bene, если при этом мы будем их
рассматривать с той стороны, которою они обращены друг к другу или,
как уже выше сказано, как бы из центра фигуры происшедшего деления.
Есть другой способ представить отношение диплоида
(сокращенное — диплоидного ядра) к своему гаплоиду — способ, который
лучше представляет пространственные отношения, а главное,
превращение диплоида в гаплоид путем редукционного деления.
Вообразим себе более простое ядро, чем раньше, всего с тремя парами
хромосом: АА, ВВ, СС, и представим его в виде неправильного
шестиугольника, соседние углы которого, однако, попарно равны. Такой
шестиугольник легко построить: отсекая у прямоугольного треугольника
с неравными катетами (т. е. с неравными углами) abc равные отрезки
от сторон каждого угла прямыми (см. чертеж), получим шестиугольник,
равные углы которого обозначим одинаковыми буквами АА, ВВ, СС.
Пусть этот шестиугольник изображает диплоид, а попарно равные углы
его пусть соответствуют по величине равным хромосомам, которые лежат
парами.
5-828
I
I82 Семя
Существенный момент редукционного
деления состоит, как известно, в том, что
одинаковые хромосомы попарно
сближаются и даже частично сливаются в метафазе
деления. Этот момент представит наш
чертеж, если мы вообразим, что одноименные
хромосомы двигаются по продолжениям
сторон шестиугольника: оба А по
продолжению сторон АС и АВ, оба В по
продолжению АВ и ВС и оба С по
продолжению АС и ВС. Мы замечаем, что
требуется для этого продолжить, собственно,
лишь три стороны, именно АВ, АС и ВС,
тогда как стороны АА, ВВ и СС остаются
не продолженными. Другими словами, мы
продолжили стороны через одну и, таким
образом, проделали то, что применяется
кристаллографией (правда, на упрощенной,
плоскостной схеме) для показания, как превращаются полиэдры в
соответственные гемиэдры, причем соответственный неправильный
октаэдр, например, дает неправильный же тетраэдр, приведенный выше в
качестве классического примера асимметрии.
Мы можем сказать, что процесс редукционного деления вполне
соответствует превращению неправильного полиэдра в гемиэдр: при этом
диплоидное ядро сначала становится, сближая попарно равные
хромосомы, само асимметричной фигурой, которой стоит лишь раздвоиться
при «сегрегации» (disjunction) гомологичных хромосом, чтобы
получилась неизменно асимметричная система обоих дочерних ядер, гаплоидов.
Гаплоидное ядро можно было бы именовать по сходству с гемиэдром
«гемикарион».
Я полагаю, что читатель согласится со мною в том, что гаплоидное
ядро, отличаясь от диплоидного наличием в составе своем лишь одной
хромосомы от каждой пары, наилучшим образом и характеризуется по
этому отличию и что гаплоидному ядру с достаточным основанием можно
приписать как системе асимметричной некоторые свойства, которых
симметричные системы лишены: последнее, по отдаленной, правда, аналогии
с асимметричными, деятельными оптическими телами химии. Однако и
последние тела проявляют не одни оптические свойства, которыми
разнятся наглядно. Для многих из них доказано различие в скорости реакции
взаимодействия с одним и тем же оптически различным телом. Так
левовращающая миндальная кислота с левовращающим ментолом
медленнее дает эфир, чем правовращающая миндальная кислота с тем же
левовращающим ментолом. Омыление того или другого эфира идет,
поэтому, тоже с различной скоростью. Это может служить, разумеется,
лишь слабым намеком на то, каковы должны быть формы химического
воздействия половых ядер на ту среду, в которой они встречаются друг
Двойное оплодотворение
83
с другом — как это представлено уже выше, в воздействии на
протоплазму яйцеклетки и зародышевого мешка. Мне думается, что
правдоподобнее предположение, уже высказанное ранее, что навстречу друг
другу должны идти одинаково настроенные ядра, т. е., например, правое
(J) к правому и левое (/) к левому, что и изображает приводимая
схема зародышевого мешка перед копуляцией обеих пар половых ядер.
Указав уже на то, что гаплоидные клетки и ядра в зародышевом
мешке должны в известном смысле разниться, я привел и фактические
доказательства этих отношений. Теперь черед за обоими спермиями,
вступающими в зародышевый мешок в виде голых ядер: нет ли и у
этой пары сестринских ядер каких-либо видимых особенностей как
примет их внутренних отличий, именно того, что одно из них возникло
из хромосом, сочетавшихся в одном порядке, а другое — из
хромосом, сочетавшихся в порядке обратном?
Из своих собственных наблюдений я могу привести лишь то, что
спермин, проникающий в яйцо, окрашивается слабее, чем спермий,
сливающийся с полярным ядром; первый выглядит постоянно поэтому более
рыхлым, чем второй. Но, подыскивая данные из чужих наблюдений, я
напоследок натолкнулся на поразительный факт, который в точности
соответствует даже моим гадательным определениям разницы в паре
сестринских клеток, которые я обозначаю как «правую» и «левую»
клетки по их ядрам. Это установлено в отношении самых крупных из
известных спермиев, именно — спермиев у саговых пальм Cyc'adaceae.
Известным исследователем этой группы голосеменных, Chamberlain, этот
факт отмечается в следующей приводимой мною дословно фразе, которой
он описывает внешность спермиев yCeratozamia и специально ту
спираль, по которой, как известно, расположены пучки ресничек спермия:
«The spiral may be either right or left, or better, it may be formed either
in the direction of the hands of a clock or contra clockwise»...«In many
instances it was possible to determine the direction of the spiral in both
of the two sperms from the same body cell, in most cases one showed the
clockwise and the other the contra clockwise direction» (Chamberlain, 1912).
Конечно, читая эту статью 15 лет тому назад, я не обратил особого
внимания на это подробное указание автора, а теперь оно совершенно
изгладилось из моей памяти. Я отыскал его теперь, напротив, совершенно
сознательно, будучи почти уверен в том, что на таком объекте, где
спермин так крупны и так сложно устроены, не может не проявиться
то соотношение, которое я предполагаю между строением ядра спермия
и прочими его свойствами, хотя бы и его внешней формой.
Chamberlain приводит свое показание с большой точностью, хотя одно
слово в нем и звучит отчасти оговоркой («most»). Во всяком случае,
у другого автора мы находим совсем уже беглое указание на направление
спирали, без упоминания о числе наблюдений с целью определить
направление, а главное — без указания, представлены ли два спермия
из одной и той же антеридиальной клетки. Так мы находим дело
представленным у Ikeno для Cycas revoluta в его прекрасном труде, доста-
6*
Семя
точно всем известном (Ikeno, 1898): на его рис. 33а и ЗЗЬ изображены
два отдельных спермия, оба с левой спиралью. В тексте (р. 184) по
поводу рисунков сказано: «Wenn man von der Spitze ausgeht und von
oben sieht, laufen die Windungen von Rechts nach Links-, d. h. umgekehrt
wie der Uhrzeiger».
Мы также не выносим окончательной уверенности из изображения
дела у Miyake (1903) в его статье о спермиях у Ginkgo, с рисунками,
заимствованными из классической работы Hirase (1898), за исключением
рисунков последних (р. 1779-1780, рис. 8-10). Рис. 8 этой статьи
представляет, может быть, даже схему по рисункам Hirase, составленную с
тем, чтобы показать число оборотов спирали; на нем мы видим оба
спермия с правыми спиралями (по часовой стрелке), т. е. оба
одинаковыми. Между тем у самого Hirase на рис. 28, где видны оба спермия
еще в антеридиальной клетке, справа лежит спермий, видимо, с левой
спиралью (против часовой стрелки), слева же — спермий с правой
спиралью (по часовой стрелке).
Итак, из данных касательно строения спермиев у Cycadaceae и у
Ginkgo как раз в тех случаях, где показания более определенны
(Chamberlain и Hirase), т. е. где речь идет о подлинном изображении обоих
спермиев еще в материнской клетке, мы находим факты, благоприятные
для моего предположения, что одинаковые по своему рождению спермий,
т. е. происшедшие от одной материнской клетки, не одинаковы по
своему сложению. Замечательным образом они при этом и разнятся на тот
же лад, как оба их ядра могут разниться при их образовании делением
материнского ядра, чему даны выше достаточные объяснения на общей
схеме деления гаплоидного ядра.
Обратимся еще за примером неодинаковости пары спермиев уже к
отечественному классику Беляеву (1885), к его описанию антеридий и
антерозоидов у разноспоровых плауновых. В тексте его труда мы вовсе
не встречаем намека на то, что интересует теперь нас; но это особенно
дорого в том смысле, что рисунки его должны были быть исполнены,
очевидно, без всякой предвзятой идеи, хотя со всегдашней точностью,
этому автору свойственной. И вот мы видим, несмотря на мелкость
рисунков в табл. I, 20 и табл. II, 10, что в материнских клетках лежит
по два спермия, уложенных спиралями, направление оборотов которых
в каждой паре спермиев противоположно. Так, на первом рисунке
верхний спермий скручен по направлению часовой стрелки, а нижний —
против этого направления. Интересно, что на другом рисунке отношения
обратные: верхний спермий скручен против направления часовой стрелки,
а нижний — согласно с часовой стрелкой. Мне думается поэтому, что
оба рисунка сделаны вполне точно с натуры. Этого нельзя сказать про
рис. табл. I, 19, в котором, мне кажется, недочет в изображении обоих
нижних спермиев, от которых на рисунке виден всего один оборот
спирали, и с левой стороны — точно простое кольцо. Вероятно,
наблюдатель не мог видеть оба эти тела отчетливо и оставил добросовестно
некоторый пробел на рисунке.
Двойное оплодотворение
85
Конечно, трудно искать факты, касающиеся идеи, явившейся много
позже того, как эти факты были установлены, притом без определенной
цели. Быть может, существуют в других областях нашей науки факты
и иного свойства: за это поручиться нельзя. Окончательная же цель
моей статьи — выяснить недостаточность наших сведений о половых
клетках и ядрах и попытаться указать морфологические условия
определенно направленной деятельности их.
ВЫВОДЫ
1. Из положения спермиев в момент, предшествующий их поступлению
по месту назначения, и из отделения их от мертвых глыбок, находящихся
в близком соседстве с ними, следует, что не механические двигатели,
например, движение протоплазмы, обусловливают это отделение. Если
бы это было так, то и мертвые глыбки увлекались бы по следам спермиев
и в яйцеклетку, и в полость зародышевого мешка.
2. Разделение обоих спермиев и направление их по двум различным
путям также невозможно приписать каким-либо механическим
воздействиям и необходимо отнести на счет различий между обоими спермиями
и обеими плазмами, через которые спермий пролагают себе путь.
3. Ввиду того, что в данном случае (у Phelipaea) спермий
совершенно лишены протоплазматической, обложки, законно заключить, что
их различия зависят лишь от природы их ядер, каковая должна быть,
следовательно, различной. Одинаково необходимо принять, что и
женские ядра, к которым стремятся спермий поодиночке, также различны
по своей природе и индуцируют своим влиянием обе соответствующие
протоплазмы тоже различно.
4. Ближайшее предположение касательно причины поступления
спермиев в протоплазму различных клеток (в яйцеклетку и полость
зародышевого мешка) может быть таково, что стремятся друг к
другу ядра, действующие на ту же самую протоплазму одинаково,
так что действие их суммируется; вследствие этого протоплазма
локально разжижается, и спермий движется в направлении
наименьшего сопротивления. Причина самого движения остается неясной.
5. Ввиду морфологического тождества ядер женского аппарата и
обоих спермиев во всех отношениях, кроме расположения их хромосом,
на последнее обстоятельство приходится смотреть как на единственное
условие, способное породить функциональное различие ядер одной и
той же пары, т. е. различие между обоими спермиями, и различие
между ядром яйцеклетки и северным полярным ядром.
6. По расположению хромосом каждая пара сестринских
гаплоидных клеток может быть приравнена к паре элементарно тождественных
химических молекул (или кристаллов), отличных по расположению
элементов или радикалов (у кристалла — его углов), которые бывают
86
Семя
все различны. Такие тела обозначаются как асимметричные и
зеркально подобные, иначе — энантиоморфные. Гаплоидное ядро содержит в
своей «экваториальной пластинке» циклически расположенные,
индивидуально различные хромосомы, а после деления дает дочерние ядра,
по расположению хромосом (в анафазе и телофазе) зеркально
подобные, которые можно приравнять к правой и левой форме исходно
асимметричной системы.
7. Как правая форма тела асимметричного строения отличается от
соответственной левой формы также и по их оптическим и химическим
свойствам (скорость реакций), так может отличаться «правое ядро» от
«левого ядра» одной и той же пары по присущим каждому из них
функциональным свойствам.
8. Сближаться и сливаться, по предыдущему примеру (ср. п. 4),
должны одинаково построенные и, следовательно, одинаково
действующие на протоплазму половые ядра: правое с правым, левое с левым.
9. В системе элементов, наличных при оплодотворении у
покрытосеменных и в процессе необходимо участвующих, мы различаем пару
женских ядер, одно правое и одно левое, и пару мужских ядер,
спермиев, также один правый и один левый. Эта система является
необходимым и достаточным условием для «выбора» яйцом и
полярным ядром соответственного спермия.
10. Как механизм редукционного деления, так и свойства системы,
указанные в п. 9, никоим образом не должны быть истолкованы
телеологически как целесообразности высокой организации
покрытосеменных. И то и другое — лишь крайние следствия процесса эволюции
половых отношений: с появлением пола явились обусловленными и
редукция числа хромосом и свойства гаплоидного ядра; общие условия
всего исторического процесса — лишь прогрессивное
дифференцирование элементов и последовательное уменьшение числа их до ступени
«необходимого и достаточного» — общий закон экономии в природе.
Беляев, 1885; Гургенова, 1928; Навашин, 1910, 1915; Chamberlain, 1912; Finn, 1925,
1926; Haberlandt, 1921; Hirase, 1898; Ikeno, 1898; Miyake, 1903; Pasteur, 1860;
Strasburger, 1900; Wylie, 1921.
ЛИЛЕЙНЫЕ — КЛАССИЧЕСКИЙ ОБЪЕКТ
ДЛЯ ИЗУЧЕНИЯ ОПЫЛЕНИЯ И ОПЛОДОТВОРЕНИЯ1
Изучение процесса оплодотворения у цветковых во всех его
аспектах требовало от ученых тщательного поиска объектов, обладаю-
В работе использованы данные, полученные Герасимовой-Навашиной и Батыгиной
(1958).
Двойное оплодотворение
87
щих такими особенностями, как
крупные размеры элементов
зародышевого мешка, пролонгирован-
ность всех этапов процесса
оплодотворения. Вероятно, не
случайно, что в серии работ,
посвященных открытию двойного
оплодотворения, два классика
эмбриологии в двух разных странах
мира — С. Г. Навашин (1898) и
L. Guignard (1899a, Ь) в
качестве модельных объектов
использовали представителей семейства
Liliaceae — Lilium martagon и
Fritillaria tenella. Это в
значительной степени предопределило
успех их исследований. В
последующие годы представители
лилейных продолжали оставаться
излюбленными объектами как
светооптических, так и электрон-
номикроскопических
исследований процесса оплодотворения
(Финн, 1931; Ноаге, 1934; Гера-
симова-Навашина, Батыгина,
1958; Герасимова-Навашина,
Коробова, 1959; Гваладзе, 1973,
1976; Gvaladze, 1983; Гваладзе,
Ахалкаци, 1986; Bhandari,
Sachdeva, 1983; Bhandari, Anu-
radha Mai, 1989; Шамров, 1990;
Бянещ, 1992).
Среди лилейных особый
интерес представляет Scilla sibirica как
модельный объект для. изучения
процесса оплодотворения sensu
lato (т. е.. от опыления до первого
деления зиготы и первичной
клетки эндосперма). Примечательно,
что на этом объекте впервые была
сделана попытка открытия двойного
оплодотворения у цветковых растений (см. Феномен двойного
оплодотворения).
Имевшиеся в литературе данные об этом процессе у видов Scilla
(Финн, 1931; Ноаге, 1934) противоречивы. Источником противоречий
в основном являлось то, что авторы не касались в полной мере цикла
Рис
1. Схематическое изображение пре-
митотического (А) и постмитоти-
ческого (Б) типов оплодотворения.
_8J3 Семя
Рис. 2. Верхняя часть зародышевого мешка S.sibirica Andr. A — анфас; Б —
профиль. Стрелками показано направление будущего расхождения спермиев.
Генцианвиолет. Подробнее см. в тексте.
развития и состояния половых элементов и не рассматривали процесс
оплодотворения в динамике. Кроме того, не рассматривался весь процесс
оплодотворения в связи с последовательностью фаз митоза, неизменно
наступающих при прохождении половыми элементами цикла развития,
как это имеет место в онтогенезе любой клетки, а также при
взаимодействии половых элементов друг с другом (Gerassimova-Navashina,
1958, 1982).
Процесс оплодотворения у видов Scilla совершается по премитоти-
ческому типу (см. Типы двойного оплодотворения), что отличает их
от других лилейных, где, как известно еще из классической работы
С. Г. Навашина (1898) и других исследований многочисленных видов
Lilium, процесс идет обычно по постмитотическому типу (рис. 1).
Представляется интересным выяснить, почему в одном семействе существуют
два различных типа оплодотворения.
Прежде чем ответить на этот вопрос, кратко остановимся на
строении отдельных элементов зародышевого мешка у S. sibirica, так как
это позволит лучше понять все аспекты двойного оплодотворения у
данного объекта.
В противоположность мнению ряда авторов, отмечавших, что у
многих лилейных клетки яйцевого аппарата слабо дифференцированы, у
S. sibirica эти клетки с большим постоянством обнаруживают резкие
различия как по своему положению, так и по характеру развития.
Синергиды — клетки с довольно плотной цитоплазмой, обычно
лежат над яйцеклеткой у самого входа в зародышевый мешок, занимая
весь его «свод». Между ними и несколько сбоку (латерально) при-
Двойное оплодотворение
Рис. 3. Различная дифференциация клеток зародышевого мешка в связи с их
положением в системе. Зародышевый мешок оплодотворен (фиксирован через
22 ч после опыления); в женских клетках заканчивается слияние половых
ядер (впадение в митотический покой мужских ядер, деспирализацня,
выделение ядрышек). Генцианвиолет. Подробнее см. в тексте.
креплена более вакуолизированная яйцеклетка. Синергиды своими
краями обхватывают ее в виде колокола; сама же яйцеклетка подобно
языку колокола помещается между ними, хотя и не совсем центрально.
Яйцеклетка, располагаясь всегда несколько ниже синергид4, вдается в
центральную клетку зародышевого мешка; между яйцеклеткой и
центральной клеткой имеется экстрацеллюлярное пространство (щель),
которое обнаруживается в той или иной степени, в зависимости от
качества фиксации (рис. 2). У синергид хорошо выражен так
называемый «нитчатый аппарат».
Можно предположить, что образование нитчатого аппарата синергид
зависит от их положения в системе зародышевого мешка и связано с
процессами, идущими в нуцеллусе. Наиболее ярко выраженным нитчатым
аппаратом обладают растения, зародышевый мешок которых окружен
разрушающимися клетками нуцеллуса. У тех растений (например,
сложноцветные), у которых имеется хорошо выраженный выстилающий слой
(эндотелий, или внутренний слой интегумента) вокруг зародышевого
90
Семя
Рис. 4. Сопоставление морфофизиологических изменений с эмбриологическими
процессами в цветке (слегка увеличено). А — бутон накануне открывания
(кастрация); Б — зацветание; раскрывание пыльников, опыление, начало
прорастания пыльцы; В — цветение, основные фазы процесса
оплодотворения; Г — начало увядания, первое деление в эндосперме; Д — увядание,
второе и третье деления в эндосперме; Е — полное увядание, первое
деление зиготы.
мешка, синергиды, концы которых далеко выдаются в микропиле, как
правило, не имеют нитчатого аппарата или он слабо выражен.
Антиподы прекрасно развиты и не только сохраняются в течение
всего хода оплодотворения, но сильно разрастаются и нередко
размножаются, вследствие чего их число достигает 6-10 (рис. 3). Поведение
антипод отличает исследованный нами вид S. sibirica от всех
изученных до сих пор видов Scilla, в том числе и S. sibirica (Schniewind-
Thies, 1901), S. hispanica (Treub, Mellink, 1880), S. campanulata,
S. nutans, S. hyacinthoides (Guignard, 1882; McKenney, 1898), S.
nonscripta (Hoare, 1934), у которых антиподы или не развиваются
совсем, или рано отмирают. Возможно, последнее обстоятельство
можно поставить в связь с тем, что у всех вышеуказанных видов у
основания зародышевого мешка развивается так называемая «антиго-
1
на», которая, используя питательные вещества, поступающие в
зародышевый мешок из халазы, может тормозить развитие антипод. У
исследованного нами вида S. sibirica к моменту образования зрелого
зародышевого мешка антигона не обнаруживалась. Сходные с антигоной
по положению и функции структуры в халазальной части
зародышевого мешка S. sibirica были описаны как трабекулы (Bhandari, Sachdeva,
1983; Bhandari, Anuradha Mai, 1989). Вероятно, необходимы
дополнительные исследования зародышевого мешка у разных видов рода
Scilla, чтобы внести в этот вопрос полную ясность.
Антигона — сохраняющаяся диада мегаспор, иногда развивающаяся до четырех*
ядерного состояния при биспорическом типе развития зародышевого мешка.
Двойное оплодотворение
91
Рис. 5. Спермиогенез (А) и оплодотворение (Б) у S.nonscripta Hoffm. et Link (По:
Hoare, 1934). Подробнее см. в тексте.
Клетки антипод имеют часто такой же вид (например, наличие
нитчатого аппарата — рис. 3), как и синергиды, особенно в начале их
развития, когда они еще недостаточно вакуолизированы. При этом
нитчатый аппарат несли только антиподы, располагавшиеся в основании
зародышевого мешка, в то время как те из них, которые лежали
выше, имели черты организации, напоминающие яйцеклетку, т. е.
были более вакуолизированы и лишены нитчатого аппарата. Эти
данные, таким образом, лишний раз подтверждают мысль ранних авторов
92
Семя
Рис. 6. Двойное оплодотворение (По: Финн, 1931).
об эквипотенциальности клеток зародышевого мешка. Все они, будучи
по своей природе клетками заростка, дифференцируются, а в дальнейшем
несут различные функции в зависимости от положения в системе
зародышевого мешка (Герасимова-Навашина, 1954, 1957). Подкреплением
сказанного может также служить аномальный случай, когда в микро-
пилярном конце зародышевого мешка совсем не дифференцировались
отдельные клетки, а весь яйцевой аппарат состоял из одной громадной
клетки; последняя как бы совмещала в себе свойства синергид и
яйцеклетки: в своей нижней части она, подобно яйцеклетке, была вакуоли-
зирована, а в верхней, более плотной, несла нитчатый аппарат.
Полярные ядра в центральной клетке к моменту оплодотворения
чаще сближены или слиты в одно вторичное ядро; в одной и той же
завязи могут формироваться зародышевые мешки со слившимися и не
слившимися полярными ядрами. Причину такой изменчивости пока еще
выяснить не удалось. Полярные ядра S. sibirica (или продукт их
слияния) лежат на продолжении продольной оси яйцеклетки, проходящей
через то место, куда впоследствии попадают спермин, чем и создаются
условия для направленного их расхождения (Герасимова-Навашина,
1947д, 1951а, 1954, 1980, 1990).
Во всех клетках зародышевого мешка S. sibirica можно наблюдать
крахмальные зерна, однако количество крахмала очень сильно варьирует.
Процесс оплодотворения у S. sibirica сильно растянут во времени,
обнаруживая часто большие колебания в наступлении отдельных фаз
даже внутри одной и той же завязи. По-видимому, это связано с тем,
что цветение растения приурочено к ранней весне с ее резкими коле-
Двойное оплодотворение
93
С-
баниями температуры. При
обильном искусственном опылении в
лабораторных условиях отдельные
фазы процесса оплодотворения
проходят более синхронно. Через 10-20 ч
после опыления наблюдается деление
генеративной клетки в пыльцевых
трубках, растущих в зоне столбика.
В интервале от 18 до 25 ч после
опыления обнаруживаются
пыльцевые трубки, входящие в завязь,
подходящие к семязачаткам,
проникающие в микропиле и в зародышевые
мешки, выход из них спермиев и,
наконец, слияние половых ядер.
Первое деление в эндосперме отмечается
через 24-28 ч, второе деление —
через 25-48 ч, третье и четвертое
деления — через 90-96 ч после
опыления. Зигота очень долго
находится в покое; через 96 ч после
опыления, когда в эндосперме имеется
уже 16 ядер, в зиготе еще
продолжается сложный морфогенетический
процесс и только после 10 дней она
приступает к делению. „
Прохождение отдельных фаз
полового процесса у S. sibirica
сопряжено с морфофизиологическими
изменениями в цветке (рис. 4).
Одновременно с раскрыванием бутона
лопаются пыльники с готовой пыльцой.
Начало прорастания пыльцевых
зерен и вступление пыльцевых трубок
в столбик совпадает с полным
раскрыванием цветка. В лабораторных
условиях цветение продолжается около суток; только в это время
околоцветник достигает полного развития, лепестки увеличиваются в
размере, полностью раскрываются, отгибаясь назад к цветоножке, столбик
сильно выдвигается (рис. 4,В), а в зародышевых мешках проходят
основные фазы оплодотворения — слияние ядер половых клеток.
К моменту, когда наступает первое деление эндосперма, в цветке
намечаются первые признаки увядания: лепестки снова изгибаются в
прежнем направлении (рис. 4,Г), и весь цветок начинает поникать,
окраска его становится более светлой. К началу второго деления в
эндосперме все эти признаки увядания усиливаются. Если растение нахо-
Рис. 7. Пыльцевая трубка со спер-
миями и ядром вегетативной
клетки (из полости завязи).
Фельген с подкраской лихт-
грюном.
94
Сел1я
Рис. 8. Верхняя часть зародышевого мешка через 25 ч после опыления. Пыльцевая
трубка только что излила свое содержимое в промежуток («щель») между
оплодотворяемыми клетками, разрушив одну из синергид (справа от
яйцеклетки); видны структурированные спермин (сп) и гомогенное ядро
вегетативной клетки (явк). Фельген с подкраской лихтгрюном.
Рис. 9. Верхняя часть зародышевого мешка в момент оплодотворения через 18 ч после
опыления. Ядра спермиев (сп) приблизились к женским половым ядрам. Спер-
мий в центральной клетке еще скручен. Видны обе синергиды (el, с2), в одной
из них измененное ядро (яс\) и задержавшееся около нее (в щели) гомогенное,
сильно вытянутое ядро вегетативной клетки (явк). Генцианвиолет.
Двойное оплодотворение
95
Рис. 10. Верхняя часть зародышевого мешка через 22 ч после опыления;
погружение мужских ядер в женские. Справа от яйцеклетки сохранившаяся синерги-
да; над яйцеклеткой (просвечивает и изображена отдельно слева, ниже)
разрушенная синергида со своим ядром (hci) и ядром вегетативной клетки
(явк). Фельген с подкраской лихтгрюном. Подробнее см. в тексте.
дится в грунте, то вся цветоножка с цветком в это время пригибается
к земле. Зигота долго готовится к делению, которое наступает после
полного увядания цветка.
Двойное оплодотворение. Спермин в пыльцевых трубках,
достигающих завязи, имеют вид телофатических ядер с плотно скрученной хро-
матиновой нитью (Ноаге, 1934). Ядро вегетативной клетки обычно в
это время уже бесструктурное и сильно красится (рис. 7). Хотя Ноаге
и указывает, что после деления генеративной клетки образуются спер-
мии-клетки, в зародышевом мешке наблюдаются лишь ядра (рис. 5, 6).
Вступая в зародышевый мешок, пыльцевая трубка сразу встречает
синергиды, в одну из которых она и изливает свое содержимое. При
этом синергида лопается, а содержимое пыльцевой трубки, как показал
еще С. Г. Навашин (1909), попадает как раз в промежуток между двумя
подлежащими оплодотворению «покоящимися» женскими клетками
(рис. 7). Ядра спермиев в это время находятся в стадии телофазы с
сильно красящимися хроматиновыми нитями, скрученными в плотный
клубок, ядрышка в них нет.
96
Семя
Рис. 11. Погружение ядра спермия в ядро яйцеклетки и впадение его в митотический
покой (деспирализация, выделение ядрышка). А, Б, В — последовательные
фазы. Фельген с подкраской лихтгрюном.
Попав в экстрацеллюлярное пространство между двумя женскими
клетками, спермин, в силу взаимного отталкивания друг от друга, которое
они начинают испытывать вскоре после своего попадания в зародышевый
мешок (Герасимова-Навашина, 1947в), расходятся в противоположных
направлениях по прямой, встречая ядра женских клеток. Последние
лежат как раз на концах этой прямой, являющихся как бы полюсами,
куда и «отбрасываются» мужские ядра (рис. 2, 9, 10). Ядро же
вегетативной клетки, войдя вместе со спермиями в то же пространство между
оплодотворяемыми клетками, оказывается, как подчеркивал еще С. Г.
Навашин (Nawaschin, 1909; Навашин, 1910), индифферентным и поэтому
остается в том месте, куда его внесло излившееся содержимое пыльцевой
трубки (рис. 8-10). Спермин, имея в пыльцевой трубке удлиненную
форму, в зародышевом мешке слегка скручиваются, по-видимому, из-
за перемены физико-химического состояния среды. Такую же форму
приобретают и их ядра. Однако, войдя в женские клетки и придя в
контакт с их ядрами, ядра спермиев снова распрямляются, они
становятся более округлыми, везикулярными. Вскоре ядра спермиев
«погружаются» в женские ядра (рис. 10, И). По мере их объединения с
женскими ядрами плотный клубок их хроматина разматывается, деспи-
рализуется, теряет способность краситься основными красителями и
отвечать на реакцию Фельгена в связи с уменьшением количества ДНК;
Двойное оплодотворение
97
Рис. 12. Верхняя часть зародышевого мешка. Типичная картина яйцевого аппарата
после вхождения одной пыльцевой трубки. Внизу последовательные фазы
разрушения ядра синергиды. Подробнее' см. в тексте, я — яйцеклетка; яя —
ядро оплодотворяющейся яйцеклетки; с\, с2 — синергиды; яс\, яс2 — ядра
синергид; явк — ядро вегетативной клетки; пт — пыльцевая трубка. Фельген
с подкраской лихтгрюном.
в ходе этого превращения выделяется ядрышко. Вероятно, под влиянием
«покоящихся» в это время женских клеток мужские ядра переходят от
телофатического состояния к покоящемуся, заканчивая только здесь свой
цикл развития и проявляя все характерные изменения, связанные с этим
процессом.
Процесс погружения ядер спермиев в женские ядра идет сходным
образом, за исключением того, что в центральной клетке он протекает
значительно быстрее (рис. 10). Последнее явление, свойственное и
многим другим растениям, побуждает некоторых авторов делать заключение
о различии, существующем между двумя спермиями и определяющем
их различную судьбу. С нашей точки зрения, это указывает в первую
очередь на различную обстановку, которую встречают спермин в столь
различно развитых женских клетках и которая заставляет сходный
процесс вхождения их в покоящееся состояние, характеризующееся рядом
превращений, проходить с различной скоростью. Отсюда проистекают
различия в ходе этих превращений, в каждый данный момент
обнаруживающиеся визуально.
■7—828
98
Рис. 13. Пыльцевые трубки в полости
завязи через 24 ч после опыления.
Фельген с подкраской лихтгрюном.
Если к моменту контакта с
ядром спермия полярные ядра
еще не слиты, то ядро спермия
погружается в одно из них,
обычно в то, которое лежит
ближе к нему; если ядро
спермия попадает между двумя
ядрами, то оно контактирует с
обоими, в результате чего
происходит тройное слияние.
Наблюдая много картин
только что описанных фаз
процесса оплодотворения, легко
убедиться в большом
постоянстве тех явлений, которые
имеют место в зародышевом
мешке вскоре после
вхождения в него пыльцевой трубки.
В яйцевом аппарате всегда
обнаруживается однотипная
картина: оплодотворяемая
яйцеклетка с деспирализующимся в
ней ядром спермия, одна,
оставшаяся неповрежденной си-
нергида с ее нормальным,
хорошо развитым ядром (рис. 12,
справа) и другая синергида,
через которую прошло
содержимое пыльцевой трубки. Ядро
поврежденной синергиды
«лопается», меняет свои очертания,
однако его всегда можно
отличить от внесенного пыльцевой
трубкой ядра вегетативной
клетки, которое часто задерживается в синергиде (рис. 10), входя вслед
за спермиями. В редких случаях, как это уже упоминалось, излившееся
содержимое пыльцевой трубки выносит ядро вегетативной клетки вместе
со спермиями в промежуток между оплодотворяемыми женскими
клетками (рис. 8, 9); ядро вегетативной клетки в это время имеет
характерный вид: очень компактное, пикнотическое и быстро лизирующее,
что часто заметно по тем тонким «струйкам», которые от него
отходят. Измененное ядро синергиды постепенно превращается тоже в
характерное пикнотическое образование (рис. 12, внизу).
В то время, как в яйцеклетке заканчивается объединение половых
ядер, а в центральной клетке оплодотворенное ядро готовится к делению
или уже делится, в завязь вновь начинает поступать большое число
Двойное оплодотворение
99
яя я
Рис. 14. Верхняя часть зародышевого мешка через 25 ч после опыления. Типичная
картина яйцевого аппарата после вхождения в зародышевый мешок двух
пыльцевых трубок. Подробнее см. в тексте, я — яйцеклетка; яя — ядро
оплодотворяющейся яйцеклетки; с\, с2 — синергиды; яс1, яс2 — ядра синер-
гид; явк\, явк2 — лизирующиеся ядра вегетативных клеток; сп2 — спермин.
Фельген с подкраской лихтгрюном.
пыльцевых трубок («пульсирующее» вхождение пыльцевых трубок).
Если раньше их можно было наблюдать лишь единицами, то сейчас
вдоль центральной части завязи они идут целыми пучками (рис. 13).
Все эти пыльцевые трубки выглядят вполне нормально, содержат по
два спермия и ядро вегетативной клетки.
Эти многочисленные пыльцевые трубки почти всегда входят в
уже оплодотворенные зародышевые мешки и изливают туда свое
содержимое. Это обстоятельство несколько усложняет только что
описанную картину. Однако в яйцевом аппарате отмечается замечательное
постоянство. Здесь всегда налицо разрушенная синергида, через
которую прошла первая пыльцевая трубка, а в ней лопнувшее собственное
ядро и лизирующее пикнотическое ядро вегетативной клетки (рис. 14,
слева). Спермин этой первой пыльцевой трубки уже объединились с
женскими клетками, причем в яйцеклетке часто видна конечная фаза
слияния ядер. Через другую синергиду прошла вторая пыльцевая
трубка с двумя спермиями и ядром вегетативной клетки (рис. 14, справа).
Все эти элементы в яйцевом аппарате можно легко отличить друг от
друга: ядра спермиев часто сохраняют свою структуру телофатических
ядер, ядро вегетативной клетки бесструктурно и начинает быстро ли-
зировать, и, наконец, разрушенное собственное ядро этой второй
синергиды всегда может быть узнано по его характерным превращениям,
с которыми мы уже познакомились выше. Кроме того, ядро второй
Т
100
разрушенной синергиды всегда
лежит вполне симметрично по
отношению к ядру первой синергиды.
Ядро яйцеклетки достигает
покоящегося состояния, когда ядро
первичной клетки эндосперма,
опустившись в ее нижнюю часть,
делится первый раз или уже
приступает ко второму делению.
Первые деления в эндосперме
происходят во взаимно
перпендикулярных направлениях, очень хорошо
иллюстрируя правило Гофмейсте-
ра-Сакса-Гертвига (деления в сво-
бодноядерном ценоците).
В это время количество
пыльцевых трубок в завязи еще
увеличивается: целые тяжи их идут
вдоль центральной части завязи,
куда обращены мик'ропиле
семязачатков, в которые, как мы уже
показали, эти дополнительные
трубки и устремляются. Иногда
они входят сразу по две,
заполняют все микропиле и свободное
пространство под ним. При
обильном опылении все
зародышевые мешки в завязи получают
дополнительные пыльцевые
трубки. В яйцевом аппарате
неизменно видны их элементы: в одной
из синергид — ядро
вегетативной клетки и собственное
погибающее ядро (рис. 15, справа), в
другой (рис. 15, слева) — два
погибающих спермия, со
ставшими уже гомогенными и пикнотическими ядрами, а также ядро
вегетативной клетки. Кроме того, видно собственное погибающее ядро этой
синергиды. В зародышевом мешке в это время уже идет энергичное
развитие эндосперма.
Изучение обширного материала позволило наблюдать лишь одну
картину, которую можно было с достаточной вероятностью толковать как
диспермию, т. е. как оплодотворение яйцеклетки двумя спермиями.
Однако судя по тому, что в данный зародышевый мешок несомненно вошла
лишь одна пыльцевая трубка, она должна была содержать удвоенное
число спермиев в результате добавочного деления. Возможно, что дис-
15. Фрагмент семязачатка с
верхней частью зародышевого мешка,
в который вошли две пыльцевые
трубки (яйцеклетка изображена
не полностью); в микропиле
видны многочисленные пыльцевые
трубки. Подробнее см. в тексте,
я — яйцеклетка; cl, с2 —
синергиды; яс\, яс2 — ядра синергид;
явк\, явк2 — ядра вегетативных
клеток; сп — спермин. Фельген
с подкраской лихтгрюном.
Двойное оплодотворение
101
пермия и произошла здесь
благодаря одновременному
вхождению удвоенного числа спермиев.
Пыльцевые трубки, в большом
количестве растущие в завязи,
проникают во все встречающиеся
им полости. Вероятно, для их
роста совершенно не нужны
нормально развитые зародышевые
мешки. Они могут входить и в
полости семязачатков, где не
произошло развития зародышевых
мешков, а имеются лишь
неорганизованные протопласты. В
полостях таких аномальных
зародышевых мешков пыльцевые трубки
могут расти довольно хорошо, по-
видимому находя там для себя
подходящие физиологические
условия (рис. 16).
В нормальный зародышевый
мешок может входить и больше
пыльцевых трубок. На рис. 17,А
видна картина вхождения трех
пыльцевых трубок; однако,
несмотря на большое число
внесенных ими элементов, последние и
в этой сложной картине
распознаются без всякого труда: в
ОДНОЙ синергиде (рис. 17,А, Рис. 16. Пыльцевые трубки с погибающим
ч содержимым в аномальном (не
справа) видны два элемента, в дифференцированном на клетки)
которых мы сразу узнаем ее соб- зародышевом мешке через 48 ч
ственное погибающее ядро и пик- после опыления. Генцианвиолет.
нотическое ядро вегетативной
клетки; в другой синергиде видны два спермия, теряющие свою
структуру, пикнотическое ядро вегетативной клетки и ее собственное
погибающее ядро; наконец, видна еще одна (третья), не лопнувшая
пыльцевая трубка (с левого края зародышевого мешка) с ее форменными
элементами — двумя спермиями, еще сохранившими свою структуру,
и ядром вегетативной клетки (лежит позади спермиев и уже лизирует).
Эта третья пыльцевая трубка вошла в зародышевый мешок между его
стенкой и одной из синергид. Яйцеклетка оплодотворена, в ее ядре
видны два ядрышка, в эндосперме идет второе деление ядер (рис. 17,Б).
Необходимо отметить, что ядра спермиев очень скоро гибнут, если
остаются неиспользованными в пыльцевой трубке или в ее содержимом,
излившемся в зародышевый мешок. К этой же среде добавляется и
102
содержимое разрушенной
синергиды с ее
погибающим ядром и гибнущим
ядром вегетативной клетки.
Однако если ядра
дополнительных спермиев
вносятся в цитоплазму
центральной клетки или
яйцеклетки, что изредка имеет
место, то они, хотя и не
принимают участия в
оплодотворении (в слиянии с
половыми ядрами), но
остаются некоторое время
вполне жизнеспособными.
Это иллюстрирует рис. 18,
где в зародышевый мешок
вошли, по-видимому, три
пыльцевые трубки, причем
та из них, которая прошла
мимо синергид (слева от
яйцевого аппарата), внесла
ядра спермиев глубоко в
цитоплазму центральной
клетки. Оба ядра
спермиев продолжают сохранять
более или менее
жизнеспособный вид, в то время как
все элементы, внесенные
второй пыльцевой трубкой
Рис. 17. Нижняя (А) и верхняя
(Б) части зародышевого
мешка к моменту второго
деления в эндосперме. В
зародышевый мешок
вошли три пыльцевые
трубки. Подробнее см. в
тексте, з — зигота; с\,
с2 — синергиды; яс\,
яс2 — ядра синергид;
явк\, явк2, явкз — ядра
трех вегетативных
клеток; сп2, спЗ — спермин
двух пыльцевых трубок;
птЗ — третья пыльцевая
трубка; а — антиподы.
Фельген с подкраской
лихтгрюном.
Двойное оплодотворение
103
Рис. 18. Зародышевый мешок (через 48 ч после опыления), в который вошли
пыльцевые трубки (обе синергиды разрушены); спермин из третьей
пыльцевой трубки (слева от яйцевого аппарата) проникли глубже в зародышевый
мешок (показаны спермин при большом увеличении), восьмиядерный
эндосперм. Подробнее см. в тексте, з — зигота; с\, с2 — синергиды; яс\, яс2 —
разрушенные ядра синергид; явк\, явк2, явкЗ — ядра вегетативных клеток
трех пыльцевых трубок; сп2, спЗ — спермин второй и третьей пыльцевых
трубок; птЗ — третья пыльцевая трубка. Фельген с подкраской лихтгрюном.
и оставшиеся лежать в районе яйцевого аппарата, превращаются в сильно
пикнотические, лизирующие тела. В эндоспермальном ценоците этого
зародышевого мешка уже прошло три деления. На основании ряда
подобных картин может быть сделан вывод, что содержимое пыльцевой
трубки вскоре после своего излияния в зародышевый мешок становится
такой средой, которая начинает оказывать на задержавшиеся в ней ядра
разрушающее действие.
Подобные факты проливают дополнительный свет и на важное мор-
фофункциональное значение того участка (щель), который находится
между оплодотворяемыми женскими клетками. Эта щель, отграничивая
яйцевой аппарат от центральной клетки, входит как неотъемлемый
элемент, в структуру любого зародышевого мешка.
Специального внимания заслуживает еще один пример, так как он
подчеркивает функциональное значение синергид в акте оплодотворения.
Мы имеем в виду случай, когда в обе синергиды вошло по пыльцевой
104
трубке, причем синергиды,
как и их ядра, остались
неразрушенными (рис. 19).
Спермин, оставшись внутри
неразрушенных синергид,
продолжали сохранять
жизнеспособную
структуру, и лишь ядра
вегетативных клеток обнаруживали
признаки лизиса, начало
которого однако можно
наблюдать уже в
пыльцевых трубках до их
вхождения в зародышевый
мешок. На рис. 19 видно,
что содержимое
пыльцевых трубок здесь не
вышло из синергид в
промежуток между двумя
оплодотворяемыми
женскими клетками и последние
остались неоплодотворен-
ными, несмотря на то, что
после опыления прошло
уже 96 ч, а в зародыше-
•••"'' вый мешок вошли две
Рис. 19. Верхняя часть зародышевого мешка че- пыльцевые трубки С
через 96 ч после опыления. В зародышевый тырЬМЯ СПерМИЯМИ. В уце-
мешок вошли две пыльцевые трубки. Жен- левШИХ СИНергидах хорошо
ские клетки остались неоплод отворенными.
Подробнее см. в тексте, я - яйцеклетка; ВИДеН нитчатый аппарат и
я я — ядро яйцеклетки; яцк — ядро цент- потоки густого содержимо-
ральной клетки; с\, с2— синергиды; го Пыльцевых трубок, КО-
яс1,яс2 — ядра синергид; явк\, явкг — яд- торое в виде каплеобразно-
ра вегетативных клеток; сп\ сп2 — спер- г
„„„ „„ _._ - — го вещества особенно
заметно по их периферии. На
основании этой редкой
картины можно предположить, что обе пыльцевые трубки вошли здесь
в синергиды строго одновременно и что обычное разрушение одной из
синергид при вхождении одной пыльцевой трубки связано с нарушением
гидростатического равновесия в системе зародышевого мешка, главным
образом в его симметричном яйцевом аппарате. Впрочем, возможно и
другое предположение, а именно, что одновременное вхождение двух
пыльцевых трубок в зародышевый мешок ослабляет напор содержимого
каждой из них и делает невозможным их разрушение и выход из них
оплодотворяющих элементов. Во всяком случае мужские элементы,
задержанные синергидой, лишены возможности функционировать.
.u.^.v/n, i-iii, i-»z —
спермин из двух пыльцевых трубок. Фельген
с подкраской лихтгрюном.
Двойное оплодотворение
105
Рис. 20. Фрагмент семязачатка с оплодотворенным зародышевым мешком к моменту
подготовки третьего деления в эндосперме. В микропиле пыльцевые трубки с
лизирующимися спермиями. Подробнее см. в тексте, з — зигота; я з — ядро
зиготы; с\, с2 — синергиды; я с\, я С2 — ядра синергид; я в к\ — ядро
вегетативной клетки; я э — ядра эндосперма; а — антиподы. Фельген с
подкраской лихтгрюном.
106
Семя
Пыльцевые трубки входят в зародышевый мешок лишь до
определенного времени; к моменту слияния половых ядер начинается
быстрое разрастание семязачатков, и клетки нуцеллуса при этом очень
плотно смыкаются, так что пыльцевые трубки уже не могут пройти
в микропиле, оставаясь у его входа, лизируют там вместе со всем
своим содержимым. В зародышевом мешке осталась целой одна из
синергид; в нее, казалось бы, могла войти еще одна пыльцевая трубка,
элементы которой лежат между клетками внутреннего интегумента в
микропиле; однако этого не произошло, так как очевидно, что клетки
нуцеллуса к моменту подхода этой трубки уже сомкнулись (рис. 20).
Пыльцевые трубки, в таком изобилии проходящие около тканей
завязи и семязачатков, никогда не проникают в их клетки, а спермин,
содержащиеся в них, постепенно подвергаются распаду.
Можно полагать, что излившееся содержимое пыльцевых трубок
вначале отдает какие-то вещества, которые побуждают к развитию
женские клетки, в первую очередь центральную клетку, начинающую
развиваться в эндосперм. Однако развитие оплодотворенной
специализированной яйцеклетки и подготовка ее к делению несколько
задерживается, так как она должна еще пройти сложный процесс дедиффе-
ренциации (Герасимова-Навашина, Батыгина, 1958; Батыгина, 1987).
Оплодотворение у Scilla протекает по премитотическому типу,
сходно с изученными в этом отношении сложноцветными и злаковыми, с
той только разницей, что процесс в первом случае идет значительно
медленнее. Из факта наличия обоих типов оплодотворения (пре- и
постмитотического) в пределах одной систематической группы можно
заключить, что причину различного протекания процесса надо искать
в состоянии половых элементов при их встрече в зародышевом мешке.
Главное своеобразие процесса оплодотворения в данном аспекте
состоит в том, что мужские и женские половые клетки проходят путь
своего развития независимо и раздельно, в резко различных условиях,
поэтому, когда они встречаются в общей системе, то их
взаимодействие у различных организмов протекает по-разному, и следовательно,
нет ничего неожиданного в существовании различных типов
оплодотворения в пределах родственных групп.
Подобного рода различия в слиянии ядер половых клеток вполне
естественны, поскольку разные организмы обладают своими
особенностями митотического цикла, в свою очередь способного видоизменяться
под влиянием среды.
Не исключена возможность, что резкие различия в ходе слияния
половых ядер у Scilla (премитотический тип оплодотворения) и Lilium
(постмитотический тип оплодотворения) связаны с тем, что: Scilla —
ранневесенний эфемероид, a Lilium — цветущее летом растение,
обладающее длинным вегетационным периодом. Плющ (1992) рассматривает
различные типы оплодотворения у покрытосеменных, установленные
Герасимовой-Навашиной (1947а-д), не что иное, как морфологическое
выражение (на световом уровне) различий в скорости абсолютно полного
Двойное оплодотворение
107 i
объединения ядер (по всей поверхности их контакта) (см. Типы
двойного оплодотворения в свете данных электронной микроскопии).
Однако механизмы различного типа объединения половых ядер у
разных видов цветковых еще остаются загадкой.
Данные по процессу оплодотворения у Scilla sibirica еще раз
проиллюстрировали, что лилейные являются классическим объектом,
так как позволяют получить полную картину не только двойного
оплодотворения, но и всех сопутствующих ему процессов.
Лилейные можно рекомендовать для исследований процесса
оплодотворения и на ультраструктурном уровне.
Батыгина, 1987; Бянещ, 1992; Гваладзе, 1973, 1976, 1983; Гваладзе, Ахалкаци,
1986; Герасимова- Навашина, 1947а-д; 1951а, б, 1954а, б, 1955, 1956, 1957, 1980,
1990; Герасимова-Навашина, Батыгина, 1958; Герасимова-Навашина, Коробова,
1959; Навашин, 1898, 1910; Плющ, 1992; Финн, 1931; Шамров, 1990; Bhandari,
Anuradha Mai, 1989; Bhandari, Sachdeva, 1983; Gerassimova-Navashina, 1958, 1982;
Guignard, 1882, 1899a, 6; Hoare, 1934; McKenney, 1898; Nawaschin, 1909;
Schniewind-Thies, 1901; Treub, Mellink, 1880.
ПРОГАМНАЯ ФАЗА ОПЛОДОТВОРЕНИЯ
ПРОВОДНИКОВЫЙ ТРАКТ ПЕСТИКА — совокупность структурных
элементов гинецея, обеспечивающих его взаимодействие с мужским
гаметофитом в прогамной фазе оплодотворения, включает все ткани
пестика (рыльца, столбика и завязи), с которыми контактируют
пыльцевые зерна и растущие пыльцевые трубки. Синоним: проводниковая
ткань.
Термин широко используется в зарубежной эмбриологической
литературе — transmitting tract (Heslop-Harrison, 1982; Randal, 1982;
Shivanna et al., 1982), в отечественной — реже. Специализация
отдельных частей проводникового тракта может быть выражена в разной
степени. Как правило, большая его часть представлена проводниковой
тканью (Esau, 1977). В рыльце и в завязи проводниковая ткань зачастую
отсутствует.
Структурная организация воспринимающей поверхности рылец.
Рыльце — часть пестика, воспринимающая пыльцу. Функционально
воспринимающая поверхность рыльца должна обладать несколькими
особенностями: улавливать пыльцу, обеспечивать ее гидратацию и
прилипание, способствовать направленному росту в столбик пыльцевых
трубок. Рыльце выполняет функцию узнавания, обеспечивая
межвидовую и межродовую несовместимость, а также самонесовместимость
(см. Самонесовместимость: структурно-функциональные аспекты).
Структурные особенности, в частности, толщина кутикулы рыльца
могут быть детерминантои автофертильности в родах, где отсутствует
самонесовместимость (Lord, Heslop-Harrison, 1984).
108
Семя
Большое разнообразие в строении рылец и различия в их
секреторной активности, отмеченные морфологами растений еще в прошлом
веке (Knuth, 1898, цит. по Y. Heslop-Harrison, Shivanna, 1977), с
успехом используются в целях систематики (Heslop-Harrison, 1981).
На основании характеристики рылец растений, принадлежащих более
чем к 1000 видам из 900 родов и 250 семейств было выделено
несколько типов их строения (Heslop-Harrison Y., Shivanna, 1977).
Наиболее важным в функциональном отношении является деление
рылец на две большие группы — сухие и влажные — в зависимости
от типа секреторной активности их воспринимающей поверхности.
Влажные рыльца к моменту восприятия пыльцы образуют на своей
поверхности секрет или секреторную слизь. Количество секрета
обусловлено механизмом его синтеза и может быть различным даже в
пределах одного семейства. Так, в сем. Fabaceae у видов рода Vigna секрет
очень обильный, а у Crotalaria juncea он представлен отдельными
каплями, расположенными между сосочками рыльца (Ghosh, Shivanna,
1982). Секрет рыльца может быть настолько обилен, что стекает по
столбику, как это наблюдается у Crinum defixum (Ama-ryllidaceae)
(Shivanna, Sastri, 1981). Основным компонентом секреторной слизи у
большой группы растений {Fabaceae, Solanaceae и др.) являются ли-
пиды. Они синтезируются в сильно развитом ЭР клеток рыльца и в
виде капель выталкиваются из протопластов. Аккумуляция липидов
происходит в межклеточных пространствах, а после разрыва кутикулы
рыльца они сливаются в виде секрета, покрывая поверхность рыльца.
Межклеточные пространства, содержащие секрет, могут увеличиваться,
сливаться между собой, образуя подобие секреторных полостей, как это
происходит, например, у некоторых бобовых (Ghosh, Shivanna, 1982;
Вишнякова, 1986). Обязательным компонентом секрета рыльца являются
белки, хотя количество их может быть весьма незначительным.
Преимущественное содержание липидов и небольшое количество воды
обусловливают липофильный характер секрета рыльца.' Другой группе
растений (например, представителям сем. Liliaceae) присущ гидрофильный
слизеобразный секрет рыльца. Основными его компонентами являются
белки и полисахариды, а липиды присутствуют лишь в виде
немногочисленных капель. В клетках таких рылец более развит аппарат Гольджи
(Knox, 1984). Независимо от количества белков в секрете всегда
обнаруживается эстеразная активность, возрастающая по мере созревания
рыльца (Ghosh, Shivanna, 1982). Ее наличие связывают с началом
восприимчивости рыльца (Mattsson et al., 1974). В секрете рыльца
выявляются также некоторые аминокислоты (Lord, Webster, 1979). Вязкость
секрету придают сахара и мукополисахариды.
Полагают, что функция секреторной слизи рыльца состоит в защите
его от высыхания (в связи с этим ее называют иногда «жидкой
кутикулой»), в улавливании пыльцевых зерен и закреплении их на
рыльце и в создании условий для прорастания пыльцевой трубки
(Линскенс, 1978). Секрет рыльца утилизируется пыльцевыми трубка-
Двойное оплодотворение
109
ми для биосинтеза пектиновых веществ оболочки трубки (Kroh,
Helsper, 1974). Возможно, он является аттрактантом для насекомых-
опылителей у тех видов, цветки которых не имеют нектарников
(Kenrik, Knox, 1981). Участие компонентов секрета рыльца в реакции
узнавания пыльцы пока не выявлено.
Сухие рыльца лишены слизистого покрытия. Их воспринимающая
поверхность представлена клетками-папиллами и покрыта тонкой гид-
ратированной пленкой — пелликулой, образующей непрерывный слой
над кутикулой рыльца (Mattsson et al., 1974; Heslop-Harrison, 1975).
Примером рыльца сухого типа является рыльце злаков, состоящее
из множества волосков, в свою очередь составленных из
многочисленных одноклеточных папилл. Сухие рыльца присущи также
представителям семейств Asteraceae, Brassicaceae, Iridaceae.
Структура кутикулы папилл сухих рылец весьма разнообразна. У
крестоцветных, например, она образована радиально расположенными
столбиками с промежутками между ними. Эта структура позволяет
воде проходить в пелликулу из протопласта сосочка рыльца при
условии его тургорного состояния. При увядании сосочка кутикулярные
столбики сближаются, доступ воды к пелликуле прекращается. У
некоторых представителей сем. Iridaceae строение кутикулы более
сложное, она имеет камерную структуру (Heslop-Harrison et al., 1975).
Однако известны виды, у которых кутикула рыльца является
непрерывной. При этом физиологически важные рыльцевые материалы,
имеющие субкутикулярную локализацию, извлекаются на поверхность
рыльца при взаимодействии с ним пыльцевого зерна путем типичной
для растений кутикулярной транспирации, как, например, у Gladiolus
gandavensis (Iridaceae) (Randal, 1982).
Пелликуле сухих рылец отводят важную роль в гидратировании
пыльцевых зерен и в активации кутиназ или кутиназных предшественников
пыльцевых трубок (Heslop-Harrison Y., 1977; Heslop-Harrison J.,
Heslop-Harrison Y., 1975). Несмотря на очень незначительную толщину
(в сем. Роасеае, например, 10-20 nm), она имеет сложный белковый
состав. Так, у Secale cereale (Роасеае) в пелликуле найдено 24 белковых
компонента (Knox et al., 1975). У Pinnesetum glaucum их около 30,
причем три из них обнаруживают эстеразную активность, четыре
идентифицированы как гликопротеиды (Heslop-Harrison J., 1982). У
представителей рода Gladiolus (Iridaceae) в пелликуле рыльца установлено
3 эстеразных изофермента и 3 гликопротеида среди 17 поверхностных
белков (Knox et al., 1976). В ней также продемонстрировано наличие
антигенов, связанных с экспрессией аллелей гена 5
(самонесовместимости) у представителей рода Brassica (Nasrallah, Wallace, 1967;
Nasrallah et al., 1972; Heslop-Harrison J., 1975). Это обстоятельство и
целый ряд других экспериментальных данных указывают на ведущую
роль пелликулы в узнавании пыльцы при самонесовместимости.
Формирование пелликулы начинается еще в бутоне. Белки
синтезируются в кортикальном слое цитоплазмы сосочка и отсюда диффунди-
110
Семя
руют наружу через пектоцеллюлозную часть оболочки и промежутки
между кутикулярными столбиками, формируя пелликулу (Heslop-
Harrison J. et al., 1975). Аналогичным образом в зрелом цветке в
пелликулу поступают S-специфичные антигены.
Структурная организация проводникового тракта в столбике.
Столбик — часть пестика, приподнимающаяся над завязью. По
существу это продолжение верхней части плодолистика (Esau, 1977).
Анатомическое разнообразие столбиков сводится к трем группам:
открытые (полые), закрытые (сплошные) и полузакрытые (Knox, 1984).
Это деление является отражением эволюции плодолистика.
Открытые (полые) столбики представляют собой результат
неполного срастания кондупликатного стилодия (Тахтаджян, 1964), в
результате чего в центре столбика имеется канал, выстланный
специализированными клетками, по происхождению являющимися адаксиальным
эпидермисом плодолистика. Эти клетки называются канальцевыми, или
стигматоидными и, как правило, имеют ярко выраженную секреторную
природу. Зачастую обращенные в полость канала стенки канальцевых
клеток, в контакте с которыми растут пыльцевые трубки, имеют
многочисленные выросты оболочки внутрь клеток, так называемый
«лабиринт оболочки» — структуру, характерную для передаточных
клеток (Васильев, 1970; Dashek et al., 1971; Вишнякова, 1986;
Kronestedt, Walles, 1986). Строение стигматоидных клеток может
быть различным даже у представителей одного и того же семейства.
Например, в сем. Fabaceae наряду с лабиринтом оболочки внутренняя
стенка канальцевых клеток к моменту опыления может иметь и другие
особенности. В частности, у Vigna unguiculata она просто утолщена, у
V. radiata — желатинизирована, а у рода Crotalaria она отсутствует
вообще (Ghosh, Shivanna, 1982). На Strelitziea reginae (Strelitziaceae)
показано, что канальцевые клетки соединены между собой и с
подлежащими клетками плазмодесмами (Kronestedt, Walles, 1986).
Канальцевые клетки могут иметь сосочкообразную природу и выстилать
полость канала в виде бахромы. Если канал продолжается непосредственно
в рыльце, как это отмечено для Nelumbo nucifera (Nelumbonaceae)
(Батыгина и др., 1983) и ряда представителей сем. Liliaceae, они
являются продолжением папиллятных клеток рыльца. Папиллятная
природа канальцевых клеток может наблюдаться и в столбиках
полузакрытого типа, имеющих между рыльцем и каналом фрагмент
проводниковой ткани, как это описано для Trifolium pratense (Fabaceae)
(Heslop-Harrison Y., Heslop-Harrison J., 1982; Вишнякова, 1991).
Следует отметить, что канал столбика заполнен секреторной
жидкостью, химический состав которой пока слабо изучен.
Закрытые столбики лишены канала и имеют один или несколько
тяжей проводниковой ткани, погруженных в основную ткань столбика
или связанных с проводящими пучками. Проводниковая ткань
закрытых столбиков у разных таксонов имеет отличительные особенности.
Она может быть представлена тесно упакованными толстостенными
Двойное оплодотворение
111
клетками, слоистые оболочки которых богаты пектиновыми
веществами, при этом растущая пыльцевая трубка проходит по одному из этих
слоев, как, например, у Gossypium hirsutum (Malvaceae) (Jensen,
Fisher, 1969). Наиболее типичной является проводниковая ткань, клетки
которой окружены обильным межклеточным слизистым веществом
пектиновой природы, в котором и растут пыльцевые трубки. Это
вещество образуется в результате нарушения первоначального контакта
между клетками при растворении срединной пластинки. Кроме пектинов в
межклеточном материале присутствуют низкомолекулярные углеводы,
различные ферменты, встречаются липиды (Knox et al., 1986). В
столбиках большинства однодольных растений преимущественным
компонентом межклеточного матрикса являются арабиногалактаны и ара-
биногалактановые белки (Knox, 1984). Однако у представителей сем.
Роасеае проводниковая ткань лишена обильного межклеточного
матрикса и ее клетки плотно прилегают друг к другу. Пыльцевые трубки
растут в межклеточных пространствах, раздвигая клетки
проводниковой ткани (Батыгина, 1974, 1989; Vishnyakova, Willemse, 1994).
Отличительными особенностями клеток проводниковой ткани
закрытых столбиков являются их вытянутая форма и наличие плазмодесм. В
молодых пестиках плазмодесмы существуют как в радиальных, так и
тангентальных стенках этих клеток (Knox, 1984). По мере развития
цветка и утрачивания контактов между клетками в силу создания
межклеточного матрикса, плазмодесмы остаются только в тангентальных
стенках клеток проводниковой ткани.. Их наличие говорит о продольной
коммуникации между клетками, создающей возможность для
прохождения сигналов опыления. До сих пор открытым остается вопрос о
возможности передачи сигналов опыления через проводниковую ткань
столбика в ткани плаценты и семязачатка (Knox, 1984). Показанное на
Triticum aestivum наличие плазмодесм между клетками проводниковой
ткани столбика и эпидермиса завязи (Vishnyakova, Willemse, 1994)
позволяет предположить, что такая возможность существует.
Клетки проводниковой ткани столбика обычно являются высоко
метаболически активными. Они содержат много митохондрий и профилей
ЭР, полисомы и амилопласты (Jensen, Fisher, 1969; Bell, Hicks, 1976;
Kenrick, Knox, 1981; Vishnyakova, Willemse, 1994), множество дикти-
осом и везикул, а также ломасомы (Cresti et al., 1976).
Межклеточный матрикс представляет собой продукт синтетической активности
этих клеток.
Полузакрытые столбики сочетают наличие проводниковой ткани и
канала, что, по-видимому, отражает степень срастания плодолистика.
Например, у ряда представителей сем. Fabaceae в верхней части
столбик закрытый и пыльцевые трубки растут в межклеточном матриксе,
в то время как в нижней части столбика они растут в хорошо
выраженном щелевидном канале. У Malus domestica (Rosaceae), напротив,
канал находится в верхней части столбика, сужаясь книзу и переходя
в тяж проводниковой ткани (Вишнякова, 1987). Эти факты, а также
112
Семя
данные о сходстве биохимического состава канальцевой жидкости и
межклеточного матрикса сплошных столбиков (Labarca et al., 1970)
свидетельствуют о том, что функциональное различие между двумя
типами столбиков не велико.
В столбиках ряда растений, например, Prunus avium (Rosaceae),
Nicotiana alata, Lycopersicon peruvianum (Solanaceae) выявлены гли-
копротеиды, связанные с экспрессией аллелей гена
самонесовместимости 5 (Raff et al., 1981; Май et al., 1982; Hoggart, Clarke, 1984).
По мере роста пыльцевых трубок в столбике происходит утилизация
ими веществ проводниковой ткани, что доказано электронно-
микроскопическими, цитохимическими и авторадиографическими
исследованиями (Loewus, Labarca, 1973; Kroh, Helsper, 1974, Vishnyakova,
Willemse, 1994). В пестиках после опыления уменьшается количество
запасных углеводов и липидов. Путь прохождения пыльцевой трубки
в проводниковой ткани очень часто отмечен изменениями структуры
клеток, в контакте с которыми она прошла (Батыгина и др,. 1961).
Зачастую эти клетки некротизируются. У ржи, например, прохождение
одной трубки через волосок рыльца вызывает некроз всех прилежащих
клеток (Heslop-Harrison J., Heslop-Harrison Y., 1981). Картина
исчезновения крахмала из клеток проводниковой ткани при прохождении
пыльцевой трубки общеизвестна. Свободные сахара, образующиеся при
гидролизе крахмала, необходимы для биосинтеза оболочки пыльцевой
трубки и ее дыхания.
Структурная организация проводникового тракта в завязи. Путь
пыльцевых трубок в завязи чрезвычайно разнообразен и зависит от
структуры и организации тканей завязи и семязачатка.
У многих видов пыльцевые трубки после выхода из проводниковой
ткани столбика растут в полости завязи. Очень часто их путь
проходит по поверхности специализированной структуры — обтуратора
(производного эпидермиса завязи или семязачатка, находящегося
рядом с микропиле семязачатка (см. Обтуратор, Т. 1). Тонкая
структура клеток этой ткани независимо от характера ее происхождения
свидетельствует об их секреторной и передаточной функции (Tilton,
Horner, 1980). В клетках обтуратора Prunus persica (Rosaceae)
отмечено большое количество крахмала, который исчезает по мере
прохождения по нему пыльцевых трубок (Herrero, Arbeloa, 1989). В сем.
Fabaceae париетальный обтуратор по существу является продолжением
стигматоидной ткани столбика и его клетки имеют морфологию,
сходную с канальцевыми клетками, как это показано, например, для
Medicago sativa (Вишнякова, 1986).
После оплодотворения клетки обтуратора облитерируют и
разрушаются. В оболочках дегенерирующих клеток обтуратора отмечены каллоз-
ные отложения (например, у Prunus persica — Herrero, Arbeloa,
1989;.
В одногнездной завязи у представителей сем. Роасеае пыльцевые
трубки после выхода из проводниковой ткани столбика входят в по-
Двойное оплодотворение
113
лость завязи, где растут в пространстве, ограниченном внутренним
эпидермисом стенки завязи и наружным интегументом. Как
свидетельствуют электронографии, эта полость заполнена мелкофибриллярным
осмиофильным веществом (Vishnyakova, Willemse, 1994).
В многогнездных завязях путь пыльцевых трубок к семязачаткам
проходит по тяжам специализированной ткани. В случае двугнездной
завязи, например в сем. Brassicaceae, трубки растут сначала в тканях
септы, центральная часть которой по существу является продолжением
проводниковой ткани столбика, затем проникают через ее кутикулу и
по фуникулярному обтуратору достигают микропиле семязачатка (Hill,
Lord, 1987). Рис. 1-4.
Батыгина, 1974, 1987; Батыгина и др., 1961, 1983; Васильев, 1970; Вишнякова,
1986, 1991; Линскенс, 1978; Тахтаджян, 1964; Bell, Hicks, 1976; Cresti et al., 1976;
Esau, 1977; Dashek et al., 1971; Ghosh, Shivanna, 1982; Herrero, Arbeloa, 1989;
Heslop-Harrison J., 1975, 1982; Heslop-Harrison J., Heslop-Harrison Y., 1975, 1981;
Heslop-Harrison J. et al., 1975; Heslop-Harrison Y., 1977, 1981; Heslop-Harrison Y.,
Heslop-Harrison J., 1982; Heslop-Harrison Y., Shivanna, 1977; Hill, Lord, 1987;
Hoggart, Clarke, 1984; Jensen, Fisher, 1969; Kenrick, Knox, 1981; Knox, 1984; Knox
et al., 1976; Knox et al., 1986; Kroh, Helsper, 1974; Kronestedt, Walles, 1986;
Labarca et al., 1970; Loewus, Labarca, 1973; Lord, Heslop-Harrison, 1984; Lord,
Webster, 1979; Mattsson et al., 1974; Mau et al., 1982; Nasrallah, Wallace, 1967;
Nasrallah et al., 1972; Peterson et al., 1979; Raff et al., 1981; Randal, 1984; Satina,
1944; Shivanna, Sastri, 1981; Shivanna et al., 1982; Tilton, Horner, 1980; Vishnyakova,
Willemse, 1994; Willemse, Franssen-Verheijen, 1986.
САМОНЕСОВМЕСТИМОСТЬ:
СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ АСПЕКТЫ
САМОНЕСОВМЕСТИМОСТЬ — неспособность обоеполого цветка с
функциональными мужскими и женскими гаметами образовывать семя
после самоопыления.
Различают две группы самонесовместимых видов: гомоморфные
(все цветки самонесовместимой популяции идентичны) и гетероморфные
(цветки в самонесовместимой популяции различаются по морфологии).
Большинство гетероморфных видов характеризуется гетеростилией (ди-
и тристилией),1 а также различиями в морфологии тычинок (Linum,
Primula, Polygonum, Fagopyrum). У ряда видов отмечен
коррелятивный диморфизм пыльцевых зерен и сосочков рыльца. В частности,
у представителей сем. Plumbaginaceae наблюдается структурный
диморфизм оболочек папилл рыльца, формы и размеров папилл, а
также диморфизм структуры экзины пыльцевых зерен. У дистильных
Наличие в цветках одного вида столбиков разной длины.
g—828
114
Семя
Схематическое изображение
морфологического проявления двух типов ге
нетического контроля самонесовместимости
(по Cornish et ah, 1988).
СПОРОФИТНАЯ САМОНЕСОВМЕСТИМОСТЬ
S,S2 S,S2 S.S2 S,S2 S,S2 S,S2
Si S2 Si S2 Si S2
<y?
Si S2
<r>
Si Sa
c>
S3 S4
ГАМЕТОФИТНАЯ САМОНЕСОВМЕСТИМОСТЬ
Si S2
C'7
Si S2
<TV>
S] S2
О
Si S2 Si S3 S3 S4
Двойное оплодотворение 115
видов рода Linum также наблюдаются различия в структуре и
скульптуре экзины. Завязывание семян при гетероморфной
самонесовместимости возможно только при переопылении растений разных
морфологических типов (Vuilleumier, 1967; Dulberger, 1974, 1975;
Nettancourt, 1977).
Основным фактором, определяющим самонесовместимость, является
ген (локус) S (East, Mangelsdorf, 1925). У некоторых растений,
в частности в сем. Роасеае, контроль признака осуществляется двумя
генами — S и Z (Hayman, 1956; Lundqvist, 1956). Известны примеры
трех- и четырехгенного контроля (Lundqvist, 1975; Osterbye, 1975). В
популяциях самонесовместимых растений ген S представлен серией
множественных аллелей. Реакция самонесовместимости заключается в
узнавании и отторжении пестиком пыльцевых зерен и пыльцевых
трубок, содержащих аналогичный аллель локуса S.
По времени действия генов и месту локализации их продуктов
различают два типа гомоморфной самонесовместимости: гаметофит-
ную (East, Mangelsdorf, 1925) и спорофитную (Hughes, Babcock,
1950). При гаметофитном контроле самонесовместимости реакция
пыльцы зависит только от ее собственного генотипа, в то время
как спорофитная самонесовместимость определяется диплоидным
генотипом спорофита. Функционально это обусловлено тем, что в
первом случае продукты гена самонесовместимости синтезируются
после мейоза — в протопласте микроспоры, во втором — поступают
в пыльцевое зерно из материнских тканей спорофита. О механизме
спорофитного контроля до сих пор* нет единого мнения.
Дискутируются возможность как домейотической экспрессии гена S в
цитоплазме микроспороцитов (Pandey, 1960, 1970), так и его постмей-
отической экспрессии в клетках тапетума, откуда вещества
самонесовместимости поступают в пыльцевое зерно при дезинтеграции та-
петальной ткани (Heslop-Harrison, 1968, 1978). Вполне возможно
и компромиссное заключение о синтезе продуктов гена S в мейоцитах
и в тапетуме одновременно (Pandey, 1979).
Генетический контроль гетероморфной самонесовместимости — спо-
рофитный, диаллельный (Nettancourt, 1977). Структурные основы
действия генов гетероморфной несовместимости изучены недостаточно.
Все остальное изложение касается только гомоморфных видов.
В пыльцевом зерне продукты генов самонесовместимости
локализуются в спородерме. При гаметофитном типе контроля они поступают
из протопласта микроспоры в интину, позднее переходя в создаваемую
ею оболочку пыльцевой трубки, а при спорофитной
самонесовместимости локализуются в экзине (Heslop-Harrison et al., 1973; Knox et
al., 1975). Молекулярные детерминанты спорофитной
самонесовместимости обнаружены и в трифине пыльцевых зерен у представителей
рода Brassica (Dickinson, 1990). Изучение возможных путей
поступления продуктов генов самонесовместимости в спородерму на ультра-
я*
116
Семя
структурном уровне явилось предметом специального обсуждения
(Heslop-Harrisson, 1978; 1983; Вишнякова, 1989, 1994).
Продуктами генов самонесовместимости являются гликопротеиды.
Иммунохимическими тестами установлено, что местом их локализации
в пестике при спорофитном контроле самонесовместимости являются
оболочки эпидермальных клеток рыльца (Kandasamy et al., 1989).
В случае гаметофитной самонесовместимости (например, у Nicotiana
alata) S -специфические гликопротеиды выявляются как компонент
межклеточного матрикса проводниковой ткани столбика и эпидермиса
плаценты (Cornish et al., 1987). То есть место их локализации
точно совпадает с путем, по которому растут пыльцевые трубки.
Сложнее обстоит дело с доказательством экспрессии гена S в
пыльнике. Незначительный ее уровень и кратковременность удалось
выявить в постмейотический период в тапетуме Brassica. После
дезинтеграции тапетума экспрессия уже не наблюдалась (Nasrallah et al.,
1991).
Существует целый ряд устойчивых корреляций между типом
генетического контроля, числом клеток пыльцевого зерна,
морфологическими особенностями рыльца и столбика и местом осуществления реакции
самонесовместимости.
Для видов со спорофитной самонесовместимостью характерны трех-
клеточные пыльцевые зерна, покрытые трифиной, сухие рыльца и
закрытые столбики. Реакция у них осуществляется рано — на рыльце
(Dickinson, 1990). Воспринимающая поверхность сухих рылец покрыта
пелликулой (Mattsson et al., 1974). Именно в ней и локализуются
реагенты самонесовместимости (Kandasamy et al., 1989). Видам с гаме-
тофитным контролем свойственны двуклеточные пыльцевые зерна,
покрытые полленкитом, влажные рыльца и открытые столбики. Реакция
самонесовместимости у них осуществляется позже в столбике или завязи.
Следует подчеркнуть, что, согласно терминологии, которой мы
придерживаемся, полленкит — это гомогенная липидная фракция, а три-
фина — более сложная гетерогенная смесь липидов с остатками
цитоплазмы тапетума, откладывающимися на поверхности пыльцевых зерен
на конечных стадиях развития пыльника (Dickinson, Lewis, 1973).
Полленкит называют простым пыльцевым покрытием, трифину —
сложным (Dickinson, 1990).
У видов с отклонениями от указанных корреляций почти всегда
отмечают более сложный, чем моногенный или промежуточный (гамето-
фитно-спорофитный) контроль самонесовместимости. Например, в сем.
Роасеае, представители которого имеют дигенный гаметофитный
контроль самонесовместимости, структурно-функциональные
характеристики реакции соответствуют спорофитному типу. Классическим примером
сочетания признаков реакции двух типов является Theobroma cacao
(Соре, 1962; Pandey, 1960). Иногда реакция гаметофитной
самонесовместимости не имеет четкой локализации. Элиминация мужских гаме-
тофитов может осуществляться в процессе всей прогамной фазы. По-
Двойное оплодотворение
117
видимому, это также является отражением сложной генетической
природы самонесовместимости, которую предполагают у некоторых
представителей сем. Fabaceae, в частности, Medicago saliva (Казачковская
и др., 1991).
Существуют представления о «поздно действующей»
самонесовместимости, выражающейся в гибели зиготы или проэмбрио.
Экспериментальным материалом для таких представлений послужили, в частности,
некоторые представители сем. Liliaceae и упомянутый вид Medicago
saliva (Cooper, Brink, 1940; Seawey, Bawa, 1986). Однако строгих
генетических доказательств постгамного проявления
самонесовместимости нет, и, как показано для Medicago saliva, гибель зародышей
после самоопыления не является проявлением самонесовместимости
(Казачковская и др., 1991).
От характера локализации продуктов гена S в пыльцевом зерне
и в пестике зависят время и место осуществления реакции,
морфологическое проявление которой лучше всего наблюдать при помощи
люминесцентного микроскопа. На основании визуальных наблюдений
можно выделить следующие стадии взаимодействия мужских гамето-
фитов с пестиком: прилипание пыльцы к рыльцу, ее гидратация,
прорастание пыльцевого зерна, проникновение пыльцевой трубки в
ткани рыльца, рост в проводниковом тракте пестика. Разнообразие
морфологического проявления реакции самонесовместимости,
наблюдаемое у разных видов, заключается в том, что она может
осуществляться на любом из этих этапов. При этом каждый S-генотип
имеет вполне конкретные время и\ место ингибирования
взаимодействия пыльцы и пыльцевых трубок с пестиком. Это позволяет
говорить о видо- и сортоспецифичности морфологического проявления
реакции самонесовместимости.
Раннее проявление спорофитной самонесовместимости обусловлено
взаимодействием веществ трифины и (или) экзины с пелликулой
рыльца и может проявляться в отсутствии прилипания пыльцы к
рыльцу, отсутствии прорастания пыльцевых зерен, ингибировании
роста появившейся пыльцевой трубки после контакта с поверхностью
рыльца или сразу после проникновения через пелликулу и кутикулу.
При гаметофитной самонесовместимости реакция происходит
позднее — после взаимодействия веществ интины с рыльцем или, что
происходит гораздо чаще, после экспонирования реагентов
самонесовместимости пыльцевой трубкой и реагирования их с веществами
проводникового тракта пестиков. Принципиальное отличие в
характере лркализации реагентов самонесовместимости в проводниковом
тракте у видов с гаметофитным контролем — по ходу роста
пыльцевых трубок, а не на поверхности рыльца, как в пестиках видов
со спорофитной самонесовместимостью, — и обусловливает
сравнительно длительный «диалог» мужского гаметофита с пестиком.
Торможение роста пыльцевых трубок может осуществляться в разных
районах столбика и даже в завязи.
118
Семя
Многие виды цветковых растений являются частично
самонесовместимыми. Морфологически это выражается в том, что в определенном
числе пестиков изучаемой выборки единичные пыльцевые трубки
преодолевают район массового ингибирования, проникают в завязь и
производят оплодотворение части семязачатков.
Реакция самонесовместимого ингибирования пыльцевых трубок
сопровождается разнообразными морфологическими аномалиями: изви-
ванием, штопорообразным закручиванием, набуханием и ветвлением
их кончиков, усиленным отложением каллозы. Ультраструктурными
исследованиями в таких трубках выявлены некроз цитоплазмы,
нарушение биосинтеза оболочки пыльцевой трубки, выражающееся, в
частности, в скоплениях углеводно-белкового материала —
предшественников веществ оболочки в кончике трубки (Nettancourt et al.,
1973; Pacini, 1981). Одной из основных особенностей структуры
самонесовместимых пыльцевых трубок являются концентрическая
агрегация профилей гранулярного ЭР, что может свидетельствовать о
блокировании белкового синтеза (Nettancourt et al., 1974; Cresti et
al., 1979).
В случаях быстрого проявления реакции самонесовместимости —
уже на рыльце — пыльцевое зерно и появившаяся пыльцевая трубка
зачастую заполняются каллозои, как это наблюдается при спорофитной
самонесовместимости у Helianthus annuus и при гаметофитной — у
Hordeum bulbosum. Зачастую верхушка пыльцевой трубки лопается
при достижении зоны блокирования. Типичным проявлением
самонесовместимого взаимодействия пыльцевых трубок с пестиком является
замедление их роста.
Морфологическим проявлением реакции самонесовместимости со
стороны пестика иногда считают появление каллозных отложений в
сосочках рыльца, контактирующих с самонесовместимыми пыльцевыми
зернами при спорофитном контроле самонесовместимости (Heslop-
Harrison J. et al., 1973; Dumas, Knox, 1983). Однако этот «биотест»
на самонесовместимость должен приниматься с определенной долей
критичности, поскольку показано, что подобные каллозные отложения
возникают в папиллах рыльца и при нанесении на них спорогенных
клеток и даже кусочков тканей вегетативных органов этого же
растения (Sood et al., 1982).
Молекулярные исследования самонесовместимости выявили, что
продуктами генов самонесовместимости являются гликопротеиды. На
представителях рода Brassica показано, что S-ген, имеет сложную
природу и связан с другими компонентами генотипа. S-аллель
специфичность определяется, по меньшей мере, двумя генами, выделенными из
одного гомозиготного генотипа: SLG (S-locus glycoproteid) и SRK
(Receptor protein kinase). Полагают, что эти гены определяют
межклеточные взаимодействия в различных тканях, которые, по-видимому,
основаны на действии общего класса связанных рецепторов протеинки-
наз. Оба гена SLG и SRK имеют 94% сходства на уровне ДНК и
Двойное оплодотворение
119
90% — на уровне аминокислотной последовательности белка и
сегрегируют вместе (Nasrallah et al., 1991).
Однако S-аллель специфичность у крестоцветных не ограничивается
экспрессией только этих двух генов. 12 разнообразных областей в
геноме имеют гомологию с локусом S. Две из них: SLR-1 и SLR-2
(S-locus related) находятся за его пределами. Они имеют 65 /о
гомологии с SLG на уровне аминокислотной последовательности в белке,
сходную структуру и так же, как и SLG, экспрессируются в оболочках
клеток рыльца. Эти гены очень консервативны и у разных S-аллелей
имеют 99% гомологии на уровне аминокислот и высокий уровень
сходства у разных видов. Все это, а также экспрессия их у
самосовместимых видов дает основание полагать, что они играют
определенную роль в процессе опыления (Nasrallah et al., 1991).
Гаметофитная самонесовместимость широко распространена в природе
и присуща представителям большинства семейств, в частности:
Caprifoliaceae, Chenopodiaceae, Commellinaceae, Fabaceae, Liliaceae,
Poaceae, Ranunculaceae, Rosaceae, Rubiaceae, Scrophulariaceae, Sola-
naceae и др. Спорофитная самонесовместимость найдена пока только в
шести семействах: Asteraceae, Brassicaceae, Caryophyllaceae, Corylaceae,
Sterculiaceae, Ulmaceae (Charlesworth D., Charlesworth В., 1979). В
пределах одного семейства никогда не отмечали оба типа гомоморфной
самонесовместимости. Однолокусная гаметофитная самонесовместимость
считается примитивной и изначальной по отношению к спорофитной (Pandey,
1962; Crowe, 1964).
Морфологическое проявление реакции свидетельствует о том, что
эволюция структурных механизмов обеспечения самонесовместимости
направлена на более раннее взаимное узнавание и, соответственно, более
раннее прерывание взаимодействия мужского гаметофита с пестиком.
Это обусловлено выносом реагирующих агентов в более поверхностные
районы пестика и пыльцевого зерна. Эволюцию пестиков,
происходившую путем срастания плодолистиков (Тахтаджян, 1964), можно
рассматривать как постепенное отдаление реагентов узнавания от женского
гаметофита путем переноса их в ткани спорофита. Вершиной этого
процесса явилось сосредоточение реагентов самонесовместимости в рыльце,
а именно, в его специализированной структуре — пелликуле, которая
приобрела компетенцию узнавания. В пыльцевом зерне наиболее
совершенным механизмом раннего узнавания пестиком является локализация
этих реагентов в трифине. И в том, и в другом случаях
самонесовместимость определяется спорофитом. При гаметофитном контроле
самонесовместимости реакция является результатом взаимодействия веществ
мужского гаметофита со спорофитными тканями пестика. Однако в
случаях позднего осуществления реакции — в завязи и, возможно, в за-,
родышевом мешке — нельзя исключить вовлечение в нее и самого
женского гаметофита. Известно, что узнавание на уровне гаметофитов
происходит у Pteridophyta и Gymnos-permae, а у древних цветковых оно
осуществлялось даже на уровне гамет (Crowe, 1964). Следовательно,
проявление реакции гаметофитного типа в завязи и в зародышевом мешке
можно рассматривать как исходное, что является аргументом в пользу
примитивности данного типа. Рис. 5.
Вишнякова, 1989, 1994; Казачковская и др., 1992; Тахтаджян, 1964; Charlesworth
D., Charlesworth В., 1979; Cooper, Brink, 1940; Соре, 1962; Cornish et al., 1987,
1988; Cresti et al., 1979; Crowe, 1964; Dickinson, 1990; Dickinson, Lewis, 1973;
Dulberger, 1974, 1975; Dumas, Knox, 1983; East, Mangelsdorf, 1925; Hayman, 1956;
Heslop-Harrison, 1968, 1978, 1983; Heslop-Harrison J. et al., 1973; Hughes, Babcock,
1950; Kandasamy et al., 1989; Knox et al., 1975; Lewis, 1954; Lundqvist, 1956, 1975;
Mattsson et al., 1974; Nasrallah et al., 1991; Nettancourt, 1977; Nettancourt et al.,
1973; Osterby, 1975; Pacini, 1981; Pandey, 1960, 1962, 1970, 1979; Seawey, Bawa,
1986; Sood et al., 1982; Vuilleumier, 1967.
ПЫЛЬЦЕВАЯ ТРУБКА — специализированная структура мужского
гаметофита, обеспечивающая доставку спермиев в зародышевый мешок
для дальнейшего осуществления двойного оплодотворения. Ее
образование впервые наблюдал Amici (1823) при исследовании прорастания
пыльцевого зерна Portulaca deracea.
По своему происхождению пыльцевая трубка представляет собой
трубкообразный вырост вегетативной клетки пыльцевого зерна.
Характерной особенностью пыльцевой трубки является ритмичный рост ее
кончика в сторону завязи и зародышевого мешка. У большинства
растений за зоной роста формируются каллозные пробки.
Взаимодействие пыльцевых зерен с тканями пестика и
формирование пыльцевых трубок происходит в ходе прогамной фазы
оплодотворения, включающей в себя попадание пыльцы на поверхность
рыльца, ее адгезию, гидратацию и прорастание, а также рост
пыльцевой трубки в тканях столбика и завязи и ее проникновение в
зародышевый мешок. Функционирование пыльцевых трубок
обеспечивается специфическими механизмами, выработанными в процессе
коэволюции мужского гаметофита со спорофитом (см. Образование
и рост пыльцевой трубки).
Пыльцевая трубка растет либо по поверхности канала столбика, во
многих случаях выстланного специализированной проводниковой
тканью, либо (в столбиках закрытого типа) по межклетникам
проводниковой (а иногда — неспециализированной) ткани. В клейстогамных
цветках пыльцевые зерна прорастают внутри пыльцевого гнезда,
откуда пыльцевые трубки переходят в тесно прилегающее к пыльнику
рыльце и далее растут по столбику нормальным путем (см.
Проводниковый тракт пестика).
Характернейшей особенностью пыльцевой трубки является наличие
внутри ее протопласта клеток-спермиев. Они выходят в пыльцевую
трубку из трехклеточного пыльцевого зерна вместе с цитоплазмой
вегетативной клетки (Apocynaceae, Cyperaceae, Menyanthaceae, Poaceae,
Valerianaceae). У растений с двуклеточными пыльцевыми зернами в
пыльцевую трубку выходит генеративная клетка и уже там делится с
Двойное оплодотворение 121 i
образованием двух спермиев (Chloranthaceae, Fagaceae, Papaveraceae,
Ranunculaceae, Liliaceae). Спермин или генеративная клетка, выйдя из
пыльцевого зерна, проходят по всей длине пыльцевой трубки почти до
ее кончика, и это положение сохраняется в дальнейшем.
Большинству растений свойственна порогамия (см. Порогамия),
когда пыльцевая трубка подходит к нуцеллусу через микропиле.
Реже встречается апорогамия, когда внедрение пыльцевой трубки в
нуцеллус семязачатка происходит в районе халазы (см. Халазогамия)
или сбоку, между халазой и микропиле (мезогамия). Во всех случаях
в зародышевый мешок пыльцевая трубка входит в районе яйцевого
аппарата. Рис. 6.
Коробова, 1977, 1979; Amici, 1823; Heslop-Harrison, 1979, 1987; Knox, 1984.
ОБРАЗОВАНИЕ И РОСТ ПЫЛЬЦЕВОЙ ТРУБКИ
Прорастание пыльцевых зерен и рост пыльцевых трубок проходит
в два этапа. На первом этапе, в ходе гидратации, проходящей
главным образом благодаря поступлению воды из тканей рыльца,
осуществляется реактивация пыльцевых зерен. У многих видов растений
движение воды регулирует экзина (Heslop-Harrison, 1971). Интина во
время прорастания пыльцевого зерна выполняет три функции: внешний
(пектиновый) слой регулирует открывание апертур; средний
(целлюлозный) слой участвует в транспорте белков на поверхность рыльца
при гидратации пыльцы; внутренний слой, содержащий глюканы и
пектины, является предшественником оболочки пыльцевой трубки
(Stanley, Linskens, 1974; Heslop-Harrison, 1979).
Во время второго этапа роста (взаимодействие пыльцевой трубки
и рыльца) происходит восприятие пыльцевых трубок либо их
отторжение, при этом существенную роль играют белки, в том числе
различные ферменты (Цингер, Петровская-Баранова, 1961; Heslop-
Harrison, 1979, 1987; Knox, 1984). Белки имеют различное
происхождение: спорофитное в экзине (из тапетума) и гаметофитное в
интине (из микроспор или клеток мужского гаметофита). Секреция
белков пыльцевой трубкой обусловлена спецификой каждой стадии
ее роста, начиная с проникновения в рыльце и до разрушения
кутикулы внутренней стенки завязи, а, возможно, и при прохождении
через нуцеллус и вхождении в синергиду (Heslop-Harrison, 1987).
Например, у видов с сухим рыльцем внедрение кончика пыльцевой
трубки требует энзиматического разрушения кутикулы,
осуществляемого кутиназой (Linskens, Heinen, 1962). В апексах пыльцевых
трубок, растущих in vitro, цитохимически выявлены различные
гидролазы, включая эстеразы и фосфатазы, а также энзимы, гидроли-
зующие пектин (Heslop-Harrison, 1987). Трехклеточные пыльцевые
122
Семя
зерна могут прорасти в течение 1 мин, при этом высокий уровень
интенсивности дыхания наблюдается сразу после гидратации. Для
двуклеточных пыльцевых зерен характерна тенденция к медленному
подъему скорости дыхания, ее максимум ниже, чем у трехклеточных
пыльцевых зерен (Hoekstra, Bruinsma, 1975), а прорастание может
осуществляться в течение 1 ч. При прорастании пыльцевого зерна
наблюдается активность диктиосом в области будущего кончика
пыльцевой трубки, которая находится по соседству с областью,
обогащенной митохондриями. Лишь с этого момента начинается этап
интенсивного роста пыльцевой трубки (Dashek, Rosen, 1966).
На искусственной среде пыльцевые трубки проявляют два типа
роста: 1) более или менее регулярные вытягивания кончика
пыльцевой трубки и 2) нерегулярные изменения направления роста
(медленные или резкие повороты). Рост пыльцевых трубок на
совместимом рыльце и в тканях столбика строго ориентирован и проходит
либо по хорошо выраженному каналу, содержащему секрет из
окружающих клеток и обеспечивающему среду для растущих пыльцевых
трубок, либо по межклеточному пространству между рядами плотно
прилегающих друг к другу вытянутых клеток (при этом пыльцевые
трубки контактируют с продуктами секреции столбика). Путь
пыльцевых трубок в завязи ограничивается рядами секреторных
поверхностных клеток, располагающихся на внутренней стенке завязи или
плаценты. Скорость роста пыльцевых трубок достигает 1,5 мкм/сек
(Shivanna et al., 1978).
В регуляции роста пыльцевых трубок принимают участие геномы
как мужского гаметофита, так и женского спорофита (Stanley,
Linskens, 1974; Knox, 1984; Heslop-Harrison, 1987). Механизмы этой
регуляции полностью не выявлены. Гипотетически возможны два типа
регуляции: 1) пыльцевая трубка находит свой путь, ориентируясь на
сигналы, поступающие от ряда мишеней, 2) строгая направленность
роста пыльцевых трубок обеспечивается окружающими условиями.
Первый тип включает хемотропную регуляцию, второй — контроль,
обусловленный структурными особенностями пути. Возможно,
пыльцевые трубки находят свой путь, реагируя на оба типа контроля
одновременно или раздельно в разных частях пестика (Heslop-Harrison,
1987).
Рост пыльцевых трубок происходит под действием трех групп
факторов: 1) скорость поступления воды и, следовательно, давление,
производимое на плазмалемму изнутри (на эти факторы влияет
осмотический баланс между содержимым клетки и средой); 2) физическое
воздействие на клеточную оболочку; 3) скорость синтеза веществ —
предшественников оболочки, а также их превращений, транспорта и
внедрения в плазмалемму пыльцевой трубки (Heslop-Harrison, 1987).
Наиболее существенным фактором, регулирующим процесс роста,
является продвижение воды в вегетативную клетку пыльцевой трубки, что
Двойное оплодотворение
123
обеспечивается различными структурными особенностями пыльцевого
зерна и поверхности рыльца.
Растущая пыльцевая трубка сохраняет характерную зональность,
теряя ее только тогда, когда рост по какой-либо причине
прекращается. Выделяют четыре зоны: апикальную, субапикальную, ядерную
и зону вакуолизации (Dashek, Rosen, 1966: Cresti et al., 1977;
Miki-Hirosige, Nakamura, 1982). Растяжение пыльцевой трубки
приурочено к апикальной зоне кончика, субклеточная организация
которого характеризуется наличием секреторных везикул,
встраивающихся в клеточную оболочку. Субапикальная зона пыльцевой трубки
содержит секреторные везикулы и различные органеллы
(митохондрии, аппарат Гольджи, ЭР), ядерная зона — ядро вегетативной
клетки и спермин. В зоне вакуолизации и формирования каллозных
пробок происходит отделение проксимальных участков пыльцевой
трубки, что обеспечивает высокий метаболический потенциал в
первых трех зонах. Следовательно, пыльцевая трубка растет за счет
растяжения в области кончика, где и происходит максимальный
синтез новых материалов для построения оболочки, состоящей из трех
слоев: внешнего пектинового, среднего целлюлозного и внутреннего
каллозного (Stanley, Linskens, 1974; Heslop-Harrison, 1979).
Основную роль при этом играют везикулы — предшественники стенки,
формирующиеся в диктиосомах, локализованных в близкой к апексу
зоне, либо из липидных и углеводных запасов пыльцевого зерна
без посредничества аппарата Гольджи (Heslop-Harrison, 1979, 1987;
Miki-Hirosige, Nakamura, 1982). В пыльцевых трубках злаковых
выявлены полисахаридные частицы, содержащие продукты активности
диктиосом (Heslop-Harrison, 1987).
Движение растворимых метаболитов в субапикальную область и
последующий транспорт предшественников компонентов оболочки в
апикальную зону роста зависит от характера движения цитоплазмы
(Iwanami, 1959). Значительную роль в регуляции устойчивости
пектиновых микрофибрилл кончика пыльцевой трубки играет кальций
благодаря его способности связывать карбоксильные группы пектинов
(Jaffe et al., 1975). Установлена связь содержания кальция с
зональностью расположения цитоплазматических везикул, мембран и органелл,
однако точное значение этих корреляций пока не ясно.
Движение цитоплазмы в пыльцевой трубке происходит в двух
направлениях — базипетальном и акропетальном (Литвак, 1971).
Полагают, что. движение гамет в пыльцевой трубке происходит либо с
помощью пассивного перемещения их током цитоплазмы (Strasburger, 1884;
Koernicke, 1903; Навашин и др., 1959; Навашин, 1968), либо благодаря
их способности к самостоятельному активному движению (Кострюкова,
Чернояров, 1938; Кострюкова, 1951, 1968; Steffen, 1953; Кострюкова,
Бенецкая, 1958; Полунина, Свешников, 1959; Полунина, 1961; Литвак,
Колесников, 1965; Литвак, 1971; Heslop-Harrison J., Heslop-Harrison
Y., 1989). Согласно Коробовой (1977, 1979), движение генеративной
124
Семя
клетки или спермиев в пыльцевой трубке можно рассматривать как
частный случай взаимодействия клеточного ядра с цитоплазмой. Это
представление основывается на том, что пыльцевая трубка с находящимися
в ней гаметами («гамоцит» — Герасимова-Навашина, 1951)
представляет собой разросшуюся вегетативную клетку пыльцевого зерна, а
генеративная клетка или спермин, находящиеся внутри протопласта
вегетативной клетки, ведут себя подобно ядрам (см. Движение ядра и
клеток в развивающемся пыльцевом зерне, Т. 1). В пользу этого
представления свидетельствует тот факт, что истинное ядро гамоцита —
ядро вегетативной клетки — ведет себя аналогично генеративной клетке
и спермиям, т. е. все время находится рядом с ними. Ядро любой клетки
на каждом этапе развития занимает строго определенное положение.
Место, где располагается в данный момент ядро, Герасимова-Навашина
(1954) назвала «динамическим центром» клетки, понимая под ним место
равновесия всех сил, влияющих на ядро. В пыльцевой трубке ядро
вегетативной клетки и ведущие себя сходным образом спермин или
генеративная клетка также локализуются в «динамическом центре». Объем
и местоположение гамоцита по мере роста пыльцевой трубки и
периодического отсечения ее верхушки каллозными пробками все время
изменяются, также меняет свое местоположение его «динамический центр»
и, соответственно, изменяется локализация вегетативного ядра и
спермиев, т. е. движение спермиев в пыльцевой трубке связано с
локализацией их в «динамическом центре» гамоцита, в свою очередь неуклонно
смещающемся по мере роста пыльцевой трубки. Согласно Heslop-
Harrison J., Heslop-Harrison Y. (1989), спермин в пыльцевой трубке
движутся самостоятельно вдоль элементов актино-миозиновой системы
в цитоплазме пыльцевой трубки. Во время роста пыльцевой трубки
расположение спермиев относительно ядра вегетативной клетки не постоянно
(Cresti et al., 1990). Каждый спермий окружен своей плазмалеммой и
плазмалеммой вегетативной клетки. Спермин локализованы в цитоплазме
вегетативной клетки, связаны друг с другом, а один из них и с ядром
вегетативной клетки (Rougier et al., 1991; Yu, Russell, 1994) (см.
Мужская оплодотворяющая система; Спермий, Т. 1).
Движение органелл и гамет в пыльцевой трубке связано с
функцией цитоскелета (микротрубочек и микрофиламентов) (Franke et
al., 1972; Heslop-Harrison, 1987; Heslop-Harrison et al., 1988;
Pierson et al., 1989). В цитоплазме вегетативной клетки обнаружено
присутствие миозина и кинезина (Moscatelli et al., 1988). Цитоскелет
генеративной клетки формируется микротрубочками (Tiezzi et al.,
1988). Рис. 6.
Батыгина, 1962а, 1974; Герасимова-Навашина, 1951а,б, 1954; Коробова, 1977, 1979;
Костркжова, 1951,1968; Кострюкова, Бенецкая, 1958; Кострюкова, Чернояров, 1938;
Литвак, 1971; Литвак, Колесников, 1965; Навашин, 1968; Навашин и др., 1959;
Полунина, 1961; Полунина, Свешников, 1959;Романов, 1966, 1970; Цингер,
Петровская-Баранова, 1961; Cresti et al., 1987, 1990; Dashek, Rosen, 1966; Franke
Двойное оплодотворение
125
et al., 1972; Heslop-Harrison, 1971, 1979, 1987; Heslop-Harrison J., Heslop-Harrison
Y., 1989a, b, c, d; Heslop-Harrison et al., 1988; Hoekstra, Bruinsma, 1975; Iwanami,
1959; Jaffe et al., 1975; Koernicke, 1903; Knox, 1984; Linskens, Heinen, 1962;
Miki-Hirosige, Nakamura, 1982; Moscatelli et al., 1988; Pierson et al., 1989; Rougier
et al., 1991; Shivanna et al., 1978; Stanley, Linskens, 1974; Steffen, 1953; Tiezzi et al.,
1988; Yu, Russell, 1994a, b, с
GENERATIVE CELL DIVISION AND SPERM CELL FORMATION
ДЕЛЕНИЕ ГЕНЕРАТИВНОЙ КЛЕТКИ И ФОРМИРОВАНИЕ СПЕРМИЕВ
Sexual plant reproduction comprises an alternation of diploid sporophytic
and haploid gametophytic generations. The plant male gametophyte develops
in the anthers following a meiotic division of the pollen mother cell and
subsequent mitotic division (Mascarenhas, 1993). In higher plants the mature
gametophyte is limited to a vegetative cell enclosing a generative cell (bicel-
lular pollen) or two sperms (tricellular pollen).
At anthesis the anthers open and mature pollen are transported by different
vectors (insects, wind, water, etc.) and deposited on the stigmatic surface
(Konar, Linskens, 1966). After pollination pollen germinate on the stigma
and pollen tubes grow through stigma and stylar transmitting tissue towards
the egg cell. It is interesting to point out that the pollen tube was discovered
by an Italian scientist Amici in 1823 (see Battaglia, 1987b).
The pollen tube growth is extremely fast, crossing a considerable distance
from several mm (e. g. Vitis vinifera, Olea europea, etc.) up to 50 cm
(e. g. Zea mays). In the category of bicellular pollen, during pollen tube
growth a second mitosis of the generative cell occurs and finally two sperms
are formed (Goldberg et al., 1993).
The pollen and pollen tubes are considered as vectors carrying the sperm
cells into the ovule and for such reason the pollen tube growth is one of
the key steps contributing to fertilization process of seed plants. Recently
an unbelievable amount of researches on the biochemistry, morphology,
physiology and molecular biology of pollen and pollen tube growth has been
done (Stanley, Linskens, 1974; Heslop-Harrison, 1987; Pierson, Cresti,
1992; Derksen et al., 1995; Ylstra, 1995). Pollen tubes have a specific
cell shape and growth pattern (tip or polar growth). The elongation of the
pollen tube occurs at their tip by the fusion of vesicles with the plasma
membrane. The secretory vesicles secreted by Golgi apparatus are transfered
to the apex by a fountain-like cytoplasmic streaming mediated by cytoskeleton
motor proteins (Cai et al., in press). There is a specific mechanism that
regulates a constant synthesis, degradation and reorganization of cytoskeletal
elements in order to maintain the delivery of the vesicles to. the tip
and the tube elongation (Derksen et al., 1995).
Generative cell division and sperm cell formation. In the last few years
thanks to the introduction of new methods such as immunolabelling, freeze
fixation and substitution, and devices allowing the three-dimensional recon-
126
Семя
struction of serial images, new insight has been gained into the morphology
and physiology of the generative cell and sperm cells in angiosperms (for
reviews sec: Russell et al., 1990a; Chaboud, Perez, 1992; Mogensen, 1992;
Palcvitz, Tiezzi, 1992; Pierson, Cresti, 1992; Russell, 1992). One of the
more encouraging findings is the discovery of dimorphism of the paired
sperm cells1 in a certain number of species including Plumbago zeylanica
(Russell, 1984), Spinacia oleracea (Wilms, 1986), Brassica campestris and
B. oleracea (Dumas et al, 1985; Mc Conchie et al., 1985, 1987b), Zea
mays (McConchie et al., 1987a; Rusche, Mogensen, 1988), Euphorbia
dulcis (Murgai, Wilms, 1988), Rhododendrum macgregoriae (Taylor et
al., 1989), Cagea lutea (Zhang et al., 1995).
The dimorphism of the sperm cells have been related to preferential
involvement in double fertilization and the possibility of selective transmission
of the male cytoplasmic organelles to the next generation (see Mogensen,
1992; Russell, 1992; Zhang et al., 1995).
One particular case showing a striking sperm cell dimorphism is reported
in Cagea lutea (Zhang et al., 1995) where the division of generative cell,
in addition to the asymmetrical division, is connected to the organization
of the microtubular apparatus. In Gagea the exceptional abundance of
microtubules in the proximal part of the generative cell at the beginning of
cell division are connected with the translocation of the generative nucleus
towards the leading end of the cell.
In Gagea lutea the generative cell is extremely large and the generative
nucleus is located in the distal part of the tube.
The microtubular organization of generative cell consists of fine bundles
of intermingled microtubules distributed in the entire cytoplasm. At the late
prophase the microtubules are in spindle-like shape and the chromosomes
become longitudinally aligned relative to the tube axis.
At the metaphase stage, about 3 to 4 hours after sowing, the microtubular
spindle became shorter and discontinuous at the site of the metaphase plate.
Generally the axis of the spindle are parallel to the axis of the pollen
tubes.
At the anaphase stage numerous bundles of microtubules interconnected
the separating chromosomes.
Telophase is characterized by the disappearance of the spindle and the
presence of prominent bundles of microtubules between the two daughter
nuclei. The end of the generative cell division occur 8 h. after sowing.
The cytokinesis was associated with the formation of phragmoplast and with
the formation of two unequal sperm cells: a smaller leading sperm cell and
a larger second sperm cell with a volume of up to 2.5 times that of the
leading one.
See Dimorphism of sperms, V. 1; Syngamy.
Двойное оплодотворение 127
The dimorphism of the two sperm cells of a pair has only been detected
in a few, mainly cellular species, on the basis of slight differences in cell
size, number of organelles and general morphology (see Zhang et al., 1995).
The Gagea lutea dimorphism represents the first case for bicellular pollen.
Fig. 7.
Battaglia, 1987b; Cai et al., 1996, in press; Chaboud., Perez, 1992; Derksen et al.,
1995; Dumas et al., 1985; Goldberg et al., 1993; Heslop-Harrison, 1987; Konar,
Linskens, 1966; Mascarenhas, 1993; McConchie et al., 1985, 1987a, b; Mogensen,
1992; Murgai, Wilms, 1988; Palevitz, Tiezzi, 1992; Pierson, Cresti, 1992; Rusche,
Mogensen, 1988; Russell, 1984, 1992; Russell et al., 1990a; Stanley, Linskens, 1974;
Taylor et al., 1989; Wilms, 1986; Zhang et al., 1995; Ylstra, 1995.
MALE GERM UNIT
МУЖСКАЯ ОПЛОДОТВОРЯЮЩАЯ СИСТЕМА
Male germ unit (MGU)1 is the functional transmission unit of sexual
reproduction in flowering plants formed by the sperm cells, or their precursor
generative cell, in physical association with the vegetative nucleus. The
MGU contains all of the hereditary DNA of the male reproductive lineage
including that of the vegetative nucleus and the male germ cells (Dumas
et al., 1984). Angiosperm pollens differ in their cellular condition at pollen
release: the majority are bicellular, containing the generative cell at release
(about 70% of angiosperms according to Brewbaker, 1967); the remainder
are tricellular, containing two sperm cells at release. The male germ cells —
the generative cell and its descendent sperm cells — are true cells in all
respects, with the rest of the pollen grain occupied by the vegetative cell,
which ultimately forms the pollen tube. The generative and sperm cells
have an unique cellular relationship with the vegetative cell — they are
entirely immersed within it and are enveloped within an internal vegetative
cell plasma membrane, which immediately surrounds the generative and sperm
cell plasma membranes. This develops through the separation of the generative
cell from the inner wall of the pollen grain where it is formed and its
subsequent immersion in the vegetative cell. A slim cell wall is frequently
present early in generative cell development, but this diminishes during
maturation and usually consists of a slim, glycosylated sheath without evident
fibrils at maturity (Russell, Cass, 1981). As pollen tubes approach the
ovule, each tube contains two sperm cells, which if successful will both
participate in separate fusion events during double fertilization. One sperm
The term was proposed by E. N. Gerassimova-Navashina (1957); description of sperm
connection was given in a number of previous publications (Wylie, 1904; Shattuck, 1905)
(Ed.).
I 128 Семя
fuses with the egg cell resulting in the formation of the embryo and the
other sperm fuses with the central cell resulting in the formation of the
nutritive endosperm. Both events are required to obtain seed through sexual
reproduction.
MGU associations: nature and origin. Two different kinds of
association are evident in the MGU: the first is the association between
the vegetative nucleus and the generative cell (evident in bicellular
pollen) and one of the two sperm cells (evident in tricellular pollen
and late in bicellular pollen tube growth); the second is the association
between the two sperm cells, which is initiated by generative cell
division, and frequently present throughout descent in the pollen tube.
The sperm cell association is based on: (1) the initial sharing of the
sperm common wall (formed during generative cell cytokinesis), (2)
the inclusion of the two sperm cells within a shared inner plasma
membrane of the vegetative cell, and (3) the presence of cytoplasmic
junctions between the sperm cells that is occupied variously by microtubules
(Heslop-Harrison J., Heslop-Harrison Y., 1988), trabeculae or
plasmodesmata-like connections (Russell, Cass, 1981). The association
between the vegetative nucleus and the generative cell usually precedes the
formation of the sperm cells. This second association is based on: (1)
the nearby position between the one end of one sperm cell or the
generative cell with the perinuclear cytoplasm of the vegetative nucleus,
(2) a tenacious maintenance of this position during the movement of
the MGU, and (3) the presence of an elongation or projection of
the associated generative or sperm cell with the vegetative nucleus.
Both types of associations are evident and tenacious in many flowering
plant species during MGU descent in the pollen tube. Although the
association of male germ cells with the vegetative nucleus is formed
first, the association of the two sperm cells is better understood and
will be discussed in detail first.
dissociation o/ the two sperm cells. The association of the two
sperm cells has its origin in the division of the generative cell. Although
generative cell division has been described frequently in the last century
(Maheshwari, 1950), the descriptions reported still generate controversy
(Palevitz, 1993a). Most of the variability in these descriptions seems
to have as its ultimate origin the space available to contain the mitotic
spindle and for the cells to undergo cytokinesis. In generative cells
that divide in the pollen tube (in bicellular pollen) space is usually
restricted, but this is not the case in generative cells that divide in
the pollen grain (in tricellular pollen).
In bicellular pollen, the generative cell becomes narrow and highly
elongated because of the constrained environment of the elongating pollen tube.
Although the metaphase plate may be slightly inclined in the widest pollen
tubes (Palevitz, 1993a), frequently the metaphase plate is highly inclined
(Yu, Russell, 1993), and in the narrower ones, it may be almost vertical
(Palevitz, Cresti, 1989). In bicellular pollen, generative cell cytokinesis may
Двойное оплодотворение
129
occur with or without a phragmoplast. In the former case, a cell plate
forms between the sperm nuclei, whereas in the latter case, the cytoplasm
appears to undergo cleavage by constriction. The most recent description
of the former case is in Nicotiana where cell plate formation is essentially
conventional (Palevitz, 1993a). The most noteworthy point is that gaps in
the forming plate are occasionally seen in the electron microscope. Although
these appear to close during later cell plate accretion (Yu, Russell, 1993)
they may provide a false impression that centripetal closure is occurring.
Cleavage accomplished by constriction has been most recently described in
Tradescantia by Palevitz and Cresti (1989). In some respects, for example
the lack of a cell wall and the evident pinching of membranes to separate
the cells, generative cell cytokinesis appears similar to an animal; however,
it also differs from animal cell cleavage since actin is apparently absent
from the generative and sperm cells (Palevitz, Liu, 1992). This is an
enigmatic model for sperm cell division which will need to be further
described. That this pattern of division has been reported since the early
literature (see Maheshwari, 1950), its existence seems well corroborated,
but ultrastructural studies have not yet been conducted.
In tricellular pollen, cell division is not particularly spatially constrained,
but the generative cell is frequently narrower in the center of the cell
forming a dumbbell-shaped profile (Charzynska, 1988). Generative cell
division consistently seems to employ a phragmoplast and cell plate formation,
but the pattern of cell plate expansion seems to vary among taxa. In one
type, cell plate expansion follows the normal somatic pattern of centrifugal
enlargement from a centrally coalesced,region towards the edges of the cell,
as reported in Hordeum, Sambucus, Secale and Triticum (Karas, Cass,
1976; Charzynska, 1988; Charzynska et al., 1988; Charzynska, Lenart,
1989; Charzynska, Lewandowska, 1990). In the second type, cell plate
expansion arises from pegs at the edge of the cell, with cell wall closure
occurring centripetally, as in Brassica (Charzynska et al., 1989), Galium,
and Trichodiadema (Weber, 1988a). Cell plate expansion in Avena sativa
(oats) appears to be either centrifugal (Charzynska, 1988) or centripetal
(Weber, 1988a), suggesting both a need for further study as well as the
possibility that variability of this character may extend below the species
level. In species in which the sperm cells separate, Weber (1988a) has
reported two patterns of separation: one in which accessory membranes seem
to be laid down prior to separation (e. g., Galium) and another in which
a central dense area in the pericellular space becomes a location of preferential
separation (e. g., Trichodiadema and Avena). It is difficult to estimate
how many sperm cells among the Angiosperms may separate completely
prior to descent in the pollen tube, but evidence for the reformation of
MGU associations is also available later in development prior to fertilization
(Mogensen, Wagner, 1987).
Association o/ the vegetative nucleus and the male germ cells. The
association between the vegetative nucleus and the generative cell and its
descendent sperm cells has a less obvious origin and basis. Close approaches
Q—828
130
Семя
between the vegetative nucleus and the young generative cell occur frequently
after microspore division, but they appear to be coincidental, since many
generative cells in the same anther seem to lack these associations. In
Plumbago, the first evidence of generative cell separation from the intine
seems to occur at the end of the cell nearest the vegetative nucleus. Only
a small beak is present at this end of the cell rather than the long projection
that is present later. As this beak elongates, the association seems to become
more stable and more consistent. The vegetative nucleus and generative cell
appear to be consistently associated from this stage onward (Russell et al.,
submitted). A greater frequency of nuclear pores seems to occur on the
side of the vegetative nucleus nearest the generative cell in Nicotiana, as
observed in freeze-fracture preparations (Wagner et al., 1990), but whether
these are involved in communication with the generative cell or represent
anchoring points for molecules involved in the MGU association is unclear.
The localization of myosin on surface membranes of the generative cell,
sperm cells and vegetative nucleus (Heslop-Harrison J., Heslop-Harrison
Y., 1989c; Tang et al., 1989) and actin present in the vegetative cell in
which they are immersed (Pierson, Cresti, 1992) may relate to the chemical
basis of the MGU associations. Myosin localizations using antibodies elicited
to the heads of fast skeletal muscle myosin have successfully labeled all
of the elements of the MGU. Antibodies against smooth muscle myosin
were not as effective, but it is still quite possible that the epitopes of
certain animal and plant myosins may have diverged beyond their ability
to meaningfully crossreact. According to fluorescence immunocytochemistry,
the specific location of the myosin label appears to be the vegetative nuclear
envelope and the inner pollen plasma membrane that ensheaths the generative
cell (Heslop-Harrison J., Heslop-Harrison Y., 1989c). Based on localizations
using squashed pollen contents, generative cell labeling was unexpectedly
variable. Heslop-Harrison J. and Heslop-Harrison Y. (1989c) proposed
that a significant number of generative cells remained coated by the pollen
plasma membrane and that these were well labeled, whereas those that
were presumably without the ensheathing layer did not label, and were
perhaps without myosin.
According to immunogold electron microscopy, anti-myosin antibodies
label few sites in the generative cell: mainly the nucleus and internal
organelles, not generative cell plasma membrane (Cresti et al., personal
communication). Based on these results, it seems possible that myosin
is absent from the actual surface of the male germ cells, but it is
also possible that it is sparse or chemically different in crossreactivity.
Preliminary results indicate that isolated sperm cells of Plumbago will
glide in an energy-dependent manner on actin filaments of giant
internode cells of the characean alga Nitella, although the sperm surface
has not yet been successfully labeled using conventional anti-myosin
antibodies (Zhang, Strout, Zhu and Russell, personal communication).
This suggest/ that myosin-like activity is present on the sperm cell
surface, even^ if immunolabeling has not yet been successful.
Двойное оплодотворение
131
Although a mechanism for the association of the vegetative nucleus with
the male germ cells is yet unclear, a number of observations seems relevant:
the vegetative nucleus and male germ cell membranes label with antibodies
(1) to myosin and (2) actin is present in a number of forms in the pollen
cytoplasm. Potentially, myosin present on the vegetative nucleus and
associated either directly or indirectly with the male germ cells could be
crosslinked via short filaments of protein possessing actin-like properties.
Potentially, this relationship could be tenacious enough to maintain a physical
association between the elements of the MGU. This would constitute a
nonmotile myosinctinyosin association, but one which could promote male
germ cell passage in association with active movement on actin bundles of
the pollen tube (Pierson, Cresti, 1992). Actin molecules with slow turnover
rates might provide linker molecules to associate the myosinrich surfaces
of these bodies. The position of the superficial myosin, in turn, may be
controlled by linkers attaching to the male germ cell microtubular
cytoskeleton. This model, although not proven, is not inconsistent with
experimental evidence (see following section).
Functional involvement of cytoskeletal elements in MGU behaviour.
Evidence for a relationship between microtubules and microfilaments in the
behavior of the MGU has come from experiments that alter these
cytoskeletal elements both chemically or physically. In experiments to
depolymerize or disrupt microtubules using colchicine, the distance
between the generative cell and the vegetative nucleus typically increases by
approximately one generative cell length (Heslop-Harrison et al., 1988);
similar results are also reported us,ing oryzalin (Palevitz, 1993b) and
during recovery from microtubule-disrupting cold treatments (Astrom
et al., 1991). A separation of the vegetative nucleus from the generative
cell is also evident during generative cell mitosis (Palevitz, 1993a; Yu,
Russell, 1993), when cortical generative cell microtubules are specifically
reorganized into a spindle. At metaphase, generative cell shape also
becomes rounder, with blunter cell elongations and significant decreases in
the length of cell projections evident in pollen tubes grown in vitro
(Palevitz, 1993b), in vivo and semi-vivo (Yu, Russell, 1994). These
observations during mitosis indicate that alterations of the MGU
association are particularly sensitive to changes specifically in microtubule
distribution within the generative cell. Given that the changes in generative
cell microtubules affect cell shape, it is difficult to tell whether the
loosening of the MGU is primarily a result of the reduction of cortical
microtubules, or whether it is a secondary consequence of changes in the
surface or surface area of the generative cell or because of decreases in
the complementarity of the surfaces between the male germ cells and the
vegetative nucleus.
Cytochalasin, which disrupts actin microfilaments, does not alter
associations within the MGU or change generative cell shape (Palevitz, Liu,
1992). Instead, cytochalasin appears to arrest the movement of the MGU
through the pollen tube, presumably through the breakdown of cortical actin
q*
132
Семя
bundles in the pollen tube (Heslop-Harrison J., Heslop-Harrison Y.,
1989b). In contrast, tube elongation and the movement of the MGU in
the tube was not radically altered by the application of colchicine, which
eliminated microtubules from growing pollen tubes and generative cells
(Heslop-Harrison et al., 1988). Based on these results, MGU movement
appears to be the result of a direct association between myosin on the
vegetative nucleus surface and surrounding the male cells, while MGU
associations are sensitive to alterations in cortical microtubules of the male
germ cells and their resulting changes in cell shape.
If actin is absent from the interior of both the generative cell and
sperm cells of flowering plants as suggested by Palevitz and Liu
(1992), this finding would have considerable implications in reducing
the possibility of independent cell movement and decreasing the odds
of cytoplasmic movement inside male germ cells. The absence of
F-actin in the phragmoplast during generative cell cytokinesis is also
believed to account for the seemingly fragile partition between newly
formed sperm cells.
MGU-based heterospermy. The MGU, since it involves association with
only one of the two sperm cells clearly establishes polarity that may be
associated with both shape differences and cytoplasmic organelle differences.
Shape differences are common since the sperm cell associated with the
vegetative nucleus (Svn) usually has an elongated projection or extension
that frequently wraps around the vegetative nucleus. It is also larger in
volume and surface area as a result of this characteristic and it may have
a flattened region that further increases the surface area of the cell. In
cases where this is also related to differences in the content of heritable
organelles, such as mitochondria or plastids, the sperm cells are cytoplas-
mically heterospermic. These include a significant number of species for
mitochondria (Table). Plumbago (Russell, 1984) has the most extreme
form of cytoplasmic heterospermy since the Svn is rich in mitochondria,
whereas the sperm cell that is unassociated with the vegetative nucleus
(Sua) is poorer in mitochondria and rich in plastids (Table). This polarity
in Plumbago is also related to preferentiality in fertilization, since the plastid-
rich Sua fuses with the egg cell in 94% of the cases examined (Russell,
1985). In plants in which there is not a clear marker for fusion, the
polarity of fertilization cannot so easily be determined. Maize (Zea mays)
sperm cells are the only flowering plant sperm to show nuclear heterospermy.
In this plant, there is a non-disjunction of B-chromosomes in the generative
cells, causing the two sperm cells to contain different numbers of B-chromosomes.
The sperm cell containing more B-chromosomes is more likely to fuse with
the egg cell (Roman, 1948). At the extremes of male cytoplasm are cotton,
which contains plentiful cytoplasm (Jensen, Fisher, 1968), to the orchids,
lacking mitochondria and plastids but containing a significant layer of
cytoplasm (Cocucci, Jensen, 1969; Yu, Russell, 1992), to the umbellifers
(Weber, 1988b), which appear to lack all but a thin almost film-like layer
of cytoplasm.
Двойное оплодотворение 133
Sperm cell motility and transport. Whether the sperm cells of flowering
plants are motile has been a classical question of flowering plant embryology,
with classical evidence for both possibilities (Maheshwari, 1950). Modern
studies have revealed that microtubules are well developed in higher plant
generative cells, but are not linked in any type of conventional motor
protein configuration, as would be expected if they were capable of
independent locomotion; they are usually even less well developed in sperm
cells (Palevitz, Tiezzi, 1992). Also, actin is absent or not convincingly
present in the male germ cells (Palevitz, Liu, 1992). Detailed examinations
of patterns of movement in living pollen tubes reflect a degree of
independence of movement in the elements of the MGU (one element can
even pass another in the pollen tube; Heslop-Harrison J., Heslop-Harrison
Y., 1987) and even suggest amoeboid shape changes in the sperm; however,
these can apparently be reconciled by actomyosin associations between the
MGU and the cytoskeleton of the pollen tube (Heslop-Harrison J., Heslop-
Harrison Y., 1989a; Pierson, Cresti, 1992). Isolated sperm cells provide
no evidence for independent motility (e. g., Cass, 1973; Russell, Cass,
1981).
Although the actomyosin model appears to answer fundamental questions
regarding the movement of sperm cells inside the pollen tube, the final
pathway of sperm cells deposited into the embryo sac appears to depend
on direct actomyosin interactions with actin trails located between critical
female cells (Huang et al., 1993; Huang, Russell, 1994; Huang, Sheridan,
1994). The sperm cells are hypothesized to migrate on the actin matrix
until they reach the site of gamete fusion. There one sperm cell migrates
on one actin trail and fuses with the egg cell to form the embryo and its
brother sperm cell migrates on a different actin trail and fuses with the
central cell to form the endosperm.
Sperm cell physiology. Since the work of Shivanna et al. (1988), there
has been some doubt about whether sperm cells are completely mature
before the germination of the pollen grain and whether they possess any
evident physiological limitations. The recent work of Zhang et al. (1993)
and Matthys-Rochon et al. (1994) indicates that sperm nuclei are
transcriptionally active, display electrophysiological activity and appear to be
fully physiologically competent. In terms of protein and immunogenic sites,
the sperm cells appear to differ from their surrounding cytoplasm (Pennell
et al., 1987; Geltz, Russell, 1988), suggesting that the transcripts are
expressed in sperm cells and that the cells are indeed autonomous and
possess a unique physiology. Further, the isolated sperm cells can be induced
to fuse with isolated egg cells in vitro (Faure et al., 1994) and the
products of fusion can be used to regenerate fertile plants (Kranz, Lorz,
1993). That the sperm cells used in these experiments are isolated from
newly released pollen grains indicates that sperm cells are fully functional
at anthesis in these plants. In bicellular pollenproducing plants, the greater
difficulty in isolating sperm cells from pollen tubes (Shivanna et al., 1988)
has resulted in fewer studies. Often exacting conditions are required for
id
-в
e
4-1
■Q
a
В
л
x
4)
ел
s
1.
0)
a
И
в
.—
60
d
id
d
.1
СЛ
=s
<u
и
s
w
0)
a
«Ф*
e
1Я
и
•з
acteri
*■
id
-Я
и
d
s
4-1
id
N
о
и
В
1)
^
V
ей
V
-^
О,
S
<в
ел
1
2
8-
Functi
>ч
ВО
0
■я
iT\ са 00
ОО Г^ ОО
С^ СО Q\
т-1 0\ г^
СС
&оо
о оо
>s on
О U
-в
в
id
0)
id
S
S
s
ел
id
г-
о
а
1X1
"-. (Я (Л (Я
3
п
QQQQ
ел ел ел ел
и
"в в
01 О
и с
t-~ Г-
on on оо со
*■* -^ » оо
- . On on
; ; 11 ii
щ CU С
-с _е >-*
U U
:Соп
:Соп
irgia,
CU -Ъ-
i °°
щ On
)OVOS
isell,
ON
ON
Cd
и о з о
SScdoi SSSacg^
*t—• -t—• T—«
II II II
в с в
1948)
(Roman,
+
са
in
II
в
1
ел
II
в
1
il
II
в
1
и и Г^
II II II
В С В
1985)
(Russell,
+
а
988
il
et al.,
, 1992
« —«
в «
в _
я 0J
>
2 з
(Я >-
чО On
II II
В В
г-
00
п, 19
988
(Я
Mogen
et al.,
. - л
££
■г- Г-
II II
с в
« >, о 1
~ S '
о >- a ,
3 U О +
С C-1/-N
" и .ti Q,
L- Р "О
and/о
ic heter
rs, con
somes;
profiles
oplasm
s diffe
chrome
=B И»
О —i Q. ..
s of
ndri
of
erar
» 2 u £
ca о ^ й
s-fSs.
u з
00 1 >, »
n ima
CH -
sperm
ining
1ssf
till
. О
.. Ё-в °
« СЛ ^_
^ о s u
G >. о i
ииииаи
-С I
ё!
CU
ел "D
CU
1 Ё
«
I*
oj
QQQQQQ
ел ел ел ел ел ел
и
Е >>
XN
а
о
-а
111
ni
са си —5
й
ш
« м -
к. ь. 3 - —, t,
саса w и aw
,4 52.3.
м§
Е
з :s
3 в
-Q 'С
Е щ
и °"
с
о
~а
<QQ<
--UeAJ
Е
з
и
л ■
ся *■»
_Н >
-с
"О Й О
ев ев U
I -С
, ей
ffl U К >- Wi
II .all
о , Ё.2 2
eu « .П Я
« l са о
- g-3-S
К & ■ I
ь, Q, * CO
^^ fe и о «
.S o-2 §"2
й -я ^-^ -3
ч О i сд
и-с-о з-S
пгс а
1 0 <! 4J
о 5«s
i- су О со
■!-! -С ^
!'
aj
О
Ё
00
_ a
и u 'c
и
о б
Ё~
•>-в|т! 2 °
С up!-S i
fc gU^. Ё
5 ggj2 is
^ та *==ч О ей
Двойное оплодотворение
135
generative cell division; therefore, in bicellular plants the maturity and
physiological competence of sperm cells is still unknown (Russell, 1991; Theunis
et al., 1991).
MGU as a functional unit of male germ cell transmission.
Evidence that the MGU is a functional unit for male reproduction
includes the widespread occurrence of MGU associations that appear
to facilitate the transmission of the gametes (Hu, 1990; Mogensen,
1992). Among the various plants that have been examined in detail,
the majority have MGUs: 6 of 7 tricellular dicotyledons (86%), 5
of 6 bicellular dicotyledons (83%), 2 of 4 tricellular monocotyledons
(50%) and 3 of 3 bicellular monocotyledons (100%) had MGUs. It
seems noteworthy that among the monocotyledons, 6 of the 7 (83%)
reportedly lacked an MGU at some time after reaching maturity.
Among the tricellular monocotyledons,. all of the examples used were
grasses. In half of them, including barley (Mogensen, Wagner, 1987),
the MGU is established prior to fertilization. In corn, which may lack
an MGU throughout its life cycle, heterofertilization — the fusion of
the egg and central cells with sperm cells from different pollen tubes —
is not uncommon (Robertson, 1984). The association between the sperm
cells and the vegetative nucleus is believed to promote a rapid
cotransmission of the sperm cells and to prevent heterofertilization (Russell,
Cass, 1981). According to P.-H. Tang's work (presented at the
International Botanical Congress in Yokohama, 1992), the vegetative
nucleus may actually be actively involved in the transmission of the
male germ cells since laser light-induced ablation of the vegetative
nucleus is reported to arrest the movement of the MGU. The above
evidence in combination with the known necessity of both sperm cells
to accomplish double fertilization (Maheshwari, 1950) constitutes strong
evidence for the significance of the MGU. The MGU therefore appears
to represent a functional male unit of sexual reproduction in flowering
plants, as proposed nearly 15 years ago (Russell, Cass, 1981). Fig.
8.
Astrom et al., 1991; Brewbaker, 1967; Cass, 1973; Charzynska, 1988; Charzynska et al.,
1988, 1989; Charzynska, Lenart, 1989; Charzynska, Lewandowska, 1990; Cocucci, Jensen,
1969; Dumas et al., 1984; Faure et al., 1994; Geltz, Russell, 1988; Heslop-Harrison J.,
Heslop-Harrison Y., 1987, 1988, 1989a, b, c; Heslop-Harrison J. et al., 1988; Hu, 1990;
Huang et al., 1993; Huang, Russell, 1994; Huang, Sheridan, 1994; Jensen, Fisher, 1968;
Karas, Cass, 1976; Kranz, Lorz, 1993: Maheshwari, 1950; Matthys-Rochon et al., 1994;
McConchie et al., 1987a, b; Mogensen, 1992; Mogensen, Rusche, 1985; Mogensen,
Wagner, 1987; Murgia, Wilms, 1988; Palevitz, 1993a, b; Palevitz, Cresti, 1989; Palevitz, Liu,
1992; Palevitz, Tiezzi, 1992; Pennell et al., 1987; Pierson, Cresti, 1992; Proovost et al.,
1988; Robertson, 1984; Roman, 1948; Rusche, 1988; Rusche, Mogensen, 1988; Russell,
1984, 1985, 1991, 1994; Russell, Cass, 1981; Russell et al., (submitted); Shivanna et al.,
1988; Tang et al., 1989; Theunis et al., 1991; Wagner et al., 1990; Wagner, Mogensen,
1987; Weber, 1988a, b; Wilms, 1986; Yu, Russell, 1992, 1993, 1994; Yu et al., 1992;
Zhang et al., 1993.
136
Семя
ПОРОГАМИЯ (греч. poros — отверстие и gamos — брак) —
проникновение пыльцевой трубки, участвующей в оплодотворении, в
семязачаток через микропиле. Синоним: акрогамия.
Порогамия характерна для всех голосеменных и большинства
покрытосеменных растений. Несмотря на множество пыльцевых трубок,
растущих в тканях рыльца и столбика, обычно лишь одна из них
проникает в микропиле и доставляет к зародышевому мешку два
спермия для оплодотворения яйцеклетки и центральной клетки. У
Triticum, Scilla sibirica отмечено проникновение в зародышевый
мешок нескольких пыльцевых трубок (Батыгина, 1974, 1987; см. также
Лилейные — классический объект для изучения опыления и
оплодотворения). Путь пыльцевой трубки от рыльца к
зародышевому мешку проходит через систему различных структур (см.
Проводниковый тракт пестика). Попадая в завязь, она продвигается
вдоль плаценты и далее, делая поворот (до 90° в анатропном
семязачатке), подходит к микропиле. На ее пути могут быть
встречены дополнительные структуры (обтуратор, папиллы плаценты и
интегументов), которые пыльцевая трубка должна преодолеть, чтобы
попасть в микропиле. Пройдя микропиле, сформированное одним или
двумя интегументами и имеющее определенные таксономические
признаки (длину, ширину, наличие кутикулы и секреторных клеток),
пыльцевая трубка входит в нуцеллус.
Морфологическая характеристика микропилярной зоны нуцеллуса,
принимающей пыльцевую трубку, также таксоноспецифична. Число
рядов клеток нуцеллярного колпачка и париетальной ткани,
отделяющих зародышевый мешок от микропиле, может быть различным
(см. Мегаспорангий, Т. 1). Многослойная ткань формируется в
микропилярной зоне нуцеллуса крассинуцеллятного семязачатка у
представителей ряда семейств (Cucurbitaceae, Degeneriaceae, Eupoma-
tiaceae, Magnoliaceae, Rutaceae, Simaroubaceae, Sonneratiaceae, Win-
teraceae, и др.), в результате чего зародышевый мешок оказывается
глубоко погруженным в ткани нуцеллуса. В других же семействах
с тенуинуцеллятным, а в ряде случаев и крассинуцеллятным типом
семязачатка, зародышевый мешок может быть отделен от микропиле
только одним-двумя слоями клеток нуцеллуса либо эпидермисом
нуцеллуса (Campanulaceae, Martyniaceae, Poaceae и др.). У ряда
растений с тенуинуцеллятным типом семязачатка нуцеллус ко времени
созревания зародышевого мешка полностью разрушается, и в этом
случае клетки яйцевого аппарата располагаются непосредственно под
микропиле (Icacinaceae, Orobanchaceae, Scrophullariaceae, Solanaceae,
и др.) (см. «Сравнительная эмбриология цветковых растений», 1981,
1983, 1985, 1987, 1990).
Эпидермис нуцеллуса обычно покрыт кутикулой. Перед вхождением
пыльцевой трубки в нуцеллус кутикула, покрывающая эпидермис
нуцеллуса, разрушается в отдельных участках под действием энзимов его
клеток (Janson, 1992). Через один из таких участков пыльцевая труб-
Двойное оплодотворение
ка проникает в нуцеллус. Микропилярная зона нуцеллуса может иметь
признаки секреторной ткани (Bruun, Olesen, 1989; Janson, 1992). У
некоторых видов (например, Spinacia oleracea) в месте
предполагаемого роста пыльцевой трубки отмечены признаки изменения в строении
оболочки клеток нуцеллуса (Wilms, 1981). Нуцеллус является
последней преградой перед вхождением пыльцевой трубки в зародышевый
мешок.
Несмотря на различия в строении тканей семязачатка, через
которые проходит пыльцевая трубка, можно выделить несколько общих
закономерностей ее роста. Рост пыльцевой трубки происходит по
межклетникам. Пыльцевые трубки растут в направлении секреции
эксудата и хемотропно-активных веществ. При недостатке эксудата
пыльцевые трубки начинают изгибаться, отклоняясь от прямолинейно
направленного роста, либо вообще могут прекратить рост. Эксудат
используется как источник питания и, одновременно, как хемотропно-
активный фактор (Тиру, 1961; Miki-Hirosige, 1964; Rosen, 1964;
Linskens, 1973; Sedgley, 1976; Heslop-Harrison, Reger, 1988; Janson,
1992). В случаях неготовности яйцевого аппарата к оплодотворению
или дегенерации его клеток пыльцевая трубка останавливает свой
рост и не проникает в нуцеллус (Herrero, Arbeloa, 1989; Janson,
1992).
Существует представление, что рост пыльцевой трубки от рыльца
через микропиле к зародышевому мешку (к клеткам яйцевого
аппарата) является направленным благодаря действию различных
факторов: секреции хемотропно-активных веществ, морфологическим
особенностям клеток и тканей, по кбторым растет пыльцевая трубка,
наличию электрических и химических градиентов. Как стимуляторы,
так и ингибиторы роста пыльцевой трубки, представленные хемо-
тропно-активными веществами, находятся в эксудате, секретируемом
клетками рыльца, столбика, плаценты и нуцеллуса. Состав эксудатов
столбика и тканей плаценты биохимически различен, благодаря чему
пыльцевые трубки имеют разную скорость роста в этих структурах
(Mascarenhas and Machlis, 1962; Miki-Hirosige, 1964; Rosen, 1964;
Welk, Millington, Rosen, 1965; Rosen, Gawlik, 1966; Linskens, 1973;
Mascarenhas, 1975; Sedley, 1976; Tilton, 1980; Mulcahy G., Mulcahy
D., 1986; Miki-Hirosige et al., 1987; Bruun, Olesen, 1989; Franssen-
Verheijen, Willemse, 1990; Janson, 1992). Имеет ли место секреция
эксудата клетками интегумента (интегументов), формирующих
микропиле, пока еще не ясно. Клетки яйцевого аппарата многих цветковых
обладают признаками секреторной активности (см. Синергиды, Т. 1).
Хемотропно-активные вещества, продукты секрета синергид, могут
также влиять на направленность роста пыльцевой трубки.
В кончике пыльцевой трубки, в микропиле, на поверхности
наружного интегумента и в синергидах обнаружена высокая
концентрация ионов Са. Учитывая важную роль ионов Са в биологических
процессах, сделано заключение об участии Са в процессах, ответ-
138
Семя
ственных за рост пыльцевой трубки (Mascarenhas et al., 1962b;
Jensen et al., 1983; Chaubal, Reger, 1992). У ряда растений
обнаружены электрические и магнитные поля вокруг пыльцевой трубки,
а также разность потенциалов между нею и тканями, по которым
она растет (Linskens et al., 1973; Wiesenseel et al., 1975; Sperber,
Dransfeld, 1981; Nakamura et al., 1991). Существенную роль, наряду
с другими факторами, направляющими рост пыльцевой трубки, играет
строение столбика (открытые и полые) и строение трихом (Wilms,
1980; Kronestedt et al., 1986; Lord, Kohron, 1986). Существует
также представление о случайном росте пыльцевой трубки по
свободным поверхностям и случайное нахождение ею микропиле. Однако
экспериментальные данные все больше опровергают эту точку зрения.
Рис. 9.
Батыгина, 1974, 1987; Bruun, Olesen, 1989: Chaubal, Reger, 1992; Franssen-Verhejen,
Willemse, 1990; Janson 1992; Jensen et al., 1983; Herrero, Arbeloa, 1989; Heslop-
Harrison, Reger, 1988; Kornestedt et al., 1986; Linskens et al., 1973; Lord, Kohron,
1986; Mascarenhas, 1975; Mascarenhas, Machlis, 1962; Miki-Hirosige, 1964; Miki-
Hirosige et al., 1987; Mulcahy G. В., Mulcahy D. L., 1986; Nakamura et al.,
1991; Rosen, 1964; Rosen, Gawlik, 1966; Sedley, 1976; Sperber, Dransfeld, 1981;
Tilton, 1980; Tupy, 1961; Welk et al., 1965; Wiesenseel et al., 1975; Wilms, 1980,
1981a.
ХАЛАЗОГАМИЯ (греч. chalaza — узелок и gamos — брак) —
проникновение пыльцевой трубки в семязачаток через интегумент (ин-
тегументы) в области халазы, минуя микропиле. При этом пыльцевая
трубка подходит к нуцеллусу снизу, далее растет вдоль него вверх,
она может ветвиться, изменять направление роста, но входит в нуцел-
лус в области микропиле. Синонимы: базигамия, апорогамия, халацога-
мия.1
Халазогамия была впервые описана Treub (1891) у Casuarina sube-
rosa, а позднее Навашиным (1895) у целого ряда других родов
цветковых: Betula, Juglans, Corylus. В дальнейшем было продолжено
изучение этого явления (Навашин, Финн, 1912; Nawaschin, Finn,
1913; Финн, 1936; Солнцева, Дгебуадзе 1974; Корчагина, 1981; Лит-
вак, 1981).
Согласно данным Поддубной-Арнольди (1976), халазогамия
описана в семействах Casuarinaceae, Betulaceae, Juglandaceae, а также в
порядках Ranales, Rosales, Rubiales, Cucurbitales и др.
Рост пыльцевых трубок при халазогамии не является строго
направленным, их поведение скорее сопоставимо с неориентированным ростом
в тканях, в результате которого одна из множества пыльцевых трубок
достигает микропилярной зоны нуцеллуса и входит в него. Между
Впервые термин употреблен в работе Навашина и Финна (1912).
Двойное оплодотворение
139
халазогамией и порогамией имеются переходные варианты (мезогамия),
когда пыльцевая трубка проникает в семязачаток в латеральной
области, между халазой и микропиле. Халазогамия в целом обнаружена у
ограниченного числа видов цветковых, при этом в большинстве случаев
одновременно с халазогамией отмечается и порогамия (Навашин, 1899;
Литвак, 1981). Халазогамия не обнаружена у голосеменных.
Халазогамия по сравнению с порогамией менее изучена. Однако
отдельные морфологические особенности строения и развития
семязачатка у халазогамных видов могут быть проанализированы. Базируясь
на сведениях по халазогамии (см. «Сравнительная эмбриология
цветковых растений», 1981), можно выделить некоторые характерные
особенности этого явления. К таким особенностям можно отнести:
наличие особенно мощно развитой микропилярной части нуцеллуса с
нуцеллярным колпачком и париетальной тканью, смещающей
зародышевый мешок вглубь нуцеллуса (Casuarinaceae, Betulaceae,
Juglandaceae); наличие широкого, не сомкнутого микропиле к моменту
созревания зародышевого мешка (Betulaceae) либо его отсутствие
(Juglan-daceae); формирование боковых выростов зародышевым
мешком, доходящих до основания семязачатка и аполярный генезис его
элементов, проявляющийся в развитии антиподы (или антипод) по
типу яйцеклетки (Casuarinaceae); замедленное формирование
зародышевого мешка и проникновение пыльцевой трубки до завершения его
развития (Betulaceae, Juglandaceae); задержка процесса
оплодотворения от одной недели после опыления (Betulaceae) до 6-7 недель
(Casuarinaceae); особенности функционирования кончика пыльцевой
трубки, связанные с его быстрым отмиранием (Betulaceae). Весь
комплекс отмеченных факторов может свидетельствовать о снижении
возможного влияния хемотропно-активных веществ на рост пыльцевой
трубки у халазогамных растений по сравнению с порогамными (см.
Порогамия).
Мнения о филогенетическом значении халазогамии противоречивы.
Одни исследователи считают, что это явление характерно для эволю-
ционно-продвинутых групп покрытосеменных и служит одним из
признаков специализации (Тахтаджян, 1966; Биологический
энциклопедический словарь, 1989). Другие считают халазогамию примитивным
признаком, исходным типом прохождения пыльцевой трубки
(Поддубная-Арнольди, 1976). Анализ некоторых морфологических
особенностей халазогамных растений, приведенный выше,
подтверждает точку зрения, что халазогамия, вероятно, является более
примитивным филогенетическим признаком, чем порогамия. Рис. 9.
Биологический энциклопедический словарь, 1989; Корчагина, 1981; Литвак, 1981;
Навашин, 1895а; Навашин, Финн, 1912; Поддубная-Арнольди, 1976; Солнцева,
Дгебуадзе, 1974; Тахтаджян, 1966; Финн, 1936; Nawaschin, Finn, 1913; Treub,
1891.
140
Семя
ОПЛОДОТВОРЕНИЕ
ДВОЙНОЕ ОПЛОДОТВОРЕНИЕ — процесс объединения одного спер-
мия с яйцеклеткой, а второго спермия (той же пары) — с
центральной клеткой зародышевого мешка (см. Сингамия; Тройное
слияние). В результате двойного оплодотворения возникает диплоидный
зародыш (из оплодотворенной яйцеклетки) и обычно триплоидный
эндосперм (из оплодотворенной центральной клетки зародышевого
мешка). Синонимы: амфимиксис, миксис.
С. Г. Навашин (1898, 1951; Nawaschin, 1898), изучая процесс
оплодотворения у лилейных (Lilium martagon и Fritillaria tenella),
впервые установил функцию обеих мужских гамет. Он показал, что
помимо хорошо известного одного оплодотворения яйцеклетки, в
зародышевом мешке совершается второе оплодотворение, участниками
которого являются второй спермий (его роль до тех пор была неясна)
и центральная клетка с полярными ядрами или её вторичным ядром.
Этот феномен и получил название «двойного оплодотворения», так
как в его основе лежит половой процесс.
Таким образом, оплодотворение названо двойным, поскольку ядро
одного из спермиев сливается с ядром яйцеклетки, а ядро другого —
с полярными ядрами или со вторичным ядром центральной клетки.
Впервые термин «двойное оплодотворение» появился в работе С. Г. На-
вашина «Об оплодотворении у сложноцветных и орхидных» (Изв. Имп.
Акад. Наук, 1900, Т. XIII, N 3, с. 335 — 340). С тех пор он навсегда
укоренился в мировой науке как определение одной из характернейших
биологических особенностей покрытосеменных растений, хотя в
последние годы установлен у отдельных представителей голосеменных (см.
Феномен двойного оплодотворения; Сингамия; Тройное слияние).
Навашин, 1898, 1900, 1951; Nawaschin, 1898.
ТИПЫ ДВОЙНОГО ОПЛОДОТВОРЕНИЯ1
Протекание цикла развития спермиев при оплодотворении зависит
от условий их образования и от той обстановки, которую они
встречают в женских клетках. В связи с этим можно выделить два
основных типа (двойного оплодотворения) оплодотворения: премитотический
и постмитотическии, в зависимости от того, когда наступает объединение
Текст печатается из работ Е. Н. Герасимовой-Навашиной (1957, 1971а) с
изменениями.
Двойное оплодотворение
141
ТИПЫ ДВОЙНОГО ОПЛОДОТВОРЕНИЯ
(Gerassimova-Navashina, 1960; Герасимова-Навашина, 1971а)
ПРЕМИТОТИЧЕСКИЙ
Морской еж и др.
Оплодотворение
зрелого яйца
Сложноцветные,
сцилла, злаки,
фукус и др.
ПРОМЕЖУТОЧНЫЙ
ПОСТМИТОТИЧЕСКИИ
Лилия,
фритиллярия, сосна
и др.
Аскарида и др.
Оплодотворение
незрелого яйца
142
Семя
половых ядер — перед митозом ядра зиготы, как только ядро
спермия придет в контакт с женским ядром, как у сложноцветных, злаков,
папоротников, мхов, многих водорослей (у животных он соответствует
так называемому «типу морского ежа»), или же лишь после
наступления митоза в ядре зиготы, как у большинства лилейных и у
голосеменных (т. н. «тип аскариды» у животных).
Существование двух типов оплодотворения вытекает из общей
цитологической закономерности, заключающейся в том, что ядра в
покоящемся состоянии не сливаются из-за наличия у них оболочки.
Слияние ядер может произойти только после растворения оболочки,
вызываемого либо вступлением в деление (при постмитотическом
типе), либо наличием у ядра спермия более раннего состояния
незаконченного деления, еще несовместимого с существованием оболочки и
поэтому вызывающего растворение последней в месте контакта с
женскими ядрами немедленно по соприкосновении (премитотический тип).
Несомненно, что растворение оболочки женского ядра в месте
соприкосновения с ядром спермия должно быть той же природы, что и
в процессе митоза, где растворение ядерной оболочки должно
осуществляться под влиянием хромосом, находящихся в соответствующем
состоянии.
Хромосомы спермия при премитотическом типе приходят в контакт
с женской ядерной оболочкой, пока они еще не потеряли способности
растворять ее и потому как бы непосредственно «заглатываются»
женским ядром.
При постмитотическом типе, когда ядро спермия достигает более
поздней стадии развития, совместимой с существованием оболочки,
растворение таковой женского ядра откладывается до момента, когда
половые ядра вступят в митоз — профазу ядра зиготы.
Промежуточная форма оплодотворения, встречающаяся у ряда
объектов (например, у бальзамина — Steffen, 1951), а также у тетраплоидных
форм растений (Герасимова-Навашина, Батыгина, 1958), исходным дип-
лоидам которых свойствен премитотический тип (например, Crepis),
представляет интерес с точки зрения проверки данной выше
интерпретации. При этой форме оплодотворения процесс идет медленнее, чем
при премитотическом типе, но быстрее, чем при постмитотическом,
поэтому ядро спермия, придя в контакт с женским ядром, успевает
частично слиться с ним (растворить его оболочку), но на наружной
своей стороне уже выделяет собственную оболочку. Этот процесс
может доходить у тетраплоидов даже до полного перехода в постмито-
тический тип, т. е. ядро спермия под влиянием женской клетки
впадает в митотический покой.
Сходное же положение мы имеем и при замедлении погружения,
вызываемом действием пониженных температур и отдаленной
гибридизации, когда погружение ядра спермия и его объединение с женским
ядром также часто затруднено (Герасимова-Навашина и др., 1968;
Двойное оплодотворение 143
Gerassimova-Navashina, 1969b; Долгова-Хведынич, 1967; Батыгина,
1966).
Итак, в то время как ядра спермиев при своем попадании в женские
клетки находятся в состоянии незавершенного митотического цикла, что
и обеспечивает их движение к женским клеткам, последние всегда
находятся в митотическом покое. Развиваясь раздельно и независимо,
половые клетки, таким образом, заходят при своем развитии в некоторый
тупик, выйти из которого они могут только совместно. Такая
противоречивость состояния половых клеток может разрешиться лишь путем их
глубокого взаимодействия, в результате которого под влиянием
покоящегося ядра женской клетки ядро спермия заканчивает свой цикл внутри
нее, впадая в покой, а оплодотворяющаяся женская клетка под влиянием
активной мужской «оплодотворяющей системы» (в основном
цитоплазмы пыльцевой трубки) выходит из покоя. Так или иначе, с момента
окончания ядром спермия своего цикла внутри женской клетки, новый
митотический цикл, с которого уже начинается эмбриогенез, наступает
в зиготе как в едином целом, и это новое развитие можно рассматривать
как разрешение противоречивости состояния мужских и женских клеток,
достигающееся при их взаимодействии в процессе дальнейшего
совместного развития в акте оплодотворения и становящееся источником
дальнейшего развития. Слияние половых элементов в свете такого
цитологического представления оказывается, с одной стороны, завершающим
этапом их развития, а с другой — началом нового онтогенеза.
Следовательно, акт оплодотворения есть лишь своеобразный момент процесса
развития, заканчивающий один онтогенез и, одновременно, являющийся
вступлением к новому онтогенезу. Рис. 10.
Батыгина, 1966; Герасимова-Навашина, Батыгина, 1958; Герасимова-Навашина и
др., 1968; Долгова-Хведынич, 1967; Gerassimova-Navashina, 1969b; Steffen, 1951.
СИНГАМИЯ (греч. syn — вместе, gamos — брак) — процесс слияния
двух гаплоидных гамет (яйцеклетки и спермия), в результате которого
образуется зигота. В собственном смысле слова этот термин означает
половую репродукцию. Синонимы: амфимиксис, конъюгация,
копуляция, эугамия1.
Термин в современном, более узком смысле слова впервые
предложил Hartog (1904) вместо термина «оплодотворение».
Сингамия включает слияние ядер — кариогамию (греч. karyon —
ядро + gamos) и слияние цитоплазмы гамет — плазмогамию (греч.
plasma, plasmat — плазма + gamos). Последние два термина
заимствованы, вероятно, из зоологической литературы (первое упоминание
относится к 1891 и 1901 гг. — см. Oxford English Dictionary, 1989);
в ботанической литературе термин плазмогамия впервые был исполь-
1 См. Battaglia, 1963.
144
Семя
зован для голосеменных растений (Ferguson, 1901). Strasburger
(1877) впервые фактически описал сингамию — одинарное
оплодотворение у цветковых растений (см. Феномен двойного
оплодотворения).
В 1898 г. С. Г. Навашин, изучая процесс оплодотворения у Lilium
martagon и Fritillaria tenella, показал, что обе мужские гаметы
участвуют в оплодотворении, одна сливается с яйцеклеткой (сингамия),
другая — с центральной клеткой, содержащей два полярных ядра
(тройное слияние) (см. Тройное слияние; Эндосперм).
Подробно процесс оплодотворения был рассмотрен Герасимовой-
Навашиной на примере представителей рода Crepis (Gerassimova,
1933). В дальнейших ее работах развивались отдельные аспекты
сингамии и тройного слияния (Герасимова-Навашина, 1947-1990).
Наиболее сложным и дискуссионным моментом в сингамии
является вопрос о механизме слияния гамет, их ядер и о темпе
прохождения этих процессов.
Известный индийский эмбриолог Maheshwari (1950, р. 194) писал:
«The time between the beginning and the end of the gametic fusions
is so short that one rarely succeeds in «catching» the material at the
right stage». Подробно рассмотрев методические трудности, которые
имеются в познании процесса оплодотворения, он сделал заключение:
«In view of these difficulties it is not suprising that our knowledge
of the events concerned with fertilization has not advanced very far
beyond where is stood during the early part of this century». Такого
же мнения придерживался и Модилевский (1958), считая, что
цитологическая сторона двойного оплодотворения у покрытосеменных
растений практически не разработана.
Применение метода темпоральных фиксаций материала
способствовало прогрессу в изучении цитологии и цитохимии этого процесса
(Герасимова-Навашина, 1947а, б, 1986; Батыгина, 1957, 1959,
1961а, б, 1962а, б, 1966, 1974; Поддубная-Арнольди, 1958, 1976;
Коробова, 1959, 1962; Савина, 1964, 1965; Яковлев, Иоффе, 1965; За-
мотайлов, 1968; Иоффе, 1968, 1976; Долгова-Хведынич, 1967; Хве-
дынич, Банникова, 1970а, б; Хведынич, 1972; Чеботарь, 1972, 1987;
Batygina, 1974; Банникова, Хведынич, 1982).
Ультраструктурные исследования также внесли свою лепту в
познание сингамии (Vazart, 1955, 1968; Jensen, 1964a, Ь, 1973; Vazart В.,
Vazart J., 1965; Jensen, Fisher, 1967, 1968a, b; Diboll, 1968;
Chebotaru, 1970; Schulz, Jensen, 1971, 1973; Герасимова-Навашина,
Гуляев, 1973; Cass, 1973, 1981; Cass, Karas, 1975; Russell, 1980,
1983, 1985a, b; Mogensen, 1982, 1986; Went van, 1984; You, Jensen,
1985; Mogensen, Rusche, 1985; Lammeren van, 1986; Hause, Schroder,
1987; Cresti et al., 1988; Жукова, 1992, 1993; Плющ, 1992; Faure et
al., 1993; Kranz, Lorz, 1993, 1994; Kranz et al., 1995). Однако, в
настоящее время наши представления об этом процессе далеко не
полные. Одна из причин заключается в методической сложности
Двойное оплодотворение 145
получения серии ультратонких срезов и компьютерной реконструкции
сингамии из-за быстротечности отдельных ее стадий. Другая
причина — в отсутствии системного сравнительного изучения цитоэмб-
риологических процессов in vivo и in vitro на световом и
ультраструктурном уровнях. Немаловажное значение имеет выбор объекта.
Идеальными модельными объектами являются представители сем.
Liliaceae и Роасеае (виды рода Triticum), у которых мужские и
женские половые элементы довольно крупные и процессы сингамии и
тройного слияния растянуты во времени.
Прежде чем рассмотреть процесс объединения спермия с
яйцеклеткой, вкратце напомним некоторые особенности строения яйцевого
аппарата, имеющие прямое отношение к механизму сингамии (см.
также Т. 1).
Яйцевой аппарат. Выявление значительных различий в строении
яйцевого аппарата у разных видов цветковых растений привело к
необходимости использовать термины «отчетливо
дифференцированный», «слабо дифференцированный» и «недифференцированный»
яйцевой аппарат (Плющ, 1992). При этом учитываются такие
признаки, как размеры, полярность и топография его элементов.
Типично дифференцированный (отчетливо дифференцированный)
яйцевой аппарат описан у видов Scilla, Crepis, Triticum, Hordeum,
Nicotiana, Tamarix, Calanthe (Gerassimova, 1933; Герасимова-
Навашина, Батыгина, 1958; Герасимова-Навашина, 1962; Батыгина,
1962, 1974, 1987; Mogensen, 1982; Плющ, 1992).
Ярким примером недифференцированного яйцевого аппарата
являются представители сем. Liliaceae, например, Lilium regale, как было
показано на световом (Герасимова-Навашина, 1960; Петрова, 1977) и
ультраструктурном уровнях (Плющ, 1987).
При рассмотрении ультраструктурной организации яйцевого
аппарата важно учитывать не столько соотношение органелл, которое
может быть одинаково у яйцеклетки и синергид, сколько частоту и
характер их распределения и электронную плотность гиалоплазмы
и нуклеоплазмы (Плющ, 1992).
Яйцеклетка у большинства цветковых растений располагается лате-
рально и обычно несколько ниже синергид (в профиль).
Центральная клетка облегает яйцеклетку со всех сторон (за исключением той
стороны, где яйцеклетка прикреплена к стенке зародышевого мешка).
Между ними остается только схизогенная «щель», в которую через
синергиду(ы) или между ними пыльцевая трубка изливает свое
содержимое со спермиями.
В процессе развития яйцеклетка претерпевает ряд сложных морфо-
генетических изменений («ядро будущей яйцеклетки» — «инициаль
Все эти термины требуют уточнения (см. Т. 1).
ю-828
146
Семя
яйцеклетки» — «незрелая яйцеклетка» — «зрелая яйцеклетка»),
касающихся строения ядра и его локализации, цитоплазмы и клеточной
оболочки (Батыгина, 1974, 1992; Батыгина и др., 1982; Беляева,
1987; см. Яйцеклетка, Т. 1; Зигота). У большинства цветковых в
сформированном зародышевом мешке все клетки яйцевого аппарата
имеют целлюлозную оболочку. В процессе созревания зародышевого
мешка происходит потеря части полисахаридных оболочек, т. е. перед
оплодотворением апикальные части яйцеклетки и синергид имеют
только плазмалемму. Продолжительность периода «созревания» яйцеклетки
варьирует. Например, у Triticum этот процесс длится 2-5 дней (в
зависимости от вида и условий произрастания). Гаметогенез в
зародышевом мешке пшеницы может быть завершён (сформированный
зародышевый мешок), но оплодотворение не происходит до тех пор, пока
не завершится дифференциация и специализация клеток всего яйцевого
аппарата, т. е. образование зрелого зародышевого мешка (поляризация
яйцеклетки и синергид, проявляющаяся в специфической вакуолизации
этих клеток и положении в них ядер, в распределении пластид в
яйцеклетке, в образовании зубовидных выростов и нитчатого аппарата
у синергид) (Батыгина, 1974; см. Т. 1).
Ультраструктурные данные говорят о том, что строение «зрелой»
яйцеклетки таксоноспецифично. Согласно Плющ (1992), у одних видов
растений (например, Calendula officinalis, Helianthus annuus, Plumbago
zeylanica, Glycine max) яйцеклетки можно охарактеризовать как
метаболически активные, у других (Capsella bursa-pastoris, Petunia hybrida,
Oryza sativa, Brassica campestris и др.) — как находящиеся в покое.
Синтетические процессы в яйцеклетке менее разнообразны, чем в,
других клетках зародышевого мешка, о чём свидетельствуют обычно
малочисленные элементы ЭР и аппарата Гольджи (Плющ, 1992).
Синергиды являются полифункциональными клетками, основная роль
которых заключается в привлечении пыльцевых трубок через микропиле
в зародышевый мешок, в обеспечении высвобождения их содержимого
и попадания спермия к женским гаметам (Gerassimova, 1933; Maheshwari,
1950; Герасимова-Навашина, Батыгина, 1958; Герасимова-Навашина,
Коробова, 1959; Went van, Linskens, 1967; Berger, Erdelska, 1973;
Mogensen, 1975; Поддубная-Арнольди, 1976; Tilton, Mogensen, 1979;
Bruun, 1987; Плющ, 1992; см. Синергиды, Т. I).
Многие исследователи придают большое значение хемотропизму
синергид, однако вопрос о химическом составе хемотропных веществ
и времени их образования продолжает оставаться дискуссионным.
Пыльцевая трубка может входить в одну из синергид либо между
синергидами, либо минуя синергиды — в район контакта
центральной клетки с яйцеклеткой. Вероятно, в определенной степени это
обусловливает характер дегенерации синергиды. У одного и того же
вида можно встретить разные способы вхождения пыльцевых трубок
в зародышевый мешок (например, у Triticum aestivum — Батыгина,
1974, 1987, 1990). Отмечены случаи, когда изменения синергид
Двойное оплодотворение
147
(их трансформация) начинаются уже с момента попадания пыльцы
на рыльца (Гургенова, 1928; Кахидзе, 1954; Jensen, 1968a) и даже
ранее, но это еще не говорит о том, что пыльцевая трубка должна
обязательно войти в трансформирующуюся синергиду.
Дискуссионными остаются вопросы: как вскрывается пыльцевая
трубка в синергиде и как попадают спермин в экстрацеллюлярное
пространство («щель»). Одни авторы утверждают, что содержимое
пыльцевой трубки изливается в синергиду через пору (Jensen, Fisher,
1967; Чеботарь, 1972; Mogensen, 1972, 1978; Wilms, 1981a, с;
Russell, Cass, 1988), другие — через разрыв оболочки пыльцевой
трубки за счет разницы осмотического давления внутри пыльцевой
трубки и синергиды (Went van, 1970; Поддубная-Арнольди, 1976)
или в результате растворения оболочки пыльцевой трубки
гидролазами синергид (Godineau, 1969). В исключительных случаях вскрытие
пыльцевой трубки происходит в «щели» (Plumbago zeylanica, Plumbagella
micrantha — Russell, 1980, 1982; Russell, Cass, 1988; Adoxa moscha-
tellina — Плющ, Банникова, 1989).
Мужская оплодотворяющая система (МОС) (англ. male germ
unit, MGU; см. Мужская оплодотворяющая система). Для
понимания механизма одновременного попадания спермиев в синергиду,
в «щель» и одновременного их расхождения к двум разным
женским клеткам представляет интерес вопрос о связи спермиев
между собой в пыльцевом зерне, пыльцевой трубке и «щели»,
а также о связи спермиев с ядром вегетативной клетки. Этот
феномен был описан в начале 20 века Shattuck (1905, р. 213) при
исследовании образования мужских гамет у Ulmus americana: «It
was definitely determined that the male structures are cells, and not
merely nuclei, delicate limiting membranes being clearly made out.
During a large part of their existence in the pollen grain these
lenticular cells are attached to each other by their adjoining ends
in such a manner as to make them appear in longitudinal section as
if as tride of the tube nucleus».
Поведение этих связанных «мужских клеток», по данным Shattuck,
в процессе их развития меняется: сначала в пыльцевом зерне они
имеют цитоплазму, далее в пыльцевой трубке они ее теряют, а в
зародышевом мешке вновь обнаруживают незначительное количество
цитоплазмы. Наличие цитоплазмы у спермиев другого вида Ulmus laevis
в зародышевом мешке подтверждено электронно-микроскопическими
данными Плющ (1989а-е). Wylie (1904, р. 10) утверждал, что связь
мужских клеток у Elodea canadensis длительна — она существует
в пыльцевом зерне, в пыльцевой трубке и сохраняется на
сравнительно значительном расстоянии: «This point of union acts like a
hinge, permitting the cells to take the most varied positions with
respect to one another even swinging about so as to lie side by side».
Аналогичную картину наблюдали С. Г. Навашин и Финн (1912) у
Juglans, изобразив две мужские гаметы, связанные друг с другом в
10*
148
Семя
виде гантелевидной структуры внутри зародышевого мешка. Авторы
рассматривали эту структуру как «двуядерную генеративную клетку»,
которая вполне соответствует двуядерной генеративной клетке
некоторых голосеменных. По их мнению, сохранение цитоплазмы вокруг двух
мужских ядер в пыльцевом зерне, пыльцевой трубке и в зародышевом
мешке у Juglans представляет собой «древний признак,
унаследованный халазогамными растениями от их голосеменных предков».
Кратковременный этап формирования «двуядерной генеративной
клетки» («двуядерной гаметной», или «двусперматогенной клетки»)
был обнаружен в процессе образования спермиев у ряда видов рода
Triticum (Батыгина, 1962а, Ь, 1974, 1987). Связь генеративной
клетки (спермиев) с ядром вегетативной клетки сохраняется в течение
всего развития пыльцевого зерна.
В настоящее время это явление описано у многих видов растений.
Природа связи гамет, а также время ее возникновения (в пыльцевом
зерне, пыльцевой трубке и зародышевом мешке) могут быть различны.
Феномен «мужская оплодотворяющая система», открытый на
световом уровне ещё в начале XX века, получил подтверждение и
дальнейшее развитие в электронно-микроскопических исследованиях
(Mogensen, Rusche, 1985; Russell, 1980, 1982-1985а, b, 1990, 1991;
см. также Мужская оплодотворяющая система). Существуют разные
точки зрения о значении этого явления. Согласно одной из них,
«ассоциация спермиев» обусловливает как порядок вхождения
спермиев в зародышевый мешок, так и их избирательность в
оплодотворении яйцеклетки и центральной клетки (Heslop-Harrison J.,
Heslop-Harrison Y., 1984; Russell, 1984). По мнению других
авторов, МОС осуществляет координацию развития всех клеток
пыльцевого зерна (Тарасенко и др., 1988), координацию процессов
оплодотворения (Dumas et al., 1985). Для понимания
общебиологического значения МОС необходимы более детальные сравнительно-
эмбриологические исследования различных таксонов голосеменных и
покрытосеменных растений.
Особенности строения мужских гамет. Открытие феномена
двойного оплодотворения поставило перед исследователями целый ряд
вопросов, касающихся характеристики мужских гамет: о диморфизме
спермиев одной пары, о наличии цитоплазмы у спермиев (в пыльце,
в пыльцевой трубке, в синергиде, в яйцеклетке и в экстрацеллюлярном
пространстве между яйцевым аппаратом и центральной клеткой), о
движении спермиев. Эти вопросы волнуют ученых почти 100 лет, их
решение, как считал еще С. Г. Навашин, приблизит нас к объяснению
всех этапов сингамии и тройного слияния.
В современной литературе — двуядерная клетка-спермий (англ. binucleate sperm
cell, см. Carmichael, Friedman, 1995).
Двойное оплодотворение
149
Впервые диморфизм, проявляющийся в энантиоморфизме (попарном
различии и сходстве), был установлен С. Г. Навашиным на светооп-
тическом уровне у цветковых. Особенно отчетливо ядерная гетероспер-
мия была описана у голосеменных, в частности у Pinus (Ferguson,
1901), С. Г. Навашин и Финн (1912) отмечали диморфизм половых
ядер у Juglans nigra, объясняя это различие тем, что у цветковых оба
ядра при двойном оплодотворении функциональны.
В настоящее время различают «цитоплазматическую гетероспермию»
(разное количество пластид, митохондрий, диктиосом) и «ядерную
гетероспермию» (Russell, 1991). Однако гетероморфизм отмечается не у
всех цветковых. Как показали исследования с применением техники
серийных ультратонких срезов и компьютерной реконструкции, у
некоторых видов растений спермин изоморфны (Mogensen, Rusche, 1985;
Ни, 1990; Russell, 1991; Zhu et al., 1992).
У одних видов цветковых ядро меньшего спермия сливается с
ядром яйцеклетки, большего — с полярным ядром, у других —
наоборот (см. Maheshwari, 1950). Яйцеклетку оплодотворяет обычно
спермий, содержащий большее число пластид (Russell, 1983, 1985).
Наблюдения за движением спермиев у Plumbago zeylanica,
изолированных из пыльцы с помощью осмотического шока, обнаружили
бимодальное распределение скорости и плотности заряда мужских
гамет (Zhang et al., 1996). Авторы связывают этот факт с
различной судьбой спермиев одной пары во время оплодотворения.
Экспериментальные исследования спермиев, изолированных из
зрелой пыльцы Spinacia, не выявили различий в структуре плазмалемм
у спермиев одной пары (Aelst van et al., 1990). Возможно,
избирательность мужских гамет, идущих к разным женским клеткам,
присуща не всем видам цветковых. Подтверждением этого может
быть наличие у цветковых растений как диморфных, так и
изоморфных спермиев.
Диморфизм спермиев является, вероятно, результатом
асимметричного цитокинеза в микроспоре, пыльцевом зерне и генеративной клетке.
У многих видов цветковых вегетативная и генеративная клетки
пыльцевого зерна содержат разное количество органелл, в частности,
пластид. При этом, как полагают исследователи, существуют разные
варианты неравномерного распределения пластид (почти все пластиды
переходят в вегетативную клетку или частично попадают в
генеративную, но полностью элиминируют в процессе ее развития, или попадают
в спермин, но не попадают в яйцеклетку).
Материнская пластидная наследственность, встречающаяся у
большинства цветковых растений, как полагают некоторые исследователи,
и объясняется теми цитоплазматическими изменениями, которые
происходят при формировании генеративной клетки и спермиев (Hage-
mann, 1981, 1983; Went van, 1984; Schroder, 1984, 1985a, b, 1986a,
b, 1988).
150
Семя
Цитоплазма мужских гамет. С. Г. Навашин и Финн (1912)
выдвинули гипотезу о редукции цитоплазмы спермиев у
представителей различных таксонов покрытосеменных и голосеменных растений.
Они рассматривали редукцию цитоплазмы в филогенетическом
плане, связывая ее с потерей самостоятельности спермиев. Как считают
эти авторы (с. 53): «С эволюцией пыльцевой трубки (ср. Wettstein,
1906, 1911) идет как бы рука об руку и упрощение мужских гамет.
У Cycadinae и Ginkgoinae, где пыльцевая трубка наиболее
примитивна, — она еще не служит для проведения мужских гамет, — мы
встречаем еще типичные сперматозоиды; у остальных голосеменных,
где пыльцевая трубка уже выполняет свою новую и главнейшую
функцию, состоящую в том, чтобы проводить оплодотворяющие элементы
к яйцеклеткам, мы наблюдаем все прогрессирующую тенденцию
редуцировать строение мужских гамет до ядер (образования двуядер-
ной генеративной клетки); у низших покрытосеменных, какими, по
нашему глубокому убеждению, являются настоящие халацогамы, где
пыльцевая трубка сохранила в значительной степени отпечаток
первобытности, существует еще, сравнительно с высшими
покрытосеменными, значительная устойчивость мужской цитоплазмы, достигающей
здесь в неразрушенном состоянии зародышевого мешка (в этом
отношении до сих пор изучены только виды Juglans); наконец, у высших
покрытосеменных, где пыльцевая трубка, пройдя длинный путь
эволюции, достигает наибольшего совершенства, наблюдается разрушение
мужской цитоплазмы в пыльцевой трубке и, быть может, иногда
даже в пыльцевом зерне».
Гипотеза редукции цитоплазмы у спермиев в зародышевом мешке
поддерживается и современными эмбриологами, но несколько в другом
аспекте. На примере Hordeum vulgare, Spinacia oleracea, Epidendrum
scutella показано, что уменьшение объема цитоплазмы и плотности
органелл может происходить в процессе развития спермиев в
пыльцевом зерне и пыльцевой трубке и во время вхождения их в
зародышевый мешок (Wilms, 1981a-d, 1985; Kadej A., Kadej F.,
1985; Mogensen, Rusche, 1985; Cocucci, 1988). Это приводит в
конечном счете, как полагают авторы, к тому, что мужские гаметы
могут быть представлены в виде «голых» ядер.
Мужские гаметы в зародышевом мешке. Согласно гипотезе энан-
тиоморфизма, выдвинутой С. Г. Навашиным, направление движения
мужских гамет к женским, вероятно, обусловлено особого рода
полярностью, возникающей при делении генеративной клетки.
Специфическая спиралеобразная форма спермиев, как он считает, служит
подтверждением «самостоятельной их подвижности».
Многие годы обсуждается вопрос, являются ли спермин в
пыльцевой трубке и зародышевом мешке активными или пассивными гаметами
(Strasburger, 1884; Кострюкова, Чернояоов, 1938; Полунина, 1961;
М. С. Навашин и др., 1959; Maheshwari, 1950; Steffen, 1953; Лит-
вак, 1968; Cass, 1973; Heslop-Harrison J., Heslop-Harrison Y., 1987a,
Двойное оплодотворение 151
b; Плющ, 1992). Существуют различные точки зрения относительно
механизма попадания спермиев в «щель». Согласно одной точке
зрения, они перемещаются в «щель» вместе с содержимым пыльцевой
трубки и, возможно, разрушенной синергиды (Навашин, 1910;
Герасимова-Навашина, Батыгина, 1958; Батыгина, 1962, 1966, 1974,
1987; Коробова, 1979, 1983). Это было обнаружено у Scilla sibirica,
видов Zea и Triticum, где содержимое пыльцевой трубки вместе со
спермиями часто в виде отдельных крупных капель наблюдается в
«щели» (см. Лилейные — классический объект для изучения
опыления и оплодотворения; Опыление и оплодотворение у злаков). У
пшеницы в пыльцевой трубке спермин имеют удлиненную форму, а в
синергиде и щели они скручиваются по спирали, сохраняя такую
форму на первых этапах прохождения в цитоплазму яйцеклетки и
центральной клетки. При подходе к женским ядрам они снова
выпрямляются и становятся везикулярными. С помощью цейтраферной съемки
была подтверждена активность движения спермия, идущего к
полярным ядрам (Erdelska, 1978, 1983). Согласно представлению Jensen
(1972), основанному на детальных электронно-микроскопических
исследованиях процесса оплодотворения у Cossypium, спермин из
синергиды в женские клетки попадают не за счет активного их движения,
а за счет физико-химического взаимодействия цитоплазмы пыльцевой
трубки и синергиды.
В настоящее время наиболее интересной представляется концепция
о роли микротрубочек, объединенных у некоторых видов цветковых в
пучки, которые часто располагаются параллельно длинной оси клетки
(Cresti et al., 1990). Согласно этой концепции, они сходны с
микротрубочками, обеспечивающими подвижность жгутиков и ресничек в
спермиях жгутико-ресничковых аксонов.
Плазмогамия и кариогамия — ключевые моменты двойного
оплодотворения. До сих пор дискутируется вопрос о том, проникают ли в
женские клетки мужские гаметы как целые клетки или в виде ядер.
Одни исследователи считают, что цитоплазма спермиев остается в
синергиде (Поддубная-Арнольди, 1958; Беляева, 1964, 1977, 1980;
Герасимова-Навашина, 1971а, б, 1980; Коробова, 1979; Смирнов,
1982; Красников, 1988), согласно другой точке зрения — в щели
между яйцеклеткой и центральной клеткой и не сливается с цитоплазмой
яйцеклетки (Mogensen, 1982, 1988; Чеботарь, 1987; Russell et al.,
1990а, b).
Однако имеются данные, свидетельствующие о том, что спермин в
момент объединения с женскими гаметами содержат цитоплазму (Wylie,
1904; Замотайлов, 1968; Jensen, 1973; Cass, 1981; Wilms, 1981a-d;
Смирнов, Граханцева, 1986; Плющ, 1992; см. Механизмы
оплодотворения; Передача цитоплазмы при оплодотворении). Так, у Plumbago
zeylanica обнаружена передача мужской цитоплазмы с митохондриями
и пластидами как в яйцеклетку, так и в центральную клетку (Russell,
1980-1983). В литературе рассматривается несколько моделей участия
152
Семя
цитоплазмы спермиев в оплодотворении при сингамии и тройном слиянии
(Went van 1970а-с; Jensen, 1973; Wilms, 1981a-d; Mogensen, 1988a,
b; Russell et al., 1990). Согласно одной из них, процесс двойного
оплодотворения включает плазмогамию, при этом происходит слияние
плазматических мембран женских и мужских гамет. Процесс плазмогамии
сопровождается образованием мостов между гаметами, через которые
проходят ядра клеток спермиев и, вероятно, их цитоплазма. Авторы
этой гипотезы (Linskens, 1968; Went van, 1970b; Jensen, 1972)
предполагают наличие у яйцеклетки специфической мембраны, которая может
меняться в процессе сингамии так, что она становится невосприимчивой
ко второй мужской гамете.
У некоторых видов (например, Capsella bursa-pastoris) наблюдается
пора в стенке синергида-яйцеклетка около открытого конца пыльцевой
трубки, через эту пору спермий, как предполагают Schulz и Jensen
(1968), входит в яйцеклетку.
Кариогамия наиболее детально (на светооптическом уровне) была
описана у Crepis capillaris (Gerassimova, 1933).
Jensen (1964) с помощью ТЭМ впервые описал механизм двойного
оплодотворения у Cossypium hirsutum. Позднее на других объектах,
включая представителей сем. Роасеае, он показал, что этот сложный
процесс состоит из ряда последовательных этапов. Впоследствии
кариогамию на ультраструктурном уровне изучали на различных объектах
(Went van, 1970; Schulz, Jensen, 1973; Kudlicka et al., 1980; Wilms,
1981a-d; Mogensen, 1982; Hause, Schroder, 1987).
Недавние исследования по индукции кариогамии in vitro с помощью
электроимпульса были проведены на изолированных мужских и женских
гаметах Zea mays (Faure et al., 1993). Благодаря применению
электронной микрографии, фазово-контрастной микроскопии и реконструкции
сливающихся ядер авторы описали так же, как и Jensen, три главные стадии
слияния ядер: 1 — наружные мембраны ядерных оболочек тесно
соприкасаются или контактируют через эндоплазматический ретикулум и затем
сливаются; 2 — внутренние мембраны ядерных оболочек сливаются и
образуются мостики между ядрами; 3 — мостики увеличиваются и могут
захватывать некоторое количество цитоплазмы.
Однако некоторые авторы считают, что при кариогамии
наблюдаются различные способы объединения мембран ядерных оболочек (Szabo,
O'Day, 1983; Плющ, 1992).
Известно, что существуют разные типы мужских гамет,
характеризующиеся различным ядерно-цитоплазматическим отношением. Например,
компактные спермин с малым количеством цитоплазмы свойственны
растениям, обладающим премитотическим типом оплодотворения. Степень
подготовленности половых элементов к оплодотворению различна у
разных видов цветковых. Быстрое объединение ядер спермиев
происходит с теми ядрами яйцеклеток, которые содержат диффузный
хроматин. Темп слияния хроматина зависит от перехода гетерохроматина
154 Семя
в эухроматин. Следовательно, чем более конденсирован хроматин в
ядрах яйцеклетки и спермия, тем длительнее идет процесс кариогамии.
Давно обсуждается вопрос о механизмах сингамии и тройного
слияния в свете митотической гипотезы и о связи этого процесса с
клеточным циклом (Gerassimova, 1933; Герасимова-Навашина, 1947,
1951, 1957, 1960, 1971а, б, в, 1980; Герасимова-Навашина, Батыгина,
1958, 1959; Коробова, 1959, 1962; Савина, 1965; Vallade, 1980;
Gerassimova-Navashina, 1982; Банникова и др., 1985; Friedman, 1991)
(Рис. 1). В ряде работ приводится количественная оценка ядерной
ДНК в гаметах и зиготе как важный показатель прохождения
периодов митотического цикла (Woodard, 1956; Bennett, Smith, 1976;
данные Алимовой — см. Герасимова-Навашина, 1980; Банникова, Хве-
дынич, 1982; Friedman, 1991; Mogensen, Holm, 1995; Sherwood,
1995).
Особый интерес процесс кариогамии приобрел в связи с открытием
предковой формы двойного оплодотворения у некоторых таксонов пор.
Gnetales *(Ephedra, Cnetum) (Friedman, 1990, 1991; Carmichael,
Friedman, 1995), возможность существования которой рассматривали и другие
авторы (Pearson, 1929; Favre-Duchartre, 1956; Герасимова-Навашина,
1958; Терехин, 1991). На основе детальных исследований содержания
ядерной ДНК в мужских и женских гаметах Gnetum gnemon с помощью
S-phase
GAMETE NUCLEI
JUST PRIOR TO
FERTILIZATION
\
INITIAL CONTACT
OF GAMETE
NUCLEI
\
FINAL CONTACT
OF GAMETE
NUCLEI
I
ZYGOTE NUCLEUS
AT INCEPTION
Рис 2. [Fig.2]. Relationships between the cell cycle and gamete caryogamy among seed
plants (from Carmichael, Friedman, 1995).
Двойное оплодотворение 155
флуоресцентной микроскопии Carmichael и Friedman (1995, 1996)
выделили три типа кариогамии у семенных растений (рис. 2):
Gi-кариогамия — ядра гамет содержат 1С ДНК во время
оплодотворения, а зигота вступает позже в фазу синтеза ДНК (перед
митозом);
S-фазная кариогамия — ядра гамет содержат 1С ДНК в
начале оплодотворения, репликация ДНК происходит перед концом
слияния ядер гамет;
Сг-кариогамия —ядра гамет проходят 5-период клеточного
цикла и увеличивают содержание ДНК от 1С до 2С до оплодотворения.
Эти типы кариогамии отражают характер взаимоотношений между
моделями клеточного цикла и процессом оплодотворения. Как видно
из приведенных авторами результатов исследования, кариогамия
может происходить в разные периоды клеточного цикла, а S-период
(т. е. период репликации ДНК) — в разные моменты процесса
оплодотворения (после слияния, перед концом слияния и до
оплодотворения).
Имеющиеся в настоящее время литературные данные по
оплодотворению у цветковых не позволяют сделать определенное заключение,
какие типы кариогамии характерны для них. Тем более, что только в
единичных работах приводятся сведения о периодах клеточного цикла
гамет и зиготы у исследуемого объекта, о длительности интерфазы и
т. д. Однако на основании уже известных фактов можно высказать
некоторые соображения. Во-первых,, при определении типа
кариогамии у цветковых необходимо, прежде всего, иметь в виду, что
существуют три типа оплодотворения (премитотический, постмитоти-
ческий и промежуточный), которые различаются по темпу объединения
мужских и женских ядер (Герасимова-Навашина, 1947а, б, 1951;
Gerassimova-Navashina, 1960, 1982). При премитотическом — ядра
спермия и женской гаметы объединяются до их вступления в митоз;
ядро спермия завершает свой митотический цикл после слияния с ядром
женской гаметы. При постмитотическом типе оплодотворения ядро
спермия оканчивает митотический цикл до объединения с ядром
женской гаметы, находясь с ним в контакте; слияние ядер осуществляется
после вступления их в митоз. Промежуточный тип оплодотворения
характеризуется кариогамией во время митоза. Сопоставляя концепцию
Герасимовой-Навашиной о типах оплодотворения с данными Carmichael
и Friedman о типах кариогамии, можно видеть, что в типах
оплодотворения кариогамия соотносится лишь с конечным периодом (М)
клеточного цикла (т. е. до, после или во время митоза), в то время
как тип кариогамии обозначает конкретный период клеточного цикла,
когда происходит слияние ядер.
Во-вторых, согласно современной концепции контроля клеточного
цикла, клетка не может вступать в митоз до тех пор, пока не
произойдет репликация ДНК (см. Jacobs, 1992, 1995).
156
Сел
Исходя из этих представлений и учитывая цитоэмбриологические
данные по процессу оплодотворения у различных видов цветковых,
можно полагать, что: 1 — премитотический тип оплодотворения
может объединять три типа кариогамии «Gj», «S» и «Сг»; 2 —
при постмитотическом и промежуточном типах оплодотворения
возможен только один тип — М-кариогамия (рис. 3).
Доказательством в пользу Gi-кариогамии у цветковых служат данные
по цитологии сингамии и содержанию ДНК в мужских гаметах и зиготе
у представителей родов Tradescantia (Woodard, 1956), Hordeum (Mogensen,
Holm, 1995; Mericle L., Mericle R., 1973; Bennett, Smith, 1976), Zea
(Moss, Heslop-Harrison, 1967; Kranz, Lorz, 1996), Petunia (Vallade, 1980),
Pennisetum (Sherwood, 1995), Triticum (Герасимова-Навашина, Батыгина,
1959; Батыгина, 1961а, b, 1962a, b, 1987; Gerassimova-Navashina, 1960,
1982). Дополнительным подтверждением существования Gj-кариогамии
у цветковых являются результаты исследования половых элементов
Crepis tectorum с помощью рентгенизации (Герасимова-Навашина и др.,
1963; Gerassimova-Navashina, 1971) и авторадиографии (данные
Алимовой — см. Герасимова-Навашина, 1980). При этом было установлено,
что мужские и женские ядра до их объединения не проходят S-период
клеточного цикла; меченый тимидин обнаруживался только в зиготе.
THE INTERCONNECTION BETWEEN FERTILIZATION TYPE, TYPE OF CARYOGAMY,
CELL CYCLE AND THE STAGE OF ZYGOTE DEVELOPMENT IN FLOWERING PLANTS
FERTILIZATION type
PREMITOTIC
INTERMEDIATE
POSTMITOTIC
Type of CARYOGAMY
jGi-
S-
G2- •:■:•:•
M-
M-'-:
Point of S-PERIOD
beginning in sexual
nuclei
after caryogamy
during caryogamy
(the end of nuclei
fusion)
before the beginning
ofsyngaray
before the end of caryogamy,
before the mitosis
Т7~ГТ7ш7ш7~7~7ТТ7Т77у
^STAGE OF ZYGOTE
/ DEVELOPMENT
/ corresponding ^ \
'/the S-period of cell cycle ^'
Косвенным указанием на С^-кариогамию у некоторых
представителей цветковых служат данные о том, что ядра спермиев удваивают
содержание ДНК до оплодотворения (D'Amato et al., 1965; Ермаков
и др., 1980).
Таким образом, можно выделить четыре типа кариогамии у
цветковых растений.
Gz-кариогамия: яйцеклетка и спермин проходят Go и Gj-периоды
клеточного цикла, ядра их сливаются в Gj-периоде, репликация ДНК
происходит после кариогамии, до митоза (в зрелой зиготе).
Ш
Z
о
Z
й
ы
о
О
m
ы
ы
Ш
ы
Й
ы
fa
о
о
й
о
ш
ы
ей
и
Я
а
Двойное оплодотворение
159
S-кариогамия: яйцеклетка и спермин проходят Go и Gj-периоды,
ядра их сливаются в S-периоде, репликация ДНК происходит во время
кариогамии, до митоза (в незрелой зиготе).
(г2-кариогамия: яйцеклетка и спермин проходят Go, C\ и S-периоды,
ядра их сливаются в Сг-периоде, репликация ДНК происходит до начала
сингамии (в гаметах).
М-кариогамия: яйцеклетка и спермин проходят Go, C\, S, Сг (и
частично М) -периоды, ядра их сливаются в М-периоде, репликация
ДНК происходит непосредственно перед окончанием кариогамии,
перед митозом (в незрелой зиготе).
Таким образом, слияние ядер гамет может происходить в разные
периоды клеточного цикла, что и определяет тип кариогамии
(рис. 4). Характер протекания клеточного цикла яйцеклетки-зиготы и
тип кариогамии, вероятно, скоррелированы с типом развития
зародышевого мешка (16 типов), семязачатка (красен- и тенуинуцеллятный
типы) и типом развития эндосперма.
Ядра мужских и женских гамет у многих видов растений проходят
интерфазу с разной скоростью, что обусловливает асинхронность их
вступления в периоды клеточного цикла (Банникова, Хведынич,
1973).
Темп плазмогамии и кариогамии. Общая продолжительность
сингамии у голосеменных растений — месяц и более, у покрытосеменных она
варьирует от нескольких минут до нескольких суток. Темп плазмогамии
и кариогамии также различен у разных видов покрытосеменных. У
Triticum плазмогамия происходит в течение 1 ч, кариогамия — 3-4 ч
(Батыгина, 1961а, б, 1974) (рис. 5). Через 5-15 мин после попадания
пыльцы на рыльце видны многочисленные пыльцевые трубки в тканях
пестика, которые достигают зародышевого мешка через 20-25 мин.
Спермин в пыльцевой трубке различны по форме, структурированы.
Ядро представляет собой клубок сильно скрученных хроматиновых
нитей, между петлями которых видны просветы. Спермин не образуют
ядрышко, практически лишены РНК, но богаты ДНК. Пыльцевая
трубка изливает свое содержимое в одну либо в обе синергиды. Через 25-30
мин спермин входят в «щель». Затем один из них проникает в
яйцеклетку, в цитоплазме которой находится около часа, претерпевая
дальнейшие превращения. При приближении к ядру яйцеклетки он
разрыхляется, отчетливо видна структура в виде хроматиновых нитей. Спермий
вблизи ядра яйцеклетки и в начале контакта имеет характерную форму:
один конец узкий, плотный, другой — широкий и более рыхлый. Ядро
спермия начинает контактировать обычно только одним, широким
концом, и затем постепенно погружается в ядро яйцеклетки. В течение 3-5
ч после опыления происходит деспирализация ядра спермия, деконден-
сация хроматина ядра. Хроматиновая нить теряет свою непрерывность
и через 3 ч после опыления появляется ядрышко. Весь процесс от
контакта ядра спермия с ядром яйцеклетки до выделения одного (или двух)
ядрышек и полной его деспирализации занимает 5-6 часов. Размер яд-
160
Семя
рышка изменяется в ходе деспирализации мужского ядра. Характер
поведения мужских и женских ядер позволяет считать, что кариогамия у
Triticum соответствует Gj-типу.
Существует определенная корреляция между характером
дифференциации гамет, метаболическим состоянием яйцеклетки и скоростью
кариогамии (Jensen, 1965; Банникова, Хведынич, 1973; Герасимова-Навашина,
Гуляев, 1973; Герасимова-Навашина, 1984; Плющ, 1992). Чем выше
хроматизация женских ядер, тем длительнее процесс кариогамии.
Как видно из схемы, в зависимости от типа оплодотворения и типа
кариогамии любая из стадий зиготогенеза может соответствовать
любому периоду клеточного цикла. Это ещё раз подтверждает таксоно-
специфичность прохождения клеточного цикла в зиготе. Возможно,
отсутствие строгой корреляции между стадией развития зиготы и
периодом клеточного цикла и объясняет противоречивость имеющихся в
литературе данных о строении зиготы, о темпах и характере сингамии у
разных видов цветковых растений. Рис. 11.
Банникова, Хведынич, 1973, 1982; Банникова и др., 1985; Батыгина, 1957, 1958,
1959, 1961а, б, 1962а, б, 1966, 1974, 1987, 1990, 1992; Батыгина и др., 1982;
Беляева, 1964, 1977, 1980, 1987; Герасимов, 1923; Герасимова-Навашина, 1947а, б,
1951, 1958, 1959, I960, 1962, 1971а, б, в, 1980, 1984, 1990; Герасимова-Навашина,
Батыгина, 1958, 1959; Герасимова-Навашина, Гуляев, 1973; Герасимова-Навашина,
Коробова, 1959; Герасимова-Навашина и др., 1963; Гургенова, 1928; Долгова-Хве-
дынич, 1967; Ермаков и др., 1980; Жукова, 1992, 1993; Замотайлов, 1968; Иоффе,
1968, 1976; Коробова, 1959, 1961, 1962, 1979, 1983; Кахидзе, 1954; Кострюкова,
Чернояров, 1938; Красников, 1988; Литвак, 1968; Модилевский, 1958; Навашин,
1898, 1910, 1911; М. С. Навашин и др., 1959; Навашин, Финн, 1912; Петрова,
1977; Плющ, 1987, 1989а-е, 1992; Плющ, Банникова, 1989; Поддубная-Арнольди,
1958, 1976; Полунина, 1961; Савина, 1956, 1964, 1965; Смирнов, 1982; Смирнов,
Граханцева, 1986; Старшова, Солнцева, 1976; Тарасенко и др., 1988; Терехин,
1991; Хведынич, 1972; Хведынич, Банникова, 1970а, Ь; Чеботарь, 1972, 1987;
Яковлев, Иоффе, 1965; Aelst van et al., 1990; Battaglia, 1963; Batygina, 1974;
Bennett, Smith, 1976; Berger, Erdelska, 1973; Bruun, 1987; Carmichael, Friedman,
1995, 1996; Cass, 1973, 1981; Cass, Karas, 1975; Chebotaru, 1970; Cocucci, 1988;
Cresti et al., 1988, 1990; D'Amato et al., 1965; Diboll, 1968; Dumas et al., 1985;
Erdelska, 1978, 1983; Favre-Duchartre, 1956; Faure et al., 1993; Ferguson, 1901a, b;
Friedman, 1990, 1991, 1995, 1996; Gerassimova, 1933; Gerassimova-Navashina, 1960,
1969, 1982; Godinaeu, 1969; Hageman, 1981, 1983; Hartog, 1904; Hause, Schr6der,
1987; Heslop-Harrison J., Heslop-Harrison Y., 1984, 1987a, b; Howard, Palk, 1953;'
Hu, 1990; Jacobs, 1992, 1995; Jensen, 1964a, b, 1965, 1968a, 1972, 1973; Jensen,
Fisher, 1967, 1968a, b; Kadej A., Kadej F., 1985; Kastern, 1860; Kranz, Lorz, 1993,
1994, 1996; Kranz. et al., 1995; Kudlicka et al., 1980; Lakshmanan, 1978; Lammeren
van, 1986; Linskens, 1968; Mericle L., Mericle R., 1973; Mogensen, 1972, 1975,
1978, 1982, 1986, 1988; Mogensen, Holm, 1995; Mogensen, Rusche, 1985; Moss,
Heslop-Harrison, 1967; Pearson, 1929; Pollock, Jensen, 1964; Russell, 1980, 1982,
1983, 1985a, b, 1990, 1991; Russell, Cass, 1988; Russell et al., 1990a, b; Schroder,
1984, 1985a, b, 1986a, b, 1988; Schulz, Jensen, 1968, 1971, 1973; Shattuck, 1905;
Sheridan, Neuffer, 1982; Sherwood, 1995; Steffen, 1953; Strassburger, 1877, 1884;
Szabo, O'Day, 1983; Taylor et al., 1957; Tilton, Mogensen, 1979; Vallade, 1980.
Двойное оплодотворение
161
Vazart, 1955, 1968; Vazart В., Vazart J., 1965; Went van, 1970a-c, 1984; Went van,
Linskens, 1967; Wettstein, 1906, 1911; Wilms, 1981a-d, 1985; Woodard, 1956; Wylie,
1904; You, Jensen, 1985; Zhang et al., 1996; Zhu et al., 1992.
ТРОЙНОЕ СЛИЯНИЕ — процесс слияния полярных ядер центральной
клетки с ядром спермия, в результате чего образуется первичное ядро
эндосперма. Синоним: кариомиксис1, кариогамия.
Прежде чем обсудить «тройное слияние», необходимо рассмотреть
элементы, участвующие в этом процессе: полярные ядра, вторичное ядро
центральной клетки, первичное ядро эндосперма2 (Davis, 1966;
«Embryology of Angiosperms», 1984; «Сравнительная эмбриология цветковых
растений», 1981, 1983, 1985, 1987, 1990). Вопрос о правомочности
использования этих терминов продолжает оставаться дискуссионным.
Battaglia (1987a), рассмотрев все эти понятия, предложил детальную
терминологическую систему. Остановимся лишь на двух рассмотренных
им терминах. Он предлагает вернуться к термину «центральные ядра»,
впервые предложенному Vesque (1897), так как замена этого термина
на «полярные ядра» (Fisher, 1880) не совсем корректна, как с
исторической и лингвистической точек зрения, так и по сути. Полярные
ядра, как совершенно справедливо отмечает Battaglia, не занимают
полярного положения в зародышевом мешке. Кроме того, Battaglia
приводит пример, с которым также трудно не согласиться, а именно:
образование так называемых полярных ядер в тетраспорических
зародышевых мешках Plumbago-типа («крестообразная полярность»).
Вместо термина «вторичное ядро», он предложил использовать
термин «центральный синкарион». В зависимости от числа центральных
ядер, участвующих в образовании синкариона (при различных типах
развития зародышевого мешка), последний может быть обозначен как
«синдикарион», «синтрикарион», «синтетракарион» и т. п.
Кроме того, Battaglia даже предлагает уйти от так называемых
«позиционных терминов», используемых Vesque, Fisher, Guignard и им
самим, и заменить их на функциональные:
1) проэндоспермальная клетка (= центральная клетка);
2) верхнее, нижнее, среднее проэндоспермальные ядра (полярные
ядра);
3) проэндоспермальный синкарион (= вторичное ядро);
4) зигоэндоспермальный синкарион (= оплодотворенное вторичное
ядро; первичное эндоспермальное ядро sensu /а/о).
Для окончательного утверждения новых терминов и замены ранее
используемых требуется широкое обсуждение в литературе, о чем пи-
Термин предложен Battaglia (1963) для обозначения процесса слияния ядер при
оплодотворении.
2
Продукт слияния трех гаплоидных ядер — ядро «зачатка» эндосперма (М. С.
Навашин, 1915) или «trophime» (Van Tieghem, 1900).
"I "J —828
162
Семя
шет и сам автор (подробнее см. Battaglia, 1987). Для удобства
изложения материала в статье используются общепринятые в классической
эмбриологии термины.
Как известно, в зависимости от типа развития женского гаметофита
количество полярных ядер в его центральной клетке может
варьировать от одного до нескольких (см. Полярные ядра, Т. 1).
Расположение полярных ядер в центральной клетке по отношению
к клеткам яйцевого аппарата и антипод до оплодотворения таксоноспе-
цифично. У многих цветковых растений отмечена миграция полярных
ядер, вторичного ядра центральной клетки и первичного ядра
эндосперма в процессе их образования и тройного слияния. Время
объединения полярных ядер варьирует у растений из различных таксонов.
Они могут сливаться до оплодотворения, во время или после него.
Вероятно, это и обусловливает то, что тройное слияние может
происходить либо одновременно, либо последовательно. Поддубной-
Арнольди (1976) была предложена следующая схема возможных
комбинаций тройного слияния.
1. Верхнее (Pi) и нижнее (Рг) полярные ядра сливаются, образуя
вторичное, или центральное ядро зародышевого мешка, которое
затем сливается с ядром одного из спермиев (sp), входящих в
зародышевый мешок (Pi + Рг) + sp. В результате слияния полярных ядер
с ядром спермия возникает первичное ядро эндосперма. Так
происходит в огромном большинстве случаев.
2. Слияние обоих полярных ядер и ядра спермия происходит
одновременно (Pi + Рг + sp).
3. Ядро спермия сначала сливается с верхним полярным ядром,
затем оплодотворенное верхнее полярное ядро сливается с нижним
полярным ядром (Pi + sp) + Рг.
4. Ядро спермия сливается сначала с нижним полярным ядром,
затем оплодотворенное нижнее полярное ядро сливается с верхним
полярным ядром (Рг + sp) + Р\.
Встречаются случаи апомиктичного развития первичного ядра
эндосперма (Коробова, 1962; Чеботарь, 1972).
Размеры полярных ядер могут различаться, при этом иногда
меньшее полярное ядро соединяется с ядром спермия (Lilium martagon,
Fritillaria tenella — С. Г. Навашин, 1898).
В зависимости от типа развития женского гаметофита первичное ядро
эндосперма может быть гаплоидным, диплоидным, триплоидным и
полиплоидным. При развитии зародышевого мешка по Polygonum-типу
первичное ядро эндосперма обычно триплоидное. Триплоидность
эндосперма впервые была установлена на примере Capsella bursa-pastoris
(Rosenberg, 1904). M. С. Навашин (1915) на основании детального
сравнительного изучения гаплоидных, диплоидных и триплоидных ядер
Crepis virens дал первую иллюстрацию метафазы триплоидного
эндосперма (Зп = 9). В зародышевом мешке Oenothera- и Eriostemones-типов
имеется лишь одно полярное ядро, при оплодотворении которого воз-
Двойное оплодотворение
163
никшее первичное ядро эндосперма оказывается диплоидным. Виды
Tulipa, Melampyrum также имеют диплоидный эндосперм, так как ха-
лазальное полярное ядро элиминирует, и ядро спермия сливается только
с микропилярным полярным ядром (Иоффе, 1976).
Проиллюстрируем возможные вариации тройного слияния.
Полярные ядра у большинства изученных злаков находятся лишь в
контакте до тройного слияния, а их объединение происходит после
контакта ядра спермия либо с одним, либо одновременно с двумя
полярными ядрами (Guignard, 1901a-c; Sax, 1918; Батыгина, 1962а,
Ь, 1974, 1987; Чеботарь, 1972; Batygina, 1974; Коробова, 1982;
Mogensen, 1982). Вероятно, последнее имеет место тогда, когда ядро
спермия попадает на границу обоих ядер. Однако у Triticum и Zea
отмечены случаи, когда сначала сливаются полярные ядра, образуя
вторичное ядро центральной клетки, потом последнее объединяется с
ядром спермия.
При объединении полярных ядер у Triticum часто видны между
ними остатки цитоплазмы, захваченной полярными ядрами при их
сближении (Батыгина, 1962а, б, 1974). Сходное явление было отмечено
у Impatiens glandulifera (Steffen, 1951) и у Arachis hypogaea
(Герасимова-Навашина, 1954b). При полном слиянии полярных ядер
участки захваченной цитоплазмы уже не видны. Электронно-
микроскопические исследования, проведенные на злаках, подтвердили
эти данные (Mogensen, 1982).
Во время тройного слияния ядро спермия меняет свою форму и
степень спирализации. У ядер спеомиев Triticum один конец тупой,
другой заостренный (Батыгина, 1962а, б, 1974, 1987), что было
подтверждено электронно-микроскопическими исследованиями (Chu,
Ни, 1981). При тройном слиянии сильно спирализованное ядро
спермия, находящееся в цитоплазме центральной клетки, меняет свою
форму при контакте с полярными ядрами. Оно как бы «расплющивается»
и его объединение с полярным ядром (или ядрами) начинается
неодновременно по всей поверхности, а обычно с его широкого конца. Анализ
электронограмм процесса двойного оплодотворения у Hordeum (Mogensen,
1982) подтвердил как разную форму и строение концов ядра спермия,
так и неодновременное погружение спермия в кариоплазму полярного
ядра. Изменение пространственной формы ядер спермиев говорит об
их активном движении.
Процесс погружения ядра спермия в полярное ядро (ядра) или
вторичное ядро центральной клетки сходен с таковым в яйцеклетке,
но происходит значительно быстрее. Тройное слияние, например, у
пшеницы занимает 1,5-2 ч и заканчивается через 2-3 ч после
опыления. В образовавшемся первичном ядре эндосперма на месте
«растворения» ядра спермия видны 1-2 ядрышка. В полярных ядрах
Triticum aestivum через некоторое время после их слияния часто
появляется довольно много дополнительных ядрышек, число которых
достигает 20; однако они сильно отличаются по своим размерам и
11*
164
Семя
окраске от ядрышек, выделенных ядром спермия. Аналогичные
ядрышки встречаются иногда и в неоплодотворенных полярных ядрах.
Природа этих дополнительных ядрышек пока неясна, но, по-
видимому, они указывают на повышенную метаболическую активность
центральной клетки. Следует отметить, что в центральной клетке
около полярных ядер неоднократно наблюдались включения, очень
схожие с этими ядрышками (Батыгина, 1974). В течение профазы
первого деления видна отдельно группа профатических нитей,
составляющих ядро спермия, которое по темпам развития несколько
опережает начало профазы полярных ядер, что также подтверждается
разновременным исчезновением ядрышек. Возможно, данное явление
объясняется очень коротким периодом покоя,1 в результате чего
мужской хроматин не успевает равномерно распределиться в женском
ядре, как это имеет место в зиготе пшеницы.
Подобное же явление, т. е. отдельную профазу мужского ядра при
тройном слиянии у пшеницы, видел Sax (1918), который отметил отличие
мужских хромосом от женских и в метафазе первого деления эндосперма.
Однако Батыгина (1974) различия мужского и женского хроматина в
этой фазе не наблюдала. Из-за кратковременности стадии интерфазы
ее довольно трудно обнаружить и только, используя метод очень дробных
темпоральных фиксаций, можно точно установить наличие указанной
стадии. По-видимому, это и явилось причиной того, что Sax не
обнаружил стадию интерфазы и пришел к неправильному заключению, что
в полярных ядрах центральной клетки пшеницы не бывает периода покоя,
а сразу наступает профаза, в которой и начинается объединение их с
ядром спермия, тоже находящимся в стадии профазы.
Процесс двойного оплодотворения у злаков идет по премитотическому
типу, т. е. объединение половых ядер происходит до митоза. Однако
объединение ядра спермия с полярными ядрами центральной клетки не
полностью соответствует премитотическому типу. Особенностью этого
процесса в центральной клетке является объединение ядра спермия с
ядрами центральной клетки до митоза и раздельное вступление ядра
спермия в профазу внутри первичного ядра эндосперма и полное
объединение хроматина спермия и полярных ядер в метафазе. Результатом
этого сложного процесса тройного слияния является отсутствие
объединения мужских и женских ядрышек в полярных ядрах центральной
клетки. Этот феномен асинхронного преобразования хроматина мужских
и женских гамет во время двойного оплодотворения у некоторых
видов растений, в том числе и злаков, некоторые исследователи
объясняют различными темпами прохождения мужскими и женскими
I ермин «интерфаза» представляется, с наших позиции, более корректным, чем
«покой». В этот период происходят сложные морфогенетические перестройки,
позволяющие первичному ядру эндосперма перейти к делению.
Двойное оплодотворение 165
гаметами периодов G\, S, Gi митотического цикла (Герасимова-
Навашина, 1980, 1990; Банникова, Хведынич, 1982).
Исходя из этого, можно полагать, что объединение ядер в центральной
клетке правильнее отнести к промежуточному типу оплодотворения, а весь
процесс двойного оплодотворения охарактеризовать все же как премито-
тический.
Время перехода первичного ядра эндосперма к делению таксоноспе-
цифично. Первичное ядро эндосперма приступает к делению сразу же
после тройного слияния (например, Juglandaceae) или спустя некоторое
время. Период интерфазы в первичном ядре эндосперма у пшеницы
кратковременен и занимает 0,5-1 ч (Батыгина, 1974). У
представителей сем. Butomaceae первичное ядро эндосперма делится почти
одновременно с зиготой спустя сутки после оплодотворения. Интерфаза
первичного ядра эндосперма Allium nutans продолжается 33-34 ч
(Стожарова, Поддубная-Арнольди, 1977). У Iris tenax деление
первичного ядра эндосперма происходит примерно через 70 ч после
оплодотворения (Соколовская, Шпилевой, 1990).
Развитие эндосперма может происходить по-разному, в зависимости
от условий произрастания вида. Так, у Anemone nemorosa в
популяциях на территории Польши он образуется из неоплодотворенной
центральной клетки (2n) (Trela, 1963 a, b; Brouland, 1967; 1969), в
то время как в условиях Ленинградской области у этого же вида —
в результате тройного слияния, (Зп = 45) (Иоффе, 1968, 1971b; Yoffe,
1969).
Модельным объектом для изучения поведения полярных ядер и
ядра спермия во время двойного оплодотворения являются
представители сем. Orchidaceae. У некоторых видов орхидей двойное
оплодотворение происходит нормально. Обычно объединение половых
ядер происходит по постмитотическому типу. В ряде случаев
наблюдаются нарушения во втором звене процесса двойного
оплодотворения — объединении ядра спермия с ядром или ядрами
центральной клетки (например, у Cypripedium insigne, Dendrobium nobile,
Calanthe veitchii и др.). Кульминационным моментом такого
нарушения является отсутствие слияния ядра спермия с ядром
центральной клетки (Oreorchis patens, Calanthe aristulifera, Listera nipponica)
(Савина, 1979; Поддубная-Арнольди, 1982; Савина, Поддубная-
Арнольди, 1990). Например, у Calanthe veitchii полярные ядра
обычно не сливаются и вместе с ядром антиподы образуют полярно-
антиподальную группу, чаще расположенную около яйцеклетки, а
впоследствии — около зиготы. Ядро спермия подходит к этой
группе ядер, но не сливается с ней, т. е. тройного слияния не
происходит. Далее вся группа ядер вместе с ядром спермия дегенерирует.
Эндосперм у этого вида орхидных не образуется (Поддубная-Арнольди,
1964, 1976). Существуют различные точки зрения относительно причин
нарушения двойного оплодотворения у орхидных. Hagerup (1944)
считает, что причиной отсутствия объединения ядра спермия с поляр-
166 Семя
ными ядрами исследованного им Orchis maculata является то, что
к моменту оплодотворения эти ядра мертвы. Герасимова-Навашина
(1954b) и Поддубная-Арнольди (1958) полагают, что нарушение
двойного оплодотворения у орхидных связано с редукцией
зародышевого мешка в процессе их развития.
Дискуссионным вопросом является наличие тройного слияния в сем.
Тгарасеае. Согласно большинству авторов (Gibelli, Ferrero, 1891; Ram,
1956; Гревцова и др., 1987), у представителей данного семейства
(Trapa natans, Т. bispinosa, Т. еигораеа и Т. сопосагра) двойное
оплодотворение происходит, но эндосперм как ткань не
образуется — первичное ядро эндосперма становится гипертрофированным и
перемещается в халазальный конец зародышевого мешка, где
постепенно дегенерирует. По сведениям Trela-Sawicka (1978), у Т. natans
эндосперм образуется; он нуклеарный, хотя и крайне эфемерный.
Следует отметить, что Trela-Sawicka судит о наличии двойного
оплодотворения лишь на основании изменения числа ядрышек во вторичном ядре
центральной клетки, а убедительные картины формирования
эндосперма в ее работе отсутствуют.
По данным Титовой (1988а, Ь, 1995), в зародышевом мешке
Т. astrachanica наблюдается, как правило, выпадение процесса
тройного слияния вследствие нарушения механизма расхождения
спермиев: задержка одного из спермиев в синергиде или в экстра-
целлюлярном пространстве. Характерно, что в отличие от других
видов Тгара, у Т. astrachanica образуются зрелые пыльцевые зерна
двух типов — дву- и трехклеточные, из которых прорастают чаще
последние. При этом ядро вегетативной клетки, как правило, не
выходит в пыльцевую трубку, как это обычно свойственно видам
с трехклеточными пыльцевыми зернами. По мнению автора,
наблюдаемое у данного вида отсутствие процесса тройного слияния может
быть обусловлено 1) нарушением связи между отдельными
элементами (ядром вегетативной клетки и спермиями) «мужской
оплодотворяющей системы», 2) тем, что вторичное ядро центральной
клетки у данного вида представляет собой продукт слияния трех ядер —
нормального, микропилярного полярного ядра и двух халазальных
ядер, не прошедших третье митотическое деление. К растениям, у
которых тройное слияние не происходит, относится Vencetoxicum
nigrum, Mitella pentandra, Zostera marina, Taraxia ovata, Zauschneria
latifolia (Maheshwari, 1950). Отсутствие тройного слияния характерно
для представителей сем. Podostemaceae (Коробова, 1985).
В апоспорических зародышевых мешках Роа pratensis в результате
нарушения дифференциации образуется много полярных ядер,
поведение которых во время оплодотворения различается. Например, одни
полярные ядра объединяются с ядром спермия, образуя первичное
ядро эндосперма, другие остаются неслившимися и включенными в
ткань эндосперма (Батыгина, Маметьева, 1979). Сходные особенности
развития апоспорических мешков были отмечены и у других растений,
Двойное оплодотворение
167
например, Elatostema, Iris и Taraxacum (Maheshwari, 1950; Поддубная-
Арнольди, 1976). i
Впервые Jensen (1964b) детально описал тройное слияние у
Gossypium hirsutum, которое впоследствии наблюдалось и на других
объектах (Schulz, Jensen, 1973; Kudlicka et al., 1980; Wilms, 1981b;
Hause, Schroder, 1987). Автор полагает, что сначала происходит
объединение наружной мембраны ядерных оболочек с участками
цистерн ЭР. Позже объединяются внутренние мембраны оболочки и
между сливающимися ядрами формируются мосты, которые
впоследствии объединяются, вытесняя цитоплазму центральной клетки,
расположенной между ядрами. Возможно, что цитоплазма центральной
клетки не вытесняется ядрами (Банникова, Плющ, 1988), а идет
ее автолиз (Батыгина, 1987). В отличие от Jensen, Плющ (1992),
изучая кариогамию у Adoxa moschatellina показала, что в зоне
эвагинаций ядерная оболочка разрывается, при этом перинуклеарное
пространство остается закрытым. Таким образом, тонкий механизм
тройного слияния не вполне ясен, поскольку отсутствуют
темпоральные электронно-микроскопические иссследования.
Продолжает оставаться дискуссионным вопрос о том, проникают ли
ядра спермиев в женские гаметы с цитоплазмой или без нее.
Известно, что в пыльцевом зерне и пыльцевой трубке спермин являются
типичными клетками. Одни авторы считают, что спермий
освобождается от цитоплазмы, оказываясь в синергиде (Поддубная-Арнольди,
1956; Красников, 1988) или в щели между яйцеклеткой и центральной
клеткой (Mogensen, 1982, 1988; Чеботарь, 1987; Russell et al., 1990a,
b). Другие авторы описывают постепенное уменьшение количества
цитоплазмы спермиев (например, у Spinacia oleracea — Wilms, 1981b,
1985; Epidendrum scutella — Cocucci, 1981) и числа органелл
(например, у Hordeum — Mogensen, Rusche, 1985).
У растений с однородительским (материнским) наследованием
элиминация элементов мужской цитоплазматической наследственности
может произойти в момент оплодотворения яйцеклетки (Mogensen,
1988), вероятно, такой же процесс происходит и при оплодотворении
центральной клетки. Mogensen (1988) и Russell et al. (1990a, b)
только в виде гипотетического варианта рассматривают вопрос о
том, что способ оплодотворения яйцеклетки и центральной клетки
у покрытосеменных различен. Различие состоит в том, что в
яйцеклетку проникает только ядро спермия, а в центральную клетку —
спермий с цитоплазматическими органеллами. Вероятно, существуют
виды растений, у которых цитоплазма попадает в яйцеклетку, и
виды — у которых остается за пределами яйцеклетки.
Дискутируется также вопрос о диморфизме спермиев у цветковых
растений. С. Г. Навашин (1927, 1951, с. 331) считал, что «спермий
одной и той же пары не одинаковы, так же как отличны друг от друга
участвующие в процессе женские ядра; и это — несмотря на то, что
и та, и другая пара ядер суть ядра сестринские, т. е. происходят от
168
Семя
деления одного материнского ядра, каковое деление в морфологической
науке принято до сих пор считать вообще эквационным». С. Г. На-
вашин показал, что спермин одной и той же пары являются энантио-
морфными «...подобно тому как асимметричное строение молекулы или
кристалла, находится в соотношении с оптической деятельностью
данного тела, так асимметрия гаплоидного ядра является условием
специфичного, половодеятельного состояния гаплоидных клеток, причем это
состояние должно проявляться в двух противоположных формах,
подобно тому, как проявляется оптическая деятельность в формах право-
и левовращающих тел одной химической природы» (Навашин, 1951,
с. 334). Последующие исследования подтвердили различия спермиев в
паре (см. Диморфизм спермиев. Т. 1). Основой направленного
расхождения являются попарные различия ядер спермиев, ядра
яйцеклетки и сестринского ему верхнего полярного ядра, т. е. различия,
которые дают возможность выбора каждому женскому ядру
соответствующего ему мужского. Так, у Casuarina equisetifolia ядро
наиболее крупного из спермиев сливается с ядром яйцеклетки, а
другого, меньшего — с полярными ядрами (или с вторичным ядром
центральной клетки у С. montana), находящихся в момент слияния вблизи
клеток яйцевого аппарата (Swamy, 1948d). Тройное слияние является
обязательным этапом двойного оплодотворения. Появление тройного
слияния привело к возникновению эндосперма, который благодаря
своей гибридной природе явился важным источником питания
зародыша (Козо-Полянский, 1949), что повысило жизнеспособность и
приспособляемость покрытосеменных (см. Двойное оплодотворение;
Эндосперм). Рис. 12.
Алимова, 1983; Батыгина, 1962а, б, 1974, 1987; Банникова, Плющ, 1988;
Банникова, Хведынич, 1982; Батыгина, Маметьева, 1979; Герасимова-Навашина,
1954, 1980, 1990; Гревцова и др., 1987; Забинкова, Кирпичников, 1957;
Замотайлов, 1958; Иоффе, 1968, 19716, 1976; Козо-Полянский, 1949; Коробова,
1962, 1979, 1982, 1985; Красников, 1988; М. С. Навашин, 1915; С. Г. Навашин,
1898, 1927, 1951; Плющ, 1992; Плющ, Банникова, 1989; Поддубная-Арнольди,
1956, 1958, 1964, 1976, 1982; Савина, 1979; Савина, Поддубная-Арнольди, 1990;
Соколовская, Шпилевой, 1990; Солнцева, Дгебуадзе, 1974; Стожарова, Поддубная-
Арнольди, 1977; Титова, 1988а, б; 1995; Чабан, Яковлев, 1974; Чеботарь, 1972,
1987; Шамров, 1990а; Battaglia, 1963, 1987а; Batygina, 1974; Brouland, 1967, 1969;
Chu, Hu, 1981; Cocucci, 1981; Davis, 1966; Fisher, 1880; Gibelli, Ferrero, 1891;
Guignard, 1901a-c; Hagerup, 1944; Hause, Schroder, 1987; Jensen, 1964b; Kudlicka et
al., 1980; Mah eshwari, 1950; Mogensen, 1982, 1988; Mogensen, Rusche, 1985; Ram,
1956; Rosenberg, 1904; Russell et al., 1990a, 6; Sax, 1918; Schulz, Jensen, 1973;
Steffen, 1951; Swamy, 1948d; Va n Tieghem, 1900; Trela, 1963a, b; Trela-Sawicka,
1978; Vesque, 1879; Wilms, 1981b, 1985; Yoffe, 1969.
Двойное оплодотворение
169 j
CYTOPLASMIC TRANSMISSION DURING FERTILIZATION
ПЕРЕДАЧА ЦИТОПЛАЗМЫ ПРИ ОПЛОДОТВОРЕНИИ
Cytoplasmic organelles, including the mitochondria and plastids, are
organelles with their own DNA, RNAs and protein synthesis machinery.
Despite this feature, they still depend on the importation of numerous critical
proteins, from which significant cytoplasmic compatibility problems may
originate. Since some phenotypic organellar characteristics are under nuclear
control (following Mendelian inheritance patterns) and others are under organellar
control (following non-Mendelian patterns), reciprocal breeding experiments
are usually needed to distinguish if their origin is cytoplasmic. If their
pattern of inheritance differs when a plant serves as a maternal or a paternal
parent, this is strong evidence of cytoplasmic inheritance. Since mitochondria
and plastids are inherited independently of one another, each organelle may
display different patterns of cytoplasmic inheritance.
In general, organelles may display either exclusively uniparental (maternal
or paternal) inheritance or display different degrees of biparental inheritance.
The most elegant evidence for biparental inheritance is the coexistence of
organelles of different origins within a single cell (heteroplasmy). Frequently,
however, these organelles may occupy different clonal lineages and appear
as variegated pigment patterns in the plant. Organelle lineages usually
segregate over time due to sorting-out so that a minority of the cells in a
mature plant may have both organella types. Variegation by itself is not
strong evidence of cytoplasmic control, however; in many cases a defect in
chloroplast pigmentation may be under nuclear control and the variegation
reflects clonal inheritance of nuclear patterns.
Plastid inheritance in the vast majority of angiosperms is uniparental
or predominantly maternal with a small «leakage» of paternal organelles
(Smith, 1989). A significant minority of angiosperms display biparental
plastid inheritance (Hagemann and Schroder, 1989). Only two cases of
predominantly paternal inheritance of plastids have been reported (Daucus —
Boblenz et al., 1990; Medicago — Smith et al., 1986). Mitochondrial
inheritance is poorly described from classical genetics because of a
scarcity of useful nonlethal markers, but it is believed to be even
more overwhelmingly maternal. A few instances using molecular methods
however have indicated the presence of male mitochondrial nucleic acids
in the offspring (Fairbanks et al., 1988; Erickson et al., 1989;
Erickson and Kemble, 1990; Faure et al, 1994).
Pre-fertilization mechanisms reducing male cytoplasmic inheritance.
Despite a common misconception about the cellular condition of the
sperm, both male and female gametes are organized as complete cells
containing a normal complement of organelles and surrounded by their
respective plasma membranes. An interesting exception is plants with
170
Семя
maternal plastid inheritance. These frequently have sperm cells that lack
plastids according to ultrastructural (Hagemann, Schroder, 1989) and
DNA fluorescence studies of plastid nucleoids (Corriveau, Coleman,
1988). Mitochondria are also reportedly absent in two orchids studied to
date, Epidendrum (Cocucci, Jensen, 1969) and Cymbidium (Yu, Russell,
1992), although ultrastructural studies outside of the orchids do not report
as extreme a condition for mitochondria.
The presence, absence, or relative quantity of heritable cytoplasmic
organelles in the male and female gametes is critical in determining the
cytoplasmic complement of the zygote. One obvious mechanism for restricting
the number of organelles from the male lineage at inception is the
asymmetrical mitotic division of the microspore, which forms a much smaller
generative cell (the immediate precursor to the two sperm cells in the
pollen grain) and a larger vegetative cell (the future pollen tube). This
mitotic field excludes significant numbers of organelles, and in the case of
plastids their larger size may cause them to vacate the future generative
cell cytoplasm. In any case, the generative cell is often less than 1 /o of
the volume of the pollen grain. Relatively little quantitative data is available
on changes in the volume of the cells of the male lineage. In Plumbago,
the generative cell is its largest at initiation and continues to lose volume
over the course of development (Russell and Strout, submitted). A relatively
small number of organelles is present in the newly formed generative cell.
The young generative cell of Plumbago contains less than five plastids and
fewer than 30 mitochondria (Russell, Strout, submitted), which is fewer
than one-fifth the number observed at maturity (Russell, 1984). Since this
plant displays biparental transmission (Russell, 1983, 1987), the secondary
increase in organelle numbers could increase the probability of inheritance
if the number of organelles containing DNA is proportionate to their numbers
(Bendich, Gauriloff, 1984). The multiplication of organelles from a restricted
population may be evidence of a «founder effect» that could reduce residual
organellar heterogeneity, if any, within the gametes.
Table: Number of organelles present in male and female gametes
at the time of fertilization in angiosperms
Species
Impatiens qlandulifera
Oenothera erythrosepala
Plumbago zeylanica
Plastids
Egg
150-480
25-32
730±110
Sperm
20
8-13
24,3+3,9
Mitochondria
Egg
1,000-2,500
NA
39,900±3,140
Sperm
50
NA
39,8+3,3
aRichter-Landmann, 1959; Meyer, Stubbe, 1974; CRussell, 1984, 1987; NA — not available.
Двойное оплодотворение 171
The diminution of male cytoplasmic organelles has been quantified in
sperm cells of barley (Mogensen, Rushe, 1985) and in developmental
stages of the orchid Cymbidium (Yu, Russell, 1992), and tobacco (Yu,
Russell, 1994a, c) through the formation of enucleated cytoplasmic bodies
(ECBs) which are shed from the cells. Each of these plants displays
predominantly maternal cytoplasmic transmission. Interestingly, there also
appears to be considerable evidence for male cytoplasmic diminution in
plants that normally transmit male organelles (Plumbago — Russell,
Strout, submitted). Possibly, such mechanisms for male cytoplasmic
diminution are present in all angiosperms regardless of their eventual
transmission. This tendency may reflect a need to streamline sperm cell
structure during pollen maturation and pollen tube growth, or it may
simply be a by-product of muscle-like actin-myosin associations that
appear to be involved in the movement of the gametes within the pollen
cytoplasm (Heslop-Harrison J., Heslop-Harrison Y., 1989; Tang et al.,
1989). Such movements may stress and stretch the cells of the male germ
line to their breaking point on numerous occasions (and at numerous sites)
during their descent in the pollen tube.
Modification of organelles during development has also been proposed
as a factor in the inheritance of the male cytoplasm. Vaughn et al. (1980)
proposed that organelles were directly «altered» (i. е., incapacitated)
within the male germ cells by an unspecified mechanism; however, their
exclusively ultrastructural approach did not eliminate the possibility of
artifacts; the use of any of the readily available cytochemical methods for
organellar function (e. g., Dickinson/1986), would have removed much of
the doubt about their conclusions. , Molecular modification of organellar
DNA has been reported in wheat microspores during tissue culture.
Organellar DNA was reported to be altered in the regenerated plants and
this was postulated as one mechanism for male DNA exclusion (Day,
Ellis, 1984). More recent work on barley has suggested that these
alterations in the chloroplast genome occur during regeneration, rather than
the earlier stages of reproductive committment (Mouritzen, Holm, 1994).
In vivo organellar DNA changes in the male lineage have not been
studied on a molecular level yet. It is also evident that cytoplasmic DNA
visible in fluorescence microscopy disappears during development in some
plants with maternal inheritance (Miyamura et al., 1987), but it is not
evident whether this occurs by the elimination of plastids (Clauhs, Grun,
1977), or if the DNA simply reduces to levels lower than can currently
be resolved using fluorescent probes. The occurrence of nuclease С
(Ca2+-dependent) has been implicated in the elimination of male
organellar DNA in higher plants (Nakamura et al., 1992); interestingly
this appears to be related to the enzyme involved in the postzygotic
elimination of organellar DNA in lower plants. During meiosis and later
development, alterations in organellar structure are readily evident,
suggesting that selection of organelles may indeed precede sperm cell
formation (Dickinson, 1986). Although identical organelles may appear
172
Семя
different within physiologically different cells (Russell, 1983), the
possibility of meiotic and post-meiotic rearrangements of organelles is
still present given the extensive associations between functional organelles
and the nucleus as observed during microsporogenesis in Cosmos
(Dickinson, 1986).
Transmission of male organelles during fertilization. Double fertilization
involves the cellular fusion of one sperm with the egg cell and the other
with the central cell. Both fusions use sperm cells derived from the same
precursor cell, the generative cell, in order to initiate distinct and dissimilar
developmental pathways. As in cytoplasmic inheritance, the transmission of
organelles during fertilization appears to follow three patterns: organelle
transmission may be exclusively maternal or exclusively paternal, or biparental.
In plants with maternal cytoplasmic inheritance, the sperm cytoplasm is
usually impoverished in organelles, particularly plastids, and in this case
the transmission of the male cytoplasm would seem to have no effect on
the egg cell. This is true of Nicotiana (Yu et al., 1994), which shows
transmission of apparently all of the male cytoplasm into both the egg and
central cell, and may also be true of Petunia (van Went, 1970), sincfe
no ECBs indicating nontransmission were captured in this plant.
In barley, apparently the entire cytoplasmic volume is stripped from the
sperm nucleus during gametic fusion (Mogensen, 1982, 1988). Since Mo-
gensen noted that only one such ECB was found (always in contact with
the egg) and that its organellar complement equalled that of intact sperm
cells, he concluded that sperm cytoplasm was excluded from the egg, but
was transmitted into the central cell. The likelihood of male cytoplasmic
exclusion from both the egg and central cells is suggested by Jensen and
Fisher's observation in cotton of two large cytoplasmic regions of the
approximate size of male cytoplasm within the degenerate synergid of the
fertilized embryo sac (Jensen, Fisher, 1968; Fisher, Jensen, 1969). Pre--
fertilization fusion of the two sperm cells was observed in spinach (Wilms,
1981); he postulated the transmission of the sperm nuclei in opposite
directions to the egg and central cell, simultaneously with the disintegration
of the remaining cytoplasm. The vacuolization of the sperm cells also appears
to be a general trend prior to fertilization and may represent another
mechanism that allows heritable cytoplasmic organelles to be excluded from later
fertilization steps. In Populus (cottonwood), this trend appears to reach an
extreme which may spatially separate the nucleus and the cytoplasm enough
to trigger male cytoplasmic exclusion (Russell et al., 1990).
Biparental inheritance appears to be the result of sperm cells rich
in cytoplasmic organelles fusing in entirety with female reproductive
cells. Essentially all of the sperm cell organelles appear to be
transmitted in Plumbago (Russell, 1983, 1984) except for a cellular
projection that physically associated one sperm cell with the vegetative
nucleus. ECBs presumably orginating from this projection account for
15% of the sperm organelles. In this plant, the pattern of membrane
fusion and subsequent vesiculation suggest that the entire surrounding
Двойное оплодотворение
173
cytoplasm of the sperm may be transmitted directly into the egg and
central cell cytoplasm (Russell, 1983, 1985, 1987). Other plants with
predominantly maternal cytoplasmic inheritance also seem to follow this
pattern (Petunia — van Went, 1970; Lycopersicon — Kadej A.,
Kadej F., 1983, 1985; Nicotiana — Yu et al., 1994).
The occurrence of strictly paternal cytoplasmic inheritance has infrequently
been reported in angiosperms (Medicago — Smith et al., 1986; Daucus —
Boblenz et al., 1990). In Medicago (Zhu et al., 1990, 1991, 1992, 1993),
careful enumeration and three dimensional reconstruction of gametes revealed
that differences in the female gamete appear to be responsible for paternal
plastid inheritance, for both 'weak' and 'strong' sperm donors had numerous
plastids in their generative cells and similar numbers of plastid nucleoids
(Shi et al., 1991). The difference appears to be in plants susceptible to
paternal inheritance in which the unfertilized egg contains plastids only in
the micropylar half of the cell. After fertilization, the maternal plastids
remain in the basal half of the zygote. Only paternal plastids are therefore
present in the apical cell that becomes the embryo proper (Zhu et al.,
1993). The basal cell organizes the suspensor, which is a terminal embryonic
lineage that is not expressed in the mature plant. A structural investigation
of Daucus muricatus revealed that only a small number of plastids (8 to
12) were present in the egg and that some apparent plastids at the periphery
of the egg appeared to be degenerating (Hause, 1991). These eggs further
displayed a relatively high degree of vacuolization when compared to the
eggs of D. carota and D. aureus, which displayed greater maternal
inheritance.
Post-fertilization mechanisms reducing male cytoplasmic inheritance.
The control of parental cytoplasmic inheritance within in the zygote most
frequently appears to be the result of organellar competition in different
cellular lineages, a process described as «sorting-out» in which relaxed cellular
control is exerted on the organelles. In this model, minority populations of
organelles are progressively eliminated from cellular lineages through time
(Birky, 1983). Given enough mitotic divisions, cells containing multiple
organelle types would be reduced in frequency until one or the other
organelle is extinct within that lineage. Superimposed on this pattern is
the possibility of sperm dimorphism, including nuclear differences (J3--
chromosome non-disjunction in the generative cell of corn — Roman,
1948) or cytoplasmic differences in content of either plastids or mitochondria
or both (Russell, 1984, 1985, 1993).
One instance of uniparental inheritance that has not been observed is
a counterpart to the «restriction» mechanisms reported in unicellular plants,
in which a single mitochondrion and plastid of each mating type is transmitted
into the zygote, but only one organelle of each type survives (Gillham,
1994). In these cases, the organellar DNA of one mitochondrion and one
plastid is destroyed after fertilization through proposed restriction sites in
the genome. The surviving mitochondrion and plastid are determined by
mating type and may be of opposite types (reviewed in Snell, 1990).
174
Семя
Evidence for a cytoplasmic restriction of male cytoplasmic organelles is not
available in angiosperms.
«Leaky» mechanisms for cytoplasmic inheritance. Frequently,
cytoplasmic inheritance mechanisms allow for the occasional penetration of
male characteristics into a predominantly maternal cytoplasmic pattern.
Many of the models of maternal cytoplasmic inheritance in flowering
plants thought to be exclusively maternal actually express some male
cytoplasmic characteristics in large scale classical genetic studies
(Nicotiana — Medgyesy et al., 1986) and in molecular studies
(Brassica — Erickson et al., 1989; Erickson, Kemble, 1990;
Medicago — Fairbanks et al., 1988; Musa — Faure et al., 1994;
Populus — Rajora et al., 1992). This penetration is common enough that
plants with traces of male cytoplasmic inheritance in normally maternal
cytoplasm can be considered as a separate class (Smith, 1989). In
Nicotiana, there is a particularly interesting opportunity for a redundant
transmission of male organelles; in this plant, the sperm nucleus itself may
sometimes contain identifiable mitochondria that are transmitted into the
fusion nuclei of the zygote and primary endosperm (Yu, Russell, 1994b).
Apparently these are incorporated into the sperm nuclei during generative
cell division when organelles are not effectively excluded from the
metaphase plate and cytoplasmic organelles may be incorporated in the
sperm nucleus during nuclear envelope reformation. This is potentially
interesting because the incorporation of organelles in the nucleus would
allow organellar DNA access to the nucleus and, through recombination,
could contribute to its permanent incorporation in the nuclear genome.
Numerical studies of heritable cytoplasmic organelles during
fertilization. Relatively few studies enumerate the organelle content of both male
and female gametes although this may be critical if «sorting-out» is a major
method determining the nature of cytoplasmic inheritance in angiosperms.
Considerable evidence to date indicates that male organelles are at a disadvantage
for future expression in the offspring. Even in the cases of biparental expression,
male cytoplasmic organelles may be in the minority. The direct numerical
impact of male and female organelles has been the subject of only three
studies in flowering plants to date (Richter-Landmann, 1959; Meyer, Stubbe,
1974; Russell, 1987). These results are given in the Table.
Impatiens, with maternal plastid inheritance, displays male: female plastid
ratios of from 7 to 24 to Plumbago displays male: female plastid ratios
of 30:1, whereas Oenothera, which displays frequent biparental inheritance
has male: female plastid ratios of from 1.92 to 4:1. Mitochondrial ratios
are on the order of 200:1 or higher for female mitochondria to male
mitochondria (200 to 500:1 for Impatiens and approximately 1:1000 for
Plumbago), which would suggest extinction of the male mitochondria in many
cell lineages during even early embryogenesis — especially since somatic
cells usually contain fewer than 200 mitochondria. The only additional avenue
to male expression is through recombination, which is relatively frequent in
mitochondria, but has been rarely reported in plastids (Smith, 1989).
i
Двойное оплодотворение 175
Although the predominant pattern of cytoplasmic inheritance is maternal,
numerous mechanisms seem designed to reduce genetic variability in the
cytoplasmic genome at the same time that it is preserved in the nucleus.
Redundant and overlapping mechanisms cause the volume of the male
cytoplasm and number of organelles to be reduced. At the same time, these
mechanisms are incomplete, since male organelles frequently do penetrate
into the cytoplasmic complement of the offspring. A remaining question is
whether there is any particular pattern to organellar inheritance. The trend
is toward an insular cytoplasmic genetic complement, but exceptions abound.
In this context, the variable nature of organelle heredity seems to provide
evidence for the lack of a clear advantage in retaining cytoplasmic
heterogeneity. However, current evidence also indicates that there are no
mechanisms that actively promote heterogeneity either. Fig. 13.
Bendich, Gauriloff, 1984; Birky, 1983; Boblenz et al., 1990; Clauhs, Grun, 1977;
Cocucci, Jensen, 1969; Corriveau, Coleman, 1988; Day, Ellis, 1984; Dickinson, 1986;
Erickson, Kemble, 1990; Erickson et al., 1989; Fairbanks et al., 1988; Faure et al.,
1994; Fisher, Jensen, 1969; Gillham; 1994; Hagemann, Schroder, 1989; Hause, 1991;
Heslop-Harrison J., Heslop-Harrison Y., 1989; Jensen, Fisher, 1968; Kadej A., Kadej
F., 1983, 1985; Medgyesy et al., 1986; Meyer, Stubbe, 1974; Miyamura et al., 1987;
Mogensen, 1982, 1988; Mogensen, Rusche, 1985; Mouritzen, Holm, 1994; Nakamura
et al., 1992; Rajora et al., 1992; Richter-Landmann, 1959; Roman, 1948; Russell,
1983, 1984, 1985, 1987, 1993; Russell et al., 1990; Russell, Strout (Submitted); Shi
et al., 1991; Smith, 1989; Smith et al., 1986; Snell, 1990; Tang et al., 1989; Went
van, 1970; Vaughn et al., 1980; Wilms, 1981; Yu, Russell, 1992, 1994a, b, c; Yu et
al., 1994; Zhu et al., 1990, 1991, 1992, 1993.
ПРОЦЕСС ДВОЙНОГО ОПЛОДОТВОРЕНИЯ И МИТОТИЧЕСКИЙ ЦИКЛ
КЛЕТКИ (МИТОТИЧЕСКАЯ ГИПОТЕЗА)1
Несмотря на многолетнее изучение процесса оплодотворения у
покрытосеменных, принявшего у этой группы растений форму «двойного
оплодотворения», остается ряд нерешенных вопросов о природе
своеобразия его прохождения, хотя преимущественное значение этой
формы оплодотворения стало очевидным с момента ее открытия. Здесь,
как показал С. Г. Навашин (1898), одновременно оплодотворяются
две соседние клетки зародышевого мешка, что благодаря различным
цитолого-морфологическим особенностям этих клеток приводит к резко
различающимся результатам: образованию зародыша и специальной
высокопродуктивной ткани, необходимой для его развития, — эндос-
Текст печатается из работы Е. Н. Герасимовой-Навашиной (1990) с
сокращениями.
176
Семя
перма, который в результате оплодотворения оказывается
одновременно и гибридной, и полиплоидной природы.
Процесс двойного оплодотворения был изучен более чем у 300
видов (Поддубная-Арнольди, 1976), причем было обнаружено, что
процесс этот сильно разнообразится в своем выражении у различных
представителей, что отметил уже и сам его открыватель Навашин
(1900, 1910), указав на принципиальные пути его изучения.
В настоящее время стало ясно, что вышеуказанное разнообразие в
формах протекания процесса двойного оплодотворения зависит от
генетически обусловленного и эволюционно закрепленного разнообразия
развития гамет в гаметофитах, которые у покрытосеменных сами
являются порождениями спорофитов, и, следовательно, подчиняются
условиям, которые складываются в последних к моменту образования
гамет. Спорофиты же сильно различаются в столь обширной группе
растений, что и отражается на подготовке половых элементов, а,
следовательно, в дальнейшем и на разнообразии форм протекания самого
процесса оплодотворения.
Основное, что определяет осуществление у покрытосеменных именно
двойного оплодотворения, — это попарное возникновение
метаболически неполноценных половых элементов как мужских, так и
женских, т. е. таких, которые в дальнейшем могут продолжать свое развитие
только совместно. Это обеспечивается функционированием определенных
структур, филогенетически унаследованных от предыдущих групп, что
сделало процесс двойного оплодотворения у покрытосеменных
возможным вполне и что явилось одним из важнейших факторов, обусловивших
господствующее положение этой группы растений.
В мужской сфере такой структурой является двуклеточное
пыльцевое зерно — по существу сокращенный в своем развитии гаметофит,
который возникает в результате дифференциального деления
микроспоры (Герасимова-Навашина, 1951). В мужском гаметофите в
дальнейшем делится лишь одна из его клеток — меньшая (генеративная, или
спермиогенная), что и приводит к одновременному возникновению
двух спермиев, которые, однако, останавливаются на том или ином
этапе своего развития. Эта остановка в основном происходит из-за
ограниченного количества и особого качества цитоплазмы, которую они
получают от генеративной клетки в пыльцевом зерне или уже в
пыльцевой трубке, где они проходят свой онтогенез.
Если количество цитоплазмы генеративной клетки очень ограничено,
то из нее образуются спермии-ядра. Они не могут стать
везикулярными, и поэтому остаются компактными — сильно хроматизированными и
часто, вследствие деспирализации своих хромосом сильно вытянутыми
телами, облеченными лишь в мембранные оболочки, что показал Cass
(1973) для ячменя на электронно-микроскопическом уровне. Такие
спермин обычно возникают в пыльцевых зернах, которые в этом
случае называются трехклеточными. Образуясь обычно в относительно
однородной среде пыльцевого зерна, такие спермин бывают сходны по
Двойное оплодотворение
177
своему внешнему виду (свойственны в основном сложноцветным,
злаковым и др.).
Если же спермин формируются из генеративной клетки, имеющей
большее количество цитоплазмы, то они продвигаются далее в своем
онтогенезе. Сохраняя вокруг себя некоторое количество цитоплазмы,
их ядра становятся везикулярными — округлыми или овальными, они
имеют более плотные оболочки, и в них возникают ядрышки, так как
начинается деконденсация их хроматиновых элементов.
Однако такие спермии-клетки тоже не могут самостоятельно
продолжать свой онтогенез из-за неполного развития элементов, для этого
необходимых. В первую очередь у такого рода спермиев не соблюдены
ядерно-цитоплазматические отношения, которые визуально сразу
сказываются на ядерно-ядрышковых отношениях, необходимых для
нормального функционирования любой клетки, так как ядрышко является
одним из основных участников выработки рибонуклеиновых, а
следовательно, белковых компонентов клетки. Другие элементы в
цитоплазме таких спермиев также находятся в ювенильном состоянии, как это
показали исследования на ультраструктурном уровне (Cocucci, 1981).
По мере прохождения пыльцевой трубки в тканях пестика
устанавливается определенный градиент, вследствие чего спермии-клетки часто
могут быть различного вида.
Вторая клетка пыльцевого зерна — большая (вегетативная, или си-
фоногенная), — хотя и не делится, но обеспечивает в основном всю
жизнедеятельность пыльцевого зерна на всех этапах его онтогенеза. Она
принимает самое активное участие в процессе оплодотворения в целом,
составляя тем самым вместе со спермиями единую оплодотворяющую
систему — мужской гаметофит (Герасимова-Навашина, 1951).
В женской сфере половые элементы образуются также гаметофитом,
сильно сокращенным в своем развитии. Обычно возникает относительно
однотипная двуполярная (биполярная, ред.) структура —
зародышевый мешок. Указанная однотипность, очевидно, возникает в силу
действующих в ходе развития зародышевого мешка определенных клеточных
закономерностей (Герасимова-Навашина, 1955, 1957, 1958).
Различные результаты (зародыш и эндоспермальная ткань) двух
соседствующих и одновременно оплодотворяемых женских клеток, по
существу возникающих от деления одной и той же клетки гаметофита,
генетически обусловлены и эволюционно закреплены с самого начала
различным положением каждой из этих клеток в системе целого.
На основании результатов исследования строения и функционирования
половых элементов у сложноцветных и анализа литературных данных
установлено два типа прохождения процесса двойного оплодотворения
(Gerassimova, 19334, Герасимова-Навашина, 1947а-в, 1951): премитотичес-
кий, когда объединение ядер половых элементов происходит перед
первым делением зиготы (сложноцветные), и постмитотический тип, когда
ядра половых элементов объединяются после начала или в ходе деления
зиготы (лилейные). Однако, как показали дальнейшие исследования,
-| 2~828
178
Семя
имеется ряд промежуточных типов. Прохождение процесса
оплодотворения по тому или иному типу обусловлено степенью подготовленности
половых элементов —^ структурно-морфологическим характером их
развития, что по существу и является определяющим в становлении
разнообразия прохождения процесса.
Установление типов оплодотворения оказалось возможным после того,
как было обнаружено, что ядра спермиев с момента своего образования
.и до объединения с женскими проходят один митотический цикл. Начав
его в том или ином типе оплодотворения в спермиогенной клетке, спермин
могут закончить этот цикл и начать новый только в женской сфере,
проходя уже совместно с ней подготовку к новому митозу — первому
делению зиготы. Аналогичный процесс происходит и в первичной клетке
зачатка эндосперма, ядро которого начинает свое деление тоже совместно
с мужским ядром для образования эндоспермальной ткани.
Премитотический цикл оплодотворения обычно свойствен
компактным спермиям, состоящим в основном из хроматиновых элементов
(спермии-ядра). Такого рода спермин вскоре после проникновения в
женские клетки погружаются в их ядра, где и могут возобновить свой
митотический цикл, здесь у них возникают ядрышки и происходит
полная деконденсация их хроматиновых элементов, о чем
свидетельствуют прекращение (или ослабление) их окрашивания основными
красителями и потеря реакции по Фельгену на ДНК при окрашивании
реактивом Шиффа, подобно тому, как это происходит при митозе в
определенных меристематических тканях с ядрами, переходящими в
интерфазное состояние.
В связи с указанными наблюдениями и возникло представление о
том, что в основе двойного оплодотворения лежит митотический цикл
клетки (Герасимова-Навашина, 1947 г). «Митотическая» гипотеза
двойного оплодотворения объяснила природу движения мужских
гамет к соседним женским в зародышевом мешке — центральный вопрос
двойного оплодотворения, решение которого С.Г. Навашин (1927)
оставил открытым, хотя и указал на безусловную самостоятельную
подвижность мужских половых элементов (Навашин, 1910).
Расхождение спермиев, согласно «митотической» гипотезе,
объяснялось взаимным отталкиванием двух мужских групп хромосом подобно
тому, как это наблюдается в ана-телофазных ядрах, и остается еще
некоторое время после окончания митоза между двумя сестринскими
ядрами в любой делящейся клетке. Отталкивание двух активных ядер,
оказавшихся в одной клетке, впервые обнаружил Герасимов (1923),
наблюдая это динамическое явление в клетках водоросли Spirogyra.
Природа этой движуще-й силы осталась не выясненной, хотя можно
полагать, что эта сила подобна электростатическому взаимодействию.
Сходное отталкивание двух мужских ядер друг от друга, очевидно,
имеет место в зародышевом мешке при постмитотическом типе
оплодотворения, когда пыльцевой трубкой вносятся спермии-клетки; здесь
они в области разрушающейся синергиды освобождаются от своего
i ■ ■
| Двойное оплодотворение 179
цитоплазматического окружения (Фшн, 1926; Гургенова, 1927;
Madge, 1929; Wylie, 1941; Беляева, 1977; Герасимова-Навашина,
1980), и только после этого округлые или овальные ядра спермиев
расходятся, попадая в женские клетки. В этом типе оплодотворения,
как уже сказано, половые элементы объединяются позднее, иногда уже
в ходе деления женского ядра в зиготе (профазе-метафазе), очевидно,
именно в силу того, что у такого рода спермиев (как бы более
зрелых) развиты оболочки их ядер, которые могут раствориться только
в ходе митоза; иногда же половые ядра, уже приходя в контакт друг
с другом, вступают в период деления почти совместно, что и
обусловливает наличие различных промежуточных типов оплодотворения.
Таким образом, митотическая гипотеза двойного оплодотворения
указала на связь двух биологических явлений — митоза и процесса
оплодотворения. Митотический, или жизненный цикл спермиев
оказался как бы растянутым в пространстве и времени и тем
самым эволюционно приспособленным для прохождения столь
своеобразного процесса оплодотворения в растительном мире.
Митотическая гипотеза получила более конкретную интерпретацию
после того, как Howard и Pelc (1953), Taylor с соавторами (1957),
Wolfsberg (1964) расчленили фазы митотического цикла на
определенные периоды, что можно было сделать и для хода оплодотворения с
половыми элементами, поскольку их развитие, структура и
функционирование уже ранее были связаны с фазами митотического цикла
(Gerassimova-Navashina, 1969; Герасимова-Навашина, 1971а, в).
В связи с тем, что и компактные спермии-ядра в пыльцевых зернах,
и спермии-клетки в пыльцевых трубках метаболически не активны, их
состояние в это время условно было названо мною Go; только попав
в зародышевый мешок, те и другие спермин могут в женских клетках
полностью закончить свой митотический цикл — вступить в период
интерфазы Gi и уже вместе с женскими клетками — в периоды S и
Ql, для подготовки к первому делению зиготы — началу развития
новой особи, и делению клетки зачатка эндосперма для развития этой
ткани. В последней клетке, как известно, развитие всегда начинается
быстрее, надо полагать, из-за более высокого уровня ядерно-цитоплазмати-
ческого отношения, сдвинутого здесь в сторону цитоплазмы и, как показано
для Crepis capillaris на электронно-микроскопическом уровне (Герасимова-
Навашина, Гуляев, 1973), в ней более развит ЭР, что и активизирует ее
к более быстрой подготовке к делению.
Однако спермин у некоторых растений, уже попав в женские ядра,
быстрее проходят периоды Q\, S и Gi и иногда неодновременно с
женским партнером вступают в метафазу зиготы. Возможно, это происходит
вследствие того, что женская сфера у некоторых растений так сильно
ингибирована, что для выхода из этого состояния требуются более
длительные сроки (т. е. генерационное время), чем спермию, который только
что в пыльцевой трубке был остановлен в своем онтогенезе. Происходит
это часто в промежуточном типе оплодотворения. Однако это явление
12*
180
Семя
наблюдалось у Lilium regale, а позднее у Galtonia candicans
(Герасимова-Навашина, 1980). Эти интересные цитохимические
превращения половых элементов изучались с помощью люминесцентной
микроскопии и другими биофизическими методами (Хведынич и др., 1978;
Сердюк и др., 1978; Khvedynich, Bannikova, 1983).
По мере развития наших знаний митотическая гипотеза получила
несколько иную интерпретацию в связи с изменениями физико-химического
порядка, обнаруженными при параллельном анализе поведения как спер-
миев, так и ядерных элементов в ходе митоза в клетках меристемати-
ческих тканей; эти данные изменили взгляд на природу расхождения
спермиев при премитотическом типе оплодотворения (Навашин,
Герасимова-Навашина, 1958; Герасимова-Навашина, 1978, 1980;
Gerassimova-Navashina, 1982; Герасимова-Навашина, Сальникова, 1982).
Как оказалось, сильно хроматизированные спермин у видов Crepis,
действительно блокированные на стадии телофазы (Go), не осуществляют
в зародышевом мешке сразу своего ана-телофазного расхождения, как
предполагалось ранее, а возобновляют ход своего прерванного развития,
вступая в дальнейший цикл митотических превращений. Однако, если
в меристематических клетках хромосомы сестринских ядер
освобождаются от своего РНК-компонента (матрикса) в телофазе, когда, как
известно, происходят деконденсация хромосом и выделение ядрышка,
то в ходе оплодотворения хромосомы спермиев освобождаются от РНК-
компонента в условиях зародышевого мешка, очевидно, после растворения
их мембранных оболочек, что и составляет замеченную уже ранее
(Gerassimova, 1933) сущность их морфолого-функционального превращения.
Происходит это, очевидно, под влиянием ферментативной деятельности
содержимого зародышевого мешка, а, возможно, и разрушающихся в это
время синергиды и вносимого содержимого пыльцевой трубки. После
указанных превращений комплексы спермиев, составленные теперь в основном
из ДНК-протеидов, получают способность взаимно отталкиваться друг от
друга, попадая одновременно в женские клетки, в ядрах которых и
наступает окончательное завершение их митотического цикла — сначала
вступление в интерфазный период G\, а после полной деконденсации их
хромосом и выделения ядрышка — в интерфазный период S зиготы, т. е.
так, как это постулировалось митотической гипотезой.
Этот вывод (Gerassimova-Navashina, 1982) сделан на основании
открытого мною нового факта, что в ходе митоза меристематических
клеток в начальных его фазах (ранняя профаза), когда хромосомные
структуры еще лишены РНК-компонента и состоят только из ДНК-
протеидов, эти структуры обнаруживают отталкивание друг от друга,
которое уменьшается лишь в поздней профазе, когда хромосомные
нити облекаются в изолирующий их РНК-компонент (матрикс).
Оттолкнувшись так или иначе друг от друга и одновременно попав
в женские клетки, ядра спермиев, по-видимому, двигаются здесь по
иному принципу, а именно: они приближаются к «динамическим центрам»
этих клеток, где в это время и лежат женские ядра (Герасимова-Навашина,
Двойное оплодотворение
181
1955). Особенно это показательно там, где ядро центральной клетки
лежит на далеком расстоянии от яйцеклетки, часто в узком тяже
цитоплазмы, иногда у самого ее халазального конца. Наиболее характерным
примером является Galtonia candicans Deche. (Герасимова-Навашина, 1980),
где ядро спермин двигается вдоль очень длинного здесь тяжа цитоплазмы,
находя в конце его как бы свой «динамический центр». Это происходит
благодаря структурно-физиологическим свойствам цитоплазмы указанной
клетки, которая у Galtonia candicans сильно вакуолизирована, и поэтому
спермий двигается здесь подобно тому, как это имеет место в условиях
пыльцевой трубки, где, как установил М. С. Навашин (1968), мужские
половые элементы останавливаются недалеко от конца пыльцевой трубки,
находя здесь как бы динамическое равновесное состояние двух
направленных навстречу друг другу токов цитоплазмы. Наиболее правильное
объяснение этому явлению, имеющему место в пыльцевой трубке, дала
Коробова (1979), которая указала, что спермин в пыльцевой трубке
занимают определенное и постоянное положение, несмотря на ее
непрерывный рост, именно потому, что в ней все время образуются каллозные
пробки, что и сохраняет неизменными ее протоплазматические размеры
и расположение ее динамического центра, в котором и находятся все
время спермин или спермиогенная клетка.
При помощи кинофотосъемки на живом материале показано, что у
Galanthus nivalis L. ядро второго спермин передвигается в
центральной клетке медленнее, чем струи цитоплазмы, постоянно
циркулирующие в любой клетке (Erdelska, 1983). Следовательно, не потоки
цитоплазмы несут здесь спермий к женскому ядру, как это полагал еще
Strasburger (1900) для Monotropa Jiypopitis, а ядро спермин
действительно стремится к «динамическому центру» клетки, т. е. туда, где в
это время располагается ее собственное ядро в силу физиологического
и структурного состояния этой клетки.
Таким образом, в общей форме мы можем сделать следующий вывод:
двойное оплодотворение хотя и охватило по существу все группы
цветковых растений, но действительно обнаружило огромное богатство форм
и выражений. Поэтому для генетика и селекционера в первую очередь
необходимо знание биологии развития половых элементов и прохождения
процесса оплодотворения у каждой конкретной культуры в тех или иных
конкретных условиях. Рис. 10, а также рис. 1 в статье Сингамия.
Беляева, 1977; Герасимов, 1923; Герасимова-Навашина, 1947а-г, 1951, 1955, 1957,
1958, 1971а, Ь, 1978, 1980, 1990; Герасимова-Навашина, Гуляев, 1973; Герасимова-
Навашина, Сальникова, 1982; Тургенева, 1927; Коробова, 1979; Навашин М.С.,
1968; Навашин, Герасимова-Навашина, 1958; Навашин С.Г., 1898, 1900, 1910,
1927; Поддубная-Арнольди, 1976; Сердюк и др., 1978; Фшн, 1926; Хведыиич и
др., 1978; Cass, 1973; Cocucci, 1981; Erdelska, 1983; Gerassimova, 1933;
Gerassimova-Navashina, 1969, 1982; Howard, Palk, 1953; Khvedynich, Bannikova, 1983; Madge,
1929; Strasburger, 1900; Taylor et al, 1957; Wolfsberg, 1964; Wylie, 1941.
182 Семя
ТИПЫ ДВОЙНОГО ОПЛОДОТВОРЕНИЯ
В СВЕТЕ ДАННЫХ ЭЛЕКТРОННОЙ МИКРОСКОПИИ1
Различие в темпах слияния гамет у покрытосеменных растений
непосредственно связано с существованием разных типов оплодотворения.
На основании светооптических наблюдений Герасимова-Навашина
(1951, 1954, 1957, 1960, 1971а, б, 1980, 1986, 1990; Gerassimova-
Navashina, 1982) предположила существование у покрытосеменных двух
основных типов оплодотворения: премитотического и постмитотического
с промежуточным между ними.
В последующих работах было показано, что у ряда растений процесс
оплодотворения характеризуется одновременно чертами двух или трех
типов оплодотворения (см., например, Гваладзе, 1973). На первых
этапах он протекает по постмитотическому типу, но слияние ядер происходит
до начала митоза, как при премитотическом типе. Такой процесс
оплодотворения у видов семейства Onagraceae (Гваладзе, Гачечиладзе, 1977,
1984; Гачечиладзе, 1981) и Galtonia candicans (Герасимова-Навашина,
1980) был отнесен к премитотическому типу в соответствии с признаками
его завершающего этапа. У видов Rhododendron (Якобсон, 1976) и
Peperomia (Плющ, 1983) он рассматривается как промежуточный, хотя
по сравнению с определением, данным Герасимовой-Навашиной (1960а),
в процессе оплодотворения названных растений более выражены черты
постмитотического типа.
О причинах, которые обусловливают существование у растений
разных типов оплодотворения, известно немного. Так, на основании ми-
тотической гипотезы двойного оплодотворения выдвинуто
предположение, что тип объединения ядер гамет в первую очередь определяется
функциональным состоянием спермиев (Герасимова-Навашина, 1957;
Герасимова-Навашина, Батыгина, 1959; Коробова, 1959). При этом особо
подчеркивалось, что ядра в «покоящемся состоянии» не сливаются из-за
наличия у них оболочки. Согласно этим представлениям, у растений с
премитотическим типом оплодотворения ядра спермиев попадают в
зародышевый мешок с еще не сформированной ядерной оболочкой, что позволяет
им быстро объединяться с ядрами женских клеток. У растений с постми-
тотическим типом оплодотворения ядра спермиев окружены оболочкой,
поэтому слияние ядер половых клеток задерживается до того момента,
когда ядра вступят в митоз и их оболочки начнут разрушаться.
С этих позиций, как видно, трудно объяснить особенности
протекания процесса оплодотворения у Galtonia candicans, видов рода
Текст печатается из работы Т. А. Плющ (1992) с разрешения автора с
сокращениями.
Двойное оплодотворение
183
Rhododendron, Peperomia, видов семейства Onagraceae, у которых ядра
гамет, находясь в контакте, в течение некоторого периода времени не
сливаются, тем не менее объединение ядер происходит до их вступления
в митоз. Следует также отметить, что при электронно-микроскопических
исследованиях спермиев ряда растений, в том числе с премитотическим
типом оплодотворения, было обнаружено, что их ядра полностью
окружены оболочкой (Jensen, Fisher, 1968a; Cass, Karas, 1975; Cheng et al.,
1980; Russell, Cass, 1981; Wilms, Aelst, 1983; McConchie et al., 1985;
Dumas et al., 1985; Mogensen, Rusche, 1985; Тарасенко, Банникова,
1986). Татинцева (1975, 1984, 1986, 1988) показала, что спермин
многих растений заканчивают митотическое деление в пыльцевом зерне или
пыльцевой трубке и в процессе дальнейшего развития спермиев
происходит выталкивание ядрышек из ядра в цитоплазму. Отсутствуют
также данные о том, что слияние ядер у покрытосеменных
сопровождается значительной фрагментацией ядерной оболочки.
Таким образом, реальность существования у покрытосеменных
разных типов оплодотворения требует дополнительного подтверждения.
При светооптическом исследовании зародышевого мешка Peperomia
blanda выяснилось, что ядра спермин и яйцеклетки длительный
промежуток времени находятся в контакте. В течение этого периода ну-
целлус превращается в перисперм, клетки интегумента заполняются
дубильными веществами (Никитичева и др., 1981). Ядра центральной
клетки, число которых равно 7-11, и ядро спермия плотно
соприкасаются. Их объединение заканчивается раньше, чем объединение ядер в
зиготе. Сформировавшееся первичнйе полиплоидное ядро эндосперма
вступает в профазу митоза. Так как начальные этапы кариогамии у
P. blanda протекают так же, как и у растений с постмитотическим
типом оплодотворения, а объединение ядер осуществляется до начала
митоза, тип оплодотворения у данного вида рассматривается как
промежуточный (Плющ, 1983).
В электронно-микроскопическом исследовании процесса слияния
ядер гамет у Peperomia blanda обнаружено, что ядра спермия и
яйцеклетки в период, который на основании светооптических данных
описывается как период контакта ядер, не являются обособленными, а
связаны несколькими мостами, т. е. фактически представляют собой
единое ядро. Мосты, вероятно, образуются сразу после
соприкосновения ядер, так как они наблюдаются еще до видимых преобразований
в ультраструктуре цитоплазмы зиготы. В таком состоянии
(объединенные мостами) ядра пребывают относительно длительное время, в
течение которого ультраструктура цитоплазмы зиготы значительно
изменяется: увеличивается количество митохондрий и пластид, развивается
ЭР (трубчатый и цистерноидный), образуется полисахаридная
оболочка клетки. Округлое ядро в зиготе появляется на стадии двуклеточного
эндосперма (Плющ, 1983).
У Gagea lutea в зиготе и в первичной клетке эндосперма в световом
микроскопе можно видеть плотно соприкасающиеся ядра спермия и
184
Семя
яйцеклетки, спермин и центральной клетки. Единого округлого ядра ни
в зиготе, ни в первичной клетке эндосперма у G. lutea не наблюдали.
В исследовании Петровой (1977) тип оплодотворения у С. lutea
определен как постмитотический.
Электронно-микроскопическое исследование зародышевого мешка
Gagea lutea выявило, что в период, когда ядра, судя по светооптическим
данным, находятся в контакте, они объединены мостами слияния.
Наличие между ядрами мостов характерно как для зиготы, так и для
центральной клетки, хроматин ядер преимущественно диффузный.
Приведенные данные свидетельствуют, что начальные этапы
объединения ядер гамет у Peperomia blanda (промежуточный тип
оплодотворения) и Gagea lutea (постмитотический тип оплодотворения)
протекают сходным образом. У обоих видов слияние ядер начинается с
образования между ними мостов. Аналогично этот процесс протекает у
других растений (Jensen, 1964, 1965b, 1973; Went van, 1970c; Jensen,
Fisher, 1967; Schulz, Jensen, 1973; Kudlicka et al., 1981; Mogensen,
1982), в том числе с премитотическим типом оплодотворения.
Таким образом, электронно-микроскопическое исследование
показывает, что при разных типах оплодотворения, которые были определены
на основании светооптических данных, объединение ядер
осуществляется по единому плану. После образования мостов, видимых только в
электронном микроскопе, ядра перестают быть обособленными и
фактически представляют собой одно сильно лопастное ядро. Различия в
функционировании ядра зиготы (и первичного эндоспермального ядра)
при быстром объединении ядер гамет по всей поверхности их контакта
и в случае длительного сохранения мостов слияния незначительные,
доказательством чего служит феномен асинхронного преобразования
хроматина мужской и женской гамет. Он был отмечен у табака и
лилии, растений соответственно с премитотическим и
постмитотический типами оплодотворения. Асинхронное преобразование «мужского»
и «женского» хроматина в ядре зиготы так же, как асинхронное
вступление в профазу митоза «мужского» и «женского» хроматина,
было показано на ряде животных и растительных объектов (см.: Хве-
дынич, 1985; Банникова, 1986).
Несмотря на то, что общая схема слияния ядер сходна при
различных типах оплодотворения, время осуществления абсолютно полного
слияния ядер варьирует у разных растений. В случае премитотического
типа оплодотворения слияние ядер по всей поверхности контакта
происходит относительно быстро, и деконденсация хроматина ядра
спермин осуществляется уже после абсолютного завершения кариогамии. В
случае промежуточного и постмитотического типов оплодотворения
процесс слияния ядер по всей поверхности контакта довольно
продолжителен. Хроматин ядра спермин деконденсируется, и образуется
ядрышко при наличии мостов, связывающих это ядро с ядром женской
гаметы. И если при промежуточном типе оплодотворения, как,
например, у Peperomia blanda, объединение ядер на значительной площади
Двойное оплодотворение
185
соприкосновения происходит до начала митоза, то при постмитотичес-
ком типе оплодотворения этот процесс до начала митоза отсутствует.
Описание длительного периода контакта ядер при постмитотическом
типе оплодотворения обусловливается недостаточной разрешающей
способностью светового микроскопа, не позволяющей выявить мосты
слияния между ядрами.
Возможно, именно различия в темпах полного слияния ядер,
обнаруженные на светооптическом уровне, привели к выделению различных
типов оплодотворения у растений. Об этом свидетельствует разная
продолжительность протекания процессов сингамии и тройного
слияния. Так, у пшеницы (премитотический тип оплодотворения) слияние
ядер в центральной клетке протекает в течение 1,5-2 ч, а а при
образовании зиготы — в течение 4-6 ч (Батыгина, 1974). У арахиса
(промежуточный тип оплодотворения) тройное слияние длится около
6 ч, а сингамия около 17 ч (Замотайлов, 1958, 1960). У лилии
(постмитотический тип оплодотворения) период контакта ядер спермия
и центральной клетки составляет 2-3 сут., ядер спермия и яйцеклетки —
4-5 сут. (Ментковская, 1982), у Cephalaria giganthea тип
оплодотворения в центральной клетке был определен как премитотический, а в
зиготе — как промежуточный, характеризующийся более медленным
протеканием; чем в центральной клетке (Солнцева, Камелина, 1976).
Еще Герасимова-Навашина обратила внимание на связь между
скоростью слияния ядер и типом оплодотворения. У тетраплоидов и
растений, выращиваемых в различных экспериментальных условиях, — при
воздействии пониженных температур и рентгеновского облучения —
Герасимова-Навашина с сотрудниками наблюдала замедление процесса
оплодотворения, а в некоторых случаях переход от премитотического
типа оплодотворения к промежуточному или постмитотическому
(Герасимова-Навашина, 1960а, б; Герасимова-Навашина и др., 1963,
1968; Герасимова-Навашина, Батыгина, 1964). Таким образом, типы
оплодотворения у покрытосеменных — не что иное, как
морфологическое выражение (на светооптическом уровне) различий в скорости
абсолютно полного объединения ядер (по всей поверхности их
контакта), т. е. принципиальной разницы между типами нет.
Банникова, 1986; Батыгина, 1974; Гачечиладзе, 1981; Гваладзе, 1973; Гваладзе,
Гачечиладзе, 1977, 1984; Герасимова-Навашина, 1951, 1954, 1957, 1960а, б, 1971а,
б, 1980, 1982, 1986, 1990; Герасимова-Навашина, Батыгина, 1959, 1964;
Герасимова-Навашина и др., 1963, 1968; Замотайлов, 1958, 1960; Коробова, 1959;
Ментковская, 1982; Никитичева и др., 1981; Петрова, 1977; Плющ, 1983, 1992;
Солнцева, Камелина, 1976; Тарасенко, Банникова, 1986; Татинцева, 1975, 1984,
1986, 1988; Хведынич, 1985; Якобсон, 1976; Cass, Karas, 1975; Cheng et al., 1980;
Dumas et al., 1985; Jensen, 1964, 1965b, 1973; Jensen, Fisher, 1967, 1968a; Kudlicka
et al., 1981; McConchie et al., 1985; Mogensen, 1982; Mogensen, Rusche, 1985;
Russell, Cass, 1981; Schulz, Jensen, 1973; Went van, 1970c; Wilms, Aelst, 1983.
186
Семя
FERTILIZATION MECHANISMS
МЕХАНИЗМЫ ОПЛОДОТВОРЕНИЯ
Double fertilization is an event that is essentially unique in flowering
plants in which one sperm cell fuses with the egg cell to form an embryo
and the other sperm cell fuses with the central cell to form the nutritive
endosperm. These fusions initiate distinct and dissimilar developmental
pathways using sperm cells that are normally genetically identical. Unlike animals,
in flowering plants the competition between gametes to fertilize the egg
occurs within the tissues of the stigma and style in the flower. Reproductive
success in angiosperms largely resides in the ability of the pollen tubes to
out-compete other tubes for the opportunity to enter the ovary and penetrate
the ovule, micropyle, and female gametophyte. Once a pollen tube arrives
within the ovule, few impediments to the eventual success of the male
gametes are known. The pollen tube releases both of its sperm cells into
a specialized cell inside the embryo sac known as the synergid which is
located between the egg and central cell. From that site, the sperm cells
will be incorporated into the egg cell and the central cell.
In the overwhelming majority of cases, the two sperm cells are identical,
being derived as brother cells from the same precursor generative cell;
however, in some cases the two sperm cells evidently compete to fuse with
the egg and may carry differing amounts of cytoplasmic DNA-containing
organelles (plastids and mitochondria) that can be expressed in the embryo.
Usually the two male gametes are linked together in a pollen tube and
are associated with the vegetative nucleus in a male germ unit (see Male
germ unit). In forming the male germ unit, the sperm cells share a common
wall or interface with each other and are usually enclosed together within
the same region of surrounding pollen plasma membrane. The vegetative
nucleus is found in association with this enveloping vegetative cell membrane.
Since sperm cells are almost always identical, double fertilization is usually
a genetically cooperative event in which brother sperm cells share in the
nutrition and destiny of one offspring.
Organization of male gametes. The male gametes of angiosperms are
indeed true cells with a distinct, though sometimes sparse cytoplasm. The
male gametes usually have fewer cellular organelles than somatic cells,- and
in species with maternal cytoplasmic heredity, the sperm cells are often
impoverished in plastids (Hagemann, Schroder, 1989). In orchids, sperm
cells may lack both plastids and mitochondria entirely (Yu, Russell, 1992),
apparently deriving all of their energy anaerobically or possibly through the
importation of energy-laden molecules. In the Apiaceae, sperm cytoplasm
may be so reduced that it is essentially nonexistent (Weber, 1988). The
sperm cells are believed to be incapable of independent motility and are
instead passively borne through the pollen tube by means of actin-myosin
Двойное оплодотворение 187
associations in which the myosin-coated male gamete (Heslop-Harrison J.,
Heslop-Harrison Y., 1989; Tang et al., 1989) moves along actin bundles
which are present throughout much of the length of the elongating pollen
tube (Pierson, Cresti, 1992). The vegetative nucleus may also assist in
PT passage because it is also coated with a myosin-like protein (Heslop-
Harrison J., Heslop-Harrison Y., 1989) and in most species, is part of
the male germ unit. Whether the generative or sperm cells have myosin
directly on their surface or on the enveloping vegetative cell membrane
awaits the greater resolution of immunoelectron microscopic results. The
sperm cells themselves may be capable of shape changes, but they are not
actively motile in comparison with animal sperm or the sperm cells of lower
plants.
The male gametes, or sperm cells, may be formed either before or after
the pollen tube germinates in different species of flowering plants. Tricellular
pollen contains the two sperm cells prior to pollen tube germination, whereas
bicellular pollen contains the precursor generative cell when it is disseminated.
Generative cell division to form the two sperm cells is delayed in bicellular
pollen until after pollen tube germination. This delayed mode of sperm cell
formation is found in a majority (2/3 or more) of the flowering plant genera
and is associated with gametophytic self-incompatibility. In either type of pollen,
two sperm cells are formed prior to fertilization. The male germ cell lineage is
established by the meiotic division of a microsporocyte which establishes the
lineage that eventually undergoes two additional mitotic divisions to form
the two «brother» sperm cells. Generative cell division results in cells with
a genetically identical nuclear complement and a similar but not identical
cytoplasmic genetic complement. The*male gametes are formed, descend in
the pollen tube, and enter the embryo sac as true cells. In the rare cases
where male germ units are loosely formed or their elements become
dissociated within the tube, the possibility of fertilization from two different
pollen tubes (heterofertilization) can occur (Robertson, 1984). Heterofer-
tilization requires the arrival of two or more pollen tubes within -the embryo
sac, but the observation of multiple pollen tubes within an ovule are rare
(Mogensen, 1978).
Organization of female gametes. The female gamete is located deep
within the ovule. It is formed as a product of a prior meiotic division of the
megasporocyte that forms an independent lineage of female cells known as the
megagametophyte or female gametophyte (commonly known as an embryo sac).
At maturity, the embryo sac contains, in addition to the egg cell, at least
two flanking synergids, some antipodal cells (conventionally three) and a
multinucleated proendospermatic central cell. The egg cell, synergids and central
cell constitute a functional unit of female reproduction that has been designated
the female germ unit (Dumas et al., 1984). This functional organization of
the mature embryo sac is remarkably similar among angiosperms. The major
variants include differences in the ploidy level of the central cell (based on
the number of polar nuclei that contribute to the central cell), and the number
of synergid cells formed. Although variability in ploidy number may have con-
188
Семя
sequences in the capacity of the endosperm, the structural alterations of
the female germ unit appear to be potentially more drastic in appearance.
In the Peperomia type, only one synergid is formed, whereas synergids are
absent in the Plumbago and Plumbagella embryo sac types (review: Huang,
Russell, 1992). The absence of synergids in the latter two embryo sac types
calls into question how a synergid, which appears to be indispensable in the
vast majority of angiosperms, could be eliminated in a normal functioning female
germ unit, but apparently the same types of cell interactions are possible as
in the majority of angiosperms (Russell, 1983; Russell, Cass, 1988).
The egg cell is a highly polarized cell, with its nucleus located either
at the center of the egg cell amid numerous small vacuoles (as in the
grasses) or its nucleus is at the chalazal end of the egg cell next to a
single large vacuole as in most other angiosperms (reviews: Huang, Russell,
1992; Russell, 1993). The egg cell appears to be quiescent as reflected
by its ultrastructural appearance (Jensen, 1965a). The synergids appear far
more active and have been implicated in uptake and secretion of materials,
storage of chemotropic agents for pollen tube attraction and the receipt of
the pollen tube. The micropylar cell wall is characterized in the overwhelming
majority of angiosperms with prominent cell wall ingrowths, forming a so-
called filiform apparatus. The central cell is far larger than the other cells
and largely surrounds them, although the egg and synergids as well as the
central cell have contacts with the external wall of the embryo sac. Based
on the surface area of the central cell and the frequent occurrence of cell
wall ingrowths and proliferations reflective of a transfer cell, the central cell
appears to be highly involved in the uptake of nutrients into the embryo
sac prior to fertilization (Huang, Russell, 1992).
The organization of female germ unit cell walls appears to reflect their
reproductive and physiological functions. Cell walls containing prominent
fibrils that presumably represent cellulose microfibrils are present in the
external wall of the embryo sac, the common wall between the two
synergids, and the micropylar end of the female germ unit. In contrast,
junctions between the egg and central cell and those adjacent to the
synergids possess absent, fibril-lacking or gellike cell walls; these are the
anticipated locations for gamete migration and fusion. Male gametes also
lack cell walls, although such walls are frequently present during earlier
stages (Russell, Cass, 1981; Dumas et al., 1984). The wall-less nature
of both the male and female gametes undoubtedly promotes their ability
to fuse and permits the plasma membranes of the gametes to contact one
another directly (Dumas et al., 1984), facilitating the merging of their
membranes.
Pollen tube arrival and delivery of male gametes. In typical
angiosperms, the pollen tube is guided to the ovary by largely mechanical forces.
Once inside the ovary, however, pollen tubes make abrupt turns (at angles
approaching 90°) to enter the small opening at the tip of the ovule, called
the micropyle. Interestingly, regardless of the pollen load, usually only one
pollen tube enters each ovule. Pollen tube elongation continues through the
Двойное оплодотворение
189
micropyle until the tip of the pollen tube contacts the embryo sac. At this
location, the tip specifically enters the embryo sac through a degenerated
or at least weakened synergid, bypassing its sister cell, the intact and
turgid persistent synergid. Since the elongation of the pollen tube is ultimately
driven by the turgor generated within the tube, it would seem logical to
assume that the final path into the embryo sac would assume a course of
lesser resistance and enter the «weakened» synergid. The pollen tube tip
usually weakens and forms a terminal pore through which the two sperm
cells and vegetative nucleus are released. During pollen tube discharge, the
plasma membrane of the pollen tube breaks down, exposing the plasma
membranes of the two male gametes. The association of one sperm cell
with the vegetative nucleus is severed by the force of pollen tube discharge
and may generate cytoplasmic bodies.
Synergid degeneration. The degeneration of typically just one of the
two synergids is believed to be a genetically preprogrammed event that
may be initiated by the presence of a chemical signal produced by the
growing pollen tubes (Jensen et al., 1983). Synergid degeneration has
been reported to occur before pollination in some species, but is usually
dependent on the presence of a pollen tube. In some plants, the actual
arrival of pollen tubes within the synergid appears to be necessary to
trigger synergid degeneration and stimulates the completion of synergid
degeneration. In tobacco, just momentary contact with the ovule is needed
to trigger synergid degeneration (Huang, Russell, 1994), whereas in
Petunia and some other species, the synergid apparently must be directly
penetrated to trigger degeneration (Russell, 1992). The receptive synergid
may undergo a radical change in physiology through the discharge of the
pollen tube cytoplasm, and the completion of synergid degeneration may
be essentially immediate.
The environment of the synergid before and after degeneration is unique.
Extraordinarily high concentrations of calcium are present in the synergid
which appear to attract pollen tubes through simple chemoattraction. Calcium
taken up during synergid development accumulates in nearly lethal levels
compared to other cells. The first evidence of this was the localization of
ash in the synergid vacuole following the microincineration of freeze dried
ovules of cotton (Jensen, 1965b). This was identified as calcium in wheat
and pearl millet synergids using energy-dispersive X-ray spectroscopy
(Chaubal, Reger, 1990, 1992). Later studies using pyroantimonate
localization revealed that calcium is distributed throughout the young synergid
of pearl millet initially, but only later becomes accumulated in the vacuole
(Chaubal, Reger, 1995). Interestingly, the onset of degeneration also appears
to be accompanied by an additional period of rapid calcium uptake. The
synergid appears to secrete some of the calcium into the micropyle in the
form of calcium pectate (Chaubal, Reger, 1995), which is a chemotropic
attractant for pollen tubes in pearl millet (Reger et al., 1992). This sequence
of events during synergid degeneration appears similar in a number of respects
to apoptosis — a form of programmed cell death described in animal cells
190
Семя
(Chaubal, Reger, 1995). The high concentration of calcium may have a
chemotropic effect on pollen tubes, but it is also possible that Ca2+ is
involved in other growth phenomena relating to fertilization as well. Changes
in calcium concentration serve as a trigger in some signal transduction
pathways and could affect egg activation, cellular fusion and the activity
of numerous enzymes within the embryo sac (Russell, 1992).
Gamete transport to the female reproductive cells. An important
structural feature of the synergid is that cell boundaries at the chalazal end of
the synergid consist of just plasma membranes in the region adjacent to
the egg and central cells. When the synergid completes degeneration, the
plasma membrane of the degenerating synergid breaks down allowing materials
within the synergid to leak into the intercellular region between the synergids,
egg cell and central cell. It is into this region that the pollen tube is
discharged. The pollen tube usually emerges from the filiform apparatus
within the micropylar end of the synergid just prior to forming a terminal
aperture and releases the cytoplasm of the pollen tube into the degenerating
synergid. Pollen cytoplasm, including the two male gametes and the vegetative
nucleus, move into the space between the egg and central cells. The problem
of short distance migration of the nonmotile sperm cells remains a potential
problem in the region between the egg and central cells. In this regard,
it seems noteworthy that a thin trail of actin is present on the surface of
the egg and central cells (Huang et al., 1993?; Huang, Russell, 1994;
Huang, Sheridan, 1994). This extends from the middle of the synergid to
the female target nucleus, providing a potential pathway for sperm passage.
Separate trails exist leading to the egg cell and the central cell. If the
sperm cells continue to be coated with myosin at this time, as they are
earlier in development (Heslop-Harrison J., Heslop-Harrison Y., 1989; Tang
et al., 1989), they could potentially migrate on this matrix to the chalazal
end of the actin trails and fuse at this site (Huang, Russell, 1994).
Gamete fusion. The major changes that.are evident in the sperm cells
prior to fertilization are that they appear more rounded in chemically and
rapidly frozen preparations (Huang et al., 1993a) and their cytoplasm
becomes significantly more vacuolated (Russell et al., 1990). Upon their
discharge from the pollen tube, the sperm cells are stripped of their
enveloping pollen tube plasma membranes, and their plasma membranes
are directly exposed to cellular environment. These single membrane-
bound cells become appressed to the egg and central cells with an
intervening distance between the plasma membranes of the male and
female gametes of 20-70 nm.
The egg and central cell are usually fertilized by brother sperm cells,
in part because the two male gametes are usually linked in a male germ
unit in most angiosperms, favoring co-transmission into the embryo sac
(Russell, 1991; see Male germ unit). Even in cases where the male gametes
are originally unlinked, as in barley, the two gametes may approach each
other and become connected as the pollen tube reaches the ovule (Mogensen,
Wagner, 1987). In rare cases, there are reports of the fertilization of the
Двойное оплодотворение
191 j
egg and central cell by sperm cells from different pollen tubes; some lines
of corn apparently lack a traditional male germ unit organization throughout
their passage in the pollen tube and may therefore display an unusually
high rate of heterofertilization (Robertson, 1984).
Cellular basis of gamete fusion. In normal cells, there are significant
biophysical forces that resist any approach closer than 20 nm. The negative
charges of the phosphate groups in membrane phospholipids and steric
hindrance from other chemical groups would seem to discourage closer approach.
The energy required to push unfused cells together increases significantly
as the distance between them decreases (Russell, 1992). Therefore, it seems
likely that the membranes of the gametes are destabilized in some fashion.
Calcium, as a divalent positive cation, may link the membranes closer by
neutralizing some of the negative charges. Calcium is known to be fusigenic
at high concentrations (Kranz, Lorz, 1994) and appears to be required
for in vitro fusion of isolated gametes of corn at a relatively high
concentrations (5 mM) (Faure et al., 1994). The fusion of gametes appears to
discriminate gametes from somatic cells (Faure et al., 1994), but it is
unclear whether this is because of fusigenic lipids present in gamete
membranes or whether there may be recognition compounds such as those involved
in viral membrane fusion (White, 1992) that may recognize specific
membranes and enhance fusion. In any case, the fusion of female gametes with
supernumerary sperm cells does not occur, and therefore barriers to
polyspermy appear to be present (Faure et al., 1994).
Few ultrastructural reports have reported how the male gametes fuse with
the egg and central cell (Russell, 1994; Yu et al., 1994); however, two
patterns appear to predominate. In 'some plants displaying maternal
cytoplasmic inheritance, the entire cytoplasm of the sperm cell is apparently
excluded from the egg cell, while the sperm nucleus is permitted to enter.
This pattern is cytoplasmically restrictive: male cytoplasmic organelles are
shed or excluded in an enucleated cytoplasmic body at the edge of the
egg cell. This pattern is typified by cotton, barley, spinach and cottonwood.
In other plants, including some with predominantly maternal cytoplasmic
inheritance, male cytoplasmic organelles are allowed to enter the egg cell.
This form of gamete fusion is cytoplasmically permissive and male
cytoplasmic inheritance is possible in this case, typified by Petunia, Plumbago,
and tobacco. Still in the latter case, significant male organelle diminution
may have occurred, which may keep the chances for male cytoplasmic
inheritance low in some plants (Russell, 1992; see Cytoplasmic transmission
during fertilization).
Evidence of the exclusion of male cytoplasm in cytoplasmically restrictive
gamete fusion is largely based on the detailed work of Mogensen (1982,
1988) and the presence of cytoplasmic bodies in the degenerated synergids
reported in cotton (Jensen, Fisher, 1968) and cottonwood (Russell et al.,
1990). In barley, serial reconstructions of a large enucleated cytoplasmic
body appressed to the exterior of the egg cell indicated that essentially all
of the male cytoplasmic organelles were excluded from the egg cell (Mo-
192
Семя
gensen, 1982, 1988). Only one such body was present in each embryo
sac, however, suggesting that sperm organelles are not excluded from the
central cell. The cell biological basis for this pattern of gametic fusion is
unclear. Cytoplasmically restrictive gamete fusion may involve the formation
and closure of a small channel of continuity between the male and female
gametes through which the male nucleus passes. The basis of this unusual
membrane behavior seems to operate against overwhelming biophysical forces;
however, the occurrence of complementary contractile proteins on the membranes
of the male and female gametes may provide the forces necessary to establish
closure. Actin is present in embryo sacs on the surface of the egg and central
cell (Huang, Russell, 1994) and myosin has been reported on the surface of
the generative cell (Heslop-Harrison J., Heslop-Harrison Y., 1989; Tang et
al., 1989) and is suspected to be present on male gametes, but the critical
observations remain to be made.
The mechanism of cytoplasmically permissive fusion of gametes has been
documented in detail in Plumbago zeylanica. In this plant, many of the
stages of fusion have been ultrastructurally observed, and the male organelles
can be identified and quantified in the female cells (Russell, 1983). Sperm
cells are deposited between the egg and central cell and are located
immediately next to each other. Fusion is initiated at one site between the
sperm and the female cell. Secondary fusion sites quickly propagate and
result in the incorporation of the male cytoplasm when the fusion membranes
vesiculate and break down in the female cytoplasm. This is also the pattern
in tobacco, which has recently been described (Yu et al., 1994). The
pattern of fusion in cytoplasmically permissive plants seems to be well known,
but lingering questions remain about the mechanism by which cytoplasmically
restrictive plants undergo gamete fusion.
Sperm specificity. Since the plasma membrane of each male gamete is
frequently in direct contact with the plasma membranes of both the egg
and the central cell (Russell, 1992), it is possible and even the likely
that gametic recognition occurs. In the two clearest examples of sperm
dimorphism, corn and Plumbago, one specific sperm cell has an advantage
in fusing with the egg, resulting in preferential fertilization. In corn, genetic
studies indicate that the sperm cell with more В-chromosomes is more likely
to fuse with the egg (Roman, 1948; Carlson, 1969), whereas in Plumbago,
the smaller sperm cell containing more and sometimes all of the plastids
is more likely to fuse with the egg (94% of the time; Russell, 1985).
The factors involved in recognition are as yet unknown; however, two--
dimensional electrophoretic and hybridoma antibody characterization of
Plumbago sperm cells reveals 13.5% polypeptide spots unique to the sperm
(Geltz, Russell, 1988) and 18 to 28% unique immunological epitopes
(Pennell et al., 1987), respectively. Therefore, the possibility of unique
interactions exists, but the molecules involved are not known. Although few
flowering plants display such distinct differences between the two sperm
cells, it is possible that some signal present on the surface of male and
female gametes identifies them as candidates for cellular fusion. The inhibition
Двойное оплодотворение
193
of spontaneous fusions between gametes of the same sex and between gametes
and somatic cells seems likely based on available data, so some recognition
of opposite sexed gametes seems plausible.
Nuclear fusion. Fusion of the male and female gamete nuclei swiftly
ensues in some plants, but is more protracted in others. The envelopes
of the gamete nuclei fuse: first the outer and then the inner envelope.
This is followed by the formation of multiple nuclear bridges (Jensen,
1964). In the fertilized egg cell, the sperm nucleus fuses with the egg
nucleus to form the zygote nucleus, whereas in the central cell, the other
sperm nucleus fuses with the polar nuclei to form the primary endosperm
nucleus. The polar nuclei often adhere to one another prior to the arrival
of the sperm nucleus in typical monosporic plants; however, in bisporic
and tetrasporic plants, which may have elevated ploidy levels, the polar
nuclei frequently fuse prior to the arrival of the sperm nucleus to form a
secondary nucleus. The zygote ultimately forms the embryo and the deriva
tives of the primary endosperm nucleus organize the nutritive endosperm.
Fig. 13.
Carlson, 1969; Chaubal, Reger, 1990, 1992, 1995; Dumas et al., 1984; Faure et al., 1994;
Geltz, Russell, 1988; Hagemann, Schroder, 1989; Heslop-Harrison J., Heslop-Harrison Y.,
1989; Huang, Russell, 1992, 1994; Huang, Sheridan, 1994; Huang et al., 1993a, b; Jensen,
1964, 1965a, b; Jensen, Fisher, 1968; Jensen et al., 1983; Kranz, Lorz, 1994; Mogensen,
1978, 1982, 1988; Mogensen, Wagner, 1987; Pennell et al., 1987; Pierson, Cresti, 1992;
Reger et al., 1992; Robertson, 1984; Roman, 1948; Russell, 1983, 1985, 1991, 1992, 1993,
1994; Russell, Cass, 1981, 1988; Russell et al., 1990; Tang et al., 1989; Weber, 1988;
White, 1992; Wilms, 1981; Yu, Russell, 1992;\Yu et al., 1994.
ЦИТОХИМИЯ ПРОЦЕССА ОПЛОДОТВОРЕНИЯ
Цитохимическое исследование процесса оплодотворения началось в
50-х годах нашего столетия с использованием для этих целей реакции
Фельгена. Наиболее детально были изучены спермин. В ряде работ
(Герасимова-Навашина, 1952, 1959, 1971а; Герасимова-Навашина,
Батыгина, 1958, 1959; Vazart, 1958; Коробова, 1959; Батыгина,
1961, 1962, 1974, 1987; см. также Лилейные — классический
объект для изучения опыления и оплодотворения; Сингамия;
Тройное слияние; Опыление и оплодотворение у злаков) показано,
что ядра спермиев в синергиде, пространстве между яйцеклеткой и
центральной клеткой, цитоплазме этих клеток и в контакте с их
ядрами представлены компактными телами, дающими интенсивную
реакцию Фельгена, что свидетельствует о сильной конденсации их
хроматина. По мере их слияния с ядрами женских клеток происходит
снижение интенсивности реакции Фельгена в результате деконден-
сации их хроматина. В конце слияния хроматин ядер спермиев в
оплодотворенных ядрах женских гамет почти не выявляется.
1 3-828
; 194
Семя
При окраске по Браше (Герасимова-Навашина, 1978, 1980, 1990;
Gerassimova-Navashina, 1982) ядра спермиев, вошедших в
зародышевый мешок, имеют багрово-красную окраску, что свидетельствует о
наличии РНК. Впоследствии в пространстве между яйцеклеткой и
центральной клеткой они освобождаются от РНК и в контакт с
ядрами этих клеток спермин вступают изумрудно-зелеными, состоящими в
основном из ДНК.
Таким образом, в результате этих исследований было установлено,
что спермин покрытосеменных растений в процессе оплодотворения
претерпевают однотипные превращения, приводящие к деконденсации
хроматина, и началом этого процесса является освобождение ядер
спермиев от РНК. Ядра женских клеток (яйцеклетки и центральной
клетки) изучены в меньшей степени. Полученные в 50-60-х годах
данные весьма противоречивы. Одни исследователи (Васильева, 1954;
Фурсов, 1964) вообще не обнаружили изменения хроматизации ядер
до и в момент оплодотворения, другие (Кахидзе, 1954; Солнцева,
1961; Делоне, Данилина, 1963) выявили усиление интенсивности
реакции Фельгена в ядрах яйцеклеток до слияния их с ядрами спермиев
во время роста пыльцевых трубок в столбике. В 70-х годах с
помощью реакции Фельгена обнаружено изменение хроматизации ядер
яйцеклеток и центральных клеток во время последовательных фаз их
слияния с ядрами спермиев (Батыгина, 1962, 1974; Хведынич,
Банникова, 1970; Банникова, Хведынич, 1973; Банникова и др., 1985).
У Hordeum vulgare и Nicotiana tabacum после контакта ядер спермиев
с ядрами женских клеток, особенно с ядрами яйцеклеток, в последних
перестают выявляться гетерохроматиновые гранулы, что приводит к
снижению интенсивности реакции Фельгена. В ходе объединения ядер гамет
интенсивность этой реакции ослабевает еще сильнее. В конце слияния
хроматин в оплодотворяемых ядрах некоторое время не выявляется. Затем
по мере подготовки оплодотворенных ядер к делению реакция Фельгена
вновь становится положительной. В полярных ядрах этот процесс
проходит быстрее, чем в ядре яйцеклетки, и изменение структуры хроматина
менее заметно, что связано с более слабой хроматизацией их до
оплодотворения.
Примененный для исследования процесса оплодотворения метод
люминесцентного микроспектрального анализа при окраске препаратов
акридиновым оранжевым (Конарев, Сердюк, 1967; Сердюк, Конарев,
1970) позволил более детально проследить изменение состояния
хроматина ядер женских клеток при слиянии их с ядрами спермиев.
У Nicotiana tabacum (Хведынич, Сердюк, 1977; Хведынич и др.,
1978) выявлены различия в структурном состоянии хроматина ядра
яйцеклетки и полярных ядер, вступающих в оплодотворение. Большая
часть ДНК хроматина ядра яйцеклетки связана с белками, что
указывает на преобладание в нем конденсированного хроматина. В полярных
ядрах, в отличие от ядра яйцеклетки, обнаруживается ДНК, связанная
с липидами, что указывает на преобладание деконденсированного хро-
Двойное оплодотворение 195
матина. После контакта ядер женских клеток с ядрами спермиев
хроматин ядра яйцеклетки претерпевает значительные изменения:
переходит из конденсированного состояния в деконденсированное
(уменьшается количество ДНК, связанной с белками, при этом увеличивается
количество ДНК, связанной с липидами) и отходит к ядерной
мембране. Только после этого начинается объединение ядра яйцеклетки с
ядром спермин.
В полярных ядрах ослабление связи ДНК с белками не
наблюдается, и ядро спермин сразу после контакта начинает объединяться с
ними.
Таким образом, структурное состояние хроматина ядер яйцеклетки
и центральной клетки до контакта их с ядрами спермиев имеет
существенное значение для объединения гамет. Наличие в ядре яйцеклетки
и центральной клетки хроматина, сходного по структуре,
обусловливает почти одинаковый темп процесса оплодотворения в обеих клетках.
Если ядра женских клеток различаются по степени конденсации
хроматина, темп процесса двойного оплодотворения не одинаков.
Поскольку у большинства покрытосеменных растений ядра яйцеклеток
характеризуются в основном компактным структурным состоянием
хроматина, а ядра центральных клеток — диффузным, становится
понятным факт более быстрого прохождения оплодотворения в центральной
клетке, чем в яйцеклетке.
По мере слияния ядра спермин с ядром яйцеклетки деконденсация
хроматина продолжается, одновременно в обоих ядрах увеличивается
количество ДНК, связанной с липидами, что свидетельствует о начале
ее синтеза. В полярных ядрах синтез ДНК наступает раньше, чем в
ядре яйцеклетки. Затем в оплодотворенных ядрах вновь увеличивается
количество ДНК, связанной с белками, наступает конденсация
хроматина ядра спермия, поскольку, как известно (Герасимова-Навашина,
Батыгина, 1959; Батыгина, 1962, 1974), его хроматин вступает в
профазу раньше хроматина ядра женской клетки. ДНК, связанная с
белками, вначале обнаруживается в первичном ядре эндосперма, что
хорошо согласуется с известным фактом более быстрого его перехода
к делению по сравнению с ядром зиготы.
Цитохимическое исследование процесса оплодотворения позволило
выявить транскрипционную активность хроматина оплодотворяемых
ядер, которая определяется по наличию новосинтезированной
свободной РНК. Анализ данных показал, что в ядре яйцеклетки в начале
слияния его с ядром спермия количество РНК, как свободной, так и
связанной, по сравнению с ее количеством до оплодотворения,
значительно уменьшается, что связано с ее выходом в цитоплазму
(количество РНК в цитоплазме увеличивается). Затем по мере слияния ядер
гамет, когда хроматин ядра спермия значительно деконденсируется,
содержание свободной РНК в ядре вновь возрастает, что
свидетельствует о ее синтезе. Увеличение количества свободной РНК
происходит до окончания оплодотворения.
13*
196
Семя
Характер изменений состояния РНК в полярных ядрах по
сравнению с ядром яйцеклетки обнаруживает некоторые отличия. В начале
оплодотворения, когда хроматин спермия уже частично деконденсиро-
вался, количество свободной РНК не уменьшается, но начинает
выявляться РНК, связанная с белками и липидами. В дальнейшем большая
часть РНК переходит в прочно связанное состояние и одновременно
происходит ее выход в цитоплазму. Затем количество свободной РНК
вновь возрастает, а к концу оплодотворения снова падает, что
обусловлено вторичным выходом ее в цитоплазму.
Таким образом, после контакта ядер спермиев с ядрами женских
клеток происходит выход РНК в цитоплазму и начинается синтез
новой РНК. Выход РНК в цитоплазму из полярных ядер происходит
в более позднюю фазу оплодотворения, чем в ядре яйцеклетки. Синтез
РНК в ядре яйцеклетки, начавшись после ее выхода, происходит
постепенно, поэтому в конце оплодотворения количество РНК заметно
увеличивается. В полярных ядрах вследствие двукратного выхода РНК
в цитоплазму наблюдается импульсное ее увеличение. Помимо этого в
полярных ядрах, в отличие от ядра яйцеклетки, в разные периоды
оплодотворения обнаруживается РНК, прочно связанная с белками и
липидами, тогда как в ядре яйцеклетки подобные РНК-липопротеидные
комплексы наблюдались только в начале оплодотворения.
При изучении процесса оплодотворения у Nicotiana tabacum, Lilium
regale обнаружено, что ядра спермиев в зиготе и первичной клетке
эндосперма всегда раньше ядер этих клеток переходят в профазу, то
есть по скорости прохождения интерфазы, которая у ядер гамет
проходит во время их слияния, мужские гаметы обгоняют женские,
независимо от того, проникает ядро мужской гаметы внутрь женского или
находится в контакте с ним. Вероятно, скорость преобразования
хроматина сливающихся гамет соответствует скорости прохождения
периодов интерфазы митотического цикла предшественниками гамет при их
образовании. Ранее было показано, что период G\ при образовании
мужских гамет короче, чем при формировании женских (Банникова и
др., 1981). Вступая в оплодотворение в фазе G\ митотического цикла,
мужские и женские гаметы проходят его периоды с разной скоростью.
Ядра спермиев быстрее ядер женских клеток проходят период G\ и,
следовательно, раньше вступают в периоды S и Gi, в конце которого
начинается конденсация хроматина, что мы наблюдали в ходе
исследования процесса оплодотворения у данных видов. Поскольку спермин
быстрее, чем женские клетки, проходят периоды интерфазы, они
раньше вступают в профазу, то есть хроматин гамет, участвующих в
оплодотворении на протяжении всего слияния, находится в разном структурном
состоянии вплоть до конца профазы, когда визуально становится
невозможно его идентифицировать.
Таким образом, цитохимическое исследование оплодотворения
позволило объяснить некоторые закономерности этого процесса. Более ранний
выход ядра спермия в профазу по сравнению с оплодотворенным ядром
—■ 1
Двойное оплодотворение 197 |
женской клетки происходит вследствие асинхронного преобразования
хроматина ядер сливающихся гамет. Различия в темпах оплодотворения
в яйцеклетке и центральной клетке определяются разным состоянием
хроматина этих клеток до оплодотворения. Переход оплодотворенного
вторичного ядра центральной клетки к делению раньше ядра зиготы
происходит в результате более быстрого слияния ядра спермия с ним,
что, в свою очередь, приводит к ранней интенсификации синтетических
процессов в этом ядре.
Банникова, Хведынич, 1973; Банникова и др., 1981, 1985; Батыгина, 1961, 1962,
1974, 1987; Василева, 1954; Герасимова-Навашина, 1952, 1959, 1971, 1978, 1980,
1982, 1990; Герасимова-Навашина, Батыгина, 1958, 1959; Делоне, Данилина, 1963;
Кахидзе, 1954; Конарев, Сердюк, 1967; Коробова, 1959; Сердюк, Конарев, 1970;
Солнцева, 1961; Фурсов, 1964; Хведынич, Банникова, 1970; Хведынич, Сердюк,
1977; Хведынич и др., 1978; Gerassimova-Navashina, 1982; Vazart, 1958.
ГЕМИГАМИЯ (греч. gemi — полу-, gamos — брак) —
незавершенный процесс сингамии, при котором ядро спермия проникает в
яйцеклетку, однако не сливается с ее ядром, а лишь стимулирует яйцеклетку к
дальнейшему развитию; в редких случаях может происходить процесс
кариогамии, но с большими нарушениями. Синоним: семигамия.
Впервые это явление было открыто итальянским ученым Battaglia в
1945 году, который предложил назвать его «семигамией» (лат. semi —
полу-, греч. gamos — брак). Однако в связи с лингвистической
неточностью он впоследствии был заменен на термин «гемигамия» (Солнцева,
1973; Battaglia, 1981) и в таком написании используется многими
авторами (Nogler, 1984; Asker, Jerihg, 1992). Гемигамию, до того как
объяснил это явление Battaglia, наблюдали и другие исследователи
(Nawaschin, 1898; Расе, 1913; Fagerlind, 1946), но не поняли ее.
Можно выделить три группы проявления гемигамии: 1 — ядро
спермия проникает в яйцеклетку и стимулирует ее ядро к делению,
однако само не делится и вскоре изолируется клеточной стенкой от
других частей зародыша; 2 — ядро спермия в яйцеклетке делится
одновременно с женским ядром, что сопровождается образованием
клеточных перегородок между всеми ядрами (как производными спермия,
так и яйцеклетки); 3 — ядро спермия в яйцеклетке делится
одновременно с женским ядром, но (в отличие от второй группы) это деление
не сопровождается формированием клеточной стенки.
Гемигамия первой группы наблюдалась у Cooperia drummondii из
семейства Amaryllidaceae (Сое, 1953). Ядро спермия, проникнув в
базальную часть яйцеклетки, отделяется клеточной оболочкой и
формирует базальную клетку суспензора.
Во второй группе (некоторые виды сем. Amaryllidaceae) отмечены
варианты в образовании клеточных перегородок при делении ядра
спермия. 1. Ядро спермия делится лишь однажды, и это деление
сопровождается формированием клеточных перегородок между всеми
ядрами проэмбрио (и отцовского, и материнского происхождения).
198
Семя
Этот вариант отмечался у Cooperia pedunculate. (Сое, 1953). 2. Ядро
спермия делится один или более раз, отделяясь при первом же делении
перегородкой от других клеток, а последующие деления происходят
либо с клеткообразованием (Cooperia pedunculata), либо без него
(Zephyranth.es macrosiphon, Argyropsis Candida). У С. pedunculata ядро
спермия делится дважды, в результате формируются четыре клетки в
латеральной части проэмбрио, но подвесок образуется из клеток,
содержащих ядра материнского происхождения (Сое, 1953). У
Zephyranthes первое же деление ядер спермиев сопровождается
закладкой клеточных стенок между всеми ядрами (Солнцева, Ворсобина,
1972, 1973). Ядра, производные спермия, могут располагаться в ба-
зальной, латеральной или в апикальной частях проэмбрио. При
последующих делениях ядер отцовского происхождения клеточные оболочки
не формируются, и тогда нарушения в делении ядер приводят к
формированию реституционных ядер.
Гемигамия третьей группы характеризуется тем, что ядро спермия,
проникнув в яйцеклетку, не изолируется клеточной оболочкой от
остальной части проэмбрио. Его деление не сопровождается
образованием клеточных перегородок. Это отмечено у ряда видов рода Rudbeckia
из сем. Asteraceae CBattaglia, 1945, 1947, 1954; Мовсесян, 1964,
1968; Солнцева, 1968, 1971, 1973; Kosuriska-Pajak, 1983) и у
Arabidopsis thaliana из сем. Brassicaceae (Gerlach-Cruse, 1970). В
этом случае наблюдается наибольшее разнообразие в поведении
мужских ядер при гемигамии. У R. laciniata первое деление мужских ядер
происходит без отклонений (Солнцева, 1968, 1971, 1973, 1974). При
втором и последующих делениях наблюдаются нарушения: выбросы
части хромосом из веретена деления, в результате чего образуются
микроядра и анеуплоидные ядра; возникают мосты между делящимися
ядрами, появляются диплоидные реституционные ядра1; производные
ядра спермия могут сливаться, находясь в одной клетке (т. е. тоже
происходит диплоидизация ядер отцовского происхождения); ядра,
производные спермия, обычно делятся синхронно с женскими ядрами,
расположенными в той же клетке, и при близком расположении фигур
деления ядер отцовского и материнского происхождения может
произойти объединение их геномов, и тогда возникают «гибридные» ядра.
Таким образом, в результате гемигамии формируется химерный
зародыш, в клетках которого ядра имеют разное происхождение:
материнские (производные ядра яйцеклетки), отцовские (производные ядра
спермия) и гибридные (в случае слияния ядер материнского и
отцовского происхождения). Плоидность ядер в клетках зародыша может
быть разной. Так, например, у R. laciniata яйцеклетки диплоидные
(Ixeris — тип развития зародышевого мешка), а спермин обычно гап-
Такие же картины обравования реституционных ядер наблюдал Battaglia (1947),
однако их анализ автором не был произведен.
Двойное оплодотворение
199
лоидные (лишь в редких случаях диплоидные). В мозаичном зародыше
R. laciniata, большинство ядер диплоидные (материнского
происхождения), некоторые ядра — гаплоидные (отцовского происхождения)
или диплоидные (в случае реституции ядер отцовского
происхождения), некоторые ядра триплоидные (при объединении мужского и
женского ядер). Триплоидные ядра обычно делятся с большими
нарушениями, и при образовании мостов формируются реституционные
гексаплоидные ядра.
Детальные цитологические исследования (Kosciriska, 1980; Pajak,
1982, 1983; Kosciriska-Pajak, 1985) подтвердили мозаичность
зародышей по плоидности у рудбекий. В клетках зародышей R. bicolor
обнаружены гаплоидные, диплоидные и триплоидные ядра. Как правило,
клетки с ядрами, производными спермия, располагаются в области
подвеска либо в базальной или латеральной частях собственно
зародыша и не участвуют в формировании апекса побега. Реже они
оказываются в апикальной или латеральной части зародыша, то есть там,
где закладывается апекс будущего побега. Поэтому новое растение
чаще всего оказывается материнского типа, реже отцовского и очень
редко с тремя типами тканей.
Гемигамия в природе — достаточно редкое явление. Среди
цветковых растений она обнаружена как у двудольных (14 видов), так и у
однодольных (13 видов) и нескольких межвидовых гибридов. Среди
двудольных она распространена в сем. Asteraceae (Rudbeckia) и
встречается в сем. Malvaceae (Gossypium). Экспериментально гемигамия
индуцирована у Arabidopsis thaliana (Brassicaceae). Среди
однодольных она характерна для семейств Amaryllidaceae (Argyropsis, Cooperia,
Habranthus, Zephyranthes) и Роасеае (Coix и Zea).
Гемигамия не представляет собой уникальное явление, присущее
только покрытосеменным. Она обнаружена также у водорослей,
например, в роде Acrosiphonia — A. incurva, A. sleneri, A. arcta (Jonsson,
1964, 1971). Образование дикарионной зиготы у грибов тоже может
рассматриваться как вариант гемигамии.
Явление гемигамии подверждается генетическими исследованиями. С
помощью методов генетического маркирования она установлена у
Gossypium (Turcotte, Feaster, 1967, 1973, 1974; Barrow, Chaundhari,
1974, 1976) и Coix (Rao, Narayana, 1980). Гемигамия проявляется
как на диплоидном, так и на гаплоидном уровнях и может быть
использована для получения гаплоидов. Гемигамия наследственно
обусловлена. У хлопчатника, например, она передается как через
яйцеклетку, так и через пыльцу, но осуществляется тогда, когда ядро
яйцеклетки содержит фактор гемигамии, представленный одним
доминантным геном (Chaundhari, 1975, 1978).
Гемигамия не облигатна, не заменяет и не исключает амфимиксис.
У Rudbeckia она обнаружена в 40-42% семязачатков, при этом в
25% семязачатков отмечается нормальное оплодотворение яйцеклетки,
а остальные — дегенерируют. Гемигамия всегда сопровождается фор-
200
Семя
мированием эндосперма половой природы. Она обнаружена у тех
растений, которые, будучи приспособленными к перекрестному опылению,
вынуждены довольствоваться самоопылением в пределах цветка или
соцветия. С другой стороны, гемигамия проявляется не только при
внутривидовых скрещиваниях, но и при межвидовых, например, у
Gossypium barbadense x G. hirsutum. У Rudbeckia при отдаленной
гибридизации она не обнаружена (Мовсесян, Каспарова, 1977а, б), но
это может быть связано с большой стерильностью семязачатков при
выбранных вариантах скрещивания. Скорее всего гемигамия является
формой проявления несовместимости на уровне ядер гамет.
Естественные популяции гемигамных видов являются
полиплоидными. Так, у Rudbeckia laciniata обнаружены ди-, три- и тетраплоиды,
у JR. fulgida — ди- и триплоиды, у R. triloba — ди- и
тетраплоиды. Все полиплоиды очень полиморфны. Однако полиморфизм не
связан с межвидовой гибридизацией (Perdue, 1959-1960). Вероятно,
полиплоидия у этого рода — результат гемигамии.
Гемигамия не является случайной аномалией процесса
оплодотворения, а будучи закрепленной генетически, играет определенную роль в
эволюции некоторых таксонов (Солнцева, 1982). Рис. 14.
Ворсобина, Солнцева 1973, 1979; Мовсесян, 1964, 1968, 1970, 1983; Мовсесян,
Каспарова, 1977а, б; Мовсесян, Хачатрян, 1975; Навашин, 1900; Солнцева, 1968,
1971, 1973а, б, в, 1974, 1976, 1978а, б, 1982; Солнцева, Ворсобина, 1972; Asker,
Jering, 1992; Barrow, Chaundhari, 1974, 1976; Battaglia, 1945a, b, 1946a, b; 1947a,
b, 1952, 1981; Chaundhari, 1975, 1978; Сое, 1953; Crane, 1978; Fagerlind, 1946;
Gerlach-Cruse, 1970; Jonsson, 1964, 1971; Kosciiiska, 1980; Kosciiiska-Pajak, 1985;
Nawaschin, 1898; Nogler, 1984; Pace, 1913; Pajak, 1982, 1983; Perdue, 1957, 1959-
1960; Rao, Narayana, 1980; Solntseva, 1974, 1978, 1982; Turcotte, Feaster, 1967,
1973, 1974; Zverzhanskaya, Komarova, 1982.
ОПЫЛЕНИЕ И ОПЛОДОТВОРЕНИЕ У ЗЛАКОВ
В последнее время термины «биология цветка» и «биология
цветения» были заменены более корректным понятием «антэкология» (греч.
anthos — цветок, oicos — дом, жилище, logos — учение)
(Пономарев, 1969, 1970). Этот термин подчеркивает, что формирование
репродуктивных органов и их функционирование зависит от условий
среды, в которых произрастает данный организм.
Злаки различаются характером (взрывчатый, порционный) и
продолжительностью цветения, типом опыления (хазмогамный, клейсто-
гамный и др.). Так, у многоцветковой пшеницы в Ленинградской
области цветение продолжается 7-8 сут., а у одно- и двуцветковой —
2-3 сут. Разные виды злаков характеризуются различными
механизмами раскрытия цветка. У пшениц, например, преобладает лодикулярный
(за счет увеличения лодикул), в случае отсутствия у них опы\ения
Двойное оплодотворение 201 I
происходит вторичное раскрытие цветка за счет разрастания завязи —
овариумный (Батыгина, 1974).
Оплодотворение sensu lato — сложный процесс, состоящий из
двух основных фаз — прогамной (от попадания пыльцы на рыльце до
вхождения пыльцевой трубки в зародышевый мешок) и двойного
оплодотворения (сингамии и тройного слияния). Многие авторы, говоря
об оплодотворении, рассматривают его только sensu stricto — имея в
виду лишь двойное оплодотворение.
Исследованию процесса оплодотворения у злаков посвящено немало
работ (Sax, 1918; Львова, 1950; Оксиюк, Худяк, 1955; Симонян,
1955; Vazart, 1955; Ключарева, 1957; Модилевский и др., 1958;
Мошкович, Чеботарь, 1978). Однако изучены лишь отдельные этапы
процесса оплодотворения, при этом некоторые вопросы, в частности,
структура половых ядер, не были достаточно освещены. Не исследован
клеточный цикл мужских и женских гамет и почти не рассмотрен
сопряженно процесс развития зиготы и эндосперма. Вероятно, все это
явилось источником возникновения ряда противоречивых трактовок
одних и тех же структур и явлений, имеющих место в процессе
оплодотворения у злаков.
Sax (1918), исследуя процесс оплодотворения у пшеницы, уделил
большое внимание цитологической стороне этого явления. Он считал,
что ядро одного спермия, как и ядро яйцеклетки, с которым он
«сливается», находится в профазе, ядро же другого спермия'/ко
времени его слияния с полярными ядрами находится в состояний' ранней
метафазы.
Позднее Morrison (1955) утверждал, что спермин при объединении
с женскими ядрами находятся в стадии покоя. Однако из приведенных
рисунков можно заключить, что это не совсем так.
Довольно детально процесс слияния половых ядер у ряда злаков
(Triticum, Hordeum, Zea, Secale, Sorghum) рассмотрен в работе Vazart
(1955). Данный автор не анализирует в полной мере митотический
цикл ядер половых клеток, придавая большее значение типам ядер,
чем последовательности фаз их развития. Однако Vazart, подобно Sax,
склоняется к мнению, что «растворение» спермия в женском ядре
совпадает с его профазной стадией, в которую в это время вступает
и ядро яйцеклетки (за исключением Sorghum).
Оксиюк и Худяк (1955), Модилевский (1953, 1963) упоминают о
структуре половых ядер к моменту их слияния. Они пишут о хрома-
тиновой сеточке, напоминающей профазу в женских ядрах, и о
возможной стадии спиремы у спермиев, о которой пишет Sax. Однако
они не смогли определить, в каком состоянии находятся спермин к
моменту объединения с женскими ядрами.
Весомый вклад в изучение процесса оплодотворения у злаков внесли
отечественные исследователи. В значительной степени этому
способствовало применение метода темпоральной фиксации (Gerassimova,
1933). Использование этого метода позволило получить последователь-
202
Семя
ные картины процесса двойного оплодотворения, что привело к
детализации морфологического описания процесса оплодотворения sen.su
/а/о на световом уровне (Герасимова-Навашина, Батыгина, 1959; Ба-
тыгина, 1959, 1961а, б, 1962, 1974, 1987; Коробова, 1959, 1961,
1979; Хведишч, 1969, 1972; Хведынич, Банникова, 1970а, б; Татин-
цева, 1975; Банникова, Хведынич, 1982).
Первые попытки цитохимического изучения процесса
оплодотворения были связаны с использованием реакции Фельгена. Были изучены
женские половые клетки и спермин (Vazart, 1958; Герасимова-
Навашина, Батыгина, 1959; Коробова, 1959; Батыгина, 1962).
Применение метода люминесцентного микроскопического
спектрального анализа позволило проследить изменения состояния хроматина и
нуклеиновых кислот в ядрах мужской и женской гамет злаков
(Хведынич и др., 1983, Хведынич, Сердюк, 1986). Выявлено, что все
клетки зародышевого мешка и спермиев различаются по структурной
организации хроматина. Ядро яйцеклетки Фельген-положительно.
Большая часть ДНК прочно связана с белками и входит в состав
гетерохроматина. Лишь небольшая часть ДНК находится в составе
диффузного хроматина. Эта часть ДНК, вероятно, и обеспечивает
необходимый уровень метаболической активности яйцеклетки, который
относительно низок перед оплодотворением, что подтверждает
характер ее органелл. Ядра центральной клетки характеризуется диффузным
хроматином. По количеству РНК ядра яйцеклетки и центральной
клетки различаются. Таким образом, ядра яйцеклетки и центральной
клетки перед оплодотворением находятся в разном исходном
состоянии. Хроматин ядра мужской гаметы всегда более конденсирован, по
сравнению с хроматином ядра женской половой клетки (см.
Цитохимия процесса оплодотворения; Сингамия; Зигота).
В последнее время появились работы по изучению процесса
оплодотворения у злаков на ультраструктурном уровне in vivo (Mogensen,
1982, 1988; Schel et al., 1984; You, Jensen, 1985; Татинцева, 1988;
Russell et al., 1990), а также в культуре in vitro (Kranz, Lorz, 1993,
1996; Kranz et al., 1995).
Прогамная фаза. Прорастание пыльцы происходит в результате
взаимной активации пыльцы и рыльца. Обычно оно начинается на
«сидячем» рыльце у большинства злаков через несколько минут после
опыления. Оптимальные условия (влажность, температура)
прорастания пыльцевых трубок специфичны для каждого вида злаковых (см.
Пыльцевая трубка). После прорастания пыльцы на воспринимающей
поверхности папилл рыльца, покрытых пелликулой, пыльцевые трубки
растут в межклеточном матриксе волосков рыльца. Далее пыльцевые
трубки проходят через лопасти перистого рыльца и растут в
проводниковой ткани столбика, раздвигая при этом плотно сомкнутые клетки
(см. Проводниковый тракт пестика). В результате этого происходит
деформация клеток, а при массовом прорастании пыльцевых трубок —
их разрушение (Батыгина, 1961а, б, 1974). Пыльцевые трубки в
Двойное оплодотворение
203
пестике часто прекращают свой рост, что особенно видно при
скрещивании различных видов злаков (Батыгина и др., 1961).
Семязачаток пшеницы по положению в завязи — апотропный, в
связи с чем и путь пыльцевых трубок от рыльца до микропиле
относительно длинный. Из столбика пыльцевые трубки попадают в завязь,
обычно проходя между стенкой завязи и наружным интегументом,
затем они достигают внутреннего интегумента, образующего микропиле
(см. Микропиле, Т. 1), через которое они проходят в зародышевый
мешок. Пыльцевые трубки могут достигать микропиле и иным путем:
по внутренней поверхности завязи, переходя на интегументы, или
только по поверхности интегументов. Как в завязь, так и в
зародышевый мешок могут входить одна или несколько пыльцевых трубок
(Батыгина, 1974, 1987).
Клетки проводниковой ткани столбика удлиненные. В центре клетки
находится крупное продолговатое ядро. Содержимое вакуоли электро-
нопрозрачное. На внутренней поверхности тонопласта наблюдаются
темные гранулы. До опыления такие гранулы отмечаются в
экстраплазматическом пространстве, после опыления они исчезают, очевидно,
включаясь в оболочку или трансформируясь в вещества межклеточного
матрикса. Продольные и поперечные стенки клеток проводниковой
ткани пронизаны многочисленными плазмодесмами. По мере
созревания завязи и увеличения количества межклеточного матрикса в
столбике, плазмодесмы исчезают, и клетки проводниковой ткани остаются
связанными плазмодесмами только через поперечные стенки (Vishnya-
kova, Willemse, 1994). У пшеницы плазмодесмы существуют не только
в проводниковой ткани столбика, но также между терминальными
клетками этой ткани и эпидермисом завязи. Это может
свидетельствовать о непрерывности проводникового тракта пестика и о системе сим-
пласта в плодолистике (Вишнякова, неопубликованные данные). Автор
считает возможным прохождение сигнала опыления от рыльца до
плаценты через систему плазмодесм. Клетки внутренней эпидермы стенки завязи
имеют морфологию и структуру, сходную с клетками проводниковой ткани
столбика. Плазмодесмы соединяют эти клетки друг с другом, а также с
нижележащими клетками стенки завязи, два-три слоя которых содержат
большое количество хлоропластов.
В полости завязи между наружным интегументом и эпидермой
стенки завязи отмечается фибриллярное вещество. Вероятно, что синтез
этого вещества связан с активностью диктиосом в эпидерме завязи и
клетках наружного интегумента, а также с формированием в них
темных глобул и их экзоцитозом.
По данным Вишняковой, имеются различия в тонкой структуре
клеток различных зон проводникового тракта пестика пшеницы (волос-
Данные по ультраструктуре, относящиеся к прогамной фазе у пшеницы, были
любезно предоставлены М. А. Вишняковой.
204
Семя
ков рыльца, проводниковой ткани стилодиев и столбика, а также
тканей завязи и семязачатка, по которым растут пыльцевые трубки). Это
проявляется в форме клеток и их ядер, характере пластидома,
активности диктиосом, содержимом вакуолей и, очевидно, характере
секреции. Общей особенностью всех клеток проводникового тракта является
их активация после опыления. Это, в частности, выражается в
увеличении трубчатых и везикулярных элементов АЭР и активных
диктиосом, приобретении плазмалеммой извилистого контура, ассоциации с
ней многочисленных везикул, образовании ломасом, а также в экзоци-
тозе. Наличие ломасом было отмечено также в клетках рылец у ржи
и ячменя (Heslop-Harrison J., Heslop-Harrison Y., 1981).
Предположительно наличие ломасом связывают с гранулокриновой секрецией
белков. В клетках проводниковой ткани пестика пшеницы отмечается
синтез белков и углеводов.
В семязачатке кукурузы после опыления обнаружен секрет (дающий
положительную реакцию на белки, пектиновые полисахариды) в
межклетниках проводниковой ткани, а до опыления — в области
микропиле и нуцеллуса. Можно предположить, что он участвует в регуляции
роста пыльцевых трубок, необходимых для оплодотворения.
Рост пыльцевой трубки осуществляется в основном за счет ее
кончика, в котором идет синтез веществ. Апикальная часть пыльцевой
трубки периодически отсекается так называемыми каллозными
пробками и позже дегенерирует. Спермин располагаются на определенном
расстоянии от кончика трубки. По мере роста пыльцевых трубок в
тканях рыльца и короткого столбика, спермин претерпевают морфоге-
нетические изменения. У пшеницы в пределах каждой пары спермин
различаются размерами и формой; чаще они являются лентовидными
или скрученными в виде спирали. Структура спермиев зависит не
только от фазы клеточного цикла, в которой они находятся, но также
и от содержания ДНК в их ядрах.
В цитоплазме пыльцевой трубки обнаружены многочисленные
пластиды, осмиофильные глобулы и другие органеллы и включения. Кроме
того, в цитоплазме имеется фибриллярное вещество, что, возможно,
объясняет движение спермиев и ядра вегетативной клетки у злаков.
Двойное оплодотворение. Процессы плазмо- и кариогамии были
впервые подробно исследованы на светооптическом уровне на примере
Triticum (Батыгина, 1962; Batygina, 1969, 1971).
Проникая в зародышевый мешок, пыльцевая трубка встречает на
своем пути синергиды и изливает в них свое содержимое. Часто
содержимое пыльцевой трубки видно в виде «струй», пронизывающих
синергиду. При вхождении пыльцевой трубки разрушаются одна или
обе синергиды. Процесс дегенерации синергид происходит в течение
длительного отрезка времени. Так, на стадии четырехклеточного
зародыша в зародышевом мешке, наряду с ядром «разрушенной»
синергиды, в которую вошло содержимое пыльцевой трубки, можно наблюдать
и целое ядро второй, еще сохранившейся синергиды. На стадии вось-
Двойное оплодотворение
205
миклеточного зародыша синергид, как правило, уже не наблюдается.
Разрушенные ядра синергид в пикнотическом состоянии имеют
большое сходство с мужскими гаметами; часто их принимают за спермин
дополнительных пыльцевых трубок.
В начале своего пребывания в зародышевом мешке спермин еще
больше спирализуются, чем в пыльцевой трубке. Излившееся содержимое
пыльцевой трубки вместе с обоими спермиями вносится в экстрацеллю-
лярное пространство между яйцеклеткой и центральной клеткой
зародышевого мешка, откуда спермин и расходятся в противоположных
направлениях: один из них попадает в центральную клетку, другой — в
яйцеклетку. Через 20-40 мин после опыления спермин пшеницы
попадают в цитоплазму обеих клеток. После проникновения в яйцеклетку
ядро спермия в течение часа находится в ее цитоплазме, что дает
возможность проследить все дальнейшие фазы его превращения. По пути
к ядру яйцеклетки, которое в это время находится в периоде «покоя» —
Gq} спермий начинает разрыхляться, отчетливо видна его структура.
Вблизи ядра яйцеклетки, а также в контакте с ним спермий. имеет
характерную форму: один конец широкий, другой узкий, широкий конец
спермия более рыхлый, чем узкий конец (более плотный). В обоих концах
спермия видны спирализованные хроматиновые нити. Деспирализация
спермия в ядре яйцеклетки, как правило, начинается с широкого конца,
теряющего свои очертания. Встречаются случаи, когда широкий конец
спермия уже растворен, в то время как узкий еще не пришел в контакт
с ядром яйцеклетки; следовательно, спермий погружается в ядро
яйцеклетки постепенно. Все полученные» данные по структуре спермия у
пшеницы, как в пыльцевом зерне и пыльцевой трубке, так и в
зародышевом мешке, подтверждают, что спермий подходят к женским
клеткам в периоде Go- При значительном их разрыхлении во время контакта
и начала погружения в женское ядро, в спермиях пшеницы не
обнаруживаются ядрышки (они находятся в периоде G;). При сильной дес-
пирализации спермия, когда хроматиновая нить уже, по-видимому,
теряет свою непрерывность, появляется ядрышко. Под влиянием женской
покоящейся клетки, спермий переходит в период G] интерфазы.
Размер мужских ядрышек заметно увеличивается в ходе
«растворения» ядра спермия в женских ядрах. Иногда ядрышко выделяется еще
при сохранившейся структуре спермия. Число ядрышек может
варьировать. У большинства злаков происходит слияние женского ядрышка с
мужским, хотя у пшеницы нам не удалось наблюдать этот процесс.
Весь процесс объединения спермия с яйцеклеткой у различных
злаков протекает в течение нескольких часов (2-6 ч), что в значительной
степени зависит от условий их произрастания. После окончательного
слияния ядра спермия с ядром яйцеклетки зигота впадает в Gz,
который продолжается у пшеницы 16-18 ч. В зиготе нельзя отличить
См. Зигота; Сингамия.
206
Семя
мужской хроматин от женского. Во время периода покоя зигота
интенсивно растет и развивается. Большую роль играет содержимое
пыльцевой трубки, излившейся в зародышевый мешок, которое
принимает непосредственное участие в росте и развитии зиготы пшеницы и,
вероятно, в какой-то степени обусловливает ее форму. В находящейся
в интерфазе зиготе происходят изменения строения ядра и
цитоплазмы. Результатом такого длительного покоя, по-видимому, и является
то, что в профазу деления зигота пшеницы вступает через 24 ч после
опыления как единое целое (см. Зигота).
Эти процессы были изучены на ультраструктурном уровне с
использованием фазовоконтрастной микроскопии и трехмерной реконструкции
у разных видов злаков. Впервые детально исследована кариогамия и
плазмогамия у Zea mays в культуре in vitro с использованием
электрических импульсов (Faure et al., 1993; Kranz, Lorz, 1993, 1996;
Kranz et al., 1995). Некоторые аспекты этих процессов были
освещены у Triticum (You, Jensen, 1985; Guo-Wei, Jia-Heng, 1992),
Triticale (Hause, Schroder, 1987) и Hordeum (Mogensen, 1982).
Кариогамия происходит у злаков в течение 1-3,5 часов.
Относительно сходная картина поэтапности и временных параметров этого
процесса наблюдалась в культуре in vitro при слиянии мужских и женских
гамет Zea mays. Через 15-18 ч после слияния образуется зигота с
двумя ядрышками, которая впадает в длительный покой (27-29 ч).
Обычно через 42-46 ч после слияния ядра яйцеклетки с ядром
спермин наблюдается первое деление (Kranz et al., 1995). Вариабельность
этого процесса у Zea mays в значительной степени зависит от длины
столбика и окружающих условий. Иногда от опыления до
оплодотворения проходит до 22 ч (Diboll, 1968; Mol et al., 1993).
Процесс погружения ядра спермия в ядро центральной клетки
сходен с таковым в яйцеклетке, но протекает значительно быстрее. Если
в цитоплазме яйцеклетки спермий находится около часа, то в
цитоплазме центральной клетки — 15-30 мин. В связи с этим очень
трудно увидеть изменения спермия в цитоплазме центральной клетки,
чаще всего уже наблюдается контакт ядра спермия с полярными
ядрами. Полярные ядра до оплодотворения у большинства злаков сближены,
но не слиты. С началом контакта ядра спермия с полярными ядрами
происходит их быстрое объединение, вследствие чего между ними можно
наблюдать цитоплазму центральной клетки, которая затем дегенерирует.
Это было подтверждено в том числе и электронно-микроскопическими
исследованиями (Mogensen, 1982, 1988). Наличие цитоплазматических
«захватов» может служить показателем начала объединения полярных
ядер, которое полностью еще не завершилось. Процесс их объединения
со спермием происходит у пшеницы в течение 1,5-2 ч. Уже через 2-3 ч
после опыления он, как правило, закончен. Во время короткой интерфазы
можно наблюдать два больших ядрышка полярных ядер и два ядрышка
спермия. Особенностью процесса деления в центральной клетке
является отсутствие объединения мужских и женских ядрышек и раздель-
Двойное оплодотворение
207
ное (асинхронное) вступление спермия в профазу внутри первичного
ядра эндосперма. Полное объединения хроматина спермия и полярных
ядер происходит у кукурузы в профазе, а у пшеницы — в метафазе
(Батыгина, 1962, 1974). Этот феномен асинхронного преобразования
хроматина мужских и женских гамет во время оплодотворения присущ
всем видам злаков (Батыгина, 1987). Это явление, вероятно, можно
объяснить разным темпом прохождения ядрами мужских и женских
гамет периодов митотического цикла {Go, Gj, S, G^) и разными
условиями, в которые попадают спермин одной пары (Батыгина, 1961а, б,
1962; Коробова, 1961).
Электронно-микроскопические исследования сингамии и тройного
слияния у различных видов злаков показали, что слияние спермиев с
яйцеклеткой и центральной клеткой начинается с контакта
плазматических мембран. Попав в женские клетки, спермий теряет свою
цитоплазму, причем никаких различимых органелл спермиев не
обнаружено. Вероятно, при сингамии мужская цитоплазма не входит в
яйцеклетку. Mogensen (1982, 1988), изучая процесс оплодотворения у
Hordeum, допускает, что имеются различия в механизме
оплодотворения яйцеклетки и центральной клетки. Он полагает, что в яйцеклетку
проникает только ядро спермия, а в центральную клетку входит как
ядро, так и цитоплазма спермия. Однако он также не исключает, что
процесс оплодотворения яйцеклетки и центральной клетки может быть
идентичен, т. е. в яйцеклетку и центральную клетку входят только
ядра спермиев.
Темп прохождения сингамии и тройного слияния неодинаков.
Вероятно, это зависит от условий, которые имеются в яйцеклетке и
центральной клетке, а также от степени конденсации хроматина в их ядрах
(Герасимова-Навашина, Батыгина, 1959; Батыгина, 1961а, б, 1962,
1974; Хведынич, 1985). В полярных ядрах в момент контакта с ядром
спермия хроматин находится в диффузном состоянии, поэтому не
происходит тех сложных перестроек, которые наблюдаются в ядре
яйцеклетки, и процесс объединения совершается быстро. Выявлена связь
между метаболическим состоянием клеток зародышевого мешка и
скоростью протекающих в них ядерных слияний (Jensen, 1965;
Герасимова-Навашина, Гуляев, 1973; You, Jensen, 1985). У тех
растений, яйцеклетки которых имеют невысокую плотность распределения
рибосом и немногочисленные органеллы цитоплазмы, темп полного
слияния ядер гамет продолжительный, например, у Peperomia blanda,
Lilium candidum, а у тех растений, у которых цитоплазма яйцеклетки
насыщена рибосомами и органеллами (Crepis tectorum, Rudbeckia hirta)
объединение ядер происходит быстро (Плющ, 1992). Разная скорость
процесса объединения ядер спермиев с женскими ядрами, вероятно,
зависит также и от плоидности клеток: ядро яйцеклетки имеет
гаплоидный набор хромосом, а вторичное ядро центральной клетки —
диплоидный. Различные размеры и строение этих двух клеток
обусловливают также и то, что у них период интерфазы разной длительности:
! 208
Семя
в зиготе — около 12-18 ч, а в первичной клетке эндосперма —
30-40 мин. Различная продолжительность интерфазы в этих клетках,
вероятно, может быть объяснена различным характером процессов их
дедифференциации (см. Зигота).
Темпы объединения половых ядер в процессе сингамии и тройного
слияния следует рассматривать в эволюционном аспекте, исходя из
разной функциональной предназначенности зародыша и эндосперма.
Процесс сингамии у злаков идет по премитотическому типу. Однако
объединение спермия с полярными ядрами не соответствует
классическому премитотическому типу. Первый этап, т. е. объединение ядра
спермия с ядрами центральной клетки происходит до митоза, что
соответствует премитотическому типу. Второй этап, т. е. полное
объединение мужского и женского хроматина не происходит до
митоза, поскольку спермий вступает в профазу внутри полярных ядер
раньше и отдельно от профазы полярных ядер. Полное их
объединение происходит либо в конце профазы, либо в метафазе. Исходя из
этого, объединение ядер в центральной клетке, вероятно, следует
отнести к промежуточному типу оплодотворения, а весь процесс
двойного оплодотворения всё же можно охарактеризовать как премитоти-
ческий.
В этой связи заслуживает внимания точка зрения Плющ (1992),
которая полагает, что различные типы оплодотворения, предложенные
Герасимовой-Навашиной, различаются только скоростью абсолютно
полного объединения ядер (по всей поверхности их контакта).
Сопряженность процессов сингамии и оплодотворения
центральной клетки. Вопросу о том, сколько времени проходит между
опылением и слиянием гамет у пшеницы, посвящено немало работ. Однако
эти сведения носят противоречивый характер. Кроме того, в работах
почти отсутствуют данные о темпах оплодотворения яйцеклетки и
центральной клетки.
Brenchley (1909) считает, что у пшеницы между опылением и
оплодотворением проходит 1-2 дня, так как профазу в зиготе он
наблюдал через трое суток после опыления.
Yensen (1918), Percival (1921) и Носатовский (1950) пишут, что
между опылением и оплодотворением проходит 24-40 ч. При этом
Персиваль и Носатовский не наблюдали самого момента слияния
мужских и женских ядер, однако они отметили, что деление полярных ядер
происходит одновременно или позже деления зиготы. Вместе с тем, из
рисунков, приведенных Персивалем, видно, что в момент объединения
спермия с ядром яйцеклетки уже имеется четыре ядра эндосперма.
Темпоральное изучение сингамии, оплодотворения центральной
клетки, развития зародыша и эндосперма было проведено у разных
видов пшеницы, которые оказались удобными объектами исследования
(Батыгина, 1959; 19626; Batygina, 1969). Процесс оплодотворения у
нее растянут во времени, что дает возможность проследить все его
этапы (например, наблюдать спермин в синергиде, в цитоплазме яйце-
Двойное оплодотворение 209
клетки и т. д.) и выявить сопряженность процесса двойного
оплодотворения на разных этапах. Кроме того, все половые элементы
пшеницы имеют достаточно крупные размеры.
Итак, через 15-20 мин после опыления спермин пшеницы обычно
уже находятся в синергиде, а через 20-25 мин их можно наблюдать
между центральной клеткой и яйцеклеткой. Этот этап довольно трудно
уловить, так как уже через 25-30 мин, а в некоторых случаях и
несколько раньше один из спермиев лежит около полярных ядер, а
иногда он уже вошел в контакт с ними. Другой спермий все это время
находится в цитоплазме яйцеклетки, продвигаясь к ее ядру. Спустя
час после опыления обычно уже начинается объединение ядра спермия
с полярными ядрами, в то время как в яйцеклетке ядро спермия еще
не вступило в контакт с ее ядром, и только через 1,5 ч можно видеть
начало слияния ядра спермия с ядром яйцеклетки, в то время как
спермий в полярных ядрах почти деспирализовался и выделил
ядрышко.
Через 2-3 ч после опыления объединение ядра спермия с
полярными ядрами уже закончено и первичное ядро эндосперма впадает в
относительный «покой», который длится около 0,5-1 ч. Процесс
слияния спермия с ядром яйцеклетки в это время достаточно хорошо
выражен. Спустя 39-60 мин после объединения полярных ядер со
спермием, т. е. через 3-4 ч после опыления, наступает профаза,
причем, как мы уже отмечали, сначала в спермий, а потом во вторичном
ядре. Этому этапу развития центральной клетки соответствует фаза
объединения спермия с ядром яйцеклетки. Через 5-6 ч после
опыления, когда в эндосперме уже можн<р наблюдать метафазу или анафазу,
в яйцеклетке происходит почти полная деспирализация спермия.
Только спустя 6-7 ч после опыления ядро зиготы вступает в S и Сг
периоды. Эта стадия длится около 16-18 ч. Таким образом, зигота
начинает делиться через 20-24 ч после опыления, когда в эндосперме
уже имеется 4-5 ядер.
Следовательно, деспирализация спермия в ядре яйцеклетки длится
4-5 ч, в то время как в полярных ядрах центральной клетки этот
процесс происходит за 1,5-2 ч. Различен также период покоя: в зиготе
он длится около 16-18 ч, в клетке зачатка эндосперма — всего лишь
0,5-1 ч.
Однако следует заметить, что нами однажды наблюдался случай
синхронного слияния ядер спермиев с женскими ядрами.
В результате проведенного нами исследования цветения, процессов
опыления и оплодотворения у Т. топососсит, Т. dicoccum, T. aestivum
установлено, что каждый вид имеет определенный характер цветения
(тип и ритм), но у всех изученных видов один тип оплодотворения —
премитотический. Темпы объединения спермиев с женскими ядрами
зародышевого мешка неодинаковы. Однако, несмотря на их
различие, скорость протекания каждого процесса в отдельности и их
корреляция детерминированы, т. е. определенному состоянию
•) 4-828
210
Семя
яйцеклетки и зиготы всегда строго соответствует определенное
состояние центральной клетки и эндосперма. Эта корреляция очень
мало подвержена влиянию внешних факторов и практически от них не
зависит, что подтвердило сравнительное изучение процессов
оплодотворения у пшеницы в разных условиях — в Ленинградской области
(г. Пушкин) и в Казахстане (Джезказган). Скорость общего процесса
двойного оплодотворения возросла, но определенная морфогенетическая
корреляция процессов сингамии и оплодотворения центральной клетки
сохранилась. Несомненно, что скорость протекания эмбриологических
процессов в целом зависит от внешних условий, поэтому процесс
двойного оплодотворения может либо замедляться, либо ускоряться, но
их сопряженность детерминирована (Батыгина, 1974). Рис. 15.
Банникова, Хведынич, 1982; Батыгина, 1959, 1961а, б, 1962а, б, 1964, 1966, 1974,
1987; Батыгина и др., 1961; Герасимова-Навашина, Батыгина, 1959; Герасимова-Нава-
шина, Гуляев, 1973; Ключарева, 1957; Коробова, 1959, 1961, 1979; Львова, 1950;
Модилевский, 1953, 1963; Модилевский и др., 1958; Мошкович, Чеботарь, 1979; Но-
сатовский, 1950; Оксиюк, Худяк, 1955; Плющ, 1992; Пономарев, 1964; Пономарев,
Букина, 1953; Пономарев, Турбачева, 1962; Симоняи, 1955; Татинцева, 1975, 1988;
Хведынич, 1969, 1972; 1985; Хведынич, Банникова, 1970а, б; Хвединич и др., 1983;
Хведынич, Сердюк, 1986; Batygina, 1969, 1977; Brenchley, 1909; Dumas, Mogensen,
1993; Faure et al., 1993; Gerassimova, 1933; Guo-Wei, Jia-Heng, 1992; Hause, Schroder,
1987; Heslop-Harrison J., Heslop-Harrison Y., 1980; Hu, Zhu, 1979; Jensen, 1918,
1965a, b; Kranz, Lorz, 1993, 1996; Kranz et al., 1995; Mogensen, 1982, 1988; Morrison,
Russell, 1992; Percival, 1921; Russell et al., 1990; Sax, 1918; Schel et al., 1984; Vazart,
1955, 1958; Vishnyakova, Willemse, 1994; You, Jensen, 1985.
INVmiO FERTILIZATION
ОПЛОДОТВОРЕНИЕ IN VITRO
The fusion of isolated male and female gametes in vitro has been
accomplished using electroporation (Kranz et al., 1990, 1991a, b),
induced chemical fusion (Kranz, Lorz, 1994), and in a model system
using a minimal incubation medium (Faure et al., 1994). Although their
experiments have clearly produced «artificial zygotes», the sperm cells in
the first two systems did not fuse spontaneously with either egg cells or
central cells. Faure et al. (1994) used a simple medium composed of
0.5 M mannitol and 5 mM CaCh and were able to obtain adhesion and
fusion. Fewer successful fusions occurred at either 1 or 10 mM CaCh,
and the effect of the CaCh can be replaced with other calcium salts.
Apparently, the event mimics natural fertilization in that fusion is
spontaneous after adherence and polyspermy is prevented; the addition of
supernumerary sperm cells to a fertilized egg cell brought no further
fusions. The exact requirements for fusion, however, are not clearly stated
in their work. One question that remains is why Kranz et al. (1991a, b)
Двойное оплодотворение 211
were unable to obtain gamete fusion by aligning isolated gametes whereas
Faure et al. (1994) using the same plant could? If successfully adhered,
the gametes fused in about three minutes. Conditions inside the embryo
sac may place the gametes under some pressure due to the turgor of intact
embryo sac cells. In vivo, the pressure of male and female gamete may
be a further aid to fusion.
Regeneration of plants from normally obtained (in vivo fertilized) zygotes
has been demonstrated in corn (Campenot et al., 1992; Mol et al., 1993)
and barley (Holm et al., 1994) and from in vitro fertilization of corn
using electroporation (Kranz, Lorz, 1993). The technical accomplishment
of plant regeneration from in vitro and in vivo fusions is significant. Isolated
gametes must be handled extremely carefully when removed from their native
milieu, and successful regeneration provides the strongest evidence that no
irreversible changes occur during this process. Modeling in vivo recognition
and fertilization events requires fusion without the use of fusigenic factors.
The isolation of male and female gametes in a diversity of species (Theunis
et al., 1991) may eventually provide this opportunity in a wider choice of
plants.
Clearly, in vitro fertilization will allow wide crosses to be made between
unrelated plants with greater facility than possible with somatic cells or
even pollination of ovules in the «classical» in vitro fertilization technique
(Zenkteler, 1990). The fusigenic properties of isolated reproductive cells
are possibly greater than those of somatic cells. Also, the zygote is a cell
that is already adapted to accept new genetic combinations and may therefore
be more tolerant of foreign nuclear and cytoplasmic genomes than somatic
cells, potentially giving greater genetic stability. In vitro fertilization of
isolated gametes will also provide the opportunity to develop a model of
fertilization that can be modified and tested under strict experimental controls.
The haploid nature of gametes and reproductive cells may also lead to
precisely defined progeny. Whether knowledge of fertilization processes will
allow us to better exploit this system remains to be established, but it
seems to be a promising emerging technology.
The factors that determine the final pathway of sperm cell migration
within the embryo sac and the possibility of gametic competition within the
embryo sac are still areas of remaining inquiry. The exact conditions within
the synergid in which preprogrammed cell death is brought to completion
through the arrival of the pollen tube are likely change rapidly at the time
of fertilization and have still not been completely characterized. Also, the
exact mechanism by which male gametes are modified during their final
descent in the tube, and their method of fusion may also have an impact
on the transmission and inheritance of cytoplasmically transmitted DNA,
such as that of the chloroplasts and mitochondria.
Campenot et al., 1992; Faure et al., 1994; Holm et al., 1994; Kranz et al., 1990,
1991a, b; Kranz, Lorz, 1993, 1994; Mol et al., 1993; Theunis et al., 1991; Zenkteler,
1990.
14*
212
Семя
ЧАСТЬ II — ЭНДОСПЕРМ, ПЕРИСПЕРМ
ЭНДОСПЕРМ (греч. endon — внутри, sperma — семя) —
гетерогенная ткань, развивающаяся в зародышевом мешке цветковых растений
из первичной клетки эндосперма; последняя возникает при двойном
оплодотворении в результате слияния центральной клетки1
зародышевого мешка со спермием.
Клетки эндосперма содержат обычно триплоидные или более
высокополиплоидные ядра с геномами отцовской и материнской особей. Плоид-
ность ядер эндосперма зависит прежде всего от числа ядер в центральной
клетке зародышевого мешка (см. Центральная клетка и Полярные ядра,
Т.1). При оплодотворении центральной клетки в зародышевых мешках
Polygonum-, Allium- и Adoxa-типов развития, где все три сливающихся
ядра являются чаще всего гаплоидными, первичное ядро эндосперма
(см. Тройное слияние), а также его производные содержат триплоидный
набор хромосом. В зародышевых мешках Oenothera-типа образуется 2п
первичное ядро эндосперма. Наличие диплоидного эндосперма
установлено и в роде Melampyrum (Scrophulariaceae), характеризующемся Drusa-
типом развития зародышевого мешка. Fritillaria-, Plumbagella-, Penaea-,
Plumbago-типам свойственно 5п первичное ядро эндосперма, a Peperomia-
типу — 9n (Peperomia pellucida) или 15п ядро (P. hispidula). Таким
образом, полиплоидным может быть уже первичное ядро эндосперма
вследствие полиплоидизации ядра его материнской клетки еще до
оплодотворения.
В ходе эндоспермогенеза ядра могут оставаться триплоидными
(например, у Nigella damascene., N. sativa — Kapoor, 1966;
Phytolacca acinosa, Rivina humilis — Enzenberg, 1961) или пентапло-
идными (Gagea lutea — Geitler, 1948; Lilium sp. — Swift, 1953).
У большинства же растений дифференциация эндосперма
сопровождается дальнейшим повышением уровня плоидности его ядер (см.
Иоффе, 1971а). Этот процесс, как правило, осуществляется путем
эндоредупликации хромосом. Наиболее высокий уровень плоидности
(24576п), соответствующий 13 циклам эндоредупликации, выявлен в
одноядерном халазальном гаустории эндосперма Arum maculatum
(Erbrich, 1965). В то же время в триплоидных ядрах эндосперма
Синонимы: материнская клетка эндосперма, проэндоспермальная клетка.
2
Первичным ядром эндосперма называется ядро первичной клетки эндосперма,
образующееся в результате слияния полярных ядер центральной клетки зародышевого
мешка (или ее вторичного ядра) с ядром спермия.
Эндосперм, перисперм
213
ряда видов растений обнаружены гигантские (политенные) хромосомы
(см. D'Amato, 1984). У видов растений с эндоспермом целлюляр-
ного типа развития, характеризующимся наличием гаусториев, уровни
плоидности ядер в различных частях эндосперма различны. При
этом у большинства представителей сем. Cucurbitaceae, например,
уровень политенизации хромосом в ядрах собственно эндосперма,
как правило, выше, чем в ядрах гаусториев (см. D'Amato, 1984).
Напротив, Cucumis sativus (Enzenberg, 1961) и Tozzia alpina
(Erbrich, 1965) характеризуются обратным соотношением уровней
плоидности ядер эндосперма и гаусториев.
Эндосперм Angiospermae подобно эндосперму Gymnospermae
первоначально рассматривали как гаметофитное образование,
представляющее собой редуцированный заросток — гомолог проталлиума других
высших растений, например, разноспоровых папоротников (Hofmeister,
1847; Sachs, 1874). Приверженцами такого представления о природе
эндосперма является и ряд современных авторов (Battaglia, 1980;
Смирнов, 1982; Терёхин, 1991).
После открытия слияния полярных ядер в центральной клетке
зародышевого мешка цветковых растений, предшествующего образованию
первичного ядра эндосперма (Strasburger, 1877), было высказано
мнение о половой природе эндосперма (Le Monnier, 1887). Согласно
такой трактовке, эндосперм является аналогом второго зародыша и,
следовательно, спорофитной тканью. Истинная картина возникновения
эндосперма цветковых растений прояснилась после открытия двойного
оплодотворения (Навашин, 1898; Guignard, 1899).
В своем исследовании над Lilium martagon и Fritillaria tenella
С. Г. Навашин (1898) установил, что у цветковых растений обе
мужские гаметы участвуют в оплодотворении: одна из них сливается с
яйцеклеткой, а другая — с центральной клеткой, содержащей два
(или более) полярных ядра. Таким образом, эндосперм, как и
зародыш, является новообразованием, возникающим в подавляющем
большинстве случаев в результате полового процесса (см. Сингамия;
Тройное слияние).
Подтверждением такого представления о природе эндосперма стали
экспериментальные исследования (La Rue, 1944, 1949; Johri, 1969,
1971, 1975). При культивировании in vitro эндосперма Zea mays,
Dendrophtoe falcata и Taxillus vestitus были получены каллусы, почки
и корни. Число хромосом в ядрах клеток каллуса и его органов
оказалось триплоидным (Johri, 1971). Еще одним аргументом в
пользу половой природы эндосперма цветковых растений является наличие
эндоспермальных гаусториев, поскольку они не имеют гомологов
среди голосеменных растений. Кроме того, эндосперм цветковых
растений является, в отличие от гаплоидного эндосперма голосеменных,
полиплоидным образованием. Открытие двойного оплодотворения дало
ключ к пониманию процесса возникновения Ксений, мозаичного
эндосперма в семенах некоторых видов цветковых растений (см. Фе-
214
Семя
номен двойного оплодотворения; Поддубная-Арнольди, 1976;
Яковлев, 1981; Vijayaraghavan, Prabhakar, 1984). Наличие двойного
оплодотворения подтвердилось почти у всех исследованных в этом
отношении видов, принадлежащих к различным по своему положению
в филогенетической системе семействам цветковых растений.
После завершения процесса двойного оплодотворения первой
приступает к делению первичная клетка эндосперма. Встречаются, однако,
исключения, когда темпы деления оплодотворенных яйцеклетки и
центральной клетки совпадают (например, у Vicia faba и Lupinus polyphyllus)
или когда зигота делится раньше, чем первичная клетка эндосперма
(Lupinus annuus и Trifolium alexandrinum) (см. Чубирко, Кострикова,
1985). Известны и такие примеры, когда в оплодотворенном
зародышевом мешке наблюдается многоклеточный проэмбрио, а первичное ядро
эндосперма еще не приступало к делению (Floerkea proserpinacoides —
Maheshwari, Johri, 1956; Alcea rosea — Жукова, ориг. данные).
Развитие эндосперма, его гистогенез характеризуется большим
разнообразием. Первыми исследователями семязачатка цветковых
растений после оплодотворения было отмечено наличие двух путей развития
эндосперма, называвшегося первоначально белком (лат. albumen). При
первом способе в эндосперме сначала образуется большое количество
свободных ядер и лишь впоследствии между ядрами закладываются
клеточные перегородки и образуются клетки (нуклеарный тип развития
эндосперма); при втором способе формирования эндосперм ab initio
становится клеточным (целлюлярный тип развития). В настоящее
время различают три основных типа эндоспермогенеза — нуклеарный,
целлюлярный и гелобиальный (см. Нуклеарный тип развития
эндосперма; Целлюлярный тип развития эндосперма; Гелобиальный тип
развития эндосперма). Эндосперм всех типов развития, независимо
от способа его образования, в конечном итоге становится клеточным
(известны, однако, исключения из этого правила — см. Нуклеарный
тип развития эндосперма). Наиболее распространенным из них
является нуклеарный тип развития эндосперма (см. «Сравнительная
эмбриология цветковых растений», 1981, 1983, 1985, 1987, 1990). Он
свойствен представителям 159 семейств двудольных растений (из 240
исследованных — в объеме филогенетической системы цветковых
растений Тахтаджяна — Takhtajan, 1980), в 18 из которых он
встречается наряду с целлюлярным, а в 6 — с целлюлярным и гелобиальным.
Кроме того, этот тип эндоспермогенеза описан в 38 семействах (из
60 исследованных) однодольных растений, в 11 из которых — наряду
с гелобиальным и целлюлярным типами развития. Целлюлярный тип
развития эндосперма характеризует представителей 103 семейств
двудольных растений (в 2 из которых — наряду с гелобиальным и в
24 — с нуклеарным или с нуклеарный и гелобиальным). В классе
однодольных он отмечен лишь в 3 семействах (в 2 из них — наряду
с гелобиальным или с гелобиальным и нуклеарным). Гелобиальный тип
развития эндосперма среди двудольных встречается лишь в 9 семейст-
Эндосперм, перисперм 215
вах (в том числе в 2 — наряду с целлюлярным и в 6 — с
целлюлярным и нуклеарным). Он свойствен преимущественно однодольным
растениям — описан в 32 семействах (в 1 из них — наряду с
целлюлярным и в 12 — с целлюлярным, с целлюлярным и нуклеарным или с
нуклеарным). Все три типа образования эндосперма характеризуются
значительной вариабельностью, что затрудняет их классификацию. В
нуклеарном типе развития эндосперма первоначально было выделено
четыре основных варианта. В основу такого деления были положены
различия во временных и пространственных параметрах начала клетко-
образования в эндоспермальном ценоците (Hegelmaier, 1885). Это
представление получило дальнейшее развитие благодаря
эмбриологическому исследованию большого числа видов семейств «центросемен-
ных» — Caryophyllaceae, Nyctaginaceae, Basellaceae, Portulacaceae
(Rocen, 1927). В зависимости от направления заложения первых
клеточных перегородок Schnarf (1929) подразделил целлюлярный тип
развития эндосперма на несколько вариантов. В типологии
эндоспермогенеза, однако, постепенно наметились тенденции пересмотра устоявшихся
представлений. Высказано мнение о том, что «...разделение развития
эндосперма на три типа является условным. Говоря по существу,
эндосперм имеет единый тип развития. Он всегда переходит из ядерной
фазы в клеточную.» (Модилевский, 1963, с. 325). Одни
исследователи сокращают число основных типов развития эндосперма до двух —
нуклеарного и целлюлярного (мегатипов, по терминологии авторов —
Di Fulvio, 1983; Di Fulvio, Cocucci, 1986), либо целлюлярного и
гелобиального (см. Новый подход к типизации эндосперма в связи
с проблемой его эволюции), другие предлагают увеличить его до
четырех, разделив целлюлярный тип развития эндосперма на два
самостоятельных типа — собственно целлюлярный и тубифлоральный (Ка-
мелина, 1991, 1996; см. О возможности выделения тубифлорального
типа развития эндосперма). Остается дискуссионным и вопрос о
необходимости выделения в самостоятельный тип гелобиального типа
развития эндосперма. Некоторые эмбриологи рассматривают его как
разновидность целлюлярного типа (Swamy, Ganapathy, 1957b; Di
Fulvio, 1983, 1986; Di Fulvio, Cocucci, 1986). Наиболее
многочисленными являются попытки классификации способов образования
эндосперма в пределах семейств, например, в семействах Bignoniaceae
(Mauritzon, 1935; Mehra, Kulkarni, 1985), Scrophulariaceae (Glicic,
1936-1937; Krishna Iyengar, 1947; Crete 1951a,. 1955b; Banerji, 1961),
Boraginaceae (Di Fulvio, 1981), Campanulaceae (см. Коробова, Жин-
кина, 1987). Исходя из сравнительно-эмбриологических исследований
в сем. Fabaceae выделен Vicieae-тип развития эндосперма
(Кострикова, 1984).
Варианты развития эндосперма в пределах типов именуются у разных авторов по-
разному — типы, формы, вариации.
216
Семя
Эндоспермогенез у разных видов цветковых растений протекает
разными темпами: у одних с момента оплодотворения до полного
формирования эндосперма проходит несколько дней (представители Astera-
сеае), у других — несколько недель (Роасеае) и даже месяцев (С/ге-
nopodiaceae).
Размеры эндосперма и его структура в зрелых семенах различных
растений также сильно варьируют. Они могут намного превышать
размеры зародыша (представители Magnoliaceae, Ranunculaceae, Роа-
сеае и др.) или быть примерно равными ему по объему (Solanaceae).
У многих видов растений эндосперм целиком или частично
поглощается во время развития зародыша (представители Capparales,
Fabales, Geraniales, Nelumbonales, Cucurbitaceae и др.). Эндосперм
часто имеет ровную поверхность, повторяя форму семени. Наряду
с этим встречается и так называемый руминированный эндосперм.
Последний снабжен глубокими складками вследствие неравномерного
разрастания семенной кожуры, образующей выросты в эндосперм, или
неравномерного разрастания поверхностных слоев самого эндосперма,
образующих выросты в нуцеллус. Руминированный эндосперм
характерен для представителей таких семейств, как Acanthaceae, An-
nonaceae, Arecaceae, Scrophulariaceae и др. (Periasamy, 1962;
Vijayaraghavan, Prabhakar, 1984; Данилова, Кирпичников, 1985;
Данилова, Савченко, 1985).
У отдельных представителей цветковых растений эндосперм вообще
не образуется (вследствие выпадения второго звена процесса двойного
оплодотворения либо по другим причинам) или развит очень слабо.
Эндосперм не образуется в сем. Podostemaceae (Терёхин, 1991) и у
отдельных представителей семейств Тгарасеае (Титова, 1988, 1996) и
Orchidaceae (Терёхин, Камелина, 1969, 1972; Савина, 1972; Поддуб-
ная-Арнольди, 1976). У некоторых орхидных (например, Calanthe vei-
tchii) полярные ядра обычно не сливаются и вместе с ядром антиподы,
которое приближается к ним, образуют полярно-антиподальную
группу, расположенную непосредственно под яйцеклеткой (см. Тройное
слияние). У большинства же представителей сем. Orchidaceae тройное
слияние обычно происходит, но продукт слияния чаще всего, не
делясь, довольно быстро дегенерирует. Там, где деление первичного
ядра эндосперма происходит, эндосперм развивается по нуклеарному
типу. Число ядер эндосперма варьирует от 2 (Cypripedium spectabile,
С. parviflorum и др.) до 16 (С. septentrionalis) (Савина, Поддубная-
Арнольди, 1990).
Согласно классическому пониманию, эндосперм служит источником
питания для развивающегося зародыша и хранилищем запасных
веществ (Hofmeister, 1849; Brink, Cooper, 1947; Цингер, 1958;
Wunderlich, 1959; Поддубная-Арнольди, 19646, 1976; Герасимова-
Навашина, 1971а; Иоффе, 1971; Raghavan, 1976; Соколов и др., 1980;
Яковлев, 1981). Согласно Wardlaw (1965), поглощение зародышем
питательных веществ непосредственно из нуцеллуса и других окружа-
Эндосперм, перисперм 217 |
ющих тканей затруднено. Посредником между материнским
организмом и зародышем и служит эндосперм. Особая посредническая роль
эндосперма обусловлена его амфимиктической природой. Участие
мужской гаметы в возникновении эндосперма делает зародыш и эндосперм
более совместимыми, чем зародыш и спорофитная ткань материнского
растения. Подобной же точки зрения придерживаются Boesewinkel и
Bouman (1984). Развитие эндосперма и резервирование им
питательных веществ осуществляется в сложном взаимодействии эндосперма
с окружающими соматическими тканями — местами локализации
запасных питательных веществ. На примере некоторых представителей
Scrophulariaceae и Orobanchaceae показано, что структурные звенья в
«цепи питания» зародышевого мешка развивающегося семени могут
различаться у разных видов (Никитичева, 19796). Некоторыми
исследователями акцент делается на том, что основная роль эндосперма
заключается в обеспечении успешного протекания процессов не только
роста и развития зародыша, но и его прорастания (Терёхин,
Никитичева, 1981). Вместе с тем, классические представления о том, что эта
роль состоит прежде всего в снабжении развивающегося зародыша
питательными веществами, нуждаются в переоценке. У Avicennia
officinale (Verbenaceae), например, в собственно эндосперме вообще не
обнаружены запасные питательные вещества. Это дало основание
предположить, что он служит лишь для транспорта питательных
веществ от гаустория эндосперма к суспензору (Swamy, Padmanabhan,
1961). Исследования последних лет показали, что по крайней мере в
ранний период эмбриогенеза, когда в*эндосперме активизированы
процессы делений, он не играет какой-либо значительной роли в
обеспечении зародыша питанием. По мнению Krishnamurthy (1988),
эндосперм цветковых растений контролирует изменение симметрии
зародыша в процессе его развития. При изучении сравнительной роли
зародыша и эндосперма семени в детерминации размера проростков
выяснилось, что количественные показатели последних определяются
массой эндосперма в большей степени, чем размером зародыша семени
(Zhang, Maun, 1989a, b).
Филогенетическая оценка типов эндоспермогенеза вызывает
значительные трудности и в настоящее время. Одни исследователи (их
большинство) склонны филогенетически исходным (первичным)
считать нуклеарный тип развития эндосперма (Juel, 1907; Samuelsson,
1913; Hakansson, 1923; Dahlgren, 1924; Svensson, 1925; Mauritzon,
1939; Stenar, 1950; Sporne, 1954; Tischler, 1956 — см. Wunderlich,
1959; Худяк, 1963). Другие, напротив, в качестве анцестрального
рассматривают целлюлярный тип развития эндосперма (Coulter,
Chamberlain, 1903; Ono, 1926; Schurhoff, 1926; Glisid, 1928; Rosen, 1947;
Muhldorf, 1951 — см. Wunderlich, 1959; Модилевский, 1953; Swamy,
Ganapathy, 1957b; Di Fulvio, 1983; Friedman, 1994, 1995; см. Эмб-
риогения семенных растений и эволюция эндосперма). Имеется
мнение, однако, что нуклеарный и целлюлярный типы развития эндос-
,218
Семя
перма следует рассматривать как два равноценных исходных типа.
Развитие одного из другого могло происходить в разных направлениях
в различных группах цветковых растений (Palm, 1915; Кордюм,
1978). Schnarf (1929, 1931) пришел к заключению, что у видов
«однопокровных» первичным мог быть нуклеарный эндосперм, а у
«многоплодниковых» таковым является целлюлярный тип развития
эндосперма. Сопоставление способа образования эндосперма с типами
семязачатков (крассинуцеллятным или тенуинуцеллятным) не дало
оснований для суждения о филогенетическом значении типов эндоспер-
могенеза (Wunderlich, 1959). Что касается гелобиального типа
развития эндосперма, то некоторые исследователи (Sporne, 1954; Swamy,
Ganapathy, 1957b) не рассматривают его в качестве самостоятельного.
Sporne относит его к нуклеарному типу развития эндосперма, a Swamy
и Ganapathy считают гелобиальный эндосперм клеточным и включают
его в целлюлярный тип развития эндосперма. Рис. 16-18, 21.
Александров, 1945; Баранов, 1955; Батыгина, 1974, 1985; Гваладзе, 1987; Гераси-
мова-Навашина, 1971а; Данилова, Кирпичников, 1985; Данилова, Савченко, 1985;
Жукова, Тучина, 1990; Иоффе, 1971а, б, 1976; Камелина, 1991, 1996; Кордюм,
1978; Коробова, Жиикина, 1987; Кострикова, 1984; Модилевский, 1950, 1953,
1963; Навашин, 1898; Никитичева, 19796; Плющ, 1992; Поддубная-Ариольди,
19646, 1976; Савина, 1972; Савина, Поддубная-Арнольди, 1990; Смирнов, 1982;
Соколов и др., 1980; Тахтаджян, 1964, 1980; Терёхин, 1991; Терёхин, Камелина,
1969, 1972; Терёхии, Никитичева, 1981; Титова, 1988б, 1996; Циигер, 1958;
Чубирко, Кострикова, 1985; Шамров, Никитичева, 1992; Эзау, 1980; Яковлев,
1965, 1981; Banerji, 1961; Battaglia, 1980; Bhatnagar, Sawhney, 1981; Boesewinkel,
Bouman, 1984; Brink, Cooper, 1947; Crete, 1951a, 1955b; Czapik, 1991; D'Amato,
1984; Di Fulvio, 1981, 1983, 1985; Di Fulvio, Cocucci, 1986; Enzenberg, 1961;
Erbrich, 1965; Friedman, 1994, 1995; Geitler, 1948; Glisic, 1936-1937; Guignard,
1899a; Hagerup, 1947; Hegelmaier, 1885, 1886; Hofmeister, 1847, 1849; Johri, 1969,
1971, 1975; Johri, Srivastava, 1973; Johri et al., 1992; Juel, 1907; Kapil, Bhatnagar,
1972, 1983 (1984); Kapoor, 1966; Krishna Iyengar, 1947; Krishnamurthy, 1988; La
Rue, 1944, 1949; Le Monnier, 1887; Lopes, Larkins, 1993; Maheshwari, Johri, 1956;
Mauritzon, 1935; Mehra, Kulkarni, 1985; Mogensen, Suthar, 1979; Pace, 1909; Palm,
1915;Periasamy, 1962; Raghavan, 1976; Rocen, 1927; Sachs, 1874; Sargant, 1900;
Schnarf, 1929, 1931; Sporne, 1954; Strasburger, 1877, 1900; Swamy, 1947; Swamy,
Ganapathy, 1957b; Swamy, Padmanabhan, 1961; Swamy, Parameswaran, 1963; Swift,
1953; Takhtajan, 1980; Tilton et al., 1984; Vijayaraghavan, Prabhakar, 1984; Ward-
law, 1965; Went van, 1970 b, c; Wunderlich, 1959; Zhang, Maun, 1989 a, b.
ТИПЫ РАЗВИТИЯ ЭНДОСПЕРМА
НУКЛЕАРНЫЙ (лат. nucleus — ядро) ТИП РАЗВИТИЯ
ЭНДОСПЕРМА характеризуется тем, что митотические деления первичного ядра
эндосперма и его дочерних ядер на начальных этапах формирования
семени не сопровождаются цитокинезом (свободноядерная, или цено-
Эндосперм, перисперм
219
цитная фаза); впоследствии эндосперм становится клеточным.
Синоним: ядерный тип развития эндосперма.1
Этот способ развития эндосперма был описан как свободное
образование клеток (нем. freie Zellbildung) (Hofmeister, 1859; Hegelmaier,
1886; Samuelsson, 1913). Термин «нуклеарный эндосперм» ввел, по-
видимому, Schnarf (1929).
Деление первичного ядра эндосперма обычно опережает деление ядра
зиготы. Перед началом деления оно остается в микропилярном районе
либо перемещается в центральный (у видов Onagraceae, Vitaceae) или
халазальный районы первичной клетки эндосперма (Capparaceae, Tilia-
сеае), а в отдельных случаях — в специализированный отросток клетки
(Fagaceae). Первые деления ядер в эндосперме на протяжении
нескольких митотических циклов проходят синхронно. У представителей сем.
Euphorbiaceae, например, синхронность делений продолжается до
стадии 16- (Chrozophora obliqua — Kapil, 1956) либо 32-ядерного
эндосперма (Acalypha indica — Johri, Kapil, 1953; A. lanceolata — Tha-
thachar, 1952), а сем. Poaceae — даже до стадии 64-ядерного
эндосперма (Triticum monococcum — Батыгина, 1974).
По мере прохождения делений ядра постепенно перемещаются к
периферии ценоцита эндосперма, оттесненные крупной центральной
вакуолью.2 Отдельные ядра эндосперма наблюдаются не постенно,
а в цитоплазматических тяжах, пересекающих крупную центральную
вакуоль (Яковлев, Алимова, 1976). В средней части эндосперма
цитоплазма образует тонкий постенный слой. В субхалазальной,
халазальнои и микропилярной частях толщина слоя цитоплазмы и
плотность расположения ядер больше, чем в средней. Наряду с крупной
центральной вакуолью наблюдаются многочисленные, иногда довольно
крупные вакуоли и в самом постенном слое цитоплазмы.
Обычным способом деления ядер эндосперма на всех этапах его
развития и во всех частях является митоз. В течение всего периода развития
эндосперма большинство его ядер сохраняет исходную плоидность,
обычную округлую форму, размер и структуру (Соколов, 1980). Однако уже
первыми исследователями эндосперма было замечено наличие в нем ядер,
отличающихся от обычных своей величиной и формой (Schnarf, 1929).
Гетероморфизм ядер наблюдается, как правило, после завершения
процесса образования свободных ядер. Ядра эндосперма, находящиеся в его
халазальнои части, начинают увеличиваться в размерах, превышая по
величине ядра, расположенные в микропилярной части. Изредка,
например, у Fagraea fragrans, наблюдается обратная картина, т. е. микропиляр-
ные ядра крупнее халазальных (Mohrbutter, 1937). Такое же явление
В эмбриологической литературе широко распространены сокращенные варианты
этих терминов — нуклеарный эндосперм, ядерный эндосперм.
У некоторых видов центральной вакуоли ие наблюдается (Oehler, 1927; Mendes,
1941; см. также иллюстрации, приведенные в работе Nijalingappa, Devaki, 1978).
220
Семя
отмечено и у представителей сем. Bombacaceae (см. Соколовская,
1983). У представителей сем. Cymodoceaceae гетероморфизм ядер
наблюдается по всей периферии ценоцита эндосперма; при этом ядра различной
величины и формы собраны в группы (Lakshmanan, 1970). Особенно
интересный пример увеличения размеров ядер эндосперма описан у Echi-
nocystis macrocarpa (Cucurbitaceae) (Scott, 1944). Сначала все ядра
эндосперма имеют 7-10 мкм в поперечнике и содержат от 1 до 3 ядрышек.
Позднее некоторые из них сильно увеличиваются, достигая в поперечнике
150-200 мкм. Количество ядрышек в таких ядрах также возрастает. Их
форма и размеры при этом становятся очень разнообразными.
К халазальной и в меньшей степени к микропилярной частям
эндосперма приурочен и наблюдаемый в нормальных условиях развития
семян полиморфизм ядер не только по размерам и форме, но и степени
плоидности и структуре. Причиной полиморфизма ядер являются так
называемые функциональные нарушения митоза. Появление крупных
высокополиплоидных ядер неправильной формы в этих частях
эндосперма является результатом аномальных митозов; такие ядра
образуются за счет эндомитоза, формирования реституционных ядер, слияния
веретен деления и объединения несестринских телофатических ядер
(Петрова, 1968, 1977; Соколов, 1968, 1975, 1978, 1980; Иоффе,
1971а). Некоторые авторы рассматривают такие ядра как результат
амитозов и слияния интерфазных ядер, что, однако, нуждается в
подтверждении.
Цитоплазма эндосперма на ценоцитной стадии развития содержит
обычный набор клеточных органелл. В ней отмечается значительная
насыщенность пластидами, митохондриями и полисомами. В отличие
от зародыша, который приблизительно у 40% цветковых растений
является хлорофиллоносным, эндосперм характеризуется отсутствием
способности к синтезу хлорофилла и, соответственно, к
дифференциации хлоропластов. Последние обнаружены в эндосперме лишь у
представителей Brassicaceae и Resedaceae (см. Таблицу).1 Пластид-
ный аппарат эндосперма у подавляющего большинства цветковых
растений (не только на ценоцитной, но и на клеточной стадии
развития) представлен лейкопластами. Лейкопласты эндосперма
являются дифференцированными, метаболически активными органеллами,
отличающимися определенным гетероморфизмом на видовом уровне
(Жукова, 1988, 1992). В первичной клетке эндосперма пластиды
концентрируются вокруг ядра (Schulz, Jensen, 1973). У Petunia
hybrida пластиды в этот период небольшие, без крахмала (Went van,
1970 b, с), хотя в центральной клетке зрелого зародышевого мешка
они крахмалоносны. В дальнейшем амилопласты в цитоплазме эндос-
Примечательно, что хлоропласты у крестоцветных и резедовых наблюдаются не
только в самом эндосперме, но и в его материнской клетке — центральной клетке
зародышевого мешка (см. Центральная клетка, Т. 1).
Эндосперм, перисперм ч 221
Таблица: Перечень семейств цветковых растений, указанные виды
которых характеризуются хлорофиллоносностью эндосперма
(в пределах семейств латинские названия растений даны
в алфавитном порядке)
Семейства, виды
Brassicaceae*
Aubrieta hybrida Hort.
Brassica juncea (L.) Czern.
Capsella bursa-pastoris (L.)
Diplotaxis erucoides DC.
Hesperis matronalis L.
Iberis umbellata DC.
Maltiola annua Sweet.
Raphanus sal'wus L.
Raphanus sativus var. radicul
Sinapis alba L.
Resedaceae*
Reseda lutea L.
Reseda odorata L.
Medik.
a Pers.
Ссылки
Жукова, ориг. данные
Иоффе, 1952
Schulz, Jensen, 1969, 1974
Pacini et al, 1975/1976
Иоффе, 1952
Жукова, ориг. данные, см. рис. 16
Иоффе, 1952
Яковлев, Жукова, 1973
Qin De-bo, Harberd, 1988
Иоффе, 1952
Иоффе, 1952-
Чабан, Яковлев, 1974
Яковлев, Жукова, 1973
* — первое упоминание о наличии «аморфного» хлорофилла в эндосперме крестоцветных и резедовых
без перечисления исследованных видов дано в работе Hofmeister (1858).
перма отмечены уже во время деления его первичного ядра (Triticum
monococcum — Батыгина, 1974) либо на двуядерной стадии развития
эндосперма (Gossypium hirsutum -*- Schulz, Jensen, 1977; Spinacia
oleracea — Wilms, 1981c; Valeriana officinalis — Жукова, ориг.
данные). У Capsella bursa-pastoris пластиды эндосперма представлены
хлоропластами, однако на двуядерной стадии развития крахмал в
пластидах отсутствует (Schulz, Jensen, 1974). На последующих
этапах ценоцитной стадии развития эндосперм большинства таксонов,
как правило, не накапливает запасных веществ (Newcomb, 1973).
У пшеницы, напротив, наличие запасного крахмала отмечено и в
многоядерном ценоците эндосперма (Батыгина, 1974, 1987). Большое
количество крупных липидных капель наблюдается в свободноядерном
эндосперме Paeonia peregrina на стадии четырехъядерного ценоцита
проэмбрио (Жукова, ориг. данные). Аккумуляция зерен
полисахаридов характерна для эндосперма на клеточной фазе его развития
(Newcomb, 1973; Vijayaraghavan, Prabhakar, 1984).
С самых ранних фаз развития в эндосперме наблюдается большое
количество мембран гранулярного ЭР. Это показано на Orchidaceae
(Cocucci, Jensen, 1969a, b), Petunia hybrida (Went van, 1970c),
Hibiscus (Ashley, 1975), Gossypium hirsutum (Schulz, Jensen, 1977),
Paeonia peregrina (Жукова, ориг. данные). В ходе дальнейшего развития
свободноядерного эндосперма количество мембран ЭР возрастает, обра-
1222
Семя
зуются крупные пачки гранулярного ЭР (Gossypium hirsutum —
Schulz, Jensen, 1978; Alcea rosea — Жукова, ориг. данные). На це-
ноцитной стадии развития эндосперма Alyssum maritimum (Vijaya-
raghavan, Prabhakar, 1984), Quercus gambelii (Singh, Mogensen, 1976)
многочисленными цистернами гранулярного ЭР окружены отдельные
участки цитоплазмы. У Valeriana officinalis уже на двуядерной стадии
эндоспермогенеза длинные концентрически расположенные профили
гранулярного ЭР наблюдаются вокруг вакуолей (Камелина, Жукова, 1987;
Жукова, ориг. данные). Для начальных стадий развития нуклеарного
эндосперма характерно также увеличение активности аппарата Гольджи
(Zea mays — Diboll, 1968; Petunia hybrida — Went van, 1970b, c;
Gossypium hirsutum — Schulz, Jensen, 1977; Triticum aestivum —
Шмараев, 1983; Alcea rosea, Paeonia peregrina — Жукова, ориг.
данные). Тонопласт крупной центральной вакуоли эндосперма
намного более электроноплотный по сравнению с другими цитоплаз-
матическими мембранами (Pacini et al., 1975/1976; Жукова, Савина,
1978; Savina, Zhukova, 1983).
По данным электронной микроскопии клеточная оболочка ценоцита
эндосперма снабжена многочисленными выростами (см. обзор Vijayaraghavan,
Prabhakar, 1984, а также Ни Shi-yi et al., 1983; Орел, Шмараев, 1987;
эл. микр. снимки Шмараева — см. Батыгина, 1987; Bhandari, Anuradha,
Mai, 1989). Выросты оболочки наблюдаются и в центральной клетке
зрелого зародышевого мешка еще до оплодотворения и начала развития
семени (Linum usitatissimum — Vazart В., Vazart J., 1966; Helianthus
annuus — Newcomb, Steeves, 1971; Lobelia dunnii — Torosian, 1971).
У Capsella bursa-pastoris в центральной клетке зрелого зародышевого
мешка выростов оболочки не отмечено. Выросты как микропилярной,
так и халазальной частей оболочки появляются в клетке эндоспермаль-
ного ценоцита в ходе раннего эмбриогенеза (Schulz, Jensen, 1969, 1971,
1973). Этот вид выделяется среди исследованных цветковых растений
и отсутствием какой-либо реорганизации в протопласте центральной
клетки после ее оплодотворения (см. Schulz, Jensen, 1973). Появление
выростов клеточной оболочки в центральной клетке только после ее
оплодотворения отмечено и у Glycine max (Tilton et al., 1984).
При нуклеарном типе развития эндосперма у большинства таксонов
после накопления большего или меньшего числа свободных ядер
инициальная ценоцитная фаза сменяется клеточной. У ряда таксонов
эндосперм остается свободноядерным на протяжении всего периода
своего существования, не переходя к клеточной фазе развития. Это отмечено
у отдельных представителей таких семейств, как Limnanthaceae
(Guignard, 1893; Maheshwari, Johri, 1956; Mathur, 1956), Juncaginaceae
(Campbell, 1898; Hill, 1900), Aceraceae (Guerin, 1901), Tamaricaceae
(Frisendahl, 1912; Puri, 1939), Melastomataceae (Subramanyam, 1951),
Fabaceae (Rau, 1953; Кострикова, 1955, 1956, 1984; Иоффе, 1957),
Chrysobalanaceae (Tobe, Raven, 1984), Zosteraceae (Терёхин, 1990а),
у исследованных видов таких родов как Lopezia, Stenosiphon (Onagraceae),
Эндосперм, перисперм
223
Cardiospermum (Sapindaceae), Tropaeolum (Tropaeolaceae), Melastoma
(Melastomaceae) (см. Schnarf, 1931; Maheshwari, 1950; Поддубная-
Арнольди, 1982). В сем. Fabaceae отсутствие клеточной фазы в ходе
эндоспермогенеза нуклеарного типа характерно для всех представителей
трибы Vicieae и лишь для одного представителя трибы Hedysareae —
Stylosanthes mucronata (Кострикова, 1984).
У большинства же растений ядра на той или иной фазе развития
эндосперма обособляются перегородками. Число свободноядерных
делений до начала образования клеточных перегородок варьирует в
различных таксонах. У одних таксонов оно незначительно и приводит к
образованию четырехъядерного (Coffea arabica — Mendes, 1941) или 8-
16-ядерного ценоцита (Asclepias cornuti — Frye, 1902; Rafflesia —
Ernst, Schmid, 1913; Leiphaimos, Cotylanthera — Oehler, 1927; Calo-
tropis procera — Sabet, 1931; Xeranthemum — Poddubnaja-Arnoldi,
1931; Crepis capillaris — Gerassimova, 1933; Diplacrum caricinum — Ni-
jalingappa, Devaki, 1979). У других таксонов свободноядерные деления
завершаются образованием ценоцита с несколькими сотнями и даже
тысячами ядер. Так, до начала цитокинеза в первичной клетке эндосперма
Mimusops elengi (Bhatnagar, Gupta, 1970), Cuscuta hyalina и С. pla-
niflora (Tiagi, 1951a) образуется до 1000 ядер. У отдельных видов
формирование клеточных перегородок начинается после образования
около 1500 ядер (Cuscuta rostrata - Smith, 1934), 2000-3000 (Gossypium
arboreum var. bhoj, G. herbaceum var. jayadhar — Joshi et al., 1967) и
более (представители Соппагасеае — Mauritzon, 1939b). Многоядерная
ценоцитная фаза характерна для эндоспермогенеза и некоторых родов таких
семейств, как Oliniaceae, Onagraceae^, Brassicaceae, Capparaceae,
Соппагасеае, Primulaceae, Sapotaceae и др. (см. Поддубная-Арнольди, 1982).
В зависимости от способа перехода свободноядерной стадии
развития в клеточную у центросеменных выделены Silene-, Melandrium-
и Heliosperma-типы клеткообразования (Rocen, 1927). У видов с
продолжительной свободноядерной стадией, в отличие от видов с
короткой, переход в клеточное состояние в разных частях эндосперма
происходит неодновременно, в результате чего в одном и том же
эндосперме в течение некоторого времени видны свободноядерные и
клеточные зоны (Александров, Александрова, 1939; Яковлев, Иоффе,
1965; Tiagi, 1970; Батыгина, 1974; Банникова, 1975).
Неодновременный переход эндосперма от свободноядерной организации к
клеточной — следствие дифференцированного состояния многоядерного
ценоцита (последний разделен на участки с плотным и редким
расположением ядер, зоны нормальных и аномальных митозов)
(Соколов, 1980). Если клеткообразование происходит в период, когда
эндосперм содержит всего четыре (например, у Coffea arabica —
Mendes, 1941) или восемь ядер (например, у Leiphaimos sp. —
Oehler, 1927) и вакуоль в нем отсутствует, то весь эндосперм сразу
становится клеточным. Направление заложения клеточных перегородок
также варьирует. Образование клеток может начинаться либо с пери-
224
Семя
ферии ценоцита и идти к центру, либо с одного из его полюсов
и продвигаться в направлении продольной, микропилярно-халазальной
оси зародышевого мешка к противоположному полюсу. При втором
варианте последовательности событий цитокинез может начинаться с
микропилярного конца эндосперма, проявляясь первоначально вокруг
зародыша и распространяясь постепенно в сторону халазального
конца, или наоборот. Реже наблюдается одновременное образование
клеточных перегородок во всех частях эндосперма. При любом из
вышеуказанных способов клеткообразования процесс цитокинеза,
начавшись, либо продолжается до полного завершения (когда эндосперм
целиком становится клеточным, что наблюдается у большинства
растений), либо охватывает не все зоны ценоцита, благодаря чему
микропилярный, центральный или халазальный районы эндосперма
остаются на стадии свободных ядер.
У некоторых таксонов свободноядерный район эндосперма может
преобразоваться в гаусторий. Эта свободноядерная зона эндосперма
очень вариабельна по своей структуре, в ней иногда имеет место
явление эндомитотической полиплоидизации ядер. При нуклеарном типе
развития эндосперма гаустории возникают преимущественно на халазаль-
ном полюсе зародышевого мешка. Халазальные гаустории характерны для
семейств Proteaceae (Kausik, 1938 a, b; 1942), Fabaceae (Rau, 1950),
Aizoaceae (Ильина, Поддубная-Арнольди, 1983), Cucurbitaceae (Дзевал-
товский, 1983), Linaceae (Никитичева, 19856), Polemoniaceae (Жукова,
1987), Elaeagnaceae (Камелина, Проскурина, 1987) и др. У
большинства видов они относительно короткие и остаются свободноядерными.
Наиболее длинные ценоцитные халазальные гаустории эндосперма
обнаружены в семействах Euphorbiaceae и Cucurbitaceae. Так, у видов Croton
гаустории длиной 1000 мкм, у Cucurbita vicifolia — 12 000 мкм. У ряда
видов халазальные гаустории становятся клеточными на сердечковидной
или ранней торпедовидной стадии развития зародыша (Дзевалтовский,
1983; Камелина, Проскурина, 1987). Микропилярные эндоспермальные
гаустории обнаружены у Cyanotis tuberosa (Chikkannaiah, Hemaraddi,
1979), у представителей сем. Frankeniaceae (Walia, Kapil, 1965;
Камелина, 1983), у Floerkea proserpinacoides (Maheshwari, Johri, 1956). У Со-
ronaria flos-cuculi (Caryophyllaceae) (Мейер, 1962) и у Scleria foliosa
(Cyperaceae) (Nijalingappa, Devaki, 1979) эндоспермальные гаустории
отмечены как на микропилярном, так и на халазальном полюсах эндосперма,
а у Acanthophyllum glandulosum (Caryophyllaceae) массивные, различной
формы многочисленные гаустории — в латеральной области эндосперма
(Турсунов, Савинова, 1979). Известны семейства, в которых наличием
эндоспермального гаустория характеризуются лишь отдельные виды. Так,
в сем. Euphorbiaceae агрессивный халазальный ценоцитный гаусторий
описан только для рода Croton (Kapil, Bhatnagar, 1972). Среди
представителей Papaveraceae выявлена корреляция между степенью
развития и продолжительностью жизнедеятельности антипод и структурой
эндосперма в его халазальной области: у растений с долго функцио-
Эндосперм, перисперм
225
нирующими антиподами эндосперм не образует гаустория; напротив, у
видов со слаборазвитыми и рано дегенерирующими антиподами хала-
зальная зона эндосперма на свободноядерной стадии развития образует
гаусторий (Platystemon и Eschscholzia — Ильина, 1981).
Полиморфизм эндосперма на клеточной стадии его развития этим не
исчерпывается. Часто отдельные из первоначально одноядерных клеток
эндосперма превращаются в многоядерные вследствие многократного
деления их ядер без последующего цитокинеза. В результате этого
процесса образуются вторичные ценоциты. У одних таксонов ядра и
клетки эндосперма в конечном итоге заполняют всю его полость, у
других — чаще всего центральная его часть остается незаполненной.
Одним из проявлений морфологической дифференциации нуклеарного
эндосперма на клеточной фазе его развития является наличие так
называемых «везикул» — шароподобных выпячиваний цитоплазмы,
которые начинают формироваться еще на ценоцитной фазе эндоспер-
могенеза. Они описаны у представителей Fabaceae (Hegelmaier, 1880),
Kusaceae (Juliano, Alcala, 1933), Poaceae (Худяк, 1952, 1955), Stack-
housiaceae (Narang, 1953), Apiaceae (Singh, Gupta, 1956; Sehgal,
1965; Кордюм, 1967), Elaeagnaceae (Камелина, Проскурина, 1987), a
также Balsaminaceae, Brassicaceae, Cucurbitaceae, Papaveraceae и др.
(см. Худяк, 1963; Гревцова, 1987). Согласно Juliano, Alcala (1933),
некоторые ядра свободноядерного эндосперма делятся более
интенсивно, чем остальные, образуя отдельные группы ядер, или «узлы».
Последние постепенно обособляются от общей массы цитоплазмы
эндосперма и принимают форму шаров. Рядом авторов, наряду с
цитоплазматическими шарами, содержащими ядра, описаны
безъядерные шары. Существующие противоречия относительно структуры цито-
плазматических шаров некоторые авторы объясняют методическими
трудностями изучения эндосперма. При поперечных срезах эндосперма в одни
из них попадают ядра целиком, в другие — лишь частично, а в третьи
вовсе не попадают (Батыгина, 1974; Поддубная-Арнольди, 1976). Роль
этих образований в развитии семени остается неясной.
Как было показано выше, начало процесса цитокинеза не связано
с каким-либо определенным числом предшествующих ему свобод-
ноядерных делений. Не отмечено строгой корреляции перехода от
ценоцитной стадии к клеточной и с какой-либо определенной стадией
эмбриогенеза. Так, у Macleaya заложение клеточных перегородок в
эндосперме начинается задолго до начала деления зиготы (Ильина, 1981).
Известны примеры начала цитокинеза в эндосперме и в проэмбриональ-
ной фазе эмбриогенеза: на стадии трех-четырех-клеточного (Bupleurum
tenue — Gupta S., Gupta M., 1964; Seetzenia orientalis — Narayana, Rao,
1963), четырех-шести-клеточного (Phoenix pusilla — Biradar, 1968; Tri-
ticum monococcum — Батыгина, 1974), восьми-десяти-клеточного (Ph.
acaulis, Ph. reclinata — Biradar, 1968; Actinophloeus macarthurii — Rao,
1959) и 16-клеточного проэмбрио (виды Delphinium — Babis, 1973).
Первые клеточные перегородки в эндосперме могут возникать и на
1 5-828
I 226 Семя
более поздних стадиях эмбриогенеза — на глобулярной (Peganum —
Kapil, Ahluwalia, 1963; Phoenix sylvestris — Mahabale, Biradar, 1968;
Crocus thomasii — Chichiricco, 1989; Glycine max — Chamberlin, Horner,
1989), сердечковидной (Diplotaxis erucoides — Pacini et al., 1975/1976;
Plumbago europaeum — Коробова, 1983) и на поздней сердечковидной
(Capsella bursa-pastoris — Schulz, Jensen, 1974). Ультраструктурные
изменения, происходящие в эндосперме в период перехода от ядерного
состояния к клеточному, описаны на примере Helianthus annuus
(Newcomb, 1973), Triticum aestivum (Mares et al., 1977), Reseda lutea
(Чабан, 1979), Ipomoea purpurea (Ponzi, Pizzolongo, 1984), Phaseolus
vulgaris (Yeung, Cavey, 1988; XuHan, van Lammeren, 1994), Glycine max
(Dute, Peterson, 1992), Ranunculus sceleratus (XuHan, van Lammeren,
1993) и др.
Механизмы образования клеточных перегородок между ядрами цено-
цита при переходе его к клеточной стадии эндоспермогенеза остаются еще
предметом дискуссии. По мнению одних авторов, клеткообразование во
всех частях эндосперма осуществляется единообразно — путем
формирования клеточных пластинок (с помощью фрагмопласта) (Jungers, 1931;
Яковлев, Иоффе, 1965; Петрова, 1968, 1977; Соколов, 1968, 1980;
Батыгина, 1974, 1987; Банникова, 1975; Fineran et al., 1982; Шмараев,
1983; Орел, Шмараев, 1987). Согласно же другим исследователям, в
эндосперме существуют способы клеткообразования, не связанные с
митозом, включая деление перетяжкой (Frye, 1902; Schnarf, 1926,1929;
Модилевский, 1953; Rao, 1959; Olszewska, Gabara, 1966; Morrison,
O'Brien, 1976; Mares et al., 1977; Morrison et al., 1978; Чабан, 1979;
Chitralekha, Bhandari, 1992; Brown et al., 1994). Полученные нами
данные об ультраструктуре эндосперма Valeriana officinalis на начальных
стадиях его развития (Жукова, 1986; Камелина, Жукова, 1987)
позволяют присоединиться к мнению второй группы авторов. Представляется
достаточно обоснованным предположение Rao (1959) и Mares с
соавторами (1977) о том, что, по крайней мере, инициация цитокинеза в
эндосперме нуклеарного типа развития связана со «свободным»,
центростремительным ростом клеточных стенок между ядрами пристенного
слоя цитоплазмы эндоспермального ценоцита.
Выявлена положительная, хотя и не строгая, корреляция
нуклеарного типа эндоспермогенеза с хлорофиллоносностью зародыша (Zhukova,
1990, 1992; Жукова, 1992). Последняя наблюдается у видов с
крупным дифференцированным на органы зародышем (Жукова, 1992,
1993). Эндоспермогенез нуклеарного типа, таким образом,
оказывается коррелятивно связанным не только с синтезом в зародыше
хлорофилла, но и, возможно, с формированием в семени крупного
зародыша. Рис. 16.
Александров, Александрова, 1939; Банникова, 1975; Батыгина, 19626, 1974, 1985,
1987; Батыгина, Колесова, 1983; Гревцова, 1987; Дзевалтовский, 1983; Жукова, 1983,
1986, 1987, 1988, 1992, 1993, 19946; Жукова, Савина, 1978; Ильина, 1981; Ильина,
Эндосперм, перисперм
227
Поддубная-Арнольди, 1983; Иоффе, 1952, 1957, 1971; Иоффе, Жукова, 1973, 1974;
Камелина, 1983; Камелина, Жукова, 1987; Камелина, Проскурина, 1987; Кордюм,
1967, 1978; Коробова, 1983; Кострикова, 1955, 1956, 1984; Литвак и др., 1987; Мейер,
1962; Модилевский, 1953; Наумова, 1978, 1981; Наумова, Яковлев, 1978; Никитичева,
19856; Никитичева, Проскурина, 1987; Орел, Шмараев, 1987; Петрова, 1968, 1977;
Плющ, 1992; Поддубная-Арнольди, 1976, 1982; Родионова, 1983а; Соколов, 1968,
1975, 1978а, б, 1980; Соколов и др., 1980; Соколовская, 1983; Тахтаджян, 1966;
Терёхин, 1990а; Турсунов, Савинова, 1979; Худяк, 1952, 1955, 1963; Чабан, 1975,
1979; Чабан, Яковлев, 1974; Шмараев, 1982, 1983; Яковлев, 1965; Яковлев, Алимова,
1976; Яковлев, Иоффе, 1965; Яковлев, Жукова, 1973; Ashley, 1975a, Ь; Babis, 1973;
Bhandari, Anuradha Mai, 1989; Bhatnagar, Gupta, 1970; Biradar, 1968; Brown et al.,
1994; Campbell, 1898; Chamberlin, Horner, 1989; Chichiricco, 1989; Chikkannaiah, He-
maraddi, 1979; Chitralekha, Bhandari, 1992; Chopra, Seth, 1967; Cocucci, Jensen, 1969a,
c; Davis, 1966; Diboll, 1968; Di Fulvio, 1981; Dute, Peterson, 1992; Ernst, Schmid, 1913;
Fineran et al., 1982; Frisendahl, 1912; Frye, 1902; Gerassimova, 1933; Guerin, 1901;
Guignard, 1893; Gupta, 1964; Gupta S., Gupta M., 1964; Hegelmaier, 1880, 1885, 1886;
Hill, 1900; Hofmeister, 1858; Hu Shi-yi et al., 1983; Johri, Garg, 1959; Johri, Kapil, 1953;
Joshi et al., 1967; Juliano, Alcala, 1933; Jungers, 1931; Kapil, 1956; Kapil, Ahluwalia,
1963; Kapil, Bhatnagar, 1972; Kausik, 1938a, b, 1942; Lakshmanan, 1970; Mahabale,
Biradar, 1968; Maheshwari, Johri, 1956; Mares et al., 1977; Mathur, 1956; Mauritzon,
1939b; Mendes, 1941; Mohrbutter, 1937; Morrison, O'Brien, 1976; Morrison et al., 1978;
Narang, 1953; Narayana, Rao, 1963; Natesh, Rau, 1984; Newcomb, 1973; Nijalingappa,
Devaki, 1978, 1979; Oehler, 1927; Olszewska, Gabara, 1966; Pacini et al., 1975/1976;
Poddubnaja-Arnoldi, 1931; Ponzi, Pizzolongo, 1984; Prasad, 1979; Puri, 1939; Qin De-
bo, Harberd, 1988; Rao С V., 1959; Rao N. A., 1955; Rao V. S., 1959; Rau, 1950,
1951, 1953; Rocen, 1927; Sabet, 1931; Savina/Zhukova, 1983; Schnarf, 1926, 1929, 1931;
Schulz, Jensen, 1969, 1973, 1974, 1977, 1978; Scott, 1944; Sehgal, 1965; Sharma, 1966;
Singh A. P., Mogensen, 1976; Singh D., Gupta, 1956; Singh R. P., 1969; Smith, 1934;
Stenar, 1925; Stephen, 1974; Subramanyam, 1951; Thathachar, 1952; Tiagi В., 1951а;
Tiagi Y. D., 1970; Tilton et al., 1984; Tobe, Raven, 1984; Venkateswarlu, Rao, 1963;
Vijayaraghavan, Prabhakar, 1984; Walia, Kapil, 1965; Went van, 1970b, c; Wilms, 1981c;
Wunderlich, 1959; XuHan, van Lammeren, 1993, 1994; Yakovlev, Zhukova, 1980; Yeung,
Cavey, 1988; Zhukova, 1990, 1992.
ЦЕЛЛЮЛЯРНЫЙ (лат. cellula — клетка) ТИП РАЗВИТИЯ
ЭНДОСПЕРМА характеризуется синхронным прохождением процессов карио-
и цитокинеза, начиная с первых делений в первичной клетке
эндосперма. Синоним: клеточный тип развития эндосперма.
Этот способ развития эндосперма был описан как последовательные
клеточные деления (нем. sukzessive Zellteilung) (Hofmeister, 1859;
Hegelmaier, 1886; Samuelsson, 1913). Термин «целлюлярный эндосперм
ввел, по-видимому, Schnarf (1929).
К началу деления ядро располагается чаще всего в микропилярной
или центральной части первичной клетки эндосперма. Деление обычно
поперечное, реже продольное или наклонное.
Целлюлярный тип развития эндосперма обнаружен преимущественно
у двудольных (см. «Сравнительная эмбриология, цветковых растений»,
15*
228 Семя
1981, 1983, 1985, 1987) и ряда однодольных (Araceae — Goldberg,
1941; Banerji, 1947; Burmanniaceae — Thisma luetzelburgii, Th. pana-
mensis — Терёхин, 19906; Lemnaceae — Maheshwari S., Kapil,
1963). Однако некоторые авторы ставят под сомнение его наличие у
однодольных'растений (Lawalree, 1952; Maheshwari S., Khanna, 1956;
Parameswaran, 1959).
Необычные черты в эндоспермогенезе обнаружены у некоторых
паразитных цветковых растений. Так, у представителей сем. Loranthaceae
(Никитичева, Анисимова, 1987), характеризующихся редуцированными
семязачатками, формируется сложный эндосперм. Он образуется путем
объединения тканей эндосперма, одновременно развивающегося во
многих зародышевых мешках после разрушения находящихся между ними
клеток завязи. В этом случае начинают развиваться несколько
зародышей, однако зрелого состояния достигает только один, реже два. У
Viscum отмечено слияние эндосперма двух соседних зародышевых
мешков (Терёхин, 19876).
В период формирования эндосперма его клетки обычно имеют
тонкостенные оболочки, вакуолизированную цитоплазму и крупные ядра с
большим числом ядрышек. Клетки периферических слоев эндосперма, как
правило, более мелкие и густоплазменные (Loganiaceae — Moore, 1948;
Loranthaceae — Никитичева, Анисимова, 1987; Nelumbonaceae — Ба-
тыгина, 1981; Styracaceae — Никитичева, 1983а). У ряда растений
такие клетки характерны для микропилярной (Ceratophyllaceae — Шам-
ров, Батыгина, 1984; Согпасеае — Алимова, 1987) либо микропилярной
и халазальной зон эндосперма (ЕЬепасеае — Никитичева, 1983в). У
видов сем. Valerianaceae микропилярные клетки эндосперма, окружающие
базальную часть зародыша, имеют более плотную цитоплазму, без
вакуолей, двуядерные, тогда как остальные клетки — вакуолизированные и
одноядерные (Камелина, Жукова, 1987), У представителей сем. Dipsaca-
сеае по мере роста зародыша клетки эндосперма, расположенные по
периферии, начиная с микропилярной зоны, становятся более мелкими и
густоплазменными, а в центре остаются крупными и вакуолизированными
(Камелина, 1980).
Сформированный эндосперм у многих таксонов гетероморфный, что
проявляется, в частности, в наличии гаусториев различного строения.
Одной из их особенностей является полиплоидизация ядер (см. D'Amato,
1984). При исследовании представителей семейств Orobanchaceae и Scro-
phulariaceae в эндосперме кроме микропилярного и халазального
гаусториев выделяют такую специализированную ткань, как «шейка»
эндосперма — узкую часть, соединяющую микропилярный гаусторий с
центральным телом эндосперма (вместе они образуют основной, или
собственно эндосперм) (Iyengar, 1947; Tiagi, 1951; Терёхин,
Никитичева, 1981). У видов сем. Orobanchaceae клетки «шейки» эндосперма
располагаются в два ряда. Они имеют небольшие размеры, заполнены
густой цитоплазмой и предположительно участвуют в проведении веществ
от микропилярного гаустория к клеткам тела эндосперма. Дегенерация
Эндосперм, перисперм
229
этих клеток наступает вслед за деструктивными изменениями в клетках
микропилярного гаустория (Tiagi, Sankla, 1963; Никитичева, Терёхин,
1976; Терёхин, Никитичева, 1981; Анисимова, 1983). Такая же
топография эндосперма характерна и для ряда других таксонов (Buddlejaceae —
Dop, 1913; Azorina vidalii из сем. Campanulaceae — Шамров, Жинкина,
1994). В последнем случае «шейка» эндосперма представлена 2-4 рядами
клеток, вытянутых вдоль продольной оси семени.
В процессе развития в клеточных оболочках эндосперма, особенно
периферического слоя, формируются вторичные утолщения (обычно
утолщаются наружная тангентальная и радиальная стенки). У Cynomorium
(Cynomoriaceae) клетки поверхностного слоя имеют равномерно
утолщенные оболочки, жизнеспособные ядра и плотную цитоплазму. Во
внутренних слоях формируются различного рода выросты клеточных
оболочек полисахаридной природы, которые вызывают руминацию
внутренней поверхности, при этом в клетках уменьшается количество
цитоплазмы, а ядра деформируются либо полностью разрушаются
(Терёхин и др., 1975).
Ультраструктурные и гистохимические исследования эндосперма цел-
люлярного типа развития весьма немногочисленны и в основном
посвящены изучению гаусториев, играющих важную роль в питании
эндосперма и зародыша. Ультраструктурное исследование первичной клетки
эндосперма у Petunia hybrida (Solanaceae) показало, что по своей
структуре она сильно отличается от центральной клетки зародышевого мешка.
После оплодотворения митохондрии становятся значительно крупнее и
приобретают неправильную форму,' особенно вблизи воспринимающей
синергиды; меняется их внутренняя структура. Сильно возрастает
количество липидов, число диктиосом, цистерн гранулярного ЭР, полисом
и уменьшается содержание крахмала (Went van, 1970c).
В клетках формирующегося эндосперма накапливается
незначительное количество крахмала, белков и липидов, которые, как правило,
расходуются в процессе развития, особенно если эндосперм является
транзиторным. В том случае, когда эндосперм сохраняется в зрелом
семени, накопление запасных питательных веществ происходит на
поздних стадиях. У одних таксонов запасными веществами является
только крахмал (Callitrichaceae, Davidiaceae, Hippuridaceae), у других —
крахмал и белки (Chloranthaceae), липиды и белки (Adoxaceae, Cyno-
moriaceae, Gesneriaceae, Magnoliaceae, Styracaceae), крахмал и липиды
(Buddlejaceae, Lardizabalaceae, Viscaceae), белки (Gunneraceae, Sauru~
raceae), липиды (ЕЬепасеае, Fouquieriaceae, Morinaceae, Symplocaceae,
Winteraceae) (см. «Сравнительная эмбриология цветковых растений»,
1981, 1983, 1985, 1987). Различия в характере накопления веществ
могут быть не только между семействами, но и отдельными родами.
Так, в сем. Dipsacaceae в эндосперме зрелого семени обнаружены
липиды и белки у Cephalaria и Кпаийа, крахмал и жиры у Succia,
жиры у Dipsacus, белки у Scabiosa (Камелина, 1980).
230
Семя
Эндосперм целлюлярного типа характеризуется разнообразием
способов развития, что нашло отражение в различных классификациях.
Данные по развитию эндосперма целлюлярного типа впервые
обобщил Samuelsson (1913). На основании положения первой и второй
перегородок и степени участия первых двух клеток в построении
эндосперма он попытался сгруппировать изученные растения, указав
названия родов, для которых это характерно. По положению клеточной
стенки во время деления первичной клетки эндосперма выделены две
группы: 1 — клеточная стенка ориентирована продольно, 2 —
поперечно. Вторая группа представлена сериями А и В. Серия А —
обе клетки принимают участие в образовании эндосперма: а —
ориентация последующих клеточных стенок вариабельна, Ь — клетки
делятся поперечно (1 — продольные или наклонные деления начинаются
после образования четырех клеток, расположенных в ряд; 2 — это
происходит после формирования большего числа клеток, обычно
восьми), с — в обеих клетках деления продольные. Серия В — только
одна из клеток образует эндосперм, а другая функционирует как
гаусторий: а — микропилярная клетка делится поперечно, в результате
чего образует ряд из трех клеток, центральная из которых образует
эндосперм, а терминальные — гаустории; Ь — верхняя клетка
образует эндосперм, а нижняя — гаусторий; с — нижняя клетка
формирует эндосперм, а верхняя — гаусторий.
Используя один из критериев Samuelsson (1913) (характер
заложения перегородок в раннем эндоспермогенезе), Schnarf (1929)
предложил одну из первых классификаций способов образования (форм,
по автору) эндосперма целлюлярного типа. Эта классификация чаще
других используется в современной литературе. Однако в ней, как
и во многих других классификациях, своеобразные способы развития
эндосперма в пределах целлюлярного типа определены как «типы»,
формы, вариации. По нашему мнению, их следует рассматривать
как вариации, поскольку обычно речь идет лишь о направлении
первой и нескольких последующих перегородок в раннем
эндоспермогенезе. Кроме того, мы сочли целесообразным внести в
классификацию Schnarf (1929) данные по всем изученным до сих пор
цветковым растениям.
Вариации классификации Schnarf объединены в пять груцп.
Первая группа характеризуется вариабельностью в заложении
первой перегородки — от поперечного через наклонное до
продольного: Diapensiaceae (Diapensia — Samuelsson, 1913), Valerianaceae
(Centranthus — Asplund, 1920) и Asteraceae (Senecio — Afzelius,
1924).
Вторая группа включает следующие вариации,
характеризующиеся продольным заложением первой перегородки. Adoxa-вариа-
ция: второе, а иногда и ряд последующих делений происходят в
продольной плоскости (Adoxaceae — Lagerberg, 1909; Circaeaste-
raceae — Junell, 1931; некоторые Chloranthaceae — Yoshida, 1957,
Эндосперм, перисперм 231
1959; Piperaceae — Johnson, 1900b; Никитичева, 1981а). Lappula-
вариация: первая перегородка неполная и заканчивается на границе
с крупной центральной вакуолью, а второе и последующие деления
ориентированы в разных плоскостях (Dipsacaceae — Doll, 1927;
Камелина, 1980, 1987; некоторые Boraginaceae — Svensson, 1925;
Swamy, Parameswaran, 1963).
В третьей и четвертой группах ориентация первой перегородки
в эндосперме происходит в поперечном направлении. В вариациях
третьей группы второе деление в обеих или хотя бы в одной из
клеток происходит продольно. Scutellaria-вариация: второе деление
в обеих клетках эндосперма ориентировано в продольной плоскости
(Lamiaceae — Schnarf, 1917; Пол1щук, Дзевалтовський, 1971; Ge-
sneriaceae — Arekal, 1961; Алимова, Яковлев, 1982; Hippuridaceae,
Lentibulariaceae — Никитичева, 1987а, б; Vahliaceae — Mauritzon,
1933). Prunella-вариация (= Brunella) — продольно делится только
микропилярная клетка, а в халазальной клетке может происходит
лишь кариокинез (Lamiaceae — Schnarf, 1917; Boraginaceae — Toks,
1976; Orobanchaceae — Tiagi, 1951b; Терёхин, Никитичева, 1981;
Анисимова, 1983; Терёхин, 1987а; Plantaginaceae — Soueges, 1923;
Scrophulariaceae — Meunier, 1897; Gscheidle, 1925; Никитичева,
1987r).
Четвертая группа включает вариации, для которых характерно
второе поперечное деление в обеих или хотя бы в одной из клеток.
Ericaceae-вариация: второе деление в обеих клетках поперечное,
дальнейшие деления идут в разных направлениях (Согпасеае — Алимова,
1987; Davidiaceae— Камелина, Шевченко, 19876; Empetraceae,
Epacridaceae — Samuelsson, 1913; Ericaceae, Pyrolaceae — Samuelsson,
1913; Якобсон, 1976; Терёхин, 1977). Annona-вариация: второе и ряд
последующих делений поперечные, в результате чего возникает ряд из
8-12 клеток; дальнейшие деления продольные (Аппопасеае — Nicolosi-
Roncati, 1903; Aristolochiaceae — Jacobson-Stiasny, 1918; Nair, Narayanan,
1961; Marcgraviaceae — Mauritzon, 1939; Menyanthaceae — Stolt, 1921;
Sarraceniaceae — Shreve, 1905). Callitriche-вариация: второе деление
происходит поперечно только в микропилярнои клетке, после чего во всех
клетках деления ориентированы в продольной плоскости; терминальные
клетки дифференцируются в микропилярный и халазальный гаустории
(Callitriche autumnalis — Jorgensen, 1923). Однако у С. vernalis, по
данным Soueges (1952), второе деление является продольным в обеих
клетках, а затем клетки делятся поперечно, т. е. развитие эндосперма
идет в соответствии со Scutellaria-вариацией. Ceratophyllum-вариация:
второе и ряд последующих поперечных делений происходят только в
микропилярнои клетке, а халазальная клетка больше не делится
(Ceratophyllum submersum — Strasburger, 1902). Однако, как
свидетельствуют наши данные (Шамров, Батыгина, 1984), у всех
изученных видов Ceratophyllum (С. demersum, С. pentacanthum, С.
submersum) халазальная клетка делится поперечной перегородкой и, таким
232
Семя
образом, первые стадии эндоспермогенеза у них идут в соответствии
с Ericaceae-вариацией.
Развитие эндосперма в пятой группе характеризуется заложением
первой перегородки в наклонном положении. Следующие деления в
обеих клетках ориентированы перпендикулярно к первой перегородке
(Boraginaceae — Svensson, 1925). Следует отметить, что у
представителей ряда семейств (Cynomoriaceae — Терёхин и др., 1975; Morina-
сеае — Камелина, 1980) первое деление ориентировано поперек, а
возникающие затем перегородки располагаются наклонно по
отношению к первой, при этом ядра в обеих клетках делятся синхронно.
В дальнейшем классификация Schnarf (1929) была дополнена
новыми вариациями. В сем. Lamiaceae, кроме Scutellaria- и
Prunella-вариаций, выделяют еще 3 вариации. Galeopsis-вариация: отличается от
Prunella-вариации незначительным развитием и ранней дегенерацией
халазальной клетки, функционирующей как гаусторий (Galeopsis —
Schnarf, 1917). По мнению Wunderlich (1967), эта вариация близка к
Prunella-вариации. Stachys-вариация: первое деление поперечное,
затем микропилярная клетка делится поперечно, а халазальная клетка
без деления становится гаусторием (Ajuga, Marrubium, Stachys —
Schnarf, 1917). Lavandula-вариация: микропилярная клетка без
деления преобразуется в гаусторий, а халазальная клетка делится
поперечно (Lavandula — Пол1щук, Дзевалтовський, 1971).
Для сем. Scrophulariaceae была предложена классификация из 13
вариаций (форм, по Glisic, 1936-1937). Первая перегородка в
эндосперме всегда поперечная. В зависимости от заложения второй и
последующих перегородок, времени дифференциации и строения гаустори-
ев вариации можно объединить в ряд групп.
Первая группа включает Verbascum-, Prolimosella- и Veronica I —
V-вариации. В результате второго деления клетки располагаются в
форме изобилатеральной тетрады, как и в случае Scutellaria-вариации,
выделенной Schnarf (1929). Verbascum-вариация: гаустории четырех-
клеточные и отделяются после третьего (халазальный гаусторий) и
четвертого (микропилярный гаусторий) деления. Prolimosella-вариа-
ция: микропилярный гаусторий (двуклеточный) образуется после
второго, а халазальный (четырехклеточныи) — после четвертого деления.
Veronica I-V-вариации: халазальный гаусторий ( двуклеточный у
Veronica IV-, V-вариаций и четырехклеточныи у остальных)
дифференцируется соответственно после второго или третьего делений, а
микропилярный (двуклеточный и двуядерный у Veronica III, IV-вариа-
ций и четырехклеточныи либо одноклеточный, но четырехъядерный у
остальных, при этом между ядрами может наблюдаться остаток
клеточной пластинки) — после третьего и четвертого делений.
Вторая группа охватывает Alectorolophus-, Limosella-, Linaria- и
Veronica VI-вариации. Второе деление, сопровождающееся
образованием продольной перегородки, происходит только в микропилярной
клетке, а халазальная клетка не делится, либо в ней отмечается только
Эндосперм, перисперм
233
кариокинез. Alectorolophus-вариация: халазальный гаусторий
(одноклеточный, двуядерный) отделяется после второго, а микропилярный
(четыре одноядерные клетки либо одна четырехъядерная клетка) —
после четвертого-пятого делений. Limosella-вариация: халазальный
гаусторий (одноклеточный, одноядерный) дифференцируется после
первого деления, а микропилярный (четырехклеточныи) — после
четвертого деления. Linaria-вариация: халазальный гаусторий (одноклеточный,
двуядерный) возникает в результате второго, а микропилярный
(четырехклеточныи) — четвертого деления. Veronica VI-вариация:
халазальный гаусторий (одноклеточный, двуядерный) отделяется после
второго, а микропилярный (две одноядерные клетки либо одна двуядерная
клетка) — после третьего-четвертого делений.
Третья группа представлена Pedicularis-вариацией. Второе
поперечное деление происходит в микропилярной клетке эндосперма, а
халазальная клетка без деления дифференцируется в гаусторий (одноклеточный,
двуядерный). Микропилярный гаусторий (одноклеточный,
четырехъядерный) образуется после четвертого деления.
К четвертой группе относится Gratiola-вариация. Она
характеризуется вариабельностью в прохождении второго деления в эндосперме:
возникают три (халазальная клетка не делится) либо четыре клетки в
виде изобилатеральной или Т-образной тетрады. Халазальный
гаусторий (одно-четырехклеточный) образуется после первого-четвертого, а
микропилярный (двенадцатиклеточный) — после четвертого делений.
Автором была предложена схема взаимосвязей различных вариаций
развития целлюлярного эндосперма в-сем. Scrophulariaceae. В
дальнейшем для этого семейства были предложены и другие системы вариаций
развития эндосперма (Iyengar, 1947; Crete, 1955a; Banerji, 1961;
Афанасьева, 1976), основанные на представлениях Glisic.
Эти же принципы использовал Rosen (1949), который различал
4 вариации (типы, по автору) развития эндосперма целлюлярного
типа для семейств Campanulaceae, Lobeliaceae, Stylidiaceae. Две
вариации (Codonopsis-, Sphenoclea-), как и Scutellaria-вариация,
описанная Schnarf (1929), характеризуются заложением первой
поперечной и второй продольной перегородок в раннем эндоспермогенезе.
При этом возникшие первые четыре клетки имеют вид
изобилатеральной тетрады. Sphenoclea-вариация: гаустории четырехклеточные,
дифференцируются после четвертого деления (Campanulaceae —
Sphenoclea — Kausik, Subramanyam, 1946). Codonopsis-вариация:
гаустории двуклеточные, микропилярный гаусторий отделяется после
третьего, а халазальный — после четвертого деления
(Campanulaceae — Codonopsis, некоторые Campanula, Cyananthus;
Lobeliaceae — Downingia, Lobelia, Pratia — Rosen, 1932; Kausik,
Subramanyam, 1945b; Stylidiaceae — Rosen, 1949). В случае двух
оставшихся вариаций (Phyteuma- и Isotoma-вариации) первое деление
в эндосперме поперечное, затем микропилярная клетка делится
продольно, а халазальная — поперечно, в результате чего образуется
234
Семя
Т-образная тетрада. Phyteuma-вариация: халазальный
(одноклеточный) и микропилярныи (двуклеточный) гаустории дифференцируются
после третьего деления, при этом верхняя производная халазальной
клетки не делится (Campanulaceae—Adenophora, Musschia, Specu-
laria; Lobeliaceae — Laurentia — Rosen, 1949). Isotoma-вариация:
в отличие от Phyteuma-вариации, верхняя производная халазальной
клетки делится сначала несколько раз поперечными перегородками, а
затем продольными (Lobeliaceae — Isotoma longiflora — Kausik, Sub-
ramanyam, 1945a). В сем. Campanulaceae выделено еще две вариации.
Pentaphragma-вариация: первое деление в эндосперме поперечное,
затем микропилярная клетка без деления становится гаусторием, а хала-
зальная клетка делится несколько раз, образуя собственно эндосперм
(Pentaphragma horsfieldii — Kapil, Vijayaraghavan, 1962, 1965).
Azorina-вариация: первое и второе деления поперечные, в результате
чего образуется линейная тетрада клеток, как и в случае Ericaceae-
вариации; халазальный гаусторий (одноклеточный) отделяется после
второго, а микропилярныи (двуклеточный) — после четвертого деления
(Azorina vidalii — Шамров, Жинкина, 1994). На основании
имеющихся данных была предложена модификация схемы Rosen (1949) по
распределению различных вариаций (= типов) развития целлюлярного
эндосперма в семействах Campanulaceae и Lobeliaceae (Коробова,
Жинкина, 1987).
В сем. Bignoniaceae выделены две особые вариации (= типы) развития
эндосперма целлюлярного типа. Catalpa-вариация характерна для
большинства видов семейства. Первое деление поперечное, затем в обеих
клетках происходят продольные деления, в результате чего возникают 8
клеток, расположенных в два яруса. Клетки нижнего яруса образуют
халазальный гаусторий, а из клеток верхнего яруса формируется
собственно эндосперм (Govindu, 1950). В случае другой Incarvillea-вариации
халазальная клетка двуклеточного эндосперма без деления становится
гаусторием, а микропилярная образует собственно эндосперм и
одноклеточный микропилярныи гаусторий (Incarvillea, Amphicome — Mauritzon,
1935).
Известны таксоны, у которых развитие эндосперма по целлюлярно-
му типу не укладывается в рамки предложенных вариаций. У ряда
растений (Icacinaceae — Swamy, Ganapathy, 1957a; Saururaceae —
Johnson, 1900a; Raju, 1961; многие Nymphaeaceae — Cook, 1902,
1906; Мейер, 1960; Батыгина и др., 1980, 1991; Винтер, 1987)
первое деление в эндосперме — поперечное, при этом нижняя клетка
трансформируется в трубкообразный халазальный гаусторий, а на базе
микропилярной клетки образуется собственно эндосперм.
Специфическое развитие эндосперма обнаружено в сем. Acantha-
сеае. В результате первого поперечного деления возникают две клетки,
из которых, как правило, халазальная преобразуется в гаусторий.
Однако у Thunbergia гаусторием становится микропилярная клетка, а
нижняя образует собственно эндосперм, из клеток которого на поздних
Эндосперм, перисперм
235
стадиях развития возникает вторичный халазальный гаусторий (Mohan
Ram, Wadhi, 1964). У многих представителей этого семейства
микропилярная клетка далее делится, отделяя микропилярныи гаусторий и клетку
собственно эндосперма, который с самого начала может быть клеточным
(Acanthus, Peristrophe) либо свободноядерным (Barleria, Chamaeranthe,
Ruellia, Schaueria) (Mohan Ram, 1962; Karlstrom, 1974 a, b; Madhavan,
Gupta, 1982).
Рядом исследователей (Di Fulvio, 1983; Di Fulvio, Cocucci, 1986)
была предложена новая общая классификация эндосперма цветковых
растений. При ее создании использованы известные подходы,
предложенные Samuelsson (1913) и Erdtman, Straka (1961). Она основана на
четырех критериях: 1 — природа эндоспермогенеза (наличие
цитокинеза при делении первичной клетки эндосперма), 2 — положение
клеточной перегородки во время первого деления, 3 — судьба клеток,
возникших в результате первого деления, 4 — положение клеточных
перегородок во время второго деления. Целлюлярному типу развития
эндосперма так же, как и нуклеарному, придан статус мегатипа,
подтипам — статус типа, а вариациям — статус подтипов. Целлюлярный
мегатип эндоспермогенеза представлен пятью типами и двенадцатью
подтипами. Типы образуют две группы, различающиеся положением
перегородки во время первого деления в эндосперме. Первая группа
характеризуется продольным заложением перегородки: изобилатераль-
ный (обе клетки принимают участие в образовании эндосперма) и
гетерополярный (участвует только одна из клеток, а другая
формирует латеральный гаусторий) типы. 'Вторая группа включает типы, в
которых первое деление поперечное; изополярный (обе клетки
участвуют в построении эндосперма), гетерополярный микропилярныи
(микропилярная клетка принимает участие в формировании
эндосперма, а халазальная — образует гаусторий), гетерополярный
халазальный (халазальная клетка образует эндосперм, а микропилярная —
гаусторий). На основании положения перегородок во время второго
деления в каждом типе выделены продольный и поперечный подтипы,
а в изополярном — еще и продольно-поперечный и
поперечно-продольный подтипы.
Существует также точка зрения (Камелина, 1991, 1996), что все
вариации целлюлярного типа развития эндосперма с терминальными
гаусториями следует рассматривать в рамках особого тубифлорального
типа (см. О возможности выделения тубифлорального типа
развития эндосперма).
В настоящее время предлагается еще одна иерархическая
классификация способов развития эндосперма, в основу которой положен онто-
филогенетический подход. Основными типами считаются целлюлярный
и гелобиальный, внутри которых выделены подтипы и вариации.
Каждая ступень иерархии имеет свои критерии (подробно см. Новый
подход к типизации эндосперма в связи с проблемой его
эволюции).
236
Семя
Функции и взаимоотношения эндосперма целлюлярного типа
развития с другими типами в процессе эволюционного становления широко
дискутируются в литературе (Friedman, 1992a, Ь, 1994, 1995; см.
Эндосперм; Гелобиальный тип развития эндосперма; Эмбриогения
семенных растений и эволюция эндосперма). Рис. 17.
Алимова, 19876; Алимова, Яковлев, 1982; Анисимова, 1983; Афанасьева, 1976; Баты-
гина, 1981; Батыгина и др., 1980,1991; Винтер, 1987; Камелина, 1980, 1987,1991,
1996; Камелина, Жукова, 1987; Камелина, Шевченко, 1987; Коробова, Жинкина,
1987; Мейер, 1960; Никитичева, 1981а, б, 1983а, б, в, 1987а, б, в, г; Никитичева,
Анисимова, 1987; Никитичева, Терёхин, 1976; Пол1щук, Дзевалтовський, 1971; Терё-
хин, 1977, 1987а, б, 19906; Терёхин, Никитичева, 1981; Терёхин и др., 1975; Шамров,
Батыгина, 1984; Шамров, Жинкина, 1994; Якобсон, 1976; Afzelius, 1924; Arecal, 1961;
Asplund, 1920; Banerji, 1947, 1961; Cook, 1902, 1906; Crete 1955a; D'Amato, 1984; Di
Fulvio, 1983; Di Fulvio, Cocucci, 1986; Doll, 1927; Dop, 1913; Erdman, Straka, 1961;
Friedman, 1992, 1993, 1994, 1995; Glisic, 1936-1937; Goldberg, 1941; Govindu, 1950;
Gscheidle, 1925; Hakansson, 1926; Hegelmaier, 1886; Iyengar, 1947; Jacobsson-Stiasny,
1918; Johnson, 1900a, b; Jorgensen, 1923; Junell, 1931; Kapil, Vijayaraghavan, 1962, 1965;
Karlstrom, 1974a, b; Kausik, Subramanyam, 1945a, b; Lageberg, 1909; Lawalree, 1952;
Madhavan, Gupta, 1982; MahesWari P., 1944; Maheshwari S. C, Kapil, 1963;
Maheshwari S. C, Khanna, 1956; Mauritzon, 1933, 1935, 1939; Meunier, 1897; Mohan Ram,
1962; Mohan Ram, Wadhi, 1964; Moore, 1948; Nair, Narayanan, 1961; Nicolosi-Roncati,
1903; Parameswaran, 1959; Raju, 1961; Rosen, 1932, 1949; Samuelsson, 1913; Schnarf,
1917, 1929; Shreve, 1905; Soueges, 1923b, 1952; Stolt, 1921; Strasburger, 1902; Svensson,
1925; Swamy, Ganapathy, 1957a; Swamy, Parameswaran, 1963; Tiagi, 1951b; Tiagi, San-
kla, 1963; Toks, 1976; Went van, 1970c; Wunderlich, 1967; Yoshida, 1957, 1959.
ГЕЛОБИАЛЬНЫЙ ТИП РАЗВИТИЯ ЭНДОСПЕРМА характеризуется
формированием из первичной клетки эндосперма двух клеток (микро-
пилярной и халазальной), в которых деления ядер первоначально не
сопровождаются цитокинезом. Синоним: промежуточный тип развития
эндосперма.
Свое название этот тип получил благодаря тому, что впервые был
обнаружен у однодольных растений группы Helobiae. Первое описание
развития эндосперма по гелобиальному типу было дано для Alisma
plantago и Sagittaria variabilis (Schaffner, 1896, 1897).Термин ввел,
по-видимому, Schnarf (1929).
Гелобиальный тип развития эндосперма характерен для многих
однодольных растений и лишь для некоторых двудольных, включая
Nymphaeaceae (Khanna, 1967), Olacaceae (Agarwal, 1963), Santalaceae
(Paliwal, 1956; Bhatnagar, 1959, 1960), Saxifragaceae (Rau, Sharma,
1967; Rau, 1970). Переисследование представителей последних трех
семейств поставило под сомнение развитие у них эндосперма по
гелобиальному типу (Swamy, Krishnamurthy, 1973). Дискутируется и
наличие эндосперма этого типа в семействах Cabombaceae (Cook, 1906;
Khanna, 1965; Davis, 1966; Padmanabhan, 1970; Батыгина, 1981,
1982; Шамров, 1981; Батыгина, Шамров, 1985; Титова, 1988; Баты-
Эндосперм, перисперм
237
гина и др.,1991) и Boraginaceae (Svensson, 1925; Swamy,
Krishnamurthy, 1973; Верещагина, 1976,1983).
В генезисе эндосперма гелобиального типа у однодольных и
двудольных растений имеются различия, касающиеся положения ядра в
первичной клетке эндосперма и времени начала цитокинеза в микро-
пилярной и халазальной клетках (Vijayaraghavan, Prabhakar,1984).
У однодольных растений ядро первичной клетки эндосперма перед
делением находится вблизи антипод. В результате неравного деления
образуются две клетки (= камеры, по терминологии ряда авторов), из
которых микропилярная клетка обычно крупнее халазальной. Микропи-
лярная клетка сильно вакуолизирована. На первых стадиях развития в
ней происходят свободноядерные деления, приводящие к формированию
многоядерного ценоцита. Ядра ценоцита располагаются в пристенном
слое цитоплазмы (Maheshwari, 1950; Swamy, Parameswaran, 1963;
Swamy, Krisbnamurthy, 1973; Bhatnagar, Sawhney, 1981; Vijayaraghavan, Pra-
bhakar, 1984).
В строении обеих клеток эндосперма у однодольных растений
отмечены различия, главным образом в числе ядер. Наиболее вариабельной
является его халазальная клетка, так называемый «базальный аппарат».
У. многих видов она густоплазменная и одноядерная. У Potamogeton densus
в результате полиплоидизйрующего митоза ядро увеличивается в размерах
в 30-40 раз, при этом плоидность достигает 192n (Hasitschka-Jenschke, 1959).
Однако у ряда таксонов (Amaryllidaceae — Dutt, 1970 a, b; Bromeliaceae —
Lakshmanan, 1967; Phylidraceae — Hamann, 1966; Typhaceae — Muller-
Doblies, 1969; Zthgiberaceae — Panchaksharappa, 1962) халазальная клетка
эндосперма — многоядерная. Она содержит, например, 4 ядра у Asphodelus
tenuifolius (Eunus, 1952), 10-20 — у Typha latifolia (Asplund, 1972), 16 —
у видов Zephyranthes и Sternbergia (Ворсобина, Солнцева, 1979; Солнцева,
Ворсобина, 1979) и 32 — у Hippeastrum rutilum, Pancratium longiflorum
(Dutt, 1970a,b). Разнообразие в числе ядер халазальной клетки эндосперма
отмечено даже в пределах одного семейства (Burmaniaceae, Juncaceae,
Zingiberaceae). Так, в сем. Juncaceae у Juncus bufonius халазальная клетка
одноядерная (Shah, 1963), у ].filiformis — одно- двуядерная (Brenner, 1922),
у J.effusus число ядер может достигать 8 (Zaman,1950), а у Luzula
pedemontana — 14-16 (Анисимова, 1990; Шамров, Анисимова, 1993а, б).
На основании различий в строении халазальной клетки было выделено 6
форм (точнее вариаций) развития гелобиального эндосперма у однодольных
(Swamy, Parameswaran, 1963). 5 форм характеризуются разным числом ядер
в клетке (типовая форма — одно ядро, А-форма — 2 ядра, В-форма —
4 ядра, С-форма — 8 ядер, D-форма — 16 ядер), при этом цитокинез не
происходит. В случае шестой формы (Е) наблюдается клеткообразование и
формируется ткань.
В отличие от однодольных, у двудольных растений ядро первичной
клетки эндосперма перед делением часто занимает центральное
положение. В результате этого образовавшиеся две клетки оказываются
равными или почти равными по величине. В микропилярной клетке в
238
Семя
дальнейшем происходят деления ядер без цитокинеза. Халазальная
клетка остается одноядерной, при этом она сильно вытягивается в
длину, а ее ядро перемещается в направлении антипод (Khanna, 1967;
Титова, 1988).
После достижения определенного числа ядер в микропилярнои, а
иногда и халазальной клетке, происходит переход от ценоцитной фазы
развития эндосперма к клеточной1. В тех случаях, когда обе клетки являются
ценоцитами, заложение клеточных стенок обычно начинается в
микропилярнои клетке. Однако у представителей семейств Bromeliaceae и Typhaceae
этот процесс наблюдается сначала в халазальной клетке (Lakshmanan, 1967;
Mtiller-Doblies, 1969). В микропилярнои клетке число ядер,
предшествующее целлюляризации, может быть различным: от 16 (например, у Spar-
ganium simplex — Muller-Doblies, 1969) до 100 (у Trillium undulatum —
Swamy, 1948c). В халазальной клетке клеткообразование может начинаться
еще на стадии двух ядер (Typha latifolia — Asplund, 1972) либо по
достижении 8-16 ядер (Juncus effusus — Zaman, 1950; Luzula pede-
montana — Шамров, Анисимова, 1993б). В дальнейшем производные
микропилярнои клетки образуют эндосперм (центральный эндосперм,
по Juel, 1907). Халазальная клетка либо ее производные (базальный
эндосперм, по Juel, 1907) функционирует в качестве гаустория и, как
правило, разрушается в процессе развития семени.
Ультраструктурные и гистохимические исследования эндосперма ге-
лобиального типа развития, проведенные на незначительном числе
видов растений, обнаружили высокую функциональную активность
обеих его клеток. В период свободноядерных делений эти клетки
характеризуются признаками передаточных клеток, при этом выросты
клеточных оболочек более развиты в халазальной клетке (например,
у Haemanthus katherinae). Вблизи этих выростов имеются
многочисленные митохондрии с обилием крист (Newcomb,1978). Цитоплазма
обеих клеток и, особенно микропилярнои, интенсивно окрашивается
на белки, ДНК и РНК (у Najas flexilis, N.marina и Potamogeton
nodosus — Kapoor, 1980). Динамика ряда пластических веществ в
процессе развития эндосперма изучена на примере Luzula pedemon-
tana (Шамров, Анисимова, 1993б). Уже перед делением вокруг
ядра первичной клетки эндосперма накапливается небольшое
количество крахмала и белков. В дальнейшем после образования двух
клеток наблюдается специфическое перераспределение веществ: в
микропилярнои клетке вокруг возникающих ядер выявляется крахмал в
небольшом количестве, тогда как в халазальной клетке — белки
(высокий уровень содержания). К стадии позднего глобулярного
зародыша, когда клеткообразование в эндосперме уже произошло, а
халазальная клетка почти полностью дегенерировала, в центральной
У представителей семейств Ruppiaceae и Zannichelliaceae клеткообразование не
происходит (Камелина, Терёхин, 1990а, б).
Эндосперм, перисперм
239 |
части эндосперма аккумулируется большое количество крахмала, а в
его трех-четырех периферических слоях обнаруживаются белки
(относительно невысокий уровень содержания). В ходе последующего
развития белки в эндосперме больше не выявляются; запасные
вещества представлены крахмалом.
Формирование эндосперма сопряжено с развитием окружающих структур
семени. Во многих работах обсуждаются прежде всего взаимосвязи
эндосперма и зародыша, исходя из классических представлений о важной
роли эндосперма в росте и развитии зародыша (Brink, Cooper, 1947;
Maheshwari, 1950; Модилевский, 1963; Bhatnagar, Sawhney, 1981;
Vijayaraghavan, Prabhakar, 1984). Большой фактический материал по
эмбриологии цветковых растений («Сравнительная эмбриология
цветковых растений», 1981, 1983, 1985, 1987, 1990; Johri et al., 1992)
свидетельствует, что существует корреляция между гелобиальным типом
развития эндосперма, типом эмбриогенеза и строением суспензора. У
представителей семейств, характеризующихся Caryophyllad-типом
эмбриогенеза (Alismataceae, Butomaceae, Hydrocharitaceae, Potamogetona-
ceae, Ruppiaceae, Zannicheliaceae), формирование эндосперма гелоби-
ального типа коррелирует с образованием одноклеточного гаусториаль-
ного суспензора. У видов с Onagrad-типом эмбриогенеза и гелобиальным
эндоспермом (Alliaceae, Amaryllidaceae, Asparagaceae, Liliaceae, Me-
lanthiaceae) подвесок длинный и многоклеточный. В других случаях
(Astead-, Solanad-типы; Pontederiaceae, Typhaceae, Zingiberaceae) cyc-
пензор короткий или морфологически слабо выражен.
Относительно филогенетической оценки типов развития эндосперма
высказывались различные точки зрения (см. Эндосперм). Исходным
типом считают либо нуклеарный, либо целлюлярный. Практически
отсутствуют работы, в которых бы обсуждалось значение гелобиального
типа в эволюции. На становление эндосперма большое влияние
оказывают окружающие ткани семени, развивающиеся сопряженно с ним
(Wunderlich, 1959; Никитичева, 19796; Erdelska, 1981;
Vijayaraghavan, Prabhakar, 1984; Терёхин, 1991; Шамров, 1995). Наибольшее
значение, вероятно, имели взаимосвязи эндосперма с зародышем, с
одной стороны, и с антиподами, с другой, а также специфика
транспорта питательных веществ, осуществляющегося через систему
последовательно функционирующих специализированных структур.
В качестве исходного типа, по-нашему мнению, следует
рассматривать эндосперм, развитие которого характеризовалось признаками цел-
люлярного и гелобиального типов (наличие стадии двух клеток, при
этом в микропилярнои клетке могли происходить сопряженно карио- и
цитокинез, либо только кариокинез). Наиболее близок к анцестраль-
ному целлюлярный эндосперм ряда примитивных таксонов двудольных
растений (Fouquieriaceae, Saururaceae, большинство Nymphaeaceae),
который возникает за счет делений микропилярнои клетки, а халазальная
клетка трансформируется в гаусторий. Однако в эволюции более
значительная роль, возможно, принадлежит целлюлярному типу эндосперма,
240
Семя
характерному, например, для Ceratophyllaceae, Monimiaceae, Nelumbona-
ceae, Winteraceae. Обе клетки участвуют в образовании эндосперма,
гаустории отсутствуют, однако имеются долго сохраняющиеся антиподы. На
основе этого мог сформироваться эндосперм более продвинутых таксонов
с терминальными гаусториями. Гелобиальный тип развития эндосперма,
близкий к анцестральному, характерен для ряда таксонов двудольных
(Cabombaceae, некоторые Nymphaeaceae) и однодольных (Alismataceae,
Butomaceae, Amaryllidaceae) в основании филогенетической системы
цветковых растений. В результате постепенной редукции его халазальной
клетки мог возникнуть нуклеарный эндосперм. Сначала происходило
формирование эндосперма без специфических гаусториальных структур
(Casuarinaceae, Ranunculaceae, Papaveraceae, Cyperaceae, Liliaceae,
Melanthiaceae и др.), что сопровождалось увеличением времени
существования антипод после оплодотворения. Дальнейшая эволюция,
вероятно, была связана с появлением гетероморфности эндосперма и
функционированием его микропилярного и халазального районов как гаусториев
(подробнее см. Новый подход к типизации эндосперма в связи с
проблемой его эволюции). Рис. 18.
Анисимова, 1990; Батыгина, 1981, 1982; Батыгина, Шамров, 1985; Батыгина и др.,
1982, 1991; Верещагина, 1976, 19836; Ворсобина, Солнцева, 1979б, 1990; Камелина,
1991; Камелина, Терёхин, 1990а, б; Кордюм, 1978; Модилевский, 1963; Никитичева,
19796, 1990а,б; Поддубная-Арнольди, 1976; Сатарова, 1990; Смирнов, 1982;
Солнцева, Ворсобина, 1979; Терёхин, 1991; Титова, 1988; Турсунов, Савинова, 1979;
Худяк, 1963; Шамров, 1981, 1995; Шамров, Анисимова, 1993а,б; Agarwal, 1963;
Asplund, 1972; Bhatnagar, 1959, 1960; Bhatnagar, Sawhney, 1981; Brenner, 1922; Brink,
Cooper, 1947; Cook, 1906; Coulter, Chamberlain, 1903; Dahlgren, 1934; Dutt, 1970a,b;
Erdelska, 1981; Eunus, 1952; Glisic, 1936-1937; Hamann, 1966; Hasitschka-Jenschke,
1959; Herr, 1961; Johri, 1938; Juel, 1907; Kapoor, 1980; Karlstrom, 1974a,b; Khanna,
1965, 1967; Lakshmanan, 1967; Madhavan, Gupta, 1982; Mohan Ram, 1962; Muller-
Doblies, 1969; Newcomb, 1978; Ono, 1929; Padmanabhan, 1970; Paliwal, 1956; Palm,
1915; Panchaksharappa, 1962? Rao, 1938; Rau, 1970; Rau, Sharma, 1967; Rocen, 1927;
Rosen, 1949; Schaffner, 1896, 1897; Schnarf, 1929; Schnarf, Wunderlich, 1939; Shah,
1963; Sporne, 1954; Svensson, 1925; Swamy, 1948c; Swamy, Ganapathy, 1957b; Swamy,
Krishnamurthy, 1973; Swamy, Parameswaran, 1963; Vijayaraghavan, Prabhakar, 1984;
Wunderlich, 1959; Zaman, 1950.
LIGHT MICROSCOPICAL STUDY OF ENDOSPERM FORMATION
IN BRASSICA NAPUS L.
РАЗВИТИЕ ЭНДОСПЕРМА У BRASSICA NAPUS L. (ПО ДАННЫМ
СВЕТОВОЙ МИКРОСКОПИИ)
Endosperm formation in angiosperms is characterized by a sequence of
events leading to a tissue that nourishes the embryo. The development of
the endosperm starts with the fusion of a sperm cell with the central cell
Эндосперм, перисперм
241
of the embryo sac but its further development varies among plant species
in a way that it might be cellular from the onset of endosperm formation
or it might have an initial nuclear phase (Bhatnagar, Sawhney, 1981;
Vijayaraghavan, Prabhakar, 1984). In the latter case cellularization is preceded
by alveolation of the nuclear endosperm. During this process endosperm
nuclei divide several times and attain an even distribution in the cytoplasm
which aligns the wall of the former central cell. Then, cell walls are generated
between the nuclei in a position anticlinal to the outer wall of the central
cell. As a result nuclei are surrounded by cell walls in a honey comb
appearance. The alveoli, however, still form a coenocyte because their ends
towards the central vacuole of the former central cell remain open. Alveolation
might happen simultaneously all around the central cell or it might start
in the vicinity of the embryo and then spread towards the antipodal side
of the central cell. Once alveoli are formed, their nuclei can divide and
after cell plate formation the first layer of endosperm cells bordering the
wall of the central cell is formed. Repeated nuclear division and cell plate
formation results in the formation of more or less regular files of cells.
Recently it was stressed that the formation of the alveolar endosperm is
strongly influenced by the microtubular cytoskeleton in a variety of plant
species such as Triticum aestivum (Van Lammeren, 1988), Ranunculus
sceleratus (XuHan, van Lammeren, 1993), Phaseolus vulgaris (XuHan,
van Lammeren, 1994) and Populus nigra (XuHan et al., 1995). A model
of the influence of the microtubules on alveolation and cell formation was
postulated.
In a study on the in vivo development of the seed of Brassica napus
we focused on the development of the endosperm applying light microscopy.
The microtubular cytoskeleton in the endosperm was visualized by
immunocytochemical staining of embedded and sectioned material.
Endosperm development in rape proceeds through a nuclear phase. Mitotic
activity of the primary endosperm nucleus and its derivatives leads to the
formation of a layer of free nuclei bordering the wall of the central cell.
In the beginning the nuclei were distantly located and all were encompassed
by the cytoplasm which formed a thin layer aligning the cell wall of the
central cell. With the increase of nuclear divisions and proliferation of the
cytoplasm, nuclei came closer to one another but still remained free in a
band of cytoplasm. A developing seed at 6 days after anthesis shows the
embryo at the globular stage and the nuclear endosperm surrounding the
central vacuole of the central cell. The free endosperm nuclei were scattered
over the cytoplasm, sometimes on distances less than 6 цт.
Immunocytochemical labelling of. the butyl methyl metacrylate (BMM) sections revealed
the occurrence of the microtubular arrays radiating from the envelope of
each interphase nucleus. Some microtubules (Mts) radiating from a nucleus,
interconnected with the radiating Mts of the neighbouring nuclei. Double
staining with DAPI showed that a great number of DNA-containing
organelles (plastids and mitochondria) occurred in the cytoplasm, especially
in spherical zones surrounding the nuclei.
16-S28
I 242
Семя
In the micropylar region of the embryo sac, again a thin layer of cytoplasm
and nuclei surrounded the embryo proper, but around the embryo suspensor
a mass of cytoplasm existed containing a cluster of nuclei not aligned in
a monolayer. The distance between nuclei in the section ranged from 6 |J,m
until 100 |j.m indicating an uneven distribution over the cytoplasm at this
early nuclear stage. In the chalazal region, the endosperm consisted of a
region of dense cytoplasm with regularly spaced nuclei. Here, short arrays
of Mts were distributed throughout the cytoplasm and sometimes bundles
of Mts radiated from the surface of the nuclei forming a three dimensional
network in the cytoplasm.
Referring to the developmental stage of the embryo it was found that
the nuclear endosperm phase persisted until the early heart shaped stage
of embryo proper, that was until about 12 days after anthesis. Cellularization
had started in the vicinity of the embryo. The mass of endosperm cytoplasm
found here in the nuclear stage, vacuolated, but the nuclei remained
surrounded by cytoplasm. Cell wall formation started in the thin layer of
cytoplasm surrounding the embryo proper and in the layer of cytoplasm
bordering the wall of the former central cell. In the micropylar region the
endosperm nuclei were surrounded by these cell walls completely. Thus real
endosperm cells were formed here. In the thin layer of cytoplasm surrounding
the embryo proper and in the layer of cytoplsm bordering the wall of the
former central cell, however, only anticlinal cell walls developed resulting
in the formation of alveolar endosperm. Alveolus formation generally started
when nuclei were closer than 30 \xm. The first alveoli had a diameter of
about 20 цт on section. At the chalazal side the endosperm was still
nuclear and contained regularly spaced nuclei.
In the phase when endosperm cells, alveoli and free nuclei existed
simultaneously, all endosperm types had their specific microtubular
configurations. Concomitant with the vacuolation in the endosperm
cytoplasm, Mts pointing to the central vacuole bent sidewards and ran
immediately underneath the tonoplast of the central vacuole. Cellularization
in the area of the alveolar endosperm was first seen when the embryo
differentiated to the late heart or early torpedo shaped stages. Cell wall
growth continued resulting in the formation of cylindrical alveoli. The
nuclei migrated from the center of the alveolus to a position near the
central vacuole. The radial Mts remained prominent but pointed
preferentially to the tonoplast of the central vacuole and to the ends of
the growing anticlinal walls. When alveolar nuclei divided, periclinal walls
appeared, and the first layer of uninucleated endosperm cells was
formed. They bordered the embryo sac wall, and at the inner side,
the layer of alveoli remained. In this way, more layers of endosperm
cells were produced. Endosperm cells at interphase exhibited Mts in
the cortical cytoplasm aligning the cell walls. Some short bundles of
Mts were detected around the flattened nuclei. Cellularization continued
until the central vacuole of the former central cell had disappeared.
A developing seed at 14 days after anthesis shows the embryo at the
Эндосперм, перисперм
243
torpedo shaped stage. The endosperm is cellular for the greater part. In
the central zone of the seed the central vacuole of the former central
cell persisted. It was still aligned by a layer of alveolar endosperm but
the nuclei of the alveoli were less densely distributed than at 6 days
after anthesis. Immunocytochemical labelling of the BMM sections revealed
that the organization of the microtubular cytoskeleton in the alveoli had
not changed at this stage.
Endosperm cells were not only formed by divisions in the alveoli. Existing
endosperm cells divided too, especially those in the outer cell layers of the
endosperm. These cells exhibited various stages of karyokinesis and cytokinesis.
Technovit embedding showed the microtubular spindles at various stages of
mitosis and Mts associated with the ends of new cell plates. In the alveolar
zone of the endosperm many nuclei were surrounded by arrays of Mts radiating
from the nuclear surface. The Mts of four neighbouring alveolar nuclei interacted
at sites where the cell walls of the alveoli are being formed.
Analyzing the successive stages of endosperm development in B. napus
it appeared that there existed large differences between ovules of the same
age. These differences probably depended on the position of the ovules in
the fruit and the position of the fruit in the inflorescence. However, the
stages of development of endosperm and embryo were related.
Cellularization of the nuclear endosperm started at the early heart shaped
stage, and either occurred directly as seen in the endosperm surrounding
the embryo suspensor, or it was mediated by alveolation, a process first
described by Hodcent (1969) in which the microtubular cytoskeleton is
highly involved (XuHan, 1995). Alveolation might occur simultaneously
throughout the embryo sac as seen in peripheral type of endosperm formation
found in e.g. wheat (Fineran et al., 1982; van Lammeren, 1988), or
cellularization varies depending on the site in the embryo sac. With B.
napus cellularization occurred immediately in the area surrounding the
suspensor, it was preceeded by alveolation along the longitudinal walls of the
embryo sac, and retarded at the chalazal site. Thus, the cellularization of
the endosperm of B. napus has characteristics as described in the lingering
type also found in e.g. bean (Yeung, Cavey, 1988; XuHan, van Lammeren,
1994).
The asynchrony of the development might be due to different distribution
of cytoplasm and nuclei over the embryo sac. The micropylar area and
the chalasal zone of the embryo sac are cone shaped, likely caused by
the differentiation of the integument at the micropylar region and by the
elongation of the embryo sac at the cost of nucellus tissue in the chalazal
region. Here the cytoplasm did not form a thin layer lining the wall of
the ejnbryo sac, but a mass of cytoplasm enabled the free nuclei to
accumulate in more than a monolayer. Once cell wall formation is initiated
it will only result in the formation of alveoli at sites where a layer of
nuclei borders a large vacuole. The remaining nuclei in the cytoplasmic
mass are surrounded by neighbouring nuclei and will be fully surrounded
by cell walls, and thus become cells without an alveolar phase.
16*
244
Семя
First signs of cell wall formation were observed in the micropylar region.
This might indicate that the signal for cellularization, if any, is located
here. It is unlikely that the density of population of nuclei causes cell wall
formation alone, because in the chalazal zone there was a high density of
nuclei, too.
Alveolus formation was preceded by a redistribution of the free endosperm
nuclei, because at the late globular stage we still observed an irregular
distribution of nuclei over the cytoplasm. As development proceeded, nuclei
became regularly spaced. It is suggested that the. regular spacing of the
nuclei is caused by Mts which radiate from the nuclear surface in a way
reported for e.g. wheat (van Lammeren, 1988).
Alveolation is the result of cell plate formation, elongation and cell wall
fusion (XuHan, van Lammeren, 1994). The formation is likely dependent on
the presence of a high density of phragmoplast Mts found after karyokinesis,
as well as on the presence of dense arrays of Mts between neighbouring
non-daughter nuclei in a way as was proposed by XuHan (1995). High
densities of microtubular arrays are only obtained when nuclei are densely
packed in the monolayer, that is after repeated mitotic divisions. Consequently,
the high density of nuclei, needed for the onset of cell wall formation also
results in the formation of alveoli with relatively small diameters. Therefore the
initial cell files at the periphery of the endosperm were slender. The increase
in size of the more centripetal endosperm cells is a result of the reduction of
the number of alveoli which continue to grow inwardly. As a result the distances
between the nuclei of neighbouring alveoli increase.
Cell formation in alveoli is caused by nuclear division and cell plate formation
in a plane perpendicular to the walls of the alveoli in a way described earlier
for e.g. wheat (van Lammeren, 1988). Once endosperm cells of B. napus
are formed, they are still able to divide. Especially we observed cell divisions
at the outer region of the endosperm. Various stages of the mitotic cycle were
found as were the microtubular configurations associated with the various stages
of karyokinesis and cytokinesis. Simultaneously cells are formed in the alveoli
until the anticlinal walls of alveoli at opposite sides of the central vacuole meet
and fuse. Thus the central vacuole of the former central cell is replaced by
cellular endosperm.
In conclusion, this study enabled us to identify three stages of endosperm
development in which the site within the embryo sac, the density of the population
of nuclei, and the configurations of the microtubular cytoskeleton were parameters
of major importance for this particular endosperm development. Fig. 19.
BaskL et al., 1992; Bhatnagar, Sawhney, 1981; Fineran et al., 1982; Hodcent, 1969;
Lammeren van, 1988; Vijayaraghavan, Prabhakar, 1984; XuHan, 1995; XuHan, van
Lammeren, 1993, 1994; XuHan et al., 1995; Yeung, Cavey, 1988.
Эндосперм, перисперм
245
CELL DIFFERENTIATION IN THE PERICARP AND ENDOSPERM
OF DEVELOPING MAIZE KERNELS (ZEA MAYS L.)
КЛЕТОЧНАЯ ДИФФЕРЕНЦИАЦИЯ В ПЕРИКАРПЕ
И ЭНДОСПЕРМЕ РАЗВИВАЮЩЕЙСЯ ЗЕРНОВКИ КУКУРУЗЫ
(ZEA MAYS L.)
Structural aspects of caryopsis development have been studied for important
cereals as wheat (Buttrose, 1963b; Campbell et al., 1981; Cochrane, 1983;
Rogers, Quatrano, 1983; Smart, O'Brien, 1983; van Lammeren, 1988), barley
(Olsen, Krekling, 1980; Felker et al., 1984; Kvaale, Olsen, 1986), rye (Pom-
eranz, 1973) and rice (Bechtel, Pomeranz, 1977; Bechtel, Juliano, 1980; Miflin
et al., 1981; Oparka, Harris, 1982). A general survey related to seed
development is given by Bhatnagar and Sawhney (1981; see also Friedman, 1994).
Developmental studies of maize go back to the last century; many early workers
analyzed spikelet formation, fertilization, and the development of fruits and
seeds from a structural point of view (see, amongst others, Guerin, 1899;
Miller, 1919; Weatherwax, 1919; Lampe, 1931; Randolph, 1936; Kiessel-
bach, 1949). More recently, electron microscopy stimulated the subcellular
analysis of fertilization (Diboll, 1964; van Lammeren, 1986a), the
development of the proembryo (van Lammeren, Schel, 1983; Schel et al., 1984),
the embryo proper (van Lammeren, 1986b), the endosperm (Khoo, Wolf,
1970; Kyle, Styles, 1977) and the' interaction between embryo and
endosperm (Schel et al., 1984).
The endosperm is considered to be an important nutritional factor for
embryo development and germination (Lampe, 1931; Lending et al., 1988;
Esen, Stetler, 1992; Mikus et al., 1992). Especially the outermost cell
layer, the aleurone layer which can be distinguished by the shape of its
cells and the organelles within the cells, accumulates storage products during
seed development and releases hydrolytic enzymes during germination. The
ultrastructural development of the aleurone layer and the subaleurone layers
have been studied before (Khoo, Wolf, 1970; Kyle, Styles, 1977); however,
although early interactions between the developing embryo and endosperm
have been reported (Schel et al., 1984), the further development of cell
shape, interactions between various tissues of the caryopsis and the
concomitant ultrastructural changes were not investigated in detail.
The present study focusses on the cellular differentiation in carpels,
integument, nucellus and parts of the endosperm starting at the moment of
cellularization of the endosperm up to and including the senescence of the
pericarp cells. In all tissues of the caryopsis cell differentiation resulted not
only in a diverse composition of the cytoplasm but in varying cell shapes
as well.
246
Семя
Development of somatic tissues in the caryopsis. The development
and degeneration of the carpels, the integument and the nucellus cells were
traced within a restricted zone at the germinal face of the caryopsis during
a period of three weeks after pollination. In the pericarp, three zones were
distinguished at 3 DAP1: an endocarp zone near the ovule, consisting of
about three cell layers of small, thinwalled fusiform cells which were often
isodiametric in section and elongated out of the plane of sectioning; a
mesocarp zone with larger, loosely arranged cells which were isodiametric
to irregular in shape and an exocarp zone containing cylindrical cells which
bordered each other leaving only little intercellular space. All pericarp cells
had large central vacuoles and only little cytoplasm in which amyloplasts
were observed. As development proceeded, however, the growth of the
developing seed forced the pericarp to enclose a larger area. At 8 DAP the
exocarp cells had elongated. In the mesocarp region a spongy mesophyll
developed with spherical, slightly elongated or curled cells. The endocarp
cells did not increase much in diameter but they separated, thus enlarging
the intercellular space. In cross-sections the cells were often found parallel
to each other forming fibrous sheaths covering the developing seed. The
length axes of the various sheaths were not fixed. At 17 DAP the pericarp
cells were still intact yet at an end phase of development. The diameter
of the endocarp cells had not enlarged much. The exocarp cells had reached
their maximal length, thereby leaving only little intercellular space. Their
cell walls had thickened giving solidity to the fruit wall. The spongy mesocarp
cells were compressed and so the thickness of the whole pericarp decreased.
The cytoplasm of the remaining cells degenerated at about 20 DAP thus
leaving a multilayered dead fruit wall mainly consisting of cell walls. At
22 DAP the small endocarp cells were often crushed, whereas the shape
of the dead exocarp cells was still preserved.
Integuments covered the nucellus and the endosperm during the early
developmental stages. Because of the retarded growth of the outer integument
during ovule development, only an inner integument covered the nucellus
at the sampling area. It consisted of two cell layers and a thin cuticle.
The integumentary cells were cylindrical at 3 DAP. Sometimes they were
only seen at this stage but occasionally the intact cytoplasm was still observed
at 8 DAP. Hereafter cells were crushed between the pericarp and the
expanding endosperm and their thin cell walls and the cuticles disappeared
completely.
The nucellus is an ephemeral tissue, too. Except for the epidermis and
its cuticle, the nucellus degenerated fast. At 3 DAP a multi-layered nucellus
still existed but at 5 DAP only 1 or 2 layers of nucellus cells remained
in the sampling area. Cell degeneration occurred near the outermost cell
layer of the endosperm. First the cells exhibited cytoplasmic degeneration.
Then they collapsed and eventually they disappeared. The nucellus epidermis
DAP — days after pollination.
Эндосперм, перисперм
247
was observed as a living tissue at 8 DAP. It consisted of flattened cells
covered with a thick, conspicuous cuticle which was still found in the late
developmental stages. There was a large central vacuole and only little
cytoplasm. From 12 DAP onwards nucellar epidermis cells collapsed. The
remnants were found up to 22 DAP because the cuticle, the outer cell
walls and the partly thickened anticlinal cell walls persisted.
The course of cell development of the various somatic tissues described
above is summarized schematically in Table 1 with respect to cell shape
development, cell wall formation and viability.
Development of the endosperm. The development of aleurone, subaleu-
rone and inner endosperm involved the multiplication, enlargement and
differentiation of cells and the accumulation of storage products. The
development of the aleurone layer became prominent from 5 DAP onwards.
Initially the outer endosperm cells, which developed into the aleurone cells,
were large (one cell of the nucellus epidermis covered 2-3 prealeurone
cells). They divided in various directions but from about 7 DAP
simultaneously and in only one direction. Many nuclei exhibited prophase
configurations at 5-6 DAP and at 8 DAP cytokinesis had resulted in the
formation of an epidermal-like cell layer in which mainly anticlinal cell walls
had formed. The newly formed cells were much smaller; up to 8 epidermal
cells were now covered by one nucellus epidermal cell which had not
increased in size. After that, the epidermal cells became rectangular, the
amount of cytoplasm and organelles still increased, and the accumulation
of storage products started 12 DAP. From 8 to 12 DAP the cells of
the outermost' cell layer of the endosperm differentiated into aleurone cells.
They enlarged in periclinal direction and up to 5 aleurone cells were covered
by one nucellus cell at 12 DAP. Sub-aleurone cells were often found in
line with the aleurone cells indicating that periclinal cell wall formation took
place repeatedly as endosperm development proceeded. These cells continued
to divide, sometimes in a meristem-like fashion forming rows of cells with
new periclinal cell walls. The newly formed isodiametric cells were often
smaller than the bordering aleurone cells. The inner endosperm cells, however,
enlarged. During further seed development the aleurone cells enlarged in periclinal
and anticlinal direction (up to 4 aleurone cells were covered by one cell of
the nucellus epidermis at 17 DAP). In the ensuing development, from 17 to
22 DAP, only slight changes in the sizes and shapes of the cells were to
be seen. The anticlinal and outer cell walls increased in thickness from 17
DAP onwards. Sub-aleurone and inner endosperm cells, however, still increased
in size. These cytomorphological data of endosperm formation are summarized
schematically in Table 1 together with the somatic tissues of the caryopsis.
The submicroscopical aspects of endosperm differentiation are summarized
for the developing aleurone layer and the sub-aleurone endosperm in Table
2 and 3 respectively. Nuclei, being the largest organelles, were about
spherical to ellipsoidal and had undulating membranes. They did not differ in
size and shape in aleurone and sub-aleurone cells, nor did their internal
structure. At 3 and 5 DAP the nuclei of the outermost endosperm layer
248
Семя
were often observed near the outer cell wall. Plastids were found in all
endosperm cells. In the aleurone layer they were smallest and accumulated
starch from 12 DAP onwards. At 22 DAP these amyloplasts occupied
up to 12% of the cell volume. In the sub-aleurone cells the plastids
accumulated starch from 8 DAP onwards and up to 46% of the cell
volume was filled with these second largest organelles at 22 DAP.
Thylakoids were found in all stages but grana were never detected.
Mitochondria were never abundant in the endosperm. At 3 DAP they
were not equally spread over the cytoplasm in the outer cell layers but
preferentially found in the cytoplasm adjacent to the outer periclinal cell
walls. This phenomenon could be observed at later stages too and also
in the sub-aleurone layer.
Vacuoles occupied about 40% of the cell volume of young aleurone and
sub-aleurone endosperm cells at 3 DAP. At 22 DAP only few, small
vacuoles were observed in the sub-aleurone cells but in the aleurone layer
about 10% of the cell volume was occupied by vacuoles. Only in the
aleurone cells they functioned as aleurone vacuoles by the accumulation of
storage proteins, a phenomenon which was observed from 5 DAP onwards.
An osmiophilic, flocculent precipitate was formed in the centre of the
spherical vacuoles at 8 DAP and at 12 DAP a dense precipitate was often
found near the tonoplast. The amount of storage proteins clearly increased
and at 22 DAP they almost filled the vacuoles, which are then called
aleurone bodies.
The endoplasmic reticulum proved to be a conspicuous organelle
system, especially in the sub-aleurone cells. Initially, at 3 DAP, the
ER occupied but a minor part of the cell volume. At 5 DAP there
was, however, a significant increase of the cisternal space because of
the swelling of the ER by which up to 15% of the cell volume was
occupied. In the subaleurone and inner endosperm the ER, to which
many ribosomes were attached, gave rise to electrondense globular
structures which are called endosperm protein bodies (EPBs). These
EPBs, which were surrounded by a ribosome carrying ER membrane,
were formed from 8 DAP onwards and had an average diameter of
0.14 ± 0.04 цт at 8 DAP and 0.44 ± 0.09 цт at 22 DAP.
Their presence was restricted to the subaleurone and inner endosperm
where they eventually occupied up to 70% of the cell volume at 22
DAP. The heavily stained ribosomes occurred singly or as short coils
of polysomes. Dictyosomes were not seen frequently and in the aleurone
layer their presence could not be established at 22 DAP because of
the densely stained cytoplasm.
Concerning other storage products, two types of spherosomes were
discerned in the developing endosperm. The first type (Type SI) was mainly
seen in the outer cell layers of the young endosperm up to an age of 8
DAP. Their number and total amount decreased in the aleurone layer
when the first spherosomes of a second type (Type S2) were discerned.
This second type predominantly occurred in the aleurone layer. Some of
Эндосперм, перисперм
249
Table 1: Schematic representation of cell differentiation in various tissues
of the developing caryopsis of maize
PHASE
TISSUE
EXOCARP
MESOCARP
ENDOCARP
INTEGUMEN
ЖЭ
AGE (DAP)
EARLY
-► LATE
'ШШШ^'^^^Ш&ШШ^^^^ШЬ ^
3 5 7 9 11 13 15 17 19 21
SYMBOLS
mm
о
Living cells
Dead cells
Cell collapse
degeneration
these spherosomes were seen in the adjacent cell layer but none in the
inner endosperm. Type S2 spherosomes were largest (1.26 + 0.68 цт at
17 DAP) and sometimes filled the aleurone cell cytoplasm for over 90%
at 22 DAP.
Cell differentiation in the caryopsis. The pericarp, known for its
determined life time (see, amongst others, Randolph, 1936), developed various
cell layers each with cells of particular shape, wall thickness and corresponding
mechanical properties. From 22 DAP onwards the exocarp consisted of
rigid cell walls while the cytoplasm of the cells was degenerated. Most
dead mesocarp cells were compressed between the exocarp and the seed
250 Семя
but the walls of the small fusiform cells of the endocarp were still well
recognizable. The pericarp, which initially showed a three-partite structure
as is common for the caryopses of many Gramineae, protected the seed.
Throughout their life span pericarp cells had a large central vacuole. As
in other Gramineae the carpels did not contribute to any food storage.
The accumulation of starch was ephemeral. The intimate relation between
pericarp and underlying tissues was expressed by the lack of a real inner
epidermis. As was also mentioned for wheat and barley the fusiform cells
of the endocarp vary in direction between individual caryopses. They appeared
as a network of so called «cellules tubulaires» (Guerin, 1899) forming the
inner face of the pericarp. Actually the nucellar cuticle is the demarcation
between fruit wall and seed because the integumentary cells had already
degenerated.
The life time of the integuments has been discussed by various authors,
amongst others, Randolph (1936), who observed initial stages of the
disintegration of the integuments at the germinal face of the caryopsis in
samples examined 3 DAP. He reported that the walls of the outer cell
layer disappeared first while nuclei and cytoplasm often persisted for some
time. In the present study the degeneration was often accomplished before
5 DAP but incidentally at 8 DAP cytoplasm with microtubules was still
observed. This asynchrony in development can be attributed to differences
in developmental rates in the various caryopses. The inner integument
influences the pathway of the pollen tube (Heslop-Harrison et al., 1985;
van Lammeren, 1986a) rather than the subsequent seed formation.
The nucellus is also an ephemeral tissue and it is likely that it functions
in nourishing the developing endosperm when cells are digested near the
endosperm epidermis. The nucellus epidermis and its cuticle existed longest
and covered the endosperm. They might function as a layer providing
mechanical protection because its cells lived until the cell walls of the aleurone
layer started to thicken. Eventually the cells died and only the remnants
of the anticlinal and outer cell walls and the cuticle of the nucellus persisted.
These remnants were called the nucellar membrane (Randolph, 1936; Ki-
esselbach, 1949). At this stage that structure is likely to function as a
protective covering of the embryo and endosperm because of its
semipermeable properties (Randolph, 1936).
In the caryopses of the maize inbred line A188 the differentiation
of the aleurone layer started at about 7 DAP with the synchronous
cell divisions by which one layer of columnar cells was formed. In
our experiments the phase of differentiation started 3 days earlier than
reported by Kyle and Styles (1977). In contrast to e. g. barley, in
which the aleurone layer consists of as many as four cell layers, one
layer is usual in maize but two cell layers were found incidentally.
Aleurone and sub-aleurone endosperm differed from each other in many
aspects. Until 8 DAP cell divisions in the outer endosperm layer
resulted in many small cells which developed into rectangular aleurone
cells. This is in contrast with the situation found e. g. in rapeseed
о
а,
«
я
СЛ
Ы1
в
■W
а
I-
о
«•*-•
(-^
Т)
а
а
О
S
а
0
о
►
V
TJ
и
щ
a
.^ч
а
<
а
•w^
a
о
я
a
о
а
Ь*
V
4-1
<-4м
«
(Л
*►>
Я
-а
<n
^
о
4-1
ел
S
о
1в Ч
g N
со
э
ш
_|
о
э
Z
со
о
<
ее
Q
§
X
о
5
^
ъ
ч
Оэ
Q
^0
со
о
э
со
ш
5
о
со
о
m
ее
«В
ее
ш
"f
ОО
2
о
со
9-
5
о
со
ш
5
о
со
8»
SB
at
со £3
сг^сош
LUlilQfc
XO.QO
CL>- ZCC
со н шо.
СЛ
(в
Е-
Эндосперм, перисперм
253
where the endosperm also exhibits small outer cells. In that case,
however, their ontogeny is strikingly different because the number of
these cells was already determined at the transition of the nuclear to
the alveolar stage (see also Groot, van Caeseele, 1993).
With respect to the type and location of organelles some similarities
were observed in the aleurone and sub-aleurone layers of this maize strain.
Both layers had the typically located mitochondria. The alignment along
the outer periclinal cell walls points to a high and local demand for energy
to permit ac tive transmembranal export and import. This phenomenon was
also observed in the synergids of maize before fertilization (van Lammeren,
1986a) and in the modified endosperm bordering the maize embryo suspensor
(Schel et al., 1984). Both cell types showed remarkable proliferation of
the ER, though, not as intense as was reported for wheat where evaginations
of the nuclear membrane took part of the ER system (Kyle, Styles, 1977).
Furthermore, an increasing amount of cytoplasm was noticed on all cell
types and starch accumulated in all plastids which is in contrast to the
observations of Khoo and Wolf (1970) who only found proplastids in the
aleurone layer. The difference might be caused by varying developmental
rates which are influenced by genotype and environmental conditions. On
the other hand the organization of the cytoplasm differed between the
epidermal, subepidermal and inner endosperm cells as early as 3 DAP.
Differences were found in the accumulation of spherosomes (Type SI) in the
various tissues at 3 DAP; the synthesis of endosperm protein bodies from
7 DAP onwards was restricted to the sub-aleurone cells and inner endosperm
cells, and the formation of aleurone bodies and spherosomes which started
at 9 DAP occurred only in the aleurone cells.
With respect to the function of the aleurone layer Bhatnagar and Sawhney
(1981) reviewed the literature about hydrolytic enzymes such as amylase
that brings about the breakdown of reserve food materials in the endosperm
tissue which are utilized by the embryo during its growth and development.
Protein bodies have several functions that were summarized by Matile
(1968). First they store certain reserve substances such as proteins, metals
and phytin the synthesis of which might be mediated by mitochondria
(Morrison et al., 1975). Second, during germination the aleurone vacuoles are
transformed to a «lysosome» and their food reserves are mobilized. Finally
they may form a lytic compartment in which other constituents of the cell
are broken down.
The development and structure of protein bodies and spherosomes in
seeds is discussed by Lott (1980), Lending et al. (1988) and Mikus et
al. (1992). Khoo and Wolf (1970) reported about the development of the
aleurone vacuoles and protein bodies in the outer cell layer of the maize
endosperm. They failed to detect protein accumulation in the vacuoles in
7-10 day kernels but found protein granules by day 12. As compared to
e. g. barley and wheat (Jacobsen et al., 1971) maize forms only few
aleurone protein bodies (see also Khoo, Wolf, 1970; Kyle, Styles, 1977)
which occupied only a minor part of the aleurone layer but spherosomes
254
Семя
were abundant and took up much more space. The origin of the spherosomes
was not established. The existence of spherosome membranes in maize was
reported by Kyle and Styles (1977). Such a membrane was only observed
in the present study when spherosomes were pressed to each other. Spherosomes
show variations in staining which might be related to the heterogenous composition
(Wolf et al., 1969). Aleurone protein bodies have electron dense and electron
opaque inclusions. The electron dense parts, which are hard and do not penetrate
well with embedded medium, often chatter during sectioning leaving holes in
the section. Protein bodies of the sub-aleurone and inner endosperm were
found to have polysomes associated with the protein body membrane. These
endosperm protein bodies of maize probably accumulate the main storage
protein called zein (Burr В., Burr F. A., 1976). When the polysomes
were isolated at a time when storage protein synthesis was active, they
were able to synthesize zein. More recently the distribution of a-, p-, y-,
and 5-zein was determined by immunocytochemical methods (Lending et
al., 1988; Esen, Stetler, 1992).
Based on the ontogeny of aleurone protein bodies and spherosomes it
can not be excluded that the structures which are called protein bodies
have originated via different pathways, i. e. via spherosomes and aleurone
vacuoles. This might explain the substantial variation and relative amounts
of the zein classes observed among protein bodies (Lending et al., 1992).
Fig. 20.
Bechtel, Juliano, 1980; Bechtel, Pomeranz, 1977; Bhatnagar, Sawhney, 1981; Burr В.,
Burr F. A., 1976; Buttrose, 1963a, b; Campbell et al., 1981; Cochrane, 1983; Diboll,
1964; Esen, Stetler, 1992; Felker et al, 1984; Friedman, 1994; Groot, Caeseele van,
1993; Guerin, 1899; Heslop-Harrison et al., 1985; Jacobsen et al., 1971; Khoo, Wolf,
1970; Kiesselbach, 1949; Kvaale, Olsen, 1986; Kyle, Styles, 1977; van Lammeren,
1986a, b, 1988; van Lammeren, Schel, 1983; Lampe, 1931; Lending et al., 1988, 1992;
Lott, 1980; Mares et al., 1975, 1976; Matile, 1968; Miflin et al., 1981; Mikus et al.,
1992; Miller, 1919; Morrison et al., 1975, 1978; Olsen, Krekling, 1980; Oparka,
Harris, 1982; Pomeranz, 1973; Randolph, 1936; Rogers, Quatrano, 1983; Schel et al.,
1984; Smart, O'Brien, 1983; Weatherwax, 1919, 1930; Wolf et al., 1969.
THE MICROPYLAR HAUSTORIUM IN IMPATIENS
WALLERIANA HOOK. EX ARN
МИКРОПИЛЯРНЫЙ ГАУСТОРИЙ У IMPATIENS
WALLERIANA HOOK. EX ARN
The ovule of Impatiens walleriana is bitegmic and tenuinucellate. Since
the antipodal cells are ephemeral, the mature embryo sac contains four
cells: the egg cell, two synergids and the large central cell. The localization
and morphology of the various cells follow the classical pattern. The part
of the inner integument, bordering the micropyle and near the egg apparatus
Эндосперм, перисперм
255
consists completely of thick-walled cells. The middle lamellae in this tissue
are lignified. The integumentary epidermis, bordering the other part of the
embryo sac has differentiated into a well developed integumentary tapetum.
In the outer tangential walls of the integumentary tapetum a layer of electron-
dense, acetolysis-resistent material is present.
Double fertilization is completed within two hours following pollination.
After fertilization is achieved, within one day the central cell divides into
a micropylar, cytoplasm-rich cell and a large chalazal, vacuolated cell.
Next divisions of the micropylar cell result in cellular endosperm, while
the chalazal cell in first instance gives rise to nuclear endosperm. The
zygote remains undivided for two days.
Directly after its formation the micropylar endosperm cell starts growing
towards and into the micropyle, forming the haustorium. During this process
the pollen tube and both the persistent and degenerated synergids are pushed
aside and shortly after disappear. After the haustorium has protruded from
the micropyle, its nucleus divides and one of the formed nuclei moves to
the protrusion outside the ovule, whereas the second one stays within the
embryo sac. Subseqently a wall with many extensions is formed in the
haustorium at the transmission position from embryo sac to micropyle,
dividing the haustorium in an external and internal part. At this stage both
haustorium parts are rich in cytoplasm, although in the outer part the
formation of a large vacuole has begun.
The zygote starts dividing at the second or third day after fertilization.
The embryo develops a short suspensor consisting of two or three cells.
The suspensor stays in close contact with the internal haustorium part, and
both structures accumulate large amounts of starch. In the meantime the
external haustorium part invades the neighbouring funiculus and placenta
tissues, whereas the integumentary tissue is not affected. The invasion by
the haustorium is accompanied by crushing, degeneration and breakdown
of cells. The external haustorium part stays unicellular and becomes very
irregular in outline. Its nucleus strongly enlarge and a giant nucleolus is formed.
Its cytoplasm shows a complex organization, with rough and smooth endoplasmic
reticulum, abundant polysomes, and many mitochondria and dictyosomes.
The development of the embryo and endosperm is accompanied by
expansion of the embryo sac volume and growth of the ovule. This involves
both breakdown of integument cells and stretching of the remaining ones.
The breakdown of integument cells occurs along the integumentary tapetum
which stays intact itself untill the sixth day of development. During this
period the electron-dense, acetolysis-resistent layer in the outer tangential
walls of the integument tapetum strongly thickens. Approximately at the
sixth day after fertilization simultaneously the integumentary tapetum rapidly
degenerates and the chalasal nuclear endosperm becomes cellular almost
completely.
Our observations clearly establish Dahlgren's conclusion (1934) that in
Impatiens the micropylar haustorium derives from the endosperm, and not
from the embryo suspensor as stated by Jacobsson-Stiasny (1914) and
j 256 Семя
Palm (1915). The haustorium is already present before the first division
of the zygote has taken place. However, eventually a specific spacial and
probably also functional relationship is achieved between the internal
haustorium part and the embryo suspensor. The latter is indicated by the
simultaneously accumulation of starch in both structures.
The formation and function of the haustorium might be related to the
presence and development of the electron-dense, acetolysis-resistent layer in the
outer tangential walls of the integumentary tapetum. This layer completely
surrounds the embryo sac, except for the micropylar area. Structure, electron-density
and acetolysis-resistency indicate the presence of sporopollenin in the layer. At
the time of fertilization the amount of deposited material is rather low and the
layer is discontinuous. Until the degeneration of the integument tapetum a
thick and continuous layer is formed. It is likely that during this period the
nourishment of the developing embryo and endosperm by the surrounding
integumentary tissue gradually decreases and changes in nourishment by the
micropylar haustorium. Fig. 20A.
Dahlgren, 1934; Maheshwari, 1950; Jacobsson-Stiasny, 1914; Palm, 1915.
THE EVOLUTION OF EMBRYOGENY IN SEED PLANTS AND
THE DEVELOPMENTAL ORIGIN AND EARLY HISTORY OF ENDOSPERM
ЭМБРИОГЕНИЯ СЕМЕННЫХ РАСТЕНИЙ
И ЭВОЛЮЦИЯ ЭНДОСПЕРМА
It has long been recognized that angiosperms possess a suite of defining
features that are associated with the process of sexual reproduction. Among
the most prominent of these is presence of endosperm, an unique embryo-
nourishing «tissue» that is formed as the result of a second and distinctive
fertilization process. For the greater part of this century, the origin and
early evolution of endosperm has remained an enigma. Within 2 years of
the discovery of the developmental origin of endosperm from a second
fertilization event (Nawaschin, 1898; Guignard, 1899), two basic hypotheses
had been formulated to explain the evolutionary origin of endosperm
(Thomas, 1907). One theory held that endosperm is a delayed continuation of
female gametophyte development, stimulated by the fusion of sperm nucleus
with the female gametophyte of more primitive seed plants (Strasburger,
1900). An alternative hypothesis, first proposed by Sargant in 1900,
maintained that endosperm represents a developmental transformation of a
supernumerary embryo sac, and hence derived from a second fertilization event.
Until recently, the evidence necessary to discriminate between these
contrasting hypotheses for the evolution of endosperm was lacking.
In addition to the fundamental issue of the origin of endosperm,
evolutionary biologists and plant embryologists have been baffled by the question
Эндосперм, перисперм
257
of which of the three basic patterns of endosperm development (free nuclear,
ab initio cellular, and helobial) characterized the earliest flowering plants
(Maheshwari, 1950; Stebbins, 1974; Sporne, 1980; Takhtajan, 1991) (Fig.
1). Among plants with a free nuclear endosperm, a series of mitotic division
follow the formation of a typically triploid fusion nucleus, but are not
accompanied by cytokinesis. The result is a coenocytic endosperm in which
cellularization may latter occur. In ab initio cellular endosperm, mitosis is
coupled with cell division from the outset of development (there is no
initial free nuclear phase). Helobial endosperm appears to blend aspects of
the nuclear and ab initio cellular patterns of development. Following formation
of a primary endosperm nucleus, a mitotic division accompanied by cytokinesis
forms a two-celled endosperm. Free nuclear divisions ensue, although the extent
of free nuclear development within the two cellular compartments of the
endosperm varies among and within taxa. Eventually, cellularization of one or
both coenocytic cells may take place (Brink, Cooper, 1947; Maheshwari, 1950;
Gifford, Foster, 1989).
It is generaly agreed that helobial endosperm represents a derived
condition among angiosperms and that character reversals between any of
free types of endosperm development have been numerous over the course
of flowering plant evolutionary history (Takhtajan, 1991). Indeed, many
genera of families exhibit more than one type of endosperm (see Davis,
1966 for information on the systematic distribution of endosperm types).
Moreover, it has been suggested that patterns of endosperm development
may correlate with other features of the seed such as nuclear volume, the
number of integuments, or the presence of endosperm haustoria (Wunder-
lich, 1959). Howewer, the basic question of whether ab initio cellular
endosperm or free nuclear endosperm characterized the earliest flowering
plants has remained lagerly intractable.
During the past 5 years, substantial evidence (which will be discussed in
this paper) has been presented that supports the hypothesis of Sargant (1900)
that endosperm evolved from a supernumerary embryo in the ancestors of
flowering plants. As a consequence, determination of the pattern of endosperm
development that is likely to have characterized the earliest flowering plants
(ab initio cellular or free nuclear) can be derived from an analysis of the
pattern of embryogeny that characterized the immediate ancestors of flowering
plants. As with endosperm, embryos of seed plants may express either a free
nuclear of ab initio cellular pattern of development (there are no seed plant
embryos that are «helobial»). As will be seen, reevaluation of the evolution
of patterns of embryogeny among the ancestors of flowering plants provides
the developmental pattern of endosperm that characterized the earliest
flowering plants.
The goals of this paper are threefold. First, the formalisms necessary
for the interpretation of comparative data within a phylogenetic context are
discussed in the section «Phylogeny-Based Character Analysis». Current
hypotheses of the phylogenetic relationships of seed plants are reviewed,
and the conceptual basis for the reconstructon of evolutionary history in
-| 7—828
258
Семя
the absence of a fossil record for the characters is developed. Second,
recent advances in our understanding of the evolutionary origin of double
fertilization and endosperm are examined in the section «Double Fertilization
in Ephedra and the Evolutionary Origin of Endosperm». The formulation
of hypotheses to explain the evolution of endosperm are shown to derive
from new information on patterns of fertilization in the closest living relatives
of angiosperms, the Gnetales. Third, the evolution of embryogenetic patterns
among seed plants is reevaluated in order to determine which pattern of
development (free nuclear or ab initio cellular) was expressed by the
progenitor of endosperm, a supernumerary embryo formed as a consequence
of a second fertilization event. This analysis forms the basis for the section
«The Evolution of Patterns of Early Embryogenesis in Seed Plants and its
Bearing on the Developmental Nature of Primitive Endosperm». Through an
examination of the relationship to endosperm, the pattern of endosperm
development that is likely to have characterized the earliest flowering plants is inferred.
Ultimately, it is hoped that this paper will serve to future stimulate the
study of character evolution based upon comparative data and its interpretation
within a phylogenetic context. It is in this interface, between comparative and
phylogenetic biology, that advances in our knowlege of the evolutionary history
of land plants will be found.
Phylogeny-based character analysis. Despite extensive analysis, many
aspects of the origin and early evolution of endosperm have remained cryptic.
Unfortunately, key intermediate states that might help to clarify the origin
of important reproductive features of flowering plants have not been found in
the fossil record, and it is unlikely that the fossil record will ever yield significant
information that can adress the evolutionary history of double fertilization (Cron-
quist, 1988), endosperm, or pattern of embryogeny. However, this does not
imply that formal means of analysis cannot be undertaken to examine and
resolve questions relating to the evolution of these unique features of angiosperm
reproductive biology.
From the level of genes to organismal morphology, biological innovation
has almost always resulted from the modification of previosly existing strutures
or processes (Bower, 1898; Jacob, 1982). Thus, questions pertaining to
the origin of identifying angiosperm features such as double fertilization and
endosperm are ultimately questions of evolutionary equivalence or homology,
and the solution of the «abominable mystery» of the origin of flowering
plants lies in the ability to recognize transformation (evolutionary homologies)
between specific structures and processes expressed in angiosperms and those
of ancestral or closely related taxa («outgroups»). For this reason, a clear
formulation of the phylogenetic relationships of angiosperms to their outgroups
and critical interpretation of comparative data are essential to the
reconstruction of the evolutionary origin of flowering plants.
During the past 10 years, significant progress has been made to elucidate
phylogenetic relationships among seed plants. The pioneering morphological
cladistic analyses of Crane (1985a, b) and Doyle, Donoghue (1986) have,
more recently, been complemented by molecular analyses based on the N-
Эндосперм, перисперм
259
FREE NUCLEAR ENDOSPERM
FREE NUCLEAR DEVELOPMENT ■
CELLULARIZATION AND FURTHER
"" CELLULAR DEVELOPMENT
CELLULAR ENDOSPERM
DIRECT CELLULAR DEVELOPMENT
HELOBIAL ENDOSPERM
ffflFh
_:::.:i
::::::.
."..II
*■- — "/
w
CELLULAR AND FREE NUCLEAR
DEVELOPMENT
CELLULARIZATION AND FURTHER
► CELLULAR DEVELOPMENT
Fig. 1. Three basic patterns of endosperm development among flowering plants. In plants
with free nuclear endosperm, mitotic division following formation of a triploid
fusion nucleus, but are not accompanied by cytokinesis. The result is a
coenocytic endosperm in which cellularization may later occur. Ab initio cellular
endosperm is characterised by a coupling of cell division with mitosis at the
outset of development. Following the formation of a primary endosperm nucleus
among taxa with helobial development, a mitotic division accompanied by
cytokinesis forms a two-celled endosperm. Free nuclear divisions ensue, although
the extent of free nuclear development within each cellular compartment varies
among and within taxa. Eventually, cellularization of one or both coenocytic cells
may take place.
terminal amino acid sequence of rubisco (Martin, Dowd, 1991), the rbcL
gene of the chloroplast (e. g., Chase et al., 1993), and the ribosomal RNA
gene of the nucleus (e. g., Hamby, Zimmer, 1992). Still, the precise
relationships of a number of seed plant taxa (particulary extinct Paleozoic
and Mesozoic groups of seed plants, cycads, conifers, and Ginkgo) remain
17*
260
Семя
I «si
8- fl s fifes » «
I i: § I l i I i i о; r s- s § g i-
Fig. 2. Strict consensus representation (Crane, 1988) of features common to earlier
phylogenetic analyses of seed plants by Crane (1985a) and Doyle and Donoghue
(1986). The relationships of basal groups of seed plants are largely unresolved,
but the close relationship between Gnetales and angiosperms is evident and
strongly supported by morphological and molecular analyses of phylogeny.
ambiguous (Crane, 1988; Fig. 2). However, phylogenetic analyses based
on morphological data (Hill, Crane, 1982; Crane, 1985a, b; Doyle,
Donoghue, 1986, 1992; Loconte, Stevenson, 1990; Doyle et al., 1994)
and molecular data (Martin, Dowd, 1986, 1991; Zimmer et al., 1989;
Hamby, Zimmer, 1992; Hasebe et al., 1992a, b; Chase et al., 1993;
Doyle et al., 1994) have yielded a consensus about the relatioship of
angiosperms to the Gnetales, a small and unusual group of seed plants that
comprises three monophyletic genera: Ephedra (approximately 45 species),
Gnetum (approximately 30 species), and Welwitschia (monotypic) (Fig. 3).
In particular, these phylogenetic studies support the hypothesis that the
Gnetales as a whole (Ephedra, Gnetum, and Welwitschia) are monophyletic
and are the closest extant relatives of angiosperms. In addition, these analyses
indicate that Ephedra is basal within the Gnetales and has retained a number
of primitive reproductive features (particulary when compared with Gnetum
and Welwitschia) that are shared in common with cycads, conifers, and
Ginkgo (Fig. 3).
As a consequence of the critical phylogenetic position of the Gnetales, an
understanding of the reproductive biology of Ephedra, Gnetum, and
Welwitschia is central to the interpretation of the evolution of uniquely derived
(apomorphic) features of flowering plants. By comparing reproduction in
angiosperms and Gnetales, it is possible to formulate explicit hypotheses of
the reproductive characteristics that defined the common ancestors of these
two groups of seed plants; as well as examine the further transformation of
Эндосперм, перисперм 261
MM)
5
■3
q>
■c
.a.
Ul
a
sot
ra>
с
<
Fig. 3. Phylogeny of extant seed plants based upon recent phylogenetic analyses.
Gnetales is the most closely related taxon to angiosperms; cycads, conifers, and
Ginkgo are less closely related to angiosperms, although their unterrelationships
are insolved. Ephedra is typically a xerophytic shrub and is native to the deserts
of southwestern North America, South America, northern Africa, Europe, and
Asia (Martens, 1971). Gnetum, most commonly a tropical rain forest liana with
broad leaves that strongly resemble those of many dicotyledonous plants, has
centres of distribution in equatorial South America, western Africa, southern
Asia, and a number of Pacific islands such as the Philippines and New Guinea
(Maheshwari, Vasil, 1961). Welwitschia, which is monotypic, is a most unusual
inhabitant of the Namib Desert in southern Africa. At maturity, the highly
determinate vegetative shoot of the sporophyte produces two large straplike leaves
that continue to grow from an intercalary meristem and sprawl across the desert
floor.
these characters in the descendant clades. Based upon this approach, the
historical/evolutionary events that led to the establishment of reproductive
features that define flowering plants can be identified and reconstructed. As
will be seen, a phylogenetically based interpretation of comparative data on
the fertilization biology of members of Gnetales leads to a significant revision
of implicit and explicit hypotheses governing the origin of double fertilization
and endosperm, the evolution of patterns of embryogenesis over the course of
seed plant history, and finally, the pattern of endosperm development that is
likely to have characterized the earliest flowering plants.
Double fertilization in Ephedra and the evolutionary origin of
endosperm. During the past 5 years, considerable progress has been made
toward the elucidation of the evolutionary origin of endosperm (Donoghue,
1989; Friedman, 1990a, b, 1991, 1992a, b; Donoghue, Scheiner, 1992).
The recent documentation of a regular process of double fertilization in
two species of Ephedra (Friedman, 1990a, 1991, 1992b) has provided
the requisite comparative and developmental information to construct an
262
Семя
explicit hypothesis concerning the nature of the fertilization process in the
common ancestor of angiosperms and Gnetales. This, in turn, has led to
the formulation of a precise and detailed theory of the early history of
double fertilization and the evolutionary establishment of endosperm.
Double fertilization in Ephedra. The female gametophyte of Ephedra
is fundamentally similar to that of most nonflowering seed plants (cycads,
conifers, and Ginkgo). The female gametophyte is monosporic, undergoes
free nuclear development followed by cellularization, and eventually matures
into a large (compared with the embryo sac of flowering plants) multicellular
structure with two or more archegonia (Martens, 1971). At the time of
fertilization, each egg cell is binucleate (Friedman, 1990a, 1992a, b) and
contains an egg nucleus and a ventral canal nucleus.
In E. nevadensis and E. trifurca, two sperm from a single pollen tube
regularly fertilize the egg nucleus and sister nucleus of the egg nucleus
(ventral canal nucleus) within an archegonium (Friedman, 1990a, b,
1991). One sperm nucleus migrates to the egg nucleus, which invaginates
as contact is established between two gamete nuclei. These two conjoined
nuclei begin a coordinated process of migration toward the base (chalasal
end) of the egg cell. Concurrent with the first fertilization event, a process
of fusion is initiated between the ventral canal nucleus and the second
sperm nucleus. This second fertilization event is highly similar to the
fertilization of the egg nucleus by the first sperm nucleus, and these two
nuclei also undertake a chalasal migration within the former egg cell
(Friedman, 1990a, b, 1991, 1992b).
At the end of the double fertilization process in Ephedra, two diploid
nuclei reside within the cytoplasm of the former egg cell (Fig. 7). The
«normal» zygote nucleus, derived from the fertilization of the egg nucleus
by a sperm nucleus, is situated at the base of the former egg cefl. А
second nucleus, formed from the fusion of the ventral canal nucleus and
a second sperm nucleus, resides within the micropylar half of the former
egg cell (Friedman, 1990b, 1991). Microspectrophotometric data indicate
that the product of the second fertilization event in E. trifurca is diploid
and contains a 4C quantity of DNA, as does the fusion product of the
egg nucleus and first sperm nucleus (Friedman, 1991). In addition, the
second fertilization product is genetically identical to the normal zygote
nucleus since each of the sperm nuclei that participate in double fertilization
are mitotic relatives, as are the egg and ventral canal nucleus. Most
significantly, the fates of the first and second fertilization products in Ephedra
are identical: each diploid nucleus will ultimately form embryos (Friedman,
1992b; also see section below on embryogeny in Ephedra). Based upon
the high degree of similarity with respect to fusion behavior, the cell cycle,
and developmental fate (i. е., the production of embryos) of the two
fertilization events in E. trifurca, the second fertilization product can be
considered a «supernumerary zygote nucleus».
Although double fertilization is a regular feature of reproduction in E.
nevadensis, and E. trifurca (and possibly in E. campylopoda (Herzfeld, 1922),
Эндосперм, перисперм
263
E. foliata (Khan, 1943), and E. distachya (Moussel, 1978) — see
Friedman, 1992b for a complete review of earlier studies in which preliminary
evidence of double fertilization events in Epherdra was presented), it is clear
that an embryo-nourishing endosperm does not result from the second fertilization
event. As is the case with basal seed plants (cycads, conifers and Ginkgo),
the large multicellular female gametophyte of Ephedra functions to nourish
developing embryos.
Comparative and evolutionary implication of double fertilization in
Ephedra. The discovery that a regular second event in Ephedra yields a
supernumerary zygote that produces embryos has profound implications for
the understanding of the evolutionary origin of endosperm. Although it may
not be possible to determine whether the processes of double fertilization
in Ephedra and angiosperms represent evolutionary homologies or are ho-
moplasious, many aspects of double fertilization in angiosperms and Ephedra
are congruent with the concept that a basic process of double fertilization
evolved in a common ancestor of Gnetales and angiosperms and hence
predates the origin of flowering plants (Friedman, 1990a).
The vast majority of flowering plants posses a monosporic («Polygonum
type») embryo sac which is considered to be primitive (plesiomorphic) among
flowering plants (Stebbins, 1974), compared with bisporic or tetrasporic embryo
sacs that are found among evolutionary derived taxa. In angiosperms with
monosporic embryo sacs, one of the two polar nuclei with which the second sperm
nucleus fuses is the sister nucleus of the egg nucleus (Thomas, 1907; Brink,
Cooper, 1947; Huang, Russel, 1992). In Ephedra, the ventral canal nucleus
is also the sister nucleus of the egg nucleus. In both groups of seed plants,
the two sperms that engage in double» fertilization are typically derived from .
a single pollen tube (Friedman, 1992b; Mogensen, 1992). Thus, double
fertilization in basal angiosperms and Ephedra involves similar sets of male and
female nuclei.
The key difference between Ephedra and angiosperms, with respect to
the nuclei involved in the second fertilization event, is that in flowering
plants, an additional female nucleus, the chalazal polar nucleus, which is
not a sister nucleus of the egg nucleus (Thomas, 1907; Brink, Cooper,
1947; Huang, Russel, 1992), participates in the second fertilization event
and through its involvement results in a typically triploid fusion product.
Among angiosperms with a monosporic embryo sacs, both polar nuclei are
genetically identical to the egg (this contrasts with bisporic and tetrasporic
embryo sacs, in which polar nuclei may differ genetically from the egg).
In Ephedra, the ventral canal nucleus is genetically identical to the egg
nucleus. Although endosperm in angiosperms with a monosporic embryo sac
and the supernumerary zygote in Ephedra differ with respect to ploidy, the
second fertilization product in each of these groups of seed plants is identical
(at the level of alleles) to the «normal» zygote resulting from the first
fertilization event.
The discovery that the second fertilization product in E. trifurca (and
probably other species of Ephedra — see Friedman, 1992a for reiew of
264
Семя
earlier studies) regulary produces a supernumerary zygote that yields
additional embryos (Friedman, 1992b) provides strong support for the hypothesis
of Sargant (1900) that endosperm represents a highly modified evolutionary
derivative of a supernumerary embryo. From this perspective, it is likely that
the original manifestation of double fertilization in seed plants involved the
fusion of a second sperm nucleus with a fecundible ventral canal nucleus and
resulted in the production of a supernumerary diploid zygote with the potential
to develop into an embryo. This stage of the evolutionary innovation would
have been established in a common ancestor of Ephedra and flowering plants
(Fig. 4). Within the context of this evolutionary hypothesis, Ephedra has
maintained a generally unchanged expression of the original double fertilization process;
whereas significant modifications to this process have occured in the angiosperm
lineage (i. е., triploidy and the development of a nonembryo product from the
second fertilization event). It is not known if double fertilization occurs in Gnetum
or Welwitschia (Friedman, 1992b).
A further element of Sargant's (1900) original hypothesis of the origin of
endosperm involved the proposition that the developmental transformation of a
supernumerary embryo (in the ancestors of angiosperms) into endosperm occured
as a consequence of the addition of a second female nucleus to the second
fertilization event. While there is merit to this proposition, it is currently not
possible to resolve whether endosperm (in the physiological and developmental
sense) evolved prior to or after the addition of a second female nucleus to
yield a triploid second fertilization product (Queller, 1983; Friedman, 1992b).
Thus,' endosperm may originally have been diploid if the addition of a third
nucleus to the second fertilization event occured after the transformation of an
embryo into an embryo-nourishing structure (Fig. 4).
The hypothesized evolution of a regular process of fusion of a second
sperm nucleus with the ventral canal nucleus to produce a supernumerary
zygote in the common ancestor of angiosperms and Gnetales was likely to
have been dependent on a number of specific developmental preconditions.
The presence of a ventral canal nucleus at the time of fertilization in
Ephedra is unusual among extant nonflowering seed plants (Friedman,
1992a). In most cycads, conifers, and Ginkgo, the venrtal canal nucleus
degenerates between the time of its formation and the entry of sperm into
the egg cell (see Friedman, 1992a for some exceptions). Persistence of
the ventral canal nucleus in Ephedra is likely to be a consequence of the
extremely short period of time (less than 24 hours (Land, 1907; Moussel,
1983; Friedman, 1990b), compared with weeks or months in other non-
flowering seed plants) between the mitotic formation of the ventral canal nucleus
and egg nucleus, and fertilization (Donoghue, 1989; Friedman, 1990a; Do-
noghue, Scheiner, 1992). Compared with most other seed plants, angiosperms
and Gnetales may have led to the developmental maintenance of the ventral
canal nucleus through the time of fertilization (Fig. 4) (Donoghue, 1989;
Donoghue, Scheiner, 1992).
The evolution of a novel structure (endosperm in the physiological sense)
capable of nourishing the young developing embryo in flowering plants or their
Эндосперм, перисперм
265 |
ycada
о
inkgo;
о
i .
!»
lilt
Fig. .4. Events during the evolution of double fertilization and endosperm. Character
advance 1 is the evolution of an abberation of the time interval between
pollination and fertilization; character advance 2, the evolution of persistence of
the sister nucleus of the egg nucleus through the time of fertilization; character
advance 3, the origin of double fertilization, in which the second fertilization
event occurs between the sister nucleus of the egg nucleus and a sperm nucleus,
and results in the production of a supernumerary zygote/embryo. Character
advance 4-6 are unique features of angiosperms: addition of a second female
nucleus to the second fertilization event to produce a triploid product;
modification of development of the second fertilization product from an embryo
to endosperm; and reduction of the female gametophyte to the embryo sac form.
The order in which character advances 4-6 evolved is uncertain.
immediate ancestors is likely initially to have created an intermediate condition
in which both the female gametophyte and endosperm participated in the
nourishment of the embryo (Fig. 5) (Queller, 1983, 1989).
This historical analysis leads to the prediction that the ovule of the
immediate ancestors of the angiosperms possesed a female gametophyte
that was still involved in the nourishment of the embryo, as well as a
primitive endosperm. It will be interesting to see if future fossil discoveries
of the immediate ancestors of flowering plants (members of the «stem
angiophytes» sensu — Doyle, Donoghue, 1993) yield information with
respect to the embryo sac form. Potential evolutionary intermediates might
include fossil seeds that contain embryos associated with two separate
embryo-nourishing structures.
With the progressive evolution of an increasingly important role for
endosperm in the nourishment and development of the embryo, the female
gametophyte of the immediate ancestor of angiosperms was ultimately freed
from the developmental and physiological obligations (constraints) previosly
associated with the nourishment of the embryo. This, in turn, made possible
266
Семя
the reduction of the female gametophyte (which in the common ancestor
of Cnetales and angiosperms was and essential to the nourishment of the
developing embryo) to the embryo sac form, now characteristic of all
flowering plants (Friedman, 1992b).
Finally, the current support for the hypothesis that endosperm evolved
from a second fertilization event that initially yielded a supernumerary embryo
leads to the inevitable conclusion that endosperm can no longer be considering
a «tissue» in the classical sense of the term. Rather, endosperm must be
seen as a highly modified evolutionary homologue of an embryo; or in
other words, as an organism, a view first espoused by Sargant (1900)
and Thomas (1907). The logical extension of the discovery of the organismal
status of endosperm is that the life cycle of angiosperms can be viewed
as triphasic and comprised of sporophyte, male and female gametophyte,
and endosperm generations.
The evolution of patterns of early embryogenesis in seed plants and
its bearing on the developmental nature of primitive endosperm. Although
much of the diversity and systematic distribution of endosperm developmental
patterns has been known for the greater part of this century, the question
of where free nuclear or ab initio cellular endosperm characterised the earliest
flowering plants has generated considerable diversity of opinion (Maheshwari,
1950; Stebbins, 1974; Sporne, 1980; Takhtajan, 1991). The evolutionary
derivation of endosperm from a supernumerary embryo (resulting from a
second fertilization event) in the ancestors of angiosperms provides the
requisite link between patterns of embryo and endosperm development. If
endosperm evolved from a supernumerary embryo, it is reasonable to infer that
the pattern of early embryo development exhibited by the common ancestor
of Cnetales and angiosperms (in which double fertilization and production of
supernumerary embryo took place) is also likely to have characterized the
endosperm of the first flowering plants.
Early embryogeny in extant seed plants. Extant basal seed plants,
with the exception of Sequoia sempervirens (Buchholz, 1939) all exhibit
a pattern of the free nuclear embryogeny. Following fertilization in cycads,
Ginkgo, and conifers, the zygote nucleus enters into a series of free nuclear
mitotic divisions to produce free nuclei that lie within the cytoplasm of the
former egg cell. In cycads, as many as 1,000 proembryonal nuclei may form
(Chamberlain, 1935), while among conifers, the number of free nuclei is more
limited and may be as few as four (Singh, 1978). Free nuclear development
of the proembryo in cycads, conifers, and Ginkgo is followed by a process
of cellularisation within the former egg cell. Cell walls are initiated between
the zygotically derived nuclei, and a single multicellular proembryo is organized
(Fig. 8). This critical stage of embryo development represents a highly
coordinated aggregation of proembryo nuclei and yields a single multicellular
sporophyte. Following cellularization of the proembryo, elongation of a multicellular
suspensor pushes the embryo proper into the nutritive tissues of the large
female gametophyte, where further embryo development occurs.
Эндосперм, перисперм
267
FEMALE GAMETOPHYTE
plesiomorphic condition (basal seed plants)
EVOLUTIONARY ESTABLISHMENT OF DOUBLE FERTILIZATION
(TO PRODUCE SUPERNUMERARY EMBRYO)
i
MODIFICATION OF SUPERNUMERARY EMBRYO TO NOURISH NORMAL EMBRYO
i
FEMALE GAMETOPHYTE + SECOND FERTILIZATION PRODUCT
intermediate condition (stem angiophytes)
i
COMPENSATORY AMPLIFICATION OF SECOND FERTILIZATION
PRODUCT (ENDOSPERM) AND REDUCTION OF FEMALE GAMETOPHYTE
TO EMBRYO SAC
i
ENDOSPERM
apomorphic condition (angiosperms)
Fig. 5. The evolution of maternal resource allocation patterns to embryos in seed plants.
Among basal seed plants (cycads, conifers, and Ginkgo), the female gametophyte
serves to nourish the young embryo. Following the evolutionary establishment of
double fertilization and the initial modification of the supernumerary embryo to
assist in the nourishment of the normal embryo, an intermediate condition is
predicted to have existed (but is not represented among extant seed plants), in
which both the female gametophyte and newly established endosperm participated
in the nourishment of the embryo. Finally, with the progressive elaboration of the
second fertilization product the embryonourishing role of the female gametophyte
is lost and the condition representative of angiosperms is established.
The free nuclear pattern of embryogeny displayed by primitive extant
seed plants stands in marked contrast to early embryo development among
all angiosperms (exept Paeonia, Stebbins, 1974) and Welwitschia, in which
formation of a zygote is followed by an entirely cellular development of
the proembryo. The traditional evolutionary interpretation has been that the
cellular embryogeny of angiosperms arose through the elimination of the
early free nuclear phase of embryogeny expressed in more primitive seed
plants (Fig. 6). In addition, most authors have concluded that the
establishment of cellular embryogeny in flowering plants or their ancestors
postdated the divergence of the angiosperm lineage from the common ancestor
of the angiosperms and Gnetales (see cladistic analyses of Crane, 1985a;
268
Семя
Doyle, Donoghue, 1986). This conclusion has been based on the proposition
that early embryogenesis in Ephedra is the free nuclear (Berridge, Sanday,
1907; Land, 1907; Martens, 1971; Stebbins, 1974; Crane, 1985a; Doyle,
Donoghue, 1986; Gifford, Foster, 1989), and that this free nuclear phase
is evolutionary and developmentally homologous with that of basal extant
seed plants (Fig. 6).
If early embryo development in Ephedra is free nuclear and homologous
with that of cycads, conifers, and Ginkgo, phylogenetic analysis indicates
that the common ancestors of angiosperms and Gnetales also retained a
free nuclear pattern of embryo development (Fig. 6). This would suggest
that the antecedent of endosperm (a supernumerary embryo in the common
ancestor of the Gnetales and angiosperms) displayed a free nuclear phase;
and that the earliest form of endosperm was also free nuclear in its
development. However, detalied developmental, comparative, and phylogeneti-
cally based analyses of embryogenesis in Ephedra and, more broadly within
the Gnetales, indicate that the pattern of early embryo development in
these enigmatic taxa, as well as the pattern of embryogeny that characterized
the common ancestors of angiosperms and Gnetales, are likely to have been
misinterpreted.
Early embryogeny in Ephedra. Shortly after the completion of sexual
fusion in Ephedra, each of the two fertilization products enters into mitosis
(Fig. 7) (Friedman, 1992b). The synchronous division of the normal
zygote nucleus results in the production of two sets of daughter nuclei.
One pair of nuclei (derived from the normal zygote nucleus) is positioned
within the apical half of the former egg cell. A second wave of mitotic
activity is initiated by each of the four nuclei within the former egg cell
to yield a total of eight nuclei. These nuclei are typically arranged in
two groups within the former egg cell cytoplasm: a basal set of four
nuclei derived from the normal zygote nucleus and an apical set of four
nuclei descendent from the second fertilization product of «supernumerary
zygote nucleus» (Fig. 7) (Friedman, 1992a, b).
Subsequent to the free nuclear proliferation of each of the two fertilization
products (zygotes) in Ephedra, elaborate arrays of microtubules (phragmoplasts)
form around each of the individual nuclei and cell walls are deposited (Land,
1907; Khan, 1943; Lehmann-Baerts, 1967; Moussel, 1977). Each spherical
cell wall separates a diploid nucleus and an associated region of cytoplasm
from the remainder of the former egg cell. As a consequence of this process
of cellularization, two sets of four unicellular/uninucleate proembryos are
formed following double fertilization in Ephedra. In E. foliata, more or
fewer than eight nuclei/proembryos have been reported to form within an
archegonium following fertilization (Khan, 1943), and this is likely to occur
in other species of Ephedra. Although most, if not all, of the unicellular
proembryos in Ephedra will undergo some further development, no more
than one embryo will ultimately survive during the maturation of the seed.
Following the establishment of two sets of four spherical unicellular/uninucleate
proembryos within an arhegonium, many to all of the proembryos initiate a
Эндосперм, перисперм 269
I 1
1 f
о 5
to
.с
Welwitsc
etum
6
•c
ft
F
V-
jiospe
с
<
I I free nuclear
ВЦ ab Initio cellular
Fig. 6. Traditional hypothesis of the evolution of early embryo development among seed
plants. Cycads, conifers, Ginkgo and Ephedra are considered to have free nuclear
development of the embryo. The cellular patterns of embryogeny in angiosperms
and Welwitschia are presumed to have evolved separately. Free nuclear embryogeny
is a shared derived character state (synapomorphy) of seed plants. The condition of
early embryo development in Gnetum is uncertain. Hatched lines indicate that
the character state is equivocal. The asterisk indicates that double fertilization
evolved prior to the establishment of a* pattern of cellular embryo development.
pattern of filamentous development (Berridge, Sanday, 1907; Land, 1907;
Khan, 1943; Lehmann-Baerts, 1967; , Moussel, 1977; Friedman, 1990b).
Filamentous growth is initiated either prior to (E. trifurca, Land, 1907) or
after (E. distachya, Berridge, Sanday, 1907 and Moussel, 1977; E. foliata,
Khan, 1943; E. nevadensis and E. trifurca, present report) mitosis of the
single nucleus of each proembryo takes place. Current observation of the first
cell division in E. trifurca and E. nevadensis indicate that a cell plate may
be initiated in conjunction with mitosis or cytokinesis may be delayed with
respect to mitosis (Land, 1907; Lehmann-Baerts, 1967; Moussel, 1977). In
the either case, free nuclear development, defined as successive mitotic division
without intervening cytokinesis (Chamberlain, 1935) does not occur during the
normal development of the individual proembryos of Ephedra.
The result of the first partioning event in each proembryo in Ephedra
is a two-celled proembryo. The basal cell will elongate considerably to
form a unicellular primary suspensor that forces the apical cell of the
proembryo into the nutritive tissue of the female gametophyte. The apical cell
will proliferate and form an embryo proper, as well as additional cells that
will comprise a secondary suspensor (Land, 1907; Khan, 1943; Lehmann-
Baerts, 1967; Moussel, 1977).
I
j 270 Семя
Fig. 7. Early embryogeny in Ephedra. Two diploid fertilization products result from
gametic fusion (A): a normal zygote (from the egg nucleus and first sperm
nucleus) and a supernumerary zygote (from the ventral canal nucleus and second
sperm nucleus). Each fertilization product divides mitotically to produce two free
nuclei (B), and these nuclei undergo an additional mitotic division to produce
two sets of four diploid nuclei ("clonal" zygote nuclei) (C). Each nucleus become
surrounded by a separate cell wall, and two sets of four unicellular/uninucleate
proembryos are formed (D). Each proembryo initiates a cellular pattern of
development with filamentous growth (E). NZ, normal zygote nucleus; SZ,
supernumerary zygote nucleus.
Evolutionary implications of embryogeny in Ephedra. Embryogeny in
Ephedra appears to follow a pattern that is typical of most basal nonflowering
seed planta: initial free nuclear development is succeeded by a process of
cellularization (Fig. 8). Indeed, plant morphologists have suggested that the
free nuclear phase following syngamy and production of a zygote in Ephedra
is equivalent to the free nuclear phase of embryogeny in primitive seed plants
(Martens, 1971; Gifford, Foster, 1989). However, comparative analysis
suggests that the formation of four free nuclei from each zygote nucleus in
Ephedra is neither developmentally nor evolutionary homologous to the free
nuclear stage of embryogeny found among basal seed plants.
Unlike cycads, conifers, and Ginkgo, in which cellularization of free
nuclei derived from a zygote nucleus yields a single multicellular embryo,
each of the free nuclei formed from a normal or supernumerary zygote
nucleus in Ephedra establishes a separate single-celled proembryo that serves
as the starting point for development of a potential sporophyte (Fig. 8)
(Friedman, 1992b). Thus, the four free nuclei derived from each zygote
in Ephedra cannot be viewed as constituent parts of a unitary organism,
Эндосперм, перисперм
271
ZYGOTE
2 NUCLEATE
STAGE
• в «
•• •
MULTINUCLEATE
STAGE
CELLULARIZATION OF PROEMBRY0NAL FREE
NUCLEI TO FORM A SINGLE SPOROPHYTE
«
«
e «
• •
e
• •
•w
1 MULTICELLULAR
PROEMBRYO
EMBRYO DEVELOPMENT IN EPHEDRA:
ZYGOTE
2 NUCLEATE
STAGE
9 Ф
4 NUCLEATE
STAGE
CELLULARIZATION OF ZYGOTCALLY DERIVED
FREE NUCLEI TO FORM FOUR INOVHXIAL
UNICELLULAR SPOROPHYTES
(•)(!)
4 unicellular
proembryos
Fig. 8. Comparison of embryo development in basal seed plants (cycads, conifers, and
Ginkgo) with postfertilization development in Ephedra. In basal seed plants, a
single zygote nucleus undergoes free njuclear development to yield a multinucleate
stage of proembryogeny. Cellularization follows, and a single aggregate
multinuclear proembryo is formed. In Ephedra, each zygote nucleus proliferates
into four free nuclei. However, cellularization of each of these «clonal» zygote
nuclei leads to the production of four individual unicellular proembryos.
as is the case following free nuclear development of the proembryo among
basal extant seed plants.
It has been suggested that the free nuclear phase of embryogeny in Ephedra
represents an extreme and precocious form of cleavage polyembryony (Gifford,
Foster, 1989). Alternatively, this free nuclear phase can be viewed as a novel
proliferation of a sexually formed zygote nucleus to yield four «clonal» zygote
nuclei that serve as the starting points for development of separate proembryos.
In either case, the mitotic proliferation of each zygote nucleus in Ephedra
appears to represent a uniquely derived (apomorphic) condition without parallel
among extant seed plants. This, in turn, suggests that the traditional concept
that Ephedra exhibits, and by inference, that the common ancestor of Gne-
tales and angiosperms exhibited, a free nuclear pattern of embryogeny must
be called into question (Fig. 6).
Additional support for the hypothesis that the common ancestor of Gne-
tales, and of Gnetales and angiosperms, did not display a free nuclear
pattern of early embryo development can be derived from a comparative
analysis of embryogenesis within the Gnetales. Embryogeny in Welwitschia
J272
Семя
has traditionally been characterised as cellular (Chamberlain, 1935; Martens,
1973; Crane, 1985a; Doyle, Donoghue, 1986; Gifford, Foster, 1989). It
has been assumed that the loss of free nuclear development, leading to
cellular embryogeny in Welwitschia, occured separately and in parallel with
the loss of this character in angiosperms or their immediate ancestors (Crane,
1985a; Doyle, Donoghue, 1986) (Fig. 6). However, when development
of the normal sexually formed zygote and early proembryo in Welwitschia
is carefully compared with that of each of the «clonal» zygotes and individual
unicellular proembryos of Ephedra, a new interpretation of the origin of
cellular embryogeny in seed plants emerges; one that is congruent with a
single origin of this character among seed plants.
In Welwitschia, following syngamy, a cell wall forms around the zygote
nucleus to produce a unicellular proembryo (only one proembryo forms from
a zygote) (Pearson, 1909; Martens, 1973). The proembryo initiates a
pattern of filamentous growth, and mitosis of a single zygote/proembryo
nucleus takes place shortly afterwards. Cell wall formation, to form a two-celled
proembryo is reported to be delayed with respect to the first mitosis (Pearson,
1909). However, free nuclear development is not expressed in the proembryo
of Welwitschia (Chamberlain, 1935). The apical cell of the two-celled proembryo
eventually produces an embryo proper and multicellular suspensor, while the
basal cell elongates and develops into a unicellular primary suspensor (Fig. 9)
(Martens, 1971, 1973).
The striking similarities between the initial development of the single
proembryo of Welwitschia and each of the multiple proembryos of
Ephedra reveal important points of developmental homology. In both
taxa, the starting point for development of an individual embryo is a
single-celled, uninucleate proembryo (Fig. 9). In the single proembryo
of Welwitschia and each of the multiple proembryos of Ephedra,
filamentous development leads to the formation of a two-celled stage
in which the basal cell will undergo further development into uni-cellular
primary suspensor, while the apical cell will produce a secondary
suspensor and embryo proper. The lack of a free nuclear stage of
development in the proembryo of Welwitschia and each of the multiple
proembryos of Ephedra again highlights the anomalous nature of mitotic
proliferation of each sexually formed zygote nucleus in Ephedra.
Although there have been a number of studies of fertilization and
early embryogeny in Gnetum, descriptions within and among species
vary considerably (Maheshwari, Vasil, 1961). At present, the pattern
of early embryo development in Gnetum cannot be resolved with
certainty (Crane, 1985a, b).
If the free nuclear proliferation of each zygote nucleus is unique
(apomorphic) to Ephedra and not developmentally or evolutionarily
homologous with the free nuclear pattern of embryogeny of basal seed
plants, phylogenetic analysis indicates that the common ancestor of
Gnetales, and by inference, the common ancestor of Gnetales and
angiosperms, had already attained a cellular embryogeny through the
G^O*
®®
--t---
=3 £ XN3inidon3A3a N1
-j m lNiOd snoocnowoH
IE
t
®
I
§
а
о
p
аз
цЩ
о
s
I
о
p
2-е
з о
a
a
щ о с 4)
™ ^ * и н щ
JS "5Ь >• о о
^ та ~ ~. (Л ~ St-1'-4 3
о •-
Ё H
41 —
О 3
>-i 1-е
a. 4i
2 n £ з
41— £-§ g^S-c
о S^g af."
n ff^-ч ьв S3 a-g
e „ .тз а S «•£ .й
v a3 S о ц § с
. м-з"ч b u-c э
a *j . <D <U Q. Q, Q.
ji > ^J a^.3
О Q.
~4
;•—. a-
tq с
с
•2 a °
41 О
> 3 О
HV.
V b «^Я
?-Q P С та
В в b- в
41 _Q
I,
ш
si
>»
-a
a
о
i»
о
a
з
с
41 </Г
41
О fe
ВО %
bc
О - ._
I-, 41 J>> _
•л ° - a£ g~S °
« .2 a « " h 2
се о
о
-О
С
се
■s-
~ -К
се
-с
Q.
14
- а-з э
а со -п
i- s s
§i^ a
v. О 41 41
ьГ 3 -С _С w ^.
■S.S " g S4-e в
- g се -Я
о « S о
41
№ о
41
£-«•
с JS
3 3
*1Л
cd из
(0
fit
о
з ^ *j
С 41. g
a
6 о
о
a
во
с
т
се «
^ "!л 41 =2
-•^ >^ 41 S «
4) 3 V *-% И
S £-9
>4 со
'I
-О м-1 ^ се
се
41
5 о
В
-а
а= 41 с
!^1
Й 1) 1) ^
.. 41
41
je се
о^^
се
41
CJ 41 41 —.
о) с -С "О
-3_3-с!
bj= « §13 *
■з .-а Т5 о .
се fe .Ь=3
м ?* се ^
II:
3'8«5
41
as
us о ее
(U О * J
•« се й
се о >, Ё 9-"^
о
§ «.2
0,[—" U
<л to
с
3^
-S 4)
41 « 41
«-в ?
■ - -з W)
.2 й n
ел
се 41
а о
Ё 3
о
3 <л
с з
п
2-1^11
а-3-5^
1 -о-д .н
з се с
; сз 41 э
41 £S
о
с се
22 «
ё_2
О. cj
a^o-^J
во
iZ
274
2 NUCLEATE
STAGE
•V •
_ 9 _ (SU-lLAIUZATlONOFPROEMeRtDMALFME
• »* NUCLEI TO РОЙМ A SINGLE SPOROPWTE
MULTINUCLEATE
STAGE
1 MULTICELLULAR
PROEMBRYO
EMBRYO DEVELOPMENT IN CYCAOS,
GINKGO AND CONIFERS
® -
1 UNICELLULAR
PROEMBRYO
EMBRYO DEVELOPMENT IN HYPOTHESIZED COMMON
ANCESTOR Of GNETALES AND ANGIOSPERMS
1 MULTICELLULAR
PROEMBRYO
/
«cote, г^п # # !(*)(•)
, 4 NUCLEATE , ...__,,.„
I cr.GE I 4UNKELLULAR
— — _ _ _ _ _ PROEMBRYOS
RE£ KJCUARAMPUnCADON
OFZVQOTENUCIEUS
(APOMGRPHTCF EPHEDRA)
EMBRYO DEVELOPMENT IN EPHEDRA
4 MULTICELLULAR
PROEMBRYOS
® -
lUNKELLULAR
PROEMBRYO
1 MULTICELLULAR
PROEMBRYO
EMBRYO DEVELOPMENT IN
ANGIOSPERMS AND WELWITSCHIA
Fig. 10. New hypothesis of the evolution of early embryo development among- seed
plants. Basal seed plants are characterized by a free nuclear pattern of
development from the zygote. Cellularization of the multiple proembryo nuclei
leads to a single multicellular proembryo. This pattern is found amoung cycads,
conifers, and Ginkgo. At some point prior to the divergence of the angiosperms
and their sister group, the free nuclear phase of proembryogeny was lost and
direct cellular development of a single unicellular proembryo was established in a
common ancestor of Gnetales and angiosperms. This pattern of development was
maintained in Welwitschia and angiosperms (and represents a shared derived
feature, or synapomorphy, of Gnetales and angiosperms). However, in Ephedra,
a modification of cellular development evolved that led to the production of
multiple unicellular proembryos from each fertilization event. According to this
hypothesis, the free nuclear phase in Ephedra is not developmentally or
evolutionarily homologous with the free nuclear phase of embryogeny among basal
seed plants.
loss of expression of initial free nuclear development of the proembryo
(Fig. 10, 11). According to this interpretation, Welwitschia has retained
a basically unchanged representation of the cellular pattern of embryo
development that characterized the common ancestor of Gnetales and
angiosperms (Fig. 10, 11). In Ephedra, the cellular part of early
Эндосперм, перисперм lib
I I free nuclear
i^H ab initio cellular
HB ephedroid type
Fig. 11. New hypothesis of the evolution of early embryo development among seed
plants. Free nuclear development is still considered to be a synapomorphy of seed
plants. At some point in the common ancestry of Gnetales and angiosperms,
cellular embryogeny evolved through the loss of an initial free nuclear phase of
development. In Ephedra, the cellular pattern of embryogeny has been modified
and a unique feature has arisen in which the zygote nucleus produces four
«clonal» free nuclei that serve as the starting points for individual cellular
embryos. Hence, in Ephedra, embryogeny represents a modified cellular pattern.
The asterisk indicates that double fertilization likely evolved after the
establishment of a pattern of cellular embryo development. The condition of early
embryo development in Gnetum is uncertain.
embryo development has also been preserved, but an additional process
expressed during postfertilization development has evolved: the free
nuclear proliferation of the zygote to yield multiple «clonal» zygote
nuclei that serve as the starting points for separate unicellular
proembryos (Fig. 10, 11).
As a consequence of this new interpretation of the evolution of patterns
of embryogeny, a previosly undetected synapomorphy (a shared derived
character state) of Gnetales and angiosperms is revealed: in Ephedra, Welwitschia
and angiosperms, individual proembryos are initiated as unicellular/uninucleate
structures (Fig. 10) and the free nuclear phase of development expressed
prior to the organization of a cellular proembryo in extant basal seed plants
(cycads, conifers, and Ginkgo) has been lost. Thus, the presence of cellular
embryogeny in Welwitschia and angiosperms can no longer be viewed as
the result of convergent evolution (i. е., as homoplasious) (Fig. 10, 11).
The developmental nature of primitive endosperm. The expression of
an essentially cellular development of proembryos from each of the two
fertilization products in Ephedra indicates that the developmental loss of
free nuclear embryogeny may predate the evolution of a process of double
18*
276 Семя
fertilization and subsequent production of a supernumerary embryo (Fig.
11). If the common ancestor of Gnetales and angiosperms displayed a cellular
pattern of embryogeny in each of its two fertilization products, this suggests
that the supernumerary embryo in this common ancestor, which later gave
rise to endosperm, was also characterized by a cellular pattern of
development. This, in turn, leads to the conclusion that the endosperm of the
earliest flowering plants inherited and expressed an ab initio cellular pattern
of development; just as the embryo in flowering plants is also cellular in
its development.
The hypothesis that the antecedent of endosperm and earliest subsequent
manifestation of endosperm were cellular in development leads to the
prediction that this pattern of development should also be characteristic of
extant basal flowering plants (barring any character reversals). Based upon
phylogenetic analysis of the relationships of basal flowering plants (Donoghue,
Doyle, 1989) and analysis of the distribution of endosperm developmental
patterns among angiosperms, Donoghue, Sheiner (1992) have observed that
ab initio cellular endosperm characterised many of the families of flowering
plants within the woody Magnoliales and other putatively basal groups of
flowering plants (Fig. 12). On the basis of this analysis, Donoghue, Sheiner
(1992) have suggested that ab initio cellular endosperm is ancestral among
angiosperms.
More recent phylogenetic analysis of basal flowering plants (Hamby,
Zimmer, 1922; Taylor, Hickey, 1992; Chase et al., 1993; Doyle et al.,
1994), derived from molecular and/or morphological data sets, have produced
Figs. 12-14. The pattern of development of the second fertilization product among
angiosperms and Gnetales within the context of several current hypotheses of
phylogenetic relationships of basal angiosperms. In Ephedra, the supernumerary
embryos from the second fertilization events are essentially cellular in
development (it is known whether Gnetum or Welwitschia undergo double
fertilization). Among angiosperms, the second fertilization product is endosperm.
As can be seen with each of these hypotheses of relationships, «putative» basal
angiosperms are likely to have inherited a cellular pattern of endosperm
development from their common ancestor with the Gnetales (in which a cellular
supernumerary embryo was produced following double fertilization). Coding of
endosperm characters is derived from Davis (1966), Cronquist (1981), Donoghue
and Doyle (1989) and Tobe et al. (1993). The pattern of endosperm development
is apparently not known for members of the Amborellaceae, Austrobaileyaceae,
Canellaceae, Eupomatiaceae, Himantandraceae, Idiospermaceae, Platanaceae and
Trimeniaceae. Stippled boxes below taxa denote groups in which more than one
pattern of endosperm development has been reported. If no box appears below a
taxon, the nature of development of the second fertilization product is not known. 12
- phylogenetic hypothesis of relationships of basal angiosperms («woody magnoliids»
primitive) from Donoghue and Doyle (1989). The interrelationships of Lauraceae,
Hernandiaceae, and Monimiaceae from Doyle et al. (1994). 13 - phylogenetic
hypothesis of relationships of basal angiosperms from Chase et al. (1993). 14 -
phylogenetic hypothesis of relationships of basal angiosperms («paleoherbs» primitive)
from Doyle et al. (1994), Nymphaeales = Nymphaeaceae and Cabombaceae,
«core» Magnoliales — Magnoliaceae, Degeneria, Myristicaceae, and Annonaceae,
«core» Laurales = Hortonia, Moniamiaceae, Atherospermataceae, Siparunaceae,
Gormotega, Hernandiaceae, and Lauraceae.
Эндосперм, перисперм
277
Fig. 12
Fig. 13
Fig. 14
{ \ free nuclear
ШШ ab Initio cellular
278
Семя
hypotheses of phylogenetic relationships that differ from those of Donoghue,
Doyle (1989). However, if the distribution of endosperm developmental
characters is analyzed within the context of any of the current alternative hypotheses
of angiosperm relationships, the putative basal flowering plant taxa within each
of these phylogenetic hypotheses also tend to exhibit ab initio cellular endosperm
(Fig. 13, 14). Thus, irrespective of which of the current major competing
hypotheses for basal angiosperms may ultimately be best supported, ab initio
cellular endosperm is likely to characterize basal taxa of flowering plants. These
findings are congruent with the concept that the antecedent of endosperm (a
supernumerary embryo) was cellular in its development and ultimately gave rise
to an endosperm characterized by ab initio cellular development (Fig. 15).
Finally, careful examination of the distribution of endosperm developmental
characters among putative basal flowering plants as (Fig. 12-14) well as
derived taxa indicates that free nuclear endosperm has had numerous
independent origins over the course of flowering plant evolutionary history. In
addition, reversions to an ab initio cellular endosperm have been frequent
(Stebbins, 1974; Cronquist, 1988; Kapil and Bhatnagar, 1991; Takhta-
jan, 1991).
Based upon a comparative developmental and phylogenetic analysis of
fertilization and embryogenesis in angiosperms and their closest extant
relatives, it is possible to construct an explicit historical hypothesis for the
origin and early evolution of double fertilization and endosperm. The
formulation of this historical record is derived entirely from and dependent
upon the determination of the reproductive features that are likely to have
characterized the common ancestors of angiosperms and their closest living
relatives, the Gnetales.
Comparative analysis of reproduction in basal angiosperms and Gnetales
indicates that the establishment of a process of double fertilization predates
the origin of flowering plants. A regular second fertilization event is likely
to have arisen as a consequence of the tendency of a second sperm nucleus
to fuse with the sister nucleus of the egg nucleus (ventral canal nucleus)
in the common ancestor of angiosperms and Gnetales. Initially, this second
fertilization event produced a supernumerary zygote that developed into a
diploid embryo genetically identical to the normal embryo derived from the
fusion of a sperm and egg nucleus. Subsequent to the divergence of
angiosperms and their sister lineage (which includes the Gnetales), development
of the supernumerary embryo was significantly modified in the immediate
ancestors of angiosperms. This led to a divergence in development and function
between the two fertilization products and the metamorphosis of the
supernumerary embryo into a embryo-nourishing structure, endosperm (Fig. 15). The
assumption of embryo-nourishing behaviour by endosperm in turn enabled the
loss of nutritive function by the female gametophyte, and its subsequent
reduction to an embryo sac form. It is still unclear whether the evolution
of triploidy in the second fertilization event predates or postdates the
development of a physiological endosperm.
CO
s
E
Ш
a.
со
О
5
z
<
<
CO
<
ffl
<o IE н
sis
occo
ССШ -J
CLO- Ш
_co>
zo ш
Ooo
B!g8
3C0 К
mS g
эш =
О^Э
°1Ч
iu
ЕЁ
£<
<to
o|
l£
oo
05
z
<
2
<
(A
<
cot
со?!
om %
surf
Ъ^ъ
SOD
§ =i
55a
"-РЬ
ш§5
ЬошЭ
эсз ч
Sg§
?5
§83
шош
с «3 <" ti
Р с
Ё й
а
о -й
3
с <и
<и
si-
V Ь. О и
<и _ с *й В й
с ?. й > »
О _й) (U (Ц у)
ьо'« У >»'
-а £ у
лив
и.ьо «2 g
-С
В
5 £"5 О
а <и о
о <и ~ ■
„ "So ti нг
S » ,, с Р « <u_2*.tJ
щ -а о > ь з
60'
2л
♦J О
о <и
.§1
ё « 8 .2
й
rs
С С л м ■*->
.s-> s
bo <u
Д Й — *^
.3 11
iflli
<и
во
280 Семя
From the perspective of the evolution of the life cycles of land plants,
the origin of endosperm from a supernumerary embryo indicates that
endosperm can no longer be viewed as «tissue». Rather, endosperm must be
seen in its evolutionary context as a highly modified embryo or organism,
as first espoused by Sargant in 1900.
Comparative analysis of embryogeny within Cnetales leads to a significant
revision of explicit and implicit assumptions about the evolution of embryogenic
patterns of development among seed plants. In particular, the current evidence
is most congruent with the concept that the common ancestor of the an-
giosperms and Gnetales, in which double fertilization had been established,
expressed a cellular pattern of embryogeny. If this hypothesis is correct,
the antecedent of endosperm (a supernumerary embryo) in this common
ancestor of Cnetales and angiosperms was also likely to have been ab initio
cellular in its development. This, in turn suggests that the endosperm of
the earliest flowering plants inherited and expressed a pattern of cellular
development.
Finally, it is hoped that as our understanding of plant phylogenetic
relationships continues to expand, comparative data will be carefully
reexamined and further analyses of the evolution of biological characters will
be undertaken. This approach has already yielded significant new insights
into the origin of land plants (Graham, 1993) and will ultimatelly allow
questions concerning the origin and early evolution of major monophyletic
groups of plants such as vascular plants, seed plants, and many of the
key monophyletic lineage among angiosperms to be addressed. It is clear
that the potential to solve some of the most intractable issues associated
with the evolution of defining biological features will only be realized through
an appreciation of the critical and interdependent roles of explicit
developmental, comparative and phylogenetically based analyses.
Berridge, Sanday, 1907; Bower, 1898; Brink, Cooper, 1947; Buchholz, 1939; Chamberlain,
1935; Chase et al., 1993; Crane, 1985a, b, 1988; Cronquist, 1981, 1988; Davis, 1966;
Donoghue, 1989; Donoghue, Doyle, 1989; Donoghue, Scheiner, 1992; Doyle, Donoghue,
1986, 1992, 1993; Doyle et al., 1994; Friedman, 1990a, b, 1991, 1992a, b; Gifford, Foster,
1989; Graham, 1993; Guignard, 1899; Hamby, Zimmer, 1992; Hasebe et al., 1992a, b;
Herzfeld, 1922; Hill, Crane, 1982; Huang, Russell, 1992; Jacob, 1982; Kapil, Bhatnagar,
1991; Khan, 1943; Land, 1907; Lehmann-Baerts, 1967; Loconte, Stevenson, 1990, 1991;
Maheshwari, Vasil, 1961; Martens, 1971, 1973; Martin, Dowd, 1986, 1991; Mogensen,
1992; Moussel, 1977, 1978, 1983; Nawaschin, 1898b; Pearson, 1909; Queller, 1983, 1989;
Sargant, 1900; Singh, 1978; Sporne, 1980; Stebbins, 1974; Strasburger, 1900; Takhtajan,
1991; Taylor, Hickey, 1992; Thomas, 1907; Tobe et al., 1993; Wunderlich, 1959; Zimmer
et al., 1989.
Эндосперм, перисперм
281
О ВОЗМОЖНОСТИ ВЫДЕЛЕНИЯ ТУБИФЛОРАЛЬНОГО ТИПА
РАЗВИТИЯ ЭНДОСПЕРМА
Тубифлоральный тип развития эндосперма характеризуется
заложением поперечной перегородки (по отношению к продольной оси
зародышевого мешка) при делении первичного ядра эндосперма, ранней
дифференциацией терминальных гаусториев; формированием собственно
эндосперма из производных только халазальной или только микропи-
лярной клеток двуклеточного эндосперма, или из производных обеих
клеток.
Этот тип развития эндосперма назван по аналогии с гелобиальным,
или Helobiae-типом (Камелина, 1991) в связи с тем, что именно
в семействах, входящих в группу, ранее называвшуюся Tubiflorae,
многие исследователи отмечали такое своеобразное развитие
эндосперма (Schnarf, 1917, 1929; Crete, 1951a, 1955a; Mauritzon, 1934,
1935; Krishna Iyengar, 1942, 1947).
В сформированном эндосперме различают центральную запасающую
ткань эндосперма, терминальные гаустории и, часто присутствующую,
специализированную ткань в виде колонки удлиненных клеток («шейка»
эндосперма), расположенную между центральной частью эндосперма и
микропилярным гаусторией (Mauritzon, .1935; Krishna Iyengar, 1940; Те-
рёхин, Никитичева, 1981). Иногда «шейка» эндосперма образуется и со
стороны халазального гаустория (Murthi, 1946; Никитичева, 1979 а,б).
Тубифлоральный тип развития эндосперма характерен в основном
для видов с однопокровным тенуинуцеллятным семязачатком, интегу-
ментальный тапетум в котором окружает лишь часть зародышевого
мешка. Микропилярная часть его центральной клетки иногда
становится гаусториеподобной уже к моменту оплодотворения, что особенно
четко выражено в семействах Escalloniaceae и Lamiaceae (Камелина,
1984; Камелина, Дзевалтовский, 1987). В сем. Campanulaceae
отмечено функционирование как гаусториев обоих концов центральной
клетки зародышевого мешка после оплодотворения, еще до деления
первичного ядра эндосперма (Шамров, Жинкина, 1994).
Терминальные гаустории значительно разрастаются в ходе эндоспер-
могенеза, число ядер и клеток в них варьирует. Гаусториальные клетки
метаболически очень активны, о чем свидетельствуют лопастные ядра
и наличие в цитоплазме активных митохондрий, ГЭР, пластид, дикти-
осом и большого числа рибосом. Наличие выростов клеточных оболочек
и растворение примыкающих к ним стенок клеток интегумента являются
показателями выполнения гаусториями функции передаточных клеток
(Bhandari, Sheel, 1992). Присутствие гаусториев отмечено и в зрелом
семени.
282
Семя
Различия в направлении заложения клеточных перегородок в
эндосперме начиная со второго деления, а также и в дифференциации клеток
позволили выделить в отдельных семействах ряд «типов» развития
эндосперма, которые теперь вполне могут быть рассмотрены как вариации
тубифлорального типа (например: Lamiaceae —Schnarf, 1917; Пол1щук,
Дзевалтовський, 1971; Campanulaceae — Rosen, 1932, 1949; Crete,
1951а; Subramanyam, 1951, 1970; Kapil, Vijayaraghavan,, 1962, 1965;
Коробова, Жинкина, 1987; Шамров, Жинкина, 1994; Acanthaceae —
Mauritzon, 1934; Mohan Ram, 1960 a,b; Kapil, Vijayaraghavan, 1962;
Bignoniaceae — Mauritzon, 1935; Scrophulariaceae — Yamazaki, 1957;
см. Целлюлярный тип развития эндосперма).
Тубифлоральный тип развития эндосперма встречается в 30
семействах двудольных и в одном семействе (Агасеае) однодольных
цветковых растений.
Еще Dahlgren (1980a), рассматривая распределение типов развития
эндосперма на своей филогенетической схеме цветковых растений,
отмечал, что целлюлярный тип эндоспермогенеза, присущий многим
семействам, расположенным в основании системы, не идентичен таковому
в семействах спайнолепестных, венчающих систему двудольных. Такой
целлюлярный с терминальными гаусториями эндосперм считают более
продвинутым. Palser (1951) на примере сем. Ericaceae предложила
называть этот тип эндоспермогенеза «гаусториальным», что не вполне
удачно, так как гаустории образуются во всех типах развития
эндосперма.
Тубифлоральный тип развития эндосперма довольно четко
отличается от целлюлярного и гелобиального типов. Признаки, отличающие
тубифлоральный тип развития от целлюлярного: постоянно поперечное
заложение перегородки в первичной клетке эндосперма; инициация
гаусториев и связанная с этим ранняя их дифференциация в первом
и/или во 2-3-ем последующих делениях; образование собственно
эндосперма только из производных первичной микропилярной или только
первичной халазальной клеток; наличие специфической ткани («шейки»
эндосперма).
От гелобиального тубифлоральный тип развития эндосперма
отличается иным назначением первичных микропилярной и халазальной
клеток: последняя может быть не только инициалью гаустория, но и при
ее поперечном делении — инициалями собственно эндосперма и
гаустория. Другие отличительные черты: первичная микропилярная клетка
не имеет ценоцитной стадии; микропилярный гаусторий, как правило,
активно развит. Кроме того, при гелобиальном типе развития, в
отличие от тубифлорального, первичная халазальная клетка не принимает
участия в формировании собственно эндосперма; специализированная
ткань не формируется.
Все вышеизложенное говорит о том, что тубифлоральный тип
развития эндосперма может расцениваться как один из основных типов
развития эндосперма, поскольку он характеризуется рядом признаков,
284
Семя
отличающих его от других типов. Кроме того, этот тип развития
эндосперма включает большое число вариаций, которые объединяются
общими закономерностями. Он довольно широко распространен среди
цветковых растений и приурочен в основном к продвинутым
семействам. Рис. 21.
Камелина, 1984, 1991, 1996; Камелина, Дзевалтовский, 1987; Коробова,
Жинкина, 1987; Никитичева, 1979а,б; Пол1щук, Дзевалтовський, 1971;
Терёхин, Никитичева, 1981; Шамров, Жинкина, 1994; Bhandari, Sheel, 1992;
Crete 1951a, 1955a; Dahlgren, 1980a; Kapil, Vijayaraghavan, 1962; Krishna
Iyengar, 1940, 1942, 1947; Mauritzon, 1934, 1935; Mohan Ram, 1960 a,b;
Murthi, 1946; Palser, 1951; Rosen, 1932, 1949; Schnarf, 1917, 1929; Yamazaki,
1957.
НОВЫЙ ПОДХОД К ТИПИЗАЦИИ ЭНДОСПЕРМА
В СВЯЗИ С ПРОБЛЕМОЙ ЕГО ЭВОЛЮЦИИ
Вопросы эволюционного становления типов развития эндосперма
цветковых растений до сих пор дискутируются (Maheshwari, 1950; Wun-
derlich, 1959; Модилевский, 1963; Поддубная-Арнольди, 1976; Кордюм,
1978; Bhatnagar, Sawhney, 1981; Vijayaraghavan, Pfabhabar, 1984;
Камелина, 1991; Терёхин, 1991). В качестве исходного типа одни авторы
(Schnarf, 1929; Sporne, 1954; Худяк, 1963; Поддубная-Арнольди, 1976;
Battaglia, 1980; Камелина, 1991) рассматривают нуклеарный, а другие
(Coulter, Chamberlain, 1903; Swamy, Ganapathy, 1957a, b; Friedman,
1994, 1995) — целлюлярный. Существует также точка зрения (Palm,
1915; Кордюм, 1978), что оба типа развития эндосперма возникли
одновременно (см. также Эндосперм). Практически отсутствуют работы, в
которых бы обсуждалось эволюционное значение гелобиального типа
развития эндосперма.
В большинстве существующих классификаций выделяют два основных
типа развития эндосперма у цветковых растений: нуклеарный
(характеризуется отсутствием цитокинеза с самых первых стадий) и целлюлярный
(каждое деление ядра в эндосперме сопровождается цитокинезом) (Sa-
muelsson, 1913; Schnarf, 1917,1929; Di Fulvio, 1983, 1985; Di Fulvio,
Cocucci, 1986). Гелобиальный эндосперм обычно рассматривается как
тип с признаками обоих вышеназванных типов — первое деление в
эндосперме приводит к образованию двух клеток, в которых (обычно
в микропилярной) затем происходят только свободноядерные деления
(Худяк, 1963; Поддубная-Арнольди, 1976; Кордюм, 1978;
Vijayaraghavan, Prabhakar, 1984). Ряд авторов увеличивают число типов до
четырех, выделяя промежуточный тип наряду с гелобиальный (Wun-
derlich, 1959) либо тубифлоральный тип наряду с целлюлярным
(Камелина, 1991).
Эндосперм, перисперм
285
При выделении различных иерархических категорий развития
эндосперма используют ряд критериев: 1) наличие клеточной
перегородки при делении первичной клетки эндосперма (целлюлярный и
нуклеарный типы), 2) положение первой и второй перегородок
(«типы», «формы», «вариации» в целлюлярном типе развития
эндосперма — Schnarf, 1917,1929; GliSid, 1936-1937; Rosen, 1949;
Верещагина, 1983), число ядер в халазальной клетке («формы» в гелоби-
альном типе развития эндосперма — Swamy, Parameswaran, 1963),
положение ядер («типы» и «подтипы» в нуклеарном типе развития
эндосперма — Di Fulvio, 1983) во время раннего эндоспермогенеза.
Samuelsson (1913) и Di Fulvio (1983) учитывали также степень участия
первичных микропилярной и халазальной клеток в образовании целлю-
лярного эндосперма.
В основу иерархической классификации способов развития
эндосперма нами положен онто-филогенетический подход, позволяющий не
только типизировать способы образования эндосперма, но и объяснить
их возникновение у цветковых растений. Мы разделяем представления
Терёхина (1994) относительно принципов, положенных им при
создании классификации типов развития зародышевого мешка, и считаем,
что классификация эндосперма должна учитывать как можно больше
различных признаков. Лишь тогда будут поняты возможные
направления эволюции эндосперма.
Предлагаемая классификация включает три ступени иерархии (типы,
подтипы, вариации), каждая из которых имеет свои критерии (см.
схему). Характерной особенностью развития эндосперма у значительного
числа видов цветковых растений является наличие двух первичных
клеток (микропилярной и халазальной), которые образуются при первом
делении в эндосперме. Исходя из этого, можно предположить, что в
основу выделения типов должна быть положена прежде всего
реализация морфогенетических возможностей первичных микропилярной и
халазальной клеток, выражающаяся в процессах цито- и кариокинеза. В
зависимости от доминирования этих процессов в период раннего
эндоспермогенеза предлагаем выделять два основных типа развития:1
целлюлярный (в обеих клетках процессы кариокинеза завершаются
процессами цитокинеза) и гелобиальный (в обеих клетках осуществляется
только кариокинез, иногда халазальная клетка остается одноядерной).
Каждый тип подразделяется на ряд подтипов по степени участия
микропилярной и халазальной клеток в построении эндосперма. В
целлюлярном типе: микропилярный с. халазальным гаусторием (эндосперм
формируется за счет микропилярной клетки, а халазальная клетка
функционирует как гаусторий — некоторые Icacinaceae, Fouquieriaceae, Sauru-
raceae, многие Nymphaeaceae), халазальный с микропилярный гаус-
Нуклеарный тип рассматривается как подтип гелобиального типа развития
эндосперма.
286
Иерархическая классификация типов развития эндосперма
у цветковых растений
Особенности развития эндосперма
Классификация
Тип
Подтип
Вариация
U
е
л
л
ю
л
я
Р
н
ы
и
г
е
л
о
б
и
а
л
ь
н
ы
й
микропилярнын
с халазальным
гаусторией
халазальныи
с микропилярньш
гаусторнем
Pedicularis
Pentaphragma
Prunella
микропилярньш
с гаусториями
Callitriche
микропилярно-
халазальный
без гаусториев
Annona
микропилярно-
халазальный
с гаусториями
Phyteuma
Scutellaria
унинуклеарная
микропилярньш
с халазальным
гаусторией
полинуклеар-
ная
нуклеарныи
Обозначение: производные первичной халазальнои клетки эндосперма отмечены точками, ядра
светлыми кружками; положение гаусториев показано клетками с темными ядрами.
Эндосперм, перисперм
287
торием (микропилярная клетка становится гаусторией, а халазальная
образует эндосперм — Loasaceae, некоторые Campanulaceae, Lamiaceae,
Scrophulariaeae), микропилярньш с микропилярньш и халазальным
гаусториями (эндосперм формируется из нижних производных
микропилярнои клетки, а халазальная клетка, как и верхние производные
микропилярнои клетки образуют терминальные гаустории — Buddlejaceae, Cras-
sulaceae, Gesneriaceae, Orobanchaceae, Pedaliaceae, Plantaginaceae, многие
Scroph.ulariace.ae, Verbenaceae), микропилярно-халазальный без
гаусториев (обе клетки принимают почти равное участие в образовании
эндосперма — Annonaceae, Aristolochiaceae, Ceratophyllaceae, Degeneriaceae, Mo-
nimiaceae, Nelumbonaceae, Sarraceniaceae, Winteraceae), микропилярно-
халазальный с микропилярньш и халазальным гаусториями (обе клетки
двуклеточного эндосперма формируют как эндосперм, так и терминальные
гаустории — Callitrichaceae, некоторые Campanulaceae, Lentibulariaceae,
Lobeliaceae, Stylidiaceae). В гелобиальном типе: микропилярньш
(собственно гелобиальный тип) (эндосперм формируется из микропилярнои
клетки, а халазальная трансформируется в гаусторий — Aponogetonaceae,
Asphodelaceae, Costaceae, Hydrocharitaceae, Limnocharitaceae, Phormiaceae,
Pontederiaceae, Potamogetonaceae, Ruppiaceae, Zannicheliaceae, некоторые
Cabombaceae, Nymphaeaceae ), нуклеарныи (выпадение первого деления,
приводящего к образованию микропилярнои и халазальнои клеток, и как
следствие этого осуществление лишь процесса кариокинеза во время
раннего эндоспермогенеза — Brassicaceae, Cactaceae, Cyperaceae, Erio-
caulaceae, Fabaceae, Gentianaceae, Poaceae, Restionaceae, Rosaceae, Zo-
steraceae).
В каждом подтипе целлюлярного типа можно выделить ряд вариаций
по положению перегородок во время второго деления в эндосперме.
Халазальныи с микропилярньш гаусторием подтип: Pedicularis-вариация —
халазальная клетка делится поперечно, в результате чего образуется
линейная триада клеток (включена Lavandula-вариация ). Pentaphragma-
вариация — деление в халазальнои клетке — продольное, а триада
клеток является обратно Т-образной. Микропилярньш с микропилярньш и
халазальным гаусториями подтип: Prunella-вариация — продольное
деление происходит только в микропилярнои клетке, образуется Т-образная
триада клеток (включены Alectorolophus-, Galeopsis-, Limosella-, Linaria-
и VeronicaVI-вариации). Callitriche-вариация: поперечное деление
происходит в микропилярнои клетке, возникает линейная триада клеток
(включены Incarvillea- и Stachys-варации). Микропилярно-халазальный
без гаусториев подтип: Annona-вариация — деление в обеих клетках
поперечное, образуется линейная тетрада клеток (включены Azorina-,
Даны приоритетные названия. Примеры таксонов с указанием авторов,
предложивших вариации, см. Целлюлярный тип развития эндосперма.
2
Здесь и далее вариации, взятые в скобки, рассматриваются как способы
образования гаусториев в эндосперме.
288
Семя
Ceratophyllum- и Ericaceae-вариации). Микропилярно-халазальный с
микропилярным и халазальным гаусториями подтип: Phyteuma-вариа-
ция — микропилярная клетка делится продольно, а халазальная —
поперечно, что приводит к формированию Т-образной тетрады клеток
(включена Isotoma-вариация). Scutellaria-вариация — деление в
обеих клетках продольное с образованием изобилатеральной тетрады
клеток (включены Catalpa-, Codonopsis-, Prolimosella-, Sphenoclea-, Ver-
bascam- и Veronica I-V-вариации).
В микропилярном подтипе гелобиального типа выделяются две
вариации по числу ядер в халазальнои клетке двуклеточного эндосперма:
унинуклеарная (= А-форма, по Swamy, Parameswaran, 1963; Аропо-
getonceae, Hydrocharitaceae, Limnocharitaceae, Potamogetonaceae, Rup-
piaceae, Zannicheliaceae, некоторые Cabombaceae, Nymphaeaceae) и
полинуклеарная (= В-Е-формы, по Swamy, Parameswaran, 1963; As-
phodelaceae, Costaceae, Phormiaceae, Pontederiaceae, Typhaceae).
Становление существующих способов образования эндосперма
происходило сопряженно с характером развития окружающих тканей
семязачатка и семени (Wunderlich, 1959; Никитичева, 1979; Erdelska,
1981; Vijayaraghavan, Prabhakar, 1984; Терёхин, 1991; Шамров,
1995). Наибольшее значение, вероятно, имели взаимосвязи эндосперма
с зародышем, с одной стороны, и с антиподами, с другой, а также
специфика транспорта питательных веществ в семязачатке и семени,
осуществляющегося через систему последовательно функционирующих
гаусториальных структур.
Эволюция эндосперма цветковых растений происходила, по-видимому,
в нескольких направлениях. Об этом свидетельствует, прежде всего,
распределение в них типов эндосперма. Для однодольных характерны
гелобиальный (34 семейства) и нуклеарный (30 семейств), а для
двудольных — нуклеарный (156 семейств) и целлюлярный (135 семейств)
типы развития эндосперма (Камелина, 1991). При этом у примитивных
однодольных эндосперм преимущественно гелобиальный, реже
нуклеарный, а у продвинутых — только нуклеарный тип эндосперма; у
примитивных двудольных наряду с целлюлярным эндоспермом широко
распространен нуклеарный эндосперм, тогда как у продвинутых таксонов —
либо нуклеарный, либо целлюлярный с гаусториями.
В качестве исходного типа, по нашему мнению, должен
рассматриваться эндосперм, развитие которого характеризовалось признаками
целлюлярного и гелобиального типов (наличие стадии двух клеток
после деления первичной клетки эндосперма, при этом в микропиляр-
ной клетке могли происходить сопряженно процессы карио- и
цитокинеза либо только кариокинеза). Об этом свидетельствует своеобразное
развитие эндосперма у представителей ряда семейств. В сем. Aqui-
foliaceae (эндосперм целлюлярного типа развития) после образования
двух клеток деления в них могут не сопровождаться цитокинезом
(Негг, 1961). Для представителей сем. Saxifragaceae характерен
эндосперм гелобиального типа развития, однако в некоторых случаях он
Эндосперм, перисперм
289
может быть целлюлярным либо нуклеарный (Коробова-Семенченко',
1977). У видов Impatiens (Balsaminaceae) в результате деления мик-
ропилярной клетки образуется ряд из трех клеток, верхняя из которых
преобразуется в микропилярный гаусторий, а в нижней и центральной
клетках происходят свободноядерные деления (Dahlgren, 1934).
Подобное обнаружено и в сем. Loganiaceae (Yamazaki, 1963). В сем.
Acanthaceae эндосперм, образующийся на базе центральной клетки,
может быть с самого начала либо клеточным (Acanthus, Peristrophe),
либо свободноядерным (Barleria, Ruellia) (Mohan Ram, 1962; Karls-
trom, 1974a, b; Madhavan, Gupta, 1982).
Наиболее близок к анцестральному типу развития целлюлярный эндосперм
(например, Fouqieriaceae, Saururaceae, многие Nymphaeaceae), который
образуется в результате делений микропилярной клетки двуклеточного
эндосперма, а халазальная клетка трансформируется в гаусторий (микропилярный
с халазальным гаусторией подтип). Такой способ формирования эндосперма,
характеризующийся высокой степенью специализации халазальнои клетки с
первых стадий развития, вероятно, оказался тупиковой линией эволюции.
Значительно большее эволюционное значение, по нашему мнению, имел
эндосперм, формирующийся за счет делений обеих клеток (первичных
микропилярной и халазальнои). Он характеризовался меньшей степенью тканевой
дифференциации, при этом отсутствовали такие специализированные
структуры, как гаустории (микропилярно-халазальный без гаусториев подтип) (Се-
ratophyllaceae, Monimiaceae, Nelumbonaceae, Winteraceae). Отсутствие
гаусториев в этом случае компенсируется формированием крупных, долго
сохраняющихся антипод (Nelumbonaceae — Батыгина и др., 1982), которые
участвуют в обеспечении питательными веществами растущего эндосперма на
первых стадиях развития. На основе этого в дальнейшем мог сформироваться
эндосперм с терминальными гаусториями. В гаустории трансформируются
либо верхние производные обеих клеток (микропилярно-халазальный с
микропилярным и халазальным гаусториями подтип — Campanulaceae, Len-
tibulariaceae, Lobeliaceae), либо один из них, халазальныи гаусторий, является
прямым продолжением одноименной клетки (микропилярный с
микропилярным и халазальным гаусториями подтип — Gesneriaceae, Orobanchaceae,
Plantaginaceae, Scrophulariaceae).
Эндосперм нуклеарного типа развития у двудольных предположительно
возник в результате постепенной редукции халазальнои клетки, функцию
которой стали выполнять другие структуры. Сначала происходило
формирование эндосперма без оформления специфических гаусториальных
структур, что характерно, например, для ряда таксонов в основании
системы цветковых растений (Casuarinaceae, Myricaceae, Myristicaceae, Ranuncu~
laceae, некоторые Hamamelidaceae, Papaveraceae и др.). Дальнейшая
эволюция была связана с гетероморфностью эндосперма и функционированием
его микропилярного и халазального районов как гаусториев. Более плотная
цитоплазма и скопления ядер, часто гипертрофированных и
полиплоидных, обнаруживаются либо только на халазальнои (y4izoaceae, Gentiana-
ceae, Polygonaceae, Rosaceae, Sapindaceae и др.), либо на обоих по-
-19-828
j 290 Семя
люсах (Brassicaceae, Caricaceae, Sterculiaceae и др.), при этом на
халазальном полюсе клеткообразование может не происходить, что
приводит затем к формированию многоядерного халазального гаустория
(Amaranthaceae, Elaeagnaceae, Fabaceae, Nyctaginaceae, Rhamnaceae).
Для представителей сем. Caryophyllaceae характерна, например, сеть
гаусториев по всей поверхности эндосперма (Rocen, 1927; Турсунов,
Савинова, 1979). Прослеживается корреляция между наличием
гаусториев в эндосперме нуклеарного типа развития и временем
существования антипод. У растений с долго сохраняющимися антиподами
эндосперм не образует гаусториев, тогда как в случае эфемерных антипод
гаустории, и прежде всего халазальный, формируются.
У однодольных на базе исходного типа в микропилярной, а иногда и ха-
лазальной клетке эндосперма стали происходить преимущественно процессы
кариокинеза (без цитокинеза). И, таким образом, первоначально
преимущественное развитие получил гелобиальный тип эндосперма. Дальнейшая
его эволюция происходила, вероятно, в направлении постепенной редукции
халазальной клетки двуклеточного эндосперма и становления нуклеарного
способа его развития. Об этом свидетельствует, например, наличие обоих
типов развития эндосперма в ряде семейств (Alismataceae, Amaryllidaceae,
Asparagaceae, Liliaceae, Melanthiaceae и др.). Гаусториальную функцию
халазальной клетки стал осуществлять весь халазальный полюс нуклеарного
эндосперма. В халазальной части эндосперма ряда таксонов (Iridaceae,
Juncaginaceae, Najadaceae, Zosteraceae и др.) отмечены более плотная
цитоплазма и скопления ядер, часто неправильной формы, иногда формируется
гаусторий (Arecaceae, Commelinaceae и др.). Возникновение нуклеарного
эндосперма у однодольных коррелирует с общей редукцией семязачатка
(уменьшением его массивности), становлением тенуинуцеллятности и
формированием двуслойных интегументов (Шамров, 1995).
Как считает ряд исследователей (Смирнов, 1982; Терёхин, 1991),
в процессе становления и дальнейшей эволюции эндосперма цветковых
растений тенденции к общей редукции эндосперма в зрелом семени в
целом не наблюдается. Она отмечается лишь у отдельных таксонов,
например, у паразитных растений, и может быть объяснена адаптацией
к специфическим условиям существования. Рис. 16—18, 21.
Батыгина и др., 1982; Верещагина, 1983; Камелина, 1991; Кордюм, 1978; Коробо-
ва-Семенченко, 1977; Модилевский, 1963; Никитичева, 19796,1981а, б, 1988; Ники-
тичева и др., 1981; Смирнов, 1982; Терёхин, 1991, 1994; Турсунов, Савинова, 1979;
Шамров, 1995; Asplund, 1920; Bhatnagar, Sawhney, 1981; Coulter, Chamberlain, 1903;
Dahlgren, 1934; Di Fulvio, 1983, 1985; Di Fulvio, Cocucci, 1986; Erdelska, 1981;
Friedman, 1994, 1995; Glisid, 1936-1937; Herr, 1961; Karlstrom, 1974a, b; Madhavan,
Gupta, 1982; Mohan Ram, 1962; Palm, 1915; Rocen, 1927; Rosen, 1949; Samuelsson,
1913; Schnarf, 1917, 1929; Swamy, 1974; Swamy, Ganapathy, 1957a, b; Swamy,
Krishnamurthy, 1973; Swamy, Parameswaran, 1963; Vijayaraghavan, 1964; Vijayarag-
havan, Prabhakar, 1984; Wunderlich, 1959; Yamazaki, 1963; Yoshida, 1957, 1959.
Эндосперм, перисперм
291
ПЕРИСПЕРМ (греч. peri — вокруг, около, sperma — семя) —
запасающая ткань семени, формирующаяся из нуцеллуса.
Термин «перисперм» был введен Juel (1907), хотя сама ткань была
описана первоначально Brown (1826) под названием «первичный
белок» (лат. albumen — белок, primarium — первичный).
Juel (1907) выделял 2 типа перисперма: настоящий (сохраняется в
зрелом семени) и транзиторный (расходуется в процессе развития).
В современной литературе перисперм обычно не подразделяют на два
типа и этим понятием обозначают лишь те случаи, когда запасающая
ткань нуцеллярного происхождения сохраняется в зрелом семени. По
нашему мнению, выделение настоящего и транзиторного типов
перисперма целесообразно, поскольку оно может быть использовано при
филогенетической оценке таксонов. Так, например, наличие
транзиторного перисперма у представителей сем. Ceratophyllaceae служит одним
из доказательств связи их с пор. Nymphaeales, характеризующимся
настоящим периспермом (Батыгина и др., 1991; Titova et al., 1993;
Шамров, 1995).
Настоящий перисперм характерен для таксонов с крассинуцеллятны-
ми семязачатками, у которых нуцеллус полностью или частично
сохраняется в зрелом семени. В клетках сохраняющегося нуцеллуса
откладываются запасные питательные вещества, чаще всего в виде
крахмала. У Hydrostemma longifolia (Barclayaceae) крахмальные зерна
сложные и состоят из множества мелких шестигранных гранул,
различающихся по размерам (Винтер, Батыгина, 1988). У видов Yucca
(Agavaceae) в перисперме обнаружены белки и липиды (Horner, Ar-
nott, 1966).
Настоящий перисперм обнаружен у представителей ряда порядков
как двудольных (Caryophyllales, Nymphaeales, Piperales), так и
однодольных {Zingiberales) растений, располагающихся в основании
филогенетической системы цветковых растений (см. «Сравнительная
эмбриология цветковых растений», 1981, 1983, 1990; «Сравнительная
анатомия семян», 1985, 1988, 1991).
Транзиторный перисперм был впервые описан в сем. Saxifragaceae
(Juel, 1907). В этом случае в нуцеллусе (семязачаток тоже является
крассинуцеллятным), сохраняющемся в семени в течение менее
продолжительного времени, также накапливается крахмал. У
представителей сем. Ceratophyllaceae аккумуляция крахмала в клетках нуцеллуса,
особенно в латеральной области, наблюдается еще задолго до его
полного разрушения. Это происходит на стадии глобулярного
зародыша. Крахмал исчезает лишь при переходе к стадии органогенеза
(Шамров, 1995).
Генезис нуцеллуса, трансформирующегося после оплодотворения в
перисперм, изучен недостаточно. Обычно констатируют лишь факт
наличия перисперма в семени. У видов таких семейств, как
Caryophyllaceae, Phytolaccaceae, Portulacaceae, перисперм возникает из клеток
так называемого «центрального тела» амфитропного и кампилотропного
19*
292
Семя
семязачатков — остатка нуцеллуса со стороны халазы, над которым
располагается изогнутый в виде дуги или подковы зародыш (Cooper,
1940; Kajale, 1954; Bocquet, 1959; Камелина, Яковлева, 1982; Тур-
сунов, 1986). У представителей семейств Barclayaceae и Nymphaeaceae
в перисперм преобразуется центральная часть нуцеллуса ортотропного
либо анатропного семязачатка (Khanna, 1964, 1967; Schneider, 1978;
Винтер, 1987). У Nuphar lutea в перисперм преобразуется не весь ну-
целлус семязачатка (Шамров, 1995). Нуцеллус является гетерогенным
образованием, характеризующимся наличием целого ряда
специализированных тканей, таких как париетальная ткань, постамент и подиум (см.
Нуцеллус, Т. 1). В процессе развития семени постамент и клетки мик-
ропилярной зоны нуцеллуса вокруг развивающегося эндосперма, в том
числе и париетальной ткани, разрушаются. Запасной крахмал в виде
крупных сложных крахмальных зерен откладывается в сохраняющихся
клетках латеральной области нуцеллуса. Свободными от крахмала
остаются подиум и идущие от него до зародыша 2-3 слоя узких субэпидермаль-
ных клеток.
Размеры и строение клеток перисперма в зрелом семени варьируют.
При анализе данных по наличию перисперма в семени выявляется
коррелятивная связь между степенью развития перисперма, с одной стороны,
и эндосперма и зародыша, с другой. Исходя из этого можно выделить 4
группы семян с периспермом. Первая группа — перисперм составляет
основную часть зрелого семени, эндосперма сравнительно мало, зародыш
небольших размеров (Barclayaceae, Cabombaceae, Cannaceae, Costaceae,
Marantaceae, Nymphaeaceae, Zingiberaceae, некоторые Saururaceae, Pipe-
raceae). Вторая группа — перисперм составляет половину объема
зрелого семени и окружает крупный изогнутый зародыш только со стороны
халазы, эндосперма относительно мало (Amaranthaceae, Caryophyllaceae,
Chenopodiaceae (подсем. Chenopodioideae), Basellaceae, Nyctaginaceae,
Phytolaccaceae, Portulacaceae, Stegnospermataceae). Третья группа —
перисперм в виде тонкого периферического слоя, зародыш небольших
размеров, эндосперм занимает основную часть зрелого семени (Heliconiaceae,
Musaceae). Четвертая группа — перисперм имеется только вокруг
верхушек семядолей, зародыш крупный, занимает почти весь объем зрелого
семени и в нем накапливаются запасные вещества, эндосперм в виде
тонкого слоя вокруг зародышевого корня (сем. Chenopodiaceae подсем.
Salsoloideae).
Ультраструктурные исследования клеток перисперма
немногочисленны. У представителей Yucca обнаружено, что наружные стенки клеток
периферического слоя перисперма являются довольно толстыми, поли-
сахаридными. Между клетками внутренних слоев перисперма имеются
плазмодесмы (Horner, Arnott, 1966). В цитоплазме клеток Silene alba
(Caryophyllaceae) обнаружены в большом количестве митохондрии,
свободные рибосомы и крупные пластиды с множеством крахмальных
зерен (Mohana Rao et al., 1988).
Эндосперм, перисперм
293;
Большинство авторов рассматривает наличие перисперма в семени
как примитивный признак. Рис. 22.
Батыгина и др., 1991; Бутник, 1991; Винтер, 1987; Винтер, Батыгина, 1988;
Камелина, 1990а, б; Камелина, Яковлева, 1982; Конычева, Кадырова, 1983;
Никитичева, 1981а, б; Турсунов, 1986; Турсунов, Матюнина, 1983; Шамров, 1995;
Bouharmont, 1963; Cooper, 1940, 1949; Gibbs, 1907; Goebel, 1923; Grootjen, 1983;
Horner, Arnott, 1966; Humphrey, 1896; Johnson, 1900a; Juel, 1907; Kajale, 1937,
1954; Khanna, 1964, 1967; McGahan, 1961; Mohana Rao et al., 1988; Panchak-
sharappa, 1962; Schneider, 1978; Titova et al., 1993; Tschirch, 1891.
I 294 Семя
I — ——.
ЧАСТЬ III — ЗАРОДЫШ
ОБЩЕЕ ПРЕДСТАВЛЕНИЕ
ЗАРОДЫШ — зачаток нового растения. Термин, по-видимому,
заимствован из зоологической литературы. В эволюционно-морфологическом
смысле зародыш — это зачаток нового поколения спорофита в
жизненном цикле высших растений. Следует иметь в виду, что в эмбриологии
семенных растений зародышем называют все стадии внутрисемейного
развития спорофита: от двуклеточного до сложного, многоклеточного,
дифференцированного на ткани и органы образования в зрелом семени.
В генетическом смысле зародыши покрытосеменных разделяются на
две основные категории: так называемые половые зародыши,
развивающиеся из зиготы или оплодотворенной синергиды.и партеногенети-
ческие зародыши, развивающиеся из неоплодотворенной яйцеклетки
(или синергиды). В агамоспермных семенах партеногенетические
зародыши могут содержать как гаплоидный набор хромосом (при так
называемых редуцированных формах гаметофитного апомиксиса), так и
диплоидный набор (при его нередуцированных формах). Подобные
зародышам образования, развивающиеся из соматических клеток нуцел-
луса или интегумента в случаях «адвентивной эмбрионии», а также
кливажной змбрионии, получили название эмбриоидов, а процесс их
образования называют эмбриоидогенией (см. Батыгина, 1993; Эмбрио-
ид; Эмбриоидогения).
Процесс формирования зародышей в течение развития семени
называют эмбриогенезом. Одна из наиболее характерных черт
эмбриогенеза — закономерный таксоноспецифичный морфогенез зародышей. Эта
особенность позволяет классифицировать разные способы (тип;/)
эмбриогенеза цветковых растений (Schnarf, 1929; Soueges, 1939; Johansen,
1950). Классификации способов (типов) эмбриогенеза обычно
основаны на последовательности и характере делений клеток (бластомеров)
в первый период развития зародышей, а также на морфогенетических
потенциях образующихся бластомеров (см. Принципы классификации
типов эмбриогенеза). При этом наибольшее значение исследователи
придают тем процессам эмбриогенеза, в результате которых проэмбрио
(так называют зародыш на начальных стадиях эмбриогенеза)
преобразуется в собственно зародыш («тело» зародыша) и подвесок (сус-
пензор).
Попытки придать классификациям типов эмбриогенеза
филогенетическое значение, по-видимому, нельзя признать удачными (Яковлев,
1958; Lebegue, 1966 и др.). С другой стороны, в границах отдельных
Зародыш
295
таксонов (например, на уровне семейств) можно в ряде случаев
проследить конкретный характер эволюционных преобразований
эмбриогенеза. Наиболее интересны в этом отношении таксоны ксенопаразитных
(Scrophulariaceae,Orobanchaceae) или микопаразитных (Pyrolaceae, Mo-
notropaceae, Burmanniaceae, Orchidaceae) растений (Терёхин, 1977).
Процесс эмбриогенеза разделяют обычно на несколько стадий,
отражающих разные аспекты морфогенеза: «проэмбриональную» (от зиготы
до дифференциации эмбриодермы), «глобулярную» (от дифференциации
эмбриодермы до инициации семядолей), «сердечковидную»
(объединяющую инициацию и первые этапы формирования семядолей), «тор-
педовидную» (отражающую процесс активного осевого роста зародыша
и формирования первичных структур гипокотиля и радикулы), стадию
«сформированного» зародыша (отражающую характер и степень
развития его структур в зрелом семени) (см. Эмбриогения).
Разнообразие форм и строения зародышей в зрелых семенах с
трудом поддается описанию или классификации (см.
Морфологическая классификация типов зародыша зрелого семени: критический
обзор основных систем). Особенности организации зародышей в
зрелых семенах (как это отметил еще Eames, 1961) довольно очевидным
образом связаны с их адаптацией к способу прорастания. Чтобы понять
это, достаточно сравнить две основных категории зародышей: зародыши
в семенах двудольных и однодольных растений или же зародыши в
зрелых семенах автотрофных и паразитных растений. У последних
зародыш в зрелом семени может состоять всего из 2-5 клеток (АПо-
tropa, Hypopitys), тогда как зародыши автотрофных растений
представляют собой многоклеточные, достаточно сложно организованные
образования.
Обычно зародыш автотрофного растения состоит из нескольких
основных органов, обеспечивающих развитие проростка: эпикотиля
(верхней части зародышевой оси, или надсемядольного колена),
располагающегося между основаниями семядолей; самих семядолей
(зачатков первых листьев, образующихся латерально на апикальной части
эмбриональной оси); гипокотиля (подсемядольного колена, нижней
части зародышевой оси), располагающегося между основанием
семядолей и радикулой,и собственно радикулы (зародышевого корня). В тех
случаях, когда эпикотиль достаточно развит и несет на себе зачатки
первых настоящих листьев, его называют почечкой (плюмулой).
У зародышей однодольных растений образуется лишь одна семядоля,
у основания которой формируется эпикотиль. Весьма интересными
особенностями организации обладают зародыши злаков. Так, базальная
область зародыша замещается колеоризой (защитной тканью), а
функции радикулы выполняет один из адвентивных корней. Этот и другие
адвентивные корни прорывают колеоризу при прорастании. У
зародышей злаков развивается также щиток, представляющий собой
разрастание части гипокотиля и выполняющий гаусториальную функцию по
отношению к эндосперму.
296
Семя
Эволюционные преобразования радикулы в запасающие или гаусто-
риальные структуры характерны и для других групп покрытосеменных.
Например, у орхидных (микопаразитных растений) базальная область
зародыша преобразована в гаусториально-запасающую ткань,
питающую зародыш при прорастании, в клетках которой происходит, в
сущности, переваривание внедрившихся в эту ткань гифов микоризных
грибов (Burgeff, 1936).
Преобразована в запасающую ткань базальная часть зародыша и у
некоторых представителей водных растений — Utricularia (Lenti-
bulariaceae) и у Ruppia (Ruppiaceae). У последнего роль радикулы
выполняет адвентивный корень, образующийся на стебле ниже плюмулы.
Для некоторых таксонов ксенопаразитных двудольных, живущих на
ветвях древесных растений,характерно преобразование радикулы в га-
усториальную структуру (Loranthaceae, Viscaceae). Элиминация
радикулы присуща другой группе стеблевых паразитов из сем. Lauraceae
(Cassytha) и Cuscutaceae (Cuscuta).
Сравнительный анализ зародышей современных покрытосеменных
не позволяет выявить у них какую-либо одну эволюционную
тенденцию (Терёхин, 1991). Мы не имеем оснований, например, для
вывода о том, что зародыши двудольных растений имеют тенденцию
к преобразованию в односемядольные зародыши или наоборот. Есть
примеры видов с односемядольными зародышами среди групп
двудольных растений или образование двух семядолей у зародышей
однодольных (см. Новая концепция происхождения зародыша
однодольных). Однако эти примеры не дают оснований для сколько-
нибудь широких обобщений.
Можно сказать, что эволюционные преобразования зародышей
покрытосеменных образуют картину их экологической (т. е. адаптивной)
радиации, что, вероятно, отражает и современный этап адаптивной
радиации цветковых растений в целом.
В истории семенных растений улавливаются два важных этапа
дивергентной эволюции. Один из них связан с периодом формирования
покрытосеменных, когда произошло резкое расхождение эмбриогенезов
голосеменных растений (процесс образования первичных и вторичных
зигот в связи с процессами конкурентного развития) и
покрытосеменных (зиготы которых гомологичны лишь первичным зиготам
голосеменных). Второй этап связан с периодом дивергенции цветковых растений
на двудольные и однодольные растения. В связи с вопросом о гомо-
логиях нельзя не вспомнить оригинальный эмбриогенез Paeonia
(Яковлев, 1951), который представляет собой, в сущности,
вторично-эволюционную попытку воспроизвести у покрытосеменных своеобразную
модель двустадийного эмбриогенеза голосеменных.
Таким образом, можно сделать два заключения.
1. В эволюционной истории семенных растений были два
очевидных этапа крупных дивергентных процессов.
Зародыш
297
2. Современный период эволюции покрытосеменных обнаруживает
множественные пути адаптивно-экологической радиации, при
отсутствии одной или немногих главных тенденций в эволюции зародышей.
Батыгина, 19936; Терёхин, 1977, 1991; Яковлев, 1951, 1958; Burgeff, 1936; Eames,
1961; Johansen, 1945, 1950; Lebegue, 1966; Schnarf, 1929; Soueges, 1939b.
ЭМБРИОГЕНИЯ (греч. embruon^ — внутриутробный плод, зародыш,
и фр. genie — свойство, совокупность черт) — раздел эмбриологии
растений, описывающий закономерности развития зародыша.
Термин предложил Treub (1879). Soueges (1935) определил эмбри-
огению как науку о развитии зародыша. Johansen (1950) рассматривал
эмбриогению как раздел общей эмбриологии, изучающий
кинематические (греч. kinematos — движение) аспекты, т. е. последовательность
стадий в развитии зародыша.
На основании изучения развития зародыша у большого числа
цветковых растений установлен ряд эмбриогенетических законов. Для их
отражения предложено использовать эмбриогенетические формулы
(Soueges, 1922), которые достаточно точно показывают преемственность
между бластомерами (клетками проэмбрио), их число, расположение и
возможные функции. Определением степени проявления
эмбриогенетических законов у различных растений занимается специальная область
эмбриогении — эмбриономия (греч. embruon — зародыш и nomos —
закон). С учетом этих законов предложены эмбриономические типы
развития зародыша в классификации Soueges (1939b) (см.
Принципы классификации типов эмбриогенеза).
Эмбриогенетические законы.2 К основным законам развития
зародыша относятся: закон происхождения, закон чисел, закон расположения,
закон назначения (Soueges, 1937) и закон экономии (Johansen, 1950).
Закон происхождения. «Для каждого вида растений эмбриогения
позволяет очень точно выявить происхождение всех бластомеров
зародыша и установить связь между ними в пределах каждой
генерации».
Происхождение гистогенов устанавливается по результатам деления
зиготы и ее производных в течение первой-третьей генераций, затем
каждого бластомера восьмиклеточного проэмбрио (после третьей
генерации), квадрантов и октантов (после четвертой генерации). Soueges
En — в, bruo — растущий от санскритского bh.ru — расти, brussa — плод.
2
Законы приведены в оригинальной трактовке авторов.
«L'embryogenie permettant, dans une espece donne, d'etablier la lignee des
blastomeres, Ton peut, par rapport a l'un ou l'autre des termes de la lignee, definir tres
exactement, dans cette espece l'origine des tous les blastomeres» (Soueges, 1937, p. 50).
298
Семя
предложил назвать область эмбриогении, изучающую дифференциацию
гистогенов и происхождение различных органов зародыша,
эмбриогенезом (греч. етЪгиоп — зародыш и лат. genesis — происхождение)
в широком смысле слова, включая в него гаметогенез, зиготогенез и
собственно эмбриогенез. В отличие от него, Johansen (1950) включал
в содержание этого термина лишь собственно эмбриогенез. В
современной эмбриологической литературе термины эмбриогенез и эмбриоге-
ния часто используются как равнозначные.
Закон чисел. «Число бластомеров в генерациях варьирует у
разных видов и зависит от скорости их делений» . Это — закон
скорости делений бластомеров. Его можно выразить графически: на оси
абцисс — генерации, на оси ординат — число образующихся
бластомеров. Скорость делений клеток свидетельствует, по мнению Soueges, о
реализации конструктивных возможностей апикальной и базальной
клеток в построении зародыша. Так, если быстрее делится клетка са
(число ее дериватов во время первых генераций значительно больше
по сравнению с дериватами базальной клетки), то это часто связано с
тем, что она образует основные органы зародыша. В случае
формирования большей части зародыша из производных клетки cb наблюдается
обратная картина. Особенности деления клеток зародыша могут быть
использованы в сравнительно-эмбриологических исследованиях для
целей систематики и филогении. Однако их ценность не всегда может
быть значима,так как скорости делений клеток в разных генерациях
могут быть различными и на одних стадиях быстрее могут делиться
производные апикальной клетки, а на других — производные
базальной.
Закон расположения. «В ходе нормального развития зародыша
бластомеры образуются за счет делений, направления которых
строго детерминированы и занимают положение в соответствии с
той ролью, которую будут выполнять клетки. Область эмбриогении,
занимающаяся изучением расположения бластомеров в зародыше,
называется эмбриотектоникой (греч. embruon — зародыш и tektoneia —
наука об особенностях взаимного положения частей).
По мнению Soueges (1937), закон происхождения бластомеров
позволяет выявить их взаимосвязи во времени, в то время как закон
расположения — в пространстве. Существование закона
расположения хорошо прослеживается в ходе первых четырех генераций. Число
ярусов и число клеток в каждом из них подчиняется определенному
«Le nombre des blastomeres products aux different generations varie avec les especes
et depend de la difference de vitesse de la segmentation dans les blastomeres de meme
generation» (Soueges, 1937, p. 58).
2
«Au cours du developpement embryonnaire normal, les blastomeres se constituent par
divisions selon des directions bien determinees et viennent occuper des positions en rapport
avec le role qu'ils deivent jouer» (Soueges, 1937, p. 68).
Зародыш 299
правилу. «Число бластомеров любого яруса равно сумме бластомеров,
образующих все нижние ярусы». Число ярусов и их строение
определяется в различных направлениях: вертикальном (согласно оси
симметрии) и горизонтальном (перпендикулярно к ней). Наблюдаются и
исключения, когда в силу разных скоростей делений число образующихся
клеток в зародыше варьирует у разных таксонов.
Закон назначения. «В ходе нормального развития бластомеры
одного вида растений дают начало детерминированным и всегда
одним и тем же частям зародыша».1 Область эмбриогении,
занимающуюся выяснением конструктивной роли бластомеров в построении
зародыша, Soueges определил французским словом embryogenergie (греч.
embruon — зародыш, gennau — порожденный, ergon — работа), русский
эквивалент которого в литературе отсутствует. В зависимости от того,
во время какой генерации действует закон, он может иметь различную
степень проявления — от первой до четвертой.
На основании доли участия апикальной и базальной клеток в
построении зародыша Soueges (1937) предложил различать восходящую
(на базе клетки са) и нисходящую (на базе клетки cb) серии мегар-
хетипов, исходя из представлений о том, что в процессе эволюции доля
клетки са возрастала, а клетки cb падала (условные сокращения
гистогенов см. Проэмбрио).
Восходящая серия:
I. са = рсо
II. са = рсо + pvt
III. са = рсо + pvt + 1/2 phy
IV. са = рсо + pvt + phy + ice
V. са — рсо + pvt + phy + ice + iec
VI. са = рсо + pvt + phy + ice + iec + со
VII. са = рсо + pvt + phy + ice + iec + со + s (частично)
Нисходящая серия:
I. cb = pvt + phy + ice + iec + со + s
II. cb = phy + ice + iec + со + s
III. cb = 1/2 phy + ice + iec + со + s
IV. cb = iec + со + s
V. cb = со + s
VI. cb = s
VII. cb — s (частично)
«Les blastomeres d'une espece donnee, quand le developpement est normal, donnent
naissance a des parties bien determinees, et tojours les memes, du corps embryonnaire»
(Soueges, 1937, p. 79).
300
Семя
В дальнейшем (Soueges, 1939b) V и VI мегархетипы были
объединены, так как в обоих случаях клетка cb полностью или частично
принимает участие только в образовании подвеска.
Примеры растений, характеризующиеся этими особенностями развития
зародыша: I — многие однодольные, II — Malva, Muscari, Senecio, Urtica,
III — Chenopodium, Myosotis, Polygonum, Salix, IV — Cruciferae, Myo-
surus, Onagraceae, Plantaginaceae, Scrophulariaceae, V — Rubiaceae, So-
lanaceae, Umbelliferae, VI — Campanulaceae, Fabaceae, Caryophyllaceae,
Saxifragaceae.
Закон экономии. «Число клеток, образующих зародыш, не
больше, чем это абсолютно необходимо». Он был сформулирован Jonan-
sen (1950) на основе предложенных Haberlandt (1918) принципов
экономии материала и эффективности.
Soueges (1937), а в дальнейшем и Johansen (1950), из всех эмбрио-
генетических законов особое значение придавали закону происхождения,
поскольку у большинства цветковых растений развитие зародыша
характеризуется высокой степенью регулярности клеточных делений.
Soueges подчеркивал, что только при нормальном развитии из
определенных бластомеров возникают определенные части зародыша. Эти
закономерности дифференциации гистогенов и образование на их
основе определенных органов зародыша используются в настоящее время в
качестве очень точного контроля за развитием зародыша при изучении
генетических, физиологических, молекулярных и других аспектов
эмбриогенеза (Mtiller, 1963; Sheridan, Neuffer, 1982; Meinke, 1986, 1991a, b;
Laux, Jtirgens, 1994). Отклонения от нормального хода развития,
выражающиеся в ином порядке деления клеток зародыша, например у Ну~
pericum, могут привести к его гибели (Bugnicourt, 1983). Остановка в
развитии зародыша у ряда мутантных растений Arabidopsis thaliana,
Zea mays, Daucus carota связана с изменениями в экспрессии регуля-
торных генов, контролирующих процесс эмбриогенеза, и проявляется в
виде различных мутаций (Meinke, Sussex, 1979; Sheridan, Neuffer, 1980,
1982; Breton, Sung, 1982; Meinke, 1982,1985,1986,1991; Giuliano et al.,
1984; Schneider et al., 1989; De Jong et al., 1992).
Новый, так называемый динамический, подход к изучению
эмбриогенеза растений, был предложен исследователями, критически
относящимися к установленным законам эмбриогении. Было высказано
предположение, что в процессе развития имеется определенная пластичность
потенций клеток, которая может проявляться на сравнительно поздних
этапах — стадии глобулярного (Foster, 1949; Swamy, Padmanabhan,
1962) или сердечковидного (Lyndon, 1990) зародыша. У Capsella bur-
sa-pastoris и Arabidopsis thaliana вплоть до стадии позднего
глобулярного зародыша не наблюдаются ультраструктурные различия между его
«No more cells are produced by the embryo than are absolutely necessary» (Johansen,
1950, p. 97).
Зародыш
301
клетками, что свидетельствует, по мнению ряда авторов, о
недетерминированности клеток в отношении формирования определенных органов
зародыша (Schulz, Jensen, 1968a; Mansfield, Briarty, 1991; см. также
Ультраструктурные аспекты эмбриогенеза).
Эти идеи в определенной мере разделяет и Терёхин (1984, 1991),
который считает, что на средних стадиях эмбриогенеза законы бласто-
меризации, сформулированные Soueges, действуют уже не в точных
рамках этажей проэмбрио, а в виде морфогенетических зон с
определенными и четко различимыми потенциями. Исследование Vallade
(1989) двух моделей, характеризующихся, разными типами развития
зародыша (лептэмбриатный, у Petunia hybrida и пахиэмбриатный, у Vitis
vinifera), показало, что различия между ними касаются лишь
относительной скорости роста зародыша в период достижения клетками
минимального объема к началу отделения протодермы: у Petunia это
происходит раньше, через 150-200 митозов, а у Vitis — через 1000-1500.
Затем у обоих видов наступает процесс дедифференциации, приводящий
к возникновению эумеристематических клеток. Дальнейший органогенез
осуществляется в целом сходно на уровне морфогенных
(полуактивных) зон. Однако процесс органогенеза легче проследить в лептэмб-
риатном, более экономичном в энергетическом плане, типе.
Wardlow (1955,1963) как сторонник динамического подхода к
изучению зародыша рассматривал законы эмбриогении в свете лишь
данных описательной эмбриологии, а не причин эмбрионального развития.
Он полагал, что постепенное координированное развитие зародыша
обусловлено комплексом физиологических факторов, а также условиями
окружающей среды. Это положение было затем развито в ряде
исследований (Natesh,Rau,1984; Jegla, Sussex, 1989; Meinke, 1991; Raghavan,
Sharma, 1995). Meinke (1991) выделил ряд общих черт, характерных
для развития зародыша покрытосеменных растений: формирование
апикальных меристем, установление основных типов симметрии и
клеточной организации, переход от гетеротрофной зиготы к автотрофному
зародышу.
В ряде исследований было показано, что этап образования
гистогенов в самом начале развития зародыша очень важен, однако
специфика гистогенеза определяется общей стратегией развития
организма (Barlow, 1991, 1994; Барлоу, 1994). На примере Arabidopsis
thaliana было показано, что хорошо выраженные ярусы клеток в
проэмбрио не всегда точно дают строго определенные органы зрелого
зародыша. Границы клонов клеток могут смещаться (Laux, Jtirgens,
1994; Jtirgens, 1995). Сделан вывод о том, что окончательное
строение зародыша устанавливается за счет клеточных взаимодействий
во время развития и зависит от положения структур в зародыше
(Laux, Jtirgens, 1994; Jtirgens, 1995).
Развитию зародыша, как и онтогенезу в целом, свойственна
определенная периодичность. В нем имеется ряд стадий (фаз, периодов),
различающихся по морфогенетической характеристике, морфофизиологичес-
302
Семя
ким процессам, функциональной перестройке и продолжительности. В
связи с тем, что инициальной клеткой зародыша является зигота, ряд
авторов (Soueges, 1937; Яковлев, 1981; Mansfield, Briarty, 1991)
выделяют зиготный период в его развитии (см. Зигота). Яковлев (1981)
подразделяет весь процесс формирования зародыша на три крупных
периода: зиготный, проэмбриональный (предзародышевая фаза, по
Яковлеву, 1972), завершающийся образованием эмбриодермы и
характеризующийся постепенным нарастанием числа клеток при отсутствии
тканевой дифференциации, и эмбриональный (зародышевая фаза, по
Яковлеву, 1972), завершающийся образованием зрелого зародыша. Ба-
тыгина (1974, 1987) считает целесообразным выделить в развитии
зародыша два этапа, или две фазы: первичной дифференциации (блас-
томеризации) и органогенеза.
По мнению других авторов, предлагающих иное толкование терминов
«проэмбрио» и «зародыш», проэмбриональный период продолжается до
сердечковидной стадии, далее начинается эмбриональный период
(Soueges, 1921a, b; Jurgens, Mayer, 1994).
Во многих исследованиях при описании раннего развития зародыша
выделяют ряд следующих стадий: 1) зигота, 2) двуклеточный
проэмбрио, 3) четырехклеточный проэмбрио, 4) стадия квадрантов
(обычно восьмиклеточный проэмбрио), 5) стадия октантов (обычно шест-
надцатиклеточный проэмбрио). Дальнейшее развитие зародыша
описывают, исходя из морфологической характеристики, главным образом его
формы. Еще Schnarf (1929)- выделил три стадии: нитевидная (пред-
глобулярная — Meinke, 1986) — зародыш представлен в виде ряда
клеток; по данным Padmanabhan (1996), окончанием этой стадии
являются первые продольные деления в терминальных клетках;
глобулярная — за счет преимущественно продольных делений производных
апикальной клетки происходит увеличение размеров зародыша и он
принимает вид глобулы; сердечковидная — начинается органогенез, и
преимущественно за счет примордиев семядолей, возникающих в апикальной
части, зародыш становится сердечковидным. Некоторые авторы (Jurgens,
Mayer, 1994) выделяют между глобулярной и сердечковидной стадиями
треугольную (англ. triangular) стадию, которая характеризуется
уплощением апикальной части зародыша, без видимых признаков
органогенеза. На сердечковидной стадии развития в зародыше происходит
переход от радиальной симметрии к билатеральной (Wardlaw, 1955; Halperin,
1966; Juguet, 1973; Tykarska, 1979; Яковлев, 1981; Natesh, Rau, 1984;
Laux, Jurgens, 1994), который объясняли наличием в зародыше особых
градиентов (Wardlaw, 1955) либо определенных эндогенных факторов
(Halperin, 1966). Обнаружено, что переход от одного типа симметрии
к другому связан с полярным транспортом ауксинов, блокировка которого
ингибиторами может привести к образованию аберрантных зародышей
(Liu et al., 1993; Schmidt et al., 1994) (подробно см. Синкотилия).
Следует отметить, что указанные выше стадии (нитевидная, глобулярная,
треугольная, сердечковидная) исходно были выделены для зародыша
Зародыш 303
двудольных растений. По мнению ряда исследователей (Schnarf, 1929;
Soueges, 1939; Johansen, 1950; Guignard, 1974, 1975; Банникова и др.,
1991), различия между двудольными и однодольными заключаются
главным образом в том, что у двудольных в зародыше формируются две
семядоли, а у однодольных — одна семядоля. Ранние стадии развития
зародыша у двудольных и однодольных растений очень сходны.
Принципиально сходно происходят затем процессы гистогенеза и
органогенеза. В этой связи стадию, следующую за глобулярной, предлагают
называть одинаково для двудольных и однодольных растений — стадией
видимой морфологической дифференциации и инициального органогенеза
(Банникова и др., 1991). Следует отметить, что, по мнению Батыгиной
(1974, 1987), развитие зародыша однодольных (в частности злаков) и
большинства двудольных различается с самых первых этапов. Это
связано со становлением характерного дорзовентрального строения
проэмбрио и зрелого зародыша у злаков и ряда других представителей
однодольных (подробно см. Graminad-тип эмбриогенеза).
Для характеристики зародыша двудольных, в котором происходят
процессы органогенеза, после сердечковидной стадии выделяют еще ряд
стадий: обратно трапециевидная (разрастание зародыша происходит
главным образом в апикальной части), торпедовидная (семядоли
уплощены, при этом их длина составляет половину общей длины
зародыша), тростевидная (для изогнутых зародышей — изгибаются лишь
верхушки семядолей),обратно U-образная (для изогнутых зародышей;
изгиб захватывает основание семядолей и верхнюю часть гипокотиля, в
результате чего зародыш принимает вид дуги) (Rijven, 1952; Wardlaw,
1955; R aghavan, 1976; Natesh, Rau, 1984; Raghavan, Sharma, 1995). Для
злаков после стадии органогенеза выделяют еще ряд стадий, известных
как стадии «1-6» (они различаются разным числом листьев в почечке,
соответственно от 1 до 6 — Abbe, Stein, 1954; Sheridan, Neuffer, 1980;
Xi, Ye, 1994). Многие из перечисленных выше стадий используются не
только в эмбриологии, но и в физиологии, генетике и молекулярной
биологии, при изучении различных аспектов формирования зародыша.
Очень длительной стадией является глобулярная, во время которой
происходит гистогенез и подготовка к органогенезу. Внутри
глобулярной стадии выделяют ряд промежуточных стадий: ранняя (глобулярный
зародыш с эмбриодермой), средняя (зародыш во время гистогенеза)
и поздняя (зародыш перед началом органогенеза) (Meinke, Sussex,
1979; Meinke, 1985,1986; Mansfield, Briarty, 1991; Шамров.Никитичева,
1992; Шамров, Анисимова, 1993; Laux, Jurgens, 1994). Последняя
стадия в литературе обозначается еще как переходная фаза (Abbe, Stein,
1954), грушевидная (Haccius, 1972), глобулярно-сердечковидная стадия
(Meinke, 1991а), булавовидная стадия у злаков (Xi, Ye, 1994).
Для оценки сопряженности морфогенетических и морфофизиологи-
ческих процессов в развитии зародыша используют понятия
«критические периоды», «критические стадии», «критические точки»
(Batygina, Vasilyeva, 1981; Батыгина, Васильева, 1983; Vasilyeva et
304
Семя
al., 1987; Красников, 1989; Шамров, 1990, 1995; Shamrov, 1991;
Шамров, Никитичева, 1992; Морозова, 1993; Шамров, Анисимова,
1993). Термин «критические периоды» был введен для обозначения
периодов развития растений, наиболее чувствительных к
неблагоприятным условиям окружающей среды (Броунов, 1897). Затем он стал
использоваться в эмбриологии животных. Одни авторы (Stockard,
1921) считали, что критические периоды в развитии зародыша
характеризуются наибольшей скоростью роста, другие (Goldschmidt, 1938),
что они представляют собой «узловые точки» пересечения кривых
скоростей роста различных независимых реакций. Основные положения
теории критических периодов были сформулированы Светловым (1960,
1978): 1) развитие зародыша и его составных частей состоит из
небольшого числа этапов, каждый из которых начинается относительно
коротким критическим периодом, после чего происходят видимые
процессы развития (рост и дифференциация); 2) главным признаком,
характеризующим критические периоды, является высокая
чувствительность клеток зародышей к действию окружающих факторов (любое
воздействие среды на онтогенез, как внутренней — среды организма,
так и наружной среды), обусловленная пониженной регуляторной
деятельностью в эти периоды; 3) эмбриологический смысл критических
периодов заключается в том, что в течение их совершаются акты
детерминации процессов развития. Согласно представлениям Wareing,
Phillips (1978), последовательные стадии развития можно
рассматривать как процесс, при котором в различные критические точки времени
и пространства происходит переключение на альтернативные пути, а те
или иные части организма становятся «детерминированными» в
отношении их дальнейшей дифференциации. В аспекте теории критических
периодов отдельные моменты развития, по мнению Токина (1987),
можно рассматривать в связи с перестройкой интеграционных
механизмов, наступающей в определенные периоды в зародыше в целом и в
отдельных его частях. Необходимо подчеркнуть, что в эмбриологии
животных наряду с термином «критические периоды» используется
термин «периоды детерминации» (в основе понимания лежит ступенчатый
характер детерминации).
В эмбриогении растений при описании эмбриональных структур
чаще всего употребляется понятие «стадия развития». Поэтому отрезки
времени, характеризующиеся сменой структурно-функциональных
характеристик в развитии зародыша и окружающих тканей семени и
плода, предлагают называть «критическими стадиями». В основу их
выделения положены морфогенетические и морфофизиологические
корреляции в развитии репродуктивных структур (Batygina, Vasilyeva,
1981; Vasilyeva et al., 1987; Шамров, Никитичева, 1992; Шамров,
Анисимова, 1993; Шамров, 1995).
Сравнительное комплексное изучение динамики роста,
дифференциации, а также динамики накопления белков, нуклеиновых кислот и
углеводов в зародыше, семенной кожуре, перикарпе и цветоложе позволило
Зародыш
305
установить 8 критических стадий в процессе образования семени Ne-
lumbo nucifera (первые 15 дней после опыления): 1 — формирование
зиготы, 2 — бластомеризация (проэмбриональная фаза) — от деления
зиготы до заложения эмбриодермы в проэмбрио, 3 — инициация
семядоли и апекса побега, 4 — формирование первого листового примор-
дия в плюмуле, апекса корня, а также проводящей системы в зародыше,
5 — второго листового примордия плюмулы, 6 — пластинки первого
листа плюмулы, 7 — третьего листового примордия плюмулы, 8 —
пластинки второго листа плюмулы (Батыгина и др., 1983; Vasilyeva et
al, 1987; Морозова, 1993а, б).
На основании динамики развития зародыша, эндосперма и нуцеллуса
у Butomus umbellatus выделены четыре критические стадии в
эмбриогенезе: 1 — начало развития зародыша и эндосперма и
дифференциация латеральной зоны нуцеллуса, 2 — выделение эмбриодермы в
зародыше, 3 — инициация семядоли, переход зародыша к интенсивному
росту, появление крахмала в базальной клетке подвеска, начало клетко-
образования в эндосперме, 4 — формирование апекса побега,
заложение примордия первого листа плюмулы, дифференциация прокамбиаль-
ных тяжей в семядоле, появление крахмала в клетках зародыша и
начало интенсивного разрушения клеток эндосперма и нуцеллуса
(Красников, 1989а, б).
Для ряда видов двудольных и однодольных растений в основу
выделения критических стадий положены данные по динамике развития
структур семязачатка и семени, а также по характеру накопления в них
некоторых веществ (белков, крахмала, декстринов, танинов). Этими
стадиями у Gentiana cruciata и Swerfia iberica (Gentianaceae) являются
стадии зиготы, глобулярного зародыша с эмбриодермой, глобулярного
зародыша перед началом органогенеза, зрелого зародыша (Шамров,
1990; Shamrov, 1991), у Luzula pedemontana (Juncaceae) — также
стадия двуклеточного проэмбрио (Шамров, Анисимова, 1993), а у Gym-
nadenia conopsea (Orchidaceae) — стадия октантов в проэмбрио
(Шамров, Никитичева, 1992).
На основании литературных данных можно указать на ряд
следующих критических стадий в развитии зародыша. Одной из них является
стадия двуклеточного зародыша, размеры клеток которого
детерминированы. Так, у Arabidopsis gnom мутация связана с изменением
неравного деления'зиготы на равное (Clark, Sheridan, 1991; Kirket et al.,
1991; Pennell et al., 1991; Mayer et al., 1993; Sheridan, Clark, 1993).
Подобное нередко наблюдается и при развитии соматических
зародышей в культуре in vitro, например у Triticum aestivum (Batygina et al.,
1993; см. Эмбриоид). В качестве следующей критической стадии
может быть стадия дифференциации эмбриодермы (протодермы) (Ба-
тыгина,'1968, 1974, 1987;Batygina, 1969; Яковлев, 1972, 1981; Vallade,
1989; Mansfield, Briarty, 1991). Это связано с достижением клетками
зародыша минимального объема (Vallade, 1989) и началом
экспоненциального роста зародыша (Nagato, 1979).
2Q-S28
306
Семя
Одной из важнейших является стадия автономности зародыша,
начиная с которой происходит переход зародыша на самостоятельный путь
развития (Батыгина, Васильева, 1979; Васильева, Батыгина, 1981;
Raghavan, 1986). Стадия автономности видоспецифична и проявляется
у разных представителей на различных стадиях развития (Batygina et
al., 1978; Батыгина и др., 1983; Vasilyeva et al., 1987; см.
Автономность зародыша).
Таким образом, критические стадии могут быть общими и
специфическими (Batygina et al., 1992). Общие критические стадии
(глобулярный зародыш с эмбриодермой, глобулярный зародыш перед началом
органогенеза, автономный зародыш, зрелый зародыш) свидетельствуют
о направленности хода эмбриональных процессов, в то время как
специфические — о лабильности их прохождения у разных таксонов
(Шамров, 1995; Shamrov, 1996).
В настоящее время результаты экспериментальных исследований
подтвердили наличие ряда критических, чувствительных к воздействию
определенных факторов среды, стадий в развитии зародыша. У Eranthis
hie malis, например, воздействие различных ростовых веществ (цитоки-
нины, ИУК, НУК и др.) на зрелые семена, содержащие не
дифференцированный на органы зародыши (стадия позднего глобулярного
зародыша перед началом органогенеза), вызывает широкий спектр вариаций
в строении семядольного аппарата (Haccius, 1959,1960,1972; Haccius,
Trorhpeter, 1960). У Brassica juncea ингибиторы полярного транспорта
ауксинов (HFCA, TIBA и др.) вызывали формирование зародышей со
слитыми семядолями, если воздействие осуществлялось в период
культивирования зародышей на поздней глобулярной стадии,и оно
оказывалось неэффективным для сердечковидных зародышей (Liu et al.,
1993; см. Синкотилия). При изучении мутантов Arabidopsis thaliana
было показано,что остановка в развитии семязачатков и семян
происходит именно во время критических стадий эмбриогенеза. Такими
стадиями являются: предглобулярная, глобулярная, сердечковидная, торпедо-
видная (зародыш с линейными семядолями), обратно U-образная
(зародыш с изогнутыми семядолями) и зрелый зародыш (Meinke,
1985,1986,1991а; Health et al., 1986; Franzmann et al., 1989). У Zea
mays критические периоды (фазы), характеризуются нарушениями
механизма становления базально-апикальной полярности
(предглобулярная стадий), радиальной симметрии и возникновения зачатков
различных органов (булавовидная и колеоптильная стадии) и формирования
листовых примордиев в почечке зародыша (стадии 1-6) (Sheridan,
Neuffer, 1980, 1981, 1982; Clark, Sheridan, 1986, 1991; Sheridan, Clark,
1993).
Зародыш является динамичной системой с пульсирующим характером
функционирования своих элементов (Batygina, 1996). В связи с этим
для успешного его изучения необходимо учитывать как особенности
раннего эмбриогенеза (порядок делений, топографию слоев, характеристику
клеток в различных областях зародыша — генеалогический подход),
Зародыш
307
так и меняющееся состояние зародыша, особенно во время критических
стадий развития (динамический подход) (Shamrov, 1996). Хорошим
подтверждением этого является изучение мутатных растений, которые
позволяют оценить значимость различных факторов в реализации
программы развития зародыша в условиях эксперимента. Рис. 23.
Банникова и др., 1991; Барлоу, 1994; Батыгин, 1993; Батыгина, 1968а, 1974, 1987;
Батыгина, Васильева, 1978, 19836; Батыгина и др., 1983; Броунов, 1897;
Красников, 1989а, б; Морозова, 1993а, б; Светлов, 1960, 1978; Терёхин, 1984,
1991; Токин, 1987; Шамров, 1990, 1995; Шамров, Анисимова, 1993; Шамров,
Никитичева, 1992; Яковлев, 1972, 1978; Abbe, Stein, 1954; Barlow, 1991, 1994;
Batygina, 1969, 1996; Batygina, Vasilyeva, 1981; Batygina et al., 1978, 1992, 1993;
Breton, Sung, 1982; Bugnicourt, 1983; Clark, Sheridan, 1986, 1991; de Jong et al.,
1992; Foster, 1949; Franzmann et al., 1989; Giuliano et al., 1984; Goldschmidt, 1938;
Guignard, 1974, 1975; Haberlandt, 1918; Haccius, 1959, 1960, 1972; Haccius,
Trompeter, 1960; Halperin, 1966; Health et al., 1986; Jegla, Sussex, 1989; Johansen, 1950;
Jurgens, 1995; Jurgens, Mayer, 1994; Kirket et al., 1991; Konar, Nataraja, 1965; Laux,
Jurgens, 1994; Liu et al., 1993;Lyndon, 1990; Mansfield, Briarty, 1991; Mayer et al.,
1991, 1993; Meinke, 1982, 1985, 1986, 1991a, b; Meinke, Sussex, 1979; Muller,
1963; Nagato, 1979; Natesh, Rau, 1984; Padmanabhan, 1996; Pennell et. al., 1991;
Poething et al., 1986; Raghavan, 1976; Raghavan, Sharma, 1995; Rijven, 1952;
Schmidt et al., 1994; Schnarf, 1929; Schneider et al., 1989; Schulz, Jensen, 1968a;
Shamrov, 1991, 1996; Sheridan, Neuffer, 1980, 1981, 1982; Sheridan, Clark, 1993;
Soueges, 1911, 1921a, b; 1922a, 1935a, 1937, 1939b; Stockard, 1921; Swamy,
Padmanabhan, 1962; Torres Riuz, Jurgens, 1994; Treub, 1879; Tykarska, 1979; Vallade, 1989;
Vasilyeva et al., 1987; Wardlaw, 1955, 1963; Wareing, Phillips, 1978; Williams,
Maheshwaran, 1986; Xi, Ye, 1994.
СТАДИИ РАЗВИТИЯ И СТРУКТУРЫ ЗАРОДЫША
ЗИГОТА (греч. zygotes — соединенный вместе) — клетка,
образующаяся в результате слияния женской гаметы (яйцеклетки) с мужской
(спермием). Синонимы: оплодотворенная, яйцеклетка, сингамета,
инициальная клетка зародыша.
Термин «зигота» (как и термин «гамета») впервые ввел Strasburger
(1877) для обозначения продукта слияния (копуляции) гамет у
водорослей Spirogyra и Acetabularia. Bateson (1902) распространил это
понятие и на индивидуум, который развивается из оплодотворенной
яйцеклетки.
Образование зиготы представляет собой начальную фазу онтогенеза.
В процессе реализации запрограммированной последовательности
сложных морфогенетических преобразований зигота развивается в
многоклеточный зародыш, а впоследствии в высокоспециализированный
индивидуум — растение.
Созревание яйцеклетки, оплодотворение, развитие зиготы и ранний
эмбриогенез довольно подробно изучены на молекулярном уровне в
20*
308
Семя
модельных системах у животных (например, у дрозофилы, нематоды и
мыши) благодаря широкому набору имеющихся эмбриональных
мутантов. Обнаружение циклина, белка cdc2 и модуляторов клеточного
деления в яйцеклетках лягушки, морского ежа и в клетках дрожжей
способствовало разработке универсальной модели митотического цикла
эукариот (см. обзоры Murray, Kirschner, 1991; Jacobs, 1992, 1995).
Успехи в области молекулярной и клеточной биологии приоткрывают
основные процессы, контролирующие эмбриогенез растений (см. обзор
Goldberg et al., 1994). Получены эмбриональные мутанты Arabidopsis,
Hordeum, Zea, анализ которых позволил выделить ряд важных генов
эмбриогенеза (Sheridan, 1988; Clark, Sheridan, 1991; Meinke, 1991a, b, c;
Castle, Meinke, 1993). Недавно идентифицированы некоторые гены,
специфичные для неоплодотворенной яйцеклетки и зиготы растений
(Dresselhaus et al., 1996).
Интенсивно разрабатывается важная проблема осевой организации
тела зародыша и растения (Mayer et al., 1991, 1993; Jiirgens, 1995).
Генетический и фенотипический анализ gnom гена, который экспресси-
руется до асимметричного деления зиготы у Arabidopsis, способствовал
определению его роли в апикально-базальной модели строения зародыша.
В последние годы появились работы по изучению взаимосвязей
клеточного цикла и половой репродукции у покрытосеменных и
голосеменных растений, освещающие в той или иной степени вопрос о структуре
гамет и хронологию кариогамии (Friedman, 1991; Carmichael, Friedman,
1995; Mogensen, Holm, 1995). На примере Zea mays описана
цитологическая картина кариогамии в культуре in vitro (Faure et al., 1993).
Однако ряд важнейших фаз сингамии вследствие их быстротечности
(у большинства цветковых растений) ускользает от внимания
исследователей. Продолжает оставаться предметом дискуссий целый ряд
вопросов, связанных с установлением апикально-базальной оси в
яйцеклетке и зиготе и трехмерной организации зародыша. А именно:
1 — периодизация развития яйцеклетки и зиготы;
2 — стадия, на которой формируется ось зародыша — в зрелой
яйцеклетке, зиготе или в раннем эмбриогенезе;
3 — связь полярной организации яйцеклетки и зиготы с
экспрессией генов в раннем эмбриогенезе;
4 — наличие жесткой и лабильной фаз в детерминации яйцеклетки;
какие факторы (эмбриональные индукторы ) — гаметофитные, гамет-
ные, спорофитные — вызывают ее изменение;
5 — универсальность закономерностей установления оси и эмбрио-
генетического контроля, описанных у Arabidopsis (типичного
двудольного), для всех цветковых растений, различающихся по строению яйце-
1 См. Гексли, де Бер (1936); Михайлов (1988).
2 Spemann (1938).
Зародыш
309
клетки, зиготы, типам развития зародышевого мешка (16 типов), и
зародыша (8 типов) и т. д.;
6 — механизмы, лежащие в основе образования зиготы у растений
и животных, способных развиваться с метаморфозом и без него.
Для решения этих вопросов может быть перспективным дальнейшее
развитие системного комплексного подхода (Batygina, Vasilyeva, 1981;
Батыгина, 1983) с учетом иерархического уровня организации
(клетка — ткань — орган — организм — популяция) и онтофилогенети-
ческого аспекта. С позиции такого подхода стратегия исследования
зиготы должна включать:
1) морфологический и цитоэмбриологический анализ всех этапов
развития яйцеклетки и зиготы;
2) рассмотрение генезиса зиготы в связи с клеточным циклом;
3) определение взаимосвязей между характером развития зиготы
(т. е. типом кариогамии) и типами развития зародышевого мешка,
эмбрио- и эндоспермогенеза, и всей системы семязачатка-семени.
4) выбор модельных объектов, которые обладали бы достаточно
крупными размерами половых элементов и пролонгированным
прохождением отдельных фаз.
При всей перспективности новейших методов (ТЭМ, СЭМ, стерео-
реконструкция, культура in vitro) для изучения зиготы,значение
световой микроскопии сохраняется, поскольку она позволяет определить
морфологию структур, точный временной ход всех фаз формирования и
поведения спермиев (в щели между яйцеклеткой и центральной клеткой,
в цитоплазме и ядре яйцеклетки), состояние хроматина (гетеро- и
эухроматин) в половых ядрах и т. д. Комплексное использование
свето- и электронооптических методов при обязательной темпоральной
фиксации материала способствует выявлению механизмов образования
зиготы.
До сих пор не разработана унифицированная терминология, которая
описывала бы все фазы развития яйцеклетки и зиготы, только
некоторые из них получили общепринятое обозначение (например, зрелая
яйцеклетка, молодая и зрелая зигота). Так, с нашей точки зрения,
одним из важнейших этапов, на который не обращают внимания
при изучении детерминации, поляризации, симметрии и
морфогенеза как яйцеклетки, так и зиготы, является заложение фрагмо-
пластов в зародышевом мешке (что определяет характер строения
зиготы, кариогамии и цитогенеза). Между тем обе эти клетки все чаще
используются в качестве модельных объектов для изучения процесса
оплодотворения и, в частности, кариогамии in vitro, для получения
эмбриональных мутантов, выявления инициальных клеток зародыша
(полового и соматического) in situ, in vivo и in vitro, при отдаленной
гибридизации и т. д. Отсутствие точных критериев выделения фаз в
генезисе яйцеклетки и зиготы осложняет сравнительный анализ
литературных данных и установление закономерностей их
развития. Кроме того, определенная периодичность, свойственная разви-
310
Семя
THE PRINCIPAL DEVELOPMENTAL STAGES
EMBRYO SAC
Formation of
a coenocyte
(the eight-nuclei
embryo sac)
Cellularization and
formation of
heterogenous gametophytic
tissue (the seven-cell,
eight-nuclei embryo
sac)
Separation of all
cells in embryo
sac and formation
of its elements
Maturation of
embryo sac elements
(embryo sac,
which is ready
for fertilization)
Penetration
of a pollen tube
into embryo sac,
plasmogamy
Caryogamy
Finishing of
double fertilization
EGG CELL AND ZYGOTE
NUCLEUS OF A FUTURE /o°\
EGG CELL / о \
(a sister one of the polar nucleus in 1 1
the micropylar part of embryo sac) \ О /
vy
EGG CELL INITIAL \ %j "" [ ° /
IMMATURE (FORMING) /оШ\ /ШШ^
EGG CELL It*=ЗШ7 \—"ff^^JX
MATURE EGG CELL ЙЩ
I/ ^\1|
c^~ *^__*-
ZYGOTE INITIAL ЙЖ^\~*^Ж^т\
IMMATURE ZYGOTE ^ШЩ^//Ш^Ш(С^^Ш\
MATURE ZYGOTE /|(^^Ш\ ^
Зародыш
311
тию зиготы (как и любой биологической системе), сложность
процессов, участвующих в нем (формирование и созревание гамет,
плазмогамия, кариогамия и т. д.) подтверждают необходимость введения
новых терминов.
Мы предлагаем систему понятий, которые описывают семь периодов
формирования яйцеклетки и зиготы (таблица). Мы надеемся, что
приведенные ниже термины будут полезны для исследования и понимания
механизмов оплодотворения и в дальнейшем могут быть расширены и
дополнены новыми данными по ультраструктуре и митотическому циклу.
I Ядро будущей яйцеклетки — нижнее из гаплоидных микро-
пилярных ядер восьмиядерного зародышевого мешка, сестринское
верхнему полярному ядру.
II — Инициаль яйцеклетки — одна из клеток (обычно —
латеральная) гаметофитной гаплоидной ткани яйцевого аппарата,
образовавшейся в результате заложения фрагмопластов. Тотипотентная,
неполярная. По структуре ядра и цитоплазмы подобна меристема-
тической клетке. Эта стадия соответствует началу образования семи-
клеточного восьмиядерного зародышевого мешка (в случае
Polygonum-типа развития зародышевого мешка).
Ш — Незрелая (формирующаяся) яйцеклетка — незрелая
женская' гамета, с момента обособления от остальных клеток яйцевого
аппарата до окончания ее формирования. Характеризуется
уменьшением тотипотентности, становлением полярности
(миграция ядра, специфическая вакуолизация), оси, определенного типа
симметрии (радиальной,билатеральной (дорзовентральной)); занимает, как
правило, латеральное положение к оси зародышевого мешка. Эта
стадия соответствует сформированному зародышевому мешку (все его
элементы сформированы), но еще не готовому к оплодотворению.
IV Зрелая яйцеклетка — зрелая женская гамета, прошедшая
путь «созревания» от сформированной до способной к оплодотворению.
Высокодифференцированная и специализированная,не-
тотипотентная, полярная; имеет апикально-базальный характер
организации; приобретает окончательную форму, специфичную для
каждого таксона растений. Эта стадия соответствует зрелому
зародышевому мешку, готовому к двойному оплодотворению.
V Инициаль зиготы — зрелая яйцеклетка, в цитоплазму
которой вошел спермий, от образования ценоцитнои структуры до начала
контакта половых ядер (контакт наружных ядерных мембран через
ЭР). Специализированная клетка, в которой начинается
дедифференциация под воздействием триггера — спермия. Нетоти-
потентная, полярная (апикально-базальная модель
организации); характеризуется увеличением объема, движением ядер, определен-
1 В цитоплазме оплодотворенной яйцеклетки присутствуют ядра мужской и женской
гамет; при быстром темпе сингамии этот этап трудно уловим.
312
Семя
ным типом симметрии, большим количеством органелл. Эта стадия
соответствует зародышевому мешку, прошедшему прогамную и
вступившему в следующую фазу оплодотворения.
VI — Незрелая зигота — зигота от начала кариогамии (слияние
наружных и внутренних мембран оболочек мужских и женских ядер и
образование мостиков между ядрами) до полного слияния ядер.
Характеризуется потерей специализации, приобретением то т и-
потентности, полярностью (апикально-базальная модель
организации), определенным типом симметрии; имеет диплоидное ядро;
мужские и женские ядрышки могут быть не слиты.
VII — Зрелая зигота — зигота, прошедшая путь «созревания» от
завершения слияния половых ядер до начала деления. Тотипо-
тентная к л е т к а, способная к пролиферации, п о ля р н а я
(апикально-базальная модель организации); имеет определенный тип
симметрии, диплоидное ядро с амплификацией ядрышек.
Длительность прохождения каждой стадии развития яйцеклетки и
зиготы различна у разных видов цветковых растений — от нескольких
секунд до нескольких дней.
Зигота обычно расположена между синергидами в микропилярной
части зародышевого мешка и прикрепляется к его стенке латерально,
что обнаруживается лишь при определенном сечении (в профиль).
Иногда зародышевый мешок вместе с зиготой выходит в микропиле и
в канал столбика (см. Embryology of Angiosperms, 1984). У некоторых
видов растений зигота образует гаустории.
Размер и форма зиготы — специфические видовые признаки (см.
«Сравнительная эмбриология цветковых растений», 1981, 1983, 1985,
1987,1990). В значительной степени эти параметры связаны с
наличием и особенностями строения суспензора. Наиболее
распространенная форма зиготы — грушевидная и цилиндрическая. Встречается
«сидячая» зигота, базальная часть которой расширена (например, у
Nelumbo — Батыгина и др., 1983).
Характер изменения объема зиготы в ходе ее развития различен. У
одних видов объем зиготы значительно увеличивается (например, у видов
рода Crepis — Герасимова-Навашина, 1954, 1957; Datura
stramonium — Satina, Rietsema, 1959), у других — уменьшается (Reseda
lutea — Чабан, 1975; на 45-50% по отношению к объему яйцеклетки
у Gossypium — Jensen, 1968b; Pollock, Jensen, 1964 и Hibiscus —
Ashley, 1972; на 17% у Nicotiana tabacum — Mogensen, Suthar, 1979).
У Capsella bursa-pastoris (Schulz, Jensen, 1968a) зигота сначала
уменьшается в размерах, а потом восстанавливает свой первоначальный
объем.
Как новый организм зигота представляет собой дочернее поколение,
которое обычно генетически отличается от соматических клеток нуцел-
луса, интегументов и от гаплоидных клеток гаметофита — синергид и
антипод.
Зародыш 313
К дочернему поколению относится и оплодотворенная центральная
клетка зародышевого мешка, дающая эндосперм, которая может иметь
различный уровень плоидности (в зависимости от типа развития
зародышевого мешка). Между зиготой и окружающими клетками и тканями
имеются трофические и регуляторные связи. Строгая координация в
развитии зиготы, зародыша и всех структур семени, как во времени, так
и в пространстве, проявляется в морфогенетических и морфофизиоло-
гических корреляциях (Sinnott, 1960; Батыгина, 1974, 1987; Wareing,
Phillips, 1978; Васильева и др., 1984; Vasilyeva, 1988; Vasilyeva et al.,
1987, 1988).
Как и большинство растительных клеток, зигота тотипотентна и
подчиняется общим законам клеточной дифференциации
(Герасимова-Навашина, 1969, 1971а, б; Jacobs, 1992), но, будучи зачатком
нового организма, является в значительной степени уникальной.
Уникальность зиготы обусловлена ее происхождением (в
результате слияния яйцеклетки и спермия), особенностями строения,
функционирования высокоспециализированных гамет и детерминированностью
процессов, происходящих в ней. Наиболее важные из них:
1 — симметричный и асимметричный цитокинез при образовании
мужских и женских гамет и как следствие — равное или неравное
деление зиготы;
2 — образование ценоцитной структуры, содержащей два ядра
разного происхождения (мужское и женское), движение этих ядер;
3 — асинхронное преобразование хроматина ядер сливающихся
гамет, обусловленное неодновременным прохождением гаметами периодов
интерфазы;
4 — привнесение в цитоплазму яйцеклетки органелл мужского
происхождения (двуродительское или однородительское наследование).
Однако вопрос о том, всегда ли спермий-клетка привносит свои ор-
ганеллы в яйцеклетку, остается все еще дискуссионным (см. Передача
цитоплазмы при оплодотворении). У некоторых представителей
цветковых в зиготе обнаружены пластиды и митохондрии мужского
происхождения. Например, неоплодотворенная яйцеклетка Oenothera erytro-
sepala имеет 14-32 пластиды, молодая зигота — 33-42 (8-13 из них
мужского происхождения), а зрелая зигота — 68-82 (14-18 —
отцовские) (Schotz, 1954). Этот факт свидетельствует о том, что пластиды
обоих типов подверглись делению (Mayer, Stubbe, 1974). Количество
пластид и митохондрий в зиготе увеличивается как за счет их
размножения, так и за счет привнесения спермиями (Hagemann, 1976, 1981).
Некоторые авторы, в частности, Possingham (1980), считают, что в
большинстве случаев спермин не имеют пластид, так как при делении
генеративной клетки и развитии спермиев они селективно исключаются,
в результате чего обычно имеет место лишь материнское наследование
пластид. В настоящее время увеличивается число работ,
подтверждающих наличие пластид в спермиях (Татинцева, 1988) и диморфность
спермиев по этому признаку. Хотя судьба пластид мужского происхож-
314
Семя
дения в онтогенезе окончательно не установлена, но несомненно
привнесение их в яйцеклетку оказывает влияние на поведение других ор-
ганелл на разных этапах дифференциации и созревания зиготы.
Подтверждением могут служить генетические данные, свидетельствующие
0 том, что «мужские органеллы» определяют характер развития
организма (двуродительское наследование) (см. Плющ, 1992).
Уникальность зиготы проявляется в комплексе таких признаков,как
изолированность, морфологическая и физиологическая полярность,
морфологическая ось, строение клеточной оболочки, характер протекания
клеточного цикла (особенно интерфазы).
Изолированность зиготы. В процессе развития от инициали
яйцеклетки через сингамию к зрелой зиготе изменяется степень и характер
изоляции этой клетки, что проявляется в типе связей с окружающими
структурами, строении ее оболочки (см. ниже) и системе транспорта.
В становлении изолированности яйцеклетки, зиготы и остальных
клеток зародышевого мешка можно выделить три критических события.
1 — заложение фрагмопластов и образование единой гетерогенной
гаметофитной ткани в восьмиядерном зародышевом мешке (II
период). Клетки этой ткани находятся в жесткой связи друг с другом,
морфологически различаются, но они в определенной степени меристе-
матичны и тотипотентны. Однако их расположение в системе
зародышевого мешка, где уже имеется полярность и симметрия, во многом
определяет их дальнейшую судьбу. II — начало изоляции клеток и
выделение трех функционально-различных типов тканей: яйцевого
аппарата, антиподального комплекса и центральной клетки (инициали
эндосперма) (III период). III — окончание изоляции клеток
яйцевого аппарата и антиподального комплекса (III период). В некоторых
случаях антиподальный комплекс продолжает оставаться в виде ткани
длительное время. Клетки яйцевого аппарата (яйцеклетка и синергиды)
становятся изолированными, полярными и аксиальными.
Строение клеточной оболочки зиготы. Незрелая яйцеклетка
обычно имеет целлюлозную оболочку со всех сторон («первичная
оболочка»1). Зрелая яйцеклетка, готовая к оплодотворению, у большинства
цветковых растений окружена оболочкой только с базального ее
полюса («вторичная оболочка» ),тогда как с апикального она
отграничена от центральной клетки лишь плазмалеммой (Schulz, Jensen, 1968a;
см. также Жукова, 1994а). В период интерфазы зиготы происходит
вновь формирование полной целлюлозной оболочки зиготы
(«третичная оболочка»3), которая имеет PAS (ШИК) — положительную ре-
Термины широко используются в ботанической и зоологической литературе (см.
Токин, 1987).
1 о же.
То же.
Зародыш
315
акцию по всей ее границе. Длительность и характер этого процесса
таксоноспецифичны (например, у Triticum — 14-18, Gossypium — 36,
Nicotiana — 40-50 ч). В исключительных случаях клетки яйцевого
аппарата полностью лишены клеточных оболочек (например, у Pota-
mogeton — Wiegand, 1900; Peperomia blanda, Gagea lutea — Плющ,
1983,1992). Зрелая зигота обычно имеет непрерывную оболочку, хотя
имеются данные, свидетельствующие о более поздней ее организации
(Helianthus - Yan, Yang, 1991).
Оболочка зиготы может претерпевать иные специфические изменения.
Так, у Rhododendron и Ledum groenlandicum в оболочке зиготы
откладывается'каллоза (Williams et al., 1984). У двух видов сем. Dillen-
iaceae — Wormia suffruticosa, Acrotrema arnottianum — значительное
увеличение размеров зиготы (в 3-4 раза) сопровождается сильным
утолщением оболочки, которая дает выросты в эндосперм (Paetow, 1931;
Swamy, Periasamy, 1955; Sastri, 1958). Она сохраняет свое строение и
в процессе раннего эмбриогенеза, образуя своеобразный чехол вокруг
зародыша. Электронно-микроскопические исследования оболочки зиготы
у разных видов рода Dillenia (D. suffruticosa, D. philippinensis, D. ova-
ta, D. retusa, D. pteropoda) подтвердили, что эти гроздевидные
ответвления являются органичной частью оболочки зиготы. Основным ее
компонентом служат полисахариды, среди которых значительное место
занимают кислые полисахариды пектиновой природы. На более поздних
стадиях развития зародыша такой своеобразный чехол, или мантия,
исчезает (Иоффе, Жукова, 1974; Яковлев, 1983а). У Saxifraga flagillaris
микропилярная часть оболочки несет многочисленные протуберанцы,
глубоко внедряющиеся в нее (Жгенти, 1986).
Клеточная оболочка зиготы, вероятно, необходима для фиксации
полярной оси, как было показано на примере Fucus (Kropf et al., 1988),
а также для поддержания дифференцированного состояния
эмбриональных клеток и для определения клеточной судьбы в развитии растения
(Berger et al., 1994).
Вхождение спермиев в яйцеклетку, по-видимому, является тем
индуктором, который вызывает кардинальное изменение оболочки
яйцеклетки — зиготы. В настоящее время практически отсутствуют
исследования, которые позволили бы определить точное время начала
формирования новой оболочки — образуется ли она сразу же после
вхождения спермиев в яйцеклетку или в процессе кариогамии, завершается
ли ее образование сразу же после слияния мужского и женского ядер
(при постмейотическом и промежуточном типах оплодотворения). Время
этого процесса видоспецифично и, вероятно, в определенной степени
обусловлено морфогенетическими корреляциями в развитии зародыша,
эндосперма и окружающих тканей спорофита.
Изолированность зиготы, обеспечиваемая ее оболочкой,в
определенной степени является относительной, поскольку, как свидетельствует
структурная ее организация, зигота на всех этапах своего развития
связана с клетками гаметофита и материнскими тканями (с нуцеллусом,
316
Семя
интегументами, интегументальным тапетумом и т.д.) через систему
транспорта. Таким образом, зиготу следует рассматривать с позиции
«открытых систем».
Полярность зиготы (греч. polos — полюс) — специфическая
ориентация процессов и структур в пространстве, приводящая к
возникновению морфофизиологических различий на противоположных
концах ее. На основе этого возникает морфологическая ось с двумя
различными полюсами: апикальным, обращенным к центральной
клетке зародышевого мешка, и базальным. Полярность зиготы
определяет впоследствии плоскость ее деления (перпендикулярная,
наклонная, продольная перегородки), различный характер цитокинеза
(асимметричный и симметричный) и как следствие — образование
двух неравных или равных дочерних клеток, и в конечном итоге
полярность зародыша. Полярность и симметрия эмбриональных
структур (зиготы, зародыша и других) — общее явление в растительном
и животном царствах. Это одна из важнейших и малоразработанных
проблем в биологии (Wardlaw, 1955; Sinnott, 1960; Батыгина, 1993а,
1994; Jiirgens, 1995; см. Полярность и эмбриогенез). Процессы
поляризации, имеющие место в зиготе до первого клеточного деления,
хорошо изучены на примере водорослей Fucus и Pelvetia (Kropf,
1992, 1994).
Различают морфологическую и физиологическую полярность.
Морфологическая полярность зиготы обнаруживается во внешнем
(форма зиготы) и внутреннем строении как результат перестроек в
клеточной оболочке, плазмалемме, цитоплазме и ядре. Как правило,
ядро и большая часть цитоплазмы, в которой распределено основное
количество органелл, располагаются в ее апикальной части, а большая
вакуоль — в базальной. У некоторых растений (например, у Triti-
сит, Zea, Hordeum, Avena, Myosotis) большая вакуоль отсутствует,
а мелкие вакуоли располагаются, главным образом, по периферии
зиготы (Батыгина, 19626, 1974, 1987; Хведишч, 1969; Чеботарь,
1972; Norstog, 1972; Поддубная-Арнольди, 1976; Коробова, 1982;
Mogensen, 1982; Russell, 1993). Органеллы (митохондрии, аппарат
Гольджи), везикулы, цитоскелетные элементы также подвергаются
реорганизации и асимметрично распределяются в клетке.
Физиологическая полярность зиготы проявляется в градиентном
распределении ионных и электрических потоков,полисахаридов,белков,
фитогормонов (и других веществ), в различной интенсивности обмена
веществ и различном тропизме ее частей. Апикальный полюс зиготы,
а в дальнейшем и зародыша, обладает отрицательным геотропизмом, а
базальный — положительным (Поддубная-Арнольди, 1976).
При рассмотрении полярности зиготы необходимо обратить особое
внимание на установление вертикальных градиентов, таких, как сила
тяжести, величина рН, свойства оболочки зиготы в апикальной и
базальной ее частях. По мнению Child (1941), система градиентов —
главный фактор происхождения полярности.
Зародыш
317
Установление определенных градиентов и приводит к специфической
ориентации элементов зиготы, т. е. к аксиальности.
Заложение оси полярности может рассматриваться как первый шаг
дифференциации и, следовательно, морфогенеза (Sinnott, 1960).
Полярность зиготы предопределена полярностью зрелой яйцеклетки, которая
имеет апикально-базальную ось (халазально-микропилярную). Ряд
данных о развитии зиготы (Батыгина, 1974,1987; Kropf, 1994)
свидетельствует о том, что в инициали яйцеклетки еще нет градиентов, т. е.
отсутствуют различия между полюсами. Затем происходит становление
полярности,и зрелая яйцеклетка представляет собой полярную клетку.
Вхождение спермия в зрелую яйцеклетку «нарушает» всю ее
организацию: происходят изменения вакуолизации, переориентация
микротрубочек, движение ядер, образование полной клеточной оболочки и т.д.
Таким образом, вновь происходит поляризация, в результате чего зрелая
зигота становится еще более поляризованной.
Направление полярности зиготы (и в дальнейшем зародыша)
зависит от осевой полярности зародышевого мешка и семязачатка. В
то же время можно говорить о пластичности морфогенетической
полярности, поскольку существуют примеры смены оси, наличия
нескольких осей и т. д. (Батыгина, 1994). Известны случаи изменения
полярности самого зародышевого мешка покрытосеменных, когда
яйцевой аппарат появляется на обоих концах или антиподы — на
микропилярном конце, а яйцеклетка — на халазальном (Swamy,
1946). В процессе оплодотворения и развития зиготы может
происходить реверсия полярности: ядро смещается к базальному ее
полюсу (например, Papaver nudicaule).
Яйцеклетка и зигота разных видов покрытосеменных
характеризуются различными типами симметрии: радиальной и билатеральной,
дорзовентральной. Выделяют ось и плоскость симметрии. Существует
морфологическое и физиологическое проявление симметрии. В ходе
развития яйцеклетки, зиготы и зародыша имеет место переход от одного
типа симметрии к другому. У некоторых цветковых растений
(например, Triticum, Nelumbo, Commelina — Батыгина, 19686,1974; Batygina,
1969; Titova, Batygina, 1996) зрелая зигота имеет внутреннюю дорзо-
вентральность, которая сохраняется в зрелом зародыше. Дорзовент-
ральность зиготы и зародыша злаков обусловлена дорзовентральностью
строения зародышевого мешка и семязачатка и является отражением
высокой специализации этой группы растений. Еще одним примером
дорзовентральности могут служить две различные клетки, возникающие
при делении зиготы Fucus (Sinnott, 1960).
Одни авторы считают, что переход от радиальной к билатеральной
симметрии происходит в момент образования семядолей (Raghavan,
1986; Jiirgens, 1995). Другие (Goldberg et al., 1994) подчеркивают, что
глобулярный зародыш в формальном смысле радиально несимметричен.
До сих пор почти ничего не известно о генетических компонентах
лево-правой асимметрии. Недавно был идентифицирован кластер генов
318
Семя
и показана асимметричная их экспрессия, приводящая к установлению
этого типа симметрии у куриного эмбриона (см. Wade. Roush, 1995).
Особенности клеточного цикла зиготы. Митотический цикл
растительной и животной клеток включает периоды Gj,S,G2,n M (Howard,
Pelc, 1953). В некоторых случаях выделяют период вынужденного
покоя, или прекращения митоза — Go (см. обзор Jacobs, 1992). Первые
три периода составляют интерфазу.
При созревании и функционировании половых элементов их
митотический цикл также можно разделить на периоды.
В настоящее время имеются лишь единичные работы, в которых
сделана попытка сопоставить явления, происходящие при
оплодотворении, с периодами и фазами митотического цикла у семенных растений
(Герасимова-Навашина, 1971а,в, 1980; Vallade, 1980; Банникова и др.,
1985; Friedman, 1991; Carmichael, Friedman, 1995).
Спермин в ходе своего развития не завершают свой митотический
цикл, оставаясь временно блокированными на одном из последних его
этапов (телофазы), условно обозначаемом как Go
(Герасимова-Навашина, 1971а, 1980). Женская гамета, пройдя полный митотический цикл
при своем образовании, вступает в период Gf, подвергается
специфической дифференциации и выходит в период Go, в котором и находится до
оплодотворения.
Переход из периода Gj в период Go может быть обратимым:
G] —> Go представляет собой путь клеточной дифференциации и
остановки митоза, a Go —> Gj — возвращение в пролиферирующее
состояние. Сложность и филогенетическое разнообразие механизмов,
контролирующих переходы Go —> Gy, можно объяснить не только
обратимостью, но и разнообразием факторов, которые управляют
этим процессом у различных видов (Jacobs, 1992).
В момент контакта ядра гамет обычно находятся в одной фазе
клеточного цикла. Незрелая (только что образовавшаяся) зигота может
находиться в разных периодах клеточного цикла в зависимости от типа
кариогамии (см. Сингамия). Исходя из современной теории клеточного
цикла, можно полагать, что зигота цветковых растений перед делением
должна находиться в С^-периоде. В то же время при разных типах
оплодотворения и, следовательно, разных типах кариогамии она будет
морфологически различной, а именно: с полностью слившимися ядрами
(премитотический тип оплодотворения, G/-, G^- и S-кариогамия) и
частично слившимися (постмитотический и промежуточный типы
оплодотворения, М-кариогамия) (см. Сингамия).
Общая продолжительность клеточного цикла и отдельных его
периодов для гамет и зиготы варьирует у различных видов цветковых. Это
обусловлено разным темпом прохождения этих стадий, строением
зародышевого мешка, семязачатка и завязи, а также антэкологиеи данного
вида.
Для соматических клеток эукариот продолжительность периода S у
разных видов неодинакова, но обычно занимает относительно неболь-
Зародыш
319
шую часть митотического цикла (Гриф, Иванова, 1975). Характерные
черты развивающихся женских половых клеток — значительная
продолжительность этого периода,увеличение длительности пресинтетичес-
кого периода, по сравнению с постсинтетическим (Банникова и др.,
1985). S-период клеточного цикла зиготы, когда идет репликация ДНК,
короче, чем Gy и G^. Так, например, у Petunia hybrida длительность Gi-
и Сг-периодов составляет 75 и 28,5 ч, соответственно, тогда как S-
период — 4,6 ч, М-период — 3 ч (Vallade, 1980).
Детально хронология процесса двойного оплодотворения была
прослежена у разных видов Triticum (Батыгина, 1961а, 1974, 1987;
Batygina, 1974) и у Zea mays (Mol et al., 1994). Процесс
формирования и созревания яйцеклетки у пшеницы относительно
длительный (24-50 ч). Gj-период зиготы (формирование зиготы)
продолжается в среднем 5-6 ч, S- и С^-периоды (созревание зиготы)
в целом занимают 7-12 ч, М-период — 6-8 ч. В S-периоде нельзя
отличить мужской хроматин от женского, и в профазу зигота обычно
вступает через 24 ч как единое целое.
Яйцеклетку и зиготу можно рассматривать как интегрированную
реактивную систему, в которой происходят сложные катаболические и
анаболические реакции (Linskens, 1969).
Однако данные, имеющиеся в литературе об изменениях,
наблюдаемых в яйцеклетке до, в момент и после оплодотворения, необходимо
интерпретировать с определенной осторожностью, поскольку детальные
исследования были проведены на ограниченном количестве видов и
часто без четкого указания на стадию развития.
Наиболее подробно изучены зиготы некоторых видов родов: Gos-
sypium, Capsella, Epidendrum Triticum, Zea, Hordeum и др.
(Батыгина, 19626, 1974, 1987; Jensen, 1964b, 1968a, b, c; Schulz,
Jensen, 1968a, b; Cocucci, Jensen, 1969a; Mogensen, 1972; Norstog,
1972; Mogensen, Suthar, 1979).
Во время созревания зиготы увеличивается плотность рибосом с
тенденцией их объединения в полисомы (Capsella — Schulz, Jensen,
1968b; Epidendrum — Coccuci, Jensen, 1969a; Petunia — Went van,
1970; Linum — D'Alascio-Deschamps, 1973). У Gossypium
большинство рибосом образует спирали размером до 20 субъединиц (Jensen,
1968с). На некотором расстоянии от ядра зиготы образуется новая
популяция рибосом, и эта область содержит значительное число цистерн
ЭР (Lycopersicon — Kadej F., Kadej A., 1981). У многих изученных
видов отмечено значительное усложнение организации ЭР.
В ядре яйцеклетки в начале слияния с ядром спермия только после
контакта уменьшается количество РНК как свободной, так и
связанной, по сравнению с неоплодотворенной яйцеклеткой. В момент
слияния ядер количество свободной РНК в женском ядре вновь
увеличивается.
Важным показателем прохождения периодов митотического цикла
является количественная оценка ядерной ДНК в гаметах и зиготе
320
Семя
(Woodard, 1956; Bennett, Smith, 1976; данные Алимовой — см. Гера-
симова-Навашина, 1980; Банникова, Хведынич, 1982; Friedman, 1991;
Mogensen, Holm, 1995; Sherwood, 1995).
Первые данные по количественному содержанию ДНК в
зародышевом мешке, находящемся на ядерной стадии развития, были получены
для Nicotiana tabacum, Lilium regale, Triticum, aestivum,Galanthus
nivalis, Triticale (Банникова и др., 1978,1981,1985). Отмечено равномерное
на протяжении всего периода синтеза увеличение количества ДНК в
ядрах, предшествующих образованию половых клеток. Среднее
количество ДНК в ядрах яйцеклеток у этих видов соответствовало 1С ДНК
гаплоидного ядра.
Процесс «созревания» зиготы характеризуется накоплением липидов,
белков и крахмала. Так, например, в базальной части зиготы Jasione
montana обнаружены жировые капли, которые исчезают лишь на
поздних стадиях эмбриогенеза (Erdelska, 1983).
Многие исследователи считают, что половые клетки (яйцеклетка
и спермий) являются высокоспециализированными клетками (Batygina,
1984, 1991; Жукова, 1994а), а зигота, вступающая в митоз,
характеризуется скорее признаками, присущими меристематической
клетке (Batygina, 1984, 1987) и, в определенном смысле, тотипо-
тентна. «Тотипотентность — это качество, воссоздаваемое каждый
раз с появлением зиготы и утрачиваемое клетками зародыша... в
ходе их специализации» (Токин, 1987, с. 31). По мнению некоторых
авторов, зигота является неспециализированной паренхимной клеткой
(Russell, 1993).
Во время интерфазы в зиготе (инициаль зиготы, незрелая зигота)
происходят сложнейшие морфогенетические преобразования, в
результате которых, с нашей точки зрения, «теряется» специализация,
присущая зрелой яйцеклетке. Этот процесс можно рассматривать как
«дедифференциацию» яйцеклетки-зиготы, во время которой
происходят структурные изменения, получившие название реорганизации
цитоплазмы.
Таким образом, вхождение спермия в яйцеклетку можно
рассматривать как триггер, стимулирующий метаболические процессы,
реорганизацию органелл (образование полисом,деление пластид и митохондрий,
уплотнение ЭР и др.) и изменение характера вакуолизации.
После структурных перестроек зрелая зигота вновь становится
тотипотентнои клеткой, приобретая способность пролиферировать
и проходить дальнейший путь эмбриогенеза.
Организация яйцеклетки и зиготы, тип кариогамии, характер
прохождения клеточного цикла — основные критерии,
определяющие последовательность и характер развития нового организма.
Изучение иерархических уровней организации (ядерный,
клеточный, организменный) зиготы и установление взаимосвязей
клеточного цикла зиготы с типом кариогамии — перспективные
направления дальнейшей работы над многогранной проблемой «Зи-
Зародыш
321
гота». Успех этих исследований в немалой степени зависит от знаний
онтогенеза и филогенетических взаимоотношений между различными
таксонами растений. Рис. 24, 49.
Банникова, Хведынич, 1982; Банникова и др., 1978, 1981, 1985; Батыгина, 1961а,
19626, 19686, 1974, 1983, 1987, 1993а, 1994; Батыгина и др., 1983; Батыгина,
Фрейберг, 1979; Васильева и др., 1984; Гексли, де Бер, 1936; Герасимова-Нава-
шина, 1954, 1957, 1971а, в, 1980; Гриф, Иванов, 1975; Жгенти, 1986; Жукова,
1994а; Иоффе, Жукова, 1974; Коробова, 1982; Михайлов, 1988; Плющ, 1983, 1992;
Савина, Поддубная-Арнольди, 1990; Татинцева, 1988; Токин, 1987; Хведишч,
1969; Чабан, 1975; Чеботарь, 1972; Яковлев, 1983а; Ashley, 1972; Batygina, 1969,
1974, 1984, 1987, 1991; Batygina, Vasilyeva, 1981; Bennett, Smith, 1976; Berger et
al., 1994; Carmichael, Friedman, 1995; Castle, Meinke, 1993; Child, 1941; Clark,
Sheridan, 1991; Cocucci, Jensen, 1969a; D'Alascio-Deschamps, 1973; Dresselhaus et
al., 1996; Erdelska, 1983; Faure et al., 1993; Friedman, 1991; Gerassimova-Navashina,
1969, 1982; Goldberg et al., 1994; Hagemann, 1976, 1981; Howard, Palk, 1953;
Jacobs, 1992, 1995; Jensen, 1964b, 1968a, Ь, с; Jurgens, 1995; Kadej F., Kadej A.,
1981; Kropf, 1992, 1994; Kropf et al., 1988; Linskens, 1969; Mayer, Stubbe, 1974;
Mayer et al., 1991, 1993; Meinke, 1991a, b, c; Mogensen, 1972; Mogensen, Holm,
1995; Mogensen, Suthar, 1979; Mol et al., 1994; Murray, Kirschner, 1991; Norstog,
1972; Padmanabhan, 1996; Paetow, 1931; Pollock, Jensen, 1964; Possingham, 1980;
Raghavan, 1986; Russell, 1993; Sastri, 1958; Satina, Rietsema, 1959; Schotz, 1954;
Schulz, Jensen, 1968a, b; Sheridan, 1988; Sherwood, 1995; Sinnott, 1960; Spemann,
1938; Strasburger, 1877; Swamy, 1946; Swamy, Periasamy, 1955; Titova, Batygina,
1996; Vallade, 1980; Vasilyeva, 1988; Vasilyeva et al, 1987, 1988; Wade Roush,
1995; Wardlow, 1955; Wareing, Phillips, 1978; Went van, 1970c; Wiegand, 1900;
Williams et al., 1984; Woodard, 1956; Yan, Yang, 1991.
ПРОЭМБРИО (греч. pro — пред-, перед и embruon — зародыш) —
не дифференцированный на органы зародыш на ранних стадиях
развития. Синоним: предзародыш.
Термин, по-видимому, заимствован из эмбриологии архегониатных
растений, у которых образованию зародыша (спорофита) предшествует
формирование талломоподобной структуры (гаметофита) — продукта
ооспоры (см., например, Favre-Duchartre, 1989). По аналогии с архе-
гониатными растениями, термин проэмбрио (нем. «Vorkeim») был введен
Hofmeister (1849) для обозначения особой глобулярной структуры,
возникающей из верхней (апикальной) клетки, продукта деления зиготы и
предшествующей формированию дифференцированного на органы
зародыша покрытосеменных растений. Такое представление сложилось в
связи с тем, что у первых исследованных видов растений (Capsella bursa-
pastoris, некоторые Orchidaceae), из дериватов апикальной клетки
образуется собственно зародыш (тело зародыша), в то время как из
дериватов базальной клетки формируется только суспензор (подвесок).
Поэтому многие авторы длительное время называли базальную клетку
«инициальной клеткой суспензора». В понимании Hofmeister термин
«проэмбрио» был принят Hanstein (1870) и использован им для харак-
2 -| —828 .
322
Семя
теристики зародыша на ранних стадиях развития у некоторых двудольных
и однодольных растений.
Дальнейшими исследованиями было установлено,что собственно
зародыш может возникать из производных не только апикальной, но и
базальной клетки двуклеточного зародыша, в связи с чем термин
проэмбрио стал пониматься как зародыш на ранних стадиях развития до
его дифференциации на ткани и органы. Однако критерии, положенные
в основу выделения стадии проэмбрио разными авторами, были
различны.
Schnarf (1929) полагал, что проэмбрио следует называть зародыш
только на самых ранних стадиях развития — до появления первых
вертикальных делений в его самой верхней клетке и начала
трехмерного роста собственно зародыша. По его мнению, Т-образный
четырехклеточный зародыш уже не является проэмбрио, в отличие
от линейного нитевидного зародыша, состоящего из 8-9 и более
клеток, расположенных в один ряд. Такое представление легло в
основу выделения им «нитевидной» стадии развития зародыша.
Soueges (1935a, b, 1937,1939b) и другие исследователи французской
эмбриологической школы считали, что стадия проэмбрио завершается с
переходом зародыша к заложению семядолей, т. е. к началу
органогенеза. В таком объеме термин проэмбрио используется некоторыми
современными авторами (Jtirgens, Mayer, 1994).
Согласно Johansen (1950), стадия проэмбрио, как правило,
завершается формированием шестнадцатиклеточного зародыша (четвертая
клеточная генерация), после чего начинается удлинение клеток подвеска и
процесс гистогенной дифференциации зародыша.
Яковлев (1971,1981) полагал, что важным критерием окончания
стадии проэмбрио является заложение эмбриодермы (протодермы), что
было положено им в основу разделения проэмбрионального и
эмбрионального периодов (фаз) в развитии зародыша (см. Эмбриогения).
Согласно автору, проэмбриональный период характеризуется
последовательным нарастанием числа клеток зародыша при отсутствии его
тканевой дифференциации, а также увеличением объема ядер в клетках и
интенсивности синтеза ДНК в них.
Следует отметить, что ряд авторов (Батыгина, 1974; Поддубная-
Арнольди, 1976) справедливо считают употребление термина
«проэмбрио» неправомерным, так как развитие зародыша представляет
единый процесс и трудно выявить момент, когда заканчивается
формирование проэмбрио и начинается развитие зародыша. Тем не менее
понятие «проэмбрио» широко используется в современной литературе
и лишь некоторые авторы предпочитают использование других
терминов, например, «предглобулярный зародыш» (Meinke, 1986). Как
свидетельствуют многочисленные данные, в ходе формирования
проэмбрио осуществляется ряд значительных морфогенетических событий
(начало трехмерного роста и тканевой дифференциации). Поэтому
Зародыш
323
стадия проэмбрио является одной из наиболее важных, критических
стадий эмбриогенеза (см. Эмбриогения).
Первое детальное исследование последовательности клеточных
делений в проэмбрио было выполнено Hanstein (1870), который описал его
развитие у некоторых двудольных (Capsella bursa-pastoris) и
однодольных (Alisma plantago) растений с позиции теории гистогенов (или
гистогенной дифференциации зародыша). Согласно этой теории, на
ранних стадих развития в проэмбрио возникают инициальные
зародышевые слои — плерома, периблема и дерматоген, дающие в
дальнейшем определенные ткани и органы зародыша. Поскольку теория
гистогенов подразумевает наличие специфической морфогенетическои
способности каждой клетки проэмбрио, в дальнейших исследованиях
основное внимание было уделено выяснению закономерностей деления
клеток в раннем проэмбрио и их участию в формировании основных
гистогенов, структур и органов (Сагапо, 1915; Chiarugi, 1925; Schnarf,
1929; Soueges, 1910-1939).
Для клеток, возникающих в ходе делений зиготы и ее
производных — гистогенов, дающих определенные части зародыша, — была
предложена система условных обозначений (Soueges, 1910, 1939b),
представляющих аббревиатуры французских слов:
са (cellule apicale) — апикальная клетка;
cb (cellule basale) — базальная клетка;
т (cellule intermediate) — средняя клетка;
сг (cellule inferieure) — нижняя клетка;
q — клетки-квадранты, возникающие в результате двух продольных
делений;
I я I' — верхние и нижние клетки-октанты, возникающие в
результате поперечного деления клеток-квадрантов;
ее и cd — верхняя и нижняя клетки, возникающие в результате
поперечного деления апикальной клетки;
рсо (partie cotylee) — семядольная область;
pvt (point vegetative de la tige) — точка роста стебля (апекс
побега);
phy (partie hypocotylee) — гипокотилярная область;
ice (initiales du cilindre central de la tige et de la racine) — инициа-
ли центрального цилиндра стебля и корня;
iec (initiales de Гёсогсе de la racine) — инициали коры корня;
со (coiffe) — корневой чехлик;
s (suspenseur) — суспензор (подвесок).
Для характеристики развития проэмбрио было введено понятие
клеточных генераций, наиболее важными из которых являются
первые пять, и установлены основные закономерности клеточных делений
в ходе этих генераций (Soueges, 1939b). В результате деления
зиготы (первая клеточная генерация), которое у большинства
покрытосеменных происходит в поперечном направлении, возникают две
дочерние клетки — апикальная (са) и базальная (cb), расположен-
21*
324 Семя
ные одна под другой. Однако возможны и другие способы деления
зиготы, например, продольное или наклонное. Во второй клеточной
генерации, в результате деления обеих клеток диады, возникает
тетрада клеток, строение которой в зависимости от направления
делений также может быть различным. Различают линейные, Т-
образные, изобилатеральные и крестообразные тетрады. В третьей
клеточной генерации две верхние клетки тетрады образуют путем
вертикальных делений квадранты. В четвертой клеточной
генерации в результате деления клеток квадрантов образуются октанты,
которые могут формироваться двумя основными способами — путем
поперечного деления клеток квадрантов, с образованием этажей, или
ярусов I и V, и диагональными перегородками, при которых октанты
располагаются в один этаж q. Согласно Soueges, именно октанты
являются первыми элементами зародыша, на основе которых и будет
идти дальнейшее развитие его структур и органов — семядолей,
эпикотиля и, в ряде случаев, гипокотиля. В ходе пятой клеточной
генерации, в результате периклинальных делений клеток октантов
происходит отделение слоя протодермы. Как правило, в этот период
в базальной части проэмбрио происходит формирование гипофизиса,
а в апикальной — эпифизиса. Согласно Soueges (1934),
производные этих клеток в дальнейшем дают апикальные меристемы корня
и побега зародыша, соответственно.
В ходе первых клеточных генераций ярусность проэмбрио является
четко выраженной, однако благодаря быстрому делению клеток в
разных направлениях она постепенно утрачивается и выявить ее на
поздних стадиях развития проэмбрио становится затруднительным. Поэтому
точно определить, какие клетки дали начало тем или иным органам
зародыша, — чрезвычайно сложная задача.
Приведенная выше схема гистогенной дифференциации проэмбрио
свойственна большинству покрытосеменных растений, однако время
дифференциации и способы образования основных гистогенов
характеризуются большим разнообразием. Принято считать, что в целом не
существует принципиальных различий в формировании проэмбрио на
ранних этапах его развития у двудольных и однодольных растений
(Soueges, 1939b; Johansen, 1950; Guignard, 1975b). Однако для
ряда однодольных растений (Poaceae, Commelinaceae) установлено
наличие дорзовентральности строения зародыша, проявляющейся в
специфической наклонной ориентации уже самых первых
перегородок в нем и связанной с типом симметрии зародыша однодольных.
Интересно, что сходная дорзовентральность проэмбрио обнаружена у
представителей некоторых, главным образом, примитивных, таксонов
двудольных растений — Juglandaceae, Nelumbonaceae, Ranunculaceae
(Батыгина, 1968а, 1974, 1987; Titova, Batygina, 1996; см. также Gra-
minad-тип эмбриогенеза; Asterad-тип эмбриогенеза) и в ряде работ
(Nast, 1941; Babis, 1976) также послужила основой для выделения
Зародыш
325
особых типов эмбриогенеза. Существуют виды, у которых трудно
выделить какие-либо закономерности гистогенной дифференциации
проэмбрио (так называемые иррегулярные типы развития зародыша, по
Soueges, 1936d; аномальные типы, по Maheshwari, 1950; типы с
задержанной гистогенной дифференциацией, по Haccius, Bhandari,
1975). Следует отметить, что классические представления о важном
значении законов клеточных генеалогий в развитии зародыша в
настоящее время подвергнуты критике. Принято считать, что функцию
клетки определяет скорее ее положение, чем предшествующий ход
развития (Christianson, 1986; Poethig, 1989; de Jong, 1993). Однако у
большого числа видов ход развития проэмбрио характеризуется
удивительным постоянством, и, вероятно, не следует окончательно ставить
точки над «i» в этом вопросе (Барлоу, 1994). Закономерности первых
четырех клеточных генераций легли в основу характеристик
эмбриональных типов в системах Schnarf (1929), Soueges (1939), Johansen
(1950), Periasamy (1977) и Yamazaki (1974, 1982). Все эти вопросы,
а также особенности ультраструктуры формирующегося проэмбрио,
генной регуляции его развития и др. освещены в соответствующих
статьях настоящего издания (см. Эмбриогения; Зигота; Протодерма;
Эпифизис; Гипофизис; Ультраструктурные аспекты эмбриогенеза;
Гистохимические и иммуногистохимические аспекты эмбриогенеза;
Принципы классификации типов эмбриогенеза). Рис. 25.
Батыгина, 1968а, 1974, 1987; Барлоу, 1994; Поддубная-Арнольди, 1976; Яковлев,
1971, 1981; Babis, 1976; Carano, 1915; Chiarugi, 1925; Christianson, 1986; Favre-Du-
chartre, 1989; Guignard, 1975b; Haccius, Bhandari, 1975; Hanstein, 1870; Hofmeister,
1849; johansen, 1950; de Jong, 1993; Jurgens, Mayer, 1994; Meinke, 1986; Nast, 1941;
Natesh, Rau, 1984; Periasamy, 1977; Poethig, 1989; Schnarf, 1929; Soueges, 1910, 1934,
1935a, b, 1936d, 1937, 1939b; Yamazaki, 1974, 1982.
СУСПЕНЗОР (лат. suspendo — подвешивать) — специализированный
орган зародыша, который дифференцируется из базальной клетки
проэмбрио (сЬ) или ее производных, служит для обеспечения
развивающегося зародыша питательными и ростовыми веществами и, часто, для
его продвижения вглубь эндосперма. Суспензор морфологически не
участвует в построении собственно зародыша и в зрелом семени, как
правило, не сохраняется. Синоним: подвесок.
Термин предложил Меуеп (1840), однако он считал, что суспензор
образуется из кончика пыльцевой трубки. Впервые суспензор как
составную часть зародыша предложил рассматривать Radlkofer (1857).
Зародыш посредством суспензора прикрепляется к стенке
зародышевого мешка и через нее контактирует с нуцеллусом или интегумен-
том. Суспензор имеет большое морфологическое разнообразие. Он
может быть одно- или многоклеточным, слабо или отчетливо
дифференцированным, разнообразным по форме (нитевидный, колонко-
видный, сферический и др. или сложной неправильной формы), может
состоять из однородных клеток или быть дифференцированным на
326
Семя
различные ткани. Так, в случае сильного разрастания базальных сус-
пензорных клеток, между ними и собственно зародышем обычно
формируется шейкообразная часть суспензора, состоящая из небольших
одноядерных клеток. Суспензорные клетки могут быть одно- и
многоядерные, с ди- и полиплоидными ядрами, в том числе с политенными
хромосомами, а также с различными утолщениями клеточной оболочки.
Такие вариации возможны даже среди клеток одного суспензора.
Строение суспензора зародыша является характерным признаком
таксонов разного ранга, как целого порядка или отдельного семейства,
так и рода или вида. Например, крупноклетный пузыревидный суспен-
зор характерен для представителей порядков Caryophyllales, Alisma-
tales, нитевидный суспензор — для представителей Scrophulariales,
гроздевидный — для Convolvulales. Семейства, объединяемые в указанных
выше порядках, как правило, имеют единообразное строение суспензора.
В некоторых семействах наблюдаются вариации в строении суспензора,
особенно многочисленные среди представителей Fabaceae (Guignard, 1880,
1882; Lersten, 1983), Orchidaceae (Treub, 1879; Swamy, 1949; Поддуб-
ная-Арнольди, 1960, 1976). В этих семействах строение суспензора
является характерным родовым признаком.
Создание классификации типов суспензора затруднено его большим
морфологическим разнообразием. Попытки классифицировать суспен-
зоры в отдельных семействах, например, у орхидных (Swamy, 1949a;
см. Эмбриогенез орхидных) не получили дальнейшего развития.
Обычно отмечают форму сформированного суспензора, некоторые
особенности его клеток (Guignard, 1880; Lloyd, 1902; Swamy, 1947;
Maheshwari, 1950; Поддубная-Арнольди, 1964, 1976; Natesh, Rau,
1984), но это не дает полной характеристики его строения. Отсутствие
классификации типов суспензора цветковых растений затрудняет
обобщение данных, касающихся различных аспектов развития этой
структуры — гистохимического, биохимического, физиологического, а в
целом функционального и эволюционного.
Для создания морфогенетической классификации типов суспензора
мы предлагаем учитывать комплекс признаков, объединяемых условно
в 4 группы.
Первая группа признаков (А) охватывает морфологические
особенности суспензора: общую форму, степень тканевой дифференциации,
наличие или отсутствие гаусториальных выростов, число и размеры
клеток, число и плоидность ядер в клетках, наличие лабиринта
клеточной оболочки и другие признаки.
Вторая группа признаков (Б) характеризует связи суспензора с
окружающими структурами, включая направление его роста и контакт
с теми или иными тканями развивающегося семени. Эти признаки
редко учитываются при характеристике суспензора. У большинства
видов разрастание суспензора происходит внутри зародышевого мешка,
в ткани эндосперма. Однако у ряда видов суспензор вырастает из
зародышевого мешка полностью или частично и внедряется в сомати-
Зародыш
327
ческие ткани семени или даже завязи. Такое поведение суспензора,
очевидно, связано с характером отложения запасных веществ в тканях
развивающегося семени и плода, а также с другими их особенностями.
Например, у видов Sedum из базального конца пузыревидной клетки
суспензора образуется трубчатый гаусторий, который проникает в ин-
тегумент, содержащий запасные углеводы (Никитичева, 1985а). У
видов Tropaeolum суспензорные гаустории внедряются в интегумент, в
стенку завязи и в плаценту, достигая сосудистого пучка; в этих тканях
содержатся в изобилии запасные вещества (Walker, 1947).
У некоторых орхидных, характеризующихся, как известно,
редуцированным эндоспермом, суспензор с первых этапов растет в микропи-
лярном направлении, выходя через микропиле развивающегося семени,
бедного запасными веществами, далее растет вдоль фуникулуса и
внедряется в богатую крахмалом ткань плаценты (например, Ophrys, На-
benaria — Swamy, 1949; Cymnadenia — Шамров, Никитичева, 1992).
Третья группа признаков (В) касается генезиса суспензора, т. е.
происхождения его из определенных гистогенов раннего проэмбрио.
Для этой характеристики можно использовать систему мегархетипов,
предложенную Soueges (1939). Основываясь на судьбе производных
клеток са и cb, Soueges выделил 6 мегархетипов эмбриогенеза, в
нисходящей серии которых отражена и судьба суспензора (см. Эмбри-
огения).
Из этих формул следует, что суспензор происходит или
непосредственно из клетки cb, или из ее производных. Если в I мегархетипе суспензор
является одним из шести элементов зародыша, производных от cb, то в
следующих мегархетипах конструктивные возможности cb последовательно
уменьшаются. В VI мегархетипе эта клетка без деления становится
инициальна суспензора, т. е. происходит наиболее ранняя дифференциация
суспензора при первом делении зиготы. Относительное время дифференциации
суспензора зародыша того или иного таксона может являться важным мор-
фогенетическим показателем его эволюционного уровня. Ранняя
дифференциация суспензора встречается у представителей ряда
высокоорганизованных семейств (Caryophyllaceae, Haloragaceae и др.)
Четвертая группа признаков (Г) характеризует период дегенерации
суспензора относительно стадии развития собственно зародыша по
комплексу морфологических и биохимических признаков.
Таким образом, можно предложить ключ к морфогенетической
классификации типов суспензора, которая учитывает как морфологические
признаки, так и особенности его развития и взаимосвязи с другими
структурами.
А. Морфологические признаки суспензора (С.) и направление
его роста:
1 — С. не дифференцирован, его роль выполняют несколько
однородных неспециализированных клеток (Peperomia, Cynomorium);
2 — С. нитевидный, из однородных вытянутых вакуолизированных
328
Семя
одноядерных клеток (Lathraea, Pinguicula, виды Loranthaceae), растет
вглубь эндосперма;
3 — С. нитевидный, из однородных вытянутых вакуолизированных
одноядерных клеток, вырастает за пределы развивающегося семени,
достигая плаценты (Gymnadenia, Ophrys);
4 — С. многоклеточный, гроздевидный, из небольших одноядерных
клеток (Cytisus, Convolvulus);
5 — С. состоит из пузыревидно разросшихся многоядерных клеток
и небольшой группы клеток «шейки» (Cuscuta reflexa, С. monogyna);
6 — С. сложный, состоит из пузыревидно разросшейся базальной
клетки (или двух клеток) с эндополиплоидным ядром и группы клеток
«шейки» (Capsella, Scheuchzeria, MyriophyUum);
7 — С. многоклеточный с гаусториальными выростами в эндосперм
(Asperula, Ipomoea obscura);
8 — С. сложной структуры, с гаусториальными выростами за
пределы зародышевого мешка (Trapa, Sedum) и семени (Tropaeolum).
(1, 2, 4, 5, 6, 7 — суспензор находится в пределах зародышевого
мешка).
Б. Контакт суспензора с теми или иными окружающими
тканями зародышевого мешка, развивающегося семени и плода:
1 — синергидами, 2 — эндоспермом, 3 — нуцеллусом, 4 — ин-
тегументом, 5 — фуникулусом, 6 — плацентой, 7 — сосудистым
пучком семени, 8 — сосудистым пучком плаценты или стенки завязи.
В. Происхождение суспензора и относительное время
дифференциации:
1 — из неподелившейся клетки сЬ (основная часть) и иногда
дополнительно из производных клетки са, образующих «шейку»
суспензора (мегархетип VI);
2 — из дочерних или внучатых производных клетки сЬ
(мегархетип V, IV);
3 — из отдаленных потомков клетки сЬ (мегархетипы III, II, I).
Г. Относительное время дегенерации суспензора:
1 — в период формирования гистогенов на глобулярной стадии
развития зародыша (Orobanche, Pinguicula);
2 — в начальный период органообразования, на сердечковидной
стадии развития зародыша (Lathraea);
3 — в период роста и развития органов зародыша — семядолей,
апексов побега и корня (Phaseolus, Capsella, Trapa, Polygala);
4 — в период дозревания зародыша, при частичном сохранении в
зрелом семени (Sedum).
Далеко не для всех видов степень эмбриологической изученности
позволяет дать полную характеристику суспензора, однако ряд видов
уже более или менее детально исследован. Приведем несколько
примеров, используя нумерацию признаков для краткой характеристики
строения суспензора. Наиболее хорошо изученный на гистохимическом
уровне суспензор зародыша Phaseolus coccineus можно характеризо-
Зародыш
329
вать как многоклеточный, состоящий из гроздевидной головчатой
базальной части и удлиненной «шейки» («рукоятки» — «handle», по
терминологии Avanzo et al., 1970) (А6); контактирует в основном с
эндоспермом (Б2); производный потомков клетки cb (B2);
дегенерирует на стадии роста и развития семядолей (ГЗ). Его тип морфогенеза
можно выразить формулой: А6 + Б2 + В2 + ГЗ.
Суспензор Lathraea squamaria, как у большинства представителей
Scrophulariaceae, нитевидный, из однородных вытянутых одноядерных
клеток (А2), имеющий контакт на значительном протяжении с хорошо
развитым клеточным эндоспермом и на небольшом участке с интегу-
ментом (Б2, 4), образуется из внучатых производных клетки сЬ в
соответствии с IV мегархетипом Soueges (B2), дегенерирует на
сердечковидной стадии развития зародыша (Г2). Его краткая Формула
будет: А2 + Б2, 4 + В2 + Г2.
Суспензор Sedum hispanicum (Crassulaceae) расчленен на 3
специализированные части: пузыревидно разросшуюся базальную клетку (с
гипертрофированным ядром и лабиринтом клеточной оболочки), от которой
отходят тонкие длинные гаусториальные выросты, внедряющиеся в инте-
гумент, а также небольшую двуслойную «шейку» (А8). Вследствие
сложного строения суспензор контактирует с различными тканями:
эндоспермом, нуцеллусом и интегументами (Б2, 3, 4); происхождение суспензора
находится в соответствии с VI мегархетипом (В1); базальная
гипертрофированная клетка сохраняется до созревания семени (Г4). Общая
формула: А8 + Б2, 3, 4 + В1 + Г4.
В эволюции растений суспензор возник как специализированный
орган зародыша, обеспечивающий его развитие в семени. Суспензор
является полифункциональным органом. В настоящее время
большинство эмбриологов предполагают три основных функции суспензора:
1) перемещение зародыша в наиболее благоприятные для его развития
условия; 2) абсорбция и транспорт питательных веществ из
окружающих соматических тканей к развивающемуся зародышу; 3) синтез
ростовых веществ.
Функция заглубления зародыша в массивный эндосперм (см. Ма-
heshwari, 1950; Поддубная-Арнольди, 1964, 1976) подтверждается
морфологическими картинами постепенного удлинения суспензора и
перемещения зачатка нового спорофита вглубь эндосперма у многих
видов цветковых растений (например, представителей Scrophulariales).
Предположение об абсорбирующей и питательной функциях суспензора
подтверждается рядом косвенных доказательств, касающихся его строения.
Так, еще Lloyd (1902), обнаружив у некоторых Rubiaceae суспензор с
разветвленными в ткань эндосперма гаусториями, рассматривал его в
качестве временного зародышевого корня. Своим базальным участком
суспензор прикреплен к нуцеллусу или интегументу; в тех таксонах, где нуцел-
лус разрушается, часто образуются гаусториальные выросты суспензора в
ткани интегумента или завязи, богатые запасными веществами. Ценоцит-
ное состояние и наличие лабиринта клеточной оболочки обнаружены у
330
Семя
клеток суспензора ряда таксонов. Все эти данные свидетельствуют об
абсорбирующей роли этих клеток.
Исследования, проведенные методами биохимии, авторадиографии и
электронной микроскопии, выявили важные детали тонкого строения
суспензора, подтверждающие его абсорбирующую и транспортную
функции (см. Ультраструктурные особенности суспензора). Клетки
суспензора связаны между собой и с собственно зародышем
многочисленными плазмодесмами; последние отсутствуют в поверхностных стенках
клеток (Schulz, Jensen, 1969). В базальных клетках суспензора клеточная
оболочка обычно неравномерно утолщена, в микропилярной ее части у
многих видов обнаружены выросты (лабиринт) оболочки внутрь клетки
(Marinos, 1970; Schnepf, Nagl, 1970; Newcomb, Fowke, 1974). У Capsella
bursa-pastoris отмечено образование выростов оболочки в сторону
эндосперма на латеральных стенках базальной клетки суспензора (Schulz,
Jensen, 1969), что свидетельствует об их транспортной функции. Интересен
тот факт, что на наружных стенках клеток суспензора у Reseda lutea, в
отличие от клеток собственно зародыша, кутикула не обнаружена
(Яковлев, Чабан, 1979), что также подтверждает возможность транспорта
веществ в суспензор из окружающих тканей.
В гипертрофированных клетках суспензора выявлены ядра с
высокой степенью плоидности (до 4096х) и ядра с политенными
хромосомами, свидетельствующие о высокой синтетической активности
этих клеток (Nagl, 1962, 1974; D'Amato, 1984; Bohdanowicz, 1987).
В цитоплазме суспензорных клеток обнаружены углеводы, липиды,
вещества белковой природы, РНК и аскорбиновая кислота, ростовые
вещества типа ауксинов и гиббереллинов. Липиды накапливаются в
суспензоре к стадии глобулярного зародыша, постепенно расходуясь в
процессе роста последнего, протеины и нуклеиновые кислоты
выявляются на поздней глобулярной стадии (Schulz, Jensen, 1969). Уровень
клеточного белка в суспензоре достигает максимума на сердечковидной
стадии зародыша (Sussex et al., 1973). Установлено, что активность
гиббереловой кислоты в клетках суспензора Phaseolus выше, чем в
меристематических клетках проэмбрио (Alpi et al., 1975). Скорости
синтеза РНК и белков в клетках суспензора также значительно выше,
чем в собственно зародыше, особенно на ранних стадиях его развития
(Sussex et al., 1973; Bhalla et al., 1981), что показано для Phaseolus
и Tropaeolum.
У многих видов в базальных клетках суспензора отмечен обильный
эндоплазматический ретикулум. Показано, что количество элементов ЭР
постепенно увеличивается ко времени максимального развития структуры
(Schulz, Jensen, 1969; Newcomb, Fowke, 1974; Khera et al., 1976;
Яковлев, Чабан, 1979). Около протуберанцев клеточной оболочки
сосредотачивается большое число митохондрий, которые, как полагают,
снабжают энергией активный транспорт метаболитов и обеспечивают высокий
уровень клеточного метаболизма. Многочисленные митохондрии и
лейкопласты обнаружены в клетках с политенными хромосомами; в этих клетках
Зародыш
331
происходят активные экструзии ядерного материала в цитоплазму (Avan-
zi et al., 1970). Предполагают, что, кроме синтеза нуклеиновых кислот
и протеинов, клетки суспензора могут производить регуляторы роста
(Shnepf, Nagl, 1970), что подтверждается наличием в них триптофана —
предшественника растительного гормона (Avanzi et al., 1970). Активную
поглощающую роль суспензора у Phaseolus подтвердили
экспериментальные авторадиографические исследования (Yeung, 1980).
Соотношение основных функций суспензора — механической
(перемещение зародыша вглубь эндосперма), транспортной, запасающей и
питательной, вероятно, зависит от комплекса факторов, создающихся в
развивающемся семени. Обнаружены определенные корреляции в
строении суспензора и окружающих его структур. Mestre и Vannerau (1980),
анализируя питательное обеспечение зародыша, установили четыре типа
развития семени, учитывая признаки строения суспензора и эндосперма.
I тип характеризуется отсутствием эндосперма и компенсацией его функции
хорошо развитым суспензором (Orchidaceae). II тип характеризуется
крупным суспензором в сочетании с ядерным, небольшим по объему,
эндоспермом (Phaseolus, Pisum, Stellaria, Tropaeolum). Ill тип — с обильным
нуклеарным эндоспермом (Linum), суспензор играет роль активного
переносчика питательных веществ. В IV типе сочетается целлюлярный эндосперм
и удлиненный суспензор. Erdelska (1981b) также высказывает мысль о
влиянии типа эндоспермогенеза на динамику развития проэмбрио.
Строение суспензора коррелирует не только с типом эндосперма, но
и с особенностями развития эндосперма и нуцеллуса (Nikiticheva, 1983;
Никитичева, 1983б). Например, короткий суспензор, имеющий широкое
основание, характерен для таксонов с небольшим эндоспермом и
развитой, длительно сохраняющейся париетальной тканью нуцеллуса (Sche-
uchzeria). У таксонов с рано разрушающимся или не развивающимся
эндоспермом образуется мощный, сложнодифференцированный
суспензор, имеющий контакт с тканью подиума (Тгара — Титова, 1988, 1996).
Суспензор с гаусториальными выростами, выходящими за пределы
зародышевого мешка, обычно наблюдается в таксонах с тенуинуцеллятным
семязачатком, характеризующимся ранней редукцией нуцеллуса,
массивностью интегумента и наличием в нем запасных веществ; при этом
эндосперм, как правило, небольшой (Tropaeolum, Sedum). Нитевидный
структурно упрощенный тип суспензора характерен для таксонов с
тенуинуцеллятным семязачатком и интенсивно развивающимся целлюляр-
ным эндоспермом с гаусториями. При этом собственно зародыш
погружается в центр массивного эндосперма, а суспензор может достигать длины
до 500 мкм, как у Tozzia alpina (Никитичева, Терёхин, 1973). Ранняя
дегенерация суспензора в этом случае обусловлена переходом зародыша к
абсорбции всей своей поверхностью содержимого клеток обильного
эндосперма, запасы которого пополняются за счет эндоспермальных гаусториев,
что характерно для представителей семейства Scrophulariaceae.
В новейших работах экспериментально показано также взаимовлияние
собственно зародыша и суспензора (Schwartz et al., 1994). В настоящее
332
Семя
время в литературе все более утверждается идея о взаимодействии сус-
пензора со всеми структурами семени (Yeung, Meinke, 1993).
Так как суспензор формируется как специализированный орган,
обеспечивающий питание молодого спорофита в развивающемся
семени, его эволюционные морфологические преобразования происходили в
тесной взаимосвязи с преобразованиями всех структур семени и
завязи, в первую очередь, в связи с особенностями локализации запасных
веществ в эндосперме, нуцеллусе, интегументе и плаценте (Nikiticheva,
1983). Эволюционные преобразования суспензора, вероятно,
происходили в направлении от нескольких слабо специализированных клеток
базальной части зародыша, прикрепляющих его к нуцеллусу до
специализированной структуры, имеющей отчетливую границу с собственно
зародышем и отмирающей по выполнении своей функции. Следующим
этапом эволюции суспензора могло быть приобретение им
абсорбционных и секреторных свойств, признаками которых являются развитие
ЭР и лабиринта клеточной оболочки, активность диктиосом, полипло-
идизация ядер и т. д., а также усложнение суспензорного аппарата.
Вторичное упрощение структуры суспензора у спайнолепестных, по-
видимому, происходило в связи с ранним переходом их собственно
зародыша на активное самостоятельное поглощение веществ из хорошо
развитого эндосперма.
В последнее десятилетие наметился прогресс в изучении суспензора
зародыша, чему способствует сочетание традиционных методов
исследования с генетическими и экспериментальными (Yeung, Meinke, 1993).
Рис. 26, 33.
Монтеверде, 1880; Никитичева, 1983; Поддубная-Арнольди, 1960, 1964, 1976; Фа-
минцын, 1879; Цингер, Поддубная-Арнольди, 1959; Яковлев, Чабан, 1979; Alpi et
al., 1975; Avanci et al., 1970; Bhalla et al., 1981; Bohdanowicz, 1987; Erdelska, 1981b,
1986; Guignard, 1880; Khera et al., 1976; Lersten, 1983; Lloyd, 1902; Mestre,
Vannereau, 1980; Meyen, 1840; Nagl, 1962, 1974; Natesh, Rau, 1984; Newcomb,
Fowke, 1974; Nikiticheva, 1983; Ponzi, Pizzolongo, 1972; Radlkofer, 1857; Schnarf,
1927 (1929); Schnepf, Nagl, 1970; Schulz P., Jensen, 1969; Schwartz et al., 1994;
Soueges, 1939; Sussex et al., 1973; Swamy, 1947, 1949; Walker, 1947; Yeung, 1980;
Yeung, Meinke, 1993.
УЛЬТРАСТРУКТУРНЫЕ ОСОБЕННОСТИ СУСПЕНЗОРА
Суспензор является производным либо только базальной клетки дву-
клеточного проэмбрио, либо базальной клетки с той или иной долей
участия производных апикальной клетки. Эти клетки различаются не
только своими размерами и формой, но и структурой протопластов и
клеточных оболочек. В основе различий лежит структурная полярность
яйцеклетки, усиливающаяся в зиготе перед ее делением. О структурной
дифференциации апикального и базального полюсов двуклеточного про-
Зародыш
333
эмбрио можно судить исходя из сравнительного анализа ультраструктуры
его клеток у Gossypium hirsutum (Jensen, 1964), Capsella bursa-pastoris
(Schulz R., Jensen, 1968a, b; Schulz P., Jensen, 1969), Linum usitatissimum
(Deschamps, 1969; d'Alascio-Deschamps, 1973), Hordeum vulgare (Cass,
Jensen, 1970), Quercus gambelii (Singh, Mogensen, 1975), Epipactis atrorubens
(Жукова, Савина, 1978), Petunia hybrida (Vallade, 1980), Alcea rosea
(Zhukova, 1981; Камалова и др., 1983; Жукова, неопубл. данные) и
Pennisetum glaucum (Taylor, Vasil, 1995). Базальная клетка Capsella bursa-
pastoris (Schulz R., Jensen, 1968b), Alcea rosea (Жукова, 1988) и большинства
других исследованных видов характеризуется более крупным, округлым ядром
(в апикальной клетке A. rosea, например, ядро намного мельче и лопастное)
и менее электроноплотной цитоплазмой. Исключение составляет Epipactis
atrorubens (Жукова, Савина, 1978; Жукова, неопубл. данные), у
которого оба ядра клеток двуклеточного проэмбрио одинакового размера и
округлой формы, а цитоплазма обеих клеток одинаковой плотности при
наблюдении как под световым, так и электронным микроскопом.
Базальная клетка содержит меньше рибосом на единицу объема
протопласта, чем апикальная, что опять же характерно не для всех
исследованных видов. Так, у Capsella bursa-pastoris (Schulz R., Jensen, 1968)
и Epipactis atrorubens (Жукова, Савина, 1978) плотность рибосом в
обеих клетках одинакова. Полярность по плотности рибосом выявляется
на стадии трех- и четырехклеточного проэмбрио. Вакуоли в апикальной
клетке двуклеточного проэмбрио Gossypium hirsutum, Capsella bursa-
pastoris, Linum usitatissimum, Quercus gambelii, Epipactis atrorubens,
Petunia hybrida и Alcea rosea мельче и их меньше, чем в базальной
клетке. У G. hirsutum, E. atrorubens в апикальной клетке пластиды и
митохондрии сосредоточены в околоядерной зоне, в то время как в
базальной распределение этих органелл менее упорядоченное. На целом
ряде объектов продемонстрирована четкая ультраструктурная полярность
клеток дву- и четырехклеточного проэмбрио по структуре пластид
(Jensen, 1964; Schulz R., Jensen, 1968a, b; d'Alascio-Deschamps, 1973;
Newcomb, Fowke, 1974; Singh, Mogensen, 1975). Базальная клетка
двуклеточного проэмбрио отличается от апикальной и большим количеством
амилопластов и липидных включений. Не обнаружено различий в
содержании липидных включений в клетках двуклеточного проэмбрио
Е. atrorubens. Количество профилей ЭР довольно ограничено в обеих
клетках. При этом базальная клетка выделяется большим содержанием
ЭР, чем апикальная. Отмечена разница и в топографии этой органеллы:
в обеих клетках профили ЭР часто расположены параллельно клеточной
оболочке; в базальной клетке, однако, протяженными цистернами ЭР
окружено и ядро. Базальная клетка двуклеточного проэмбрио
G. hirsutum, в отличие от апикальной, богата трубчатым ЭР (Jensen,
1964). Быстро удлиняющаяся базальная клетка двуклеточного проэмбрио
Capsella bursa-pastoris (Schulz R., Jensen, 1968a, b) отличается от
апикальной клетки большей активностью аппарата Гольджи. У
двуклеточного проэмбрио Epipactis atrorubens обнаружены различия и в структуре
334
Семя
плазмалеммы ее клеток. Базальная клетка двуклеточного проэмбрио
характеризуется наличием выростов клеточной оболочки (Capsella bursa-
pastoris — Schulz R., Jensen, 1968b). У Е. atrorubens наружные
клеточные оболочки обеих клеток извилисты, электроноплотны,
неравномерной толщины. Особенно большие утолщения и выросты характерны
для латеральных клеточных стенок базальной клетки. Эти выросты
наблюдаются не только в самой базальной клетке, но и в клетке эндосперма
в месте их контакта (Жукова, Савина, 1978). Плазмодесмы
наблюдаются в клеточной стенке, разделяющей клетки двуклеточного проэмбрио.
В наружных клеточных стенках исследованных видов плазмодесмы не
обнаружены.
Апикальная и базальная клетки двуклеточного проэмбрио
большинства исследованных видов, таким образом, различаются по размеру и
форме ядер, по свето- и электронооптической плотности гиалоплазмы,
по количеству рибосом на единицу объема протопласта, по степени его
вакуолизации и структуре вакуома, по структуре пластид, по
количеству и топографии мембран ЭР, по степени развития и активности
аппарата Гольджи, по структуре клеточных оболочек.
По мере дальнейшего развития проэмбрио различия в
ультраструктуре клеток суспензора и собственно зародыша становятся еще более
выраженными. Одновременно с этим в суспензоре явственно
проступает структурный градиент (см. ниже) в направлении микропилярно-
халазальной оси зародыша.
В отличие от клеток собственно зародыша, клетки суспензора могут
быть многоядерными или с полиплоидными ядрами, часто их ядра
содержат политенные хромосомы (Cavara, 1899; Nagl, 1962, 1970,
1973, 1974, 1976а-с; Schulz P., Jensen, 1969; Newcomb, Fowke, 1974;
Khera Paramjit, Tilney-Bassett, 1976; Yeung, Clutter, 1979;
Верещагина, 1983a). Полиплодные ядра возникают в основном путем эндоре-
дупликации. У Phaseolus плоидность ядер клеток суспензора
постепенно возрастает по направлению к его микропилярному полюсу; ядро
базальной клетки обладает наиболее высоким уровнем плоидности (см.
Graves, 1908). У разновидностей Ph. vulgaris последний варьирует от
8х до 2048х; у Ph. hysterinus и Ph. multiflorus плоидность достигает
4096х, а у Ph. coccineus гигантские ядра могут претерпевать до 12
циклов эндоредупликации; по данным цитофотометрии количество
ДНК в базальной клетке суспензора составляет 8192С (Brady, 1973).
У этого вида ядра с политенными хромосомами имеют лопастной вид;
отдельные инвагинации ядра достигают хроматина (Nagl, 1976b). На
эвагинациях ядра наблюдаются многочисленные поры.
В проэмбриональной и эмбриональной (на стадии глобулярного
зародыша) фазах развития клетки суспензора по сравнению с клетками
В понимании Яковлева (1972, 1981); см. также Эмбриогения.
Г
| Зародыш 335
собственно зародыша более вакуолизированы (например, у Capsella
bursa-pastoris — Schulz R., Jensen, 1968a, b; Schulz P., Jensen, 1969;
Stellaria media — Newcomb, Fowke, 1974; Diplotaxis erucoides — Si-
moncioli, 1974; Tropaeolum majus — Nagl, 1976c; Phaseolus
coccineus — Nagl, 1977; Yeung, Clutter, 1979; Arabidopsis thaliana —
Mansfield, Briarty, 1991; Pennisetum glaucum — Taylor, Vasil, 1995).
Клетки микропилярного полюса суспензора характеризуются при этом
большей вакуолизацией по сравнению с клетками халазального полюса
(Helianthus annuus — Newcomb, 1973; Pennisetum glaucum —
Taylor, Vasil, 1995; Geranium gracile — Жукова, неопубл. данные).
Клетки суспензора в проэмбриональной фазе эмбриогенеза, а также
на стадии глобулярного и сердечковидного зародыша выделяются и
более развитым ЭР. Особенно обильный ЭР отмечен в суспензоре
Capsella bursa-pastoris (Schulz R., Jensen, 1968a, b; Schulz P., Jensen,
1969) и Pelargonium x hortorum Bailey (Khera Paramjit, Tilney-Bassett,
1976). Длинные профили его мембран тянутся главным образом вдоль
клеточных оболочек. Отмечены различия в форме ЭР. У одних растений,
таких как Phaseolus vulgaris (Nagl, 1970; Schnepf, Nagl, 1970), Ph.
coccineus (Nagl, 1977; Yeung, Clutter, 1979), Ipomoea purpurea (Ponzi,
Pizzolongo, 1972) и Stellaria media (преимущественно в базальной клетке
суспензора, Newcomb, Fowke, 1974), наблюдается большое количество
гладкого ЭР (на фоне свободных рибосом), тогда как у других
(Helianthus annuus — Newcomb, 1973; Stellaria media, во всех клетках
суспензора, кроме базальной, — Newcomb, Fowke, 1974 и Diplotaxis
erucoides — Simoncioli, 1974) формируется гранулярный ЭР.
Клетки суспензора большинства исследованных видов содержат
больше диктиосом, которые находятся в состоянии гиперсекреции
(Schulz P., Jensen, 1969; Simoncioli, 1974). У Helianthus annuus
(Newcomb, 1973) и Stellaria media (Newcomb, Fowke, 1974) однако
диктиосом в суспензоре мало и они выглядят относительно неактивными.
Протопласт клеток суспензора характеризуется меньшей электронной
плотностью и меньшим количеством рибосом, чем протопласт клеток
собственно зародыша (Deschamps, 1968; Schulz R., Jensen, 1968a, b;
Schulz P., Jensen, 1969; Simoncioli, 1974; Yeung, Clutter, 1979;
Mansfield, Briarty, 1991). В суспензоре Diplotaxis erucoides при этом
отмечено уменьшение плотности рибосом на единицу объема протопласта
его клеток в направлении к микропиле (Simoncioli, 1974). Исключение
составляет Reseda lutea, у которой клетки суспензора отличаются от
клеток собственно зародыша большей плотностью рибосом (Яковлев,
Чабан, 1979).
В отличие от клеток собственно зародыша, пластиды клеток
суспензора представлены дифференцированными, метаболически активными
органеллами уже в проэмбриональной фазе и на глобулярной стадии
развития. У Capsella bursa-pastoris (Schulz R., Jensen, 1968a, b; Schulz
P., Jensen, 1969), Helianthus annuus (Newcomb, 1973), Ipomoea purpurea
(Ponzi, Pizzolongo, 1973), Diplotaxis erucoides (Simoncioli, 1974),
336
Семя
Pelargonium x hortorum Bailey (Khera Paramjit, Tilney-Bassett, 1976),
Alcea rosea (Жукова, 1988) пластиды суспензора накапливают крахмал.
Не обнаружено крахмала в этот период эмбриогенеза в суспензоре Reseda
lutea (Яковлев, Чабан, 1979), Vicia faba (Johansson, Walles, 1994).
Пластиды суспензора С. bursa-pastoris (Schulz P., Jensen, 1969) и
Phaseolus coccineus (Yeung, Clutter, 1979) увеличиваются при этом в
числе. Для суспензора С. bursa-pastoris, H. annuus, P. x hortorum Bailey,
Ph. coccineus, Tropaeolum majus характерны также запасные вещества в
виде липидных включений (Schulz R., Jensen, 1968a, b; Schulz P., Jensen,
1969; Newcomb, 1973; Khera Paramjit, Tilney-Bassett, 1976; Nagl, 1976c,
1977). Как известно, лейкопласты зародыша при переходе от глобулярной
к сердечковидной стадии развития у хлороэмбриофитов трансформируются
в хлоропласты (Zhukova, 1978, 1981; Whatley, Price, 1983; Жукова,
1988, 1993; см. также Хлорофиллоносность зародыша как признак
для классификации цветковых растений). При этом у одних
хлороэмбриофитов суспензор сердечковидного зародыша также оказывается
хлорофиллоносным, а у других — пластиды суспензора остаются
лейкопластами. В структуре суспензора зародыша исследованных
цветковых растений, таким образом, наблюдаются различия по типу пластид
(см. таблицу).
Среди бобовых, например, являющихся хлороэмбриофитами, известны
виды, несущие хлоропласты и в суспензорах зародышей. Это показано
на 8 видах Crotalaria (Anantaswamy, 1950). Суспензор хлороэмбриофита
Lupinus albus также характеризуется наличием хлоропластов (Атабеко-
ва, Лин Цзянсин, 1964; Худяк, 1964), правда, со слабо развитыми
гранами и тилакоидами (Davey, 1978). У хлороэмбриофита
Pelargonium х hortorum Bailey (Geraniaceae), исследованного начиная с
сердечковидной стадии, во всех клетках зародыша, включая суспензор,
отмечено наличие хлоропластов. В тонкой организации этих органелл у
зародыша и суспензора, однако, обнаружены различия. На всех стадиях
развития форма хлоропластов неправильная, но исключительно
своеобразной она выглядит у хлоропластов суспензора. Хлоропласты гаустория
суспензора выделяются наличием супергран большого диаметра (до 40
тилакоидов в пачке). Описаны и другие различия (Khera, Tilney-Bassett,
1976). У Reseda lutea хлоропласты суспензора отличаются от
хлоропластов клеток собственно зародыша более мощным развитием
периферического пластидного ретикулума (Яковлев, Чабан, 1979). Пластиды
суспензора хлороэмбриофитов С. bursa-pastoris (Schulz P., Jensen, 1969),
Pisum sativum (Marinos, 1970), Phaseolus vulgaris (Schnepf, Nagl,
1970), Diplotaxis erucoides (Simoncioli, 1974), Phaseolus coccineus (Nagl,
Подобно Schimper (1885) и Wareing, Phillips (1978), под основными типами
зрелых пластид автор понимает хлоропласты, лейкопласты и хромопласты, положив в
основу их классификации пигментный набор (или отсутствие такового). По мнению
автора, характер запасных веществ — один из критериев подтипа, но не типа пластид.
Зародыш
337
Таблица. Сводка даииых о типе пластид зародыша и суспензора
у цветковых растений1 '
Вид растения
Alcea rosea L.
Capsella bursa-pastoris (L.) Medik.
Helianthus annuus L.
Ipomoea purpurea (L.) Roth
2-
Linum usitatissimum L.
2
Pelargonium x hortorum Bailey
Phaseolus coccineus L.
Pisum sativum L.
Reseda lutea L.
Stellaria media (L.) Cyrill.
Tropaeolum majus L.
Vicia faba L.
Тип пластид
зародыша
собственно
зародыш
Л
Л
Хл
Л
л
Хл
л*
л*
Хл*
л
л
Хл
Хл
Хл
Хл
л
л
Хл
Хл
л
л
л
Хл
л*
л*
л*
Хл
л
Хл не
обнаружены
Хл
суспензор
Л
л
л
л
л
л
л
л
л
л
л
л
Хл
Хл
Хл
Хл
л
л
л
л
л
л
Хл
л
л
л
л
л
Хл
л
л
суспензор
элиминирован
Фаза, стадия
эмбриогенеза
проэмбриональная фаза
эмбриональная фаза:
стадия шаровидного 3
стадия сердечковидного 3
восьмиклеточный 3
глобулярный 3
сердечковидный 3
проэмбрио
поздний глобулярный 3
сердечковидный 3
в суспеизоре — на всех
стадиях развития 3
двуклеточный проэмбрио
глобулярный 3
сердечковидный 3
сердечковидный 3
ранний вытянутый 3
полн. сформированный 3
3 зрелого семени
поздняя глобулярная
стадия
сердечковидная стадия
переход к фазе быстрого
роста зародыша
проэмбрио
ранний глобулярный 3
глобулярный 3
стадия заложения
семядолей в 3
трехклеточный 3
нитевидный 3
глобулярный 3
сердечковидный 3
торпедовидный 3
сердечковидная стадия
глобулярный 3
сердечковидный 3
(12 дней после опыления)
сердечковидный 3
(20 дней после опыления)
Ссылки
Жукова, 1988
Schulz R.,
Jensen, 1968a, b;
Schulz P.,
Jensen, 1969
Newcomb, 1973;
* — Яковлев,
Жукова, 1973
Ponzi,
Pizzolongo, 1973;
* — Яковлев,
Жукова, 1973
Deschamps,1969
Deschamps,1968;
Pretova, 1985
Khera Paramjit,
Tilney-Bassett,
1976
Yeung, Clutter,
1979
Marinos, 1970
Яковлев, Чабан,
1979
Newcomb, Fowke,
1974
* — Яковлев,
Жукова, 1973
Nagl, 1976c
Johansson,
Walles, 1994
Примечание: при обозначении стадий эмбриогенеза сохранена авторская терминология; хлоропласты
собственно зародыша и суспензора Linum usitatissimum (судя по снимкам) и Pelargonium x hortorum
различаются своей организацией; хлоропласты собственно зародыша и суспензора Tropaeolum majus имеют
сходную ультраструктуру. Условные обозначения: Хл — хлоропласты, Л — лейкопласты, 3 —
зародыш.
22-828
338
Семя
1977; Yeung, Clutter, 1979) представлены лейкопластами (в собственно
зародыше этих видов на сердечковидной стадии развития наблюдаются
хлоропласты). Пластиды суспензора Linum usiiatissimum (Deschamps,
1968), Capsella bursa-pastoris (Schulz P., Jensen, 1969), Diplotaxis eru-
coides (Simoncioli, 1974), Pelargonium x hortorum Bailey (Khera Param-
jit, Tilney-Bassett, 1976), Alcea rosea (Жукова, 1988, 1992) содержат
заметные количества пластоглобул. Подобные пластиды у Phaseolus сос-
cineus могут рассматриваться скорее как хромопласты (Nagl, 1977;
Yeung, Clutter, 1979).
Различия в ультраструктуре пластид собственно зародыша и
суспензора отмечены и у видов, несущих лейкопласты во всех тканях зародыша.
У Stellaria media (Newcomb, Fowke, 1974) особым своеобразием
ультраструктуры выделяются пластиды суспензора. Уже на трехклеточной
стадии развития лейкопласты базальной клетки отличаются по своей
структуре от пластид двух других клеток проэмбрио. Они крупнее последних.
В них наблюдаются две морфологически различные зоны: внутренняя,
плотно заполненная мелкими трубочками, и окружающая ее зона, менее
плотно упакованная более крупными трубочками. Авторы называют эти
пластиды белковыми пластидами. В ходе эмбриогенеза (этот процесс
прослежен до стадии торпедовидного зародыша) отмечено увеличение
числа чашеобразных профилей у пластид суспензора; особенно много
их наблюдается на глобулярной стадии развития зародыша.
В отличие от собственно зародыша пластидом суспензора у многих
исследованных видов дифференцирован в значительно большей
степени. Пластиды являются одним из компонентов, определяющих
структурный градиент в суспензоре Linum usitatissimum (Deschamps,
1968), Stellaria media (Newcomb, Fowke, 1974), Diplotaxis erucoides
(Simoncioli, 1974), Tropaeolum majus (Nagl, 1976c), Lupinus albus
(Davey, 1978). Отмечены различия не только в размерах пластид,
объем которых возрастает по направлению к микропиле, но и в их
ультраструктуре. Степень морфологической дифференциации пластид
суспензора различна у разных растений. Высокая степень дифференциации
свойственна, например, пластидому суспензора зародыша Tropaeolum
majus. На глобулярной и сердечковидной стадиях развития в
апикальных «розеточных» клетках суспензора наблюдаются хлоропласты без
крахмала, в клетках средней зоны — крахмалоносные хлоропласты, а
в базальных клетках суспензора — лейкопласты с электроноплотным
матриксом. В ультраструктуре хлоропластов халазальных клеток
суспензора каких-либо отличительных черт по сравнению с хлоропластами
собственно зародыша не отмечено. Их внутренняя мембранная система
представлена лишь несколькими тилакоидами. Других морфологических
характеристик хлоропластов не приводится. В гаусториях суспензора
дифференцируются пластиды со своеобразной ультраструктурой: в
одном — этиопласты, а в другом — недифференцированные
лейкопласты, которые в ходе автолиза суспензора преобразуются в пластиды с
электроноплотным матриксом (Nagl, Ktihner, 1976/1977).
Зародыш
339
У ряда видов (Capsella bursa-pastoris, Diplotaxis erucoides, Helianthus
annuus) пластиды суспензора слабо дифференцированы. У большинства
растений, напротив, они характеризуются высокой степенью внутренней
дифференциации. Пластиды суспензора Pisum sativum (Marinos, 1970),
Phaseolus vulgaris (Schnepf, Nagl, 1970; Yeung, Clutter, 1979), Ipomoea
purpurea (Ponzi, Pizzolongo, 1972, 1973), Stellaria media (Newcomb,
Fowke, 1974), Tropaeolum majus (Nagl, Ktihner, 1976/1977), Ph. coc-
cineus (Yeung, Clutter, 1979), Vicia faba (Johansson, Walles, 1994), как
хлоропласты, так и лейкопласты, могут рассматриваться как
высокоспециализированные пластиды. В большинстве случаев такие пластиды
свойственны только суспензору и не встречаются в клетках собственно
зародыша. У Phaseolus vulgaris пластиды суспензора на поздней
сердечковидной стадии претерпевают преобразование, подобное которому
не наблюдалось у других исследованных видов (Schnepf, Nagl, 1970).
Отдельные участки цитоплазмы, содержащие ЭР, полисомы и липид-
ные капли, оказываются охваченными пластидами. Цитохимическими
исследованиями в них установлена высокая активность кислой фосфа-
тазы (Nagl, 1977; Gartner, Nagl, 1980). Такие «пластолисомы» на
более поздних стадиях эмбриогенеза превращаются в автофагические
вакуоли. Они, как полагают, связаны с процессом старения
суспензора. У Ph. coccineus (Yeung, Clutter, 1979) подобные
специализированные пластиды особенно многочисленны на поздней глобулярной и
сердечковидной стадиях. По мере созревания зародыша они исчезают.
Эти пластиды, возможно, играют какую-то специфическую роль в
эмбриогенезе.
В целом считается, что на протяжении проэмбриональной фазы и
глобулярной стадии эмбриональной фазы развития зародыша, например,
Capsella bursa-pastoris, явных изменений в ультраструктуре клеток
суспензора не происходит. В ультраструктуре пластид, однако, они
прослеживаются. На стадии октантов (в суспензоре 6 клеток) пластиды
стержневидной формы с плотной стромой и одиночными тилакоидами,
часто везикулированными. Они содержат также рибосомы, пластоглобулы,
незначительные запасы крахмала (Schulz P., Jensen, 1969). На стадии
глобулярного зародыша пластиды суспензора приобретают чашевидную
форму. Выявляется еще одна важная черта пластидома суспензора. Цитоплазма
клеток суспензора С. bursa-pastoris, как оказалось, остается интактной до
сердечковидной стадии развития зародыша. Явные признаки ее дегенерации
(почти полное исчезновение рибосом, появление автофагических вакуолей,
потеря способности окрашиваться на белки и нуклеиновые кислоты и др.)
отмечены только на стадии сердечковидного зародыша. Пластиды при этом
опять-таки составляют исключение — они не несут никаких признаков
дегенерации. В пластидах по-прежнему наблюдаются одиночные везику-
лированные тилакоиды, пластоглобулы, способность интенсивно
краситься на белки. В них отмечено появление новых структурных элементов
в виде плотных тел, упакованных правильными рядами, и полное
исчезновение крахмала. Особо следует отметить утрату пластидами чаше-
22*
340
Семя
видной формы (а именно она часто и рассматривается как один из
показателей дегенерации цитоплазмы), а также то, что они остаются
лейкопластами, в то время как пластиды собственно зародыша на сер-
дечковидной стадии трансформируются в хлоропласты.
Клетки суспензора, особенно в базальной его части, у большинства
видов имеют структуру передаточных клеток (см. Deschamps, 1968,
1969; Schulz P., Jensen, 1969; Marines, 1970; Nagl, 1970, 1973,
1976a; Schepf, Nagl, 1970; Newcomb, Fowke, 1974; Simoncioli, 1974;
Khera Paramjit, Tilney-Bassett, 1976; Yeung, Clutter, 1979; Johansson,
Walles, 1994). Клеточные стенки, разделяющие клетки суспензора, а
также стенка между суспензором и собственно зародышем пронизаны
многочисленными плазмодесмами (Schulz P., Jensen, 1969; Newcomb,
1973; Newcomb, Fowke, 1974; Simoncioli, 1974; Johansson, Walles,
1994), но протоплазматические связи между суспензором и
эндоспермом отсутствуют. В эндосперме, на границе с латеральными стенками
суббазальных и средних клеток суспензора, образуются пальцевидные
выросты клеточной оболочки. В отличие от собственно зародыша,
наружная поверхность эмбриодермы которого на поздней глобулярной и
сердечковидной стадиях развития покрыта кутикулой, суспензор в этот
период эмбриогенеза от кутикулы свободен. Это показано на Arabidopsis
thaliana, Capsella bursa-pastoris u Stellaria media (Rodkiewicz et al., 1994;
Yeung et al., 1996).
Суспензор зародыша цветковых растений, по данным как световой
(см. Суспензор), так и электронной микроскопии, имеет отличительные
особенности не только на тканевом, но и на видовом уровне организации.
Несмотря на большое морфологическое разнообразие этого органа
зародыша, имеется целый ряд структурных особенностей, характерных для
суспензора всех или большинства исследованных видов. К ним относятся:
ранняя (в период формирования проэмбрио) дифференциация, полипло-
идизация ядер, сильная вакуолизация протопласта, относительно высокое
по сравнению с клетками собственно зародыша развитие ЭР и аппарата
Гольджи, невысокая плотность рибосом на единицу объема протопласта,
наличие высокоспециализированных пластид, организация клеток по типу
передаточных, отсутствие кутикулы на наружной поверхности клеток
суспензора. По большинству из перечисленных показателей, включая
размеры клеток суспензора, наблюдается структурный градиент в
направлении его микропилярно-халазальной оси.
Долгое время суспензор рассматривали как орган, единственной
функцией которого является «проталкивание» зародыша в эндосперм
и ориентировка его в нем (Maheshwari, 1950). Однако еще в 1902
году Lloyd заметил, что гаустории суспензора некоторых Rubiaceae
придают этому органу функцию временного зародышевого корня. В
настоящее время функции суспензора зародыша цветковых растений
приравниваются к функциям трофобласта млекопитающих (см. Nagl,
1973). По данным свето- и электроннооптической микроскопии,
суспензор полифункционален. Он принимает участие в абсорбции и
Зародыш
341
транслокации питательных веществ и, возможно, регуляторов роста
из окружающих тканей семени к развивающемуся зародышу. Наряду
с функциями передаточных клеток (которые приурочены главным
образом к клеткам основания суспензора) он несет также запасающие
функции. Обнаружение в клетках суспензора гладкого ЭР позволяет
предположить участие этого органа зародыша в синтезе биологически
активных метаболитов (энзимов, гормонов) (подробно см. Функции
суспензора). В связи с этим интересно отметить отсутствие или
редукцию суспензора у эмбриоидов, развитие которых протекает в
искусственных условиях. Обсуждается также секреторная функция
суспензора. Рис. 27.
Атамбекова, Лин Цзянсин, 1964; Верещагина, 1983а; Жукова, 1988, 1992, 1993;
Жукова, Савина, 1978; Камалова и др., 1983; Худяк, 1964; Яковлев, Жукова, 1973;
Яковлев, Чабан, 1979; Anantaswamy, 1950; D'Alascio-Deschamps, 1973; D'Amato,
1984; Bohdanowicz, 1973; Brady, 1973; Cass, Jensen, 1970; Cavara, 1899; Cela
Renzoni, Viegi, 1984; Clutter, Sussex, 1968; Corsi, 1972; Davey, 1978; Deschamps,
1968,1969; Gartner, Nagl, 1980; Graves, 1908; Guignard, 1899; Jensen, 1964a;
Johansson, Walles, 1994; Khera Paramjit, Tilney-Bassett, 1976; Lloyd, 1902;
Mansfield, Briarty, 1991; Marinos, 1970; Masand, Kapil, 1966; Nagl, 1962a, b, 1970, 1973,
1974, 1976a-c, 1977; Nagl, Kuhner, 1976/1977; Natesh, Rau, 1984; Newcomb, 1973;
Newcomb, Fowke, 1974; Norstog, 1972; Ponzi, Pizzolongo, 1972, 1973; Pretova, 1985;
Pritchard, 1964; Rodkiewicz et al., 1994; Sangduen et al., 1983; Satina, Rietsema,
1959; Schimper, 1885; Schnepf, 1974; Schnepf, Nagl, 1970; Schulz D., 1975; Schulz
P., Jensen, 1969; Schulz R., Jensen, 1968a, b; Simoncioli, 1974; Singh, Mogensen,
1975; Subramanyam, 1960; Taylor, Vasil, 1995; Vallade, 1980; Wareing, Phillips,
1978; Whatley, Price, 1983; Yeung, 1980; Yeung, Clutter, 1978, 1979; Yeung, Me-
inke, 1993; Yeung et al., 1996; Zhukova, 1978, 1981.
SUSPENSOR FUNCTIONS
ФУНКЦИИ СУСПЕНЗОРА
In flowering plants, after fertilization, the zygote usually divides
transversely and gives rise to a terminal cell and a basal cell. The terminal
cell invariably gives rise to the embryo proper while the basal cell develops
rapidly and gives rise to the suspensor. Classically, the function assigned
of the suspensor has been that of holding the embryo in a fixed position
in the seed. Hence, the suspensor was thought to play a rather passive
role in the development of the embryo. However, there is increasing evidence
from microscopic, physiological, biochemical, and genetic analyses which
indicates that the suspensor plays an active role during early embryo
development. Several recent reviews related to different aspects of suspensor
biology are currently available (Yeung, Meinke, 1993; Goldberg et al.,
1994; Meinke, 1995; Raghavan, Sharma, 1995; Schwartz et al., 1995).
In this review, the structural development of the suspensor will be emphasized.
Structural development of the suspensor. The suspensor when present is
342
Семя
a short living embryonic organ. It is important to note that derivatives of
the basal cell can contribute cells to the embryo proper as in Brassica
napus (Tykarska, 1979). On the other hand, derivatives of the terminal cell
can also contribute to the formation of the suspensor as in Stellaria media
(Pritchard, 1964). The number of cells in a suspensor is limited. It ranges
from a single cell such as in Phaius tankervilliae, or as a few cells such as
in Arabidopsis (Mansfield, Briarty, 1991) and Alisma (Bohdanowicz, 1987)
to a few hundreds as in Phaseolus vulgaris. Morphologically, the suspensor
can appear simply as a large vacuolated cell as in Phaius tankervilliae,
as a uniseriate file of cells such as in Arabidopsis (Mansfield and Briarty,
1991), or with elaborate extensions such as in Cymbidium sinense. During
early embryogeny, the development of the suspensor is rapid in terms of
size when compared to the embryo proper. The growth of the suspensor
can simply be due to cell enlargement or both cell enlargement and
increase in cell number.
The rapid growth of the suspensor may be in part aided by the cy-
toskeletal elements, i. e. microtubules and microfilaments. In Arabidospsis,
during proembryo development, microtubules within the suspensor cells tend to
orient transversely to direction of elongation (Webb, Gunning, 1991). In Cym-
bidium sinense, only 5—6 suspensor cells are present. The suspensor cells
elongate and extend outwards forming close contact with the seed coat. The
suspensor cells are highly vacuolated. A fine network of cortical microtubules
can be found in the cytoplasm. A majority of microtubules orient transversely
to the long axis of the cells except at the tip. Near the tip of the suspensor
cells, microtubules tend to orient along the axis of the cell. Judging from
the fluorescence intensity, more microtubules are present near the tip. In
contrast, although cytoskeletal elements are present in the embryo proper,
they usually take on a net-like appearance and are not as distinct as those
found in the cytoplasm of the suspensor cells. The microtubular pattern as
seen in the suspensor of Cymbidium indicates that microtubules are important
in the maintenance of cell shape as well as regulating the direction of cell
expansion and elongation. Furthermore, cytoskeletal elements may also be
important for the translocation process. In Cymbidium, the rapid expansion
of suspensor cells during early embryogeny suggests that the water potential
within the suspensor cells must be very negative. The cytoskeletal elements
are necessary in reinforcing the cell wall in order to maintain the turgor
pressure within the cell. This will aid in ensuring proper water balance
within the cells.
Different structural specializations can be found in suspensors of flowering
plants. One of the most common features of structural specialization is that
the suspensor cells take on a transfer cell morphology, i. e. the presence
of wall ingrowths and an abundance of organelles. Well documented
information is available for Phaseolus species (Nagl, 1974; Yeung, Clutter,
1978, 1979), Tropaeolum majus (Nagl, 1976; Nagl, Kuhner, 1976),
and Alisma (Bohdanowicz, 1987). Structural specializations can be observed
at the proembryo stage of development. In Alisma, specializations begin in
Зародыш
343
the basal cell as early as the two-celled stage (Bohdanowicz, 1987).
Elaborate wall ingrowths can be found in suspensor cells, especially in the
walls abutting the maternal tissue. The nucleus can be highly polyploid
with polytene chromosomes. Smooth and rough ER, polysomes, mitochondria,
and plastids are abundant within the cells. These structural specializations
are not found in cells. All these studies indicate that the suspensor is an
unique embryonic organ and structural specializations occur at the time
which is most likely to be the most critical period in embryo development,
i. e. early growth and histodifferentiation.
In comparison with the embryo proper, another feature regarding the
suspensor is the absence of cuticular material in the suspensor cell wall.
In Capsella, Arabidopsis, and Stellaria cuticular substance is present in the
wall of the protoderm of the embryo proper (Rodkiewicz et al., 1994). A
similar observation has been found in Cymbidium (Yeung, Zee, and Ye,
unpubl. results) and carrot (Lackie and Yeung, unpubl. results) zygotic
embryo. Although the synthesis of cuticular substance may be unique to
protoderm in general, the absence of cuticular substance clearly indicates the
distinct difference between the suspensor and the embryo proper cells.
Maximum development of the suspensor generally occurs at the
globular-heart stage of embryo development. Soon after, the suspensor begins
to degenerate and subsequently compresses as the embryo matures.
Degeneration of the suspensor is a programmed process. In Alisma, the large
basal suspensor cell begins to degenerate 7 days after pollination.
Vacuoles increase in size and frequently contain dense inclusions; the
organelles also begin to degenerate (Bohdanowicz, 1987). One of the features
associated with the senescing suspensor is an increase in acid phosphatase
activity in the plastids and cytoplasmic membrane (Nagl, 1977; Gartner,
Nagl, 1980). Nagl suggests that «the suspensor of plant embryos
undergoes programmed cell death, allowing the mobilization of stored
material and its utilization by the embryo proper» (Nagl, 1976). In this
respect, Arabidopsis suspensor mutants can be excellent tools in the study
of the degenerative process. Mutants are currently available that fail to
undergo programmed cell death (Schwartz et al., 1995). Through the
study of these mutants, it may be possible to determine the signal(s)
necessary to initiate or inhibit the degenerative process.
The absence of structural specialization as seen using light and electron
microscopes in some species does not necessarily mean that the suspensor
is not specialized. Physiological specializations such as unique transport
mechanisms may be present which cannot simply be detected by using
conventional structural techniques. If the suspensor can maintain a more
negative water potential, it may still be able to serve as conduit for the
movement of water and dissolved material.
. In monocotyledonous plants such as Zea mays (Schel et al. 1984),
the size of the suspensor is small and structural specialization is not
present within the suspensor. However, when the surrounding endosperm
cells are examined, it is found that they take on a transfer morphology
344
Семя
(Schel et al., 1984). Similarly, the elaborate endosperm haustorium of
Rhir\anthus minor certainly can play an important role in embryo
development (Nagl, 1992). Different mechanisms must be present in seeds
that ensure proper embryo development. It is not surprising to see a
division of labour has taken place within seeds and some of the functions
of the suspensor reside in cells surrounding the embryo.
The embryonic environment can modulate suspensor development. In
somatic embryos, a suspensor may or may not be present. Even when it is
present, structural specialization similar to that found in zygotic embryos
is absent. Since somatic embryos, especially those derived from the liquid
suspension system are bathed in a relatively uniform nutritive environment,
structural specialization related to nutrient uptake is not necessary. In the
in vitro-grown ovules from intra- and interspecific crosses in the genus
Beta, the suspensor degenerates rapidly as compared to the in situ-grown
seeds (Bruum, 1991a, b). In parthenogenetically induced embryos of Poaceae
species, endosperm fails to develop; however, larger suspensors are found
(Matzk, 991). Therefore, changes in the environment or nutrient uptake
can modulate suspensor development and function.
Developmental potential of the suspensor. Judging from the structural
specialization and growth characteristics of suspensors in flowering plants,
the suspensor is a differentiated embryonic organ. From the works by Haccius
(1963), Akhundova et al. (1978), Clark, Sheridan (1991) and others (see
Yeung, Meinke, 1993), it appears that further development can occur in
the suspensor if the growth of the embryo proper is disrupted. Using genetic
approaches, a number of suspensor mutants have been identified (Schwartz
et al., 1995). It has been shown earlier that embryo-lethal mutants' of
Arabidopsis have abnormal suspensors (Marsden, Meinke, 1985). Recently,
additional suspensor mutants have been characterized. It has been shown
that defects occurring within the embryo proper of some Arabidopsis mutants
have lead to suspensor enlargement and developing characteristics which are
normally restricted to the embryo proper (Goldberg et al., 1994; Schwartz
et al., 1994; Yadegari et al., 1994). These results clearly indicate that
under normal development, interaction between the embryo proper and the
suspensor leads to the suppression of the embryonic program in the suspensor,
thus maintaining its identity (Schwartz et al., 1995). Therefore the suspensor
is not a terminally differentiated organ and is capable of further development
under unusual circumstances.
Recently, another embryo mutant has been characterized which promises
to provide important information concerning how suspensor development is
regulated. The Twn mutation in Arabidopsis results in the formation of
twin embryos. One of the twin embryos is a secondary embryo derived
from the suspensor (Vernon, Meinke, 1994). Therefore, this mutant is an
attractive system in the study of embryo development, especially the
intercommunication between the suspensor and the embryo proper.
Suspensor functions. Morphogenetically, the presence of the suspensor is
essential to the development of the embryo proper. Using in vitro culture
Зародыш
345
methods, the presence of the suspensor greatly enhances the growth of the
embryo proper during the early stages of development (Yeung, Sussex,
1979; Monnier, 1995). The presence of the suspensor significantly increases
the protein content in the embryo proper (Brady, Walthall, 1985; Walthall,
Brady, 1986). In its absence, the growth of the embryo proper is retarded
or even stopped leading to the death of the embryo. The failure to
successfully cultured small proembryos may be due to the injury of the suspensor
during the isolation process (Monnier, 1995).
More specifically, the function of the suspensor has been demonstrated
to be the main uptake site for the developing embryo. Labelling studies
indicate that different metabolites and tracer compounds are preferentially
taken up through the suspensor and translocated to the embryo proper
(Yeung, 1980; Brady, Combs, 1988; Nagl, 1990). Orchid embryos can
be excellent systems in the study of suspensor function. Unlike seeds of
many flowering plants, vascular tissue is absent from the seed coat. This
suggests that nutrient transfer from the maternal tissue to the embryo may
not be very efficient. Thus, orchid embryos must evolve special means in
order to obtain nutrients from the maternal tissues in order for them to
grow. A great diversity of suspensor morphology in the Orchidaceae as
noted by Swamy (1949) may simply be one of the mechanisms for obtaining
nutrients for embryo development. In Cymbidium sinense, the suspensor is
characterized by having elaborate outgrowths of suspensor cells. The
suspensor cells are tightly appressed onto the seed coat. Histochemical staining
indicates the absence of cuticular substances in the suspensor wall and the
cell wall remains primary in nature. The absence of cuticular substance
indicates that apoplastic transport is possible between the maternal tissue
and the suspensor cells. Judging from the growth pattern of the Cymbidium
suspensor, it is conceivable that it has developed mechanism(s) in maintaining
a negative water potential within the cell. This will then account for the
ability of water uptake as well as of dissolved materials for the growth of
the embryo proper. Using orchid embryos as experimental systems, future
testing of the above hypothesis will provide a/ more definitive answer to
the mechanism of uptake and transport by suspensor cells.
The suspensor can function as a site for growth substance synthesis. In
Phaseolus coccineus, the suspensor has the ability to synthesize gibberellins,
a number of them have been identified using gas chromatography-mass
spectroscopy (see Alpi, 1990). Based on the qualitative and quantitative
gibberellin pattern between the suspensor and the embryo proper, Piaggesi et
al. (1989) suggest that the embryo proper may depend on the suspensor
for the supply of growth substances during early stages of its development.
Besides Phaseolus coccineus, gibberellins have also been identified in
suspensors of Tropaeolum and Cytisus (Picciarelli et al., 1984; Picciarelli,
Alpi, 1987). Gibberellic acid has been shown to increase the protein content
and protein synthesis activity of the embryo proper (Brady, Walthall, 1985;
Walthall, Brady, 1986) as well as RNA synthesis in bean suspensor cells
containing polytene chromosomes (Forino et al., 1992). Other plant growth
346
Семя
substances, i. e. auxin (Przybyllok, Nagl, 1977), cytokinin (Lorenzi et
al., 1978), and abscisic acid (Perata et al., 1990) have been detected in
the suspensor as well. These growth substances may play a direct role in
tissue differentiation within the embryo proper. However, whether the ability
to synthesize plant growth substances is common to suspensors of other
flowering plants remains to be determined.
Future perspectives. In the last two decades, significant advances
have been made in our understanding of suspensor biology of flowering
plants. Embryo mutants have proven to be a useful tool in the study
of suspensor biology as well as other aspects of embryo development
(Meinke, 1995). Once these genes can be identified and cloned, it
will be possible to proceed with the molecular analysis of interactions
between the embryo proper and suspensor. Some progress has already
been made in respect to one of the suspensor mutants (see Meinke,
1995; Schwartz et al., 1995). At present, physiological studies focus
mainly on species with a relatively large suspensor such as Phaseolus.
Whether the information obtained from the study of Phaseolus species
is also applicable to other species awaits further study. Furthermore,
little information is available on the suspensor of Gymnospermae species.
Since many Gymnospermae species are important economically, more
efforts should be placed in the area of investigation (Yeung, 1995).
Fig. 28.
Akhundova et al., 1978; Alpi, 1990; Bohdanowicz, 1987; Brady, Combs, 1988; Brady,
Walthall, 1985; Bruun L., 1991a, b; Clark, Sheridan, 1993; Forino et al., 1992;
Gartner, Nagl, 1980; Goldberg et al., 1994; Haccius, 1963; Lorenzi et al., 1978;
Mansfield, Briarty, 1991; Marsden, Meinke, 1985; Matzk, 1991; Meinke, 1995; Mon-
nier, 1995; Nagl, 1974, 1976, 1977, 1990, 1992; Nagl, Kuhner, 1976; Perata et al.,
1990; Piaggesi et al., 1989; Picciarelli, Alpi, 1987; Picciarelli et al., 1984; Pritchard,
1964; Przybyllok, Nagl, 1977; Raghavan, Sharma, 1995; Rodkiewicz et al., 1994; Schel
et al., 1984; Schwartz et al., 1994, 1995; Swamy, 1949a; Tykarska, 1979; Vernon,
Meinke, 1994; Walthall, Brady, 1986; Webb, Gunning, 1991; Yadegari et al., 1994;
Yeung, 1995; Yeung, Clutter, 1978, 1979; Yeung, Meinke, 1993; Yeung, Sussex, 1979;
Zee, Aziz-Un-Nisa, 1991.
ПРОТОДЕРМА (греч. protos — первичный и derma — кожа) —
покровная ткань зародыша. Синонимы: дерматоген, эмбриодерма,
эпидермис.
Термин протодерма используется в зарубежной литературе для
обозначения: 1) инициальных клеток эпидермиса зародыша и 2)
наружного слоя апексов побега и корня.
Термин дерматоген (греч. derma — кожа, genos — рождение)
был введен Hanstein (1870) для обозначения инициальных клеток
эпидермиса всего зародыша. Хотя он используется в данном значении
в отдельных работах и в настоящее время (Никитичева, 1979;
Mansfield, Briarty, 1991; Guignard et al., 1991), в основном термин
зародыш. 347
употребляется при описании строения корня (первичный дерматоген,
см. Зародышевый корень).
Термин эмбриодерма (греч. embruon — зародыш, derma —
кожа), по-видимому, впервые был использован Яковлевым (1971) для
обозначения инициальных клеток эпидермиса зародыша.
В настоящее время в иностранной литературе наиболее
распространен термин протодерма, тогда как в отечественной — эмбриодерма.
В некоторых эмбриологических работах для обозначения покровной
ткани зародыша используют термины, употребляемые при описании
развития конуса нарастания. Так, по мнению Поддубной-Арнольди
(1976), в результате деления октантов наружные клетки дают начало
тунике, а внутренние — корпусу. Из туники впоследствии развивается
эпидермис, а из корпуса — кора и центральный цилиндр взрослого
растения.
Формирование протодермы зародыша. Эпидермис зародыша
покрытосеменных растений проходит путь от инициальных клеток до
специализированной ткани. Процесс формирования инициалей протодермы
таксоноспецифичен. Как правило, у зародышей, имеющих регулярный
тип эмбриогенеза, вычленение инициалей и формирование
эпидермального слоя наблюдаются после стадии октантов. Периклинальные деления
октантов приводят к образованию наружных и внутренних клеток.
Наружные клетки представляют собой инициальные клетки эпидермиса.
Отмечается, что вычленение протодермы наблюдается одновременно в
правой и левой половинах зародыша, но никогда периклинальные деления
не проходят одновременно в верхнем и нижнем ярусах (Mansfield,
Briarty, 1991). Процесс заканчивается формированием четкого
эпидермального слоя, который окружает зародыш (Hanstein, 1870; Soueges, 1934;
Johansen, 1950; Яковлев, Алимова, 1976; Никитичева, 1979; Lyndon,
1990; Guignard et al., 1991; Jtirgens, 1995). Дальнейший рост
эпидермального слоя происходит за счет антиклинальных делений клеток.
Таким образом, положение клеток эпидермального слоя фиксируется уже
на стадии октантов, когда вычленяются восемь инициалей, клонирование
которых посредством антиклинальных делений приводит к увеличению
числа клеток в наружном слое и способствует установлению его
целостности (Jtirgens, 1995). В тех случаях, когда упорядоченность делений
в зародыше (иррегулярный тип эмбриогенеза) отсутствует, момент
появления протодермы установить трудно (Поддубная-Арнольди, 1976).
По данным Christianson (1986), у Gossypium, имеющего иррегулярный
тип эмбриогенеза, отдельные клетки протодермы выделяются на стадии
зародыша, состоящего из 50 клеток, и только на стадии 100-клеточного
зародыша она представляет собой четкий слой. Из этого можно
заключить, что зародыш хлопчатника на стадии 50 клеток или не имеет
наружного слоя, или же этот слой присутствует, но он не является эпи-
дермальным.
Четкое разграничение между эпидермальным слоем и внутренними
тканями характерно для зародыша большинства покрытосеменных рас-
j348
Семя
тений. Эпидермис как слой отчетливо прослеживается во всех частях
зрелого зародыша, включая апексы побега и корня. У других
сосудистых растений четкого слоя эпидермиса не наблюдается даже на стадии
зрелого зародыша (Periasamy, 1977).
Для паразитных форм покрытосеменных растений характерно
отсутствие выраженной протодермы на апикальном полюсе зародыша в
результате нарушений последовательности и ориентации клеточных
перегородок в верхнем этаже октанта (Orobanche pallidiflora — Ники-
тичева, 1979; Терёхин, Никитичева, 1981). Считается, что данный
признак коррелирует с особенностями прорастания паразитов. У
некоторых представителей сем. Orchidaceae слой эпидермиса может
нарушаться не только в апикальной (например, Thunia alba — Andronova,
Batygina, 1992), но и в других частях зародыша (например, Goody era
discolor — Treub, 1879; Johansen, 1950). Однако у данных видов он
устанавливается в процессе развития апекса побега при прорастании
зародыша и формировании протокорма.
Согласно классическому представлению, временем вычленения ини-
циалей протодермы считается стадия прохождения клетками проэмбрио
периклинальных делений. Возможную роль периклинальных делений в
становлении эпидермального слоя можно проследить на примере Ага-
bidopsis и других покрытосеменных растений с упорядоченными
делениями на первых этапах эмбриогенеза. Недавно был идентифицирован
ген (KN), продукт которого участвует в процессе инициации тканей в
радиальном направлении. У зародыша, имеющего kn фенотип, не
происходит вычленение эпидермальных инициалей за счет периклинальных
делений, в результате чего у проростков отсутствует характерный эпи-
дермальный слой (Mayer et al., 1991). Однако участие гена KN в
регуляции ориентации клеточных перегородок при периклинальных
делениях до конца не выяснено.
Согласно другой точке зрения (Kaplan, 1992), эпидермис
определяется топографически как самый наружный слой тела растения. Первый
шаг в установлении тканевой дифференциации зародыша — увеличение
количества слоев в поперечном (радиальном) плане — не связан с
закономерностями в направлении делений клеток (Jurgens, 1995; Raghavan,
Kiran Sharma, 1995).
Torres и Jurgens (1994) продемонстрировали, что несмотря на то,
что деления клеток на ранних этапах развития зародыша fs фенотипа
Arabidopsis не имеют определенной ориентации, ткани в радиальном
плане у мутантного проростка устанавливались так же, как и у
зародышей дикого фенотипа. Высказано предположение о важной роли
клеточных взаимодействий в инициации тканеспецифичной генной
экспрессии и дальнейшей интегрированности между тканями.
Предполагается, что генетические различия между наружными и внутренними
тканями могут устанавливаться за счет постепенного блокирования
связи посредством плазмодесм между клетками, как это наблюдается
между эпидермальными и субэпидермальными клетками у проростка
L
Зародыш
349
(Duckett et al., 1994). Отмечено, что плазмодесмы можно обнаружить
во всех клетках зародыша Arabidopsis, начиная со стадии октантов и
вплоть до поздней глобулярной стадии. Таким образом, выделившийся
в результате периклинальных делений слой эпидермиса может иметь
контакт посредством плазмодесм с внутренними тканями зародыша на
протяжении всей глобулярной стадии. Различия между клетками
зародыша становятся очевидными на стадии «сердечка». Это проявляется
в том, что клетки протодермы на данной стадии развития зародыша
менее вакуолизированы, чем клетки прокамбия и апекса побега. На
стадии «торпеды» тканевые различия еще более усиливаются. В
клетках протодермы появляются крахмальные зерна и многочисленные
пластиды с хорошо развитой системой гран. На этой стадии зародыш
способен приобретать зеленую окраску. Пластиды в протодерме
достигают большей степени дифференциации, чем в других внутренних клетках.
Наибольшая плотность рибосом отмечена в эпидермальном слое и
семядолях. Скорость делений во всех частях зародыша очень высокая, во
многих клетках клеточные стенки не успевают полностью сформироваться.
Отмечено появление электроноплотных тел, которые присутствуют во всех
клетках зародыша, но больше всего их содержится в эпидермисе, однако
их роль и происхождение не ясны (Mansfield, Briarty, 1991; см.
Ультраструктурные аспекты эмбриогенеза).
Цитогистологическое исследование зародыша Arabidopsis показало,
что хотя эпидермис и вычленяется в результате периклинальных
делений на стадии октантов, как слой он обособляется только к концу
глобулярной стадии (Mansfield, Briarty, 1991). Авторы считают, что
данный факт может свидетельствовать в пользу «регуляционной теории
организации», высказанной еще Wardlaw (1955), и подвергают
сомнению теорию «гистогенов» Hanstein (1870), которая предполагает, что
происхождение тканей зародыша связано со специфическими клетками
проэмбрио.
Клеточные взаимодействия могут быть обусловлены не только
происхождением, но и положением клеток в зародыше (Jurgens, 1995;
Барлоу, 1994; Schmidt et al., 1994). Направление заложения
клеточных прегородок при делении клеток соответствует общему
направлению роста организма (Lyndon, 1990). В результате пространственного
разделения клеток' по их свойствам в организме обнаруживаются
различные типы тканей. Это осуществляется на самых ранних этапах
развития проэмбрио и совпадает по времени с дифференциацией
эпидермы, плеромы и, периблемы. Уже первое деление зиготы определяет
домены корня и побега. Этап образования гистогенов в самом начале
эмбриогенеза очень важен, поскольку возникшая при этом новая
модель дифференциации сохраняется и усложняется в ходе всего
последующего развития растения.
У зародышей контуры и состав тканей в целом сходны у разных
видов, хотя направления заложения клеточных перегородок могут
существенно различаться. Это означает, что в становлении формы заро-
350
Семя
дыша составляющие его клетки и их клеточные оболочки играют
довольно случайную роль. В то же время к важным морфогенетическим
событиям относятся процессы, которые затрагивают модель роста
поверхности зародыша. Поэтому развитие эпидермиса с его кутикулой,
происходящее в раннем эмбриогенезе, может иметь важное значение
для формообразования на последующих его этапах (Нага, 1961, 1971,
1995; Hardham, 1982; Green, 1992; Green, Selker, 1991; Barlow, 1994;
Барлоу, 1994).
У Daucus carota появление кутикулы вокруг зародыша наблюдалось
сразу после заложения протодермы (Lackie, Yeung, 1995). Однако у
других видов кутикула может появляться и на более ранних стадиях.
Например, у Citrus jambhiri это происходит на стадии зиготы. На
основании данного факта, Bruck и Walker (1985) считают, что
тенденцию к дифференциации эпидермального слоя можно проследить со
стадии зиготы. По мнению Kaplan (1992), образование кутикулы
является свойством организма, но не эпидермиса. Эпидермис.не
определяется кутикулой, хотя и располагается под ней и возникает после нее.
Это только позиционная связь.
Согласно Rodkiewicz и Szczuka (см. Кутикула развивающегося
зародыша), кутикулярный слой играет роль в процессе поляризации
зародыша и формировании оси «апекс побега — апекс корня». На
ранних этапах эмбриогенеза он изолирует зародыш от эндосперма, тем
самым устанавливается поляризованный поток веществ от суспензора
к зародышу, на поздней стадии, вероятно, он участвует в процессе
созревания зародыша.
По мнению Яковлева (1971), образование эмбриодермы
(протодермы) свидетельствует о переходе проэмбрионального периода в
эмбриональный. Стадия вычленения эмбриодермы считается критической
стадией в развитии зародыша (Nagato, 1979; Батыгина, Васильева
19836, 1987; Batygina, Vasilyeva, 1988). Как только происходит
выделение протодермы и начинаются антиклинальные деления в ней,
упорядочиваются деления и во всех остальных клетках зародыша (Pollock,
Jensen, 1964; Christianson, 1986).
Важность стадии заложения инициалей протодермы
демонстрируется при анализе строения мутантов Arabidopsis. Показано, что
морфологический дефект у sus 2-1 зародышей проявляется в
иррегулярности слоя протодермы на глобулярной стадии. Клетки
протодермы увеличиваются в размерах. Наблюдается остановка развития
зародыша данного фенотипа на глобулярной стадии (Yeung, Meinke,
1993).
У глобулярных зародышей жизнеспособного мутанта keu Arabidopsis
наружный слой состоит из гроздевидных крупных клеток, в то время
как внутренние клетки нормальные. Неясно, является ли ген KEU
прямо вовлеченным в установление тканевой специфичности или же
изменение в эпидермисе связано с глубокими общими аномалиями в
физиологии развития (Laux, Jurgens, 1994).
Зародыш -'■>
Важность стадии образования протодермы показана и при
развитии соматических зародышей в культуре in vitro. Считается, что
аномалии в образовании протодермы ассоциируются с остановкой
развития соматического зародыша. Идентифицированы гликопротеины,
локализованные в протодерме, которые снимают остановку развития
и способствуют дальнейшему развитию соматических зародышей (Еп-
gelen von et al., 1991; Satoh et al., 1992). Это указывает на
взаимодействие между наружным и внутренними слоями, которое
осуществляется при развитии соматического зародыша (Yeung, 1995).
Протодерма, как и другие основные ткани растения, формируется
на глобулярной стадии зародыша. В ходе последующего развития
дифференцируются эпидермис гипокотиля, семядолей, протодерма апекса
побега и дерматоген корня. Появляются специализированные клетки
(трихомы, клетки устичного аппарата и др.). Однако не все клетки
специализируются, и некоторые из них, оставаясь тотипотентными, при
изменении условий способны перейти на другой путь развития.
Поэтому все части зародыша используют в качестве эксплантов для
культуры тканей.
При культивировании эксплантов эмбрионального происхождения
(щиток злаков, гипокотиль, семядоли и т. д.) наблюдается, как
правило, «прямой эмбриоидогенез». При этом развитие соматических
зародышей происходит, как правило, из эпидермальных клеток
(Pretova et al., 1993; Yeung, 1995).
При изучении инициации соматических зародышей из
эпидермальных клеток щитка злаков показано, что первым сигналом индукции
эмбриоидогенеза является изменение направления клеточных делений
в поверхностном слое от антиклинальных к периклинальным и
наклонным (Jones, Rost, 1989). Такие деления обнаруживаются уже
через 24 часа культивирования. По-видимому, данный факт
свидетельствует о слабой детерминированности эпидермальных клеток
зародыша злаков.
Протодерма соматических зародышей, например, у Quercus, Daucus
и др., имеет тенденцию к пролиферации и формированию вторичных
соматических зародышей (Shamrov et al., 1992; Yeung, 1995). По
мнению Yeung (1995), феномен вторичных эмбриоидов может быть
результатом отсутствия полной дифференциации протодермы у
соматических зародышей.
Зародыш и протокорм орхидей имеют тенденцию к формированию
вторичных протокормов из эпидермиса, что обусловлено высокими
потенциями к вегетативному размножению, начиная с самых ранних
этапов онтогенеза растений (Батыгина, Шевцова, 1985).
Williams, Maheshwaran (1986) выдвинули гипотезу о существовании
клеток, различающихся по степени детерминированности и способности
к «прямому эмбриоидогенезу» в культуре in vitro. Меристематические
клетки («pre-embryogenic determined cells», PEDC) компетентны для
эмбриогенеза и требуют только подходящих условий для того, чтобы
;352
Семя
стать детерминированными как эмбриональные клетки. По мере
специализации тканей число клеток, имеющих эмбриогенную
детерминированность, снижается и лишь некоторые из эпидермальных клеток
остаются способными к прямому эмбриоидогенезу. Данная гипотеза
призвана объяснить различные способы формирования соматических
зародышей — из группы клеток или из одной клетки.
Предполагается, что способ их формирования зависит от того, насколько соседние
клетки эпидермиса различаются по степени детерминированности к
«прямому эмбриоидогенезу». Одни и те же клетки на определенном
этапе своей дифференциации могут иметь эмбриогенную и эпидермаль-
ную детерминацию. Рис. 29.
Барлоу, 1994; Батыгина, Васильева, 1983б, 1987; Батыгина, Шевцова, 1985; Ни-
китичева, 1979а; Поддубная-Арнольди, 1976; Терёхин, Никитичева, 1981; Яковлев,
1971; Яковлев, Алимова, 1976; Andronova, Batygina, 1992; Barlow, 1994; Batygina,
Vasilyeva, 1988; Bruck, Walker, 1985; Christianson, 1986; Duckett et al., 1994;
Engelen von et al. 1991; Green, 1992; Green, Selker, 1991; Guignard et al., 1991;
Hara, 1961, 1971, 1995; Hanstein, 1870; Hardham, 1982; Johansen, 1950; Jones, Rost,
1989; Jurgens, 1995; Kaplan, 1992; Laux, Jurgens, 1994; Lyndon, 1990; Mansfield,
Briarty, 1991; Mayer et al., 1991; Nagato, 1979; Periasamy, 1977; Pollock, Jensen,
1964; Pretova et al., 1993; Raghavan, Sharma, 1995; Satoh et al., 1992; Schmidt et
al., 1994; Shamrov et al., 1992; Soueges, 1934; Torres, Jurgens, 1994; Treub, 1879;
Wardlaw, 1955; Williams, Maheshwaran, 1986; Yeung, 1995; Yeung, Meinke, 1993.
ГИПОФИЗИС (греч. hypo-, hyp — под, снизу и physo-, physi —
вздутие, разрастание) — клетка или группа клеток в базальной части
проэмбрио, из которых образуются элементы зародышевого корня
(Johansen, 1950; Яковлев, 1981). Синонимы: гипофиз, гипофиза,
покоящийся центр.
Термин введен Hanstein (1870) для обозначения клетки, лежащей
на границе суспензора и тела зародыша, и ее производной
(линзовиднои клетки). Согласно Hanstein, посредством этих клеток
осуществляется связь зародыша с суспензором (нем. «Keim-Anschluss»).
Первичная гипофизарная клетка (h) отделяется апикальной клеткой
суспензора, как правило, на ранней глобулярной стадии развития
зародыша, сразу после отделения в нем слоя дерматогена (протодермы),
и является клеткой, его замыкающей (нем. «Schlusszelle»). Затем она
делится с образованием клетки линзовиднои формы (/г'), при этом
образующийся комплекс из двух клеток имеет «вдавленное» положение
в проэмбрио, что, вероятно, и послужило основанием для его
названия. Гипофизарная клетка была обнаружена автором у зародышей
целого ряда двудольных растений, наиболее детально ее развитие было
прослежено у Capsella bursa-pastoris (Brassicaceae).
Позднее существование гипофизиса было подтверждено в ряде
других работ по эмбриогенезу Capsella bursa-pastoris (Coulter,
Chamberlain, 1903; Schaffner, 1906; Soueges, 1919, 1934). Некоторые
авторы, вслед за Hanstein, дают достаточно близкие определения ги-
Зародыш
353
пофизиса, расходясь, главным образом, в обозначении данной
структуры и ее производных. Coulter и Chamberlain определяли гипофизис
как апикальную клетку суспензора, обозначая последнюю, а также
ее внутренние производные латинской буквой «р», тогда как
наружные — латинской «d», подразумевая, что из них образуются
периблема (инициальные клетки коры) и дерматоген корня,
соответственно.
Soueges называл гипофизисом апикальную клетку суспензора,
делящуюся клеточной перегородкой в форме «часового стекла» с
образованием линзовиднои клетки, а также все ее дериваты, внутренний
ряд которых порождает кору корня, наружный — инициали
эпидермиса и чехлика корня. В связи с этим Soueges предложил различать
инициальную клетку гипофизиса, обозначая ее, как и Hanstein,
латинской буквой «h», и гипофизарную ткань, в которой клетки,
дающие кору и чехлик корня, обозначаются латинскими буквами «zee»
(франц. initiales de Гёсогсе de la racine — инициали коры корня) и
«со» (франц. coiffe — корневой чехлик), соответственно,.
В отличие от вышеупомянутых авторов Schaffner (1906) полагал,
что гипофизисом следует называть только линзовидную клетку,
образующуюся в результате деления клетки, лежащей между
суспензором и зародышем. Эта клетка является инициалью точки роста корня
и остается покоящейся в течение некоторого времени, тогда как ее
сестринская клетка, обозначаемая автором латинской буквой «d»,
функционирует как инициаль корневого чехлика. Такое определение
гипофизиса приняли Swamy and Krishnamurthy (1975).
Однако большинство исследователей (Johansen, 1950; Maheshwari,
1950; Lebegue, 1952; Яковлев, 1958; Crete, 1963;
Поддубная-Арнольди, 1976; Natesh, Rau, 1984; Данилова, Кирпичников, 1985;
Raghavan, 1990) используют термин гипофизис в понимании Soueges. Вместе
с тем анализ всего разнообразия способов возникновения гипофизиса,
установленного Soueges и другими исследователями, позволил
некоторым авторам дать более широкое определение этого термина, принятое
в настоящем издании.
Время, способы возникновения и характер деления гипофизиса у
разных видов обнаруживают значительное разнообразие. Soueges
(1934) выделил 6 способов формирования гипофизиса.
А. Единственная гипофизарная клетка дает начало инициалям коры
и чехлика корня, при этом она может делиться:
а) горизонтально, с образованием клеточной стенки в форме
часового стекла (Capsella bursa-pastoris, Oenothera biennis, Mentha
viridis, Veronica arvensis);
б) дважды вертикально, с образованием четырех клеток — «ги-
пофизарных квадрантов» (Euphorbia exiqua, Miosurus minimus, Sedum
acre).
Б. Единственная гипофизарная клетка дает начало только медианной
части чехлика (Nicotiana acuminata, Papaver rhoeas, Sagina procumbens).
23- 828
354
Семя
В. Две клетки одного яруса или клетки двух ярусов проэмбрио,
расположенных один под другим, дают начало инициалям коры и
чехлика корня, соответственно (Senecio vulgaris, Urtica pilulifera).
Г. Группа клеток проэмбрио дифференцируется в гипофизарную
ткань, из которой образуются кора и чехлик корня:
а) эта группа клеток происходит из единственной
детерминированной клетки проэмбрио — производной клетки cb (Erodium cicutarium,
Geranium molle);
б) эта группа клеток отделяется от другой группы, возникающей
из недетерминированной клетки проэмбрио (собственно зародыша) —
производной клетки са достаточно поздно в эмбриогенезе (Trifolium
minus, Medicago lupulina, Lotus corniculatus).
Производные гипофизиса могут принимать участие не только в
образовании коры и чехлика корня, но и центрального цилиндра, как
например, у Physalis minima (Solanaceae), Daucus carota (Apiaceae)
(Soueges, 1922b; Johansen, 1950). Такие случаи Soueges предлагал
отличать от образования истиного гипофизиса, участвующего в
формировании только коры и чехлика корня.
Способы формирования чехлика корня из гипофизиса у двудольных
и однодольных растений принципиально различаются. У двудольных из
гипофизиса образуется только медианная часть чехлика, тогда как его
латеральные части формируются из дерматогена (протодермы)
зародыша; у большинства однодольных из гипофизиса возникает весь чехлик
целиком (Soueges, 1936d; Guttenberg von, 1960; см. подробнее
Зародышевый корень).
Особый интерес представляет способ деления и трехмерная
организация инициальной клетки гипофизиса и так называемой линзо-
видной клетки, отделяемой ею. Детальное исследование процесса
развития гипофизиса у различных представителей семейств
Scrophulariaceae и Orobanchaceae в различных плоскостях строения
с учетом литературных данных (Soueges, 1919; Tiagi, 1952a, b;
Crete, 1953, 1954, 1955а; Arekal, 1963, 1966) позволило установить,
что гипофизарная клетка имеет особую форму (Никитичева, 1971).
Она цилиндрическая в основании и конусовидная на вершине, что
определяет положение и форму разделяющих ее в дальнейшем
перегородок. Инициальная гипофизарная клетка делится последовательно
двумя косыми перегородками, причем первое деление происходит,
как правило, во время отделения дерматогена в октантах, второе —
во время разделения инициалей плеромы и периблемы в нижнем
этаже октантов. В результате этих двух делений отделяется клетка
iec, которая имеет классическую линзовидную форму лишь при
рассмотрении в фас, тогда как при рассмотрении в профиль — вид
треугольника или ромба. После этого нижняя дочерняя клетка
гипофизиса делится еще раз. Таким образом, в итоге трех делений
инициальной гипофизарной клетки образуются клетка iec и три
клетки ico.
Зародыш
355
Другая важная особенность гипофизиса — его участие в
формировании покоящегося центра зародышевого корня. Swamy и
Krishnamurthy (1975), считая гипофизисом линзовидную клетку в
основании зародыша, обратили внимание на важное наблюдение
Schaffner (1906) об относительно низкой скорости ее деления в
течение значительного периода в эмбриогенезе. Например, у
Sphenoclea zeylanica (Sphenocleaceae) эта клетка делится только два
раза, образуя пластинку из четырех клеток, которые остаются в таком
состоянии даже на стадии зрелого зародыша. Дальнейшие деления
производных этой клетки отмечаются лишь в ходе прорастания. Лин-
зовидная клетка и ее производные отличаются более мелкими по
сравнению с остальными клетками проэмбрио размерами,
характеризуются слабой окрашиваемостью и низким содержанием протеинов.
Сравнение особенностей строения и поведения этой клетки в ходе
эмбриогенеза с таковыми клеток покоящегося центра в корнях
взрослых растений (Clowes, 1961) привело Swamy и Krishnamurthy к
выводу о том, что линзовидная клетка и ее производные (гипофизис
в их понимании) обладает функциями покоящегося центра корня.
Попытки проследить происхождение покоящегося центра
зародышевого корня из гипофизиса у различных растений предпринимались
неоднократно (Sterling, 1955; Alfieri, Evert, 1968; Vallade, 1972;
Jones, 1977; Clowes, 1978a, b; Raghavan, O'Konkwo, 1982). Однако
долгое время не удавалось идентифицировать специфические клетки
на ранних стадиях развития зародыша, дающие ему начало. Согласно
данным ультраструктурных и гистохимических исследований, клетки
гипофизиса, например, у Capsella bursa-pastoris (Schulz, Jensen,
1968b), Linum usitatissimum (Deschamps, 1969), Diplotaxis ericoides
(Simoncioli, 1974), характеризуются низкой метаболической
активностью (незначительное количество рибосом, низкое содержание
нуклеиновых кислот и белков, низкая интенсивность синтеза ДНК).
Очевидно, клетки покоящегося центра обладают редуцированной
способностью к включению меченых предшественников синтеза ДНК,
что затрудняло получение четких структурных, физиологических или
метаболических маркеров для идентификации его клеток. И лишь
использование метода in situ гибридизации между клеточной полиА-
РНК и меченой [3Н] полиуридиловой кислотой позволили
подтвердить происхождение покоящегося центра из клеток гипофизиса, а
именно — из производных его внутренней, линзовидной клетки
(Raghavan, 1990).
В последние годы появились данные по генетической регуляции
процесса формирования гипофизиса и апикальной меристемы корня
зародыша. В частности, у gnom-мутантных зародышей Arabidopsis tha-
liana происходит образование нормального гипофизиса и линзовидной
клетки в период отделения дерматогена в проэмбрио, однако
дальнейшее развитие дериватов этих клеток и формирование апекса корня не
происходит. Нарушение развития этих структур и, как следствие, от-
23*
356
Семя
сутствие корня и гипокотиля в зародыше характерно и для monopteros-
мутантов этого вида (Mayer et al., 1993).
В заключение следует отметить, что такие признаки, как
особенности происхождения, строения, а также время дифференциации гипофи-
зиса в зародыше, являются таксоноспецифичными и характеризуют
прогрессивную эволюцию в пределах отдельных таксонов (Soueges,
1934; Lebegue, 1952). Данные признаки легли в основу выделения
вариаций в типах эмбриогенеза по системе Johansen (1950) и типов
эмбриогенеза по классификации Yamazaki (1974, 1982) и широко
используются в филогенетических построениях (см. Принципы
классификации типов эмбриогенеза; раздел Типы эмбриогенеза). Рис. 30.
Данилова, Кирпичников, 1985; Никитичева, 1971; Яковлев, 1958, 1981; Alfieri,
Evert, 1968; Arekal, 1963, 1966; Clowes, 1961, 1978a, b; Coulter, Chamb erlain, 1903;
Crete, 1953, 1954, 1955a, 1963; Deschamps, 1969; Hanstein, 1870; Johansen, 1950;
Jones, 1977; Lebegue, 1952; Mayer et al., 1993; Natesh, Rau, 1984; Raghavan, 1990;
Raghavan, O'Konkwo, 1982; Schaffner, 1906; Schulz, Jensen, 1968b; Simoncioli, 1974;
Soueges, 1919, 1922b, 1934, 1936d; Sterling, 1955; Swamy, Krishnamurthy, 1975;
Tiagi, 1952a, b; Vallade, 1972; Yamazaki, 1974, 1982.
ЭПИФИЗИС (греч. epi — на, сверху, physo — вздутие,
разрастание) — клетка или группа клеток в апикальной части проэмбрио,
являющиеся инициалями коры и эпидермиса побега.
Термин был введен Soueges (1921) при исследовании развития
зародыша у Myosotis hispida (сем. Boraginaceae). По мнению Soueges
(1921, 1934), у двудольных растений в апикальной части проэмбрио
отделяется эпифизис или эпифизарная ткань, по аналогии с гипофизисом,
дифференцирующимся в базальной его части. Soueges не распространял
данные понятия на зародыш однодольных растений, поскольку считал,
что ось зародыша однодольных недоразвита и его верхняя часть
представляет собой орган, имеющий листовую природу, при этом апекс побега
закладывается и развивается в латеральном положении. Однако его
представление о строении и развитии зародыша однодольных растений было
ошибочным (см. Новая концепция происхождения зародыша
однодольных; Принципы классификации типов эмбриогенеза).
Soueges (1934) суммировал свои представления о времени
дифференциации эпифизиса в виде следующей схемы:
А. В апикальной части проэмбрио дифференцируется одна
эпифизарная клетка:
а) эта клетка является самой верхней клеткой линейной тетрады
(Papaver rhoeas, Sagina procumbens);
б) самая верхняя (клиновидная) клетка квадрантов (Geum urba-
пит, Erodium cicularium, Trifolium minus);
в) самая верхняя (клиновидная) клетка октантов (Myosotis
hispida).
Б. Четыре клетки, располагающиеся по окружности, составляют
эпифизарную ткань и представляют собой:
Зародыш
357
а) квадранты, расположенные горизонтально:
1) с вертикальными перегородками (Geranium molle),
2) с диагональными перегородками (представители сем. Asteraceae);
б) клетки верхнего яруса октантов:
1) дифференцируется один слой инициалей коры стебля (Myosurus
minimus, Sedum acre),
2) дифференцируются несколько слоев инициалей коры стебля (Le-
pidium sativum).
В отличие от Soueges Johansen (1950) считал, что эпифизис
дифференцируется не у всех представителей двудольных растений.
Наличие или отсутствие эпифизиса у проэмбрио было использовано
им при разработке принципов классификации типов эмбриогенеза у
покрытосеменных растений. Он не выявляется у зародышей, развитие
которых соответствует Solanad- или Piperad-типу. Эпифизис
присутствует в проэмбрио, развивающемся в соответствии с Trifolium-
вариацией Onagrad-типа, Geum- и Erodium-вариациями Asterad-типа,
Polemonium- и Myosotis-вариациями Chenopodiad-типа, Sagina-, Vac-
caria-, Hypecoum-, Corydalis-вариациями Caryophyllad-типа. Johansen
(1950) критиковал Soueges за то, что тот при выделении эпифизиса
придавал большое значение ориентации перегородки при делении
клеток в апикальной части проэмбрио. Он привел примеры
варьирования ориентации данной перегородки от вертикальной до
наклонной у тех представителей покрытосеменных растений, у которых
эпифизис не дифференцируется.
По мнению Swamy и Krishnamurthy (1977), эпифизис (эпикоти-
лярный локус) — универсальная структура зародыша всех
покрытосеменных растений, хотя он дифференцируется у двудольных и
однодольных по-разному:
— у двудольных растений эпифизис дифференцируется на стадии
октантов и занимает осевое положение, тогда как семядольный локус
располагается в периферической зоне апикальной части зародыша;
— у однодольных растений «эмбриональный» апекс побега
становится разделенным на эпикотилярный и семядольный локусы с первым
вертикальным делением апикальной клетки (са), т. е. эти два локуса
располагаются рядом друг с другом в горизонтальной плоскости.
Показано, что с момента инициации клетки эпикотилярного локуса
(эпифизарная зона), по сравнению с клетками других частей
зародыша, делятся редко. При переходе зародыша от глобулярной стадии к
сердечковидной клетки эпифизиса также остаются покоящимися.
Покоящийся центр в осевой зоне формирующегося апекса побега
сохраняет гистологические и гистохимические характеристики, присущие
клеткам эпифизарной зоны (Mestre, Guignard, 1967; Swamy,
Krishnamurthy, 1977). В работе Pritchard (1964) на примере Stellaria media
установлено, что апикальные клетки зародыша на ранней стадии
развития (клетки эпифизиса, по Swamy, Krishnamurthy, 1977) отличаются
от остальных клеток крупными ядрами с мелкими ядрышками, низким
358
Семя
уровнем цитоплазматической РНК и сравнительно большим
количеством гранул, окрашивающихся по Фельгену. Рис. 31.
Johansen, 1950; Mestre, Guignard, 1967; Pritchard, 1964; Soueges, 1921a, 1934;
Swamy, Krishnamurthy, 1977.
ЗАРОДЫШЕВЫЙ КОРЕНЬ
Зародыши семенных растений, как правило, образуют зародышевые
корни. В тех случаях, когда зародышевый корень у покрытосеменных
растений отсутствует или слабо развит, можно определенно говорить о
редукции (например, у Ceratophyllum, некоторых Orchidaceae и др.).
Наличие зародышевого корня, продолжающего собой зародышевую ось,
резко отличает семенные растения от птеридофитов, у которых первый
корень спорофита хотя и закладывается очень рано, но почти всегда
несколько сбоку по отношению к главной оси (Guttenberg von, 1960;
Воронин, 1964).
Гипокотиль — корневая ось
Гипокотиль и зародышевый корешок первоначально представляют
собой единое целое — так называемую гипокотиль — корневую ось.1
Очень рано в средней части зародыша, благодаря периклинальным
делениям, отделяется слой протодермы, или первичный дерматоген (по
терминологии Von Guttenberg, 1960; см. Протодерма). Лежащие под
дерматогеном клетки претерпевают продольное растяжение, что влечет
за собой антиклинальные деления клеток в дерматогене. Благодаря
делениям, происходящим во внутренних слоях зародыша и направленным
параллельно его продольной оси, создается несколько концентрических
слоев клеток, составляющих периблему и плерому. Плерому можно
отчетливо различить на поперечных срезах в виде группы более мелких
клеток в центральной части корня. На продольных срезах на дистальном
конце корня можно видеть несколько ярусов клеток, на которые
замыкаются все зародышевые слои — дерматоген, периблема и плерома —
и которые возникают из одной клетки или группы клеток проэмбрио —
гипофизиса (см. Гипофизис). Эти клетки, по Von Guttenberg (1960),
носят название центральных, или соединительных клеток.
I ипокотиль — корневая ось зародыша является частью морфологической оси
зародыша (см. Формирование оси в эмбриогенезе: гипотезы и факты).
Зародыш
359
На определенной стадии развития зародыша (иногда очень рано)
появляются различия в гистогенезе зародышевого корня у двудольных
и однодольных растений. В то время как у двудольных наружные и
внутренние слои периблемы не обнаруживают никаких различий в
характере клеточных делений, у однодольных в самом наружном слое
периблемы изменяется направление деления клеток. Если внутренние
слои периблемы делятся периклинально, за счет чего их число
возрастает в толщину, то в самом наружном слое имеют место только
антиклинальные деления, вследствие чего возникает новый покровный
слой — вторичный дерматоген, который при прорастании семени и слу-
щивании первичного дерматогена формирует ризодерму.
Корневой чехлик, согласно Hanstein (1870), берет начало в гипо-
физисе, состоящем из замыкающих (соединительных) клеток
зародыша. Гипофизис может возникать из различных этажей проэмбрио,
большей частью из «т» или из «п», реже из «о». Встречаются также
случаи, где типичный гипофизис отсутствует (например, у Legumino-
sae); здесь эмбриональный конус замыкается блоком клеток (гипофи-
зарной тканью), которые примыкают к суспензору.
У Capsella (классический пример эмбриогенеза двудольных,
описанный Hanstein) клетка «са» проэмбрио является исходной почти для
всего зародыша. Клетка «сЬ» отделяет кверху одну клетку, которая
далее делится поперек. Это и есть гипофизис, верхние производные
которого дают соединительные клетки, в то время как нижняя
образует чехлик, точнее, его центральную часть — колумеллу. Фланговые
(периферические) части чехлика возникают за счет периклинальных
делений в дерматогене.
Von Guttenberg (1960) в качестве примеров для иллюстрации
развития зародышевого корня у двудольных приводит Biophytum dendroi~
des, Brassica napus и Helianthus annuus.
Корневой полюс у Biophytum dendroides состоит из нескольких
массивов клеток; в центре находится цилиндр плеромы, который
замыкается центральными клетками. Под ними расположена колумелла,
которая своими периферическими слоями граничит с дерматогеном.
У зрелого зародыша Brassica napus можно видеть две центральные
клетки, которые граничат с еще неподелившимися элементами
периблемы, позже претерпевающими Т-деления. Центральная плерома
отщепляет инициали перикамбия (перицикла). Корневой чехлик и дерматоген
формируются из одного и того же инициального слоя клеток — дер-
мокалиптрогена.
Дальнейший ход развития чехлика прослежен Von Guttenberg (1960)
у Helianthus. Гипофизису соответствует здесь этаж «о» проэмбрио; он
поставляет элементы только для чехлика, а не для соединительных
клеток, которые относятся к этажу «п». Гипофизис производит только один
центральный блок клеток чехлика, а периферическая часть последнего,
по-видимому, возникает из дерматогена. Временно обе эти части сначала
резко разграничены, позднее граница становится неясной.
360 Семя
Гипофизарная часть поставляет цепочку клеток, которая
располагается более или менее параллельно оси. Клетки делятся два—четыре
раза продольно и образуют первичную колумеллу. Далее имеют место
только поперечные деления, за счет которых колумелла достигает 12
клетак в высоту. Боковые инициали гипофизиса формируют
клинообразные пакеты клеток, которые претерпевают антиклинальные деления
и растягиваются тангенциально.
Таким образом, у двудольных чехлик имеет двоякое происхождение:
центральная его часть (колумелла) происходит из гипофизиса, а
периферическая зона — из дерматогена.
Особенности развития зародышевого корня у однодольных описаны
на ряде примеров (Guttenberg von, 1960).
У Allium giganteum соединительные клетки возникают из этажа
«т». Зачатки первичной периблемы и плеромы ведут себя так же, как
и у двудольных (т. е. претерпевают периклинальные деления, причем
первичный дерматоген откладывает наружу слои корневого чехлика).
Однако вскоре начинает обособляться вторичный дерматоген
(прекращаются Т-образные деления в наружном слое периблемы). Чехлик
у Allium giganteum в зародыше остается маленьким. Его центральная
часть состоит на продольном срезе из двух-трех рядов колумеллы.
Один ряд краевых клеток, которые называют также боковыми иници-
алями корневого чехлика, примыкает к короткой зоне слабо
выделяющихся клеток дерматогена.
У Galtonia canadensis дифференциация в меристеме наступает еще
раньше в процессе развития зародыша. Т-образные деления (в
первичном дерматогене) локализуются только в наружных производных
дерматогена, за счет чего формируется меристема периферической
зоны корневого чехлика. Внутренний слой клеток после последнего пе-
риклинального деления продолжает делиться только антиклинально,
преобразуясь во вторичный дерматоген. Во всех случаях инициальные
клетки колумеллы сохраняют самостоятельность. По-видимому, они же
на более поздних стадиях формирования корневых меристем
поставляют клеточный материал также и для периферической зоны корневого
чехлика.
Корневой чехлик у зародыша Galtonia крупнее. Это связано с
ранним и более сильным развитием гипофизиса. Так называемые боковые
(периферические) инициали чехлика теперь представлены в виде
клинообразного пакета клеток, примыкающего к участку дерматогена. До
полного развития зародыша формирование чехлика происходит так же,
как у двудольных. Самые верхние клетки чехлика также
состыковываются с клетками первичного дерматогена зародыша.
Есть другой тип развития чехлика у однодольных, где
эмбриональный дерматоген не участвует в образовании чехлика. У Сагех,
например, корневой чехлик образуется исключительно из гипофиза и
охватывает с боков дерматоген. Последний находит свое продолжение в
зарождающемся вторичном дерматогене.
Зародыш
361
Особые случаи формирования первичного корня
а) Роясеае.
По данным Von Guttenberg (1960, 1968), у большинства Angio-
spermae первичный корень возникает экзогенно. Клеточные слои чехлика
образуются за счет периклинальных делений первичного дерматогена,
который лежит на поверхности зародыша. При нарастании чехлика
никакие другие ткани не разрушаются. В отличие от первичного корня
боковые и придаточные корни почти всегда возникают эндогенно. Чехлик
образуется здесь не на наружной поверхности, а внутри тканей растения.
При его прорастании окружающие ткани разрушаются.
Первый зародышевый корень злаков представляет собой исключение,
возникая не экзогенно, а эндогенно, как боковые и придаточные корни.
Чехлик окружен другой тканью — колеоризой, которая разрушается при
прорастании корня. Первичный дерматоген не принимает участия в
формировании корневого чехлика, а его продолжение составляет наружный
слой колеоризы (Guttenberg von et al., 1954; Philip, Haccius, 1976).
Чисто эндогенное заложение первичного корня у злаков, по мнению
Pankow и Von Guttenberg (1957), является уникальным среди
однодольных. Снаружи зачатка корня остается солидный чехол — колео-
риза, которой нет ни у одного другого представителя этого класса.
Эволюционно, по мнению этих авторов, колеориза есть не что иное,
как главный корень, а зародышевый корень — это бывший
придаточный корень (см. Эмбриогенез злаков).
б) СоттеНвасеае.
Несмотря на категорическое утверждение Von Guttenberg об
уникальности эндогенного заложения корня злаков, до сих пор остается
неясным, встречается ли колеориза у других однодольных. Solms-
Laubach (1878) и Gravis (1898) привели рисунки, согласно которым
возникающие эндогенно корни у представителей Commelinaceae
обладают колеоризой. Только первичные корни у этих растений очень
короткие. Позднее эти данные были подвергнуты сомнению.
Согласно Pankow и Von Guttenberg (1957), у Tradescantia чехлик возникает
так же, как и у других растений, из первичного дерматогена, и
никоим образом не эндогенно. Weinhold (1967) присоединился к
этому мнению. Он однако указывает, что у Commelina ко времени
прорастания чехлик расщепляется на внутреннюю и наружную части,
и наружная его часть воспринимается как колеориза.
Tillich (1977) и Lakshmanan (1978) обнаружили у основания гипо-
котиля проростков Commelina своеобразную структуру, которую Tillich
обозначил как «Wurzelhals» (корневая шейка).
Развитие этой структуры прослежено Yamashita (1983) у
Commelina communis. Зародыш С. communis не обладает суспензором. На
стадии торпеды зародыш начинает вытягиваться. Затем семядоля
искривляется и нависает над апексом побега. Первичный дерматоген
362
Семя
корневого полюса еще не обнаруживает периклинальных делений.
Формирование корневого чехлика также еще не начинается. В
середине следующего за наружным слоя можно различить две рядом
лежащие клетки, которые на более поздних стадиях отчетливо оформляются
как центральные клетки периблемы (инициали коры корня, по Soueges,
1934).
Первичный корень у Commelina communis закладывается, как у
большинства растений, экзогенно. Однако в развитии чехлика на
более поздних стадиях наблюдаются некоторые особенности,
связанные с общей морфологией самого зародыша. Последний на корневом
полюсе расширен, и возникающие из первичного дерматогена первые
слои корневого чехлика имеют довольно большую протяженность по
периферии зародыша. Кроме этого, его периферическая зона
разрастается сильнее, чем центральная часть чехлика. Вскоре после
прорастания внутренняя ткань периферической зоны начинает
разрушаться, вследствие чего возникает полость внутри корневого чехлика,
которая делит его на внутреннюю и наружную зоны. Внутренняя
зона соединена с телом корня, а наружная при росте корня
разрывается, при этом часть ткани периферической зоны чехлика
остается в виде воротничка (шейки) у основания гипокотиля. В связи
с описанными особенностями развития корневого чехлика Yamashita
предлагает считать способ возникновения корня у Commelinaceae
переходным между экзогенным и эндогенным.
в) Агесасеае.
Наблюдения над Trachycarpus и Phoenix показали, что базальная
(корневая) часть зародыша дифференцируется очень поздно, уже
после прорастания. Молодые зародыши обладают сначала
недифференцированным зачатком корня (Pankow, Guttenberg von, 1957). На
корневом полюсе различают субапикальную и апикальную зону меристемы.
Меристематическая субапикальная зона преобразуется в апикальную
меристему корня. Субапикальная зона имеет куполообразную форму и
состоит из меристематических клеток («зона Gatin»), которые в
процессе разрастания отделяются от апикальной паренхимной зоны
(«корневого влагалища», по Gatin, 1906). Несмотря на слабую дифферен-
цировку корневого полюса, в покоящемся зародыше различается
прокамбиальный тяж, направляющийся в корень от семядольного узла
(Vallade, 1966).
Данных по эмбриогенезу у пальм явно недостаточно, чтобы снять
вопрос о наличии или отсутствии колеоризы, хотя нельзя не видеть
определенных различий в характере развития зародышевого корня у
представителей Агесасеае по сравнению с Роасеае. Сходство скорее
надо искать с Commelinaceae.
Зародыш
363
Апикальная меристема корня
Общая характеристика
Корни обычно содержат ряд меристематических тканей,
различающихся по происхождению, положению и характеру развития. До
прорастания зародыша корень часто представлен только апикальной
меристемой. Апикальные меристемы состоят из инициальных клеток и их
пролиферативных дериватов. Все инициали вместе составляют проме-
ристему, клетки которой обычно не дифференцируются и дают начало
клеткам другого типа, оставаясь все время в меристеме. В
противоположность этому пролиферативные дериваты инициалей делятся
несколько раз и затем покидают меристему. Число инициальных клеток
варьирует в зависимости от вида и стадии развития, причем их много
в апикальных меристемах голосеменных и покрытосеменных и мало в
корневых апексах низших сосудистых растений (MacLeod, 1991).
Структура апикальной меристемы главного зародышевого корня у
большинства растений складывается в общих чертах уже в позднем
эмбриогенезе, хотя после прорастания семени она может претерпеть
определенные изменения (Guttenberg von, 1955).
Изучение корневых апикальных меристем имеет длительную историю,
неоднократно излагавшуюся в сводных работах (Schuepp, 1926; Clowes,
1959а; Guttenberg von, 1960). В последние десятилетия в
многочисленных экспериментальных исследованиях разрабатывались,
главным образом, проблемы динамики деления и растяжения клеток в
отдельных зонах меристемы, выявлялись взаимоотношения между этими
зонами, их структурно-функциональные особенности и влияние внешних
и внутренних факторов на морфогенетическую активность меристемы в
целом и ее составных частей. Некоторые из последних сводок (Иванов,
1987; MacLeod, 1991) излагают современное состояние и перспективы
развития исследований именно в этих направлениях. В нашем обзоре
дана лишь общая характеристика организации корневой меристемы.
Структурное разнообразие меристем нашло отражение в ряде
классификаций. Одна из них, основанная на гистогенетическом анализе,
разработана Von Guttenberg (1960) (см. схему 1). Все разнообразие
корневых меристем у покрытосеменных Von Guttenberg свел к 4
типам: 1) закрытый тип двудольных, 2) открытый тип двудольных, 3)
закрытый тип однодольных, 4) открытый тип однодольных. Закрытые
типы имеют отграниченные друг от друга инициали различных гисто-
генов, вследствие чего исключена возможность обмена клеточным
материалом между чехликом и корой, корой и стелой. В открытых типах
центральные (соединительные) клетки дают материал для всех гисто-
генов, лишенных строго определенных инициалей. Апикальные
меристемы двудольных и однодольных различаются происхождением
корневого чехлика и протодермы. У первых дерматоген и калиптроген
I 364
Семя
происходят из одного инициального слоя, и протодерма возникает как
внутренний дериват этого слоя, а калиптроген как его наружное
производное. Общий инициальный слой носит поэтому название дермока-
липтрогена, а корни двудольных с закрытым типом меристемы
определяются как климакоризные. У однодольных дерматоген возникает
как наружный слой коры, а чехлик имеет самостоятельные
инициала — лиоризный тип корня. Схематическое представление о типах
гистогенеза в корнях покрытосеменных дает Yamashita (1984). Его
схема (см. схему 2) предполагает также возможный переход из одного
типа меристемы в другой в процессе развития корня.
Воронин (1964) предлагает схему эволюционного преобразования
апикальных структур корня от голосеменных через открытый тип
двудольных к закрытому типу (схема 3). Было показано (Воронин, 1956), что
открытый тип меристем явно тяготеет к более примитивным порядкам,
стоящим в основании системы. Так, открытый тип распространен у
Magnoliales, Nymphaeales, Randies. В этот же список из двудольных
попадают многие раздельнолепестные (Rosales, Fabales, Myrtales, Sa-
pindales, Malvales и др.), а из однодольных — Liliales, Arales, Arecales,
Alismatales. Как считает Воронин, дальнейшая разработка типологии
корневых апексов должна сделать схему, предложенную Von Guttenberg,
более детальной: число типов будет увеличиваться за счет выделенных
ранее и вновь открытых более мелких типов, а также переходных форм,
имеющих эволюционное значение. Однако в последние годы вопросам
классификации и эволюции корневых меристем уделялось сравнительно
мало внимания. Актуальность приобрели функциональные аспекты
изучения меристем, а экспериментальные работы в силу их специфики
проводятся на сравнительно немногих видах растений. Отчасти поэтому
современные исследователи не увеличивают число типов меристем, сводя
их по-прежнему к открытому и закрытому типам (см. Clowes, 1981a).
Все же некоторые авторы отмечают как различие в происхождении
эпидермы и чехлика в пределах одного и того же закрытого типа, так и
возможность перехода одного типа меристемы в другой в процессе
развития (MacLeod, 1991; Yamashita, 1983).
Из-за сложности организации и большого числа клеток в меристеме
высших сосудистых растений, а также с учетом функциональных
особенностей отдельных комплексов клеток выделяют три различные, но
взаимодействующие зоны: проксимальная меристема, включающая ини-
циали стелы, дистальная меристема, включающая инициали корневого
чехлика, и покоящийся центр (Feldman, Torrey, 1975).
Покоящийся центр
Покоящийся центр состоит из относительно небольшого числа
клеток (0,8% от общего числа клеток апикальной меристемы у Vicia
faba, по данным MacLeod и McLachlan, 1974) и происходит из гипо-
физиса (Raghavan, 1993). Существование зоны относительно неактив-
Зародыш
365
Двудольные
Однодольные
* с а с *
Схема 1. Типы гистогенеза в корнях покрытосеменных растений; вд — вторичный
дерматоген, идк — инициали дермокалиптрогена, ипл — инициали плеромы,
ипр — инициали периблемы, ич — инициали чехлика, кп — паренхима коры,
п — перицикл, пд — первичный дерматоген, пк — перикамбий, пр —
периблема, прв — проводящие ткани, р — ризодерма, цц — центральные клетки,
ч — чехлик, э — эндодерма, эк — экзодерма (Guttenberg von, 1960, цит.
по: Воронин, 1964).
366
Семя
Закрытый тип Открытый тип
Схема 2. Первичное строение корня у двудольных и однодольных: Р1 — плерома,
Per — периблема, iec — инициали периблемы и дерматогена, D — первичный
дерматоген зародыша, Dk — дермокалиптроген, К — калиптроген, S — сус-
пензор, d — вторичный дерматоген корня (ризодермис) (Yamashita, 1983).
Зародыш
367
сем.
ыто
а
о
с
S
о
и
голе
а
&
о
>3
К
а
<и
н
с
закрытые
открытые
с
единств.
инициальной
клеткой
с
t»
группой
инициальных
клеток
закрытый закрытый
двудольный однодольный
\ . .
\ /
открытый открытый
двудольный однодольный
\ I
открытый
голосеменной
хвощ. лепт.
\ папор.
\
\
1 осмунд.
\ ужовн. i
\ ч \
\ \ /
\ \ \ /
1 > /
\ маратт. /
\ папор. /
\
\
плаун из.
//
исходный тип
Схема 3. Представление эволюции апикальных меристем в корнях растений: от
голосеменных (А) через открытый тип (Б) к закрытому типу (В) меристем
двудольных и однодольных; из. — изоэтовые, лепт, папор.—лептоспоранги-
атные папоротники, маратт. папор. — мараттиевые папоротники, плаун. —
плауновидные, осмунд. — осмундиевые, селяг. — селягинелловые, ужовн.—
ужовниковые, хвощ. — хвощевые (Воронин, 1964).
368
Семя
ных клеток в меристеме было впервые постулировано Clowes (1954)
на основании анализа общей геометрии корня, а затем было
неоднократно подтверждено с помощью различных подходов: распределения
фигур митоза (Jensen, 1958), введения радиоактивных нуклеотидов во
вновь синтезируемые ДНК (Clowes, 1956, 1959а) и сравнения тонкой
структуры клеток (Clowes, Juniper, 1964; De la Torre, Clowes, 1972)
в различных частях апекса корня. Современные исследования
показали, что хотя общее время удвоения числа клеток покоящегося центра
порядка 100 — 500 или более часов (Clowes, 1969), многие клетки
делятся иногда со значительной скоростью. Таких клеток у Zea mays
от 32 до 42% (Clowes, 1971, 1976а), а у Allium — 22% (Taylor,
Clowes, 1978).
Степень клеточной пролиферации в покоящемся центре различна в
меристемах разного типа. В меристемах открытого типа эта активность
значительно выше, так как дистальные клетки покоящегося центра
регулярно делятся, поставляя новые инициали для корневого чехлика.
Этого не происходит в закрытых меристемах (Clowes, 1981a, 1982).
Однако все клетки покоящегося центра потенциально способны к
делению, что дает возможность пополнять популяцию инициальных
клеток в случае приостановки по каким-то причинам их митотической
активности или при нарушении роста корня в целом.
В результате покоящийся центр может рассматриваться как банк
клеток, которые обеспечивают восстановление меристемы, а
следовательно, и рост корня после повреждения различными факторами, о чем
свидетельствует ряд экспериментальных работ (Clowes, 1959b, 1961;
Davidson, 1961; Hall et al., 1962; Clowes, Stewart, 1967; Иванов,
1974; Barlow, Rathfelder, 1985).
Проксимальная и дистальная меристемы
Эти две части меристемы различаются по своему положению в
апикальной меристеме корня, а также по своим морфогенетическим
возможностям.
Проксимальная меристема расположена внутрь от покоящегося
центра и обращена к основному телу корня; она включает пролифери-
рующие клетки периблемы и плеромы, в том числе и специфические
инициали, прослеживающиеся вплоть до покоящегося центра.
Проксимальная граница этой меристемы не столь четко очерчена, так как
клеточные деления заканчиваются в разных филах клеток вдоль по
корню в разное время. Проксимальная меристема составляет большую
часть меристемы корня (98% клеток у Fagus sylvatica, по данным
Clowes, 1981b).
При обычных условиях роста как инициальные клетки
проксимальной меристемы, так и их меристематические производные имеют
определенную продолжительность жизни в меристеме, т. е. сохраняют
способность к делению только определенный период времени. Однако
Зародыш.
369
каждая инициальная клетка время от времени замещается за счет
деления соседней с ней клетки в покоящемся центре. Это обеспечивает
необходимый для роста корня продолжительный период существования
меристемы и непрерывную пролиферацию ее клеток в корневом апексе
(Barlow, 1976). Вместе с тем клетки проксимальной меристемы,
ближайшие к покоящемуся центру, могут принимать участие в
образовании нового покоящегося центра при нарушении роста корня. Более
того, корни способны восстанавливать апикальную меристему вместе с
покоящимся центром, если часть ее подверглась деструкции (Feldman,
1976; Clowes, 1978).
Дистальная меристема локализована в проксимальной части
корневого чехлика и примыкает к покоящемуся центру с другой стороны. В
морфологическом смысле это калиптроген в меристемах однодольных и
дермокалиптроген в меристемах двудольных. Клетки центральной части
этой меристемы образуют колумеллу корневого чехлика и расположены
в несколько (4—6) рядов.
Поскольку в корневом чехлике слои клеток, находящиеся на его
поверхности, постоянно слущиваются, одной из главных функций дис-
тальной меристемы является замещение этих слоев и регенерация
чехлика. Время оборота всех клеток в чехлике составляет у Zea mays от
22 до 33 часов (Clowes, 1976b), у Allium sativum (Taylor, Clowes,
1978) и Ave.ua saliva (Harkes, 1976) — 5-6 дней, у Vicia faba и
Convolvulus arvensis — от 6 до 9 дней (MacLeod, 1976; Phillips,
Torrey, 1971).
У большинства растений митозы встречаются только в одном или
нескольких слоях клеток, непосредственно примыкающих к главному
телу корня. Число слоев делящихся клеток, как правило, меньше в
более тонких корнях и зависит от организации гистогенеза, наличия
или отсутствия собственных инициальных клеток чехлика (Иванов,
1987).
Дифференциация в дистальной меристеме
Соответственно скорости обновления всего клеточного состава
корневого чехлика осуществляется и дифференциация клеток в этом
органе. Чехлик, по крайней мере его центральную часть, можно более или
менее отчетливо разделить на три зоны: меристематических инициалей,
центральной паренхимы и периферических секреторных клеток.
Наблюдать превращение отделившихся от меристематических инициалей
клеток сначала в запасающие, а затем в секреторные можно на одном и
том же продольном медианном срезе (Данилова, Бармичева, 1980;
схема 4). Эти наблюдения дают представление о чрезвычайно
активных метаболических процессах, осуществляющихся в корневом чехлике
за краткий период его существования. Каждая производная калиптро-
гена по выходе из меристемы проходит фазу запасающей клетки,
отличительной чертой которой является наличие пластид с крупными
24—828
370
Семя
гранулами крахмала. При этом у многих растений формируются так
называемые сложные крахмальные зерна, в которых отдельные
гранулы объединяются в крупные конгломераты. Именно наличие пластид
со множественными крахмальными зернами дало основание для
разработки гипотезы о специфической роли центральной зоны корневого
чехлика в геотропической реакции растения. Эта гипотеза подвергалась
многократной экспериментальной проверке и поддерживается в
настоящее время многими исследователями (см. обзор Servers, Hensel,
1991). Центральная зона корневого чехлика в связи с предполагаемой
функцией в рамках этой гипотезы носит название статенхимы, а
составляющие ее клетки называют статоцитами. В то же время
существуют и другие представления о регуляторных механизмах
геотропической реакции в корне. Kutschera (1996), в частности, главную роль в
этих механизмах отводит асимметричному выделению слизи как
реакции на изменение оводненности прилегающих к корню участков почвы.
Секреция слизи — одна из главных функций корневого чехлика —
приурочена к его периферической зоне. Только у ряда водных
растений, например у водного гиацинта и ряски, эта функция сильно
подавлена, что влечет за собой изменение ультраструктурной
характеристики клеток кармашка, заменяющего у этих видов корневой чехлик. У
большинства же растений ультраструктура периферической зоны
чехлика весьма сходна и специфична. По данным ультраструктуры, эти
клетки могут быть безошибочно диагностированы как секретирующие
полисахаридную слизь.
Переход клеток к выполнению секреторной функции сопровождается
перестройкой в расположении амилопластов. Они не скапливаются в
углах клеток, а располагаются равномерно вокруг ядер. Наблюдается
постепенное «подтаивание» крахмальных зерен в связи с мобилизацией
углеводов на производство слизи.
Резко изменяется структура аппарата Гольджи. Возрастает число
отчленяемых диктиосомами везикулярных элементов, становящихся более
разнообразными. В наиболее дистальных клетках наблюдается и общее
изменение структуры диктиосом: расширяются, заполняясь продуктами
секреции, отдельные цистерны. В корневом чехлике осуществляется гра-
нулокриновый тип секреции. Секретируемая слизь аккумулируется между
плазмалеммой и клеточными стенками. По всей вероятности, вместе со
слизью секретируются также и гидролитические ферменты, принимающие
участие в размягчении клеточной стенки и последующем ее распаде,
т. е. в процессе, ведущем к слущиванию наружных клеток чехлика.
Обособлению клеток способствует и разрыв цитоплазматических связей —
разрушение плазмодесм в результате скопления слизи между клеточной
стенкой и плазмалеммой. В некоторых клетках слизь, скапливаясь в
пространстве между оболочкой и цитоплазмой, постепенно занимает
почти весь объем клетки. После слущивания в некоторых клетках секреция
слизи может продолжаться. В конце концов обособившаяся клетка
чехлика представляет собой мешочек со слизью, в которую погружены бес-
Зародыш
37lj
Схема 4. Изменение структуры клеток в колумелле корневого чехлика от инициален
до периферического секреторного слоя (Данилова, Бармичева, 1980).
форменные остатки цитоплазмы. В дальнейшем цитоплазма
разрушается полностью, клеточная оболочка также подвергается
ферментативному разрушению, и на поверхности корня остаются только скопления
слизи (Данилова, Бармичева, 1980).
Дифференциация в протодерме
У двудольных растений дистальная меристема наряду с корневым
чехликом формирует также ризодерму, морфогенез которой
существенно отличается от развития чехлика. Дивергенция в дермокалипт-
рогене осуществляется посредством периклинальных Т-образных
делений. Внутренний слой дермокалиптрогена выполняет функцию
инициального слоя до завершения периклинальных делений, после чего
он претерпевает дифференцировку, свойственную протодерме.
Специфическая дифференциация в протодерме начинается еще в зоне
меристемы, когда последняя закрыта с поверхности несколькими слоями
чехлика.
24*
372 1_ел«я
Наиболее очевидное проявление этой дифференциации,
намечающееся у многих растений еще в меристеме, — различие между двумя
типами клеток ризодермы: несущими корневые волоски (трихобласта-
ми) и безволосковыми клетками (атрихобластами). Дифференциация в
ризодерме исследована как у двудольных, так и у однодольных
растений (Leavitt, 1904; Cormack, 1947, 1949; Bunning, 1952; Cutter, Feld-
man, 1970; Данилова, Бармичева, 1972; 1980; Иванов, Филипенко,
1976). Подробно этот процесс прослежен на примере Raphanus sativus
(Данилова, Бармичева, 1972).
Существуют различия в происхождении и цитологической
характеристике трихобластов у разных групп растений. Злаки в этом
отношении делятся на две группы: у фестукоидных злаков трихобласты
возникают в результате последних неравных делений в протодерме, у
паникоидных злаков трихобласты с четко выраженными
морфологическими и цитологическими характеристиками вообще не появляются —
считается, что в этом случае любая клетка протодермы потенциально
способна сформировать корневой волосок. У крестоцветных ряды
трихобластов чередуются с рядами атрихобластов.
При этом поперечные клеточные деления в рядах атрихобластов
заканчиваются очень рано, и клетки начинают растягиваться еще не
выходя за пределы меристематической зоны. В то же время
трихобласты в этой зоне претерпевают деления по типу комплексов и
не растягиваются за пределы их исходной длины. Более того, они
начинают делиться, не достигнув длины материнской клетки. В
результате нескольких таких делений возникает комплекс очень
коротких клеток («стопка монет»), сохраняющих на некоторое время
общую клеточную оболочку вокруг всего комплекса. При этом
поддерживается согласованный рост всего комплекса трихобластов и
соседних безволосковых клеток, равным образом как и клеток
первичной коры, примыкающих к трихобластам с внутренней стороны.
Эти отношения иллюстрирует схема, приведенная MacLeod (1991)
(схема 5). В результате на выходе в зону быстрого растяжения
обсуждаемые типы клеток находятся на разных стадиях роста: без-
волосковые клетки уже имеют центральные вакуоли и достигают
значительной по сравнению с трихобластами длины. Трихобласты
практически еще не вакуолизированы, их рост в длину только
начинается. Именно сохранение потенций к активному росту в зоне
растяжения, по-видимому, способствует образованию пальцевидных
выростов у этих клеток и росту корневых волосков (Данилова,
Бармичева, 1972; Данилова, 1975).
У Hydrocharis morsus-ranae и Trianea bogotensis трихобласты
обнаруживают специфические черты дифференциации, связанные в
первую очередь с эндоредупликацией. По данным Cutter и Feldman
(1970а, Ь), ядра в трихобластах к началу развития корневого
волоска накапливают в 8 раз больше ДНК по сравнению с
безволосковыми клетками. При этом трихобласты сильно увеличиваются
Зародыш
373
А
В
А'
А'
В
А"
А"
А"
А"
В
Схема 5. Взаимоотношения между ростом двух соседних клеток А и В в продолжение
двух последовательных митотических циклов. А' и А" представляют собой
производные клетки А соответственно после первого и второго циклов делений,
клетка В не делится в течение этого периода, но должна расти в соответствии
с ростом и делением клетки А, с которой она связана физически по оси ab, так
как клетки удлиняются в течение митотического цикла приблизительно вдвое,
клетка В должна удлиниться сначала на двойную длину клетки А', а затем в 4
раза превысить длину клетки A" (MacLeod, 1991).
в размерах (в противоположность злакам и крестоцветным
у Hydrocharis трихобласты крупнее атрихобластов). Еще одна важная
цитологическая особенность дифференциации ризодермы в этой
группе растений, связанная, по-видимому, с водным образом жизни:
меристематические инициали обоих типов клеток ризодермы имеют
хлоропласты со слаборазвитой системой гран. В процессе
дифференциации хлоропласты полностью утрачивают граны и становятся
обычными лейкопластами, свойственными большинству тканей корня
наземных растений. В то же время гранальная система хлоропластов
безволосковых клеток становится более мощной, т. е. эти клетки,
как и клетки практически всех других тканей корня у этих видов
растений, являются фотосинтезирующими. Таким образом, чисто
корневой метаболизм сохраняют в данном случае только корневые
волоски, развивающиеся из трихобластов.
В итоге развитие трихобластов у крестоцветных, водокрасовых и
злаков, несмотря на различие в их происхождении и некоторых
цитологических характеристиках, сходно в некоторых существенных чертах:
374
Семя
во всех случаях происходит задержка трихобластов на эмбриональной
стадии роста. Это осуществляется разными путями: или за счет
длительных делений по типу комплексов (Brassicaceae), или за счет эн-
доредупликации (Hydrocharis, Trianea), или, наконец, за счет
поддержания эмбриональности в результате неравного деления клеток
протодермы (Роасеае). Вследствие этого материнские клетки
трихобластов и атрихобластов к началу зоны максимального растяжения
имеют различные потенциальные возможности для активного роста.
Механизмы апикального роста корневого волоска здесь не
рассматриваются, так как выходят за рамки эмбриологических проблем.
Дифференциация в прокамбии. Переходная зона
Известно, что у покрытосеменных и голосеменных растений при
следовании проводящих пучков из корня в семядоли наблюдается
перестройка в расположении проводящих тканей, приуроченная к так
называемой переходной зоне (Esau, 1965; Александров, 1966).
Необходимость такой перестройки определяется различием в относительном
расположении элементов проводящих тканей в корне, с одной стороны,
и в семядолях — с другой. Прокамбий, объединяющий инициальные
клетки проводящих тканей, в проростках представлен непрерывными
тяжами, идущими от кончика корня до верхушек семядолей. При этом
в корне прокамбий обычно имеет вид сплошного стержня, а в гипоко-
тиле разбивается на два или большее число тяжей, идущих к
семядолям и листьям (если зачатки последних имеются у зародыша).
Самые первые проводящие элементы протоксилемы
дифференцируются в прокамбиальном цилиндре корня в экзархном положении —
непосредственно под перициклом, а в семядолях — на внутренней
стороне прокамбиального тяжа. Постепенно перемещаясь с наружной
стороны прокамбиального пучка на внутреннюю, цепочка сосудистых
элементов протоксилемы остается все время в так называемой
семядольной плоскости, т. е. в плоскости симметрии семядолей,
проходящей через медианную жилку (Данилова, 1963). Благодаря этому на
поперечных срезах, проведенных на разных уровнях в проростке,
элементы протоксилемы располагаются в прокамбии то в экзархном (в
корне), то в мезархном (в гипокотиле, иногда в основании семядолей),
то, наконец, в эндархном положении по отношению к позднее
дифференцирующейся метаксилеме. Соответственно этому первичная флоэма,
чередующаяся в корне с группами протоксилемы, постепенно переходит
в положение, супротивное первичной ксилеме. Формируется
коллатеральный пучок, свойственный семядоле.
Каждый тяж флоэмных элементов, располагающихся в корне в
межсемядольной плоскости, расщепляется в зоне перехода на два тяжа,
отходящих к разным семядолям. Каждая семядоля оказывается, таким
образом, связанной с двумя флоэмными группами корня, занимающими
в последнем диаметрально противоположные позиции. Следовательно,
Зародь
375
Схема 6. Перестройки взаимного расположения проводящих тканей в зоне перехода
у двудольных (А, Б) и злаков (В): 1 - корень, 2 - зона перехода, 5 —
семядоля; мкс — метаксилема, пкс — протоксилема, ф — флоэма (.Данилова,
Соколовская, 1973).
при перестройке расположения проводящих тканей в зоне перехода
у двудольных растений тяж протоксилемных элементов перемещается
по радиусу в одной и той же плоскости (семядольной плоскости), пока
протоксилемные элементы не займут адаксиального положения. В то
же время тяжи флоэмных элементов в корне и семядолях располагаются
в накрестлежащих плоскостях, и их перемещение происходит по
окружности.
Описанный тип перестройки взаимного расположения проводящих
тканей в зоне перехода принципиально одинаков не только у всех
групп двудольных растений, но и у голосеменных. Различия связаны,
главным образом, с числом флоэмных и ксилемных групп в корне, что,
в свою очередь, отражает характер связи семядолей и первых листьев
с корнем. Так, например, у Onobrychis echidna при триархной
структуре корня третья группа ксилемы и флоэмы связана с боковыми
жилками обеих семядолей (Данилова, Жоголева, 1971).
У подсолнечника при тетрархной структуре корня боковые жилки
семядолей также имеют непосредственное продолжение в стеле корня
(Василевская, 1961). При рано развивающемся эпикотиле медианные,
а иногда и боковые жилки также непосредственно связаны со стелой
корня. Во всех этих случаях строение зоны перехода, естественно,
376
Семя
усложняется. Однако описанный выше тип связи между проводящей
системой корня и средней жилкой семядоли остается без изменения.
Тем более поразительно принципиальное отклонение от этого типа,
обнаруженное у злаков (Данилова, Соколовская, 1973). По схеме 6
можно судить о характере различий в строении зоны перехода у
двудольных (А, Б) и злаков (В). В отличие от двудольных флоэмный
тяж, снабжающий семядолю, у злаков в зоне перехода не меняет
своего положения, располагаясь как в корне, так и семядоле в одной
и той же, семядольной, области. Своеобразие строения зоны перехода
у злаков заслуживает особого внимания при обсуждении гипотез
происхождения однодольности. Рис. 32.
Александров, 1966; Василевская, 1961; Воронин, 1956, 1964; Данилова, 1963, 1974,
1975; Данилова, Бармичева, 1972, 1980; Данилова, Жоголева, 1971; Данилова,
Соколовская, 1973; Иванов, 1974, 1987; Иванов, Филипенко, 1976; Соколовская,
1967; Barlow, 1976; Barlow, Rathfelder, 1985; Banning, 1952; Clowes, 1954, 1956,
1959а, Ь, 1971, 1975, 1976а, Ь, 1978а, Ь, 1981а, Ь, 1982; Clowes, Juniper, 1964;
Clowes, Stewart, 1967; Cormack, 1949; Cutter, Feldman, 1970a, b; Davidson, 1961;
Feldman, 1976; Feldman, Torrey, 1975; Gatin, 1906; Gravis, 1898; Guttenberg von,
1960, 1968; Guttenberg von, Semlov, 1957; Guttenberg von et al., 1954, 1955; Hall
et al., 1962; Hanstein, 1870; Harkes, 1976; Jensen, 1958; Lakshmanan, 1978; Leavitt,
1904; MacLeod, 1976, 1991; MacLeod, McLachlan, 1974; Pankow, Guttenberg von,
1957; Philip, Haccius, 1976; Phillios, Torrey, 1971; Schuepp, 1926; Sievers, Hensel,
1991; Solms-Laubach, 1878; Taylor, Clowes, 1978; De la Torre, Clowes, 1972; Tillich,
1977; Vallade, 1966; Weinhold, 1967; Yamashita, 1983.
ЭПИКОТИЛЬ (греч. epi — на, kotuledon — чашевидный сосуд) —
часть стебля, расположенная над семядольным узлом (Eames, 1961).
Синонимы: почечка, плюмула, надсемядольное колено, точка роста.
В широком смысле под этим термином подразумевают ось,
заканчивающуюся апикальной меристемой, и зачатки листьев (когда они
есть). В узком смысле под эпикотилем понимают только осевую часть
зародыша и проростка, заключенную между семядольным узлом и
узлом первого листа (Eames, 1961; Яковлев, 1981; Данилова,
Кирпичников, 1985).
В ходе эмбриогенеза на противоположных концах продольной
оси зародыша организуются две группы стволовых клеток:
первичные клетки меристемы побега и меристемы корня (Jurgens, 1995;
Padmanabhan, 1996). Становление оси будущего зародыша происходит
с первым делением в эмбриогенезе. При этом поляризация зиготы уже
предопределяется поляризацией яйцеклетки (см. Зигота). Первым
шагом в дифференциации зародыша является обособление слоя протодер-
мы на ранней глобулярной стадии. Зародыш в это время представлен
массой меристематических клеток, ультраструктурные различия между
которыми не всегда обнаруживаются. В ходе дальнейшего развития
деления клеток концентрируются в апикальном и базальном районах
глобулярного зародыша. Эти зоны считают прямыми потомками октан-
377
Зародыш
тов зародыша, но не меристематическими клетками,
закладывающимися de novo (Barlow, 1994; Jurgens, 1995; Padmanabhan, 1996).
У большинства изученных видов, которые в основном относятся к
двудольным растениям, дифференциация апекса побега связывается
с переходом от беспорядочного распределения делений клеток к их
концентрации только в апикальной части и с наличием цитологи-
пеской дифференциации апикального домена зародыша на
периферическую и центральную зоны (Raghavan, Sharma, 1995; Padmanabhan,
1996; Барлоу, 1994). Центральная (или осевая) зона служит для
самообновления и поддержания целостности меристемы. В периферической
(или фланговой) зоне формируются примордии латеральных органов
(Steeves, Sussex, 1989; Барлоу, 1994). В процессе дальнейших делений
и дифференциации клеток формируются семядоли и эпикотиль.
У двудольных растений эпикотиль формируется на базе апикального
(терминального) яруса / проэкбрио (Soueges, 1921, 1934, 1936, 1939;
Johansen, 1950).
Существует мнение, что определенная морфогенетическая
зональность, складывающаяся в процессе развития зародыша (зоны апекса
побега, гипокотиля и корня), не совпадает с системой этажей (Lyndon,
1990; Терёхин, 1991; Jurgens, 1995). Так, в зародыше Arabidopsis
через день после оплодотворения вдоль его продольной оси можно
выделить три района: апикальный, центральный и базальный,
связанные по происхождению с верхним, нижним (I и I ') ярусами и гипо-
физисом проэмбрио, соответственно. Однако эти ярусы не связаны с
примордиями органов и тканей проростка. Апикальный район
впоследствии дает меристему побега и большую часть семядолей,
центральный — часть семядоли, гипокотиль и корень, базальный —
меристему корня (Jurgens, 1995).
У однодольных растений эпикотиль может формироваться на базе
терминального либо субтерминального ярусов. У зародыша Halophila
ovata деление его терминальной клетки на четыре квадранта
посредством двух вертикальных клеточных перегородок приводит к выделению
семядольного и эпикотилярного локусов (Swamy, Lakshmanan, 1962).
У зародыша Sagittaria эпикотилярная зона занимает 1/4 часть от
фланговой зоны эмбрионального апекса, т. е. располагается наклонно
к оси зародыша (субтерминально), остальные 3/4 этой зоны
представляют собой основание и влагалище семядоли, т. е. семядоля
формируется и из терминального, и из субтерминального ярусов (Padmanabhan,
1996).
Существуют две точки зрения относительно природы структур,
возникающих на апикальном домене зародыша. По данным Swamy и
Lakshmanan (1962), дериваты апикальной клетки проэмбрио можно
рассматривать как первично организованный апекс побега. Согласно
Raghavan и Sharma (1995), концентрирование меристематической
деятельности в апикальной части зародыша и установление
цитологической зональности (осевая и фланговая зоны) наблюдаются до диффе-
378
Семя
ренциации семядолей. Из этого делается вывод, что семядоли
являются первыми латеральными органами, формируемыми апексом побега.
Считается, что семядоли как первые латеральные органы имеют
листовую природу и являются модифицированными листьями (Батыгина,
Андронова, 1988; Raghavan, Sharma, 1995). Свидетельством листовой
природы семядолей, по крайней мере у двудольных растений, могут
служить молекулярно-генетические данные по развитию зародыша
Arabidopsis. Выявлены мутанты по генам, которые регулируют
широкий спектр эмбриоспецифической программы, начиная со стадии
«сердечка». Отсутствие функции LEAF COTYLEDON генов приводит к
тому, что семядоли у мутантных проростков теряют свои характерные
особенности и функции (запасание питательных веществ, устойчивость
к обезвоживанию) и приобретают черты, свойственные вегетативным
листьям (наличие трихом, чувствительность к обезвоживанию,
дифференцированная сосудистая система) (Meinke et al., 1994).
Согласно второй точке зрения, семядоли как аппендикулярные
структуры не имеют листовой природы и возникают, как и апекс побега, из
различных локусов апикального домена зародыша. Эта точка зрения
также основывается на том, что: 1) во время закладки семядолей
отсутствует характерная трехслойная (туника — корпус) организация
апикальной части зародыша, присущая вегетативному апексу побега, 2)
получены мутанты (shoot meristem-less), у которых отсутствует эпикотиль,
но формируются нормальные семядоли (Laux, Jiirgens, 1994). Показано,
что SHOOT MERISTEM-LESS ген необходим для нормального образования
побега не только у зародыша, но и при регенерации побега в каллусной
культуре in vitro (Barton, Poethig, 1993).
Данные по генетико-клональному анализу зародыша Gossypium
показывают, что не только две семядоли, но и первые два настоящих
листа происходят из различных локусов апикальной части глобулярного
зародыша, тогда как третий и все последующие листья имеют общее
происхождение (Christianson, 1968). Несмотря на это, листовая
природа двух первых листьев не оспаривается.
Существуют две точки зрения относительно времени появления
специализированных клеток апекса побега в онтогенезе растений. В
соответствии с классическим представлением, которое берет свое начало от
концепции «гистогенеза» Hanstein (1870) и развивается в работах
эмбриологов французской школы, гисто- и органогенез связаны с
возникновением и ранней детерминацией отдельных специфических клеток
проэмбрио (см. Эпифизис).
Согласно второй точке зрения, предложенной Foster (1949), Wardlaw
(1955), Swamy и Padmanabhan (1968) и разделяемой другими авторами
(Lyndon, 1990; Терёхин, 1991; Barlow, 1994; Jiirgens, 1995;
Padmanabhan, 1996), в процессе развития проявляется определенная
пластичность потенций клеток, т. е. специализация клеток происходит
постепенно как результат координированного развития всех частей зародыша
(стадийность процесса). Показано, что судьба клеток не фиксируется
Зародыш
379
в момент заложения тканей и органов. Они способны к дедифферен-
циации и формированию новых растений (Lyndon, 1990; Барлоу, 1994;
Jiirgens, 1995; Raghavan, Sharma, 1995).
На примере reduced мутанта Lycopersicon, у которого отсутствует
стадия органогенеза, показано, что хотя полярность зародыша
(наличие оси апекс побега — апекс корня) детерминируется на стадии
проэмбрио, однако это не предполагает одновременной детерминации
локусов различных тканей и органов (Lyndon, 1990).
Специализация клеток апекса побега, приводящая к появлению при-
мордиев аппендикулярных структур, формирование системы полярного
транспорта ауксина и проводящей системы зародыша
взаимообусловлены (Sachs, 1991). У reduced мутанта в связи с отсутствием зачатков
семядолей и листьев отсутствует и источник ауксина. Без него не
формируется система полярного транспорта ауксина, что ведет к
отсутствию проводящей системы у мутантного зародыша. Однако после
прививки апекса побега зародыша дикого типа (ауксин-синтезирую-
щего района) на апикальную часть мутантного зародыша в его осевой
зоне наблюдается формирование прокамбия. По всей видимости,
зародыш данного фенотипа не имеет структурных аномалий, которые бы
препятствовали его дальнейшему развитию, но в его апикальной части
отсутствуют ауксин-синтезирующие клетки. Следовательно, такая
мутация связана с одним из генов в цикле синтеза ауксина. Данный ген
является еще и ключевым геном в морфогенезе, без нормального
функционирования которого переход апекса побега от эмбриональной
стадии развития к последующей, например, вегетативной, невозможен.
Функционирование меристемы побега зависит от ее физиологического
статуса, что обусловлено участием ключевых генов, без которых
последовательное преобразование апикальной полусферы зародыша в
вегетативный, а затем в генеративный побеги невозможно. Так, у
мутантных проростков embryonic flower фенотипа Arabidopsis отсутствует
вегетативный апекс побега и генеративный побег формируется сразу при
прорастании зародыша (Sung et al., 1992). Данные по embryonic flower
мутантам подтверждают представление о существовании вегетативной и
генеративной фаз в развитии апекса побега. Данные по shoot meristem-
less мутантам доказывают существование эмбриональной фазы в
развитии апекса побега и показывают правомерность введения понятия
«эмбриональный апекс побега», которое было сформулировано Padmanabhan
(1993, 1996). По его мнению, в зародыше покрытосеменных растении
можно выделить три основные части: эмбриональный побег, первичную
меристему корня и суспензор. Эмбриональный побег, в свою очередь,
состоит из нескольких компонентов: гипокотилярной оси, семядоли(-лей)
и эпикотилярной меристемы. Апикальный домен зародыша начинает
функционировать как эмбриональный апекс побега после инициации пе-
риклинальных делений (т. е. отделения протодермы) в терминальном
ярусе проэмбрио. Терминальный и субтерминальный ярусы вместе
образуют эмбриональную меристему побега. Меристема эпикотиля проис-
380
Семя
ходит из апикального домена, и ее можно рассматривать как апекс побега
проростка. Эпикотиль — это лишь та часть апикальной полусферы
зародыша, которая не принимает участия в образовании семядолей. "
В настоящее время считается общепринятой точка зрения о том, что
апекс побега берет свое начало от клеток апикальной части зародыша.
Впервые она была сформулирована в теории «гистогенов» Hanstein
(1870) и получила дальнейшее развитие в работах классиков
эмбриологии — Soueges, Johansen, Swamy. Таким образом, используя методы
классического структурного анализа, можно предсказать судьбу клеток
зародыша, начиная со стадии октантов. Однако при использовании
генетико-клонального и молекулярно-генетического анализов показано,
что судьба клеток зародыша не детерминируется на ранних стадиях
его развития (Lyndon, 1990). Высказано предположение, что
доминирует физиологический, а не клеточный (генеалогический) механизм,
контролирующий дифференциацию тканей, органов и всего
растительного организма (Барлоу, 1994). Авторы в большинстве своем все же
не отвергают полностью значимость неравных делений и
последовательности деления клеток в морфогенезе. При этом подчеркивается,
что данные процессы могут быть более важны в случае растительных,
чем животных организмов (Lyndon, 1990). В настоящее время
«клеточную теорию» морфогенеза растений нельзя не принимать во
внимание (Барлоу, 1994). Рис. 31.
Барлоу, 1994; Батыгина, Андронова, 1988; Данилова, Кирпичников, 1985; Терёхин,
1991; Яковлев, 1981; Barlow, 1994; Barton, Poethig, 1993; Christianson, 1968; Foster,
1949; Hanstein, 1870; Johansen, 1950; Jurgens, 1995; Laux, Jurgens, 1994; Lyndon,
1990; Meinke et al., 1994; Padmanabhan, 1993, 1996; Raghavan, Sharma, 1995; Sachs,
1991; Soueges, 1921, 1934, 1936, 1939; Sleeves, Sussex, 1989; Sung et al., 1992;
Swarny, Krishnamurthy, 1977; Swamy, Lakshmanan, 1962; Swamy, Padmanabhan, 1968;
Wardlaw, 1955.
СЕМЯДОЛЯ (греч. kotuledon — чашевидный сосуд) — первый
особый лист, закладывающийся в зародыше. Особенности строения
семядолей обусловлены местом (в семени), временем образования
(начальные фазы онтогенеза), а также выполняемыми функциями
(запасающая, гаусториальная, защитная, фотосинтезирующая).
Термин введен Linnaeus (цит. по: Jackson, 1916) для обозначения
первых листьев зародыша («семенных долей»): одного — у однодольных
растений (см. Монокотилия) или двух и более — у двудольных
растений (см. Дикотилия; Поликотилия). Разделение растений по
признаку числа семядолей в зародыше на два больших класса —
Двудольные и Однодольные — было предложено Jussieu (1789). Семядоли
характеризуются значительным разнообразием по своей форме, функции
и анатомическому строению (см. раздел Вариации в строении
семядольного аппарата).
Зародыш
381
Семядоли у всех покрытосеменных (как у двудольных, так и у
однодольных) возникают преимущественно из дериватов апикальной клетки
зародыша на разных стадиях его развития, и характер их окончательной
дифференциации в значительной степени зависит от функций.
Семядоли — аппендикулярные органы, часто модифицированные в связи с
выполняемой функцией. В значительной степени эти модификации связаны
со строением зародыша и семени в целом (наличием или отсутствием
эндосперма, перисперма и т. д.).
Апикальная часть зародыша (происходящая из апикальной клетки и
ее дериватов) может быть уподоблена апикальной меристеме побега,
функционирование которой дает либо одну, либо две семядоли (в редких
случаях — много, иногда — ни одной). Таким образом, апикальную
часть зародыша можно рассматривать как апекс стебля, на котором у
разных цветковых растений возникают или семядоли, или примордии
листьев (Батыгина, Андронова, 1988; Batygina, Andronova, 1991;
Padmanabhan, 1996). Вероятно, не стоит искать семядоли в постсеменном
развитии — в проростке, если в зрелом семени их нет, так как,
возможно, в процессе эволюции произошла их редукция либо они вообще
не образовывались (например, Orchidaceae).
Свидетельством листовой природы семядолей, по крайней мере у
двудольных, могут служить молекулярно-генетические данные по развитию
зародыша Arabidopsis. У мутантных проростков семядоли теряют свои
характерные признаки и приобретают черты, характерные для настоящих
листьев (Meinke et al., 1994; см. Эпикотиль).
Вероятно, в процессе эволюции односемядольный зародыш произошел
от двусемядольного, однако способы такого эволюционного
преобразования остаются дискуссионными (см. Новая концепция происхождения
зародыша однодольных).
Батыгина, 1974, 1987; Батыгина, Андронова, 1988; Данилова, Соколовская, 1973;
АгЬег, 1925; Batygina, Andronova, 1991; Campbell, 1930; Guignard, Mestre, 1969;
Jackson, 1916; Jaques-Felix, 1982; Jussieu, 1789; Juquet, 1989, 1990, 1992; Lyon,
1901; Meinke et al., 1994; Mahlberg, 1960; Spurr, 1950; Padmanabhan, 1996.
ВАРИАЦИИ В РАЗВИТИИ СЕМЯДОЛЬНОГО АППАРАТА
ДИКОТИЛИЯ (греч. di, dis — два, дважды и kotuledun —
чашевидный сосуд) — явление возникновения двух семядолей в зародыше
семенных растений. Наличие двух семядолей в зародыше является
одним из признаков класса Двудольных (Dicotyledones)
покрытосеменных растений. Строение семядольного аппарата зародыша двудольных
очень разнообразно. Вопрос об эволюционных взаимоотношениях ди-,
моно- и поликотилии до настоящего времени остается предметом
дискуссии (см. Новая концепция происхождения зародыша
однодольных; Поликотилия).
382
Семя
ПСЕВДОДИКОТИЛИЯ (греч. pseudo — ложный, фальшивый и ko-
tuledun — чашевидный сосуд) — явление образования двух семядолей
в зародыше однодольных растений («двусемядольные однодольные»).
Достоверные факты наличия псевдодикотилии известны только для
Agapanthus umbellatus и Cyrtanthus sanguineus (Alliaceae, Amaryllida-
ceae — Coulter, Land, 1914; Farrell, 1914; см. также Синкотилия) и
Colocasia antiquorum (Araceae — Suessenguth, 1920). В других случаях,
например, у Cocos nucifera (Arecaceae — Haccius, Philip, 1979),
сведения такого рода не были подтверждены. Ряд примеров двусемядоль-
ности у однодольных рассматривается некоторыми авторами как
проявление гетерокотилии (Arum, Arisaema — Araceae — A. Hill, 1906; см.
также Гетерокотилия; Новая концепция происхождения зародыша
однодольных). Рис. 33.
Coulter, Land, 1914; Eames, 1961; Farrell, 1914; Haccius, Philip, 1979; Haines, Lye,
1979; Hill A., 1906; Lawton J.R.S., Lawton J.R., 1967; Solms-Laubach, 1878;
Suessenguth, 1920.
МОНОКОТИЛИЯ (греч. monos — один и kotuledun — чашевидный
сосуд) — явление возникновения единственной семядоли в зародыше
семенных растений. Явление монокотилии характеризуется появлением у
растений в эволюции целого комплекса признаков, на основании
которых среди покрытосеменных был выделен класс Однодольных
растений — Monocotyledones (Jussieu, 1848). Способ эволюционного
становления однодольности окончательно не установлен (см. Новая
концепция происхождения зародыша однодольных).
ПСЕВДОМОНОКОТИЛИЯ (греч. pseudo — ложный, фальшивый и
kotuledun — чашевидный сосуд) — явление образования единственной
семядоли в зародыше двудольных растений («односемядольные
двудольные»). Синоним: ложноодносемядольность.
Термин «псевдомонокотилия» был введен ранними авторами (Winkler
А., 1874; Hegelmaier, 1874, 1875, 1878 и др.) для обозначения случаев,
когда в результате резкого неравенства семядолей в двусемядольном
зародыше (вследствие недоразвития одной из них) создается ложное
впечатление наличия в нем единственной семядоли. Понятие ложной
односемядольности было также связано с представлениями ранних
авторов о том, что в отличие от зародыша настоящих однодольных
растений, где семядоля занимает терминальное положение, а точка роста —
латеральное, у «односемядольных двудольных» семядоля всегда является
латеральной, а точка роста — терминальной. Случаи псевдомонокотилии
также рассматривали как разновидность гетерокотилии (см. Cooke, 1873;
Jackson, 1916). Позднее некоторые авторы (Winkler H., 1931; Arzt,
1933) стали понимать этот термин более широко, включая в него и
случаи полного отсутствия второй семядоли в зародыше двудольных,
причем возникшего как вследствие крайней степени редукции одной из
двух семядолей, так и в результате их полного слияния в процессе
Зародыш
383
эмбриогенеза. Однако Haccius (1952) все же справедливо предлагает
различать эти явления, но называть случаи, когда рудимент второй
семядоли в зародыше присутствует, анизокотилией. Термин
«псевдомонокотилия», по ее мнению, следует употреблять для тех случаев, когда
в зародыше имеется единственная семядоля (без каких-либо признаков
второй), независимо от способа ее возникновения (слияние или
редукция). Следует отметить, что в ряде современных изданий (Данилова,
Кирпичников, 1985) термин «псевдомонокотилия» сохранен в его
первоначальном значении. Случаи образования ложноодносемядольных
зародышей довольно широко распространены среди двудольных растений.
По сведениям Haccius (1952) и Haccius, Trompeter (1960), имеется 17
родов двудольных, у которых один или несколько видов в норме
обладают ложноодносемядольными зародышами. Такие случаи обнаружены
у представителей семейств Apiaceae (Bunium bulbocastaneum, Scaligeria
cretica), Ranunculaceae (Anemone apennina, Ficaria verna), Fumariaceae
(Corydalys cava), Primulaceae (Cyclamen persicum), Lentibulariaceae
(Pinguiqula vulgaris), Portulacaceae (Claytonia virginica), Trapaceae (Trapa
natans) и многих других.
Наличие единственной семядоли в зародыше многих двудольных
растений послужило аргументом в поддержку точки зрения о происхождении
односемядольного зародыша от двусемядольного. Однако в большинстве
случаев природа единственной семядоли в зародыше
ложноодносемядольных видов, а также наличие в нем рудимента второй семядоли являются
дискуссионными. Этим обусловлено возникновение различных гипотез
о происхождении однодольности (см. Новая концепция происхождения
зародыша однодольных; Синкотилия; Гетерокотилия). Рис. 33.
Данилова, Кирпичников, 1985; Титова, 1988, 1996; Arzt, 1933; Campbell, 1930;
Cooke, 1873; Cook, 1903; Gibelli, Ferrero, 1891; Gressner, 1874; Haccius, 1952,
1953a, b, 1954; Haccius, Baude, 1957; Haccius, Fischer, 1959; Haccius, Lakshmanan,
1963; Haccius, Trompeter, 1960; Hagemann, 1959a, b; Haines, Lye, 1979; Hegelmaier,
1874, 1875, 1878; Hildebrand, 1898; Hill A., 1920; Holm, 1901; Irmisch, 1854;
Jackson, 1916; Lubbock, 1892; Metcalf, 1936; Schmid, 1902; Titova, 1992; Weisse,
1930; Winkler A., 1874, 1894; Winkler H., 1931.
СИНКОТИЛИЯ (греч. sun — с, вместе и kotuledun — чашевидный
сосуд) — явление «срастания»1 семядолей в процессе эмбриогенеза
путем объединения их инициалей.
Ряд авторов (Goebel, 1928; Кренке, 1950; Данилова, Кирпичников, 1985)
считают более правильным употреблять по отношению к данному явлению термин
«слияние» семядолей, подразумевая при этом, что при синкотилии происходит не
буквальное срастание семядолей уже после их заложения, а осуществляется их конге-
нитальное объединение. Однако анализ данных по этому вопросу показывает
значительное разнообразие способов срастания семядолей, которое может происходить
как конгенитально, так и постгенитально.
384
Семя
Термин впервые предложен De Vries (1895, 1903) для обозначения
различных форм и степеней тератологического срастания семядолей
проростков своими краями (тератологическая синкотилия — Weisse,
1930), но в дальнейшем стал использоваться для аналогичных явлений,
встречающихся у целого ряда видов в норме (естественная
синкотилия — Weisse, 1930).
Естественная синкотилия достаточно широко распространена среди
двудольных растений и наиболее характерна для представителей
древнейших, архаичных таксонов (Ranunculaceae, Berberidaceae, Papavera-
сеае и др.). Как полагают многие авторы (Sargant, 1903; Haccius,
1952, 1953а; Барыкина, 1971, 1995; Tamiira et al., 1977; Haines, Lye,
1979), у ряда групп цветковых ее возникновение связано с
приспособлением зародыша к прорастанию в условиях геофитного образа жизни.
Это проявляется в комплексе признаков, названных Haccius (1952)
«синдромом геофилии» — формировании укороченного клубневидного
гипокотиля и так называемой семядольной трубки, образующейся в
результате срастания двух семядолей. Семядольная трубка —
полифункциональный орган (Haccius, 1952, 1953а; Барыкина, 1995). Ее
нижняя часть, окружающая точку роста, становится корнеподобной,
формируя ризодермис со всасывающими волосками, и приобретает
положительный геотропизм. Одновременно клетки ее паренхимы служат
вместилищем запасных питательных веществ. Благодаря этим
преобразованиям в процессе прорастания обеспечивается, с одной стороны,
постепенное заглубление апекса побега в почву, что создает
благоприятные условия для его перезимовывания, с другой — его защита при
прохождении сквозь толщу почвы. Однако в норме синкотилия
обнаружена не только у геофитов, но и у представителей других
жизненных форм цветковых растений, например гидрофитов (Nymphaeaceae,
Nelumbonaceae, СаЪотЪасеае — Lyon, 1901, 1905; Cook, 1902, 1906)
и фанерофитов (Magnoliaceae, Fagaceae — Earle, 1932; Белостоков,
1966).
Для продвинутых групп цветковых растений (Cactaceae, Fabaceae,
Balsaminaceae, Asteraceae и др.) более характерна тератологическая
синкотилия, которая может возникать спонтанно (De Vries, 1903;
Compton, 1913) или быть индуцирована экспериментально, путем
физико-химических воздействий (Hanf, 1950; Mcllrat et al., 1950; Ga-
vaudan et al., 1953; Haccius, 1955c, 1960, 1969, 1972; Schuster, 1956;
Haccius, Trompeter, 1960; Liu et al., 1993). Тератологическая
синкотилия имеет наследуемый характер (De Vries, 1903).
Геофилия — способность некоторых многолетних травянистых растений
углубляться своей перезимовывающей частью в почву либо путем втягивания побега сократимыми
корнями, либо при помощи геотропически положительного врастания побега в почву
(Викторов, 1957).
Зародыш
385
Формы синкотилии. De Vries (1903) различал следующие формы
срастания семядолей:
синкотилия (в узком смысле) — срастание семядолей лишь вдоль
одного из их краев;
амфисинкотилия (= амфикотилия) (греч. amphi — вокруг, с двух
сторон) — срастание семядолей по обоим краям с образованием
трубчатой, бокаловидной структуры (т. н. асцидиальная форма семядолей,
от лат. ascidiiformis — в виде асцидии, кувшинчатый).
Позднее для обозначения одностороннего срастания семядолей
некоторые авторы (Haccius, Trompeter, 1960) стали использовать термин
«унимаргинальная синкотилия». Для двустороннего срастания
семядолей, по аналогии со сходным явлением гамофиллии у листьев, было
введено понятие гамокотилии (Gavaudan et al., 1953; Haccius, 1960;
Данилова, Кирпичников, 1985). Примером одностороннего срастания
семядолей являются зародыши Bunium bulbocastaneum, Scaligeria cre-
tica (Apiaceae), двустороннего — Podophyllum peltatum (Berberida~
ceae), Smyrnium olusatrum, S. perfoliatum, Chaerophyllum bulbosum
(Apiaceae) (Haccius, 1952, 1953a). Кроме того, был описан еще один
способ срастания семядолей — их внутренними смежными
поверхностями (Eranthis hiemalis — Haccius, 1953a; некоторые представители
Loranthaceae — Johri et al., 1957; Maheshwari et al., 1957; Dixit,
1958), но специального названия он не получил. Следует отметить,
что большинство упомянутых терминов, используемых для обозначения
различных форм срастания семядолей, по-видимому, являются не
вполне удачными. В частности, термин De Vries «синкотилия» в узком
смысле не отражает односторонний характер обозначаемой им формы
срастания, и в то же время в широком смысле служит для обозначения
явления срастаний в целом. Аналогично термин «гамокотилия» (греч.
gamos — брак и kotuledon) не несет в себе указания на двусторонний
характер срастания. Очевидно, что при разработке терминологии по
данному вопросу необходимо учитывать такие признаки, как части
органов, посредством которых осуществляется срастание (края,
поверхности, стороны — вентральная, или адаксиальная, дорзальная, или
абаксиальная — семядолей), а также характер (направление)
срастания (с одной, с двух сторон) и т. д.
Степень синкотилии. Для обозначения частичного слияния
семядолей как вдоль одного, так и обоих их краев De Vries (1895, 1903)
ввел понятие гемисинкотилии (греч. hemi — полу-). Семядоли могут
срастаться лишь в своем основании (Anemone alpina) частично, вдоль
черешков или пластинок (некоторые виды Combretum — Combretaceae,
Smyrnium olusatrum, S. perfoliatum) и полностью (Bunium —
Apiaceae, Quercus arizonica — Fagaceae). Результатом крайней степени
синкотилии является образование односемядольных зародышей.
Особенности прорастания зародыша при различных формах
синкотилии. При одностороннем срастании семядолей выход листьев
плюмулы при прорастании часто осуществляется сбоку, супротивно
25-828
386
Семя
месту срастания — через щель между свободными, не сросшимися
краями семядолей. При двустороннем срастании, в случае образования
короткой, расширяющейся в верхней части семядольной трубки, листья
плюмулы растут сквозь короткий канал, сохраняющийся внутри нее,
выходя наружу сверху. Однако в некоторых случаях (как при
естественной, так и тератологической синкотилии) прорастание может
быть затруднено. Например, у тератологической синкотильной расы
Helianthus annuus (Asteraceae) большинство проростков —
карликовые, имеют задержки при выходе зародыша из тесты и росте листьев
плюмулы через семядольную трубку (Compton, 1913). У синкотильных
в норме проростков Prangos ferulacea (— Cachrys ferulacea) (Apiaceae)
и Polygonum bistorta (Polygonaceae) только первый настоящий лист
проходит через канал и отверстие вверху трубки, тогда как выход
последующих листьев осуществляется путем механического разрыва
тканей трубки сбоку (Bernhardi, 1832; Winkler A., 1874). У Chaero-
phyllum bulbosum листья плюмулы выходят лишь после отмирания
семядольной трубки (Haines, Lye, 1979). У большинства же
естественных трубчатых форм для прорастания выработалось особое
приспособление — отверстие в основании семядольной трубки, через которое
осуществляется выход листьев плюмулы наружу и происхождение
которого остается невыясненным. В этих случаях канал трубки может
быть редуцирован, как, например, у Smyrnium rotundifolium, где
семядольная трубка становится сплошной, и лишь остатки клеток эпидермы
указывают на его присутствие в прошлом.
Заслуживает внимания тот факт, что для многих синкотильных
форм (виды Clematis, Anemone, Ranunculus, Podophyllum, Corydalis, San-
guinaria, Nelumbo, Quercus и др.) характерен подземный тип прорастания
(Барыкина, 1971, 1995; Ильина, 1988а, б; Колесова (Титова), Батыгина,
1988; Трифонова, 1988).
Заложение семядолей при синкотилии. Как при одно-, так и при
двусторонней синкотилии срастание семядолей, как правило, носит
конгенитальный характер. Однако способ заложения семядолей при
различных формах синкотилии во многом является дискуссионным.
Согласно представлениям ранних авторов, заложение семядолей
начинается с формирования общей (для двух семядолей) семядольной зоны,
имеющей вид «серповидного» или «почти кольцевидного валика»
(«crescentic ridge» — Lyon, 1901a; «circular ring broken at one side by
notch or indentation», «single primordium» — Lewis, 1904; Mottier, 1905),
на котором затем (при частичном срастании — Г.Т.) формируются две
семядоли, характерные для зародышей типичных двудольных растений.
Такой характер заложения и развития семядолей был впервые описан Lyon
(1901а, 1905) для зародыша Nelumbo lutea (Nelumbonaceae) и позднее
обнаружен у целого ряда других двудольных растений (Nymphaeaceae,
Ranunculaceae, Berberidaceae, Papaveraceae, Magnoliaceae, Portulacaceae)
(Schmid, 1902; Cook, 1902, 1903, 1906; Lewis, 1904; Schaffner, 1904;
Mottier, 1905; Earle, 1938; Титова, 1988; Titova, 1990, 1992; Juguet, 1990,
Зародыш
387
1992; Titova, Batygina, 1996).1 Степень выраженности общего
семядольного валика в зародыше может различаться как у разных видов растений,
так и в пределах одного и того же вида. Например, у Sanguinaria canadensis
(Papaveraceae) и Aquilegia canadensis (Ranunculaceae) валик в зародыше
присутствует всегда, но у S. canadensis он хорошо выражен, а у A. canadensis —
едва заметен. У представителей этих же семейств Actaea alba и Stylophorum
diphyllum наряду с зародышами с хорошо выраженным семядольным валиком
встречаются зародыши, у которых он едва выражен или вообще отсутствует
(Mottier, 1905). Аналогичная картина наблюдается в пределах группы
родственных семейств N elumbonaceae, Nymphaeaceae и Cabombaceae: у Nelumbo
lutea, Cabomba piauchiensis и Brasenia schreberi валик хорошо выражен и
охватывает апикальную часть зародыша почти полностью, у Castalia odorata
(Nymphaea odorata) — лишь ее две трети; у Nymphaea advena,
произрастающей в северной части США, семядольный валик окружает апикальную
часть зародыша почти полностью, а в популяциях этого же вида на о, Куба —
лишь наполовину (Lyon, 1901a; Cook, 1902, 1906). Согласно Mottier (1905),
имеется корреляция между степенью выраженности семядольного валика и
«временем разделения его на две семядоли» (степенью срастания
семядолей). Например, у зародышей S. canadensis, обладающих хорошо
выраженным валиком, его «разделение» на семядоли наступает позже, чем у
S. diphyllum, с меньшей степенью выраженности валика.
В ходе эмбриогенеза, по-видимому вследствие интеркалярного роста
общей семядольной зоны, образуется общее семядольное основание
(семядольное влагалище), уровни соединения которого со свободными,
не сросшимися частями семядолей различны с противоположных краев.
В ходе дальнейшего развития эти уровни могут выравниваться, как
полагали некоторые авторы (Lewis, 1904; Mottier, 1905), за счет
различных темпов роста тканей зародыша, заключенных между краями
семядолей (в области основания так называемых синусов семядолей).
В зависимости от соотношения скорости роста в соответствующих
частях зародыша образующееся общее семядольное основание будет
иметь вид трубки, чаши, бокала (двустороннее срастание) или трубки,
открытой с одной стороны щелью (одностороннее срастание).
Согласно Haccius (1952, 1953а), у синкотильных видов семейств
Apiaceae, Berberidaceae и Ranunculaceae семядольная трубка образуется из
особой базальной зоны в апикальной части зародыша, окружающей
область плюмулы в виде кольца и не эквивалентной двум семядолям
двусемядольного зародыша. При этом Haccius игнорирует данные ранних
авторов о наличии стадии серповидного валика в процессе заложения
семядолей, рассматривая одностороннее сближение меристематических
Существуют и другие интерпретации этого явления, как, например, заложение при-
мордия единственной анцестральнои семядоли, раздваивающейся в ходе дальнейшего
развития (Lyon, 1901a, Ь; 1905), как аномальный эмбриогенез (Lewis, 1904; Mottier,
1905) и другие (см. подробнее Titova, Batygina, 1996).
25*
388 Семя
бугорков двух семядолей и различную глубину их синусов как «.случайное
впечатление» или тератологическое, а не нормальное для зародышей
поведение. В то же время она отмечает другую, очень важную особенность
развития зародыша у видов, обладающих длинной семядольной трубкой, —
наличие на внутренней стороне основания семядолей особой вентральной,
или адаксиальной меристемы. В результате периклинальных делений клеток
этой меристемы в зародыше Podophyllum peltatum (Berberidaceae) канал
внутри трубки сильно сужается, так что на ее поперечном срезе он имеет
вид очень узкой щели. У Eranthis hiemalis благодаря деятельности этой
меристемы происходит постгенитальное срастание внутренних, смежных
сторон семядолей, которое осуществляется настолько рано и быстро после
их заложения (еще до образования кутикулы на поверхности), что
практически не остается следов от срастания в виде канала или шва и создается
ложное впечатление эндогенного заложения плюмулы. Вероятно, у
упомянутых выше представителей семейства Loranthaceae, а также Smirnium
rotundifolium (Apiaceae) имеют место аналогичные процессы.
Juguet (1990, 1992) проанализировал с помощью световой и
сканирующей электронной микроскопии процесс заложения семядолей у
различных таксонов двудольных и однодольных растений, в том числе у
обладающих синкотилией. Он пришел к выводу, что и серповидный
валик, и семядольная трубка, а также целый ряд других модификаций
семядольного аппарата возникают на базе единой исходной
кольцевидной семядольной зоны («ringlike cotyledon area»), расположенной
по периферии апикальной части зародыша.
Таким образом, каждый из вышеупомянутых авторов вносит свой
вклад в развитие представлений о заложении и развитии семядолей у
синкотильных форм растений и делает попытку объяснить структурное
разнообразие общего семядольного основания с точки зрения участия
в его формировании различных зон и типов клеточного роста. При
этом ранние авторы обращают внимание на присутствие, хотя бы и
временное, в процессе заложения семядолей при всех формах синкоти-
лии стадии серповидного валика, свидетельствующей об одностороннем
характере срастания семядолей. Haccius логично обосновывает способ
образования трубчатой структуры семядольного основания за счет
наличия «базальной зоны» в основании семядолей, но, как справедливо
отмечали еще Haines и Lye (1979), не объясняет некоторых
особенностей прорастания трубчатых форм, в частности образования у
некоторых из них в основании семядольной трубки отверстия для выхода
листьев плюмулы при прорастании. Точка зрения Juguet, сочетающая
в себе позитивные элементы («серповидный валик» и «базальная
зона») теорий двух предыдущих авторов, кажется наиболее правомерной
с позиций современных представлений о закономерностях морфогенеза
аппендикулярных органов на апексе побега. Однако не совсем ясно,
считает ли автор наличие семядольной трубки и серповидного валика
самостоятельными явлениями или взаимосвязанными. Вместе с тем
стадия серповидного валика часто присутствует при формировании
Зародыш
389
трубчатых форм и может быть связана с тенденцией к образованию
щели или отверстия в основании трубки, необходимого для
беспрепятственного выхода листьев плюмулы при прорастании.
Анализ особенностей развития зародыша у видов,
характеризующихся различными формами синкотилии, показывает, что:
1) в ходе эмбриогенеза у синкотильных форм растений, очевидно,
возможны варианты сочетания различных форм срастаний (одно- и
двустороннего; одно-, двустороннего и внутренними поверхностями и т. д.)
и, соответственно, различных зон (базальная кольцевидная зона, общий
семядольный (серповидный) валик, внутренняя поверхность семядолей),
типов (апикального, базального, интеркалярного) и направлений (акро-
петального, базипетального) клеточного роста. Несомненна
целесообразность разработки унифицированной терминологии для обозначения
перечисленных зон с позиций закономерностей клеточного роста;
2) в пределах близкородственных таксонов с различными формами
синкотилии можно наблюдать стадии перехода от заложения семядолей
типичным для двудольных способом до конгенитально срастающихся
семядолей (сближение зачатков, различная степень выраженности валика).
Особенности эмбриогенеза при синкотилии. Влияние синкотилии
на развитие зародыша изучено, преимущественно, на тератологических
формах, главным образом на стадии проростка. Информация такого
рода в отношении естественных синкотильных форм, а также самых
ранних стадий развития зародыша при синкотилии весьма ограничена.
Исследование анатомии тератологических проростков с различными
формами и степенью срастания семядолей, полученных спонтанно (син-
котильная раса Helianthus annuus — Compton, 1913) или в результате
экспериментального воздействия 2,4-Д (Eranthis hiemalis — Haccius,
Trompeter, 1960), показали, что наиболее интересные изменения в
строении зародыша вызывает одностороннее срастание семядолей. У обоих
видов был получен непрерывный ряд переходных форм от проростков
с двумя одинаково развитыми, односторонне сросшимися лишь в
основании семядольными пластинками до проростков с единственной, без
каких-либо следов срастания, семядолей. При увеличении степени
срастания у Е. hiemalis наблюдалось усиление доминирования одной из
семядолей над другой (различия в размерах), смещение ее центрального
пучка, а также плоскости ксилемных полюсов диархной стелы
зародышевого корня к линии слияния и, соответственно, сдвиг общей симметрии
строения проростка. Одновременно с этим происходила постепенная
редукция центрального пучка подавляемой в развитии семядоли, а также
одного из латеральных (по линии слияния) проводящих пучков обеих
срастающихся семядолей. Аналогичный характер изменения проводящей
системы при срастании семядолей был отмечен и у проростков Н. annuus,
но в этом случае редукция проводящих пучков в сросшихся семядолях
вызывала также и соответственное уменьшение числа лучей ксилемы
исходно тетрархной стелы гипокотиля и зародышевого корня. По данным
Liu et al. (1993), слияние семядолей с образованием трубчатой структуры
j 390
Семя
в зародышах Brassica juncea (Brassicaceae), полученное при воздействии
ингибиторов полярного транспорта ауксинов (TIBА и др.),
сопровождалось некоторой задержкой в развитии апекса побега, который выглядел
при этом «ювенильным». Трубчатая структура была пронизана шестью
сосудистыми пучками сходных размеров, тогда как в норме каждая
семядоля снабжена главной и несколькими латеральными жилками. Гипо-
котиль был более коротким и менее развитым по сравнению с нормой,
число пучков в нем было трудно различимым. Интересно, что
тератологическая синкотилия может одновременно сопровождаться схизокоти-
лией одной или обеих срастающихся семядолей (De Vries, 1903).
Характеризующийся в норме сочетанием одно- и двустороннего
частичного срастания семядолей зародыш Nelumbo nucifera (Nelumbonaceae)
проходит в процессе их заложения стадию «серповидного валика» и имеет
общее семядольное основание в виде короткой трубки, открытой в своей
верхней части щелью (Титова, 1988; Titova, Batygina, 1996). Процесс
инициации семядолей начинается с характерного для зародышей типичных
двудольных растений уплощения апикальной части зародыша в двух
направлениях (сверху и с боков), в результате чего форма последней меняется
от округлой до эллипсоидальной (стадия «сердечка»). Однако в ходе
развития происходит постепенное одностороннее разрастание зародыша в
направлении линии будущего слияния двух семядолей. Форма апикальной
части зародыша вновь становится округлой, и вместо примордиев двух
семядолей формируется единственный примордий, имеющий вид
кольцевидного валика, разделенного с одной стороны тонкой бороздой.
Образование валика связано с активацией периклинальных делений в субэпидер-
мальном слое апикальной части зародыша. Одновременно в субэпидермаль-
ном слое прослеживается присутствие двух почти симметрично
расположенных меристематических зон, дающих в дальнейшем зачатки двух
семядолей зародыша, образующихся на валике. Инициация одной из зон
несколько запаздывает по сравнению с другой, а образующаяся на ее базе
семядоля несколько отстает в развитии и имеет меньшие размеры.
Характерно, что уровни вхождения пучков семядолей в стелу гипокотиля несколько
различаются. В 4 /о случаев образования двух семядолей на валике не
происходило, в результате непрерывного роста общей семядольной зоны
образовывались типично односемядольные зародыши.
Апекс побега располагается примерно в центре апикальной части
зародыша, однако вследствие одностороннего разрастания последней в
направлении медианной плоскости общего семядольного валика он
перестает занимать центральное положение, а односторонний интерка-
лярный рост клеток в области серповидного валика, связанный с
образованием общего семядольного основания, вызывает его постепенное
смещение из прямого (горизонтального) в наклонное по отношению к
морфологической оси зародыша положение. Иными словами, апекс
побега приобретает так называемое «латеральное» положение,
свойственное зародышам ряда однодольных растений. Заложение примордия
первого листа на апексе побега зародыша происходит в целом супро-
Зародыш
391
тивно медианной плоскости общего семядольного основания, однако
его положение несколько смещено в направлении медианной плоскости
доминирующей семядоли. Таким образом, в ходе развития зародыша
N. nucifera и, по-видимому, других синкотильных видов (например,
упомянутых тератологических проростков Е. hiemalis) происходит
неоднократное изменение его симметрии. По мнению некоторых авторов,
изменение симметрии апекса играет важную роль в детерминации
положения аппендикулярных органов на нем и может влиять на струк
туру последующих узлов побега (Hernandez, Green, 1993).
Подтверждением связи между образованием общего семядольного
валика и изменением положения точки роста служит анализ строения
зародышей Aconitum soongaricum (Ranunculaceae) с частичным одно
сторонним срастанием семядолей в их основании (Титова, ориг.
данные). У зародышей этого вида с хорошо выраженным семядольным
валиком точка роста смещена в наклонное по отношению к их
морфологической оси положение, тогда как у зародышей, близких к
типичным двусемядольным (без валика), это смещение отсутствует.
В связи с отмеченными выше особенностями строения зародыша Ne-
lumbo и Eranthis становятся понятными имеющиеся в литературе
отдельные сведения о различиях в размерах срастающихся семядолей у
некоторых видов сем. Ranunculaceae (Actaea alba — Mottier, 1905), a
также о «латеральном» положении точки роста в зародыше в случаях
естественной (Nymphaeaceae, Са bombaceae — Cook, 1906, 1909; Ра-
paveraceae, Corydalis cava — Schmid, 1902; Campbell, 1902;
Ranunculaceae, Delphinium tricorne — Mottier, 1905) и тератологической (De
Vries, 1903) синкотилии.
Вопрос о влиянии способа закладки семядолей на характер
гистогенной дифференциации при синкотилии остается неясным.
Развитие зародыша N. nucifera происходит в соответствии с Asterad-типом
Penaea-вариацией по классификации Johansen (1950). Наиболее четко
закономерности клеточных делений прослеживаются при изучении его
строения в межсемядольной плоскости; в семядольной плоскости они
кажутся беспорядочными. Это связано с тем, что начиная со стадии
зиготы зародыш Nelumbo обладает дорзовентральностью внешнего и
внутреннего строения, плоскость симметрии которого совпадает с
плоскостью одностороннего срастания семядолей. Это проявляется в:
1) наклонном по отношению к продольной оси проэмбрио
положении первой клеточной перегородки в проэмбрио, латеральном
положении клетки т и ее производных, дающих в дальнейшем инициали
главного зародышевого корня и нижнюю часть гипокотиля;
2) последующем одностороннем разрастании зародыша в области
производных клеток т и са, направление которого совпадает с
медианной плоскостью возникающего позднее из производных клетки са
общего семядольного валика (медианной плоскостью одностороннего
срастания семядолей).
392
Семя
Следствием этих процессов, по-видимому, является латеральное
положение главного зародышевого корня в зародыше и, соответственно,
несовпадение морфологической оси зародыша с его продольной
геометрической осью.
Дорзовентральность строения зародыша с самых ранних этапов
развития свойственна, по-видимому, не только N. nucifera, но и другим
видам, характеризующимся наличием синкотилии. Например, для многих
видов рода Delphinium отмечено срастание семядолей, образование
серповидного валика при заложении семядолей, а также смещение точки
роста в «латеральное» положение (Lubbock, 1892; Stercks, 1900;
Mottier, 1905). В то же время, согласно Babis (1976), зародыши D.
tricolor и D. cariopetalum характеризуются дорзовентральным строением
как «в отношении основного габитуса, так и наклонного положения
первых перегородок в проэмбрио», на основании чего автор выделяет два
новых типа эмбриогенеза — Valerianae! и Ranunculad.
В этой связи следует отметить, что эмбриогенез видов, у которых
синкотилия встречатся в норме (Eranthis hiemalis, Podophyllum pelta-
tum и др.), часто относят к иррегулярным типам, при которых
невозможно проследить закономерности гистогенной дифференциации
зародыша (Haccius, 1953a). Возможно, как и в случае с Nelumbo,
представление об иррегулярности клеточных делений у данных видов
является ошибочным и возникает в связи с изучением строения
зародыша, главным образом в семядольной плоскости, которая вследствие
дорзовентральности зародыша не совпадает с его морфологической
осью (апекс побега — апекс зародышевого корня).
Природа ранней дорзовентральности зародыша Nelumbo и
некоторых других видов, характеризующихся синкотилией, остается неясной.
Возможно, она обусловлена постепенным смещением (в эволюции)
одностороннего разрастания апикальной части зародыша в направлении
линии слияния семядолей на все более ранние стадии развития.
Таким образом, срастание семядолей может вызывать существенные
изменения в строении проводящей системы зародыша, положении и
развитии его отдельных органов.
Факторы индукции и регуляции синкотилии. Первые сведения о
зависимости процессов синкотилии от гормонов были получены при
изучении действия на растения гербицидов (Hanf, 1950; Mcllrath et
al., 1950; Gavaudan et al., 1953; Schuster, 1956). Различные формы и
степени срастания семядолей, а также первых листьев проростка
наблюдались при проращивании семян Cossypium, Helianthus и др.,
собранных с растений, обработанных 2,4-Д, ИУК, НУК на различных
стадиях развития (проростка, бутонизации, цветения).
Попытки уточнить характер воздействия ростовых веществ на
заложение и развитие семядолей были предприняты в работах Haccius с
соавторами (Haccius, 1955c, 1960, 1969, 1972; Haccius, Schneider, 1958;
Haccius, Trompeter, 1960). Для этой цели автором была разработана
более точная методика исследования и подобраны удобные объекты —
Зародыш 393 |
виды растений (представители сем. Ranunculaceae), зародыши которых
в момент опадения с материнского организма не дифференцированы на
органы и характеризуются отсутствием каких-либо признаков заложения
семядолей. Обработка семян, помещенных в горшки с землей, путем полива
растворами натриевой и аммонийной солей 2,4 Д вызывала появление
различных форм срастаний семядолей, которые были исследованы анатомически
(см. выше). Воздействие оказалось эффективным лишь в весьма узком
интервале развития зародыша — непосредственно перед инициацией
семядолей — и не оказывало влияния после дифференциации их зачатков.
Более тонкие исследования по гормональной регуляции срастания
семядолей и связанного с нею изменения типа симметрии зародыша были
выполнены на изолированных зародышах Brassica juncea (Brassicaceae),
культивируемых на искусственной среде с добавлением ингибиторов
полярного транспорта ауксинов (TIBA, HFCA, транс-циннамовая кислота)
в разных концентрациях (Liu et al., 1993). Было установлено, что при
воздействии данных ингибиторов наблюдалось блокирование процесса
перехода зародыша от радиальной симметрии к билатеральной и образование
вместо двух семядолей трубчатой структуры (срастание семядолей). При
этом тип срастания зависел не от типа ингибитора, а от его концентрации.
Оптимальная концентрация, при которой 100 /о глобулярных зародышей
развивались в зародыши с полностью сросшимися с обеих сторон
семядолями, составляла 2 цМ для TIBA, 10 (J.M — для HFCA и 80 цМ —
для транс-циннамовой кислоты. Увеличение концентрации ингибиторов не
вносило дополнительных изменений. При концентрациях несколько ниже
оптимальных (например, 5 (J.M HFCA) наблюдалось образование
зародышей с односторонне сросшимися семядолями, причем слитая сторона в
этом случае находилась, как правило, в контакте со средой. Как и в опытах
Haccius, в данной работе было установлено, что стадией, чувствительной
к воздействию указанных веществ, является стадия глобулярного зародыша
(до появления зачатков семядолей).
Согласно Liu с соавторами, зародыши В. juncea со слитыми
семядолями представляют собой фенокопии (в отношении семядолей)
зародышей pin-formed мутантов pin 1-1 Arabidopsis thaliana (Brassicaceae)
с редуцированной активностью полярного транспорта ауксинов в оси
соцветия (Okada et al., 1991), а также зародышей етЬЗО (gnom)
летальных мутантов этого же растения (Meinke, 1985; Mayer et al.,
1993). Исходя из этого, Liu с соавторами пришли к выводу, что
изменение симметрии зародыша при переходе от глобулярной к сер-
дечковидной стадии и образование трубчатой структуры семядолей (их
двустороннее слияние) связано с редукцией в нем полярного
транспорта ауксинов, тогда как частичное (одностороннее) слияние
семядолей — с его остаточным уровнем. Они предложили две возможные
модели синтеза и транспорта ауксинов в процессе инициации
семядолей и высказали предположение, что продукт гена етЬЗО может
играть прямую или косвенную роль в полярном транспорте ауксинов и,
следовательно, становлении симметрии зародыша при инициации семя-
394
Семя
долей. Автор биофизической теории регуляции филлотаксиса Green
(см. Hernandez, Green, 1993) полагает, что неспособность
кольцевидной (трубчатой) структуры у pin-formed мутантных зародышей Arabi-
dopsis разделяться на дискретные органы (две семядоли) может быть
связана с нарушением способности апекса к нормальному
складкообразованию («buckling») его поверхности.
Следует отметить, что образование сросшихся семядолей является
характерным признаком зародышей ряда других мутантных форм Ага-
bidopsis, в том числе двойных мутантов — /eel /ec2 (Meinke et al., 1994).
Показано, что локус «сросшиеся семядоли/отсутствие корней» (эмбриоле-
тальный мутант етЬЗО) тесно связан с локусом «искривленные трихомы»
(мутант dis\) (Meinke et al., 1989). Мутантные зародыши етЬЗО
характеризовались наличием редуцированного гипокотиля, отсутствием
отчетливого апекса главного корня и были не способны развивать корни при
создании соответствующих условий в культуре in vitro (Baus et al., 1986).
Однако в таких зародышах не наблюдалось каких-либо нарушений в
ультраструктурных характеристиках их клеток, в частности формировании
белковых и липидных тел — основного маркера нормального развития зародышей
на цитологическом уровне (Patton, Meinke, 1990). Это свидетельствует о
том, что данные мутантные зародыши имеют измененный тип морфогенеза,
но продолжают дифференциацию на клеточном уровне, т. е. не
характеризуются утратой основной функции — «housekeeping function». Мутант
етЬЗО заслуживает дальнейшего внимательного изучения, поскольку он
относится к группе бескорневых мутантов. Кроме того, слитые семядоли,
характерные для него, напоминают аномалии, которые часто наблюдаются
у соматических зародышей в культуре in vitro (Meinke, 1985).
Роль синкотилии в эволюции цветковых растений. Как известно,
теория возникновения зародыша однодольных растений в результате
срастания двух семядолей зародыша двудольных (теория синкотилии)
была предложена Sargant (1903, 1908). При разработке своей теории
автор основывалась на фактах присутствия в семядоле зародыша
некоторых однодольных (Liliaceae) двух простых или двойных пучков, а
также наличия у них особого, так называемого Anemarrhena-типа
строения зоны перехода, отмеченного также у ряда примитивных двудольных
растений (Eranthis hiefnalis и др.). Такой тип строения зоны перехода,
по мнению Sargant, является примитивным и исходным у цветковых
растений.
В последующие годы теория Sargant была подвергнута критике, при
этом против нее были выдвинуты следующие аргументы:
1) наличие нескольких прокамбиальных пучков в семядолях
однодольных не может служить доказательством, так как неизвестно, какое
их число считать исходным; известны факты двойной сосудистой
симметрии в семядолях голосеменных и ряда двудольных; невозможно
объяснение всех типов зоны перехода у цветковых как простого
отклонения от модели Liliaceae (Boyd, 1932 —1935; Eames, 1961);
зародыш. 395
2) срастание пучков происходит и в семядолях однодольных,
имеющих двойные пучки (Кудряшов, 1964);
3) отсутствие каких-либо следов срастания в строении, закладке и
развитии семядоли однодольных и односемядольных двудольных (Met-
calf, 1936; Eames, 1961; Haccius, Lakshmanan, 1966);
4) синкотилия не приводит ни к изменению листорасположения, ни
к онтогенетическому ускорению развития зародыша, характерному для
зародышей однодольных (Красников, 1989).
Однако большинство приведенных аргументов являются не вполне
справедливыми. Так, отсутствие следов срастания в строении и развитии
проводящей системы единственной семядоли в зародышах
односемядольных двудольных Ficaria verna и Claytonia virginica (Metcalf, 1936;
Haccius, 1954), закладывающейся однако в виде серповидного валика
(Stercks, 1900; Cook, 1903), легко объяснимо. Данные по
тератологическим синкотильным проросткам (Compton, 1913; Haccius, Trompeter,
1960) убедительно показывают, что при крайней степени синкотилии
следы срастания могут отсутствовать.
Вызывает возражение и аргумент об отсутствии следов срастания
семядолей в зародыше однодольных растений. В частности, у
типичных однодольных Agapanthus umbellatus (Alliaceae) и Cyrtanthus sari'
guineus (Amaryllidaceae) было обнаружено образование наряду с
односемядольными зародышами дву-, а в случае Cyrtanthus — даже
четырехсемядольных зародышей (Coulter, Land, 1914; Farrell, 1914).
При этом односемядольный зародыш всегда сначала проходит в своем
развитии стадии дву-, а у Cyrtanthus — четырех- и двусемядольности.
Механизм последовательного преобразования двух и четырех примор-
диев в один на «периферической семядольной зоне» очень сходен с
таковым у Nelumbo и Eranthis. Доказательства происхождения одно-
дольности путем синкотилии получены и при изучении заложения
семядолей у ряда однодольных растений (Tamus communis —
Dioscoreaceae; Endymion nonscriptus — Hyacinthaceae) методом
сканирующей микроскопии (Juguet, Pare, 1989; Juguet, 1990, 1992). В этой
же связи весьма интересны данные Даниловой и Соколовской (1973),
согласно которым структуру зоны перехода в зародышах и проростках
некоторых злаков так же, как и асцидиальную форму их семядоли,
невозможно объяснить с точки зрения гипотезы недоразвития, но она
хорошо согласуется с теорией синкотилии.
Довод о том, что синкотилия не может привести к изменению
листорасположения в эпикотиле, также является спорным. Приведенные
выше данные по эмбриогенезу Nelumbo nucifera показывают, что
срастание семядолей, положение примордия первого листа в эпикотиле и
наличие междоузлия между зачатками семядолей у этого вида — по-
видимому, связанные явления. Сходный вывод на основании анализа
морфологии проростков двудольных растений с различными типами
строения семядольного аппарата делают Haines and Lye (1975, 1979), также
отстаивающие синкотильный вариант возникновения однодольности.
396
Семя
И наконец, в пользу теории синкотилии свидетельствует сравнение
особенностей эмбриогенеза Nelumbo и других видов,
характеризующихся синкотилией, с таковыми однодольных растений (Titova, 1990,
1992; Titova, Batygina, 1996):
во-первых, обнаруживается большое сходство в «механизме»
развития дорзовентральности зародыша Nelumbo и некоторых однодольных,
в частности злаков (см. Graminad-тип эмбриогенеза);
во-вторых, общий семядольный валик в зародыше видов,
обладающих синкотилией, как по способу заложения (серия почти
одновременных периклинальных делений в субэпидермальном слое по всей
периферии апикальной части зародыша), так и функционально
(наличие единой системы анастомозирующих пучков в общем
семядольном основании), правомерно рассматривать как примордии
единственной семядоли, сходный с таковым однодольных растений;
в-третьих, следствием формирования общего семядольного валика в
зародыше (т.е. одностороннего срастания семядолей) является так
называемая «латеральность» точки роста в зародыше, также
свойственная зародышам однодольных растений;
в-четвертых, анализ мутантных форм зародышей Arabidopsis,
характеризующихся формированием слитых семядолей, выявляет сцеплен-
ность данного признака с признаком отсутствия корней и редукции
гипокотиля, что представляет интерес в связи с общей тенденцией
однодольных к редукции главного корня в зародыше. Однако в
отличие от мутантных зародышей, где указанные нарушения в развитии
носят летальный характер, естественные синкотильные формы
получили развитие в эволюции и, вполне возможно, послужили основой для
возникновения нового класса цветковых растений. Рис. 36.
Барыкина, 1971, 1995; Белостоков, 1966; Данилова, Кирпичников, 1985; Данилова,
Соколовская, 1973; Ильина, 1988а, б; Колесова, Батыгина, 1988; Красников, 1989а,
б; Кренке, 1950; Кудряшов, 1964; Титова, 1988а, б; Трифонова, 1988; Babis, 1976;
Baus et al., 1986; Bernhardi, 1832; Boyd, 1932—1935; Campbell, 1902; Compton,
1913; Cook, 1902, 1903, 1906; Coulter, 1915; Coulter, Land, 1914; Dixit, 1958; Earle,
1938; Farrell, 1914; Gavaudan et al., 1953; Haccius, 1952, 1953a, 1954; 1955c, 1960,
1969, 1972; Haccius, Lakshmanan, 1966; Haccius, Schneider, 1958; Haccius, Trompe-
ter, 1960; Haines, Lye, 1975, 1979; Hanf, 1950; Hernandez, Green, 1993; Jackson,
1916; Johri et al., 1957; Juguet, 1990, 1992; Juguet, Pare, 1989; Lewis, 1904; Liu et
al., 1993; Lubbock, 1892; Lyon, 1901a, b, 1905; Maheshwari et al., 1957; Mayer et
al., 1993; Mcllrat et al., 1951; Meinke, 1985; Meinke et al., 1989, 1994; Metcalf,
1936; Mogensen, 1970; Mottier, 1905; Okada et al., 1991; Patton, Meinke, 1990;
Sargant, 1903, 1908; Schaffner, 1904; Schmid, 1902; Schuster, 1956; Sterdex, 1900;
Tamura et al., 1977; Titova, 1990, 1992; Titova, Batygina, 1996; De Vries, 1895,
1903; Winkler A., 1874.
СХИЗОКОТИЛИЯ (греч. schizo — раскалывать, расщеплять и
kotuledun — чашевидный сосуд) — явление разделения семядолей в процессе
их развития на две или более (см. Поликотилия). Рис. ЗЗА.
Зародыш
397
ПОЛИКОТИЛИЯ (греч. polus — много и kotuledun — чашевидный
сосуд) — явление образования в зародыше более чем двух семядолей.
Синонимы: плейокотилия (греч. pleion — больше, более и kotuledun),
многосемядольность.
Термин, по-видимому, заимствован из работ по морфологии
зародышей голосеменных (Jussieu, 1789; Salisbury, 1807; Richard, 1808; Gaert-
ner, 1807), которые нередко характеризуются наличием большого числа
семядолей. В ряде работ по эмбриогении покрытосеменных растений,
особенно ранних авторов (Duchartre, 1848), по аналогии с
голосеменными, принято отличать явление истиной поликотилии от так
называемого разделения семядолей, или схизокотилии. При истиной
поликотилии в зародыше образуется несколько более или менее одинаковых,
симметрично расположенных семядолей, имеющих собственные
примордии при заложении и самостоятельную сосудистую связь со стелой
гипокотиля. При схизокотилии примордии одной или обеих исходных
семядолей разделяются в процессе развития более или менее глубоко
на две, реже три и более, семядоли, и при этом, как правило, можно
проследить характер сосудистой связи, свойственный двусемядольному
зародышу. Однако многие авторы не видят принципиальной разницы
между поли- и схизокотилией, часто используя термин «поликотилия»
по отношению к обоим упомянутым явлениям (см. De Vries, 1903; Guil-
laumin, 1911; Compton, 1913; Haskell, 1954b).
Термин «схизокотилия» введен Worsdell (цит. по: Jackson, 1916)
для обозначения, главным образом, тератологического разделения
семядолей проростков на доли или лопасти различной степени наряду с
ранее использовавшимися терминами «гемитри»- и «гемитетракоти-
лия» (De Vries, 1903). Аналогичные явления, встречающиеся у
некоторых видов растений в норме, первоначально были отнесены к
категории «разделенных семядолей» (Lubbock, 1892), однако позднее по
отношению к ним также стал использоваться термин «схизокотилия».
Процессы, имеющие место при схизокотилии, необходимо отличать
от тех формообразовательных процессов, когда изначально цельная
пластинка семядоли аналогично пластинке сложного листа становится
разделенной на доли или даже листочки («дольчатые семядоли», по
Lubbock, 1892, «сложные семядоли», «листочковость», по Haccius, 1955a,
1972а, Ь), а также от случаев образования в апикальной части семядолей
выемок различной глубины («выемчатые семядоли», по Lubbock,
1892). Примером дольчатых семядолей являются семядоли проростков
Malva, Oenothera, Lavatera, Althaea, Petiveria и др. Образование
выемчатых семядолей часто связано с наличием на кончике семядолей
особых железок, гидатод (Galium aparine), а также с особенностями
строения окружающих зародыш структур семени (вдающиеся внутрь семени
халаза, постамент и т. д. — Impatiens parviflora, Urtica dioica,
Convolvulus soldanella, Ipomoea purpurea, некоторые виды Brassica, Raphanus,
Cuphea и др.). Согласно Lubbock, выемчатость семядолей может
сохраняться в ходе эмбриогенеза и прорастания (G. aparine, Senecio
398
Семя
erucaefolius, виды Lithospermum) и, наоборот, присутствовать в какой-то
отдельный период развития {Oenothera lindleyana). В отличие от схи-
зокотилии, формообразовательные процессы по типу образования
сложных или выемчатых семядолей не приводят к увеличению числа их
зачатков и, по некоторым данным (Haccius, 1972a, b), регулируются
действием цитокининов, а не ауксинов (см. ниже).
Следует также отметить, что для обозначения частей семядолей,
образующихся в результате как схизокотилии, так и упомянутых
формообразовательных процессов, в литературе часто используются одни
и те же термины — «доли», «лопасти», что затрудняет их описание.
Поли- и схизокотилия широко распространены, главным образом
среди двудольных растений (см. обзоры Duchartre, 1848; Thiselton-
Dyer, 1902; De Vries, 1903; Compton, 1913; Buchholz, 1919; Haskell,
1954b; Haccius, 1955a; Eames, 1961; Поддубная-Арнольди, 1976).
Согласно Eames (1961), 2—6% проростков многих таксонов
британской флоры являются многосемядольными, причем особенно это
характерно для древесных Ranales. Среди однодольных образование
многосемядольных зародышей почти не отмечено. Единственный пример
представляет Cyrtanthus sanguinensis (Amaryllidaceae), у которого
наряду с односемядольным обнаружено образование дву~ и че-
тырехсемядольных зародышей (Farrell, 1914; см. также Синкотилия).
Образование глубоко двудольчатого зародыша у Alpinia nutans (Zin-
giberaceae), отмеченное Tschirch (1891), связано с особенностями
строения постамента, вдающегося в полость семени, и, по-видимому,
относится к категории «выемчатых семядолей».
В большинстве описанных случаев речь идет о тератологических
явлениях (тератологические поли- и схизокотилия — Г.Т.). Достоверные
случаи истинной поликотилии, свойственной данному виду в норме
(естественная поликотилия — Г.Т.), достаточно редки и отмечаются
преимущественно для примитивных покрытосеменных. В частности, она
обнаружена у представителей семейств Degeneriaceae (Degeneria vitiensis —
Swamy, 1949b), Idiospermaceae (Idiospermum australiense — Blake, 1972)
и некоторых других. Наличие истинной поликотилии у ряда видов остается
дискуссионным (Acer pseudo-platanoides, Aceraceae — Duchartre, 1848;
Lubbock, 1892; Thiselton-Dyer, 1902; Cola vera, Sterculiaceae — Masters,
1868; Lubbock, 1892; Dalziel, 1937; Engler, 1964; некоторые виды
Pittosporum, Pittosporaceae — Lubbock, 1892; Thomas, 1914). Поликотилия
отмечена для зародышей многих паразитных (некоторые виды Nuytsia,
Loranthus, Loranthaceae — Engler, 1889, 1926; Fletcher, 1909; Narayana,
1958b; Persoonia, Proteaceae — Brown, 1810; von Muller, 1882; Fletcher,
1909; Engler, 1964), а также мангровых (Bruguiera eriopetala, B. ca-
ryophylloides, Rhizophoraceae — Никитичева, Яковлев, 1985) растений,
Приведенная статистика, по-видимому, заимствована из сводок Gruppy (1895) и
Lubbock (1896).
Зародыш
399
однако характер поликотилии в ряде этих случаев окончательно не
установлен. Биологический смысл многосемядольности у паразитных
растений неясен.
Естественная схизокотилия отмечена у представителей ряда
примитивных таксонов двудольных, например, Papaveraceae (Chelidonium
majus — Soueges, 1937c; Eschscholzia californica — Sachar, Mohan
Ram, 1958), Ranunculaceae (Miller, 1927 —1931), а также некоторых
более продвинутых семейств, например Brassicaceae (Schizopetalon
walkeri — Lubbock, 1892). Lubbock полагал, что в большинстве
случаев она является своеобразным приспособлением зародыша к
освобождению из семян с узким отверстием, через которое тонкие, узкие
доли семядолей поочередно выходят при прорастании. В некоторнх
случаях наличие схизокотилии также является предметом дискуссии.
Например, семядоли зародышей fuglandaceae глубоко четырехраздель-
ные (Lubbock, 1892; Nast, 1941; Stone, 1970). Образующиеся
семядольные доли, как правило, одинаковы по размерам, однако у
некоторых видов (Platycarya strobilacea) они заметно неравные, а в ряде
случаев (Pterocarya caucasica, Juglans regia, J. olanchana) разделение
на доли соответствует характеру разделения семени и плода на ячейки.
Исходя из этих особенностей, семядоли Juglandaceae можно отнести и
к категории «выемчатых семядолей» Lubbock.
Тератологические поликотилия и схизокотилия могут возникать
спонтанно или при физико-химических воздействиях у представителей
самых различных таксонов двудольных растений (Duchartre, 1848;
A. Winkler, 1894; De Vries, 1903; Diels, 1910; Guillaumin, 1911;
Tronchet, 1925a, b; Bugnon, Parrot, 1932; Datta, 1941, 1954; Barnes,
1943; Holtorp, 1944; Went, 1944; Chowdhury, Mitra, 1953; Jurkat, 1953;
Reed, 1954 — 1955; Johri, Konar, 1955; Kapil, Bhandari, 1964;
Sethumadhavan, Gopakumar, 1973). При этом причины их возникновения
могут быть различными. Согласно De Vries (1903), образование
многосемядольных проростков является более характерным для культурных
растений, а также тех диких видов, которые длительное время возде-
лывались человеком. Увеличение процента многосемядольных проростков
наблюдалось в результате скрещивания {Beta vulgaris — Munerati,
Costa, 1934), при получении полиплоидных форм (Noguti et al., 1940;
Janaki-Ammal — цит. по Haskell, 1954b). Возникновение поликотилии
связывают с неблагоприятными внешними условиями, при которых
происходит формирование семян, а именно: с недостаточным питанием (Ли-
товченко, 1940; Straub, 1948), пониженными температурами (Straub,
1948; Harrison, 1964) и т. д. Семена некоторых растений,
развивающиеся в летний период, имели лишь 0,5 /о трехсемядольных зародышей,
тогда как в осенний — 20%; удаление листьев и, следовательно,
ухудшение условий их питания также значительно увеличивало процент
трехсемядольных проростков из образующихся семян (Straub, 1948).
Следует отметить, что тератологические схизо- и поликотильные проростки
не всегда являются жизнеспособными. Например, у Nicotiana tabacum
400
Семя
(Solanaceae) наблюдались торможение роста таких проростков, утрата
зеленой окраски семядолей, отсутствие развития плюмулы (Deb, 1955).
Степень схизокотилии может быть различной — от небольшой
выемки на верхушке семядоли до глубокого, практически полного ее
разделения, приводящего к состоянию поликотилии. Для обозначения
состояния, промежуточного между ди- и поликотилией, ранними
авторами (De Vries, 1903) были введены понятия гемитри- и гемитетра-
котилии для случаев, когда происходит частичное расщепление одной
или двух семядолей двусемядольного зародыша, соответственно. Для
целого ряда видов, например Oenothera hirtella (De Vries, 1903),
Cannabis sativa, Phacelia tanacetifolia (Compton, 1913), Delphinium
ajacis (Haccius, 1955a), путем отбора удалось получить поли- и схи-
зокотильные расы с непрерывной серией переходов от двусемядольных
зародышей к многосемядольным через схизокотильные формы
различной степени выраженности. Частота поли- и схизокотилии в таких
расах нередко составляет свыше 50%.
Отмечено, что при поли- и схизокотилии наиболее частыми являются
случаи образования трехсемядольных зародышей (Junger, 1869—1870;
Krause, 1880; Lubbock, 1892; De Vries, 1902; Литовченко, 1940; Hol-
torp, 1944; Rao, Reddy, 1979). Это утверждение, по-видимому, наиболее
справедливо преимущественно для тератологических случаев (виды Pha~
seolus — Gain, 1900; Amomospermum — Diels, 1910; Morus multi-
caulis — Datta, 1941; Cochorus capsularis — Datta, 1954; Cinnamomum
camphora — Chowdhury, Mitra, 1953; Daphne longilobata — Tan,
1980). Согласно De Vries (1902, 1903), некоторые виды образуют
большее число трехсемядольных проростков, чем другие. При этом среди
них можно выделить две расы: полурасы («half races»), которые
представлены истинно трехсемядольными проростками и в которых процесс
отбора не увеличивает их процент в потомстве, и промежуточные расы
(«intermediate races»), в которых процент трехсемядольных проростков
в процессе отбора или под действием внешних условий изменяется.
Состояние трехсемядольности часто достигается путем разделения одной
из двух исходных семядолей в процессе развития. Однако Holtorp (1944)
установил три способа образования трехсемядольных проростков у
Brassica: а) простое расщепление («simple fission»), когда расщепляется
одна из семядолей, при этом она, как правило, имеет аномальную форму
и растет медленнее, чем другая, нерасщепленная; б) «удвоение»
семядолей («twinning»), по-видимому, связанное с кливажной полиэмбрио-
нией и образованием зародышей-близнецов и в) появление
дополнительных семядолей («supplementation»), которые могут возникать вместо
первого листа эпикотиля или супротивно ему, а также вместо второго
или некоторых последующих листьев эпикотиля. Последний способ
обнаружен также у Indigofera linifolia (Rao, Reddy, 1979).
Виды с естественной поликотилией весьма немногочисленны, поэтому
говорить о какой-либо тенденции к три- или тетракотилии трудно.
Например, у Degeneria vitiensis из общего числа проростков 87 /о имеют
Зародыш
401
три семядоли и только 13% — четыре (Swamy, 1949). У Idiospermum
australiensis отмечаются три или четыре одинаковые семядоли (Blake,
1972), у Nuytsia floribunda — только три (Narayana, 1958).
В случаях естественной схизокотилии чаще происходит синхронное,
симметричное разделение обеих семядолей (Eschscholzia californica —
Lubbock, 1892; Schizopetalon walked — Sachar, Mohan Ram, 1958;
виды Juglandaceae — Lubbock, 1892; Nast, 1941; Stone, 1970).
Порядок разделения семядолей при естественной схизокотилии также
может быть различным и влияет на число образующихся семядолей.
Например, для Е. californica характерно однократное разделение
семядолей на две, приводящее к образованию четырехсемядольных
проростков. Однако иногда у этого вида наблюдалось образование и пятисемя-
дольных проростков, что происходит, по-видимому, благодаря
разделению одного из исходных примордиев на три. Такой характер разделения
как одного, так и обоих семядольных примордиев и образование пяти-
и шести семядолей был отмечен у тератологических проростков
родственного вида Papaver rhoeas (De Vries, 1903). Глубоко четырехраз-
дельные семядоли в зародышах Juglandaceae являются, как отмечалось
выше, следствием двух последовательных (первичного и вторичного)
разделений примордиев каждой из двух исходных семядолей на две.
Особенности развития зародыша и заложения семядолей при
поли- и схизокотилии почти не изучены. Следует отметить, что
эмбриогенез некоторых исследованных в этом отношении видов (D. vitiensis,
Е. californica, J. regia, J. manshurica, Carya glabra) характеризуется
иррегулярностью клеточных делений (Langdon, 1934; Nast, 1941; Soueges,
1949; Swamy, 1949b; Sachar, Mohan Ram, 1958). Согласно Langdon
(1934) и Nast (1941), бифуркация семядолей в зародыше Juglandaceae
(/. regia, J. manshurica, C. glabra) происходит в результате прекращения
деятельности апикальной меристемы первичного зачатка семядолей и
образования на его верхушке апикальной борозды, разделяющей семядолю
на две. Однако у /. manshurica апикальная меристема сохраняется еще
некоторое время и на верхушках вновь образовавшихся примордиев.
Более детальны данные анатомического исследования
тератологических переходных форм между дву- и многосемядольными зародышами,
которые показали, что разделение семядолей приводит к серьезным
изменениям как в строении зародышевого корня и гипокотиля, так и в
последовательности дифференциации листовых примордиев на апексе
побега (De Vries, 1903; Compton, 1913; Holden, Bexon, 1918; Bexon,
1920; Harris et al., 1921; Holden, Daniels, 1921; Tronchet, 1925b, 1928;
Bexon, Wood, 1930; Munerati, Costa, 1934; Литовченко, 1940; Banerji,
1961, 1962). Так, у Cannabis sativa (Urticaceae) разделение семядолей
вызывало соответственное увеличение числа лучей ксилемы в стеле
зародышевого корня и гипокотиля, которое осуществляется путем расщепления
ксилемных полюсов исходно диархного корня (Compton, 1913). При этом
чем глубже разделение, тем соответственно на более низком уровне оси
гипокотиль — зародышевый корень происходит это расщепление. Крайняя
26~ 828
402
Семя
степень разделения семядолей приводит к столь глубокому изменению
структуры проводящей системы, что образуются многосемядольные
проростки без каких-либо следов их схизокотильного происхождения. В
ряде случаев у данного, а также некоторых других видов (Phacelia
tanacetifolia (Hydrophyllaceae), Clarkia pulhella (Onagraceae), Amaranthus
speciosus (Amaranthaceae)) наблюдался иной способ изменения проводящей
системы, при котором разделение семядолей не влияло на структуру
зародышевого корня: новые семядольные следы не связаны с расщеплением
исходных ксилемных полюсов корня, а возникают в семядолях de novo,
постепенно «затухая» (слепо заканчиваясь) в гипокотиле. Семядоли такого
рода характерны для многосемядольных зародышей некоторых голосеменных
растений и относятся к категории так называемых «дополнительных
семядолей» («subsidiary cotyledons» — Hill Т., de Fraine, 1908—1910).
Глубокое разделение семядолей, независимо от того, вызывает оно
вышеуказанные изменения в строении зародышевого корня или нет,
приводит к увеличению числа листовых зачатков в первом узле эпикотиля.
Например, у упомянутых выше трехсемядольных проростков С. sativa
и P. tanacetifolia в первом узле эпикотиля наблюдалось образование трех
листовых зачатков вместо двух исходных. Аналогично у четырехсемя-
дольных проростков P. tanacetifolia (результат глубокого разделения
обеих исходных семядолей) в первом узле эпикотиля закладывались
четыре листовых примордия (Compton, 1913). У растений, полученных
из многосемядольных проростков, иногда наблюдалось образование фас-
циированных побегов (Went, 1944; White, 1948), причем, согласно Went
(1944), эти изменения могут быть связаны с процессами восстановления
размеров апекса побега зародыша, увеличивающегося под влиянием поли-
котилии.
Факторы индукции и регуляции схизо- и поликотилии. Согласно
Haccius (1969, 1972а, Ь), обработка семян Eranthis hiemalis (Ranunculaceae)
в процессе их доразвития некоторыми искусственными аналогами ростовых
веществ (аммонийная соль 2,4 Д, натриевая соль 2-метил-4-хлор-
феноксиуксусной кислоты — МРСА) вызывала образование в них до 80%
многосемядольных зародышей. Половину из них составляли трех- и четы-
рехсемядольные зародыши, причем первые преобладали. Другая половина
обладала пятью и более семядолями, однако анатомическое изучение таких
зародышей в развитии показало, что они представляют собой результат
частичного срастания нескольких зародышей-близнецов, образующихся в
результате кливажной полиэмбрионии. В ряде работ поликотилия была
индуцирована воздействием на семена (Eranthis hiemalis — Haccius,
Reinholz, 1953) или целые растения (Nicotiana tabacum — Devreux,
Scarascia Mugnozza, 1964; Chenopodium album — Singh, Chauchan,
1977) рентгеновским облучением. В экспериментах с Eranthis,
чувствительной к воздействиям оказалась стадия позднеглобулярного
зародыша без признаков инициации семядолей, у Nicotiana поликотилия
возникала также при облучении растений на стадии формирования гамет
и зиготы.
Зародыш
403
Тератологические поли- и схизокотилия являются наследуемыми
признаками (De Vries, 1903; Brozek, 1926; Holtorp, 1944; Straub,
1948; Haskell, 1949, 1954a, b; Harrison, 1964). Согласно Straub
(1948), признак трехсемядольности контролируется двумя парами
генов. Поэтому образование упомянутых выше поли- и схизокотильных
рас растений может являться результатом различной комбинации
генов, контролирующих количественный характер проявления признака
(Haskell, 1954b).
У атр~1 мутантных растений Arabidopsis thaliana 20 /о проростков
являлись трех- и четырехсемядольными (по сравнению с 0,1% у дикого
типа). При этом такие растения обладали измененным типом филло-
таксиса на апексе побега (три листа в узле вместо двух у дикого типа),
пониженными степенью апикального доминирования и уровнем фертиль-
ности, более сильным вегетативным ростом и конституционным типом
фотоморфогенеза (Chaudhury et al., 1993). Данный мутант
характеризуется высоким уровнем содержания цитокининов (в 6 раз больше по
сравнению с диким типом), что позволяет предположить важную роль
данного класса ростовых веществ в индукции поликотилии. Факты
корреляции между увеличением числа семядолей и числа плодолистиков
(Tucker, 1938) и частей околоцветника в цветке (Holtorp, 1944) у растений,
полученных из многосемядольных проростков, возможно, объясняются
изменением уровня содержания фитогормонов в растении в целом.
Роль процессов поли- и схизокотилии в эволюции цветковых
растений. По мнению ряда авторов (Sachs, 1882; Masters, 1891; Dorety,
1910 — см. Coulter, Chamberlain, 1910; Поддубная-Арнольди, 1976),
поликотилия является более примитивным состоянием, чем дикотилия,
поскольку она свойственна наиболее древним, как они полагали, группам
голосеменных (Podocarpaceae, Araucariaceae). Однако, согласно Duchartre
(1848), Dangeard (1892), Hill Т., de Fraine (1908—1910), Eames
(1961), Haccius (1955a), поликотилия представляет эволюционно более
продвинутое состояние по сравнению с дикотилией и возникла путем
постепенно углубляющегося процесса раздвоения исходных семядолей
двусемядольного зародыша (схизокотилии). Данное мнение основывалось на
тех фактах, что увеличение числа семядолей путем разделения двух
исходных представляет собой более или менее наследуемую аномалию у
большого числа двудольных цветковых, а анатомия схизокотильных
проростков (в частности, наличие «subsidiary cotyledons») сходна с таковой
нормальных поликотильных проростков голосеменных растений. Являясь
сторонниками точки зрения о производном характере поликотилии,
некоторые авторы (Haccius, 1955) предпочитают термин «плейокотилия», а не
«поликотилия», так как последний означает просто множество семядолей,
а первый — превышение числа семядолей по сравнению с нормальным.
Оригинальная точка зрения о взаимоотношении явлений поли-, ди-
и монокотилии высказана Buchholz (1919), согласно которой эволюция
зародыша шла в направлении от поли- к ди- и монокотилии путем
последовательного попарного слияния многочисленных семядолей пред-
26*
404
Семя
ковых форм. Следует однако отметить, что наличие по крайней мере
трех упомянутых выше способов образования трехсемядольных
проростков в зародыше цветковых не позволяет прийти к окончательному
решению вопроса о происхождении многосемядольности.
Определенное сходство схизокотилии и синкотилии по ряду признаков
(наличие единственного исходного примордия при заложении семядолей,
аналогичный характер поведения проводящей системы — Compton,
1913) породило существование двух противоположных точек зрения о
взаимоотношении явлений ди- и монокотилии: гипотеза Lyon (1901b)
о происхождении двусемядольного зародыша от односемядольного путем
разделения единственной семядоли на две и теория Sargant (1903, 1908)
о происхождении односемядольного зародыша от двусемядольного путем
срастания двух семядолей последнего — теория синкотилии (см. Син-
котилия). Многолетняя дискуссия по этому вопросу, по-видимому,
обусловлена отсутствием детальных знаний о закономерностях заложения
и развития семядолей при этих двух явлениях и, как следствие, четких
критериев, их определяющих. Рис. ЗЗА.
Литовченко, 1940; Никитичева, Яковлев, 1985; Banerji, 1961, 1962; Barnes, 1943;
Bexon, 1920; Bexon, Wood, 1930; Blake, 1972; Brown, 1810; Brozek, 1926; Buchholz,
1919; Bugnon, Parrot, 1932; Chaudhury et al., 1993; Chowdhury, Mitra, 1953;
Compton, 1913; Coulter, Chamberlain, 1910; Dalziel, 1937; Dangeard, 1892; Datta, 1941,
1954; Deb, 1955; Devreux, Scarascia Mugnozza, 1964; Diels, 1910; Duchartre, 1848;
Engler, 1889, 1926, 1964; Farrell, 1914; Fletcher, 1909; Gaertner, 1807; Gain, 1900;
Gruppy, 1895; Guillaumin, 1911; Haccius, 1955a, 1969, 1972a, b; Haccius, Frey, 1965;
Haccius, Reincholz, 1953; Harris et al., 1921; Harrison, 1964; Haskell, 1949, 1954a,
b; Hill, De Fraine, 1908—1910; Holden, Bexon, 1918; Holden, Daniels, 1921; Holtorp,
1944; Jackson, 1916; Johri, Konar, 1955; Junger, 1868—1870; Jurkat, 1953; Jussieu,
1789; Kapil, Bhandari, 1964; Krause, 1880; Langdon, 1934; Leger, 1890; Lubbock,
1892, 1896; Lutz, 1911; Lyon, 1901b; Maheshwari, Johri, 1956; Masters, 1868, 1891;
Miller, 1927 — 1931; von Muller, 1882; Munerati, Costa, 1934; Narayana, 1958b; Nast,
1941; Noguti et al., 1940; Rao, Reddy, 1979; Reed, 1954—1955; Richard, 1808;
Sachar, Mohan Ram, 1958; Sachs, 1882; Salisbury, 1807; Sargant, 1903, 1908;
Saunders, 1928; Sethumadhavan, Gopakumar, 1973; Singh, Chauhan, 1977; Soueges, 1928,
1937c, 1949; Stone, 1970; Straub, 1948; Swamy, 1949b; Tan, 1980; Thiselton-Dyer,
1902; Thomas, 1914; Tronchet, 1925a, b, 1928; Tschirch, 1891; Tucker, 1938; De
Vries, 1902, 1903; Went, 1944; White, 1948; Winkler A., 1874, 1894.
АКОТИЛИЯ (греч. а — частица отрицания, без и kotuledun —
чашевидный сосуд) — отсутствие семядолей в зародыше. При акотилии
семядоли полностью элиминированы и не образуются ни на одной из
стадий развития зародыша.1 Синоним: апокотилия.
Акотилию часто смешивают с явлением задержки дифференциации зародыша на
органы в зрелом семени у видов, характеризующихся доразвитием зародыша в период
после опадения семени с материнского организма до начала его прорастания (см.
Редуцированные и недифференцированные зародыши; Покой семян).
406
Семя
Акотилия свойственна, главным образом, представителям цветковых,
ведущим паразитный или сапрофитный образ жизни, среди которых
встречаются как двудольные (Rafflesiaceae, Orobanchaceae, Scrophularia-
ceae, Cynomoriaceae, Balanophoraceae, Lennoaceae, Hydnoraceae,
некоторые Loranthaceae, Viscaceae), так и однодольные (Burmaniaceae, Orchida-
ceae и др.) растения.
Акотилия у паразитных организмов — эволюционно вторичное
явление и в большинстве случаев является следствием постепенной
редукции семядолей под воздействием перехода нового спорофита к
чужеядному способу питания в процессе его прорастания. Результатом
этой редукции является униполярный (с одной активной морфогенети-
ческой областью) способ развития зародыша. Как известно, семядоли
двудольных растений при автотрофном способе питания выполняют,
главным образом, фотосинтезирующую и запасающую функции и
обеспечивают питание проростка на первых этапах его развития. У
паразитных растений они становятся ненужными, так как функцию питания
у них берут на себя особые присоски (гаустории), образующиеся на
корнях, стеблях или так называемых протосомах, возникающих из
базальной или апикальной областей зародыша (Терёхин, 1977).
В близкородственных таксонах паразитных растений можно наблюдать
некоторые стадии редукции семядолей в зародыше (Терёхин, 1977;
Терёхин, Никитичева, 1981). В семействе Scrophulariaceae
наблюдается постепенная утрата семядолей при переходе молодого спорофита
(проростка) от автотрофного способа питания (например, Verbascum)
к чужеядному — через факультативный паразитизм (Odontites verna)
к различным формам облигатного паразитизма (Pediccularis, Bartsia,
Lathraea squamaria, Striga orobanchoides, Harveya) (см. схему). В ряде
случаев эта редукция заходит столь глубоко, что вызывает
существенные изменения в ходе эмбриогенеза. Например, у некоторых
Orobanchaceae наблюдаются нарушения в дифференциации эмбриодермы в
апикальной части зародыша (Aeginetia indica — Tiagi, 1952a),
вариабельность поведения клетки са двуклеточного проэмбрио (Epiphagus
americana — Cooke, Shively, 1941; Orobanche pallidiflora —
Никитичева, 1971; Phacellanthus tubiflorus — Терёхин, 1973).
Наличие акотилии у некоторых однодольных, в частности в сем.
Orchidaceae, до сих пор остается дискуссионным вопросом (см.
Эмбриогенез орхидных). Согласно мнению многих авторов (Veyret,
1974, и др.), зародыш большинства орхидных не имеет семядолей.
Однако у ряда видов (Sobralia macrantha, Bletilla striata, Arundina
graminifolia, Thunia marshalliana) в зрелых зародышах отмечено
наличие зачатка единственной семядоли (Treub, 1879; Burgeff, 1936;
Swamy, 1942,1949a; Поддубная-Арнольди, Селезнева, 1957;
Nishimura, 1981, 1991). Существует точка зрения, что у некоторых
орхидных (Bletia purpurea, Thunia marshalliana и, возможно, других
видов) семядоли дифференцируются в процессе прорастания семени,
но имеются разногласия в отношении их числа: одна (Nishimura,
Зародыш
407
1991) или две (Терёхин, Никитичева, 1968; Терёхин, 1977; см.
также Редуцированные и недифференцированные зародыши). По
данным Батыгиной и Андроновой (1988), в зародыше так
называемых семядольных видов орхидных семядоли отсутствуют, первые
листовые органы являются настоящими листьями; высказана точка
зрения, что в процессе эволюции произошла их редукция или они
вообще не образовывались (см. Семядоля). Сведения о наличии
семядоли у представителей орхидных, считающихся наиболее
продвинутыми в данном семействе (Nishimura, 1991), послужили основой
для предположения, что так называемые семядоли в этом случае
являются эволюционно вторичным образованием, возникшим de novo
в связи со спецификой прорастания семян у этих растений (Назаров,
1995). В аспекте вышеизложенной дискуссии вызывает интерес
оригинальное мнение о том, что зародыш однодольных растений не
имеет семядоли вообще и представляет собой бессемядольный
разветвленный протокорм (Jacques-Felix, 1958, 1982).
Акотилия может быть вызвана экспериментальным путем у
растений, зародыш которых в норме имеет семядоли. Например,
воздействие на двусемядольный зародыш Eranthis hiemalis и ложноодносемя-
дольные зародыши Ranunculus ficaria и Anemone appenina
(Ranunculaceae) на самых ранних стадиях инициации семядолей фе-
нилборной кислотой (искусственным аналогом растительных гормонов)
вызывало образование бессемядольных зародышей. Причем в двух
последних случаях акотилия сопровождалась преждевременным
развитием первого листа почечки (Haccius, 1959, 1960, 1972; Haccius,
Lakshmanan, 1967). Рис. 34.
Андронова, 1988а, б; Батыгина, Андронова, 1988; Назаров, 1995; Никитичева, 1971;
Поддубная-Арнольди, Селезнева, 1957; Терёхин, 1973, 1977; Терёхин, Никитичева,
1968, 1981; Burgeff, 1936; Cooke, Shively, 1941; Haccius, 1959, 1960, 1972; Haccius,
Lakshmanan, 1967; Jacques-Felix, 1958, 1982; Nishimura, 1981, 1991; Swamy, 1942,
1949a; Tiagi, 1952a; Treub, 1879; Veyret, 1974.
ГЕТЕРОКОТИЛИЯ (греч. heteros — другой, различный, разнородный
и kotuledun — чашевидный сосуд) — различие семядолей одного и
того же зародыша по размерам, строению и функциям. Синоним:
анизокотилия (греч. aniso — неравный и kotuledon).
Термин «гетерокотилия» первоначально был введен для
обозначения, главным образом, различий семядолей зародыша по размерам.
Такое неравенство семядолей нередко связано с характером положения
и «упаковки» зародыша в семени. Например, у Cereus (Cactaceae),
Raphanus, Hesperis (Cruciferae), Cannabis (Cannabaceae), Abronia,
Oxybaphus, Mirabilis (Nyctaginaceae), где зародыш сильно изогнут или
сложен U-образно, одна из его семядолей может быть несколько
короче и тоньше другой (Lubbock, 1892). В качестве примера резкого
неравенства семядолей часто приводят так называемые ложноодносе-
408
Семя
мядольные зародыши {Trapa natans, Ranunculus ficaria, Claytonia
virginica и др.). одна из семядолей которых, как принято считать,
находится в рудиментарном состоянии вследствие своего недоразвития.
Однако наличие этого рудимента в большинстве отмеченных случаев
является предметом дискуссии (см. Псевдомонокотилия).
Позднее у некоторых растений были обнаружены существенные
различия семядолей одного и того же зародыша не только по размерам,
но и по строению, функциям и дальнейшей судьбе в ходе прорастания.
Впервые это явление было описано A. Hill (1906) при исследовании
морфологии проростков группы геофильных видов Peperomia — Р. реги~
viana, P. parvifolia и др. В отличие от большинства видов Peperomia,
которые имеют две строго супротивные семядоли, выходящие при
прорастании из семени и функционирующие как ассимилирующие органы (Johnson,
1900), у этих видов одна из семядолей остается внутри семени и выполняет
функцию абсорбции питательных веществ из тканей эндосперма и
перисперма. При этом у P. peruviana в зрелом семени ассимилирующая (эпи-
гейная) семядоля более массивная, ее пластинка дифференцирована на
эпидермис с устьицами и гидатодами, палисадную и водозапасающую ткани
и содержит три (медианный и два латеральных) проводящих пучка.
Абсорбирующая (гипогейная) семядоля меньше по размерам, имеет слабо пель-
татную форму, не дифференцирована на ткани, свойственные
ассимилирующей семядоле, почти лишена устьиц и гидатод и содержит лишь один
проводящий пучок. У P. parvifolia специализация одной из семядолей как
абсорбирующего органа выражена еще сильнее, что проявляется в полном
отсутствии устьиц на ее поверхности и утрате дорзовентрального строения.
Пластинка эпигейной семядоли при этом дифференцирована в меньшей
степени, чем у P. peruviana, и занимает в зрелом семени значительно
меньший объем.
Доказательством того, что в зародыше упомянутых видов Peperomia
мы имеем дело именно с двумя семядолями, а не с единственной
семядолей и первым настоящим листом плюмулы, по мнению A. Hill,
является: 1) наличие в зрелом семени двух типичных для
двусемядольных зародышей семядолей, 2) их строго супротивное расположение и
3) наличие единого узла их проводящих пучков. Следует, однако,
отметить, что данные по эмбриогенезу и, в частности, по заложению
и развитию семядолей у этой группы растений отсутствуют.
Согласно данным некоторых ранних авторов (Gressner, 1874; Hil-
debrand, 1898; Schmid, 1902), зародыш геофильного вида Cyclamen
persicum (Primulaceae) является ложноодносемядольным и имеет две
семядоли, резко различающиеся по размерам: одну — рудиментарную и
вторую — нормальную, выполняющую при прорастании фотосинтезирую-
щую функцию. Другие авторы (Bernhardi, 1832; Sargant, 1903) полагали,
что в зародыше этого растения имеется единственная семядоля,
возникшая в результате слияния двух исходных. Используя результаты
экспериментальных работ Goebel (1902) и Н. Winkler (1902) по регенерации
различных частей проростка Cyclamen, H. Hill (1920) попытался полу-
409
Зародыш
чить доказательства в пользу семядольной природы рудиментарного
придатка в зародыше этого растения. Хирургическое удаление
нормальной семядоли индуцировало развитие рудиментарной. Последняя
располагалась строго супротивно первой и имела сходство с ней как
по морфологическим (форма пластинки, характер ее окраски и
окаймления), так и анатомическим (строение проводящей системы)
признакам, резко отличающим ее от первых настоящих листьев. В отличие
от последних, как нормальная, так и индуцированная к развитию
рудиментарная семядоли были способны к регенерации корней, будучи
изолированными от проростка, а также к образованию новой
пластинки в случае удаления первоначальной. Тем самым Н. Hill подтвердил
интерпретацию строения зародыша Cyclamen как гетерокотильного, лож-
ноодносемядольного. Эту точку зрения разделяли впоследствии Rauh
(1937) и Roth (1955).
У представителей сем. Gesneriaceae {Streptocarpus, Chirita, Saintpaulia,
Ramondia и др.) различия в строении, судьбе и функциях семядолей
проявляются лишь в ходе прорастания (Hill A., 1938), в отличие от
Peperomia и Cyclamen, где они начинают проявляться, по-видимому,
еще в ходе эмбриогенеза. Согласно автору, у проростков Gesneriaceae
одна из двух исходно равных семядолей задерживается в росте и
абортируется, тогда как другая заметно увеличивается в размерах и
приобретает вид, сходный по форме, строению, характеру опушения и
т. д. с настоящими листьями, возникающими на апексе побега. У ряда
видов — так называемых однолистных, или семядольных геснериевых
{Streptocarpus dunnii, Chirita monophylla и др.), — в ходе всего
жизненного цикла развитие листовых примордиев на апексе побега не
происходит, и все растение представлено единственным листовым
органом — разросшейся семядолей — в противоположность розеточным
видам, где формируется розетка из 3—4 или более настоящих листьев.
У однолистных геснериевых никаких следов плюмулы не сохраняется,
а увеличение в размерах второй семядоли происходит не за счет роста
пластинки, а благодаря деятельности особой базальной меристемати-
ческой зоны, расположенной в основании черешка, в месте соединения
с гипокотилем. Собственно пластинка семядоли едва различима на
кончике этого, по выражению A. Hill, «пяточного» листа проростка.
У Chirita и Streptocarpus часто наблюдается развитие в пазухе
сохраняющейся семядоли дополнительных пазушной, а нередко и внепазуш-
ной почек, что, вероятно, связано с деятельностью базальной
меристемы.
В более поздних работах данные по морфологии проростков
упомянутых видов растений были подвергнуты ревизии. Так, детальное ци-
тоэмбриологическое и анатомическое исследование развития зародыша
Cyclamen persicum (Hagemann, 1959a, b) показало, что в зрелом
зародыше и проростке этого растения не существует никаких следов
рудиментарной семядоли; листовой орган, расположенный супротивно
единственной семядоле, является первым настоящим листом проростка,
410
Семя
образующимся на апексе побега в постэмбриональный период.
Проводящий пучок первого листа действительно имеет прямую связь со
стелой гипокотиля, что, однако, не может быть принято за аргумент
против его эпикотилярной природы, так как такой тип связи хорошо
известен как Allium-тип в зародышах многих однодольных.
Попытка ингибировать единственную семядолю в зародыше этого
же вида воздействием фенилборной кислоты (в концентрации
2 • 10" 3 М) на стадии ее инициации (Haccius, Lakshmanan, 1967)
не привела к развитию какой-либо второй семядоли супротивно
первой, как это следовало ожидать исходя из экспериментов Н. Hill.
Вместо примордия единственной семядоли наблюдалось образование
двух других, явно неравных размеров, примордиев, объединенных
общим семядольным основанием. При этом точка роста располагалась
не строго посередине между двумя образующимися примордиями,
как у зародышей типичных двудольных растений, а оказалась
несколько смещена в латеральное по отношению к общему
семядольному основанию положение, как это наблюдается в некоторых
случаях срастания семядолей.
С точки зрения Haines и Lye (1979), из двух первых листовых
органов (семядолей, по A. Hill) у зародышей геофильных видов Ре-
peromia и Gesneriaceae лишь один, абортирующийся в ходе
прорастания, имеет семядольную природу и является результатом срастания
двух исходных семядолей, а другой, разрастающийся в ходе развития,
представляет собой первый лист эпикотиля. В качестве доказательств
авторы приводят данные A. Hill о частом образовании междоузлия
(мезокотиля) между этими двумя листовыми органами у геснериевых
и особенности их положения по отношению к последующим листовым
зачаткам, возникающим на апексе побега проростка. Следует, однако,
учитывать, что целый ряд данных по эмбриогенезу Gesneriaceae
(Crete, 1949; Arecal, 1961; Adatia et al., 1971; Алимова, Яковлев,
1982, 1987) убедительно показывает заложение и развитие в
зародыше двух совершенно идентичных друг другу семядолей.
Значительные различия семядолей в размерах, строении и функциях
были позднее отмечены также у некоторых представителей семейств
Bombacaceae (Pachira oleaginea, P. macrocarpa, Gatostemma digitata, Gy-
ranthera caribensis — Baker, 1960; Roth, 1977; Shepherd, Alverson, 1981;
Вышенская, 1992), Dipterocarpaceae (Dryobalanops aromatica, Vateria in-
dica, Hopea ponga — Gilg, 1925; Swaraupanahdan, 1986;
Немирович-Данченко, 1992), Hyppocastanaceae (Aesculus woerlitzensis — List, Steward,
1965; Алимова, 1985б). Последний случай особенно сходен с тем,
который наблюдал A. Hill у Peperomia.
Особенности морфологии проростков геофильных видов Peperomia
были положены A. Hill (1906, 1908) в основу теории происхождения
односемядольного зародыша от двусемядольного путем постепенного
разделения функций между семядолями и превращения одной из них
в сосательный орган (теория гетерокотилии). В качестве переходного
Зародыш
411
к односемядольному состоянию среди однодольных A. Hill приводит
зародыш некоторых Araceae (Arum, Arisaema), у которых наблюдается
сходное с Peperomia строение проростка и наличие единого узла
пучков единственной семядоли и первого листа плюмулы. Становление
односемядольности у этих растений коррелирует с формированием гео-
фильного габитуса (клубневидный гипокотиль, укороченный побег и
т. д.) и является приспособлением к переживанию проростком
длительного засушливого сезона. Согласно A. Hill, разделение функций
семядолей при прорастании способствует быстрому созданию резервов
запасных веществ в клубневидном гипокотиле без участия плюмулы —
за счет транспорта из перисперма семени абсорбирующей семядолей и
за счет ассимиляции фотосинтезирующей.
Однако, исходя из некоторых вышеизложенных спорных моментов,
ряд авторов (Haines, Lye, 1979; Juguet, 1992) ставят под сомнение
соответствующий путь эволюционного преобразования двусемядольного
зародыша в односемядольный.
Наличие резкого неравенства семядолей по размерам в зародыше
целого ряда цветковых, и в первую очередь ложноодносемядольных
растений, было положено в основу еще одной теории происхождения
зародыша однодольных — путем недоразвития одной из семядолей
зародыша двудольных (гипотеза недоразвития — Hegelmaier, 1874,
1878; см. Новая концепция происхождения зародыша однодольных).
В связи с этим весьма интересен факт экспериментального подавления
развития зачатков семядолей в зародыше Eranthis hiemalis (Ranuncu-
laceae — Haccius, 1960). Воздействие на зародыш этого растения (до
начала инициации в нем семядолей) фенилборной кислотой в
концентрациях от 600 до 1200 ррт вызывало недоразвитие одной из двух
семядолей вплоть до полного ее отсутствия. В последнем случае единственная
семядоля обладала простым семядольным черешком, а не закрытой
семядольной трубкой, которая свойственна зародышу Eranthis в норме, а
также при индукции у него единственной семядоли путем слияния двух
исходных семядолей. Такие зародыши характеризовались
преждевременным развитием плюмулярных листьев в ходе эмбриогенеза. Последняя
особенность свойственна зародышам многих однодольных растений (так
называемая «акселерация», т. е. онтогенетическое ускорение развития
зародыша, по Guignard, 1984) и, по мнению Haccius, может служить
доказательством в пользу гипотезы недоразвития.
В заключение следует отметить, что последствия различий семядолей
одного и того же зародыша по строению, судьбе и функциям в онто-
и филогенезе растений являются несколько иными по сравнению с теми,
которые возникают в результате простого неравенства или недоразвития
семядолей. В связи с этим следует различать указанные явления и
использовать для обозначения неравенства семядолей по размерам более
узкий по значению термин «анизокотилия», как это предлагала Haccius
(1952). Рис. 35.
412
Семя
Алимова, 19856, 1987а; Алимова, Яковлев, 1982; Вышенская, 1992; Комар, 1991;
Немирович-Данченко, 1992; Adatia et al., 1971; Arecal, 1961; Baker, 1960; Bernhardi,
1832; Crete, 1949; Dengler, Sanchez-Burgos, 1988; Gilg, 1925; Goebel, 1902; Gress-
ner, 1874; Guignard, 1984; Haccius, 1952, 1960; Haccius, Lakshmanan, 1967; Hage-
mann, 1959a, b; Haines, Lye, 1979; Hegelmaier, 1874, 1878; Hildebrand, 1898; Hill
A., 1906, 1908, 1938^ Hill H., 1920; Johnson, 1900; Juguet, 1992; Juguet, Pare,
1989; List, Steward, 1965; Lubbock, 1892; Rauh, 1937; Rosenblum, Basile, 1984;
Roth, 1955, 1977; Sargant, 1903; Schmid, 1902; Shepherd, Alverson, 1981; Swarau-
panahdan, 1986; Winkler H., 1902.
AXIS FORMATION IN PLANT EMBRYOGENESIS: CUES AND CLUES
ФОРМИРОВАНИЕ ОСИ В ЭМБРИОГЕНЕЗЕ: ГИПОТЕЗЫ И ФАКТЫ
Imagine a textbook entitled Developmental Biology that focuses entirely
on plants, mentioning animals only for their peculiar way of making germ
cells by setting aside a group of precursor cells early in the embryo. The
converse has been, and still is, common practice. It is true that the
regenerative potential of plants, which is indeed impressive, sets them apart
from the more familiar animal models: individual cells can give rise to
embryos in culture; localized groups of stem cells called meristems make
the adult plant in a seemingly autonomous fashion not only during normal
development, but also by regeneration from lumps of undifferentiated cells
in culture. These special features notwithstanding, plants do develop from
a fertilized egg cell, the zygote, during the normal course of their life cycle
and, like animals, have to establish the characteristic body organization of
the multicellular adult form. Are the underlying mechanisms the same or
different? In the past few years, the genetic and molecular analysis of
flower development in two plant model species, Arabidopsis and Antirrhinum
(snapdragon), has established a network of MADS domain transcription
factors and others that regulate this best-characterized process in plant
development (Weigel, Meyerowitz, 1994). However, flower development is
like putting the finishing touches on the adult plant and may thus not give
clues to mechanisms that underlie earlier processes such as axis formation
and the generation of the overall body organization. By drawing largely on
recent genetic studies in Arabidopsis, I will briefly discuss postembryonic
development that eventually culminates in the formation of flowers, but
mainly focus on pattern formation in the embryo that establishes the basic
body organization of flowering plants.
The shoot meristem: linking up the embryo with the flower. Pattern
formation in animals is largely confined to embryogenesis such that the future
adult form is represented in the body organization of the mature embryo.
Зародыш
413
By contrast, plant embryogenesis produces a juvenile form, the seedling,
that lacks most structures of the adult plant. Embryogenesis in essence
organizes two groups of stem cells at the opposite ends of the body axis,
the primary meristems of the shoot and the root. These meristems then
add new structures to the seedling, thus generating the species-specific
adult form during postembryonic development (Steeves, Sussex, 1989).
Regardless to the appearance of the adult plant, the shoot meristem is
organized essentially the same way in different plant species. Two
functional units can be distinguished within the meristem: a central zone,
which is required for self-renewal and integrity of the meristem, and a
peripheral zone, which makes primordia of lateral organs and their
associated secondary shoot meristems, such as leaves and flowers (Steeves,
Sussex, 1989). Whether leaves or flowers are produced depends on the
physiological state of the meristem. In embryonic flower (em/) mutant
seedlings, for example, the primary shoot meristem skips the vegetative
phase of making leaves altogether, producing flowers directly (Sung et al.,
1992). Shoot meristem identity seems to be conferred by the continuous
expression of genes like the maize homeobox gene Knotted (Knl ), whose
ectopic expression can cause the formation of shoot meristems on leaves
(Sinha et al., 1993; Jackson et al., 1994). A putative Arabidopsis
homolog of Knl, the SHOOT MERISTEM-LESS (STM) gene, is required
for shoot meristem formation both in the embryo and during regeneration
from tissue culture (Barton, Poethig, 1993). How the activity of such
shoot meristem-specific genes is established and maintained properly is not
known. However, there are candidate genes in Arabidopsis for performing
these functions. For example, the ZWILLE (ZLL) gene is specifically
involved in establishing the primary shoot meristem in the embryo but not
in any other (nonembryogenic) context (Jurgens et al., 1994). Mutations
in another gene, CLAVATA1 (CLVl), cause overgrowth of primary and
secondary shoot meristems that also results in the formation of one or
more supernumerary whorls in the center of the flower (Clark et al.,
1993). This phenotype suggests that the organization of the meristem is
altered, owing to an enlargement of the central zone required for self-
renewal. Although more genes need to be identified to clarify this point,
it is conceivable that the primary shoot meristem may acquire a specific
organization in the embryo that is subsequently maintained by cellular
interactions within the meristem.
Pattern formation in the Arabidopsis embryo. The primary meristems
of the shoot and the root originate at distinct positions in the embryo as
part of the overall body organization of the seedling (Barton, Poethig,
1993; Dolan et al., 1993). The latter may be viewed as the superimposition
of an apical-basal pattern along the main body axis and a radial pattern
perpendicular to this axis. The apical-basal pattern consists of a top-to-bottom
array of elements: shoot meristem, cotyledons (embryonic leaves), hypocotyl
(embryonic stem), radicle (embryonic root), and root meristem. The radial
pattern is made up of concentric rings of tissue layers: epidermis, ground
tissue (cortex and endodermis), and vascular tissue (pericycle, xylem and
414
Семя
phloem). The origins of the apical-basal and radial pattern elements have
been traced back to cell groups of the early embryo in Arabidopsis where
the very regular patterns of cell division facilitated these analyses (Mansfield,
Briarty, 1991; Jurgens, Mayer, 1994).
Formation of the apical-basal axis. Apical-basal pattern formation starts
with the asymmetric division of the zygote that gives two daugther cells
of unequal sizes and different fates. The small apical cell generates, by
cleavage divisions, an 8-celled proembryo that will give rise to most of
the embryo. The large basal cell produces a file of 7-9 cells, of which
all but the uppermost one will form the extraembryonic suspensor; the
uppermost cell (hypophysis) joins the proembryo later to give rise to part
of the root meristem. Within one day of fertilization, three embryonic regions
are thus established along the axis: apical and central, which correspond
to the upper and lower tiers within the proembryo, and basal, which is
represented by the adjacent hypophysis. The three embryonic regions differ
in their cell division patterns: apical cells divide without preferential
orientation; central cells produce cell files, thus expanding the axis; and the
founder cell of the basal region undergoes a stereotyped program of division.
However, the early regions (apical, central, and basal) do not correspond
to primordia of seedling structures. The apical region gives rise to the
shoot meristem and most of the cotyledons; the central region also contributes
to the cotyledons, but mainly produces hypocotyl, root, and root meristem
initials; and the basal region gives the remainder of the root meristem,
comprising the quiescent center and the initials of the central root cap.
Data from clonal analysis support the view that cell ancestry does not play
a role in generating apical-basal pattern elements: clone boundaries are
variable and, moreover, can run across specific seedling structures, such as
the cotyledons or the root meristem (Scheres et al., 1994; Dolan et al.,
1994). Furthermore, the regularity of cell divisions in the early embryo is
deceptive since mutations in the FASS (FS) gene totally alter the pattern
of cell division, without affecting pattern formation (Torres Ruiz, Jurgens,
1994). Thus, the apical-basal pattern elements appear to be established
by cellular interactions in a position-dependent manner.
What is the significance of the early regions along the apical-basal axis?
Evidence comes from the embryonic phenotypes of mutations in three genes,
MONOPTEROS (MP), FACKEL (FK), and GURKE (GK), which delete specific
seedling structures (Mayer et al., 1991). In mp embryos, the cells in the
central and basal regions divide abnormally, resulting in the absence of
hypocotyl, root, and root meristem (Berleth, Jurgens, 1993). In fk embryos,
the central region is affected while the basal region is not; in the seedling,
the hypocotyl is missing such that the cotyledons are directly attached to
the root (Mayer et al., 1991; Jurgens et al., 1994). Since the root meristem
is composed of cells from both the basal and the central regions, the basal
region appears to induce the adjacent cells of the central region to become
root meristem initials that in turn produce the meristem-derived embryonic
root. A similar argument can be made for the cotyledons, which are derived
Зародыш
415
from both the apical and the central regions. The phenotype of gk mutants
is essentially complementary to mp: the apical region of the embryo is
altered, and, later on, gk seedlings lack shoot meristem and cotyledons
(Mayer et al., 1991). This suggests that the cotyledons are initiated within
the apical region, which then signals to adjacent cells of the central region
to participate in cotyledon formation. Thus, the early regions may define
genetically distinct groups of cells (compartments?) that generate the apical-
basal pattern by cellular interactions.
How are the early regions established along the apical-basal axis?
The boundary separating the central from the basal region originates
with the first division of the zygote. The basal daugther cell produces
a file of cells of which the uppermost one becomes the founder coll
of the basal region of the embryo. This file of cells is initially normal
in mp embryos when the earliest defect becomes apparent in the
proembryo, whereas later on both the central and basal regions develop
abnormally (Berleth, Jurgens, 1993). Thus, in normal development, the
central region may induce the uppermost derivative of the basal cell
of the zygote to become the founder cell of the basal region. By
contrast, the apical and the central regions are established by the
transverse cell divisions within the proembryo that is derived from the
apical daughter cell of the zygote.
Before dividing asymmetrically, the zygote elongates about 3-fold in the
future axis, and concomitantly the cortical microtubules, which were previously
oriented at random, become aligned perpendicular to the axis (Webb,
Gunning, 1991).^ This reorganization may reflect polarization of the zygote in
response to some as yet unknown signal (s). Its significance for axis formation
is suggested by mutations in the GNOM (GN) gene that affect the zygote
and can completely abolish regional differentiation of the seedling axis (Mayer
et al., 1991). The CN zygote expands but does not elongate, producing
an enlarged apical cell at the expense of the basal cell (Mayer et al.,
1993). Subsequent development is highly abnormal, and the region-specific
MP gene was shown to be ineffective in gn embryos. The asymmetric
division of the zygote seems to be involved in fixing the apical-basal axis
of the embryo, but it is not known how the CN gene brings about its
specific effect at the molecular level. Although the predicted 160 kDa GN
(also called EMB30) protein shows sequence similarity to several other
proteins over a stretch of 200 amino acids that is referred to as the Sec7
domain, the significance of this domain is not known, nor does the remainder
of the CN protein readily suggest a specific function within the cell (Shevell
et al., 1994). Since CN is the only Arabidopsis gene known to be specifically
required for apical-basal pattern formation from the zygote on, determining
the primary function of the CN protein will be an important step in further
analysis of axis formation.
Radial pattern formation. Radial pattern formation, which commences
in the 8-celled proembryo, involves two choices of oriented cell division:
periclinal (radial), which gives a new tissue layer, and anticlinal (circum-
416
Семя
ferential), which increases the number of cells in a given layer. New tissue
layers are successively formed from the periphery toward the center. Initially,
an outer layer of epidermal precursor cells is separated from an inner cell
mass. The epidermis layer then expands by anticlinal cell divisions, thus
maintaining its integrity in the growing embryo. Further development of the
radial pattern is confined to the central region of the axis that gives rise
to hypocotyl, root and root meristem initials; neither the apical nor the
basal region is involved (Jurgens, Mayer, 1994; Scheres et al., 1995).
The inner cell mass splits into an outer layer of ground tissue and the
centrally located vascular precursor cells. The latter cells again divide peri-
clinally to give a layer of pericycle cells surrounding the precursors of
conductive tissue (phloem and xylem). This basic organization of the radial
pattern is complete before the heart stage of embryogenesis. One further
subdivision occurs within the ground tissue, generating an outer cortex layer
and an inner endodermis layer.
By the time the root meristem has become active, clonal boundaries
reflect the basic organization of the radial pattern (Dolan et al., 1994;
Scheres et al., 1994). Are tissue-specific cell fates fixed early and then
transmitted clonally? Mutant phenotypes suggest that this may be the case.
For example, the epidermis cells are abnormally enlarged in early keule
(keu) embryos (Mayer et al., 1991), and the endodermis layer is absent
in short root (shr) embryos (Benfey et al., 1993; Scheres et al., 1995).
Furthermore, the epidermis is marked by the tissue-specific expression of
the LTR gene both in the embryo and during postembryonic development
(Thoma et al., 1994). The genetic distinction of different tissues might
involve blocking of plasmodesmata-mediated cell communication as has been
observed between the epidermis and subepidermal tissues in the seedling
(Duckett et al., 1994). While the available evidence seems to favor a
model of genetically determined tissue types, oriented cell divisions do not
appear to be required for radial pattern formation: cell divisions occur at
random in early /s embryos such that the characteristic radial organization
of tissues is not apparent, but later on the mutant seedlings display all
tissues found in wild type (Torres Ruiz, Jurgens, 1994). This flexibility
suggests that cellular interactions may play an important role in initiating
and (possibly) maintaining tissue-specific gene expression in a
position-dependent manner.
How is the radial pattern initiated in the early embryo? So far, only
one gene has been identified that may be involved in this process: in
knolle (kn) embryos, the epidermis is not separated from the inner cell
mass by periclinal divisions within the proembryo, and the mutant seedlings
appear to lack the characteristic epidermis layer (Mayer et al., 1991). How
the KN gene relates, at the molecular level, to the periclinal divisions in
the early embryo remains to be determined.
What mechanisms may underlie pattern formation in the plant
embryo? Pattern formation in the Arabidopsis embryo appears to depend largely
on cell-cell communication, both in the apical-basal axis and in the radial
Зародыш 417
dimension. This is formally similar to pattern formation in the familiar
animal models (e. g. vulva development in Caenorhabditis elegans or post-
blastoderm embryogenesis and imaginal disc development in Drosophila).
However, the underlying mechanisms might be different in plants. For
example, plant cells are cytoplasmically interconnected by plasmodesmata,
allowing various kinds of molecules to pass freely from cell to cell.
Unfortunately, it is not known whether this potential plant-specific means of
intercellular communication is actually used and how "it is regulated during
development. Another serious problem in the analysis of plant pattern
formation is the shortage of markers, both morphological (which cannot be
changed) and molecular. As more genes with tissue-specific or region-specific
expression patterns in the embryo will become available, some of the ideas
presented here can be tested.
The initial events of pattern formation in the Arabidopsis embryo are
different from the later phases since they cannot involve cell-cell
communication: the asymmetric division of the zygote as well as the periclinal
divisions in the 8-celled proembryo appear to segregate fates within cells.
How is position translated into cell fate in these cases? One possible
mechanism is suggested by the observation that in C. elegans, the unequal
division of the zygote is associated with the different degradation of a
specific uniformly distributed maternal mRNA, thus establishing territories
of differential gene expression along the main body axis of the early embryo
(Evans et al., 1994). A potentially plant-specific alternative for embryonic
axis fixation is suggested by recent results from the brown alga, Fucus.
The Fucus zygote also divides asymmetrically, giving an upper thallus cell
and a lower rhizoid cell. If the cell wall of the zygote is removed, the
axis can be formed, but not fixed (Quatrano et al., 1991). Moreover, cell
ablation studies on early embryos suggest that the different cell fates of
thallus versus rhizoid may be imprinted into the cell wall (Berger et al.,
1994). Which mode, if either, of cell-fate segregation applies in the early
embryo of Arabidopsis remains to be determined. The two proteins thus
far identified do not appear to regulate gene expression directly, unlike the
transcription factors that play decisive roles in flower development. Does
axis formation in higher-plant embryos involve an extracellular detour on
its way to the nucleus? Fig. 37.
Barton, Poethig, 1993; Benfey et al., 1993; Berger et al., 1994; Berleth, Jurgens, 1993;
Clark et al., 1993; Dolan et al., 1993, 1994; Duckett et al., 1994; Evans et al., 1994;
Jackson et al., 1994; Jurgens, Mayer, 1994; Jurgens et al., 1994; Mansfield, Briarty,
1991; Mayer et al., 1991, 1993; Quatrano et al., 1991; Scheres et al., 1994, 1995;
Shevell et al., 1994; Sinha et al., 1993; Sleeves, Sussex, 1989; Sung et al., 1992;
Thoma et al., 1994; Torres Ruiz, Jurgens, 1994; Webb, Gunning, 199i; Weigel,
Meyerowitz, 1994.
27—82S
418
Семя
МОРФОЛОГИЧЕСКАЯ КЛАССИФИКАЦИЯ ЗАРОДЫША
ЗРЕЛОГО СЕМЕНИ: КРИТИЧЕСКИЙ ОБЗОР ОСНОВНЫХ СИСТЕМ
Морфологические классификации зародыша зрелого семени
рассматриваются лишь в рамках классификации внутренней морфологии семени
как целого. В них, как правило, учитываются такие признаки, как
расположение зародыша в семени, его форма, относительные размеры,
степень дифференциации и соотношение его частей, а также некоторые
другие признаки (см., в частности, Артюшенко, 1990).
В пределах отдельных крупных таксонов покрытосеменных
растений попытки создания морфологических классификаций зародыша
предпринимались неоднократно (см., например, Reeder, 1957; Ко-
жанчиков, 1967; Данилова и др., 1990; Вышенская, 1992, 1996а-о;
Оганезова, 1993 и др.). Однако выделение типов строения семени,
охватывающих морфологическое разнообразие зародыша в пределах
покрытосеменных в целом и позволяющих судить об основных
направлениях эволюции зародыша, было осуществлено лишь Martin
(1946) и Смирновой (1965).
Классификация Martin. В своем известном труде «The Comparative
Internal Morphology of Seeds» (1946) Martin обобщил результаты
оригинальных исследований, выполненных методом gross anatomy (быстрой,
грубой анатомии), семян 1108 родов цветковых и 19 родов голосеменных
растений, представленные в виде диаграмм их продольных и поперечных
срезов. Основной целью его работы была разработка способа
идентификации растений по строению семени и создание типологической
классификации внутренней морфологии семени. В основу классификации
положен зародыш и его изменчивость по форме, размеру и положению в
семени. Выделены 12 типов семени, объединенных в 3 отдела, -один из
которых включает три подотдела (см. схему 1).
При описании зародыша используется термин «ось» (гипокотиль-
корневая ось; гипокотиль и зародышевый корень при этом автор
не разграничивает), а запасающих тканей — только термин
«эндосперм». Для характеристики размеров зародыша вводится 5
градаций, установленных на основании соотношения объемов зародыша
и запасающих тканей — от «мелкого» до «заполняющего»
(тотального) (см. схему 2).
Martin дает следующую характеристику выделяемым им отделам,
подотделам и типам строения зародыша в зрелом семени.
Базальный отдел — зародыш чаще мелкий, редко превышающий
половину объема семени, располагается в нижней половине семени;
размер семян от среднего до крупного; встречается у однодольных и
двудольных растений:
Зародь
419
БАЗАЛЬНЫЙ
ОТДЕЛ
о о
рудиментарный
тип
широкий
тип
головчатый
тип
латеральный
тип
ПЕРИФЕРИЧЕСКИЙ
ОТДЕЛ
ОСЕВОЙ
ОТДЕЛ
О
периферический
тип
линейный подотдел миниатюрный подотдел
oi
линейный карликовый
ТИП ТИП
ФОЛИАРНЫЙ ПОДОТДЕЛ
iff
лопатовидиый согнутый свернутый
тип тип тип
микроскопи
ческий тип
•
облекающий
тип
Схема 1. Типологическая классификация (Martin, 1946).
(менее /4)
половина
четверть
(более /4) (более /г)
доминирующий
(более /4)
тотальный
Схема 2. Градации относительных размеров зародыша (Martin, 1946).
27*
420
Семя
рудиментарный тип — зародыш мелкий, глобулярный, овальный или
удлиненный, семядоли от визуально неразличимых до развитых, могут
напоминать семядоли зародышей линейного или лопатовидного типов;
широкий тип — зародыш в ширину больше, чем в длину;
головчатый тип — апикальная часть зародыша головчатой формы;
встречается только у однодольных растений;
латеральный тип — зародыши варьируют по размерам от мелких
до занимающих половину объема семени, иногда — крупнее,
располагаются в семени базально-латерально или латерально; встречается только
у злаков.
Периферический отдел — зародыш, как правило, крупный,
удлиненный, занимает /4 часть объема семени и более, располагается по
периферии запасающей ткани, семядоли узкие или расширенные, в
контакте с семенной кожурой; встречается только у двудольных растений:
периферический тип — имеет признаки отдела.
Осевой отдел — зародыш значительно варьирует по форме и
размерам; встречается у однодольных и двудольных растений:
Линейный подотдел — имеет признаки типа:
линейный тип — длина зародыша превышает ширину в несколько
раз, по форме прямой или искривленный, семядоли не разрастаются;
для очень мелких семян не характерен;
Миниатюрный подотдел — семена мелкие и очень мелкие:
карликовый тип — зародыш от мелкого до заполняющего, как
правило, с преобладанием осевой части и слабо развитыми семядолями,
по форме от овального до эллиптического и удлиненного, часто ширина
равна длине, семена от 0,3 мм до 2,0 мм длиной;
микроскопический тип — зародыш от мельчайшего до
заполняющего, обычно глобулярный, состоит всего из 50—150 клеток, семена, как
правило, менее 0,2 мм длиной (исключая тесту);
Фолиарный подотдел — зародыш крупный, от Д до тотального,
располагается скорее центрально, чем по периферии семени, семядоли
разросшиеся, семена преимущественно среднего размера:
лопатовидный тип — зародыш прямой, семядоли варьируют от
тонких до толстых, ширина их слегка превышает длину;
согнутый тип — зародыш обычно лопатовидный по форме, но
согнутый, семядоли в основном толстые;
свернутый тип — зародыш, как правило, с тонкими, сильно
разрастающимися и разнообразно свернутыми семядолями;
облекающий (ось) тип — зародыш прямой, обычно тотальный, с
толстыми семядолями, налегающими друг на друга и укрывающими
довольно маленькую ось, по крайней мере на половину ее длины.
В постскриптуме к статье Мартин отмечает, что изменил свое мнение в пользу
объединения базального и периферического отделов в один — периферический, за
исключением рудиментарного типа.
Зародыш
421
Направления эволюции семени и зародыша в связи с
филогенией и систематикой цветковых растении (по: Martin, 1946). На
основании проведенного типологического анализа обширного
.фактического материала Martin построил схему эволюции типов семени у
цветковых растений (схема 3).
Сделан вывод о том, что для представителей примитивных таксонов
характерны семена среднего и крупного размеров с относительно
мелкими зародышами, доразвивающимися после завершения периода покоя,
а таксоны высокого ранга эволюционного развития имеют семена,
которые обладают хорошо развитыми зародышами, занимающими
большую часть семени или весь его объем и формирующимися до
наступления периода покоя. Появление миниатюрных семян с очень мелкими,
значительно редуцированными зародышами расценивается как
специализация и признак эволюционной продвинутости.
По мнению Martin, три основных отдела классификации — базаль-
ный, периферический и осевой — отражают основные направления
эволюции семени (см. схему 3) и заслуживают особого внимания при
решении вопросов систематики и филогении цветковых растений.
Рудиментарный тип базального отдела рассматривается как наиболее
вероятный предшественник всех других типов этого отдела, а также
многих модификаций линейного типа. Совмещение обоих типов и
переходы между ними встречаются, например, у представителей Агесасеае,
Ranunculaceae, Apiaceae. Различия в степени выраженности семядолей
в определенной мере нарушают единство рудиментарного типа.
Широкий тип строения зародыша в зрелом семени распространен у
ограниченного числа четко очерченных групп как однодольных, так и
двудольных (см. схему 3), и поэтому, возможно, имел отношение к
становлению однодольности в эволюции покрытосеменных растений. В
одних группах он близок к рудиментарному типу (Nymphaeaceae, Sau-
гигасеае),в других — более автономен. Широкий тип можно
рассматривать как анцестральныи для головчатого и латерального, а также как
переходный от рудиментарного к линейному типу специализированных
однодольных; есть вероятность происхождения широкого типа от
латерального.
Головчатый тип характерен только для ограниченного числа
однодольных (Cyperaceae, Dioscoreaceae, Commelinaceae), встречается в
пределах семейств наряду с рудиментарным, широким, иногда — линейным
типами (например, у Cyperaceae); он ближе к последним двум типам,
встречающимся у однодольных, чем к латеральному типу строения
зародыша злаков.
Латеральный тип обособлен среди однодольных растений и
характерен для представителей семейства злаковых; близок к
периферическому типу.
В базальном отделе между тремя типами — широким, головчатым
и латеральным, относимыми Martin к семипериферическим, автор
предполагает наличие филогенетических лакун.
422
| ОБЛЕКАЮЩИЙ
Rhamnaceae
Lythraceae
Caesalp'miaceae
Mimosaceae
Labiatae
Blgnoniaceae
Betulaceae
Lauraceae
Juglandaceae
Fagaceae
СВЕРНУТЫЙ
Malvaceae
Convolvulaceae
МИКРОСКОПИЧЕСКИЙ j
Burmanniaceae
Orchidaceae
Pyrolaceae
Monotropaceae
СОГНУТЫЙ
\Anacardiaceae
Fabaceae
Cruciferae
КАРЛИКОВЫЙ
Ericaceae
Loganiaceae
Campanulaceae
Gentianaceae
Scrophulariaceae
ЛОПАТОВИДНЫИ
Rubiaceae
Oleaceae
I Euphorbiaceae
Rosaceae
I Rutaceae
ЛИНЕЙНЫЙ
Umbelliferae Liliaceae
Vacciniaceae Amaryllidaceae
Solanaceae Pontederiaceae
Utricaceae
Cornaceae
Polemoniaceae
Asclepiadaceae
Compositae
|ПЕРИФЕРИЧЕСКИЙ
Portulacaceae
Cactaceae
Caryophyllaceae
Chenopodiaceae
Amaranthaceae
Polygonaceae
Nyctaginaceae
ОСЕВОЙ
периферический
I ГОЛОВЧАТЫЙ I
шСурегасеае
\Commelinaceae
|
РУДИМЕНТАРНЫЙ
I Aquifoliaceae
1 Araliaceae
Magnoliaceae
[ Ranunculaceae
Papaueraceae
БАЗАЛЬНЫИ!
ШИРОКИЙ
Saururaceae
Nymphaeaceae
Eriocaulaceae
Juncaceae
Mayacaceae
Схема 3. Филогения типов семени (Martin, 1946).
Зародыш
423
Периферический тип одноименного отдела, характерный для
представителей многих семейств естественной группы, относимой сейчас к
подклассу Caryophillidae (Тахтаджян, 1987), является слепой ветвью
эволюции, отделенной значительной филогенетической лакуной от типов
базального отдела (см. схему 3); этот тип ближе к однодольным, как
по расположению зародыша (сходство с латеральным типом), так и по
наличию крахмала в «эндосперме» (у представителей подавляющего
числа семейств, в действительности, — в перисперме. — Т.В.).
Периферическое расположение зародыша вряд ли могло возникнуть из
осевого. С другой стороны, зародыш периферического типа с
разрастающимися семядолями напоминает зародыши некоторых типов фолиарного
подотдела, что можно расценивать как проявление параллелизма в
эволюции принципиально различных групп.
Линейный тип у однодольных (характерен для семейств пор.
Liliales) — это вершина прогресса по отношению к типам базального
отдела. У двудольных (например, в семействах Umbelliferae,
Solanaceae) он занимает промежуточное положение между примитивными
и подвинутыми типами семян, беря начало от рудиментарного типа
и являясь исходным для фолиарного и миниатюрного подотделов,
так что иногда трудно определить, где два последних подотдела
отходят от родительского ствола. Семена линейного типа с
изогнутыми зародышами, по-видимому, не дали начала другим основным
типам семян.
Карликовый тип с крупным относительно размеров семени
зародышем распространен у представителей семейств Scrophulariaceae, Saxifra-
gaceae и др., с мелким зародышем — у Campanulaceae,Gentianaceae,
Orobanchoideae из Scrophulariaceae и др., относящихся к далеким друг
от друга порядкам. Роды с карликовым типом семени встречаются
изолированно в некоторых линейных и фолиарных семействах.
Отсутствие четких границ между линейным и карликовым типами (например,
в пределах сем. Saxifragaceae), свидетельствует в пользу происхождения
последнего от первого.
Микроскопический тип, распространенный очень ограниченно (см.
схему 3), встречается на вершине филогенетического древа однодольных
растений и у высокоразвитых двудольных. Он выводится из
карликового типа. Доказательством этому может служить распространенность
обоих типов в пределах родственных семейств — Ericaceae
(карликовый тип), Monotropaceae и Pyrolaceae (оба — микротип; по Тахтаджян
(1987) два последних семейства рассматриваются в ранге подсемейств
Ericaceae. — Т.В.) и наличие переходных форм между двумя типами у
некоторых родов семейства Scrophulariaceae.
В фолиариый подотдел объединены типы семян,
характеризующиеся значительным развитием зародыша и распространенные у огромного
числа таксонов (преимущественно двудольных — см. схему 3). Здесь
реализуются три основные линии прогрессивного развития семядолей:
разрастание узких семядолей (лопатовидный тип), возникновение
424
Семя
складчатости листовидных семядолей (свернутый тип), формирование
массивных семядолей, содержащих основные запасающие вещества
семени (согнутый и облекающий типы).
Лопатовидный тип по Martin происходил, по-видимому, двумя
путями: от линейного или прямо от рудиментарного типа. В первом случае
семядоли более толстые, чем во втором.
Складчатый тип, независимо от способа сложения семядолей, по-
видимому, ведет свое начало от лопатовидного или согнутого типов,
зародыши которых также имеют тонкие семядоли, а согнутый и
облекающий типы — от лопатовидного типа с толстыми семядолями.
Анализ классификации Martin. Работа Martin уникальна по охвату
оригинального фактического материала. Несомненными
преимуществами его типологической классификации являются: иерархический
принцип построения и ограниченное число используемых категорий, удачный
выбор наиболее существенных признаков для разграничения отделов и
типов, емкость и наглядность самих типов. Это подтверждается
широким использованием классификации Martin в описательных
сравнительных исследованиях (см., например, «Сравнительная анатомия семян»,
1985, 1988, 1991, 1992, 1996). Кроме того, система Martin оставляет
возможность для ее дальнейшего усовершенствования. Важным
обобщением в труде Martin является схема зволюционных взаимоотношений
различных типов строения семени,основанная на выявлении переходов
между ними.
В то же время в отношении типологии и филогенетических
построений Martin может быть высказан целый ряд критических замечаний.
В общих чертах они сводятся к следующему:
1) при выборе критериев разграничения классификационных единиц
проявляется определенная логическая непоследовательность; в
пересмотре нуждаются некоторые термины;
2) в связи с тем, что Martin использует достаточно грубый метод
анатомического исследования (gross anatomy), в целом ряде случаев
остаются неучтенными данные по морфологической дифференциации
зародыша, что приводит к неправильному выделению типов;
3) выявленное на исследованном материале морфологическое
разнообразие зародыша цветковых отражено в типологии очень неполно, что
проявляется в недостаточном числе соподчиненных классификационных
единиц внутри отделов;
4) в схеме эволюции типов семени не отражено значительное
разнообразие отдельных семейств по типу строения семени/зародыша:
семейства характеризуются по единственному типу семени. В этом
проявляется авторская тенденция связывать конкретный тип с определенной
линией филогенетического развития цветковых, с чем трудно
согласиться;
5) установление типа на основании филогенетического родства
приводит в ряде случаев к тому, что семена, сходные по морфологии
425
Зародыш ■
зародыша, попадают в разные типы, поскольку они относятся к
неродственным таксонам;
6) ряд филогенетических построений весьма дискуссионен.
Приведем более подробные обоснования высказанных критических
замечаний в соответствии с перечисленными пунктами.
1. Критерии выделения каждого класса иерархической системы
(отделов, подотделов, типов) должны быть четко определены и не должны
смешиваться. Исходя из этого, подразделение на отделы по единому
признаку положения зародыша в семени следует признать у Martin
весьма удачным. В связи с этим трудно согласиться с его позднейшим
мнением (см. сноску на стр. 403) о перенесении широкого и
головчатого типов в периферический отдел. В то же время латеральный тип,
действительно, тяготеет к последнему.
Подотделы же (в осевом отделе) выделены по совершенно
разнородным признакам: по форме зародыша — линейный подотдел, по
размеру семени — миниатюрный, по наличию развитых семядолей — фоли-
арный. Однако линейный подотдел, характеризующийся, в частности,
преобладанием в зародыше осевой части, может быть сопоставлен по
критерию выделения с фолиарным подотделом — по природе
преобладающей части зародыша (этот критерий представляется очень важным
и широко используется в нашей новой версии типологии — см. ниже).
Миниатюрный же подотдел выделяется совершенно искусственно
(однако эта проблема снимается, если семена карликового типа с
крупными относительно размеров семени зародышами отнести к линейному
типу, а карликового и микроскопического типов с мелкими зародышами
включить в базальный отдел, выделив их в особый тип — см. ниже).
Типы, за некоторым исключением, довольно органично выделяются
в основном по форме зародыша.
На основании вышеизложенного логически неприемлемы
наименования: периферический тип (здесь используется критерий и название
отдела), линейный подотдел (это наименование следует сохранить за
типом), карликовый и миниатюрный типы. Рудиментарный тип,хоть он
и выделяется не по критерию формы зародыша, следует сохранить.
Однако в пересмотре нуждается сам термин.
Если в зарубежной литературе, как указывает Грушвицкий (1961),
под термином «rudimentary embryo» подразумевается недоразвитое,
зачаточное образование (что отнюдь не противоречит значению
латинского rudimentum), то в русском языке термин «рудиментарный»
используется в другом значении — остаток, след какой-то редуцированной
структуры. Поэтому рудиментарный тип лучше всего назвать
«зачаточным», а семена с явно редуцированным зародышем, относимые автором
к микроскопическому типу, отнести к «редуцированному типу».
2. У таксонов с семенами, относимыми к базальному отделу —
широкому, головчатому и латеральному типам, характерным для
однодольных растений, — зародыш характеризуется только по его очертаниям
на срезах семени (в значительной мере обусловленным единственной
426
Семя
семядолей). Данные по морфологической дифференциации зародыша
для них не приводятся, в то время как степень ее значительно
варьирует. Например, у представителей семейств Mayacaceae, Eriocaulaceae,
Xyridaceae и Juncaceae зародыш в семенах широкого типа слабо или
очень слабо дифференцирован, а в семействах Сурегасеае и Commeli-
пасеае, где семена этого типа также иногда встречаются, — очень
значительно. Таким образом,по признаку морфологической расчлененности
зародыша широкий тип, безусловно, не является единым.
Данные по дифференциации зародыша видов сем. Агесасеае,
отсутствующие у Martin, показывают, что он по своей структуре (слабо
выраженная ось и достаточно развитые семядоля и почечка) скорее
должен быть отнесен к одной из вариаций широкого типа с
дифференцированным зародышем, чем к линейному или рудиментарному типам.
Не отмечена высокая степень морфологической расчлененности
зародыша семян латерального типа, встречающегося у представителей сем.
Роасеае, морфология которого используется в систематике этого
семейства (Reeder, 1957). Соотношение осевой и семядольной частей
совершенно не исследовано у зародышей семян линейного типа, характерных
для представителей семейств порядка Liliales. Исходя из авторской
характеристики линейного типа («семядоли не разрастаются») и
диаграмм семени, их зародыш можно отнести к полностью осевому по
природе, тогда как у лилейных очень часто цилиндрическая семядоля
зародыша значительно преобладает над его осевой частью (виды
Allium, Yucca, Iris, Agave и многие др.); в других случаях
действительно преобладает ось (например, в роде Tulipa).
3. В единственном типе периферического отдела, охватывающем
огромное число семейств (практически весь подкласс Caryophyllidae), не
отражен спектр изменчивости зародыша, который в значительной мере
является параллельным таковому для линейного и фолиарного
подотделов осевого отдела (что отмечает и сам Martin): от зародышей со
слаборазвитыми семядолями (близких к изогнутым зародышам
линейного типа) до зародышей с разрастающимися семядолями —
листовидными, свернутыми или массивными.
В один линейный тип, охватывающий самые разные, в том числе
далекие друг от друга таксоны, включены семена с зародышами от
прямых до разнообразно изогнутых, сильно варьирующих по степени
преобладания осевой или семядольной частей.
В пределах фолиарного подотдела, включающего типы зародышей
с разрастающимися семядолями, не учтены (или недостаточно
учтены) такие признаки, как массивность семядолей, чрезвычайное
разнообразие способов сворачивания фолиарных (а иногда и
мясистых) семядолей в семени, разнообразие способов укрывания оси
зародыша семядолями.
4. Попытка Martin соотнести выделенные им отделы, подотделы и
типы с филами цветковых, безусловно, заслуживает внимания для
дальнейшего выяснения значения признаков внутренней морфологии семени
Зародыш
427
и структуры зародыша в филогении цветковых. Однако нельзя
признать удачной попытку связать каждое из рассматриваемых семейств
преимущественно с одним типом семени (см. схему 3), тем более что
сам автор указывает на наличие уклоняющихся типов в пределах
целого ряда семейств. Следует, конечно, учесть, что у Martin изучены
представители далеко не всех семейств покрытосеменных, а многие
выводы сделаны на основании анализа единичных видов всего одного
или нескольких родов семейства.
Есть семейства и таксоны более высокого ранга, не выходящие
в основном за рамки единственного или нескольких родственных типов
семени (например, Ranunculaceae и Araliaceae — рудиментарный тип,
Apiaceae — линейный тип, семейства подкласса Caryophillidae —
преимущественно периферический тип, Fabaceae — согнутый тип с
массивными семядолями и т.д.).
С другой стороны, для некоторых крупных семейств, как показывают
новые данные, характерна исключительная полиморфность зародыша.
Такие семейства у Martin слабо проанализированы. Зародыш здесь
может сильно варьировать как по морфологии, так и по относительным
и абсолютным размерам. Примерами являются семейства Araceae, Sa-
pindaceae, Myrtaceae,Theaceae, Dipterocarpaceae и многие другие. Так, в
семействе Myrtaceae (общий признак семейства — заполняющий
зародыш) встречаются семена линейного типа (с зародышем от прямого до
спирально извитого), согнутого, складчатого и облекающего типов,
причем зародыши последнего типа — как с массивными семядолями, так
и с фолиарными складчатыми. Зародыш у представителей этого
семейства сильно варьирует и по своим абсолютным размерам. В сущности
Martin попытался сделать свою типологию филогенетической, однако
при огромной пластичности форм зародыша, при параллельном
возникновении сходных типов в отдаленных таксонах, а в пределах одних и
тех же семейств — различных типов, это практически невозможно.
Только иногда по типу семени можно определить филогенетический
статус таксона. Чаще это будет относиться к архаичным или высоко
специализированным таксонам (см. выше). В других случаях
оценивать филогенетический статус таксона надо не по единственному типу,
а по спектру вариабельности присущих ему типов.
5. Стремление к сохранению целостности филы, характеризуемой
периферическим типом семени (семейства подкласса Caryophyllidae), по-
видимому, не позволило Martin отнести к этому типу семена видов
далеких от Caryophyllidae семейств. В их число входят Capparidaceae,
Malvaceae и др., семена которых Martin относит к линейному типу с
изогнутыми зародышами, а также Ulmaceae, Moraceae, относимые к
согнутому типу, хотя в семенах представителей упомянутых семейств
зародыши явно располагаются периферически.
6. Оценка широкого типа в качестве исходного при становлении
однодольности в ходе эволюции семени не может быть принята,
поскольку этот тип характерен только для однодольных, а отнесение к
428
Семя
нему двудольных семейств Piperaceae и Nymphaeaceae, семя которых,
несомненно, рудиментарного типа, является ошибкой (очевидно, Martin
принял за границы зародыша контур незначительного эндосперма,
окруженного обильным периспермом).
Далее, трудно согласиться с выводом Martin о близости
периферического типа латеральному типу, присущему однодольным. У зародышей
латерального типа семени другие строение и функция семядолей, а его
богатый крахмалом эндосперм нельзя отождествить с крахмалистым
периспермом периферического типа?
Классификация Смирновой. В работе Смирновой «Типы структур
семян цветковых растений в филогенетическом аспекте» (1965)
классификация семян по признакам их внутренней морфологии предпринята
в целях оценки «однородности таксонов филогенетических систем».
Автор анализирует все порядки цветковых растений, выделенных в
соответствии с филогенетической системой Тахтаджяна (1959),
используя данные по строению семени и зародыша, содержащиеся в
известных монографиях (Engler, 1898—1910; Netolitzky, 1926; Гроссгейм,
1945; Martin, 1946; Hutchinson, 1959; Тахтаджян, 1948, 1959, 1964 —
цит. по: Смирнова, 1965) и полученные в результате собственных
наблюдений. В качестве классификационных категорий предлагаются
группы,уровни и типы.
В зависимости от природы запасающей ткани и степени ее развития
выделяется пять групп строения семени: эндоспермальная, периспер-
мальная, эндопериспермальная, эмбриональная (эндосперм
утилизирован) и проэмбриональная (эндосперм развит незначительно).
По признаку отношения длины зародыша к длине семени выделяется
шесть уровней: 0 (нулевой) уровень — это отношение лежит в
пределах О-Ув; I уровень — У 8-У 4; II уровень — У А-У г; III уровень —
V2-V4; IV уровень — больше 3/4; V уровень — около 1 (зародыш
заполняет все семя).
Выделение типов строения семени проведено по следующему
комплексу признаков: положение зародыша в семени (зародыш
характеризуется как базальный, боковой, осевой, изогнутый, периферический,
заполняющий весь объем семени), морфо-функциональная характеристика
семядолей, причем преимущественно функциональная (по функции
семядоли характеризуются как гаусториальные, фотосинтезирующие,
запасающие, по форме — как листовидные, щитковидные и пр.), степень
морфологической дифференциации зародыша и преобладание в нем
осевой или семядольной части (оценивается по соотношению длин:
семядоли + почечка / гипокотиль + корень). Приводится 26
основных типов (при этом отмечается, что их возможное число значительно
больше), выделяемых отдельно для двудольных и однодольных. Типам
присваиваются родовые названия, например, Alisma-, Monotropa-,
Viola-, Piper-типы.
Классификация Смирновой изображена на схеме 4. Шесть уровней
показаны в виде равных отрезков, отложенных по оси ординат, в верх-
Зародыш
429
ней части схемы по этим уровням распределены группы и типы
двудольных растений, в нижней — однодольных. Каждому уровню и
каждой группе соответствуют свои типы семени. В характеристики типов
включаются характеристики уровней и групп.
Схема 4. Типологическая классификация внутренней морфологии семени (Смирнова,
1965): O-V — относительные уровни, А — группы и типы семян двудольных
растений: 1—5 — эндоспермальная группа: семена типов Apium (1),
Podophyllum (2), Saxifraga (3), Viola (4), Althaea (5); 6—13 — собственно
зародышевая группа: семена типов Urtica (6), Rosa (7), Lotus (8), Cannabis
(9), Helianthus (10), Hippuris (11), Faba (12), Malachra (13); 14 — 16 —
периспермальная группа: семена типов Cereus (14), Echinocactus (15),
Phytolacca (16); 17 — эндопериспермальная группа, семя типа Piper; 18 —
проэмбриональная группа, семя типа Monotropa; В — группы и типы семя
однодольных растений; 19 — собственно зародышевая группа, семя типа
Alisma; 20 — 24 — эндоспермальная группа: семена типов Lilium (20),
Bromelia (21), Anthurium (22), Juncus (23), Poa (24); 25 — эндоспермальная
группа, семя типа Musa; 26 — проэмбриональная группа, семя типа Orchis.
Примечание. Рисунки семян схематизированы; они отражают строение и
соотношение основных структур семени, но не его форму.
Смирнова дает следующую характеристику выделяемым типам
зрелых семян двудольных растений.
430
Семя
Проэмбриональная группа:
0 уровень — Monotropa-тип (18): семя содержит только проэмб-
рио и скудный эндосперм.
Эндоспермальная группа:
1 уровень — Apium-тип (1): зародыш гораздо меньше эндосперма,
базальный, семядоли гаусториальные, длина семядолей с почечкой
примерно равна длине осевой части. В семенах I уровня встречаются мало
дифференцированные, «доразвивающиеся» (по Грушвицкому, 1961)
зародыши;
II уровень — Podophyllum-тип (2): зародыш меньше эндосперма,
осевой (здесь и далее подразумевается прямой, располагающийся вдоль
оси семени зародыш. — Т.В.), семядоли фолиарные, по длине семядоли
и почечка примерно равны длине гипокотиля и корня;
III уровень — Saxifraga-тип (З): зародыш меньше эндосперма,
осевой, семядоли фолиарные, длина семядолей с почечкой меньше
длины оси; Viola-тип (4): зародыш больше эндосперма, осевой, семядоли
фолиарные, широкие, преобладают над осевой частью; Althea-тип
(5) — зародыш больше эндосперма, изогнутый, семядоли фолиарные,
преобладает осевая часть. Начиная с III уровня увеличивается
разнообразие типов семени.
Эмбриональная группа:
IV уровень — типы Urtica- (6), Rosa- (7), Lotus- (8),
Cannabis- (9): зародыш заполняет почти весь объем семени,
основные различия между типами относятся к форме зародыша и к
соотношению величин его частей. Зародыш семян типов 6 и 7 —
осевой, а типов 8 и 9 — изогнутый; у трех первых типов длина
семядолей и почечки больше или много больше длины осевой части,
а у Cannabis-типа — меньше;
V уровень — наибольшее число типов, по крайней мере, четыре
основных: Helianthus- (10), Hippuris- (11), Faba- (12), Malachra-
(13). Два первых типа имеют осевой зародыш, два последних —
изогнутый; семядоли всех типов запасающие, фолиарные, у 10 и 12 типов
в длину много больше оси, у 11 и 13 типов — меньше оси.
Периспермальная группа:
III—V уровни — типы Cereus- (14), Echinocactus (15), Phytolacca-
(16): зародыш преобладающий над периспермом или заполняющий семя,
изогнутый, периферический, семядоли фолиарные, длина семядолей
примерно равна длине оси.
Эндопериспермальная группа:
I уровень — Piper-тип (17): зародыш меньше эндосперма и много
меньше перисперма, осевой, семядоли гаусториальные, семядольная и
осевая части приблизительно равны по длине.
У однодольных растений выделены свои типы семян.
Проэмбриональная группа:
О уровень — единственный Orchis-тип (26): семя обычно
содержит только недифференцированный зародыш.
Зародыш
431
Эндоспермальная группа (наиболее разнообразна по типам,
объединена общим признаком — гаусториальнои функцией семядолей,причем
ею обладает либо апикальная часть семядоли,либо она вся):
I уровень — типы Juncus- (23) и Роа- (24): зародыш много
меньше эндосперма, у первого — зародыш базально-центральный, у
второго — базально-латеральный, у обоих семядоли скутеллярные,
особенно отчетливо — у Роа-типа;
II уровень — Bromelia-тип (21): зародыш меньше эндосперма,
базально-латеральный, в семядолях проявляются признаки скутел-
лярности. Иногда семена очень мелкие, зародыш мало
дифференцирован;
III уровень — центральный тип эндоспермальной группы — Lili-
um-тип (20): зародыш меньше эндосперма, осевой;
IV уровень — Anthurium-тип (22): — зародыш больше
эндосперма, осевой.
Зародышевая группа:
V уровень — AIisma-тип (19): — зародыш тотальный, изогнут,
семядоля запасающая, листовидная, вальковатая, почечка латеральная.
Эндопериспермальная группа:
II уровень — Musa-тип (25): зародыш меньше эндосперма и
меньше перисперма, осевой, семядоля гаусториальная.
Периспермальная группа у однодольных отсутствует.
Основные направления эволюции семени и зародыша в связи с
филогенией цветковых растений (по: Смирнова, 1965). Исходной
группой для цветковых Смирнова считает эндоспермальную группу.
Эта группа дает начало двум противоположным направлениям
приспособительной эволюции: а) характерной для двудольных линии с
преобладающим развитием зародыша, связанной с усилением запасающей и
ассимилирующей функций семядолей; б) характерной для однодольных
линии с преобладающим развитием запасающей ткани при
сравнительно небольшом зародыше, связанной с преобладанием гаусториальнои
функции семядолей. В то же время она подчеркивает общность групп
семян двудольных и однодольных по типам строения семени,
свидетельствующую, по ее мнению, в пользу монофилетичности цветковых
растений в целом.
Смирнова отмечает, что семена представителей разных семейств
образуют по изменчивости признака относительного размера зародыша
параллельные ряды развития. Причем, чем крупнее зародыш (начиная
с III уровня), тем выше разнообразие типов семени (и, соответственно,
морфологии зародыша) в семействах и порядках.
Анализ классификации Смирновой. Важным результатом работы
Смирновой является установление на основании анализа строения
семени типов у большого числа порядков и семейств цветковых растений
(в соответствии с системой Тахтаджяна, 1959), а степень изменчивости
относительных размеров зародыша (уровни) оценена для всех
порядков цветковых.
432
Семя
По сравнению с Martin, ею предложен новый — комбинаторный
(а не иерархический) принцип классификации. Он оказался
продуктивным для графического представления классификации (схема 4):
распределение типов семени по уровням и группам,а также независимое
размещение на схеме типов семени однодольных и двудольных дает
наглядную картину основных вероятных направлений эволюции семени
и зародыша в двух классах цветковых растений. Эта схема в
определенной мере сопоставима с филогенетической схемой Martin.
Признаки, положенные в основу классификации Смирновой, по
сравнению с классификацией Martin, дополнены важными параметрами
морфологической дифференциации зародыша (в частности, соотношением
размеров оси и семядолей); приняты во внимание функциональные
характеристики органов зародыша (семядоли гаусториальные,
запасающие и т. п.); учтена природа запасающих тканей семени
(эндосперм/перисперм). Для однодольных описаны типы строения семени и
зародыша, отсутствующие у Martin; сделаны выводы относительно
различий в направлениях эволюции зародыша однодольных и двудольных
растений.
Однако с точки зрения практического использования — при
анализе конкретного таксономического разнообразия зародыша — система
Смирновой не очень успешна. Показателем этого является редкое
обращение к ней в ботанических работах. Основные недостатки
классификации Смирновой затрагивают следующие аспекты:
1) категории, введенные в классификацию, перекрывают друг друга;
2) крайне избыточно число выделяемых типов;
3) предлагаемыми типами трудно пользоваться при анализе
реального систематического разнообразия зародыша в связи с
неудовлетворительными критериями их выделения;
4) выводы относительно эволюции семени и зародыша, сделанные
на основании рассматриваемого материала, очень ограничены.
Остановимся подробнее на высказанных критических замечаниях.
1. Характеристики групп и уровней, выделенные в качестве отдельных
категорий, тем не менее включаются в характеристики типов.
Зародышевая группа и V уровень перекрываются по своим характеристикам
(«зародыш заполняет все семя или большую его часть»).
2. Избыточное число типов обнаруживается в том, что очень часто
семена, структурно сходные по расположению зародыша в семени и его
морфологии, выделяются как самостоятельные типы для каждого
уровня (в то время как они различаются только относительными размерами
зародыша — ср. типы 3 и 11, 4 и 6, 7 и 10,8 и 12), а также — для
однодольных и двудольных (ср. типы 3 и 20, 9 и 19).
3. Избыточное число типов и затрудненность их идентификации при
сравнительных исследованиях связаны с тем, что для их выделения
используется слишком большое число признаков, далеко не всегда
четких и однородных. Они или слишком ограничивают типы (как
относительный размер зародыша — см. выше), или не вполне морфологичес-
Зародыш
433
ки определенны (как, например, гаусториальные или запасающие
семядоли). Кроме того, для одних типов приводится соотношение
семядольной и осевой частей зародыша (для большинства типов двудольных с
развитыми зародышами), для других — нет (например, для Alisma-,
Anthurium- и Lilium-типов однодольных, имеющих морфологически
расчлененные зародыши).
В результате для конкретной систематической группы одни типы
оказываются слишком узкими, другие — широкими и
неопределенными. Так, например, для очень однородного по строению семени и
зародыша семейства бобовых выделяются, по крайней мере, два типа —
Lotus и Faba. У однодольных, напротив, для характеристики обширной
группы, включающей Liliales и еще 10 порядков, используется один
Lilium-тип, причем только самые общие и расширенные его
характеристики, как то: семя содержит эндосперм, зародыш меньше, равен или
больше эндосперма, базально-центральный или осевой, семядоли
гаусториальные. Для представителей порядков Bromeliales,Commelinales,
Xyridales,Eriocaulales описан единый ВготеНа-тип.хотя в
действительности у них наблюдается значительное разнообразие в строении
зародыша.
Затрудняет пользование классификацией и наименование типов не
по принципиальным структурным признакам, а по родовым
названиям.
4. Так же как и Martin, Смирнова не делает отчетливых выводов о
параллельной эволюции семени и зародыша у различных таксонов, хотя
в рамках ее классификаци сходные типы продемонстрированы в
различных группах, на различных уровнях, у однодольных и двудольных
растений.
В заключение необходимо отметить, что обе рассмотренные
классификации (Martin, 1946; Смирнова, 1965) в целом ряде аспектов
дополняют друг друга и, безусловно, являются существенной базой
для дальнейшей разработки классификации внутренней морфологии
семени.
Накопленный за последние годы фактический материал, обобщенный
в фундаментальных сводках «Сравнительная анатомия семян» (1985,
1988,1991, 1996) и «Сравнительная эмбриология цветковых растений»
(1981, 1983, 1985, 1987, 1990), значительно расширяет наши
представления о морфологическом разнообразии зародыша. Учитывая эти
данные и базируясь на типологии Martin (1946), мы предлагаем новый
вариант классификации внутренней морфологии семени. Основная
цель, преследуемая этой классификацией, — разработка
унифицированных, сопоставимых для различных таксонов способов морфологического
описания зародыша по комплексу значимых для систематики и
филогении признаков.
Предлагаемая классификация (схема 5) содержит три основных
категории — отделы, подотделы, типы, и две дополнительных — подтипы
и разновидности.
28—828
434 Семя
По признаку расположения зародыша в семени выделяются
четыре отдела: базальный, периферический, центрально-осевой и
тотальный.
Подотделы выделяются для всех отделов по степени и характеру
морфологической дифференциации зародыша. Их всего шесть:
недифференцированный, слабодифференцированный,
дифференцированный, семядольно-осевой, осевой и семядольный.
К недифференцированному подотделу относятся семена с мелким
зародышем, не расчлененным на органы; у семян слабодифференци-
рованного подотдела органы зародыша слабо развиты; в
дифференцированном подотделе все органы зародыша, соответственно, хорошо
дифференцированы, однако, сам зародыш при этом имеет небольшие
размеры в семени (этот подотдел можно рассматривать как вариант
семядольно-осевого подотдела); в семядольно-осевом подотделе как
Схема 5. Типологическая классификация внутренней морфологии семени:
1 — Degeneria (Degeneriaceae, D), Trillium (Trilliaceae, M); 2, 3 — Piper
(Piperaceae, D), Hydnora (Hydnoraceae, D), Burmannia (Burmanniaceae, M),
Hydatella (Hydatellaceae, M); 4 — Siparuna (Siparunaceae, D), Papaver
(Papaveraceae, D); 5 — Eriocaulon (Eriocaulaceae, M), Mayaca (Mayacaceae,
M); 6—Juncus (Juncaceae, M); 7— Commelina (Commelinaceae, M), Musa
(Musaceae, M); 8 — Phoenix (Arecaceae, M); 9 — Scirpus (Cyperaceae, M);
10 — Zea (Poaceae, M); 11 — Dyckia (Bromelliaceae, M); 12 — Gypsophylla
(Caryophyllaceae, D), Portulaca (Portulacaceae, D); 13 — Kochia
(Chenopodiaceae, D), Spergula (Caryophyllaceae, D); 14 — Polygonum (Poly-
gonaceae, D); 15 — Mirabilis (Nyctaginaceae, D); 16 — Pereskia (Cactaceae,
D); 17 — Althea (Malvaceae, D); 18 — Opuntia (Cactaceae, D); 19 —
Echinocactus (Cactaceae, D); 20 — Mamillaria (Cactaceae, D); 21 —
Balanophora (Balanophoraceae, D); 22 — Rafflesia (Rafflesiaceae, D), Cytinus
(Cytinaceae, D); 23 — Actinidia (Actinidiaceae, D), Primula (Primulaceae,
D); 24 — Lycium (Solanaceae, D), Menispermum (Menispermaceae, D); 25 —
Helianthemum (Cistaceae, D); 26 — Iris (Iridaceae, D); 27 — Cordyline
(Dracaenaceae, M); 28 — Croton (Euphorbiaceae, D); 29 — Oxalis (Oxali-
daceae, D); 30 — Bixa (Bixaceae, D); 31 — Dianella (Phormiaceae, M); 32 —
Allium (Alliaceae, M); 33—Jatropa (Euphorbiaceae, D); 34 — Rhododendron
(Ericaceae, D); 35 — Callitriche (Callitrichaceae, D); 36 — Eustoma
(Gentianaceae, D); 37 —Tulipa (Liliaceae, D); 38 — Metrosideros
(Myrtaceae, D); 39 — Climacoptera (Chenopodiaceae, D); 40 — Heliophila
(Brassicaceae, D); 41 — Hydrocleis (Limnocharitaceae, M); 42 — Pistia
(Araceae, M); 43 — Posidonia (Posidoniaceae, M), 44 — Ruppia (Ruppiaceae,
M); 45 — Pilea (Urticaceae, D); 46 — Lafoensia (Lythraceae, D); 47 — Tri-
folium (Fabaceae, D); 48 — Gomidesia (Myrtaceae, D); 49 — Cassytha
(Lauraceae, D); 50 — Pyrenaria (Theaceae, D), Memecylon (Melastomataceae,
D); 51 — Chimonanthus (Calycanthaceae, D); 52 — Ouratea (Ochnaceae, D);
53 — Aponogeton (Aponogetonaceae, M); 54 — Rubus (Rosaceae, D), Clusia
(Clusiaceae, D); 55 — Camellia (Theaceae, D); 56 — Combretum
(Combretaceae, D), Juglans (Juglandaceae, D); 57 — Trapa (Trapaceae, D);
58 — Warneckea (Melastomataceae, D); 59 — Peltandra (Araceae, M); 60 —
Hypocalymma (Myrtaceae, D); 61 — Ternstroemia (Theaceae, D); 62 —
Campomanesia (Myrtaceae, D); 63 — Pimenta (Myrtaceae, D); точками
обозначена семядоля, штриховкой — ось зародыша.
D — Dicotyledonae, М — Monocotyledonae.
Зародыш
435
I
п/о НЕДИФФЕРЕНЦИРОВАННЫЙ
о. БАЗАЛЬНЫЙ
п/о СЛАБО-
ДИФФЕРЕНЦИРОВАННЫЙ
т. зачаточный т. редуцированный т. зачаточный
п/о ДИФФЕРЕНЦИРОВАННЫЙ
т. линейный т. головчатый
Q
2 3
ч2У
4
5 6
7 8
,Г\
II
о. ПЕРИФЕРИЧЕСКИЙ
п/о СЕМЯДОЛЬНО-ОСЕВОИ
т. согнутый
т. скутеллярныи т. линейный
ю и
12 13
л/о ОСЕВОЙ
т. линейный
14 15 16 17
18 19 20
III
п/о НЕДИФФЕРЕН
ЦИРОВАННЫЙ
о. ЦЕНТРАЛЬНО-ОСЕВОИ
п\о СЕМЯДОЛЬНО-ОСЕВОИ
п\о СЕМЯДОЛЬНЫЙ
т. линейный
т. лопатовидиыи
т. лопатовидиыи
т. редуци--
роваииыи
т. линейный
ро_ ^
09 (fj)f§(
21 22 W W
т. линейный
©О С
23 24 25 26 27 28 29 30 31 32 33 34 35 36 37
IV
о. ТОТАЛЬНЫЙ
п\о СЕМЯДОЛЬНО-ОСЕВОИ
т. линейный
т. лопатовидиыи т. согнутый
т. облекающий
щуп im
О
38 39 40 41 42 43 44 45 46 47 48 49 50 51
п\о СЕМЯДОЛЬНЫЙ
п\о ОСЕВОЙ
т. линейный т. лопатовид- т- облекающий
, , ИЫЙ i
т. субсферический
т. лииеииыи
VJ Ь.
52 53 54 55 56 57
58 59
т. субсфери-
60 61 62 63
0\i
28*
436
Семя
семядоли, так и ось зародыша более или менее одинаково развиты;
в осевом — у зародыша отчетливо преобладает осевая часть (вплоть
до полной редукции семядолей), а в семядольном — семядольная.
Типы, как правило, выделяются по основным параметрам формы
зародыша. Всего выделяется 9 типов: зачаточный, редуцированный
(в названных двух типах мы вынужденно отходим от строгого
критерия формы), головчатый, скутеллярный (щитковидный),
линейный, лопатовидный, согнутый, облекающий (ось),
субсферический. Типы повторяются внутри отделов и подотделов. В линейный
тип включаются широко распространенный утолщенный зародыш,
высота которого лишь немногим превышает ширину (см. схему 5—36,
42, 60), и неравномерно утолщенный зародыш, (см. схему 5—43,
44). В лопатовидный тип добавляются вариации зародыша со
складчатыми семядолями (см. схему 5—30), в согнутый и облекающий —
с разнообразно свернутыми листовидными семядолями (см. схему
5—48, 50, 51). К субсферическому типу, впервые выделяемому,
относятся семена с заполняющими семя зародышами, у которых
сохраняется преимущественно семядольная или же осевая часть, и
приобретающими форму, близкую к шарообразной. Эти зародыши
могут иметь вид морфологически нерасчлененных образований, в
которых, однако, выражена гистологическая дифференциация (см. схему
5—58, 63); известны случаи срастания двух полушаровидных
семядолей, составляющих зародыш. Здесь мы имеем дело со
специализацией — вторично морфологически нерасчлененным зародышем.
Выделение подтипов и особенно разновидностей — достаточно
произвольно и зависит от того, насколько подробно требуется описать
зародыш.
Подтипы и разновидности выделяются по признакам,
детализирующим характеристики формы зародыша: прямолинейность или
изогнутость зародыша и характер его искривленности, тип сложения и
степень утолщенности семядолей, степень утолщенности (раздутости)
всего зародыша и равномерность (неравномерность) утолщенности его
частей и т.д., и т.п. Ниже приводятся варианты названий подтипов и
разновидностей для ряда морфологических вариаций, изображенных на
диаграммах схемы 5 (наименования даются в мужском роде, например:
разновидность — раздутоосевой, поскольку они относятся к
характеристике зародыша):
1 — подтип глобулярный; 4 — подтип двулопастной; 5 — подтип лин-
зовидный; 7 — подтип широкоцилиндрический; 12, 13, 24, 27, 32, 35,
39—41, 44, 52, 61, 62 — подтип изогнутый: 12 — разновидность
кольцевидный, 13, 39, 62 — разновидность спиралевидный, 40 —
разновидность дважды-перегнутосемядольный, 44 — разновидность
раздутоосевой; 23, 26, 37, 38, 42, 43, 53, 60 — подтип прямой: 42, 60 —
разновидность утолщенный, 43 — разновидность раздутоосевой; 28, 33 —
подтип фолиарно-плоскосемядольный; 29, 45, 47, 49, 54, 55, 56, 57 —
подтип мясисто- (массивно-) семядольный: 56 — разновидность
Зародыш
437
лопастносемядольный с руминацией, 57 — разновидность с одной
редуцированной семядолей; 30 — подтип складчатосемядольный; 46, 48,
50, 51 — подтип фолиарный свернутосемядольный.
В подписях к схеме 5 приводятся примеры встречаемости вариантов,
изображенных на диаграммах, у отдельных родов цветковых растений с
указанием семейства и класса.
Морфологическое описание зародыша должно последовательно
проводиться на основе отнесения его к: 1) одному из четырех отделов,
2) одному из шести подотделов, 3) одному из девяти типов и, если это
необходимо, 4) одному из подтипов, включая разновидности. Такое
описание позволит дать достаточно подробную характеристику по
основным параметрам его строения.
Предложенная классификация, безусловно, подлежит дальнейшему
совершенствованию, дополнению новыми морфологическими
модификациями зародыша, особенно значительно уклоняющимися от уже
известных.
Артюшенко, 1990; Вышенская, 1992, 1996а-о; Грушвицкий, 1961; Данилова и-др.,
1990; Кожанчиков, 1967; Оганезова, 1993; Смирнова, 1965; Тахтаджян, 1948, 1959,
1964, 1987; Тахтаджян, Данилова, 1985, 1988, 1991, 1992, 1996; Martin, 1946; Reeder,
1957.
О ПРИНЦИПАХ СОЗДАНИЯ ЭКОЛОГИЧЕСКОЙ КЛАССИФИКАЦИИ
ЗАРОДЫШЕЙ
Как показал опыт изучения эмбриональных структур паразитных
цветковых растений (Терёхин, 1965, 1968а, б, 1972, 1977; Терёхин,
Никитичева, 1968) понятие «поведение» может быть использовано для
описания образа жизни растительных организмов. Леме (1976)
отметил, что экология как животных, так и растений включает два основных
аспекта: 1) изучение характера среды, в контакте с которой живут
организмы, т. е. мезологическую экологию, или мезологию, и 2)
изучение поведения и реакций организмов в этой среде, т. е. этологическую
экологию, или этологию.
Понимание того обстоятельства, что взаимодействие между средой и
эволюцией растений может быть удовлетворительно объяснено только
с помощью понятий этологической экологии, позволяет нам обсудить
вопрос о возможности создания экологической классификации типов мор-
фогенетической организации зародышей цветковых растений, о ее
адаптивной и филогенетической значимости. Попытки создания полной
экологической классификации зародышей в настоящее время еще не могут
иметь, вероятно, достаточного фактического обоснования в связи со
слабой изученностью как строения зародышей, так и способов адаптивного
функционирования проростков. Однако уже сейчас на основании со-
438
Семя
бранных исследователями материалов имеется возможность обсудить
пути создания такой классификации и основные составляющие ее элементы.
В эмбриологии растений известно несколько морфологических
классификаций зародышей, разработанных с большей или меньшей полнотой
и основанных на тех или иных особенностях эмбрионального развития
или строения зрелых зародышей. Две из них (Schnarf, 1929; Soueges,
1939), построенные на закономерностях ранних стадий эмбриогенеза,
не утратили своего значения и по сей день.
Постепенно становится все более очевидно, что попытки придать этим
классификациям широкое филогенетическое значение не увенчались
успехом. По-видимому, и сам Schnarf (1929) не придавал созданной им
системе типов раннего эмбриогенеза филогенетической значимости.
Последующие разработки этой системы (Johansen, 1950; Яковлев, 1958;
Rutishauser, 1969) внесли в нее существенные дополнения или изменения
и в то же время подтвердили ее весьма ограниченные возможности в
решении филогенетических проблем.
По сравнению с системой Schnarf классификация Soueges выигрывает
в том, что ее подразделения (периоды, мегархетипы и серии) образуют
стройную систему морфогенетически взаимосвязанных способов раннего
эмбриогенеза. Однако эта стройность отражает, как показывает
накопившийся к настоящему времени фактический материал, не столько
действительные филогенетические взаимосвязи между таксонами, сколько
некоторые закономерности способов эволюционных преобразований
эмбриональных структур. Это довольно очевидно при сопоставлении системы
Soueges с любой из ныне существующих филогенетических систем
покрытосеменных растений.
Существование так называемых иррегулярных типов эмбриогенеза
подрывает филогенетическую значимость системы Soueges. Как показал
еще Johansen (1950), существование «иррегулярных» типов
эмбриогенеза не может быть сколько-нибудь удовлетворительно объяснено
явлениями гибридизации. В действительности мы имеем во многих
случаях именно «неправильные», с точки зрения системы Soueges, типы
раннего эмбриогенеза, и притом нередко у таких растений, более
«гибридная» природа которых в сравнении с другими близкими видами
кажется весьма сомнительной. К таким растениям автором отнесены
некоторые представители сем. Loranthaceae, два вида Scabiosa (S. suc~
cisa, S. columbaria), а также Datura stramonium. Solarium dulcamarum
и S. sisymbrifolium, Adonis autumnalis, Linum catharticum, Chelidonium
majus и др. (Soueges, 1961).
В последние годы были предприняты попытки «либерализации»
классификации Soueges (Crete, 1963; Lebegue, 1966; Mestre, 1967),
однако они не снимают принципиальных возражений против широкой
филогенетической значимости общих построений Soueges.
Возникает, естественно, вопрос: почему типы раннего эмбриогенеза
покрытосеменных не отражают реальную филогению цветковых
растений? Ответ на него можно искать в выяснении роли и значения ранних
Зародыш
439
стадий эмбриогенеза в развитии зародышей, а также в особенностях их
эволюционного преобразования.
Согласно данным монографической сводки «Сравнительная
эмбриология цветковых растений» (1981—1990) по распространению разных
типов развития зародыша, приведенных Johansen (1950), Onagrad-тип
эмбриогенеза обнаружен у представителей 88 семейств, Asterad-
тип — 78, Caryophyllad-тип — 36, Solanad-тип — 47, Chenopodiad-
тип — 20, Piperad-тип — 7 (см. Типы эмбриогенеза). Это
распределение показывает, во-первых, что формирование весьма разнообразных
зрелых зародышей (например, у представителей 58 семейств с
Onagrad-типом) обеспечивается немногими способами раннего
эмбриогенеза, во-вторых, что список семейств, в которых встречается тот или
иной тип раннего эмбриогенеза, со всей очевидностью вскрывает
несоответствие между существующими представлениями об их родственных
связях и происхождении и общностью способов раннего эмбриогенеза.
Нельзя не обратить внимания также и на тот факт, что в одних и
тех же семействах нередко можно найти не один, а два или больше
типов эмбриогенеза (например, в семействах Loranthaceae,Gentianaceae,
Primulaceae, Balanophoraceae, Lauraceae, Orchidaceae). Отсутствие
строгой детерминированности в способах дифференциации ранних стадий
эмбриогенеза было обнаружено также в пределах отдельных видов
орхидей и, в частности, у Cymbidium bicolor (Swamy, 1942), Epidendrum
prismatocarpum (Swamy, 1948), Angraecum distichum (Veyret, 1958),
Neottia nidusavis (Терёхин, Камелина, 1969) и т. д. Это же явление
обнаружено и у представителей других семейств, характеризующихся
редукцией тех или иных структур зрелого зародыша, например, у
Aeginetia indica (Orobanchaceae),Moneses uniflora (Pyrolaceae), у
некоторых видов Balanophora (Balanophoraceae), y Cuscuta europaea
(Cuscutaceae) и у ряда других видов (Tiagi,1952; Терёхин, 1962,1977;
Терёхин, Яковлев, 1967).
Если сравнить эмбриогенез и строение зрелых зародышей у видов с
более строгой и менее строгой детерминированностью способов раннего
эмбриогенеза, можно получить определенное представление о причинах
этого явления. У большинства видов со строгой детерминированностью
эмбриогенеза наблюдается соответственно и четкая структурная
организация морфогенетических инициалей основных органов и тканей
зрелого зародыша. Напротив, там, где эта четкость отсутствует по тем или
другим причинам, можно всегда наблюдать и усиление вариабельности
эмбриогенеза на его средних и начальных стадиях.
Вариабельность ранних и средних стадий эмбриогенеза или даже
почти полную утрату упорядоченности делений клеток проэмбрио мы
обнаруживаем, в частности, у видов Cuscuta, для которых характерна
полная редукция радикулы и семядолей, и у некоторых представителей
семейств Orobanchaceae и Pyrolaceae,для которых характерна редукция
радикулы и полная утрата эпикотиля. Пожалуй, наиболее яркие
примеры дают виды Utricularia: отсутствие сколько-нибудь строгой структур-
440
Семя
ной организации сформированных зародышей, что отчетливо показал
еще Каменский (1886); редукция радикулы и семядолей и
преобразование эпикотилярной зоны зародыша сопровождается и
соответствующими перестройками средних и ранних этапов эмбриогенеза.
Некоторые закономерности эволюционных преобразований
эмбриональных структур в связи со сменой покрытосеменными растениями
экологической ниши были выявлены на примере группы семейств
чужеядных растений (Терёхин, 1968а, б, 1972, 1977). Удалось
выяснить, в частности, что переход автотрофных цветковых растений
к чужеядности вызывает перестройку их индивидуального развития
в связи с изменением питающего субстрата и способов извлечения
питательных веществ. Анализ переходных форм из семейств Scro-
phulariaceae, Orobanchaceae, Pyrolaceae, Orchidaceae показывает, что
эволюционные преобразования зародышей происходят в тесной связи
и в соответствии с характером функциональных и структурных
преобразований послесеменного этапа развития спорофита, в процессе
которого как раз и совершается в онтогенезе переход к новому
(чужеядному) способу питания. Особенности средних и ранних
этапов эмбриогенеза изменяются последовательно в соответствии с
изменением конечных этапов развития зародыша (Терёхин, 1977).
Довольно очевидно также, что морфогенетические особенности
ранних этапов эмбриогенеза определяются и характером строения
семязачатка и семени, что предопределяет, вероятно, строение суспензора —
специализированного гаусториального аппарата зародыша (см. Суспен-
зор). Эти взаимосвязи в наиболее отчетливой форме проявляются у
представителей семейств Cuscutaceae, Orchidaceae и Pyrolaceae.
Интересно, что вариабельность первого деления проэмбрио наблюдается
только у видов, не имеющих суспензора, например, у Balanophora
(Терёхин, Яковлев, 1967).
Таким образом, характер раннего эмбриогенеза определяется двумя
факторами: особенностями строения сформированного зародыша и
особенностями строения семязачатка и семени. В процессе же эволюции
ранний эмбриогенез является результатом морфогенетического
компромисса между двумя комплексами факторов: способом питания
спорофита в послесеменном периоде и особенностями эволюционной адаптации
семян в отношении их распространения (поскольку именно эти
особенности определяют в основном строение зрелого семени).
Высказанные соображения удовлетворительно объясняют
многочисленные случаи совпадений (что отметила Поддубная-Арнольди, 1976)
способов развития проэмбрио у представителей, очевидно, не
родственных таксонов, а также их различия у представителей
близкородственных таксонов.
Известны, по крайней мере, три классификации зародышей
покрытосеменных, основывающиеся на особенностях строения зрелых
зародышей. Это прежде всего разделение зародышей покрытосеменных на
двусемядольные и односемядольные. Различиям в числе семядолей
Зародыш
441
придается широкая и существенная филогенетическая значимостью чем
можно судить, заглянув в почти любую из известных сегодня систем
цветковых растений. Однако хотя признак различия числа семядолей
и указывает на возможность большой филогенетической значимости
эмбриональных структур,его адаптивное значение остается неясным, а
классификация внутри каждого из подразделений еще далеко не
достаточно разработана (Грушвицкий, 1961, 1963; Смирнова, 1965). Но,
пожалуй, самое основное заключается в том, что семядоли являются
структурами аппендикулярными и по этой причине, по-видимому, не
могут вполне отразить основные эволюционные преобразования осевых
структур зародыша. Вместе с тем уже имеющиеся данные по
различиям в строении семядолей в связи с их функциями в процессе
прорастания достаточны для того, чтобы войти в качестве одного из основных
элементов в экологическую классификацию зародышей.
Наиболее разработанной классификацией зародышей, основанной на
изучении их формы, размеров и положения в зрелом семени, является
классификация Martin (1946). Можно, однако, привести много
свидетельств формалистичности его построений. Так, например, критерии
этой классификации позволяют объединять в один тип зародыши таких
существенно различных семейств, как Orchidaceae и Pyrolaceae, Scro-
phulariaceae и Ericaceae, Rosaceae и Compositae (Asteraceae) и т. д.
Именно вследствие своей формалистичности и в результате полной
оторванности от эктогенетических факторов эволюции зародышей
система Martin не может быть включена в экологическую классификацию
зародышей.
Основными эволюционными факторами, обусловливающими
изменения эмбриональных структур, являются, очевидно, особенности
функционирования (поведения) проростков по отношению к среде, их этоло-
гическая экология (Терёхин, 1962, 1965, 1968а, б, 1972, 1975, 1977;
Терёхин, Никитичева, 1968,1976; Никитичева, 1971). Эти особенности,
в свою очередь, закономерно связаны с изменениями окружающей
среды (мезологическая экология).
Зародыш в зрелом семени находится в функционально
недеятельном состоянии, его связи с внешней средой проявляются лишь с
началом прорастания. Отсюда понятно, что именно особенности среды
обитания, воздействуя на характер функциональной активности проростка,
приводят к определенным эволюционным преобразованиям строения и
морфогенетических потенций зародыша (см. Редуцированные и
недифференцированные зародыши).
Любая классификация зародышей будет отражать действительные
эволюционные процессы только в том случае, если она будет учитывать
описанную выше систему взаимозависимостей между воздействующими
факторами и изменяющимися структурами.
Различные особенности организации зародышей имеют разное
адаптивное значение: одни — более общее, другие — более конкретное.
Эти различия представляют ценную возможность разделять более и
442
Семя
менее экологически (и, возможно, филогенетически) значимые признаки
зародышей, дают возможность исследовать иерархию морфогенетических
структур. Иерархичность адаптивного значения организационных
признаков была подчеркнута еще Шмальгаузеном (1939\ а его последние
работы в области изучения контроля и регуляции эволюционного
процесса (Шмальгаузен, 1958, 1968) явились одной из отправных точек
развиваемых в настоящей работе представлений.
В связи с изложенным выше, наряду с трудностями в построении
филогенетически значимой классификации зародышей, упомянутыми
Поддубной-Арнольди (1964а), следует указать и на очевидную
ограниченность наших знаний о процессах прорастания покрытосеменных
растений. Основное внимание в создании классификации процессов
прорастания уделяется явлениям надземного и подземного прорастания
(Klebs, 1885; Boyd, 1932—1935; Грушвицкий, 1963). Однако и в этом
вопросе еще далеко не все ясно. Так, если Klebs выделяет группы с
надземными и подземными семядолями, то Грушвицкий и другие авторы
считают необходимым различать основные способы прорастания по
функциям семядолей: при подземном прорастании семядоли выполняют одну
из двух функций (запасающую или гаусториальную) и отмирают,
оставаясь в семени; при надземном прорастании семядоли всегда выполняют
две функции: запасающую (или гаусториальную) и ассимиляционную.
Предложенная Грушвицкий (1963) классификация и интерпретация
типов прорастания двудольных цветковых растений не охватывает всех
возможных способов прорастания. В эту классификацию не
укладываются растения с гетерофункциональными семядолями (например, Тгара),
и эти растения нельзя отнести к переходным, промежуточным формам.
Это свой особый тип прорастания. Нам представляется в то же время,
что выделение двух особых форм подземного прорастания, с единственно
гаусториальной и единственно запасающей функцией, является, может
быть, более существенным, филогенетически значимым явлением, нежели
разделение прорастания на надземное и подземное. Действительно, и
надземное, и подземное прорастание (в том смысле, что семядоли могут
выполнять или не выполнять ассимилирующую функцию) довольно часто
встречается у представителей одного и того же рода (например, в родах
Phaseolus, Acer, Caesalpinia, Prunus, Sophora и Peperomia) или даже
вида (Clematis recta). Это свидетельствует о высокой вариабельности
признака и сравнительной скорости его эволюционного изменения. В
то же время запасающая или гаусториальная функция семядолей и,
соответственно, отсутствие или присутствие эндосперма в зрелых семенах
характеризуют, как правило, крупные таксоны покрытосеменных в ранге
семейств и порядков.
Еще Klebs (1885), разделив семенные растения на три основные
группы (с двумя или большим числом семядолей, с одной семядолей
и с редуцированными семядолями), пытался связать эти особенности
строения зародышей с теми или иными особенностями прорастания.
Это ему плохо удалось по той причине, что в каждой из этих
Зародыш 443
групп существует, как оказывается, несколько оригинальных
специфических типов структурной организации зародышей и способов
прорастания. Естественно, что все эти различия имеют адаптивный
характер.
Нам представляется в то же время, что экологическая,
филогенетически значимая классификация зародышей не может быть сведена
только к структурным или функциональным изменениям семядолей.
Необходимо подвергнуть анализу все основные структуры и функции
спорофита как в сформированном зародыше, так и в процессе
прорастания.
Зародыши покрытосеменных растений претерпели в процессе
эволюции весьма существенные и разнообразные изменения. Анализ этих
изменений позволяет выявить следующие их основные аспекты: 1)
изменения морфогенетических потенций осевых структур зародышей,
2) изменения морфогенетической активности осевых структур
зародыша (период покоя, темп развития), 3) изменения зародышей по степени
дифференциации осевых структур, 4) изменения зародышей по
характеру дифференциации осевых структур, 5) изменения суспензорного
аппарата, 6) изменения строения семядолей, 7) изменения зародышей
по их размерам, 8) изменения зародышей по соотношению основных
структур, 9) изменения общей формы зародыша, 10) изменения
зародышей по их отношению к биомассе эндосперма и положению в семени,
И) изменения зародышей по характеру запасных веществ, их
присутствию и распределению.
К настоящему времени наиболее полно выявлены различия
зародышей по способам ранних стадий их развития, равно как и по
особенностям образования суспензорного аппарата.
Наименее разработанными областями остаются: 1) проблема
взаимосвязи эволюционных изменений зародышей с особенностями среды
(проблема факторов эволюции зародышей), 2) проблема
взаимосвязей различных этапов эмбриогенеза в эволюционных
преобразованиях структур зародыша (проблема морфогенетических
взаимосвязей) и 3) проблема выявления сравнительного экологического
(и, возможно, филогенетического) значения различных аспектов
этих изменений (проблема иерархичности структур и факторов).
Что касается первой из перечисленных проблем, то интересно
отметить почти полное отсутствие в литературе попыток увязать данные об
эволюционных изменениях зародышей с данными об особенностях
прорастания этих растений, хотя такие взаимосвязи в некоторых случаях
бывают весьма отчетливы (Salisbury, 1942; Корчагина, 1964; Терёхин,
1968а, б, 1977; Никитичева, 1971). Исследователи, изучающие процессы
прорастания, избегают, как правило, обсуждения особенностей
эмбриональных структур и, наоборот, исследователи, изучающие эмбриогенез,
не рассматривают данные об особенностях развития и
функционирования спорофита в процессе прорастания,что обусловлено исторически
сложившейся дифференциацией этих научных областей.
444
Семя
Однако, как показывает наш опыт изучения эволюции зародышей
паразитных и хищных цветковых растений, закономерности этой
эволюции нельзя понять без привлечения сведений о прорастании растений,
об особенностях их существования и среды обитания (Терёхин, 1977).
Что касается второй проблемы, то ее разработка тормозится
отсутствием обобщений наших знаний о многих аспектах эволюционных
изменений зародышей, и прежде всего отсутствием наиболее
необходимых сведений о строении сформированных зародышей (Поддубная-
Арнольди, 1964а).
Третья проблема получила, вследствие некоторых исторических
причин, неоправданно однобокое развитие. Достаточно широко известно,
что в настоящее время ботаники-эволюционисты, в том числе и
эмбриологи, придают весьма важное филогенетическое значение изменению
числа семядолей зародыша. Однако возникает вопрос —
действительно ли само по себе уменьшение числа семядолей от двух до одной
представляет собой наиболее важное и существенное в процессе
эволюции преобразование зародышей, или же это изменение является
одним из видимых морфогенетических отражений каких-то более глубоких
и существенных преобразований молодого спорофита, связанных с
особенностями его существования. В пользу второго суждения
свидетельствует, вероятно, наличие целого ряда отличительных черт в строении
и развитии спорофитов однодольных растений, а также явления так
называемой ложной однодольности.
От внимания исследователей ускользают, как нам представляется,
более существенные преобразования осевых структур зародышей. Это
происходит,вероятно, потому,что подобные преобразования
вскрываются лишь при сопряженном изучении строения сформированных
зародышей и их прорастания. Можно думать, что такого рода изменения
играют в эволюции зародышей в целом более значимую роль, нежели
изменения семядолей, т. е. аппендикулярных структур зародыша.
На основе такого сопряженного анализа мы попытались выявить
некоторые общие, экологически значимые изменения осевых структур
зародышей и сопоставить их с изменениями строения и функций семядолей.
Как можно видеть из данных, представленных на схеме, зародыши
цветковых растений можно разделить на пять основных типов,
различающихся по характеру морфогенетических потенций осевых структур:
I тип — с биполярной морфогенетическои активностью зародыша
при прорастании за счет эпикотиля и радикулы;
II тип — с биполярной морфогенетическои активностью зародыша
при прорастании за счет эпикотиля и адвентивных корней (морфогене-
тические потенции радикулы утрачены);
III тип — с биполярной морфогенетическои активностью зародыша
при прорастании за счет радикулы и адвентивных побегов (морфогене-
тические потенции эпикотиля утрачены);
IV тип — с униполярной морфогенетическои активностью эпикоти-
лярного полюса редуцированного зародыша при прорастании (морфоге-
Зародыш
445
нетические потенции гипокотилярно-радикулярнои зоны зародыша
утрачены);
V тип — с униполярной морфогенетическои активностью радикуляр-
ного полюса редуцированного зародыша при прорастании (морфогене-
тические потенции эпикотилярной зоны зародыша утрачены).
Схема: Типы зародышей цветковых растений по характеру
морфогенетических потенций осевых структур
Эпикотиль
Г\
Гипокотиль
Эпикотиль
г\
Гипокотиль
Радикула
\J
Радикула \^
Rhizophora
Neottia У
Orobanche
Характеристики этих основных типов, естественно, не включают в
себя сравнительные данные об уровнях организации апикальных
структур, о темпах морфогенетическои активности при прорастании и ряд
других более частных признаков, которые изучены еще далеко не
полно. Более изучены особенности строения и функции аппендикулярных
структур зародыша (семядолей), в связи с чем мы сопоставили
выделенные основные типы с доступными данными в отношении строения
и функций семядолей. Это сопоставление можно рассматривать одним
из первых шагов к выявлению сложных взаимозависимостей функций
и структур зародыша покрытосеменных.
s -
Я!
О
а
s
Я!
>>
КС
S
а
а
3
S
>>
а
s
О)
S
S
о
о
I
^0.
Е 5
з ~
§Е 2
Е .3 Е
5 ~, u
~3^ "*
с +
3
О"
II
О.
to
с
«5
+ +
|? +
I
+ + +
«5
Е
з
+ +
+ +
•СО
•с =
^ 3
+ +
+ +
-а
с
3
II!
72
'S
оэ
||
И
31 5
та-
и I
{!
1!
и в
в a
•* >*
я в*
S
S «К
К U
« 5
° £
н кс
и к
° S
й о
я" <
и л а
II
г
v я £
В К
я « К*
а о
г
г s
2 >>
а. ю
я н
Я £ Н
"■а о
Ш ^ Е-
чч5
ааО
All
1 s 1 з
пи
в ° а. "
I
3S Ы
о о
И и
о. s*
?g 2
lis
u|b
- 2 as
Is
(J 6-
Q.
Я s О
m Я К
a ё a
д *o S
н о и
о в ю
о в
S я Ь
шив
в as u
_; о к в ч
аН °Я 5*
О ° °
= 5 о
о. v го
о I S
В о «
«г»
_; £■£
« ° к
« Е ев
йЗ
2 я о я
S g 1 8-
*£ ° * я
й м f- та
U|l§2
>|6S3
Е-. Е се Л И
пз
и е-
>о
Зародыш
447
Каждому из перечисленных выше пяти типов морфогенетической
организации осевых структур зародышей соответствует определенный
спектр морфогенетических и функциональных изменений семядолей,
если таковые образуются.
Основные морфогенетические изменения семядолей включают
изменение их числа, сравнительных морфогенетических потенций (изокоти-
лия и гетерокотилия) и их редукцию вплоть до полной элиминации.
Таким образом, можно различать следующие формы
морфогенетических состояний зародышей в отношении организации семядолей (I, II и
III типы зародышей с биполярным развитием осевых структур):
1) двусемядольные и многосемядольные зародыши с
морфогенетической изокотилией;
2) двусемядольные и многосемядольные зародыши с
морфогенетической гетерокотилией;
3) односемядольные зародыши (включая так называемые ложноод-
нодольные);
4) бессемядольные зародыши (включая зародыши с
редуцированными семядолями, утратившими функциональные потенции).
С другой стороны, известны различия в функциях семядолей
зародыша при прорастании:
1) зародыши с запасающей и фотосинтезирующей функциями
семядолей: а) с более выраженной фотосинтезирующей функцией, б) обе
функции выражены, в) с более выраженной запасающей функцией;
2) зародыши с запасающей функцией семядолей;
3) зародыши с гаусториальной и фотосинтезирующей функцией
семядолей: а) с более выраженной фотосинтезирующей функцией, б) обе
функции выражены, в) с выраженной гаусториальной функцией;
4) зародыши с гаусториальной функцией семядолей;
5) зародыши, утратившие семядоли.
Разумеется, рассмотренные общие аспекты строения и функций
семядолей далеко не исчерпывают всего структурно-функционального их
разнообразия, но они могут дать представление о направлении и
характере дальнейшего накопления необходимых данных. Большое значение,
в частности, могут иметь данные о биомассе семядолей, о «частных»
особенностях их строения, о соотношениях с другими органами зародыша,
о топографическом расположении семядолей в семени (с точки зрения
трофических связей зародыша и эндосперма) и т. д. Однако вследствие
крайней редукции зародышей или утраты семядолей у редуцированных
зародышей, включенных нами в V и VI типы, необходимы иные подходы
к их классификации. Существенное значение приобретают такие
особенности морфогенетической организации, как степень общей редукции
зародышей, уровень дифференциации их базальной и апикальной зон и т. д.
Как можно видеть из данных таблицы, каждый из пяти основных
типов морфогенетической организации зародышей включает в себя
вариации строения и функций семядолей и, конечно, другие структурные
и функциональные особенности.
448
Семя
Нам важно было показать, что общий адаптивный смысл того или
другого типа морфогенетическои организации зародышей может быть
раскрыт в результате изучения различных его внутритиповых вариаций.
Первые три типа включают в себя различные вариации автотрофного
существования, адаптивный смысл которого раскрывается (через
посредство изучения семядолей и их функций при прорастании) наиболее
полно в вариациях I типа. В эволюционном становлении II и III типов
зародышей участвуют и другие, еще не вполне раскрытые особенности
существования проростков. IV и V типы обусловлены чужеядным
существованием.
Рассмотрим кратко некоторые примеры соответствия структурной
организации зародышей и особенностей их прорастания, раскрывающие
адаптивный смысл системы в целом и ведущее значение в ее
становлении экологических (этологических) факторов.
Зародыши Phaseolus характеризуются хорошо развитыми осевыми
структурами, а также развитыми семядолями, выполняющими
запасающую и ассимиляционную функции. Эндосперм в семени отсутствует.
Такое строение зародыша вполне соответствует «нормальному»
биполярному развитию проростка с высокой морфогенетическои
активностью обоих осевых апексов при прорастании, а способ прорастания
соответствует каким-то определенным, но еще не вполне выясненным
особенностям поддержания численности видов Phaseolus в
биогеоценозах, как раз требующей повышенной активности осевых апексов
зародыша. Однако в то время как одни виды Phaseolus (например, Ph.
vulgaris) характеризуются надземным прорастанием, т. е. запасающе-
ассимиляционной деятельностью семядолей, для других (например, Ph.
multiflorus) характерны отчетливое подземное прорастание и
исключительно запасающая функция семядолей. Эта вариабельность дает нам
возможность изучить адаптивный смысл перехода от надземного
прорастания к подземному (или наоборот).
Еще Rauh (1937) показал, что в процессе эволюции боковые побеги
часто замещают отмирающий главный побег в процессе
индивидуального развития. Много примеров замещений подобного рода
накоплено при изучении жизненных форм растений. На примере
паразитных цветковых удалось выяснить, что такого рода субституционные
явления могут осуществляться и в их онтогенезе (Терёхин, Никити-
чева, 1968; Никитичева, Терёхин, 1976; Терёхин, 1977). Однако
столь значительные преобразования в строении и в морфогенетичес-
ких процессах осевых структур зародышей не обязательно связаны
с паразитизмом. Например, у прибрежных растений (Barringtonia) и
растений мангров (Rhizophora) можно наблюдать процесс замещения
основного корня адвентивными структурами; то же характерно и для
злаков (см. Эмбриогенез злаков). Весьма ярко адаптивный смысл
гетерокотилии выявляется при изучении строения зародыша и
проростка у Trapa natans (Titova, 1992).
Зародыш 449
Известно также, что зародыши некоторых цветковых растений
утратили вследствие редукции те или иные апикальные структуры, и
развитие таких растений в первый период прорастания является строго
униполярным либо за счет морфогенетически активных структур на эпи-
котилярном полюсе зародыша (Utricularia, Aldrovanda, Cuscuta, Orchida-
ceae), либо за счет морфогенетически активных (но эволюционно пре-
образованнных) структур на радикулярном полюсе зародыша (Pyrola,
Orobanche). Адаптивный смысл этих преобразований вполне ясен, как
ясен и адаптивный смысл недоразвития (но не редукции!) зародышей
у ряда эфемерных растений (Erythronium и др.). Однако в необходимой
степени соответствие особенностей прорастания и строения зародышей,
равно как и адаптивный их смысл, у большинства растений еще не
изучено.
Создание эколого-морфологической классификации зародышей
не только принципиально возможно, но и необходимо, поскольку
такого рода исследования могут и должны внести существенный вклад
в понимание эволюции и филогении цветковых растений.
Грушвицкий, 1961, 1963; Каменский, 1886; Корчагина, 1964; Леме, 1976; Никитичева,
1971; Никитичева, Терёхин, 1976; Поддубная-Арнольди, 1964а, 1976; Смирнова, 1965;
Терёхин, 1962, 1965, 1968а, б, 1972, 1975, 1977; Терёхин, Камелина, 1969; Терёхин,
Никитичева, 1968, 1976, 1979; Терёхин, Яковлев, 1967; Шмальгаузен, 1939, 1958,
1968; Яковлев, 1958; Boyd, 1932—1935; Crete, 1963; Johansen, 1950; Klebs, 1885;
Lebegue, 1966; Martin, 1946; Mestre, 1967; Rauh, 1937; Rutishauser, 1969; Salisbury,
1942; Schnarf 1929; Soueges, 1939; Swamy, 1942, 1948; Tiagi, 1952; Titova, 1992;
Veyret, 1958.
РЕДУЦИРОВАННЫЕ И НЕДИФФЕРЕНЦИРОВАННЫЕ ЗАРОДЫШИ
У эмбриологов и морфологов-эволюционистов до сих пор нет
четкого понимания различий между зародышами с редуцированными
органами и так называемыми «недоразвитыми» зародышами, у которых
в зрелом семени основные органы еще отсутствуют, но они
нормальным образом развиваются после опадения семян с материнского
растения (Eames, 1961; Поддубная-Арнольди, 1976; Natesh, Rau, 1984).
С другой стороны, редуцированные зародыши и зародыши с
редуцированными органами представляют собой наиболее яркие примеры
адаптивности эволюционных преобразований.
Процесс редукции мы понимаем как процесс последовательного (в
ряду поколений) сокращения развития той или иной структуры,
утратившей или изменившей свою основную функцию. При полной утрате
функций структура полностью исчезает (элиминируется) из онтогенеза;
при смене главной функции — в большей или меньшей степени
сохраняются рудименты структур (инициали). В сложных структурах мы
различаем два основных направления редукции: общую редукцию и изби-
29-828
450
Семя
рательную редукцию (Терёхин, 1968в, 1977, 1991). В случае
избирательной редукции (по отношению к структурам зародыша) мы говорим
о зародышах с редуцированными органами. Например, у зародышей
орхидных редуцирована радикула, а инициали гипокотиля развиваются
в особую запасающую ткань, обеспечивающую кроме главной
(запасающей) функции также и функцию контакта и «утилизации» гаусторий
микоризного гриба. Согласно нашим представлениям, несмотря на
«укорочение» эмбриогенеза, семядоли и эпикотиль дифференцируются и
развиваются у орхидных в послесеменном периоде обычным для
однодольных цветковых растений путем (Терёхин, 1977). Именно это
обстоятельство позволяет нам говорить о зародышах в зрелых семенах
орхидных как о зародышах с редуцированными органами.
Редуцированные зародыши многих (но не всех)
высокоспециализированных паразитных цветковых утрачивают или изменяют функции всех
основных органов (эпикотиля, семядолей, гипокотиля и радикулы). При
этом утрата функций фотосинтеза приводит к редукции семядолей и
эпикотиля, утрата и изменение функций радикулы приводят к
преобразованию рудиментов радикулы в гаусториеобразующие органы, утрата
и изменение основных функций гипокотиля приводит к развитию из его
рудиментов (инициалей) новых структур — «клубенька» или «клубня»
(запасающих органов с функцией инициации адвентивных
репродуктивных побегов и гаусториеобразующих органов). Редуцированный зародыш
в зрелом семени высокоспециализированных растений-паразитов — это
качественно новая структура с функциями, принципиально отличными
от функций зародыша автотрофных растений.
Ключ к пониманию происхождения редуцированных зародышей и
зародышей с редуцированными органами заключен в экологических
особенностях тех видов растений, у которых такие зародыши образуются.
Точнее говоря, причины эволюционных изменений зародышей,
приводящих к редукции, лежат в изменении поведения и способа развития
проростков.
Распознать эти сложные эволюционные преобразования удается
лишь в результате сочетания морфологических и экологических
исследований. Именно поэтому экологическая эмбриология имеет статус
дисциплины, способной «расшифровать» биологический смысл
эволюционных преобразований эмбриогенеза (Терёхин, 1977, 1991).
Зародыши с редуцированными органами. Зародыши с
редуцированными органами обнаружены среди паразитных растений (как ксено-,
так и микопаразитных), а также среди свободноплавающих и
погружённых водных растений. Среди таксонов наземных автотрофных растений
редукция одной из осевых структур (радикулы) обнаружена только у
представителей сем. Роасеае, что, по-видимому, обусловлено водным
или микотрофным образом жизни их предковых форм. Нет свидетельств
того, что именно хищничество некоторых водных свободноплавающих
растений (Aldrovanda, Utricularia) приводит каким-либо образом к
редукции зародышей. И, напротив, образ жизни свободноплавающих вод-
Зародыш
451
ных растений, который ведут эти растения-хищники, может быть
причиной редукции и полной элиминации радикулы зародышей этих
растений, поскольку ее функции при свободноплавающем способе
существования оказываются ненужными и утрачиваются. С другой стороны,
свободноплавающий образ жизни, вероятно, способствует более
эффективному осуществлению хищничества, расширяя территориальный
контроль этих растений над пищевыми ресурсами. Utricularia ушла
сравнительно дальше в своей специализации к новому образу жизни в водной
среде по сравнению с Aldrovanda. Для Utricularia ненужными оказались
и семядоли, также утраченные зародышами.
В направлении утраты функций радикулы движутся и многие виды
погруженных водных растений (Ruppia и др.), для которых развитие
системы адвентивных корней оказывается более эффективным для
осуществления жизнедеятельности, нежели развитие радикулы
(возможно, все дело в способе «заякоривания» проростков в зыбком
грунте). У высокоспециализированных водных погруженных растений
(например, у видов Zostera радикула полностью элиминирована, а
на эпикотиле зародыша (или на его границе с гипокотилем) часто
формируется зачаток адвентивного корня. Сходные адаптивные
изменения присущи и некоторым растениям мангров. У «живородящих»
видов Rhyzophora, при мощном развитии гипокотиля, радикула
существенно редуцирована, а у видов Barringtonia — полностью
отсутствует.
У другой категории растений редукция органов зародышей
обусловлена их чужеядным (паразитным) способом питания и соответствующим
ему поведением проростков. Именно на стадии проростков происходит
переход к паразитизму. Первая группа из этой категории представлена
стеблевыми паразитами (с «наземным» стартом развития проростков)
из семейств Cuscutaceae (Cuscuta) и Lauraceae (Cassytha). Радикула
зародышей у видов этих родов отсутствует. У более специализированной
к паразитизму повилики (описано около 100 видов рода Cuscuta)
отсутствуют также и семядоли. У проростков Cassytha filiformis сначала
развиваются адвентивные корни, но после перехода к паразитизму они
отмирают. У Cassytha переход к паразитизму происходит посредством
преобразованных в гаустории адвентивных корней, и после этого также
отмирает вся базальная часть проростков. Эволюционные изменения
зародышей Cassytha, и особенно у видов Cuscuta, отчетливо адаптированы
к поведению их проростков и обусловлены, в конечном счете, переходом
к стеблевому паразитизму.
Вторая группа паразитных таксонов из пор. Santalales (Loranthaceae,
Myzodendraceae, Viscaceae) также представлена специализированными
стеблевыми паразитами. Все они зеленые растения, завершающие свой
жизненный цикл на ветвях растений-хозяев (обычно это деревья).
Распространению плодов этих растений способствуют птицы, а
прикреплению к ветвям хозяев — специальная липкая ткань в перикарпе, которая
в желудке птиц не переваривается, но обнажается. Радикула у заро-
29*
452 Семя
дышей этих растений не просто редуцирована, но и преобразована в
зачаток довольно сложного гаусториального органа, посредством
которого они проникают в ткани растений-хозяев. У зародышей более
специализированных таксонов (Phrygilanthus aphyllus, некоторые виды
Viscum и Arceuthobium) листья редуцированы и, соответственно,
редуцированы и семядоли. Это связано с особенностями их гетеротрофного
питания.
Интересные примеры зародышей с редуцированными органами дает
нам сем. Orchidaceae. Орхидные относятся к м'икопаразитным
однодольным растениям. У зародышей всех исследованных видов радикула
редуцирована, а гипокотиль преобразован в запасающую ткань. После
прорастания семени орхидеи гифы микоризного гриба внедряются в
клетки базальной области проростка, и здесь начинается их
«переваривание». Микопаразитизм является формой взаимного паразитизма,
когда на основе антагонистических отношений происходит взаимный
обмен разными группами питательных веществ между цветковым
растением и грибом. По степени приспособления к микопаразитизму
среди орхидных различают несколько уровней и соответствующих им
групп таксонов (Терёхин, 1977). Степень адаптации к
микопаразитизму отражена не только в редукции радикулы и преобразовании гипо-
котиля, но и в уровне недоразвития таких органов зародыша, как
семядоля и эпикотиль. Мы говорим именно о недоразвитии, а не о
редукции этих органов, потому что у многих видов орхидей они или
доразвиваются или даже начинают свое развитие уже после
прорастания, в процессе развития проростков. Обратим на это особое
внимание, потому что даже у очень специализированных видов бесхлоро-
филльных (и, следовательно, безлистных) орхидей, таких как виды
Neottia, Corallorhiza, Epipogium, в апикальной области зародыша
сохраняются морфогенетические потенции к развитию репродуктивного
побега обычным для цветковых растений образом. Ниже мы приводим
список таксонов, у которых те или иные органы зародышей
редуцированы. Степень и форма этой редукции зависят от уровня и
направления экологической специализации таксонов.
ДВУДОЛЬНЫЕ
1. Cuscutaceae: все виды Cuscuta.
Экологическая ниша: бесхлорофилльные травянистые лианы,
стеблевые паразиты (с наземным стартом).
Зародыш: полностью отсутствуют радикула и семядоли.
Терёхин, 1977.
2. Lauraceae: Cassytha filiformis.
Экологическая ниша: стеблевой паразит с зелеными листьями
(лиана) и «наземным» стартом развития проростков.
Зародыш
453
Зародыш: редуцирован апекс радикулы.
Терёхин, 1977.
3. Loranthaceae: все виды Атуета, Lysiana, Loranthus,
Phrygilanthus и др.
Экологическая ниша: стеблевые (редко — корневые) паразиты с
зелеными листьями; иногда листья редуцированы до чешуи.
Зародыш: с развитыми семядолями, обычно с выраженным эпикоти-
лем и с проводящей системой в оси (иногда — ив семядолях); радикула
редуцирована и замещена меристематическои тканью с сосочковидным
эпидермисом.
Dixit, 1958; Prakash, 1961; Терёхин, 1977.
4. Myzodendraceae: все виды Myzodendron.
Экологическая ниша: стеблевые паразиты с зелеными листьями.
Зародыш: радикула редуцирована и преобразована в инициаль
гаустории.
Kuijt, 1969.
5. Viscaceae: все виды Viscum, Phoradendron, Korthalsella,
Arceuthobium и др.
Экологическая ниша: стеблевые паразиты с зелеными листьями;
листья иногда редуцированы.
Зародыш: с разной степенью редукции радикулы и (иногда)
семядолей.
Kuijt, 1969; Терёхин, 1977.
6. Rhizophoraceae: виды Rhyzophora, Barringtonia.
Экологическая ниша: мангровые растения.
Зародыш: с редуцированной радикулой и системой замещающих ее
адвентивных корней.
Терёхин, ориг.
7. Droseraceae: Aldrovanda vesiculosa.
Экологическая ниша: свободноплавающее водное растение-хищник.
Зародыш: радикула полностью редуцирована и замещена (с частью
гипокотиля) запасающей тканью.
Терёхин, 1985а.
8. Lentibulariaceae: все виды Utricularia.
Экологическая ниша: свободноплавающее водное хищное растение.
454
Семя
Зародыш: радикула и эпикотиль полностью редуцированы и
замещены запасающей тканью, в апикальной области зародыша зачатки
вегетативных органов; семядоли элиминированы.
Никитичева, 1985.
ОДНОДОЛЬНЫЕ
1. Роасеае: все виды Роа, Secale, Triticum, Oryza, Zea и др.
Экологическая ниша: наземные автотрофные травянистые растения.
Зародыш: радикула редуцирована, преобразована в колеоризу и
замещена адвентивными корнями.
Пашков, 1951; Guttenberg, 1957; Терёхин, 1991.
2. Orchidaceae: все виды Bletilla, Sobralia, Thunia, Habenaria, Van-
da, Orchys, Ophrys, Neottia, Pogonia, Gastrodia, Corallorhyza, Epipo-
gium и др.
Экологическая ниша: зеленые или бесхлорофилльные травянистые
растения-микопаразиты.
Зародыш: полностью элиминирована радикула, замещенная
своеобразной микогаусториальной структурой; по степени недоразвития
апикальных структур зародыши могут быть разделены на 5 групп, в
зависимости от уровня адаптации к микопаразитизму.
Терёхин, Никитичева, 1968; Терёхин, 1977; и др.
3. Hydrocharitaceae: виды Ottelia и др.
Экологическая ниша: водные погруженные растения.
Зародыш: радикула элиминирована, базальная часть разросшегося
гипокотиля преобразована в запасающую ткань.
Терёхин, 1985а.
4. Ruppiaceae: виды Ruppia.
Экологическая ниша: водные погруженные растения.
Зародыш: радикула полностью редуцирована и преобразована (вместе
с частью гипокотиля) в запасающую ткань.
Терёхин, 19856.
5. Zosteraceae: все виды Zostera и Phyllospadix.
Экологическая ниша: водные (морские) погруженные растения.
Зародыш: радикула полностью редуцирована и замещена
оригинальной лопастной запасающей структурой.
Taylor, 1957a, Ь; Терёхин, 1985г.
Зародыш
455
Редуцированные зародыши. Зародыши с общей редукцией
встречаются исключительно среди древних представителей ксенопаразитных
и микопаразитных растений. Редуцированные зародыши полностью
лишены всех органов, обычных для зародышей автотрофных растений
(радикулы, гипокотиля, семядолей и эпикотиля). Как правило, они
лишены и проводящих тканей. Общая редукция зародыша (в
отношении массы и структуры) может достигать при этом крайних степеней.
Так, например, у Allotropa virgata и Hypopithys monotropa
(Monotropaceae) зародыш в зрелом семени состоит всего из 2—3
недифференцированных клеток.
Редуцированные зародыши от зародышей других типов отличает
несколько принципиальных свойств:
1) такие зародыши характерны только для таксонов с наиболее
высоким уровнем специализации к паразитизму;
2) даже при крайней степени редукции базальный («радикулярный»)
полюс редуцированного зародыша сохраняет морфогенетический
потенциал. Начальные этапы развития проростков из редуцированных
зародышей всегда характеризуются униполярным развитием. Это связано с
первоочередной необходимостью поиска подходящего питающего
субстрата (растения-хозяина или микоризного гриба), так как эти
паразитные растения не способны к образованию собственных фотосинте-
зирующих структур и все свое питание получают от партнера по
паразитному симбиозу;
3) в связи с высокой степенью адаптации к паразитизму развитие
проростков из редуцированных зародышей паразитных растений
происходит на основе метаморфоза их организации в период освоения
питающего субстрата, т. е. партнера по паразитному симбиозу (Терё-
хин, 1968в, 1977, 1991).
Микопаразитные цветковые растения, например виды Pyrola (Luck,
1940; Lihnell, 1942), отличаются тем, что униполярный, с упрощенной
структурой (часто разветвленный) проросток живет некоторое время
в почве в ожидании «атаки» микоризного гриба, и его развитие
продолжается только после установления паразитного симбиоза с этим грибом.
Таким образом, все случаи общей редукции зародышей обусловлены
длительной эволюционной адаптацией к паразитному существованию и
сопровождаются метаморфозом проростков этих растений, связанным с
переходом к ксено- или микопаразитизму. Ниже перечислены таксоны
паразитных растений с общей редукцией зародыша.
Растения-ксенопаразиты:
1. Balanophoraceae: все виды Balanophora, Chlamydophytum, Cory-
паеа, Dactylanthus, Ditepalanthus, Hachettea, Helosis, Langsdorffia, Mis~
tropetalon, Rhopalocnemis, Sarcophyte, Scibalium и др.
Экологическая ниша: бесхлорофилльные многолетние травянистые
растения, корневые паразиты.
456 Семя
Зародыш: с разной степенью редукции —
1) до стадии глобулярного зародыша, с дифференцированной
эмбриодермой, на продольном срезе из 40—50 клеток (Helosis mexicanum,
Langsdorffia hypogaea, Sarcophyte sangUinea);
2) до стадии шаровидного проэмбрио из 4—6 клеток на
продольном срезе, с дифференцированной эмбриодермой (Balanophora abbre-
vlata).
Fagerlind, 1945a, b; Терёхин, 1977, 1988.
2. Cynomoriaceae: Cynomorium coccineum.
Экологическая ниша: бесхлорофилльные многолетние травянистые
растения, корневые паразиты.
Зародыш: сферический, сплюснутый с полюсов, многоклеточный, с
неотчетливой эмбриодермой и полярной дифференциацией клеток.
Терёхин и др., 1975, Терёхин, Никитичева, 1976.
3. Hydnoraceae: все виды Hydnora и Prosopanche.
Экологическая ниша: бесхлорофилльные, вероятно, многолетние
травянистые растения, корневые паразиты.
Зародыш: глобулярный немногоклеточный проэмбрио, без
дифференциации эмбриодермы, но с сохраняющимся в зрелом семени суспен-
зором (Hydnora africana).
Терёхин, 1988а.
4. Lennoaceae: все виды Ammobroma, Lennoa, Pholisma.
Экологическая ниша: бесхлорофилльные, вероятно, многолетние
травянистые растения, корневые паразиты.
Зародыш: сферический, с эмбриодермой и неотчетливой полярной
дифференциацией клеток (Lennoa coerulea, Pholisma arenaria).
Терёхин, 1977.
5. Orobanchaceae: все виды Aeginetia, Boschniakia, Christisonia, Cis-
tanche, Conopholis, Diphelypaea, Epifagus, Gleadovia, Kopsiopsis, Man-
nagettaea, Phacellanthus, Xylanche.
Экологическая ниша: бесхлорофилльные, многолетние травянистые
растения, корневые паразиты.
Зародыш: с разной степенью редукции —
1) до стадии многоклеточного глобулярного зародыша, с
эмбриодермой и инициалями радикулы или без них, с полярной дифференциацией
клеток (Cistanche phelypaea, Phacellanthus tubiflorus);
2) до стадии овально-сферического зародыша (поздняя глобулярная
стадия), с дифференцированной эмбриодермой (15—30 клеток на
продольном срезе), с более или менее выраженной полярной дифференциа-
Зародыш
457
цией клеток (Cistanche tubulosa, Orobanche purpurea, Diphelypaea coc-
cinea);
3) до стадии овального проэмбрио из 9 —10 клеток на продольном
срезе, дифференциация эмбриодермы отсутствует (Aeginetia indica).
Tiagi, 1952a, b; Терёхин, 1977.
6. Rafflesiaceae: все виды Apodanthes, Brugmansia, Cytinus, Mitra-
stemon, Pilostyles, Rafflesia и др.
Экологическая ниша: бесхлорофилльные, обычно многолетние
травянистые растения, корневые или стеблевые паразиты.
Зародыш: с разной степенью редукции —
1) до стадии овального проэмбрио без признаков полярной
дифференциации, из 8—9 клеток на продольном медианном срезе (Rafflesia
arnoldii);
2) до стадии октантов с полярной дифференциацией клеток
(Apodanthes pringlei, Cytinus ruber, Pilostyles thurberi, P. ingae);
3) до стадии четырёхклеточного проэмбрио (Mitrastemon yamamotoi).
Терёхин, 1977, 19886.
7. Scrophulariaceae: некоторые виды Striga, все виды Harveya и
Hyobanche.
Экологическая ниша: бесхлорофилльные многолетние травянистые
растения, корневые паразиты.
Зародыш: глобулярный с дифференцированной эмбриодермой и
слабой полярной дифференциацией клеток (Harveya coccinea, H. obtusifo-
lius, Hyobanche sp., Striga gesnerioides).
Терёхин, 1977.
Растения-микопаразиты:
1. Pyrolaceae: все виды Chimaphila, Moneses, Orthilia, Pyrola.
Экологическая ниша: многолетние травянистые зеленые растения,
часто с редуцированными листьями, микопаразиты.
Зародыш: два уровня общей редукции —
1) овальные многоклеточные зародыши с дифференцированной
эмбриодермой и полярной дифференциацией клеток (Orthilia secunda, Pyrola
minor);
2) овальный немногоклеточный проэмбрио без дифференцированной
эмбриодермы, с четкой полярной дифференциацией клеток (Moneses uni-
flora).
Терёхин, 1977.
458
Семя
2. Monotropaceae: все виды Allotropa, Hypopitys, Cheilotheca, Hemi-
tomes, Monotropa, Monotropsis, Monotrapastium, Pleuricospora,
Pterospora, Sarcodes и др.
Экологическая ниша: бесхлорофилльные многолетние травянистые
растения, микопаразиты.
Зародыш: два уровня общей редукции —
1) до стадии глобулярного проэмбрио с дифференцированной эмб-
риодермой и слабой полярной дифференциацией клеток (Pterospora
andromeda, Sarcodes sanguinea);
2) до стадии 2—5-клеточного проэмбрио (Hypopithys monotropa,
Monotropsis uniflora, Allotropa virgata).
Copeland, 1939, 1941; Терёхин, 1977.
3. Gentianaceae: Bartonia, Cotylanthera, Leiphaimos, Obolaria, Voyria,
Voyriella.
Экологическая ниша: бесхлорофилльные травянистые растения,
микопаразиты.
Зародыш: два уровня общей редукции —
1) до стадии малоклеточного овального зародыша с
дифференцированной эмбриодермой, 9 — 10-клеточного на продольном медианном
срезе (Bartonia virginica);
2) до стадии 3—4-клеточного проэмбрио (Voyria mexicana,
Leiphaimos auranthicus).
Oehler, 1927; Терёхин, 1977.
4. Lobeliaceae: Lobelia dentata.
Экологическая ниша: растения с зелеными листьями,
микопаразиты.
Зародыш: глобулярный, многоклеточный.
Fraser, 1931.
5. Polygalaceae: Epirhizanthes.
Экологическая ниша: бесхлорофилльные травянистые растения,
микопаразиты.
Зародыш: глобулярный, без дифференциации на органы.
Van der Pijl, 1934.
6. Burmanniaceae: все виды Apteria, Burmannia, Dictiostega, Gymno-
syphon и др.
Экологическая ниша: бесхлорофилльные травянистые растения,
микопаразиты.
Зародыш
459
Зародыш: проэмбрио на стадии квадрантов или октантов (Apteria
setacea, Burmannia disticha, B. selloviana, Dictiostegia orobanchoides, Gy-
mnosiphon squamatus).
Терёхин, 1977; Rtlbsamen, 1988.
7. Corsiaceae: все виды Arachnites, Corsia.
Экологическая ниша: бесхлорофилльные травянистые растения,
микопаразиты.
Зародыш: глобулярный, с нечеткой дифференциацией эмбриодермы
и сохраняющимся суспензором.
Терёхин, 1985д.
8. Thismiaceae: все виды Sciaphila, Thismia.
Экологическая ниша: бесхлорофилльные многолетние или однолетние
травянистые растения, микопаразиты.
Зародыш: глобулярный с дифференцированной эмбриодермой, из
10—20 клеток на продольном медианном срезе (Thismia americana,
Th. javanica).
Терёхин, 1977.
9. Petrosaviaceae: все виды Petrosavia, Protolirion.
Экологическая ниша: бесхлорофилльные травянистые растения,
микопаразиты.
Зародыш: глобулярный.
Hutchinson, 1959 Ь.
10. Triuridaceae: все виды Sciaphila, Triuris.
Экологическая ниша: бесхлорофилльные многолетние или однолетние
травянистые растения, микопаразиты.
Зародыш: на стадии октантов (Sciaphila maculata).
Терёхин, 1977.
Недифференцированные зародыши. В отличие от предыдущих
групп растений, все таксоны, растения которых содержат зародыши, не
дифференцированные на органы, принадлежат к автотрофным, наземным
растениям. У таких растений все основные органы и ткани зародыша (ра-
дикула, эпикотиль, семядоли, проводящая система) развиваются в период
«покоя» семян, после их опадения с материнского растения1. Этот тип
Зародыш в семенах таких растений может быть и дифференцирован на органы (см.
Покой семян).
460
Семя
адаптации связан, возможно, с необходимостью относительно более
быстрого «созревания» семян в сравнении со временем, требующимся для
развития зародыша. Вероятно, этот тип адаптации связан и с
особенностями распространения семян или плодов этих растений. Среди таких
растений много эфемеров.
Разрыв между началом диссеминации и прорастанием, связанный
у многих растений с периодом покоя, здесь «заполняется» доразвити-
ем зародыша, что необходимо для нормальной жизнедеятельности (и
при этом конкурентоспособности и выживания) проростков. К
сожалению, особенности репродуктивной биологии (диссеминации,
прорастания, жизнедеятельности проростков) у этих растений изучены еще
крайне недостаточно. В этой области можно ожидать много
интересных находок. Ниже приведены таксоны растений с не
дифференцированными на органы зародышами в зрелых семенах.
ДВУДОЛЬНЫЕ
1. Chloranthaceae: виды Chloranthus, Hedyosmum.
Экологическая ниша: растения-автотрофы.
Зародыш в зрелом семени: в виде глобулярной массы клеток, не
дифференцированной на органы (Chloranthus japonicus, С. serratus и
ДР-)-
Yoshida, 1957, 1959.
2. Papaveraceae: некоторые виды Corydalis и, возможно, другие
родственные таксоны.
Экологическая ниша: растения-автотрофы, эфемеры.
Зародыш в зрелом семени: глобулярный (Corydalis cava).
Eames, 1961.
3. Piperaceae: виды родов Peperomia, Heckeria, возможно, Piper.
Экологическая ниша: растения-автотрофы.
Зародыш в зрелом семени: овальный, не дифференцированный на
органы.
Никитичева, 1981а.
4. Saururaceae: виды Houttuynia, Saururus.
Экологическая ниша: растения-автотрофы.
Зародыш в зрелом семени: глобулярный.
Никитичева, 19816.
Зародыш
461
5. Ranunculaceae: виды родов Anemone, Caltha, Eranthis,
Ranunculus.
Экологическая ниша: растения-автотрофы.
Зародыш в зрелом семени: глобулярный, не дифференцированный
на органы.
Soueges, 1913; Haccius, 1957.
ОДНОДОЛЬНЫЕ
1. Eriocaulaceae: виды Eriocaulon.
Экологическая ниша: растения-автотрофы.
Зародыш в зрелом семени: в виде линзовидной массы клеток, не
дифференцированной на органы (Eriocaulon hookerianum и др.)
Arekal, Ramaswamy, 1980, и др.
2. Pandanaceae: виды Pandanus.
Экологическая ниша: растения-автотрофы.
Зародыш в зрелом семени: не дифференцирован на органы.
Solms-Laubach, 1878.
3. Xyridaceae: виды Xyris.
Экологическая ниша: растения-автотрофы.
Зародыш в зрелом семени: не дифференцирован на органы.
Guignard, 1961.
Рис. 38.
Поддубная-Арнольди, 1976; Терёхин, 1968в, 1977, 1991; Eames, 1961; Lihnell,
1942; Luck, 1940; Natesh, Rau, 1984.
ХЛОРОФИЛЛОНОСНОСТЬ ЗАРОДЫША
КАК ПРИЗНАК ДЛЯ КЛАССИФИКАЦИИ ЦВЕТКОВЫХ РАСТЕНИЙ
Хлорофиллоносность зародыша означает его свойство
синтезировать хлорофилл в тот или иной период своего развития. Зародыш
считается хлорофиллоносным независимо от того, к каким именно
органам зародыша этот пигмент приурочен и сохраняется ли он при
созревании и соответствующем обезвоживании семени. При таком
понимании этого явления становится очевидным, что для обнаружения
свойства хлорофиллоносности зародыша у исследуемого объекта
нельзя ограничиваться анализом лишь зрелых семян. В это понятие не
входит способность зародыша некоторых видов зеленеть при про-
462
Семя
растании семени, которое может начинаться еще в плоде (например,
у некоторых тыквенных) (Яковлев, Жукова, 1973). Термин бесхло-
рофилльность зародыша означает отсутствие у него способности к
синтезу хлорофилла до наступления процесса прорастания семени.
Хлорофиллоносность зародыша чрезвычайно широко распространена
среди цветковых растений. Она обнаружена нами у 508 видов,
принадлежащих к 261 роду 75 семейств (всего исследовано 1213 видов,
712 родов из 193 семейств — в объеме филогенетической системы
цветковых растений Тахтаджяна, 1987, включая данные других
авторов), т. е. приблизительно у 40% исследованных видов (Жукова,
19686, 1988, 1992; Яковлев, Жукова, 1968, 1971, 1973; Yakovlev,
Zhukova, 1975, 1980).
Наличие зеленой окраски у зародыша целого ряда цветковых растений
было установлено благодаря прижизненному эмбриологическому
исследованию материала. При этом показано, что не только зародыш, но и
тесно связанные с ним эндосперм и семенная кожура, т.е. структуры,
не специализированные к фотосинтезу, скрытые в глубине других тканей
и не подвергающиеся прямому солнечному освещению, могут обладать
зеленой окраской (Hofmeister, 1858, 1859; Flahault, 1879; Lubbock,
1892; Lubimenko, 1906; Brand, 1907; Любименко, 1916; Монтеверде,
Любименко, 1909; Netolitzky, 1926; Васильченко, 1936; Поддубная-
Арнольди, 1952; Иоффе, 1952, 1957; Чернояров, 1952; Кантор, 1955;
Жукова, 1963, 1967, 1968а, б, 1987а, б, 1992, 1993; Худяк, 1964;
Николаева, 1973, 1983; Яковлев, Жукова, 1973; Yakovlev, Zhukova,
1975, 1980; Камалова, Абуховская, 1986; Оганезова, 1993; Родионова,
1993). Первоначально был неясен не только состав пигментного
комплекса таких нелистовых зеленых тканей, но даже химическая природа
самого зеленого пигмента, придающего этим тканям зеленую окраску
(см. Жукова, 1967, 19686; Яковлев, Жукова, 1973).
Применение метода хроматографии на бумаге со спектрофотометри-
ческим контролем позволило определить качественный состав
основного пигментного набора пластид зеленого зародыша. Установлено, что
в отличие от зеленого пигмента семенной кожуры некоторых Си-
curbitaceae, представляющего собой протохлорофилл, не тождественный
пигменту этиолированных проростков, зеленый пигмент зародыша
исследованных цветковых растений, принадлежащих к различным
систематическим группам, является хлорофиллом а и Ъ. Такие методики
идентификации растительных пигментов, как хроматография на бумаге
в сочетании со спектрофотометрическим контролем, не обнаруживают
каких-либо различий между хлорофиллом зародыша и хлорофиллом
листа. Это относится и к хлорофиллу зеленой почечки зародыша в
зрелом семени лотоса (Жукова, 1963, 1967, 19686; Яковлев, Жукова,
1973). Следует отметить, что плодик лотоса характеризуется
светонепроницаемостью семенной кожуры и деревянистого перикарпа, мало
прозрачных уже на первых этапах формирования семени и совершенно
светонепроницаемых при его созревании (Toyoda, 1960). Таким обра-
Зародыш
463
зом, мы не располагаем пока никакими данными, позволившими бы
присоединиться к мнению Toyoda о том, что «хлорофиллы, которые
образовались в семенах, по-видимому, несколько отличаются от хлоро-
филлов нормальных листьев, особенно у Nelurnbo и Cucurbita»
(Toyoda, 1959, с. 167). В зеленом эндосперме незрелых семян Raphanus
sativus (Brassicaceae) также обнаружены хлорофилл а и хлорофилл Ь
(Яковлев, Жукова, 1973).
В составе каротиноидов зеленого зародыша незрелого семени Acer
platanoides (Aceraceae), Alcea rosea (Malvaceae), Geranium ruprechtii
(Geraniaceae), Iberis gibraltarica, I. umbellata (Brassicaceae), Linum al-
pinum (Linaceae), Raphanus sativus (Brassicaceae), Vicia faba (Fabaceae)
содержатся каротин, лютеин, виолаксантин, неоксантин и,
предположительно, лютеин-эпоксид (Жукова, 1965, 1967, 19686; Яковлев, Жукова,
1973). Кроме того, из зеленых зародышей Alcea rosea и Geranium
ruprechtii выделен еще один желтый пигмент, который по положению на
хроматограмме соответствует пигменту 4Г (Лосев, 1964) или х-ксан-
тофиллу, по другой терминологии (Сааков, Ширяева, 1966).
Пигментный комплекс каротиноидов зеленой почечки зародыша Nelurnbo nucifera
(Nelumbonaceae) характеризуется отсутствием каротина, в то время как
последний входит обязательной составной частью в набор пигментов
зародыша всех остальных проанализированных видов (Жукова, 1963,
1965, 1967, 19686; Яковлев, Жукова, 1973; Yakovlev, Zhukova, 1980).
Такая же особенность характеризует и зародыш другого вида лотоса —
N. lutea (Meeuse, Ott, 1962). У большинства исследованных видов,
таким образом, основной пигментный набор хлоропластов зародыша
аналогичен таковому листа — основного фотосинтезирующего органа
зеленого растения. Исключение составляет пигментный комплекс зеленой
почечки зародыша обоих видов рода Nelurnbo (см. выше). В составе
каротиноидов зародыша Linum usitatissimum в ходе его развития
отсутствует неоксантин (Pretova, 1977, 1985). В процессе роста хлоро-
филлоносного зародыша и дифференциации его на органы (Haemanthus
katherinae. Laburnum anagyroides, Lunaria annua, Caragana sp., Linum
usitatissimum) отмечены количественные изменения в содержании хло-
рофиллов а и b (Ryczkowski, Szewczyk, 1972; Szewczyk, Ryczkowski,
1977; Pretova, 1985).
Ультраструктура зеленых пластид зародыша исследована на
довольно большом числе различных видов цветковых растений (Orsenigo,
1964; Rezende-Pinto, 1964; Bain, Mercer, 1966; Жукова, Яковлев,
1966, 1967; Klein, Pollock, 1968; Opik, 1968; Жукова, 19686, 1969,
1974, 1975a, б, 1979, 1983, 1985, 1988, 1992; Яковлев, Жукова,
1973; Khera, Tilney-Bassett, 1976; Pretova, 1977, 1978, 1985;
Zhukova, 1978; Яковлев, Чабан, 1979; Yakovlev, Zhukova, 1980; Casadoro
et al., 1980; Жукова, Драгунова, 1980; Whatley, Price, 1983;
Casadoro, Rascio, 1987; см. также электронно-микроскопические снимки
Жуковой в работе Алимовой, 1985а). Сравнительный анализ
ультраструктуры пластид зеленого зародыша исследованных таксонов выявил
464
Семя
высокую степень их дифференциации, хорошее развитие их внутренней
мембранной системы, а также целый ряд отличительных черт по
сравнению со структурой типичного хлоропласта мезофилла листа. Он
показал также, что эти органеллы, несмотря на наличие некоторого
морфологического своеобразия, являются хлоропластами (Жукова,
Яковлев, 1966; Жукова, 19686, 1971, 1972, 1979, 1988, 1992, 1993;
Яковлев, Жукова, 1973; Zhukova, 1978).
Хлоропласты зародыша цветковых растений не являются, как
считают a priori некоторые исследователи, инертными, утратившими свое
физиологическое значение органеллами. Судя по ультраструктуре хло-
ропластов зародыша целого ряда цветковых растений, предположение
об их инертности или рудиментарном состоянии представляется
малообоснованным. Обнаруженная электронно-микроскопическими и
отчасти биохимическими исследованиями (см. выше) сложность организации
этих органелл, хорошее развитие их внутренней мембранной системы,
наличие разнообразных модификаций в ультраструктуре хлоропластов
зародыша различных растений, своеобразие формы, их контакт с
элементами ЭР, собственный биогенез и другие показатели
свидетельствуют в пользу предположения о метаболической активности
хлоропластов в ходе эмбриогенеза, а не об их функциональной инертности
(Жукова, 1971, 1988, 1992; Яковлев, Жукова, 1973). Только после
того, как было дрстоверно установлено, что зеленый пигмент
зародыша является хлорофиллом, не отличающимся по исследованным
показателям от хлорофилла листа, а его пластиды — хлоропластами, была
доказана правомерность термина хлорофиллоносность зародыша.
В распространении свойства хлорофиллоносности зародыша среди Ап-
giospermae выявляются определенные закономерности: 1) виды одного
рода не различаются по признаку хлорофиллоносности зародыша
(Жукова, 19686; Яковлев, Жукова, 1973); 2) способность
синтезировать хлорофилл, как и отсутствие этой способности, свойственны
во многих случаях зародышу целых групп растений, объединенных
в крупные таксономические единицы: подсемейства, семейства и
даже порядки (Жукова, 19686; Яковлев, Жукова, 1973). Так, например,
все исследованные представители Convolvulaceae, Brassicaceae, Dipsa-
caceae, Geraniaceae, Rhamnaceae, Tiliaceae, Capparales, Fabales и Plum-
baginales характеризуются хлорофиллоносностью зародыша, a Boragi-
naceae, Caprifoliaceae, Oleaceae, Ranunculaceae, Solanaceae, Araliales,
Ericales, Papaverales и Saxifragales — бесхлорофилльностью.
К числу выявленных закрномерностей можно отнести и тот факт,
что 3) среди исследованных представителей таких примитивных
семейств, как Magnoliaceae, Illiciaceae, Trochodendraceae, Cercidiphylla-
ceae, Annonaceae, Monimiaceae, Lauraceae, Myristicaceae, Dilleniaceae,
Flacourtiaceae, Proteaceae, Actinidiaceae, Paeoniaceae, Helleboraceae,
Ranunculaceae, Podophyllaceae, Berberidaceae, не было обнаружено ни
одного случая позеленения зародыша. Исключение составляют
семейства, характеризующиеся гидрофилией (Жукова, 19686; Яковлев, Жу-
Зародыш
465
кова, 1973). К числу таких семейств, у исследованных представителей
которых обнаружен в зародыше хлорофилл, относятся Ceratophyllaceae,
Nelumbonaceae и Nymphaeaceae (Netolitzky, 1926; Meeuse, Ott, 1962;
Жукова, 19686; Яковлев, Жукова, 1973; Батыгина, Шамров, 1981; Ва-
tygina, Vasilyeva, 1981). Среди однодольных растений, которым в
основном свойственна бесхлорофилльность зародыша, позеленение
последнего также часто коррелирует с гидрофилией. В системе Тахтаджяна
(1987) семейства Nymphaeaceae, Ceratophyllaceae и Nelumbonaceae
составляют самостоятельные порядки Nymphaeales, Ceratophyllales и Ne-
lumbonales, соответственно. Кузнецов (1936), Гроссгейм (1945) и
Hutchinson (1959) относят Nymphaeaceae (включая род Nelumbo) и
Ceratophyllaceae к Ranales. Представители указанных семейств обладают
целым рядом особенностей, обусловленных гидрофилией, что наложило
особый отпечаток на строение их вегетативных органов. К ряду
признаков, выделяющих эти семейства среди других примитивных, относится
и позеленение их зародыша. При этом род Nelumbo, который обладает
рядом черт, отличных от остальных Nymphaeaceae, что позволило
некоторым авторам выделить его в самостоятельное семейство и даже
порядок (см. Takhtajan, 1959; Тахтаджян, 1966, 1970, 1987), обладает
и некоторой особенностью в отношении позеленения зародыша —
зелеными у лотоса являются только два первых листа зародыша, а две
массивные, полушаровидные семядоли бесцветны.1
Особый интерес должны представлять случаи обнаружения в одном
таксоне того или иного ранга растений, различающихся по обсуждаемому
признаку. Ряд семейств, включая крупные полиморфные группы (Ага-
ceae, Chenopodiaceae, Euphorbiaceae, Meliaceae, Myrtaceae, Polemonia-
ceae, Scrophulariaceae и др.), объединяет виды (а возможно, это
относится и к родам в целом) с зеленым и бесцветным зародышем. Так,
например, среди проанализированных представителей сем.
Scrophulariaceae (18 родов и 31 вид) 4 вида оказались с зеленым зародышем (Lz-
mosella sp. — Netolitzky, 1926; Collinsia heterophylla, Penstemon hu-
milis — Яковлев, Жукова, 1973; Euphrasia disperma — Simpson, 1977),
в то время как все остальные исследованные виды имели бесцветный
зародыш (Яковлев, Жукова, 1973; Жукова, 1988). Род Penstemon
выделяется среди Scrophulariaceae (Афанасьева, 1960) целым рядом
эмбриологических особенностей. Известна и еще одна особенность рода
Penstemon (Монтеверде, 1892). На основании данных по
распространению маннита и дульцита в сем. Scrophulariaceae Монтеверде заключил,
что присутствие этих соединений является не только родовым признаком,
но, по-видимому, признаком, характерным даже для некоторых подколен
и колен. «Странное исключение в этом отношении составляет одно лишь
Существует мнение, что зародыш Nelumbo nucifera характеризуется наличием не
двух, а одной семядоли с двумя лопастями, возникшей в результате конгенитального
срастания семядолей (Титова, 1988; Titova, 1992; Titova, Batygina, 1996).
3Q-828
466
Семя
колено Chelonae: из 14 родов только у рода Penstemon был найден
маннит, для остальных родов результат получен отрицательный» (Мон-
теверде, 1892, с. 448). Особенностью рода Penstemon является и
наличие хлорофилла в его зародыше. Относительно другого рода с зеленым
зародышем — Collinsia — известен следующий любопытный факт.
Цветок Collinsia по форме и устройству очень напоминает цветок видов
Fabaceae (Willis, 1966). Последним, как показало исследование 47
родов (101 вид) Fabaceae, также свойственна хлорофиллоносность
зародыша (Яковлев, Жукова, 1973; Жукова, 1988). Данные по микроспо-
рогенезу и спермиогенезу у некоторых представителей сем. Scrophula-
riaceae говорят о необходимости пересмотра генетических связей между
некоторыми из них в пределах триб и семейства в целом (Афанасьева,
1960). Наличие в пределах этого семейства представителей с зеленым
и бесцветным зародышем является еще одним фактом,
свидетельствующим о сложности внутрисемейственных филогенетических отношений
в сем. Scrophulariaceae.
В тех случаях, когда признак хлорофиллоносности зародыша
характеризует целое семейство, он может быть использован для уточнения
родственных связей между семействами наряду с другими таксономи-
чески полезными признаками. Как известно, в системе Энглера
семейство Cruciferae является одним из 6 семейств порядка Rhoeadales
наряду с Papaveraceae, Capparidaceae, Resedaceae, Moringaceae и Tova-
naceae. Однако многие систематики (Takhtajan, 1959; Тахтаджян,
1966, 1987; Cronquist, 1965 и др.) сочли необходимым разделить этот
порядок на ряд самостоятельных порядков: Papaverales, куда вошли
Papaveraceae, Fumariaceae, Moringales с сем. Moringaceae и Сарра-
rales, к которому относят остальные семейства. Результаты пыльцевого
анализа, а также данные морфологии, эмбриологии (Soueges, 1939b;
Яковлев, 1958) и биохимии (Благовещенский, 1955, цит. по Takhtajan,
1959) обнаружили существенные различия между Papaverales и Сар-
parales. Так, Soueges (1939b), давший классификацию типов развития
зародыша, отнес крестоцветные вместе с резедовыми и каперцовыми к IV
мегархетипу первого периода, тогда как Papaveraceae — к V, и поставил
последние в другую группу. Papaveraceae, которые, согласно данным
Благовещенского, биохимически не имеют ничего общего с Cruciferae,
Capparidaceae, Resedaceae, отличаются от последних и отсутствием
хлорофиллоносности в эмбриогенезе.
В задачу первых исследователей феномена хлорофиллоносности
зародыша не входило дать представление о масштабе этого явления; их
данные о наличии зеленой окраски у зародыша в том или ином семействе,
как правило, либо приведены без указания числа и наименования
исследованных видов и родов, либо ограничены единичными примерами.
Кроме того, многие из них ограничивались в своем исследовании лишь
зрелыми семенами. Для выявления же свойства хлорофиллоносности
зародыша необходимо исследование его не только в зрелом, но и в
развивающемся семени, поскольку при окончательном созревании послед-
Зародыш
467
него зародыш многих видов растений теряет свою зеленую окраску (см.
ниже). Подробные перечни семейств, родов и видов с указанием наличия
(4-) или отсутствия (-) признака хлорофиллоносности зародыша
приводятся в работах Жуковой (1968а, 1988), Яковлева и Жуковой (1973)
и Yakovlev, Zhukova (1980). Признак хлорофиллоносности зародыша
является альтернативным (см. таблицу). Наличие его у одних растений
и отсутствие у других позволяет разделить цветковые растения на две
большие группы (Жукова, 1968а, б; Яковлев, Жукова, 1971, 1973;
Yakovlev, Zhukova, 1975, 1980). Эти группы названы «хлороэмбрио-
фиты» и «лейкоэмбриофиты» (Yakovlev, 1969).
Хлороэмбриофит — растение, эмбриогенез которого протекает с
трансформацией лейкопластов клеток собственно зародыша в хлоро-
пласты (изменения типа пластид суспензора при этом может не
происходить, а если происходит, то подчиняется иным закономерностям
по сравнению с пластидами собственно зародыша). Среди хлороэмб-
риофитов (Жукова, 1988, 1992, 1993) четко выделяются хлороэмбри-
офиты первого (основного) типа, у которых свойством
хлорофиллоносности обладают прежде всего семядоли зародыша (подавляющее
большинство хлороэмбриофитов), и хлороэмбриофиты второго типа,
зеленой окраской у которых обладает только почечка зародыша, а
семядоли ахлорофилльны.
Лейкоэмбриофит — растение, в зародыше которого, в отличие от
хлороэмбриофита, не наблюдается образования хлоропластов ни на одной
из фаз эмбриогенеза в процессе формирования семени.
Первое появление хлоропластов в зародыше хлороэмбриофитов
происходит в эмбриональной фазе развития зародыша и у большинства
хлороэмбриофитов связано с переходом от шаровидной к сердечковид-
ной стадии развития (хлороэмбриофиты первого типа). Хлоропласты
при этом наблюдаются во всех клетках сердечковидного зародыша.
Это установлено благодаря комплексным сравнительным исследованиям
эмбриогенеза хлоро- и лейкоэмбриофитов на живом материале и с
применением электронной микроскопии (Zhukova, 1978, 1981;
Жукова, 1988, 1992, 1993). Хлорофиллоносность зародыша с момента ее
появления сохраняется на протяжении последующего процесса его
развития «совпадая с периодом наиболее активной синтетической
деятельности развивающегося зародыша...» (Яковлев, Жукова, 1973, с. 50).
Это подтверждено прижизненными исследованиями эмбриогенеза 29
видов сем. Malvaceae (Камалова, Абуховская, 1986). На
заключительных этапах органогенеза у ряда хлороэмбриофитов первого типа
происходит обесцвечивание отдельных или всех тканей осевой части
зародыша (Brassicaceae, Fabaceae, Scrophulariaceae и др.). Это происходит
благодаря обратной трансформации хлоропластов в лейкопласты. В
созревающем и зрелом, воздушно-сухом семени большинства
хлороэмбриофитов этого типа бесхлорофилльными оказываются и семядоли
зародыша (Жукова, 1988, 1992, 1993). Встречаются хлороэмбриофиты,
у которых трансформация лейкопластов в хлоропласты происходит на
30*
я
н
и
о
я
и
о
я
о
<
<
я
в"
о
°> т
о а
< н
И S
►. f"
я 5
* *2
s s
а. я
О 3S
Б V
«!
°Я S
Я «
К й
н н
a s
af
a *
= i
В |
v а.
а о
ев
я I
< S
« Б
5 в
* я
°- £•
« и
О си
I <
Я S
яг ся
= a
в |
v а,
S <*
3
S
ИОФ
а
S
СП
о
г*
ЛЕЙ
«5*4
s э < о
в < S
°> Ч д. 2-
\0 Си О X
я О. -
зотекает
ластид з
ся бесхло
нии всегс
е а н s «
_ я я к s-
л в h н s
u s 2 о и
S ь о О.Л
<и в я
бриог
нения
родыш
IM на
оего р
г и я а в
Я S Я X О
OS
S
X
Ы
Е-
О
<
а
ы
3
оэ
о
Е-
Ы
03
3
я
а
о
Я
и
о
яг
s
«!
«О
ев
н
3
н
S
в
о
S
а
Я)
о
а
О
<
X
Я
о ш
В я
В я.
и в
о я
о я
ЕЕ
п и
О В
н о
т
о
а
я
01
§"^
х В
х з
« I
& I
с
зЯ
а; Я
Я В
Я! X
Я Е4
S-
Я Я
Ч S
I
о о
а, я
х
я
<
и
u g
- я
X
и я
cig
Й- о.
в о
2 *
X п
CJ
о я
я a
Си д
*S <
S О
я а,
л
н
я
ч
о
X
и
я
о
а
X
X
жет
о
S
X
ю
я
а
и
о
X
5>
ся
1-
о
X
мер
о
я
О Л
я
О X
а a
* 5 <
в s о
а, я) н
в Л К
S S я
в а 2
2 <
и я
В 01
я _
о> Я
S-
JJ Я
я a
S о
то О а м
й Я u и
0 » в о
s и 2^>
я sr-g-c
01 U fc О.
« в4 з о
х о ~ •д
g с « 2
я §^0
S О
Я S-
я
о
<
о
а
в е
Я ч
*> я
^^ н
за я
в <
а в
в СЧ
я 3,
Я Я!
в я
w S
а
« о
it
«
в S
s о и
о. < S
с я я
в в а
^ 2 и
s S я
4,°- я
X S &
u a,s
я 2 о
2 а я
в 5
* о я
S О s
я и 2
в ч 5
я ° «Я"
и х *£
о о z
а, а, со
я и
С в и
h о в
и С Э'В
о * 2 о
в а о в
8 ?»я в
0 ч о и
ч s 5 §
a s S *
а в S «
ч S Я ч
Я о a °
01 < a „
< я
§ в в в
в 2 ™ 5
° § | я
. X Я И
R О я
в к Э* 5
s- о в а,
<°
G- «
о 2
< к.
X <
t>. ffl
Jb
2 о
s о
m о
s „
Q. л
С Ь
S
G ©.
С о
S
й а
я ю
« S
в
в
a
А
2-^
ю и
о
и £
Зе
2 °
<; О.
Я S
4 а
О О
в а
—* о
5 X
я
Ч О
я и
о о
05
О
а,
о
О сб
S
4) Сб
'О
W О^
1,3 S „;
CO, Е- ев
s ° 9.
Й- а к
«ч ъ
Зародыш
469
более поздних стадиях эмбриогенеза и охватывает не все органы
зародыша. У видов Nelumbo (Яковлев, Жукова, 1973; Васильева, Ба-
тыгина, 1981) и представителей сем. Ceratophyllaceae (Netolitzky,
1926; Батыгина, Шамров, 1981) зеленой окраской обладает только
почечка зародыша, а семядоли бесцветны. Это хлороэмбриофиты
второго типа. Появление слабой зеленоватой окраски у одного из двух
первых листьев почечки зародыша Nelumbo nucifera, например,
отмечено приблизительно на 10—12-й день после распускания цветка
(в условиях оранжереи). Почечка зародыша на этой стадии развития
уже дифференцирована, но еще не достигает окончательных размеров
и формы, характерных для зародыша зрелого семени. Пластидный
аппарат представлен органеллами с проламеллярными телами и
отдельными тилакоидами (Жукова, 19686; Яковлев, Жукова, 1973).
Свойство хлорофиллоносности характеризует виды с крупным
дифференцированным на органы зародышем (представители Convolvulales,
Capparahs, Fabales, Ceraniales, Malvales, Plumbaginales, Rhamnales,
Tropaeolales, Aceraceae, Asclepiadaceae, Celastraceae, Cornaceae, Dipsa-
caceae, Linaceae, Nyctaginaceae, Simaroubaceae, Violaceae и др.). Эта
корреляция, однако, не является полной. Представители Asterales, BaU
saminales, Cucurbitales, Rosales, Thymelaeales, Caryophyllaceae, Ona-
graceae, Solanaceae и др., имея крупный дифференцированный на
органы зародыш, не являются хлороэмбриофитами. Виды же с
относительно небольшим слабо дифференцированным зародышем,
составляющим лишь часть семени с обильным эндоспермом (например,
представители Dilleniales, Paeoniales, Papaverales, Ranunculales), и виды
с не дифференцированным на органы зародышем (Orchidaceae)
являются лейкоэмбриофитами (хлороэмбриофитов среди них достоверно не
установлено) (Жукова, 1992, 1993). Признак хлорофиллоносности
зародыша коррелирует также с таким эмбриологическим признаком, как
нуклеарный тип развития эндосперма (Zhukova, 1990, 1992; Жукова,
1992). Выявлена и еще одна корреляция: хлорофиллоносные зародыши
чаще всего наблюдаются в семенах безбелкового типа (Dahlgren,
1980b). По данным, имеющимся на сегодняшний день,
хлороэмбриофиты сосредоточены главным образом в классе двудольных растений
(Яковлев, Жукова, 1973, рис. 16—18; Оганезова, 1993).
Разделение цветковых растений по признаку хлорофиллоносности
зародыша на две группы (хлоро- и лейкоэмбриофиты) подобно
делению их по числу семядолей зародыша на два класса (двудольные и
однодольные) подтверждается комплексом признаков. Так, хлороэмб-
риофитам свойственны не только способность к синтезу хлорофилла в
зародыше в определенный период его развития, но также крупный
дифференцированный на органы зародыш (преимущественно
двусемядольный), эндосперм нуклеарного типа развития, семена безбелкового
типа. Подтверждением сказанного являются и данные Browse и Slack
(1985) о том, что хлороэмбриофиты отличаются от лейкоэмбриофитов
и некоторыми особенностями липидного метаболизма. Рис. 39.
470
Семя
Алимова, 1985а; Афанасьева, 1960; Батыгина, Шамров, 1981; Васильченко, 1936;
Гроссгейм, 1945; Жукова, 1963, 1965, 1967, 1968а, б, 1969, 1971, 1972, 1974;
1975а, б, 1979, 1983, 1985, 1987а, б, 1988, 1992, 1993; Жукова, Драгунова, 1980;
Жукова, Яковлев, 1966, 1967, 1976; Иоффе, 1952, 1957; Камалова, Абуховская, 1986;
Кантор, 1955; Кордюм, 1978; Кузнецов, 1936; Лосев, 1964; Любименко, 1916; Мон-
теверде, 1892; Монтеверде, Любименко, 1909; Нарматов, 1988; Николаева, 1973,
1983; Оганезова, 1993; Пащенко и др., 1970; Поддубная-Арнольди, 1952; Родионова,
1993; Сааков, Ширяева, 1966; Тахтаджян, 1966, 1970, 1987; Титова, 1988; Худяк,
1964; Чернояров, 1952; Яковлев, 1958, 1981; Яковлев, Жукова, 1968, 1971, 1973;
Яковлев, Чабан, 1979; Bain, Mercer, 1966; Batygina, Vasilyeva, 1981; Brand, 1907;
Browse, Slack, 1985; Casadoro et al., 1980; Casadoro, Rascio, 1987; Cronquist, 1965;
Dahlgren, 1980b; Dahlgren, Clifford, 1981; Erdelska, 1981; Flahault, 1879; Hofmeister,
1858, 1859; Hudak et al., 1983; Hutchinson, 1959, 1964; Khera, Tilney-Bassett, 1976;
Klein, Pollock, 1968; Lubbock, 1892; Lubimenko, 1906; Meeuse, Ott, 1962; Netolitzky,
1926; Opik, 1968; Orsenigo, 1964; Palanisamy, Vivekanandan, 1985; Periasamy,
Vivekanandan, 1981; Pretova, 1977, 1978, 1985; Rezende-Pinto, 1964; Rodkiewicz et al.,
1994; Ryczkowsky, Szewczyk, 1972, 1973, 1975; Simpson, 1977; Soueges, 1939b; Szew-
czyk, 1974; Szewczyk, Ryczkowsky, 1977; Takhtajan, 1959; Titova, 1992; Titova,
Batygina, 1996; Toyoda, 1959, 1960; Whatley, Price, 1983; Willis, 1966; Yakovlev, 1969;
Yakovlev, Zhukova, 1975, 1980; Zhukova, 1978, 1981, 1990, 1992.
НОВАЯ КОНЦЕПЦИЯ ПРОИСХОЖДЕНИЯ
ЗАРОДЫША ОДНОДОЛЬНЫХ
Эмбриологические данные имеют огромное значение для
эволюционной морфологии покрытосеменных. Для установления непрерывных рядов
эволюционных последовательностей совершенно необходимо знание всего
онтогенеза, особенно его ранних этапов. Специфика эмбрионального
периода развития, закономерности и характер дифференциации зародышей,
их адаптивные приспособления, морфогенетические корреляции их
развития и т. п. невозможно игнорировать при построении любой
филогенетической системы.
Как известно, вопрос о происхождении двух основных классов
цветковых (одно- и двудольных), тесно связанный с происхождением
цветковых вообще, имеет первостепенное значение. Так, Engler, Warming,
Strasburger, Навашин, Campbell считали, что двудольные и
однодольные растения являются группами, независимыми по своему
происхождению. Celakovsky, Lyon и другие полагали, что древние
однодольные — основная группа, от которой произошли двудольные. Этот
вопрос до сих пор волнует как морфологов, так и систематиков. Для
правильного решения на первый план выходит проблема
происхождения односемядольности зародыша, привлекающая внимание биологов
на протяжении многих десятилетий и являющаяся одной из основных
в эволюционной эмбриологии цветковых.
Зародыш
471
В настоящее время большинство исследователей, изучающих
эмбриогенез одно- и двудольных растений, считают, что зародыш
однодольных — результат эволюционного преобразования зародыша двудольных,
хотя имеются и другие точки зрения. Однако наиболее дискутируемыми
являются способы преобразования зародыша при становлении одно-
дольности и гомологизация его структур у различных групп
растений. Разногласия в интерпретации фактов обусловлены разнообразием
строения зародышей современных форм однодольных, неравномерностью
скорости эволюции различных групп признаков, переоценкой значения
отдельных черт развития, методическими трудностями изучения
эмбриогенеза. Часто возникновение различных структур и особенностей
зародышей рассматриваются в отрыве друг от друга, без учета специфики
фаз онтогенеза. Во многом трудности в решении проблемы
происхождения односемядольности были связаны с представлениями о
классификации типов эмбриогенеза (Soueges, 1939a, b; Schnarf, 1929; Johansen,
1945, 1950), сильно критикуемыми, но, тем не менее, существующими
до настоящего времени. Поскольку в их основе лежат только
последовательность первых делений и «вклад» различных „этажей" проэмбрио
в формирование основных органов зародыша, основной вопрос о
различии эмбриогенеза двух классов цветковых часто сводится к тому,
дериватами какой из клеток двуклеточного проэмбрио являются семядоля
и апекс побега в каждом из них? Но, как представляется, проблема
намного сложнее, и для ее успешного решения необходимо рассмотрение
эмбриогенеза в целом, включая механизм и экологию прорастания
(Батыгина, 1974, 1987). Необходимо также выявление адаптивного смысла
типов морфологической организации зародышей. Однако, как ни
странно, очень мало внимания уделяется экологическим факторам, способным
вызывать специфические изменения зародыша и проростка. Учитывая
все эти моменты, мы попытались в нашей работе дать критический
анализ основных гипотез эволюционного становления
односемядольного зародыша и, разработав другой подход, на основе имеющихся
оригинальных и литературных данных предложить новое решение этой
проблемы.
По нашему мнению, принципы и закономерности преобразований в
онто- и филогенезе при возникновении эмбриональных приспособлений
(эмбриоадаптаций) — типы влияния этих приспособлений на
дефинитивный морфогенез и ранние стадии развития, сдвиг закладок во
времени (гетерохрония), сдвиг закладок по месту (гетеротопия) и др. —
для всех многоклеточных организмов являются универсальными.
Необходимо уточнить вопрос о том, что следует понимать под
семядолей (см. Семядоля). Большое разнообразие форм семядолей,
их специфические функции, время появления в онтогенезе и, по
крайней мере, в ряде случаев отсутствие принадлежности к одному
листовому ряду с последующими листьями вызывали разногласия по поводу
морфологической природы этих органов. Большинство исследователей
считают семядоли специализированными листьями, а не органами sui
472 Семя
generis. Действительно, семядоли, как и листья, закладываются как
аппендикулярные структуры, их развитие осуществляется благодаря
апикальному, базальному и маргинальному росту, они имеют дорзо-
вентральную симметрию (цилиндрическая форма у некоторых
однодольных — вторична), их проводящая система сходным образом
контактирует с проводящей системой стебля (гипокотиля).
Эмбриологические данные показывают, что семядоли закладываются
в апикальной части глобулярного зародыша подобно тому, как на апексе
стебля возникают примордии листьев (Arber, 1925; Mahlberg, 1960;
Guignard, Mestre, 1971; Батыгина, 1974, 1987; Батыгина, Андронова,
1988; Raghavan, Sharma, 1995; Padmanabhan, 1996). Вероятно, следуя
подобной логике рассуждений, ряд авторов (Arber, 1925; Лодкина,
1988) принимают семядоли за первые листья растения. Однако
гомология листьев и семядолей не есть их тождество. С точки зрения общих
закономерностей развития, семядоли — провизорные органы, по
терминологии А. Н. Северцова (1939), так как они развиваются на
эмбриональной стадии и атрофируются у взрослого растения.
Но, как известно, «провизорными органами обычно служат те,
которые были хорошо развиты у предков данного вида, а у потомков
утратили это значение» (Шмидт, 1968, с. 110). Семядоли, вероятно,
гомологичны первой паре листьев (подвергшихся затем
прогрессивной эмбрионизации в связи с изменением времени появления в
онтогенезе). Они могут не включаться в один листовой ряд с
последующими листьями, так как, относясь к разным этапам онтогенеза, могли
эволюционировать относительно независимо.
Существование семядолей в эмбриональный период онтогенеза
обусловливает и их особые функции. Зародыш, для того чтобы
дефинитивная форма вообще могла возникнуть и развиваться дальше,
формирует специальные приспособления, позволяющие, с одной стороны,
обеспечить собственную жизнедеятельность, и с другой — сделать
возможным качественный переход в дефинитивное состояние.
Семядоли, по нашему мнению, и являются типичным примером таких
приспособлений, или эмбриоадаптаций.
Таким образом, семядоли — провизорные органы зародыша,
имеющие листовую природу, модифицированные в связи с
выполняемыми функциями (защитная, запасающая, трофическая, фото-
синтезирующая и др.). Семядоли обеспечивают жизнедеятельность
зародыша и его переход в дефинитивное состояние (проросток).
При сравнении зародышей двух классов цветковых, как правило,
основное внимание уделяется разнице в числе семядолей, что, собственно,
и отражено в их названии — Дву- и Однодольные. Вследствие такого
подхода при решении вопросов их происхождения исследователи в
основном пытаются решить проблему количественного изменения органов.
Однако необходимо подчеркнуть, что разница в числе семядолей у
зародышей этих групп не является ни основной, ни обязательной. Хорошо
известны зародыши двудольных с одной или более двух семядолями
Зародыш
473
(Cyclamen persicum, Ficaria verna, и др.). Кроме того, зародыши этих
групп различаются по времени и месту дифференциации апикальной
меристемы стебля и характеру развития почки. У двудольных точка
роста, как правило, остается покоящейся на протяжении всего
эмбрионального периода, в лучшем случае имеется лишь зачаточная почка. У
однодольных точка роста, сначала покоящаяся, переходит в стеблевую
меристему в семени, что приводит к «онтогенетическому ускорению»
развития зародыша (Батыгина, 1974; Guignard, 1984). Вторым
важнейшим отличием одно- и двудольных следует признать поведение
зародыша при прорастании. Для однодольных оно в основном
подземное, причем выход зародыша из семенной оболочки, как правило,
связан с удлинением влагалищной части семядоли. Почечка зародыша
при прорастании защищена стенками семядольного влагалища или более
специализированными структурами типа колеоптиля у злаков.
Другими отличиями являются особенности заложения листьев и
порядок листорасположения (супротивное у двудольных и очередное
у однодольных), а также развитие у проростков адвентивных корней
при редукции главного.
По нашему мнению, гипотеза происхождения однодольности
должна объяснять возникновение всех перечисленных черт в их
тесной взаимосвязи с экологическими факторами.
Происхождение семядоли зародыша однодольных. Для выяснения
конкретных путей становления односемядольности необходимо
учитывать данные о природе органов зародыша. При этом большое значение
имеют изменения положения семядолей, апекса побега, имеющие
прямое отношение к вопросу о сходстве и различии в характере
дифференциации зародышей однодольных и двудольных растений.
Богатый фактический материал демонстрирует большое сходство
в эмбриогенезе обоих классов цветковых на всех этапах. Однако у
эмбриологов существовали большие разногласия по поводу заложения и
взаимного расположения апекса побега и семядоли в зародыше
однодольных. Одни исследователи признают латеральное, резко отличное от
двудольных заложение апекса побега и терминальное положение
семядоли, другие считают, что эти структуры в зрелом зародыше имеют
псевдолатеральное и псевдотерминальное положение,
соответственно, возникающее вследствие преобразований в ходе эмбриогенеза.
(см. Батыгина, 1974).
Интерпретация семядоли зародыша однодольных как терминального
образования и точки роста как образования латерального была долгое
время распространена в литературе (Hofmeister, 1861; Hanstein, 1876;
Фаминцын, 1879; Soueges, 1931a, Ь, 1940, 1954; Swamy, 1962; Цвелев,
1975). Однако еще Hegelmaier (1874, 1878) предположил, что
терминальное положение семядоли в зародыше является результатом ее
смещения из латерального.
Впервые Campbell (1897), исследуя развитие зародыша Zannichellia
palustris, показал, что семядоля и точка роста стебля зарождаются из
1474
Семя
терминального сегмента проэмбрио. Несколько позднее это положение
было подтверждено исследованием зародыша некоторых представителей
сем. Hydrocharitaceae (Najas, Potamogeton, Ruppia — Sussenguth, 1921).
Было показано, что почечка в зародыше этих растений занимает
терминальное положение.
Однако эти исследования не получили должного развития, вероятно,
потому что почти в течение трех десятилетий один из крупнейших
эмбриологов — Soueges (1924a-c, 1931а, Ь, 1940, 1954, 1959) отстаивал
совершенно противоположную точку зрения, которую он наиболее ярко
изложил в 1954 г. Взгляды Soueges были навеяны исследованиями Hof-
meister (1861), Hanstein (1870) и Фаминцына (1879), высказавших
идею о принципиальном различии развития зародыша однодольных (тип
Alisma) и двудольных (тип Capsella) растений. По мнению этих авторов,
у однодольных семядоля располагается точно на продольной оси
зародыша и не имеет симметричных аналогов, развиваясь из апикальной
клетки зародыша. Апекс же стебля возникает как латеральная структура.
Яковлев (1946а, б) показал один из возможных способов эволюционного
преобразования двусемядольного зародыша в односемядольный путем
недоразвития одной из семядолей. Он пришел к выводу, что точка роста
у злаков терминальна, а семядоля — латеральна. Терминальное
положение семядоли в зародыше является вторичным вследствие
неравномерного темпа деления клеток в различных частях зародыша.
Haccius (1952) на примере зародыша Ottelia alismoides показала,
что единственная семядоля и апекс стебля происходят у него из
терминального сегмента глобулярного проэмбрио и что первоначально
семядоля занимает в зародыше латеральное положение. В статье Haccius
и Lakshmanan (1966) приведены рисунок эмбриогенеза Pistia stratiotes
и схема, показывающие постепенное «смещение» стеблевого апекса из
терминального в латеральное положение у зародышей однодольных
растений как в онтогенетическом, так и в эволюционном аспекте. В
последующих публикациях Haccius с соавторами (1957, 1959, 1966) на
примере ряда представителей однодольных и двудольных растений
обосновали идею онтогенетического и эволюционного «смещения»
семядоли в терминальное положение и редукции второй семядоли как
у однодольных, так и у некоторых двудольных (ложнооднодольных).
Кроме того, ею была показана ошибочность взглядов Soueges, а также
его данных о латеральном заложении семядоли у Potamogeton.
Baude (1956), исследовав эмбриогенез Stratiotes aloides, также
приходит к выводу, что терминальное положение семядоли у зародышей
этого растения — явление вторичное.
Работы Haccius с соавторами вызвали оживленную дискуссию и
новые исследования по вопросу положения точки роста в зародыше
однодольных.
Так, Soueges (1954), осуществив новые исследования по эмбриогенезу
у Potamogeton natans, вновь подтвердил высказанные им ранее
представления о различном характере эмбриогенеза у двудольных (точка
Зародыш
475
роста из производных са и терминально) и однодольных (точка роста
из производных сЪ и латерально) и подверг резкой критике взгляды
Haccius. Вероятно, под влиянием взглядов Soueges Swamy (1962)
выдвинул свою гипотезу эволюционного преобразования двусемядольного
зародыша в односемядольный, но вскоре от нее отказался и разделил
взгляды Haccius1. В работах по эмбриологии Najadaceae (Swamy,
Lakshmanan, 1962а, b) и эмбриогенезу у Potamogeton indicus (Swamy, Ра-
rameswaran, 1962) можно видеть принципиальное изменение взглядов
Swamy на онтогенетическое и эволюционное происхождение семядоли у
однодольных. Так, в последнем труде исследователи приходят к выводу,
что топографически семядольный и эпикотилярный локусы в проэмбрио
P. indicus примыкают один к другому, и оба происходят из
терминального локуса проэмбрио. Клетки лежащих ниже этажей, например т, не
принимают участия в организации стеблевого апекса.
После выхода работы Haccius (1952) и Soueges (1954) Swamy
(1963), переисследовав Ottelia, подтвердил выводы Haccius,
подкрепив их детальным изучением ранних стадий эмбриогенеза. Он показал,
что семядоля и эпикотиль у зародышей происходят из общего
терминального локуса проэмбрио. При этом деление апикальной клетки
проэмбрио вертикальной перегородкой указывает на различия потенций
дочерних клеток. По его мнению, у Ottelia деление полусферической
терминальной клетки проэмбрио уже является первым признаком
активности локусов будущих стеблевого апекса и семядоли. Главный же
вывод из этой работы заключается в том, что апикальная клетка
проэмбрио зародышей однодольных растений, точно так же, как и у
двудольных, обладает всеми потенциями стеблевого апекса.
Несколько позднее, на примере Eichhornia crassipes Swamy (1966)
еще раз подтвердил, что топографическое взаиморасположение семядоли
и эпикотиля у зародышей однодольных такое же, как и у двудольных.
Концепция, выдвинутая Haccius, как он подчеркивает, хорошо
согласуется с наблюдаемыми фактами. Обобщив данные, Swamy и Lakshmanan
(1962) обнаружили два типа потенций терминальной области проэмбрио
однодольных растений. У Halophilla (Swamy, Lakshmanan, 1962),
Potamogeton (Swamy, Parameswaran, 1962), Ottelia (Haccius, 1952; Swamy,
1963) и некоторых других растений одна половина терминального этажа
проэмбрио формирует в дальнейшем семядолю, а другая функционирует
Основное положение гипотезы заключается в том, что у представителей обоих
классов апикальная часть проэмбрио включает инициали двух семядолей и апекса побега.
Однако у зародышей двудольных они производят соответствующие структуры — две
семядоли и апекс побега. У однодольных же дериваты инициалей стеблевого апекса и
семядолей объединяются в единую морфогенетическую «стерильную» структуру,
которую он условно называет терминальной семядолей. Автор считает, что у двудольных
инициали семядолей развиваются раньше и быстрее, чем инициальные клетки апекса
побега, а у однодольных — одновременно. Их дериваты сливаются в единую структуру,
содержащую в своей основе инициали трех структур.
476
Семя
как эпикотилярная меристема. У Sparganium (Campbell, 1897), Ponte-
deria (Soueges, 1940), Eichhornia (Swamy, 1966) три четверти инициалей
стеблевого апекса зародыша развивается в семядолю, в то время как
оставшаяся четверть — в эпикотиль.
Данные по эмбриогенезу Agapanthus umbellatus (Guignard, Mestre,
1969) и Eriophorum angustifolium, Cyperus fuscus (Juguet, 1968, 1969)
иллюстрируют происхождение семядоли и точки роста из дериватов са
и «смещение» точки роста в латеральное положение за счет сильного
разрастания семядоли.
Кудряшов (1964) в результате исследования эмбриогенеза у
некоторых представителей Helobiae и анализа литературы пришел к
выводу, что однодольность в ряду Nymphaeaceae-Helobiae произошла
путем постепенного преобладания в онтогенетическом развитии одной
семядоли над другой. Автор отмечает, что у Alisma, Saggitaria,
Butomus и других Helobiae семядоля и точка роста образуются из
терминального сегмента проэмбрио, «сдвиг» семядоли из латерального
положения в терминальное происходит на разных этапах эмбриогенеза,
а апекс побега всегда терминален и его смещение в латеральное
положение — явление кажущееся.
Дискуссионное состояние проблемы происхождения однодольности
покрытосеменных, а также принципиально новые данные, полученные
Guignard (1961a, b) в отношении зародыша злаков (семядоля из са,
а не из cb, как это утверждал ранее Soueges) вызвали необходимость
тщательного изучения эмбриогенеза у различных видов пшеницы
и рассмотрения проблемы эволюционного становления однодольности
применительно к злакам.
Результаты нашего исследования и анализ литературных данных по
эмбриогенезу злаков показали, что терминальное положение
семядоли и латеральное апекса побега — явления кажущиеся и
обусловлены изменениями хода их развития. Это положение вторично,
как в онтогенетическом, так и в эволюционном плане (Батыгина,
1968а, б, 1974, 1987; Batygina, 1969).
Исследование эмбриогенеза у Triticum топососсит, Т. dicoccum,
Т. aestivum, а также анализ литературных данных по сорго, кукурузе,
ячменю показали, что оригинальное дорзовентральное строение их
зародыш приобретает уже в результате первых двух делений.
Неизменное воспроизведение структуры четырехклеточного проэмбрио в
каждом случае и сохранение дорзовентрального типа симметрии в
течение всех следующих этапов дают основание считать, что
характер первых делений проэмбрио имеет самое непосредственное
отношение к дорзовентральности зародыша на следующих этапах его
развития. В результате первичных разрастаний, возникающих как
следствие различий в митотической активности и скорости роста
клеток в разных зонах зародыша пшеницы, происходит развитие
щитка на его дорзальной стороне. Таким образом, своеобразное
расположение органов в зрелом зародыше пшеницы определяется ориги-
Зародыш
477
нальным сложным «перераспределением» зон митотической активности
в течение эмбриогенеза. Специфическое строение и развитие
зародыша злаков — результат длительных эволюционных
преобразований этой группы растений (см. Эмбриогенез злаков).
В связи с изучением становления однодольности несомненный
интерес представляют и другие однодольные, у которых дорзовентраль-
ность проявляется также с первых этапов развития зародыша. К этим
растениям относится, например, Commelina forskalaei (Maheshwari, Bal-
dev, 1958). Анализ рисунков по эмбриогении этого растения показал,
что ориентация первых шести делений в проэмбрио идентична таковой
в зародыше Triticum, и изменение положения семядоли происходит в
результате аналогичных процессов.
Довольно раннее появление дорзовентральной симметрии
наблюдается и у Cyperus fuscus (Juguet, 1972, 1973). Причем в данном случае
наблюдается максимальное «искривление» морфологической оси
зародыша. Процесс происходит настолько быстро, что семядоля появляется
в апикальном, относительно первичной оси зародыша, положении.
Исследования последних лет существенно расширили спектр данных о
характере дифференциации основных структур однодольного зародыша.
Известно, что для установления непрерывных рядов эволюционных
последовательностей огромное значение имеет изучение примитивных
(наиболее близких к исходным) форм. Данные, полученные по
развитию зародыша кокосовой пальмы (Haccius, Phillips, 1979), некоторых
Helobiae (Ly ТЫ Ва, 1981), Tamus communis, Endymion nonscriptus
(Juguet, Pare, 1989), Butomus umbellatus (Красников, 1989а, б, 1990),
подтвердили, что у этих однодольных семядоля возникает как
латеральная структура, а точка роста — как терминальная.
Однако существенная разница во времени и характере заложения
основных органов зародыша у различных таксонов однодольных все еще
позволяла проводить различные толкования этих процессов.
Определенная ясность в этом вопросе была внесена нами (Батыгина, 1968а, б,
1974, 1987). Причиной споров о месте возникновения апикальной
меристемы побега (терминальном или латеральном) служит неправильное
применение термина «точка роста» к «покоящейся области». Апикальная
меристема образуется в различном положении по отношению к оси
зародыша из клеток «покоящейся области», возникающей всегда
терминально. Таким образом, термин «точка роста» должен использоваться
для обозначения района или группы инициальных клеток, из которых
образуется настоящий апекс побега. По положению, в котором
дифференцируется в зародыше однодольных апекс побега, Guignard определил
три основных типа эмбриогенеза однодольных: Cocos-, Agapanthus- и
Cyperus-типы. Он показал также, что в пределах этих типов происходит
переход от пахиэмбриатиого развития к лептэмбриатному (по
терминологии Vallade, 1976, 1992), т. е. наблюдается тенденция к
уменьшению числа клеток проэмбрио, увеличению регулярности сегментации,
раннему и одновременному выделению протодермы.
478
Семя
Развивая это направление, Juguet (1989) выделяет уже четыре
основных типа эмбриогенеза однодольных. Первые два типа
характеризуются поздним появлением дорзовентральной (билатеральной, по Juguet)
симметрии и массивным многоклеточным зародышем, развивающимся
по пахиэмбриатному типу. I — Tamus-тип: семядоля возникает лате-
рально и имеет листоподобную морфологию (как у двудольных), апекс
побега — субаксиально. II — Cocos-, или Elaeis-тип: семядоля
возникает латерально или латерально-апикально, но в зрелом зародыше
занимает терминальное положение; апекс побега возникает в
субапикальном положении, но впоследствии смещается в латеральное. III —
Agapanthus-, или Endymion-тип: эмбриогенез этого типа протекает
быстрее и включает формы, промежуточные между пахиэмбриатным и
лептэмбриатным развитием; билатеральность наступает на стадии
около 500 клеток; как семядоля, так и будущая апикальная меристема
закладываются в латерально-апикальном положении, но становятся,
соответственно, терминальной и латеральной. IV — Cyperus-тип:
развитие быстрое, лептэмбриатное; билатеральность наступает на стадии
40 клеток; семядоля и будущая апикальная меристема образуются,
соответственно, терминально и латерально. К последнему типу автор
относит эмбриогенез Роасеае и Commelinaceae.
Таким образом, Батыгина, Guignard и Juguet, признавая
происхождение однодольных из двудольных, показали общий ход
«смещения» семядоли и апикальной меристемы зародыша однодольных в
онто- и филогенезе. При этом Juguet основным критерием «продви-
нутости» типа эмбриогенеза считает время перехода от радиальной
симметрии к дорзовентральной. Полностью разделяя общий ход этих
рассуждений, мы, однако, должны отметить, что, как уже
упоминалось выше, дорзовентральность в зародыше злаков возникает уже
на стадии дву-четырехклеточного проэмбрио, развитие зародыша идет
быстрее и обладает целым рядом специфических черт. В соответствии
с этим, одним из авторов (Батыгина, 1968а, б, 1974, 1987) было
предложено выделить Graminad-тип эмбриогенеза (см. Graminad-тип
эмбриогенеза). Вероятно, этим типом можно дополнить
предложенную Juguet классификацию. Что касается утверждения об изначально
терминальной закладке семядоли и латеральной — апекса побега в
зародыше Cyperus (Juguet, 1989; Juguet, Pare, 1989), то следует
отметить, что, согласно рисункам (Juguet, 1973), в зародыше этого
вида наблюдается очень раннее «искривление» морфологической оси
и, вероятно, правильнее говорить о сублатеральном заложении
семядоли и об аксиальном положении апикальной меристемы.
Таким образом, детальные исследования эмбриогенеза однодольных
показывают, что не существует принципиальных различий в
развитии зародышей двух классов цветковых. Вариации в пределах
различных групп однодольных могут быть объяснены эволюционной
продвииутостью типов их эмбриогенеза (Батыгина, 1974). И если у
высокоспециализированных форм, например злаков, мало общих черт
Зародыш
479
развития с зародышем двудольных, то эмбриогенез примитивных
однодольных демонстрирует их полную преемственность.
Основные направления исследований проблемы эволюционного
становления однодольности. В литературе высказывались мнения о
том, что «потеря» семядоли могла происходить в результате
следующих процессов:
1) недоразвитие одной из семядолей (Hegelmaier, 1874, 1878;
Fleischer, 1874; Яковлев, 1946а, б; Haccius, 1952—1979; Guignard, 1961a,
Ь; Батыгина, 1968—1987; Guignard, Mestre, 1969; Ly ТЫ Ва, 1981,
1984);
2) срастание двух семядолей (Sargant, 1902, 1903; Данилова,
Соколовская, 1973; Цвелев, 1975; Dahlgren, Clifford, 1982; Juguet, Pare,
1989; Juguet, 1990; Titova, 1990, 1992; Titova, Batygina, 1996; см.
Синкотилия);
3) гетерокотилия (анизокотилии) — разделения функций между
семядолями и превращения одной из них в сосательный орган (Hill,
1906, 1908) (см. Гетерокотилия);
4) внезапное изменение начальных стадий развития (Солнцева,
Яковлев, 1964);
5) превращение семядоли в продолжение оси, не имеющей
аналогов, а апекса побега — в латеральную структуру (Soueges, 1931a, b;
Johansen, 1945; Смирнов, 1953; Jacques-Felix, 1957; Swamy, 1962;
Guignard, 1975a, b; Цвелев, 1975; Рытова, Цвелев, 1982);
6) отсутствие у однодольных семядолей вообще и соответствие
их зародыша разветвленному протокорму (Jacques-Felix, 1982);
7) изменение числа семядолей в результате изменения
листорасположения, семядоли при этом рассматриваются как первые
листья растения (Arber, 1925; Батыгина, Андронова, 1988; Лодкина,
1988).
С точки зрения теории филэмбриогенеза Северцова (1939), эти
гипотезы можно разделить на две основные группы. Первая группа
включает в себя гипотезы недоразвития, синкотилии и гетерокотилии,
подразумевающие, что «потеря» семядоли произошла по типу девиации
в соответствии с законом олигомеризации гомологичных органов
(Догель, 1954). В основе каждой из них лежит один из трех возможных
механизмов реализации этого закона, известных для растений
(редукция, слияние, субституция органов) (Синянинова-Корчагина, 1968).
Вторая группа отражает мнение, что глубокие изменения произошли
у однодольных на ранних этапах их развития и соответствуют изменениям
типа архалаксиса. Сюда можно отнести помимо непосредственного
указания на этот тип онтогенетических изменений (Солнцева, Яковлев,
1964) все теории, подразумевающие новообразования в зародыше,
повлекшие появление основных органов зародыша принципиально нового
типа. Особняком стоят гипотезы Арбер (1925), где автор подразумевает,
что изменение дефинитивного морфогенеза повлекло коренное изменение
480
Семя
начальных этапов развития, и гипотеза Рытовой и Цвелева (1982),
считающих, что семядоли у дву- и однодольных имеют осевую природу.
Те из гипотез, в основе которых лежат онтогенетические
преобразования типа архалаксиса, кажутся наименее обоснованными. Богатый
фактический материал демонстрирует большую преемственность в
образовании зародышей однодольных и двудольных на всех этапах их
развития. Эмбриогенез Butomus, Potamogeton, Ottelia и других
представителей примитивных однодольных не имеет принципиальных
отличий от эмбриогенеза двудольных. Постепенное смещение семядоли в
онто- и филогенезе из латерального положения в терминальное и
обратное этому точки роста убедительно доказано работами Haccius,
Swamy, Батыгиной, Guignard, Juguet и других авторов (см. выше).
Нельзя не остановиться на гипотезе Смирнова (1953) и
высказанной позднее независимо от него гипотезе Jacques-Felix (1957)
относительно становления монокотилии у злаков. Из рассуждений этих
авторов вытекает, что главная почечка, которая должна была располагаться
на главной оси, полностью редуцирована и заменена боковой почечкой.
В пользу этой гипотезы высказывались и некоторые другие
исследователи (Цвелев, 1975; Guignard, 1975a, b), считающие, что у
некоторых однодольных, в частности злаков, происходит редукция главной
оси зародыша и образование придаточной почки. Процесс, приводящий
сначала к появлению у зародыша верхушечной почечки, созданию в
результате ее деятельности другой, аналогичного строения
(адвентивной почки), затем редукции первой при сохранении второй, кажется
нам крайне умозрительным.
Интересные соображения о проблеме однодольности растений были
высказаны Коломыцевым (1977). Исходя из того, что основным
органом высшего растения является ось, он делит все покрытосеменные
на: двусемядольные (прямостебельные) и бессемядольные (бокос-
тебельные). У прямостебельных ось зародыша совпадает с осью целого
растения (ось первого порядка), а у бокостебельных — ось второго
порядка формируется на оси первого порядка предзародыша:
проросток — побег второго порядка. Коломыцев придавал большое значение
соотношению поверхностного роста и объема в зародыше, считая, что
тело сложной формы образуется в результате преобладания роста
поверхности формирующегося органа над увеличением его объема
(основной закон морфогенеза живых тел). При определенном соотношении
поверхности и объема образуются семядоли у двудольных и различные
выросты у бессемядольных. По его мнению, семядоли — боковые
уплощенные выросты ограниченного роста на оси зародыша.
Появление различных искажений у бессемядольных в результате «уплощения»
верхней части зародыша — широко распространенное явление, кото-
Т. е. односемядольные. — Т.Б.
Зародыш
481
рое встречается при дихотомическом ветвлении талломов у водорослей,
мхов, при формировании заростков у папоротников и т. д. Все это,
как полагает Коломыцев, является результатом не близкого родства, а
общности закона морфогенеза. Деление на два класса вполне
оправданно, считает Коломыцев, так как коренным отличием их
являются размеры зародыша в период образования семядолей; отношение
ширины к длине зародыша у двудольных никогда не превышает
единицы (у Capsella bursa-pastoris оно составляет 0,64), но деление
на два класса по числу семядолей, по его мнению, — анахронизм.
Близкие взгляды были высказаны также и Jacques-Felix (1982),
считающим, что однодольные не имеют семядоли, которая, по его
мнению, соответствует разветвленному протокорму.
Мы полагаем, что, вероятно, нет серьезных оснований считать
происхождение семядоли и точки роста у однодольных отличным от
зародышей двудольных. Кроме того, наиболее убедительным
экспериментальным доказательством простого преобразования двусемядольного
зародыша в односемядольный служит работа Haccius (1960) по
искусственной индукции однодольности у двудольного Eranthis hiemalis, в
результате которой были получены зародыши, морфологически сходные с
однодольными.
Более убедительными, с нашей точки зрения, представляются
гипотезы, объединяющиеся в том, что основным механизмом при переходе
к однодольности было количественное изменение органов.
Значительное число сторонников в настоящее время имеет гипотеза недоразвития
(abort-hypothese). Она предполагает постепенную редукцию одной из
семядолей. Одним из доводов в ее пользу является то, что у
зародышей двудольных можно обнаружить разную степень изменения одной
или другой семядоли. Гипотеза хорошо объясняет изменение характера
морфогенеза побега, формы основания зачатка листа и порядок
листорасположения, но тем не менее имеет и некоторые трудности. Она
«работает» только в том случае, если признать, что у представителей
однодольных не сохраняется никаких остатков второй семядоли.
В противном случае, если в той или иной форме зачаток семядоли
присутствует, первый лист почечки просто не может образоваться на
своем месте (супротивно от основной семядоли) и составлять с ней
единый семядольный узел (последнее характерно для многих одно-
льных и ложнооднодольных, например Allium, Anemone).
Следовательно, чтобы объяснить изменение листорасположения, необходимо
признать не постепенную редукцию, а единовременное выпадение
второй семядоли и ее зачатка. В этом случае гипотеза «недоразвития»
превращается в гипотезу «неразвития», что отметает традиционные
доводы в ее защиту о разной степени редукции семядоли у
двудольных. Кроме того, гипотеза «недоразвития» не объясняет возникновение
механизма «онтогенетического ускорения» в развитии зародыша.
Согласно гипотезе синкотилии, высказанной Sargant (1902, 1903),
семядоля однодольных образовалась путем срастания по краям семядо-
31-828
482
Семя
лей у двудольного предка, превратившись в терминальную трубчатую
структуру, приспособленную для проникновения в почву в момент
прорастания. В последнее время в ее защиту выступили многие авторы
(Данилова, Соколовская, 1973; Haines, Lye, 1975, 1979; Dahlgren,
Clifford, 1982; Рытова, Цвелев, 1982; Juguet, Pare, 1989; Titova,
1990, 1992; Juguet, 1992; Titova, Batygina, 1996). Веским аргументом
в пользу этой гипотезы служит структура проростков и зародышей
нимфейных, в строении семядолей которых усматриваются следы
срастания (Dahlgren, Clifford, 1982). Однако этот вопрос остается
дискуссионным. Возможно, что явление, принятое за срастание, представляет
расщепление единственной семядоли, подобное экспериментально
вызванной «ложнодвудольности» (Haccius, Lakshmanan, 1967). Кроме
того, нимфейные — довольно обособленная группа, и становление
односемядольное™ могло происходить у них независимо от основной
части однодольных и присуще только этой группе.
Против этой гипотезы можно привести следующие аргументы. Не
наблюдается случаев рудиментарного образования двусемядольности у
однодольных, которая должна бы встречаться в случае справедливости
этой гипотезы (Haccius, Lakshmanan, 1967). Нет никаких следов
срастания и в закладке, развитии и строении семядоли зародыша
однодольных. Наличие нескольких прокамбиальных пучков в семядоле не
может служить таким аргументом, так как неизвестно, какое их число
считать исходным (Eames, 1961). С другой стороны, известно много
случаев срастания семядолей у двудольных, которые, срастаясь,
напоминают шейку единственной семядоли многих однодольных (например,
Eranthis — Eames, 1961), но это сходство, вероятно, аналогичного
свойства, и не в одном из этих случаев синкотилия не приводит ни к
изменению листорасположения, ни к изменению строения зародышевой
почки.
Согласно гипотезе гетерокотилии (анизокотилии) (Hill, 1906),
преобразование двусемядольного зародыша в односемядольный происходит
на основе разделения функций между семядолями. Одна из них
преобразуется в «сосательный орган» и остается при прорастании в
семени, вторая соответствует надземной и становится листом почечки. В
качестве примера НШ приводит двусемядольный зародыш Peperomia
parvifolia, сравнивая его с односемядольным зародышем Arisaema,
относящимся к однодольным. Hill считает, что единственная семядоля
Arisaema соответствует той семядоли Peperomia, которая при
прорастании остается в семени; первый же лист почечки Arisaema
соответствует «надземной» семядоле. При этом автор полагает, что точка
роста однодольных сдвигается в сторону вследствие быстрого роста
первой «сосательной» семядоли, которая поэтому располагается в
семени терминально. Таким образом, он невольно касается вопроса
гомологии органов дву- и односемядольного зародыша.
Сильной стороной гипотезы безусловно является отмеченная связь
эволюционных преобразований с экологическими факторами, в данном
Зародыш
483
случае с изменением типа прорастания. Однако, согласившись с автором,
мы должны были бы признать первичность подземного прорастания у
однодольных и связанного с ним строения зародыша, характерного для
наиболее продвинутых семейств (Poaceae, Commelinaceae и др.), тогда
как характер прорастания и строение зародышей примитивных
однодольных (Butomus, Potamogeton, Ottelia), не имеющих сосательной
семядоли и сразу освобождающихся от семени при прорастании, —
производными. Кроме того, с точки зрения этой гипотезы, нельзя объяснить
механизм изменения листорасположения и причины «онтогенетического
ускорения» в развитии зародыша, что отчасти обусловлено тем, что
онтогенез растения рассматривается как монотонный процесс, без учета
различий эмбриональной и дефинитивной фаз развитие.
Гипотеза Arber (1925) подразумевает преобразование^ зародыша
вследствие изменения листорасположения. Не придавая семядолям особого
морфологического значения и рассматривая их как первые листья (изменение
в связи с функцией), Arber считала, что однодольность и двудольность —
результат различного расположения листьев (у двудольных —
супротивное, у однодольных — очередное) на апексе с самого начала их
дифференциации. По ее представлениям, однодольность является
следствием изменения листорасположения уже в 1-м узле побега, при этом
у однодольных растений не может заложиться 2-й лист, так как способ
закладки у них имеет свои особенности. Таким образом, Arber полагает,
что семядоли — это первые листья растения, которые могут
формироваться на узле по одному, по два и т. д. Характер дифференциации
листьев у однодольных таков: развитие широкого основания, которое
имеет тенденцию к окружению оси, что исключает закладку на узле
второго листа, как это бывает у двусемядольного зародыша. По мнению
Arber, ботаники, загипнотизированные своей терминологией, придумали
термин «семядоля», считая их органами sui generis. Arber ставит под
сомнение попытки гомологизировать семядоли двудольных со
структурами односемядольного зародыша. По ее мнению, вопрос о монокотилии
в том плане, в котором рассматривают его большинство морфологов,
отпадает.
Некоторые положения этой гипотезы, на наш взгляд, имеют
существенное значение для понимания проблемы монокотилии, в частности
вопроса, касающегося гомологизации структур зародыша однодольных
и двудольных растений и термина «семядоля». В связи с этим следует
несколько подробнее остановиться на работах Серебрякова (1952) и
Даниловой и Соколовской (1973), в которых авторы высказывают ряд
критических замечаний по гипотезе Arber. Серебряков считает, что
построение Arber не может быть принято, так как оно ничего не объясняет
и только парализует дальнейшие исследования в этой области. Кроме
того, Arber якобы игнорирует филогенетические связи между
однодольными и двудольными в объяснении важнейшего эмбриологического
признака — односемядольности их зародыша. С этих позиций, по мнению
Серебрякова, остается совершенно непонятной терминальность единст-
31*
484
Семя
венной семядоли зародыша однодольных. В доказательство своих
рассуждений он ссылается на то, что «нигде в растительном мире очередное
листорасположение не сопровождается терминальным положением
листьев на стебле» (1952, с. 67). Критикуя концепцию Arber, Серебряков
пишет: «Не ширина основания листьев определяет отсутствие других
листьев на узле, а, наоборот, позднее заложение следующего листа,
разрыв во времени заложения, величина пластохрона определяет
разрастание примордия листа по окружности узла, ширину основания
выросшего листа». Таким образом, по его мнению, она ставит этот вопрос
«с ног,на голову». Однако Arber впервые попыталась прямо связать
изменение в положении аппендикулярных органов зародыша с
характером филлотаксиса на апексе побега.
Данилова и Соколовская (1973) приводят ряд критических
замечаний относительно гипотезы Arber, еще раз определяя в этой работе
свою позицию в отношении гомологизации семядолей и листьев. Они
пишут: «Во-первых, вряд ли можно, зная о существенных различиях
в характере заложения и развития семядолей и листьев, считать
семядоли за первые члены листового ряда, как это делает Arber, не
придавая этим органам самостоятельного значения. Семядоли
возникают иа первом этапе дифференциации проэмбрио из ткани про-
эмбрио и без участия позже формирующейся апикальной
меристемы стебля. Во-вторых, указывая на асцидиальную форму семядоли
как основное условие однодольности, Arber не пытается объяснить,
как такая форма семядоли возникла» (1973, с. 347).
Гипотеза Лодкиной (1988) подразумевает, что односемядольный и
двусемядольный зародыши могли произойти от общего предка, имевшего
две или более очередно расположенных семядоли. При этом зародыш
типа однодольных мог возникнуть либо путем превращения второй
семядоли в колеоптиль, либо путем утраты одной семядоли. В такой
трактовке эта гипотеза в целом является объединением гипотез недоразвития,
гетерокотилии и гипотезы Arber. Кроме того, трудно представить мор-
фогенетический механизм, приводящий к появлению двух очередных
семядольных узлов с однотипными семядолями и междоузлиями у
зародыша. Либо обе семядоли образуются из апикальной части глобулярного
зародыша, и тогда он будет близок к двусемядольному типу (в этом
случае вопрос снова сводится к выяснению механизмов образования
односемядольности). Либо вторая семядоля должна образоваться на
более поздней стадии развития зародыша из иного зачатка, и в этом
случае трудно представить появление второго органа такого же строения.
Гипотеза Лодкиной также не объясняет разницу в организации почечки
у этих классов зародышей и морфогенетический механизм
преобразования двусемядольного зародыша в односемядольный.
Экологические предпосылки возиикиовеиия однодольности. В
литературе уже высказывалось мнение, что однодольные возникли в связи
с переходом их предков к водному образу жизни (Henslow, 1911; Тах-
таджян, 1964), который, по мнению многих авторов, вызвал упрощение
Зародыш
485
их строения. Эта точка зрения аргументируется тем, что представители
наиболее примитивных порядков однодольных, а также нимфейные —
водные растения. Это мнение кажется нам наиболее обоснованным и
в общем согласуется с эмбриологическими данными. В этих группах
сосредоточены наиболее примитивные зародыши, имеющие наиболее
простой среди однодольных способ прорастания — большинство из них
сразу же освобождается от семенной кожуры. Как известно, новые
таксоны крупного ранга обычно возникают на границе ареала в связи с
освоением новых биотопов. Для однодольных это, вероятно, была
литоральная зона пресноводных водоемов, еще не занятая другими высшими
растениями.
Рассмотрим это на примере Butomus umbellatus — наиболее
примитивного представителя однодольных (Тахтаджян, 1966). Анализ среды
обитания этого вида показывает, что она очень сходна с той, с которой могли
столкнуться предки однодольных при завоевании водных биотопов. Он
растет на небольшой глубине стоячих или медленно текущих, хорошо
прогреваемых водоемов. Как правило, занимает свободные участки мягких
илистых грунтов и является типичным гидрофитом. Подобные условия
характерны для жизни представителей и некоторых других примитивных
семейств однодольных. С какими же проблемами должны были
столкнуться их предки при постепенном освоении литоральной зоны?
Очевидно, что наиболее уязвимы при освоении новых биотопов у
растений должны быть этапы онтогенеза, целиком проходящие в новых
условиях, т. е. этапы формирования семени и проростков. Вероятно,
предки однодольных обладали более примитивным (характерным для
большинства двудольных) надземным типом прорастания. Но в этой
среде семя, попадая на мягкий илистый грунт, неизбежно погружается
в его толщу вследствие постоянных отложений и/или перемешивания
его верхних слоев. Следовательно, проросток оказывается в условиях
подземного прорастания:
— погрузившись в ил и находясь в наиболее прогреваемой части
водоема (литоральная зона), семя и проросток оказываются в условиях
острого дефицита кислорода;
— после выхода из семенной кожуры проросток длительное время
испытывает влияние светового дефицита;
— слишком мягкий грунт создает сложности в надежной фиксации
растения на субстрате.
Как мы попытаемся показать на примере Butomus umbellatus и
других водных однодольных, все основные «новоприобретения» их
зародышей и проростков, вероятно, непосредственно связаны с решением
этих проблем.
Кислородный дефицит затрудняет процесс дозревания зародышей в
семени (характерный для примитивных покрытосеменных), что
способствует превращению семядолей в запасающий орган. Зрелые семена у
представителей Helobiae и некоторых Nymphaeales s.l. (например, Ne-
lumbonales) лишены эндосперма.
486
Семя
«Онтогенетическое ускорение» в развитии зародыша, столь
характерное для всех однодольных и нимфейных, вероятно, необходимо для
быстрого достижения поверхности и преодоления недостатка света и
кислорода. До этого момента зародышу и проростку требуется
длительное потребление запасных веществ, особенно в форме крахмала
(обеспечивающего возможность бескислородного обмена), что
отражается на интенсификации запасающей функции семядоли.
Укрытие апекса побега внутри семядольного влагалища, ставшее
возможным в результате перехода к однодольности и изменения формы
семядоли, возникновение дифференциального роста семядоли в
постсеменном развитии, несомненно, являются адаптациями к прорастанию в
толще илистого грунта. Илы — довольно мягкие субстраты, поэтому
приспособления зародыша носят сравнительно компромиссный характер.
У Butomus точка роста зародыша, защищенная стенками влагалища,
выносится на поверхность за счет удлинения влагалищной части семядоли,
причем зародыш сразу освобождается от семенной кожуры. Переход к
подземному прорастанию с помощью преобразования семядоли в
гаусторию в данном случае невозможен, вследствие отсутствия в зрелых
семенах эндосперма. После этого семядоля может развернуться и
функционировать некоторое время подобно настоящему листу, что характерно
для многих примитивных однодольных (Eames, 1961).
Интересно, что критерий, предложенный Esau (1977) для
определения подземного прорастания (одна семядоля остается под землей в
семени), в данном случае не «работает». Вероятно, более надежным
следует считать другой признак — выносится или не выносится
семядоля на поверхность (Eames, 1961).
Редукция главного корня проростка и возникновение адвентивных
корней — вероятно, адаптация к тому же необычно рыхлому грунту.
Система множественных адвентивных корней должна лучше
удерживать молодое растение на субстрате и уменьшать вероятность его
повреждения в результате гидродинамических воздействий. Кроме
того, максимальное количество влаги сконцентрировано здесь у
поверхности грунта, а не на глубине, что делает развитие длинного главного
корня невыгодным.
Таким образом, отличительные особенности зародышей
примитивных однодольных могут быть объяснены как необходимые адаптации,
появившиеся у их предков в связи с завоеванием литоральной зоны
водоемов.
Возможный механизм преобразования двусемядольного
зародыша в односемядольный. Развитие зародыша примитивных
однодольных до глобулярной стадии проходит так же, как и у двудольных.
Например, у Butomus семядоля образуется из апикальной части проэмб-
рио, закладывается латерально, и её основание занимает латеральное по
отношению к апексу побега положение даже в зрелом зародыше. Прокам-
биальный пучок дифференцируется в гипокотиле, в семядоле и в районе
заложения первого листа. Образование единого узла проводящего пуч-
Зародыш
487
ка 1-го листа с проводящим пучком семядоли — явление, широко
распространенное у однодольных и известное как Allium-тип (Haccius,
Lakshmanan, 1967). У Butomus, так же, как и у многих низших
однодольных (например, у Ottelia alismoides — Swamy, 1962), проводящий
пучок листа закладывается почти одновременно с семядольным пучком.
Изгиб основания проводящего пучка семядоли и вентральная половина
зародыша Butomus на срезе принципиально не отличаются от
зародыша двудольных. Цилиндрическая форма его семядоли вторична и
возникает из асцидиальной в результате своеобразного способа
нарастания со спиральным распределением клеточных делений. Следовательно,
основные отличия этих зародышей касаются только характера
морфогенеза дорзальной части зародыша. Аналогично другим однодольным,
у Butomus на глобулярной стадии развития часть клеток «апикальной
полусферы» зародыша характеризуется снижением интенсивности
деления, образуя «покоящуюся зону». Топографически этот участок
соответствует локусу инициальных клеток апикальной меристемы стебля и
одной из семядолей (pvt\+ico2) двусемядольного зародыша. Основание
закладывающейся семядоли окружает его полукольцевидным валиком.
По мере ее развития края валика расширяются и удлиняются
(маргинальный рост семядоли), образуя семядольное влагалище, полностью
окружающее формирующуюся почечку. Зона более медленного
развития, вследствие обрастания ее растущей семядолей, оказывается
погруженной в глубокую выемку, открывающуюся на вентральной стороне
зародыша. Когда клетки «покоящейся зоны» начинают делиться,
интенсивность делений увеличивается в абаксиальном направлении. В
результате образуется небольшой валик, охватывающий
дифференцирующийся несколько медленнее апекс побега. Порядок дифференциации и
расположение этих структур зеркально-симметрично повторяет картину
заложения семядоли и «покоящейся зоны». Таким образом, у Butomus
апекс побега образуется после начала дифференциации примордия
первого листа из клеток «покоящейся зоны», которая соответствует части
(il\ +pvt) апикального сегмента проэмбрио (локус ico+pvt+il\).
Возникновение первого листа не связано с деятельностью апикальной
меристемы стебля.
Из анализа литературы видно, что и у других однодольных примерно
такие же отношения первого листового примордия и апикальной
меристемы. Например, в эмбриогенезе Ottelia alismoides (Haccius, 1952) ини-
циали примордия первого листа и апикальной меристемы располагаются
в едином локусе и некоторое время находятся в состоянии покоя. В его
проксимальном участке возникает небольшой бугорок, отделяя основание
семядоли от дифференцирующегося примордия первого листа. В
результате примордий охватывает этот бугорок подобно семядольному влага-
ill — инициали примордия первого листа.
488
Семя
лищу. Haccius считает, что этот бугорок — примордий второго листа
почечки, а точка роста расположена в «щели» между примордиями. По
нашему же мнению, эта структура — не примордий второго листа, а
типичная апикальная меристема стебля. Это хорошо видно на схеме
поперечного среза. Примордий второго листа должен заложиться позже,
полукольцевидным валиком охватывая апикальную меристему (как это
характерно для однодольных), а не конусообразным бугорком внутри
«серпа» первого листового примордия.
Таким образом, процесс возникновения апикальной меристемы у Ot-
telia находится в полном соответствии с аналогичными процессами у
Butomus.
В других случаях, например у Eichhornia crassipes, Cyperus fuscus,
Agapanthus umbellatus (Swamy, 1966; Juquet, 1968; Guignard, Mestre,
1969), развитие конуса нарастания в зародыше несколько
запаздывает. Его инициали, вероятно, находятся в основании полусферического
выступа, заключенного в семядольное влагалище. Хотя авторы
называют всю эту структуру апикальной меристемой (точка роста
зародыша, pvt), Haccius и Lakshmanan (1966) считают ее примордием
первого листа, что, по нашему мнению, больше согласуется с фактами.
Этот зачаток полностью соответствует зачатку первого листа у других
однодольных по положению, размерам и характеру морфогенеза. Конус
нарастания в это время еще заметно не оформился и должен быть,
вероятно, представлен теми же инициалями, которые составляли часть
«покоящейся зоны». Следовательно, у этих растений в зрелом
зародыше имеется зачаток, включающий дифференцированный примордий
первого листа и инициали апикальной меристемы, который должен
обозначаться l\+pvt. '
Противоположный описанным выше случай образования апикальной
меристемы отмечен у Stratioites alloides (Baude, 1956). У этого
растения развитие всех органов зародыша начинается относительно
поздно, причем зачатки конуса нарастания и первого листа появляются
очень быстро после инициации семядоли. Конус нарастания массивнее
и быстрее дифференцируется, чем первый листовой примордий. Но и
в этом случае, как можно проследить по рисункам автора, обе
структуры происходят из единого локуса апикальной части проэмбрио, и
листовой примордий возникает до начала деятельности апикальной
меристемы, хотя конус нарастания и развивается быстрее, чем обычно.
Вероятно, для однодольных характерно развитие примордия первого
листа, не связанное с деятельностью апикальной меристемы стебля. В
проанализированных нами случаях они происходят из единого локуса,
возникающего на стадии глобулярного зародыша, темп делений клеток
которого в первый период органогенеза сильно снижается по
сравнению с остальными частями проэмбрио. Как мы уже упоминали,
приближенно можно считать, что он соответствует части апикальной
полусферы глобулярного зародыша, заключающей инициали одной из
семядолей и точки роста. При последующей дифференциации в этом
Зародыш
489
локусе характер возникновения примордия первого листа и апикальной
меристемы точно такой же, как у меристемы и конуса нарастания
зародыша двудольных. Проводящие пучки этих структур у
примитивных однодольных и двудольных образуют единый семядольный узел.
Следовательно, если наши рассуждения верны, первый лист
однодольных гомологичен одной из семядолей двудольных, и на ранних
этапах развития, до появления примордия первого листа, в
формирующемся семядольном влагалище находится не точка роста
зародыша, как обычно считали, а общий «покоящийся локус»,
содержащий инициали примордия первого листа и апикальной
меристемы побега (i/i + pvt). При этом он постепенно смещается в
латеральное положение, как в индивидуальном развитии, так и в
филогенезе (см. Батыгина, 1987). Время активизации этих инициалей
относительно друг друга, а также начала инициации семядоли может
отличаться у разных видов, что и приводит к разнообразию
организации эпикотилярного района и положения апикальной меристемы в
зрелом зародыше. Наша точка зрения перекликается с последними
выводами Guignard (1984), считавшего, что конус нарастания образуется в
различном положении по отношению к оси зародыша из клеток
покоящейся зоны, возникающей всегда терминально. И причиной споров о
месте его возникновения (терминальном или латеральном) служит
неправильное применение термина «точка роста» к покоящемуся центру
(Guignard, 1984). Мы также считаем, что термин «точка роста»
может применяться в основном только к зародышам двудольных как
обозначение района или группы инициальных клеток, из которых
впоследствии образуется настоящая апикальная меристема стебля.
Поскольку первый лист однодольных, вероятно, гомологичен одной
из семядолей двудольных, следует признать, что при возникновении
односемядольности произошел сдвиг закладки второй семядоли во
времени (гетерохрония) на более поздние этапы эмбриогенеза. Само по
себе подобное изменение не представляет ничего необычного и широко
известно эмбриологам животных. Матвеев (1942) считает, что
приспособительное значение (полезность) признака определяет время его
появления в эмбриогенезе. Но какое же приспособительное значение
могла иметь задержка заложения одной семядоли? По нашему мнению,
это сравнительно простое преобразование имело целый ряд
исключительно важных последствий, главным образом по характеру
воздействия на морфогенез других органов, осуществляемого через систему
ступенчатых зависимостей (ступенчатых корреляций) (Шмальгаузен,
1939; Шмидт, 1940). При этом каждая из промежуточных ступеней
(членов корреляционной цепи) могла не иметь самостоятельного при-
У высших однодольных происходит усложнение проводящей системы, связанное
с дальнейшей эволюцией всех органов.
490
Семя
J
способительного значения, существуя как связь от одного
эмбрионального приспособления к другому (Шмидт, 1940).
1. Отставание в развитии одного из семядольных локусов приводит
к изменению морфогенеза семядолей. Основание семядоли расширяется,
вплоть до почти кольцевидного валика, и форма растущей семядоли
становится асцидиальной (цилиндрическая форма, например у Butomus,
как показали наши исследования, — вторична). Эпикотилярный локус
в результате оказывается заключенным в семядольное влагалище,
защищающее апекс побега при прорастании. Подобный способ
преобразования семядоли разделяется и всеми сторонниками гипотезы
недоразвития.
2. Резкие изменения эмбриональных приспособлений могут сильно
влиять на ранние стадии морфогенеза дефинитивных органов (Шмидт,
1968). В данном случае меняется морфогенез эпикотилярной области.
Локус инициалей второй семядоли и точки роста в результате
задержки развития дифференцируется с образованием апикальной меристемы
и примордия только одного листа, приобретающего в основании такую
же форму, как и семядоля. Зачаток следующего листа соответственно
возникает на противоположной стороне конуса нарастания,
максимально удаленной от центра предыдущего, согласно закону филлотаксиса,
и т. д. Таким образом, гетерохрония в закладке семядолей связана с
изменением формы листьев и листорасположения.
3. В результате задержки развития вторая семядоля существует
на более позднем этапе онтогенеза и не может выполнять свои
прежние функции, тесно связанные с трофическими отношениями с
эндоспермом. Происходит «смена функций» (Dohrn, 1875, цит. по
Дорн, 1937) (главная запасающая функция ослабевает,
второстепенная ассимиляционная возрастает) в результате превращения
провизорного органа (семядоли) в дефинитивный — лист. Подобные
превращения провизорных органов в дефинитивные представляют одну
из закономерностей преобразований онтогенеза и нередко встречаются
у беспозвоночных. Например, глотка, бывшая у предков (Linneus
desori) провизорным органом, стала дефинитивным органом у немер-
тины Linneus ruber (Шмидт, 1968). Одновременно с этим процессом
происходит интенсификация и «расширение функций» (Plate, 1913)
первой семядоли, вызванные олигомеризацией и изменением ее роли
при прорастании.
4. Изменение средних этапов эмбриогенеза оказывает
непосредственное влияние и на его начальные фазы, приводя к утрате радиальной
симметрии проэмбрио. Это явление может проявляться в разной
степени у разных видов, обнаруживаясь у наиболее продвинутых —
злаков — уже в направлении перегородки первого деления зиготы (Ба-
тыгина, 1968а, б, 1974, 1987). Потеря симметрии на ранних этапах
естественно приводит к изменению положения морфологической оси
зародыша и перемещению единственной семядоли в терминальное
положение. У водных однодольных можно наблюдать вариации в интен-
Зародыш
491
сивности этого процесса. Максимального выражения он достигает в
родах Saggitaria и Alisma, что, вероятно, и привело некоторых авторов
к представлению о латеральности «точки роста» у этих растений.
В эмбриогенезе беспозвоночных можно найти аналогичные и более
значительные влияния эмбриональных приспособлений на ранние
стадии дробления. Например, у полихет, при переходе от эмбриогенеза с
планктонной личинкой к неличиночному развитию, может полностью
выпадать анимальная полусфера бластулы (Светлов, 1923).
5. Временной сдвиг закладки одной из семядолей связан с
механизмом «онтогенетического ускорения», что можно проиллюстрировать
следующим примером. Зародыши пшеницы и некоторых примитивных
однодольных различаются по времени инициации семядоли, заложения
первого листа и относительному временному разрыву (степени
гетерохронии) между началом закладки семядоли и началом дифференциации
в покоящейся зоне (ili+pvt). В этом ряду обнаруживается
коррелятивная зависимость между этими признаками и величиной
«онтогенетического ускорения» (которое тем больше, чем быстрее закладываются
второй и последующие листья в эмбриогенезе).
Из анализа выявленных корреляций и сопоставления эмбриогенеза
разных систематических групп однодольных следует, что
онтогенетическое ускорение, вероятно, связано корреляционной зависимостью
со степенью гетерохронии в закладке семядоли и первого листа и
«смещением» закладки семядоли на все более ранние стадии
развития. Эта зависимость (если графически построить ее с учетом
законов корреляций) в общем виде можно представить в декартовой
системе координат.
Таким образом:
1. Односемядольный зародыш, вероятно, произошел от предка,
имевшего две семядоли.
2. Все основные отличительные признаки зародыша
примитивных однодольных являются прямыми или косвенными
(реализующими адаптивное значение через систему морфогенетических
корреляций) эмбриоадаптациями к изменившимся условиям среды.
3. Экологическими факторами, обусловившими пребразования
двусемядольного зародыш в односемядольный, вероятно, были
особенности илистого грунта, кислородный и световой дефицит, предъявляющие
особые требования к прорастанию и укоренению в условиях
литоральной зоны пресноводных водоемов.
4. Большинство адаптивных признаков односемядольный
зародыш приобрел вследствие сдвига закладки одной из семядолей на
более поздний этап онтогенеза (гетерохрония). Не имея собственного
адаптивного значения, это преобразование через систему
морфогенетических корреляций вызвало проявление сразу трех признаков,
являющихся непосредственными адаптациями — «онтогенетического
ускорения» развития, изменения формы листьев и листорасположения,
подземного прорастания.
492
Семя
5. Сдвиг закладки второй семядоли, вероятно, сопровождается
сменой ее функций и превращением в дефинитивный орган — первый
лист проростка.
6. Сдвиг закладки второй семядоли приводит к изменению не
только конечных стадий эмбриогенеза, но отражается и на самых
ранних его этапах, что выражается в потере радиальной симметрии.
Это влияние тем сильнее, чем раньше происходит закладка семядоли.
7. Степень «онтогенетического ускорения» оказывается у
зародышей разных видов коррелятивно связанной с «величиной гетерохронии»
и временем закладки семядоли в эмбриогенезе, причем перемещение
закладки последней на начальные этапы эмбриогенеза усиливает
эффект увеличения гетерохронии.
В заключение мы хотим отметить, что предложенная нами модель
механизма преобразования двусемядольного зародыша в
односемядольный является не единственной, хотя она, видимо, могла не раз
использоваться в эволюции. У ложнооднодольных потеря одной из
семядолей, вероятно, служит приспособлением к влажным местам обитания
(Ly Thi Ва, 1981) и в ряде случаев к подземному прорастанию.
Таким образом, «потеря» семядоли, по-видимому, представляет пример
перспективной онтогенетической дифференцировки, «обеспечивающей
жизнь не только в этих конкретных условиях, но и в гораздо более
широкой адаптивной зоне, а может быть, и обеспечивающей
возможность перехода в иную зону» (Тимофеев-Ресовский и др., 1977,
с. 179). Она некоторое время без решающего успеха находилась в
разных филлумах, прежде чем нашла «серьезное применение» при
переходе к водному образу жизни. Успех был, возможно, вызван тем,
что в результате одного, в общем-то не такого сложного изменения,
появляется ряд адаптивных признаков, сочетание которых идеально
подходило для освоения нового биотопа. Рис. 40.
Батыгина, 1968а, б, 1974, 1987; Батыгина, Андронова, 1988; Данилова,
Соколовская, 1973; Догель, 1954; Дорн, 1937; Коломыцев, 1977; Красников, 1989а, б,
1990; Кудряшов, 1964; Лодкина, 1988; Матвеев, 1942; Рытова, Цвелев, 1982;
Светлов, 1923; Северцов, 1939; Серебряков, 1952; Синянинова-Корчагина, 1968;
Смирнов, 1953; Солнцева, Яковлев, 1964; Тахтаджян, 1964, 1966; Терёхин, Ни-
китичева, 1968; Тимофеев-Ресовский и др., 1977; Титова, 1988а, б; Фаминцын,
1879а, б; Цвелев, 1975; Шмальгаузен, 1938, 1939; Шмидт, 1940, 1968; Яковлев,
1946а, б; Arber, 1925; Batygina, 1969; Baude, 1956; Campbell, 1897; Dahlgren,
Clifford, 1981; Eames, 1961; Fleischer, 1874; Guignard, 1961a, b, 1975a, b, 1984;
Guignard, Mestre, 1969, 1971; Haccius, 1952—1972; Haccius, Fischer, 1959; Haccius,
Hartl-Baude, 1957; Haccius, Lakshmanan, 1966, 1967; Haccius, Phillips, 1979; Haines,
Lye, 1975, 1979; Hanstein, 1870; Hegelmaier, 1874, 1878; Henslow, 1911; Hill, 1906,
1908; Hofmeister, 1861; Jacques-Felix, 1957, 1982; Johansen, 1945, 1950; Juguet,
1968, 1969, 1972, 1973, 1989, 1990; Juguet, Pare, 1989; Ly Thi Ba, 1981; Mahlberg,
1960; Padmanabhan, 1996; Plate, 1913; Raghavan, Sharma, 1995; Sargant, 1902, 1903;
Schnarf, 1929; Soueges, 1924a-c, 1931a, b, 1939a, b; 1940, 1954, 1959; Sussenguth,
1921; Swamy, 1962, 1963, 1966; Swamy, Lakshmanan, 1962a, b; Swamy, Parame-
swaran, 1962; Titova, 1990, 1992; Titova, Batygina, 1996; Vallade, 1976, 1992.
Зародыш
493
ТИПЫ ЭМБРИОГЕНЕЗА
ПРИНЦИПЫ КЛАССИФИКАЦИИ ТИПОВ ЭМБРИОГЕНЕЗА
Ранние представления. Уже в первой половине XIX века были
изучены отдельные стадии формирования зародыша цветковых
растений (Treviranus, 1815; Brongniart, 1830; Schleiden, 1839; Meyen,
1840; Schacht, 1850). Деление зиготы, образование двуклеточного
и затем глобулярного зародыша из его верхней (апикальной) клетки
обнаружил Hofmeister (1849, 1859). Hanstein (1870) первым
подробно проследил закономерности формирования зародыша, описал
стадию квадрантов и рассмотрел строение зародыша, исходя из
наличия в нем трех гистогенов: дерматогена, периблемы и плеромы.
На основании различий в строении четырехклеточного зародыша,
прохождении стадии квадрантов, времени дифференциации и
структуре вышеупомянутых гистогенов им были описаны три типа развития
зародыша двудольных: Capsella, Oenothera и Nicotiana. С этими
типами он сравнил развитие зародыша других растений, как
двудольных, так и однодольных. Следует отметить, что Norner (1881)
на основании особенностей заложения перегородок в раннем
эмбриогенезе выделил три типа развития зародыша злаков: 1 — первое
и второе деления поперечные, 2 — первое деление поперечное, а
второе наклонное, 3 — оба деления наклонные.
Westermaier (1876), переисследовав эмбриогенез Capsella bursa-pas-
toris (Brassicaceae), уточнил представления Hanstein (1870)
относительно первых стадий развития зародыша и, реконструировав строение
зародыша по серии продольных и поперечных срезов, впервые описал
стадию октантов. Этот вид оказался удобным модельным объектом, на
котором в дальнейшем были изучены основные закономерности
эмбриогенеза цветковых растений в силу ряда преимуществ: 1)
непродолжительный период формирования семян, 2) большое число семязачатков
и семян, положение которых в завязи совпадает с направлением их
продольной оси в плоскости среза, 3) небольшие размеры зародыша,
4) хорошо выраженная ярусность клеток в зародыше. Тип эмбриогенеза
С. bursa-pastoris считается классическим для двудольных.
Классификация Сагапо (1915) и Chiarugi (1925). Сагапо (1915)
предложил различать два типа развития зародыша: Cruciferae-тип
(эмбриогенез Capsella bursa-pastoris) и Asteracee-тип (эмбриогенез
представителей сем. Asteraceae — Сагапо, 1913, 1915), исходя из
особенностей строения четырехклеточного проэмбрио и последовательности
делений его клеток в ходе дальнейшего развития. Позже Chiarugi (1925)
на основании специфики строения тетрады клеток проэмбрио, а также
494
Семя
Рис. 1. Классификация типов эмбриогенеза Schnarf (1929): А — поперечное
деление в зиготе и образование двуклеточного зародыша, В, С — дальнейшее
развитие зародыша по Cruciferae-типу, D, Е — Asteraceae-типу, F, G —
Solanaceae-типу, Н, J — Chenopodiaceae-типу, К, L — Caryophyllaceae-типу
(по: Wardlaw, 1955).
степени участия апикальной и базальной клеток в построении зародыша
обосновал необходимость выделения для двудольных еще двух типов
развития зародыша: Solanaceae и Chenopodiaceae, включив в последний
эмбриогенез представителей сем. Caryophyllaceae, изученный Soueges
(1922а, 1924с).
Классификация Schnarf (1929). Использовав критерии Chiarugi
(1925), Schnarf (1929) дал иное толкование критерия, касающегося
участия базальной клетки в построении зародыша. В связи с этим в
классификацию дополнительно был включен Caryophyllaceae-тип
эмбриогенеза. В типах, предложенных Chiarugi, базальная клетка принимает
участие в образовании органов зародыша, тогда как в Caryophyllaceae-типе
она не участвует. Классификация включает пять основных типов (для
названий типов выбран немецкий вариант написания семейства, тогда
как позже в большинстве исследований стал использоваться его
латинский вариант): Cruciferen (= Cruciferae), Asteraceen (= Asteraceae),
Зародыш
495
Solanaceen (= Solanaceae), Chenopodiaceen (= Chenopodiaceae), Ca-
ryophyllaceen(= Caryophyllaceae) (см. Типы эмбриогенеза) (рис.1).
Анализируя литературу, Schnarf (1929) пришел к выводу, что у
разных видов растений, характеризующихся одним типом
эмбриогенеза, прохождение ряда стадий (например, стадии октантов) и
организация зародыша (строение отдельных ярусов, а также суспен-
зора, эпифизиса, гипофизиса) являются таксоноспецифичными (более
детально этот вопрос рассмотрен им позже — Schnarf, 1931) и могут
быть определены как модификации. Однако модификации не
получили официальный статус и, соответственно, не нашли свое
отражение в классификации. Следует подчеркнуть, что, отметив
отсутствие принципиальных различий в развитии зародыша двудольных и
однодольных растений, Schnarf тем не менее распространил
приведенные типы только на двудольные. Для однодольных типы
эмбриогенеза не были определены, несмотря на наличие подробных данных
по ряду представителей. Также они не были указаны и для таксонов
с недифференцированными зародышами в зрелом семени (кроме сем.
Orobanchaceae).
Классификация Soueges (1939b). Основу классификации составляют
широкие и детальные исследования, проведенные автором у большого
числа таксонов цветковых растений. Она является, по мнению Soueges
(1939b), эмбриогенетической классификацией эмбриономических
типов, поскольку построена с учетом основных законов эмбриогении
(Soueges 1937; см. Эмбриогения). Исследования Soueges показали, что
на поздних стадиях трудно идентифицировать все бластомеры и точно
указать их местоположение в общей системе развивающегося зародыша.
Особенно это относится к законам чисел и расположения. Поэтому
было предложено выделять эмбриогенетические группы, включающие в
себя все виды, эмбриогенез которых на протяжении первых четырех
генераций подчиняется одним и тем же законам.
Для объяснения построения классификации Soueges вводит понятие
эмбриономический тип. Им было выделено четыре категории
эмбриономических типов: 1) основные, или архетипы; 2) вторичные, или
производные; 3) налагающиеся; 4) иррегулярные.
Следует отметить, что кроме эмбриономических типов, включенных
в классификацию, Soueges выделил так называемые геометрические
типы, которые устанавливаются лишь по ориентации клеточных
перегородок в ходе сегментации проэмбрио, исходя из законов симметрии:
1) орторадиальиый (перегородки закладываются под прямым углом
друг к другу, а бластомеры располагаются вокруг продольной оси;
радиальная симметрия); 2) спиральный, или наклонный (перегородки
наклонные, а бластомеры смещены и не располагаются ярусами);
3) линейный, или параллельный (перегородки закладываются
параллельно друг к другу и перпендикулярно к оси; зародыш
цилиндрический, с осевой симметрией); 4) смешанный; 5) иррегулярный.
496
Семя
Для выделения архетипов использованы конструктивные возможности
бластомеров. Наибольшее значение в построении основных частей
зародыша Soueges придает бластомерам первой генерации (клетки са и
cb). В дальнейшем, по его мнению, идет, с одной стороны, увеличение
числа клеток, а с другой — более дробная гистогенная дифференциация,
при этом после четвертой генерации трудно обнаружить признаки,
характеризующие тип. При выделении архетипов основными являются
законы происхождения и назначения, действующие с первой генерации.
Другие законы используются в случае четких типов для сравнения числа
бластомеров и ярусов, начиная со второй генерации.
Вторичные типы представляют собой модификации архетипов. В
основе их выделения лежат признаки, связанные с явлением
конвергенции и проявляющиеся в разной скорости делений (например, у
исследованных видов Nicotiana после третьей генерации зародыш
состоит из шести клеток в четыре яруса, а у Hyoscyamus — из восьми
клеток в шесть ярусов), разном времени дифференциации бластомеров
(например, гипофизарной клетки), в различной ориентации клеточных
перегородок в ходе развития, в различном строении отдельных
структур зародыша (например, подвеска). Хотя значение этих признаков не
велико, тем не менее большая скорость сегментации бластомеров с
самых первых стадий развития и более ранняя реализация их
конструктивных возможностей, по мнению Soueges, могут быть
интерпретированы как эффект акселерации в онтогенезе.
Налагающиеся типы характеризуются тем, что эмбриогенез
начинается в соответствии с определенными архетипами и производными
типами. Затем в развитии зародыша появляются черты других
архетипов и производных типов.
Иррегулярные типы могут быть различными. Во-первых, сюда
относятся типы эмбриогенеза, в которых отсутствуют четкие
закономерности. В таких типах деления клеток сопровождаются
образованием наклонных перегородок, а бластомеры зародыша не
располагаются в виде четко выраженных ярусов. Во-вторых, к категории
иррегулярных типов могут быть отнесены случаи, когда у
значительного числа индивидуумов одного и того же вида наблюдается
вариабельность в эмбриогенезе, вследствие чего развитие зародыша
может быть отнесено к различным архетипам или производным
типам.
В эмбриогенетическую классификацию Soueges (1939b) включил
только архетипы и налагающиеся типы. Для того чтобы можно было
точно определить место любого вида растений в соответствии с
законами развития зародыша, эмбриогенетической системе придан
вид таблицы, подобно периодической системе химических элементов
Менделеева. Она состоит из двух больших делений, или периодов:
в первом периоде законы эмбриогении относятся к зиготе, а во
втором — только к апикальной клетке (базальная клетка не
принимает участия в построении зародыша). В периоде по вертикали
Зародыш
497
расположены мегархетипы (главные среди архетипов), а по
горизонтали — эмбриогенетические группы. Используя принцип нисходящей
серии (см. Эмбриогения), в каждый период включено по 6 мегар-
хетипов. На основании особенностей строения тетрады клеток про-
эмбрио (серии А, В, С в первом периоде и А', В', С во втором)
выделены 16 эмбриогенетических групп: группы 1—8 для первого
и 9—16 для второго периодов. И, таким образом, каждый период
максимально охватывает 48 эмбриономических типов.
Первый период системы характеризуется тем, что в нем законы
эмбриогении относятся к зиготе и ее производным на протяжении
первых четырех генераций. Серии А, В, С различаются типами
строения первичных тетрад клеток проэмбрио, возникающих в результате
второй генерации: А — Т-образная тетрада, С — линейная, В —
промежуточного типа (в апикальной клетке деление наклонное, а в ба-
зальной — поперечное) (рис. 2).
В отличие от первого периода, во втором периоде законы эмбриогении
применимы только к клеточным генерациям апикальной клетки,
поскольку базальная клетка не принимает участия в построении собственно
зародыша, а образует лишь подвесок. В этом случае производные
апикальной клетки (верхняя клетка се и нижняя — cd) уподоблены дву-
клеточному проэмбрио: клетка ее конструктивно и функционально
замещает клетку са, а клетка cd — клетку cb. Переход от первого периода
ко второму периоду осуществляется посредством серии С. Она
представлена тремя подсериями (а, Ъ, с), исходя из конструктивных
возможностей клетки ее: а — клетка ее делится вертикально, с —
поперечно, Ь — наклонно. На этом основании были выделены так
называемые вторичные тетрады. В каждой подсерии могут быть два варианта
(gj, a2, bj, \>2, С], С2) в зависимости от того, как делится нижняя
производная клетки ее. Варианты а.2, b2, C2 поставлены во главу трех новых
серий А', В', С второго периода. По сути дела при выделении этих
серий повторяются общие закономерности образования тетрад, но этот
процесс поднят как бы на ступеньку выше и начинается заново от
апикальной клетки линейной тетрады серии С (рис. 2).
Следует подчеркнуть, что таблица второго порядка не является
копией первого, а представляет собой новую, следующую ступень
периодической системы эмбриономических типов. Как считает Soueges,
периодов может быть несколько, при этом сериями следующего
периода становятся варианты предыдущего периода.
Soueges рассмотрел некоторые филогенетические аспекты развития
зародыша. Серия А, характеризующаяся Т-образной тетрадой
проэмбрио, рассматривается им как исходная. В пользу этого положения
приведены следующие аргументы: 1) более поздняя дифференциация
гистогенов, поскольку продольное деление в апикальной клетке
является формирующим и приводит лишь к увеличению числа клеток, а
разделение на гистогены (ярусы I и /') происходит только после
четвертой генерации, а не после второй или третьей; 2) обнаружена у
32—828
498
Семя
примитивных двудольных растений; 3) присуща тем мегархетипам, у
которых апикальная клетка принимает незначительное участие в
построении зародыша.
В дальнейшем автор многократно возвращался к своей эмбриогене-
тической классификации эмбриономических типов. Он ввел
дополнительные понятия (проархетип, субархетип), что в определенной
степени усложнило восприятие его системы и возможность ее использования
как специалистами в области эмбриогении, так и систематиками и
филогенетиками (Soueges, 1948, 1951, 1961a-d, и др.). Отдельные
представления, положенные им в основу классификации, подверглись
критике со стороны некоторых авторов (Яковлев, 1958; Crete, 1963,
1964; Lebegue, 1966; Mestre, 1967, 1981; Батыгина, 1968, 1974,
1987; Batygina, 1969; Guignard, 1975a, b).
В отличие от Soueges (1939b), который рассматривал первый ме-
гархетип в качестве исходного (процесс эволюции зародыша
характеризовался возрастанием конструктивных возможностей апикальной
клетки, а она в этом мегархетипе образует лишь семядоли зародыша),
Яковлев (1958) считал, что примитивные мегархетипы
характеризуются большим числом возможностей и, следовательно, наиболее
примитивным является шестой мегархетип (все органы зародыша, за
исключением подвеска, возникают из апикальной клетки).
Mestre (1964) высоко оценил классификацию Soueges за
открывающиеся возможности проводить сравнительные исследования и
определять местоположение любого вновь описываемого эмбриономи-
ческого типа. Однако он считал, что эмбриономический тип
характеризует не отдельные виды и роды растений, а целые семейства,
что связано с общими закономерностями эволюции зародыша. Эту
точку зрения поддержал Lebegue (1966), утверждавший, что
несмотря на вариабельность в строении четырехклеточного проэмбрио
(на этой основе Soueges выделял различные серии), общий план
развития и строения зародыша очень часто идентичен для
представителей гомогенных семейств и даже порядков. Кроме того, он
полагал, что при выделении мегархетипов должны учитываться
конструктивные возможности не только клеток двуклеточного проэмбрио,
но и бластомеров четырех- и восьмиклеточного проэмбрио. Их
следует принимать во внимание не только во втором и последующих
периодах, когда функцию базальнои клетки гипотетически замещает
нижняя производная клетки са, но и при характеристике
мегархетипов первого периода.
Mestre (1967, 1981), кроме того, предложил сокращенный вариант
системы Soueges. Он выделил четыре периода (по горизонтали) и три
мегархетипа (по вертикали). Первый период основан на
закономерностях деления зиготы, второй — апикальной клетки, третий и
четвертый — верхней производной апикальной клетки во время третьей и
четвертой генерации. Теоретическое число периодов не ограничено, но
фактически все разнообразие, по его мнению, укладывается в рамки
О
Z.
со
У "«
СИ
<Г Г -S
*3
<ЕР
п
-3_
Г
е
Ы
I
со
So
S.i
со
О.
CD
0J
CL.
=3
со
а> *
Ю
а.
со
о
о.
э
Е
со
«9 •
СО
о.
а»
Э
(О
01
С
?
ю
О
-о
о
«1
'5
сг
«1
2
с
(0
И
»
"О
с
о
с
СП
"й
-о
■о
л
•о
о
а
а.
я
а
£
■S
(Л
в}
с
со
<да
9 •§
5
о
ii
(О
о
CD
и •
СЧ1
'с
-в}
со
f
f
»
t
о
С-
О 32 а
о. с
сз
CD
.82 "о $
Е JS
аз о
а.
аз
гэ
сг
'с
.03
СЛ
ь
£
03
сто
си
о.
е
CD
О)
.аз
I
!
l-j|
+
II
>
1
<s
a
а
32*
о U
-со
«р
(Л
3
о
СО
cti
'С
V)
I
э
о
to
Шг?
■sI3A
V) "Ч,
6tD
flj Я Я
t
та ц ц ц
2
е
«о
8
0)3
о.
о
СО
ю
о.
о
о.
=3
о
*>;
о.
=э
о
с
»•
СО
(О
о.
=9
о
ел
»•
сч!
о.
=3
£
CD
с
9)
е
со
■о
с
<£
о
л
<0
(0
с
4)
>
'-5
(Л
«
Ъ
■*з
л
о
с
0)
о
JS
(Л
о
ТЗ
с
о
с
СП
'й
•4)
-о
i
1
1
"С
•в)
СО
о.
'<
о
'Z
-0)
«о
в
О)
<3
о
о
й
«я
р
о
СП
(0
о
сага
S
сэ
«9 •
СП
Е
X
о
С <U
О "О с UJ
Q2 £т, <*= g
CD
-о
С
ос
с_
О
х J2 -о
СО
CD
О.
то
СП
05
•а
-1
fe"S
>1
<0
я
о.
Зародыш
501
двух первых периодов. Мегархетипы установлены по конструктивным
возможностям апикальной и базальной клеток в образовании стебля и
корня зародыша: А — стебель и корень возникают из производных
клетки cb, С — оба формируются из клетки са, В — са образует
стебель, a cb — корень. В мегархетипе В выделены два субархетипа
в зависимости от того, весь гипокотиль (Вг) или только его большая
часть (В/) образуется из апикальной клетки.
Guignard (1974, 1975а, Ь) на основании изучения особенностей
возникновения апексов побега и зародышевого корня пришел к
выводу, что способ развития зародыша очень сходен у большинства групп
цветковых растений. Вследствие этого, по его мнению, особенности
эмбриогенеза могут быть использованы лишь для уточнения
родственных взаимосвязей, а не для характеристики крупных
таксонов.'Исследование эмбриогенеза у представителей однодольных и некоторых
двудольных растений (например, Fabaceae) привело его к заключению,
что мегархетипы I,V,VI должны быть исключены из системы Soueges,
поскольку в мегархетипе I (однодольные) в образовании апекса побега
принимает участие не клетка cb, а клетка са, а в V и VI мегархетипах
(Fabaceae) клетка cb принимает участие не только в построении
подвеска (мегархетип VI) или подвеска и корневого чехлика (V), но и
апекса корня.
Классификация Johansen (1945, 1950). Эта классификация
представляет собой трансформированный вариант классификации Schnarf
(1929). Johansen изменил названия типов эмбриогенеза, так как считал
не совсем верным совпадение названий типов и семейств. Он
предложил сохранить в названии типа только корень латинского названия
семейства и добавить к нему суффикс ad (= к, до), т.е. буквально
тип эмбриогенеза, относящийся к семейству. Кроме того, название
Cruciferae-типа было им заменено на Onagrad-тип, исходя из
представлений Soueges (1937) о том, что в основу описания Cruciferae-типа
следует положить эмбриогенез не Capsella bursa-pastoris, наиболее
излюбленного эмбриогенетического объекта, a Oenothera biennis, так как
у последнего зародыш, и особенно повесок, более прост по строению.
Эмбриогенез Capsella, no Soueges, представляет собой производный
тип, или вариацию. Классификация была дополнена еще одним
критерием — характером деления зиготы. На основании этого критерия
был выделен Piperad-тип эмбриогенеза (в отличие от других типов
зигота делится продольно). Следует отметить, что на потенциальную
возможность деления зиготы продольной перегородкой указывал и
Soueges (1937), однако он считал, что у цветковых растений такое
Рис. 3—5. Классификация Johansen (1950) (3); 4,5 — строение зародыша в
соответствии с классификацией Periasamy (1977) у Papaver rhoeas (4 — по
данным Soueges, 1926) и Halophila ovata (5 — по данным Swamy, Lakshmanan,
1962); (по: Natesh, Rau, 1984).
502
Тип
Деление I
Деление II
Деление Ш
Деление IV
ONAGRAD
ASTERAD
SOLANAD
CHENOPODIAD
CARYOPHYLLAD
Г\*
-ей
КЗ
cd]
rf=fe
0 I© -п
^
PIPERAD
Зародыш -^ I
деление никогда не происходит и лишь у некоторых таксонов,
например у Scabiosa succisa, наблюдается наклонное деление, близкое к
продольному.
Таким образом, классификация типов эмбриогенеза у Johansen {.lVDu;
представлена шестью типами: Onagrad, Asterad, Solanad, Chenopodiad,
Caryophyllad, Piperad (рис.3). Все многообразие способов развития
зародыша внутри типов рассматривается как вариации, при этом их
названия даны по названию родов, у представителей которых они
описаны впервые. Следует отметить, что о вариациях, а точнее
модификациях говорил еще Schnarf (1929). С другой стороны, Johansen в своей
классификации использовал принципы построения системы Soueges,
поскольку типы, по Johansen, — это по сути мегархетипы Soueges, а
вариации — это производные типы.
В классификации Johansen отсутствует единый подход для
обоснования выделения вариаций. Например, в разных типах эмбриогенеза
для этого использованы совершенно различные критерии: в Piperad-
типе _ ориентация перегородок во время второго деления, строение
подвеска и наличие семядолей; в Onagrad-типе — ярусность проэмб-
рио после третьей генерации, наличие квадрантов, октантов, эпифизи-
са, гипофизиса, строение подвеска; в Asterad-типе — различная
судьба производных базальной клетки, наличие эпифизиса и гипофизиса,
строение подвеска; в Solanad-типе — число ярусов в проэмбрио после
третьей генерации, судьба яруса 1, строение подвеска; в Chenopodiad-
типе — наличие эпифизиса, особые деления средней клетки; в Сагу.о-
phyllad-типе — наличие гипофизиса и эпифизиса, строение базальной
клетки, число семядолей (см. раздел Типы эмбриогенеза).
Johansen подверг критике отдельные положения классификации
Soueges (1939b): 1) система носит абстрактный характер; 2) в
классификацию включены только изученные Soueges виды.^ хотя к тому
времени имелось большое число детальных исследований других
авторов по эмбриогенезу; 3) хорошо изучен генезис только проэмбрио;
4) для практических целей эмбриогении, систематики и филогении
наиболее четко распознаются только типы и вариации; 5) не учтена
специфика развития зародышей с продольным делением зиготы;
6) вызывает сомнение необходимость выделения серий А и В в
первом периоде, при этом не приведены примеры растений серии Б
второго периода. На все эти замечания Soueges (1961e) дал в
дальнейшем развернутые ответы.
Рядом авторов в дополнение классификации Johansen (1950) были
предложены еще несколько оригинальных типов развития зародыша.
Один из них — Paeoniaceae-, или Paeoniad-тип (Яковлев, 1951,
1958, 1983а; Яковлев, Иоффе, 1957а, б, 1961), — характеризуется
наличием ценоцитной стадиии развития проэмбрио и формированием на
его основе большого числа зародышеподобных структур, одна из
которых развивается в хорошо дифференцированный половой зародыш.
Батыгиной дается иная трактовка Paeoniad-типа эмбриогенеза. Соглас-
504 Семя
но ее представлениям (Batygina, 1989c, 1994; Batygina et al., 1992b;
Brukhin, Batygina, 1994; см. также Paeoniad-тип эмбриогенеза),
в семени пионов происходит последовательное формирование двух
типов зародышей: полового (его развитие заканчивается на стадии
заложения протодермы в ценоцитно-клеточной структуре) и
соматического (образуется из клеток протодермы). В зрелом семени зародыш
является не половым, а соматическим. Другой, Graminad-, или
Poad-тип (Батыгина, 1968а, 1974, 1987), выделен на основании
наклонного положения перегородок в раннем периоде формирования
зародыша и специфики органогенеза на последующих этапах его
развития (см. Graminad-тип эмбриогенеза). Батыгиной было поставлено
под сомнение распространенное положение о полном сходстве
начальных фаз эмбриогенеза и высказано впервые положение о различии в
развитии зародышей некоторых однодольных и двудольных растений.
Таким образом, классификация типов эмбриогенеза в настоящее время
включает 8 типов (Батыгина, 1974).
Была предложена еще одна классификация типов эмбриогенеза (Ru-
tishauser, 1969), которая и по форме, и по содержанию является
комбинацией представлений Schnarf (1929) и Johansen (1950).
Классификация Yamazaki (1974, 1982). Она основана главным
образом на закономерностях дифференциации инициалей корня и гипоко-
тиля и относится только к двудольным. Используя преимущественно
данные исследований Soueges, выделены шесть основных типов
эмбриогенеза: Asterad, Geraniad, Onagrad, Polygonad, Solanad,
иррегулярный (рис. 6). В ряде типов отмечены вариации. Хотя некоторые
названия типов (Asterad, Onagrad, Solanad) заимствованы из
классификации Johansen (1950), их диагностика иная:
— инициали корня дифференцируются из производных базальной
клетки: за счет клетки т — ярус т из нескольких слоев, нижний
слой дает начало инициалям корня, а верхний — гипокотилю (Poly-
gonad-тип); ярус т многослойный, клетки верхних слев представляют
собой инициали коры корня, а нижних — инициали корневого чехлика
и часть подвеска (Geraniad-тип; в случае двуслойного строения яруса
m дифференцируются только инициали коры корня и корневого
чехлика — Myrtus-вариация); ярус т однослойный, инициалями корня
становятся верхние (гипофизарные) клетки, отделяющиеся в результате
поперечных делений (Onagrad-тип; клетки яруса т могут делиться
сначала продольно, а затем поперечно — Ruta-вариация); за счет
клетки ci — инициали корня дифференцируются из клеток яруса п,
верхней производной клетки ci (Asterad-тип);
— инициали корня дифференцируются из производных апикальной
клетки: ярус cd из двух слоев, верхние клетки становятся инициалями
гипокотиля, а нижние — инициалями корня (Solanad-тип);
— иррегулярный тип характеризуется отсутствием закономерностей
дифференциации инициалей корня.
Зародыш
505
v l,- MQR2V I — Polygonad-тип, II — Solanad-тип,
р„е. б^К-сс^Ц^-bJ^J^ vVS_ 0nagrad.THn (A _.Ruta.
вариация, В — Onagrad-вариация).
506
Семя
Yamazaki считал тип формирования инициалей корня относительно
стабильным признаком, который может характеризовать семейства и
даже целые порядки. Например, Geraniad-тип: Betulaceae, Calycanthaceae,
Geraniaceae, Magnoliaceae, Menispermaceae, Vitaceae; Asterad-тип: As-
teraceae, Malvaceae, Moraceae, Sterculiaceae, Valerianaceae, Urticaceae;
Onagrad-тип: Brassicaceae, Campanulales, Datiscaceae, Onagraceae, Re-
sedaceae, Scrophulariales; Polygonad-тип: Apiaceae, Caryophyllaceae, Che-
nopodiaceae, Polygonaceae, Primulaceae, Saururaceae, Salicaceae; Sola-
nad-тип: Caprifoliaceae, Gentianaceae, Plumbaginaceae, Rubiaceae, Sola-
naceae; Иррегулярный тип: Adoxaceae, Buxaceae, Dipsacaceae, Pipera-
ceae, Violaceae.
Классификация Periasamy (1977). Periasamy подверг критике
существующие к тому времени классификации (Schnarf, 1929; Soueges,
1939b; Johansen, 1950), основанные на закономерностях формирования
проэмбрио. По его мнению, критерии, положенные в основу этих
классификаций, выбраны достаточно произвольно. Он считал, что в
процессе эмбриогенеза изменяется соотношение поверхности к объему
клеток и важным морфогенетическим событием, свидетельствующим об
изменениях в строении проэмбрио, является формирование первой
внутренней клетки. В результате этого в проэмбрио дифференцируются
две группы клеток (наружные и внутренние), развивающиеся
самостоятельными путями.
Классификация зародышей включает группы, серии и вариации, при
этом каждая ступень иерархии имеет свой критерий: число клеточных
ярусов в проэмбрио, когда начинается дифференциация внутренних
клеток (группы), расположение ярусов с изменяющимся числом клеток
(серии), расположение ярусов, в которых формируются первые
внутренние клетки (вариации).
Ярус проэмбрио определен как слой, возникающий на базе одной
клетки, делящейся продольно. На поперечном срезе число клеток
должно быть не менее четырех, а после отделения внутренних
клеток -— не менее восьми. Подвесок считается как один ярус, и
границей между ним и собственно зародышем служит клетка, не
претерпевающая продольное деление. Выделение первой внутренней
клетки может произойти, когда проэмбрио состоит не менее чем из
двух ярусов, и завершается дифференциация внутренних клеток после
достижения шести ярусов. Исходя из этого, Peryasamy определяет
пять групп строения зародыша. В зависимости от числа клеток в
терминальном слое (четыре, восемь или больше четырех, но меньше
восьми) им выделены серии: в первой группе — три, во второй —
пять, третьей-пятой — шесть. Вариации касаются выделения
внутренних клеток в терминальном (вариация 1) или субтерминальном
(вариация 2) ярусах. Они отсутствуют в первой группе и первой серии
других групп.
Строение зародыша у любого изучаемого растения в случае
регулярного эмбриогенеза можно охарактеризовать с помощью трех
Зародыш
507
цифр — эмбрионального индекса: номер группы (1—5), номер серии
(1—6) и номер вариации (1—2) (рис. 4, 5). Автором приведен
список 50 видов растений, представляющих 23 из возможных 45
вариантов строения зародыша двудольных и однодольных. Эмбриональный
индекс, например, у Trifolium minus — 121, т. е. строение зародыша
укладывается в первую группу, вторую серию и первую вариацию. У
Lactuca sativa он выражается как 351 (третья группа, пятая серия и
первая вариация), а у Gentiana asclepiadea — 532 (пятая группа,
третья серия и вторая вариация).
Таким образом, в настоящее время существует несколько
классификаций типов эмбриогенеза, основанных на различных критериях.
Большинство из них объединяет единый подход к созданию —
генеалогический, согласно которому развитие зародыша характеризуется
закономерностями, позволяющими уже в проэмбрио выявить
компетентные клетки, дающие в дальнейшем определенные органы зрелого
зародыша. В отличие от классификаций, основанных на
генеалогическом подходе, классификация Periasamy (1977) основана на морфоге-
нетическом подходе, который, несомненно, является оригинальным и
перспективным. По мнению Periasamy, строение зрелого зародыша,
исходя из инициалей на 8- или 16-клеточной стадии развития, по-
видимому, основано больше на топографическом соответствии, чем на
действительном доказательстве происхождения этих частей зародыша
из определенных инициалей. Однако классификация Periasamy трудна
для восприятия, а выделение групп, серий и вариаций в строении
зародыша весьма условно.
Создание морфогенетической классификации типов эмбриогенеза,
охватывающей существующее многообразие развития и строения
зародыша, — дело будущего. Несмотря на ряд определенных трудностей
в применении классификаций для понимания эволюционных проблем
эмбриогении, следует отметить, что наиболее простым и чаще
используемым вариантом является классификация Johansen (1950).
Предлагаемые типы, а иногда и вариации эмбриогенеза используются в
сравнительно-эмбриологических исследованиях при решении вопросов
систематики и филогении. Кроме того, тип эмбриогенеза, как правило,
характеризуется четкими закономерностями в прохождении первых
стадий в развитии зародыша (зиготы, дву- и четырехклеточного
проэмбрио, квадрантов, октантов), что можно также использовать как
контроль при изучении физиологических и молекулярно-генетических
аспектов эмбриогенеза.
В настоящем издании использована классификация Johansen (1950),
согласно которой даны описания всех выделяемых типов и вариаций
эмбриогенеза. В дополнение к предложенным вариациям официальный
статус получила типовая вариация, характеризующаяся, по Johansen,
теми же особенностями, что и собственно тип эмбриогенеза.
508
Семя
Батыгина, 1968а, 1974, 1987; Яковлев, 1951, 1958, 1983а; Яковлев, Иоффе, 1957а, б,
1961; Batygina, 1969, 1989с, 1994; Batygina et. al., 1992; Brongniart, 1830; Brukhin,
Batygina, 1994; Carano, 1913, 1915; Chiarugi, 1925; Crete, 1963, 1964; Guignard, 1974,
1975a, b; Hanstein, 1870; Hofmeister, 1849, 1859; Johansen, 1945, 1950; Lebegue, 1966;
Mastre, 1967, 1981; Meyen, 1840; Natesh, Rau, 1984; Norner, 1881; Periasamy, 1977;
Rutishauser, 1969; Schacht, 1850; Schleiden, 1839; Schnarf, 1929, 1931; Soueges, 1922a,
1924c, 1936d, 1937, 1939b, 1948, 1951, 1961a-e; Swamy, Lakshmanan, 1962a; Trevi-
ranus, 1815; Vallade, 1989; Wardlow, 1955; Westermaier, 1876; Yamazaki, 1974, 1982.
ТИПЫ ЭМБРИОГЕНЕЗА
PIPERAD-ТИП ЭМБРИОГЕНЕЗА характеризуется продольным или
наклонным положением клеточной перегородки при делении зиготы,
крестообразным («глобулярным», по Johansen) типом тетрады клеток
проэмбрио и равной степенью участия производных клеток са и сЪ в
образовании зародыша; гистогенная дифференциация зародыша в
зрелом семени ограничена вычленением эмбриодермы, суспензор и
семядоли, как правило, не формируются или рудиментарные.
Впервые тип выделен Johansen (1945, 1950) на основании
исследований эмбриогенеза у Peperomia pellucida (Johnson, 1900b; Fisher,
1914) и назван по сем. Piperaceae, к которому принадлежит род
Peperomia. Особенности эмбриогенеза этого вида положены в основу
характеристики данного типа (его типовой вариации).
Исследования других представителей рода Peperomia (P. blanda,
P. eburnea, P. maculosa и P. obtusifolia) подтвердили наличие этого
типа в сем. Piperaceae (Никитичева и др., 1981) и дополнили его
характеристику. Nikiticheva (1981) предложила называть данный тип
Peperomia-типом, поскольку род Peperomia выделяется рядом авторов
в самостоятельное сем. Peperomiaceae. Piperad-тип эмбриогенеза
характерен и для других родов сем. Piperaceae (Никитичева, 19816).
Иногда наблюдается поперечное (Peperomia) деление зиготы, что не
изменяет, однако, дальнейшего хода эмбриогенеза. Суспензор слабо
выражен у Heckeria и Piper и отсутствует у Peperomia. В зрелом
семени зародыш глобулярный, не дифференцированный на органы
(Peperomia) или с зачатками семядолей (Piper, Macropiper)
(Никитичева, 19816). У Peperomia peruviana и P. parvifolia отмечено
явление гетерокотилии, выявленное на стадии проростка (Hill, 1906,
1908).
В тип Piperad включены все известные случаи развития зародыша,
когда зигота делится продольной либо близкой к ней наклонной
перегородкой. Piperad-тип эмбриогенеза отмечен также в семействах Ra-
nunculaceae (Babis, 1976), Fagaceae (Brown, Mogensen, 1972), Leit-
neriaceae (Johansen, 1950 — по данным Pfeifer, 1912), Cynomoriaceae
(Терёхин и др., 1975), Viscaceae (Терёхин, 1987) и Orchidaceae
(Савина, 1990).
Зародыш
509
Специфические особенности эмбриогенеза у представителей других
семейств, у которых зигота делится продольно, позволили выделить в
данном типе кроме типовой еще три вариации — Balanophora, Sca-
biosa и Dendrophtoe. Их характеристики в настоящее время
дополнены и откорректированы в связи с появившимися новыми данными.
Balanophora-вариация описана на основании особенностей
эмбриогенеза у Balanophora dioica (Ecambaram, Panjie, 1935):
зигота делится продольно, каждая дочерняя клетка двуклеточного
проэмбрио делится также продольно, но клеточные стенки изогнуты
так, что обоими концами касаются первоначальной стенки; клетки
квадрантов делятся периклинально, вычленяя эмбриодерму; зародыш
не дифференцирован на органы, число клеток сильно редуцировано.
Исследование эмбриогенеза у В. fungosa subsp. indica var. indica
(Терёхин, Яковлев, 1967; Терёхин, 1977) подтвердили уникальность
типа развития зародыша в сем. Balanophoraceae. Однако авторы
отметили, что ориентация деления зиготы не фиксирована, а плоскости
деления клеток двуклеточного проэмбрио располагаются всегда
перпендикулярно плоскости деления зиготы, развитие зародыша завершается
также на третьей клеточной генерации, хотя клетки эмбриодермы
могут еще делиться антиклинально. По мнению одного из авторов
(Терёхин, 19876), развитие зародыша Balanophora не укладывается в
существующие классификации типов эмбриогенеза покрытосеменных
растений.
Scabiosa-вариация описана по данным исследований эмбриогенеза у
Scabiosa succisa (Soueges, 1937a) и дополнена более полными
сведениями по развитию зародыша у других представителей сем. Dipsa-
caceae (Soueges, 1957, 1963а, Ь; Камелина, 1977, 1979, 1980):
зигота делится с заложением первой клеточной перегородки
вертикально, наклонно или почти горизонтально, клеточные стенки при двух
последующих делениях в каждой дочерней клетке двуклеточного
проэмбрио поперечные и перпендикулярны (реже наклонны) к
первоначальной стенке. Тетрада глобулярная, дальнейшие деления часто
нерегулярные; характерна поздняя гистогенная дифференциация зародыша;
суспензор образуется, иногда рудиментарный. Данная вариация
характеризуется наличием дифференцированного на органы зрелого
зародыша. У Cephalaria gigantea производные клеток са и cb участвуют в
образовании зародыша не совсем в равной степени, и развитие
последнего идет по следующей схеме:
са = 1/2рсо + l/2pvt + 1/2рЬу
сЬ — i/2pco + l/2pvt + l/2pby + ice + iec + со + s.
Развитие зародыша, соответствующее Scabiosa-вариации, описано
у отдельных представителей семейств Lauraceae (Johansen, 1950 — по
данным Cow, 1928) и Valerianaceae (Шугаева, 1985).
510
Семя
Dendrophtoe-вариация выделена, исходя из особенностей
эмбриогенеза у представителей сем. Loranthaceae:
зигота делится продольно; и зигота, и двуклеточный проэмбрио
значительно удлиняются; следующие деления поперечные, проэмбрио
двурядный, нитевидный; собственно зародыш образуется из пары
терминальных клеток, длинный подвесок дву-, иногда трех-шестирядный,
часто спирально скрученный. Как и в Scabiosa-вариации, зародыш в
семени дифференцирован на органы, но с редуцированным корнем.
Следует отметить, что при выделении данной вариации Johansen
учитывал также и такой признак, как образование в семени
многочисленных проэмбрио (за счет процессов ложной полиэмбрионии — Dixit,
1958), в отличие от остальных вариаций, при которых это явление не
наблюдалось.
Последующие работы подтвердили наличие этой вариации в сем.
Loranthaceae (Никитичева, Анисимова, 1987). Сходным является
развитие зародыша у представителя сем. Viscaceae — Eubrachium ambi-
сиит (Bhandari, Indira, 1969), которое, однако, отличается тем, что
первое деление зиготы поперечное.
Piperad-тип эмбриогенеза и его вариации имеют ограниченное
распространение и встречаются в порядках, расположенных ближе к
основанию системы, или в высокоспециализированных (Santalales, Bala-
nophorales). Только Scabiosa-вариация отмечена в продвинутой группе
спайнолепестных, в порядке Dipsacales. Рис. 41.
Камелина, 1977, 1979, 1980; Никитичева, 19816; Никитичева, Анисимова, 1987;
Никитичева и др., 1981; Савина, 1990; Терёхин, 1977, 1987в; Терёхин, Яковлев,
1967; Терёхин и др., 1975; Шугаева, 1985; Babis, 1976; Bhandari, Indira, 1969;
Bhandari, Nanda, 1968a, b; Brown, Mogensen, 1972; Cow, 1928; Dixit, 1958; Ecam-
baram, Panjie, 1935; Fisher, 1914; Hill, 1906, 1908; Johansen, 1945, 1950; Johnson,
1900b; Narayana, 1958a,b; Nikiticheva, 1981; Pfeifer, 1912; Soueges, 1937a, 1957,
1963a, b.
ONAGRAD-ТИП ЭМБРИОГЕНЕЗА характеризуется заложением
поперечной клеточной перегородки при делении зиготы, Т-образным
расположением клеток четырехклеточного зародыша и образованием
основных его структур из производных апикальной клетки, а подвеска и
гипофизиса из базальной клетки двуклеточного проэмбрио.
Название Onagrad-тип эмбриогенеза ввел Johansen (1950) вместо
предложенного ранее Cruciferae-типа (Сагапо, 1915). Johansen описал
тип на основании ревизии данных по эмбриогенезу у некоторых
представителей сем. Onagraceae — Oenothera biennis, Circaea pacifica, Go-
detia amoena (Soueges, 1920d; Johansen, 1934, 1950) и др. В
настоящее время Onagrad-тип эмбриогенеза установлен у представителей 88
семейств как двудольных, так и однодольных растений (см.
«Сравнительная эмбриология цветковых растений», 1981 —1990). Среди них
такие виды, как Capsella bursa-pastoris и Arabidopsis thaliana
(Brassicaceae), являющиеся модельными объектами для эмбриологичес-
Зародыш
511
ких и генетических исследований (Hanstein, 1870; Westermaier, 1876;
Фаминцын, 1879а; Schaffner, 1906; Soueges, 1914а, Ь, 1916, 1919;
Яковлев, Алимова, 1976; Meinke, 1985, 1992; Laux, Jurgens, 1994;
Jurgens, Mayer, 1994; Holding et al, 1994), а также целый ряд
хозяйственно-ценных — зернобобовых (гречиха, фасоль, соя),
овощных (капуста, горчица, репа, редис, редька), тыквенных (арбуз,
кабачки, лагенария, люффа), кормовых (люпин, эспарцет, лядвенец), —
и сорных растений (заразиха).
Общая схема Onagrad-типа эмбриогенеза:
са = рсо + pvt + phy + ice
cb — ice + со + s.
В Onagrad-типе Johansen (1950) выделил 16 вариаций: типовая
(собственно Onagrad-тип), Alyssum, Capsella, Catalpa, Euphorbia,
Heloniopsis, Juncus, Lilium, Lotus, Lythrum, Mentha, Myosurus, Ru-
ta, Sonerila, Trifolium, Veronica. Эти вариации выделены на основе
следующих критериев: наличие или отсутствие стадий октантов, эпи-
физиса, гипофизиса, число ярусов в зародыше после третьей
генерации, особенности генезиса гипофизарной клетки и подвеска. Однако,
на наш взгляд, при характеристике некоторых вариаций используется
не весь комплекс предложенных критериев, что затрудняет проведение
сравнительного анализа характеристик вариаций, а также заставляет
усомниться в целесообразности выделения некоторых из них. Наиболее
отчетливыми являются вариации, различающиеся особенностями
возникновения гипофизарной клетки и подвеска.
Типовая вариация: гипофизарной клеткой становится
непосредственно клетка т, производные клетки ci образуют короткий (дву-, трех-
клеточный) подвесок. Характерна для представителей сем. Onagraceae
и др. (Johansen, 1930a, Ь, 1931а, Ь, 1932, 1934; Soueges, 1935b; Le-
begue, 1954, 1955).
Myosurus-вариация отличается от типовой одно-, двурядным, более
или менее длинным подвеском. Характерна для семейств Ranuncula-
ceae, Magnoliaceae, Berberidaceae, Phytolaccaceae, Capparaceae, Morin-
gaceae, Elaeagnaceae и др. (Crata, 1951b, 1952; Phouphas, 1952; Ly
Thi Ba et al., 1970; Yamazaki, 1975; Dutt, 1978).
Capsella-вариация: гипофизарной клеткой становится верхняя
производная клетки т. Клетка ci не делится, становится более или менее
пузыревидной и вместе с нижними производными клетки m образует
длинный однорядный подвесок. Характерна для семейств Brassicaceae,
Capparaceae, Datiscaceae и др. (Raghavan, 1937; Crete, 1952;
Родионова, 1966, 1983а, б; Яковлев, Алимова, 1976; Mansfield, Briarty,
1991).
Juncus-вариация отличается от Capsella-вариации тем, что подвесок
короткий, дву-, трехклеточный. Характерна для семейств Juncaceae,
512
Семя
Cyperaceae, Centrolepidaceae и др. (Juguet, 1969; Шамров, Анисимова,
1993а, б; Nijalingappa, Tejavathi, 1977).
Lythrum-вариация отличается от Capsella- и Juncus-вариаций тем,
что клетка ci делится. Подвесок вариабельный по числу клеток и их
строению. Характерна для семейств Begoniaceae и Vahliaceae (Ragha-
van, Srinivasan, 1942; Swamy, Parameswaran, 1960).
Из вариаций, выделенных на основании других признаков, следует
отметить Trifolium-вариацию, которая характеризуется заложением
наклонных перегородок в апикальной и базальнои клетках, а также в их
производных на ранних стадиях развития. Характерна для семейств
Lauraceae, Fagaceae, Caricaceae, Fabaceae, Apocynaceae, Arecaceae и
др. (Johansen, 1950; Goursat, 1969).
Позднее в Onagrad-типе был описан еще ряд вариаций. Philydrum-
вариация предложена на основании особенностей заложения
перегородок при делении апикальной клетки: первое и второе деления не
являются строго медианными и приводят к образованию неравных
клеток. Характерна для сем. Philydraceae (Kapil, Walia, 1965). Му-
riophyllum-вариация выделена на основе особенностей возникновения
и строения подвеска. Он представлен двумя сильно разросшимися
пузыревидными клетками (с крупными полиплоидными ядрами),
которые образуются в результате продольного деления клетки сЪ.
Характерна для Haloragis micrantha из сем. Haloragaceae (Nijalingappa,
1975).
Терёхин и Никитичева (1981) при изучении представителей сем.
Orobanchaceae описали 8 вариаций: Aeginetia, Boschniakia, Chris-
tisonia, Cistanche, Diphelypaea, Epifagus, Mannagettaea, Orobanche.
При их выделении учитывались такие признаки, как ориентация
перегородок в апикальной клетке двуклеточного проэмбрио и клетках
этажа /, а также степень дифференциации инициалей гипокотиля и
зародышевого корня. Рис. 42.
Анисимова, 1983; Никитичева, 1971; Родионова, 1966, 1983а, б; Терёхин, Никитичева,
1981; Фаминцын, 1879а; Шамров, Анисимова, 1993а, б; Яковлев, Алимова, 1976;
Jergens, Mayer, 1994; Carano, 1915; Crete, 1951b, 1952; Dutt, 1978; Goursat, 1969;
Hanstein, 1870; Holding et al., 1994; Johansen, 1930a, b, 1931a, b, 1932, 1934, 1950;
Juguet, 1969; Kapil, Walia, 1965; Laux, Jiirgens, 1994; Lebegue, 1954, 1955; Ly Thi Ba
et al., 1970; Mansfield, Briarty, 1991; Meinke, 1985, 1992; Nijalingappa, 1975;
Nijalingappa, Tejavathi, 1977; Phouphas, 1952; Raghavan, 1937; Raghavan, Srinivasan, 1942;
Schaffner, 1906; Soueges, 1914a, b, 1916, 1919, 1920d, 1933, 1935b; Swamy,
Parameswaran, 1960; Westermaier, 1876; Yamazaki, 1975.
ASTERAD-ТИП ЭМБРИОГЕНЕЗА характеризуется заложением
поперечной клеточной перегородки при делении зиготы, Т-образным, как
правило, расположением клеток в четырехклеточном проэмбрио и более
или менее равным участием производных апикальной и базальнои клеток
двуклеточного проэмбрио в построении собственно зародыша.
Зародыш 513
Впервые был установлен Carano (1913, 1915) как Asteracee-тип на
основе данных по эмбриогенезу различных представителей сем. Aste-
raceae (Bellis perennis, Calendula arvensis, Helianthus annuus, Cicho-
rium intybus). Позднее, с учетом результатов работ Soueges (1920c,
1923а) по видам из этого же и других семейств, данный тип был
подтвержден в системах Chiarugi (1925) и Schnarf (1929) (Asteraceae-
и Astereen-типы, соответственно). В настоящее время данный тип
эмбриогенеза обнаружен у представителей 66 семейств двудольных и
16 — однодольных растений (см. «Сравнительная эмбриология
цветковых растений», 1981—1990). Среди них такие важные в
экономическом отношении растения, как подсолнечник, хлопчатник и многие
другие.
Схема эмбриогенеза Asterad-типа:
са = рсо + pvt
cb — phy + ice + iec + со + s.
В типе Asterad Johansen (1950) выделял 10 вариаций — Senecio,
Geum, Erodium, Polygonum, Urtica, Lamium, Oxalis, Muscari, Poa
и Репаеа. Основные критерии выделения этих вариаций следующие:
способ образования октантов и наличие этажей / и /', наличие или
отсутствие эпифизиса и гипофизиса, степень участия производных
клеток т и п в образовании тканевых зон гипокотиля и зародышевого
корня, особенности формирования и строения суспензора.
В качестве типовой вариации Asterad-типа Johansen приводит Sene-
cio-вариацию, описанную впервые у Senecio vulgaris (Asteraceae)
(Soueges, 1920c). У данного вида зигота делится поперечно с образованием
двуклеточного проэмбрио. В результате продольного деления
апикальной клетки и поперечного — базальнои формируется четырехклеточ-
ный проэмбрио Т-образного типа. Производные клетки са, делясь
продольно, образуют квадранты (ярус q). Характерной особенностью
строения зародыша при переходе к следующей стадии развития
является диагональное расположение клеточных стенок, разделяющих
клетки-квадранты, в результате чего октанты и этажи / и /' в их
классическом понимании не образуются. Поведение производных базальнои
клетки — клеток т и ci несколько различно: клетка т дает средний
ярус т, клетки которого далее делятся продольно, клетка ci несколько
раз делится поперечно с образованием расположенных линейно, друг
под другом, клеток п, п, о и р. В ходе дальнейшего развития в
ярусах q и т происходит отделение кнаружи слоя клеток эмбриодермы
путем периклинальных перегородок. Производные яруса q дадут в
дальнейшем семядоли и точку роста, яруса m — верхнюю часть
гипокотиля. Производные клетки п являются инициальными для
формирования коры корня, клетки о — чехлика и дерматогена, клетка р
дает начало суспензору. Следует отметить, что типовая вариация
Asterad-типа характеризуется отсутствием четко выраженной гипофи-
33-828
514
Семя
зарной клетки. Данная вариация обнаружена и у некоторых других
представителей семейства Asteraceae, а также Menyanthaceae, Apocy-
пасеае.
Вариации Urtica, Lamium и Oxalis, как и Senecio-вариация,
характеризуются наличием диагональных перегородок, разделяющих
квадранты на октанты, отсутствием четко выраженных гипофизиса и эпи-
физиса, но различаются долей участия производных клетки т в
формировании гипокотиля и корня. Urtica-вариация встречается,
главным образом, у представителей семейств Urticaceae и Bombacaceae,
Lamium-вариация — у Lamiaceae и Valerianaceae, Oxalis-вариация —
у Oxalidaceae, Monimiaceae, некоторых Asteraceae.
Polygonum-вариация выделяется среди остальных вариаций Asterad-
типа наличием классических октантов, четко выраженных этажей I и
/' (производных яруса q) и гипофизиса. Эта вариация отмечена
у представителей семейств Polygonaceae, Ceratophyllaceae, F ouquieria-
ceae, Combretaceae, Rutaceae, Asteraceae, Arecaceae.
Geum- и Erodium- вариации характеризуются, в первую очередь,
дифференциацией особой клиновидной эпифизарной клетки, которая
образуется в результате деления наклонной перегородкой клетки са
двуклеточного проэмбрио. Основное отличие этих двух вариаций
друг от друга — в степени участия производных клетки п в
построении суспензора (при Geum-вариации участвуют, при Erodium —
не участвуют) и наличии гипофизарной клетки (при Geum —
отсутствует, при Erodium — имеется). Развитие зародыша в
соответствии с Geum-вариацией происходит у представителей семейств
Pittosporaceae, Rosaceae, Cneoraceae, Vitaceae, Adoxaceae и других,
в соответствии с Erodium-вариацией — Geraniaceae, Combretaceae,
Thymelaeaceae.
Согласно Johansen, Penaea-вариация отличается от всех остальных
вариаций, главным образом, отсутствием четко выраженного
суспензора и примерно равным участием производных клеток са и cb в
построении тела зародыша. Исходя из описаний некоторых авторов
(Cook, 1902; Joshi et al., 1967; Soueges et al., 1967), характеристика
этой вариации может быть дополнена такими признаками, как
наклонное положение клеточной стенки при делении зиготы,
«глобулярный» (крестообразный или изобилатеральный) тип тетрады,
характерное взаиморасположение клеток га и ci четырехклеточного
проэмбрио (не друг под другом, а бок о бок) и вариабельность
(иррегулярность) клеточных делений после стадии квадрантов. Репаеа-
вариация обнаружена у представителей семейств Penaeaceae, Nym-
phaeaceae, Cabombaceae, Melianthaceae, .Biebersteiniaceae и некоторых
Caprifoliaceae.
Muscari- и Роа-вариации выделены Johansen для зародышей
однодольных растений на основании результатов работ Soueges (1924b,
1932). В обеих вариациях производные клетки са дают начало лишь
семядоле, тогда как точка роста образуется за счет клеток этажа
Зародыш
515
т. Различия между этими двумя вариациями начинают проявляться
в третьей клеточной генерации и состоят в неодинаковой степени
участия производных клеток т, п и о в образовании органов
зародыша. При Muscari-вариации ряд т, кроме точки роста, дает
начало гипокотилю, при Роа-вариации — также инициалям
центрального цилиндра, коры корня и частично колеоптилю. Однако
выделение Muscari- и Роа-вариаций является предметом дискуссии.
Исследования ряда авторов (Haccius, 1952; Guignard, 1961; Haccius,
Lakshmanan, 1966; Батыгина, 1968а, 1974, 1987; Guignard, Mestre,
1969, 1971) показали, что точка роста в зародыше злаков и других
однодольных в целом возникает за счет производных клетки са, а
не cb, как считали Soueges и Johansen (см. также Graminad-тип
эмбриогенеза).
На основании некоторых особенностей развития зародыша у
представителей сем. Commelinaceae в Asterad-типе для однодольных
выделена еще одна вариация — Commelina (Maheshwari, Baldev, 1958;
Soueges 1958a, b; Chikkannaiah, 1962). Развитие зародыша при этой
вариации сходно с таковым при Muscari-вариации, но отличается от
последней отсутствием суспензора, «соседствующим» положением
клеток m и ci в четырехклеточном проэмбрио, делением этих двух
клеток в различных плоскостях и, как следствие, «асимметрией» в
развитии их производных, образованием всех (за исключением
семядоли) основных органов зародыша из производных клетки cb. По
мнению Батыгиной (1974), такая ориентация клеточных перегородок
в ходе первых делений в проэмбрио Commelina является проявлением
дорзовентральности ее односемядольного зародыша с самых первых
этапов развития.
Следует отметить, что перечисленные признаки свидетельствуют о
большом сходстве между Commelina- и Penaea-вариациями,
выделенными в Asterad-типе для зародышей однодольных и двудольных
растений, соответственно. Более того, у некоторых видов двудольных
растений, эмбриогенез которых относится к Penaea-вариации (Nelumbo
nucifera — Nelumbonaceae), с самых первых этапов развития
отмечена дорзовентральность строения зародыша, свойственная зародышам
однодольных растений и связанная, в частности, с наклонным
положением первых клеточных перегородок в проэмбрио (Titova, Batygina,
1996) (см. Синкотилия; Graminad-тип эмбриогенеза). С другой
стороны, большое сходство по тем же признакам имеется и между Репа-
еа-вариацией Asterad-типа, Trifolium-вариацией Onagrad-типа и Sca-
biosa-вариацией Piperad-типа, вследствие чего между ними часто
трудно провести границу (например, Lauraceae, Fagaceae, Dipsaca-
сеае). По мнению Natesh и Rau (1984), эмбриогенез видов,
характеризующихся Penaea-вариацией, требует переисследования. Очевидно,
это справедливо для всех упомянутых вариаций дискуссионного
характера. Рис. 43, 47.
33*
516 Семя
Батыгина, 1968а; 1974; 1987; Камелина, Коинова, 1990; Поддубная-Арнольди,
1976; Шамров, Батыгина, 1984; Сагапо, 1913, 1915; Chiarugi, 1925; Chikkannaiah,
1962; Cook, 1902; Guignard, 1961; Guignard, Mestre, 1969, 1971; Haccius, 1952;
Haccius, Lakshmanan, 1966; Johansen, 1950; Joshi et al., 1967; Lebegue, Poix, 1956;
Maheshwari, Baldev, 1958; Natesh, Rau, 1984; Schnarf, 1929; Soueges, 1920c, 1923a,
1924b, 1932, 1935c, 1937a, 1939a, 1958a, b; Soueges et al., 1967; Titova, Batygina,
1996.
SOLANAD-ТИП ЭМБРИОГЕНЕЗА характеризуется поперечным
положением клеточной перегородки в зиготе, линейной тетрадой клеток
проэмбрио и формированием зародыша преимущественно
производными апикальной клетки двуклеточного проэмбрио (из базальной клетки
образуются только суспензор и иногда гипофизис).
Впервые выделен как Solanaceae-тип Chiarugi (1925) на основании
работ Soueges (1920, 1921) по эмбриогенезу различных видов сем.
Solanaceae. Позднее был подтвержден как Solanaceen-тип в системе
Schnarf (1929). В настоящее время этот тип эмбриогенеза установлен
для 47 семейств двудольных (Campanulaceae, Linaceae, Papaveraceae,
Teaceae, Hydnoraceae, некоторые Rubiaceae и др.) и однодольных
(Asparagaceae, Trilliaceae и др.) цветковых растений.
Общая схема эмбриогенеза Solanad-типа:
са = рсо + pvt + phy + ice + iec
сЪ = со + s.
В классификации типов развития зародышей Johansen (1950)
выделено в Solanad-типе 8 вариаций: Hyoscyamus, Nicotiana, Physalis I,
II, III, Datura, Papaver, Sherardia, Linum, Hydnora. Критериями для
их выделения явились следующие признаки: наличие гипофизарной
клетки, особенности ее образования и характер деления, наличие эпи-
физарной клетки, особенности формирования и функционирования сус-
пензора, число клеток проэмбрио на стадии третьей клеточной
генерации. Шесть из восьми упомянутых вариаций встречаются в пределах
сем. Solanaceae.
В качестве типовой вариации Solanad-типа можно привести
развитие зародыша у Nicotiana tabacum (Solanaceae) (Soueges, 1922). При
делении зиготы клеточная перегородка закладывается поперечно к
продольной оси зародыша. Последующие поперечные деления в каждой
из клеток двуклеточного проэмбрио приводят к формированию
линейного четырехклеточного проэмбрио. Далее происходит образование
октантов путем деления двух верхних ярусов — I и V — проэмбрио
продольными перегородками, направленными под прямым углом к
первоначальной перегородке (третья клеточная генерация), и отделение
эмбриодермы. В дальнейшем за счет производных клеток октантов
происходит образование семядолей, точки роста, гипокотиля и
зародышевого корня. Гипофизарная клетка отсутствует, а плерома и
периблема зародышевого корня образуются из самых нижних производных
Зародыш
517
яруса V. В результате поперечных, иногда продольных, делений клеток
двух нижних ярусов проэмбрио (т и ci) образуются подвесок и
корневой чехлик.
Очень близкими к Nicotiana-вариации являются Hyoscyamus- и
Physalis I-вариации, отличающиеся практически лишь числом рядов клеток
суспензора, а также вариация Datura, характеризующаяся
вариабельностью числа клеток в проэмбрио на стадии третьей клеточной генерации.
Вариации Papaver, Physalis II и Physalis III выделяются на
основании различного характера участия производных этажа I в построении
собственно зародыша. Так, в Papaver-вариации производные этажа I
образуют лишь апекс побега с предварительным обособлением эпифи-
зарной клетки (в настоящее время обнаружена у Ostrowskia magnifica,
сем. Campanulaceae — Камелина, Жинкина, 1998, в печ.). В случае
Physalis П-вариации за счет производных этажа / образуются
семядоли, точка роста и гипокотиль, a Physalis-III — также плерома и
периблема зародышевого корня.
Linum-вариация отличается от всех перечисленных вариаций
дифференциацией гипофизарной клетки.
Вариация Hydnora, обнаруженная у представителей рода Hydnora
(Hydnoraceae), выделена по наличию своеобразного линейного (15 и
более клеток) проэмбрио, образующегося прежде, чем произойдет
деление в его клетке са. Следует отметить, что очень часто выделение
вариаций в Solanad-типе затруднено в связи с невозможностью
определить характер деления клеток, что, по-видимому, обусловлено
вариабельностью положения зародыша внутри семени. Рис. 44.
Камелина, 1994; Сатарова, 1990; Bhaduri, 1936; Dnyansagar, Cooper, 1960; Hewitt,
1939; Johansen, 1950; Maheshwari, 1950; Schnarf, 1929; Soueges, 1920a, 1921a, 1922,
1924c, 1925.
CHENOPODIAD-ТИП ЭМБРИОГЕНЕЗА характеризуется поперечным
положением клеточной перегородки в зиготе, линейной тетрадой клеток
проэмбрио и формированием зародыша из производных как
апикальной (семядоли и апекс побега), так и базальной (гипокотиль,
зародышевый корень, подвесок) клеток двуклеточного проэмбрио.
Впервые был установлен как Chenopodiaceae-тип Chiarugi (1925) на
основании данных Soueges (1920) по эмбриогенезу некоторых
представителей сем. Chenopodiaceae. Позднее подтвержден как Chenopodia-
ceen-тип в системе Schnarf (1929). В настоящее время этот тип
эмбриогенеза обнаружен в 20 семействах двудольных растений
(Chenopodiaceae, Amaranthaceae, Polemoniaceae, Convolvulaceae, Bora-
ginaceae и др.).
Общая схема эмбриогенеза Chenopodiad-типа:
са = рсо + pvt + 1/2 phy
cb = 1/2 phy + ice + iec + со + s.
518
Семя
Согласно классификации Johansen (1950), в Chenopodiad-типе
выделены 3 вариации: типовая (собственно Chenopodiad-тип), Polemo-
nium, Myosotis. Критериями для их выделения явились следующие
признаки: наличие гипофизарной клетки, особенности ее образования
и характер деления, наличие эпифизарной клетки, особенности
образования и функционирования суспензора, число клеток проэмбрио на
стадии третьей клеточной генерации.
В качестве примера типовой вариации Chenopodiad-типа можно
привести развитие зародыша у Chenopodium bonus-henricus (Chenopo-
diaceae) (Soueges, 1920). При делении зиготы клеточная перегородка
закладывается в поперечном направлении, в результате чего образуется
апикальная (са) и базальная (cb) клетки двуклеточного зародыша.
Последующие поперечные деления в каждой из этих двух клеток
приводят к формированию линейного четырехклеточного проэмбрио.
При дальнейшем развитии в обеих производных апикальной клетки
проэмбрио, путем заложения вертикальных перегородок под прямым
углом к первоначальной перегородке, происходит образование ярусов I
и Г. Клетка т также дважды делится вертикальной перегородкой с
образованием четырех клеток. Клетка ci в результате двух
последовательных поперечных делений образует четыре клетки — h, k, о и р,
которые, за исключением клетки h, дают подвесок. Для данной
вариации (Chenopodiaceae, Amaranthaceae, Lentibulariaceae) характерно
отсутствие четко дифференцированного гипофизиса.
Вариации Polemonium и Myosotis отличаются от типовой вариации,
главным образом, наличием эпифизиса. Однако при Polemonium-ва-
риации клетка т тетрады делится поперечно с образованием клеток d
и /. Производные клетки d дают чехлик корня, клетки / — часть
суспензора. С точки зрения Johansen, данная вариация является
переходной между Chenopodiad- и Solanad-типами. Вариация Polemonium
обнаружена у Polemonium caeruleum (Polemoniaceae) (Soueges, 1939).
При Myosotis-вариации деление клетки т происходит вертикально, ее
производные образуют часть гипокотиля и центральный цилиндр
корня. Характерно образование хорошо выраженного гипофизиса. Данная
вариация встречается у представителей семейств Boraginaceae,
Polemoniaceae (Polemonium pauciflorum), Convolvulaceae. Рис. 45.
Иоффе, 1962, 1965; Artschwager, Starrett, 1933; Johansen, 1950; Schnarf, 1920;
Soueges, 1920b, 1921, 1924, 1939.
CARYOPHYLLAD-ТИП ЭМБРИОГЕНЕЗА характеризуется поперечным
положением клеточной перегородки при делении зиготы, линейной
тетрадой клеток проэмбрио и формированием основных структур
зародыша из апикальной клетки двуклеточного проэмбрио.
Выделен, по-видимому, Schnarf (1929) как Caryophyllaceen-тип на
основании исследований Soueges (1924) по эмбриогенезу видов сем. Са-
ryophyllaceae. В настоящее время данный тип эмбриогенеза установлен
Зародыш 519
для 19 семейств двудольных (Cercidiphyllaceae, Crassulaceae, Dro-
seraceae, Fumariaceae, Haloragaceae, Pyrolaceae и др.) и 17 однодольных
(Alismataceae, Araceae, Ruppiaceae, Zannichelliaceae и др.) растений.
В классификации типов развития зародышей Johansen (1950) описал
13 вариаций Caryophyllad-типа: Sagina, Vaccaria, Hypecoum, Co-
rydalis, Sedum, Medicago, Myriophyllum, Drosera, Fumaria, Ruppia,
Sagittaria, Zannichellia, Aglaonema. Критериями для их выделения
явились следующие признаки: наличие или отсутствие гипофизарной
клетки, наличие или отсутствие и характер деления эпифизарной
клетки, особенности формирования и функционирования суспензора.
В качестве типовой вариации Caryophyllad-типа следует рассматривать
Sagina-вариацию. При делении зиготы у Sagina procumbens (Caryo-
phyllaceae) клеточная перегородка закладывается поперечно. В
дальнейшем дважды поперечно делится только клетка са, в результате
образуется четырехклеточный линейный проэмбрио. Клетка cb не делится
и превращается в крупное пузыревидное образование, которое не
принимает участия в построении тела зародыша. Во второй клеточной
генерации из производных клетки са образуются ярусы ci, т, I и Г.
Клетки трех ярусов (т, I, V) делятся продольно, а клетки яруса ci —
поперечно, в результате чего в третьей клеточной генерации образуется
восьмиклеточный проэмбрио из пяти ярусов. Следующие деления в
ярусах I, V и т происходят также продольно, а клетка п делится поперечно,
образуя ярусы о и р. В четвертой клеточной генерации образуется 16-
клеточный проэмбрио, состоящий из 6 ярусов. Из клеток яруса /
образуется конус нарастания стебля, из Г — семядоли, из т — подсе-
мядольное колено, из п — корневой чехлик. Суспензор формируется
за счет производных как клетки cb, так и клетки са. Следует отметить,
что для Sagina-вариации характерно отсутствие гипофизиса и наличие
эпифизиса.
Схема развития зародыша по типовой вариации Caryophyllad-типа:
сЬ = 1/2 s
са = pvt + рсо + pby + ice + iec + со + 1/2 s.
Vaccaria-вариация отличается от Sagina-вариации лишь наличием
длинного суспензора, описана у некоторых представителей сем. Caryo-
phyllaceae.
Вариации Hypecoum и Corydalis отличаются от Sagina-вариации
наличием гипофизиса. Кроме того, при Hypecoum-вариации суспензор
отсутствует, а при Corydalis он представлен двумя пузырчатыми клетками
с двумя или тремя ядрами. Вариация Hypecoum отмечена для
представителей сем. Hypecoaceae, а вариация Corydalis — для сем. Fumariaceae.
Sedum-вариация характеризуется наличием гипофизиса и
отсутствием эпифизиса. Базальная клетка cb активно делится и дает нитевидные
выросты. Вариация Sedum отмечена для представителей сем.
Crassulaceae.
520
Семя
При вариациях Medicago, Myriophyllum, Drosera и Fumaria гипофи-
зис отсутствует. Однако в отличие от всех других вариаций данного
типа, для последних трех вариаций характерно формирование суспен-
зора только за счет базальной клетки двуклеточного проэмбрио. При
Myriophyllum-вариации базальная клетка делится продольно, а при
Drosera-вариации — несколько раз поперечно. При Fumaria-вариации
четких закономерностей в делении базальной клетки не наблюдается,
и для нее характерно формирование крупного суспензора. Medicago-
вариация развития зародыша описана у представителей сем. Fabaceae,
Myriophyllum-вариация — сем. Haloragaceae, Drosera-вариация —
сем. Droseraceae, Fumaria-вариация — сем. Fumariaceae.
Следует отметить, что перечисленные 9 вариаций Johansen выделил
для двусемядольных зародышей. Для односемядольных зародышей
автор выделил вариации Ruppia, Sagittaria и Zannichellia. Эти вариации
описаны для представителей семейств Ruppiaceae, Alismataceae и Zan-
nichelliaceae, соответственно. И наконец, еще одна вариация — Ag-
laonema — описана им для некоторых бессемядольных видов, в
частности представителей сем. Meliaceae. Однако, как отметил Johansen
(1950), последняя очень сходна с Sagittaria-вариацией. Позднее в
дополнение к 13 перечисленным вариациям в Caryophyllad-типе была
выделена еще одна вариация — Phytolacca, описанная для одного из
представителей сем. Phytolaccaceae — Phytolacca dioica (Kajale,
1954). Рис. 46.
Johansen, 1950; Johri, 1935; Kajale, 1954; Maheshwari, 1950; Natesh, Rau, 1984; Soueges,
1924, 1927, 1936,a,b,c, 1937, 1941, 1943; Tohda, 1971.
НОВЫЕ ТИПЫ ЭМБРИОГЕНЕЗА
GRAMINAD-ТИП ЭМБРИОГЕНЕЗА характеризуется серией наклонных
(«косых») перегородок (по отношению к продольной оси зародыша),
обусловливающих дорзовентральность внутреннего строения раннего
проэмбрио и зрелого зародыша, а также спецификой органогенеза и
уникальным строением основных органов, присущих только зародышу злаков
(щиток, колеоптиль, эпибласт, колеориза, мезокотиль, почечка).
Впервые этот тип был выделен при исследовании эмбриогенеза
Triticum (Батыгина, 1968а,б; Batygina, 1969). Ревизия литературных
данных (Randolph, 1936; Maheshwari, 1950; Narayanaswamy, 1956;
Чеботарь, 1960, 1970, 1972; Paulson, 1969; Хазова, 1970) и особенно
иллюстраций по развитию зародыша других злаков (Zea, Hordeum,
Panicum и др.), а также оригинальные данные по эмбриогенезу Роа
(Батыгина, Кириллова, 1971; Батыгина, Маметьева, 1979)
подтвердили наше предположение (Batygina, 1969), что Graminad-тип
эмбриогенеза присущ всем злакам (Батыгина, 1974, 1987). В настоящее
время имеется много работ, касающихся строения зародыша злаков,
Зародыш
521
которые подтверждают правомочность выделения типа Graminad (Цве-
лев, 1975; Natesh, Rau, 1984; Петрова и др., 1985).
Как известно, характеристика эмбриогенеза злаков долгое время
вызывала дискуссию.
Еще Norner (1881) сделал первую попытку классифицировать
зародыш злаковых и выделил три типа его развития: I — первое и второе
деления поперечные, II — певое деление поперечное, а второе
наклонное, III — оба деления наклонные. Он не рассматривал
дорзовентральность проэмбрио и всю специфику развития зародыша, но обратил
внимание на две наклонных перегородки в проэмбрио (III тип).
Позднее эмбриогенез злаков относили к Onagrad- (Яковлев, 1946а,б) или
Asterad-типу (Поддубная-Арнольди, 1976), к мегархетипу I (Soueges,
1939) или к мегархетипу II (Guignard, 1961a,b). Guignard выявил
несостоятельность положения Soueges относительно происхождения
точки роста у злаков. Он показал, что точка роста у злаков
образуется из апикальной, а не базальной клетки двуклеточного проэмбрио,
как это утверждал Soueges (1924). Guignard (1961a,b) предложил
принципиально новую схему развития зародыша злаков:
са = рсо + pvt
cb = рЬу + ice + iec + со + s
в отличие от схемы Soueges (1924b):
са = рсо
cb = pvt + phy + ice + iec + со + s.
Maheshwari (1950) считал, что эмбриогенез злаков не укладывается
ни в один из типов по имеющимся классификациям, аргументируя
это тем, что в зародыше злаков нет определенного порядка в
направлении клеточных делений. Это послужило основанием отнести
эмбриогенез злаков к аномальному типу развития («unclassified or
abnormal embryos»). В подтверждение своего заключения Maheshwari
привел рисунки зародыша кукурузы (Randolph, 1936). К сожалению,
и в настоящее время многие исследователи, занимающиеся изучением
эмбриогенеза как кукурузы, так и других злаков, ссылаются на эту
работу Randolph. Идею Maheshwari о нерегулярном заложении
перегородок в зародыше позднее поддержал Norstog (1972), изучавший
ультраструктуру проэмбрио Hordeum. Ранее также отмечалось, что
клеточные перегородки в проэмбрио ячменя по отношению к оси зародыша
располагаются иррегулярно и под разными углами (Merry, 1941). Однако
Коробова (1962) убедительно показала, что имеется определенная
закономерность заложения первых перегородок в проэмбрио Zea mays.
Зигота злаков представляет собой систему с определенной
полярностью размещения клеточных органелл и запасных веществ.
Апикальный ее полюс становится зоной протеинового синтеза, в то время как
522
Семя
базальный содержит осмотически активные вещества (см. Зигота;
Эмбриогенез злаков).
Вследствие неравномерной вакуолизации зиготы фигура первого
деления у всех злаков располагается асимметрично, оказываясь сдвинутой
к апикальному ее концу. Дочерние клетки, возникающие в результате
дифференцирующего митоза, получаются неравными. Апикальная
клетка (са) оказывается меньше, чем базальная (cb), которая более
сильно вакуолизирована.
В отдельных случаях в зиготе пшеницы наблюдался симметричный
митоз с усеченным веретеном деления, что обусловлено, вероятно,
относительно близким расположением ядра к клеточной оболочке зиготы.
Возможно, в этом случае степень асимметрии веретена в будущем
определит различное поведение хромосом в поздней анафазе и телофазе
(Geitler, 1935; Герасимова-Навашина, 1951а,б). Известно, что такой
асимметричный митоз является базой неравного деления клеток в пыльце
злаков (Батыгина, 1974). Однако не всегда асимметричный митоз
является обязательным условием неравного деления, так как и при
симметричной фигуре деления могут также формироваться неравные клетки
(Geitler, 1935; Maheshwari, 1950; Алимова, 1994; Голубовская, 1994).
Первая клеточная перегородка, как это видно при дорзовентральном
сечении, ко времени второго деления располагается наклонно.
Наклонное положение первой перегородки в зиготе у одних растений
(например, Sorghum) в основном зависит от наклонного положения веретена
деления, а у других (Triticum, Poa и др.) — также и от
одностороннего разрастания зиготы.
Итак, специфическое дорзовентральное строение зародыша
злаковых распознается уже по характерному наклонному положению
перегородки в зиготе.
Следующее деление, также дифференциальное, происходит всегда в
клетке cb, образуются клетки т и ci. Вторая клеточная перегородка
также располагается наклонно к продольной оси зародыша, обычно
в плоскости, перпендикулярной к первой перегородке, а не
параллельно, как отмечалось ранее (Soueges, 1924b; Roth, 1955; Guignard,
1961a,b), при этом верхний ее край соединяется с перегородкой,
разделяющей бластомеры са и cb. Третье деление происходит в апикальной
клетке трехклеточного зародыша. Третья клеточная перегородка
закладывается наклонно к первой, однако ее ориентация по отношению к оси
проэмбрио может быть вариабельной. Своеобразный характер
расположения клеток в проэмбрио показывает, что зародышу злаков
присущ особый тип тетрады бластомеров. Следующее неравное деление
происходит в клетке ci. Перегородка здесь закладывается также
наклонно к стенке, разделяющей клетки тип'. Клетка т делится вер-
Имеется разное толкование понятия «асимметричный митоз» (см. Батыгина, 1974;
Пыльцевое зерно, Т. 1).
Зародыш
523
тикальной перегородкой, образуя два новых бластомера. В результате
следующего наклонного деления клетки п образуются клетки о и р.
Характерное раннее дорзовентральное строение проэмбрио злаков,
его способ развития и определенное участие бластомеров в построении
зародыша позволило представить следующую схему его генезиса
(Батыгина, 1968а,б, 1974):
ca = pvt + рсо (частично щиток) и частично эпибласт + колеоптиль
cb = рсо (частично щиток) + частично эпибласт + pby + ice + iec + со + s.
Согласно критериям, положенным в основу выделения классических
типов эмбриогенеза (Schnarf, 1929; Soueges, 1939; Johansen, 1950),
имелись все основания для выделения нового типа эмбриогенеза —
Graminad (Батыгина, 1968а,б, 1974; Batygina, 1969).
Таким образом, тип Graminad характеризуется, не столько
положением перегородки в зиготе, сколько специфическим положением
серии наклонных («косых») клеточных перегородок в зародыше на
ранних стадиях его развития (дорзовентральность внутреннего
строения зародыша), спецификой его органогенеза.
Для зрелого зародыша большинства злаков характерно наличие
следующих органов: щитка, эпибласта, колеоптиля, мезокотиля, колеори-
зы, почечки, состоящей из нескольких примордиев листьев, и корня
(или нескольких корней).
Установлено, что латеральное положение апекса побега и
терминальное положение семядоли в зрелом зародыше вторично, как в
онтогенетическом, так и в филогенетическом плане (Батыгина,
1968а,б, 1974, 1987; Batygina, 1969; Guignard, Mestre, 1971; Natesh,
Rau, 1984). Следует отметить, что дорзовентральность зародыша во
многом обусловлена дорзовентральностью тех структур, в которых он
развивается (зародышевого мешка, семязачатка, завязи).
Ранние этапы эмбриогенеза у различных видов злаков сходны, в
то время как строение зрелого зародыша несколько различается
(см. Эмбриогенез злаков).
В заключение следует остановиться на возможных причинах
дискуссии о типе эмбриогенеза злаков.
Одной из основных, с нашей точки зрения, причин, не позволяющей
вскрыть закономерный характер заложения первых перегородок в
проэмбрио злаков является методическая неточность. Большинство
исследователей не обращали должного внимания на то, с какой плоскостью
среза зародыша, зародышевого мешка, семязачатка и завязи они
имеют дело. Это создало противоречивое толкование эмбриологических
данных по одному и тому же объекту и не дало возможности выявить
специфические закономерности дорзовентрального строения проэмбрио
злаков. Для того, чтобы составить правильное представление об
эмбриогенезе злаков, необходимо изучать строение зародыша на всех этапах
524
Семя
его развития в трех плоскостях (дорзовентральной, латеральной и
трансверсальной).
Особое внимание следует обратить на ориентацию зародыша при
электронно-микроскопических исследованиях. Без указания плоскости
среза трудно судить, насколько корректны выводы автора о характере
заложения перегородок в проэмбрио (это относится и к световой
микроскопии). Вероятно, это связано как со спецификой внутреннего
строения зародыша, так и со сложностью получения объемного
изображения из-за большого количества ультратонких срезов. В
последнее время зародыш злаков стал излюбленным объектом исследований
генетиков, физиологов, селекционеров, в которых особое внимание
уделяется положению первых перегородок в проэмбрио (Clark, Sheridan,
1986, 1988, 1991). Поэтому следует особенно корректно относиться к
методике его изучения.
Другой причиной дискуссионности вопроса о типе эмбриогенеза
у злаков является, вероятно, сильное влияние взглядов и
представлений видных ученых (Schnarf, 1929; Soueges, 1939; Johansen,
1950) о полном сходстве развития проэмбрио всех однодольных
и двудольных.
Анализ данных по раннему эмбриогенезу у злаков и у других
представителей цветковых позволил выдвинуть положение о
различии развития зародышей однодольных (в частности, злаков) и
большинства двудольных с самых первых этапов (Батыгина, 1974).
Даже если гипотетически можно было бы признать принципиальное
сходство эмбриогенетических законов для однодольных и двудольных,
то возникают большие сомнения в правильности такого положения,
когда в существующих классификациях зародыши однодольных и
двудольных помещены в один эмбриогенетический тип и в то же время
зародыши двудольных растений (даже одного таксона) распределены
по разным типам, и при этом не был выделен ни один тип
эмбриогенеза для зародыша однодольных.
Кроме того, следует особо подчеркнуть, что в предшествующих
исследованиях по раннему эмбриогенезу у цветковых растений не
обсуждался вопрос о том, насколько рано может происходить
становление характерного внутреннего дорзовентрального строения
проэмбрио и какое отношение оно имеет к дорзовентральности
зрелого зародыша. Не обсуждался также ранее вопрос о том, имеется
ли такое дорзовентральное строение проэмбрио у представителей
других таксонов двудольных и однодольных (Батыгина, 1973, 1974). Все
эти вопросы были нами в той или иной мере освещены в связи с
изучением проблемы становления односемядольности у цветковых
растений (Батыгина, 1974; Batygina, 1978 a,b; см. также Новая
концепция происхождения зародыша однодольных).
Несомненный интерес представляет эмбриогенез Commelina /ors-
kalai. У этого растения зрелый зародыш имеет дорзовентральное
строение. Специализация зародыша у Commelina настолько сильно выра-
Зародыш 525
жена, что проявилась и на ранних этапах развития проэмбрио. Анализ
рисунков и частично описание процессов показали, что ориентация
клеточных перегородок при первых шести делениях в проэмбрио
идентична таковой в зародыше Triticum, Zea, Setaria, Hordeum, Роа, Ave-
па и др. Таким образом, и у некоторых других представителей
однодольных, дорзовентральность зародыша наблюдается с самых первых
этапов их развития.
Аналогичная картина выявлена и при развитии зародыша Nelumbo —
растения, которое большинство авторов относит к классу двудольных.
Внутренняя дорзовентральность раннего проэмбрио лотоса,
развивающегося в соответствии с Репаеа-вариацией Asterad-типа, в определенном
смысле обусловливает и дорзовентральность строения зародыша на
поздних стадиях развития вплоть до зрелого состояния (Батыгина и др.,
1983; Titova, Batygina, 1996; см. Синкотилия; Новая концепция
происхождения зародыша однодольных). Сходное явление отмечено нами
для развития соматического зародыша в семени Paeonia (см.
Эмбриогенез пионовых; Paeoniad-тип), а также для полового зародыша
Scabiosa succisa (Soueges, 1937b) (Scabiosa-вариация Piperad-типа) и
др. Таким образом, наличие наклонных перегородок при делении зиготы
при Репаеа-вариации Asterad-типа и Scabiosa-вариации Piperad-типа,
возможно, свидетельствует о внутренней дорзовентральности раннего
проэмбрио и у ряда двудольных растений (см. Asterad-тип). Вопрос
о том, как проявляется внутренняя дорзовентральность зародыша у
двудольных на поздних этапах развития, еще остается дискуссионным.
Специфическое строение и развитие зародыша злаков есть
результат его длительных эволюционных преобразований. Эволюция
злаков привела к высокой степени их специализации, в том числе и
к специфическому дорзовентральному строению зародышей, и эта
специфика проявляется уже с первых этапов эмбриогенеза, начиная
с положения первой перегородки.
При характеристике любого эмбриогенетического типа
исследователи никогда не учитывали строение зрелого зародыша и
особенности всего эмбриогенеза. Между тем неоднократно высказывалась идея
(Поддубная-Арнольди, 1964, 1976; Батыгина, 1968а,б, 1987), что
формалистичность существующих классификаций типов
эмбриогенеза может быть преодолена только в том случае, если будет
рассмотрен эмбриогенез в целом, т.е. не только его ранние, хотя и
очень важные, этапы развития, но и средние, и поздние стадии, с
учетом строения, формы, величины и расположения зародыша в зрелом
семени и экологии прорастания.
Поэтому, для более полной характеристики типа Graminad, кроме
«классических» признаков, используемых для определения
эмбриогенетического типа, мы сочли необходимым учитывать характер всего
эмбриогенеза, включая строение зрелого зародыша злаков. Рис. 47.
526
Семя
Алимова, 1994; Батыгина, 1968а,б, 1973, 1974, 1987; Батыгина, Кириллова, 1971;
Батыгина, Маметьева, 1979; Герасимова-Навашина, 1951а,б; Голубовская, 1994;
Коробова, 1962; Модилевский и др., 1958; Петрова и др., 1985; Поддубная-Арнольди,
1964, 1976; Хазова, 1970; Цвелев, 1975; Чеботарь, 1960, 1961, 1970, 1972;
Яковлев, 1946а,б; Яковлев, Солнцева, 1965; Batygina, 1969, 1978а,b; Clark, Sheridan,
1986, 1988, 1991; Geitler, 1935; Guignard, 1961a,b; Guignard, Mestre, 1971; Johansen,
1950; Kihara, Nishiyama, 1932; Maheshwari, 1950; Maheshwari, Baldev, 1958; Merry,
1941; Narayanaswamy, 1956; Natesh, Rau, 1984; Norner, 1881; Norstog, 1972;
Paulson, 1969; Randolph, 1936; Reeder, 1957; Roth, 1955, 1957; Schnarf, 1929; Soueges,
1924b, 1937b, 1939.
PAEONIAD-ТИП ЭМБРИОГЕНЕЗА характеризуется уникальным для
цветковых прохождением первых этапов развития зародыша —
образованием ценоцитно-клеточнои структуры, незавершенностью процесса
развития полового зародыша (отсутствием гистогенной
дифференциации, семядолей, апексов побега и корня) и формированием на базе
ценоцитно-клеточнои структуры соматического зародыша.
На основании открытия уникального развития «предзародыша» и
выявления двух фаз в развитии полового зародыша Paeonia впервые
Яковлевым (1958,1983а) был предложен новый тип эмбриогенеза —
Paeoniad (Paeoniaceae).
Детальные исследования по инициации и формированию
двусемядольного зародыша, образующегося на базе ценоцитно-клеточнои
структуры у различных видов рода Paeonia, и принципиально новый
подход к системам репродукции цветковых позволили
переосмыслить представление Яковлева о наличии в зрелом семени пиона
полового, дифференцированного на органы зародыша (см.
Эмбриогенез пионовых) и дать новую вышеуказанную трактовку Paeoniad-
типа эмбриогенеза.
С нашей точки зрения, Paeoniad-тип эмбриогенеза характеризуется
своей незавершенностью, т.е. формирование полового зародыша
заканчивается иа ранних стадиях развития — на стадии ценоцитно-
клеточнои структуры, в которой формируется эпидермис; в
классическом понимании в зрелом семени пиона половой зародыш
отсутствует.
Особенностью полового зародыша, образующегося в результате
сингамии, является отсутствие стадий развития, свойственных
большинству половых зародышей цветковых: двуклеточного проэмбрио,
тетрады, квадрантов, октантов, гистогенной дифференциации,
формирования семядолей, апексов побега и корня.
Следует отметить еще одну особенность полового зародыша
пиона — тенденцию к бесполому (вегетативному) размножению,
проявляющуюся в способности к клонированию. Это приводит к тому,
что на базе ценоцитно-клеточнои структуры в развивающемся семени
образуется множество соматических зародышей (эмбриоидов), но
только один сохраняется в зрелом семени (Batygina, 1989c, 1994;
Batygina et al.,1992; Brukhin, Batygina, 1994). Ценоцитно-клеточная
I
528 Семя
структура дегенерирует у разных видов на разных стадиях развития
семени, что является видоспецифичным (см. Эмбриогенез
пионовых).
Вероятно, в результате блокировки нормальной клеточной,
гистогенной и органогенной дифференциации произошла смена полового пути
развития на бесполый. Такой «метаморфоз» в системе репродукции
привел к тому, что в зрелом семени пиона мы имеем не половой, а
соматический зародыш, нормально дифференцированный на органы
(семядоли, апекс побега и радикулу) и развивающийся по типу Aste-
rad (Brukhin, Batygina, 1994).
У многих цветковых растений на первых этапах онтогенеза, начиная
с зиготы, а также и на последующих имеется тенденция к бесполому
размножению — кливажиая эмбриоидогения (Batygina, 1989a-c).
У пионовых имеется особый тип монозиготической, кливажной эмб-
риоидогении (Батыгина 1991).
У представителей сем. Paeoniaceae переход от гетерофазной
репродукции к гомофазной произошел в эволюции на очень раннем этапе
эмбриогенеза — образования ценоцитно-клеточной структуры.
Развитие полового зародыша пиона протекает уникальным образом,
неизвестным для других покрытосемянных растений. Уникальность
типа заключается в том, что первые деления в зиготе и последующие в
зародыше не сопровождаются заложением перегородок. Только после
того, как в зародыше пиона будет достигнута определенная плотность
ядер (критическая масса), наступает заложение перегородок между
сестринскими и несестринскими ядрами. Этот процесс напоминает
заложение перегородок при нуклеарном типе развития эндосперма.
Таким образом, в развивающемся семени можно наблюдать два
типа последовательно образующихся, различающихся по
происхождению зародышей: полового, не дифференцированного на органы
зародыша, который прекращает свое развитие и уступает место
формированию другого, соматического зародыша, дифференцированного на
все основные органы. Рис. 48.
Ьатыгина, 1991; Брюхин, 1993; Яковлев, 1958, 1983а; Batygina, 1989a-c, 1994;
Batygina et al., 1992; Brukhin, Batygina, 1994.
ЭМБРИОГЕНЕЗ ЗЛАКОВ
Среди однодольных растений злаковые выделяются формой и
строением зародыша. Такие специфические органы, как щиток, колеоп-
тиль, мезокотиль, колеориза, сформированный эпикотиль с плюмулой,
лигула, характерны только для зародышей сем. Poaceae (Gramineae).
Первое обстоятельное изучение эмбриогенеза злаков (наиболее
подробно — у Роа annua) было предпринято Soueges (1924b). Автор
пришел к выводу, что апекс побега у зародыша злаков развивается из
i _
Зародыш 529
базальной клетки (cb), а семядоля — из апикальной клетки (са)
двуклеточного проэмбрио. По его мнению, ранние этапы развития
зародыша двудольных и однодольных принципиально сходны.
Позднее были предложены другие схемы построения зародыша
злаков (Guignard, 1961а,Ь; Батыгина, 1968а,б; Batygina, 1969; Guignard,
Mestre, 1969). Guignard полагал, что апекс побега и семядоля
происходят только из клетки са. Согласно нашим данным, из клетки са
образуется апекс побега и только частично щиток и эпибласт; в
образовании последних участвует также и клетка сЪ.
Внимание исследователей привлекали различные аспекты развития
зародышей злаковых, как, например, морфология и сравнительная анатомия
зародышей Triticum, Zea, Avena (Avery, 1930; Arber, 1934),
дифференциация отдельных органов зародыша злаков (Roth, 1955, 1957, 1961;
Иоффе, 1957; Pankow, Von Guttenberg, 1957, 1959; Von Guttenberg,
1960; Pankow, 1962; Модилевский, 1963), тип эмбриогенеза Triticum
(Поддубная-Арнольди, 1944, 19646). Ряд работ посвящен проблеме
эволюционного становления однодольности (Яковлев, 1946а,б, 1951,
1971; Батыгина, 1968а,б, 1974, 1987; Guignard, Mestre, 1969; Guignard,
1975а,b). Обсуждалась также проблема гомологии отдельных структур
зародыша злаков и органов других покрытосеменных (Соколовская,
1965, 1968; Данилова, Соколовская, 1971, 1973).
В литературе существуют различные взгляды на морфологическую
сущность органов зародыша злаков. Так, щиток, колеоптиль и
мезокотиль чаще всего рассматриваются исследователями как структуры,
связанные между собой. В настоящее время щиток принимают за
единственную настоящую семядолю, а колеоптиль — за ее вырост или
за первый лист почечки. Относительно происхождения эпибласта
имеются две точки зрения. Одни исследователи (Velenovsky, 1907;
McCall, 1934; Красовская, 1952; Roth, 1955, 1957, 1961; Brown,
1960, 1965; Eam.es, 1961) высказываются в пользу того, что эпибласт
является семядолей. Другие (Яковлев, 1950; Brown, 1959;
Соколовская, 1965, 1968; Guignard, Mestre, 1971) считают эпибласт выростом
щитка или колеоризы. Мы полагаем, что щиток, колеориза, эпибласт
являются производными одной семядоли, но в процессе эволюции они
приобрели различные функции.
Для понимания природы органов зародыша злаков необходимо знать
анатомию проводящей системы зародыша. Как было установлено,
злакам свойствен особый характер связи жилки семядоли с проводящей
системой гипокотиля (Данилова, Соколовская, 1971). Это позволило
авторам присоединиться к точке зрения Merry (1941) и Brown (1959,
1960, 1965) о том, что щиток и колеоптиль — части единой
семядоли. Мезокотиль они рассматривали как основание семядоли, слившееся
с гипокотилем.
Природа базальной области зародыша злаков также является
предметом дискуссии. Согласно классическому представлению, колеориза
злаков представляет собой нижнюю часть гипокотиля, в которой эндо-
34-828
530
Семя
генно закладывается главный зародышевый корень (Velenovsky, 1907;
Goebel, 1932). Этого мнения придерживаются и некоторые другие
исследователи злаков (Roth, 1957, 1961; Brown, 1965; Соколовская,
1967, 1968).
Другая точка зрения сводится к утверждению, что колеориза злаков
является метаморфизированным главным корнем зародыша, а первый
корень, который эндогенно закладывается в колеоризе, — придаточным
(Пашков, 1951; Pankow, Von Guttenberg, 1957; Von Guttenberg, 1960;
Guignard, 1970, 1975a,b; Guignard, Mestre, 1971; Tillich, 1977).
Соколовская (1967, 1968) рассматривает колеоризу как наружную
часть чехлика, поскольку в процессе эмбриогенеза эти структуры
развиваются как единое целое, и считает, что нет оснований лишать
главный зародышевый корень злаков его собственного
морфологического значения. Представляет интерес и тот факт, что у
культивируемых зародышей Hordeum на щитке образуются листовые волоски с
зеленой окраской, тогда как на колеоризе — корневые волоски (Nor-
stog, 1969).
Апекс побега зародыша злаков, как у большинства других
однодольных, развивается на базе дериватов апикальной клетки зародыша.
Однако остается дискуссионным вопрос, закладывается ли апекс
побега латерально (John, 1984) или терминально (Batygina, 1969; Juguet,
1969; Батыгина, 1974, 1987). Более детально он будет рассмотрен
ниже.
Фазы развития зародыша. В развитии зародыша злаков можно
выделить две фазы: 1) бластомеризация (первичная дифференциация) —
образование критической массы клеток зародыша, которая заканчивается
дифференциацией эмбриодермы, и 2) органогенез, включая гистогенез
(дифференциация гистогенов) — обособление зачатков органов и
последующая их тканевая дифференциация.
Дорзовентральность строения, характерная для зародышей всех
злаков, устанавливается уже на стадии зиготы. Определенную роль при
этом играет дорзовентральность структур зародышевого мешка,
семязачатка и завязи, в которых они развиваются.
Следует отметить, что дорзовентральность проявляется на всем
протяжении формирования зародыша, получая на поздних этапах все
более ощутимое морфологическое выражение. Однако, если в процессе
развития зиготы и проэмбрио она устанавливается вследствие
различной степени растяжения клеточной оболочки на их дорзовентральной
и вентральной сторонах, то во время органогенеза дорзовентральность
зародыша проявляется в специфической ориентировке и частоте
клеточных делений и в растяжении клеточных оболочек. В силу своей
дорзовентральности, зародыш злаков представляет большую трудность
для изучения (см. Graminad-тип эмбриогенеза). Так, например,
латеральное положение зиготы и зародыша в зародышевом мешке
можно обнаружить только при рассмотрении в профиль, в то время как
в фас они обычно занимают центральное положение. Истинное
Зародыш
531
взаимное расположение перегородок в зародыше также может быть
выявлено лишь при сопоставлении картин деления проэмбрио в транс-
версальном, дорзовентральной и билатеральном сечениях.
Бластомеризация, или фаза первичной дифференциации.
Обычно через сутки после опыления зигота злаков, в частности Triticum,
приступает к делению. Форма зиготы у разных злаков различна
(см. Зигота): У пшеницы она, как правило, грушевидная, но в
процессе своего развития она может изменяться. Фигура первого
деления обычно располагается наклонно к продольной оси зиготы,
как это видно при дорзовентральной сечении, вследствие
неравномерной ее вакуолизации, и оказывается сдвинутой к ее апикальному
концу. В результате такого асимметричного митоза, который
является следствием полярности зиготы, образуются две неравные
клетки. Апикальная клетка (са) оказывается меньше, чем ба-
зальная (cfe), которая более сильно вакуолизирована. Такое неравное
деление зиготы отмечалось для многих видов злаков (Randolf, 1936;
Яковлев, 1946а,б; Чеботарь, 1960, 1970; Батыгина, 19626;
Коробова, 1962; Хазова, 1970). Наклонное положение первой
перегородки в зиготе и последующих в проэмбрио зависит в одних случаях
от наклонного положения веретена, а в других — также и от
неравномерного «разрастания» зиготы и проэмбрио. Возможно, это
«разрастание» стимулируется излившимся содержимым пыльцевой
трубки, которая изменяет характер роста зиготы и проэмбрио.
Для зародыша Triticum характерно и то, что следующее деление
происходит всегда в клетке сЪ. Однако у других злаков, например у
Zea, первой может делиться базальная либо апикальная клетка
(Randolf, 1936). Вторая клеточная перегородка у всех изученных видов
злаков обычно располагается наклонно в плоскости, перпендикулярной
к первой перегородке, а не параллельно, как отмечали ранее
некоторые авторы (Soueges, 1924b; Roth, 1955; Guignard, 1961a,b). При
этом ее верхний край соединяется с перегородкой, разделяющей клетки
са и сЪ. Это деление, как и несколько последующих, тоже
дифференцирующее (неравное). Третье деление происходит в апикальной клетке
зародыша Triticum, при этом клеточная перегородка также
закладывается наклонно к первой, однако ее ориентация относительно оси
зародыша вариабельна. Зародышу злаков присущ особый тип тетрады
клеток, хотя при изучении проэмбрио в билатеральной плоскости
видно, что четырехклеточный зародыш имеет как будто типичное Т-образное
строение (см. Graminad-тип эмбриогенеза). Следующее асимметричное
деление происходит в клетке ci. Перегородка здесь закладывается также
наклонно к стенке т и ci, образуя бластомеры п и п'. Клетка т делится
перегородкой вертикально, образуя две новые клетки. В результате
следующего наклонного деления п' образуются бластомеры о и р.
Эмбриодерма, которая в зародыше пшеницы развивается базипе-
тально, т.е. сначала дифференцируется в апикальной части зародыша,
но вскоре образуется и в базальной области.
34*
532
Семя
Ультраструктурное изучение первых этапов развития зародыша
Hordeum выявило, что все его клетки вакуолизированы; в клетках
суспензора вакуоли более крупных размеров. Наиболее крупные
вакуоли располагаются по периферии клеток (Norstog, 1972). Первые
этапы эмбриогенеза сопровождаются увеличением числа и размеров
органелл (рибосом, митохондрий, пластид и др.) и изменением их
процентного соотношения по сравнению с зиготой. Клетки зародыша
связаны между собой плазмодесмами. На этом этапе развития
зародыша можно наблюдать остатки содержимого пыльцевой трубки.
В цитоплазме клеток зародыша по сравнению с эндоспермом
наблюдается более низкая концентрация рибосом, диктиосомы имеют
пузырьки значительно меньших размеров (см. Ультраструктурные
аспекты эмбриогенеза).
Органогенез. В результате пульсирующих делений в определенных
кластерах клеток зародыш становится многоклеточным, образуются его
уникальные органы и структуры. В процессе роста и развития
зародыша сильно изменяется его форма. Во всех сложных
преобразованиях, происходящих в ходе органогенеза, определяющую роль играют
последовательные изменения ритма митотической активности и
ориентация клеточных делений в разных областях зародыша, что
обусловливает своеобразное положение и строение органов зародыша злаков.
Там, где есть клеточные деления, клетки меньших размеров и богаче
цитоплазмой; там, где митозы происходят реже, они крупнее, более
вакуолизированы и беднее цитоплазмой. По степени окрашиваемости
клеток можно судить об очагах меристематической активности в
развивающемся зародыше. Следует отметить, что в нем существует
определенные «волны» митотических делений. В ходе развития зародыша,
когда он достигнет значительной степени дифференциации и
сформируются все его органы, митозы обнаруживаются, как в апикальной и
базальнои частях щитка, так и в некоторых других зонах зародыша
(корень и др.).
Через несколько суток после опыления (у пшеницы — 5—6)
происходит разрастание апикально-латеральной области проэмбрио в
сторону плацентохалазы. Клетки этой области активно делятся, они
несколько крупнее, чем клетки с противоположной стороны зародыша,
где вскоре будет формироваться апекс побега. Дальнейшее разрастание
апикально-латеральной области зародыша приводит к образованию
щитка. В это время значительное увеличение размеров клеток
наблюдается и в верхней центральной части зародыша.
В ходе дальнейшего развития происходят сложные преобразования,
в результате которых щиток из латерального переходит в терминальное
положение, свойственное зрелому зародышу. Таким образом, в
зародыше пшеницы органогенез начинается с образования щитка, а не
колеоптиля, как считает Roth (1955, 1957, 1961). Форма и размеры
щитка различаются у разных видов злаков. В процессе развития
зерновки и при ее прорастании в клетках щитка происходят значительные
Зародыш 533
изменения. Щиток состоит из гетерогенных клеток. Эпидермис щитка,
прилегающий непосредственно к эндосперму, имеет специфическую
форму и строение. У некоторых сортов пшеницы и кукурузы он руми-
нирован, у кукурузы в нем могут образовываться железки. На щитке
у некоторых видов злаков формируется лигула (брюшная чешуя),
представляющая собой вырост щитка. У зародыша риса имеется дву-
килевая лигула, ее верхушки носят название «аурикулы» («ушки»)
(Saha, 1956; Tateoka, 1964). Ьго клетки можно рассматривать как
передаточные и секреторные. В щитке дифференцируется проводящая
система. В нем имеется большое количество алейроновых зерен и
других включений. Основная функция щитка — установление связи
между эндоспермом и всеми структурами зародыша (см. Щиток и его
роль при прорастании). В специализированном эпителиальном слое,
содержащем большое количество гидролитических ферментов,
происходят превращения веществ, поступающих из эндосперма в зародыш и в
дальнейшем в проросток. В процессе прорастания щиток служит
источником гиббереллинов (Stoddart et al., 1973).
Несколько позднее, после начала разрастания щитка, наблюдается
увеличение митозов в зоне образования апекса побега (точки роста),
который закладывается терминально. Дальнейшее развитие этой
области приводит к появлению перетяжки, разделяющей семядолю и точку
роста, а затем — к обособлению колеоптиля и дифференциации
листьев и точки роста плюмулы.
Колеоптиль имеет форму полого конуса с расположенным в верхней
его части отверстием, через которое побег выходит наружу во время
прорастания. Отверстие имеет форму щели, в которой внутренняя и
наружная эпидермы смыкаются между собой (O'Brien, Thimann,
1967). Обычно на обеих поверхностях колеоптиля сосредоточено
большое количество устьиц, причем некоторые из них функционируют в
качестве гидатодных пор (Esau, 1977). Главная функция колеоптиля
состоит в защите конуса нарастания при «пробивании» корки почвы
прорастающим семенем. У некоторых видов злаков колеоптиль может
выполнять фотосинтетическую функцию.
Заложение колеоптиля и дифференциация прокамбиального тяжа в
щитке совпадают по времени с началом образования первого
зародышевого корня, поэтому область митотической активности
(интенсивной окраски клеток) видна в это время в центральной части зародыша
и в основании щитка, где начинается дифференциация прокамбия.
Элементы ксилемы и флоэмы в зародышевом корне расположены
группами, чередующимися по окружности стелы (Jung, 1937). Таким
образом, формирование корня начинается эндогенно в базальнои части
зародыша, вблизи основания щитка. Наличие самостоятельных гисто-
генов плеромы, периблемы и чехлика корня у зародыша позволяет
отнести развитие корня злаков, в частности у Triticum, к закрытому
типу (Von Guttenberg, 1960). Дерматоген корня образуется из
внешнего слоя периблемы.
534
Семя
В этот же период наблюдаются значительные изменения в суспен-
зоре зародыша: клетки значительно увеличиваются, становятся сильно
вакуолизированными. Самые нижние клетки суспензора к моменту
дифференциации колеоптиля (а иногда и несколько раньше) становятся
«пустыми» и слущиваются.
У различных видов злаков в зародыше может закладываться разное
количество адвентивных корней, например, у пшеницы — 2—4, у
ржи — 3—4, а у кукурузы — 5. Озимые и яровые сорта часто также
различаются их числом и иногда происхождением.
Чехлик и колеориза (корневое влагалище) возникают и
развиваются как единое образование, и лишь в конце эмбриогенеза, когда
зародыш созревает, происходит отделение колеоризы от чехлика. Причиной
их разъединения являются, как полагают некоторые авторы
(Соколовская, 1967), различные темпы роста чехлика и колеоризы. В клетках
колеоризы пшеницы обнаружены алейроновые зерна. Основная
функция колеоризы — защита зародышевого корня. Кроме того, она
является источником воды и питательных веществ, необходимых для роста
корня (или корней) при прорастании. Для паникоидных злаков
характерно наличие щели между колеоризой и основанием щитка (Reeder,
1957, 1961).
Эпибласт дифференцируется несколько позже, чем корень, и
располагается на стороне, противоположной щитку, образуя чешуевидный
вырост, не содержащий сосудов (Narayanaswamy, 1955a,b). По
характеру строения клеток он близок колеоризе. У пшеницы (сорт Диамант)
в отдельных его клетках обнаружены алейроновые зерна, сходные с
таковыми щитка и колеоризы. Судя по изменению формы и размеров
клеток при прорастании зерновки, он, так же как и колеориза,
поставляет воду развивающемуся зародышу. Некоторые исследователи
рассматривают эпибласт как вторую, редуцированную семядолю. Размеры
и форма эпибласта различаются у разных видов растений; у Panicum,
Zea он отсутствует (Narayanaswamy, 1955a,b). Различия в функциях
щитка (выполняющего гаусториальную роль) и эпибласта
(поглощающего влагу в момент прорастания зерна) позволяют понять и более
позднее заложение и развитие последнего. Эпибласт не контактирует,
как щиток, с эндоспермом; возможно, этим и определяется его
функция. Наличие эпибласта или отсутствие, а также его размеры зависят
от условий произрастания той или иной группы злаков, что имеет
существенное значение при прорастании зерновки.
Анализ строения различных структур и органов зародыша злаков
выявил, что в колеоптиле имеются два проводящих пучка. В эпибласте,
колеоризе и лигуле васкулярной ткани нет. Прокамбиальный тяж в щитке
сильно разветвленный (Яковлев, 1950). Проводящие пучки щитка и
колеоптиля входят в стелу оси зародыша в одном и том же узле,
представляя собой единую систему (Данилова, Соколовская, 1973).
Таким образом, эпибласт, колеоптиль и щиток представляют собой
как бы единую структуру. В связи с рассмотрением природы эпиб-
ЗародыШ
535
ласта мы выскажем некоторые соображения, касающиеся строения
апекса побега зародыша. Данные о развитии зародыша пшеницы (Ба-
тыгина, 1974, 1987) позволяют присоединиться к точке зрения,
согласно которой апикальная часть проэмбрио может быть уподоблена
апикальной меристеме стебля и рассматриваться как первый апекс
побега растения. Существует также мнение, что апекс побега
возникает после заложения семядолей, у однодольных — из дериватов
клетки сЪ (см. Новая концепция происхождения зародыша
однодольных). Противопоставлять апикальный полюс зародыша
апикальной меристеме побега нельзя, так как они являются
производными апикальной клетки (са). Семядоли — продукт деятельности
апикальной меристемы зародыша, поэтому щиток и эпибласт можно
рассматривать как семядолю и первый, модифицированный лист,
соответственно. Нельзя согласиться с тем, что не следует гомологизиро-
вать эпибласт с листом (семядолей), поскольку он не имеет прокам-
биальных тяжей. У редуцированных листьев (чешуйчатых) не
образуется прокамбиальных тяжей (Eames, 1961), так как из-за
редукции они не достигли той «критической массы», при которой
начинается дифференциация проводящей системы. Известно, что
проводящий пучок возникает при определенном уровне дифференциации
листового зачатка. На одном из этапов развития зародыша идет
дальнейшая дифференциация почечки (плюмулы). Внутри нее
дифференцируются листья, закладывающиеся валиком, число которых у разных
видов злаков различно (2—4). Зачаточный побег представляет собой
ось, состоящую из узлов и междоузлий. Междоузлия сближены и
имеют вид «пачки» плоских дисков. В каждом междоузлии
формируется лист путем интеркалярного роста. Размеры междоузлий зависят
от вида растений, а также от условий прорастания, что практически
обусловливает высоту растения. Рост конуса нарастания происходит за
счет инициальных клеток апикальной меристемы, находящейся на
самой верхушке побега.
Эволюционное становление зародыша злаков. Понимание
нормального эмбриогенеза злаков невозможно без учета
филогенетического положения исследуемой группы растений и особенностей
эволюционного становления зародыша однодольных в целом. Проблема
однодольности к настоящему времени исследована недостаточно, что
видно из дискуссий, продолжающихся до сих пор и затрагивающих
самые разные аспекты этой проблемы (см. Новая концепция
происхождения зародыша однодольных).
Существует, как известно, несколько принципиально различных
гипотез эволюционного становления семядоли у зародыша однодольных
растений. Одним из центральных вопросов этой проблемы является
вопрос о положении апекса побега в зародыше однодольных
(латеральное или терминальное). Злаки представляют в этом отношении
несомненный интерес, так как среди однодольных дорзовентральность их
строения проявляется с первых этапов развития зародыша (Batygina,
536 Семя
1969, 1976; Батыгина, 1974, 1987). Анализ литературных данных и
результаты исследования по пшенице показали, что смещение апекса
побега в латеральное положение в эмбриогенезе у различных групп
однодольных протекает с различной скоростью. Guignard и Mestre
(1969, 1971), Guignard (1984) считают, что приобретение
однодольное™ следует рассматривать в качестве прогрессивной тенденции. У
большинства однодольных, которые считаются более примитивными,
особенно Fluviales, а также у типичных однодольных ('например, у
Liliiflores) «смещение» инициального локуса апекса побега в
латеральное положение происходит в эмбриогенезе сравнительно медленно и
относительно поздно. Напротив, у групп, специализация которых
продвинулась далеко, дорзовентральность зародыша происходит настолько
быстро, что создается впечатление, будто и точка роста в самый
момент своего появления формируется латерально. Злаки являются
ярким примером этого положения. Детальный анализ развития
зародыша Triticum позволил уловить постепенное «смещение» зоны
заложения апекса побега в процессе онтогенеза из терминального положения
в латеральное в результате специфического сочетания аллометрических
ростовых процессов, характерных именно для эмбриогенеза злаков.
Латеральное положение точки роста и терминальное положение
семядоли в зрелом зародыше пшеницы — явление вторичное, как в
онтогенетическом, так, по-видимому, и в эволюционном плане (Батыгина,
1968а,б; Batygina, 1969; Paulson, 1969).
Подобным же образом, как отмечают Guignard и Mestre,
инициальный локус побега очень рано в эмбриогенезе «смещается» в
латеральное положение у Pontederiaceae (Swamy, 1966), Juncaceae, Typhaceae,
Cyperaceae (Guignard, 1961a,b; Haccius, Lakshmanan, 1966; Juguet,
1968, 1969, 1975, 1989, 1992). Однако в одной из последних работ
Padmanabhan (1996) высказано положение, что развитие апекса
побега у некоторых однодольных происходит с самого начала латерально.
Это дало возможность автору предположить, что существует не одна
модель формирования апекса побега у однодольных растений, а
несколько. Анализ литературы и собственные данные по развитию
зародыша однодольных позволили нам высказать положение о том, что
апикальная часть проэмбрио как однодольных, так и двудольных
может быть уподоблена апикальной меристеме стебля, а семядоли можно
рассматривать как первую пару листьев, образующихся на ней подобно
тому, как на апексе стебля возникают примордии листьев (Guignard,
Mestre, 1969, 1971; Б атыгина, 1974; Батыгина, Андронова, 1988;
Padmanabhan, 1996). Как считает Padmanabhan, присутствие
«листовых» семядолей с зелеными пластинками, черешком и пазушными
почками у зародышей двудольных является весомым доказательством
того, что апикальный домен — первая меристема побега зародыша, а
семядоля — боковой орган по отношению к оси полярности. Jacques-
Felix (1988) рассматривает семядолю однодольного зародыша как про-
филл боковой оси, считая остальной зародыш протокормом без семя-
Зародыш
537
долей. Padmanabhan (1993a,b) рассматривает семядолю у Commelina
и пальм как профилл, верхушка которого превратилась в гаусториаль-
ный орган.
Однако продолжает оставаться дискуссионным механизм
образования одной семядоли у однодольных, в том числе у злаков (см. Новая
концепция происхождения зародыша однодольных).
При рассмотрении проблемы однодольности необходимо особое
внимание уделять изучению полярности и симметрии (включая и
внутреннюю) зародыша, поскольку оба признака имеют большое значение при
обсуждении терминального или латерального положения меристемы
эпикотиля у зародыша однодольных.
Известно, что полярность устанавливается уже в зиготе, которая,
как считает Wardlaw (1955), и определяет полярность всего зародыша.
По мнению Padmanabhan (1996), такая концепция обоснована, так
как зиждется на наблюдениях за зародышами, у которых клеточные
деления идут закономерно и предсказуемо. Однако у некоторых видов
однодольных дериваты зиготы не расположены правильными моделями
и трудно проследить терминальный полюс. В таких случаях полярность
зиготы, вероятно, не в полной мере определяет полярность зародыша.
Кроме того, в последнее время появились новые факты, указывающие,
что положение оси полярности яйцеклетки и зиготы может изменяться
в процессе их развития (Kropf, 1994). Несомненно, большой вклад в
изучение полярности вносят генетические работы с мутантами.
Предложена апикально-базальная модель образования оси полярности (на
примере зародыша Arabidopsis) и выделен один из нескольких генов
(gnom), определяющих ее (Mayer et al., 1993).
Строение зерновки. Невскрывающийся сухой односемянный плод
злаков называется зерновкой. Обычно он имеет тонкий пленчатый или
кожистый околоплодник, плотно облегающий семя, что создает
впечатление их срастания (Richard, 1808). Размер зерновки варьирует,
форма ее может быть также различной, от овально-яйцевидной до
узкоцилиндрической (Цвелев, 1982). В зерновке выделяют вентральную,
дорзальную и латеральные стороны, а также верхушку и рубчик.
Рубчик является местом прикрепления семени к стенке плода. На
вентральной стороне плода, в месте срастания краев плодолистика, часто
образуется бороздка, которая иногда хорошо выражена по всей длине
зерновки (Triticum aestivum, Festuca rubra) или приурочена только к
базальной части плода (трибы Paniceae, Cynodonteae); в отдельных
случаях бороздка не выявляется (триба Oryzeae) (Петрова и др.,
1985).
Зародыш расположен в основании зерновки, занимая пристенное
положение, и обращен к вентральной ее стороне. Заполняя небольшую
часть общего объема зерновки, зародыш соприкасается с эндоспермом
только щитком, а не всей поверхностью, как у большинства
однодольных.
538
Семя
Зародыши злаков, несмотря на большое сходство, все же
различаются по генезису и строению. Признаки строения зрелого зародыша
могут служить для характеристики структурных типов злаков
(Bruns, 1892; Tieghem van, 1897; Martin, 1946; Reeder, 1957;
Guignard, 1961a, b; Kinges, 1961; Swift, O'Brien, 1972a,b; Петрова и
др., 1985). Было выделено 6 типов: фестукоидные, бамбузоидные,
центотекоидные, арундиноид-дантониоидные, хлоридоид-
эрагростоидные и паникоидные (Reeder, 1957). Зародыши пшеницы,
ржи, ячменя и овса относятся к фестукоидному типу развития, а
кукурузы — к паникоидному.
У фестукоидных злаков зародыш занимает меньше половины
зерновки (Dactylis glomerata, Festuca rubra), у паникоидных злаков (Coix,
Zea) — крупный зародыш, занимающий больше половины зерновки, у
эрагростоидных (хлоридоидных) злаков (триба Cynodonteae — Sporo-
bolus, Eragrostis) зародыш по размеру промежуточного типа (Петрова
и др., 1985). У бамбуков зародыш отличается сильно разросшейся
семядолей, занимающей всю центральную часть плода, а также
расположением почечки и корешка, изогнутых в одну сторону (Петрова,
Яковлев, 1968; Яковлев, Камелина, 1973). Соотношение размеров
эндосперма и зародыша в плоде злаков имеет важное систематическое
значение. Эндосперм зрелой зерновки может быть твердым, мягким,
плотным, рыхлым и т.д. Его разная консистенция обусловлена разным
соотношением белка и крахмала.
Прорастание у злаков подземное. Зародышевый побег, закрытый
колеоптилем, выносится на поверхность почвы в результате удлинения
первого междоузлия (Onderdonk, Ketcheson, 1972; Петрова и др.,
1985). Рис. 49.
Алимова, 1994; Батыгина, 19626, 1968а,б; 1974, 1987; Батыгина, Андронова, 1988;
Данилова, Соколовская, 1971, 1973; Иоффе, 1957; Коробова, 1962; Красовская,
1952; Модилевский, 1963; Пашков, 1951; Петрова, Яковлев, 1968; Петрова и др.,
1985; Поддубная-Арнольди, 1944, 1964; Соколовская, 1965, 1967, 1968; Хазова,
1970; Цвелев, 1982; Чеботарь, 1960, 1970; Яковлев, 1946а,б, 1950, 1951, 1958,
1971; Яковлев, Камелина, 1973; АгЪег, 1934; Avery, 1930; Batygina, 1969, 1976;
Brown, 1959, 1960, 1965; Bruns, 1892; Goebel, 1932; Goldberg et al., 1994;
Guignard, 1961a,b, 1975a,b, 1984; Guignard, Mestre, 1969, 1971; Guttenberg v., 1960;
Haccius, Lakshmanan, 1966; Jacques-Felix, 1988; Juguet, 1969, 1972, 1975, 1989,
1992; Jung, 1937; Kinges, 1961; Kropf, 1994; Martin, 1946; Mayer et al., 1993;
McCall, 1934; Merry, 1941; Narayanaswamy, 1955a,b; Norstog, 1969, 1972; O'Brien,
Thimann, 1967; Onderdonk, Ketcheson, 1972; Padmanabhan, 1993a,b, 1996; Pankow,
1962; Pankow, Guttenberg v., 1957, 1959; Paulson 1969; Randolf, 1936; Reeder, 1957,
1961; Richard, 1808; Roth, 1955, 1957, 1961; Saha, 1956; Sinnott, 1960; Soueges,
1924b; Stoddart et. al., 1973; Swamy, 1966; Swift, O'Brien, 1972a,b; Tateoka, 1964;
Tieghem van, 1897; Tillich, 1977; Velenovsky, 1907; Wardlaw, 1955.
Зародыш
539
ЭМБРИОГЕНЕЗ ПИОНОВЫХ
Большой интерес для систематиков и эмбриологов представляет
изучение эмбриогенеза у древних таксонов, к которым относится сем.
Paeoniaceae (Тахтаджян, 1966). Ранее считалось, что первое деление
в зиготе и последующие деления в проэмбрио и зародыше у всех
цветковых растений сопровождаются образованием клеточных стенок.
Яковлев (1951) впервые отметил, что развитие полового зародыша
пиона протекает уникальным образом, не известным для
покрытосеменных растений. Это позволило автору в 1958 году предложить
новый тип эмбриогенеза — Paeoniaceae (=Paeoniad). Уникальность
типа заключается в том, что первое деление в зиготе и последующие
деления (более 1000) в «предзародышевом образовании» не
сопровождаются заложением перегородок, в результате чего образуется
ценоцитная структура (Яковлев, Иоффе, 1957а,б, 1960, 1965; Ya-
kqvlev, Yoffe, 1957). Другой особенностью полового зародыша, по
представлениям Яковлева и Иоффе, является двухфазность его
развития. Первая фаза начинается с деления зиготы и заканчивается
заложением в ценоцитной структуре клеточных стенок. Вторая фаза
развития полового зародыша характеризуется образованием
«меристематических очагов» (до 25) по периферии ценоцитно-
клеточного предзародыша. Преимущественное развитие получает лишь
один из очагов, который в конечном счете и развивается в хорошо
дифференцированный половой зародыш (Яковлев, 1983а).
Открытие нового типа эмбриогенеза цветковых растений привлекло
внимание эмбриологов разных стран мира (Cave et al, 1961; Matthis-
sen, 1962; Москов, 1964; Wunderlich, 1966; Carniel, 1967; Жгенти,
1974; Батыгина и др., 1978; Батыгина, Бутенко, 1981; Natesh, Rau,
1984). Большинство исследователей, занимающихся развитием
зародыша различных видов пиона (Paeonia albiflora (= lactiflora), P. anomala,
P. brownii, P. califomica, P. caucasica, P. delavayi, P. lutea, P. majko,
P. officinalis, P. suffruticosa (= moutan), P. tenuifolia, P. veitchii (= be-
resowski), P. wittmanniana), согласились с точкой зрения Яковлева и
Иоффе об уникальности первых этапов эмбриогенеза пиона, а также
с тем, что у всех изученных видов они сходны. Тем самым они
опровергли мнение индийской исследовательницы Murgai (1959, 1962)
о том, что клеточное деление зиготы пиона сопровождается
заложением перегородки.
Однако, несмотря на это, многие исследователи пришли к выводу,
что эмбриогенез пиона в связи с его уникальностью требует
дальнейших детальных исследований, особенно его ранних этапов.
С позиции новых представлений о системе репродукции цветковых
растений (Батыгина, 1978, 1992, 1993а,б; Batygina, 1989a-c, 1990), а
540 Семя
также новых экспериментальных данных, полученных по развитию
зародыша разных видов пиона в естественных условиях и в культуре in
vitro (Батыгина и др., 1978; Васильева и др., 1978; Батыгина, Бутенко,
1981), мы смогли внести определенные коррективы в понимание
эмбриогенеза пиона и дали новую интерпретацию природы зародыша,
формирующегося в процессе развития семени пиона (Batygina, 1989a-c,
1990, 1993, 1994; Batygina et al., 1992; Batygina, Shamrov, 1993;
Brukhin, Batygina, 1994).
С наших позиций, в семени пиона последовательно образуются
два типа зародышей, различающихся между собой
происхождением, а именно: половой и соматический (эмбриоид). Половой
зародыш образуется в результате полового процесса (сингамии) — гете-
рофазная репродукция. Его развитие завершается образованием
ценоцитно-клеточной структуры и эпидермиса в ней, дальнейшей
дифференциации полового зародыша не происходит (I фаза
развития полового зародыша, по Яковлеву и Иоффе, 1965; Яковлеву,
1983а). Далее начинается формирование соматических зародышей
(гомофазная репродукция — 2п=2п), которые образуются из
одиночных клеток эпидермиса ценоцитно-клеточного полового предзародыша
(II фаза развития полового зародыша, по Яковлеву и Иоффе, 1965;
Яковлеву, 1983а). В ходе дальнейшего развития обычно один из
соматических зародышей проходит процесс дифференциации на органы,
остальные — гибнут. Таким образом, в результате сложных морфоге-
нетических преобразований в зрелом семени пиона обычно остается
лишь соматический зародыш (как правило, один), а не половой,
согласно Яковлеву (1951, 1958, 1983а).
Образование многочисленных соматических зародышей на ценоцитно-
клеточной структуре у пиона, по нашему мнению, есть не что иное, как
процесс клонирования полового зародыша на ранней стадии его
развития (кливажная, монозиготическая эмбриоидогения) (см. Эмбрио-
идогения). Таким образом, на первых этапах раннего онтогенеза
происходит переход от гетерофазной репродукции к гомофазной (Batygina
1989а,Ь,с, 1990; Батыгина, 1992, 1993а,б). В связи с этим мы полагаем,
что на ранних этапах онтогенеза у разных видов цветковых растений
(пионы, орхидеи, некоторые паразитные) в семенном или в послесе-
менном развитии происходит своеобразный «метаморфоз». Он
проявляется в смене путей морфогенеза: эмбриогенез (половой способ)
=> эмбриоидогенез, или соматический эмбриогенез (бесполый) (Batygina
1993). Б есполый способ образования соматических зародышей в семени
пиона, а также у некоторых других видов растений (орхидные и др.),
для которых характерна кливажная (монозиготическая-эмбриональная)
эмбриоидогения, так же как и нуцеллярная и интегументальная (ову-
лярная), представляет собой репродуктивную эмбриоидогению (см.
Эмбриоид; Эмбриоидогения). Все вышесказанное позволяет говорить
о развитии в семени пиона последовательно формирующихся
зародышей двух типов, различающихся своим происхождением, но не о
Зародыш
541 |
двухфазности в развитии одного и того же полового зародыша, о которой
пишет Яковлев (1983а).
Интересно отметить, что Яковлев в работе, посвященной развитию
ценоцитных структур у пиона, пишет: «...столь своеобразный
ступенчатый тип эмбриогенеза (полового — Т.Б.), идущий от ценозиготы
через соматический эмбриогенез к зрелому зародышу, я рассматриваю
как один из путей в эволюции покрытосеменных» (1965, с. 38). К
этому следует добавить, что в одной из работ Yakovlev и Yoffe (1957)
рассматривают образование зародышей на ценоцитно-клеточной
структуре как полиэмбрионию. Однако, несмотря на все эти совершенно
правильные рассуждения, авторы все же продолжают придерживаться
прежней позиции, что в семени пиона развивается половой
зародыш, как и у всех цветковых растений.
Следует отметить, что ранее мы также (Yakovlev, Batygina, 1977;
Батыгина, Бутенко, 1981) придерживались интерпретации развития
зародыша пиона, предложенной Яковлевым и Иоффе, и считали, что в
зрелом семени пиона образуется половой зародыш. Только
сравнительно-эмбриологический анализ происхождения и развития нуцел-
лярных, интегументальных и «кливажных» зародышей у различных
видов растений, а также экспериментальные данные, полученные по
развитию соматических зародышей в культуре in vitro, позволили нам
дать новую трактовку процессов, происходящих в семени пиона
(образование двух типов последовательно развивающихся зародышей).
Рассмотрим особенности развития полового и соматического
зародышей пиона более подробно.
Развитие полового зародыша пиона. У пиона, так же как и у
большинства цветковых растений, происходит процесс двойного
оплодотворения. Никаких отклонений при сингамии и тройном слиянии
отмечено не было. При делении зиготы кариокинез не сопровождается
цитокинезом, в результате чего образуется двуядерный ценоцит.
Цитоплазма этой двуядерной клетки более или менее равномерно вакуо-
лизирована. Затем наступает второе деление, при котором ядра
делятся синхронно, и формируется четырехъядерный ценоцит. Иногда при
делении ядер в середине фрагмопласта закладывается «зернистая
дорожка» — зачаток будущей клеточной пластинки, однако сама
пластинка так и не образуется. В ходе дальнейшего развития возникает
содержащая 16 и более ядер ценоцитная структура. В начале развития
ядра ценоцита равномерно распределены по всей клетке. Однако,
начиная с восьмиядерной стадии, в зародыше формируется большая
центральная вакуоль (в результате слияния мелких вакуолей), и ядра
располагаются по периферии ценоцита. Синхронный характер ^делений
нарушается примерно после 7—8 последовательных ядерных делений.
Ценоцитно-клеточная стадия эмбриогенеза. По достижении
определенной критической массы (на стадии приблизительно 400—500
ядер) в ценоците начинается заложение клеточных перегородок. Время
заложения перегородок у разных видов рода Paeonia различно: напри-
542
Семя
мер, у P. anomala это происходит на 15—18 день после опыления, а
у P. lactiflora несколько позже, примерно на 18 —19 день после
опыления. Заложение клеточных перегородок в ценоците происходит в
базипетальном направлении, от периферической части зародыша к
центру, где продолжается деление ядер без образования клеточных
перегородок. Это сопровождается постепенным уменьшением объема
центральной вакуоли и появлением множества довольно крупных
вакуолей.
На 19—21 день после опыления в образовавшейся ценоцитно-кле-
точной структуре благодаря периклинальным делениям периферических
клеток начинает асинхронно дифференцироваться эпидермальный слой,
клетки которого отличаются более густой цитоплазмой и слегка
увеличенными ядрами.
Развитие полового зародыша пиоиа заканчивается
формированием эпидермального слоя и является единственным признаком его
гистогенной дифференциации.
Развитие соматического зародыша (эмбриоида). После
заложения клеточных перегородок и обособления эпидермального слоя
в ценоцитно-клеточном зародыше начинается дифференциация клеток,
являющихся инициалями будущих соматических зародышей. Эти
клетки выделяются среди остальных своим меристематическим
характером, более густоокрашенной цитоплазмой, повышенным ядерно-ци-
топлазменным отношением и более утолщенной по сравнению с
другими клетками оболочкой. Гистохимические исследования показали, что
в цитоплазме инициальных клеток содержится больше белка, чем в
окружающих их клетках.
Заложение эмбриоидов происходит преимущественно в апикальной
части ценоцитно-клеточного полового зародыша, экзогенно, за счет
периклинальных делений клеток эпидермального слоя (Batygina et al.,
1992; Брюхин, 1993; Brukhin, Batygina, 1994).
Время заложения эмбриоидов, а также их число и темп развития у
разных видов неодинаковы. Например, у P. anomala их инициация на
поверхности ценоцитно-клеточного зародыша происходит раньше (на
22—24 день после опыления), чем у P. lactiflora (на 23—30 день
после опыления), при этом на ценоцитно-клеточной половой структуре
P. anomala закладывается меньше эмбриоидов (7—10) по сравнению
с P. lactiflora (9—17).
Несмотря на заложение столь большого количества эмбриоидов,
обычно лишь один из них развивается до состояния дифференциации
на органы, остальные же гибнут на ранних стадиях развития. Были
отмечены лишь отдельные случаи наличия в зрелом семени P. anomala
двух полностью сформированных эмбриоидов.
С самого момента заложения и почти до полной его
дифференциации эмбриоид сохраняет связь с «породившей» его
ценоцитно-клеточной структурой полового зародыша.
Зародыш
Однако следует отметить, что со стадии инициации эмбриоидов
происходит постепенная потеря тургора в ценоцитно-клеточной
структуре, лизис внутренних клеток и уменьшение ее объема; на стадии
зрелого семени она, как правило, полностью дегенерирует.
Развитие большинства образующихся эмбриоидов подчинено
определенным закономерностям. Первое поперечное деление в инициалях
эмбриоидов на ценоцитно-клеточной структуре приводит к
образованию апикальной (са) и базальной (cb) клеток двуклеточного
эмбриоида. В дальнейшем апикальная клетка делится почти наклонной
перегородкой, в то время как базальная дает качало двум ^клеткам —
средней m и нижней сг. Каждая производная апикальной клетки
делится перегородкой, ориентированной перпендикулярно к первой
наклонной стенке, образуя квадранты (ярус q). При следующем делении
эти квадранты дают начало октантам, выделяются ярусы I и I'.
Верхний ярус впоследствии образует семядоли зародыша. Клетка m сходно
делится на четыре квадранта, которые затем дают начало гипокотилю
и инициалям плеромы корня. Дальнейшие деления в производных
клетки cb приводят к формированию инициалей периблемы корня и
корневого чехлика. Поскольку базальная и апикальная клетки принимают
приблизительно равное участие в образовании тела зародыша, а сус-
пензор отсутствует, можно считать, что развитие соматического
зародыша пиона идет по Asterad-типу Репаеа-вариации, согласно
классификации Johansen (1950).
Обычно на глобулярной стадии развития в эмбриоиде происходит
формирование эпидермального слоя. В дальнейшем в субэпидермальном слое
его апикальной части наблюдаются периклинальные деления и формируются
семядоли (сердечковидная стадия развития, 35—38 день после опыления).
По мере дальнейшего роста семядолей (38—40 день после опыления, тор-
педовидная стадия) происходит дифференциация в них прокамбиальных
тяжей, апекс побега слабо выражен. Обращает на себя внимание некоторая
асимметрия в развивающемся эмбриоиде. В зрелом семени эмбриоид
занимает примерно его десятую часть.
Таким образом, при развитии семени пиона имеет место
своеобразная полиэмбриония (Яковлев, 1965; Carniel, 1967; Haccius, 1955b;
Батыгина, Бутенко, 1981). Соматический зародыш, получивший
преимущественное развитие среди других зародышей, образующихся на
ценоцитно-клеточной структуре, проходит стадии, свойственные
развитию полового зародыша двудольного растения, т. е.
глобулярную, сердечковидную и торпедовидную стадии.
Экспериментальные данные подтверждают идентичность развития
соматического зародыша in situ (в семени) и соматических
зародышей пиона в культуре in vitro (см. Эмбриоид). Рис. 48.
Батыгина, 1978, 1987, 1992, 1993а,б; Батыгина, Бутенко, 1981; Батыгина и др.,
1978- Брюхин, 1993; Васильева и др., 1978; Жгенти, 1974; Москов, 1964; Тах-
таджян, 1966; Яковлев, 1951, 1958, 1965, 1983а; Яковлев, Иоффе, 1957а,б, 1960,
544
Семя
1961, 1965; Batygina, 1989a,b,c, 1990, 1993, 1994; Batygina, Shamrov, 1993; Baty-
gina et al., 1992; Brukhin, Batygina, 1994; Carniel, 1967; Cave et al., 1961; Haccius,
1955b; Johansen, 1950; Matthissen, 1962; Murgai, 1959, 1962; Natesh, Rau, 1984;
Wunderlich, 1966; Yakovlev, Batygina, 1977; Yakovlev, Yoffe, 1957.
ЭМБРИОГЕНЕЗ ОРХИДНЫХ
Семейство Orchidaceae является одним из наиболее многообразных
по морфологии вегетативных и генеративных структур. Оно
насчитывает около 25 тысяч видов (Dressier, 1981). Несмотря на большой
интерес к этим удивительным растениям, эмбриологически изучено
немногим более 60 видов.
Эмбриогенез. Наиболее значительные достижения в области изучения
эмбриогенеза и послесеменного развития орхидных связаны с
исследованиями Veyret (1965, 1974). На основании анализа литературных и
оригинальных данных по изучению зародыша и проростка у 34 видов
из 21 подтрибы1 сделан вывод о том, что ранние этапы развития зародыша
орхидных протекают так же, как и у других представителей цветковых
растений. Деление зиготы, обычно поперечное, приводит к формированию
двуклеточного проэмбрио. В результате деления апикальной (са) и ба-
зальной (cb) клеток формируется четырехклеточный проэмбрио (стадия
тетрады, или первичной тетрады2) Дальнейшая дифференциация
проэмбрио может осуществляться на основе первичной (серии первого периода1)
или вторичной тетрады , которая образуется за счет деления дериватов
апикальной клетки четырехклеточного проэмбрио, т. е. в этом случае
клетка cb не принимает участие в построении собственно зародыша
(серии второго периода2) (Таблица 1). У орхидных обнаружены 4 типа
первичных и вторичных тетрад — А\, Ai, Q, С2 3 (или изобилатераль-
ный, Т-образный, обратно Т-образный и линейный типы,
соответственно). Образование тетрад В типа (т.е. с наклонной перегородкой
при делении клетки са) у орхидных не отмечено. В ряде случаев у
одного и того же вида наблюдаются разные типы тетрад. Так, линейные
и Т-образные тетрады обнаружены у Polystachya microbambusa (Veyret,
1965, 1974), Dactylorhiza baltica и D. incarnata (Андронова, 1988),
Orchis purpurea, O. provincialis (Лагутова, Чеботарь, 1992), Calypso
Veyret (1965) использовала систему классификации видов орхидей Schlechter
(1926). В настоящее время систематика орхидей существенно пересмотрена (Dressier,
1981).
2
Здесь и далее по классификации Soueges (1939): см. также Принципы
классификации типов эмбриогенеза.
з
Обозначение типов тетрад зародыша в соответствии с классификацией Soueges
(1936, 1939) в модификации Veyret (1965, 1974).
Зародыш
545
Таблица 1. Ключ для определения типов развития зародышей
у различных групп орхидных (Veyret, 1974)
А. Виды с зародышем без семядоли
В. Виды первого периода
С. Тетрада А\
зародыш = ca+cb
СС. Тетрада А2
зародыш = ca+cb
зародыш = са+т+п+о
зародыш = са+т+п
зародыш = ca+m+h'
зародыш = са+т
ССС. Тетрада Cl
зародыш = са+т+п+о
ВВ. Виды второго периода
Д. Вторичная тетрада А\
зародыш = cc+cd
/\/\. Вторичная тетрада Al
зародыш = cc+m+ci
зародыш = сс+т
АА. Виды с зародышем, имеющим
семядолю
Е. Виды первого периода
Тетрада Al
зародыш = са+т
ЕЕ. Виды второго периода
Вторичная тетрада Al
зародыш = cc+m+ci
(Группа Neottia nidus-avis)
(Группа Manniella gustavi)
(Группа Limodorum abortivum)
(Группа Lecanorchis japonica)
(Группа Orchis maculata)
(Группа Liparis pulverulenta)
(Группа Eulophia oedoplectron)
(Гру
ппа эагсап
theae)
(Группа Polystachya geraensis)
(Группа Coelogyne parishii)
(Группа Epidendrum vitellinum)
(Группа Polystachya microbambusa)
здесь и далее суспензор не учитывается.
ЕЛ.
bulbosa. (Yeung, Law, 1992), изобилатеральный и Т-образный типы —
у Epidendrum vitellinum и Polystachya geraensis (Veyret, 1965, 1974).
В ходе дальнейшего развития проэмбрио проходит стадии
квадрантов и октантов. В зависимости от вида, данные стадии проходят как
дериваты клетки са, так и некоторые дериваты клетки cb. Этажи I и
/' представлены производными апикальной клетки двуклеточного
проэмбрио. Зародыш может иметь также ярусы т, ci и др., в
зависимости от того, какие дериваты клетки cb участвуют в формировании его
тела. В исследованиях Veyret не было выявлено признаков гистогенной
дифференциации, кроме вычленения инициалей протодермы за счет
периклинальных делений клеток всех ярусов. В слое протодермы
обнаружена гетерогенность клеток по размерам (Johansen, 1950).
У Gymnadenia conopsea было показано, что продольные деления в
клетках этажей октантов (ярусы / и /') соответствуют делениям, в
35-828
546
Семя
результате которых отделяются инициали периблемы и плеромы
(Шамров, Никитичева, 1992). Клетка т и ее дериваты претерпевают
поперечные деления, образуя ряд клеток. Верхняя клетка из этого
ряда становится гипофизарной (h), а остальные формируют
нитевидный подвесок. Однако авторы подчеркнули, что выделяют данные
гистогены по их положению в собственно зародыше. Структурной
дифференциации клеток различных гистогенов не наблюдается. По
мнению Johansen (1950), наличие гипофизарной клетки у зародышей
Orchis, Gymnadenia и других, близких к ним видов орхидных, спорно.
Он считает, что, хотя и существует клетка, которая по аналогии с
зародышем у других цветковых растений занимает положение,
характерное для гипофизарной клетки, ее роль, в случае зародыша
орхидных, сводится только к участию в нарастании массы клеток суспензо-
ра.
Существует точка зрения о зональности, присущей зародышу
орхидных, которая выделяется на основе различий в размерах клеток
(Veyret, 1965, 1974; Batygina, Vasilyeva, 1983; Батыгина, Шевцова,
1985; Шамров, Никитичева, 1992) или ультраструктурной организации
(Жукова, Савина, 1978). Зональность устанавливается на ранней стадии
развития вследствие того, что тенденция к делению сохраняется лишь в
клетках эмбриодермы и нижележащих клетках апикальной части
зародыша, тогда как остальные клетки рано теряют способность делиться и
значительно увеличиваются в размерах, превращаясь в паренхимные
клетки. Соотношение размеров зон (мелкоклеточной и крупноклеточной)
варьирует в зависимости от вида растения и стадии развития зародыша. В
период активного роста зародыша мелкоклеточная зона составляет
У2 — Уд часть от объема зародыша, ее клетки активно делятся. По мере
созревания семени деления в апикальной части зародыша прекращаются.
У одних видов зональность на стадии зрелого зародыша сохраняется.
Мелкоклеточная зона в случае Goodyera repens, Polystachya microbambusa
(Veyret, 1965), Thunia alba (Андронова, 1988) составляет Уз часть от
объема зародыша или менее, а у Bletilla striata (Андронова, 1988) —
примерно V2 часть. У других видов — Epipactis palustris, E.atrorubens,
Limodorum abortivum, Cephalanthera ensifolia — такая зональность на
стадии зародыша зрелого семени выражена слабо или отсутствует
(Veyret, 1965).
У большинства видов зародыш зрелого семени имеет только
гистологическую дифференциацию, выражающуюся в обособлении трех
тканей — покровной, паренхимной и меристематической.
Дифференциация элементов проводящей системы отсутствует.
Локализация и динамика Питательных веществ в процессе
развития зародыша. Гистохимическое изучение показало, что на первых
этапах эмбриогенеза в клетках развивающегося зародыша начинает
аккумулироваться крахмал. Так, у Calypso bulbosa отдельные
крахмальные зерна появляются сначала в базальной клетке трехклеточного
проэмбрио. К моменту созревания семени он составляет основной за-
Зародыш
547
пасной продукт всех клеток зародыша. Наряду с крахмалом в клетках
также присутствуют жировые капли. Все клетки зрелого зародыша, за
исключением базальной, густоплазменные, дают положительную
реакцию на белки при окрашивании амидо черным 105. Однако отдельных
белковых зерен в цитоплазме клеток зародыша не выявлено (Yeung,
Law, 1992).
У Gymnadenia conopsea накопление крахмала и белков приурочено
к различным ярусам зародыща: для мелкоклеточной апикальной зоны
характерно высокое содержание крахмала, тогда как в клетках базаль-
ного района аккумилировались белки (Шамров, Никитичева, 1992).
У Dactylorhiza baltica крахмал появляется в клетках зародыша на
4—6-клеточной стадии его развития (Андронова, 1988). К 30 дню
после начала цветения в клетках зародыша накапливается большое
количество крахмала. После этого начинается постепенная его
утилизация. В первую очередь этот процесс затрагивает клетки апикального
района. К 45 дню после начала цветения крахмал обнаруживается
лишь в базальных клетках, прилегающих к суспензору, и в некоторых
клетках эмбриодермы. На более поздних стадиях развития зародыша
крахмальных зерен в его клетках не обнаружено. Через 45 дней после
начала цветения прекращаются деления клеток апикального района
зародыша, происходит дегенерация клеток суспензора, а также клеток
(или клетки) зародыша, непосредственно контактирующих с ним.
Кроме того, происходит быстрая дегенерация содержимого клеток
наружного интегумента, из которого образуется семенная кожура. Все это
говорит о том, что зародыш (и все семя) вступает в период
подготовки к покою.
Начало утилизации крахмала совпадает с началом синтеза запасных
белков. В клетках зародыша через 40 дней после начала цветения
можно обнаружить мелкие белковые глобулы. По мере дальнейшего
развития количество и размер глобул значительно увеличивается.
В зародыше зрелого семени крупные белковые глобулы равномерно
распределены по всем клеткам зародыша. По мере утилизации
крахмала в клетках зародыша одновременно с белками начинают
появляться жировые капли.
Накопление зерен крахмала в зародышах других видов рода
Dactylorhiza не всегда имеет место. Однако динамика накопления белкой и
жиров сходна с таковой D. baltica (Андронова, 1988). В зрелых
зародышах Cypripedium acaule также накапливаются белки и липиды,
крахмал не обнаружен (Leroux et al., 1995).
Таким образом, имеющиеся данные свидетельствуют о том, что все
клетки зародыша, независимо от их размеров и местоположения, к
моменту полного созревания семени заполняются запасными питатель-
Полное созревание семян у данного вида происходит обычно через 60 дней после
начала цветения.
35*
548 Семя
ными веществами (белками и липидами или крахмалом и липидами).
Возможно, это является аргументом в пользу существующего мнения,
что зародыш зрелого семени лишен меристематической ткани (Nishimura,
1991). Однако, несмотря на то, что функционирование меристемы в
апикальной части зародыша прекращается в период созревания семени,
меристематическая активность в данном районе восстанавливается при
его прорастании.
Причины слабой дифференциации зародыша орхидных.
Согласно Поддубной-Арнольди (1964), слабая дифференциация зародыша
связана с отсутствием или недоразвитием эндосперма. Редукция
эндосперма характерна для всего семейства орхидных. При этом возможны
две ситуации: 1) двойное оплодотворение осуществляется нормально,
первичное ядро эндосперма делится, образуется несколько ядер
эндосперма; 2) двойное оплодотворение нарушается, при этом возможны
следующие варианты: а) ядро спермия объединяется с ядрами
центральной клетки, но первичное ядро эндосперма дегенерирует, не
делясь; б) ядро спермия вступает в контакт с ядрами центральной
клетки, но не объединяется с ними, и вся группа впоследствии
разрушается; в) спермий не входит в центральную клетку. По данным
Савиной (1972), в одной завязи Ophrys insectifera можно наблюдать
формирование первичного ядра эндосперма, которое не делится, а
также случаи, когда первичное ядро эндосперма не образовывалось.
Автор считает, что имеет место как структурная, так и функциональная
редукция эндосперма, поскольку даже если и формируется несколько
его ядер, то они не имеют существенного значения для питания
зародыша. Другие исследователи (Терёхин, Камелина, 1969), однако,
полагают, что у орхидей имеет место только структурная редукция
эндосперма. Он активно выполняет свою трофическую функцию на
ограниченном отрезке времени в ходе развития молодого спорофита,
хотя и представлен всего лишь клеткой с одним ядром.
Согласно данным некоторых авторов, редукция эндосперма у
орхидных находится в прямой зависимости от степени редукции зародыша
и в обратной — от степени развития суспензора (Терёхин, Камелина,
1969, 1972; Терёхин, 1977). Например, многоядерныи эндосперм
встречается, главным образом, у тех видов орхидей, зародыши
которых имеют слабо развитый суспензор или лишены его. Кроме того,
число ядер эндосперма сокращается с уменьшением массы, числа
клеток и степени дифференциации зародыша зрелого семени. Однако это
правило не всегда выполняется. Так, например, несмотря на то, что
зародыши у Thunia alba и Bletilla striata (1) имеют хорошо развитый
суспензорный аппарат, (2) состоят из большого количества клеток,
(3) различаются степенью дифференциации зародыша (у Thunia —
без зачатка листоподобного органа, у Bletilla — с зачатком листопо-
добного органа), эти два вида характеризуются наличием многоядерного
эндосперма, содержащего 4—10 ядер (Андронова, 1988).
Зародыш
549
Возможно, степень редукции эндосперма связана с
продолжительностью созревания зиготы. У Thunia и Bletilla период времени от
момента оплодотворения до деления зиготы составляет 1 месяц или
более, после чего развивается зародыш, у которого очень быстро
формируется длинный нитевидный (Thunia) или мощный
разветвленный (Bletilla) суспензор. У данных видов первое деление ядра
эндосперма происходит до деления зиготы и позднее формируются 4—10
ядер, которые функционируют на ранних стадиях развития зародыша.
После того как у зародыша быстро развивается суспензор, с помощью
которого он сможет получать питание из материнских тканей, ядра
эндосперма дегенерируют. У других видов (например, Dactylorhiza
sp.) деление зиготы происходит спустя всего 1—2 дня после
оплодотворения. По мере развития зародыша, у которого так же, как у
Thunia и Bletilla, быстро формируется суспензор, происходит
постепенная дегенерация первичного ядра эндосперма без деления.
Отсутствие дифференциации на органы в зародыше орхидных
связывается в ряде работ с экологией и физиологией прорастания семян
и микопаразитическим способом жизни (Терёхин, 1977, 1992).
У небольшого числа изученных видов орхидных отмечено
образование в апикальной части зародыша зачатка «семядоли» (Polystachya
microbambusa — Veyret, 1965, 1974; Bletilla striata (= hyacintina) —
Bernard, 1909; Tohda, 1968; Nishimura, 1991; Epidendrum vitelli-
num _ Veyret, 1965, 1974; Sobralia macrantha — Treub, 1879;
Nishimura, 1991; Arundina graminifolia — Nishimura, 1991; Thunia alba
(— marshalliana) — Терёхин, Никитичева, 1968; Терёхин, 1977,
1991). Однако данные по генезису «семядоли» зародыша орхидных
часто отсутствуют. Различные авторы за семядолю принимают:
1) «бугорок», который в процессе прорастания зародыша
преобразуется в «листоподобный» орган у Bletilla striata (Tohda, 1968);
2) «семядольный выступ», состоящий из 3—7 клеток, который
образуется в эмбриогенезе у Bletilla striata, Sobralia macrantha и
Arundina graminifolia или в послесеменном развитии — у Bletia purpurea.
При этом, если в случае Bletilla и Sobralia этот «выступ» в процессе
прорастания зародыша и формирования протокорма преобразуется в
листоподобный орган, то у Arundina и Bletia подобного не
наблюдается (Nishimura, 1991);
3) апикальную часть зародыша, преобразующуюся в «трубчатую»
семядолю («листоподобный орган» — Е.А.) — у Thunia и Bletilla.
Второй листоподобный орган также рассматривают как семядолю
(Терёхин, Никитичева, 1968; Терёхин, 1977, 1991);
4) примордий листоподобного органа, закладывающийся валиком,
при этом ставится под сомнение целесообразность использования
термина «семядоля» для орхидных (Батыгина, Васильева, 1980, 1983;
Batygina, Vasilyeva, 1983; Батыгина, Андронова, 1988; Batygina, And-
ronova, 1991).
550
Семя
При рассмотрении вопроса о наличии семядоли у орхидных можно
выделить два аспекта. Во-первых, история вопроса показывает, что
главным критерием для отнесения зародыша к группе «семядольных»
является его форма. Зародыши зрелых семян большинства видов на
продольных срезах, как правило, имеют овальную форму, их относят
к бессемядольным (Veyret, 1965, 1974; Поддубная-Арнольди, 1976;
Batygina, Vasilyeva, 1983). Зародыши отдельных представителей
семейства имеют веретенообразную форму. В его апикальной части
отдельные эпидермальные клетки могут выделяться более крупными
размерами и выступать в виде бугорка и, таким образом, существенно
отличаться от других эпидермальных клеток (Manniella gustavi, Po/y-
stachya microbambusa, Spiranthes autumnalis — Veyret, 1965; Thunia
alba — Андронова, 1988). В апикальной части зародышей других
видов может наблюдаться выемка (Rangaeris muscicola, Vanilla frag-
rans — Veyret, 1965). Некоторых представителей орхидных, имеющих
отличную от овальной форму зародыша, относят к «семядольным», а
других — к «бессемядольным» видам. Данные по Thunia alba
противоречивы. Одни авторы (Терёхин, 1977, 1991; Nishimura, 1991)
относят этот вид к «семядольным». Согласно другим (Andronova, Batygina,
1992), зародыш Thunia не имеет семядоли (подробнее — далее по
тексту).
Второй аспект проблемы наличия семядоли у орхидных связан с
дискуссией по поводу самого термина «семядоля» (см. Акотилия;
Семядоля; Новая концепция происхождения зародыша
однодольных).
С целью выяснения морфологической и функциональной природы
структур зародыша орхидных был детально прослежен процесс
прорастания в культуре in vitro у видов, контрастирующих по степени
дифференциации зародыша.
Прорастание зародышей, не дифференцированных на органы
(на примере Dactylorhiza baltica и Phalaenopsis hybridum). Для Dae-
tylorhiza и Phalaenopsis, а также близкородственных видов характерно
отсутствие семядоли (Veyret, 1965, 1974; Nishimura, 1981, 1991;
Batygina, Vasiljeva, 1983; Батыгина, Шевцова, 1985; Шевцова и др.,
1986; Батыгина, Андронова, 1988; Batygina, Andronova, 1991).
В процессе первой стадии прорастания зародыша (набухания)
происходит существенное увеличение объема почти всех его клеток, что
приводит к разрыву семенной кожуры. Формируется проросток,
ранняя стадия которого называется «протокорм» . Некоторые
эпидермальные клетки формируют волоски. В случае D. baltica волоски однокле-
Протокорм (греч. protos — первоначальный, первый, cormos — ствол, побег) —
первичный Побег; впервые данный термин применительно к проросткам орхидных
использовал Treub (1879) по аналогии с «протокормом» — структурой, которая
возникает при прорастании спор у плаунов.
а 551
зародыш -'-"
точные, располагающиеся по одному. На данном этапе зародыш и
протокорм представляет собой единую зону по признаку наличия
эпидермальных волосков (зона I). На последующем этапе наблюдается
формирование новой зоны (которой не было у зародыша зрелого
семени) за счет деления клеток апикального района протокорма (зона
II). По мере роста и дифференциации клеток зоны II некоторые из
эпидермальных клеток также становятся способными формировать
эпидермальные волоски того же типа, что и в зоне I.
Недифференцированный протокорм имеет радиально-симметричную форму. В
апикальной части зоны II формируется зеленый апекс побега (зона III). Зона
III лишена эпидермальных волосков. Первый листовой орган
закладывается валиком. Время его формирования совпадает с
дифференциацией проводящего пучка протокорма. Проводящий пучок никогда не
заходит в зону I и закладывается на границе зон II и III. На первых
этапах своего развития побег у Dactylorhiza имеет сближенные
междоузлия. Основание побега (зона I + зона II) разрастается. Оно имеет
молочно-белый цвет и густо покрыто эпидермальными волосками. По
мере роста побега (зона III) в узлах первого и последующих листьев
закладываются эндогенно адвентивные корни. Тип волосков,
формирующихся на корне, соответствует типу волосков в зоне I и разросшемся
основании побега (зона II).
Гистохимические исследования показали, что начальные этапы
формирования протокорма связаны с утилизацией в его клетках запасных
белков и жиров. В клетках протокорма D. baltica через 15 дней
культивирования можно видеть изменение состояния белковых глобул:
они становятся крупнее, их центральная часть не прокрашивается.
К моменту выхода протокорма из семенной кожуры белковые
глобулы почти полностью исчезают, в базальных клетках проростка
появляются крахмальные зерна, количество которых постепенно
увеличивается. В клетках апекса побега как до закладки примордиев,
так и после нее крахмал не обнаружен. На примере Cypripedium
acaule показано, что при прорастании зародыша также происходит
утилизация белков и жиров. В клетках протокорма, за исключением
апекса побега и прокамбия, накапливаются крахмальные зерна
(Leroux et al., 1995).
Прорастание зародыша Phalaenopsis характеризуется рядом
особенностей. Протокорм на ранней стадии имеет радиально-симметричную
форму и зеленый цвет. В базальной части протокорма формируются
волоски, расположенные группой. Появление выемки в апикальной
части протокорма, которую окружают булавовидные железки с
головками, направленными к центру выемки, свидетельствует о начале
дифференциации апекса побега. С этой стадии начинается изменение
формы проростка. Он приобретает дорзовентральное строение. На его
верхней стороне образуется «гребень», покрытый
волосками-железками. Нижняя сторона, а также адвентивные корни имеют волоски,
расположенные группой.
552
Семя
Проросток Dactylorhiza и Phalaenopsis условно можно разделить на
две части: нижнюю (зона I + зона II), которая имитирует внешний
вид корня и выполняет его функции (запасание веществ и контакт с
субстратом), и верхнюю, которая представляет собой апекс побега
(зона III).
Прорастание зародышей с зачатком «семядоли» (на примере Ble-
tilla striata и Thunia alba). Исследование строения проростков у Ble-
tilla striata с применением сканирующего электронного микроскопа
показало, что первый листоподобный орган (семядоля) у данного вида
закладывается валиком (Батыгина, Андронова, 1988; Batygina, And-
ronova, 1991). На продольных срезах, в зависимости от ориентации
объекта, валик может выглядеть как один бугорок (или выступ) или
как два бугорка. Bernard (1909) обозначил один из двух «бугорков»
как «семядолю», а другой — как «первый лист». Однако фактически
два «бугорка» являются не двумя отдельными органами, а
противоположными краями одного и того же органа, имеющего форму валика
(Batygina et al., 1994). Представление о листоподобном органе
(семядоле) как «бугорке» или «выступе» послужило причиной
неправильного понимания строения зародыша и проростка не только у Bletilla, но
и у некоторых других видов орхидных, в частности у Thunia alba. На
продольном срезе зародыш Thunia имеет в апикальной части бугорок,
который считают, как и в случае Bletilla striata, «семядолей». Однако
генезис и строение этой части зародыша и проростка у Thunia
существенно отличается от такового у Bletilla. У зародыша Thunia валик
не обнаружен, но в его апикальной части в протодерме отмечены
крупные клетки, имеющие пирамидальную форму. Они как бы
прерывают слой эмбриодермы, состоящий из правильных, однотипных по
строению и размерам клеток. На первом этапе прорастания
формируется веретенообразный протокорм, у которого сохраняется апикальный
бугорок. Деления клеток протокорма начинаются в зоне ниже этого
бугорка, но потом они затрагивают и его клетки. В результате
происходит постепенное исчезновение бугорка, формируется четкий эпи-
дермальный слой в апикальной части, апекс уплощается и затем
формируется валик первого листового органа (Andronova, Batygina, 1992).
Природа и функции бугорка у Thunia до конца не выяснены.
Исходя из данных о развитии протокорма у этих двух, считающихся
«семядольными» видами, орхидей, очевидно, что «бугорок» в
апикальной части зародыша Thunia и валик зародыша Bletilla не являются
гомологичными структурами. Тогда как первый листоподобный орган,
закладывающийся в послесеменной период у Thunia, гомологичен
таковому, но образующемуся в ходе развития зародыша при
формировании семени у Bletilla.
Таким образом, под «семядолей» у разных видов орхидей понимают
либо апикальный конец оси зародыша или протокорма, либо первый
листоподобный орган, формирующийся в их апикальной части.
Длительная дискуссия по вопросу о наличии или отсутствии семядоли у
Зародыш
553 1
Таблица 2. Схема типов эмбриогенеза (по Swamy, 1949)
ЗИГОТА
деление поперечное
базальиая клетка делится
поперечно, апикальная
продольно
инициальная клетка суспеизора",
средняя и апикальная клетки
участвуют в построении собственно
зародыша, суспеизор отсутствует
Asterad-тип
(Группа А)
деление поперечное
дальнейшие деления в базальиой и
терминальной клетках иррегулярные,
формируется нитевидный проэмбрио,
суспеизор присутствует
Cymbidium-форма
инициальная клетка суспеизора
развивается в суспензор, средняя i
апикальная клетки формируют
собственно зародыш
Onagrad-тип
(Группа Б)
1
клетка cb — E.A.
орхидных (Veyret, 1965, 1974; Терёхин, 1977, 1991; Nishimura, 1981,
1991; Jacques-Felix, 1982; Batygina, Vasilyeva, 1983; Guignard, 1984;
Батыгина, Андронова, 1988; Batygina, Andronova, 1991; Andronova,
Batygina, 1992) еще не окончена. Необходимы дальнейшие
исследования (с применением новых методов) развития зародышей у тех видов
орхидных, у которых, по аналогии с Thunia, апикальную часть
зародыша рассматривают как зачаток «семядоли».
Классификация зародышей орхидных. По-видимому, самая первая
классификация зародышей орхидных была предложена Swamy (1949).
Он считал, что только первые два-три клеточных деления при
формировании зародыша у этих растений упорядочены, последующие деления
не подчиняются каким-либо определенным законам. Согласно Swamy,
зародыши орхидных можно разделить на две группы: группа А —
зародыши, у которых суспензор отсутствует, при этом дериваты базальной
554
Семя
и апикальной клеток могут принимать более или менее равное участие
в построении собственно зародыша; группа Б — зародыши с суспен-
зором, при этом роль базальной клетки в построении тела зародыша
минимальна. Группы А и Б, по мнению Swamy, соответствуют Asterad-
и Onagrad- типам эмбриогенеза по классификации Johansen (1945, 1950).
Случай, когда деления апикальной и базальной клеток двуклеточного
проэмбрио иррегулярны, Swamy обозначил как Cymbidium-форма
(Таблица 2).
Swamy (1949) выделил 5 типов подвеска у орхидных: тип 1 —
инициальная клетка суспензора (cb — Е. А.) не делится и практически не
растет, лишь у некоторых видов она удлиняется, при этом такой сус-
пензор не выходит за пределы семенной кожуры; тип 2 — инициальная
клетка суспензора делится, формируется нитевидный суспензор,
состоящий из 5 —10 клеток; суспензор удлиняется, выходит из микропиле и
внедряется в ткани плаценты, превращаясь в гаусторий; тип 3 —
инициальная клетка суспензора и ее дериваты делятся в поперечном и
продольном направлениях, формирующийся суспензор напоминает «гроздь
винограда»; тип 4 — инициальная клетка суспензора делится трижды,
формируется 8-клеточный суспензорный аппарат; его клетки обычно
растут по направлению к халазе, окружая тело зародыша; тип 5 — деление
зиготы и производных клеток са и cb происходит иррегулярно,
формируются 6—10 клеток; большинство из этих клеток, ближе всего
расположенные к микропиле, удлиняются, формируя суспензорный аппарат,
в то время как нитевидный зародыш развивается из неудлиняющейся
клетки.
Veyret (1965, 1974) выделила три типа развития зародышей у
орхидных, основываясь на законах бластомеризации Soueges (1939)
(Таблица 1):
1) основной тип, при котором развитие происходит по
определенным правилам;
2) иррегулярный тип, при котором развитие происходит по
различным моделям, для каждой из которых существуют четкие законы
развития;
3) вторичный тип, при котором ранняя стадия развития отличается
от основного типа по: а) скорости сегментации гомологичных бласто-
меров, б) направлению заложения определенных клеточных стенок, что
приводит к ранней дифференциации зародыша, с) различиям в
дифференциации большей части клеток тела зародыша, которые не имеют
решающего значения.
Veyret показала, что дериваты апикальной клетки (са) всегда
принимают участие в построении тела зародыша, тогда как дериваты
базальной клетки (cb) могут входить в тело зародыша в самых
различных комбинациях. Это было положено в основу разделения на
типы.
Однако, как показано на примере Dactylorhiza baltica и D. incarnata,
количество дериватов клетки cb по продольной оси собственно заро-
Зародыш
555
дыша варьирует (Андронова, 1988). Если следовать логике Veyret,
это должно приводить к различному количеству ярусов, составляющих
собственно зародыш, и, следовательно, к нескольким формулам
эмбриогенеза для одного и того же вида.
В последнее время при описании типа развития зародышей часто
используется классификация Johansen (1950). Развитие зародышей
орхидных относят к Onagrad-, Asterad- и Piperad-типам (Савина, Под-
дубная-Арнольди, 1990). Однако использование классификации
Johansen для орхидных связано с двумя особенностями.
1. Развитие зародышей у одного и того же вида может идти
различными путями, начиная с первых делений (наличие нескольких типов
тетрад). Например, у Calypso bulbosa отмечено два типа развития
зародыша — Onagrad и Chenopodiad (Yeung, Law, 1992).
2. Формула эмбриогенеза в классификации Johansen (1950)
отражает происхождение органов зародыша и проростка из дериватов клеток
са и cb. Например, в Onagrad-типе из дериватов клетки са
формируются семядоли, апекс побега и гипокотиль; из дериватов cb —
зародышевый корень. Как отмечалось выше, зародыш у большинства видов
орхидных не дифференцирован на органы. Выделение гистогенов
затруднено, поскольку между клетками различных зон зародыша
структурных отличий не выявлено (Шамров, Никитичева, 1992).
Общепринято считать, что с достоверностью можно определить лишь
морфогенетическую природу терминального (I) яруса зародыша, из
которого формируется апекс побега (Veyret, 1965, 1974; Поддубная-Ар-
нольди, 1976; Batygina, Vasilyeva, 1983; Батыгина, Шевцова, 1985;
Шевцова и др., 1986). Зародышевый корень у орхидных
морфологически не выражен. Базальные клетки зародыша рано теряют способность
к делению, и эта способность не восстанавливается при прорастании.
Меристема корня не формируется.
Как уже было показано, зародыш у большинства изученных видов
представляет собой единую (за исключением нескольких осевых
апикальных клеток) по строению и функциональному предназначению
зону, которая увеличивается в послесеменном развитии по мере роста
протокорма. Разросшееся основание проростка по строению и функции
представляет собой запасающий орган. Относительно его морфогенети-
ческой природы существуют две точки зрения. Высказано мнение, что
базальная часть зародыша и протокорма — это гипокотиль (Nishi-
mura, 1991; Шамров, Никитичева, 1992). Bernard (1909) и Veyret
(1965, 1974) считали, что протокорм у орхидных имеет корневую
природу. Следует отметить, что в соответствии с Onagrad-типом
эмбриогенеза в образовании гипокотиля участвуют дериваты са, а
корня — cb. Однако, как отмечалось выше, базальная часть зародыша и
протокорма у орхидных представлена как дериватами са, так и
дериватами cb в различных соотношениях. Это противоречит принципам,
положенным Johansen в основу характеристики эмбриогенеза Onagrad-
типа. Таким образом, вышеуказанные особенности эмбриогенеза ор-
556
Семя
хидных не дают возможности использовать для его описания
существующие классификации зародышей, основным критерием
подразделения на типы в которых является направление заложения клеточных
перегородок при делении клеток (т. е. клеточная генеалогия).
При сопоставлении строения зародыша орхидных и других
однодольных и двудольных растений становится ясно, что зародыш
орхидных, несмотря на свою слабую морфологическую дифференциацию,
имеет дифференциацию особого рода: физиологическую, которая не
зависит от типа эмбриогенеза. В то время как у большинства растений
запасающие органы в виде корневищ и клубней появляются в
онтогенезе в послесеменной период, у орхидных они формируются на первых
этапах онтогенеза, в эмбриогенезе, в результате преобразования ба-
зальнои зоны зародыша в запасающий орган (Veyret, 1965, 1974;
Batygina, Vasilyeva, 1983). По-видимому, функции клеток зародыша и
протокорма у орхидных определяются не происхождением от дериватов
са или cb, а их положением в собственно зародыше. Таким образом,
формирующаяся зональность имеет не генеалогический, а
физиологический характер. Поэтому, в случае орхидных, имеет смысл
применение классификации, учитывающей наличие морфогенетических зон,
ответственных за формирование органов проростка: апекса побега,
гипокотиля и корня, как это принято в последние годы в ряде работ
по морфологическим и генетическим аспектам эмбриогенеза (Терёхин,
1991; Laux, Jurgens, 1994; Jurgens, 1995; см. Эмбриогения). В
зародыше орхидных можно выделить две морфогенетические зоны, дающие
апекс побега и «запасающий орган». Последний имитирует строение и
функции корня, но, по-видимому, является гипокотилем, так как
развивается из средней зоны зародыша, которая у других цветковых
растений дает именно этот орган. На примере мутантов Arabidopsis
было показано, что мутации, которые затрагивают зародышевый
корень, как правило, затрагивают и гипокотиль (Holding et al., 1994).
Это может быть показателем того, что эти два органа зародыша
имеют общее происхождение. Возможно, орхидеи также являются
примером, подтверждающим такое предположение. Рис. 50.
Андронова, 1988; Батыгина, Андронова, 1988; Батыгина, Васильева, 1980, 1983; Ба-
тыгина, Шевцова, 1985; Жукова, Савина, 1978; Лагутова, Чеботарь, 1992; Поддубная-
Арнольди, 1964, 1976; Савина, 1972; Савина, Поддубная-Арнольди, 1990; Терёхин,
1977, 1991; Терёхин, Камелина, 1969, 1972; Терёхин, Никитичева, 1968; Шамров,
Никитичева, 1992; Шевцова и др.,1986; Andronova, Batygina, 1992; Batygina, An-
dronova, 1991; Batygina et al., 1994; Batygina, Vasilyeva, 1983; Bernard, 1909; Dressier,
1981; Guignard, 1984; Jacques-Felix, 1982; Johansen,1945, 1950; Jurgens, 1995; Holding
et al., 1994; Laux, Jurgens, 1994; Leroux et al., 1995; Nishimura, 1981, 1991; Meinke et
al., 1994; Schlechter, 1926; Soueges, 1936, 1939; Swamy, 1949; Tohda, 1968; Treub,
1879; Veyret, 1965, 1974; Yeung, Law, 1992.
Зародыш 557 I
УЛЬТРАСТРУКТУРНЫЕ И ГИСТОХИМИЧЕСКИЕ АСПЕКТЫ
ЭМБРИОГЕНЕЗА
УЛЬТРАСТРУКТУРНЫЕ АСПЕКТЫ ЭМБРИОГЕНЕЗА
Эмбриогенез играет центральную роль в жизненном цикле растений.
Использование метода световой микроскопии позволило выявить
определенные закономерности в последовательности и направленности
клеточных делений в раннем эмбриогенезе, которые послужили основой
для выделения типов развития и построения классификаций
эмбриогенеза (см. Принципы классификации типов эмбриогенеза). Вопросам
закономерностей эмбриогенеза посвящен ряд обзорных работ (Natesh,
Rau, 1984; Raghavan, 1986; Crouch, 1987; Goldberg et al., 1989;
Meinke, 1991; de Young et al., 1993; Lindsey, Topping, 1993; Merilyn
et al., 1993; West, Harada, 1993). Ультраструктурные исследования
репродуктивных процессов растений, и эмбриогенеза в том числе,
были начаты с шестидесятых годов XX века. Этот метод дает
возможность проводить исследования на уровне клетки, интерпретировать
характер метаболических процессов, происходящих в ней, и связать
воедино структурные и функциональные преобразования, происходящие
в процессе дифференциации зародыша.
Ультраструктурные исследования эмбриогенеза являются весьма
трудоемкими, что связано с методическими особенностями и труднодоступ-
ностью изучаемого объекта — зародыша цветковых. На начальных
этапах развития он занимает незначительный объем семени, и найти
правильно сориентированные единственную клетку — зиготу — и дву-
пятиклеточные зародыши в системе многоклеточных структур семени —
отнюдь не простая задача. Число видов, эмбриогенез которых исследован
на электронно-микроскопическом уровне, во много раз меньше по
сравнению с изученными на светооптическом. Использование методов
электронно-микроскопической авторадиографии и цитохимии наряду с
детальными ультраструктурными исследованиями позволили глубже
понять процессы, происходящие при формировании зародыша, в частности,
роль суспензора (см. Ультраструктурные особенности суспензора) и
собственно зародыша, а также характер взаимодействия последнего с
окружающими тканями семени. В настоящее время проявляется особый
интерес к проблеме эмбриогенеза, используются новые
экспериментальные подходы к ее решению. Изучение генетической регуляции
эмбриогенеза на модельных системах (Arabidopsis, Zea), а именно: процессов
асимметричного деления зиготы, синтеза запасных веществ и т. д.,
привлекает особое внимание исследователей (Patton, Meinke, 1990; Meinke,
1991; Lindsey, Topping, 1993; de Yong et al., 1993; Marilyn et al.,
558
Семя
1993). К сожалению, результаты ультраструктурных исследований
эмбриогенеза практически не используются для обсуждения этих вопросов
(Thomas, 1993). Вместе с тем эти данные могут быть полезны для
обнаружения эффекта активности гена, проявляющегося в
интенсификации определенных метаболических процессов. Обобщение имеющихся
ультраструктурных данных по последовательным стадиям и фазам зи-
готического эмбриогенеза разных в систематическом отношении таксонов
цветковых, а также выявление общих закономерностей дифференциации
клеток и тканей зародыша в норме могут быть использованы в
интерпретации результатов молекулярно-генетических исследований.
Зигота. Для того чтобы понять процессы, происходящие на
начальных этапах развития зародыша, необходимы знания о структуре
зиготы. Кратко отметим лишь самые характерные ультраструктурные
черты этой клетки (подробнее см. Зигота), с тем чтобы в
дальнейшем иметь возможность сопоставить их с событиями,
происходящими в раннем эмбриогенезе. Зигота большинства цветковых
является поляризованной и функционально активной клеткой. У многих
видов для нее характерно наличие крупной вакуоли, расположенной
в базальной части клетки и смещающей ядро с большей частью
клеточных органелл в апикальную зону. При этом процесс
формирования вакуоли сопровождается значительным увеличением размеров
зиготы по сравнению с яйцеклеткой. Примерами могут служить
зиготы Zea, Linum, Capsella, Epidendrum, Quercus, Arabidopsis, Pen-
nisetum (Vazart, 1966; Diboll,. 1968; Schulz, Jensen, 1968; Coccuci,
Jensen, 1969; Чеботарь, 1972; Singh, Mogensen, 1979; Mansfield,
Briarty, 1995; Taylor, Vasil, 1995).
У ряда других родов цветковых таких как Hordeum, Triticum, Не-
lianthus, Reseda, Pennisetum, а также у половой аллополиплоидной
линии Triticum крупная вакуоль в зиготе отсутствует, ее вакуом
представлен множеством вакуолей разных размеров, клеточные органеллы
более или менее равномерно распределены в цитоплазме клетки (Cass,
Jensen, 1970; Norstog, 1972; Яковлев, Чабан, 1978; You, Jensen,
1985; Yan et al., 1991; Taylor, Vasil, 1995; Naumova, Matzk, in press).
Ядро занимает либо центральное положение, либо несколько смещено
к базальной части клетки. При этом интенсивного роста зиготы в
большинстве случаев не происходит, и по достижении зрелости по
размерам она остается близкой к яйцеклетке.
У ограниченного числа видов, включая исследованные виды Alcea,
Cephalaria, Gossypium, Hibiscus, Nicotiana и Reseda (Беляева, 1980;
Pollock, Jensen, 1964; Чабан, 1965; Ashley, 1972; Камелина, 1977,
1980; Mogensen, Suthar, 1979; Жукова, 1988), зигота уменьшается в
размерах по сравнению с яйцеклеткой за счет исчезновения крупной
вакуоли. В случае отклонений от характерной вакуолизации зиготы,
возникающих в результате гибридизации или иных воздействий,
возможны нарушения в последующем ходе эмбриогенеза (гибриды
Hibiscus) (см. Зигота).
Зародыш
559
Деление зиготы у подавляющего большинства цветковых
осуществляется в поперечном направлении. Это деление может быть
симметричным либо асимметричным. При симметричном делении обе
сестринские клетки зародыша имеют одинаковые размеры; при асимметричном
делении они неодинаковы, и апикальная клетка оказывается меньше
базальной. Деление зиготы асимметрично обычно в тех случаях, когда
она имеет крупную вакуоль и еще до деления является структурой с
отчетливо выраженной полярностью. В некоторых случаях, когда
зигота лишена крупной вакуоли, может также преобладать
асимметричное деление (Triticum, Reseda, Helianthus, Pennisetum — Батыгина,
19746, 1996; Яковлев, Чабан, 1978; You, Jensen, 1985; Yan et al.,
1991; Taylor, Vasil, 1995). Однако у Hordeum (Cass, Jensen, 1970;
Norstog, 1972) деление зиготы описано как симметричное. Известно,
что характер поляризации зиготы зависит от уровня ее зрелости (см.
Зигота; Эмбриогенез злаков). Вполне возможно, что не всеми из
авторов была описана зигота, достигшая зрелости. На примере
эмбриогенеза gnom-мутанта Arabidopsis показана исключительная значимость
механизма асимметричного деления у растений. Предполагается
наличие генетического контроля, координирующего размеры базальной и
апикальной клеток зародыша растений (Kirket et al., 1991; Pennel et
al., 1991).
Зародыш. Вопросам периодизации эмбриогенеза посвящено большое
количество работ. При этом критерии выделения ключевых состояний
развивающегося зародыша и терминология, используемые авторами,
различны (см. Эмбриогения). Данные ультраструктурных исследований
практически не использованы при построении классификаций типов
эмбриогенеза. Однако, благодаря специфике метода, они могут дать весьма
важный материал, характеризующий структурно-функциональное
состояние клеток и тканей зародыша. При исследовании ультраструктурных
особенностей развивающегося зародыша авторы не всегда четко следуют
известным классическим представлениям о стадийности эмбриогенеза
(стадии квадрантов, октантов и др.). Часто ими выделяются и
описываются дополнительные стадии развития, представляющие определенный
интерес. Вместе с тем все они могут быть легко объединены и
использованы для описания структурно-функциональных преобразований,
происходящих в эмбриогенезе.
Ультраструктурная характеристика последовательного развития
зародыша цветковых, включая его зиготный проэмбриональный и
эмбриональный периоды (Яковлев, 1981), с подразделением их на стадии
(глобулярную, сердечковидную, торпедовидную, сформированного
зародыша) либо более мелкие градации (там, где это дано авторами),
представлена в настоящем сообщении. Особое внимание обращено на
такие аспекты развития, как полярность зародыша, дифференциация
его тканей и органов, синтез в них запасных веществ.
Проэмбриональный период. Двуклеточный проэмбрио, как и
зигота, имеет отчетливую полярность, которая сохраняется и на всех пос-
560
Семя
ледующих этапах его развития. Размеры и ультраструктурная
организация сестринских клеток могут различаться у разных видов
цветковых. Это зависит от симметричности или асимметричности деления
зиготы (см. Зигота). В связи с тем, что базальная клетка в основном
принимает участие в образовании подвеска, ультраструктура этой
клетки и ее производных будет рассмотрена в соответствующем разделе
(см. Ультраструктурные особенности суспензора). Здесь будет дано
описание только апикальной клетки и ее производных.
Апикальная клетка, образовавшаяся в результате асимметричного
деления зиготы, по размерам меньше, чем базальная, имеет
удлиненное, неправильной формы ядро, которое занимает большую часть
клетки (Quercus — Singh, Mogensen, 1972; Pennisetum — Taylor, Vasil,
1995). Размер двуклеточного зародыша обычно не превышает размера
зиготы (Jensen, 1976). У Gossypium он остается меньше размера
зиготы до стадии 75 клеток (Pollock, Jensen, 1964). В апикальной
клетке находится значительно большее количество клеточных органелл,
чем в базальной. Неравномерное распределение клеточных органелл
между сестринскими клетками зародыша как по количеству, так и по
составу (Nagl, 1973; Newcomb, Fowke, 1974; Vallade, 1980; Meinke,
1993), вероятно, и определяет разные генетические возможности этих
клеток.
Апикальная клетка имеет оптически плотную цитоплазму и
интенсивно окрашивается на белки и РНК (Capsella — Schulz, Jensen,
1968). У нее отсутствует крупная вакуоль, что, по мнению Jensen
(1976), важно для развития собственно зародыша. Плотность рибосом
увеличивается по сравнению с зиготой (Petunia — Vallade, 1980;
Arabidopsis — Mansfield, Briatry, 1991; Epipactis — Жукова, Савина,
1978). Митохондрии морфологически подобны зиготическим (Quercus
— Singh, Mogensen, 1975; Pennisetum — Taylor, Vasil, 1995).
Структура пластид по сравнению с пластидами зиготы изменяется
незначительно, но их размеры увеличиваются (Quercus — Singh, Mogensen,
1975). Синтез крахмала и жиров в апикальной клетке интенсивнее,
чем в зиготе (Capsella — Schulz, Jensen, 1968). Крахмальные зерна
присутствуют в апикальной клетке у Pennisetum (Taylor, Vasil, 1995),
у Quercus они единичны (Singh, Mogensen, 1975). Эндоплазматичес-
кий ретикулум (ЭР) по степени развитости и активности аналогичен
ЭР зиготы (Capsella — Schulz, Jensen, 1968), однако он более развит
и активен у Quercus (Singh, Mogensen, 1975). По числу и активности
диктиосом наблюдаются значительные межвидовые различия. Они
редки и слабоактивны у Capsella и Petunia (Schulz, Jensen, 1968; Vallade,
1980), многочисленны и активны — у Quercus (Singh, Mogensen,
1975), Arabidopsis (Mansfield, Briarty, 1991).
Наружная стенка клеток двуклеточного проэмбрио лишена плазмо-
десм у всех исследованных видов, в то время как оболочка между
апикальной и базальной клетками тоньше наружной и имеет
многочисленные плазмодесмы. Наружная оболочка может быть неравномерно
Зародыш
561
утолщенной (Epipactis atrorubens — Жукова, Савина, 1978;
Arabidopsis — Mansfield, Briarty, 1991) либо более однородной по толщине
(Pennisetum — Taylor, Vasil, 1995). Достройка клеточной оболочки
обычно завершается на стадии зиготы (Schulz, Jensen, 1968;
Mogensen, 1972; Norstog, 1972; Singh, Mogensen, 1975; Bruck, Wallart,
1985; Камелина, Жукова, 1987). Однако у Helianthus это происходит
несколько позднее — после деления зиготы (Yan et al., 1991).
Вакуоли мелкие, расположены равномерно по всей апикальной клетке.
Апикальная клетка, возникшая в результате симметричного деления
зиготы, равная по размеру базальной, характеризуется тем, что у нее
преобладают одиночные рибосомы, лишь некоторые из них
сгруппированы в полисомы. Митохондрии по размерам близки к зиготическим,
но система крист выглядит у них более развитой. Пластиды
морфологически не изменяются, они продолжают синтезировать крахмал. ЭР
несколько активнее по сравнению с зиготой и представлен удлиненными
цистернами. Диктиосомы немногочисленны и не проявляют высокой
активности. Клеточная оболочка, окружающая зародыш, утолщена, лишена
плазмодесм, в отдельных участках, между плазмалеммой и клеточной
оболочкой, отмечается отложение электроноплотного вещества.
Клеточные оболочки, разделяющие сестринские клетки, тонкие, с множеством
плазмодесм (Hordeum — Norstog, 1972).
У аллополиплоидной линии Triticum (Naumova, Matzk, in press)
сестринские клетки двуклеточного зародыша близки по размерам и
ультраструктурной организации. Плотность рибосом по сравнению с
зиготой уменьшается, в то же время другие ультраструктурные
различия между ними отсутствуют. Размер двуклеточного зародыша
увеличивается незначительно по сравнению с зиготой.
В трех-пятиклеточных проэмбрио наблюдается увеличение
плотности цитоплазмы в апикальной части зародыша по сравнению с
базальной (Capsella — Schulz, Jensen, 1968). Рибосомы
многочисленны у всех исследованных видов, полисомы единичны, иногда они
отсутствуют. Число митохондрий увеличивается, по форме они
овальные или чашевидные (Hordeum — Norstog, 1972; Helianthus — Yan
et al., 1991). Пластиды также многочисленные, но синтез крахмала в
них становится менее активным (Capsella — Schulz, Jensen, 1968;
Helianthus — Yan et al., 1991). Запасные липиды и крахмал исчезают
вскоре после деления апикальной клетки (Capsella — Schulz, Jensen,
1968). Уменьшение их содержания наблюдается также у Helianthus
(Yan et al, 1991). ЭР обилен у Helianthus (Yan et al., 1991).
Диктиосомы многочисленны и функционально активны у Helianthus (Yan
et al., 1991). Наблюдается увеличение поверхности плазмалеммы и
усложнение ее структуры (Epipactis — Жукова, Савина, 1978).
Слабая вакуолизация клеток зародыша отмечена у Helianthus (Yan et al.,
1991), при этом вакуоли ориентированы пр периферии клетки
(Hordeum — Norstog, 1972). Признаки поляризации проэмбрио усиливаются
у видов с «недифференцированными» зародышами (Epipactis — Жу-
36-828
562
Семя
кова, Савина, 1978). Размер зародыша после первых двух делений
увеличивается незначительно по сравнению с размером зиготы (АгаЫ-
dopsis — Mansfield, Briatry, 1991).
Шести- двадцатиклеточные проэмбрио. У Hordeum (Norstog,
1972), Quercus (Singh, Mogensen, 1975) клетки собственно зародыша
по ультраструктуре протопласта и клеточных органелл сходны между
собой и напоминают апикальную клетку двуклеточного зародыша.
Размеры и форма ядер не изменяются, но ядрышки становятся более
крупными. В то же время уменьшение размера ядер обнаружено у Reseda
(Яковлев, Чабан, 1978). Эти авторы также наблюдали в зародыше этого
вида четкое выделение двух ярусов — эпикотильного и гипокотильного
в фазе октантов, но различий в ультраструктуре их клеток не
обнаружено. В целом у исследованных видов усиливается меристематический
характер клеток зародыша, число органелл на клетку уменьшается, но
общее их число в зародыше становится значительно больше, чем в
апикальной клетке двуклеточного зародыша. Уменьшение числа и объема
вакуома обнаружено у Hordeum (Norstog, 1972) и Reseda (Яковлев,
Чабан, 1978). У Capsella объем вакуома к стадии октантов уменьшается
приблизительно в 3 раза (Schulz, Jensen, 1968 a, b). Увеличение
плотности рибосом отмечено для Hordeum (Norstog, 1972) и Helianthus
(Yan et al.,' 1991); у Capsella клетки зародыша также богаты рибосомами
и полисомами (Schulz, Jensen, 1968 a, b).
У Reseda (Яковлев, Чабан, 1978) и Helianthus (Yan et al, 1991)
почти все митохондрии одинакового размера, у Quercus (Singh,
Mogensen, 1975) они несколько крупнее и по структуре похожи на
митохондрии подвеска у Hordeum (Norstog, 1972). Митохондрии делятся,
увеличиваются в числе, но уменьшаются в размерах как у Hordeum
(Norstog, 1972), так и у Capsella (Schulz, Jensen, 1968 a, b).
Пластиды у Capsella и Reseda (Schulz, Jensen, 1968 a, b; Яковлев, Чабан,
1978) находятся в ювенильном состоянии и не синтезируют крахмал.
Пластиды, синтезирующие крахмал, характерны для Quercus (Singh,
Mogensen, 1975) и Ranunculus (XuHan, 1995). Отсутствие липидов
установлено в клетках собственно зародыша у Reseda (Яковлев,
Чабан, 1978). Однако запасные липиды обнаружены в ограниченном
количестве у Ranunculus (XuHan, 1995). ЭР слабо развит у Capsella
(Schulz, Jensen, 1968) и Reseda (Яковлев, Чабан, 1978) в отличие от
Quercus, где он интенсивно развит и представлен тремя типами:
гладким, шероховатым и ламеллярным (Singh, Mogensen, 1975). У
Helianthus ЭР представлен узкими цистернами (Yan et al., 1991). Диктио-
сомы малочисленны в клетках собственно зародыша у Quercus (Singh,
Mogensen, 1975). Однако наблюдается постепенное увеличение их
числа и активности, связанное с формированием клеточных оболочек, у
Capsella (Schulz, Jensen, 1968 a, b).
Наружная стенка клеток зародыша продолжает утолщаться по
сравнению с более ранними стадиями, в то время как внутренние стенки
между клетками зародыша тонкие, имеют многочисленные плазмодес-
Зародыш
563
мы. Плазмалемма извилистая (Quercus — Singh, Mogensen, 1975).
Размер клеток собственно зародыша продолжает уменьшаться вплоть
до глобулярной стадии. Так, у Capsella зародыш на стадии октантов
составляет половину размера зародыша на стадии квадрантов (Schulz,
Jensen, 1968). Однако у Reseda размеры зародыша в фазе октантов
не изменяются по сравнению с предыдущими фазами (Яковлев, Чабан,
1978). Двадцатиклеточный зародыш Hordeum по размерам не крупнее,
чем на более ранних стадиях (Norstog, 1972). Соотношение между
размерами клеток зародыша и размерами самого зародыша детально
прослежено у Gossypium (Jensen, 1976).
Представленные ультраструктурные данные по развитию зародыша
на стадии проэмбрио у разных видов далеко не единообразны.
Основные тенденции в преобразовании клеток зародыша на стадии
проэмбрио по мере его развития включают: увеличение плотности рибосом,
преобладание одиночных рибосом по сравнению с полисомами, которые
остаются немногочисленными. Эти данные могут свидетельствовать об
ослаблении на стадии проэмбрио, по сравнению со стадией зиготы,
интенсивности белкового синтеза. Наличие многочисленных
митохондрий со слабо развитой внутренней мембранной системой, тенденция к
увеличению числа митохондрий у некоторых видов вследствие их
делений, вероятно, указывает на относительно невысокий энергетический
потенциал клеток проэмбрио и возможность его увеличения на
последующих стадиях. Многочисленные пластиды, способные к синтезу
крахмала, характерны для многих видов, однако наличие крахмала в
проэмбрио отмечается не для всех из них. Вполне вероятно, что
синтезируемый крахмал интенсивно используется делящимися клетками
зародыша. Метаболизм углеводов, по всей вероятности, играет важную
роль в раннем эмбриогенезе (Schulz, Jensen, 1968). На стадии
проэмбрио именно углеводы в основном используются в качестве
энергетического источника для клеточных делений. Диктиосомы и эндоплаз-
матический ретикулум не проявляют высокой активности, однако
продолжается утолщение наружной стенки клеток и строятся новые
оболочки между клетками внутри зародыша, участие ЭР в этом
процессе вполне возможно.
Размеры проэмбрио у большинства цветковых, несмотря на
большое количество клеток, незначительно превышают размеры зиготы.
Увеличение числа клеток при практически неизменном объеме
приводит, естественно, к уменьшению размеров клеток при каждом
последующем делении. Высказано предположение о том, что лишь
после достижения клеткой минимального размера становится
возможной ее дифференциация (Jensen, 1976). Следовательно, на стадии
проэмбрио происходит деспециализация его клеток, они постепенно
становятся меристематическими, утрачивая, таким образом, признаки
зиготы, которая, как хорошо известно, представляет собой высоко
специализированную клетку. Однако имеется другая точка зрения,
говорящая о том, что зигота, приступающая к делению, является
36*
564
Семя
тотипотентной меристематической клеткой (Batygina, 1978, 1996; Ба-
тыгина, 1987; см. Зигота).
Исследования также показали, что зародыши разных таксонов
цветковых растений, как однодольных, так и двудольных, на стадии про-
эмбрио не проявляют отчетливых ультраструктурных различий на
клеточном уровне. Следовательно, ультраструктурная характеристика про-
эмбрио, по всей вероятности, не может быть использована в качестве
таксоноспецифического признака. Согласно Natesh, Rau (1984),
существующие классификации, основанные на последовательности клеточных
делений, не отражают внутренних факторов морфогенеза зародышей на
стадии проэмбрио, присущих цветковым в целом. Исследования
последних лет по зиготическому эмбриогенезу все более подтверждают, что у
растений, по всей вероятности, положение клетки в зародыше, в большей
степени, чем ее предшествующая история, определяет ее функции (Chris-
tianson, 1986; Poethig, 1989; Irish, Sussex, 1992; de Jong et al., 1993).
Эмбриональный период. Глобулярная стадия подразделяется
некоторыми авторами либо на три более мелкие: раннеглобулярную, сред-
неглобулярную и позднеглобулярную (Singh, Mogensen, 1975), либо на
две: раннеглобулярную и глобулярную (Shulz, Mogensen, 1968a).
Раннеглобулярная стадия характеризуется завершением образования
эмбриодермы. Формирование последней у Capsella происходит на стадии
16 -клеточного зародыша. На этой стадии не обнаружено различий между
клетками зародыша ни в ультраструктуре, ни в распределении в них
белков и нуклеиновых кислот. Пластиды, митохондрии, рибосомы, дик-
тиосомы и ЭР морфологически не отличаются от аналогичных органелл
зародыша на стадии проэмбрио. Однако у Capsella на раннеглобулярной
стадии появляются различия в форме клеток и характере вакуолизации
в связи с их положением в зародыше (Schulz, Jensen, 1968 a, b). У
Quercus одни клетки имеют крупную и мелкие вакуоли одновременно,
в то время как другие клетки содержат только мелкие вакуоли (Singh,
Mogensen, 1975). У Helianthus сохраняется слабая вакуолизация всех
клеток (Newcomb, 1973). У Petunia наблюдается постепенное и
прогрессивное уменьшение размеров вакуолей от 4—5 мкм у двуклеточного
зародыша до менее чем 0,5 мкм у глобулярного (Vallade, 1980). Ядро
содержит ядрышко с мелкими ядрышковыми вакуолями (Pennisetum —
Taylor, Vasil, 1995). Наружная мембрана ядерной оболочки имеет
множество рибосом • (Quercus — Singh, Mogensen, 1975). В цитоплазме
рибосомы многочисленны, большинство объединены в полисомы (Quer~
cus — Singh, Mogensen, 1975). Многочисленные рибосомы, частично
объединенные в полисомы, характерны для Helianthus (Newcomb, 1973).
Митохондрии многочисленные, мало изменились морфологически по
сравнению с митохондриями стадии проэмбрио (Quercus — Singh,
Mogensen, 1975), они мелкие у Helianthus (Newcomb, 1973), кристы выглядят
несколько более развитыми по сравнению с более ранней стадией у
Pennisetum (Taylor, Vasil, 1995). Пластиды многочисленные. Они
изменились в нескольких аспектах: наблюдается увеличение их размеров,
Зародыш
565
просветление стромы, более интенсивный синтез крахмала. У Helianthus
и Arabidopsis пластиды все еще остаются слабо дифференцированными
с электроноплотной стромой, от чашевидных до овальных по форме
(Newcomb, 1973; Mansfield, Briarty, 1991). У пластид Pennisetum
начинает дифференцироваться внутренняя ламеллярная система (Taylor,
Vasil, 1995). Шероховатый ЭР преобладает у Quercus (Singh, Mogensen,
1975). Диктиосомы единичны у Helianthus (Newcomb, 1973). Запасные
белки, липиды не обнаружены. Наружная стенка клеток зародыша по
структуре не отличается от таковой на стадии проэмбрио.
Среднеглобулярная стадия. На данной стадии развития зародыш
Capsella состоит из тридцати двух клеток. У него не выявлено
ультраструктурных различий между клетками эмбриодермы, прокамбия и
основной меристемы. Ядра, пластиды, митохондрии, диктиосомы,
рибосомы, ЭР и вакуоли сходны морфологически во всех клетках
зародыша. Гистохимические различия между клетками зародышей
отсутствуют (Schulz, Jensen, 1968 a, b). У Reseda (Яковлев, Чабан,
1979) также не обнаружено значительных ультраструктурных различий
между клетками зародыша на глобулярной стадии, хотя количество
цистерн ЭР и диктиосом несколько возрастает, утолщается наружная
стенка клеток, а зародыш заметно увеличивается в размерах.
Позднеглобулярная стадия у Quercus (Singh, Mogensen, 1975)
характеризуется в целом увеличением размеров клеток за счет увеличения
числа и размера вакуолей. Большинство вакуолей имеют различного рода
включения. Происходит увеличение гидратации клетки, в связи с чем
просветляются мембраны всех органелл. Концентрация рибосом,
полисом, а также ЭР достигает максимума. Многочисленны и активны
диктиосомы. Пластиды и митохондрии многочисленны, митохондрии
относительно неизменны, пластиды изменяются более значительно. Они
увеличиваются в размерах, и большинство из них содержит крахмал. Другие
запасные вещества в клетках отсутствуют. Утолщаются клеточные стенки
между сестринскими клетками внутри зародыша, но срединная пластинка
трудно прослеживается. Аналогичные изменения характерны также для
Arabidopsis (Mansfield, Briarty, 1991).
Основные структурно-функциональные преобразования зародыша на
глобулярной стадии развития (включая раннеглобулярную, среднегло-
булярную и позднеглобулярную стадии) связаны с увеличением
размеров клеток зародыша и, как следствие, размера самого зародыша за
счет возрастания объема вакуома, свидетельствующего об
интенсификации обменных процессов. Для этой стадии характерно достижение
наивысшей плотности рибосом и преобладание полисом, что может
свидетельствовать о резком возрастании белкового синтеза.
Часть белков накапливается в вакуолях в виде включений. Наряду
с синтезом нерастворимых белков, производимых полисомами,
интенсифицируется синтез гликопротеинов, продуцируемых эндоплазматичес-
ким ретикулумом и диктиосомами, число и активность которых на
глобулярной стадии резко возрастает у многих видов. Активностью
566 Семя
пластид обеспечивается необходимый запас углеводов (крахмала).
Другие запасные вещества по-прежнему отсутствуют. Ультраструктурные
различия между клетками зародыша на глобулярной стадии, как и на
стадии проэмбрио, за исключением характера вакуолизации и формы
клеток (Capsella), продолжают отсутствовать. Изоляция зародыша,
проявляющаяся в утолщении наружной стенки клеток и сопутствующем
этому процессу отложении каллозы и кутина у некоторых видов,
продолжает усиливаться (Williams et al., 1984).
Сердечковидная стадия. Число клеток в зародыше при переходе к
процессу заложения семядолей, определяющему начало сердечковидной
стадии, может быть различным у разных таксонов цветковых. У
Capsella (Schulz, Jensen, 1968) на сердечковидной стадии наблюдается
усиление некоторых ультраструктурных и гистохимических различий
между клетками различных частей зародыша. Эти различия
проявляются в более сильной вакуолизации клеток прокамбия и основной
меристемы по сравнению с клетками эмбриодермы. На поверхности
зародыша хорошо видна электроноплотная кутикула. Те части
зародыша, которые активно растут, особенно семядоли, имеют высокую
активность энзимов и более высокое содержание РНК (Capsella —
Schulz, Jensen, 1968). Аналогичная дифференциация имеет место у
Diplotaxus, Reseda и Arabidopsis (Simonsioly, 1974; Яковлев, Чабан,
1979; Mansfield, Briatry, 1991). У Reseda происходят значительные
изменения в ультраструктуре клеток зародыша: увеличивается
количество шероховатого ЭР, пластиды и митохондрии становятся крупнее,
в пластидах формируется ламеллярная система и большинство из них
синтезирует крахмал.
На сердечковидной стадии эмбриогенеза происходят преобразования
пластидома, приводящие к позеленению зародыша у видов цветковых,
относящихся к хлороэмбриофитам. Позеленение зародыша связано с
дифференциацией в пластидах ламеллярной системы и возможностью
фотосинтеза. Пластиды клеток основной меристемы и эмбриодермы
формируют более интенсивную ламеллярную систему по сравнению с
пластидами клеток прокамбия (Liniirn — Deschamps, 1968; Capsella — Schulz,
Jensen, 1968; Jensen, 1976). Вопросы, касающиеся пластидного аппарата
зародыша цветковых, подробно рассмотрены в ряде работ (Яковлев,
Жукова, 1973; Жукова, 1979, 1993; Yakovlev, Zhukova, 1980; Rod-
kiewicz et al, 1994; см. также Хлорофиллоносность зародыша как
признак для классификации цветковых растений). На сердечковидной
стадии продолжаются преобразования структуры наружной стенки
клеток зародыша. У Reseda, в частности, на поверхности зародыша
появляется электроноплотная кутикула (Яковлев, Чабан, 1979).
Основными отличительными чертами сердечковидной стадии
эмбриогенеза являются дифференциация тканей и появление
ультраструктурных и гистохимических различий между ними. Клетки прокамбия
и основной меристемы (периблемы) становятся более вакуолизиро-
ванными, чем клетки эмбриодермы. Продолжает возрастать интен-
ародыш
сивность синтеза белков и нуклеиновых кислот (Vasilyeva et al.,
1987; см. также Автономность зародыша). Метаболизм клеток
зародыша в целом изменяется в сторону синтеза запасных веществ.
Кроме крахмала в клетках присутствуют белковые глобулы и ли-
пидные капли. Изменение пластидома, связанное с дифференциацией
гран, характерно для хлороэмбриофитов.
Исследования на летальных мутантах Arabidopsis показали, что у
зародыша на сердечковидной стадии развития происходит снижение
уровня синтеза запасных белков, и, кроме того, время начала их
синтеза сдвигается на более поздние стадии эмбриогенеза. Появление
белковых тел в клетках зародыша использовалось авторами в качестве
маркерного признака, позволяющего определить временные параметры
синтеза белков (Patton, Meinke, 1990). Вполне возможно, что и у
других цветковых интенсивность и время начала синтеза запасных
веществ, являясь генетически регулируемыми, как и у Arabidopsis,
могут быть использованы в качестве маркерных признаков.
Торпедовидная стадия характеризуется интенсивным ростом
семядолей и дальнейшей дифференциацией корневого и стеблевого апексов
(Schulz, Jensen, 1968a, b; Яковлев, Жукова, 1973; Tang et al., 1980;
Mansfield, Briarty, 1991). У Capsella, Reseda наблюдали дальнейшее
увеличение ультраструктурных различий между тканями зародыша, при
которой клетки плеромы имеют наибольшую степень вакуолизации.
Отмечено также изменение направленности метаболизма зародыша в
целом в сторону аккумуляции запасных веществ. Накопление крахмала
происходит во всех частях зародыша одновременно, но наиболее
интенсивно — в семядолях. У Capsella наряду с крахмалом
синтезируется большое количество липидов. У Arabidopsis отмечено появление
во всех клетках зародыша многочисленных сферических электроноплот-
ных тел с гомогенным матриксом неизвестной природы (Mansfield,
Briarty, 1991). Сердечковидная и торпедовидная стадии
рассматриваются некоторыми авторами как единое целое и описываются в
комплексе как стадия основных физиологических функций, на которой
запасные вещества синтезируются и аккумулируются (Nelumbo —
Tang et al., 1989).
Стадии сформированного и зрелого зародыша. Сформированный
зародыш — это зародыш, завершивший дифференциацию тканей и
органов и достигший своих максимальных размеров. Клетки
сформированного зародыша имеют высоко дифференцированные органеллы
(Secale — Hallam, 1972). Однако по мере созревания семени в
зародыше происходят значительные структурно-функциональные
преобразования, связанные с переходом семени в состояние покоя. Процесс
созревания зародыша сопровождается обезвоживанием и сжатием его
клеток (Tang et al., 1989). При этом, например, у Phaseolus в лейкопластах
исчезают строма и ламеллы, в пластидах исчезают граны, ЭР фрагмен-
тируется на мелкие пузырьки, митохондрии теряют внутреннюю
организацию, исчезают полисомные комплексы и вместо них в цитоплазме
568
Семя
преобладают отдельные рибосомы. Отмеченные ультраструктурные
преобразования скорее носят физиологический, а не деструктивный
характер. Полагают, что они являются приспособлением, препятствующим
обезвоживанию семени. Такого типа упрощения ультраструктуры
клеточных органелл считаются типичными для тканей с низкой
метаболической активностью (Hallam, 1972). Рис. 51.
Батыгина, 1974, 1978, 1987, 1996; Беляева, 1980; Жукова, 1988, 1993; Жукова,
Савина, 1978; Камелина, 1977, 1980; Камелина, Жукова, 1987; Поддубная-Арноль-
ди, 1976; Чабан, 1975; Чеботарь, 1972; Яковлев, 1971, 1981; Яковлев, Жукова,
1973; Яковлев, Чабан, 1979; Ashley, 1972; Bruck, Walker, 1985; Cass, Jensen, 1970;
Christianson, 1986; Cocucci, Jensen, 1969; Crouch, 1987; Deschamps, 1968; Diboll,
1968; Goldberg et al., 1989; Gurdon, 1992; Jensen, 1968a,b, 1976; Johansen, 1950; de
Jong et al., 1993; Hallam, 1972; Hua Yan et al., 1991; Irish, Sussex, 1992; Klain,
Shimon, 1968; Lammeren van, 1986; Lindsey, Topping, 1993; Mansfield, Briarty, 1991;
Marilyn et al., 1993; Mayer et al., 1993; Meinke, 1991; Mogensen, Suthar, 1979; Nagl,
1973; Natesh, Rau, 1984; Naumova, Matzk, in press; Newcomb, 1973; Newcomb,
Fowke, 1974; Norstog, 1972; Patton, Meinke, 1990; Poethig, 1989; Pollock, Jensen,
1964; Raghavan, 1986; Rodkiewicz et al., 1994; Schnarf, 1929; Schulz, 1975; Schulz,
Jensen, 1968a,b, 1969; Simonsioly, 1974; Singh, Mogensen, 1975; Smart, O'Brein,
1983; Soueges, 1939; Tang et al, 1989; Taylor, Vasil, 1995; Thomas, 1993; Vallade,
1980; Vazart В., Vazart J., 1966; Wardlow, 1955; Webb, Gunning, 1991; Went van,
Willemse, 1984; West, Harada, 1993; Williams et al, 1984; Xiaoping Gao et al.,
1992; XuHan, 1995; Yakovlev, Zhukova, 1980; Yan et al., 1991; You, Jensen, 1985.
ГИСТОХИМИЧЕСКИЕ И ИММУНОГИСТОХИМИЧЕСКИЕ
АСПЕКТЫ ЭМБРИОГЕНЕЗА
Гисто- и иммуногистохимические методы позволяют выявить
динамику запасных веществ в клетках зародыша и окружающих его
структур в процессе развития семени, а также биохимические изменения в
ходе эмбриогенеза, в частности в процессе гистогенной
дифференциации.
Гистохимические методы исследования в ботанике появились в
20—30-х годах нашего века. Их преимущество определяется прежде
всего меньшим количеством материала по сравнению с тем, которое
необходимо для проведения обычных биохимических процедур.
Данные, полученные посредством такого рода методик, отражают
морфологическую сложность исследуемых тканей и показывают точную
локализацию веществ в клетках.
Особое значение гистохимические методы имеют при исследовании
эмбриогенеза и процесса созревания семян, поскольку зародыш и семя
обычно имеют мелкие размеры и вместе с тем представляют собой
очень сложные структуры. Так, в работах по покою семян Cerasus с
использованием гистохимических методик было показано, что анализ
целых семян не может дать удовлетворительных результатов по лока-
Зародыш
569
лизации веществ в процессе созревания (Pollock, Olney, 1959; Olney,
Pollock, 1960). Расчленяя зародыши на отдельные части, определяли
степень поглощения кислорода, а также содержание азота и фосфора
в разные периоды и при разных условиях хранения семян. Полученные
данные позволили обнаружить в метаболизме составных частей
зародыша такие изменения, которые выявить было бы невозможно, если
бы семя изучалось как единое целое.
При исследовании гистохимическими методами раннего
эмбриогенеза Linum было определено, что апикальная клетка в двуклеточном
проэмбрио интенсивнее окрашивается на РНК и белки, чем базальная
(D'Alascio-Deschamps, 1973), хотя у некоторых видов, по-видимому,
базальная клетка содержит больше общего белка и РНК, чем
апикальная (Pritchard, 1964; Singh, Mogensen, 1975).
Pritchard (1964), изучавший ядерную ДНК на ранних стадиях
развития зародыша Stellaria media, отметил ослабление окрашивания ядер
на стадии 30—60-клеточного проэмбрио, сопровождавшееся появлением
Фёльген-положительных гранул в цитоплазме. У Gossypium в течение
всего эмбриогенеза количество общей ДНК в ядре остается более или
менее постоянным, в цитоплазме ДНК не появляется (Fisher, Jensen,
1972).
У Gymnadenia conopsea обнаружено дифференциальное
распределение крахмала и белков в тканях глобулярного зародыша (Шамров,
Никитичева, 1992). В апикальной части зародыша, представленной
мелкими клетками, аккумулируется крахмал, в базальной,
образованной крупными клетками, — белки, которые присутствуют также в
подвеске. В зародыше Stellaria в течение нескольких клеточных
генераций значительных изменений в распределении РНК и белков не
происходит, при этом в глобулярном зародыше все клетки одинаково
интенсивно окрашиваются на РНК и белки (Pritchard, 1964). На
стадии сердечковидного зародыша наибольшее накопление нуклеиновых
кислот и белков происходит в зачатках семядолей по сравнению с
гипофизисом и суспензором. У Luzula pedemontana в клетках
зародыша на глобулярной стадии исчезает крахмал и обнаруживаются
декстрины и белки. Во время инициации различных органов в зародыше
(одна из критических стадий) увеличивается содержание белков в
зародыше, исчезают декстрины (Шамров, Анисимова, 1993).
Наряду с традиционными гистохимическими методами, такими, как
окрашивание реактивом Шиффа по Фёльгену (для выявления ДНК),
проционовыми красителями (для одновременного обнаружения белков
и нерастворимых углеводов), ШИК-реакция (для определения
содержания полисахаридов клеточных оболочек и запасного крахмала), при
исследовании эмбриогенеза получили развитие методы количественного
определения ферментов (см. Raghavan, 1976; Natesh, Rau, 1984).
Последние основываются не на определении содержания ферментов в
тканях, а на их активности: по степени использования ферментом
субстрата, по накоплению конечного продукта ферментативной реак-
570
Семя
ции. Известно, что ферменты катализируют биохимические реакции в
клеточных системах. Их появление и исчезновение на
последовательных стадиях развития дает возможность познать физиологические
механизмы регуляции морфогенеза. Исследования по изучению
локализации ферментов показали, что, например, щелочная фосфатаза,
гидролизующая фосфорные эфиры, обнаруживается как в собственно
зародыше, так и в суспензоре Stellaria media (Pritchard, Bergstresser,
1969). В клетках собственно зародыша этот фермент распределен
равномерно, а в клетках суспензора он локализован в пластидах.
Активность же кислой фосфатазы, наоборот, минимальна в суспензоре и
максимальна в собственно зародыше, особенно в эмбриодерме. Гипо-
физис вообще не проявляет фосфатазной активности. Что касается
активности цитохромоксидазы, ключевого дыхательного фермента, то у
Stellaria она выше в меристематических областях. На примере
Tropaeolum majus показано также, что наивысшая активность
дыхательных ферментов наблюдается в глобулярном проэмбрио, тогда как
по мере созревания зародыша она снижается, что, вероятно, связано
с наступлением физиологического покоя в зрелом семени и снижением
метаболических процессов. Окислительно-восстановительный фермент
пероксидаза, регулирующий уровень ауксина в тканях, имеет
наивысшую активность на ранних этапах развития зародыша, которая
постепенно снижается на поздних; последнее, вероятно, связано с утратой
клетками зародыша тотипотентности и постепенным началом
дифференциации (Bhalla et al., 1979). Показано также, что содержание
ферментов в зародыше и в семени может влиять на прорастание семян.
Так, например, одной из причин трудного прорастания семян пиона,
относящегося к группе «оксидазных» растений, может быть низкая
концентрация гидролитических ферментов в семенах (Цингер, 1951).
Развитие зародыша сопряжено с окружающими его структурами
семязачатка и семени. В процессе развития семени происходят изменения
в содержании пластических веществ в различных структурах. Так,
например, у Gymnadenia conopsea после оплодотворения крахмал исчезает
из клеток интегументов и появляется в большом количестве в апикальной
части зиготы, интактнои синергиде и первичной клетке эндосперма
(Шамров, Никитичева, 1992). В целом снижается реакция на декстрины
и белки в тканях семязачатка, сохраняясь на среднем уровне в
эпидермисе нуцеллуса и постаменте вплоть до стадии октантов. Декстрины
выявляются в разрушенной синергиде и единственной антиподальной
клетке, а белки — также в средней части зиготы и вокруг ядра
первичной клетки эндосперма. Постепенно крахмал и белки начинают
накапливаться преимущественно в развивающемся зародыше.
У Luzula pedemontana во время оплодотворения и первых делений
в эндосперме происходит накопление крахмала в наружном
интегументе и латеральной области нуцеллуса, во внутреннем интегументе
откладываются танины (Шамров, Анисимова, 1993а). Во время клет-
кообразования в эндосперме на тангентальных стенках клеток пари-
Зародыш
571
етальной ткани образуются каллозные утолщения. Во время
инициации органов в зародыше появляется реакция на белки в эпидер-
мальном слое нуцеллуса, начинается секреция слизи полисахаридной
природы в клетках наружной эпидермы семени. При созревании
зародыша наблюдается формирование таниносодержащих слоев клеток
во внутреннем интегументе, гипостазе и халазе. Таким образом,
происходит постепенное перераспределение питательных веществ в
пользу созревающего зародыша, сопровождающееся формированием
защитных покровов семени.
К тонким методам исследования эмбриогенеза относятся иммуно-
гистохимические. Они основаны на способности организма
животного к образованию специфических антител против чужеродного
материала (антигенов). Антиген и антитело взаимодействуют друг с
другом с высокой специфичностью. Для установления локализации
исследуемого вещества получают конъюгат антител с флюоресцентным
красителем, не вызывая при этом ослабления сродства антител к
антигену. При нанесении такого конъюгата на срез ткани происходит
реакция антиген—антитело, которую легко увидеть в
ультрафиолетовом свете с помощью флюоресцентного микроскопа. Существуют
методы прямой локализации антигена, при которой меченые антитела
непосредственно наносятся на срез и происходит специфическое
связывание их с антигеном, и непрямой локализации с использованием
серологически активных слоев, так называемый «сэндвич-метод». При
использовании последнего метода происходит повышение
чувствительности реакции и более интенсивная флюоресценция благодаря тому,
что каждое антитело способно связывать несколько молекул
флюоресцирующего анти-у-глобулина.
Иммуногистохимические методы играют большую роль в изучении
цитоскелета и процесса митотического деления клеток. В свою
очередь, расположение препрофазных тяжей тубулина, ассоциированного
с актином, и митотического веретена в клетке определяет направление
и плоскость деления клеток, что в итоге и обусловливает морфогене-
тические процессы.
Спектрин — один из важнейших протеинов кортикальной сети
животных клеток, являющийся одним из компонентов так
называемого мембранного цитоскелета, обнаружен также в плазматической
мембране растительных клеток. Используя в качестве модели
соматический зародыш, полученный в суспензионной культуре моркови,
иммуноцитохимическими методами с применением поликлональных
антител к спектрину было выявлено, что инициальная клетка
соматического зародыша обнаруживает сильное связывание с
флюоресцирующим антителом преимущественно в районе плазмалеммы (Ruijter,
Emons, 1993). Дегенерирующие и мертвые клетки, как ясно из
изображения, полученного с помощью DAPI (4,6-диамино-2-
фенилиндол) окрашивания и наблюдения в дифференциальном
интерференционном контрастном микроскопе, не проявляли флюоресценции.
572
Семя
В клетках соматического зародыша моркови было обнаружено
неравномерное распределение спектрина. В клетках проэмбрионального
клеточного комплекса метка обнаруживалась в плазмалемме,
аналогично тому, что наблюдали в единичной клетке суспензии моркови.
В соматических зародышах на глобулярной стадии, особенно в эмб-
риодерме, метка связывалась с плазмалеммой и ядрами. Обычно,
когда метились ядра, ядрышки оставались негативными. В эпидер-
мальных клетках зародышей на стадии торпеды метка была видна
не только на плазмалемме, но также в цитоплазме и ядрах.
Другой пример тканеспецифичного связывания со спектриновой
меткой был обнаружен в зиготических зародышах кукурузы (Ruijter,
Emons, 1993). Во всех клетках щитка метилось большое количество
пластид, однако в прилегающих тканях колеоптиля метка практически
не наблюдалась, несмотря на то что под фазовоконтрастным
микроскопом обнаруживалось присутствие пластид в клетках колеоптиля.
В амилопластах метка не обнаруживалась. У более мелких пластид,
сместившихся к границам клеток, метка обнаруживалась в их
мембранах.
На основе представленных выше данных высказано
предположение, что спектрин прикрепляет к мембране другие белки и, таким
образом, стабилизирует органеллы. Возможно, что присутствие
спектрина в протопластах (клетках, лишенных клеточной оболочки)
объясняется тем, что спектриновая сеть необходима для стабилизации
клеточной мембраны. Единичные клетки, небольшие кластеры клеток
в клеточной суспензии обладают сходными свойствами, поскольку
они практически лишены клеточных контактов и имеют неригидную
клеточную стенку, подверженную деформации (Ruijter, Emons, 1993).
Методами иммунофлюоресцентной микроскопии изучались также
ткани семени, окружающие зародыш. Так, инъецирование клеток
эндосперма Haemanthus katherine, находящихся в состоянии митоза,
флюоресцентным фаллоидином позволило проследить in vivo динамику
F-актинового цитоскелета во время миграции хромосом (Schmit,
Lambert, 1990). Обнаружено присутствие коротких актиновых микрофи-
ламентов, которые были расположены параллельно оси веретена
деления в районе экватора во время перехода анафаза—телофаза и
были связаны с кортикальной F-актиновой сетью. При этом было
установлено, что актин организуется заново при развитии клеточной
пластинки, а не является пассивным перераспределением обломков
полимеров актина в результате деятельности микротрубочек. Рис. 52.
Цингер, 1951; Шамров, Анисимова, 1993а; Шамров, Никитичева, 1992; Bhalla et al.,
1979; D'Alascio-Deschamps, 1973; Fisher, Jensen, 1972; Junqueria et al., 1975;
Natesh, Rau, 1984; Obey, Pollock, 1960; Pollock, Obey, 1959; Pritchard, 1964;
Pritchard, Bergstresser, 1969; Raghavan, 1976; Ruijter, Emons, 1993; Schmit,
Lambert, 1990; Shulz, Jensen, 1968a; Singh, Mogensen, 1975.
Зародыш 573
THE CUTICLE OF DEVELOPING EMBRYO
КУТИКУЛА РАЗВИВАЮЩЕГОСЯ ЗАРОДЫША
Several authors, especially Yakovlev and Tshaban (1979) and Chamberlin
et al. (1993), investigating embryogenesis respectively in Reseda lutea and
Glycine max have described an electron-dense layer, assumingly a cuticle,
covering an embryo proper at the late globular and the heart stages. The
cuticle was not present on the suspensor.
We have confirmed these observations following embryogenesis in Stellaria.
The outer cell wall of the early globular embryo is at first homogenously
dense for electrons. There is no distinguishable cuticle at this stage. The
cuticle is visible on the more developed globular embryo proper and on
the heart-shaped embryo but not on the suspensor cell walls.
In order to follow in detail the course of the cuticle development in
embryogenesis we applied fluorescence microscopy (Rodkiewicz et al., 1994).
Cuticular cutin was visualized by auramine О in embryos of various species
of dicotyledonous and one species of monocotyledonous plants (Table).
Table. List of investigated species
Alismataceae — Alisma plantago-aquatica
Campanulaceae — Campanula rotundifolia
Caryophyllaceae — Melandrium album, Stellaria media
Cruciferae — Arabidopsis thaliana, Berteroa incana, Brassica
campestris, Brassica napus, Capsella bursa-pastoris,
Iberis umbellata, Lepidium ruderale, Sinapis alba
Geraniaceae — Geranium pratense
Linaceae — Linum usitatissimum
Malvaceae — Malva silvestris
Papilionaceae — Lathyrus vernus, Pisum sativum
Plantaginaceae — Plantago media
Tiliaceae — Tilia cordata
Violaceae — Viola arvensis, Viola tricolor
Formation and extension of fluorescing and nonfluorescing areas of the
embryo surface change during embryogenesis according to a pattern similar
in all investigated species. We may assume therefore that this pattern is
common to a great number of plants (Szczuka et al., 1995; Szczuka,
Rodkiewicz, in press).
The first fluorescing cuticle appears on the apical part of a
proembryo, just before delimitation of protoderm. This cuticle is
574
Семя
gradually extending over the whole embryo proper while the suspensor
remains nonfluorescent. The cuticle persists during the heart stage.
There is no fluorescence on the suspensor and the walls between the
embryo proper and the suspensor.
The fluorescing cuticle disappears during transition to the torpedo stage
or in the early torpedo embryo but it appears again on the entire embryo
by the end of the torpedo stage being particularly strong at the radicular
tip. Subsequently, in the U-shaped embryo fluorescence disappears from
the radicular part, but there is fluorescing cuticle on the shoot apex,
cotyledons and the upper part of the hypocotyl.
A cuticle formed over the surface of an embryo may be impervious
to solute exchange, as suggested by Chamberlin et al. (1993). We
assume that a very thin cuticle may only decrease exchange between
the embryo and endosperm. A layer of cutin, however, isolates to a
certain extent the globular and heart-shaped embryos. Therefore some
substances must be transported only by the suspensor whose cell walls
are without cutin. The stream of substances entering a globular embryo
from one direction may enhance polarization of the embryo and
formation of the root-shoot axis.
The cuticle's presence over the embryo proper and its absence on the
suspensor supports the prevalent view that in a number of angiosperms
the suspensor plays an active role as an important route for the transport
of substances into the early embryo (Yeung, Meinke, 1993).
Obliteration of the suspensor in the late heart or early torpedo
stages apparently coincides with or is followed by disappearance of
fluorescing cutin. Then the torpedo embryo should absorb materials
directly from the endosperm. It was shown by several authors that
after transition from suspensorial to surface nutrition, the cotyledons
appear to be the major uptake region of the embryo (Erdelska, 1984;
Johansson, Walles, 1993).
During the late torpedo stage or during transition from the torpedo
stage to the next stage of embryogenesis the embryo forms a new
fluorescing cutin layer over its entire surface. This layer should to some
extent isolate the embryo from the endosperm influence and limit exchange
of solutes. Cuticular isolation at this stage may act as a factor for
induction of the early maturation processes in the embryo. When these
processes have begun, the cutin layer on the radicular part of the embryo
is degraded and unimpeded communication between embryo and
endosperm is partially restored. This apparently may promote further
maturation of the embryo.
We assume that cuticular changes during embryogenesis are linked with
differentiation and maturation of embryos. Fig. 53.
Chamberlin et al., 1993; Erdelska, 1984; Johansson, Walles, 1993; Rodkiewicz et al.,
1994; Szczuka et al., 1995; (Yakovlev, Tshaban) Яковлев, Чабан, 1979.
Зародыш
575
EMBRYOGENESIS OF STRIGA HERMONTHICA (Del.) Benth.
(SCROPHULARIACEAE), ACTION OF HERBICIDES
AND OTHER FACTORS: AN OVERVIEW
ЭМБРИОГЕНЕЗ STRIGA HERMONTHICA (Del.) Benth. (SCROPHULARIACEAE),
ВЛИЯНИЕ ГЕРБИЦИДОВ И ДРУГИХ ФАКТОРОВ
Striga species, plants belonging to the Scrophulariaceae, especially 5. her-
monthica and 5. aspera have a devastating effect on food crops in semi-arid
tropical area, with very great economical impact (Salle et al., 1990).
Innumerable tiny dark seeds are spread on the soil in the fields: a single
dehiscing fruit produces from 400 to 1000 seeds; each spike produces 50
to 70 fruits, and there are several (10—100 or more) Striga for one host
plant! (Dembelle, 1985; Raynal, Salle, 1987; Anonymus, 1990; Pare, Ray-
nal-Roques, 1992; Ouedraogo, 1995).
Owing to the ravages caused by Striga species on food crops, we directed
our effort in the area of embryology to obtain more information to contribute
to the resolution of the important agronomical problem.
Although the embryology of the Scrophulariaceae has been comparatively
well studied, little is yet known about parasitic weeds Striga (Srinivasan,
1946, 1947; Tiagi, 1956): a feature of the embryology of parasitic plants
has hitherto received little attention in spite of the interest of the knowledge
of the production of seeds to contribute to an improvement of agronomic
control. The most important part of the studies concerns the biological
aspects (Salle et al., 1987, 1988), the study of germination of the root
parasite (Raghavan, Okonkwo, 1982). Other research concerns the
diversification in the genus Striga (Raynal, 1991) and the plasticity of the
different species of this parasitic weed.
The evidence although consistent was nevertheless rudimentary, and our
embryological position may stimulate further research in this neglected area
(Pare et al., 1991 a, b; Pare, 1992).
Our research rationale is based on characterising mechanisms of the
development of the embryo and understanding the dynamics of seed
formation. Our hypothesis is that embryological mechanisms can be defined
to give a basis for controlling Striga by disrupting the process of reproduction
(Pare et al., 1995).
Using this approach we developed an effective assay to precise the mode
of treatment with herbicide (Pare, 1994) and also to test the utility of
biological control with the use of insects (Pare et al., 1996, in prep.).
Standard light microscopy remains the most usual way of examining
embryo and endosperm in routine embryology. It is essential to provide
embryologists with standard illustrations to allow them to make accurate
identifications.
576
Семя
Scanning electron microscopy is a good method when details of the
internal structure of the seed are required. Micromorphological data are
increasingly used in plant embryology for improving the interpretation of
the seeds' development.
Embryo development. Observation of serial sections of a large number
of seeds allowed a definitive embryological knowledge from fertilization to
mature embryos.
In the cylindrical zygote the formation of two poles results in the
differentiation causing the symmetry which is an essential prerequisite for
subsequent division and proembryo formation. The first wall in the zygote
is horizontal; this brings about the formation of two superposed cells: a
long and filamentous basal cell (cb) and a very small apical cell (ca) with
a high cytoplasmic density. As a result of the vertical division of ca in
two juxtaposed cells and the transversal compartmentalization of cb in two
superposed cells (m) and (ci) a T-tetrad is built up. Furthermore, arising
from the division of the upper elements of the tetrad, four quadrants (q)
are arranged about an axis in a horizontal plane. Their equatorial
compartmentalization results in octants with two superposed fundamental tiers each
of four cells. The cotyledonary part of the embryo (/) is built from the
upper octants; the lower octants are at the origin of the hypocotyledonary
part (/') of the embryo. The young embryo is surrounded by a thick
membrane of the cellular endosperm. In the tier / the lower epidermic cell
compartmentalizes vertically. Under epiderm, initial of meristem of cotyledon
and initial of the shoot apex are individualized. In the tier /' protoderm
(dermatogen) appears rapidly, the first after the vertical division. Internal
differentiation and vertical tangential partitions allow the edification of the
plerome and periblem. The intermediate cell of the tetrad (m) divides into
two superposed elements; the upper element behaves in the same way as
the hypophysis cell while the sujacent cells contribute to the edification of
the filamentous suspensor. The hypophysial initial is characterized by the
formation of a horizontal wall shaped like a watch glass whose periphery
touches the lower part of the dermatogen of the hypocotyledonary region.
From the two cells thus obtained, arise the initial of the root cortex and
the primordium of the root cap. The significant role of the suspensor,
particularly in early embryonic stages, and its capacity for progressive change
during embryogeny, takes an important part in the edification of the embryo
proper and at a later stage of the young plantlet.
Micropylar zone. The micropylar part of the embryo sac and of the
seed during the development of the embryo is long and gently curved. It
contains a cellular endosperm, which has developed although the zygote
has not yet been divided.
Five to six tiers of small endosperm cells surround the suspensor; the
external cell, the nearest from the exit point of the micropyle, ends in a
vesicle of a haustorial character. The endosperm cells of this area become
progressively bigger in transition with the endosperm cells surrounding the
embryo.
Зародыш
577
Action of herbicides. After these embryological studies the aim of
research was to study the effect of herbicides on embryos and the production
of seeds. Comparative studies were undertaken after treatment with herbicides
and without. The herbicides were used at different concentrations, in one
of several treatments (Pare, 1994).
Some plants are totally destroyed by the action of herbicide; generally
only some part of the inflorescence is sensitive to the action of the herbicide,
especially the meristematic apical part.
The first formed fruits escape the destruction. The seeds are embryologically
normal and able to germinate (Ouedraogo, 1995). Our studies have
demonstrated that the precocity of differentiation of the embryo, the stability
of the structure of endosperm and seed offer the possibilities of adjustement
of structures and functioning which reduce the success of treatment.
When the herbicide has a direct action on the seed, we can observe the
necrosis of the haustorial vesicles. The membranes of the cells which make up
the micropylar area are destroyed. We can also observe diverticulum from the
haustorium worming their way into the seed coat in the micropylar area.
Shiga hermonthica seems to be sensitive to the treatment only during
a short period: before fertilization and at the early stages of development
of the embryo, we suggest a precocious treatment; to be sure to treat
vegetative plant, before the apparition of flower buds, it is better to treat
two or three times to kill the parasite, taking into account the different
stages of development in the fields. It is also a good technique to use less
herbicide: it is better for environmental conditions.
Impact of insect. Until now, the various methods used against Striga
have been inefficient in the African countries. The possibility of using an
insect, the Smicronyx (Curculionideae), as a means of control in the
biological fight against the Striga hermonthica, by using its ability to induce
galls in the fruits of the Striga, appeals to researchers.
The contribution with embryological results to these various studies is
undertaken within an international framework especially with entomologists
(Pare et al., 1996, in prep.).
As we now know the development of the seeds and fruits of Striga, the
new part of the embryological study is devoted to the knowledge of biology
and behaviour of Smicronyx; the information available in these topics is at
present very limited. The Smicronyx-Striga biology has been fully
investigated with an entomological point of view (Traore et al., 1991) but still
there were many unanswered questions concerning the action of larvae on
the mechanism of the production of seeds. This research consists of a synthesis
of recent data concerning the syncronism between the life cycle of Striga
hermonthica and that of Smicronyx. It thus reveals the impact that the galls
induced by the larvae influence on the production of Striga seeds.
From the egg of Smicronyx, deposited in the deep epiderm of the young
ovary at the moment of anthesis, the larva develops. In both, gall and
seeds, the embryos develop normally. But the larva grows concurrently and
progressively migrates inside the ovary, between the seeds. These seeds and
37-828
578
Семя
most of the ovary tissues are destroyed, eaten by the larva. Ultimately the
larva fills the gall completely, all the seeds are destroyed. There is a kind
of synchronism between the development of Smicronyx and the fruit of Striga.
The results are resourceful in research that has been undertaken until
now in Striga biocontrol. Our conclusion allows one to consider rationally
that using the Smicronyx as a biological control agent against the Striga
hermonthica, and the production of its seeds, and associating it with another
method of combat, which would, in a short space of time, allow an increase
in the yield of the parasite infected crop.
At first embryology dealt with embryogeny and its prime concerns were
to clarify a plan of segmentation and spatial distribution of blastomeres.
Gradually technical improvements in microscopy, cytological examination of
reproductive elements, of embryo and endosperm, have contributed to the
knowledge of histological criteria. So it has been possible to define
characteristics relating to a quiescent centre, vegetative point, meristematic cells,
embryonic territories and polarity of the zygote. Naturally, this type of
research has evolved towards the more dynamic and physiological aspects
of the development the malleability and adaptation of the endosperm,
endosperm-embryo complex, the role which the suspensor could play.
Nowadays plant embryology has become a method of study, a kind of
reference, the necessary base for reliable taxonomy, experimentation and
agronomy. Finally, plant embryology, using new techniques, becomes a
method of study in different modern research.
The development of biotechnologies and the expansion of their
applications in the industrial field should not make us overlook the basic role that
botanical and embryological research play: the complementary nature of
botany, plant embryology and biotechnology must inevitably be added to
the interdisciplinarity of a technique which relies on the knowledge of
methods of research.
As part of my desire to understand embryo development, I gradually
built up facts from numerous observations. I seek to develop this method
to provide a new conception in plant embryology. In order to add to the
patient prognosis it is required to link two quite different technologies: the
existing one is to focus on the embryological development, and the second
one, with its emphasis on the relation between the different parts of the
seed complex during seedling formation.
At the end, with these results based on the information we have collected,
it might be possible to speculate that such technique could be of interest
with some other systems involving development studies and that plant
embryology could become a method of study used in various researches presently
underway. Fig. 54.
Anonyme, 1990; Dembelle, 1985; Dembelle, Salle, 1990; Ouedraogo, 1995; Pare, 1992,
1994; Pare, Raynal-Roques, 1992; Pare et al., 1991a, b, 1995, 1996; Raghavan, Ok-
onkwo, 1982; Raynal-Roques, 1991; Raynal-Roques, Salle, 1987; Salle et al., 1987, 1988,
1990; Srinivasan, 1946, 1947; Tiagi, 1956; Traore et al., 1991.
Зародыш
579
ФИЗИОЛОГО-БИОХИМИЧЕСКИЕ И ГЕНЕТИЧЕСКИЕ
АСПЕКТЫ ЭМБРИОГЕНЕЗА
АВТОНОМНОСТЬ ЗАРОДЫША
АВТОНОМНОСТЬ ЗАРОДЫША (греч. autos — сам и nomos —
закон) — свойство зародыша, характеризующее его способность к
саморегуляции и независимому от материнского растения развитию.
Синонимы: автономия, самостоятельность, независимость.
Термины «автономия», «автономный» и «автономное развитие» в
широком смысле слова использовали для обозначения развития
растительного организма, независимого от внешних факторов (Cooke,
[1873?]; Roux, 1912; Викторов, 1957; Кирпичников, Забинкова, 1977;
Чайлахян и др., 1982). Прогрессивная автономизация развития
прослежена у позвоночных на сравнительно-эмбриологическом материале,
дополненном экспериментальными данными (Шмальгаузен, 1968,
1988). Известную автономность обнаруживают даже отдельные части
организма.
Шмальгаузен (1968, с. 352—358) считал автономность одной из
наиболее ярких характеристик всего живого: «Все биологические
системы характеризуются большей или меньшей способностью к
саморегуляции, т. е. гомеостазису. С помощью авторегуляции
поддерживается само существование каждой данной системы, ее состав и структура
с ее характерными внутренними связями и закономерными
преобразованиями всей системы в пространстве и времени». По мнению Шмаль-
гаузена (1968, 1988), автономизация онтогенеза является одним из
направленных процессов эволюции органического мира.
Применительно к зародышу растений термин автономность был
впервые предложен одним из авторов (Батыгина, 1975) и получил
экспериментальное подтверждение и дальнейшее развитие (Batygina et
al., 1977/1978; Батыгина, Васильева, 1979, 1987; Лукьянюк,
Игнатова, 1980; Батыгина, Бутенко, 1981; Васильева, Батыгина, 1981).
Вопрос о самостоятельности зародыша растений обсуждался в
литературе неоднократно. Однако авторы давали различную, чаще всего
одностороннюю трактовку этого свойства зародыша. Так, при
рассмотрении зависимости зародыша от материнского организма, особенно в
связи с некоторыми вопросами систематики и филогении, учитывались
морфогенетические взаимосвязи с эндоспермом (в основном
соотношение размеров зародыша и эндосперма в зрелом семени) (Тахтаджян,
1966; Поддубная-Арнольди, 1976). Примитивным считался тот тип
зародыша, который отличался слабым развитием и меньшей
самостоятельностью, т. е. большей зависимостью от эндосперма.
37*
580
Семя
В ряде работ акцент ставился на физиологическую
самостоятельность, или зрелость зародыша (семени), его способность к автотроф-
ному существованию и прорастанию (Зубкус, 1950; Цингер, 1958;
Harrington, 1972; Raghavan, 1976).
Автономность зародыша в широком смысле слова означает его
независимость от всех факторов окружающей среды, включая материнский
организм. Поскольку наши знания о влиянии многих внешних факторов
(температуры, гравитации, излучения и т.д.) на первые этапы онтогенеза
растения далеко не полные, здесь будет рассмотрено это свойство только
в аспекте взаимосвязей зародыша с материнским организмом.
Зародыш становится автономным на определенном, специфичном
для каждого таксона этапе эмбриогенеза (Батыгина, Васильева, 1979;
Batygina, Vasilyeva, 1981; Батыгина, Васильева, 1983а, б; Батыгина и
др., 1983). Это — наиболее важный из критических периодов
онтогенеза, так как именно с него начинается переход зародыша (нового
спорофита) на относительно самостоятельный путь развития, т. е.
происходит автономизация онтогенеза. Это свойство присуще зародышу,
развивающемуся в семени в естественных условиях.
Становление автономности зародыша — сложный многоступенчатый
процесс. По мере развития зародыша на материнском растении
возрастает «степень автономности». В связи с этим можно различать
полную и относительную автономность (Батыгина, 1987; Batygina,
Vasilyeva, 1988).
Полная автономность зародыша достигается по завершении
прорастания семени и образования проростка, когда все связи (структурные
и функциональные) с материнским организмом (плодом, семенем)
исчезают. У различных видов эта связь прерывается на разных этапах
онтогенеза, что обусловлено спецификой строения зрелого семени и
плода (наличием эндосперма, перисперма, строением семенной
кожуры, плодовой оболочки и т. д.) и в конечном итоге всем комплексом
адаптивных признаков данного вида растения.
Относительную автономность1 зародыш приобретает, когда он
становится независимым от ряда факторов материнского организма
(гормонов, углеводов, витаминов и др.). Ее можно выявить
экспериментальным путем, в частности, с помощью эмбриокультуры — по
способности зародыша завершить нормальный эмбриогенез и дать
нормальный проросток на простой безгормональной среде,
содержащей минеральные соли, сахарозу и витамины. Она появляется,
вероятно, также в разное время в разных частях зародыша
(например, у Brassica napus — Fernandez, Bisgrove, 1992).
Долгое время наиболее распространенной считалась точка зрения,
что стадия, начиная с которой изолированный зародыш может дать
Для краткости далее используется термин «автономность».
"«
Ч
V
Ос
и
[альной
м
ормо
го на безг
viti
■«
туре
<
ать в ку.
ораст.
в
«S
3
3
Ч
О
а
ч
В)
В
ия способное
в
V
<
а
№
о
а
в
№
S
ВС
«
«
*
s
<
Н
Ссылки
S
ч
я
О
ч
S
са
е
йств
V
Е
В
3
о
а
<
сч
»5
S
т
о
ы
3"
г о т и
S
О)
1956
Калинин,
са
и
си
с
фференциация ai
бега
S О
ч в
anthus annuus
Д—•
CU
X
eae
ь.
о
60
994
1976
1956
Meinke, 1
Monnier,
Калинин,
0ч О
2 и
X CU
ч в
эдечковидная
нняя сердечкови
фференциация а
бега
си са к о
о а ч в
со
'С
а о
bidopsis thalian
sella bursa-pasi
hanus sativus
a «.§■
^6*
§
ace
t<j
60
M
Br,
чО
teler, 19
_a
, Zen
Guzowska
s
s
Л1
ca
зародыш
иаметр
j*
CO
cuta lupuliform
CO
Я
U
V
■ a
u
"3
а
"3
а
с
о
и
arenhas,
1979
льева,
" я
, Mas
ussex,
, Вас)
Eisenberg
1985
Yeung, Si
Батыгина
ориг.
ции
са
s
ифференц
й
видная
идная
чало д
мядоле
рдечко
рпедов
са си си о
X о о н
со
cine max
.seolus coccineu
a faba
о
a
-o
4,
y, 1970
Ix
Degiv
Le Page
1идная
рпедов
о
gnolia soulangeana,
grandiflora
ca .
SS
u
cea.
Via
с
bo
«
s
Patil, 1966
в 5
0vo^
"в" в
ч ч
г—* тч
ntum
elmoscus esculei
manihot
_Q .
<^
о
а
(3
£
. к
ОЧ "е-*
Г~ 00
ОчОч
[льева, 1
ыгина, 1
Я f.
cgto
- са
Батыгина
Васильев
/~N
Я И
3 *
4 «
8.1
сб с
т«
торпедовидная
( сформированный
с хорошо развито
umbo nucifera
<u
^
a
пае
о
£
3
о
^
1
в
а
<
S
и
U
се
и
-00
On 00
t- On
On t-«
я Ч
<L>
Л S
S ca
и is
ca s
CQ s
л
- f"
ь- ...
л о
HoO
Ion
ua
о
a
о
X
и
Э
5
ч
о
Я
д
со
о
и
S
<
9- s
со
№
са
в
a
?
ю
о
<
U
л
со
a
в
S
3
S
в
сч
са
а-
* * *
S
в
«*,
3*
г?"*
<*
>> ■
*
*
*
*
i
*
*
*
*
1
5-<;* * *
о
оо
On
тч
.
са
о
гна
2
к
л
■л
г».
ел
00
к, 19
2
в
«
а
а
ON
Г»
On
Г-"
в"
в
са
Смет
|Г?
в
о
э
о
л
СЛ
00
caON
hi
Ix
са
vO
ON
тч
s
в
s
5
тч
ca
mons
>>
00
I
a *.
s *
a1 *
В i
CO *
a i
со са ^
*
*
#
*
I
*
*
ч в .
NO
iA
On
тч
в*
IS
IS
<
£
о
On
О
S
BO
ca
s
IS
a
о
са"
si
о
а.
CQ
са
a
Ы
са"
в
is
u
3
н
са
са
и
а
со
В
са
К 1
S*.
3*
В i
СО #
a i
СО *
во
£*
ч >
s
s
ЕЯ
са
S
Я1
a
в-
в-
S »S
ч ч
<
° £
< ч
са к
V S
са со
В и
к
са
в
Ч
s
a
о
а
V
СО
ч
a
СО
и
№
№
аз
ч
Я)
о
в
V)
»5
00
Г- v-
On оо
Coo ON
Ron
On
- i Я
_; ч I;
" « -
.5 л я
во < fa
л са са са
ca ca ca
CQCQtQ
CJ
aS
ca
S
3 U U
5 о ii
a < <o
Э о о
« в-в
я P 2
а о" в
„ о н и
g в-о а
S ©. ca
и s s 9.
ce 4 о* я
<x-*^ a e
И
I
=S .SJ
60
3
"3 S
со .K
U "О
з-~ a£
"a S 3
со О О
о."г a .2
•С Э£ с
3-й -
nJQQE-,
0
Ьс
deum vul
и.
о
а;
s
з
»
za sativa
cum aesti
Ory
Triti
a
ca "a
в л
.s-e
'«.2
3 5
3 5
Й CO
ca
в
ca
us americ
Ulm
^
e
•r,
riana offi
Vale
ca
с
S S
о а Я
с с .У
са о -К
a •= Hvfc
• im *«^ it r^
с- и«йЧ
о а з з
I
о
О.
о
СО
S
с
о
СО
«3
О.
Зародыш
583
нормальное растение, одинакова для всех двудольных и
характеризуется дифференциацией семядолей и апекса побега (Модилевский,
1958; Иоффе, Жукова, 1965; Raghavan, 1976; Raghavan, Srivastava,
1982). Однако большой фактический материал, накопленный к
настоящему времени в эмбриологии (см. Сравнительная эмбриология
цветковых растений, 1981, 1983, 1985, 1987, 1990), и особенно работы
по культуре зародыша позволяют сделать вывод, что автономность
зародыша у разных представителей цветковых проявляется на
различных стадиях эмбриогенеза, например: глобулярной (Orchidaceae), сер-
дечковидной (Capsella bursa-pastoris, Arabidopsis thaliana), торпедо-
видной с разной степенью развития почечки (начало образования
апекса побега — Vicia faba, хорошо развитая почечка, с двумя
формирующимися листьями — Nelumbo nucifera); у типичных
однодольных — на стадии формирования щитка и апекса побега (Triticum
aestivum, Hordeum vulgare, Oryza sativa) (см. Табл.).
Различия в степени структурной и функциональной дифференциации
зародыша на стадии автономности обусловлены не только генотипом
самого зародыша (тип эмбриогенеза, специфика развития зародыша и
проростка), но и условиями внутри развивающегося семени (генотип
материнского организма и т. д.). Сложившиеся в ходе эволюции
каждого таксона растений морфогенетические и морфофизиологические
корреляции в развитии зародыша и окружающих тканей (Батыгина,
1974; Батыгина и др., 1983; Vasilyeva et al., 1987) и определяют
вндоспецифичность стадии автономности зародыша.
Эта стадия характеризуется комплексом морфогенетических и
физиолого-биохимических признаков. Главные из них: размер (в
основном критическая масса клеток)1 и степень дифференциации зародыша,
соотношение размеров зародыша и окружающих тканей, скорость роста
и дифференциации, активность определенных ферментов, потребность в
различных питательных веществах и регуляторах роста, а также
чувствительность зародыша к факторам внешней среды. Такие признаки
автономного зародыша, как независимость от экзогенных гормонов и
способность к прорастанию, являются общими для всех цветковых растений.
На примере модельного объекта Nelumbo nucifera было прослежено
постепенное становление автономности зародыша в семени in vivo
(Vasilyeva et al., 1987; Титова, 1988а; Васильева, 1993а; Морозова,
1993a). В ходе этого процесса последовательно разворачиваются
критические морфогенетические события: 1 — бластомеризация
(накопление критической массы клеток) и установление полярности, 2 —
заложение эмбриодермы, 3 — инициация семядоли, апексов побега и
корня, 4 — дифференциация примордиев и 5 — последовательное
Под критической массой обычно понимают то количество клеток в клеточном ас-
социате или в экспланте, превышение которого индуцирует размножение, а в ряде
случаев и дифференциацию (см. Конев, Мажуль, 1977).
584
Семя
развитие пластинки первого, второго и третьего листьев почечки.
Изменения дифференциации зародыша строго скоррелированы во времени
со степенью развития (или дегенерацией) окружающих тканей и с
определенными максимумами (или минимумами) относительных
скоростей роста и изменения уровней растворимых Сахаров, общего белка и
нуклеиновых кислот.
На стадии автономности (10—11 д.п/оп.; весь процесс развития и
созревания семени — 30—40 д.п/оп.) зародыш достигает в длину
Уь своего конечного размера, имеет сформированную семядолю с
двумя лопастями и проводящей системой в них и почечку, состоящую
из пластинки первого листа и примордия второго листа. При этом
наблюдается: 1) утолщение полисахаридных оболочек клеток
эпидермиса на концах лопастей семядоли и дифференциация элементов ксилемы
в апексе корня; 2) максимумы относительной скорости роста по сухой
массе и длине зародыша (соответственно, второй и третий пики на
кривых скорости роста); 3) второй (в ходе эмбриогенеза) подъем
содержания растворимых Сахаров; 4) появление крахмальных зерен в
верхушках семядольных лопастей и в почечке; 5) позеленение почечки;
6) синтез специфических для данной стадии белков (мол.в — 96,6;
94,0; 56.2; 47,9 кД); 7) появление АБК в зародыше; 8) способность
к прорастанию на безгормональной среде.
Готовность зародыша лотоса к самостоятельному развитию
коррелирует со значительным сокращением размеров эндосперма и внутреннего
интегумента, а также с заметным усилением дифференциации элементов
проводящей системы семени. Кроме того, к стадии автономности
происходит завершение преобразования клеток эндосперма, оттесненных в
халазальную часть семени растущими семядольными лопастями. Его
клетки становятся многоядерными, а ядра — многоядрышковыми;
оболочки (полисахаридной природы) утолщаются. Такие клетки эндосперма
располагаются группами или отдельно и «внедряются» в ткань хала-
зальной части семени, способствуя, по-видимому, поглощению
зародышем питательных веществ из окружающих тканей.
Вероятно, как характеристику автономности зародыша Capsella bur-
sa-pastoris и Arabidopsis thaliana можно рассматривать критические
события в их эмбриогенезе, описанные Meinke (1994) (хотя сам автор
не использует термин «автономность»). Он отмечает, что в период от
глобулярной до сердечковидной стадии происходят: изменение
симметрии зародыша в связи с инициацией семядолей, заложение проваску-
лярной ткани, позеленение зародыша, становление автотрофности,
проявляющейся в способности зародыша расти в культуре на простой
среде, клеткообразование в эндосперме (Meinke, 1991a, 1994).
Здесь и далее д.п/оп. означает дни после опыления.
См. подробнее Синкотилия; Титова, 1988а, б; Titova, Batygina, 1996.
Зародыш
585
Уже на ранних этапах онтогенеза растения, в зиготе, имеется так-
соноспецифичная программа развития, характеризующаяся
поливариантной детерминированностью процесса роста и развития (Батыгин,
Демьянчук, 1995). Одним из примеров детерминированности является
потенциальная многовариантная способность зародыша к
прорастанию, проявляющаяся в автономности, «преждевременном
прорастании» и нормальном прорастании зрелого семени. Программа на
прорастание перекрывается программой на эмбриональный рост,
который регулируется, вероятно, сосудистой системой, связывающей
зародыш с материнским растением (Dure, 1975).
Согласно схеме, приведенной Ihle и Dure (1972), в эмбриогенезе
Cossypium имеются по крайней мере два периода, когда зародыш
способен к преждевременному прорастанию. При изоляции зародыша
в первый период (20—30 д.п/оп.) наблюдается медленное
преждевременное прорастание. В таком незрелом зародыше отсутствует мРНК
прорастания, однако после удаления тканей семени в нем активируются
необходимые гены, происходит транскрипция и затем трансляция
информации на прорастание. Во втором периоде (30—50 д.п/оп.), когда
исчезает сосудистая связь между семенем и материнским растением,
прекращается синтез ДНК (как и в случае изоляции зародыша на
более ранней стадии), начинается транскрипция мРНК прорастания,
но без трансляции. Последнее привело бы к вивипарии — летальному
событию, которому в естественных условиях препятствует накопление
АБК в тканях семени. Зародыш, изолированный в этот период,
также обнаруживает преждевременное прорастание.
Автономность присуща не только зиготическому, но и
соматическому зародышу. Так, например, у Paeonia anomala и P. suffruticosa
соматический зародыш, формирующийся в семени (Brukhin, Batygina,
1994), способен прорастать на безгормональной среде и,
следовательно, становится автономным на ранней торпедовидной стадии (2 мес.
п/цв.) (Batygina et al., 1977/1978; Васильева и др., 1978; Батыгина,
Бутенко, 1981).
У вивипарных видов Bryophyllum процесс автономизации
длительный и проявляется в образовании отделительного слоя между
соматическим зародышем и материнскими тканями листа (Bragina et al.,
1995; Batygina et al., 1996). Вероятно, эмбриоид В. daigremontianum
становится автономным на торпедовидной стадии (сформированные
семядоли и почечка с двумя примордиями листьев, заложение в стеле
гипокотиля адвентивных корней). При изоляции на этой стадии он
развивается в нормальное растение в обычных условиях. Автономность
Мес. п/цв. — месяцы после цветения.
Вероятно, это — переходная форма между эмбриоидом и почкой (см. Эмбрио-
идогения).
586
Семя
соматического зародыша В. calycinum наступает также на торпедовид-
ной стадии, но при выходе корней из тканей материнского листа.
Известно, что в процессе развития зародыша происходит постепенный
переход от гетеротрофного способа существования к автотрофному. При
этом постепенно изменяется потребность зародыша в органическом азоте,
углеводах, гормонах, витаминах, а также в специфических для каждого
вида растений факторах (например, в фенольных соединениях у Papaver
somniferum — Понтович и др., 1976). На ранних этапах эмбриогенеза
эти вещества поступают в основном из окружающих тканей семени. По
мере дальнейшего формирования семени, зародыш становится способным
синтезировать те вещества, которые отсутствовали в нем в начале
эмбриогенеза. Интенсивное перераспределение веществ между плацентой и
развивающимся семенем продолжается почти до момента «эмансипации»
семян от материнских тканей (Поляков, 1970). Начиная со стадии
автономности строгая согласованность ритмики различных процессов,
происходящих в зародыше и окружающих тканях, нарушается в результате
приобретения зародышем способности к саморегуляции (Васильева,
19936).
Механизмы становления автономности зародыша до конца еще не
познаны. Одним из них может быть последовательная разблокировка
метаболических путей для автотрофного существования (Raghavan,
1976). Подобная идея была детально разработана в эмбриологии
животных. Отражением автономной регуляции у растений на
внутриклеточном уровне служит активация и ингибирование различных
ферментов на определенной стадии развития, в основе которой лежит
регуляция активности генов (Wareing, Phillips, 1978).
Разблокирование ферментных систем, необходимых для автономного развития
зародыша у растений, можно проследить, например, по таким ключевым
ферментам, как нитратредуктаза и рибулезобисфосфаткарбоксилаза
(Raghavan, Sharma, 1995).
Автономность зародыша можно выявить не только с помощью
культуры in vitro. Известно, что незрелые зародыши основных хлебных
злаков (Triticum, Hordeum, Avena) способны прорастать при посеве
их в естественных условиях (Модилевский, 1958). Возможность
получения проростков из незрелых зародышей в обычных условиях
выращивания имеет практическое значение, так как позволяет сократить
период покоя семян и ускорить образование проростков.
При неблагоприятных погодных условиях (повышенной влажности
воздуха и почвы) или при экспериментальном воздействии можно
наблюдать прорастание незрелых зародышей еще в семени на
материнском растении (Леманн, Айхеле, 1936; Pope, Brown, 1943).
Mangelsdorf (1923) выделил расу Zea mays под названием
«прорастающее семя», у которой прорастание, как правило, происходит в
початках. Прорастание мутантных зародышей кукурузы на
гетерозиготных колосьях совпадает с потерей регуляторного фактора, который
ингибирует прорастание во время развития семени (Robertson, 1955).
Зародыш
587
Использование вивипарных мутантов другого модельного объекта,
Arabidopsis thaliana позволило идентифицировать важный блок
генов — LEC1, LEC2 и FUS3, которые вместе с геном ABI3 играют
критическую роль в регуляции позднего эмбриогенеза, подавляя виви-
парию (преждевременное прорастание) (Meinke et al., 1994).
Незрелые зародыши таких вивипарных мутантов преждевременно вступают
на путь прорастания начиная с торпедовидной стадии. При
культивировании на простой среде они дают жизнеспособные растения, которые
имеют нормальный вид, за исключением наличия листоподобных
семядолей с трихомами на их адаксиальной стороне. Следует отметить,
что, как было указано выше, у дикого типа Arabidopsis способность к
прорастанию (автономность, в нашем понимании) зародыша
проявляется раньше — на сердечковидной стадии.
Эти исследования инициируют ряд вопросов, заслуживающих
внимания эмбриологов: как связана с эволюционным процессом
многовариантная способность зародыша к прорастанию; почему автономность
зародыша возникает раньше его естественного созревания; имеется ли
стадия автономности у зародышей вивипарных мутантов; какие гены
экспрессируются на стадии автономности. К основным причинам,
которые тормозят решение этой важной проблемы, можно отнести:
определенный консерватизм во взглядах на оптимальную стадию
изоляции зародыша для эмбриокультуры; отсутствие в литературе четкого
морфологического описания стадии «незрелого» зародыша, способного
прорастать; недостаточную изученность путей и закономерностей
морфогенеза и, в частности, генной регуляции эмбриогенеза.
В связи с этим представляется актуальной дальнейшая разработка
теоретических основ культивирования in vitro различных генеративных
(пыльника, семязачатка, зародыша и др.) и вегетативных структур.
Изучение всех этапов эмбриогенеза и, особенно, стадии автономности
зародыша — необходимая теоретическая предпосылка ряда прикладных
исследований: преодоления несовместимости при отдаленной
гибридизации, получения гаплопродукции, сокращения периода покоя семян,
выбора оптимального срока сбора урожая и т. д. Это один из основных
путей повышения эффективности селекционных процессов и методов
сохранения редких, исчезающих и хозяйственно-ценных видов растений.
Автономность зародыша как генетический признак, определяющий
универсальную способность растений к вивипарии, заслуживает
специального внимания и дальнейшего изучения, поскольку имеет важное
теоретическое и практическое значение. Рис. 36, 48, 55, 58.
Батыгин, Демьянчук, 1995; Батыгина, 1974, 1987; Батыгина, Бутенко, 1981; Батыгина,
Васильева, 1979, 1980, 1983а, б, 1987; Батыгина и др., 1983, 1988; Васильева, 1993а,б;
Васильева, Батыгина, 1981; Васильева и др., 1978; Давоян, Сметанин, 1979; Зубкус,
1950; Иоффе, Жукова, 1965; Калинин, 1956; Конев, Мажуль, 1977; Крокер, 1950;
Леманн, Айхеле, 1936; Лукьянкж, 1983; Лукьянюк, Игнатова, 1980; Модилевский,
1958; Морозова, 1993а; Поддубная-Арнольди, 1976; Поляков, 1970; Понтович и др.,
588
Семя
1976; Тахтаджян, 1966; Титова, 1988а; Чайлахян и др., 1982; Цингер, 1958;
Шмальгаузен, 1968, 1982; Anagnostakis, 1977; Batygina, Vasilyeva, 1981, 1988; Batygina
et al., 1977/1978, 1996; Bragina et al., 1996; Brukhin, Batygina, 1994; Cooke, [1873?];
Crocker, 1925; Dure, 1975; Eisenberg, Mascarenhas, 1985; Fernandez, Bisgrove, 1992;
Guzowska, Zenkteler, 1969; Harrington, 1972; Ihle, Dure, 1972; Le Page Degivry, 1970;
Mangelsdorf, 1923; Meinke, 1991a, 1994; Meinke et al., 1994; Merkle et al., 1995;
Monnier, 1976; Pope, Brown, 1943; Raghavan, 1976, 1986; Raghavan, Sharma, 1995;
Raghavan, Srivastava, 1982; Robertson, 1955; Roux, 1912; Sharma, Gill, 1982; Symons et
al., 1983; Titova, Batygina, 1996; Vasilyeva et al., 1987; Wareing, Phillips, 1978; Yeung,
Sussex, 1979.
OBSERVATIONS ON LIVING EMBRYO
ПРИЖИЗНЕННЫЕ НАБЛЮДЕНИЯ ЗАРОДЫША
The study of living embryos connected with the direct observation and
monitoring of their life processes is the irreplaceable part of the efforts to
elucidate the basic embryological problems for scientific and educational
purposes. Besides this, the study of living embryos has been carried out
also for various practical purposes. The development of living plant embryos
may be studied in vivo and in vitro. In addition, recently have been
elaborated methods for gamete isolation, in vitro fusion (fertilization) and
embryo development from zygotes originated from fused gamete protoplasts.
Embryos in vivo. The short-term study of the embryos in vivo is limited
to plant species with thin and relatively transparent seed coats (Orchidaceae,
some Campanulaceae etc.) and also to early embryogenesis because of seed
transparency decreasing with the development of the endosperm. The
observation of living embryos in seeds may be realized in some nutrient fluids
or media (sucrose, agar-sucrose media), nearly inert fluids (silicone oils,
mineral oils) or in clearing fluids (methyl salicylate, NaOH, chloralhydrate,
solution by Herr, 1971, etc.). The clearing fluids increase the seed
transparency but shorten the survival of seeds and embryos and shorten also
the possibility of observation to few hours or only minutes. The observation
in simple nutrient or inert media is possible during some hours and even
some days. Complete nutrient solutions composed from macro- and
microelements, sucrose, vitamins and growth substances are usually not very
suitable for the direct microscopical observation of embryos inside seeds.
They promote the further cell development of seed coat layers and in this
way decrease the transparency of seeds.
The main significance of the in vivo study consists in possibility of
direct observation and measurement of events taking place in early embryo-
genesis in semi-controlled conditions. For instance, by time-lapse technique
the time course of zygote and linear embryo development of Jasione montana
L. (Campanulaceae) was stated. In this species the zygote formed the
Зародыш
589
tubular outgrowth, 60—80 mm long, growing to the centre of embryo sac
shortly after fertilization. The growth of the zygote lasted 12—16 hours
with growth speed 5 — 6 (J,m • h._1 (Erdelska, Klasova, 1978). The speed of
the zygote growth was correlated and strictly adjusted to the speed of the
first cell wall development in the cellular endosperm of this species.
The further time-lapse monitoring brought the results about the duration
of mitotic cycle in individual cells of linear embryo. The mitotic cycle of
the basal cell of two-celled proembryo was shorter than that of the apical
cell. This typical time gradient in the duration of the mitotic cycle, reflecting
polarity of the embryo, persisted throughout the whole linear phase of the
embryo development. It was connected also with increasing length and
vacuolization of cells in direction from embryo apex to its basis. The shorter
was the mitotic cycle, the more differentiated was the embryonal cell. The
cells of the future suspensor with advanced cell differentiation had the shorter
mitotic cycle than these of future main embryo.
The zygote growth and the time course of individual phases of the first
mitosis of the zygote in correlation with the development of free nuclear
endosperm of Galanthus nivalis has been also followed by time-lapse
technique (Erdelska, IWF, 1982).
The more advanced phases of embryo development have been studied
in vivo in some orchids (Poddubnaya-Arnoldi, 1976) in connection with
parallel histochemical studies.
The seeds of chloroembryophytes (Brassicaceae, Linaceae, etc.) are
often used for observation of embryos in vivo for educational purposes
or to distinguish the developmental stage of the embryo for further
study. After clearing it is possible to characterize the size, shape and
degree of differentiation of globular, heart- and torpedo-shaped
dicotyledonous embryos also in some leucoembryophytes. This method
aids to find the appropriate stage for further experimental procedure,
for instance for excision and further cultivation in vitro, for fixation
following methods of optical or electron microscopy, etc.
The study in vivo, in comparison with that in vitro, enables to take
in account contemporary developmental correlations of all tissues and cells
in embryo sac.
Embryos in vitro. The study of the embryo in vitro requires its excision
from tissues of the seed and also from correlative influences which act in
the seed. The cultivation in vitro supposes the metabolic and developmental
adaptation of embryos to the new life conditions. The competency to
adaptation and to further development in vitro is dependent on genotype and
developmental phase of the embryo in the moment of the excision. The
transition of embryos from heterotrophy to autotrophy, connected with the
competence of the development outside the seed, is reached at different
developmental phases in different plant species (Batygina, Vasilyeva, 1981).
But in general, the more advanced is the development of the embryo in
the moment of excision, the more successfull is its further development in
artificial conditions.
590
Семя
It is important to adjust the medium composition to the developmental
phase of the embryo in time of the excision. Older (mature or nearly
mature) embryos can develop and germinate on relatively simple media
consisting of essential inorganic salts (macro- and microelements) and carbon
source, usually sucrose, solidified with agar-agar. The cultivation of younger
embryos requires besides a suitable, well-balanced solution of macro-, mi-
cronutrients and sucrose also organic nitrogen, vitamins and growth
substances. The younger is the embryo in the time of excision, the higher
are also its requirements of the specific quality of micro-environmental
conditions during the cultivation (osmotic value, consistency and pH value of
the medium, position on the medium, aeration, temperature and illumination).
The suitability of life conditions for embryos in vitro consists in
competency to:
a) maintain the meristematic character of cells and to promote cell
divisions in the early embryogenesis (during the cell determination and
early differentiation),
b) promote the growth processes in the central phase of the embryo
development,
c) in promoting the maturation in the last phase of the embryo
development.
The respect to different physiological requirements of embryos in individual
phases of its development in vitro is the important supposition for the
success of the embryo culture. It is usefull to modify the concentration of
mineral salts, sucrose and amino acids during the cultivation and during
very dramatical changes in the morphology of embryos (Monnier, 1976).
The idea of the medium change during cultivation was recently used in
experiments with proembryos of Brassica juncea too (Liu et al., 1993).
The culture system was composed of two agar layers, with the top layer
containing higher osmolarity than the bottom layer. Proembryos were placed
on the top layer, osmotic pressure of which decreased gradually during
culture because of the diffusion of osmotically active compounds into the
bottom layer.
The developmental analysis of embryos in vitro seems to show some
characteristics. The growth curve of the embryo and the morphological
characteristics of the development of embryos in vitro are in some features
different in comparison with the similar features in vivo. Embryos in vitro
show the tendency to overcome the phase of maturation by the direct
transition of the embryonal to the postembryonal phase of the development,
by passing reserve substances accumulation and the entrance to dormancy.
Differences in the rythm of growth. The typical growth curve of
embryos in vivo is composed from early slower phase (globular and early
heart-shaped embryo), the second phase of relatively fast longitudinal growth
(from heart-shaped to late torpedo stage of the embryo) and the third
phase with very slow culmination of the growth. Embryo in vitro mimics
the same growth tendency but with expressively lower speed and for longer
time. For instance, the daily values of the longitudinal growth of flax embryo
Зародыш
591
excised as heart-shaped (8 days after fertilization) are lower than those of
the embryos in vivo, whereas the duration of the growth phase is in vitro
longer. The increase in length of the embryo represents during 7 days of
cultivation (from 8—15 day in vivo) only 10—15% of that of the embryo
in vivo. However, embryos in vitro very often do not achieve the full
length of seed embryos at all, because of very soon decrease of the
longitudinal growth in favour of the growth of embryo (cotyledon) width.
The detailed microcinematographical analysis of the growth course of
excised flax embryos in vitro revealed oscillations partly regular but not
strictly linked to the diurnal rythm. All growth differences between embryos
in vivo and in vitro are evidently caused by different life conditions. In
microcinematographical time-lapse investigations have to be considered also
the regular light impulses during the expositions.
Morphological differences. The development of embryos in vivo is
strictly regular particularly as regards to the number and order in cell divisions.
This is manifested in regular longitudinal and radial patterning and typical
shape of the embryo and its parts (tissues and organs) correlated with the
developmental stage of tissues in the seed and fruit. The character of the
epigenetic control of the embryo development changes after the excision.
This is structurally manifested by decrease of regularity in the development
and by changes in proportionality of individual tissues of the embryo. The
degree of abnormalities increases in direction from mature to very young
excised embryos and depends on suitability of the cultivation medium for
different developmental stages of embryos. Well-balanced nutrient medium,
of high osmotic value, enriched with amino acids, vitamins and some growth
regulators (kinetin) was succesfully used for the cultivation of globular
proembryos of several angiosperm species, excised after the protoderm
establishment. Embryos of most of the dicotyledons can be cultivated in vitro
after the establishment of cotyledons closely following the establishment of
both patternings (radial = establishment of the dermatogen, periblem and
plerom and longitudinal = establishment of the embryo axis). This belongs
to the crucial points of embryogenesis. If the basic patternings do not
become established, the embryo continues in the development as a globular
or callus-like structure, or it dies.
In the cultivation of excised embryos, the embryo length/width ratio
(«coefficient of embryo differentiation», after Monnier, 1968) decreases
compared with in vivo development. The value of this ratio is the lower the
younger is the embryo in the time of excision. In vitro cotyledons are
shorter, wider, usually deviate from each other at an obtuse angle with
often irregulary ordered cell rows. Their cells often lose very soon the
meristematic character, enlarge and vacuolize. The same is valid also for
the scutella of grasses. Cotyledons develop as more or less direct structures
even in species with U-shaped embryos in seeds (e. g. Capsella bursa-
pastoris).
Whereas for the cultivation of proembryos the establishment of cotyledons
following the differentiation of plumula-radicular axis is decisive, for the
592
Семя
cultivation of torpedo-shaped embryos the maintenance of functionality of
established radicular and plumular tissues is important. The gradual loss of
the meristematic character of the embryo axis cells, mainly after excision
of older heart-shaped or torpedo-shaped embryos, is connected with cessation
of cell divisions and tendency to precocious ger mination (Erdelska et al.,
1973). Sometimes original meristems (e. g. radicular meristem) degenerate
and are replaced by laterally originated new ones.
Plants originating from the excised embryos in vitro are usually smaller
than those cultivated from seeds. This is connected with the imperfect
completion of the process of cell determination and differentiation in vitro.
However, the more suitable are the cultivation conditions, the more does
the structure of embryos in vitro resemble that in vivo.
Embryo maturation in vitro. The embryo maturation inside the seed
is characterized by the decrease of growth, synthesis and accumulation of
reserve substances, by decrease of the water content and entrance to
dormancy. Embryo in vitro has a tendency to avoid these processes and
to germinate without accumulation of reserve substances and without
acquisition of the physiological characteristics important for the entrance
to the dormancy (e. g. drought and frost resistance). Embryos in vitro
mimic sometimes one or two processes of all characteristics important for
maturation. For instance, in the medium of relatively low osmotic value
(medium with macro-, micronutrients and 5g • Г of sucrose), flax embryos
excised 14 days after fertilization (torpedo stage) show some signs of the
enter to dormancy. It is the temporary loss of chlorophyll and reduction
of the growth connected with the aquisition of the ultrastructural features
typical for dormant embryos for about 14 days. Then embryos gradually
became green and began to germinate even on the unchanged cultivation
medium (Pretova et al., 1981). The high osmotic concentration of the
cultivation medium and/or presence of abscissic acid (ABA) in the
medium for older embryos will prevent the premature germination and
allow the embryogenesis to be completed in most plant species. Sometimes
the presence of suitable precursors in the cultivation medium is necessary
for reserve substance synthesis in phase of maturation. In this way, for
instance, excised flax embryos synthesize storage lipids if they obtain
acetate and biotin from culture medium (Kurtz, Miramon, 1957). ABA
content and high osmotic value of the medium enables the reserve
substance accumulation of Brassica embryos (Finkelstein, Crouch, 1984).
The frost resistance may be achieved by maturation of Capsella embryos
on the medium with high osmotic value (Monnier, Leddet, 1978).
The embryo cultures are used as a tool for elucidation of some
fundamental embryological problems such as embryo nutrition, regulation of embryo
development, the role of different embryo organs, tissues and cells in different
phases of plant development, or to solve different tasks of plant improvement
and breeding (breaking of seed dormancy, «embryo rescue» in some hybrids,
utilization of immature embryos as initial explants for initiation of callus
formation for organogenesis or somatic embryogenesis, using of immature
Зародыш
593
embryos for experiments with cellular genetic manipulations etc.). The number
of papers and reviews published on this topic from the beginning of the
century but especially in its second half is considerable (e. g. Raghavan,
1980; Monnier, 1995) and enables to regard the living plant embryos as
one of the most important objects lying in the centre of biological research
activities.
Embryos from zygotes cultivated in vitro. The attempts to cultivate a
zygote and linear or early globular embryo in vitro have been unsuccessful
for very long time. Recently, the methodical break was realized in this area
of research. First, partially isolated embryo sacs of Zea mays, shortly after
fertilization, were cultured in vitro. The zygotes underwent normal embryo
development and embryos grew to maturity and, regenerated into plants
(Campenot et al., 1992; Mol et al., 1993). Also, success was achieved
in the isolation of male and female gamete protoplasts, their cultivation and
in vitro fusion (fertilization) to zygote. The individual phases of embryo
and plant development from zygote was also described and observed in
details (Kranz, Lorz, 1993). This process seems to resemble in most
structural features that of the development of embryos from isolated
protoplasts of somatic cells.
These successes predict the considerable improvement in the understanding
of higher plant reproduction inclusive the embryo formation over the next
few years. Рис. 56.
Batygina, Vasilyeva, 1981; Campenot et al., 1992; Erdelska, 1978, 1991; Erdelska,
IWF, 1971, 1982; Erdelska, Klasova, 1978; Erdelska et al., 1973; Finkelstein,
Crouch, 1984; Herr, 1971; Kranz, Lorz, 1993; Kurtz, Miramon, 1957; Liu et al., 1993;
Mol et al., 1993; Monnier, 1968, 1976, 1995; Monnier, Leddet, 1978; Pretova et al.,
1981; Raghavan, 1980.
PERSPECTIVES ON GENETIC ANALYSIS OF PLANT EMBRYOGENESIS
ПЕРСПЕКТИВЫ ГЕНЕТИЧЕСКОГО АНАЛИЗА ЭМБРИОГЕНЕЗА
Embryogenesis plays a central role in the life cycle of flowering plants.
Ever since the process of double fertilization was documented at the turn
of the century, plant embryologists have attempted to characterize the cellular
and biochemical changes that occur within developing seeds (Maheshwari,
1950; Raghavan, 1976). For many years, the emphasis was on comparative
morphology and the analysis of cell division patterns during early stages of
embryo development (Johansen, 1950; Wardlaw, 1955). Attention then
shifted to experimental studies of somatic embryogenesis, embryo culture,
and haploid embryos derived from microspores (Raghavan, 1986).
Manipulation of zygotic embryos was limited by the presence of surrounding maternal
tissues. Electron microscopy provided additional details on cellular changes
associated with embryogenesis but generally failed to identify the mechanisms
38-828
594
Семя
responsible. Plant embryologists believed that genetic factors played an
important role in morphogenesis, but mutants with altered patterns of embryo
development were largely ignored (Meinke, 1986).
Recent advances in molecular biology have led to a renewed interest in
plant embryology and the underlying patterns of gene expression that occur
throughout seed development (Goldberg et al., 1989). Many genes
transcribed during embryonic maturation have now been examined at the
molecular level. Genetics provides a complementary approach to the study of
plant embryo development by allowing the identification of genes with
essential functions during this critical stage of the life cycle (Meinke, 1986).
The purpose of this review will be to explore the potential benefits and
limitations of mutant analysis in relation to plant embryo development.
Additional information can be obtained through recent reviews on plant
development (Steeves, Sussex, 1989; Lyndon, 1990), experimental plant em-
bryogenesis (Johri, 1984; Raghavan, 1986; Williams, Maheswaran, 1986),
and plant developmental genetics (Sheridan, 1988; Meinke, 1991a, b).
Overview of plant embryogenesis. Plant embryologists originally
attempted to explain characteristic patterns of cell division observed early in
development by establishing fundamental laws of embryogeny (Johansen,
1950). These laws of parsimony, numbers, origin, disposition, and destination
were thought to reflect the fundamental organization of embryos from different
species. This view has gradually been replaced by the realization that cell
division patterns are determined more by genetic and biophysical factors
than by laws of embryogeny. Examination of developmental pathways in
different angiosperms has nevertheless revealed a number of common features.
The most critical events appear to be the formation of apical meristems,
the establishment of basic patterns of symmetry and cellular organization,
and the transition from a heterotrophic zygote dependent upon nutrient
reserves of surrounding maternal tissues to an autotrophic embryo capable of
surviving desiccation and producing a viable seedling after germination. Early
stages of plant embryo development are characterized by cell division and
morphogenesis. This is followed by a period of cell specialization and
embryonic maturation in preparation for dormancy and germination. Several
features distinguish embryogenesis in angiosperms from related pathways in
animal systems: (1) the process of double fertilization and subsequent
interactions between embryo and endosperm tissues, (2) the apparently minor
role played by maternal mRNAs stored in unfertilized eggs, (3) the absence
of cellular migration during embryo development, (4) the absence of a
germ line established early in development, (5) the activation of large
numbers of zygotic genes during very early stages of embryogenesis, (6) the
presence of a male gametophyte active in transcription that leads to
elimination of many deleterious alleles before fertilization, (7) the establishment
of relatively few specialized cell types, (8) the formation of apical meristems
that ultimately produce the adult plant, and (9) the small size of the
zygote and its location deep within maternal tissues. The zygote in flowering
plants is also not unique; a wide range of somatic cells can be induced
Зародыш
595
to produce embryos either as part of the normal life cycle or through
experimental manipulation. Genetic studies of embryogenesis in Drosophila
and C. elegans may therefore not be directly applicable to higher plants.
Capsella (Cruciferae) has served for many years as a model for embryo
development in dicots (Maheshwari, 1950; Schulz, Jensen, 1968). A similar
pattern of development has been found in Arabidopsis (Mansfield, Briarty,
1991; Webb, Gunning, 1991). The egg at fertilization is located within a
multicellular megagametophyte that contains eight haploid nuclei derived from
a single functional megaspore within the developing ovule. Two sperms from
a single pollen tube enter the megagametophyte and participate in fertilization.
One fuses with the egg to produce the zygote. The other fuses with two
polar nuclei to produce the primary endosperm nucleus. Molecular signals
responsible for double fertilization remain to be identified, but recent studies
have shown that in many plants the two sperm cells involved are dimorphic
(Russell, 1991) К
The zygote produces an embryo composed of two parts: the embryo
proper and the suspensor. Initial patterns of cell division in the suspensor
and early embryo proper are highly reproducible. The periclinal division
that produces the 16-cell embryo proper is particularly significant because
it establishes an epidermal layer known as the dermatogen2. Subsequent
planes of cell division in the embryo proper are more irregular. The suspensor
attaches the embryo proper to surrounding maternal tissues and functions
early in development to provide nutrients to the embryo proper (Yeung,
1980). The distal portion of the suspensor in contact with the embryo
proper is known as the hypophysis and gives rise to both the root apex
and root cap.
Several critical events occur during the transition from globular to heart
stages of embryogenesis in Capsella: (1) the embryo proper establishes bilateral
symmetry with the initiation of cotyledons, (2) cellular differentiation becomes
apparent with the formation of incipient vascular tissue, (3) the embryo proper
begins to turn green and becomes visible through the translucent seed coat,
and (4) the triploid endosperm tissue that was present as a syncytium of
free nuclei during early stages of embryogenesis starts to become cellular.
Both the suspensor and cellular endosperm begin to degenerate during later
stages of development and not present at maturity. Further expansion of the
cotyledons and hypocotyl occurs as the embryo passes through the torpedo,
early curled, and mature cotyledon stages of development. The shoot apex
forms a cluster of small cells between the expanding cotyledons but remains
quiescent until the initial stages of germination.
Although the pattern of development observed in Capsella can serve as
a model for plant embryogenesis, it cannot reflect the diversity of embryonic
See also S. G. Nawaschin (1927); Dimorphism of sperms, Vol. I (Ed.).
Syn. protoderm, embryoderm (Ed.).
38*
596
Семя
pathways observed throughout the angiosperms (Wardlaw, 1955).
Development of the megagametophyte itself is highly variable (Maheshwari, 1950).
Some plants lack synergids, whereas others differ in the number and
placement of antipodals and polar nuclei. The endosperm tissue is not always
triploid; it can range from 2n to 15n depending on the number of polar
nuclei produced during megagametogenesis. Two or more megaspores may remain
functional and contribute to the mature megagametophyte. This can result in
genotypic differences among the haploid nuclei present at the time of fertilization.
The initial division of the zygote is often transverse, but subsequent
division patterns clearly differ between taxonomic groups. Particular emphasis
has been placed on division of the terminal cell at the two-cell stage and
the relative contributions of the basal cell and its descendants to the embryo
proper (Johansen, 1950; Maheshwari, 1950). Many angiosperms can be
classified according to predictable patterns of cell division during early
stages of embryogenesis. Other species exhibit irregular patterns even at
the earliest stages of development. Gymnosperm embryos differ in a more
dramatic fashion because they often progress through a free nuclear phase
before the globular stage of development. The size and appearance of the
suspensor also differ greatly among angiosperms. Suspensors range from a
single cell to a massive column of several hundred cells. Some contain
polytene chromosomes, others are polyploid or multinucleate, and a few
produce large haustoria that invade surrounding maternal tissues and
apparently facilitate the transfer of nutrients to the developing embryo proper.
The extent of differentiation at the time of seed maturation also varies. In
a few cases, the «mature» seed contains an undifferentiated globular embryo
that completes the remaining stages of development after being shed from
the plant. The shoot apex is quiescent and barely visible in some embryos
at maturity, whereas in others it produces several leaves before germination.
Most embryos prepare for extended periods of desiccation and dormancy
following completion of embryogenesis, but in viviparous mangroves,
precocious germination occurs within the fruit. Endosperm development among
angiosperms also differs in the timing and extent cellularization, the presence
of specialized haustoria, and the amount of tissue present at maturity. Models
of gene function in relation to plant embryo development must therefore
account for both the common features and interesting variations observed
among angiosperm embryos.
Genetic analysis of plant embryogenesis. Mutants have been used in
several ways to study plant development (Meinke, 1991a). One approach
has been to analyze cell division patterns by genetically marking single
cells or cell layers and noting the distribution of resulting clonal sectors
(Tilney-Bassett, 1986; Poethig, 1989). Three major questions have been
addressed through clonal analysis: (1) how many cells within the meristem
contribute to the formation of a particular plant structure? (2) when do
meristematic cells become restricted to predictable developmental fates? and
(3) how variable are the lineages and division patterns of meristematic cells
at different stages of development? Clonal analysis has provided extensive
Зародыш
597
information on the origin and developmental fates of cells within the
embryonic shoot apex of maize (Poethig et al., 1986; McDaniel, Poethig,
1988). The conclusion from these studies has been that meristematic cells
become restricted in their developmental fates but do not always divide in
the same manner or contribute to precisely the same portion of the adult
plant. Similar studies with other plants have supported the conclusion that
cell lineages play a minor role in plant development (Jegla, Sussex, 1989).
Clonal analysis has not been widely used to study cell lineages during
early stages of embryogenesis (Christianson, 1989). One problem has been
the identification of cell-autonomous genetic markers that can be readily
scored throughout embryonic development. Another limitation has been
marking specific cells at precisely the same stage of development. It should
nevertheless be possible to apply the principles of clonal analysis to
embryogenesis in Arabidopsis and to characterize in detail the nature of cell
lineages during early stages of embryo development.
Mutants can also be used to identify genes with important developmental
functions. The field of plant developmental genetics has expanded dramatically
in recent years with the identification of mutants defective in almost every
aspect of development (Meinke, 1991a). With floral mutants of Arabidopsis
(Bowman et al., 1991) and Antirrhinum (Schwarz-Sommer et al., 1990),
considerable progress has been made toward identifying genes with direct
roles in the regulation of morphogenesis (Coen, 1991). Emphasis in this
case was placed on a small number of mutants with homoeotic changes in
floral structure. Embryogenesis presents a greater challenge with respect to
mutant analysis because a large number of genes are first expressed at this
stage of the life cycle. Jtirgens et al. (1991) have followed the Drosophila
approach and focused on a small number of pattern mutants with defects
in both embryo development and the establishment of apical-basal pattern
elements in adult plants. My laboratory has taken the approach that a
wide range of mutants with different phenotypes must be examined to
understand the relationship between gene function and embryo development.
Many embryonic mutants are likely to be defective in essential
housekeeping functions (Haughn, Somerville, 1988). Several strategies have been
proposed to facilitate the identification of genes involved in the regulation
of morphogenesis (Meinke, 1991a). These include focusing on mutants with
phenotypes that appear to result from changes in cellular identity, mutants
defective in genes with embryo-specific functions, mutants with defective
embryos that are green rather than white, and mutants that consistently
block at a critical stage of morphogenesis. Mutations in housekeeping genes
expressed during both gametogenesis and embryogenesis may be eliminated
before fertilization (Meinke, 1982; Ottaviano, Mulcahy, 1989). The long
style of maize provides a greater selective barrier to mutant pollen tubes
than the short style of Arabidopsis. Housekeeping defects that result in
embryonic lethality may still provide valuable information on the genetic control
of cellular functions. For example, a biotin auxotroph of Arabidopsis that becomes
lethal during embryogenesis has provided the most definitive information to date
598
Семя
О
on biotin synthesis in plants (Schneider et al., 1989; Shellhammer, Meinke,
1990). Other mutants should facilitate the identification of genes that function
in cell division and metabolism. Many laboratories are utilizing molecular
approaches to identify housekeeping genes with important functions. Analysis
of embryonic mutants will enable a complementary genetic approach to be
pursued.
Some embryonic lethals may be defective in genes with important
developmental functions. Early stages of embryo development are characterized
by patterns of morphogenesis that differ from subsequent iterative events
associated with the shoot apex (Poethig, 1990). Defects in genes regulating
early embryogenesis may result in lethality, whereas defects in genes
regulating the shoot apex may result in homoeosis or heterochrony. Some
transcription factors required for completion of embryogenesis may also serve
global functions throughout growth and development. Loss of a single factor
through mutation may consequently disrupt a wide range of essential functions
and result in lethality during embryogenesis. Although pattern mutants are
clearly interesting and should provide valuable insights into the genetic control
of plant embryogenesis, there are several reasons why research with other
embryonic mutants should also be continued. Perhaps the most compelling
reason is that polarity and pattern formation are not the only questions
that merit analysis in relation to plant embryogenesis. Many genes are
likely to play a critical role in the complex interactions that occur between
different parts of a developing seed. Understanding the nature of interactions
between the embryo proper, suspensor, endosperm, seed coat, nucellus, and
maternal plant is as important from a developmental perspective as
understanding how meristems become positioned in the proper location. Other
genes may play important roles in determining cell division patterns in the
early embryo, cellularization of endosperm tissues, nuclear changes in the
suspensor, establishment of the dermatogen, initiation of cotyledons, and
differentiation of provascular tissues. Identifying these genes may be difficult,
but defining their functions during embryogenesis will be required to answer
fundamental questions in plant development. Embryonic lethals, defectives,
and pattern mutants should therefore play complementary roles in the genetic
analysis of plant embryo development.
Diversity of embryonic mutants. Embryonic mutations have been
identified in a wide range of flowering plants including Arabidopsis (Muller,
1963; Franzmann et al., 1989; Jurgens, 1991; Meinke, 1991b), Zea
(Sheridan, Neuffer, 1982; Dolfini, Sparvoli, 1988; Clark, Sheridan, 1991), Яог-
deum (Bosnes et al., 1987; Felker et al., 1987), Daucus (Lo Schiavo et
al., 1988; Schnall et al., 1988), Oryza (Nagato et al., 1989), and Pisum
(Bhattacharyya et al., 1990). Many of these mutations have been induced
with chemical mutagens (Neuffer, Sheridan, 1980; Meinke, 1985; Jurgens
et al., 1991), X-irradiation (Muller, 1963), transposable elements (Clark,
Sheridan, 1991), or T-DNA from Agrobacterium (Errampalli et al., 1991).
Important features of maize and Arabidopsis as model systems for genetic
analysis of plant embryogenesis are summarized (see Table).
Зародыш
599
Table. Maize and Arabidopsis — model systems for genetic
analysis of plant embryogenesis
General Feature
Chromosome number
Haploid genome size
Generation time
Fruits per plant
Seeds per fruit
Seed length
Seed weight
Shoot apex (seed)
Leaf primordia (seed)
Endosperm at maturity
Target of mutagenesis
Insertional mutagenesis
Embryo mutants
Endosperm mutants
Chromosome walking
Plant transformation
B-A translocations
Somatic embryogenesis
Clonal analysis
Relevance of model
Arabidopsis
n - 5
7 x Ю4 kb
40 days
Many
30—60
0,5 mm
30 ng
Small
Absent
Absent
Seeds
Available
Numerous
Uncertain
Practical
Established
Absent
Difficult
Possible
Dicots
Maize
n = 10
3 x 106 kb
120 days
Few
400—600
8 mm
200 mg
Large
Present
Present
Pollen
Available
Numerous
Numerous
Impractical
Limited
Available
Difficult
Established
Monocots
Various strategies have been employed to identify mutants defective in
embryo development: (1) screening ears of maize produced by Mi plants
after pollen mutagenesis (Neuffer, Sheridan, 1980), (2) screening immature
siliques of Arabidopsis produced by chimeric Mi plants after seed
mutagenesis (Muller, 1963; Meinke, Sussex, 1979a,b), and (3) screening M2
seedlings of Arabidopsis germinated on agar plates (Jurgens et al., 1991).
Variant lines of carrot defective in somatic embryogenesis have also been
identified in culture (Lo Schiavo et al., 1988; Schnall et al, 1988).
Recessive embryonic lethals are generally maintained as heterozygotes that
produce 25% aborted seeds after self-pollination. Heterozygous and wild-
type plants are distinguished at maturity by screening for the presence of
defective seeds.
The high frequency of mutants defective in embryogenesis is consistent
with a large number of target genes performing essential functions at this
stage of the life cycle. Molecular studies of RNAs present in developing
seeds indicate that 20.000 genes may be expressed during embryogenesis
(Goldberg et al., 1989). Many of these genes may perform nonessential
functions, be duplicated in the genome, or be required during gametogenesis.
The precise number of genes identified through loss-of-function mutations
is therefore difficult to predict. Jurgens et al. (1991) estimate that Arabidopsis
600
Семя
3
contains approximately 4000 genes essential for embryogenesis. This number
is based on the relative frequencies of embryonic lethals and pigment mutants
recovered following seed mutagenesis. The actual number of essential genes
may be significantly lower because spontaneous embryo abortion in large
populations of M2 plants may lead to overestimates of the frequency of
embryo-lethal mutations. We estimate that only 500 genes may be identified
through embryonic lethals and defectives in Arabidopsis. Existing collections
of embryonic mutants have therefore not approached saturation.
Most embryonic mutants are defective in either (1) early stages of cell
division and morphogenesis, (2) accumulation of pigments and storage
materials during embryonic maturation, or (3) preparation for dormancy and
germination. Included in the first class are many defective-kernel (dek) and
germless (emb) mutants of maize (Sheridan, 1988; Clark, Sheridan, 1991)
and embryonic (emb) mutants of Arabidopsis (Meinke, 1991b). The second
class includes a wide range of mutants defective in endosperm development in
maize (Сое et al., 1988) and barley (Bosnes et al., 1987). Tester lines of
maize carrying B-A chromosomal translocations have been particularly useful
in demonstrating which mutants are defective only in endosperm development
(Neuffer, Sheridan, 1980). A wrinkled seed mutant of pea defective in starch-
branching enzyme (Bhattacharyya et al., 1990) and mutants of soybean with
altered levels of abundant seed proteins (Goldberg et al., 1989) have also
been described. Albino and pale-green mutants identified following seed
mutagenesis in Arabidopsis (Muller, 1963; Feldmann, 1991; Jurgens et al., 1991)
can be viewed as embryonic mutants because wild-type embryos remain green
before maturation. Fusca mutants that accumulate anthocyanin during embryo-
genesis and become lethal at germination have also been described in Arabidopsis
(Weiland, Miiller, 1972). The final class of mutants defective in seed dormancy
includes viviparous mutants of maize (McCarty et al., 1989) and hormone
mutants of Arabidopsis (Finkelstein et al., 1988).
A wide range of interesting phenotypes has been identified among
Arabidopsis mutants defective in embryo development. Jurgens et al. (1991)
have devided their pattern mutants into four classes: (1) pattern deletions
that lack specific regions in the mature embryo, (2) deletions associated
with duplications of embryonic structures, (3) multiplication of cotyledons,
and (4) transformation of cotyledons into shoots. The first class is further
divided into phenotypic groups that differ with respect to deletion pattern.
Included among this class is the gnom mutant, which results in deletion
of the root apical meristem. The second class includes a particularly
interesting mutant known as doppelwurzel, in which the apical portion of the
embryo, including the shoot meristem, is deleted and replaced with a mirror
image of the basal portion. The resulting seedling is well differentiated but
produces roots from both apices. Genetic studies indicate that after screening
44000 M2 families on plates and identifying 250 pattern mutants representing
perhaps 40 to 50 different genes, Jurgens et al. (1991) may have saturated
for putative pattern mutants of Arabidopsis. Further analysis of these pattern
Зародыш
601
mutants should provide dramatic insights into genetic control of plant
development.
Interesting phenotypes have also been identified among embryonic lethals
and defectives of Arabidopsis (Meinke, 1991b). These include the presence
of fused cotyledones, twin embryos, abnormally large suspensors, green
blimps, distorted epidermal layers, single cotyledons, enlarged shoot apices,
split hypocotyls, embryos with altered patterns of symmetry, bloated embryos
with giant vacuolated cells, reduced hypocotyls that fail to produce roots,
and embryos that protrude through the seed coat late in maturation. A
female gametophytic factor that results in 50% aborted seeds regardless of
pollen genotype has also been identified. These mutants may be used to
study the establishment and maintenance of symmetry during embryo
development, the relationship between cell size and embryogenesis, the genetic
control of polyembryony, the fusion of plant tissues during development,
the regulation of cell division patterns in the dermatogen, the control of
apical development during embryogenesis, the relationship between embryo
development and seed maturation, and the nature of interactions between
the developing embryo proper and suspensor.
Two approaches to mutant isolation are likely to become more widespread
in the future: transposon tagging in maize (Chandlee, 1991) and T-DNA
tagging in Arabidopsis (Feldmann, 1991). Over 50 emb mutants of maize
have recently been isolated from lines containing Robertson's Mutator (Clark,
Sheridan, 1991). Other collections of putatively tagged dek mutants are
being analyzed by Donald Robertson (Iowa State), Mary Tierney (Ohio
State), and Carol Rivin (Oregon State). Screening of 6000 transgenic
Arabidopsis families produced at Du Pont after ^grobacterium-mediated
seed transformation has yielded at least 100 additional mutants defective
in embryo development. Analysis of these mutants is being performed in
my laboratory at Oklahoma State University and in the laboratories of
Robert Goldberg, Robert Fisher, and John Harada at the University of
California. Populations of transgenic Arabidopsis plants generated through
other methods (Koncz et al., 1989, 1990; Van Lijsebettens et al., 1991)
may also yield tagged embryonic mutants. Mutagenesis with diepoxybutane
and molecular cloning of deletion mutants through genomic subtraction
represents an approach to gene isolation that may become more widespread
in the future (Straus, Ausubel, 1990).
Two questions will need to be addressed as embryonic mutants become
more abundant: (1) which mutants should be examined in detail? and
(2) which mutants are defective in the same gene? The first question may
be addressed from opposite directions. Some tagged mutants will be chosen
simply because their pattern of insertion facilitates gene cloning. Others will
be selected on the basis of interesting phenotypes, sequence similarities with
known genes, or existence of multiple alleles. The second question is not
trivial in cases where large number of target genes involved. Over 10.000
pairwise crosses would be required to complete allelism tests among the
150 embryonic mutants currently maintained in my laboratory. This number
602
Семя
could be reduced if crosses were limited to mutants with similar phenotypes,
but alleles with different patterns of abnormal development would be missed.
The alternative approach is to map the chromosomal locations of mutant
genes and limit complementation tests to genes that map to similar regions.
Sixteen genes essential for embryo development in Arabidopsis have already
been mapped relative to visible markers (Patton et al., 1991). Another 75
lines including T-DNA insertional mutants are currently being mapped in my
laboratory. Many dek and emb loci of maize have also been localized to
chromosome arms (Neuffer, Sheridan, 1980; Clark, Sheridan, 1991; Scanlon
et al., 1991).
Molecular analysis of embryonic mutants. Detailed analysis of
embryonic mutants will require molecular isolation of the defective genes. The
most promising approach with maize involves transposon tagging (Sheridan,
1988). This approach has already been used to isolate genes with important
functions (Chandlee, 1991) and should be applicable to the analysis of
embryonic mutants (Clark, Sheridan, 1991). Several methods of gene
isolation are currently being employed with Arabidopsis: (1) chromosome
walking from adjacent restriction fragment length polymorphism markers,
(2) insertional mutagenesis with T-DNA or maize transposons followed by
recovery of flanking plant sequences, and (3) deletion mutagenesis and
subsequent gene isolation through genomic subtraction. T-DNA insertional
mutagenesis offers several advantages for the near future. Numerous mutants
have already been isolated following ylgrobac/erium-mediated seed
transformation (Errampalli et al., 1991; Feldmann, 1991; R. B. Goldberg,
personal communication), and additional families are being generated that
should contain new mutations. Flanking plant sequences can be isolated
through either plasmid rescue (Yanofsky et al., 1990), inverse polymerase
chain reaction (Earp et al., 1990), or screening of genomic libraries. The
primary disadvantages of seed transformation are that approximately half
of the embryonic mutants identified to date are not tagged, and most have
duplications and rearrangements of T-DNA that complicate molecular
analysis. Transposon tagging could become a valuable alternative to seed
transformation if maize elements transpose at high frequency to linked
chromosomal sites in Arabidopsis. Chromosome walking is likely to remain
tedious for several years but should become the method of choice once a
physical map of the genome is completed.
Molecular complementation of embryonic lethals presents a special
challenge because homozygous mutant tissues are not readily available. This
problem may be circumvented if multiple alleles are isolated and shown to
differ in nucleotide sequence. An alternative approach might be to transform
heterozygotes and screen for a distortion of segregation ratios in the next
generation. The disadvantage in this case might be the limited number of
seeds produced by primary transformants. The best approach may be to
introduce the putative wild-type allele into wild-type plants through
transformation, cross Fi plants carrying this inserted gene with plants heterozygous
for the embryonic mutation, and test for a reduction in the percent mutant
Зародыш
603
seeds produced after self-pollination. The frequency of defective seeds in
rescued transformants should be reduced from 25% to 6% if the introduced
wild-type gene is unlinked to the mutant locus and restores normal function
to homozygous mutant embryos. Another advantage to this strategy is that
any wild-type ecotype can be chosen for transformation.
Future directions. Research with mutants defective in plant embryogenesis
has reached a critical transition point. Previous studies with maize and
Arabidopsis have clearly demonstrated that a wide range of mutants can be
isolated. The challenge now is to demonstrate the value of these mutants to
plant biology. The most significant long-term contribution will be the
identification and molecular isolation of a large number of essential genes in
higher plants. These genes are likely to play critical roles in cell division,
metabolism, and differentiation.
The immediate concern is how specific mutants can provide information
relevant to plant embryo development. The presence of abnormal suspensors
in embryonic mutants of Arabidopsis illustrates how lethality can be informative.
The suspensor is known to play an active role in regulating development of
the embryo proper during early stages of plant embryogenesis (Yeung, 1980).
Much less attention has been placed on the role of the embryo proper in
regulating the development of the suspensor. Several studies have shown
that destruction of the embryo proper at early stages of development is
often followed by abnormal growth of the suspensor (Raghavan, 1976).
One model proposed to explain this phenomenon states that continued growth
of the suspensor is normally inhibited by the embryo proper, and that the
developmental potential of cells in the suspensor is revealed when this
inhibitory effect is removed through a mutation lethal only to the embryo
proper (Marsden, Meinke, 1985). This model is consistent with the relatively
high frequency of mutants found with abnormal suspensors. It also suggests
that variations in suspensor morphology found in angiosperms may be caused
in part by different levels of inhibition by the embryo proper. This model
can be tested at a molecular level now that several T-DNA insertional
mutants of Arabidopsis have been shown to produce adnormal suspensors
(Errampalli et al., 1991).
Embryonic mutants with a nonrandom distribution of aborted seeds in
heterozygous siliques have been equally valuable in providing information
on the extent of overlap between gametophytic and sporophytic gene
expression in higher plants (Meinke, 1982). Similar patterns of gene expression
have been described in maize (Clark, Sheridan, 1988; Ottaviano et al.,
1988). The hypothesis that dek mutants represent null alleles of quantitative
trait loci in maize (Lee et al., 1991) is being tested by comparing map
locations of Mufafor-induced dek mutants and known quantitative trait loci
(Scanlon et al., 1991). Molecular isolation of embryonic genes from maize
and Arabidopsis will provide access to a valuable collection of promoters
active at different stages of embryo development. Suicide genes fused to
these promoters could be used to examine the developmental consequences
of selective cell death at different stages of embryogenesis. This represents
604
Семя
a powerful new approach to experimental plant embryology. These promoters
could also be used to change the timing of accumulation of major storage
materials, introduce novel gene products into specialized cell types, or
eliminate unwanted seeds during fruit production. Expression of essential genes
during somatic and zygotic embryogenesis could be compared by inducing
mutant cells to undergo embryogenesis in culture and determining whether
defects occur at the same stage of development. Embryonic mutants might
also be used to identify genes responsible for embryo abortion in interspecific
hybrids (Brink, Cooper, 1947) and spontaneous embryo abortion in nature
(Wiens et al., 1987, 1989).
Continued advances in related disciplines will be required to complement
genetic approaches to plant embryogenesis. Recent studies on the mic-
rotubular cytoskeleton in Arabidopsis (Webb, Gunning, 1991) and double
fertilization in a nonflowering seed plant (Friedman, 1990) serve as reminders
that microscopy will continue to play an important role in plant embryology.
The potential application of confocal light microscopy to this field remains
to be explored. Experimental manipulation of somatic embryos (Schiavone,
Racusen, 1990), in vitro fertilization of ovules (Zenkteler, 1990), and
growth of immature seeds in culture (Raghavan, 1986) are methods that
should complement genetic analysis of embryonic mutants. In situ localization
of mRNAs (Fernandez et al., 1991) and p-glucuronidase fusions with cis-
acting elements (Benfey et al., 1990) may provide additional information
on patterns of cellular differentiation. With this combination of genetic,
experimental, and molecular approaches, it should be possible over the next
decade to make dramatic advances in our understanding of plant embryology.
Fig. 57.
Benfey et al., 1990; Bhattacharyya et al., 1990; Bosnes et al., 1987; Bowman et al., 1991;
Brink, Cooper, 1947; Chandlee, 1991; Christianson, 1986; Clark, Sheridan, 1986, 1988,
1991; Сое et al., 1988; Coen, 1991; Dolfini, Sparvoli, 1988; Earp et al., 1990; Errampalli
et al., 1991; Feldmann, 1991; Felker et al., 1987; Fernandez et al., 1991; Finkelstein et al.,
1988; Foster, Gifford, 1974; Franzmann et al., 1989; Friedman, 1990; Goldberg et al.,
1989; Haughn, Somerville, 1988; Jegla, Sussex, 1989; Johansen, 1950; Johri, 1984; Jurgens
et al., 1991; Koncz et al., 1989, 1990; Lee et al., 1991; Lo Schiavo et al., 1988; Lyndon,
1990; Mansfield, Briarty, 1991; Marsden, Meinke, 1985; McCarty et al., 1989;
McDaniel, Poethig, 1988; Meinke, 1982, 1985, 1986, 1991a, b; Meinke, Sussex, 1979a,b;
Miiller, 1963; Nagato et al., 1989; Neuffer, Sheridan, 1980; Ottaviano, Mulcahy, 1989;
Ottaviano et al., 1988; Patton et al., 1991; Poethig, 1989, 1990; Poethig et al., 1986;
Raghavan, 1976, 1986; Russell, 1991; Scanlon et al., 1991; Schiavoane, Racusen, 1990;
Schnall et al., 1988; Schneider et al., 1989; Schulz, Jensen, 1968; Schwarz-Sommer et al.,
1990; Shellhammer, Meinke, 1990; Sheridan, 1988; Sheridan, Clark, 1987; Sheridan,
Neuffer, 1982; Sleeves, Sussex, 1989; Straus, Ausuabel, 1990; Tilney-Bassett, 1986; Van
Lijsebettens et al., 1991; Wardlaw, 1955; Webb, Gunning, 1991; Weiland, Muller, 1972;
Wiens et al., 1987, 1989; Williams, Maheswaran, 1986; Yanofsky et al., 1990; Yeung,
1980; Zenkteler, 1990.
Зародыш
605
ЭКСПРЕССИЯ ГЕНОВ В ЭМБРИОГЕНЕЗЕ
Существует гипотеза о том, что изменения в клеточной
дифференциации отражают изменения в программе генной экспрессии.
Основанные на этой гипотезе эксперименты позволили изолировать
большое количество генов, которые специфически экспрессируются
во времени и в пространстве у животных и растений (Davidson,
1986). Однако гены или классы генов, которые экспрессируются в
зиготогенезе (Dresselhaus et al., 1992, 1996) и раннем эмбриогенезе
растений, изучены недостаточно.
Эмбриогенез цветковых растений относительно консервативен.
Отдельные его стадии (глобулярная, сердечковидная и торпедовидная),
характеризующиеся морфологическими изменениями, присущи
практически всем семействам двудольных. Зародыш многих однодольных
также проходит в своем развитии стадии, характерные для большинства
семейств этого класса, а на самых ранних стадиях его развитие в
основном сходно с таковым у двудольных. В связи с этим можно
было бы ожидать, что у всех цветковых растений (или хотя бы в
пределах одного класса) работает единая генетическая программа,
определяющая те черты их развития, которые не зависят от
индивидуальных особенностей вида. Тем не менее, несмотря на большие успехи
в анализе генов, экспрессирующихся в эмбриогенезе у разных видов
растений, универсального гена (или генов), являющегося регулятором
эмбриогенеза, пока не описано.
Наиболее полные исследования в этой области проведены на
суспензионной культуре моркови в связи с тем, что в ней при помощи
специальной методики (Guiliano et al., 1983) удается получать высо-
косинхронизированную культуру эмбриоидов. Как было показано
(Borkird et al., 1988), экспрессия генов происходит одинаково в
соматическом и зиготическом зародышах моркови, что позволяет говорить
об универсальности программ их развития.
Поиск эмбриоспецифичных генов. Первые работы, связанные с
поиском специфических генов, экспрессирующихся на определенных
стадиях эмбриогенеза, начались с анализа белков, соответствующих
этим генам. При сравнении трансляционных профилей
неорганизованного каллуса и соматических зародышей моркови было найдено два
белка, появление и исчезновение которых происходило на несколько
дней раньше начала образования зародыша и обратного
преобразования зародыша в каллус (Sung, Okimoto, 1981). Поскольку функция
этих белков не была установлена, они были названы «маркерами
раннего эмбриогенеза».
Дальнейшие исследования белков при помощи двумерного
электрофореза показали, что подавляющее их большинство присутствует как
606
Семя
в неорганизованных клеточных кластерах, так и в соматических
зародышах (Sung, Okimoto, 1983; Choi, Sung, 1984). Это сходство генной
экспрессии может отражать эмбриогенную компетенцию клеток,
культивируемых еще в присутствии 2,4-Д до перенесения на
безгормональную среду (эта смена сред является, как правило, необходимым
условием развития соматических зародышей в культуре in vitro). Такие
клеточные кластеры, называемые часто «проэмбриогенной массой»
(ПЭМ) (Halperin, 1966), возможно, имеют эмбриогенную программу,
но в присутствии 2,4-Д они неспособны реализовать эмбриональное
развитие и морфогенез (Fienberg et al., 1984).
Детерминация развития соматических зародышей может происходить
на уровне 6—10-клеточных агрегатов (Nomura, Komamine, 1985, 1986).
Их дальнейшее развитие осуществляется только в отсутствие индуктора.
При исследовании эмбриогенеза с помощью трансляции in vitro РНК
выделяли из гипокотилей, листьев, ПЭМ и торпедовидных зародышей
моркови и транслировали в пшеничной системе в присутствии 535-ме-
тионина (Wilde et al., 1988). Хотя существует некоторая разница между
генной экспрессией в ПЭМ и торпедовидных зародышах, их белковые
профили очень похожи между собой и резко отличаются от профилей,
полученных для гипокотилей и листьев проростка. Так, 21 продукт
трансляции, присутствующий в ПЭМ и торпедовидном зародыше, отсутствует
в гипокотиле и листьях (9 из этих 21 проявляются в листьях после
очень длительной экспозиции). Только три белка экспрессировались
исключительно на торпедовидной стадии зародыша.
Таким образом, показано, что почти все молекулярные процессы,
необходимые для возникновения и нормального протекания эмбриоидо-
генеза на среде без ауксина, устанавливаются еще в ПЭМ в присутствии
2,4-Д. При сравнении трансляционных профилей эксплантов из гипо-
котиля, эмбриогенной и неэмбриогенной культур, соматических
зародышей было выявлено несколько специфических белков. Так, в
эмбриогенной культуре появляются четыре белка, которых нет в неэмбриогенной
культуре и экспланте из гипокотиля, и один белок отсутствует. Три из
этих четырех белков отмечены и в соматическом зародыше, причем в
большем количестве. Кроме того, обнаружены два белка, которые
характерны только для соматического зародыша, а шесть белков из двадцати
одного, напротив, исчезают на этой стадии.
Роль гликопротеииов в развитии зародыша. Известно, что число
ПЭМ медленно возрастает в начальной культуре в течение шести
недель. Замена половины среды в стандартной начальной культуре на
среду от семидневной эмбриогенной культуры приводила (при
дальнейшем субкультивировании только на свежей среде) к такому
увеличению числа ПЭМ, которое в норме наблюдалось бы только через
месяц. Был сделан вывод о существовании внеклеточных факторов в
установившейся эмбриогенной среде, способных увеличивать эмбрио-
генный потенциал начальной культуры (Hari, 1980; Smith, Sung,
1985). Высказаны предположения, что стимулирующими факторами
Зародыш
607
могут быть фитогормоны (Kohler, Wenzel, 1985), олигосахариды (Тгап
Thanh Van et al., 1985), полиамины (Fienberg et al., 1984). Кроме
того, был описан гликопротеин с молекулярным весом 65 кД,
являющийся экстраклеточным фактором, присутствующим только в среде с
соматическими зародышами моркови (Satoh et al., 1986).
В процессе увеличения эмбриогенного потенциала культуры
накапливаются в большом количестве белки 27 и 72 кД (de Vries et al.,
1988). Эти белки отсутствуют в среде, содержащей соматические
зародыши. Секретируемые в среду белки являются гликопротеинами,
содержание которых может регулироваться балансом ауксины/цитокинины.
Соматический эмбриогенез может быть полностью блокирован
добавлением туникамицина, вызывающего дегликозилирование белков 46
и 52/54 кД. Цитологические исследования показали, что блокирование
эмбриоидогенеза происходило на очень ранней стадии, до образования
глобулы. Оказалось, что эмбриогенная суспензионная культура имеет
измененный (по сравнению с неэмбриогенной) профиль
экстраклеточных белков. Белки 29, 46, 72 кД и дуплет 52/54 кД являются
гликопротеинами высокоманнозного типа.
Все эти результаты позволяют говорить о том, что соматический
эмбриогенез зависит от присутствия в среде соответствующим образом
гликозилированных внеклеточных белков. Дальнейшие исследования
этих гликопротеииов, их генов и способов их регуляции
представляются на сегодняшний день одним из наиболее перспективных подходов к
анализу регуляции процессов эмбрио- и эмбриоидогенеза.
Анализ генов, экспрессирующихся в эмбрио- и эмбриоидогенезе.
Выход на соответствующие гены через синтезируемые ими белки был
произведен с помощью иммунологических методов на эмбриоидах
моркови и других растений (Choi et al., 1987). В результате зондирования
библиотеки кДНК из соматических зародышей моркови в фаге Xgt И
было обнаружено 22 рекомбинантных фага, продуцирующих белки,
которые реагируют с антителами, соответствующими эмбриоспецифичным
белкам.
Блот-гибридизация полиА-РНК из эмбриоидов и неорганизованных
клеточных кластеров с этими плазмидами выявила три клона: 8, 49 и
59. Уровень РНК, гомологичных этим клонам, был в несколько раз
выше в зародышах, чем в неорганизованных клеточных кластерах.
При помощи моноспецифических антител было выявлено
соответствие между интересующими клонами и соответствующими им белками.
Так, клону 8 соответствует белок 66 кД, количество которого в
неорганизованных клеточных кластерах невелико, но возрастает в
несколько раз на глобулярной стадии и сохраняется на повышенном
уровне на торпедовидной стадии. В процессе прорастания белок 66 кД
исчезает. Иммуноцитохимический анализ показал, что белок Dc8
локализован большей частью в белковых телах и клеточных оболочках
зародышей, а также в эндосперме. Некоторое количество белка Dc8
отмечено в цитоплазме. При электронно-микроскопическом исследова-
608
Семя
нии выяснилось, что белок Dc8 локализован в вакуолях и мелких
пузырьках, а также в полостях ЭР и аппарата Гольджи в клетках
зародыша на торпедовидной стадии. Функции этого белка неизвестны,
однако отмечено, что он не может быть запасным белком семян
моркови. Клону 49 соответствует белок 50 кД, содержание которого
довольно высоко и в неорганизованных клеточных кластерах, но еще
выше в соматических зародышах. Клону 59 соответствует белок 20
кД. Присутствие этого белка характерно только для соматических
зародышей, и, как показали иммунологические исследования, он резко
отличается от всех других белков моркови.
При помощи моноспецифических антител этими же авторами были
исследованы также соответствующие белки в соматических зародышах
других растений (маниок, персик, кукуруза), а также в зиготических
зародышах и листьях сорго. В зародышах этих растений отсутствовали
белки, соответствующие клонам 59 и 8, но обнаружен белок 50 кД,
соответствующий клону 49. Во всех случаях экспрессия этого белка
была существенно выше в зародышах, чем в клетках каллуса. Тем не
менее молодые листья проростков маниока, полученных из
соматических зародышей, содержат значительное количество этого белка; в
зрелых листьях растений его нет.
Секвенирование генов Dc59 и Dc8 моркови (Franz et al., 1989;
Hatzopoulos et al., 1990) показало, что эти гены начинают экспресси-
роваться на стадии глобулярного зародыша, причем количество белка,
соответствующее гену Dc59, резко возрастает на седьмой день
развития зародыша, а потом плавно снижается вплоть до пятнадцатого дня.
При этом его содержание в период 7—15 дней, соответствующий
глобулярной стадии развития зародыша, очень высоко и
приблизительно в 2—2,5 раза выше, чем содержание белка Dc8, которое плавно
возрастает в течение всего этого периода. Высказано мнение, что
экспрессия этих генов связана непосредственно с последующим
формированием сердечковидного зародыша (Borkird et al., 1988).
Сравнение последовательности ДНК гена Dc59 с
последовательностью гена Dc8 (см. Borkird et al., 1988) выявило несколько районов
гомологии, локализованных в обоих генах на приблизительно
одинаковом расстоянии от сайта начала транскрипции.
Исследование трансактивных факторов и цис-элементов,
вовлеченных в регуляцию гена Dc59, позволило обнаружить два комплекса —
СЗ и С4, которые формируются с трансактивными факторами,
специфически координирующими оба гена, экспрессирующихся в эмбриогенезе
(Hatzopoulos et al., 1990). Два других комплекса, С1 и С2, были
образованы с ДНК-связывающими факторами, которые могут контролировать
экспрессию только гена Dc59.
Ген Dc59 имеет высокую гомологию с геном L-3 белка, связанного
с мембраной липидных тел кукурузы (Vance, Huang, 1987). Эта
гомология ограничивалась гидрофобными районами, найденными в обоих
белках. Оба гена проявляют одинаковую временную и пространствен-
Зародыш
609
ную экспрессию (Vance, Huang, 1988; Hatzopoulos et al., 1990).
Сделан вывод, что полипептид, соответствующий гену Dc59, является
одним из белков липидных тел, как и белок L-3. Участок гена Dc59,
кодирующий гидрофобный участок белка Dc59, гибридизовался с
двумя другими мРНК, присутствующими только в эмбриональных тканях
(Hatzopoulos et al., 1990). Возможно, этот район пронизывает
мембрану липидного тела и поэтому имеет гомологию с другими белками
мембраны липидного тела.
Представляет интерес сравнение программы развития соматических
и зиготических зародышей на примере экспрессии генов Dc8, Dc59.
В случае этих генов программы развития соматических и зиготических
зародышей одинаковы (Borkird et al., 1988). Однако гены Dc8 и
Dc59 экспрессируются в проростках, развивающихся из соматических
зародышей, но не экспрессируются в проростках, полученных из
семян. Это связано с тем, что соматические зародыши при своем
развитии минуют период покоя и развиваются сразу в проростки, тогда
как зиготические зародыши, находящиеся в семенах, обычно перед
прорастанием проходят период покоя. Этот процесс включает
ликвидацию генов, вовлеченных в эмбриогенетические функции, и появление
генов, необходимых для прорастания (Dure et al., 1981; Dasgupta,
Bavley, 1988). По-видимому, экспрессия некоторых эмбриоспецифич-
ных генов в проростках из соматических зародышей обусловлена
отсутствием у них периода покоя.
Крайне интересен тот факт, что анализ генов эмбриоидов моркови
в других исследованиях при помощи иных методов выявил совершенно
другой набор генов, специфически экспрессирующихся на стадиях
глобулы, сердечка и торпеды. Так, исследование генов, специфически
экспрессирующихся в соматическом эмбриогенезе, производили,
используя дифференциальный гибридизационный скрининг библиотеки
кДНК. Б ыла сконструирована библиотека кДНК, представленная
полиА-РНК популяциями из глобулярных, сердечко- и торпедовидных
зародышей. Выявлены специфические транскрипты, количество
которых возрастает в процессе эмбриоидогенеза — кДНК DC3, Dc5 и
Dcl3 (Wilde et al., 1988).
Последовательности РНК, гомологичные кДНК клона DC3,
представлены в большом количестве в ПЭМ, на глобулярной и
торпедовидной стадиях развития зародыша, слабо — в каллусных клетках и
отсутствуют в гипокотиле и листьях. Экспрессия гена Dc5,
представленного двумя транскриптами, возрастает в ПЭМ, глобулярных и
торпедовидных зародышах. Количество транскрипта, соответствующего
клону Dcl3, немного увеличивается на стадии глобулярного зародыша
и более заметно на стадии торпедовидного, а экспрессия в ПЭМ
соответствует экспрессии в глобулярном зародыше. Кроме того, Dcl3
экспрессируется в гипокотиле и листьях. Хотя Dc5 и Dcl3
экспрессируются не только в ПЭМ и эмбриоидах, их экспрессия, вероятно,
специфически регулируется в эмбриогенезе. Специфическая экспрессия
—828
610
Семя
DC3 в ПЭМ, а также в соматических и зиготических зародышах
показала, что этот ген может быть маркером эмбриогенетических
процессов у моркови (Wilde, 1988).
Клон кДНК DC3 был использован для поиска ОСЗ-подобных
последовательностей ДНК из геномной библиотеки ДНК моркови
(Seffens et al., 1990). Основываясь на частоте появления рекомбинантов
бактериофага, числе различных рестрикционных участков, рекомби-
нантных фагов, гибридизирующихся с DC3, и результатах геномного
блот-анализа, было установлено, что DC3 и ЬСЗ-подобные мРНК
кодируются маленьким генным семейством, включающим 4—10
членов.
Для дальнейшего исследования был выбран один представитель
семейства генов DC3-DcG3 и выяснен полный сиквенс геномного
участка, включающего транскрипционный участок DcG3. Анализ различных
генов, составляющих DC3 и ОСЗ-подобное семейство: DcG3, DC3,
Dcl4, Dcl6, показал, что между ними существует гомология, которая
на уровне аминокислот составляет 84—97%, при этом у всех четырех
белков выявлен консенсус-тетрапептид, высококонсервативный (97%)
для каждого из них. По мнению ряда авторов (Seffens et al., 1990),
кодирующие и некодирующие последовательности семейства генов DC3
высоко консервативны вместе с трансактивными факторами,
необходимыми для регуляции их экспрессии.
Наконец, еще один путь исследования белков, контролирующих
соматический эмбриогенез в культуре ткани моркови, заключался в
получении на основе гибридом моноклональных антител к определенным
белкам, в результате чего был выявлен клон 21D7, с помощью
которого во всех пролиферирующих тканях соматического зародыша был
обнаружен полипептид с молекулярной массой 45 кД. Этот полипептид
присутствует также в соматических зародышах других видов растений
(Smith et al., 1988). Он относится к разряду негистоновых ядерных
белков, что позволяет говорить о его возможном участии в регуляции
процесса клеточного деления.
Анализ эмбриоспецифичных генов других растений позволил
выявить гены, экспрессирующиеся в основном в позднем эмбриогенезе.
Описаны мРНК (названные /еа-мРНК, lea — сокращ. от late embryo
abundance), которые накапливались в основном в позднем эмбриогенезе
хлопчатника (Dure et al., 1981, 1983). С помощью метода трансляции in
vitro (Galau et al., 1986) было обнаружено 10 lea -полипептидов,
кодируемых соответственно 10 (из 18) /еа-мРНК. Каждая /ea-мРНК
последовательность составляет 0,04-1,3% от полиА-РНК зрелого зародыша, что
в десятки-сотни раз превышает ее уровень в молодых зародышах или в
проростках. Многие из /ea-мРНК последовательностей транскрибируются
с 1—3 генов из каждого из двух субгеномов хлопчатника, что позволяет
говорить о существовании соответствующих семейств lea-генов. При
помощи гибридизации была найдена некоторая гомология
последовательностей между /ea-мРНК из разных семейств /еа-генов.
S
S
V
S"
и
«
а
S
s
v
и
V
з
я
V
S
е-
S
яг
Щ
В
и
О
S
а
о
Е
<Т)
(в
И!
S
<
It
Н
Ссылки
Время экспрессии в
эмбрио-
и эмбриоидогеиезе
Сведения
о соответствующем
белке
Гомология между
генами
Вид растения
Ген
Franz et al., 1989
Choi et al., 1987
Hatzopoulos et al.,
1990
глобулярная и
торпедовидная стадии
глобулярная и
торпедовидная стадии
глобулярная стадия
66 кД, присутствует в
белковых телах клеток
зародыша, эндосперма
50 кД1
20 кД, белок
липидных тел
гомологичен Dc3 моркови,
D7 хлопчатника,
pLea 76 редьки,
pHVAl ячменя
морковь
Q Q Q
Seffens et al., 1900
Wilde et al., 1988
глобулярная и
торпедовидная стадии
глобулярная и
торпедовидная стадии
торпедовидная стадия
предсказана
аминокислотная
последовательность
соответствующих белков
Dc3 гомологичен
D1 хлопчатника,
pLea76 редьки,
pHVAl ячменя
морковь
о
В)
Е-
U
as
V
S
<и
О "(V4 »*"*■
ил и и « и и
qSqqqq q
Smith et al., 1988
торпедовидная стадия
45 кД, негистоновый
ядерный белок
морковь
21D7
Galau et al., 1987;
Baker et al., 1988
созревание
и
начало
высыхания
Zea-белок
lea-белок
lea-белок
lea-белок
lea-белок
/ea-белок
гомологичен
pHVAl ячменя,
pLea76 редьки,
Dc59 и Dc3
моркови
гомологичен
RAB21 риса
гомологичен
Ет пшеницы
хлопчатник
39*
Ссылки
Время экспрессии в
эмбрио-
и эмбриоидогеиезе
Сведения
о соответствующем
белке
Гомология между
генами
Вид растения
Ген
Harada et al., 1989
поздний эмбриогенез
30 кД, /еа-белок
гомологичен Dc59,
Dei моркови,
pHVAl ячменя,
D7 хлопчатника
редька
pLea 76
Williamson et al., 1985;
Litis et al., 1987
зрелый зародыш
Ят-белок, /еа-белок
гомологичен
D19 хлопчатника
пшеница
Е
Mundy et al., 1989
высыхание
о
<
«о
<3
i
гомологичен
Dll хлопчатника
рис
RAB21
Vance, Huang, 1987
раииий, средний
и поздний эмбриогенез
L-3 белок
фосфолипидного слоя
липидных тел
кукуруза
L-3
Gomez et al., 1988
перед переходом
к периоду покоя
предсказана
аминокислотная
последовательность
кукуруза
аз
О.
Hong et al., 1988
поздний эмбриогенез
22/27 кД белок
алейронового слоя
(/еа-белок)
гомологичен
Dc3, Dc59
моркови,
pLea76 редьки,
D7 хлопчатника
ячмень
2
с
Meinke et al., 1994
поздний эмбриогенез
арабидопсис
LEC1
LEC2
FUS3
ABI3
Зародыш
613
Исследованы клоны кДНК для некоторых lea-генов (Galau et al.,
1987) и определен период высокого уровня экспрессии этих /еа-генов
в эмбриогенезе при помощи дот- и нозерн-блот-анализов. мРНК и
белки соответствующих генов накапливаются в тканях зародыша при
созревании семени и начале его высыхания. Регуляция экспрессии этих
генов происходит на транскрипционном уровне, так как увеличение
уровня белка происходит в результате увеличения уровня
соответствующей мРНК.
Секвенирование 6 клонов: D7, Dll, D29, D21, D19, D34, и анализ
соответствующих аминокислотных последовательностей показали, что
аминокислотный состав lea-белков необычен: 5 из них крайне
гидрофильны, 4 — не содержат цистеин или триптофан и 4 имеют домены
с возможными амфифильными спиральными структурами (Baker et al.,
1988).
Другой подход, представляющий модификацию метода трансляции in
vitro, использован на зародышах кукурузы (Vance, Huang, 1987).
Известно, что в семенах растений запасные липиды упакованы в липидные
тела, содержащие триацилглицероловое «ядро», окруженное фосфолипид-
ным монослоем, содержащим белки. Из четырех мажорных белков,
связанных с липидными телами, был выбран для исследования белок с
наименьшей массой, названный L-3. Клон кДНК L-3 идентифицировали
с помощью гибрид-селективного трансляционного анализа.
Иммунофлуоресцентная микроскопия показала, что аккумуляция белка
L-3 является тканеспецифичной, ограниченной зародышем и
алейроновым слоем в развивающемся семени. Нозерн-блот-анализ показал, что
L-3 мРНК также накапливается в больших количествах в зародыше и
не найдена ни в одной ткани, не относящейся к семени. Уровень L-3
мРНК изменяется в процессе развития семени: на ранних стадиях он
увеличивается, достигая максимума в середине развития, затем медленно
уменьшается до 20% от максимального уровня в зародыше зрелого
семени, а при прорастании весь пул L-3 мРНК стремительно разрушается.
При помощи Саузерн-блот-анализа геномной ДНК кукурузы было
выяснено, что ген L-3 имеет 1—4 копии на гаплоидный геном. Поэтому
можно заключить, что высокий уровень экспрессии гена L-3 в процессе
развития семени не связан с его амплификацией, а регулируется на
уровне транскрипции. При помощи run off транскрипции в
изолированных ядрах зародышей было показано, что изменения в уровнях L-3
мРНК, связанные с развитием зародыша, происходят параллельно
изменениям в транскрипции гена L-3.
Определена нуклеотидная последовательность клона pLea76,
выделенного из библиотеки кДНК редьки. мРНК, соответствующая этому
клону, начинает накапливаться в позднем эмбриогенезе, сохраняется в
сухих семенах и исчезает в ходе прорастания (Harada et al., 1989).
Выделен соответствующий белок 30 кД, имеющий необычную
первичную структуру. Основываясь на характере экспрессии,
соответствующей мРНК и предсказанной последовательности полипептида, авторы
614
Семя
заключили, что мРНК pLea-76 кодируется геном, относящимся к
группе /еа-генов.
Проведено секвенирование клона кДНК, соответствующее гену Ет
в пшенице (Williamson et al., 1985). Этот ген активно экспрессируется
только в зародышах зрелых семян, обусловливая появление
соответствующего £т-белка (Litts et al., 1987).
Подробно исследованы также клоны pHVAl ячменя (Hong et al.,
1988), рМАН9 кукурузы (Gomez et al.,1988), RAB21 риса (Mundy et
al., 1988), которые активно экспрессируются в зародышах, но не могут
тем не менее быть отнесены к специфическим генам эмбриогенеза.
Сравнение белков Lea-класса различных видов. Lea-гены можно
определить как гены, экспрессирующиеся в норме в позднем
эмбриогенезе перед периодом покоя, а также в других ситуациях в ответ на
экзогенную АБК, водный и солевой стрессы. Несмотря на то что
экспрессия /ea-генов и генов запасных белков семени очень сходна
(Thomas, Wilde, 1985; Galau et al., 1987), сделан вывод о том, что
функционирование /еа-генов связано с процессом высыхания семени, а
не с процессом запасания белков. Очевидно, что четких критериев
принадлежности генов к классу /еа-генов пока нет.
Для сравнения различных /еа-генов (Dure et al., 1989) были
использованы шесть последовательностей ДНК хлопчатника (Baker et
al., 1988), две — моркови (Seffens, 1989; Franz et al., 1989) и по
одной — ячменя (Hong et al., 1988), риса (Mundy et al., 1988),
редьки (Harada et al., 1989) и пшеницы (Williamson et al., 1985).
Аминокислотные последовательности этих /еа-белков сравнивали при
помощи gom-матричного анализа и компьютерной программы DSAS2,
созданной J. Neigel. Показано, что исследуемые последовательности
можно разделить на три группы по районам высокой гомологии между
белками: Leal9 хлопчатника и Ет пшеницы; Leall хлопчатника и
RAB21 риса; Lea7 хлопчатника и /еа-белки из ячменя, редьки и два
белка моркови, соответствующие генам Dc59 и DC3.
Районы гомологии между /еа-белками группы 3 включают повторы
в 11 аминокислот, которые, "возможно, существуют в виде а-спиралей,
поверхность которых обладает амфифильными свойствами.
Предполагают, что именно филогенетические домены lea -пептидов могут выполнять
функцию защиты клеточных структур в процессе высыхания семян,
однако механизм этой защиты пока неизвестен. Отмечают, что /еа-белки
являются частью системы ответа на засуховый стресс, который является
нормальным фактором формирования семени, но опасен для других фаз
жизненного цикла растений. Авторы предлагают называть их в связи
с этим WSP (water stress proteins — белки водного стресса) по аналогии
с HSP (heat shock proteins — белки теплового шока).
Подводя итоги всему вышесказанному, нельзя не задаться
вопросом, каким образом к /еа-классу оказались отнесены два гена моркови
Dc59 и Dc3, которые изначально были выделены как гены,
экспрессирующиеся на более ранних стадиях эмбриогенеза моркови (глобуляр-
Зародыш
615
ной, сердечковидной, торпедовидной) в отличие от всех остальных
описанных генов, действительно экспрессирующихся в позднем
эмбриогенезе и перед периодом покоя. Отнесение этих генов к /еа-классу
явно противоречит их специфической роли в процессе перехода от
одной стадии раннего эмбриогенеза к другой, о чем сообщалось в
первых работах, посвященных этим генам (см. выше).
Влияние АБК на экспрессию /еа-генов. Помимо секвенирования
генов, анализа аминокислотной последовательности соответствующих
белков практически во всех упомянутых работах проводилось
исследование роли АБК в экспрессии генов. Отмечалось, что АБК
регулирует экспрессию описанных выше специфических генов в зародышах
моркови, редьки, хлопчатника, сои, пшеницы, риса, ячменя, кукурузы
и других (Dougherty, Hiebert, 1980; Quatrano, 1986; Litts et al., 1987;
Hatzopoulos et al., 1990). Регуляция может осуществляться на уровне
транскрипции, трансляции или в результате одновременной индукции
этих двух процессов. Во всех описанных случаях АБК индуцировала
или активировала работу соответствующих генов, а не ингибировала
их.
Использование мутантных зародышей для выявления эмбриоспе-
цифичных генов. Генетический контроль эмбриогенеза у высших
растений был исследован при помощи выделения и характеристики
мутантов развития.
Наиболее обширные исследования были проведены с дефектными
зерновками (dek) мутанта кукурузы (Sheridan, Clark, 1987) и эмбрио-
летальными (emb) мутантами арабидопсиса (Meinke, 1986).
В этом случае для скрининга используют так называемый метод
(А* — D*), при котором растения одновременно скринируются по фе-
нотипическому маркеру и по эмбриолетальности. Он требует
небольшого количества растений и может быть использован для определения
сцепления генов и процента рекомбинации одновременно (Servitova,
Cetl, 1984). При помощи этого подхода было, например,
продемонстрировано, что локус «сросшиеся семядоли/отсутствие корней»
(мутант етЬЗО, 112А) тесно связан с локусом «искривленные трихомы»
(мутант disl) на хромосоме 1, а также была определена локализация
мутации bio/ на хромосоме 5 (Meinke et al., 1989).
Наиболее перспективным подходом к молекулярно-генетическому
анализу эмбриолеталей у арабидопсиса является клонирование генов
путем «прогулки по хромосоме» от близлежащего RELP-сайта (Меуе-
rowitz, 1987), с помощью чего уже произведено картирование
хромосомной локализации наиболее интересных мутантных генов.
Многообещающим подходом в молекулярной генетике растений (при
исследовании эмбриогенеза, в частности) является трансформация
растений с помощью Agrobacterium tumefaciens, с последующим выявлением
генов, затронутых мутацией, вызванной вставкой Т-ДНК. Выявленные
гены затем клонируют и определяют их последовательность. Этот
подход для арабидопсиса описан в работе Feldmann et al. (1989). Несмотря
616
Семя
на то, что геном моркови менее удобен для получения мутантов при
помощи Agrobacterium ввиду наличия в нем большого количества не-
смысловых последовательностей, есть успешные работы по
трансформации гипокотиля моркови при помощи Agrobacterium (Thomas et al.,
1989).
Возможности трансформации в сочетании с исследованиями
соматического эмбриогенеза дают очень важный ключ к пониманию генной
регуляции эмбриогенеза у растений. Очень интересная работа была
выполнена с термочувствительной мутантной линией клеток моркови
(ts59) (Lo Schiavo et al., 1988). Клетки этой линии при температуре
24°С и соответствующих условиях культивирования развиваются в
эмбриоиды с последующим формированием из них проростков, тогда
как при температуре развитие соматических зародышей
блокируется на глобулярной стадии.
Варьирование интервала, в течение которого эмбриогенные клетки
выдерживались при температуре 32°С, показало, что наиболее
значимым для дальнейшего развития является период 5 —10 дней (после
переноса эмбриогенной клеточной фракции на среду без ауксина),
когда происходит дифференциация ПЭМ в глобулярные эмбриоиды. В
этом случае подавляется развитие почти 100% эмбриоидов.
Второй период, в течение которого температура 32°С сильно
подавляет эмбриоидогенез, соответствует переходу от сердечковидной стадии
к торпедовидной. В этом случае влияние температуры несколько
меньше — эмбриоидогенез блокируется в 80—90 /о случаев. Эта работа,
без сомнения, очень важна для выделения критических периодов в
соматическом эмбриогенезе моркови, а также для установления ранга
биологической значимости критических периодов (Lo Schiavo et al.,
1988).
В прилагаемой таблице представлен список эмбриоспецифичных
генов, обсуждаемых в данной статье.
Baker et al., 1988; Borkird et al., 1988; Choi et al., 1987; Choi, Sung, 1984;
Davidson, 1986; Dresselhaus et al., 1992, 1996; Dure III, Chlan, 1981; Dure III,
Galan, 1981; Dure III et al., 1981, 1983, 1989; Feldmann et al., 1989; Fienberg et
al., 1984; Franz et al., 1989; Galau, Hughes, 1987; Galau et al., 1986, 1987; Gomez
et al., 1988; Guiliano et al., 1983; Halperin, 1966; Harada et al., 1989; Hari, 1980;
Hatzopoulos et al., 1990; Hong et al., 1988; Kohler, Wenzel, 1985; Litts et al., 1987;
Lo Schiavo et al., 1988; Meinke, 1986; Meinke et al., 1989, 1994; Meyerowitz, 1987;
Mundy, Chua, 1988; Nomura, Komamine, 1985, 1986; Quatrano, 1986; Satoh et al.,
1986; Seffens et al., 1990; Servitova, Cetl, 1984; Smith, Sung, 1985; Smith et al.,
1988; Sung, Okimoto, 1981, 1983; Thomas J. et al., 1989; Thomas Т., Wilde, 1985;
Tran Thanh Van et al., 1985; Vance, Huang, 1987, 1988; Vries et al., 1988a, b;
Wilde et al., 1988; Williamson et al., 1985.
Зародыш
617
ПОЛЯРНОСТЬ И ЭМБРИОГЕНЕЗ
ПОЛЯРНОСТЬ, т. е. осевая (аксиальная) организация растительного
организма, является одним из наиболее существенных элементов его
целостности. Осевая симметрия является тем принципом, на основе
которого создается специфическая трехмерная структура организма,
осуществляется ориентация растения в пространстве, обеспечивается
координация функций и адекватная реакция на различные
раздражители (Медведев, 1996). Процессам поляризации клеток и тканей при
морфогенезе принадлежит определяющая роль, поскольку возникающие
при этом градиенты морфогенетических факторов служат основой для
дифференциальной активности генома на различных этапах развития
растений.
У растений при формировании физиологической оси полярности
наиболее существенное значение имеет взаимодействие по крайней мере
трех факторов — процесса активного базипетального транспорта фи-
тогормона ауксина (ИУК), градиентов биоэлектрических потенциалов
(БЭП), а также градиентов ионов кальция, создающихся за счет
полярных потоков этого катиона (Медведев и др., 1989а, б, 1991;
Медведев, 1990, 1996; Medvedev, 1994). Выяснение принципов
формирования и взаимодействия этих градиентов в растениях позволяет
понять механизмы не только полярного роста и тропизмов, но также
аттрагирующего эффекта фитогормонов, апикального доминирования,
донорно-акцепторных отношений, регенерации, эмбриогенеза и
морфогенеза в целом.
В индукции дифференциации первым шагом является поляризация
объекта, которая может быть инициирована как с помощью
физических, так и химических воздействий (факторы внешней среды, а также
сигналы и процессы, возникающие в самом организме). Отличительной
особенностью поляризующих воздействий является их векторный,
направленный характер. При этом принципиальное значение имеют и тип
поляризующего воздействия, и его количественные параметры.
Наиболее выраженным поляризующим внешним фактором является
гравитация, поскольку направление и величина гравитационного стимула
в каждой конкретной точке пространства не меняется во времени,
сопровождая растения в течение всего их онтогенеза (Меркис, 1976, 1990).
Поэтому естественно, что растения сформировали тонкие механизмы,
благодаря которым они могут контролировать и корректировать
положение своего тела относительно вектора силы тяжести, создавая новые
оси полярности.
Еще одним существенным фактором внешней среды, определяющим
жизнедеятельность растительного организма, является свет. Процессы
фотосинтеза, фотоморфогенеза и фототропическая реакция связаны с
618
Семя
поглощением света специальными структурами (рецепторы, пигменты,
белки) различных участков электромагнитного спектра (Волотовский,
1992). Векторное воздействие света имеет наиболее важное значение
при фототропизме, фотоморфогенезе, а также индукции дифференциации
зиготы у некоторых водорослей (Schafer, Haupt, 1983). На ранних
этапах развития у растения, по-видимому, происходит формирование
аксиальных световых градиентов вдоль надземной части и корневой
системы, поскольку растительные клетки и ткани могут выполнять роль
световодов. При этом, вследствие интенсивного поглощения тканями
надземной части высокоэнергетической части спектра, корневая система
нередко оказывается под воздействием красных или дальних красных
лучей.
В естественных условиях растительные организмы чаще всего
находятся под воздействием сразу нескольких поляризующих факторов
внешней среды. Обычно при совпадении направления света и
гравитационного стимула изгиб в латеральном направлении усиливался. Если
свет и гравитация действовали в противоположных направлениях,
обнаруживался антагонистический характер взаимодействия этих
факторов (Mirza, 1987). При сравнении фототропической реакции у зеленых
и этиолированных растений оказалось, что при этиоляции
доминирующей становится гравитропическая реакция. При зеленении проростков,
несмотря на возрастание способности к гравитации, фототропическая
реакция возрастает еще в большей степени, настолько, что
фотостимуляция подавляет или даже обращает гравитропический изгиб (Hart,
McDonald, 1981).
У большинства растений наблюдается полярный характер
распределения клеток в зародышевом мешке вдоль микропилярно-халазальной
оси. Яйцеклетка и синергиды располагаются вблизи микропиле, а клетки-
антиподы находятся у халазального полюса (Магешвари, 1954; Под-
дубная-Арнольди, 1976; Полевой, Саламатова, 1991; West, Harada,
1993). Поэтому уже в зародышевом мешке яйцеклетка может быть
поляризована вдоль оси микропиле-халаза. Поляризация является основой
и для всех последующих этапов эмбриогенеза. В зиготе многих видов
растений удалось обнаружить полярность распределения пластид,
митохондрий и эндоплазматического ретикулума в аксиальном направлении
(West, Harada, 1993). Поэтому при поперечном делении поляризованной
зиготы образующиеся клетки зародыша имеют цитоплазму с различным
составом органелл. Показано, например, что у злаков, существует
жесткая поляризация формирующегося зародыша, поскольку семязачаток и
зародышевый мешок исходно асимметричны, биполярны (Батыгина,
1974; 1987; 1993; Esau, 1977). В семенной кожуре, эндосперме и
частично в самом зародыше Haemanthus katherinae возникают градиенты
осмотической величины, нередуцирующих Сахаров и аминного азота в
направлении халаза—микропиле (Ryczkowski, 1980).
В ходе дифференциации соматических зародышей моркови по мере
перехода к сердечковидной и торпедовидной стадиям обнаруживаются
Зародыш
619
специфические белки: одни локализованы в базальной части зародыша,
другие — в апикальной (Schiavone, Racusen, 1989). Эти полярно
локализованные белки, вероятно, могут задавать градиент
морфогенеза, поскольку при экспериментальном разделении эмбриоида новые
корни формируются только в апикальной части зародыша. У зародыша
хлопчатника апикальная клетка содержит больше пластид и
митохондрий, в то время как базальная клетка более вакуолизирована. Однако
у ряда растений (лотосовые, орхидные, паразитные растения и др.) в
процессе эволюции в эмбриогенезе может происходить утрата
«первичной» биполярности и переход к монополярности (Батыгина, 1993).
При дальнейшем развитии этих структур возникает вторичная бипо-
лярность, но уже на другой основе, в процессе формирования
адвентивных структур. Поэтому целостная картина морфогенеза может быть
получена только при анализе всего цикла развития, включающего как
раннюю полярную дифференциацию, так и последующие
морфологические изменения вдоль главной оси организма.
В качестве моделей для изучения ранних этапов роста и
дифференциации могут служить прорастающие зиготы водорослей, таких, как
Fucus и Pelvetia (Sinnot, 1960; Bentrup, 1984; Goodner, Quatrano, 1993).
Неоплодотворенные яйцеклетки радиально симметричны. После
оплодотворения зигота опускается на дно и через 12—24 ч при нормальных
условиях на ее нижней стороне образуется ризоидальный выступ. Первое
деление происходит в плоскости, перпендикулярной оси выступа.
Возникающие при этом две дочерние клетки (ризоидная и талломная) сильно
различаются по строению и характеру дальнейшего развития. Уже при
первом делении зиготы формируется постоянная ось полярности
будущего организма. Поляризацию зиготы можно индуцировать и
экспериментально: односторонним освещением, дополнительными
гравитационными воздействиями, градиентами фитогормонов и некоторых ионов (К+,
Н+, Са2+), электрическим полем и рядом других воздействий.
Способность к поляризации в определенной степени видоспецифична. Так, для
зиготы Fucus, прорастающей на сравнительно небольшой глубине,
важным фактором поляризации является свет, тогда как в яйцеклетке Cys-
tosira barbata, родственной Fucus, но развивающейся в темноте, ризоид
возникает в месте проникновения сперматозоида (Sinnott, 1960;
Robinson, Jaffe, 1975; Robinson, McCaig, 1980; Bentrup, 1984).
Градиенты биоэлектрических потенциалов. В процессе
дифференциации зиготы и зародыша, а также в ходе ризогенеза возникают
«эмбриональные» электрические токи, формируется специфический
рисунок силовых линий, указывающий на точки с максимальной
скоростью роста и зоны закладки будущих органов растения.
Важным условием для понимания процессов поляризации клеток
явилось открытие трансцеллюлярных ионных потоков (Jaffe, 1980). У
растительных клеток, характеризующихся полярным типом роста (зигота,
прорастающая пыльца, корневые волоски, ризоиды и т.п.),
регистрируются электрические токи (движение положительных зарядов), входящие
620
Семя
в растущие и выходящие из закончивших рост участков клетки (Jaffe
et al., 1975; Weisenseel et al., 1975, 1979; Jaffe, Nuccitelli, 1977;
Robinson, 1977; Quatrano, 1978; Brawley et al., 1984). Эти электрические
токи, как правило, предшествуют морфологическим изменениям и
связаны с такими носителями зарядов, как ионы Са2+, К+ и Н+.
Так, у бурой водоросли Pelvetia (через 30 мин после
оплодотворения) происходит «электрическая» поляризация зиготы и появляется
трансцитоплазматический ток, входящий в область будущего ризоида
и выходящий с противоположной, талломной стороны. Причем
наибольшая плотность тока регистрировалась в области наиболее
интенсивно растущего ризоидного полюса (Nuccitelli, Jaffe, 1975, 1976).
Аналогичные петли электрического тока были обнаружены в ходе
развития зародыша (Brawley et al., 1984; Goldsworthy, Rathore, 1985).
Вокруг дифференцирующихся эмбриоидов дикой моркови уже на
глобулярной стадии регистрируется электрическое поле со
специфическим рисунком силовых линий, который сохраняется на протяжении
всего его развития (Brawley et al., 1984). Наибольшая плотность
входящего тока регистрировалась на апикальном полюсе в зонах
формирующихся семядолей. Максимум выходящего тока был приурочен к
области закладки апикальной меристемы корня. При этом плотность
электрического тока в вышеуказанных зонах на каждой новой стадии
развития зародыша возрастала. В аналогичных исследованиях
эмбриоидов, полученных в каллусной культуре табака и суспензионной
культуре клеток моркови, помимо электрического градиента между
формирующимися семядолями и корнем было также обнаружено появление
градиента рН вдоль оси эмбриоида (Goldsworthy, Rathore, 1985;
Goldsworthy, 1986; Rathore et al., 1988; Rathore, Robinson, 1989).
При изучении процесса формирования корневой системы в растениях
пшеницы, овса, фасоли, гороха и картофеля зарегистрированы
электрические токи, входящие в апикальную меристему главного корня и
зону растяжения и выходящие из зоны зрелых, закончивших рост
клеток (Ezaki et al., 1988a,b; Miller, Gow, 1989a, b; Toko et al.,
1989).
Полярный транспорт ИУК. Эндогенные градиенты
биоэлектрических потенциалов, по-видимому, в первую очередь оказывают влияние на
распределение в растительных тканях фитогормонов (Медведев и др.,
1980; Med vedev, Markova, 1990). Обеспеченность тканей фитогормонами
имеет определяющее значение в процессе эмбриогенеза. Например, при
переходе каллуса к образованию эмбриоида в нем возрастает количество
эндогенных ИУК и АБК. В тканях неэмбриогенного каллуса в два раза
больше, чем в эмбриогенном, накапливается цитокининов (Rajasenkaran et
al., 1987). По-видимому, именно с электрической поляризацией связан
полярный характер транспорта ауксина, обнаруженный в зародышах
фасоли и клена (Fry, Wangermann, 1976).
Процесс активного полярного транспорта ИУК необходим для
эмбриогенеза, вероятно, уже с глобулярной стадии, поскольку ингибиторы
Зародыш
621
транспорта ауксина подавляли переход к сердечковидной стадии
развития зародыша (West, Harada, 1993). Было установлено, что
внешнее электрическое поле способно оказывать влияние на процесс
активного базипетального транспорта и экзогенной С-ИУК и эндогенного
ауксина (Medvedev, Markova, 1990). Причем в обоих случаях
пропускание через растительную ткань электрического тока стимулирует
транспорт ИУК в направлении отрицательно заряженного электрода, что не
может быть объяснено в рамках теории тропизмов Холодного-Вента.
Нами было высказано предположение о том, что и нативные, и
приложенные извне электрические градиенты способны влиять на работу
мембранных белков — переносчиков ауксина, изменяя их активность или
локализацию в плазматической мембране, что в итоге и является истинной
причиной изменения параметров активного базипетального транспорта
ИУК (Медведев и др., 1986; Medvedev, Markova, 1990). При анализе
распределения С-ИУК вдоль отрезков молодых побегов Impatiens
sultani был обнаружен четкий градиент ИУК (Warren Wilson et al.,
1988a, b). Концентрация гормона двукратно возрастала на каждый
миллиметр в базальном направлении. При этом наблюдалось активное
образование адвентивных корней и формирование отделительного слоя.
Авторы приходят к выводу, что именно градиент концентрации ауксина
является необходимым условием для инициации отделительного слоя.
Тот факт, что зачатки адвентивных корней формируются, как правило,
на внешней стороне изгиба корня (Warren Wilson, 1978), свидетельствует
о важности для ризогенеза не только аксиального, но также и
латерального градиента ИУК.
Полярные потоки и градиенты ионов кальция. В растительных
тканях помимо полярного базипетального транспорта ИУК обнаружены
акропетально направленные потоки ионов Са . Активные полярные
потоки ионов кальция, вероятно, необходимы для формирования градиентов
этого катиона в первую очередь в клетках и тканях с поляризованным
типом роста, а также в тканях с несформировавшейся сосудистой
системой, при отсутствии транспирации, в тропизмах. Полярное передвижение
кальция зарегистрировано у отрезков гипокотилей подсолнечника
(Guzman, Fuente, 1984, 1986), молодых плодов томатов и черешков салата
(Banuelos et al., 1987, 1988), колеоптилей кукурузы и междоузлий гороха
(Медведев и др., 1989а, б). Overvoorde и Grimes (1994) изучали роль
ионов Са + и кальмодулина в соматическом эмбриогенезе моркови. Было
установлено, что для формирования эмбриоидов необходимо присутствие
кальция в среде в концентрации не ниже 200 мкМ. С помощью
флюоресцентных зондов обнаружено, что на сердечковидной и торпедовидной
стадиях уровень Са-кальмодулинового комплекса повышается в зонах
формирующихся семядолей и корня. Обработка блокаторами Са-каналов
верапамилом и нифедипином, а также Са-ионофором А23187 угнетала
развитие эмбриоидов. То есть для нормального эмбриогенеза необходим
определенный градиент ионов Са + на плазматической мембране
развивающихся клеток.
622
Семя
Ионы Са являются обязательным фактором в процессе
поляризации. При этом важное значение имеет соотношение уровня кальция в
апопласте и цитоплазме, функционирование мембранных систем
транспорта кальция, клеточные и тканевые градиенты этого катиона,
участие ионов Са в работе системы вторичных посредников. В опытах
Tirlapur et al. (1993) анализировался характер распределения мембран-
носвязанного кальция и кальмодулина в зародышевых мешках петунии
и табака с помощью флюоресцентных зондов хлортетрациклина и флю-
офеназина. Оказалось, что в период формирования зародышевого мешка
кальций и кальмодулин концентрируются в синергидах и центральной
клетке, тогда как в яйцеклетке и антиподах содержание ионов Са было
ниже. В синергидах обнаружен аксиальный градиент распределения
кальция, возрастающий по направлению к микропилярному концу
зародышевого мешка. Позже при созревании зародышевого мешка петунии
повышенное содержание кальция регистрируется только в одной из синергид
и в яйцеклетке.
Формирование полярных потоков ионов Са2+ в растительных
тканях, очевидно, происходит за счет согласованного функционирования
Са-каналов и Са-АТФаз (Медведев, Штонда, 1989; Медведев и
др., 19896; Medvedev, 1994; Маркова и др., 1995). Инициация
морфогенеза у растений начинается, по-видимому, в первую очередь
с формирования полярных потоков ионов Са2+, которые создают
электрическую ось полярности и влияют на распределение в тканях
фитогормонов. Таким образом, вероятно, именно кальций несет
первичную информацию о возникающем векторе поляризации. Вслед за
появлением градиента ионов кальция в клетке формируются градиенты
активности кальций-кальмодулиновой системы, систем других мессенд-
жеров и в конечном итоге активности многочисленных ферментов. Таким
путем может происходить становление вторичных градиентов:
секреторных, мембранных, метаболических и прочих. И наконец, чувствительные
к изменению активности ионов Са2+ элементы цитоскелета завершают
структурную поляризацию клетки.
Цитоскелет. Носителем информации о пространственной
организации и будущем развитии яйцеклетки служит ее цитоархитектоника,
особенно те участки цитоскелета, которые ассоциированы с
плазматической мембраной (Исаева, 1994). Обработка цитохалазином,
подавляя полимеризацию и функционирование актиновых филаментов,
нарушает нормальную ориентацию кортикального цитоскелета, например, у
яиц морского ежа и яйцеклеток водоросли Pelvetia wrightii, вызывая
появление амебоидности протопласта и неестественных форм этих
организмов. При этом в первую очередь нарушается поляризация и
яйцеклетки, и зародыша (Исаева, 1990, 1994). Анализ действия ци-
тохалазина на дифференцировку зигот Fucus и Pelvetia показывает,
что фибриллярному актину принадлежит ключевая роль в процессах
поляризации клетки, в поддержании осевой анизотропии ее
морфогенеза (Исаева, 1994). Комплекс актина с актинсвязывающими белками,
Зародыш
623
вероятно, осуществляет механохимическую фиксацию содержимого
цитоплазмы, в том числе и носителей морфогенетической информации,
что может оказывать определяющее влияние на пространственную
детерминацию дифференциальной активности генома не только в
процессе эмбриогенеза, но также и в ходе дальнейшего развития организма
(Davidson, 1986, 1994).
Наиболее важными факторами, влияющими на организацию
кортикальных микротрубочек, являются ионы Са , гормоны и градиенты
БЭП (Hush, Overall, 1991; Warren Wilson et al., 1991; Shibaoka, 1991;
1993). Концентрация ионов Са2+ в цитоплазме и рН имеют важное
значение в процессах сборки (и разборки) актиновых и промежуточных
филаментов, а также тубулина. Warren Wilson J. и Warren Wilson P.
(1993) обращают внимание на то, что элементы флоэмы, ксилемы и
трахеид ориентируются, как правило, параллельно потоку ауксина. Они
предполагают, что полярный транспорт ауксина способен индуцировать
поперечную ориентацию микротрубочек по отношению к главной оси
клетки; это, в свою очередь, приводит к регулярному расположению
целлюлозных микрофибрилл и далее к аксиальной ориентации клеток. Слабые
электрические поля (1 мВ на клетку) вызывают переориентацию
кортикальных микротрубочек, направление которых становится
перпендикулярным приложенному полю (Hush, Overall, 1991). У поляризованных
клеток асимметрия комплекса плазмалемма-цитоскелет, связанная с
асимметричным распределением ионных каналов и ионных насосов
мембраны, проявляется, соответственно, в векторизации ионного
транспорта (Hopkins, 1991) и генерации электрических градиентов (Aimers,
Stirling, 1984). Вероятно, поэтому цитохалазины полностью, но
обратимо подавляют электрофизиологическую поляризацию зиготы (Braw-
ley, Robinson, 1985).
Осцилляции. Инициацию морфогенеза можно вызвать многими, чаще
всего стрессовыми, воздействиями. При этом ответная реакция, как
правило, развивается не линейно, а в колебательном режиме. В большинстве
случаев стрессовые воздействия (внутренние и внешние) инициируют
осцилляции электрофизиологических характеристик растительных тканей.
Поэтому волновые явления играют важную роль в процессах роста,
морфогенеза и регенерации у растительных организмов. Например, в
процессе регенерации зонтика водоросли Acetabularia наблюдаются
электрические волны, распространяющиеся вверх по растению со скоростью около
400 мкм/с (Коф, Кефели, 1994). В основе многих волновых явлений
лежат химические процессы, промежуточные ингредиенты которых могут
меняться автоколебательно. Одним из таких примеров являются колебания
концентрации ионов (К, Са, Na, Mg и др.) в развивающемся эндосперме
(Ryczkowski, Reczynski, 1988) и ионизированного кальция в цитозоле.
Так, после проникновения сперматозоида в яйцеклетку в точке
проникновения сперматозоида возникает кальциевая волна, распространяющаяся
по цитоплазме (Tsien R.W., Tsien R.Y., 1990; Gillot, Whitaker, 1993;
Miyazaki et al., 1993).
624
Семя
В наших опытах было показано, что процесс полярного
передвижения ионов Са2+ у отрезков колеоптилей кукурузы в аксиальном
направлении шел в импульсном, колебательном режиме (Медведев,
1996). Следует отметить, что ритмичность полярного транспорта
кальция совпадала с характеристиками импульсного полярного
передвижения ИУК по камбию у древесных растений, обнаруженного
Wod zicki и Zajaczkowski (1989). Поскольку снабжение растительных
тканей ауксином осуществляется в ритмичном режиме, авторы полагают,
что и регуляция ИУК ростовых процессов в растениях осуществляется также
на волновой, импульсной основе. Подтверждением этому могут
служить данные Kristie и Jolliffe (1986), зарегистрировавших
10-минутные осцилляции скорости роста у проростков горчицы. Как видно из
этих примеров, не собственно концентрация морфогена, а характер его
осцилляции является носителем морфогенетической информации.
Батыгина, 1987, 1993; Волотовский, 1992; Исаева, 1990, 1994; Коф, Кефели, 1994;
Маркова и др., 1995; Медведев, 1990, 1996; Медведев, Штонда, 1989; Медведев и
др., 1980, 1986, 1989а,б, 1991; Меркис, 1976, 1990; Поддубная-Арнольди, 1964;
Полевой, Саламатова, 1991; Aimers, Stirling, 1984; Banuelos et al., 1987, 1988; Bentrup,
1984; Brawley, Robinson, 1985; Brawley et al., 1984; Davidson, 1986, 1994; Ezaki et al.,
1988; Fry, Wangermann, 1976; Gillot, Whitaker, 1993; Goldsworthy, 1986; Goldsworthy,
Rathore, 1985; Goodner, Quatrano, 1993; Guzman, 1984, 1984; Hart, Macdonald, 1981;
Hopkins, 1991; Hush, Overall, 1991; Jaffe, 1980; Jaffe, Nuccitelli, 1977; Jaffe et al., 1975;
Kristie, Jolliffe, 1986; Medvedev, 1994; Medvedev, Markova, 1990; Miller, Gow, 1989a,b;
Mirza, 1987; Miyazaki et al., 1993; Nuccitelli, Jaffe, 1975, 1976; Overvoorde, Grimes,
1994; Quatrano, 1978; Rajasekaran et al., 1987; Rathore et al., 1988; Rathore, Robinson,
1989; Robinson, 1977; Robinson, Jaffe, 1975; Robinson, Mc Caid, 1980; Ryczkowski,
1980; Ryczkowski, Reczynski, 1988; Schafer, Haupt, 1983; Schiavone, Racusen, 1989;
Shibaoka, 1991, 1993; Sinnott, 1960; Tirlapur et al., 1993; Toko et al., 1989; Tsien R.W.,
Tsien R.Y., 1990; Warren Wilson, 1978; Warren Wilson et al., 1988a,b, 1991; Warren
Wilson J., Warren Wilson P., 1993; Weisenseel et al., 1975, 1979; West, Harada, 1993;
Wodzicki, Zajaczkowski, 1988.
ЭМБРИОИДОГЕНИЯ
ЭМБРИОИД (греч. embruon — зародыш, oidos — вид) — зачаток
индивидуума, образующийся асексуально in situ, in vivo и in vitro.
Эмбриоиду так же, как и половому зародышу, свойственна биполярная,
организация на всех стадиях его формирования. Синонимы:
соматический зародыш, зародышеподобная структура, адвентивный зародыш.
Впервые термин «эмбриоид» был предложен Vasil и Hildebrandt
(1966) для зародышеподобных структур, образующихся в культуре
in vitro, а также для зародышей, образующихся в процессе бесполого
(нуцеллярных) и вегетативного (фолиарных) размножения. Haccius,
Lakshmanan (1969), Haccius (1971) впервые обсудили вопрос о
Зародыш
625
понятии «эмбриоид» и его критериях. Они пришли к заключению,
что этот термин может быть применен ко всем образованиям,
включая «адвентивные» (не половые) зародыши, для которых характерен
закрытый радикулярный полюс, расположенный напротив стеблевого,
а также для зародышеподобных структур в культуре in vitro.
Эмбриоид формируется экзогенно или эндогенно, обычно из одной
соматической клетки, реже из эмбрионального клеточного комплекса,
в условиях гомофазной репродукции (т. е. в отсутствие мейоза и
оплодотворения).
Для эмбриоида характерно образование новой оси, соединяющей
полярно формирующиеся апексы побега и корня. Как правило, он не
имеет общей васкуляриой системы с материнским организмом
(закрытый радикулярный полюс). Генезис эмбриоида так же, как его
форма и размеры, таксоноспецифичны. Эмбриоиду присущи
основные признаки, которые установлены для половых зародышей
(полярность, клеточная и гистогенная дифференциация, автономность и др.).
При прорастании эмбриоида сразу же «рождается» новая особь
(Batygina, 1989a,b; Батыгина, 1987, 1993), причем у некоторых видов
отмечена кратковременная связь с материнским организмом.
Продолжительность контакта и стадия развития эмбриоида, на которой
этот контакт осуществляется, различны у разных видов растений.
Почка, с которой часто путают соматический зародыш, является мо-
нополярно развивающейся структурой, и только в процессе дальнейшей
регенерации она преобразуется в биполярную структуру, дающую
новый индивидуум.
В свете новой концепции о способах и типах воспроизведения и
размножения цветковых растений (Батыгина, 1978—1995) эмбриоид
рассматривается как элементарная структурная единица, лежащая в
основе эмбриоидогенного типа бесполого размножения (см.
Эмбриоидогения). Установлено, что на всех этапах онтогенеза, начиная
с зиготы, у цветковых растений имеется тенденция к бесполому
размножению путем образования соматических зародышей.
Эмбриоиды могут возникать в естественных условиях на разных
структурах и органах: на базе зиготы и зародыша (монозиготи-
ческая эмбриоидогения, например, у Paeonia, Triticum, Zea и
представителей сем. Orchidaceae), из клеток нуцеллуса (нуцеллярная
эмбриоидогения, например, у Citrus, некоторых видов Роа,
Orchidaceae), интегумента (интегументальная эмбриоидогения,
например, у Allium), листа (фолиарная эмбриоидогения, например, у
Bryophyllum, Hammarbia palludosa), стебля (каулигенная
эмбриоидогения, например, у Ranunculus) и корня (ризогенная
эмбриоидогения).
У одних таксонов (например, Paeonia) процесс образования
соматического зародыша вместо полового в семени закреплен в процессе
эволюции (см. Paeoniad-тип). У других (например, Eranthis —
Haccius, 1965) реализация эмбриоидогенного пути морфогенеза проис-
40-828
626
Семя
ходит только в стрессовых ситуациях. Встречаются случаи, когда у
одного и того же таксона образование эмбриоидов может протекать
параллельно половому процессу, т. е. формированию полового
зародыша (например, Bryophyllum daigremontianum, В. calycinum).
Основным тезисом концепции об эмбриоидогении является универсальность
процессов морфогенеза эмбриоидов, имеющих место как в
естественных условиях, так и эксперименте, в культуре in vitro.
Блестящей иллюстрацией развития эмбриоида в естественных
условиях является его формирование в семени пиона. Генезис эмбриоида
идет в соответствии с Репаеа-вариацией Asterad-типа эмбриогенеза
(Брюхин, 1993; Brukhin, Batygina, 1994). Апикальная и базальная
клетки принимают почти одинаковое участие в построении зародыша.
Сходно развивается соматический зародыш пиона и в культуре in vitro
(подробнее см. Paeoniad-тип; Эмбриогенез пионовых).
У Ranunculus sceleratus развитие эмбриоида в культуре in vitro и
полового зародыша в семени протекает также по типу Asterad (Konar,
Nataraja, 1965; Konar et al., 1972).
Нарушения закономерностей развития эмбриоида, как и полового
зародыша, могут происходить на любом этапе его формирования
и затрагивают как первые деления в эмбриоиде, так и его
органогенез. Это часто приводит к аномалиям развития эмбриоида, а также
проростка и взрослого растения, как in situ, так и in vitro.
Так, анализ развития эмбриоидов в культуре тканей Aconitum he-
terophyllum (Ranunculaceae) (Ahuja, Титова, Батыгина, ориг. данные)
показал большое сходство в развитии эмбриоидов и половых
зародышей этого'растения. Эмбриоиды образуются из единичных
инициальных клеток каллуса и проходят все основные стадии, свойственные
развитию половых зародышей (квадрантов, октантов), — глобулярную,
сердечковидную и торпедовидную. В целом эмбриоидогенез A. hetero-
phyllum протекает в соответствии с Onagrad-типом эмбриогенеза,
характерным для сем. Ranunculaceae (Соколовская, 1981). Следует
отметить наличие в эмбриоиде хорошо дифференцированного суспензора.
В условиях проводимого эксперимента были выявлены аномалии в
развитии эмбриоидов, наиболее частая из которых —
преждевременная дифференциация элементов ксилемы на стадии сердечковидного
зародыша. Отмеченная аномалия существенно снижает выход регене-
рантов и, по-видимому, связана с нарушением баланса углеводов и
гормонов в среде и каллусной ткани.
Аналогичная картина наблюдалась в культуре каллуса, полученного
из незрелых зародышей Triticum aestivum (Batygina et al., 1993).
Эмбриоиды образовывались эндогенно, из единичных клеток особой
меристематической зоны, возникающей в толще глобулярно
оформленного каллуса. Несмотря на то что развитие эмбриоидов в целом
было сходным с развитием половых зародышей Triticum in vivo
(Батыгина, 19686, 1974, 1987; Batygina, 1969), оно
характеризовалось рядом нарушений закономерностей с самых первых стадий.
Зародыш
627
Наблюдались различная ориентация инициальных клеток эмбриоидов
и, соответственно, их апикальных и базальных полюсов по
отношению к поверхности каллуса, задержка делений в клетках-дериватах
апикальной клетки (са) по сравнению с дериватами клетки сЪ и
далее нарушение последовательности их делений, приводящее к
недоразвитию и «линейному» строению апикального полюса эмбриоида.
Такие эмбриоиды в дальнейшем дегенерировали и не давали
растений-регенерантов.
Сравнительно-морфологические исследования половых и
соматических зародышей выявили наличие переходных форм между
классическим типом зародыша и почкой. Эти переходные формы также
проходят в своем развитии глобулярную, сердечковидную и торпедовидную
стадии, характеризуются наличием семядолей, плюмулы и гипокотиля,
но при этом имеют ряд специфических признаков (Батыгина, 1992).
Обычно они формируются на вегетативных органах, у них, как
правило, отсутствует главный корень, образуются адвентивные корни, и на
определенном этапе имеется связь с проводящей системой растения.
Такой переходной формой, возможно, является структура,
образующаяся на листьях Bryophyllum diagremontianum и В. calycinum (так
называемая «пропагула»). Морфогенез этих структур протекает в
целом сходно: они возникают из дериватов «dormant» меристемы,
которая пролиферирует в процессе развития листа. «Глобулярная» стадия
пропагулы Bryophyllum по морфологии отличается от классической
глобулярной стадии полового зародыша. Формирование семядолей
пропагулы у обоих видов происходит так же, как у половых зародышей
двудольных: обычно одна из семядолей меньше другой на ранних
этапах развития, затем они становятся практически одинакового
размера. В клетках семядолей присутствует крахмал. Сформированная и
зрелая пропагула биполярна, имеет хорошо дифференцированные
семядоли, почечку (плюмулу) и несколько адвентивных корней. Отделение
проростков от материнского листа происходит благодаря образованию
отделительного слоя клеток, часть которых заполнена танинами. Время
отделения пропагулы от материнского организма зависит от условий,
в которых произрастает взрослое растение. Можно полагать, что
пропагула становится автономной, когда она утрачивает связь с
проводящей системой листа, и у нее формируются адвентивные корни.
У В. diagremontianum это происходит на поздней торпедовидной
стадии (Batygina et al., 1996; см. также Автономность зародыша).
Несмотря на определенную ясность, имеющуюся в толковании
термина «эмбриоид», продолжает дискутироваться вопрос о
целесообразности его использования. Так, известные индийские эмбриологи
Swamy и Krishnamurthy (1981) предложили вообще отказаться от
термина «эмбриоид». Их позиция основана на том, что в этой структуре
отсутствуют инициали клеток эпифизиса и гипофизиса и ряд других
признаков присущих половому зародышу (см. Параллели в развитии
полового и соматического зародышей).
40*
628 Селя
Следует отметить, что исторически для обозначения зачатка нового
организма, образующегося в результате оплодотворения, используется
термин «зародыш». В этой связи словосочетание «соматический
зародыш», наиболее часто употребляемое в работах по культуре тканей,
представляется несколько курьезным, поскольку в нем заключены
одновременно два взаимоисключающих понятия: половой («зародыш»)
и бесполый («соматический») процессы.
С позиций современного состояния эмбриологической науки это
противоречие сглаживается, так как «соматический зародыш», как и «эмб-
риоид», означает зачаток нового индивидуума, который отличается от
полового зародыша в основном своим происхождением (из
соматической клетки или клеток) (Batygina, 1996).
Что касается термина «адвентивный зародыш», то его вряд ли
стоит использовать для эмбриоидов, формирующихся в каллусной и
суспензионной культурах, поскольку неизвестно, какой из них
основной, а какой — дополнительный. Это также относится к эмбриоидам,
образующимся на вегетативных органах.
Вероятно, дальнейшее развитие сравнительных исследований по
морфогенезу соматических и половых зародышей in situ и in vitro с
применением морфологических, биохимических, молекулярно-генетических
методов позволит подойти к расшифровке механизмов эмбриогенеза и
эмбриоидогенеза и решить эти терминологические вопросы.
Однако уже в настоящее время сравнительный анализ генезиса
полового и соматического зародышей позволяет говорить о параллелизме
в их развитии (Batygina, 1996). Рис. 58.
Батыгина, 1968б, 1974, 1978, 1987, 1992, 19936; Брюхин, 1993; Соколовская, 1981--
Batygina, 1969, 1989а, Ь, 1990, 1996; Batygina et al., 1993, 1996; Brukhin, Batygina!
1994; Haccius, 1965, 1971; Haccius, Lakshmanan, 1969; Konar, Nataraja, 1965; Konar et
al., 1972; Swamy, Krishnamurthy, 1981; Vasil, Hildebrandt, 1966.
ЭМБРИОИДОГЕНИЯ (греч. embryon — зародыш, oidos — вид, genus —
происхождение) — тип бесполой (в широком смысле слова, вегетативной)
репродукции цветковых растений in situ, in vivo, in vitro, элементарной
структурной единицей которой является эмбриоид. Размножение
осуществляется либо миниатюрными проростками, развивающимися на растении
из эмбриоидов, либо семенами, в которых формируются эмбриоды (см.
Эмбриоид).
Впервые понятие «эмбриоидогения» в качестве новой категории
бесполого размножения было предложено нами; также рассмотрена роль
этого явления в системе репродукции цветковых растений (рис. 1, 2)
(Batygina, 1987, 1989а, Ь, 1990, 1991, 1992, 1996; Батыгина, 1993а, б
1994).
Как известно, образование новой особи у цветковых растений
происходит либо половым способом, т. е. эмбриогенезу предшествует
половой процесс (гетерофазная репродукция), либо бесполым, т. е.
Зародыш
629
MODES AND TYPES OF REPRODUCTION AND
MULTIPLICATION IN ANGIOSPERMS
with alternation of
generations
sexual
without alternation of
generations
asexual
SEED
gamo-
spermy
amphy-
mixis
agamospermy
apomixis
(gameto-
phytic)
EMBRYOGENY
Mangrove,
Hordeum,
Zea, Arabi-
dopsis
viviparity
Antennaria,
Hieraceum,
Taraxacum etc.
VEGETATIVE
aspermy
amixis
EMBRYOIDOGENY
floral
embryonic
(cleavage)
Or-
chis,
Paeo-
nia,
Eritro-
nium
etc.
ovular
(nucel-
Ur.
integumentary)
Citrus,
Allium,
etc.
vegetative
foliar
cauli-
genic
rhizo-
genic
Crassula,
Bryophyllum,
Ranunculus,
etc.
GEMMORHIZOGENY
floral
Allium,
Festuca,
Poa, etc.
vegetative
foliar
cauli-
genic
rhizo-
genic
Lilium,
Hammarbia,
etc.
VIVIPARITY
sar-
men-
tation
cipation
Рис. 1.
образование соматических зародышей, почек и корней происходит, из
соматических клеток без участия гамет и полового процесса (гомо-
фазная репродукция).
Согласно нашей концепции, существуют две формы эмбриоидоге-
нии: флоральная (репродуктивная) и вегетативная. Флоральная
Органогенез: геммогенез, ризогенез и гемморизогенез.
630
TOTIPOTENT CELL
I. EMBRYOGENESIS II. EMBRYOIDOGENESIS Ш. ORGANOGENESIS IV. HISTOGENESIS
GEMMORHIZOGENESIS GEMMOGENESIS RHIZOGENESIS
PLANT
W
Рис. 2. Morphogenetic pathways and types of sexual (embryogeny, I) and asexual
(embryoidogeny, II; gemmorhizogeny, III) reproduction and multiplication in
flowering plants. K
Зародыш
631
EMBRYOIDOGENIC
TYPE OF REPRODUCTION IN ANGIOSPERMS
Clone F,
1
HOMOPHASIC REPRODUCTION (STOROPHYTE -+ SPOROPHYTE)
Рис. 3.
эмбрноидогения — образование зародышеподобных структур в
семени — включает эмбриональную (монозиготическую), овулярную
(интегументальную и нуцеллярную) и отдельные формы гомофазной
вивипарии , положение и роль которых в системе репродукции
недостаточно определены и дискуссионны. Вегетативная
эмбрноидогения — образование зародышеподобных структур на вегетативных
органах (листе, стебле, корне), представлена, соответственно, фоли-
арной, каулигенной и ризогенной формами.
Поскольку термин «кливажная эмбриония» не отражает происхождение эмбрио-
идов, он заменен термином «эмбриональная эмбрноидогения». Нами введен термин
«овуляриая (лат. ovulum — семязачаток) эмбрноидогения», который объединяет
явления интегумеитальиой и нуцеллярной эмбрнонни (эмбрнондогенни). Введение
этих понятий позволяет сразу же определить не только происхождение этих
соматических зародышей (из соматических клеток зародыша или семязачатка), но и этапы
онтогенеза, на которых они образуются.
2
Термин «вивипария» (греч. viviparia — живорождение) используется нами как для
живородков, образующихся на вегетативных органах из соматических клеток (гомофазная
репродукция), так и для истинных живородков, образующихся у мангровых (гетерофазная
репродукция) (Batygina, 1996). В настоящей статье рассматриваются лишь случаи
гомофазной репродукции.
632
EMBRYOIDOGENIC TYPE OF ASEXUAL REPRODUCTION AND MUETIPLICATION
OF FLOWERING PLANTS. HETEROGENEITY OF SEEDS
Nucellar and integumental embryonic
"N^\ar . II II (reproductive)
cauligenic || ,| |(
rhizogenic em в г
(vegetative) i
СЬЛ Embryoid symbol of mono- and dicotyledones
Л> of different generations
*"§ Seed with sexual embryo and embryoids
/of different generations
ИЙ1 j Different stages of gametophyte
- lm/ development
tClone of the Ufa A new daughterr>. Gone of the
'malema pldntW sporophyte
'daughter plant
Рис. 4.
Как правило, эмбриоидогения характеризуется заложением
(инициацией) в генеративных или вегетативных органах большого количества
эмбриоидов (полиэмбриоидогения = полиэмбриония). Поэтому явление
полиэмбриоидогении в системе репродукции цветковых надо
рассматривать шире, включая все вышеуказанные формы (Поддубная-
Арнольди, 1976; Grant, 1981; Батыгина, 1978, 1993) и не сужать его
до адвентивной (нуцеллярной и интегумеитальной), как это делают
некоторые исследователи (Наумова, 1989). Термин «адвентивный
зародыш» (лат. adventivus — пришлый, adventitius — дополнительный)
следует использовать только для тех соматических зародышей,
которые образуются в семязачатке наряду с половым зародышем. '
Для проростков, образующихся из эмбриоидов, как в семени, так и
на вегетативных органах, мы используем понятие «клон» (или
«микроклон»). Этот термин, хотя и непривычен, но вполне корректен,
отражая суть эмбриоидогенного типа размножения. Следует отметить^
что у некоторых представителей цветковых (Citroideae, Orchidaceae и
др.) в одном семени могут образовываться два разных клона — два
Зародыш 633
поколения: клон материнского организма (за счет нуцеллярной и
интегумеитальной эмбриоидогении) и клон дочерней особи (за счет
эмбриональной эмбриоидогении) (рис. 3).
Теоретически можно полагать, что за счет монозиготической эмб-
рионии (эмбриоидогении) и вивипарии (эмбриоидогенной) в течение
одного сезона мы можем наблюдать генетически однородную, но
разновозрастную популяцию. В то же время за счет нуцеллярных и
интегументальных эмбриоидов, являющихся производными той же
зиготы, что и эмбриоиды, образующиеся при монозиготической
эмбриоидогении и вивипарии, в популяции в течение нескольких сезонов
сохраняется родительский (материнский) генотип.
Следует еще раз отметить, что в случае, когда в одном семени
могут образовываться эмбриоиды разного происхождения:
материнского (овулярные) и нового дочернего (эмбриональные), в популяции
развиваются растения двух генотипов. Это является предпосылкой
создания гетерогенности семян, которая в конечном счете обусловливает
генетическую гетерогенность популяции (рис. 4).
Сравнительно-эмбриологический и морфологический анализ структур,
образующихся на вегетативных органах, показал, что некоторые формы
вегетативной вивипарии являются одной из форм эмбриоидогении
(Batygina, 1989a, b, 1990). В этом случае так же, как при эмбриональной
и овулярной эмбриоидогении, из соматических клеток листа, стебля и
корня образуются биполярные структуры — эмбриоиды,
представляющие собой клон материнского организма на более позднем этапе
онтогенеза (по сравнению с монозиготическими эмбриоидами).
Приуроченность образования «живородков» к определенному
вегетативному органу (стебель, лист, корень) таксоноспецифична.
Явление вивипарии наблюдается у разных видов растений и в
разных экологических зонах.
Эмбриоидогения, представленная различными формами, имеет
большее адаптивное значение для цветковых, чем другой тип вегетативного
размножения — гемморизогенез. Преимущество эмбриоидогенного типа
размножения перед гемморизогенным заключается в том, что в первом
случае единицей размножения является зачаток целого организма
(эмбриоид или маленький проросток), образованный в семени или на
вегетативных органах, а не отдельные органы (почка или корень), как
это имеет место при гемморизогении. В последнем случае необходимы
определенные условия и время для регенерации части организма до целой
особи. При вивипарии формируется сразу полноценный биполярный
организм (миниатюрный проросток), способный у некоторых видов
растений не только сразу укореняться, но и разноситься, подобно семенам,
ветром, водой на малые и большие расстояния.
Анализ литературы выявил, что у многих цветковых растений
наряду с семенным (половым) размножением имеется и вегетативное,
представленное разными формами эмбриоидогении и
гемморизогении. Соотношение этих форм размножения таксоноспецифично. Так, у
634
Семя
представителей сем. Orchidaceae (Nigritella nigra, Eulophea epiden-
draea, Spiranthes australis) имеются все формы эмбриоидогении, геммо-
ризогении и полового размножения (Afzelius, 1928; Swamy, 1943,
1948b; Batygina, 1989c). В сем. Crassulaceae у разных видов
отмечены семенное размножение и вивипария. Для представителей сем.
Роасеае установлена наряду с образованием половых зародышей ову-
лярная (нуцеллярная) и эмбриональная (монозиготическая)
эмбриоидогения, а также гемморизогения. У представителей Citroideae наряду с
половым процессом имеет место овулярная (нуцеллярная)
эмбриоидогения (Батыгина, Маметьева, 1979). У некоторых луков (например, у
Allium odorum) отмечены также интегументальная эмбриоидогения
(Модилевский, 1931) и гаметофитный апомиксис (Wojciechowicz,
Strzelecka, 1997).
Таким образом, эмбриоидогения имеет вполне определенное
биологическое значение в системе репродукции цветковых растений, являясь
способом бесполого (вегетативного) воспроизведения и размножения.
Такие установленные формы репродукции, как овулярная
(нуцеллярная, интегументальная), эмбриональная (монозиготическая, кли-
важная) и некоторые формы вивипарии, являются лишь
элементами одного общего типа размножения — эмбриоидогенного.
Имеется определенная таксоноспецифичность форм эмбриоидогении.
В основе вышеописанного явления лежит исключительное свойство
растительной клетки — ее тотипотентность.
В связи с вышесказанным, трудно согласиться с утверждением
некоторых авторов, которые приписывают особую роль отдельным
формам эмбриоидогении в системе репродукции цветковых
растений. Это не совсем корректно, так как для установления роли
каждой формы эмбриоидогении она должна рассматриваться в
сравнительном плане и во взаимосвязи с другими формами, а также
эмбриогенией, гемморизогенией и гаметофитным апомиксисом.
Не вызывает сомнений, что при всем разнообразии форм
эмбриоидогении мы имеем дело с оригинальным типом вегетативного
размножения. Это согласуется с мнением Grant (1981) о том, что и
адвентивная эмбриония, и вивипария (гомофазная — Т. Б.) являются
формами вегетативного размножения (т. е. индивидуум образуется без
полового процесса). Роль явления эмбриоидогении в эволюции
окончательно не установлена в силу слабой изученности различных форм
репродукции, которые ее составляют. Рис. 59.
Батыгина, 1978, 1992, 1993а, б, 1994; Батыгина, Маметьева, 1979; Модилевский,
1931; Поддубная-Арнольди, 1976; Afzelius, 1928; Batygina, 1987, 1989а, Ь, с, 1990,
1991, 1992, 1996; Batygina et al., 1996; Bragina, et al., 1995; Grant, 1981; Konar,
Nataraja, 1965; Swamy, 1943, 1948b; Wojciechowicz, Strzelecka, 1997.
Зародыш
635
ПАРАЛЛЕЛИ В РАЗВИТИИ ПОЛОВОГО И СОМАТИЧЕСКОГО
ЗАРОДЫШЕЙ
Длительный процесс адаптивной эволюции, который в значительной
степени определяет соотношение способов репродукции у различных
видов растений (т. е. их репродуктивную стратегию) (Батыгина, 1992),
привел к возникновению большого разнообразия репродуктивных
структур. Наряду с половым зародышем существуют адвентивные почки, про-
пагулы, специализированные побеги, бульбы, соматические зародыши и
т. д. Для обобщения разнообразия зародышеподобных структур,
возникающих в культуре растительных тканей in vitro и в процессе бесполого
размножения растений in situ и in vivo, был предложен термин «эмб-
риоид» (Vasil, Hildebrandt, 1966). Позднее на основании литературных
и оригинальных данных нами было дано следующее определение: «эмб-
риоид (соматический зародыш) — зачаток индивидуума, образующийся
асексуально in situ, in vivo и in vitro, (см. Эмбриоид; Эмбриоидогения).
Эмбриоидам, так же как и половым зародышам, свойственна биполярная
организация на всех стадиях его формирования. В отличие от эмбриоида,
почка — монополярно развивающаяся структура, и только в процессе
дальнейшей регенерации происходит ее преобразование в биполярную
структуру, которая позднее развивается в новый индивидуум.
Вопрос о сходстве путей развития полового и соматического
зародышей является одним из важнейших аспектов проблемы, касающейся
единства и разнообразия путей морфогенеза упомянутых выше структур,
которые служат для размножения растений — полового и бесполого.
Можно ли говорить о сходстве первых этапов развития индивидуума
при различных путях морфогенеза — эмбриогенезе, эмбриоидогенезе и
гемморизогенезе — до сих пор не ясно.
Дискуссионным является вопрос, насколько морфогенез соматического
зародыша соответствует морфогенезу полового зародыша, т. е. в какой
степени он подчиняется законам развития полового зародыша —
законам происхождения, чисел, положения и назначения — Soueges, 1937
и закону экономии — Johansen, 1950 (подробнее см. Эмбриогения).
Не ясно также, в какой степени выполняются законы клеточного деления
Errera, Sach и Hertwig (рис. 1) при развитии соматического зародыша.
Недостаточное внимание уделяется роли соматического зародыша как
элементарной структурной единицы в системе размножения растений
(см. также Haccius, Padmanabhan, 1985; Swamy, Krishnamurthy, 1981;
Батыгина, 1978—1996; Эмбриоид; Эмбриоидогения; Зародыш).
Вопросы терминологии, связанные с зародышеподобными
структурами, а также их классификация до сих пор остаются предметом дискуссии.
В литературе обсуждаются лишь отдельные аспекты сравнительно-
эмбриологического изучения морфогенеза полового и соматического за-
636
Семя
родышей. Известные индийские эмбриологи Swamy и Krishnamurthy
(1981) пришли к заключению, что сходство в развитии полового и
соматического зародышей in vitro отсутствует. Они полагали, что эмб-
риоид лишен основных признаков, присущих половому зародышу,
аргументируя это следующим образом:
инициальная клетка соматических зародышей не имеет оси
полярности;
в эмбриоиде отсутствует упорядоченность модели деления клеток
(иррегулярный ход делений);
нарушены законы деления клеток Errera и Sach;
отсутствует суспензор;
нарушено заложение эпидермы;
отсутствуют инициали и типичные центры полярной организации —
эпифизис и гипофизис;
отсутствуют (часто) инициали гипокотиля;
нарушена нормальная организация главного корня;
отсутствуют плерома, периблема и т. д.
По их мнению, эмбриоид по своей морфологии ближе к адвентивной
почке, чем к половому зародышу.
За последние десятилетия получено много данных по развитию
соматического зародыша in situ и in vitro, в свете которых становится
ясно, что признаки, приведенные Swamy и Krishnamurthy как
характерные для половых зародышей и отсутствующие у соматических, не
всегда могут быть использованы для определения
морфологического статуса как эмбриоида, так и полового зародыша.
Системный подход к исследованию репродуктивных систем впервые
позволил сопоставить типы формирования полового и соматических
зародышей in situ, in vivo и in vitro и открыл принципиально новые
возможности при выборе модельных объектов для сравнительного изучения
этих структур (Batygina, Vasilyeva, 1982; Батыгина, Васильева, 1983).
Анализ литературы и оригинальных данных с этой точки зрения
позволили прийти к выводу, что развитие половых и соматических зародышей
in vivo и in vitro протекает сходно, различно лишь происхождение
зародышей (половые — путем гетерофазной репродукции, соматические
— путем гомофазной) (Batygina 1996). Был установлен новый тип
бесполого размножения цветковых растений — эмбриоидогения,
элементарной структурой которого является эмбриоид (Батыгина, 1987, 1993,
1994).
В связи с этим представляется необходимым провести
сравнительный анализ развития полового и соматического зародышей, который,
возможно, позволит судить о сходстве эмбрио- и эмбриоидогенеза.
Мы предлагаем для сравнения следующие структуры:
инициальные клетки полового и соматического зародышей (in situ,
in vitro);
Зародыш
637
половые зародыши растений, принадлежащих к таксонам с
различными типами эмбриогенеза и формирования проростков, в связи с
различной экологией;
соматические зародыши, развивающиеся в природных условиях (in
situ, in vivo), отличающиеся по месту возникновения (семя, лист,
стебель, корень) и характеру развития на растении;
соматические зародыши, полученные из тканей растений различных
таксонов, различающиеся по способу образования и развития в
культуре in vitro.
Инициальные клетки полового и соматического зародышей.
Нельзя отрицать тот факт, что морфогенез инициальных клеток как полового,
так и соматического зародыша в большой степени обусловливает ход
эмбрио- и эмбриоидогенеза. Характеристика инициальных клеток и
сейчас остается одной из основных проблем морфогенеза зародыша.
Системный подход предполагает сравнение инициальных клеток
соматического зародыша in vitro не только с яйцеклеткой и зиготой,
но и с инициальными клетками, которые в естественных условиях
дают соматические зародыши в семени (кливажные, нуцеллярные,
интегументальные) и на вегетативных органах (фолиарные, каулиген-
ные и ризогенные). В связи с этим первоочередными являются
вопросы:
1. Какую клетку в зародышевом мешке можно рассматривать как
аналог инициальной клетки соматического зародыша (in situ и in
vitro): яйцеклетку (гамету) или зиготу (спорофит)?
2. На какой стадии митотического цикла находятся эти клетки и
каков темп прохождения всех его периодов (например, интерфазы)?
Многие исследователи, занимающиеся изучением инициальных
клеток соматического зародыша, часто сравнивают их с яйцеклеткой или
зиготой. Однако у эмбриологов, изучающих развитие зародышевого
мешка и процесс оплодотворения, нет полной ясности относительно
фаз развития самой яйцеклетки и зиготы, хотя в отдельных работах
используется термин «зрелая зигота» и т. д.
Следует отметить, что сравнение соматической инициальной клетки
как с яйцеклеткой (гаметой), так и с зиготой (спорофитом)
правомерно. Как известно, яйцеклетка некоторых видов растений в природных
условиях дает партеногенетические зародыши, развивающиеся по
определенным законам. Однако вопрос о том, является ли яйцеклетка,
встающая на путь партеногенеза, действительно яйцеклеткой по своему
внутреннему состоянию, или она в этом смысле ближе к зиготе,
неясен.
Кроме того, сравнение инициалей соматических зародышей,
образующихся in vivo, с яйцеклеткой или зиготой является более
корректным, чем сравнение с инициалями соматического зародыша in
vitro, поскольку инициали соматического и полового зародышей in
vivo генетически детерминированы и развиваются в системе целого
638
Семя
Л*
otf
IMITIAUCELLS
(ТОПфтЕНТ)
mature
zygote
(totipotent cell)
ictophytc (n, 2n)
(n)
ipdrophyto (n, 2a)
cambium (2n)
parenchyma <"
phloem (2n)
xylem (2n)
' Ы t
initiaJcells
(totifctent)
^PBRENTIATIO*
fi^BRHNTlA-n0*
SpeCJALIZATlO*
Схема образования инициальных клеток полового и соматического зародышей in
vivo и в культуре in vitro.
Зародыш
639
организма. Их генезис легче установить, и, следовательно, их легче
идентифицировать.
Подробное сравнительное изучение генезиса яйцеклетки и зиготы in
situ у разных видов цветковых (Батыгина, 1962—1996) явилось
основанием для уточнения периодизации их развития. Это дает
возможность более детально характеризовать сложные структурные
преобразования, которые происходят в яйцеклетке и зиготе, связанные с
процессами их специализации, дифференциации и дедифференциации,
а также частичной потерей тотипотентности и затем ее
восстановлением (подробнее — см. Зигота).
Первые этапы формирования яйцеклетки у всех изученных
таксонов цветковых, у которых развитие зародышевого мешка идет по
Polygonum-типу, относительно единообразны. Инициали яйцеклеток
морфогенетически сходны и тотипотентны. Они имеют центрально
расположенное ядро, характерную для меристематической клетки
вакуолизацию и оболочку.
В процессе развития «инициали яйцеклетки» в «сформированную»,
а затем в «зрелую» яйцеклетку увеличиваются ее размеры, меняется
форма, происходит становление полярности и симметрии. При этом
свойство тотипотентности частично утрачивается. Для зрелой
яйцеклетки характерны: специфичная вакуолизация цитоплазмы, перемещение и
расположение ядра и преобразование оболочки (в апикальной части).
Эти признаки являются таксоноспецифичными.
Во время объединения женских и мужских половых ядер в
образовавшейся инициали зиготы начинается процесс дедифференциации. Он
продолжается и в интерфазе зиготы: цитоплазма, оболочка и ядро
претерпевают ряд изменений, что приводит, с одной стороны, к
формированию таксоноспецифического облика зрелой зиготы, а с
другой — к обретению ею вновь меристематического состояния
(тотипотентности) и способности к пролиферации.
Таким образом, в системе «яйцеклетка-зигота» имеет место
пульсирующий характер процессов: меристематизация, дифференциация,
специализация, дедифференциация и снова меристематизация. Вероятно,
только те стадии развития системы «яйцеклетка-зигота», которые
отличаются меристематичностью, способностью к пролиферации, можно
сравнивать с инициалями соматического зародыша, как в природных
условиях, так и в культуре in vitro.
Большое влияние на развитие инициальных клеток оказывают внешние
условия их формирования. Инициаль яйцеклетки, а также незрелая и
зрелая яйцеклетка, как и зигота, находятся в сложной системе яйцевого
аппарата. В процессе генезиса яйцеклетка и зигота становятся
изолированными и относительно автономными. Кроме того, сам яйцевой
аппарат находится в сложной системе зародышевого мешка, которая сильно
различается у разных таксонов по характеру развития (установлено 16
типов зародышевых мешков). Тип зародышевого мешка в значительной
степени определяет полярность и симметрию яйцеклетки, процесса оп-
640
Семя
лодотворения и зиготы и характер первого деления (симметричный и
асимметричный).
До сих пор достоверно не установлено, происходят ли подобные
процессы в клетках, дающих соматические зародыши in situ. Сравнение
инициалей соматических зародышей, образующихся in situ, с яйцеклеткой
или зиготой является более корректным, чем сравнение с инициалями
соматического зародыша in vitro. Инициали соматического и полового
зародышей in situ развиваются в системе целого организма, их легче
идентифицировать, поскольку легче установить их генезис.
Инициальные клетки соматических зародышей у различных видов
цветковых в природных условиях относительно единообразны по своей
морфологии и структуре. Установлено, что во всех системах эмбрио-
генные клетки, из которых развиваются эмбриоиды, имеют ряд общих
признаков, которые характерны для быстро делящихся меристематичес-
ких клеток. Это — малые размеры, плотная цитоплазма, крупное ядро
с заметно увеличенным ядрышком и наличие мелких вакуолей.
Гистохимические и ультраструктурные их особенности свидетельствуют об
интенсивном синтезе РНК и метаболической активности (Batygina,
1984; Williams, Maheswaran, 1986). Меристематичные эпидермальные
клетки полового зародыша (у разных видов сем. Paeoniaceae) и стебля
(у Ranunculus sceleratus), из которых образуется соматический
зародыш, перед первым делением приобретают полярность (образуется
вакуоль, ядро часто располагается эксцентрично).
Соматические инициальные клетки эмбриоида, развивающегося в
природе, и инициальные клетки полового зародыша имеют свои собственные
пути развития (см. Зигота), которые подчиняются общим законам
деления клетки и эмбриогенеза, так как протекают в системе целого
индивидуума. Это, как мы увидим ниже, и обеспечивает нормальное развитие
соматического зародыша, проростка и растения in vivo.
Изучение инициальных клеток соматических зародышей в культуре
in vitro является одной из сложнейших проблем морфогенеза, так как
в большинстве случаев эксплант по своей структуре является
гетерогенным, т. е. инициальные клетки различаются по своему
происхождению. В культуре ткани существуют две модельные системы,
различающиеся по характеру взаимодействия клеток: каллусная и суспензионная
культуры. Каллусная культура является моделью с более жесткими
связями между клетками. Это проявляется в том, что периферические
клетки чаще, чем нижележащие, становятся компетентными и дают
соматические зародыши. Полярность и деление в этих клетках обычно
определяется их местоположением по отношению к поверхности
каллуса (например, у злаков).
В литературе встречались указания на то, что изоляция отдельных
клеток каллуса (например, у Citrus — Button et al., 1974; Daucus
carota — Petru, 1970) способствует переходу их к эмбриогенному
развитию, что соответствовало бы, вероятно, относительно
изолированному состоянию зрелой зиготы в зародышевом мешке. Однако более
Зародыш
641
поздние наблюдения не подтвердили, что это явление имеет общий
характер (Konar et al., 1972a; Maheswaran, Williams, 1985).
Согласно гипотезе, предложенной Sharp et al. (1980) и
разработанной Evans et al. (1981) и Sharp et al. (1982), прямой эмбрио-
идогенез in vitro дают клетки, которые были детерминированы еще
до их эксплантирования; необходим лишь триггер, стимулирующий
их морфогенез. Непрямой эмбриоидогенез in vitro происходит из
клеток, требующих пролиферации и дифференциации. В обеих
системах дифференциация и специализация инициальных клеток и самого
зародыша в значительной степени определяется критической массой
этих клеток, каллуса и структур, образующихся в культуре in vitro
(Halperin, 1967, 1970; Батыгина и др., 1978, 1984).
Представляют интерес данные, полученные по инициальным
клеткам в суспензионной культуре Daucus carota (Komamine et al.,
1992). Эти клетки перед делением полярны, имеют большую
вакуоль и ядро, оттесненное к оболочке клетки. Соответствует ли
этот процесс формированию яйцеклетки или зиготы, или инициалей
соматического зародыша в естественных условиях, еще предстоит
выяснить.
К сожалению, в настоящее время, в связи с недостатком
фактических данных по морфогенетическим процессам в клетках экспланта,
очень сложно сравнивать развитие инициалей соматических зародышей
in vitro и яйцеклетки-зиготы. Однако даже весьма неполные данные,
имеющиеся в настоящее время, позволяют говорить о сходстве в
морфологии инициальных клеток полового зародыша и соматических
зародышей in vivo и in vitro. Получение большого количества соматических
зародышей у разных таксонов в культуре in vitro зависит от полноты
нашего знания генезиса инициальных клеток и их основных
характеристик (фазы митотического цикла, строение оболочки, состояние
цитоплазмы, количество и распределение органелл и т. д.). Это позволит
более корректно оценивать и сравнивать инициальные клетки
соматического зародыша in vitro с инициальными клетками полового и
соматического зародышей в естественных условиях.
Половые зародыши. Высокая тотипотентность, свойственная зрелой
зиготе, сохраняется в клетках са и сЪ. Нельзя не отметить значительное
разнообразие вклада клеток са и сЪ в построение тела зародыша. Soueges
(1934) выявил в зародыше различных видов цветковых эпифизарную
и гипофизарную области и их инициали, дериваты которых дают апексы
побега и корня. Формирование этих районов, так же как и их инициалей,
обычно происходит на ранних стадиях развития зародыша, но время их
дифференциации таксоноспецифично. Между эпифизисом и гипофизисом
устанавливается морфологическая ось.
Онто-филогенетический подход позволил выявить, по крайней мере,
пять групп зародышей, различающихся по этому признаку:
1 группа — имеются типичные инициали эпифизиса и гипофизиса
и их центры (например, Geum rivale — Soueges, 1934);
41—828
642
Семя
2 группа — имеются только типичная инициаль гипофизиса и его
центр (например, Arabidopsis thaliana — Яковлев, Алимова, 1976;
Capsella bursa-pastoris — Maheshwari, 1950);
3 группа — имеются только типичная инициаль эпифизиса и его
центр (например, Polemonium caeruleum — Soueges, 1934; Kapil et al.,
1968);
4 группа — отсутствуют типичные инициали эпифизиса и
гипофизиса и их центры (например, Роасеае — Батыгина, 1987);
5 группа — имеются инициали эпифизиса и (или) гипофизиса, но
отсутствуют типичные эпифизарный и (или) гипофизарный центры,
(например, Platantera bifolia — Veyret, 1965,* Gymnadenia conopsea —
Шамров, Никитичева, 1992).
У зародышей первых четырех групп формируется морфологическая
ось и полярность и нормально развиваются апексы побега и корня (в
первых трех группах — главного корня, а в четвертой —
адвентивного). В пятой группе в зрелом зародыше имеется морфологическая
полярность, однако апексы побега и корня морфологически не
выражены.
Нельзя не отметить значительное разнообразие участия клеток са и
cb в построении тела полового зародыша. Используя этот признак,
Soueges (1939) создал свою классификацию типов эмбриогенеза,
выделив шесть основных типов (мегархетипов).
Таким образом, высокая тотипотентность, характерная для зрелой
зиготы, сохраняется и в клетках са и cb. С развитием зародыша в
процессе гистогенной дифференциации и специализации отдельных
комплексов клеток она сохраняется лишь в отдельных клеточных
кластерах зародыша, проростка и растения.
Переходные формы между зародышем и почкой. Анализ
имеющихся литературных и оригинальных данных по развитию половых и
соматических зародышей в естественных условиях выявил, что
существуют структуры, которые отличаются от типичного полового зародыша
и почки по морфологии. В связи с этим нами введен термин
«переходная форма», под которым мы понимаем структуру, имеющую
признаки зародыша (например, наличие глобулярной, сердечковидной,
торпедовидной стадий развития) и почки (образование адвентивных
корней в процессе регенерации) (Батыгина, 1993). Зародыши таких
растений, как Nelumbo nucifera (Nelumbonaceae), Ceratophyllum de-
mersum (Ceratophyllaceae), представителей семейств Роасеае, Orchida-
ceae, Orobanchaceae, иллюстрируют возможные пути такого перехода.
В зародышах Nelumbo, Ceratophyllum отсутствуют эпифизис и ги-
пофизис. У зародыша Nelumbo (гидрофита) при его прорастании
имеет место замещение главного корня системой адвентивных корней,
которые закладываются в основаниях листьев почечки уже на поздних
стадиях эмбриогенеза. Однако зародыш Nelumbo с самого начала
своего существования биполярен (Снегиревская, 1964; Колесова,
Батыгина, 1988).
Зародыш
643
Зародыш Ceratophyllum (гидатофита) на первых этапах своего
развития также, вероятно, биполярен, так как имеется группа клеток,
которые можно рассматривать как инициали главного корня. В зрелом
зародыше имеется лишь хорошо развитая почечка, а главный корень
отсутствует, при этом адвентивные корни не образуются ни в
семенном, ни в послесеменном развитии. В проростке роголистника
отсутствует типичная биполярность (Шамров, Батыгина, 1984, 1988).
У большинства представителей Роасеае (ксерофитов) в зрелом
зародыше имеются сформированная почечка и хорошо развитые адвентивные
корни (число последних варьирует в зависимости от вида растения, места
и времени произрастания), главный корень отсутствует. Ряд авторов
(Velenovsky, 1907; Goebel, 1932; Roth, 1956, 1961; Brown, 1956, 1965),
однако, полагают, что главный корень в зародыше злаков имеется.
Другие авторы (Пашков, 1951; Pankow, von Guttenberg, 1957; Guttenberg
von, 1960; Guignard, 1961) считают, что в процессе эволюции он
преобразовался в колеоризу (см. Эмбриогенез злаков). Биполярность
развития и дорзовентральность симметрии наблюдаются с самых ранних
этапов развития зародышей злаков, хотя вопрос о сохранении первичной
полярности или смене ее на вторичную в процессе развития остается
спорным.
У представителей сем. Orchidaceae в зрелом зародыше отсутствуют
апексы побега и корня. Позже, в процессе образования проростка
(протокорма), наряду с почкой появляется и адвентивный корень. В
результате устанавливается вторичная полярность (Терёхин,
Никитичева, 1968; Терёхин, 1977; Batygina, Vasilyeva, 1983).
Анализ зародышей различных видов паразитных растений с разной
степенью редукции говорит о том, что биполярность может наблюдаться
с самых первых этапов развития зародыша, но в процессе развития она
утрачивается, и вторичная полярность возникает лишь при прорастании
семени (в контакте с растением-хозяином), причем настоящие корни не
образуются. Зародыш паразитных растений представляет собой
прекрасную модель для изучения процесса редукции типичных инициалей
эпифизиса, гипофизиса, а также апексов побега и корня. Особенностью
его развития является большая вариабельность первых этапов развития,
которая проявляется в разной степени участия дериватов клеток са и
cb в построении тела зародыша. Например, у Aeginetia indica уже первые
деления являются иррегулярными, что не позволяет отнести развитие
этого зародыша к какому-либо типу эмбриогенеза. Но организация
сформированного зародыша ясно свидетельствует о соответствии
эмбриогенеза A. indica и других Orobanchaceae Onagrad-типу. У Orobanchaceae
в различной степени нарушается дифференциация инициалей гипокотиля
и радикулы. У голопаразитных растений, кроме того, наблюдаются
нарушения процесса образования эпидермиса в некоторых частях зародыша
(Терёхин, Никитичева, 1968, 1981; Терёхин, 1977).
Представленный ряд половых зародышей цветковых растений
показывает, что морфогенез полового зародыша обусловлен происхождени-
41*
644
Семя
ем его инициалей (зиготы или яйцеклетки в случае партеногенеза),
типом зародышевого мешка, типом семязачатка, а также
особенностями биологии таксона. Пластичность клеток зародыша весьма высока,
что, вероятно, обусловлено высокой степенью их тотипотентности. Это
свойство делает возможными глубокие морфогенетические перестройки
на разных этапах развития зародыша и проростка с сохранением их
общей организации. Эти перестройки в процессе адаптивной эволюции
происходили, вероятно, в результате нарушения определенных морфо-
генетических корреляций (на клеточном, тканевом, органном, организ-
менном и, возможно, популяционном уровнях). Результаты этих
перестроек могут проявляться на самых первых этапах развития зародыша
(иррегулярность делений, разное участие дериватов са и cb в
построении тела зародыша), на средних (отсутствие гипофизиса и
эпифизиса) и поздних этапах (отсутствие главного корня и адвентивных
корней не только у зародыша, но и у проростка), а также в общей
редукции уровня дифференциации зародыша, начиная с ранних этапов
его развития. В ходе этих перестроек в процессе развития полового
зародыша изменяется время появления первичной полярности, а также
становится возможным замещение ее вторичной полярностью в
процессе образования проростка.
Весь комплекс перечисленных признаков можно трактовать как
свидетельство возможных эволюционных тенденций к переходу от
классического полового зародыша к почке (либо от почки к половому
зародышу).
Соматические зародыши, развивающиеся in situ. Гомофазная
репродукция у цветковых растений осуществляется двумя разными по
морфологической природе элементарными структурными единицами:
соматическим зародышем (индивидуум) и адвентивной почкой (часть
организма). Подавляющее большинство ботаников, говоря о
вегетативном размножении, рассматривают лишь одну его форму — гемморизо-
генез. Вероятно, обе структуры в процессе эволюции сформировались
параллельно и реализуются наряду с половым зародышем (гетерофазной
репродукцией) в разной степени у разных таксонов. Морфогенез
соматического зародыша, а затем и проростка in situ протекает в системе
материнского организма, под его влиянием. В этом плане он имеет
сходство с половым зародышем, но отличается от последнего происхождением
(гомофазная репродукция). Эта особенность его развития, вероятно, и
обусловливает нормальное течение всего эмбриогенеза и высокий процент
выхода проростков, в отличие от соматического зародыша,
развивающегося in vitro, где процент нормальных растений-регенерантов, как
правило, очень невысок.
Уникальным примером образования соматического зародыша in situ
в семени (особая форма монозиготической-кливажной эмбриоидогении)
является зародыш Paeonia (см. Paeoniad-тип эмбриогенеза).
Развитие полового зародыша в зародышевых мешках всех видов пиона
заканчивается на стадии образования эпидермиса в ценоцитно-клеточной
Зародыш
645
структуре (гетерофазная репродукция). Далее идет процесс
клонирования полового зародыша посредством образования соматических
зародышей из клеток его эпидермы. Эти соматические зародыши по
характеру своего морфогенеза ничем не отличаются от полового зародыша
типичного двудольного растения. Уже на стадии инициальной клетки
начинается становление полярной оси. Затем происходит нормальное
развитие всех гистогенов корня и апекса побега. Соматический
зародыш Paeonia является прекрасной моделью для изучения нормального
протекания соматического эмбриогенеза по типу Asterad. Правильность
строения соматического зародыша Paeonia, на наш взгляд,
определяется формированием его инициальных клеток в зародышевом мешке,
полярностью и строением зародышевого мешка и семязачатка, под
влиянием которых и развивается эмбриоид. .Вероятно, развитие нуцел-
лярных и интегументальных зародышей определяется этими же
факторами. Хотя первые деления в них происходят иррегулярно,
отсутствуют инициали гипофизиса и эпифизиса и их центры, однако развитие
эпидермиса, апексов побега и корня и дифференциация главного корня
со всеми его элементами протекает нормально, так же как и у половых
зародышей (Наумова, 1987).
Экзоморфа соматического зародыша Paeonia (монозиготическая
кливажная эмбриоидогения) и нуцеллярных зародышей (овулярная
эмбриоидогения), а также внутренняя их организация сходна с
таковой полового зародыша. Следовательно, эти соматические
зародыши, развивающиеся в естественных условиях, нельзя сравнивать
с такой морфологической моделью, как адвентивная почка.
Подобным образом происходит образование соматического
зародыша (in situ) из эпидермальных клеток стебля у Ranunculus sceleratus
(Konar et al., 1972). Его развитие соответствует типу Onagrad.
Авторы отмечают у него отсутствие дифференциации суспензора, в отличие
от половых зародышей. Развитие соматического зародыша из
дериватов эпидермальных клеток листа также описано у Crassula multicava
(McVeigh, 1938). Несмотря на отсутствие типичных инициалей
эпифизиса и гипофизиса и их центров, развитие внутренней структуры, в
частности апексов побега и корня, в этих зародышах протекает в
основном так же, как и у всех половых зародышей.
У видов Bryophyllum структуры, образующиеся на листе, не имеют
инициалей гипофизиса и эпифизиса и их центров. Однако наличие в их
морфогенезе «глобулярной», «сердечковидной», «торпедовидной»
стадий развития говорит скорее об их принадлежности к соматическим
зародышам или переходной форме между почкой (образование
адвентивных корней) и зародышем. Морфогенез этих структур
свидетельствует о том, что их можно сравнивать с половым зародышем злаков
(Bragina et al., 1995; Batygina, Bragina, 1996).
Таким образом, проведенный анализ соматических зародышей,
развивающихся в естественных условиях у разных таксонов, говорит о
том, что их строение и генезис таксоноспецифичны и, вероятно, в
646
Семя
значительной степени определяются местом формирования их
инициальных клеток, а также условиями, в которых происходило развитие
индивидуума и всей популяции в целом. Наличие у некоторых типов
эмбриоидов морфогенетического сходства с адвентивной почкой
подтверждает существование переходных форм между этими двумя
структурами.
Соматические зародыши в культуре in vitro. Как уже было
отмечено, культура in vitro предоставляет исследователям две
различные модельные системы для получения соматических, зародышей
(суспензионную и каллусную). Эти системы различаются по многим
своим параметрам, что обусловливает как различное строение и
поведение инициальных клеток, так и генезис всего соматического
зародыша.
На примере полученных нами оригинальных данных рассмотрим
генезис соматических зародышей in vitro у различных видов цветковых
растений, контрастирующих по ряду признаков.
В каллусной культуре пшеницы (Triticum aestivum) (Batygina et al.,
1993) было выявлено эндогенное заложение меристематической зоны,
представляющей собой особую ткань, которая состоит из рядов клеток,
строго ориентированных по отношению к поверхности каллуса. В
дальнейшем клетки этой зоны становятся инициальными клетками
соматических зародышей.
Сравнительный анализ развития соматических и половых
зародышей выявил, что на ранних этапах их развития первые деления
протекают сходно, хотя и наблюдается некоторая их вариабильность,
сохраняющаяся на последующих этапах эмбриогенеза (Graminad-тип).
В некоторых соматических зародышах отмечено нарушение заложения
первых перегородок. Это, вероятно, часто приводит к нарушению
нормального гистогенеза, а впоследствии — к гибели эмбриоидов.
Возможно и образование нормальных эмбриоидов, напоминающих
половой зародыш злаков.
Сранительный анализ развития соматического зародыша Aconitum
heterophyllum, в каллусной культуре in vitro, с половым зародышем
выявил относительное их сходство (тип Onagrad) (Титова, Батыгина,
Ahuja, ориг. данные). В процессе развития у эмбриоидов были
выявлены различные аномалии: например ранняя дифференциация
элементов ксилемы на стадии сердечка. Вероятно, одной из причин
этого является большой процент аномалий на ранних стадиях
развития соматического зародыша.
Анализ работ по соматическому зародышу Daucus carota в
суспензионной и каллусной культурах, сравнительных данных по строению и
организации соматического и полового зародышей (см. Батыгина и
др., 1978; Komamine et al., 1992) позволил выявить относительное
сходство в развитии полового и соматического зародышей.
Следует отметить, что в настоящее время трудно корректно оценить
данные по всем этапам развития зародыша, поскольку:
Зародыш
647 1
1) отсутствует метод, позволяющий выделить инициальные клетки,
сходные по своему генезису и положению их в системе ткани, органа
и организма;
2) недостаточна информация по морфологии и анатомии проростков,
возникших из соматических зародышей (процент нормальных и
аномальных растений), позволяющая установить причины снижения
выхода регенерантов;
3) недостаточно количество сравнительных исследований
соматического зародыша in vitro с соматическим in situ и с половым зародышем
(в онто-филогенетическом аспекте);
4) отсутствует математическая обработка данных по всем стадиям
развития соматического зародыша и проростка.
Однако даже на основании уже имеющихся сведений можно сделать
следующие обобщения:
половой и соматический зародыши (в природных условиях и в
культуре in vitro) различаются по своему происхождению — гетерофазная
и гомофазная репродукция, соответственно;
аналогом инициальной клетки диплоидного соматического зародыша
in vitro и in situ, вероятно, можно считать инициаль яйцеклетки
(партеногенез) или зрелую зиготу, прошедшую сложный путь морфогене-
тических преобразований и способную к пролиферации. Высокая
степень тотипотентности — основное свойство всех инициальных клеток;
как известно, развитие полового зародыша происходит в
соответствии с законами деления клетки Errera, Sach, Gertwig и законами
эмбриогении Soueges. Однако вариабельность первого деления зиготы
и последующих стадий эмбриогенеза (8 типов эмбриогенеза и более
50 вариаций), наличие переходных форм свидетельствуют, что эти
правила и законы не следует считать абсолютными. Сходная ситуация
наблюдается при развитии соматического зародыша в природных
условиях и в культуре in vitro;
генезис и структура соматического зародыша в природе таксоноспе-
цифичны. Возможно, они предопределены местом формирования его
инициальной клетки, а также условиями развития материнского
растения и всей популяции. Тип формирования соматического диплоидного
зародыша в культуре in vitro зависит от происхождения его
инициальной клетки, ее положения и детерминации в системе материнского
растения, от уровня ее тотипотентности и условий культивирования;
параллелизм в развитии полового и соматического зародышей
также проявляется в основных закономерностях морфогенеза: полярность
(биполярность и формирование новой оси), симметрия (радиальная,
билатеральная, дорзовентральная), клеточная и гистогенная
дифференциация, морфогенетические и морфофизиологические корреляции,
способность к пролиферации. В их развитии существуют критические
стадии: заложение первых перегородок, дифференциация на органы,
автономность и т. д. Как половые, так и соматические зародыши ха-
648 Семя
рактеризуются огромным полиморфизмом, среди тех и других
существуют переходные формы, а также аномалии;
адаптивная эволюция привела к разнообразным путям решения как
первых (например, разные типы и вариации эмбриогенеза), так и
последующих этапов морфогенеза и реализации перехода «гемморизо-
генез <± эмбриогенез, эмбриоидогенез» («почка <± зародыш»);
параллелизм между половым и соматическим зародышами,
формирующимися in situ и in vitro, проявляется в общих чертах,
характерных для анцестральной формы (таких, как полярность, симметрия,
форма, система градиентов и т. д.). Важнейшими являются
полусферическая и сферическая формы инициалей, яйцеклетки, зиготы и
зародыша, а также апексов побега и корня. В любой зиготе,
зародыше, независимо от типа эмбриогенеза и от вида растения,
заложена вся генетическая информация о характере делений в про-
эмбрио и о последующих морфогенетических событиях. В процессе
эволюции для каждого таксона закрепился свой тип эмбриогенеза,
однако более полная реализация исходного морфогенетического
потенциала, как в половом, так и в соматическом зародыше, может
происходить обычно в стрессовой ситуации (культура ткани,
гибридизация, мутации и т. д.). Рис. 60—62.
Батыгина, 1962а, б, 1974, 1978, 1987, 1992, 1993а, б, 1994, 1996; Батыгина,
Васильева, 19836; Батыгина и др., 1978, 1984; Камелина, 1987; Колесова,
Батыгина, 1988; Наумова, 1981; Пашков, 1951; Снегиревская, 1964; Терёхин, 1977;
Терёхин, Никитичева, 1968, 1981; Шамров, Батыгина, 1984, 1988; Шамров,
Никитичева, 1992; Яковлев, Алимова, 1976; Batygina, 1984, 1989а, Ь, с, 1990,
1991, 1992, 1996; Batygina, Bragina, 1996; Batygina, Vasilyeva, 1981, 1982;
Batygina et al., 1990, 1992a, b, 1993; Bragina et al., 1995; Brown, 1956, 1965; Button et
al., 1974; Evans et al., 1981; Esau, 1965; Goebel, 1932; Guignard, 1961; Guttenbervon,
1960; Haccius, Padmanabhan, 1985; Halperin, 1967, 1970; Jurgens, 1995; Kapil et
al., 1968; Komamine et al., 1992; Konar et al., 1972; Maheswaran, Williams, 1985,
1986; Maheshwari, 1950; McVeigh, 1938; Pankow, von Guttenberg, 1957; Petru, 1970;
Roth, 1957, 1961; Sharp et al., 1980, 1982; Soueges, 1934, 1935a-c, 1936a-d, 1937,
1939a, b; Swamy, Krishnamurthy, 1981; Vasil, Hildebrandt, 1966; Velenovsky, 1907;
Veyret, 1965; Williams, Maheswaran, 1986.
Семя
649
ЧАСТЬ IV — СЕМЯ
СЕМЯ — единица диссеминации, свойственная семенным растениям;
развивается на материнском растении из семязачатка и содержит
зачаточное дочернее растение1 (зародыш) и специализированную
запасающую ткань (эндосперм, перисперм и др.), окруженные защитным
покровом — семенной кожурой. Синоним: диаспора.
Семена различаются по форме, величине, структуре поверхности,
окраске, а также по внутреннему строению. Исключительно
разнообразна общая форма семени: оно может быть шаровидным, округлым,
эллипсовидным, яйцевидным, веретеновидным, почковидным, чечевице-
образным или линзовидным, кубаревидным, грушевидным, вогнуто-
выпуклым, двояковыпуклым, плоско-выпуклым, сплюснутым, плоским,
дисковидным, линейным, цилиндрическим, призматическим, угловатым,
треугольным и иной формы.
Сильно колеблется и размер семян. Обычно они невелики, лишь
изредка достигая 1 см длины. Очень мелкие — пылевидные семена, почти
неразличимые простым глазом и обладающие ничтожной массой,
свойственны, в частности, видам сем. Orchidaceae и многим паразитным
цветковым растениям. Крупные семена встречаются у многих Fabaceae
(особенно у лиан из p. Entada), у видов p. Aesculus, у некоторых Cucurbitaceae
(например, у Sechium edule) и др. Самые крупные семена известны у
представителей сем. Агесасеае; у Lodoicea maldivica они достигают 50 см
в диаметре и весят до 15—20 кг.
Форма, размеры и масса семени у одного и того же вида могут
заметно колебаться (ср. гетероспермия) или быть практически
неразличимы. У некоторых видов семена отличаются исключительным
постоянством признаков, как, например, у Ceratonia siliqua; в прошлом
семена этого растения служили у ювелиров мерой веса (карат).
По характеру светопреломления поверхности семя бывает блестящим,
сильно блестящим или глянцевитым, жирно- или маслянисто-блестящим,
как бы лакированным, или вовсе лишенным всякого блеска, т. е. матовым.
Семя часто лишено всякого опушения; такое семя называют голым.
Однако семя бывает и опушенным — с опушением шелковистым,
бархатистым, шерстистым; покрытым отдельными волосками —
волосистым, иногда жесткими волосками и т. д. Поверхность семени силь-
1 п
В семенах многих видов цветковых растении наряду с дочерним зародышем
формируется зародыш материнского происхождения (см. Эмбриоидогения).
650
Семя
но варьирует, она может быть совершенно гладкой, т. е. лишенной
каких бы то ни было выступов или углублений. Часто, однако, семя
бывает шероховатым, желобчатым, бороздчатым, ребристым,
морщинистым, сетчатым, ячеистым, ямчатым, бугорчатым, точечным и т. д.
Различаются семена и по окраске. Часто семя темное, черное, буро-
коричневое, реже серое, желтое, зеленое, белое и иной окраски и
оттенков.
Семя обычно прикреплено в плоде фуникулусом, но изредка оно
оказывается прикрепленным непосредственно к плаценте; такое семя
называют сидячим. Иногда зрелые семена свисают на нитевидных фуни-
кулусах. Важным систематическим признаком для некоторых семейств
(например, для Chenopodiaceae) является расположение семян в плоде.
В связи с этим различают семена вертикальные и горизонтальные.
Семена часто снабжены разного рода придатками (присемянниками,
ариллусами) и выростами, например крыловидными; иногда семя
снабжено пучком волосков.
При сравнительно-анатомическом изучении семени учитываются
происхождение и структура его покровов, наличие, степень развития,
природа и структурные особенности запасающих тканей (перисперма,
эндосперма), степень дифференциации зародыша, его форма,
положение в семени, количественное соотношение тканей зародыша и
эндосперма, их относительное участие в запасании веществ и т. п.
Особое значение для характеристики определенных таксономических
групп растений имеют детали строения таких частей семени, как
рубчик и рафе, микропиле и халаза (см. Семязачаток; Микропиле;
Халаза, Т. 1). В зоне микропиле ткани интегумента, а иногда и
нуцеллуса при развитии семени часто трансформируются, образуя
зародышевую крышечку, микропилярный воротничок и другие
структуры, различающиеся у разных растений по происхождению и строению.
Специфическими чертами строения обладает у ряда таксонов и хала-
зальный район семени (см. Новый подход к трактовке структур
базальной области семязачатка; Гипостаза; Подиум; Постамент,
Т. 1). Рис. 63.
Данилова, Кирпичников, 1985.
СЕМЕННАЯ КОЖУРА — покров семени, в образовании которого
принимают участие интегументы, а в ряде случаев также другие части
семени (нуцеллус, халазальная ткань и др.). Синонимы: теста (в
широком смысле), спермодерма.
Термин «теста» (лат. testa — скорлупа) ввел Gaertner (1788) для-
обозначения наружной жесткой оболочки семенной кожуры. Термин
«тегмен» (фр. tegument — мембрана, покров) предложил Mirbel
(1829) для обозначения внутренней оболочки семенной кожуры (см.
Шамров, 1995). По предложению Corner (1976), термином «теста»
большинство современных авторов обозначают только ту часть семен-
Семя
651
ной кожуры, которая является производным наружного интегумента, в
отличие от «тегмена» — производного внутреннего интегумента.
В зависимости от преобладающего участия того или другого
интегумента в формировании семенной кожуры различают тестальные или
тегмальные семена. В тестальных семенах внутренний интегумент в
процессе формирования семени разрушается полностью, сохраняясь в
семенной кожуре только в виде бесструктурной пленки, в которой
лишь иногда различимы очертания клеточных оболочек сжатых,
лишенных содержимого клеток. Для группы тегмальных семян специфичным
является полное разрушение наружного интегумента в ходе созревания
семян и специализация внутреннего интегумента. Участие в
формировании семенной кожуры обоих интегументов (тестально-тегмальные
семена) также распространено. Инода в семенную кожуру органически
включаются ткани присемянника.
Происхождение семенной кожуры из наружного или внутреннего
(или обоих) интегументов учитывается в сравнительной анатомии
семян как одна из основных характеристик. Однако только в редких
случаях все ткани интегумента (интегументов) трансформируются в
семенную кожуру. Часть клеточных слоев интегумента облитерируется,
и только один или несколько таких слоев, дифференцируясь, образуют
собственно защитный покров семени. Участие тех или иных слоев
интегументов в формировании защитного (механического) слоя
семенной кожуры, согласно Corner (1976), имеет важное значение для
классификации семян и таксономии.
Семена могут быть классифицированы в соответствии с тем, к какому
слою тесты или тегмена (или обоих этих компонентов семенной кожуры)
относится защитный (механический) слой. Всего может быть выделено
более 20 различных комбинаций в расположении защитных слоев в
семенной кожуре. Приведем некоторые из них: 1) экзотестальное семя
(механический слой формируется на основе наружной эпидермы
наружного интегумента, образуя экзотесту); 2) экзо-мезотестальное семя
(механические слои формируются на основе наружного интегумента и ин-
тегументальной паренхимы); 3) экзо-эндотестальное семя (механические
слои включают наружную и внутреннюю эпидермы наружного
интегумента); 4) эндотестальное семя (механический слой формируется на
основе внутренней эпидермы наружного интегумента); 5) экзотегмальное
семя (механический слой дифференцируется в наружном слое
внутреннего интегумента); 6) эндотегмальное семя (в формировании
механического слоя семенной кожуры участвует преимущественно эндотегмен);
7) экзотестально-эндотегмальное семя (механические слои в наружной
эпидерме наружного интегумента и внутренней эпидерме внутреннего
интегумента); 8) семя, кожура которого лишена механических слоев и
представлена в виде бесструктурной пленки.
В процессе трансформации отдельных слоев интегументов в
механическую ткань оболочки клеток инкрустируются веществами различной
природы. У большинства двудольных растений основным инкрустиру-
652
Семя
ющим соединением является лигнин, у однодольных чаще встречается
фитомелан и флобафены. Черный пигмент фитомелан откладывается
преимущественно в клетках наружной эпидермы тесты, при этом
клеточная структура часто становится неразличимой и образуется
сплошная меланиновая корка. У ряда однодольных эта корка достигает
значительной толщины, так как в ее состав включаются подстилающие
эпидерму слои интегументальной паренхимы (роды Astella, Cordyline,
Geitenoplesium, Dianella, Hypoxis, Hereria и др.).
Наличие меланина в семенах из ягод и ягодообразных плодов
расценивают как доказательство вторичного и недавнего происхождения
этих плодов (Huber, 1969; Dahlgren, Clifford, 1981). У Asphodelaceae
меланиновая корка оказывается только в третьем или в четвертом слое
от поверхности, так как над ней располагаются ткани ариллуса,
участвующие в формировании семенной кожуры.
Флобафены откладываются в клетках наружной эпидермы гораздо
реже; встречаются они в тестальной паренхиме или эндотесте
(Hypoxidaceae, Philydraceae, Stemonaceae, Dioscoreaceae, Flagellaria-
ceae, Musaceae), но не в экзотесте. Чаще же всего их обнаруживают
в тканях тегмена.
На примере пор. Liliales прослежена корреляция между развитием
многослойной тесты и отложением меланина с образованием меланиновой
корки. В большинстве семейств это тестальные семена, в которых
внутренний интегумент разрушается в процессе развития семени. В тех
семействах, где меланиновая корка как таковая отсутствует, семена, как
правило, имеют в той или иной степени развитый тегмен с флобафенами
в качестве инкрустирующих веществ (Данилова и др., 1990).
Производные дубильных веществ — флобафены и меланины — окрашивают
семена в красно-коричневый или черный цвет. Как сказано выше, для
многих двудольных, а также для ряда Однодольных характерна
бесцветная семенная кожура, состоящая из клеток, лишенных содержимого, но
сохраняющих форму за счет лигнификации клеточных стенок. Huber
(1969) считает, что в пор. Liliales этот признак — наиболее
примитивный. Он выявлен в семействах Melanthiaceae, Iridaceae, Velloziaceae,
Alstroemeriaceae и других из этого порядка. Однако лигнин обнаружен
в семенной кожуре и в некоторых других порядках однодольных, в
частности, Burmanniales, Bromeliales, Commelinales, Pandanales, Arales. Как
видно из этого перечня, лигнин в семенах встречается и среди
высокоорганизованных таксонов, где в ряде случаев он полностью вытесняет
другие инкрустирующие соединения. В связи с этим вряд ли можно
полностью согласиться с мнением о примитивности лигнифицированной
семенной кожуры.
Из прочих инкрустирующих веществ в семенной кожуре и перикарпии
встречается кремнезем. В качестве включений в клетках семенной
кожуры наиболее обычны кристаллы и рафиды оксалата кальция.
Специальные кристаллоносные слои обычно используются в качестве хороших
диагностических признаков для ряда семейств однодольных (например,
Семя
653
Dioscoreaceae и Agavaceae). Среди двудольных кристаллоносный слой
имеют семена видов Magnolia, Miristica, Aristolochia, Ribes, Liqui-
dambar, Carica, Drosophyllum, Oenothera, а также представителей
семейств Geraniaceae, Oxalidaceae, Meliaceae, Polygalaceae, Aceraceae,
Myrtaceae, Vitaceae, Tiliaceae, Proteaceae, Lythraceae, Primulaceae,
Dioscoreaceae, Violaceae и др.
Особым вниманием исследователей пользовались семена с
многослойной и сочной семенной кожурой, так называемой «саркотестой»
(Зажурило, 1940; Тахтаджян, 1948; Pijl van der, 1955; Corner, 1976).
Саркотестальные семена встречаются иногда среди однодольных, но
более распространены у двудольных. Этот признак ряд ботаников
определяет как характерный для исходного типа строения семян.
Примитивной семенной оболочкой покрытосеменных Зажурило (1940)
считал оболочку с мощно развитым периферическим слоем из живых
паренхимных клеток, свойственную Magnolia. Он предполагал, что
такой тип семенной оболочки является исходным не только для сем.
Magnoliaceae, но и для покрытосеменных в целом.
Среди однодольных семена с саркотестой встречаются у Ornithoga-
lum, Pushkinia, Eucomis, Bomaria и др. У видов сем. Агасеае
присутствует ослизняющаяся саркотеста. Вообще же семена с ослизняющи-
мися покровами — это преимущественно наружная эпидерма тесты —
представлены в обоих классах Magnoliophyta. Это явление получило
название «миксоспермии» (Grubert, 1974). Миксоспермии
приписывают две функции: 1) рассеивания семян на дальние расстояния и
прикрепления к покровам животных и 2) закрепления диаспор (семян и
плодов) в почве в непосредственной близости к материнскому
растению, что очень важно, например, для растений аридных районов
произрастания (Fahn, Cutler, 1992).
Слизеобразование может быть свойственно всем эпидермальным
клеткам семенной кожуры или может быть приурочено только к
специализированным железистым клеткам или железистым волоскам.
Электронно-микроскопические исследования показали, что эти клетки
обладают структурой, типичной для секреторных клеток,
синтезирующих полисахаридную слизь (Hyde, 1970). В ходе развития семени
эпидермальные клетки обычно увеличиваются в размерах и секретиру-
ют слизь в периплазматическое пространство. Ко времени созревания
семени слизь обычно заполняет почти весь объем слизеобразующей
клетки, а протопласт в виде крошечного комочка остается около одной
из стенок (Fahn, 1990). При подсыхании объем слизи уменьшается,
а при намачивании семян разбухшая слизь обычно разрывает
клеточные стенки и выходит на поверхность, обволакивая все семя. Пример
специфической адаптации миксоспермии к условиям прорастания семян
представляет собой многолетнее пустынное растение Blepharis ciliaris,
у которого железистой функцией обладают только верхушечные клетки
многоклеточных волосков. При высыхании они способствуют плотному
прилеганию волосков к поверхности семени, при увлажнении они рас-
654
Семя
правляются, отодвигаются друг от друга благодаря спиральным
утолщениям стенок и ориентируют семя по отношению к субстрату
(Gutterman, Witzum, 1977 — цит. по Fahn, Cutler, 1992).
В формировании покровов семени участвуют структуры, которые по
своему происхождению могут относиться к фуникулусу или интегумен-
там, но дифференцируются в качестве разного рода придатков:
ариллусов и ариллоидов, крыльев, летучек, волосков, мешочков и т. п.,
имеющих обычно большое биологическое значение и вместе с тем
составляющих важные таксономические признаки.
У ряда групп растений семена приобретают уникальные
характеристики за счет морфогенетической активности их микропилярного и хала-
зального участков. Безусловное значение для установления родственных
отношений между таксонами имеют наличие, природа и способ
формирования такой специализированной структуры, как семенная
(зародышевая) крышечка, встречающаяся у ряда однодольных и некоторых
двудольных растений. Наиболее специализированная крышечка встречается
у представителей порядков Zingiberales и Commelinales. Зародышевая
крышечка строится главным образом на основе наружного интегумента,
и ее развитие сопровождается формированием так называемого
микропилярного воротничка, возникающего вследствие локальной активности
клеточных делений в микропилярной зоне наружного интегумента. В
других случаях развитие зародышевой крышечки не сопровождается
формированием микропилярного воротничка (семейства Philydraceae, Ara-
ceae, Lemnaceae). У представителей сем. Hydatellaceae зародышевая
крышечка формируется за счет внутреннего интегумента. Также при
участии внутреннего интегумента формируется зародышевая крышечка
в сем. Мауасасеае, что отличает это семейство от сем. Commelinaceae.
Среди двудольных зародышевая крышечка известна в семействах На-
loragaceae, Nymphaeaceae, Penaeaceae и др.
В некоторых таксонах двудольных семенные покровы формируются
с большим или меньшим участием халазы. При разрастании халазы в
одном направлении или в разных направлениях возникают особые типы
семян. Перихалазальное семя — семя, у которого проводящий пучок,
идущий от фуникулуса, продолжается до микропиле, а интегументы
сливаются друг с другом в медианной плоскости семени почти на всем
протяжении и обособляются только возле самого микропиле.
Предполагается, что такое строение семени складывается в процессе развития
за счет интеркалярного разрастания халазы в медианной плоскости.
Пахихалазальное семя — семя, покров которого формируется главным
образом за счет разрастающейся во всех направлениях халазы, в то
время как интегументы, оба или один из них, остаются в
редуцированном состоянии только на микропилярном конце. При этом семенная
кожура может быть пронизана большим числом проводящих пучков,
эндосперм часто руминирован.
Среди признаков строения семени, имеющих важное
таксономическое значение, в последние годы особый интерес приобрели признаки
Семя
655
скульптуры поверхности. В зависимости от происхождения различают
первичную, вторичную и третичную скульптуру поверхности (Barthlott,
1981, 1984). Первичная скульптура формируется за счет расположения
и формы эпидермальных клеток семенной кожуры; различного рода
кутикулярные образования, а также всевозможные выросты наружных
стенок эпидермальных клеток формируют вторичную скульптуру;
наконец, микроморфология отложений эпикутикулярного воска
характеризует третичную скульптуру поверхности семян. Рис. 64.
Данилова, Кирпичников, 1985; Данилова и др., 1990; Зажурило, 1940; Комар, 1985,
1996; Меликян, 1988; Немирович-Данченко, 1988; Савченко, 1973; Савченко,
Комар, 1965; Тахтаджян, 1948; Шамров, 1994, 1995; Barthlott, 1981, 1984; Вое-
sewinkel, Bouman, 1984; Corner, 1976; Cutler, 1992; Dahlgren, Clifford, 1981; Fahn,
1990; Fahn, Cutler, 1992; Fahn, Loesener, 1930; Grubert, 1974; Gutterman, Witzum,
1977; Huber, 1969; Hyde, 1970; Pijl van der, 1955.
656
Семя
ЧАСТЬ V — ПОКОЙ И ПРОРАСТАНИЕ СЕМЯН
ПОКОЙ СЕМЯН
Рост растения начинается с прорастания семени. Возобновление
роста зародыша включает важные процессы, которые составляют
предмет изучения разных наук. Изучение таких процессов, как покой и
прорастание семян, несомненно является одним из приоритетных
направлений физиологии растений, и именно с этих позиций будет
рассмотрен материал в настоящей статье.
Зрелые семена многих растений, попав в соответствующие условия
(влажность, температура, аэрация), прорастают довольно быстро.
Однако семенам подавляющего большинства дикорастущих, а также
многих культурных растений присуще состояние покоя. Различают покой
вынужденный и органический (Гребинский, 1961; Николаева, 1967).
Вынужденный покой вызывается внешними причинами —
отсутствием влаги, неблагоприятными для прорастания температурными или
световыми условиями. Семена, находящиеся в органическом покое,
не способны прорастать даже при наличии всех благоприятных для
этого процесса условий. У некоторых видов покой семян настолько
глубок, что для их прорастания необходима длительная специальная
предпосевная подготовка. В естественных условиях прорастание таких
семян начинается через несколько месяцев, а нередко — через 1—2
года после посева, и появление всходов может растягиваться на
несколько лет. Способность находиться в состоянии вынужденного
или органического покоя предотвращает преждевременное прорастание
семян, способствуя выживанию видов и созданию банка семян в
почве.
Следует подчеркнуть следующий момент, на который, как правило,
не обращается внимание в литературе, посвященной данной проблеме.
Возникнув в процессе эволюции как адаптивное свойство для
перенесения (переживания) неблагоприятных внешних условий, прохождение
покоя (латентного периода) стало необходимой частью онтогенеза.
Нормальное растение может вырасти из семян, имеющих покой,
только после соответствующей обработки последних. В противном случае
проростки, которые иногда могут образовываться из покоящихся
семян, характеризуются карликовостью и нарушением нормального
развития междоузлий. Обычно они образуют растения розеточного типа,
что было показано на примере семян Acer tataricum (Николаева и др.,
1974) и некоторых плодовых (Come, 1980/81).
Покой и прорастание семян
657
Глубина органического покоя семян, причины, его вызывающие, и
условия его преодоления сильно варьируют у разных видов. Поэтому
систематизация всего многообразия проявления покоя семян представляет
собой сложнейшую задачу, подойти к решению которой пытались многие
исследователи. Первая классификация типов покоя семян была
предложена Croker (1916), в которой он выделил 7 типов покоя на основании
причин, определяющих замедленное прорастание семян. Сходная
классификация типов покоя для семян древесных растений была разработана
Шумилиной (1949). Все последующие попытки систематизации типов
покоя (Vegis, 1964), как и упомянутые выше, несомненно помогают
разобраться в некоторых сторонах этого сложного явления, но не дают
отчетливого представления об отдельных типах покоя семян.
В настоящее время наиболее полной является классификация,
разработанная Николаевой в 1967 году и дополненная ею в последующие
годы (Николаева, 1977, 1982). В основу классификации были
положены взаимоотношения между причинами торможения прорастания и
условиями их устранения. В пользу этой классификации говорит тот
факт, что вновь обнаруживаемые типы покоя семян легко находят в
ней свое место (см. табл.).
По данной классификации все существующее в природе
многообразие проявлений органического покоя подразделяется на 3 группы:
экзогенный, эндогенный и комбинированный покой.
В первую группу входят три типа экзогенного покоя (физический,
слабый и сильный), которые определяются исключительно свойствами
внешних покровов и, главным образом, околоплодника. Следует
подчеркнуть, что автором классификации семена рассматриваются в том
виде, в каком они отделяются от материнского растения и
распространяются в природе. Это могут быть семена как таковые, плоды или их
части. Околоплодник представляет собой дополнительное, а в
отдельных случаях (у плодовых, орехоплодных) основное препятствие при
прорастании семени. Наиболее характерным примером экзогенного
покоя является твердосемянность. Явление твердосемянности широко
распространено в растительном мире и встречается у представителей
семейств Mimosaceae, Fabaceae, Malvaceae, Tiliaceae, Caesalpiniaceae,
Cannaceae и др. Из экзогенного покоя семена выводят путем
нарушения целостности окружающих их покровов. С этой целью семена
подвергают различным температурным воздействиям, а также физическим
и химическим обработкам (Попцов, 1976).
Ко второй группе (типы эндогенного покоя) Николаева относит
задержку прорастания, связанную, главным образом, со свойствами
зародыша, а также покровов, его окружающих. Эта группа объединяет
морфологический покой, разные по глубине типы физиологического и
морфофизиологического покоя.
Третья группа представлена типами комбинированного покоя,
которые обусловливаются сочетанием причин, определяющих экзогенный
и эндогенный покой.
42-828
658
Семя
Таблица. Классификация типов органического покоя семян
(Николаева и др., 1985)
Формула
покоя
Тип покоя
Причины
покоя
Условия
нарушения
покоя
Примеры
Типы экзогенного покоя (А)
Ai
А2
Аф
Собственно
экзогенные:
слабый
сильный
Физический
Тормозящее
действие околопл.:
слабое
сильное
Водонепрониц.
покровов
Удаление или
повреждение
околопл.,
промывание
плодов, длительная
тепл. или хол.
стратиф.,
некоторые другие
термические
воздействия
То же (кроме
промывания
плодов)
Скариф.,
термическое
воздействие,
обработка H2SO4 и
т.д.
Fraxinus japonica
Blume
Pistacia vera L.
Gleditsia triacanthos
L., Robinia
pseudoacacia L.
Типы эндогеииого покоя (Б и В)
Б
В
Bi
в2
Морфологический
Физиологические:
неглубокий
промежуточный
нз
ФМТ прорастания
ФМТ слабый
ФМТ средний
Тепл. стратиф.
Повреждение
покровов, короткая
хол. стратиф., сух.
хранение,
проращивание на
свету, обработка
ГБ и т.д.
Длительная
хол. стратиф.
и иногда
другие
воздействия
Аапопа crassiflora
Mart.
Triticum
aestivum L.„
Pinus
syhestris L.,
Impatiens
balsamina L.
Acer pseudoplatanus
L. (без околопл.),
Fraxinus viridis
Michx. (без
околопл.)
Покой и прорастание семян
659
Продолжение таблицы
Формула
покоя
Вз
Б—В
Б—В1
Б—В2
Б—Вз
Б-Bf
Б-Bf
БВ—В
Тип покоя
глубокий
Морфофизиологи-
ческие простые
неглубокий
промежуточный
глубокий
Морфофизиологи-
ческий глубокий
ЭПИКОТИЛЬИЫЙ
Морфофизиологи-
ческий глубокий
двойной
Морфофизиологи-
ческие сложные
Причины
покоя
ФМТ сильный
Сочетание НЗ и
ФМТ прорастания
ФМТ слабый
ФМТ средний
ФМТ сильный
Сочетание НЗ и
сильного ФМТ
развития апикотиля
Сочетание НЗ и
сильного ФМТ
прорастания и
развития эпикотиля
Сочетание НЗ и
ФМТ доразвития
зар. и прорастания
Условия
нарушения
покоя
Только длительная
хол. стратиф.
(в некоторых
случаях обработка
ГБ или ЦТК
сокращает
стратиф.,
расширяет ее
температурные
границы и даже
заменяет ее)
Двухэтапная
стратиф.: тепл.,
затем хол. или
обработка ГКз
То же, иногда
обработка ГКз
То же, но
обработка ГКз
стимулирует только
доразвитие зар.
Двухэтапная
стратиф.: в тепле
семена прорастают
и образуются
корни, затем хол.
стратиф. для
появления
способности к
росту побега
Четырехэтапная
стратиф.: тепл. —
для доразвития
зар., хол. — для
прорастания, опять
тепл. — для роста
корня, опять
хол. — для
появления способности
к развитию
эпикотиля
Примеры
Malus domestica
Borkh., Acer
tataricum L.,
Impatiens parviflora
DC.
Actinidia kolomikta
Maxim.
Alalia mandshurica
Rupr. et Max.
Panax ginseng
C. A. Mey.,
Euonymus europaea
Viburnum opulus L.
(без косточки)
Trillium erectum L.
42*
660
Семя
Окончание таблицы
Формула
покоя
БВ—Bi
БВ—В2
БВ—Вз
Тнп покоя
неглубокий
промежуточный
глубокий
Причины
ПОКОЯ
ФМТ слабый
ФМТ средний
ФМТ сильный
Условия
нарушения
ПОКОЯ
Хол. стратиф. или
обработка ГК.З
Хол. стратиф. и в
некоторой мере
•обработка ГК.З
Только хол.
стратиф.
Примеры
Aralia continentahs
Kitag.
Magnolia kobus
DC.
Типы комбинированного покоя (А—Б—В)
Различные
сочетания типов
экзогенного и
эндогенного покоя
Сложная
предпосевная
подготовка или
длительная
стратиф.
Для растений, обитающих в умеренном климате, наиболее
характерен физиологический тип покоя. Такой покой обусловлен пониженной
активностью зародыша, которая в сочетании с плохой
газопроницаемостью покровов образует двойной механизм торможения
(физиологический механизм торможения — ФМТ). Универсальным фактором,
устраняющим ФМТ, является действие на набухшие семена
пониженных температур (холодная стратификация). В зависимости от силы
действия ФМТ физиологический покой делится на три типа, границы
между которыми относительны: неглубокий, промежуточный и
глубокий.
Неглубокий физиологический покой проявляется во временной
задержке прорастания или в сужении диапазона температур, при которых
возможно прорастание. Этот тип покоя широко распространен у семян
сельскохозяйственных (хлебные злаки, виды Lactuca, Helianthus annuus)
и сорных (виды Xanthium, Hyoscyamus и др.) травянистых растений,
а также встречается у некоторых древесных пород (виды родов Pinus,
Betula, Corylus и др.). Неглубокий физиологический покой обусловлен
низкой ростовой активностью зародыша, который не может преодолеть
тормозящее действие окружающих его покровов. При удалении
последних или даже при их частичном повреждении семена с неглубоким покоем
хорошо прорастают. Обычно он нарушается в процессе сухого хранения
и под действием таких факторов, как кратковременная холодная
стратификация, проращивание при переменных температурах, действие света
Покой и прорастание семян 661
на набухшие семена, обработка семян нитратами, нитритами, тиомоче-
виной, гибберелловой кислотой (ГКз), а также повышенным
содержанием кислорода в атмосфере. У некоторых видов тип физиологического
покоя выражен неотчетливо: с одной стороны, для его устранения
необходима довольно длительная холодная стратификация, с другой —
зародыши, извлеченные из таких семян, могут прорастать без всякой
предварительной подготовки. Этот тип покоя называется промежуточным
и характеризуется ФМТ средней силы. Он наблюдается у семян таких
видов, как Acer negundo, A. pseudoplatanus, Fraxinus lanceolate., Prunus
armeniaca, видов Amaranthus и некоторых других растений. Сухое
хранение таких семян обычно ослабляет их покой, а обработка ГКз
стимулирует прорастание семян при условии удаления околоплодника или
косточки.
Глубокий физиологический покой свойствен семенам многих
древесных (виды родов Acer, Malus, Pyrus, Sorbus и др.) и травянистых
растений (некоторые виды Impatiens, Ambrosia и др.). Зародыши,
извлеченные из покоящихся семян, или не растут совсем, или трогаются
в рост медленно и в большинстве случаев, как упоминалось выше,
характеризуются физиологической карликовостью. Рост их носит
ненормальный характер: растут одна или обе семядоли, иногда растет гипо-
котиль, и на нем возникают опухолевидные образования, но корень
большей частью не способен к росту. Интактные семена приобретают
способность расти нормально только после воздействия на них пониженными
температурами, причем этот способ обработки долгое время не удавалось
заменить никакими другими факторами. Только в последние годы
удалось стимулировать прорастание таких семян при помощи гормональных
обработок.
О действии гормонов на прорастание семян, находящихся в
физиологическом покое, накоплен большой фактический материал, который
позволяет сделать некоторые обобщения (Разумова, Николаева, 1981).
У семян, покой которых связан с ФМТ прорастания, реакция на
обработку гиббереллинами зависит от глубины покоя, т. е. от силы
действия ФМТ. Известно, что у семян с неглубоким покоем гиббе-
реллины ускоряют прорастание, а у семян с глубоким покоем могут
стимулировать только рост изолированных зародышей. Обработка ГКз
не заменяет у интактных семян, находящихся в глубоком покое,
потребность в холодной стратификации, но в некоторых случаях (виды
Impatiens) может расширить диапазон температур, при которых
происходят стратификационные изменения. Сведения о действии цитоки-
нинов на семена с неглубоким покоем ограничены данными о
стимулирующем действии кинетина на прорастание светочувствительных
семян (виды рода Lactuca и др.). Установлено, что обработка семян
кинетином весьма перспективна для нарушения глубокого покоя у
некоторых видов Acer, но при условии удаления околоплодника.
Обработкой кинетином в сочетании с тиомочевиной и диметилсульфоксидом
можно устранить состояние покоя и у семян в околоплоднике {Acer,
662
Семя
Sorbus — Поздова, 1986; Разумова, 1987). В нарушении
физиологического покоя весьма эффективны также такие физиологически
активные вещества, как фузикокцин и жасмоновая кислота (Николаева и
др., 1987а). Следующая наиболее сложная группа семян с
затрудненным прорастанием характеризуется недоразвитием зародыша к моменту
диссеминации.
Прежде чем перейти к рассмотрению явления покоя у таких семян,
необходимо затронуть некоторые вопросы доразвития зародыша вне
материнского растения. Семена с недоразвитым зародышем являются
наименее изученными из всех типов семян. По мнению Грушвицкого
(1961), «...процесс развития зародыша в семени, опавшем с
материнского растения, оказывается как бы в нейтральной зоне между
позициями эмбриологов, изучающих этапы эмбриогенеза вплоть до
созревания семени на растении, и морфологов в узком смысле слова, которые
исследуют этапы онтогенеза, как правило, лишь с момента
прорастания семян». Следует, однако, сказать, что семена с недоразвитым
зародышем не были обделены вниманием эмбриологов, но эмбриогенез
у таких семян рассматривался вне связи с типом их покоя.
Степень развития зародыша в зрелых семенах у разных видов
может быть различной. У одних растений он глобулярный без признаков
дифференциации на органы (Hepatica nobilis, Paraquilegia microphyla,
Acanthopanax sessiliflorum), у других — на сердечковидной стадии
(Adonis vernalis, Helleborus purpurascens, некоторые виды рода Aconi-
tum). Размеры зародыша также сильно различаются. Так, у Ilex opaca
он составляет лишь 0,00004 часть эндосперма и может быть
обнаружен лишь под микроскопом (Иванова, 1967). Среди семян имеются и
такие, процесс формирования зародыша у которых при диссеминации
заканчивается на более поздних стадиях, когда уже явно выражены
семядоли, составляющие иногда более половины его длины (Corydalis
cava, Fumaria capreolata, Trollius altaicus, Nigella damascena, Heracle-
um sosnowskyi). Наконец, зародыши могут иметь не только
значительную степень дифференциации, но и крупные размеры. В качестве
примера можно привести семена некоторых видов Fraxinus и Еиопу-
mus (Николаева, 1979).
В филогенетическом аспекте семена с недоразвитым зародышем
характерны для наиболее древних семейств. Martin (1946) в своей
работе, основанной на изучении соотношения между размерами
зародыша и семени у 1287 видов, в основном североамериканских, выделяет
11 семейств, имеющих семена с недоразвитым зародышем. У 5 из них
(Aquifoliaceae, Araliaceae, Magnoliaceae, Papaveraceae, Ranunculaceae)
этот тип преобладает. Семена с недоразвитым зародышем встречаются
Особенности покоя семян с редуцированным зародышем, характерным для эпи-
фитных и паразитных растений, в данной статье не рассматриваются (см.
Редуцированные и недифференцированные зародыши).
Покой и прорастание семян
663
у отдельных представителей еще 6 семейств: Apiaceae, Berberidaceae,
Oleaceae, Liliaceae, Arecaceae, Smilacaceae. Грушвицкий (1961)
значительно расширяет этот список (до 38 семейств), • включив в него
многие семейства из порядков Magnoliales, Laurales, Ranales и др.
Установлено, что величина зародыша и степень его дифференциации
зависят от видовой принадлежности семян и географического
распространения видов (Попцов и др., 1981).
Семена с недоразвитым зародышем очень отличаются по биологии
прорастания. Способность к прорастанию таких семян, как известно,
в первую очередь связана с доразвитием зародыша. Поэтому в
литературе дискутировался (и обсуждается до настоящего времени)
вопрос о связи сроков прорастания семян с величиной их зародыша.
Ряд авторов (Валишина, Цингер, 1952; Попцов и др., 1981)
считают, что между этими показателями есть прямая зависимость.
Другие отрицают существование подобной корреляции. Более того,
зародышам некоторых растений, имеющих разную величину (Panax,
Euonymus), необходим одинаковый период для их доразвития.
Другая более сложная проблема — длительность всего срока
предпосевной подготовки (включающего доразвитие зародыша и нарушение
покоя), приводящей в конечном счете к прорастанию семян с
недоразвитым зародышем. Пролить свет на этот вопрос, на наш
взгляд, помогает классификация типов покоя семян, о которой
упоминалось выше (Николаева, 1967). В ней недоразвитие зародыша
рассматривается как фактор покоя семян. Такой покой носит
название морфологического, и чаще всего он наблюдается у
представителей тропической флоры и только лишь у некоторых растений
умеренной зоны (некоторые виды родов Aquilegia, Anemone,
Buplerum, Thalictrum, Lilium). Доразвитие зародыша у таких семян
происходит обычно при 20—30°С в течение короткого (реже
длительного) периода, после чего семена сразу прорастают.
У растений умеренных и субтропических широт недоразвитие
зародыша часто сочетается с ФМТ прорастания. Такой покой носит название
морфофизиологического. В зависимости от глубины физиологического
покоя, т. е. «силы действия ФМТ», Николаева (1985) выделяет
несколько типов морфофизиологического покоя семян. Нарушение
простого морфофизиологического покоя (неглубокий, промежуточный,
глубокий), как правило, происходит в ходе двухэтапной стратификации:
теплой (для доразвития зародыша) и холодной при 0—10°С (для снятия
ФМТ). Касаясь условий прорастания семян со сложными типами
морфофизиологического покоя, следует подчеркнуть, что часто в
естественных условиях, после посева, за осенний период в семенах не успевает
закончиться процесс доразвития зародыша, таким образом в зимний
период у них не может произойти нарушение покоя. Доразвитие
зародыша в таких семенах заканчивается только в течение следующего лета,
и, следовательно, ФМТ устраняется только во вторую зиму. Устранению
ФМТ, которое, как и в случаях с физиологическим покоем, происходит
664
Семя
только в условиях холодной стратификации, должно всегда
предшествовать доразвитие зародыша.
Среди способов, ускоряющих прорастание семян с недоразвитым
зародышем, наибольшее внимание уделялось обработкам фитогормона-
ми. Обработка семян ГКз ускоряет доразвитие зародыша и
способствует расширению диапазона температур, при которых происходит этот
процесс (виды семейств Araliaceae, Celastraceae, Ranunculaceae, Schi-
sandraceae). Однако ГКз действует неоднозначно у разных видов как
на процесс доразвития зародыша, так и на нарушение состояния
покоя. В тех случаях, когда недоразвитие зародыша сочетается с
неглубоким физиологическим покоем («слабый ФМТ») (Aralia cordata и
Aral'ta continentalis), обработка ГКз оказывается эффективной на
обоих этапах, т. е. ГКз не только заменяет теплую стратификацию, но
даже исключает необходимость холодной. У семян Aralia mandshurica,
покой которых, наоборот, достаточно глубок, намачивание семян в
растворе ГКз вызывает также энергичное прорастание в тепле
значительной части семян (Богданова, 1971).
В случаях глубокого морфофизиологического покоя, когда
доразвитие зародыша происходит в тепле, а снятие ФМТ на холоде
(например, у некоторых видов родов Bupleurum, Eleutherococcus, Euonymus,
Panax и др.), обработка семян ГКз позволяет полностью исключить
необходимость теплой стратификации, но не оказывает влияния на
длительность последующей холодной.
Среди семян с морфофизиологическим покоем имеются такие, у
которых доразвитие зародыша, как и снятие ФМТ, происходит только
при низкой температуре, около 0—3°С (сложный глубокий морфофи-
зиологический покой). У таких семян (виды родов Tulipa,
Heracleum — Разумова, Николаева, 1981; Fritillaria, Ornithogalum —
Поздова, Разумова, 1994; Osmorhisa, Erythronium и Delphinium —
Baskin С, Baskin Y., 1994, 1995) обработка ГКз не ускоряет
доразвитие зародыша и последующее прорастание. Кроме того, у семян
Fritillaria eduardii и F. raddeana, низкие температуры необходимы не
только для доразвития зародыша и прорастания, но и для снятия
эпикотильного покоя (Поздова, Разумова, 1994). Несколько
неожиданными оказались данные, полученные на семенах некоторых видов
рода Trollius, которые характеризуются глубоким
морфофизиологическим покоем и прорастают под действием холода (0—3°С) в течение
не менее 3—8 месяцев. Однако после обработки семян ГКз они
успешно прорастали при 18—20°С за 7—30 суток (Николаева и др.,
19876).
При рассмотрении данных о действии ГКз на прорастание семян с
морфофизиологическим покоем следует сказать, что у отдельных видов
(так же, как и у некоторых видов, характеризующихся
физиологическим покоем) ГКз расширяет температурный диапазон их прорастания.
Так, на примере видов рода Aconitum было показано, что ГКз
вызывает их прорастание при 9—10°С, в то время как в контрольном
Покой и прорастание семян 665
варианте при этой температуре имело место только доразвитие
зародышей (Поздова, Балмасова, 1994).
С помощью кинетина можно вызвать ускоренное прорастание
семян с морфофизиологическим покоем после того, как закончится
процесс доразвития зародыша либо в условиях теплой стратификации
(например, у Panax — Богданова, 1971), либо под влиянием
обработки семян ГКз (например, у Euonymus — Разумова, Николаева,
1981). В то же время обработка кинетином не ускоряет прорастание
семян, находящихся в сложном, глубоком морфофизиологическом
покое, что было установлено на примере Tulipa tarda (Николаева,
Разумова, 1973), а также видов родов Heracleum и Magnolia
(Разумова, 1978).
Сведения о морфолого-анатомических изменениях в процессе
доразвития зародыша крайне ограничены, однако имеющиеся
немногочисленные данные (Лодкина и др., 1971; Ляшук, 1971, 1972)
свидетельствуют о том, что в этот период происходят существенные изменения в
строении проводящей системы зародыша, дифференциация апексов
побега, тканей семядолей и др.
На примере семян Aconitum soongaricum (Поздова и др., 1994)
показано, что в момент опадения семени с материнского организма зародыш
находится на ранней торпедовидной стадии развития и дифференцирован
на семядоли, точку роста, зародышевый корень и гипокотиль. В процессе
доразвития зародыша наблюдалось значительное увеличение его
размеров, дифференциация в семядолях палисадного слоя мезофилла, развитие
примордия первого листа в почечке. Наиболее существенные изменения
отмечались в развитии проводящей системы зародыша.
Без заметных изменений остается лишь апикальная меристема
зародышевого корня. Процесс доразвития зародыша у изученного вида
начинался в широком диапазоне температур (20—22, 9—10 и 0—3°С).
Однако нормальное прохождение этапов дифференциации в процессе
его доразвития имело место только при 9—10°С.
Особая роль в процессе доразвития зародыша отводится комплексам
так называемых таблитчатых клеток, формирующихся в его различных
тканях и органах. О наличии таких комплексов клеток в осевых частях
зародышей зрелых семян Quercus и Castanea сообщал Ковалев (1974).
В зародыше семян Acer tataricum (физиологический покой), комплексы
таблитчатых клеток закладываются в области гипокотиля и зародышевого
корня еще в процессе созревания (Лодкина и др., 1971). У видов семян,
характеризующихся морфофизиологическим покоем — Euonymus euro-
paea, Fraxinus excelsior и Panax ginseng, их образование происходит
также в области гипокотиля и зародышевого корня в процессе доразвития
зародыша в специфических (в зависимости от вида) условиях: у
Euonymus europaea и Panax ginseng — в основном в конце теплого этапа
стратификации (18—20°С), у Fraxinus excelsior — после прохождения
теплой стратификации и перенесения семян в условия холодной
стратификации (0—3 С) (Ляшук, 1971). У Aconitum soongaricum таблитчатые
666
Семя
клетки формируются также в процессе доразвития зародыша, однако в
области основания семядолей. Подтверждено предположение, что
дифференциация таблитчатых клеток является необходимым условием для
осуществления прорастания семян: быстрое и одновременное растяжение
клеток в комплексах позволяет зародышу легко прорывать окружающие
семя покровы и вынести проросток на поверхность.
По мере совершенствования методических подходов к изучению
проблемы покоя семян и накопления экспериментальных данных
изменялись и представления о сущности процессов, происходящих в
семенах при нарушении состояния покоя (Khan, 1977). Следует
подчеркнуть, что главное внимание уделялось изучению процессов,
происходящих в покоящихся семенах под действием низких температур,
которые, как указывалось выше, являются основным фактором,
приводящим к нарушению эндогенного покоя. В 60 — 70 годах широкое
распространение получило представление о важной роли фитогормо-
нов в нарушении покоя семян. Гипотеза о ведущей роли
гормонального баланса была впоследствии конкретизирована (Кефели, 1974;
Николаева, 1977; Khan, 1977). Имеется в виду временная
последовательность гормональных изменений (абсцизовой кислоты, цитоки-
нинов, гиббереллинов), происходящих в семенах при выходе из
состояния глубокого покоя. Так, на примере некоторых видов рода
Acer было показано, что имеет место следующая последовательность
таких изменений: в начале холодной стратификации резко
уменьшается содержание абсцизовой кислоты, увеличивается активность ци-
токининов, после чего возрастает содержание гиббереллинов (Webb
et al., 1973a, b). Следует отметить, что до настоящего времени роль
абсцизовой кислоты в этом балансе остается наиболее спорной (Le
Page Degivry et al., 1990; Le Page Degivry, Garello, 1992), а
некоторыми авторами отвергается совсем (Николаева, 1991).
Обращает на себя внимание также тот факт, что в работах по
фитогормональной регуляции покоя семян почти не обсуждается роль
такого стимулятора, как индолилуксусная кислота (ИУК). Однако
работами Николаевой с соавторами (1974а,б) показано, что высокое
содержание ИУК и неравномерное ее распределение в зародыше семян
Acer tataricum является причиной его ненормального роста, вызывая
явление физиологической карликовости, о котором говорилось выше.
Накопление ИУК в супероптимальных концентрациях рассматривается
авторами как важный фактор индукции покоя. Снижение ее
содержания происходит у семян с глубоким физиологическим покоем только
тогда, когда они под действием холодной стратификации приобретают
способность к прорастанию.
Существует точка зрения, что состав и активность фитогормонов
изменяются под действием ферментов. Об этом свидетельствуют данные
по определению активности ферментов в семенах с неглубоким, а также
глубоким физиологическим покоем (Lewak et al., 1975; Biswas et al.,
1978; Николаева, 1982; Беккер, Николаева, 1984; Полякова и др.,
Покой и прорастание семян
667
1986). Более того, на примере кислой фосфатазы показано, что под
действием холодной стратификации в семенах A. tataricum появляются
новые изоферменты (Полякова, Николаева, 1990).
Таким образом, в изучении причин затрудненного прорастания
покоящихся семян на настоящий момент достигнуты определенные
результаты: установлены типы покоя и условия его нарушения у
многих видов (см. Справочник по проращиванию покоящихся семян,
1985), разработаны способы ускоренного проращивания покоящихся
семян с помощью комбинированного воздействия температур и
фитогормонов, выявлены определенные закономерности в реакции семян
представителей отдельных семейств и родов на экзогенное действие
гормонов.
Тем не менее разработка рассматриваемой проблемы далека от
своего завершения. Экспериментальные данные, на которых базируется
гипотеза о ведущей роли фитогормонов в индуцировании и нарушении
покоя семян, имеют разрозненный характер и в основном содержат
сведения по динамике и возможной роли отдельных гормонов у семян
некоторых видов. Остается также неясным механизм активации
ферментного аппарата под влиянием пониженных температур. И наконец,
как уже упоминалось выше, остается много «белых пятен» в изучении
биологии прорастания семян с недоразвитым зародышем. Вопрос о
том, как и при каких внешних воздействиях осуществляется
постэмбриональное развитие у данной группы семян, по существу, не изучен.
Решение его имеет принципиальное значение, так как выявление
основных этапов эмбриогенеза и факторов, определяющих их
прохождение, является важным как для понимания природы типа покоя,
характерного для семян определенного рода или вида, так и для разработки
методов их предпосевной подготовки. Рис. 65.
Беккер, Николаева, 1984; Богданова, 1971; Валишина, Цингер, 1952; Гребинский,
1961; Грушвицкий, 1961; Иванова, 1967; Кефели, 1974; Ковалев, 1977; Лодкина и
др., 1971; Ляшук, 1971, 1972; Николаева, 1967, 1977, 1979, 1982, 1991, 1993;
Николаева, Разумова, 1973; Николаева и др., 1974, 1985, 1987а, б; Поздова, 1986;
Поздова, Балмасова, 1994; Поздова, Разумова, 1994; Поздова и др., 1994;
Полякова, Николаева, 1990; Полякова и др., 1986; Попцов, 1976; Попцов и др.,
1981; Разумова, 1978, 1987; Разумова, Николаева, 1981; Шумилина, 1949; Baskin
С, Baskin J., 1994, 1995; Biswas et al., 1978; Come, 1980/81; Khan, 1977; Le Page
Degivry, Garello, 1992; Le Page Degivry et al., 1990; Lewak et al., 1975; Martin,
1946; Vegis, 1964; Webb et al., 1973a,b.
МОРФОЛОГИЯ И ФИЗИОЛОГИЯ ПРОРАСТАНИЯ СЕМЯН
Прорастание можно определить как последовательность событий,
которые заставляют сухое семя, находящееся в состоянии
вынужденного покоя, ответить на поступление воды подъемом общей ме-
668
Семя
таболической активности и инициировать образование проростка из
зародыша (Mayer, Poljakoff-Mayber, 1989). Прорастание начинается
с поглощения воды семенем и оканчивается формированием
проростка, способного к фотосинтезу. В жизненном цикле растения
прорастание предшествует ювенильному периоду жизни.
Прорастание включает:
1) период «раннего прорастания» — от начала набухания до
наклевывания семени (прорыва семенной кожуры кончиком корня);
в течение этого периода происходят активация метаболизма и
подготовка осевых органов зародыша к началу роста клеток
растяжением;
2) период формирования проростка — от проклевывания корня
до завершения формирования автотрофного проростка; он включает
в себя переход к активному росту осевых органов, приводящий к
выносу над поверхностью земли почечки, в ряде случаев и
семядолей, и к углублению корня в почву; этот период завершается
зеленением и ростом листьев, а также формированием корневой
системы.
Мобилизация запасных веществ не является непосредственным
компонентом прорастания, но обеспечивает начало роста в первом периоде
(за счет запасных отложений в самих осевых органах) и интенсивный
рост в течение второго периода (за счет запасающих органов или
тканей семени).
Типы прорастания. При гипогеальном (греч. hyp, hypo — под и
geo, geus — земля) прорастании семядоли остаются под землей, не
зеленеют, не растут и играют роль вместилища запасных отложений.
Первым начинает расти гипокотиль, выталкивая зародышевый корень
из семени. Гипокотиль растет недолго, увеличиваясь в длину в
несколько раз. Сам корень трогается в рост после проклевывания.
Последним начинает интенсивно расти эпикотиль, выносящий наверх
почечку с примордиями листьев. Гипогеальное прорастание характерно,
например, для семян гороха, бобов, дуба и конского каштана.
При эпигеальном прорастании (греч. epi — на и geo, geus — земля)
семядоли выносятся над землей и превращаются в семядольные листья.
Корень начинает удлиняться первым, прорывает семенную кожуру.
После ускорения роста корня начинает быстро расти гипокотиль,
вынося над почвой семядоли и заключенную между ними почечку.
Примеры семян с эпигеальным типом прорастания: фасоль, огурцы,
томаты, хлопчатник, редис, подсолнечник.
У однодольных растений формирование проростка также происходит
по гипогеальному (Роасеае) или эпигеальному (АШасеае) типу
(Васильев и др., 1978).
На клеточном уровне начало роста при обоих типах прорастания
происходит одинаково — за счет растяжения клеток, без участия
деления.
П,
окои и прорастание семян
669
Гипогеальное
прорастание
Эпигеальное
прорастание
проклевывание корня
начало
растяжения
клеток
гипокоти-
ля
начало
начало
растяже- делений
ния
клеток
корня
проклевывание
клеток
кория
корня
начало
растяжения
клеток
эпикотиля
начало
растяжения
клеток
корня
начало
делений
клеток
корня
начало
растяжения
клеток
гипокоти-
ля
начало
делений
клеток
гипокоти-
ля
Проклевывание
корня — результат
растяжения
апикальных клеток
гипокотиля
Проклевывание
корня — результат
растяжения
базальиых клеток корня
У гипогеально прорастающих семян деления в корневой меристеме
начинаются всегда несколько позже начала роста гипокотиля
(например, у конского каштана — через 40 ч, у кормовых бобов — через
20 ч, у гороха — через 4 ч). У эпигеально прорастающих семян
деления в корне происходят после начала растяжения в нем, также в
разные сроки после проклевывания (например, у хлопчатника — через
10 ч, у фасоли — почти одновременно).
Растяжение клеток является обязательным для начала роста всех
органов зародыша (Обручева, 1982). Начало растяжения клеток и
подготовка к нему запускаются достижением критических уровней
оводненности, результатом чего является накопление осмотически-
активных веществ и размягчение оболочек клеток. В качестве
пусковых факторов деления клеток чаще всего рассматривают цитоки-
нины и ауксины, а также дигидрофуронан-оксиметилпиррол-карбо-
ксиальдегид (Evans et al., 1987). В процессе перехода клеток к
делению (выход из периода Gj) происходит синтез и удвоение ДНК
и образование белков, необходимых для прохождения митотического
цикла (Троян и др., 1983; Deltour, 1985; Doerner, 1994).
Корень — по существу первый из органов зародыша, который
начинает интенсивно расти после прорастания, обеспечивая доступность
воды. Рост остальных органов начинается позднее и осуществляет
доступ к свету — второе обязательное условие формирования
проростка.
В зародышевом корне первыми растягиваются базальные клетки,
формируя зону растяжения. Впоследствии зона растяжения
пополняется клетками образовавшейся меристемы. Сама меристема формируется
позднее, чем зона растяжения. У одних семян (например, горох,
конский каштан) меристема образуется за счет не перешедших к
растяжению апикальных и срединных клеток и сразу содержит обычное
количество клеток и имеет типичный размер. У других семян (дуб) не
переходят к растяжению только апикальные клетки, составляющие
небольшую меристему; в ней сразу начинается пролиферация клеток, в
результате чего размер меристемы возрастает до нормы. Формирова-
670
Семя
ние зональной структуры обеспечивает координацию между
образованием клеток и их растяжением вдоль оси корня, что необходимо для
быстрого удлинения (Обручева, 1982).
Другая структурная особенность корня, необходимая для
поддержания резерва инициальных клеток меристемы, — наличие в ней
покоящегося центра, представляющего собой группу апикальных клеток,
которые редко делятся, но способны быстро регенерировать меристему
при ее повреждении (например, под действием облучения или низких
температур). Покоящийся центр возникает еще в раннем эмбриогенезе,
когда образуются инициали корневого чехлика, а во время прорастания
выявляется при начале митотической активности в корне; по мере
ускорения делений его объем уменьшается вследствие перехода к
делению периферических инициальных клеток (Rondet, 1965; Byrne,
Heimsch, 1970; Vallade, 1972; Обручева, 1982; Иванов, 1987; Barlow,
1995).
Ускорение делений связано, вероятно, с изменением соотношений
между цитокининами, обнаруженными в периферических клетках
покоящегося центра, ауксинами, поступающими из более взрослых частей
корня, и абсцизовой кислотой, поступающей в меристему из корневого
чехлика. Ускорение растяжения можно интерпретировать как
изменение соотношения между ауксинами и гиббереллинами, синтезируемыми
в зоне растяжения (Jones, Phillips, 1966; Sitton et al., 1967; Robbins,
Harvey, 1969; Barlow, 1976; Zavala, Branden, 1983; Barlow et al.,
1991; Tanimoto, 1992; Muller et al, 1994).
Рост эпикотиля при гипогеальном прорастании начинается с
медленного растяжения базальных клеток, которое постепенно усиливается
по направлению к апексу, вовлекая вновь образующиеся клетки.
Деления клеток в эпикотиле гороха происходят ниже зачатка первого
листа в течение 2—5 дней. Тем самым достигается длительное, но
быстрое удлинение эпикотиля, обеспечивающее продвижение через
почву. На свету рост эпикотиля затормаживается как за счет
сокращения периода делений, так и за счет растяжения клеток до меньшей
длины (Nougarede, Rembour, 1980; Miyamoto, Kamisaka, 1988).
Рост гипокотиля при эпигеальном прорастании происходит также
долго и интенсивно и осуществляется аналогично: сначала медленное
растяжение базальных клеток, затем на его фоне начинается
интенсивное деление клеток в апикальной части. Дальнейшее удлинение
происходит только за счет растяжения клеток, распространяющегося к
апексу. Свет тормозит и деление, и растяжение клеток (Mohr, Peters,
1960; Hacker et al., 1964; Sakurai et al., 1974; Stuart et al., 1977;
Taylor, Cosgrove, 1989).
У злаков вынос надземных органов сквозь слой почвы происходит
за счет роста мезокотиля (междоузлия между семенем и первым
узлом), выталкивающего предохраняемый колеоптилем апекс стебля с
листьями. На свету проросток злаков растет за счет удлинения
листьев и стебля. Быстрый (часто длительный) рост гипокотиля, эпико-
Покой и прорастание семян
671
тиля или мезокотиля в темноте, происходящий путем интенсивного
растяжения имевшихся и образовавшихся клеток, обеспечивает прорыв
проростка к свету сквозь плотный и толстый слой земли, что
гарантирует выживание проростка.
Свет задерживает рост гипокотиля, эпикотиля и мезокотиля, но
стимулирует рост листьев. У двудольных растений лист растет в
результате делений растягивающихся клеток, достигая таким образом
60—70 /о окончательного размера; дальнейшее разрастание листовой
пластинки происходит за счет только растяжения клеток. У злаков
зона делений клеток находится в нижней части листа, клетки сначала
делятся, а затем растягиваются. Под действием света увеличивается
число клеток палисадной паренхимы листа и устьиц. В зеленеющих
листьях этиопласты превращаются в хлоропласты, которые затем
делятся, одновременно синтезируются хлорофилл и другие пигменты,
экранирующие действие света (Maksymovich, 1973; Dale, 1982;
Иванов, 1987). На свету в проростках начинаются процессы
фотоморфогенеза. Тем самым завершается формирование автотрофного проростка
из жизнеспособного семени.
Рассмотрим теперь ретроспективно всю совокупность процессов,
протекающих в воздушно-сухом семени с момента его контакта с
водой и завершающихся его наклевыванием, т. е. началом роста.
Поступление воды в семя. Прорастание начинается с момента
поступления воды в семя. Влажность воздушно-сухих семян перед
началом набухания составляет в среднем 10% на сырой вес. Для
большинства культурных растений нижним критическим уровнем
влажности, при котором еще сохраняется жизнеспособность семян, считают
5% (Ellis et al, 1989a-c).
Первой обычно набухает семенная кожура, после чего постепенно
увеличивается оводненность семядолей и осевых органов зародыша.
Скорость набухания зависит от доступности воды, размеров семени,
поверхности контакта семени с водой, степени проницаемости
семенных покровов, а также от температуры.
Семена различаются по влажности, достигнутой к моменту накле-
вывания, которая определяется их составом. Основными водо-
сорбирующими веществами являются белки, а также полисахариды
клеточной оболочки, крахмал и наружные слизи. Крахмалистые и
масличные семена поглощают меньше воды, чем белковистые. Осевые
органы поглощают воду быстрее и достигают более высокого уровня
влажности, чем запасающие органы и ткани; диапазон оводненности
осевых органов при проклевывании корешка составляет 63 — 80%
(на сырой вес) (Обручева, 1982; Mayer, Poljakoff-Mayber, 1989).
Типичная кривая зависимости поступления воды в семена от
времени имеет трехфазный характер: 1) резкий подъем — быстрое
набухание; 2) лаг-период — медленное набухание до наклевывания семени;
3) плавный подъем, связанный с началом растяжения клеток в осевых
органах (Bewley, Black, 1978, 1985).
672
Семя
Движущей силой поглощения воды семенами является разница между
водными потенциалами почвенного раствора и семени. Водный потенциал
воздушно-сухих семян очень низок и составляет от -400 до -50 МПа.
На первой фазе набухания он быстро увеличивается, т. е. становится
менее отрицательным, в результате чего способность семян насасывать
воду ослабевает. Во время лаг-периода водный потенциал медленно
повышается, приближаясь к нулю. Семена успешно начинают прорастать
при водных потенциалах в интервале от -1,0 до -0,1МПа. После на-
клевывания водный потенциал растущих органов несколько понижается
(Bewley, Black, 1978; Ross, Hegarty, 1979; Аскоченская, 1982).
В течение периода раннего прорастания меняется также
соотношение между составляющими водного потенциала, т. е. между
матричным, осмотическим и тургорным потенциалами. Матричный потенциал
обусловлен адсорбцией воды различными биополимерами клеток, а
также поступлением и удержанием воды в различных
микрокапиллярах. Быстрое набухание семян на первой фазе приписывается в
основном действию матричных сил и часто называется «физическим»,
поскольку мертвые или потерявшие всхожесть семена также способны
набухать. Роль осмотического потенциала на первой фазе набухания
невелика; он обусловлен присутствием ионов, Сахаров и других
растворенных веществ в тканях. В течение лаг-фазы роль матричного
потенциала незначительна, осмотический потенциал становится
доминирующим. В конце лаг-фазы в поступлении воды, по-видимому, начинает
участвовать тургорный потенциал. После проклевывания, на третьей
фазе, по мере интенсивной вакуолизации растягивающихся клеток
осевых органов, поступление воды обусловлено взаимодействием
осмотического и тургорного потенциалов; на этой фазе участие матричного
потенциала незначительно и сводится к связыванию воды вновь
образующимися клеточными структурами (Bewley, Black, 1978;
Аскоченская, 1982; Обручева и др., 1993).
Период раннего прорастания подразделяется на два этапа: 1)
активация метаболизма и 2) подготовка клеток осевых органов к началу
растяжения. Границей между ними является уровень оводненности
осевых органов, достигнутый за счет «физического» набухания, что
соответствует концу первой фазы набухания. Первый этап раннего
прорастания осуществляется как в семядолях, так и в осевых органах
зародыша. Он заключается в резком усилении всех процессов
основного (первичного) метаболизма, от крайне вяло протекающих в
воздушно-сухих жизнеспособных семенах до активно функционирующих,
сравнимых по интенсивности с таковыми у вегетирующих растений.
При набухании происходит гидратация всех ферментных белков,
изменение конформации их молекул и переход ферментов в активное
состояние (Bewley, Black, 1985; Mayer, Poljakoff-Mayber, 1989).
Поскольку дыхание является интегральным показателем
метаболизма, его усиление характеризует активацию основных метаболических
систем. Воздушно-сухие семена дышат очень слабо. Уже через 15 мин
Покой и прорастание семян
673
при беспрепятственном доступе воды интенсивность дыхания осевых
органов увеличивается в 10 раз. В семени с неповрежденными
покровами усиление дыхания происходит позднее, по мере постепенного
проникновения воды. Доминирующим дыхательным путем с самого
начала набухания является окисление субстрата через гликолиз — цикл
Кребса — электрон-транспортную цепь. Вместе с подъемом дыхания в
набухающих семенах усиливается фосфорилирование, обеспечивая
энергией основной метаболизм и последующее начало ростовых процессов
(Pradet, 1982; Asahi, Maeshima, 1983; Обручева, Ковадло, 1985).
В осевых органах скорость активации различных процессов первичного
метаболизма выше, чем в семядолях, из-за более быстрого повышения
оводненности; характер же активации и последовательность инициации
процессов одинаковы. Быстрое поступление воды в зародыши вызывает
как начальную активацию дыхания, так и превращения аминокислот и
кислот цикла Кребса, о чем свидетельствует появление Н3-аминокислот
и Н3- органических кислот при набухании зародышей в Н3гО. Позднее
начинается синтез сахарозы и липидов (Collins, Wilson, 1972). Синтез
белка в набухающих семенах также обнаруживается очень рано (в
семенах без кожуры — через 20 мин), что обусловлено наличием в сухих
семенах всех компонентов белоксинтезирующей системы (моносом,
тРНК, аминокислот, факторов инициации и элонгации), а также дол-
гоживущей (запасенной) мРНК, считываемой в самом начале
прорастания. Запасенные мРНК, синтезированные еще в формирующихся
семенах, кодируют синтез белков двух типов: 1) обеспечивающих
дальнейшее функционирование основного метаболизма и 2) типичных для
собственно прорастания; к ним относится, например, джермин, фитохром
и недавно открытый экспансии, необходимый для инициации растяжения
клеток (Брукер и др., 1982; Дюр, 1982; Aspart et al., 1984; Bewley,
Black, 1985; Grzelczak et al., 1985; Sato, Furuya, 1985; Cosgrove, Zhen-
Chang Li, 1993).
Синтез мРНК de novo при набухании начинается рано и
обеспечивает усиление синтеза белков. Вновь образованная мРНК через
несколько часов уже обнаруживается в составе функционирующих
полисом, тогда как полисомы, образовавшиеся из предсуществовавших
моносом и содержавшие долгоживущие мРНК, постепенно
разрушаются рибонуклеазами, в результате чего происходит обновление
белоксинтезирующей системы. Синтез ДНК начинается обычно позже
синтеза РНК и белков; он предшествует началу деления клеток (Осборн,
1982).
Таким образом, активация основных метаболических систем
происходит и завершается в течение первой фазы набухания. При наличии
воды эти силы обеспечивают автоматическое поступление ее в семена
до уровня 55—60% влажности и, следовательно, полную активацию
метаболизма. В нерастущих семядолях, оставшихся при гипогеальном
прорастании в почве, в течение дальнейшего прорастания сохраняется
данный уровень влажности и достигнутая активация метаболизма, их даль-
43-828
674
Семя
нейшая специфика заключается лишь в индуцированном синтезе
гидролитических ферментов, обеспечивающих интенсивную мобилизацию
основного фонда запасных веществ. В осевых же органах достигнутой
степени оводненности и активации метаболизма недостаточно для начала
ростовых процессов.
Процессы, подготавливающие растяжение клеток (второй этап
раннего прорастания), протекают только в осевых органах во время лаг-
фазы набухания, они начинают функционировать на фоне интенсивно
протекающего основного метаболизма, энергетической обеспеченности
и поступления веществ из собственных запасных фондов.
Физиологические механизмы, подготавливающие начало растяжения
клеток, должны обеспечить как поступление воды в клетки и их
вакуолизацию, так и увеличение пластичности клеточных оболочек.
Первым физиологическим механизмом является накопление
осмотически-активных веществ, что позволяет клетке поглощать новые
порции воды и повышать свою оводненность. Накопление эндогенных
осмотиков происходит за счет гидролиза крахмала и запасного белка,
а также фитина. При достижении осевыми органами 66—68%
влажности накопление осмотически-активных веществ становится столь
заметным, что обеспечивает дальнейшее поступление воды в клетки. Эти
процессы тесно связаны с образованием вакуолей по мере гидролиза
запасных белков и фитина в белковых телах. Усиление вакуолизации,
приводящее к формированию осмотического компартмента,
предшествует началу растяжения клеток.
Процесс накопления осмотически-активных веществ продолжается в
осевых органах и после проклевывания за счет притока сахарозы,
амидов и калия из семядолей (Pernollet, 1982; Обручева и др., 1993).
Однако усиления осмотического поступления воды недостаточно для
начала собственно растяжения клеток.
Второй физиологический механизм, подготавливающий растяжение
клеток, заключается в активации Н -АТФазы в плазмалемме
клеток осевых органов, что обеспечивает вынос протонов из цитоплазмы
в оболочку и ее разрыхление. Подкисление приводит к ослаблению
связей между компонентами клеточных оболочек и вызывает
активацию ферментов, гидролизующих частично гемицеллюлозу и пектин.
Участие протонной АТФазы подтверждается действием специфичных
ингибиторов и стимуляторов, в частности фузикокцина, на подкисление
осевыми органами окружающего раствора и на начало растяжения
клеток в них (Обручева, Антипова, 1994; Kutschera, 1994).
Функционирование обоих физиологических механизмов,
начинающееся незадолго до проклевывания, обеспечивает дальнейшее
поступление воды в клетки и увеличение их объема.
Мобилизация запасных веществ при прорастании. «Запасные
вещества растений представляют собой компактную форму хранения
активных метаболитов, которая остается инертной при созревании и
подвергается быстрому и в то же время дозированному использованию
Покой и прорастание семян
675
при прорастании» (Соболев, Жданова, 1982). В семенах культурных
растений содержание запасных веществ значительно превышает
потребности проростка, что вызвано селекцией растений, направленной
на повышение питательной ценности семян для человека.
Соотношение запасных белков, жиров, углеводов видоспецифично,
хотя семена условно подразделяются на крахмалистые,
высокомасличные и белковистые. В крахмалистых семенах соотношение белков,
жиров и крахмала составляет, соответственно, 10—15 : 2—4 : 60—75
(злаки, гречиха), в высокомасличных — 17 — 31 : 48 — 68 : 0,1 —12
(подсолнечник, арахис, клещевина), а в белковистых — 23—31 : 1 —
6 : 47—54 (бобовые).
Запасные вещества откладываются обычно в специализированной
запасающей паренхиме зародыша, а также в его осевых органах,
имеющих крупные клетки, например, в гипокотиле при гипогеальном
прорастании. Запасные белки находятся в алейроновых зернах (белковых
телах), имеющих вакуолярное происхождение и различающихся по
способу образования, составу белков и наличию глобоида. Сложные
алейроновые зерна содержат фитин в виде кристаллического глобоида,
простые — в форме фитин-белкового комплекса. Эти показатели
нельзя считать видоспецифичными, так как даже в семядолях одного и
того же растения (например, люпина желтого) клетки периферической
паренхимы содержат сложные алейроновые зерна, а центральные
слои — только простые. При прорастании белковые тела формируют
вакуолярную систему. Запасные липиды представлены обычно в виде
жировых капель (липидных телец), а крахмал, являющийся основной
формой углеводных запасов, локализован в крахмальных зернах.
Менее распространены галактоманнаны и другие маннаны,
откладывающиеся в клеточных оболочках эндосперма у семян некоторых бобовых,
лилейных, ирисовых, пальмовых и вьюнковых. Форма и размеры
крахмальных зерен являются видоспецифическим признаком (Seidemann,
1966; Соболев, Жданова, 1982; Pernollet, 1982; Соболев, 1985).
Триггером мобилизации запасных белков и крахмала при
прорастании является повышение оводненности до пороговых уровней.
Например, у кормовых бобов расщепление крахмала начинается при
достижении уровня влажности 45% (на сырой вес), а расщепление белка
— при 50%. В случае запасных белков такая гидратация, по-
видимому, обеспечивает модификацию и солюбилизацию запасных
глобулинов путем ограниченного протеолиза, после чего начинается
последовательный гидролиз модифицированных белков. Ход протеолиза
запасных белков различен у семян однодольных и двудольных
растений, что обусловлено, в первую очередь, видоспецифичным составом
запасных белков и их упаковкой при отложении в запас (Хавкин,
1982; Preston, Kruger, 1986; Wilson, 1986; Обручева и др., 1988;
Вайнтрауб и др., 1990).
Поскольку в осевых органах зародыша оводненность при набухании
повышается быстрее, чем в семядолях, мобилизация резервов в них также
43*
676
Семя
начинается раньше и обеспечивает подготовку и начало роста до притока
продуктов мобилизации из семядолей. Например, у семян сосны описан
более быстрый автолиз белковых тел в осевых органах, чем в эндосперме.
В осевых органах гороха половина собственных запасов белков
(альбумины) подвергается гидролизу еще до проклевывания, а другая
(глобулины) гидролизуется медленнее, во время проклевывания. Аналогично,
у кукурузы сначала подвергаются протеолизу глобулины в осевых
органах зародыша, а как долгосрочный резерв используются проламины
и глютелины эндосперма. Активная мобилизация запасных веществ в
семядолях начинается примерно тогда, когда завершается мобилизация
резервов, имевшихся в осевых органах. Из запасающих органов
передвигаются в осевые органы сахароза, амиды и калий, освобождающийся
при гидролизе фитина (Simola, 1974; Хавкин, 1982; Laidman, 1982;
Гумилевская и др., 1993).
Мобилизация крахмала и запасных белков в семядолях гороха
происходит в два этапа: 1) гидролиз части резервов (до 25—30%)
запускается повышением оводненности до 45—50% и обеспечивается
имевшимися ферментами; его продукты начинают поступать в осевые
органы через 15 ч после наклевывания; 2) гидролиз основных резервов
начинается примерно на пятый день после наклевывания, он
запускается фитогормонами (гиббереллинами, цитокининами), поступившими
из начавших расти осевых органов, и осуществляется через индукцию
гидролаз. Мобилизация этих запасов поддерживает в течение 5—10
дней формирование проростка в результате установившихся донорно-
акцепторных отношений. Таким образом, стратегия успешного
прорастания поддерживается двухступенчатой мобилизацией резервов,
основная масса которых используется только тогда, когда осуществлены
начальные этапы прорастания (Обручева и др., 1988).
Общая схема физиологических процессов при раннем
прорастании семян, находившихся в вынужденном покое. Пусковыми
факторами (триггерами) начала прорастания семян, находившихся в
вынужденном покое, могут быть внешние (температура, содержание
По оси абсцисс — время достижения данного уровня оводненности, а после
наклевывания семени — обычная шкала времени (час); по оси ординат —
влажность осевых органов н семядолей (в /о на сырую массу).
Сплошная лнння — осевые органы; пунктирная линия — семядоли, стрелками показано
включение различных метаболических систем: 1 — активация дыхания; 2 — начало превращения
аминокислот; 3 — начало транскрипции новообразованных мРНК; 4 — завершение митохонд-
риогенеза и интенсификация дыхания; 5 — начало мобилизации крахмала; 6 — начало
мобилизации запасных белков; 7 — начало синтеза белков на запасенных мРНК; 8 — накопление
осмотически активных веществ; 9 — увеличение объема вакуолярной системы; 10 — начало
подкислення клеточных оболочек; И — начало растяжения клеток в гнпокотнле (гнпогеальное
прорастание) или в корне (эпигеальное прорастание); 12 — начало растяжения клеток в корне
(гнпогеальное прорастание); 13 — инициация деления клеток в корнях различных растении;
14 — синтез гиббереллннов н абсцнзовой кислоты; 15 — мобилизация основных запасов в
семядолях; 16 — начало притока в осевые органы из семядолей.
1 — по Vertucci, 1989; Eldan, Mayer, 1972; 2 — по Linko, Milner, 1959; 3 — no Comai,
Harada, 1990; 4 — no Asahi, Maeshima, 1983; Обручева, Ковадло, 1985; 5,6 — по Обручева
и др., 1988; 7 — по Marcus et al., 1966; 8,9 — по Обручева н др., 1993; 10 — по Обручева,
Антипова, 1994; 14 — по Sponsel, 1983; Обручева и др., 1985.
R
Е
<и
и
В
В
В
<е
н
и
<е
а
о
eu «
в S
в о
а в
8 Е
S *
I s
яг я
О SS
а в
в 2
к н
в ц
•л
и
<U R
9 v
В Ц
О
<
О
в
Я!
В
6"
к
в
яг
<в
в
»
в
в
л
Е
U
в
3
н
в
ч
о
а
В
этгвятаэгаойц
8 8
о
о
to
о
ю
9
% 'эмонжвен
8
о
678
Семя
кислорода и влаги в почве) и внутренние (фитогормоны) факторы.
Содержание кислорода нельзя считать пусковым фактором, поскольку
в почвенном воздухе его уровень заметно превышает 0,1—1%, т. е.
концентрацию, лимитирующую прорастание (Come, Tissaoui, 1973), и
поскольку повышение концентрации кислорода до 21% не влияет на
прорастание семян, находившихся в вынужденном покое. Температуру
также нельзя рассматривать как фактор, запускающий прорастание,
прежде всего потому, что в интервале температур, при которых
возможно прорастание, повышение ее действует неоднозначно, сначала
ускоряя, а потом замедляя процесс (Roberts, 1988). Таким образом,
содержание кислорода выше уровня, лимитирующего прорастание, и
температура в диапазоне между нижней и верхней предельными
величинами представляют собой факторы, разрешающие прорастание
(обязательные условия прорастания), но не его триггеры.
Пусковым фактором является повышение оводненности семени в
результате поглощения им влаги из почвы. Из приведенных выше
данных следует, что каждая группа метаболических процессов имеет
свой собственный пороговый уровень оводненности, достижение
которого обеспечивает начало функционирования этих процессов. Роль
воды в качестве триггера можно представить себе как достижение
такой степени оводненности, при которой имеющиеся ферменты и
субстрат приобретают необходимую конформацию и могут
взаимодействовать.
Предложенная нами обобщенная схема (Обручева, 1991; Obrouche-
va, 1993) охватывает период раннего прорастания и начальный этап
периода формирования проростка.
Пусковая роль оводненности проявляется только в течение периода
раннего прорастания. В начале этапа активации основного метаболизма
(при набухании до 20% влажности) происходят гидратация
ферментных белков, изменение конформации их молекул и переход ряда
ферментов в активное состояние. Достижение 21—25% влажности
приводит к скачкообразному усилению дыхания (в семенах сои), появлению
активности цитохром-редуктазы (в семенах салата) и глютаматдекар-
боксилазы (в семенах пшеницы). Набухание до 40—45% запускает
транскрипцию новых мРНК (в семенах рапса), приводит к
завершению биогенеза митохондрий и резкому усилению дыхания (у семян
гороха). Увеличение оводненности до 45—50% запускает синтез
белка на запасенных мРНК (в семенах пшеницы), а также инициирует
гидролиз крахмала и запасных белков (в семенах гороха). Во всех
описанных случаях экспериментально доказано, переключение системы
из неактивного в активное состояние. Следовательно, для каждой
метаболической системы необходим свой пусковой уровень гидратации.
Приведение в действие основного метаболизма с помощью
поступающей за счет физических сил воды возможно лишь потому, что
ферменты, субстраты и мРНК были синтезированы заранее, при
формировании и созревании семени.
Покой и прорастание семян
679
Этап подготовки к росту растяжением (например, в осевых органах
кормовых бобов) характеризуется накоплением осмотически-активных веществ,
запускаемым повышением влажности до 65—68 /о, увеличением объема
вакуолярной системы и активацией плазмалеммной Н+-АТФазы при
дальнейшем повышении оводненности до 68—:70%. Тем самым реализуется
пусковая роль оводненности в подготовке к растяжению, которое происходит
только при поступлении воды до 72—73%. Роль оводненности, как
триггера, подтверждается' тем, что при потере воды набухающим семенем,
начиная с любого уровня оводненности, уже начавшиеся процессы
замирают, но при повторном набухании возобновляются с того уровня,
которого достигли перед дегидратацией. Если какой-то процесс еще не
начался до дегидратации, то в ходе регидратации он начнется при
достижении того же уровня оводненности, с какого начался бы при первом
набухании.
При составлении прилагаемой схемы в качестве временной шкалы до
начала наклевывания принято время достижения данного уровня
оводненности, тогда как во всех исследованиях обычно учитывают просто
время набухания семян. Такой подход позволил согласовать ход событий
при запуске прорастания у различных видов семян на базе их влажности
и продемонстрировал общую закономерность запуска физиологических
процессов через достижение пороговых уровней оводненности.
В пользу фитогормонального запуска раннего прорастания при
выходе из вынужденного покоя нет убедительных доказательств, хотя
семена содержат различные фитогормоны в свободном и конъюгиро-
ванном состоянии. Известные факты выведения семян из
органического покоя гиббереллинами и цитокининами не имеют отношения к
семенам, находящимся в вынужденном покое. Их обработка разными
фитогормонами не влияет, как правило, на скорость наклевывания
семян. Содержание АБК в семенах, находящихся в вынужденном
покое, гораздо ниже того уровня, который тормозит ростовые процессы;
поэтому нельзя объяснить начало роста тем, что необходимо
вымывание АБК из семени в ходе набухания (Обручева, 1982; Wang et al.,
1995). Фитогормоны нельзя рассматривать как эндогенные триггеры
раннего прорастания.
По-видимому, фитогормоны, синтезированные еще на самых
ранних этапах формирования семени, обеспечивают его нормальное
развитие до состояния физиологической зрелости, которое может
проявиться во влажных условиях в преждевременном прорастании семян
в колосе или плоде. Другими словами, эти фитогормоны способны
обеспечить в созревающих семенах метаболическую готовность семян
к прорастанию, которая сохраняется при высыхании семени и
вынужденном покое и реализуется в ходе раннего прорастания
благодаря поступлению воды и последовательному запуску метаболических
систем. В течение раннего прорастания синтез новых фитогормонов
не происходит, пока не начнутся интенсивные ростовые процессы в
осевых органах.
680
Семя
Наиболее наглядно неучастие фитогормонов в регуляции раннего
прорастания можно проиллюстрировать превращениями гиббереллинов
в созревающих и прорастающих семенах гороха, поскольку именно
гиббереллины, согласно схеме Кана (1982), считаются индукторами
прорастания. В формирующихся семенах в первые 5 дней после
опыления синтезируются гиббереллины, связанные с ростом зародыша и
плода. Этого достаточно, чтобы формирующийся зародыш мог
впоследствии прорасти, так как ингибирование синтеза гиббереллинов
после этих первых дней почти не нарушает способности семян к
прорастанию. Кроме того, нахождение семян в растворах, содержащих все
эндогенные гиббереллины, не ускоряет проклевывания. В ходе
созревания семени, гиббереллины выводятся из сферы метаболизма;
превращаются в неактивные соединения, частично разрушаются, частично
перемещаются в семядоли и оболочку семени. При набухании инакти-
вированные гиббереллины частично вымываются из семенной кожуры.
Уровень гиббереллинов в осевых органах набухающих семян очень
низок, а синтез гиббереллинов de novo начинается в них в период
формирования проростка (Hirada et al., 1972; Кан, 1982; Sponsel,
1983; Gaskin et al., 1985; Garcia Martinez et al., 1987).
Возвращаясь к общей схеме прорастания, рассмотрим события,
протекающие в начале периода формирования проростка, т. е. после на-
клевывания семени. При гипогеальном прорастании начинается
растяжение и затем деление клеток корня, а также растяжение клеток
эпикотиля; при эпигеальном прорастании начинает расти гипокотиль.
В растущих осевых органах происходит интенсивный синтез большого
набора гиббереллинов, абсцизовой кислоты и других фитогормонов;
гиббереллины и цитокинины передвигаются из начавших расти осевых
органов в семядоли (или в эндосперм), вызывая там индукцию ряда
гидролаз. При индукции синтез гидролитических ферментов на новых
матрицах происходит за счет аминокислот, образовавшихся при
начальной мобилизации запасного белка. Эти ферменты осуществляют
мобилизацию основных запасов семядолей, в дополнение к начальной
мобилизации крахмала и белка, начавшейся вследствие повышения
оводненности семян до порогового уровня. В результате образуется
фонд Сахаров и амидов и начинается их приток в осевые органы. Тем
самым поддерживается интенсивный рост осевых органов проростка
(Sponsel, 1980; Laidman, 1982; Обручева и др., 1985, 1988; Bewley,
Black, 1985).
Аскоченская, 1982; Вайнтрауб и др., 1990; Васильев и др., 1978; Гумилевская и др.,
1993; Дюр, 1982; Иванов, 1987; Кан, 1982; Николаева, 1982; Обручева, 1982;
Обручева, Антипова, 1994; Обручева, Зембднер, 1985; Обручева, Ковадло, 1985;
Обручева и др., 1984, 1988; Осборн, 1982; Соболев, 1985; Соболев, Жданова,
1982; Троян и др., 1983; Хавкин, 1982; Aspart et al., 1984; Barlow, 1976, 1995;
Barlow et al., 1991; Bewley, Black, 1978, 1985; Byrne, Heimsch, 1970; Cohen,
Bandurski, 1982; Collins, Wilson, 1972; Comai, Harada, 1990; Come, Tissaoui, 1973;
Cosgrove, Zhen-Chang Li, 1983; Deltour, 1985; Doerner, 1994; Eldan, Mayer, 1972;
Покой и прорастание семян
681
Ellis et al., 1989a-c; Evans et al., 1987; Garcia Martinez et al., 1987; Gaskin et al.,
1985; Hacker et al., 1964; Jones, Phillips, 1966; Kutschera, 1994; Linko, Milner, 1959;
Marcus et al., 1966; Mayer, Poljakoff-Mayber, 1989; Muller et al., 1994; Nougarede,
Remeour, 1980; Robbins, Harvey, 1969; Rondet, 1965; Ross, Hegarty, 1979; Sitton et
al., 1967; Sponsel, 1983; Sponsel, Mac Millan, 1980; Taylor, Cosgrove; 1989; Vallade,
1972; Vertucci, 1989; Wang et al, 1995; Zavala, Branden, 1983.
ЩИТОК И ЕГО РОЛЬ ПРИ ПРОРАСТАНИИ
Щиток — семядоля зародыша злаковых. Дорзальной стороной он
прилегает к эндосперму, а вентральной частично прикрывает зародыш. Форма
и размер щитка варьируют у разных видов злаковых (см. подробнее
Эмбриогенез злаков). В щитке обычно выделяют три типа клеток.
Паренхимные клетки изодиаметрической формы составляют
основную массу щитка. Между ними расположены многочисленные
воздухоносные межклетники. В сухих зерновках цитоплазма парен-
химных клеток плотная, невакуолизированная, содержит
многочисленные липидные капли, белковые тела с фитином, рибосомы и
митохондрии со слабо развитыми кристами (Nieuwdorp, 1963; Swift,
O'Brien, 1972).
Эпителиальные клетки (клетки эпидермиса щитка) расположены в
один слой на стороне щитка, граничащей с эндоспермом. Они имеют
вытянутую цилиндрическую форму, плотную цитоплазму с большим
количеством сферосом вдоль клеточной стенки и белковых тел,
локализованных, как правило, в апикальной части клеток. В эпителиальных
клетках обнаружены также фрагменты ЭР и митохондрии. Клеточные
стенки у эпителия первичные; у пшеницы, ячменя и овса они не
содержат пектиновых веществ и лигнина (Nieuwdorp, 1963; Swift,
O'Brien, 1972).
Клетки проводящей системы. Проводящая система щитка
представлена крупным пучком, отходящим от стелы гипокотиля зародыша,
имеющим множество разветвлений в области эпителиальных клеток.
Ее отдельные элементы закладываются во время дифференциации
зародыша, но окончательное формирование происходит во время
прорастания зерновок. Зрелые элементы ситовидных трубок
обнаруживаются в щитке через 3—6 ч, а первые элементы трахеид — через
18 ч после начала набухания зерновки. Еще через 12 ч комплекс
проводящей системы щитка в основном сформирован (Swift, O'Brien,
1970, 1971).
В прорастающих зерновках щиток выполняет запасающую,
секреторную, всасывающую и транспортную функции.
Запасающая функция щитка состоит в накоплении белков,
крахмала, липидов, фитина. В нем найдены растворимые сахара, органические
кислоты, витамины (аскорбиновая кислота и тиамин ), РНК и ДНК,
682 Семя
минеральные элементы (Panchaksharappa, Rudramunijappa, 1975;
Овчаров, 1976; Birch et al., 1977).
Во время прорастания запасные полимеры распадаются внутри
клеток под действием гидролаз на простые, растворимые соединения
(внутриклеточное пищеварение). Остается нерешенным вопрос, каким
образом поддерживаются кислые значения рН в органеллах клеток,
где идет автолиз пищевых запасов. На ранних этапах прорастания
(первые 2 суток) зародыш практически полностью обеспечивается
питательными веществами за счет запасов щитка, значительная часть
которых идет на его собственные нужды, в первую очередь на
дыхание, обеспечивающее энергией и метаболитами секреторные и
транспортные процессы, а также на синтез de novo гидролаз в
эпителиальных клетках щитка (Dure, 1960).
Секреторная функция щитка заключается в переваривании запасных
полисахаридов и белков эндосперма при прорастании. Механизм этого
процесса сходен с тем, что происходит при переваривании животной
пищи у насекомоядных растений или при пищеварении в желудке
животных, где расщепление белков осуществляется под действием кислот
и кислых гидролаз (кислое внеклеточное пищеварение). За секрецию
отвечают эпителиальные клетки щитка. В набухающих зерновках они
делятся, значительно удлиняются и глубоко внедряются в эндосперм,
увеличивая тем самым свою всасывающую поверхность. При этом
ослабевают контакты между соседними эпителиальными клетками и
появляется межклеточное пространство. Клетки эпителия принимают форму
папилл, вытянутых в сторону эндосперма. Замечены также инвагинации
эпителиальных клеток внутрь щитка, смысл которых пока неясен
(Nieuwdorp, Buys, 1964; Swift, O'Brien, 1972; Zamski, 1975).
С началом прорастания значительные изменения происходят и в
ультраструктуре эпителиальных клеток. Запасные вещества из
белковых тел и сферосом используются на образование компонентов
ЭР. Появляется вакуоль, развивается аппарат Гольджи, возрастает
число митохондрий и их функциональная активность. Таким образом,
клетки эпителия переходят к активному синтезу гидролаз и секреции.
Одним из ранних событий в начавшем набухать семени является
секреция щитком ионов Н+ в эндосперм. Способность щитка подкислять
внешнюю среду была открыта сравнительно недавно у кукурузы, ячменя
и пшеницы (Lado et al., 1975; Щипарев и др, 1976; Mukhtar, Laidman,
1982; Drozdowicz, Jones, 1995). Выделение протонов щитком
кукурузы — процесс активный, требующий энергии. Дыхательные яды —
малонат, фторид натрия и динитрофенол — подавляли секрецию ионов
Н+, а ионы К+, Са2+ и Na+ значительно увеличивали выход Н+.
Последнее может указывать на электрогенную природу Н+-насосов на плаз-
малемме эпителиальных клеток щитка (Щипарев и др., 1988).
Изолированные щитки выделяли в инкубационную среду фосфорную, глюко-
новую, лимонную, уксусную, пропионовую и масляную кислоты
(Щипарев, Чупрова, 1980). Вероятно, такой набор кислот неслучаен. Не-
Покой и прорастание семян
683
которые из них являются стимуляторами прорастания семян, а лимонная
кислота способна даже восстанавливать жизнеспособность семян,
потерявших всхожесть (Radua et al., 1967). Какую роль эти кислоты играют
в эндосперме кукурузы после их секреции щитком, пока неизвестно.
Однако нет сомнений в том, что в набухающей зерновке кукурузы
происходит подкисление эндосперма за счет щитка. Доказательством этому
являются результаты опытов, в которых определяли рН гомогенатов
эндоспермов, выделенных из сухой зерновки, и интактных набухающих.
Этот показатель значительно снижался (с 5,6 после двух часов набухания
до 4,8 — после четырнадцати) только у интактных эндоспермов, тогда
как у изолированных снижение рН было незначительным и плавным
(Щипарев и др., 1976). Подкисление эндосперма при прорастании
осуществляется неравномерно в разных участках. На поперечных срезах
зерновок кукурузы, пшеницы и ячменя, окрашенных индикаторами рН,
видно, что уже через сутки с начала набухания эндосперм имеет кислую
реакцию (рН 5,2—5,8), причем волна подкисления исходит от щитка,
рядом с которым реакция среды значительно более кислая (рН 4,5) по
сравнению с другими зонами эндосперма (Филимонов, Щипарев, 1995).
Подкисление эндосперма пшеницы и ячменя происходит, вероятно, также
под действием алейронового слоя, но лишь на 2—3 сутки прорастания
(Micola, Virtanen, 1981).
Каковы же механизмы выделения кислот щитком? В эпителиальных
клетках ячменя и кукурузы была обнаружена АТФаза, но вклад ее в
ацидофицирующую деятельность щитков не был выяснен (Wheeler,
Humphreys, 1979; Chaffey, Harris, 1985). Более поздние работы с
использованием ингибиторов транспортных АТФаз плазмалеммы (орто-
ванадата, диэтилстилбестрола и дициклогексилкарбодиамида) показали,
что в выделении Н+ щитками кукурузы принимает участие Н+-АТФаза.
Ингибиторы снижали ацидофицирующую способность щитков лишь на
20—40%, даже если они применялись в концентрациях выше обычных,
причем на щитки, изолированные через сутки с начала набухания, они
практически не действовали-(Щипарев и др., 1993). Эти данные
указывали на то, что наряду с АТФазой могут быть и другие механизмы
секреции Н+ щитками, например, редокс-цепь в плазмалемме
эпителиальных клеток. Подтверждение этому было получено в работе Щипарева
и Мячина (1990), обнаруживших способность изолированных щитков
кукурузы восстанавливать экзогенный феррицианид (индикатор редокс-
цепей). Используя гистохимический метод, им удалось показать, что
наибольшей феррицианидредуктазной активностью обладает поверхность
щитка, обращенная к эндосперму. Восстановление феррицианида
щитками кукурузы сопровождалось усилением подкисления внешней среды,
а этанол, добавленный в нее, усиливал подкисление среды щитками и
восстановление ими феррицианида. Все эти результаты доказывают
наличие в плазмалемме эпителиальных клеток редокс-цепи, которая
является Н+-помпой и одновременно принимает участие в ацидофицирующей
деятельности щитков кукурузы. К сожалению, сведений о функциони-
684
Семя
ровании редокс-цепей в зерновках других видов злаковых в литературе
пока не имеется. Остается открытым и вопрос о возможности
пузырьковой секреции кислот щитком в везикулах аппарата Гольджи вместе
с гидролазами, которые секретируются в эндосперм.
Определенную роль в подкислении эндосперма может, вероятно,
играть углекислый газ, выделяемый щитком при дыхании и
растворяющийся в жидкой фазе эндосперма. Действительно, интенсивность
дыхания щитка кукурузы на порядок выше, чем у эндосперма, дыхательный
коэффициент больше единицы (1,5—1,8). В щитке обнаружены и де-
карбоксилирующие ферменты — маликэнзим, пируватдекарбоксилаза,
причем их активность гораздо выше в части щитка, прилегающей к
эндосперму, по сравнению с остальной частью зародыша (Белозерова,
Плотникова, 1984; Белозерова и др., 1986). В связи с этим возникает
вопрос, не является ли бикарбонатный ион, образующийся при
растворении СОг в эндосперме, активатором Н+-АТФазы плазмалеммы
эпителиальных клеток щитка кукурузы, как это имеет место в слизистой
желудка человека.
Секреция кислот щитком в эндосперм и подкисление его тканей —
первый и очень ответственный этап переваривания пищевых запасов
эндосперма. Благодаря ей, во-первых, создается оптимальное рН
среды для работы кислых гидролаз в эндосперме (в сухих зерновках
эндосперм имеет нейтральную реакцию). Во-вторых, подавляется
функциональная активность белковых ингибиторов протеаз и амилазы
(Polanowski, 1967; Jin-a-Jin et al., 1993). В третьих, усиливается
работа транспортных систем в плазмалемме эпителиальных клеток
(оптимум их деятельности находится в кислой среде) (Stewart, 1971).
Только вслед за подкислением начинается активная секреция
щитком гидролаз в эндосперм. Среди гидролаз обнаружены целлюлаза, а-
и (3-амилазы, фосфатаза, протеазы, нуклеаза и другие, под действием
которых растворяются запасные вещества эндосперма (Fincher, 1989).
Процесс секреции тормозится ингибиторами дыхания, колхицином, но
стимулируется ионами Са + и ГКз (Полевой и др., 1981; Щипарев,
Ильчуков, 1983). Кальций необходим для слияния мембран
секреторных везикул с плазмалеммой при экзоцитозе, а также для синтеза
амилазы. Возможно, он играет определенную роль в сопряжении
стимула и секреции (Саламатова, Зауралов, 1991). Гидролазы
синтезируются de novo гранулярным ЭР и в везикулах аппарата Гольджи и
секретируются через плазмалемму в клеточную стенку. Механизм их
транспорта через нее пока не изучен. Характер посттрансляционных
изменений гидролаз, формирование их конечной структуры подробно
исследуются в настоящее время.
Всасывающая активность щитка резко увеличивается на 2—3-й сутки
прорастания. Растворимые продукты гидролиза запасных веществ
эндосперма поглощаются эпителием щитка. Транспорт питательных
веществ из эндосперма к зародышу осуществляется проводящей системой
щитка. Глютамин и сахароза являются основными транспортными фор-
Покой и прорастание семян
685
мами азота и углерода в щитке, их синтез происходит в клетках
паренхимы щитка. Механизм транспорта по флоэме щитка сходен,
вероятно, с транспортом ассимилятов в стебле. Транспорт Сахаров через
плазмалемму эпителиальных клеток хорошо изучен у кукурузы. Ее щиток
лучше всего поглощает сахарозу и мальтозу при кислых (не более 5)
рН, но величина рН не влияет на поглощение ими глюкозы и фруктозы
(Humphreys, Garrard, 1964; Щипарев и др., 1990). Механизм
транспорта нейтральных соединений (например, сахарозы) в клетках щитка
включает в себя систему симпорта ионов Н+ и сахарозы, отрицательно
заряженный свободный переносчик и нейтральный комплекс переносчик-
сахароза-Н + . Транспорт поддерживается градиентом сахара и
электрохимическим градиентом Н+, создаваемым редокс-цепью и Н+-АТФазой
плазмалеммы эпителиальных клеток (Humphreys, 1978). Подобная
система сопряженного транспорта существует, вероятно, для аминокислот
и пептидов, поглощение которых оптимально в кислой среде (рН 5,0).
В щитках различных видов злаковых обнаружены как неспецифичные,
общие для основных аминокислот, так и специфичные для отдельных
аминокислот переносчики (Salmenkallio, Sopanen, 1989). Пока неясно,
сопряжен ли транспорт дисахаридов и пептидов через плазмалемму с
их гидролизом, вызывающим дополнительную энергизацию мембраны.
Щиток перестает функционировать на 8—10-ые сутки с начала
прорастания. В эти сроки наблюдается дегенерация его тканей и
автолиз клеток. Он выполнил свою роль на гетеротрофном этапе развития
проростка.
Белозерова и др., 1986; Белозерова, Плотникова, 1984; Овчаров, 1976; Полевой и
др., 1981; Саламатова, Зауралов, 1991; Филимонов, Щипарев, 1995; Щипарев,
Ильчуков, 1983; Щипарев, Мячин, 1990; Щипарев, Чупрова, 1980; Щипарев и др.,
1976, 1988, 1990, 1993; Birch et al., 1977; Chaffey, Harris, 1985; Drozdowicz, Jones,
1995; Dure, 1960; Fincher, 1989; Hamabata et al., 1988; Humphreys, 1978;
Humphreys, Garrard, 1964; Jin-a-Jin et al., 1993; Lado et al., 1975; Micola, Virtanen, 1981;
Mukhtar, Laidman, 1982; Nieuwdorp, 1963; Nieuwdorp, Buys, 1964; Panchaksharappa,
Rudramunijappa, 1975; Polanowski, 1967; Radua et al., 1967; Salmenkallio, Sopanen,
1989; Smart, O'Brien, 1979; Stewart, 1971; Swift, O'Brien, 1970, 1971, 1972;
Wheeler, Humphreys, 1979; Zamski, 1975.
ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ РОСТА
И РАЗВИТИЯ ПРОРОСТКОВ
Фитогормоны являются эндогенными регуляторами, необходимыми
для взаимодействия клеток, тканей и органов в ходе онтогенеза и для
адекватного реагирования организма на сигналы, поступающие из
внешней среды. Гормональная система начинает формироваться в ходе
эмбриогенеза. У некоторых двудольных растений изолированный
зародыш на торпедовидной стадии уже обладает гормональной независи-
686
Семя
мостью (автономностью), т. е. осуществляет синтез всех необходимых
фитогормонов и не нуждается в их поступлении извне (Понтович,
1978; Батыгина, Васильева, 1983; Embryology of Angiosperms, 1984).
Роль фитогормонов при набухании н проклевывании семян в
явлениях этиоляции. В семенах фитогормоны находятся в связанном
состоянии с сахарами, аминокислотами, белками, полисахаридами
(Schreiber et al., 1986). Связанные ауксины (ИУК — индолил-3-ук-
сусная кислота) и цитокинины в зерновках злаков присутствуют в
эндосперме и щитке, а гиббереллины и АБК (абсцизовая кислота) —
в щитке и других частях зародыша.
При набухании семян содержание свободных ИУК, гиббереллинов
и цитокининов быстро возрастает в результате гидролиза связанных
форм (см. Физиология и биохимия покоя и прорастания семян, 1982).
Дальнейший ход прорастания зависит от соотношения концентраций
свободных фитогормонов. Высокий уровень цитокининов и
гиббереллинов в тканях активирует прорастание. АБК, наоборот, тормозит
прорастание, что, как правило, наблюдается при обработке прорастающих
семян экзогенной АБК.
Разрыву семенных оболочек и выходу кончика корня (проклевыва-
ние) способствует рост растяжением клеток зародышевой оси (см.
Морфология и физиология прорастания семени). У двудольных
растений активируется рост растяжением клеток гипокотиля, что
индуцируется резким повышением синтеза этилена тканями зародыша, а
также увеличением концентрации СО2 (Abeles et al., 1992). Диоксид
углерода способствует закислению цитоплазмы, что активирует Н+-
помпу (Н+-АТФазу) в плазмалемме клеток гипокотиля. Активный
выход ионов Н+ из цитоплазмы в клеточные стенки создает эффект
«кислого роста» в результате увеличения пластической растяжимости
клеточных стенок при их подкислении.
Рост проростков в почве осуществляется при отсутствии света.
В этих условиях наблюдается интенсивное вытягивание растущих
междоузлий. Органы проростка имеют белый или желтый цвет, так как в
клетках не происходит синтез хлорофилла (у покрытосеменных
растений). Такое состояние проростков называется этиолированным. У
многих видов вытягивание междоузлий определяется повышенным
содержанием гиббереллинов и ауксина (Саламатова, 1994; Okamoto et al.,
1995).
Роль фитогормонов в регуляции гетеротрофного способа питания
проростков. В отсутствие света питание клеток растущего проростка
осуществляется за счет веществ, поступающих из запасающих органов.
Механизм регуляции использования запасных веществ лучше всего
изучен у проростков злаков. Запасенные -в эндосперме фитогормоны (ИУК,
цитокинины, гиббереллины), переходя из связанного состояния в
свободное, активируют пищеварительную функцию эпителиальных клеток
щитка (см. Щиток и его роль при прорастании), в результате чего
Покой и прорастание семян
687
происходит «переваривание» как запасных веществ, так и самих клеток
эндосперма, прилегающих к щитку.
«Переваривание» периферических клеток эндосперма
осуществляется «посредством» клеток алейронового слоя. На вторые-третьи сутки
прорастания из щитка и зародышевой оси в клетки алейронового слоя
диффундируют гиббереллины. Под действием этих гормонов в
алейроновых клетках активируется распад запасных белков, синтез РНК, в
том числе мРНК, необходимых для интенсивного синтеза гидролаз.
Эти гидролазы (амилаза, целлюлаза, РНКаза, протеиназы и др.) из
алейроновых клеток секретируются в эндосперм (Jacobsen, Chandler,
1988). Наряду с этим возрастает активность протонной помпы (Н+-
АТФазы) в плазмалемме алейроновых клеток, в результате чего
происходит закисление тканей эндосперма и осуществляется процесс
внеклеточного кислого пищеварения, т. е. наблюдаются те же явления,
которые характерны для пищеварительной функции щитка. Для инду-
цирующето действия гиббереллинов на функциональную активность
алейроновых клеток необходимо присутствие цитокинина. АБК
подавляет действие этих фитогормонов. Продукты переваривания,
накапливающиеся в эндосперме (сахара, аминокислоты и др.), всасываются
эпителиальными клетками щитка, загружаются во флоэмные окончания
и по проводящим пучкам поступают в растущие части проростка. Все
эти процессы также находятся под гормональным контролем (Mikola,
Virtanen, 1981; Полевой и др., 1990).
Фитогормоны и двигательная активность проростка. Для
ориентации в пространстве растущие в темноте (в почве) корень и побег
проростка используют гравитационное поле. Причем корень растет к
центру Земли (положительный гравитропизм), а побег — от центра
Земли (отрицательный гравитропизм). Гравитационный сигнал
воспринимается клетками корневого чехлика (колумеллой), колеоптиля (у
злаков) и верхнего растущего междоузлия (у двудольных). Восприятие
направления силы тяжести происходит в клетках (статоцитах) с
участием внутриклеточных органоидов, имеющих высокую плотность (ста-
толитов). В результате давления статолитов на мембраны ЭР и,
возможно, вакуолей в цитоплазме локально увеличивается концентрация
ионов Са , которые выполняют функции вторичного внутриклеточного
мессенджера (посредника). Ионы Са способствуют латеральному
смещению транспорта ИУК» (механизм неизвестен). На нижней
стороне горизонтально расположенных осевых органов увеличивается
концентрация ауксина. В осевых органах побегов это приводит к
усилению роста клеток с нижней стороны органа, что и лежит в основе
отрицательного гравитропизма. Рост нижних клеток в зоне растяжения
корня, наоборот, будет тормозиться из-за высокой чувствительности
этих клеток к ауксину и ингибирующего действия ауксина на рост при
повышении его концентрации. В результате корень будет изгибаться к
центру Земли. Участок, где произошел ростовой (тропический) изгиб,
через некоторое время выпрямляется (явление автотропизма). Благо-
688 Семя
даря этому механизму вертикально растущие побег и корень постоянно
совершают круговые движения (нутации), которые можно
рассматривать как корректировку направления роста и как поисковые движения
в пространстве (Меркис, 1990; Konings, 1995).
Удлинение побега и корня благодаря растяжению клеток в
соответствующих зонах роста является способом движения (необратимой
двигательной активности) этих органов, который можно рассматривать
как первичный механизм перемещения осевых органов многоклеточных
растений. При дефиците минерального питания, особенно азотного, у
многих растений уменьшается синтез азотсодержащих ИУК и цитоки-
нинов, в результате чего снижается рост побега, а рост корня
ускоряется. Целесообразность такого поведения вполне очевидна, так как
позволяет корню быстрее продвинуться в новые горизонты почвы в
поисках минеральных веществ (Kuiper et al., 1988; Кудоярова, Усма-
нов, 1991).
Стратегия продвижения побега и корня в почве различна. Кончик
корня не оказывает существенного давления на частицы почвы, а
выискивает промежутки между этими частицами. Корректировка этих
поисковых движений осуществляется корневым чехликом с участием
ИУК и, возможно, АБК. Если кончик корня упирается в препятствие,
то это приводит к усилению синтеза стрессового гормона — этилена —
в зоне роста растяжением. Этилен способствует дезорганизации
микротрубочек в кортикальном слое клеток, в результате чего клетки
начинают растягиваться не в длину, а изодиаметрически, и в зоне
роста растяжением образуется утолщение. Это утолщение раздвигает
почвенные частицы, позволяя кончику корня снова продвигаться
вперед (Дарвин, 1941; Abeles et al., 1992).
Растущий побег, наоборот, оказывает сильное давление на
почвенные частицы. Для успешного продвижения в почве у злаков служит
колеоптиль, а у двудольных — верхняя часть гипокотиля или эпикоти-
ля, изогнутая в виде колена (крючка). Изогнутая форма определяется
высоким уровнем синтеза этилена в субапикальной части стебля
(Abeles et al., 1992).
Фитогормоны и переход к автотрофному способу питания.
Этиолированные проростки обладают высокой чувствительностью к свету.
Восприятие световых сигналов у растений осуществляется
молекулярными фоторецепторами, локализованными в мембранах. Рецептором
красного и дальнего красного света является фитохром, синего — крип-
тохром и, возможно, фитохром. Концентрация фитохрома особенно
высока в апикальной части побега и в кончике корня (Кузнецов и др.,
1986). Поэтому эти доминирующие центры первыми реагируют на
появление света. При локальном освещении свет может распространяться
во все части растения, так как ткани обладают свойствами световода
(Vogelmann, 1993). Выход к свету приводит к деэтиоляции проростков:
резко тормозится рост в длину растущих междоузлий, происходит
разгибание субапикального крючка у двудольных и временное усиление
Покой и прорастание семян 689
роста колеоптилей у злаков, индуцируются синтез хлорофилла и
формирование хлоропластов, активируются рост и развертывание первых
настоящих листьев. Световой сигнал переключает генетическую
программу скотоморфогенеза1 на программу фотоморфогенеза, что обеспечивает
растению переход к фототрофному способу питания (De Greef, Frederico,
1983; Mohr, 1983).
Во всех этих процессах гормональная система играет важнейшую
роль. Показано, что торможение светом роста в длину растущих
междоузлий может быть связано с торможением полярного транспорта
ИУК, снижением поступления гиббереллинов (Scott et al., 1969; То-
yomasu et al., 1992). Разгибание субапикального крючка обусловлено
резким торможением синтеза этилена в клетках этой зоны стебля
(Abeles et al., 1992). Рост и развертывание листьев злаков
определяется повышением в них содержания активных, гиббереллинов (АррПе-
ford, Lenton, 1991; Kopcewicz, Madels, 1992). Для роста листовых
пластинок двудольных растений необходимо повышение концентраций
ауксина, гиббереллинов и цитокининов (Wareing, Phillips, 1978;
Goodwin, Erwee, 1983). Функциональная активность зеленого листа
драматически зависит от постоянного притока цитокининов из корней (Ку-
лаева, 1982).
Приведенные выше данные носят еще весьма фрагментарный
характер. Однако они убедительно указывают на ведущую роль фитогормо-
нов в системе интеграции у растений.
Общая характеристика гормональной системы растений.
Верхушка побега является местом синтеза ауксина ИУК. Синтез цитокинина
осуществляется в кончике корня. ИУК из верхушки побега по живым
клеткам проводящих пучков полярно перемещается до кончика корня
со скоростью 0,5—1,5 см/ч. Цитокинины (зеатин, его конъюгаты —
зеатинрибозид, зеатинриботид и др.) и гиббереллины из кончика
корня, где они синтезируются, транспортируются по проводящим пучкам
пассивно в составе ксилемного сока. Ауксин необходим для регуляции
деления клеток (вместе с цитокинином), роста клеток растяжением,
дифференциации проводящих пучков. Он активирует деление клеток
камбия и рост осевых органов в толщину, тормозит рост пазушных
почек, а также регулирует скорость деления и растяжения клеток в
дистальной части корня, заложение боковых корней, являясь
индуктором генетической программы корнеобразования. Цитокинин, в свою
очередь, необходим для деления клеток (вместе с ауксином), снижая
поляризацию клеток и способствуя их изодиаметрическому росту. Он
тормозит заложение боковых корней, индуцирует рост пазушных
почек, активирует рост растяжением клеток мезофилла (у двудольных
растений), препятствует старению листа, необходим для закладки и
Греч, scotos — темнота.
44-В28
690
Семя
роста апекса побегов, являясь главным индуктором генетической
программы формирования побега.
Таким образом, ИУК, образующаяся преимущественно в
верхушечной почке и молодых растущих листочках, индуцирует закладку новых
апексов корней, которые синтезируют цитокинин, способствующий
закладке и росту новых верхушек побегов. Эти два фитогормона
составляют главный контур гормональной системы растений,
действующий по принципу обратной положительной связи, что обеспечивает
поступательное развитие проростка. Гиббереллины в ходе
формирования побега начинают синтезироваться в листьях, абсцизовая кислота
(АБК) — главным образом в листьях, а также в корневом чехлике.
Синтез этилена может осуществляться во всех клетках, но особенно
там, где высока концентрация ИУК или цитокинина. ГА необходим
для роста стебля, перехода растения к цветению, регуляции многих
других физиологических и морфогенетических программ. АБК, как
правило, выполняет функции гормона-тормозителя. Концентрация АБК
и этилена в тканях резко возрастает в условиях стресса и в ходе
старения органов (Полевой, 1982; Дерфлинг, 1985; Полевой, Салама-
това, 1991; Bewley, Black, 1994).
Батыгина, Васильева, 1983; Дарвин, 1941; Дерфлинг, 1985; Кудоярова, Усманов,
1991; Кузнецов и др., 1986; Кулаева, 1982; Меркис, 1990; Полевой, 1982; Полевой,
Саламатова, 1991; Полевой и др., 1990; Понтович, 1978; Саламатова, 1994;
Физиология и биохимия покоя и прорастания семян, 1982; Abeles et al., 1992; Appleford,
Lentbn, 1991; Bewley, Black, 1994; Conjugated plant hormones: structure, metabolism
and function, 1986; De Greef, Frederico, 1983; Embryology of Angiosperms, 1984;
Goodwin, Erwee, 1983; Jacobsen, Chander, 1988; Konings, 1995; Kopcewisz, Madela,
1992; Kuiper et al., 1988; Mikola, Virtanen, 1981; Mohr, 1983; Okamoto et al., 1995;
Scott, Wilkins, 1969; Toyomasu et al., 1992; Vogelmann, 1993; Wareing, Phillips,
1978.
Литература
691
ЛИТЕРАТУРА
Александров В.Г. К вопросу о двойном оплодотворении//Усп. совр. биол. 1945.
20(1). С. 95-180.
Александров В.Г. Анатомия растений. М.: Высшая школа, 1966. С. 1-431.
Александров В.Г., Александрова О.Г. Формирование эндосперма твердых и
мягких пшениц // ДАН СССР. 1939. 25(4). С. 320-323.
Алимова Г. К. Семейство Passifloraceae // Сравнительная эмбриология цветковых
растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983. С. 103-106.
Алимова Г.К. Семейство Асегасеае// Сравнительная эмбриология цветковых
растений. Brunellaceae—Tremandraceae. Л.: Наука, 1985а. С. 183-185.
Алимова Г.К. Семейство Hippocastanaceae// Сравнительная эмбриология
цветковых растений. Brunelliaceae—Tremandraceae. Л.: Наука, 19856. С. 185-189.
Алимова Г.К. Семейство Gesneriaceae// Сравнительная эмбриология цветковых
растений. Davidiaceae—Asteraceae. Л.: Наука, 1987а. С. 273-278.
Алимова Г.К. Семейство Согпасеае// Сравнительная эмбриология цветковых
растений. Davidiaceae—Asteraceae. Л.: Наука, 19876. С. 18-21.
Алимова Г.К. Микроспора// Эмбриология цветковых растений. Терминология и
концепции. / Ред. Батыгина Т.Б. Т.1. СПб: Мир и семья, 1994. С. 82-83.
Алимова Г.К., Яковлев М.С. К эмбриологии Streptocarpus rexii (Gesneriaceae)//
Ботан. журн. 1982. 67(4). С. 470-479.
Андронова Е.В. Эмбриогенез и постсеменное развитие орхидных (на примере
Dactylorhiza baltica, D.incarnata, Thunia marshalliana, Bletilla striata): Автореф. дис. ...
канд. биол. наук. Л., 1988а. С. 1-17.
Андронова Е.В. Эмбриогенез и постсеменное развитие орхидей (на примере
Dactylorhiza baltica, D. incarnata, Thunia marshalliana, Bletilla striata): Дисс. ... канд.
биол. наук. Л., 19886. С. 1-225.
Анисимова Г.М. Развитие семени у Orobanche cumana и О. alsatica (Oroban-
chaceae)// Ботан. журн. 1983. 68(4). С. 473-482.
Анисимова Г.М. Семейство Juncaceae// Сравнительная эмбриология цветковых
растений. Однодольные. Butomaceae—Lemnaceae. Л.: Наука, 1990. С. 183-187.
Артюшенко З.Т. Атлас по описательной морфологии высших растений. Семя. Л.:
Наука, 1990. С. 1-204.
Аскоченская Н.А. Водный режим семян// Физиология семян. / Ред. Прокофьев
А.А. М.: Наука, 1982. С. 184-222.
Атамбекова А.И., Лин Цзянсин. Эмбриогенез у люпина// Известия ТСХА.
1964. 4. С. 38-42.
Афанасьева Н.Г. К познанию филогении семейства Норичниковых: Дисс. ... канд.
биол. наук. Казань, 1960. Т.1. С. 1-200, Т.2. С. 1-154.
Афанасьева Н.Г. Эмбриология вероник (p. Veronica L.). Казань: Изд-во
Казанского Ун-та, 1976. С. 1-143.
Баннжова В.П., Хведишч О.А. Процесс зашйднения у Nicotiana rustica [Процесс
оплодотворения у Nicotiana rustica] // Укр. ботан. журн. 1973. 30(4). С. 668-670.
44*
692
Семя
Банникова В.П. Цитоэмбриология межвидовой несовместимости у растений. Киев:
Наукова думка, 1975. С. 1-284.
Банникова В.П. Межвидовая несовместимость у растений. Киев: Наукова думка,
1986. С. 1-230.
Банникова В.П., Баранова Е.А., Ильченко К.В. Общие структурные и
функциональные характеристики эмбриогенеза // Основы эмбриогенеза злаков. / Ред.
Яковлев М.С. Киев: Наукова думка, 1991. С. 155-163.
Банникова В.П., Плющ Т.А. Ультраструктура зародышевого мешка и зародыша
Calanthe vestite (Orchidaceae) // Ботан. журн. 1988. 73(10). С. 1401-1408.
Банникова В.П., Хведынич О.А. Основы эмбриологии растений. Киев: Наукова
думка, 1982. С. 1-164.
Банникова В.П., Хведынич О.А. Процесс оплодотворения у Nicotiana rustica //
Укр. ботан. журн. 1973. 30(4). С. 668-670.
Банникова В.П., Хведынич О.А., Овсянникова О.В. Исследование митотических
циклов гаметогенеза некоторых покрытосеменных // ДАН УССР. Сер. биол. 1978.
240(4). С. 963-966.
Банникова В.П., Хведынич О.А., Шпилевая СП., Остапенко Е.К.,
Овсянникова О.В. Изучение динамики синтеза ДНК при гаметогенезе у растений // Журн.
общ. биол. 1981. 42(2). С. 226-233.
Банникова В.П., Хведынич О.А., Шпилевая СП., Остапенко Е.К., Сидорова
Н.В., Плющ Т.А. Половые клетки и оплодотворение у покрытосеменных и
водорослей. Киев: Наукова думка, 1985. С. 1-220.
Баранов П.А. История эмбриологии растений. М.-Л.: Изд-во АН СССР, 1955.
С. 1-439.
Барлоу П.У. Деление клеток в меристемах и значение этого процесса для
органогенеза и формообразования растений // Онтогенез. 1994. 25(5). С. 5-28.
Барыкина Р.П. Особенности первых этапов онтогенеза Podophyllum emodi Wall, и
P.peltatum L. // Ботан. журн. 1971. 56(7). С. 921-931.
Барыкина Р.П. Морфолого-экологические закономерности соматической эволюции
в семействе лютиковых (Ranunculaceae Juss.): Автореф. дис. ... докт. биол. наук. М.,
1995. С. 1-46.
Батыгин Н.Ф. К вопросу о жесткости связей в пределах системы // Тез. докл.
III Съезда ВОФР. СПб, 1993. С 259.
Батыгин Н.Ф., Демьянчук A.M. Расчет онтогенеза пшеницы (методические
рекомендации). СПб: ВИР, 1995. С. 1-36.
Батыгина Т.Б. О состоянии половых элементов в процессе оплодотворения у
пшениц // Тез. докл. делегат, съезда ВБО. Вып. 8. М.-Л., 1957. С. 45-46.
Батыгина Т.Б. Цитология процесса оплодотворения при отдаленной гибридизации у
пшениц // Тез. координац. совещ. по проблеме «Узловые вопросы цитологии». Л.,1959.
С.19-20.
Батыгина Т.Б. Некоторые данные по цитологии процесса оплодотворения у пшениц
// Морфогенез растений. / Ред. Александров В.Г. М.: Изд-во МГУ, 1961а.
С. 334-340.
Батыгина Т.Б. Изменение мужских гамет в ходе оплодотворения у пшениц //
ДАН СССР. 19616. 137(1). С 220-223.
Батыгина Т.Б. Микроспорогенез и развитие пыльцевого зерна у пшениц // ДАН
СССР. 1962а. 142(5). С. 1205-1208.
Батыгина Т.Б. Процесс оплодотворения у пшениц // Тр.БИН АН СССР.
Cep.VII, 19626. 5. С. 260-293.
Литература
693
Батыгина Т.Б. Процесс оплодотворения при отдаленной гибридизации в роде
Triticum L // Ботан. журн. 1966. 51(10). С. 1461-1479.
Батыгина Т.Б. О возможности выделения нового типа эмбриогенеза Angiospermae
// ДАН СССР. 1968а. 186(6). С. 1499-1502.
Батыгина Т.Б. Эмбриогенез в роде Triticum L. (в связи с вопросами однодоль-
ности и отдаленной гибридизации у злаков) // Ботан. журн. 19686. 53(4). С.
480-490.
Батыгина Т.Б. Эмбриология пшеницы: Дисс. ... докт. биол. наук. Л.,1973. С. 1-243.
Батыгина Т.Б. Эмбриология пшеницы. Л.: Колос, 1974. С. 1-206.
Батыгина Т.Б. О некоторых закономерностях морфогенеза при регенерации
растений in vitro // Тез. докл. регион, конф. «Теоретические вопросы регенерации
растений». Махачкала, 1978. С. 13-14.
Батыгина Т.Б. Семейство Nelumbonaceae // Сравнительная эмбриология
цветковых растений. Winteraceae—Juglandaceae. Л.: Наука, 1981. С. 116-120.
Батыгина Т.Б. О положении порядков Nymphaeales и Nelumbonales в системе
покрытосеменных растений (по данным эмбриологии) // Матер. VI Моск. совещ. по
филоген. раст. М.: МГУ, 1982. С. 18-21.
Батыгина Т.Б. Системный подход к проблеме дифференциации зародыша
покрытосеменных растений // Тез. докл. VII Всес. совещ. по эмбриологии растений
«Проблемы гаметогенеза, оплодотворения и эмбриогенеза». Ташкент: Фан, 1983. С.
25-26.
Батыгина Т.Б. Семейство Onagraceae // Сравнительная эмбриология цветковых
растений. Brunelliaceae—Tremandraceae. Л.: Наука, 1985. С. 104-110.
Батыгина Т.Б. Хлебное зерно. Л.: Наука, 1987. С. 1-102.
Батыгина Т.Б. Эмбриологические основы пластичности и адаптивные возможности
систем репродукции цветковых растений // Биологическое разнообразие: подходы к
изучению и сохранению. 1992. С. 201-212.
Батыгина Т.Б. Некоторые аспекты морфогенетической полярности в онтогенезе
растений // Тез. докл. III Съезда ВОФР. СПб, 1993а. С. 258.
Батыгина Т.Б. Эмбриоидогения — новая категория способов размножения
цветковых растений // Тр. БИН им. В.Л. Комарова. 19936. 8. С. 15-25.
Батыгина Т.Б. Апомиксис, агамоспермия и вивипария и их роль в системе
репродукции цветковых растений // Тр. междун. симп. «Апомиксис у растений: состояние
проблемы и перспективы исследований». Саратов, 1994. С 16-18.
Батыгина Т.Б., Андронова Е.В. Есть ли семядоля у орхидных? // ДАН СССР.
1988. 30(4). С. 1017-1019.
Батыгина Т.Б., Андронова Е.В., Куликов П.В., Филиппов Е.Г. Эмбриокультура
как способ репатриации и реинтродукции редких видов растений (на примере
орхидей) // Тез. докл. междун. конф. «Биология культивируемых клеток и
биотехнология». Новосибирск, 1988. 2. С. 231.
Батыгина Т.Б., Бутенко Р.Г. Морфогенетические потенции зародыша
покрытосеменных растений (на примере представителей рода Paeonia, сем. Paeoniaceae) //
Ботан. журн. 1981. 66(11). С. 1531-1547.
Батыгина Т.Б., Васильева В.Е. Поведение зародышей некоторых покрытосеменных
в культуре in vitro // Тез. докл. III Всес. конф. «Культура клеток растений».
Абовян: Изд. АН Арм.ССР, 1979. С. 125-130.
Батыгина Т.Б., Васильева В.Е. Система воспроизведения у орхидных // Тез.
докл. Всес. симп. «Охрана и культивирование орхидей». Таллин, 1980. С. 107-110.
694
Семя
Батыгина Т.Б., Васильева В.Е. Развитие зародыша и проростка некоторых
орхидных // Матер. II Всес. совещ. «Охрана и культивирование орхидей». Киев, 1983а.
С. 73-75.
Батыгина Т.Б., Васильева В.Е. Целесообразность системного подхода к проблеме
дифференциации зародыша покрытосеменных растений // Онтогенез. 19836. 14(3).
С. 304-311.
Батыгина Т.Б., Васильева В.Е. Прикладные аспекты эмбриологии. Автономность
зародыша и эмбриокультура цветковых растений // Ботан. журн. 1987. 72(2). С.
155-161.
Батыгина Т.Б., Васильева В.Е., Маметьева Т.Б. Проблемы морфогенеза in vivo и
in vitro. Эмбриогенез у покрытосеменных растений// Ботан. журн. 1978. 63(11). С.
87-111.
Батыгина Т.Б., Долгова О.А., Коробова С.Н. Поведение пыльцевых трубок при
внутри- и межвидовой гибридизации // ДАН СССР. 1961. 136(6). С. 1482-1485.
Батыгина Т.Б., Кириллова И.М. Эмбриогенез мятлика // Матер. V Всес. совещ.
по эмбриологии растений. Кишинев: Штиинца, 1971. С. 15-16.
Батыгина Т.Б,, Колесова Г.Е. Семейство Euphorbiaceae // Сравнительная
эмбриология цветковых растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983. С. 267-
277.
Батыгина Т.Б., Колесова Г.Е., Васильева В.Е. Эмбриология нимфейных и
лотосовых. III. Эмбриогенез Nelumbo nucifera // Ботан. журн. 1983. 68(3). С. 311-325.
Батыгина Т.Б., Кравцова Т.И., Шамров И.И. К сравнительной эмбриологии
представителей порядков Nymphaeales и Nelumbonales // Ботан. журн. 1980. 65(8).
С. 1071-1088.
Батыгина Т.Б., Маметьева Т.Б. К эмбриологии рода Роа L. // Актуальные
вопросы эмбриологии покрытосеменных растений. / Ред. Яковлев М.С. Л.: Наука,
1979. С. 89-95.
Батыгина Т.Б., Титова Г.Е., Шамров И.И. Сравнительная эмбриология
нимфейных (Nymphaeales s.l.) в связи с вопросами их филогении и систематики // Матер.
VIII Моск. совещ. по филоген. раст. М.: Наука, 1991. С. 11-14.
Батыгина Т.Б., Фрейберг Т.Е. Полиэмбриония у Роа pratensis L. (Роасеае) //
Ботан. журн. 1979. 64(6). С. 793-804.
Батыгина Т.Б., Шамров И.И. Семейство Ceratophyllaceae // Сравнительная
эмбриология цветковых растений. Winteraceae—Juglandaceae. Л.: Наука, 1981. С. 110-
115.
Батыгина Т.Б., Шамров И.И. Сравнительная эмбриология порядков Nymphaeales
и Nelumbonales и вопросы их систематики и филогении // Ботан. журн. 1985. 70(3).
С. 368-373.
Батыгина Т.Б., Шамров И.И., Колесова Г.Е. Эмбриология нимфейных и
лотосовых. II. Развитие женских эмбриональных структур // Ботан.журн. 1982. 67(9). С.
1179-1183.
Батыгина Т.Б., Шевцова Г.Г. Метаморфоз в онтогенезе орхидных (на примере
Cymbidium hybridum, Orchidaceae) //■ Ботан. журн. 1985. 70(12). С. 1614-1621.
Бекетов А.Н. Учебник ботаники. СПб: Тип. общества «Общественная польза»,
1883. С. 1-911.
Беккер A.M., Николаева М.Г. Изменение липолитической активности семян
яблони в процессе стратификации // Физиология и биохимия культурных растений. 1984.
16. С. 523-528.
Белозерова Л.С, Древаль Г.М., Железкова Е.В. Маликэнзим щитков
прорастающих зерновок кукурузы // Вестн. ЛГУ. Биол. 1986. 1. С. 62-66.
Литература
695
Белозерова Л.С, Плотникова Т.П. Некоторые ферменты анаэробного
метаболизма прорастающей зерновки кукурузы // Вестн. ЛГУ. Биол. 1984. 9(2). С. 98-101.
Белостоков Г.П. Строение проводящей системы проростков лиственных древесных
растений с подземным прорастанием // Ботан. журн. 1966. 51(5). С. 705-716.
Беляев В. Антеридии и антерозоиды разноспоровых плауновых. Дисс. М.: Унив.
Тип., 1885. С. 1-71.
Беляева Н.С. Процесс оплодотворения у хлопчатника (Gossypium barbadense L.):
Автореф. дис. ... канд. биол. наук. Ашхабад, 1964. С. 1-16.
Беляева Н.С. Развитие зародышевого мешка и оплодотворение у покрытосеменных
(на примере представителей флоры Туркмении): Дисс. ... докт. биол. наук. Ашхабад,
1977. С. 1-288.
Беляева Н.С. Взаимоотношение мужских гамет с клетками женского гаметофита у
покрытосеменных растений. Гипотеза двойного оплодотворения // Изв. АН Туркм.
ССР. Сер. биол. наук. 1980. 5. С. 43-51.
Беляева Н.С. Строение и развитие женского гаметофита покрытосеменных после
клеткообразования // Изв. АН Туркм. ССР. Сер. биол. наук. 1987. 6. С. 3-10.
Биологический энциклопедический словарь. / Ред. Гиляров М.С. Изд. 2-е. М.:
Советская энциклопедия, 1989. С. 1-846.
Богданова В.М. Условия прорастания семян аралиевых Дальнего Востока и пути
его ускорения: Автореф. дис. ... канд. биол. наук. Л., 1971. С. 1-23.
Броунов П.И. Значение сельскохозяйственно-метеорологических наблюдений и
краткое руководство для производства их. СПб, 1897. С. 1-137.
Брукер Дж.Д., Ченг СП., Маркус А. Синтез белка и прорастание семян //
Физиология и биохимия покоя и прорастания семян. / Ред. Николаева М.Г.,
Обручева Н.В. М.: Колос, 1982. С. 387-396.
Брюхин В.Б. Развитие зародыша пиона in vivo и in vitro: Автореф. дис. ... канд.
биол. наук. СПб, 1993. С. 1-21.
Бутник А.А. Сем. Chenopodiaceae // Сравнительная анатомия семян. Л.; Наука,
1991. 1. С. 77-82.
Вайнтрауб И.А., Шутов А.Д., Ропот Е.С. Регуляция распада запасных белков в
прорастающих семенах // Физиология семян: формирование, прорастание,
прикладные аспекты. Душанбе: Дониш, 1990. С. 142-149.
Валишина В.П., Цингер Н.В. Зависимость прорастания семян аконитов от
размеров зародыша // Бюлл. ГБС 1952. Вып.13. С. 45-47.
Василева О.А. Изменение нуклеиновых кислот в ходе оплодотворения у гороха //
ДАН СССР. 1954. 95(1). С. 163-166.
Василевская В.К. О связи между строением корня и жилкованием семядолей //
Вестник ЛГУ. Сер. биол. 1961. 21(4). С. 14-22.
Васильев А.Е. Ультраструктура стигматоидных клеток Lilium // Физиология
растений, 1970. 17(6). С. 1240-1248.
Васильев А.Е., Воронин Н.С, Еленевский А.Г., Серебрякова Т.И. Ботаника:
анатомия и морфология растений. М.: Просвещение, 1978. С. 1-480.
Васильева В.Е. Эндогенная ритмика процессов в развивающемся семени // Тез.
докл. III Съезда ВОФР. СПб, 1993а. 3. С. 272.
Васильева В.Е. Некоторые морфофизиологические аспекты эмбриогенеза растений
// Тез. докл. II Съезда ВОФР, Минск, 1990. М., 19936. С. 36.
Васильева В.Е., Батыгина Т.Б. Культивирование in vitro зародышей и семяпочек
лотоса, изолированных на разных стадиях развития // Физиология растений. 1981.
28(2). С. 319-327.
696
Семя
Васильева В.Е., Колесова Г.Е., Чочиа К.А., Батыгина Т.Б. Морфофизиологичес-
кие корреляции в развитии семяпочки лотоса // Матер. Всес. симп. «Морфофункци-
ональные аспекты развития женских генеративных структур семенных растений».
Телави, 1984. С. 11.
Васильева В.Е., Фрейберг Т.Е., Батыгина Т.Б. Развитие зародышей пиона в
культуре in vitro // Тез. докл. VII Всес. симп. по эмбриологии растений. Киев,
1978. 3. С. 9-11.
Васильченко И.Т. О значении морфологии прорастания семян для систематики
растений и истории их происхождения // Тр.БИН АН СССР. Сер.1. 1936. 3. С.
7-66.
Верещагина В. А, Некоторые эмбриологические особенности гинодиэцичных видов
Echium (Boraginaceae) // Ботан. журн. 1976. 61 (11). С. 1582-1589.
Верещагина В.А. Семейство Violaceae // Сравнительная эмбриология цветковых
растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983а. С. 111-115.
Верещагина В.А. Развитие эндосперма у Pulmonaria (Boraginaceae) // Ботан.
журн. 19836. 68(8). С. 1107-1112.
Викторов Д.П. Краткий словарь ботанических терминов. М.: Сов. наука, 1957. С.
1-213.
Винтер А.Н. Эмбриология рода Hydrostemma (Barclaya) в связи с его
систематическим положением: Автореф. дис. ... канд. биол. наук. Л., 1987. С. 18.
Винтер А.Н., Батыгина Т.Б. Семейство Barclayaceae // Сравнительная анатомия
семян. Л.: Наука, 1988. С. 147-152.
Вишнякова М.А. Исследование прогамной фазы оплодотворения у люцерны в
связи с самонесовместимостью // Тр. по прикл. бот., ген. и селекции. Л., 1986. 99.
С. 17-22.
Вишнякова М.А. Рост пыльцевых трубок в пестиках цветка яблони (Malus
domestica Borkh.) в связи с самонесовместимостью // Бюлл. ВИР. 1987. Вып. 170.
С. 34-38.
Вишнякова М.А. Структурно-функциональные основы самонесовместимости у
цветковых растений // Ботан. жури. 1989. 74(2). С. 137-152.
Вишнякова М.А. Роль рыльца и столбика во взаимодействии пыльцы с пестиком
у Trifolium pratense (Fabaceae) // Ботан. журн. 1991. 76(5). С. 677-686.
Вишнякова М.А. Структурные основы действия генов самонесовместимости //
Генетика. 1994. 30(10). С. 107-117.
Волотовский И.Д. Фитрхром — регуляторный фоторецептор растений. Минск:
Наука и техника, 1992. С. 1-167.
Вооонин Н.С. Об эволюции корней у растений. 1. Верхушечные меристемы корней
// Бюлл. МОИП. Отд. биол. 1956. 61(5). С. 47-58.
Воронин Н.С. Эволюция первичных структур в корнях растений // Уч. зап.
Калужск. Гос. Пед. ин. 1964. 13. С. 3-179.
Ворсобина Д.И., Солнцева М.П. Оплодотворение и ранний эмбриогенез у
Zephyranthes Candida Herb. // Половой процесс и эмбриогенез. М., 1973. С. 41-42.
Ворсобина Л.И., Солнцева М.П. Особенности цветения и процесс оплодотворения
у некоторых амариллисовых // Актуальные вопросы эмбриологии покрытосеменных.
/ Ред. Яковлев. М.С. Л.: Наука, 1979а. С. 28-38.
Ворсобина Л.И., Солнцева М.П. Развитие гелобиального эндосперма в семействе
амариллисовых у родов Zephyranthes и Sternbergia // Актуальные вопросы
эмбриологии покрытосеменных растений. /Ред. Яковлев М.С. Л.: Наука, 19796. С. 75-81.
Литература ""'
Ворсобина Л.И., Солнцева М.П. Семейство Amaryllidaceae // Сравнительная
эмбриология цветковых растений. Butomaceae—Lemnaceae. Л.: Наука, 1990. С. 87-96.
Вышенская Т.Д. Семейство Centrolepidaceae // Сравнительная анатомия семян.
Л.: Наука, 1985. 1. С. 187-189.
Вышенская Т.Д. Направления развития зародыша в семействе Myrtaceae в связи
с его систематикой // Матер. VIII Моск. совещ. по филоген. раст.
«Общебиологические аспекты филогении растений». М.: Наука, 1991. С. 28-30.
Вышенская Т.Д. Семейство Bombacaceae // Сравнительная анатомия семян. Л.:
Наука, 1992. 4. С. 305-325.
Вышенская Т.Д. Семейство Psiloxylaceae // Сравнительная анатомия семян. СПб:
Мир и семья-95. 1996а. 5. С. 153.
Вышенская Т.Д. Семейство Heteropyxidaceae // Сравнительная анатомия семян.
СПб: Мир и семья-95. 19966. 5. С. 153-155.
Вышенская Т.Д. Семейство Myrtaceae // Сравнительная анатомия семян. СПб:
Мир и Семья-95, 1996в. 5. С. 155-185.
Вышенская Т.Д. Семейство Alzateaceae // Сравнительная анатомия семян. СПб:
Мир и семья-95. 1996г. 5. С. 186-187.
Вышенская Т.Д. Семейство Rhynchocalycaceae // Сравнительная анатомия семян.
СПб: Мир и семья-95. 1996д. 5. С. 187-189.
Вышенская Т.Д. Семейство Репаеасеае // Сравнительная анатомия семян. СПб:
Мир и семья-95. 1996е. 5. С. 189-191.
Вышенская Т.Д. Семейство Oliniaceae // Сравнительная анатомия семян. СПб:
Мир и семья-95. 1996ж. 5. С. 191-193.
Вышенская Т.Д. Семейство Combretaceae // Сравнительная анатомия семян.
СПб: Мир и семья-95. 1996з. 5. С. 193-203.
Вышенская Т.Д. Семейство Crypteroniaceae // Сравнительная анатомия семян.
СПб: Мир и семья-95. 1996и. 5. С. 203-206.
Вышенская Т.Д. Семейство Melastomataceae // Сравнительная анатомия семян.
СПб : Мир и семья-95. 1996к. 5. С. 206-221.
Вышенская Т.Д. Семейство Lythraceae // Сравнительная анатомия семян. СПб:
Мир и семья-95. 1996л. 5. С. 221-230.
Вышенская Т.Д. Семейство Punicaceae // Сравнительная анатомия семян. СПб:
Мир и семья-95. 1996м. 5. С. 230-233.
Вышенская Т.Д. Семейство Duabangaceae // Сравнительная анатомия семян.
СПб: Мир и семья-95. 1996н. 5. С. 233-234.
Вышенская Т.Д. Семейство Sonneratiaceae // Сравнительная анатомия семян.
СПб: Мир и семья-95. 1996о. 5. С. 234-236.
Гачечиладзе М.И. Эмбриология некоторых видов семейства онагровых: Автореф.
дис. ... канд. биол. наук. Тбилиси, 1981. С. 1-24.
Гваладзе Г.Е. Сравнительно-эмбриологическое исследование зародышевых мешков
типов Polygonum, Oenothera, Allium, Fritillaria у некоторых растений: Автореф. дис.
... докт. биол. наук. Тбилиси, 1973. С. 1-54.
Гваладзе Г.Е. Халазальиое полярное ядро центральной клетки зародышевого
мешка покрытосеменных. Тбилиси: Мецниереба. 1976. С. 1-121.
Гваладзе Г.Е., Гачечиладзе М.И. К эмбриологии онагровых // Изв. АН ГССР.
Сер. биол. 1977. 3(6). С. 514-520.
Гваладзе Г.Е., Гачечиладзе М.И. К митотической гипотезе двойного
оплодотворения у покрытосеменных // Сообщ. АН ГССР. 1984. 115(3). С. 613-616.
698
Семя
Гваладзе Г.Е., Гачечиладзе М.И. Эндосперм онагровых // Изв. АН СССР. Сер.
биол. 1987. 6. С. 942-945.
Гексли Дж., Бер Г. де. Экспериментальная эмбриология. М.-Л.: ОГИЗ, Биомед-
гиз, 1936. С. 1-466.
Герасимов И.И. Некоторые замечания о функции клеточного ядра // Русские
классики морфологии растений. / Ред. Арнольди В.М. М.: Госиздат., 1923. С.
123-129.
Герасимова-Навашииа Е.Н. Морфологические данные о цитоплазме мужского га-
метофита у Crepis // ДАН СССР. 1947а. 56(4). С. 415-418.
Герасимова-Навашина Е.Н. О развитии и строении спермиев у Crepis // ДАН
СССР. 19476. 56(6). С. 643-646.
Герасимова-Навашина Е.Н. О поведении спермиев в пыльцевой трубке у Crepis
// ДАН СССР. 1947в. 57(3). С. 285-288.
Герасимова-Навашина Е.Н. О развитии и строении спермиев у Crepis // Реф.
научно-исслед. работ за 1945 г. Отд. биол. наук АН СССР. 1947г. С. 265.
Герасимова-Навашина Е.Н. Митотическая гипотеза двойного оплодотворения //
ДАН СССР. 1947д. 57(4). С. 395-398.
Герасимова-Навашина Е.Н. Оплодотворение у диплоидного и тетраплоидного кок-
сагыза // Реф. научно-исслед. работ за 1945 г. Отд. биол. наук АН СССР. 1947е.
С. 264-265.
Герасимова-Навашииа Е.Н. Пыльцевое зерно, гаметы и половой процесс у
покрытосеменных растений // Тез. докл. делегат, совещ. ВБО. Вып. 4. М.-Л., 1951а. С.
28-33.
Герасимова-Навашина Е.Н. Пыльцевое зерно, гаметы и половой процесс у
покрытосеменных растений // Тр. БИН АН СССР. Cep.VII. 19516. 2. С. 294-355.
Герасимова-Навашина Е.Н. К цитолого-эмбриологическому пониманию процесса
опыления // Тр. БИН АН СССР. Cep.VII. 1952. 3. С. 165-211.
Герасимова-Навашина Е.Н. Двойное оплодотворение покрытосеменных, его
природа и происхождение: Дисс. ... докт. биол. наук. Л., 1954а.
Герасимова-Навашииа Е.Н. Развитие зародышевого мешка, двойное
оплодотворение и вопрос о происхождении покрытосеменных // Ботан. журн. 19546. 39(5). С.
655-681.
Герасимова-Навашина Е.Н. Двойное оплодотворение покрытосеменных, его
природа и происхождение: Автореф. дис. ... докт. биол. наук. Л., 1955. С. 1-42.
Герасимова-Навашина Е.Н. Некоторые цитологические закономерности
процесса оплодотворения у растений // Проблемы современной эмбриологии. / Ред.
Токин Б.П. Л.: Изд-во ЛГУ, 1956. С. 48-57.
Герасимова-Навашина Е.Н. Оплодотворение как онтогенетический процесс //
Ботан. жури. 1957. 42(11). С. 1654-1673.
Герасимова-Навашииа Е.Н. О гаметофите и об основных чертах развития и
функционирования воспроизводящих элементов у покрытосеменных растений // Проблемы
ботаники. М.-Л.: Изд-во АН СССР, 1958. 3. С. 125-167.
Герасимова-Навашина Е.Н. Эмбриологические наблюдения над Arachis hypogaea
L. // Ботан. журн. 1959. 44(10). С. 1453-1466.
Герасимова-Навашина Е.Н. Процесс оплодотворения у тетраплоидных форм //
Тез.докл. III Всес. совещ. эмбриологов. М.: Изд-во Моск. ун-та, 1960а. С. 39-40.
Герасимова-Навашина Е.Н. Влияние температурных условий на ход
эмбриологических процессов у растений // ДАН УССР. 19606. 131(3). С. 688-691.
Литература
699
Герасимова-Навашина Е.Н. Цитологические данные о стимуле к развитию клеток
зародышевого мешка // Тр. БИН АН СССР. Cep.VII. 1962. 5. С. 238-249.
Герасимова-Навашина Е.Н. Двойное оплодотворение покрытосеменных и
некоторые его теоретические аспекты // Матер. Всес. симп. по эмбриологии растений, поев.
70-летию открытия двойного оплодотворения академиком С.Г. Навашиным. Киев,
1968. С. 44-49.
Герасимова-Навашина Е.Н. Двойное оплодотворение покрытосеменных и
некоторые его теоретические аспекты // Проблемы эмбриологии. / Ред. Зосимович В.П.
Киев: Наукова думка, 1971а. С. 113-152.
Герасимова-Навашина Е.Н. О закономерностях процесса оплодотворения у
покрытосеменных // Тез. докл. V Всесоюз. совещ. по эмбриологии растений. Кишинев:
Штиинца, 19716. С. 34-36.
Герасимова-Навашина Е.Н. О периодах митотического цикла гамет
покрытосеменных растений // Вест. Моск. ун-та. Сер. биол. 1971в. 3. С. 93-94.
Герасимова-Навашина Е.Н. Некоторые дополнительные данные о ходе митоза
растительной клетки // ДАН СССР. 1978. 243(1). С. 265-267.
Герасимова-Навашина Е.Н. Двойное оплодотворение и митоз // Цитология и
генетика. 1980. 14(6). С. 69-82.
Герасимова-Навашина Е.Н. Основные черты развития и строения женского гаме-
тофита — гамет у покрытосеменных растений и некоторые принципы разнообразия их
функционирования // Матер. Всес. симп. «Морфо-функциональные аспекты развития
женских генеративных структур семенных растений». Телави, 1984. с 14.
Герасимова-Навашина Е.Н. Оплодотворение у покрытосеменных // Тр. по прикл.
бот., ген. и селекции. Л., 1986. 99. С. 97-100.
Герасимова-Навашина Е.Н. Оплодотворение у покрытосеменных растений //
Ботан. журн. 1990. 75(8). С. 1061-1071.
Герасимова-Навашина Е.Н., Батыгина Т.Б. Процесс оплодотворения у Scilla
sibirica Andr. // Ботан. жури. 1958. 43(7). С. 959-988.
Герасимова-Навашина Е.Н., Батыгина Т.Б. О ходе слияния половых ядер при
оплодотворении у злаков // ДАН СССР. 1959. 124(1). С. 223-226.
Герасимова-Навашина Е.Н., Батыгина Т.Б. Некоторые дополнительные данные о
половом аппарате и процессе оплодотворения у покрытосеменных растений (на
примере Scilla sibirica Andr.) // Проблемы современной эмбриологии. М.: Изд-во Моск.
ун-та, 1964. С. 86-99.
Герасимова-Навашина Е.Н., Батыгина Т.Б., Коробова С.Н., Долгова О.А.
Оплодотворение и развитие зародыша при рентгенизации половых элементов // Тез. докл.
IV совещ. эмбриологов. М.-Л., 1963. С. 12.
Герасимова-Навашина Е.Н., Гуляев В.А. Некоторые данные по ультраструктуре
клеток зародышевого мешка Crepis capillaris (L.) Wallr. после опыления // Бюлл.
ГБС АН СССР. 1973. 89. С. 14-20.
Герасимова-Навашииа Е.Н., Капил Р.Н., Коробова С.Н., Савина Г.И. Процесс
двойного оплодотворения при пониженных температурах // Ботан. журн. 1968.
53(5). С. 614-627.
Герасимова-Навашина Е.Н., Коробова С.Н. О роли сииергид в процессе
оплодотворения // Бюлл. МОИП. Отд. биол. 1959. 61(5). С. 69-76.
Герасимова-Навашина Е.Н., Сальникова Т.В. Влияние этиленимина и диметил-
сульфата на ядра растительных клеток // Цитология и генетика. 1982. 4. С. 7-11.
Голубовская И.Н. Мейоз // Эмбриология цветковых растений. Терминология и
концепции. / Ред. Батыгина Т.Б. СПб: Мир и семья, 1994. 1. С. 70-76.
700
Семя
Горожанкин И.Н. О корпускулах и половом процессе у голосеменных растений //
Уч. зап. Москов. унив., отд. ест.-ист. Вып. 1, 1880. 8. С. 1-177.
Гребинский СО. Рост растений. Львов: Изд-во Львовского ун-та. 1961. С.
1-296.
Гревцова Н.А. Семейство Apiaceae // Сравнительная эмбриология цветковых
растений. Davidiaceae—Asteraceae. Л.: Наука, 1987. С. 35-44.
Гревцова Н.А., Назарова В.Ю., Тихомиров В.Н. К эмбриологии рода Trapa L.
Сравнительно-эмбриологическое исследование женской генеративной сферы Тгара
europaea Fler. и Т. conocarpa (Aresch.) Fler. // Биологические науки. 1987. 7. С.
89-93.
Гриф В.Г., Иванов В.Б. Временные параметры митотического цикла у цветковых
растений // Цитология. 1975. 17(6). С. 694-717.
Гроссгейм А.А. К вопросу о графическом изображении системы цветковых
растений // Советская ботаника. 1945. 13(3). С. 3-27.
Грушвицкий И.В. Роль недоразвития зародыша в эволюции цветковых растений
// Комаровские чтения. XIV. М.-Л.: Изд-во АН СССР, 1961. С. 1-46.
Грушвицкий И.В. Подземное прорастание и функции семядолей // Ботан. журн.
1963. 48(6). С. 906-915.
Гуляев В.А., Герасимова-Навашина Е.Н. Изучение процесса оплодотворения с
помощью электронного микроскопа // Матер. Всес. симп. по эмбриологии растений.
Киев: Наукова думка, 1968. С. 53-57.
Гумилевская Р.А., Чумикина Л.В., Арабова Л.И., Зимин М.В. Действие
теплового шока на мобилизацию белковых отложений в осевых органах набухающих
зародышей гороха Pisum sativum L. // Физиология растений. 1993. 40(1). С. 110-116.
Гургенова М. Процесс оплодотворения yPhelipaea ramosa C.A.Mey (Orobanchaceae)
// Сб. им. С.Навашииа. М.:Изд. Ин-та К.А.Тимирязева,1928. С. 157-168.
Давоян Э.И., Сметанин А.П. Получение каллуса и регенерация растений риса //
Физиология растений. 1979. 26(2). С. 323-328.
Данилова М.Ф. О принципах строения проводящего аппарата проростков
двудольных // Ботан. журн. 1963. 48(9). С. 1249-1270.
Данилова М.Ф. Структурные основы поглощения веществ корнем. Л.: Наука,
1974. С. 1-205.
Данилова М.Ф. Структура корня как органа поглощения веществ: Дисс. ... докт.
биол. наук. Л., 1975. С. 1-705.
Данилова М.Ф., Бармичева Е.М. Дифференциация клеток в ризодермисе Raphanus
sativus L. // Ультраструктура растительных клеток. / Ред. Козубов Г.М. и Васильев
А.Е. Л.: Наука, 1972. С. 103-123.
Данилова М.Ф., Бармичева Е.М. Корневой чехлик // Атлас ультраструктуры
растительных ткаией / Ред. Данилова М.Ф., Козубов Г.М. Петрозаводск: Карелия,
1980. С. 331-338.
Данилова М.Ф., Жоголева Е.П. Анатомия проростка Pnobrychis echidna Lipsky
// Ботан. журн. 1971. 56(9). С. 1307-1317.
Данилова М.Ф., Кирпичников М.И. Словарь терминов // Сравнительная
анатомия семян. Л.: Наука, 1985. 1. С. 8-31.
Данилова М.Ф., Немирович-Даичеико Е.Н., Комар Г.А., Лодкина М.М.
Некоторые направления структурной эволюции семян однодольных // Ботан. журн. 1990.
75(6). С. 755-773.
Данилова М.Ф., Савчеико М.И. Семейство Агесасеае // Сравнительная анатомия
семян. Л.: Наука, 1985.1. С. 236-253.
Литература
701
Данилова М.Ф.,Соколовская Т.Б. Анатомия семядольного узла зародыша злаков //
Матер. Всес. совещ. по эмбриологии растений. Кишинев: Штиинца,1971. С. 47-48.
Данилова М.Ф., Соколовская Т.Б. Анатомия проростка некоторых видов злаков и
вопрос о происхождении однодольных // Ботан. журн. 1973. 58(3). С. 337-349.
Дарвин Ч. Способность к движению у растений // Сочинения. М.-Л.: Изд-во
АН СССР, 1941. 8. С. 153-317.
Делоне Н.А., Данилина А.Н. Цитохимические свойства интерфазных ядер клеток
с различными физиологическими функциями // ДАН СССР, 1963. 151(5). С. 1195-
1198.
Дерфлинг К. Гормоны растений. Системный подход. М.: Мир, 1985. С. 1-304.
Дзевалтовский А.К. Семейство Cucurbitaceae // Сравнительная эмбриология
цветковых растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983. С. 127-138.
Догель В.А. Олигомеризация гомологичных органов Л.: ЛГУ, 1954. С. 1-195.
Долгова-Хведынич О.А. Оплодотворение при отдаленной гибридизации видов
рода Crepis // Ботан. журн. 1967. 52(6). С. 759-771.
Дорн А. Происхождение позвоночных животных и принцип смены функций. М.:
Биомедгиз, 1937. С. 1- 201.
Дюр Л.С. Запасенная информационная рибонуклеиновая кислота и прорастание
семян // Физиология и биохимия покоя и прорастания семяи. / Ред. Николаева
М.Г. и Обручева Н.В. М.: Колос, 1982. С. 373-386.
Ермаков И.П., Морозова Е.М., Карпова Л.В. О содержании ДНК в ядрах
мужского гаметофита некоторых цветковых растении // ДАН СССР. 1980. 251(4).
С. 1023-1024.
Жгенти Л.П. Цитоэмбриология некоторых кавказских видов рода Paeonia: Авто-
реф. дис. ... каид. биол. наук. Тбилиси, 1974. С. 1-47.
Жгенти Л.П. Ультраструктура зиготы и центральной клетки Saxifraga flagellaris
Willd // Тез. докл. IX Всес. совещ. по эмбриологии растений «Гаметогенез,
оплодотворение и эмбриогенез семенных растений, папоротников и мхов». Кишинев:
Штиинца, 1986. С. 91-92.
Жукова Г.Я. О качественном составе пигментного комплекса пластид зеленых
зародышей конских бобов // Ботан. журн. 1963. 48(9). С. 1380-1382.
Жукова Г.Я. О качественном составе пигментного комплекса пластид зеленых
зародышей Vicia faba L. Качественный состав ксантофиллов // Ботан. журн. 1965.
50(11). С. 1601-1602.
Жукова Г.Я. О качественном составе пигментного комплекса пластид зеленого
зародыша некоторых покрытосеменных // Ботан. журн. 1967. 52(8). С. 1085-1095.
Жукова Г.Я. Хлорофиллоносность зародыша у покрытосеменных растений: Дисс. ...
канд. биол. наук. Л., 1968а. С. 1-176.
Жукова Г.Я. Хлорофиллоносность зародыша у покрытосеменных растений: Авто-
реф. дис. ... канд. биол. наук. Л., 1968б. С. 1-17.
Жукова Г.Я. Электрониомикроскопическое исследование хлоропластов зародыша
Iberis umbellata DC. // Тез. докл. VII Всес. конф. по электрон, микроскопии. Киев,
1969. С. 1-162.
Жукова Г.Я. Электронномикроскопические данные об активном состоянии и
морфологических особенностях хлоропластов зародыша некоторых Angiospermae //
Тез. докл. V Всес. совещ. по эмбриологии растений. Кишинев: Штиинца, 1971. С.
56-57.
Жукова Г.Я. О форме хлоропластов зародыша некоторых видов покрытосеменных
растений и её значении // Ботан. журн. 1972. 57(3). С. 290-298.
702
Семя
Жукова Г.Я. Электронномикроскопическое исследование хлоропластов семядолей
зародыша Tilia platyphyllos Scop. // Матер. Ill Bcec. симп. по прим. электрон,
микроскопии в бот. иссл. Петрозаводск, 1974.' С. 147-150.
Жукова Г.Я. Пластидный аппарат зародыша хлоро- и лейкоэмбриофитов и его
функциональное значение // ДАН СССР. 1975а. 224(6). С. 1425-1427.
Жукова Г.Я. Проблема происхождения и эволюции пластид в свете данных
эмбриологии растений // Ботан. журн. 19756. 60(5). С. 713-738.
Жукова Г.Я. Особенности пластидного аппарата зародыша у хлороэмбриофитов и
лейкоэмбриофитов // Актуальные проблемы эмбриологии покрытосеменных растений.
/ Ред. Яковлев. М.С. Л.: Наука, 1979. С. 104-119.
Жукова Г.Я. Семейство Tiliaceae // Сравнительная эмбриология цветковых
растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983. С. 245-248.
Жукова Г.Я. Семейство Geraniaceae // Сравнительная эмбриология цветковых
растений. Brunelliaceae—Tremandraceae. Л.: Наука, 1985. С. 208-211.
Жукова Г.Я. Ультраструктура зародышевого мешка Valeriana officinalis L. после
оплодотворения // Тез. докл. IX Всёс. совещ. по эмбриологии растений. Кишинев:
Штиинца, 1986. С. 91-92.
Жукова Г.Я. Семейство Polemoniaceae // Сравнительная эмбриология цветковых
растений. Davidiaceae—Asteraceae. Л.: Наука, 1987а. С. 206-209.
Жукова Г.Я. Семейство Hydrophyllaceae // Сравнительная эмбриология цветковых
растений. Davidiaceae—Asteraceae. Л.: Наука, 19876. С. 209-211.
Жукова Г.Я. Пластиды зародыша цветковых растений: Дисс. ... докт. биол. наук.
Л., 1988., Т.1. С. 1-456, Т.2. С. 1-161, Т.З. С. 1-197.
Жукова Г.Я. Пластиды зародыша цветковых растений: Автореф. дис. ... докт.
биол. наук. СПб, 1992. С. 1-33.
Жукова Г.Я. Пластиды гамет и зародыша цветковых растений // Ботан. журн.
1993. 78(4). С. 18-35.
Жукова Г.Я. Яйцеклетка // Эмбриология цветковых растений. Терминология и
концепции. Генеративные органы цветка. / Ред. Батыгина Т.Б. СПб: Мир и семья,
1994а. 1. С. 188-192.
Жукова Г.Я. Центральная клетка зародышевого мешка // Эмбриология цветковых
растений. Терминология и концепции. Генеративные органы цветка. / Ред. Батыгина
Т.Б. СПб: Мир и семья, 19946. 1. С. 195-197.
Жукова Г.Я., Драгунова Е.В. Ультраструктура хлоропластов семядолей зародыша
Acer platanoides (Aceraceae) // Ботаи. журн. 1980. 65(10). С. 1404-1411.
Жукова Г.Я., Савина Г.И. Электронномикроскопическое исследование зародыша
Epipactis atrorubens (Hoffm.) Schult. (Orchidaceae) иа ранних фазах его развития //
Ботан. журн. 1978. 63(9). С. 1241-1246.
Жукова Г.Я., Тучина Н.Г. Семейство Агесасеае // Сравнительная эмбриология
цветковых растений. Butomaceae—Lemnaceae. Л.: Наука, 1990. С. 255-266.
Жукова Г.Я., Яковлев М.С. Электронномикроскопическое исследование
хлоропластов зародыша Nelumbo nucifera Gaertn. // Ботан. журн. 1966. 51(11).
С. 1542-1546.
Жукова Г.Я., Яковлев М.С. Некоторые черты субмикроскопической структуры
хлоропластов зеленого зародыша покрытосеменных // Матер. II Всес. симп. по
прим. электрон, микроскопии в бот. иссл. Киев, 1967. С. 66-68.
Жукова Г.Я., Яковлев М.С. Хлоропласты почечки зародыша ископаемого плодика
лотоса (электронномикроскопическое исследование) // Ботан. журн. 1976. 61(6).
С. 869-872.
Литература
703
Забинкова Н.Н., Кирпичников М.Э. Справочное пособие по систематике высших
растений. II. Латинско-русский словарь для ботаников. / Ред. Шишкин Б.К. М.-Л.:
Изд-во АН СССР, 1957. С. 1-335.
Зажурило К.К. К анатомии семеииых оболочек Magnoliaceae (Liriodendron tulipi-
fera L.) // Бюлл. Об-ва естествоисп. при Воронеж. Гос. ун-те, 1940. 4(1). С. 33-40.
Замотайлов С.С. Об особенностях слияния ядер половых клеток у арахиса (Ага-
chis hypogaea L.) // ДАН СССР. 1958. 123(5). С. 941-943.
Замотайлов С.С. Об оплодотворении у арахиса // Тез. докл. III Всес. совещ.
эмбриологов. М.: Изд-во Моск. ун-та, 1960. С. 59-60.
Замотайлов С.С. Оплодотворение арахиса и влияние температуры на этот
процесс// Тр. Кубан. с.-х. ии-та. 1968. 17(45). С. 134-142.
Зубкус Л.П. О жизнеспособности незрелых зародышей фасоли иа питательных
средах// Агробиология. 1950. 1. С. 137-141.
Иванов В.Б. Клеточные основы роста растений. М.: Наука, 1974: 1-223.
Иванов В.Б. Пролиферация клеток в растениях // Итоги науки и техники. Сер.
Цитология. М., 1987. 5. С. 1-219.
Иванов В.Б., Филипенко В.Н. Роль асимметричных митозов в дифференциации
клеток ризодермы фестукоидных злаков // ДАН СССР. 1976. 230(3). С. 712-715.
Иванова И.А. Биология прорастания семяи с недоразвитым зародышем: Автореф.
дис. ... канд. биол. наук. М., 1967. С. 1-20.
Ильина Г.М. Семейство Papaveraceae // Сравнительная эмбриология цветковых
растений. Winteraceae—Juglandaceae. Л.: Наука, 1981. С. 142-150.
Ильина Г.М. Семейство Papaveraceae // Сравнительная анатомия семян. Л.:
Наука, 1988а. 2. С. 208-221.
Ильина Г.М. Семейство Fumariaceae // Сравнительная анатомия семян. Л.:
Наука, 19886. 2. С. 227-231.
Ильина Г.М., Поддубная-Арнольди В.А. Семейство Aizoaceae //■ Сравнительная
эмбриология цветковых растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983. С.
16-19.
Иоффе М.Д. О наличии хлорофилла в эндосперме Крестоцветных // ДАН
СССР. 1952. 82(3). С. 473-476.
Иоффе М.Д. Развитие зародыша и эндосперма у пшеницы, конских бобов и
редиса // Тр. БИН АН СССР. Cep.VII. 1957. Вып.4. С. 211-269.
Иоффе М.Д. К эмбриологии Trochodendron arabioides Sieb. et Zucc. //Тр. БИН
АН СССР. Cep.VII. 1962. 5. С. 250-259.
Иоффе М.Д. К эмбриологии Trochodendron arabioides Sieb. et Zucc. (Развитие
зародыша и эндосперма) // Морфология цветка и репродуктивный процесс у
покрытосеменных растений. / Ред. Яковлев М.С. М.-Л., 1965. С. 177-188.
Иоффе М.Д. Процесс оплодотворения у Anemone nemorosa L. и Anemone
ranunculoides L. // Ботан. жури. 1968. 53(7). С. 891-905.
Иоффе М.Д. Полиплоидия в эндосперме цветковых растений // Проблемы
эмбриологии. / Ред. Зосимович В.П. Киев: Наукова думка, 1971а. С. 170-196.
Иоффе М.Д. Развитие эндосперма и зародыша у Anemone nemorosa L. // Ботаи.
журн. 19716. 56(11). С. 1582-1592.
Иоффе М.Д. Особенности двойного оплодотворения в роде Melampyrum L. (Scro-
phulariaceae) (в связи с формированием диплоидного эндосперма) // Ботан. журн.
1976. 61(11). С. 1515-1530.
Иоффе М.Д., Жукова Г.Я. Культура изолированных зародышей покрытосеменных
растений на искусственной среде // Ботан. жури. 1965. 50(8). С. 1157-1182.
704
Семя
Иоффе М.Д., Жукова Г.Я. Некоторые особенности формирования оболочки
зиготы и клеток проэмбрио в семействе Dilleniaceae // Тез. докл. Всес. симп. «Половой
процесс и эмбриогенез растений». М., 1973. С. 88-89.
Иоффе М.Д., Жукова Г.Я. Модификация оболочки зиготы в процессе ее развития
в роде Dillenia (Dilleniaceae) // Ботан. жури. 1974. 59(10). С. 1409-1416.
Исаева В.В. Нарушение поляризации зигот бурой водоросли Pelvetia wrightii:
эффект цитохалазина // Онтогенез. 1990. 21(4). С. 422-428.
Исаева В.В. Клетки в морфогенезе. М.: Наука, 1994. С. 1-224.
Казачковская Е.Б., Вишнякова М.А., Орел Л.И. Самонесовместимость и
отмирание семяпочек до опыления как фактор снижения семенной продуктивности Medicago
sativa и M.varia (Fabaceae) // Ботан. журн. 1991. 76(2). С. 41-53.
Калинин Ф.Л. Физиолого-биохимические особенности эмбрионального развития
растений: Автореф. дис. ... докт. биол. наук. М., 1956. С. 1-30.
Камалова Г.В. , Абуховская А.П. Эмбриология видов семейства мальвовых.
Ташкент: ФАН, 1986. С. 1-128.
Камалова Г.В..Жукова Г.Я., Руми В.А. Семейство Malvaceae // Сравнительная
эмбриология цветковых растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983. С.
260-266.
Камелина О.П. Сравнительно-эмбриологическое исследование представителей сем.
Dipsacaceae и Morinaceae. Автореф. дис. ... канд.биол. наук. Л., 1977. С. 1-26.
Камелина О.П. Развитие зародыша у представителей семейств Dipsacaceae и
Morinaceae // Актуальные вопросы эмбриологии покрытосеменных растений. / Ред.
Яковлев М.С. Л.: Наука, 1979. С. 82-89.
Камелина О.П. Сравнительная эмбриология семейств Dipsacaceae и Morinaceae.
Л.: Наука, 1980. С. 1-104.
Камелина О.П. Семейство Frankeniaceae // Сравнительная эмбриология
цветковых растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983. С. 175-179.
Камелина О.П. К эмбриологии рода Escallonia L. (Escalloniaceae)// Ботан. журн.
1984. 69(10). С. 1304-1316.
Камелина О.П. Семейство Dipsacaceae // Сравнительная эмбриология цветковых
растений. Davidiaceae—Asteraceae. Л.: Наука, 1987. С. 184-192.
Камелина О.П. Развитие мужских и женских эмбриональных структур в семействе
Marantaceae // Ботан. журн. 1990а. 75(4). С. 480-493.
Камелина О.П. Семейство Marantaceae // Сравнительная эмбриология цветковых
растений. Однодольные. Butomaceae—Lemnaceae. Л.: Наука, 1990б. С. 247-254.
Камелина О.П. Сравнительно-эмбриологический анализ как метод
филогенетической систематики цветковых растений: Дис. ... докт. биол. наук в форме научного
доклада. Ташкент. 1991. С. 1-80.
Камелина О.П. Эмбриология и систематическое положение рода Tetradiclis (Tetra-
diclidaceae) // Ботан. журн. 1994. 79(5). С. 11-27.
Камелина О.П. Эндосперм семени. К типологии и филогенетической оценке //
Матер, совещ. «Проблемы репродуктивной биологии растений». Пермь, 1996. С. 5-7.
Камелина О.П., Дзевалтовский А.К. Семейство Lamiaceae // Сравнительная
эмбриология цветковых растений. Davidiaceae—Asteraceae. Л.: Наука, 1987. С. 225-236.
Камелина О.П., Жинкина Н.А. К эмбриологии Ostrowskia magnifica (Campa-
nulaceae): семяпочка и семя // Ботан. журн. 1997 (в печати).
Камелина О.П., Жукова Г.Я. Семейство Valerianaceae // Сравнительная
эмбриология цветковых растений. Davidiaceae—Asteraceae. Л.: Наука, 1987. С. 171-177.
Литература
705
Камелина О.П., Коннова В.А. Эмбриологические признаки рода Biebersteinia Steph.
в связи с его систематическим положением // ДАН Тадж. ССР. 1990. 33(3). С.
193-195.
Камелина О.П., Проскурина О.Б. Семейство Elaeagriaceae // Сравнительная
эмбриология цветковых растений. Davidiaceae—Asteraceae. Л.: Наука, 1987. С. 105-110.
Камелина О.П., Терёхин Э.С. Семейство Ruppiaceae // Сравнительная
эмбриология цветковых растений. Однодольные. Butomaceae—Lemnaceae. Л.: Наука, 1990а. С.
39-44.
Камелина О.П., Терёхин Э.С. Семейство Zannichelliaceae //Сравнительная
эмбриология цветковых растений. Однодольные. Butomaceae—Lemnaceae Л.: Наука,
19906. С. 44-50.
Камелина О.П., Шевченко СВ. Семейство Davidiaceae // Сравнительная
эмбриология цветковых растений. Davidiaceae—Asteraceae. Л.: Наука, 1987. С. 7-12.
Камелина О.П., Яковлев Г.В. Мегаспорогенез и развитие зародышевого мешка у
Dianthus caryophyllus L.(Caryophyllaceae) // Ботан. журн. 1982. 67(1). С. 80-87.
Каменский Ф. Сравнительные исследования по развитию и строению пузырчаток
(Utricularia) // Тр. СПб Об-ва естествоисп. 1886. 17. С. 1-71.
Кан А.А. Покой семян: смена концепций и теорий // Физиология и биохимия
покоя и прорастания семян. / Ред. Николаева М.Г., Обручева Н.В. М.: Колос,
1982. С. 347-371.
Кантор Т.С. Об активности хлоропластов зародыша льна // Бюлл. ГБС АН
СССР. 1955. 23. С. 61-67.
Кахидзе Н.Т. Изменение элементов зародышевого мешка при оплодотворении у
томатов // Изв. АН СССР. Сер. биол. 1954. 1. С. 71-78.
Кефели В.И. Природные ингибиторы роста и фитогормоны. М.: Наука, 1974. С.
1-248.
Кирпичников М.Э., Забинкова Н.Н. Русско-латинский словарь для ботаников.
/Ред. Боровский Я.М. Л.: Наука, 1977. С. 1-854.
Ключарева М.В. Оплодотворение у пшеницы // Журн. общ. биол. 1957. 18(4).
С. 288-297.
Ковалев А.Г. Рост корней проростков Quercus robur L. и Aesculus hippocastanum
L. (клеточный анализ): Дисс. ... канд. биол. наук. М.: МГУ, 1977. С. 1-148.
Кожанчиков В.И. Морфологические признаки семян семейства Caryophyllaceae и
возможные пути их эволюции // Ботан. журн. 1967. 52(9). С. 1277-1286.
Козо-Полянский Б.М. Способы изображения эволюционной системы растений //
Ьотн. журн. 1949. 34(3). С. 245-252.
Колесова Г.Е., Батыгина Т.Б. Семейство Nelumbonaceae // Сравнительная
анатомия семян. Л.: Наука, 1988. 2. С. 157-162.
Коломыцев Г.Г. О развитии однодольных растений и природе их семядолей //
Тр. Ленингр. Об-ва естествоисп., 1977. 73(3). С. 78-99.
Комар Г.А. Семейство Grossulariaceae // Сравнительная анатомия семян. СПб:
Мир и семья- 95. 1996. 5. С. 60-67.
Комар Г.А. Семейство Alliaceae // Сравнительная анатомия семян. Однодольные.
Л.: Наука. 1985. 1. С. 78-82.
Комар Г.А. Семейство Hemerocallidaceae // Сравнительная анатомия семян.
Однодольные. Л.: Наука. 1985. 1. С. 82-83.
Комар Г.А. Семейство Asphodelaceae // Сравнительная анатомия семян.
Однодольные. Л.: Наука. 1985. 1. С. 93-96.
45 828
706
Семя
Комар Г.А. Семейство Smilacaceae // Сравнительная анатомия семян.
Однодольные. Л.: Наука. 1985. 1. С. 132-133.
Комар Г.А. Семейство Nyctaginaceae// Сравнительная анатомия семян. Л.:
Наука. 1991. 3. С. 12-17.
Конарев В.Г., Сердюк Л.С. Определение состояния ДНК в клетке // Методы
исследования НК растений. / Ред. Коиарев В.Г. Л.: Наука, 1967. С. 21-26.
Конев СВ., Мажуль В.М. Межклеточные контакты. Минск: Наука и Техника,
1977. С. 1-291.
Конычева В.И., Кадырова Р.У. Семейство Chenopodiaceae // Сравнительная
эмбриология цветковых растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983. С.
49-52.
Кордюм Е.Л. Цитоэмбриология семейства зонтичных. Киев: Наукова думка, 1967.
С. 1-176.
Кордюм Е.Л. Эволюционная цитоэмбриология покрытосеменных растений. Киев:
Наукова думка, 1978. С. 1-219.
Коробова С.Н. О ходе оплодотворения у кукурузы (Zea mays L.) // ДАН
СССР. 1959. 127(4). С. 921-924.
Коробова С.Н. Процесс оплодотворения у кукурузы (Zea mays L.)// Морфогенез
растений. М.: Изд-во МГУ, 1961.(1). С. 514-519.
Коробова С.Н. К эмбриологии кукурузы // Тр. БИН АН СССР. Сер.VII.
1962. 5. С. 294-314.
Коробова С.Н. Движение спермиев в пыльцевой трубке покрытосеменных растений
// Ботан. жури. 1977. 62(11). С. 1585-1589.
Коробова С.Н. Движение спермиев покрытосеменных растений в пыльцевой трубке
и в зародышевом мешке // Актуальные вопросы эмбриологии покрытосеменных. /
Ред. Яковлев М.С. Л.: Наука, 1979. С. 5-19.
Коробова С.Н. Формирование женского гаметофита, оплодотворение, развитие
зародыша и эндосперма кукурузы // Культурная флора. М., 1982. С. 151-176.
Коробова С.Н. Семейство Plumbaginaceae // Сравнительная эмбриология
цветковых растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983. С. 59-64.
Коробова С.Н. Семейство Podostemaceae // Сравнительная эмбриология
цветковых растений. Brunelliaceae—Tremandraceae. Л.: Наука, 1985. С. 80-83.
Коробова С.Н., Жинкина Н.А. Семейство Campanulaceae // Сравнительная
эмбриология цветковых растений. Davidiaceae—Asteraceae. Л.: Наука, 1987. С. 300-308.
Коробова-Семенченко Л.В. К эмбриологии семейства Saxifragaceae. VII.
Отклонение при развитии эндосперма у Bergenia crassifolia (L.) Fritsch. // Вестн. Моск.
ун-та, Сер. биол. 1977. 2. С. 81-84.
Корчагина И.А. Сравнительное исследование способа прорастания и внутренней
морфологии семян некоторых березовых // Ботан. журн. 1964. 49(10). С. 1487-
1496.
Корчагина И.А. Семейство Betulaceae // Сравнительная эмбриология, цветковых
растений. Winteraceae—Juglandaceae. Л.: Наука, 1981. С. 201-210.
Кострикова Л.Н. Эмбриологическое исследование Vicia faba L. // Бюлл. МОИП.
Отд. биол. 1955. 60(6). С. 101-106.
Кострикова Л.Н. Эмбриологическое исследование рода Vicia // Вестн. Моск.
уи-та, сер. геол., геогр., биол., почв. 1956. 2. С. 59-80.
Кострикова Л.Н. Об эндосперме покрытосеменных // Вестн. Моск. ун-та, сер.
биол. 1984. 4. С. 3-9.
Литература
707
Кострюкова К.Ю. К вопросу о разнокачественности спермиев-клеток,
происходящих из одной пыльцевой трубки // Ботан. журн. 1951. 8(3).
Кострюкова К.Ю. Разнокачественность спермиев в двойном оплодотворении //
Матер. Всес. симп. по эмбриол. растений. Киев, 1968. С. 107-111.
Кострюкова К.Ю., Беиецкая Г.К. Подтверждает ли дальнейшее развитие
эмбриологии учение С.Г.Навашина о самостоятельной подвижности мужских гамет
покрытосеменных // Изв. АН Арм. ССР, биол. и с.-х. науки, 1958. 11(9). С. 7-24.
Кострюкова К.Ю., Чернояров М.В. Споростережения над прорастаниями пилку
Clivia miniata Hort. in vitro // Труды Бот. сада, 1938. 8. С. 82-85.
Коф Э.М., Кефели В.И. Рост и морфогенез ацетабулярии. М.: Наука, 1994. С.
1-112.
Красников Л.Г. Оплодотворение у Butomus umbellatus L. // Тр. 2 Молодежной
конф. ботаников Ленинграда. Л.: Деп. ВИНИТИ 14.07.88, N 5684-В 88, 1988.3.
С. 22-23.
Красников Л.Г. Эмбриология семейства Butomaceae: Автореф. дис. ... канд. биол.
наук. Л., 1989а. С. 1-20.
Красников Л.Г. Эмбриология семейства Butomaceae: Дисс. ... канд. биол. наук.
Л., 19896. С. 1-191.
Красовская И.В. Аиатомо-морфологические закономерности в ходе корневой
системы хлебных злаков // Уч. зап. Саратов. Ун-та, 1952. 35. С. 15-70.
Кренке Н.П. Регенерация растений. М.-Л.: Изд-во АН СССР, 1950. С. 1-676.
Крокер В. Рост растений. М.: ИЛ, 1950. С. 1-359.
Кудоярова Г.Р., Усманов И.Ю. Гормоны и минеральное питание // Физиология
и биохимия культурных растений, 1991. 23(3). С. 232-244.
Кудряшов И.В. Происхождение односемядольиости однодольных на примере
Helobiae // Ботан. журн. 1964. 49(4). С. 473-486.
Кузнецов Е.Д., Сечняк Л.К., Киндрук Н.А., Слюсаренко O.K. Роль фитохрома
в растениях. М.: Агропромиздат, 1986. С. 1-288.
Кузнецов Н.И. Введение в систематику цветковых растений. Л.: Огиз, гос. изд-во
биолог, и медиц. лит-ры, 1936. С. 1-456.
Кулаева О.Н. Гормональная регуляция физиологических процессов у растений иа
уровне синтеза РНК и белка // 41-е Тимирязевское чтение. М.: Наука, 1982.
С. 1-84.
Лагутова О.И., Чеботарь А.А. Исследование эмбриогенеза Orchis purpurea и
Orchis provincialis (Orchidaceae) // Ботан. журн. 1992. 77(12). С. 53-57.
Леманн Е., Айхеле Ф. Физиология прорастания семян злаков. М.-Л.: Сельхозгиз,
1936. С. 1-483.
Леме Ж. Основы биогеографии. М.: Прогресс, 1976. С. 1-309.
Линскеис Г.Ф. Реакция торможения при несовместимом опылении и ее
преодоление // Физиология растений. 1978. 19(1). С. 192-204.
Литвак В.П. Карельска береза (Betula verrucosa var.carelica Sae) в Украшскому
n0Aicci // Укр. ботан. журн. 1968. 25(1). С. 103-106.
Литвак А.И. Люминесцентная микроскопия в исследовании опыления и роста
пыльцевых трубок в пестике // Генетика и селекция в Молдавии. Кишинев, 1971. С.
1-105.
Литвак А.И. Семейство Juglandaceae // Сравнительная эмбриология цветковых
растений. Winteraceae—Juglandaceae. Л.: Наука, 1981. С. 216-223.
45*
708
Семя
Литвак А.И., Алимова Г.К., Якимов Л.М. Семейство Vitaceae // Сравнительная
эмбриология цветковых растений. Davidiaceae—Asteraceae. Л.: Наука, 1987. С. 98-
101.
Литвак А.И., Колесников СМ. Использование микрофотосъёмки в изучении
процессов развития мужского гаметофита покрытосеменных растений // Биология
оплодотворения и гетерозис культурных растений. / Ред. Коварский А.Е. Кишинев:
Картя Молдавеняск, 1965. С. 186-206.
Литовченко А.Г. Роль трехсемядольности в социалистической индустрии растений
// ДАН СССР. 1940. 27. С. 816-820.
Лодкина М.М. Эволюционные отношения однодольных и двудольных по данным
изучения зародыша и проростков // Ботан. журн. 1988. 73(5). С. 617-629.
Лодкина М.М., Ляшук А.И., Николаева М.Г. Анатомические изменения в
зародышах Acer tataricum L. во время созревания и в процессе стратификации семян //
Ботан. журн. 1971. 56(3). С. 321-334.
Лосев А.П. О методике получения радиохимически чистых ксантофиллов //
Физиология растений. 1964. 11(6). С. 1098-1104.
Лукьянюк С.Ф. Разработка приемов in vitro для получения гаплоидов ячменя и
тритикале: Автореф. дис. ... канд. биол. наук. М., 1983. С. 1-18.
Лукьянюк С.Ф., Игнатова С.А. Методы культуры тканей и органов в селекции
растений. Методические рекомендации. Одесса: ВСГИ, 1980. С. 1-21.
Львова И.Н. Некоторые вопросы цитофизиологии оплодотворения у злаков //
Селекция и семеноводство. 1950. 9. С. 11-23.
Любименко В.Н. О превращениях пигментов пластид в живой ткани растения //
Зап. Импер. Акад. наук, сер.8. 1916. 13(12). С. 1-274.
Ляшук А.И. Анатомические изменения зародыша Fraxinus excelsior L. в процессе
стратификации // Ботан. журн. 1971. 56(11). С. 1689-1693.
Ляшук А.И. Анатомия зародышей Fraxinus excelsior L. и Acer tataricum L. в
процессе стратификации семян: Автореф. дис. ... канд. биол. наук. Л., 1972. С.
1-18.
Маркова И.В., Батов А.Ю., Мошков А.В., Максимов Г.Б., Медведев С.С.
Кальций-транспортирующие системы плазмалеммы колеоптилей кукурузы //
Физиология растений. 1995. 42(2). С. 262-267.
Матвеев Б.С. О приспособлениях к лактации у млекопитающих// Зоол. журн.
1942. 21( 3). С. 47-68.
Медведев С.С. Электрические поля и рост растений // Электронная обработка
материалов. Кишинев: Штиинца, 1990. 3. С. 68-74.
Медведев С.С. Физиологические основы полярности растений // Тр. СПб Об-ва
естествоисп. СПб.: Изд-во «Кольиа», 1996. С. 1-159.
Медведев С.С, Белькииа Ю.В., Шевцов Ю.И. Активация роста растяжением
отрезков колеоптилей кукурузы и междоузлий гороха под действием слабого
электрического тока // Вестн. ЛГУ. Сер.З, Биол. 1986. 4. С. 109-113.
Медведев С.С, Максимов Г.Б., Маркова И.В. Роль ионов кальция в регуляции
гравиотропизма // Experimental Biology. Vilnius. Lietuva, 1991. 4. С. 71-92.
Медведев С.С, Максимов Г.Б., Полевой В.В. Значение разности потенциалов
между мезокотилем и корневой системой для ростовых процессов и накопления
минеральных элементов проростками кукурузы // Вестн. ЛГУ. Биол. 1980. 4. С. 85-90.
Медведев С.С, Маркова И.В., Батов А.Ю., Максимов Г.Б. Полярные потоки
ионов кальция и рост растительных тканей // Физиология растений. 1989а. 36(5).
С. 990-997.
Литература
709
Медведев С.С, Маркова И.В., Шишова М.Ф., Сопова Т.М. О полярном
транспорте кальция в растительных тканях // Вестн. ЛГУ. Сер.З. 19896. 1(3): 79-83.
Медведев С.С, Штонда И.А. О роли ионов кальция в гравиотропической реакции
// Биологические науки, 1989. 6. С. 94-97.
Мейер К.И. К эмбриологии Nuphar luteum Sm. // Бюлл. МОИП, Отд. биол.
1960. 65(6). С. 48-59.
Мейер К.И. К эмбриологии Coronaria floscuculi (L.) A.Br. // Ботан. журн. 1962.
47(6). С. 847-852.
Ментковская Е.А. Особенности процесса оплодотворения у лилии // Цитолого-
эмбриологические и генетико-биохимические основы опыления и оплодотворения
растений. / Ред. Банникова В.П. Киев: Наукова думка, 1982. С. 243-245.
Меркис А.И. Значение силы тяжести в ростовых процессах растений //
Проблемы космической биологии. М.: Нау"а, 1976. 33. С. 116-173.
Меркис А.И. Сила тяжести в процессах роста растений // Проблемы
космической биологии. М.: Наука, 1990. 68. C/l-185.
Михайлов А.Т. Эмбриональные индукторы. М.: Наука, 1988. С. 1-216.
Мовсесян С.Н. Процесс оплодотворения у Rudbeckia maxima // Изв. АН Арм.
ССР. 1964. 17(2). С. 77-83.
Мовсесян С.Н. Сравнительное эмбриологическое исследование некоторых видов
рудбекии // Матер. Всес. симп. по эмбриологии растений. Киев: Наукова думка,
1968. С. 138-140.
Мовсесян С.Н. Цитоэмбриологическое исследование апомиксиса у представителей
рода Rudbeckia // Апомиксис и селекция. / Ред. Хохлов С.С. и др. М.: Наука,
1970. С. 126-134.
Мовсесян С.Н. Особенности семигамии // Апомиксис и цитоэмбриология
растений. Вып.5. / Ред. Гришина Е.В. и др. Саратов: Изд-во Сарат. Ун-та, 1983. С.
93-104.
Мовсесян С.Н., Каспарова И.П. Семигамия у Rudbeckia laciniata L. при
различных способах опыления // Ботан. журн. 1977а. 62(3). С. 422-429.
Мовсесян С.Н., Каспарова И.П. О некоторых особенностях семигамии // Цито-
генетические основы селекции растений. / Ред. Петров Д.Ф. Новосибирск: Наука,
19776. С. 151-159.
Мовсесян С.Н., Хачатрян Г.Л. Структура семигамного предзародыша у Rudbeckia
laciniata L. // Уч. Зап. Ереван, ун-та. 1975. 2. С. 110-117.
Модилевский Я.С. Про утворения зародив Allium odorum L. // BicH. Кшв.
ботан. саду. 1931. 12-13. С. 27-48.
Модилевский Я.С. Сугасиии стой питания про зашйднения у покритонасшних
рослин. (Совремеииое состояние вопроса об оплодотворении у покрытосеменных
растений)// Ботан. журн. АН УРСР, 1949. 6(3). С. 3-18.
Модилевский Я.С. Современное состояние вопроса об эндосперме у
покрытосеменных растений в связи с формированием зародыша, семени и плода // Изв. АН
СССР. Сер. биол. 1950. 2. С. 23-37.
Модилевский Я.С. Эмбриология покрытосеменных растений. Киев: Изд-во АН
УССР, 1953. С. 1-244.
Модилевский Я.С. Онтогенез вищих рослин i теор1я стадшного розвитку // Укр.
ботан. журн. 1958. 15(1). С. 3-21.
Модилевский Я.С. Цитоэмбриология высших растений. Киев: Изд-во АН УССР,
1963. С. 1-372.
710 Семя
Модилевский Я.С, Оксиюк П.Ф., Худяк М.И., Дзюбенко Л.К., Бейлис-
Выровая Р.А. Цитоэмбриология основных хлебных злаков. Киев: Изд-во АН УССР,
1958. С. 1-336.
Монтеверде Н.А. Результаты исследований над развитием зародыша у орхидных
// Тр. СПб О-ва естествоисп. 1880. 11(2). С. 152-154.
Монтеверде Н.А. О распространении маннита и дульцита в растительном царстве
// Бот. зап., изд. при Бот. саде СПб унив., 1892. III. С. 431-451.
Монтеверде Н.А., Любименко В.Н. О зеленом пигменте внутренней оболочки
семян Cucurbitaceae и его отношении к хлорофиллу // Изв. СПб бот. сада, 1909.
9(2-3). С. 27-42.
Морозова Н.М. Изучение морфофизиологических корреляций в развивающемся
зародыше (на модельных системах Nelumbo nucifera Gaertn. и Daucus carota L.):
Дисс. ... канд. биол. наук. СПб, 1993а. С. 1-248.
Морозова Н.М. Изучение морфофизиологических корреляций в развивающемся
зародыше (на модельных системах Nelumbo nucifera Gaertn. и Daucus carota L.):
Автореф. дис. ... канд. биол. наук. СПб, 1993б. С. 1-25.
Москов И.В. О развитии зародыша у некоторых видов пионов// Ботан. журн.
1964. 49(6): 887-894.
Мошкович А.А., Чеботарь А.А. Рожь: кариология, эмбриология, цитология.
Кишинев: Штиинца, 1976. С. 1-192.
Навашин М.С. Гаплоидные, диплоидные и триплоидные ядра у Crepis virens //
Зап. Киевск. Об-ва естествоисп. 1915. 25. С. 139-152.
Навашин М.С. Пыльцевая трубка покрытосеменных как полярно-дифферен-
цированная система // Матер. Всес. симп. по эмбриологии растений. Киев: Наукова
думка, 1968. С. 141-146.
Навашин М.С. Теория С.Г. Навашина о структурном диморфизме половых ядер
как основа их функционировании в двойном оплодотворении и ее дальнейшая
конкретизация // Бюлл. Гл. бот. сада. 1973. 89. С. 10-14.
Навашин М.С, Герасимова-Навашина Е.Н. Об изучении клеточных процессов на
фиксированном материале // Ботан. журн. 1958. 43(2). С. 167-177.
Навашин М.С, Макушенко Л.М. О начальных фазах регенерации в связи с
вопросами о генезисе растительной клетки // Тр. совещ. по эмбриологии «Проблемы
современной эмбриологии». Л., 1956. С. 356.
Навашин М.С, Макушенко Л.М., Волховских З.В. Морфологическое
исследование пыльцевой трубки // Тез. координац. совещ. по проблеме «Узловые вопросы
цитологии». Л., 1959. С. 17.
Навашин М.С, Макушенко Л.М., Волховских З.В. Новые наблюдения над
живыми пыльцевыми трубками // Тез. IV совещ. эмбриологов. Л., 1963. С. 30-31.
Навашии СГ. Об оплодотворении у вяза и орешника // Тр. СПб Об-ва
естествоисп., Отд. бот. 1895а. 25. С. 23-25.
Навашин СГ. Об обыкновенной березе и о морфологическом значении халазога-
мии // Тр. СПб общ. естествоисп., Отд. бот. 1895б. 25. С. 5-61.
Навашии С.Г. Новые данные по эмбриологии орешника Corylus avellana //
Протоколы СПб общ. естествоисп. Отд. бот. 1895в. 5. С. 11-15.
Навашин С.Г. Об оплодотворении у Juglans // Тр. СПб Об-ва естествоисп.
1897. 28(1). С. 1-4.
Навашии СГ. Новые наблюдения иад оплодотворением у Fritillaria tenella и Lilium
martagon // Дневник X съезда русских естествоиспытателей и врачей. Киев:
1898.(6). С. 16-21.
Литература
711
Навашин С Г. Об оплодотворении у сложноцветных и орхидных // Известия
Импер. Акад. наук. 1900. 13(3). С. 335-340.
Навашин С.Г. Диморфизм ядер у Plasmodiophora Brassicae // Зап. Киевск. об-ва
естествоисп. 1901. 17(1). С. 26.
Навашин С.Г. О самостоятельной подвижности мужских половых ядер //
Зап.Киевского об-ва естествоисп. 1910. 20(4). С. 321-336.
Навашин С.Г. Подробности об образовании мужских половых ядер у Lilium
martagon // Зап. Киевск. об-ва естествоисп. 1911. 21(4). С. 119-151.
Навашин С.Г. Гаплоидное, диплоидное и триплоидное ядро у Crepis virens // Зап.
Киевск. общ-ва естествоисп. 1915. 25(1). С. 139-152.
Навашин С.Г. Опыт структурного изображения свойств половых ядер // Сб.
посвященный И.П.Бородину. Л., 1927. С. 94-114.
Навашин С.Г. Избранные труды. М.-Л.: Изд-во АН СССР, 1951. 1. С. 1-363.
Навашин С.Г., Финн В.В. К истории развития халазогамных Juglans nigra и
Juglans regia // Зап. Киевского об-ва естествоисп. 1912. 22(3-4). С. 1-85.
Назаров В.В. Репродуктивная биология орхидных Крыма: Дисс. ... канд. биол.
иаук. СПб, 1995. С. 1-294.
Нарматов Б. Биология цветения и цитоэмбриология однолетних эспарцетов:
Автореф. дис. ... каид. биол. наук. Ташкент, 1988. С. 1-20.
Наумова Т.Н. Особенности развития нуцеллярной ткаии и нуцеллярная полиэмб-
риония у Opuntia elata (Cactaceae) // Ботаи. журн. 1978. 63(3). С. 344-355.
Наумова Т.Н. Семейство Fagaceae //Сравнительная эмбриология цветковых
растений. Winteraceae—Juglandaceae. Л.: Наука, 1981. С. 197-201.
Наумова Т.Н. Нуцеллярная и интегументальная эмбриоиия в системе семенного
воспроизведения цветковых растений: Автореф. дис. ... докт. биол. наук. Л., 1989.
С. 1-47.
Наумова Т.Н., Яковлев М.С. Половое воспроизведение Opuntia ficus-indica
(Cactaceae) // Ботан. журн. 1978. 63(4). С. 548-556.
Немирович-Даиченко Е.Н. Семейство Dipterocarpaceae // Сравнительная
анатомия семян. Л.: Наука, 1992. 4. С. 263-278.
Никитичева З.И. Эмбриогенез некоторых паразитирующих видов из семейств
Scrophulariaceae и Orobanchaceae // Ботан. журн. 1971. 56(1). С. 93-105.
Никитичева З.И. Развитие зародыша, эндосперма и семени у паразитных
представителей семейства Scrophulariaceae // Актуальные вопросы эмбриологии
покрытосеменных. / Ред. Яковлев М.С. Л.: Наука, 1979а. С. 130-157.
Никитичева З.И. О взаимосвязях в развитии эндосперма и тканей семязачатка у
видов семейств Scrophulariaceae и Orobanchaceae // Ботан. журн. 19796. 64(11). С.
1567-1582.
Никитичева З.И. Семейство Saururaceae // Сравнительная эмбриология цветковых
растений. Winteraceae—Juglandaceae. Л.: Наука, 1981а. С. 81-84.
Никитичева З.И. Семейство Piperaceae // Сравнительная эмбриология цветковых
растений. Winteraceae—Juglandaceae. Л.: Наука, 19816. С. 84-90.
Никитичева З.И. Семейство Styracaceae // Сравнительная эмбриология цветковых
растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983а. С. 221-226.
Никитичева З.И. Морфогеиетические преобразования подвеска зародыша в разных
группах цветковых растений // Матер. 8 Всес. совещ. по эмбриологии растений.
Ташкент: ФАН, 19836. С. 13-14.
Никитичева З.И. Семейство ЕЬепасеае // Сравнительная эмбриология цветковых
растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983в. С. 229- 233.
[712
Семя
Никитичева З.И. Семейство Crassulaceae// Сравнительная эмбриология цветковых
растений. Brunelliaceae—Tremandraceae. Л.: Наука, 1985а. С. 29-34.
Никитичева З.И. Семейство Linaceae // Сравнительная эмбриология цветковых
растений. Brunelliaceae—Tremandraceae. Л.: Наука, 19856. С. 196-201.
Никитичева З.И. Семейство Cuscutaceae // Сравнительная эмбриология
цветковых растений. Davidiaceae—Asteraceae. Л.: Наука, 1987а. С. 201-206.
Никитичева З.И. Семейство Lentibulariaceae // Сравнительная эмбриология
цветковых растений. Davidiaceae—Asteraceae. Л.: Наука, 19876. С. 283-288.
Никитичева З.И. Семейство Hippuridaceae // Сравнительная эмбриология
цветковых растений. Davidiaceae—Asteraceae. Л.: Наука, 1987в. С. 295-299.
Никитичева З.И. Семейство Scrophulariaceae // Сравнительная эмбриология
цветковых растений. Davidiaceae—Asteraceae. Л.: Наука, 1987г. С. 251-259.
Никитичева З.И. О закономерностях деления зиготы покрытосеменных // Тез.
докл. 7 делегат, съезда ВБО. Алма-Ата: Наука, 1988. С. 359-360.
Никитичева З.И. Семейство Aponogetonaceae // Сравнительная эмбриология
цветковых растений. Butomaceae—Lemnaceae. Л.: Наука, 1990а. С. 24-25.
Никитичева З.И. Семейство Alismataceae // Сравнительная эмбриология
цветковых растений. Однодольные. Butomaceae—Lemnaceae. Л.: Наука, 1990б. С. 16-20.
Никитичева З.И., Анисимова Г.М. Семейство Loranthaceae // Сравнительная
эмбриология цветковых. Davidiaceae—Asteraceae. Л.: Наука, 1987. С. 74-82.
Никитичева З.И., Проскурина О.Б. Семейство Convolvulaceae // Сравнительная
эмбриология цветковых растений. Davidiaceae—Asteraceae. Л.: Наука, 1987. С. 196-
201.
Никитичева З.И., Проскурина О.Б. Эмбриология видов рода Convolvulus
(Convolvulaceae). Развитие семяпочки и семени // Ботан. журн. 1989. 74(8). С. 1108-1128.
Никитичева З.И., Терехин Э.С. К эмбриологии Tozzia alpina L. (Scrophulariaceae)
// Ботан. журн. 1973. 58(5). С. 680-691.
Никитичева З.И., Терёхии Э.С. Развитие семени и проростка Orobanche palli-
diflora Wimm. et Grab. (Orobanchaceae) // Ботан. журн. 1976. 61(5). С. 690-700.
Никитичева З.И., Яковлев М.С. Семейство Rhizophoraceae // Сравнительная
эмбриология цветковых растений. Brunelliaceae—Tremandraceae. Л.: Наука. 1985. С.
120-125.
Никитичева З.И., Яковлев М.С, Плющ Т.А. Развитие семяпочки, зародышевого
мешка, зародыша и эндосперма у некоторых видов рода Peperomia (Piperaceae) //
Ботан. журн. 1981. 66(10). С. 1388-1397.
Николаева Е.С. Позеленение зародышей в онтогенезе семени у некоторых
Angiospermae // Матер. Всес. симп. «Половой процесс и эмбриогенез растений». М.,
1973. С. 168-169.
Николаева Е.С. Семейство Salicaceae // Сравнительная эмбриология цветковых
растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983. С. 188-192.
Николаева М.Г. Физиология глубокого покоя семян. Л.: Наука, 1967. С. 1-206.
Николаева М.Г. Некоторые итоги изучения покоя семян // Ботан. журн. 1977.
62(9). С. 1350-1368.
Николаева М.Г. Ускоренное проращивание покоящихся семян. Л.: Наука, 1979.
С. 1-80.
Николаева М.Г. Покой семян // Физиология семян. М.: Наука, 1982. С.
125-183.
Николаева М.Г. Участвует ли абсцизовая кислота в регуляции процессов
формирования и прорастания семян? // Ботан. журн. 1991. 76(8). С. 1144-1150.
Литература
713
Николаева М.Г. Покой семян и способы его преодоления // Онтогенез. 1993.
24(4). С. 75-86.
Николаева М.Г., Разумова М.В. О влиянии температуры и ростовых веществ на
прорастание семян тюльпана // Бюлл. ГБС АН СССР. 1973. Вып. 89. С. 73-75.
Николаева М.Г., Разумова М.В., Гладкова В.Н. Справочник по проращиванию
покоящихся семян. / Ред. Данилова М.Ф. Л.: Наука, 1985. С. 1-347.
Николаева М.Г., Далецкая Т.В., Поздова Л.М., Разумова М.В., Тихонова В.Л.
Условия прорастания покоящихся семян видов Trollius (Ranunculaceae) и некоторых
других редких и нуждающихся в охране растений // Ботан. журн. 1987а. 72(2). С.
238-244.
Николаева М.Г., Поздова Л.М., Полякова Е.Н., Далецкая Т.В., Разумова М.В.,
Фирсов Г.А. Изучение возможности ускоренного проращивания семян древесных
растений с глубоким покоем // Ботан. журн. 19876. 72(4). С. 480-489.
Николаева М.Г., Лодкина М.М., Ляшук А.И. К вопросу о природе
физиологической карликовости зародышей покоящихся семян // Ботан. журн. 1974. 59(1). С.
14-23.
Носатовский А.И. Пшеница [Биология]. М.: Колос, 1965. С. 1-568.
Обручева Н.В. Прорастание семян // Физиология семян. / Ред. Прокофьев А.А.
М.: Наука, 1982. С. 223-274.
Обручева Н.В. Физиология начальных этапов прорастания семян двудольных
растений: Автореф. дис. ... докт. биол. наук. М., 1991. С. 1-48.
Обручева Н.В., Антипова О.В., Иванова И.М. Запуск роста осевых органов и
его подготовка при прорастании семяи, находящихся в вынужденном покое. 1.
Накопление осмотически-активных веществ в осевых органах семян кормовых бобов //
Физиология растений. 1993. 40(5). С. 742-748.
Обручева Н.В., Антипова О.В. Запуск роста осевых органов и его подготовка при
прорастании семян, находящихся в вынужденном покое. 2. Инициация «кислого
роста» в осевых органах семян кормовых бобов // Физиология растений. 1994. 41(3).
С. 443-447.
Обручева Н.В., Зембднер Г., Дате В. Эндогенная абсцизовая кислота в
прорастающих семенах гороха // ДАН СССР. 1985. 280(1). С. 254-256.
Обручева Н.В., Ковадло Л.С. Два этапа усиления дыхания прорастающих семян
гороха по мере увеличения оводненности // Физиология растений. 1985. 32(4). С.
753-761.
Обручева Н.В., Ковадло Л.С, Прокофьев А.А. Уровень оводненности как
пусковой фактор мобилизации крахмала и белка при прорастании семян гороха //
Физиология растений. 1988. 35(2). С. 322-328.
Овчаров К.Е. Физиология формирования и прорастания семян. М.: Колос, 1976.
С. 1-225.
Оганезова Г.Г. О структуре зародыша в родстве лилейных и возможностях ее
использования в систематике // Ботан. журн. 1993. 78(12). С. 9-23.
Оксиюк П.Ф., Худяк М.И. Новые данные об оплодотворении у пшеницы //
ДАН СССР. 1955. 105(4). С. 835-837.
Орел Л.И., Шмараев И.Г. Ультраструктура оболочки зародышевого мешка
Triticum aestivum (Poaceae) после оплодотворения // Ботан. журн. 1987. 72(6). С.
753-757.
Осборн Д.Дж. Нуклеиновые кислоты и прорастание семян // Физиология и
биохимия покоя и Прорастания семян. / Ред. Николаева М.Г. и Обручева Н.В.
М.: Колос, 1982. С. 357-372.
Семя
Пашков Г.Д. О морфологической природе корневого влагалища злаков // Ботаи.
журн. 1951. 36(6). С. 597-606.
Пащенко З.М., Семенихина Л.В., Филатова Р.С. Хлорофиллоносность зародыша
хлопчатника // Узб. биол. журн. 1970. 1. С. 61-62.
Петрова Л.Р., Садина Л.К. Семейство Dioscoreaceae // Сравнительная анатомия
семян. Л.: Наука. 1985. 1. С. 133-135.
Петрова Л.Р., Федотова Т.А., Николаевская Т.С. Сем. Роасеае //
Сравнительная анатомия семян. Однодольные. Л.: Наука, 1985. 1. С. 192-205.
Петрова Л.П., Яковлев М.С. Морфология и анатомия плодов и семян бамбуков
Mesocanna bambusoides Trin. и Phyllostachys bambusoides Sieb. et Zucc. // Ботаи.
журн. 1968. 53(12). С. 1688-1703.
Петрова Т.Ф. Цитоэмбриологические исследования Lilioideae: Автореф. дис. ...
канд. биол. наук. Л., 1968. С. 1-30.
Петрова Т.Ф. Цитоэмбриология лилейных. Подсемейство Lilioideae. M.: Наука,
1977. С. 1-216.
Плиско М.А. Семейство Marantaceae // Сравнительная анатомия семян. Л.:'
Наука, 1985. 1. С. 230-235.
Плющ Т.А. Субмикроскопическая характеристика репродуктивных структур
семязачатка Peperomia blanda (Piperaceae): Автореф. дис. ... каид. биол. наук. Л., 1983.
С. 1-14.
Плющ Т.А. Ультраструктура клеток зародышевого мешка Lilium regale и Lilium
candidum (Liliaceae) до оплодотворения // Ботан. журн. 1987. 72(5). С. 651-657.
Плющ Т.А. Электроииомикроскопическое наблюдение спермиев в зародышевом
мешке Calanthe vestita (Orchidaceae) и Nicotiana rustica (Solanaceae) // Ботаи. журн.
1989a. 74(3). С. 325-328.
Плющ Т.А. Ультраструктура зародышевого мешка Rudbeckia hirta (Asteraceae) //
Ботан. жури. 19896. 74(7). С. 932-940.
Плющ Т.А. Ультраструктура зародышевого мешка Tamarix kotschyi Bungs до и
после оплодотворения // Укр. ботан. журн. 1989в. 46(1). С. 64-69.
Плющ Т.А. Ультраструктура зародыщевого мешка Allium-типа у Scilla sibirica
(Liliaceae) и Nicotiana rustica (Solanaceae) // Ботан. жури. 1989 г. 74(11). С.
1598-1602.
Плющ Т.А. Ультраструктура зародышевого мешка Allium-типа у Convallaria maja-
lis (Convallariaceae) // Ботан. журн. 1989д. 74(12). С. 1724-1729.
Плющ Т.А. Ультраструктура зародышевого мешка Ulmus laevis (Ulmaceae) //
Ботан. журн. 1989е. 74(10). С. 1450-1455.
Плющ Т.А. Ультраструктура зародышевого мешка покрытосеменных. Киев: На-
укова думка, 1992. С. 1-145.
Плющ Т.А., Банникова В.П. Ультраструктура зародышевого мешка и
оплодотворение у Adoxa maschatellina (Adoxaceae) // Ботан. журн. 1989. 74(1). С. 59-65.
Поддубная-Ариольди В.А. Эмбриология покрытосеменных растений и ее значение
для систематики, селекции и генетики: Дисс. ... докт. биол. наук. М., 1944. С. 1-250.
Поддубная-Арнольди В.А. Исследование зародышей у покрытосеменных растений
в живом состоянии // Бюлл. ГБС АН СССР. 1952. 14. С. 3-12.
Поддубная-Арнольди В.А. Исследование процесса оплодотворения у некоторых
покрытосеменных растений на живом материале // Ботан. журн. 1958. 43(2). С.
178-193.
Поддубная-Арнольди В.А. О подвесочном гаустории зародышей в семенах
орхидей // Бюлл. ГБС АН СССР. 1960. 37. С. 47-52.
Литература
715
Поддубная-Арнольди В.А. Сравнительно-эмбриологическое исследование
представителей семейства орхидных // Бюлл. ГБС АН СССР. 1964а. 54. С. 51-62.
Поддубная-Арнольди В.А. Общая эмбриология покрытосеменных растений. М.:
Наука, 19646. С. 1-482.
Поддубная-Арнольди В.А. Цитоэмбриология покрытосеменных растений. М.:
Наука, 1976. С. 1-507.
Поддубная-Арнольди В.А. Характеристика семейств покрытосеменных растений по
цитоэмбриологическим признакам. М.: Наука, 1982. С. 1-352.
Поддубная-Ариольди В.А., Селезнева В.А. Орхидеи и их культура. М.: Изд-во
АН СССР, 1957. С. 1-174.
Поздова Л.М. Нарушение глубокого покоя у семяи клена татарского обработкой
кинетином в присутствии диметилсульфоксида // Физиология растений. 1986. 33(2):
338-343.
Поздова Л.М., Балмасова М.А. Особенности латентного периода некоторых видов
рода Aconitum семейства Ranunculaceae // Тез. докл. «Изучение онтогенеза растений
природных и культурных флор в ботанических учреждениях Евразии». Киев, Львов,
1994. С. 194.
Поздова Л.М., Бутузова О.Г., Титова Г.Е. Особенности доразвития зародыша
Aconitum soongaricum Stapf (Ranunculaceae) при различном температурном режиме //
Тез. докл. X Совещ. по семеноведению интродуцентов. «Особенности развития и
прорастание семян интродуцентов». М., 1994. С. 29.
Поздова Л.М. , Разумова М.В. Покой и прорастание некоторых редких растений
семейства Liliaceae // Ботан. журн. 1994. 79(6). С. 69-73.
Пол1щук B.C., Дзевалтовський А.К. До ембрюлоп лаванды колосово! (Lavandula
spica L.) // Укр. ботан. журн. 1971. 28(6). С. 778-781.
Полевой В.В. Фитогормоны. Л.: Изд-во ЛГУ, 1982. С. 1-249.
Полевой В.В., Саламатова Т.С. Физиология роста и развития растений. Л.:
Изд-во ЛГУ, 1991. С. 1-240.
Полевой В.В., Щипарев СМ., Ильчуков В.В. Действие иидолилуксусной кислоты
и кальция на секрецию белков щитками кукурузы // ДАН СССР. 1981. 256(3). С.
763-765.
Полевой В.В., Щипарев С<М., Москалева О.В. Гормональная регуляция
прорастания семян // Физиология семяи. Душанбе, 1990. С. 119-130.
Полунина Н.Н. Микрофотосъёмка при изучении пыльцы некоторых растений //
Морфогенез растений. / Ред. Александров В.Г. М.: Изд-во Моск. Гос. Ун-та, 1961.
2. С. 459-462.
Полунина Н.Н., Свешников А.И. Микрофотосъёмка при изучении пыльцы и
пыльцевых трубок некоторых амариллисовых // ДАН СССР. 1959. 127.(1). С.
217-219.
Поляков И.М. Три фазы процесса оплодотворения у цветковых растений // Респ.
межвед. темат. науч. сб.«Селекция и семеноводство». Киев, 1970. (15). С. 3-12.
Полякова Е.Н., Николаева М.Г. Изменение изоферментного состава кислой фос-
фатазы при нарушении покоя семян клена татарского // Физиология растений. 1990.
37(4). С. 707-711.
Полякова Е.Н., Николаева М.Г., Далецкая Т.В. Активность кислой фосфатазы
при нарушении и индуцировании покоя в семенах клена татарского // Физиология
растений. 1986. 33(6). С. 1130-1137.
Понамарев А.Н. Цветение и опыление злаков // Учеи. зап. Перм. Гос. Ун-та.
1964. 114. С. 115-179.
716 Семя 1
Понамарев А.Н., Букина И.А. Суточный ритм цветения и опыления злаков //
ДАН СССР. 1953. 91(5). С. 1217-1220.
Понамарев А.Н., Трубачева Т.П. Взрывчатое и порционное цветение злаков //
ДАН СССР. 1962. 146(6). С. 1437-1440.
Понтович В.Э. Ранний эмбриогенез покрытосеменных и его гормональная
регуляция // Рост растений. Первичные механизмы. / Ред. Кефели В.И. М.: Наука, 1978.
С. 205-234.
Понтовнч В.Э., Иванова О.Б., Марченко Т.Ф. Влияние некоторых фенольных
соединений плаценты масличного мака на эмбриогенез изолированных семяпочек //
ДАН СССР. 1976. 288. С. 1489.
Попцов А.В., Некрасов В.И., Иванова И.А. Очерки по семеноведению. М.:
Наука, 1981. С. 1-113.
Попцов А.В. Биология твердосемянности. М.: Наука, 1976. С. 1-156.
Разумова М.В. Эндогенный покой семян и возможности его преодоления
действием гиббереллина и кинетина: Автореф. дис. ... канд. биол. наук. Л., 1978. С. 1-22.
Разумова М.В. Биология прорастания семян видов рода Sorbus // Ботан. журн.
1987. 72(1). С. 77-83.
Разумова М.В., Николаева М.Г. Действие гиббереллинов и цитокининов на
прорастание семян с разным типом покоя // Роль температуры и фитогормонов в
нарушении покоя семян. / Ред. Николаева М.Г. Л.: Наука, 1981. С. 56-75.
Родионова Г.Б. Относительно эмбриогенеза Lunaria annua L. // Ботан. журн.
1966. 51(10). С. 1506-1511.
Родионова Г.Б. Семейство Саррагасеае // Сравнительная эмбриология цветковых
растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983а. С. 150-154.
Родионова Г.Б. Семейство Brassicaceae // Сравнительная эмбриология цветковых
растений. Phytolacaceae—Thymelaeaceae. Л.: Наука, 19836. С. 154-164.
Родионова Г.Б. Сравнительная эмбриология семейств порядка Capparales Hutch, в
связи с их систематическим положением: Автореф. дис. ... докт. биол. наук. СПб,
1993. С. 1-55.
Романов И.Д. Специфические особенности развития пыльцы злаков // ДАН
СССР. 1966. 169(2). С. 456-459.
Романов И.Д. Развитие пыльцы пшеницы по наблюдениям на живом материале //
Бюлл. ВИР. 1970. Вып.15. С. 38-46.
Рытова Н.Г., Цвелев Н.Н. О гомологии зародышей и боковых почек у злаков
(Роасеае) и природе однодольности // Бюл. МОИП. Отд. биол. 1982.87(1). С.
78-85.
Сааков B.C., Ширяева Г.А. К вопросу о методике хроматографирования кароти-
ноидов на бумаге // Тр. БИН АН СССР. Сер.IV. Экспер. бот. 1966. 18. С.
289-306.
Савина Г.И. Оплодотворение у Cypripedium calceolus L. // Ботан. журн. 1964.
49(9). С. 1317-1322.
Савина Г.И. Оплодотворение у орхидных (Orchidaceae): Автореф. дис. ... канд.
биол. наук. Л., 1965. С. 1-17.
Савина Г.И. Процесс оплодотворения у Ophrys insectifera L. // Ботан. журн.
1972. 57(3). С. 382-392.
Савина Г.И. Особенности эмбриологии семейства Orchidaceae // Актуальные
вопросы эмбриологии покрытосеменных. / Ред. Яковлев М.С. Л., 1979. С. 19-28.
Литература
717
Савина Г.И., Поддубная-Арнольди В.А. Семейство Orchidaceae // Сравнительная
эмбриология цветковых растений. Однодольные. Butomaceae—Lemnaceae. Л., Наука,
1990. С. 172-179.
Савченко М.И. Морфология семяпочки покрытосеменных растений. Л.: Изд-во
АН СССР, 1973. С. 1-110.
Савченко М.И., Комар Г.А. Морфология семяпочек некоторых однодольных //
Морфология цветка и репродуктивный процесс у покрытосеменных растений. / Ред.
Яковлев М.С. М.-Л.: Наука, 1965. С. 74-113.
Саламатова Т.С. Влияние красного света на содержание гиббереллинов в
проростках кукурузы при деэтиоляции // Вестник. СПбГУ. Сер.З. 1994. 4(24). С. 97-102.
Саламатова Т.С, Зауралов О.А. Физиология выделения веществ растениями. Л.:
Изд-во ЛГУ, 1991. С. 1-150.
Сатарова Т.Н. Семейство Asparagaceae // Сравнительная эмбриология цветковых
растений. Однодольные. Butomaceae—Lemnaceae. Л.: Наука, 1990. С. 114-124.
Светлов П.Г. Ранние стадии развития Rhynchelmis limosella Hoffmeister
(предварительное сообщение) // Изв. биол. ин-та и биол. станц. Перм. ГУ. 1923. 2(4).
С. 141-152.
Светлов П.Г. Теория критических периодов и ее значение для понимания
принципов действия среды на онтогенез // Вопросы цитологии. М.-Л., 1960. С. 263-285.
Светлов П.Г. Физиология (механика) развития. Л.: Наука, 1978. 1. С. 1-279; 2.
С. 1-262.
Северцов А.Н. Морфологические закономерности эволюции. М.: Изд-во АН
СССР, 1939. С. 1-160.
Селянинова-Корчагина М.В. О кодексе примитивности и специализации в
филогенетической системе // Журн. общ. биол. 1968. 29(5). С. 574-586.
Сердюк Л.С, Конарев В.Г. Флуоресцентный анализ структурного состояния ДНК
в ядре // Клеточное ядро и его ультраструктура. /Ред. Збарский И.Б. М.: Наука,
1970. С. 235-238.
Сердюк Л.С, Хведынич О.А., Банникова В.П. Изучение функционального
состояния нуклеиновых кислот ядер сливающихся гамет табака // ДАН СССР. 1978.
241(3). С. 730-732.
Серебряков И.Г. Морфология вегетативных органов высших растений. М.: Сов.
наука, 1952. С. 1-216.
Симонян Е.Г. Оплодотворение у ржи // Изв. АН Арм. ССР. 1955. 8(11). С.
61-68.
Смирнов А.Г. Женский гаметофит покрытосеменных и его эволюция. Казань:
Изд-во Казанского ун-та, 1982. С. 1-120.
Смирнов А.Г., Граханцева Л.Ш. Двойное оплодотворение у представителей рода
Peperomia L. // Тез. докл. IX Всес. совещ. по эмбриологии растений «Гаметогенез,
оплодотворение и эмбриогенез семенных растений, папоротников и мхов». Кишинев:
Штиинца, 1986. С. 169.
Смирнов П.А. Морфологические исследования злаков // Бюлл. МОИП. Отд.
биол. 1953. 58 (6). С. 71-75.
Смирнова Е.С. Типы структур семян цветковых растений в филогенетическом
аспекте // Журн. общ. биол. 1965. 26(3). С. 310-325.
Снигиревская Н.С. Материалы к морфологии и систематике рода Nelumbo Adans.
// Тр. БИН АН СССР. 1964. 1(13). С. 104-172.
Соболев A.M. Запасание белка в семенах растений. М.: Наука, 1985. С. 1-113.
718
Семя
Соболев A.M., Жданова Л.П. Отложение веществ в запас // Физиология семян.
/ Ред. Прокофьев А.А. М.: Наука, 1982. С. 48-101.
Соколов И.Д. Цитология эндосперма луков // Матер. Всес. симп. по
эмбриологии растений. Киев: Наукова думка, 1968. С. 209-211.
Соколов И.Д. Пути образования ядер различной формы в эндосперме
покрытосеменных растений // Рукопись представлена Донецким универ. Деп. в ВИНИТИ
12 мая 1975, N 1297-75 Деп. Донецк, 1975. С. 1-13.
Соколов И.Д. Цитология эндосперма нуклеарного типа на клеточной стадии
развития // Тез. докл. VI делегатского съезда ВБО. Л.: Наука, 1978а. С. 91-92.
Соколов И.Д. Спонтанные нарушения митоза и их последствия в эндосперме
некоторых однодольных // Тез. докл. VII Всес. симп. по эмбриологии растений.
Киев: Наукова думка, 19786. 2. С. 52-54.
Соколов И.Д. Развитие эндосперма нуклеарного типа: Автореф. дис. ... докт.
биол. наук. Л., 1980. С. 1-41.
Соколов И.Д., Романов И.Д., Аминов Н.Х. Цитология эндосперма цветковых
растений. Киев-Донецк: Головное изд-во издательского объединения «Вища школа»,
1980. С. 1-141.
Соколовская Т.Б. К вопросу о природе эпибласта // Ботан. журн. 1965. 50(12).
С. 1686-1693.
Соколовская Т.Б. О природе колеоризы // Ботан. журн. 1967. 52(12). С.
1773-1784.
Соколовская Т.Б. Природа органов зародыша злаков: Дисс. ... канд. биол. наук.
Л., 1968. С. 1-103.
Соколовская Т.Б. Семейство Ranunculaceae // Сравнительная эмбриология
цветковых растений. Winteraceae—Juglandaceae. Л.: Наука, 1981. С. 130-138.
Соколовская Т.Б. Семейство Bombacaceae // Сравнительная эмбриология
цветковых растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983. С. 256-259.
Соколовская Т.Б., Шпилевой Б.Е. Семейство Iridaceae // Сравнительная
эмбриология цветковых растений. Butomaceae—Lemnaceae. Л.: Наука, 1990. С. 129-134.
Солнцева М.П. Некоторые данные о процессе оплодотворения у Fragaria ananassa
Duch. // Ботан. журн. 1961. 46(3). С. 371-377.
Солнцева М.П. О поведении спермиев в зародышевом мешке Rudbeckia laciniata
L. // Матер. BcecNcHMn. по эмбриологии растений. Киев: Наукова думка, 1968. С.
211-214.
Солнцева М.П. О поведении ядер половых клеток и образовании мозаичного
зародыша при семигамии у Rudbeckia laciniata L. // ДАН СССР. 1971. 197. С.
87-110.
Солнцева М.П. Семигамия и оплодотворение у Rudbeckia laciniata L. // Бо-
тан.журн. 1973а. 58(9). С. 1261-1277.
Солнцева М.П. Типы развития зародышевого мешка и морфология зародыша
Rudbeckia laciniata L. // Эмбриология покрытосеменных растений. / Ред. Коварский
А.И. и др. Кишинев: Штиинца, 19736. С. 47-56.
Солнцева М.П. О поведении половых ядер и образовании мозаичных зародышей
при семигамии у Rudbeckia laciniata L. // Проблемы апомиксиса у растений и
животных. / Ред. Петров Д.Ф. Новосибирск: Наука, 1973в. С. 161-169.
Солнцева М.П. Гемигамия и ее проявление у растений // Апомиксис и его
использование в селекции. / Ред. Петров Д.Ф. М.: Колос, 1976. С. 73-81.
Солнцева М.П. Некоторые закономерности гемигамии у растений // Апомиксис и
цитоэмбриология растений. Саратов, 1978а.(4). С. 108-110.
Литература
719
Солнцева М.П. Гемигамия и возможности ее использования как одной из форм
апомиксиса // Актуальные вопросы эмбриологии покрытосеменных. / Ред. Яковлев
М.С. Л.: Наука, 1978в. С. 38-46.
Солнцева М.П. Эволюционное значение гемигамии // Матер. VI Моск. Совещ.
по филогении раст. М., 1982. С. 134-136.
Солнцева М.П., Ворсобина Л.И. Семигамия у Zephyranthes macrosiphon Herb.//
ДАН СССР. 1972. 206(4). С. 1006-1009.
Солнцева М.П., Ворсобина Л.И. Развитие эндосперма в роде зефирантес (сем.
Amaryllidaceae Jaume St. Hilaire) // ДАН СССР. 1979. 245(2). С. 509-512.
Солнцева М.П., Дгебуадзе Н.В. К эмбриологии пекана Carya illinoinensis
(Wangenheim) K.Koeh (Juglandaceae) // Ботан. журн. 1974. 59(12). С. 1794-1804.
Солнцева М.П., Камелина О.П. Двойное оплодотворение и зародыш у Cephalaria
gigantea (Ledeb.) Bobr. (Dipsacaceae) // Ботан. журн. 1976. 61(2). С. 254-263.
Солнцева М.П., Яковлев М.С. Предпосылки однодольности в раннем
эмбриогенезе ковылей // Ботан. журн. 1964. 49 (5). С. 625-683.
Сравнительная анатомия семян. Л.: Наука. 1985. С. 1-317; 1988. С. 1-257; 1991.
С. 1-240; 1992. С. 1-432; СПб: Мир и семья-95. 1996. С. 1-512.
Сравнительная эмбриология цветковых растений. Л.: Наука. 1981. С. 1-264; 1983
С. 1-363; 1985. С. 1-285; 1987. С. 1-391; 1990. С. 1-332.
Старшова Н.П., Солнцева М.П. Процесс оплодотворения у бархата амурского
Phellodendron amurense // ДАН СССР. 1976. 228(6). С. 1485-1488.
Стожарова И.А., Поддубная-Арнольди В.А. Роль синергид при оплодотворении,
эмбрио- и эндоспермогенезе у Allium nutans L. // Бюлл. ГБС АН СССР, 1977.
105. С. 70-78.
Тарасенко Л.В., Банникова В.П. Ультраструктура трехклеточного пыльцевого
зерна тритикале // Укр. Бот. журн. 1986. 43(1). С. 71-73.
Тарасенко Л.В., Банникова В.П., Сытник К.М. Взаимосвязь клеток в пыльцевых
зернах ржи и маттиолы // ДАН УССР. Сер.Б. 1988. 3. С. 81-84.
Татинцева С.С. Образование и развитие спермиев у некоторых покрытосеменных.
I. Poaceae (Gramineae). II. Asteraceae (Compositae) // Ботан. журн. 1975. 60(12). С.
1707-1720.
Татинцева С.С. Образование и развитие спермиев у представителей рода Muscari
Mill. // Изв. АН ТуркмССР. Сер. биол. наук. 1984. 3. С. 49-52.
Татинцева С.С. Ультраструктура мужских генеративных элементов пыльцы
некоторых покрытосеменных // Тез. докл. IX Всес. совещ. по эмбриологии растений.
«Гаметогенез, оплодотворение и эмбриогенез семенных растений, папоротников и
мхов». Кишинев: Штиинца, 1986. С. 119.
Татинцева С.С. Образование и развитие спермиев у некоторых покрытосеменных.
III. Boraginaceae. IV. Najadaceae // Изв. АН ТуркмССР. Сер. биол. наук. 1988. 1.
С. 3-9.
Тахтаджян А.Л. Морфологическая эволюция покрытосеменных. М., 1948. С. 1-
301.
Тахтаджян А.Л. Основы эволюционной морфологии покрытосеменных. М.-Л.:
Наука, 1964. С. 1-236.
Тахтаджян А.Л. Система и филогения цветковых растений. М.-Л.: Наука, 1966.
С. 1-610.
Тахтаджян А.Л. Происхождение и расселение цветковых растений. Л.: Наука,
1970. С. 1-146.
720
Семя
Тахтаджян А.Л. Гаметофит, гаметангии и оплодотворение // Жизнь растений.
Введение. / Ред. Тахтаджян А.Л. М.: Просвещение, 1978. 4. С. 32.
Тахтаджян А.Л. Оплодотворение // Жизнь растений. Общая характеристика. /
Ред. Тахтаджян А.Л. М.: Просвещение, 1980. 5(1). С. 78-80.
Тахтаджян А.Л. Система магнолиофитов. Л.: Наука, 1987. С. 1-439.
Терёхин Э.С. Влияние некоторых экологических факторов на развитие
эмбриональных структур Proleae- Monotropeae // Ботан. журн. 1962. 47(4). С. 571-577.
Терёхин Э.С. О терминах «сапрофит», «полусапрофит» и «полупаразит» (в связи
с характером биотических отношений некоторых покрытосеменных растений) //
Ботан. журн. 1965. 50(1). С. 60-69.
Терёхин Э.С. Метаморфоз в онтогенезе покрытосеменных растений-паразитов //
ДАН СССР. 1968а. 178(4). С. 657-659.
Терёхин Э.С. К проблеме редукции зародыша паразитных покрытосеменных
растений // Моофология высших растений. / Ред. Кудряшев Л.В. М.: Наука, 19686.
С. 37-48.
Терёхин Э.С. О возможности использования понятия «поведение» в изучении
эволюции растений // Ботан. журн. 1972. 57(1). С. 75-89.
Терёхин Э.С. Эмбриология Orobanchaceae. II. К эмбриологии и экологии
Phacellanthus tubiflorus S. et Z. // Ботан. журн. 1973. 58(12). С. 1775-1888.
Терёхин Э.С. О способах, направлениях и эволюционном значении редукции
биологических структур // Ботан. журн. 1975. 58(12). С. 1401-1412.
Терёхин Э.С. Паразитные цветковые растения. Л.: Наука, 1977. С. 1-219.
Терёхин Э.С. Особенности строения и эволюции зародышей некоторых
однодольных растений // Тез. докл. I Всес. конф. по анатомии растений. Л., 1984. С.
153-154.
Терёхин Э.С. Семейство Corsiaceae // Сравнительная анатомия семян.
Однодольные. Л.: Наука, 1985а. 1. С. 140-141.
Терёхин Э.С. Семейство Hydrocharitaceae // Сравнительная анатомия семян.
Однодольные. Л.: Наука, 19856: 1. С. 38-43.
Терёхин Э.С. Семейство Ruppiaceae // Сравнительная анатомия семян.
Однодольные. Л.: Наука, 1985в. 1. С. 53-55.
Терёхин Э.С. Семейство Zannichelliaceae // Сравнительная анатомия семян.
Однодольные. Л.: Наука, 1985г. 1. С. 55-57.
Терёхин Э.С. Семейство Zosteraceae // Сравнительная анатомия семян.
Однодольные. Л.: Наука, 1985д. 1. С. 59-62.
Терёхин Э.С. Семейство Droseraceae // Сравнительная эмбриология цветковых
растений. Brunelliaceae—Tremandraceae. Л.: Наука, 1985е. С. 48-52.
Терёхин Э.С. Семейство Orobanchaceae // Сравнительная эмбриология цветковых
растений. Davidiaceae—Asteraceae. Л.: Наука, 1987а. С. 268-272.
Терёхин Э.С. Семейство Viscaceae // Сравнительная эмбриология цветковых
растений. Davidiaceae—Asteraceae. Л.: Наука, 19876. С. 82-86.
Терёхин Э.С. Семейство Balanophoraceae// Сравнительная эмбриология цветковых
растений. Davidiaceae—Asteraceae. Л.: Наука, 1987в. С. 89-93.
Терёхин Э.С. Порядок Rafflesiales // Сравнительная анатомия семян. Л.: Наука,
1988а.2. С. 114-119.
Терёхин Э.С. Порядок Hydnovales // Сравнительная анатомия семян. Л.: Наука,
19886.2. С. 112-113.
Терёхин Э.С. Порядок Balanophorales // Сравнительная анатомия семян. Л.:
Наука, 1988в.2. С. 120-132.
Литература
721
Терёхин Э.С. Семейство Zosteraceae // Сравнительная эмбриология цветковых
растений. Однодольные. Butomaceae—Lemnaceae. Л.: Наука, 1990а. С. 52-54.
Терёхин Э.С. Семейство Burmaniaceae // Сравнительная эмбриология цветковых
растений. Однодольные. Butomaceae—-Lemnaceae. Л.: Наука, 19906. С. 165-169.
Терёхин Э.С. Проблемы эволюции онтогенеза семенных растений // Тр. БИН
АН СССР. 1991. 2. С. 1-69.
Терёхин Э.С. Иерархическая классификация зародышевых мешков //
Эмбриология цветковых растений. Терминология и концепции, т. 1. / Ред. Батыгина Т.Б.
СПб: Мир и Семья, 1994. С. 239-248.
Терёхин Э.С, Камелина О.П. Эндосперм Orchidaceae (К вопросу о редукции) //
Ботан. журн. 1969. 54(5): 657-669.
Терёхин Э.С, Камелина О.П. Эндосперм Habenaria linearifolia Maxim, и Neottia
nidus-avis (L.) Rich. (К вопросу об эволюции эндосперма у орхидных) // Ботан.
журн. 1972. 57(11). С. 1373-1383.
Терёхин Э.С, Никитичева З.И. Постсеменное развитие паразитных Angiospermae.
I. Метаморфоз // Ботан. журн. 1968. 53(1). С. 39-57.
Терёхин Э.С, Никитичева З.И. Развитие генеративного побега и опыление у
Cynomorium songaricum // Бюлл. МОИП. Отд. биол. 1976. 81(3). С. 74-89.
Терёхин Э.С, Никитичева З.И. О принципах создания экологической
классификации зародышей покрытосеменных растений // Актуальные вопросы эмбриологии
покрытосеменных растений. / Ред. Яковлев М.С. Л.: Наука, 1979. С. 120-130.
Терёхин Э.С, Никитичева З.И. Семейство Orobanchaceae. Онтогенез и
филогенез. Л.: Наука, 1981. С. 1-228.
Терёхин Э.С, Никитичева З.И., Яковлев М.С. Развитие семени, зародыша и
эндосперма Cynomorium songaricum (Cynomoriaceae) // Ботан. журн. 1975. 60(11).
С. 1651-1660.
Терёхин Э.С, Яковлев М.С. Эмбриология Balanophoraceae (к вопросу о гомоло-
гиях «цветка» Balanophora) // Ботан. журн. 1967. 52(6). С. 745-758.
Тимофеев-Ресовский Н.В., Воронцов Н.Н., Яблоков А.В. Краткий очерк теории
эволюции. М.: Наука, 1977. С. 1-301.
Титова Г.Е. Эмбриология некоторых водных растений (Nelumbo nucifera Gaertn.,
Cabomba caroliana A.Gray, Trapa astrachanica (Fler.) Winter.): Дисс. ... канд. биол.
наук. Л., 1988а. С. 1-211.
Титова Г.Е. Эмбриология некоторых водных растений (Nelumbo nucifera Gaertn.,
Cabomba caroliniana A. Gray, Trapa astrachanica (Fler.) Winter): Автореф. дис. ...
канд. биол. наук. Л., 1988б. С. 1-17.
Титова Г.Е. Семейство Тгарасеае // Сравнительная анатомия семян. СПб.: Мир
и семья-95, 1996. 5. С. 242-259.
Токин Б.П. Общая эмбриология. М.: Высшая школа, 1987. С. 1-480.
Трифонова В.И. Семейство Ranunculaceae // Сравнительная анатомия семян. Л.:
Наука, 1988. 2. С. 176-181.
Турсунов Д.Ю. Биология цветения и эмбриология сапониноносных видов сем.
Caryophyllaceae Средней Азии: Автореф. дис. ... докт. биол. наук. Ташкент, 1986. С.
1-45.
Турсунов Д.Ю., Матюнина Т.Е. Семейство Caryophyllaceae // Сравнительная
эмбриология цветковых растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983. С.
39-47.
46-828
722
Семя
Турсунов Д.Ю., Савинова Г.Ю. Эндоспермо- и эмбриогенез у колючелистника
железистого // Биологические и структурные особенности полезных растений
Узбекистана. Ташкент: ФАН, 1979. С. 101-104.
Фаминцын А.С. Эмбриологические исследования // Зап. Рос. АН. 1879а. 7(26).
С. 1-19.
Фаминцын А.С. Развитие зародышей Alisma plantago и Capsella bursa-pastoris//
Тр. СПб Об-ва. естествоисп. Отд. бот. 18796. 10. С. 104-105.
Федотова Т.А. Семейство Stemonaceae // Сравнительная анатомия семян.
Однодольные. Л.: Наука, 1985. С. 128-129.
Филимонов СВ., Щипарев СМ. О подкислении эндосперма в зерновках
злаковых // Вестник. СПбГУ. 1995. 10. С. 90-95.
Фшн В.В. Чолов1ч1 кл1тини скритонасшьових рослин. II. Сперматогенез у
Vincetoxicum nigrum та V.officinale // Зап. Кшвськ. ш-ту нар. освгги., 1926. 1. С.
129-132.
Финн А.А. До icTOpii розвитку халацогамных, Ostrya carpinifolia Scop. // Журнал
института ботаники АН УССР. 1936. 8(16). С. 15-28.
Фурсов В.И. Динамика нуклеиновых кислот в онтогенезе цветка и зерновки
пшеницы // Биология нуклеинового обмена у растений. / Ред. Конарев В.Г. и др.
М.: Наука, 1964. С. 100-102.
Хавкин Э.Е. Обмен веществ в прорастающих семенах // Физиология семян. /
Ред. Прокофьев. А.А. М.: Наука, 1982. С. 275-310.
Хазова И.И. К эмбриологии культурных видов сорго // Ботан. журн. 1970.
55(1). С. 93-102.
Хведишч О.А. Процес подвшного заплщнення у ячменю (Hordeum vulgare L.) //
Укр. ботан. журн. 1969. 26(5). С. 123-126.
Хведынич О.А. Процесс оплодотворения и ранние стадии развития зародыша и
эндосперма при отдаленной гибридизации: Дисс. ... канд. биол. наук. Киев, 1972. С.
1-154.
Хведынич О.А., Банникова В.П. Нарушение в процессе оплодотворения при
гибридизации ячменя с рожью // Ботан. журн. 1970а. 55(8). С. 1111-1120.
Хведынич О.А., Банникова В.П. Изменение хроматизации женских и мужских
половых ядер в процессе оплодотворения у ячменя // Цитология и генетика. 19706.
4(5). С 387-391.
Хведынич О.А., Банникова В.П., Сердюк Л.С. Цитохимическое исследование
зародышевого мешка Nicotiana tabacum L. // Укр. ботан. журн. 1981. 38(6). С.
18-21.
Хведин1ч О.А., Банникова В.П., Сердюк Л.С, Цитох1мичне досл1дження
голов1чного гаметофп-а Lilium regale Wils. // Укр. ботан. журн. 1983. 40(2). С.
57-59.
Хведынич О.А., Сердюк Л.С. Физико-химическое состояние хроматина
сливающихся гамет табака // III съезд Всес. об-ва генетиков и селекционеров им. Н.
И.Вавилова. Л., 1977. С. 83-84.
Хведынич О.А., Сердюк Л.С. Состояние хроматина в ядрах клеток зародышевого
мешка тритикале // Ботан. журн. 1986. 71(5). С. 617-622.
Хведынич О.А., Сердюк Л.С, Банникова В.П. О темпе процесса оплодотворения
// Тез. докл. VI делегат, съезда ВБО. Л.: Наука, 1978. С. 85-96.
Худяк М.И. Новые данные об образовании клеток в эндосперме яровых пшениц
//'ДАН СССР. 1952. 84(1). С. 143-145.
Литература
723
Худяк M.I. Особливост1 в утворенш ендосперму пллясто1 пшениц1 Кахетинська //
Ботан. журн. АН УССР 1955. 12(3). С. 52-67.
Худяк М.И. Эндосперм покрытосеменных растений (особенности развития и роль
в плодообразовании). Киев: Изд-во АН УССР. 1963. С. 1-184.
Худяк М.И. К вопросу о роли неассимилирующих хлоропластов в процессе пло-
дообразования // Журн. общ. биол. 1964. 25(5). С. 364-370.
Царькова В.А. О природе покоя семян у плодовых растений // Бюлл. ГБС АН
СССР. 1970. Вып.75. С. 56-60.
Цвелев Н.Н. О природе частей зародыша злаков (Роасеае) в связи с
происхождением односемядольности // Бюл. МОИП. Отд. биол. 1975. 80(3): 68-75.
Цвелев. Н.Н. Семейство злаки (Роасеае) // Жизнь растений. М.: Просвещение,
1982. 6. С. 314-378.
Цингер Н.В. О причинах медленного прорастания семян пионов // Тр. Гл. Бот.
сада. 1951. II.'С. 103-145.
Цингер Н.В. Семя, его развитие и физиологические свойства. М.: Изд-во АН
СССР, 1958. С. 1-285.
Цингер Н.В., Петровская-Баранова Т.П. Оболочка пыльцевого зерна — живая
физиологически активная структура // ДАН СССР. 1961. 138. С. 466-469.
Цингер Н.В., Поддубная-Арнольди В.А. Применение гистохимической методики к
изучению эмбриональных процессов у орхидей // Тр. Гл. Бот. сада. 1959. VI. С.
90-169.
Чабан И.А. Эмбриогенез и эндоспермогенез Reseda lutea L. и Chelidonium majus
L. по данным световой и электронной микроскопии: Автореф. дис. ... канд. биол.
наук. Л., 1975. С. 1-26.
Чабан И.А. Электронно-микроскопическое исследование эндосперма у Reseda lutea
L. // Актуальные вопросы эмбриологии покрытосеменных. Л.: Наука, 1979. С.
58-69.
Чабан И.А., Яковлев М.С Эмбриология Reseda lutea L. Мегаспорогенез и
развитие зародышевого мешка // Ботан. журн. 1974. 59(1). С. 24-37.
Чайлахян М.Х., Бутенко Р.Г., Кулаева О.Н., Кефели В.И., Аксенова Н.И.
Терминология роста и развития высших растений. М.: Наука, 1982. С. 1-96.
Чеботарь А.А. Влияние некоторых факторов среды на процессы оплодотворения и
эмбриогенеза кукурузы// Труды первой научн. конференции молодых ученых
Молдавии. Кишинев, 1960. 1. С. 49-74.
Чеботарь А.А. Влияние некоторых факторов среды на процессы опыления,
оплодотворения и раннего эмбриогенеза кукурузы: Автореф. дис. ... канд. биол. наук.
Киев, 1961. С. 1-17.
Чеботарь А.А. Цитоэмбриологическое и электронномикроскопическое исследование
кукурузы (Zea mays L.): Автореф. дис. ... докт. биол. наук. Кишинев: Изд-во ЦК
КП Молдавии, 1970. С. 1-60.
Чеботарь А.А. Эмбриология кукурузы. Кишинев, 1972. С. 1-384.
Чеботарь А.А. Цитологические аспекты концепции неоплазмы зиготы водорослей,
мохообразных, папоротникообразных и семенных растений // Эмбриология и
анатомия репродуктивных и вегетативных органов некоторых низших и высших растений.
Кишинев: Штиинца, 1987. С. 3-14.
Чернояров М.В. О зелености развивающихся зародышей // Изв. АН Арм.ССР,
биол. и с.-х. науки. 1952. 5(7). С. 89-92.
Чубирко М.М., Кострикова Л.Н. Семейство Fabaceae // Сравнительная
эмбриология цветковых растений. Brunelliaceae—Tremandraceae. Л.: Наука, 1985. С. 67-77.
46*
724
Семя
Шамров И.И. Эмбриология сем. Ceratophyllaceae (Роголистниковые) в связи с его
систематическим положением: Дисс. ... канд. биол. наук. Л., 1981. С. 1-206.
Шамров И.И. Семяпочка Gentiana cruciata (Gentianaceae): структурно-
функциональные аспекты развития // Ботан. журн. 1990а. 75(10). С. 1363-1379.
Шамров И.И. Семейство Liliaceae // Сравнительная эмбриология цветковых
растений. Однодольные. Butomaceae—Lemnaceae. Л.: Наука, 19906. С. 63-74.
Шамров И.И. Халаза // Эмбриология цветковых растений. Терминология и
концепции / Ред. Батыгина Т.Б. СПб: Мир и семья, 1994. 1. С. 163-164.
Шамров И.И. Семязачаток цветковых растений. Принципы организации и
типизация: Дисс. ... докт. биол. наук. СПб, 1995. С. 1-479.
Шамров И.И., Анисимова Г.М. Особенности преобразования семязачатка в семя
у Luzula pedemontana (Juncaceae) // Ботан. журн. 1993а. 78(12). С. 24-44.
Шамров И.И., Анисимова Г.М. Семязачаток и семя у Juncus filiformis (Juncaceae):
особенности возникновения и характер преобразования структур в процессе развития
// Ботан. журн. 19936. 78(11). С. 18-33.
Шамров И.И., Батыгина Т.Б. Развитие зародыша и эндосперма у представителей
семейства Ceratophyllaceae // Ботан. журн. 1984. 69(10). С. 1328-1335.
Шамров И.И., Батыгина Т.Б. Семейство Ceratophyllaceae // Сравнительная
анатомия семян, т. 2. Л., Наука, 1988. С. 153-156.
Шамров И.И., Жинкина Н.А. Развитие семязачатка у Azorina vidallii (Campa-
nulaceae) // Ботан.журн. 1994. 79(6). С. 19-34.
Шамров И.И., Никитичева З.И. Морфогенез семяпочки и семени у Gymnadenia
conopsea (Orchidaceae): структурное и гистохимическое исследование // Ботан. журн.
1992. 77(4). С. 45-60.
Шевцова Г.Г., Батыгина Т.Б., Лаврентьева А.Н. Некоторые аспекты системы
воспроизведения орхидных на примере Cymbidium hybridum (Orchidaceae) // Ботан.
журн. 1986. 71(11). С. 1457-1467.
Шмальгаузен И.И. Организм как целое в индивидуальном и историческом
развитии. М.: Изд-во АН СССР, 1938. С. 1-209.
Шмальгаузен И.И. Пути и закономерности эволюционного процесса. М.-Л.: Изд-
во АН СССР, 1939. С. 1-230.
Шмальгаузен И.И. Контроль и регуляция в эволюции // Бюлл. МОИП. Отд.
биол. 1958. 63(5). С. 93-121.
Шмальгаузен И.И. Факторы эволюции. Теория стабилизирующего отбора. М.:
Наука, 1968. С. 1-451.
Шмальгаузен И.И. Организм как целое в индивидуальном и историческом
развитии. М.: Наука, 1982. С. 1-383.
Шмараев И.Г. Ультраструктурное изучение эндосперма Triticum aestivum L. на
стадии клеткообразования // Бюлл. ВИР. 1982. Вып. 118. С. 24-25.
Шмараев И.Г. Ультраструктурное изучение начальных этапов развития эндосперма
Triticum aestivum L. // Тр. по прикл. бот., ген. и селекции. 1983. 74. С. 15-21.
Шмидт Г.А. Типы эмбриогенеза и их приспособительное значение. М.: Наука.
1968. С. 1-231.
Шугаева Е.В. Цитоэмбриология некоторых лекарственных видов рода Valeriana
L.: Автореф. .дис. ... канд. биол. наук. Л., 1985. С. 1-19.
Шумилина З.К. Подготовка к посеву семян древесных и кустарниковых пород.
М.-Л.: Гослесбумиздат, 1949. С. 1-48.
Щипарев СМ., Алиева Э.А., Шинкарев А.Н. Действие ингибиторов АТФаз на
подкисление среды щитками кукурузы // Вестник СПбГУ. 1993. 10. С. 86-88.
Литература
lib
Щипарев СМ., Ильчуков В.В. Действие гиббереллина на секрецию белков
щитками кукурузы // Вестник ЛГУ. Биол. 1983. 21. С. 66-69.
Щипарев СМ., Мячин Ф.В. Изучение феррицианид-редуктазной активности
щитков зерновок кукурузы // Вестник ЛГУ. Биол. 1990. 4. С. 89-93.
Щипарев СМ., Полевой В.В., Подсобляева И.В. Поглощение Сахаров щитками
кукурузы // Мембранный транспорт и биоэлектрическая активность растений.
Горький: Изд-во ГГУ, 1990. С. 16-20.
Щипарев СМ., Чупрова Г.В. Выделение кислот щитками прорастающих зерновок
кукурузы и его физиологическая роль // Фотосинтез, дыхание и органические
кислоты. Воронеж: Изд-во ВГУ, 1980. С. 149-154.
Щипарев СМ., Чупрова Г.В., Полевой В.В. Секреция кислот изолированными
щитками кукурузы // Вестник ЛГУ. 1976. 21. С. 130-133.
Якобсон Л.Я. Эмбриологические исследования рододендронов // Изв. АН Латв.
ССР. 1976. 352(11). С. 84-96.
Яковлев М.С. Однодольность в свете данных эмбриологии // Советская
ботаника. 1946а. 14(5). С. 351-363.
Яковлев М.С. Опыт построения системы злаков на основе морфологии зародыша
и структуры эндосперма: Дисс. ... докт. биол. наук. Л., 19466. С. 1-313.
Яковлев М.С Структура эндосперма и зародыша злаков как систематический
признак // ТР. БИН АН СССР. Сер. VII. 1950. 1. С. 121-218.
Яковлев М.С. О единстве эмбриогенеза покрытосеменных и голосеменных
растений // Тр. БИН АН СССР. Cep.VII. 1951. Вып.2. С. 231-242.
Яковлев М.С. Принципы выделения основных эмбриональных типов и их значение
для филогении покрытосеменных // Проблемы ботаники. Вып.З. Л., 1958. С. 168-
195.
Яковлев М.С. Ценоцитные структуры // Морфология цветка и репродуктивный
процесс у покрытосеменных растений. М.-Л.: Наука, 1965. С. 131-139.
Яковлев М.С. Основные задачи в области изучения эмбриогенеза // Проблемы
эмбриологии. /Ред. Зосимович В.П. Киев: Наукова думка, 1971. С. 152-169.
Яковлев М.С. Зародыш // Большая советская энциклопедия. М.: Советская
энциклопедия, 1972. С. 370-371.
Яковлев М.С Словарь основных терминов // Сравнительная эмбриология
цветковых растений. Winteraceae—Juglandaceae. Л.: Наука, 1981. С. 7-25.
Яковлев М.С Семейство Paeoniaceae // Сравнительная эмбриология цветковых
растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 1983а. С. 70-77.
Яковлев М.С. Семейство Dilleniaceae // Сравнительная эмбриология цветковых
растений. Phytolaccaceae—Thymelaeaceae. Л.: Наука, 19836. С. 65-68.
Яковлев М.С, Алимова Г.К. Эмбриогенез у Arabidopsis thaliana (L.) Heynh.
(Cruciferae) // Ботан. журн. 1976. 61(1). С. 12-24.
Яковлев М.С, Жукова Г.Я. Явление хлорофиллоносности зародыша, его
распространение среди покрытосеменных и возможное таксономическое значение // Реф.
докл. Всес. межвуз. конф. морф. раст. М., 1968. С. 347-348.
Яковлев М.С, Жукова Г.Я. Хлороэмбриофиты и лейкоэмбриофиты // Тез. докл.
IV Моск. совещ. по филоген. раст. М., 1971. С. 53-55.
Яковлев М.С, Жукова Г.Я. Покрытосеменные растения с зеленым и бесцветным
зародышем (хлоро- и лейкоэмбриофиты). Л.: Наука, 1973. С. 1-100.
Яковлев М.С, Иоффе М.Д. Новый тип эмбриогенеза среди покрытосеменных
растений // Тез. докл. 2-го совещ. эмбриологов СССР. М., 1957а. С. 213-214.
726
Семя
Яковлев М.С., Иоффе М.Д. Особенности эмбриогенеза рода Paeonia L. // Бо-
тан. журн. 19576. 42(10). С. 1491-1502.
Яковлев М.С., Иоффе М.Д. Мегаспорогенез у Paeonia anomala L. // Вопросы
эволюции, биогеографии, генетики и селекции. М.-Л.: Изд-во АН СССР, 1960. С.
320-325.
Яковлев М.С., Иоффе М.Д. Дальнейшее изучение нового типа эмбриогенеза пот
крытосеменных // Ботан. журн. 1961. 46(10). С. 1402-1421.
Яковлев М.С., Иоффе М.Д. Эмбриология некоторых представителей рода Paeonia
L. // Морфология цветка и репродуктивный процесс у покрытосеменных растений. /
Ред. Яковлев М.С. М.-Л.: Наука, 1965. С. 140-176.
Яковлев М.С, Камелина О.П. Развитие зародыша Melocanna bambusoides Trin
// Ботан. журн. 1973. 58(2). С. 248-263.
Яковлев М.С, Солнцева М.П. Некоторые вопросы морфологии цветка и
эмбриологии ковылей // Морфология цветка и репродуктивный процесс у покрытосеменных
растений. / Ред. Яковлев М.С. М.-Л.: Наука, 1965. С. 61-73.
Яковлев М.С, Чабан И.А. Ультраструктурные аспекты эмбриогенеза Reseda lutea
L. // Актуальные вопросы эмбриологии покрытосеменных растений / Ред. Яковлев
М.С. Л.: Наука, 1979. С. 96-104.
Abbe Е.С, Stein O.L. The growth in the shoot apex in maize: embryogeny // Amer.
J. Bot., 1954. 41: 285-293.
Abeles F.B., Morgan P.W., Saltveit M.E., Jr. Ethylene in plant biology. San Diego
a. o.: Acad. Press, 1992: 1-414.
Adatia R.D., Sharma Y.B., Vijayaraghavan M.R. Studies in the Gesneriaceae.
I. Morphology and embryology of Platystemma violoides Wall. // Bot. Not., 1971.
124(1): 25-38.
Aelst A.C.van, Theunis C.H., Went J.L. van. Freeze-fracture studies on isolated
sperm cells of Spinacia oleracea L. // Protoplasma, 1990. 153(3): 204-207.
Afzelius K. Embryologische und zytologische Studien in Senecio und verwandten
Gattungen // Acta Horti Berg., 1924. 8(7): 123-219.
Afzelius K. Die Embryobildung bei Nigritella nigra // Svensk. Bot. Tidskr., 1928.
22: 82-91.
Agarwal S. Morphological and embryological studies in the family Olacaceae —
I. Olax L. // Phytomorphology, 1963. 13(2): 185-196.
Alfieri J.R., Evert R.F. Analysis of meristematic activity in the root tip of Melilotus
alba Desr. // New Phytol., 1968. 67: 641-647.
Aimers W., Stirling С Distribution on transport proteins over animal cell membranes
// J. Membr. Biol., 1984. 77(3): 169-186.
Alpi A. Gibberellins in embryo development // Plant Growth Substances. / Eds.
Pharis R.P., Rood S.B. Berlin: Springer-Verlag, 1990: 468-475.
Alpi A., Tognoni F., D'Amato F. Growth regulator levels in embryo and suspensor
of Phaseolus coccineus at two stages of development // Planta, 1975. 127: 153-162.
Amici G.B. Observations microscopiques sur diverses especes de plantes // Ann. Sci.
Nat. Bot., 1823. 2: 41-70, 211-248.
Anagnostakis S.L. In vitro culture of immature embryos of American elm // Hort.
Sci., 1977. 12(1): 44.
Anantaswamy R. The suspensor haustoria of some species of Crotalaria // Linnean,
N. S., 1950. 14(56): 557.
Литература
727
Andronova E.V., Batygina T.B. Uniformity of initiation of the first leaf during
germination of the orchids (on example of the Thunia marshalliana Rchb.f.) // Proc. XI
Int. Symp. «Embryol. a. Seed Reprod.» Leningrad, July 3-7, 1990. St.Petersburg:
Nauka, 1992: 37-38.
Anisimova G.M., Lakshmi Sita G., Batygina T.B., Shamrov I.I. Are the plants from
the seeds and from the embryoids in tissue culture embryologically similar? // Proc. XI
Int. Symp. «Embryol. a. Seed Reprod.», St. Petersburg, Nauka, 1992: 43-44.
Anonyme. Petite graine et gros degats... le Striga // Spore, C.T.A., 1990. 29: 5.
Appleford N.E.J., Lenton J.R. Gibberellins and leaf expansion in near-isogenic wheat
lines containing Rht 1 and Rht 3 dwarfing alleles // Planta, 1991. 183(2): 229-236.
Arabidopsis. An Atlas of Morphology and Development. / Eds. Meyerowitz E.M.,
Somerville C.R. Cold Spring Harbor Lab. Press. 1994: 1-450.
Arber A. Monocotyledons: a morphological study. Cambridge: Univ. Press, 1925:
1-258.
Arber A. The Gramineae: a study of cereal bamboo and grass. Cambridge, 1934.
1-480.
Arekal G.D. Embryology of Klugia notoniana // Bot. Gaz. (Chicago), 1961. 123(2):
144-150.
Arekal G.D. Embryological studies in Canadian representatives of the tribe Rhihantheae,
Scrophulariaceae // Canad. J. Bot., 1963. 41(2): 267-302.
Arekal G.D. Embryology of Veronica serpyllifolia L. // Proc. Indian Acad. Sci.,
1966. 64(5): 241-258.
Arekal G.D., Ramaswamy S.N. Embryology of Eriocaulon hookerianum Staff, and the
systematic position of Eriocaulaceae // Bot. Not., 1980. 133: 295-309.
Artschwager E., Starrett R.C The time factor in fertilization and embryo development
in the sugar beet // J. Agric. Res., 1933. 47: 823-843.
Arzt T. Uber die Embryobildung von Pseudomonocotylen (Podophyllum emodii und
Eranthis hiemalis) // Beih. Bot. Centralbl., 1933. 50(1): 671-696.
Asahi Т., Maeshima M. Biogenesis of mitochondria in higher plant cells // The new
frontiers in plant biochemistry. / Eds. Nijhoff M.,. Yunk W. Tokyo: Japan Sci. Soc.
Press, 1983: 119-132.
Ashley T. Zygote shrinkage and subsequent development in some Hibiscus
hybrids// Planta, 1972. 108(4): 303-317.
Ashley T. Fine structure of early endosperm development in Hibiscus // Caryologia,
1975a. 28(1): 63-71.
Ashley T. Alterations in the fine structure of developing endosperm of Hibiscus
hybrids // Caryologia, 1975b. 28(1): 73-80.
Asker S., Jering L. Apomixis in Higher Plants. Boca. Ration Florida: С R. С Press.
1992: 1-298.
Aspart L.( Mayer Y., Laroche M., Penon P. Developmental regulation in the
synthesis of protein encoded by stored mRNA in radish embryos // Plant Physiol.,
1984. 76(3): 664-673.
Asplund E. Studien uber die Entwicklungsgeschichte der Bluten einiger Valerianaceen//
Kongl. Svenska Vetenskapsakad. Handl. N. S.,1920. 61(3): 3-66.
Asplund J. Embryological studies in the genus Typha // Svensk Bot. Tidskr., 1972.
66(1): 1-17.
Astrom H.,Vitranen L.Raudaskoski M. Cold stability in the pollen-tube cytoskeleton//
Protoplasma.1991. 160:99-107.
728
Семя
Avanzi S., Clionini P.G., D'Amato F. Cytochemical and autoradiographic analyses on
the embryo suspensor cells of Phaseolus coccineus // Caryologia, 1970. 23(4): 605-638.
Avery G.S. Comparative anatomy and morphology of embryos and seedlings of maize,
oats and wheat // Bot. Gas. (Chicago), 1930. 89(1): 1-39.
Babis H. General description of a mature ovule and embryo sac, early stages
development of the endosperm and of embryo development in some species of Delphinium
L. genera // Genet. Polon, 1973. 14(1): 29-36.
Babis H. Development of the embryo in some species of the genus Delphinium L.
// Acta Soc. Bot. Polon., 1976. 45(1-2): 135-142.
Bain J.M., Mercer F.V. Subcellular organization of the developing cotyledons of
Pisum sativum L. // Austral. J. Biol. Sci., 1966. 19(1): 49-67.
Baker H.G. Apomixis and polyembryony in Pachira oleaginea (Bombacaceae) // Amer.
J. Bot., 1960. 47(4): 296-301.
Baker J.C., Stelle C, Dure L.III. Sequence and characterisation of 6 Lea proteins and
their genes from cotton // Plant Molec. Biol., 1988. 11: 277-291.
Banargi M. On the anatomy of teratological seedlings. II. Calendula officinalis L.
// Bull. Bot. Soc. Bengal., 1962. 16 (1).
Banerji J. Life history of Typhonium trilobatum // Proc. Natl. Inst. Sci. India, 1947.
13(3): 207-230.
Banerji I. The endosperm in Scrophulariaceae // J. Indian Bot. Soc, 1961. 40(1):
1-11.
Banuelos G.S., Bangerth F., Marschner H. Relationship between polar basipetal auxin
transport and acropetal Ca transport into tomato fruits // Physiol. Plant.
(Copenhagen), 1987. 71(3): 321-327.
Banuelos G.S., Bangerth F., Marschner H. Basipetal auxin transport in lettuce and its
possible involvement in acropetal calcium transport and incidence of tipburn // J. Plant
Nutr., 1988. 11(5): 525-533.
Barlow P.W. Towards an understanding of the behaviour of root meristems// J.
Theor. Biol., 1976. 57: 433-451.
Barlow P.W. From cell wall networks to algorithms. The simulation and cytology of
cell division patterns in plants // Protoplasma, 1991. 162: 69-85.
Barlow P.W. Rhythm, periodicity and polarity as bases for morphogenesis in plants
// Biol. Rev., 1994. 69: 475-525.
Barlow P.W. Structure and function at the root apex — phylogenetic and ontogenetic
perspectives on apical cells and quiescent centres // Structure and Function of Roots.
/ Eds. Baluska P., et al. Dordrecht: Kluner Acad. Publ., 1995: 3-18.
Barlow P.W., Brain P., Parker J.B. Cellular growth in roots of a gibberellin-deficient
mutant of tomato (Lycopersicon esculentum Mill.) and its wild-type // J. Exp. Bot.,
1991. 42: 339-351.
- Barlow P.W., Rathfelder E.L. Cell division and regeneration in primary root meristems
of Zea mays recovering from cold treatment // Environm. Exp. Bot., 1985. 25: 303-314.
Barnes B. Seedling abnormalities in Anagallis arvensis L. // Proc. Linn. Soc.
London, 1943. 154: 88-91.
Barrow J., Chaundhari H. Cotton haploids produce by semigamy from specific breeding
lines// Haploids in higher plants: advances and potential. Guelph., 1974: 274.
Barrow J.R., Chaundhari H.K. A homozygous interspecific F2 hybrid of Gossypium
barbadense x Gossypium hirsutum via the semigametic haploid method // Crop. Sci.
(Madison), 1976. 16(3): 441-442.
Литература
729
Barthlott W. Scanning electron microscopy of the epidermal surface in plants // Scanning
electron microscopy in taxonomy and functional morphology. The systematics Association.
Special Vol., N11. Oxford: Clarendon Press. 1990: 69-94.
Barton M.K., Poethig R.S. Formation of the shoot apical meristem in Arabidopsis
thaliana: an analysis of development in the wild type and in the shoot meristemless mutant
// Development, 1993. 119: 823-831.
Baskin C.C., Baskin J.M. Deep complex morphophysiological dormancy in seeds of the
mesic woodland herb Delphinium tricorne (Ranunculaceae) // Int. J. PI. Sci., 1994.
155(6): 738-743.
Baskin C.C., Meyer S.E., Baskin J.M. Two types of morphophysiological dormancy
in seeds of two genera (Osmorhiza and Erythronium) with in Acto-Tertiary distribution
pattern // Amer. J. Bot., 1995. 82(3): 293-298.
Baskin T.I., Busby C.H., Fowke L.C., Sammut M., Gubler F. Improvements in
immunostaining samples embedded in methacrylate: localization of microtubules and other
antigenes throughout developing organs in plants of diverse taxa // Planta, 1992. 187:
405-413.
Battaglia E. Fenomeni citologici nuovi hella embriogenesi («Semigamia») e hella
microsporogenesi. («Doppio nucleo di restituzione») di Rudbeckia laciniata L. (nota,
preventiva) // Nuovo Giorn. Bot. Ital., n.s., 1945a. 52(1): 34-38.
Battaglia E. Semigamie chez Rudbeckia sullivantii Boynton et Beadle (Compositae)
// Proc. 8th Int. Bot. Congr. (Paris). Sec. 7-8. 1945b: 245-247.
Battaglia E. Ricerche cariologiche ed embriologiche sul genere Rudbeckia. VI.
Apomissia in Rudbeckia speciosa Wender. // Nuovo Giorn. Bot. Ital., n.s., 1946a.
53(1): 27-69.
Battaglia E. Ricerche cariologiche ed embriologiche sul genere Rudbeckia. VIII.
Semigamia in Rudbeckia laciniata L. // Nuovo Giorn. Bot. Ital., n.s., 1946b. 53(3-4):
483-511.
Battaglia E. Le «semigamia», singolare comportamento del nucleo spermatico helle
nova diploidi del be specie apomictiche del genere Rudbeckia (Asteraceae) e consequente
embriogenesi di tipo chimarico // C. R. Acad. Lincei Roma. Ser. 8, 1947a. 2: 63-67.
Battaglia E. Ricerche cariologiche ed embriologiche sul genere Rudbeckia (Asteraceae).
XI. Semigamia in Rudbeckia speciosa Wender. // Nuovo Giorn. Bot. Ital., n.s., 1947b.
54(3-4): 531-559.
Battaglia E. Nuovi reperti di apomissia a di amfimissia nel genere Rudbeckia
(Compositae) // Atti Soc. Tosc. Sci. Nat., Ser. B. 1952. 59: 205-209.
Battaglia E. Ricerche citotassonomiche in Dipcadifulium Webb. //Caryologia, 1953 -
1954. 6 (1): 63-76.
Battaglia E. Apomixis. In: Recent Advances in the Embryology of Angiosperms.
/ Ed. P. Maheshwari. Delhi: Univ. Delhi, 1963: 221-264.
Battaglia E. Embryological questions: 2. Is the endosperm of angiosperms sporophytic
or gametophytic? // Ann. Bot. (London), 1980. 39(1): 9-30.
Battaglia E. Embryological questions: 3. Semigamy, hemigamy and gynandroemb-
ryony// Ann. Bot. (London), 1981. 39(2): 173-175.
Battaglia E. Embryological questions: 10. Have the expressions polar nuclei «and
secondary nucleus» been rightly established? Appendix: Hofmeister W. (1847), «Unter-
suchungen bei Oenothereen» // Atti Soc. Tosc. Sci. Nat., Ser. B. 1987a. 94: 127-150.
Battaglia E. Plant embryology: the Tuscan contribution. / Eds. Garbari, F., Pacini, E.
A // Atti Soc. Tosc. Sci. Nat., Ser. B. 1987b., 94: 53-125.
Batygina T.B. On the possibility of separation of a new type of embryogenesis in
Angiospermae // Rev. Cytol. Biol. Veg., 1969. 32(3-4): 335-341.
730
Семя
Batygina Т.В. Some peculiar features of macrosporogenesis and development of the
female gametophyte in wheat // Ann. Univ. A.R.E.R.S., 1971: 46-50.
Batygina T.B. Fertilization process in cereals // Fertilization in Higher Plants. / Ed.
Linskens H.F. Amsterdam: North-Holland Publishing Company, 1974: 205-220.
Batygina T.B. Embryological processes related to distant hybridization in Gramineae//
Abst. Indo-Soviet Symp. «Embryology of Crop Plants». March 2-6, 1976. Delhi: 18-20.
Batygina T.B. Embryology of wheat // Proc. Indian Natl. Sci. Acad., В., 1978а.
44: 13-29.
Batygina T.B. Embryological processes at distant hybridization in Gramineae
family// Proc. Indian Natl Sci. Acad.,В.,1978b. 44:30-42.
Batygina T.B. Problems of morphogenesis in situ, in vivo and in vitro // Proc. Int.
Symp. «Plant tissue and cell culture application to crop improvement». Olomouc.
Czechoslovakia, 24-29 September, 1984. Prague, 1984: 43-56.
Batygina T.B- New concept of asexual reproduction in flowering plants // Abstr.
XIV Int. Bot. Congress. Berlin, 1987: 5.
Batygina T.B. New approach to the system of reproduction in flowering plants
// Apomixis Newsletter, 1989a. 1: 52-55.
Batygina T.B. A new approach to the system of flowering plants // Phytomorphology,
1989b. 39(4): 311-325.
Batygina T.B. New concept of asexual reproduction in flowering plants // Some
aspects and actual orientation in Plant Embryology, «Dedicatory volume to Prof.
A.Lebegue». / Eds. Pare J., Bugnicourt M. Amiens: Univ. Picardie, 1989c: 28-44.
Batygina T.B. Embryoidogenic type of reproduction in flowering plants // Apomixis
Newsletter, 1990. 2: 58-66.
Batygina T.B. New hypothesis about the initials and genesis of embryoids (somatic
embryos) and a position of embryoidogeny in the reproduction system // Apomixis
Newsletter, 1991. 3: 19-24.
Batygina T.B. Relation between embryoidogeny (somatic embryogeny) and apomixis//
Abstr.. XIII Eucarpia Congr. July 6-11. Angers, 1992: 333-334.
Batygina T.B. Totipotency of ovule and seed cells in reproduction system of
Angiosperms // Abstr. XV Int. Bot. Congr. Yokohama, Japan, August 28-September 3.
1993: 362.
Batygina T.B. The ecology role of vivipary and pseudovivipary in the adaptive
evolution of reproductive systems in angiosperms // Proc. VI Int. Congr. Ecol. 21-26
August, 1994, UK. 1994: 311. . ■ -
Batygina T.B. Parallel development of somatic and sexual embryos // Abstr. 14 Int.
Congr. Sex. Plant Reprod., Lome, Australia, February 18-23. 1996: 4.
Batygina T.B.,Andronova E.V. Is there a cotyledon in the Orchidaceae? An opinion //
Recent Advances in Plant Biology / Eds. Malik C.P.,AbroI J.P. Delhi,1991:369-374.
Batygina T.B., Andronova E.V., Kartseva L.A. Morphogenesis of the embryo and
seedling of flowering plants (an example of orchid) /■/ Proc. 13 Int. Congr. Electron
Microscopy. Paris, July 17-22 1994, vol.3B, Application in biological science. 1994:
1039-1040.
Batygina T.B., Bragina E.A., Titova G.E. Morphogenesis of propagules in viviparous
species Bryophyllum daigremonotianum and B. calycinum // Acta Soc. Bot. Polon.,
1996. 65(1-2): 127-133.
Batygina T.B., Freiberg Т.Е., Vasilyeva V.E. Development of excised embryos in
Paeonia species // Abstr. Indo-Soviet Symp., «Embryology of Crop Plants.» Leningrad,
August 23-26, 1977. (New Delhi, India). 1978: 17.
Литература
731
Batygina T.B., Shamrov I.I. Ovule and seed structure in Poa, Paeonia and orchids
from the point of reliability // Abstr. XV Int. Bot. Congr. Yokohama, Japan, August
28-September 3. 1993: 96.
Batygina T.B., Shamrov 1.1., Titova G.E. Somatic embryogenesis in cereals (comparative
embryological approach) // Abstr. XV Int. Bot. Congr. Yokohama, Japan. 1993: 564.
Batygina T.B., Shamrov 1.1., Titova G.E., Vasilyeva V.E. Concurrent development of
the ovule structures in some flowering plants // Angiosperm pollen and ovules. / Eds.
Ottaviano Ei, Mulcahy D.L., Sari Gorla M., Bergamini Mulcahy G. New York a.o.:
Springer-Verlag,'1992a: 144-148.
Batygina T.B., Titova G.E., Brukhin V.B. Is the embryo in the mature seed of
Paeonia sexual? // Abstr. XII Intr. Congr. on Sexual Plant Reproduction, Columbus,
Ohio, USA. 1992b: 4-5.
Batygina T.B., Vasilyeva V.E. Experimental study of embryo differentiation in
angiosperms // Acta Soc. Bot. Polon., 1981. 50(1-2): 257-264.
Batygina T.B., Vasilyeva V.E. System of reproduction of Orchidaceae (on example of
Dactylorhiza maculata (L.) Soo.) // Proc. VII Int. Symp. «Fertilization and Embryogenesis
in Ovulated Plants». High Tatra (Rackova dolina), June 14-17, 1982. Czechoslovakia*
Bratislava, 1983: 27-33.
Batygina T.B., Vasilyeva V.E. Some aspects of autonomy of embryo in flowering
plants // Phytomorphology, 1988. 38(4): 293-297.
Baude E. Die Embryoentwicklung von Stratioides abides // Planta, 1956. 46(6):
649-671.
Baus A.D., Franzmann L., Meinke D.W. Growth in vitro of arrested embryos from
lethal mutants of Arabidopsis thaliana // Theor. Appl. Genet., 1986. 72: 577-586.
Bechtel D.B., Juliano B.O. Formation of protein bodies in the starchy endosperm of
rice (Oryza sativa L.): a re-investigation // Ann. Bot. (London), 1980. 45: 503-509.
Bechtel D.B., Pomeranz Y. Ultrastructure of the mature ungerminated rice (Oryza
sativa) caryopsis. The caryopsis coat and the aleurone cells // Amer. J. Bot., 1977. 64:
966-973.
Bell J., Hicks G. Transmitting tissue in the pistil of tobacco: light and electron
microscopic observations // Planta, 1976. 131: 187-200.
Bendich A.J., Gauriloff L.P. Morphometric analysis of cucurbit mitochondria: the
relationship between chondriome volume and DNA content // Protoplasma, 1984. 119:
1-7.
Benfey P.N., Linstead P.J., Roberts K., Schiefelbein J.W., Hauser M.-Th.,
Aeschbacher R.A. Root development in Arabidopsis: four mutants with dramatically
altered root morphogenesis // Development, 1993. 119: 57-70.
Benfey P.N., Ren L., Chua N.-H. Tissue-specific expression from CaMV 35S
enhancer subdomains in early stages of plant development // EMBO J., 1990. 9:
1677-1684.
Bennett M.D., Smith J.B. The nuclear DNA content of the egg, the zygote and
young proembryo cells in Hordeum // Caryologia, 1976. 29: 435-446.
Bentrup F.-W. Cellular polarity // Cellular interactions / Eds. Linskens H.F.,
Heslop-Harrison J. Berlin a.o., 1984: 473-490.
Berg R.Y. Seed dispersal, morphology of Trillium // Skr. Narske vid.-akad. Oslo,
1958. 1: 1-36.
Berger C, Erdelska O. Ultrastructural aspects of the embryo sac of Jasione montana
L.: cell walls // Caryologia, 1973. 25 (suppl.) 109-119.
Berger F., Taylor A., Brownlee C. Fate-determining positional information provided
by the plant cell wall during embryogenesis // Science, 1994. 263(5152): 1421-1423.
732
Семя
Berleth Т., Jiirgens G. The role of the monopteros gene in organizing the basal body
region of the Arabidopsis embryo // Development, 1993. 118: 575-587.
Bernard N.N. L'Bvolution dans la symbiose les orchidees et leurs champignons
commensaux // Ann. Sci. Nat., Bot., 1909. 9: 1-196.
Bernhardi J.J. Uber die merkwurdegsten Verschiedenheiten des entwickelten Pflan-
zenembryo und ihren Wert fur die Systematik // Linnaea, 1832. 7: 561-613.
Berridge E.M., Sanday E. Oogenesis and embryogeny in Ephedra distachya // New
Phytol., 1907. 6: 128-134.
Beweley J.D., Black M. Physiology and Biochemistry of Seeds in Relation to
Germination. V.l. Development, Germination and Growth. Berlin: Springer, 1978: 1-306.
Beweley J.D., Black M. Seeds: Physiology of Development and Germination. New
York: Plenum Press, 1985: 1-367.
Beweley J.D., Black M. Seeds: Physiology of Development and Germination. New
York: Plenum Press, 1994: 1-448.
Bexon D. Observations on the anatomy of teratological seedlings. II. On the anatomy
of some polycotylous seedlings of Centranthus ruber // Ann. Bot. (London), 1920. 34:
81-94.
Bexon D., Wood A.E. Observations on the anatomy of the teratological seedlings.
VII. The anatomy of some polycotylous seedlings of Impatiens Roylei Walp. / Ann. Bot.
(London), 1930. 44 (CLXXIV): 297-309.
Bhaduri P.N. Studies in the embryology of the Solanaceae I. // Bot. Gaz. (Chicago),
1936. 98:.283-295.
Bhalla R.L., Singh M.B., Malik C.P. Physiology of sexual reproduction. VI.
Embryogenesis in Tropaeolum majus L. Enzyme changes // Acta Bot. Indica, 1979.
7(1): 72-86.
Bhalla R.L., Singh M.B., Malik C.P. Studies on the comparative biosynthetic
activities of embryo and suspensor in Tropaeolum majus L. // Z. Pflanzenphysiol., 1981.
103(2): 115-119.
Bhandari N.N., Anuradha Mai. Wall ingrowth or trabecula in the free nuclear embryo
sac of Scilla sibirica Sato // Phytomorphology, 1989. 39(1): 21-28.
Bhandari N.N., Indira K. Studies in the Viscaceae. IV. Embryology of Eubraehion
(Hook, et Am.) Engl. // Bot. Not., 1969. 122(2): 183-203.
Bhandari N.N., Nanda K. Studies in the Viscaceae. II. A reinvestigation of the female
gametophyte of Arceuthobium douglasii // Amer. J. Bot., 1968a. 55(9): 1028-1031.
Bhandari N.N., Nanda K. Studies in Viscaceae. I. Morphology and embryology of the
Indian dwarf mistletoe — Arceuthobium minntissemum // Phytomorphology, 1968b.
18(4): 435-450.
Bhandari N.N., Sachdeva A. Some aspects of organization and histochemistry of the
embryo sac of Scilla sibirica Sato // Protoplasma, 1983. 117: 170-178.
Bhandari N.N., Sheel Km. Ultrastructural studies on endosperm haustoria in
Andrographis serpyllifolia // Proc. XI Int. Symp. «Embryol. a. Seed Reprod.»
Leningrad, July 3-7, 1990. St.Petersburg: Nauka, 1992: 76-77.
Bhatnagar S.P. Some observations on the post-fertilization development of the embryo
sac of Santalum // Phytomorphology, 1959. 9(1): 87-91.
Bhatnagar S.P. Morphological and embryological studies in the family Santalaceae.
IV.Mida salicifolia A.Cunn. // Phytomorphology, 1960. 10(2): 198-207.
Bhatnagar S.P., Gupta M. Morphology and embryology of Mimusops elengi L. //
Bot. Not., 1970. 123(4): 455-473.
Литература
733
Bhatnagar S.P., Sawhney V. Endosperm — its morphology, ultrastructure, and
histochemistry // Int. Rev. Cytol., 1981. 73: 55-102.
Bhattacharyya M.K., Smith A.M., Ellis T.H.N., Hedley C, Martin С The wrinkled-
seed character of pea described by Mendel is caused by a transposon-like insertion in a
gene encoding starch-branching enzyme // Cell (Cambridge), 1990. 60: 115-122.
Biradar N.V. Studies on palms: embryology of Phoenix pusilla Gaertn., P.acaulis
Buch. and P.reclinata Jacq. // Proc. Indian Acad. Sci., 1968. 67(4): 165-173.
Birky C.W. Relaxed cellular controls and organelle heredity // Science, 1983. 222:
468-475.
Biswas P.K., Devi A., Roy P.K., Paul K.B. Enzyme activity in dormant and
nondormant large crabgrass (Digitaria sanguinalis) seeds following hydration // Weed
Sci., 1978. 26(1): 90-93.
Blake S.T. Idiospermum (Idiospermaceae), a new genus and family for Calycanthus
australiensis // Contribution from the Qeensland Herbarium, 1972. 12: 1-37.
Boblenz K., Nothnagel Т., Metzlaff M. Paternal inheritance of plastids in the genus
Daucus // Molec. Gen. Genet., 1990. 220: 489-491.
Bodmer W.F. The genetics of homostyly in populations of Primula vulgaris // Philos.
Trans., Ser. B, (London) 1966. 242: 517.
Boesewinkel F.D., Bouman F. The seed: structure // Embryology of Angiosperms. /
Ed. B.M. Johri. Berlin a.o.: Springer-Verlag, 1984: 567-610.
Bohdanowicz J. Caryological anatomy of the suspensor in Alisma L. I. Alisma
plantago-aquatica L. // Acta Biol. Cracov., Ser. Bot., 1973. 16: 235-246.
Bohdanowicz J. Alisma embryogenesis: the development and ultrastructure of the
suspensor // Protoplasma, 1987. 137(23): 71-83.
Borkird C, Choi J.H., Jin Z.H., Franz G., Hatzopoulos P., Chorneau R., Bonas U.,
Pelegri F., Sung R.Z. Developmental regulation of embryogenic genes in plants // Proc.
Natl. Acad. Sci. USA, 1988. 85: 6399-6403.
Bosnes M., Harris E., Aigeltinger L., Olsen O.A. Morphology and ultrastructure of
11 barley shrunken endosperm mutants // Theor. Appl. Genet., 1987. 74: 177-187.
Bouharmant J. Evoluton de l'ovule fecondee chez Musa acuminata, Colla subsp.
brormannica Simmonds // Cellule, 1963. 63(2): 261-279.
Bower F.O. The British Association. Bristol meeting. Section К (Botany). Opening
address by Prof. F.O. Bower, Sc.D., F.R.S., President of the section. II // Nature,
1898. 59: 88-91.
Bowman J.L., Smyth D.R., Meyerowitz E.M. Genetic interactions among floral
homeotic genes of Arabidopsis // Development, 1991. 112: 1-20.
Boyd L. Monocotylous seedlings. Morphological studies in the post-seminal development
of the embryo // Trans. & Proc. Bot. Soc. Edinburgh, 1935. 31: 1-224.
Brady J. Feulgen cytophotometric determination of the DNA content of the embryo
proper and suspensor cells of Phaseolus coccineus // Cell Different., 1973. 2: 65-75.
Brady Т., Combs S.H. The suspensor is a major route of nutrients into proembryo,
globular and heart stage Phaseolus vulgaris embryos // Sexual Reproduction in Higher
Plants! / Eds. Cresti M., Gori P., Pacini E. Berlin: Springer-Verlag, 1988: 419-424.
Brady Т., Walthall E.D. The effect of the suspensor and gibberellic acid on Phaseolus
vulgaris embryo protein content // Developm. Biol., 1985. 107: 531-536.
Bragina E.A., Titova G.E., Batygina T.B. The models of the formation of new
sporophyte in genus Bryophyllum (Crassulaceae) // Abstr. VII Conf. of Plant
Embryologists of Czech Republic, Slovakia a.nd Poland, 14-16 September. Lublin,
1995: 8.
734 Семя
Brawley S.H., Robinson K.R. Cytochalasin treatment distract the endogenous currents
associated with cell polarization in fucoid zygotes: Studies of the role of F-actin in
embryogenesis // J. Cell Biol., 1985. 100(4): 1173-1184.
Brawley S.H., Wetherell D.F., Robinson K.R. Electrical polarity in embryos of wild
carrot precedes cotyledon differentiation // Proc. Natl. Acad. Sci. USA, 1984. 81(19)-
6064-6067.
Brenchley W.E. On the strengthand development of wheat,Triticum vulgare // Ann.
Bot. (London),1909. 23:117-139.
Brenchley W.E. The development of the grain of barley. // Ann. Bot. (London),
1912. 26: 903-928.
Brenner W. Zur Kenntnis der Blutenentwicklung einiger Juncaceen // Acta Soc. Sci.
Fenn., 1922. 50(4): 1-37.
Breton A.M., Sung Z.R. Temperature-sensitive carrot variants impaired in somatic
embryogenesis // Developm. Biol., 1982. 90: 58-66.
Brewbaker J.L. The distribution and phylogenetic significance of binucleate and
trinucleate pollen grains in the angiosperms // Amer. J. Bot., 1967. 54: 1069-1083.
Brink R.A., Cooper D.C. The endosperm in seed development // Bot. Rev
(Lancaster), 1947. 13(8-9): 423-541.
Brongniart A. Die Zeugung und Entwicklung des Embryo in den phanerogamischen
Pflanzen // Vermischte botanische Schriften. / Ed. Brown R. Numbers, 1830 4-
167-326.
Brouland M. A propos de la formation de l'albumen a partir du noyau secondaire non
feconde chez l'Anemone nemorosa L. // Ann. Univ. A.R.E.R.S, 1967. 5(4): 165-169.
Brouland M. Recherches cytologique sur la fecondation chez quelques Ranunculacees:
Caltha palustris L., Anemone nemorosa L., Ranunculus acris L., Helleborus foetidus
L. // Rev. Cytol. Biol. Veg., 1969. 32(3-4): 309-317.
Brown R. On the natural order of plants called Proteaceae // Trans. Linn. Soc.
London, 1810. 10: 15-226.
Brown R. Sur la structure de l'ovule anterieurement a l'impregnation dans les plantes
phanerogames et sur la fleur femelle des Cycadees et des Coniferees // Ann. Sci. Nat.
Bot., 1826. 7: 211-244.
Brown R.C., Lemmon B.E., Olsen O.-A. Endosperm development in barley:
microtubule involvement in the morphogenetic pathway // Plant Cell, 1994. 6(9)-
1241-1252. .
Brown R.S., Mogensen H.L. Late ovule and early embryo development in Quercus
gambelii // Amer. J. Bot., 1972. 59(4): 311-316.
Brown W. The epiblast and coleoptile of the grass embryo // Bull. Torrey Bot.
Club, 1959. 86(1): 13-16.
Brown W. The morphology of grass embryo // Phytomorphology, 1960. 10(3):
215-233.
Brown W. The grass embryo — a rebuttal // Phytomorphology, 1965. 15(3):
274-284.
Browse J., Slack C.R. Fatty-acid synthesis in plastids from maturing sunflower and
linseed cotyledons // Planta, 1985. 166(1): 74-80.
Brozek A. Inheritance in the Monkey Flower //J. Heredity, 1926. 17: 113-129.
Buchholz J.T. Studies concerning the evolutionary status of polycotyledony // Amer.
J. Bot., 1919. 6: 106-119.
Bruck D.K., Walker D.B. Cell determination during embryogenesis in Citrus jambhiri.
I. Ontogeny of the epidermis // Bot. Gaz. (Chicago), 1985. 146(2): 188-197.
Литература
ii
Brukhin V.B., Batygina T.B. Embryo culture and somatic embryogenesis in culture of
Paeonia anomala // Phytomorphology, 1994. 44(3-4): 151-157.
Bruns E. Der Grasembryo. Diss. Miinchen, 1892: 1-37.
Bruun L. The mature embryo sac of the sugar beet, Beta vulgaris: a structural
investigation // Nordic. J. Bot., 1987. 7(5): 543-551.
Bruun L. A statistical analysis of some genetical, physiological and anatomical
parameters of the development of in situ and in vitro-grown ovules from intra- and
interspecific crosses in the genus Beta // Sex. Plant Reprod., 1991a. 4: 118-125.
Bruun L. Histological and semi-quantitative approaches to in vitro cellular responses of
ovule, embryo and endosperm in sugar beet, Beta vulgaris L. // Sex. Plant Reprod.,
1991b. 4: 64-72.
Bruun L., Olesen P. A structural investigation of the ovule in sugar beet, Beta
vulgaris: The micropylar nucellus // Nordic J. Bot., 1989. 9: 81-97.
Buchholz J.T. The morphology and embryogeny of Sequoia gigantea // Amer. J.
Bot., 1939. 26: 248-257.
Bugnicourt M. Embryogenie des Hypericum de France // Bull. Soc. Bot. France,
1983. 130: 195-205.
Bugnon P., Parrot A. Sur la valeur morphologigue du cotyledon chez les Ombelliferes
monocotyledones // Compt. Rend. Hebd. Sea. Acad. Sci., 1932. 95: 332.
Biinning E. Weitee Untersuchungen iiber die Differenzierungsvorgange in Wurzeln
// Z. Bot., 1952. 40(4): 385-406.
Burgeff H. Samenkeimung der Orchideen und Entwicklung ihrer Keimpflanzen. Jena:
G. Fischer 1936: 1-312.
Burr В., Burr F.A. Zein synthesis in maize endosperm by polyribosomes attached to
protein bodies // Proc. Natl. Acad. Sci. USA, 1976. 73: 515-519.
Button J., Kochba J., Borman.C.H. Fine structure of an embryoid development from
embryogenic ovular callus of «Shamonti» orange (Citrus sinensis Osb.) // J. Exp. Bot.,
1974. 25: 446-457.
Buttrose M.S. Ultrastructure of the developing wheat endosperm // Austral. J. Bot.,
1963a. 16: 301-317.
Buttrose M.S. Ultrastructure of developing aleurone cells of the wheat grain
// Austral. J. Biol. Sci., 1963b. 16: 768-774.
Byrne J.M.,HeimschC. The root apex of Malva sylvestris: 2. The quiescent center //
Amer. J. Bot.,1970. 57:1179-1184.
Cai G., Moscatelli A., Del Casino C, Cresti M. Cytoplasmic motors and pollen tube
growth // Sex. Plant Reprod., 1996. (In Press)
Campbell D.H. A morphological study of Najas and Zannichellia // Proc. Calif.
Acad. Sci., 1897. 3(1): 1-67.
Campbell D.H. The development of the flower and embryo in Lilaea subulata H.B.K. //
Ann. Bot. (London),1898. 12:1-28.
Campbell D.H. On the affinities of certain anomalous dicotyledons // Amer.
Naturalist, 1902. 36(421): 7-12.
Campbell D.H. The phylogeny of monocotyledons // Ann. Bot. (London), 1930.
44(17): 311-331.
Campbell W.P., Lee J.W., O'Brien T.P., Smart M.G. Endosperm morphology and
protein body formation in developing wheat grain // Austral. J. Plant Physiol., 1981. 8:
5-19.
736
Семя
Campenot M.K., Zhang G., Cutler A.J., Cass D.D. Zea mays embryo sacs in
culture. I. Plant regeneration from 1 day after pollination embryos // Amer. J. Bot.,
1992. 79: 1368-1373.
Carano E. Alcune osservazioni sull'embriogenesi delle Asteraceae // Ann. Bot.
(Rome), 1913. 11(2): 313-315.
Carano E. Ricerche sull'embriogenesi delle Asteraceae // Ann. Bot. (Rome), 1915.
13(2): 251-301.
Carlson W.R. Factors affecting preferential fertilization in maize // Genetics, 1969.
62: 543-554.
Carmichael J.S., Friedman W.E. Double fertilization in Gnetum gnemon: the
relationship between the cell cycle and sexual reproduction // Plant Cell, 1995. 7:
1975-1988.
Carniel K. Uber die Embryobildung in der Gattung Paeonia // Oesterr. Bot. Z.,
1967. 114(1): 4-19.
Casadoro G., Colombo P.M., Rascio N. Plastids in the quiescent embryo and young
seedlings of the chloroembryophyte Citrus nobilis x Citrus aurantium amara pumila
// Ann. Bot. (London), 1980. 45(4): 415-418.
Casadoro G., Rascio N. Cotyledonal chloroplasts in the hypogeal seeds of clementine
// Planta, 1987. 170: 300-307.
Cass D.D. An ultrastructural and Nomarski-interference study of the sperms of barley
// Canad. J. Bot., 1973. 51(3): 601-605.
Cass D.D. Structural relationships among central cell and egg apparatus cells of barley
as related to transmission of male gametes // Acta Soc. Bot. Polon., 1981. 50(1/2):
177-180.
Cass D.D., Fabi G.C. Structure and properties of sperm cells isolated from the pollen
of Zea mays // Canad. J. Bot., 1988. 66(5): 819-825.
Cass D.D., Jensen W.A. Fertilization in barley // Amer. J. Bot., 1970. 57(1):
62-70.
Cass D.D., Karas J. Ultrastructural organization of the egg of Plumbago zeylanica //
Protoplasma, 1974. 81(1): 49-62.
Cass D.D., Karas J. Development of sperm cells in barley // Canad. J. Bot., 1975.
53(10): 1051-1162.
Castle L.A., Meinke D.W. Embryo-defective mutants as tools to study essential
functions and regulatory processes in plant embryo development // Seminars Developm.
Biol., 1993. 4: 31-39.
Cavara F. Studi sul the richerche intorno alio svilluppo del frutto della «Thea
chinensis» sims., cultivata nel orto botanico di Pavia // Atti Inst. Bot. Univ. Pavia,
1899. Ser. 2, 5: 265-326.
Cave M.S., Arnott H.J., Cook S.A. Embryogeny in the California peonies with
reference to their taxonomic position // Amer. J. Bot., 1961. 48(3): 397-404.
Cela Renzoni G., Viegi L. Le suspenseur embryonnaire chez les Cruciferes. II. Etude
cytophotometrique dans Capsella bursa-pastoris (L.) Medicus. // Ann. Sci. Nat., Bot.
Biol. Veg., 1984. 6(4): 245-249.
Chab oud A., Perez R. Generative cells and male gametes: isolation, physiology and
biochemistry // Int. Rev. Cytol., 1992. 140: 205-232.
Chaffey N.J., Harris N. Localization of ATPase activity of scutellar epitelial cells of
germinating barley (Hordeum vulgare L.) // J. Exp. Bot., 1985. 36(171): 1612-1619.
Chamberlain C.J. Morphology of Ceratozamia // Bot. Gaz. (Chicago), 1912. 53(1):
1-19.
Литература
Til
Chamberlain C.J. Gymnosperms, Structure and Evolution. Chicago, IL: Univ. Chicago
Press. 1935.
Chamberlin M.A., Horner H.T. A study of endosperm development in Glycine max
// Amer. J. Bot., 1989. 76(6), suppl.: 27.
Chamberlin M.A., Horner H.T., Palmer G.R. Nutrition of ovule, embryo sac and
young embryo in soybean: an anatomical and autoradiographic study // Canad. J. Bot.,
1993. 71: 1153-1168.
Chandlee J.M. Analysis of developmentally interesting genes cloned from higher plants
by insertional mutagenesis // Developm. Genet., 1991. 12: 261-271.
Charlesworth D., Charlesworth B. The evolution and breakdown of S-allele systems
// Heredity, 1979. 43: 41-55.
Charzynska M. Some aspects of development and division of generative cell in
tricellular type pollen grains // Ann. Sci. Univ. Reims A.R.E.R.S, 1988. 23: 81-84.
Charzynska M., Ciampolini F., Cresti M. Generative cell division and sperm cell
formation in barley // Sex. Plant Reprod., 1988. 1: 240-247.
Charzynska M., Lenart N. Pollen grain of barley (Hordeum vulgare L.) — pattern of
development // Acta Soc. Bot. Polon., 1989. 58: 313-320.
Charzynska M., Lewandowska F. Generative cell division and sperm cell association in
the pollen grain of Sambucus nigra // Ann. Bot. (London), 1990. 65: 685-689.
Charzynska M., Murgia M., Milanesi C, Cresti M. Origin of sperm cell association
in the «male germ unit» of Brassica pollen // Protoplasma, 1989. 149: 1-4.
Chase M.W., Soltis D.E., Olmstead R.G., et al. Phylogenetics of seed plants: an
analysis of nucleotide sequences from the plastid gene rbcL // Ann. Missouri Bot. Gard.,
1993. 80: 528-580.
Chaubal R., Reger B.J. Relatively higher calcium is localized in synergid cells of
wheat // Sex. Plant Reprod., 1990. 3: 98-102.
Chaubal R., Reger B.J. Calcium in the synergid cells and other regions of pearl millet
ovaries // Sex. Plant Reprod., 1992. 5: 34-46.
Chaubal R., Reger B.J. Localization of calcium in young synergid cells of pearl millet
by antimonate: indications of calcium influx, programmed cell death, and calcium release
// Sex. Plant Reprod., 1995. 8.
Chaudhury A.M., Letharn S., Craig S., Dennis E.S. Ampl — a mutant with high
cytokinin levels and altered embryonic pattern, faster vegetative growth, constitutive
photomorphogenesis and precocius flowering // Plant Journal, 1993. 4(6): 907-916.
Chaundhari H.K. The production of haploids by semigamy and their potential
utilization in breeding cotton // Diss. Abstr. Int.В., 1975. 1534-B.
Chaundhari H.K. Use of semigamy in the production of cotton haploide // Bull.
Torrey Bot. Club, 1978. 105(2): 98-103.
Chebotaru A.A. Maize embryology. Ultrastructure of embryo sac before and at the
moment of fertilization // 7e Congress Int. Micr. Electr., 1970. Grenoble. 3: 443-444.
Cheng Z., Shiyi H., Liyun X., et al. Ultrastructure of sperm cell in mature pollen
grain of wheat // Sci. Sin., 1980. 23(4): 371-379.
Chiarugi A. Embryologia della Cistaceae // N. G. Bot. Ital. N.S., 1925. 32:
223-314.
Chichiriccy G. Embryology of Crocus thomasii (Iridaceae) // Plant Syst. Evol.,
1989. 168(1-2): 39-47.
Chikkannaiah P.S. Morphological and embryological studies in the Commelinaceae //
Plant embryology. A symposium (New Delhi, 1960). 1962: 23-36.
47—828
738 Семя
Chikkannaiah P.S., Hemaraddi B. A note on the megasporogenesis and endosperm of
some Commelinaceae // Curr. Sci., 1979. 48(8): 363.
Child CM. Patterns and Problems of Development. Chicago: Univ. Chicago press,
1941: 1-811.
Chitralekha P., Bhandari N.N. Cellularization of endosperm in Asphodelus tenuifolius
Cav. // Phytomorphology, 1992. 42(3-4): 185-193.
Choi J.H., Liu L.-S., Borkird C, Sung Z.R. Cloning of genes developmentally
regulated during plant embryogenesis // Proc. Natl. Acad. Sci. USA, 1987. 84:
1906-1910.
Choi J.H., Sung Z.R. Two-dimensional gel analysis of carrot somatic embryonic
proteins // Plant Molec. Biol. Rep., 1984. 2: 19-25.
Chowdhury J.K., Mitra J.N. Abnormal tricotyledonous embryo and the morphological
structure of normal fruit and seed of Cinnamomum camphora // Sci. Cult., 1953. 19:
159-160.
Christianson M.L. Fate map of the organizing shoot apex in Gossypium // Amer. J.
Bot., 1986. 73: 947-958.
Clark J.K., Sheridan W.F. Developmental profiles of the maize embryo-lethal mutants
dek22 and dek23 // J. Heredity, 1986. 77: 83-92.
Clark J.K., Sheridan W.F. Characterization of the two maize embryo-lethal defective
kernel mutants rgh*-12l0 and fl*-1253B: Effects on embryo and gametophyte development
// Genetics, 1988. 120: 279-290.
Clark J.K., Sheridan W.F. Isolation and characterization of 51 embryo-specific
mutants of maize // Plant Cell, 1991. 3: 935-951.
Clark S.E., Running M.P., Meyerowitz E.M. // Development, 1993. 119: 397-418.
Clauhs R.P., Grun P. Changes in plastid and mitochondrial content during maturation
of generative cells of Solanum (Solanaceae) // Amer. J. Bot., 1977. 64: 377-383.
Clowes F.A.L. The promeristems and the minimal constructional centre in grass root
apices // New Phytol., 1954. 53: 108-116.
Clowes F.A.L. Nucleic acids in root apical meristems of Zea // New Phytol., 1956.
55: 29-34.
Clowes F.A.L. Apical meristems of roots // Biol. Rev. Cambridge Philos. Soc,
1959a. 34: 501-529.
Clowes F.A.L. Reorganization of root apicies after irradiation // Ann. Bot. (London),
1959b. 90: 205-210.
Clowes F.A.L. Apical meristems. Oxford, UK: Blackwell, 1961
Clowes F.A.L. The proportion of cells that divide in root meristems of Zea mays //
Ann. Bot. (London), 1971. 35: 249-261.
Clowes F.A.L. The quiescent centre // Third Cabot Symp. «The development and
function of roots». / Eds. Tarrey J.G., Clarcsin D.T. London: AP. 1975: 3-19.
Clowes F.A.L. Estimation of growth fractions in meristems of Zea mays // Ann. Bot.
(London), 1976a. 40: 933-938.
Clowes F.A.L. Cell production by cap cells // New Phytol., 1976b. 77: 39.9-407.
Clowes F.A.L. Origin of quiescence at the root pole of pea embryos // Ann. Bot.
(London), 1978a. 42: 1237-1239.
Clowes F.A.L. Origin of the quiescent centre in Zea mays // New Phytol., 1978b.
80: 409-419.
Clowes F.A.L. Cell proliferation in ectotrophic mycorhizas of Fagus sylvatica L. //
New Phytol., 1981a. 87: 547-555.
Литература
739
Clowes F.A.L. The difference between open and closed meristems // Ann. Bot.
(London), 1981b. 48: 761-767.
Clowes F.A.L. Changes in cell population kinetics in an open meristem during root
growth // New Phytol., 1982. 91: 741-748.
Clowes F.A.L., Juniper B.E. The fine structure of the quiescent centre and
neighbouring tissues in root meristems // J. Exp. Bot., 1964. 15: 622-630.
Clowes F.A.L., Stewart H.E. Recovery from dormancy in roots // New Phytol.,
1967. 66: 115-123.
Clutter M., Sussex I.M. Macromolecular synthesis during plant embryogeny. Cellular
rates of RNA synthesis in diploid and polytene cells in bean embryo // (Abstr.) J. Cell
Biol., 1968. 39: 26a.
Cochrane M.P. Morphology of the crease region in relation to assimilate uptake and
water loss during caryopsis development in barley and wheat // Austral. J. PI. Physiol.,
1983.10: 473-491.
Cocucci A.E. Aspectos ultrastructurales de la fertilization en angiosperms // Kurtziana,
1981. 14: 41-62.
Cocucci A.E. Ultrastructural aspects of Epidendrum male gametogenesis (Orchidaceae)
// Abstr. X Int. Symp. Sex. Reprod. in Higher Plants, Siena, 30 May 4 June, 1988.
Siena Univ. 1988: 30.
Cocucci A.E., Jensen W.A. Orchid embryology: megagametophyte of Epidendrum
scutella following fertilization // Amer. J. Bot., 1969a. 56(6): 629-640.
Cocucci A.E., Jensen W.A. Orchid embryology: pollen tetrads in Epidendrum scutella
in the anther and on the stigma // Planta, 1969b. 84: 215-229.
Cocucci A.E., Jensen W.A. Orchid embryology: the mature megagametophyte of
Epidendrum scutella // Kurtziana, 1969c. 5: 23-38.
Сое C.E. Cytology of reproduction in Cooperia pedunculate // Amer. J. Bot., 1953.
40(5): 335-343.
Сое E.H.Jr., Neuffer M.G., Hoisington D.A. The genetics of corn // Corn and corn
improvement / Eds. Sprague G.F., Dudley J.W. Madison, WI: Amer. Soc. Agronomy,
1988: 81-258.
Coen E.S. The role of hameotic genes in flower development and evolution // Ann.
Rev. Plant Physiol. Plant Molec. Biol., 1991. 42: 241-279.
Collins D.M., Wilson A.T. Metabolism of the axis and cotyledons of Phaseolus
vulgaris seeds during early germination // Phytochemistry, 1972. 11(6): 1931-1935.
Come D., Tissaoui T. Interrelated effects of imbibition, temperature and oxygen on
seed germination // Seed Ecology. London: Butterworths, 1973: 157-167.
Compton R.H. An anatomical study of syncotyly and schizocotyly // Ann. Bot.
(London), 1913. 27(108): 793-821.
Conjugated Plant Hormones: Structure, Metabolism and Function // Proc. Int.
Symp. in Gera, GDR, Berlin: VEB Kongressund Werbedruck. / Eds. Schreiber K.,
Schutte H.R., Sembdner G. 1986: 1-405.
Cook M.T. Development of the embryo sac and embryo of Castalia odorata and
Nymphaea advena // Bull. Torrey Bot. Club, 1902. 29: 211-220.
Cook M.T. The development of the embryo sac and embryo of Claytonia virginica //
Ohio Naturalist, 1903. 3(3): 349-353.
Cook M.T. The embryology of some Cuban Nymphaeaceae // Bot. Gaz., 1906.
42(5): 376-392.
Cooke E.A., Shively A.F. Observations on the structure and development of Epiphagus
virginiana // Trans. Proc. Bot. Soc. Pennsylvannia, 1941. 2: 352-398.
47*
740 Семя
Cooke M.C. A manual of Botanic Terms. London: W.H.Allen a. Co., [1873?]:
1-118.
Cooper D.C. Embryology of Pisum sativum // Bot. Gaz., 1938. 100(1): 123-132.
Cooper D.C. Macrosporogenesis and embryology of Portlulaca oleracea // Amer. J.
Bot., 1940. 27(5): 326-330.
Cooper D.C. Flower and seed development in Oxybaphus nyctagineus // Amer. J.
Bot., 1949. 36(4): 348-355.
Cooper D.C, Brink R.A. Partial self-incompatibility and the collapse of fertile ovules
and factors affecting seed formation in alfalfa // J. Agric Res., 1940. 60(7): 453-472.
Cope F.W. The mechanism of pollen incompatibility in Theobroma cacao // Heredity,
1962. 17: 157-182.
Copeland H.F. The structure of Monotropis and the classification of the Monotropoideae
// Madrono, 1939. 5(4): 105-119.
Copeland H.F. Further studies on Monotropoideae // Madrono, 1941. 6(4): 97-119.
Cormak R.G.H. The development of root hair in angiosperms // Bot. Rev. (Lancaster),
1949. 15(9): 583-612.
Corner E.J.H. The Seed of Dicotyledons. Cambridge: Cambridge Univ. Press. 1976.
1: 1-311, 2: 1-552.
Cornish E.C., Anderson M.A., Clarke A.E. Molecular aspects of fertilization in
flowering plants // Ann. Rev. Cell Biol., 1988. 4: 209-228.
Cornish E.C., Pettitt J.M., Bonig I., Clarke A.E. Developmentally-controlled tissue-
specific expression of a gene associated with self-incompatibility in Nicotiana alata // Nature,
1987. 326: 99-102.
Correns C. Untersuchungen uber die Xenien bei Zea mays // Ber. Deutsch. Bot.
Ges., 1899. 17: 410-417.
Corriveau J.L., Coleman A.W. Rapid screening method to detect potential biparental
inheritance of plastid DNA and results for over 200 angiosperm species // Amer. J.
Bot., 1988. 75: 1443-1458.
Corsi G. The suspensor of Eruca sativa Miller (Cruciferae) during embryogenesis in
vitro // Giom. Bot. Ital., 1972. 106: 41-54.
Cosgrove D.J., Zhen-Chang Li. Role of expansins in cell enlargement of oat
coleoptiles. Analysis of developmental gradient and photocontrol // Plant Physiol., 1983.
103(4): 1321-1328.
Coutler J.M. The origin of monocotyledony. II. Monocotyledony in grasses // Ann.
Missouri Bot. Gard., 1915. 2: 175-183.
Coutler J.M., Chamberlain C.J. Morphology of Angiosperms. New York: Appleton a.
Co. 1903: 1-471.
Coutler J.M., Chamberlain C.J. Morphology of Gymnosperms. Chicago: Univ.
Chicago Press. 1910: 1-458.
Coutler J.M., Land W.J.G. The origin of monocotyledony // Bot. Gaz., 1914. 57:
509-519.
Cow G.V. Morphology of Sassafras in relation to phylogeny of angiosperms // Bot.
Gaz., 1928. 86: 149-171.
Crane P.R. Apomixis and crossing incompatibilities in some Zephyranthes Ph. D.
Diss. Univ. Texas // Diss. Abstr. Int. В., 1978. 39(4): 1605-B.
Crane P.R. Phylogenetic analysis of seed plants and the origin of angiosperms // Ann.
Missouri Bot. Gard.,1985a. 72:716-793.
Crane P.R. Phylogenetic relationships in seed plants // Cladistics, 1985b. 1: 329-
348.
Литература
1A\
Crane P.R. Major clades and relationships in the «higher» gymnosperms // Origin
and evolution of gymnosperms / Ed. Beck C.B. New York, NY: Columbia Univ. Press.
1988: 218-272.
Cresti M., Ciampolini F., .Sarfatti G. Ultrastructural investigations in Lycopersicon
peruvianum pollen activation and pollen tube organization after self- and cross-pollination
// Planta, 1980. 150: 211-217.
Cresti M., Milanesi C, Tiezzi A. Ultrastructure of Linaria vulgaris pollen grains
// Acta. Bot. Neerl., 1988. 37(3): 379-386.
Cresti M., Murgia M., Theunis C.H. Microtubule organization in sperm cells in the
pollen tubes of Brassica oleracea L. // Protoplasma, 1990. 154(2/3): 151-156.
Cresti M., Pacini E., Ciampolini F., Sarfatti G. Germination and early tube
development in vitro of Lycopersicum peruvianum pollen: ultrastructural features // Planta,
1977. 136: 239-247.
Cresti M., Went J.L.van, Pacini E., Willemse M.T.M. Ultrastructure of transmitting
tissue of Lycopersicon peruvianum style: Development and histochemistry // Planta,
1976. 132: 305-312.
Crete P. Recherches embryologiques sur les Gesneriacees. Developpement de l'albumen
et de l'embryon chez le Chirita lavandulacea Stapf // Bull. Soc. Bot. France, 1949.
96(7-9): 234-235.
Crete P. Repartition et interet phylogenetique des albumens. Formations haustoriales
chez les Angiospermes et plus particulierement chez les gamopetales // Ann. Sci. Nat.
Bot. Biol. Veg., 1951a. 12: 131-191.
Crete P. Embryogenie des Capparidacees. Developpement de l'embryon chez le
Cleome graveolens Rafin. // Compt. Rend. Hebd. Sea. Acad. Sci., 1951b. 233(9):
562-564.
Crete P. Embryogenie des Datiscacees. Developpement de l'embryon chez le Datisca
cannabina L. // Compt. Rend. Hebd. Sea. Acad. Sci., 1952. 234(10): 1082-1084.
Crete P. Embryologie des Scrophulariacees. Developpement de l'albumen et de
l'embryon chez le Digitalis purpurea L. // Phytomorphology, 1953. 3(3): 168-172.
Crete P. Embryologie de L'Erinus aipinus L. (Scrophulariacees). Les relations entre
les genres Erinus L. et Digitalis L. // Phytomorphology, 1954. 4(3-4): 325.
Crete P. L'application de certains donees embryologiques a la systematique des
Orobanchacees et de quelques families voisines // Phytomorphology, 1955a. 5(4): 422-
435.
Crete P. L'origine du sac embryonnaire et le developpement de l'albumen chez
l'Allopletus songuineus Mart. (Gesneriacees) // Bull. Soc. Bot. France, 1955b. 102(5-
6): 205-207.
Crete P. Embryo // Recent Advances in the Embryology of Angiosperms / Ed.
Maheshwari P. Delhi: Univ. Delhi 1963: 171-220.
Crete P. L'embryogenie et son role dans les essais de classification
phylogenetique // Phytomorphology, 1964. 14: 70-78.
Crocker W. Mechanics of dormancy in seeds // Amer. J. Bot., 1916. 3: 99-120.
Crocker W. Points of agronomic interest in the physiology of germination // J. Amer.
Soc. Agron., 1925. 17: 696-705.
Cronquist A. The status of the general system of classification of flowering plants // Ann.
Missouri Bot. Gard.,1965. 52(3): 281-303.
Cronquist A. An Integrated System of Classification of Flowering plants. New York:
Columbia Univ. Press. 1981: 1-396.
742
Семя
Cronquist A. The Evolution and Classification of Flowering plants. Bronx, (NY) a.o.:
New York Botanical Garden. 1988: 1-555.
Crouch M.L. Regulation of gene expression during seed development in flowering
plants // Developmental Biology: A Comprehensive Synthesis. Vol.5. / Ed. Browder L.W.
New York: Plenum Press, 1987: 367-404.
Crowe L.K. The evolution of outbreeding in plants. I. The angiosperms // Heredity,
1964. 19(3): 435-457.
Cutter E.G., Feldman L.J. Trichoblasts in Hydrocharis. I. Origin, differentiation,
dimensions and growth // Amer. J. Bot., 1970a. 57(2): 190-201.
Cutter E.G., Feldman L.J. Trichoblasts in Hydrocharis. II. Nucleic acids,proteins and
a consideration of cell growth in relation to endopolyploidy // Amer. J. Bot., 1970b.
57(2): 202-211.
Czapik R. Some research problems of the endosperm in Angiospermae // Polish Bot.
Stud., 1991. 2: 109-120.
Dahlgren K.V.O. Uber das Verkommen von Starke. in den Embryosacken der
Angiospermen // Ber. Deutsch. Bot. Ges., 1927. 45: 374-384.
Dahlgren K.V.O. Die Morphologie des Nuzellus mit besonderer Berucksichtigung der
deckzellosen Typen // Jahrb. Wiss. Bot., 1927. 67(2): 374-426.
Dahlgren K.V.O. Die Embryologie von Impatiens raylli // Svensk Bot.Tidskr., 1934.
28(1): 103-125.
Dahlgren R. A reviseal system of classification of the angiosperms // J. Linn. Soc,
Bot., 1980a. 80: 91-124.
Dahlgren R. The taxonomic significance of chlorophyllous embryos in angiosperm seeds
// Bot. Not., 1980b. 133: 337-341.
Dahlgren R.M.T., Clifford H.T. The Monocotyledons. A Comparative Study.
London, New York, 1982: 1-378.
D'Alascio-Deschamps R. Modification ultrastructurales liees a la fecondation chez le
Lin. Memoires Coll Morphologie // Bull. Soc. Bot. France, 1973a. 137-146.
D'Alascio-Deschamps R. Organization du sac embryonaire du Linum catharticum L.,
espece recoltee en station naturelle: Etude ultrastructurale // Bull. Soc. Bot. France,
1973b. 120(56): 189-195.
Dale J.E. The Growth of Leaves. London: Arnold, 1982: 1-60.
Dalziel J.M. The Useful Plants of West Tropical Africa. London: The Orown agents
for the colonies, 1937: 1-612.
D'Amato F. Role of polyploidy in reproductive organs and tissues // Embryology of
Angiosperms. / Ed. B.M. Johri Berlin a.o.: Springer. Verlag. 1984: 519-566.
D'Amato,F., Devreux M., Scarascia Mugnozza G.T. The DNA content of the nuclei
of the pollen grains in tobacco and barley // Caryologia, 1965. 18: 377-381.
Dangeard P.-A. Les maladies du pommier et du porier. Poitiers — Paris: Libraire
Blanchier. 1892: 1-64.
Danilova M.F., Nemirovich-Danchenko E.N., Komar G.A., Lodkina M.M. The seed
of monocotyledons // Monocotyledons: Systematics and Evolution / Eds. Rudal P.J.,
Gribb P.J., Cutler D.F., Humphries C.J. Kew: Royal Bot. Gardens. 1995: 461-472.
Dashek W.V., Rosen W.G. Electron microscopical localization of chemical components
in the grown zone of lily pollen tubes // Protoplasma, 1966. 61: 192-203.
Dashek W.V., Thomas R.S., Rosen W.G. Secretory cells of lily pistils. II. Electron
microscope cytochemistry of canal cells // Amer. J. Bot., 1971. 58: 909-920.
Datta R.M. Tricotyledony in Morus multicaulis Perr. // Curr. Sci., 1941. 10: 440.
Литература
743
Datta R.M. Tricotyledony in Corchorus capsularis Linn. / Sci. Cult., 1954. 20:
240-241.
Davey J.E. The white lupin suspensor // Proc. Electron Microscopy Soc. South Afr.,
1978. 8: 113-114.
Davidson D. Mechanisms of reorganization and cell repopulation in meristems in roots
of Vicia faba following irradiation and colchicine // Chromosoma, 1961. 12: 484-504.
Davidson E.H. Gene Activity in Early Development. New York: Acad. Press, 1986:
1-670.
Davidson E.H. Molecular biology of embryonic development: how far have we come
in the last ten years? // Bioessays, 1994. 16(9): 603-615.
Davis G.L. Systematic Embryology of the Angiosperms. New York a.o.: John Wiley
a. Sons. 1966: 1-528.
Day A., Ellis T.H.N. Chloroplast DNA deletions associated with wheat plants
regenerated from pollen: possible basis for maternal inheritance of chloroplasts // Cell
(Cambridge), 1984. 39: 359-368.
Deb D.B. The phenomen of tri- and schizocotyly in Nicotiana tabacum L. // Sci.
Cult., 1955. 21(6): 329-330.
De Greef J.A., Frederico H. Photomorphogenesis and hormones // Enc. Plant
Physiol. New Ser., 1983. 16A: 401-427.
De la Torre C, Clowes F.A.L. Timing of nucleolar activity in meristems // J. Cell.
Biol., 1972. 11: 713-721.
Dembele B. Contribution a l'Etude de la biologie de deux Scrophulariacees tropicales:
S.hermonthica (Del.) Benth. et S.gesnerioides (Willd.) Vatke. Diplome d'Agronomie
Tropicale, C.N.E.A.R.C. 1985: 1-40.
Dembele В., Salle G. Recherches sur les methodes de lutte contre le Striga au Mali
// 14е Conference du COLUMA, Versailles, 3. 1990: 371-377.
Dengler N.G., Sanchez-Burgos A.A. Effect of light level on the expression of
anisophylly in Paradrymonia ciliosa (Gesneriaceae) // Bot. Gaz., 1988. 149: 158-165.
Derksen J., Rutten Т., Amstel T.van, Win A.de, Doris F., Steer M. Regulation of
pollen tube growth // Acta Bot. Neerl., 1995. 44: 93-119.
Deschamps R. L'embryon du Lin, Linum usitatissimum L., etude au microspore
electronique // Rev. Cytol. Biol. Veg., 1968. 31: 357-360.
Deschamps R. Premier stades du developpement de l'embryon et de l'albumen du Lin:
Etude au microscope Electronique // Rev. Cytol. Biol. Veg., 1969. 32(3/4): 379-390.
Devreux M., Scarascia Mignozza G.T. Effects of gamma radiation on the gametes,
zygote and proembryo in Nicotiana tabacum L. // Radiat. Bot., 1964. 4: 373-386.
Diboll A.G. Electron microscopy of female gametophyte and early embryo development
in Zea mays. Doct. diss. Univ. Texas, 1964.
Diboll A.G. Fine structural development of the megagametophyte of Zea mays
following fertilization // Amer. J. Bot., 1968. 55(7): 797-806.
Dickinson H.G. Organelle selection during flowering plant gametogenesis // The
Chondriome — Chloroplast and Mitochondrial Genomes. /Eds. Mantell S.H., Chapman
G.P., Street P.F.S; London: Longman, 1986: 37-60.
Dickinson H.G. Self-incompatibility in flowering plants // Bioessays, 1990. 12(4):
155-161.
Dickinson H.G., Lewis D. Cytochemical and ultrastructural differences between
intraspecific compatible and incompatible pollinations in Raphanus // Proc. Roy. Soc.
London. Ser. В., Biol. Sci., 1973. 183: 21-38.
;744
Семя
Diels L. Menispermaceae // Das Pflanzenreich / Ed. Engler A. Leipzig: Engelmann,
1910. 4.
Di Fulvio Т.Е. La embriologia en la sistematica de angiospermas // Kurtziana, 1981.
14: 21-39.
Di Fulvio Т.Е. Los «tipos» de endosperma у de haustorios endospermicos. Su
clasificacion // Kurtziana, 1983. 16(1-4): 7-31.
Di Fulvio Т.Е. El sistema EODP en el ordenamiento de Tubiflorae у en la
endospermogenesis nuclear // Anales Acad. Nac. Cj. Exact., Buenos Aires, 1985.
37(1-4): 111-119.
Di Fulvio Т.Е., Cocucci A.E. La endospermogenesis nuclear у el sistema EODP
// Kurtziana, 1986. 18: 13-21.
Dixit S.N. Morphological and embryological studies in the family Loranthaceae. IV.
Amyema Van Tiegh. // Phytomorphology, 1958. 8(3-4): 346-364.
Dolan L., Duckett СМ., Grierson C, Linstead P., Schneider K., Lawson E., Dean
C, Poethig S., Roberts K. Clonal origin and patterning in the root epidermis of
Arabidopsis // Development, 1994. 120: 2465-2474.
Dolan L., Janmaat K., Willemsen V., Linstead P., Poethig S., Roberts K.,
Scheres B. Cellular organization of the Arabidopsis thaliana root // Development, 1993.
119: 71-84.
Dolfini S.F., Sparvoli F. Cytological characterization of the embryo-lethal mutant
dek-1 of maize // Protoplasma, 1988. 144: 142-148.
Doll W. Beitrage zur Dipsaceen und Dipsaceen-anlicher Pflanzen // Bot. Arch.,
1927. 17: 107-146.
Donoghue M.J. Phylogenies and the analysis of evolutionary sequences, with examples
from seed plants // Evolution, 1989. 43: 1137-1156.
Donoghue M.J., Doyle J.A. Phylogenetic analysis of angiosperms and the relationships
of Hamamelideae // Evolution, Systematics and Fossil History of the Hamamalideae /
Eds. Crane P.R., Blackmore S. Oxford: Clarendon. 1989. 1: 17-45.
Donoghue M.J., Scheiner S.M. The evolution of endosperm: a phylogenetic account//
Ecology and Evolution of Plant Reproduction / Ed. Wyatt R.E. New York: Chapman
and Hall. 1992: 356-389.
Dop P. Recherches sur le developpement et la nutrition du sac embryonnaire et de
l'endosperme des Buddleja // Bull. Soc. Bot. France, 1913. 60: 9-16, 45-50, 92-98.
Doyle J.A., Donoghue M.J. Seed plant phylogeny and the origin of angiosperms: an
experimental cladistic approach // Bot. Rev. (Lancaster), 1986. 52: 321-431.
Doyle J.A., Donoghue M.J. Fossils and seed plant phylogenies reanalyzed //
Brittonia, 1992. 44: 89-106.
Doyle J.A., Donoghue M.J. Phylogenies and angiosperm diversification // Paleobiology,
1993. 19: 141-167.
Doyle J.A., Donoghue M.J., Zimmer E.A. Integration of morphological and ribosomal
RNA data on the origin of angiosperms // Ann. Missouri Bot. Gard., 1994. 81:
419-450.
Dresselhaus Т., Fuchs S., Heuer S., Kranz E., Lorz H. Gene isolation from egg cells
and in vitro produced zygotes of maize // Abstr. 14th Int. Congr. Sex. Plant Reprod.
«Plant Reproduction'96», February 18-23, 1996, Lome, Australia. 1996: 12.
Dresselhaus Т., Kranz E., Lorz H. Isolation and characterization of zygote-specific
genes from maize (Zea mays L.) // Abstr. XII Int. Congr. Sex. Plant Reprod. «Plant
reproductive biology. Pollen, ovules and seed». July 19-23, 1992. Columbus, Ohio,
USA. 1992: 14.
Литература
745
Dressier R.L. The Orchids: Natural History and Classification. Cambridge etc.:
Harvard Univ. Press. 1981: 1-332.
Drozdowicz J.M., Jones R.L. Hormonal regulation of organic and phosphoric acid
release by barley aleurone layers and scutella // Plant Physiol. 1995. 108: 769-776.
Duchartre P. Sur les embryons dits polycotyles // Ann. Sci. Nat., Bot., 1848. ser.3,
X: 207.
Duckett СМ., Oparka K.J., Prior D.A.M., Dolan L., Roberts K. Dye -coupling in
the root epidermis of Arabidopsis is progressively reduced during development //
Development, 1994. 120: 3247-3255.
Dulberger R. Structural dimorphism of stigmatic papillae in distylous Linum species
// Amer. J. Bot., 1974. 61: 238-243.
Dulberger R. Intermorph structural differences between stigmatic papillae and pollen
grains in relation to incompatibility in Plumbaginaceae // Proc. Roy. Soc. London. Ser.
В., Biol. Sci., 1975. 188: 257-274.
Dumas C, Knox R.B. Callose and determination of pistil viability and incompatibility
// Theor. Appl. Genet., 1983. 67(1): 1-10.
Dumas C, Knox R.B., Gaude T. The spatial association of the sperm cells and
vegetative nucleus in the pollen grain of Brassica // Protoplasma, 1985. 124(3): 168-
174.
Dumas C, Knox R.B., McConchie C.A., Russell S.D. Emerging physiological
concepts in fertilization // What's New Plant Physiol., 1984, 15: 17-20.
Dumas C, Mogensen H.L. Gametes and fertilization: maize as a model system for
experimental embryogenesis in flowering plants // Plant Cell, 1993. 5: 1337-1348.
Dupuis I., Roeckel P., Mathys-Rochon E., Dumas С Procedure to isolate viable
sperm cells from corn (Zea mays L.) pollen grains // Plant Physiol., 1987. 85(4):
876-878.
Dure L. III. Cross nutritional contributions of maize endosperm and scutellum to
germination and growth of axis // Plant Physiol., 1960. 35(6): 919-925.
Dure L. III. Seed formation // Ann. Rev. Plant Physiol., 1975. 26: 259-278.
Dure L. Ill, Chlan С Developmental biochemistry of cotton-seed embryogenesis and
germination. XII Purification and prooerties of principal storage proteins // Plant
Physiol., 1981. 68: 180-186.
Dure L. Ill, Galau G.A. Developmental biochemistry of cotton-seed embryogenesis
and germination: XIII Regulation of biosynthesis of principal storage proteins // Plant
Physiol., 1981. 68: 187-194.
Dure L. Ill, Greenway S.C., Galau G.A. Developmental biochemistry of cottonseed
embryogenesis and germination: changing messenger ribonucleic acid population as shown
by in vitro and in vivo protein synthesis // Biochemistry, 1981. 20: 4162-4168.
Dure L. Ill, Crouch M., Harada J., Ho T.-H.D., Mundy J., Quatrano R.S., Thomas
Т., Sung L.R. Common amino acid sequence domains among the LEA proteins // Plant
Molec. Biol., 1989. 12(5): 475-486.
Dure L. Ill, Pyle J.В., Chlan C.A., Baker J.C, Galau G.A. Developmental
biochemistry of cottonseed embryogenesis and germination: developmental expression of
genes for the principal storage protein // Plant Molec. Biol., 1983. 2: 199-206.
Dute R.R., Peterson CM. Early endosperm development in ovules of soybean,
Glycine max (L.) Merr. (Fabaceae) // Ann. Bot. (London), 1992. 69(3): 263-271.
Dutt B.S.M. Amaryllidaceae // Bull. Indian Natl. Sci. Acad., 1970a. 41: 365-367.
Dutt B.S.M. Embryology of Pancratium longiflorum // Phytomorphology, 1970b.
20(1): 1-5.
746
Семя
Dutt B.S.M. Embryo development in Moringa concanensis Nimno // Curr. Sci.,
1978. 47(18): 693.
Eames A.J. Morphology of the Angiosperms. New York — Toronto — London:
Mc-Grawhill, 1961: 1-518.
Earle T.T. Embryology of certain Ranales // Bot. Gaz., 1938. 100(2): 257-275.
Earp D.J., Lowe В., Baker B. Amplification of genomic sequences flanking transposable
elements in host and heterologous plants: A tool for transposon tagging and genome
characterization // Nucl. Acids Res., 1990. 18: 3271-3279.
East E.M., Mangelsdorf A. A new interpretation of the hereditary behaviour of
self-sterile plants // Proc. Natl. Acad. Sci. USA, 1925. 11: 1174-1175.
Eisenberg A.J., Mascarenhas J.P. Abscisic acid and the regulation of synthesis of
specific seed proteins and their messenger RNAs during culture of soybean embryos
// Planta, 1985. 166(4): 505-514..
Ekambaram Т., Panije R.R. Contribution to our knowledge of Balanophora. II. Life-
history of B.dioica // Proc. Indian Acad. Sci., 1935. 1: 522-543.
Embryology of Angiosperms. / Ed. B.M. Johri. Berlin a.o.: Springer-Verlag, 1984:
1- 602.
Engelen F.A.von, Sterk P., Booij H., Cordewener J.H.G., Rook W., Kammen
Ab.van, Vries S.C.de. Heterogeneity and cell typespecific localization of a cell wall
glycoprotein from carrot suspension cells // Plant. Physiol., 1991. 96: 705-711.
Engler A. Proteaceae// Die naturlichen Pflanzenfamilien /Eds. Engler A., Prantl K.
Leipzig. 1889. 3(1): 1-289.
Engler A. Introduction to Angiosperms // Die naturlichen Pflanzenfamilien. Second
edition /Eds. Engler A., Prantl K. Leipzig: 1926.
Enzenberg U. Beitrage zur Karyologie des Endosperms // Osterr. Bot. Z., 1961.
108(3): 245-285.
Erbrich P. Uber Endopolyploidie und Kernstrukturen in Endospermhaustorien //
Osterr. Bot. Z., 1965. 112(3): 197-262.
Erdelska O. Reaction of flax embryos to excision // Biologia (Bratislava), 1978. 33:
17-24.
Erdelska O. Die zweierlei Funktionen des Griffels der Campanulaceen // Ziva, 1978.
26: 88-89.
Erdelska O. Embryologia krytosemennych rastlin. Bratislava: Veda, 1981a: 1-199.
Erdelska O. Dynamics of early embryo development in reference to endosperm and
embryo types in angiosperm // Acta Soc. Bot. Polon., 1981b, 50(1-2): 269-272.
Erdelska O. Microcinematographical investigation of the female gametophyte, fertilization
and endosperm development // Proc. 7th Int. Symp. «Fertilization and Embryogenesis in
Ovulated Plants», High Tatra (Rackova dolina), Czechoslovakia, 1982. Bratislava, 1983:
49-54.
Erdelska O. Some structural features of the embryo/endosperm interaction in
angiosperms // Sexual Reproduction in Seed, Plants, Ferns, and Mosses. /Eds.
Willemse M.T.M., Went J.L.van Wageningen: PUDOC, 1984: 168-170.
Erdelska O. Embryo development in vitro // Experimental Morphogenesis and
Integration of Plants. / Eds. Sebanek J., Sladky Z., Prochazka S. Praha: Academia,
1991: 336-344.
Erdelska O., and Inst. Wiss. Film. Jasione montana (Campanulaceae) — Entwicklung
des Endosperm. Film E 1751 des IWF. Gottingen: Publication von O.Erdelska, 1971:
1-10.
Литература
747
Erdelska O., and Inst. Wiss. Film. Befruchtung und friihe Entwicklung von Embryo
and Endosperm beim Schneeglockchen. Film С 1463 des IWF. Gottingen: Publ. von
O.Erdelska, Publ. Wiss. Film, Sekt. Biol Ser. 17,20/C 1463, 1982: 15.
Erdelska O., Klasova A. La region micropylaire du sac embryonnaire de Jasione
montana L. avant et apres la fecondation // Soc. Bot. France. Actual, botan., 1978. 1-2:
249-252.
Erdelska O., Kobetieova D., Pretova A. The development of excised flax embryos in
vitro (in Slovak) // Biologia (Bratislava), 1973. 28: 235-239.
Erdtman G., Straka H. Cormophyte spore classification. An outline based on the
apertures (tremata) // Forh. Geol. Foren. Stockholm, 1961. 83(1): 65-78.
Erickson L., Kemble R. Paternal inheritance of mitochondria in rapeseed (Brassica
napus)// Molec.Gen.Genet., 1990. 222: 135-139.
Erickson L., Kemble R., Swanson E. The Brassica mitochondrial plasmid can be
sexually transmitted. Pollen transfer of a cytoplasmic genetic element // Molec. Gen.
Genet., 1989. 218: 419-422.
Ernst A., Schmid E. Ueber Blute und Frucht von Rafflesia // Ann. Jard. Bot.
Buitenzorg, 1913. 2(12): 1-58.
Errampalli D., Patton D., Castle L., Mickelson L., Hansen K., Schnall J.,
Feldmann K., Meinke D. Embryonic lethals and T-DNA insertional mutagenesis in
Arabidopsis // Plant Cell, 1991. 3: 149-157.
Esau K. Plant Anatomy. New York.: J. Wiley and Sons, 1965.
Esau K. Anatomy of Seed Plants. New York.: J. Wiley and Sons, 1977: 1-550.
Esen A., Stetler D.A. Immunocytochemical localization of d-zein in the protein bodies
of maize endosperm cells // Amer. J. Bot., 1992. 79(3): 243-248.
Eunus A.M. .Contributions to the embryology of Liliaceae. 3. Embryogeny and
development of the seed of Asphodelus tenuifolius Cav. // Lloydia., 1952. 15(3):
149-155.
Evans D.A., Sherp W.R., Flick C.E. Growth and behaviour of cell cultures.
Embryogenesis and organogenesis //Proceedings of UNESCO Symposium, San Paulo,
Brazil, 1978. «Plant Tissue Culture: Methods and Applications in Agriculture» / Ed.
T.A. Thorpe. New York: Acad. Press, 1981. 45-113.
Evans T.C., Crittenden S.L., Kodoyianni V., Kimble J. // Cell (Cambridge), 1994.
77: 183-194.
Ezaki В., Toko K., Yamafuji K., Irie F. Electric potential patterns around a root of
the higher plant // Trans. Inst. Electron., Inf. Commun. Eng., E., 1988. 71(10):
965-967.
Facques-Felix H. Les Monocotyledones n'ont pas de cotyledon // Adansonia, 1982.
(1-2): 3-40.
Fagerlind F. Bau der floralen Organe bei der Gattung Langsdorffia // Svensk Bot.
Tidskr., 1945a. 39(2): 197-210.
Fagerlind F. Blute und Blutenstand der Gattung Balanophora // Bot. Not., 1945b.
39: 330-350.
Fagerlind F. Sporogenesis, Embryosackentwicklung und pseudogame Samenbildung bei
Rudbeckia laciniata // Acta Horti. Berg., 1946. 14(3): 39-90.
Fahn A. Plant Anatomy. Oxford: Pergamon Press. 1990.
Fahn A., Cutler D.F. Xerophytes. Berlin — Stuttgart. 1992: 1-176.
Fahn A., Werker E. Anatomical mechanisms of seed dispersal // Seed Biology / Ed.
Kozlowski T.T. New York: Acad, press. 1972: 151-221.
748
Семя
I
Fairbanks D.J., Smith S.E., Brown J.K. Inheritance of large mitochondrial RNAs in
alfalfa // Theor. Appl. Genet., 1988. 76: 619-622.
Farrell M.E. Ovary and embryo of Cyrtanthus sanguineus // Bot. Gaz., 1914. 57(5):
428-436.
Faure J.-E., Mogensen H.L., Dumas Ch., Lorz H., Kranz E. Caryogamy after
electrofusion of single egg and sperm cell protoplasts from maize: cytological evidence and
time course // Plant Cell, 1993. 5: 747-755.
Faure J.-E., Digonnet C, Dumas C. An in vitro system for adhesion and fusion of
maize gametes // Science, 1994a. 263: 1598-1600.
Faure S., Noyer J.L., Carreel F., Horry J.P., Lanaud C. Maternal inheritance of
chloroplast genome and paternal inheritance of mitochondrial genome in bananas (Musa
acuminata) // Curr. Genet., 1994b. 25: 265-269.
Favre-Duchartre M. General view over plant proembryos // Some aspects and actual
orientations in plant embryology. Dedicatory Volume to prof. A. Lebegue. Univ. Picardie.
Amiens, Cedex, France 1989: 167-180.
Feldman L.J. The de novo origin of the quiescent centre in regenerating apices of Zea
mays // Planta, 1976. 128: 207-212.
Feldman L.J., Torrey J.G. The quiescent centre and primary vascular tissue pattern
formation in cultured roots of Zea // Canad. J. Bot., 1975. 23: 2796-2803.
Feldmann K.A. T-DNA insertion mutagenesis in Arabidopsis: 1. Mutational spectrum
// Plant Journal, 1991. 1: 71-82.
Feldmann K.A., Marks M.D., Christianson M.L., Quatrano R.S. A dwarf mutant of
Arabidopsis generated by T-DNA insertion mutagenesis // Science, 1989. 243: 1351-
1354.
Felker F.C., Peterson D.M., Nelson O.E. Development of tannin vacuoles in chalaza
and seed coat of barley in relation to early chalazal necrosis in the segl mutant // Planta,
1984. 161: 540-549.
Felker F.C., Peterson D.M., Nelson O.E. Early grain development of the seg2
maternal-effect shrunken endosperm mutant of barley // Canad. J. Bot, 1987. 65:
943-948.
Ferguson M.C. The development of the egg and fertilization in Pinus strobus // Ann.
Bot. (London), 1901. 9: 435-479.
Fernandez D.E., Bisgrove S.P. Accumulation of mRNAs during embryo maturation
and precocious germination in Brassica napus // Abstr. XII Int. Congr. Sex. Plant
Reprod. «Plant Reproductive Biology. Pollen, Ovules and Seeds». Ohio, July 19-23,
1992. 1992: 19.
Fernandez D.E., Turner F.R., Crouch M.L. In situ localization of storage protein
mRNAs in developing meristems of Brassica napus embryos // Development, 1991. Ill:
299-313.
Fienberg A.A., Choi J.H., Lubich W.P., Sung Z.R. Developmental regulation of
polyamine metabolism in growth and differentiation of carrot culture // Planta, 1984.
162: 532-539.
Fincher G.B. Molecular and cellular biology associated with endosperm mobilization in
germinating cereals grains // Ann. Rev. Plant Physiol. Plant Molec. Biol., 1989. 40:
305-346.
Fineran B.A., Wild D.J.C., Ingerfeld M. Initial wall formation in the endosperm of
wheat, Triticum aestivum: a reevaluation // Canad. J. Bot, 1982. 60(9): 1776-1795.
Finkelstein R., Estelle M., Martinez-Zapater J., Somerville C. Arabidopsis as a tool
for the identification of genes involved in plant development // Temporal and Spatial
Литература 749
Regulation of Plant Genes. / Eds. Verma D.P.S., Goldberg R.B. New York: Springer-
Verlag, 1988: 1-25.
Finkelstein R.R, Crouch M.L. Precociously germinating rapeseed embryos retain
characteristics of embryogeny // Planta, 1984. 162: 125.
Finn W. Male cells in angiosperms // Bot.Gaz., 1925. 80(1): 1-25.
Finn W. Spermazellen bei Vincetoxicum nigrum und V. officinale // Ber. Deutsch.
Bot. Ges., 1926. 44(2): 133-137.
Finn W. Zur Geschichte der Entdekkung der doppelten Befruchtung // Ber. Deutsch.
Bot. Ges., 1931, 49(3): 153-157.
Fisher D.B., Jensen W.A. Cotton embryogenesis: the identification as nuclei of the
x-bodies in the degenerated synergid // Planta, 1969. 84: 122-133.
Fisher D.B., Jensen W.A. Nuclear and cytoplasmic DNA synthesis in cotton embryos:
A correlated light and electron microscope autoradiographic study // Histochemie, 1972
32: 1-22.
Fisher G.C. Seed development in the genus Peperomia // Bull. Torrey Bot. Club
1914. 41: 137-156.
Flahault M.Ch. Sur la presence de la matiere verte dans les organes actuellement
soustraits a l'influence de la lumiere // Bull. Soc. Bot. France, 1879. 26: 249-255.
Fleischer E. Beitrage zur Embryologie der Monocotylen. Flora. 1874. 57: 369-448.
Fletcher J.J. Illustrations of Polycotyledony in the genus Persoonia with some reference
to Nuytsia // Proc. Linn. Soc. New South Wales, 1909. 33: 867.
Focke W.O. Die Pflanzen-Mischlinge. Ein Beitrag zur Biologie der Gewachse. Berlin:
Verl. von Gebr. Borntraeger. 1881: 1-570.
Forino L.M.C., Tagliasacchi A.M., Cavallini A., Cionini G., Giraldi E., Cionini P.G.
RNA synthesis in the embryo suspensor of Phaseolus coccineus at two stages of
embryogenesis, and the effect of supplied gibberellic acid // Protoplasma, 1992. 167-
152-158.
Foster A.S. Practical Plant Anatomy. New York: Van Nostrand, 1949: 1-155.
Foster A.S., Gifford E.M.Jr. Comparative Morphology of Vascular plants. San
Francisco: Freeman, 1974.
Franke W.W., Herth W., Van der Wonde W.J., Morr D.J. Tubular and filamentous
structures in pollen tubes: possible involvement as guide elements in protoplasmic streaming
and vectorial migration of secretory vesicles // Planta, 1972. 105(4): 317-341.
Franssen-Verheijen M.A.W., Willemse M.T.M. The ovule of Gasteria verrucosa at
receptivity of the stigma: an ultrastructural study // Acta Bot. Neerl., 1990. 39: 53-63.
Franz G., Hatzopoulos P., Jones T.S., Krauss M., Sung R.Z. Molecular and genetic
analysis of an embryonic gene, DC8, from Daucus carota L. .// Molec. Gen. Genet.,
1989. 218: 143-151.
Franzmann L., Patton D.A., Meinke D.W. In vitro morphogenesis of arrested embryos
from lethal mutants of Arabidopsis thaliana // Theor. Appl. Genet., 1989. 77: 609-616.
Fraser L. An investigation of Lobelia gibbosa and L.dentata. 1. Mycorrhiza, latex
system and general biology // Proc. Linn. Soc. London, 1931. 56: 497-525.
Friedman W.E. Double fertilization in Ephedra, a nonflowering seed plant: its bearing
on the origin of angiosperms // Science, 1990a. 247: 951-954.
Friedman W.E. Sexual reproduction in Ephedra nevadens (Ephedraceae): further
evidence of double fertilization in a nonflowering seed plant // Amer. J. Bot., 1990b
77: 1582-1598.
750
Семя
Friedman W.E. Double fertilization in Ephedra trifurca, a non-flowering seed plant:
the relationship between fertilization events and the cell cycle // Protoplasma, 1991. 165:
106-120.
Friedman W.E. Double fertilization in nonflowering seed plants and its relevance to
the origin of flowering plants // Int. Rev. Cytol., 1992a. 140: 319-355.
Friedman W.E. Evidence of a pre-angiosperm origin of endosperm: implications for
the evolution of flowering plants // Science, 1992b. 255: 336-339.
Friedman W.E. The evolution of embryogeny in seed plants and the developmental
origin and early history of endosperm // Amer. J. Bot., 1994. 81(11): 1468-1486.
Friedman W.E. Organismal duplication, inclusive fitness theory, and altruism:
understanding the evolution of endosperm and the angiosperm reproductive syndrome // Proc.
Natl. Acad. Sci. USA, 1995. 92: 3913-3917.
Frisendahl A. Cytologische und entwicklunggeschichtliche Studien iiber Myricaria
germanica Desv. // Kongl. Svehska Vetenskapsakad. Handl. N. S., 1912. 48(7): 1-62.
Fry S.C., Wangermann E. Polar transport of auxin through embryos // New Phytol.,
1976. 77(2): 313-317.
Frye T.C. A morphological study of certain Asclepiadaceae // Bot. Gaz., 1902. 34:
389-413.
Gaertner K.F. De fructibus et seminibus plantarum. Leipzig, 1805-1807. 3: 1-256.
Gain E. Sur la tricotylie et l'anatomie des plantules de Phaseolus tricotyles // Rev.
Gen. Bot., 1900. 12: 1-369.
Galau G.A., Bijaisoradot P., Hughes D.W. Accumulation kinetics of cotton late
embryogenesis abundance (Lea) mRNAs and storage protein mRNAs: coordinate
regulation during embryogenesis and the role of abscisic acid // Developm. Biol., 1987.
123: 198-212.
Galau G.A., Hughes D.W. Coordinate accumulation of homologous transcripts of sum
cotton Lea gene families during embryogenesis and germination // Developm. Biol.,
1987. 213: 213-221.
Galau G.A., Hughes D.W., Dure L. III. Abscisic acid induction of cloned cotton late
embryogenesis-abundant (Lea) mRNAs // Plant Molec. Biol., 1986. 7: 155-170.
Garcia Martinez J.L., Sponsel V.M., Gaskin P. Gibberellins in developing fruits of
Pisum sativum cv.Alaska: studies on their role in pod growth and seed development
// Planta, 1987. 170(1): 130-137.
Gartner P.-J., Nagl W. Acid phosphatase activity in plastids (plastolysomes) of
senescing embryo-suspensor cells // Planta, 1980. 149: 341-349.
Gaskin P., Gilmour S.J., Mac Millan J., Sponsel V.M. Gibberellins in immature seeds
and dark-grown shoots of Pisum sativum // Planta, 1985. 163(2): 283-289.
Gatin C.L. Recherches anatomiques et chimiques sur la germination des palmiers // Ann.
Sci. Nat.,Bot.,1906. 3:191-314.
Gavandan P., Debraux G., Bonnenfaut A. La gamocotylie experementale // C.R. Torr.
Lab. Biol. Ved. Fac. Sci., Poitiers, 1953. 4.
Geitler L. Beobachtungen die erste Teilung in Pollenkorn der Angiospermen // Planta,
1935. 24(3): 361-386.
Geitler L. Notizen zur endomitotischen Polyploidisierung in Trichocyten und Elaiosomen
sowie tiber Kernstrukturen bei Gagea lutea // Chromosoma, 1948. 3: 271-281.
Geltz N.R., Russell S.D. Two-dimensional electrophoretic studies of the proteins and
polypeptides in mature pollen grains and the male germ unit of Plumbago zeylanica // Plant
Physiol.,1988. 88:764-769.
Литература
751
Gerassimova H.N. Fertilization in Crepis capillaris // Cellule, 1933. 42(1): 103-
148.
Gerassimova-Navashina H.N. On some cytological principles underling double fertilization
// Phytomorphology, 1958. 7(2): 150-167.
Gerassimova-Navashina H. A contribution to the cytology of fertilization in flowering
plants // Nucleus, 1960. 3(1): 111-120.
Gerassimova-Navashina H. Some cytological aspects of double fertilization // Rev.
Cytol. Biol. Veg., 1969a. 32(3-4): 301-308.
Gerassimova-Navashina H. Influence of low temperature on the process of fertilization
in Crepis capillaris // Phytomorphology, 1969b. 19(1).
Gerassimova-Navashina H. Process of double fertilization in angiosperms and mitotic
cycle of the cell // Phytomorphology, 1982. 32(1-3): 222-233.
Gerlach-Cruse D. Experimentelle Auslosung von Semigamie bei Arabidopsis thaliana
(L.) Heynh. // Biol. Zentralbl, 1970. 89: 435-456.
Ghosh S., Shivanna K.R. Anatomical and cytochemical studies of the stigma and style
in some legumes // Bot. Gaz., 1982. 143(3): 311-318.
Gibbs L.S. Notes on the development and structure of the seed in the Alsinoideae
// Ann. Bot. (London), 1907. 21(31): 25-55.
Gibelli G., Ferrero F. Ricerche di anatomia e morphologia intorno alio sviluppo e des
seme delle Trapa natans L. // Malpighia, 1891. 5: 1-64.
Gifford E.M., Corson G.E.Jr. The shoot apex in seed plants // Bot. Rev., 1971.
37(2): 143-229.
Gifford E.M., Foster A.S. Comparative Morphology of Vascular Plants. San
Francisco: Freeman W.H.. 1989.
Gilg E. Dipterocarpaceae // Die naturlichen Pflanzenfamilien. 2. Aufl. / Ed. Engler
A. Leipzig. 1925. 21: 237-269.
Gillham N.M. Organelle genes and genomes. New York: Oxford Univ. Press, 1994.
Gillot I., Whitaker M. Imaging calcium waves in eggs and embryos // J. Exp. Biol.,
1993. 184: 213-219.
Giuliano G., Lo Schiavo F., Terzi M. Isolation and developmental characterization of
temperature-sensitive carrot cell variants // Theor. Appl. Genet., 1984. 67: 179-183.
Clisii L.M. Ein Versuch der Verwertung der Endospermmerkmale fur typologische und
phylogenetische Zwecke innerhalb der Scrophulariaceen // Bull. Inst. Jard. Bot. Univ.
Belgrade, 1936.4: 42-73.
Godineau J.C. Ultrastructure du sac embryonnaire de Crepis tectorum L.: etat apres
la cellularisation et la fusion des noyaux polaires // Ann. Univ. A.R.E.R.S, 1996. 9(1):
78-88.
Goebel K. Uber Regeneration im Pflanzenreich // Biol. Zentralbl., 1902. 22(13):
385-505.
Goebel K. Organographie der Pflanzen, insbesondere der Archegoniaten und
Samenpflanzen. Jena: G. Fischer, 1923: 1-581.
Coebel K. Organographie der Pflanzen. Ill, I. Samenpflanzen. Jena: G. Fischer, 1932:
1379-1820.
Goldberg B. Life history of Peltandra virginica // Bot. Gaz., 1941. 102: 641-662.
Goldberg R.B., Barker S.J., Peres-Grau L. Regulation of gene expression during plant
embryogenesis // Cell (Cambridge), 1989. 56: 149-160.
Goldberg R.B., Beals T.P., Sanders P.M. Anther development; basic principles and
practical applications // Plant Cell, 1993. 5: 1217-1229.
752
Семя
Goldberg R.B., Paiva G.de, Yadegari R. Plant embryogenesis: zygote to seed
// Science, 1994. 266(5185): 605-614.
Goldschmidt R. Physiological Genetics. New York, 1938: 1-247.
Goldsworthy A. The electric compass of plant // New Sci., 1986. 109(1489): 22-23.
Goldsworthy A., Rathore K.S. The electrical control of growth in plant tissue cultures:
the polar transport of auxin // J. Exp. Bot., 1985. 36(168): 1134-1141.
Gomez J., Sanchez-Martinez D., Stiefel V., Rigau J., Puigdomenech P., Pagest M.
A gene induced by the plant hormone abscisic acid in response to water stress encodes a
glycinerich protein // Nature, 1988. 334(21): 262-264.
Goodner В., Quatrano R.S. Fucus embryogenesis: a model to study the establishment
of polarity // Plant Cell, 1993. 5(10): 1471-1481.
Goodwin P.В., Erwee M.G. Hormonal influences on leaf growth // The Growth and
Functioning of Leaves. / Eds. Dale J.E., Milthorpe E.L. Cambridge a. o.: Cambridge
Univ. Press, 1983: 207-232.
Goursat M. Recherches sur l'embryogenie des Papilionacees. These Doct. pharm. Fac.
pharm. Univ. Paris.: 1969: 1-187.
Govindu H.C. Studies in the embryology of some members of the Bignoniaceae
// Proc. Indian Acad. Sci., 1950. 32(4): 164-178.
Graham L.E. Origin of Land Plants. New York: John Wiley and Sons. 1993.
Grant V. Plant Speciation. New York., 1981: 1-528.
Graves A.H. The morphology of Ruppia maritima // Trans.Connecticut Acad. Arts
Sci., 1908. 14(2): 59-170.
Gravis A. Recherches anatomiques et physiologiques sur le Tradescantia virginica L.
Bruxelles, 1898.
Green P.B. Pattern formation in shoots: a likely role for minimal energy configurations
of the tunica // Int. J. Plant Sci., 1992. 153(3): 59-75.
Green P.B., Selker J.M.L. Mutual alignments of cell walls, cellulose and cytoskeleton:
their role in meristems // The Cytoskeletal Basis of Plant Growth and Form / Ed.
Lloyd C.W. London: Acad. Press. 1991: 277-288.
Gressner H. Zur Keimungsgeschichte von Cyclamen // Bot. Zeitung (Berlin), 1874.
32(50): 800-814, (51): 816-825, (52): 830-840.
Groot E.P., Caeseele L.A.van. The development of the aleurone layer in canola
(Brassica napus) // Canad. J. Bot, 1993. 71: 1193-1201.
Grootjen C.J. Development of ovule and seed in Marantaceae // Acta Bot. Neerl.,
1983. 32(1-2): 69-86.
Griibert M. Studies on the distribution of myxospermy among seeds and fruits of
Angiospermae and its ecological importance // Acta Biol. Venezuela, 1974. 8: 315-534.
Gruppy H.B. Irregulatory of some cotyledons // Sci. Gossip., 1895. 171.
Grzelczak Z.F., Rahman S., Kennedy T.D., Lane B.G. Compartmentation of the
protein, its translatable mRNA, and its biosynthesis among roots, stems and leaves of
wheat seedlings // Can. J. Biochem. Cell Biol., 1985. 63(9): 1003-1013.
Gscheidle A. Uber Haustorienbildung in der Gattung Veronica // Flora, 1925.
117(1): 144-172.
Guerin P. Recherches sur le developpement du tegument seminal et du pericarpe des
Graminees // Ann. Sci. Nat., Bot., 1899. 8(9): 1-59.
Guerin P. Developpement de la graine et en particulier du tegument seminal de
quelques Sapindacees // J. Bot. Agric, 1901. 15: 336-362.
Guignard J.L. Recherches sur l'embryogenie des Graminees; rapports des Graminees
avec les autres Monocotyledones // Ann. Sci. Nat., Bot., 1961a. 12(2,3): 491-610.
Литература
15Ъ
Guignard J.L. Embryogenie des Palmiers. Developpement de l'embryon chez le
Chamaerops humilis L. // Compt. Rend. Hebd. Sea. Acad. Sci., 1961b. 253: 1834-1936.
Guignard J.L. Du cotyledon des monocotyledones // Phytomorphology, 1974. 25,
Silver Jub. vol.: 193-200.
Guignard J.L. Du cotyledon des Monocotyledones // Phytomorphology. 1975a.
25(2): 193-220.
Guignard J.L. Embryogenie et classification embryogenique // Bull. Soc. Bot. France,
1975b. 122: 281-294.
Guignard J.L. Le cotyledon des Monocotyledones // Bull. Mus. Hist. Nat. (Paris),
Ser.4., 1984. 1: 19-27.
Guignard J.L., Agier C, Bury M. Developpement de l'embryon zygotique chez
I'Arabidopsis thaliana Schur. // Bull. Soc. Bot. France, 1991. 138, Letters bot.(2):
149-154.
Guignard J.L. Mestre J.C. L'origine du cotyledon et du cone vegetatif chez les
Monocotyledones. // Bull. Soc. Bot. France, 1969. 116: 207-214.
Guignard J.L., Mestre J.C. L'embryon des Graminees // Phytomorphology, 1971.
20(2): 190-197.
Guignard L. Note sur la structure et les functions du suspenseur chez quelques
Legumineuses // Bull. Soc. Bot. France, 1880. 27: 253-257.
Guignard L. Recherches sur le sac embryonnaire des phanerogames angiospermes
// Ann. Sci. Nat., Bot., 1882. 13:
Guignard L. Observation sur les ovules et la fecondation des Cactees // Bull. Soc. Bot.
France, 1886. 33: 276-280.
Guignard L. Recherches sur le developpement de la graine et en particulier du tegument
seminal // J. Bot. Agric, 1893. 7: 1-311.
Guignard L. Sur les antherozoides et la double copulation sexuelle chez les vegetaux
angiosperm // Compt. Rend. Hebd. Sea. Acad. Sci., 1899a. 128: 864-871.
Guignard L. Sur les antherozoides et la double copulation sexuelle chez les vegetaux
angiosperm // Rev. Gen Bot., 1899b. 11: 129-135.
Guignard L. L'appareil sexuel et la double fecondation dans les Tulipes // Ann. Sci.
Nat, Bot., 1900. 11: 365-384.
Guignard L. La double fecondation dans le Mais // J. Bot. Agric, 1901a. 15(2):
37-50.
Guignard L. La double fecondation dans le Najas major // J. Bot. Agric, 1901b.
15(7): 205-213.
Guignard L. La double fecondation chez les Renonculacees // J. Bot. Agric, 1901c
15(12): 394-408.
Guignard L. La double fecondation chez les Solanees // J. Bot. Agric, 1902. 16(5):
145-167.
Guignard L. La fecondation et la polyembryonie chez les Vincetoxicum // Mem.
Acad. Sci. Inst. France, 1922. 57: 1-25.
Guiliano G., Rosselini D., Terzi M.A. A new method for the purification of the
different stages of carrot embryoids // Plant Cell Rep., 1983. 2: 216-218.
Guillaumin M.A. Germinations anormales // Bull. Soc. Bot. France, 1911. 58:
481-488.
Gunell S. Die Entwicklungsgeschichte von Circaeaster agrestis // Svensk Bot. Tidskr.,
1931. 25(2): 238-270.
Gupta S.C. The embryology of Coriandrum sativum L. and Foeniculum vulgare Mill.
// Phytomorphology, 1964. 14(4): 530-547.
48-828
754
Семя
Gupta S.C., Gupta M. Some observation on the embryology of Bupleurum tenue
Buch. Ham ex D.Don // Curr. Sci., 1964. 33(18): 563-564.
Gurdon J.B. The generation of diversity and pattern in animal cells // Cell (Cambridge),
1992. 68: 185-199.
Guttenberg H.von. Embryologische und histogenetische Untersuchungen an Mono-
cotyledonen // Bot. Stud., 1957. 7: 1-161.
Guttenberg H.von. Grtindzuge der Histogenese von hoherer Pflanzen. I. Die Angiospermen.
Handb. Pflanzenanat. Berlin: Gebmder Borntrader, 1960. 8(3): 1-315.
Guttenberg H.von. Der primare Bau der Angiospermenwurzel. Handb. Pflanzenanat.
Berlin: Gebrtider Borntrader, 1968. 9(5).
Guttenberg H.von., Burmeister J., Brosell H.J. Studien liber der Entwicklung der
Wurzelvegetationpunktes der Dikotyledonen // Planta, 1955. 46(2).
Guttenberg H.von., Heydel H.-R., Pankow H. Embryologische Studien an Monokotyle-
donen. I. Die Entstehung der Primarwurzel bei Poa annua // Flora, 1954. 141: 298-311.
Guttenberg H.von., Semlow A. Die Entwicklung des Embryos und des Keimpflanze
von Cyperaceen // Bot. Stud., 1957. 7.
Gutterman Y., Witzum A. The movement of integumentary hairs in Blepharis ciliaris
(L.) Bum // Bot. Gaz., 138: 29-34.
Guzman C.Cde, Fuente R.K. de la. Polar calcium flux in sunflower hypocotyl
segments. I. The effectaof auxin // Plant Physiol., 1984. 76(3): 347-352.
Guzman C.C.de, Fuente R.K. de la. Polar calcium flux in sunflower hypocotyl
segments. 2. The effect of segment orientation, growth and respiration // Plant Physiol.,
1984. 76(3): 347-352;
Guzowska J., Zenkteler M. In vitro development of immature embryos of Cuscuta
lupuliformis Krock. // Bull. Soc. Sci. Lett. Lodz; CL. 3, 1969. 9: 37-38.
Gvaladze G.E. Ultrastructural study of the embryo sac of Galanthus nivalis //Proc.
VII Int. Cytoembr. Symp. «Fertilization and Embryogenesis in Ovulated Plants», High
Tatra (Rackova dolina), 14-17 June, 1982, Czechoslovakia, Bratislava: VEDA, 1983:
203-205.
Haberlandt G. Physiologische Pflanzenanatomie. Leipzig: Verlag von Wilhelm
Engelmann, 1918: 1-650.
Haberlandt G. Die Entwicklungserregung der Eizellen einiger partenogenetischen
Compositen // Sitzungsber. Deutsch. Akad. Wiss., Berlin, 1921.
Haccius B. Verbreitung und Ausbildung der Einkeimblattrigkeit bei den Umbelliferen //
Osterr. Bot. Z., 1952. 99(4): 483- 505.
Haccius B. Histogenetische Untersuchungen an Wurzelhaube und kotyledonarscheide
geophiter keimpflanzen Podophyllum und Eranthis // Planta, 1953a. 41: 439-458.
Haccius B. Embryologische und histogenetische Studien an «monocotylen Dicotyledon».
Bau und Funktion des Keimblatt-Stiels // Ber. Deutsch. Bot. Ges., 1953b. 66: 17-19.
Haccius B. Embryologishe und histogenetische Studien an «monocotylen Dikotylen».
1. Claytonia virginica L. // Osterr. Bot. Z., 1954. 101(3): 285-303.
Haccius B. Schizokotylie und Pleiokotylie bei Delphinium ajacis // Zeitschrift inductive
Abstammungs-und Vererbungslehre, 1955a. 86(4): 498-520.
Haccius B. Versuche zur somatischen Beeinflussung der Organbildung pflanzlicher
Embryonen // Experientia (Basel), 1955b. 11: 194.
Haccius B. Experimentally induced twinning in plants // Nature, 1955c. 176: 355-
357.
Haccius B. Embryologissce und histogenetische Studien an «monocotylen Dicotylen».
2. Pinguicula vulgaris L. und P. alpina L. // Osterr. Bot. Z., 1957. 103(5): 567-587.
Литература 755
Haccius B. Morphoregulatorische Beeinflussung pflanzlicher Embryonen durch Phenylbor-
saure // Naturwiss. Wochensehr., 1959. 46: 153.
Haccius B. Experimentell induzierte Einkeimblflttrigkeit bei Eranthis hiemalis. II.
Monocotylie durch Phenylborsaure // Planta, 1960. 54(5): 482-497.
Haccius B. Restitution in acidity-damaged plant embryos: regeneration or regulation?
// Phytomorphology, 1963. 13: 107-115.
Haccius B. Untersuchungen iiber Somatogenese aus den Syspensorenzellen von Eranthis
hiemalis Embryonen // Planta, 1965. 64: 219-224.
Haccius B. Anomalien der pflanzenlichen Embryogenese nach Einwirkung von 2,4-D,.
TIBA und Morphaktinen, ein Vergleich // Deutsch. Bot.Ges.Neue Folge, 1969. 3-
89-101.
Haccius B. Zur derzeitigen Situation der Angiospermen Embryologie // Bot. Jahrb.
Syst., 1971. 91(2/3): 309-329.
Haccius B. Experimentelle Embryologie der Pflanzen // Forschungsber. Johannes
Gutenberg Univ. Mainz, 1972. 1: 68-73.
Haccius В., Bhandari N.N. Delayed histogen differentiation as a common primitive
character in alt types of nonzygotic embryos // Phytomorphology, 1975. 25(1): 91-94.
Haccius В., Fischer E. Embryologische und histogenetische Studien an «monocotylen
Dicotylen». 3. Anemone apennina L. // Osterr. Bot. Z., 1959. 106(5): 373-389.
Haccius В., Frey G. Anomalien der Pflanzlichen Embryoentwicklung nach Anwendung
von 2,4-D haltigen Herbiziden // Qual. Plant. Mater. Veget., 1965. 12: 349-362.
Haccius В., Hartl-Baude E. Embryologische und histogenetische Studien an
«monokotylen Dikotylen». 2. Pinguicula vulgaris und Pinguicula alpina // Osterr. Bot.
Z., 1957. 103(5): 567-587.
Haccius В., Lakshmanan K. Vergleichende Untersuchungen der Entwicklung von
Kotyledon und Sprosscheitel bei Pistia stratiotes und Lemna gibba, ein Beitrag zum
Problem der sogenanten terminalen Blattorgane // Beitr. Biol. Pflanzen., 1966. 42 (3):
425-443.
Haccius В., Lakshmanan K.K. Experimental studies on monocotyledonous dicotyledons:
phenyl-boric acid — induced «dicotyledonous» embryos in Cyclamen persicum //
Phytomorphology, 1967. 17(1-4): 488-494.
Haccius В., Lakshmanan K.K. Adventiv-Embryonen, Embryoide, Adventiv-Knospen.
Ein Beitrag zur Klarung der Begriffe // Osterr. Bot. Z., 1969. 116: 145-158.
Haccius В., Philip V.J. Embryo development of Cocos nucifera L. // Plant Syst.
Evol., 1979. 132: 91-106.
Haccius В., Reinholz E. Somatisch induzierte Veranderung der Keimblattzahl bei
Eranthis hiemalis durch Rentgen — Stahlen // Naturwiss., 1953. 40: 533.
Haccius В., Schneider W. Untersuchungen zur Stadienspezifitat des teratogenen Effectes
der 2,4-Dichlorphenoxyessigsaure bei Galium aparine // Planta, 1958. 52: 206.
Haccius В., Trompeter G. Experimentell induzierte Einkeimblattrigkeit bei Eranthis
hiemalis. 1. Synkotylie durch 2,4-Dichlorphenoxyessigsaure // Planta, 1960. 54(5):
466-481.
Hacker M., Hartmann K.M., Mohr H. Zellteilung und Zellwachstum im Hypokotyl
von Lactuca sativa L. unter dem Einfluss des Lichtes // Planta, 1964. 63(3): 253-268.
Hagemann R. Plastid distribution and plastid competition in higher plants and the
induction of plastom mutations by nitroso-urea-compounds // Genetics and Biogenesis of
Chloroplasts and Mitochondria. / Eds. Bucher Th., Neuper W., Siebald W., Werner S.
Amsterdam: North Holland, 1976: 331-338.
48*
756
Село*
Hagemann R. Unequal plastid distribution during the development of male gametophyte
of angiosperms // Acta Soc. Bot. Polon., 1981. 50: 321-327.
Hagemann R. The formation of generative and sperm cells without plastids in angiosperms
and the underlying mechanisms // Proc. 7th Int. Symp. «Fertilization and Embryogenesis
in Ovulated Plants», High Tatra (Rackova dolina), 14-17 June, 1982, Czechoslovakia.
Bratislava: VEDA, 1983: 97-99.
Hagemann R., Schroder M-B. The cytological basis of the plastid inheritance in
angiosperms // Protoplasma, 1989. 152: 57-64.
Hagemann W. Zur Entwicklungsgeschichte von Cyclamen persicum Mill. // Beitr.
Biol. Pflanzen, 1959a. 35: 77-94.
Hagemann W. Vergleichende morphologische, anatomische und entwicklungsgeschichtliche
Studien an Cyclamen persicum Mill, sowie einigen weiteren Cyclamen-Arten // Botanishe
Studien /Eds. Troll W., Guttenberg H.von. Jena. 1959b. 9: 1-88.
Hagerup O. On fertilization, polyploidy and haploidy in Orchis maculatus L. //
Dansk. Bot. Ark., 1944. 11(5): 1-26.
Hagerup O. The spontaneous formation of haploid, polyploid, and aneuploid embryos
in some orchids // Det Kgl. Dansk Videns, Selsk., 1947. 20(9): 1-22.
Haines R.W., Lye K.A. Seedlings of Nymphaeaceae // J. Linn. Soc. Bot., 1975. 70:
255-265.
Haines R.W., Lye K.A. Monocotylar seedlings: a review of evidence supporting an
origin by fusion // J. Linn. Soc. Bot., 1979. 78(2): 123-140.
Hakansson A. Zur Zytologie von Celsia und Verbascum // Acta Univ. Lund., 1926.
21(10): 1-47.
Hall E.J., Lajth J.G., Clowes F.A.L. The role of the quiescent centre in the recovery
of Vicia faba roots from irradiation // Radiat. Bot., 1962. 2: 189-194.
Hallam N.D. Embryogenesis and germination in rye (Secale cereale L.). 1. Fine
structure of developing embryo // Planta, 1972. 104(2): 157-166.
Halperin W. Alternative morphogenetic events in cell suspension // Amer. J. Bot.,
1966. 53: 443-453.
Halperin W. Population density effects on embryogenesis in carrot cell cultures //
Exp. Cell Res., 1967. 48(1): 170-173.
Halperin W. Embryos from somatic plant cells // Control Mechanism in the Expression
of Cellular Phenotypes. /Ed. H.A. Padykula (Symp. Int. Soc. Cell Biol.) New York,
London: Acad. Press, 1970. 9(4): 169-191.
Halperin W., Jensen W.A. Ultrastructural changes during growth and embryogenesis
in carrot cell cultures //J. Ultrastruct. Res., 1967. 18: 428-443.
Hamabata A., Garsia M., Romero T. Ph-dependence of p-amilase induction in wheat
aleurone layer // Plant Physiol., 1987. 83(44).
Hamann U. Embryologische, morphologische, anatomische und systematjsche Untersu-
chungen an Philydraceen // Willdenowia, 1966. 4(1): 1-178.
Hamby R.K., Zimmer E.A. Ribosomal RNA as a phylogenetic tool in plant systematics
// Molecular Systematics of Plants / Eds. Soltis P.S., Soltis D.E., Koyle J.J. New
York: Chapman and Hall. 1992: 50-91.
Hanf M. Ke imung von Unkrautern und Kulturpflanzen nach Behandlung des Bodens
mit 2,4-D-Mitteln // Nbl. Dtsch. Pflanzen-Schutzdienst, 1950. 2(6).
Hanstein J. Die Entwicklung des Keimes der Monokotylen und Dikotylen // Bot.
Abh., 1870. 1(1): 1-112.
Hara N. Apical views of vegetative shoot apex // Bot. Mag. Tokyo, 1961. 74:
267-268.
Литература
757
Нага N. Structure of the vegetative shoot apex of Clethra barbinervis. I. Superficial
and transectional views // Bot. Mag. Tokyo, 1971. 84(991): 8-17.
Hara N. Ontogeny of the reproductive shoot apex of Clethra barbinervis, especially on
the superficial view // Bot. Mag. Tokyo, 1977. 90: 89-102.
Hara N. Developmental anatomy of the three-dimensional structure of the vegetative
shoot apex // J. Plant Res., 1995. 108(1089): 115-125.
Harada J.J., Delisle A.J., Baden C.S., Crouch M.L. Unusual sequence of an abscisic
acid-inducible mRNA which accumulates late in Brassica napus seed development //
Plant Molec. Biol., 1989. 12: 395-401.
Hardham A.R. Regulation of polarity in tissue and organs // Cytoskeleton in Plant
Growth and Development / Ed. Lloyd C.W. London: Acad. Press. 1982: 377-403.
Hari V. Effect of cell density changes and conditioned media on carrot cell embryogenesis
// Z. Pflanzenphysiol., 1980. 96: 227-231.
Harkes P.A.A. Organization and activity of the root cap meristem of Avena sativa L
// New Phytol., 1976. 76: 367-375.
Harrington J.F. Seed storage and longevity // Seed Biology, Vol. III. / Ed.
Kozlowski T.T. New York, London: Acad, press., 1972: 145-245.
Harris J.A., Sinnott E.W., Pennypacker J.Y., Durham G.B. The vascular anatomy of
dimerous and trimerous seedlings of Phaseolus vulgaris // Amer. J. Bot., 1921. 8: 63.
Harrison B.J. Factors affecting the frequency of tricotyly in Antirrhinum majus
// Nature, 1964. 201(4317): 424.
Hart J.W., Macdonald I.R. Phototropism and geotropism in hypocotyls of cress
(Lepidium sativum L.) // Plant Cell Environm., 1981. 4(3): 197-201.
Hartog M. Some problems of reproduction // Quart. J. Microscop. Sci., 1904.
N.S.47(188): 583-608.
Hasebe M., Ito M., Kofuji R., Iwatsuki K., Ueda K. Phylogenetic relationships in
Gnetophyta deduced from rbcL gene sequences // Bot. Mag. Tokyo, 1992. 105:
385-391.
Hasebe M., Kato M., Kofuji R., Ito M., Iwatsuki K., Ueda K. Phylogeny of
gymnosperms inferred from rbcL gene sequences // Bot. Mag. Tokyo, 1992. 105:
673-679.
Hasitschka-Jenschke G. Bemerkenswerte Kernstrukturen in Endosperm und im Suspensor
zweier Helobiae // Osterr. Bot. Z., 1959. 106: 301-314.
Haskell G. Changes accompanying selection for pleiocotyly // Heredity, 1949. 3:
382.
Haskell G. Influence of position of truss on pleiocotyly in tomato // Nature, 1954a.
173: 311.
Haskell G. Pleiocotyly and differentiation within angiosperms // Phytomorphology,
1954b. 4: 140-152.
Hatzopoulos P., Franz G., Choy L., Sung R.Z. Interaction of nuclear factors with
upstream sequences of a lipid body membrane protein gene from carrot // Plant Cell,
1990. 2: 457-467.
Haughn G.W., Somerville C.R. Genetic control of morphogenesis in Arabidopsis
// Developm. Genet., 1988. 9: 73-89.
Hause G. Ultrastructural investigations of mature embryo sacs of Daucus carota,
D. aureus and D. muricatus — possible cytological explanations of paternal plastid
inheritance // Sex. Plant Reprod., 1991. 4: 288-292.
Hause G., Schroder M.B. Reproduction in Triticale 2. Karyogamy // Protoplasma,
1987. 1939(2/3): 100-104.
758
Село*
Hayman D.L. The genetical control of incompatibility in Phalaris caerulescens //
Austral. J. Biol. Sci., 1956. 9: 321-331.
Health J.D., Weldon R., Monnot C, Meinke D.W. Analysis of storage proteins in
normal and aborted seeds from embryo-lethal mutants of Arabidopsis thaliana // Planta,
1986. 169: 304-312.
Hegelmaier F. Zur Entwicklungsgeschichte monokotyledoner Keime nebst Bemerkungen
iiber die Bildung der Samendeckel // Bot. Zeitung (Berlin), 1874. 32(39-44): 631-639,
648-656, 657-672, 673-688, 689-699, 705-711.
Hegelmaier F. Gesellschaften // Bot. Zeitung (Berlin), 1875. 33(5): 75.
Hegelmaier F. Vergleichende Untersuchungen fiber Entwicklung dicotyledoner Keime
mit Berucksichtigung der Pseudomonokotyledonen. Stuttgart: E. Schweizerbartische
Verlagshandlung (E. Koch). 1878: 1-211.
Hegelmaier F. Zur Embryogenie und Endospermentwicklung von Lupinus // Bot.
Zeitung (Berlin), 1880. 38(5-9): 65-73, 81-91, 97-104, 121-151.
Hegelmaier F. Untersuchungen fiber die Morphologie des Dicotyledonen-Endosperms//
Nova Acta Leop., 1885. 49(1): 1-104.
Hegelmaier F. Zur Entwicklungsgeschichte endospermatischer Gewebekorper // Bot.
Zeitung (Berlin), 1886. 44: 529-596.
Henslow H. The origin of monocotyledons from dicotyledons through self-adaptation to
a moist or aquatic habit //Ann. Bot. (London), 1911.25: 717-744.
Herr J.M. A new clearing squash technique for the study of ovule development in
angiosperms // Amer. J. Bot., 1961. 58: 785-790.
Herrero M., Arbeloa A. Influence of the pistil on pollen tube kinetics in peach
(Prunus persica) // Amer. J. Bot., 1989. 76(10): 1441-1447.
Herzfeld S. Ephedra campylopoda Mey. Morphologie der weiblichen Blfite und
Befruchtungsvorgang // Denkschr. Kaiserl Akad. Wiss., Math. Naturwiss. Kl., 1922.
98: 243-268.
Heslop-Harrison J. Ribosome site and S-gene action // Nature, 1968. 218: 90-91.
Heslop-Harrison J. Sporopollenin in the biological context // Sporopollenin. / Eds.
Brooks J., Grant P.R., Muir M., P. van Gijzel G., Shaw G. London, 1971: 1-30.
Heslop-Harrison J. Incompatibility and the pollen stigma interaction // Ann. Rev.
Plant Physiol., 1975. 26: 403-425.
Heslop-Harrison J. Genetics and physiology of angiosperms incompatibility systems
// J. Cell Sci., 1978. 202: 73-92.
Heslop-Harrison J. Pollen walls as adaptive systems // Ann. Missouri Bot. Gard.,
1979. 66: 813-829.
Heslop-Harrison J. Aspects of the structure, cytochemistry and germination of the
pollen of rye (Secale cereale L.) // Ann. Bot. (London), 1979. 44: 1-47.
Heslop-Harrison J. Pollen-pistil interaction and cross-incompatibility in grasses //
Science, 1982. 215(4538): 1358-1364.
Heslop-Harrison J. Self-incompatibility: phenomenology and physiology // Proc.
Roy. Soc. London. Ser. В., Biol. Sci., 1983. 218: 371-395.
Heslop-Harrison J. Pollen germination and pollen tube growth // Int. Review of
Cytology. Pollen: Cytology and development. / Eds. Giles K.L., Prakash J. London,
1987:/;l-78.
Heslop-Harrison J., Heslop-Harrison Y. Enzymic removal of the proteinaceous pellicle
of the stigma papilla prevents pollen tube entry in the Caryophyllaceae // Ann. Bot.
(London), 1975. 39: 163-165.
Литература
759
Heslop-Harrison J., Heslop-Harrison Y. The pollen-stigma interaction in the grasses.
2. Pollen tube penetration and the stigma response in Secale // Acta Bot. Neerl., 1981.
30(4): 289-307.
Heslop-Harrison J., Heslop-Harrison Y. The disposition of gamete and vegetative cell
nuclei in the extending pollen tubes of grass species Alopecurus pratensis L. // Acta Bot.
Neerl., 1984. 33(1): 131-134.
Heslop-Harrison J., Heslop-Harrison Y. An analysis of gamete and organelle movement
in the pollen tube of Secale cereale L. // Plant Sci., 1987a. 51: 203-213.
Heslop-Harrison J., Heslop-Harrison Y. The disposition of gamete and vegetative cell
nuclei in the extending pollen tubes of a grass species Alopecurus pratensis L. // Ann.
Bot. (London), 1987b. 60(5): 595-601.
Heslop-Harrison J., Heslop-Harrison Y. Tubulin and male gamete interconnections in
the pollen tube of grass Alopecurus pratensis // Ann. Bot. (London), 1988. 61:
249-254.
Heslop-Harrison J., Heslop-Harrison Y. Myosin associated with the surfaces of
organelles, vegetative nuclei and generative cells in angiosperm pollen grains and tubes
// J. Cell Sci., 1989a. 94: 319-325.
Heslop-Harrison J., Heslop-Harrison Y. Actomyosin and movement of the vegetative
nucleus of the angiosperm pollen tube: association with the actin cytosceleton // J. Cell
Sci., 1989b. 93: 229-308.
Heslop-Harrison J., Heslop-Harrison Y. Actomyosin and movement in the angiosperm
pollen tube: an interaction of some recent results // Sex. Plant Reprod., 1989c. 2:
199-207.
Heslop-Harrison J., Heslop-Harrison Y. Cytochalasin effects on structure and movement
in the pollen tube of Iris // Sex. Plant Reprod., 1989d. 2: 27-37.
Heslop-Harrison J., Heslop-Harrison Y., Barber J. The stigma surface in incompatibility
response // Proc. Roy. Soc. London. Ser. A., 1975. 188: 287-297.
Heslop-Harrison J., Heslop-Harrison Y., Cresti M., Tiezzi A., Moscatelli A.
Cytoskeleton elements, cell shaping and movement in the angiosperm pollen tube // J.
Cell Sci., 1988. 91: 49-60.
Heslop-Harrison J., Heslop-Harrison Y., Knox R.B. The callose rejection reaction: a
new bioessay for incompatibility in Cruciferae and Compositae // Incompat. Newslett.,
1973. 3: 75-76.
Heslop-Harrison Y. The pollen-stigma interaction: pollen tube penetration in Crocus
// Ann. Bot. (London), 1977. 41: 913-922.
Heslop-Harrison Y. Stigma characteristics and angiosperms taxonomy // Nordic J.
Bot., 1981. 1(3): 401-420.
Heslop-Harrison Y., Heslop-Harrison J. Pollen-stigma interaction in the Leguminosae:
The secretory system of the style in Trifolium pratense // Ann. Bot. (London), 1982.
50: 635-645.
Heslop-Harrison Y., Heslop-Harrison J., Reger B.J. The pollen-stigma interaction in
the grasses. 7. Pollen-tube guidance and the regulation of tube number in Zea mays L.
// Acta Bot. Neerl., 1985. 34(2): 193-211.
Heslop-Harrison Y., Reger J. Tissue organisation, pollen receptivity and pollen tube
guidance in normal and mutant stigmas of the grass Pennisetum typhoides (Burm.) Stapf
et Hubb. // Sex. Plant Reprod., 1988. 1: 182-193.
Heslop-Harrison Y., Shivanna K.R. The receptive surface of angiosperm stigma //
Ann. Bot. (London), 1977. 41: 1233-1258.
Hewitt W.C. Seed development of Lobelia amoena // J. Elisha Mitchell. Sci. Soc,
1939. 55: 63-82.
760 Семя ^^^
Hildebrand F. Die Gattung Cyclamen L. (eine systematische und biologische
Monographie). Jena. 1898: 1-190.
Hildebrand F. Die Keimung der Samen Anemone apennina // Ber. Deutsch. Bot.
Ges., 1899. 17: 161-166.
Hill A.W. The morphology and seedling structure of the geophilous species of
Peperomia, together with some views on the origin of monocotyledons // Ann. Bot.
(London), 1906. 20(80):
Hill A.W. The origin of Monocotyledons // Ann. Bot. (London), 1908. 22(88):
713-714.
Hill A.W. The monocotyledons seedling of certain Dicotyledons with special reference
to the Gesneriaceae // Ann. Bot. (London), 1938. II: 127-143.
Hill C.R., Crane P.R. Evolutionary cladistics and the origin of angiosperms //
Problems of Phylogenetic Reconstruction / Eds. Joysey K.A., Friday A.E. New York-
Acad. Press. 1982: 269-361.
Hill H.W. Studies in seed germination. Experiments with Cyclamen // Ann. Bot.
(London), 1920. 34: 417-423.
Hill J.P., Lord E.M. Dinamics of pollen tube growth in the wild radish Raphanus
raphanistrum (Brassicaceae). II. Morphology, cytochemistry and ultrastructure of transmitting
tissues and path of pollen tube growth // Amer. J. Bot., 1987. 74(7): 988-997.
Hill T.G. The structure and development of Triglochin maritimum // Ann. Bot.
(London), 1900. 14(53): 83-107.
Hill T.G., Fraine E.de. On the seedling structure of Gymnosperms // Ann. Bot.
(London), 1908. 22(88): 689-712; 1909. 23(90): 189-227, 23(91): 433-457..
Hirada K., Yokota Т., Murofushi N.. Takahashi N. Isolation and characterization of
free gibberellins and glucosyl esters of gibberellins in mature seeds of Phaseolus vulgaris
// Agric. Biol. Chem., 1972. 36(2): 345-347.
Hirase S. Etudes sur la fecondation et l'embryogenie du Gingko biloba // lourn
Coll. Sci., Tokyo, 1898. 12, part.2:
Hoare G.V. Gametogenesis and fertilization in Scilla nonscripta // Cellule, 1934. 42:
269-292.
Hodcent E. Recherch sur les facteur entrant en jeu lors de I'alveolization des prothalles
femelles de l'Araucaria araucana // Rev. Cytol. Biol. Veg., 1969. 32: 155-164.
Hoekstra F.A., Bruinsma J. Respiration and vitality of binucleate and trinucleate
pollen // Physiol. Plant. (Copenhagen), 1975. 34: 221-225.
Hofmeister W. Untersuchungen des Vorgangs bei der Befruchtung der Oenotheren
// Bot. Zeitung (Berlin), 1847. 5: 785-792.
Hofmeister W. Die Entstehung des Embryo der Phanerogamen. Eine Reihe micro-
scopischer Untersuchungen. Leipzig: Verlag von F.Hofmeister, 1849: 1-89.
Hofmeister W. Neuere Beobachtungen fiber Embryobildung der Phanerogamen // lahrb
Wiss. Bot., 1858. 1: 82-186.
Hofmeister W. Neuere Beitrage zur Kenntnis der Embryobildung der Phanerogamen.
I. Dikotyledonen mit ursprunglich einzelligem, nur durch Zelltheilung wachsendem
Endosperm // Abh. Konigl. Sachs. Ges. Wiss., 1859. 6: 535-672.
Hofmeister W. Neue Beitrage zur Kenntniss der Embryobildung der Phanerogamen.
II. Monocotyledonen // Abh. Konigl. Sachs. Ges. Wiss., 1861. 7: 631-760.
Hoggart R.M., Clarke A.E. Arabinogalactans are common components in angiosoerm
styles // Phytochemistry, 1984. 23: 1571-1573.
Литература
76l]
Holden H.S. Bexon D. Observation on the anatomy of teratological seedlings. I. On
the anatomy of some polycotylous seedlings of Chieranthus cheiri // Ann. Bot. (London),
1918. 32: 513-530.
Holden H.S., Daniels M.E. Observation on the anatomy of teratological seedlings.
IV. Further studies on the anatomy of atypical seedlings of Impatiens roylii Walp.
//Ann. Bot. (London), 1921. 35(NCXL): 461-492.
Holding D.R., McKenzie R.J., Coomber S.A. Genetic and structural analysis of five
Arabidopsis mutants with abnormal root morphology generated by the seed transformation
method // Ann. Bot. (London), 1994. 74(3): 193-204.
Holm P.В., Khudsen S., Mouritzen P., Negri D., Olsen F.L., Roue C. Regeneration
of fertile barley plants from mechanically isolated protoplasts of the fertilized egg cell
// Plant Cell, 1994. 6: 531-543.
Holm Th. Erigenia bulbosa Nutt. A morphological and anatomical study // Amer. J.
Sci., 1901. Ser. IV, 11: 63-72.
Holtorp H.E. Tricotyledony // Nature, 1944. 153(3870): 13-14.
Hong В., Uknes S.I., Ho T.H.D. Cloning and characterization of a cDNA encoding
a mRNA rapidly-induced by ABA in barley aleurone layers // Plant Molec. Biol.,
1988. 11: 495-506.
Hopkins C.R. Polarity signals // Cell (Cambridge), 1991. 66: 827-829.
Horner H.T., Arnott H.J. A histochemical and ultrastructural study of pre- and
postgerminated Jucca seeds // Bot. Gaz., 1966. 127(1): 48-64.
Howard A., Palk S.R. Synthesis of RNA in normal and irradiated cells and its
relation to chromosome breakage // Heredity, 1953. 6: 261-273.
Hu S.Y. Male germ unit and sperm heteromorphism: the current status // Acta Bot.
Sin., 1990. 32(2): 230-240.
Hu Shi-yi, Zhu Cheng, Zee S.Y. Transfer cells in suspensor and endosperm during
early embryogeny of Vigna sinensis // Acta Bot. Sin., 1983. 25(1): 1-7.
Hua Yan., Hong-Yuan Yang. Ultrastructure of the developing embryo sac of sunflower
(Helianthus annuus) before and after fertilization // Canad. J. Bot, 1991. 69: 191-202.
Huang B.Q., Pierson E.S., Russell S.D., Tiezzi A., Cresti M. Cytosceletal
organization and modification during pollen tube arrival, gamete delivery and fertilization
in Plumbago zeylanica // Zygote, 1993. 1: 143-154.
Huang B.Q., Russell S.D. Female germ unit: organization, reconstruction and isolation
// Int. Rev. Cytol., 1992. 140: 233-293.
Huang B.Q., Russell S.D. Fertilization in Nicotiana tabacum. Cytoskeletal modifications
in the embryo sac during synergid degeneration. A hypothesis for short-distance transport
of sperm cells prior to gamete fusion // Planta, 1994. 194: 200-214.
Huang B.Q., Sheridan W.F. Female gametophyte development in maize. Microtubular
organization and embryo sac polarity // Plant Cell, 1994. 6: 845-861.
Huang B.Q., Strout G.W., Russell S.D. Fertilization in Nicotiana tabacum: ultrastructural
organization of propane jet-frozen embryo sacs in vivo // Planta, 1993. 191: 256-264.
Hfiber H. Die Samenmerkmale und Verwandtschaftssverhaltnisse der Liliifloren
// Mitt. Bot. Staatssamml. Mfinchen, 1969. 8(2): 219-538.
Hudak J., Herich R., Bobak M. Plastidy. Bratislava: Veda, 1983: 1-103.
Hughes M.B., Babcock E.B. Self-incompatibility in Crepis foetida subsp. rhaeadifolia
// Genetics, 1950. 35: 570-588.
Humphrey J.E. The development of the seed in the Scitamineae // Ann. Bot.
(London), 1896. 10(37): 1-40.
762
Семя
Humphreys Т.Е. A model for sucrose transport in the maize scutellum // Phytoche-
mistry, 1978. 17(4): 679-684.
Humphreys Т.Е., Garrard L.A. Glucose uptake by the corn scutellum // Phytoche-
mistry, 1964. 3(4): 647-656.
Hush J.M., Overall R.L. Electrical and mechanical fields orient cortical microtubules
in higher plant tissues // Cell Biol. Int. Rep., 1991. 15(7): 551-559.
Hutchinson J. The Families of Flowering Plants. Oxford: Clarendon Press, 1959a. 1:
1-510; 2: 1-281.
Hutchinson J. The Genera of Flowering Plants. Dicotyledones. Oxford: Clarendon
Press, 1964. 1.
Hyde B.B. Mucilage-producing cells in the seedcoat of Plantago ovata: developmental
fine structure // Amer. J. Bot., 1970. 57: 1197-1206.
Ihle J.N., Dure L. III. The developmental biochemistry of cotton seed embryogenesis
and germination. III. Regulation of the biosynthesis of enzymes utilized in germination
// J. Biol. Chem., 1972. 247(16): 5048-5055.
Ikeno S. Untersuchungen tiber die Entwicklung der Geschlechtsorgane, etc. bei Cycas
revoluta // J. Coll. Sci., Tokyo, 1898. 12, part.3.
Irish V.L., Sussex J.M. A late map of the Arabidopsis embryonic shoot apical
meristem // Development, 1992. 115: 745-753.
Irmisch Th. Beitrage zur vergleichenden Morphologie der Pflanzen // Abh. Naturf.
Ges. zu Halle, 1 Abt. 1854. 1: 31-80., 1856. 2 Abt. 3: 1-44.
Iwanami Y. Physiological Studies of Pollen // J. Yokohama Municip. Univ., 1959.
116: 1-137.
Jackson B.D. A Glossary of Botanic Terms. London: Duckworth & Co.; J.B.Lippincott
Company, 1916: 1-428.
Jackson D., Veit В., Hake S. // Development, 1994. 120: 405-413.
Jacob F. The Actual and the Possible. Seattle: Univ. Washington Press. 1982.
Jacobs T.W. Control of the cell cycle // Developm. Biol., 1992. 153: 1-15.
Jacobs T.W. Cell cycle control // Annual Rev. Plant Physiol. Plant Molec. Biol.,
1995. 46: 317-339.
Jacobsen J.V., Chander P.M. Gibberellin and abscisic acid in germinating cereals
// Plant Hormones and their Role in Plant Growth and Development. / Ed. Davies P.J.
Dordrecht a. o.: Kluwer Acad. Publ., 1988: 164-193.
Jacobsen J.V., Knox R.B., Pyliotis N.A. The structure and composition of aleurone
grains in the barley aleurone layer // Planta, 1971. 101: 189-209.
Jacobsson-Stiasny E. Zur Embryologie der Aristolochiaceae // Denkschr. Kaiserl.
Akad. Wiss., Math.-Naturwiss. Kl. 1918. 95(1): 65-77.
Jacques-Felix H. Sur une interpretetion nouvelle de l'embryon des Graminees. La
nature axillaire de la gemmule // C.R. Acad. Sci. Paris, 1957. 245: 1260-1263.
Jacques-Felix H. Evolution des idees sur l'embryon des Gramineae // 83е Congres
des Societes Savantes. Poitiers, 1958: 323-337.
Jacques-Felix H. Les Monocotyledones n'out pas de Cotyledon // Bull. Mus. Hist.
Nat., Paris Ser.4., 1982. 1-2: 3-40.
Jacques-Felix H. Les Liliopsida (ex Monocotyledones) n'ont pas de Cofyledon. II. La
prefeuille de la planluse: ses rapports avec cells des axes feluiles // Bull. Mus. Nat.,
Hist. Nat., Paris, 1988. 4(10): 275-333.
Jaffe L.A., Nuccitelli R. Electrical control of development // Annual Rev. Biophys.
Bioengin., 1977. 6: 445-476.
Литература
763
Jaffe L.A., Weisenseel M.N., Jaffe L.F. Calcium accumulation within the growing tips
of pollen, tubes // J. Cell Biol., 1975. 67: 488-492.
Jaffe L.F. Calcium explosion as triggers of development // Ann. New York Acad.
Sci., 1980. 339: 86-101.
Janson J. Pollen Tube-pistil Interaction and Fertilization in Lilium longiflorum.
Wageningen : Landbouwuniversiteit Wageningen, 1992: 1-145.
Jegla D.E., Sussex I.M. Cell lineage patterns in the shoot meristem of the sunflower
embryo in the dry seed // Developm. Biol., 1989. 131: 215-225.
Jensen G.H. Studies on the morphology of wheat // Wash. State Agric. Exp. Sta.
Bull., 1918. 1-150.
Jensen W.A. The nucleic acid and protein content of root tip cells of Vicia faba and
Allium сера // Exp. Cell. Res., 1958. 44: 575-583.
Jensen W.A. Cell development during plant embryogenesis // Meristems and
Differentiation. Brookhaven Symposia in Biology, 1964a. 16: 179-202.
Jensen W.A. Observation on the fusion of nuclei in plants // J. Cell Biol., 1964b.
23(3): 669-672.
Jensen W.A. The ultrastructure and histochemistry of the synergids of cotton
// Amer. J. Bot., 1965a. 52: 238-256.
Jensen W.A. The ultrastructure and composition of the egg and central cell of
cotton// Amer.J.Bot., 1965b. 52(8): 781-797.
Jensen W.A. Cotton embryogenesis. Polysome formation in the zygote // J. Cell
Biol., 1968a. 36: 403-406.
Jensen W.A. Cotton embryogenesis: The zygote // Planta, 1968b. 79(4): 346-366.
Jensen W.A. Cotton embryogenesis: The tube-containing endoplasmic reticulum
// J. Ultrastruct. Res., 1968c. 22: 296-302.
Jensen W.A. The embryo sac and fertilization in Angiosperms // Havaii: Harold L.
Lyon Arboretum, 1972. 3: 2-31.
Jensen W.A. Fertilization of flowering plants // BioScience, 1973. 23(1): 21-27.
Jensen W.A. The role of cell division in angiosperm embryology // Cell Division of
Higher Plants. London, 1976: 391-405.
Jensen W.A., Ashton M.E., Beasley C.A. Pollen-tube-embryo sac interaction in
cotton // Pollen: Biology and Implications for Plant Breeding. / Eds. Mulcahy D.L.,
Ottaviano E. New York: Elsevier Science Publ. Co. (Elsevier Biomed. Press), 1983:
67-72.
Jensen W.A., Fisher D.B. Cotton embryogenesis: double fertilization // Phytomor-
phology, 1967. 17(1/4): 261-269.
Jensen W.A., Fisher D.B. Cotton embryogenesis: the sperm // Protoplasma, 1968a.
65(3): 277-286.
Jensen W.A., Fisher D.B. Cotton embryogenesis: the entrance and discharge of the
pollen tube in the embryo sac // Planta, 1968b. 78(2): 158-183.
Jensen W.A., Fisher D.B. Cotton embryogenesis: the tissue of the stigma and style
and their relation to the pollen tube // Planta, 1969. 84: 97-121.
Jin-a-Jin, Boihon C.J., Wong J.H. Tioredoxin-linked changes in regulatory properties
or barley p-amilase / subtilisin inhibitor protein // Plant Physiol. Biochem., 1993.
31(6): 1112-1121.
Johansen D.A. Studies on the morphology of the Onagraceae. II. Embryonal
manifestations of fasciation in Clarkia elegans // Bot. Gaz. (Chicago), 1930a. 90(1):
75-91.
764
Семя
Johansen D.A. Studies on the morphology of the Onagraceae. IV. Stenosiphon
linifolium // Bull. Torrey Bot. Club., 1930b. 57(5): 315-326.
Johansen D.A. Studies on the morphology of the Onagraceae. 3. Taraxia ovata //
Ann. Bot. (Chicago), 1931a. 45(177): 111-124.
Johansen D.A. Studies on the morphology of the Onagraceae. 5. Zauschneria latifolia,
typical of a genus characterized by irregular embryology // Ann. New York Acad. Sci.,
1931b. 33: 1-26.
Johansen D.A. Studies on the morphology of the Onagraceae. 7. Gayophytum
ramosissimum // Bull. Torrey Bot. Club., 1933. 60(1): 1-8.
Johansen D.A. Studies on the morphology of the Onagraceae. 8. Circaea pacifica
// Amer. J. Bot., 1934. 21: 508-510.
Johansen D.A. A critical review of the present status of plant embryology // Bot.
Rev., 1945. 11: 87-107.
Johansen D.A. Plant Embryology. Waltham, MA: Chronica Botanica, 1950: 1-305.
Johansson M., Walles B. Functional anatomy of the ovule in broad bean (Vicia faba
L.) I. Histogenesis prior to and after pollination // Int. J. Plant Sci., 1993. 154: 80-8.
Johansson M., Walles B. Functional anatomy of the ovule in broad bean (Vicia faba
Z.):Ultrastructural seed development and nutrient pathways // Ann. Bot. (London),
1994. 74(3): 233-244.
Johnson D.S. On the development of Saururus cernuus // Bull. Torrey Bot. Club.,
1900a. 27(7): 365-372.
Johnson D.S. On the endosperm and embryo of Peperomia pellucida // Bot. Gaz.,
1900b. 30(1): 1-11.
Johri B.M. Studies in the family Alismataceae. 3. Sagittaria quanensis H.B.K. and
S.batifolia Willd. // J. Indian Bot. Soc, 1935. 22(1): 33-48.
Johri B.M. The embryo sac of Limnocharis emarginata L. (=L.flava Buchen) // New
Phytol., 1938. 37(3): 279-285.
Johri B.M. Morphogenetic response of mature endosperm // Abstr. XI Int. Bot.
Congr. Seattle. 1969: 103.
Johri B.M. Differentiation in plant tissue cultures // Proc. 58th Indian Sci. Congr.
Assoc. Bangalore, Pt. II 1971: 159-186.
Johri B.M. Organogenesis in the tissue culture of endosperm and embryo // Abstr.
XII Int. Bot. Congr. July 3-310. Leningrad. 1975: 218.
Johri B.M., Agrawal J.S., Sudha G. Morphological and embryological studies in the
family Loranthaceae — I. Helicanthes elastica (Desr.) Dans // Phytomorphology, 1957.
7(3-4): 336-354.
Johri B.M., Ambegaokar K.B., Srivastava P.S. Comparative Embryology of Angiosperms.
Berlin a. o.: Springer-Verlag, 1992. 1: 1-614, 2: 615-1221.
Johri B.M., Garg S. Development of endosperm haustoria in some Leguminosae
// Phytomorphology, 1959. 9(1): 34-46.
Johri B.M., Kapil R.N. Contribution to the morphology and life history of Acalypha
indica L. // Phytomorphology, 1953. 3(3): 137-151.
Johri B.M., Konar R.N. A contribution to the morphology and embryology of Ficus
religiosa Linn. // Curr. Sci., 1955. 24(11): 382-385.
Johri B.M., Srivastava P.S. Morphogenesis in endosperm cultures // Z. Pflanzen-
physiol., 1973. 70(4): 285-304.
Jones P.A. Development of the quiescent center in maturing embryonic radicules of
pea (Pisum sativum L. ev. Alaska) // Planta, 1977. 135: 233-240.
Литература
765
Jones R.L., Phillips I.D.J. Organs of gibberellin synthesis in light-gowth sunflower
plants // Plant Physiol., 1966. 41(8): 1381-1386.
Jones T.J., Rost T.L. Histochemistry and ultrastructure of rice (Orhyza sativa L.)
zygotic embryogenesis // Amer. J. Bot., 1989. 76: 504-513.
Jong A.J. de, Cordewener J., Lo Schiavo F., Terzi M., Vandekerckhove J., Kammen
A.van, Vries S.C. de. A carrot somatic embryo mutant is rescued by chitinase // Plant
Cell, 1992. 4: 425-433.
Jong A.J. de, Schmidt E.D.L., Vries S.C. de. Early events in higer plants
embryogenesis // Plant Molec. Biol., 1993. 22: 367-377.
Jonsson S. Nouveau type de parthenogenese haploide chez les Algues: la partenogenese
plasmogamic // Compt. Rend. Hebd. Sea. Acad. Sci., 1964. 258: 2145-2148.
Jonsson S. Des lignees apocaryogamiques et segregation dans la population de
l'Acrosiphonia arcta, Chlorophycee marine d'Heligoland // Helgoland. Wiss. Meerun-
tersuch., 1971. 22: 281-294.
Jorgensen C.A. Studies on Callitrichaceae // Bot. Tidsskr., 1923. 38(1): 81-126.
Joshi P.C., Wadhwani A.M., Johri B.M. Morphological and embryological studies of
Gossypium L. // Proc. Natl. Inst. Sci. India, 1967. 33(1-2): 37-93.
Juel H.O. Studien iiber die Entwicklungsgeschichte von Saxifraga granulata // Nova
Acta Regiae Soc. Sci. Upsal., 1907. 4(1): 1-41.
Juguet M. Observations embryogenesis chez les Cyperacees et les Juncacees // Abstr.
93 Congr. des Societes Savantes, Tours, 1968, Sec. Sci. 3 Paris, 1972: 547-572.
Juguet M. Embryologie des Juncacees. Developpement de l'embryon chez le Luzula
pilosa (L.) Willd. // Compt. Rend. Hebd. Sea. Acad. Sci., 1969. 268(25): 3036-
3039.
Juguet M. Expression pricoce de la monocotyledonic et mise en place du cotyledon et
du point vegetatif de la tige chez quelques monocotyledones avec quelques remarques sur
les types de symetrie des embryons de monocotyledones et de dicotyledones. //Bull. Soc.
Bot. France. 1973. : 337-353.
Juguet M. Not all the Monocotyledons are as monocotyledonous as it is believed //
Dedicatory volume to Prof. A. Lebegue / Eds. J. Pare, M. Bugnicourt. Amiens Univ.
de Picardie, 1989: 206-222.
Juguet M. Origin and stages of monocotyly in the monocotyledons // Abstr. XI Int.
Symp. «Embryology and Seed Reproduction». Leningrad, USSR, July 3-7, 1990.
St.Petersburg: Nauka, 1990: 68.
Juguet M. Origin and stages of monocotyly in the monocotyledons. I. A preliminary
report// Proc. XI Int. Symp. «Embryology and Seed Reproduction». Leningrad, USSR,
July 3-7, 1990. St.Petersburg: Nauka, 1992: 236-237.
Juguet M., Pare J. Etude au microscope electronique a balayage de l'edification du
cotyledon et du futur meristeme, caulinaire chez deux Monocotyledones, avec quelques
remarques sur les divers etats et l'origine de la monocotylie // Bull. Soc. Bot. France,
1989. 136(3): 225-233.
Juliano J.В., Alcala P.E. Floral morphology of Musa errans (Blanco) Teodoro var.
Botoan Teodoro // Philipp. Agric, 1933. 22: 91-126.
Junell S. Die Entwicklungsgeschichte von Circaeaster agrestis // Svensk Bot. Tidskr.,
1931. 25: 238-270.
Jung C.T. Developmental anatomy of the seedling of the rice plant // Bot. Caz.,
1937. 99: 786-802.
Junger E. Uber tricotyledone Embryonen // Uebersicht d'Arbeiten und Veranderungen
d. Schlesischen Gesellschaft fur Vaterlandishe Kultur 1968-1970: T. 48-46.
766
Семя
Jungers V. Figures caryocinetiques et cloisonnement du protoplasme dans l'endosperme
d'Iris // Cellule, 1931.40(3): 293-354.
Junqueira L.C., Caneiro J., Contopoulos A.N. Basic Histology. 2-nd edition. Los
Altos! Lange Medical Publication, 1975.
Jiirgens G. Axis formation in plant embryogenesis: cues and clues // Cell (Cambridge),
1995. 81: 467-470.
Jiirgens G., Mayer U. Arabidopsis // Embryos. Colour Atlas of Development. / Ed.
Bard J.B.L. London: Wolf Publ., 1994: 7-21.
Jiirgens G., Mayer U., Torres Ruiz R.A., Berleth Т., Misera S. Genetic analysis of
pattern formation in the Arabidopsis embryo // Molecular and Cellular Basis of Pattern
Formation. / Ed. Roberts K. Cambridge: Company of Biologists, Ltd., 1991: 27-38.
Jiirgens G., Torres Ruiz R.A., Laux Т., Mayer U., Berleth T. Early events in
apical-basal pattern formation in Arabidopsis // Plant Molecular Biology: Molecular-
genetic Analysis of Plant Development and Metabolism./ Eds. Coruzzi G., Puigdomenech
P. Berlin: Springer, 1994: 95-103.
Jurkat G. Anomalien bei Pulsatilla-Keimlingen. Diss. Tubinggen. 1953.
Jussieu A.L.de. Genera Plantarum secundum ordines naturales disposita. Paris, 1789:
1-499.
Jyengar C.V.K. Development of seed and its nutritional mechanism in Scrophulariaceae
// J. Mysore Univ. В., 1947. 2: 82-98.
Kadej A., Kadej F. The ultrastructure of the egg cell in Lycopersicon esculentum
Miller at the moment of fertilization // Proc. VII Int. Cytoembr. Symp. «Fertilization
and Embryogenesis in Ovulated Plants». High Tatra (Rackova dolina), June 14-17,
1982./Ed. Erdelska O. Bratislava: VEDA, 1983: 249-252.
Kadej A., Kadej F. Sperm cells in the fertilization process in Lycopersicon esculentum
// Proc. of the 8th Int. Symp. on Sexual Reprod. «Sexual Reproduction in Seed Plants,
Ferns, and Mosses», August 20-24, 1984. / Eds. Willemse M.T.M., Went J.L.van.
Wageningen: PUDOC, 1985: 149.
Kadej F., Kadej A. Ultrastructural organization of the tomato embryo sac at the time
of fertilization // Acta Soc. Bot. Polon., 1981. 50: 139-142.
Kajale L. Embryology of Achyranthes aspera Linn. // Proc. Indian Acad. Sci., 1937.
5(5): 195-205.
Kajale L. A contribution to the embryology of the Phytolaccaceae. 2. Fertilization and
the development of embryo, seed and fruit in Rivina humilis and Phytolacca dioica
// J. Indian Bot. Soc, 1954. 33(3): 206-225.
Kandasamy M.K., Paolillo D.J., Faraday CD., et al. The S-locus specific glycoproteins
in Brassica accumulate in the cell wall of developing stigma papillae // Developm. Biol.,
1989. 134: 462-472.
Kapil R.N. A further contribution to the morphology and life history of Chrozophora
Neck. // Phytomorphology, 1956. 6(3-4): 278-288.
Kapil R.N., Ahluwalia K. Embryology of Peganum harmala Linn. // Phytomorphology,
1963. 13(2): 127-140.
Kapil R.N., Bhandari N.N. Morphology and embryology of Magnolia // Proc. Natl.
Inst. Sci. India, 1964. 30(5-6).
Kapil R.N., Bhatnagar A.K. Endosperm in Euphorbiaceae — a critical appraisal
// Adv. Plant Morph., 1972. 376-393.
Kapil R.N., Bhatnagar A.K. Central cell: pre- and postfertilization parameters
// Phytomorphology, 1983(1984). 33(1/4): 157-167.
Литература
767
Kapil R.N., Bhatnagar A.K. Embryological evidence in angiosperm classification and
phylogeny // Bot. Jahrb. Syst., 1991. 113: 309-338.
Kapil R.N., Rustagi P.N., Venataraman Rukmani. A contribution to the embryology
of Polemoniaceae // Phytomorphology, 1968. 18(3): 403-412.
Kapil R.N., Vijayaraghavan M.R. Embryology and the systematic position of
Pentaphragma horsfieldii (Mig.) Airy // Curr. Sci., 1962. 31(7): 270-272.
Kapil R.N., Vijayaraghavan M.R. Embryology of Pentaphragma horsfieldii (Mig.)
Airy Shaw with a discussion on the systematic position of the genus // Phytomorphology,
1965. 15(1): 93-102.
Kapil R.N., Walia K. The embryology of Philydrum lanuginosum and the systematic
position of the Philydraceae // Beitr. Biol. Pflanzen, 1965. 41(3): 381-404.
Kaplan D.R. The relationship of cells to organisms in plants: problem and implications
of an organismal perspective // Int. J. Plant Sci., 1992. 153(3): 28-37.
Kapoor B.M. Contributions to the cytology of endosperm in some angiosperms. X.
Nigella damascene and N. sativa // Caryologia, 1966. 19: 73-83.
Kapoor T. Embryological and histochemical studies in some aquatic monocotyledons —
Potamogetonaceae and Najadaceae. PhD Thesis. Delhi: Univ. Delhi, 1980.
Karas I., Cass D.D. Ultrastructural aspects of sperm cell formation in rye: evidence
for cell plate involvement in generative cell division // Phytomorphology, 1976. 26:
36-45.
Karlstrom P.O. Embryological studies in Acanthaceae. III. The genera Barleria L. and
Grobbea Harv. // Svensk Bot. Tidskr., 1974a. 68(2): 121-135.
Karlstrom P.O. Embryological studies in Acanthaceae. IV. The genera Asystasia Bl.
and Chamaeranthemum Nees. // Svensk Bot. Tidskr., 1974b. 68(3): 325-328.
Karnicke M. Der heutige Stand der Pflanzlichen Zellforschung // Ber. Deutsch. Bot.
Ges., 1903. 21: 66-134.
Karsten G. Uber die Entwicklung der weiblichen Blflten bei einigen Juglandaceen
// Flora, 1902. 90(1): 316-333.
Karsten H. Das Geschlechtsleben der Pflanzen und die Partenogenesis. Berlin: Verlag,
1860: 1-52.
Kausik S.B. Studies in the Proteaceae. I. Cytology and floral morphology of Grevillea
robusta Cunn. // Ann. Bot. (London), 1938a. 2(8): 899-910.
Kausik S.B. Studies in the Proteaceae. II. Floral anatomy and morphology of
Macadamia ternifolia F. Muell. // Proc. Indian Acad. Sci., 1938b. 8(1): 45-62.
Kausik S.B. Studies in the Proteaceae. VII. The endosperm of Grevillea robusta
Cunn. with special reference to the structure and development of the vermiform appendage
// Proc. Indian Acad. Sci., 1942. 16(5): 121-140.
Kausik S.B., Subramanyam K. An embryological study of Isotoma longiflora Presl.
// Proc. Indian Acad. Sci., 1945a. 21: 269-278.
Kausik S.B., Subramanyam K. Development of endosperm in Lobelia nicotianaefolia
Heyne. // Curr. Sci., 1945b. 21: 269-278.
Kenrick J., Knox R.B. Structure and cytochemistry of the stigma and style of some
Australian species of Acacia // Austral. J. Bot., 1981. 29: 733-745.
Khan A.A. Seed dormancy: changing concepts and theories // The Physiology and
Biochemistry of Seed Dormancy and Germination. / Ed. Khan A.A. Amsterdam, New
York, Oxford, 1977: 29-45.
Khan R. Contributions to the morphology of Ephedra foliata Boiss. II. Fertilization
and embryogeny // Proc. Natl. Acad. Sci., India, 1943. 13: 357-375.
768
Семя
Khanna P. Morphological and embryological studies in Nymphaeaceae. l.Euryale ferox
Salisb. // Proc. Indian Acad. Sci., 1964. 59(4): 237-247.
Khanna P. Morphological and embryological studies in Nymphaeaceae. II. Brasenia
schreberi Gmel. and Nelumbo nucifera Gaertn. // Austral. J. Bot.7~ 1965. 13(3):
379-387.
Khanna P. Morphological and embryological studies in Nymphaeaceae. III. Victoria
cruziana D'Orb and Nymphaea stellata Willg. // Bot.Mag. Tokyo, 1967. 80(950):
309-312.
Khera Paramjit K., Tilney-Bassett R.A.E. Fine structural observation of embryo
development in Pelargonium x hortorum Bailey with normal and mutant plastids
// Protoplasma, 1976. 88(1): 7-23.
Khoo U., Wolf M.J. Origin and development of protein granules in maize endosperm
// Amer. J. Bot., 1970. 57: 1042-1050.
Khvedynich O.A., Bannikova V.P. Chromatin transformations in fertilized nuclei of
embryo sac // Abstr. 8th Int. Cytoembr. Symp. «Fertilization and Embryogenesis in
Ovulated Plants», High Tatra, June 14-17, 1982. 6, 1983: 257-259.
Kiesselbach T.A. The structure and reproduction of corn // Nebraska Agric. Exp.
Sta. Bull., 1949. 161: 1-96.
Kihara H., Nishiyama J. Different compatibility in reciprocal crosses of Avena with
special reference to tetraploid hybrids between hexaploid and diploid species // Japan J.
Bot., 1932. 6(2): 245-305.
Kinges H. Merkmale des Gramineenembryos // Bot. Jahrb. Syst., 1961. 81(1):
50-93.
Kirk D.L., Kaufman M.R., Keeling R.M., Stamer K.A. Genetic and cytological
control of the asymmetric divisions that pattern the Volvox embryo // Development
(suppl.), 1991. 1: 67-82.
Klebs G. Beitrage zur Morphologie und Biologie der Keimung. Tubingen: Untersuch.
Bot. Inst, 1885: 536-635.
Klein S., Pollock B.M. Cell fine structure of developing lima bean seeds related to
seed desiccation // Amer. J. Bot., 1968. 55(6), pt. 1: 658-672.
Knox R.B. Pollen-pistil interactions // Enc. Plant Physiol. New Ser., 1984. 17:
508-608.
Knox R.B. The pollen grain // Embryology of Angiosperms Ed. Johri B.M. Berlin
a. o.: Springer-Verlag, 1984: 197-221.
Knox R.B., Clarke A., Harrison S., Smith P., Marchalonis J.J. Cell recognition in
plants determinants of the stigma surface and their pollen interactions // Proc. Natl.
Acad. Sci. USA, 1976. 73(8): 2788-2792.
Knox R.B., Heslop-Harrison J., Heslop-Harrison Y. Pollen wall proteins: localisation
and characterisation of gametophytic and sporophytic fractions // Biol. J. Linn. Soc,
1975. 7(1): 177-187.
Knox R.B., Williams E.G., Dumas C. Pollen, pistil and reproductive function in crop
plants // Plant Breed. Rev., 1986. 4: 7-79.
Koernicke M. Der heutige Stand der pflanzlichen Zellforschung // Ber. Deutsch. Bot.
Ges., 1903. 21(1): 66-134..
Kohler F., Wenzel G. Regeneration of isolated barley microspores in conditioned
media and trials to characterize the responsible factor // Sex. Plant Physiol., 1985. 121:
181-191.
Komamine A., Kawahara R., Matsumoto M., Sunabori S., Toya Т., Fujiwara A.,
Tsukahara M., Smith J., Ito M., Fukuda M., Nomura K., Fujimura T. Mechanisms of
Литература
769
somatic embryogenesis in cell cultures: physiology, biochemistry and molecular biology
// In vitro Cell Dev. Biol., 1992. 28(1): 11-14.
Konar R.N., Linskens H.F. Physiology and biochemistry of the stigmatic fluid of
Petunia hybrida // Planta, 1966. 71: 372-387.
Konar R.N., Nataraja K. Experimental studies in Ranunculus sceleratus L. Development
of embryos from the stem epidermis // Phytomorphology, 1965. 15(2): 132-137.
Konar R.N., Thomas E., Street H.E. Origin and structure of embryoids arising from
epidermal cells of the stem of Ranunculus sceleratus L. // J. Cell Sci., 1972. 11: 77-93.
Koncz C, Martini N.. Mayerhofer R., Koncz-Kalman Z., Korber H., Redeui G.P.,
Schell J. High-frequency T-DNA mediated gene tagging in plants // Proc. Natl. Acad.
Sci. USA, 1989. 86: 8467-8471.
Koncz C, Mayerhofer R., Koncz-Kalman Z., Nawrath C, Reiss В., Redeui G.P.,
Schell J. Isolation of a gene encoding a novel chloroplast protein by T-DNA tagging in
Arabidopsis thaliana // EMBO J., 1990. 9: 1337-1346.
Konings H. Gravitropism of roots: an evaluation of progress during the last three
decades // Acta Bot. Neerl., 1995. 44(3): 195-223.
Kopeewisz J., Madela K. Phytochrome-controlled level of growth substances in
etiolated oat seedlings // Acta Soc. Bot. Polon., 1992. 61(3-4): 381-388.
Korobova S.N. On the behaviour of sperms in the process of fertilization in higher
plants // Fertilization in higher plants/ Ed. Linskens H.F. Amsterdam: North-Holland
Publ. Co., 1974: 161-166.
Korobova S.N. Sperms in the embryo sac of some flowering plants // Proc. 7th
Intern. Cytoembr. Symp. «Fertilization and Embryogenesis in Ovulated Plants. High
Tatra (Rackova dolina), June 14-17, 1982. Bratislava: VEDA , 1983: 241-244.
Koscinska M. Embryo and endosperm in Rudbekia bicolor Butt. // Acta Biol.
Cracov., Ser. Bot., 1980. 22(1): 71-79.
Koscinska-Pajak M. Caryological instability in semigamie Rudbeckia bicolor Nutt.
// Acta Biol. Cracov., Ser. Bot., 1985. 27: 39-55.
Kranz E., Bautor J., Lorz H. In vitro fertilization of single, isolated gametes,
transmission of cytoplasmic organelles and cell reconstitution of maize (Zea mays L.)
// Progress in Plant Cellular and Molecular Biology. / Eds. Nijkamp A.H.J., Plas
L.H.W. van der, Aartrijk J. van. Dordrecht: Kluwer, 1990: 252-257.
Kranz E., Bautor J., Lorz H. Electrofusion-mediated transmission of cytoplasmic
organelles through the in vitro fertilization process, fusion of sperm cells with synergids
and central cells, and cell reconstitution in maize // Sex. Plant Reprod., 1991a. 4:
17-21.
Kranz E., Bautor J., Lorz H. In vitro fertilization of single, isolated gametes of maize
mediated by electrofusion // Sex. Plant Reprod., 1991b. 4: 12-16.
Kranz E., Lorz H. In vitro fertilization with isolated single gametes results in zygotic
embryogenesis and fertile maize plants // Plant Cell, 1993. 5: 739-746.
Kranz E., Lorz H. In vitro fertilization of maize by single egg and sperm cell
protoplast fusion mediated by high calcium and high pH // Zygote, 1994. 2: 125-128.
Kranz E., Lorz H. In vitro fertilization with angiosperm gametes // Abstr. 14th Int.
Congr. Sex. Plant Reprod. «Plant Reproduction'96», February 18-26, Australia. 1996:
42.
Kranz E., von Wiegen P., Lorz H. Early cytological events after induction of cell
division in egg cells and zugote development following in vitro fertilization with angiosperm
garnets // Plant Journal, 1995. 8: 9-23.
49-828
770
Семя
Krasnikov L.G. New conception of monocotyledon embryo origin //Proc. XI Int.
Symp. «Embryology and Seed Reproduction». Zeningrad, 3-7 July, 1990. St. Petersburg:
Nauka. 1992: 284-285.
Krause K.E.H. Drei Kotyledonen // Arch. Ver. Freunde Naturg. Mecklenburg,
1880: 236.
Krishna Iyengar C.V. Development of the embryo sac and endosperm haustoria in
some members of Scrophulariaceae. V. Ilysanthes hyssopioides Benth and Bonnaya
tenuifolia Sprengh. // J. Indian Bot. Soc, 1940. 19: 5-17.
Krishna Iyengar C.V. Development of seed and its nutritional mechanism in
Scrophulariaceae. Part. 1. Rhamphicarpa longifolia Benth., Centranthera hispida Br., and
Pedicularis zeylanica Behth. // Proc. Natl. Inst. Sci. India, 1942. 8: 249-261.
Krishna Iyengar C.V. Development of seed and its nutritional mechanism in the
Scrophulariaceae. Pt. II. // J. Mysore Univ. В., 1947. 7B(2): 82-98.
Krishnamurthy K.V. Endosperm controls symmetry changes in the developing embryos
of angiosperms // Proc. Indian Acad. Sci., 1988. 98(4): 257-259.
Kristie D.N., Jolliffe P.A. High resolution studies of growth oscillations during stem
elongation // Can. J. Bot, 1986. 64(11): 2399-2405.
Kroh M., Helsper J.P.F.G. Transmitting tissue and pollen tube growth // Fertilization
in Higher Plants. / Ed. Linskens H.F. Amsterdam: North-Holland Publ. Co., 1974:
167-178.
Kronestedt E., Walles B. Anatomy of Strelitzia reginae flower (Strelitziaceae)
// Nordic J. Bot., 1986. 6: 307-320.
Kronestedt E., Walles В., Alkemar J. Structural studies of pollen tube growth in the
pistil of Strelitzia reginae // Protoplasma, 1986. 131: 224-232.
Kropf D.L. Establishment and expression of cellular polarity in fucoid zygotes
// Microbiol. Rev., 1992. 56: 316-339.
Kropf D.L. Review: Cytoskeletal control of cell polarity in a plant zygote // Developm.
Biol., 1994. 165(2): 361-371.
Kropf D.L., Kloareg В., Quatrano R.S. Cell wall is required for fixation of the
embryonic axis in Fucus zygotes // Science, 1988. 239: 187-190.
Kudlicka K., Kuras M., Rodkiewicz B. The ultrastructure of the nucellus and the
gametophyte in developing ovules of Stellaria media // Acta Med. Polon., 1980. 21(4):
363-364.
Kudlicka K., Kuras M., Rodkiewicz B. Embryo sac development in Stellaria media
// Acta Soc. Bot. Polon., 1981. 50(1-2): 143146.
Kuijt J. The Biology of Parasitic Flowering Plants. Los Angeles: Berkeley, 1969:
1-246.
Kuiper D., Schuit J., Kuiper P.J.C. Effects of internal and external cytokinin
concentration on root growth and shoot to ratio of Plantago major ssp. pleiosperma at
different nutrient conditions // Plant Soil, 1988. 3(1): 231-236.
Kurtz E.B., Miramon A. A system for the study of fat synthesis in flax embryos
// Plant Physiol., 1957. 37: 32.
Kutschera U. The current status of the acid-growth hypothesis // New Phytol., 1994.
126(10): 549-569.
Kvaale A., Olsen O.A. Rates of cell division in developing barley endosperm // Ann.
Bot. (London), 1986. 57: 829-833.
Kyle D.J., Styles E.D. Development of aleurone and sub-aleurone layers in maize
// Planta, 1977. 137: 185-193.
Литература
771
Labarca C, Kroh M., Loewus F. The composition of stigmatic exudate from Lilium
longiflorum. Labelling studies with myo-inositol, d-glucose and L-proline // Plant
Physiol., 1970. 46: 150-156.
Lackie S., Yeung E.C. Zygotic embryo development in Daucus carota // Canad. J.
Bot., 1996. 74: 990-998.
Lado P., Rasi-Caldogno F., Colombo R. Acidification of the medium assotiated with
normal and fusicoccin induced seed germination // Plant Physiol. (Copenhagen), 1975.
34(4): 359-364.
Lagerberg T. Studien iiber die Entwicklungsgeschichte und systematische Stellung von
Adoxa moschatelina L. // Kongl. Svenska Vetenskapsakad. Handl. N. S., 1909. 44(4):
1-86.
Laidman D.L. Control mechanisms in the mobilization of stored nutrients in
germinating cereals // The Physiology and Biochemistry of Seed Development, Dormancy
and Germination. Amsterdam: Elsevier Biomed, 1982: 371-392.
Lakshmanan K.K. Embryological studies ih the Bromeliaceae. I. Lindmannia penduflora
(C.H.Wright) Stapf // Proc. Indian Acad. Sci., 1967. 65(2): 49-55.
Lakshmanan K.K. Potamogetonaceae // Bull. Indian Natl. Sci. Acad., 1970. 41:
348-351.
Lakshmanan K.K. Studies on the embryo development of Commelina benghalensis. III.
Cotyledons // Phytomorphology, 1978. 28: 253-261.
Lammeren A.A.M.van. Developmental morphology and cytology of the young maize
embryo (Zea mays L.) // Acta Bot. Neerl., 1986a. 35: 169-188.
Lammeren A.A.M.van. A comparative ultrastructural study of the megagametophytes
in two strains of Zea mays L. before and after fertilization. Wageningen: Agricult. Univ.,
1986b: 1-37.
Lammeren A.A.M.van. Structure and function of the microtubular cytoskeleton during
endosperm development in wheat: an immunofluorescence study // Protoplasma, 1988.
146: 18-27.
Lammeren A.A.M.van, Schel J.H.N. Embryogenesis in Zea mays L. Development of
structure and polarity during proembryo formation // Proc. VII Jnt. Cytoembr. Symp.
«Fertilization and Embryogenesis in Ovulated Plants». High Tatra (Rackova dolina),
14-17 June, 1982 / Ed. Erdelska O. Bratislava: Veda, 1983: 283-285.
Lampe L. A microchemical and morphological study of the developing endosperm of
maize // Bot. Gaz., 1931. 91: 337-376.
Land W.J.G. Fertilization and embryogeny in Ephedra trifurca // Bot. Gaz.
(Chicago), 1907. 44: 273-292.
Langdon L.M. Embryogeny of Carya and Juglans, a comparative study // Bot. Gaz.
(Chicago), 1934. 96(1): 93-117.
Larson D.A. Fine-structural changes in the cytoplasm of germinating pollen // Amer.
J. Bot., 1965. 52(2): 139-154.
La Rue CD. Regeneration of endosperm of gymnosperms and angiosperms // Amer.
J. Bot., 1944. 31(8): 45.
La Rue CD. Cultures of the endosperm of maize // Amer.J.Bot., 1949. 36, suppl.
10: 798.
Laux Т., Jiirgens G. Establishing the body plan of the Arabidopsis embryo // Acta
Bot. Neerl., 1994. 43(3): 247-260.
Lawalree A. L'embryology des Lemnaceae. Observation sur Lemna minor L. // Cellule,
1952. 54(3): 305-326.
49*
772
Семя
Lawton J.R.S., Lawton J.R. The morphology of the dormant embryo and young
seedling anatomy of five species of Dioscorea from Nigeria // Proc. Linn. Soc. London,
1967. 178: 153-159.
Le Monnier G. Sur la valeur morphologique de l'albumen chez les Angiosperms // J.
Bot. Agric, 1887. 1: 140-142.
Le Page Degivry M.T. Dormance de graine associee a une immaturite de l'embryon:
etude en culture in vitro chez Magnolia soulangeana Soul. Bod. et Magnolia grandiflora
L. // Planta, 1970. 90(3): 267-271.
Le Page Degivry M.T., Barthe P., Garello G. Involvement of endogenous abscisic
acid in onset and release of Helianthus annuus embryo dormancy // Plant Physiol.,
1990. 92(4): 1164-1168.
Le Page Degivry M.T., Garello G. In situ abscisic acid synthesis. A requirement for
induction of embryo dormancy in Helianthus annus // Plant Physiol., 1992. 98(4):
1386-1390.
Leavitt R.G. Trichomes of the root in vascular cryptogams and angiosperms // Proc.
Boston. Soc. Nat. Hist., 1904. 31(7): 273-307.
Lebegue A. Recherches embryogeniques sur quelques Dicotyledones Dialypetales
// Ann. Sci. Nat. Bot., 1952. Ser.II.,8_8.
Lebegue A. Embryogenie des Oenotheracees. Developpement de l'embryon chez le
Gaura biennis L. // Compt. Rend. Held. Sea. Acad. Sci., 1954. 239(9): 616-618.
Lebegue A. Le Lopezia coronata Audr.; Son embryogenese et sa position systematique
chez les Oenotheracees // Bull. Soc. Bot. France, 1955. 102(9): 503-505.
Lebegue A. Nouveau aspects d'une classification embryologique // Bull. Soc. Bot.
France, 1966. 113(3-4): 129-133.
Lebegue A., Poix R. Le developpement embryonnaire chez l'Urtica urens L. // Bull.
Soc. Bot. France, 1956. 103(9-10): 587-589.
Lee M., Veldboom L., Scanlon M., Myers A., James M., Robertson D. Mutator-
tagged defective kernel mutants as putative QTL for kernel size // Maize Genet. Coop.
Newslett., 1991. 65: 10-11.
Leger L.J. Note sur les germinations anormales d'Acer platanoides // Bull. Soc. Linn.
Normandie, 1890. Ill: 199.
Lehmann-Baerts M. Etude sur les Gnetales — XII. Ovule, gametophyte femelle et
embryogenese chez Ephedra distachya L. // Cellule, 1967. 67: 53^87.
Lending C.R., Kriz A.L., Larkins B.A., Bracker C.E. Structure of maize protein
bodies and immunocytochemical localization of zeins // Protoplasma, 1988. 143: 51-62.
Leroux G., Barabe D., Vieth J. Morphogenese comparee de protocormes du
Cypripedium acaule (Orchidaceae) cultives in vitro avec ou sans sucre // Canad. J. Bot.,
1995. 73(9): 1391-1406.
Lersten N.R. Suspensors in Leguminosae // Bot. Rev., 1983. 49(3): 233-257.
Lewak S., Rychter A., Zarska-Maciejewska B. Metabolic aspects of embryonal
dormancy in apple seeds // Physiol. Veg., 1975. 13(1): 13-22.
Lewis C.E. Studies on some anomalous dicotyledonous plants // Bot. Gaz. (Chicago),
1904. 37: 127-138.
Lewis D. Comparative incompatibility in angiosperms and fungi // Advances Genet.,
1954. 6: 235-246.
Lihnell D. Keimungsversuche mit Pyrolasamen // Symb. Bot. Upsal., 1942. VI(3):
1-37.
Литература •'*
Lijsebettens M. van, Vanderhaeghen R., Montagu M. van. Insertional mutagenesis in
Arabidopsis thaliana: Isolation of a T-DNA-linked mutation that alters leaf morphology
// Theor. Appl. Genet., 1991. 81: 277-284.
Lindsey K., Topping J.F. Embryogenesis: a question of pattern // J. Exp. Bot.,
1993. 44(259): 359-374.
Linskens H.F. Fertilization mechanisms in higher plants // Fertilization — comparative
morphology, biochemistry and immunology. / Eds. C.B. Metz, A. Monray. New York:
Acad. Press, 1969. 4: 189-253.
Linskens H.F. Activation of the ovary // Caryologia, 1973. 25(suppl.): 27-41.
Linskens H.F., Heinen W. Cutinase-Nachwies in Pollen // Z. Bot., 1962. 50(4):
338-347.
Linskens H.F., Spanjers A.W. Changes of the electrical potential in the transmitting
tissue of Petunia styles after cross- and self-pollination // Plant Cell Incomp. Newsl.,
1973. 3: 81-85.
List A.Jr., Steward F.C. The nucellus, embryo sac, endosperm and embryo of
Aesculus and their interdependence during growth // Ann. Bot., N. S. 1965. 29(113):
1-15.
Litts J.C., Colwell G.W., Chakerian R.L., Quatrano R.S. The nucleotide sequence of
a cDNA clone encoding the wheat Em protein // Nucl. Acids Res., 1987. 15: 3607-
3618.
Liu C.-M., Xu Z.-H., Chua N.-H. Auxin polar transport is essential for the
establishment of bilateral symmetry during early plant embryogenesis // Plant Cell, 1993.
5: 621-630.
Liu C.M., Xu Z.H., Chua N.H. In vitro development of early globular stage zygotic
embryos from Brassica juncea // Plant Journal, 1993. 3: 291-300.
Lloyd F.E. The comparative morphology of the Rubiaceae // Mem. Torrey Bot.
Club., 1902. 8: 1-112.
Lo Schiavo F., Giuliano G., Sung Z.R. Characterization of a temperature-sensitive
carrot cell mutant impaired in somatic embryogenesis // Plant Sci., 1988. 54: 157-164.
Loconte H., .Stevenson D. W. Cladistics of the Spermatophyta // Brittonia, 1990.
42: 197-211.
Loconte H., Stevenson D. W. Cladistics of the Magnoliidae // Cladistics, 1991. 7:
267-296.
Loesener Th. Zingiberaceae // Die naturlichen Pflanzenfamilien / Ed. Engler A. 2
Aufl. Leipzig: 1930: 541-650.V. 15.
Loewus F., Labarca C. The nutritional role of pistil exudate in pollen tube wall
formation in Lilium longiflorum. II. Production and utilization of exudate from stigma and
stylar canal // Plant Physiol., 1973. 52: 87-92.
Lopes M.A., Larkins B.A. Endosperm origin, development and function // Plant
Cell, 1993. 5(10): 1383-1399.
Lord E.M., Heslop-Harrison Y. Pollen-stigma interaction in Leguminosae: stigma
organisation and the breeding systems in Vicia faba L. // Ann. Bot. (London), 1984.
54(6): 827-836.
Lord E.M., Kohorn L.N. Gynoecial development, pollination, and the path of pollen
tube growth in the tepary bean, Phaseolus acutifolius // Amer. J. Bot., 1986. 73:
70-78.
Lord E.M., Webster B.D. The stigmatic exudate of Phaseolus vulgaris L. // Bot.
Gaz., 1979. 140: 266-271.
774
Семя
Lorenzi R., Bennici A., Cionini P.G., Alpi A., D'Amato F. Embryo-suspensor
relations in Phaseolus coccineus: cytokinins during seed development // Planta, 1978.
143: 59-62.
Lo Schiavo F., Guiliano G., Sung Z.R. Characterization of a temperature sensitive
carrot cell mutant impaired in somatic embryogenesis // Plant Sci., 1988. 54: 157-164.
Lotsy P. Resultate einer Untersuchung tiber die Embryologie von Gnetum gnemon L.
// Bot. Centralbl., 1898. 75(9): 257-261.
Lott J.N.A. Protein bodies // The Biochemistry of Plants. Vol.1. The Plant Cell.
/ Eds. Stumpf P.K., Conn E.E., Tolbert N.E. New York, London: Acad. Press, 1980.
Lubbock J. Contribution to our knowledge of seedlings. London: Kogan Paul, Trench
Trubner and Co.Ltd., 1892. 1: 1-608, 2: 1-646.
Lubbock J. On seeds and seddlings. London: Kegan Paul, Trench Trubner. 1896:
1-288.
Lubimenko W. Etude spectroscopique des pigments verts des graines meres // Compt.
Rend. Held. Sea. Acad. Sci., 1906. 38560: 1-4.
Luck R. Zur Biologie der heimischen Pirola-Arten // Schrift. Physik.-okonom. Ges.,
1940. 71(2): 300-334.
Lundgvist A. Self-incompatibility in rye. I. Genetic control in the diploid // Hereditas,
1956. 42(3-4): 293-348.
Lundgvist A. Complex self-incompatibility systems in angiosperms // Proc. Roy. Soc.
London. Ser. В., Biol. Sci., 1975. 188: 235-245.
Lutz L. Germinations a trois cotyledons // Bull. Soc. Bot. France, 1911. 58: 488.
Ly Thi Ba. Comparative embryogeny and phylogeny of Ranales and Helobiales. IV.
The conclusions //Rev. Gen. Bot. 1981. 88.(1049-1051): 347-373.
Ly Thi Ba, Guignard J.L., Mestre J.C. Embryogenie des Magnoliacees. Developpement
de l'embryon chez Magnolia grandiflora L. // Compt. Rend. Held. Sea. Acad. Sci.,
1970. 271(15): 1272-1275.
Lyndon R.F. Plant Development. London: Unwin Hyman, 1990: 1-310.
Lyon H.L. Observation on the embryogeny of Nelumbo // Minnesota Bot. Stud.,
1901a. 2(5): 643-655.
Lyon H.L. The phylogeny of cotyledon // Postelsia. The book of the Minnesota
seaside station. 1901b: 57-86.
Lyon H.L. The embryo of the angiosperms // Amer. Naturalist, 1905. 39: 13-34.
Madge M. Spermatogenesis and fertilization in the cleistogamous flowers of Viola
odorata var. praecox // Ann. Bot. (London), 1929. 43(5): 545-577.
MacLeod R.D. Cap formation during the elongation of lateral roots of Vicia faba L.
// Ann. Bot. (London), 1976. 40: 877-885.
MacLeod R.D. The root apical meristem and its margins // Plant Roots: the Hidden
Half / Eds. Waisel Y., Eshel A., Kafkafi U. N.Y, Bales, Hong Kong: Marcel Dekker,
JNC. 1991: 75-103.
MacLeod R.D., McLachlan S.M. The development of a quiescent centre in lateral
roots of Vicia faba // Ann. Bot. (London), 1974. 433: 212-219.
Madhavan R., Gupta S.C. Histochemical studies on postfertilized ovules of Peristrophe
bicalyculata. 1. Total carbohydrates of insoluble polysaccharides // Beitr. Biol. Pflanzen,
1982. 57(2): 309-321.
Mahabale T.S., Biradar N.V. Studies on palms: embryology of Phoenix sylvestris
Roxb. // Proc. Indian Acad. Sci., 1968. 67(2): 77-96.
Литература ''?
Maheswaran G., Williams E.G. Origin and development of somatic embryos formed
directly on immature embryos of Trifolium repens in vitro // Ann. Bot. (London),
1985. 57: 109-117.
Maheswaran G., Williams E.G. Direct secondary somatic embryogenesis from immature
embryos of Trifolium repens cultured in vitro // Ann. Bot. (London), 1986. 56:
619-630.
Maheshwari P. The origin of the haustoria in the ovule of Lobelia // J. Indian Bot.
Soc, 1944. 23: 79-81.
Maheshwari P. An Introduction to the Embryology of Angiosperms. New York:
McGraw-Hill Book Company, 1950: 1-453.
Maheshwari P., Johri B.M. The morphology and embryology of Floerkea proserpinacoides
Willd. with a discussion on the systematic position of the family Limnanthaceae // Bot.
Mag. Tokyo, 1956. 69(820-821): 410-423.
Maheshwari P., Johri B.M., Dixit S.N. The floral morphology and embryology of the
Loranthoideae (Loranthaceae) // J. Madras Univ., 1957. 27: 121-136.
Maheshwari P., Vasil V. Gnetum. New Delhi: Council Sci. Industr. Res. India. 1961.
Maheshwari S.C, Kapil R.N. Some Indian contributions to the embryology of
angiosperms // Phytomorphology, 1966. 16(3): 239-291.
Maheshwari S.C, Baldev B. A contribution to the morphology and embryology of
Commelina forskalai Vahb. // Phytomorphology, 1958. 8(3-4): 277-298.
Maheshwari S.C, Kapil R.N. Morphological and embryological studies on the
Lemnaceae. 2. The endosperm and embryo of Lemna paucicostata // Amer. J. Bot.,
1963. 50: 907-914.
Maheshwari S.C, Khanna P.P. The embryology of Arisaema wallichianum, and the
systematic position of the Araceae // Phytomorphology, 1956. 6(3-4): 379-388.
Mahlberg P.G. Embryogeny and histogenesis in Nerium oleander L. I. Organization
of primary meristematic tissues //Phytomorphology, 1960. 10(2): 118-131.
Maksymowych R. Analysis of Leaf Growth. Cambridge Univ. Press., 1973: 1-109.
Mangelsdorf P.С The inheritance of defective seeds in maize // J. Heredity, 1923.
14: 119-125.
Mansfield S.G., Briarty L.G. Early embryogenesis in Arabidopsis thaliana. II. The
developing embryo // Canad. J. Bot, 1991. 69: 461-476.
Mares D.J., Jeffery C, Norstog K. The differentiation of the modified aleurone of
wheat endosperm: nuclear membrane-mediated endoplasmic reticulum development
// Plant Sci. Lett., 1976. 7: 305-311.
Mares D.J., Norstog K., Stone B.A. Early stages in the development of wheat
endosperm. I. The change from free nuclear to cellular endosperm // Austral. J. Bot.,
1975. 23: 311-326.
Mares D.J., Stone B.A., Jeffery C, Norstog K., Early stages in development of wheat
endosperm. II. Ultrastructural observations on cell wall formation // Austral. J. Bot.,
1977. 25(6): 599-613.
Marilyn A.L.West, Harada J.J. Embryogenesis in higher plants: an overview // Plant
Cell, 1993. 5: 1361-1369.
Marinos N.G. Embryogenesis of the pea (Pisum sativum) II. An unusual type of
plastids in the suspensor cells // Protoplasma, 1970. 71(3): 227-233.
Marsden M.P.F., Meinke D.W. Abnormal development of the suspensor in an
embryo-lethal mutant of Arabidopsis thaliana // Amer. J. Bot., 1985. 72: 1801-1812.
Martens P. Les Gnetophytes. Encyclopedia of Plant Anatomy. Berlin: Gebruder
Borntraeger. 1971. 12.
776
Семя
Martens P. Recherches sur Welwitchia mirabilis — V. Evolution ovulaire et embryogenese
// Cellule, 1973. 70: 165-258.
Martin A.C. The comparative internal morphology of seeds // Amer. Midi.
Naturalist, 1946. 36(3): 573-660.
Martin P.G., Dowd J.M. A phylogenetic tree for some monocotyledons and gymnosperms
derived from protein sequences // Taxon, 1986. 35: 469-475.
Martin P.G., Dowd J.M. Studies of angiosperm phylogeny using protein sequences
// Ann. Missouri Bot. Gard., 1991. 78: 296-337.
Masand P., Kapil R.N. Nutrition of the embryo sac and embryo — a morphological
approach // Phytomorphology, 1966. 16(2): 158-175.
Mascarenhas J.P. The biochemistry of angiosperm pollen development // Bot. Rev.,
1975. 41: 259-314.
Mascarenhas J.P. Molecular mechanisms of pollen tube growth and differentiation
// Plant Cell, 1993. 5: 1303-1314.
Mascarenhas J.P., Machlis L. Chemotropic response of Antirrhinum majus pollen to
calcium // Nature, 1962. 196: 292-293.
Mascarenhas J.P., Machlis L. The pollen tube chemotropic factor from Antirrhinum
majus: bioassay, extraction and partial purification // Amer. J. Bot., 1962. 49: 482-489.
Mass G.I., Heslop-Harrison J. A cytochemical study of DNA, RNA, and protein in
the developing maize anther // Ann. Bot. (London), 1967. 31: 555-572.
Masters M.T. // Flora of Tropical Africa /Ed. Oliver D. Zondon 1886. 1.
Mathur N. The embryology of Limnanthes // Phytomorphology, 1956. 6(1): 41-51.
Matile P. Aleurone vacuoles as lysosomes // Z. Pflanzenphysiol., 1968. 58: 365-
368.
Matthissen A. A contribution to the embryology of Paeonia // Acta Horti Berg.,
1962. 20(2): 57-61.
Matthys-Rochon E. et. al. Male germ unit isolation from three tricellular pollen
species: Brassica oleracea, Zea mays and Triticum aestivum // Plant Physiol., 1987.
83(3): 464-466.
Matthys-Rochon E., Mol R., Heizmann P., Dumas C. Isolation and microinjection of
active sperm nuclei into cells and central cells of isolated maize embryo sacs // Zygote,
1994. 2: 152-157.
Mattsson O., Knox R.B., Heslop-Harrison J., Heslop-Harrison Y. Protein pellicle of
stigmatic papillae as a probable recognition site in incompatibility reaction // Nature,
1974. 247: 298-300.
Matzk F. A novel approach to differentiated embryos in the absence of endosperm
// Sex. Plant Reprod., 1991. 4: 88-94.
Mau S.-L., Raff J., Clarke A.E. Isolation and partial characterisation of components
of Prunus avium L. styles, including an antigenic glycoprotein associated a self-incompatibility
genotype // Planta, 1982. 156: 505-516.
Mauritzon J. Studen iiber die Embryologie der Familien Crassulaceae und Saxifragaceae.
Lund: Gleerupska Univ. Bokhandeln., 1933: 1-152.
Mauritzon J. Die Endosperm—und Embryoentwicklung einiger Acanthaceen // Acta
Univ. Lund., 1934. 30: 1-41.
Mauritzon J. Etwas tiber die Embryologie der Bignoniaceen // Bot. Not., 1935.
60-77.
Mauritzon J. Uber die Embryologie von Marcgravia // Bot. Not., 1939a. 1: 249-255.
Mauritzon J. Contribution to the embryology of the orders Rosales and Myrtales
// Acta Univ. Lund., 1939b. Avd. 2, 35(2): 1-121.
Литература
777
Mayer A.M., Poljakoff-Mayber A. The Germination of Seeds. Oxford: Pergamon
Press, 1989: 1-270.
Mayer U., Buttner G., Jurgens G. Apical-basal pattern formation in the Arabidopsis
embryo: studies on the role of the gnom gene // Development, 1993. 117: 149-162.
Mayer U., Torres Ruiz R.A., Berleth Т., Misera S., Jurgens G. Mutations affecting
body organization in the Arabidopsis embryo // Nature, 1991. 353: 402-407.
McCall M.A. Development, anatomy and homologies in wheat // J. Agr. Res., 1934.
48(4): 283-321.
McCarty D.R., Carson C.B., Stinard P.S., Robertson D.S. Molecular analysis of
viviparous-1: an abscisic acid-insensitive mutant of maize // Plant Cell, 1989. 1:
523-532.
McConchie C.A., Hough Т., Knox R.B. Ultrastructural analysis of the sperm cells of
maize, Zea mays // Protoplasma, 1987. 139: 9-19.
McConchie C.A., Jobson S., Knox R.B. Computer-assisted reconstruction of the male
germ unit in pollen of Brassica campestris // Protoplasma, 1985. 127: 57-63.
McConchie C.A., Jobson S., Knox R.B. The structure of sperm cells in Brassica
// Sexual reproduction in seed plants, ferns and mosses. Proc. 8th Int. Symp. Sex. Plant
Reprod., 20-24 August 1984. Wageningen: PUDOC, 1985: 147-148.
McConchie C.A., Russell S., Dumas C, Knox R.B. Quantitative cytology of the
mature sperm cells of Brassica campestris and B.oleracea // Planta, 1987. 170: 446-452.
McDaniel C.N., Poethig R.S. Cell-lineage patterns in the shoot apical meristem of the
germinating maize embryo // Planta, 1988. 175: 13-22.
McGahan M.W. Studies on the seed of banana. I. Anatomy of the seed and embryo
of Musa balbisiana // Amer. J. Bot., 1961. 48(3): 230-238.
Mcjlrath W.J., Erogle D.R., Dunlap A.A. Persistance of 2,4 D-stimulus in cotton
plants with reference to its transmission to the seed // Bot. Gaz., 1950. 112(4): 511-518.
McKenney R.E.B. Observations on the development of some embryo-sac // Contr.
Bot. Lab. Univ. Pennsylvania, 1898. 11,1, New ser., 5.
McVeign J. Regeneration in Crassula multicava // Amer. J. Bot., 1938. 25: 7-11.
Medgyesy P., Pay A., Marton L. Transmission of paternal chloroplasts in Nicotiana
// Molec. Gen. Genet., 1986. 204: 195-199.
Medvedev S.S. The nature of polarity in plants // Biologija (Vilnius), 1994. 3:
99-106.
Medvedev S.S., Markova I.V. How can the electrical polarity of axial organs regulate
plant growth and IAA transport // Physiol. Plant. (Copenhagen), 1990. 78(1): 38-42.
Meeuse A.D.J. , Ott E.C.J. The occurrence of chlorophyll in Nelumbo seeds // Acta
Bot. Neerl., 1962. 11(2): 227-228.
Mehra K.R., Kulkarni A.R. Embryological studies in Bignoniaceae // Phytomorphology,
1985. 35(3-4): 239-251.
Meinke D.W. Embryo-lethal mutants of Arabidopsis thaliana: evidence for gametophytic
expression of the mutant genes // Theor. Appl. Genet., 1982. 63: 381-386.
Meinke D.W. Embryo-lethal mutants of Arabidopsis thaliana: analysis of mutants with
a wide range of lethal phases // Theor. Appl. Genet., 1985. 69: 543-552.
Meinke D.W. Embryo-lethal mutants and the study of plant embryo development
// Oxford Surv. Plant Molec. Cell. Biol., 1986. 3: 122-165.
Meinke D.W. Perspectives on genetic analysis of plant embryogenesis // Plant Cell,
1991a. 3(9): 857-866.
778
Семя
Meinke D.W. Genetic analysis of plant development // Plant Physiology: A Treatise,
Vol. 10, Growth and Development. / Eds. Steward F.C., Bidwell R.G.S. New York:
Acad. Press, 1991b: 437-490.
Meinke D.W. Embryonic mutants of Arabidopsis thaliana // Developm. Genet.,
1991c. 12: 382-392.
Meinke D.W. A homeotic mutant of Arabidopsis thaliana with leafy cotyledons
// Science, 1992. 258: 1647-1650.
Meinke D.W. Seed development in Arabidopsis thaliana // Arabidopsis. / Eds. E.
M. Meyerowitz, C.R. Somerville. Cold Spring Harber, N-Y: Cold Spring Harber
Laboratory Press, 1994: 253-295.
Meinke D.W. Molecular genetics of plant embryogenesis // Annual Rev. Plant
Physiol. Plant Molec. Biol., 1995. 46: 369-394.
Meinke D.W., Franzmann L.M., Nickle T.C., Yeung E.C. Leafy cotyledon mutants
of Arabidopsis // Plant Cell, 1994. 6(6): 1049-1064.
Meinke D.W., Patton D., Shellhammer J., Reynolds-Duffer A., Franzmann L.,
Scheider Т., Robinson K. Developmental and molecular genetics of embryogenesis in
Arabidopsis thaliana // The Molecular Basis of Plant Development. /Ed. Goldberg R.
New York: Alan Liss, 1989: 121-132.
Meinke D.W., Sussex I.M. Embryo-lethal mutants of Arabidopsis thaliana: a model
system for genetic analysis of plant embryo development // Developm. Biol., 1979. 72:
50-61.
Meinke D.W., Sussex I.M. Isolation and characterization of six embryo-lethal mutants
of Arabidopsis thaliana // Developm. Biol., 1979. 72: 62-72.
Mendes A.J.T. Cytological observations in Coffea. VI. Embryo and endosperm
development in Coffea arabica L. // Amer. J. Bot., 1941. 28(9): 784-789.
Mericle L.W., Mericle R.P. Confounding the quandary of zygotic DNA // Barley
Genet. Newslett., 1973. 3 : 39-42.
Merkle S.A., Parrott W.A., Flinn B.S. Morphogenic aspects of somatic embryogenesis
// In vitro Embryogenesis in Plants. /Ed. Thorpe T.A. Dordrecht a. o.: Kluwer Acad.
Publ., 1995: 155-203.
Merrell W.D. A contribution to the life history of Silphium // Bot. Gaz., 1900. 29:
99-133.
Merry J. Studies on the embryo of Hordeum sativum. I. The development of the
embryo // Bull. Torrey Bot. Club., 1941. 68(8): 585-598.
Mestre J.C. La signification phylogenetique de l'embryogenie // Rev. Gen. Bot.,
1967. 74(877): 273-324.
Mestre J.C. Embryogenie et phylogenie des vegetaux superieurs // Ann.Biol., 1981.
20(1): 61-96.
Mestre J.C, Guignard J.-L. La mise en place des meristemes caulinaire et raduculaire
au cours de l'embryogenese du Cerastium pumilum Curt. // Bull. Soc. Bot. France,
1967. 114(9): 387-396.
Mestre J.C, Vannereau A. La nutrition de l'embryon au cours de l'embryogenese des
Angiospermes // Bull. Soc. Bot. France, Actual. Bot., 1980. 3/4: 39-50.
Metcalf C.R. An interpretation of the morphology of a single cotyledon of Ranunculus
ficaria based on embryology and seedling anatomy // Ann. Bot. (London), 1936. 50:
103-120.
Meunier A. Le developpement seminal dans le genere Veronica // Cellule, 1897. 12:
297-333.
Литература
779
Meyen F.J.F. Noch einige Worte iiber den Befruchtungsakt und die Polyembryonie
bei den hoheren Pflanzen. Berlin: Haude und spenersche Buchhaus, 1840: 1-50.
Meyer В., Stubbe W.F. Das Zahlenverhalthis von mutterlichen und vaterlichen
Plastiden in den Zygoten von Oenotera erythrosepala Borbas (syn. O. lamarckiana)
// Ber. Deutsch. Bot. Ges., 1974. 87: 29-38.
Meyerowitz E.M. Arabidopsis thaliana // Annual Rev. Genet., 1987. 21: 93-111.
Micola I., Virtanen M. Regulation of pH in the starchy endosperm of barley grain
during reserve protein mobilization // Abh. Acad. Wiss. DDR, Abt. Math., Natur.,
Techn., 1981. 5: 257-258.
Miflin B.J., Burgess S.R., Shewry P.R. The development of protein bodies in the
storage tissues of seeds: subcellular separations of homogenases of barley, maize, and
wheat endosperms and of pea cotyledons // J. Exp. Bot., 1981. 32: 199-219.
Miki-Hirosige H. Tropism of pollen tubes to the pistils// Pollen Physiology and
Fertilisation. / Ed. Linskens H.F. Amsterdam: North-Holland Publ. Company, 1964:
152-158.
Miki-Hirosige H., Hoek J.H.S., Nakamura S. Secretions from the pistil of Lilium
longiflorum // Amer. J. Bot., 1987. 74: 1709-1715.
Miki-Hirosige H., Nakamura S. Process of metabolism during pollen-tube wall
formation // J. Electron Microscopy, 1982. 31(1): 51-62.
Mikus M.M., Bobak M., Lux A. Structure of protein bodies and elemental composition
of phytin from dry germ of maize (Zea mays L.) // Bot. Acta, 1992. 105: 26-33.
Miller A.L., Gow N.A.R. Correlation between profile of ion-current circulation and
root development // Physiol. Plant. (Copenhagen), 1989a. 75(1): 102-108.
Miller A.L., 'Gow N.A.R. Correlation between root-generated ionic currents, pH,
fusicoccin, indoleacetic acid, and growth of the primary root of Zea mays // Plant
Physiol., 1989b. 89(4): 1198-1206.
Miller E.C Development of the pistillate spikelet and fertilization in Zea mays L.
// J. Agr. Res., 1919. 18(5): 255-293.
Miller E.W. On the occurrence of schizocotyly in certain Ranunculaceous seedlings
// Trans. Proc. Bot. Soc. Edinburgh., 1927-1931. 30: 21.
Mirza J.I. The effect of light and gravity on the horizontal curvature of roots of
gravitropic and agravitropic Arabidopsis thaliana // Plant Physiol., 1987. 83(1): 118-
120.
Miyake K. The spermatozoid of Ginkgo // J. Appl. Microscop., 1903. 5(5).
Miyamoto K., Kamisaka S. Stimulation of Pisum sativum epicotyl elongation by
gibberellin and auxin. Different effects of two hormones on osmoregulation and cell walls
// Physiol. Plant. (Copenhagen), 1988. 74: 457-466.
Miyamura S., Kuroiwa Т., Nagata T. Disappearance of plastid and mitochondrial
nucleoids during the formation of generative cells of higher plants revealed by fluorescence
microscopy // Protoplasma, 1987. 141: 149-159.
Miyazaki S., Shirakawa H., Nakada K., Honda Y. Essential role of inositol 1,4,5,-
9-1- 9-I- Э 4-
triphosphate receptor /Ca release channel in Ca waves and Ca oscillations at
fertilization of mammalian eggs // Developm. Biol., 1993. 158: 62-78.
Mogensen H.L. Syncotyly in Quercus arizonica // Amer. J. Bot., 1970. 57(101):
1207-1210.
Mogensen H.L. Fine structure and composition of the egg apparatus before and after
fertilization in Quercus gambelii: the functional ovule // Amer. J. Bot., 1972. 59(9):
931-941.
780
Семя
Mogensen H.L. Fine structure of the unfertilized abortive egg apparatus in Quercus
gambelii// Phytomorphology, 1975. 25(1): 19-30.
Mogensen H.L. Pollen tube-synergid interactions in Proboscidea lousianica (Martyniaceae)
// Amer. J. Bot., 1978a. 65(9): 953-964.
Mogensen H.L. Synergids of Proboscidea louisianica (Martyniaceae) before fertilization
// Phytomorphology, 1978b. 28(1): 114-122.
Mogensen H.L. Double fertilization in barley and the cytological explanation for
haploid embryo formation, embryoless caryopses, and ovule abortion // Carlsberg Res.
Comm., 1982. 47: 313-354.
Mogensen H.L. Juxtaposition of the generative cell and vegetative nucleus in the
mature pollen grain of Amaryllis (Hippeastrum vitatum) // Protoplasma, 1986. 134(2/3):
67-72.
Mogensen H.L. Exclusion of male mitochondria and plastids during syngamy as a
basis for maternal inheritance // Proc. Natl. Acad. Sci. USA, 1988. 85: 2594-2597.
Mogensen H.L. The male rerm unit: concept, composition, and significance // Int.
Rev. Cytol., 1992. 140: 129-147.
Mogensen H.L., Holm P.B. Dynamics of nuclear DNA quantities during zygote
development in barley // Plant Cell, 1995. 7: 487-494.
Mogensen H.L., Leduc N., Matthys-Rochon E., Dumas C. Nuclear DNA amounts
in the egg and zygote of maize (Zea mays L.) // Planta, 1996.
Mogensen H.L., Rusche M.L. Quantitative ultrastructural analysis of barley sperm:
occurrance and mechanism of cytoplasm and organelle reduction and the question of sperm
dimorphism // Protoplasma, 1985. 128(1): 1-13.
Mogensen H.L., Suthar H.K. Ultrastructure of the egg apparatus of Nicotiana
tabacum (Solanaceae) before and after fertilization // Bot. Gaz, (Chicago), 1979.
140(2): 168-179.
Mogensen H.L., Wagner V.T. Association among components of the male germ unit
following in vivo pollination in barley // Protoplasma, 1987. 138: 161-172.
Mohan Ram H.Y. Post-fertilization studies in the ovule of Ruellia tuberosa // Lloydia.,
1960a. 23(1): 21-27.
Mohan Ram H.Y. The development of the seed of Andrographis serpyllifolia
// Amer. J. Bot., 1960b. 47(3): 215-219.
Mohan Ram H.Y. Post-fertilization development of the ovule in Barleria cristata
// J. Indian Bot. Soc, 1962. 41(2): 288-296.
Mohan Ram H.Y., Wadhi M. Embryology and the delimination of the Acanthaceae
// Phytomorphology, 1964. 14(3): 388-413.
Mohana Rao P.R., Guignard J.-L., Duret S. An ultrastructural study of perisperm
and endosperm in Silene alba Miller E.H.L. Krause // Bull. Soc. Bot. France, 1988,
135(2): 123-130.
Mohr H. Pattern specification and realization in photomorphogenesis // Enc. Plant
Physiol. New Ser., 1983. 16A: 336-357.
Mohr H., Peters E. Der Phototropismus und das lichtabhangige Langenwachstum des
Hypokotyls von Sinapis alba L. // Planta, 1960. 55(6): 637-646.
Mohrbutter C. Embryologische Studien an Loganiaceen // Planta, 1937. 26(1):
64-80.
Mol R., Matthys-Rochon E., Dumas C. In vitro culture of fertilized embryo sacs of
maize. Zygotes and two-celled proembryos can develop into plants // Planta, 1993. 189:
213-217.
Литература
781
Mol R., Matthys-Rochon E., Dumas C. The kinetics of cytological events during
double fertilization in Zea mays L. // Plant Journal, 1994. 5(2): 197-206.
Monnier M. Comparaison du developpement des embryons immatures de Capsella
bursa-pastoris, in vitro et in situ // Bull. Soc. Bot. France, 1968. 115: 15-29.
Monnier M. Culture in vitro de l'embryon immature de Capsella bursa-pastoris
Moench.(l) // Rev. Cytol. Biol. Veg., 1976. 39(1-2): 1-120.
Monnier M. Culture of zygotic embryos // In vitro Embryogenesis in Plants. /Ed.
Thorpe T.A. Dirdrecht: Kluwer Acad. Publ., 1995: 117-153.
Monnier M., Leddet C. Sur l'aquisition de la resistance au froid des embryons
immatures de Capsella bursa-pastoris // Compt. Rend. Held. Sea. Acad. Sci., 1978.
287: 615.
Moore R.J. Cytotaxonomic studies in the Loganiaceae. II. Embryology of Polypremum
procumbens L // Amer. J. Bot., 1948. 35(7): 404-410.
Morrison I.N., Kuo J., O'Brien T.P. Histochemistry and fine structure of developing
wheat aleurone cells // Planta, 1975. 123: 105-116.
Morrison I.N., O'Brien T.P. Cytokinesis in the developing wheat grain; division with
and without a phragmoplast // Planta, 1976. 130(1): 57-67.
Morrison I.N., O'Brien T.P., Kuo J. Initial cellularization and differentiation of the
aleurone cells in the ventral region of the developing wheat grain // Planta, 1978.
140(1): 19-30.
Morrison J.W. Fertilization and postfertilization development in wheat // Canad. J.
Bot., 1955. 33(2): 168-176.
Moscatelli A., Tiezzi A., Vignaini R., Cai G., Bartalesi A., Cresti M. Presence of
kinetin in tobacco pollen tube // Sexual Reproduction in Higher Plants. /Eds. Cresti
M., Gori O., Pacini E. Berlin, Heidelberg: Springer-Verlag, 1988: 205-209.
Mottier D.M. Uber das Verhalten der Kerne bei der Entwickslung des Embryosackes
und die Vorgange bei der Befruchtung // Jahrb. Wiss. Bot., 1898. 31: 125-158.
Mottier D.M. Fecondation in plants. Washington: Carnegie Institution 1904: 1-187.
Mottier D.M. The embryology of some anormalous dicotyledons // Ann. Bot.
(London), 1905. 19(76): 447-463.
Mouritzen P., Holm P.B. Chloroplast genome breakdown in microspore cultures of
barley (Hordeum vulgare L.) occurs primarily during regeneration // J. Plant Physiol.,
1994. 144: 586-593.
Moussel B. Structures protoplasmiques au sein de la cavite archegoniale et modalites
de la proembryogenese chez I'Ephedra distachya L. // Rev. Cytol. Biol. Veg., 1977. 40:
73-123.
Moussel B. Double fertilization in the genus Ephedra // Phytomorphology, 1978. 28:
336-345.
Moussel B. Donnees temporalles concernant les diverses phases du cycle de reproduction
sexuee chez I'Ephedra distachya L. // Rev. Cytol. Biol. Veg., 1983. 6: 103-109.
Muchtar N.O., Laidman P.L. Mineral ion transport in the embryos of germinating
wheat (Triticum aestivum) // J. Exp. Bot., 1982. 33(135): 643-655.
Mulcahy G.B., Mulcahy D.L. More evidence on the preponderant influence of the
pistil on pollen tube growth // Biology of Reproduction and Cell Motility in Plants and
Animals. /Eds. Cresti M., Dallai R. Siena: Univ. Siena, 1986: 139-144.
Miiller F. von. Plurality of cotyledons in the genus Persoonia // New Zealand J.
Sci., 1882. 115.
Miiller-Doblies U. Uber die Bliitenstande und Bliiten sowie zur Embryologie von
Sparganium // Bot. Jahrb. Syst., 1969. 89(3): 359-450.
782
Семя
Muller A.J. Embryonentest zum Nachweis rezessiver Letalfaktoren bei Arabidopsis
thaliana // Biol. Zentralbl., 1963. 82: 133-163.
Muller M.L., Barlow P.W., Pilet P.-E. Effect of abscisic acid on the cell cycle in
the growing maize root // Planta, 1994. 195: 10-16.
Mundy J., Chua N.H. Abscisic acid and water-street induce the expression of a novel
rice gene // EMBO J., 1988. 7: 2279-2286.
Munerati O., Costa T. Di alcune forme teratologiche della Beta vulgaris L. e loro
eredita. // Z. Induct. Abstammungs—Vererbungsl., 1934. 66: 463-489.
Murgai P. The development of the embryo in Paeonia — a reinvestigation // Phy-
tomorphology, 1959. 9(3): 275-277.
Murgai P. Embryology of Paeonia together with a discussion on its systematic position
// Plant embryology. New Delhi: Council. Sci. Industr. Res., 1962: 215-223.
Murgia M., Wilms H.L. Three dimensional image and mitochondrial distribution in
sperm cells of Euphorbia dulcis // Plant Sperm Cells as Tools for Biotechnology. /Eds.
Wilms H.J., Keijzer C.J. Wageningen: PUDOC, 1988: 75-79.
Murray A.W., Kirschner M.W. What controls the cell cycle // Scientific American,
1991. 264(3): 34-41.
Murthi S.N. Studies in the Labiatae. II. Contribution to the morphology of Ocimum
adscendens Wind // J. Univ. Bombay, 1946. 14(5): 37-46.
Nagato J. Incorporation of H -uridine and H -leucine during early embryogenesis of
rice and barley in caryopsis culture // Plant Cell Physiol., 1979. 20(4): 765-773.
Nagato Y., Kitano H., Kamijima O., Kikuchi S., Satoh H. Developmental mutants
showing abnormal organ differentiation in rice embryos // Theor. Appl. Genet., 1989.
78: 11-15.
Nagl W. 4096-Ploidie und «Riesenchromosomen» im Suspensor von Phaseolus
coccineus // Naturwiss. Wochenschp., 1962a. 49: 261-262.
Nagl W. Uber Endopolyploidie, Restitutionskernbildung und Kernstrukturen im
Suspensor von Angiospermen und einer Gymnosperme // Osterr. Bot. Z., 1962b. 109:
431-494.
Nagl W. Inhibition of polytene chromosome formation in Phaseolus by polyploid
mitoses // Cytologia, 1970. 35:
Nagl W. The angiosperm suspensor and the mammalian trophoblast: organs with
similar cell structure and function? // Bull. Soc. Bot. France, 1973. mem. Coll.
Morphol.: 289-301.
Nagl W. The Phaseolus suspensor and its polytene chromosomes // Z. Pflanzenphysiol.,
1974. 73(1): 1-44.
Nagl W. Ultrastructural and developmental aspects of autolysis in embryo-susoensors
// Ber. Deutsch. Bot. Ges., 1976a. 89(23): 301-311.
Nagl W. Ultrastructure of the polytene nuclei in the embryo-suspensor of the bean,
Phaseolus coccineus: toothing of cytoplasm and nucleoplasm // J. Biol. Sci., 1976b. 6:
11-17.
Nagl W. Early embryogenesis in Tropaeolum majus L.: ultrastructure of the embryo-
suspensor// Biochem. Physiol. Pflanzen, 1976c. 170(3): 253-260.
Nagl W. «Plastolysomes» — plastids involved in the autolysis of the embryo-
suspensor in Phaseolus // Z. Pflanzenphysiol., 1977. 85(1): 45-51.
Nagl W. Endopolyploidy and polyteny in differentiation and evolution. New York:
North-Holland Publ. Сотр., 1978.
Nagl W. Translocation of putrescine in the ovule, suspensor and embryo of Phaseolus
coccineus// J. Plant Physiol., 1990. 136: 587-591.
Литература
783
Nagl W. The polytene endosperm haustorium of Rhinanthus minor (Scrophulariaceae):
functional ultrastructure // Canad. J. Bot, 1992. 70: 1997-2004.
Nagl W., Kiihner S. Early embryogenesis in Tropaeolum majus L.: diversification of
plastids // Planta, 1976. 133(1): 15-19.
Nair N.C., Narayanan K.R. Studies on the Aristolochiaceae. 2.Contribution to the
embryology of Bragantia wallichii // Lloydia., 1961. 24(2): 199-203.
Nakamura S., Fukushima A., Iwayama H., Suzuki H. Electrotropism of pollen tubes
of Camellia and others plants // Sex. Plant Reprod., 1991. 4: 138-143.
Nakamura S., Ikenara Т., Uchida H., Suzuki Т., Sodmergen. Fluorescence microscopy
of plastid nucleoids and a survey of nuclease С in higher plants with respect to the mode
of plastid inheritance // Protoplasma, 1992. 169: 68-74.
Narang N. The life-history of Stackhousia linariaefolia A.Cunn. with a discussion on
its systematic position // Phytomorphology, 1953. 3(4): 485-493.
Narayana H.S., Rao C.G.P. Floral morphology and embryology of Seetzenia orientalis
Decne. // Phytomorphology, 1963. 13(2): 197-205.
Narayana R. Morphological and embryological studies ih the family Loranthaceae. 2.
Lysiana exocarpi (Behs.) Van Tiegh. // Phytomorphology, 1958a. 8(1-2): 146-168.
Narayana R. Morphological and embryological studies in the family Loranthaceae —
3. Nuytsia floribunda (Labill.) R.Br. // Phytomorphology, 1958b. 8(3-4): 306-323.
Narayanaswamy S. The structure and development of the caryopsis in some Indian
millets. 4. Panicum miliare Lamk. and 1. miliaceum L. // Phytomorphology, 1955a.
12(2): 61-73.
Narayanaswamy S. The structure and development of the caryopsis in some Indian
millets. 5. Echinochloa frumentaceae Link // Phytomorphology, 1955b. 18(5): 161-181.
Narayanaswamy S. Structure and development of the caryopsis in some Indian millets.
IV. Setaria italica // Bot. Gaz., 1956. 118: 112-121.
Nasrallah J.В., Nishio Т., Nasrallah M.E. The self-incompatibility genes of Brassica:
Expression and use in genetic ablation of floral tissues // Ann. Rev. Plant Physiol
1991. 42: 393-422.
Nasrallah M.E., Wallace D.H. Immunogenetics of self-incompatibility in Brassica
oleracea // Heredity, 1967. 22: 519-527.
Nasrallah M.E., Wallace D.H., Savo R.M. Genotype, protein phenotype, relationships
in self-incompatibility in Brassica // Genet. Res., 1972. 17: 151-160.
Nast C.G. The embryogeny and seedling morphology of Juglans regia // Lilloa.,
1941. 6(1): 163-206.
Natesh S., Rau M.A. The embryo // Embryology of Angiosperms. / Ed. Johri B.M.
Berlin a. o.: Springer-Verlag, 1984: 377-443.
Nawaschin S. Ein neues Beispiel der Chalazogamie // Bot. Centralbl., 1895. 63(12):
23-25.
Nawaschin S. Uber das Verhalten der Pollenschlauches bei der Ulme. // Bull.
l'Acad. Sci. St. Petersbourg, 1898a. 8(5): 345-359.
Nawaschin S. Resultate einer Revision der Befruchtungsvorgange bei Lilium martagon
und Fritillaria tenella // Bull. Acad. Imp. Sci. St. Petersbourg, 1898b. 9(4): 377-382.
Nawaschin S. Uber die Befruchtungsvorgange bei einigen Dicotyledonen // Ber.
Deutsch. Bot. Ges., 1900. 18(5): 224-230.
Nawaschin S. Uber das selbststandige Bewegungsvermogen der Spermakerne bei
einigen Angiospermen // Osterr. Bot. Z., 1909. 59(12): 457-467.
Nawaschin S. Noheres uber die Bildung der Spermakerne bei Lilium martagon
// Ann. Jard. Bot. Buitenzorg, 1910. 3, Suppl.2: 871-904.
784
Семя
Nawaschin S., Finn W. Zur Entwicklungsgeschichte der Chalazogamen, Juglans regia
und Juglans nigra // Mem. Acad. Sci. St-Petersbourg, 1913. 31(9): 1-59.
Netolitzky F. Anatomie der Angiospermen-Samen // Handb. Pflanzenanat., 1926. 10:
1-364.
Nettancourt D.de. Incompatibility in Angiosperms. Berlin, Heidelberg, New York:
Springer-Verlag, 1977: 1-230.
Nettancourt D.de, Devreux M., Bozzini A., Cresti M., Pacini E., Sarfatti G.
Ultrastructural aspects of self-incompatibility mechanism in Lycopersicon peruvianum .
// J. Cell Sci., 1973. 12: 403-419.
Neuffer M.G., Sheridan W.F. Defective kernel mutants of maize. I. Genetic and
lethality studies // Genetics, 1980. 95: 929-944.
Newcomb W. The development of the embryo sac of sunflower Helianthus annuus
after fertilization // Canad. J. Bot, 1973. 51(5): 879-890.
Newcomb W. The development of cells in the coenocytic endosperm of the African
blood lily Haemanthus katherinae // Canad. J. Bot, 1978. 56(5): 483-501.
Newcomb W., Fowke K.C. Stellaria media embryogenesis: the development and
ultrastructure of the suspensor // Canad. J. Bot, 1974. 52(3): 607-614.
Nicolosi-Roncati F. La formazione dell'endosperma nell Anona cherimolia // Bull.
Soc. Bot. Ital., 1903. 4: 115-117.
Nieuwdorp P.J. Electron microscopic structure of the epithelial cells of the scutellum
of barley, I. The structure of the epithelial cells before germination // Acta Bot. Neerl.,
1963. 12(3): 295-301.
Nieuwdorp P.J., Buys M.C. Electron microscopic structure of the epithelial cells of
the scutellum of barley. II. Cytology of the cells during germination // Acta Bot. Neerl.,
1964. 13(4): 59-65.
Nijalingappa B.H.M. Embryological studies in Haloragis micrantha // Phytomorphology,
1975. 25(2): 146-155.
Nijalingappa B.H.M., Devaki N. Embryological studies in Diplacrum caricinum R.Br.
// Beitr. Biol. Pflanzen, 1978. 54(2): 215-225.
Nijalingappa B.H.M., Devaki N. Endosperm of Scleria foliosa Hochstetter ex A.
Richard. // Curr. Sci., 1979. 48(10): 451-452.
Nijalingappa B.H.M., Tejavathi D.H. Embryo development in Scirpus mucronatus L.
// Curr. Sci., 1977. 46(3): 84-85.
Nikiticheva Z.I. Embryological features of some Piperales // Acta Soc. Bot. Polon.,
1981. 50(1-2): 329-332.
Nikiticheva Z.I. The suspensor structure in some angiosperms // Proc. VII Int.
Cytoembr. Symp. «Fertilization and Embryogenesis in Ovulated Plants» High Tatra
(Rackova dolina), June 14-17, 1982. Bratislava: Veda, 1983: 279-282.
Nishimura G. Comparative morphology of Cattleya and Phalaenopsis (Orchidaceae)
seedlings // Bot. Gaz., 1981. 142(3): 360-365.
Nishimura G. Comparative morphology of cotyledonous orchid seedlings // Lindleyana,
1991. 6(3): 140-146.
Nogler G.A. Gametophytic apomixis // Embryology of Angiosperms. /Ed. Johri
B.M. Berlin a. o.: Springer-Verlag, 1984: 476-518.
Noguti Y., Oka U,, Otuka T. Studies of polyploids in Nicotiana induced by the
treatment with colchicine. II. Growth rate and chemical analysis of diploid and its
autotetraploid in Nicotiana rustica and N.tabacum // Jap. J. Bot., 1940. 10: 343-364.
Литература
785
Nomura K., Komamine A. Identification and isolation of single cells that produce
somatic embryos at a high frequency in carrot suspension culture // Plant Physiol., 1985.
79: 988-991.
Nomura K., Komamine A. Polarized DNA synthesis and cell division in cell clusters
during somatic embryogenesis from single carrot cells // New Phytol., 1986. 104: 25-32.
Norner C. Beitrag zur Embryoentwicklung der Gramineen. Ph. Diss. Regensburg,
1881: 1-35.
Norstog K. Morphology of coleoptile and scutellum in relation to tissue culture
responses // Phytomorphology, 1969(1970). 19(3); 235-241.
Norstog K. Early development of the barley embryo: fine structure // Amer. J. Bot.,
1972. 59(2): 123-132.
Nougarede A., Remebour J. Extension cellulaire, division cellulaire et niveaux de
ploidie des cellules corticales de l'epicotyle du pois au cours de l'elongation // Canad. J.
Bot, 1980. 58(4): 486-501.
Nuccitelli R., Jaffe L.F. The pulse current pattern generated by developing fucoid
eggs // J. Cell Biol., 1975. 64(4): 636-643.
Nuccitelli R., Jaffe L.F. Current pulses involving chloride and potassium efflux relive
excess pressure in Pelvetia embryos // Planta, 1976. 131: 315-320.
O'Brien T.P., Thimann K.V. Observation on the fine structure of oat coleoptile. 3.
Correlated light and electron microscopy of the vascular tissues // Protoplasma, 1967.
63(4): 443-478.
Obroucheva N.V. Early germination: growth initiation and role of water // Fourth
International Workshop on Seeds: Paris. Univ. P. et M. Curie, 1993. 1: 275-280.
Oehler E. Entwicklungsgeschichtlich-zytologische Untersuchungen an einigen
saprophytischen Gentianaceen // Planta, 1927. 3(4): 641-733.
Okada K., Keda J., Komaki M.K., Bell C.J., Shimura Y. Requirement of the auxin
polar transport system in early stages of Arabidopsis floral bud formation // Plant Cell,
1991. 3: 677-684.
Okamoto A., Katsumi M., Nojiri H., Murofushi N., Okamoto H. The relationship
between levels of endogenous gibberellins and the response of Vigna hypocotyls to
exogenous indole-3-acetic acid // Plant Cell Physiol., 1995. 36(1): 165-171.
Olney H.O., Pollock B.M. Studies of the rest period. II. Nitrogen and phosphorous
changes in the embryonic organs of after-ripening cherry seed // Plant Physiol., 1960.
35(4): 970-975.
Olsen O.A., Krekling T. Grain development in normal and high lysine barley
// Hereditas, 1980. 93: 147-160.
Olszewska M.J., Gabara B. Recherches sur les cytocineses dans l'endosperme d'Iris
pseudoacorus et d'Iris sibirica. I. Les cytocineses au cours du developpement de
l'endosperme // Acta Soc. Bot. Polon., 1966. 35(4): 557-573.
Onderdonk I.J., Ketcheson J.W. A standartization of terminology for the morphological
description of corn seedlings // Canad. J. Plant Sci., 1972. 52(6): 1003-1006.
Ono T. Embryologie der Liliaceae, mit besonderer Rttcksicht auf die Endospermbildung.
I. Melanthioideae und Aletroideae // Sci. Rep. Tohoku Imp. Univ., Ser. 4, Biol., 1929.
4(2): 381-393.
Oparka K.J., Harris N. Rice protein body formation: all types are initiated by dilation
of the endoplasmic reticulum // Planta, 1982. 154: 184-188.
Opik H. Development of cotyledon cell structure in ripening Phaseolus vulgaris seeds
// J. Exp. Bot., 1968. 19(58): 64-75.
5Q-828
786
Семя
Orsenigo M. Modificazioni strutturali dei plastidi in semi germinanti. Osservazioni sui
cotiledoni di Citrus nobilis x C.aurantium amara pumila e sull endosperma di Ricinus
communis // Giorn. Bot. Ital., 1964. 71(1-2): 43-56.
Osterbye U. Self-incompatibility in Ranunculus acris L. // Hereditas, 1975. 80:
91-112.
Ottaviano E., Mulcahy D.L. Genetics of angiosperm pollen // Advances Genet.,
1989. 26: 1-64.
Ottaviano E., Petroni D., Ре М.Е. Gametophytic expression of genes controlling
endosperm development in maize // Theor. Appl. Genet., 1988. 75: 252-258.
Ouedrago O. Contribution a l'etude de quelques phanerogames parasites des cultures
au Burkina Faso: incidence, biologie et methodes de lutte. These Doct., Paris: Univ.
Pierre et Marie Curie,. 1995: 1-95.
Overton E. Beitrag zur Kenntniss der Entwicklung und Vereinigung der Geschlecht-
sprodukte bei Lilium martagon. Zurich: 1891.
Overvoorde P.J., Grimes H.D. The role of calcium and calmodulin in carrot somatic
embryogenesis // Plant Cell Physiol., 1994. 35(2): 135-144.
Pace L. The gametophytes of Calopogon // Bot. Gaz. (Chicago), 1909. 48: 126.
Pace L. Apogamy in Atamosco // Bot. Gaz. (Chicago), 1913. 56: 371-394.
Pacini E. Pollen-stigma interactions in plants with gametophytically controlled self-
incompatibility // Phytomorphology, 1981. 31: 175-180.
Pacini E., Simoncioli C, Cresti M. Ultrastructure of nucellus and endosperm of
Diplotaxis erucoides during embryogenesis // Caryologia, 1975(1976). 28(4): 525-538.
Padmanabhan D. Nymphaeaceae // Bull. Indian Natl. Sci. Acad., 1970. 41: 60-62.
Padmanabhan D. Embryogenesis in Cocos nucifera L. A new interpretation // J. Swamy
Bot. CI., 1993a. 10: 169-171.
Padmanabhan D. Dicot and monocot embryos. A comparative study // J. Swamy
Bot. CI., 1993b. 10: 173-182.
Padmanabhan D. Tracing the shoot apex in angiosperm embryos // Advances in
Botany. /Ed. Mukerji K.G. New Delhi: Aph Publ. Corporation, 1996: 39-51.
Paetow W. Embryologische Untersuchungen on Taccaceen, Meliaceen und Dilleniaceen
// Planta, 1931. 14: 441-470.
Pajak M. Development of embryo and chromosome mosaicism in Rudbeckia bicolor
Nutt // Abstr. «Fertilization and embryogenesis in ovulated plants». High Tatra
(Rackova dolina), Czechoslovakia, June 14-17. 1982: 52.
Pajak M. Development of embryo and chromosome mosaicism in Rudbeckia bicolor
Nutt. // Proc. VII Int. Cytoembr. Symp. «Fertilization and Embryogenesis in Ovulated
Plants». High Tatra (Rackova dolina), 1982. Bratislava: Veda, 1983: 295-298.
Pajak M. Karyological instability in semigamie Rudbeckia bicolor Nutt //Acta Biol.
Cracov., Ser. Bot., 1985. 27: 39-55.
Palanisamy K., Vivekanandan M. Formation of chloroplast pigments in the chloroembryo
of Dolichos lablab L. // Photosynthetica, 1985. 19(2): 172-176.
Palevitz B.A. Organization of the mitotic apparatus during generative cell division in
Nicotiana tabacum // Protoplasma, 1993. 174: 25-35.
Palevitz B.A. Relationship between the generative cell and vegetative nucleus in pollen
tubes of Nicotiana tabacum // Sex. Plant Reprod., 1993. 6: 1-10.
Palevitz B.A., Cresti M. Cytoskeletal changes during generative cell division and
sperm cell formation in Tradescantia virginiana // Protoplasma, 1989. 150: 54-71.
Palevitz B.A., Liu B. Microfilaments (F-actin) in generative cells and sperm: an
evalution // Sex. Plant Reprod., 1992. 5: 89-100.
Литература
787
Palevitz B.A., Tiezzi A. Organization, composition, and function of generative cell and
sperm cytosceleton // Int. Rev. Cytol., 1992. 140: 149-185.
Paliwal R.L. Morphological and embryological studies in some Santalaceae // Agra
Univ. J. Res., Sci., 1956. 5(1): 193-284.
Palm B.T. Studien iiber Konstruktionstypen und Entwicklungswege des Embryosackes
der Angiospermen. PhD Thesis. Stockholm. 1915.
Palser B.F. Early endosperm development and embryogeny in Cassiope hypnoides
// Trans. Illinois State Acad. Sci., 1951. 44: 51-57.
Panchaksharappa M.G. Embryological studies in some members of the Zingiberaceae
// Plant Embryology. A Symposium CSIR. New Delhi: 1962: 224-238.
Panchaksharappa M.J., Rudramunjappa C.K. Scutellum and endosperm in the
seedlings of Gramineae, a histochemical study // Proc. Indian Acad. Sci., 1975.
13(82/6): 211-217.
Pandey K.K. Evolution of gametophytic and sporophytic systems of self-incompatibility
in Angiosperms // Evolution, 1960. 14: 98-110.
Pandey K.K. A theory of S-gene structure // Nature, 1962. 196: 236-238.
Pandey K.K. Time and site of S-gene action, breeding systems and relationships in
incompatibility // Euphytica, 1970. 19: 364-372.
Pandey K.K. Overcoming incompatibility and promoting genetic recombination in
flowering plants // New. Zealand J. Bot., 1979. 17(4): 645-663.
Pankow H. Histogenetische Studien an den Bliiten einiges Phanerogamen // Bot.
Stud., Jena, 1962. 13: 1-106.
Pankow H., Guttenberg H.von. Vergleichende Studien iiber die Entwicklung monokotyler
Embryonen und Keimpflanzen // Bot. Stud., 1957. 7: 1-39.
Pankow H., Guttenberg H. Studien iiber die Anlage der Achselknospen und
Blattprimordien bei Gramineen // Planta, 1959. 52(6); 629-643.
Parameswaran N. A contribution to the embryology of Theriophonum minutum
// Proc. Indian Acad. Sci., 1959. 50(1): 15-25.
Pare J. Example of the use of computers to study the variability of seed development
of a parasitic weed: Striga hermonthica (Del.) Benth. (Scrophulariaceae) after treatment
by herbicide // 5th Biothermokinetics Workshop, Bordeaux (France). 1992: 173-176.
Pare J. Resistance to herbicide (2,4 D) of Striga hermonthica (Scrophulariaceae) in
relation to embryonic development // Studies on Embryology and Reproduction of
Angiosperms. / Ed. Czapik R. Polish Botanical Studies; Polish Acad. Sci., 1994: 51-59.
Pare J., Bugnicourt M., Raynal-Roques A., Salle G. Embryological investigations of
the development of the parasitic weed Striga hermonthica (Del.) Benth., Scrophulariaceae
// Proc. 5th Int. Symp. Parasitic Weeds, Nairobi, Kenya. /Eds. Ransom J.K.,
Musselman L.J., Worsham A.D., Parker С 1991: 523-524.
Pare J., Raynal-Roques A. The genus Striga (Scrophulariaceae): taxonomy, geography,
distribution; first embryological results in Striga hermonthica (Del.) Benth. scourge of
food crops in tropical Africa, with special reference to action of an herbicide on seed
development // Acta Biol.Cracov., Ser.Bot., 1992. 34: 27-35.
Pare J., Raynal-Roques A., Salle G. Striga hermonthica (Del.) Benth., Scrophulariaceae,
parasitic weed of food crops in tropical Africa. New embryological aspects //V Conf.
Plant Embryologists Poland a. Czechoslovakia. Torun-Bachotek, Pologne. 1991.
Pare J., Salle G., Raynal-Roques A., Ouedraogo O., Dembele В., Tuquet C. How
embryology can help agronomists to improve herbicide treatments against Striga hermonthica
and Striga aspera // Int. Workshop «Parasitic plants: Biology and Resistance». 1995: 22.
50*
788
Семя
Pare J., Traore D., Vincent C, Stewart R.K. Larval feeding of Smicronyx spp.
(Curculionidae) on Striga hermonthica (Srophulariaceae): an histological study. 1996.
Pasteur L. De la dissymetrie moleculaire des produits organiques naturels // Leon
professee devant la Societe chimique de Paris, 1860.
Patil J.A. The culture in vitro of immature embryos of okra (Abelmoschus esculentus)
// Indian J. Plant Physiol., 1966. 9(1): 59-65.
Patton D.A., Franzmann L.H., Meinke D.W. Mapping genes essential for embryo
development in Arabidopsis thaliana // Molec. Gen. Genet., 1991. 227: 337-347.
Patton D.A., Meinke D.W. Ultrastructure of arrested embryos from mutants of
Arabidopsis thaliana // Amer. J. Bot., 1990. 77(5): 653-661.
Paulson I.W. Embryogeny and caryopsis development of Sorghum bicolor Moench.
// Crop. Sci., 1969. 9(1): 97-102.
Pearson H.H.W. Further observations on Welwitschia // Philos. Transact. Royal
Soc. London (B), 1909. 200: 331-402.
Pearson H.H.W. Gnetales. New York: Cambridge, 1929: 1-194.
Pennell R.I., Geltz N.R., Korner E., Russell S.D. Production and partial
characterization of hybridoma antibodies elicited to the sperm of Plumbago zeylanica // Bot.
Gaz., 1987. 148: 401-406.
Perata P., Picciarelli P., Alpi A. Pattern of variations in abscisic acid content in
suspensor, embryos, and integuments of developing Phaseolus coccineus seeds // Plant
Physiol., 1990. 94: 1776-1780.
Percival J. The wheat plant. London, 1921: 1-463.
Perdue R.E. Synopsis of Rudbeckia subgenus Rudbeckia // Podora, 1957. 59(708):
289-300.
Perdue R.E. The somatic chromosomes of Rudbeckia and related genera of the
Compositae // Contrib. Gray Herbarium Harvard Univ., 1959(1960). 185, 186: 129-
162.
Periasamy K. The ruminate endosperm: development and types of rumination // Plant
embryology. New Delhi: Council Sci. a. Industr. Res., 1962: 61-74.
Periasamy K. A new approach to the classification of angiosperm embryos // Proc.
Indian Acad. Sci., 1977. 86(1): 1-12.
Periasamy K., Vivekanandan M. Photosynthesis in the chloroembryo of Cyamopsis
tetragonaloba Taub. // Ann. Bot. (London), 1981. 47(6): 793-797.
Pernollet Y.C. Les corpusculus proteiques des graines, stade transitoire de vacuoles
specialesees // Physiol. Veg., 1982. 20(2): 259-276.
Peterson R.L., Scott M.G., Miller S.L. Some aspects of carpel structure in Caltha
palustris (Ranunculaceae) // Amer. J. Bot., 1979. 66: 334-342.
Petru E. Development of embryoids in carrot root callus culture (Daucus carota L.)
// Biol. Plant, 1970. 12: 1-5.
Pfeiffer W.M. The morphology of Leitneria floridana // Bot. Gaz. (Chicago), 1912.
53(3): 189-203.
Philip V.J., Haccius B. Embryogenesis in Bambusa arundinacea and structure of the
mature embryo // Beitr. Biol. Pflanzen, 1976. 52: 83-100.
Phillips H.L., Torrey J.G. Deoxyribonucleic acid synthesis in root cap cells of
cultured roots of Convolvulus // Plant Physiol., 1971. 48: 213-218.
Phouphas C. Developpement du proembryon chez le Gynandropsis pentaphylla D.C.
(Capparaceae) // Bull. Soc. Bot. France, 1952. 99(1-3): 18-20.
Литература
789
Piaggesi A., Picciarelli P., Lorenzi R., Alpi A. Gibberellins in embryo-suspensor of
Phaseolus coccineus seeds at the heart stage of embryo development // Plant Physiol.,
1989. 91: 362-366.
Picciarelli P., Alpi A. Embryo-suspensors of Tropaeolum majus: identification of
gibberellin A63 // Phytochemistry, 1987. 26: 329-330.
Picciarelli P., Alpi A., Pistelli L., Scalet M. Gibberellin-like activity in suspensors of
Tropaeolum majus L. and Cytisus laburnum L. // Planta, 1984. 162: 566-568.
Pierson E.S., Cresti M. Cytoskeleton and cytoplasmic organization of pollen and
pollen tubes // Int. Rev. Cytol., 1992. 140: 73-125.
Pierson E.S., Kengen H.M.P., Derksen J. Microtubules and actin filaments co-
localize in pollen tubes of Nicotiana tabacum L. and Lilium longiflorum Thunb.
// Protoplasma, 1989. 150: 75-77.
Pijl L.van der. Die Mycorrhiza von Burmannia und Epirrizanthes und die Fortpflanzung
ihrer Endophyten // Recueil. Trav. Bot. Need., 1934. 31: 761-779.
Pijl L.van der. Sarcosta, aril, pulpa and the evolution of the Angiosperm fruit
// Proc. Kon. Ned. Acad. Wetensch., ser.C, 1955. 58(2-3): 154-161.
Plate L. Selektionsprinzip und Probleme der Artbildung. Ein Handbuch des
Darwinismus. Von Ludwig Plate 4-te sehr verm. Aufl. Leipzig — Berlin: W. Engelmann,
1913. 15: 1-650.
Poddubnaja-Arnoldi V.A. Ein Versuch der Anwendung der embryologischen Methode
bei der Losung einiger systematischer Fragen // Beih.Bot.Centralbl., 1931. 48b: 141-
237.
Poethig R.S. Genetic mosaic and cell lineage analysis in plants // Trends Genet.,
1989. 5: 273-277.
Poethig R.S. Phase change and the regulation of shoot morphogenesis in plants
// Science, 1990. 250: 923-930.
Poethig R.S., Сое E.H.Jr., Johri M.M. Cell lineage patterns in maize embryogenesis:
A clonal analysis // Developm. Biol., 1986. 117: 392-404.
Polanovski A. Tripsin inhibitor from rye seeds // Acta Biochim. Polon., 1967.
14(4): 389-395.
Pollen Biology Biochemistry and Management. Berlin a. o.: Springer-Verlag, 1974.
Pollock B.M., Olney H.O. Studies of the rest period. I. Growth, translocation and
respiratory changes in the embryonic organs of the afterripening cherry seed // Plant
Physiol., 1959. 34(1): 131-142.
Pollock E.G., Jensen W.A. Cell development during early embryogenesis in Capsella
and Gossypium // Amer. J. Bot., 1964. 51(9): 915-921.
Pomeranz Y. Structure and mineral composition of cereal aleurone cells as shown by
scanning electron microscopy // Cereal Chem., 1973. 50: 504-511.
Ponzi R., Pizzolongo P. The ultrastructure of suspensor cells of Ipomoea purpurea
Roth // J. Submicrosc. Cytol., 1972. 4: 199-204.
Ponzi R., Pizzolongo P. Ultrastructure of plastids in the suspensor cells of Ipomoea
purpurea Roth // J. Submicrosc. Cytol., 1973. 5: 257-263.
Ponzi R., Pizzolongo P. Ultrastructural study of change from free-nuclear to cellular
endosperm in Ipomoea purpurea Roth and Cytinus hypocistis L. // Giorn. Bot. Ital.,
1984. 118(3-4): 147-154.
Pope M.N., Brown E. Induced vivipary in three varieties of barley possessing extreme
dormancy // Amer. Soc. Agron. J., 1943. 35: 161-163.
Porsch O. Versuch einer phylogenetischen Erklarung des Embryosackes und der
dopelten Befruchtung der Angiospermen. Jena: 1907: 1-49.
790
Семя
Possingham J.V. Plastid replication and development in the life cycle of higher plants
// Ann. Rev. Plant Physiol., 1980. 31: 113-129.
Pradet A. Oxidative phosphorylation in seeds during the initial phases of germination
// The Physiology and Biochemistry of Seed Development, Dormancy and Germination.
Amsterdam: Elsevier Biomed. Press, 1982: 347-369.
Prakash S. Morphological and embryological studies in the family Loranthaceae. VII.
Atkinsonia ligustrina (Cunningh). F.V. Muell. // Phytomorphology, 1961. 11: 4-325.
Prasad K. Morphology and histochemistry of the nucellus and endosperm in certain
species of Cruciferae // Bot. Jahrb. Syst., Pflanzengesch. Pflanzengeogr., 1979. 100(4):
536-541.
Preston K.R., Kruger J.E. Mobilization of monocot protein reserves during germination
// Plant Proteolytic Enzymes. Boca Ration: CRC Press , 1986. 2: 2-18.
Pretova A. Pigments in young embryos of Linum usitatissimum L. // Photosynthetica,
1977. 11(2): 217-219.
Pretova A. Embryogenesis of the flax: changes in the contents of pigments and fats in
vitro and in situ // Biologia (Bratislava), 1978. 33(1): 29-34.
Pretova A. Asimilacne pigmenty, tuky a ultrastruktura plastidov pocas embryogenezy
l'anu in situ a in vitro // Acta Bot. Slov., B.4, 1985. 1-73.
Pretova A., Eiamporova M., Erdelska O. Chlorophyll content and culture of flax
embryos in vitro // Acta Soc. Bot. Polon., 1981. 50: 291-293.
Pretova A., Ostrolucka M.G., Shamrov 1.1., Batygina T.B. Morpho- histological
examination of calli, somatic embryos and other structures derived in vitro in Quercus sp.
// Biologia (Bratislava), 1993. 48(4): 451-456.
Pritchard H.N. A cytochemical study of embryo development in Stellaria media
// Amer. J. Bot., 1964. 51(3): 472-479.
Pritchard H.N., Bergster K.A. The cytochemistry of some enzymatic activities in
Stellaria media embryos // Experientia (Basel)., 1969. 25(10): 1116-1117.
Proovost E., Southworth D., Knox R.B. Three dimensional reconstruction of sperm
cells and vegetative nucleus in pollen of Gerbera jamesonii // Plant Sperm Cells as Tools
for Biotechnology. /Eds. Wilms H.J., Keijzer C.J. Wageningen: PUDOC, 1988: 69-73.
Przybyllok Т., Nagl W. Auxin concentration in the embryo and suspensors of
Tropaeolum majus, as determined by mass fragmentation (single ion detection)
// Z. Pflanzenphysiol., 1977. 84: 463-465.
Puri V. Studies in the order Parietales.l. A contribution to the morphology of
Tamarix chinensis Lour. // Beih. Bot. Centralbl., 1939. 59A: 335-349.
Qin De-bo, Harberd D.J. Ultrastructural study of early embryo development,
Raphanus sativus L. // Acta Bot. Sin., 1988. 30(5): 473-479.
Quatrano R.S. Development of cell polarity // Ann. Rev. Plant Physiol., 1978. 29:
487-510.
Quatrano R.S. Regulation of gene expression by abscisic acid during angiosperm
embryo development // Oxford Surv. Plant Molec. Cell Biol., 1986. 3: 467-477.
Quatrano R.S., Brian L., Aldridge J., Schultz T. // Development, 1991. 113(SuppI.l):
11-16.
Queller D.C. Kin selection and confict in seed maturation // J. Theor. Biol., 1983.
100: 153-172.
Queller D.C. Inclusive fitness in a nutshell // Oxford Surveys in Evolutionary
Biology / Eds. Harvey P.H., Partridge L. Oxford: Oxford Univ. Press. 1989. 6:
73-109.
Литература
791
Radlkofer L. Der Befruchtungsprocess im Pflanzenreiche und sein Verhaltniss zu dem
Thierreiche. Leipzig: W.Engelmann, 1857: 1-97.
Radua P., Sarano M., Barcelo Y. Contenido de acido citrico у grado de viabilidad en
las semillas de trigo // Farmacognossia, 1967. 27(1-2): 57-60.
Raff J.W., Knox R.B., Clarke A.E. Style and S-allele-associated antigenes of Prunus
avium // Planta, 1981. 153(2): 124-129.
Raghavan V. Experimental Embryogenesis in Vascular Plants. London a.o.: Acad.
Press, 1976: 1-603.
Raghavan V. Embryo culture // Int. Rev. Cytol., 1980. suppl. 11 B: 209-240.
Raghavan V. Embryogenesis in Angiosperms: a developmental and experimental study.
Cambridge a. o.: Cambridge Univ. Press, 1986: 1-303.
Raghavan V. Origin of the quiescent center in the root of Capsella bursa-pastoris (L.)
Medik. // Planta, 1990. 181: 62-70.
Raghavan V., O'Konkwo S.N.C. Studies on the germination of seeds of the root
parasites, Alectra vogelii and Striga gesnerioides. II. DNA synthesis and development of
the quiescent center in the radicle // Amer. J. Bot., 1982. 69(10): 1646-1656.
Raghavan V., Sharma K.K. Zygotic embryogenesis in gymnosperms and angiosperms
//In Vitro Embryogenesis in Plants. / Ed. Thorpe T.A. Dordrecht a. o.: Kluwer Acad.
Publ., 1995: 73-115.
Raghavan V., Srinivasan V. A contribution to the life history of Vahlia viscosa and
V.oldenlandioides // Proc. Indian Acad. Sci., 1942. 15(2): 83-105.
Raghavan V., Srivastava P.S. Embryo culture // Experimental Embryology of
Vascular Plants. Berlin a. o., 1982: 195-230.
Rajasekaran K., Hein M.B., Davis G.C., Carnes M.G., Vasil J.K. Endogenous
growth regulators in leaves and tissue cultures of Pennisetum purpureum Schum. // J.
Plant Physiol., 1987. 130(1): 13-25.
Rajora O.P., Barrett J.W., Dancik B.P., Strobeck C. Maternal transmission of
mitochondrial DNA in interspecific hybrids of Populus // Curr. Genet., 1992. 22:
141-145.
Raju M.V.S. Morphology and anatomy of Saururaceae. I. Floral anatomy and
embryology // Ann. Missouri Bot. Gard., 1961. 48(2): 107-124.
Ram M. Floral morphology and embryology of Trapa bispinosa, with a discussion on
the systematic position of the genus // Phytomorphology, 1956. 6(3-4): 312-323.
Randal J.A. The tansmitting tract in Gladiolus. I. The stigma and pollen-stigma
interaction // Amer. J. Bot., 1982. 69: 389-401.
Randolph L.F. Developmental morphology of the caryopsis in maize //J. Agric. Res.,
1936. 53(12): 881-916.
Ranghavan T.S. Studies in the Capparidaceae. I. The life history of Cleome chelidonii
Linn fil. // J. Linn. Soc, Bot., 1937. 51: 43-72.
Rao C.V. Contributions to the embryology of Palmae. II. Ceroxylineae // J. Indian
Bot. Soc, 1959. 38(1): 46-75.
Rao N.A. A contribution to the embryology of Vateria indica // Proc. Natl. Inst.
Sci. India, В., 1955. 21(5): 247-255.
Rao P.N., Narayana D.C. Occurrence and identification of semigamy in Coix aquatica
// J. Heredity, 1980. 71: 117-120.
Rao P.N., Reddy B.V.N. Tricotyledony in Indigofera linifolia Retz. // Geobios.,
1979. 6(1): 29-30.
Rao V.S. The correlation between embryo type and endosperm type // Ann. Bot.
(London), 1938. 2(3): 535-536.
792 Семя
Rao V.S. «Nuclear endosperm» or non-cellular endosperm? // Ann. Bot. (London),
1959. 23(90): 364.
Rathore K.S., Hodges Т.К., Robinson K.R. A refined technique to apply electrical
currents to callus cultures // Plant Physiol., 1988. 88(3): 515-517.
Rathore K.S., Robinson K.R. Ionic currents around developing embryos of higher
plants in culture // Biol. Bull., 1989. 176(2), suppl.: 46-48.
Rau M.A. Endosperm in Cassia tora Linn. // Nature, 1950. 165(4187): 157.
Rau M.A. The endosperm in some species of Cassia L.// Svensk Bot.Tidskr., 1951.
45(3): 516-522.
Rau M.A. Some observations on the endosperm in Papilionaceae // Phytomorphology,
1953. 3(2): 209-222.
Rau M.A. Saxifragaceae // Bull. Indian Natl. Sci. Acad., 1970. 41: 90-92.
Rau M.A., Sharma V.K. Early embryogeny in Saxifraga Linn. // Phytomorphology,
1967. 17(1-4): 252-255.
Rauh W. Die Bildung von Hypokotyl und Wurzelsprossen und ihre Bedeutung fur die
Wuchsformen der Pflanzen // Nova Acta Leop., 1937. 4(24): 395-553.
Raynal-Roques A. Diversification in the genus Striga // 5th Int. Symp. on Parasitic
Weeds, Nairobi, Kenya. / Eds. Ransom J.K., Musselman L.J., Worsham A.D., Parker
С 1991: 251-261.
Raynal-Roques A., Salle G. Striga Lour. (Srophulariaceae), essai etymolmogique //
J. Agric Trop. Bot. Appl., 1987. 34: 47-49.
Reed C.F. The comparative morphology of the Olacaceae, Opiliaceae and Octoknemaceae
// Mem. Soc. Brot., 1954-1955. 10: 29-80.
Reeder J.R. The embryo in grass systematics // Amer. J. Bot., 1957. 44(9)-
756-768. ''
Reeder J.R. The grass embryo in systematics // Rec. Adv. Bot., 1961. 1(2): 91-96.
Reger B.J., Pressey R., Chaubal R. Chemotropic responses of pearl millet pollen tubes
// Sex. Plant Reprod., 1992. 5: 47-56.
Rezende-Pinto M.C. de. On the metamorphosis of cotyledon plastids of Phaseolus
multiflorus Willd. // Portug. Acta Biol., 1964. A8(3-4): 177-185.
Richard M.L.C. Demonstrations botaniques ou analyse du fruit. Paris: 1808: 1-111.
Richter-Landmann W. Der Befrunchtungsvorgang bei Impatiens grandulifera Royle
unter Berucksichtigung der plasmatischen Organelle von Spermzelle, Eizelle und Zygote
// Planta, 1959. 53: 162-177.
Rijven A.H.G.C. In vitro studies on the embryo of Capsella bursa-pastoris. // Acta
Bot Need., 1952. 1(2): 157-200.
Robbins W.J., Harvey A. Auxin and growth of excised roots of Bryophyllum
calycinum // Proc. NASA, 1969. 64(2): 495-497.
Roberts E.H. Temperature and seed germination // Plants and temperature: Sump.
Soc. Exper. Biol. V.42.: 1988: 109-132.
Robertson D.S. The genetics of vivipary in maize // Genetics, 1955. 40: 745-760.
Robertson D.S. A study of heterofertilization in diverse lines of maize // J. Heredity,
1984. 75: 457-462.
Robinson K,.R. Reduced external calcium or sodium stimulates calcium influx in
Pelvetia eggs // Planta, 1977. 136(2): 153-158.
Robinson K.R., Jaffe L.F. Polarizing fucoid eggs drive a calcium current through
themselves // Science, 1975. 187: 70-72.
Литература
Robinson K.R., McCaid С Electrical fields, calcium gradients and cell growth
// Ann. New York Acad. Sci., 1980. 132-138.
Rocen T. Zur Embryologie der Centrospermen. Ph. Diss. Uppsala: Appelbergs
Boktryckeri Aktiebolag, 1927: 1-184.
Rodkiewicz В., Fyk В., Szczuka E. Chlorophyll and cutin in early embryogenesis in
Capsella, Arabidopsis and Stellaria investigated by fluorescence microscopy // Sex. Plant
Reprod., 1994. 7: 287-289.
Rogers S.O., Quatrano R.S. Morphological staging of wheat caryopsis development
// Amer. J. Bot., 1983. 70: 308-311.
Roman H. Directed fertilization in maize// PNAS (USA), 1948. 34: 36-42.
Rondet P. Mise en place des meristems ches les Angiospermes au cours de
l'embryogenese // Bull. Soc. Frans. Physiol. Veget., 1965. 11(2): 175-183.
Rosen W. Zur Embryologie der Campanulaceen und Lobeliaceen // Acta Horti
Gothob., 1932. 7: 31-42.
Rosen W. Endosperm development in Campanulaceae and closely related families
// Bot. Not., 1949. 2: 137-147.
Rosen W.G. Chemotropism and fine structure of pollen tubes // Pollen physiology
and fertilization. / Ed. Linskens H.F. Amsterdam: North-Holland Publ. Company, 1964:
159-166.
Rosen W.G., Gawlik R. Relation of lily pollen tube fine structure to pistil
compatibility and mode of nutrition // 6th Int. Congr. Electron Microscopy, Kyoto.
Maruzen, Tokyo. Electron Microscopy. Vol.2. 1966: 313-314.
Rosenberg O. Uber die Individualist der Chromosomen im Pflanzenreich // Flora,
1904. 3-8.
Rosenblum J.M., Basile D.V. Hormonal regulation of morphogenesis in Streptocarpus
and its relevance to evolutionary history of the Gesneriaceae // Amer. J. Bot., 1984. 71:
52-64.
Ross H.A., Hegarty T.W. Sensetivity of seed germination and seedling radicle growth
to moisture stress in some vegetable crop species // Ann. Bot. (London), 1979. 43(2):
241-243.
Roth I. Zur morphologischen Deutung des Grasembryos und verwandter Embryotypen
// Flora, 1955. 142(4): 564-600.
Roth I. Histogenese und Entwicklungsgeschichte des Triticum-Embryos // Flora,
1957. 144(2): 163-212.
Roth I. Histogenesis and morphological interpretation of the grass embryo // Recent
advances in botany, I. Montreal, 1961: 96-99.
Roth J. Uber die anisokotylen Keimlinge von Gyranthera caribensis, Bombacaceae.
Struktur der Samenschale des Makro- und Mikrokotyledons und der Primarblatter
// Bot. Jabrb. Syst., 1977. 97(4): 515-575.
Rougier M., Inoud N., Said C, Russell/S., Dumas С Male gametophyte
development and formation of the male germ unit in Populus deltoides following
compatable pollination // Protoplasma, 1991. 162(2-3): 140-150.
Roux W. Terminologie der Entwicklungsmechanik der Tiere und Pflanzen. Leipzig:
W.Engelmann, 1912: 1-465.
Rubsamen T.von. Morphologische, embryologische und systematische Untersuchungen
an Burmanniaceae und Corsiaceae (Mit Ausblick auf die Orchidaceae. Apostasioideae)
// Diss. Botanicae. Berlin-Stuttgart: J. Cramer. 1988. 92: 1-310.
. Ruijter N.. Emons A.M. Immunodetection of spectrin antigens in plant cells // Cell
Biol. Int. Rep., 1993. 17(2): 169-182.
794
Семя
Rusche M.L. The male germ unit of Zea mays in the mature pollen grain // Plant
Sperm Cells as Tools for Biotechnology. / Eds. Wilms H.J., Keijzer C.J. Wageningen:
PUDOC, 1995
Rusche M.L., Mogensen H.L. The male germ unit of Zea mays: quantative
ultrastructure and three-dimensional analysis // Sexual Reproduction in Higher Plants.
/Eds. Cresti M., Gori P., Pacini E. Berlin, Heidelberg: Springer-Verlag, 1988: 221-
226.
Russell S.D. Participation of male cytoplasm during gamete fusion in angiosperm
Plumbago zeylanica // Science, 1980. 210(4466): 200-201.
Russell S.D. Fertilization in Plumbago zeylanica: entry and discharge of the pollen
tube in the embryo sac// Canad. J. Bot, 1982. 60(11): 2219-2230.
Russell S.D. Fertilization in Plumbago zeylanica: gametic fusion and fate of the male
cytoplasm // Amer. J. Bot., 1983. 70(3): 416-434.
Russell S.D. Ultrastructure of the sperm of Plumbago zeylanica: 2. Quantitative
cytology and three-dimensional reconstruction // Planta, 1984. 162(4): 385-391.
Russell S.D. Preferential fertilization in Plumbago: Ultrastructural evidence for
gamete-level recognition in an angiosperm // Proc. Natl. Acad. Sci. USA, 1985a.
82(18): 6129-6132.
Russell S.D. Sperm specificity in Plumbago zeylanica // Proc. 8th Int. Symp. Sexual
Reprod. August 20-24, 1984. Sexual Reproduction in Seed Plants, Ferns and Mosses.
Wageningen: Pudoc, 1985b: 145-146.
Russell S.D. Isolation of sperm cells from the pollen of Plumbago zeylanica // Plant
Physiol., 1986. 81, № 2: 317-319.
Russell S.D. Quantitative cytology of the egg and central cell of Plumbago zeylanica
and its impact on cytoplasmic inheritance patterns // Theor. Appl. Genet., 1987. 74:
693-699.
Russell S.D. Isolation and characterization of sperm cells in flowering plants // Ann.
Rev. Plant Physiol. Plant Molec. Biol., 1991. 42: 189-204.
Russell S.D. Double fertilization // Int. Rev. Cytol., 1992. 140: 357-388.
Russell S.D. The egg cell: development and role in fertilization and early embryo
development // Plant Cell, 1993. 5: 1349-1359.
Russell S.D. Fertilization in higher plants // Pollen-Pistil Interactions and Pollen
Tube Growth. Current Topics in Plant Physiology, American Society of Plant Physiologist
Series, volume 12. /Eds. Stephenson A.G., Kao Т.Н. Beltsville: ASPP, 1994: 140-152.
Russell S.D., Cass D.D. Ultrastructure of fertilization in Plumbago zeylanica // Acta
Soc Bot. Polon., 1981a. 50(1-2): 185-190.
Russell S.D., Cass D.D. Ultrastructure of the sperm of Plumbago zeylanica: 1.
Cytology and association with the vegetative nucleus // Protoplasma, 1981b. 107:
85-107.
Russell S.D., Cass D.D. Fertilization in Plumbagella micrantha // Amer. J. Bot.,
1988. 75(6): 778-781.
Russell S.D., Cresti M., Dumas C. Recent progress on sperm characterization in
flowering plants // Physiol. Plantarum (Copenhagen), 1990a. 80: 669-676.
Russell S.D., Rougier M., Dumas C. Organization of the early post-fertilization
megagametophyte of Populus deltoides. Ultrastructure and implications for male cytoplasmic
transmission // Protoplasma, 1990b. 155(1-3): 153-165.
Russell S.D., Strout G.W. Development, polarization and morphogenesis of the
generative cell of Plumbago zeylanica. 2. Quantitative cytology and organelle dynamics
// Eur. J. Cell Biol., 1995.
Литература
795
Russell S.D., Strout G.W., Mislan T.W., Stramski A.K., Thompson R.A., Scoemann
L.M. Development, polarization and morphogenesis of the generative cell of Plumbago
zeylanica: 1. Descriptive cytology and three-dimensional organization // Eur. J. Cell
Biol., 1995.
Rutishauser A. Embryologie und Fortpflanzungsbiologre der Angiospermen. Wien-
N.Y.: Springer-Verlag, 1969.
Ryczkowski M. Physico-biochemical and physiological gradients in the ovule during
embryogenesis // Bull. Soc. Bot. France, Actual. Bot., 1980. 127(3/4): 51-58.
Ryczkowski M., Reczynski W. Concentration of elements in the central vacuole sap
during proembryogenesis Clivia sp // Ann. Sci., 1988. 23: 176-177.
Ryczkowski M., Szewczyk E. Changes of the chlorophylls content in the developing
embryo of Haemanthus katharinae Bak. // Bull. Acad. Polon. Sci., Ser. Sci. Biol., 1972.
20(1): 49-53.
Ryczkowski M., Szewczyk E. Photosynthesis in the developing embryo of Haemanthus
katharinae Bak. (monocotyledonous plant) // Bull. Acad. Polon. Sci., Ser. Sci. Biol.,
1973. XXI(10): 695-699.
Ryczkowski M., Szewczyk E. Further research on the photosynthesis in the green
developing embryo (dicotyledonous plants) // Z. Pflanzenphysiol., 1975. 75(2): 175-
180.
Sabet Y.S. Development of the embryo sac in Calotropis procera with special reference
to endosperm formation // Ann. Bot. (London), 1931. 45(179): 503-518.
Sachar R.C., Mohan Ram H.Y. The embryology of Eschscholzia californica // Phyto-
morphology, 1958. 8(1-2): 114-124.
Sachs J. Lehrbuch der Botanik. 4 Aufl. Leipzig, 1874: 1-928.
Sachs T. Cell polarity and tissue patterning in plants // Development., 1991. 1
(suppl): 83-93.
Saha B. Studies on the development of the embryo of Oryza sativa L. and the
homologies of its parts // Proc. Natl. Inst. Sci. India В., 1956. 22(2): 86-101.
Sakurai N., Shibata K., Kamisaka S. Stimulation of cucumber hypocotyl elongation by
dihydroconiferyl alcohol. Interaction between dihydroconiferyl alcohol and auxin or
gibberellin // Plant Cell Physiol., 1974. 15(4): 709-716.
Salisbury E. The Reproductive Capacity of Plants. London. 1942: 1-224.
Salle G., Dembele В., Raynal-Roques A., Hallais M.F., Tuquet C. Biological aspects
of Striga species, pest of food crops (Srophulariaceae) // Proc. 4th I.S.P.F.P., Parasitic
Flowering Plants, Marburg (R.F.A.). /Eds. Weber Chr., Forstreuter W. 1987: 719-731.
Salle G., Dembele В., Raynal-Roques A., Tuquet C. Les Striga: degats, biologie et
lutte // Afri. Agr., 1988. 158: 41-43.
Salle G., Dembele В., Tuquet C, Raynal-Roques A. Le Striga en Afrique: impact
economique, biologie et methode de lutte // 14e Conference du COLUMA, Versailles,
3. 1990: 361-369.
Salmenkallio M., Sopanen T. Amino acid peptide uptake in the scutella of germinating
grains of barley, wheat, rice and maize // Plant Physiol., 1989. 89: 1285-1291.
Samiielsson G. Studien iiber die Entwicklungsgeschichte einiger Bicornes -Typen. Ein
Beitrag zur Kenntnis der systematischen Stellung der Diapensiaceen und Empetraceen
// Svensk Bot. Tidskr., 1913. 7(2): 97-188.
Sangduen N., Kreither G.L., Sorensen E.L. Light and electron microscopy of embryo
development in perennial and annual Medicago species // Canad. J. Bot, 1983. 61(3):
837-849.
796
Семя
Sargant E. Recent work on the results of fertilization in angiosperms // Ann. Bot.
(London), 1900. 14: 689-712.
Sargant E. The origin of the seed-leaf in Monocotyledons // New Phytol., 1902. 1:
25-48.
Sargant E. A theory of the origin of Monocotyledons founded on the structure of their
seedlings // Ann. Bot. (London), 1903. 17: 1-92.
Sargant E. The reconstruction of a race of primitive angiosperms // Ann. Bot.
(London), 1908. 22: 121-186.
Sastri R.L.N. Floral morphology and embryology of some Dilleniaceae // Bot. Not.,
1958. 111(3): 495-511.
Satina S. Periclinal chimeraes in Datura in relation to development and structure (A)
of the style and stigma (B) of calyx and carolla // Amer. J. Bot., 1944. 31: 493-502.
Satina S., Rietsema J. Seed development // The genus Datura. /Eds. Avery A.G.,
Satina S., Rietsema J., Blakeslee A.F. New York: Ronald, 1959: 181-195.
Sato N., Furuya M. Synthesis of translatable mRNA for phytochrome during
imbibition in embryonic axes of Pisum sativum L. // Plant Cell Physiol., 1985. 26(8):
1511-1517.
Satoh S., Kamada H., Harada H., Fuji T. Auxin-controlled glycoprotein release into
the medium of embryogenic carrot cells // Plant Physiol., 1986. 81: 931-933.
Satoh S., Sturm A., Fujii Т., Chispeels M.J. cDNA cloning of an extracellular dermal
glycoprotein of carrot and its expression in response to wounding // Planta, 1992. 188:
432-440.
Saunders E.K. Mattiola // Bibl. Genet., 1928. 4: 141-169.
Savina G.I., Zhukova G.Ya. Ultrastructural aspects of the embryo sac development in
Epipactis atrorubens (Hoffm.) Schult. // Proc. 7th Int. Cytoembryol. Symp. Fertilization
and Embryogenesis in Ovulated Plants. High Tatra (Rackova dolina), June 14-17, 1982.
Bratislava: VEDA, 1983: 207-209.
Sax K. Behaviour of the chromosomes in fertilization // Genetics, 1918. 3: 309-327.
Scanlon M.J., James M., Stinard P.S., Robertson D.S. Genetic placement and
mapping of Mutator-induced detective kernel mutants // Maize Genet. Coop. Newslett.,
1991. 65: 11.
Schacht H. Entwicklungsgeschichte des Pflanzen-Embryon. Ph. Diss. Amsterdam.
1850: 1-234.
Schafer E., Haupt W. Blue-light effects in phytochrome-mediated responses // Pho-
tomorphogenesis. Berlin a. o.: 1983: 723-744.
Schaffner J.H. The embryo sac of Alisma plantago // Bot. Gaz. (Chicago), 1896.
21: 123-132.
Schaffner J.H. The life history of Sagittaria variabilis// Bot. Gaz. (Chicago), 1897.
23: 252-273.
Schaffner J.H. Some morphological peculiarities of the Nymphaeaceae and Helobiae
// Ohio Naturalist, 1904. 4: 83-92.
Schaffner M. The embryology of the shepherds purse // Ohio Naturalist, 1906. 7(1):
1-8.
Schel J.H.N., Kieft H., Lammeren A.A.M.van. Interactions between embryo and
endosperm during early developmental stages of maize caryopses (Zea mays) // Canad.
J. Bot, 1984. 62: 2842-2853.
Scheres В., Laurenzio L.di, Willemsen V., Hauser M.-T., Jaanmat K., Weisbeek P.,
Benfey P.N. // Development, 1995. 121: 53-62.
Литература
797
Scheres В., Wolkenfelt H., Willemsen V., Terlouw M., Lawson E., Dean C,
Weisbeek P. Embryonic origin of the Arabidopsis primary root and root meristem initials
// Development, 1994. 120: 2475-2487.
Schiavone F.M., Racusen R.H. The development of a new root at the apical end of
surgically-transected embryo: Reestablishment of the original root-shoot pattern // Amer. J.
Bot., 1989. 76(6) Suppl.: 69.
Schiavone F.M., Racusen R.H. Microsurgery reveals regional capabilities for pattern
reestablishment in somatic carrot embryos // Developm. Biol., 1990. 141: 211-219.
Schimper A.F.W. Untersuchungen fiber die Chlorophyllkorper und die ihnen homologen
Gebilde // Jahrb. Wiss. Bot. 1885. 16(1-2).
Schleiden M.J. Einige Blicke auf die Entwicklungsgeschichte des Vegetablischen
Organismus bei den Phanerogamen // Arch. Naturgesch. (Wiegmann), 1837. 3(1):
289-320.
Schleiden M.J. Beitrage zur Anatomie der Cacteen // Von M.J. Schleiden. Boon:
H.Cohen. 1839: 335-380.
Schleiden M.J. Uber die Bildung des Eichens und Entstehung des Embryos bei den
Phanerogamen // Nova Acta physico-medica Acad. Caes. Leopoldino — Carolinae
nature curiosorum, 1839. 19: 27-58.
Schmid B. Beitrage zur Embryo-Entwicklung einiger Dicotylen // Bot. Zeit. (Berlin),
1902. 60: 207-230.
Schmidt E.D.L., Jong A.J.de, Vries S.C.de. Signal molecules involved in plant
embryogenesis // Plant Molec. Biol., 1994. 26: 1305-1313.
Schmit A.C., Lambert A.M. Microinjected fluorescent phalloidin in vivo reveals the
F-actin dynamics and assembly in higher plant mitotic cells // Plant Cell, 1990. 2(2):
129-138.
Schnall J.A., Cooke T.J., Cress D.E. Genetic analysis of somatic embryogenesis in
carrot cell culture: initial characterization of six classes of temperature-sensitive variants //
Developm. Genet., 1988. 9: 49-67.
Schnarf K. Beitrage zur Kenntnis der Samenentwicklung der Labiaten // Denkschr.
Kaiserl. Akad. Wiss. Math.—Naturwiss. Kl., 1917. 94: 211-275.
Schnarf K. Kleine Beitrage zur Entwicklungsgeschichte der Angiospermen. VI. Uber
die Samenentwicklung einiger Gramineen // Osterr. Bot. Z., 1926. 75(4-6): 105-113.
Schnarf K. Embryologie der Angiospermen. Berlin: Gebriider Borntrager, 1929:
1-684.
Schnarf K. Vergleichende Embryologie der Angiospermen. Berlin: Gebriider Borntraeger,
1931: 1-354.
Schnarf K. Die Befruchtung der Andiospermen // Biologie, 1941. 10: 258-264.
Schnarf K., Wunderlich R. Zur vergleichenden Embryologie der Liliaceae —
Asphodeloideae // Flora, 1939. 33: 297-327.
Schneider E.L. Morphological studies of the Nymphaeaceae. IX. The seed of Barclaya
longifolia Wall. // Bot. Gaz., 1978. 139(2): 223-230.
Schneider Т., Dinkins R., Robinson K., Shellhammer J., Meinke D.W. An embryo-
lethal mutant of Arabidopsis thaliana is a biotin auxotroph // Developm. Biol., 1989.
131: 161-167.
Schnepf E. Gland cells // Dynamic aspects of plant ultrastructure. / Ed. Robards
A.W. London: McGraw-Hill, 1974: 331-357.
Schnepf E., Nagl W. Uber einige Strukturbesonderheiten der Suspensorzellen von
Phaseolus vulgaris // Protoplasma, 1970. 69(1): 133-143.
798
Семя
Schniewind-Thies J. Die Reduction der Chromosomenzahl und ihre folgenden Kerntei-
lungen in den Embryosackmutterzellen der Angiospermen. Jena: Verl. Gust. Fisch., 1901.
Schotz F. Uber Plastidenkonkurrenz bei Oenothera // Planta, 1954. 43: 182-240.
Schroder M.-B. Ultrastructural studies on plastids of generative and vegetative cells in
the family Liliaceae. 1. Lilium martagon L. // Biol. Zentralbl., 1984. 103(5): 547-555.
Schroder M.-B. Ultrastructural studies on plastids of generative and vegetative cells in
the family Liliaceae. 2. Fritillaria imperialis and F. meleagris // Ibid., 1985a. 104(1):
21-27.
Schroder M.-B. Ultrastructural studies on plastids of generative and vegetative cells in
Liliaceae. 3. Plastid distribution during the pollen development in Gasteria verrucosa
(Mill.) Duval. // Protoplasma, 1985b. 124(1-2): 123-129.
Schroder M.-B. Ultrastructural studies on plastids of generative and vegetative cells in
Liliaceae. 5. The behaviour of plastids during pollen development in Chlorophytum
comosum (Thunb.) Jacques // Theor. Appl. Genet., 1986a. 72(6): 840-844.
Schroder M.-B. Ultrastructural studies on plastids of generative and vegetative cells in
Liliaceae. 4. Plastid degeneration during generative cell maturation in Convallaria majalis
L. // Biol. Zentralbl., 1986b. 105(4): 427-433.
Schroder M.-B. The cytological basis of the plastid distribution during the formation
and development of the male gametophyte in Liliaceae // Abstr. X Int. Symp. Sex.
Reprod. Higher Plants: Maj 30 — June 4 1988, Siena Univ. 1988: 144.
Schtiepp O. Meristeme // Linsb. Handb. Psflanzen anat. Abst. 1., 1926. 2(4).
Schulz D. The orchid embryo — a revision on the base of several electron
microscopical preparation methods // Abstr. XII Int. Bot. Congr., July 3-10, 1975.
Leningrad: Nauka, 1975. 233.
Schulz P., Jensen W.A. Capsella embryogenesis: the suspensor and the basal cell
// Protoplasma, 1969. 67(2-3): 139-163.
Schulz P., Jensen W.A. Capsella embryogenesis: the chalazal proliferating tissue
// J. Cell Sci., 1971. 8(1): 201-227.
Schulz P., Jensen W.A. Capsella embryogenesis: the central cell // J. Cell Sci.,
1973. 12(3): 741-763.
Schulz P., Jensen W.A. Capsella embryogenesis: the development of the free nuclear
endosperm // Protoplasma, 1974. 80(1-3): 183-205.
Schulz P., Jensen W.A. Cotton embryogenesis: the early development of the free
nuclear endosperm // Amer. J. Bot., 1977. 64(4): 384-394.
Schulz P., Jensen W.A. Ultrastructural studies of early endosperm development in
fertilized and unfertilized cotton ovules // Bull. Soc. Bot. France, 1978. 125(1/2):
267-271.
Schulz R., Jensen W.A. Capsella embryogenesis: the egg, zygote and young embryo
// Amer. J. Bot., 1968a. 55(7): 807-819.
Schulz R., Jensen W.A. Capsella embryogenesis: the early embryo // J. Ultrastruct.
Res, 1968b. 22(5-6): 376-392.
Schulz R., Jensen W.A. Capsella embryogenesis: the synergids before and after
fertilization // Amer. J. Bot., 1968c. 55(5): 542-552.
Schtirhoff P.N. Zur Phylogenie des Angiospermen-Embryosackes // Ber. Deutsch.
Bot. Ges., 1919. 37: 160-168.
Schtirhoff P.N. Die Zytologie der Bltitenpflanzen. Stuttgart: Enke Verlag, 1926. 8:
1-792.
Литература
799
Schuster W. Untersuchungen tiber die Wirkung der 2,4-D und der a-NAA auf die
Bliite und den Samen der Sonnenblurne sowie die Nachwirkungen in den folgenden
Generationen // Der Zuchter., 1956. 26(3): 78-83.
Schwartz B.W., Vernon D.M., Meinke D.W. Development of the suspensor:
differentiation, communication, and programmed cell death during plant embryogenesis
// Cellular and Molecular Biology of Plant Seed Development. / Eds. Larkins B.A.,
Vasil I.K. Kluwer Acad. Publ., 1995.
Schwartz B.W., Yeung E.C., Meinke D.W. Disruption of morphogenesis and
transformation of the suspensor in abnormal suspensor mutants of Arabidopsis //
Development, 1994. 120: 3235-3245.
Schwarz-Sommer Z., Huijser P., Nacken W., Saedler H., Sommer H. Genetic control
of flower development by homeotic genes in Antirrhinum majus // Science, 1990. 250:
931-936.
Scott F.M. Cytology and microchemistry of nuclei in developing seed of Echinocystis
macrocarpa // Bot. Gaz. (Chiccago), 1944. 105(3): 329-338.
Scott Т.К., Wilkins M.B. Auxin transport in roots. IV. Effect of light on IAA
movement and geotropic responsiveness in Zea roots // Planta, 1969. 87(2): 249-258.
Seawey S.R., Bawa K.S. Delayed self-incompatibility in angiosperms // Bot. Rev.,
1986. 52: 195-219.
Sedley M. Control by the embryo sac over pollen tube growth in the style of the
avocado (Persea americana Mill.) // New Phytol., 1976. 77: 149-152.
Seffens W.S., Almoguera C, Wilde H.D., Vonder Haar R.A., Thomas T.L. Molecular
analysis of a phylogenetically conserved carrot gene: developmental and environmental
regulation // Developm. Genet., 1990. 11: 65-76.
Sehgal C.B. The embryology of Cuminum cyminum L. and Trachyspermum ammi (L.)
Spragne (=Carum copticum Clarke) // Bot. Univ. Delhi, 1965. 31B(5-6): 175-201.
Seidemann Y. Starke-Atlas. Berlin: Paul Parley, 1966: 1-360.
Servitova H., Cetl I. The use of recessive lethal mutants for linkage mapping of
Arabidopsis thaliana (L.) // Heynh. Arabidopsis Inf. Serv., 1984. 21: 59-64.
Sethumadhavan P., Gopakumar K. Occurrence of tricotyly in Brinjal (Solanum
melongena Linn.) and sweet potato (Ipomea batatas Lam.) // Agr. Res. J. Kerala, 1973.
11(2): 181.
Shah C.K. The life history of Juncus bufonius Linn // J. Indian Bot. Soc, 1963.
42(2): 238-251.
Shamrov I.I. The ovule of Swertia iberica (Gentianaceae): structural and functional
aspects // Phytomorphology, 1991. 41(3-4): 213-229.
Shamrov I.I. Genealogical and dynamic approaches to embryo study // Abstr. Plant
Embryogenesis Workshop, Hamburg, Germany, 1996: 26.
Shamrov 1.1., Alimova G.K., Koudarov B.R., Dyachuk T.L., Nikiforova I.D.,
Batygina T.B. Some morphogenetic aspects of secondary embryoidogeny (somatic
embryogeny) in tissue culture // Abstr. XIII Eucarpia Congr., Angers, France. 1992:
387-388.
Sharma H.C., Gill B.S. Effect of embryo age and culture media on plant growth and
vernalization response in winter wheat // Euphytica, 1982. 31(3): 629-634.
Sharma V.K. Embryology of Elaeagnus conferta Roxb. // Curr. Sci., 1966. 35(7):
185-186.
Sharp W.R., Evans D.A., Sondahl M.R. Application of somatic embryogenesis to
crop environment // Plant tissue culture / Ed. A. Fujuwara, 1982. 839 pp. Proceed.
5th Int. Congr. Plant Tissue a. Cell Culture, Japan. Japanese Assoc. Plant Tissue
Culture, Tokyo.
800
Семя
3
Sharp W.R., Sondahl M.R., Cadlas L.S., Maratta S.B. The physiology of in vitro
asexual embryogenesis // Hort. Rev. (Cairo), 1980. 2: 268-310.
Shattuk C.H. A morphological study in Ulmus americana // Bot. Gaz. (Chicago),
1905. 20: 209-223.
Shellhammer J., Meinke D. Arrested embryos from the bio 1 auxotroph of Arabidopsis
thaliana contain reduced levels of biotin // Plant Physiol., 1990. 93: 1162-1167.
Shepherd T.D., Alverson W.S. A new Gatostemma (Bombacaceae) from Columbia
// Brittonia, 1981. 33(4).
Sheridan W.F. Maize developmental genetics: genes of morphogenesis // Ann. Rev.
Genet., 1988. 22: 353-385.
Sheridan W.F., Clark J.K. Maize embryogeny: a promising experimental system
// Trends Genet., 1987. 3: 3-6.
Sheridan W.F., Clark J.K. Mutational analysis of morphogenesis of the maize embryo
// Plant Journal, 1993. 3(2): 347-358.
Sheridan W.F., Neuffer M.G. Defective kernel mutants of maize. II. Morphological
and embryo culture studies // Genetics, 1980. 95: 945-960.
Sheridan W.F., Neuffer M.G. Maize mutants altered in embryo development //
Levels of Genetic Control in Development. /Eds. Subtelney S., Abbot U. New York:
Alan R. Liss., 1981: 1137-1156.
Sheridan W.F., Neuffer M.G. Maize developmental mutants // J. Heredity, 1982.
73: 318-329.
Sherwood R.T. Nuclear DNA amount during sporogenesis and gametogenesis in sexual
and aposporous buffelgrass // Sex. Plant Reprod., 1995. 8: 85-90.
Shevell D.E., Leu W.-M., Gilimor C.S., Xia G., Feldmann K.A., Chua N.-H.
// Cell, 1994. 77: 1051-1062.
Shi L., Zhu Т., Mogensen H.L., Smith S.E. Paternal plastid inheritance in alfalfa —
plastid nucleoid number within generative cells correlates poorly with plastid number and
male plastid transmission strength // Curr. Genet., 1991. 19: 399-402.
Shibaoka H. Microtubules and the regulation of cell morphogenesis by plant hormones
// The Cytoskeletal Basis of Plant Growth and Form. /Ed. Lloyd C.W. London: Acad.
Press, 1991: 159-182.
Shibaoka H. Regulation by gibberellins of the orientation of cortical microtubules in
plant cells // Austral. J. Plant Physiol., 1993. 20: 461-470.
Shivanna K.R., Heslop-Harrison Y., Heslop-Harrison S.S. Inhibition of the pollen-
tube in the self-incompatibility response of grasses // Incompat. Newslett., 1978. 10:
5-7.
Shivanna K.R., Sastri D.C. Stigma-surface esterase activity and stigma receptivity in
some taxa characterized by wet stigmas // Ann. Bot. (London), 1981. 47(1): 53-64.
Shivanna K.R., Xu H., Taylor P., Knox R.B. Isolation of sperms from the pollen
tubes of flowering plants during fertilization // Plant Physiol., 1988. 87: 647-650.
Shivanna R.B., Heslop-Harrison Y., Heslop-Harrison J. The pollen-stigma interaction
in the grasses. III. Features of self-incompatibility response // Acta Bot. Neerl., 1982.
31: 307-319.
Shreve F. The development of Sarracenia purpurea // Johns Hopkins Univ. Circ,
1905. 178: 31-34.
Sievers A., Hensel W. Root cap // Plant Roots. The Hidden Half /Eds. Waisel
Y., Eshel A., Kafkafi U. N.Y.-Basel-Hong Kong: 1991: 53-74.
Simola L.K. The ultrastructure of dry and germinating seeds of Pinus sylvestris L.
// Acta Bot. Fenn., 1974. 103:
Литература
801
Simoncioli C. Ultrastructural characteristics of Diplotaxis erucoides (L.) DC. suspensor
// Giorn. Bot. Ital., 1974. 108(34): 175-189.
Simpson M.J.A. Fruit characters and seed germination of Euphrasia disperma Hook f.
// New Zealand J. Bot. 1977. 15(1): 181-183.
Singh A.P., Mogensen H.L. Fine structure of the zygote and early embryo in Quercus
gambelii // Amer. J. Bot., 1975. 62(2): 105-115.
Singh A.P., Mogensen H.L. Fine structure of early endosperm in Quercus gambelii
// Cytologia, 1976. 41: 345-361.
Singh D., Gupta Y.S. Cytoplasmic nodules in the endosperm of Coriandrum sativum L.
// Sci. Cult., 1956. 22: 342-343.
Singh H. Embryology of gymnosperms. Berlin: Gebrtider Borntraeger. 1996.
Singh R.P. Structure and development of seeds in Euphorbia helioscopia Linn. //
Bot. Mag., Tokyo, 1969. 82(973): 287-293.
Singh R.P., Chauhan Y.S. Experimental production of pleiocotyly in Chenopodium
album L. // Recent trends and contacts between cytogenetics, embryology and
morphology. 1977: 517-522.
Sinha N.. Williams R., Hake S. // Genes Dev., 1993. 7: 787-795.
Sinnott E.W. Plant Morphogenesis. New York-Toronto-London: McGraw-Hill Book
Company, Inc., 1960: 1-550.
Sitton D., Richmond A., Vaadia Y. On the synthesis of gibberellins in roots//
Phytochemistry, 1967. 6(8): 1101-1105.
Sivaramakrishna D. Size relationships of apical cell and basal cell in two-celled
embryos in angiosperms // Canad. J. Bot, 1978. 56: 1434-1438.
Smart M.G., O'Brien T.P. Observation on the scutellum. Overall development during
germination in four grasses // Austral. J. Bot., 1979. 27(4): 391-401.
Smart M.G., O'Brien T.P. The development of wheat embryo in relation to the
neighbouring tissue // Protoplasma, 1983. 114: 1-13.
Smith B.E. A taxonomic and morphological study of the genus Cuscuta, dodders in
North Carolina // J. Elisha Mitchell. Sci. Soc, 1934. 50: 283-302.
Smith J.A., Krauss M.R., Borkird C, Sung Z.R. A nuclear orotein associated with
cell division in plants // Planta, 1988. 174: 462-472.
Smith J.A., Sung Z.R. Increase of regeneration of plant cells by cross feeding with
regenerating Daucus carota cells // Proc. Somatic Embryogenesis Workshop. San
Miniato, Italy. IPRA. /Eds. Terzi M., Pitto L., Sung Z.R. Rome, 1985: 133-136.
Smith S.E. Biparental inheritance of organelles and its implicatios in crop improvement
// Plant Breed. Rev., 1989. 6: 361-393.
Smith S.E., Bingham E.T., Fulton R.W. Transmission of chlorophyll deficiencies in
Medicago sativa —evidence for biparental inheritance of plastids //J. Heredity, 1986.
77: 35-39.
Snell W.J. Adhesion and signaling during fertilization in multicellular and unicellular
organisms // Curr. Opin. Cell Biol., 1990. 2: 821-832.
Solms-Laubach H. Monographia Pandanacearum. Hermanno camite de Solnms-Laubach.
Brl., Wiegandt, Hempelu. Parey. 1878
Solms-Laubach H. Uber monocotyle Embryonen mit Scheitelburtigen Vegetationspunkt
// Bot. Zeitung (Berlin), 1878. 36: 65-74, 81-93.
Solntseva M.P. Disturbances in the process of fertilization in Angiosperms under
hemigamy: hemigamy and its manifestations in plants // Fertilization in Higher Plants. /
Ed. H.F. Linskens. North-Holland Amsterdam: 1974: 311-324.
51-828
802
Семя
Solntseva M.P. Apomixis and hemigamy as one of its form // Proc. Indian Natl. Sci.
Acad., В., 1978. 44: 78-90.
Solntseva M.P. Pattern hemigamy in Rudbeckia laciniata L. // Abstr. «Fertilization
and Embryogenesis in Ovulated Plants». High Tatra (Rackova dolina), Czechoslovakia,
June 14-17. 1982.
Sood R., Prabha K., Gupta S.C. Is the «rejection reaction» inducing ability in
sporophytic self-incompatibility system restricted only to pollen and tapetum? // Theor.
Appl. Genet., 1982. 63: 27-32.
Soueges R. Recherches sur l'embryogenie des Renonculacees — Clematidees. 1.
L'embryon // Bull. Soc. Bot. France, 1910. 57: 242-252, 266-275.
Soueges R. Recherches sur l'embryogenie des Renonculacees — Anemonees. Genre
Anemone // Bull. Soc. Bot. France, 1911. 53: 128-134, 144-151, 188-195.
Soueges R. Recherches sur l'embryogenie des Renonculacees — Renonculacees
(genre Ranunculus) // Bull. Soc. Bot. France, 1913. 60: 506, 542, 615.
Soueges R. Nouvelle recherche sur le developpement de l'embryon chez les Cruciferes
// Ann. Sci. Nat., Bot., 1914a. 19(9): 311-339.
Soueges R. Nouvelles observations sur l'embryogenie des Cruciferes // Compt. Rend.
Held. Sea. Acad. Sci., 1914b. 158: 1356-1359.
Soueges R. Les principales divisions de l'oeuf et l'origine de I'hypophyse chez le
Capsella bursa-pastoris // Compt. Rend. Held. Sea. Acad. Sci., 1916. 163: 158-160.
Soueges R. Les premieres divisions de l'oeuf et les differenciations du suspenseur chez le
Capsella bursa-pastoris Moench // Ann. Sci. Nat., Bot., 1919. Ser.10, 1: 1-28.
Soueges R. Embryogenie des Solanacees. Developpement de l'embryon chez les
Nicotiana // Compt. Rend. Held. Sea. Acad. Sci., 1920a. 170: 1125-1127.
Soueges R. Developpement de l'embryon chez le Chenopodium bonus-henricus L. //
Bull. Soc. Bot. France, 1920b. 67: 233-297.
Soueges R. Embryogenie des Composees. I. Les premiers stades du developpement de
l'embryon chez le Senecio vulgaris L. II. Les derniers stades du developpement de
l'embryon chez le Senecio vulgaris L. // Compt. Rend. Held. Sea. Acad. Sci., 1920c.
171: 254-256; 356-357.
Soueges R. Embryogenie des Oenotheracees: Developpement de l'embryon chez
l'Oenothera biennis // Compt. Rend. Held. Sea. Acad. Sci., 1920d. 170: 946-948.
Soueges R. Embryogenie des Boragacees. Les premier terms du developpement de
l'embryon chez le Myosotis hispida // Compt. Rend. Held. Sea. Acad. Sci., 1921a, 173:
726-728.
Soueges R. Embryogenie des Scrophulariacees. Developpement de l'embryon chez le
Veronica arvensis L. // Compt. Rend. Held. Sea. Acad. Sci., 1921b. 172: 703-705,
1057-1058.
Soueges R. embryogenie des Caryophyllacees. Les premiers stades du developpement
de l'embryon chez le Sagina procumbens. Les derniers stades du developpement chez le
Sagina procumbens // Compt. Rend Hebd. Sea. Acad. Sci., 1922a. 175: 709-711,
894-896.
Soueges R. Recherches sur l'embryogenie des Solanacees // Bull. Soc. Bot. France,
1922b. 69: 163-178, 236-241,352-365, 555-585.
Soueges R. Developpement de l'embryon chez le Geum urbanum L. // Bull. Soc.
Bot. France, 1923a. 70: 645-660.
Soueges R. Embryogenie des Plantaginacees. Developpement de l'embryon chez le
Plantago lanceolata L. // Compt. Rend. Held. Sea. *cad. Sci., 1923b. 177(20): 964-967.
Литература 803
Soueges R. Developpement de l'embryon chez le Myosotis hispida Schlecht // Bull.
Soc. Bot. France, 1924a. 70: 385-401.
Soueges R. Embryogenie des Graminees, Developpement de l'embryon chez le Poa
annua L. // Compt. Rend. Held. Sea. Acad. Sci., 1924b. 178: 1307-1310.
Soueges R. Developpement de l'embryon chez le Sagina procumbens L. // Bull. Soc.
Bot. France, 1924 с 71: 590-614.
Soueges R. Developpement de L'embryon chez'le Sherardia arvensis L. // Bull. Soc.
Bot. France, 1925. 72: 546-565.
Soueges R. Developpement de l'embryon chez le Sedum acre L. // Bull. Soc. Bot.
France, 1927. 74: 234-251.
Soueges R. Developpement de l'embryon chez le Papaver kholus L. // Bull. Soc.
Bot. France, 1928. 75: 452.
Soueges R. Recherches sur l'embryogenie des Liliacees. Anthericum ramosum et
Alliumursinum // Bull. Soc. Bot. France, 1931a. 78(9-10): 662-681.
Soueges R. L'embryon chez le Sagittaria sagittifolia. Le cone vegetativ de la tige et
1'extremite radialaire chez le monocotyledones // Ann. Sci. Nat., Bot., 1931b. 13(1-2):
353-402.
Soueges R. Recherches sur l'embryogenie des Liliacees, Muscari comosum // Bull
Soc. Bot. France, 1932. 79(1): 11-23.
Soueges R. Recherches sur l'embryogenie des Juncacees // Bull. Soc. Bot. France,
1933. 80: 51-69.
Soueges R. L'hypophyse et 1'epiphyse: les problemes d'histogenese qui leur sont lies
// Bull. Soc. Bot. France, 1934. 81: 737-748, 769-778.
Soueges R. Exposes d'embryologie et de morphologie vegetales. IV. La segmentation.
Premier fascicule: I — Les fondaments. II — Les phenomenes internes // Act. Sci.
Industr., 1935a. 266: 1-88.
Soueges R. Embryogenie des Oenotheracees. Les principaux termes du developpement
de l'embryon chez le Ludwigia palustris Elliott. // Compt. Rend. Held. Sea. Acad. Sci.,
1935b. 200: 1626-1628.
Soueges R. Observations embryologiques sur quelques Fragaria de culture // Bull.
Soc. Bot. France, 1935c. 82: 458-461.
Soueges R. Embryogenie des Saxifragacees. Developpement de l'embryon chez le
Saxifraga granulata L. // Compt. Rend. Held. Sea. Acad. Sci., 1936a. 202: 240-242.
Soueges R. Embryogenie des Hypericacees. Developpement de l'embryon chez
l'Androsoemum officinale All. //Compt. Rend. Held. Sea. Acad. Sci., 1936b. 202: 679-
681.
Soueges R. Embryogenie des Droseracees. Developpement de l'embryon chez le
Drosera rotundifolia L. // Compt. Rend. Held. Sea. Acad. Sci., 1936c. 202: 1457-1459.
Soueges R. Exposes d'embryologie et de morphologie vegetales. La segmentation.
Deuxieme fascicule: III.- Les phenomenes externes. IV.-Les blastomeres // Act. Sci.
Industr., 1936d. 318: 1-80.
Soueges R. Embryogenie des Dipsacacees. Developpement de l'embryon chez le
Scabiosa succisa L. // Compt. Rend. Held. Sea. Acad. Sci., 1937a. 204: 292-294.
Soueges R. Exposes d'embryologie et de morphologie vegetales VII. Les lois du
developpment // Act. Sci. Industr., 1937b. 521: 1-94.
Soueges R. Developpement de l'embryon chez Chelidonium majus L. // Ann. Sci.
Nat., Bot., 1937c. 19: 445.
Soueges R. Embryogenie des Oxalidacees. Developpement de l'embryon chez l'Oxalis
cornicuiata L. // Compt. Rend. Held. Sea. Acad. Sci., 1939a. 209(19): 698-700.
51*
804
Семя
Soueges R. Exposes d' embryologie et de morphologie vegetales. X. Embryogenie et
classification. Deuxieme fascicule: Essai d'un systeme embryogenique (Partie generale)
// Act. Sci. Industr., 1939b. 1-85.
Soueges R. Embryogenie des Potamogetonacees. Developpement de l'embryon chez
Potamogeton natans L. // Сотр. Rend. Held. Sea. Acad. Sci., 1940. 211: 232-233.
Soueges R. Embryogenie des Fumariacees. L'origin du crops de l'embryon chez le
Fumaria officinalis L. // Compt. Rend. Held. Sea. Acad. Sci., 1941a. 213(1-26): 528-530.
Soueges R. Embryogenie des Fumariacees. La differenciation des rigions fondamentales '
du corps chez le Fumaria officinalis L. // Compt. Rend. Held. Sea. Acad. Sci., 1941b.
213(1-26): 699-701.
Soueges R. Embryogenie des Fumariacees. L'origine et les premieres divisions de la
cellule embryonnaire proprement dite chez L'Hypecoum procumbens L. // Compt. Rend.
Held. Sea. Acad. Sci., 1943. 216: 310-311.
Soueges R. Exposes d'embryologie et de morphologie vegetales. Embryogenie et
classification. 3. Essai d'un systeme embryogenique (Partie speciale: Premiere periode du
systeme) // Act. Sci. Industr., 1948. 1060: 1-101.
Soueges R. Embryogenie des Papaveracees. Developpement de l'embryon chez
l'Eschscholzia californica Cham. // Compt. Rend. Held. Sea. Acad. Sci., 1949. 229(9):
485-487.
Soueges R. Embryogenie et classification. IV. Essai d'un systeme embryogenique
(Partie speciale: Deuxieme periode du systeme) // Act. Sci. Industr., 1951. 1154: 1-95.
Soueges R. L'albumen et l'embryon chez le Callitriche vernalis (C.verna) // Compt.
Rend. Held. Sea. Acad. Sci., 1952. 235: 453-456.
Soueges R. Embryogenie et classification // Huitieme Congr. Int. Botanique. Sect.8.
Paris: 1954: 23.
Soueges R. Embryogenie des Dipsacacees. Developpement de l'embryon chez le
Scabiosa columbaria L. // Compt. Rend. Held. Sea. Acad. Sci., 1957. 245(5): 465-468.
Soueges R. Embryogenie des Commelinacees. Developpement de l'embryon chez le
Commelina communis L. // Compt. Rend. Held. Sea. Acad. Sci., 1958a. 246(14):
2082-2086.
Soueges R. Embryogenie des Commelinacees. Developpenrent de l'embryon chez le
Rhoeo discolor Hance. // Compt. Rend. Held. Sea. Acad. Sci., 1958b. 246(17): 2436-
2440.
Soueges R. Embryogenie des Hydrocharitacees. Developpement de l'embryon chez
l'Hydrocharis morsus-ranae L. // Сотр. Rend. Held. Sea. Acad. Sci., 1959. 248 (IV
45-49.
Soueges R. Embryologie vegetale. Embryogenie et classification. Notions preliminaires
fondamentales. Concepts nouveaux apportes par embryogenie // Compt. Rend. Held. Sea.
Acad. Sci., 1961a. 252: 3906-3911.
Soueges R. Embryologie vegetale: proarchetypes, archetypes et sous-archetypes en
embryogenie. 3. Les sous-archetypes // Compt. Rend. Held. Sea. Acad. Sci., 1961b. 252:
2481-2486.
Soueges R. Proarchetypes, archetypes et sous-archetypes en embryogenie. I. Les
proarchetypes dans la premiere periode du systeme embryogenique // Compt. Rend.
Held. Sea. Acad. Sci., 1961c. 252(11): 1536-1541.
Soueges R. Proarchetypes, archetypes et sous-archetypes en embryogenie. II. Les
proarchetypes dans la deuxieme periode du systeme embryogenique // Compt. Rend.
Held. Sea. Acad. Sci., 1961d. 252(14): 2045-2049.
Литература
805
Soueges R. Embryoligie vegetale: Reponse aux observations critiques de D.A. Johansen
relatives a mon essai de classification embryogenique // Compt. Rend. Held. Sea. Acad.
Sci., 1961e. 252(22): 3359-3364.
Soueges R. Embryogenie des Dipsacacees. Developpement de l'embryon chez le
Knautia arvensis // Compt. Rend. Held. Sea. Acad. Sci., 1963a. 256(6): 1190-1194.
Soueges R. Embryogenie des Dipsacacees. Developement de l'embryon chez le Cephalaria
tatarica // Compt. Rend. Held. Sea. Acad. Sci., 1963b. 256(1): 45-48.
Soueges R., Guignard J.L., Mestre J.С Developpment de l'embryon chez le Laurus
nobilis L.(Lauracees) // Phytomorphology, 1967. 17(1-4): 255-266.
Spemann H. Embryonic Development and Induction. N.-Y.: Yale Univ. Press, 1938.
Sperber D., Dransfeld K. Oriented growth of pollen tubes in strong magnetic fields
// Naturwiss. Wochenschr., 1981. 68: 40-41.
Sponsel V.M. The localization metabolism and biological activity of gibberellins in
maturing and germinating seeds of Pisum sativum, vr. Progress N9 // Planta, 1983.
159(5): 454-468.
Sponsel V.M., Mac Millan J. Metabolism of 13cl-gibberellin A29 to 13cl-gibberellin
catabolite in maturing seeds of Pisum sativum cv. Progress N9 // Planta, 1980. 150(1):
46-52.
Sporne K.R. A note on nuclear endosperm as a primitive character among dicotyledons
// Phytomorphology, 1954. 4(3-4): 275-278.
Sporne K.R. A re-investigation of character correlations among dicotyledons // New
Phytol., 1980. 85: 419-445.
Spurr A.R. Organization of the procambium and development of secrettory cells in the
embryo of Pinus strobus L. //Amer. J. Bot., 1950. 37: 185-197.
Srinivasan A.R. Morphological and cytological studies in Scrophulariaceae. V.-Striga
euphrasioides Benth // Proc. Indian Acad. Sci., 1946. 24B: 21-33.
Srinivasan A.R. Some new hosts for Striga // Curr. Sci., 1947. 16: 320-321.
Stebbins G.L. Flowering Plants: Evolution above the Species Level. Cambridge:
Harvard Univ. Press. 1974: 1-380.
Steeves T.A., Sussex I.M. Patterns in Plant Development. Cambridge: Cambridge
Univ. Press, 1989
Steffen K. Zur Kenntnis des Befruchtungsvorganges bei Impatiens glanduligera Lindl.
Cytologische Studien am Embryosack der Balsamineen // Planta, 1951. 39(3): 175-244.
Steffen K. Zytologische Untersuchungen an Pollenkorn und-schlauch.I. Phasenkontrast-
optische Levenduntersuchungen an PoUenschlauchen von Galanthus nivalis // Flora,
1953. 140(1): 140-174.
Steffen K. Male Gametophyte. // Recent Advances in the Embryology of Angiosperm.
/ Ed. Maheshwari P. Dehli: Univ. Delhi, 1963a: 15-40.
Steffen K. Fertilization // Recent Advances in the Embryology of Angiosperm. / Ed.
Maheshwari P. Dehli: Univ. Delhi, 1963b: 105-133.
Stenar H. Embryologische Studien. 1. Zur Embryologie einiger Columniferen. 2. Die
Embryologie der Amaryllidaceen. Diss. Uppsala, 1925. 1-197.
Stephen J. Cytological investigations on the endosperm of Borassus flabellifer Linn.
// Cytologia, 1974. 39(2): 195-207.
Sterclex R. Recherches anatomiques sur l'embryon et les plantules dans la famille
Renonculacees // Arch. Ins. Bot. Univ. Liepe, 1900. 2: 1-120.
Sterling С Embryogeny in the lima bean // Bull. Torrey Bot. Club., 1955. 82:
325-338.
806
Семя
Steward C.R. Some characteristics of the uptake of glutamine by corn scutellum
// Plant Physiol., 1971. 47(2): 157-161.
Stockard Ch.R. Developmental rate and structural expression an experimental study of
twins, double monsters and single deformities, and interaction among embryonic organs
during their origin and development // Amer. J. Bot., 1921. 28(2): 115-226.
Stoddart J.L., Thomas H., Robertson A. Protein synthesis patterns in barley embryos
during germination // Planta, 1973. 112(3): 309-321.
Stolt K.A.H. Zur Embryologie der Gentianaceen und Menyanthaceen // Kongl. •
Svenska Vetenskapsakad. Handl. N.S., 1921. 61(14): 1-56.
Stone D.E. Evolution of cotyledonary and nodal vasculature in the Juglandaceae
// Amer. J. Bot., 1970. 57(10): 1219-1225.
Strasburger E. Uber Befruchtung und Zellteilung // Jen. Zeit Naturw., 1877. 11:
435-536.
Strasburger E. Einige Bemerkungen uber vielkernige Zellen und Embryogenie von
Lupinus // Bot. Zeitung (Berlin), 1880. 38: 845-854, 858-868.
Strasburger E. Neue Untersuchungen Uber den Befruchtungsvorgang bei den
Phanerogamen als Grundlage fur eine Theorie der Zeugung. Jena: G. Fischer. 1884:
1-176.
Strasburger E. Uber das Verhalten des Pollens und die Befruchtungsvorgange bei den
Gymnospermen. Jena: G. Fischer. 1892: 1-158.
Strasburger E. Einige Bemerkungen zur Frage nach der «doppelten Befruchtung» bei
den Angiospermen // Bot. Zeitung (Berlin), 1900. 58(19-20): 293-316.
Strasburger E. Ein Beitrag zur Kenntnis von Ceratophyllum submersum und phylogene-
tische Erorterungen // Jahrb. Wiss. Bot., 1902. 37(3): 477-526.
Straub J. Zur Genetik der Trikotylie // Zeitschrift fur induktive Abstammungs und
Vererbungslehre, 1948. 88(1-2): 331-338.
Straub J. Pseudomonocotyle Keimlinge bei Antirrhinum majus // Ber. Deutsch. Bot.
Ges., 1953. 66(8): 312-320.
Straus D., Ausubel F.M. Genomic subtraction for cloning DNA corresponding to
deletion mutations // Proc. Natl. Acad. Sci. USA, 1990. 87: 1889-1893.
Stuart D.A., Durnam D.J., Jones R.L. Cell elongation and cell division in elongating
lettuce hypocotyle sections // Planta, 1977. 135(3): 249-255.
Subramanyam K. Embryology of Oxyspora paniculata DC. // Phytomorphology,
1951. 1(3-4): 205-212.
Subramanyam K. Nutritional mechanism of the seed. 2. Nutritional mechanism of the
embryo //J. Madras Univ., 1960. 30: 45-56.
Suessenguth K. Beitrage zur Frage des systematischen Auschlusses der Monocotylen
// Beih. Bot. Centralbl., 1920. 38,11(1): 1-79.
Sung Z.R., Belachew A., Shunong В., Bertrand-Garcia R. EMF, an Arabidopsis
gene required for vegetative shoot development // Science, 1992. 258: 1645-1647.
Sung Z.R., Okimoto R. Embryonic proteins in somatic embryos of carrot // Proc.
Natl. Acad. Sci. USA, 1981. 78: 205-211.
Sung Z.R., Okimoto R. Embryonic proteins in somatic embryos of carrot // Proc.
Natl. Acad. Sci. USA, 1983. 80: 2661-2665.
Sussex I., Clutter M., Walbot V., Brady J. Biosynthetic activity of the suspensor of
Phaseolus coccineus // Caryologia, 1973. 25(suppl.): 261-272.
Svensson H.G. Zur Embryologie der Hydrophyllaceen, Borraginaceen und Heliotropia-
ceen // Uppsala Univ. Arsskr., 1925. 2: 1-176.
Литература 807
Swamy, B.G.L. Female gametophyte and embryogeny in Cymbidium bicolor Lindl.
// Proc. Indian Acad. Sci., 1942. 15: 194-201.
Swamy B.G.L. Gametogenesis and embryogeny of Eulophea epidendrae Fischer // Proc.
Natl. Inst. Sci. India, 1943. 9: 59-65.
Swamy B.G.L. Inverted polarity of the embryo sac of angiosperms and its relation to
the archegonium theory // Ann. Bot. (London), N.S., 1946. 10: 171-183.
Swamy B.G.L. On the life history of Vanilla planifolia // Bot. Gaz. (Chicago),
1947. 108: 449-456.
Swamy B.G.L. Agamospermy in Spiranthes cernua // Lloydia., 1948a. 11: 149-162.
Swamy B.G.L. The embryology of Epidendrum prismatocarpum // Bull. Torrey Bot.
Club., 1948b. 75(3): 245-249.
Swamy B.G.L. On the post-fertilisation development of Trillium undulatum // Cellule,
1948c. 52(1): 7-14.
Swamy B.G.L. A contribution to the life history of Casuarina // Proc. Amer. Acad.
Arts. Sci., 1948d. 77(1): 1-32.
Swamy B.G.L. Embryological studies in the Orchidaceae. I. Gametophytes.
II. Embryology // Amer. Midi. Naturalist, 1949a. 41(1): 184-201, 202-233.
Swamy B.G.L. Further contributions to the morphology of the Degeneriaceae //J.
Arnold. Arbor., 1949b. 30: 10-38.
Swamy B.G.L. Contribution to the embryology of the Najadaceae // J. Indian Bot.
Soc. 1962. 41 (2): 247-267.
Swamy B.G.L. The origin of cotyledon and epicotyl in Ottelia alismoides //Beitr.
Biol. Pflanzen, 1963. 39 (1): 1-16.
Swamy B.G.L. The origin and the organization of the embryonic shoot apex in
Eichhornia crassipes // Bull. Torrey Bot. Club., 1966. 93 (1): 20-34.
Swamy B.G.L. Female gametophyte and embryogeny in Cymbidium bicolor Lindl.
// Proc. Indian Acad. Sci., 1972. 15: 194-201.
Swamy B.G.L. A critique of the «intermediate» type of endosperm in Angiosperms
// Phytomorphology, 1974. 24(1,2): 35-41.
Swamy B.G.L., Ganapathy P.M. A new type of endosperm haustorium in Nothapodytes
foetida // Phytomorphology, 1957a. 7(3-4): 331-336.
Swamy B.G.L., Ganapathy P.M. On endosperm in dicotyledons // Bot. Gaz., 1957b.
119(1): 47-50.
Swamy B.G.L., Krishnamurthy K.V. The helobial endosperm: a decennial review
// Phytomorphology, 1973. 23(1,2): 74-79.
Swamy B.G.L., Krishnamurthy K.V. Certain conceptual aspects of meristems. I On
hypophysis and quiescent centre // Phytomorphology, 1975. 25(1): 60-65.
Swamy B.G.L., Krishnamurthy K.V. Certain conceptual aspects of meristems.
II. Epiphysis and shoot apex // Phytomorphology, 1977. 27(1): 1-8.
Swamy B.G.L., Krishnamurthy K.V. On embryos and embryoids // Proc. Indian
Acad. Sci., 1981. 96: 401-414.
Swamy B.G.L., Lakshmanan K.K. The origin of epicotylary meristem and cotyledon
in Halophila ovata Gaudich. // Ann. Bot. (London), 1962a. 26(102): 243-249.
Swamy B.G.L., Lakshmanan K.K. Contribution to the embryology of the Najadaceae
//J. Indian Bot. Soc, 1962b.41 (2): 247-267. .
Swamy B.G.L., Padmanabhan D. Notulae embryologicae. 1. The functions of
endosperm in Avicennia officinalis // Curr. Sci., 1961. 30(11): 424-425.
Swamy B.G.L., Padmanabhan D. A reconnaissance of angiosperm embryogenesis
// J. Indian Bot. Soc, 1962. 41: 422-437.
808
Семя
Swamy B.G.L., Parameswaran N.A. A contribution to the embryology of Begonia
crenata // J. Indian Bot. Soc, 1960. 39(4): 140-148.
Swamy B.G.L., Parameswaran N.A. On the origin of cotyledon and epicotyl in
Potamogeton indicus // Osterr. Bot. Z., 1962. 109 (3): 344-349.
Swamy B.G.L., Parameswaran N.A. The helobial endosperm // Biol. Rev., 1963.
38(1): 1-50.
Swamy B.G.L., Periasamy K. Contributions to the embryology of Acrotrema
arrnottianum // Phytomorphology, 1955. 5(2-3): 301-314.
Swarupanahdan K. Late embryogenesis and morphology of mature embryos in three
species of Dipterocarpaceae // Canad. J. Bot., 1986. 64(11).
Swift H. Quantitative aspects of nuclear nucleoproteins // Int. Rev. Cytol., 1953. 2:
1-76.
Swift I.G., O'Brien T.P. Vascularization of the scutellum of weat // Austral. J. Bot.,
1970. 18(1): 45-53.
Swift I.G., O'Brien T.P. Vascular different action in the wheat embryo // Austral.
J. Bot., 1971. 19(1): 63-71.
Swift I.G., O'Brien T.P. The fine structure of the wheat scutellum before germination
// Austral. J. Biol. Sci., 1972a. 25(1): 9-22.
Swift I.G., O'Brien T.P. The fine structure of the wheat scutellum during germination
// Austral. J. Biol. Sci., 1972b. 25(5): 469-486.
Symons S.J., Angold R.E., Black M., Chapman J.M. Changes in the growth capacity
of the developing wheat embryo // J. Exp. Bot., 1983. 34(148): 1541-1550.
Szabo S.P., O'Day D.H. The fusion of sexual nuclei // Biol. Rev., 1983. 58(3):
323-342.
Szczuka E., Fyk В., Rodkiewicz B. Cutin and chlorophyll fluorescence in developing
embryos of some angiosperms // Platinum Jubilee Volume of the Indian Botanical
Society. 1995. 74A: 273-282.
Szczuka E., Rodkiewicz B. A cutin fluorescence pattern in developing embryos of
some angiosperms // Acta Soc. Bot. Pol. 1996. 65 (1-2): 155-160.
Szewczyk E. Photosynthesis in the developing embryo of Crambe tatarica Pall,
(dicotyledonous plants) // Bull. Acad. Polon. Sci. Ser. Sci. Biol., 1974. 22(1): 53-57.
Szewczyk E., Ryczkowski M. Changes in the chlorophyll content in the developing
embryo (dicotyledonous plants) // Bull. Acad. Polon. Sci. Ser. Sci. Biol., 1977. 25(10):
679-683.
Takhtajan A. Die Evolution der Angiospermen. Jena: Fischer, 1959: 1-344.
Takhtajan A.L. Outline of the classification of flowering plants (Magnoliophyta)
// Bot. Rev., 1980. 46(3): 1-225.
Takhtajan A.L. Evolutionary Trends in Flowering Plants. New York: Columbia Univ.
Press, 1991: 1-241.
Tamura M., Mizumoto J., Kubota H. Observations in seedlings of the Ranunculaceae
// Jap. J. Bot., 1977. 52(10): 233-304.
Tan K. Studies in the Thymelaeaceae. 1. Germination, seedling, fruit and seeds
// Not. Roy. Bot. Gard. Edinburgh, 1980. 38(1): 149-164.
Tang Pei-hua, Sun De-lan, Zhao Jing, Su Xiu-Zheu. Light and electron microscopic
observation on the developing pattern of cotyledons of Nelumbo nucifera // Acta Bot.
Sin., 1989. 31(10): 750-756.
Tang X., Hepler P.K., Scordilis S.P. Immunocytochemical identification of myosin
heavy chain polypeptide in Nicotiana pollen tubes //J. Cell Sci., 1989. 92: 569-574.
Литература
809
Tanimoto E. Gibberellin requirement for the normal growth of roots // Gibberellins.
/Eds. Takahashi N.. et al. New York: Springer, 1992: 229-240.
Tateoka T. Notes on some grasses. XVI. Embryo structure of the genus Oryza in
relation to the systematics // Amer. J. Bot., 1964. 51(5): 539-543.
Taylor A., Cosgrove D.J. Gibberellic acid stimulation of cucumber hypocotyl
elongation. Effect on growth, turgor, osmotic pressure and cell wall properties // Plant
Physiol., 1989. 90: 1335-1340.
Taylor A.R.A. Studies of the development of Zostera marina L. 1. The embryo and
seed // Canad. J. Bot, 1957a. 35(4): 477-499.
Taylor A.R.A. Studies of the development of Zostera marina. L. 2. Germination and
seedling development // Canad. J. Bot, 1957b. 35(5): 681-695.
Taylor А.Т., Clowes F.A.L. Temperature and the coordination of cell cycles within
the root meristem of Allium sativum // New Phytol., 1978. 81: 671-680.
Taylor D.W., Hickey L.J. Phylogenetic evidence for the herbaceous origin of
angiosperms // Plants Syst. Evol., 1992. 180: 137-156.
Taylor F., Kenrick J., Li Y., Kaul V., Gunning B.E.S., Knox R.B. The male germ
unit in Rhododendron: quantitative cytology, three-dimensional reconstruction, isolation
and detection using fluorescent probes // Sex. Plant Reprod., 1989. 2: 254-264.
Taylor M.G., Vasil J.K. The ultrastructure of zygotic embryo development in pearl
millet (Pennisetum glaucum, Poaceae) // Amer. J. Bot., 1995. 85(2): 205-219.
Taylor I.H., Woods P.H., Huges W.L. The organization and duplication of
chromosomes as revealed by autographic studies using tritium labelled timidine // Proc.
Natl. Acad. Sci. USA, 1957. 43: 122-134.
Thathachar T. Morphological studies in the Euphorbiaceae: 1. Acalypha lanceolata
Willd. // Phytomorphology, 1952. 2: 197-201.
Theunis C.H., Pierson E.S., Cfesti M. Isolation of male and female gametes in higher
plants // Sex. Plant Reprod., 1991. 4: 145-154.
Thiselton-Dyer W.T. Morphological notes. VIII. On polycotylodony // Ann. Bot.
(London), 1902. 16(63): 553-558.
Thoma S., Hecht U., Kippers A., Botella J., Vries S.C.de, Somerville C. Tissue-
specific expression of a gene encoding a cell wall-localized lipid transferprotein from
Arabidopsis // Plant Physiol., 1994. 105: 35-45.
Thomas E.N. Some aspects of «double fertilisation» in plants // Science Progress,
1907. 1: 420-426.
Thomas E.N.Seedling anatomy of Ranales, Rhoedales and Rosales // Ann. Bot.
(London), 1914. 28: 695-733.
Thomas E.N., Davey A.J. Morphology and anatomy of certain Pseudomonocotyledons
// Report 84th Meet. Brit. Ass. Sci. Sect.K. 1914: 578.
Thomas J., Guiltinan M.J., Bustos S., Thomas T.L, Nessler C. Carrot (Daucus
carota) hypocotyl transformation using Agrobacterium tumefaciens // Plant Cell Rep.,
1989. 8: 354-357.
Thomas T.L. Gene expression during plant embryogenesis and germination: an
overview // Plant Cell, 1993. 5: 1401-1410.
Thomas T.L., Wilde D. Analysis of gene expression in carrot // Proc. Somatic
Embryogenesis Workshop. San Miniato, Italy. IPRA. / Eds. Terzi M., Pitto L., Sung
Z.R. Rome, 1985: 77-85.
Tiagi B. A contribution to the morphology and embryology of Cuscuta hyalina Roth,
and C. planiflora Tenore. // Phytomorphology, 1951a. 1(1-2): 9-21.
i
|810 Семя
Tiagi В. Studies in the family Orobanchaceae. III. A contribution to the embryology
of Orobanche cernua Loefl. and O. aegyptiaca Pers // Phytomorphology, 1951b. 1(3-4):
158-169.
Tiagi B. Studies in the family Orobanchaceae.II.A contribution to the embryology of
Aeginetia indica L // Bull. Torrey Bot. Club., 1952a. 79(1): 63-78.
Tiagi B. Studies in the family Orobanchaceae. I. A contribution to the embryology of
Cistanche tubulosa // Lloydia., 1952b. 15(3): 129-148.
Tiagi B. A contribution to the embryology of Striga orobanchioides Benth and Striga
euphrasioides Benth // Bull. Torrey Bot. Club., 1956. 83: 154-170.
Tiagi В., Sankla H. Studies in the Orobanchaceae. V. A contribution to the embryology
of Orobanche lucorum // Bot. Mag., Tokyo, 1963. 76: 81-88.
Tiagi Y.D. Cactaceae // Bull. Indian Natl. Sci. Acad., 1970. 41: 29-35.
Tieghem P.E.L. van. Morphologie de l'embryon et de la plantule chez les Graminees
et les Cyperacees // Ann. Sci. Natur. (Paris), 1897. 8(3): 259-309.
Tieghem Ph. van. Sur le prothalle femelle des stigmatees //J. Bot. Agric.,, 1900.
14: 101.
Tiezzi A., Moscatelli A., Ciampolini F., Milanesi C., Murgia M., Cresti M. The
cytoskeletal apparatus of the generative cell in several angiosperm species // Sexual
Reproduction in Higher Plants. /Eds. Cresti M., Gori P., Pacini E. Berlin, Heilderberg:
Springer, 1988: 215-220.
Tillich H.-J. Vergleichend-morphologische Untersuchungen zur Identitat der Gramineen-
Primarwurzel // Flora, 1977. 166: 415-421.
Tilney-Bassett R.A.E. Plant Chimeras. London: Arnold, 1986.
Tilton V.R. The nucellar epidermis and micropyle of Ornithogalum caudatum
(Liliaceae) with a review of these structures in other taxa // Canad. J. Bot, 1980. 58:
1872-1884.
Tilton V.R., Horner H.T.Jr. Stigma, style and obturator of Ornithogalum caudatum
(Liliaceae) and their function in reproductive process // Amer. J. Bot.,1980. 67:1113-1131.
Tilton V.R., Mogensen H.L. Ultastructural aspects of the ovule of Agave parryi
before fertilization // Phytomorphology, 1979. 29(3-4): 338-350.
Tilton V.R., Wilcox L.W., Palmer R.G. Postfertilization wandlabirinthe formation
and function in the central cell of soybean, Glycine max (L.) Merr. (Leguminosae)
// Bot. Gaz., 1984. 145(3): 334-339.
Tirlapur U.K., Went J.L.van, Cresti M. Visualization of membrane calcium and
calmodulin in embryo sacs in situ and isolated from Petunia hybrida L. and Nicotiana
tabacum L. // Ann. Bot. (London), 1993. 71(2): 161-167.
Titova G.E. The Nelumbonales and Nymphaeales embryogenesis and the origin of the
monocotyledony // Abstr. XI Int. Symp. «Embryology and Seed Reproduction».
Leningrad, USSR, July 3-7, 1990. 1990: 173.
Titova G.E. The embryo development of Trapa astrachanica (Fler.) Winter (Trapaceae)
// Abstr. XII Int. Symp. Plant Embryology. USA, Columbus. 1992: 69-70.
Titova G.E. The Nelumbonales and Nymphaeales embryogenesis and the origin of the
monocotyledony // Proc. XI Int. Symp. «Embryology and seed reproduction». Leningrad,
USSR, July 3-7, 1990. 1992: 560-561.
Titova G.E., Batygina T.B. Is the embryo of Nymphaealean plants (Nymphaeales s.l.)
dicotyledonous? // Phytomorphology, 1996. 46(2): 171-190.
Titova G.E., Shamrov I.I., Batygina T.B. Comparative embryology of Nymphaeales
s.l. in relation to phylogeny and taxonomy // Abstr. XV Int. Bot. Congr., Yokohama,
Japan. 1993: 235.
' Литература 8111
Tobe H., Raven P.H. An embryological contribution to systematics of the Chrysoba-
lanaceae. I. Tribe Chrysobalaneae // Bot. Mag., Tokyo, 1984. 97(1047): 397-411.
Tobe H.T., Stuessy T.F., Raven P.H., Oginuma K. Embryology and karyomorphology
of Lactoridaceae // Amer. J. Bot., 1993. 80: 933-946.
Tohda H. Development of the embryo of Bletilla striata // Sci. Rep. Tohoku Imp.
Univ., Ser.4, Biol., 1968. 34(2-4): 125-131.
Tohda H.'Embryological study on Indonesia polycarpa // Sci. Rep. Тбпоки Imp.
Univ. Ser. 4, Biol., 1971. 35(4): 231-237.
Toko K., Fujiyoshi Т., Tanaka C, Iiyama S., Yoshida Т., Hayashi K., Yamafuji K.
Growth and electric current loops in plants // Biophys. Chem., 1989. 33(2): 161-176.
Toks E. Endosperm and embryo development in Cynoglossum officinale L. // Acta
Biol. Cracov., Ser. Bot., 1976. 19: 47-59.
Torres Ruiz R.A., Jurgens G. Mutations in the FASS gene uncouple pattern
formation and organogenesis in Arabidopsis thaliana // Development, 1994. 120: 2967-
2978.
Toyoda K. On the chlorophylls in some angiospermous seeds // Bot. Mag., Tokyo,
1959. 72(850): 159-168.
Toyoda K. The ratio of chlorophyll «a» to «b» in the plumule of Nelumbo nucifera
// Bot. Mag., Tokyo, 1960. 73(868): 398-403.
Toyomasu Т., Yamane H., Yamaguchi I., Murofushi N., Takahashi N., Inoue Y.
Control by light of hypocotyl elongation and levels of endogenous gibberellins in seedlings
of Lactuca sativa L. // Plant Cell Physiol., 1992. 33(6): 695-701.
Tran Thanh Van K., Tonbart P., Cousson A., Darvill A.G., Gollin D.J., Chelf P.,
Albersheim P. Manipulation of the morphogenetic pathways of tobacco by oligosaccharides
// Nature, 1985. 314: 615-617.
Traore D., Vincent C, Seres A. Prospects for biological control of Striga (witchweed)
in Burkina Faso // Proc. 5th Int. Symp. Parasitic Weeds, Nairobi, Kenya. / Eds.
Ransom J.K., Musselman L.J., Worsham A.D., Parker С 1991: 328.
Trela Z. Embryological studies in Anemone nemorosa L. // Acta Biol. Cracov., Ser.
Bot., 1963a. 6(1): 1-14.
Trela Z. Cytological studies in the differentiation of the endosperm in Anemone
nemorosa L. // Acta Biol. Cracov., Ser. Bot., 1963b. 6(2): 177-183.
Trela-Sawicka Z. Embryology studies of Trapa natans L. // Acta Biol. Cracov.,
1978. 21-22(2): 101-103.
Treub M. Notes sur l'embryogenie de quelques Orchidees // Verh. Kon. Ned. Acad.
Wetensch., Afd. Natuurk., Tweede Sect., 1879. 19: 1-50.
Treub M. Sur les Casuarinees et leur place dans le systeme naturel // Ann. Jard.
Bot. Buitenzorg, 1891. 10: 145-231.
Treub M., Mellink J. Notice sur le developpement du sac embryonnaire dans quelques
Angiospermes // Arch. Neerl., 1880. 15:
Treviranus L.Ch. Von der Entwicklung des Embryo und seiner Umhullungen in
Pflanzen-Ey. Berlin: Realschulbuchhandlung, 1815: 1-102.
Tronchet A. La polycotylie et la schizocotylie dans la Dimorphotheca pluvalis Moench.
// Compt. Rend. Hebd. Sea. Acad. Sci., 1925a. 180: 1862.
Tronchet A. L'Acceleration vasculaire dans la schizocotylie // Compt. Rend. Hebd.
Sea. Acad. Sci., 1925b. 181: 73.
Tronchet A. Sur la reduction du nombre des convergents chez les phaherogames, ses
rapports avec la polycotylie et le developpement vasculaire //Rev. Gen. Bot., 1928.
40: 1.
812
Семя
Tschirch A. Physiologische studien fiber die Samen, insbesondere die Saugorgane
derselben // Ann. Jard. Bot. Buitenzorg, 1891. 9: 143-183.
Tsien R.W., Tsien R.Y. Calcium channels, stores and oscillations // Ann. Rev. Cell
Biol., 1990. 6: 715-760.
Tucker L.R. Relation between number of carpels and number of cotyledons of the
apple // Proc. Amer. Soc. Hort. Sci. for 1937, 1938: 9-11.
Tupy J. Changes in glucose and fructose level in Nicotiana alata styles and ovaries
accompanying compatible and incompatible pollen tube growth // Biol. Plantarum, 1961..
3: 1-14.
Turcotte E.L., Feaster C.V. Semigamy in Pima cotton // Heredity, 1967. 58(2):
55-57.
Turcotte E.L., Feaster C.V. The origin of 2n and n sectors of chimeral Pima cotton
plants // Crop. Sci., 1973. 13(1): 111-112.
Turcotte E.L., Feaster C.V. Semigametic production of cotton haploids // Haploids
in higher plants. Advances and potential. Guelph., 1974: 53-64.
Tykarska T. Rape embryogenesis. II. Development of embryo proper // Acta Soc.
Bot. Polon., 1979. 48: 391-421.
Upadhyay N., Makoveychuk A.Yu., Nikolaeva L.A., Batygina T.B. Organogenesis
and somatic embryogenesis in leaf callus culture of Rauwolfia caffra Sond. // J. Plant
Physiol., 1992. 140: 218-222.
Vallade J. Organisation et functionnement de l'apex radiculaire d'Elaeis guineensis
Jacq. au cours de la germination // Compt. Rend. Hebd. Sea. Acad. Sci., 1966. ser. D.
263(25): 1961-1964.
Vallade J. Structure et fonctionnement du meristeme lors de la formation de la jeune
racine primaire chez un Petunia hybrida Hort // Compt. Rend. Hebd. Sea. Acad. Sci.,
1972. ser. D. 274: 1027-1030.
Vallade J. Structure et fonctionnement du meristeme lors de la formation de la juene
racine primaire chez un Petunia hybrida // Compt. Rend. Hebd. Sea. Acad. Sci., 1972.
270: 1893-1896.
Vallade J. Contributions a la connaissance des problemes fondamentaux de l'embryogenese
chez les Angiosperms. Recherches sur le Petunia hybrida Hort. et quelgues autres especes.
These. Dijon. 1976.
Vallade J. Donnees cytologiques sur la proembryogenese du Petunia: interest pour une
interpretation morphogenetique du developpement embryonnaire // Bull. Soc. Bot. France,
1980. 127(3-4): 19-37.
Vallade J. Embryogenesis and research of fundamental morphogenetic processes //
Some Aspects and Actual Orientations in Plant Embryology. Dedicatory Volume to Prof.
A. Lebegue. Amiens: Univ. de Picardie, 1989: 171-187.
Vallade J.Different kinds of growth processes during embryogenesis // Proc. XI Int.
Symp. «Embryology and Seed Reproduction», Leningrad, USSR, July 3-7, 1990. St.
Petersburg, 1992: 584-585.
Vance V.B., Huang A.H.C. The major protein from lipid bodies of maize // J. Biol.
Chem., 1987. 262: 1275-1279.
Vance V.B., Huang A.H.C. Expression of lipid body protein gene during maize seed
development // J. Biol. Chem., 1988. 263: 1476-1481.
Vasil I.K., Hilderbrandt A.C. Variations of morphogenetic behaviour in plant tissue
cultures. Il.Petroselinum hortense // Amer. J. Bot., 1966. 25: 7-11.
Vasilyeva V.E. Morpho-physiological correlations in the development of the reproductive
structures of Nelumbo nucifera Gaertn. // Ann. Scient. (Actes IX Coll. Int. Cytobiol.
Литература
813
reprod. Sex. Plant. Super. Reims, Sept. 1986, Univ. Reims Champagne-Ardenne et
A.R.E.R.S.). 1988. 23: 168-170.
Vasilyeva V.E., Batygina T.B., Titova G.E. Morpho-physiological correlations in the
development of the reproductive structures of Nelumbo nucifera Gaertn. //
Phytomorphology, 1987. 37(4): 349-358.
Vasilyeva V.E., Titova G.E., Ermakov LP., Morozova N.M., Chochya K.A. Time
and space concordance of the growth, differentiation and metabolism in the developing
seed of Nelumbo nucifera Gaertn. // Proc. 10th Int. Symp. «Sexual Reproduction in
Higher Plants». May 30 — June 4 1988, Univ. Siena, Siena, Italy. /Eds. Cresti M.,
Gori P., Pacini E. Berlin a. o.: Springer Verlag, 1988: 487.
Vaughn K.C., DeBonte L.R., Wilson K.G., Schaffer G.W. Organelle alteration as a
mechanism for maternal inheritance // Science, 1980. 208: 196-198.
Vazart B. Contribution a l'etude caryologique des elements reproducteurs et de la
fecondation chez lex vegetaux angiospermes // Rev. Cytol. Biol. Veg., 1955. 16(3-4):
209-406.
Vazart B. Befruchtung und Kernversehmelzung // Protoplasmatologia. Handbuch
Protoplasmaforschung. Wien: Springer, 1958. 7: 158.
Vazart B. Differenciation des cellules sexualles et fecondation chez les Phanerogames
// Protoplasmatologia, 1958. 7(3a): 1-158.
Vazart В., Vazart J. Infrastructure de l'ovule de Lin, Linum usitatissimum L. Les
cellules du sac embryonnaire // Compt. Rend. Hebd. Sea. Acad. Sci., 1965. 261(17):
3447-3450.
Vazart В., Vazart J. Deposition et infrastructure des cellules du sac embryonaire du
lin (Linum usitatissimum L.) // Rev. Cytol. Biol. Veg., 1966. 24(3-4): 251-266.
Vazart J. Infrastructure de l'ovule du lin, Linium usitatissimum L. Le complexe
antipodal // Compt. Rend. Hebd. Sea. Acad. Sci., 1968. 266(3): 211-213.
Vegis A. Dormancy in higher plants // Ann. Rev. Plant Physiol., 1964. 15:
185-224.
Velenovsky J. Vergleichende Morphologie der Pflanzen, Prague, 1907: 279-731.
Venkateswarlu J., Rao P.N. Endosperm in Euphorbiaceae and occurrence of endosperm
haustoria in two sps. of Croton Linn. // Curr. Sci., 1963. 32(11): 514-516.
Vernon D.M., Meinke D.W. Embryogenic transformation of the suspensor in twin, a
polyembryonic mutant of Arabidopsis // Developm. Biol., 1994. 165: 566-573.
Vesque J. Nouvelles recherches sur le developpement du sac embryonnaire des
Phanerogames Angiospermes // Ann. Sci. Nat. Bot., 1879. 6(8): 261-390.
Veyret Y. Embryogenie des Orchidacees. Developpement de l'embryon chez l'Angraecum
distichum Lindl. // Bull. Soc. Bot. France, 1958. 105(5-6): 227-230.
Veyret Y. Embryogenie comparee et blastogenie chez les Orchidaceae-Monandrae
// O.R.S.T.O.M. Paris, 1965. 106.
Veyret Y. Development of the embryo and the young seedling stages of orchids
// The Orchids Scientific Studies. /Ed. Withner C.L. New York a. o.: Acad, press,
1974: 223-265.
Vijayaraghavan M.R. Morphology and embryology of a vesselless dicotyledon Sarcandra
irvingbaileyi Swamy and systematic position of the Chloranthaceae // Phytomorphology,
1964. 14(3): 429-441.
Vijayaraghavan M.R., Gard M.Z. Histochemical and ultrastructural aspects of embryo-
suspensor in Crotalaria retusa and Crotalaria spectabilis // Phytomorphology, 1988.
38(1): 53-63.
814
Семя
Vijayaraghavan M.R., Prabhakar К. The endosperm // Embryology of Angiosperms.
/Ed. Johri B.M. Berlin a. o.: Springer-Verlag, 1984: 319-376.
Vishnyakova M.A., Willemse M.T.M. Pollen-pistil interaction in wheat // Acta Bot.
Neerl., 1994. 43(1): 51-64.
Vogelmann T.C. Plant tissue optics // Ann. Rev. Plant Physiol. Plant Molec. Biol.,
1993. 44: 231-252.
Vries H.de. Sur la fecondation hybride de l'albumen // Compt. Rend. Hebd. Sea.
Acad. Sci., 1899. 129(23): 973-975.
Vries H.de. Over de Erfelijkheid van Synfisen // Bot. Jaarb., 1895. 7: 129-197.
Vries H.de. Sur la culture des monstruosites. Paris: Gauthier-Villars, 1899: 1-4.
Vries H.de. Uber tricotyle Rassen // Ber. Deutsch. Bot. Ges., 1902. 20(2): 45.
Vries H.de. Die Mutationstheorie. Leipzig: Verlag von Veit & Сотр., 1903. 2:
1-752.
Vries S.C.de, Boadj H., Meyerink P., Huisman G., Widle H.D., Thomas T.L, van
Kammen A. Acquisition of embryogenic potential in carrot cell-suspension cultures
// Planta, 1988a. 176: 196-204.
Vries S.C.de, Booij H., Janssens R., Vogels R., Saris L., Loschiavo F., Terzi M.,
Kammen A. van. Carrot somatic embryogenesis depends on phytohormone-controlled
presence of correctly glycosylated extracellular proteins // Genes a. Development,
1988b. 2: 462-476.
Vuilleumier B.S. The origin and evolutionary development of heterostyly in angiosperms
// Evolution, 1967. 21: 210-226.
Wade Roush. Embryos travel forking path as they tell left from right // Science,
1995. 269(5230): 1514-1515.
Wagner V.T., Dumas C, Mogensen H.L. Morphometric analysis of isolated Zea
mays spem // J. Cell Sci., 1989a. 93: 179-184.
Wagner V.T., Song Y.C., Matthys-Rochon E., Dumas C. Observations on the
isolated embryo sacs of Zea mays L. // Plant Sci., 1989b. 59: 127-132.
Wagner V.T., Cresti M., Salvatica P., Tiezzi A. Changes in volume, surface area,
and frequency of nuclear pores on the vegetative nucleus of tobacco pollen in fresh,
hydrated, and activated conditions // Planta, 1990. 181: 304-309.
Wagner V.T., Mogensen H.L. The male germ unit in the pollen and pollen tubes of
Petunia hybrida: ultrastructural quantitative and three dimensional features // Protoplasma,
1987. 143: 93-100.
Walia K., Kapil R.N. Embryology of Frankenia Linn, with some comments on the
systematic position of the Frankeniaceae // Bot. Not., 1965. 118(4): 412-429.
Walker R.I. Megasporogenesis and embryo development in Tropaeolum majus L.
// Bull. Torrey Bot. Club, 1947. 74(3): 240-249.
Walthall E.D., Brady T. The effect of suspensor and gibberellic acid on Phaseolus
vulgaris embryo protein synthesis // Cell Different., 1986. 18: 37-44.
Wang M., Heimovaara-Dijkstra S., Duijn B.van. Modulation of germination of embryos
isolated from dormant and non-dormant barley grains by manipulation of endogenous
abscisic acid // Planta, 1995. 195(4): 586-592.
Wardlaw C.W. Embryogenesis in Plants. London: Methuen, 1955: 1-391.
Wardlaw C.W. Plant embryos as reaction systems // Recent Advances in the
Embryology of Angiosperms. /Ed. Maheshwari P. Delhi: Univ. of Delhi, 1963.
Wardlaw C.W. Physiology of embryonic development in Cormophytes // Encyclopedia
of Plant Physiology /Ed. Ruhland E. Berlin, Heidelberg, New York: Springer-Verlag,
1965. XV(1): 844-965.
Литература
815
Wareing P.F., Phillips J.D.J. The Control of Growth and Differentiation in Plants.
New York-Toronto: Pergamon Press Oxford, 1978: 1-347.
Warren Wilson J. The position of regenerating cambia: auxin-sucrose ratio and the
gradient induction hypothesis // Proc. Roy. Soc. London. Ser. В., Biol. Sci., 1978.
B203(1151): 153-176.
Warren Wilson J., Walker E.S., Warren Wilson P.M. The role of basipetal auxin
transport in the positional control of abscission sites induced in Impatiens sultani stem
explants // Ann. Bot. (London), 1988. 62(5): 487-495.
Warren Wilson J., Warren Wilson P.M. Mechanisms of auxin regulation of structural
and physiological polarity in plants, tissues cells and embryos // Austral. J. Plant
Physiol., 1993. 20(4/5): 555-571.
Warren Wilson J., Warren Wilson P.M., Walker E.S. Effects of applied IAA on the
position of abscission sites induced in wounded explants from Impatiens sultani internodes
// Ann. Bot. (London), 1988. 62(3): 235-243.
Warren Wilson J., Warren Wilson P.M., Walker E.S. Patterns of tracheary
differentiation in lettuce pith explants: positional control and temperature effects // Ann.
Bot. (London), 1991. 68: 109-128.
Weatherwax P. Gametogenesis and fecondation in Zea mays as the basis of xenia and
heredity in the endosperm // Bull. Torrey Bot. Club, 1919. 46: 73-90.
Weatherwax P. The endosperm of Zea and Coix // Amer. J. Bot., 1930. 17:
371-380.
Webb D.P., Staden J .van, Wareing P.F. Seed dormancy in Acer: changes in
endogenous cytokinins, gibberellins and germination inhibitors during the breaking of
dormancy in Acer saccharum Marsh. // J. Exp. Bot., 1973a. 24(78): 105-116.
Webb D.P., Staden J.van, Wareing P.F. Seed dormancy in Acer: changes in
endogenous germination inhibitors, cytokinins and gibberellins during the breaking of
dormancy in Acer pseudoplatanus L. // J. Exp. Bot., 1973b. 24(81): 741-750.
Webb M.C., Gunning B.E.S. The microtubular cytoskeleton during development of
the zygote, proembryo and free-nuclear endosperm in Arabidopsis thaliana (L.) Heynh.
// Planta, 1991. 184: 187-195.
Weber M. Formation of sperm cells in Galium mollugo (Rubiaceae), Trichodiademe
setuliferum (Aizoaceae), and Avena sativa (Poaceae) // Plant Syst. Evol., 1988a. 161:
53-64.
Weber M. Unusual sperm cells in Apiaceae // Plant Syst. Evol., 1988b. 159: 273-
276.
Weigel D., Meyerowitz E.M. // Cell, 1994. 78: 203-209.
Weiland U., Muller A.J. In -vitro-Kultur der Wurzeln von letalen fusca-Mutanten von
Arabidopsis thaliana // Kulturpflanze, 1972. 20: 151-164.
Weisenseel M.N., Dorn A., Jaffe L.F. Natural currents traverse growing roots and
root hairs of barley (Hordeum vulgare L.) // Plant Physiol., 1979. 64(3): 512-518.
Weisenseel M.N., Nuccitelli R., Jaffe L.F. Large electrical currents traverse growing
pollen tubes // J. Cell Biol., 1975. 66: 556-567.
Weisze A. Blattstellungsstudien an Samlingen abnorm Keimender Dikotylen // Beitr.
Biol. Pflanzen, 1930. 18(1): 17-80.
Welk Sr.M., Millington W.F., Rosen W.G. Chemotropic activity and the pathway of
the pollen tube in lily // Amer. J. Bot., 1965. 52: 774-781.
Went F.W. Morphological observations on the tomato plant // Bull. Torrey. Bot.
Club, 1944. 71: 77-92.
816
Семя
Went J.L.van. The ultrastructure of the synergids of Petunia // Acta Bot. Neerl.,
1970a. 19(2): 121-132.
Went J.L.van. The ultrastructure of the egg and central cell of Petunia // Acta Bot.
Neerl., 1970b. 19(3): 313-322.
Went J.L.van. The ultrastructure of the fertilized embryo sac of Petunia // Acta Bot.
Neerl., 1970c. 19(4): 468-480.
Went J.L.van. Unequal distrubution of plastids during generative cell formation in
Impatiens // Theor. Appl. Genet., 1984. 68(4): 305-309.
Went J.L.van, Linskens H.F. Die Entwicklung des sogenannten «Fadenapparates» im
Embryosack von Petunia hybrida // Genet. Breed. Res., 1967. 37(1): 51-56.
Went J.L.van, Willemse M.T.M. Fertilization // Embryology of Angiosperms /Ed.
Johri B.M. Berlin: Springer-Verlag, 1984: 273-317.
West M.A.L., Harada J.J. Embryogenesis in higher plants: an overview // Plant
Cell, 1993. 5: 1361-1369.
Westermaier M. Die ersten Zellteilungen im Embryo von Capsella bursa-pastoris
// Flora, 1876. 59(31-33): 483-520.
Wettstein R.R. Leittaden der Botanik fur die obern Klassen der Mittelschulen. Wien:
Tempsky, 1906: 1-240.
Wettstein R.R. Handbuch der Systematischen Botanik. Leipzig, Wien: Deuticke, 1911:
1-914.
Whatley J.M. , Price D.N. Do lemon cotyledons green in the dark? // New Phytol.,
1983. 94(1): 19-27.
Wheeler H., Humphreys T. Localization of a phosphatase (ATPase) on the plasmalemma
of the maize scutellum // Phytochem., 1979. 18: 549-554.
White J.M. Membrane fusion // Science, 1992. 258: 917-924.
White O.E. Fasciation // Bot. Rev., 1948. 14: 319-358.
Weinhold L. Histogenetische Studien zum Grenzwurzel Problem // Beitr. Biol.
Pflanzen, 1967. 43: 367-454.
Wiegand K.M. Notes on the embryology of Potamogeton // Bot. Caz., 1900. 30(1):
25-47.
Wiens D., Calvin C.L., Wilson C.A., Davern C.I., Frank D., Seavey S.R. Reproductive
success, spontaneous embryo abortion, and genetic load in flowering plants // Oecologia,
1987. 71: 501-509.
Wiens D., Nickrent D.L., Davern C.I., Calvin C.L., Vivrette N.J. Developmental
failure and loss of reproductive capacity in the rare palaeoendemic shrub Dedeckera
eurekensis // Nature, 1989. 338: 65-67.
Wilde H.D., Nelson W.S., Booij H., Vries S.C.de, Thomas T.L. Gene expression
programs in embryogenic and non-embryogenic carrot cultures // Planta, 1988. 176:
205-211.
Willemse M.T.M., Franssen-Verheijen M.A.V. Stylar development in the open flower
of Gasteria verrucosa (Mill.) H.Duval // Acta Bot. Neerl., 1986. 35(3): 297-309.
Williams E.G., Knox R.B., Kaul V. Post-pollination callose development in ovules of
Rhododendron and Ledum (Ericaceae): zygote special wall //J. Cell Sci., 1984. 69:
127-135.
Williams E.G., Maheshwaran G. Somatic embryogenesis: factors influencing coordinated
behaviour of cells as an embryogenic group // Ann. Bot. (London), 1986. 57(4):
443-462.
Литература
817
Williamson J.D., Quatrano R.S., Cuming A.C. Em polypeptide and its messenger
RNA levels are modulated by abscisic acid during embryogenesis in wheat // Eur. J.
Biochem., 1985. 152: 501-507.
Willis J.C. A Dictionary of the Flowering Plants and Ferns. Cambridge Univ. Press:
1966: 1-1214.
Wilms H.J. Ultrastructure of the stigma and style of Spinach in relation to pollen
germination and pollen tube growth // Acta Bot. Neerl., 1980. 29: 33-47.
Wilms H.J. Pollen tube growth through nucellus into embryo sac of Spinacia, an
ultrastructural investigation // Acta Bot. Neerl., 1981a. 50(1): 191-194.
Wilms H.J. Ultrastructure of the developing embryo sac of spinach // Acta Bot.
Neerl., 1981b. 30(1/2): 75-99.
Wilms H.J. Pollen tube penetration and fertilization in spinach // Acta Bot. Neerl.,
1981c. 30(1/2): 101-122.
Wilms H.J. Ultrastructure of the egg apparatus of Spinacia // Acta Soc. Bot. Polon.,
1981d. 50(1/2): 165-168.
Wilms H.J. Behaviour of spinach sperm cell in pollen tubes prior to fertilization
// Proc. 8th Int. Symp. Sexual Reprod. «Sexual Reproduction in Seed Plants, Ferns
and Mosses». August 20-24, 1984. Wageningen: PUDOC, 1985: 143-144.
Wilms H.J. Dimorphic sperm cells in the pollen grain of Spinacia // Biology of
Reproduction and Cell Motility in Plants and Animals. /Eds. Cresti M., Dallai R. Siena:
Univ. Siena, 1986: 193-198.
Wilms H.J., Aelst A.C.van. Ultrastructure of spinach sperm cells in mature pollen //
Proc. 7th Int. Cytoembr. Symp. High Tatra (Rackova dolina), June 14-17 1982.
Bratislava: VEDA, 1983: 105-112.
Wilson K.A. Role of proteolytic enzymes in the mobilization of protein reserves in the
germinating dicot seed // Plant Proteolytic Enzymes. Boca Raton: CRC Press, 1986:
19-47.
Winkler A. Uber die Keimblutter der deutschen Dicotylen // Verhandl. Botan.
Vereins Provinz Brandenburg, 1874. 16: 6-21, 54-56.
Winkler A. Die Keimblatter der deutschen Dicotylen // Verhandl. Botan. Vereins
Provinz Brandenburg, 1884. 26: 30.
Winkler A. Anomale Keimungen // Verhandl. Botan. Vereins Provinz Brandenburg,
1894. 36: 127.
Winkler H. Uber die Regeneration der Blattspreite bei einingen Cyclamen Arten
// Ber. Deutsch. Bot. Ges., 1902. 20: 81-87.
Winkler H. Die Monokotylen sind monokotyl // Beitr. Biol. Pflanzen, 1931. 19: 29.
Wodzicki T.J., Zajaczkowski S. Auxin waves in cambium and morphogenetic information
in plants // Proc. 14th Biochem. Congr. Prague. «Signals in Plant Development». July
10-15, 1988. /Eds. Krekule J., Sedlova F. Netherlands: SPB Acad. Publishing bv.,
Hague, 1989: 45-64.
Wojciechowicz M. K., Strzelecka K. Antipodal embryos formation in Allium odorum
// Abstr. VIII Conf. of Plant Embryologists, 16-18 September. Gdansk, Poland, 1997:
93.
Wolf M.J., Khoo U., Seckinger H.L. Distribution and subcellular structure of
endosperm protein in varieties of ordinary and high-lysine maize // Cereal Chem., 1969.
46: 253-263.
Wolfsberg M.F. Cell population kinetics in the epithelium of the forestomach of the
mouse // Exp. Cell. Res., 1964. 35: 119-131.
52-828
818 Семя
Woodard J.W. DNA in gametogenesis and embryogeny in Tradescantia // J. Biophys.
Biochem. Cytol., 1956. 2: 765-776.
Wunderlich R. Zur Frage der Phylogenie der Endospermtypen bei den Angiospermen
// Oesterr. Bot. Z., 1959. 106(3-4): 203-293.
Wunderlich R. Zur Deutung der eigenartigen Embryoentwicklung von Paeonia
// Oesterr. Bot. Z., 1966. 113(3-4): 395-407.
Wunderlich R. Ein Vorschlag eu einer natiirlichen Gliederung der Labiaten anf Grund
der Pollenkorner, der Samenentwicklung und des reifen Samens // Oesterr. Bot. Z.,
1967. 114(4-5): 383-483.
Wylie R.B. The morphology of Elodea canadensis // Bot. Gaz., 1904. 37: 1-22.
Wylie R.B. Sperms of Vallisneria spiralis // Bot. Gaz., 1923. 75(2): 191-202.
Wylie R.B. Some aspects of fertilization in Vallisneria // Amer. J. Bot., 1941. 28(1):
169-174.
Xi X.-J., Ye B.-X. [Изучение развития зародыша и накопление запасных веществ
у Coix lacryna-jobi (на китайском яз.)] // Acta Bot. Sin., 1994. 36(8): 573-580.
Xi-Jin Mu., Fu-Xiong Wang. The early development of embryo and endosperm of
Paeonia lactiflora // Acta Bot. Sin., 1985. 27(1): 7-12.
Xiaoping Gao, Ormrod F.J.C., Bennett M.D. An electron microscopic study of
double fertilization in allohexaploid wheat Triticum aestivum L. // Ann. Bot. (London)
1992. 70: 561-568.
XuHan X. Seed development in Phaseolus vulgaris L., Populus nigra L., and
Ranunculus sceleratus L. with special reference to the microtubular cytoskeleton. Doct
Thesis. Wageningen. 1995: 1-150.
XuHan X., Lammeren A.A.M. van. Microtubular configurations during the cellularization
of coenocytic endosperm in Ranunculus sceleratus L. // Sex. Plant Reprod , 1993 6-
127-132.
XuHan X., Lammeren A.A.M. van. Microtubular configurations during endosperm
development in Phaseolus vulgaris // Canad. J. Bot, 1994. 72: 1489-1495.
XuHan X., Souvre A., Granier C., Petitprez M. An improved immunolabelling
method for microtubular cytoskeleton in poplar (Populus nigra L.) free nuclear endosperm
// Biotech. Histochem., 1995.
Yadegari R., Paiva G.R.de, Laux Т., Koltunow A.M., Apuya N.. Zimmerman J.L.,
Fischer R.L., Harada J.J., Goldberg R.B. Cell differentiation and morphogenesis are
uncoupled in Arabidopsis rasberry embryos // Plant Cell, 1994. 6: 1713-1729.
Yakovlev M.S. Embryogenesis and some problems of phylogenesis // Rev. Cytol.
Biol. Veg., 1969. 32: 325-330.
Yakovlev M.S., Batygina T.B. Possible ways of in vitro morphogenesis in cultivated
peonyembryo // Abstr. Indo-Soviet Symposium «Embryology of Crop Plants». 1977:
35-36.
Yakovlev M.S., Yoffe M.D. On some peculiar features in the embryology of Paeonia
// Phytomorphology, 1957. 7(1): 74-82.
Yakovlev M.S., Zhukova G.Ya. On the presence of chlorophyll in embryos of angiosperm
seeds // Form, Structure and Function in Plants. Prof. Johri B.M. Commemor. vol. Sarita
Prakashan, Nauchandi, Meerut. India, 1975: 223-229.
Yakovlev M.S., Zhukova G.Ya. Chlorophyll in embryos of angiosperm seeds, a review
// Bot. Not., 1980. 133: 323-336.
Yamashita T. Embryo-und Wurzelentwicklung bei Commelina communis mit besonderer
Berucksichtigung der Coleorhiza Wurzelokologie und if-e Nutzanwendung // Int. Symp.
Литература 819
«Root Ecology and its Practical Application». Gumpenstein, 1982, • Bundesansalt
Gumpenstein, A-8952 Irdning, 1983: 21-32.
Yamazaki T. Taxonomical and phylogenetic studies of Scrophullariaceae-Veronicae,
with special reference to Veronica and Veronicastrum in Eastern Asia // J. Fac. Sci.
Univ. Tokyo, Sec. 3, 1957. 7: 91-162.
Yamazaki T. Embryology of Mitrosacme alsinoides var. indica // Sci. Rep. Tohoku
Imp. Univ., Ser. 4, Biol., 1963. 29: 201-205.
Yamazaki T. A system of Gamopetalae based on the embryology //J. Fac. Sci.
Univ. Tokyo, Sec. 3, 1974. 11: 263-281.
Yamazaki T. Embryogeny of Elaeagnus umbellata Thunb. // Jap. J. Bot., 1975.
50(9): 281-284.
Yamazaki T. Recognized types in early development of the embryo and the phylogenetic
significance in the Dicotyledons // Acta Phytotax. Geobot., 1982. 33: 400-409.
Yan Hua, Hong-Yuan Yang. Ultrastructure of the developing embryo sac of sunflower
(Helianthus annuus) before and after fertilisation // Canad. J. Bot, 1991. 69: 191-202.
Yanofsky M.F., Ma H., Bowman J.L., Drews G.N., Feldmann K.A., Meyerowitz E.M.
The protein encoded by the Arabidopsis homeotic gene agamous resembles transcription
factors // Nature, 1990. 346: 35-39.
Yeung E.C. Embryogeny of Phaseolus: the role of the suspensor // Z. Pflanzen-
physiol., 1980. 96(1): 17-28.
Yeung E.C. Structural and developmental patterns in somatic embryogenesis // In
vitro Embryogenesis in Plants. /Ed. Thorpe T.A. Dordrecht: Kluwer Acad. Publ., 1995:
205-247.
Yeung E.C, Cavey M.J. Cellular endosperm formation in Phaseolus vulgaris.I. Light
and scanning electron microscopy // Canad. J. Bot, 1988. 66(6): 1209-1216.
Yeung E.C, Clutter M.E. Embryology of Phaseolus coccineus: growth and microanatomy
// Protoplasma, 1978. 94(1-2): 19-40.
Yeung E.C, Clutter M.E. Embryogeny of Phaseolus coccineus: the ultrastructure and
development of suspensor // Canad. J. Bot, 1979. 57(2): 120-136.
Yeung E.C, Law S.K. Embryology of Calypso bulbosa. II. Embryo development
// Canad. J. Bot, 1992. 70(3): 461-468.
Yeung E.C, Meinke D.W. Embryogenesis in Angiosperms: development of suspensor
// Plant Cell, 1993. 5: 1371-1381.
Yeung E.C, Sussex I.M. Embryogeny of Phaseolus coccineus: the suspensor and the
growth of the embryo proper in vitro // Z. Pflanzenphysiol., 1979. 91(5): 423-433.
Yeung E.C, Zee S.Y., Ye X.Z. Embryology of Cymbidium sinense: embryo
development // Ann. Bot. (London), 1996. 78(1): 105-110.
Yoffe M.D. Fertilization and formation of the primary endosperm nucleus in Anemone
nemorosa L.. // Rev. Cytol. Biol. Veg., 1969. 32: 319-323.
Yoshida O. Embryologische Studien ttber die Ordnung Piperales. 1. Embryologie von
Chloranthus japonicus // J. Coll. Arts Chiba Univ. (Nat. Sci.), 1957- 2(2): 172-178.
Yoshida O. Embryologische Studien ttber die Ordnung Piperales. 2.Embryologie von
Chloranthus serratus // J. Coll. Arts Chiba Univ. (Nat. Sci.), 1959. 2(2): 295-303.
You R., Jensen W.A. Ultrastructural observation of the mature megagametophyte and
fertilisation in wheat (Triticum aestivum) // Canad. J. Bot, 1985. 63(2): 163-178.
Yu H.S., Hu S.Y., Russell S.D. Sperm cells in pollen tubes of Nicotiana tabacum
L.: three-dimensional reconstruction, cytoplasmic diminution and quantitative cytology
// Protoplasma, 1992. 168: 172-183.
52*
820
Семя
Yu H.S., Huang B.Q., Russell S.D. Transmission of male cytoplasm during fertilization
in Nicotiana tabacum // Sex. Plant Reprod., 1994. 7: 312-323.
Yu H.S., Russell S.D. Male cytoplasmic diminution and male germ unit in young and
mature pollen of Cymbidium goeringii: a 3-dimensional and quantitative study // Sex.
Plant Reprod., 1992. 5: 169-181.
Yu H.S., Russell S.D. Three-dimensional ultrastructure of generative cell mitosis in
the pollen tube of Nicotiana tabacum // Eur. J. Cell Biol., 1993. 61: 338-348.
Yu H.S., Russell S.D. Male reproductive cell development in Nicotiana tabacum:
male germ unit associations and quantitative cytology during sperm maturation // Sex.
Plant Reprod., 1994a. 7: 324-332.
Yu H.S., Russell S.D. Occurrence of mitochondria in the nuclei of Nicotiana tabacum
sperm cells // Plant Cell, 1994b. 6: 1477-1484.
Yu H.S., Russell S.D. Quantitative differences in sperm cells and organelles of
tobacco (Nicotiana tabacum L.) grown under differing environmental conditions // Theor.
Appl. Genet., 1994c. 89: 814-817.
Zaman B. The embryology of Juncus prismatocarpus Br. and J.effusus Linn. // Proc.
Indian Acad. Sci., 1950. 31(4): 223-234.
Zamski E. Light and electron microscope observation on scutellum epithelial cells
during germination of Zea mays seeds // Israel. J. Bot., 1975. 22: 211-230.
Zavala M.E., Branden D.L. Localization of a phytohormone using immunocytoche-
mistry // J. Cell Biol., 1983. 97(4): 1235-1239.
Zee S.Y., Aziz-Un-Nisa. Mitosis and microtubule organization changes in isolated
generative cells of Allemanda neriifolia // Sex. Plant Reprod., 1991. 4: 132-137.
Zenkteler M. In vitro fertilization and wide hybridization in higher plants // Crit.'
Rev. Plant Sci., 1990. 9: 267-279.
Zhang G., Gifford D.J., Cass D.D. RNA and protein synthesis in sperm cells isolated
from Zea mays L. pollen // Sex. Plant Reprod., 1993. 6: 239-243.
Zhang H.Q., Bohdanowicz J., Pierson E.S., Li Y., Tiezzi A., Cresti M. Microtubular
organization during asymmetrical division of the generative cell in Gagea lutea //J. Plant
Cell, 1995. 108: 269-276.
Zhang J., Maun M.A. The role of embryo and endosperm in the determination of
seedling size in two dune species // ([Pap.] Joint Meet. Can. Bot. Assoc, Toronto,
6-10 Aug., 1989), Amer. J. Bot. 1989a. suppl., 76(6): 132.
Zhang J., Maun M.A. Effect of partial removal of endosperm on seedling sizes of
Panicum virgatum and Agropyron psammophilum // Oikos., 1989b. 56(2): 250-255.
Zhang Z., Struot G.W., Zhu H., Russell S.D. Cell surface biology of male gametes
of Plumbago zeylanica // Abstr. 14th Int. Congr. Sex. Plant Reprod. «Plant Reproduc-
tion'96». February 18-26, Australia. 1996: 42.
Zhu Т., Mogensen H.L., Smith S.E. Generative cell composition and its relation to
male plastid inheritance patterns in Medicago sativa // Protoplasma, 1990. 158: 66-72.
Zhu Т., Mogensen H.L., Smith S.E. Quantitative cytology of the alfalfa generative
cell and its relation to male plastid inheritance patterns in three genotypes // Theor.
Appl. Genet., 1991. 81: 21-26.
Zhu Т., Mogensen H.L., Smith S.E. Heritable paternal cytoplasmic organelles in
alfalfa sperm cells. Ultrastructural reconstruction and quantitative cytology // Eur. J. Cell
Biol., 1992. 59: 211-218.
Zhu Т., Mogensen H.L., Smith S.E. Quantitative, three-dimensional analysis of
alfalfa egg cells in two genotypes. Implications for biparental plastid inheritance // Planta,
1993. 190: 143-150.
Литература
821
Zhukova G.Ya. Ultrastructural aspects of formation of some storage substances in the
embryo of angiosperms // Proc. Ind. Natl. Sci. Acad., 1978. 44: 133-140.
Zhukova G.Ya. Embryogenesis of angiosperms: ultrastructural transformations of plastids
// Acta Soc. Bot. Polon., 1981. 50(1-2): 303-306.
Zhukova G.Ya. On the correlation of endospermogenesis type with one of alternative
features of embryogenesis, i.e. occurrence or absence of chlorophyll in flowering plant
embryo // Abstr. XI Int. Symp. «Embryology and Seed Reproduction». Leningrad,
1990: 196.
Zhukova G.Ya. On the correlation of endospermogenesis type with one of alternative
features of embryogenesis, i.e. occurrence or absence of chlorophyll in angiosperm embryo
// Proc. XI Intern. Symp. «Embryology and Seed Reproduction.» Leningrad, July 3-7,
1990. St.-Petersburg, 1992: 634-635.
Zimmer E.A., Hamby R.K., Arnold M.L., LeBlanc D.A., Theriot E.C. Ribosomal
RNA phylogenies and flowering plant evolution // The Hierarchy of Life /Eds. Fernholm
В., Bremer K., Jornvall H. Amsterdam: Elsevier Science. 1989: 205-214.
Zinger N.V., Poddubnaya-Arnoldi V.A. Application of histochemical techniques to
the study of embryonic processes in certain orchids // Phytomorphology, .1966. 16(2):
111-124.
Zverzhanskaya L.S., Komarova P.I. Embryological bases of the origin of haploids and
of chimeras in the progeny of restitution maize linies // Abstr. «Fertilization and
Embryogenesis in Ovulated Plants». High Tatra (Rackova dolina), Czechoslovakia. June
14-17, 1982.
822
Предметный указатель
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Автономность зародыша 579
Антипода 90
Апекс корня 363
— дерматоген 358, 363
— периблема 365
— плерома 365
— чехлик 359
Апекс побега 379
Бесхлорофилльность зародыша 462
Вариации в строении и развитии
семядольного аппарата 381
— дикотилия 381
— псевдодикотилия 382
— монокотилия 382, 472
— псевдомонокотилия 382
— акотилия 404
— гетерокотилия 407
— поликотилия 397
— синкотилия 383
— схизокотилия 396
Вегетативная клетка 125, 170
Гемигамия 197
Генеративная клетка 125, 170
Гетеростилия ИЗ
Гипокотиль 296, 359
Гипофизарная ткань 354
Гипофизис 353
Двойное оплодотворение 31, 95, 140,
141, 175, 182, 204
— кариогамия 143, 151, 319
— сингамия 143, 208, 319
— тройное слияние 161, 166
— типы: 140
— премитотический 140, 156, 177,
183, 209
— постмитотический 140, 156, 177, 183
— промежуточный 142, 178, 183, 209
Зародыш 294, 323, 472, 588, 635
Зародышевый корень 296, 358
Зигота 307, 312, 313
Колеоптиль 296, 535
Кутикула зародыша 351, 575
Мужская оплодотворяющая система
124, 127, 147
Несовместимость 113
Оплодотворение 86, 140, 169, 186,
193, 200
— in vitro 210
Опыление 86, 200
Пелликула 109
Перисперм 213, 291
— настоящий 291
— транзиторный 291
Покой семян 656
Покоящийся центр 364
Полярность 316, 617
Полярные ядра 92, 162, 163
Проводниковый тракт пестика 107
— завязь 112
— рыльце 107
— столбик 110
Прогамная фаза оплодотворения 107, 200
Прорастание 667
типы прорастания:
— гипокотильный 668
— эпикотильный 668
Проросток 668, 685
Протодерма (эмбриодерма) 324, 346
Проэмбрио 321
Пыльцевая трубка 98, 120, 121
Самонесовместимость 113
Семигамия (см. Гемигамия)
Семенная кожура 650
Семя 649
Семядоля 296, 380, 381
Семядольный аппарат (см. Вариации в
развитии семядольного аппарата)
Синергида 88, 146
Собственно зародыш 294, 322
Спермий 32, 96, 125, 149
Суспензор 321, 325, 333, 341
Типы вхождения пыльцевой трубки в
зародышевый мешок: 121, 136
— мезогамия 121
— порогамия 121, 136
Семя
823
— халазогамия 121, 136
Трифин 116
Хлорофиллоносность зародыша 461
Центральная клетка 163
Щиток 296, 532, 681
Экспрессия генов 593, 605
Эмбриогенез 493, 508, 557, 568, 575,
579
типы эмбриогенеза: 493, 508
— Asterad 512
— Caryophyllad 518
— Chenopodiad 517
— Graminad 520, 528
— Onagrad 510
— Paeoniad 528, 541
— Piperad 508
— Solanad 516.
Эмбриогения 297
Эмбриоид 295, 306, 542, 624, 635
Эмбриоидогения 295, 624, 628
Эндосперм 116, 212, 248
— базальный аппарат 237
— гаустории 214, 224, 228, 254, 288
— первичная клетка 212
— первичное ядро 163, 212
— собственно эндосперм 218, 230
— типы развития 214, 218, 285
— гелобиальный 214, 236, 285
— клеточный (см. целлюлярный)
— нуклеарный 214, 218, 285
— промежуточный (см. гелобиальный)
— тубифлоральный 215, 235, 281, 286
— целлюлярный 214, 227, 285
— ядерный (см. нуклеарный)
фазы развития эндосперма
— клеточная 223, 238, 242
— свободноядерная (см. ценоцитная)
— ценоцитная 220, 238, 242
Эпикотиль 296, 376
Эпифизариая ткань 356
Эпифизис 356
Яйцеклетка 145, 311
ИЛЛЮСТРАЦИИ
II ТОМА
Рис. 1. Проводниковый тракт пестика.
1-3 — строение пестика Brassica oleracea: вндны папиллятное рыльце сухого типа, тяж
проводниковой ткани в столбике и септа в завязи (1), папиллы рыльца и пыльцевые зерна на
продольном срезе (2), проводниковая ткань столбика на поперечном срезе (3); 4-9 —
проводниковый тракт Medicago saliva: продольный срез рыльца, видна пыльцевая трубка в секрете
влажного рыльца (4), поперечный срез проводниковой ткани в верхней части столбика (5),
электронография этого же участка столбика (6), поперечный срез канала столбика (7),
продольный срез через обтуратор и микропнле семязачатка (8), электронография клеток обтуратора (9);
к кл — канальцевые клетки, к с — канал столбика, м — микропиле, об — обтуратор, п з —
пыльцевое зерно, п р — папиллы рыльца, п т — пыльцевые трубки, п т cm — проводниковая
ткань столбика, с з — септа завязи, с р — секрет рыльца.
1-3,5,6,9 — Вишнякова, ориг.; 4,7,8 — по: Вишнякова, 1986.
и m
1*"
2 ла'ж
Рис. 1 (продолжение).
*T#
*-. n1 ;
ir. 2.
Воспринимающая поверхность рыльца.
1,2 — электронографии поперечных срезов воспринимающих волосков рыльца Triticum aesiivum
до опыления (\) и после опыления (2); 3,4 — продольный (3) и поперечный (4) срезы
лопастей рыльца в бутоне Helianthus annuus; п р — папиллы рыльца, п т — пыльцевая трубка,
п т cm — проводниковая ткань столбика.
1, 2 — по: Vishnyakova, Willemse, 1994; 3, 4 — Вишнякова, ориг.
, 50 мкм j
Рис. 3. Строение столбика.
1-6 — типы столбика, открытый (1), закрытый (2,3) и полузакрытый (4-6): 1 — канал
в столбике Trifolium pratense, 2 — тяж проводниковой ткани в столбике Lonicera turczaninowii,
3 — два тяжа проводниковой ткани в столбике Lycopersicon esculentum, 4-6 — влажное рыльце
и верхняя часть столбика (4), канал столбика с растущими пыльцевыми трубками (5),
проводниковая ткань нижней части столбика (6) Malus domestical
Рис. 3 (продолжение).
7-9 — столбик и верхняя часть завязи (7), проводниковая ткань столбика с пыльцевыми
трубками (8,9) 1 nticum aeshvum; в и — внутренний интегумент, к кл - канальцевые клетки,
кл п т cm — клетка проводниковой ткани столбика, к с — канал столбика, ни — наружный
интегумент, п т — пыльцевые трубки, п т cm — проводниковая ткань столбика, с р — секрет
рыльца.
1 — по: Вишнякова, 1991; 2,3,5,6 — Вишнякова, ориг.; 4 - по: Вишнякова, 1987; 7-9 — по:
Vishnyakova, Willemse, 1994.
7Л * К
' lit • wV*&£ Ч*£
ЦЧ/л ...
74 W .МФ ®ЙЖ8й5§ £
№' Mk ft
?>гс *£$№
0; 5' мкм f Ml '■$?* Я
'ИС.
4. С
троение завязи.
1-4 —■ электронографии срезов завязи Triiicum aestivum: t — внутренний эпидермис стенки
завязи и наружный интегумеит семязачатка в кеопыленном пестике, 2 — несколько растущих
(одиночные стрелки) и одна остановившаяся (двойная стрелка) пыльцевые трубки между
стенкой завязи и наружным интегументом семязачатка, 3 — соединение клеток проводниковой ткани
столбика и внутреннего эпидермиса стенки завязи, стрелкой показаны плазмодесмы, 4 —
мелкофибриллярное вещество в полости завязи; ни — наружный интегумеит, п з — полость
завязи, з с з — эпидермис стенки завязи.
1-3 — по: Vishnyakov-i, Willemse, 1994; 4 — Вишнякова, орнг.
Pi
^ а М021 ее совместимость.
1.7 — :-амето(!>итная (1, j-1) и спорофишая 12) самокесовместимость, проявляющаяся в ингиби-
?ГТ^ПР°СТЧ ;Ь!Л^ЦеВЫХ ТРУб°/%(^"""«ие^ная микроскопия): на рыльце Hordeum bulbosum
(1, хЪС) Kjlehanthus annuus (2, х!80), в столбике Viburnum oPu!,n (3, хЮО), в апикальной
7wiPnT0A°HKa «""'"с т,™т™™' (4- Д3?-°). » базальной части столбика С. coneinrw
р, xltO,, в столбике Sambucus mgrn (6, х70), где наблюдается росг только одной пыльцевой
трубки и, как результат, оплодотворение оД„ого ■емяяачатка, в завязи перед микропиле
семязачатка Medicago sail,:,. (7, x2t<0); сз — семязачаток.
1-6
эишнякова, ориг.;
Казачковская и до., 1992
Рис. 6. Рост пыльцевой трубки и движение в ней ядра и клеток.
1 — схема движения ядра вегетативной клетки и генеративной клетки в пыльцевой трубке
с формирующимися каллозными пробками; 2-6 — прорастание пыльцевого зерна и выход ядра
вегетативной клетки и спермиев в пыльцевую трубку Zea mays; 7 — спермин и ядро
вегетативной клетки Scilla sibirica.
1 — по: Коробова, 1977; 2-6 — по: Коробова, 1962; 7 — по: Коробова, 1979.
Г/Л
т
Fig. 7. Generative eel! division and sperm eel! formation in Gsgea lutea.
[Рис. 7. Деление генеративной клетки и формирование сиермиев у Gagea In tea]
1 — differential interference contrast micrograph of the generative cell and the generative cell nucleus
in a pollen tube Arrows indicate the adges of the generative cell. Bar: 20 |дт; 2 — a spindle-like
organization of the microtubules (a) and the generative cell (b) appeared at late prophase in a pollen
tube. Bar: _ 20 цт; 3 - a short microtubule spindle (a) and the chromosomes (b) showed at
metaphase in a pollen tube. The metaphase plate was net labelled by an'i-a-l'ibuli" -ntibodv Bar
10 p.m;
53~828
Fig. 7 (continued).
4 microtubule boundls (a) were interconnected the separating chrqmosomes (b) at anaphase in a
pollen tube. Bar: 10 (Xm; 5 — in pollen tube after cytokinesis, microtubules were arranged in
a phragmoplast-like structure (left image). The cell plate was not labelled by anti-a-tubulin antibody.
The two daughter nuclei showed unequal numbers of nucleoli,'less in the leading sperm cell (middle
image). The arrow indicates the direction of the pollen tube tip. The right image was formed by
merging the other two images showing the cell plate is close to the leading sperm cell. Bar: 10 nm
GC — generative cell, GJV — generative cell nucleus.
1-5 — Cresti, Li, orig. data.
10 |im.
PfW
\vc-\
:v.n:-
Fig. 8. Male germ unit.
[Рис. 8. Мужская оплодотворяющая система]
1 — formation and immersion of the generative cell in the pollen grain
during microgametogenesis and the origin of the internal pollen plasma
membrane: A. The generative cell is formed as a lens-shaped cell
adjacent to the vegetative cell in contact with the inner pollen wall.
The inner wall is a conventional cell wall known as the intine, whereas
the exterior layer is a resistant wall layer called exine, which is composed of sporopollenin. The
vegetative cell membrane is indicated by the unlabeled arrowhead. B. As the generative cell separates
from the intine, the vegetative cell membrane (arrowhead) remains associated with the cell. C. As
the generative cell enters the vegetative cell and becomes fully immersed in the vegetative cytoplasm,
the plasma membrane of the vegetative cell (arrowhead) moves inward with it, forming the inner
pollen plasma membrane; 2 — reconstruction of the male germ unit of Plumbago zeylanica inside a
pollen grain at anthesis : A. Two sperm cells are connected by a common crosswall (unlabeled
arrowheads). The sperm cell to the left is the one that is associated with the vegetative nucleus.
B. Cytoplasmic heterospermy is evident in a sectional view of the two sperm cells showing their
cytoplasmic contents and nuclei. The sperm cell associated with the vegetative nucleus has the
majority of mitochondria, whereas the other sperm cell contains the majority of plastids; 3 —
reconstruction of the male germ unit of Nicotiana tabacum, showing: 1. the vegetative nucleus with a
prominent nucleolus in the vegetative cytoplasm, 2. the sperm cell associated with the vegetative
nucleus and 3. the trailing unassociated sperm cell. The two sperms are connected by a common cell
wall. Various cytoplasmic organelles including Golgi bodies, a lipid body, mitochondria and small
vacuoles are shown. Diminution of the sperm cytoplasm occurs through the production of vesicle-
containing bodies (unlabeled arrows) and enucleated cytoplasmic bodies;
53*
Fig. 8 (continued).
4 — cytokinesis and sperm cell separation in Galium : A. Centripetal cell plate extension is followed
by (B) the completion of a first division wall. C. A second division wall then forms and (D) is
completed, followed by (E) cell wall separation (arrows) from the edge to the center and ultimately
(F) causes the separation of the two sperm cells; 5 — cytokinesis and sperm cell separation in
Trichodiadema and Avena : A. Centripetal cell plate extension is followed by (B) the completion of
the division wall. C. A dense layer present at the center of the wall is the site of cell wall separation
(arrows), which (D) proceeds from one edge of the cell to the other, ultimately (E) causes the
separation of the two sperm cells. Dl — dense layer, Dwj, Da>2 — first and second division walls,
E — exine, ECB — enucleated cytoplasmic bodies, С — Golgi bodies, GC — generative cell, / —
intine, L — lipid body, M — mitochondria, MGU — male germ unit, NU — nucleolus, P —
plastid, S — sperm cell, Scl, Sc2 — two sperm cells, SN — sperm nucleus, Sua — sperm cell
unassociated with vegetative nucleus, Svn — sperm cell, associated with vegetative nucleus, V —
vacuole, VC — vegetative cytoplasm, VN — vegetative nucleus, W — cell wall.
1 — after Russell, 1994; 2 — after Russell, 1984; 3 — after Yu et al., 1992; 4,5 — after Weber,
1988a.
Рис. 9. Порогамия. Халазогамия.
1 — порогамия: схема завязи и семязачатка с зародышевым мешком, пунктиром показан путь
пыльцевой трубки от столбика к клеткам яйцевого аппарата; 2,3 — халазогамия: 2 — схема
прохождения пыльцевой трубки по фуиикулусу и иуцеллусу к яйцевому аппарату (Betula ermani),
3 — продольный срез иуцеллуса с ветвящейся пыльцевой трубкой над яйцевым аппаратом
(Betula costata); з — завязь.
1 — по: Батыгина, 1974, 1987; 2,3 — по Корчагина, 1981.
V V.'i Sm vOgJg» ..?f,0
Рис. 10. Типы двойного оплодотворения.
премитотическии тип оплодотворения у Crepis capillaris (Asteraceae); 2
кий тип оплодотворения у видов Lilium (Liliaceae).
1,2 — по: Герасимова-Наватина, 1957.
постмитотичес-
v. V.3
Рис. 11. Сингамия у Listera. ovata.
1 — спермий в пыльцевой трубке; 2-7 — слияние половых ядер.
1-7 — по: Savina,1974.
Рис. 12. Тройное слияние.
1,2 — миграция полярных ядер в восьмиядерном, семи-
клеточном зародышевом мешке Passiflora coerulea: 1 —
пристенное положение полярных ядер в средней части
центральной клетки, 2 — полярные ядра лежат под
яйцеклеткой; 3-20 — последовательные фазы тройного слияния
у злаков, начиная с подхода ядра спермия к ядрам
центральной клетки до полного их слияния, и первого деления
ядра первичной клетки эндосперма: 3, 4 — ядро спермия
на границе двух полярных ядер, 5, 6, 8, 9 — ядро
спермия объединяется с одним из полярных ядер, 7 — ядро
спермия объединяется сразу с обоими полярными
ядрами, 10-1*2 — ядро первичной клетки эндосперма в иитер-
фазе (10), профазе (11) и метафазе (12), 13-17 —
объединение ядра спермия с одним из полярных ядер, 18,19 —
профаза деления ядер первичной клетки эндосперма,
Я СП
Рис. 12 (продолжение).
". ЭР* Л* * V-
-^'*■"?>'
*'■. ,». ■ '■. .
■, ■ . ь - ■ * .
*"■ ■ tttf-, ■
|»:А\::*х\..:*-
l?^1 .',fc * S* ■■■-
^.J.1''^■'■Чг
"'If V
^^1^/
0*
^ГЖ№
20
Рис. 12 (продолжение).
20 — ядро спермия, сливающееся с полярным ядром через 2 — 2 3/4 ч п/опыл. (3-7, 10, 11
Triticum aestivum, 8, 9, 12 — Т. топососсит, 13-19 — Zea mays, 20 — Hordeum sp.);
м п
X П Я
п я э
X П Я
п я э
Рис. 12 (продолжение).
21-24 — двойное оплодотворение и начальные фазы развития эндосперма у Melampgrum
nemorosum: 21 — ядро одного из спермиев находится иа ядре яйцеклетки, второго — на микро-
пилярном полярном ядре, 22 — погружение ядра спермия в микропилярное полярное ядро, 23,
24 — в ядре зиготы выделилось второе ядрышко, объединяющиеся первичное ядро эндосперма и
халазальиое полярное ядро находятся в профазе;
28 29 30
Рис. 12 (продолжение).
25-27 — зародышевый мешок Сагда illinensis до оплодотворения (25), в момент оплодотворения
(26) и после оплодотворения (27): 25 — полярные ядра находятся в контакте, 26 — спермин
вышли из синергид, вегетативное ядро пыльцевой трубки осталось в синергиде, полярные ядра
слились, образовалось вторичное ядро центральной клетки, 27 — слияние гамет; 28-30 —
поведение ядер в зародышевом мешке у Allium nutans: 28 — сформированный зародышевый мешок,
одно полярное ядро в микропилярной части зародышевого мешка, другое — в халазальной, 29 —
тройное слияние, 30 — ядро первичной клетки эндосперма в метафазе;
Рис. 12 (продолжение).
31-40 — формирование зародышевого мешка (31-33) и последовательные фазы объединения
ядра спермия с вторичным ядром центральной клетки (34-39) у Anemone nemorosa: 31 — в
зародышевом мешке полярные ядра еще разделены вакуолью, антиподы одноядерные, 32 —
полярные ядра сближены перед слиянием, имеют одинаковый размер, антиподы двуядериые, 33 —
зародышевый мешок полностью сформирован, полярные ядра слились и образовали вторичное
ядро центральной клетки, примыкающее к четырехъядерным антиподам, 34-39 — слияние ядра
спермия с вторичным ядром центральной клетки, 40 — первые два ядра эндосперма;
45
49
41-49
Рис. 12 (продолжение).
двойное оплодотворение у Neottia nidus avis (41-46) и Cymnadenia conopsea (47-49);
я в кл
Рис. 12 (продолжение).
50-58 — одинарное оплодотворение у Calanthe veitchii: 50 — пыльцевая трубка в зародышевом
мешке, одна из синергид разрушена, 51, 52 — спермин вблизи яйцеклетки и полярно-аитиподальной
группы ядер, 53 — ядра спермиев вблизи ядер яйцеклетки и одной из синергид, 54, 55 —
слияние ядра яйцеклетки с ядром спермия, ядра полярно-аитиподальиои группы и ядро спермия
не сливаются между собой, причем в случае 54 обе синергиды оказались неразрушенными, так
как пыльцевая трубка прошла сбоку от них, 56, 57 — зиготы, 58 — деление ядра значительно
увеличившейся зиготы, ядра полярно-антиподальиой группы остались неслившимися;
я с
я с
я я
вт я ц кл 71
69
70
Рис. 12 (продолжение).
69-73 — процесс оплодотворения, иллюстрирующий отсутствие тройного слияния у Тгара astra-
chanica: 69 — зрелый зародышевый мешок, 70-73 — задержка одного из спермиев в синергиде
или в щели между синергндои и центральной клеткой;
зар
вт я ц кл
11
73
Рис. 12 (продолжение).
54-828
Рис. 12 (продолжение).
74, 75 — двойное оплодотворение у Arachis hypogea: 74 — ядра спермиев подошли к ядру
яйцеклетки и полярным ядрам, 75 — слияние ядер яйцеклетки и спермия, тройное слияние;
76-79 — тройное слияние (76-78) и деление ядра первичной клетки эндосперма (79) у Cagea
stipitata; 80 — экваториальная пластинка из двуядериого эндосперма Crepis virens; a\, a^, aj, —
длинные гомологичные хромосомы, Ь\, Ъ-£, Ът, — средние гомологичные хромосомы, С\, С2, Сз —
короткие гомологичные хромосомы, в я — вегетативное ядро, вт я jj кл — вторичное ядро
центральной клетки, зар — зародыш, м п я — микропилярное полярное ядро, п я — полярное
ядро, п я э — первичное ядро эндосперма, сп — спермий, х п я — халазальное полярное ядро,
ц кл — центральная клетка, я s кл — ядро вегетативной клетки, я я — ядро яйцеклетки, я с —
ядро сииергиды, яд п я — ядрышко полярного ядра, я сп — ядро спермия.
1, 2 — по: Алимова, 1983; 3-12 — по: Батыгииа, 1987; 13-19 — по: Коробова, 1982; 20 —
по: Mogensen, 1982; 21-24 — по: Иоффе, 1976; 25-27 — по: Солицева, Дгебуадзе, 1974;
28-30 — по: Стожарова, Поддубиая-Арнольди, 1977; 31-40 » по: Иоффе, 1968; 41-49 — по:
Савииа, 1990; 50-58 — по: Поддубная-Арнольди, 1964; 59-68 — Лагутова, ориг.; 69-73 —
по: Титова, 1988; 74, 75 — по: Замотайлов, 1958; 76-79 — по: Шамров, 1990; 80 — по:
С. Г. Навашии, 1915.
Fig. 13. Fertilization mechanisms.
[Рис 13. Механизмы оплодотворения]
1 — representation of the egg cell, central cell and two synergids, forming the female germ unit —
the cells directly involved in sexual reproduction in flowering plants. Micropylar cell wall ingrowths in
the synergids constitute the filiform apparatus, a secretory structure that receives the pollen tube.
Small arrows indicate the attachments of the synergids to the embryo sac wall forming so-called
synergid 'hooks' enclosing apical pockets of central cell cytoplasm;
54*
-.. VN-
PT
Sua
Svn
Fig. 13 (continued).
2 — release of sperm cells from the pollen tube: A. One sperm is associated with the vegetative
nucleus, whereas the other sperm cell is unassociated. The pollen tube cell wall thins at the tip prior
to pollen tube discharge. B. Pollen plasma membranes break down quickly after the tip of the pollen
tube ruptures, releasing its contents and breaking the MGU association. C. The two sperm cells
separate as they are ejected from the tube, forming cytoplasmic bodies; 3 — postulated events
involving the discharge of the pollen tube and its interactions within the embryo sac. Fertilization
events in a conventionally-organized embryo sac. A. Pollen tube . .ival in the synergid releases the
two sperm cells and vegetative nucleus into the embryo sac. These are postulated to attach to the
actin coronas (arrowheads) and move toward the egg and central cell. B. Migration of the sperm cells
on actin trails to the site of gamete fusion between the egg and central cell. C. Fusion of sperm
nuclei with the nuclei of the egg, forming the embryo, and the central cell, forming the endosperm;
s s s
Q. С >•
2~ "
и
-а
я «J •
_о о
™ -5 Q S -а ^
1:74 2 ■ «. О4
О. u S щ
в 2S " = =
« — . м=3 3
О С i— *\ О ***
(л "ее; о.
«'1=16; II
s » £
Э ц Я u .S С м „
*11о
2- ■» ьо
•Со - - 2 6 2
е~<si°c
с с
Втз о
J^3
-О,
во
сю
S.2
S"S
4) '
О С
It
Jihl
He-lS
.те
Ч 3
;«
.2—• * Ы
* a .s
ft, "ев
U ^
>
sJl!
Лп5си *■
5 я и " о -2
2-я u « -a,-i
r"
ь- Г Я
. '_: x
щ « <U
Й Ь-S^i^
41:
It» p
4is
« « >■ э о
Э Й О О О
-* fl О С
ЛИ
о S о ьс
f.a
W
lif:
и
<л
а с
о <и
Isc
~ 2-
c я о
"5 S>~
&0 «
<u -o
j ip»
ill'
Ш
Iffi
_. о е. o> s-S S <*><:
Fig. 13 (continued).
5 — preferential double fertilization in Plumbago, a plant in which synergids are absent. Cytoplasmic
organelles of both of the sperm cells are transmitted in this model: A. Single membrane bound sperm
cells are deposited between the egg and the central cell. The pollen tube is located near the two
sperm cells. B. Fusion is initiated at one site on the surface of the male and female gametes
(arrowhead) and is followed by simultaneous fusion at additional sites (arrows). C. Subsequent to
fusion, the cytoplasm of the sperm cell, associated with the vegetative nucleus, is evident immediately
surrounding its nucleus; it is delimited by the egg-central cell boundary (below) and the remnant
plasma membrane of the sperm cell near its fusion point in the central cell (arrows). Fusion
membranes undergo progressive vesiculation, and disintegrate rapidly enough that they become
difficult to detect several minutes after fusion (arrowhead). Mitochondria of the sperm cell surround
the sperm nucleus in the central cell and sperm plastids are transmitted into the egg. The presence
of sperm plastids in the egg cell indicates that the sperm cell unassociated with vegetative nucleus
preferentially fused with this cell; CB — cytoplasmic bodies, CC — central cell, E — egg cell,
FA — filiform apparatus, Ms — mitochondria of the sperm cell, Ps — plastids of the sperm cell,
PN — polar nucleus, PT — pollen tube, S — sperm cells, Sua — sperm cell unassociated with the
vegetative nucleus, Svn — sperm cell associated with the vegetative nucleus, St/ — synergid, VN —
vegetative nucleus.
1 — after Russell, 1993; 2,3 — after Russell, 1994; 4 — after Russell et al„ 1990; 5 — after
Russell, 1983.
Рис. 14. Гемигамия.
1-19 — Rudbeckia laciniata (Asteraceae): 1 — ядра яйцеклетки и спермия в профазе деления,
2 — синхронные фигуры деления ядер яйцеклетки и спермия, 3 — двуклеточный проэмбрио,
в базальиой клетке которого видны два мелких ядра, производных спермия,
Рис. 14 (продолжение).
4 — синхронное деление ядер материнского и отцовского происхождения в базальной клетке,
приводящее к формированию "гибридных" ( триплоидных ) ядер, 5 — формирование ядер
разной плоидности в клетках проэмбрио (схемат.), 6, 7 — проэмбрио с ядрами разного
происхождения и плоидности (7а — видно крупное триплокдное ядро), 8 — ядра, производные
спермия, расположены в латеральной части проэмбрио, 9 — деление ядер, производных
спермия, с образованием реституционных ядер отцовского происхождения, 10 — реституционное
ядро сформировалось при делении зиготы, 11 — синхронные деления мужских и женских ядер
в базальной клетке проэмбрио, 12 — триплоидиое ядро в апикальной части зародыша,
13 — ядра, производные спермиев, и микроядра в базальиых клетках проэмбрио,
Рис. 14 (продолжение).
14 — ядро яйцеклетки и ядро спермия в профазе деления, 15, 16 — метафазы деления ядер
спермия и яйцеклетки (14-16 — реконструкции по двум последоват. срезам), 17, 18 —
проэмбрио с ядрами разной плоидности: гаплоидные (мелкие, производные спермия) — в базальной
клетке, триплоидное (крупное) — в клетке центральной части (последовательные срезы), 19 —
более развитый проэмбрио, ядра, производные спермия, в базальной клетке;
28 30
Рис. 14 (продолжение).
20-28, 31-33 — Zephyranth.es macrosiphon и 29-30 — Habranihus andersonii var. texanus
(Amaryllidaceae): 21-22 — яйцеклетка со спермием в базальнои части, 23 — телофаза деления
ядра спермин в одной из клеток проэмбрио, 24 — ядра, производные спермия, в базальнои
части проэмбрио, 25-27 — ядра, производные спермия, в разных частях проэмбрио, 28 —
в апикальной клетке проэмбрио сформировалось реституционное ядро из производных спермия,
29 —^ядро яйцеклетки в профазе деления, мелкое ядро спермвя в интерфазе, 30 — мвогокле-
точный зародыш, в базальнои клетке которого рядом с крупным ядром материнского
происхождения расположены 4 мелких ядра, производных спермия,
Рис. 14 (продолжение).
31 — яйцеклетка, ядро спермия около ее ядра, 32 — анафаза деления ядра спермия в
базальнои клетке проэмбрио, 33 — двуклеточный проэмбрио, крупные ядра — производные
ядра яйцеклетки, мелкое ядро в базальнои клетке — производное спермия (второе мелкое ядро
в плоскости другого среза). Масштабная линейка 10 мкм; а — антиподы, з — зародыш,
п сп — производные спермия, с — синергиды, сп — спермий, m я — триплоидное ядро, я —
яйцеклетка.
1-3,8,11,13 — по: Solntseva, 1974; 4,6,7 — по: Солнцева, 1971; 5,12,18 — по: Солнцева, 1973;
9,10,23,24,31-33 — по: Solntseva, 1976; 20-22,25.28 — по: Солнцева, Ворсобииа, 1972;
14,15,17 — по: Солнцева, 1979; 29 — по: Ворсобина, Солнцева, 1990, с измен., 16,19,30 —
Солнцева, ориг.
.,.,,„..ff,:rai
Рис. 15. Опыление и оплодотворение у злаков.
1-37 — двойное оплодотворение у Triticum: 1-9 — зародышевый мешок через 30 мин (1),
1 ч (2), 1,5 ч (3), 2,5 ч (4), 3 ч (5), 5 ч (6), 6 ч (7), 7 ч (8), 24 ч (9) после опыления,
расстояние между яйцеклеткой и полярными ядрами уменьшено,
10-26 — последовательные фазы изменения формы и структуры спермия от вхождения его в
зародышевый мешок до полного слияния с яйцеклеткой (премитотический тип оплодотворения):
10 — спермин нз синергнд, 11 — спермин из«щели», 12-15 — спермни вошли в яйцеклетку,
16-24 — слияние ядра спермия с ядром яйцеклетки, 25 — ядро зиготы в интерфазе, 26 —
профаза ядра зиготы; 27-37 — последовательные фазы изменения формы и структуры ядра
спермия от подхода его к ядрам центральной клетки до полного слияния с ними и первого
деления ядра эндосперма (27, 28 — ядра спермиев на границе двух полярных ядер, 29, 30, 32,
33 — ядра спермиев объединяются с одним полярным ядром, 31 — ядро спермия объединяется
сразу с обоими полярными ядрами, 34 — ядро первичной клетки эндосперма в интерфазе, 35,
36 — профаза ядра эндосперма, 37 — метафаза ядра эндосперма (1, 3-5, 11-15, 18-20, 23,
27-31, 34-36 — Т. aestivum. 2, 10, 21, 25 — Т. dicoccum, 6-9, 16, 17, 22, 24, 26, 32, 33,
37 — Т. топососсит); 38-51 — процесс оплодотворения у Zea mays: 38 — микропилярная
часть зародышевого мешка через 19,5 ч после опыления, ядра спермиев около женских ядер,
39 — то же через 23 ч, слияние ядра спермия с одним из полярных ядер закончилось, мужское
и женское ядрышки слились (видиа характерная для оплодотворенных ядер Zea mays хромати-
новая сеточка, в зиготе процесс слияния ядер еще не завершен, видны два ядрышка; в этот
зародышевый мешок вошли две пыльцевые трубки: первая, спермин которой произвели
оплодотворение, вошла через правую синергиду, вторая — дополнительная — через левую, ее спермин,
изображенные рядом при большем увеличении, дегенерируют), 40-51 — последовательные фазы
изменения формы и структуры спермия от вхождения его в зародышевый мешок до полного
слияния с ядром яйцеклетки (40-48 — объединение ядра спермия с яйцеклеткой, 49-51 —
профаза деления ядра зиготы); 52-57 — двойное оплодотворение у Hordeum vulgare:
микропилярная часть зародышевого мешка через 20 мин (52), 30 мин (53), 1 ч (54), 2 ч (55), 4 ч
(56), 6 ч (57) после опыления; 58-64 — отдельные стадии двойного оплодотворения у Hordeum
vulgare (ТЭМ): 58 — пыльцевая трубка в районе микропиле между стенкой завязи и
внутренним иитегументом через 2-2 /4 ч после опыления, видна дегенерировавшая цитоплазма
пыльцевой трубки; 59 — спермий в межклеточном пространстве между яйцеклеткой и
центральной клеткой через 1 /4 ч после опыления, видна плазмалемма (стрелка), 60 — тот же
препарат, хорошо виден контакт плазмалемм яйцеклетки и спермия (стрелки), 61 — ядро
спермия в цитоплазме около ядра яйцеклетки, 62 — поздние стадии слияния ядер "яйцеклетки и
спермия через 4-4 /4 ч после опыления, видно вновь образованное ядрышко спермия н
остатки ядерных мембран яйцеклетки и спермия (стрелки), 63 — ядро спермия,
сливающееся с полярным ядром, через 2-2 Д ч после опыления, 64 — контакт полярных ядер,
видны остатки цитоплазмы центральной клетки, захваченной во время слияния; 65-74 —
процесс оплодотворения у Triticale АД 537: микропилярная часть зародышевого мешка
через 60 мин после опыления (65), 70 мин (66), 80 мин (67), 1 ч 50 мин (68), 3 ч (69),
4 ч (70), 5 ч (71), 6 ч (72), 8 ч (73) (нарушения), 9 ч (74) после опыления; 75-79 —
процесс слияния изолированных гамет Zea mays при индукции электрическими импульсами
(76-79 — ТЭМ): 75 — продукт слияния через 8 мин после электроиндукции (фазовый
контраст); стрелкой показано ядро спермия, цитоплазма содержит многочисленные
периферические вакуоли и центральное скопление органелл вокруг ядра яйцеклетки, 76 — то же, ядро
спермия лежит в цитоплазме яйцеклетки, хроматин ядра — плотный, 77 — через 10,5 мин
после злектроиндукции с электроноплотиым ядром спермия и ядром яйцеклетки, 78 — через 21
мин после электроиндукции, контакт ядер спермия и яйцеклетки, на серии срезов соединение
ядер ие наблюдали, 79 — через 30 мин после индукции, ядра спермия и яйцеклетки
контактируют друг с другом, ядерные оболочки с ядерными порами расположены очень близко друг к
другу, ио ие объединены, мелкие митохондрии расположены вдоль оболочки ядра спермия,
контраст их крист — высокий; 80, 81 — слияние ядра спермия с ядром яйцеклетки после
электроиндукции изолированных гамет Zea mays: 80 — продукт слияния через 58 мин после
индукции (фазовый контраст), ядра спермия и яйцеклетки (показаны стрелками) сливаются,
81 — то же (ТЭМ), видно слияние ядра спермия с ядром яйцеклетки, плотность хроматина
ядер различна, видны остатки ядерной оболочки (показаны стрелкой) рядом с мужским
хроматином; 82 — временная последовательность событий после слияния изолированных гамет Zea
mays, индуцированного электрическими импульсами; В — вакуоль, ВИ — внутренний интегу-
мент, ДС — дегенерирующая синергида, Дсп — дополнительный спермий, Зг — зигота, Кр —
крахмал, М — митохондрия, Л — липидное тельце, ОМ — осмиофильный материал, П —
пластида, Пм — плазмалемма, По — поры ядерной оболочки, ПЯ — полярное ядро, С —
синергида, в которую вошла пыльцевая трубка, С — неразрушенная синергида, СЗ — стенка
завязи, Сп — спермий, Т — пыльцевая трубка, ЦКл — центральная клетка, Я — яйцеклетка,
Яд — ядрышко, ЯдСп — ядрышко спермия, ЯдЯц — ядрышко яйцеклетки, ЯЗг — ядро
зиготы, ЯС — ядро первой синергиды (разрушающейся), ЯС — ядро второй синергиды,
ЯСп — ядро спермия, ЯЯц — ядро яйцеклетки.
1-37 — По: Батыгина, 1974, с изм.; 38-51 — по: Коробова, 1982; 52-57 — по: Хведынич,
1969; 58-64 — по: Mogensen, 1982, с изм.; 65-74 — по: Хведыиич, 1983; 75-79 — по: Faure
et al., 1993; 80-82 — по: Kranz et al., 1991b.
Рис. 15 (продолжение).
Рис. 15 (продолжение).
JO мкм
* '. ■'!'•*•'{* jf*"*;- ™5rc.. *'•*•-■
' 54
Рис. 15 (продолжение).
Ж***
1 /"Vr''
4)
Я
и
о
X
<
в
ч
е
а
в
и
Я
а
55-828
■ш
■'•"V-
#■■
\/
Я
v,> Vc«>*-
*-»«НЩ^Г
JH ,1
*
60
Рис. 15 (продолжение).
I
ь
*£№
- -^ Д.
•Jf*
Л
"-*»
***f>
j.1 "&'
*
e
ч
о
a
a
r:
s»
, .Ш$*№й9
-i>C
*
и
и
a
'•. :'*#■
sfflSS»*"""
55*
"■& cf
ч-
WpPT-i 1*Jj "л
^^L^-4
^И>
^
„%
,BJjfe
It
63
я
Рис. 15 (продолжение).
Си
1" I
////
•
"\A
>Л
.*-.
'• /
i-(-
I - ■ 'l&T * - * d -
, " " "Cs' 1. -"
h ■.,
;-, -j
>;■.-.-v*-.,
////
64 .,
Рис. 15 (продолжение).
<
о
п
о
о.
в
s
а
«l^jj
gfij.
отГ;
«f
§
SS.
'"СГАуг", «-
Выя.
5Г
■^5
^
fr„.<1'^
Я
еч
i~
<
о
е
а
в
s
а
Йя^вгКиЛай
Ai
;ж>»
ВЖ ,.j4L у 'Lip!: '-i 4 - j£",' „*,>■*; 1,4 v -'Я
i -г i1 —J" Mfl^MH_|HN||| 1ж«3 ЯИК ' ! * ,+ *■ «_* ,ife* j * ■■ • ■ T ■ „, ■ ■■' л, . '■ 1 ".„к 11* ^ -
Рис. 15 (продолжение).
80
81
2 ядра контакт 2 сливаю-
2х ядер щшсся ядра
ID © • Р
1адро
ID
ID С # © ©
ID €CID С С®
I г
0
Т"
60
1—~т~
90
ID
-1 г-
120
—i—
150
т—-I г
30 60 90 120 150 180
Время (мин) от индуцированного слияния до. фиксации его продуктов.
82
Рис. 15 (продолжение).
0,1мм
Рис. 16. Нуклеариый тип развития эндосперма.
1-9 — развитие эндосперма /Inemone nemorosa (1-7,9 — продольные срезы зародышевых
мешков, 8 — поперечный срез плодолистика, 8а — его фрагмент; антиподы, сохраняющиеся очень
долго, на рис. 1-5 показаны лишь контуром): 1-3 — деление первичного ядра эндосперма и
образование 2-ядерного эндосперма, 4,5 — 4- и 8-ядерный эндосперм, 6 — образование
многоядерного ценоцита эндосперма, зигота к делению еще не приступила, антиподы многоядерные,
Рис. 16 (продолжение).
7 — между ядрами эндосперма, начиная с микропилярного полюса, закладываются клеточные
стенки, зародыш 6-клеточный, 8 — двуслойный эндосперм в процессе образования, видны
фрагмопласты, 8а — фрагмент формирующегося двуслойного эндосперма при большем
увеличении, 9 — эндосперм и зародыш зрелого семени (семенная кожура и перикарп удалены, вокруг
зародыша небольшая полость, образовавшаяся в результате разрушения клеток эндосперма);
Рис. 16 (продолжение).
Ю-13 — последовательные стадии развития эндосперма Tilia platyphyllos (первые деления ядер
эндосперма приурочены к его халазальному полюсу, что ие приводит, однако, к образованию
эндосперма гелобиального типа развития), видны большие количества запасного крахмала в эи-
доспермальном цеиоците на начальных фазах его развития, на 13 представлена халазальная часть
многоядерного цеиоцита с подлежащей тканью; 14-22 — схематическое изображение
последовательных этапов образования центральной вакуоли в ценоците эндосперма (14-19) и постепенное
заполнение ее клетками (20-22);
Рис. 16 (продолжение).
23-28 — эидоспермогенез Diplacrum caricinum, протекающий без образования крупной
центральной вакуоли на свободноядерной фазе развития: 23 — продольный срез микропиляриой части
развивающегося семени с первичным ядром эндосперма в оплодотворенной центральной клетке,
видиы обтуратор и остатки пыльцевой трубки в микропиле, 24-28 — последовательные стадии
развития эндосперма, на 26 показано начало клеткообразования в эидоспермальиом ценоците (не
исключена инициация процесса путем «свободного роста» антиклинальных клеточных стенок —
прим. Г.Ж.);
Рис. 16 (продолжение).
29-32 — последовательные стадии развития эндосперма Melo sativus (2x) , формирующего
гаустории (29 — поперечный срез зародышевого мешка, 30-32 — продольные срезы
зародышевых мешков), гаустории остаются свободноядериыми и в период клеткообразовакия в
эндосперме, в частности, на сердечковидной стадии развития зародыша (32);
Рис. 16 (продолжение).
33-41 — схематическое изображение эндосперма (и его фрагментов — 33,34) с халазальными
ценоцитными гаусториями различной формы и протяженности у отдельных видов на клеточной
стадии его развития (40 — на свободиоядерной) (33 — Cassia miangustijalius, 34 — Prosopis
juliflora, 35 — Mimosa hamata, 36 — Cassia sophera, 37 — Crotalaria medicagenia, 38,39 —
Echinocystis lobata, 40,41 — Croton sparsiflorus): 33, 34 — гаустории сложной конфигурации,
35 — пузыревидный гаусторий, 36 — спиралевидный, 37 — гаусторий со слегка обрубленным
кончиком, 38,39 — сильно вытянутые гаустории иа глобулярной (38) и более подвинутой (39)
стадиях развития зародыша, гаусторий с гипертрофированными ядрами;
Рис. 16 (продолжение).
42-46 — последовательные стадии развития эндосперма Elaeagnus argentea: 42 — проэмбрио и
микропилярная часть свободиоядерного эндосперма, 43 — схема развивающегося семени на
булавовидной стадии развития зародыша (44), Показано начало клеткообразования в центральной
части эидоспермального цеиоцита, иа рис. 44 видны «везикулы» эндосперма, 45,46 — хала-
зальный эндоспермальиый гаусторий на свободиоядерной и клеточной стадиях эндоспермогеиеза;
Рис. 16 (продолжение).
47 — зародышевый мешок Musa errans с эндоспермом нуклеарного типа развития и
«пузырьком» с 5 ядрами эндосперма; 48 — эндосперм Stackhousia linariaefolia на свободиоядерной
стадии развития с цитоплазматическими выростами («везикулами»); 49 — фрагмент эндосперма
Euphorbia helioscopia, видны безъядерные цитоплазматическне пузырьки («везикулы»); 50-52 —
преобразование зародыша и эндосперма Convolvulus scammonia на завершающих стадиях развития
семени;
56-828
/
i S S "
S в « 2
ft) 4)
2 a
о <o
S
о m
Rt О
„ft) ^
s t, я с
о я
-?■» а к
-*■ a в я
>пю <<
•^ S о vo
о ffi Q'
m
о я
S S К S
&Ч» <
К Я Н о
< S- Я X
>, о я я
ю я я
< а О, я
2 S
^« "3 8*
С < о
w в <■> к
•я S ■ я
д о.
V
S
а
V
<
е
ч
е
a
в
и
S
a
и о
очо a
о»п <
< . R
m*n о
да и
к £ a
„ я с
2 § с
О ь- К
I В й
S
а _ _
a ►> в
и s s
с о <
* S-
alf 5
«Г Р 8
ft)
ft) <U
о. о
с
я о
I- -
•£ Я
S
— . a
eg
я <u
в- S
О OS
я
a, 4)
и и
s а
Я 4)
Я й
о
§ я о
a 31 я
« 2 S
5 >. a
gaga
5 я к
2 о. °
9е
в Я
ft)
_ Я
«и
«in' S
О
all
8- 5. *
о о я
Е (У Q
я с
чО
1П
а >.
о а
57-59 — фрагменты протопласта эндосперма Alcea rosea на свободноядерной стадии развития в
период наличия в развивающемся семени раннего глобулярного зародыша, идет образование
выростов клеточной оболочки (показаны фрагменты пристенного слоя эндосперма, его микропи-
лярного — 57,59, н среднего — 58, районов), пластиды (лейкопласты) чашевидной формы (с
крупными инвагинациями — 57), с ничтожным содержанием крахмала, ЭР гранулярной формы,
представлен одиночными протяженными цистернами (близ апикальной части зародыша отмечено наличие
эргастоплазмы), митохондрии наблюдаются в тесном контакте с инвагинациями плазмалеммы —
показано стрелками; 60 — фрагмент микропнлярной части развивающегося семени Epipactis
atrorubens на стадии 2-клеточного проэмбрио (у этого вида эндосперм развивается до 4-ядериого
состояния), ценоцит эндосперма сильно вакуолизнрован, халазальный полюс зародыша окружен
лишь тонким слоем его цитоплазмы; 61 — фрагменты проэмбрио и ценоцита эндосперма
Е. atrorubens, видна активность вакуома эндосперма, стрелкой показана инвагинация тонопласта
вакуоли, заключающая в себе более мелкую вакуоль (то же и на рнс. 67), цитоплазма ценоцита
эндосперма менее насыщена рибосомами, чем цитоплазма клеток проэмбрио; 62-64 —
фрагменты микропнлярной части протопласта ценоцита эндосперма Е. atrorubens: 62 — близ субапи-
кальиой клетки раннего проэмбрио, виден также участок сохранившейся синергиды, 63 — близ
базальной части проэмбрио, видны лейкопласты (стрелкой отмечена инвагинация лейкопласта) и
фрагмент ядра эндосперма (на 64 — участок одного из последующих срезов того же фрагмента
эндосперма, видна эвагннация наружной мембраны оболочки ядра, показана двойной стрелкой);
65,66 — фрагменты халазальной части протопласта эндоспермального ценоцита Е. atrorubens
близ сохраняющихся антипод (развивающееся семя на стадии многоклеточного проэмбрио);
лейкопласты в ассоциации как между собой (65), так и с митохондриями (65, 66), ЭР развит
слабо: 65 — видны группа лейкопластов в контакте с сохраняющимися антиподами и фрагмент
одного из ядер эндосперма, 66 — на одном из срезов лейкопластов видно небольшое крахмальное
зерно; 67 — фрагмент пристенного слоя эндосперма Е. atrorubens (на стадии многоклеточного
проэмбрио), тонопласт центральной вакуоли эндоспермального ценоцита толще плазмалеммы, в
пластиде видно параллельное оболочке пластиды н тонопласту вакуоли расположение одиночного
тилакоида (68 — фрагмент одного из последующих срезов того же участка эндосперма, в
пластиде видно наличие наряду с одиночным периферическим тилакоидом, других мембранных
структур и пластоглобул); 69,70 — хлоропласта эндоспермального ценоцита Iberis umbellata
(на стадии многоклеточного проэмбрио); 71,72 — фрагменты пристенного слоя протопласта
эндосперма Paeonia peregrina на свободноядерной фазе развития (субмикропилярная зона)
(зародыш — в состоянии четырехъядерного ценоцита); ЭР гранулярного типа, хорошо развит, хотя
эргастоплазмы не наблюдается. Аппарат Гольджн в состоянии секреции, пузырьки Гольджи (они
с электронопрозрачным содержимым) часто наблюдаются в контакте с плазмалеммой или близ
нее (отмечено стрелкой) (54,55 — СМ, 60-72 — ТЭМ). Масштабная линейка — 1 мкм; а —
антиподы, 6 и, п — безъядерные цитоплазматические пузырьки, в — вакуоль, в ин —
внутренний ннтегумент, в к о — вырост клеточной оболочки, в сн — воспринимающая сииер-
гида, гт — гаусторий эндосперма, д — диктиосома, з — зародыш, зг — зигота, к з —
крахмальное зерно, к о з м — клеточная оболочка зародышевого мешка, л к — липидная капля,
лп — лейкопласт, м — митохондрия, н — нуцеллус, общ — обтуратор, пг — пластоглобула,
пл — плазмалемма, п гп — пыльцевая трубка, пэм — проэмбрио, п я эн — первичное ядро
эндосперма, с сн — сохраняющаяся синергида, хп — хлоропласт, и, в эн — центральная
вакуоль ценоцита эндосперма, эн — эндосперм, эр — эндоплазматический ретикулум, я
пэм — ядро проэмбрио, я эн — ядро эндосперма.
1-9 — по: Иоффе, 19716, 10-13 — по: Stenar, 1925, 14-22 — по: Батыгина, 1974, 23-28 —
по: Nijalingappa, Devaki, 1978, 29-32 — по: Дзевалтовский, 1983, 33 — по: Rau, 1951, 34-37
— по: John, Garg, 1959 с нзмен., 38, 39 — по: Chopra, Seth, 1967 — цит. по: Maheshwari,
Kapil, 1966, с измен., 40, 41 — по: Venkateswarlu, Rao, 1963, 42-46 — по: Камелииа,
Проскурина, 1987, 47 — по: Juliano, Alcala, 1933, 48 — по: Narang, 1953, 49 — по:
R.P.Singh, 1969, 50-52 — по: Ннкнтичева, Проскурина, 1987, 53-61, 63-72 — Жукова, ориг.,
62 — по: Жукова, 1994а, с измен.
56*
. A* '.
Рис, 16 (продол «ние).
>t
4?
ЙЕ1Й?
.1 -r
И „
■'S$i.."
I'i
*
**
,1 tf "
•s-
*&
Л
^\- V
.тЧ^
v.- :чл
1 * ■■ 4jji
■V 'la
■41
* V «.*■ *
"та Ы
Hid '*. «J
*. !
-, ■*
w^*"
P-
\?-
V3
, »
fr' Б.' « <j
*s
^0: :4i7
¥f
*-.*'.'
..V P
L-*l '
*w*fe
Ч:,ч
.#:
.M£ *
Sift -XL"* -£■*■
«<L
4J
&'S.;- r-'-^m
vr
лс*
->л'
'&■' ■?*.
.!> tH
-■f
t1-,-^.r'J *"^L'C,,•"■ ■'■ ~ " * ' ■?.
Рис. 16 (продолжение).
• &)&V.i.-
И" i; n „ jVj
я
И
<
e
ч
е
а
в
J
, t
.111
* \
&-
-:i
s
M
:m
ft.
* ■ j
' «i * 5,-
л
65
i :, чЬ-
.ife~#-*
■ rf>-
'^ V
i ■*
Рис. 16 (продолжение).
*«й«:
\
^smm^
шшт
ШШр
щ
ть-
«да? 1
3Sft?t:
1*"Я
цвэн
s^"
.•■JV
щщ,^.
$К
"Ж
^мш^штщ^
70
Рис. 16 (продолжение).
V
в
s
V
<
о
ч
e
a
a
и
S
a
Рис. 17. Целлюляриый тип развития эндосперма.
1-33 — различные вариации развития эндосперма: 1-4 — Adoxa-вариация у Circaeaster agrestis
(1, 2) и Peperomia blanda (3, 4); 5-8 — Lappula-вариация у представителей сем. Dipsacaceae
(5 — схема первых делений эндосперма, 6,7 — у Succisa pratensis и 8 — у Cephalaria
bvipalea);
Рис. 17 (продолжение).
Рис. 17 (продолжение).
9-11 — Prunella-вариация у Orobanche cumana; 12-16 — Аппопа-вариация у Bragantia wallichii
(12, 13), Menyanthes trifoliata (14) и Vi//arsia reniformis (15, 16);
17, 18 —
Рис. 17 (продолжение).
Phyteuma-вариация у Trochodendron aralioides;
у Rhododendron mucronulatum;
19, 20 — Ericaceae-вариация
21-25
Рис. 17 (продолжение).
Ceratophyllum-вариация у Ceratophyllum pentacanihum (21, 22), С. demersum (23) и
С. submersum (24, 25);
Рис. 17 (продолжение).
26-30 — Azorina-вариация у Azorina vidalii;
• «
о_ о
2-°.
1.0 Oj
оо\ /о о
о о I Го о
IT/ yEZ
I *
/ о о
\5~ о
Codonopsis
Scutellaria
• »\ / • •
о о\ loo
о I ~ I о "о
о / I о .о.
О / \ О |о
Т7 \~*7
Isotoma
Pentaphragma
31
Рис. 17 (продолжение).
31-33 — вариации развития эндосперма в семействах Campanulaceae и Lobeliaceae (31)
57-828
-ц(±±
о о I Го о
• «7 \»"т.
Verbascum
Prolimosella
Linaria
Limoselks
Veronica I
Veronica II
Veronica III
Veronica IV
32
Рис. 17 (продолжение).
и Scrophulariaceae (32, 33);
Veronica V
Alectorolophus
Veronica VI
Pedicularis
Gratiola
33
Рис. 17 (продолжение).
a — антиподы, и ц т э — ннициалн центрального тела эндосперма, м г — мнкропнлярный
гаусторий, х г — халазальнын гаусторий, ш э ч — шейка эндосперма.
1,2 — по: Junell, 1931; 3,4 — по: Никитичева, 1981; 5 — по: Камелнна, 1987; 9-11 — по:
Аннснмова, 1983; 12,13 — по: Nair, Narayanan, 1961; 14-16 — по: Stolt, 1921; 17,18 — по:
Иоффе, 1962; 19,20 — по: Якобсон, 1976; 21-25 — по: Шамров, Батыгина, 1984; 26-30 —
по: Шамров, Жинкнна, 1994; 31 — по: Коробова, Жинкнна, 1987; 32,33 — по: Glisic,
1936-1937.
57*
м к
Рис. 18. Гелобиальный тип развития эндосперма.
1-7 — первые стадии развития гелобиального эндосперма у однодольных растений: Juncus
filiformis (1-3), Sagittaria sagittifolia (4),
Рис. 18 (продолжение).
Polygonatum roseum (5, 5a, 5б), Tofieldia japonica (6,7); 8,9 — халазальный район эндосперма
Polygonatum roseum (8) и Asphodelus tenuifolius (9) на стадии целлюлиризации; 10,11 —
первые стадии развития гелобиального эндосперма у двудольного растения Nymphaea stellata;
Рис. 18 (продолжение).
12-19 — динамика содержания белков в различных структурах семени с гелобиальным типом
развития эндосперма у Luzula pedemontana (условно высокий уровень содержания белков
черные участки, средний и низкий — точки разной плотности, отсутствие веществ светлые
участки);
Рис. 18 (продолжение).
20 — схема возможных направлений эволюции эндосперма у цветковых растений (объяснение в
тексте); масштабная линейка: 12, 17а, 18а — 0,03 мм; 13-16 — 0,1 мм, 17-19 — 0,3 мм; а —
антиподы, ей — внутренний интегумент, г — гипостаза, з — зародыш, м к — мнкропилярная
клетка эндосперма, н — нуцеллус, ни — наружный интегумент, п — поднум, п т —
париетальная ткань, пр п — проводящий пучок, х к — халазальная клетка эндосперма.
1_3 — по: Анисимова, 1990; 4 — по: Никитичева, 1990а; 5,8 — по: Сатарова, 1990; 6,7 —
по: Опо, 1929; 9 — по: Eunus, 1952; 10,11 — по: Khanna, 1967; 12-19 — по: Шамров.
Анисимова, 19936; 20 — Шамров, ориг.
Fig. 19. Light microscopical study of endosperm formation
in Brassica napus L.
[Рис. 19. Развитие эндосперма у Brassica napus L.
(по данным световой микроскопии)]
1 — topographic overview of median section of rape seed at 6 days after anthesis showing a globular
embryo and nuclear endosperm. The endosperm cytoplasm forms a thin layer surrounding the embryo
and the greater part of the central vacuole of the central cell, and forms a mass of cytoplasm at the
chalazal region. Bar represents 200 |im; 2 — light micrograph of a median section of a Technovit-
embedded rape seed at 6 days after anthesis. Note the free nuclei of the endosperm scattered
throughout the cytoplasm aligning the suspensor, the embryo proper and the wall of the central cell.
Bar represents 100 ]lm; 3 — light micrograph of a median section of a Technovit-embedded rape-
seed at 9 days after anthesis. Note the vacuolation and the onset of cellularization of the endosperm
surrounding the suspensor. The embryo proper is still surrounded by a layer of nuclear endosperm.
Bar represents 100 цт; 4 — light micrograph of a median section of a Technovit-embedded rape
seed at 6 days after anthesis showing the nuclear endosperm at the chalazal region of the embryo sac.
Note the regular spacing of the nuclei throughout the cytoplasm. Bar represents 100 \xm; 5 —
fluorescence micrograph of the microtubular cytoskeleton in sectioned alveolar endosperm of rape seed
at 12 days after anthesis. Note the fluorescent bundles of microtubules surrounding the endosperm
nuclei (arrows). Bar represents 20 |im; 6 — fluorescence micrograph of the microtubular cytoskeleton
in the nuclear endosperm of sectioned rape seed at 6 days after anthesis. The detail is in the chalazal
region where the free nuclei are regularly spaced in a mass of cytoplasm. Note -the short arrays of
fluorescent Mts distributed throughout the cytoplasm. Bar represents 10 |J.m;
Fig. 19 ^continued).
7 — topographic overview of a median section of a rape seed at 14 days after anthesis showing a
torpedo shaped embryo and cellular endosperm. Note that the central region of the central cell is still
occupied by the central vacuole. Bar represents 200 |im; 8 — light micrograph of median section
of a Technovit-embedded rape seed at 14 days after anthesis showing cellular endosperm and the
base of the embryo. Bar represents 100 цт; 9 — detail of cellular endosperm at 14 days after
anthesis. The outer cell layers of the endosperm exhibit cell divisions. Note the presence of arrays
of Mts in mitotic spindles (arrows). Bar represents 10 |^m; 10 — detail of cellular endosperm at
14 days after anthesis. The outer cell layers of the endosperm exhibit cell divisions. Note the
presence of arrays of Mts at the outer margins of the phragmoplast which forms the cell plate
(arrows). Bar represents 10 (Xm; 11 — light micrograph of a median section of a Technovit-
embedded rape seed at 14 days after anthesis showing the area of alveolar endosperm bordered by
cellular endosperm and the central vacuole. Arrays of Mts radiate from the nuclear surfaces and
sometimes point to the place where freely growing wall-ends are being formed. Bar represents
10 (im. AE — alveolar endosperm, Ch — chalazal region of endosperm, CE — cellular
endosperm, CV — central vacuole of central cell, En — endosperm, Em — embryo proper, II —
inner integument, M — micropyle, Mt — microtubule, OI — outer integument, N — nucleus,
NE — nuclear endosperm, Su — suspensor, V — vacuole.
1-11 — Lammeren van, Kieft, Ma, Veenendaal van, orig. data.
-ovary '-"•■=—„
-ovule
-nucellus
^endosperm
4embryo
—pericarp
integument
nucellus
aleurone layer
Гр-sub-aleurone layer
J_Linner endosperm
Fig. 20. Cell differentiation in the pericarp and endosperm of developing maize
kernels {Zea mays L.).
[Рис. 20. Клеточная дифференциация в перикарпе и эндосперме
развивающейся зерновки кукурузы (Zea mays L.)]
1 — Schematic representation of the median section of a young caryopsis with the sampling area
enlined (A) and the anatomy of the sampling block (B).
1-
"iUC
■■■-'"' -4 '-■■ r"
' " ' * -WW—■
- r, ' ■'
r ^ - » * ■■ *l.
*»-;/« 1^ ' ■■-/>
v * y. "' "' * '" .'• *"
. >' i" ~.
., * At,
&
^ШЙ$
3£ .
■ '■^f ?\ -'J»
'2a«''VQaym/' ь
4 •$
*■ «•*«.. ip
:*Ж
■ .lSAL ' At ■■ -'-v ' *>Si*.--'* ■*. ?V*
' IE
'4■ v
d
Fig. 20 (continued)..
2 - Low magnification light micrographs of 2 Цт Epon sections from the sampling area of the
malze caryopsis at various developmental stages. Note the enlargement, differentiation and subsequent
degeneration of the endocarp mesocarp and exocarp cells. The integument and sub-epidermal
nucellus cells degenerated soon (a-b). The endosperm developed into the aleurone, sub-aleuroneTnd
inner endosperm, all accumulating proteins and starch, a _ 3 DAP, b — 8 DAP с — 17 DAP
d — 20 DAP. The bars represent 100 Цт.
^=^,^
-/•*'
NUC
^S1
,m
^4
г.. '*<-* •
,', "><-4 •-
. , H,
Г ?
^0 ,
/i?""- X
Jv^ ^
/s'''»t:
,$&Л
*****. -"•
,; »V !
Ф
*#*#
#~
END
3a
*~*£0 um
Fig.
auriKed).
3 — Electron micrographs of the developing maize caryopsis in the sampling area at various
developmental stages. Conspicuous changes in the aleurone and sub-aleurone layers include the
differentiation of an epidermal-like tissue (a-b) and the accumulation of starch (S, b-c) and storage
products in two types of spherosomes (SI, S2), aleurone bodies (AB) and endosperm protein bodies
(EPB). a — 5 DAP, b — 12 DAP, с — 22 DAP. The bars represent 10 \xm.
4aV -:.4v%.-t
Fig. 20 (continued).
4 — High magnification electron micrographs of the aleurone cells of endosperm at various'stages of
development. Note the accumulation о spherosomes (SI) and the development of the aleurone bodies
(AH) trom the aleurone vacuoles (AV). a — 8 DAP, b — 12 DAP, c-d — 19 DAP,
e — 22 DAP. The bars represent 1 y.m.
Г
* л • «we"**- ;
-fir-
V t
Ччл
7%; -л?! **
fc ^Л
rf*f
m&**&*i >
гг^»#'*
у ,. j-
1м*&
Fig. 20 (continued).
5 — High magnification electron micrographs oi the cytoplasm of sub-aleurone and inner endosperm
cells at various developmental stages. Note the changes in ER configuration, the development and
accumulation of endosperm protein bodies (EPB) from the ER and the appearance of amyloplasts.
a — 5 DAP, b -- 8 DAP, с -■ 12 DAP, A - 17 DAP, e -- 19 DAP, f — 22 DAP. The
bars represent 1 jj.m.
^S Д ^" J~ **■
ЬГ
йф'
-^
Ос
L* г.
A\
A- -- *'
f: *** '*
A
v -V-
*.
'*• v:
Fig. 20 (continued).
nfThPEleC7n micro*"Phs f cytoplasm and cortical microtubules (arrows) in ultrathin Epon sections
of the endosperm, Glutaraldehyde-Os04 fixation and Pb-citrate and Ur-acetate post staining,
a. Inner endosperm at 8 DAP; b. Aleurone cells at 8 DAP; с Aleurone cells at 17 DAP The
bars represent 1 m AB _ aleurone body; AL - aleurone layer; DAP - days after pollination;
EC - endocarp; LM _ embryo; END _ endosperm; EXC _ exocarp; EPB - endosperm
pro em body; I mtegument; IE _ inner endosperm; IS - intercellular space; MC - mesocarp;
NUC - „ucellus; PC _ pericarp; S _ starch; SAL - sub-aleurone layer; SI - spherosome
type 1 present m aleurone and sub-aleurone layer; S2 _ spherosome type 2 present in the aleurone layer
from 8 DAP onwards,
l-6c — Lammeren van, Kieft, Schel, orig. data.
Fig. 20A. The micropylar haustorium of Impatiens walleriana Hook, ex Am.
[Рис. 20А. Микропилярный гаусторий у Impatiens walleriana Hook, ex Am.]
1 — longitudinal section through ovule, showing the unfertilized embryo sac, integument tapetum, and
thick-walled integumentary cells near micropyle, хЗОО; 2 — thick-walled integumentary tissue, x2200;
3 — integument tapetum shortly after fertilization, x2200; 4 — fertilized embryo sac with zygote,
two-celled endosperm, persistent and degenerated synergid, and pollen tube; the micropylar
endosperm cell grows through the filiform apparatus into the micropyle, xl6C0; 5 — endosperm cell
growing into the micropyle, x7500; 6 — haustorium protruding from the micropyle, containing a large
nucleus; the zygote has not yet divided, xl500; 7 — globular embryo with short suspensor.
Haustorium with internal and external part, separated by a wall, xlOOO; 8 — wall between internal
and external haustorium part, хбООО; 9 — haustorium growing into funiculus, x2200; 10 — survey of
haustorium, showing its large nucleus, x400; 11 — portion of haustorium and adjacent degenerating
funiculus cell, xl3000; dS — degenerated synergid, eH — external part of haustorium, En —
endosperm, F — funiculus, FA — filiform apparatus, H — haustorium, iH — internal part of
haustorium, IT — integument tapetum, N — nucleus, pS — persistent synergid, PT — pollen tube,
S — suspensor, Z — zygote.
1-11 — van Went, orig. data.
'!$. Г 'i V
&**L «A» * "W Ч - «>*''„ ■* Y*,4
к
t **
Ж* ЙШ
И
§c*
w^S***
Fig. 20A (continued).
,." г i -« '- **Jft«rt %Ш draws fl
^
V^***
■v.
^■e
J*. . -*»• *
А К
■■- ■ * ■
й&я^
.4 >-'?*
.«
'г^Лд-^-А 4 .«9< . Ilk. ЗДдо+
58*
*»
4f» ip
Fig. 20A (continued).
Рис. 21. Тубифлоральныи тип развития эндосперма.
1-4 — развитие эндосперма у Stachys trinervis; з э — запасающий эндосперм, ж г — микропи-
лярный гаусторий, х г — халазальный гаусторий, ш э — «шейка» эндосперма.
1-4 — Камелина, ориг.
прп
пер
пер
Рис. 22. Перисперм.
1-6 — семена с периспермом, относящиеся к различным группам (объяснение см. в тексте):
группа первая — Saururus cernuus (1), Houttuynia cordata (2) (1,2 — Saururaceae), Calathea
picturata (3) (Maranthaceae); группа вторая — Stellaria media (4) (Caryophyllaceae); группа
третья — Heliconia psittacorum (5) (Heliconiaceae); группа четвертая — Climacoptera crassa (6)
(Chenopodiaceae);
ОД им
Щ)П
Рис. 22 (продолжение).
7-11 — стадии развития семязачатка и семени Nuphar lutea из сем. Nymphaeaceae
(первая группа семяи): 7 — зрелый семязачаток,
Рис. 22 (продолжение).
8 — семя на стадии глобулярного зародыша (8а),
Рис. 22 (продолжение).
9 — зрелое семя (мелкими точками показана область перисперма, крупными точками —
центральная часть подиума^ представленная клетками с лигнифицированными оболочками,
заполненными ^танинами; сеткой — латеральная часть подиума с тонкостенными клетками; наклонной
линией — узкие клетки в латеральной части нуцеллуса), 10,11 — крахмал (мелкие зерна —
транзиторный и крупные — запасной) в клетках латеральной части подиума и нуцеллуса,
преобразующихся в перисперм на стадии глобулярного (10, деталь рис. 8) и зрелого (11, деталь
рис. 9) зародыша; а — ариллоид, ей — внутренний иитегумент, г — гипостаза, з —
зародыш, м — микропиле, ни — наружный интегумент, н к — нуцеллярный колпачок, о —
оперкулум, п — перикарпий, пд — подиум, пер — перисперм, пр п — проводящий пучок,
пс — постамент, у к н — узкие клетки нуцеллуса, эк — экзокарпий, экт — экзотеста, эн —
эндокарпий, энд — эндосперм, энд г — эндоспермальный гаусторий.
1 — по: Johnson, 1900; 2 — по: Никнтичева, 1981а; 3 — по: Grootjen, 1983; 4 — по- Gibbs
1907; 5 — по: Humphrey, 1896; 6 — по: Бутник, 1991; 7-11 — по: Шамров, 1995.
I II Ш IV
1г.е 2? 3? 4? 5?
Generation
(proembryon bicellulaire) 3
Рис. 23. Эмбриогеиия: законы и стадии.
1,2 — проявление законов происхождения и расположения в период первых четырех генераций
в проэмбрио (I, II, III, IV) у Saxifraga granulata (1) и Euphorbia exigua (2); 3-5 — закон
чисел, проявляющийся в разной скорости делений апикальной и базальнои клеток во время
первых пяти генераций у Polygonum persicaria (3),
16
Cellules
12
Cellules
8
Cellules
4
Cellules
4
о/У
$У
V
■ )
f
i
\b/
N
/
№'*'
У . .1* >
rGtTav
S*
^Г
ФУ
„-'
■jera 2? 3е 4е
Generation
(proembryon bicellulaire)
16
Cellules
12
Cellules
8
Cellules
4
Cellules
'
Tetrafc
****
S>
yy
r
r
d<*
#'
/
t' iw\5
Й^
/
Л/
$i
W
8
t J
,v
(Й/
W
1ere 2? 3?
Generation
(proembryon bicellulaires)
4? 5?
Рис. 23 (продолжение).
Oenothera biennis (4), Erodium cicutarium (5);
Рис. 23 (продолжение).
схематическое изображение стадий развития зародыша Capsella bursa-pastoris
глобулярной до обратно U-образной;
EMBRYO
PERISPERM
ENDOSPERM
HYPOSTASE
OUTER
INTEGUMENT
INTEGUMENTARY
TAPETUM
INNER
INTEGUMENT
NUCEULAR CAP
NUCEWUS
PARIETAL
TISSUE
(0
in
и
Э EMBRYO
t- PERISPERM
О ENDOSPERM
Э HYPOSTASE
ct outer
INTEGUMENT
t- INTEGUMENTARY
TAPETUM
СП INNER
INTEGUMENT
NUCELLAR CAP
U> NUCELLUS
J PARIETAL
TISSUE
>
о
EMBRYO
PERISPERM
ENDOSPERM
HYPOSTASE
INTEGUMENTARY
■ TAPETUM
INTEGUMENT
NUCELLAR CAP
NUCELLUS
PARIETAL
TISSUE
Nuphar lutea (L.) Sm.
Nelumbo nucifera Gaertn.
A Ih EN T
JmniiflHIIIIIIIIIIIII
№^M»
А В S EN T
^®аш
Ceratophyllum demersum L.
DEVELOPMENTAL STAGES:
1-ARCHESP0R1UM 5-GLOBULAR EMBRYO
2-MEIOSISl 6-EARLY ORGANOGENESIS
3-MATURE EMBRYO SAC 7-MATURE EMBRYO
4-ZYGOTE 6-GEMINATION
Triticum aestivum L.
I I \***Ш?&ШШ-&
I |a В | S E |n T | |
i i ишшшшт
„лишим, i i i i
i^^^^^^i
I | А В | S E j N T | |
^?Я%%?ЗХ$$Ш#№$'Жя-.
I I* » h e
^^tataL^
I |a В I S E
N T| I
I I
N T
2 3 k 5 6 7
Gentiam cruciata L.
^ГТуШууУуШ:
| А В | S E | N T | |
I J*^*«?eWM^
illllllllllllllllllk
/|l Ml т пгТу
^ШШШ
| А В 1 S E
A 1 1
|a в j s e
| 1
1 1
1 1
N T| |
1
N T | |
3 A 5 6 7
DEVELOPMEN
12 3 4 5 6 7
TAL STA&ES
Рис. 23 (продолжение).
7, 8 — критические стадии в развитии семязачатка и семени у Ceratophyllum demersum,
Centiana cruciata, Nelumbo nucifera, Nuphar lutea, Triticum aestivum (7)
+
+ + +
111 Ш LUf Ш
—о
++ +
о
1
о
1Ш1ГШ—Ш—LwJ И
^-^^^^^^^^^^^^^^
Внутренний,
интегумент
^^^^^^^^^^^^^^^^r
Ги.поста.за.
\\\\\\?^УчУгт-г
Фуникулус
IE
~щ
lJ
ипщапш
ш
Примордий
семязачатка
Семязачаток
Т£
23
-щ
Семя
Рис. 23 (продолжение).
и Cymnadenia conopsea (8: по оси абсцисс — стадии развития, по оси ординат — развитие
структур и содержание веществ; в верхней части схемы представлена динамика веществ в
структурах, начиная с археспориальнои клетки до зародыша н эндосперма; 1-11 — критические
стадии; 0, + , + + , + + + — уровни содержания веществ: жирной линией показан крахмал,
тонкой — белки, пунктирной — декстрины; 0-1 — уровни развития структур; А-Г —
относительное время возникновения (А), максимального развития (Б), начала дегенерации (В) и
полного исчезновения структур (Г); заштрихованный участок — условный объем данной
структуры); а — археспориальная клетка, д — диада, г з — глобулярный зародыш, з —
зародыш, з м — зародышевый мешок, м — мегаспороцнт, on — оплодотворение, пр — проэмбрио,
т м — тетрада мегаспор, э — эндосперм, са, сЬ .
1-5 — по: Soueges, 1937; 6 — по: Rijven, 1952; 7 — по: Batygina et al., 1992; 8 — по:
Шамров, Никитичева, 1992.
са, сЪ и др. обозначения ярусов зародыша приводятся в статье «Проэмбрио»
Рис. 24. Зигота.
1 — яйцевой аппарат и часть центральной клетки с полярными ядрами (одно налегает иа
. .ругое) в зрелом зародышевом мешке Triticum aestivum, сорт Диамант, вверху справа — деталь
верхней части синергиды («воронка» и зубовидный вырост);
Рис. 24 (продолжение).
2-4 — процесс оплодотворения у Zea mays: 2 — микропилярная часть зародышевого мешка
через 19,5 ч п/оп., ядра спермиев около женских ядер, 3 — то же через 23 ч п/оп.,
в зародышевый мешок вошли две пыльцевые трубки: одна, спермин которой произвели
оплодотворение, вошла через первую синергиду, другая, дополнительная — через вторую синергиду, ее
спермин (изображенные рядом при большом увеличении) дегенерируют, в зиготе процесс
слияния ядер еще не завершен, видны два ядрышка, слияние ядра спермин с одним из полярных
ядер закончилось, мужское и женское ядрышки слились (видна характерная для
оплодотворенных ядер кукурузы хроматиновая сеточка), 4 — то же через 24 ч п/оп., в ядре зиготы мужские
и женские ядрышки еще не слились, ядро первичной клетки эндосперма в ранней профазе; 5,6 —
двойное оплодотворение (постмитотический тип) у Limodorum abortivum: 5 — зигота на стадии
слияния ядер, 6 — ядро зиготы в профазе митотического деления, слияние ядер завершается,
видны мужское и женское ядрышки;
Рис. 24 (продолжение).
7-12 — особенности строения клеточных оболочек зиготы (Dillenia suffruticosa — 7, 8) и
зародыша (Acrotrema arnottlanum — 9-12): 7 — зигота с утолщенной оболочкой в базальной
части, 8 — более поздняя фаза развития зиготы, оболочка значительно утолщена, с большими
выростами, 9,10 — дву- н восьмиклеточныи проэмбрио в окружении разбухшего чехла зиготы,
выросты проникают в эндосперм, 11 — конец проэмбриональной фазы, выросты чехла главным
образом в базальной части проэмбрио, 12 — зародыш с зачатками семядолей, видны остатки
чехла вокруг суспензора;
5Э-828
1 2
3
Серяи А
Серю В
Серии С
е...
iec
Рис. 25. Проамбрио.
1-3 —- типы двуклеточного проамбрио; 4 — типы проэмбриональных тетрад, выделенные иа
основании ориентации плоскости деления в апикальной клетке (вертикальной в серии А,
наклонной в серии В и поперечной в серии С) и базальиой клетке (вертикальной в подсериях Aj, Bj,
С) и поперечной в подсериях Аг, Вг, Сг) и использованные в классификации типов
эмбриогенеза Soueges (1939); 5-8 — типы проэмбриональных тетрад первого, второго, третьего и
четвертого порядков серии С классификации Soueges; 9-12 — способы формирования октантов:
9-10 — с образованием двух этажей I и Г, 11-12 — с образованием одного этажа q; 13 —
схема расположения основных гистогеиов в проэмбрио иа заключительных этапах его
формирования (х-у, pq — продольная и экваториальная оси симметрии проэмбрио);
Ф®
14-61
59*
Рис. 25 (продолжение).
геометрические типы проэмбрио: 14-24 - орторадиальный (Муошги* minimus),
Л-ЭЭ _ линейный (Solatium sisimbrifolium),
Рис. 25 (продолжение).
36-45 — спиральный (Adonis autumnalis), 46-61 — иррегулярный (Datura stramonium);
62
Рис. 25 (продолжение).
62-63 — типы эмбриогенеза у Juglans regia: 62 — первый тип, с поперечной перегородкой
при делении зиготы,
A=2-celled
D=3,4-celled
B=4,5-celled
D=6-8-celled
E=8-11-celled
E=many-celled
1.
half only shown
5. 6
Рис. 25 (продолжение).
63
63 — второй тип, с наклонной перегородкой (с ранней дорзовентральностью в строении
проэмбрио — Г.Т., И.Ш.).
1-3 — по: Soueges, 1937; 4-12 — по: Natesh, Rau, 1984; 13 — по: Crete, 1963; 14-61 — по:
Soueges, 1936; 62-63 — по: Nast, 1941 с измен.
ОН
ан
0.05 т
1-7
Рис. 26. Суспеизор.
проэмбрио без дифференцированного суспензора: 1, 2 — Peperomia blanda, 3
P.eburnea, 4-7 — Cynomorium songaricum;
Рис. 26 (продолжение).
8-Ю — развитие нитевидного суспензора, погружающего собственно зародыш в центральную
часть эндосперма у Pinguicula vulgaris; 11-13 — развитие нитевидного суспензора, выходящего
из семязачатка и внедряющегося в плаценту у Gymnadenia conopsea;
и
Рис. 26 (продолжение).
14-17 — гроздевидный многоклеточный суспензор Convolvulus scammonia, видно соотношение
размеров суспензора и собственно зародыша иа разных стадиях эмбриогенеза и прикрепление
суспензора к интегументу; 18 — суспензор Cuscuta japonica, состоящий из пузыревидных
миогоядерных клеток;
Рис. 26 (продолжение).
19-23 — суспензор с разросшимися вдоль границы с нуцеллусом гаусториальными клетками, с
лабиоиитом оболочки в базальнои стеике и эндополиплоидными ядрами у bcheuclizeria palustns
лабиринтом оболочки в
(18-22) и Myriophyllum spicatum (23);
Рис. 26 (продолжение).
24 — суспензор, дифференцированный на несколько
зон с различными типами клеток: гипертрофированные
многоядериые клетки в базальнои части, крупные
одноядерные клетки в средней части и небольшие
клетки в зоне «шейки» суспензора, примыкающие к
собственно зародышу у Cuscuta monogyna; 25 —
сложный суспензор Sedum hispanicum,
дифференцированный иа ткани различных типов: мелкие клетки
«шейки», основную гипертрофированную клетку с эн-
дополиплоидным ядром и лабиринтом оболочки,
образующую тонкие гаусториальные выросты в иитегумеит;
26 — схема созревающего семени 5. hispanicum, видно
соотношение зародыша, суспеизора, нуцеллуса,
эндосперма и ннтегумента; ан — антиподы, ей — внутренний
интегумеит, з — зародыш, ин — интегумент, н — ну-
целлус, пл — плацента, пс — постамент, с — суспензор,
сн — синергида, эн — эндосперм.
1-3 — по: Никитичева, 1981; 4-7 — по: Терехии и др., 1975; 8-10 — по: Никитичева, 1987;
11-13 — по: Шамров, Никитичева, 1992; 14-16 — по: Никитичева, Проскурина, 1989;
17,24 — по: Никитичева, Терехин, 1987; 18-21 — по: Никитичева, Проскурина, 1992; 22, 23,
25, 26 — по: Никитичева, 1985.
Рис. 27. Ультраструктурные особенности суспензора.
1-10 — двуклеточный проэмбрио (1), фрагменты трехклеточного проэмбрио (2-5), ранний и
поздний шаровидный зародыш (6-10) Alcea rosea: l — базальная клетка во много раз крупнее
апикальной и сильно вакуолизирована, ядра этих клеток различны по размерам и форме, 2, 4 —
фрагменты базальной части проэмбрио, запасные вещества поделившейся базальной клетки —
крахмал и липиды, 3, 5 — место контакта апикальной и поделившейся базальной клеток
проэмбрио, видна разница в размерах крахмальных зерен амилопластов этих клеток, на 6, 7 —
два последовательных среза раннего глобулярного зародыша, 8-10 — три последовательных
среза позднего глобулярного зародыша: видна гетероморфность клеток суспензора, эндосперм
еще свободноядерный; 11-13 — двуклеточный проэмбрио Epipactis atrorubens: И — общий вид
проэмбрио (СМ), 12 — фрагменты обеих клеток проэмбрио, ценоцита эндосперма и клеток
внутреннего интегумента, 13 — фрагменты базальной клетки проэмбрио и ценоцита эндосперма;
14-16 — четырехклеточный проэмбрио Е. atrorubens: 14 — общий вид проэмбрио (СМ), 15^ —
базальная клетка проэмбрио и фрагмент медианной клетки, 16 — фрагменты базальной и
медианной клеток проэмбрио и ценоцита эндосперма, видно парамуральное тело в зоне контакта
базальной клетки проэмбрио с эндоспермом (стрелка); (1, 6-11, 14 — СМ, 2-5, 12, 13, 15,
16 — ТЭМ). Масштабная линейка — 1 мкм, И, 14 — х500, 12 — х9400, 13 — х10700,
15 х8800, 16 — х9000; а к — апикальная клетка проэмбрио, ам — амилопласт, б к —
базальная клетка проэмбрио, к з — крахмальное зерно, ко — клеточная оболочка, к э —
клетка эндосперма, л к — липидная капля, м — митохондрия, м к — медианная клетка четы-
рехклеточного проэмбрио, н — нуцеллус, п к о — протуберанец клеточной оболочки, пл —
плазмалемма, эр — эндоплазматический ретикулум, я — ядро, я о — ядерная оболочка.
1-10 — Жукова, ориг.; 11-16 — по: Жукова, Савина, 1978 (16 с измен.).
Рис. 27 (продолжение).
Vv *' '
h~—{
9
'■л *'
t - <4
©1
> '*
■fa- !ч
'# Wife"' ■*■#»*'
P«c. .?? (иродолжсвче).
"::,.!Ч ' „WW.';' ■/' Zm>?*htem%&m* '&■ ч ■:■'■ ?4*w'"(. «feMasbs, ! ,„MP"-
11*
"Ж
J.1'.
«-■
V*jr
ийШй*
Рис. 27 (продолжение).
КЗ ~
#
:.^1 .-
12
j*sttf .£?&,-
«^
Ци
"г
/Г:
л**-.-
~i*".
A* ^
*■
": . .--П/ > Г*-«-J ^4#* "■ -■■'rf.
&•
13
Рис. 27 (продолжение).
#
■г -сАл,«-' ,^
VI
к J-'
>\ ''«$**
*",,'" Vй к .'\ S^jsij *йЕ
5Q-828
Рис. 27 (продолжение).
Fig. 28. Suspensor functions.
[Рис. 28. Функции суспензора]
—- A longitudinal section through a Phaius tankewilliae embryo. This orchid embryo is charac-
^ I , have a single large, vacuolated suspensor cell; 2 — A longitudinal section through a bean
i„ o/tfs vulgaris) embryo at the cotyledon stage. The multicellular suspensor is large. The cells
«• Ictus cytoplasm; 3 — Light micrograph showing the organization of a Cymbidium sinense
L *tj with large elongating suspensor cells. The embryo was dissected from the seed coat and
4<J -Шд an interference contrast microscope; 4 — Microtubule configuration within the suspensor
1 /i Cymbidium. The microtubules (arrow) tend to align at right angles to the long axis of the
I lin the tip region (arrowhead), the microtubules appear to be more abundant and arranged in the
it «iTfcion as the cell axis. The embryo was fixed, dissected from the seed, and stained with
&^ «-, against tubulin. For viewing, the embryo was stained with FITC-conjugated secondary
\-o ie» and viewed with a MRC-600 BioRad confocal laser scanning microscope. For details, see
Лее and Aziz-Un-Nisa (1991);
ада"
St"
Fig. 28 (continued).
5 — Electron micrograph showing the transfer cell morphology of a bean (Phaseolus coccineus)
suspensor cell at the globular stage of embryo development. Wall ingrowths (arrowheads) are present.
Mitochondria tend to localize near the wall ingrowths. The electron dense plastids are more centrally
located; 6 — Smooth endoplasmic reticulum is very abundant within the cytoplasm of the bean
suspensor cells; 7 — Fields of polysomes can be found in the bean suspensor cells as early as the
proembryo stage. M — mitochondria, P — plastids, S — suspensor. Scale bars: 1-3 — 20 Цт,
4 — 25 |.im, 5 — 1 цт, 6 — 0.4 jam, 7 -- 0.2 Jim.
1-7 — Yeung, Zee. 'Ye, orig. data.
60*
Рис. 29. Протодерма (эмбриодерма).
1-12 — формирование протодермы в процессе эмбриогенеза у Bartsia alpina: 1-5 — стадии
развития проэмбрио, 6-12 — вычленение ииициалей протодермы на стадии октантов путем
периклииальиых делений клеток в ярусах / и /' (6,7) и их антиклинальные деления на
последующих стадиях развития зародыша (8-12); 13-16 — нарушения в процессе дифференциации
протодермы у Orobanche pallidiflora (Orobanchaceae): 13-14 — отсутствие периклинальных
делений и вычленения инициалей протодермы в ярусе /, 15,16 — наружные клетки апикальной
части зародыша в зоне нарушения дифференциации протодермы крупнее, чем клетки базальной
части; 17-20 — нарушения в слое протодермы по всей поверхности зародыша у Goodyera.
discolor {Orchidaceae), наружные клетки имеют различные размеры;
EARLY EMBRYO
Entire tissue
meristematic
Multicell budding
from more than
one cell layer
(cleavage
polyembryony)
BIPOLAR EMBRYO
OR PLANTLET
Epidermis still
immature
OLDER PLANTLET
OR SEEDLING
Some epidermal
cells still immature
Multicell budding
from young
epidermis
Single-cell
budding from
maturing
epidermis
MATURE TISSUE
•i
И
м
Embryogenesis only
possible by callus
induction and
redetermination
(ie. through lEDCs)
21
Рис. 29 (продолжение).
21 — гипотетическая схема различий в эмбриогеннои способности эпидермальных и субэпидер-
мальных клеток зародыша; преэмбрионально-детерминироваиные клетки (PEDC) могут
непосредственно формировать соматические зародыши (прямой соматический эмбриогенез), но,
вероятно, эту способность утрачивают по мере своего созревания; клетки зрелых тканей могут стать
«индуцировано эмбрионально детерминированными» (IEDC) только через образование каллуса и
редетермииацию; количество и распределение PEDC показано точками; пр — протодерма.
1-16 — по: Никитичева, 1979; 17-20 — по: Treub, 1878; 21 — по: Williams, Mabeshwaran,
1986 (см. Lyndon, 1990).
остаются^
покоящимися
в течение
некоторого времени
Рис. 30. Гипофизис.
1-19 — формирование гипофизиса в эмбриогенезе Capsella bursa-pastoris согласно представлениям
Hanstein (1-4), Coulter, Chamberlain (5-9), Schaffner (10-13) и Soueges (14-19);
Рис. 30 (продолжение).
20-46 — различные способы формирования гипофизиса по Soueges: 20-23 — А.а: единственная
гипофизарная клетка делится горизонтально с образованием перегородки в форме часового
стекла и дает начало инициалям коры и чехлика кория (Oenothera biennis), 24-27 — А.б:
единственная гипофизарная клетка делится дважды вертикально с образованием четырех гиаофн-
зарных квадрантов и дает инициали коры и чехлика кория (Myosurus minimus), 28-32 — Б:
единственная гипофизарная клетка дает начало только медианной части чехлика (NicoSiuna
acuminata), 33-37 — В: две клетки одного яруса или клетки двух ярусов проэмбрио рвеаоло-
жены один под другим и дают начало ииициалям коры и чехлика корня, соответственио (Senecio
vulgaris), 38-42 — Г.а: группа клеток проэмбрио, происходящая из единственной
детерминированной клетки ароэмбрио - производной клетки cb, дифференцируется в гипофизариую ткань, на
которой образуются кора и чехлик корня (Erodium cicutarium), 43-46 — Г.б: группа клеток
отделяется от другой группы клеток, возникающей из недетерминированной клетки ароэмбрко -
производной клетки са, и дает кору и чехлик корня (Trifolium minus);
Рис. 30 (продолжение).
47 — схема положения перегородок в инициальной клетке гипофизиса при различной ее
ориентации: А — в "профиль", В — в промежуточном между А и С положении, С — "в фас"
(I — после первого деления, II — после второго деления, III — после третьего деления);
48-60 — характер деления инициальной клетки гипофизиса в эмбриогенезе Lathraea squamaria:
48-53 — начальные этапы эмбриогенеза, 54-56 — отделение дерматогена и начало
дифференциации гипофизиса, 57-60 — дифференциация инициалей периблемы и плеромы в глобулярном
зародыше;
Рис. 30 (продолжение).
61-66 — происхождение гипофизиса/покоящегося центра в главном корне зародыша (61-65) и
проростка Sphenoclea zeylanica;
Рис. 30 (продолжение).
67-72 — происхождение гипофизиса/покоящегося центра в латеральном корне Commelina
bengalensis, закладывающихся в основании междоузлия (67, 68) и в области соединения корня
и гипокотиля (69-72): 67, 68 — инициали покоящегося центра отсутствуют, 69, 70 — раииее
обособление ииициалей покоящегося центра (обозначены крестиком), 71, 72 — их дальнейшее
развитие, начало интенсивных клеточных делений; d , d', de — дерматоген, h.h' — гипофизис,
ico — ииициаль корневого чехлика, гее — инициаль коры корня, р, р' — периблема, pi —
плерома, s — суспензор.
1-4 — по: Hanstein, 1870; 5-9 — по: Coulter, Chamberlain, 1903 — цит. по: Swamy,
Krishnamurty, 1975; 10-13 — по: Schaffner, 1906 — цит. по: Swamy, Krishnamurty, 1975;
14-19 — по: Soueges, 1919; 20-46 — по: Spueges, 1934; 47-60 — по: Никитичева, 1971;
61-72 — по: Swamy, Krishnamurty, 1975.
на деталях 10-12, 31, 51 d — один из ярусов, производных базальной клетки.
/£$* s^i*,'4^i
24
de os
25
Рис. 31. Эпнфнзнс. Эпнкотиль.
1-26 — различные способы образования эпифизарной ткани у Papaver phoeas (1-5), Erodium
cicutarium (6-10), Sinecio vulgaris (11-14), Myosurus minimus (15-18), Lepidium sativum (19-23),
Sedum acre (24-26);
27
Рис. 31 (продолжение).
27-60 — развитие эпнкотнлярного (показан точками) и семядольного локусов у двудольных
(27-50) и однодольных (51-60) растений: 27-38 — клетки октантов расположены в одном
ярусе, 39-50 — в двух ярусах (27-32, 39-44 — продольные срезы, 51-55 — срединные срезы
в эпикотнлярно-семядольной плоскости, 33-38, 45-50, 56-60 — поперечные срезы,
соответствующие определенному продольному срезу, на схеме расположены один под другим);
apical zone апикальная зона
central zone центральная зона
distal zone дистальная зона
meristeme d'attente меристема ожидания
axial zone осевая зона
Оч
leaf primordium
примордий листа
сердцевидная
колончатая
меристема
flank me lis tern фланговая меристема
peripheral zone периферическая зона
sub-distal zone субдистальная зона
anneau initial инициальное кольцо
sub-apical region
субапикальная зона
61
Рис. 31 (продолжение).
61 — зональность н направление роста тканей в
гипотетическом вегетативном апексе побега
двудольного растения: указаны термины, которые
используются разными авторами для обозначения
зон апекса побега (русские синонимы
перечисленных терминов — Е.А.); 62, 63 — модель
образования метамера и схема распределение клеток в
апексе побега, выполненная по результатам
работы Plantefol (1947): 62 — клетки в осевой зоне
делятся поперечно (количественный мнтоз 1, Q1),
после чего одна нз дочерних клеток остается в
осевой зоне, другая дочерняя клетка,
расположенная на границе между осевой и фланговыми
зонами, переходит в зону инициального кольца, она
претерпевает второе поперечное деление
(количественный мнтоз 2, Q2), давая 2 дочерние
клетки — дистальную н проксимальную, от которых
берут начало, соответственно, узел с
соответствующим листом нлн междоузлие, являющиеся
составными частями метамера; в результате
последующих поперечных делений производные этих
клеток покидают зону инициального кольца н
продолжают свое дальнейшее развитие; в
представленной схеме пластохрон эквивалентен среднему
времени удвоения клеток в инициальном кольце;
63 — гипотетическая схема генеалогии клеток,
формирующих узел и междоузлие метамера апекса
побега, дополняющая модель 62, число клеток в
узле и междоузлии указано приблизительно; / н
V — две самые верхние клетки тетрады, лежащие
одна под другой, т — средняя клетка, сг — нижняя клетка тетрады, е — эпифизнс, п —
верхняя производная клетки ci нлн этажа сг, о и р — производные клетки п', которая является
нижней производной ci, q — квадранты, iep — иннцналн эпидермы стебля, iec' — инициалн
коры стебля, а и р — дочерние клетки квадрантов или верхних октантов, гсс' — нннциали
центрального цилиндра стебля, os — верхние октанты, oi — нижние октанты, de — дерматоген,
а — осевая зона, / — фланговая зона, т — туника, с — корпус, ir — инициальное кольцо
(«initiating ring»), ds — днстальная и рг — проксимальная клетки в инициальном кольце.
1-26 — по: Soueges, 1934; 27-60 — по: Swamy, Krishnamurthy, 1977; 61 — по: Gifford, Jr.,
Corson, Jr., 1971; 62,63 — no: Barlow, 1994.
В большинстве работ iec и ice означают инициали коры корня и центрального цилиндра коры и стебля,
соответственно; гистогены iec' и ice' использованы Soueges (1934) применительно к стеблю.
Рис. 32. Зародышевый корень.
1 — Capsella bursa-pastoris: фрагмент , продольного среза развитого зародыша, на корневом
полюсе представлены производные гипофизиса: инициальные клетки центрального цилиндра, две
соединительные клетки, колумелла; 2-5 — Biophytum dendroides: 2 — глобулярная стадия
развития зародыша, сформированы 4 этажа — q, т, п, о, 3 — несколько более продвинутая
стадия — начало дифференциации тканей, 4а, 4б — начало дифференциации органов, из п и о
нозиикает ткань гипофизиса (4а — поперечный срез через соединительные ткаии периблемы
зародыша, 4б — продольный срез), 5 — корневой полюс зрелого зародыша (медианный
продольный срез); 6 — Brassica napus: корневой апекс зрелого зародыша: соединительные
клетки подстилаются снизу корневым чехликом, клетки которого в калиптрогене делятся;
Рис. 32 (продолжение).
7-10 — Helianthus annuus: 7а, 7б — молодые зародыши, возникновение соединительных клеток
из этажа п, 8 — дальнейшее развитие корневого полюса: клетки гипофизиса расположены в
виде свода и образуют ряды колумеллы, которые с боков контактируют с делящимся
дерматогеном, соединительные клетки делятся антиклинально, 9 — несколько более поздняя стадия, 10 —
корневой полюс зрелого зародыша;
Рис. 32 (продолжение).
11 — Allium giganteum: фрагмент продольного среза почти зрелого зародыша, виден делящийся
дерматоген; 12 — Galtonia candicans: 12a — корневой полюс молодого зародыша, видны
первичный и вторичный дерматогены, под ним расположены иницналн периблемы, стыкующиеся
в центре с соединительными клетками, выше — иницналн плеромы (эта часть возникает нз
этажа п), гнпофнзис возникает нз этажа о н образует иннцнали колумеллы (дерматоген
делится), 12б — корневой полюс зрелого зародыша, гнпофнзис расширяется за счет деятельности
иннцналей корневого чехлика, число соединительных клеток увеличивается и вторичный
дерматоген занимает свое место в качестве покрова корня; 11, 12а, 126 — граница гипофизнса
обозначена хх; 13 — Carex arenaria: фрагмент продольного среза зрелого зародыша, на корневом
полюсе чехлик охватывает первичный н вторичный дерматогены, последний смыкается с
соединительной тканью; 14, 15 — Роа annua: развивающийся зародыш, нннциалн периблемы и
плеромы дифференцируются на базе яруса т, иннциалн колумеллы — из п, 15 — несколько
более развитый зародыш с зачатком корня;
Рис. 32 (продолжение).
16-20 — развитие корневого чехлика у Commdina communis: 16-18 — продольные срезы
зародыша на разных стадиях развития, 19, 20 — кончикн корней проростков на разных стадиях
прорастания;
61 -828
Рис. 32 (продолжение).
21 — продольный срез кончика корня Washingtonia robusta; 22 — схематическое изображение зародыша Phoenix canariensis;
^ uj
я
о
13
Я
з:
я
к>
я
•о
о
о
>
S
S
л
I
Рис. 32 (продолжение).
24 — апекс кория проростка Zea mays; 25, 26 — строение апикальной меристемы корня
Triticum aestivum;
Рис. 32 (продолжение).
27 — медианные срезы корневых апексов Zea mays (А) и Pisum sativum (Б) (стрелки
показывают лннню раздела между делящимися клетками и покоящимся центром), у Zea mays
дистальная граница покоящегося центра строго определяется калиптрогеном, непрерывные ряды
клеток от покоящегося центра прослеживаются только в проксимальном направлении, у Pisum
sativum видны непрерывные ряды клеток от покоящегося центра по обе стороны, т. е. клетки
покоящегося центра время от времени делятся и вносят свой вклад также и в меристему
корневого чехлика;
.4 rf-^Hb-j^^
/: J.I
'.!
т JeW-v^ r I.* I :i! 'S^fSt mm
f v ^У ^ ■ ,|й м нш\. ж s lift Ji
S Itr.-','
^\
в
:У*--^
•к .» иди! ;;» ' *»ui ч -Я1|
Рис, 32 (продолжение).
28, 29 — дифференциация в протсдерме Raphanus sativus (28 А, Б, В — поперечные срезы,
28 Г — продольный срез поверхности зпкдермиса, 29 — продольные срезы);
*?'
am
-л.
-л
1~«
Mfr -TV h - - ^~
№r"—^~ *"" :- ?*- -=■"
ill it"' ' *™"-k-iIj-- ■■—' —*™-- *"
7~ i»" «,.." „"J^r £.\ ' , t" \ , ""\ Si
' am»,;
29
Рис. 32 (продолжение).
тс
В
30
Рис. 32 (продолжение).
30 — последовательные этапы дифференциации тканей корня Lycopersicon esculentur,
Рис. 32 (продолжение).
31 — «переходная зона» 5-диевного проростка Lycopersicon esculentum (последовательные срезы
от основания корня к семядолям): А — основание корня (дифференцированы элементы прото- и
метофлоэмы и протоксилемы), Б — средняя зона гипокотиля, В — основание семядольного узла,
Г — семядольный узел, средняя часть, Д — верхняя часть семядольного узла, Е — основание
семядолей, Ж — основание семядолей на более высоком уровне, 3 — продольный срез через
середину проростка в семядольной плоскости; an — апикальная меристема побега, am — атрихоб-
ласт, в — воротничок, в д — вторичный дерматоген, з к — зародышевый корень, и и, и, —
инициальные клетки центрального цилиндра, и ч — ннициалн чехлика, к — колумелла, к в —
корневое влагалище, кл — колеориза, ко — колеоптиль, кр — кора, л — лист, м — меристематн-
ческая зона, формирующая кору и чехлик (у пальм), мкс — метаксилема, мф — метафлоэма, пб —
периблема (илн инициали периблемы), п д — первичный дерматоген (или дерматоген), пк —
перикамбий (перицикл), пкс — протоксилема, пл — плерома (или инициали плеромы), птд —
протодерма, пф — протофлоэма, п ц — покоящийся центр, сд — семядоля, с к —
соединительные клетки, т — трихобласт, у, п б — центральные инициали периблемы, Ц с к — центральная
соединительная клетка, ц и, — центральный цилиндр зародышевого корня, ч — чехлик, эн —
эндодерма, эп — эпидермис.
1 — по: Hanstein, 1870 — цит. по: Guttenberg, 1960; 2, 6, 12 — по: Guttenberg, 1960; 7-10 —
по: Guttenberg et al., 1955; И, 14, 15 — по: Guttenberg et al., 1954; 13 — no: Guttenberg,
Smelow, 1957; 16-20 — no: Yamashita, 1984; 21, 22 — no: Gatin, 1906; 23 — no:
Воронин, 1964; 24 — по: Соколовская, 1967; 25, 26 — Демченко, ориг.; 27 — по:
Clowes, 1975; 28, 29 — по: Данилова, Бармичева, 1972; 30, 31 — по: Данилова, 1963.
Рис. 33. Псевдомонокотилия. Псевдодикотилия.
1-3 — строение проростков Cyclamen persicum (1,3) и С. пеароШапит (2) по Hill (1920): 1 —
проросток с одной, нормальной (с;) и другой, рудиментарной (сг) семядолями, 2,3 — задержка
большей семядоли в семеин (2), а также ее удаление (3) стимулируют развитие рудиментарной
(с^) семядоли»
19
21
22
23
Рис. 33 (продолжение).
4-28 — развитие зародыша и проростка Cyclamen persicum по Hagemann (1959 а, Ь), показано
отсутствие в нем второй семядоли: 9 а, Ь — положение первых клеточных перегородок в про-
эмбрно (схемат.),
Рис. 33 (продолжение).
24-28 — серия поперечных срезов молодого проростка на уровне гнпокотиля (24), апекса
побега (25) и семядоли (26-28), иллюстрирующих наличие в нем единственной семядоли;
29-34 — особенности строения нормального (29, 32) н аномального, возникшего в результате
обработки фенилборной кислотой (30,33), зародышей Cyclamen persicum по сравнению с типич
ным двусемядольным зародышем (31,34): 29-31 — схемат., 32-34 — на поперечных срезах;
Рис. 33 (продолжение).
35-69 — развитие зародыша и проростка Ттара astrachanica (35-61) и Т. natans (62-69), природа
чешуевидного органа которого является днскусснонной (рудиментарная вторая семядоля илн вырост
влагалища единственной семядоли — см. Батыгнна, Колесова, 1985; Титова, 1996): 35-44 —
формирование проэмбрио,
Рис. 33 (продолжение).
органогенез, развитие семядоли и чешуевидного органа (51, 52 — фрагменты
полюса зародыша), 53,54 — различные стадии развития проростка,
Рис. 33 (продолжение).
64
Рис. 33 (продолжение).
62-69 — формирование гаусториального выроста суспензора, внедряющегося в ходе развития семени между семядолей и подиумом: 62-65 —
схема строения семени, 66-68 — продольные срезы семени, 69 — фрагмент халазальной части семени (68) при большем увеличении
(55-59 — СЭМ, 60, 61, 66-69 — СМ);
О)
"О
S
о
а
•о
о
О
>
.г л хт.'^ А.
= " *
* fl£f*?
• i-- '" ' *■ - ■■' -■ ■- ь
v^iW -: ч'\ *">j'""1 \ ** * -: *Vt*», **
* * ' x ■ -*-Je^"
«го;гШйШ^
Bis*-.: ^.j-
Рис. 33 (продолжение).
70 — схема строения прорастающего двусемядольного зародыша Agapanthus umbellatus (a-o —
поперечные срезы в области семядольного влагалища и семядольного узла); а п, v — апекс
побега, аде к — адвентивные кории, б п — боковая почечка, ей — внутренний интегумент,
г — гипостаза, г п — главная почечка, г с — гаусторий суспензора, г з к — главный
зародышевый корень, з — зародыш, л\, Л2 — первые листья почечки, ни — наружный
интегумент, п — подиум, пост — постамент, п п — проводящий пучок, с, Cj, с^, со, со/,
со 2 — семядоля, сус — суспеизор, ф — фуникулус, чеш — чешуевидный орган.
1-3 — по: Hill, 1920; 4-28 — по: Hagemann, 1959а, Ъ; 29-34 — по: Haccius, Lakshmanan,
1967; 35-59 — по: Титова, 1988, 1996; 60-69 — Титова, Захарова, ориг.; 70 — по: Coulter,
Land, 1914.
Рис. ЗЗА. Поликотилия. Схизокотилия.
1-4 — прорастание Schizopetalon walkeri {Brassicaceae), узкие семядольные доли по очереди
выходят из семени;
62*
Рис. ЗЗА (продолжение).
5 23 - прорастание (5) и развитие зародыша с иррегуляриым характером клеточных делении
(6 23) уYschTcholzia califо°пгса (Р>apaveraceae), видно разделение примордия каждой из двух
семядолей на два (\Ч-£эу,
Рис. ЗЗА (продолжение).
24-38 — прорастание (24) и развитие зародыша (25-38) у видов Juglandaceae: 24 —
проросток Pterocarya caucasica с глубоко четырехраздельиыми семядолями, 25,26 — четырехраздель-
иые семядоли Engelhardia roxburghianum (25) и Platycarya strobilacea (26) с равными и
неравными долями соответственно, 27 — одна из стадий развития зародыша Juglans mandshurica с
апикальной меристемой на кончиках исходных семядольных примордиев, 28-36 — первичное
(28-31) и вторичное (32-36) разделение исходных семядольных примордиев на четыре доли в
зародыше /. regia, 37,38 — внешний вид семени (37) и поперечный срез плода (38) Pterocarya
caucasica, иллюстрирующие характер заполнения семядольными долями четырех полостей семени
и плода;
Рис. ЗЗА (продолжение).
39-50 — тератологические схизокотильные проростки Oenothera hiriella (Onagraceae) (39-45) и
Papaver rhoeas (Papaveraceae) (46-50): ряд переходных форм от цельной до полностью
разделенной надвое пластинки одной из семядолей (39-48, вторая семядоля удалена) н обеих
семядолей (49), 50 — пятисемядольиый проросток — результат разделения одного из исходных
семядольных примордиев на два, другого — на три; 51-59 — изменения в строении проводящей
системы проростков Cannabis sativa {Urticaceae) при тератологической схизокотилии разной
степени: 51-54 — частичное разделение одной из двух семядолей на две (гемитрикотилия),
увеличение числа лучей ксилемы в стеле зародышевого корня путем расщепления одного из
полюсов исходно диархиого корня, 55-57 — полное расщепление одной из двух семядолей
(трикотилия), в строении проводящей системы нет никаких признаков исходной дикотилии, видны
три главных следа листовых зачатков плюмулы (57), 58,59 — трикотилия, возникновение
семядольных следов de novo («subsidiary cotyledon»);
Рис. ЗЗА (продолжение).
60-62 — диаграммы, показывающие характер сосудистого снабжения семядолен у истинно трех-
семядольных в норме проростков у Degeneria vitiensis (60,61) по сравнению с двусемядольными
проростками у Magnolia grandiflora (62);
Рис. ЗЗА (продолжение).
63-71 — примеры формообразовательных процессов в семядолях, отличных от схизокотнлии:
63 — трехлопастные семядоли у Malva moschata, 64-66 — перисто-трехдольчатые семядоли у
Lepidium sativum (65,66 — поперечные срезы семени, показывающие характер «упаковки» в
нем зародыша с цельными семядольными пластинками у L. graminifolium (65) и с
рассеченными на доли у L. sativum (66), 67,68 — перисто-пятидольчатые семядоли у Tilia vulgaris на
стадиях проростка (67) и зародыша (68), 69-71 — выемчатые семядоли Pentapeies phaenicea
(69), Ipomaea quamoclit (70) н Alpirda nutans (71); a 6 — апикальная борозда, а м с —
апикальная меристема семядоли, з — зародыш, п — перисперм, о — радикула, с. С;, с2 —
семядоли, э — эндосперм, пост — постамент.
1-5, 24, 37, 38, 63-70 — по: Lubbock, 1892; 6-23 — по: Sachar, Mohan Ram, 1958; 25-26 —
П Stone, 1970; 27 — по: Langdon, 1934; 28-36 — по: Nast, 1941; 39-50 — по: De Vries,
1903; 51-59 — no: Compton, 1913; 60-62 — no: Swamy, 1949; 71 — no: Tschirch, 1891.
Рис. 34. Акотилия.
1-16 — послесеменное развитие некоторых паразитных представителей сем. Scrophulariaceae с
различной степенью морфогенетической адаптации к паразитному образу жизни (и редукции
семядолей — Г.Т.) (схемат.): 1-4 — Euphrasia, 5-8 — Lathraea, 9-12 — Striga orobanchoides,
13-16 — Hyobanche (1,5,9,13 — зародыш в зрелом смени; 2,3,6,7,10,11,14,15 — проростки;
4,8,12,16 — цветущий побег);
Рис. 34 (продолжение).
17-20 — послесеменное развитие Orobanche crenata (Orobanchaceae): 17 — зрелое
18,19 — начало прорастания, 20 — внедрение в ткани растения-хозяина;
Рис. 34 (продолжение).
21-26 — строение зародыша и эндосперма в зрелом семени некоторых представителей сем.
Orobanchaceae: 21 — Cistanche phelypaea, 22 — Phacellanthus tubiflorus, 23 — Cistanche
tubulosa, 24 — Orobanche purpurea, 25 — Phelypaea coccinea, 26 — Aeginetia indica (22,
24-26 — с семенной кожурой);
27 U 28
51 52 "53 J54"55 56 57 58
Рис. 34 (продолжение).
27-58 — эмбриогенез некоторых представителей семейства Orobanchaceae: 27-36 — Lathraea
squamana, 31'-44 — Phacellanthus tubiflorus, 45-49 — Orobanche colorata, 50-58 — Aeginetia
indica (37-49 — нарушение дифференциации эмбриодермы, 50-58 — нарушение в
последовательности делений клетки са); an — апикальный полюс зародыша, б п — базальный полюс
зародыша; эн — эндосперм.
1-26 — по: Терехин, 1977; 27-49 — по: Терехин, Никитичева, 1981, с измен.; 50-58 — по:
Tiagi, 1952.
НС вС
Рис. 35. Гетерокотилия.
1-5 — схемы строения молодых проростков (1,3) и семян на поперечных срезах (2,4,5) двух
видов Peperomia с нормальным двусемядольным (P. pellucida — 1,2) и гетерокотильиым
(P. peruviana — 3-5) зародышами; 6-8 — семя (6,7) и проросток (8) видов, зародыши которых
характеризуются анизокотилией: 6 — Cereus napoleonis, 7,8 — Raphanus sativus (внутренняя
семядоля меньше наружной);
Рис. 35 (продолжение).
9-15 — проростки видов сем. Gesneriaceae с различной судьбой семядолей в ходе прорастания:
9 — Oreocharis primuloides, видны две неравные семядоли — крупная, сохраняющаяся в ходе
развития, с хорошо опушенным черешком (с с) и меньшая, постепенно абортирующаяся, без
волосков на черешке (с д), плюмула развивает розетку из нескольких пар листьев (группа
розеточных геснериевых); 10-12 — Slreptocarpus galpinii (10) н Streptocarpus sp. (11, 12), видна
большая, сохраняющаяся в ходе развития семядоля (с с) с адвентивной пластинкой,
образующейся из базальной меристемы черешка семядоли, первичная пластинка семядоли хорошо
заметна на ее кончике, развития плюмулы не наблюдается (группа однолистных геснериевых);
у Streptocarpus sp. меньшая, обычно дегенерирующая в ходе развития семядоля (с д) также
часто развивает адвентивную пластинку (11а — ее вид сверху), а в ряде случаев (12) имеет
сходное с большей семядолей строение; 13, 14 — проросток Chirita lavandulacea с двумя
неравными семядолями и удаленной плюмулой (13) и его фрагмент на более поздней стадии
развития в области гипокотиля и плюмулы; в пазухе большей семядоли формируются
пазушная и виепазушная почки (14), заметен различный уровень соединения семядолей с осью
(образование мезокотиля); 15 — Didymocarpus platypus, виден мезокотиль между сохраняющейся
и дегенерирующей семядолями;
16-41
Рис. 35 (продолжение).
развитие зародыша Streptocarpus rexli, заложение и развитие в эмбриогенезе двух
идентичных друг другу семядолей;
Рис. 35 (продолжение).
42-50 — схемы, иллюстрирующие теорию происхождения односемядольного зародыша от
двусемядольного путем превращения одной семядоли в гаусториальный орган: 42, 43 — семена и
проростки Peperomia pellucida, обе семядоли выходят из семенной кожуры; 44-47 —проростки
P. peruviana (44,45) и P. parvifolia (46,47), одна семядоля выходит наружу и становится
ассимилирующим органом, другая — остается в семени и превращается в абсорбирующий орган;
у P. parvifolia абсорбирующая семядоля более специализирована и имеет булавообразную форму,
ассимилирующая семядоля — в рудиментарном состоянии; 48-50 — проростки однодольного
растения, одна семядоля в прорастающем семени — абсорбирующий орган, другая — "первый
лист"; an — адвентивная пластинка семядоли, в с — внутренняя семядоля, в тк —
воздухоносная ткаиь, гп — гипокотиль, д с — дегенерирующая семядоля, м — микропиле, мз —
мезокотиль, не — наружная семядоля, п — полость в семени, остающаяся после выхода
ассимилирующей семядоли, п к — первичный корень, пл — плюмула, пл Cj — пластинка
абсорбирующей семядоли, пл сх — пластинка ассимилирующей семядоли, пм — перисперм,
п п — первичная пластинка семядоли, п тк — палисадная ткань, с — семядоля, с/ —
абсорбирующая семядоля, с^ — ассимилирующая семядоля, с к — семенная кожура, ее —
сохраняющаяся семядоля, энд — эндосперм.
1-5, 42-50 — по: Hill А., 1906; 6-8 — по: Lubbock, 1892; 9-15 — по: Hill А., 1938;
16-41 — по: Алимова, Яковлев, 1987.
3J •"»"*.
v.Jl-''.-"'..'.-.3
m
m
&iV.'
K*vV«^Kl
Рис. 36. Синкотилия.
1-5 — формы синкотилии: 1,2 — одиостороииее н 3,4 — двустороннее срастание семядолей
(еннкотилия в узком смысле и амфнеинкотилия, соответственно, по De Vries), 5 срастание
внутренними, смежными сторонами семядолей (1-4 — Oenothera glauca, 5 Helicanthes
elastica); 6-9 — семядоли проростка Polygonum convolvulus, характеризующиеся сочетанием
процессов синкотилии и схизокотилии;
63-Ю8
Smyrnium
perfoliatum
Ш
Petroselinum Smyrnium
sativum olusatrum
I II
'Chaerophyllum
bulbosum
IV
Bunium
bulbocastanum
VI
Smyrnium \?amp
perfoliatum Ш Chaerophyllum
bulbosum IV
emp
Smyrnium
Conopoiium 0iusatrum
eyminum ц
I
emp
emp
Scaligeria B„aium
eretica buibocastanum
V VI
10
Рис. 36 (продолжение).
10 — схема, иллюстрирующая направления эволюции проростк в (А) и зародышей (Б) в сем.
Apiaceae при переходе к геофитному образу жизни: от типично двусемядольных — к
проросткам, различающимся по степени и типу срастания семядолей (одинарной стрелкой указаио
положение вегетативной точки роста по отношению к поверхности почвы, крестиком — граница
геотропически отрицательной и положительной частей семядольной трубки);
{QOOOO
29 30 31 32
33 34 35 36 37
Рнс. 36 (продолжение).
11-37 — формирование общей семядольной зоны (серповидного валика) у видов,
характеризующихся частичным односторонним срастанием семядолей в норме: 11-15 — Sanguinaria canadensis,
16-20 — Actaea alba, 21 — Cabomba piauhiensis, 22-26 — Nymphaea advena, 27-37 —
Magnolia grandiflora (11 — продольный срез, 17-19, 21 — поперечные срезы, 12-15, 22-37 —
серия поперечных срезов (схемат.), 16, 20 — объемная реконструкция зародыша по серии
поперечных срезов, 18, 19 — симметричный {типично двусемядольный) н «кососимметричиый»
„„. зародыши);
Рис. 36 (продолжение).
38-57 — образование длинной семядольной трубки (дву 'роинее срастание семядолей)
у Podophyllum emodi (38-45) и Eranthis hiemalis (46-57): 38-40, 46-48 — этапы
формирования проростков, 41-45, 49-57 — формирование вентральной меристемы иа внутренних сторонах
оснований семядолей, за счет которой осуществляется их постгеиитальное срастание, 43-45 —
щелевидный канал в семядольной трубке сохраняется,
52-57
52-54
Рнс. 36 (продолжение).
щелевидный канал отсутствует (41-42, 44-45, 49-51, 55-57 — продольные и 43
поперечные срезы зародыша в области семядольной трубки, стрелками отмечена
граница между ризодермисом и корневым чехликом);
i ':i
•s
=5 s
О
v©
u
IP
Jc
a «
Hi
Щ
If
!i
3
is
«fu | М в^в
else
SO
1Л
ON
1Л
о
SB
SB
о
Я
<
e
ч
e
a
S3
S §
з *
«-5s
" w 3 *>
О т Я °
114
m о
II
* s
ел
и
SB
a
о
и о
s в
В s
ч
f- О,
О О
a
о о
a
с и
s
х s я
я « 2
о о й.
о
с
*.- О
и
■* S <
о 2, °
2 * °
II
а н5
5-S §
О о)
«; о
о в
Й <
2 о
Я- с
11
о
и1?
я.
и 5
о 5
=• 2-
<t) S
в о
о
о я
а, о
о а
! .в? а у
<3fc~-h; 1:
И
и
S
О
<
я
а
<
о
с
«
я-
>>
■ С
в
a a
а «;
в- «
>> a
с н
3
я 5 к
а- ° < S
a B a *
и н >>
В 41 Ч
О О О) U
с х Я) a
Рис. 36 (продолжение).
62-986 — развитие зародыша Nelumbo nucifera, характеризующегося сочетанием частичного
одно- и двустороннего срастания семядолей в их основании в норме: 62-69, 72, 73 — проэмбрио,
70, 71, 74, 75 — глобулярный зародыш;
■Ааг
Рис. 36 (продолжение).
О.Мми
766
79в
Рис. 36 (продолжение).
76а-85 — заложение семядолей (формирование общей семядольной зоны (серповидного валика)
и двух семядолей иа ней);
81 :
86
86
jhc„ 36 (продолжение).
развитие общего семядольного основания;
87
непрерывный рост общей семядольной
зоны, отсутствие ее «раздел;
кия» на две семядоли и формирование односемядольного зародыша;
89а
896
Рис. 36 (продолжение).
88, 89 — рост семядолей и формирование торпедовидного зародыша,
Рис. 36 (продолжение).
90 — зрелый зародыш, на рис. 89а,б и 90а,б показано несовпадение морфологичекой оси
зародыша (А-А') с его геометрической осью (В-В') и смещение апекса побега в наклонное
положение (DD') по отношению к общему семядольному основанию (СС),
91а
91д
Рис. 36 (продолжение).
91 — поперечные срезы зрелого зародыша иа уровне свободной части семядолей (а), общего
семядольного основания и почечки (б, в), семядольного узла (г-ж), гипокотиля (з),
зародышевого кория (и-л), иллюстрирующие строение проводящей системы (черным цветом отмечены
пучки первой семядоли, белым — второй);
Рис. 36 (продолжение).
92-986 — формирование эпикотиля: 92, 93. — заложение примордия первого листа супротивно
общему семядольному основанию и линии слияния семядолей, 94, 95 — формирование
пластинки первого листа и примордня второго листа, 96 — формирование пластинки второго и примор
дия третьего листа, 97-986 — прилистников в основании второго листа почечки;
114
Рис. 36 (продолжение).
^продольные срезы зародыша в его межсемядольной (62-76а, 88, 89а,90а) и семядольной (76б,
срезов U Т) 7 71 SOT/00™' ~ 3аР0дь,ш' Реконструированный по серии поперечных
срезов (&-г), . /, /В, SO, 84 — поперечные срезы апикальной части зародыша, 79а б — той
последовательных среза апикальной части одного и того же зародыша, иллюстрирующие актива
цию периклинальных делений в субэпидермальном слое, 83?- лоперечньй с'р^семени на
уровне апикальной части зародыша, иллюстрирующий положение семядольного валика по отно!
шеиию к проводящему пучку фуникулуса, 72-75, 83, 84, 86, 93, 95 - СМ, 81-83 87 92 94
99 114 »«« "" ВИД Прилистник„ов с адаксиальнон и 98б - абаксиальной сторон);'
(102-1077нЕГТ? "ЙИ^ СаЬотЬа P'iauhie™s (99-101), Nymphaea advena
латеоа»ь1Р "elphynium tricolor (108-114) с частичным односторонним срастанием семядолей:
латеральное положение зародышевого корня и точки роста (99-107) и дорзовеитральность
внутреннего строения проэмбрио (108-114);
a>b
a >b
b'>b"
a'>a"
СЛИЯНИЕ СЕМЯДОЛЕЙ
двусемядольный
зародыш
слияние
семядолей
односемядольный
зародыш
двусемядольный
зародыш
слияние
семядолей
односемядольный
зародыш
115
Рис. 36 (продолжение).
115 — схема, иллюстрирующая изменение положения апекса побега и примордия первого листа
почечки в процессе слияния семядолей по сравнению с таковыми у типичных дву- и
односемядольных зародышей: I — смещение из центрального положения в боковое, 11 — смещение из
горизонтального положения в наклонное по отношению к общему семядольному основанию,
III — положение примордия первого листа на апексе побега супротивно общему семядольному
основанию. Масштабная линейка: 81, 82 - 10 мкм, 85, 92, 96-98 - 100 мкм, 87 -
1000 мкм- в т р и V — вегетативная точка роста, в э с т — внутренний эпидермис
семядольной трубки, г — граница между отрицательно и положительно геотропическими частями
семядольной трубки, д — дерматоген, з к — зародышевый корень, кл — клубенек, к ч
и WH — корневой чехлик, пч — почечка, рд и Rh — ризодермис, с — семядоля, с в —
семядольное влагалище, с п и Csp — семядольная пластинка, с т и Lbch — семядольная
трубка, щ — щель канала семядольной трубки, эд — экзодермис, Ьр — эпидермис, VM —
вентральная меристема.
1.4, 6-9 - по: De Vries, 1903; 5 - по: Johri et al., 1957; 10 - no: Haccius, 1952; 11-20 -
no- Mottier, 1905; 21-26 - no: Cook, 1906; 27-37 - no: Earle, 1937; 38-57 - no: Haccius.
1953- 58-61 - no: Haccius, Trompeter, 1960; 62-86, 88-93, 96-98 - no: Titova Batygma,
1996; 87, 93 — 95 — Титова, Васильева, ориг.; 99-107 — no: Cook, 1906; 108-114 — по:
Babis, 1976; 115 — Титова, ориг.
Fig. 37. Axis formation in plant embryogenesis: cues and clues.
[Рис. 37. Формирование оси в эмбриогенезе: гипотезы и факты]
1. Fo rmation of the apical-basal axis in the Arabidopsis embryo: A — asymmetric division of the
zygote, giving a small apical and large basal cell, В — the 8-cell stage, the proembryo consists of
two tiers each of four cells (apical and central regions) and is connected to the extraembryonic
suspensor via the founder cell of the basal region of the embryo, С — embryo at heart stage,
approximate locations of cell groups that give rise to the primordia of seedling structures are
indicated, D — embryo at torpedo stage, clonal boundaries are marked by thick lines, the broken line
indicates the upper end of the embryonic root derived from the root meristem initials, below the
quiescent center of the root meristem are initials of central root cap, primordia of seedling structures:
cotyledons, hypocotyl, embryonic root, root meristem, shoot meristem; 2 — formation of the radial
pattern in the Arabidopsis embryo — schematic cross sections through the central region (see Fig. 1)
of embryo (A and B) and through the root primordium (C and D): A — dermatogen stage,
periclinal (radial) divisions within the proembryo (Fig. IB) give the outer epidermis layer and an
inner cell mass, В — globular embryo, the inner cell mass has split into the ground tissue and the
centrally located vasculated primordium, С — embryo at heart stage (Fig. 1С), the pericycle layer
surrounds the primordium of the conductive tissue, the basic organization of the radial pattern is
complete, D — embryo at torpedo stage (Fig. ID), periclinal divisions in the ground tissue generate
an outer cortex and an inner endodermis layer; a — apical cell, A,B,C — apical, basal and central
regions of the embryo, b — basal cell, CRC — central root cap, CT — conductive tissue, CO —
cortex, COT — cotyledons, EN — endodermis layer, EP — epidermis layer, ER — embryonic root,
G — ground tissue, HY — hypocotyl, ICM — inner cell mass, PC — pericycle, proE — proembryo,
QC — quiescent center, RM — root meristem, RMI — root meristem initials, SM — shoot meristem,
sus — suspensor, V — vasculated primordium.
64-828
1,2 — after: Jiirgens, 1995.
мз
33
Рис. 38. Редуцированные и недифференцированные зародыши.
1-9 — зародыши с редуцированными органами: 1,2 — зародыши некоторых водных и
насекомоядных растений — Utricularia vulgaris (Lentibulariaceae) (1), Zostera marina (Zosteraceae) (2);
3-5 — зародыши стеблевых растений-паразитов — Cuscuta europaea (Cuscutaceae) (За,б),
Рис. 38 (продолжение).
6-9-зародыши микопаразитных растений - Thunia marschalliana (6) Paphiopedium insigne
(7), Neottia nidus-avis (8), Corallorrhiza innata (9) (Orchidaceae);
Рис. 38 (продолжение).
10-24 — редуцированные зародыши: 10-15 — зародыши корневых растений-паразитов —
Balanophora laxiflora (Balanophoraceae) (10), Apodanthes pringlei (11), Mitrastemon yamamotoi (12)
(Rafflesiaceae), Hydnora africana (Hydnoraceae) (13), Harveya coccinea (Scrophulariaceae) (14),
Orobanche hederae (Orobanchaceae) (15), 16-24 — зародыши микопаразитных растений — Moneses
uniflora (16), Hypopitys monotropa (17) (Ericaceae), Bartonia virginica (18), Voyria mexicana (19),
Leiphaimos auranthica (20) (Gentianaceae), Sciaphila maculata (Triuridaceae) (21), Apteria setaceae
(22), Gymnosyphon squamatum (23), Burmannia disticha (24) (Burmaniaceae); as —
апикальная зона зародыша, 6 з — базальная зона зародыша, г — гаусторий, гп — гипокотиль, з з —
запасающая зона зародыша, зар — зародыш, и эп — инициали эпикотиля, л — лист, м з —
микропилярная зона зародыша, ок. — околоплодник, п — почечка, пс — перисперм, с — семядоля,
с к — семенная кожура, тс — ткань соцветия, энд — эндосперм, эп — эпикотиль,
1-11, 13-24 — Терехин, ориг.; 12 — по: Watanabe, 1934.
Рис. 38 (продолжение).
Рис. 38 (продолжение).
Рис. 39. Хлорофиллоносность зародыша как признак
для классификации цветковых растений.
1-36 — лейкопласты и хлоропласты зародыша отдельных хлороэмбриофитов первого
(основного) (1-27) и второго типов (28-36) в проэмбриональной и эмбриональной фазах его
развития: 1-8—Alcea rosea: 1, 2 — продольные срезы синергнд (1) и яйцеклетки (2), 3 —
зародыш иа ранией глобулярной стадии развития, эмбрнодерма уже сформирована (период
перехода от проэмбриональной к эмбриональной фазе развития), 4 — лейкопласт раннего глобулярного
зародыша, 5 — хлоропласт основной меристемы (зародыш с примордиями семядолей), 6-8 —
хлоропласты и фрагмент хлоропласта мезофилла семядолей зародыша незрелого семени; 9, 10 —
хлоропласты мезофилла семядолей зародыша незрелого семени Iberis umbellata (зародыш достиг
1/2 своей окончательной длины); 11 — хлоропласт мезофилла семядолей незрелого зародыша
A. rosea, достигшего максимального размера; 12-18 — хлоропласты и фрагменты хлоропластов
мезофилла семядолей зародыша незрелого семени Tilia platyphyllos: 14 — видна глубокая
инвагинация оболочки в тело хлоропласта, 15,16 — ассоциация хлоропластов с вакуолью,
17,18 — срезы одного хлоропласта, видна связь между профилями его лопастей (стрелка),
видны также окружающие хлоропласты мембраны ЭР; 19 — пластида мезофилла семядолей
зародыша зрелого семени Т. platyphyllos; 20-27 — хлоропласты и фрагменты хлоропластов
мезофилла семядолей зародыша незрелого семени Acer platanoides (20-22), A. tataricum
(23,24), A. rtegundo (25-27): 20 — стрелкой отмечено включение гранулярной природы, 21 —
суперграиа внутренней мембранной системы, 22 — видны две группы двойных мембран,
разделяющие эвагинацию перистромия иа компартмеиты (двойная стрелка) и мембраны гранулярного
ЭР, окружающие хлоропласт и его эвагинацню, 23,24 — суперграиы в составе внутренней
мембранной системы, видны также окружающие хлоропласты мембраны гранулярного ЭР,
25-27 — в хлоропластах зародыша — периферический пластидный ретикулум, концентрические
мембранные образования; суперграны отсутствуют; 28,29 — хлоропласты почечки зародыша
зрелого семени Nelumbo nucifera, видны окружающие хлоропласт мембраны ЭР (28), стрелкой
отмечено место инвагинации внутренней мембраны оболочки хлоропласта; 30 — хлоропласт
взрослого надводного листа N. nucifera; 31,32 — пластиды с проламелляриыми телами
(почечка зародыша незрелого семени N. nucifera начинает зеленеть, 20 дней после распускания
цветка); 33,34 — фрагменты хлоропластов зародыша незрелого семени N. nucifera (через
27 дней после распускания цветка), видно параллельное оболочке хлоропласта расположение
тилакоида периферической части внутренней мембранной системы (= ламелла стромы второго
типа) (отмечено стрелкой), двойной стрелкой обозначено место расхождения периферического
тилакоида и оболочки хлоропласта; 35,36 — фрагмент хлоропласта и хлоропласт почечки
зародыша зрелого семени N. nucifera, видно отхождеиие периферического тилакоида от пластид-
иой оболочки и его неупорядоченное расположение в строме пластиды (стрелки), двойной
стрелкой обозначено место связи этого тилакоида с оболочкой (1-3 —СМ, 4-36 —ТЭМ). Масштабная
линейка —1 мкм; 28 — х 36000, 29 — х 34800, 30 — х 38900, 33 —х 45000, 34 —х 36300,
35 — х 39600, 36 — х 39000; б m — белковое тело, вк — вакуоль, г или гр — граиа, г.э.р —
гранулярный ЭР, д — диктиосома, к.з — крахмальное зерно, к.м.о — концентрическое мембранное
образование, к.о или кс — клеточная оболочка, л — включение липидной природы, л.к — липид-
иая капля, лс — см. т.п.с, мл — см. т.е., о или о.х — оболочка хлоропласта, on — см. пг, п —
пластида, пг — пластоглобула (= осмиофильиая пластоглобула — on), пд — плотная пачка
дисков (= суперграиа — сг), п.п.р или п.р — периферический пластидный ретикулум, п.т или
пт — проламелляриое тело, с — строма хлоропласта, сг — суперграна, т.к — трубчатый
комплекс, т.п — трубочки пластид, т.п.с — тилакоид периферической части внутренней
мембранной системы (= тилакоид периферической мембранной системы = периферический тилакоид =
ламелла стромы второго типа — лс), т.с — тилакоид стромы (= межграниый тилакоид =
межграниая ламелла — мл), э.п.х — эвагинация перистромия хлоропласта, эр — эидоплазма-
тический ретикулум, я — ядро.
1.3, 5-8 — по: Камалова и др., 1983; 4 — по: Zhukova, 1978; 9, 28-30, 33-35 — по: Жукова,
1972 (9 с измен.); 10, 31 — по: Яковлев, Жукова, 1973; 11, 13 — по: Жукова, 1975а; 12,
15-17, 19 — по: Жукова, 1983; 14, 18, 32 — по: Жукова, 1979 (14, 18 с измен.); 20-22 — по:
Жукова, Драгунова, 1980, с измен.; 23-27 — по: Жукова, 1985; 36 — по: Жукова, Яковлев,
1966, с измеи.
- '' ^ Wj
Рис. 39 (продолжение).
^w
\
i
ч. 1*
Рис. 39 (продолжение).
л*.
Рис. 39 (продолжение).
Рис. 39 (продолжение).
l*&
':i/**-iA.
"S *'
згу.
ft ^4 ' '&' '/fo^
' taj
■4 Т&
K.I
№:.*
*;-*.
'* , . •
'4
'»
•«•rt.
«г-ЗЕч ь < ■ s . «Sato irr
feS
&'
t> i -Знак *i* * >тв?£» * '. , ^
•4 v'f^ '£
" . (Ml * ■» -
I? ^W?-"^
IV
Рис. 39 (продолжение).
'J f.w-'-■»:■
№
<L"" i
t
hp-H
Л'Л
ni1- 'f*
(Л
rt; с
n ** ^
*-;•, ■"?- r^
.;'i^
C- ;>
'^'., ,
-У^' *«'i
»*
■^■t
• '.'1
• J
/ • ;iV
( 11* 4
, 4'
21
■:?,
'4isV
.■■ i> 1
fi4
4- '!
Рис. 39 (продолжение).
tfV
*">s
^td.B.p'f ^
штт-^/з^^>: :;\ш
5 *Ж* ^ifci
Рис. 39 (продолжение).
<U0
n,n.p
K.O
■KM.O*
J ft
,*>.-■
'."«.*
flfe
л л
25
Л/г
#
fr.ff
/7./7./J ■.
■. -Л У
.Jff. %
iiU:i
/?./?;
v..
J:V.3J
55-828
Рис. 39 (продолжение).
\
<te1
•rfWfct- -v.'.-
Л
/fj
!>■
ft
en
■J«
F. * ■# ■ - 4
jk»J ■£?■ ft * ■,.*.
.^
if 4-1
Ч
/,9
%-ilA
Рис. 39 (нродолжение).
Ф? ^**
%Лйь1
Шг
■ - .«*
rfl
11- -■-■J.
«few > *s . i. n ,-> >
4 4P1
32
65*
Рис. 39 (продолжение).
■'*■■' •■'■■'■"&
*&*&*-**&
Рис. 39 (продолжение).
>Я1
Рис. 40. Новая концепция происхождения зародыша однодольных.
1-35а — эмбриогенез у Ottelia alismoides: 1-9 — ранние этапы развития проэмбрио, 10-25 —
различные способы деления клеток октантов, 26-29 — зародыш перед началом органогенеза 30-346 —
зрелый зародыш, поперечный срез на уровне плюмулы (1-7 — продольные срезы, 8 — поперечные
срезы зародыша, представленного на рис.7, на разных его уровнях, 9-17 23-28 30 32 33 34а —
продольные срезы, 18-22, 25, 29, 31, 34б, 35а — поперечные срезы); ' '
mp
Рис. 40 (продолжение).
36-46 — положение семядоли и точки роста у зародыша разных видов цветковых растений иа
средних этапах их развития: 36 — Stratiotes aloides, 37, 42-46 — Pistia stratiotes, 38 — Ottelia
aloides, 39 — Carex arenaria, 40 — Cyperus articulatus, 41 — Lemna gibba (штриховка —
гипокотиль, двойная штриховка — семядоля, крестики — точка роста побега, точка — лист
почечки); 47-56 — эмбриогенез у Potamogeton;
Рис. 40 (продолжение).
57-76 — эмбриогенез у Stratiotes aloides: 73-75 — органогенез, 76
— зрелый зародыш;
и
Я
О „-0S К
§li&
4 н в" S
5 о о 3
,5|
^ 3 ' т с
о 3
й о
° -л
<J *-,
" со
«И
IJMS-
2 ? a a <;
£■ о о s я
с а я с s
S g а а%
Я I S
О- Я Q.
U К С
_ Я"
IS О 1
н
5 о
a c
я
К
"я™
Sov д
1^ 1 S «
о=о "So
со»- g s g
■>■£ | °? a
" - Г"*4 си
со к яг- S
!>■ <■ *-н ^^ я
• 1 § I a
я — о з <:
JO р о. о В
СО о Я о t=f
^ S я к
СО vo «Я „ щ
w о 3 £ о
S в 5£ S
а - о. о a
а -о от е ^
о от и
щ а я е«
О
со
И!
с я
о
К - G.
- | г. ГО >-
[>. и' <и I-
wcg s & I
«^ у*'
■й г- "g я о
ИГ~. ° К О
S .. о ag
"«„So.
.s i s 11
>> £ а. я я
•> a ей «
1 S i 8
solg?
I 5 . к я
1 н о g 5
„ oco «i 2
ел a
со 5 - я
[>. a t>- о
Рис. 40 (продолжение).
84-95 — развитие зародыша у Agapanthus umbellatus (точками показана апикальная зона);
mp
102
Рис. 40 (продолжение).
96-102 — органогенез у Cocos nucifera;
О
I
i*JULbL~*
I
t /
s. H /
a
Я
a
«
<
о
КС
о
&
в
О
*?
и
Я
а
1
1
i
ел
О
Рис. 40 (продолжение).
104-108 — схема первых четырех делений квадрантов в средних сегментах зародыша, 109-114 ■
органогенез (срез проходит параллельно валику семядоли),
Рис. 40 (продолжение).
115-121 — динамика развития зародыша и изменение направления прокамбиальных тяжей, 122 —
поперечный срез зародыша через примордии первого листа и апикальную меристему стебля
(показано точками), 123-124 — продольные срезы примордия первого листа и стенки семядольного
влагалища;
133 134 136
137 NT 139 W 1(L//
138 \_T 140 Vj?^ 141
Рис. 40 (продолжение).
125-141 — становление билатеральной симметрии, семядоли и апекса побега (эпикотилярного локу-
са) у зародыша однодольных (125-128 — Tamus, 129-132 — Cocos, 133-136 — Endymion,
137-139, 141 — Cyperus. 140 — Carex): 125, 129, 133, 137 — зародыш с радиальной симметрией,
126, 127, 130, 131, 134, 135, 138, 139 — начало становления билатеральной симметрии, 128, 132,
136, 140, 141 — зрелый зародыш (поперечные срезы на уровне, обозначенном пунктирной
линией (127, 131, 135, 139) и продольные сагиттальные срезы, точками показана семядоля);
сд сд1 сд]
Рис. 40 (продолжение).
142-144 — поперечный срез через двусемядольный (142), односемядольный (143) и
бессемядольный (144) зародыши Eranthis hiemalis; 145-148 — продольные срезы через двусемядольный
(145), анизокотильный (146), односемядольный (147) и бессемядольный (148) зародыши
Eranthis hiemalis; 149-154 — заложение семядоли у Pinguicula vulgaris; 155-157 — проростки
Pinguicula vulgaris на различных стадиях развития; аз — апикальная зона, а к — апекс корня,
6 к — базальная клетка, в к, в к;, в К2 — вторичный корень, з и р — зона интеркаляоного
роста, и т р — инициали точки роста, инициали коры корня, к ч — корневой чехлик, л, Л), Л2 —
лист, п — прокамбий, п к — первичный корень, п л — примордий листа, сд, сд;, сдг — семядоля,
т р — точка роста побега.
1-35а — по: Haccius, 1962; 36-46 — по: Haccius, Lakshmanan, 1966; 47-56 — по: Soueges,
1954; 57-75 — по: Baude, 1956; 77-80 — Swamy, 1966; 81-83а — Swamy, Lakshmanan, 1962;
84-95 — no: Guignard, Mestre, 1969; 96-102 — no: Haccius, Philip, 1979; 103-124 — no:
Красников, 1989; 125-141 — no: Juguet, 1989; 142-148 — no: Haccius, 1960; 149-157 — no:
Haccius, Hartl-Baude, 1956.
ин
стз
Рис. 41. Piperad-тип эмбриогенеза.
1-5 — типовая вариация (Peperomia blanda); 6-12 — Balanophora-вариацня (Balanophora laxiflora
(6-10) и В. poliandra (11-12));
4
66"
Рис. 41 (продолжение).
13-30 — Scabiosa-вариация (Cephalaria gigantea);
Рис. 41 (продолжение).
31-34 — Dendrophtoe-вариация (Nuytsia flonbunda, Loranthaceae); а м к — апикальная
меристема корня, а м с — апикальная меристема стебля, з — зародыш, ин — интегумент, к ч —
корневой чехлик, пс — перисперм, п т — прокамбиальный тяж, cm з — стенка завязи, х — халаза;
эн — эндосперм.
1-5 — по: Никитичева, 1981; 6-12 — по: Терехин, Яховлев, 1967, с измен.; 13-30 — по: Камелииа,
1980; .31-34 —по: Narayana, 1958.
Рис. 42. Onagrad-тип эмбриогенеза.
1-7 — типовая вариация у Oenothera biennis;
66*
Рис. 42 (продолжение).
8-33 — Capsella-вариация у Capsella bursa-pastoris (8-19)
Рис. 42 (продолжение).
и Arabidopsis thaliana (20-33);
Рис. 42 (продолжение).
34-43 — Orobanche-вариация у Orobanche ситапа subsp. cernua; 44-52 — Philydrum-вариация у
Philydrum lanuginosum;
Рис. 42 (продолжение).
53-66 — Juncus-вариация у Luzula pedemontana.
1-7 — по: Soueges, 1920; 8-16 — по: Soueges, 1919; 17-19 — по: Schaffner, 1906; 20-33 — по:
Яковлев, Алимова, 1976, с измен.; 34-43 — по: Анисимова, 1983; 44-52 — по: Kapil, Walia,
1965; 53-66 —по: Шамров, Акисимова, 1993.
Рис. 43. Asterad-тип эмбриогенеза.
1-99 — различные вариации Asterad-типа: 1-9 — Senecio-вариация (Senecio vulgaris,
Asteraceae ); 10-27 — Oxalis-вариация (Oxalis corniculata, Oxalidaceae);
Рис. 43 (продолжение).
28-56 — Urtica-вариация (Urtica urens, Urticaceae);
Рис. 43 (продолжение).
57-79 — Polygonum-вариация (Ceratophyllum demersum, Ceratophyllaceae);
Рис. 43 (продолжение).
80-99 — Geum-вариация (Geum urbanum. Rosaceae).
1-9 — no: Soueges, 1920a; 10-27 — no: Soueges, 1939; 28-56 — no: Lebegue, Poix, 1956;
57-79 — по: Шамров, Батыгина, 1984; 80-99 — no: Soueges, 1923.
Рис. 44. Solanad-тип эмбриогенеза.
1-77 — развитие зародыша по Solanad-типу: 1-8 — Nicotiana-вариация у Nicotiana tabacum
(Solanaceae), 9-38 — Linum-вариация у Linum catharticum (Linaceae),
Рис. 44 (продолжение).
39-59 — у Solanum tuberosum (Solanaceae),
Рис. 44 (продолжение).
60-68 — у Tetradiclis tenella (Teiradiclidaceae)
74
Рис. 44 (продолжение).
и 69-77 — у Ruscus ponticus (Asparagaceae) (60-77 — вариации не установлены); со — чехлик,
со* — семядоля, epi — эпидермис (протодерма), hy — гипокотиль, ртп — плюмула, st —
апекс побега, v s — проводящий пучок.
1.8 — по: Soueges, 1922; 9-38 — по: Soueges, 1924; 39-59 — по: Dnyansagar, Cooper, 1960;
60-68 —по: Камелина, 1994; 69-77 — по: Сатарова, 1990.
Рис. 45. Chenopodiad-тип эмбриогенеза.
1-9 — типовая вариация (Chenopodium bonus-henricus);
tec
Рис. 45 (продолжение).
10-18 — Polemonium - вариация (Polemonium caeruleum); 19-25 — Myosotis-вариация (Myosotis
hispida).
1-9 — no Soueges, 1920; 10-18 — no Soueges, 1939; 19-25 — no Soueges, 1921.
g7-828
me
Рис. 46. CaryophyHad-тип эмбриогенеза.
1-14 — Sagina-вариация у Sagina procumbens ; 15-20 — Medicago-вариация у Idezia polycarpa;
Рис. 46 (продолжение).
21-26 — РЛуЫасса-вариация у Phytolacca dioica; 27-37 — Drosera-вариация у Drosera
rotnndifolia;
67*
Рис. 46 (продолжение).
38-88 — Fumaria -вариация у Fumaria officinalis ;
Рис. 46 (продолжение).
89-96 — Sagittaria-вариация у Sagittaria quayanensis; 97-105 — развитие зародыша у Sedum
acre, вариация не установлена, видны нитевидные выросты базальнои клетки суспензора.
1.14 — по: Soueges, 1924; 15-20 — по: Tohda, 1971; 21-26 — по: Kajale, 1954; 27-37 — по:
Soueges, 1936; 38-88 — по: Soueges, 1941; 89-96 — по: Johri, 1935; 97-105 — по: Soueges,
1927.
Рис. 47. Graminad-тип эмбриогенеза.
1-31 — раииие стадии развития зародыша у различных представителей сем. Роасеае, которые
иллюстрируют положение первых клеточных перегородок: 1-11 — Zea mays,
12 13
14
15
Рис. 47 (продолжение).
I2"15 TJ%rghum' 16'25 ~ Роа' 26 - Tri«c«™. 27, 28 - Stipa, 29 - Hordeum, 30, 31 -
Avena (Ib-ZV — дорзовентральное сечение; 21-25 — различные сечения; 23, 24 — показаны
«прямые» зародыши и «кажущаяся» поперечная перегородка);
54a
55a
56a
57a
TSnS
ЗарКор
КорЧ
Рис. 47 (продолжение).
32-60 — развитие зародыша (схемат.) ТгШсит aestivum (32-50) и Т. топососсит (51-59),
дорзовентральное сечение (32-50, 51-59) и его стереоскопическое изображениее (33а-37а, 54а-
57а) (на 45-50 точками обозначена зона митотической активности); 51 — схема развития
зародыша Triticum;
Рис. 47 (продолжение).
Рис. 47 (продолжение).
61 А, Б
61 (А-Г) — строение раннего проэмбрио пшеницы в различных проекциях (А,Б 1-4а, В, Г — схемат. и Б5, 5а — микрофот. с препарата
М.Д.Иоффе): А — разные сечения зерновки пшеницы (а — дорзовентральное, б — латеральное, в — трансверзальное); Б — верхняя часть
зародышевого мешка в дорзовентральной (1-5) и латеральной (1а-5а) проекциях, до оплодотворения (1,1а), в момент оплодотворения (2, 2а),
на стадии двуклеточного (3, За), трехклеточного (4, 4а) и четырехклеточного зародыша
В
61 В, Г
Рис. 47 (продолжение).
В — последовательные стадии развития раннего проэмбрио в дорзовентральной (1-13) и латеральной (1а-13а) проекциях; Г
четырехклеточного зародыша в трех проекциях — латеральной, дорзовентральной и трансверзальной;
строение
Рис. 47 (продолжение).
62-79 — развитие зародыша Commelina forskalai: 62 — зигота, 63, 64 — дву-, 65, 66 —
четырех-, 67 — шести-, 68, 69 — восьми- (квадранты сформировались из верхнего
слоя), 70 — десяти-, 71 — тринадцати- и 72 — семнадцатиклеточный проэмбрио, 73-
74 — формирование выемки на вентральной стороне зародыша и дифференциация
семядоли, 76-78 — поздние стадии развития зародыша, 79 — зрелый зародыш с хорошо развитой
проводящей системой; (75-79 — схемат.); зар — зародыш, ЗарКор, зар кор — зародышевый
корень, ДЗарКор, д зар кор — дополнительный зародышевый корень, ДП — дополнительная
почка, Кл — колеоптнль, Клр — колеориза, КорЧ — корневой чехлик, Л1, Л2, ЛЗ — первые
листочки почечки, Лг — лигула, с — семядоля, се — семядольное влагалище, сн —
синергида, сус — суспензор, ТР, m р — точка роста, Щ — щиток, энд — эндосперм, Эпб —
эпибласт.
1, 3, 5 — по: Яковлев, 19466; 2, 4 — по: Чеботарь, 1961; 6, 7 — по: Коробова, 1962; 8-11 —
по: Randolph, 1936; 12-15 — по: Хазова, 1970; 16-25 — по: Батыгина, 1974; 26, 29 — по:
Модилевский и др., 1958; 27, 28 — по: Яковлев, Солнцева, 1966; 30, 31 — по: Kihara,
Nishiyama, 1932; 32-61 — по: Батыгина, 1968, 1987; 62-79 — по: Maheshwari, Baldev, 1958.
0,2 мм
Ш^
0,05 мм
1—2 1
Рис. 48 (продолжение).
4 восьмиядериый ценоцит, все ядра которого находятся в поздней телофазе; 5 — многоядер-
иый цеиоцит; 6 — заложение клеточных перегородок в проэмбрио и эндосперме; 7, 8 —
цеиоцитно-клеточная структура с соматическими зародышами;
Рис. 48 (продолжение).
9-11 — стадии развития полового и соматических зародышей пеона: 9 — ценоцитный
проэмбрио, видны большая вакуоль в центре и ядра в периферическом слое цитоплазмы, 10 —
заложение клеточных перегородок и инициация соматических зародышей (эмбриоидов) в эпидер-
мальном слое апикальной части ценоцитно-клеточного проэмбрио, 11 — формирование
многочисленных эмбриоидов;
i:
15
\ЙГ-^
► ■*■■ i
Рис. 48 (продолжение).
12-18 — стадии развития одного из эмбриоидов на ценоцитно-клеточном проэмбрио (остальные
дегенерируют), эндосперм клеточный, внутренний интегумент практически полностью разрушен:
соматический зародыш на глобулярной (12-14), сердечковидной (15, 16) и торпедовидной (17, 18)
стадиях развития (12, 13, 15, 17 — СМ и 14, 16, 18 — СЭМ);
Рис. 48 (продолжение).
19-29 — последовательные стадии развития эмбриоида в семени пеона (схемат ) 20а 23я
стереоскопическое изображение зародыша (пояснение в тексте) (16 7 9 10 12 15 1Я ~~
Peeome anomala; 2-5, 8, 11, 13, 14 - Р lactiflora. Масштабная линейка 'для 14 16, 18 Z
100 мкм.
1-5, 8 — по: Яковлев, Иоффе, 1961; 6, 7, 9-29 — по: Брюхин, 1993.
68-828
Рис. 49. Эмбриогенез злаков.
зигота Hordeum vulgare (52x70 мкм), окруженная цит<- .азмой ценоцита эндосперма и
непосредственно граничащая (внизу) с нуце.л.лусом (ТЭЛ4):
Рис. 49 (продолжение).
2-14в — развитие зародыша видов ТгШсчгп и его положение в семени: 2, 3 — четырехклеточ-
ныи зародыш в дорэсЕе^ральном и лат,, . .ЬЧОм сечениях, 444 -1 последующие этапы
развития зародыша (4, Эа, 6а, 8а. 10а, U - зародыши в развивающейся зерТовке
68"
11а,б, 12а, 14а-в
Рис. 49 (продолжение).
отдельные детали зародышей при большом увеличении, 13
зародыша в зерновке (схемат.);
положение
-:'W
■ .'№4
\fr\i „> . -> : , ■& Я^!
Рис. 49 (продолжение).
Эпд
£'Ъ*
Кл
\
\
•> '-»\
'"' Ш
lie. чЛ *• w
\
А1
\ i i
1С —
г |*
14
Рис. 49 (продолжение).
Рис. 49 (продолжение).
15-21 — развитие зародыша и эндосперма видов Triticum на раииих этапах развития семеии:
15 — двуклеточиый зародыш (анфас), видиы ядра эндосперма, 16 — трехклеточный зародыш,
заложение клеточных перегородок в эндосперме, 17 — четырехклеточиый зародыш, обе сииер-
гиды разрушены, в эндосперме поляризация сильно вакуолизироваииой цитоплазмы, 18 —
четырехклеточиый зародыш, в эндосперме продолжение образования перегородок, 19 —восьми-
клеточный и 20-15-клеточный зародыш, в верхней части эндосперма прошло клеткообразоваиие,
21 — продольный и поперечный срезы выростов эндоспермальнои ткаии в сторону центральной
вакуоли;
1&у&Г ЗфКвр
фи»
Рис. 49 (продолжение).
22-28 — развитие зародыша видов Triticum от начальных стадий дифференциации органов до
полного ее завершения (СЭМ, СМ): 22,23 — общий вид зародыша, вычлененного из незрелой
зерновки, 24 — то же из зрелой зерновки, 25,26 — положение зародыша в зерновке (25 —
вид спереди, 26 — вид сбоку), 27 — продольный срез зародыша из незрелой зериовки, 28 —
то же из зрелой зериовки;
Забязь
ИнтегументЫ
Нуцеллус
Зародыш $><£>$ Эндосперм ооро Антиподы
Дегенерирующие антиподы
Рис. 49 (продолжение).
29-37 — последовательные фазы развития зародыша и эндосперма в зериовке пшеницы (сорт
Диамант) (29 - через 5-6 ч, 30 - 1 сут, 31 - 2, 32 - 3-4, 33 - 7-8, 34 - 9-10,
35 — 11-12, 36 — 13-15, 37 — 25-30 сут п/оп.),
о
9\
г*}
в
в
<
о
ч
о
а
в
>а^
&•
•*
и
в
а
ее
IS JJ I
SI1
§•82
" Ho a
о «2 о
4)
X fr-
1
ч,
l*!l
till
- Я
в «2
и в
>> У
о >>
о о
S я
к S
§ s
КС о
я
х
КС
о
о о „
о я
" Я
Hi в
со л
О « о
я «J
я
m
я „
ао
о ts
X
s i
О ON
ко а
оо
ел
S «
о*»
U
сч
-I
a, «
и
u
- < °
- e- 2 S
a x°<
? S "* я
во в я
з о я -
S 3 *°g
з s a."
К
m
ч * S
КС S <
0 < vo
я >% s I
01 ^ „ я
КС о
Я
u
OO
Л J
СЛ И о ч-»
Рис. 49 (продолжение).
41 — 20-клеточный зародыш, на рис. видны И клеток, распределение вакуолей в клетках
зародыша варьирует, наиболее крупные из них — в суспензорном районе, эндосперм окружает
зародыш, непосредственного контакта зародыша с нуцеллусом нет (х2500);
61 62 63 64 65 66a 67a 68 69
Рис. 49 (продолжение).
42-70 — зародыш некоторых злаков и его преобразование в процессе прорастания зерновки:
42-51 — Ave.ua saliva, 52-60 — Zea mays, 61-70 — Triticum vulgare (42-46, 52-56, 61-65 —
различные стадии прорастания зерновки; 47,57,66 — срезы (латеральные) зародыша; 47а, 57а,
66а — зерновка и положение в ней зародыша (вид спереди); 48, 58, 67 — срезы (дорзовеит-
ральные) зародыша; 48а, 58а, 67а — зерновка и положение в ней зародыша (вид сбоку);
49,59 — срез зародыша через 24-36 ч после начала прорастания зериовки; 50 — проросток
через 5 сут после начала прорастания зериовки; 51, 60, 70 — фрагменты проростков,
иллюстрирующие интеркалярныи рост и расположение узлов, апекса побега, щитка и других структур;
68 — проросток через 7 сут после начала прорастания зерновки, заметно начало удлинения оси
непосредственно над узлом щитка; 69 — проросток через 1 мес после начала прорастания
зерновки, междоузлия значительно удлиняются);
Capsella bursa-
I pastoris сд >Ь ся
(Soueges, 1914-19)
III
Ч а _ Г ся
сд^<тр тТ
Pinguicula vulgaris у-]
II (Haccius a. Hartl-Baude,\ /
1957) V
Ottelia alismoides
(Haccius, 1952)
TV Eleusine coracana
1V (Guignard, 1961)
Cd
Cd
Triticum aestivum
(Батыгина, 1968) a a
71
Рис. 49 (продолжение).
71 — схема эволюционного становления однодолъности (I — развитие семядолей у двудольного
растения Capsella bursa'pastoris; II — преобладающее развитие одной из семядолей у ложиоод-
нодольного растения Pinguicula vulgaris; III-V — разрастание семядоли и смещение апекса
побега в латеральное положение у однодольных (III — Ottellia alismoides, IV — Eleusina
coracana, V — Triticum aestivum); AK — адвентивный корень, ATI — адвентивная почка,
Б — бороздка, В — вакуоль, ВФ — волокна фрагмопласта, Д — диктиосома, 3 —
завязь, Вар — зародыш, ЗарКор — зародышевый корень, Кл —- колеоптиль, Клр —
колеориза, КорЧ — корневой чехлик, Кр — крахмал, Л , Л , Л — первые листочки
почечки, Лг — лигула, МО — меристематическая область, М — митохондрия, Н —
нуцеллус, ОТ — осмиофильная глобула, П — пластиды, ПК — первичный корень
(зародышевый корень), ПлО — плодовая оболочка (перикарп), Плх — плацеитохалаза, ПрС —
проводящая система, ПТ — прокамбиальный тяж, С — сииергида, Сд — семядоля, Сем —
семязачаток, СПТр — содержимое пыльцевой трубки, Сус — суспеизор, ТР — точка роста
почечки, УЩ — узел щитка, Щ — щиток, Энд — эндосперм, Эпб — эпибласт, Я —
ядро, Яд — ядрышко.
1, 38-41 — по: Norstog, 1972, с изм.; 2-21, 27, 28 — по: Батыгииа, 1974; 4 — Шмараев,
неопубл. даииые; 22-26 — Рытова, неопубл. данные; 29-37, 71-75 — по: Батыгииа, 1987;
42-70 — по: Avery, 1930; McCall, 1934, с измен.
Рис. 50. Эмбриогенез орхидных.
1 — типы тетрад зародышей: изобилатеральный (А1), Т-образиый (А2), обратно Т-образиый
(CJ), линейный (С2); 2-4 — ранние этапы развития зародыша у видов с иррегулярным типом
эмбриогенеза: а — стадия тетрады у видов первого периода, а' и а" — стадии первичной и
вторичной тетрад, соответственно, у видов второго периода, b и с — последующие стадии (2 —
Eulophia oedoplectron; 3 — Angraecum distichum; 4 — Polystachya microbambusa);
Рис. 50 (продолжение).
5, 6 — развитие зародыша у видов с регулярным типом эмбриогенеза (5, а-е — Coelogyne
parishii,
Рис. 50 (продолжение).
6, а-д — Separias longipetala); 7-9 — сформированный зародыш и зародыш зрелого семени
Dactylorhiza baltica (7,8) и Bletilla striata (9) иа продольном срезе: 7 — четко видна эмбрио-
дерма (тройная окраска: Фельген, алциаиовый сииий, гематоксилин по Эрлиху), 8 — клетки
заполнены запасным белком, дифференциация иа зоны по размерам клеток выражена слабо
(окраска сафранином по Картису с подкраской алциановым сииим), 9 — валик в апикальной
части продольного среза зародыша выглядит как бугорок, все клетки заполнены запасным
белком, дифференциация на мелкоклеточную и крупноклеточную зоны четко выражена, при
этом соотношение зон примерно равное (окраска проциоиовым ярко-синим RS по Иванову,
Литииской);
17
с=ё
Рнс. 50 (продолжение).
10-21 — зародыш зрелого семени иа продольных срезах: 10 — Gooduera repens И —
Limodorum abortwum 12-- Epipactis atrorubens, 13 - Cephalanthera ensifolia, 14 - Rangaeris
Polystachya microbambusa, 19 - Epidendrum vUellinum, 20 - Thunia alba, 21 — Bletilla
striata (масштабная линейка для 20,21);
V469-828
Рис. 50 (продолжение).
22 — многочисленные семязачатки D. baltica на плаценте; 23 — зародыш D. baltica на стадии
начала дегенерации суспензора и базальных клеток, прилегающих к нему (продольный срез);
24-26 а,б — динамика накопления запасных питательных веществ в азвивающемся зародыше и
проростке D. baltica: 2A — зародыш на 30-й день после начала цвь'.ения, в клетках
наблюдаются крахмальные зерна, сконцентрированные преимущественно в крупных базальных клетках
(ШИК-реакция), 25 — фрагмент зародыша на 40-45-й день после начала цветения:
цитоплазма равномерно окрашена, видны малочисленные белковые глобулы (окраска проционовым ярко-
синим RS);
Рис. 50 (продолжение).
27а,6-35 — прорастание зародыша D. baltica в культуре in vitro по данным световой
микроскопии: 27 а,б, 28 — зародыши на стадии набухания семени и выхода из тесты, видно разрушение
белковых глобул и появление в клетках вакуолей (27 б), увеличение размеров центральных
клеток и исчезновение запасных питательных веществ (окраска проционовым ярко-синим RS),
7Q-828
Рис. 50 (продолжение).
29 — начало делений клеток апикальной части зародыша и формирование протокорма, его
центральные клетки заполнены крахмалом (ШИК-реакция), 30 — недифференцированный на
органы протокорм, апикальный полюс состоит из мелких клеток, крупные паренхимиые клетки
заполнены крахмалом (ШИК-реакция), 31-35 — проростки: стадия заложения валика первого
листа и дифференциации проводящей систеыга (31, тройная окраска);
Рис. 50 (продолжение).
стадия проростка с несколькими листьями (32), все его клетки, за исключением апекса побега
заполнены крахмалом, проводящая система в паренхиме отсутствует (ШИК-реакция);
дальнейшие стадии развития проростка: утолщеине основания стебля проростка, междоузлия сближены
(33, тройная окраска), образование адвентивных корней в узлах первого и последующих
листьев, проводящая система объединяет утолщенное основание стебля и корин, корни утолщенные
(34,35);
70*
3 36
Рис. 50 (продолжение).
36-44 — развитие проростка D. baltica в культуре in vitro (36 А-3 — схемат., 37-39 —
СЭМ и 40-44 — стереоскопическая микроскопия): 36 А, 37 — стадия набухания (вид сбоку),
рост зародыша происходит за счет увеличения объема клеток, а не их числа, эпидермальиые
клетки всех ярусов тела зародыша (/, /', т) имеют тенденцию к формированию волосков
(исключение составляют только несколько клеток осевой зоны апикальной части зародыша,
однако в данной проекции эта зона ие видна), 36 Б, 38 — стадия активного роста апикальной
зоны протокорма (зона II), формирующейся за счет деления и роста нескольких
клеток осевой зоны апикальной части зародыша,
Рис. 50 (продолжение).
36 В, 36 Г, 39, 40 — стадия дифференциации апикальной части протокорма (зоны II),
формирование одноклеточных, одиночных эпидермальиых волосков (тип волосков тот же, что и
в зоне I) и заложение примордия первого листоподобиого органа (зона III), эпндермальные
волоски и железки отсутствуют, 36 Д, 41 — стадия проростка с несколькими сформированными
листьями; листья влагалищные (трубчатые), первый лист может быть чешуевидным, междоузлия
обычно сближены, стебель утолщен; эпидермальиые клетки в зоне I и зоне II (запасающая зона)
образуют волоски одного типа, 36 Е, 42, 43, 36 Ж — проростки с корнями, формирующимися
иа границе зон II и III, часть запасающей зоны (зона I + зона II) отмирает, запасающая
зона и корень имеют одиночные одноклеточные эпидермальиые волоски, 36 3, 44 —
проросток с запасающим корнем (корнеклубием);
Рис. 50 (продолжение).
45-49 — формирование проростка у Phalaenopsis hybridum в культуре in vitro (45-48 — СЭМ,
49 схемат.): 45, 49 А — стадия формирования апекса побега, протокорм радиальио
симметричной формы, в его апикальной части (зона III) видна выемка, вокруг которой расположены
одноклеточные булавовидные одиночные железки, в остальной части (зона I + II) формируются
одноклеточные расположенные группой эпидермальные волоски (в зоне I волоски могут
отсутствовать), 46, 47, 49 Б, 49 В — становление дорзовеитральности проростка, его нижняя
(вентральная) сторона имеет волоски, расположенные группой, верхняя (дорзальная) — вид «гребня»,
иа котором располагаются булавовидные одиночные железки (47, 49 В), 48, 49 Г —
сформированный проросток с несколькими настоящими листьями, хорошо виден «гребень» на
вентральной стороне наблюдаются расположенные группой волоски;
Рис. 50 (продолжение).
50-53 — прорастание зародыша Bletilla striata в культуре in i.'ifro (СЭМ): 50 — зародыш
зрелого семени с зачатком листоподобного органа, видна борозда, расположенная латерально, и
терминальный бугорок, 51, 51а — набухание зародыша, борозда и терминальный бугорок
являются частями примордия листоподобного органа, имеющего форму валика, 52, 52а —
протокорм на стадии выхода из тесты, утолщение тела протокорма и рост валика листоподобного
органа, 53, 53а — сформированный проросток, первый листоподобный орган имеет листовую
пластинку и влагалище:
Рис. 50 (продолжение).
It чо~лпР°йстан^дсемен.и Thuma alb? вгкультУРе in vitr0 (54- 56-58- 61-64, 66-72-СЭМ
ЭЭ, ЭУ, 60, 65-CM, тронная окраска): 54, 58 — зрелое семя в момент высадки на питатель!
ную среду н на стадии набухания, 55 - продольный срез зрелого семенн, зародыш имеет форму
веретена, в его апикальной части видны несколько крупных пирамидальных клеток 56 —
клетокШ59ЗВ6Л0ЧебТШ Г ЗРеЛ°Г° СеМеНИ' "Г апикальная часть зародыша с группой крупных
клеток, ЗУ, 6U, 61 — продольные срезы набухающего зародыша, формирование протокорма
центральные клетки заметно увеличиваются в размерах, в апикальной (мелкоклеточной) зоне
наблюдается бугорок, занимающий осевое положение (61),
Рнс. 50 (продолжение).
62-67 — дальнейшее преобразование протокорма, бугорок постепенно исчезает- 65 (а-б) —
строение апикального бугорка на продольных срезах, на стадии трех (а) и более 10 клеток (б)
клетки бугорка крупнее, чем другие клетки апикального района протокорма, самая апикальная из
них имеет пирамидальную форму, 65 (в) - апикальная часть протокорма, не имеющего
апикального бугорка, эмбриодерма представляет собой непрерывный слой клеток (тройная окраска)
Рис. 50 (продолжение).
73 — диаграмма типов суспензора зародыша орхидных. Масштабная линейка: 37, 38, 45-47,
50-53а, 54, 58, 61-64, 66, 68-72 — 100 мкм; 39—1000 мкм; 48, 51а, 52а, 56, 57, 67, 68а,
69а, 70а — 10 мкм; б — бугорок, б г — белковые глобулы, в — валик листоподобного
органа, г — «гребень», д з — дегенерирующая зона, д к з — дегенерирующие клетки
зародыша, д к с — дегенерирующие клетки суспензора, з д — зона делений протокорма, к —
корень, кз — крахмальные зерна, кк — корнеклубень, л\, л%, л$ — листья 1,2,3, п к —
пирамидальная клетка, п п — проводящий пучок, у — зона узла, э — эмбриодерма, с —
семядоля-валик первого листоподобного органа, «с» — апикальный бугорок, с(?) — неизвестно,
является ли эта структура валиком нли бугорком.
1-6 — по: Veyret,1974; 7-9, 20-72 — по: Андронова, 1988; 10-19— по: Veyret, 1965; 73 —
по: Swamy, 1949.
Рис. 51. Ультраструктурные аспекты эмбриогенеза.
1.6 — ультраструктура зародыша Triticum aestivum на ранних стадиях развития, аллоплазмати-
ческая линия aS: 1 — микропилярная часть семязачатка с зиготой через 17 ч п/оп., 2 —
фрагмент протопласта зиготы, пластиды продолговатые или овальные с крахмальными зернами,
митохондрии овальные с развитой системой крист, большинство рибосом сгруппированы в
полисомы, 3 — базальная клетка двуклеточного проэмбрио, вакуолизация несколько более выражена
по сравнению с апикальной клеткой, 4-5 — фрагменты протопласта апикальной клетки
двуклеточного проэмбрио, пластиды и митохондрии не изменились по сравнению с зиготическими,
рибосомы в основном одиночные, полисомы редки, наружная клеточная оболочка утолщена,
лишена плазмодесм, наблюдается отложение электроноплотного вещества между плазмалеммои и
клеточной оболочкой (5), 6 — клеточная оболочка между сестринскими клетками тонкая с
множеством плазмодесм;
' '/-$?!
V-
$к
7--' if^S^/^PwA- - ,'"*'■ •';«" 8P
'«v-. 'I! W ^ -ж. ' ? J" %.Ъ''
1 \ ' tmk, ^
Рис. 51 (продолжение).
* о
flf?!*4
^^'"Щр^'
«£
чу
***
<-*
Рис. 51 (продолжение).
Рис. 51 (продолжение).
L1iA7nHnfT7HTnT УльтРастРУктУР"°и °Я™™ЧР« зародыша Reseda lutea (Resedaceae) на ранней
глобулярной (7-10) и торпедовидной (11,12) стадиях развития: 7 - общий вид зародыша
с вычлеиившеися протодермой (х1200),
♦■V
"v
N
o-a'^v;^
W
1^У^Ш
^^ > " Ф £* 4\ . • - ; г Чйй "V
su
*щ&*«й
J»
sris;
^'l- ч ■''-/ ' *->шь *' '.^^
v>-
» Vf ^
^.T*
1
*' 'W<
**^
4 ,>«2v;^:^..
-^-f>-
эн^
- ^«s
Рис. 51 (продолжение).
— гипофизарная зона (х7500), 9 — клетки апикальной зоны зародыша (х7500),
- 14
Рис. 51 (продолжение).
10 — фрагмент клетки глобулярного зародыша (х8500), 11 — фрагмент клетки из зоны гипокотиля
(хлоропласты с крахмальными зернами, х9000), 12 — фрагмент клетки семядоли (хлоропласты без
крахмала, х7500); в — вакуоль, д — диктиосома, ко — клеточная оболочка, кр — крахмал,
л — лейкопласт, лз к — ликзовидная клетка, л к — липидная капля, м — митохондрия., н
— нуцеллус, п — пластида, пдв — подвесок, пл — плазмодесма, р — рибосома, m —
тонопласт, хл — хлоропласт, энд — эндосперм, эр — эндоплазматический ретикулум, я —
ядро, ядр — ядрышко, я с — ядро спермия, я я — ядро яйцеклетки.
1-6 —■ Naumova, Matzk, orig. data; 7-12 — по: Яковлев, Чабан, 1979.
Рис. 52. Гистохимические и иммуногистохимические
аспекты эмбриогенеза.
1а,б — локализация нуклеиновых кислот и белков в сердечковидном зародыше Capsella bursa-
pastoris (окраска анилиновым сине-черным): 1а — клетки зародыша интенсивно окрашиваются
на нуклеиновые кислоты, производные гипофизиса — менее интенсивно, суспензор — очень
слабо, за исключением ядрышек, которые окрашиваются только на РНК; 1б — протодерма,
прокамбий и основная меристема проявляют различия по гистохимическим реакциям, верхушки
семядолей окрашиваются на белки очень интенсивно, производные гипофизиса — менее
интенсивно, суспензор — очень слабо; 2 — распределение цитохромоксидазы в сердечковидном
зародыше Stellaria media, фермент находится во всех клетках собственно зародыша и суспензо-
ра, однако сконцентрирован, главным образом, в верхушках семядолей, меристеме корня и
прокамбиальном тяже; 2а — фрагмент цитоплазмы базальной клетки суспензора; видно, что
активность цитохромоксидазы обнаруживается в матриксе цитоплазмы вокруг пластид, а не
внутри протеинопластов; 3 — схема, иллюстрирующая прямую (А) и непрямую (Б) локализацию
антигена в клетках;
Рис. 52 (продолжение).
4-7 — динамика распределения спектрина С, выявляемая методом иммунофлуоресценции в
клетках соматического зародыша Daucus carota в условиях суспензионной культуры: 4 —
единичные удлиненные клетки суспензионной культуры, характерно сильное связывание метки анти-
спектрина С. 1/100 с плазматической мембраной, мертвые клетки не метятся, ядра проявляют
слабую автофлуоресценцию; 5 — флуоресценция проэмбриогенной массы после метки анти-
спектрином С. 1/160, плазматическая мембрана помечена, цитоплазма слабо окрашена; 6 —
иммунофлуоресценция соматического зародыша на глобулярной стадии после приготовления кри-
осрезов и нанесения анти-спектрина С. 1/125, видно слабое свечение на плазматической
мембране и сильное свечение ядер, свечение ядрышек, отсутствует; 7 — иммунофлуоресценция
соматического зародыша на торпедовидной стадии (на поперечном срезе), заключенного в
полиэтиленгликоль и помеченного аити-спектрнном С. 1/180, эпндермальные клетки
демонстрируют сильное свечение в районе плазматической мембраны, цитоплазмы и ядер; интенсивность
автофлуоресценции в сосудистой ткани отличается от флуоресценции FITC-конъюгата; 8 —
распределение F-актина в момент телофазы при микроинъекции родамин-фаллоидином в живую
клетку эндосперма Haemanthus katherinac, через 5 минут после инъекции выявляются короткие
актиновые пучки, формирующие кольцо в районе экватора клетки, где формируется клеточная
пластинка (показано стрелкой); микрофиламенты располагаются параллельно оси веретена
деления и связаны с кортикальной F-актиновой сетью, расположенной в цитоплазме, окружающей
дочерние ядра (на вставке — эта же клетка при фазовом контрасте в момент инъекции); с —
семядоли, с / — каллусная ткань, g т — основная меристема, h — гипофизис, рс — прокамбий;
ро — протодерма, su — суспензор, и I — сосудистая ткань.
1а,б — по: Schulz, Jensen, 1968; 2, 2а Pritcba.u, Bergstresser, 1969; 3 — по: Junqueria
et al., 1975; 4-7 — no: Ruijter, b...>u, 1993; 8 — no: Schmit, Lambert, 1990.
V271 82a
Fig. 53. The cuticle of developing embryo.
[Рис. 53. Кутикула развивающегося зародыша]
1,2 — Stellaria media: 1 — protodermal cell wall of early globular embryo, thin homogeneous outer
cell walls, 2 — late globular embryo, outer cell wall with distinct cuticular layer; 3-5 — Alisma
plantagc-aquatica: 3 — multicellular, globular embryo with a protoderm, 4 — cutin fluorescence on
the apex of the same embryo as in fig. 3, 5 — cutin fluorescence around the ovoid embryo proper;
6-7 — Stellaria media: 6 — about ten-celled proembryo, Nomarski microscope, 7 — weak cutin
fluorescence on the apical surface of the same proembryo as in fig. 6; 8 — Capsella bursa-pastoris,
cutin fluorescing surface of the globular embryo proper and nonfluorescing cell walls of suspensor;
9-11 — Linum usitatissimum: 9 — cutin fluorescence in heart-shaped embryo, 10 — basal region
of the heart embryo proper, fluorescing cutin on the embryo surface and the upper part of the
suspensor cell, 11 — basal region of the squashed heart embryo, cutin fluorescence in the side wall
of the suspensor cell and a nonfluorescing cell wall between the suspensor and the embryo proper;
12 — Plantago media, torpedo embryo without cutin fluorescence; 13 — Sirmpis alba, late torpedo
stage, very distinct fluorescence of the embryo surface; 14-16 — Capsella bursa-pastoris: 14 —
strongly fluorescent radicular region at the late torpedo stage embryo, 15 — radicular region of
U-shaped embryo without cutin fluorescence, 16 — upper part of curved hypocotyl; 17 — Iberis
umbellata , part of cotyledon of U-shaped embryo — cutin fluorescence.
1-17 — Rodkiewicz, Szczuka, orig. data.
*й(Г' *.
,^",>"'
w
? Mi!
- - *Г
*vi
Ш
Fig. 53 (continued).
) V
Hg. 53 (cosstmaed).
Fig. 54. Action of herbicides and other factors on embryogenesis of Striga
hermonthica (Scrophulariaceae).
[Рис. 54. Влияние гербицидов и других факторов на эмбриогенез Striga
hermonthica (Scrophulariaceae)}
1-20 — the most important stages of the embryo development: from the zygote to the mature
embryo;
72~ 828
cot
18
cot
tec
Fig. 54 (continued).
к^я
Ж??Ч "^ die 1» :l- =V Y4£fi$
.1' '' Л
/24]
Fig. 54 (continued).
21-24 -some aspens of the embryo development (SEM): 21 - embryo octam stage completly fits
into cellular erido?pe,m, 22 — globmar embryo showing the initial ec-il, f,.r different tissues of the
future embryo and p.antlet, i.j - the upper part of the embryo curves and become concave as soon
as the cotyledons appear, J.A -- continuation of the compartm^tulivAhon in .he different tiers of the
cmlvyo and. evolution to a n.aicie ::mbv\;>;
72*
Fig. 54 (continued).
25-26 — micropylar part of endosperm during seed development: 25 — in endosperm the vesicles
of haustorial character (short arrow) are seen, embryo at quadrant stage of development, 26 —
micropylar part of endosperm and globular embryo during formation of the initial cells in the root
apex, the vesicles disappear, the locking of the micropyle is seen;
Fig. 54 (continned).
27-30 — different patterns after action of the herbicide and Smicornyx: 27 — the inflorescence after
treatment with herbicide some meristematic parts of it are destroyed (asters), 28 — micropylar zone
of a seed with globular embryo, 5 days after treatment; some diverticulum between the cells of the
seed coat (arrows), 29 — after action of the herbicide directly on the young seed, the embryo is
destroyed (aster) and the necrosis of the haustorial vesicles is seen (arrows), 30 — the larva
progressively migrates inside the ovary, between the seeds, eating seeds and most of the ovary tissues.
Bars: 21-23 — 10 urn, 24 — 0.1 urn, 25, 26 — xllOO, 27-30 — x430; al — albumen
(endosperm), со — initials of the root cap, cot — cotyledons, de — dermatogen, ice — initials of
the root core, mc — meristem of the cotyledon, mv — vegetative meristem, ov — ovary, pe —
periblem, pi — plerome, s — suspensor (21-23,25), s — seed (30).
1-30 — Pare, orig. data.
о
Nehanbo micifera
(Nehanbonaceae)
Viciafaba
(Fabaceae)
Triticum aestivum
(Poaceae)
Paeonia anomala
(Paeoniaceae)
Dactylorhiza, metadata
(Orchidaceae) /
Рис. 55. Автономность зародыша.
различные морфологические типы полового и соматического зародышей на стадии
автономности;
12 т
i •
0 •,
в -■
б ■■
4 -
2 -
-
г~
3
0)
X
о
U
и
01
н
и
ч
0
к
с
и
1
В!
Н
а
я
m
S
U
о
х
и
ь
и
«1
ч
Ю
• I
/1
/
-4-
2
Я
2
а
а>
ч
0
ь
0
а
в
-1—
3
s
ч
0
чя
к и
2 0)
0 10
о о
е
Ч
в я
а и
ев М
a e
s «з
X
я я
т—1—
4 S
-Я
Я Е«
Ь> Я
о а> a
к я s
с; о о
Ч н
О A U
U S
1 - О
м в;
я«
«&()
SOB
чм ч
Ь q
о о о
S М Ю
к о о
ь в о
в я е
1
1
■rfidu*
б 7 б 0 11
Й
ь
о
X
ч
о
и
1
СЧ
«
м
ч
Ь
о
X
S
а,
в
я
ь
о
X
ч
о
и
Ч-t
я
м
X
S
ь
и
ев
ч
в
С Длима
—О—Суюмнкеа
\
^AjT^aj-^e^-A
11 1!
л
я я
ь ь
о о
S В
ч ч
о о
t, U
«N с*>
я «
и х
X Ч
S Ь
h О
О X
Ki В
ч о.
в е
13 14 IS
СИНЕРГИДЫ С ПЫЛЬЦ.СОДЕРЖ.
Рис. 55 (продолжение).
2-18 — морфофизиологические корреляции в развитии зародыша Nelumbo nucifera: 2 —
относительная скорость роста зародыша in vivo, 3 — морфогенетические событии во время
эмбриогенеза, 4 — динамика развития структур зародышевого мешка и окружающих тканей в семени
(схемат.), вертикальной пунктирной линией обозначен момент оплодотворения (6-8 ч п/оп.),
8 S 10 И 12 13 14 15
Рис. 55 (продолжение).
5 — относительная скорость изменений содержания растворимых сахароз и крахмала в
зародыше, 6 — изменения концентрации нуклеиновых кислот в семядоле, почечке, эндосперме
(в усл. ед.),
Рис. 55 (продолжение).
7-12 строение эндосперма: 7, 8 — эндосперм на глобулярной и раиией сердечковидной
стадиях эмбриогенеза, видны периферическая и центральная зоны, 9-12 — изменения в
строении клеток эндосперма в халазальной части семени (увеличение числа ядер, формирование
утолщенных оболочек) и эпидермиса верхушек семядолей (увеличение плотности цитоплазмы,
утолщение полисахаридных оболочек) на стадии автономности зародыша (9-10 дней п/оп.),
клетки эндосперма (11) и семядоли (12) крупным планом;
шшт
ДИИ ПОСЛЕ ОПЫЛЕНИЯ
U-30
V
РАСТЕНИЕ
18
Рис. 55 (продолжение).
13-14 — зародыш, изолированный из семени иа стадии автоиомиости (10-11 дней п/оп.): 13 —
общий вид и 14 — почечка зародыша (одна семядоля удалена); 15 — почечка зародыша через
15 дней п/оп. (13-15 — под бииокуляриым микроскопом); 16-17 — культивирование in vitro
автономного зародыша на модифицироваииой безгормоиальной среде Мурасиге и Скуга: 16 —
начало прорастания; 17 — развитие растения; 18 — схема зависимости прорастания зародыша
от стадии изоляции, знак «—» — отсутствие прорастания, © — крахмальные зериа, двойные
пунктирные линии — проводящая система (усл.), точками обозначеио появление зеленой окраски
почечки;
Рис. 55 (продолжение).
19-27 — культивирование in vitro автономного зародыша Dactylorhiza maculata на
безгормоиальной среде Кнудсона: 19 — зародыш в семени на стадии автономности, 20-27 —
формирование и прорастание протокормов: «почкование» протокорма (20, 21), протокормы с двумя
апексами побега (22), с двумя побегами и корнем (23), с корнем (24), проростки (25-27);
31
Рис. 55 (продолжение).
28-31 — культивирование in vitro эмбриоида Paeonia anomala на модифицированной
безгормональной среде Мурасиге и Скуга: 28, 29 — эмбриоид, изолированный из семеии иа стадии
автономности (28 — общий вид, 29 — на продольном срезе), 30-31 — проростки, получеииые
из эмбриоидов, стрелкой обозначен эмбриоид;
<8w) тогам Hsa«j ыоаятдхоэ
Зч5
а « £
«So
> cj
О о .
"я S
5 g s
в ь s
а ч
ока.
"о 2 о
*. ■*•
« S s
■° 8
1,
1 =
о
Ч о
О "
ХА
ХА
Ы
н
<
к
ы
н
ft,
<
со
>■
<
D
В
м
0)
«;
о
ч
о
а
к
1Л
1Л
.
Рис
^шУ
Я
И
К
чатн:
с
хло
я
я
CJ
CJ
ЙОГ
с
ю
г
m
ч
о
к
о.
CJ
в
•S
3
К
л
•<
о
ч
о.
я
я
1
1
"1
на,
о
я
«
я
в
аль
я
Я
ю
1
1
\о
я*
о
я
«
л
к.
а)
CJ
ю
я
оси
о
U~l
S
сч
К
с
2
3
о сперм;
S
т
1
1
ч
к
V
К
•<
eg
О
CJ
К
ующ
ч
0J
•<
и
о
в
К
«
я
а>
>>
ч
реды
в
I
га
*"~'
5
■г-
s 3 S
1>Г Я .
СО B<N
Ь1
я I
I
•II
I
и о
OJ CJ
s в
'II
>
ЧО О
gc-o
СО
СЛ
СО
о
Г^ Я
> -
• о о
^-Ь «
'Г 'ся cj
с- Я н
5> ^
°> L2
О «
я -
я .5 g
я я S
НИ Й
.-и
я о
а в у
rsi
iriO
s
а
о
*.
СЛ
ж
гм
СО
Я
>
U
К
а
о
.
я
а
о
и
я
Е-
1
1
>>™
VO
»я
и
а
Я
„
я
га
щ
иль
о
я
са
Sco
>
СЛ1^
>> . -
ясо
п ..
5 §.
>: о
я
CQ
о
в
| с Я
■ I S
я
Fig. 56. Observation on living embryo.
[Рис. 56. Прижизненные наблюдения зарсдыша]
1, 2 — Jasione montana L. (Campanulaceae): 1 — living ovules in silicone fluid, la — tubular
zygote with vacuolized basal part and two nucleoli in the apically situated nucleus; besides
zygote, the endosperm cells (one in division) are also visible, lb — linear embryo inside
endospermal cells, lc — older embryo in the seed cleared with NaOH (50 g/1), 2 — duration
of mitotic cycle in cell, expressing the time gradient connected with the position and structure
of cells in the polarised linear embryo;
Fig. 56 (continued).
3 — partly isolated embryo sacs of Galanlhus nivalis L. (Amaryllidaceae): 3a — zygote before the
iirst division, 3b — two-celled embryo after the division of zygote from the fig. 3a, 3c —
four-celled embryo with the longitudinal wall between two apical cells-
4000n-
3000
heart
/
/
I!
iorpedo
maiuration
„**..
У
/
/
thu*ngS.S.^..
days
~\ fTTTTTTI l'o l'l \l 13 % 15 16 17 16
Fig. 56 (continued).
4-6 — Linum usitatissimum L. (Linaceae): 4 — growth of the embryo in uiuo,
Fig. 57. Perspectives on genetic analysis of plant embryogenesis.
[Рис. 57. Перспективы генетического анализа эмбриогенеза.]
1 — common pathway of megagametophyte development in angiosperms: A — immature ovule
containing the megasporocyte (2n) before meiosis, В — immature ovule after meiosis, the surviving
megaspore (n) undergoes three postmeiotic mitoses to form the megagametophyte, С — ovule with a
mature megagametophyte containing the egg, two synergids, three antipodals, and two polar nuclei;
2 — three stages of seed development in Arabidopsis: A — ovule at the time of fertilization, the
megagametophyte (clear) is located within maternal nucellar tissue (hatched), В — immature seed at
a globular stage of embryogenesis, the nuclear endosperm tissue (stippled) and chalazal nucellar
tissue (hatched) are in contact with the inner integument (seed coat), С — mature seed (0.5 mm
in length) with a hypocotyl (right) and two cotyledons (left) visible;
./^лЕГЯЗТЗй-ч.
H
0 @^>|| y-s tzO
PROEMBRYO TRANSITION COLEOPTILAR
t=C>
STAGE 1
Fig. 57 (continued).
3 — early stages of embryogenesis in Capsella and Arabidopsis: A-C — early development of
proembryo, D — octant stage, four cells of the embryo proper are visible, the filamentous suspensor
terminates with an enlarged basal cell, E — initiation of the epidermal layer (dermatogen; protoderm)
at the 16-cell stage, F-H — globular stages of embryogenesis, the globular embryo of Arabidopsis
is approximately 40 цт in diameter, I — heart stage of embryogenesis; 4 — early stages of
embryogenesis in maize, each stage is represented by a face view (left) and a longitudinal section
(right) with the embryo face at left. The transition embryo contains an embryo proper and suspensor.
The scutellum, shoot apex, suspensor, and coleoptilar ring are visible at the coleoptilar stage. The
first leaf primordium appears at the base of the shoot apex at stage 1. Bar — 0.5 mm;
Fig. 57 (continued).
5 — variations in development of the suspensor in angiosperms: A — basal portion of the ovule of
Sedum acre showing the suspensor with branched haustoria, B-G — immature embryos from various
Fabaceae, each embryo is oriented with the suspensor below the embryo proper. A — antipodals (on
fig. 1) and apex (on fig. 4), E — egg cell, CR — coleoptilar ring, EP — embryo proper, LP —
leaf primordium, M — megagametophyte, P — polar nuclei, S — suspensor (on fig. 3,4) and
synergid (on fig. 1).
1 — after Foster, Gifford, 1974; 2 — after Muller, 1963; 3 — after Maheshwari, 1950; 4 — after
Clark, Sheridan, 1986, see also Sheridan, Clark, 1987; 5 — after Wardlaw, 1955
Рис. 58. Эмбриоид.
1-6 — образование соматического зародыша (эмбриоида) из клеток суспензора полового
зародыша иа разных стадиях его развития в экспериментальных условиях у Eranthis hiemalis;
73-828
Рис. 58 (продолжение).
7-13 — развитие полового зародыша у Caliha palustris ■ (Ranunculaceae) в семени (in vivo) no
Onagrad-типу; 14-36 — последовательные стадии развития эмбриоидов Aconitum heterophyllum
(Ranunculaceae) в культуре in uifro по Onagrad-типу (14-21 24-32), встречаются аиомаХии:
преждевременная дифференциация ксилемы в области центрального цилиндра (22, 23, 33, Д5),
миогоядериые инициальные клетки (34), формирование односемядольного зародыша (36);
Рис. 58 (продолжение).
37-42 — эмбриоидогенез у Triticum aesfwum в условиях in vitm- 47 ЧЯ
формирование в ней меристематической зоны в котооой „™„ ' ~ каллусиая ткань и
40 - начальные стадии развития эмбриоидов, кГт рГорГнГрГан^Г^" ™б*»™*°°- "•
носи казуса различным образом, 41, 4*2 -^^^^^й™ * П°ВеРХ'
73*