Текст
СРАВНИТЕЛЬНАЯ
r^lVf K'pito nnrwa
a_*
^-^ _—^ "m я- ■■!—^ ■"/■" jf^4 FT^ -щ-%
?
АКАДЕМИЯ НАУК СССР
БОТАНИЧЕСКИЙ ИНСТИТУТ ИМЕНИ В. Л. КОМАРОВА
О. П. КАМЕЛИНА
СРАВНИТЕЛЬНАЯ
ЭМБРИОЛОГИЯ
СЕМЕЙСТВ
DIPSACACEAE
И MORINACEAE
ЛЕНИНГРАД
«НАУКА»
ЛЕНИНГРАДСКОЕ ОТДЕЛЕНИЕ
1980
УДК 581.3+582.4/9
Камелина О. П. Сравнительная эмбриология семейств
Dipsacaceae и Morinaceae. — Л.: Наука, 1980. — 104 с.
На основании сравнительно-эмбриологического изучения
представителей семейств Dipsacaceae и Morinaceae составлены
полные эмбриологические характеристики этих семейств.
Приведен ряд новых данных по строению и процессам
развития многих эмбриональных структур и решены некоторые
дискуссионные вопросы, в частности о типе тапетума у
ворсянковых (описан новый тип), об особенностях строения
семяпочки и зародышевого мешка у мориновых и др.
Пересмотрены существующие классификации типов тапетума у
покрытосеменных и предложен новый вариант. Дополнена
характеристика эмбриогенеза Scabiosa-вариации Piperad-
типа. Приведена сводка морфологических,
палинологических, кариосистематических и биохимических признаков
представителей D ipsacaceae и Morinaceae, что наряду с
оригинальными эмбриологическими данными позволило с
достаточным основанием подтвердить самостоятельность семейства
Morinaceae и обсудить вопрос о положении исследованных
семейств в филогенетической системе покрытосеменных.
Книга предназначена ботаникам — систематикам и филоге-
нетикам и эмбриологам. Лит. — 250 назв., ил. — 35
и 6 табл. микрефотографий, табл. — 1.
Ответственный редактор
доктор биологических наук
проф. М. С. ЯКОВЛЕВ
К ————454-80 2004000000 © Издательство «Наука», 1980 г.
055(02)-80
ПРЕДИСЛОВИЕ
Сравнительная эмбриология растений— важнейший раздел эмбриологии,
который не только дает основные критерии для теории эмбриональных
процессов у растений, ной предоставляет возможность использовать данные
эмбриологии в других отраслях ботаники, и прежде всего в
филогенетической систематике растений. Однако успешное применение данных
сравнительно-эмбриологических исследований"в~Систематике тормозится тем, что
многие группы растений недостаточно изучены и охарактеризовать их
даже по важнейшим эмбриологическим признакам невозможно.
Детальное и всестороннее исследование генеративных структур
пыльника и семяпочки цветковых растений всегда привлекало внимание
ботаников. Здесь происходит зарождение и воспроизведение новых
эмбриональных структур, имеющих первостепенное значение для существования
вида и его эволюции. Половой процесс у покрытосеменных носит
уникальный характер и не имеет аналога среди других высших растений. Процесс
становления эмбриональных структур также позволяет выделить ряд
константных диагностических признаков, характерных не только для
вида, но и для более крупных систематических единиц. Эти признаки
должны обязательно учитываться при решении спорных вопросов
систематики и филогении. Как раз с этой точки зрения монография О. П. Ка-
мелиной по сравнительной эмбриологии семейств Dipsacaceae и Morinaceae
является хорошим примером. В ней наряду с критическим обзором
литературных данных приведены собственные обстоятельные данные по
развитию пыльника, пыльцевых зерен, семяпочки, мегаспор, зародышевого
мешка, по оплодотворению, эмбрио- и эндоспермогенезу.
О. П. Камелиной обработан большой фактический материал — по
23 видам Dipsacaceae и 3 видам Morinaceae, причем исследуемые виды
относятся к разным родам, секциям и рядам. Собраны они в различных
экологических условиях — от лесов умеренной зоны европейской части
СССР до гор и субальпийских лугов Средней Азии и Кавказа — и
достаточно полно и разнообразно охватывают семейство ворсянковых. Виды
морин, как и большая часть ворсянковых, исследуются впервые. Анализ
эмбриологических признаков у ворсянковых выявил их однородность, что
позволило автору, во-первых, подтвердить мнение систематиков о
естественности этого семейства, а во-вторых, составить достаточно полную
эмбриологическую характеристику этого семейства. То же относится и к мо-
риновым.
Автор настоящей монографии сумел критически подойти к оценке
имевшихся к этому времени в литературе данных по эмбриологии
изучаемых семейств и разрешить многие вопросы, основываясь на выводах своего
тщательного и детального исследования. Часто приходится сталкиваться
с так называемой «инерцией первоописания». Каким первые авторы увидят
и опишут определенное явление, таким зачастую видят его и последующие
исследователи. О. П. Камелина смогла избежать этого, разобралась во
многих явлениях и описала их для упомянутых семейств фактически
заново. Это относится к типу тапетума, строению зрелых пыльцевых зерен,
особенностям развития антипод, эмбриогенезу, наличию в семяпочках
морин проводящей системы и к другим признакам.
Важным является пересмотр классификаций типов тапетума у
покрытосеменных. Предложенный автором вариант носит стройный характер,
включает все имеющееся разнообразие тапетума в пыльниках и, очевидно,
■будет принят эмбриологами.
^*
3
Сравнение всех эмбриональных процессов и структур у изучаемых
видов позволило на большом объеме признаков подтвердить правомочность
выделения рода Morina в отдельное семейство Morinaceae. Что же касается
филогенетических связей, то эмбриологические признаки показали, что
мориновые более близки к некоторым жимолостным, чем к ворсянковым и
валериановым.
Работа снабжена очень хорошими оригинальными рисунками, что
делает ее еще более убедительной.
Подобного рода монографии по отдельным семействам или целым
порядкам крайне желательны как для разработки теоретических основ
самой эмбриологии, так и для целей систематики и филогении цветковых
растений.
Проф. М. С. Яковлев
ВВЕДЕНИЕ
Для современного периода развития ботаники характерен возрастающий
интерес к наукам синтезирующего характера, стремление выразить в
общих закономерностях вскрытое уже разнообразие структур, функций,
биологических отдельностей. В связи с этим возрос и интерес к
систематике как к науке, обобщающей в системе данные различных отраслей
ботаники. Несмотря на то что общепринятой системы, отражающей ход
эволюции, не существует, а есть только различные ее варианты, в разной
степени приближающиеся к природе, достоверность систем растет, что
обусловлено чрезвычайно возросшим объемом фактов, положенных в их
основу.
Эмбриология растений, как самостоятельная отрасль ботанической
науки, поставляет филогенетической систематике большое число
фактических данных, которые не способна дать ни одна другая отрасль ботаники.
Прежде всего это данные о закономерностях развития эмбриональных
структур (от археспория до зрелого зародыша). Структуры эти, а также
процессы их становления устойчивы, консервативны, мало зависят от
изменений среды, а значит особенно важны для целей систематики. Кроме
того, данные по онтогенезу (и в том числе по морфогенезу эмбриональных
структур), наряду с палеоботаническими и
сравнительно-морфологическими, всегда считались важнейшими для создания эволюционных
(филогенетических) систем.
Большинство эмбриологов убеждены в высокой значимости
сравнительно-эмбриологического метода в решении вопросов систематики и
филогении, позволяющего «установить наиболее типичные черты сходства
и различия при зарождении и формировании эмбриональных структур,
которые несомненно отражают особенности индивидуального и
исторического хода развития организмов» (Яковлев, 1958, с. 168). Известно, что
основные типы высших растений могли быть обоснованы лишь после
классических эмбриологических работ морфологов старшего поколения (Hof-
meister, 1858, 1859а, 1859b; Горожанкин, 1880; Беляев, 1897; Навашин,
1894, 1898; Арнольди, 1900, 1906, и др.).
Уже довольно давно морфологи обратились к
сравнительно-эмбриологическому изучению покрытосеменных (Treub, 1891; Samuelsson, 1913;
Dahlgren, 1916, 1920; Schurhoif, 1919; Жадовский, 1925, и др.). К началу
30-х годов нашего века появились первые сводные работы (Schnarf,
1927, 1929, 1931, 1933; Mauritzon, 1930, 1939; Поддубная-Арнольди,
1930, 1931); в них был намечен круг тех признаков, которые эмбриология
может дать систематике. Примерно в это же время был начат огромный
цикл работ по сравнительному эмбриогенезу, который стал делом жизни
Суэжа и был впервые систематически обобщен им самим (Soueges, 1938,
1939, 1948, 1951), а затем продолжен его сотрудниками и учениками (Le-
begue, 1952,1966; Mestre, 1967, и др.). Сравнительная эмбриология успешно
развивалась, и к 50—60-м годам появилась уже целая серия важных
сводных работ, предоставивших новые факты в распоряжение
систематиков.. Наметились крупные центры сравнительно-эмбриологических
исследований — индийская школа Магешвари (Maheshwari, 1950; Магеш-
вари, 1954; Johri, 1963; Johri et al., 1967, и др.) и советская (Герасимова-
Навашина, 1951, 1958; Поддубная-Арнольди, 1951, 1958, 1964, 1976;
Баранов, 1955; Яковлев, 1958, 1960; Романов, 1960, 1971; Яковлев, Иоффе,
1965; Ильина, 1968, 1971; Кордюм, 1968, 1971, 1978; Яковлев, Жукова,
1973; Терехин, 1977, и др.). Важную роль в развитии сравнительной
5
эмбриологии сыграли также сводки Вундерлих (Wunderlich, 1954, 1959),
Джогансена (Johansen, 1950) и Дэвис (Davis, 1966). Последняя сводка,
наиболее полная для того времени, показала, что многие группы
растительного мира лишь начаты эмбриологическим изучением, что существуют
пробелы даже в первичных эмбриологических характеристиках семейств,
ряд семейств вообще не изучался, а имеющиеся данные для отдельных
семейств иногда противоречивы. Тем не менее именно создание подобных
сводок способно в какой-то мере удовлетворить интересы филогенетической
систематики.
Однако, несмотря на значительное развитие сравнительной
эмбриологии, систематики используют ее данные еще недостаточно. Правда, число
эмбриологических признаков, вводимых в системы, все возрастает (Козо-
Полянский, 1965; Тахтаджян, 1966; Dahlgren, 1975a, 1975b), но все же
это скорее исключение, чем правило. В чем же причина такого
положения? Конечно, прежде всего это вызвано отсутствием полной и
авторитетной сводки по сравнительной эмбриологии всех семейств, а также
недостаточной изученностью родов внутри семейств. Кроме того, очень многие
и важные с точки зрения эмбриологов признаки по уровню своей
подвинутости и по константности их проявления не совпадают с данными других
дисциплин и не укладываются в рамки даже крупных подразделений той
или иной системы. Возможно, что это свидетельствует о недостатках самих
систем, а не эмбриологического метода, но отчасти это объективно
обусловливается резкой гетеробатмией эмбриологических и внешнеморфологи-
ческих или анатомических признаков. Очень важной причиной
недостаточного применения систематиками эмбриологических признаков является
и то, что теория эмбриологических процессов еще не дает собственных
достаточно четких критериев подвинутости и примитивности признаков
и следует в определении их за данными морфологии и анатомии.
Обобщив результаты эмбриологических исследований, существенные
для целей систематики, В. А. Поддубная-Арнольди (1976) показала, что
в настоящее время большинство исследователей считают, что прямая крас-
синуцеллятная семяпочка с двумя покровами, сильно развитый нуцеллус,
кроющие клетки, многоклеточный женский археспорий, Polygonum-тип
зародышевого мешка, порогамия, большое число семяпочек в завязи,
отсутствие гаусториев, семена с эндоспермом и особенно с периспермом,
небольшой, прямой, слабо дифференцированный зародыш, двуклёточная
пыльца, отсутствие апомиксиса и пр. — признаки примитивные,
исходные. Наоборот, обращенная, тенуинуцеллятная семяпочка с одним
покровом, слабо развитый нуцзллус, отсутствие кроющих клеток,
одноклеточный женский археспорий, отклоняющиеся типы зародышевого мешка,
присутствие разного типа гаусториев, небольшое число семяпочек в завязи,
апорогамия, семена без эндосперма и перисперма, крупный, согнутый,
хорошо дифференцированный зародыш, трехклеточная пыльца, наличие
апомиксиса и др. — это признаки прогрессивные, вторичные. Однако
в одном и том же семействе зачастую обнаруживаются как первичные,
так и вторичные эмбриологические признаки. Это говорит о том, что в
развитии эмбриологических признаков нет полного параллелизма, а также
и о том, что ряд признаков, служащих критериями для определения
примитивности или подвинутости, нуждается в пересмотре и обсуждении
с точки зрения теории эмбриологических процессов.
При сравнительно-эмбриологическом исследовании, особенно при
определении объэма или систематического положения семейств, родов
или видов, необходимо принимать во внимание весь комплекс
эмбриологических признаков, поскольку любой из них может иметь важное значение
при проверке и установлении систематических и филогенетических
взаимоотношений как между крупными, так и между более мелкими
таксономическими единицами (Поддубная-Арнольди, 1930, 1958, 1976; Schnarf,
1933; Магешвари, 1954; Кордюм, 1971, и др.). Правда, известны случаи,
6
когда и отдельных признаков, например типа эмбриогенеза, структуры
эндосперма и зародыша (Яковлев, 1949; Lebegue, 1952; Яковлев, Иоффе,
1965, и др.) или строения мужского гаметофита (Руденко, 1959),
оказывалось достаточно для систематических заключений.
В настоящее время число семейств, родов и видов, систематическое
положение которых обсуждалось эмбриологами на основании проведенных
ими исследований, все возрастает; список работ значителен, но, очевидно,
нет смысла здесь приводить его, так как большая часть их упомянута
В. А. Поддубной-Арнольди (1964, 1976) и Е. Л. Кордюм (1971, 1978).
Появились и попытки пересмотра крупных разделов системы, а именно —
спайнолепестных, на основании данных эмбриогенеза (Jamazaki, 1974).
И все же еще остаются большие пробелы в эмбриологических
характеристиках целого ряда семейств и порядков. Более того, до сих пор отсутствуют
какие-либо сведения по эмбриологии представителей значительного
числа семейств, а количество родов, эмбриологически не изучавшихся,
вероятно, превышает изученные. Поэтому создание возможно более
полных эмбриологических характеристик семейств цветковых растений по-
прежнему остается важнейшей задачей эмбриологов.
В связи с недостаточностью и противоречивостью конкретных данных
по эмбриологии семейств Dipsacaceae и Morinaceae, а также в связи с
различием во мнениях систематиков по поводу систематического положения
Morinaceae, мы и предприняли эмбриологическое исследование
значительного числа видов из разных родов этих семейств. Оригинальные данные,
полученные нами при всестороннем изучении эмбриологии указанных
семейств, помогли разрешить многие спорные вопросы в трактовке
отдельных эмбриологических процессов, составить полные эмбриологические
характеристики семейств Dipsacaceae и Morinaceae, подтвердить
целесообразность выделения сем. Morinaceae в качестве самостоятельного таксона
и обсудить положение исследуемых семейств в филогенетической системе
покрытосеменных.
Настоящая монография является результатом многолетнего
исследования представителей Dipsacaceae и Morinaceae, проведенного автором в
Лаборатории эмбриологии Ботанического института им. В. Л. Комарова
АН СССР (Ленинград). Были изучены 23 вида из 6 родов Dipsacaceae и
3 вида Morinaceae, причем все виды мориновых и 21 вид ворсянковых
исследованы эмбриологически впервые. В работе наряду с общепринятой
эмбриологической терминологией приведены параллельно (в скобках)
наименования терминологии М. С. Яковлева (1974), применявшиеся нами
и в ранее опубликованных работах.
В процессе работы я имела возможность консультироваться и
обсуждать отдельные вопросы по эмбриологии исследуемых семейств с М. С.
Яковлевым, 3. И. Никитичевой, М. П. Солнцевой, Э. С. Терехиным, В. А.
Поддубной-Арнольди, 3. Т. Артюшенко, а по вопросам систематики —
с Р. В. Камелиным, который оказал мне также большую помощь в сборе
и фиксации материала. Всем им выражаю свою сердечную благодарность.
КРАТКИЙ ОБЗОР СИСТЕМАТИКИ СЕМЕЙСТВ
DIPSACACEAE И MORINACEAE
Одним из наиболее естественных таксонов покрытосеменных является
небольшая группа родов, объединяющая примерно 270 видов, которая
во всех современных системах покрытосеменных составляет семейство
Dipsacaceae Juss. Состав этого семейства определен в основном Культером,
который был автором первой монографии о ворсянковых и обработал это
7
семейство для знаменитой сводки Декандолля (Coulter, 1823). После этого
заметными вехами в познании ворсянковых были обработка их Хеком
для сводки Энглера и Прантля (Hock, 1891), а затем работы Сабо (Szab6,
1911, 1940 и др.), его ученика Баксаи (Baksay, 1952) и эволюционно-
кариосистематические исследования Эрендорфера (Ehrendorfer, 1964a,
1964b). Весомый вклад в систематику семейства внесли также Е. Г. Бобров
(Бобров, 1929а, 19296, 1932, 1957) и А. С. Шхиян (Шхиян, 1956, 1969,
1974).
Однако общепринятой и детально разработанной системы этого
небольшого семейства все же нет. Разные авторы приводят в его составе
различное число родов, то более крупных, то небольших по числу видов; весьма
различно определяется и количество видов в крупных родах. Вызвано это
не только субъективными, но и объективными причинами. Именно из-за
большой естественности семейства, где крупные роды весьма близки друг
к другу по большой группе признаков, а отчасти и связаны между собой
переходными типами, и возможно столь значительное расхождение в числе
и объеме таксонов в семействе.
Для всех .таксонов семейства равно характерен целый набор признаков.
Это прежде всего особое соцветие — голорка и наличие сросшейся вокруг
цветка обвертки (или внешней чашечки), которая морфологически
представляет собой 4 (редко 2) сросшихся друг с другом прицветника. Собственно
чашечка видов семейства редуцирована и либо полностью исчезает, либо
представлена паппусом из ограниченного числа щетинок. Всем видам
свойственны также односемянные орешковидные плоды — семянки и
семена со скудным эндоспермом. Цветки ворсянковых, как правило, в той
или иной степени зигоморфны, и особенно резко зигоморфны нередко
увеличенные краевые цветки. Систематика семейства строится обычно на
основании различий в структуре внешней чашечки, паппуса, отчасти —
зрелых семян.
На основании монографических обработок отдельных таксонов Dipsa-
сасеае, а также обработок этого семейства в ряде крупных флор
средиземноморских стран можно считать, что его составляют следующие 10 родов,
1. Cephalaria Schrad. — Около 70 видов; полукустарники,
многолетники и однолетники. Характерны упрощенные листья, слабое развитие
краевых цветков и особенно зубчатая внешняя чашечка при обычно
отсутствующем паппусе, однако у некоторых более уклоняющихся видов зача^
точный паппус есть; основное число хромосом в роде х=9,.у уклоняющихся
видов х=5. — Особенно обильны видами страны Древнего Средиземья
и юг Африки, однако род хорошо представлен и во всей Африке, а также
выходит в умеренную Евразию.
2. Simenia Chiovenda. — Один вид, очень близкий к видам рода
Cephalaria, но почти бесстебельный полукустарничек, растущий в Сомали
и Эфиопии.
3. Dipsacus L. — 15 видов; многолетние и двулетние травы с почти не
увеличенными краевыми цветками, с почти цельной внешней чашечкой
и без паппуса. Род близок к Cephalaria; x=9. — Распространен в Пале-
арктике и отчасти Палеотрописе (Эфиопия, Центральная Африка и Южная
Азия).
4. Succisella G. Beck. — Один вид; альпийский некрупный травянистый
многолетник с полностью редуцированными зубцами внешней чашечки
и паппусом; х=10. — Встречается в горах Европы.
5. Succisa Hall. — 3 вида; многолетние травы. Есть зачаточный паппус;
х=10. — Один вид — северопалеарктический, типичное растение
болотистых лугов и лесов, два других эндемичны для Западного Средиземья
и для массива Камерун в Западной Африке.
6. Knautia L. — 45 видов; многолетние, редко однолетние травы,
по признакам внешней чашечки и паппуса более близкие к роду Succisa
и к некоторым обособленным видам Cephalaria, но по облику часто очень
8
похожи и на виды Scabiosa; х=10, в одном случае х=8. — Наиболее
многочисленны виды в Европе, меньше их в Средиземье и Северной Африке,
один вид выходит далеко в умеренную и холодную Палеарктику.
7. Scabiosa L. — 120 видов; полукустарники, многолетники, реже
однолетники. Характерно развитие краевых цветков, часты усложненные
листья; высокоспециализированная внешняя чашечка обычно имеет
крыловидный ворончатый отгиб; хорошо развит паппус; х=9, реже х=8. —
Многочисленные виды в Древнем Средиземье, единичные виды достигают
Восточной и Южной Африки, Северной Евразии; своеобразные группы
видов в Восточной Азии.
8. Tremastelma Raf. — Один вид; однолетняя трава; близок к видам
Scabiosa, но с редуцированным ворончатым отгибом внешней чашечки;
х=7. — Древнее Средиземье (восток Средиземья и Передняя Азия).
9. Руспосотоп Hoffmg. et Link. — 2 вида; многолетние травы с сильно
рассеченными листьями и восьмизубой внешней чашечкой, в остальном
близки к видам Scabiosa, куда их и относит большинство систематиков;
х=9. — Западное Средиземье.
10. Pterocephalus Vaill. — 18 видов, различных по жизненным формам:
полукустарнички, многолетники, однолетники, по облику напоминающие
виды Scabiosa, но без крыловидного отгиба внешней чашечки и с
гипертрофированно развитым паппусом из многочисленных длинных
щетинок; х=9. — Древнее Средиземье до Гималаев, Аравия, Восточная
Африка.
Однако очень многие систематики относят к ворсянковым также и
весьма отличающийся от них род Morina L. В этом роде примерно 15 видов,
все они многолетние травы, обычно с колючими листьями, колючими
прицветниками и зубцами обверток, со сложными облиствленными соцветиями
из многих расставленных мутовок резко зигоморфных цветков, похожих,
как и соцветия, скорее на виды Lamiaceae или Acanthaceae. У видов Morina
также есть внешняя чашечка, но нет паппуса, а чашечка состоит из двух
чаще двузубчатых листовидных чашелистиков, внизу сросшихся друг
с другом. Несмотря на то что еще Бунге (Bunge, 1852) выделял в роде
Morina 3 секции — Cryptothladia Bunge (тип М-. parviflora), Morina
(=Diotocalyx DC.) (тип М. persica) и Acanthocalyx Bunge (тип М. brevi-
flora), а в роде существует, видимо, еще одна группа — тип М. bulleyana,
тем не менее род Morina очень естественный и виды его близки друг
другу. Основное число хромосом в роде х = 17. Ареал рода — от гор
Греции и Южной Болгарии до Центрального и Юго-Западного Китая, на
севере до Джунгарского Алатау. Наибольшее число видов и типов рода
в Гималаях и Юго-Западном Китае.
Для того чтобы включить род Morina в семейство Dipsacaceae, филоге-
нетикам приходится принимать морфологическую близость облиствленного*
сложного соцветия из многих мутовок с разным количеством цветков —
тирса, состоящего из менее сложных тирсов (Vieth, 1963—1964) (у видов
Morina), и настоящих головок — верхушечных соцветий из
многочисленных скученных цветков на общем цветоложе, окруженных обверткой из
нескольких спирально-упорядоченных листьев (у видов Dipsacaceae).
Несмотря на всю сложность этого сближения с точки зрения морфологов,
а также на ряд других существенных различий (резко отличная пыльца,
хорошо развитый эндосперм и др.), количество систематиков, включающих
род Morina в семейство ворсянковых, очень велико, если не подавляюще
велико. Так поступали Бентам и Хукер, Энглер и Веттштейн, Халлир
и Бесси и многие другие выдающиеся систематики XIX и XX вв. (Bentham
Hooker, 1862-1883; Engler, 1892; Bessey, 1897, 1915; Wettstein, 1901;
Hallier, 1912; Кузнецов, 1914; Козо-Полянский, 1922; Rendle, 1925;
Hutchinson, 1926, 1959; Гроссгейм, 1945; Wagenitz, 1964; Тахтаджян,
1966). Более того, начиная, вероятно, с работы Хека (Hock, 1891), наряду
с родом Morina в состав ворсянковых включают нередко и монотипный
»
род Triplostegia Wall, ex DC. (один вид, Гималаи), впервые описанный
как представитель Valerianaceae.
Что касается авторов-систематиков, решительно отделяющих Morina
от Dipsacaceae, то их сравнительно немного (Van Tieghem, 1909; Попов,
1949; Novak, 1954, 1961; Бобров, 1957; Ehrendorfer, 1971; Шхиян, 1974).
Однако по мере всестороннего изучения рода число фактов в пользу выде^
ления Morina в отдельное семейство растет. Помимо макроморфологиче-
ских признаков, в основном отмеченных еще Ван Тигемом, Новаком и
Бобровым, и данных биохимических исследований (Tammes, 1909, 1911;
Lys, 1951) резкие различия показали такие микроморфологические тонкие
признаки, как строение пыльцевых зерен (Erdtman, 1952; Винокурова,
1959), число хромосом и кариотип (Кахидзе, 1929; Ehrendorfer, 1964a,
1964b; Verlaque, 1977a), строение эпидермиса и волосков (Holzl, 1959;
Bancher, Holzl, 1959), структура стенки пыльника и тип тапетума,
особенности строения семяпочки и зародышевого мешка, эндоспермо- и
эмбриогенез (Vijayaraghavan, Sarveshwari, 1968; Камелина, Яковлев, 1974, 1976;
Камелина, 1976, 1977, 1979а, 19796).
Практическая ценность видов Dipsacaceae и Morinaceae невелика.
Единственный издавна применяемый и до недавнего времени незаменимый
продукт, используемый в народном хозяйстве, который давали
ворсянковые, это ворсянка, или ворсовальная шишка, — сухое соцветие или
соплодие культивируемого вида Dipsacus sativus. Этот вид, возникший в
культуре, возделывался на юге СССР, в зоне, где встречаются дикорастущие
виды ворсянки — D. fullonum и D. laciniatus, исходные для культурного
вида. Ворсовальная шишка применялась для ворсования тканей, особенно
для шерстяных высококачественных драпов (Гунько, 1932; Лещук, 1954).
Однако ряд биохимических признаков, свойственных ворсянковым,
позволяет предполагать, что среди них могут быть обнаружены важные
полезные растения. Все ворсянковые содержат в семенах значительное
количество масел, в том числе и пищевых (Lys, 1951). Один вид из рода
Cephalaria — С. syriaca (махобели) применяется в Грузии именно в этом
качестве. Добавка некоторого количества семянок махобели в муку
позволяет получать хлеб, который не черствеет дольше обычного, так как
семянки содержат высококачественные невысыхающие растительные масла
(Вульф, Малеева, 1969; Zeven, Zhukovsky, 1975). Большое количество
масла содержат и семянки видов Morina (Lys, 1951). У ряда видов
ворсянковых обнаружены алкалоиды, сапонины, гликозиды (Мирзоян и др.,
1948; Lys, 1951) и красящие вещества (Tammes, 1909, 1911), что делает
их перспективными для использования в медицине и в качестве источников
растительных красок.
Ряд дикорастущих ворсянковых и почти все виды рода Morina
принадлежат к числу красивоцветущих растений и являются перспективными
декоративными видами. В садовом хозяйстве давно уже культивируются
виды рода Scabiosa (особенно S. atripurpurea, S. lucida, S. caucasica).
Достоинство большинства видов Scabiosa и ряда видов Knautia — большое
разнообразие окрасок и длительное цветение. Среди декоративных
многолетников не так много видов с полным набором цветовой гаммы, виды
Scabiosa — одни из немногих с окраской цветков от белого через все оттенки
розового до темно-красного, синего, сиреневого и желтого цветов. Особенно
ценными для цветоводства являются группы очень крупноцветковых видов
с разнообразными окрасками — S. caucasica, S. alpestris, S. songarica.
Очень декоративны и все виды рода Knautia и ряд видов Cephalaria и,
конечно, виды рода Morina, которые отличаются своими яркими цветками
в крупных соцветиях и красивой листвой.
10
К ИСТОРИИ ИЗУЧЕНИЯ
ЭМБРИОЛОГИИ СЕМЕЙСТВ
DIPSACACEAE К MORINACEAE
Сем. Dipsacaceae в разные годы привлекало внимание эмбриологов, которые
при исследовании отдельных видов сталкивались с явлениями,
вызывающими особый интерес, а часто и дискуссии. В настоящее время можне
привести значительный список работ, посвященных отдельным вопросам
эмбриологии сем. Dipsacaceae, однако полной и исчерпывающей информации
по эмбриональным процессам для этого семейства до сих пор не было.
Сем. Morinaceae эмбриологически было почти не изучено. Имелись
только единичные, но во многом противоречивые работы.
Проанализировав литературный эмбриологический материал, мы
систематизировали его и приводим по следующим основным разделам.
Пыльник. В сводке Дэвис (Davis, 1966) по систематической
эмбриологии покрытосеменных дана следующая характеристика пыльников сем.
Dipsacaceae: пыльник тетраспорангиевый, его стенка развивается в
соответствии с типом двудольных; эндотеций с фиброзными утолщениями,
средний слой эфемерный, а клетки амебоидного тапетума становятся
многоядерными; микроспоры образуются симультанным делением; пыльцевые
зерна при рассеивании трехклеточные.
Сем. Morinaceae в сводке Дэвис не фигурирует, а род Morina
упоминается в составе сем. Dipsacaceae, как и в более ранней систематико-эмбрио-
логической сводке Шнарфа (Schnarf, 1931). Следовало полагать, что и для
мориновых характерны все приведенные выше черты строения пыльника
и микроспорогенеза. Однако работа по эмбриологии Morina longifoUa
двух индийских авторов (Vijayaraghavan, Sarveshwari, 1968), появившаяся
уже после выхода в свет сводки Дэвис, продемонстрировала отличия в
строении стенки пыльника (сохраняющийся средний слой) и пыльцевых зерен
(при рассеивании они двуклеточные), а также в типе тапетума (у Morina
он секреторный).
Работ, посвященных исследованию пыльников у ворсянковых, довольно
много, однако большая часть их посвящена одному, более частному,
вопросу — типу тапетума у представителей семейства. Этот вопрос
оказался наиболее дискуссионным, а данные, приведенные авторами, весьма
противоречивыми: это работы Страсбургера (Strasburger, 1882, 1889),
Юэля (Juel, 1915), Риссе (Risse, 1926, 1929), Чиаруги (Chiarugi, 1927a),
Рази и Субраманьяма (Razi, Subramanyam, 1952), Карниеля (Carniel,
1963а), в которых исследовались разные виды ворсянковых.
Мейоз в материнских клетках микроспор Dipsacaceae детально
исследовался Риссе (Risse, 1929); образование спорогенных клеток в пыльниках
обсуждалось в работах Лавиаля (Lavialle, 1926) и Карниеля (Carniel,
1963а); развитие стенки пыльника кратко описано Рази и Субраманьямом
и более подробно Карниелем; спермиогенез у одного вида Scabiosa —
В. А. Поддубной-Арнольди (1934) и Рази и Субраманьямом (Razi,
Subramanyam, 1952). В последнее время к этим работам добавились и краткие
сведения по развитию пыльников у двух видов Scabiosa, опубликованные
Фреем (Frey, 1978),
Данные по развитию пыльников в сем. Morinaceae имеются лишь в
одной известной нам работе на примере М. longifoUa (Vijayaraghavan,
Sarveshwari, 1968), но они, на наш взгляд, далеко не полны, равно как
и не совсем точны.
Таким образом, анализ данных в литературных источниках показал,
что их совершенно недостаточно для полной характеристики генезиса
мужских эмбриональных структур, а тем более для целей сравнительной
эмбриологии исследуемых семейств.
Семяпочка. Относительно строения семяпочки у представителей
Dipsacaceae не существует различных мнений. Все авторы, описывавшие семя-
11
почку ворсянковых кратко (Guignard, 1882; Hegelmaier, 1885; Lavialle,
1925а) или более подробно (Doll, 1927; Szabo, 1923; Razi, Subramanyam,
1952), а вслед за ними Шнарф (Schnarf, 1931) и Дэвис (Davis, 1966),
характеризуют ее как висячую, анатропную, с одним массивным интегументом,
тенуинуцеллятную. Характерной особенностью ее является наличие
хорошо выраженного проводящего сосудистого пучка, который входит в фу-
никулус, следует по краю интегумента, огибая семяпочку по вентральной
стороне, и заканчивается вблизи микропиле (Szab6, 1923; Doll, 1927;
Razi, Subramanyam, 1952).
Внутренний эпидермис интегумента образует эндотелий или
интегументальныи тапетум, строение которого описано Лавиалем (Lavialle,
1925а, 1925b, 1925c) и Доллем (Doll, 1927) для Knautia arvensis и Фреем
(Fray, 1976) для Scabiosa lucida и S. ochroleuca.
Нуцеллус разрушается на ранних стадиях развития зародышевого
мешка (Lavialle, 1925a; Doll, 1927; Razi, Subramanyam, 1952), и последний
непосредственно примыкает к интегументальному тапетуму. В халазальной
части семяпочки отмечено наличие радиально расположенных клеток,
которые некоторые авторы трактуют как гипостазу (Lavialle, 1925c;
Razi, Subramanyam, 1952; Davis, 1966). Долль называет это образование
ненастоящим халазальным гаусторией (Doll, 1927).
Обычно в завязи ворсянковых развивается одна семяпочка. Долль,
однако, наблюдал у Knautia arvensis образование в завязи двух, а иногда
и трех семяпочек.
Очень краткое описание семяпочки у представителей Morinaceae мы
находим в работе Балицкой-Ивановской (Balicka-Iwanowska, 1899),
а более полное — в уже упоминавшейся работе индийских эмбриологов
(Vijayaraghavan, Sarveshwari, 1968) на примере Morina longifolia.
Семяпочка у мориновых одиночная, висячая, анатропная, однопокровная
и тенуинуцеллятная. Интегумент массивный, а микропиле узкое и
длинное. Отмечается, что для семяпочки Morina характерно отсутствие
проводящих пучков в интегументе и образование гипостазы из клеток нуцел-
луса, которые лежат непосредственно под развивающимся зародышевым
мешком. Однако это не подтвердилось нашими исследованиями (Камелина,
Яковлев, 1974; Камелина, 1977).
Данные литературы о строении семяпочек в сем. Dipsacaceae, а особенно
в сем. Morinaceae, как выяснилось, во многом весьма схематичны и
предварительны. Сравнительный анализ особенностей строения семяпочек
у ворсянковых и мориновых, выполненный индийскими эмбриологами,
из-за ограниченного количества материала, привлеченного к анализу,
и из-за неточностей, допущенных авторами, также не может считаться
окончательным.
Мегаспорогенез и зародышевый мешок. Мегаспорогенез описан для
сем. Dipsacaceae на примере Dipsacus leschenaultii, Scabiosa caucasica,
Cephalaria ambrosioides (Razi, Subramanyam, 1952), Scabiosa lucida, S.
ochroleuca (Frey, 1976). Авторы отмечают, что одноклеточный археспорий
функционирует непосредственно как материнская клетка мегаспор, которая,
в результате мейоза продуцирует линейную тетраду. Из халазальной
мегаспоры развивается зародышевый мешок по Polygonum-типу. Описание
строения зрелых зародышевых мешков мы встречаем в работах Гиньяра
(Guignard, 1882), Мольяра (Molliard, 1895), Лавиаля (Lavialle, 1925a,
1925b), Долля (Doll, .1927), Рази и Субраманьяма (Razi, Subramanyam,
1952) и Фрея (Frey, 1976) для видов Scabiosa, Pterocephalus, Knautia,
Cephalaria и Dipsacus. Здесь особое внимание авторов привлекли антиподы
и их своеобразное развитие (Molliard, 1895; Lavialle, 1925a, 1925b), а также
питание зародышевого мешка, в котором участвуют, по их мнению,
антиподы, интегументальныи тапетум и прилегающая к антиподам область
халазальной части интегумента (Doll, 1927).
12
Большой интерес представляют также обнаруженные аномалии в мега-
спорогенезе. Так, приводятся факты наличия в семяпочке Cephalaria
ambrosioides двух материнских клеток мегаспор, двойного образования
диад или развития (до стадии двуядерного зародышевого мешка) третьей
мегаспоры тетрады (Razi, Subramanyam, 1952).
Описание мегаспорогенез а у мориновых имеется все в той же работе
индийских эмбриологов (Vijayaraghavan, Sarveshwari, 1968). Процесс
протекает идентично таковому у ворсянковых, а зародышевый мешок
развивается по Polygonum-типу.
В описаниях строения халазального конца зародышевого мешка
у Morina, в частности антиподального аппарата, имеется существенное
противоречие. Балицка-Ивановска (Balicka-Iwanowska, 1899), Асплунд
(Asplund, 1920) и Долль (Doll, 1927) указывают на образование у М.
longifolia в зародышевом мешке из трех начальных клеток антипод
многократно разделившегося антиподального комплекса, который активно
функционирует продолжительное время. Индийские же эмбриологи (цит.
выше) у этого вида наблюдали рано дегенерирующие эфемерные антиподы.
Эндосперм. В сводках Шнарфа (Schnarf, 1931) и Дэвис (Davis, 1966)
есть указание, что эндосперм у ворсянковых изначально клеточный.
Начальные стадии развития эндосперма у представителей ворсянковых
впервые были описаны на примере Scabiosa prolifera Хегельмайером
(Hegelmaier, 1885). Он считал, что вначале в узком постенном слое цитоплазмы
центральной клетки образуются свободные ядра эндосперма, между
которыми затем возникают перегородки, причем процесс этот протекает
очень быстро. В дальнейшем весь зародышевый мешок заполняется
клетками эндосперма. Дальгрен (Dahlgren, 1923) высказал сомнение в наличии
начальной ядерной стадии эндосперма у ворсянковых и предположил,
что последний у этого семейства должен быть изначально клеточным.
Долль (Doll, 1927) на примере Scabiosa holosericea и Knautia arvensis
детально и на значительном материале исследовал первые деления ядер
эндосперма и показал, что у обоих видов деление первичного ядра
эндосперма происходит вблизи яйцевого аппарата и дочерние ядра расходятся
к стенкам зародышевого мешка в поперечном направлении. При этом он
отмечал, что у К. arvensis первые два ядра образуются в свободной
цитоплазме, без перегородки, тогда как у S. holosericea она появляется сразу же
лосле первого деления; у К. arvensis клеточные перегородки образуются
после второго деления ядер. Первая перегородка пролегает вдоль
зародышевого мешка. Образующиеся затем клетки эндосперма на ранней стадии
развития располагаются вдоль стенок зародышевого мешка, оставляя
в нижней части последнего вакуоль.
Наблюдая начальные стадии развития эндосперма у Morina longifolia,
которую Долль считал представителем ворсянковых, он отметил, что
у этого вида, в отличие от двух предыдущих, деление первичного ядра
эндосперма происходит с закладкой перегородки в поперечном
направлении и не у самого яйцевого аппарата, а почти в центре зародышевого мешка.
Такой же способ образования эндосперма у М. longifolia описали и
индийские эмбриологи (Vijayaraghavan, Sarveshwari, 1968). По их данным,
в. зрелом семени эндосперм руминированный и содержит глобулы жира.
Таким образом, изучение эндосперма у представителей Dipsacaceae
и Morinaceae ограничивается тремя работами, затрагивающими в основном
начальные стадии его развития. Отсутствуют сведения о состоянии
эндосперма в зрелом семени у ворсянковых. Указание систематиков, что
у Dipsacaceae «скудный эндосперм в зрелом семени» (Бобров, 1957; Тах-
таджян, 1966), справедливо, как мы выяснили (Камелина, 1977, 1979а),
лишь по отношению к роду Scabiosa.
Зародыш. В публикациях прошлых лет по вопросам эмбриологии
сем. Dipsacaceae наиболее полно и детально освещен, пожалуй,
эмбриогенез. Еще в 1937 г. Суэж (Soueges) опубликовал работу по эмбриогенезу
13
у Scabiosa succisa, в которой показал, что у этого вида первое деление в
зиготе почти вертикальное или скорее диагональное и перегородка делит
зиготу на две неравные клетки. Ориентация этой первой перегородки
определяет все последующие процессы развития и непосредственно
влияет на дальнейшую дифференциацию зародыша. Когда Суэж (Soueges,.
1939) предложил свою классификацию эмбриогенеза, то тип развития
зародыша S. succisa он не включил ни в одну из серий, оставив его вне-
серии, так как строение тетрады этого вида не подходило ни к одному и»
типов его классификации.
Джогансен (Johansen, 1950), создавая свою классификацию
эмбриональных типов, выделил в типе Piperad Scabiosa-вариацию эмбриогенеза,,
основываясь на данных Суэжа по эмбриогенезу у S. succisa. Для этой
вариации характерными явились следующие черты: наклонная первая
перегородка, вторичные стенки поперечные (т. е. перпендикулярные к
первичной стенке) в каждой дочерней клетке; суспензор и семядоли
рудиментарные, многочисленных зародышей не образуется.
Магешвари (1954), также опираясь на работу Суэжа, считал, что для-
видов Dipsacaceae характерен аномальный тип эмбриогенеза.
В дальнейшем Суэж (Soueges, 1957) изучил эмбриогенез еще у одного
вида ворсянковых — Scabiosa columbaria и получил данные,
подтверждающие результаты первой работы: первая перегородка очень наклонная
или более или менее вертикальная, делит зиготу на две удлиненные клетки^,
которые почти в равной мере должны обеспечивать построение основных
частей зародыша. Образующаяся затем тетрада не подходит ни к одной
из категорий тетрад системы Суэжа, а дальнейшие деления не обладают
четкой ориентацией. В заключение Суэж отмечает, что семейство с таким
типом эмбриогенеза является менее подвинутым в порядке Asterales.
Связывая эти данные с принципами, которые послужили для определения
эмбриогенических законов, Крете (Crete, 1968) полагает, что Scabiosa-
тип должен рассматриваться как примитивный.
В 1963 г. Суэж опубликовал еще три работы, посвященные
эмбриогенезу у представителей трех других родов сем. Dipsacaceae: Cephalaria
tatarica (Soueges, 1963a), Knautia arvensis (Soueges, 1963b), Dipsacus syl-
vestris (Soueges, 1963c). У С. tatarica процессы эмбриогенеза протекают
аналогично таковым у S. columbaria. В этой работе Суэж еще раз говорит
о том, что тетрада, характерная для проэмбрио этого вида, ставит
Dipsacaceae вне серии, в особый тип — «Apo-serie». Трансверзальное же
направление митотического веретена в зиготе, равно как и особый тип
тетрады, свидетельствует в поддержку выделения ДжогансеномР1регас1-типа.
Эмбриогенез у К. arvensis очень близок к таковому у S. columbaria
и С. tatarica. Здесь также наблюдалось деление зиготы перегородкой,
близкой к вертикальной, и образование глобулярной тетрады. Однако
отмечалось образование тетрад, подходящих к тетрадам категории А1
или А2; проэмбрио на стадии квадрантов в этих случаях напоминали по
общему построению таковые у Valerianaceae (Soueges, 1923). В связи с этим
Суэж предлагает тип эмбриогенеза у К. arvensis отнести к неправильным
(нерегулярным) типам.
Эмбриогенез Dipsacus sylvestris представляет собой вариант,
сравнимый с эмбриогенезом упомянутых видов этого семейства. Здесь
отмечены вариация, сходная с образованием зародыша у Senecio vulgaris,
т. е. проархетипа серии Ах, связанная с архетипом Compositae, и, кроме
того, большое количество вариаций и неправильностей в делениях на
ранних стадиях развития проэмбрио. Поэтому Суэж считает, что и для этого
вида характерен нерегулярный тип эмбриогенеза. Описания зрелого или
созревающего зародыша для Scabiosa columbaria, Cephalaria tatarica,
Knautia arvensis и Dipsacus sylvestris у Суэжа очень краткие и показывают
однотипность зародышей у этих видов. К моменту появления семядолей
U
становятся различимыми периблема и плером, обособляются инициали
коры на верхушке корешка, дифференцирующиеся за счет гипокотиля,
и хорошо выделяются по направлению вдоль внешнего слоя периблемы;
средняя часть чехлика увеличивается за счет горизонтальных или тан-
гентальных делений и образует усеченный конус, гипофизарная ткань
представлена 12—15 (20) слоями клеток, сжатых и уплощенных. У Knautia
суспензор уменьшен, слабо развит, у Dipsacus — быстро исчезающий.
Таким образом, на основании литературных данных, фактически
одного автора — Суэжа, мы может заключить, что для представителей
Dipsacaceae характерны варианты особого типа эмбриогенеза, не
укладывающиеся в рамки классификаций, построенных на четких, идущих
в одних и тех же последовательностях, делениях. Здесь налицо
неправильность и даже некоторая произвольность в закладке перегородок на
ранних стадиях эмбриогенеза. Причину этого явления не мог найти и
Суэж, вряд ли его можно объяснить и гибридогенным происхождением
видов (Crete, 1963).
Развитие зародыша у представителей Morinaceae кратко описано
для одного вида — Morina longifolia (Vijayaraghavan, Sarveshwari, 1968).
Авторы показали, что зигота делится поперечной перегородкой, а затем
развитие зародыша идет по Solanad-типу. Зрелый зародыш
двусемядольный, с развитой проводящей системой. Интерпретация авторами
приводимых ими рисунков развития зародыша вызывает некоторые
сомнения (см. далее).
Таким образом, в отличие от ворсянковых, у которых изучено 4 (5)
родов и очень детально показан ход эмбриогенеза, для мориновых данные
по эмбриогенезу фрагментарны и их совершенно недостаточно для целей
сравнительной эмбриологии.
Подводя итог краткому обзору литературных данных по эмбриологии
двух рассматриваемых семейств, можно сказать, что в отличие от
имеющихся великолепных и полных морфологических сводок по отдельным
родам Dipsacaceae, систематических обработок и палинологических работ,
о которых упоминалось выше, эмбриологические данные разрознены,
очень фрагментарны, а в некоторых случаях и противоречивы. Особенно
слабо изученным эмбриологически оказалось сем. Morinaceae.
Поэтому, проводя сравнительно-эмбриологическое исследование
представителей Dipsacaceae и Morinaceae, мы вынуждены были заново
обратиться к рассмотрению всех эмбриональных процессов, чему и посвящены
следующие разделы нашей работы.
МАТЕРИАЛЫ ИССЛЕДОВАНИЯ И МЕТОДИКА
Эмбриологически исследовались 23 вида сем. Dipsacaceae и 3 вида
сем. Morinaceae, прбизрастающих в различных экологических условиях,
располагающиеся в системе, используемой Е. Г. Бобровым (1957) и Эрен-
дорфером (Ehrendorfer, 1964b), следующим образом:
Сем. Dipsacaceae Juss.
Триба Dipsaceae Van Tiegh.
Род Dipsacus L. — 2 вида
Род Cephalaria Schrad. — 3 вида
Род Pterocephalus Adans. — 2 вида
Триба Scabioseae Van Tiegh.
Род Succisa Haller — 1 вид
Род Scabiosa L. — 12 видов
Триба Knautieae Van Tiegh.
Род Knautia L. — 3 вида
Сем. Morinaceae (Dum.) Van Tiegh.
Род Morina L. — 3 вида
15
Род Dipsacus представлен в нашем исследовании двумя резко
различными видами, собранными в естественных местообитаниях.
1. D. laciniatus L. — Очень крупное жесткошипиковатое растение до
2 м вые. с крупными лировидными или перистораздельными листьями,
на стебле попарно сросшимися и образующими чашевидные влагалища,
с продолговато-яйцевидными головками бледно-розовых цветков и
колючими прицветными листьями. Виды родства D. laciniatus, особенно
культурный D. sativus, как раз и соответствуют представлению о настоящей
ворсянке (или ворсовальной шишке). — Растет от Средней Европы по
степным районам всей Восточной Европы, а также в Западном и
Восточном Средиземье от Португалии до Тянь-Шаня. Обычно встречается в
местах повышенного увлажнения, у ручьев, в долинах рек, реже на
влажных луговых полянах в пойменных лесах.
Материал собран в кишлаке Муминабад (Таджикистан), в большом
лесопитомнике близ крупного арыка, где этот вид был эдификатором
сорных увлажненных лужаек.
2. D. dipsacoides (Kar. et Kir.) Botsch. — Крупное опушенное растение
с лировидно-перистыми листьями и шаровидными головками ярко-сине-
фиолетовых или ярко-синих цветков и малоколючими прицветными
листьями. Один иэ резко отличающихся видов в роде. — Растет в Средней
Азии от Джунгарского Алатау до Памиро-Алая, а также в Северном
Афганистане и Пакистане. Преимущественно среднегорный вид,
встречающийся в лиственных лесах, в кустарниках, особенно в поясе
чернолесья, а также в теплых арчовниках.
Материал собран в нижней части ущелья Кондара на южных склонах
Гиссарского хребта в бассейне р. Варзоб (Таджикистан), где растение
встречалось нередко в разреженных чернолесных группировках с
участием арчи.
Крупный род Cephalaria представлен 3 видами из различных секций
и рядов рода (Бобров, 1957; Шхиян, 1974).
Секция Cephalaria (=Atrocephalae Szabo) представлена видами из
двух рядов, резко габитуально различными, но весьма
близкородственными.
Ряд Tataricae Bobr.
1 (3). С. gigantea (Ledeb.) Bobr. — Крупное многолетнее растение
с почти голыми стеблями до 1—1.5—2 м вые, с лировидно-перисторас-'
сеченными листьями, с шаровидной головкой; цветки серно-желтые,
наружные — крупнолучевые до 2.5 см дл. — Эндемик Кавказа, где
встречается на лужайках в поясах горной лесостепи, лесном и субальпийском
до верхней границы лесных группировок.
Материал собран на Северном Кавказе в Тебердинском заповеднике
и в условиях интродукции — в Ботаническом саду БИН АН СССР
(Ленинград).
Ряд Brevipaleae Schshian.
2 (4). С. brevipalea (Somm. et Lev.) Litv. — Многолетнее растение
с мягковолосистым, до 1 м вые. стеблем, с лировидно-перистыми листьями,
шаровидными головками серно-желтых слаболучевых цветков. —
Эндемик Кавказа, растет в светлых лесах, на полянах.
Материал собран в Тебердинском заповеднике (Северный Кавказ).
Секция Echinocephalae Lange, содержащая резко отличные от
типичных головчаток виды-, представлена в работе одним видом.
3 (5). С. syriaca (L.) Schrad. — Однолетнее, но часто высокое (почти
до метра) груботравное растение с цельными листьями и
немногоцветковыми головками бледно-лиловых или белых цветков, которые образуют
рыхлое соцветие. — Широко распространенное по всему Древнему Сре-
диземью от Португалии и Марокко до Средней Азии и Гималаев растение,
один из наиболее обычных сорняков богарных (неполивных) и поливных
посевов зерновых культур.
16
Материал собран в интродукционном питомнике травянистых
растений Средней Азии Ботанического сада АН УзССР (Ташкент), где вид
возобновляется самосевом.
Род Pterocephalus представлен двумя не очень близкими,
относящимися к разным рядам, а возможно и секциям, видами.
1(6). Pterocephalus afghanicus (Aitch. et Hemsl.) Boiss. —
Многолетнее низкое плотнодерновинное растение с сильно разветвленным
одревесневающим каудексом, простыми зубчатыми листьями и плотными
головками розовато-сиреневых цветков на коротких цветоносах. —
Довольно редкое растение низкогорий и среднегорий Гиндукуша, Южного
и Западного Памиро-Алая, где растет на высотах от 800 до 2500 м на
известняковых скальных обнажениях в поясе шибляка и арчовников,
реже на продуктах разрушения известняков, гипсов и на пестроцветных
породах в нижнем поясе гор.
Материал, собран в южной части хребта Бабатаг, в массиве Бешарча
(Узбекистан), на выходах известняков с гипсами (1400—1500 м).
2(7). P. plumosus (L.)Coult. — Однолетнее растение с прямым
ветвящимся стеблем,'цельными прикорневыми и лировидно-перистыми
стеблевыми листьями и головками розовых (бледно-розовых, бледно-сирене-'
вых до почти белых) цветков на верхушках ветвей. — Восточносредизем-
номорский вид (от Италии и Болгарии до Копетдага), растущий от
приморских низменностей до нижних поясов гор.
Материал собран на склонах гор, обращенных к долине Аракса близ
с. Шванидзор (Мегринский район Армянской ССР), в поясе фриганоид-
ной растительности,
Олиготипный род Succisa изучался по материалу одного вида.
1 (8). S. pratensis Moench. — Многолетнее высокое растение с
розеткой цельных прикорневых листьев и многочисленными головками
голубых цветков на длинных цветоносах. — Обычное растение всей таежной
и лесостепной зон Европы и Западной Сибири (до Енисея). Растение
заболоченных лугов, влажных полян в хвойных и мелколиственных лесах,
болот, а южнее — речных долин и солончаковатых лугов.
Материал собран на побережье Финского залива близ станций
Горская и Александровская (Ленинградская область) на заболоченных лугах.
Наиболее многочисленный род семейства Scabiosa исследовался на
материале 12 видов, принадлежащих к разным секциям (и рядам) рода.
Виды довольно разнообразной секции Asterocephalus Coult. хорошо
различаются и принадлежат к 5 разным рядам.
Ряд Elegantes Bobr.
1 (9). S. caucasica M. Bieb. — Очень эффектное многолетнее растение
с цельными слабо лировидно-перистыми листьями и крупными (до 8 см
в диам.) головками голубых и ярко-синих цветков, причем венчики
краевых цветков особенно увеличены в размерах (до 3 см дл.). — Малоази-
атско-кавказский вид, на Кавказе растущий в лесном и субальпийском
поясах, в том числе и выше границы древесной растительности, на лесных
полянах и субальпийских лугах.
Материал собран в Тебердинском заповеднике (Северный Кавказ)
и в условиях интродукции — в Ботаническом саду БИН АН СССР
(Ленинград), где растения регулярно цветут и плодоносят.
2(10). S. songarica Schrenk. —Более низкорослое и опушенное, но
в целом весьма близкое к предыдущему виду растение с
лировидно-перистыми и перистораздельными листьями и крупными (до 5 см в диам.)
головками бледно-сиреневых, сиреневых, розовых и красных, реже
лиловых цветков, с особо крупными венчиками краевых цветков. —
Горносреднеазиатское растение, широко распространенное от Джунгарского
Алатау до Памиро-Алая и Гиндукуша, где растет от низкогорных
кустарниковых группировок шибляка до лесных полян арчовников и
чернолесья.
2 О. П. Камелина
17
Материал собран в ущелье Кондара на южных склонах Гиссарского
хребта в бассейне р. Варзоб (Таджикистан) и в ущелье р. Сорбо (Кафир-
ниган) выше кишл. Тувиш (Таджикистан) в группировках чернолесья.
Ряд Olgeanae Bobr.
3(11). S.olgae Alb. —Многолетнее растение, обильно облиствленное
цельными и густо беловолосистыми листьями с относительно некрупными
голубовато-синими цветками. — Узкий эндемик известняковых хребтов
Западного Закавказья, где растет исключительно на каменистых склонах
и скалах от приморской полосы до верхних границ лесного пояса.
Материал собран в культуре на каменистой горке в Сухумском
ботаническом саду, где растение хорошо цветет и плодоносит.
Ряд Micranthae Bobr.
4 (12). S. sicula L. — Однолетнее, довольно высокое (до 50—60 см)
растение с тройчатыми или немного парноперистыми листьями и
небольшими головками розовых цветков с приближенными к ним и звездчато
распростертыми крупными прицветными листьями. — Средиземноморский
и субсредиземноморский вид, растущий от приморских равнин до лесного
пояса на каменистых склонах в эфемеровых сообществах, лесах, между
кустарниками, а также широко сорничающий.
Материал собран в Южной Болгарии в окрестностях с. Калиманци
на опушке богатых шибляковых группировок с господством Quercus
pubescens.
Ряд Rotatae Bobr.
5(13). S. rotataM. Bieb. — Резко отличающееся от предыдущих
однолетнее некрупное (до 35—40 см вые.) растение с цельными или
лировидными листьями и с полушаровидными, а в плодах шаровидными
головками розовых или кремовых цветков с увеличенными венчиками
краевых цветков. — Восточносредиземноморское растение, в СССР обычное
в Крыму, Закавказье, Средней Азии (в Южной Туркмении до Бадхыза).
Всюду растет в эфемеровых сообществах на каменистых склонах, а также
сорно у дорог и в поселках.
Материал собран в Центральном Копетдаге, в ущелье Чули на
щебнистых склонах в разреженных сообществах эфемеретума, а также
в условиях интродукции — в питомнике травянистых растений Средней
Азии в Ботаническом саду АН УзССР (Ташкент).
Ряд Flavidae Bobr.
6(14). S. olivieri Coult. —Однолетнее растение, беловатое или серое
от густого мягкого опушения, с цельными листьями и мелкими (не более
1 см в диам.) головками из 5—12 белых или розоватых цветков с
незначительно увеличенными краевыми цветками. — Восточносредиземномор-
ский (от Палестины до Тянь-Шаня и Афганистана), но заходящий также
и в пустыни Ирано-Турана вид, обычный в Южном Закавказье,
Казахстане и Средней Азии, где встречается преимущественно в пустынных
и эфемеровых сообществах предгорных равнин и в шибляке низкогорий.
Материал собран в окрестностях г. Джамбула (КазССР) в горной
полупустыне массива Тектурмез на крайнем западе Киргизского Алатау.
7(15). S. rhodantha Kar. et Kir. —Очень близкий к предыдущему
вид, отличающийся большим числом цветков в головках и красноватой
или розовой окраской венчиков. — Казахстанско-среднеазиатский
(заходящий также в Джунгарию) вид, встречающийся главным образом
в предгорной зоне,'реже в мелкосопочниках и на равнинах.
Материал собран в Казахстане, на подгорной равнине Каратау, между
поселками Сузак и Чолак, на песчаных наносах.
Из многочисленных близких видов, составляющих секцию Scabiosa,
мы смогли исследовать 4 вида.
8 (16).5. bipinnata С. Koch. —Многолетнее дернистое невысокое
растение с дважды перистыми листьями и небольшими головками бледно-
желтых (с увеличенными краевыми) цветков. — Переднеазиатско-кав-
18
казский вид, встречающийся обычно в лесах на полянах и в субальпий'
ских лугах.
Материал собран в Тебердинском заповеднике (Северный Кавказ).
9(17). S. imeretica (Somm. et Lev.) Sulak. — Многолетнее невысокое
растение с лировидно-перистыми листьями и довольно крупными (для
видов секции) головками белых цветков. — Узкий эндемик гор
Западного Закавказья, растущий на каменистых склонах в верхней части
лесного пояса и в субальпах.
Материал собран в условиях интродукции — на каменистой горке
в Сухумском ботаническом саду.
10(18). S. sosnowskyi Sulak. — Довольно высокое (до 1 м) слабо
облиствленное многолетнее растение с лировидно-перистыми листьями и
довольно мелкими (около 1 см в диам.) головками кремовых или почти белых
цветков. — Колхидско-лазистанский эндемик, встречающийся на
щебнистых склонах, по обнажениям, а также на дюнных песках в приморской
полосе и в предгорьях.
Материал собран в заповедной роще пицундской сосны на мысе
Пицунда (Черноморское побережье Кавказа).
11 (19). S. lucida Vill. — Невысокое многолетнее растение с зубчатыми
или лировидными листьями и довольно крупными головками сиреневых
или сиренево-лиловых с резко увеличенными краевыми венчиками
цветков. — Горный европейский (от Пиренеев до Карпат) вид, в Пиренеях,
Юре, Альпах, горах Балканского полуострова широко
распространенный в верхней части лесного и субальпийском поясах, в зароелях
кустарников, по лугам и пустошам, в Карпатах — на полянах в лесах и на по-
лонинах.
Материал собран* в условиях интродукции — на альпийской горке-
в Ботаническом саду БИН АН СССР (Ленинград), где растение ежегодно,
цветет и плодоносит.
12 (20). S. africana hort. — Культивируемый вид, относящийся;
к группе S. columbaria. — Многолетнее растение с розеткой лировидных
опушенных листьев и бледно-лиловыми довольно крупными головками,
цветков.
Материал собран в Батумском ботаническом саду.
Из рода Knautia исследовано 3 вида, представляющие типовую
секцию подрода Trichera (Schrad.) Rouy, но хорошо отличающиеся друг-
от друга и относящиеся к разным подсекциям.
1(21). К. arvensis (L.) Coult. — Многолетнее, иногда высокое,
растение с лировидными или перистонадрезными листьями, с головками
розовых, сиреневых, синевато-лиловых и лиловых цветков с нередко
увеличенными венчиками краевых цветков. — Евросибирский
широкораспространенный вид, обычное растение таежной и лесостепной зон, где
встречается едва ли не повсеместно, но тяготеет к суходольным лугам
и опушкам лиственных лесов.
Материал собран в окрестностях г. Киева, в Боярском лесхозе, в
сосновом лесу, и в окрестностях г. Ленинграда, севернее Муринского ручья
на суходольном лугу.
2(22). К. montana (Bieb.) DC. — Высокое (до 1.5 м) растение с
цельными листьями и крупными головками желтых цветков. — Переднеази-
атско-кавказский вид, типичный для опушек лиственных лесов и
березняков, с которыми поднимается до субальп.
Материал собран в Тебердинском заповеднике (Северный Кавказ).
3(23). К. macedonica Griseb. — Красивоцветущее многолетнее
растение с цельными листьями и некрупными головками ярко-малиновых
или вишневых цветков с незначительно увеличенными краевыми
цветками. — Южнобалканский вид, растущий в светлых хвойных лесах,
на каменистых склонах.
2*
19.
Материал собран в условиях интродукции — на альпийской горке
в Ботаническом саду БИН АН СССР (Ленинград), где обильно цветет
до поздней осени и плодоносит.
Сем. Morinaceae (Dum.) Van Tiegh. исследовалось на материале 3
видов рода Morina, относящихся к типовой секции рода — sect. Morina
(=sect. Diotocalyx DC).
1. M. kokanica Regel. — Крупное многолетнее растение 60—100
см вые, с большими, почти цельными блестящими листьями,
собранными на стеблях в мутовки по 4, и с мощным мутовчатым соцветием из
цветков с бледно-розовыми или ярко-розовыми с белыми длинными
трубками венчиками. — Довольно обычен в Западном Тянь-Шане от Сырдарь-
инского Каратау и Машаттау до Кураминского хребта и очень редок
в западной части Зеравшанского хребта. Растение типично среднегорное,
входит в состав группировок шибляка (Amygdalus petunnikowii Litv.,
Cerasus erythrocarpa Nevski, C. tianschanica Pojark.) и особенно в ксерофит-
ные варианты разреженных арчовников из Juniperus seravschanica Kom.
Материал собран в средней части ущелья Кошман-сай в бассейне
р. Акбулак на высоте 1800—2000 м (Узбекистан), где М. kokanica
является эдификатором микрогруппировок полян в разреженных арчовниках.
Дополнительно материал по этому виду собирался в интродукционном
питомнике травянистых растений Средней Азии в Ботаническом саду
АН УзССР (Ташкент).
2. М. lehmanniana Bunge. — Крупное растение (50—70 см вые.)
с сильно колючими листьями по 4—6 в мутовках и с мутовчатыми
соцветиями из ярких лимонно-желтых цветков. — Растет в высокогорьях,
реже в среднегорьях всего Памиро-Алая, обычно на осыпях или
каменистых россыпях по гребням хребтов, на перекальных площадках.
Как правило, является эдификатором своеобразных группировок
первопоселенцев на этих участках и крайне редко входит в сформированные
сообщества степного типа.
Материал собран на перевале Анзоб в Гиссарском хребте
(Таджикистан) на высоте 3360 м над ур. м., где М. lehmanniana образует небольшие
заросли по полузакрепленным осыпям.
3. М. persica L. — Высокое многолетнее растение с многочисленными
прикорневыми и собранными в стеблевые мутовки колючими блестящими
листьями и крупными верхушечными соцветиями, состоящими из многих
многоцветковых мутовок. Цветки розовые. — Восточнодревнесредиземно-
морский дизъюнктивный вид, обладающий наибольшим в роде, но сильно
разорванным ареалом, от Болгарии и Греции до Таджикистана, растет
преимущественно на каменистых склонах в среднем горном поясе, часто
в разреженном шибляке или фригане.
Материал собран на северо-западной границе ареала, в Южной
Болгарии близ с. Триград, в разреженном шибляке на сильно каменистых
склонах и скалах.
Перечисленные виды были исследованы не в равной степени. Это
зависело как от полноты собранного материала, так и от поставленных
задач исследования.
Материал (большая часть) документирован гербарными экземплярами,
хранящимися в Гербарии БИН АН СССР (Ленинград).
Фиксировались зачатки соцветий, бутоны различной величины,
завязи и пыльники во время цветения, завязи после опыления, созревающие
и зрелые семена.
Для фиксации использовались фиксаторы Навашина, Левитского
и смесь FAA (70%-й спирт, формалин и ледяная уксусная кислота в
пропорции 100 : 7 : 7). Материал проводился через серию спиртов
повышающейся концентрации и хлороформ, затем заключался в парафин.
Препараты готовились по общепринятой методике. Толщину срезов варьиро-
вали'в зависимости от объекта от 8 до 18 мкм. Были применены различные
20
красители, позволившие выявить структурные изменения эмбриональных
тканей, проследить динамику накопления и потребления питательных
веществ и др. Окраска производилась кислым фуксином по Фёльгену с
подкраской гематоксилином по Эрлиху или алциановым синим, пикроинди-
гокармином по Аксенову, генциан-виолетом с подкраской оранжем «G»
в гвоздичном масле по Ньютону и проционовыми красителями по
Иванову и Литинской (1967). Следует отметить, что проционовые красители
для эмбриологических объектов оказались весьма полезными не только
для гистохимической реакции как реактивы, дающие одновременную
окраску белков и углеводов, но и как общие красители, удобные в работе,
не требующие дополнительной дифференцировки и подкраски. Однако
нами отмечено, что на прохождение реакции влияют не только условия,
предложенные методикой, но и использованный фиксатор. Наилучшие
результаты были получены после фиксации FAA, значительно хуже
идет окраска материала, фиксированного смесью Навашина, а после
фиксатора Левитского реакция практически не проходит.
Рисунки выполнены с помощью рисовального аппарата РА-4 на
микроскопах МББ-IA и «Ergaval». Микрофотографии сделаны на универсальном
микроскопе фирмы Zeiss.
РАЗВИТИЕ ПЫЛЬНИКА И ПЫЛЬЦЕВОГО ЗЕРНА
В СЕМЕЙСТВАХ DIPSACACEAE И MORINACEAE
Андроцей
Цветки у представителей Dipsacaceae и Morinaceae обоеполые,
зигоморфные, олигомеризованные, однако морфологически значительно
отличаются, в том числе и важными признаками строения андроцея и гинецея.
Во «Флоре СССР» мы читаем следующее описание андроцея
ворсянковых: «Андроцей из четырех тычинок, равных между собой, с нитями,
прикрепленными в трубке венчика, чередующихся с его долями при
четырехлопастном венчике, а при пятилопастном четыре тычинки
располагаются так, что тычинка, которая должна помещаться между двумя
задними долями, отсутствует; тычиночные нити прикрепляются к спинке
пыльников, состоящих из трех гнезд (опечатка.3 — О. К.), открывающихся
продольно и внутрь цветка» (Бобров, 1957, с. 10).
У мориновых: «Андроцей из двух плодущих тычинок, типически он
пятичленный, а плодущие тычинки по происхождению боковые задние;
средняя тычинка и две боковые передние редуцированы, последние две
иногда представлены в виде рудиментов, а срединная редуцирована
полностью. Пыльники четырехгнездные, раскрывающиеся продольно внутрь
цветка. Плодущих тычинок две, прикрепленных в зеве, и иногда две
рудиментарных, бесплодных, помещающихся в трубке» (Бобров, 1957,
с. 1, 3).
К этим описаниям можно добавить следующее.
У ворсянковых пыльники удлиненной формы, симметричные, на
тонкой тычиночной нити, которая прикреплена к спинке пыльника точно
посредине (рис. 1, 4). В раскрывшемся цветке пыльники находятся
вначале внутри цветка, а тычиночная нить изогнута в виде петли, затем она
распрямляется, выносит пыльник далеко за пределы околоцветника
(рис. 1, 1—3), где он и вскрывается. При этом наблюдается изменение
положения пыльника — от интрорзного до экстрорзного. Например,
у Knautia macedonica пыльники в бутоне интрорзные, после выноса их из
околоцветника они либо остаются интрорзиыми, либо, поворачиваясь
на 90° или на 180°, становятся экстрорзными, причем в одном и том же
цветке можно наблюдать один или два пыльника, раскрывшихся в сто-
21
Рис. 1. Положение пыльников в бутоне и цветке.
1—в — у Knautia macedonica (6 — пыльник перед вскрытием в более крупном масштабе); Т—10 —
у Мотгпа hohanica (10 — пыльник перед вскрытием).
рону своего цветка, т. е. внутрь, и один или два пыльника, обращенных,
в сторону соседних цветков или вверх, т. е. наружу (рис. 1, 3—5). У Се-
phalaria gigantea пыльники большей частью поворачиваются на 90° (т. е.
в положение 4 на рис. 1) и при вскрываниивсегда экстрорзные. Отпылив,.
пыльники облетают, отрываясь от тычиночных нитей.
У мориновых фертильные тычинки расположены рядом со столбиком
рыльца, соединены между собой в нижней части. Тычиночные нити
массивные, толстые, пыльники прикреплены базальной частью (рис. 1, 10).
При раскрывании цветка тычиночные нити не выносят пыльники за
пределы околоцветника, причем раскрываются пыльники одновременно
при нажатии на нижнюю губу венчика (тренинг) и внутрь цветка.
По сравнению с положением в бутоне в раскрывшемся цветке пыльники
меняют свое положение, поворачиваясь на 90°, остаются интрорзными
и не облетают до полного отцветания цветка (рис. 1, 7—9). В трубке
венчика в нижней его трети наблюдаются два стаминодия, наличие
которых отмечалось и ранее (Doll, 1927; Vijayaraghavan, Sarveshwari,
1968).
У представителей обоих семейств пыльники 4-гнездные, гнезда объ^-
единены попарно в две теки, раскрывающиеся продольно (рис. 5).
Стенка пыльника
Наши наблюдения за развитием пыльника начались с момента, когда'
гнездо его на поперечном срезе представляло собой
недифференцированный бугорок меристематических клеток, в субэпидермисе которого затем
вычленяется археспориальная клетка (меристемоцит) (рис. 2). Археспо-
риальная клетка, делясь периклинальной перегородкой, отчленяет
кнаружи первичный париетальный слой и ковнутри спорогенный слой
(промейоциты), клетки которого заметно увеличиваются в размерах в.
четко выделяются среди остальных клеток пыльника (рис. 3, 1, 2, 4, !)■
22
Рис. 2. Меристематический
бугорок, будущее гнездо пыльника
у Knautia arvensis (поперечный срез).
Первичный париетальный слой
в результате периклинального
деления продуцирует тапетум
и вторичный париетальный слой
(рис. 3, 1, 2, табл. II, 1);
последний в свою очередь
претерпевает периклинальные
деления, вследствие чего образуется
эндотеций и средний слой. Этим
и завершается формирование
наружной стенки пыльника
у всех исследованных видов
Dipsacaceae (рис. 3, 2, 3). У представителей Morinaceae средний слой
еще раз делится периклинально, образуя два промежуточных слоя
(рис. 4, 1).
Схематично образование стенки пыльника можно изобразить так.
У ворсянковых:
Первичный париетальный слой
I J
Вторичный париетальный слой тапетум
Ф Ф Ф
эндотеций средний слой тапетум
У мориновых:
Первичный париетальный слой
ф ф
Вторичный париетальный слой тапетум
Ф Ф Ф
эндотеций средний слой тапетум
Ф ф"
средний II средний I
Формирование стенок пыльника у представителей Dipsacaceae и
Morinaceae происходит центробежно по типу двудольных (Davis, 1966), что
ранее отмечалось и для других видов этих семейств (Carniel, 1963a;
Vijayaraghavan, Sarveshwari, 1968).
Сформированная стенка молодого пыльника у представителей обоих
семейств состоит из 4 (у мориновых чаще из 5) слоев: эпидермиса, эндо-
теция, среднего слоя (у мориновых два средних слоя) и тапетума, однако
судьба этих слоев у них несколько различна.
Тапетум исследованных видов обоих семейств двоякого
происхождения, как и вообще у покрытосеменных (Periasamy, Swamy, 1966):
в наружной стенке он является производным первичного париетального
слоя, а со стороны связника дифференцируется из меристемы последнего,
примыкающей к спорогенным клеткам. Однако гетерогенность тапетума
можно наблюдать лишь на ранней стадии развития пыльника, когда
происходит деление первичного париетального слоя. В это время со стороны
наружной стенки тапетум еще не обособился и не оформлен в виде
отдельного слоя, а со стороны связника он уже полностью сформирован и четко
отличается от остальных клеток ткани связника более крупными
клетками и ядрами и обилием цитоплазмы (рис. 3,1, табл. II, 1). В дальнейшем
тапетум формируется как единая структура, окружающая материнские
клетки микроспор, и гетерогенность его клеток не сказывается на его
морфологической однородности (рис. 3, 2—5).
23
Рис. 3. Развитие стенки пыльника и пыльцевого зерна у представителей сем. Dipsa-
сасеае.
1—в, 9 — поперечные, 7, 8, 10, 11 — продольные срезы через пыльцевое гнездо; Н — Knautia аг-
vensis, дифференциация спорогенных клеток и деление первичного париетального слоя; 2 — Scabiosa
lucida, деление вторичного париетального слоя, завершение образования наружной стенки пыльника;
3 — S. bipinnata, 4-слойная сформированная стенка пыльника в период интерфазы материнских
клеток микроспор; 4 — S. bipinnata, синапсис в материнских клетках микроспор, начало
дегенерации среднего слоя, разрастание клеток и деление ядер в тапетуме; б — S. lucida, тетрады микроспор,
тапетум представлен крупными вакуолизированными многоядерными клетками;
У ворсянковых к моменту завершения митотических делений в споро-
генном слое в клетках тапетума заметно начало дифференциации,
выражающееся в появлении вакуолей (рис. 3, 2, 3). В дальнейшем, ко
времени I деления мейоза в материнских клетках микроспор, клетки
тапетума значительно увеличиваются в размерах, а число их ядер
удваивается (рис. 3, 3, 4). Во время I и II деления мейоза и образования тетрад
микроспор в клетках тапетума происходит до трех митозов, в
результате чего они становятся 4—8-ядерными ценоцитами (рис. 3, 4, 5).
Это явление и ранее отмечалось у других видов Dipsacaceae (Risse, 1929;
24
Рис. 3 (продолжение).
6 — S. lucida, вакуолизация одноядерных микроспор, образование тапетальной ткани,
заполняющей пыльцевое гнездо; 7 — £. songarica, двуклеточная пыльца; S — Pterocephalus afghanicus — дву-
илеточная пыльца, дифференциация эндотеция; 9 — S. lucida, образование спермиев, постепенный
лизис цитоплазмы и ядер тапетальной ткани, фиброзные утолщения в эндотеции; 10 — S. bipinnata,
трехклеточная пыльца, почти полный лизис ядер и цитоплазмы тапетальной ткани; 11 — S. bipinnata,
зрелый пыльник.
Razi, Subramanyam, 1952; Carniel, 1963a; Frey, 1976), причем количество
митотических делений в клетках тапетума зависит от величины самой
клетки и от степени ее вакуолизации. 8-ядерные клетки образуются
довольно редко, так как не всегда проходят три митоза и не все ядра всту-
лают в деление; с другой стороны, заметны и слияния ядер (рис. 3, 5).
25
У мориновых дифференцированный тапетум также состоит из крупных
гклеток, однако они менее вакуолизированы и имеют более густую
цитоплазму (рис. 4, 1, 2). Число ядер в них удваивается во время профазы
в материнских клетках микроспор; второе митотическое деление
наблюдается редко, чаще ядра сливаются, повышая свою плоидность
(рис. 4, 2).
После стадии тетрад микроспор поведение тапетума у представителей
обоих семейств резко различается.
У мориновых при обособлении микроспор из тетрад тапетум является
слоем стенки пыльника (рис. 4, 2); затем по мере роста микроспор и их
вакуолизации клетки тапетума деформируются, их оболочки постепенно
рассасываются, иногда наблюдается выпячивание протопластов в полость
пыльцевого гнезда (рис. 4, 3, 4), но периплазмодий не образуется. Далее
происходит довольно быстрый лизис ядер и на стадии двуклеточнои пыльцы
от тапетума остаются лишь сгустки цитоплазмы, которые можно
наблюдать и в пристенном слое, и частично между пыльцевыми зернами (рис.
4, 4, табл. II, 2, 3). К моменту созревания пыльцевых зерен тапетум
полностью лизируется (рис. 4, 6, табл. II, 4). Тапетум мориновых мы
рассматриваем как клеточный, двуядерный, секреторный.
1 У ворсянковых после стадии тетрад, когда микроспоры
обособляются из общей каллозной оболочки, тапетум также сохраняется как слой
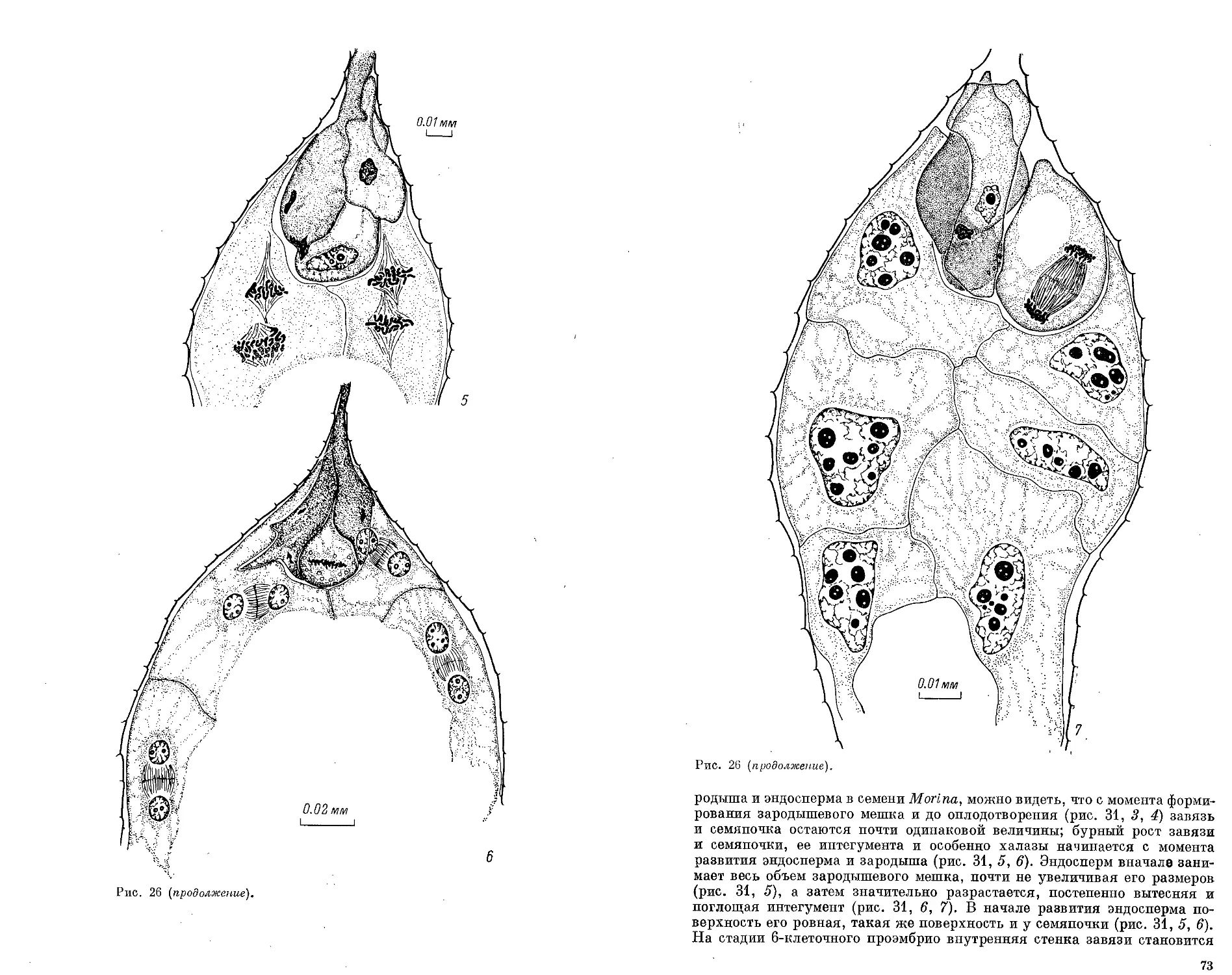
стенки пыльника и имеет клеточную структуру, плотно прилегая к
микроспорам. К моменту вакуолизации одноядерных пыльцевых зерен вся
полость пыльцевого гнезда заполняется тапетальной клеточной тканью
таким образом, что пыльцевые зерна оказываются погруженными в нее
(рис. 3, 6, табл. I, 1). Эта тапетальная ткань функционирует
продолжительное время, вплоть до образования в пыльцевом зерне двух спермиев
(рис. 3, 7—10, табл. I, 1—4). По мере развития и созревания пыльцевых
зерен становятся заметными изменения, происходящие в клетках тапе-.
тальной ткани: уменьшаются вакуоли, уменьшаются и лизируются
ядра, цитоплазма, а затем и клеточные оболочки (рис.3, 7—11). Иногда
в тапетальной ткани заметно накопление белковых гранул, они
наблюдаются у клеточных оболочек (рис. 3, 8), а у Scabiosa olgae заполняют
весь объем клеток. Оболочки полисахаридной природы, орбикулы ни
у ворсянковых, ни у мориновых не обнаружены. В зрелом пыльнике
следов тапетума уже нет (рис. 3, 11). Полученные данные позволяют считать,
что в сем. Dipsacaceae тапетум клеточный секреторный, многоядерный,
в процессе развития пыльцевых зерен претерпевающий преобразование
в тапетальную клеточную ткань, заполняющую пыльцевое гнездо, которая
даже на довольно поздних стадиях развития пыльника не теряет
клеточной организации. Ранее эта ткань была названа нами «трофической»
(Камелина, Яковлев, 1976; Камелина, 19786).
Средний слой, как показано выше, является продуктом пери-
клинальных делений клеток вторичного париетального слоя (рис. 3, 2).
У ворсянковых этот слой эфемерный. Уже на стадии синапсиса в
материнских клетках микроспор заметны дегенерация ядер и уплощение клеток
среднего слоя (рис. 3, 4); дальнейшая дезинтеграция его происходит
одновременно с I и II делением мейоза и мощным развитием тапетума.
К моменту образования тетрад микроспор средний слой почти полностью
исчезает (рис. 3, 5).
В отличие от ворсянковых, у мориновых средний слой становится
двурядным (I и II средний слой) в результате периклинальных делений,
Рис. 4. Развитие стенки пыльника и пыльцевого зерна у Morina lehmanniana.
1 — сформированная 5-слойная стенка пыльника и тяж материнских клеток микроспор; В
—^микроспоры после стадии тетрад, дегенерация среднего слоя I, тапетум из двуядерных клеток с густой
цитоплазмой; 3 — вакуолизация одноядерных микроспор, начало деструкции тапетума, лизис первого
среднего слоя; 4 — двуклеточная пыльца, лизис тапетума; 5 —■. двуклеточная пыльца, появление
фиброзных поясков в эндотеции; в — участок зрелого пыльника с трехклеточной пыльцой.
27
Рис. 5. Поперечные срезы зрелых пыльников и отдельные клетки эндотелия с
фиброзными утолщениями.
1 — Scabiosa lucida; 2 — Knautia macedonica; 3 — Dipsacus laciniatus; 4 — Morina lehmannianar
происходящих в нем при формировании стенки пыльника (рис. 4, 1).
На ранней стадии развития в клетках средних слоев содержатся в
небольшом количестве крахмальные зерна (рис. 4, 1). В дальнейшем средний
слой I, примыкающий к тапетуму, постепенно дегенерирует и на стадии
одноядерных микроспор почти полностью лизируется (рис. 4, 2, 3).
Средний слой II, примыкающий к эндотецию, сохраняется на протяжении
всего развития пыльника. В нем довольно продолжительное время заметны
деления клеток, идущие и в антиклинальном и в периклинальном
направлениях (рис. 4, 2), в результате чего четкость слоя часто нарушается.'
И если на стадии одноядерной вакуолизированной пыльцы клетки этого
слоя несколько сплющиваются, как, впрочем, и клетки эндотеция (рис. 4, 3,
табл. II, 2), то уже на стадии двуклеточной пыльцы, когда от тапетума
остаются лишь сгустки цитоплазмы, а тем более на поздних стадиях,
клетки среднего слоя II распрямляются, увеличиваются в размерах^
становятся толстостенными и вакуолизированными (рис. 4, 4, 5, табл. II,
3, 4). К моменту созревания пыльцы во многих из них, как и в клетках
эндотеция, появляются фиброзные утолщения (рис. 4, 6, табл. II, 4).
Сохранение среднего слоя свойственно также и Morina longifolia (Vija-
yaraghavan, Sarveshwari, 1968).
Эндотеций также является продуктом деления вторичного
париетального слоя (рис. 3, 2). И у ворсянковых и у мориновых эндотеций
сохраняется на всем протяжении развития пыльника. На ранних стадиях
в клетках эндотеция имеются крахмальные зерна (рис. 4, 1). У
ворсянковых на стадии двуклеточной пыльцы клетки эндотеция становятся
толстостенными и вакуолизируются (рис. 3, 8), а во время образования спер-
миев в них появляются характерные фиброзные утолщения (рис. 3,
9—10, табл. I, 2, 4). В зрелом пыльнике клетки эндотеция еще крупнее
(рис. 3, 11). У представителей, обоих семейств эндотеций формируется н&
только в наружной стенке пыльника, но и со стороны связника. Лишь
в местах раскрытия пыльников, попарно в гнездах и симметрично в теках
остаются клетки без фиброзных утолщений (рис. 5). У мориновых фиброз-
28
ные утолщения в эндотеций появляются на стадии двуклеточной пыльцы
(рис. 4, 5, табл. II, 4), а в зрелом пыльнике эндотеций представлен
крупными клетками с фиброзными поясками (рис. 4, 6).
На рис. 5 схематично изображены поперечные срезы пыльников
нескольких видов исследуемых растений. Как видим, характер
распределения фиброзных утолщений (сплошная черная линия) у всех пыльников
сходен, чем и обусловлен одинаковый способ вскрывания. Однако в
отличие от ворсянковых, где фиброзный слой представлен одним рядом
клеток, у Morina он многорядный вследствие образования фиброзных
утолщений не только в эндотеций, но и в остающемся среднем слое и
в тканях связника. При раскрывании пыльников фиброзный слой
действует как «пружина», разворачивая стенки пыльника.
Эпидермис в процессе развития пыльников претерпевает
значительные изменения (рис. 3, 6—11, 4, 1—6, табл. I, II). На ранних стадиях
развития пыльника клетки эпидермиса почти квадратные или несколько
удлиненные, содержат крахмальные зерна — у ворсянковых в
незначительном количестве, а у мориновых — в довольно большом. В дальнейшем,
к моменту появления фиброзных утолщений в эндотеций, клетки
эпидермиса у ворсянковых становятся зубчатыми, толстостенными и часто
тоже с фиброзными утолщениями (рис. 3, 9—11). У мориновых клетки
эпидермиса в зрелом пыльнике толстостенные, с характерными
утолщениями наружных оболочек в виде гребешков (рис. 4, 6).
Таким образом, в зрелом пыльнике у видов Dipsacaceae стенка
пыльника двуслойная (эпидермис, эндотеций), а у Morinaceae — трехслойная
(эпидермис, эндотеций, II средний слой).
Микроспорогенез
Спорогенные клетки являются производными археспориальных клеток.
У ворсянковых спорогенные клетки расположены в один ряд, они крупные,
с густой цитоплазмой. Во время формирования наружной стенки пыльника
в отдельных спорогенных клетках проходят митозы в антиклинальном
направлении, причем веретено деления располагается, как правило, косо,
в результате чего четкость ряда спорогенных клеток нарушается: в
отдельных местах он утолщается за счет вновь образовавшихся клеток
(рис. 3,1, 3, 4, табл. II, 1). Это явление довольно детально описал Карниель
(Carniel, 1963a). На примере 4 изученных им видов ворсянковых он
показал, что в тяже спорогенных клеток митотическому делению подвергается
лишь до трех клеток (очень редко 4) и что количество их, как и
материнских клеток микроспор, в гнезде константно для каждого вида. Так,
подсчет из 100 пыльцевых гнезд дал следующие результаты:
Спорогенные Ma™Te
клетки
микроспор
Knautia drymeya 9—14 13(11—16)
К. arvensis, 2n 10—15 15(12—18)
К. arvensis, in 11—15 16(13—18)
Scabiosa hladnikiana 18—22 23 (21—25)
Наибольшее число клеток, подвергающихся митотическим делениям
в спорогенном слое, наблюдалось нами у видов Cephalaria. Здесь
большая часть клеток делится, и образуется двуслойный тяж материнских
клеток микроспор почти на всем протяжении.
Карниель своими данными о поведении спорогенных клеток и
материнских клеток микроспор опроверг существовавшее ранее мнение об
образовании в молодом пыльнике ворсянковых 50—80 спорогенных
клеток, из которых продолжает функционировать лишь ряд из 12—14 клеток,
тогда как остальные отмирают (Lavialle, 1926; Schnarf, 1931).
29
0.01мм
i 1
Рис. 6. Симультанный тип образования микроспор на примере Scabiosa lucida.
i_3 _ i деление, 4—в — II деление мейоза; 7 — тетрада микроспор в каллозной оболочке; * -'
обособившиеся микроспоры.
Наши наблюдения, распространенные на ряд других видов,
подтверждают данные Карниеля. Митотические деления в тяже спорогенных
клеток завершаются к моменту образования стенки пыльника, и эти клетки
^преобразуются в материнские клетки микроспор (мейоциты) (рис. 3, 4).
У мориновых тяж мейоцитов представлен одним (реже двумя) четкими
рядами клеток, не образующих утолщений, характерных для таковых
у ворсянковых (рис. 4, 1).
Образование микроспор (микрогаметоцитов) у представителей обоих
семейств протекает идентично. К началу I деления мейоза вокруг
мейоцитов наблюдается образование каллозной оболочки, которая затем
заметно утолщается, особенно на стадии тетрад (рис. 3, 5, 4, 1, 6). Очень
четко видны каллозные оболочки при окраске препаратов проционо-
выми красителями или алциановым синим. Мейоциты заметно
увеличиваются в размерах, в их цитоплазме появляются полисахариды или белки
(рис. 3, 2, 3, 4, 1). Образование тетрад микроспор происходит симуль-
танно (рис. 6).
Редукционное деление большей частью протекает правильно. Это же
отмечал для исследованных им видов Риссе (Risse, 1929). Наиболее
длительной в профазе является стадия синапсиса.
Тетрады микроспор, изобилатеральные или тетраэдрические (рис. 3, 5,
6, 6, 7), образуются перешнуровыванием не от веретена, а от стенок,
и вскоре после образования распадаются на отдельные микроспоры
(рис.6, 8). Деления мейоза проходят в пыльниках одного цветка не
синхронно. В одном и том же цветке, а иногда и в одном и том же пыльнике,
можно наблюдать разные фазы мейоза.
Встречались и неправильности в делении: хромосомы делились над
веретеном, отставали от веретена, в двух случаях наблюдалось трехполюсное
веретено (Risse, 1929). В нашем материале у Scabiosa bipinnata и Cepha-
laria brevipalea отмечались выбросы хромосом, отставание их от веретена,
но случаи эти редки.
30
Пыльцевое зерно
Микроспоры с густой цитоплазмой, с ядром, расположенным в центре-
клетки, невелики (рис. 4, 2, 6, 8). Последовательно прослежен и по
возможности показан на рисунках весь процесс развития пыльцевого зерна
(микрогаметогенез) у представителей обоих семейств: увеличение и
вакуолизация клетки, расположение цитоплазмы в пристенном слое и
перемещение ядра из центрального в боковое положение, где и происходит
его деление на два дочерних, из которых одно становится ядром
генеративной, а другое — вегетативной клетки (рис. 7, 1—4, 8, 1, 2).
Генеративная клетка вначале имеет характерную для покрытосеменных линзовидную-
форму и располагается у стенки пыльцевого зерна, затем перемещается
внутрь вегетативной клетки, где вблизи ее ядра делится, образуя два
спермин — мужские гаметы (рис. 7, 5—7, 8, 4, 5). По мере созревания
пыльцевого зерна у исследованных видов наблюдаются изменения спер-
миев и вегетативной клетки, характерные и для некоторых других
покрытосеменных (Герасимова-Навашина, 1954; Татинцева, 1975) и ранее
описанные у ворсянковых на примере Scabiosa purpurea В. А. Поддуб-
ной-Арнольди (1934). У видов Dipsacaceae спермин вначале представлены
веретеновидными клетками с хорошо различимой цитоплазмой и ядромг
в котором имеется 1—2 ядрышка. В дальнейшем происходит постепенное
уменьшение количества цитоплазмы в спермиях, их ядра хроматизуются
и вытягиваются, ядрышки исчезают. Спермин ярко красятся по Фёльгену,
они овальной формы, в зрелом пыльцевом зерне располагаются рядом
с ядром вегетативной клетки. В это время цитоплазму у них уже различить
не удается (рис. 7, 7), хотя вокруг них заметна гомогенно окрашивающаяся
зона. Ядро вегетативной клетки уменьшается, форма его становится
неправильной, оно уже совершенно не окрашивается по Фёльгену, но'
не дегенерирует полностью, как писала В. А. Поддубная-Арнольди
(1934), а при прорастании пыльцевой трубки вносится в одну из синер-
гид зародышевого мешка (Солнцева, Камелина, 1976). У ворсянковых
деление генеративной клетки наблюдается в то время, когда клетки
тапетальной ткани еще не подверглись лизису (рис. 3, 9, 10, табл. I, 3, 4).
У мориновых спермин образуются в почти зрелом пыльнике, где нет и
следов тапетума, перед рассеиванием пыльцы (рис. 4, 6). Спермин в
зрелом пыльцевом зерне мориновых сохраняют тонкий слой цитоплазмы
и ядрышки, хотя ядра их уже довольно сильно хроматизованы (рис. 8, 6),
чем они и отличаются от описанных выше спермиев ворсянковых.
' В вегетативной клетке по мере созревания пыльцевого зерна
уменьшается вакуоль и появляются крахмальные зерна (рис. 7, 4—6, 8, 2—4).
Цитоплазма зрелых пыльцевых зерен заполнена запасными питательными,
веществами — это белки, жиры и в небольшом количестве крахмал.
Таким образом, зрелая пыльца у представителей обоих семейств
трехклеточная. Правда, имеются данные, что у Morina longifolia пыльца
рассеивается на двуклеточной стадии (Vijayaraghavan, Sarveshwari,
1968). Авторы ссылаются на рисунок, где генеративная клетка находится
у стенки пыльцевого зерна (fig. 2, V), но именно поэтому его нельзя
расценивать как зрелое пыльцевое зерно. .
Таковы в норме процессы развития мужских генеративных структур
у исследованных видов Dipsacaceae и Morinaceae.
В роде Scabiosa, Succisa и Knautia уже были отмечены случаи гино-
диэции (Knuth, 1898; Письяукова, 1939; Пономарев, Демьянова, 1975).
Мы наблюдали гинодиэцичные формы у Scabiosa bipinnata, S. rotata,.
Cephalaria brevipalea, Knautia arvensis и Succisa pratensis, у которых
во всем соцветии стерилизуются и не развиваются пыльники, а
развиваются только семяпочки; само соцветие при этом имеет значительно
меньшие размеры. Стерилизация пыльников происходит обычно после
31:
Рис. 7. Развитие пыльцевого зерна в сем. Dipsacaceae.
1—3 — Scabiosa songarica; 4—7 — S. bipinnata (7 — зрелое пыльцевое зерно).
Рис. 8. Развитие пыльцевого зерна у Morina lehmanniana (1—5).
S — зрелое пыльцевое зерно; в — спермин при большем увеличении.
3 О. П. Камелипа
Рис. 9. Аномальное развитие пыльцевых зерен у Scabiosa rotata.
мейоза, на стадии одноядерных микроспор. При этом не наблюдается
реорганизации тапетума в тапетальную ткань, а дезинтеграция
микроспор и тапетума происходит либо сразу после стадии тетрад, либо позже,
когда микроспоры становятся более крупными. В отдельных случаях
у S. rotata отмечены деления одноядерной пыльцы на две почти равные
клетки, из которых одна дегенерировала, а вторая разрасталась и ядро
ее делилось на мелкие, одинаковые по величине ядра (их было до 8—16);
такая пыльца была деформированной, очень крупной и, конечно,
стерильной (рис. 9). У S. bipinnata и С. brevipalea наблюдались случаи
стерилизации пыльцы в результате нарушения мейоза.
У Morina lehmanniana в отдельных пыльниках и даже гнездах также
отмечена стерилизация пыльцы после стадии тетрад, которая
сопровождалась гипертрофированным ростом тапетальных клеток. Происходила
постепенная деформация пыльцевых зерен, ядра их дегенерировали и
оболочки растворялись. Возможно, что этот факт обусловлен
неблагоприятными внешними условиями во время бутонизации, так как мы
встретились с ним только в материале фиксации одного года.
Итак, наши исследования показали, во-первых, что различия
в мужских генеративных структурах между родами и видами у
ворсянковых довольно тонкие и относятся в основном к размерам пыльников,
пыльцы, числу спорогенных клеток и материнских клеток микроспор,
во-вторых, что наряду с идентично протекающими процессами при
34
формировании пыльников и пыльцевых зерен у Dipsacaceae и Morina-
сеае каждому семейству присущи и особые черты.
Общими чертами для обоих семейств являются: центробежное
образование наружной стенки пыльника по типу двудольных, симультанное
образование микроспор, трехклеточные зрелые пыльцевые зерна.
Признаки, отличающие представителей Dipsacaceae и Morinaceae:
1) строение стенки молодого и зрелого пыльника: у ворсянковых она
вначале 4-, а затем 2-слойная, у мориновых — 5- и 3-слойная (вследствие
сохранения одного из средних слоев);
2) характер и степень развития фиброзных утолщений: у ворсянковых
они имеются лишь в эндотеции, иногда в эпидермисе, у мориновых —
во всех слоях стенки зрелого пыльника и в ткани связника, которая более
массивна, чем у ворсянковых;
3) тип тапетума: у ворсянковых он клеточный, многоядерный,
секреторный с реорганизацией после стадии тетрад в клеточную тапетальную
ткань, заполняющую пыльцевое гнездо, у мориновых — клеточный,
двуядерный, секреторный без реорганизации;
4) строение тяжа материнских клеток микроспор: у ворсянковых тяж
с характерными утолщениями в отдельных местах, у мориновых —
один (или два) четких ряда клеток;
5) структура спермиев в зрелом пыльцевом зерне: у ворсянковых
спермин «голые», у мориновых — бедноплазменные.
Наиболее существенными систематическими признаками можно
считать строение стенки пыльника, тип тапетума и способ его реорганизации.
Тип тапетума у ворсянковых
Данные, полученные нами в результате сравнительного исследования
мужских генеративных структур у представителей Dipsacaceae и
Morinaceae, существенно дополняют и изменяют имеющиеся сведения.
В первую очередь это относится к вопросу о типе тапетума у
ворсянковых, который был предметом наиболее частого обсуждения. Еще Страс-
бургер (Strasburger, 1882, 1889), исследуя Cephalaria tatarica и Scabiosa
caucasica, отметил образование в пыльниках первого вида периплазмодия,
а у второго описал внедрение протопластов тапетума между пыльцевыми
зернами. Юэль (Juel, 1915) установил, что у Knautia silvatica образуется
не типичный периплазмодий, а лишь приближающийся к таковому,
благодаря заметным в цитоплазме пограничным линиям. Риссе (Risse, 1926,
1929) посвятил две работы распаду клеток тапетума у Dipsacaceae. Он
исследовал Knautia arvensis, Scabiosa prolifera, Succisella inflexa,
Cephalaria leucantha, Dipsacus sylvestris, Pterocephalus broussonetti и пришел
к выводу, что у всех этих видов тапетум секреторного типа, т. е.
периплазмодий не образуется. Лишь у К. arvensis возможно образование
амебоидного тапетума. Чиаруги (Chiarugi, 1927a) исследовал Knautia neglecta и
виды Scabiosa* Он показал, что голые протопласты, не смешиваясь,
внедряются между пыльцевыми зернами, при этом остаются ясные границы
между отдельными клетками тапетума. У Scabiosa он отметил даже, что
часть перегородок между клетками тапетума остается. В работе Рази и
Субраманьяма (Razi, Subramanyam, 1952) кратко описано развитие
пыльника и нужского гаметофита у Dipsacus leschenaultii, Scabiosa caucasica
и Cephalaria ambrosioides и отмечено, что тапетальные клетки
дезорганизуются в периплазмодий; то же описано для Scabiosa lucida и <S\ ochro-
leuca Фреем (Frey, 1976).
Последней из известных нам работ, посвященных изучению
тапетума в этом семействе, была работа Карниеля (Carniel, 1963a). Он
исследовал Scabiosa hladnikiana, Knautia drymeia и К. arvensis (2n, 4n).
На основании полученных результатов КарниеЛь отнес тапетум
ворсянковых, согласно своей классификации (Carniel, 1952, 1963b), к клеточ-
3* 35
ному многоядерному типу, что мы вполне разделяем. Однако он считает,
что после стадии тетрад клеточные оболочки в тапетуме исчезают
и у всех исследованных им видов образуется амебоидный тапетум.
Наши исследования показали иное. Изучив довольно значительное
число представителей нескольких родов Dipsacaceae и в том числе тот же
вид, что и Карниель (К. arvensis), мы установили, что у всех видов после
стадии тетрад на стадии вакуолизации одноядерных пыльцевых зерен
образуется не периплазмодий и не амебоидный тапетум, а клеточная
тапетальная ткань, заполняющая пыльцевое гнездо. Возможно, что
неточности в наблюдениях Карниеля и других авторов объясняются
применением таких красителей, которые не прокрашивали оболочек клеток та-
петума. Именно в таких случаях (а у нас есть и подобные препараты)
получаются картины, описанные некоторыми исследователями: «голые»,
но не слившиеся протопласты со всегда заметными границами между ними
заполняют все пространство пыльцевого гнезда. Можно только
предполагать, что такая амебоидная фаза в тапетуме возникает сразу
после стадии тетрад, и тогда клеточные перегородки, наблюдаемые в та-
петальной ткани со стадии вакуолизации одноядерной микроспоры,
являются уже вторичным образованием.
Трудно согласиться и с Риссе (Risse, 1926, 1929), который, относя
тапетум ворсянковых к секреторному типу, неверно трактовал самый
процесс дальнейшего (после тетрад) развития тапетума, считая, что
проникновение цитоплазмы с ядрами между пыльцевыми зернами это
неактивный жизненный процесс, так как, по его мнению, цитоплазма
к этому времени уже дегенерировала. В действительности же тапетальная
ткань образуется из активно функционирующих клеток, о чем
свидетельствует наличие в их цитоплазме белковых соединений и ядер, богатых
хроматином. Выполняя трофическую функцию, ткань, естественно,
в процессе развития пыльцевых зерен подвергается лизису. В этой связи
нам импонирует взгляд Мифема и Лени (Mepham, Lane, 1969), которые
считают, что изменение тапетума, например образование периплазмодия,
это его реорганизация, а не дезорганизация. У ворсянковых мы и
наблюдаем такую функциональную реорганизацию (перестройку) тапетума,
которая наилучшим образом обеспечивает формирование фертильнои
пыльцы у представителей этого семейства. В случаях, когда тапетальная
ткань не образуется, наблюдается полная стерилизация пыльцы в пыль*-
нике. У видов Morinaceae такой реорганизации тапетума не
наблюдается.
О классификации типов тапетума у покрытосеменных
В эмбриологических сводках, монографиях и отдельных работах
тапетум в пыльниках покрытосеменных классифицируется по-разному,
поэтому мы считаем уместным кратко остановиться на этом вопросе.
Чаще всего авторы различают два типа тапетума: секреторный и
амебоидный (Chiarugi, 1927a; Risse, 1929; Schnarf, 1929; Магешвари, 1954;
Wunderlich, 1954; Davis, 1966; Поддубная-Арнольди, 1976, и др.), при
этом одни авторы рассматривают периплазмодий как особый случай
амебоидного тапетума (Чиаруги, Риссе, Шнарф), другие же ставят знак
равенства между амебоидным тапетумом и периплазмодием (Магешвари,
Поддубная-Арнольди). Вслед за Тишлером (Tischler, 1915) большинство
авторов различают два вида периплазмодия — настоящий и ложный
(Чиаруги, Риссе, Поддубная-Арнольди). Здесь критерием для
определения служит наличие или отсутствие ядер в цитоплазме периплазмодия.
Поддубная-Арнольди к этому добавляет еще степень слияния
протопластов, растворения оболочек и интенсивность окрашивания ядер. Клаусен
(Clausen, 1927) в своей работе, посвященной обзору литературы по
тапетальному периплазмодию, описал 4 типа, различающихся по времени
36
образования периплазмодия в пыльниках, — во время мейоза, на стадии
тетрад (два типа), после стадии тетрад.
Заметно отличается от предыдущих классификация типов тапетума,
предложенная Карниелем (Carniel, 1952, 1963b). Он считает, что
существует два типа тапетума, которые можно строго отличить с самого начала.
У первого всегда сохраняются стенки клеток, это клеточный тапетум;
у второго с началом мейоза стенки клеток исчезают, протопласты
перемешиваются и образуют однородный периплазмодий, который Карниель* и
считает настоящим периплазмодием (=Triglochin-Tnn по Клаузену). В свою
очередь у клеточного тапетума можно различить два типа —
многоядерный и одноядерный. В настоящем периплазмодии, который встречается
у немногих семейств, можно наблюдать одноразовое митотическое деление-
ядер, которое идет синхронно во всей однородной цитоплазме. В
клеточном тапетуме митотическая активность ядер обычно завершается со
стадией образования тетрад микроспор, после чего начинаются процессы,
как считает автор, ведущие к постепенной дегенерации тапетума. Именно
эти процессы, указывает Карниель, служили критериями при отнесении
тапетума в какому-либо определенному типу. Поэтому автор рекомендует
не смешивать тапетум, который во время митотической активности
является клеточным и лишь после стадии тетрад в результате дегенерации
образует периплазмодий, с настоящим периплазмодиальным тапетумом,
который имеет совершенно другое развитие несмотря на одинаковость
конечных стадий. Периплазмодий, возникший после прекращения
митотической активности в клетках тапетума, после стадии тетрад микроспор,
Карниель называет ложным. Как видим, здесь совершенно другой подход
и другие критерии для определения настоящего и ложного периплазмо-
диев, чем у предыдущих авторов. Классификация типов тапетума Карниеля,
которая была принята в последнее время Е. Л. Кордюм (1978), построена
с учетом происхождения его и в связи со всеми остальными процессами,
протекающими в пыльнике, что отлично иллюстрирует приведенная
в работе Карниеля таблица.
Принимая за основу классификацию типов тапетума Карниеля
(Carniel, 1952, 1963b), мы, как и ранее (Камелина, 1977, 19786), изменяем и
дополняем ее типами реорганизации тапетума. Нельзя, на наш взгляд,
согласиться с утверждением Карниеля, что изменения в структуре
клеточного тапетума, происходящие в отдельных случаях после стадии
тетрад, есть результат его дегенерации. Роль тапетума многогранна и не
ограничивается периодом микроспорогенеза. По-видимому, здесь нужно
говорить о функциональной перестройке — реорганизации тапетума,
так как во время развития микроспор, несмотря на прекращение митоти-
ческих делений ядер, тапетум остается физиологически активным, о чем
говорит наличие в его цитоплазме физиологически активных веществ,
ферментов и витаминов (Поддубная-Арнольди, 1971). Совершенно
очевидно, что функциональная перестройка тапетума после стадии тетрад
для многих видов жизненно необходима, так как нарушение нормального
развития тапетума приводит к стерилизации пыльцы, что мы наблюдали
и на нашем материале.
Как и тип тапетума, способ его реорганизации является постоянным
признаком у отдельных видов, родов, а иногда и целых семейств. Поэтому
при описании типов тапетума для клеточного секреторного типа мы
рекомендуем указывать и способ его реорганизации, если таковая имеет
место после стадии тетрад. На основании полученных нами данных по
семейству Dipsacaceae мы включаем в классификацию типов тапетума
еще один способ реорганизации клеточного тапетума — тапетальную
ткань.
Таким образом, принимая основными типами тапетума в пыльниках
покрытосеменных клеточный секреторный тапетум (I) — одноядерный
и многоядерный и периплазмодиальный тапетум (II) (настоящий пери-
37
плазмодий), остальные образования, до сих пор считавшиеся типами та-
петума, мы рассматриваем только как способы реорганизации клеточного
тапетума. Реорганизации в отдельных случаях может не происходить
(а) или она происходит тремя разными способами: в амебоидный тапетум (б),
в ложный периплазмодий (в) и в тапетальную ткань (г). Остановимся
на характеристике основных типов тапетума и способах его
реорганизации.
I. Клеточный секреторный тапетум сохраняет клеточную структуру
до стадии тетрад микроспор, обособления микроспор, а иногда и до
формирования двуклеточных пыльцевых зерен. Клеточный секреторный
тапетум может быть одноядерным, когда в его клетках содержится по
одному ядру на протяжении всего существования тапетума (например,
в семействах Myristicaceae, Orchidaceae и др.), и многоядерным, когда
в клетках его проходит от 1 до 3—4 митозов, не сопровождающихся
цитокинезом, и они становятся многоядерными (например, в семействах
Dipsacaceae, Valerianaceae и многих других).
а) В случае, если реорганизации тапетума не происходит, клетки его
остаются в подстенном слое, где постепенно и лизируются (например,
в семействах Daphniphyllaceae, Calycanthaceae, Morinaceae и многих
других). Одной из интересных фаз развития такого тапетума, а не
реорганизации его, может, очевидно, считаться «окаймляющий симпласт» (Ви-
dell, 1964), когда протопласты сливаются в подстенном слое без
проникновения в полость гнезда пыльника (например, у отдельных видов ВегЪе-
ridaceae, Piperaceae).
б) Реорганизация клеточного секреторного тапетума в амебоидный
происходит после стадии тетрад и характеризуется частичным
растворением оболочек клеток, образованием впячиваний и выростов
протопластов в полость пыльцевого гнезда, но при этом цитоплазма их не
смешивается, всегда остаются заметными границы между отдельными
протопластами (например, у отдельных видов Lauraceae, Rubiaceae, Asteraceae).
в) Реорганизация в ложный периплазмодий происходит после стадии
тетрад микроспор. Во время или после обособления микроспор оболочки
клеток тапетума растворяются, затем все пыльцевое гнездо заполняется
однородной цитоплазмой периплазмодия, в которой содержатся ядра
(иногда многочисленные) (например, в семействе Valerianaceae и др.).
г) Реорганизация в клеточную тапетальную ткань происходит также
после стадии тетрад. Изначально однослойный тапетум превращается
в ткань, заполняющую пыльцевое гнездо и сохраняющую клеточную
структуру вплоть до формирования в пыльце спермиев, причем оболочки
ее лизируются в последнюю очередь (сем. Dipsacaceae).
II. Периплазмодиальный тапетум (настоящий периплазмодий)
образуется до или во время мейоза. Однородная цитоплазма заполняет
пыльцевое гнездо. Ядра в ней митотически делятся синхронно во всей
массе (семейства Araceae, Commelinaceae).
Приведем некоторые объяснения к схеме, отражающей ход
образования различных типов тапетума у покрытосеменных. Основой для нее
послужила таблица Карниеля (Carniel, 1963b), однако мы внесли в нее
некоторые коррективы и дополнения.
Развитие тапетума тесно сопряжено с развитием всего пыльника.
Последнее можно четко разграничить на три периода: до мейоза — пре-
мейотический, во время мейоза в материнских клетках микроспор —
мейотический и после мейоза, во время развития пыльцевого зерна —
постмейотический. В премейотический период происходит формирование
стенки пыльника. Мы не можем принять мнение многих авторов (в том
числе и Карниеля), что тапетум происходит не только из париетального
слоя, но и из вторичного археспория. Исследовав в последнее время
развитие пыльников на большом фактическом материале у видов из разных
семейств, мы убедились, что правы Дэвис (Davis, 1966) и поддержавшая
38
ее точку зрения Е. Л. Кордюм (1978), которые считают, что все слои
пыльника париетального происхождения. Тапетум является производным или
первичного париетального слоя — при образовании стенки пыльника
центробежно по типу двудольных и в редуцированном типе, или
вторичного париетального слоя — при образовании стенки по основному типу
и центростремительно по типу однодольных. В этом же периоде в ряде
случаев образуется настоящий периплазмодий, но чаще это происходит
в следующем периоде — мейотическом. В это время и в клеточном и
в периплазмодиальном тапетуме проходят митозы, за исключением тех
случаев, когда тапетум остается одноядерным. Клеточный тапетум
становится дву- или многоядерным в зависимости от количества прошедших
митозов в его клетках, а в периплазмодиальном тапетуме количество
ядер увеличивается либо синхронным делением во всей массе цитоплазмы,
либо еще на клеточной стадии, перед растворением оболочек. В начале
постмейотического периода, во время вакуолизации одноядерных
микроспор, происходит реорганизация клеточного тапетума, если таковая
имеет место, разными способами. Со стадии двуклеточной пыльцы
начинается лизис тапетума, ведущий к полному его исчезновению в зрелом
пыльнике.
Предложенный нами вариант классификации типов тапетума у
покрытосеменных включает в себя известные в настоящее время
разнообразные случаи развития тапетума, но, конечно, не может считаться
окончательным. Очевидно, что с накоплением знаний и фактов в
классификацию будут вноситься дальнейшие изменения.
РАЗВИТИЕ ЖЕНСКИХ ЭМБРИОНАЛЬНЫХ СТРУКТУР
В СЕМЕЙСТВАХ DIPSACACEAE И MORINACEAE
Семяпочка
Завязь у представителей обоих семейств нижняя, у Dipsacaceae она
состоит из двух плодолистиков, из которых плодущим бывает передний,
а у Morinaceae — из трех плодолистиков, из которых нормально
развивается только один из боковых задних и становится плодущим (Бобров,
1957). Поэтому у исследованных семейств завязь одногнездная и в ней,
как правило, развивается лишь одна семяпочка.
Семяпочка у представителей обоих семейств висячая, прикреплена
в верхней части гнезда завязи на коротком фуникулусе; у мориновых она
почковидная, у ворсянковых — овальная (рис. 10, 1—6, 11). Возникая
на плаценте в виде полушаровидного меристематического бугорка,
семяпочка интенсивно растет внутрь полости завязи и довольно рано,
с началом закладки валика интегумента и дифференциацией археспори-
альной клетки, начинает изгибаться, а к началу мейоза почти полностью
завершается ее поворот в анатропное положение. Таким образом,
семяпочка поворачивается на 180° по сравнению с начальным положением
и становится висячей анатропной, что характерно для обоих семейств.
Нуцеллус возникает на плаценте первым (Савченко, 1973) и у
исследованных семейств представлен эпидермальным слоем и 1—2 слоями
клеток под ним (рис. 12, 1—4, 18, 1, 2). Во внутренних слоях нуцеллуса
на ранних стадиях часто заметны крахмальные зерна (рис. 12, 4). К
моменту образования 4-ядерного зародышевого мешка клетки нуцеллуса
почти полностью дезинтегрируют, сохраняясь лишь вокруг халазаль-
ного конца зародышевого мешка (рис. 13, 3, 5, 18, 4, 5). У обоих семейств
нуцеллус в семяпочках развит слабо; семяпочки тенуинуцеллятные.
В семяпочках обоих семейств развивается только один интегумент.
Возникает он в виде валика, с наружной стороны нуцеллуса (рис. 12, 1а)
40
02
1ЯЮ
Рис. 10. Семяпочки на стадии зрелых зародышевых мешков в сем. Dipsacaceae
Н™"™ "?№»» *ДРа центральной клетки ва-
дорсовентральный срезы завязи и проводящие пучни
1 — билатеральный, г, з — поперечные 4
на поперечных срезах сречные, *
и за счет интенсивного деления клеток быстро вытягивается в длину.
У ворсянковых к началу мейоза края интегумента близко подходят друг
к другу, окружая нуцеллус (рис. 12, 1а); у мориновых это происходит
несколько позже — на стадии тетрады мегаспор (рис. 18, 2). На стадии
2—4-ядерного зародышевого мешка, когда нуцеллус почти полностью
дезинтегрирует, края интегумента смыкаются, но не срастаются, и
образуют микропилярный канал (рис. 13, 2, 3, 5, 18, 5); у ворсянковых
он узкий и довольно длинный, у мориновых — значительно короче
(рис. 10, 1—5, 11, 1, 4)
Клетки внутреннего эпидермиса интегумента, соприкасающиеся с
зародышевым мешком, именно на этой стадии образуют интегументальныи
тапетум (или эндотелий), который четко выделяется в семяпочке при
окраске всеми использованными нами красителями. Интегументальныи тапетум
заметно изменяется в процессе развития и на стадии зрелого зародышевого
мешка представлен крупными таблитчатыми клетками с густой
цитоплазмой и крупными ядрами у Cephalaria, Scabiosa, Pterocephalus и Knautia;
у Succisa, Dipsacus и Morina клетки интегументального тапетума более
мелкие. В этот период оболочки его со стороны зародышевого мешка
кутинизированы (рис. 15, 5, 16, 1, 2, 5, 21, 1, 2, табл. III, 1—4).
У ворсянковых зародышевый мешок расположен в халазальной части
семяпочки; рост ее осуществляется в основном за счет увеличения микро-
пилярной части интегумента (рис. 10, 1—5, 28, 1—3). У мориновых
наблюдается размещение зародышевого мешка в микропилярной части
интегумента и незначительное ее увеличение, тогда как халазальная часть
заметно увеличивается по мере роста семяпочки (рис. 31, 1—5). По
классификации, предложенной Периасами (Periasamy, 1962), семяпочки у
ворсянковых могут быть отнесены к нормально-халазовым, т. е. когда халаза
после оплодотворения продолжает занимать сравнительно небольшую
часть семени и почти не увеличивается в объеме по сравнению с
состоянием до оплодотворения (рис. 28, 2, 3). У мориновых семяпочки относятся
к массивно-халазовым, т. е. когда халаза после оплодотворения заметно
увеличивается в объеме и занимает большую часть семени (рис. 31, 3—5).
Проводящая система семяпочки у представителей обоих семейств
хорошо развита. На стадии материнской клетки мегаспор происходит
дифференциация прокамбиального тяжа, расположенного у основания
семяпочки. С ростом и развитием семяпочки проводящий пучок
продолжает дифференцироваться по направлению к халазе и заходит в инте-
гумент. У ворсянковых простой проводящий пучок из фуникулуса
входит в интегумент и проходит не только по дорсальной, но и по вентральной
стороне, огибая семяпочку, и заканчивается немного не доходя до
микропиле, что хорошо видно при дорсовентральном срезе семяпочки (рис. 10,
1—6). Проводящий пучок состоит из нескольких слоев удлиненных
густоплазменных клеток, часть которых затем трансформируется в сосуды
с кольчатыми и спиральными утолщениями и образует участки ксилемы,
свойственные и другим видам этого семейства (Doll, 1927; Szabo, 1940;
Razi, Subramanyam, 1952). Для сем. Morinaceae в литературе известно
указание, что в семяпочке проводящие пучки отсутствуют, в отличие
от ворсянковых (Vijayaraghavan, Sarveshwari, 1968). Наши исследования
показали иное. У изученных нами представителей мориновых проводящая
система в семяпочке даже более развита, чем у ворсянковых. Здесь
массивный проводящий пучок из фуникулуса входит в интегумент (рис. 11, 1)
и, также огибая семяпочку, заканчивается немного не доходя до
микропиле (рис. 11, 4, реконструкция). Однако на дорсовентральном срезе
семяпочки, когда в него попадает зародышевый мешок, пучка, как
правило, обнаружить не удается, поскольку расположены они не в одной
плоскости (рис. 11, 2, 3), в отличие от ворсянковых (рис. 10, 6, 7), у
которых пучок хорошо виден на срезах вместе с зародышевым мешком.
На билатеральном же срезе проводящий пучок всегда виден в нижней
42
части халазы, здесь он срезается поперек (рис. 11, 1). То же удается
обнаружить и на поперечных срезах через семяпочку (рис. 11, 2, 3), при этом
на уровне зародышевого мешка пучок срезается косо, вследствие того
что следует он по краю и соответственно конфигурации семяпочки
(рис. 11, 2). Пучок состоит из нескольких сосудов со спиральными или
кольчатыми утолщениями и проходит в периферийных слоях меристема-
тических клеток интегумента по вентральной стороне (рис. 11, 1—4).
Применение проционовых красителей позволило нам проследить
динамику накопления питательных веществ, в частности углеводов и
белков, в интегументе семяпочек у представителей обоих семейств на
протяжении почти всего развития семяпочки и семени — от археспориальной
клетки до зрелого зародыша. У ворсянковых (роды Knautia, Scabiosa,,
Succisa) на стадии материнской клетки мегаспор, диады и тетрады
мегаспор крахмала в интегументе нет; отдельные зерна крахмала в это время
имеются в нуцеллусе (не в эпидермисе) и в крупных клетках, лежащих
под халазальной мегаспорой (рис. 12, 3, 4). Со стадии двуядерного цено-
цита (зародышевого мешка) в микропилярной части интегумента
появляется незначительное количество крахмала, а со стадии 4—8-ядерного
зародышевого мешка — по периферии вдоль проводящего пучка. До стадии
зрелого зародышевого мешка количество крахмала остается примерно
прежним, располагается он большей частью в микропилярной зоне
интегумента и в фуникулусе; крахмальные зерна очень мелкие. Во время
созревания зародышевого мешка, когда происходит дифференциация
его элементов, заметны изменения в интегументальном тапетуме и первых
внутренних слоях интегумента, примыкающих к нему. Клетки этих слоев
вытягиваются и сжимаются, между ними появляется слизь. Клетки
интегументального тапетума увеличиваются, цитоплазма их становится
густой и содержит белковые соединения, а внутренние стенки покрываются
утолщенной полисахаридной оболочкой (табл. III, 1—4). На стадии
булавовидного зародыша, когда весь зародышевый мешок уже заполнен
эндоспермом, в эпидермисе интегумента, где ранее наблюдались только
липиды, появляется в небольшом количестве крахмал; в периферийных
слоях интегумента его становится значительно больше. Увеличивается
зона гидролиза: около интегументального тапетума остается лишь один
слой клеток, а дальше (примерно 5—6 слоев) — сплошная зона,
заполненная слизью, без ядер, без оболочек (табл. V, 1). На стадии сердечко-
видного зародыша, в уже разросшемся семени, клетки оставшихся слоев
и эпидермис интегумента полностью заполнены крупными сложными
зернами крахмала; та же картина наблюдается и на более поздней стадии,
хотя максимальное количество крахмала здесь находится в
периферийных слоях. В почти зрелом семени у Succisa pratensis крахмал отмечен
в семенной кожуре, в эпидермисе эндосперма и отдельными мелкими
зернами в зародыше. В гинодиэцичных соцветиях, где, как уже упоминалось,
развиваются лишь семяпочки, у видов Knautia и Scabiosa во всех
семяпочках на ранних стадиях развития (от двуядерного до зрелого
зародышевого мешка) наблюдается заметно большее количество крахмала
в интегументе, чем в обычных соцветиях на этих же стадиях.
У мориновых крахмал в интегументе появляется раньше, чем у
ворсянковых, — уже на стадии материнской клетки мегаспор в халазальной
части семяпочки видны отдельные зерна крахмала, количество которого
увеличивается по мере роста семяпочки, так что на стадии тетрад мега-
"спор его уже довольно много в халазе, в микропилярной части и в
фуникулусе. В семяпочке со зрелым зародышевым мешком крахмала очень
много и в периферийных слоях интегумента, и в самом зародышевом
мешке. Клетки интегументального тапетума в это время окрашиваются
в интенсивный фиолетовый цвет, содержат густую цитоплазму; так же
окрашиваются 6—7 слоев клеток интегумента, примыкающих к инте-
гументальному тапетуму, что говорит о наличии большого количества
43
белковых соединений в их цитоплазме. За ними следует зона с пустыми
клетками или заполненными розовой слизью (2 — 3 ряда), а затем крупные
бедноплазменные клетки с большим количеством крахмала. Эта же
картина наблюдается и на стадии 6-клеточного проэмбрио, только в
периферийных слоях интегумента крахмала становится еще больше,
практически клетки полностью заполнены его зернами. По мере роста зародыша
и эндосперма и уменьшения интегумента крахмал остается в
периферийных слоях и эпидермисе последнего, но постепенно количество его
уменьшается. В зрелом семени эндосперм содержит специфические жиры,
а зародыш — белок и в незначительном количестве крахмал.
Таким образом, у представителей обоих семейств в завязи
развивается одна висячая анатропная однопокровная тенуинуцеллятная
семяпочка с интегументальным тапетумом и хорошо развитой проводящей
системой. Однако у мориновых семяпочка массивно-халазовая, а у
ворсянковых — нормально-халазовая. На всех стадиях развития семяпочки
ш семени в интегументе отмечено наличие углеводов, в частности
крахмала.
Мегаспорогенез и развитие зародышевого мешка
На ранних фазах развития семяпочки у исследованных видов обоих
семейств в субэпидермисе нуцеллуса выделяется одна клетка — архе-
спориальная (меристемоцит). Ослабление митотической активности,
а затем и полная приостановка деления — первый признак начавшейся
дифференциации этой меристематической клетки и переход ее на иной
путь развития (Яковлев, 1951). Эта клетка заметно увеличивается и
отличается от остальных клеток нуцеллуса величиной ядра и ядрышка,
густотой цитоплазмы (рис. 12, 1, 18, 1). Такая дифференциация теснейшим
образом связана с изменениями в обмене веществ, что приводит к
возникновению качественно новых свойств этой клетки как
морфологических, так и функциональных (Яковлев, Иоффе, 1965). Археспориальная
клетка непосредственно становится материнской клеткой мегаспор —
мейоцитом (рис. 12, 1, 18, 2), что соответствует IV типу женского
археспория по классификации В. А. Поддубной-Арнольди (1976).
Материнская клетка мегаспор претерпевает два последующих деления
мейоза, сопровождающихся цитокинезом, в результате чего у
исследованных видов обоих семейств образуется тетрада мегаспор (мегагаметоци-
тов) (рис. 12, 2 — 4, 18, 2). Как правило, тетрады линейные (рис. 13, 2,
18, 2), редко у ворсянковых наблюдаются квадратные или неправильно
Т-образные с косой верхней перегородкой (рис. 12, 3, 4). При окраске
проционовыми красителями в мегаспорах хорошо выявляются каллозные
оболочки, свойственные и другим видам покрытосеменных (Rodkiewicz,
1968, 1970; Kuran, 1972; Bednara, Rodkiewicz, 1975; Родкевич и др.,
1976). У мориновых халазальная мегаспора — клетка более крупная и
продолжает развиваться, тогда как три верхних постепенно дегенерируют
и отмирают, а затем поглощаются развивающимся зародышевым мешком
(рис. 18, 2, 3). Это обусловлено самим ходом мегаспорогенеза, в процессе
которого первая перегородка закладывается высоко, образуя две
неравные клетки. После второго деления халазальная мегаспора оказывается
более крупной, с большим содержанием цитоплазмы и несколько более
крупным ядром, чем у остальных сестринских клеток тетрады (рис. 18, 2).
У ворсянковых часто наблюдается также первое неравное деление, но
бывают случаи образования совершенно равных клеток в диаде, а затем
и в тетраде (рис. 12, 2, 3). Дальше развивается халазальная мегаспора,
что обусловлено, как считают отдельные авторы, условиями ее питания
ж исчезновением каллозы из оболочки в халазальной части клетки
(Rodkiewicz, 1970).
У ворсянковых отмечены редкие случаи дальнейшего развития двух
мегаспор, что является, вероятно, нарушением нормального процесса
44
Рис. 12. Мегаспорогенез у представителей сем. Dipsacaceae.
1*— Scabiosa songarica, материнская клетка мегаспор; 1а — семяпочка на этой ,же стадии- 2
S. bipinwta, диада мегаспор; з — S. bipinnata, тетрада мегаспор; 4 — S. rotata, тк> же- 4а —'
семяпочка на этой же стадии.
и ведет к дальнейшей стерилизации семяпочки. Рази и Субраманьям
(Razi, Subramanyam, 1952) наблюдали у Cephalaria ambrosioides развитие
третьей мегаспоры в тетраде, но лишь до стадии двуядерного
зародышевого мешка. У Succisa pratensis мы наблюдали тетраду мегаспор, в трех
микропилярных мегаспорах которой было по два ядра, тогда как в
халазальной — только одно, но более крупное ядро, и сама мегаспора была
значительно больших размеров. У Scabiosa bipinnata нами было отмечено
образование двух зародышевых мешков в одной семяпочке, окруженных
единым интегументальным тапетумом, причем в одном случае это были
примерно одинаковые зародышевые мешки, оба сформированные, а в
другом — второй зародышевый мешок был 4-ядерным, в то время как
первый — полностью развитым (рис. 17, 1, 2). Возможно, что эти аномалии
и являются результатом развития двух мегаспор тетрады.
Зародышевый мешок у представителей исследуемых
семейств развивается по Polygonum-типу (Камелина, Яковлев, 1974, 1975;
Камелина, 1978а), что свойственно и другим видам этих семейств (Razi,
Subramanyam, 1952; Vijayaraghavan, Sarveshwari, 1968; Frey, 1976).
45
Рис. 13. Развитие зародышевого мешка в роде Scabiosa.
1 — тетрада мегаспор (S, rotata); г — двуядерный зародышевый мешок (S. bipinnata); 3,5 — 4-ядер-
ный зародышевый мешок (8. bipinnata, 8. calcarea); в — третье деление ядер в зародышевом мешке
(S. rhodantha); 4,7 — 8-ядерный зародышевый мешок, начало клеткообразования (8. bipinnata,
S. olivierii).
Рис. 13 (продолжение).
Развитие зародышевого мешка и дифференциация его элементов у
ворсянковых детально прослежены нами на примере видов рода Scabiosa,
а у мориновых — у М. lehmanniana и М. kokanica.
Халазальная мегаспора к моменту первого деления ядра значительно
увеличивается в размерах и вакуолизируется (рис. 13, 1, 18, 3). Мито-
тические деления ядер в материнской клетке зародышевого мешка
проходят синхронно. После первого деления образуется двуядерный цено-
цит, ядра которого расходятся к полюсам, а между ними возникает
вакуоль, что и является первопричиной полярности зародышевого мешка
(рис. 13, 2, 18, 4). Каждое ядро снова делится, образуется 4-ядерный
ценоцит (рис. 13, 3, 5, 18, 5), ядра которого остаются на полюсах и снова
делятся, в результате чего образуется 8-ядерный ценоцит (рис. 13, 4,
6, 7, 18, 6). С прекращением митотических делений в микропилярном и
халазальном концах зародышевого мешка вокруг полярных групп ядер,
которые в это время все равной величины и с одинаковой хроматизацией,
локализуется цитоплазма и начинается клеткообразование,
завершающееся формированием 7-клеточного 8-ядерного зародышевого мешка (рис. 13,
4, 7, 18, 6).
Сформированные зародышевые мешки у видов обоих семейств — это
правильно поляризованные структуры с яйцевым аппаратом в микропи-
лярной части, состоящим из яйцеклетки и двух синергид, с антиподаль-
ным аппаратом из трех клеток в халазальной части, строением
напоминающим яйцевой, и с центральной клеткой с двумя полярными ядрами
(рис. 14, 1, 18, 7). Во время митотических делений клетка зародышевого
мешка постепенно увеличивается в размерах (рис. 13, 2—7, 18, 3—7),
но наиболее интенсивный рост зародышевого мешка наблюдается в период
дифференциации его элементов, которая начинается сразу же после клетко-
образования (рис. 14, 15, 19).
Халазагьная часть зародышевого мешка вначале опережает в
развитии микропилярную, что связано, очевидно, с той ролью, которую играют
антиподы в развитии зародышевого мешка, и обусловлено более
интенсивным притоком питательных веществ в эту часть зародышевого мешка.
У ворсянковых клетки и ядра антипод заметно увеличиваются по
сравнению с яйцевым аппаратом, в них появляются вакуоли. Ядра двух,
а иногда и трех антипод вскоре начинают делиться (рис. 14, 2). У видов
Scabiosa, Knautia, Pterocephalus и Cephalaria наблюдались деления ядер
антипод, которые не сопровождались цитокинезом, в результате чего
антиподы становились 2-, реже 4-ядерными ценоцитами (рис. 14, 3—5,
16, 3—6). В одном случае у S. bipinnata в зародышевом мешке были
обнаружены две двуклеточные антиподы, в которых базальные клетки были
двуядерными, а апикальные — одноядерными, третья антипода была
4-ядерной (рис. 14, 6).
В зрелых зародышевых мешках ядра антипод ярко окрашиваются по
Фёльгену и варьируют как по количеству их в одной клетке (от 1 до 4),
так и по величине, что свидетельствует о разной их плоидности.
Цитоплазма в антиподах густая, без вакуолей, содержит большое количество
белковых соединений (рис. 15, 6, 16,1—6). Антиподы функционируют
продолжительное время, постепенно дегенерируя по мере развития
эндосперма.
Образование ,двуядерных антипод отмечалось и ранее для Knautia
arvensis, Scabiosa holosericea (Lavialle, 1925a, 1925b; Doll, 1927) и
Cephalaria ambrosioides (Razi, Subramanyam, 1952). У видов Dipsacus и Succisa
деления ядер антипод наблюдать не приходилось, поэтому можно лишь
предполагать, что это явление присуще всем ворсянковым.
Образование ценоцитных антипод известно и для представителей
других семейств. Так, у отдельных видов Asteraceae, Malvaceae, Ranuncula-
ceae, Stackhousiaceae (Narang, 1953; Venkata Rao, 1954; Maheswari Devi,
1957; Иоффе, 1968) и некоторых других (Davis, 1966) антиподы стано-
48
Рис. 15 (продолжение).
вятся многоядерными. Это же характерно и для видов Valerianaceae
(Asplund, 1920), где все три антиподы в зрелом зародышевом мешке всегда
двуядерные. Этот факт свидетельствует об активности антипод, а
следствием его является более длительный период их функционирования.
Дифференциация яйцевого аппарата начинается с вакуолизации
клеток и их поляризации. Синергиды — это две, вначале небольшие,
лежащие рядом клетки с ядрами почти в центре и с вакуолями в апикальной
части (рис. 14, 1). Такое положение ядер и вакуолей сохраняется и далее,
а форма клеток и их величина изменяются по мере роста зародышевого
мешка: базальные части клеток вытягиваются, почти заходя в микропиле,
апикальные — округляются, на внешних сторонах, в местах контакта
с центральной клеткой, появляются выступы, ядра заметно
увеличиваются в размерах, синергиды приобретают грушевидную форму (рис. 14,
2, 3, 15, 1, 5). Нитчатый аппарат у синергид отсутствует, но их базальные
концы на поздних стадиях окрашиваются темнее и содержат более
густую и гомогенную цитоплазму, чем остальная часть клетки (рис. 15,
1, 5, 16, 1, 5). На стадии созревания зародышевого мешка, перед
оплодотворением, в синергидах происходят заметные качественные изменения.
У ворсянковых нам приходилось наблюдать (на значительном материале),
как еще до момента вхождения пыльцевой трубки в зародышевый мешок
(в крупных бутонах и в раскрывшихся цветках) одна, а чаще две
синергиды постепенно дегенерируют: ядра их деформируются и уменьшаются
4* 51
в размерах, уменьшаются и почти совсем исчезают вакуоли, апикальные
части синергид сжимаются, цитоплазма становится густой и плотной,
с большим содержанием белковых соединений (темно-фиолетовая окраска
проционовыми красителями) (рис. 15, 2—4, 6, 16, 4, табл. III, 2—4).
Особенно характерно это для видов Scabiosa и Knautia.
В последнее время многие авторы обращают внимание на явление
дегенерации синергиды (или обеих синергид) до оплодотворения. Это
наблюдалось, например, у Ыпит usitatissimum (Vazart, 1971), у видов
Acanthaceae (Karlstrom, 1974), у Vigna unquiculata (Ojeaga, Sanyaoly,
1970); именно в дегенерирующую синергиду входит пыльцевая трубка
у хлопчатника (Jensen, 1965; Jensen, Fischer, 1968), у Oryzopsis miliacea
(Maze et al., 1970). Достаточно полно картина изменений в синергидах
до оплодотворения прослежена у Calendula officinalis на
ультраструктурном уровне М. А. Плиско (1977), где, кроме того, показано, что
дегенерирующая синергида выделяет протеинсодержащее вещество, которое,
по мнению автора, направляет рост пыльцевой трубки в эту синергиду
и является хемотропноактивным. Дженсен (Jensen, 1973) считает, что
изменения, связанные с дегенерацией синергиды, способствуют выделению
веществ, направляющих рост пыльцевой трубки в эту измененную
синергиду. Вполне возможно, что в случае дегенерации обеих синергид они
обе секретируют хемотропноактивные вещества и становятся в равной
мере доступными для пыльцевой трубки.
Ссылаясь на имеющиеся в литературе факты, считаем нужным
подчеркнуть, что дегенерация одной или двух синергид до оплодотворения
у видов ворсянковых отнюдь не исключение. Очевидно также, что она
не является препятствием для процесса оплодотворения и присуща ряду
видов покрытосеменных (Поддубная-Арнольди, 1976).
Яйцеклетка в только что сформированном зародышевом мешке ничем,
кроме положения, не отличается от синергид (рис. 14, 1), но затем в ней
отчетливо проявляется иная, чем у синергид, и свойственная лишь ей
поляризация: ядро яйцеклетки располагается в апикальной части клетки,
а вакуоль — в базальной. Вначале яйцеклетка отстает в росте и не
превышает длины синергид (рис. 14, 2), но по мере развития заметно
увеличивается, ядро ее становится более крупным, с большим ядрышком,
в цитоплазме появляются белковые тельца (рис. 14, 3, 15, 1). Ко времени
созревания зародышевого мешка, к моменту оплодотворения, яйцеклетка ,
(особенно у видов Scabiosa и Knautia) становится очень крупной,
грушевидной формы, в цитоплазме накапливается большое количество белковых
телец и крахмала (рис. 15, 2—4, 6, 16, 4, табл. III, 2—4), который
появляется уже с началом дегенерации синергид (рис. 15, 2, 16, 4).
Центральная клетка зародышевого мешка содержит центральное ядро,
которое у видов Scabiosa, Cephalaria, Pterocephalus и Dipsacus
располагается в густой цитоплазме под яйцевым аппаратом, почти прилегая к нему,
а у видов Knautia и Succisa — ближе к центру зародышевого мешка.
Образуется центральное ядро в результате слияния двух полярных ядер
(рис. 14, 2, 3); вначале оно не очень крупное, а затем заметно
увеличивается в размерах, часто приобретая неправильную форму; в нем имеется
крупное ядрышко с вакуольками. Вся центральная клетка пронизана
тяжами цитоплазмы, между которыми располагаются вакуоли (рис. 16,
1, 2, 5, табл. III, 1—4), кроме видов Scabiosa, у которых вакуоли
появляются после оплодотворения (рис. 15, 2—6); в клетке отмечено
наличие белковых соединений и жиров. У всех видов ворсянковых полное
слияние полярных ядер происходит, как правило, до оплодотворения,
за исключением С. gigantea, произраставшей в условиях интродукции
в Ленинграде (рис. 16, 1, 22, 3, 4); вероятно, это связано с
климатическими условиями — с недостатком суммы положительных температур
в особо активный период ее развития. У растений же этого вида с
Северного Кавказа в большинстве зрелых зародышевых мешков обнаружива-
52
ются крупные, неправильной формы центральные ядра с большим
ядрышком, возникшие после полного объединения полярных ядер
{рис. 23, м).
Зародышевые мешки разных видов ворсянковых, как и семяпочки
в целом, морфологически однородны, отличаются лишь размерами w
формой (рис. 10, 1—5). Наиболее крупные зародышевые мешки у видов
Cephalaria (до 25—30 мкм дл. и 6—10 мкм шир.), веретеновидной формы,
с суживающимися концами (рис. 16, 1); такая же форма, но несколько
меньшие размеры у видов Dipsacus (табл. III, 4), а еще меньшие —
у Succisa (18—24x6 мкм) и Pterocephalus (17.5x7 мкм) (рис. 16, 2, 5,
табл. III, 3). У видов Scabiosa и Knautia зародышевые мешки более
округлые и короткие (12x6 мкм) (рис. 15, 5, табл. III, 1, 3).
Мы считаем, вслед за Е. Н. Герасимовой-Навашиной (1972), что при
изучении морфологии зародышевого мешка важно учитывать ориентацию
его элементов. У ворсянковых при дорсовентральном срезе семяпочки
яйцевой аппарат располагается в фас: синергиды плотно прилегают друг
к другу, занимая микропилярную часть зародышевого мешка, яйцеклетка
находится за ними (рис. 16, 1, 5). При ориентации зародышевого мешка
в профиль (билатеральный срез семяпочки) можно видеть место
прикрепления яйцеклетки к стенке зародышевого мешка, где ее базальная
часть несколько расширена и уплощена (рис. 16, 2). Антиподальный
аппарат напоминает яйцевой. Две антиподы лежат рядом, их базальные
концы вытянуты, ядра находятся в расширенной и уплощенной
апикальной части клетки. Третья антипода, больших размеров, расположена за
ними (рис. 16, 1—6). Наиболее вариабельной у ворсянковых является
центральная клетка. Именно она у видов с меньшими зародышевыми
мешками меньших размеров, остальные же элементы даже более крупные
(рис. 15, 5, табл. III, 2, 3).
Отдельные случаи аномального развития зародышевых мешков
встречались нам у скабиоз: нарушение полярности, когда все 8 ядер остаются
в микропилярной части зародышевого мешка, где образовалось 4 клетки,
из которых две двуядерные, а под ними слившиеся полярные ядра
(рис. 17, 3), и задержка третьего митоза в микропилярной группе ядер
(рис. 17, 4), тогда как в халазальной части уже образовались три
антиподы.
) У исследованных видов Morinaceae зародышевый мешок имеет
характерную форму: на более ранних стадиях — с расширенной
микропилярной и суженной удлиненной халазальной частями (рис. 18, 7), а по мере
его роста микропилярная часть тоже вытягивается и зародышевый мешок
приобретает веретеновидную форму (рис. 19, 1, 2). К моменту
оплодотворения он разрастается по сравнению с состоянием только что
сформированного зародышевого мешка и достигает довольно крупных размеров —
28x8 мкм (рис. 21,1, 2), К этому же времени происходит и окончательная
дифференциация его элементов. Яйцеклетка приобретает грушевидную
форму с уплощенным основанием, синергиды становятся крупными,
с удлиненными базальными концами, подходящими к самому микропиле.
j Развитие зародышевых мешков у всех изученных нами видов мори-
новых происходит идентично, но у М. kokanica зрелые
зародышевые мешки отличаются большими размерами яйцеклетки и синергид
(рис. 21, 2). Кроме того, у М. kokanica is. M. persica полярные ядра
сливаются довольно рано, тогда как у М. lehmanniana полного объединения
полярных ядер часто не происходит до самого оплодотворения (рис. 21,1,
25, 1). Ядро центральной клетки располагается под яйцевым аппаратом
в густой цитоплазме. Цитоплазма центральной клетки и яйцеклетки
содержит большое количество крахмала, что особенно проявляется при
окраске препаратов проционовыми красителями и генциан-виолетом
(рис. 21, 2). В синергидах цитоплазма становится густой и содержит
белковые соединения.
53
Рис. 16. Зрелые зародышевые мешки в сем. Dipsacaceae.
1 — у Cephalaria gigantea; 2 — у Succisa pratensis и S — у Pterocephalus plumosus; 3, 4 —многоядерные
антиподы у С. gigantea (з — в зародышевом мешке до оплодотворения, 4 — после оплодотворения,
с 4-клеточным эндоспермом); в — антиподы у P. plumosus.
Рис. 16 (продолжение)
Подробнее остановимся на образовании и развитии антипод у
исследованных видов мориновых. Эти процессы на примере М. longifolia
изучались разными авторами, но результаты получены противоречивые,
между тем этот признак несомненно имеет систематическое значение
(Поддубная-Арнольди, 1976).
Еще Балицка-Ивановска (Balicka-Iwanowska, 1899), кратко описав
строение семяпочки и зародышевого мешка М. longifolia, указала, что
в его основании находятся три четко выраженные антиподы, которые
располагаются над удлиненными клетками халазальной части семяпочки,
делятся и сохраняются довольно долго. На рисунках, приведенных в ее
работе, зародышевые мешки характерной веретеновидной формы, а
разделившиеся антиподы изображены в виде цепочки клеток
(Balicka-Iwanowska, 1899, табл. IX—X, рис. 62—64). Долль (Doll, 1927) в описании
зародышевого мешка М. longifolia также указывает на многократно
разделившиеся антиподы; на его рисунке они изображены тоже в виде
цепочки клеток (Doll, 1927, рис. 108, 109). Это же наблюдал у М.
longifolia ранее и Асплунд (Asplund, 1920). Однако Вийджаярагхаван и Сар-
вешвари в своей работе по эмбриологии М. longifolia при описании
развития зародышевого мешка указывают, что образовавшиеся три антиподы
весьма эфемерны, не дробятся и дегенерируют до оплодотворения. На их
рисунках зародышевые мешки изображены с более округлой
халазальной частью, а антиподы — в виде клеточных образований различной
конфигурации (Vijayaraghavan, Sarveshwari, 1968, с. 393, рис. 5). Вместе
с тем авторы отмечают, что на 4—8-ядерной стадии развития
зародышевого мешка клетки нуцеллуса, лежащие под ним, становятся
густоплазменными и трансформируются в гипостазу. После оплодотворения они
дробятся, образуя глобулярную массу, которая вдается внутрь
зародышевого мешка. На медианных срезах эти клетки кажутся раздробившимся
антиподальным комплексом (там же, с. 398). К сожалению, рисунков этих
образований авторы не приводят.
Используя разные красители для выявления структур зародышевого
мешка и окружающих его тканей, мы провели тщательное исследование
(Камелина, Яковлев, 1976) и получили следующие результаты.
Уже на 4-ядерной стадии зародышевый мешок мориновых приобретает
характерную форму — имеет узкий удлиненный халазальный конец
(рис. 18, 5). Напомним, что семяпочка мориновых тенуинуцеллятная и
на этой стадии нуцеллус сохраняется 1—2 слоями лишь вокруг халазаль-
ного конца зародышевого мешка. Клетки нуцеллуса мелкие, бедны
содержимым и постепенно дезинтегрируют. Клеток, которые выглядели бы
иначе, чем все остальные, за счет уплотнения цитоплазмы, оболочек или
увеличения их ядер, ни на этой стадии, ни на более поздних обнаружить
не удалось. Более того, не наблюдалось и деления этих клеток. В
зародышевых мешках в процессе их развития также не было видно признаков
депрессии халазального конца, ведущей к раннему исчезновению
антипод. Напротив, все ядра 4—8-ядерного зародышевого мешка выглядели
одинаково жизнеспособными (рис. 18, 5, 6). На 8-ядерной стадии они
образуют микропилярную и халазальную группу, три ядра последней
проникают в узкий конец зародышевого мешка (рис. 18, 6), где и
формируются три клетки антипод (рис. 18, 7). Как правило, антиподы
располагаются в определенном порядке: две рядом и третья под ними, заполняя
узкий халазальный конец зародышевого мешка. Ядра их крупные,
цитоплазма на этой стадии вакуолизирована (рис. 18, 7}. Затем антиподы
делятся (рис. 19, 1, 20, 1) и приобретают характер многоклеточных
недифференцированных зародышеподобных структур (рис. 19, 2, 20, 2—4,
21,1, 2). Клетки многоклеточных антипод имеют всегда густую цитоплазму
и очень тонкие оболочки, при любой окраске они четко отличаются от
клеток нуцеллуса. На стадии созревания зародышевого мешка они
окрашиваются так же, как и клетки интегументального тапетума, обнаруживая
57
Рис. 18. Мегаспорогенез и развитие зародышевого мешка у Morina lehmanniana.
1 — материнская клетка мегаспор; 2, 3 — линейная тетрада мегаспор, халазальная мегаспора
становится материнской клеткой зародышевого мешка; 4 — двуядерный, 5 — 4-ядерныЙ, в — 8-ядер-
ный зародышевый мешок; 7 — сформированный 7-клеточный 8-ядерный зародышевый мешок.
Рис. 19. Дифференциация элементов и рост зародышевых мешков.
1 — у Morina hokanica; 2 —■ У М. persica.
большое количество белковых веществ в цитоплазме. Антиподальные
образования весьма жизнеспособны и начинают дегенерировать лишь
к моменту заполнения всей полости зародышевого мешка эндоспермом.
Следует отметить, что при использовании красителей, которые не
прокрашивают клеточных оболочек и позволяют четко выявить халазальный
конец зародышевого мешка, многоклеточные антиподы можно принять
за структуры, образовавшиеся в ткани нуцеллуса; в связи с этим возможны
ошибки в описании формы зародышевого мешка и в объяснении происхож-
59
Рис. 20. Развитие антипод у Morina kokanica (I, 2) и М. lehmanniana (3, 4).
1 — халазальная часть сформированного зародышевого мешка с тремя двуклеточными антиподами;
2—4 — халазальная часть зародышевого мешка с многоклеточными зародышеподобными
структурами, возникшими из антипод (4 — в зрелом зародышевом мешке).
дения данных структур. Гипостаза у видов мориновых, так же как и у
ворсянковых, не выражена.
Надо сказать, что дробление антипод у представителей
покрытосеменных — явление довольно редкое, присущее лишь немногим
семействам, и природа его до сих пор неясна (Магешвари, 1954; Поддубная-
Арнольди, 1964, 1976; Davis, 1966). Особенно оно характерно для злаков,
некоторых сложноцветных и мареновых, у которых из антипод иногда
образуются зародышеподобные структуры (Afzelius, 1924; Chiarugi,
1927Ь; Александров, Александрова, 1946, 1952; Narayanaswami, 1953;
60
Рис. 21. Зрелые зародышевые мешки Morina lehmanniana (1) и М. kokanica (2).
Яковлев, Солнцева, 1965; Андронова, 1978, и др.). Как отмечали
В. Г. Александров и О. Г. Александрова (1952), образование
многоклеточных антиподальных структур чаще свойственно видам, в семяпочках
которых отсутствует интегументальный тапетум. Однако, как показано
выше, у видов Morina последний четко выржен, а вместе с тем
образуются антиподальные зародышеподобные структуры, которые
функционируют продолжительное время и, по-видимому, играют активную роль
в процессе формирования и созревания зародышевого мешка, выполняя
функцию питания. В пользу этого свидетельствует тот факт, что
непосредственно к узкому халазальному концу зародышевого мешка, где
расположены многоклеточные антиподы, из халазы подходят тяжи,
состоящие из удлиненных клеток; на стадии зрелого зародышевого мешка
61
в последних появляются сосудистые элементы. Образование такого
мощного аппарата, выполняющего функцию питания, связано, очевидно, с
необходимостью накопления максимального количества питательных
веществ в зародышевом мешке к моменту оплодотворения и для дальнейшего
развития зародыша и эндосперма и, вероятно,.экологически обусловлено.
Возможно, что подобные структуры наряду с другими структурами,
обеспечивающими ускоренное развитие многочисленных и крупных семян,
являются одним из приспособлений, создающих «эфемероидный» (после
цветения) ритм развития монокарпических побегов в условиях
продолжительного жаркого и засушливого лета в горах Средней Азии.
Заключая, следует отметить, что исследование женских эмбриональных
структур у представителей ворсянковых и мориновых выявило как общие
для обоих семейств признаки, так и специфические, присущие только
одному семейству. Общими признаками являются следующие:
1) нижняя и одногнездная завязь;
2) развитие в завязи одной висячей анатропной тенуинуцеллятной
однопокровной семяпочки с хорошо развитой проводящей системой и
выраженным интегументальным тапетумом;
3) локализация в интегументе семяпочки значительного количества
крахмала;
4) дифференциация в субэпидермисе нуцеллуса одной археспориаль-
ной клетки, которая становится материнской клеткой мегаспор;
5) образование линейной тетрады мегаспор;
6) развитие зародышевого мешка из халазальной мегаспоры по
Polygonum-типу;
7) высокая степень дифференциации элементов зародышевого мешка.
Отличительные признаки следующие:
1) у ворсянковых завязь состоит из двух, а у мориновых — из трех
плодолистиков;
2) у ворсянковых нормально-халазовая семяпочка, у мориновых мас-
сивно-халазовая;
3) у ворсянковых зародышевый мешок располагается в халазальной
части семяпочки, у мориновых — в микропилярной;
4) у ворсянковых в цитоплазме центральной клетки зародышевого
мешка обнаружены белковые соединения и жиры, у мориновых —
большое количество крахмала;
5) у ворсянковых антиподы часто становятся 2—4-ядерными цено-
цитами, у мориновых из антипод образуются многоклеточные зародыше-
подобные структуры;
Признаком, несомненно связанным с экологическими факторами,
можно считать неполное слияние полярных ядер до оплодотворения,
наблюдаемое у отдельных видов.
ОПЛОДОТВОРЕНИЕ
Процесс двойного оплодотворения у представителей ворсянковых детально
исследован нами на примере Cephalaria gigantea (Камелина, Солнцева,
1971; Солнцева, Камелина, 1976). ,
В семяпочке к моменту оплодотворения уже имеется зрелый
зародышевый мешок, элементы которого полностью дифференцированы. У видов
Scabiosa и Knautia в зародышевых мешках жизнеспособными остаются
крупная яйцеклетка с белковыми тельцами и крахмалом в цитоплазме
и центральная клетка зародышевого мешка. Синергиды и антиподы к этому
времени являются уже передифференцированными структурами (Гераси-
мова-Навашина, 1954) и дальнейшего развития не имеют. У С. gigantea
хотя и заметны признаки дегенерации синергид, выражающиеся в
изменении формы и структуры ядер и самих клеток (рис 16, 1), однако в боль-
62
шинстве случаев дегенерирует одна из синергид, вторая остается вполне
жизнеспособной и дегенерирует уже после оплодотворения. Пыльцевая
трубка проходит по микропиле, внедряется в дегенерирующую синергиду
и изливает в нее содержимое — два спермия и дегенерирующее ядро
вегетативной клетки с ее цитоплазмой (рис. 22, 1), которое остается в
разрушенной синергиде у апикального конца, тогда как спермин попадают
в пространство между яйцеклеткой и центральной клеткой. В центре
разрушенной синергиды довольно долго сохраняется сильно
деформированное и тоже дегенерирующее ядро самой синергиды. Спермин в это время
имеют ту же форму, что и в пыльцевом зерне, сильно красятся по Фёль-
гену, сквозь густую сеть нуклеального хроматина их ядрышки различить
не удается. Один из спермиев проникает в яйцеклетку, второй —• в
центральную клетку и оба вступают в контакт с их ядрами (рис. 22, 2, 3,
23, б, и). Спермий, контактирующий с ядром яйцеклетки, становится
овальным, заметно увеличивается в размерах, а затем та сторона, которая
соприкасается с женским ядром, уплощается и расширяется. Объединение
спермия с ядром яйцеклетки было прослежено нами более подробно, чем
его слияние с ядром центральной клетки, так как последнее происходит
значительно быстрее.
Уже с начала контакта спермия с ядром яйцеклетки среди ярко
окрашенных глыбок хроматина спермия можно различить выделяющееся
небольшое ядрышко. В дальнейшем оно увеличивается и появляются
дополнительные ядрышки (рис. 22, 4, 23, б—д). Если до сингамии ядро
яйцеклетки было округлым и фёльгенотрицательным, то при контакте
со спермием оно уплощается и с той же стороны усиливается его хромати-
зация. Одновременно с этим недалеко от места контакта появляется
небольшое ядрышко и в ядре яйцеклетки (рис. 23, е—з); в этой же части
женского ядра наблюдается и наибольшая концентрация хроматина
(рис. 23, г, д). Хроматиновые нити другой части женского ядра не столь
ярко красятся по Фёльгену. В это время можно все еще различить
отдельные ядерные оболочки, отграничивающие мужское и женское ядро, хотя
расстояние между ними чрезвычайно мало (рис. 23, в, г). Уже с момента
контакта спермия с ядром яйцеклетки наблюдается увеличение объема
мужского ядра и появляются просветы между глыбками хроматина.
В дальнейшем происходит все большее уплощение спермия, просвет между
ядрами совсем исчезает и различить оболочки между ними не удается, но
продолжает оставаться заметной плоскость контакта ядра спермия и
яйцеклетки — их разграничивает светлая пластинка, с обеих сторон
которой расположены хроматиновые гранулы (рис. 23, е). Эта пластинка
прослеживается довольно долго, хотя гранулы хроматина постепенно
уменьшаются (рис. 23, ж), но в конце концов она перестает быть видимой.
Одновременно с этим ослабевает хроматизация и в ядре спермия. Тем не менее
ядрышки, появившиеся в ядре спермия, так и остаются в этой же части
ядра зиготы и не мигрируют в полость женского ядра и не сливаются даже
тогда, когда исчезает видимая граница между мужским и женским ядрами
(рис. 23, ж, з). Ядро зиготы так и не принимает полностью сферической
формы, и по неровности ядерной оболочки, по ее выпуклости и перетяжке
можно определить место контакта спермия (рис. 23, з—к). В стадии
профазы деления зиготы хромосомы спермия остаются в той части ядра
зиготы, где произошел контакт ядра спермия с ядром яйцеклетки (рис. 23, л).
Полярные ядра, как уже отмечалось, к моменту оплодотворения иногда
находятся на стадии объединения. В этом случае спермий контактирует
обычно с одним из полярных ядер (рис. 22, 5, 23, к). Ядро спермия, ярко
окрашенное по Фёльгену и не принимающее округлой формы, несколько
разрыхляется, в месте контакта в полярном ядре появляются сильно
окрашенные сгустки хроматина женского ядра, в остальной части
полярные ядра остаются фёльгенотрицательными. Погружение спермия в
полярное ядро происходит быстро, одновременно выделяется его ядрышко.
63
Рис. 22. Двойное оплодотворение у представителей сем. Dipsacaceae.
1 — Scabiosa olivierii — пыльцевая трубка вошла в зародышевый мешок и внесла в него два спермия
и ядро вегетативной клетки; г — S. rhodantka — контакт мужских и женских ядер; 3—7 — Cephalaria
gigantea, процесс оплодотворения, постепенное объединение спермия с ядром яйцеклетки и ядром
центральной клетки зародышевого мешка (6, 7 — деление первичного ядра эндосперма); 8 — то же
у Succisa pratensis.
Оболочка, разграничивающая мужское и женское ядра, быстро исчезает,
и в полярном ядре выявляются ярко окрашенные хроматиновые гранулы.
Наибольшая концентрация их обнаруживается в месте погружения
спермия. Одновременно с этим исчезает оболочка, разграничивающая поляр-
64
Рис. 22 (продолжение).
ные ядра, ядрышки сильно увеличиваются в размерах, в них исчезает
крупная вакуоль и появляется большое количество мелких вакуолей
(рис. 22, 4, 23, п). Впоследствии ядрышки полярных ядер сливаются, и
5 О. П. Камелина
65
Рис. 23. Слияние половых ядер в процессе двойного оплодотворения у Cephalaria
gigantea.
а, м — ядра до оплодотворения; б—л — объединение спермия с^ядром яйцеклетки; н—р —Гто ж&
с ядром центральной клетки зародышевого мешка.
возникает одно крупное ядрышко с большим числом вакуолей (рис. 22, 5t
23, р). Затем наблюдается уменьшение хроматиновых гранул, в
небольшом количестве они сохраняются только в месте погружения спермия,.
где так и остается выделенное им ядрышко. Первичное ядро эндосперма
становится единым морфологическим образованием, значительно
увеличивается в размерах, в нем появляются дополнительные мелкие ядрышки
(рис. 22, 5, 23, р) и вскоре оно приступает к делению (рис. 22, 6, 7).
При этом профазные хромосомы вначале обособляются отдельной
группой в месте погружения ядра спермия, тогда как по всей остальной части*
ядра хромосомы находятся только в начальной стадии профазы. В ядре
зиготы в это время все еще можно видеть место погружения спермия
(рис. 22, 7); ядро приступает к делению в то время, когда в эндосперме уже
насчитывается 10—16 клеток (рис. 26, 7).
Таким образом, результаты исследования двойного оплодотворения
у С. gigantea показывают, что процесс объединения спермия с ядром
яйцеклетки протекает в значительно более замедленном темпе, чем при
тройном слиянии. Если тип объединения мужских и женских ядер при
тройном слиянии следует расценивать как премитотический, то процесс
объединения ядер в яйцеклетке значительно растянут во времени и
является промежуточным типом оплодотворения, по терминологии Е. Н. Ге-
расимовой-Навашиной (1954). '
Такой тип сингамии встречался у тетраплоидных форм
сложноцветных — у Crepis tectorum (Герасимова-Навашина, Батыгина, 1958; Гераси-
мова-Навашина, 1960, 1961). На основании рисунков, приводимых
в статьях Стеффена (Steffen, 1951) и Базара (Vazart, 1955), Е. Н.
Герасимова-Навашина высказала предположение, что именно промежуточный
тип слияния половых ядер наблюдается у Impatiens glandulifera и у Сут-
balaria muralis. Очень подробно промежуточный тип оплодотворения
описан С. С. Замотайловым (1968) у Arachis kypogaea, причем автор
отмечает, что по промежуточному типу происходит и объединение спермия
с ядром яйцеклетки, и тройное слияние. Процесс объединения ядер
спермия и яйцеклетки у Cephalaria gigantea очень сходен с таковым у арахиса,
66
Рис. 24. Аномальное явление в семяпочке Scabiosa rotata после оплодотворения.
но отличается тем, что в ядре спермия не выделяется одно большое ядрышко,
сливающееся затем с ядрышком женского ядра. У С. gigantea при
кариогамии выделяется несколько мелких ядрышек как в контактирующем
спермин, так и в женском ядре, которые не сливаются и присутствуют
вплоть до поздней профазы митоза зиготы.
У остальных видов ворсянковых процесс оплодотворения мы не
исследовали с такой подробностью, как у С. gigantea. Однако с уверенностью
можно сказать, что у всех этих видов развитие зародыша и эндосперма
происходит вследствие двойного оплодотворения. Наглядным примером
может служить картина, которую мы наблюдали в одной из семяпочек
Scabiosa rotata (рис. 24). Здесь мы видим уже шаровидный зародыш и не-
разделившееся центральное ядро. Двойного оплодотворения не произошло
(второй спермий остался в синергиде и не оплодотворил центральное ядро),
и эндосперм не развился. Отдельные картины ранних фаз развития
эндосперма и первых делений, зиготы у разных видов ворсянковых
подтверждают наличие у них двойного оплодотворения (рис. 22, 8, 26, 1—6).
У видов Scabiosa спермий, контактирующий с ядром яйцеклетки, также
округляется и в нем появляется ядрышко. Но в зиготе, в отличие от С.
gigantea, наблюдается ядро с одним крупным ядрышком, образовавшимся
в результате слияния ядрышек яйцеклетки и спермия (рис. 22, 2, 26, 1).
Зигота к моменту первого деления уменьшается в размерах по
сравнению с неоплодотворенной яйцеклеткой, очевидно за счет уменьшения
вакуоли. Это явление отмечалось и у других покрытосеменных — у
хлопчатника (Pollak, Jensen, 1964; Jensen, 1968) и у резеды (Чабан, 1975).
Период покоя ядра зиготы у видов Cephalaria исчисляется 3—4 делениями
эндосперма (рис. 26, 6, 7), у Scabiosa — также 3—4 делениями (рис. 26, 4),
у Succisa — 2 делениями (рис. 26, 2). Те же пределы, очевидно, характерны
5* 67
Ряс. 25. Двойное оплодотворение у Morina lehmanniana (1) и М. kokanica (2).
Контакт спермия с ядром яйцеклетки (1, 2), контакт спермпя е ядром центральной клетки (1) и
деление первичного ядра эндосперма (2).
для видов Knautia и Dlpsacus. Первичное ядро эндосперма у ворсянковых,,
по-видимому, периода покоя практически не имеет, так как приступает
к делению сразу же после объединения со спермием в то время, когда
в яйцеклетке процесс оплодотворения еще не завершен (рис. 22, 6—8).
Правда, у Scabiosa holosericea Долль (Doll, 1927) отмечал длительный
период покоя и зиготы и первичного ядра эндосперма.
Пыльцевая трубка у ворсянковых массивная, вносит довольно большое
количество цитоплазмы в зародышевый мешок и при любой окраске хорошо
заметна. Остатки ее сохраняются продолжительное время: даже на стадии
булавовидного зародыша они заметны в микропиле. Содержимое
пыльцевой трубки постепенно лизируется, она ослизняется, оболочка ее
утолщается. Возможно, что она участвует также в транспорте метаболитов
из тканей интегумента в зародышевый мешок на ранних стадиях развития
проэмбрио и эндосперма, как это предполагается для видов, у которых
пыльцевые трубки сохраняются продолжительное время после
оплодотворения (Магешвари, 1954). Это же явление свойственно и видам мори-
новых, у которых двойное оплодотворение также имеет место (Vijayaragha-
van, Sarveshwari, 1968; Камелина, 1973). Однако детально изучить этот
процесс нам не удалось, так как материал был собран в экспедиционных
условиях, где не было возможности провести темпоральную фиксацию.
Имеющиеся данные говорят о том, что пыльцевая трубка входит в одну
дз синергид и вносит в нее спермин, вхождения ядра вегетативной клетки
68
не наблюдается. На рис. 25,1 показаны спермин, контактирующие с ядром
яйцеклетки и с одним из полярных ядер, которые также находятся в
контакте (у Morina lehmanniana). Спермин в это время уже округлые, с
заметным ядрышком и довольно интенсивной хроматизацией. На следующем
рисунке (рис. 25, 2) мы видим образование двух клеток эндосперма
(у М. kokanica), тогда как второй спермий, увеличившийся в размерах
и с двумя ядрышками, все еще находится в контакте с ядром яйцеклетки.
Полное погружение спермия происходит в то время, когда в эндосперме
насчитывается 6 клеток (рис. 29, 1), а слияние ядрышек яйцеклетки и
спермия — еще позднее (рис. 29, 2). Зигота находится в состоянии покоя
продолжительное время и к моменту первого деления значительно
увеличивается в размерах (рис. 29). Первое деление в зиготе происходит, когда
эндосперм насчитывает 16—24 клетки. Отмечен случай вхождения в
зародышевый мешок двух пыльцевых трубок — в обе синергиды. Однако
в процессе оплодотворения участвовала лишь первая пара спермиев,
вторая оставалась в синергиде.
Таким образом, у мориновых, как и у ворсянковых, развитию
зародыша и эндосперма предшествует процесс двойного оплодотворения.
При этом процесс тройного слияния протекает значительно быстрее, чем
объединение ядер спермия и яйцеклетки. Говорить о типе оплодотворения
у Morinaceae по столь немногочисленным картинам преждевременно.
Здесь нужны дополнительные исследования.
Итак, для исследуемых семейств характерны порогамия и двойное
оплодотворение. Нами отмечено, что у ворсянковых ядро вегетативной
клетки вносится в синергиду, а у мориновых этого не происходит.
В зиготогенезе также обнаружены различия: у ворсянковых зигота
уменьшается по сравнению с величиной неоплодотворенной яйцеклетки,
у мориновых — заметно увеличивается.
ЭНДОСПЕРМОГЕНЕЗ И ЭМБРИОГЕНЕЗ
В СЕМЕЙСТВАХ DIPSACACEAE И MORINACEAE
Развитие эндосперма
Как уже указывалось (Камелина, 1979а), деление первичного ядра
эндосперма у всех изученных видов обоих семейств, как правило, опережает
деление ядра зиготы.
У видов ворсянковых деление первичного ядра эндосперма наблюдается
недалеко от яйцевого аппарата, немного ниже зиготы, и происходит
так, что фигура деления располагается поперек центральной клетки,
а клеточная стенка закладывается в продольном направлении (рис. 22, 6, 7).
У Cephalaria gigantea фигура деления достаточно крупная и дочерние
ядра расходятся на значительное расстояние. Между ядрами в центре
фрагмопласта закладывается клеточная пластинка, а затем возникает и
клеточная стенка, которая образуется не только в центре бывшего
фрагмопласта, но доходит до края клетки, а с другой стороны оканчивается около
центральной вакуоли. Дочерние ядра оказываются с двух сторон зиготы,
а на месте первичного ядра эндосперма появляется перегородка. Так
возникают две клетки эндосперма. Это же характерно и для видов Scabiosa
и Dipsacus (рис. 26, 1, 3). Лишь у Succisa pratensis деление первичного
ядра эндосперма ориентировано не всегда одинаково, что связано,
очевидно, с отсутствием в этот момент в центральной клетке большой вакуоли,
наблюдаемой у остальных видов, и первая перегородка у этого вида
в эндосперме бывает соответственно от продольной до косо-поперечной
(рис. 22, 8, 26, 2). У видов Knautia нам не приходилось наблюдать деления
первичного ядра эндосперма. Долль (Doll, 1927) обнаружил его у К. аг-
vensis в ночных фиксациях и показал, что оно протекает без закладки пере-
G9
городки, однако ядра также расходятся к стенкам зародышевого мешка
в таком же направлении. Перегородка между ними возникает после
второго деления ядер эндосперма.
При втором делении, которое происходит в обеих клетках синхронно,
строгой ориентации не наблюдается: фигуры деления располагаются либо
перпендикулярно направлению первого деления, либо параллельно или
наклонно ему (рис. 26, 2, 3). Между дочерними ядрами, которые
располагаются друг под другом или вдоль стенки зародышевого мешка, также
закладываются клеточные перегородки. Третье деление ядер эндосперма
во всех четырех клетках тоже происходит синхронно (рис. 26, 4—6) и
в направлениях, перпендикулярных, наклонных или параллельных
предыдущим. В дальнейшем синхронность делений нарушается.
Таким образом, ориентация первых трех делений эндосперма у
ворсянковых двоякая, различие проявляется во втором делении. Схематично
это показано на рис. 27.
В результате следующих делений возникает все большее число клеток
эндосперма, причем вначале ими заполняются микропилярная и
центральная части зародышевого мешка, тогда как в халазальной части еще
сохраняется уменьшающаяся вакуоль. Ядра эндосперма на ранних стадиях его
развития очень крупные, с большим количеством ядрышек (рис. 26, 7).
При 4—6-клеточном проэмбрио эндосперм заполняет весь зародышевый
мешок (табл. IV, 1). По мере роста проэмбрио клетки эндосперма,
расположенные по периферии зародышевого мешка, начиная с микропилярной
части, становятся более мелкими и густоплазменными, а в центре остаются
крупными с небогатой цитоплазмой и вакуолизированными (табл. IV, 2).
По мере роста зародыша эндосперм, расположенный в центральной части
зародышевого мешка, постепенно расходуется растущим зародышем,
тогда как в периферийных слоях эндосперма с момента, когда зародыш
достигает половины своей величины (рис. 28, 5), начинают накапливаться
запасные питательные вещества. В зрелом семени у большинства видов
ворсянковых эндосперм сохраняется и представляет собой плотную
ткань, окружающую зародыш, клетки которой заполнены запасными
питательными веществами; только вокруг базальной части зародыша
эндосперма практически не остается, а видна лишь тонкая пленка,
состоящая из сплющенных клеток (рис. 28, 6, 34, 1—5, табл. V, 4).
Запасными питательными веществами у видов Cephalaria являются в основном
жиры и белки в виде мелких алейроновых зерен, у Knautia — белки и
жиры, у Succisa в эпидермисе эндосперма имеются зерна крахмала,
в остальных слоях — жиры; жиры являются основными запасными
веществами в эндосперме и у видов Dipsacus. У видов Scabiosa в зрелых
семенах эндосперм представлен очень тонким слоем — в 2—3 (редко 6) ряда
клеток, запасные питательные вещества — только белок. Эндосперм
у всех видов ворсянковых не содержит хлорофилла и имеет гладкую
поверхность (рис. 28, 6, 34, 1—5).
Первичное ядро эндосперма у видов мориновых делится таким образом,
что дочерние ядра расходятся вдоль зародышевого мешка, а первая
перегородка закладывается поперек его или немного наклонно (рис. 25, 2).
Два следующих деления в клетках эндосперма синхронные, с закладкой
в основном наклонных перегородок. Уже после второго деления вся
центральная клетка зародышевого мешка заполняется клетками эндосперма,
ядра которых крупные, неправильной формы, с большим количеством
ядрышек, что говорит о их высокой метаболической активности, а
цитоплазма содержит крахмал, количество которого постепенно уменьшается
(рис. 29, 1, 2).
Схема первых делений в эндосперме мориновых может быть
представлена следующим образом (см. рис. 30), хотя нужно оговориться, что строгой
последовательности в заложении перегородок после второго деления не
наблюдается.
70
Рис. 26. Начальные стадии развития эндосперма у представителей сем. Dipsacaceae.
1 — двуклеточный эндосперм (Scabiosa rotata); г — второе деление зндосперма (Succisa pratensis);
3 — 4-клеточный эндосперм (Dipsacus dipsacoides); 4—6 — третье синхронное деление эндосперма:
4 — у Scabiosa rotoia, 5 — у Cephalaria gigantea, 6 — у С. brevipalea; 7 — 16-клеточный эндосперм (на
медианном срезе в клеток) и первое деление зиготы у С. gigantea.
Как уже упоминалось, в литературе имеется указание на то, что
эндосперм в зрелом семени у Morina longifolia руминирован (Vijayaraghavan,
Sarveshwari, 1968). Однако авторы не показали, каким образом происходит
руминация эндосперма и к какому типу она относится. Исследуя материал
по трем видам мориновых, мы попытались ответить на эти вопросы.
На схеме (рис. 31), демонстрирующей динамику развития семяпочки, за-
71
Рис. 26 (продолжение).
родыша и эндосперма в семени Morlna, можно видеть, что с момента
формирования зародышевого мешка и до оплодотворения (рис. 31, 3, 4) завязь
и семяпочка остаются почти одинаковой величины; бурный рост завязи
и семяпочки, ее интегумента и особенно халазы начинается с момента
развития эндосперма и зародыша (рис. 31, 5, 6). Эндосперм вначале
занимает весь объем зародышевого мешка, почти не увеличивая его размеров
(рис. 31, 5), а затем значительно разрастается, постепенно вытесняя и
поглощая интегумент (рис. 31, 6, 7). В начале развития эндосперма
поверхность его ровная, такая же поверхность и у семяпочки (рис. 31, 5, 6).
На стадии 6-клеточного проэмбрио внутренняя стенка завязи становится
73
Рис. 27. Схема первых делений эндосперма (/—III) в сем. Dipsacaceae.
волнистой (рис. 31, 5), а когда зародыш приобретает булавовидную форму
и эндосперм занимает уже значительный объем семени (рис. 31, 6), ткани
стенки завязи заметно видоизменяются. В эндокарпе можно видеть хорошо
развитую механическую ткань, насчитывающую 5—6 слоев клеток с сильно
утолщенными оболочками и с наличием в них кристаллов оксалата
кальция. Вся внутренняя поверхность стенки завязи становится неровной,
в ней появляются выступы и впадины, которые начинают сминать и
прилегающие слои интегумента (рис. 31, 6, 7, табл. IV, 3). Поверхность
интенсивно растущего эндосперма некоторое время еще продолжает
оставаться ровной (рис. 31, 7), но по мере уменьшения количества слоев
интегумента также становится неровной за счет врастания эндосперма
в пустоты между выступами эндокарпа (рис. 31, 8—10). В перикарпе
происходит дальнейшее одревеснение и окремнение, поэтому на стадии созре-
Рис. 28. Развитие семяпочки и семени у Succisa pratensis.
1 — стадия 4-ядерного зародышевого мешка; г — стадия зрелого зародышевого мешка; 3 —
булавовидный зародыш; 4 — сердечковидный зародыш; 5 — зародыш на стадии торпеды; гб — зрелое семя.
74
Рис. 29. Ранние стадии развития
эндосперма у Morina lehmanniana.
•Объяснение в тексте.
вания зародыша завязь целиком
нельзя ни зафиксировать, ни
резать на микротоме, из-за чего на
рис. 31, 7—10 мы вынуждены были
изобразить ее без перикарпа. Так
осуществляется руминация
эндосперма у мориновых, который
вместе с семенной кожурой,
состоящей из 1—2 слоев клеток,
повторяет скульптурированную
внутреннюю поверхность перикарпа,
являясь как бы его зеркальным
отражением. Наружная
поверхность перикарпа во время
созревания семени также становится
скульптурированной, так что
руминация наружной поверхности
эндосперма происходит
исключительно за счет руминации
перикарпа.
Все вышеизложенное говорит
о том, что руминация эндосперма
у видов Morinaceae не подходит
ни под один тип классификации
руминации эндосперма Дальгрена
(Dahlgren, 1922) и Периасами (Ре-
riasamy, 1962), поскольку авторы
рассматривали и учитывали лишь
случаи руминации эндосперма за
счет деятельности интегументов,
семенной кожуры или самого
эндосперма. Руминацию
эндосперма у мориновых можно
характеризовать как ложную
(подтип сетчатой или струйчатой
руминации, по типологии С. Г. Тамамшян, 1951), к которой относятся
случаи складчатости и выемчатости эндосперма, возникшие в
результате воздействия стенок завязи и эндокарпа или тканей рубчика и
семяножки. Примеры такой руминации описаны у зонтичных и кизиловых
(Тамамшян, 1946, 1951).
В зрелом семени у мориновых эндосперм окружает весь зародыш кроме
базальной части, где он остается в виде тонкой пленки из сплющенных
клеток (рис. 31, 10), и представляет собой плотную бесхлорофильную
ткань, клетки которой заполнены глобулами, окрашивающимися процио-
новыми красителями в ярко-синий цвет. В литературе указывалось, что
эндосперм у М. longifolia заполнен глобулами жира. Биохимические
исследования семян мориновых также показали высокое содержание в них
(до 25%) жиров (Lys, 1951). Поэтому можно предполагать, что и у
исследованных нами видов в эндосперме содержатся жиры, возможно
специфического состава, так как они дают иную окраску, чем у видов ворсянковых
<табл. IV, 4).
Таким образом, наши данные по развитию эндосперма у
представителей ворсянковых и мориновых, с одной стороны, подтвердили наличие
у видов этих семейств изначально клеточного эндосперма, с другой,
75
Рис. 30. Схема первых делений эндосперма (I—III) в сем. Morinaceae.
Рис. 31. Развитие семяпочки и семени у Morina kokanica.
1 — стадия материнской клетки мегаспор; 2 — тетрада мегаспор; 3 — зрелый зародышевый мешок;
4 — оплодотворение; з — 6-клеточный проэмбрио; 6 — булавовидный зародыш; 7 — сердечковид-
ный зародыш; 8, 9 — зародыш на стадии торпеды; 10 — зрелое семя; а — зародыш; б — эндосперм;
в — интегумент; г — перикарп.
продемонстрировали особенности и различия в эндоспермогенезе на
ранних стадиях развития эндосперма, а также в его строении в зрелом
семени.
Развитие зародыша
Развитие зародыша у представителей Dipsacaceae детально исследовалось
на примере Cephalaria gigantea, у представителей Morinaceae — на
примере М. kokanica и М. lehmanniana (Камелина, 19796).
Развитие зародыша у двух исследуемых семейств рассмотрено нами
в свете концепции М. G. Яковлева, согласно которой зародыш проходит
через две фазы развития — проэмбриональпую и эмбриональную, границей
между которыми является вычленение эмбриодермы (Яковлев, 1971,1972).
Проэмбриональная фаза развития зародыша у С. gigantea начинается
с момента первого деления зиготы (рис. 32, 1, 33, 1). Зигота делится
перегородкой, положение которой варьирует от почти вертикального через
диагональное или наклонное до почти горизонтального (при наблюдении
на билатеральных срезах семяпочки при одной и той же ориентации)
(рис. 33, 1—3). В результате первого деления образуются две неравные
клетки: меньшая (а) и большая (Ь), которые отличаются и качественно —
а содержит более густую цитоплазму, а в Ъ продолжительное время
сохраняется вакуоль. В большинстве случаев следующее деление происходит
в клетке Ъ (рис. 33, 2), но иногда раньше делится клетка а (рис. 32, 2,
33, 3), при этом каждая клетка делится более или менее поперечно,
образуя дочерние клетки с, d, производные а, и е, /, производные b (рис. 32, 3,
33, 4—6). В результате этих делений образуется тетрада, которая своим
строением отличается от всех категорий тетрад классификации
эмбриональных типов Суэжа и которую сам Суэж назвал глобулярной или
головчатой (Souages, 1983b).
Несмотря на то что положение первой перегородки в зиготе
вариабельно, все же в большинстве случаев наблюдается четкая закономерность
делений при образовании тетрады: деления проходят в обеих клетках
двуклеточного проэмбрио с закладкой стенок, перпендикулярных или
наклонных по отношению к первой перегородке (рис. 32, 1, 2, 33, 4—7).
Ориентация первой перегородки обусловливает и степень участия
производных клеток а и b в построении зародыша; в большинстве случаев она
примерно равная.
На рис. 32 прослежена проэмбриональная фаза развития зародыша
С. gigantea в случае заложения первой перегородки с почти вертикальной
ориентацией. После стадии тетрады клетки, производные а и Ь, делятся
поперечно, образуя ряды клеток, расположенные друг над другом, со
стенками, внешне прикрепленными к периферической стенке проэмбрио,
а внутренне — к первой вертикальной стенке, положение которой
сохраняется и различимо вплоть до стадии вычленения эмбриодермы
включительно (рис. 32, 4—8). Эмбриодерма вычленяется лишь в терминальной
части проэмбрио в результате периклинальных делений в клетках
последней (рис. 32, 7, 8). При такой сегментации проэмбрио очевидно, что
производные клеток с, d и е (с', с", d', e, е") дают начало точке роста стебля,
семядолям и гипокотилю. Апикальная меристема корня, корневой чехлик
и суспензор возникают из / и d (рис. 32, 5, 6). При ориентации первой
перегородки ближе к горизонтальной (рис. 33, 3, 5, 6) участие в построении
зародыша клеток — производных а и b — иное: здесь образование точки
роста стебля и семядолей происходит за счет с и d — производных а
(рис. 33, 5, 6). Следует отметить, что в большинстве случаев сегментация
в проэмбрио после тетрад четкой ориентацией не отличается и проследить
ее довольно трудно.
Таким образом, проэмбриональная фаза развития зародыша
характеризуется вариабельностью заложения первой перегородки, глобулярной
77
Рис. 32. Проэмбриональная фаза развития зародыша у Cephalaria gigantea в случае-
заложения первой перегородки в вертикальном направлении.
Обозначения см. в тексте.
тетрадой и дальнейшей сегментацией, в которой нельзя выделить стадии;
квадрантов и октантов в принятом смысле слова, а равно и образование-
этажей в проэмбрио, наблюдаемых в других типах эмбриогенеза. В
большинстве случаев производные клеток а и Ъ участвуют в образовании
зародыша почти в равной степени и развитие проэмбрио идет примерно
по такой схеме:
са = V2PC0 + 1j%pvt + ikphy,
сЪ = Чгрсо -\- ^Izpvt -)•- 1liPhy -\- ice -\- iec -f- со -f- s,
где рсо — семядольная часть, pvt — точка роста стебля, phy — гипо-
котиль, ice — инициали центрального цилиндра, iec — инициала коры:
корня, со — инициали клеток чехлика, s — подвесок.
С вычленением эмбриодермы заканчивается проэмбриональная фаза
развития зародыша и начинается собственно эмбриональная,
характеризующаяся дальнейшим ростом и дифференциацией зародыша.
В начале эмбриональной фазы зародыш становится шаровидным, на
небольшом подвеске, а затем булавовидным (рис. 33, 12—14). Здесь мы
встречаемся с фактом поздней закладки инициалей. Этим обусловлена и
поздняя гистологическая дифференциация зародыша, на которую
указывал Суэж. И эпифизарные и гипофизарные клетки на ранних стадиях могут
быть показаны лишь гипотетически (рис. 32, 7, 8, 33, 10—14). Вплоть да
стадии булавовидного зародыша последний состоит из массы почти
однородных недифференцированных клеток (рис. 33, 13, 14). Лишь на стадии
заложения бугорков семядолей начинается дифференциация базальной
части зародыша: выделяются инициали корня, дифференцирующиеся за
счет гипокотиля, и начинается обособление корневого чехлика (рис. 33,15).
С началом роста семядолей становится заметным различие между
клетками периблемы и плерома, ранее не наблюдавшееся. Клетки периблемы
крупные, вакуолизированные, клетки плерома более мелкие, вытянутые,
с более густой цитоплазмой. Рис. 33, 16—21 демонстрирует динамику
роста зародыша С. gigantea — от сердечковидного до зрелого. По мере
роста зародыша с увеличением семядолей и гипокотиля дифференцируются
прокамбиальные пучки, идущие от центрального — гипокотильного —
в семядоли (рис. 33,16—20), где к моменту созревания зародыша образуют
разветвленную проводящую систему, напоминающую сетчатое жилкова-
78
Рис. 33. Проэмбриональная (1—11) и эмбриональная (12—27) фазы развития зародыша
у Cephalaria gigantea.
1—5 — вариабельность заложения первой перегородки; 13, 14 — булавовидный зародыш; is — ста->
дия предсердечка; 16 — стадия сердечна; 17—20 — стадия торпеды; 21 — зрелый зародыш; остальные,
обозначения см. в тексте.
ние листьев (рис. 33, 21); увеличивается число слоев в центральной части
чехлика за счет делений, идущих в горизонтальном направлении, четко
выделяются клетки апикальной меристемы корня (рис. 33, 16—21, табл. V,
2), дифференцируется точка роста стебля, она становится выпуклой
(рис. 33, 16—21, табл. V, 3). В клетках периблемы гипокотиля и в
семядолях по мере созревания зародыша накапливается большое количество
запасных питательных веществ — жиров и белков. Полная
дифференциация зародыша завершается к моменту созревания семени (рис. 33, 21, 34).
Зрелый зародыш у С. gigantea довольно крупных размеров (7Х2.5Х
1 мм), прямой. Состоит из зародышевого корня, гипокотиля, апекса побега
и двух больших овальных и мясистых семядолей с сильно разветвленной
системой проводящих пучков (рис. 33, 21, 34, 5). В зародышевом корне
можно наблюдать апикальную меристему, клетки которой располагаются
по типу закрытой меристемы, свойственной двудольным (Guttenberg,
1960), и корневой чехлик, который, охватывая довольно большую зону,
четко отделяется от соседних тканей; в не.м различается колумелла,
насчитывающая 15—20 слоев клеток. Апекс побега имеет выпуклую форму
и состоит из двуслойной туники и меристематической зоны, к которой
подходит центральный проводящий пучок, состоящий из тонкостенных
вытянутых клеток (табл. V, 3, 4). Клетки зрелого зародыша, кроме клеток
проводящих пучков, заполнены запасными питательными веществами —
жирами и белком. Сам зародыш ярко-зеленый, при этом зеленая окраска
обнаруживается на ранних стадиях его развития и к созреванию семени
становится наиболее интенсивной.
У всех остальных исследованных нами видов Dipsacaceae ход
эмбриогенеза прослежен не столь детально. Однако имеющиеся данные позволяют
считать, что и у них наблюдаются черты эмбриогенеза, свойственные
описанному выше виду: это вариабельность закладки первой
перегородки — от вертикальной до почти горизонтальной, образование
характерной для ворсянковых тетрады, поздняя гистологическая
дифференциация зародышей. Еще один признак характерен для представителей
семейства — слабое развитие подвеска, что особенно ярко выражено
в родах Dipsacus, Knautia и Succisa,— шаровидные зародыши у них
почти «сидячие» (табл. V, 1, 5). Зрелые зародыши у всех видов
дифференцированные и в общем однотипные, различаются в основном размерами
(рис. 34), а у Scabiosa rotata, S. olivierii и S. rhodantha и формой, а также
запасными веществами (рис. 34,1, 3).У этих видов округлые толстые
семядоли, а запасные вещества — белок в виде крупных алейроновых зерен
с глобоидами (табл. V, 7, 8), в отличие от видов Dipsacus, Cephalaria,
Knautia и Succisa, где основными запасными веществами являются жиры и
только частично белки и крахмал. У Cephalaria syriaca более сильно
дифференцирован апекс побега, где кроме точки роста стебля выделяются и
бугорки первых листьев (рис. 34, 4). Как и у Dipsacus sativus, у этого вида
в зрелом семени наибольшее количество жиров — содержание масел до
30% (Вульф, Малеева, 1969). У всех видов Dipsacaceae зародыши зеленые —
по признаку хлорофиллоносности относятся к хлороэмбриофитам (по
терминологии М. С. Яковлева, 1969).
Таким образом, на основании наших исследований и литературных
данных можно заключить, что представителям Dipsacaceae свойствен тип
эмбриогенеза, не входящий в строгие рамки классификации
эмбриональных типов Суэжа (Soueges, 1939), который сам Суэж называл
нерегулярным и который Джогансен (Johansen, 1950) включил в число Piperad-типа
как Scabiosa-вариацию. Однако в ключ-описание Джогансена необходимо
внести некоторые дополнения и поправки на основании имеющегося в
настоящее время материала. В ключе указано, что у зародышей этой
вариации суспензор и семядоли рудиментарные, но это справедливо лишь по
отношению к суспензору и ни в коей мере не может относиться к семядолям,
которые у всех видов хорошо развиты; кроме того, необходимо учесть и
80
Табл. II. Фрагменты пыльников на разных стадиях развития.
1 — Knautia arvensis, материнские клетки микроскор и формирование стенки пыльника-
2—& — Marina lehmanniana: г — двуклеточная пыльца, тапетум в постенном слое в
эпидермисе крахмал; 3 — двуклеточная пыльца, лизис тапетума; 4 — созревающий пыльник.
»*-Va*S
~ ЩЩЧ*
Табл. III. Созревающие и зрелые зародышевые мешки ворсянковых,
1,2 — Knautia arvensis; 3 — Succisa pratensis; 4 — Dipsacus laciniatus.
Табл. IV. Эндосперм ворсянковых - и мориновых.
^?гвд"™~^^^
Табл. V. Зародыши ворсянковых.
1 — шаровидный зародыш и эндосперм, заполняющий весь зародышевый мешок у Succisa vratensis-
2 — сердечковидный зародыш Cephalaria gigantea; з — точка роста стебля и 4 — зародышевый корень
в зрелом зародыше у С. gigantea; 5 — шаровидный зародыш Knautia arvensis; в—9 — зрелый 8ародыш
,™oloso гоШа: * — общий вид, 7 — участок семядоли, 8 — точка роста стебля, 9 — зародышевый
корец Ett
Табл. V" (продолжение).
Табл. VI. Зародыш Morina kokanica.
1 — сердечковидный; г — о небольшими семядолями; 3 — точка роста и 4 — зародышевый, корень
на стадии торпеды; 5—7 — зрелый зародыш; 5 — точка роста стебля, в — зародышевый корень, 7 —
общий вид зародыша.
Табл. VI (продолжение).
0.6 mm
L 1
амс
Рис. 34. Зрелые семена ворсянковых.
J — Seabiosa olivierii; 2 — Knautia macedonica; 3 — Seabiosa roiata; 4 — Cephalaria iyriaca; S — C. gi*
gantea; ав — эндосперм; з — зародыш; амк — апикальная меристема корня; амс — апикальная
меристема стебля; кч — корневой чехлик; пк — прокамбиальные пучки.
тот факт, что первая в зиготе перегородка не просто наклонная, а может
варьировать от вертикальной через наклонную до почти горизонтальной;
наконец, выяснено, что в проэмбриональной фазе после тетрады четких
регулярных делений, предшествующих раннему заложению гистогенов,
не наблюдается, и это обусловливает в дальнейшем позднюю
гистологическую дифференциацию зародыша.
В итоге краткая характеристика Scabiosa-вариации Piperad-типа
будет следующей: первая перегородка в зиготе вариабельна — от
вертикальной через наклонную до почти горизонтальной, вторичные стенки
перпендикулярны (или наклонные) к первичной стенке в каждой
дочерней клетке; тетрада глобулярная; дальнейшие деления нерегулярные;
позднее заложение гистогенов и поздняя гистологическая
дифференциация зародышей; суспензор рудиментарный; семядоли хорошо развиты;
зародыши зеленые. Вероятно, в дальнейшем, при накоплении большего
количества фактов по эмбриогенезу семейств, включенных в Piperad-тип,
выяснится, что эмбриогенез в сем. Dipsacaceae настолько своеобразен,
что его следует выделить в отдельный тип.
У Morina kokanica зигота делится поперечной перегородкой на две
неравные клетки — а ж Ъ (рис. 35, 1). Апикальная клетка а меньше
размером, содержит густую цитоплазму и делится продольной перегородкой
(рис. 35, 2); базальная клетка Ъ больше и с крупной вакуолью, делится
поперечной перегородкой на две расположенные одна над другой клетки
т и г. В результате образуется тетрада (рис. 35, 3), свойственная II мегар-
хетипу I периода I группы серии А (т. е. Ах) классификации Суэжа
(Soueges, 1939). Проследим дальнейшую сегментацию и долю участия
производных а и Ъ в образовании зародыша. Все четыре клетки тетрады
делятся снова, в' результате чего в апикальном ярусе образуются клетки-
квадранты q, средний ярус т содержит две смежные клетки, а клетка i
делится поперек, образуя дочерние клетки и и и' (рис. 35, 4). Четыре
клетки яруса q делятся, образуя стадию октантов, причем стенки,
разделяющие клетки квадрантов, ориентируются более или менее по диагонали
(рис. 35, 5). Две клетки яруса т делятся по вертикали, образуя 4 клетки,
лежащие под октантами (рис. 35, 5). Клетка п также делится
вертикальной стенкой, а п' немного позже — поперечной, образуя клетки о и р.
В ярусах q и т закладываются периклинальные перегородки, отделяющие
наружный слой клеток — эмбриодерму (рис. 35, 6), что служит
завершением проэмбриональной фазы развития зародыша у М. kokanica.
Таким образом, клетки яруса q — производные клетки а — дают
начало апексу побега и семядолям, клетки яруса т — производные Ъ —
гипокотилю, яруса п — инициалям корня и чехлику, о и р — подвеску.
Тем самым развитие зародыша Morina проходит по схеме
са = рсо -\- pvt^
сЪ = phy -f- ice -\- tec -f- со -\- s
и соответствует II мегархетипу I периода серии Ах классификации
Суэжа или Asterad-типу Джогансена и Ямадзаки (Jamazaki, 1974). В отличие
от ворсянковых у М. kokanica можно проследить четкую сегментацию
и вычленение инициалей также в соответствии с Asterad-типом (Soueges,
1934; Jamazaki, 1974). Так, инициали стеблевого апекса формируются
в соответствии :С 3-м типом, а инициали корневого апекса — с 6-м типом
классификации упомянутых авторов, т. е. следующим образом.
Инициали стеблевого апекса образуются в результате деления
квадрантов диагональными перегородками на два элемента — а и р. Эти
клетки в дальнейшем дают стеблевой апекс и область семядолей (рис. 35, 6).
Инициали стеблевого апекса закладываются после вычленения эмбриодермы,
в производных от а, непосредственно под ней (рис. 35, 8, iep — инициали
стеблевого апекса).
82
После обособления эмбриодермы происходит вычленение инициалей
корневого апекса в этаже п. Две лежащие рядом клетки делятся
поперечно, причем одна из них делится на неравные клетки наклонной
перегородкой, в результате чего образуется гипофизарная клетка, дающая
начало инициалям корня, которая сразу отличается величиной и более
крупным ядром (рис. 35, 7). В дальнейшем она становится еще большей
и с более густой цитоплазмой и крупным ядром, чем остальные клетки
зародыша (рис. 35, 8). Нижние производные клеток этажа п дают начало
и корневому чехлику, что соответствует Calendula-вариации Asterad-типа
(Jamazaki, 1974), т. е. n=iec-\-co.
Дальнейшее развитие зародыша сопровождается его гистологической
дифференциацией. Уже на булавовидной стадии дифференцируется
апикальная меристема корня, заметно вычленение корневого чехлика, четко
проявляется разница между слоями периблемы и плерома (рис. 35,10, 11).
Далее развитие зародыша происходит так же, как и у большинства
двудольных: дальнейший рост сопровождается дальнейшей дифференциацией
зародыша и органогенезом, и в общем принципиально не отличается от
такового у ворсянковых (рис. 35, 12—17). Закладываются бугорки и
развиваются семядоли, формируется зародышевый корень и апекс побега,
дифференцируется прокамбиальная система, зародыш заметно и
значительно увеличивается в размерах (рис. 35, 12—17, табл. VI, 1—4).
Полная дифференциация зародыша также завершается к моменту созревания
семени (рис. 31, 10, 35, 17).
Развитие зародыша у М. lehmanniana протекает идентично
вышеописанному виду. Исследовать эмбриогенез у М. persica не представилось
возможным, так как материал был собран весной, до начала
плодоношения. У М. kokanica отмечались случаи образования трехсемядольных
зародышей.
Зрелый зародыш у видов Morina крупный (5x0.8мм), прямой, состоит,
так же как и у С gigantea, из зародышевого корня, гипокотиля, апекса
побега и двух округлых тонких и больших листовидных семядолей
(рис. 35, 17, табл. VI, 7). Зародышевый корень состоит из апикальной
меристемы и корневого чехлика, четко выделяющегося на срезах (рис. 35,17,
табл. VI, 6). В центральной части гипокотиля проходит прокамбиальный
пучок, который достигает апикальной меристемы стебля и разветвляется
в семядоли, где образуются прокамбиальные пучки, напоминающие
сетчатое жилкование листьев (рис. 35,17, табл. VI, 7). Точка роста стебля более
выпуклая, чем у предыдущего вида (рис. 35, 17, табл. VI, 5). В периблеме
гипокотиля и в семядолях накапливаются запасные питательные
вещества, в основном это белки и частично крахмал (табл. VI, 5, 6). Зародыш
не содержит хлорофилла, лейкоэмбриофит (по терминологии М. С.
Яковлева, 1969).
Таким образом, полученные данные позволяют сделать вывод, что
видам Morina присущ четко проходящий эмбриогенез, соответствующий
Asterad-типу. Поэтому мы не можем согласиться с интерпретацией
рисунков по эмбриогенезу у М. longijolia в работе индийских эмбриологов
(Vijayaraghavan, Sarveshwari, 1968). Авторы считают, что эмбриогенез
у этого вида протекает по Solanad-типу, однако приведенные рисунки
не могут с полной достоверностью служить обоснованием такого
утверждения, так как не охватывают достаточно подробно фазы эмбриогенеза.
Вместе с тем строение зрелого зародыша, изображенного схематично,
настолько идентично строению таковых у М. kokanica и М. lehmanniana,
что позволяет предположить, что и тип эмбриогенеза у этих видов должен
быть одинаковым.
Сравнивая данные по эмбриогенезу у представителей Dipsacaceae и
Morinaceae, видим, что этот процесс протекает у них различно и что
каждому семейству свойствен определенный тип эмбриогенеза-: Piperad-тип
Scabiosa-вариация — ворсянковым и Asterad-тип — мориновым. Кроме того,
84
у всех ворсянковых зародыши содержат хлорофилл, тогда как у мориновых
они бесхлорофильные.
В заключение еще раз кратко остановимся на результатах
исследования эндоспермогенеза и эмбриогенеза у представителей ворсянковых и
мориновых.
Обоим семействам свойственно образование изначально-клеточного
эндосперма, однако имеются существенные различия: 1) в способе
заложения первой перегородки при делении первичного ядра эндосперма:
у ворсянковых она закладывается вдоль, у мориновых — поперек
зародышевого мешка; 2) в строении эндосперма в зрелом семени: у
ворсянковых он с гладкой поверхностью, у мориновых — с руминированной.
Тип эмбриогенеза у этих двух семейств разный: у ворсянковых —
Piperad-тип, Scabiosa-вариация; у мориновых — Asterad-тип. И еще один
существенный признак отличает зародыши ворсянковых и мориновых:
у ворсянковых они зеленые (хлороэмбриофиты), у мориновых
бесхлорофильные (лейкоэмбриофиты).
ПОЛОЖЕНИЕ СЕМЕЙСТВ DIPSACACEAE
И MORINACEAE В ФИЛОГЕНЕТИЧЕСКОЙ СИСТЕМЕ
ПОКРЫТОСЕМЕННЫХ ПО ДАННЫМ
ЭМБРИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
Результаты сравнительно-эмбриологического исследования
представителей Dipsacaceae и Morinaceae, изложенные в предыдущих разделах, как
видим, выявили однородность признаков, присущих представителям
родов Dipsacaceae (Cephalaria, Dipsacus, Scabiosa, Knautia, Succisa,
Pterocephalus), что еще раз подтверждает естественность этого таксона.
Вместе с тем обнаружены признаки, которые существенно отличают род
Morina от ворсянковых; из них в первую очередь следует упомянуть
строение стенки пыльника, тип тапетума в пыльнике, развитие халазы
в семяпочке, особенности развития антипод, строение эндосперма, тип
эмбриогенеза (см. таблицу на с. 88).
В то же время представителям обоих семейств свойственны
эмбриологические признаки, характерные для большинства спайнолепестных:
это тенуинуцеллятная семяпочка с одним интегументом,
дифференциация одной материнской клетки мегаспор, отсутствие кроющей клетки, на^
личие интегументального тапетума вокруг зародышевого мешка, клеточный
эндосперм, крупные, хорошо дифференцированные зародыши, трехклеточ-
ные пыльцевые зерна и др.( Поддубная-Арнольди, 1964, 1976). Однако
несмотря на это почти всем эмбриональным структурам каждого
исследованного семейства присущи свои особенности развития или строения.
С помощью сравнительно-эмбриологического метода исследования
нам удалось получить достаточно большое количество признаков, которые
говорят о самостоятельности рода Morina и подтверждают
целесообразность выделения его в отдельное семейство Morinaceae.
Как уже упоминалось, известно значительное количество признаков,
полученных в результате исследований видов Dipsacaceae и Morinaceae
другими методами, которые также существенно отличают род Morina
от собственно ворсянковых. В первую очередь — это морфологические
признаки, отмеченные рядом авторов (Van Tieghem, 1909; Бобров, 1957;
Novak, 1954, 1961; Vieth, 1963, 1963—1964, 1964; Verlaque, 1977b),
касающиеся типа соцветия у представителей обоих семейств, строения
цветка, андроцея и гинецея, формы плодов и др. Это и данные
палинологического исследования, которое показало, что пыльцевые зерна мори^
новых отличаются от таковых ворсянковых отсутствием бакуль в сэкзине
и крышечек на поровых мембранах, наличием своеобразных апертур,
85
утолщений эндосэкзины в области этих апертур, отсутствием шипов
в скульптуре экзины и иной формой пыльцевых зерен. Лишь пыльца
наиболее примитивной секции рода Morina — Acanthocalyx имеет ряд
близких черт с пыльцой ворсянковых (Винокурова, 1959).
Данные биохимических исследований свидетельствуют о том, что видам
^ворсянковых присущи хромоген «дипсакан», который у мориновых
отсутствует на всех стадиях развития растения (Tammes, 1909, 1911),
и горькое вещество гликозидной природы, описанное под названием
«скабиозида» или «цефаларозида», которое у видов рода Morina не
обнаружено (Lys, 1951).
Анатомическое исследование выявило у мориновых наличие
секреторных клеток специфического строения, которые располагаются в слое
эпидермиса и обнаружены во многих частях растения. Подобные клетки
не найдены ни у одного из видов ворсянковых (Bancher, Holzl, 1959;
Holzl 1959).
Отличаются мориновые и основным числом хромосом. Если у
ворсянковых в родах Dipsacus, Pterocephalus, Picnocomon, Scabiosa и Cepha-
laria x=9 (кроме уклоняющихся видов Cephalaria, где х=5, и Scabiosa,
где х=7,8); в родах Knautia, Succisa, Succisella x=10 (кроме
уклоняющихся видов Knautia, где x=8), а в роде Tremastelma x=7, то у Morina
x=17 (Кахидзе, 1929; Ehrendorfer, 1964b; Хромосомные числа. . ., 1969;
Frey, 1969; Verlaque, 1977a).
Таким образом, в настоящее время получен такой комплекс признаков,
отличающих род Morina от ворсянковых, что факт выделения этого
рода в отдельное семейство Morinaceae не должен вызывать сомнений.
Вопрос о ближайшем родстве сем. Dipsacaceae (включая Morina)
в филогенетических системах разных авторов решается довольно
единообразно. Уже с середины прошлого века, начиная с систем Бентама и
Гукера (Bentham, Hooker, 1862—1883) и Эйхлера (Eichler, 1883),
подчеркивается его родство с сем. Valerianaceae, и во всех системах нового
времени эти два семейства сближаются друг с другом. Это обусловливают
в первую очередь внешнеморфологические признаки, особенно наличие
у связующего эти семейства рода Triplostegia (иногда выделяемого
и в отдельное семейство) обверточки семянок, соответствующей внешней
чашечке ворсянковых. Ворсянковым и валериановым свойственны
остающиеся при плодах чашечки, обычно превращающиеся в перистый паппус,
5—4-членные цветки с тенденцией к редукции числа элементов, псевдо-
мономерный гинецей и односемянные плоды. Существенно также
сходство этих семейств по вегетативным органам, пыльце, основным числам
хромосом.
Различия же обоих семейств, кроме значительно более продвинутых
соцветий и далее олигомеризованных цветков, сводятся прежде всего
к наличию (хотя иногда и скудного) эндосперма в семенах у ворсянковых
и к отсутствию его в семенах валериановых, а также к характерным
для каждого семейства биохимическим признакам (наличие соединений
валериановой кислоты у валериановых и дипсакана у
ворсянковых).
Эмбриологические признаки дополняют различия этих семейств (см.
таблицу). Прежде всего это особый тип эмбриогенеза у ворсянковых
(Piperad-тип, Scabiosa-вариация), часто протекающий нерегулярно; у
валериановых эмбриогенез соответствует, хотя также с некоторыми
отклонениями, Asterad-типу (Soueges, 1923, 1941). Спорогенная ткань в
пыльнике у ворсянковых расположена в один ряд, тогда как у валериановых
она многослойна. Различен и способ реорганизации тапетума в
пыльниках: у ворсянковых клеточный многоядерный тапетум реорганизуется
в тапетальную ткань, у валериановых — в ложный периплазмодий
(см. также: Skalinska, 1958; Камелина, Малдыбекова, 1980). Однако
несмотря на эти отличия основные эмбриологические процессы у предста-
86
жителей обоих семейств проходят сходно (Asplund, 1920), обоим им
свойственны зеленые зародыши, и близкое положение их в филогенетических
системах вполне оправдано.
Семейство Morinaceae отличается от Dipsacaceae и Valerianaceae по
эмбриологическим признакам (как это видно из таблицы), а также по
внешнеморфологическим, кариологическйм и палинологическим более
резко, чем ворсянковые и валериановые друг от друга.
Относительно положения валериановых и ворсянковых в порядках
различных филогенетических систем существуют разные мнения.
Старые авторы (например, Эйхлер) сближали их с Compositae в большом
порядке Aggregatae (Eichler1, 1883). По другой традиции, идущей еще от
Бентама и: Гукера, оба семейства сближались с мареновыми, обычно в.
составе большого порядка Rubiales. Так поступало и большинство
авторов филогенетических систем нового времени, начиная с Бэсси и Галира
(Bessey, 1915; Hallier, 1912), из отечественных — Б. М. Козо-Полянский
(1922), М. И. Голенкин (1937), Н. А. Буш (1944) и А. А. Гроссгейм (1945).
Однако уже давно возникла и традиция обособления Dipsacaceae и
Valerianaceae от Rubiaceae, причем ряд авторов, например JiHHflneu.(Lindley,
1836), первый выделивший порядок Dipsacales, Энглер (Engler, 1892),
Н. И. Кузнецов (1914), Хатчинсон (Hutchinson, 1926), отделяли их от
Caprifoliaceae. После работ Накаи (Nakai, 1952), Вагеница (Wagenitz,
1959, 1964), новейших вариантов систем А. Л. Тахтаджяна (1966, 1970),
Эрендорфера (Ehrendorfer, 1971), Дальгрена (Dahlgren, 1975a) состав
порядка Dipsacales в основном установился и сюда относят семейства
Caprifoliaceae,. Adoxaceae, Valerianaceae, Dipsacaceae, а также Morinaceae,
признаваемое не всеми авторами.
Чтобы закончить перечень групп, с которыми сближались
ворсянковые и валериановые, необходимо упомянуть о том, что еще Хатчинсон
отнес в один порядок с ними небольшое семейство Calyceraceae, на
сходство с которым указывал и изучавший ворсянковые Долль (Doll, 1927).
Это семейство сближается с ворсянковыми в составе большого порядка
Rubiales и| Новаком (Novak, 1961). А. Л. Тахтаджян, однако, считает
необходимым выделить это семейство в особый порядок на основании
морфологии вегетативных органов и цветка.
Все семейства, с которыми сближают валериановых и ворсянковых,
в настоящее время в той или иной степени изучены эмбриологически
(Davis, 1966). . -
Множество работ посвящено эмбриологии Asteraceae (Compositae),
семейства, огромного по числу видов и поэтому' очень разнообразного
морфологически, кариологически, палинологический, конечно,
эмбриологически (Поддубная-Арнольди, 1964, 1976; Davis, 1966). В эмбриональных
процессах Asteraceae есть много черт, общих с Dipsacaceae, однако они
при всем многообразии признаков отличаются в основном реорганизацией
тапетума в амебоидный и ложный периплазмодий, анатропной
прямостоячей семяпочкой, типом эмбриогенеза, наличием Bi различных группах
семейства антиподальных или синергидных гаусториев, а также обычно
отсутствием эндосперма в зрелых семенах и хлоропластов в зародыше,
наличием апомиксиса и полиэмбрионии (см. таблицу). Если учесть, что
при всем разнообразии морфологических признаков сем. Asteraceae
свойственны такие важные признаки, как синандрия, наличие
разнообразных придатков у пыльников, полностью отсутствующих у
ворсянковых, то следует признать, что близость этих семейств относительна
и связана, вероятно, с конвергенцией, что давно уже признает
большинство систематиков. ;
Также очень разнообразное'семейство Rubiaceae, ранее считавшееся
непосредственно родственным Dipsacaceae и Valerianaceae, в последнее
время убедительно сближается, с Gentianales (прежде всего с Loganiaceae)
и отделяется от собственно Dipsacales Вагеницем. Внешнеморфологиче-
87;
Эмбриологические признаки семейств порядка Dipsacales и нзкэтэры*
Семейство
Dipsaca-
сеае
Valeriana-
сеае
п = 7, 8, 9, 12
14, 16, 21, 23
24, 28, 32
Моппа-
сеае
Adoxaceae
Caprifo-
liaceae
Число
хромосом
п = 5, 7, 8, 9,
10,18, 20, 30, 32
п = 17
п = 18 (27, 28)
п = 8, 9, 12,
16, 18, 19, 20,
27, 36
Стенка
пыльника
Тапетум
в пыльнике
Материнские
клетки
микроспор,
образование
тетрад
Calyeera-
сеае
Asteraceae
п = 8, 15, 18,
21
п = 4,.-6, 8, 10,
12, 14, 14, 16,
20, 22, 24,
28, 30, 32,
36, 38,
. . 60, 62,
.88, 90. . .
102, 106. . .
130-140. . .
18,
26,
34,
40. .
64. .
Образуется
центробежно
по типу
двудольных. В
зрелом
пыльнике 2-слой-
ная
То же
По типу
двудольных. В
зрелом
пыльнике 3-слой-
ная, все слои
с фиброзными
утолщениями
По типу
двудольных. В
зрелом
пыльнике 2-слой-
ная
По типу
двудольных; 2-
слойная; у
Weigela и Ш-
ervilla 3-слой-
ная, все с
фиброзными
утолщениями
В зрелом
пыльнике 2-
слойная
По типу
двудольных. В
зрелом
пыльнике 2-слой-
ная
Клеточный,
многоядерный
с
реорганизацией в тапе-
тальную
ткань
Клеточный
многоядерный
с
реорганизацией в
ложный
периплазмодий
Клеточный 2—
4-ядерный, без
реорганизации, секретер-
ный
Клеточный,
2-ядерный, с
реорганизацией в
ложный
периплазмодий (?)
Клеточный,
2—4-ядерный,
без
реорганизации; у 1а-
nicera и Sym-
phoricarpus с
реорганизацией в
ложный
периплазмодий
Клеточный,*
секреторный
Клеточный,
многоядерный, без
реорганизации
или с
реорганизацией в
амебоидный,
редко в
ложный
периплазмодий
1 ряд с
утолщениями.
Симультанное,
тетрады тет-
раэдрические
и изобилате-
ральные
Многослойная
ткань.
Симультанное,
тетрады тетра-
эдрические
1(2) ряда.
Симультанное,
тетрады тетра-
эдрические
Симультанное
Зрелая
пыльца
Семяпочка
3-клеточ-
ная
То же
То же
2-клеточ-
ная
3-клеточ-
ная
Анатропная, те-
нуинуцеллятная,
висячая, нор-
мально-халазо-
вая, с эндотелием,
с одним интегу-
ментом, в нем
крахмал, с
хорошо развитой
проводящей системой
То же
Анатропная, те-
нуинуцеллятная,
висячая, с одним
интегументом,
массивно-халазо-
вая, с эндотелием,
с крахмалом, с
сильно развитой
проводящей
системой
Анатропная, те-
нуинуцеллятная,
висячая, с одним
интегументом
Анатропная,
висячая, с одним
интегументом, те-
нуинуцеллятная,
у Viburnum крас-
синуцеллятная (?)
Анатропная,
висячая, с одним
интегументом, те-
нуинуцеллятная
Анатропная,
прямостоячая, тенуи-
нуцеллятная, о
одним
интегументом, с эндотелием
семейств спайнолепестных
Женский
археспорий
Одноклеточный, без
кроющей клетки
Тип
зародышевого
мешка
Polygonum
То же
Одноклеточ-и
ный, без
кроющей клетки,
иногда с
кроющей
Одноклеточный, без
кроющей клетки
Одно-многоклеточный
То же
Adoxa
Polygonum
Allium
Adoxa -
Polygonum
Polygonum
Allium, Pape-
romia, Drusa,
Frltillaria,
Adoxa
Антиподы
3 клетки,
становятся 2—4-
ядерными
То же
Эндосперм
3 клетки
становятся
многоклеточными
зародышепо-
добными
структурами
2 клетки, одна
всегда
крупнее
3 клетки,
эфемерные
То же
3 клетки,
становятся 2—4-
многоядерны-
ми или
многоклеточными
и
многоядерными
Клеточный, в
зрелом семени
сохраняется,
у Scabiosa
скудный, с
гладкой
поверхностью
Клеточный,
скудный или
нет в зрелом
семени
Клеточный, в
зрелом,"семени
сохраняется,
руминирован
по типу
ложной румина-
ции
Клеточный,
обильный, с
гладкой
поверхностью
Клеточный,
обильный, у
Viburnum
руминирован по
типу Spigelia
Клеточный
Ядерный;|кле-
точный;
скудный или
отсутствует в
зрелом семени
Эмбриогенез,
зрелый
зародыш
Scabiosa-ва-
риация Pipe-
rad-типа,
часто
нерегулярный.
Зародыш
крупный, прямой,
дифференцированный
Asterad-тип
или
нерегулярный.
Зародыш
прямой,
ренцированный
Asterad-тип.
Зародыш
крупный,
прямой,
ренцированный
Asterad-тип,
Зародыш
ференцированный
Asterad-тип и
нерегулярный. Зародыш
не крупный,
прямой,
ференцированный
? Solanad-тип.
Зародыш
ференцированный
Asterad-тип.
Зародыш
крупный,
прямой,
ренцированный
Хло
рофилл
в
родыше
Есть
Есть
Нет
Нет
Нет
Примечание
Яйцевой аппарат
сильно
дифференцирован, синер-
гиды часто
дегенерируют до
оплодотворения
В центральной
клетке
зародышевого мешка
крахмал
Единичны случаи
полиэмбрионии у
Adoxa
Синергидный, ан-
типодальный
гаусторий.
Обтуратор. Апомиксис.
Партеногенез. По-
лиэмбриония
7 О. П. Камелина ;gg
Семейство
Rubiaceae
Acantha-
ceae
Tubiflorae
Число
хромосом
n = 9, 10, 11,
12, 13, 14, 15,
18, 20, 22, 28,
33, 34, 36, 42,
54, 77
n = 9, 10, 11,
12, 13, 14, 15,
16, 17, 18, 19,
20, 21, 22, 24,
25, 26, 28, 30,
31; 40, 56, 68
Стенка
пыльника
По типу
двудольных. В
зрелом
пыльнике 2-слой-
ная
По типу
двудольных. В
зрелом
пыльнике 2-слой-
ная
По типу
двудольных, в
зрелом
пыльнике 2-слой-
ная
Тапетум
в пыльнике
Клеточный
секреторный,
одноядерный,
без
реорганизации или с
реорганизацией в
амебоидный
Клеточный,
секреторный,
2—4-ядерный
Клеточный,
секреторный,
иногда с
реорганизацией
в амебоидный
Материнские
клетки
микроспор,
образование
тетрад
Симультанное
То же
» »
Зрелая
пыльца
3(2)-клеточная
2-клеточ-
ная
(3)2-клеточная
Семяпочка
Гемианатропная,
анатропнан, с
одним интегументом
(до редукции), те-
нуинуцеллятная
(до редукции),
эндотелия нет
Анатропная, ам-
фитропная, кам-
пилотропная, те-
нуинуцеллятная,
с одним
интегументом
Анатропная,
гемианатропная,
реже кампило-
тропная, тенуи-
нуцеллятная, с
одним
интегументом, с эндотелием
ские признаки, свидетельствующие в пользу отделения Rubiaceae от
остальных семейств порядка Dipsacales, следующие: интерпетиолярные
прилистники, иной тип железистого опушения (пучками железок), акти-
номорфные цветки (кроме трибы Henriquezieae), нередуцированный андро-
цей. Очень важны отличия в биохимических признаках: виды Rubiaceae
исключительно богаты специфическими алкалоидами, которые у
ворсянковых и валериановых отсутствуют. Различия дополняют и
эмбриологические признаки: разные типы женского археспория, секреторный без
реорганизации или с реорганизацией в амебоидный тапетум в
пыльниках, разнообразные типы зародышевых мешков, часто многоклеточные
антиподы, ядерный эндосперм, обильный в зрелых семенах, а иногда ру-
минированный по Spigelia-типу руминации, Solanad-тип эмбриогенеза,
наличие простых или сложных суспензорных гаусториев, отсутствие
хлоропластов в зародышах и пр. (см. таблицу) (Fagerlind, 1937; Wage-
nitz, 1959; Periasamy, 1964; Андронова, 1972, 1973, 1975, 1977, 1978).
Эмбриология сем. Calyceraceae изучена далеко не полно (Warming,
1913; Dahlgren, 1915, 1923). Однако некоторые отличия от Dipsacaceae
можно отметить и по этим неполным данным. В частности, у Calyceraceae
зрелые пыльцевые зерна двуклеточные, антиподы эфемерны, Solanad-
тип эмбриогенеза. Тип эмбриогенеза отличает их даже от сем. Astera-
сеае,к которому (особенно к трибе A mbrosieae) они морфологически очень
близки (см. таблицу).
Родство Dipsacaceae и Valerianaceae, с одной стороны, и Caprifoliaceae
и Adoxaceae, с другой, которое принимается во многих новейших системах,
обосновать эмбриологически, однако, весьма не просто. Это связано с тем,
что не столь и обильное по числу родов и видов сем. Caprifoliaceae, весьма
гетероморфно по структурам, свойственным различным родам, а изучены
в нем, да и то недостаточно полно, к сожалению, лишь треть родов,
которые показали значительное различие в эмбриологических признаках
90
Продолжение таблицы
Женский
археспорий
Многоклеточ- Polygonum
ный, редко Allium, oco-
Тип
зародышевого
мешка
Антиподы
Эндосперм
одноклеточный, без
кроющих клеток
Одноклеточный
бые типы
Polygonum
Эмбриогенез,
зрелый
зародыш
Хло
рофилл|
в
родыше
Одноклеточный, реже
многоклеточный
Polygonum
(реже Drusa,
Allium)
3 клетки,
становятся
многоклеточными
и
многоядерными; иногда
эфемерные
3 клетки,
иногда стано
вятся много
ядерными,
эфемерные
или длительно
существующие
3 клетки,
эфемерные, реже
многоклеточные и
многоядерные,
длительно
существующие
Ядерный
(реже
клеточный),
обильный до
скудного, руми-
нирован по
типу Spigelia
Клеточный,
скудный или
нет его в
зрелом семени
Клеточный,
скудный, реже
обильный или
нет его в
зрелом семени;
редко руми-
нированный
Примечание"
Solanad-тип.
Зародыш
крупный или
мелкий,
ференцированный
Onagrad-, So-
lanad-типы.
Зародыш
изогнутый,
ренцированный
Onagrad-, So-
lanad-типы.
Зародыш от
мелкого
дифференцированного до
крупного
ференцированного
Нет
Нет
Нет,
очень
редко
есть
I
Простые и
сложные суспензорные
гаустории. Анти-
подальные
гаустории. Полизмбрио-
Эндосперма льные-
микропилярные и
халазальные
гаустории
различных типов.
Сложные суспензорные
гаустории
Огромное
разнообразие эндоспер-
мальных
гаусториев. Редко
сложные суспензорные
гаустории
(Sunesson, 1933; Moissl, 1941; Soueges, 1945; Crete, 1954; Wunderlich,
1959, и др.).
He все роды жимолостных отличаются от ворсянковых и валериановых
одинаковым набором признаков. Так, большей части жимолостных,
видимо, присущ клеточный секреторный 2-, реже 4-ядерный тапетум
в пыльниках, но у видов Lonicera и Symphoricarpus он реорганизуется
в ложный периплазмодий. Видам Diervilla свойственна трехслойная
с фиброзными утолщениями стенка зрелого пыльника (Голенкин, 1937),
тогда как у остальных видов (возможно, только кроме Weigela) она
двуслойная; у видов Weigela, Leicesteria и отчасти Symphoricarpus семяпочки
в завязи многочисленные; для некоторых видов Viburnum характерны'
крассинуцеллятные семяпочки. Почти у всех исследованных видов
антиподы эфемерны. У видов жимолостных эндосперм в зрелых семенах
обильный, а не скудный, как у некоторых ворсянковых, или
отсутствующий, как у валериановых; у Viburnum он руминирован (по типу Spigelia),
Зародыши у всех видов без хлоропластов. Кроме того, у видов Sambucus
Adoxa-тип развития зародышевого мешка (см. таблицу).
Все эти признаки, как и существенные различия в морфологии
гинецея и плода, с одной стороны, отличают Caprifoliaceae (и очень близкое
к роду Sambucus семейство Adoxaceae) от Dipsacaceae и Valerianaceae,
а с другой — указывают на значительную гетерогенность Caprifoliaceae,
которая проявляется и в строении древесины, вегетативных органов,
соцветий, чашечек.
Интересно, что некоторые характерные черты в эмбриональных
процессах, которые отличают жимолостных от ворсянковых, общи у
жимолостных с мориновыМи. Это и секреторный клеточный двуядерный тапетум,
и трехслойная зрелая стенка пыльника (общий признак с Diervilla,
Weigela), и достаточно обильный эндосперм в зрелом семени, и правильно
протекающий по Asterad-типу эмбриогенез, и бесхлорофильные зародыши.
7*
91
Однако характерные длительно существующие и многоклеточные
антиподы, руминированный по типу ложной руминации эндосперм, и, видимо,
массивная халаза не свойственны ни жимолостным, ни ворсянковым и
валериановым.
Вообще в сем. Caprifoliaceae у видов отдельных родов можно найти
и ряд внешнеморфологических признаков, которые могут быть расценены
как близкие к признакам мориновых. Так, чашечки, подобные таковым
у АЪеЫа, вполне могут быть сопоставлены с чашечкой мориновых. У ряда
жимолостных ( Abelia, Weigela, виды Lonicera) имеются
специализированные прицветные листья, которые иногда срастаются в общие обверточки,.
аналогичные внешней чашечке морин. Но все же ни один современный род
жимолостных не может, конечно, считаться предковым типом мориновых.
В лучшем случае таковыми могли быть вымершие типы предковых
жимолостных; еще вероятнее общее происхождение предковых типов морин
и жимолостных от какого-то неизвестного нам типа, равно предкового и
для валериановых.
О том же свидетельствуют и эмбриологические характеристики семейств,
исходя из которых мы можем говорить о большем родстве мориновых
с жимолостными, чем с валериановыми и ворсянковыми.
Характерные внешнеморфологические признаки мориновых — резко
зигоморфный (двугубый) венчик, наличие двух фертильных из
потенциально возможных четырех тычинок (две стерильные тычинки иногда
представлены рудиментами), одногнездная завязь, развивающаяся из
одного из трех плодолистиков, несомненно могут быть сопоставлены с
признаками различных родов жимолостных, но одновременно они напоминают
черты строения некоторых Tubiflorae (Lamiaceae, Scrophulariaceae,
отчасти Acanthaceae) (Doll, 1927). Поэтому вероятно, что в основной линии
развития спайнолепестных неоднократно параллельно возникали весьма
сходные структуры, высоко специализированные к высшим насекомым
типа ночных бабочек (бражников). Одним из таких вариантов и является
цветок морин. Губоцветные или акантовые, достигшие столь же высокой
специализации цветка, конечно, не близко родственны моринам. В
эмбриональном развитии Tubiflorae в целом есть ряд специфических
признаков, которые отсутствуют у морин, равно как и у жимолостных,
ворсянковых и валериановых (см. таблицу): это многослойная спорогенная ткань
в пыльниках, двуклеточная пыльца, разные типы семяпочек, в том числе
гемианатропные, кампилотропные, но главное — Onagrad (реже Solanad)-
тип эмбриогенеза, наличие сложных суспензорных гаусториев, часто
недифференцированные зародыши и огромное разнообразие эндоспермаль-
ных гаусториев (см.: Davis, 1966; Никитичева, 1970; Терехин, 1977,
и др.). В таком же более обособленном и богато развитом семействе, как
Acanthaceae, эмбриональные процессы еще более специализированы,
структуры, образующиеся при этом, еще более сложны. В первую
очередь это относится к типу образования эндосперма и наличию различных
типов эндоспермальных гаусториев, Onagrad- и Solanad-типам
эмбриогенеза с образованием сложных суспензорных гаусториев, изогнутому
зрелому зародышу, двуклеточной пыльце и др. (Mohan Ram, Wadhi,
1964, 1965; Karlstrom, 1972, 1973, 1974, и др.).
Подводя итоги вышесказанному, можно отметить следующее:
1) по совокупности всех признаков мориновые должны быть отделены
от ворсянковых в особое семейство;
2) ближайшее родство ворсянковых и валериановых доказывается
как совокупностью морфологических признаков, так и ходом
эмбриональных процессов;
3) совокупность эмбриологических признаков свидетельствует о
большем родстве мориновых с жимолостными, чем с валериановыми и
ворсянковыми;
92
4) отдаленное родство на уровне общих предковых типов есть,
вероятно, у жимолостных и мориновых, с одной стороны, и у ворсянковых
и валериановых, с другой;
5) несмотря на ряд сходных внешнеморфологических структур,
близкого родства мориновых с основным стволом порядков трубкоцветных
нет, а сходство структур здесь, видимо, есть результат параллельной
специализации;
6) эмбриологические процессы, изученные у представителей Rubi-
асеае и Aster асеае, также дают достаточно оснований для отчленения
семейств порядка Dipsacales от Rubiales и Asterales;
7) порядки и семейства спайнолепестных хорошо отличаются друг
от друга не только по признакам внешней морфологии, анатомии, палино-
логически и кариологически, но и характеризуются различными,
свойственными лишь им, эмбриональными структурами и процессами.
В самом начале нашей работы по изучению эмбриологических
особенностей видов семейства Dipsacaceae и рода Morina была поставлена
определенная задача: выявить все отличия в эмбриологических признаках
у морин, если таковые имеются, и подтвердить или взять под сомнение
целесообразность выделения этого рода в отдельное семейство. Для
этого было необходимо детально исследовать все эмбриональные
структуры и процессы их становления параллельно у видов Morina и у видов
собственно Dipsacaceae.
Однако знакомство с литературой по эмбриологии этих семейств,
а также и само исследование, поставили перед нами еще ряд конкретных
задач: это и определение типа тапетума у ворсянковых, и уточнение
строения семяпочки и зародышевого мешка, и выявление особенностей в
развитии антипод, и определение типа эмбриогенеза у морин, и др.
В процессе исследования все задачи были решены. Подтверждена
целесообразность выделения рода Morina в отдельное семейство, так как
по большому комплексу эмбриологических признаков он отличается от
всех ворсянковых. Отличия эти наблюдаются в мужских и женских
эмбриональных структурах, в эндоспермо- и эмбриогенезе. Большая часть
видов, исследуемых нами, ранее эмбриологически не изучалась.
Некоторые эмбриональные процессы и структуры в исследованных семействах
описаны впервые. Так, введено понятие о реорганизации клеточного
тапетума и описан новый способ его реорганизации у ворсянковых (тапе-
тальная ткань); прослежена динамика накопления питательных веществ
в процессе развития семяпочки и семени в обоих семействах; детально
описаны дифференциация элементов зародышевого мешка, процесс
оплодотворения у Cephalariagigantea (последний совместно с М. П. Солнцевой),
и др.
Кроме того, дополнена характеристика Scabiosa-вариации Piperad-
типа эмбриогенеза по классификации Джогансена; детально описан
эмбриогенез у мориновых; по признаку хлорофиллоносности определен
тип зародыша у морин — лейкоэмбриофит.
Анализ эмбриологических признаков семейств порядка Dipsacales
и нескольких семейств спайнолепестных, с которыми когда-либо сближали
ворсянковых и мориновых, позволил сделать некоторые (частью
предварительные) выводы в отношении филогенетических связей изученных
нами семейств. Порядки и семейства спайнолепестных хорошо отличаются
друг от друга не только по признакам внешней морфологии, анатомии,
палинологически и кариологически, но и характеризуются различными,
свойственными лишь им, эмбриональными структурами и процессами.
Однако многие семейства, а еще более — роды спайнолепестных
эмбриологически изучены недостаточно или совсем не изучены. Именно это не
позволяет нам сделать более определенные выводы о постоянстве тех
93
или иных эмбриологических признаков и их значении для
филогенетической систематики семейств и порядков спайнолепестных, которые кратко
были затронуты в нашем сравнительном обзоре в связи с исследованием
ворсянковых и мориновых.
Каковы же те конкретные задачи, которые еще требуют своего
разрешения?
В семействе Dipsacaceae эмбриологически пока не исследованы роды
Simenia, Tremastelma и Руспосотоп. Для завершенной эмбриологической
характеристики семейства изучение эмбриологии этих родов необходимо.
Интересно было бы на субмикроскопическом уровне проследить этапы
реорганизации тапетума у ворсянковых, определить способ и время
образования в тапетальной ткани клеточных стенок, как это, например,
сделано при изучении клеткообразования в нуклеарном типе эндосперма,
а также проследить за изменениями, происходящими в синергидах до
оплодотворения.
В семействе Morinaceae, где исследованы только виды секции Morina
(=Diotocalyx), для получения более полной эмбриологической
характеристики следовало бы изучить виды, принадлежащие к другим секциям —
Cryptothladia и Acanthocalyx. Интересно также более детально изучить
двойное оплодотворение у видов этого семейства.
Что касается остальных семейств порядка Dipsacales, то здесь
непочатый край работы. Совершенно необходимо детальное изучение
эмбриологии родов разнообразнейшего семейства Caprifoliaceae. Это, во-первых,
как и в случае с родом Morina, поможет решению спорного вопроса о
систематическом положении рода Sambucus и, во-вторых, покажет все
разнообразие эмбриологических признаков внутри семейства, что
позволит составить и его полную эмбриологическую характеристику. То же
относится и к семейству Adoxaceae, которое заметно отличается от других
семейств порядка и в котором еще не все эмбриологические признаки
известны.
В семействе Valerianaceae необходимо детальное исследование
эмбриогенеза, так как тип его окончательно не определен. Не изучен
эмбриологически род Triplostegia, а его исследование настоятельно необходимо,
поскольку род этот считается связующим между Dipsacaceae и
Valerianaceae. Как эти связи выражаются в эмбриологических признаках, нам
пока ничего неизвестно. Исследование эмбриологии семейства Calyceraceae
также поможет более определенно решить вопрос о его положении в
филогенетической системе покрытосеменных.
Возвращаясь к вопросу о значении сравнительно-эмбриологического
метода для филогенетической систематики растений, отметим следующее.
Совершенно очевидно, что такие эмбриологические признаки, как типы
образования стенки пыльника, тапетума, микроспорогенеза, строение
зрелого пыльцевого зерна, типы семяпочки и развития зародышевого
мешка, особенности их строения, типы эндоспермо- и эмбриогенеза,
строение зрелого семени, наличие или отсутствие хлорофилла в зародыше
и другие особенности эмбриональных структур и процессов, не менее
важны, чем разнообразные морфологические, палинологические, ка-
риологические и другие признаки, и должны учитываться
систематиками как при решении частных вопросов взаимоотношений между
определенными таксономическими единицами растительного мира, так и при
составлении филогенетических систем цветковых растений. Предоставить
эти данные систематикам могут только эмбриологи. Поэтому важнейшей
задачей эмбриологов является исследование еще не изученных таксонов
и заполнение тех пробелов, которые имеются в эмбриологии
покрытосеменных .
ЛИТЕРАТУРА
Александров В. Г., Александрова О. Г. Об антиподах и
зародышевом мешке. — Бот. журн., 1946, т. 31, № 6, с. 13—24.
Александров В. Г., Александрова О. Г. К физиологии зародышевого
мешка. — Тр. ВИН АН СССР. Сер. VII, 1952, вып. 3, с. 147—164.
Андронова Н. Н. К эмбриологии Fadogia cienkowskii Schweinf. — Бот. журн.,
1972, т. 57, № 7, с. 826—831.
Андронова Н. Н. К эмбриологии Octodon setosum Hiern. {Rubiaceae). — Бот.
журн., 1973, т. 58, № 9, с. 1371—1377.
Андронова Н. Н. Спорогенез и развитие гаметофитов у Macrosphyra longistyla
(DC.) Hook. fil. (Rubiaceae Juss., Gardenieae DC.). — Бюлл. МОИП. Сер. биол.,
1975, т. 80, № 2, с. 68—76.
Андронова Н. Н. О строении семяпочки у Rubiaceae Juss. — Бот. журн., 1977,
т. 62, № 10, с. 1461—1469.
Андронова Н. Н. Спорогенез и развитие гаметофитов у Asperula odorata L.
(Rubiaceae Juss., Galieae Dumort.). — Бот. журн., 1978, т. 63, № 3, с. 404—410.
Арнольди В.М. Очерк явлений истории индивидуального развития у некоторых
представителей группы Seqvoiaceae. M., 1900. 90 с.
Арнольди В.М. Морфологические исследования над процессом
оплодотворения у некоторых голосеменных. Харьков, 1906. 18 с.
Баранов П. А. История эмбриологии растений в связи с развитием
представлений о зарождении организмов. М.—Л., 1955. 440 с.
Беляев В.И. Отношение семенных растений к споровым. Варшава, 1897. 10 с.
Бобров Е. Г. К познанию рода Cephalaria Schrad. I. Cephalaria syriaca (L).
Schrad. — Тр. по прикл. бот., генет. и селекц., 1929а, т. 21, с. 311—320.
Бобров Е. Г. К познанию рода Cephalaria Schrad. II. Некоторые однолетние
виды Прикавказья. — Изв. Главн. бот. сада АН СССР, 19296, т. 28, с. 386—392.
Бобров Е. Г. К познанию рода Cephalaria Schrad. III. Многолетние виды
СССР. — Бот. журн., 1932, т. 17, № 5-6, с. 483—505.
Бобров Е. Г. Сем. Morinaceae. Сем. Dipsacaceae. — В кн.: Флора СССР. Т. 24.
М.—Л., 1957, с. 4-10, 10-91.
Буш Н. А. Курс систематики высших растений. 2-е изд. М.—Л., 1944, 583 с.
Винокурова Л. В. Палинологические данные к систематике семейств
Dipsacaceae и Morinaceae. — В кн.: Проблемы ботаники. Л., 1959, вып. 4, с. 51—67.
В у л ь ф Е. В., Малеева О. Ф. Мировые ресурсы полезных растений. Пищевые,
кормовые, технические, лекарственные и др. Л., 1969. 565 с.
Герасимова-Н а в а ш и н а Е. Н. Пыльцевое зерно, гаметы и половой
процесс у покрытосеменных. — Тр. БИН АН СССР. Сер. VII, 1951, вып. 2, с. 294—
355.
Герасимова-Навашина Е. Н. Двойное оплодотворение
покрытосеменных, его природа и происхождение. Дис. Л., 1954. Ботанический ин-т АН СССР.
Герасимова-Навашина Е. Н. О гаметофите и об основных чертах
развития и функционирования воспроизводящих элементов у покрытосеменных
растений. — В кн.: Проблемы ботаники. Л., 1958, вып. 3, с. 125—167.
(Герасимова-Навашина Е. Н.) Gerassimova-Nava-
shina H.N. A contribution to the cytology of fertilization in flowering plants. —
Nucleus, 1960, v. 3 (1), p. 111—120.
Герасимова-Навашина Е. Н. Цитологические вопросы двойного
оплодотворения. — В кн.: Морфогенез растений. М.—Л., 1961, с. 431—436.
Герасимова-Навашина Е. Н. Некоторые данные об обусловленности
строения зародышей покрытосеменных растений. — Бот. журн., 1972, т. 57, № 4,
с. 441—447.
Герасимова-Навашина Е. Н., Батыгина Т. Б. Процесс
оплодотворения у S с ilia sibirica Andevs. — Бот. журн., 1958, т. 43, № 7, с. 959—988.
Герасимова-Навашина Е. Н., Капил Р. Н., Коробова С. Н.,
Савина Г. И. Процесс двойного оплодотворения при пониженных
температурах. — Бот. журн., 1968, т. 53, № 5, с. 614—627.
Г о л е н к и н М. Г. Курс высших растений. М.—Л., 1937. 579 с.
Горожанкин И. Н. О корпускулах и половом процессе у голосеменных
растений. — Учен. зап. Московск. ун-та, 1880, вып. 1, с. 1—177.
Гроссгейм А. А. К вопросу о графическом изображении системы цветковых
растений. — Сов. бот., 1945, т. 13, № 1, с. 3—27.
Г у н ь к о Г. К. Ворсянка. (Возделывание и техническое использование). Л., 1932.
122 с.
95
Жадовский А. Э. Типы развития зародышевых мешков у покрытосеменных
растений. — Журн. Русск. бот. об-ва, 1925, т. 10, № 3—4, с. 339—354.
Замотайлов С. С. Оплодотворение арахиса и влияние температуры на этот
процесс. — Тр. Кубанск. с.-х. ин-та, 1968, вып. 17 (45), с. 36—44.
Иванов В. Б., Литинская Т. К. Одновременная окраска белков и
углеводов проционовыми красителями. — Цитология, 1967, т. 9, № 9, с. 112—116.
Ильина Г. М. Сравнительно-эмбриологическое исследование семейства маковых
(Papaveraceae) в связи с положением в системе покрытосеменных. Автореф. дис.
М., 1968.
Ильина Г. М. Эмбриология Platystemon californicus Benth. в связи с положением
его в системе маковых. — В кн.: Морфология цветковых растений. М., 1971, с. 142—
156.
Иоффе М. Д. Процесс оплодотворения у Anemone nemorosa L. и Anemone ranun-
culoides L. — Бот. журн., 1968, т. 53, № 7, с. 891—905.
Камелина О. П. К эмбриологии Morina lehmanniana Bunge. — В кн.: Половой
процесс и эмбриогенез. М., 1973, с. 92—93. (Материалы Всесоюзного симпозиума
по эмбриологии растений).
Камелина О. П. О сравнительно-эмбриологическом исследовании
представителей семейств Dipsacaceae и МоНпасеае. — Матер. V Моск. совещ. по филогении
раст., М., 1976, с. 71—73.
Камелина О. П. Сравнительно-эмбриологическое исследование представителей
сем. Dipsacaceae и сем. МоНпасеае. Автореф. дис. Л., 1977.
Камелина О. П. Развитие зародышевого мешка и дифференциация его
элементов в роде Scabiosa L. (сем. Dipsacaceae). — Тез. докл. VII Всес. симпозиума по
эмбриол. раст., Киев, 1978а, ч. 3, с. 33—35.
Камелина О. П. Тапетум у ворсянковых (Dipsacaceae) и классификация типов
тапетума у покрытосеменных. — Тез. докл. VI Делегатск. съезда ВБО, Л., 19786,
с. 78-79.
Камелина О. П. Развитие клеточного эндосперма в семействах Dipsacaceae и
МоНпасеае. — В кн.: Актуальные вопросы эмбриологии покрытосемянных
растений. Л., 1979а, с. 69—74.
Камелина О. П. Развитие зародыша у представителей семейств Dipsacaceae и
МоНпасеае. — В кн.: Актуальные вопросы эмбриологии покрытосемянных
растений. Л., 19796, с. 82—89.
Камелина О. П., Малдыбекова К. С. Развитие пыльника и пыльцевого
зерна у Valeriana phu (Valerianaceae). — Бот. журн., 1980, т. 65, № 5, с. 640—
646.
Камелина О. П., Солнцева М. П. К эмбриологии Cephalaria gigantea
(Ledeb.) Bobr. (сем. Dipsacaceae). — Тез. докл. V Всес. совещ. по эмбриол. раст.,
Кишинев, 1971, с. 66—67.
Камелина О. П., Яковлев М. С. Развитие зародышевого мешка в роде
Morina L. — Бот. журн., 1974, т. 59, № 11, с. 1609—1917.
Камелина О. П., Яковлев М. С. К эмбриологии рода Scabiosa L.
(Dipsacaceae). — Тез. докл. XII МБК, Л., 1975, с. 251.
Камелина О. П., Яковлев М. С. Развитие пыльника и микрогаметогене э
у представителей сем. Dipsacaceae и МоНпасеае. — Бот. журн., 1976, т. 61, № 7,
с. 932-945.
(К а х и д з е Н. Т.) К а с h i d z e N. Karyologische Studien uber die Familie der
Dipsacaceae. — Planta, 1929, Bd 7, S. 482—505.
Козо-Полянский Б. М. Введение в филогенетическую систематику высших
растений. Воронеж, 1922. 167 с.
Козо-Полянский Б.М. Курс систематики высших растений. Воронеж, 1965.
407 с.
К о р д ю м Е. Л. Сравнительная эмбриология и цитология видов зонтичных в связи
с их филогенией и эволюцией. Автореф. дис. Л., 1968.
Кордюм Е.Л. Значение эмбриологии для решения вопросов систематики и
филогении покрытосеменных растений. — В кн.: Проблемы эмбриологии. Киев, 1971,
с. 196-215.
Кордюм Е. Л. Эволюционная цитоэмбриология покрытосеменных растений.
Киев, 1978. 220 с.
Кузнецов Н. И. Введение в систематику цветковых растений. Юрьев, 1914.
655 с.
Л е щ у к Т. Я. Ворсовальная шишка. Симферополь, 1954. 52 с.
Магешвари П. Эмбриология покрытосеменных. М., 1954. 440 с.
М и рз о я н С. А., Р а о и н о в и ч М. С, А м и р з а д я н Ц. А. Об
алкалоидной смеси и индивидуальном алкалоиде аргацине из Cephalaria gigantea. — Докл.
АН АрмССР, 1948, т. 8, № 2, с. 91—96.
(Навашин С. Г.) Nawaschin S. G. Zur Embryobildung der Birke (Vorlau-
fige Mitteihmg). — Bui. Acad. Sci. Petersb., 1894, t. B, p. 345—348.
(Навашин С. Г.) Nawaschin S. G. Resultate einer Revision der Befruch-
tungsvorgange bei Lilium martagon und Fritillaria tenella. — Bui. Acad. Sci. Petersb.,
1898, v. 9, N 4, p. 377-382.
96
Никитичева З. И. Эмбриология паразитных представителей семейств Scro-
phulariaceae и Orobanchaceae в связи с их образом жизни. Дис. Л., 1970.
Ботанический институт АН СССР.
Письяу.кова В. В. Направление эволюции соцветий некоторых Cruciferae и
Dipsacaceae. К вопросу о возникновении антодиев в различных рядах цветковых
растений. — Учен. зап. ЛГПИ им. Герцена, 1939, т. 16, вып. 6, с. 117—142.
П л и с к о М. А. Ультраструктура синергид у Calendula officinalis L. в начальный
период их развития (до вхождения пыльцевой трубки в зародышевый мешок). —
Бот. журн., 1977, т. 62, № 2, с. 161—172.
Поддубная-Арнольди В. А. Эмбриологический метод в систематике
покрытосеменных растений. — Изв. Ассоц. н.-и. ин-та физ.-мат. 1 МГУ, 1930, т. 3,
вып. I-A, с. 61—101.
(Поддубная-Арнольди В. A.) Poddubnaja-Arnoldi V. A.
Ein Versuch der Anwendung der embryologischen Methode bei der Losung einiger
systematischer Fragen. — Beih. Bot. Cbl., 1931, Bd 48, N 2, S. 242—275.
(Поддубная-Арнольди В. A.) Poddubnaja-Arnoldi V. A.
Spermazellen in der Familie Dipsacaceae. — Planta, 1934, Bd 21, H.3, S. 381—386.
Поддубная-Арнольди В. А. Значение эмбриологических исследований
высших растений для систематики. — Усп. совр. биол., 1951, т. 32, вып. 3, с. 352—
392.
Поддубная-Арнольди В. А. Значение эмбриологических исследований
для филогенетической системы покрытосеменных растений. — В кн.: Проблемы
ботаники. Л., 1958, вып. 3, с. 196—247.
Поддубная-Арнольди В. А. Общая эмбриология покрытосеменных
растений. М., 1964. 482 с.
Поддубная-Арнольди В. А. Микроспорогенез и мужской гаметофит
покрытосеменных растений. — В кн.: Проблемы эмбриологии. Киев, 1971а, с. 26—
72.
Поддубная-Арнольди В. А. Значение цито-эмбриологического метода
для филогении И систематики покрытосеменных растений. — Матер. IV Моск.
совещ. по филогении раст., М., 19716, с. 75—77.
Поддубная-Арнольди В. А. Цитоэмбриология покрытосеменных'
растений. Основы и перспективы. М., 1976. 507 с.
Пономарев А. Н., Демьянова Е. И. К изучению гинодиэции у
растений. — Бот. журн., 1975, т. 60, № 1, с. 3—15.
Попов М. Г. Очерк растительности и флоры Карпат. М., 1949. 303 с.
Родкевич В., Бэднара Й., С н е ж к о Р. Поляризация клеток в мега-
спорогенезе у Onagraceae. — Бот. журн., 1976, т. 61, N° 7, с. 905—909.
Романов И. Д. Параллелизм в эволюции зародышевого мешка
покрытосеменных. — В кн.: Вопросы эволюции, биогеографии, генетики и селекции. М.—Л.,
1960, с. 217—223.
Романов И. Д. Типы развития зародышевого мешка покрытосеменных
растений. — В кн.: Проблемы эмбриологии. Киев, 1971, с. 72—ИЗ.
Руденко Ф. Е. Значение мужского гаметофита для систематики
покрытосеменных (Angiospermae). — Бот. журн., 1959, т. 44, №. 10, с. 1467—1475.
Савченко М. И. Морфология семяпочки покрытосеменных растений. Л., 1973,
110 с.
Солнцева М. П., Камелина О. П. Двойное оплодотворение и зародыш
у Cephalaria gigantea (Ledeb.) Bobr. (Dipsacaceae). — Бот. журн., 1976, т. 61, № 2,
с. 254—263.
Тамамшян С. Г. Род Hohenackeria С. А. М. и его место в системе зонтичных. —
Сов. бот., 1946, т. 14, № 4, с. 219-238.
Тамамшян С. Г. Руминация эндосперма у покрытосеменных. — Бот. журн.,
1951, т. 36, № 5, с. 497—514.
Татинцева С. С. Образование и развитие спермиев у некоторых
покрытосеменных. I. Poaceae (Graminea); II. Asteraceae (Compositae). — Бот. журн., 1975, т. 60,
№ 12, с. 1746—1752.
Тахтаджян А. Л. Система и филогения цветковых растений. М.—Л., 1966.
612 с.
Тахтаджян А. Л. Происхождение и расселение цветковых растений. Л., 1970.
146 с.
Терёхин Э. С. Паразитные цветковые растения. Л., 1977. 220 с.
Хромосомные числа цветковых растений. Л., 1969. 928 с.
Чабан И. А. Эмбриогенез и эндоспермогенез Reseda lutea L. и Chelidonium majus L.
по данным световой и электронной микроскопии. Автореф. дис, Л., 1975.
Шх и'ян А. С. Pop, Scabiosa Ь.на Кавказе. —Тр. Тбилисск. бот. ин-та, 1956,т.18, с. 3—68.
Ш х и я н А. С. Обзор кавказских видов рода Cephalaria Schrad. — Тр. Ин-та бот.
АН ГрузССР. Сер. флоры и системат., 1969, т. 26, с. 76—118.
Щ х и я н А. С. Семейство Dipsacaceae A. L. Jussieu на Кавказе. Автореф. дис.
Тбилиси, 1974.
Яковлев М. С. Структура эндосперма и зародыша злаков как систематический
признак. — Тр. БИН АН СССР. Сер. VII, 1949, вып. 1, с. 121-218.
97
Яковлев М. С. О некоторых характерных чертах морфогенеза у высших
растений. — Тр. ВИН АН СССР. Сер. VII, 1951, вып. 2, с. 243—267.
Яковлев М. С. Принципы выделения основных эмбриональных типов и их
значение для филотении покрытосеменных. — В кн.: Проблемы ботаники. Л., 1958,
вып. 3, с. 168—195.
Яковлев М. С. Эмбриогенез и его значение для филогении растений. М.—Л.
1960. 40 с.
(Яковлев М. С.) Yakovlev M. S. Embryogenesis and some problems of
phylogenesis. — Rev. cytol. biol. veg., 1969, v. 32, p. 325—330.
Яковлев М. С. Основные задачи в области изучения эмбриологии. — В кн.:
Проблемы эмбриологии. Киев, 1971, с. 152—170.
Яковлев М. С. Зародыш. — БСЭ. Т. 9. 4-е изд. 1972, с. 370.
Яковлев М. С. Основные типы эмбрионального развития высших растений. —
В кн.: Эмбриология покрытосеменных растений. Кишинев, 1973, с. 16—24.
Яковлев М. С. Гаметогенез, зародышевый мешок и пыльцевое зерно (к проблеме
происхождения Angiospermae). — Бот. журя., 1974, т. 59, № 12, с. 1721—
1727.
Яковлев М. С, Жукова Г. Я. Покрытосемянные растения с зеленым и
бесцветным зародышем (хлоро- и лейкоэмбриофиты). Л., 1973. 116 с.
Яковлев М. С, Иоффе М. Д. Эмбриология некоторых представителей рода
Paeonia L. — В кн.: Морфология цветка и репродуктивный процесс у
покрытосеменных растений. М.—Л., 1965, с. 140—176.
Яковлев М. С, Солнцева М. П. Некоторые вопросы морфологии цветка
и эмбриологии ковылей. — В кн.: Морфология цветка и репродуктивный процесс
у покрытосеменных растений. Л., 1965, с. 61—73.
Afzelius К. Embryologische und zytologische studien in Senecio und verwandten
Gattungen. — Acta Horti Bergiani, 1924, Bd 8 (7), S. 123—219.
Asplund E. Studien fiber die Entwicklungsgeschichte der Bliiten einiger Valeriana-
ceen. — Kungl. Svenska Vet. Akad. Handlingar, 1920, Bd 61, N 3, S. 3—66.
В a k s а у L. Monographie der Gattung Succisa. — Ann. Hist.-Nat. Mus. Hungar.
Ser. nova, 1952, t. 2, S. 237—259.
Balicka-Iwanowska G. P. Contribution a l'etude du sac embryonnaire
chez certains Gamopetales. — Flora, 1899, Bd 86, S. 47—71.
Bancher E., Holzl J. Uber die Exkretzellen von Morina longifolia Wall. I.
Vorkommen, Entwicklung und Bau. — Flora, 1959, Bd 147, H. 2, S. 186—206.
Bednara J., Rodkiewicz B. Cell polarization in female gametophyte
development in Epilobium (Onagraceae). — Ann. Med. Sec. Pol. Acad. Sci., 1975, v. 20,
N 2, p. 57-68.
Bentham G., Hooker J. D. Genera plantarum. I—III. London, 1862—1883.
В e s s e у С. Е. Phylogeny and taxonomy of angiosperms. — Bot. Gaz., 1897, v. 23,
p. 145—178.
Bessey С. Е. The phylogenetic taxonomy of flowering plants. — Ann. Miss. Bot.
Gard., 1915, v. 2, p. 109—164.
В u d e 11 B. Untersuchungen der Antherenentwicklung einiger Blutenpflanzen. —
Zeitschr. Bot., 1964, Bd 52, Hf. 1, S. 1—28.
В u n g e A. Beitrag zur Kenntnis der Flor Russlands und der Steppen Central-Asien.
I. Abt. Alexandri Lehmann reliquiae botanice etc. . . — Mem. Acad. Sci. Petersb.,
1852 (1854), t. 8, p. 177—536.
Carniel K. Das Verhalten der Kerne in Tapetum der Angiospermen mit. besonderer
Berucksichtigung von Endomitosen und sogenannten Endomitosen. — Osterr. bot.
Zeitschr., 1952, Bd 99, Hf. 2—3, S. 318—362.
Carniel K. Contribution to the developmental history of the sporogenous tissues
and of the tapetum in some Dipsacaceae. — Osterr. bot. Zeitschr., 1963a, Bd 110,
H. 5-6, S. 547-555.
Carniel K. Das Antherentapetum. — Osterr. bot. Zeitschr., 1963b, Bd 110, Hf. 2—
3, S. 145—176.
Chiarugi A. L'evoluzione delle cellule del tapeto e la formazione del periplazmodio
in alcune Asteraceae. — Nuovo giorn. bot. Ital. Nov. ser., 1927a, v. 34, p. 783—828.
Chiarugi A. Richerche sulla embriologia dell' Asteraceae. — Nuovo giorn. Bot.
Ital. Nov. ser., 1927b, v. 34, p. 864-871.
Clausen P. tlber das Verhalten das Antherentapetum bei einigen Monocotylen und
Ranales. — Bot. Arch., 1927, Bd 18, S. 1—27.
Coulter T. Memoire sur les Dipsacees. — Mem. Soc. Phys. Hist. Nat. Geneve 1823,
v. 2, p. 13—60.
Crete P. Origine et structure du sac embryonnaire, de l'albumen et du tegument
seminal chez le Leycesteria formosa. — Bui. Soc. bot. France, 1954, t. 101, N 3—4,
p. 130-133.
Crete P. Embryo. — In: Recent advances in the embryology Angiosperms. —
Delhi, 1963, p. 170-185.
98
D a h 1 g r e n K. V. O. Uber die Embryologie von Acicarpa tribuloides. — Svensk bot.
tidskr., 1915, Bd 9, S. 184—191.
Dahlgren K. V. O. Zytologische und embryologische Studien uber die Reihen
Primulales und Plumbaginales. — Kungl. Svenska Vet. Akad. Handlingar, 1916,
Bd 56, N 4, S. 1-80.
Dahlgren K. V. O. Zur Embryologie der Kompositen mit besonderer Beriiksichti-
gung der Endospermbildung. — Zeitschr. Bot., 1920, Bd 12, S. 481—516.
Dahlgren K. V. O. Notes on the ab initio cellular endosperm. — Bot. Notiser,
1923, p. 1-24.
Dahlgren R. A system of classification of the angiosperms to be used to
demonstrate the distribution of characters. — Bot. Notiser, 1975a, v. 128, p. 119—147.
Dahlgren R. The distribution of characters within an Angiosperm system. 1. Some
embryological characters. — Bot. Notiser, 1975b, v. 128, p. 181—197.
Davis G. L. Systematic embryology of angiosperms. New York—London—Sidney,
1966. 528 p.
Doll W. Beitrage zur Dipsaceen und Dipsaceen-anlicher Pflanzen. — Bot. Arch.,
1927, Bd 17, S. 107-146.
Ehrendorfer F. Evolution and karyotype differentiation in a family of
flowering plants: Dipsacaceae. — Genetics today, 1964a, p. 399—407.
Ehrendorfer F. Uber stammesgeschichtliche Differenzierungsmuster bei den
Dipsacaceen. — Ber. Deutsch. Bot. Ges., 1964b, Bd 77, S. 83—94.
Ehrendorfer F. Systematik und Evolution. — In:Strasburger E. Lehr-
buch der Botanik. 19. Aufl. Jena, 1971, S. 379—745.
Eichler A. W. Syllabus der Vorlesungen uber specielle und medizinisch-pharmazeu-
tische Botanik. 3. Aufl. Berlin, 1883. 63 S.
E n g 1 e r A. Syllabus der Vorlesungen uber specielle und medizinisch-pharmazeutische
Botanik. Kleine Ausgabe. Berlin, 1892. 143 S.
Erdtman G. Pollen morphology and plant taxonomy. III. Morina L. with an
addition on pollenmorphological terminology. — Svensk bot. tidskr., 1945, Bd 39,
N 2, S. 187-191.
Erdtman G. Pollen morphology and plant taxonomy. Stockholm, 1952, 539 p.
E u n u s A. M. Contribution to the embryology of the Liliaceae. V. Life history of A mi-
anthium muscaetoxicum Walt. — Phytomorphology, 1950, v. 1, N 1, p. 18—24.
Fagerlind F. Embryologische, zytologische und bestaubungsexperimentelle
Studien in der Familie der Rubtaceae. — Acta Horti Bergiani, 1937, Bd 11, N 9, S. 195—
470.
F г е у L. Chromosome numbers in the genus Scabiosa L. — Fragm. Flor. Geobot.,
1969, v. 15, p. 179—184.
F г е у L. Embryological studies on Scabiosa lucida Vill. and S. ochroleuca L. in
Poland. — Acta Biol. Cracov. Ser. bot., 1976, v. 19, N 2, p. 173—179.
Guignard L. Recherches sur le sac embryonnaire des phanerogames angiospermes. —
Ann. sci. natur. bot., 1882, t. 6 (13), p. 136—199.
Guttenberg H. Grundzuge der Histogenese hoherer Pflanzen. I. Die
Angiospermen. Berlin, 1960. 315 S.
Hallier H. Uber die Verwandtschaftsverhaltnisse der Tubifloren und Ebenalen,
den polyphyletisches Ursprung der Sympetalen und Apetalen und die Anordnung der
Angiospermen uberhaupt. Vorstudien zum Entwurf eines Stammbaums der
Blutenpflanzen. — Abh. naturwiss. Vereins in Hamburg, 1901, Bd 16, S. 1—112.
Hallier H. L'origine et le systeme phyletique des angiospermes. — Arh. Neerl.
Sci. Exact. Nat. Ser. IIIB, 1912, v. 1, p. 146—234.
Hegelmaier M. Untersuchunger uber die Morphologie des Dikotyledonen.
Endosperms. — Nova Acta Ksl. Deutsch. Akad. Natur., 1885, Bd 49, N 1, S. 3—104.
Hofmeister W. Neuere Beobachtungen uber die Embryobildung der Phaneroga-
men. — Jahrb. f. wiss. Bot., 1858, Bd 1, S. 82—190.
Hofmeister W. Neue Beitrage zur Kenntnis der Embryobildung der Phaneroga-
men. I. Dikotyledonen. — Abh. Sachs. Ges. Wiss., 1859a, Bd 6, S. 533—672.
Hofmeister W. Neue Beitrage zur Kenntnis der Embryobildung der Phaneroga-
men. II. Monocotyledonen. — Abh. Sachs. Ges. Wiss., 1859b, Bd 7, S. 629—760.
Hock F. Dipsacaceae. — In: A. E n g 1 e r und K. P r a n 11. Naturlichen Pflan-
zenfamilien. T. IV, Abteil 4. Leipzig 1891, S. 182—189.
Holzl J. Die Differenzierung der Exkretzellen von Morina longifolia Wall, unter
verschiedenen Anzuchtbedingungen. — Zeitschr. Bot., 1959, Bd 47, H. 1—2, S. 167—
176.
Hutchinson J. The families of flowering plants. London, 1926. 328p.
Hutchinson J. The families of flowering plants, arranged according to a new
system based on their probably phylogeny. V. 1—2. 2nd ed. Oxford, 1959. 792 p.
Jamazaki T. A. System of Gamopetale based on the embryology. — J. Facult.
Sci. Univ. Tokyo. Ser. Ill, 1974, v. 11, N 8—9, p. 263—281.
Jensen W. A. The ultrastructure and histochemistry of the synergids of cotton. —
Amer. J. Bot., 1965, v. 52, N 3, p. 32—37.
Jensen W. A. Fertilization of flowering plants. — Bio Sciense, 1973, v. 23, N 1,
p. 21-27.
99
Jensen W. A., Fischer D. B. Cotton embryogenesis: the entrance and discharge
of the pollen tube in the embryo sac. — Planta, 1968, v. 178, N 2, p. 87—94.
J о h a n s e n D. A. Plant embryology. Embryogeny of the spermatophyta. Waltham,
■ 1950.. 305 p. .
J о h r i В. М. Embryology and taxonomy. — In: Recent advances in the embryology
of angiosperms. Delhi, 1963, p. 210—234.
Johri В. М., Kap.il R., Bhatnagar S., Bhandari N., V i j а у a-
raghavah. W. Comparative embryology of angiosperms. Delhi, 1967. 347 p.
J u e 1 H. 0. Untersuchungen tiber die Auflosung der Tapetenzellen in der Pollensa-
cken der Angiospermen. — Jahrb. f. wiss. Bot., 1915, Bd 56, S. 336—364.
К a r 1 s t г о m P. 0. Embryological studies in the Acanthaceae. I. The genus Ruel-
lia L. — Svensk bot. tidskr., 1972, Bd 66, N 4, S. 303—313.
Karlstrom P. 0. Embryological studies in the Acanthaceae. II. The genera Pseu-
deranthemum Radlk., Ruspolia Lindau, Eranthemum L. and Lankesteria Lindl. —
Svensk bot. tidskr., 1973, Bd 67, N 3, S. 257—280.
Karlstrom P.O. Embryological studies in the Acanthaceae. III. The genera Bar-
leria L. and Grabbea Harv. — Svensk bot. tidskr., 1974, Bd 68, N 2, S. 121—135.
К n u t h P. Handbuch der Bliitenbiologie. Bd 2, Teil 1. Leipzig, 1898. 697 S.
К u r a n H. Callose localization in the walls of megasporocytes and megaspores in the
course of development of monospore embryo sacs. — Acta Soc. bot. Polon., 1972,
v. 41, N 4, p. 519—534.
Lavialle P. Sur le sac embryonnaire des Dipsacees. — C. R. Acad. Sci. Paris,
1925a, t. 180, p. 1127—1129.
Lavialle P. Sur les antipodes et la region chalazienne de l'ovule des Dipsacees. —
С R. Acad. Sci. Paris, 1925b, t. 180, p. 1606—1608.
Lavialle P. Sur la nutrition du sac embryonnaire chez Knautia arvensis. —
С R. Acad. Sci. Paris, 1925c, t. 180, p. 2055—2056.
Lavialle P. Le developpement de l'anthere et du pollen chez Knautia arvensis
Coult. — С R. Acad. Sci.. Paris, 1926, t. 182, p. 77—79.
Lebegue A. Recherches embryogeniques sur quelques Dicotyledones Dialypetales. —
Ann. Sci. Nat. Bot. Ser. II, 1952, v. 13, p. 287—321.
Lebegue A. Nouveaux aspects d'une classification embryologique. — Bui. Soc.
Bot. France, 1966, v. 113, N 3, p. 87—98.
Lindley J. A natural system of botany. 2nd ed. London, 1836. 526 p.
L у s P. Recherches biochimiques sur les dipsacacees du Lyban et de la Syrie. —
Theses Univ. de Lille, 1951. 144 p.
Maheshwari P. An introduction to the embryology of Angiosperms. New York-
Toronto—London, 1950. 453 p.
Maheshwari Devi H. Embryological studies in Compositae. III. Cerbera ja-
mesonnii Bolus. — Proc. Ind. Acad. Sci., 1957, v. 46, N 1, p. 24—31.
Mauritzon J. Beitrage zur Embryologie der Crassulaceen. — Bot. Notiser, 1930,
S. 233-250. . .
Mauritzon J. Die Bedeutung der embryologischen Forschung fur das naturliche
System der Pflanzen. — Lunds. Univ. Arsskrift. N. F., Adv. 2, 1939, Bd 35, N 15,
S. 76-135.
Maze J., В ohm L. R., Mehlenbacher L. E. Embryo sac and early ovule'
development in Oryzopsis miliacea and Stipa tortilis. — Can. J. Bot., 1970, v. 48,
N1, p. 27-41.
Mepham R. H., Lane G. R. Formation and development of the tapetal periplas-
modium in Tradescantia bracteata. — Protoplasma, 1969, v. 68, N 1—2, p. 175—192.
Mestre J. La signification phylogenetique de l'embryogenie. — Rev. gen. bot.,
1967, v. 74, p. 18—35.
Mohan Ram H. J., Wadhi W. Endosperm in A canthaceae. — Phytomorpho-
logy, 1964, v. 14, N 3, p. 388—413.
Mohan Ram H.J., Wadhi W. Embryology and delimination of the
Acanthaceae. — Phytomorphology, 1965, v. 15, N 2, p. 201—205.
M о i s s 1 H. E. Vergleichende embryologische Studien iiber die Familie der Capri-
foliaceae. — Osterr. bot. Zeitschr., 1941, Bd 90, Hf. 3, S. 153—212.
M о 11 i a r d M. Sur le sort des cellules antipodes chez le Knautia arvensis. — Bui.
Soc. bot. France, 1895, v. 42, p. 9—10.
N а к a i T. A sinoptical sketch of Korean flora of vascular plants indigenous to Korea,
arranged in a new, natural order. — Bui. Nat. Sci. Mus. Tokyo, 1952, v. 31, p. 1—152.
N a r a n g N. The life history of Stackhousia linariaefolia A. Cunn. with a discussion
on its systematic position. — Phytomorphology, 1953, v. 3, N 1, p. 26—31.
Narayanaswami S. The structure and development of the caryopsis in some
Indian Millets. I. Pennisetum. typhaideum Rich. — Phytomorphology, 1953, v. 3,
- N 1-.2, p. 98-112. У
Novak F. A. Systema Angiosperm. — Preslia, 1954, v. 26, p. 337—364.
Novak F. A. Vyssi rostliny. Tracheophyta. Praha, 1961. 943 pi
Ojeaga О. О., Sanyaoly. Ovule formation and embryo development in
persisting and abortive fruits of the cowpea Vigna unguicculata (L.) Walp. — Niger. J.
Sci., 1970, v. 34, N 1, p. 31-40.
100
Periasamy K. The ruminate endosperm: development and types, of rumination. —
In: Plant embryology. Delhi, 1962, p. 62—74.
Periasamy K. Studies on seeds with ruminate endosperm. 5. Seed development
and rumination in two genera of the Rubiaceae. — Proc. Ind. Acad. Sci., ,1964, v, 60,
p. 351—360.
Periasamy K., S w a m у В. G. L. Morphology of anther tapetum of
angiosperms. — Current Sci., 1966, v. 35, N 17, p. 427—431.
Pollack E.G., Jensen W. A. Cell development during early embryogenesis
in Capsella and Gossypium. — Amer. J. Bot., 1964, v. 51, N 2,, p. 135—140.
Razi B. A., Subramanyam K. Embryology of the Dipsacaceae. I. Glands,
the male and female gametophytes. — Proc. Ind. Acad. Sci. Sect. B, 1952, v. 36,
N 6, p. 249—257.
R e n d 1 e A. B. The classification of flowering plants. V. 2. Dicotyledons. Cambridge,
1925. 636 p.
R i s s e K. Chromosomenzahlen und Peri Plasmodium bildung in der Familie der
Dipsacaceae. — Ber. Deutsch. Bot. Ges., 1926, Bd 44, S. 296—297.
R i s s e K. Beitrage zur Zytologie der Dipsacaceae. — Bot. Arch., 1929, Bd 23, H. 1—
2, S. 266—288.
Rodkiewicz B. Callose isolation in megasporogenesis in some flowering plants. —
Bui. Soc. Sci. et lett. Lodz., 1968, v. 19, N 5, p. 1—12.
Rodkiewicz B. Callose in cell walls during megasporogenesis in angiosperms.—
Planta, 1970, Bd 93, N 1, S. 39-47.
Rodkiewicz В., Kuran H. The specif ity of callose distribution in cell walls
during megasporogenesis in Onagraceae, Caryophyllaceae et Scrophylariaceae. — Ann.
Univ. Reims, 1971, v. 9> N 1, p. 31—35.
Samuelsson G. Studien iiber die Entwicklungsgeschichte einiger Bicornestypen.
Ein Beitrag zur Kenntnis der systematischen Stellung der Diapensisceen und Empetra-
ceen. — Svensk bot. tidskr., 1913, Bd 7, S. 97—188.
Schnarf K. Embryologie der Angiospermen. Berlin, 1927. 417 S.
Schnarf K. Embryologie der Angiospermen. — In: Handbuch der Pflanzenanatomie.
Herausg. K. Linsbauer. II. AM., 2. Teil. Berlin, 1929. 684 S.
Schnarf K. Vergleichende Embryologie der Angiospermen. Berlin, 1931. 354 S.
Schnarf K. Die Bedeutung der embryologischen Forshung fur das naturliche
System der Pflanzen. — Biologia Generalis, 1933, Bd 9, H. 2, S. 57—189.
Schiirhoff P. Zur Phylogenie des Angiospermen Embryosackes. — Ber. Deutsch.
Bot. Ges., 1919, Bd 37, S. 98—135.
Skalinska M. Studies in the karyological differentiation of the tapetum in
Valeriana officinalis L. — Acta Biol. Cracov. Ser. Bot., 1958, v. 1, N 1, p. 18—22.
Soueges R. Embryogenie des Valerianacees. Developpement de I'embryon chez
le Valerianella olitoria. — С R. Acad. Sci. Paris, 1923, t. 176, 1081—1083.
Soueges R. L'hypophyse e Tepiphyse : les problemes d'histogenese qui leur sont lies.
I et II. — Bull. Soc. Bot. France, 1934, t. 81, p. 734—758.
Soueges R. Embryogenie des Dipsacacees. Developpement de I'embryon chez le
Scabiosa succisa L. — С R. Acad. Sci. Paris, 1937, t. 204, p. 292-294.
Soueges R. Embryogenie et classification. Fasc. 1. L'espece et les classification
actuelles. Paris. 1938. 93 p.
Soueges R. Embryogenie et classification. Fasc. 2. Essai d'un systeme embryoge-
nique: Partie generale. Paris, 1939. 95 p.
Soueges R. Embryogenie des Valeriacees. Developpement de 1 embryon chez le
Centranthus. — С R. Acad. Sci. Paris, 1941, t. 212, N 17, p. 718—720.
Soueges R. Embryogenie des Caprifoliacees. Developpement de I'embryon chez le
Lonicera biflora. — С R. Acad. Sci. Paris, 1945, t. 222, N 14—18, p. 480-482. f
Soueges R. Embryogenie et classification. Fasc. 3. Essai d'un systeme embryoge-
nique. (Partie speciale: Premiere periode du systeme). Paris, 1948. 101 p.
Soueges R. Embryogenie et classification. Fasc. 4. Essai d'un systeme embryoge-
nique. (Partie speciale: Deuxieme periode du systeme.). Paris, 1951. 95 p.
Soueges R. Embryogenie des Dipsacacees. Developpement de I'embryon chez le
Scabiosa columbaria L. — C. R. Acad. Sci. Paris, 1957, t. 245, N 5, p. 465—468.
Soueges R. Embryogenie des Dipsacacees. Developpement I'embryon chez le Ce-
phalaria tatarica. — С R. Acad. Sci. Paris, 1963a, t. 256, N 1, p. 45—48.
Soueges R. Embryogenie des Dipsacacees. Developpement de I'embryon chez le
Knautia arvensis. — C. R. Acad. Sci. Paris, 1963b, t. 256, N 6, p. 1190-1194.
Soueges R. Embryogenie des Dipsacacees. Developpement de I'embryon chez le
Dipsacus sylvestris. — С R. Acad. Sci. Paris, 1963c, t. 256, N 11, p. 2268-2273.
Steffen K. Zur Kenntnis des Befruchtungvorganges bei Impatiens glandulifera
Lindl. Cytologische studies. Embryosack der Balsamineen. — Planta, 1951, Bd 39,
H. 3, S. 25-37. .. ' , , , „ „,_..
Strasburger E. Uber den Bau und das Wachstum vegetabilisher Zellhaute.
Histologische Beitrage. H. 1. Jena, 1882. 264 S.
Strasburger E. Uber das Wachstum vegetabilischer Zellhaute. Histologische
Beitrage. H. 2. Jena, 1889. 186 S.
101
Sunesson S. Zur Embryologie der Gattung Viburnum. — Bot. Notiser, 1933,
S. 181—194.
Szabo Z. A Knautia-genusz monografiaja. Budapest, 1911. 435 p.
S z a b 6 Z. The development of the flower of Dipsaeaceae. — Amer. J. Bot., 1923, v. 37,
p. 325—334.
S z a b 6 Z. A Cephalaria-geaasz monografiaja. (Monographia genus Cephalaria).
Budapest, 1940. 392 p.
T a m m e s T. Dipsacan und Dipsacotin, ein neuer Farbstoff der Dipsaeaceae. — Rec.
Trav. bot. Neerl., 1909, t. 5.
T a m m e s T. Notisz iiber das Vorkommen von Dipsaean bei den Dipsaeaceae. — Rec.
Trav. bot. Neerl., 1911, t. 8.
T i e g h e m Ph. van. Remarques sur les Dipsacacees. — Ann. Sci. Nat. Ser. 9, 1909,
t. 10, p. 148—200.
Tischler G. Die Periplasmodienbildung in den Antheren der Comubrigen Mono-
cotylen. — Jahrb. wiss. Bot., 1915, Bd 55, S. 52—90.
T г e u b M. Sur le Casuarinees et leur place dans le systeme natural. — Ann. jard. bot.
Buitenzorg, 1891, v. 10, p. 145.-231.
Va z art B. Contribution a I'etude caryologique des elemente reproducteuers et de
la fecondation chez les vegetaux angiospermes. — Rev. Cytol. Biol, veg., 1955, v. 16,
p. 76-89.
V a z a r t J. Degenerescence d'une synergide et penetration du tube pollinique dans le
sac embryonnaire de Linum usitatissimum L. — Ann. Univ. et ARERS, 1971, v. 9,
N 1, p. 89-97.
Venkata Rao C. Embryologycal studies in Malvaceae. I. Development of gameto-
phytes. — Proc. Nat. Inst. Sci. India, 1954, v. 20, p. 56—62.
Verlaque R. Rapports entre les Valerianaceae, les Morinaceae et les Dipsaeaceae. —
Bui. Soc. bot. France, 1977a, t. 124, N 7—8, p. 475—482.
Verlaque R. Importance du fruit dans la determination des Dipsaeaceae. — Bui.
Soc. bot. France, 1977, t. 124, N 9, p. 515—527.
•V i e t h J. Etude de quelques inflorescences anormales de scabiesus. — Bui. Soc. bot.
France, 1963, t. 110, N 1—2, p. 36—45.
V i e t h J. Etude d'inflorescences partielles anormales chez Morina longifolia. — Bui.
Sci. Bourgogne, 1963—1964, v. 22, p. 47—52.
Vieth J. Le capitule de Dlpsacus represente—t-il un systeme bijuque?—Bui.
Soc. bot. France, 1964, t. Ill, N 1—2, p. 38—47.
Vijayaraghavan M. R., Sarveshwari G. S. Embryology and
systematic position on Morina longifolia Wall. — Bot. Notiser, 1968, v. 121, fasc. 3, p. 383—
402.
Wagenitz G. Die systematische Stellung der Rubiaceae. Ein Beitrag zum System
der Sympetalen. — Bot. Jahrb. Stuttgart, 1959, Bd 79, H. 1, S. 17—35.
Wagenitz G. Reihe Dipsacales (Rubiales p. p.). — In: E n g 1 e r A. Syllabus der
Pflanzenfamilien. Bd. 2, Berlin. 1964, S. 472—478.
Warming E. Observations sur la valeur systematique de l'ovule. — Mind. Jap.
Steen., 1913, v. 24, p. 1—45.
Weberling F., Schwantes H. O. Pflanzensystematik. Stuttgart, 1972.
381 S.
Wettstein R. Handbuch der systematischen Botanik. Bd 1, 2. 4 ed. Leipzig—
Wien, 1901, 1908. 201 S., 578 S.
Wunderlich R. Uber das Antherentapetum mit besonderer Beriicksichtigung
seiner Kernzahl. — Oster. bot. Zeitschr., 1954, Bd 101, H. 1—2, S. 1—63.
Wunderlich R. Zur Frage der Phylogenie der Endospermatypen bei den Angio-
spermen. — 6ster. bot. Zeitschr., Bd 106, N 3—4, S. 203—293.
Zeven A. C., Zhukovs k.y P. M. Dictionary of cultivated plants and their
centres of diversity. Wageningen, 1975. 219 p.
СОДЕРЖАНИЕ
Стр.
Предисловие 3
Введение 5
Краткий обзор систематики семейств Dipsaeaceae и Morinaceae 7
К истории изучения эмбриологии семейств Dipsaeaceae и Morinaceae 11
Материалы исследования и методика 15
Развитие пыльника и пыльцевого зерна в семействах Dipsaeaceae и
Morinaceae 21
Андроцей 21
Стенка пыльника 22
Микроспорогенез 29
Пыльцевое зерно 31
Тип тапетума у ворсянковых 35
О классификации типов тапетума у покрытосеменных 36
Развитие женских эмбриональных структур в семействах Dipsaeaceae и
Morinaceae 40
Семяпочка 40
Мегаспорогенез и развитие зародышевого мешка 44
Оплодотворение 62
Эндоспермогенез и эмбриогенез в семействах Dipsaeaceae и Morinaceae .... 69
Развитие эндосперма 69
Развитие зародыша 77
Положение семейств Dipsaeaceae и Morinaceae в филогенетической системе
покрытосеменных по данным эмбриологических исследований 85
Литература 95
Ольга Петровна Камелина
СРАВНИТЕЛЬНАЯ ЭМБРИОЛОГИЯ СЕМГСмГ.ТВ,
DIPSACACEAE И MORINACEAE
Утверждено к печати
Ботаническим институтом им. В. Л. Комарова
Академии наук СССР
Редактор издательства Г. Н. Антик
Художник Д. С. Данилов
Технический редактор Г. А. Смирнова
Корректор С. И. Семиглазова
ИБ № 9124
Сдано в набор 12.03.80. Подписано к печати 02.07.80. М-20912. Формат
70xl08Vio- Бумага типографская МЬ 1. Гарнитура обыкновеннал.
Печать высокая. Печ. л. 67а+4 вкл. (>/г печ. л.)=9.80 усл. печ. л.
Уч.-изд. л. 10.22. Тираж 1000. Изд. № 7426. Тип. зак. 1247.
Цена 1 р. 50 к.
Ленинградское отделение издательства «Наука»
199164, Ленинград, В-164, Менделеевская лин., 1
Ордена Трудового Красного Знамени
Первая типография издательства «Наука»
199034, Ленинград, В-34, 9 линия, 12