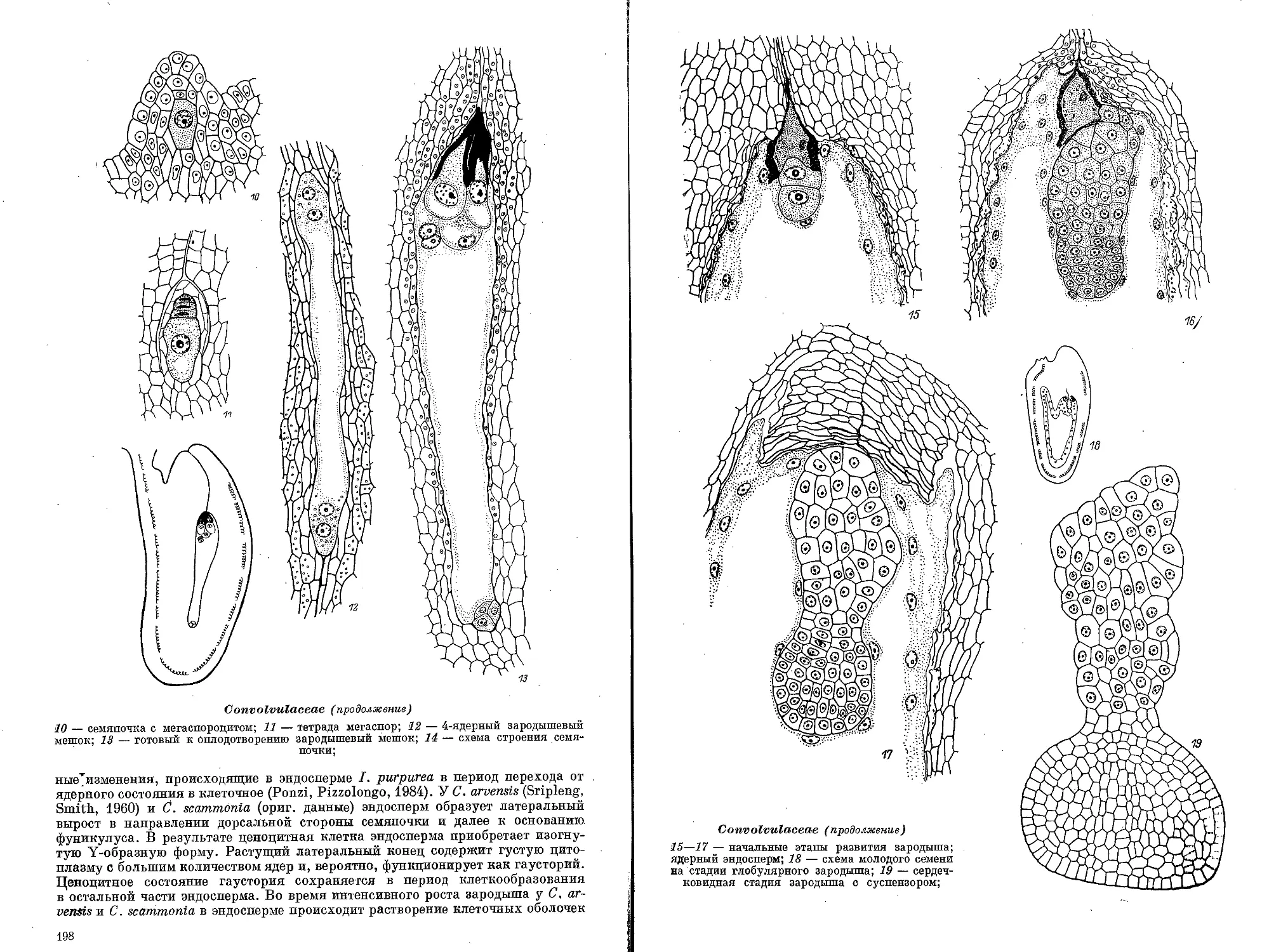
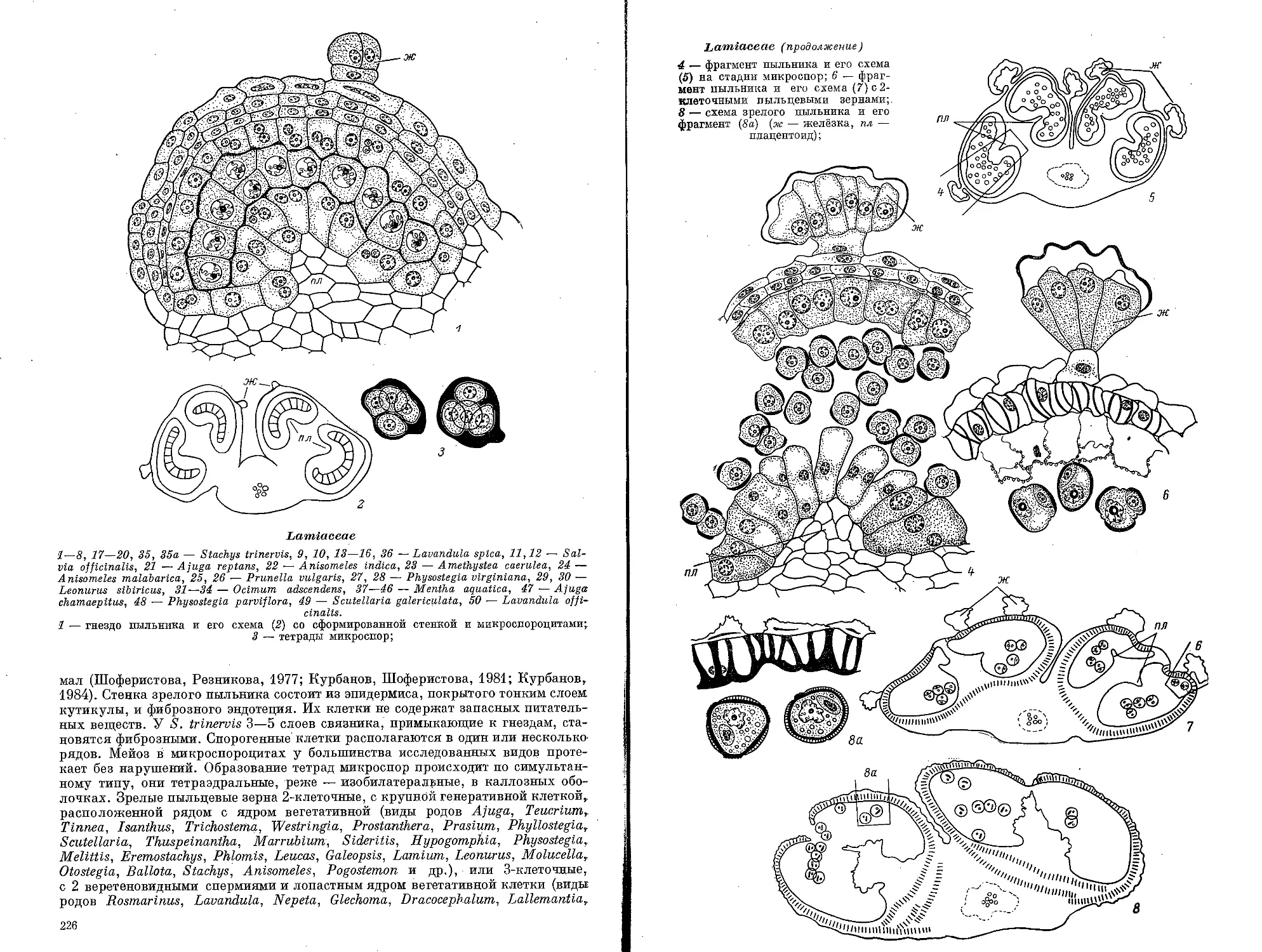
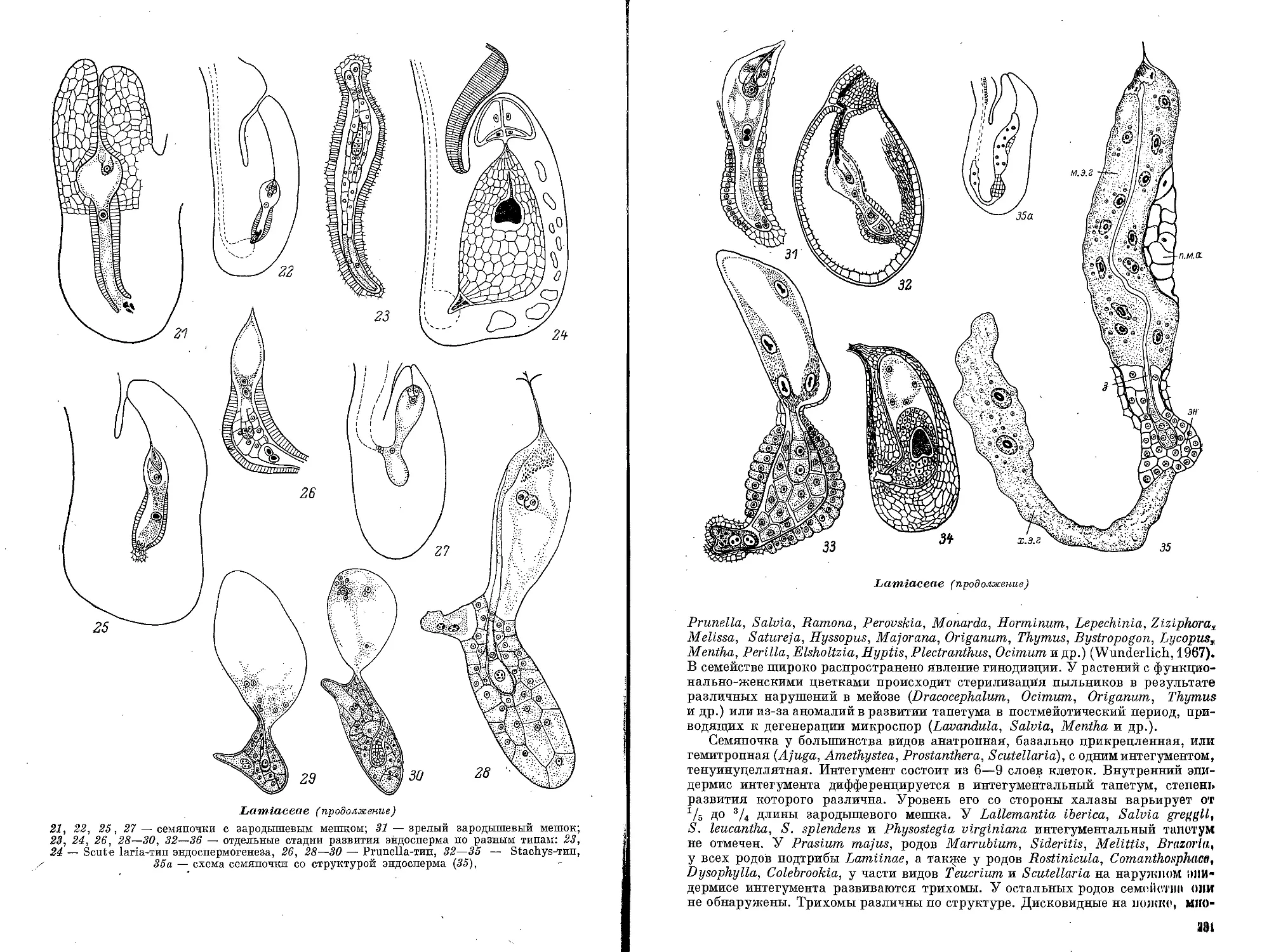
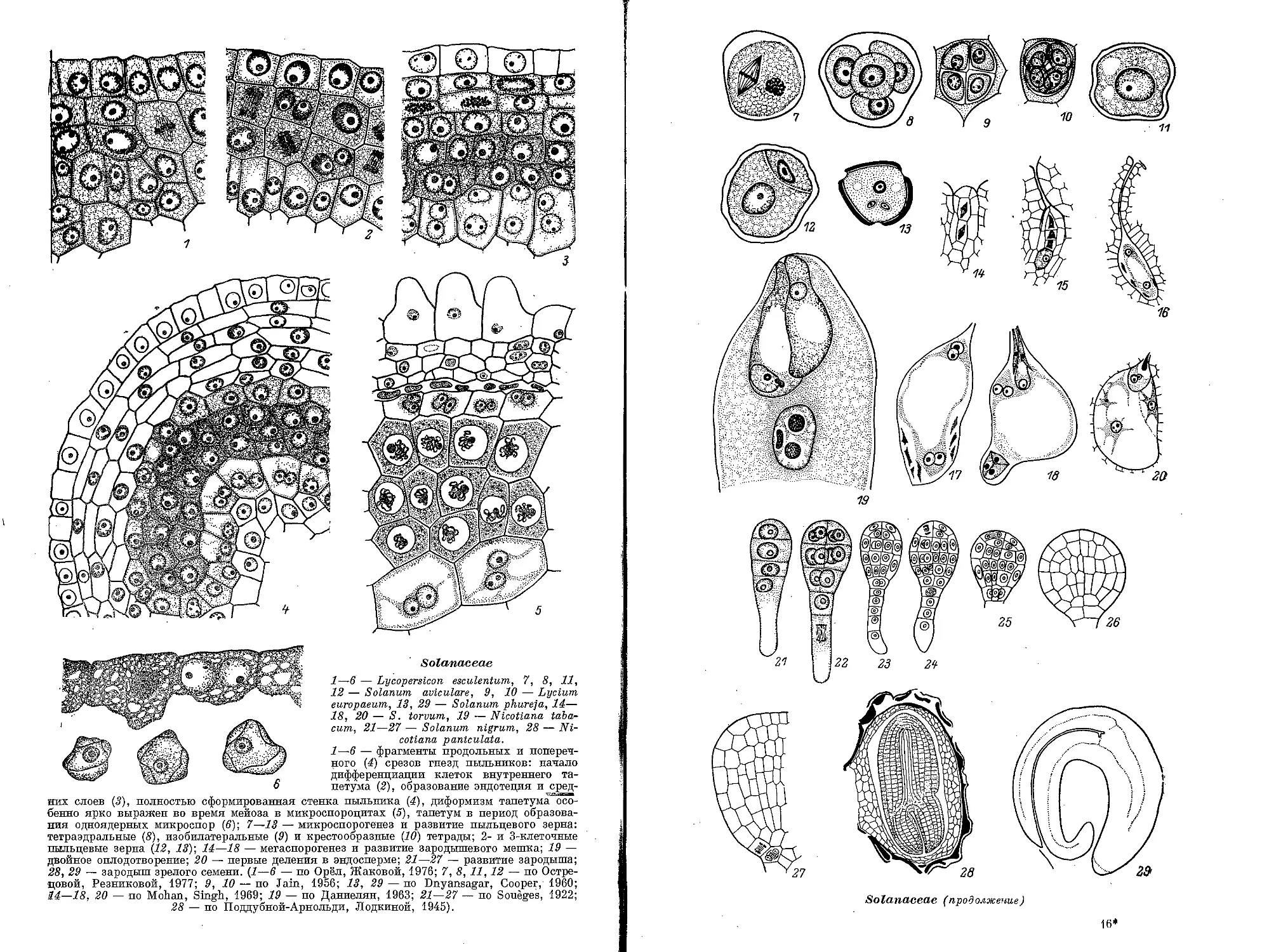
Текст
АКАДЕМИЯ
НАУК
СССР
СРАВНИТЕЛЬНАЯ
ЭМБРИОЛОГИЯ
ЦВЕТКОВЫХ
АКАДЕМИЯ НАУК СССР
БОТАНИЧЕСКИЙ ИНСТИТУТ им. В. Л. КОМАРОВА
ACADEMY OF SCIENCES OF THE USSR
КОМА ДО V BOTANICAL INSTITUTE
COMPARATIVE
EMBRYOLOGY
OF FLOWERING
PLANTS
DAVIDIACEAE-ASTERACEAE
t ~
LENINGRAD
«NAUKA» PUBLISHERS
LENINGRAD BRANCH
1987
СРАВНИТЕЛЬНАЯ
ЭМБРИОЛОГИЯ
ЦВЕТКОВЫХ
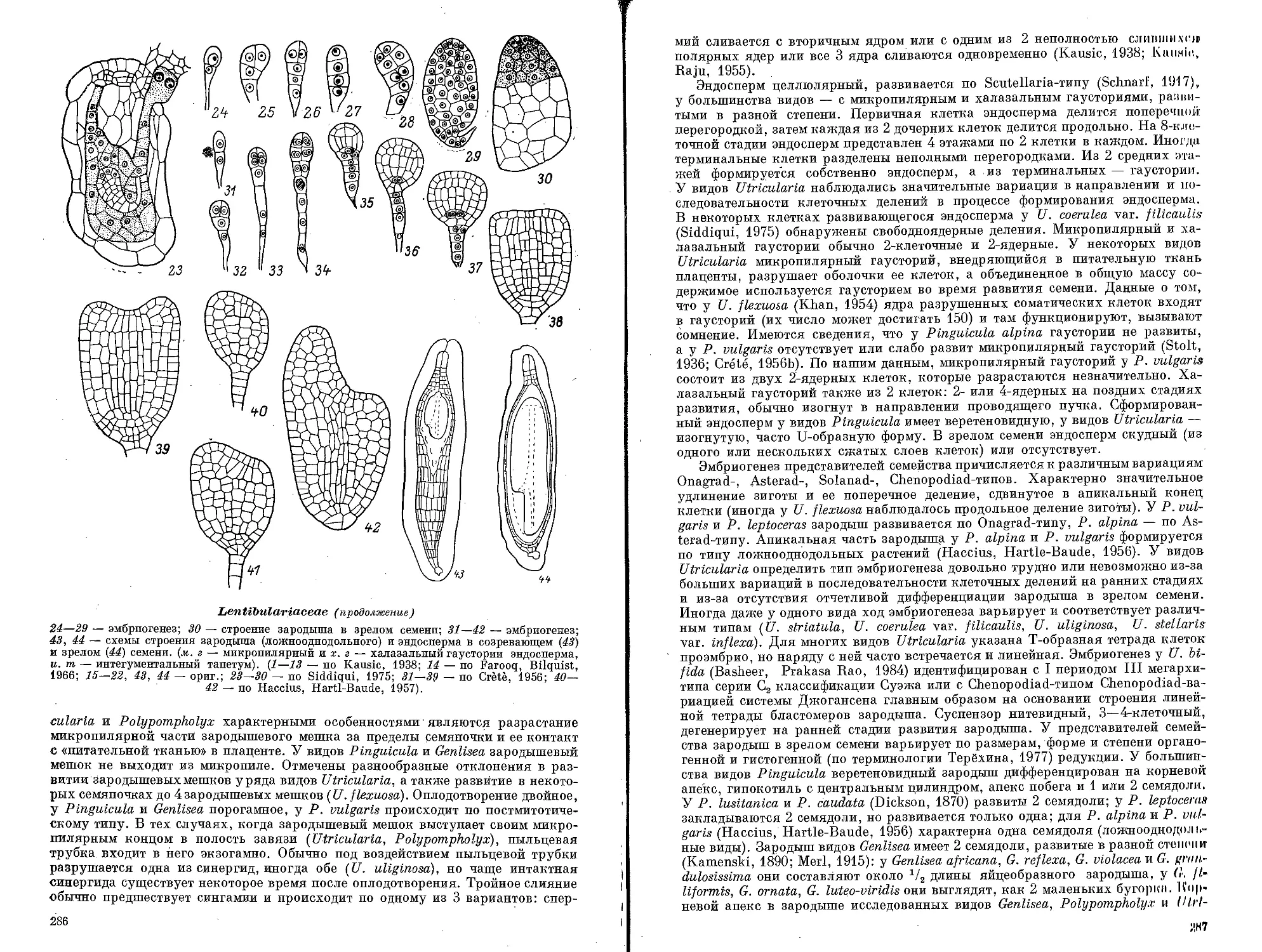
РАСТЕНИЙ
DAVIDIACE AE -ASTERACEAE
. —,
ЛЕНИНГРАД
ИЗДАТЕЛЬСТВО «НАУКА»
ЛЕНИНГРАДСКОЕ ОТДЕЛЕНИЕ
1987
УДК 581.3+582.4/9
Сравнительная эмбриологии цветковых растений. Davidiaceae-Asteraceae/Отв. ред
I. Б. Батыгина, М. С. Яковлев. — Л.: Наука, 1987. —392 с.
В книге, которая является четвертым томом многотомного издания по сравнительной эмбтто-
логии цветковых растений, даны эмбриологические характеристики ЭТ™ейстЕ покрыто
семенных, составленные на основании имеющихся литературных сведенийи в ряде сшейси
дополненные оригинальными данными, иллюстрированные рисунками и мтаройотогмГи^
на световом и электронном уровнях. Библиогр*. 2296 назв. Ил 85(73 рисГ-+12табл -W)
Авторы:
Г. К. АЛИМОВА, Н. Н. АНДРОНОВА, Г. М. АНИСИМОВА, Т. Б. ВАТЫГИНА
В. Е. ВАСИЛЬЕВА, В. А. ВЕРЕЩАГИНА, М. А. ВИШНЯКОВА, Н. А. ГРЕВЦОВА,
[а. к.дзевалтовский[.е. в, драгунова, н. а. жинкина, г. я. Жукова,.
О. П. КАМЕЛИНА, Г. Е. КОЛЕСОВА, С. Н. КОРОБОВА, Л. Г. КРАСНИКОВ,
А. И. ЛИТВАК, Н. М. ЛИТВИНЕНКО, Т. Б. МАМЕТЬЕВА, Т. Н. НАУМОВА^
3. И. НИКИТИЧЕВА, [в. А. ПОДДУБНАЯ-АРНОЛЬДЙ|. О. Б. ПРОСКУРИНА,
Г. И. САВИНА, Т. Б. СОКОЛОВСКАЯ, М. П. СОЛНЦЕВА, Э. С. ТЕРЁХИН,
А. А. ТИТОВА, Т. Е. ФРЕЙБЕРГ, И. И. ШАМРОВ,. С. В. ШЕВЧЕНКО,
Л. М. ЯКИМОВ, М. С. ЯКОВЛЕВ
Редакционная коллегия:
Т. В. БАТЫГИНА (ответственный редактор), Г. Я. ЖУКОВА, О. П. КАМЕЛИНА
(ответственный секретарь), А. Л. ТАХТАДЖЯН, М. С. ЯКОВЛЕВ (ответственный редактор}»
Рецензенты:
Н. Н. ЦВЕЛЕВ, | А. А. ЯЦЕНКО-ХМЕЛЕВСКИЙ ,'
Authors:
G. К. ALIMOVA, N. N. ANDRONOVA, G. M. ANISIMOVA, Т. В. BATYGINA,
Е. V. DRAGUNOVA, |А. К. DZEVALTOVSKy|, Т. Е. FREIBERG, N. A. GREVTSOVA^
О. P. KAMELINA, G. E. KOLESOVA, S. N. KOROBOVA, L. G. КRASNIKОV,
A. I. LITVAK, N. М. LITVINENKO, Т. В. MAMETYEVA, Т. N. NAUMOVA,'
Z. I. NIKITICHEVA, | У. A. PODDUBNAYA-ARNOLDI |, О. В. PROSKURINA,
G. I. SAVINA, I. I. SHAMROV, S. V. SHEVCHENKO, Т. В. SOKOLOVSKAYA,
М. P. SOLNTSEVA, E. S. TERYOKHIN, A. A. TITOVA, V. Е. VASILYEVA, '
V. A. VERESHCHAGINA, M. A. VISHNYAKOVA, L, M. YAKIMOV, M. S. YAKOVLEV,
N. A. ZHINKINA, G. Ya. ZHUKOVA
Editorial board:
Т. В. BATYGINA (editor), О. P. KAMELINA (secretary), A. L. TAKHTAJAN,
M. S. YAKOVLEV (editor), G. Ya. ZHUKOVA
Reviewers:
N. N. TSVELEV | A. A. YATSENKO-KHMELEVSKY
2004000000-710
042(02)-87 235-87J— IV q Издательство «Наука», 1987 г.
ПРЕДИСЛОВИЕ
В настоящий, четвертый том «Сравнительной эмбриологии цветковых
растений» включены семейства от Davidiaceae до Aiteraceae из подклассов Rosidae
(порядки Cornales—Proteales) и Asteridae (порядки Genlianales—Asterales),
которые занимают высшее положение в классе двудольных в филогенетической
системе цветковых (Тахтаджян, 1980). Порядки, упомянутые выше, в основном
характеризуются прогрессивными эмбриологическими признаками. Так,
наряду с секреторным тапетумом в пыльниках, который характерен для
большинства семейств этих порядков, встречаются семейства с тапетумом, развитие
которого проходит с реорганизацией по тому или иному способу, что особенно
свойственно порядкам подкласса Asteridae (Dipsacales, Gentianales, Polemonia-
les, Asterales). В большинстве семейств, .рассматриваемых в этом томе,
семяпочки с одним интегументом, тенуинуцеллятные; зародышевые мешки разных
типов; целлюлярный, чаще с гаусториями эндосперм.
Эмблемой IV тома послужил зародыш в зрелом семени Cephalaria syriaca
(Dipsacaceae).
В IV том вошли эмбриологические характеристики 87 семейств из 18 порядков.
Принцип составления эмбриологической характеристики семейства,
иллюстраций и их описаний тот же, что и в предыдущих томах. Здесь, как и раньше,
во многих семействах приведены не полные списки исследованных видов,
а общее число видов исследованных родов (в скобках). Список литературы
составлен по тому же принципу, что и в III томе этого издания. В конце
эмбриологической характеристики каждого семейства приводится по возможности
полный перечень литературных источников (автор, год). В общий список
библиографии IV тома вошли основные эмбриологические работы по каждому
семейству. В связи с ограниченным объемом тома в него не включены работы,
упомянутые в I—III томах, статьи с фрагментарными сведениями по
эмбриологии, тезисы докладов совещаний, диссертации и их авторефераты,
фундаментальные труды по ботанике и другие ботанические сводки, из которых, однако,
были почерпнуты некоторые сведения по отдельным признакам для
эмбриологически не изученных семейств.
Внесена некоторая упорядоченность в терминологию. Это в первую очередь
касается типов формирования стенки пыльника. Центробежный и
центростремительный типы употребляются без дублирующих названий «двудольный»
и «однодольный» соответственно. При этом остальные критерии в
классификации Дэвис (Davis, 1966) остаются прежними (см. раздел «Пыльник» в «Словаре
основных терминов» в I томе этого издания). Более четко определены границы
стадии микроспоры — от тетрады микроспор до митоза ее ядра, когда
образуется 2-клеточное пыльцевое зерно.
В составлении IV тома кроме сотрудников Лаборатории эмбриологии БИН
АН СССР принимали участие эмбриологи из других учреждений: В. А. Под-
дубная-Арнольди (Москва, ГБС), Н. Н. Андронова (Калининград,
университет), В. А. Верещагина (Пермь, университет), М. А. Вишнякова
(Ленинград, ВИР), Н. А. Гревцова (Москва, МГУ), А. К. Дзевалтовский (Киев,
Ботан. сад КГУ), А. И. Литвак, Л. М. Якимов (Кишинев, Институт садовод-
5
ства и виноградарства), Н. М. Литвиненко (Киев, ЦРВС), А. А. Титова (Куста
наи Пединститут), С. В. Шевченко (Ялта, Никитский ботан. сад) (У
»™ К°НЦе Т°Ма пРиведана сводная таблица (см. Приложение, с. 332) с
данными по запасным питательным веществам зародыша и эндосперма для се-
ГтГленГй 0МВ ПпГГ" ™VKa3aTeJIb ЛаТИНСКИХ Н"ё Pa--i
составленный О. В. Проскуриной. Копии рисунков из опубликованных работ
HZf? ХуДОЖНИЦеЙ Р- А- Лейкиной, оригинальные рисунки - авторами!
В характеристики многих семейств вошли материалк исследований авторов
что, как и в предыдущих томах, отмечено в каждом случае (<<ориг. данные?-
под характеристикой и «ориг.» - в подписях к рисункам). Материал для
исследования собирался в Батумском, Никитском, Душанбинском! Сухумском
и 1ашкентском ботанических садах, в оранжереях и саду ВИН АН СССР
В ТЕГТЫХ УСЛ°ВИЯХ КрЫМа' КавКаза' СРе*ней Азии' Ленинградской обл.'
Авторы и редколлегия выражают искреннюю благодарность за помощь
1™°Т0ВЛеШШ пРепаРатАов,? техническую работу при составлении и
оформлении данного тома Н А Жинкиной, О. Б. Проскуриной, Н. Г. Тучиной,
Л. М. Ротенфельд, С. И. Исаковой, Е. В. Драгуновой, М. Д Иоффе
Порядок 54. GORNALES
Семейство DAVIDIACEAE
Пыльники у Davidia involucrata,* по нашим данным, 4-гнездные, 2-тековые,
вскрываются продольно. Гнезда в теках перед вскрытием объединяются из-за
разрушения перегородки между ними. Сформированная центробежно стенка
гнезда пыльника состоит из эпидермиса, эндотеция, 2—3 средних слоев и та-
петума. Тапетум клеточный секреторный, нерегулярно 2-слойный, клетки его
2—4-ядерные или с одним полиплоидным ядром, к началу мейоза хорошо
дифференцирован. На ранних стадиях развития клетки внутренней (со стороны
связника) части тапетума значительно крупнее наружных (в стенке пыльника),
но уже во время мейоза тапетум становится морфологически однородным.
Со стадии вакуолизации микроспор на поверхности тапетума заметны мелкие
орбикулы. Деструкция тапетума и лизис содержимого его клеток начинаются
со времени образования 2-клеточных пыльцевых зерен. В зрелом пыльнике
тапетум отсутствует, лишь едва заметна тапетальная пленка с орбикулами.
Один или 2 средних слоя, примыкающих к тапетуму, в период мейоза
постепенно дегенерируют, а третий, примыкающий к эндотецию слой, сохраняется
на всем протяжении развития пыльника, почти до полной его зрелости. На
ранних стадиях в этом слое, в эндотеции и особенно в эпидермисе содержится
значительное количество зерен крахмала, которые к моменту образования
2-клеточных пыльцевых зерен практически полностью исчезают. На. этой же
стадии в увеличившихся клетках эндотеция появляются массивные
фиброзные пояски. Стенка зрелого пыльника состоит из~ сплющенных клеток
эпидермиса, фиброзного эндотеция и одного среднего слоя. Спорогенная ткань
многослойная. Образование тетрад микроспор симультанное. Тетрады в кал-
лозных оболочках, изобилатеральные, тетраэдральные, изредка линейные.
Довольно часто встречаются пентады, гексады и полиады. Зрелые пыльцевые
зерна одиночные, 2-клеточные. Генеративная клетка относительно крупная,
располагается рядом с ядром вегетативной клетки. В цитоплазме
развивающихся пыльцевых зерен содержится крахмал, в зрелых — липиды. Развитие
пыльцевых зерен часто протекает асинхронно. В одном и том же гнезде
пыльника можно наблюдать все промежуточные стадии между вакуолизированной
микроспорой с ядром у оболочки и 2-клеточным пыльцевым зерном с
генеративной клеткой в центре зерна. В отдельных пыльниках отмечается много
стерильных пыльцевых зерен; возможны случаи полной дегенерации
пыльников.
Семяпочка анатропная, висячая, на очень коротком фуникулусе, с одним
интегументом из\10—12 слоев клеток, крассинуцеллятная. Внутренний
эпидермис интегумента дифференцируется в интегументальный тапетум,
состоящий из густоплазменных, но не очень крупных клеток. Микропиле довольно
длинное и прямое, направлено вверх. В интегументе имеются крахмальные
зерна и кристаллы оксалата кальция. Проводящий пучок из фуникулуса
доходит до халазы. Нуцеллус хорошо развит, в результате деления его
эпидермиса в микропилярной части образуется 3—4-слойный нуцеллярный
колпачок, под ним располагаются 3—4 слоя париетальной ткани, которая, как и
2-слойная латеральная часть нуцеллуса, дезинтегрирует в процессе
созревания зародышевого мешка. Халазальная часть нуцеллуса в виде колонки из
тонкостенных вытянутых клеток и клетки нуцеллярного колпачка, которые
значительно увеличиваются в размерах, сохраняются до ранних стадий
развития эндосперма. Археспорий одноклеточный, реже — 2- или
многоклеточный (Ногпе, 1909). Археспориальная клетка, делясь периклинально, образует
первичную париетальную клетку, которая формирует париетальную ткань,
и спорогенную, превращающуюся в мегаспороцит. В результате мейоза обра-
Материал собран в Никитском ботаническом саду.
7
1—20 — развитие пыльника и пыльцевого зерна: 1—3 — формирование стенки пыльника
и спорогенной ткани, 4 — фрагмент пыльника с микроспороцитами, тапетум 2-слойный,
5 — метафаза мейоза I и б — телофаза мейоза II в микроспороцитах, 7 — фрагмент
пыльника на стадии тетрад микроспор; тетраэдральные, изобилатеральная и линейная (8)
тетрады микроспор,
зуется линейная тетрада мегаспор. Халазальная мегаспора продолжает
функционировать, остальные постепенно дегенерируют.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Зрелый зародышевый мешок узкий и длинный. Яйцеклетка крупная,
грушевидная, с ядром в апикальной части клетки и вакуолью — в базальной. Синер-
гиды с округлыми и широкими базальными концами, с хорошо различимым
8
Davidiaceae (продолжение)
9—11 — полиады, 12, 13 — специализация слоев стенки пыльника, 14 — фрагмент зрелого
пыльника (12а—14а — схемы пыльников на этих стадиях, заштрихован фиброзный слой),
нитчатым аппаратом и крючковидными латеральными выростами, с плотной
цитоплазмой и вакуолью в апикальной части клетки, над которой находится
ядро. Центральная клетка зародышевого мешка длинная, пронизапа тяжами
цитоплазмы, в которой локализуется, как и в цитоплазме яйцеклетки,
большое количество зерен крахмала. Полярные ядра сливаются до оплодотноропия.
Центральное ядро располагается в верхней трети зародышевого мошка ИЛИ
II
шш
15-
24,
Davidiaceac (продолжение)
-20 — развитие пыльцевого зерна; 21—23 — начальные стадии
25 — тетрады мегаспор; 26—28 — развитие зародышевого мешка;
мешка в пуцедлусе;
развития семяпочки;
29 — 2 зародышевых
Davidiaceae (продолжение)
30 — зрелый зародышевый мешок; 31 — семяпочка; 32, 33 — двойное оплодотворенил;
дополнительные спермин (33) в заррдышевом мешке; 34, 35 — зиготогенез и развитие
эндосперма; 36 — 2-клеточный проэмбрио. (1—36 — ориг.).
под яйцевым аппаратом. Антиподы — 3 округлые клетки с вытянутыми
кончиками. В сформированном зародышевом мешке они одноядерные, затем
становятся 2- или многоядерными, иногда образуют многоклеточный антиподаль-
ный комплекс и сохраняются вплоть до образования многоклеточного
эндосперма.
В случае многоклеточного археспория в семяпочке образуются несколько
тетрад мегаспор и несколько зародышевых мешков, но нормального развития
чаще достигает только один, остальные с 2—4-ядерной стадии дегенерируют.
В развитии зародышевых мешков отмечены аномалии, выражающиеся в
изменении числа ядер, их положения и формы, в нетипичном строении яйцевого
и антиподального аппаратов, в числе полярных ядер и др. Все такие аномалии
чаще всего приводят к стерилизации семяпочки (Ноте, 1909).
Оплодотворение порогамное, двойное, осуществляется но премитотическому
типу. Пыльцевая трубка проникает в зародышевый мешок, разрушая синер-
гиду. Наблюдалось вхождение дополнительной пыльцевой трубки в
зародышевый мешок, при этом разрушалась вторая синергида, а спермин находились
в пространстве между яйцеклеткой и центральной клеткой или в центральной
клетке около уже оплодотворенного центрального ядра. Период покоя зиготы
длительный — до 3 недель. Зигота перед делением значительно увеличивается
и удлиняется, в ней накапливается крахмал.
Эндосперм целлюлярный. Первые перегородки закладываются поперечно
длинной оси зародышевого мешка, следующие — в различных направлениях.
В зрелом семени эндосперм сохраняется, содержит запасной крахмал.
Эмбриогенез исследован недостаточно. Зигота делится поперечной
перегородкой. Тетрада Т-образная. Базальная клетка многоклеточного подвеска
становится пузыревидной. Зрелый зародыш прямой, дифференцированный, с
продолговатыми семядолями и цилиндрическим гипокотилем, занимает большую часть
семени. Лейкоэмбриофит.
Исследованный вид. Davldia involucrata.
Литература. Home, 1909, 1914; Тахтаджян, 1966; Шевченко, Ка-
мелина (ориг. данные).
Семейство NYSSACEAE
Пыльник у Nyssa sylvatica 4-гнездный; ко времени созревания пыльцы в
результате разрушения перегородки гнезда попарно сливаются в теках.
Сформированная стенка гнезда пыльника состоит из эпидермиса, эндотеция (в котором
впоследствии развиваются фиброзные утолщения), 3 (Mohana Rao, 1972) или
$-—5 (по нашим данным) средних слоев и тапетума. Иногда наблюдаются
дополнительные периклинальные деления в клетках эндотеция. При этом 2
дочерние клетки не выходят за пределы одного ряда. Средние слои эфемерны.
Имеются различные мнения о начале их отмирания. Есть указания, что средние
слои обнаруживают признаки дегенерации ко времени мейотического деления
микроспороцитов (Mohana Rao, 1972). По нашим данным, в этот период
происходит уплощение клеток средних слоев, которое начинается со слоя,
примыкающего к тапетуму, и постепенно распространяется на слои, лежащие
кнаружи. Во время мейоза клетки средних слоев еще сохраняют свою
жизнеспособность и отмирают позднее. Тапетум секреторный, ко времени формирования
микроспороцитов становится 2-ядерным. В результате аномалий митотических
делений тапетальных ядер (происходящих в период мейоза микроспороцитов)
в клетках может образоваться от 1 до 3 ядер неправильной формы и различной
плоидности. В зрелом пыльнике стенка состоит из эпидермиса и эндотеция.
Спорогенная ткань многорядная, многоклеточная. Во время мейоза нередки
нарушения: при переходе от лептотены к пахитене наблюдаются аномальная
вакуолизация микроспороцитов, фрагментация хромосом, образование
микроядер, появление в ядрах и цитоплазме гомогенных структур различной формы
и размера, дающих реакцию на ДНК; не исключено наличие цитомиксиса.
Иногда наблюдается дегенерация ядер тапетальных клеток, окружающих
12
Nyssaceae '
1—20, 23—26 — Nyssa sylvatica, 21—22 — N. biflora.
1 — фрагмент пыльцевого гнезда: археспорий, формирующаяся стенка пыльника; 2 -•-
микроспороцит в стадии лептотены; 3,4 — фрагменты пыльцевых гнезд на различных
стадиях профазы I мейотического деления микроспороцитов; 5 — метафаза I мейотического
деления; 6 — телофаза I мейотического деления; 7 — тетрада микроспор; 8 — микроспора;
9 — деление микроспоры; 10 — 2-клеточное пыльцевое зерно; 11 — тапетальная клетки;
объединение 2 веретен деления; 12 — фрагмент гнезда пыльника с аномальными микро-
спороцитами и частью тапетума; 13—20 — мегаспорогенез и развитие зародышевого mouiku
по Polygonum-типу; 21, 22 — начало развития биспорического зародышевого мешка; 28 —
первичное ядро эндосперма; слияние женского и мужского ядрышек; 24 — оплодотпороппый
зародышевый мешок; 25 — зародышевый мешок на стадии нуклеарного эпдосиорма; 26 —
целлюлярный эндосперм. (1—12 — ориг.; 13—20, 23—26 — по Mohana Rao, 1972; 21, 22 —
по Tandon, Herr, 1971).
г.
Nyssaceae (продолжение)
i
такие аномальные микроспороциты. В одном и том же пыльнике одни гнезда
могут развиваться нормально, тогда как в других происходят различные
нарушения развития. Образование микроспор симультанное. Тетрады —
тетраэдральные или крестообразные. Зрелые пыльцевые зерна 2-клеточные,
содержат крахмал.
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная. У Nussa
■aquatica, N. biflora и N. sylvatica клетки эпидермиса нуцеллуса делятся пери-
клинально, образуя нуцеллярный колпачок (Tandon, Herr, 1971). По данным
Мохана Pao (Mohana Rao, 1972), у N. sylvatica нуцеллярного колпачка нет.
Археспорий одноклеточный. Археспориальная клетка дифференцируется
непосредственно в мегаспороцит. В результате мейоза образуется линейная
(иногда — у N. biflora — Т-образная) тетрада мегаспор, из которых
функционирует халазальная. Дегенерация нефункционирующих мегаспор начинается
с эпихалазальной, а затем распространяется и на микропилярные мегаспоры.
Развитие 1—3-рядного интегументального тапетума ко времени формирования
2-ядерного зародышевого мешка (Tandon, Herr, 1971) не согласуется с данными
Мохана Pao (Mohana Rao, 1972), который вообще отрицает наличие
интегументального тапетума у N. sylvatica.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Описан биспорический тип зародышевого мешка, встречающийся у N. biflora,
и высказано предположение о возможности этого типа у N. aquatica (Tandon,
Herr, 1971). Зрелый зародышевый мешок овальной формы, с крупными
клетками яйцевого аппарата. Отмеченные случаи дегенерации обеих синергид до
•оплодотворения (Tandon, Herr, 1971) вызывают сомнение. Синергиды у N.
sylvatica дегенерируют после, оплодотворения. Полярные ядра сливаются до
оплодотворения. Антиподы эфемерны — дегенерируют до того, как спермин
проникнут в зародышевый мешок. Процесс оплодотворения практически не
изучен. Судя по рисункам (Mohana Rao, 1972), он происходит по премитоти-
ческому типу.
Эндосперм нуклеарный, но довольно быстро (на стадии 20—25 ядер)
переходит в целлюлярную стадию. У Лг. aquatica описан целлюлярный эндосперм
{Tandon, Herr, 1971).
Тип эмбриогенеза не определен. Зародыш прямой, двусемядольный,
относительно крупный, имеет подвесок.
Исследованные виды. Nyssa aquatica, N. biflora, N. sylvatica.
Литература. Schnarf, 1931; Davis, 1966; Тахтаджян, 1966; Tandon,
Herr, 1971; Mohana Rao, 1972a; Corner, 1976; Поддубная-Арнольди, 1982;
Коробова, 1986 и ориг. данные.
Семейство ALANGIACEAE^
Пыльник 4-гнездный; гнезда объединены в 2 теки. У большинства видов
перед созреванием пыльника перегородка между 2 соседними гнездами каждой
теки разрушается, и гнезда сливаются попарно, за исключением Alangium
longiflorum (Eyde, 1968). По нашим данным, формирование стенки гнезда
пыльника у A. platanifolium происходит по основному типу. Сформированная стенка
гнезда пыльника состоит из эпидермиса, эндотеция, 1—3 средних слоев и
тапетума. Для ряда видов (A. havilandii, A. javanicum, A. ridleyi, A.
platanifolium) характерен эпидермис с сосочковидными клетками, которые образуются
в результате радиального роста. Их наружные стенки кутинизированы. В :шд<>-
теции фиброзные утолщения не образуются (Eyde, 1968; ориг. данные). Тале-
тум клеточный секреторного типа; клетки тапетума становятся 2-ядерними
на стадии профазы мейоза в микроспороцитах и сохраняются до стадии обра
зования 2-клеточного пыльцевого зерна. Стенка зрелого пыльника состоит
только из эпидермального слоя. В каждом гнезде пыльника у A. pla/.an.tfoliiim.
микроспороциты представлены 1—2 слоями клеток. Цитокинез н
микроспороцитах проследить не удалось. Тетрады микроспор изобилатералыше. К арапом
Alangiaceae
1—IS — Alangium platanifolium, 16—19 — A. chinense.
i~15 — развитие пыльника и пыльцевого зерна: 1 — выделение в субэлипермальном слое
археспориальнои ткани и начало ее деления, 2, 3 — образование в гнезде пыльника клеток
париетального слоя и спорогенной ткани, 4—10 — формирование стенки пыльника и спода-
генная ткань на продольном и поперечном срезах гнезда пыльника 11 — 5—6-слойная
стенка пыльника и микроспороциты, 12 — 5—6-слойная стенка пыльника и микроспора
13 — метафаза митоза в микроспоре, '
14 — 7—8-слойная стенка пыльника и 2-клеточное пыльцевое зерно, 15 — 2-клеточное
пыльцевое зерно; 16 — схема строения семяпочки на стадии зрелого зародышевого мешка;
17, 18 — микропилярная часть зародышевого мешка; 19 — халазальная часть
зародышевого мешка. (1—19 — ориг.).
пыльце наблюдается одно ядро (Gopinath, 1945). Однако, по нашим
наблюдениям, у A. platanifolium зрелая пыльца 2-клеточная.
Семяпочка анатропная, с одним интегументом, крассинуцеллятная. Данные
Вангерина (Wangerin, 1906, 1910) о наличии у Alangium 2 интегументов не
нашли подтверждения в работах других авторов. Массивный интегумент,
состоящий из 25—28 слоев, образует длинное узкое микропиле. Внутренний
слой эпидермиса интегумента дифференцируется в интегументальный тапетум.
В микропилярном районе семяпочки эпидермис нуцеллуса делится перикли-
нально и антиклинально, образуя нуцеллярный колпачок толщиной в 2—3 слоя
клеток. В ходе развития зародышевого мешка нуцеллус разрушается, за
исключением микропилярной и халазальной его части. В халазальном районе после
оплодотворения формируется гипостаза, состоящая из 4—5 слоев клеток,
богатых цитоплазмой. У A. chinense (ориг. данные) на стадии зрелого
зародышевого мешка наблюдалось образование подиума. Проводящий тяж семяпочки
заходит в халазу и, минуя гипостазу, продолжается по интегументу,
заканчиваясь вблизи микропиле. Археспорий одноклеточный, делится периклинально,
образуя первичную париетальную и спорогенную клетки. Париетальная клотка
формирует париетальную ткань. Спорогенная клетка преобразуется и мсга-
спороцит, который в результате мейоза образует линейную тетраду мегаспор.
Из халазальной мегаспоры формируется зародышевый мешок.
2 Сравнительная эмбриология
17
Зародышевый молкж рампинаотсн но Polygonum-типу. Яйцевой аппарат
представлен 2 оишфгидпми, и которых четко выражен нитчатый аппарат, и
крупной яйцеклоткой. Полярные ядра располагаются под яйцеклеткой и чаще
остаются но слипшимися до оплодотворения. Антиподы одноядерные, в
большинстве случаен догояорируют еще до оплодотворения. У A. lamarckii
дальнейшее развитие) антипод приводит к формированию 4—6-клеточных зародыше-
подобных структур (Gopinath, 1943, 1945). Вхождение пыльцевой трубки в
зародышевый мошок происходит по порогамному типу, что вызывает частичное
разрушопио иуцоллярмых клеток, находящихся над зародышевым мешком.
Эндосперм иуклоариый у A. lamarckii (Gopinath, 1945) и целлюлярный
у А. chi/uinse (M'itra, Datta, 1947, 1949). На ранних стадиях развития в эндо-
спормо обнаруживается крахмал, а на более поздних стадиях — только жиры
и^ бол ок. Опдоснерм в семени обильный.
Эмбриогенез не изучен. В семени зародыш прямой, с листовидными
семядолями. Хлороэмбриофиты.
Исследованные виды. Alangium chinense (=A. begoniaefolium),
Л. handelii, A. havilandii, A. favanicum, A. lamarckii, A. longiflorum, A. pla-
laru folium, A. ridleyi, A. rotundifolium, A. заЪЩоИит^ A. villosum.
""'л и т е р а т у р aT^angerin,' 1906, 1910; Schnarf, 1922; Netolitzky, 1926;
Mauritzon, 1939; Gopinath, 1943b, 1945; Mitra, Datta, 1947, 1949; Chopra, Kaur,
1965; Kapil, Mohana Rao, 1966; Davis, 1966; Eyde, 1968; Яковлев, Жукова,
1973; Corner, 1976; Поддубная-Арнольди, 1976; Алимова, 1986 и ориг. данные.
Семейство CORNACEAE
Пыльник 4-гнездный. По нашим данным, у Cornus controversa стенка
пыльника развивается центробежно. Сформированная стенка гнезда пыльника
состоит из эпидермиса, эндотеция, 2—3 средних слоев и нерегулярно 2-слой-
ного тапетума. Тапетум клеточный секреторного типа, 2-ядерный, встречаются
единичные 4-ядерные клетки. На стадии 2-клеточного пыльцевого зерна стенка
пыльника представлена эпидермисом, фиброзным эндотецием, 2—3 средними
слоями. Тип образования тетрад микроспор симультанный. Тетрады
микроспор, как правило, тетраэдральные. У С. controversa обнаружено
одновременное присутствие в пыльнике 3 типов тетрад микроспор: тетраэдральных, изо-
билатеральных и крестообразных. Зрелые пыльцевые зерна- 2-клеточные.
Семяпочка анатропная, реже — гемитропная (С. controversa, С. oblonga),
крассинуцеллятная у большинства видов, как исключение, тенуинуцеллятная
у С. florida, С. mas и С. suecica, с одним интегументом. Микропиле относительно
длинное. Внутренний эпидермис интегумента во время образования тетрад
мегаспор преобразуется в интегу ментальный тапетум, состоящий из квадратных
мелких, с плотной цитоплазмой клеток. Местами он становится 2-слойным
в результате периклинальных делений отдельных клеток. После разрушения
клеток нуцеллуса 4-ядерный зародышевый мешок контактирует непосредственно
с интегументальным тапетумом и лишь несколько нуцеллярных клеток
сохраняются в апикальной части. У всех исследованных видов четко выражена
гипостаза. Проводящий пучок проходит по фуникулусу и достигает халазы. В суб-
эпидермальном слое нуцеллуса дифференцируется от одной до нескольких
археспориальных клеток. В крассинуцеллятных семяпочках археспориальные
клетки делятся, образуя париетальные и спорогенные клетки. Париетальные
клетки, формируют 3—5-слойную париетальную ткань. У большинства видов
Cornus I и II деления мейоза в мегаспороците сопровождаются цитокинезом
и заканчиваются образованием линейной, реже — Т-образной тетрады.
У С. атотит в одной семяпочке одновременно могут встречаться линейные
и Т-образные тетрады. У С. florida и С. mas мейоз не сопровождается
цитокинезом, и образуются 4 мегаспориальных ядра с распределением их в первичном
зародышевом мешке 1+3, причем верхнее ядро заметно увеличивается, а 3
других становятся мельче и продвигаются к основанию клетки. У С: florida (Morse,
1907) 3 нижних ядра растворяются, а верхнее ядро путем 3 последующих син-
18
Сотасеае
2—9 11—17 — Cornus controversa, 10 — Cynoxylon florida.
1—3 _ формирование стенки пыльника и; микроспороциты; 4-7 — тетрады микроспор;
8,9- стенка пыльника и микроспоры; 10 - стенка пыльника на стадии 2-клеточного
пыльцевого зерна;
хронных делений образует 8-ядерный зародышевый мешок. У С. mas все 4 ядра
сохраняются в клетке, причем верхнее ядро значительно крупнее нижних,
лежащих сближенно и отделяющихся от верхнего ядра вакуолью. В результате
последующего митотического деления в верхней части ценоцита образуются
2 крупных гаплоидных ядра, а в нижней части - 2 небольших ядра три-
плоидной природы (Fagerlind, 1939). При наличии нескольких мегаспороцитов
2*
19
Сотасеае (продолжение)
11 —■ мегаспороцит в семяпочке; 12 — диада; 13 — тетрада мегаспор; 14 — 2-ядерный
зародышевый мешок; 15 — 4-ядерный зародышевый мешок; 16 — 7-клеточный зародышевый
мешок; 17 — зрелый зародышевый мешок. (1—10 — ориг.; 11—17 — по Sato, 1976).
в каждом из них проходит мейоз и образуются несколько тетрад мегаспор. Время
и место дегенерации мегаспор в тетраде варьируют. В Т-образной тетраде
у С. атотит первой разрушается эпихалазальная мегаспора, тогда как в
линейной тетраде вначале разрушается субмикропилярная мегаспора. Иногда
•субмикропилярная и зпихалазальная мегаспоры дегенерируют одновременно
(Smith, 1973). Функционирующей мегаспорой, как правило, оказывается хала-
зальная, хотя и другие мегаспоры тетрады способны образовывать зародышевые
мешки, что наблюдалось у С. oblonga (Chopra, Kaur, 1965). В семяпочках можно
встретить следующие комбинации зародышевых мешков, образовавшихся из
мегаспор одной тетрады: 2 зародышевых мешка и оба на 2-ядерной стадии;
один зародышевый мешок — на 2-ядерной, другой — на 4-ядерной стадии;
«дин — на 2-ядерной, другой — на. 8-ядерной стадии; оба мешка на 8-ядерной
стадии; 3 зародышевых мешка и все на 2-ядерной стадии; 4 зародышевых мешка
и все на 4-ядерной стадии. В большинстве случаев только один зародышевый
мешок достигает зрелости. Согласно данным Смит (Smith, 1973), у С. florida
наблюдается усиленный рост микропилярной мегаспоры из нуцеллуса и
внедрение ее в микропиле.
Зародышевый мешок моноспорический, у большинства видов развивается
ло Polygonum-типу. Исключением являются С. florida (Morse, 1907) и С. mas
(Hakansson, 1923; Fagerlind, 1939; D'Amato, 1946). У зтих видов формируются
тетраспорические зародышевые мешки по Fritillaria-типу, в редких случаях
встречаются тетраспорические зародышевые мешки Pyrethrum-формы (7-ядер-
ные) или Clintonia-формы (5-ядерные) Drusa-типа. Количественные методы
исследования (Smith, 1975) показали, что у разных видов Cornus зародышевые
мешки варьируют по скорости роста. Сформированный зародышевый мешок
небольшой. Яйцевой аппарат состоит из 2 синергид и яйцеклетки. Синергиды
имеют крючковидные выросты. У С. oblonga одна или обе синергиды могут
дегенерировать вскоре после их организации или могут сохраняться вплоть
до образования 2-клеточного эндосперма. Полярные ядра сливаются в центре
зародышевого мешка или вблизи яйцеклетки еще до вхождения пыльцевой
трубки, образуя крупное центральное ядро. Антиподы варьируют по разме-
20
рам, форме и расположению и часто наблюдаются на ранних стадиях рцмштин
эндосперма. Зрелый зародышевый мешок содержит крахмальные зерна. У С. oh ■
longa был описан зародышевый мешок, который имел 4-клеточный яйцовой
аппарат и дополнительную пару полярных ядер (Chopra, Kaur, 1965).
Эндосперм целлюлярный. Первые 2 деления первичного ядра эндосперма
сопровождаются закладкой поперечных перегородок; следующие деления
клеток эндосперма продольные. На 8-клеточной стадии эндосперм обычно
представлен 2 рядами клеток, каждый из которых состоит из 4 клеток.
Последующие деления в эндосперме происходят в различных направлениях. В
конечном итоге образуется массивная ткань. В микропилярном районе эндосперма
клетки мельче, с более плотной цитоплазмой. Наблюдается значительное
накопление крахмала на ранних стадиях развития эндосперма. Эндосперм
сохраняется в зрелом семени.
Эмбриогенез не изучен. Зрелое семя имеет крупный зародыш, почти
такой же длины, как и самое семя, с листоподобными семядолями и длинным
гипокотилем. Хлороэмбриофиты.
Исследованные виды. Cornus alba, С. alternifolia, С. атотит,
С. asperifolia, С. controversa, С. florida, С. macrophylla, С. mas, С. oblonga, С. san-
guinea, С. stolonifera, С. stricta, С. suecica.
Литература. Vesque, 1878, 1879; Warming, 1878, 1913; J6nsson,
1881; Harms, 1898; Morse, 1907; Winkler, 1908; Wangerin, 1910; Home, 1914;
Hakansson, 1923; Dermen, 1932; Fagerlind, 1939; Wilkinson, 1944; D'Amato,
1946; Chao, 1954; Chopra, Kaur, 1965; Ferguson, 1966; Ерамян, 1967; Eyde,
1967; Juhasz, 1967; Kaur, 1970; Дудукал, 1973, 1974, 1976a, 1976b, 1981; Smith,
1973, 1975; Яковлев, Жукова, 1973; Sato, 1976; Алимова (ориг. данные).
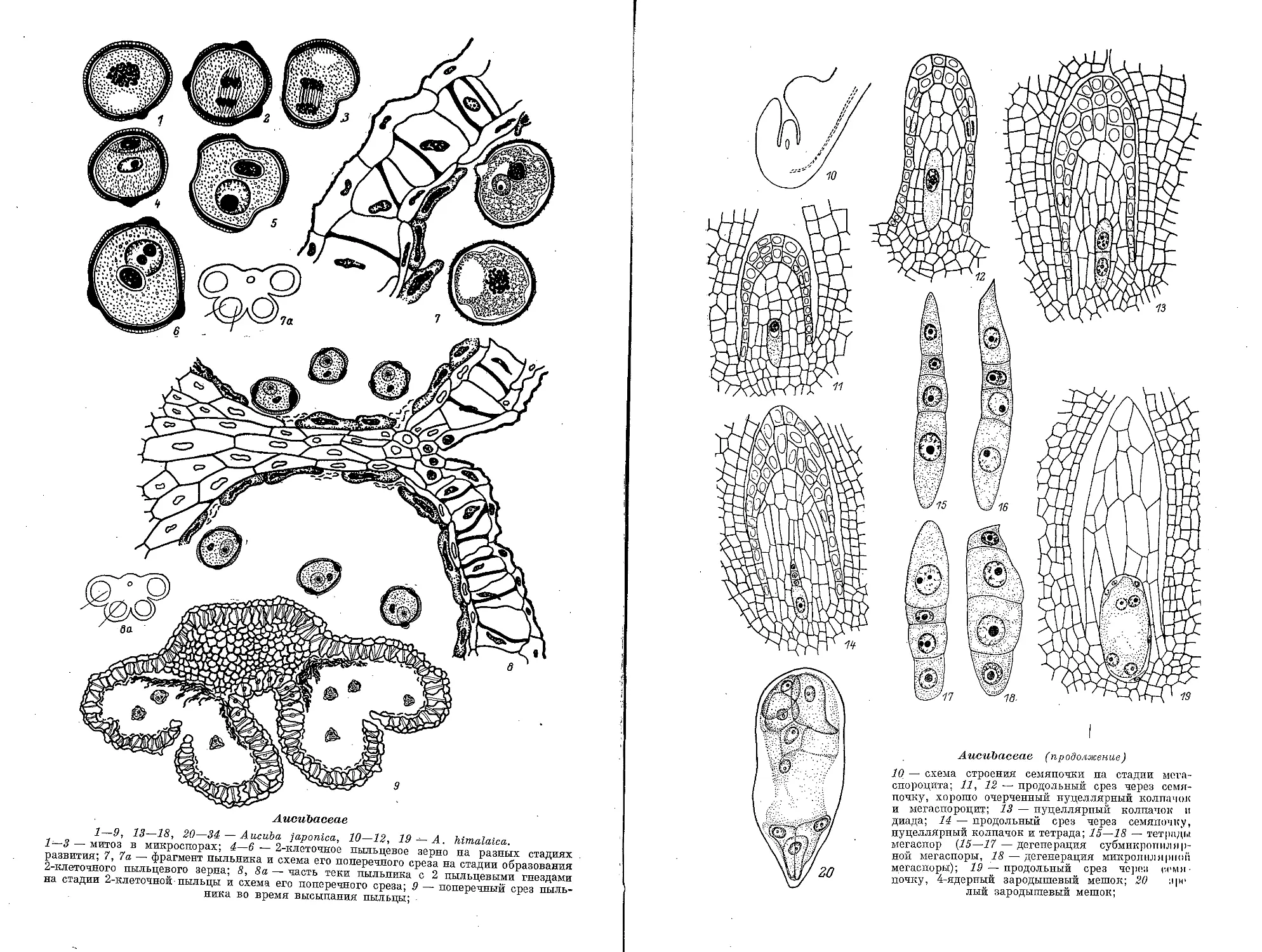
Семейство AUCUBACEAE
Пыльники 4-гнездные, раскрываются продольно; гнезда попарно
объединены в 2 теки. Перед созреванием пыльников гнезда в теках сливаются в
результате разрушения перегородки между ними. По нашим данным, у Aucuba
himalaica и A. japonica * сформированная стенка гнезда пыльника состоит из
эпидермиса, эндотеция, среднего слоя и тапетума. Тапетум клеточный
секреторный, 2-ядерный, сохраняется до образования 2-клеточного пыльцевого
зерна. Стенка зрелого пыльника представлена эпидермисом и фиброзным эндо-
тецием. Зрелая пыльца 2-клеточная.
Семяпочка анатропная, с одним интегументом, крассинуцеллятная. Инте-
гумент многослойный, образует длинный микропилярный канал. По нашим
данным, клетки нуцеллуса крупные, вытянутые, выделяются среди клеток
семяпочки. На стадии зрелого зародышевого мешка клетки нуцеллуса
заполнены крахмалом (Palm, Rutgers, 1917). Эпидермальные клетки нуцеллуса
образуют 2—3-слойный нуцеллярный колпачок. 2 клетки нуцеллярного
колпачка постепенно увеличиваются в размере перед формированием
зародышевого мешка и выдвигаются в микропилярный канал подобно «клюву»; именно
через них может входить в нуцеллус пыльцевая трубка (Sato, 1976).
Проводящий пучок проходит по фуникулусу в семяпочку, достигая ее халазы.
Археспорий одноклеточный. Археспориальная клетка делится периклинально на
париетальную и спорогенную клетки. Париетальная клетка путем
последующих делений формирует 6—7 слоев париетальной ткани. Спорогенная клетка
преобразуется в мегаспороцит. Мегаспороцит образует линейную или реже —
Т-образную тетраду. В некоторых тетрадах мегаспор наблюдается ранняя до-
генерация субмикропилярной мегаспоры. Функционирующей мегаспорой, как
правило, становится халазальная. По нашим данным, функционирующей МОГИ-
спорой может быть также микропилярная, субмикропилярная или
эпихалазальная. Известны случаи, когда 2 мегаспоры тетрады, обычно халааилышо,
Материал собран в Батумском ботаническом саду.
21
Aucubaceae
1—9, 13—18, 20—34— Aucuba japonica, 10—12, 19 — A. himalaica.
1—3 — митоз в микроспорах; 4—6 — 2-клеточное пыльцевое зерно на разных стадиях
развития; 7, 7а — фрагмент пыльника и схема его поперечного среза на стадии образования
2-клеточного пыльцевого зерна; 8, 8а — часть теки пыльника с 2 пыльцевыми гнездами
на стадии 2-клеточной пыльцы и схема его поперечного среза; 9 — поперечный срез
пыльника во время высыпания пыльцы;
Aucubaceae (продолжение)
10 — схема строения семяпочки на стадии мога-
спороцита; И, 12 — продольный срез через
семяпочку, хорошо очерченный нуцеллярньш колпачок
и мегаепороцит; 13 — нуцеллярньш колпачок и
диада; 14 — продольный срез через семяпочку,
нуцеллярньш колпачок и тетрада; IS—18 — тетрады
мегаспор (IS—17 — дегенерация субмикропил
ирной мегаспоры, 18 — дегенерация микропилнрион
мегаспоры); 19 — продольный срез черен семи-
почку, 4-ядерный зародышевый мешок; 30 :ipc
лый зародышевый мешок;
АисиЪасеае (продолжение)
21—34 — эмбриогенез. (1—19 — ориг.; 20 — по Sat6, 1971; 21—34 — по Mestre, Guignard,
1970).
но реже — микропилярные, способны делиться, в результате чего образуются
2 зародышевых мешка (Ногпе, 1914; Palm, Rutgers, 1917; Sato, 1971, 1976).
Зародышевый мешок, как правило, развивается по Polygonum-типу.,
Описан случай образования 8-ядерного зародышевого мешка путем слияния двух
4-ядерных зародышевых мешков в результате дегенерации разделяющей их
перегородки (Sato, 1971). Такой способ развития зародышевого мешка, по
мнению автора, представляет собой промежуточный тип между моноспори-
ческим и биспорическим типами. Отмечалось одновременное присутствие в
семяпочке 4-ядерного и 8-ядерного зародышевых мешков или двух 8-я'дерных
зародышевых мешков. Зрелый зародышевый мешок небольшой, занимает 1/4 ну-
целлуса. Яйцевой аппарат состоит из яйцеклетки и 2 синергид. В халазальной
части зародышевого мешка 3 маленькие антиподы. Полярные ядра сливаются
во время оплодотворения.
Эндосперм целлюлярный. Его формирование предшествует образованию
зародыша. В зрелом семени эндосперм обильный.
Развитие зародыша АисиЪа относится к нерегулярному типу и соответствует
III мегархитипу I периода эмбриогенетической классификации (Mestre, Guig-
nard, 1970). Зрелый зародыш дифференцированный, небольших размеров,
прямой, с 2 семядолями. В литературе описан случай развития зародыша пар-
теногенетическим способом (Eichler, 1878), но он заслуживает тщательной
проверки.
Исследованные виды. АисиЪа himalaica, A. japonica.
Литература. Eichler, 1878; Harms, 1898; Winkler, 1908; Home
1914; Palm, Rutgers, 1917; Hakansson, 1923; Mestre, Guignard, 1970; Sato',
1971, 1976; Жинкина, 1986; Алимова, Жинкина (ориг. данные).
24
Garryaceae
1, 5—13 — Garry a elliptica, 2—
.i 14—20 — G. veatchii.
Il— фрагмент пыльника со споро-
тенными клетками, тапетум с 2-ядер-
ными клетками; 2 — 2-ядерные та-
петальные клетки и делящиеся споро-
генные; 3 — более поздний этап
развития пыльника: 2-ядерные тапеталь-
ные клетки и микроспоры; 4 —
зрелое пыльцевое зерно, заполненное
крахмальными зернами; 5 —
семяпочка с археспориальной клеткой;
в — тетрада мегаспор, окруженная
клетками нуцеллуса; на
периферии — внутренний слой интегу-
мента; 7 — тетрада мегаспор;
заметно увеличение халазальной
мегаспоры; 8 — зрелый зародышевый
мешок; 9 — зародышевый мешок со
множеством антиподальных клеток;
10—12 — стадии развития про-
эмбрио; 13 — сформированный
зародыш;
Garryaceae (продолжение)
14—18 — стадии развития дополнительных зародышей из подвеска; 19 — сердечковидный
зародыш; 20 — сформированный зародыш. (1, 5—13 — по Hallok, 1930; 2—4 — по Kapil,
Mohana Rao, 1966; 14—20 — по Mohana Rao, 1967b).
Семейство GARRYACEAE
Пыльник 4-гнездный. Сформированная стенка гнезда пыльника состоит-
из эпидермиса, эндотеция, в котором развиваются фиброзные утолщенияг
1—2 средних слоев и тапетума. Относительно типа тапетума существуют
различные данные для разных представителей семейства. У Garrya elliptica (Hallok,
1930) на ранних этапах развития клетки тапетума 2-ядерные, на более поздних
стадиях пространство вокруг тетрад микроспор занято периплазмодием^
У G. veatchii и G. flavescens var. pallida (Kapil, Rao, 1966) тапетум секреторного
типа; периплазмодий не образуется. Ядра тапетума делятся. Образующиеся
в результате деления ядра при слиянии становятся полиплоидными.
Образование микроспор симультанное, расположение их в тетрадах тетраэдральное-
или крестообразное. Зрелое пыльцевое зерно 2-клеточное, содержит
крахмальные зерна.
Семяпочка анатропная, с одним массивным интегументом, крассинуцеллят-
ная. У G. wrigktii отмечено наличие тенуинуцеллятных семяпочек. Археспо-
риальная клетка отделяет париетальную, которая или не делится, или
образует несколько слоев. париетальной ткани. Апикальные клетки эпидермиса
нуцеллуса при делении формируют нуцеллярный колпачок. В результате
мейоза образуется тетрада линейно расположенных мегаспор; развитие
зародышевого мешка происходит из халазальной мегаспоры. У ряда видов (Gar-,
rya veatchii, G. flavescens) в халазальной части нуцеллуса наблюдается
дифференциация гипостазы. Отмечен фуникулярный или плацентарный обтуратор.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Он имеет удлиненную форму, состоит из 7 клеток. Полярные ядра сливаются
перед оплодотворением. У G. elliptica антиподальные клетки во время
начальных этапов образования эндосперма делятся, образуя многочисленный
клеточный комплекс, занимающий х/5 часть зародышевого мешка. У G. veatchii
ж G. flavescens антиподальные клетки обычно дегенерируют после слияния по-
26
ляриых ядер, но иногда делятся, образуя от 5 до 7 клеток. Оплодотворение
иорогамное.
Эндосперм нуклеарный. Ядра его более многочисленны около яйцевого
аппарата, где клеточные стенки закладываются быстрее, чем в халазальной
части. Клетки эндосперма содержат крахмальные зерна.
Зародыш развивается по Solanad-типу. Оплодотворенная яйцеклетка
удлиняется, затем делится поперечно. 2 последующих деления происходят
параллельно первому. У проэмбрио на ранних этапах развития наблюдается
подвесок.
У G. veatchii отмечена монозиготическая полиэмбриония; дополнительные
зародыши развиваются из клеток подвеска. Одновременно могут развиваться
1—3 дополнительных зародыша, но в конечном итоге зрелости достигает
только основной зародыш.
Исследованные виды. Garrya douglas, G. elliptica, G. flavescens,
G. veatchii, G. wrightii.
Литература. Home, 1914; Hallok, 1930; Schnarf, 1931; Mohana Rao,
1963; Eyde, 1964; Davis, 1966; Kapil, Mohana Rao, 1966a; Тахтаджян, 1966;
Поддубная-Арнольди, 1982.
Семейство MELANOPHYLLACEAE
Эмбриологически не изучено.
Семейство GRISELINIACEAE
Эмбриологически изучено недостаточно.
По нашим данным, у Griselinia littoralis * семяпочка анатропная, с одним
интегументом, крассинуцеллятная. Интегумент 5—7-слойный, образует
микропиле. Внутренний эпидермис интегумента дифференцируется в интегументаль.
ный тапетум. Нуцеллус представлен сравнительно небольшим числом клеток.
Griselinia сеае
1—4 — Griselinia littoralis.
1 — продольный срез через семяпочку,
диада; 2 — 2-ядерный зародышевый
мешок; 3 — схема продольного среза через
■семяпочку со зрелым зародышевым
мешком; 4 — зрелый зародышевый мешок.
(1—4 — ориг.).
* Материал собран в оранжереях БИН АН СССР (Ленинград).
27
В халазальной части семяпочки четко выражена гиспостаза, образованная
1—2 слоями толстостенных клеток. Проводящий пучок из фуникулуса
проникает в халазалъную часть семяпочки, подходя близко к клеткам гипостазы.
Археспорий одноклеточный, отделяет париетальную клетку. На стадии диады
париетальная ткань представлена одним слоем клеток.
Тип развития зародышевого мешка не определен. Зародышевый мешок
7-клеточиый, иобольшой, вытянутый. Яйцевой аппарат состоит из круцной-
грушевидной яйцеклетки и 2 синергид, в которых четко выражен нитчатый
аппарат. Ядро центральной клетки располагается в середине зародышевого-
мешка или непосредственно под яйцеклеткой. В халазальной части
зародышевого мошка 3 антиподы.
Эндоспермогенез и эмбриогенез не изучены.
Большую часть семени занимает крупный зародыш, который имеет
длинные листообразные семядоли. Зародыш окружен эндоспермом.
Исследованные виды. Griselinia lateralis, G. lucida.
Литература, Harms, 1898; Home, 1914; Алимова (ориг. данные).
Helwingiaeeae
1—10 — Helwingla japonica.
1 — схема продольного разреза семяпочки; 2 — мегаспороцит; 3,4 — тетрады мегаспор;
5 — дегенерация одной из микропилярных мегаспор; 6—10 — развитие зародышевого мешка.
(1—10 — по Sato, 1976).
28
Семейство TORIGELLIAGEAE
Эмбриологически не изучено.
Семейство HELWINGIAGEAE
Пыльник не изучен.
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная.
Внутренний эпидермис интегумента дифференцируется в интегументальный тапетум
со стадии тетрад мегаспор. Нуцеллус в верхней части семяпочки довольно
быстро разрушается. Эпидермальные клетки апикальной его части начинают
дегенерировать со времени образования 2-ядерного зародышевого мешка,
и к 4-ядерной стадии верхняя половина зародышевого мешка контактирует
с интегументальным тапетумом, а нижняя половина остается окруженной
клетками' халазальной части нуцеллуса. Археспорий одноклеточный,
преобразуется непосредственно в мегаспороцит. В результате мейоза образуется
линейная тетрада мегаспор. Изредка 2 микропилярные мегаспоры
располагаются косо вследствие диагональной ориентации веретена деления микропи-
лярной клетки диады. Функционирует халазальная мегаспора. Дегенерация
микропилярных мегаспор начинается с субхалазальной мегаспоры. Иногда
эта мегаспора не отмирает и, по мнению Сато (Sat6, 1976), дает начало
дополнительному зародышевому мешку, судьба которого после 2-ядерной стадии
не прослежена.
Зародышевый мешок развивается по Polygonum-типу. Сформированный
зародышевый мешок состоит из яйцевого аппарата, содержащего яйцеклетку
и 2 синергиды, центральной клетки с находящимися в контакте друг с другом
полярными ядрами, которые располагаются непосредственно под яйцевым
аппаратом, и 3 антипод. Антиподальные клетки эфемерны и исчезают ко
времени оплодотворения.
Эндоспермогенез и эмбриогенез не изучены.
Исследованный вид. Helwingia japonica.
Литература. Sat6, 1976.
Порядок 55. ARALIALES
Сомойство ARALIAGEAE
Пыльник /|-гжшд1ШЙ, вскрывается продольно. Формирование стенки гнезда
пыльника у lilautherococcus senticosus происходит центробежно.
Сформированная «тонка гшшда пыльника состоит из эпидермиса, эндотеция, у большинства
изученных иидои из одного, а у Brassaia actinophylla и Hedera nepalensis из
2 сродни х. слооп и тапетума. Тапетум клеточный секреторный, однослойный,
у Acatdhopanax sessiliflorum со стороны связника 2—3-слойный. Клетки
тапетума у И. australiana одноядерные, у A. sessiliflorum, Aralia continentalis, A. man-
shurlca, A. schmidtii, A. pentaphylla, В. actinophylla, Oplopanax elatus, Panax
fruticosum и P. ginseng — 2-ядерные, у Н. nepalensis и Tieghemopanax sambuci-
fo/Лш — многоядерные, причем у последних 2 видов в результате слияния
образуются полиплоидные ядра. Средние слои эфемерны, у видов с 2 средними
слоями сначала разрушается внутренний слой, а затем — наружный. В эндо-
теции развиваются фиброзные утолщения. У Т. sambucifolius (Rao, 1972) и
Е. senticosus (наши данные) они формируются также в 2 слоях клеток со
стороны связника. У О. elatus стенка гнезда зрелого пыльника представлена 2
слоями: эпидермисом, покрытым кутикулой, и фиброзным эндотецием; у Т.
sambucifolius обнаруживаются также остатки среднего слоя и тапетума. У A.
sessiliflorum, Н. nepalensis и P. ginseng эпидермальный слой к моменту вскрывания
пыльников разрушается, и эндотеций становится наружным слоем. Тетрады
микроспор образуются симультанно. У большинства видов они тетраэдральные,
у Т. sambucifolius встречаются также крестообразные, а у Н. nepalensis — изо-
билатеральные. Зрелые пыльцевые зерна 2-клеточные у A. sessiliflorum и Т.
sambucifolius и 3-клеточные у Aralia, H. nepalensis, О. elatus и P. ginseng. В зрелых
пыльцевых зернах A. sessiliflorum и О. elatus обнаружен крахмал.
Семяпочка анатропная, с одним интегументом, крассинуцеллятная, у
Aralia и Т. sambucifolius — тенуинуцеллятная. По нашим данным, интегумент
состоит из 8 слоев клеток у Е. senticosus ж 10—12 слоев у Delarbrea lauterbachii.
У видов Aralia, D. lauterbachii, H. helix и Т. sambucifolium дифференцируется
интегументальный тапетум. У Nothopanax arboretum, P. fruticosum, Polyscias
pinnata и A. sessiliflorum имеется гипостаза. У большинства видов имеется
хорошо развитый фуникулярный обтуратор; у Н. nepalensis он выражен слабо.
У A. sessiliflorum в клетках обтуратора обнаружены кристаллы оксалата
кальция. Через фуникулус в семяпочку входит проводящий пучок. У A.
sessiliflorum он состоит из кольчатых сосудов и оканчивается в халазе; у P. ginseng
проводящий пучок доходит до средней части интегумента. Археспорий
одноклеточный; у В. actinophylla, H. australiana, Heptapleurum venulosum и P.
pinnata и иногда у D. lauterbachii представлен 2 клетками. У большинства видов,
за исключением Aralia, Т. sambucifolius и редко — Н. nepalensis, археспори-
альная клетка преобразуется в мегаспороцит с отделением париетальной клетки.
У P. fruticosum, P. pinnata, H. australiana, H. venulosum и В. actinophylla
париетальная клетка, как правило, в дальнейшем не делится; у остальных видов
формируется париетальная ткань. Мейоз завершается образованием линейной
тетрады мегаспор или триады. У Н. australiana и P. pinnata (Gopinath, 1944)
наблюдалось развитие нескольких мегаспор тетрады до 2—4-ядерной стадии.
Зародышевый мешок моноспорический, развивается, как правило, из ха-
лазальной мегаспоры по Polygonum-типу. У A. racemosa (Ducamp, 1902) и
В. actinophylla (Gopinath, 1944) в некоторых случаях зародышевый мешок
формируется по Oenothera-типу. У Н. venulosum иногда наблюдается
нарушение полярности зародышевого мешка. У большинства видов яйцевой аппарат
хорошо дифференцирован. Яйцеклетка крупная; у видов Aralia (Кордюм,
1967) содержит крахмальные зерна. Синергиды грушевидной формы, с крючко-
видными выростами. У Н. australiana синергиды заостренные на обоих концах.
Одноядерных антипод обычно 3, дегенерируют до оплодотворения. У P. gin-
30
Araliaeeae
j_g jj 22 16 17 2а, 4а 11а, 12а — Eleutherococcus senticosus, 7—9, 14, 21, 22, 9а, 14а ■-
Delarbrea lauterbachii, 10 - Panax ginseng, 13, 15, 18-20,-23-28 — Tieghemopanax saiuhu-
cifolius.
2—4 _ формирование стенки Гнезда пыльника и спорогенной ткани; 5 — сформиролпишш
стенка пыльника и микроспороциты; 7—9 — фрагменты стенки пыльника на стадии данндм
микроспор, вакуолизированной микроспоры и 2-клеточного пыльцевого зерна; 2а, 4а, в, Ра •■ •
схемы строения пыльника на разных стадиях развития;
Araliaceae (продолжение)
10—18, 11a, 12a, 14a — ранние стадии развития семяпочки, тетрады мегаспор и стаджж
формирования зародышевого мешка;
Araliaceae (продолжение)
19—21 — отдельные.стадии развития эндосперма; 22 — микропилярная часть семени hi
стадии 2-клеточного проэмбрио;
seng (Петровская-Баранова, 1959) антиподы 2-ядерные. У Н. australiana,
P. fruticosum и P. pinnata (Gopinath, 1944) клеткообразование при
формировании антипод не происходит. У В. actinophylla и Н. venulosum антиподы по
форме сходны с синергидами. Полярные ядра сливаются до оплодотворения.
У A. sessiliflorum (Артамонова, Иванов, 1969) во всех клетках зрелого зароды-
3 Сравнительная эмбриология 'Л'Л
Araliaceae (продолжение)
23—28 — отдельные стадии развития зародыша. (1—9, 11, 12, 14, 16, 17, 21, 22, 2а, 4at
9а, 11а, 12а, 14а — ориг.; 10 — по Петровской-Барановой, 1959; 13, 15, 18—20, 23—28 —
Mohana Rao, 1972).
шевого мешка обнаружен крахмал. Порогамия. Пыльцевая трубка при
вхождении в зародышевый мешок разрушает одну из синергид.
Эндосперм нуклеарного типа; клеткообразование начинается с периферии
зародышевого мешка. В зрелом семени обильный эндосперм с гладкой
поверхностью у Fatsia japonica и P. ginseng и руминированный — у A. sessiliflorum,
Н. helix, H. fragrans и Oreopanax fulvum. Клетки эндосперма богаты запасными
питательными веществами в виде белков и жиров, за исключением клеток,
окружающих зародыш.
Эмбриогенез изучен недостаточно. Зигота продолжительное время
находится в покое. У P. ginseng она приступает к делению на стадии 50—60 ядер
в эндосперме, у N. агЪогеит — на клеточной стадии развития эндосперма.
Эмбриогенез у A. cachemirica, A. cordata, A. racemosa, F. japonica и Н. helix —
Onagrad-типа, у Н. australiana и P. fruticosum — Chenopodiad-тина. Зародыши
в сформированных семенах варьируют от небольших слабодифференцирован-
ных, с зачатками семядолей (A. sessiliflorum, A. cordata, A. manshurica, E. sen-
ticosus) до крупных, дифференцированных на семядоли, почечку, гипокотиль
и зародышевый корень (F. japonica, H. helix, N. агЪогеит). У видов со слабо-
дифференцированным зародышем дальнейшая дифференциация происходит
после опадания семени с растения, при этом зародыш сильно увеличивается
в длину: у P. ginseng почти в 15 раз, у Е. senticosusB 20, у A. sessiliflorum в 30 раз-
34
В зародыше постепенно дифференцируются зачатки всех органов будущего
растения.
Исследованные виды. Acanthopanax sessiliflorum, A. spinosum,
Aralia cachemirica, A. continentalis, A. cordata, A. edulis, A. manshurica, A. pen-
taphylla, A. racemosa, A. schmidtii, A. spinosa, Brassaia actinophylla, Delarbrea
lauterbachii, Eleutherococcus senticosus, Fatsia japonica, Gastonia lyrata, Hedera
australiana, H. helix, Я. nepalensis, H. rhombea, Heptapleurum venulosum, Hete-
ropanax fragrans, Meryta macrophylla, Nothopanax агЪогеит, Oplopanax elatum,
Oreopanax capitatum, 0. fulvum, 0. mexicanum, Panax fruticosum, P. ginseng,
P. murrayi, P. sessiliflorum, Polyscias pinnata, Tieghemopanax sambucifolius.
Литература. Jonsson, 1879—1880, 1881; Hegelmaier, 1886; Ducamp,
1901a, 1901b, 1902; Cammerloher, 1910; Faure, 1911; Pigott, 1915; Gopinath,
1943a, 1944; Singh, 1954; Петровская-Баранова, 1959; Periasamy, 1962, 1966;
Иванова, 1965; Кордюм, 1967; Артамонова, Иванов, 1969; Богданова, Груш-
вицкий, 1970; Mohana Rao, 1972b; Симонова, 1979; Анисимова, 1986 и ориг.
данные.
Семейство APIACEAE (UMBELLIFERAE)
Пыльник 4-гнездный, раскрывается интрорзно; гнезда сближены попарно
в 2 теки. Гнезда в теках перед вскрыванием сливаются в результате
разрушения перегородки между ними. Развитие стенки пыльника происходит как
центростремительно (у Astrantia, Eryngium, Conium, Heracleum sosnowskyi), так
и центробежно (у большинства представителей семейства). У Phlojodicarpus
sibiricus наряду с центробежным типом развития стенки отмечен и основной
тип (Гревцова, Троицкая, 1981). Сформированная стенка гнезда пыльника,
как правило, состоит из эпидермиса, эндотеция, среднего слоя (у Ph.
sibiricus — 2 средних слоя) и тапетума. На наружной стенке клеток эпидермиса
имеется кутикула. Форма и толщина ее различна у разных видов. У Coriand-
rum sativum, Foeniculum vulgare, Cuminum cyminum, Trachyspermum ammi
и Seseli rigidum отмечены папиллообразные клетки эпидермиса. В клетках
эндотеция и тапетума у Ph. sibiricus неоднократно отмечались периклинальные
деления, в результате которых образуются 2-слойные эндотеций и тапетум;
в этом случае стенка пыльника становится 6—7-слойной. В эндотеций
образуются четковидные и лентовидные фиброзные утолщения, форма которых
может служить диагностическим признаком. Четковидные утолщения нередко
возникают также на стенках клеток эпидермиса и связника. Средний слой
разрушается либо при втором делении мейоза, либо сохраняется до образования
микроспор. Тапетум клеточный секреторный, без реорганизации,
морфологически неоднородный. В стенке пыльника тапетум 1—2-слойный, с 1—3 ядрами
в клетках, со стороны связника он 2—4-слойный, из многоядерных клеток,
нередко вдающийся в полость гнезда. В тапетуме были обнаружены
диплоидные, тетраплоидные и октоплоидные ядра с большим числом ядрышек, а также
реституционные ядра (Кордюм, Веледницкая, 1964; Гревцова и др., 1980).
Время полного лизиса клеток тапетума различно у разных родов. У
большинства представителей тапетум исчезает ко времени созревания пыльцы, но у Реи-
cedanum baicalense (ориг. данные) его остатки сохраняются ив зрелом
пыльнике. На радиальных и тангентальных стенках тапетума отмечены орбикулы.
В клетках стенки пыльника содержатся пластиды, крахмал, кристаллы. Стенка
зрелого пыльника состоит из эпидермиса и фиброзного эндотеция. Спороген-
ная ткань многослойная. В цитоплазме микроспороцитов у Bifora radians,
Pimpinella saxifraga, Anethum graveolens и Laserpitium hispidum наблюдались
небольшие сферические тельца рибонуклеино-протеидной природы (Кордюм,
1967г). Тетрады микроспор образуются симультанно. У Chaerophyllum aroma-
ticum наряду с симультанным типом отмечен и так называемый сукцедашшй,
когда разделение протопласта происходит путем заложения борозд и его норо-
шнуровывания (Кордюм, 1964). Тетрады микроспор тетраэдральные,
крестообразные, реже — изобилатеральные и ромбические. У Peucedanum officinale
■л* :ir,
vulgare,
1
Apiaceae
1—S, 8, 19, 32 — Peucedanum cer-
variifolium, 6, 7, 21 — P. officinale,
9, 10 — Phlojodicarpus sibiricus,
11—18, 27, 28 — Prangos pabularia,
20, 22—24 — Elaeosticta allioides,
25—26 — Bupleurum rotundifolium,
29, 33 — Eryngium planum, 30, 31 —
Peucedanum alsaticum, 34—36 — Bu-
nium paucifolium, 37 —■ Foeniculum
Coriandrum sativum, 48 — Trachyspermum ammi.
8 — формирование стенки пыльника и микроспорогенез;
нами отмечены линейные тетрады. В микроспорах и в 2-клеточной пыльце'
наблюдались кристаллы. Природа их не выяснена. Зрелые пыльцевые зерна
3-клеточные, содержат крахмал и жир. Спермин различной формы и по-разному
ориентированы по отношению к ядру вегетативной клетки: иногда отмечается
полярность спермиев (Paliwal, 1951). В процессе мейоза при микроспорогенезе
наблюдаются нарушения: неравномерное расхождение хромосом; образование-
36
Apiaceae (продолжение)
9, 10 — фрагменты стенки гнезда пыльника при развитии мужского гаметофита (9а — схема
поперечного среза пыльника; в. т — внутренняя часть тапетума); 11—18 — развитие
пыльцевого зерна;
Аргасеае (продолжение)
19—21 — продольно-осевые срезы развивающихся семяпочек с одним, 2 и несколькими
мегаспороцитами; 22, 23 — тетрады мегаспор; 24 — триада; 25 — развитие биспорического
зародышевого мешка из нижней клетки диады, в ней нитчатые тела; 26 — развитие тетра-
споричеекого зародышевого мешка; 27, 28 — развитие моноспорического зародышевого
мошка; 29, 30 — зрелые зародышевые мешки; 31 — семяпочка; 32 — халазальная часть
зародышевого мешка с антиподами и вторичным ядром зародышевого мешка; 33 — антипо-
дальный комплекс на постаменте; 34 — двойное оплодотворение;
мостов и микроядер, диплоидных микроспор и гигантских — с 8—9 ядрами,
а также диад микроспор. В пыльцевых зернах отмечено увеличение числа и
размера спермиев и ядер вегетативных клеток.
Семяпочка висячая, анатропная, тенуинуцеллятная, с одним массивным
(до 15—20 слоев клеток) интегументом. В каждом гнезде 2-гнездной завязи
накладываются 2 семяпочки — верхняя и нижняя. Как правило, полного
развития достигает нижняя семяпочка. У Eryngium maritimum, Astrantia major,
Chaerophyllum roseum, Ch. aromaticum, Anisum vulgare, Seseli rigidum, Prangos
pabularia, Elaeosticta allioides, Bunium paucifolium, Coriandrum sativum и Foeni-
culum vulgare развиваются обе семяпочки. Длина фуникулуса варьирует:
наиболее длинный у Sc'andix pecten-veneris. Фуникулярный обтуратор хорошо
развит у Azorella trifurcata, в родах Hydrocetyle, Didiscus, Actinotus, у Daucus
carota, Bunium paucifolium, Elaeosticta allioides и Osmorhiza aristata. Иногда
роль обтуратора выполняют клетки эпидермиса интегумента, расположенные
над микропиле (Bupleurum tenue — Gupta S., Gupta M., 1964a). Внутренний
эпидермис интегумента дифференцируется в интегументальный тапетум, за
исключением Eryngium juccifolium (Jurica, 1922) и Pastinaca sativa (Beghtel,
1925). У Aegopodium podagraria, Eryngium planum, Bunium paucifolium и Oedi-
basis apiculata он становится в некоторых местах 2-слойным. Верхушка
нуцеллуса может быть округлой, плоской и вытянутой. Отдельным видам
(Bupleurum rotundifolium, Daucus carota, Prangos pabularia, Eryngium planum,
Chaerophyllum aureum) свойственно деление клеток эпидермиса нуцеллуса и
образование нуцеллярного колпачка. В халазальной части семяпочки под архе-
спориальными клетками располагается группа клеток нуцеллуса с ярко
окрашивающейся цитоплазмой. Роль этих клеток не выяснена, возможно это
гипостаза.
Археспорий многоклеточный (от 2 до 12 клеток; у Drusa их 30—40 — На-
kansson, 1952) или одноклеточный. Развитие мегаспороцитов при
многоклеточном археспории может проходить синхронно или асинхронно. Мейоз
завершается, как правило, лишь в одном мегаспороците, остальные отмирают.
В.цитоплазме мегаспороцитов отмечены сферические тельца (рибонуклеопротеиды).
у Laserpitium hispidum — эллипсоидальные рбразования, напоминающие
пластиды, у Petroselinum crispum — каплеобразные тельца (липопротеиды), а у
Bupleurum rotundifolium — образования, представляющие собой тельца
сферической формы с нитью; варьировали длина, толщина, число и форма нитей (Кор-
дюм, 1965а). Такие же образования были отмечены ранее и у других видов —
Bupleurum dianthifolium и В. spinosum (Marano, 1954a, 1954b). Природа этих
образований не вполне выяснена. Возможно, что это митохондрии, достигшие
очень больших размеров и принимающие участие в клеточном метаболизме.
Тетрады мегаспор линейные, реже — Т-образные и изобилатеральные. Иногда
образуются диады и триады клеток. Функционирующей становится халазаль-
ыая мегаспора, а у Pimpinella saxifraga (Кордюм, 1967г) — микропилярная.
Отмечена тенденция к развитию не только халазальной, но и субмикропиляр-
ной (Carum carvi) или эпихалазальной (Elaeosticta allioides) мегаспоры. Развитие
2 мегаспор одной тетрады характерно для Seseli gracile. Однако образование
дополнительных сформированных зародышевых мешков не наблюдалось,
вероятно, они дегенерируют на ранних стадиях развития (Foeniculum vulgare,
Elaeosticta lutea, Malabaila graveolens, Bunium ferulaceum).
Развитие зародышевого мешка происходит по Polygonum-типу. Наряду
с этим типом отмечены: Allium-тип (Bupleurum rotundifolium, Crithmum
maritimum, Bupleurum aureum, Trachyspermum ammi, Eryngium planum), Adoxa-тип
(Sanicula europaea, Bupleurum rotundifolium), Drusa-тип (Drusa oppositifolia,
Bowlesia tenera) и Репаеа-тип (Azorella trifurcata) развития. У одного и того же
вида были отмечены 2 или 3 типа развития зародышевого мешка. Размеры
зародышевых мешков и их форма варьируют у разных видов: крупные
зародышевые мешки отмечены у Pastinaca sativa, Cachrys odontalgica, Laser trilobum и
Turgenia latifolia; небольшие зародышевые мешки — у Cicuta virosa и Physo-
caulis nodosus. Зародышевый мешок может быть овально-удлиненным,
овальным, в халазальной конце узким или несколько расширенным. У Bupleurum
tenue отмечено вытягивание зародышевого мешка в микропиле. Яйцеклетка
41
обычного строении, нисколько крупное синергид. Отмечены яйцеклетки, которые
но расположению и них ядер и вакуолей напоминают синергиды (Eryngium
planum, Osmorhlza aiinlata и др.). В яйцеклетке и в цитоплазме центральной
клохии аародьииоиого Мошки обнаружены пластиды с крахмалом. Форма
синергид и их рааморы рааличны у разных представителей. Чаще они овальные или
груиншидиыо. У Anthriscus sylvestris, Caucalis platycarpos, Carum carvi и Elaeo-
stMa allioides лорхние части синергид, обращенные к микропиле, вытягиваются
:н идшотсн и микронилярный канал. Нитчатый аппарат в синергидах, как пра-
НИ.1К), отсутствует, за исключением Daucus carota (Borthwick, 1931). Иногда
сиио|Н'ИД1.( дифференцированы по типу яйцеклетки (Eryngium planum,
Peucedanum, corvai'Ufolium и др.), но отличаются от нее меньшим размером и
небольшими ядрами. В синергидах Scandix pecten-veneris, S. iberica и других отмечены
крахмальные зерна. Полярные ядра сливаются до или во время (Levisticum
officinale, Seseli gummiferum) оплодотворения. Антиподы представлены 3
одноядерными многоугольными клетками, расположенными Т-образно или линейно
и чашевидном углублении (Prangos pabularia) или на постаменте,
образованном клетками нуцеллуса (Eryngium planum). У Bunium paucifolium антиподы
напоминают яйцевой аппарат; у Seseli rigidum они грушевидные, с
расширенными концами, обращенными в центральную клетку. Иногда ядра антипод
делятся, и клетки становятся 2-ядерными (Daucus carota, Trinia multicaulis,
Oenanthe aquatica, Caucalis platycarpos, Astrodaucus orientalis, Elaeosticta lutea,
Pimpinella saxifraga, Peucedanum alsaticum). У Eryngium planum число их
достигает 10. Отмечены и полиплоидные ядра. У Astrantia major, Sanicula euro-
paea и Eryngium planum число клеток антипод увеличивается до 4—6; у
Eryngium amethystinum — до 5—6; у Astrantia major — до 10. По нашим данным,
число антипод может достигать у Eryngium planum 13, у Peucedanum alsaticum
и Oedibasis apiculata 4. Антиподы у разных представителей разрушаются в
разное время: у Bunium paucifolium, Peucedanum cervariifolium, Bupleurum tenue
и Elaeosticta allioides — до оплодотворения, у Coriandrum sativum, Foeniculum
vulgare, Cuminum cyminum и Bupleurum rotundifolium — вскоре после
оплодотворения, а у Peucedanum alsaticum, Angelica gmelinii, Carum и Pimpinella
они сохраняются и после оплодотворения. Были отмечены аномалии в развитии
женского гаметофита: зародышевые мешки с нарушенной полярностью или без
яйцевого аппарата, формирование зародышевых мешков из 2 мегаспор одной
тетрады или из мегаспор 2 соседних тетрад. Порогамия. Пыльцевая трубка
входит в зародышевый мешок, разрушая одну синергиду либо минуя ее, и тогда
обе синергиды остаются неразрушенными. Оплодотворение происходит через
4—6 ч после опыления и соответствует премитотическому типу. Лишь у Тог-
dylium maximum был отмечен постмитотический тип оплодотворения яйцеклетки
(Кордюм, 1967г). Первым приступает к делению первичное ядро эндосперма.
Эндосперм нуклеарный. Размеры ядер и число ядрышек в них различно
у разных видов. Ядра эндосперма сначала располагаются в постенном слое
цитоплазмы, а вакуоль — в центральной части. Переход к клеточной стадии
совпадает с делением зиготы или с ранней стадией развития проэмбрио.
Заложение клеточных перегородок происходит центростремительно от микропиляр-
ного конца к халазальному. Клетки эндосперма одноядерные, но в результате
митозов в периферических районах некоторые из них становятся 2—4-ядерными.
Плоидность ядер эндосперма различна; увеличение ее связано со слиянием
ядер эндосперма или образованием тетраплоидного эндосперма в результате
слияния ядер эндосперма с гаметами дополнительных пыльцевых трубок
(Pimpinella anisum — Szujko-Lacza, 1976). Клетки эндосперма богаты
крахмалом, жиром, алейроновыми зернами, кристаллами оксалата кальция. Отмечены
и мелкие сферические тельца рибонуклеопротеидной природы. У Coriandrum
sativum наблюдались выпячивание постенной цитоплазмы эндосперма в полость
зародышевого мешка и образование шароподобных «везикул» (Singh, Gupta,
1956; Кордюм, 1967). Они отмечены также у Foeniculum vulgare, Anethum
graveolens, Daucus carota, Heracleum sphondylium, Psan ogeton biternatum
(Gupta, 1964), Cuminum cyminum, Trachyspermum ammi (Sehgal, 1965), Torilis
nodosa и Pseudorlaya pumila (Al-Attar Adnan, 1977). В зрелом семени эндосперм
сохраняется.
42
Развитие зародыша у представителей разных триб зонтичных нропжапт
сходным образом (редко — с небольшими вариациями) и соответствует Sola-
nad-типу. Первое деление зиготы происходит всегда поперечно и приводит
к образованию апикальной и базальной клеток. Из производных апикальной
клетки образуются семядоли, почечка, гипокотиль и зародышевый корень, из
базальной — подвесок и гипофизис. Лишь у представителей трибы Saniculeae
тип эмбриогенеза сходен с видоизмененным Onagrad-типом. Длина подвеска
варьирует. Дифференцированные зародыши относят по системе Мартина
(Martin, 1946) к 2 типам — линейному и лопатчатому. В зрелых семенах зародыш
располагается в микропилярной части. Лейкоэмбриофиты.
В семействе распространено явление плейкотилии, развитие 3—4 семядолей
(Ammi, Anthriscus, Daucus, Petroselinum, Eryngium, Angelica, Tordylium, С ого-
podium platycarpum, Foeniculum vulgare, Coriandrum sativum, Cuminum cyminum,
Trachyspermum ammi, Daucus carota и Angelica palustris). Отмечены также и
случаи монокотилии в родах Caropodium, Bunium и Biasoletiia.
Полиэмбриония встречается довольно редко. Дополнительный зародыш
у Physospermum cornubiense (Кордюм, 1967) развивается из синергиды; у
Caropodium platycarpum (Тамамшян, Денисова, 1959) и Ammi majus (Hakansson,
1923) — из клеток интегумента. Искусственно вызванная полиэмбриония под
действием стимулирующих веществ описана у Anethum graveolens (Johri,
Sehgal, 1963), а также у Cuminum cyminum ж Trachyspermum ammi (Sehgal, 1965).
Исследованные роды и виды. Actinotus sp., Aegopodium podag-
raria, Aethusa cynapium, Ammi majus, Anethum graveolens, Angelica archangelica,
A. gmelinii, A. palustris, A. sylvestris, Anisum vulgare, Anthriscus cerefolium,
A. sylvestris, Apium graveolens, A. inundatum, Astrantia major, Astrodaucus
orientalis, Azorella trifurcata, Bifora radians, Bilacunaria caspia, Bowlesia tenera,
Bunium chaerophylloides, B. ferulaceum, B. paucifolium, B. setaceum, Bupleurum
(7), Cachrys odontalgica, Calestania palustris, Caropodium platycarpum, Carum
carvi, Caucalis platycarpos, Cenolophium denudatum, Chaerophyllum (5), Cicuta
virosa, Cnidium dubium, Conium maculatum, Coriandrum sativum, Crithmum
maritimum, Cuminum cyminum, Daucus carota, D. muricatus, D. sativus, Didiscus
pilosus, Drusa oppositifolia, Elaeoselinum sp., Elaeosticta allioides, E. lutea,
Eryngium amethystinum, E. juccifolium, E. maritimum, E. planum, Falcaria vulgaris,
Ferula (9), Ferulago campestris, Foeniculum vulgare, Heracleum (6), Hydrocotyle
ranunculoides, H. vulgaris, Lagoecia cuminoides, Laser trilobum, Laserpitium his-
pidum, L. siler, Levisticum officinale, Ligusticum meum, Malabaila graveolens,
Myrrhis odorata, Oedibasis apiculata, 0. platycarpa, 0. tamerlani, Oenanthe aquatica,
Orlaya grandiflora, Osmorhiza aristata, Palimbia rediviva, Pastinaca sativa,
Petroselinum crispum, Peucedanum (11), Phlojodicarpus sibiricus, Physocaulis nodosus,
Physospermum cornubiense, Pimpinella adscendens, P. anisum, P. diversifolia,
P. saxifraga, Prangos pabularia, Psammogeton bit°rnatum, Pseudorlaya pumila,
Rumia crithmifolia, Sanicula europaea, Scandix iberica, Sc. pecten-veneris, Schren-
kia involucrata, Selinum carvifolia, Seseli (6), Siella erecta, Silaum silaus, Sium
cicutaefolium, S. sisaroideum, Tordylium maximum, Torilis japonica, T. nodosa,
Trachyspermum ammi, Trinia multicaulis, Turgenia latifolia, Visnaga daucoides.
Литература. Hofmester, 1858; Sieler, 1870; Hegelmaier, 1875, 1878,
1885; Strasburger, 1884; Mez, 1887; Van-Tieghem, 1891; Coulter, Chamberlain,
1908; Cammerloher, 1910; Juel, 1915; Jurica, 1922; Hakansson, 1923, 1927, 1933,
1952; Beghtel, 1925; Soueges, 1926a, 1930,1945a, 1952b, 1954a, 1954b, 1954c, 1954d,
1954e, 1955a, 1955b, 1955c, 1958b; Dahlgren, 1927; Ogawa, 1929; Schnarf, 1929,
1931; Nordheim, 1930; Borthwick, Phillips, Robbins, 1931; Васильченко, 1941;
Johansen, 1945, 1950; Martin, 1946; Flemion, Henrickson, 1949; Муратов, 1949;
Agrawal, 1950; Paliwal, 1950, 1951; Adatia, 1952; Cooper, 1952; Erdtman, 1952;
Shah, 1953a, 1953b; Marano, 1954a, 1954b; Singh, Gupta, 1956; Gupta S.,
Gupta M., 1959; 1964a, 1964b; Gupta, Kumari, 1959; Тамамшян, Денисова, 1!)ГИ);
Gupta, 1960, 1962a, 1962b, 1964, 1967, 1970; Moar, 1960; Денисова, 1961; Zonlc-
teler, 1962; Johri, Sehgal, 1963, 1966; Sehgal, 1963, 1964, 1965, 1968; Wolhomll,
Halperin, 1963; Gupta M., 1964; Halperin, Wetherell, 1964, 1965; Кордюм,
1964, 1965, 1966a, 19666, 1967a, 19676, 1967b, 1967r, 1968a, 19686, 1908n, IIMlHi',
'1Я
1968д, 1978а, 11)780; Кордюм, Веледницкая, 1964; Hjelmgvist, Grazi, 1965;
Нгуои Даш- «Doirr, 1905; Davis, 1966; Гаврилова, 1967; Dhakre, 1968; Hiroyuki,
J968; UuckH-lIiiHoinuum, Heinert, 1970; Dumas, 1971, 1978; Mestre, Guignard,
11)71; Sssujko-Luczu, 1971, 1976, 1978; Cerceau-Larrival, Roland-Heydacker,
1970; I'uMfiapojiu, 1973; Яковлев, Жукова, 1973; Al-Attar Adnan, 1974, 1977;
Jonort, 11)74; Минаева, 1974; Кордюм, Глущенко, 1976; Arora, Tiagi, 1977;
Дцскалопа, 1977; Harry, Mestre, Guignard, 1977; Мохамед, Дмитриева, 1977;
Скуичошсо, Коломийцева, Александрова, Моисеев, 1977; Скупченко, Моисеев,
Ск'унчонко, 1977; Cerceau-Larrival, Dervuet, Munsch, 1980; Гревцова,
Тихомиров Троицкая, 1980, 1986; Скокова, Курлянчик, 1980; Скупченко, Мои-
O0OD, 1980; Srivastava, Chauhan, 1980; Гревцова, Троицкая, 1981, 1982; Под-
дуОиия-Арнольди, 1982; Spitzer, Lott, 1982a, 1982b; Kumar, Pillari, Pillai,
11Ш; Скупченко, 1983, 1984; Гревцова, Джалилова, 1986; Гревцова, 1987;
Гревцова, Джалилова, Троицкая (ориг. данные).
Порядок 56. CELASTRALES
Семейство ICACINACEAE
Сформированная стенка гнезда пыльника у Gomphandra polymorpha состоит
и-з эпидермиса, эндотеция, одного или 2 средних слоев и секреторного тапе-
тума. Эндотеций с фиброзными утолщениями. Средний слой разрушается и
облитерируется. В клетках тапетума во время мейоза в микроспороцитах видно
от 4 до 6 ядер. Ядра тапетальных клеток имеют включения, которые
напоминают пучки кристаллов, лежащие в центре, вблизи ядрышек. Они окрашиваются
гематоксилином в коричневый или черный цвет. Природа этих включений
неизвестна. Тетрады микроспор образуются по симультанному типу,
тетраэдральные. Зрелые пыльцевые зерна 2-клеточные.
Семяпочка анатропная, с одним интегументом, обычно крассинуцеллятная.
У Phytocrene dasycarpa и Lasianthera apicalis — тенуинуцеллятная. Археспорий
многоклеточный, и хотя каждая археспориальная клетка отчленяет
париетальную, только производные одной из них образуют 5—6 слоев париетальной
ткани. Тетрада мегаспор линейная.
Зародышевый мешок развивается по Polygonum-типу из халазальной
мегаспоры. Синергиды у Gomphandra polymorpha крупные, грушевидные, с
крючкообразными выростами и хорошо развитым нитчатым аппаратом. Цитоплазма
у них густая, без вакуолей. Полярные ядра сливаются до оплодотворения.
У G. polymorpha, G. javanica и Gonocarium puriforme 3 антиподальные клетки
маленькие. У Ph. dasycarpa антиподы по своей величине и форме напоминают
яйцевой аппарат. У всех изученных видов они эфемерны. У Gonocarium
puriforme яйцевой аппарат и центральная клетка содержат зерна крахмала,
у Ph. dasycarpa крахмальные зерна имеются только в центральной клетке.
Для данного семейства характерны порогамия и двойное оплодотворение.
Эндосперм у G. polymorpha нуклеарный, эндоспермальные гаустории не
развиваются; у Nothapodytes foetida — изначально целлюлярный. Деление
первичного ядра эндосперма сопровождается заложением перегородки между
дочерними ядрами. Микропилярная клетка делится, в то время как халазальная
функционирует как инициаль гаустория. Ядро халазальной клетки теряет
свою сферическую форму и на более поздних стадиях становится лопастным.
Инициальная гаусториальная клетка значительно увеличивается, образуя
короткий мешкоподобный вырост в направлении халазы. Первоначально он
растет между клетками, а впоследствии проникает в окружающие клетки
халазы. В месте контакта гаустория с соседними клетками клеточные стенки
растворяются, образуя порообразное отверстие. Клетки эндосперма,
расположенные над гаусторием, крупнее и менее компактно расположены, чем клетки
в микропилярной части. 2 или 3 слоя клеток эндосперма, граничащие с
гаусторием, очень сильно удлиняются, продвигаясь между окружающими клетками
халазальной ткани семяпочки. Активность гаустория начинает спадать ко
времени заложения семядолей зародыша. В зрелом семени эндосперм массивный.
Эмбриогенез не исследован. Известно, что у Apodytes dimidiata, Phytocrene
macrophylla и Villaresia mucronata зародыш маленький. Хлороэмбриофиты.
Исследованные виды Apodytes dimidiata, Desmostachys preussii,
Gomphandra javanica, G. polymorpha, Gonocaryum pyriforme, Lasianthera apicalis,
Leptaulus daphnoides, Phytocrene dasycarpa, P. macrophylla, Rhaphiostylis farm-
ginea, Stemonurus secundiflorus, Villaresia mucronata, V. paniculata.
Литература. Mauritzon, 1936a, 1936b; Sleumer, 1942; Fageriind, :1!)4Гм1;
Swamy, Ganapathy, 1957; Padmanabhan, 1961b; Яковлев, Жукова, '197.4.
M;
Icacinaceae
1—11, 14, 17, 18 — Gomphandra polymorpha, 12, 13 — Gonocaryum pyrijorme, 15, 16 — Phyto-
crene dasycarpa, 19 — Nothapodytes foetida.
1—4 — микроспорогенез и развитие пыльцевого зерна; 5,6 — ядра клеток тапетума с
включениями; 7 — схема молодой семяпочки; 8 — семяпочка с мегаспороцитом и бугорком инте-
гумента; 9—11 — мегаспорогенез; 12—14 — развитие зародышевого мешка из
халазальной мегаспоры; 15, 16 — зрелый зародышевый мешок: яйцеклетка, синергиды и'
центральная клетка содержат зерна крахмала; 17 — яйцевой аппарат и полярные ядра; 18 — нукле-
арный эндосперм; 19 — эндоспермальный халазальный гаусторий. (1—11 14 17 18 —
по Padmanabhan, 1961; 12, 13, 15, 16 — по Fagerlind, 1945; 19 — по Swamy, Ganapathy
Sphenostemonaceae
1 — Sphenostemon pachycladum, 2 — Nouhuysia arfakensis, 3 ■— Idenburgia sp.
1—3 — поперечный срез пыльников у представителей разных родов. (1, 2 — по Bailey,
1956; 3 — по Bailey, Swamy, 1953).
Семейство SPHENOSTEMONACEAE
Эмбриологически не исследовано.
Пыльники 4-гнездные. Развитие стенки гнезда пыльника не изучалось, но
отмечено, что имеется фиброзный эндотеций, причем у Sphenostemon
pachycladum он ограничен областью гнезд (которые сливаются), а у N ouhuysia он
захватывает и связник (Bailey, 1956). Пыльцевые зерна одиночные.
Семяпочка анатропная, с одним интегументом. Имеется фуникулюс с
обтуратором.
Зародыш у Idenburgia в зрелом семени очень маленький (Bailey, 1956).
Семена в роде Nouhuysia сильно руминированные (Bernard, 1964), у
Sphenostemon — не руминированные.
Исследованные виды. Sphenostemon pachycladum, S. papuanum,
JSfouhuysia arfakensis, Idenburgia sp.
Литература. Bailey, Swamv, 1951, 1953; Steenis, 1955; Bailey, 1956;
Metcalfe, 1956; Bernardi, 1964; Тахтаджян, 1966; Airy Shaw, 1972.
Семейство AQUIFOLIACEAE
Пыльники 4-гнездные, вскрываются 2 продольными щелями. Тапетум одно-
шга 2-слойный, секреторного типа. Клетки его на поздних этапах развития
становятся 2-ядерными. Зрелые пыльцевые зерна 2-клеточные.
Семяпочка анатропная, с одним массивным интегументом. Она может быть
тенуинуцеллятной или переходной к крассинуцеллятной даже у особей одного
вида (Ilex cornuta, I. aquifolium). В первом случае археспориальная клетка
становится непосредственно мегаспороцитом, во втором — отделяет
париетальную клетку, которая затем делится, формируя 1—3 слоя клеток париетальной
ткани. Нуцеллус наиболее сильно развит на стадиях мегаспорогенеза и на
начальных этапах развития зародышевого мешка. Со стадии 4-ядерного
зародышевого мешка он интенсивно разрушается и позднее полностью исчезает
в микропилярной и латеральной областях. Зрелый зародышевый мешок
граничит с интегументом, внутренний эпидермис которого дифференцируется в инте-
гументальный тапетум. Сохраняется нуцеллус в халазальной зоне, где под
зародышевым мешком формируется гипостаза, морфологически выделяющаяся
после оплодотворения. Развивается обтуратор. Сосудистые пучки из фуникулуса
входят в интегумент. Археспориальных клеток закладывается от 1 до 3, однако
лишь одна из них становится мегаспороцитом. Тетрада мегаспор линейная,
реже — Т-образная. Халазальная мегаспора обычно становится
функциональной, остальные дегенерируют. Иногда возможно развитие 2 зародышевых
мешков из 2 мегаспор.
Зародышевый мешок развивается по Polygonum-типу, он 7-клеточиый,
8-ядерный. Синергиды грушевидные. Яйцеклетка отличается от синоргид
более крупными размерами и отсутствием вакуолизации цитоплазмы. Антиподы
могут быть эфемерными либо они увеличиваются в размерах, вакуолииирукп'он
'/7
7 'б
Aquifoliaceae
1—11 — Ilex opaca.
7 - зрелый -родншевыи^мешок, ^ П^ *$**,_„ _ по НегГ) 1961).
и тшсутствуют при развивающемся эндосперме. Полярные ядра сливаются до
оплодотворен^. Характерны порогамия и двойное оплодотворение.
Продолжительность Функционирования сохранившейся синергиды неодинакова: иногда
ТЛ^инает разрушаться до завершения сингамии; иногда же увеличивается
Граз2рах! ваРк7олизируетсДя и сохраняется вплоть до начальных стадии раз-
В™доспермеРцМеялюлярный, начинает развиваться вскоре после завершения
ттюйногсдшшия. В результате первого деления образуются 2 клетки: микро-
пилярная и х™азальная; по размерам первая клетка обычно больше второй,
^вым делится ядро халазальной клетки в вертикальном направлении,
?alee - делится ядро микропилярной клетки в горизонтальном направлении,
обГзуя таким обозом, 2 клетки, лежащие одна под другой.
Последовательность дальнейших делений в эндосперме вариабельна. В отдельных случаях
ность Дальней £ халазальной клетках, последующие деления
Гогут нГсоГовоХаться клеткообразованием; в связи с этим некоторые авторы
Жег1961? такой тип развития эндосперма склонны рассматривать как
переходный-отнуклеарного к целлюлярному. В зрелом семени эндосперм массив-
НЫ1]игГа^^^^^^ - К™ - И СЪ- *""**** КЛ6ТКа
обт,а^еГм?огоклеточный суспензор. Зрелый зародыш прямой, очень
маленький иногда сердечковидный, с гипокотилем, почечкой и начинающими
развиваться семядолями, бесхлорофилльныи.
Исследованные виды. Ilex aquifolium, I. cornuta, I. crenata,
I. decidua, I. opaca, I. verticillata, I. vomitona.
^ о cuTiiiT-Wf 1921- Ives, 1923; Schnarf, 1931; Mauntzon,
1936; нЦР1959аУ, ?8U Kf bf Copelaad, 1963; Davis, 1966; Comer, 1976;
Поддубная-Арнольди, 1982.
48
Семейство PHELLINAGEAE
Эмбриологически не изучено.
Пыльник 4-гнездный. У Phelline comosa семяпочка гемитропная или слабо-
кампилотропная, с микропиле, которое направлено вверх и внутрь.
Семена с обильным эндоспермом.
Литература. Billardire, 1837; Тахтаджян, 1966.
Семейство PARACRYPHIACEAE
Пыльник 4-гнездный, состоит из 2 тек; перед созреванием гнезда в теках
попарно сливаются. Каждое гнездо имеет хорошо развитый эндотеции с лигни-
фицированными лентовидными утолщениями, которые отсутствуют в области
связника и перегородок между гнездами. Пыльцевые зерна одиночные.
Семяпочка анатропная, с одним 3—4-слойным интегументом.
Эндосперм сохраняется в зрелом семени.
Зародыш дифференцированный, прямой, 0.5—0.7 мм дл., с гипокотилем,
превышающим по длине семядоли.
Исследованный вид. Paracryphia sp.
Литература. Dickison, Baas, 1977.
Семейство CARDIOPTERYGACEAE
Эмбриологически не изучено.
Зрелая пыльца у Cardiopteris moluccana и C.tlobata одиночная.
В зрелом семени маленький ^зародыш окружен обильным эндоспермом.
Литература. Willis, 1966; Lobreau, 1969; Takhtajan, 1980.
Семейство MEDUSANDRACEAE
У Soyauzia floribunda пыльники 4-гнездные.
Зрелое семя с обильным эндоспермом и маленьким зародышем.
Литература. Brenan, 1953.
Семейство CELASTRACEAE
Пыльники 4-гнездные. При созревании гнезда в теках сливаются в
результате разрушения перегородок между ними у Celastrus paniculata, Euonymus
macroptera и Е. planipes. Но у других исследованных видов пыльники могут
оставаться 4-гнездными. Сформированная стенка гнезда пыльника состоит из
эпидермиса, эндотеция (2—3-слойного у Е. japonlca и Gymnosporia rothiana),
2—3 средних слоев и секреторного тапетума, который нестрого однослойный.
По мере созревания в эндотеции формируются фиброзные утолщения. Ядра
тапетальных клеток делятся, возможно образование до 8 ядер в одной клетке,
а также их полиплоидизация. Микроспороциты многочисленные; в результате
мейоза образуются симультанно тетраэдральные или изобилатеральные тетрады
микроспор. Деление в микроспорах асимметричное; генеративная клетка
небольшая, удлиненная, вегетативная клетка значительно крупнее. Зрелые
пыльцевые зерна 2-клеточные. Спермиогенез происходит в пыльцевой трубке.
У G. rothiana, E. macroptera и Е. planipes имеет место неодновременное деление
микроспороцитов, что приводит в дальнейшем к асинхронности их развития
и присутствию в зрелых пыльниках наряду с 2-клеточными также
одноклеточных или уже начавших прорастать 3-клеточных пыльцевых зерен.
Дегенерация тетрад микроспор наблюдается у Е. verrucosa. ffii
Семяпочка с 2 интегументами, анатропная у большинства видов, гишф'гроц.
ная у Euonymus planipes и Е. macroptera. Оба интегумента принимиют участие
4 Сравнительная эмбриология
49
1 — Celastrus paniculata, 2,4 — Gymnosporia rothiana, 3 — G. spinosa, 5 —■ Elaeodendron
glaucum, 6, 7, 15, 16, 19, 20 — Celastrus orbiculata, 8, 9 — Euonymus latifolia, 11—14, 17, 18,
21—44 — E. macroptera, 10 — Tripterygium wilfordii.
1—3 — пыльники; 4,5 — пыльцевые зерна; 6,7 — линейные тетрады мегаспор; 8,9 —
2- и 4-ядерные зародышевые мешки; 10 — семяпочки с зародышевым мешком и прилежащим
к нему интегументальнымтапетумом; 11,12 — фрагменты пыльников: 11 — с микроспорами,
12 — с 2-клеточными пыльцевыми зернами, прорастающими in situ; 13, 15, 16 — семяпочки
с мегаспороцитами, образование кроющих клеток непостоянно; 14 — семяпочка с
функционирующей халазальной мегаспорой линейной тетрады; 17, 19 — зрелые зародышевые мешки
с прилежащим к ним интегументом и разрушающимися клетками нуцеллуса; 18 —
зародышевый мешок с делящимися ядрами эндосперма, синергиды не разрушены, яйцеклетка
не оплодотворена; 20 — зигота, разрушенная синергида и многоядерный эндосперм; 21 —
инициальные клетки и начинающие развиваться интегументальные зародыши;
в формировании микропиле. Семяпочка тенуинуцеллятная. Единственная архе-
спориальная клетка становится непосредственно мегаспороцитом. В родах
Elaeodendron и Celastrus семяпочка описывалась как крассинуцеллятная (Ап-
dersson, 1931; Adatia, Gavde, 1962). Согласно нашим данным, у С. orbiculata и
С. scandens отделение париетальной клетки происходит не постоянно, а в тех
случаях, когда она образуется, к делению часто не приступает. Нуцеллус
разрушается еще до достижения зародышевым мешком стадии зрелости.
Следовательно, он развит слабо, и семяпочку у С. orbiculata и С. scandens следует
считать тенуинуцеллятной, подобно большинству других видов семейства.
Интегументальный тапетум формируется у С. paniculata, С. scandens и
Tripterygium wilfordii. Археспорий одноклеточный, но у С. scandens и G. rothiana
50
22
Celastraceae (продолжение)
-42 — развитие интегументальных зародышей:
23—25 — 3-клеточные зародыши, 26—30 — 4-клеточ-
ные зародыши, 35—38 — зародыши с
дифференцирующейся эмбриодермой, 39—42 — органогенез; 43 — инте-
гументальный зародыш, сформировавшийся в халазаль-
ной части семяпочки; 44 — схема созревающего семени
с несколькими зародышами. (1—5 — по Adati, Gavde
1962; 6—10 — по Andersson, 1931; 11— 44 — ориг )
могут закладываться 2, а у С. paniculate/, — до 4 клеток. У этих видов возможно
образование более одной линейной или Т-образной тетрады мегаспор
Зародышевый мешок развивается по Polygonum-типу из халазальной
мегаспоры. У С. paniculata функциональными могут оставаться и другие мегаспоры
тетрады. В зрелом зародышевом мешке яйцеклетка несколько крупнее синеп
гид. Последние грушевидные, с нитчатым аппаратом. Полярные ядра сливаются
до оплодотворения. Антиподы эфемерны, но у некоторых видов они сохраняются
52
«плоть до начала развития эндосперма. У С. paniculata антиподы иногда шисуо-
лизируются и уподобляются клеткам яйцевого аппарата. Развитие 2
зародышевых мешков описано у С. orbiculata и нескольких — у G. rothiana. Дегенерация
зародышевых мешков в процессе их развития наблюдается у Е. еигораеа и
Е. japonica. Пыльцевые трубки в условиях Ленинграда имеют замедленные
темпы роста. Часто они не дорастают до зародышевого мешка (Наумова, 1970а,).
Двойное оплодотворение в родах Euonymus и Celastrus происходит в редких
случаях. Деление зиготы наблюдается у Е. еигораеа и G. spinosa через 1—2
педели, у С. paniculata — через 2—3 мес после опыления.
Эндосперм нуклеарный; начинает развиваться раньше зиготы. У С. scandens
и Е. japonica первичное ядро эндосперма делится через 2—3 недели после
опыления. Формирование клеточных перегородок центростремительное, происходит
после образования 200 ядер. Возможность образования эндосперма без
оплодотворения обнаружена у Е. macroptera (2n=32).
Сведения об эмбриогенезе противоречивые и неполные. Развитие зародыша
из зиготы у G. spinosa и С. paniculata протекает по Solanad-типу. Эмбриогенез
Е. еигораеа и С. scandens первоначально был отнесен к Sagina-вариации Сагуо-
phyllad-типа. Однако Местре (Mestre, 1976) считает, что развитие зародыша
у Е. еигораеа не соответствует ни одному из типов эмбриогенеза. У Е. еигораеа,
Е. macroptera и Е. planipes нами также отмечалась определенная вариабельность
в направлении и последовательности клеточных делений на начальных этапах
развития половых зародышей. Зрелое семя имеет крупный прямой
дифференцированный зеленый зародыш и обильный эндосперм. Семядоли плоские, листо-
подобные: почечка и гипокотиль маленькие. Хлороэмбриофиты.
Интегументальная полиэмбриония характерна для многих видов рода
Euonymus и некоторых видов рода Celastrus. Развитие интегументальных
зародышей у Е. macroptera и Е. planipes начинается через 2—3 недели после
цветения (Наумова, 19706), а у Е. japonica — через 2 мес (Copeland, 1966). Началу
развития интегументальных зародышей у Е. macroptera, согласно нашим
данным, предшествует разрастание ткани внутреннего интегумента после цветения
в его микропилярной и халазальной зонах за счет митотических делений
клеток, наиболее близко расположенных к полюсам зародышевого мешка. Клетки
этой вновь возникшей ткани интегумента характеризуются тем, что они слабо
вакуолизированы, богаты клеточными органеллами, их крупное ядро занимает
центральное положение, запасные вещества отсутствуют. Некоторые из этих
клеток становятся инициальными и из них развиваются итенгументальные
зародыши. Инициальные клетки имеют крупное, часто лопастное ядро с одним
или несколькими ядрышками. Цитоплазма богата пластидами и митохондриями,
структура которых свидетельствует об их высокой функциональной активности;
обильны рибосомы и полисомы; эндоплазматический ретикулум развит слабо;
диктиосомы не отличаются повышенной активностью; клеточная оболочка
утолщенная. Органеллы равномерно распределяются по всей клетке. Клетки
внутреннего интегумента, сформировавшиеся в процессе развития семяпочки
до цветения и удаленные от зародышевого мешка, к этому времени накапливают
в значительном количестве запасные питательные вещества белковой природы.
Ядро и цитоплазма в них занимают пристенное положение; центральная часть
занята вакуолью.
Интегументальные зародыши возникают в большинстве случаев в
результате равного деления инициальной клетки. Клетки 2-клеточного зародыша
сходны по размерам и по ультраструктуре. Их наружные клеточные оболочки,
производные оболочки инициальной клетки, лишены плазмодесм. Направления
и последовательность клеточных делений в таких зародышах на начальных
этапах их развития очень вариабельны, при этом число клеток быстро
увеличивается и зародыш достигает глобулярной стадии. Такие зародыши имеют
сформированную эмбриодерму. После ее образования происходят дальнейшая
дифференциация и органогенез. Последовательно начинает формироваться виродм-
шевый корень; расположенные под ним инициали дают начало центральному
цилиндру и коре; дифференцируется прокамбиальный тяж. В апикальной чисти
зародыша происходят закладка и затем развитие семядолей. В таких народы-
шах отчетливо выявляется билатеральная симметрия. Развитие интегумоитиль-
Г>!1
ных зародышей ие может быть отнесено ни к одному из типов эмбриогенеза.
Зрелые интегументальные зародыши дифференцированы, морфологически не
отличаются от аародышей половой природы. Частота образования
интегументальных зародышей различна у разных видов. У Е. macroptera и Е. planipes
интегументальные зародыши образуются постоянно, а половые — редко,,
у Е. еигораеа и Е. verrucosa чаще образуются зародыши половой природы.
Способность к образованию интегументальных зародышей и связанная с этим,
полиэмбриония обнаружены у Euonymus americana, E. fimbriata, E. latifolia
(Braun, 1860), Е. dielsiana, E. oxyphylla, E. verrucosoides (Brizicky, 1964),.
E. alata, E. alata var. apretus, E. alata f. angustifolia, E. koopmani, E.
macroptera, E. maximowicziana, E. miniata, E. planipes, E. sachalinensis, E. vagans
(Наумова, 1978), E. japonica (Gopeland, 1966), Celastrus scandens (Andersson,
1931), С paniculata (Adatia, Gavde, 1962). Интегументальная полиэмбриония
является, вероятно, характерной чертой рода Euonymus в целом, так как она
обнаружена у видов, принадлежавших всем в той или иной степени
исследованным секциям этого рода.
Партенокарпия описана у С. scandens и Ё. japonica.
Исследованные виды. Celastrus orbiculaia, С. paniculata, С.
scandens, Elaeodendron glaucum, Euonymus alata, E. alata var. angustifolia, E. alata
var. apretus, E. americana, E. bungeana, E. dielsiana, E. еигораеа, Е. fimbriata?
E. hamiltoniana, E. japonica, E. koopmani, E, latifolia, E. macroptera, E.
maximowicziana, E. miniata, E. oxyphylla, E. planipes, E. sachalinensis, E. vagans,
E. verrucosa, E. verrucosoides, Gymnosporia rothiana, G. spinosa, Maythenus boaria,
M. ilicifolia, Putterlickia pyracantha, Tripterygium wilfordii.
л итература. Grebel, 1820; Braun, 1860; Strasburger, 1878; Jonsson, 1881;.
Jager, 1914; Bally, Basel, 1916; Andersson, 1931; Dahlgren, 1938; Щепотьев, 1939;
Манжос, 1948; Сапанкевич, 1951, 1953; Мерзликина, 1954; Багаев, 1955;
Adatia, Gavde, 1962; Brizicky, 1964; Mestre, 1965, 1967; Copeland, 1966; Лодкина,.
1966; Наумова, 1970а, 19706, 1971, 1978a, 19786, 1979, 1982 и ориг. данные^
Яковлев, Жукова, 1973, 1980.
Семейство STACKHOUSIACEAE
Пыльник 4-гнездный. Сформированная стенка гнезда пыльника состоит из
эпидермиса, эндотеция, в котором развиваются фиброзные утолщения,
эфемерного среднего слоя и тапетума. Тапетум секреторного типа, с 2-ядерньши
клетками. Образование микроспор симультанное. Тетрады микроспор изобила-
теральные, тетраэдральные или крестообразные. Зрелые пыльцевые зерна
3-клеточные, содержат крахмальные зерна. У Stackhousia linariifolia иногда
встречаются стерильные пыльцевые зерна.
Семяпочка анатропная, с 2 интегументами. тенуинуцеллятная. Отмечено
наличие гипостазы, состоящей из клеток с утолщенными стенками. Микропиле
образуется обоими интегументами или только наружным. Археспориальная
клетка, не отделяя париетальной, преобразуется в мегаспороцит. В результате
мейоза обычно образуется линейная или Т-образная тетрада мегаспор. У S. Ъги-
nonis в результате подавления делений в верхней клетке диады наблюдалось
образование триады клеток. Функционирующей становится халазальная
мегаспора.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Синергиды имеют грушевидную форму, у S. linariifolia они эфемерны и
дегенерируют до оплодотворения.. Полярные ядра сливаются перед оплодотворением.
Число антипод от 3 (S. linariifolia) до 10—15 (S. monogyna и S. viminea). Клетки
антипод одно или многоядерные. Оплодотворение порогамное.
Эндосперм нуклеарный. У S. lineariaefolia ядра эндосперма вначале
распределяются более или менее равномерно в тонком периферическом тяже
цитоплазмы. Иногда наблюдаются направленные внутрь зародышевого мешка
безъядерные выросты этого тяжа. После образования значительного числа ядер
(свыше 100) происходит заложение клеточных стенок эндосперма, вначале
54
1—20 —■ Stackhousia linariaefolla.
1 — гнездо пыльника; видны эпидермис, эндотеций, средний слой, тапетум и микроспоро-
циты; 2, 3 — тетраэдральный и изобилатеральный типы тетрад микроспор; 4 —
микроспора; 5 — 2-клеточное пыльцевое зерно; 6 — 3-клеточное пыльцевое зерно; 7 —
продольный срез семяпочки; виден мегаспороцит и нуцеллус; 8 — диада; 9, 10 — Т-образна» и
линейная тетрады мегаспор; 11 — продольный срез семяпочки со зрелым зародышош.Ш
мешком и дегенерирующим внутренним иитегументом; 12 — 8-ядерный зародышевый мошок
•с 3 антиподами; 13 — зрелый зародышевый мешок; видны вторичное ядро и мшшшдоримо
антиподы; 14 — развитие эндосперма; 15 — эндосперм; видны цитоплазматическио пмростм
«везикулы»; 16—20 — развитие зародыша. (1—20 — по Narang, 1953).
ь микропиляриой части, блин прркмбрио, затем постепенно оно
распространяется и халапальпую часть, Когда зиродыш сформирован, весь зародышевый
мешок наиолнлотсн клоточным апдоспермом. Клетки эндосперма содержат
крахмальные нерпа, II пролом сомеши эндосперм сохраняется.
!)мбрио1'(шо11 AhIoi'IkI-tmiiu (Davis, 1966). Зародыш занимает 3/4 семени,
крупный, примой, с хорошо раинитыми массивными семядолями, почечкой, гипоко-
тилом и корешком, ('«одержит запасные липиды.
И с о л од о и а и и ы е вид ы. Stackhousia brunonis, S. linariifolia,
S. тош)КЦ1Ш, S. />ubescens, S. viminea.
Л и т о p а т у р a. Hofmeister, 1858; Billings, 1901; Mauritzon, 1936a,
1i);i()b; NuraiiB, 1953; Davis, 1966; Тахтаджян, 1966; Gulati, 1967; Поддубная- .
Лриольди, 1982.
Семейство SIPHONODONTACEAE
Эмбриологически не изучено.
Зролое семя со скудным эндоспермом. Зародыш с большими семядолями.
Литература. Willis, 1966; Тахтаджян, 1980. '
Семейство GOUPIACEAE
Эмбриологически не изучено.
Семейство GEISSOLOMATACEAE
Пыльник 4-гнездный, вскрывается продольными щелями. Развитие
пыльника не исследовано. В эндотеции зрелого пыльника имеются фиброзные
утолщения.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная, с
постаментом. Микропиле образовано обоими интегументами. Фуникулус разрастается,
формируя ариллус. Археспорий одноклеточный. Преобразование его в мега-
спороцит идет с отделением париетальной клетки. Тетрады мегаспор линейные.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
3 антиподальпые клетки эфемерны, дегенерируют перед оплодотворением.
Полярные ядра сливаются до оплодотворения в халазальной части
зародышевого мешка. В центральной клетке, особенно вокруг полярных ядер и затем
вокруг вторичного ядра, имеется большое количество крахмала.
Развитие эндосперма не прослежено. Судя по рисункам (Stephens, 1909),
со стадии грушевидною проэмбрио он целлюлярный. В зрелом семени имеется
обильный эндосперм.
Первые стадии эмбриогенеза не исследованы. Развитие зародыша сходно
с таковым у представителей сем. Penaeaceae (Stephens, 1909; Johansen, 1950),
т. е., вероятно, относится к Репаеа-вариации Asterad-типа. Проэмбрио без
подвеска. Зародыш в зрелом семени прямой, вытянутый, достигает в длину
центральной части семени. Семядоли длинные, линейные, мясистые. Почечка
слабо выражена. Имеется короткий, циливдрической формы зародышевый
корень.
Исследованный вид. Geissoloma marginatum.
• Литература. Gilg. 1895; Stephens, 1909, 1925; Schnarf, 1931; Johansen,
1950; Davis, 1966; Dahlgren, Rao, 1969.
56
Geissolomataceae
1—13 — Geissoloma marginatum.
rt {1,2 — no Dahlgren, Rao, 1969; 3-13 - no Stephens, 1909).
Семейство SALVADORACEAE
Развитие пыльника изучено недостаточно. Сформированная °^«а г»3
пыльника состоит из.эпидермиса, эндотеция, в котором Развиваются <K>P»
утолщения, 1-2 средних слоев и тапетума. Образование микроспор симулыШ-
ное. Зрелое пыльцевое зерно 2-клеточное.
Г>7
Семяпочки шш'фопппм, с, 2 интегументами, крассинуцеллятная. У Salva-
dora parsica и AzIiihi mnnentosa микропиле образуется только внутренним,
а у A. totratianUia наружным интегуменхом. Археспорий представлен одной
или несколькими клетками. Археспориальная
клетка отделяет париетальную, деление кото-
рол приводит к возникновению под
эпидермисом нуцеллуса значительного числа (до 10)
париетальных слоев. В результате мейоза ме-
гаспороцита возникает линейная тетрада
мегаспор. В некоторых случаях как следствие
подавления деления микропилярной клетки диады
образуется триада клеток. Функционирует ха-
лазальная мегаспора.
Зародышевый мешок моноспорический,
развивается по Polygonum-типу. Синергиды имеют
грушевидную форму. Полярные ядра
сливаются перед оплодотворением или во время
его. Антиподальние клетки имеют крупные
размеры.
Эндосперм нуклеарный.
Эмбриогенез Asterad-типа. Зародыш
прямой, с 2 массивными семядолями, клетки
которых содержат липиды.
Исследованные виды. Azima sarmentosa, A. tetracantha, Salva-
dora persira.
Литература. Mauritzon, 1936; David, 1938; Davis, 1966; Тахтаджян,.
1966; Maheshwari Devi, 1969, 1972; Comer, 1976; Поддубная-Арнольди, 1982.
Salvadoraceae
1,2 — Azima tetracantha.
1 — продольный разрез
семяпочки с остатками нуцеллуса; 2 —
зрелое семя с зародышем. (1,2 —
по Corner, 1976).
Семейство CORYNOCARPACEAE
Пыльники у Corynocarpus laevigata завершают развитие значительно раньше,,
чем формируется зародышевый мешок.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная.
Париетальная ткань представлена 5—8 слоями клеток; возможно также образование
нуцеллярного колпачка. Микропиле образовано внутренним интегументом.
В процессе развития нуцеллус и внутренний интегумент разрушаются.
Незначительная часть нуцеллуса сохраняется в микропилярной и халазальной
зонах семяпочки, вблизи зародышевого мешка.
Тип развития зародышевого мешка не определен. Зрелый зародышевый
мешок имеет 2 синергиды, яйцеклетку и центральную клетку со сливающимися
до оплодотворения полярными ядрами. Клеток антипод до 7—8, они эфемерны.
В завязь могут проникать 2,—3 пыльцевые трубки, но только одна из них
достигает зародышевого мешка. Двойное оплодотворение не обнаружено. Однако
были отмечены случаи, когда ядро яйцеклетки и спермий находились рядом
друг с другом.
Эндосперм нуклеарный; предполагается, что он начинает развиваться до
оплодотворения, т. е. апомиктически. Клеткообразование начинается при
наличии глобулярного зародыша. Ткань эндосперма не заполняет всей
центральной клетки, и на протяжении всего развития сохраняется крупная вакуоль.
Первое деление зиготы поперечное, завершается образованием базальной
и апикальной клеток. Базальная клетка далее не делится. У зародыша
отсутствует отчетливо выраженный подвесок. Апикальная клетка дважды делится
поперек, но далее закономерностей в клеточных делениях не наблюдается.
Зрелый зародыш крупный, с дифференцированными почечкой, гипокотилем,
зародышевым корнем и массивными, занимающими большую часть семени,
семядолями.
Исследованный вид. Corynocarpus laevigata.
Литература. Pigott, 1927.
58
Семейство LOPHOPVXIDAGEAE
Эмбриологически не изучено. *
У Lophopyxis maingayi пыльники интрорзные, вскрываются продольными
щелями.
Зрелый зародыш прямой, с длинными семядолями и коротким гипокотилем.
Литература. Hooker, 1887-1888; Engler, 1896; Pax, 1896.
Порядок .57. SANTALALES
Семейство OLAGAGEAE
Пыльник /ычюидпый, покрывается продольными щелями. Сформированная
стоики гноидп пыльника состоит из эпидермиса, эндотеция, одного (Ximenia
nmtirlcniia), 2— 'Л (Slrombosia), 3—4 средних слоев (Olax) и тапетума. У Strom-
/ш/м и нроцоссо развития клетки эпидермиса постепенно уплощаются, эндо-
тпции етнноим'ся иногда нерегулярно 2-слойным. Средние слои эфемерны,
один ко у Olax (Agarwal,. 1963a) в некоторых клетках среднего слоя развиваются
фиброин mo утолщения. Тапетум секреторный, с одноядерными клетками
у X. amoricana, 2—4-ядерными — у Olax и Strombosia. За счет слияния в
клетках, тппотума часто возникают полиплоидные ядра. Стенка зрелого пыльника
обычно представлена эпидермисом и эндотецием с фиброзными утолщениями.
Обрпношшие тетрад микроспор происходит симультанно. Тетрады микроспор
тотрпадральные, крестообразные, реже — изобилатеральные. Для Olax
характерно образование полиспорад из 5—6 микроспор разных размеров. Зрелые
пыльцевые зерна 2-клеточные у О. stricta, Strombosia и X. americana и 3-кле-
Olacaceae
1—4, 6, 7, 13—16 — Olax wightiana, 8, 17—19, 21, 17а — О. stricta, 5, 9—12, 20, 22—28 —
Strombosia ceylanica.
1 — фрагмент сформированной стенки гнезда пыльника на стадии микроспороцитов; 2 —
фрагмент стенки пыльника на стадии вакуолизированных микроспор; фиброзные
утолщения в эндотеции и сохраняющихся клетках среднего слоя; 3—5 — образование тетрады
микроспор; 6 — полиспорада из 5 микроспор; 7,8 — зрелые пыльцевые зерна; 9 —
многоклеточный археспорий; 10 — семяпочка на стадии мегаспороцита; 11—17 — некоторые
стадии развития зародышевых мешков: 11, 12 — моноспорического (по Polygonum-типу),
13—17 — биспорического (по Allium-типу), 17а — схема строения завязи (продольный
срез); показано начало внедрения эндоспермального халазального гаустория в цветоложе;
60
■ja^lfSfr-fH^'H
Olacaceae (продолжение)
,S-!1 - „.ОВД-, сади, раз,™ »»"™Сы£ I/T'/m й,Т"по Ste^l
гуо*, ^, о °,-< > 20^ 22—28 — по Agarwal, 19Mi>)-
точные у О. *£*&« и О. irfefttf ала. Зрелая пыльца у О. striata крупнее в 2 раза,
чем у О. scandens и О. w'^^ x атеНсапа крассинуцеллят-
Семяпочка анатропная, тенуинуцеллятная .у■ л. a Eeisteria cyanocarpa,
«eyZoraica и 5. уошшса, C«JJ?°^; 0Za«ndes, P. petiolatum и X. omericano.
л/jdronensM, 0. mbnmto, Ptychopetalumошсошеs> ^ интегументы,
У большинстваученных ^Ь ^^^н^^гЛм-, KaropJyOto
SJSiJSKSS^y видов* с'двупокровными семяпочками микро-
.62
пиле образовано внутренним интегументом. От разветвленной проводящой
системы плацентарной колонки в каждую семяпочку входит один пучок,
достигающий основания зародышевого мешка. Археспорий одноклеточный, реже - -
дифференцируются несколько археспориальных клеток (S. ceylanica, X. ате-
ricana). В дальнейшем развивается, как правило, одна археспориальная клетка,
которая становится непосредственно мегаспороцитом. У большинства видов
формируется линейная, у Olax и Strombosia — иногда Т-образная тетрада
мегаспор.
Зародышевый мешок у большинства видов моноспорический, развивается
из халазальной мегаспоры по Polygonum-типу. У О. wightiana (Shamanna,
1954; Agarwal, 1963a) микропилярная клетка диады дегенерирует, а биспориче-
ский зародышевый мешок формируется из халазальной клетки диады по Allium-
типу. Зрелый зародышевый мешок у S. ceylanica овально-продолговатый,
у Olax — удлиненной формы, с латеральным отростком, формирующимся вблизи
халазального конца. У О. scandens и О. wightiana отросток проникает через
халазу в фуникулус, а у О. stricta он достигает центральной плацентарной
колонки. У некоторых видов микропилярный конец зародышевого мешка в ходе
развития входит в микропиле (С. edulis, S. ceylanica) и может достигать
основания канала столбика (О. scandens, О. stricta) и даже рыльца (О. wightiana)
(Fagerlind, 1947, 1948). Яйцеклетка крупнее синергид. Синергиды
грушевидные, с крючковидными выростами и нитчатым аппаратом. Антиподы по
размерам меньше, чем яйцеклетка и синергиды. Обычно они представлены 3
одноядерными клетками. У Olax отмечены аномалии в строении антиподального
аппарата: имеются 2 клетки, одна из которых 2-ядерная, или только одна
3-ядерная клетка (Agarwal, 1963a). Антиподы эфемерны, дегенерируют до
оплодотворения. Полярные ядра сливаются перед оплодотворением. У Erythro-
palum и Strombosia в яйцеклетке и центральной клетке зародышевого мешка
обнаружен крахмал.
Данные по двойному оплодотворению малочисленны; сингамия и тройное
слияние наблюдались у Strombosia.
Эндосперм развивается у Strombosia по целлюлярному, а у Olax — по ге-
лобиальному типу. В обоих случаях в результате деления первичной клетки
эндосперма формируется поперечная перегородка; у Olax она закладывается на
уровне латерального отростка зародышевого мешка. Образуются
микропилярная и халазальная клетки эндосперма. У Strombosia деления микропилярнои
клетки и ее производных сначала преимущественно поперечные, затем клетки
делятся в различных направлениях. В результате этого формируется
клеточный эндосперм грушевидной формы. Халазальная клетка эндосперма
Strombosia функционирует как одноядерный гаусторий, который имеет
гипертрофированное ядро с очень крупными ядрышками. Халазальный гаусторий
у Strombosia постепенно удлиняется и входит в фуникулус. У Olax последний
2—4-, реже — 5-ядерный. Он проникает через фуникулус в цветоножку, в
тканях которой образует многочисленные разветвления, сохраняющиеся и в
зрелом плоде.
Эмбриогенез изучен мало. Зигота делится поперечно. У Strombosia
заложение перегородок в апикальной клетке варьирует. Базальная клетка образует
только подвесок. Зрелый зародыш с 2 небольшими семядолями и гипокотилем.
Исследованные виды. Anacolosa frutescens, Chaunochiton kap-
pleri, Coula edulis, Erythropalum scandens, Eeisteria cyanocarpa, Liriosma acuta,
' Macrotheca elaeocarpa, Minquartia guianensis, Ochanostachys amentacea, Olax
andronensis, 0. imbricata, 0. scandens, 0. stricta, 0. wightiana, Ptychopetalum
olacoides, P. petiolatum, Schoepjia brasiliensis, S. fragrans, Strombosia ceylanica,
S. javanica, Tetrastylidium janeirense, Ximenia americana.
Литература. Miers, 1851; Tieghem, 1896; Smith F., Smith K., 11)42
(1943); Fagerlind, 1946b, 1947a, 1948; Shamanna, 1954, 1961; Johri, DhnUniKiir,
1960; Agarwal, 1961, 1963a, 1963b; Johri, 1962; Ram, 1970a; Sankarn lino, Shi-
varamiah, 1978; Johri, Ambegaokai, 1984.
<M
Семейство OPILIACEAE
Пыльник 4-гнездный; гнезда объединены в 2 теки и перед созреванием
пыльника попарно сливаются вследствие разрушения перегородки между ними.
Стенка гнезда пыльника у Cansjera rheedii формируется центробежно и состоит
из эпидермиса, эндотеция, 1—2 средних слоев и тапетума. Тапетум секреторный,
с 2—4-ядерпыми клетками. Средние слои эфемерны. В эндотеции развиваются
фиброзные утолщения. У С. rheedii при созревании пыльника клетки
эпидермиса разрушаются и эндотеции становится наружным слоем. Образование
тетрад микроспор происходит по симультанному типу. Тетрады микроспор
тетраэдральные. Зрелые пыльцевые зерна 2-клеточные.
Семяпочка (редко их 2) у большинства изученных видов возникает на
центральной плацентарной колонке. Степень развития колонки и семяпочки варьи-
Opiliaceae
1—7, 15 — Cansjera rheedii, 8—14 — Opilia amentacea.
I—4 — некоторые стадии развития пыльника; 5—12 — ранние стадии развития семяпочки
(5—7) и развитие зародышевого мешка (6—12);
64
ОрНгасеае (продолжение)
13—15 — некоторые стадии развития эндосперма. (1—7, 15 — по Swamy, 1960; 8—12 — по
Shamanna, 1955; 13, 14 — по Swamy, Rao, 1963).
рует (Fagerlind, 1948). Наименее редуцированы колонка и семяпочка у Rho-
palopilia и Opilia, наиболее — у Cansjera. Семяпочка анатропная, с одним ин-
тегументом, тенуинуцеллятная. Микропиле узкое. Нуцеллус сильно
редуцирован. У Agonandra silvatica семяпочка не дифференцируется совсем, и
археспорий закладывается в тканях довольно мощной центральной колонки.
Археспорий . одноклеточный, преобразование его в мегаспороцит происходит без
отделения кроющей клетки. Тетрада мегаспор линейная.
Зародышевый мешок моноспорический, развивается из халазальной
мегаспоры по Polygonum-типу. Яйцевой аппарат дифференцирован. Синергиды
грушевидной формы, с небольшими крючковидными выростами и нитчатым
аппаратом. 3 довольно крупные антиподы дегенерируют, по-видимому, до
оплодотворения. Полярные ядра сливаются перед оплодотворением вблизи
5 Сравнительная эмбриология
65
яйцевого аппарата. Сформированный зародышевый мешок удлиненно-овальной
формы и расширенным микропилярным и узким халазальным концами. До
оплодотворения наблюдается вторичный рост зародышевого мешка. Его хала-
зальный конец значительно удлиняется и изгибается в направлении основания
гинецея, приобретая U-образную форму, при этом антиподы у О. amentaceae-
остаются в первоначальном положении, а у С. rheedii мигрируют в отросток,.
но вскоре дегенерируют. Отросток по длине почти равен остальной части
зародышевого мешка (О. amentacea) либо в 3 раза превышает ее (у С. rheedii).
У С. rheedii в зародышевом мешке отмечено значительное количество
крахмальных зерен.
Эндосперм целлюлярный. Первичное ядро делится в области изгиба
центральной клетки зародышевого мешка. Образовавшаяся в результате этого
деления перегородка делит центральную клетку на 2 неравные клетки —
овально-продолговатую микропилярную и длинную узкую халазальную.
Последующие деления в микропилярной клетке приводят к образованию-
эндосперма, клетки которого постепенно заполняются крахмалом и другими
питательными веществами. Халазальная клетка значительно удлиняется
к основанию гинецея и функционирует как гаусторий. У О. amentacea
одноядерный неразветвляющийся гаусторий проходит через цветоложе и внедряется
в ткани цветоножки. Ядро в процессе роста гаустория постепенно
передвигается в направлении роста клетки, но никогда не занимает терминального-
положения (Swamy, Rao, 1963). Длина гаустория варьирует от 960 до 1520 мкм.
У С. rheedii первичный гаусторий, имеющий веретеновидную форму и
содержащий полиплоидное ядро, разрастается в виде многочисленных ветвящихся
отростков, которые представляют собой сложную систему вторичного
гаустория. Его развитие ограничивается зоной каменистых клеток в цветоложе-
(Swamy, 1960). Эндосперм в зрелом семени обильный, богат питательными
веществами.
Эмбриогенез не изучен. Зародыш в зрелом семени небольших размеров,
цилиндрический, с линейными семядолями, плотно прижатыми друг к другу,
и изогнутой почечкой. Семядолей 3—4, реже — 2 (Reed, 1954—1955).
Щ И с с л е д о в а н н ы еЩв и д ы. Agonandra silvatica, Cansjera rheedii,
Opilia afzelii, 0. amentacea, 0. celtidifolia, 0. tomentella, Rhopalopilia umbel-
lulata.
Литература. Fagerlind, 1948; Reed, 1954—1955; Shamanna, 1955;
Johri, Bhatnagar, 1960; Swamy, 1960; Swamy, Rao, 1963; Ram, 1970; Johri,
Ambegaokar, 1984.
Семейство SANTALACEAE
Пыльник 4-гнездный, у Exocarpus 2-гнездный; гнезда в каждой теке
вскрываются общей щелью. У Leptomeria сливаются все 4 гнезда. Развитие стенки
гнезда пыльника происходит центробежно. Сформированная стенка гнезда
пыльника состоит из эпидермиса, эндотеция, 1—2 (у Iodina rhombifolia и San-
talum album — 2—3) средних слоев и тапетума. Тапетум секреторный, у Би-
ckieya lanceolata, S. album, Thesium arvense нерегулярно 2-слойный. Клетки
тапетума обычно 2—4-ядерные, у Exocarpus — 1—2-ядерные, у Osyris —
одноядерные во все время существования. Ядра в многоядерных клетках тапетума
часто сливаются и становятся полиплоидными. Стенка гнезда зрелого пыльника
у многих видов состоит из эпидермиса, и эндотеция. Однако у Thesium (Pali-
wal, 1956) и Exocarpus (Fagerlind, 1959) отмечено разрушение эпидермиса
пыльника на стадии микроспор. По нашим данным, у S. album и Т. arvense все стенки
клеток эпидермиса утолщены, при этом наружные тангенциальные стенки
клеток кутинизированы. Эидотеций становится фиброзным. У Quinchamalium
chilense (Johri, Agarwal, 1965) и Т. arvense (наши данные) фиброзные утолщения
наблюдаются и в слое клеток со стороны связника. Средние слои эфемерны.
Тетраэдральные, изобилатеральные и крестообразные тетрады микроспор
формируются по симультанному типу. Зрелые пыльцевые зерна одиночные,
60
Santalaceae
1,1а, 2-5а 11, 11а 12, 12а, 20 — Thesium arvense, 6-10, 13, 17, 19, 21-22, 6а, 10а, 13а,
19а — Santalum album, 14, 15, 23 — Thesium humifusum, 16, 18 — Osyris arborea, 24—31 —
Quinchamalium chilense.
*> 4~7> l0 — гнездо пыльника на разных стадиях развития; 2, 3, 8,9 — тетрады
микроспор; 1а, 5а, 6а, 10а — схемы пыльников;
5*
2-клеточные (Comandra, Exocarpus, Leptomeria acida, Osyris, Thesium) или 3-кле-
точные {Leptomeria cunninghamii, Mida, Santalum).
. Висячие семяпочки (от 2 до 5) образуются на свободной центральной
плаценте, которая либо прямая (ВисЫеуа, Leptomeria, Mida, Osyris, Santalum),
либо более или менее спирально скрученная (Comandra, Iodina, Scleropyrum,
Thesium). Семяпочки анатропные (Choretrum, Comandra, Iodina, Leptomeria,
Osyris), гемитропные (Mida, Quinchamalium) либо ортотропные (ВисЫеуа,
Santalum, Thesium), тенуинуцеллятные, с одним интегументом более (Comandra,
Quinchamalium, Thesium) или менее (Leptomeria, Osyris) дифференцированным,
который в процессе развития потребляется растущим эндоспермом, вследствие
чего семя лишено покрова. У Mida и Santalum интегумент полностью
редуцирован. У Exocarpus археспорий закладывается непосредственно в ткани
свободной центральной плаценты (Fagerlind, 1959; Bhatnagar, Joshi, 1965). В суб-
эпидермальном слое микропилярной зоны нуцеллуса обычно дифференцируется
68
Santalaceae (продолжение)
16—19 — развитие зародышевого мешка, 19а — схема расположения зародышевых мешков>
в завязи; 20 — схема свободной центральной плаценты и зародышевого мешка;
от 1 до 8 археспориальных клеток, преобразующихся в мегаспороцит без
отделения кроющих клеток. У Comandra закладываются 1—2 археспориальные клетки,
у Osyris — 1—4, у Thesium — 1—6, у Quinchamalium — 6—8. Тетрады
мегаспор обычно линейные, у Leptomeria acida встречаются также Т-образные
тетрады; у Exocarpus cupressiforum и Leptomeria cunninghamii микропилярная клетка:
диады не делится. У Exocarpus и Thesium в одной семяпочке начинают
развиваться 1'—2 зародышевых мешка, но зрелого состояния достигает один.
Зародышевый мешок у большинства видов моноспорический, развивается
по Polygonum-типу из халазальной клетки тетрады или триады. У ВисЫеуа
и Iodina он биспорический и развивается по Allium-типу, а у Thesium
intermedium и Т. montanum — тетраспорический и соответствует Adoxa-типу. У
Leptomeria, Mida, Santalum и Quinchamalium микропилярный конец зародышелого
мешка вырастает за пределы семяпочки (или плаценты у Exocarpus) в сторону
канала столбика. У ВисЫеуа, Iodina, Osyris и Thesium, напротив,
микропилярная область зародышевого мешка не имеет заметной тенденции к росту, однако'
его халазальный конец активно врастает в ткань свободной центральной
плаценты, где сливается с гаусториальными выростами зародышевых мешков
других семяпочек. У Leptomeria и Santalum*наблюдаются гаусториалыше раз»-
растания халазальной области зародышевого мешка. У Comandra гаусторий
центральной клетки зародышевого мешка латеральный, образуется вблизи
69'
Santalaceae (продолжение)
SI—26 — некоторые стадии развития эндосперма: 22 — микропилярная часть эндосперма
и синергиды с гаусториальными выростами; 27—31 — некоторые стадии развития зародыша.
{1—13, 17, 20, 5а, 6а, 10а—13а, 19а — ориг., 14—16, 18, 19, 21—23 — по Paliwal, 1956;
24—31 — по Johri, Agarwal, 1965).
яйцевого аппарата. Гаусториальиые разрастания микропилярной области
центральной клетки зародышевого мешка отмечены у Exocarpus и Santalum.
У Santalum и Quinchamalium гаусториальиые выросты образуют также и си-
яергиды, причем у Santalum они ветвятся, а у Quinchamalium выходят в канал
столбика (на 1/3 его длины). У Santalum отмечены гаусториальиые разрастания
;антипод, которые становятся наиболее заметными после оплодотворения.
70
Эндосперм у большинства изученных представителей семейства доллю-
лярный, однако у Santalum и Mida он гелобиальный. Первичная клетка
эндосперма делится поперечно на микропилярную и халазальную клетки. У
Quinchamalium обе клетки делятся затем поперечно, а каждая из вновь
образовавшихся — продольно. Клетки халазальной части вслед за этим разрастаются,
образуя 4 гаусториальных выроста, внедряющихся в плаценту. Из
микропилярной тетрады клеток развивается собственно эндосперм. У Osyris, Scleropy-
гит и Thesium деления в микропилярной части эндосперма менее упорядочены.
У Comandra и Mida некоторые клетки микропилярной части эндосперма
образуют гаусториальиые выросты. Халазальный гаусторий обычно одноклеточный,,
однако у Quinchamalium (Johri, Agarwal, 1965), Exocarpus (Ram, 1959a) и Mida
(Bhatnagar, 1960) он многоклеточный. У Comandra в результате первого
деления центральной клетки отделяется латеральный гаусториальный вырост, иа
которого впоследствии образуются 4 гаусториальиые клетки (Ram, 1957).
Эндоспермальный халазальный гаусторий у Iodina сильно ветвится, а его ядро^
становится гипертрофированным (возможно в результате ряда эндомитозов).
У Thesium (Erbrich, 1965) за счет эндомитозов ядро халазального гаустория
также достигает высокой степени плоидности (до 384п). В зрелом плоде
эндосперм обильный.
Эмбриогенез нерегулярный. Первое деление зиготы продольное {Comandra,.
Quinchamalium) или поперечное (Exocarpus, Leptomeria, Mida, Osyris, Santalum,
Scleropyrum, Thesium). В следующей клеточной генерации обычно образуются
тетрада накрест лежащих бластомеров или же нитевидный зародыш из одного^
ряда клеток (Exocarpus). У Mida и Quinchamalium развивается массивный
многоклеточный суспензор, у Exocarpus он из одного ряда клеток; у Leptomeria и
Santalum образуется небольшой суспензор из нескольких клеток. Зародыши
Comandra, Osyris и Thesium без морфологически выраженного суспензора.
Время существования суспензора также вариабельно. Зародыш в зрелом плоде
обычно с 2 семядолями, однако у Santalum отмечены и 3-семядольные зародыши.
В зародыше у всех изученных представителей семейства апекс корня
преобразован в гаусторий.
У Buckleya (Raj, 1970), Exocarpus (Ram, 1959), Mida (Bhatnagar, I960),.
Santalum (Bhatnagar, 1959a, 1959b) обнаружена полиэмбриония. -
Исследованные роды и виды. Buckleya lanceolata, Choretrum.
later iflorum, Comandra umbellata, Exocarpus bidwillii, E. cupressiforum, E. gaudi-
chaudii, E. latifolius, E. menziesii, E. sparteus, E. strictus, Iodina rhombtfolia,.
Leptomeria acida, L. billardieri, L. cunninghamii, Mida salicifolia, Osyris alba?
0. arborea, 0. nepalensis, 0. wightiana, Pyrularia, Quinchamalium chilense,
Santalum acuminatum, S. album, S. freycinetianum, S. obtusifolium, S. pyrulariumt
S. yasi, Scleropyrum, Thesium alpinum, T. arvense, T. divaricatum, T. humi-
fu sum, T. intermedium, T. linophyllum, T. montanum, T. rostratum, T. wigh-
tianum.
Литература. Griffith, 1841a, 1843; Schacht, 1850, 1865—1866; Hen-
frey, 1856; Hofmeister, 1858a, 1858b, 1859; Strasburger, 1877, 1878, 1885;
Warming, 1878; Jonsson, 1879—1880; Guignard, 1885; Tieghem, 1896; Habermann,
1906; Модилевский, 1928; Schulle, 1933; Iyengar, 1937; Rutishauser, 1937a;
Schaeppi, Steindl, 1937; Rao, 1942; Schaeppi, 1942; Smith F. H., Smith E. C,
1942; Fagerlind, 1948, 1959; Ghosh, 1955; Maheshwari, Ghosh, 1955; Paliwal,
1956; Ram, 1957, 1959a, 1959b, 1959c; Bhatnagar, 1959a, 1959b, 1960, 1964,.
1965, 1966, 1970; Johri, Bhatnagar, 1960, 1969; Joshi, 1960; Agarwal, 1961, 1962;.
Bhatnagar, Agarwal, 1961; Johri, 1962; Raj, 1964, 1965, 1970b, 1972; Bhatnagar,
Joshi, 1965; Erbrich, 1965; Johri, Agarwal, 1965; Bhatnagar, Sabharwal, 1 !)(><),
1968 (1969); Терёхин, 1977; Kulkarni, Srimathi, 1981; Sedgley, 1982; Johri,
Ambegaokar, 1984; Терёхин, Анйсимова (ориг. данные).
711
Misodendraceae
1 — Misodendrum recurvum, 2 — M. linearifolium, 3 — M. quadriflorum, 4—13 — M. punctu-
latum, 14—17 — M. brachystachyum.
1 — зрелый пыльник (поперечный срез); 2 — вскрывшийся пыльник и гинецей
(продольный срез); 3 — 2 мегаспороцита в нуцеллусе; 4—6 — стадии развития зародышевого мешка,
видно удлинение его халазального конца; 7 — эндосперм с зародышем; 8,9 — схема
строения эндосперма с халазальным гаусторием, врастающим в плацентарную колонку; 10 —
терминальный конец халазального гаустория; 11, 12 — зародыш на глобулярной стадии (11) и
в период дифференциации (12); 13 — зародыш и эндосперм с гаусторием; 14 —
дифференцированный на органы зародыш: радикулярный конец расширен, семядоли, сросшиеся в
полую трубку, заключают апекс побега; 15, 16 — положение зародыша в плоде перед и
во время прорастания; 17 — проросток, прикрепленный радикулярным концом к питающей
ветви дерева-хозяина. (1—6, 9— по Skottsberg, 1913; 7, 8, 10—13 — по Johnson, 1889;
14—17 —по Hooker, 1847).
Семейство MISODENDRACEAE
Пыльник у видов Misodendrum монотековый, 2-гнездный, при созревании
перегородка между гнездами частично разрушается, что приводит к слиянию
гнезд; вскрывается терминальной щелью. Стенка гнезда зрелого пыльника
2-слойная: эпидермис состоит из мелких изодиаметрических клеток, эндоте-
ций — из крупных, радиально удлиненных клеток с фиброзными
утолщениями. Пыльцевые зерна одиночные, сферические.
Три ортотропные беспокровные висячие семяпочки закладываются на
вершине свободной базальной плаценты. Обычно развивается только одна из них.
Однослойный нуцеллус в апикальной части семяпочки разрушается в процессо-
формирования эндосперма. Археспорий одно- или 2-клеточный, преобразуется
непосредственно в мегаспороцит. Тетрада мегаспор линейная.
Зародышевый мешок моноспорический, развивается, вероятно, по Polyfto-
num-типу. Яйцевой аппарат 3-клеточный, антиподы рано дегенерируют,
строение их не описано. Антиподальный конец зародышевого мешка
удлиняется, образуя трубчатый гаусторий в плацентарную колонку.
Эндосперм целлюлярный, с длинным халазальным гаусторием. У М. 1>Ш1"
ctulatum, по наблюдениям Джонсона (Johnson, 1889), гаусторий первошииии.Н^
состоит из длинной многоклеточной трубки, которая затем, в результате ис.'НШ-
новения перегородок, становится многоядерной, кроме вздутого конца, сохии-
П
няющого KJKVi'ouiioo состояние. Скоттсберг (Skottsberg, 1913) у этого же вида
наблюдал одноядерный трубчатый гаусторий, который разветвляется в
основании щишш над иаскулнриым нучком, пронизывая окружающие соматические
ткани. В пролом ccMonvr эндосперм значительный по объему,
овально-удлиненный и продольном сечении и округлый в поперечнике.
Юмбриогоиоз ие исследован. Зигота, после образования нескольких клеток
эндосперма, долится поперечной перегородкой. Проэмбрио в своем развитии
проходит глобулярную стадию; суспензор морфологически не выражен. В
зрелом ('.((мини зародыш небольшой, дифференцированный, расположен в микро-
ншшрпой части эндосперма, а головчато расширенным радикулярным концом
'иыходит за его пределы. Короткие семядоли, сросшиеся в полый цилиндр,
яаключают апекс побега (Hooker, 1847; Hofmeister, 1859). В гипокотиле развит
прокамбиальный тяж; радикула преобразована в зачаток гаустория
конической формы и окружена массивной висциновой тканью из длинных нитевидных
миогоядерных клеток, косо расположенных к оси зародыша. Из этой ткани
■формируется дисковидная присоска, с помощью которой зародыш
прикрепляется к ветви растения-хозяина. Проросток образует гаусторий, который,
раздвигая висциновую ткань, внедряется в побег питающего растения.
Исследованные виды. Misodendrum brachystachyum, M. lineari-
folium, М. punctulatum, М. quadriflorum, M. recurvum. \
Литература. Hooker, 1847; Hofmeister, 1859; Tieghem van, 1869,
1896; Johnson, 1889; Hieronimus, 1894 (1889); Skottsberg, 1913, 1935; Тахтад-
экян, 1966; Ram, 1970b.
Семейство LORANTHACEAE
Пыльники 4-гнездные, реже — 2-гнездные (Helixanthera ligustrina, Psit-
itacanthus cuneifolius) или одногнездные (Dendropemon—Phthirusa). У Loranthus
•europaeus наряду с типичными 4-гнездными пыльниками изредка встречаются
-3-гнездные пыльники, возникающие в результате слияния 2 смежных гнезд
разных тек (ориг. данные). У Helixanthera оба гнезда пыльника разделены на
несколько отсеков поперечными перегородками. Для многих видов характерен
массивный связник, в клетках которого накапливаются танинсодержащие
вещества. Пыльник вскрывается продольными щелями (за исключением
Lepeostegeres и Macrosolen). Формирование стенки гнезда пыльника происходит
центростремительно, что детально прослежено у Strutanthus vulgaris.
Сформированная стенка состоит из эпидермиса, эндотеция, 1—2 средних слов и тапе-
тума. У большинства видов в эндотеции развиваются фиброзные утолщения,
во они не обнаружены у Amylotheca dictyophleba, Lepeostegeres gemmiflorus,
Macrosolen cochinchinensis. Средние слои эфемерны, но у Атпуета miquelli в
некоторых клетках наружного среднего слоя развиваются фиброзные утолщения,
жак и в эндотеции. Тапетум секреторный, однослойный, иногда местами 2-слой-
лый. Во время мейоза тапетальные клетки обычно становятся 2-ядерными либо
многоядерными с последующим слиянием ядер, но у Baraihranthus, Dendrophthoe,
-Scurrula atropurpurea остаются одноядерными. У Hyphear (Pisek, 1924) и у
Scurrula (Raj, 1970) был отмечен амебоидный тапетум. Однако у S. atropurpurea
'{Ranch, 1936) и 5. pulverrulenta (ориг. данные) установлен тапетум
секреторного типа. На внутренней тангентальной стенке клеток тапетума у ряда видов
{виды Атуета, Moquiniella rubra, L. europaeus) обнаружены мелкие орбикулы.
Мейоз в микроспороцитах завершается симультанным цитокинезом. Тетрады
микроспор тетраэдральные или крестообразные. Зрелые пыльцевые зерна
2-клеточные, с крахмалом, имеют 3-лучевую форму у большинства исследован-
Loranthaceae
1—11, 30, 32—34, 37 — Loranthus europaeus, 12—14, 31, 35, 36 — Scurrula pulverrulentha,
15, 16, 25, 29 — Атуета miquelii, 17, 28 — A. preissii, 18, 19, 27 — Lepeostegeres gemmiflorus,
20—24, 26 — Nuytsia floribunda.
1 — лопасть пыльника со спорогенными клетками; 2—8 — стадии микроспорогенеза;
9, 10 — фрагменты гнезда пыльника на стадии образования тетрад микроспор;
74
■ных видов, лишь у отдельных видов пыльцевые зерна сферической формы (Ти-
■peia antarctica, Atkinsonia ligustrina).
Семяпочка (как и плацента) у представителей семейства крайне
редуцирована или полностью элиминирована как морфологическое образование. В
полости завязи некоторых видов (Amyema) имеется небольшой базальный вырост
(сосочек — mamelon), у ряда видов — с 3—4 лопастями в его основании (Nuyt-
sia floribunda, M. cochinchinensis, L. gemmiflorus, Peraxilla tetrapetala, A. di-
ctyophleba, Lysiana exocarpi). У многих таксонов (Baraihranthus, Loranthus,
Psiltacanihus, Scurrula) полость завязи сведена к узкому каналу, лишенному
каких-либо выростов. Характерна гипостаза разнообразной формы — от
чашевидной до трубковидной, состоящая из нескольких слоев толсто-
■стенНых клеток, расположенная в ткани завязи под спорогенным комплексом
и сохраняющаяся до созревания плода. Археспорий многоклеточный, редко —
1—2-клеточный, дифференцируется как пластинка клеток в гиподермальном
•слое различных морфологических образований: либо под основанием полости
76
Loranthaceae (продолжение)
15 — археспорий в субэпидермапьном слое под основанием полости завязи; 16, 17 — споро-
генный комплекс: на стадии завершения митозов (16) и на стадии формирования могшяюро-
цитов (17); 18, 19 — 4-ядерный (18) и сформированный (19) зародышевый мошок:
микропипярная, средняя и халазальная части; 20 — микропипярная часть зародышоиого мошки
с латеральным выростом;
21—25 — ранние стадии эмбриогенеза! Яэ \
завязи, либо в апексе сосочка, либо в каждой из его лопастей. Археспориальные
клетки делятся митотически, образуя многоклеточный спорогенный комплекс
(у видов Атуета из 50—85 клеток). Преобразование спорогенных клеток в ме-
гаспороциты происходит без отделения кроющих клеток. Характерна верете-
новидная форма мегаспороцитов. Тетрады мегаспор обычно линейные, в норме
функционирует халазальная мегаспора, реже — приступают к развитию
другие мегаспоры. Широко распространена частичная дегенерация спорогенных
клеток, мегаспороцитов и даже зародышевых мешков, развивающихся
конкурентно.
Зародышевый мешок моноспорический. У большинства видов образуются
несколько зародышевых мешков в одной завязи (у S. atropurpurea — от 3 до
5, у видов Атуета, Tolypanthus, Dendrophtoe — до 12, у Nuytsia — до 16),
но у S. vulgaris — только один. У некоторых видов 2 халазальных ядра 4-ядер-
ного зародышевого мешка делятся быстрее, чем 2 микропилярных ядра,
вследствие этого возникает 6-ядерная стадия зародышевого мешка и антиподы
дифференцируются раньше, чем яйцевой аппарат. Для представителей семейства
отмечено сильное удлинение зародышевых мешков, начинающееся с 4-ядерной
стадии. В этом семействе обнаружены самые длинные зародышевые мешки
среди покрытосеменных: до 48 мм. У некоторых видов они достигают основания
столбика, у других растут по каналу столбика до различной высоты и даже
78
Loranthaceae (продолжение)
26 — 2-рядный зародыш в окружении эндосперма;
27 — 2 эндосперма, объединенные в халазальной части
« погруженными в нее проэмбрио: видны длинные
скрученные суспензоры; 28 — часть проэмбрио с
расширенным апикальным концом; 29 — плод со
зрелым зародышем, семядольной частью погруженным
в эндосперм;
Loranthaceae (продолжение)
30, 31 — схема гинецея на стадии мегаспороцитов (30) и сформированных зародышевых
мешков (31); 32 — комплекс мегаспороцитов; 33 — тетрады мегаспор; 34 — 2-ядерные
зародышевые мешки; 35 — халазальные части 2 зародышевых мешков с антиподами; под
ними видна гипостаза из толстостенных клеток; 36 — 2 проэмбрио в эндосперме; под
эндоспермом видна гипостаза; 37 — зрелый зародыш в окружении эндосперма (схема). (1, 9—14 —
поперечные срезы; 30—37 — продольные срезы). (1—14, 30—37 — орпг.; 15—17, 25, 28, 29 —
по Dixit, 1958а; 18, 19, 27 — по Dixit, 1958 (1959); 20—24, 26 — по Narayana, 1958 (1959).
достигают рыльца. У N. floribunda и A. llgustrina развивается латеральный
отросток центральной клетки зародышевого мешка на уровне яйцевого аппарата;,
у большинства видов возникает небольшой халазальный отросток,
углубляющийся ниже уровня антипод и достигающий, как правило, гипостазы. В
зародышевом мешке аккумулируется крахмал, особенно около яйцевого аппарата,
хорошо дифференцированного. Яйцеклетка крупная, синергиды грушевидные,,
с крючковидными выростами и нитчатым аппаратом. У N. floribunda отмечена
дегенерация синергид до оплодотворения. У S. vulgaris синергиды сохраняются
в период ранних стадий эмбриогенеза. Антипод 3, но встречаются и 2, тогда
одна из клеток 2-ядерная (Amylotheca, Atkinsonia, Lepeostegeres). Антиподы
у большинства видов сохраняются на ранних стадиях развития эндосперма.
Полярные ядра сливаются до оплодотворения вблизи яйцевого аппарата.
Оплодотворение норогамное, двойное. Пыльцевая трубка входит в одну из
синергид.
Эндосперм целлюлярный. Первичное ядро эндосперма у всех видов
опускается в халазальную часть клетки, где и происходит его деление. Оно обычно
опережает деление зиготы (S. vulgaris, Dendrophthoe pentandra), но иногда
задерживается (виды Атуета). Первое деление эндосперма поперечное. У
большинства видов эндоспермогенез происходит одновременно в нескольких
зародышевых мешках; эндоспермы впоследствии сливаются, разрушая
находящуюся между ними ткань завязи и образуя единую массу сложной формы.
Основная масса эндосперма формируется в халазальном конце зародышевого-
мешка над гипостазой. Клетки формирующегося эндосперма крупные, сильно
вакуолизированные, но клетки 2—3 слоев по периферии его халазальной части
обычно более мелкие и густоплазменные (Атуета, Scurrula). У Tapinostemma
acaciae некоторые из них становятся клиновидными и принимают гаусториаль-
ный облик. У S. vulgaris отмечен один гаусториальный отросток. В зрелом
плоде эндосперм хорошо развит, содержит крахмал; он удлинен по оси плода,,
у многих видов имеет 5—8 продольных лопастей, в пространство между
которыми вклинивается ткань перикарпа с васкулярными тяжами.
Эмбриогенез характеризуется продольным делением зиготы, как в Piperad-
типе, но отличается от него процессом дальнейшего развития. За первым
делением следуют несколько поперечных, что приводит к образованию нитевидного
2-рядного проэмбрио с длинным подвеском. Подвесок по всей длине обычно
остается 2-рядным, реже — 3—6-рядным, его клетки после деления сильно
вытягиваются, благодаря чему апикальный конец проэмбрио продвигается.
в центральную часть развивающегося эндосперма, где и начинается
интенсивное развитие зародыша. Подвесок зародыша часто спирально
скручивается. В сложном эндосперме первоначально начинают развиваться несколько
зародышей, иногда они сливаются суспензорами, однако зрелого состояния
достигает, как правило, один, редко — 2. Зрелый зародыш у большинства
исследованных видов крупный, дифференцирован на семядоли, почечку и гипоко-
тиль, содержит запасные вещества, погружен в эндосперм, за исключением
радикулярного конца. Обычны 2 семядоли, свободные по всей длине
(Amylotheca, Atkinsonia, Elytranihe, Атуета congener, Lepeostegeres, Macrosolen, Nuytsia,
Peraxilla, Struthanthus, Psittacanthus) либо выше почечки сросшиеся на
значительном протяжении (A. miquelli, Barathranthus, Dendrophthoe, Helicanthes,
Lysiana, Moquinella). У N. floribunda зародыш с З семядолями. У видов Атуета
семядоли в зрелом семени не равны по длине. У Phrygillanthus aphyllus
зародыш маленький, бессемядольный. У всех исследованных видов зародышевый
корень редуцирован. Радикулярный конец зародыша обычно расширен, а его-
поверхностные . клетки образуют сосочковидные выросты, при прорастании
зародыша внедряющиеся в стебли растения-хозяина. Такая структура
обусловлена приспособлением представителей семейства к стеблевому паразитизму.
Хлороэмбриофиты.
Исследованные роды и виды. Атуета congener, A. gravis,.
A. miquelli, A. pendula, A. preissii, Amylotheca dictyophleba, Atkinsonia ligustrina,
Barathranthus axanthus, Dendropemon (=Phthirusa), Dendrophthoe falcata, D.
pentandra, Elytranthe, Helicanthes elastica, Helixanthera ligustrina, Lepeostegeres
6 Сравнительная эмбриология
81
gemmiflorus, Loranthus :bicolor, L. europaeus, L. globosus, L. rubromarginatus,
Lysiana expocarpi, Macrosolen cochinchinensis (=Loranthus sphaerocarpus), M. for-
mosus, M. pseudoperfoliatus, Moquiniella rubra, Nuytsia floribunda, Peraxilla
tetrapetala, Phihirusa, adunca, P. pyrifolia, Psittacanthus cuneifolius, Scurrula
atrop игр urea, S. pulverrulenta, Struthanthusflexicaulis, S. vulgaris, Tapinostemma
acaciae, Tolypanthus involucratus, T. lagenifer, Tupeia antarctica.
; [Литература. Griffith, 1841b, 1843; Hofmeister, 1858a, ' 1858b, 1859;
Jonsson, 1881; Treub, 1881 (1885), 1882, 1882 (1883); Tieghem van, 1895a, 1895b;
Pisek, 1924; Rauch, 1936; Ernst, 1942; Schaeppi, Steindl, 1942; Smith F. H.,
Smith E. C, 1942; Maheshwari, Johri, 1950; Maheshwari, Singh, 1952; Pienaar,
1952; Smart, 1952; Agrawal, 1954; Dixit, 1954a, 1954b, 1955a, 1955b, 1956a,
1956b, 1958 (1959)a, 1958 (1959)b, 1961; Johri, Agrawal, 1954; Narayana, 1954,
1955, 1956,1958 (1959)a, 1958 (1959)b; Johri, Agrawal, Garg, 1957; Maheshwari,
Johri, Dixit, 1957; Garg, 1958; Johri, Bhatnagar, 1960; Prakash, 1960, 1961,
1963; Johri, 1963; Johri, Prakash, 1965; Johri, Raj, 1965, 1969; Raj, 1965, 1970a,
1970b; Bhatnagar, Chandra, 1968; Johri, Jag, 1974; Lamont, Perry, 1976;
Bhatnagar, Gandhi, 1979—1980; Berhard, Knox, Galder, 1980; Venturelli, 1981,
1983, 1984; Bhatnagar, Garg, 1984; ^Cocucci, Venturelli, 1984; Никитичева,
Анисимова (ориг. данные).
Семейство VISCACEAE
и некоторых видов Viscaceae пыльники объединены в синандрии (Viscum
.album, Korthalsella} opuntia). Вопрос о числе микроспорангиев в пыльниках
Arceuthobium является спорным. По мнению одних исследователей, пыльники
A. oxycedri одногнездные (Heinricher, 1915; Dowding, 1931), по другим данным —
2-гнездные (Bhandari, Nanda, 1968a). Наши данные показали, что пыльники
у этого вида одногнездные. Сформированная стенка гнезда пыльника 3-слойная
■{A. oxycedri, A. minutissimum) или4-слойная (Eubrachion ambiguum, К. opuntia).
У Arceuthobium в результате периклинальных делений клеток археспория
образуются спорогенный и париетальный слои; клетки последнего отделяют внутрь
однослойный секреторный тапетум и наружу — средний слой. С внешней
•стороны гнезда клетки тапетума 1— 2-ядерные, с внутренней стороны — 2—
4-ядерные, с полиплоидными, часто сливающимися ядрами. У видов
Arceuthobium фиброзные утолщения образуются в клетках эпидермиса (Johnsson, 1888;
Nanda, 1966; Raj, 1970; ориг. данные). У Е. ambiguum и К. opuntia фиброзные
утолщения развиваются в эндотеции (Rutishauser, 1937; Bhandari, Indira,
1969). Образование тетрад микроспор происходит по симультанному типу.
.'Зрелые пыльцевые зерна одиночные, 2-клеточные.
Семяпочки у представителей сем. Viscaceae редуцированы. Археспориальные
клетки формируются непосредственно в ткани центральной колонки (сосочка)
или латерально у ее вершины (Arceuthobium), либо в тканях основания завязи
(Viscum). Недифференцированные рудименты семяпочек описаны у Dendro-
phthora, Korthalsella и Phoradendron (York, 1913; Billings, 1933; Correa, 1958;
Raj, 1970). Археспорий одноклеточный у Dendrophihora, Korthalsella и
Phoradendron, 2-клеточный у большинства видов Arceuthobium, многоклеточный
у Eubrachion и Viscum. Сведения о наличии многоклеточного археспория у
Arceuthobium americanum (Dowding, 1931) нуждаются в подтверждении. Мега-
■спорогенез завершается образованием диады 2-ядерных клеток.
Функционирующей может быть как верхняя клетка диады (Arceuthobium), так и нижняя
(Eubrachion, Viscum).
Зародышевый мешок биспорический, развивается по Allium-типу или по
его Endymion-форме. Сведения о тетраспорическом развитии зародышевого
•мешка у A. douglasii (Jones, Gordon, 1965) при переисследовании этого вида
не были подтверждены (Bhandari, Nanda, 1968a). Сведения о тетраспорическом
развитии зародышевого мешка у Phoradendron villosum и P. flavescens (Billings,
1933) также нуждаются в подтверждении.
.•82
1—3, 5, 26, 39 — Arceuthobium oxycedri, 4,10—15,18—22 — Viscum album, 6—9,17, 35—38 —
Eubrachion ambiguum, 16, 23—25, 27—34 — Arceuthobium minutissimum.
1—5 — пыльники, синандрии и стенка гнезда пыльника: 1 — продольный срез
раскрывшихся пыльников, 2 — сформированная стенка гнезда пыльника (поперечный срез), 3 —
стенка зрелого пыльника (поперечный срез) и зрелое пыльцевое зерно, 4 — синандрии
(поперечный срез),
В строении зародышевых мешков у разных представителей семейства
имеются своеобразные черты. У Е. ambiguum, V. album и V. articulatum
зародышевый мешок прямой. У A. minutissimum и A. oxycedri из латеральной области
центральной клетки зародышевого мешка формируется гаусториалъный вырост,
проникающий к основанию сосочка (Скробишевский, 1890; Bhandari, Nanda,
1968а). У A. pusillum халазальная часть зародышевого мешка также образует
гаусторий, растущий к основанию сосочка. Микропилярная область
зародышевого мешка у видов Arceuthobium разрастается за пределы сосочка в полость
завязи, где и заканчивается развитие эндосперма и зародыша. У видов
Dendrophihora, Ginalloa, Korthalsella, Phoradendron за счет роста микропилярного
конца зародышевого мешка за пределы сосочка, в направлении вершины
завязи, формируется его характерная U-образная форма. У A. minutissimum
и V. album зрелый зародышевый мешок 8-ядерный, 7-клеточный, с 3
эфемерными антиподами. Оплодотворение двойное.
Эндосперм целлюлярный. У V. album первые поперечные деления в
эндосперме образуют ряд из 8—10 клеток, а затем, начиная от микропилярного
конца, его клетки делятся продольными перегородками. Халазальные клетки
эндосперма выполняют у V. album гаусториальные функции. У представитолой
большинства родов первое поперечное деление разделяет эндосперм на 2
неравные клетки; собственно эндосперм обычно развивается из микропиллрпой
6*
Ш
Viscaceae (продолжение)
6 — завязь перед заложением археспориаль-
ной ткани: 6-8 - развитие завязи и
зародышевого мешка; 9 - положение
многоклеточного археспория; W - завязь со
сформированным зародышевым мешком; 11—17 — мега-
спорогенез, развитие и строение зародышевого
мешка;
Viscaceae (продолжение)
18—26 — развитие и строение эндосперма;
жлетки 2-клеточного эндосперма, но у видов ЕиЪгасШоп, Ginalloa, Korthalsella
(Rutishauser, 1937; Bhandari, Indira, 1969) клетки, образующиеся в халазаль-
ной части эндосперма, также участвуют в его построении. Халазальная часть
эндосперма, как правило, выполняет гаусториальную функцию. У A. minutis-
simum и A. oxycedri первое деление в эндосперме отчленяет латеральный
гаусторий (Скробишевский, 1890; Bhandari, Nanda, 1968a), который обычно
остается одноклеточным, но иногда состоит из 2—3 клеток. В дальнейшем микро-
пилярная область развитого эндосперма преобразуется в гаусториальную
ткань, клетки которой выполняют функции суспензора зародыша. Эндоспермы
2 развивающихся зародышевых мешков у V. album могут срастаться в процессе
развития, при этом в плоде развивается один или, реже, оба зародыша. У Dend-
rophthora (York, 1913) отмечено слияние халазальных частей обоих
развивающихся зародышевых мешков; развиваются эндосперм и зародыш лишь одного
из них. В плоде эндосперм обильный, содержит крахмал и жир.
Зигота долго находится в покое, а затем делится обычно поперечной, режо —
наклонной или почти продольной перегородкой у изученных видов Arceutlwblum
и Viscum. У A. minutissimum и Korthalsella (Correa, 1958; Bhandari, Naiidu,
1968a; Raj, 1970) описано закономерное заложение наклонной перегородки
М
ф
27
Viscaceae (продолжение)
27—38 — эмбриогенез; 39 — строение зрелого плода (продольный медианный срез). (1—4*
10, 15, 18—22 39 — ориг.; 5, 26 — по Скробишевскому, 1890; 6—9, 17, 35—38 — no Bhan-
dari, Indira 1969- 11—14 — no Steindl, 1935; 16, 23—25, 27—34 — no Bhandari, Nanda,.
1968).
при делении зиготы. Второе деление всегда происходит перпендикулярно-
первому У видов Arceuthobium суспензор отсутствует, у V. album образуется
слаборазвитый 2-клеточный суспензор. Особый случай представляет
эмбриогенез у Е ambiguum (Bhandari, Indira, 1969): зигота у этого вида делится
поперечно однако все дальнейшее развитие зародыша соответствует таковому
представителей сем. Loranthaceae. Зрелый зародыш в плоде
дифференцированный Радикулярная область его преобразована в гаусториальный орган.
Семядоли хорошо развиты у видов Viseun^ao более или менее рудиментарны у видов
Arceuthobium и Phoradendron. m,
У V album, по нашим данным, — истинная полиэмбриония, но иногда
встречается"'и «ложная» (вследствие слияния эндоспермов одной завязи).
Исследованные виды. Arceuthobium americanum, A. douglasiir.
A minutissimum, A. oxycedri, A. pusillum, Dendrophthora gracilis, D. opuntioides,,.
Eubrachion ambiguum, Ginalloa linearis, Korthalsella dacrydii, K. opuntia,
Phoradendron calijornicum, P. flavescens, P. villosum, Viscum album, V. articulatum.
Литература. Griffith, 1841, 1845; Treub, 1883a; Scrohischewsky,.
1884- Johnson, 1888; Jost, 1888; Скробишевский, 1890; York, 1913; Heinricher,.
1915: Pisek 1923, 1924; Thoday, Johnson, 1930; Dowding, 1931; Billings, 1932„
1933: Rutishauser, 1935, 1937b; Steindl, 1935; Schaeppi, Steindl, 1945; Johri,..
Bhatnagar 1960; Cohen, 1963; Jones, Gordon, 1965; Bhandari, Nanda, 1968a,.
1968b- Bhandari, Indira, 1969; Raj, 1970;Терёхин, 1977; Терёхин (ориг. данные)..
86
Порядок 58. BALANOPHORALES
Семейство CYNOMORIACEAE
Пыльники 4-гнездные; гнезда соединены попарно в 2 латеральные теки.
Развитие стенки гнезда пыльника происходит по центробежному типу.
Сформированная стенка состоит из 4 слоев. Секреторный тапетум представлен одним
Супотоггааеае
1—23 — Cynomorium songaricum.
1—4 — развитие стенки гнезда пыльника (поперечные срезы) и мейоз; 5 — развитию мшфо»
«пор; 6 — зрелые пыльцевые зерна и фрагмент стенки зрелого пыльника; 7—11 — моги-
спорогенез и развитие зародышевого мешка; 12 — зародышевый мешок после оплодотшцш-
ния; 13 — схема строения семяпочки и ее положение в завязи;
Н7
слоем клеток, которые становятся 2-ядерными на стадии профазы мейо:т.
Разрушение среднего слоя происходит во время развития микроспор. Клетки
эндотелия с отчетливыми фиброзными утолщениями. Спорогенная ткань
массивная, деления в ее клетках заканчиваются ко времени завершения
формирования стенки микроспорангия. В период первого деления мейоза вокруг
материнских клеток микроспор заканчивается формирование каллозной оболочки.
Тетрады микроспор тетраэдральные, формируются по симультанному типу.
Деления в пыльцевых зернах происходят синхронно. Зрелые пыльцевые зерна
одиночные, 2-клеточные.
Семяпочка у видов Cynomorium висячая, апотропная, ортотропная, с одним
интегументом, крассинуцеллятная. Единственная археспориальная клетка
преобразуется в мегаспороцит без отделения кроющей клетки. Нуцеллярный
колпачок из 2—3 слоев клеток образуется в результате периклинальных
делений эпидермиса нуцеллуса (Juel, 1903; Терёхин, Яковлев, Никитичева, 1975).
Формирование микропиле завершается на стадии 2-ядерного зародышевого
мешка. Дифференцированный интегументальный тапетум примыкает не к
зародышевому мешку, а к нуцеллусу.
Зародышевый мешок развивается по Polygonum-типу из халазальной
мегаспоры Т-образной тетрады. Полярные ядра сливаются перед оплодотворением.
Обе синергиды эфемерны: одна из них разрушается во время оплодотворения,
другая — вскоре после него. У С. songaricum образуется от 3 до 5 антипод:
крупных густоплазменных клеток, которые сохраняются долго, почти до
созревания семени. Оплодотворение двойное. В оплодотворенной семяпочке клетки
луцеллуса значительно разрастаются, особенно в центральной части.
Характерная особенность Cynomorium — отсутствие деструктивных процессов в ну-
целлусе в период развития зародышевого мешка и первых стадий развития
эндосперма. На более поздней стадии в нуцеллусе происходят одновременно
2 процесса: увеличение размеров клеток и постепенное поглощение его
развивающимся эндоспермом.
Эндосперм целлюлярный. Первое деление центральной клетки поперечное,
второе — продольное или наклонное, протекающее синхронно в обеих
дочерних клетках. Ориентация дальнейших делений вариабельна. Сформированный
эндосперм многоклеточный, почти шаровидной формы. В зрелом семени
оболочки клеток эндосперма имеют мощные вторичные утолщения. Клетки
поверхностного слоя эндосперма заполнены жировыми и белковыми веществами, имеют
равномерные оболочки. Во внутренней части эндосперма оболочки образуют
многочисленные впячивания в полость клеток, которые постепенно возрастают
от периферии эндосперма к его центру.
Перед делением зигота С. songaricum — крупная шаровидная клетка.
Первое ее деление, как правило, поперечное. Плоскости деления дочерних клеток
располагаются перпендикулярно друг к другу и к плоскости деления зиготы;
в результате образуется 4-клеточный проэмбрио с накрест лежащими клетками.
■Затем наблюдается типичная стадия октантов. Иногда зигота делится
продольной перегородкой. Суспензор отсутствует. После образования эмбриодермы
дальнейшей дифференциации зародыша не происходит. Зародыш в зрелом
семени представляет собой линзовидное многоклеточное тело, лишенное основных
органов и расположенное у микропилярного полюса семени. Клетки зародыша
заполнены жировыми и белковыми веществами.
Исследованные виды. Cynomorium coccineum, С. songaricum.
Литература. Weddel, 1858—1861; Juel, 1903; Терёхин, Никитичева,
Яковлев, 1975; Терёхин, Яковлев, Никитичева, 1975.
Семейство BALANOPHORACEAE ,
В пределах семейства в мужских цветках наблюдается переход от алдроцея
из свободных тычинок с 4-гнездными пыльниками (Lophophytum) до апдроцея,
представленного синандрием из сросшихся в единое образование тычинок
(большинство видов Balanophora, Hachettea austro-caledonica, Rhopnlocnemis
89
Balanophoraceae
1, 17, 18 — Lophophytum mirabile, 2 — Langsdorffia hypogea, 3 — Corynaea, 4, 11—13 —
Rhopalocnemis phalloides, 5, 6—10, 22—31 — Balanophora thwaitesii (-B. fungosa), 14—
16, 44 — Helosis cayenensis, 19, 20, 32—34 — Balanophora globosa (=B. fungosa), 21 —B. elon-
gata, 35—39 — B. laxiflora, 40, 41—B. poliandra, 42, 43 — Dactylanthus teylori.
1, 2 — строение пыльников (поперечные срезы); 3—5 — строение синандриев (поперечные-
срезы); 6—10 — строение стенки гнезда пыльника, микроспорогенез и строение пыльцевого
зерна (6 — мейоз 1,7 — мейоз II, 8 — тетрада микроспор, 9 — одноядерные микроспоры,^
10 — зрелое пыльцевое зерно); 11—18 — схемы развития завязи; 19—31 — развитие
семяпочки и зародышевого мешка;- 32—41 — развитие эндосперма и зародыша;
Balanophoraceae (продолжение)
42 — зародышевый мешок после оплодотворения; 43 — конкурентное развитие 2
зародышевых мешков в одной завязи, справа — гелобиальный эндосперм, слева — отставший в своем
развитии зародышевый мешок; 44 — продольный срез зародыша, окруженного эндоспермом,
из зрелого семени. (1, 17, 18 — по Eichler, 1869; 2 — по Fagerlind, 1945b; 3 —по Fagerlind,
1939; 4, 11—13 — по Lotsy, 1901; 5—10, 22—41 — по Терёхину, Яковлеву, 1967; 14—16 —
ло Fagerlind, 1938; 19, 20 — по Lotsy, 1899; 21 — по Fagerlind, 1945а; 42—44 — Терйхин,
ориг.).
phalloides и др.). У Balanophora elongata, Corynaea sphaerica и Langsdorffia
hypogaea в синандрии еще прослеживается сегментация, обозначающая границы
отдельных пыльников. Один синандрии может включать от 16 до 20 (В. fungosa
subsp. indica var. indica) или 20—30 (В. elongata) пыльцевых гнезд (Тербхин,
Яковлев, 1967). Развитие стенки гнезда пыльника у Balanophora центробежное
{Zweifel, 1939; Fagerlind, 1945b). Сформированная стенка представлена
эпидермисом, эндотецием, средним слоем и тапетумом. Секреторный тапетум
состоит из одного слоя одноядерных клеток. У Balanophora и Ditepalanthus в
процессе развития микроспор облитерируются и абсорбируются тапетум, средний
слой и эндотеций (Fagerlind, 1938, 1945b). Тапетум облитерируется позже
и в развивающихся пыльниках синандрия непосредственно примыкает к
эпидермису. По нашим данным, в процессе созревания синандриев у Balanophora
dioica, В. fungosa subsp. indica var. globosa (==B. globosa) и H. austro-caledonica
стенки пыльников разрушаются и функцию освобождения пыльцы принимают
на себя структуры околоцветника мужских цветков. У представителей родов
Lophophytum, Lathrophytum и Ombrophytum, имеющих в мужских цветках
отдельные тычинки, вскрывание пыльников происходит обычным для
покрытосеменных способом: перед созреванием оба гнезда каждой теки пыльника
сливаются й тека вскрывается общей продольной щелью. Наружная стенка зрелого
пыльника состоит у этих растений из эпидермиса и эндотеция, с типичными
•фиброзными утолщениями. Образование микроспор у Balanophora abbreviata
ж В. fungosa subsp. indica var. indica (=B. thwaitesii) происходит по
симультанному типу (Zweifel, 1939; Тербхин, Яковлев, 1967). Тетрады микроспор
тетраэдральные. Зрелые пыльцевые зерна одиночные, 2-клеточные у Balanophora
и 3-клеточные у Rhopalocnemis.
У Lophophytum mirabile и близких ему таксонов, а также у R. phalloides
зародышевые мешки развиваются в выростах свободной центральной плаценты,
•представляющих собой рудименты нуцеллусов. В женских цветках Н. сауеп-
Jtensis и S. sanguinea и у ряда других представителей семейства одшшчи ш)
-археспориальные клетки образуются непосредственно в гиподерме
литоральных участков свободной центральной плаценты («колонки»). При этом у //. сац-
HI
ennensis образуются 2, супротивно расположенные, а у 5. sanguinea — 3 архе-
спориальные клетки (Marloth, 1913; Fagerlind, 1938). Биспоричеекий
зародышевый мешок развивается у Helosis и Ditepalanthus afzelii довольно своеобразно:
распределение ядер происходит в нем таким образом, что формируются 3
полярных ядра (Fagerlind, 1938, 1939). Яйцевой аппарат имеет обычное строение;'
антиподальная клетка одна, 2-ядерная. В литературе имеются требующие
подтверждения сведения (Chodat, Bernard, 1900; Lotsy, 1901) о тетраспоричес-
ких зародышевых мешках у Helosis и Rhopalocnemis.
У Dactylanthus teylori полость, разделяющая плаценту и стенку, в завязи:
отсутствует и лишь на ранних стадиях развития в плаценте различим эпидер-
мальный слой. У видов Balanophora завязи лишены даже рудиментов плаценты.
Развитие крайне редуцированной завязи происходит сходно с развитием нуцел-
луса семяпочек автотрофных растений. Верхняя субэпидермальная клетка
зачатка завязи преобразуется в археспорий, функционирующий в качестве'
мегаспороцита, без отделения кроющей клетки. Эпидермальные клетки на
вершине завязи энергично делятся и разрастаются, формируя столбик с
морфологически недифференцированным рыльцем. Утверждение Трейба (Treub,.
1898) о том, что «пыльцеприемник» у Balanophora происходит из кроющей клетки;
первичного археспория, в дальнейших исследованиях не было подтверждено.
В результате мейоза у В. fungosa subsp. indica var. indica) образуется тетрада
мегаспор своеобразной формы: обе клетки диады делятся наклонными
перегородками (Терёхин, Яковлев, 1967). В зародышевый мешок развивается одна
из верхних по отношению к основанию завязи мегаспор. Ранние сообщения
(Treub, 1898; Lotsy, 1899) о тетраспорическом развитии зародышевого мешка
Balanophora позднее не подтвердились. По мнению Кувады (Kuwada, 1928),
у В. japonica зародышевый мешок развивается из клетки диады. Однако у В.
abbreviata и В. fungosa subsp. indica var. indica (=B. indica) (Zweifel, 1939),.
а также у В. fungosa subsp. indica var. globosa (=B. globosa и В. elongata)
(Fagerlind, 1945a) также обнаружено моноспорическое развитие зародышевого мешка.
Развитие зародышевого мешка у видов Balanophora происходит
оригинальным образом. Вскоре после первого деления и образования
центральной вакуоли в зародышевом мешке около дегенерирующих мегаспор
образуется латеральный вырост. Этот вырост, включающий одно из 2 ядер
зародышевого мешка, разрастается вдоль боковой стенки ранее образовавшейся
части зародышевого мешка. Затем в терминальном конце выроста зародышевого-
мешка образуется яйцевой аппарат. Деление ядер на другом полюсе
зародышевого мешка происходит асинхронно и без цитокинеза. Все 3 антиподальных ядра
часто сливаются. По мере созревания зародышевый мешок приобретает овальную'
форму. Сходным образом развивается зародышевый мешок у D. teylori (наши
данные) и L. hypogaea (Fagerlind, 1945b), с тем, однако, различием, что у
последнего вида вырост образуется в середине боковой стенки зародышевого мешка.
Кажущаяся инверсия полярности в формировании зародышевого мешка этих
растений — результат их оригинального развития, весьма сходного с развитием
некоторых представителей пор. Santalales, у ■ которых зародышевый мешок
вырастает из плацентарной ткани в направлении столбика.
Целлюлярный эндосперм с большим халазальным гаусторием,
образующимся при первом делении центральной клетки, описан у всех изученных
представителей семейства: Balanophora, Dactylanthus, Hachettea, Langsdorffia,
Helosis, Thonningia и Rhopalocnemis. По данным ряда авторов (Lotsy, 1899; Ernst,
1914; Ekambaram, Panje, 1935; Zweifel, 1939), в образовании эндосперма у
Balanophora участвует только верхнее полярное ядро. Эти сведения не были
нами подтверждены при изучении развития В. fungosa subsp. indica var. indica
(=B. thwaitesii), у которой в образовании эндосперма участвуют оба полярных
ядра (Терёхин, Яковлев, 1967). После отделения халазального гаустория ми-
кропилярная клетка («камера») эндосперма дважды делится продольными
взаимно перпендикулярными перегородками. Затем следуют несколько
поперечных и различно ориентированных делений в каждой из клеток «квадрантов»
и их производных. На этом развитие эндосперма Balanophora заканчивается.
Фагерлинд (Fagerlind, 1945b) описал сходное развитие эндосперма у L.
hypogaea и отнес его к гелобиальному типу. Однако, на наш взгляд, развитие эндо-
92
сперма у Balanophora и Langsdorffia вполне соответствует целлюлярному типу
с ранней дифференциацией халазального гаустория.
По мнению некоторых исследователей (Hofmeister, 1858; Ernst, 1914),
зигота у Balanophora делятся поперечно. Согласно другим данным (Ekambaram,.
Panje, 1935; Zweifel, 1939; Fagerlind, 1945b), зигота у Balanophora и Langsdorffia
делится продольной перегородкой. По нашим данным (Терёхин, Яковлев, 1967;
Терёхин, 1977), ориентация деления зиготы у В. fungosa subsp. indica var.
indica не фиксируется. Плоскость второго деления располагается всегда
перпендикулярно плоскости первого. В третьей клеточной генерации деления
в каждой из 4 производных клеток происходят периклинально, формируя
эмбриодерму. На этом развитие зародыша у В.. fungosa subsp. indica var. indica
заканчивается. У В. abbreviata каждая из клеток эмбриодермы еще раз делится
антиклинально (Shivamurthy, Arekal, Swamy, 1981). Таким образом, развитие
зародыша Balanophora не укладывается в существующие классификации типов
эмбриогенеза покрытосеменных.
Исследованные роды и виды. Balanophora abbreviata, В. dio-
ica, В. elongata, В- fungosa subsp. indica var. globosa (=5. globosa), B. fungosa
subsp. indica var. indica (—B.indica, =B. thwaitesii), B. japonica, B. laxiflora,
B. polyandra, Corynaea sphaerica, Dactylanthus teylori, Ditepalanthus afzelii,
Hachettea austro-caledonica, Helosis cayennensis, Langsdorffia hypogaea, LatrophytumY
Lophophytum mirabile, Ombrophytum, Rhopalocnemis phalloides, Sarcophyte
sanguinea, Thonningia.
Литература. Hooker, 1855, Hofmeister, 1858; Eichler, 1869; Engler,
1894; Lecomte, 1896; Tieghem van, 1896; Treub, 1898; Lotsy, 1899,1901; Chodat,
Bernard, 1900; Marloth, 1913; Ernst, 1914; Kuwada, 1928; Goebel, 1933;
Ekambaram, Panje, 1935; Fagerlind, 1938a, 1939, 1945a, 1945b; Zweifel, 1939;
Терёхин, Яковлев, 1967; Терёхин, 1977; Shivamurthy, Arekal, Swamy, 1981-
Терёхин (ориг. данные).
Порядок 59. RHAMNALES
Семейство RHAMNACEAE
Пыльники 4-гнездные. Стенка гнезда пыльника развивается центробежно
и состоит из эпидермиса, эндотеция, 2—3 средних слоев и тапетума. Эпидермис
слабокутинизированный. Число средних слоев варьирует: у Scutia myrtina —
3, у Rhamnus alaternus и Zizyphus — 2. В процессе мейоза средние слои сильно
уплощаются и начинают дегенерировать. Тапетум секреторного типа, его клетки
вначале одноядерные, в ходе мейоза они становятся 2—4- (у R. alaternus 3—6)-
ядерными. Имеются орбикулы. Начало деструкции тапетума отмечается на
стадии распада тетрад микроспор. По нашим данным, стенка зрелого пыльника
у Paliurus spina christi представлена сильно уплощенным эпидермисом и эндо-
тецием с фиброзными утолщениями. Тетрады микроспор тетраэдральные,
реже — изобилатеральные и крестообразные, образуются симультанно (Srini-
vasachar, 1940; ориг.). Зрелые пыльцевые зерна 2-клеточные.
Семяпочка анатропная, крассинуцеллятная, с 2 интегументами. Микропиле
образовано наружным интегументом или только внутренним. Наружный
интегумент 4-слойный, в области микропиле — 6-слойный. Внутренний
интегумент 3-слойный. Наружный эпидермис наружного интегумента и внутренний
эпидермис внутреннего интегумента у Zizyphus имеют кутикулу. После
оплодотворения в клетках внутреннего интегумента накапливаются жиры (Srini-
vasachar, 1940). В семяпочке дифференцируется проводящий пучок, который
у всех исследованных видов, за исключением Berchemia polyphylla. достигает
халазальной части семяпочки и следует в наружный интегумент. У Zizyphus.
и Colletia формируется нуцеллярная клювообразная структура, выступающая
из микропиле и образующаяся путем деления париетальных клеток и клеток
эпидермиса нуцеллуса. Имеется 5—7-слойный нуцеллярный колпачок. После
оплодотворения нуцеллус преобразуется в перисперм. В семяпочке Zizyphus
и Govenia имеется гипостаза, Z. glabrata и R. wightii — эпистаза (Агога, 1953).
Археспорий обычно многоклеточный, однако у S. myrtina, Z. cenoplia и P. spina
christi встречается одноклеточный. Каждая археспориальная клетка делится
с образованием париетальной и спорогенной клеток. В результате образуются
несколько мегаспороцитов. У Z. rotundifolia обычно развивается только один
мегаспороцит, остальные дегенерируют.
Зародышевый мешок у Colletia, Rhamnus, Paliurus и Govenia развивается
по Polygonum-типу. У видов Pomaderris, у Z. mauritiana, Z. cenoplia, Z. sativa
и Z. nummularia отмечено образование биспорических зародышевых мешков
Allium-типа (Chiarugi, 1930; Kajale, 1944; Arora, 1953; Harvey, Braggins, 1985).
Зрелый зародышевый мешок удлиненной формы, состоит из яйцевого аппарата,
центральной клетки с 2 полярными ядрами и 3 антипод. Яйцеклетка длиннее
синергид, имеет ядро, расположенное в апикальной части, и вакуоль — в ба-
зальной. В синергидах Z. sativa, Z. jujuba, Z. cenoplia и Р. spina christi
дифференцируется нитчатый аппарат. У S. myrtina он не выражен. Полярные ядра
сливаются после оплодотворения. Антиподы у P. spina christi крупные, сильно ва-
куолизированные (ориг. данные), у Z. sativa и Z. mauritiana антиподы имеют
по 2—4 ядра (Chiarugi,. 1930; Srinivasachar, 1940). Антиподы дегенерируют
вскоре после оплодотворения. В развитии зародышевых мешков Z. jujuba
часто наблюдаются различные аномалии (Эрккенова, 1973). Встречается
нарушение полярности зародышевых мешков — 4 или 8 ядер расположены
в центре зародышевого мешка или в его халазальной части. Отмечены случаи
дифференциации 2 яйцеклеток и одной синергиды. У Z. mauritiana, Z. jujuba,
Z. nummularia, Colletia ferrox и Noltea africana обнаружены многочисленные
дополнительные зародышевые мешки (Nair, 1970a). Оплодотворение порогамное.
У Z. rotundifolia тройное слияние предшествует сингамии; одна из синергид
в процессе оплодотворения разрушается. Пыльцевая трубка сохраняется в
зародышевом мешке до стадии глобулярного зародыша (Агога, 1953).
94
Эндосперм нуклеарный. Первичное ядро эндосперма делится раньше
зиготы. Клеточные перегородки в эндосперме закладываются (у Z. rotundifolia
на стадии 16 ядер) в направлении от микропилярного к халазальному концу
зародышевого мешка. У R. wightii, Z. jujuba и S. myrtina эндосперм в
халазальной части остается в свободноядерном состоянии, выполняя гаусториаль-
ную функцию. У R. wightii ядра при этом сливаются в одно или несколько
полиплоидных ядер неправильной формы (Nair, 1970а). У Z. glabrata и G. micro-
сагра эндосперм очень небольшого размера.
Развитие зародыша у Rhamnus и Ceanothus протекает по Asterad-типу,
у Zizyphus — по Solanad-типу. У С. azureus первая клеточная перегородка
95
Rhamnaceae (продолжение)
-9—30 — мегаспорогенез и развитие зародышевого мешка: 9—26 — по Polygonum-типу
(14 — многоклеточный археспорий, 22 — две 2-ядерные антиподы, 23, 25 —
дополнительные зародышевые мешки, 26 — 8-ядерный зародышевый мешок с нарушенной полярностью),
27—30 — по Allium-типу; 31 — процесс оплодотворения;
в зиготе закладывается поперечно (иногда наклонно). Базальная клетка
зародыша делится поперечно, а апикальная —■ продольно (иногда наклонно),
с образованием Т-образной тетрады клеток (Soueges, 1939, 1941). В результате
деления апикальных клеток тетрады формируются 4 клетки квадранта,
расположенные в виде тетраэдра. Верхняя из них образует эпифизис, 3 других —-
семядоли и зачаток стебля. Производные клетки т составляют часть гипо-
котиля. Производные клетки ci тетрады образуют слаборазвитый суспензор
и гипофизис, дающий начало коре корня и корневому чехлику. У Z. nummularia
клетки са и сЪ делятся поперечно, образуя линейную тетраду клеток зародыша
(Авога, 1953). Зрелый зародыш прямой или согнутый, имеет массивные
семядоли, почечку, гипокотиль и зародышевый корень. Хлороэмбриофиты.
•96
Rhamnaceae (продолжение)
32—47—развитие зародыша (39 — формирование 2 зародышей). (1—12— ориг.; 13—
22, 31, 41—47 — по Srinivasachar, 1940; 23 — по Nair, 1970a; 24—26 — по Эрккеновой,.
1973; 27—30, 32—40 — по Агога, 1953).
У Z. nummularia обнаружена апогаметия — дополнительные зародыши
развиваются из синергид (Агога, 1953). У Pomaderris phylicaefolia var. polifolia
возможен факультативный апомиксис (Harvey, Braggins, 1985).
Исследованные виды. Berchemia polyphylla, Ceanothus azureus,
Colletia ferox, C. spinosissima, Gouania tiliaefolia, Govenia microcarpa, Helinus
lanceolatus, Noltea africana, Paliurus spina christi, Pomaderris hamiltonii, P. ku-
meraho, P. phylicaefolia var. cricifolia, Rhamnus alaternus, R. cathartica, R. fran-
gula, R. wightii, Scutia myrtina, Ventilago bombaiensis, V. calyculata, Zizyphus
cenoplia, Z. glabrata, Z. jujuba, Z. mauritiana, Z. nummularia, Z. rotundifolia,.
Z. sativa.
Литература. Lindau, 1891, 1928; Chiarugi, 1927, 1930; Juel, 1929;.
Schnarf, 1931; Soueges, 1939, 1941; Srinivasachar, 1940; Dolcher, 1941, 1947;
Kajale, 1944a, 1944b; Martin, 1946; Arora, 1953; Шваварава, 1959; Davis, 1966;
Nair, 1970a; Эрккенова, 1970, 1971a, 1971b, 1972a, 1972b, 1973a, 1973b; Laguna,.
Cocucci, 1971; Поддубная-Арнольди, 1982; Harvey, Braggins, 1985; Батыгина,
Колесова, Драгунова (ориг. данные).
Семейство VITACEAE
Пыльники 4-гнездные, но иногда 2-гнездные (Vitis himalayana, V. latifolia).
Развитие стенки гнезда пыльника происходит но основному типу.
Сформированная стенка состоит из эпидермиса, эндотеция, 2 средних слоев и тапетума.
В эндотеции образуются фиброзные утолщения. Средние слои эфемерны. Тапе-
тум клеточный секреторный; число ядер в клетках тапетума может варьировать
от 4 до 8, они могут сливаться, образуя полиплоидные ядра. Исключением
является V. trifolia, у которого клетки тапетума 2-ядерные и в постмейотический-
период происходит их реорганизация в ложный периплазмодий (Adatia et al.,
1950). Образование тетрад микроспор осуществляется по симультанному типу.
98
Тетрады микроспор тетраэдральные, реже — изобилатеральные и
крестообразные. Зрелые пыльцевые зерна 3-клеточные, реже — 2-клеточные (Cyphostemma
setosum).
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Наружный
интегумент 4—9-слойный, внутренний 2—3-слойный, в области микропиле
3—4-слойный. Микропиле образовано только внутренним интегументом. У
Cissus trilobata внутренний интегумент сильно вырастает в длину, превышает
пуцеллус в 2—3 раза и образует скрученную тубулярную структуру (Nair,
1965). Клетки наружного эпидермиса наружного интегумента и внутреннего
эпидермиса внутреннего интегумента у Cissus заполнены коричневым
содержимым, вероятно танином, что не наблюдается в семяпочках Cyphostemma. У
отдельных видов отмечен обтуратор. У V. trifolia клетки основания завязи
удлиняются, огибают микропиле или входят в него, в то время как у V. latifolia
эти клетки почти сливаются с фуникулусом (Kashayp, 1958). У Cissus
quadrangularis в обтуратор разрастается плацентарная ткань (Yoyal, 1959).
Образуется нуцеллярный колпачок, состоящий из 2—4 слоев клеток; у Vitis pedata
он отсутствует. Гипостаза хорошо развита и выделяется толстостенными
клетками. Проводящий пучок семяпочки по фуникулусу и наружному интегументу
доходит до халазы. Археспорий одноклеточный, иногда 2-клеточный.
Археспорий делится, образуя париетальную и спорогенную клетки. Из
париетальной клетки образуются 4—7 слоев париетальной ткани. Спорогенная клетка
дифференцируется в мегаспороцит. У V. pallida были отмечены семяпочки
с 2 мегаспороцитами (Nair, Parasuraman, 1962). Тетрады мегаспор линейные
или Т-образные. В одной семяпочке V. latifolia наблюдались 2 тетрады,
лежащие одна над другой, причем нижняя тетрада — Т-образная, а верхняя —
линейная. Ядро нижней мегаспоры верхней тетрады делится, образуя 2-ядер-
ный зародышевый мешок (Nair, Suri, 1957). Как правило, функционирующей
становится халазальная мегаспора. YV. latifolia были описаны 2
функционирующие мегаспоры, лежащие рядом или одна над другой.
Зародышевый мешок моноспорический, развивается по Polygonum-типу,
8-ядерный, 7-клеточный. Яйцевой аппарат представлен центрально
расположенной яйцеклеткой и 2 синергидами с крючкообразными выростами. У V.
latifolia и С. setosum синергиды крупнее яйцеклетки. Полярные ядра сближаются
в центре зародышевого мешка и перемещаются к яйцевому аппарату, где до
оплодотворения сливаются, образуя ядро центральной клетки. 3 антиподы
располагаются Т-образно или линейно в халазальной части зародышевого мешка.
Они чаще эфемерны и дегенерируют перед слиянием полярных ядер, реже —
сохраняются после оплодотворения. У V. trifolia спорадически антиподы имеют
строение, сходное с элементами яйцевого аппарата (Kashyap, 1958). У Cissus
pallida, С. quadrangularis и С. vitiginea наблюдается выход микропилярного
конца зародышевого мешка из семяпочки. У С. pallida в семяпочке описаны
2 зрелых зародышевых мешка, апикальные концы которых выступали из нее;
нторой зародышевый мешок образован, вероятно, в результате делений второй
мегаспоры тетрады. Для представителей семейства характерна порогамия.
Пыльцевая трубка через микропиле входит в зародышевый мешок, разрушая
одну из синергид, вторая синергида немедлено дегенерирует. У Cissus, где
зародышевые мешки выступают из семяпочек, пыльцевые трубки непосредственно
из плаценты врастают в зародышевые мешки. Признаки двойного
оплодотворения обнаруживаются, как правило, спустя 24—72 ч после опыления. Тип
оплодотворения премитотический. Часто наблюдается псевдогамия, иногда
одинарное оплодотворение (Самвелян, 1973).
Эндосперм формируется по нуклеарному типу, хотя отдельные авторы (Pratt,
1961) указывают на возможность образования эндосперма по гелобиальному
типу. Первичное ядро эндосперма перемещается в центр зародышевого мешка,
где сразу же приступает к делению. Первые деления в эндосперме синхронные.
'\ [а начальных этапах развития семени эндосперм малоактивен и занимает no-
большую часть апикальной области семени. Большая часть семени на этой
стадии занята нуцеллусом, который становится руминированным из-за внедрении
лыростов семенной кожуры. Когда семя приближается к зрелости, зндоошфм
становится клеточным, быстро растет, замещая нуцеллус, и также румиии-
7* 90
руется. Эндосперм руминирован по Аппопа-типу (Periasamy, 1962a). В зрелом
семени клетки эндосперма толстостенные и содержат жиры, алейроновые зерна
и друзы оксалата кальция.
Зародыш развивается по Geum-вариации Asterad-типа. Зигота приступает
к делению, когда в эндосперме уже образовалось 16—20 ядер. Она делится
поперечно. Производные апикальной клетки 2-клеточного проэмбрио
развиваются в дальнейшем в апекс побега, семядоли и часть гипокотиля, а
производные базальной клетки образуют корневой чехлик, корневой апекс и верхнюю
часть гипокотиля. Зрелый зародыш очень мал по сравнению с размером семени.
Лейкоэмбриофиты.
Партенокарпическое развитие плодов — частое явление; семена таких
плодов лишены зародыша и эндосперма, но имеют нормально развитые семекные
покровы.
Исследованные виды. Ampelocissus latifolia, A. tomentosa, Атре-
lopsis hederacea, Cayratia carnosa, С. pedata, Cissus pallida (=Vitis pallida),
C. quadrangularis, C. trilobata, C. vitiginea, Cyphostemma setosum, Parthenocissus
semicordata, Tetrastigma lancedarium, Vitis amurensis, V. himalayana, V. pedala,
V. rotundifolid, V. silvestris, V. trifolia ( = Cissus trifolia, —Cayratia trifolia),
V. vinifera.
Литература. Pfeffer, 1872; Elfving, 1879; Berlese, 1882; Tischler,
1913; Dorsey, 1914; Sartorius, 1926; Баранов, 1927а, 19276, 1946; Баранов,
Иванова-Паройская, 1927; Баранов, Райкова, 1930; Pearson, 1932;
Лазаревский, 1934; Негруль, 1934; Adatia, Mulay, Hingorani, 1950, 1953; Mulay, Nair,
Sastri, 1953; Nair, Parasuraman, 1954, 1962; Kashyap, 1955, 1959; Nair, Suri,
1957; Soueges, 1957a; Ткаченко, 1958а, 19586, 1959, 1961, 1969; Yoyal, 1959;
Nair, Mani, 1960; Periasamy, 1962a, 1962b; Watanabe, 1963; Nair, 1965, 1970b;
Randhawa, Negi, 1965; Симонян, Самвелян, 1965; Литвак, 1966, 1978, 1980;
NahvBajaj, 1966; Воловцев, 1967; Kim, 1967; Раси-Заде, .1967; Bhore, 1968;
Ramirez, 1968; Tarnavschi, Petrea, 1968a, 1968b; Литвак, Якимов, 1971; Лудни-
кова, 1971; Negi, Olmo, 1971; Pratt, 1971; Харитонашвили, 1971а, 19716, 1981;
Petria, 1972, 1973; Самвелян, 1973; Якимов, Журавель, Малтабар, 1973; Ха-
чатрян, 1975; Якимов, Литвак, Балан, Малтабар, 1977, Новикова, 1978;
Харитонашвили, Микаберидзе, 1978; Carraro, Lombardo, Cargnello, Gerola, 1979,
1981; Смирнов, Перепелица, 1979; Bouquet, 1980; Смирнова, 1984.
Семейство LEEACEAE
Пыльник 4-гнездный. Перед вскрытием гнезда в обеих теках сливаются
вследствие разрушения перегородки между ними. Сформированная стенка
\ гнезда пыльника состоит из эпидермиса, эндотеция, 2 средних слоев и тапетума.
Эндотеций имеет фиброзные утолщения, которые формируются и в отдельных,
клетках со стороны связника. Средние слои эфемерны. Тапетум секреторного
типа, однослойный. В процессе развития его клетки становятся многоядерными,
некоторые ядра сливаются, образуя большое полиплоидное реституционное
ядро. Первые признаки деструкции в тапетуме отмечаются во время форми-
Vitaceae
1,2,7 — Cyphostemma setosum, 3—6, 8, 17, 18 — Vitis latifolia, 9—16 — V. vinifera, 19—26 —■
Ampelopsis hederacea, 27, 28 — Cissus.
1 — стенка пыльника и микроепороциты; 2 — стенка зрелого пыльника; 3—6 — микро-
спорогенез; 7 — 2-клеточное пыльцевое зерно; 8 — 3-клеточное пыльцевое зерно; 9 —
семяпочка на стадии мегаспороцита; 10 — мегаспороцит; 11 — диада; 12 — тетрада мегаспор;
13—15 — стадии развития зародышевого мешка; 16 — 7-клеточный зародышевый мешок;
17 — эндосперм в зародышевом мешке, клеточный в халазальной части; 18 — мшеропиляр-
ная часть зародышевого мешка, зародыш и клеточный эндосперм; 19—26 — эмбриогенез;
27, 28 — схема продольного и поперечного среза зрелого семени с руминироиапным
эндоспермом. (1, 2,7 — ио Nair, Bajaj, 1966; 3—6, 8, 17, 18 — по Kashyap, 1958; 9—16 — по
Баранову, 1946; 19—26 — по Soueges, 1957; 27, 28 — по Periasamy, 1962).
101
рования тетрад микроспор; полный лизис его наступает к моменту образования
пыльцевых зерен. Стенка зрелого пыльника состоит из эндотеция и эпидермиса,
который в основном разрушается. Тип образования микроспор симультанный,
клеткообразование осуществляется посредством борозд, образующихся центри-
петально. Тетрады микроспор тетраэдральные, судя по рисункам, в каллозных
оболочках. В результате деления ядра микроспоры образуются маленькая
генеративная клетка и большая вегетативная. В процессе развития пыльцевого
'зерна у Leea sambucina отмечено перемещение генеративной клетки и ядра
вегетативной. Зрелые пыльцевые зерна 3-клеточные.
Семяпочка, анатропная, с 2 интегументами, крассинуцеллятная. Микропиле
образовано обоими интегументами. У L. sambucina в микропилярной части
внутренний интегумент 3-слойный, в халазальной — 2-слойный. Наружный
интегумент — 4—5-слойный. В клетках наружного эпидермиса наружного
интегумента и внутреннего эпидермиса внутреннего интегумента обнаружено
таниноподобное вещество. Гипостаза представлена несколькими клетками,
оболочки которых утолщены. Имеется обтуратор. Фуникулярный сосудистый
пучок заканчивается в халазе. Археспорий одноклеточный. Археспориальная
клетка делится периклинально, образуя первичную париетальную и спороген-
ную клетки, в дальнейшем развивается париетальная ткань, состоящая из
нескольких слоев. Клетки эпидермиса также претерпевают деления, образуя
нуцеллярный колпачок. На стадии зрелого зародышевого мешка над ним
имеются 8—9 слоев ткани двойственного происхождения, образовавшейся за счет
деления эпидермиса нуцеллуса и париетальной клетки. Тетрада мегаспор
линейная.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
В удлиненном, несколько расширенном в микропилярной части зрелом
зародышевом мешке яйцевой аппарат представлен 2 синергидами и яйцеклеткой,
которые по своей форме очень сходны. Синергиды крючковидные, в апикальной
102
Leeaceae (продолжение)
8—20 — мегаспорогенез и развитие зародышевого мешка; 21 — продольный срои осмоли,
видны выросты интегумента внутрь нуцеллуса; 22 — клетки эндосперма с звсздообрппимми
кристаллами. (1—18 — по Nair, Nambisan, 1957; 19—22 — по Nair, 1970b).
их части имеется вакуоль. Полярные ядра обычно сливаются перед
оплодотворением в халазальной области зародышевого мешка. Антиподы эфемерны,
дегенерируют до оплодотворения. Был отмечен случай образования двуядерных
антипод. Порогамия.
Эндосперм развивается по нуклеарному типу. Особенностью его развития
является различие темпов на разных стадиях формирования. В зрелом семени
эндосперм руминированный. В клетках эндосперма имеются жиры и
звездообразные кристаллы неизвестного происхождения.
Эмбриогенез Asterad-типа. Двусемядольный зародыш в зрелых семенах
очень маленький по сравнению с общим размером всего семени.
Исследованные виды. Leea edgeworthii, L. indica, L. robusta,
L. sambucina.
Литература. Nair, Nambisan, 1957; Periasamy, 1962; Nair, 1967,
1968, 1970b.
Порядок 60. ELAEAGNALES
Семейство ELAEAGNACEAE
Пыльник 4-гнездный, вскрывается продольной щелью; гнезда в теках перед
вскрытием объединяются в результате разрушения перегородки между ними.
По нашим данным, у видов Elaeagnus, Shepherdia canadensis и Hippophae rham-
noides стенка гнезда пыльника формируется центробежно и состоит из
эпидермиса, эндотеция, 1—2 средних слоев и тапетума. Дополнительные перикли-
нальные деления в отдельных клетках могут наблюдаться во всех слоях. Тапе-
тум секреторный, морфологически однородный. У Elaeagnus и Shepherdia
во время профазы мейоза в микроспороцитах ядра в клетках тапетума делятся,
2-ядерные клетки наблюдаются на протяжении мейотического периода
развития пыльника. Затем ядра сливаются и на стадии вакуолизированных
микроспор в клетках тапетума присутствуют крупные, с несколькими ядрышками
полиплоидные ядра. С этой же стадии на поверхности клеток тапетума
различимы орбикулы. У Н. rhamnoides тапетум 2—4-ядерный, к концу мейоза клетки
его сильно увеличиваются в размерах, содержат плотную цитоплазму. Затем
появляются крупные вакуоли, а на поверхности клеток — орбикулы. У
Shepherdia лизис тапетума происходит медленнее, чем у остальных родов семейства.
В зрелом пыльнике тапетум не сохраняется, как и средние слои, дегенерация
которых начинается во время мейоза. Клетки эндотеция у видов Elaeagnus
во время мейоза разрастаются, их оболочки становятся утолщенными, в клетках
накапливаются танины, что у Е. umbellata наблюдается уже со стадии микро-
спороцитов, а у остальных видов ■— после мейоза. На стадии 2-клеточных
пыльцевых зерен в отдельных клетках эндотеция присутствуют кристаллы оксалата
кальция, в стенках появляются фиброзные пояски. У Sh. canadensis^ Н. rhamno-
ides клетки эндотеция увеличиваются значительно позже: у Hippophae на стадии
2-клеточных пыльцевых зерен, у Shepherdia во время или после деления
генеративной клетки, тогда же соответственно появляются фиброзные утолщения.
Эпидермис покрыт тонким слоем кутикулы; к созреванию пыльника почти
полностью разрушается. Стенка зрелого пыльника состоит из сжатых остатков
оболочек эпидермиса и фиброзного эндотеция, клетки которого у видов
Elaeagnus в отличие от Hippophae и Shepherdia заполнены дубильными веществами.
Спорогенная ткань 2—4-слойная, с прекращением митозов клетки ее
увеличиваются, превращаясь в микроспороциты, в оболочках которых откладывается
каллоза. Микроспорогенез без нарушений, тетрады микроспор образуются
по симультанному типу, в основном они тетраэдральные, изредка встречаются
изобилатеральные, крестообразные и линейные. Зрелые пыльцевые зерна
у Н. rhamnoides 2-клеточные, у видов Elaeagnus и Shepherdia — 3-клеточные,
с 2 овально-удлиненными спермиями, цитоплазма которых хорошо различима,
и лопастным ядром вегетативной клетки. Цитоплазма пыльцевых зерен у
Elaeagnus заполнена крахмалом и липидами, у Shepherdia и Hippophae — липидами
и белком.
Семяпочка базально прикрепленная на коротком и широком фуникулусе,
анатропная, с 2 интегументами, крассинуцеллятная. Наружный интегумент
состоит из 5—7, у Elaeagnus до 11 слоев клеток, внутренний — из 3—6 слоев.
Клетки эпидермиса наружного интегумента разрастаются, покрыты кутикулой.
Микропиле зигзагообразное, образуется обоими интегументами; экзостом
и эндостом лежат в разных плоскостях. Гипостаза хорошо развита,
представлена группой клеток с утолщенными оболочками. Широкий проводящий пучок
с сосудистыми элементами из фуникулуса входит в халазу, подходит к
гипостазе и, огибая ее, заканчивается у основания наружного интегумента. У Jil.ua-
agnus вдоль проводящего пучка располагаются клетки, в которых
накапливаются танины. Последние отмечены в гипостазе, в отдельных клетках
наружного интегумента и во внутреннем эпидермисе внутреннего интегумонти,
Имеется массивный фуникулярный обтуратор. Нуцеллус с нуцеллярным кол ничком
(до 6 слоев у Elaeagnus), сохраняющимся продолжительное время, и Г>~ 8 слой-
10!>
<Z—3 — формирование стенки пыльника и спорогенной ткани; 4—7 — фрагменты
пыльника: 4 — на стадии тетрад микроспор, 5 — на стадии 1—2-клеточных пыльцевых зерен, 6 —
на стадии 2-клеточных пыльцевых зерен, 7 — зрелого вскрывшегося пыльника; За, 5а, 7а —
схемы пыльников на соответствующих (3, 5, 7) стадиях развития (1—7 — поперечные срезы);
ной париетальной тканью, 8—13-слойной латеральной и многослойной хала-
зальной частями. Последняя у видов Elaeagnus значительно более массивная,
чем у Н. rhamnoides. В нуцеллусе от гипостазы и проводящего пучка семяпочки
дифференцируется прокамбиальный тяж, подходящий к зародышевому мешку.
Археспорий одноклеточный, реже — 2—4-клеточный. Каждая археспориаль-
ная клетка делится периклинально, образуя первичную париетальную и споро-
генную клетки. Мейоз в мегаспороците завершается образованием линейной
106
или Т-образной тетрад мегаспор, иногда образуется триада. Халазальная
мегаспора продолжает функционировать, остальные отмирают. У Н. rhamnoides
отмечались случаи одновременного развития халазальной и эпихалазалытой
мегаспор до 2-ядерной стадии.
Зародышевый мешок моноспорический, развивается по Polygonum-тилу.
Для Elaeagnus характерна утолщенная оболочка в зародышевом мешке,
особенно на ранних стадиях развития. Зрелый зародышевый мешок
овально-удлиненный, с небольшими дифференцированными элементами. Яйцеклетка с
большим ядром и вакуолью над ним, крупнее синергид, в которых цитонлпамп
плотная, вакуоли и ядра небольшие, нитчатый аппарат не выражен. Полярных»
ядра сливаются до оплодотворения, и ядро крупной центральной клетки рис-
107
Шаеадпасеае (продолжение)
Elaeagnaceae (продолжение)
Si — проэмбрио и ядра эндосперма; 35 — схема семяпочки на булавовидной стадии
развития зародыша (36), начало клеткообразования в эндосперме, видны «везикулы»;
37, 38 —халазальный эндоспермальный гаусторий на ядерной и клеточной стадиях;
полагается почти в ее центре в густой цитоплазме, тджи которой пронизывают
всю клетку. В цитоплазме яйцеклетки и центральной клетки содержится
крахмал. 3 антиподы расположены Т-образно, их ядра с 2 ядрышками, цитоплазма
плотная, вакуоли мелкие. Дегенерируют антиподы после оплодотворения.
Оплодотворение порогамное.
Эндосперм нуклеарный. Большое число свободных ядер располагается в
плотной цитоплазме по периферии и концам зародышевого мешка, центральная
часть которого занята вакуолью. Клеткообразованйе в эндосперме у видок
Elaeagnus начинается на булавовидной стадии развития зародыша в
центральной части зародышевого мешка, у Н. rhamnoides — в микропилярной части
на стадии закладки семядолей у зародыша. У видов Elaeagnus отмечен
эндоспермальный халазальный гаусторий, внедряющийся в нуцелляриую ткань
и содержащий ядра разной плоидности и величины. У Е. conferta гаусторий
остается свободноядерным (Sharma, 1966), у Е. argentea (по нашим, данным)
101»
Elaeagnaceae (продолжение)
39—54 — эмбриогенез. (1—38, 51—54 — ориг., 39—50 — по Yamazaki, 1975).
он становится клеточным с сердечковидной или ранней торпедовидной стадии
развития зародыша, но клетки гаустория часто многоядерные. В зрелом семени
эндосперм скудный, сохраняется только около корешка (Hippophae),
несколькими слоями вокруг зародыша (Shepherdia) или совсем отсутствует (Elaeagnus).
Данные по эмбриогенезу противоречивы и требуют уточнения. Так,
эмбриогенез у Н. rhamnoides классифицируется как Solanad-тип (Кондорская 1967);
у Е. conferta — Asterad-тип. (Sharma, 1966), у Е. umbellata — сходный с
таковым у Myrtus communis (Yamazaki, 1975), т. е. близкий к Onagrad-типу Мио-
surus-вариации, где производные клетки са формируют зародыш, а сЪ — мощно
развитый подвесок. Зрелый зародыш прямой, крупный, дифференцированный,
имеет прямой утолщенный гипокотиль и выраженный корневой апекс с
корневым чехликом, 2 большие семядоли с придатками, частично облекающими
гипокотиль, и почечку с 2 примордиями листьев. В семядолях накапливаются
запасные вещества — крахмал, белки и липиды. /Лейкоэмбриофиты.
У Н. rhamnoides отмечены случай многосемядольности и полиэмбрионии
(Елисеев, 1984).
Исследованные виды. Elaeagnus angustifolia, E. argentea,
Е. conferta, E. multiflora, E. songarica, E. umbellata, Hippophae rhamnoides,.
Shepherdia canadensis.
Литература. Servettaz, 1909; Fuchs, 1936; Sharma, 1966; Кондорская,
1967a, 19676, 1973; Rau, Sharma, 1970; Yamazaki, 1975; Елисеев, 1984;
Проскурина, 1986; Камелина, Проскурина, 1987 и ориг. данные.
Порядок 61. PROTEALES
Семейство PROTEAGEAE
Пыльник 4-гнездный. В зрелом пыльнике у ряда видов наблюдается
попарное слияние гнезд. Сформированная стенка гнезда пыльника состоит из
эпидермиса, эндотеция, в котором образуются фиброзные утолщения (у Placospermum
в эндотеции нет фиброзных утолщений), 2—3 эфемерных средних слоев и тапе-
тума. Тапетум секреторного типа, клетки его обычно 2-ядерные, но у некоторых
представителей семейства (Placospermum) встречаются и многоядерные. У Ьо-
matia tinctoria тапетум со стороны связника 2-слойный. Образование микроспор
симультанное. Расположение их в тетрадах тетраэдральное, крестообразное
или изобилатеральное. Зрелые пыльцевые зерна 2-клеточные, содержат
крахмальные зерна.
Семяпочка ортотропная (Placospermum coriaceum и др.), анатропная(бт;/7-
lea vieillardi, G. leucopteris и др.), гемитропная {Grevillea ilicioflia, G: crithmi-
folia) или амфитропная (Накеа saligna, Grevillea banksii), с 2 интегументами,
крассинуцеллятная. В образовании микропиле участвует только внутренний
интегумент. Микропиле обычно прямое, хотя у Grevillea rubiginosa оно слабо
искривлено. У многих представителей семейства наблюдается образование
нуцеллярного колпачка толщиной от 3 д о 8 клеток; у Placospermum и Synaphea
юн отсутствует. У видов Grevillea клетки нуцеллярного колпачка в микропиляр-
ном районе становятся удлиненными и выявляют железистый характер. В
пределах семейства выявлены 2 структурно различающихся вида семяпочек:
II'
Proteaceae (продолжение)
9, 10 — мегаспорогенез; 11 — семяпочка, содержащая зрелый
зародышевый мешок; 12 — микропилярная часть семяпочки,
содержащая оплодотворенный зародышевый мешок, рядом
обтуратор; 13—17 —чэтапы развития зародыша; 18—24 — этапы развития
эндосперма. (5—7 — ориг.; 1—3, 12—17 — по Vencata Rao, 1960;
4, 8, 18, 19 — по Vencata Rao, 1967a; 9—11, 20—22 — по Vencata
Rao, 1963; 23, 24 — Venkata Rao, 1967b).
1) семяпочки, содержащие небольшой зародышевый мешок, окруженный мае,
сивным нуцеллусом (Cenarrhenes, Stirlingia, Protea, Conospermum, Synaphea)
и 2) семяпочки, содержащие удлиненный зародышевый мешок, окруженный
относительно небольшим нуцеллусом (Bellendena, Persoonia, Agastachys). В обоих
видах семяпочек образуется париетальная ткань. У Bellendena, Persoonia и
Agastachys над зародышевым мешком формируется эпистаза из удлиненных
клеток, содержащих крахмал. У Cenarrhenes, Stirlingia, Protea, Conospermum
и $ynaphea в халазальной части семяпочки отмечено наличие гипостазы.
У Persoonia наблюдается плацентный обтуратор. В клетках интегументов
и нуцеллуса у ряда представителей семейства (Grevillea, Protea, Stirlingia)
отмечено наличие крахмала, в клетках интегументов — танина. Археспорий
обычно многоклеточный, но у видов Lomatia и Grevillea, за исключением
G. rosmarinifolia, одноклеточный. Археспориальные клетки отделяют
париетальные; функционирует чаще всего один мегаспороцит, но у Synaphea и некоторых
других представителей их может функционировать несколько. Расположение
мегаспор в тетраде, как правило, линейное или Т-образное, зародышевый
мешок обычно развивается из халазальной-мегаспоры, но у Lomatia polymorpha
отмечено развитие зародышевого мешка из микропилярной мегаспоры.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Синергиды с крючкообразными выростами имеют нитчатый аппарат. Полярные
ядра объединяются после вхождения пыльцевой трубки в зародышевый мешок.
Антиподы небольшие, наблюдаются иногда в неразрушенном состоянии даже
во время ранних этапов развития семени. У видов Lomatia антиподы эфемерны.
У представителей родов Conospermum, Grevillea, Placospermum в зародышевых
мешках обнаружены крахмальные зерна. Оплодотворение порогамное. В ходе
оплодотворения один из спермиев объединяется с ядром яйцеклетки, второй —
со вторичным ядром зародышевого мешка.
Эндосперм нуклеарный. На начальных этапах развития концентрация ядер
эндосперма больше на микропилярном конце, где и начинается формирование
его клеток. У Cenarrhenes nitida отмечено, что эндосперм остается ядерным даже
во время формирования зародыша, я, по-видимому, заложения клеточных
стенок в эндосперме вообще не происходит. У ряда видов наблюдается образование
перисперма, который, как и эндосперм, абсорбируется развивающимся
зародышем. В халазальной части эндосперма у ряда видов наблюдается развитие
одного или нескольких выростов, проявляющих гаусториальные функции.
Самая высокая гаусториальная активность эндосперма отмечена у видов
Grevillea и Накеа. У Bellendena, Persoonia, Knightia и Orites ткань эндосперма,
не дает выростов и гаусториальная активность ее не выявляется. Установлено,
что крахмальные зерна встречаются в клетках эндосперма у более примитивных
представителей семейства, таких как Bellendena и Protea; у более продвинутых
групп не выявляется никаких видимых запасов органических веществ. У всех
Proteaceae, за исключением Bellendena и Persoonia, весь эндосперм
потребляется развивающимся зародышем, и только у представителей 2 указанных родо»
показано, что семена содержат эндосперм.
Развитие зародыша происходит по Asterad-типу. У видов рода Grevillea
семядоли тонкие, лентовидные, у G. endlicheriana иногда наблюдаются зародыши
с 3 семядолями.
Исследованные виды. Cenarrhenes nitida, Conospermum (15),
Grevillea (16), Knightia excelsa, Lambertia formosa, L. inermis, L. multiflora,
L. uniflora, Lomatia (7), Macadamia integrifolia, M. ternifolia, Orites acicularis,
0. diversifolia, 0. lancifolia, 0. milligani, 0. myrtoides, 0. revoluta, Placospermum
coriaceum, Protea lepidocarpon, Stenocarpus sinuatus, Synaphea acutiloba, S.
favosa, S. polymorpha, S. reticulata.
Литература. Schacht, 1850; Hofmeister, 1858a, 1858b; Tassi, Ш8;
Ballantine, 1909; Messeri, 1927; Hamilton, 1930; Schnarf, 1931; Brough, ИШ;
Kausik\ 1938a, 1938b, 1938c, 1939a, 1940, 1941, 1942; Garside, 1946; Jonlanii,
1946; Haber, 1959, 1966; Venkata Rao C, 1960, 1961, 1962, 1963, 1964, Ш1Й,
1967a, 1967b, 1967c, 1968, 1969; D.avis, 1966; Тахтаджян, 1966; Sedioy, 1IIH1;
По ддубная-Арнольда, 1982.
8 Сравнительная эмбриология
Порядок 62. GENTIANALES
Семейство LOGANIAGEAE
Строоиио пыльника, его развитие и микроспорогенез не исследованы.
Тшютум клеточный секреторный, нерегулярно 2-слойный в стенке гнезда и
2-олойцшй со стороны связника. Перед мейозом клетки тапетума содержат
крупную иакуоль и плотную цитоплазму; во время мейоза они сильно увеличиваются,
становятся 2-ядернъши; на стадии тетрад вакуоль исчезает и цитоплазма
равномерно распределяется по клетке. После этой стадии тапетум снова становится
пакуолизированным и довольно быстро полностью лизируется. Зрелые пыльце-
выо зерна 3-клеточные (Mohrbutter, 1937).
Семяпочка у большинства видов семейства анатропная, с одним интегумен-
том, тенуинуцеллятная, у Polypremum procumbens — амфитропная. Интегу-
ментальный тапетум развивается только у видов рода Polypremum. Археспо-
риальная клетка становится непосредственно мегаспороцитом. Тетрада
мегаспор линейная.
Зародышевый мешок развивается по Polygonum-типу из халазальной
мегаспоры. Зрелый зародышевый мешок P. procumbens вырастает за пределы
семяпочки и не покрыт интегументом. Яйцеклетка и синергиды похожи по форме.
Синергиды Spigelia splendens грушевидные. Полярные ядра сливаются до
оплодотворения. 3 антиподальные клетки дегенерируют вскоре после
оплодотворения.
Эндосперм у Fagraea fragrans, F. lanceolata, F. litoralis, Strychnos laurina,
S. sansibariensis, Spigelia splendens нуклеарный, без гаусториев; у Р.
procumbens эндосперм целлюлярный, с микропилярным и халазальным гаусториями;
Loganiaceae
1—4 —■ Strychnos sansibariensis, 5—12 — Fagraea fragrans, 13—16, 18—-24 — Polypremum
procumbens, 17 — Fagraea lanceolata^ 25 — Spigelia splendens.
1—4 — стадии развития тапетума; 5 — семяпочка с одним интегументом и мегаспороцит;
6,7 — линейная тетрада мегаспор;
114
Loganiaceae (продолжение)
8—10 — 2-, 4- и 8-ядерные зародышевые мешки; 11 — двойное оплодотворение; 12 —
нуклеарный эндосперм; 13 — интегументальный тапетум; 14—17 — целлюлярный эндосперм:
14, 15 — начало развития, 16 — микропилярный и халазальный гаустории, 17 —
отдельная клетка с белком и липидами; 18—23 — эмбриогенез; 24 — зародыш и целлюлярный
эндосперм; 25 — зародыш и руминированный эндосперм. (1—12, 17 — по Mohrbultor, 1111)7;
13—16, 18—24 — по Мооге, 1948; 25 — по Dahlgren, 1922).
К*
в центре анродышоиого мошка клетки крупные, неправильной формы и вакуоли-
зироышныо,, л то иромя как в гаусториях они мелкие и содержат протопласты
•с густым содержимым. В зрелом семени эндосперм сохраняется. У видов рода
Sinffella он руминированный.
.г)мГ)|Ш01'оиоз Onagrad-типа. Первое деление зиготы поперечное. Зародыш
имеет сусионаор. Зрелый зародыш прямой.
Исследованные виды. Fagraea fragrans, F. lanceolata, F. li-
toralls, Gelsemium nitidum (=G. semprevirens), Geniostoma moluccanum, Polypre-
mum procumbens, Spigelia splendens, Strychnos laurina, S. sansibariensis.
Литература. Juel, 1915; Dahlgren, 1922; Dop, 1923; Mohrbutter,
1936; Moore, 1948: Gulati, 1967; Bendre, 1975.
Семейство RUBIACEAE
Пыльники 4-гнездные; пыльцевые гнезда объединены попарно в 2 теки.
У Macrosphyra longistyla внутрь микроспорангиев вдаются плацентоиды —
выросты стерильной ткани связника. Стенка гнезда пыльника развивается
центробежно и у большинства представителей семейства состоит из эпидермиса,
эндотеция, 1—2 средних слоев и тапетума. Реже — стенка пыльника с
несколькими средними слоями (Tricalysia reticulata, M. longistyla и др.). Тапетум
обычно представлен 1—2 слоями. Многослойный тапетум обнаружен у Manet-
tia bicolor, Coffea dewevrei, С. excelsa и Tarenna asiatica со стороны связника и
у М. longistyla в области плацентоида. У большинства мареновых клетки
тапетума одноядерные. У Spermacoce hispida (==Borreria hispida) клетки тапетума
2-ядерные, но в процессе дальнейшего развития тапетума ядра сливаются
в одно. У Вorreria pusilla (=5. stricta) клетки тапетума многоядерные, и в
дальнейшем ядра также сливаются (Shivaramiah, Rajan Sundara, 1979). 2-ядерные
клетки тапетума отмечены у Coffea arabica (Faber, 1912). Для большинства
представителей семейства характерен клеточный секреторный тапетум без
реорганизации. У Asperula humifusa (=Galium humifusum) в большинстве пыльников
происходит реорганизация тапетума в ложный периплазмодий, у Asperula
odorata (=Galium odoratum) — реорганизация в амебоидный тапетум. Иногда
наблюдается реорганизация в ложный периплазмодий у Galium verum. У
мареновых с 4-слойной стенкой пыльника единственный средний слой эфемерен,
у видов с многослойной стенкой 1—3 средних слоя сохраняются до вскрывания
пыльника. У большинства представителей семейства фиброзные слои почти
полностью окружают гнезда: фиброзные утолщения образуются и с внешней
стороны пыльцевого гнезда (в клетках эндотеция и сохранившихся средних
слоев), и со стороны связника (в одном-нескольких слоях), лишь в местах
вскрывания пыльника остаются небольшие участки без фиброзных утолщений.
У Hydrophylax maritima (Ganapathy, 1956, цит. по: Venkateswarlu, Rajeswara
Rao, 1958) фиброзные утолщения в эндотеции отсутствуют. Стенка зрелого
пыльника обычно представлена эпидермисом и эндотецием, реже —
присутствуют средние слои. Спорогенные клетки располагаются в один или несколько
рядов. Тетрады микроспор образуются симультанно и только у М. citrifolia —
сукцессивно; они тетраэдральные, изобилатеральные, крестообразные и
ромбические. Зрелые пыльцевые зерна 2- или 3-клеточные, чаще одиночные, реже —
остаются объединенными в тетрады (М. longistyla и др.). Цитоплазма
пыльцевых зерен заполнена крахмалом и жирами. У Ophiorrhiza mungos (Omana,
Mathew, 1975) при развитии пыльцы ядро вегетативной клетки распадается
на многочисленные частицы неправильной формы, которые выходяг через
поры на поверхность пыльцевого зерна, образуя сфероидальные «почки»,
отпадающие от пыльцы еще до вскрывания пыльников. В результате из пыльника
высеивается одноядерная пыльца.
Семяпочки в гнезде завязи от одной до многочисленных, с одним интегумен-
том, тенуинуцеллятные. Для многих представителей семейства характерно
формирование обтураторов, ариллусов,. строфиолей. Типичными для семей-
•116
Rubiaceae
1, 15, 16, 19 — Mussaenda frondosa, 2,
13 — Tricalysia reticulata, 3, 23 — Bor-
reria hebecarpa, 4, 5 —• Galium boreale, 6,
7, 17, 34 — Octodon setosum, 8, 9, 18, 22,
31 — Phuopsis styldsa, 10 — Cruciata laevi-
pes, 11, 33 — Asperula odorata, 12 —
Asperula humifusa, 14—■ Ixoraradiata, 20, 25—
30 — Macrosphyra longistyla, 24 — Borreria
verticillata, 32 — Fadogia cienkowskii, 35—
46 — Spermacoce tenuior. 1 — участок
формирующегося пыльника; 2 — многослойная
стенка пыльника на стадии епорогенных
клеток; 3 — фрагмент пыльника в начале
мейоза; 4—9 — микроспорогенез;
МиЫасеае (продолжение)
15 — участок стенки пыльника перед векрыванием; 16—18 — 2-й 3-клеточная пыльца;
19, 20 — схемы строения зрелого пыльника;
ства являются анатропная и гемитропная семяпочки, реже — наблюдаются
другие типы (цирцинотропная у Knoxia corymbosa и гипертропная у Fadogia
cienkowskii). Нуцеллус либо типичного симпетального типа, либо одна-не-
сколько его клеток располагаются в виде «подушечки» над археспорием, либо
соматические клетки нуцеллуса редуцированы полностью. Микропиле узкое
и длинное; отсутствует микропиле у видов Houstonia и, очевидно, у Richardia
scabra, если у этого вида нуцеллус действительно Houstonia-типа, как считают
Сундара Райан и соавторы (Sundara Rajan et al., 1975). Археспорий в
семействе варьирует от многоклеточного до одноклеточного. Кроющие клетки
отсутствуют. Интегументальный тапетум не формируется, лишь у Mussaenda fron-
dosa, A. humifusa и Ophiorrhiza harrisiana намечается его образование, а у Ron-
deletia odorata отмечено его наличие. Тетрады мегаспор линейные, реже Т-
или обратно-Т-образные.
Зародышевый мешок у большинства мареновых моноспорический,
развивается по Polygonum-типу. У видов Crucianella и Rubia olivierii зародышевый
мешок тетраспорический, Drusa-типа; у Scyphiphora hydrophyllacea — биспори-
ческий, АИшт-типа. Яйцевой аппарат из 3 клеток; синергиды с крючковидными
выростами либо без них; нитчатый аппарат четко выражен только у A. odorata.
У F. cienkowskii базальные концы синергид сильно вытянуты. Видимо, у
данного вида синергиды выполняют гаусториальную функцию, заменяя сонор-
шенно отсутствующие антиподы. Полярные ядра у большинства мареноных
сливаются до оплодотворения. У Oldenlandia nudicaulis иногда они сливаются
но время оплодотворения. В зародышевом мешке значительной изменчивостью
МП
Oldenlandia - тип
\ /
Chiococca- тип,
\ /
Исходный тип
VaiUantia- тип.
21
21
Rubiaceae (продолжение)
схема эволюции нуцеллуса и археспория семяпочки у мареновых;
по форме, числу и продолжительности существования отличаются антиподы»
У некоторых мареновых (особенно у Rubieae) халазальная антипода очень
крупная, гаусториальная. У Octodon setosum иногда все 3 антиподы ^выполняют
гаусториальную функцию. У Phyllis nobla антиподы сильно вздувшиеся,
многоядерные. У Diodia virginiana (и у Putoria calabrica и др.) формируется
многоклеточный антиподальный комплекс. Иногда антиподы имеют форму,
напоминающую яйцевой аппарат. У F. cienkowskii антиподальные ядра разрушаются
до формирования клеток зародышевого мешка, в результате у этого вида
зрелый зародышевый мешок 4-клеточный (3 клетки яйцевого аппарата и
центральная клетка с диплоидным вторичным ядром). У видов Oldenlandia и многих
других мареновых антиподы небольшие, как правило, эфемерны. Гаусториаль-
ные и крупные антиподы обычно функционируют продолжительное время.
У многих мареновых в зародышевых мешках накапливается крахмал. У С. ага-
Ыса, О. -setosum и у других представителей семейства описаны случаи
формирования 2 или нескольких зародышевых мешков в одной семяпочке. У Asperula
montana (Lloyd, 1902) и Galium lucidum (Fagerlind, 1937) наблюдалось
выпячивание зародышевого мешка из микропиле семяпочки. У некоторых видов
Galium Фагерлинд обнаружил семяпочки, в которых наряду с нормально
расположенными зародышевыми мешками формировались зародышевые мешки
в халазе, фуникулусе, интегументе (по-видимому, апоспорические зародышевые
мешки). Формирование зародышевых мешков в фуникулусе семяпочки наблюдал
и Ллойд у A. montana.
120
Rubiaceae (продолжение)
22 — многоклеточный археспорий с эпидермисом нуцеллуса в виде «крышечки» (Vaillantia-
тип); 23—25 — Bouvardia-тип (23), Oldenlandia-тип (24), Phyllis-тип (25) нуцеллуса и
археспория;
Для большинства представителей семейства характерна порогамия. Апоро-
гамия отмечалась только у Houstonia coerulea. По данным Сундара Райана и
соавторов (Sundara Rajan et al., 1975), у R. scabra иуцеллус Houstonia-типа,
следовательно, микропиле должно отсутствовать, как и у видов Houstonia.
Вместе с тем, согласно этим исследователям, у R. scabra наблюдалась порогамия.
Возможно, в тексте статьи допущена опечатка и вместо термина «апорогамия»
напечатано «порогамия» или тип нуцеллуса обозначен неправильно.
Оплодотворение двойное.
Эндосперм у большинства мареновых нуклеарный. Целлюлярный
эндосперм обнаружен у О. mungos, T. asiatica и, предположительно, у Randia mala-
barica. У Oldenlandia dichotoma эндосперм, как правило, нуклеарный, но иногда
встречается и целлюлярный. Для некоторых представителей семейства
характерен руминированный эндосперм (Т. asiatica и др.)- У большинства мареновых
в зрелом семени сохраняются несколько слоев эндоспермальной ткани.
Зародыш развивается по Solanad-типу. У Coffea canephora эмбриогенез
приближается к Onagrad-типу. Суспензор зародыша чаще однорядный, реже —
многорядный или объемный. У представителей Rubieae клетки базальной части
суспензора формируют многочисленные булавовидные или пузыревидаыо
гаустории, вследствие чего суспензор часто напоминает «виноградную гроздь».
Полиэмбриония обнаружена у некоторых видов Asperula, Galium и Coffea,
Иногда 2 зародыша развиваются у Dentella serpyllifolia.
121
Rubiaceae (продолжение)
26^-31 — мегашорогенез и
развитие зародышевого мешка;
Rubiaceae (продолжение)
32 — 4-клеточный зародышевый мешок (с дегенерирующими ядрами антипод); 33 —
зародышевый мешок с многоклеточным антиподальным комплексом; 34 — эндосперм ни
стадии 2-клеточного проэмбрио; 35—46 — развитие зародыша. (1—34 — ориг. и по
Андроновой, 1972, 1973, 1975, 1977, 1978, 1984; 35—46 — по Ly Thi Ba, 1961).
И с с л о д о в и и и ы е роды и виды. Adina cordifolia, Adina sp.,
Anotis lancifoUa, A. wightiana, Asperula (14), Borreria hebecarpa, B. hispidct
(=Spermacoce hispida), B. pusilla (=B. stricta), B. verticillata, Bouvardia
coccinea, II. humboldti, B. leiantha, Bouvardia sp., Callipeltis cucullaria, Can-
thium sp., Cephalanthus sp., Chiococca sp., Coffea (8), Crucianella (10), Cruciate
laevl/ws (—Galium ctuciata), Dentella repens, D. serpyllifolia, Diodia dasycephala,
D. teres, D. uirginiana, Fadogia cienkowskii, Galium (27), Gardenia sp., Guettarda
speciosa, Hamelia patens, Hoffmannia ghiesbreghtii, H. refulgens, Hoffmannia
sp., Iloustonia coccinea, H. coerulea, H. longifoUa, Houstonia sp., Hydrophylax
maritima, Ixora (6), Knoxia corymbosa, Leptodermis lanceolata, Leptodermis sp.,
Macrosphyra longistyla, Manettia bicolor, M. inflata, Manettia sp., Mericarpaea sp.,.
M. vaillantioides, Morinda citrifolia, Mussaenda erythroneura, M. frondosa, Mussa-
enda sp., Myrmecodia echinata, Myrmecodia sp., Nauclea orientalis (=Sarcocepha-
lus cordatus), Octodon setosum, Oldenlandia (10), Ophiorrhiza harrisiana, 0. mungos,
Oxyanthus sp., Paederia sp., Pagamea sp., Pavetta sp., Pentas cornea, P. rubra,.
Pentas sp., Phuopsis stylosa, Phyllis nobla, Portlandia sp., Psychotria calva,
P. emetica, P. leucocephala, Psychotria sp., Putoria calabrica, Randia malabarica,
Randia sp., Richardia scabra, Richardsonia pilosa (=R. brasillensis), Richardsonia
sp., Rondeletia (7), Rubia cordifolia, R. olivierii, R. tinctorum, Scyphiphora hydro-
phyllacea, Serissa foetida, Sherardia aruensis, Spermacoce longifoUa, S. tenuior,
Spermacoce sp., Stephegyne parviflora, Tarenna asiatica, Tricalysla reticulata,
Vaillantia hispida, Warburgina factorovskyi. Часть видов изучена фрагментарно,
по 1—2 признакам.
Литература. Schleiden, 1837; Hofmeister, 1858; Vesque, 1878, 1879;
Jonsson, 1881; Hegelmaier, 1886; Karsten, 1891; Hanausek. 1895; Lloyd, 1902;
Mathewson, 1906; Faber, 1912; Juel, 1915; Pierpaoli, 1917; Soueges, 1924, 1925,
1951b; Schurhoff, 1926; Dahlgren, 1927; Fagerlind, 1936a, 1936b, 1937, 1939;
Graner, 1936; Houk, 1936; 1938, Schnarf, 1937; Krug, Carvalho, 1939; Bacchi,
1941; Mendes, 1941, 1944, 1950; Raghavan, Rangaswamy, 1941; Raghavan, Sri-
nivasan, 1941; Carniel, 1952, 1963; Farooq, 1952, 1953, 1958b, 1959, 1960; Lebegue,
1952; Raman, 1954; Crete, 1956d; Ganapathy, 1956a, 1956b; Dublin, 1957, 1958,
1960; Orlido, Gapinpin, 1957; Venkateswarlu, Rao Rajeswara, 1958; Ly Thi Ba,
1960, 1961; Medina, 1960; Dufau, 1961; Gopinath, Chennaveeraiah, 1961; Shiva-
ramiah, Ganapathy, 1961; Periasamy, Parameswaran, 1962, 1965; Godineau,
1963; Wormer, 1963; Periasamy, 1964; Shivaramiah, Dutt, 1964; Moens, 1965a,
1965b; Vishveshwara, Chinnappa,.1965: Brewbaker, 1967; Siddiqui S. A., Siddi-
qui S. В., 1968а, 1968b, 1983; Farooq, Inamuddin, 1969; Shivaramiah, 1971;
Wunderlich, 1971; Андронова, 1972, 1973, 1975, 1977, 1978, 1982a, 19826,
1983a, 19836, 1984; Кордюм, 1973, 1978; Shivaramaiah, Sundara Rajan, 1973,
1979; Philip Omana, Mathew, 1975; Prakasa Rao, Sarat Babu, 1975; Sundara
Rajan, Shivaramaiah, Sathyananda, 1975, 1976; Rodriguez, 1976; Gopal, Laksh-
manan, 1977; Shivaramiah, Sankara Rao, 1977; Ahmad, 1978; Vijaya, Lakshma-
nan, 1979; Maheshwari Devi, Krishnam, 1978, 1980; Krishnam, 1979; Bai V. Nar-
matha, Lakshmanan, 1984; Андронова (ориг. данные).
Семейство THELIGONACEAE
Пыльники 4-гнездные, раскрываются продольной шелью. Сформированная
стенка гнезда пыльника состоит из эпидермиса, эндотеция, среднего слоя и
тапетума (Kapil, Mohana Rao, 1966). Тапетум секреторный, с одноядерными
Iheligonaceae
1—33 — Theligonum cynocrambe.
1 — поперечный срез пыльника; 2 — фрагмент пыльника со спорогенным слоем; 3 — гнездо
пыльника с микроспороцитами; 4 — фрагмент сформированной стенки пыльника, микро-
спороциты в профазе с мощными каллозными оболочками; 5 — стенка пыльника во время
образования тетрад й типы тетрад; 6 — гнездо пыльника на стадии микроспор; 7 —
продольный срез участка пыльника в момент второго митоза в пыльцевых зернах; 8 — 2-клеточное
пыльцевое зерно: 8а — профаза генеративного ядра с 10 бивалентами; 9 — зрелое 3-кле-
точное пыльцевое зерно; 10 — продольный срез стенки зрелого пыльника, эндотеций
состоит из крупных клеток с фиброзными утолщениями; 11 — вид клеток эндотеция с
поверхности; 12 — пыльник в момент раскрывания;
124
T hetig onaceae (продолжение)
13 — бугорок семяпочки с археспорпальной клеткой; 14, 15 — семяпочка и ее фрагмент
з момент профазы мейоза мегаспоропита; 16 — часть семяпочки с мегаспороцитом,
окруженным одним слоем нуцеллуса; 17 — тетрада мегаспор; 18 — 2-ядерный зародышевый мешок;
19 — схема семяпочки на этой стадии; 20 — 4-ядерный, 21 — 8-ядерный зародышевый
мешок; 22 — сформированный зародышевый мешок с 2 полярными ядрами; 23 — семяпочка;
24 — зрелый зародышевый мешок;
клетками. Ко времени формирования микроспор средний слой и тапетум
дезорганизуются. Стенка зрелого пыльника состоит из эпидермиса и эндотеция
с фиброзными утолщениями. Клетки эпидермиса сильно вытянуты в длину.
В каждой клетке фиброзного слоя формируются 6—8 фиброзных поясков,
которые при рассмотрении эндотеция с поверхности имеют очень своеобразный
вид. Особенно обращает на себя внимание очередное прикрепление фиброзных
126
Theligonaceae (продолжение)
25 — зародышевый мешок в момент второго митоза ядер эндосперма; 26 — то же, с 2-клеточ-
ным зародышем и 4-ядерным эндоспермом; 27 — зародышевый мешок с 6-клеточным
зародышем и клеточным эндоспермом; 28—31 — стадии развития зародыша; 32, 33 —
разновозрастные зародыши. (2, 4, 5, 7—11, 14—19, 22, 23, 25 — ориг.; 1,3,6, 12, 13, 20, 21, 24, 26,
33 — по Kapil, Rao P. R., 1966).
поясков в соседних клетках и неодинаковая их толщина (ориг. данные). Микро-
спороциты располагаются в несколько (3—4) рядов. Мейоз завершается
симультанным цитокинезом (Schneider, 1913; Kapil, Mohana Rao, 1966). Тетрады
тетраэдральные, изобилатеральные, реже — крестообразные. Каллозная
оболочка довольна толстая, в некоторых местах сильно утолщена в виде гребней.
Первый митоз в микроспоре происходит после перемещения ядра к стенке и
образования крупной вакуоли в центре клетки. Линзообразная генеративная клетка
с маленьким ядром, отделяясь от стенки, перемещается внутрь пыльцевого
зерна и становится округлой (Schneider, 1913). Цитоплазма генеративной
клетки хорошо заметна. По нашим данным, деление ядра генеративной клетки
проходит в центре вегетативной клетки, цитоплазма которой уже заполнена
крахмальными зернами. Зрелые пыльцевые зерна 3-клеточные, содержат
крахмал. Спермин овальные, с хорошо различимой цитоплазмой.
Семяпочка кампилотропная, тенуинуцеллятная, с одним интегументом,
имеет длинное микропиле (Schneider, 1913; Dahlgren, 1916; Kapil, Mohana
Rao, 1966). Сведения о наличии у Theligonum cynocrambe двупокровной красси-
нуцеллятной семяпочки (Schnarf, 1931) ошибочны. Археспорий одноклеточный;
париетальных клеток не образуется (Kapil, Mohana Rao, 1966; Wunderlich,
1971; ориг. данные). Имеющиеся сведения о формировании нуцеллярного
колпачка (Davis, 1966; Поддубная-Арнольди, 1982) не подтвердились. В
результате мейоза образуется линейная тетрада мегаспор. Как правило, халазальиая
мегаспора развивается в зародышевый мешок, а остальные дегенерируют.
В редких случаях функционирует эпихалазальная мегаспора.
Зародышевый мешок моноспорический, -развивается по Polygonum-типу.
В результате 3 митозов формируется 8-ядерный зародышевый мешок с 3-кле-
127
точным яйцошлм пшифатом, 3 антиподами и 2-ядерной центральной клеткой.
Позд1гсо ядра центральной клетки сливаются, центральное ядро располагается
недалеко от яйцеклетки. Антиподы вначале одноядерные, но часто ядра их
делится и клетки становятся 2—4-ядерными (Kapil, Mohaha Rao, 1966).
Антиподы обычно остаются жизнеспособными длительное время (даже когда
зародыш находится на стадии квадранта, они не проявляют признаков
дегенерации), ко в некоторых зародышевых мешках они дегенерируют вскоре после
оплодотворения. Проникновение пыльцевой трубки в зародышевый мешок
происходит через микропиле; обычно разрушается одна из синергид.
Оплодотворение двойное, протекает, вероятно, по премитотическому типу, что можно
заключить по имеющимся иллюстрациям (Schneider, 1913).
О типе эндосперма нет единого мнения. Капил и Мохана Pao (Kapil, Mohana
Rao, 1966) определяют эндосперм у Т. cynocrambe как нуклеарный, но уже после
8-ядерной стадии он становится клеточным, т. е. когда зародыш достигает
стадии квадранта. Однако, судя по рисункам Шнейдера (Schneider, 1913), довольно
развитый многоклеточный эндосперм имеется на стадии 3-клеточного про-
эмбрио. Мауритсон (Mauritzon, 1934) считает эндосперм Т. cynocrambe
клеточным. В дальнейшем формируется мощный эндосперм, который сохраняется
и в зрелом семени. Запасные вещества в эндосперме — крахмал (Woodcock,
1929; Kapil, Mohana Rao, 1966) или белки и жиры (Wunderlich, 1971).
Зародыш развивается по Ghenopodiad-типу; к такому заключению
приходит Вундерлих (Wunderlich, 1971), анализируя имеющиеся в литературе
иллюстрации (Kapil, Mohana Rao, 1966). Подвесок зародыша длинный (9
клеток); по сведениям одних авторов (Schneider, 1913; Wunderlich, 1971) — он
однорядный, по данным других (Kapil, Mohana Rao, 1966) — 2-рядный. В
зрелом семени подвесок короткий, зародыш изогнут подковообразно, имеет 2
узкие плоские семядоли, почечку и цилиндрический зародышевый корень.
Прокамбиальная система развита хорошо.
Исследованный вид. Theligonum cynocrambe.
Литература. Schneider, 1913; Dahlgren, 1916; Woodcock, 1929;
Schnarf, 1931; Mauritzon, 1934; Davis, 1966; Kapil, Mohana Rao, 1966b;
Wunderlich, 1971; Поддубная-Арнольди, 1982; Солнцева (ориг. данные).
Семейство APOCYNACEAE
Пыльник 4-гнездный. Стенка гнезда пыльника формируется центробежно.
У всех исследованных видов, за исключением Voacanga foetida, она состоит
из эндотеция, 1—2 (иногда 3) средних слоев и 1—2-слойного тапетума.
У V. foetida в результате дополнительных периклинальных делений вторичного
париетального слоя образуются 10—14 средних слоев и многослойный эндо-
теций (Maheswari Devi, 1971). Тапетум клеточный секреторный, клетки его
одноядерные, у V. foetida с орбикулами. Наружные стенки эпидермальных клеток
сильно утолщаются. В зрелом пыльнике стенка состоит из эпидермиса и
фиброзного эндотеция. Микроспороциты большинства видов делятся симультанно и
образуют тетраэдральные и изобилатеральные тетрады. У Аросупит androsa-
emifolium (Davis, 1966) отмечен сукцессивный тип образования тетрад, а у Rau-
wolfia canescens — оба типа. У Vinca major и V. minor, по нашим данным,
микроспороциты делятся симультанно и возможна дегенерация одной или
2 микроспор в тетраде. У Lochnera rosea наблюдалось образование Т-образных и
ромбовидных тетрад (Pannocchia-Lay, 1938). Зрелые пыльцевые зерна 3-кле-
точные, одиночные. Спермин удлиненные, веретеновидной формы. У Vinca
herbacea Финном (Finn, 1928) обнаружены двойные пыльцевые зерна.
Семяпочка анатропная (Rauwolfia, Vinca) и гемитропная (остальные виды),
с одним интегументом и дифференцированным интегументальным тапетумом,
тенуинуцеллятная. Археспорий одно-, иногда 2-клеточный, дифференцируется
в мегаспороцит. В результате мейоза формируется линейная тетрада мегаспор;
у Catharanthus roseus и Holarrhena antidysenterica — чаще Т-образная.
Функционирующей является халазальная мегаспора, остальные дегенерируют.
128
Аросупасеае
1, 3, 38—42 — Rauwolfia tetraphylla, 2, 30—37 — Catharanthus roseus, 4, 8—10 —
Holarrhena antidysenterica, 5, 25—29 — Voacanga fortida, 6, 11, 13, 19—21, 24, 44, 45 — Vinca
minor, 7, 12 — Vinca major, 14 — Carissa grandiflora, 15 — Amsonia tabernaemontana, 16, 23 —
Rhazya orientalis, 17 — Nerium oleander, 18 — Allamanda neriifolia, 22 — Acokanthera spocta-
bilis, 43 — Rauwolfia serpentina.
1—13 — этапы формирования стенки яыльника и пыльцевого зерна;
9 Сравнительная эмбриология
Аросупасеае (продолжение)
14-23 — мегаспорогенез и развитие зародышевого мешка; 24 — процесс двойного
оплодотворения;
Зародышевый мешок моноспорический, развивается по Polygonum-типу,,
у большинства видов с яйцеклеткой и синергидами грушевидной Ф°Рмы-
У Rauwolfia tetraphylla сиНергиды крючковидные (Maheswari Devi, 1971),
у V. major и V. minor, по нашим данным, яйцеклетка грушевидной формы,
а синергиды удлиненные, с крючковидными выростами. Слияние полярных
ядер происходит до оплодотворения у всех исследованных видов, кроме С. го-
seus, у которого они сливаются во время оплодотворения. В халазальном конце
130
Аросупасеае (продолжение)
25—42 — разные типы эмбриогенеза (25—29 — Asterad-тип, 30—37 — Onagrad-тип, 38—
42 — Ghenopodiad-тип); 43 — полиэмбриония; 44, 45 — развитие эндосперма. (1—5, 8—10,
25—42, 43 ^- по Maheswari Devi, 1971; 6, 7, 11—13, 19—21, 24, 44, 45 — ориг.; 14—18,
22, 23 — по Andersson, 1931).
зародышевого мешка формируются 3 одноядерные антиподы. У R. tetraphylla,
R. serpentina, Catharanthus pusillus, V. major и V. minor антиподы дегенерируют
после оплодотворения, у остальных видов они эфемерны. В цитоплазме
яйцеклетки и центральной клетки имеются крахмальные зерна. Отмечены случаи
развития 2 зародышевых мешков в одной семяпочке у R. serpentina, R.
tetraphylla и Н. antidysenterica обычного строения, но без антипод. Андерсон (Anders-
son, 1931) наблюдал начальные этапы образования 2 зародышевых мешков
в одной семяпочке у V. minor, что отмечено и нами у этого же вида. Имели
место аномалии в строении зародышевых мешков. У V. foetida в них различались
2 синергиды, одна антипода и 3 ядра вблизи халазального конца. В других
случаях в зародышевых мешках с 6 ядрами 2 представляли собой синергиды и
4 ядра свободно лежали в халазальном конце. У Н. antidysenterica из 6 ядер
одно было ядром яйцеклетки, остальные 5 находились в центральной клетке.
В нескольких случаях у этого же вида встречались зародышевые мешки
с 12 ядрами, 8 из которых располагались в микропилярной части и 4 в халазаль-
ной (Maheswari Devi, 1971). У V. minor могут быть отклонения в
дифференциации клеток как яйцевого, так и антиподального аппарата и в числе ядер в
центральной клетке (Pannocchia-Lay, 1938; ориг. данные). Оплодотворение ио-
рогамное. Сингамия и тройное слияние происходят почти одновременно.
9* 131
Эндосперм иуклоарный, деление первичного ядра эндосперма предшествуем
делению зиготы. Поело нескольких делений свободных ядер эндосперма они
располагаются по периферии зародышевого мешка и образуется большая
центральная вакуоль. Закладка клеточных перегородок начинается с периферии:
и. продолжается внутрь зародышевого мешка, заполняя его клеточной тканью.
У С. гояеш, С. pusillus и Trachelospermum fragrans отмечено образование хала-
залышх эндоспермальных гаусториев (Maheswari Devi, 1971; Sud, 1984).
Подобное же явление наблюдалось у Lochnera pusilla (Murty, Ghauban, 1966).
В арелом семени эндосперм сохраняется, содержит липиды, белки и крахмал..
У Ervatamia heyneana и Voacanga grandifolia эндосперм руминированный,.
у Amsonia \abernaemontana — не руминирован (Periasamy, 1963).
Развитие зародыша было прослежено разными исследователями у многих,
видов, в результате отмечено несколько типов его формирования: Trifolium-
вариация Onagrad-типа у С. roseus, С. pusillus и L. pusilla; Senecio-вариация
Asterad-типа у V. foetida, Ghenopodiad-тип у R. tetraphylla и Solanad-тип —
у Trachelospermum fragrans (Murty, Chaubau, 1966; Maheswari Devi, 1971; Sud,.
1984). У L. rosea и V. minor описаны только отдельные стадии развития
зародыша (Andersson, 1931; ориг. данные), что не позволяет классифицировать тип
его развития. Зрелый зародыш прямой или изогнутый, дифференцированный.
Лейкоэмбриофиты.
Полиэмбриония отмечена у Kopsia longifolia, Nerium indicum и Rauvolfia
serpentina.
Исследованные виды. Acokanthera spectabilis, Allamanda cathar-
tica, Amsonia tabernaemontana, Apocynum androsaemifolium, A. cannabinum,
Carissa carandas, C. grandiflora, Catharanthus pusillus, C. roseus, Cerbera odollam,
Epvatamia heyneana, Holarrhena antidysenterica, Kopsia longifolia, Lochnera
pusilla, L. rosea, Nerium indicum, N. oleander, Odontadenia speciosa, Plumeria
bicolor, Rauwolfia canescens, R. serpentina, R. tetraphylla, Rhazya orientalis,.
Thevetia nereifolia, Trachelospermum fragrans, Vallaris heynii, Vinca herbacea,.
V. major, V. minor, Voacanga foetida, V. grandifolia.
Литература. Hofmeister, 1858; Vesque, 1878; Helm, 1895; Billings,
1901; Frye, Blodgett, 1905; Leger, 1913; Guignard, 1917a, 1917b; Tackholm,
Soderberg, 1918; Finn, 1928; Andersson, 1931; Schnarf, 1931; Schurhoff, Miiller,
1937; Meyer, 1938; Pannocchia-Lay, 1938a, 1938b; Benetskaja, 1939; Rau, 1940;
Mablberg, 1959, 1960, 1961; Periasamy, 1962, 1963; Rao, Ganguli, 1963; Davis,
1966; Murty, Chauhan, 1966; Latoo, 1969, 1974; Khan, 1970b; Maheswari Devi,
1970, 1971; Corner, 1976; Lamba, 1976; Поддубная-Арнольди, 1982; Sud, 1984;
Шевченко (ориг. данные).
Семейство ASCLEPIADACEAE
В семействе наблюдаются четкие различия в развитии
мужских.генеративных структур между подсемействами Cynanchoidea,e и Periplocoideae, но в обоих
случаях образование стенки гнезда пыльника происходит по центробежному
типу, генеративная клетка имеет веретеновидную форму, зрелые пыльцевые
зерна 3-клеточные. Пыльник вскрывается продольно. В роде Secamone
сочетаются признаки обоих подсемейств. В подсем. Cynanchoideae в родах Acerates,
Asclepias, Calotropis, Caralluma, Daemia, Leptadenia, Pentatropis, Tylophora
и Vincetoxicum пыльники 2-гнездные. Эпидермис у Vincetoxicum officinale
представлен удлиненными клетками. Эндотеций у всех исследованных видов
без фиброзных утолщений, 2—3-слойный — у Cynanchum, Pergularia и
Tylophora и многослойный — у Caralluma и Calotropis. Средних слоев — у V.
officinale — 1—2. Тапетум секреторный, 1— 2-слойный, клетки его от 1—3-
до многоядерных. Спорогенные клетки преобразуются в микроспороцитьи
Тетрады микроспор линейные, формируются по сукцессивному типу. Зрелые
пыльцевые зерна объединены в поллинии. Стенка поллиния, согласно данным
сканирующей электронной микроскопии, значительно толще стенки пыльцевых
зерен; она имеет гомогенное строение и состоит из веществ спорополлениновой
132
Asclepiaclaceae
1—5 — Caralluma attenuata, 6—8 — Hemidesmus indicus, 9—11, 17—27 — Vincetoxicum
officinale, 12—16 — Cryptostegia grandiflora.
1 — 2-гнездный пыльник со спорогенными клетками; 2, 6 — гнезда пыльников с мегаспоро-
цитами и сформированной стенкой; 3 — линейная тетрада микроспор; 4 — гнездо
пыльника с одноядерными пыльцевыми зернами, объединенными в поллиний; 5 — зрелое 3-кле-
точное пыльцевое зерно поллиния; 7 — одно из гнезд 4-гнездного пыльника с различными
типами тетрад микроспор в нем; 8 — зрелые 3-клеточные пыльцевые зерна, объединенные
в тетраду; 9 — одно из гнезд 2-гнездного пыльника с микроспороцитамиг 10 — фрагмент
сформированной стенки гнезда этого пыльника; тапетум из нескольких слоев клеток; 11 —
фрагмент гнезда пыльника с 2-клеточными пыльцевыми зернами, объединенными в полшший;
стенка поллиния утолщенная;
природы, ацетолизоустойчива, за исключением того участка, где происходит
прорастание пыльцевых трубок. Морфологически строение стенки поллииии
может быть различным у разных видов цветковых. В ней могут быть
перфорации, имеющие различные размеры, форму и положение. Проникновение
пыльцевых трубок через стенку поллиния наблюдается именно в месте расположоишг
Ш
Asclepiadaceae (продолжение)
12, 13, 17—21 — семяпочки с мегаспороцитами; 14—/б — фрагменты семяпочек с тетрадами
мегаспор; нупеллус редуцирован;
перфораций. При отсутствии их пыльцевые трубки могут быть обнаружены
в любой зоне поллиния, на его внешней или внутренней стороне (Galil, 1969;
Shill, Jakel, 1978; Sreedevi, Namboodiri, 1982). У V. officinale пыльцевые
трубки прорастают через внешнюю стенку поллиния (ориг. данные).
В подсем. Periclocoideae пыльники 4-гнездные в родах Hemidesmus, Crypto-
lepis, Periploca и Secamone. Эндотеций имеет фиброзные утолщения, состоит
из одного слоя клеток у Hemidesmus, Ceropegia и Leptadenia. Тапетум
секреторный, однослойный, клетки его 1—2-ядерные. Тетрады микроспор
разнообразных типов: тетраэдральные, изобилатеральные, Т-образные или переходные,
формируются симультанно. Зрелые пыльцевые зерна объединены в тетрады.
Стенка тетрад утолщается после разрушения клеток тапетума.
Семяпочка анатропная у всех исследованных представителей семойстни;
гемианатропная у Sarcostemma brevistigma, с одним интегументом, топуину-
целлятная. Семейство характеризуется редуцированным нуцеллусом. Одлико
у представителей некоторых родов образуется нуцеллярный колпачок (Тц1о-
phora, Leptadenia, Cynanchum, Stapelia, Gomphocarpus, Asclepias, Marsdenia),
135
но он, как и нось иуцеллус, разрушается к стадии зрелого зародышевого мешка.
У V. officinale иуцеллус представлен 2 эпидермальными клетками,
расположенными над могаспороцитом или тетрадой мегаспор. Интегумент 2—3-слойный
в микронилиршш районе и более мощный у основания. После цветения,
интегумент сильно увеличивается в размерах главным образом за счет роста объема
клеток. Лрхоспориальная клетка чаще одна, закладывается субэпидермально.
У Calotropis, Asclepias, Cynanchum, Ceropegia и Vincetoxicum обнаружены 2—3
архосиориальные клетки, но продолжает дальнейшее развитие лишь одна
из них. Без отделения кроющей клетки археспориальная клетка преобразуется
в мегаспороцит. Тетрады мегаспор линейные. У Cynanchum callialata, Tylophora
cordifolia и Daemia extensa обнаружены также Т-образные и JL-образные тетрады.
Зародышевый мешок формируется из халазальной мегаспоры. Возможность
функционирования других мегаспор отмечена для Asclepias tuberosa, Crypto-
stegia grandiflora и V. officinale.
Зародышевый мешок развивается по Polygonum-типу. Данные об
образовании биспорического зародышевого мешка Allium-типа в родах Vincetoxicum
и Cynanchum (Chauveaud, 1892; Seefeldner, 1912; Pardi. 1933) требуют
уточнения. Наши данные, как и данные Кордюм (1961а), подтверждают развитие
зародышевого мешка у V. officinale no Polygonum-типу. В зрелом зародышевом
мешке клетки яйцевого аппарата крупные, занимают до половины объема
зародышевого мешка. Несколько мельче они у V. officinale. Синергиды
грушевидные, с крючковидными выростами. Антиподы эфемерны, в родах Ceropegia
и Cynanchum они могут быть яйцеклеткоподобными. Полярные ядра сливаются
до оплодотворения. Двойное оплодотворение обнаружено у большинства
исследованных видов. Тройное слияние и деление первичного ядра эндосперма
происходят раньше, чем заканчивается объединение яйцеклетки со спермием.
Эндосперм формируется по нуклеарному типу: клеткообразование
начинается при наличии 8, 16 или 32 ядер. Клеточные стенки закладываются центри-
петально. У Calotropis procera (Sabet, 1931) описана возможность формирования
эндосперма и по нуклеарному, и по клеточному типам. В зрелом семени
эндосперм частично сохраняется.
Эмбриогенез у Cynanchum acutum и Asclepias curassavica Solanad-типа,
у Calotropis gigantea, С. grandiflora, D. extensa он соответствует Solanad-типу
Lilium-вариации. Зародыши начинают развиваться лишь после образования
клеток в эндосперме. У Cynanchum nigrum развитие зародыша не может быть
отнесено ни к одному из классических типов эмбриогенеза (Hausner, 1976;
ориг. данные). Зрелые зародыши крупные, занимают почти все семя. Хлоро-
эмбриофиты.
Образование апоспорических зародышевых мешков, согласно проведенному
нами анализу данных Шевье (Chauveaud, 1892), вероятно, имеет место в роде
Vincetoxicum. Адвентивная эмбриония описана для V. officinale (Кордюм.
1961а), С. nigrum, С. vincetoxicum (=V. officinale) (Hausner, 1976). Мнения
авторов расходятся в вопросе о том, из клеток какой ткани формируются
адвентивные зародыши. Е. Л. Кордюм (1961а) считает их интегументальными,
а Хауснер (Hausner, 1976) — нуцеллярными. Проведенное нами исследование
подтвердило положение первого из авторов об интегументальном
происхождении зародышей у V. officinale. У этого вида, произрастающего в условиях
Ленинграда, в ткани интегумента и вблизи зародышевых мешков нами не было
обнаружено ни пыльцевых трубок, ни их остатков. Синергиды оставались
неповрежденными при развивающемся эндосперме, яйцеклетка не оплодотворялась,
образования зиготы не наблюдалось. Интегументальные зародыши начинают
развиваться либо при целлюлярном, либо при нуклеарном состоянии
эндосперма. Для V. officinale характерна полиэмбриония; до 70 % семян имеют
несколько интегументальных зародышей (ориг. данные).
Исследованные виды. Acerates longifolia, A. viridiflora, Araufia
albens, Asclepias comuti, A. curassavica, A. donglasii, A. incarnata, A. mexicana,
A. phytolaccoides, A. speciosa, A. syriaca, A. tuberosa, A. verticillata, Calotropis
gigantea, С procera, Caralluma attenuata, C. fimbriata, Ceropegia candelabrum, C.
debilis, С elegans, С funcea, С sandersoni, С stapeliaeformis, Cryptolepisbuchanani,
136
Cryptostegia grandiflora, Cynanchum acutum, С callialata, С fuscatum, C. la are,
C. medium, C. nigrum, С speciosum, C. vincetoxicum, Daemia externa, Dictyanlhus
ceratopetala, Dregea. volubilis, Gomphocarpus fruticosus, Hemidesmusindicus, Holo-
stenima rheedei, Hoya carnosa, Huernia kirkii, Leptadenia pyrotechnica, L.
reticulata, Marsdenia erecta, M. volubilis, Oxypetalum coeruleum, Pentatropis spiralis,
Pergularia daemia, P. pallida, Periploca graeca, Sarcostemma brevistigma, Seca-
mone frutescens, Stapelia asterias, S. munbyana, S. planiflora, S. semota, S. va-
riegata, Tylophora asthmatica, T. cordifolia, T. indica, Vincetoxicum medium,
V. nigrum, V. officinale.
Литература. Schleiden, 1837, 1839; Schacht, 1853; Braun, 1860;
Chatin, 1870; Vesque, 1878; Baillon, 1882; Corry, 1883, 1884; Strasburger, 1889,
1901; Chauveaud, 1892a, 1892b, 1892c, 1902; Hubert, 1896; Stevens, 1898;
Billings, 1901; Frye, 1901, 1902; Dop, 1902a, 1902b, 1903a, 1903b; Gager, 1902;
Guignard, 1903; Wefelscheid, 1911; Seefeldner, 1912; Leger, 1913; Финн, 1921,
1926; Dahlgren, 1923, 1927; Finn, 1925, 1926; Francini, 1927a, 1927b; Sabet,
1931; Pardi, 1933; Richharia, 1934; Бенецкая, 1939; Nirula, 1945a, 1945b; Nirula,
Richharia, 1945; Moore, 1946; Crete, 1950e; Volk, 1950; Patwardhan, 1953;
Rao, Rao, 1954; Biswas, 1955, 1957; Кордюм, 1961а, 19616; Safwat, 1962;
Maheswari, 1964; Mulay et al., 1965; Galil, Zeroni, 1969; El-Gazzar, Hamza,
1973; El-Gazzar et al., 1974; Jala, Namboodiri, 1975; Hausner, 1976; Wyatt,
1976; Dan Dicko-Zafimanova, 1978; Schill, Jakel, 1978; Sreedevi, Namboodiri,
1979, 1982; Bookman Susan, 1983; Р1аумова (ориг. данные).
Семейство GENTIANACEAE
Пыльник 4-гнездный, вскрывается продольными щелями либо с помощью
одной (Cotylanthera) или 2 (Ехасит) апикальных пор. По нашим данным, у
Gentiana lutea, как и у большинства видов семейства, стенка гнезда пыльника
формируется центробежно. Сформированная стенка состоит из эпидермиса, эндо-
теция, 1—3 средних слоев и тапетума. У Cotylanthera tenuis тапетум представлен
одним, у G. lutea — 1—2, у G. fetisowi — 2, у G. angustifolia — 3—4 слоями
клеток. Клетки тапетума одноядерные, реже — 2-(G. lutea) и A-(Cicendia, Enico-
stema) ядерные. У Enicostema littorale за счет слияния наблюдается образование
полиплоидных ядер. У Gentiana cruciata вследствие эндомитоза ядра тапетума
становятся тетраплоидными. У многих видов в премейотический и постмейо-
тический периоды в пыльцевых гнездах формируются своеобразные тапеталь-
ные перегородки, разделяющие клетки спорогенного комплекса, а затем микроспо-
роциты на небольшие группы (по 2—3 клетки). Вопрос о способе образования
их в пыльнике до сих пор остается спорным. По нашим данным, у G. lutea 5—7
археспориальных клеток располагаются в будущем гнезде дугообразно.
Деления в них происходят таким образом, что и в дальнейшем дугообразное
расположение спорогенных клеток сохраняется. Клетки тапетума со стороны
связника делятся в радиальном направлении и, вклиниваясь между спорогенными
клетками, соединяются с клетками тапетума, возникшими из париетального
слоя, формируя своеобразные перегородки. Тапетум клеточный секреторный,
без реорганизации в дальнейшем. Со стадии вакуолизированных микроспор
оболочки между клетками тапетума не выявляются, однако протопласты четко
отграничены друг от друга. Электронно-микроскопическое исследование
пыльника Gentiana acaulis (Lombardo, Carraro, 1976) показало, что на этой стадии
клетки тапетума ограничены только плазмалеммой, вдоль которой
располагаются очень мелкие орбикулы, невидимые в световой микроскоп. Такой способ
формирования тапетума характерен, вероятно, также для G. angustifolia (Guerin,
1926) и видов Leiphaimos и Voyria (Oehler, 1927). Однако для G. cruciata и G. lutea
ранее (Steffen, Landmann, 1958) указывалось, что в результате стерилизации
спорогенной ткани возникают один или несколько слоев тапетума и 1—2-слой-
ные так называемые трабекулы (перегородки между группами спорогошгых
клеток). Наши данные по G. lutea не позволяют согласиться с выводами укаиац-
ных авторов, так как они не изучили ранние стадии пыльника и нолорцо, по
нашему мнению, интерпретируют способ образования тапетума в пыльцоиом
137
1—28, 30, 31, 35, 37—56 — Gentiana lutea, 29, 32 — G. cruciata, 33, 36 — Gentianella lingul-
lata, 34 -•- Gentianopsis barbata.
1—18 — развитие пыльника: 1 — схема пыльника на ранних стадиях развития, 2—4 —
образование париетального и спорогенного слоев клеток; дифференциация клеток тапетума,
5 — образование за счет тапетума перегородок между группами спорогенных клеток, 6 —
схема пыльника на стадии профазы I мейоза в микроспороцитах, 7 — сформированная
стенка пыльника,
Gentianaceae (продолжение)
8—11 — фрагменты пыльцевого гнезда на стадии тетрад микроспор, одиночных вакуоли-
зированных микроспор (клетки тапетума продолжают функционировать, однако клеточные
оболочки не выявляются) и 2-клеточных пыльцевых зерен, 12 — схема зрелого пыльника
перед вскрыванием, на которой показано расположение клеток с фиброзными утолщениями,
13 — фрагмент стенки зрелого пыльника в области стомиума; пыльцевые зерна 3-клеточпые,
14—18 — отдельные стадии микроспорогенеза;'
Gentianaceae (продолжение)
19—36 — развитие семяпочки: 19 — семяпочка на стадии дифференциации археспориаль-
ной клетки, 20 — дифференциация 2 археспориальных клеток, 21 — заложение интегу-
мента в семяпочке, 22 — семяпочка на стадии мегаспороцита, 23—25 — мегаспорогенез;
образование линейной тетрады мегаспор,
гнезде. У Chlora perfoliata и Е. littorale тапетальные перегородки в пыльнике
не образуются. Стенка зрелого пыльника представлена эпидермисом и эндо-
тецием с фиброзными утолщениями. У G. lutea фиброзные утолщения
формируются во всех клетках субэпидермального и иногда нижележащих слоев,
в результате чего проводящий пучок связника практически со всех сторон
оказывается окружен слоями клеток с фиброзными утолщениями. В оболочках
микроспороцитов откладывается каллоза. Образование тетрад микроспор
происходит симультанно. Тетрады микроспор тетраэдральные, реже — изобила-
теральные и крестообразные. Зрелые пыльцевые зерна у Gentianopsis barbata,
Gentiana cruciata, G. septemfida, Gentianella lingulata (ориг. данные), С. tenuis,
Hoppea dichotoma, Swertia minor — 2-клеточные, у G. lutea, видов Canscora и
Exacum — 3-клеточные. Для G. lutea ранее указывались 2-клеточные зрелые
140
Gentianaceae (продолжение)
26—30 —' развитие зародышевого мешка (на30 в семяпочке 2 зародышевых мешка),
шыльцевые зерна. У Canscora decussata, Exacum petiolare и G. lutea обнаружена
дегенерация пыльцы, отдельных пыльцевых гнезд и пыльников в целом.
Семяпочки преимущественно анатропные, реже — ортотропные (Halenia
■ elliptica, С. tenuis, виды Voyria) или гемитропные (Gentiana tenella, Gentianella
lingulata), тенуинуцеллятные, с одним интегументом. У некоторых паразитных
представителей семейства (С. tenuis, виды Voyria) семяпочки лишены
интегумента. Заложение интегумента происходит перед началом мейоза в мегасиоро-
.ците. Толщина интегумента варьирует от 2—3 у Gentianopsisciliata, 4—5 у S, mi-
,И0Г) 8—10 у Gentianella campestris до 20 слоев у G. Zwiea.'Микропиле у Swertia
141
Gentianaceae (продолоюепив)
31—33 — зрелые зародышевые мешки у разных видов, 34 ■— часть зрелого зародышевого
мешка с антиподами, 35 — схема анатропной семяпочки, 36 — схема гемитропной
семяпочки; 37—40 — развитие эндосперма: 37 — синхронные деления первых 2 ядер
эндосперма, 38 — образование ядер по периферии первичной клетки эндосперма, 39 —
эндосперм в ыикропилярной части из 4—5 слоев клеток (в других частях он 1—2-слойный),
40 — схема семени, эндосперм и зародыш соответствуют 39; 41—55 — развитие зародыша;
56 — зрелое семя с зародышем и эндоспермом, (ср. ел — средний слой, т — тапетум, тр —
трабекулы, ф. у — фиброзные утолщения, э — эпидермис, эн — эндотеций). (1—56{—
ориг.).
carolinensis изогнутое, близко подходит к плаценте. Нуцеллус однослойный.
G началом развития зародышевого мешка его клетки дегенерируют. У S. longi-
folia (Jacobson-Paley, 1920) и, вероятно, у Н. elliptica (Stolt, 1921) семяпочка
с гипостазой. Проводящий пучок в семяпочке не дифференцируется. Археспо-
риальная клетка, реже — их 2 (Centaurium ramosissimum, G. lutea),
преобразуется в мегаспороцит без отделения кроющей клетки. Тетрада мегаспор
линейная.
Зародышевый мешок развивается из халазальной мегаспоры линейной
тетрады по Polygonum-типу. Зрелый зародышевый мешок расширен в микропи-
лярной и сужен в халазальной частях. Яйцеклетка и синергиды грушевидные.
У G. lutea синергиды с нитчатым аппаратом и крючковидными выростами.
У большинства видов полярные ядра сливаются до оплодотворения вблизи
яйцевого аппарата. У Chlora perfoliata, Erythraea centaurium и Exacum affine
полярные ядра перед оплодотворением находятся в контакте. По строению и
числу антипод в семействе выделяют 3 группы: 1) антиподы одноядерные,
слаборазвитые, дегенерируют до оплодотворения, их может быть постоянно 3 (Gen-
142
Liana prostrata) либо 3—9 (Gentiana asclepiadea, G. tibetica); 2) антипод всегда З,
они одноядерные, хорошо развитые, дегенерируют после оплодотворения
(Е. Uttorale, E. ajfine, H. dichotoma); 3) антиподы многоядерные, сильноразвитые,
их 3 (77. elUplica), либо 6 (G. tenella), либо больше 6 (Gentianella amarella, G. uli-
ginosa). У изученных нами видов строение антипод в зрелом зародышевом мешке
имеет ряд особенностей. У G. lutea антиподы хорошо развитые и сохраняются
до норных стадий эмбриогенеза, тогда как ранее (Stolt, 1921) считалось, что они
у этого вида слаборазвитые и эфемерные. В антиподах G. lutea на стадии сформи-
pomunroro зародышевого мешка наблюдаются деления ядер без цитокинеза,
возникают 2-ядерные клетки, которых иногда не 3, а 4. В процессе созревания
мародышевого мешка ядра сливаются, образуя слегка лопастные диплоидные
ядра. У G. barbata антипод 3, каждая с очень крупным полиплоидным ядром.
У G. cruciata типично 6-клеточное строение антиподального аппарата, при этом
клетки сначала 2-ядерные, а затем их ядра сливаются. У G. lingulata
образуются 9—12 гигантских антипод с полиплоидными ядрами, причем антиподы
занимают более половины объема зародышевого мешка.
Порогамия. У S. carolinensis (McCoy, 1949) пыльцевая трубка входит в
зародышевый мешок через 10 ч после опыления. При вхождении пыльцевой трубки
происходит разрушение одной, реже — обеих синергид. Оплодотворение
двойное. Спермин, проникшие в зародышевый мешок, различаются морфологически
и величиной. Спермий, сливающийся с ядром яйцеклетки, округлой формы,
а другой — эллипсоидный. Первый спермий по размерам меньше второго почти
в 2 раза (Руденко, 1960). У С. perfoliata, E. affinem Leiphaimos spectabilisuonx])-
ные ядра сливаются одновременно с одним из спермиев. Тройное слияние
заканчивается быстрее, чем сингамия. У ряда растений Карпат (Gentianella car-
paihica, G. livonica) оплодотворение не наблюдалось, что связано, вероятно,
с влиянием неблагоприятных низких температур на развитие пыльцевых зерен
и зародышевых мешков.
Эндосперм нуклеарный. У большинства видов веретено первого деления
ориентировано продольно, реже — поперечно (С. tenuis, G. lutea) относительно
оси первичной клетки эндосперма. При втором делении ядра эндосперма у Е. сеп-
taurium располагаются в продольном, а у G. lutea, как и ранее, в поперечном
направлении. Образовавшиеся ядра находятся в постенном слое цитоплазмы.
Клеткообразование в эндосперме у многих видов начинается к моменту
формирования 4—8-клеточного проэмбрио, причем заложение и формирование
клеточных перегородок во всех частях эндосперма происходит одновременно.
У С. tenuis и L. spectabilis эндосперм становится клеточным со стадии 8 ядер.
У G. lutea (ориг. данные) клеткообразование в эндосперме наступает после
образования 128 свободных ядер перед делением зиготы. Оно начинается с
середины и идет в микропилярную и халазальную части. С началом эмбриогенеза
клетки 1—2-слойного эндосперма, как колпачком, окружают со всех сторон
развивающийся проэмбрио. Клетки эндосперма различной величины, с ядрами
различной плоидности. У Voyria coerulea и Voyriella parviflora эндосперм с
самого начала формируется по целлюлярному типу. В зрелом семени имеется
обильный эндосперм. У паразитных видов он представлен 12—15 клетками
у Leiphaimos и Voyriella и 30—40 — у Cotylanthera. Наружные стенки клеток
периферического слоя эндосперма утолщены. Запасные питательные вещества
в виде крахмала и кристаллов белка.
Эмбриогенез происходит в соответствии с Solanad-типом. Особенность
развития зародыша у G. lutea — нестабильность в заложении перегородок и числе
клеток, производных средней (т) и нижней (ci) клеток 4-клеточного проэмбрио.
Зародыши в сформированных семенах автотрофных и паразитных растений
находятся на разных стадиях дифференциации. У первых зрелый зародыш
больших размеров, достигает иногда средней части семени, с зачатками семядолей,
апексом побега, гипокотилем и зародышевым корнем с чехликом. Подвесок
нитчатый, разного строения. Клетки его располагаются в один ряд в числе 1—2
у Erythraea,, 3—4 — у Chlora и 5—6 — у G. prostrata. У G. lutea подвесок 1—2-
рядный, с большим (7—8) числом клеток в каждом ряду. У паразитных видов
зародыши в семени разделяют на 2 уровня специализации (Терёхин, 1977):
1) зародыши представлены малоклеточным (16—24 клеток) глобулярным обра-
144
зованием (Bartonia, Cotylanthera), 2) зародыши находятся в состоянии puiuicni
проэмбрио (3—10 клеток) (Leiphaimos, Voyria и др.). Подвесок из 2—3 клотик.
В семействе описан апомиксис. У С. tenuis (Ernst, 1914; Oehler, 1927) отмочен
нередуцированный партеногенез. У Е. centaurium (Crete, 1949) выявлены случаи
апогаметии, когда один из 2 развивающихся зародышей имел синергидиоо
происхождение. У G. livonica (Руденко, 1961) обнаружено возникновение
дополнительных зародышей из тканей нуцеллуса и интегумента. В семейстио
встречаются лейко- и хлороэмбриофиты (Яковлев, Жукова, 1973).
Исследованные виды. Bartonia virginica, Blackstonia perfoliata
(=Chloraperfoliata), Canscora decurrens, C. decussata, C. diffusa, C. pauciflora,
Centaurium erythraea (—Erythraea centaurium), C. ramosissimum, C. roxburghii
(=Eryfhraea roxburghii), Cicendia filiformis, Comastoma tenellum (=Gentiana tenella),
С otylanthera tenuis, Enicostema hyssopifoUum, E. Uttorale, E. verticillatum, Eustoma
exaltatum (=Gentiana exaltatum), Exacum affine, E. bicolor, E. pedunculatum,
E. petiolare, E. pumilum, E. saulieri, Gentiana acaulis, G. angustifolia, G.
asclepiadea, G. crinita, G. cruciata, G. fetisowi, G. germanica, G. lutea, G. pedicellata,
G. pneumonanthe, G. prostrata, G. punctata, G. guadrifaria, G. septemjida, G. stra-
minea, G. tibetica, G. walujewi, Gentianella amarella (=Gentiana amarella),
G. campestris (=Gentiana campestris), G. carpathica (=Gentiana carpathica),
G. lingulata, G. livonica (=Gentiana livonica), G. uliginosa (=Gentiana uliginosa),
Gentianopsis barbata (=G?ntiana barbata), G. ciliata (=Gentiana ciliata), Hale-
nia elliptica, Hoppea dichotoma, H. fastigiata, Leiphaimos auranliacus, L.
spectabilis, Obolaria virginica, Swertia carolinensis, S. corymbosa, S. lawii, S.
longifolia, S. minor, S. perennis, Voyria coerulea, V. mexicana, V. obconica,
V. tenella, V. trinitatis, V. uniflora, Voyriella parviflora.
Литература. Don, 1838; Hofmeister, 1858a, 1858b; Eichler, 1875;
Chatin, 1879; Guignard, 1881, 1901; Johow, 1885, 1889; Leclerc du Sablon, 1885;
Baillon, 1891; Knoblauch, 1894; Gilg, 1895; Figdor, 1897; Holm, 1897; Billings,
1901; Swedelius, 1902; Guerin, 1903, 1904, 1924, 1925, 1926; Ernst, 1914; Coulter,
Chamberlain, 1915; Jacobson-Paley, 1920; Stolt, 1921, 1927; Schnarf, 1923,
1931; Oehler, 1927; Sussenguth, 1927; Woycicki, 1932a,'1,1932b, 1933, 1935; Srini-
vasan, 1941; Baum, 1948; Crete, 1949a, 1949b, 1949c, 1955, 1956c, 1959b; McCoy,
1949; Johansen, 1950; Steffen, Landmann, 1958; Руденко, 1960, 1961; Arekal,
1961; Maheshwari Devi, 1962a, 1962b; Sharma, Upadhyay, 1962; Singh, 1964;
Gulati, 1967; Vijayaraghavan, Padmanabhan, 1969; Maheshwari Devi, Satyana-
rayana, 1971; Sankara Rao, 1975, 1978, 1979, 1984; Corner, 1976; Lombardo,
Carraro, 1976b; Maheshwari Devi, Lakshminarayana, 1977; Терёхин, 1977; Drex-
ler, Hakki, 1979; Rao, Nagaraj, 1982; Padmanabhan, Rajasekaran, 1983; Sankara
Rao, Chinnappa, 1983; Lakshminarayana, Maheshwari Devi,|1985; Шамров, 1986 и
ориг. данные.
Семейство MENYANTHACEAE
Пыльники 4-гнездные. Развитие стенки гнезда пыльника происходит центро-
бежно (Guerin, 1926). Сформированная стенка пыльника состоит из эпидермиса,
эндотеция, 1—2 средних слоев и тапетума. Средние слои эфемерны. У Limnan-
themum nymphoides (=Nymphoides peltatum) и L. indicum (=N. indicum) один
средний слой, у L. cristatum (N. cristatum) 2. Тапетум однослойный,
секреторного типа. У видов рода Lymnanthemum в области связника он 2-слойный.
На стадии синапсиса клетки тапетума становятся 2-ядерными (Limnanthemum)
или многоядерными (Menyanthes). Часто эти ядра сливаются, образуя
полиплоидные ядра, которые у М. trifoliata могут вновь делиться. У L. cristatum
деструкция тапетума начинается после образования тетрад микроспор (Srinivusun,
1941). У Nymphoides humboldtianum имеются орбикулы (ориг. данные). Столки
зрелого пыльника представлена кутинизированным эпидермисом и эидотоциом
с фиброзными утолщениями. У N. humboldtianum фиброзные утолщения, рни-
виваются не только в эйдотеции, но и в 4—5 слоях клеток со стороны оинн-
ника. Спорогенная ткань состоит из 4—5 слоев клеток у L. nymphoides, Г) —10 -«
у L. indicum. К стадии синапсиса число микроспороцитов увеличивается у &.
Ю Сравнительная эмбриология
145
Menyanthaceae
1—3, 37—47 — Lymnanthemum nymphoides, 4—31 — Nymphoides humboldtiana, 32—34 —•
Menyanthes trifoliata, 35, 36 — Villarsia reniformis, 48 — Lymnanthemum indicum.
1—13 — развитие стенки пыльника и пыльцевого зерна; 14—31 — мегаспорогенез и
развитие зародышевого мешка (19, 24 — схема строения семяпочки на стадиях одноядерного
и 8-ядерного зародышевых мешков, 29 — сформированный зародышевый мешок с
антиподами, представленными ядрами, 31 — зрелый зародышевый мешок); 32—36 —
развитие клеточного эндосперма; 37—47 — развитие зародыша; 48 — образование зародышей
из синергид. (1—3— по Guerin, 1926; 4—31 — ориг.; 32—36 — по Stolt, 1921;
37—47 — по Crete, 1956; 48 — по Maheswari Devi, 1962).
nymphoides и М. trifoliata до 15—20 рядов клеток за счет митотических делений
спорогенных клеток. Тетрады микроспор тетраэдральные и изобилатеральные,
образуются симультанно. Зрелые пыльцевые зерна 3-клеточные. У видов рода
Limnanthemum отмечены случаи дегенерации одного из гнезд пыльника, а также
отдельных микроспор в тетрадах, что в дальнейшем приводит к уменьшению
числа нормальных пыльцевых зерен.
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная, с
коротким фуникулусом. Нуцеллус представлен лишь слоем эпидёрмальных клеток.
Интегумент состоит из 3—4 слоев клеток в микропилярной части семяпочки и из
4—6 — в халазальной. На более поздних стадиях развития все клетки инте-
гумента, за исключением эпидермиса, приобретают утолщенные оболочки.
Скорость формирования интегумента варьирует в пределах одного вида: в
одних случаях интегумент смыкается над нуцеллусом еще на стадии мейоза,
в других — достигает не более чем половины нуцеллуса на стадии диад или
тетрад мегаспор (Stolt, 1921). У всех изученных видов имеется интегументаль-
ный тапетум. У большинства видов он дифференцируется на стадии 4-ядерного
зародышевого мешка (Stolt, 1921), а у N. humboldtianum — тетрад мегаспор (ориг.
данные); после разрушения нуцеллуса непосредственно прилегает к
зародышевому мешку, за исключением его микропилярной части. После оплодотворения
клетки наружного эпидермиса интегумента становятся удлиненными и на
стадии октантов зародыша приобретают характерную скульптуру: отдельные пары
эпидёрмальных клеток с правильными интервалами выпячиваются таким
образом, что поверхность семенной оболочки приобретает волнистые очертания.
Остальные слои интегумента дегенерируют, исключая интегументальный
тапетум, который сохраняется до поздних стадий развития зародыша и эндосперма.
У L. cristatum имеется гипостаза (Davis, 1966). В семяпочке развивается про-
водящий пучок, который идет из фуникулуса и продолжается в интегументе,
■ 146
Menyanthaceae (продолжение)
Menyanthaceae (продолжение)
Menyanthaceae (продолжение)
доходя до микропиле. У N. humboldtiana проводящий пучок дифференцируется
на стадии археспориальной: клетки и в зрелой семяпочке представлен прокам-
■биальным тяжем клеток и элементами спиральных сосудов (ориг. данные).
Единственная археспориальная клетка закладывается субэпидермально и
преобразуется непосредственно в мегаспороцит. Тетрады мегаспор линейные,
у N. peltatum, N. humboldtianum — Т-образные и изобилатеральные. Нижняя
клетка диады у L. nymphoides и М. trifoliata всегда крупнее, чем верхняя,
деление в ней, как правило, происходит раньше. Хапазальная мегаспора, дающая
начало зародышевому мешку, всегда значительно больше остальных. У М.
trifoliata отмечено развитие зародышевых мешков из 2 соседних мегаспор (Stolt,
1926).
Зародышевый мешок развивается по Polygonum-типу. Положение ядер и
вакуолей на стадии 4-ядерного зародышевого мешка варьирует (Stolt, 1921).
Зрелый зародышевый мешок удлиненной формы, расширенный в микропиляр-
ной части, особенно у М. trifoliata. Он состоит из яйцевого аппарата и
центральной клетки с 2 сливающимися перед оплодотворением полярными ядрами. Яйцо-
клетка длиннее синергиды, ее ядро расположено в апикальной части, а крупная
вакуоль — в базальной. Синергиды грушевидной формы, имеют большие mi"
15)
жуоли в базальной части. Антиподы эфемерны. У N. peltatum и L. cristatum
клетки антипод не образуются — халазальные ядра зародышевого мешка быстро
дегенерируют (Schnarf, 1931; Stover, 1932; Davis, 1966). У L. indicum и N. hum-
boldtianum антиподы могут быть представлены как клетками, так и ядрами (ориг.
данные). У L. indicum и М. trifoliata они сохраняются на ранних стадиях
развития зародыша. Расположение антипод может варьировать: у М. trifoliata они
расположены линейно в один ряд, у Villarsia reniformis и N. humboldtianum —
в виде треугольника. Оплодотворение порогамное. Столт (Stolt, 1921) наблюдал
в одном зародышевом мешке V. reniformis ядро спермия в контакте с
яйцеклеткой, в другом — в контакте с полярным ядром. У М. trifoliata в процессе
оплодотворения разрушаются обе синергиды, у V. reniformis — лишь одна.
Эндосперм целлюлярный. У всех изученных видов клеточные перегородки
в первом и во втором делениях закладываются в поперечном по отношению к
продольной оси зародышевого мешка направлении, в результате чего образуется ряд
из 4 клеток. У М. trifoliata дальнейшие деления в халазальной паре клеток
происходят раньше, чем в микропилярной, при этом одна из этих клеток всегда
делится в продольном направлении. У V. reniformis либо все 4 клетки делятся
в поперечном направлении, образуя ряд из 8 клеток, либо 2 средние делятся
продольно, а 2 крайние — поперечно. В отличие от М. trifoliata у V. reniformis
микропилярные клетки эндосперма делятся раньше халазальных. В ходе
дальнейшего развития деления в эндосперме происходят как в продольном, так и
в поперечном направлениях. В клетках эндосперма на поздних стадиях развития
откладываются запасные белки и жиры. В зрелом семени сохраняются.
Развитие зародыша соответствует Asterad-типу Senecio-вариации. Перед
делением зигота значительно увеличивается в размерах, удлиняется и опускается
глубоко в зародышевый мешок. Деление зиготы происходит на стадии 16 и более
клеток эндосперма. Первая клеточная перегородка делит зиготу поперечно
с образованием клеток са жсЪ, дериваты которых принимают участие в
образовании тела зародыша. 4-клеточный проэмбрио имеет Т-образную форму. Клетка
•cb многократно делится как продольно, так и поперечно, образуя
многоклеточный суспензор. Клетка т дает начало гипокотилю и инициалям корня.
Клеточные перегородки при образовании квадрантов наклонные. Эмбриодерма
закладывается на стадии октантов. Противоречивые мнения существуют относительно
типа развития зародыша у L. nymphoides. Джогансен (Johansen, 1950, по даннным:
Stover, 1932 — одноклеточный суспензор, линейная тетрада клеток зародыша)
охарактеризовал его как Garyophyllad-тип. По сведениям Крете (Crete, 1956),
он развивается по Asterad-типу Senecio-вариации. В зрелом семени зародыш
прямой, дифференцированный, маленький.
У L. indicum обнаружен апомиксис — апогаметия: кроме полового
зародыша в зародышевом мешке наблюдались 2 дополнительных зародыша,
развивающихся из синергид (Maheshwari Devi, 1962a).
Исследованные виды. Limnanthemum cristatum {=Nymphoides
cristatum), L. indicum (=N. indicum), L. nymphoides (=N. peltatum), Menyanthes
trifoliata, Nephrophyllidium crista-galli (=Fauria crista-galli)
,]Nymphoideshumboldtianum, Villarsia reniformis.
Литература. Warming, 1878; Billings, 1901; Stolt, 1921, 1927; Guerin,
1925, 1926; Schnarf, 1931; Stover, 1932; Srinivasan, 1941; Soueges, 1943a;
Johansen, 1950; Crete, 1956; Maheshwari Devi, 1962a; Davis, 1966; Gulati, 1967; Под-
дубная-Арнольди, 1982; Батыгина, Колесова (ориг. данные).
Семейство DIALYPETALANTHACEAE
Эмбриологически не изучено.
Пыльник у Dialypetalanthus fuscescsns А-тв.езщш.ж, вскрывается продольными
щелями.
Эндосперм в зрелом семени скудный; клетки его содержат жиры.
Зародыш прямой.
Л и т е р а т у р a. Rizzini, Occhioni, 1949; Melchior, 1964.
Порядок 63. OLEALES
Семейство OLEAGEAE
Пыльник 4-гнездный. Сформированная стенка гнезда пыльника, развитие
которой осуществляется центробежно, состоит из эпидермиса, однослойного
эндотеция, в клетках которого по мере созревания пыльника появляются
фиброзные утолщения, 2—5 средних слоев и тапетума секреторного типа. В начале
профазы мейоза I клетки слоев стенки пыльника не отличаются друг от друга,
исключая клетки эпидермиса, которые заметно больших размеров. Но уже на
стадии синапсиса слои стенки пыльника становятся резко дифференцированными.
Средние слои эфемерные и к завершению мейоза I лизируются. Большие
одноядерные клетки эпидермиса к этому времени вытягиваются в длину и в них
появляются вакуоли. Клетки тапетума крупные, первоначально одноядерные,
затем становятся 2-ядерными, иногда наблюдается слияние этих ядер. Ядра
в основном с одним ядрышком, но встречаются по 2 и 3 ядрышка. В клетках
просматриваются крупные вакуоли. Тапетум в стенке пыльника однослойный,
со стороны связника — 2- или многослойный {Jasminum, Syringa). У Fraxinus
и Nyctanthes тапетум становится 2-слойным (Davis, 1966). У Syringa тапетум
многоядерный, с орбикулами. Эндотеций дифференцируется в фиброзный слой.
На стадии 2-клеточных пыльцевых зерен клетки эпидермиса значительно
увеличены, фиброзный слой становится нерегулярно 2-слойным. Спорогенная
ткань многослойная. Микроспороциты в течение профазы мейоза плотно
прилегают друг к другу. Они угловатой формы и лишь к концу профазы
округляются, в их оболочках откладывается каллоза. Формирование микроспор
осуществляется по симультанному типу. Их расположение в тетрадах
тетраэдральное и изобилатеральное. У Fraxinus lanceolata и гибрида F. velutina изредка
наблюдается образование Т-образных, еще реже — линейных тетрад, но всегда
наряду с тетрадами тетраэдрической и изобилатеральной формы. У Jasminum
зрелые пыльцевые зерна 2—3-клеточные (Maheshwari Devi, 1975). У всех
остальных родов семейства пыльцевые зерна 2-клеточные. Расположенная у стенки
пыльцевого зерна линзовидная генеративная клетка заметно меньше
вегетативной клетки. Окруженное цитоплазмой ядро генеративной клетки
окрашивается сильнее, чем ядро вегетативной клетки. Деление генеративной клетки
происходит в пыльцевом зерне, находящемся на рыльце-пестика непосредственно
перед началом его прорастания в пыльцевую трубку. Отмечено, что в
пыльцевую трубку первым входит вегетативное ядро, однако в ряде случаев в
пыльцевую трубку могут первыми входить и спермин, за которыми следует
вегетативное ядро. Иногда последнее остается в пределах пыльцевого зерна. Обычно
спермин удлиненной формы, их ядра довольно крупные, окружены цитоплазмой.
У Syringa villosae и S, josikaea спермин первоначально округлой формы и лишь
двигаясь по пыльцевой трубке они вытягиваются и приобретают удлиненную
форму (Иванов, Шаренкова, 1969). Запасные вещества пыльцевых зерен —
крахмал и белковые гранулы. У S. vulgaris последних в 1.5—2 раза больше,
чем у S. reflexa и S. chinensis. Сахара в пыльцевых зернах этих видов отмечены
в незначительном количестве.
У S. chinensis наблюдается ряд нарушений редукционного деления микро-
спороцитов (ускорение или отставание хромосом при переходе от мета- к
анафазе, россыпи хромосом по всему веретену, образование наряду с тетрадами
монад и иолиад). Отмечены также и аномалии в морфологии пыльцевых зерен.
Все подобного рода явления приводят в конечном итоге к образованию
стерильной пыльцы. Аналогичные нарушения вмейозе I и II были отмечены и у
Fraxinus. У Jasminum angustifolium наблюдались многоядерные пыльцевые зерна.
Семяпочка висячая, анатропная, тенуинуцеллятная, с одним мощно
развитым интегументом. У Fraxinus отмечены кампилотропные семяпочки (Валь-
цева, 1959). Нуцеллус однослойный, быстро разрушающийся. Запасные
вещества в интегументе у S. vulgaris, S. reflexa и S. chinensis — крахмал, сахара,
белки (Литвиненко, Жоголева, . 1980). Дифференцируются интегументальный
154
тапетум и гипостаза. Как правило, в семяпочке субэпидермально
закладывается одна археспориальная клетка, которая, не образуя париетальных клеток,
«ступает в профазу мейоза, трансформируясь в материнскую клетку мегаспор.
У S. josikaea, S. amurensis и Fraxinus americana отмечено заложение 2 археспо-
риальных клеток. У Jasminum закладываются 4—12 археспориальных клеток,
каждая из которых становится мегаспороцитом (Maheshwari Devi, 1975).Мейоз
завершается формированием линейной или Т-образной тетрады мегаспор.
Функционирующей является халазальная мегаспора.
Зародышевый мешок моноспорический, у большинства видов развивается
ко Polygonum-типу. У S. chinensis нами отмечено развитие зародышевого мешка
из микропилярной мегаспоры. Только у Olea europaea Тмейоз I завершается
формированием диады клеток, микропилярная из которых дегенерирует, а из
халазальной происходит формирование зародышевого мешка по Allium-типу
(Messeri, 1950; Mazzolani, 1973; Altamura Betti et al., 1982a). Зародышевый
мешок удлиненной формы, несколько расширенный в микропилярной части.
В зрелом состоянии он 7-клеточный, биполярный. Яйцевой аппарат представлен
яйцеклеткой с небольшим количеством постенной цитоплазмы и ядром,
расположенным в базальной части, апикальную часть заполняет вакуоль. Синергиды
грушевидной формы. У Nyctanthes arbortristis они имеют крючковидные выросты
на уровне ядер. Полярные ядра у Syringa равной величины и перед
оплодотворением опускаются ближе к халазальной части центральной клетки; у видов
Fraxinus они сливаются до оплодотворения. Антиподы представлены 3
эфемерными клетками, дегенерация которых завершается к моменту оплодотворения.
В цитоплазме центральной клетки зародышевого мешка наблюдаются зерна
крахмала.
Отклонения в развитии семяпочки и зародышевого мешка обнаружены
у S. chinensis и Fraxinus и выражаются в отмирании нуцеллуса еще до деления
мегаспороцита, в приостановке развития зародышевого мещка на 1—2-ядерной
стадии, в отмирании яйцевого аппарата и в дегенерации тканей семяпочки и
эндотелия. Оплодотворение у Oleaceae порогамное, осуществляется по пост-
митотическому типу. У Syringa отмечено одновременное слияние полярных
ядер и спермия, у большинства видов Fraxinus вторичное ядро зародышевого
мешка сливается со спермием. Период от опыления до деления оплодотворенной
яйцеклетки длительный. У Fraxinus и Jasminum слияние спермия с ядром
яйцеклетки и центральным ядром зародышевого мешка проходит одновременно.
Эндосперм целлюлярный. У S. josikaea первичное ядро эндосперма делится
через 1 сут после опыления. При первых 3 делениях эндосперма 'заложение
перегородок осуществляется в разных направлениях. От момента возникновения
и до развития зародыша клетки эндосперма Syringa приобретают разнообразную
форму и размеры. У Jasminum эндосперм нуклеарный и только после 32—64-
ядерной стадии в нем начинают образовываться клеточные перегородки
(Maheshwari Devi, 1975). Поверхность эндосперма руминирована по типу настоящей
руминации (Тамамшян, 1951). Деление зиготы происходит после образования
многоклеточной эндоспермальной ткани.
Эмбриогенез осуществляется по Onagrad-, Asterad-, Coryophyllad- и Solanad-
типам. У S. vulgaris первое деление зиготы поперечное. Зародыш развивается
по Onagrad-типу. Базальная клетка, делясь многократно, образует очень
длинный, состоящий из 15—17 клеток подвесок. В формировании собственно зародыша
принимает участие только апикальная клетка (Шаренкова, 1969). У S.
amurensis и О. europaea зародыш формируется по Asterad-типу. Первое деление
зиготы у О. europaea происходит поперечно через 20 сут после оплодотворения.
Апикальная клетка делится продольно. Обе клетки 2-клеточного проэмбрио
принимают участие в формировании зародыша. Подвесок у этих видов короткий
(Messeri, 1950; Шаренкова, 1969; Altamura Betti et al., 1982b). У F. velutina
апикальная клетка делится поперечно. Из нее формируется зародыш по Caryophyl-
lad-типу. Из базальной клетки образуется длинный подвесок (Copeland, I960).
У S. josikaea, S. villosa, Ligustrum ovalifolium, Nictanthesи Jasminum зародыши
■формируются по Solanad-типу из апикальной клетки. Подвесок, состоящий
у этих видов из 2—4 клеток, короткий и образуется из базальной клетки (SoutV
:ges, 1942a; Шаренкова, 1969; Maheshwari Devi, 1975). Зрелый зародыш прямой,
1Г)Г»
^
n
Oleaceae
1, 18—21 — Syrlnga chinensis, 2—17, 22—29 — S. vulgaris, 30 — Jasminum sambac, 31 —
/. angustifolium, 32—44 — Ligustrum ovalifolium.
1—3 — фрагменты формирования пыльника и пыльцевого зерна; 4—12 — микроспорогенез;
13—15 — развитие пыльцевого зерна; 16, 17 — прорастание пыльцевого зерна; 18, 19 ■—
аномальные явления в мейозе; 20, 21 — нарушения развития пыльцевого зерна; 22—26 —
мегаспорогенез и развитие зародышевого мешка; 27 — зрелый зародышевый мешок; 28 —
оплодотворение; 29 — зигота и развитие эндосперма;
дифференцированный, с 2'семядолями. У разных родов он занимает от х/4. до 3Д
общего объема семени. Клетки семядолей зародыша содержат липиды,
алейроновые зерна и кристаллы оксалата кальция. Лейкоэмбриофиты.
У Fraxinus nigra, F. velutina и Jasminum отмечалось наличие полиэмбрионии,
у видов Syringa — адвентивная эмбриония и партенокарпия.
156
Oleaceae (продолжение)
Oleaceae (продолжение)
■30 — ядерный эндосперм; 31 — зародыш и клеточный эндосперм; 32—44 —
последовательные стадии развития зародыша. (1—29 — ориг.; 30, 31 — по Maheswari Devi, 1975; 32—44 —
по Soueges,. 1942).
Исследованные виды. Fraxinus americana, F. excelsior, F. glabra,
F. lanceolata, F. nigra, F. ornus, F. oxycarpa, F. pallisae, F. pensylvanica, F. pu~
bescens, F. quadrangulata, F. syriaca, F. toumeyi, F. velutina, F. viridis, Jasminum
angustifolium, J. grandiflorum, J. nudiflorum, J. pubescens, J. sambac, Ligustrum
■ovalifolium, Nyctanthes arbortristis, Olea europaea, Syringa amurensis, S. chinensis,
S. josikaea, S. persica, S. reflexa, S. villosa, S. vulgaris.
Литература. Hoffmeister, 1858; Wanning, 1878; Jonsson, 1881; Guig-
nard, 1882; Wille, 1886; Juel, 1900; Borgenstam, 1922; Haberlandt, 1922; Dahlgren,
1923; Sommer, 1929; Andersson, 1931; King, 1938; Johnson, 1941; Soueges, 1942a;
:Steinbauer, 1943; Gopeland, 1950; Messeri, 1950; Тамамшян, 1951; Battaglia, Bre-
viglieri, 1955; Вальцева, 1959а, 19596; Mazzolani, 1961, 1963, 1973; Николаева,
1962, 1966; Bradley, Griggs, 1963; Davis, 1966; Кулиева, 1966, 1969; Иванов,
Шаренкова, 1969; Кудрявцева, Бибикова, 1969; Шатенкова, 1969; Шаренкова,
Иванов, 1970; Гецадзе, 1971; Maheswari Devi, 1975; Schrauwen, Sondheimer,
1975; Pacini, 1977b; Pacini, Juniper, 1979a, 1979b; Bhargava, 1980; Литвиненко,
Жоголева, 1980; Pacini, Gasadoro, 1981; Altamura Betti et al., 1982a, 1982b;
Makde, 1982; Поддубная7Арнольди, 1982; George, Geethamma, 1983; Bhargava,
1985; Pacini, Franchi, Bellani, 1985; Литвиненко (ориг. данные).
Порядок 64. DIPSACALES
Семейство GAPRIFOLIAGEAE
Пыльник 4-гнездный, раскрывается продольно. Гнезда в теках сохраняют
свою индивидуальность до самого вскрытия. Стенка гнезда пыльника
формируется центробежно и состоит из эпидермиса, эндотеция, одного (Abelia, Leyce-
steria), 1—2 (Sambucus), 2—3 (Lonicera, Diervilla, Weigela) средних слоев и
тапетума. У Abelia grandiflora в отдельных клетках эндотеция, среднего слоя
и тапетума могут проходить дополнительные периклинальные деления. Тапетум
2—4-ядерный, реже — многоядерный (Abelia), клеточный во время премейо-
тического и мейотического периодов. В постмейотический период происходит
реорганизация тапетума в ложный периплазмодий у видов родов Abelia, Lin-
паеа, Leycesteria, Lonicera, Symphoricarpos и Triosteum. У Diervilla, Sambucus и
Viburnum тапетум клеточный секреторный, без реорганизации, с орбикулами.
Изменения в ультраструктуре цитоплазмы тапетума до и после его
реорганизации прослежены М. А. Вишняковой у Lonicera turczaninowii и L. edulis. До
первого митоза в микроспорах тапетум обладает ярко выраженной функциональной
активностью, которая проявляется, в частности, в формировании полленкита
(пыльцевого клея). Синтез полленкита, состоящего из веществ, содержащих ка-
ротиноиды, осуществляется в тапетальных клетках начиная с премейотических
стадий. В это время в тапетуме наблюдается большое количество лейкопластов
с осмиофильными глобулами. К концу первого деления мейоза количество и
размеры глобул в пластидах увеличиваются, их осмиофилия уменьшается. К стадии
тетрад, когда начинается реорганизация тапетума в периплазмодий, ламел-
лярная структура, а затем и оболочка пластид разрушаются, строма
дегенерирует, а глобулы распределяются в цитоплазме тапетума. Процесс образования,
низкая электронная плотность и дальнейшая судьба этих глобул дают основание
предполагать их каротиноидную природу. Наряду с этими глобулами в
цитоплазме тапетального периплазмодия присутствуют липидные капли, элементы
ГЭР, многочисленные пузырьки, митохондрии и рибосомы. Деструктивные
процессы в тапетуме начинаются перед первым митозом в микроспорах —
образуются автолитические вакуоли, осуществляющие локальный автолиз
цитоплазмы. К моменту созревания пыльцевых зерен в гнезде пыльника
наблюдаются только остатки дегенерировавшей цитоплазмы и глобулы полленкита,
которые аккумулируются на экзине пыльцевых зерен. Еще одно проявление
функциональной активности плазмодиального тапетума — формирование эк-
стратапетальной мембраны, окружающей по периферии протопласт
периплазмодия. Формирование экстратапетальной мембраны происходит за счет
предшественников спорополленина, поступающих в экстраплазматическое
пространство из цитоплазмы тапетума, начиная со стадии тетрад микроспор, и.
заканчивается к началу митоза в микроспорах. Со стадии вакуолизированных
микроспор экстратапетальная мембрана становится ацетолизоустойчивой. У видов
Lonicera* после ацетолиза она представяет собой мелкогранулированное
образование средней электронной плотности с определенной для каждого вида
скульптурированностью. Межвидовые различия выражаются в густоте
расположения, в величине и форме спорополлениновых гранул. У видов с
секреторным тапетумом в зрелом пыльнике содержимое его клеток не сохраняется,
заметны лишь остатки тапетальной пленки с орбикулами. Исследование орбикул
у 7 видов рода Sambucus** также показало их таксономическую специфичность.
Орбикулы различаются частотой расположения, формой и величиной. Форма
орбикул может быть почти сферической (S. racemosa, S. ebuhis), овально-
удлиненной (S. pubens, S. sieboldiana), асимметрично-лопастной (S. tigranll).
* Исследовались Lonicera caprifolium, L. edulis, L. kamtschatica, L, tatarica, L. ttiirziilil*
nowii.
** Исследовались Sambucus coreana, S. ebulus, S. nigra, S. racemosa, S. pubens, S. aid-
boldiana, S. tigranii.
1П1»
6a
Caprifoliaceae
1—6, 31—36, 46, 47, 64 — Leycesteria formosa, 7—10, 40—43 — Sambucus coreana, 11—24,
39, 44, 45, 48 — S. racemosa, 25, 26, 29, 30 — Viburnum opulus, 27, 28 — V. dentatum, 37, 38 —
Abelia grandiflora, 49—63 — Sambucus nigra.
1—6 — развитие пыльника с реорганизацией тапетума (3, 4) в ложный периплазмодий;
.За, 6а — схемы пыльников, штриховкой показан фиброзный слой (6а) во вскрывающемся
пыльнике;
Caprifoliaceae (продолжение)
7—12 — развитие пыльника с секреторным тапетумом; 9а, 11а, 12а — схемы пыльников;
зачернен эпидермис, клетки которого заполнены танином (1—12а — поперечные срезы);
13—19 — микроспорогенез; 20—26 — развитие пыльцевого зерна: 24, 26 — зрелое 3-кло-
точное и 2-клеточное пыльцевое зерно; 27—30 — спермиогенез в пыльцевой трубке;
Ц Сравнительная эмбриология
11a
Caprifoliaceae (продолжение)
■■■■■^т> i-& ..:a:j.>a:i-5V«:^iJf:.../-;;;::;WTv.'-:',i:;,,[l|;if> " \
Caprifoliaceae (продолжение)
11«
Caprifoliaceae (продолжение)
31S4 — мегаспорогенез; 35—37 — развитие зародышевого мешка по Polygonum-типу; 35а,
38 — семяпочка с 2-ядерным и зрелым зародышевым мешком, окруженным эндотелием (37);
Caprifoliaceae (продолжение)
39—42 — мегаспорогенез и развитие зародышевого мешка по Adoxa-типу; 43, 44 — зрелые
зародышевые мешки, окруженные эпидермисом нуцеллуса;
Средние слои разрушаются во время или после мейоза и в зрелом пыльнике
у большинства родов не сохраняются, за исключением Diervilla и Weigela,
у которых слой, примыкающий к эндотецию, присутствует и в зрелом пыльнике.
Клетки эндотеция увеличиваются, в них со стадии 2-клеточных пыльцевых зерен
появляются фиброзные утолщения. Последние образуются также в 2—3 слоях
клеток связника, примыкающих к каждому гнезду, в клетках перегородки между
гнездами, в сохраняющихся средних слоях (Diervilla, Weigela). Отсутствуют
они в мелких клетках, замыкающих гнезда, в месте вскрытия тек. Клетки
эпидермиса становятся зубчатыми, покрыты тонким слоем кутикулы. У Samhu-
cus они очень крупные, заполнены танином. Стенка гнезда зрелого пыльника
состоит из 2 слоев — эпидермиса и фиброзного эндотеция — у больши истин
видов или из 3 слоев у Diervilla и Weigela. Спорогенная ткань расположена ОД"
ним (Abelia, Leycesteria), 2 (Lonicera) или несколькими слоями (Samburiis).
|!1Л
Микроспороциты и тетрады микроспор в каллозных оболочках, которые у S. со-
геапа значительно тоньше, чем у других видов. Мейоз в разных гнездах одного
пыльника проходит асинхронно, как правило, без нарушений. Образование
тетрад микроспор симультанное. У Lonicera alpigena отмечались случаи сукцес-
сивного цитокинеза (Feng, 1934). Тетрады микроспор тетраэдральные, реже '—
изобилатеральные. Зрелые пыльцевые зерна одиночные, 3-клеточные. У видов
Sambucus спермин крупные, с заметной цитоплазмой. У видов Lonicera в период,
когда генеративная клетка располагается у оболочки пыльцевого зерна, в ней
отмечается активно функционирующий аппарат Гольджи, ЭР,
митохондрии, пластиды, мелкие вакуоли. У видов Viburnum спермиогедез проходит
либо в пыльцевом зерне и они становятся 3-клеточными (Moissl, 1941), либо
166
Caprifoliaceae (продолжение)
49—63 — эмбриогенез; 64 — зрелое семя с зародышем и массивным эндоспермом; клетка
эндосперма с запасным белком, (ин. т — интегументальный тапетум, эн — эндосперм,
н — нуцеллус). (1—6, 31—38, 46, 47, 64 — рис. О. П. Камелиной; 7—24, 39—45, 48 —
рис. Н. Г. Тучиной; 25—30 — по Якобсон и др., 1984; 49—63 — по Soueges, 1959).
в пыльцевой трубке, а зерна остаются 2-клеточными с крупной генеративной
клеткой (Cave, 1962; Якобсон и др., 1984). Цитоплазма вегетативной клетки
заполнена липидами, крахмалом и белком; ядро ее чаще лопастной формы.
Семяпочка анатропная, висячая, с одним интегументом, тенуинуцеллятная.
Интегумент толщиной от 6 до 18 слоев, с хорошо выраженным
интегументальный тапетумом, который у всех исследованных родов, кроме Sambucus,
дифференцируется во время мегаспорогенеза и развития зародышевого мешка.
У видов Sambucus интегументальный тапетум дифференцируется во время
развития эндосперма, после разрушения нуцеллуса (Billings, 1901; ориг.
данные). В наружном эпидермисе интегумента накапливается танин (Abelia,
Sambucus). У Leycesteria formosa оболочки его клеток значительно утолщаются
и одревесневают. Гипостаза представлена несколькими клетками с
утолщенными оболочками и плотной цитоплазмой под зародышевым мешком. У
Sambucus — это тяж из 3—4 крупных тонкостенных клеток, иногда 2-ядерных. Халаза
нормальная. Проводящий пучок из фуникулуса доходит до халазы (Sambucus)
или до микропиле, заходя в интегумент (Leycesteria и др.). Нуцеллус развит
слабо, представлен эпидермисом, окружающим мегаспороцит, и несколькими
клетками под ним. У Viburnum acerifolium отмечалось наличие одного
париетального слоя под эпидермисом (Sunesson, 1933). Нуцеллус дезинтегрирует
во время мейоза и первых фаз развития зародышевого мешка. Исключением
является род Sambucus, у представителей которого эпидермис нуцеллуса
сохраняется в течение всего развития зародышевого мешка. Дезинтеграция его>
происходит на ранних стадиях эндоспермогенеза. Археспорий одноклеточный,
иногда 2-клеточный. Археспориальная клетка преобразуется в мегаспороцит.
Мегаспорогенез завершается образованием линейной тетрады мегаспор или
4 мегаспориальных ядер (Sambucus), распределяющихся в первичном
зародышевом мешке 2+2. Функционирующей становится, как правило, халазальная
мегаспора, иногда субмикропилярная (.Symphoricarpos) или эпихалазальная
(Abelia).
Зародышевый мешок у большинства видов моноспорический, развиваете»
по Polygonum-типу. У V. acerifolium и V. lantana отмечалось развитие-биспорн-
ческогр зародышевого мешка по Allium-типу (Sunesson, 1933), что нуждмотон
в подтверждении, так как у других исследованных видов этого рода
зародышевый мешок развивается по Polygonum-типу (Moissl, 1941; Demi, 1953). П |><>д<>'
1117
Sambucus шфодышонмй мешок тетраспорический, разнимется но Adoxa-типу.
Зрелые шфодышопыо мошки овальные, с зауженными халазальными концами,
различаются морфологией элементов. Так, у A. grandiflora яйцеклетка
грушевидной формы, сикергиды с широким округлым основанием, поляризация их
тиимчпа дли нйцового аппарата, в то время как у Sambucus все 3 клетки яйце-
ного аппарата грушевидные, дифференцированы по типу яйцеклетки (с ядром
и апикальной и вакуолью в базальной части клетки). Нитчатый аппарат хорошо
омрпжец в синергидах Ыппаеа borealis. ' Полярные ядра сливаются до или
по мремя (Sambucus, Viburnum) оплодотворения. В цитоплазме центральной
клетки у Sambucus имеется крахмал. Антиподы — 3 крупные клетки, строением
напоминающие яйцевой аппарат (Sambucus), или значительно меньше по
размерам и иной формы (Abelia); иногда представлены ядрами, быстро
дегенерирующими (Lonicera pyrenaica, Symphoricarpos racemosus). Оплодотворение поро-
гамное, двойное. У Sambucus в яйцеклетке слияние ядер происходит по
промежуточному, а в центральной клетке — по постмитотическому типу (Токе,
1980). У видов Viburnum оплодотворение осуществляется по промежуточному
типу (Якобсон и др., 1984).
Эндосперм целлюлярный. Первая перегородка закладывается поперечно
длинной оси зародышевого мешка. У Viburnum эндосперм руминирован по Spi-
gelia-типу (Periasamy, 1962). В зрелом семени эндосперм сохраняется,
содержит запасной крахмал, липиды и белок.
Эмбриогенез отличается нерегулярностью ранних стадий. У Leycesteria,
Sambucus и Symphoricarpos он чаще соответствует Solanad-типу Capsicum-вариации,
у Lonicera — Asterad-типу Репаеа-вариации. Зародыш в семени прямой,
дифференцированный, с небольшими семядолями, занимает 1/3—2/3 длины семени.
Лейкоэмбриофиты,
Исследованные виды. Abelia grandiflora, Diervilla japonica,
Leycesteria formosa, Linnaea borealis, Lonicera alpigena, L. caerulea, L. capri-
folium, L. edulis, L. involucrata, L. kamtschatica, L. ledebourii, L. myrtilloides,
L. pileata, L. pyrenaica, L. standishii, L. turczaninowii, Sambucus coreana, S- ebu-
lus, S. nigra, S. racemosa, Symphoricarpos occidentalis, S. racemosus, Viburnum
acerifolium, V. dentatum, V. foetens, V. lantana, V. lentago, V. mongolicum, V. opu-
lus, V. tinus.
Литература. Elfving, 1878; Vesque, 1878a, 1878b; Jonsson, 1879—
1880; Guignard, 1882; Hegelmaier, 1886; Helsted, 1887; Strasburger, 1889;
Billings, 1901; Tieghem van, 1908b; Lagerberg, 1909; Boenicke, 1911; Giger, 1913;
Home, 1914; Juel, 1915; Schurhoff, 1916, 1919, 1926; Dahlgren, 1923, 1927;
Netolitzky, 1926; Yamaha, 1926; Schnarf, 1931, 1938; Sunesson, 1933; Feng,
1934; Moissl, 1941; Soueges, 1945c, 1948. 1959; Dolcher, 1951; Crete, 1953, 1954;
Gave, 1962; Periasamy, 1962, 1966; Yamazaki, 1974; Вишнякова, 1983, 1984,
1986; Koncalova, Hfib, Jicinska, 1983; Тучина, 1983, 1984, 1985; Тучина, Ка-
мелина, 1983; Рустамова, Ходжаева, 1984; Якобсон и др., 1984; Плеханова,
Вишнякова, 1986; Weberling, Hildenbrand, 1986; Камелина (ориг. данные по
Abelia и. Leycesteria*); Вишнякова (ориг. данные по видам Lonicera и
Sambucus — ультраструктурные аспекты); Тучина (ориг. данные по видам
Sambucus **).
Семейство ADOXACEAE
Пыльник 2-гнездный. Сформированная стенка гнезда пыльника состоит
из эпидермиса, эндотеция, среднего слоя и тапетума, клетки которого становятся
2-ядерными. Тапетум секреторный (Cave, 1962), указание Дэвис (Davis, 1966)
об амебоидном типе' требует проверки. В эндотеции образуются фиброзные
утолщения. Средний слой эфемерный. Стенка зрелого пыльника представлена
* Материал собран в Сухумском ботаническом саду.
** Материал собран в Ватумском ботаническом саду, в Ботаническом саду ВИН
АН СССР, ГВС, дендрарии ЛТА им. С. М. Кирова.
168
Adoxaceae
1—18.—■ Adoxa moschatellina.
1 — мейоз II в микроспороците; 2,3 —
стадии развития пыльцевого зерна; 4 —
зрелое 3-клеточное пыльцевое зерно;
5,6 — мегаспорогенез; 7 — 2 мегаспороцита в нуцеллусе; 8 — 2 зародышевых мешка п
семяпочке; 9 — двойное оплодотворение; 10 — зигота и первичное ядро эндосперма; 11 — 1,4 —
первые фазы развития эндосперма; 14—18 — ранние фазы эмбриогенеза. (1—18 — но Lutfer-
berg, 1909).
эпидермисом и фиброзным эндотецием. Образование микроспор происходит
по симультанному типу. Тетрады микроспор тетраэдральные. Спермиогенез
проходит в пыльнике. Зрелые пыльцевые зерна 3-клеточные, с 2 крупными
спермиями, и которых хорошо различима цитоплазма и большие ядра, и ядром
вегетативной клетки неправильной формы. Цитоплазма пыльцевого зерна
заполнена липидами и белком.
Семяпочка анатропная, висячая, на коротком фуникулусе, с одним интегу-
ментом, состоящим из/7—8 слоев клеток, тенуинуцеллятная. Нуцеллус развит
слабо, представлен эпидермисом, окружающим археспориальную клетку,
и несколькими клетками под ней, но длительно существующий. На протяжении
всего развития зародышевого мешка эпидермис нуцеллуса сохраняется,
постепенно разрушаясь после оплодотворения, во время раннего эндоспермогенеза.
Внутренний эпидермис интегумента дифференцируется в интегументальный
тапетум после оплодотворения, во время начальных стадий развития эндосперма
и после дегенерации нуцеллуса. Гипостаза формируется также после
оплодотворения и состоит из группы небольших клеток с плотной цитоплазмой, зона
которых доходит до проводящего пучка в халазе. Такая же зона активных
густоплазменных клеток выделяется и в микропилярной части семяпочки.
В наружном эпидермисе интегумента отмечен крахмал. Проводящая система
семяпочки хорошо развита. Археспорий одноклеточный. В редких случаях
закладываются 2 археспориальные клетки рядом или одна под другой. Архе-
спориальная клетка становится непосредственно мегаспороцитом. Мегаспоро-
генез завершается образованием тетрады мегаспориальных ядер.
Зародышевый мешок тетраспорический, развивается по Adoxa-типу, с
распределением мегаспориальных ядер по полюсам зародышевого мешка 2+2.
Митотическое деление этих ядер приводит к образованию 8-ядерного
зародышевого мешка, в котором формируется яйцевой и антиподальный аппараты и
центральная клетка с 2 полярными ядрами. При этом иногда наблюдаются
неодновременное протекание митоза ядер 4-ядерного зародышевого мешка и
депрессия одного из микропилярных и халазальных ядер, в результате чего
в зародышевом мешке образуются неравноценные ядра, а затем и клетки в
яйцевом и антиподальном аппаратах. В зрелом зародышевом мешке яйцевой
аппарат представлен 2 синергидами, небольшими, с маленькими ядрами, без
нитчатого аппарата, и крупной округлой, с большим ядром яйцеклеткой. Полярные
ядра сливаются до или во время оплодотворения. Из 3 клеток антипод одна
всегда более крупная и с большим ядром, чем 2 остальные. В случае, когда
нижнее халазальное ядро 4-клеточного зародышевого мешка не делится,
образуются только 2 антиподы. Оплодотворение порогамное, двойное. Пыльцевая
трубка входит в зародышевый мешок, минуя и не разрушая синергиды,
дорастает до апикального конца яйцеклетки и вскрывается. Оплодотворение
осуществляется по премитотическому типу. Остатки пыльцевой трубки еще
некоторое время заметны в зародышевом мешке. Синергиды и антиподы
постепенно дегенерируют на ранних стадиях развития эндосперма. Отклонения
от нормального для A. moschatellina развития зародышевого мешка отмечались
в тетраплоидных популяциях этого вида и состояли главным образом в
нарушениях мейоза и митоза, приводящих к образованию в зародышевом мешке ядер
разной плоидности (Чапик, 1977). Отмечалась также вариабельность
распределения мегаспориальных ядер в первичном 4-ядерном зародышевом мешке.
Добавочные зародышевые мешки характерны для этого вида. Они образуются
из клеток археспория, находящихся рядом или под основной клеткой,
развивающейся в зародышевый мешок. Однако 8-ядерной, 7-клеточной стадии
достигают лишь первые; халазальные зародышевые мешки прекращают свое развитие
на 2- или 4-ядерной стадии, хотя и в них иногда происходит клеткообразование
(Lagerberg, 1909; Чапик, 1977).
Эндосперм целлюлярный. Начало его развития намного опережает деление
зиготы. 2 первых деления проходят с заложением продольных стенок;
образуются 4 удлиненные клетки, которые затем делятся поперечно. В зрелом
семени эндосперм массивный, содержит запасные белки и жиры.
Эмбриогенез Asterad-типа Geum-вариации. Зигота делится поперечной
перегородкой. Зародыш образуется из дериватов са и частично из сЪ,
многого
слойный подвесок — из сЪ. Зрелый зародыш маленький, прямой,
дифференцированный, с 2 небольшими семядолями, с запасным крахмалом.
Отмечены единичные случаи полиэмбрионии. Дополнительный зародыш
развивается рядом с основным. Лагерберг (Lagerberg, 1909) считает, что ов
образуется в результате «расщепления» основного зародыша. Чапик (1977)
предполагает, что дополнительный зародыш синергидного происхождения.
Апомиксис отмечен в тетраплоидных популяциях A. moschatellina, где
происходит образование нередуцированных диплоспорических зародышевых,
мешков (Czapik, 1976; Чапик, 1977).
Исследованный вид. Adoxa moschatellina.
Литература. Eichinger, 1907; Lagerberg, 1909; Schurhoff, 1926; Fager-
lind, 1938; Johansen, 1950; Soueges, 1956; Cave, 1962; Czapik, 1976; Чапик, 1977.
Семейство VALERIANACEAE
Пыльники 4-гнездные, раскрываются продольно; гнезда в теках сохраняют
свою индивидуальность. Стенка гнезда пыльника формируется центр обежно'
и состоит из эпидермиса, эндотеция, среднего слоя и тапетума. Тапетум гетеро-
морфный: в стенке пыльника он состоит из одного слоя (только у Patrinia-
intermedia иногда нерегулярно 2-слойный), а внутренняя его часть (со стороны,
связника) 2-слойная, с выростом, вдающимся внутрь спорогенной ткани,
который особенно выражен у Patrinia и Centranthus. В мейотический период
клетки тапетума становятся 4—8-ядерными. В постмейотический период
происходит реорганизация клеточного многоядерного тапетума в ложный
периплазмодий, однородная масса которого заполняет все гнездо пыльника. В зрелом:
пыльнике тапетум не сохраняется. Средний слой эфемерный, исчезает к началу
или во время мейоза. В эндотеции на ранних стадиях развития пыльника,
имеется большое количество крахмала, на поздних — в стенках клеток
образуются фиброзные пояски. Фиброзный слой окружает каждое гнездо;
отсутствуют фиброзные утолщения только в клетках, замыкающих гнезда. У
Centranthus 2 слоя клеток со стороны связника также становятся фиброзными.
Эпидермис на ранних стадиях содержит крахмал, который исчезает по мер е>
созревания пыльника. Стенка зрелого пыльника состоит из зубовидных, с
утолщенной наружной оболочкой клеток эпидермиса и эндотеция. Спорогенная
ткань 1—2- (Centranthus, Patrinia и Valerianella) или многослойная (Valeriana).
Образование тетрад микроспор происходит симультанно. Мейоз протекает
синхронно (V. phu) или асинхронно, в норме без нарушений. У P. intermedia-
в одном гнезде пыльника наблюдались последовательно все фазы мейоза I,
от профазы до телофазы. Последние были приурочены к основанию пыльника.
Тетрады микроспор в каллозных оболочках, тетраэдральные. Зрелые
пыльцевые зерна крупные, одиночные, 3-клеточные, с 2 овальными бедноплазменными:
спермиями. Ядро вегетативной клетки неправильной формы, цитоплазма
заполнена запасным белком.
Семяпочка анатропная, с одним 6—8-слойным интегументом, висячая,,
на довольно длинном (особенно у Centranthus) фуникулусе, тенуинуцеллятная,.
овальная или шаровидная (Centranthus). У V. officinalis клетки, выстилающие-
канал микропиле, покрыты кутикулой. Тонкий слой кутикулы отмечен и
на наружном эпидермисе интегумента, что характерно и для других
валериановых (Netolitzky, 1926). Дифференцируется интегументальный тапетум. У С.
ruber он нерегулярно 2-слойный. Оболочки его клеток толстые, особенно со
стороны зародышевого мешка, полисахаридные, покрыты слоем кутикулы, за
исключением нескольких клеток халазальной части. У V. officinalis радиальные-
стенки имеют большое количество плазмодесм. На тангентальных стенках
смежных с зародышевым мешком, плазмодесм не обнаружено. В семяпочках
созрелым зародышевым мешком ядра клеток интегументального тапетума
крупные. Центральная вакуоль отсутствует. Гиалоплазма плотная, насыщена
рибосомами. ЭР образует участки эргастоплазмы (из 8—11 цистерн). Аппарат"
Горльджи развит слабо. Количество пластид и митохондрий умеренное. Лейко-
171
Valerianaceae
1—10 — Valeriana phu, 11, 12 — Patrinia intermedia, 13—19 — Valerianella sp., 20, 21,
23—32 — Centranthus ruber, 22, 33, 34 — C. calcitrapa.
1—4 — развитие стенки пыльника и спорогенной ткани; 5, 6 — микроснорогенез; 7,8 —
реорганизация клеточного тапетума в ложной периплазмодий; развитие пыльцевых зерен;
9 — фрагмент зрелого пыльника и его схема (10); зачернен фиброзный слой;
пласты неправильной формы, с длинными эвагинациями перистромия,
слаборазвитым периферическим пластидным ретикулумом, одиночными тилакои-
дами, пластоглобулами и концентрическими мембранными образованиями.
После оплодотворения (наблюдение велось до торпедовидной стадии зародыша)
в интегументальном тапетуме отмечены изменения в вакуолизации протопласта,
в ультраструктуре лейкопластов, прогрессивное уменьшение плотности гиало-
плазмы, свободных рибосом и количества эргастоплазмы. Клеточные стенки,
172
Valerianaceae (продолжение)
■обращенные к зародышевому мешку, постепенно утоныпаются, их структура
изменяется, происходит накопление слизи полисахаридной природы; при этом
слой кутикулы сохраняется. Одновременно возрастает активность аппарата
Гольджи — увеличивается как число диктиосом (10—12 на срез клетки),
так и количество их цистерн (6—8). Крахмал не накапливается. В семяпочках
-со зрелым зародышевым мешком значительное количество запасного крахмала
отмечено в эпидермисе и в наружных слоях паренхимы микропилярнои части
интегумента. Во внутренних слоях интегументальной паренхимы с фазы 4-ядер-
ного зародышевого мешка наблюдается секреция слизистых веществ в экстра-
леллюдярное пространство. Она усиливается по мере созревания семени.
Выделение секрета сопровождается активизацией аппарата Гольджи,
вакуолизацией цитоплазмы, исчезновением крахмала и постепенной дегенерацией
протопласта. Гипостаза из мелких, с утолщенными стенками клеток формируется
после оплодотворения у видов Centranthus и Fedia, не выражена у остальных
родов. У V. officinalis, однако, под зародышевым мешком выделяется несколько
клеток со слабоутолщенными стенками (Asplund, 1920). По данным электронной
микроскопии, такие клетки имеют типичные целлюлозные клеточные оболочки
(с параллельным расположением фибрилл), которые постепенно утолщаются.
На них развиваются небольшие выросты. В этих клетках отмечены крупные
ломасомы. сильно развитый хондриом, аппарат Гольджи (30—40 диктиосом
на срез клетки), но без признаков гиперсекреции, и чашевидные лейкопласты
без крахмала. Нижележащие и латеральные слои клеток халазы содержат
большое количество запасного крахмала. Хлоропласты в тканях семяпочки
не обнаружены. Проводящий пучок, в котором дифференцируются кольчатые
сосуды, из фуникулуса входит в халазу и следует по интегументу почти до
микропиле. У С. ruber и некоторых видов Valeriana клетки эпидермиса
фуникулуса становятся сосочковидными и образуют обтуратор. Нуцеллус развит
слабо, представлен эпидермисом и еще одним слоем с латеральных и халазаль-
ной сторон мегаспороцита; париетальная ткань не образуется. Во время мега-
спорогенеза и развития зародышевого мешка нуцеллус постепенно разрушается
и почти полностью исчезает, сохраняясь лишь тонким слоем рядом с зауженной
халазальной частью зародышевого мешка. Археспорий одноклеточный
(изредка у С. macrosiphon, V. montana и видов Valeriana ряда Officinalis
наблюдались 2 археспориальные клетки), становится непосредственно мегаспороци-
том. Мегаспорогенез завершается образованием линейной, Т-образной или
неправильно Т-образной тетрады мегаспор. Функционирующей становится хала-
зальная мегаспора. У V. montana наблюдалось образование в нуцеллусе 2 то-
трад мегаспор (Asplund, 1920); у V. phu отмечено развитие не только халаяаль-
лой, но и эпихалазальной и субмикропилярной мегаспор до 2-ядерной стадии.
173
Valerianaceae (продолжение)
11—14 —мегаспорогенез; 15—18 — развитие зародышевого мешка;
Это же характерно для видов Valeriana ряда Officinalis, у которых в
семяпочке иногда развиваются 2 зародышевых мешка (Шугаева. 1985).
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Зрелый зародышевый мешок овальный или округлый, с зауженным халазаль-
ным концом. Яйцевой аппарат типично поляризован, состоит из очень крупных
вакуолизированных яйцеклетки и 2 грушевидных синергид с боковыми,
выростами и неярко выраженным нитчатым аппаратом. Апикальная часть всех
3 клеток у V. officinalis имеет неполные клеточные оболочки (ограничена только
плазмалеммами). Преобладающей органеллой яйцеклетки являются свободные
рибосомы. ЭР и аппарат Гольджи развиты слабо. Липидные капли редки.
Митохондрии неправильной формы, их количество заметно превышает число
Valerianaceae (продожение)
19, 20 — семяпочка; 21 — зрелый зародышевый мешок; 22 — шаровидный зародыш и
эндосперм с густоплазменными 2-ядерными микропилярными клетками; халазапьный гаусторий
эндосперма расположен в ткани гипостазы; 23—32 — эмбриогенез; 33, 34 — зрелый
зародыш в 2 плоскостях. (1—10 — по Камелиной, Малдыбековой, 1980; 11—22, 33, 34 —
рис. О. П. Камелиной; 23—32 — по Soueges, 1941).
амилопластои. Наличие крахмала-характерно для всех элементов
зародышевого мешка, il антиподы вариабельны по форме и расположению, чаще подобны
яйцевому аппарату, но значительно меньших размеров, как правило 2-ядерные,
иногда .'I ^-ядерные (С. macrosiphori). У V. officinalis их протопласты обладают
наибольший электронной плотностью по сравнению с другими клетками за-
родышопого мешка благодаря высокой плотности гиалоплазмы и обилию
свободных рибосом. Клеточная оболочка полная, с протуберанцами на всех
стенках. Полярные ядра сливаются до оплодотворения. Крупное лопастное ядро
центральной клетки располагается под яйцевым аппаратом. В рудиментарных
семяпочках стерильных камер завязи Valeriana отмечались случаи развития
тетраспорических зародышевых мешков, число свободных ядер в которых
варьировало от 4 до 32 (Asplund, 1920; Шугаева, 1985).
Оплодотворение порогамное, двойное, осуществляется по премитотическому-
типу (Шугаева, 1983, 1985). Пыльцевая трубка входит в зародышевый мешок,
разрушая одну из синергид. Вторая синергида дегенерирует, как и антиподы,
во время развития эндосперма. Иногда в зародышевый мешок входят несколько
пыльцевых трубок. У V. officinalis в ходе зиготогенеза и раннего эндоспермо-
генеза происходит постепенное достраивание клеточной оболочки зиготы и
сохраняющейся синергиды. Цитоплазма последней отличается от цитоплазмы
зиготы меньшей плотностью рибосом и наличием ЭР 2 типов — гранулярного
и агранулярного. Амилопласты синергиды с большими запасами крахмала и
распределены по всему протопласту в отличие от зиготы, где они
сконцентрированы преимущественно вокруг ядра. В антиподах хроматин ядер
конденсирован, ядрышки крупные. Контраст мембран ядерной оболочки, как и других
мембран антипод, низкий. Плотность гиалоплазмы и рибосом (преимущественно
моносом) исключительно высокая. Цистерны гранулярного ЭР протяженные,
их межмембранное пространство неравномерной толщины. Встречаются
небольшие участки эргастоплазмы. Аппарат Гольджи в состоянии гиперсекреции,
развит намного сильнее, чем в эндосперме. Митохондрии многочисленные.
Крахмальные зерна в пластидах средней величины по сравнению с эндоспермом,
где они очень крупные. На стадии 2-клеточного эндосперма количество
крахмала в антиподах сильно сокращается в отличие от сохраняющейся синергиды.
Эндосперм целлюлярный. Деление первичного ядра эндосперма
сопровождается закладкой перегородки, направление которой может варьировать
от поперечного через наклонное до продольного (Asplund, 1920; Шугаева,
1985). По данным электронной микроскопии, у V. officinalis появлению
перегородки между дочерними ядрами предшествует формирование в протопласте
первичной клетки эндосперма выпячиваний плазмалеммы и извилистых
разветвленных неравномерной толщины образований, содержащих вещество
клеточной оболочки. Срединная пластинка в них отсутствует, как и в первой
перегородке 2-клеточного эндосперма. Клеточные оболочки обеих его клеток
снабжены протуберанцами (на латеральных стенках и в отдельных зонах стенок,
смежных с сохраняющейся синергидой и сохраняющимися антиподами).
Рибосомы как свободные (преимущественно в полисомах), так и прикрепленные.
ЭР (гранулярный и агранулярный) развит очень сильно. Участки
эргастоплазмы образуют обкладки вокруг крупных вакуолей. Аппарат Гольджи
(из 4—6 цистерн) находится в состоянии гиперсекреции. Протопласт обеих
клеток эндосперма сильно вакуолизирован. Липидные тела редки.
Амилопласты неправильной формы, с сильно развитым периферическим пластидным
ретикулумом и концентрическими мембранными образованиями. Последующие
направления делений в эндосперме не упорядочены. В ходе эндоспермогенеза
наблюдается появление большого количества ломасом в месте контакта с инте-
гументальным тапетумом, выпадение хлопьевидного, а также электронно-
плотного гомогенного осадка в вакуолях вдоль тонопласта. Значительно
возрастает количество и размеры липидных тел, исчезает крахмал. Когда зародыш
достигает половины окончательной длины, лейкопласты эндосперма становятся
чашевидными. У С. calcitrapa в семяпочке с многоклеточным эндоспермом и
глобулярным зародышем отмечено наличие многоядерного халазального эндо-
спермального гаустория, внедренного в гипостазу и граничащего с собственно
эндоспермом. Цитоплазма его, оптически плотная и зернистая, и ядра отли-
176
чаются от таковых в окружающих тканях. Клетки эндосперма неоднородны:
микропилярные, окружающие базальную часть зародыша, с более плотной
цитоплазмой, без вакуолей и с 2 ядрами, а остальные клетки — одноядерные
и вакуолизированные. На более поздних стадиях таких различий уже не
наблюдается. В зрелом семени видов Valerianaceae эндосперм сохраняется одним
слоем вокруг зародыша или полностью отсутствует.
Эмбриогенез Asterad-типа Lamium-вариации или Piperad-типа Scabiosa-
вариации (Шугаева, 1985). Зигота делится чаще всего наклонной перегородкой,
только у P. rupestris — всегда поперечной. Очень часто эмбриогенез
нерегулярен, без четкой последовательности в заложении перегородок (Asplund, 1920;
Soueges, 1941). Структура суспензора вариабельна: у С. macrosiphon он 2-ряд-
ный, у С. ruber и V. dioica — длинный однорядный. Пластиды глобулярного
зародыша V. officinalis с мелкими крахмальными зернами, умеренно развитым
периферическим пластидным ретикулумом и редкими одиночными тилакои-
дами. Пластидом сердечковидного зародыша представлен хлоропластами
с 2—3 тилакоидами в гранах. У хлоропластов зародыша, достигшего половины
длины, в гранах 3—4 тилакоида, мелкие крахмальные зерна, пластоглобулы,
концентрические мембранные образования. Зрелый зародыш валерьяновых
прямой, дифференцированный, с 2 округлыми семядолями, гипокотилем,
выраженными корневым и стеблевым апексами, прокамбиальной системой,
образующей в семядолях разветвленную сеть. Запасные липиды и белки
локализуются в основном в семядолях. Хлороэмбриофиты. У V. officinalis хлоропласты
наблюдаются в зародыше с момента заложения бугорков семядолей и до
созревания семени. Пластиды зрелого зародыша представлены лейкопластами.
У видов Valeriana ряда Officinalis отмечена полиэмбриония (Шугаева,
1985).
Исследованные виды. Centranthus calcitrapa, С. macrosiphon,
С. ruber, Fedia cornucopiae, Patrinia intermedia, P. rupestris, Valeriana alliariae
folia, V. collina, V. dioica, V. fauriei, V. montana, V. nitida, V. officinalis, V. phu,
V. sambucifolia, V. supina, V. wolgensis, Valerianella coronata, V. eriocarpat
V. olitoria, V. pumila, V. rimosa, Valerianella sp.
'Литература. Hofmeister, 1858a, 1858b; Vesque, 1878; Elfving, 1879;.
Jonsson, 1881; Hegelmaiei, 1889; Tieghem van, 1908; Juel, 1915; Asplund, 1920;.
Soueges, 1923b, 1941b; Netolitzky, 1926; Schiirhofi, 1926; Skalinska, 1958; Да-
гите, Моркунас, 1968; Шугаева, 1972, 1979, 1982, 1983, 1985; Камелина, 1977,
1980; Камелина, Малдыбекова, 1980; Жукова, 1981, 1986 и ориг. данные по
электронной микроскопии V. officinalis; Камелина (ориг. данные по С. calcitrapa,.
С. ruber, P. intermedia, Valerianella sp.).
Семейство MORINACEAE
Пыльник 4-гнездный, раскрывающийся продольно. Гнезда объединены
попарно в 2 теки и не сливаются перед вскрытием пыльника, сохраняя свои>
индивидуальность. Стенка гнезда пыльника формируется центробежно и
состоит из эпидермиса, эндотеция, 2 средних слоев и тапетума. Тапетум
клеточный секреторный, морфологически однородный. 2-ядерный, на стадии 2-клеточ-
ных пыльцевых зерен полностью лизируется. Внутренпий, примыкающий
к тапетуму средний слой дезинтегрирует и исчезает раньше тапетума; второй
средний слой, примыкающий к эндотецию, становится нерегулярно 2-слойным
и сохраняется в зрелом пыльнике. В нем, как и в клетках эндотеция, образуются
тонкие фиброзные утолщения. В нескольких слоях клеток связника,
примыкающих к пыльцевому гнезду, также образуются фиброзные пояски, в
результате чего каждое гнездо пыльника окружено массивным фиброзным слоем.
Отсутствуют фиброзные утолщения только в местах вскрытия гнезд. На
ранних стадиях развития пыльника в эпидермисе, в средних слоях и эндотеции
имеется значительное количество крахмала, который постепенно исчезает
по мере развития пыльника. Стенка в зрелом пыльнике состоит из
толстостенного эпидермиса, с характерными утолщениями наружных оболочек в виде
12 Сравнительная эмбриология
177'
Morinaceae
1—14, 17, 18, 21, 24, 26, 27 — Morina lehmanniana, 15, 16, 19, 20, 22, 25, 28—50 — M. ko-
kanica, 23 — M. persica.
1—6 — развитие стенки пыльника и пыльцевого зерна; 7 — схема зрелого пыльника с
зачерненным фиброзным слоем (поперечный срез);
Morinaceae (продолжение)
8, 9 — мегаспорогенез; 10—14 — развитие зародышевого мешка;
гребешков, фиброзных эндотеция и среднего слоя. Спорогенные клетки и микро-
спороциты расположены в один или 2 четких ряда. Образование тетрад
микроспор происходит по симультанному типу. Тетрады в каллозных оболочках,
тетраэдральные, реже — изобилатеральные. Спермиогенез осуществляется
в пыльцевых зернах, находящихся в пыльнике, перед самым его вскрытием.
Зрелые пыльцевые зерна 3-клеточные, с 2 овальными, сохраняющими тонкий
слой цитоплазмы и ядрышки, спермиями и лопастным ядром вегетатипиоЙ
клетки. Цитоплазма заполнена запасным белком и крахмалом.
Семяпочка анатропная, висячая, на коротком фуникулусе, почкоииднаЯ,
с одним интегументом, тенуинуцеллятная. Из фуникулуса в халаау нходит
12*
179
Movinaceae (продолжение)
15—18 — развитие антипод;
проводящий пучок, который огибает семяпочку по вентральной стороне и
заканчивается в интегументе у микропиле. Халаза массивная, в ней и в инте-
гументе локализуется большое количество крахмала. Микропиле короткое.
Интегумент многослойный. Внутренний эпидермис интегумента
дифференцируется в интегументальный тапетум, который после дезинтеграции нуцеллуса1
примыкает к зародышевому мешку в микропилярной и центральной его части.
Гипостаза не выражена. Археспорий одноклеточный, становится
непосредственно мегаспороцитом. Мегаспорогенез завершается образованием линейной
тетрады мегаспор.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. Сформированный зародышевый мешок 7-клеточный 8-ядерный. Зрелый
180
Моггпасеае (продолжение)
20 — семяпочка (срезы в разных плоскостях); 21—23 — зрелый зародышопый мшиок;
;§»£
%,ЩШ£ЩЩ.' ]-%
25
Morinaceae (продолжение)
24 — оплодотворение; 25 — первое
деление в эндосперме ;26, 27 — ранние-
стадии развития эндосперма и зигото-
генез; 28—33 — динамика развития
семени; руминация эндосперма (32, 33);
34—50 — эмбриогенез. (1—50 — по Ка-
мелиной, 1980).
зародышевый мешок веретеновидный, крупный. Яйцеклетка — грушевидная,,
с уплощенным основанием, синергиды — с вытянутыми базальными концами,
подходящими к самому микропиле, нитчатый аппарат в них не выражен.
Полярные ядра у Morina kokanica и М. persica сливаются до оплодотворения, а у М.
lehmanntana ■— во время оплодотворения. Цитоплазма центральной клетки и
яйцеклетки содержит большое количество крахмала. Антиподальных клеток 3,
строением они напоминают яйцевый аппарат и расположены в узком халазаль-
ном конце зародышевого мешка. В процессе развития они делятся и
приобретают вид многоклеточных недифференцированных зародышеподобных структур,
функционирующих продолжительное время. Их дегенерация происходит
во время раннего эндоспермогенеза. Характерны порогамия и двойное
оплодотворение. Пыльцевая трубка вносит в одну из синергид, которая при этом,
разрушается, 2 спермия. Иногда разрушаются обе синергиды. Во время
оплодотворения объединение спермия с ядром яйцеклетки происходит намного
медленнее, чем таковое с ядром центральной клетки. Зигота перед делением заметно-
увеличивается в размерах.
Эндосперм целлюлярный. Первая перегородка закладывается поперечно
к длинной оси зародышевого мешка. В зрелом семени эндосперм сохраняется,
окружая зародыш, кроме его базальной части. Поверхность эндосперма руми-
нирована по типу ложной руминации, которая происходит за счет выростов
перикарпа. Запасные питательные вещества в эндосперме — липиды.
Эмбриогенез соответствует Calendula-вариации Asterad-типа. Зигота делится
поперечно; тетрада Т-образная; эмбриодерма вычленяется в октантах. Четко
прослеживаются закладка инициален и дальнейшая гистологическая
дифференциация зародыша. Зрелый зародыш крупный, прямой, с зародышевым корнем, в.
котором хорошо различимы апикальная меристема и корневой чехлик, с ги-
покотилем, в центральной части которого проходит прокамбиальный
пучок, достигающий выпуклого апекса побега и разветвляющийся в семядоли,
и с 2 округлыми тонкими и большими листовидными семядолями. В периблеме
гипокотиля и в семядолях накапливаются белки и в небольшом количестве-
крахмал. Зародыш не содержит хлорофилла. У М. kokanica отмечались
случаи образования 3-семядольных зародышей.
Исследованные виды. Morina kokanica, M. lehmanniana, M. longi-
folia, M. persica.
Литература. Balicka-Iwanowska, 1899; Asplund, 1920; Doll, 1927;
Vijayaraghavan, Sarveshwari, 1968; Камелина, 1973, 1976, 1977, 1978, 1979a,
19796, 1980, 1983; Камелина, Яковлев, 1974, 1976.
Семейство DIPSACACEAE
Пыльник 4-гнездный, 2-тековый, раскрывается продольной щелью. Перед,
раскрытием пыльника гнезда в теках не сливаются. Стенка гнезда пыльника
формируется центробежно и состоит из эпидермиса, эндотеция, среднего слоя
и тапетума. Тапетум в премейотический и мейотический периоды развития
пыльника — клеточный, однослойный, морфологически однородный,
многоядерный (в отдельных клетках его проходит до 3 митозов без цитокинеза);
в постмейотический период происходит его реорганизация в клеточную тапе-
тальную ткань, заполняющую гнездо пыльника. По нашим данным, во время:
реорганизации тапетума наблюдаются 2 фазы: амебоидная и клеточная.
Амебоидная фаза непродолжительная. Во время разобщения микроспор из тетрад,
стенки клеток тапетума растворяются, и протопласты с многочисленными
ядрами проникают внутрь гнезда, заполняя пространство между микроспорами.
Клеточная фаза начинается на стадии вакуолизации микроспор закладкой
между протопластами тапетума вторичных стенок и заканчивается на стадии
3-клеточного пыльцевого зерна полным лизисом тапетума, который происходит
постепенно, причем последними исчезают клеточные стенки. Средний слой
эфемерный, дегенерирует во время мейоза. На ранних стадиях в эпидермисе и
эндотеции имеются зерна крахмала. Фиброзные утолщения образуются не
184
Dipsacaceae
1 — Knautia arvensis, 2, 4—10, 12, 29 — Scabiosa lucida, 3, 15, 16, 19, 21, 25 — S. bipinnata,
11—13, 18 — S. songarica, 14 — Pterocephalus afghanicus, 17, 27 — Dipsacus laciniatus, 20, 24,
.33 — Scabiosa rotata, 22 — S. calcarea, 23 — S. olivierii, 26. 41—58 — Cephalaria gigantea,
.28 — Knautia Montana, 30, 32, 34, 37—40 — Succisa pratensis, 31 — Scabiosa rhodantha,
35 — Dipsacus dipsacoides, 36 — Cephalaria brevipalea.
1—3 — формирование гнезда пыльника; 4—10 — микроспорогенез; тапетум становится
многоядерным (10);
Dipsacaceae (продолжение)
11—15 — развитие пыльцевых зерен; реорганизация тапетума в тапетальную ткань,
заполняющую пыльцевое гнездо (11 — амебоидная, 13—15 — клеточная фазы); дифференциация^
э-ндотеция (14, 15); 16, 17 — зрелый пыльник; на схеме (17) зачернен фиброзный слой;
Dipsacaceae (продолжение)
-20 — мегаспорогенез; 21—25 — развитие
зародышевого мешка;
только в эндотеции, но и в слое, прилегающем к гнезду со стороны связника.
Стенка зрелого пыльника состоит из зубчатых толстостенных клеток эпидермиса
и фиброзного эндотеция. Спорогенная ткань однорядная, лишь в отдельных,
ее клетках проходит митоз с закладкой наклонной перегородки, в результате
чего тяж микроспороцитов, располагающихся также в один ряд, приобретает
характерные утолщения в отдельных местах. Количество спорогенных клеток
и микроспороцитов константно для видов. Мейоз в микроспороцитах протекает
без нарушений и сопровождается симультанным цитокинезом. Тетрады
микроспор изобилатералъные и тетраэдральные, в каллозных оболочках. Спермио-
генез происходит в пыльцевом зерне, находящемся в пыльнике. Зрелые пыльце-
j88
Dipsacaceae (продолжение)
вые зерна одиночные, 3-клеточные, с 2 овальными беднопл а змеиными спермиями
ш лопастным ядром вегетативной клетки, цитоплазма которой заполнена
крахмалом и липидами.
В гинодиэцичных формах отдельных видов Scabiosa, Knautia, Cephalaria
и Succisa pratensis пыльники развиваются до стадии тетрад микроспор, после
чего происходит дегенерация тапетума и микроспор, и. пыльники отмирают.
Семяпочка анатропная, висячая, на коротком фуникулусе, овальная,
« одним массивным (12—18-слойным) интегументом, тенуинуцеллятная.
Внутренний эпидермис интегумента дифференцируется в интегументальный тапе-
тум, который у видов Cephalaria, Scabiosa, Pterocephalus и Knautia представлен
крупными таблитчатыми клетками с густой цитоплазмой, а у Succisa и Dipsa-
eus — более мелкими. Оболочки его клеток со стороны зародышевого мешка кути-
визированы. Проводящий пучок из фуникулуса заходит в интегумент и
проходит не только по дорсальной, но и по вентральной стороне, огибая
семяпочку, и заканчивается немного не доходя до микропиле. В интегументе, за
исключением интегументального тапетума, локализуется значительное количество
крахмала. Микропиле длинное и прямое. Халаза нормальная, гипостаза не
выражена. Нуцеллус дезинтегрирует во время развития зародышевого мешка.
Археспорий одноклеточный, становится непосредственно мегаспороцитом. В
результате мейоза образуется линейная тетрада мегаспор, реже — неправильно
Т-образная.
J Зародышевый мешок моноспорический, развивается из халазальной
мегаспоры по Polygonum-типу. Зрелые зародышевые мешки веретеновидные или
округлые, с удлиненным халазальным концом, с крупными
дифференцированными элементами. Клетки яйцевого аппарата грушевидной формы, с обычной
для покрытосеменных поляризацией. Синергиды с крючковидными выростами
и вытянутыми базальными концами, цитоплазма в которых более плотная и
гомогенная, чем в остальной клетке. В яйцеклетке накапливается большое
количество белковых телец и крахмала. Наблюдается дегенерация одной или
2 синергид до оплодотворения, что особенно характерно для видов Scabiosa и
Knautia. Полярные ядра сливаются до оплодотворения; крупное, с большим
ядрышком ядро центральной клетки располагается под яйцевым аппаратом.
Цитоплазма центральной клетки содержит белковые соединения и липиды.
3 антиподы напоминают строением яйцевой аппарат, функционируют
продолжительное время; ядра их увеличивают плоидность либо делятся, в результате
чего у видов Cephalaria, Knautia, Pterocephalus и Scabiosa антиподы становятся
2—4-ядерными.
У видов Scabiosa отмечались отдельные случаи аномального развития
зародышевых мешков, выражавшиеся в нарушении полярности, числа митозов
190
Dipsacaceae (продолжение)
41—571— развитие зародыша; 58 — зрелое семя. (а. м. с — апикальная меристема стебля,
а. м. к — апикальная меристема корня, з — зародыш, к. ч — корневой чехлик, п. т —
ирокамбиальный тяж, эн — эндосперм). (1—10,12—58 — по Камелиной,|1980;{22 — ориг.).
и клеткообрппошшия. В некоторых семяпочках развивались дополнительные
зародышош.ш мошки, что связано, очевидно, с функционированием 2 мегаспор
тетрады.
Всем нидам свойственны порогамия и двойное оплодотворение. Пыльцевая
трубки проходит по микропиле и вносит в одну из синергид 2 спермия и ядро
вегетативной клетки. У Cephalaria gigantea оплодотворение яйцеклетки
происходит по промежуточному, а центральной клетки — по премитотическому
типу. Зигота перед делением уменьшается в размерах по сравнению с
состоянием яйцеклетки до оплодотворения.
Эндосперм целлюлярный. Первая перегородка чаще всего закладывается
вдоль зародышевого мешка. В зрелом семени эндосперм сохраняется и окружает
зародыш, кроме его базальной части. Поверхность эндосперма гладкая.
Запасные питательные вещества у большинства'видов — липиды и в незначительном
количестве белки и крахмал. У видов Scabiosa эндосперм в зрелом семени
представлен 2—4 (реже 6) слоями клеток, заполненных запасным белком.
Зародыш развивается в соответствии со Scabiosa-вариацией Piperad-типа,
при этом наблюдаются вариабельность заложения первой перегородки (от
вертикальной через наклонную до почти горизонтальной); почти равное участие
клеток, производных са и cb, в построении зародыша; глобулярная тетрада;
довольно раннее вычленение эмбриодермы, но позднее заложение гистогенов
и поздняя гистологическая дифференциация зародыша; рудиментарный суспен-
зор (особенно у видов Knaiitia и Scabiosa). Часто эмбриогенез нерегулярный.
Зрелый зародыш крупный, прямой, дифференцированный, с хорошо развитыми
семядолями и прокамбиальной системой. Основные запасные питательные
вещества — липиды и в незначительном количестве белки и крахмал. У Scabiosa
rotata и S. olivieri запасные вещества в зародыше — только белок в виде
крупных алейроновых зерен с глобоидами. У всех видов зародыши зеленые [(хлоро-
эмбриофиты).
Исследованные виды. Cephalaria alpina, С. ambrosioides, С. brevi-
palea, С. gigantea, С. leucantha, С. syriaca, С. tatarica, Dipsacus dipsacoides,
D. laciniatus, D. leschenaultii, D. sylvestris, Knautia arvensis, K. drymeja, К. ma-
cedonica, K. montana, K. neglecta, K. sylvatica, Pterocephalus afghanicus, P. brous-
sonetii, P. plumosus, Scabiosa africana, S. bipinnata, S. caucasica, S. columbaria,
S. hladnikiana, S. holosericea, S. imeretica, S. lucida, S. ochroleuca, S. olgae,
S. olivieri, S. prolifera, S'. purpurea, S. rhodantha, S. rotata, S. sicula, S. son-
garica, S. sosnowskyi, Succisa pratensis, Succisella inflexa.
Литература. Coulter, 1823; Braun, 1860; Guignard, 1882; Strasburger,
1882, 1889; Hegelmaier, 1885; Molliard, 1895; Juel, 1915; Asplund, 1920; Szabo,
1923; Lavialle, 1925a, 1925b, 1925c, 1926; Risse, 1926, 1929; Chiarugi, 1927c;
Doll, 1927; Schnarf, 1931; Поддубная-Арнольди, 1934; Soueges, 1937a, 1957b,
1963a, 1963b, 1963c; Johansen, 1950; Razi, Subramanyam, 1952; Garniel, 1963;
Камелина, Солнцева, 1971; Камелина, Яковлев, 1975, 1976; Камелина, 1976,
1977, 1978, 1979а, 19796, 1980, 1983; Frey, 1976; Солнцева, Камелина, 1976;
Вишнякова, Лебский, 1986; Камелина (ориг. данные).
Порядок 65. LOASALES
Семейство LOASACEAE
Строение пыльника, его развитие и микроспорогенез не исследованы.
Семяпочка у большинства видов семейства анатропная, с одним интегумен-
том, тенуинуцеллятная. У Blumenbachia hieronymi семяпочка гемитропная
(Garcia, 1962). Микропиле длинное. Интегумент состоит из 10—17 слоев
клеток; внутренний* эпидермис его развивается в хорошо дифференцированный
интегументальный тапетум. Гипостаза у Mentzelia laevicaulus хорошо развита,
у Loasa bergii и Caiophora lateritia не выражена. Археспориальная клетка одна,
становится непосредственно мегаспороцитом. У Mentzelia aurea, M. albescens
и М. gonsatti часто встречаются 2 археспориальные клетки, лежащие рядом,
но развивается только одна. Тетрада мегаспор линейная.
Зародышевый мешок моноспорический, развивается по Polygonum-типу,
у Loasa vulcanica из микропилярной (Kratzer, 1918), а у L. bergii и В. hieronymi
из халазальной (Garcia, 1962) мегаспоры. Изредка может сохраняться
некоторое время и субхалазальная мегаспора. После 2-ядерной стадии
зародышевый мешок начинает быстро увеличиваться и к 4-ядерной стадии становится
очень длинным. Яйцевой аппарат дифференцирован. Синергиды грушевидной
формы. Полярные ядра до оплодотворения не сливаются. 3 антиподы
продолжают существовать после оплодотворения, до образования нескольких клеток
эндосперма.
Эндосперм целлюлярный. Характерная его особенность — развитие гаусто-
риев. Микропилярный гаусторий у В. hieronymi состоит из 2 двуядерных
клеток, лежащих одна над другой; сохраняется он и в зрелом семени. Халазаль-
ный гаусторий представлен одной, сильно разветвленной одноядерной клеткой.
При дальнейшем развитии зародыша и эндосперма халазальный гаусторий
разрушается, но его остатки наблюдаются продолжительное время в основании
собственно эндосперма. Халазальный гаусторий у различных видов имеет
различную структуру: у Loasa он одноклеточный и пузыревидный, у Blumenbachia
представляет собою ветвистый слепой отросток, который врастает в интегумент,
у Caiophora я Mentzelia он многоклеточный и сильно ветвится в основании. Ядра
эндоспермальных гаусториев высокоплоидные (Hasitschka-Jenschke, 1962).
Собственно эндосперм вначале растет путем поперечных делений до
образования линейного ряда из 12 клеток. После этого продольные деления клеток
приводят к увеличению эндосперма в диаметре. Часть эндосперма потребляется
во время развития зародыша, но несколько слоев всегда остаются в зрелом
семени.
Эмбриогенез соответствует Solanad-типу. Зрелый зародыш
дифференцированный, имеет толстые мясистые семядоли, почечку и зародышевый корень.
Loasaceae
1—3 — Loasa vulkanica, 4—10 — Blumenbachia hieronymi, 11—17 — Loasa lateritia.
1—3 — мегаспорогенез; 4 — зрелый зародышевый мешок; 5—8 — эндоспермогенез;
образование микропилярного и халазального гаусториев; 9, 10 — микропилярный и халазаль-
пый гаустории; 11—17 — эмбриогенез. (1—3 — по Kratzer, 1918; 4—10 — по Garcia, 1962;
11—17 — по Crete, 1946).
13 Сравнительная эмбриология
193
9 15 " 16
Loasaceae (продолжение)
Исследованные виды. Blumenbachia hieronymi, Caiophora
lateritia, С. silvestris, Gronovia scandens, Loasa bergii, L. hispida, L. lateritia, L.
tricolor, L. vulcanica, Mentzelia albescens, M. aurea, M. gonsatti, M. laevicaulus.
Литература. Hofmeister, 1849, 1858, 1859; Soltwedel, 1882; Samuels-
son, 1913; Kratzer, 1918; Dahlgren, 1927; Crete, 1946a, 1946b; Garcia, 1962;
Hasitschka-Jenschke, 1962.
13*
Порядок 66. POLEMONIALES
Семейство GONVOLVULAGEAE
Пыльник 4-гнездный. Стенка гнезда пыльника развивается центробежн»
и D сформированном состоянии 4—5-слойная.. Средние слои ко времени
вскрытия пыльника полностью разрушаются, сохраняются эпидермис и фиброзный
эндотеций. Тапетум секреторный, с 2-ядерными клетками. У Ipomoea reptans-
(Chan, Hillson, 1971) вскоре после мейоза в тапетуме разрушаются клеточные
оболочки, протопласты сливаются в многоядерную массу периплазмодия
(ложного), который или остается в париетальном положении, или проникает вглубь,
гнезда, абсорбируясь по мере развития микроспор. Изучение генезиса тапетума.
у Convolvulus scammonia (ориг. данные) подтверждает принадлежность его к
секреторному типу. На стадии микроспороцитов клетки тапетума узкие, сильно
вытянутые радиально, в дальнейшем они разрастаются в ширину и становятся
2-ядерными. На стадии свободных микроспор тапетум сохраняет постенное-
положение, иногда его отдельные клетки образуют выпячивания внутрь гнезда.
В цитоплазме и на поверхности тапетальных клеток, а также на поверхности
пыльцевых зерен на короткий период появляются глобулы полленкита. После
их исчезновения на стенках клеток тапетума хорошо видны крупные орби-
кулы. Ко времени созревания пыльцевых зерен от тапетума остается лишь
пленка с орбикулами. Клетки спорогенного слоя не делятся митотически,
а функционируют непосредственно как микроспороциты. Тетрады микроспор<
образуются симультанно, обычно они тетраэдральные, но встречаются и изо-
билатеральные. С помощью флюоресцентной микроскопии (Waterkeyn, Bien-
fait, 1968) установлена сложная структура клеточных оболочек микроспор на
стадии тетрад. Зрелые пыльцевые зерна 2- или 3-клеточные.
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная или крас-
синуцеллятная. Интегумент массивный, 15—25 слоев у видов Ipomoea и
Convolvulus, его клетки богаты крахмалом. Наружные слои интегумента
специализируются в процессе развития семени и образуют семенную кожуру, а
внутренние паренхимные слои постепенно абсорбируются. Микропиле длинное,
изогнутое, обращено к обтуратору, развивающемуся из плаценты. Сосудистый
пучок входит в интегумент, почти достигая его вершины у видов Ipomoea (Kaur,
Singh, 1970) и Convolvulus (ориг. данные), но у Evolvulus alsinoides (Tiagi,
Gupta, 1963) заканчивается в халазе. Нуцеллус слабо развит, разрушается
вовремя формирования зародышевого мешка. Археспорий обычно одноклеточный,
реже — 2-клеточный, у многих видов Ipomoea и у С. scammonia и С. arvensis-
отделяет париетальную клетку, из которой образуется 2—6-слойная
париетальная ткань. У Е. alsinoides, Ipomoea aquatica, I. batatas ж I. staphylina археспори-
альная клетка без деления преобразуется в мегаспороцит. Тетрада мегаспор*
линейная.
Зародышевый мешок моноспорический, развивается по Polygonum-типу,,
в зрелом состоянии имеет характерную удлиненную форму. У некоторых видов
Ipomoea в семяпочке отмечены 2—3 зародышевых мешка (Jos, 1963; Kaur, 1981).
Синергиды заостренные в базальной части, иногда с крючковидными выступами
(Jacquemontia violacea, Ipomoea pulchella). У С. scammonia и Calystegia sylvestris-
базальная часть клеточной оболочки синергид сильно утолщена и имеет вид
массивного колпачка с шероховатой поверхностью. Одна из синергид
разрушается пыльцевой трубкой, другая обычно долго сохраняется и, возможно,
выполняет гаусториальную функцию. Иногда сохраняются обе синергиды и
наблюдаются jia ранних фазах эмбриогенеза (С. scammonia). Антиподы из 3
клеток, мелкиеj обычно эфемерные (Ipomoea, Convolvulus). У Evolvulus они
разрастаются и могут сохраняться после оплодотворения. Полярные ядра не
сливаются до вхождения пыльцевой трубки (Ipomoea obscura, С. scammonia).
Оплодотворение порогамное, двойное.
Эндосперм нуклеарный. Клеткообразование начинается в многоядерном
ценоците на стадии позднего глобулярного зародыша. Описаны ультраструктур-
196
Conyolvulaceae
1—8, 10—14, 16, 18—23 — Convolvulus scammonia, 9, 15, 17 — С. arvensis, 24—31 —
Ipomoea obscura.
IS _ формирование стенки пыльцевого гнезда и спорогенной ткани (продольные срезы);
4 — гнездо пыльника на стадии микроспороцитов; 5 — схема строения пыльника на стадии
микроспороцитов; 6,7 — фрагменты пыльцевых гнезд с одноклеточными и 2-клетотпыми
пыльцевыми зернами; 8,9 — схемы строения зрелого и вскрывшегося пыльника (4—9 -■■
поперечные срезы);
Convolvulaceae (продолжение)
10 — семяпочка с мегаспороцитом; 11 — тетрада мегаспор; 12 — 4-ядерный зародышевый
мешок; 13 — готовый к оплодотворению зародышевый мешок; 14 — схема строения
семяпочки;
ные^изменения, происходящие в эндосперме /. purpurea в период перехода от
ядерного состояния в клеточное (Ponzi, Pizzolongo, 1984). У С. arvensis (Sripleng,
Smith, 1960) и С. scammonia (ориг. данные) эндосперм образует латеральный
вырост в направлении дорсальной стороны семяпочки и далее к основанию
фуникулуса. В результате ценоцитная клетка эндосперма приобретает
изогнутую Y-образную форму. Растущий латеральный конец содержит густую
цитоплазму с большим количеством ядер и, вероятно, функционирует как гаусторий.
Ценоцитное состояние гаустория сохраняется в период клеткообразования
в остальной части эндосперма. Во время интенсивного роста зародыша у С,
arvensis и С. scammonia в эндосперме происходит растворение клеточных оболочек
198
Convolvulaceae (продолжение)
15—17 — начальные этапы развития зародыша;
ядерный эндосперм; 18 — схема молодого семени
на стадии глобулярного зародыша; 19 — сердеч-
ковидная стадия зародыша с суспензором;
Convolvulaceae (продолжение)
20—22 — преобразование зародыша и эндосперма на завершающих стадиях развития
семени; 23 — зрелый зародыш; 24—31 — эмбриогенез и зрелый зародыш. (2—23 — ориг.,
24—31 — по Kaur, 1969 (1970)).
и слияние содержимого клеток, за исключением 2—3 мелкоклеточных наружных
слоев (ориг. данные). В зрелом семени у исследованных представителей
семейства эндосперм скудный, представлен несколькими слоями клеток.
Эмбриогенез характеризуется поперечным делением зиготы и значительной
вариабельностью в делении первых бластомеров. Принадлежность его к тому
или иному типу определяется с большими допущениями. Джогансен (Johansen,
1950) отнес эмбриогенез С. arvensis к Onagrad-типу Lothus-вариации, Е: alsi-
noides — к Chenopodiad-типу Myosotis-вариации, эмбриогенез Ipomoea и Аг-
gyreia — к Caryophyllad-типу Myriophyllum-вариации. Эмбриогенез Ipomoea
cornea, I. purpurea, I. sinuata отнесен к Caryophyllad-типу Fumaria-вариации
(Kaur, Singh, 1970). Для представителей всех изученных родов характерен
массивный многоклеточный суспензор. У /. obscura его периферические клетки
своими пальцеобразными выростами внедряются в клеточную ткань эндосперма
(Kaur, 1969). Исследована ультраструктура клеток суспензора у /. purpurea
на последовательных стадиях развития, отмечено своеобразие пластид,
приобретающих амебоидную форму и сложную структуру, в состав которой входят
трубчатые элементы, крахмал, фитоферритин, осмиофильные глобулы и
кристаллы белка (Ponzi, Pizzolongo, 1972, 1973). Во время органогенеза зародыша
200
суспензор сжимается и не прослеживается в зрелом семени. Зрелый зародыш
имеет зародышевый корень, относительно короткий гипокотиль и крупные
листовидные, иногда складчатые, раздвоенные до основания семядоли (/.
obscura, С. scammonia). Все исследованные виды относятся к хлороэмбриофитам
(Яковлев, Жукова, 1973).
Полиэмбриония отмечена у некоторых видов рода Ipomoea ж у С. sepium.
У последнего вида предполагается синергидное происхождение дополнительного
зародыша.
Исследованные виды. Argyreia speciosa, Calystegia sylvestris,
Convolvulus arvensis, C. scammonia, Evolvulus alsinoides, Ipomoea aquatica, /.
batatas, I. biloba, I. cornea, I. hederacea, I. hispida, I. horsfalliae, I. leari, I.
obscura, I. pes-tigridis, I. pulchella, I. purpurea, I. reptans, I. sepiaria, I. sinuata,
I. staphylina, I. trifida, Jacquemontia violacea, Operculina turpethum.
Литература. Peters, 1908; Macpherson, 1921; Yamaha, 1926; Dahlgren
1927a, 1927b; Kenyan, 1928; Федорчук, 1932; Mathur, 1934; Juliano, 1935b-'
Tiwari, Rao, 1936; Soueges, 1937b; Rao K. V. R., 1940; Woodcock, 1943; Rao V. S.'
1944; Johansen, 1950; Sripleng, Smith, 1960; Bobde, 1963; Jos, 1963; Tiagi'
Gupta, 1963; Ishii, 1964; Chan, Hillson, 1968, 1971; Waterkeyn, Bienfait, 1968:
Kaur, 1969 (1970), 1981; Govil, 1970a; Kaur, Singh, 1970; Ponzi, Pizzolongo'
1972, 1973, 1984; Яковлев, Жукова, 1973, 1980; Ponzi, 1974; Dynansagar, Morning
1975; Momin, 1975; Никитичева, 1986; Никитичева, Проскурина (ориг. данные
по Convolvulus scammonia, С. arvensis, Calystegia sylvestris).
Семейство CUSCUTACEAE
Пыльник 4-гнездный, вскрывается продольными щелями в каждой теке.
Стенка пыльцевого гнезда формируется центробежно и в сформированном
состоянии представлена 4 слоями клеток, Тапетум секреторный однослойный, его
клетки' становятся 2-ядерными (Cuscuta monogyna, С. calycina, С. europaea
С. hyalina, С. planiflora) или 4-ядерными (С. epithymum), иногда одноядерными
вследствие слияния ядер. Характерно образование крупных липидных глобул
(Johri, Tiagi, 1952) или орбикул на внутренней тангентальной стенке тапе-
тальных клеток ко времени формирования одноядерных микроспор. Лизис
клеток тапетума происходит во время развития пыльцевого зерна. В зрелом
пыльнике сохраняются эпидермис и эндотеций с фиброзными утолщениями,
средний слой эфемерен. Спорогенная ткань обычно 2-слойная. Тетрады
микроспор образуются по симультанному типу, разделяются центрипетально
бороздами. Расположение микроспор в тетрадах чаще тетраэдральное, но встречается
и изобилатеральное, и крестообразное. Данные о состоянии зрелых пыльцевых
зерен противоречивы. Финн (1937), а вслед за ним Тиаги (Tiagi, 1951) считали
что для видов Cuscuta типичны 3-клеточные пыльцевые зерна, хотя вследствие
различных воздействий деление генеративной клетки может задержаться
и происходить в пыльцевой трубке. У С. reflexa (Johri, Tiagi, 1952) в зрелом
пыльнике процент 2-клеточных пыльцевых зерен выше, чем 3-клеточных.
У С. europaea и С. calycina (Govil, Lavania, 1980), С. japonica и С. monogyna
(ориг. данные) пыльцевые зерна 2-клеточные.
Семяпочка описана в литературе как анатропная (Tiagi, 1951; Johri, Tiagi,
1952; Davis, 1966), с одним интегументом, тенуинуцеллятная. По нашим
данным, у С. monogyna сформированная семяпочка амфитропная, у С. japonica —
кампилотропная. Интегумент массивный, многослойный, в зрелой семяпочке
содержит много крахмала. Клетки интегумента, примыкающие к
зародышевому мешку, начинают абсорбироваться уже во время его созревания; процесс
усиливается в период эндоспермогенеза. В зрелом семени обычно сохраняются
3 наружных слоя интегумента (Каменский, 1928). Проводящий пучок заходит
в интегумент. Характерен обтуратор, образованный удлиненными клетками
эпидермы плаценты. Нуцеллус однослойный, разрушается в период рагшитин
зародышевого мешка. Археспорий одноклеточный, редко — 2-клеточный, но
отделяет париетальных клеток.
Ш>|
Cuscutaceae
1—14, 26 — Cuscuta monogyna, 15—21, 25, 28—30 — С japonica, 22—24, 27 — С europaea.
1 — схема строения пыльника на стадии микроспороцитов; 2 — фрагмент стенки
пыльцевого гнезда со спорогеннои тканью; 3 — гнездо пыльника с микроспороцитами; 4 — тетрады
микроспор; 5—7 — фрагменты стенки пыльцевого гнезда на стадии одноклеточных и зрелых
пыльцевых зерен; 8 — схема строения вскрывшегося пыльника;
Зародышевый мешок у большинства исследованных видов (С. calycina,
С. europaea, С. japonica, С. lupuliformis, С. monogyna, С. refleza) биспорический,
АШшп-типа (Johri, Tiagi, 1952; Tiagi, 1965; Govil, Lavania, 1980; ориг. данные).
В более ранних исследованиях Федорчука (1У31) и Финна (1937) был описан
моноспорический зародышевый мешок Polygonum-типа (С. epithymum, С. hya-
lina, С. planiflora), что требует проверки. Зрелый зародышевый мешок 7-клеточ-
202
Cuscutaceae (продолжение)
9 — семяпочка с мегаспороцитом; 10 — второе деление мейоза в нижней клетке димдм;
11 — семяпочка с 2-ядерным зародышевым мешком; 12, 13 — сформированный it iipwiuli
зародышевые мешки; 14 — схема строения семяпочки, готовой к оплодотпорсмикц
ный. Синергиды грушевидные, у С. japonica и С. monogyna имеют нитчатый им
парат (ориг. данные). В центральной клетке имеется крахмал, особоппо и
большом количестве около яйцевого аппарата. Полярные ядра могут «лииитмш
до оплодотворения или в процессе объединения со спермием. Аптшпдм обычно
из 3 клеток, эфемерные; у С. japonica (Терёхин, Котов, ориг. днинык) одни II-
ядерная антипода. Оплодотворение порогамное, двойное. Пыльцоннн трубки
Ж\
Cuscutaceae (продолжение)
15—24 — начальные стадии эмбриогенеза; 25, 26 — глобулярный зародыш с
гипертрофированными многоядерными клетками суспензора, окруженный эндоспермом; 27 — спирально
скрученный зародыш в зрелом семени; 28—30 — строение эндосперма и прилегающих клеток
интегумента на стадиях: ядерного (28) и клеточного эндосперма (29) и в зрелом семени (30)
(когда клеточные оболочки эндосперма разрушены). (1—14, 25—27 — ориг.; 15—24, 28—
v 30 — по Терёхину, 1977).
входит в одну из синергид, хотя отмечены случаи сохранения обеих синергид
рядом с пыльцевой трубкой (С. calycina, С. еигораеа). Интактная синергида
обычно увеличивается в объеме и сохраняется, тесно примыкая к суспензору
зародыша, до поздней стадии его развития. Состояние этой синергиды
позволило исследователям предположить ее гаусториальную функцию.
Эндосперм нуклеарный. Клеткообразование наступает по достижении
многоядерного состояния ценоцита: около 1500 ядер у С. rostrata (Smith, 1934) или
около 1000 ядер у С. hyalina и С. planiflora (Tiagi, 1951). Основное запасное
вещество эндосперма — крахмал. На завершающих этапах эмбриогенеза
происходит лизис клеточных оболочек эндосперма и превращение его в гомогенную
желеобразную массу (Johri, Tiagi, 1952; Терёхин, 1977), которая в значительной
степени потребляется во время развития зародыша и при прорастании. В зрелом
семени эндосперм имеется в небольшом количестве.
Зигота делится поперечно. Поведение базальной и апикальной клеток 2-
клеточного проэмбрио вариабельно, в связи с чем определение типа эмбриогенеза
затруднено (Федорчук, 1931; Johri, Tiagi, 1952). В зависимости от того,
делится ли базальная клетка (cb), эмбриогенез одних видов отнесен к Caryophyl-
lad-типу Corydalis-вариации (Johansen, 1950), а других — к Solanad-типу
(Johri Tiagi, 1952), но это в значительной мере условно. У видов Cuscuta
описаны 2 типа'строения суспензора. У одних видов суспензор образуется из не-
поделенной базальной клетки (cb) и производных апикальной клетки (са) и
состоит из 2—4 гипертрофированных ценоцитных клеток (С. monogyna, С. ja-
ponica, С. lupuliformis), содержащих до 70 ядер. У другой группы видов (С.
еигораеа, С. gronovli, С epithymum, С. hyalina) суспензор состоит из нескольких
одноядерных клеток, производных базальной клетки (cb). Однако у С. reflexa
(Johri Tiagi, 1952) встречаются оба типа суспензора. Зрелый зародыш сильно
удлиненный и спирально закрученный, апекс побега образует иногда 1—2
чешуевидных листовых зачатка; семядоли и зародышевый корень отсутствуют.
У С. reflexa отмечены случаи полиэмбрионии предположительно синергид-
ного типа. Зародыши у С. campestris, С. еигораеа, С. lupuliformis содержат
хлорофилл (Яковлев, Жукова, 1973).
204
Cuscutaceae (продолжение)
Исследованные виды. Cuscuta calycina, С. epithymum, С. euro-
раеа, С. gronovii, С. hyalina, С. japonica, С. lupuliformis, С. monogyna, С. plani-
flora, С. reflexa.
Литература. Coulter, Chamberlain, 1903; Peters, 1908; Asplund, 1920;
Macpherson, 1921; Dahlgren, 1927a; Каменский, 1928; Федорчук, 1931; Johri,
Nand, 1934; Smith, 1934; Финн, 1937; Johri, 1951; Tiagi, 1951a, 1965c; Johri,
Tiagi, 1952; Govil, 1970; Яковлев, Жукова, 1973; Терёхин, 1977; Narayana,
Sundari, 1978; Govil, Lavania, 1980; Johri, Ambegaokar, 1984; Lyshede, 1984;
Никитичева, Терёхин (ориг. данные).
Семейство POLEMONIACEAE
Пыльник 4-гнездный. Стенка гнезда пыльника формируется центробежно-
и состоит из эпидермиса, эндотеция, среднего слоя и тапетума. Клеточные
оболочки эндотеция зрелого пыльника содержат фиброзные утолщения. Средний
слой эфемерный. Тапетум секреторного типа или с реорганизацией в
амебоидный тапетум или в ложный периплазмодий; при определении типа тапетума
встречаются и противоречивые данные, что требует дополнительных
исследований. По одним данным, тапетум Polemoniaceae, за исключением Cobaea scan-
dens, — амебоидный (Schnarf, 1931), по другим данным, у С. scandens
наблюдается реорганизация тапетума в ложный периплазмодий, а у Polemonium
caeruleum реорганизация отсутствует (Juel, 1915). Имеется, однако, описание
реорганизации тапетума в ложный периплазмодий и у P. caeruleum; она начинается
на стадии тетрад микроспор (Sundar Rao, 1940): клетки тапетума увеличиваются,
их оболочки утоныпаются. В период развития экзины и интины пыльцевых
зерен клеточные оболочки тапетума уже не выявляются. Протопласты его клеток:
распределяются между пыльцевыми зернами, когда они становятся 2-клеточ-
ными. Эндотеций в этот период уже полностью дифференцирован. У Gilia ca-
pitata и видов Polemonium, включая P. caeruleum, подобных явлений не
наблюдали (Kapil et al., 1968). У P. caeruleum (Simdar Rao, 1940) и G. capitata
(Kumar, Jain, 1977) клетки тапетума сначала становятся 2-ядерными, а в период,
цитокинеза в микроспороцитах ядра в них сливаются, становясь тетраплоид-
ными. У P. caeruleum и P. pulcherrimum ядра тапетума в процессе полиплоиди-
зации претерпевают несколько делений и слияний (Kapil et al., 1968). У Phlox
paniculata (Cooper, 1933) клетки тапетума описаны как одноядерные; отмечены,
однако, случаи и 2-ядерного тапетума. Образование тетрад микроспор
симультанное. Тетрады микроспор тетраэдральные или крестообразные. У G.
capitata отмечены и изобилатеральные тетрады. Пыльцевые зерна 2-клеточные.
Генеративная клетка P. caeruleum веретеновидной формы.
Семяпочка анатропная, с одним массивным интегументом, 7—10- {Gilia).
или 15—20-слойным {Polemonium), тенуинуцеллятная. Микропиле длинное,
изогнутое. У лейкоэмбриофита P. caeruleum при распускании цветка все ткани
интегумента содержат хлоропласты. Протопласты его клеток богаты
рибосомами, преимущественно моносомами, и сильно вакуолизированы, особенно
клетки паренхимы интегумента. Клетки наружной эпидермы неправильной
формы. Контур их наружных стенок чрезвычайно извилист. После
оплодотворения отмечены значительные изменения в структуре и размерах этих клеток,
что связано, по-видимому, с переходом их к секреторной активности. Они
увеличиваются в несколько раз; их наружные и радиальные клеточные стенки
выпрямляются. Клетки эпидермы выделяются и некоторыми особенностями
ультраструктуры протопластов. Уже в период цветения в них довольно сильно
развит аппарат Гольджи. Диктиосомы состоят из 5—6 цистерн, находятся в
состоянии гиперсекреции. Хлоропласты интегументальной паренхимы в 2—3 раза
крупнее хлоропластов эпидермы и субэпидермального слоя; они содержат
больше крахмала, имеют более развитую систему тилакоидов (до 7—9 тилакои-
дов в гранах против 2—3) и расположены в узком пристенном слое цитоплазмы.
Они неправильно-овальной формы, с длинными эвагинациями перистромия.
Размер пластид не превышает 3.5—4.0 мкм по длинной оси хлоропласта. Для
хлоропластов интегумента характерны также рибосомы, пластоглобулы, пери-
206
Polemoniaceae
1—3, 6—8, 10, 18—26, 28 — Polemonium caeruleum, 4, 5, 11,13, 15, 16,27 — Gilia capitata,
9, 12, 14 — Polemonium pulcherrimum, 17 — Leptosiphon androsaceus (=Gilia androsacea).
1—10 — микроспорогенез; развитие стенки гнезда пыльника и пыльцевого зерна;
ферический пластидный ретикулум (изредка встречаются периферические ти-
лакоиды) и контакты с митохондриями. Последние при этом собраны в группы.
У видов Polemonium и у С. capitata дифференцируется интегументальный
тапетум. Он отсутствует у Leptosiphon androsaceus {==Gilia androsacea) и Phlox
drummondii (Billings, 1901). Нуцеллус развит слабо. У С. scandens клетки
эпидермы нуцеллуса в районе микропиле увеличиваются и удлиняются. Их
увеличение происходит одновременно с усилением вакуолизации цитоплазмы,
которая наблюдается в виде тонкого пристенного слоя. У G. capitata и P.
pulcherrimum описана гипостаза; у G. capitata на стадии зрелого
зародышевого мешка отмечен слабодифференцированный фуникулярный обтуратор.
У Ph. drummondii он хорошо выражен, снабжен сосочковидными клетками.
Проводящий пучок не достигает халазы (Савченко, 1973). Археспорий
одноклеточный. Париетальная ткань не образуется. У P. pulcherrimum отмечены
207
Polemoniaceae (продолжение)
11—15 — мегаспорогенез и развитие зародышевого мешка; 16, 17 — отдельные фазы эндо-
спермогенеза; видны синхронные деления ядер эндосперма (16) и эндоспермальный
гаусторий (17); 18—26 — последовательные фазы эмбриогенеза; 27 — зародыш в период
органогенеза; 28 — зародыш семени. (1—3, 6—8, 10 — по Sundar Rao, 1940; 4, 5, 9, 11—16, 27
28 — по Kapil et al., 1968(1969); 17 — no- Billings, 1901; 18—26 — no Soueges, 1939)!
случаи заложения нескольких археспориальных клеток. Функциональной
становится только одна из них (Kapil et al., 1968). Тетрада мегаспор линейная,
изредка Т-образная. Функционирует халазальная мегаспора.
Зародышевый мешок развивается но Polygonum-типу. У L. androsaceus его-
халазальная половина заужена и вытянута в виде трубки. Синергиды
грушевидные. Антиподы — 3 клетки, они эфемерны, дегенерируют перед или вскоре после-
оплодотворения. Полярные ядра сливаются до оплодотворения. Описано
двойное оплодотворение (Маркова, 1947). Пыльцевая трубка сохраняется на
протяжении свободноядерной фазы развития эндосперма.
Эндосперм нуклеарный. Его первичное ядро делится намного раньше
зиготы. Первые деления ядер эндосперма синхронны. У L. androsaceus описан
эндоспермальный , гаусторий (Billings, 1901). Клеткообразование в эндосперме
G. capitata начинается при наличии в нем не менее 64 ядер, в то время как у Ро-
lemonium во время перехода к клеткообразованию в эндосперме насчитывается
128 или 256 ядер. Семя с обильным (Polemonieae и Gilieae) или скудным
эндоспермом; иногда без эндосперма. Клетки зрелого эндосперма тонкостенны и
насыщены запасным крахмалом.
Согласно Джогансену (Johansen, 1950), развитие зародыша соответствует
Polemonium-вариации (P. caeruleum) или Myosotis-вариации (Polemonium раи-
ciflorum) Chenopodiad-типа. У G. capitata, однако, первое деление апикальной
клетки вертикальное. Зародыш зрелого семени крупный, прямой, дифференци-
208
рованный, с 2 семядолями, выраженными стеблевым и корневым (с четко
выделяющимся чехликом) апексами и проваскулярными пучками (Gilia,
Polemonium), или слегка согнутый, дифференцированный на 2 семядоли, почечку,
гипокотиль и зародышевый корень. У представителей триб Cantueae и СоЬаееае
зародыш бесцветный, а у некоторых видов из подсем. Polemonioideae, например
у Phlox bifida, зародыш зеленый (Brand, 1907). По нашим данным, не только-
виды СоЪаеа, но и Polemonium относятся к лейкоэмбриофитам; исключение
составляют виды Phlox и Collomia coccinea, зародыш которых в период
органогенеза содержит хлорофилл (Яковлев, Жукова, 1973, 1980).
Отмечены случаи полиэмбрионии. У P. caeruleum — естественная партено-
карпия (Кордюм, 1963).
Исследованные виды. Cobaea scandens, Collomia coccinea, С. gran-
diflora, Gilia capitata, G. millefoliata (=G. multicaulis), G. tricolor, Leptosiphon
androsaceus (—Gilia androsacea), Navarretia squarrosa (=Gilia squarrosa), Phlox
bifida, P. drummondii, P. paniculata, Polemonium caeruleum, P. flavum, P. la-
cteum, P. pauciflorum, P. pulcherrimum.
Литература. Jonsson, 1879—1880; Billings, 1901; Brand, 1907; Juel,
1915; Farr, 1920; Schnarf, 1921a, 1931, 1938; Netolitzky, 1926; ScMrhoff, 1926;.
Dahlgren, 1927; Cooper, 1933; Soueges, 1939a, 1942b, 1945b; Sundar Rao, 1940;.
Маркова, 1945, 1947; Miller, Wetmore, 1945; Johansen, 1950; Кордюм, 1963;
Crete, 1965; Davis, 1966; Тахтаджян, 1966; Kapil et al., 1968 (1969); Govil, 1970b;
Савченко, 1973; Яковлев, Жукова, 1973, 1980; Corner, 1976; Kumar, Jain, 1977;
Поддубная-Арнольди, 1982; Bouman, 1984; Жукова (ориг. данные по Polemonium
caeruleum).
Семейство HYDROPHYLLACEAE
Развитие стенки гнезд пыльника не исследовано. Тапетум секреторный,,
одноядерный (Davis, 1966). Образование тетрад микроспор происходит симуль-
танно. Зрелые пыльцевые зерна 2-клеточные. У Nemophila maculata и N. insig-
nis форма генеративной клетки варьирует от эллипсоидальной до веретеновид-
ной. Генеративная клетка Hydrophyllum virginicum, как и ее ядро, очень
сильно вытянута в длину; один ее конец заостренный, другой — тупой. У Pha-
celia congesta ядро генеративной клетки продолговатое; цитоплазма при свето-
оптическом исследовании выявляется с трудом (Schnarf, 1938).
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная.
У Ph. congesta и Ph. tanacetifolia семяпочка сильно вытянута в длину, у Ph. whit-
lavia она короткая. Интегумент 6—8-слойный (Hydrolea). Клетки его наружного
эпидермиса очень крупные, на ранних фазах развития содержат крахмал.
Внутренний эпидермис дифференцируется в интегументальный тапетум. Увеличение
его клеток и удлинение их в радиальном направлении начинаются в период
деления мегаспороцита. Он сохраняется вплоть до почти полной резорбции
паренхимы интегумента или имеется и в зрелом семени в качестве запасающей
ткани (Kainradl, 1927). Нуцеллус дезинтегрирует в процессе созревания
зародышевого мешка (сохраняются лишь несколько клеток между его зауженной
халазальной частью и интегументальным тапетумом). Сосудистый пучок
доходит до халазы. Между его концом и основанием зародышевого мешка
дифференцируется тяж вытянутых в длину клеток, который особенно ярко выражен
на фазе сформированного зародышевого мешка. Археспорий одноклеточный.
У Hydrolea zeylanica и Pholistoma membranaceum изредка встречаются 2 архе-
спориальные клетки. Париетальные клетки отсутствуют. Тетрада мегаспор
линейная. Функционирует халазальная мегаспора.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Яйцеклетка меньше синергид (у видов Pholistoma несколько крупнее их).
Синергиды грушевидные; у Ph. tanacetifolia — с нитчатым аппаратом, у Hydrolea
zeylanica в них наблюдаются крупная микропилярная и халазальная вакуоли.
Цитоплазма центральной клетки зародышевого мешка Н. zeylanica и бидон J'Iid-
listoma сильно вакуолизирована. -Полярные ядра сливаются до оплодотпоро-
ния. 3 мелкие антиподы эфемерны. Описано двойное оплодотворение.
14 Сравнительная эмбриология
Ж
Hydrophyllaceae
1 — Hydrolea spinosa, 2 — Phacella congesta, 3—9, 23 — Ph. tanacetifolia, 10—15—Ne-
mophila insignis, 16—22 — Ellisia nyctelea.
1 — зародышевый мешок перед оплодотворением; 2 — семяпочка в ранний период
эмбриогенеза; 3—22 — последовательные фазы эмбриогенеза; 23 — продольный срез семени;
хорошо виден руминированный эндосперм. (1 — по Kainradl, 1927; 2 — по Billings, 1901;
■3—9 — по Crete, 1946; 10—15 — по Crete, 1947; 16—22 — по Crete, 1954; 23 — по Каден,
1971).
Эндосперм целлюлярный (Hydrolea spinosa, Nemophila aurita (=Pholistoma
auritum), N. insignis, Ph. congesta, Ph. viscida, виды Pholistoma, Romanzoffia
sitchensis) или нуклеарный (Phacelia malvaefolia ж Ph. tanacetifolia). Y.Ph.par-
ryi описан эндосперм промежуточного типа (Davis, 1966). На обоих полюсах
зародышевого мешка образуются эндоспермальные гаустории. У видов
Nemophila халазальный гаусторий крупнее микропилярного; он разрушает
основание нуцеллуса и часть халазы (Netolitzky, 1926). У Н. spinosa гаустории
представлены гигантскими, сильно разветвленными одноядерными клетками,
которые пронизывают интегумент. Максимально'го развития они достигают в период
заложения семядолей у зародыша (Kainradl, 1927). Виды Phacelia
характеризуются отсутствием микропилярного гаустория (Svensson, 1925; Netolitzky, 1926;
Davis, 1966). Халазальный гаусторий у Ph. congesta, Ph. parryi и Ph.
tanacetifolia короткий, а у Ph. malvaefolia и Ph. viscida имеются 1—2-ядерные выросты.
У N. aurita (=Pholistoma auritum) отмечены микропилярный и 2 халазальных
210
гаустория. Латеральные ответвления одноядерных гаусториев у видов
Pholistoma достигают плаценты (Berg, 1985). У Romanzoffia гаустории не отмечены
(Davis, 1966). В зрелом семени эндосперм обильный, окружающий зародыш,
руминированный. Его клеточные оболочки сильно утолщены, пронизаны
порами; дают амилоидную реакцию (Ellisia, Hydrophyllum, Nemophila). Клетки
эндосперма не содержат крахмала. Запасные вещества эндосперма Н. spinosa —
белки и липиды.
Эмбриогенез Ph. tanacetifolia соответствует Hyoscyamus-вариации Solanad-
типа (Johansen, 1950). При исследовании эмбриогенеза N. insignis (Crete, 1947)
и Ellisia nyctelea (Crete, 1954) отмечены значительные отклонения от указанного
типа. Эмбриогенез Pholistoma membranaceum Onagrad-типа (Berg, 1985).
Зародыш Ph. tanacetifolia в период органогенеза содержит хлорофилл (в зрелом
семени зародыш бледно-желтый). В зародыше Hydrophyllum canadense и Н. vir-
ginicum в этот период эмбриогенеза хлорофилл не обнаружен. Это подтвердило
установленную ранее (Яковлев, Жукова, 1973, 1980) принадлежность видов,
рода Hydrophyllum к лейкоэмбриофитам. Зародыш зрелого семени небольшой,
занимает от V4 до 3/4 его длины, прямой или слегка изогнутый, дифференцирован
на 2 семядоли, гипокотиль, почти равный по длине семядолям, и почечку.
Зародыш без крахмала.
Исследованные виды. Ellisia nyctelea, Hydrolea spinosa, H. zey-
lanica, Hydrophyllum canadense, H< fendleri, H. occidentale, H. virginicum,
Nemophila aurita (=Pholistoma auritum), N. insignis, N. maculata, Phacelia
congesta, Ph. malvaefolia, Ph. parryi, Ph. tanacetifolia, Ph. viscida, Ph. whitlavia,
Pholistoma auritum, Ph. membranaceum, Ph. racemosum, Romanzoffia sitchensis.
Литература. Hofmeister, 1858a, 1958b, 1959; Jonsson, 1879—1880;
Strasburger, 1884; Billings, 1901; Svensson, 1925; Netolitzky, 1926; Kainradl,
1927; Schnarf, 1931,1938; Wulff, Raghavan, 1938; Mitra. 1945,1947a; Crete, 1946d,.
1947, 1954d; Johansen, 1950; Davis, 1966; Тахтаджян, 1966, 1970, 1980; Chen,
1968; Каден, 1971; Яковлев, Жукова, 1973, 1980; Corner, 1976; Поддубная-
Арнольди, 1982; Berg, 1985; Жукова (ориг. данные по Hydrophyllum canadense,
Н. virginicum).
Семейство BORAGINACEAE
Пыльник 4-гнездный; гнезда попарно объединены в 2 теки. Перед вскрыва-
нием гнезда пыльников сливаются вследствие разрушения перегородки между
ними. Стенка гнезда пыльника, развивающаяся центробежно, состоит из
эпидермиса, эндотеция, среднего слоя и тапетума. Средний слой эфемерный. Та-
петум секреторный, 2—4—6-ядерный у Echium, Lycopsis, Anchusa, Coldenia,
Heliotropium и Tournefortia и одноядерный у Cynoglossum, Pulmonaria,
Symphytum, Trichodesma и Mertensia. У Mertensia platyphylla полиплоидные ядра
тапетальных клеток образуются путем слияния диплоидных ядер; в них
содержатся скопления хроматина, напоминающие хромосомы. У Trichodesma indicum
и Т. zeylanicum наметается тенденция к слиянию ядер тапетальных клеток в
полиплоидные. Лизис тапетума завершается ко времени образования 2-клеточной
пыльцы. В зрелом пыльнике стенка представлена эпидермисом, наружные
стенки которого кутинизированы, и эндотецием с фиброзными утолщениями.
Мейоз в микроспороцитах завершается симультанным образованием тетрад
микроспор изобилатерального типа. У гибридов Pulmonaria отмечена поли-
спория. У Echium часть растений в популяциях имеет стерильные пыльники
(гинодиэция). Стерилизация пыльников происходит после образования тетрад
микроспор; ей предшествуют регулярные нарушения мейоза. Зрелые
пыльцевые зерна 3-клеточные (Coldenia, Echium, Mertensia paniculata) и 2-клеточные
(М. platyphylla, Trichodesma, Heliotropium). В пыльцевых зернах присутствует
крахмал. Спермин веретеновидные.
Семяпочка анатропная или гемитропная (Trichodesma, Coldenia), с
удлиненным фуникулусом (Adelocaryum), с одним многослойным интегументом, тенуин-
уцеллятная. У Cynoglossum количество слоев клеток в интегументе в период
развития зародышевого мешка 18—19, у Coldenia proc'umbens — 10, при созрева-
& 14* 211.
Boraginaceae
1, 2, 4,6,8 — Pulmonaria obscura, 3, 5, 7, 9—18 — P. mollissima, 19—26 —Echium amoenum,
27—37 — Mertensia platyphylla, 38—42 — M. paniculata.
1—4 — развитие пыльника: 1 — профаза мейоза I в микроспороцитах, тапетум
одноядерный, 2 — микроспоры; средний слой и тапетум дегенерируют, 3 — микроспоры; начало
дифференциации тапетума, 4 — 3-клеточная пыльца; эндотеций с фиброзными утолщениями;
нии зародыша их остается 5—6. У Heliotropium образуется интегументальный
тапетум. У С. procumbens и Trichodesma развивается массивный обтуратор.
Проводящий пучок, разветвляясь, проходит по фуникулусу к интегументу. Архе-
спориальная клетда, становящаяся непосредственно мегаспороцитом,
закладывается субэпидермально. У Coldenia, Mertensia, Heliotropium, Lycopsis и
Borago отмечались 2 археспориальные клетки. Тетрада мегаспор линейная, но
у Т. zeylanicum и Ehretia тетрада мегаспор Т-образная.
Зародышевый мешок моноспорический, развивается по Polygonum-типу
из халазальной мегаспоры. У Anchusa, Lycopsis ж Cynoglossum описан Allium-тип
развития зародышевого мешка. Иногда в зародышевом мешке встречаются
боковые выросты (Anchuseae, Echieae). Зрелый зародышевый мешок состоит из
яйцеклетки, 2 грушевидных синергид и центральной клетки. Антиподы, как
правило, быстро исчезают, но у М. platyphylla они сохраняются. У Heliotropium
europaeum наблюдалось 6 антипод. Полярные ядра сливаются до оплодотворения
[Ehretia, Heliotropium, Cordia, Echium vulgare, E. amoenum) или после него
(Adelocaryum malabaricum, A. coelestinum, Cynoglossum amabile, Echium russi-
cum). Оплодотворение порогамное, пыльцевая трубка проникает в зародышевый
мешок, разрушая синергиду.
Начальные стадии развития эндосперма разнообразны. В 3 подсемействах
(из 5) — Cordioideae, Ehretioideae и Heliotropioideae — эндосперм целлюлярный.
Данные о подсем. Wellstedioideae неизвестны. В подсем. Boraginoideae у Ompha-
lodes, Cynoglossum, Lindelofia, Solenanthus, Lappula, Amsinsckia, Asperugo и
Myosotis эндосперм целлюлярный; у Mertensia, Trichodesma, Onosma, Borago,
E. russicum, С amabile — нуклеарный. У Echium plantagineum Свенсоном
(Svensson, 1923c) эндосперм был описан как гелобиальный, и эта точка зрения
поддержана Шнарфом (Schnarf, 1931) и Магешвари (Maheshwari, 1954). Сход-
212
ное развитие эндоснерма отмечено у Е. vulgare (Malecka, 1975; Верещагина,
1976). Однако Свами с соавторами (Swamy, Ganapathy, 1957; Swamy, Parames-
waran, 1963; Swamy, Krishnamurthy, 1973; Swamy, 1974) считают
неправомерным относить развитие эндосперма Е. plantagineum к гелобиальному типу.
Своеобразно протекает развитие эндосперма у Pulmonaria, описанное как
вариация гелобиального типа (Верещагина, 1982). Развитие эндосперма в
подсемействе бурачниковых отличается большим разнообразием, в пределах
которого намечается ряд промежуточных вариантов, связывающих нуклеарный и
целлюлярный типы эндосперма, что отражено на схеме. Клеткообразование
в эндосперме начинается у Trichodesma, когда зародыш становится 6—8-клеточ-
ным, у Pulmonaria и ЕсЫит — при шаровидном зародыше. У Heliotropium
формируется эндоснермальный микропилярный гаусторий. Зародыш
развивается по Asterad-типу (Lycopsis, Anchusa, Trichodesma, Alcanna, Pulmonaria,
Omphalodes, Onosma); Solanad-тип описан у Heliotropium strigosum, H. curas-
savicum и H. ovalifolium; Chenopodiad-тип — у Myosotis, Echium, Coldenia,
Cynoglossum, Heliotropium Iperuvianum и Н. indicum. У Н. scabrum обнаружен
Onagrad-тип развития зародыша (Khaleel, 1978).
213
Вогадгпа.сеае (продолжение)
11, 12 — двойное оплодотворение; 13—17 — развитие эндосперма: 13 — первое деление
первичного ядра эндосперма, сопровождающееся образованием перегородки, 14, 15 —
деление халазальной клетки, 16 — образование 4 халазальных клеток, 17 — зародышевый,
мешок с шаровидным зародышем; переход от ценоцитной стадии к клеточной; в халазаль-
ном конце клетки с полиплоидными ядрами; 18 — сравнительный размер ядер
халазалъной клетки и центральной клетки эндосперма (я. х. к — ядро халазальной клетки,.
я. и. к — ядра центральной камеры);
Boraginaceae (продолжение)
19-22 - двойное оплодотворен^; 23-26 - развитие эндосперма (яц - яйцеклетка
спермий, ц. я — центральное ядро); '
Boraginaceae (продолжение)
27—42 — развитие зародыша; 43 — схема развития эндосперма у некоторых бурачниковых.
(1—4 — орнг.; 5—26, 43 — по Верещагиной, 19786, 1983; 27—42 — по Khanna, 1964a).
У Cynoglossum развивается короткий подвесок, дегенерирующий после
достижения зародышем зрелости. Лейкоэмбриофиты.
Исследованные роды и виды. Adelocaryum coelestinum,
A. malabaricum, Alkanna, Amsinckia, Anchusa officinalis, Asperugo, Borago,
Cerinthe minor, Coldenia procumbens, Cordia sebestena, Cynoglossum amabile,
Echium amoenum, E. plantagineum, E. russicum, E. vulgare, Ehretia laevis, E. mi-
crophylla, E. ovalifolia, Heliotropium curassavicum, H. europaeum, H. indicum,
H. ovalifolium, H. peruvianum, H. scabrum, H. strigosum, H. supinum, Lappula,
Lindelofia, Lycopsis orientalis, Mertensia paniculata, M. platyphylla, Myosotis,
Omphalodes, Onosma, Pulmonaria mollissima, P. obscura, Solenanthus,
Symphytum officinale, Tournefortia, Trichodesma indicum, T. zeylanicum.
Литература. Soueges, 1921a, 1938b, 1938c, 1941a, 1943b, 1950a, 1950b,
1951a, 1952a, 1958a; Svensson, 1922, 1923a, 1923b; Singh, 1931; Strey, 1931;
Pitot, 1938; Crete, 1949d, 1959; Venkateswarlu, Atchutaramamurti, 1955; Johrir
Vasil, 1956; Swamy, Ganapathy, 1957; Lebeque, 1962; Swamy, Parameswaran,
1963; Khanna, 1964a, 1964b; Модилевский, Дзюбенко, 1967; Nagaraj, Tasneem,.
1968; Верещагина, 1971, 1973, 1976, 1978a, 19786, 1979, 1983; Khaleel, 1974,
1975, 1977, 1978, 1982; Swamy, 1974; Malecka, 1975, 1977a, 1981a, 1981b; Toks,
1976; Joshi, Dwivedi, 1980b; Rao В. Н., Prakasa Rao, 1980, 1983, 1984.
216
Семейство LENNOACEAE
Пыльники 4-гнездные. Развитие и строение стенки гнезда пыльника, микро-
спорогенез и развитие пыльцевого зерна не изучены. Зрелые пыльцевые зерна
одиночные.
Семяпочка у Lennoa madreporoides кампилотропная, с одним интегументом,
Lennoaceae
1—11 —• Lennoa madreporoides, 12 —• L. caerulea.
1 — семяпочка с археспориальной клеткой; 2 — семяпочка с линейной тетрадой мегаспор;
■3—5 — развитие зародышевого мешка; 6, 7 — эндосперм и зародыш в развивающомод оо-
мени; 8—11 — эмбриогенез; 12 — зародыш и эндосперм в зрелом семени (1—11 — ко И\№~
seguth, 1927; 12 — ориг.).
217
тенуинуцеллятная. Единственная археспориальная клетка преобразуется
непосредственно в мегаспороцит. Тетрада мегаспор линейного типа.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. Антиподы сохраняются долго и, вероятно, выполняют гаусториальную
функцию.
Эндосперм в зрелом семени сохраняется; запасные вещества —
преимущественно крахмал и жиры.
Зигота делится поперечной перегородкой. Дальнейшее развитие зародыша
не прослежено. Зародыши в зрелых семенах Lennoa caerulea и Pholisma
arenarium представлены глобулярными образованиями, лишенными основных
органов, в них наблюдается дифференциация клеток на полюсах по размерам и
содержимому. Клетки апикальной области более крупные. У зародышей
Lennoa эта дифференциация клеток выражена слабо.
Исследованные виды. Lennoa caerulea, L. madreporoides, Pholisma
arenarium.
Литература. Tieghem van, 1901; Suessenguth, 1927; Drugg, 1962;.
Kuijt, 1969; Терёхин, 1977.
Семейство HOPLESTIGMATACEAE
Эмбриологически не изучено.
Эндосперм в зрелом семени Hoplestigma скудный.
Зрелый зародыш прямой, дифференцированный, с продолговатыми
семядолями.
Литература. Тахтаджян, 1966.
Порядок 67. LAMIALES
Семейство VERBENACEAE
Щ Пыльник 4-гнездный, 2-тековый с плацентоидами — стерильными
выростами перегородок, внедряющимися в полость каждого гнезда. Ко времени
созревания пыльника перегородки и плацентоиды разрушаются, гнезда в те-
ках сливаются. Стенка гнезда пыльника развивается центробежно (у Lippia
nodiflora—центростремительно) и состоит из эпидермиса, эйдотеция, среднего
слоя и тапетума. У Avicennia officinalis число средних слоев увеличивается до 2.
Эпидермис покрыт кутикулой, эндотеций с тангентально вытянутыми клетками,
с утолщенными оболочками, фиброзные пояски в нем появляются ко времени
созревания пыльцевых зерен. У Premna latifolia и P. serratifolia фиброзные
утолщения развиваются и в клетках связника. Единственный средний слой
дегенерирует вскоре после формирования микроспор (L. nodiflora, L. citriodora).
Тапетум секреторный, однослойный (у P. latifolia и P. serratifolia 2—3-слойный
со стороны связника), одноядерный на ранних стадиях (у видов Premna остается
одноядерным), позднее 2-ядерный, реже — 3—4-ядерный (Lippia, Verbena,
Callicarpa, Phryma). Тапетум сохраняется длительно, и начало его лизиса
отмечается лишь на стадии вакуолизированных микроспор. На поверхности тапе-
тальных клеток образуются орбикулы. Стенка зрелого пыльника состоит из
эпидермиса и фиброзного эндотеция (Caryopteris wallichiana, С. mongholica,
Clerodendron flomidis, Lantana camara, Phryma lep,ostachya: P. latifolia, P.
serratifolia). Спорогенная ткань 1—3-рядная, мейоз проходит без нарушений,
тетрады микроспор тетраэдральные, изобилатеральные и крестообразные,
образуются симультанно. Зрелые пыльцевые зерна 2-клеточные у L. nodiflora,
L. citriodora, A. officinalis и Verbena angu&tifolia и 3-клеточные у С. wallichiana
и Stachytarpheta dichotoma (Junnell, 1934). Пыльцевые зерна содержат крахмал.
У L. nodiflora отмечены случаи дегенерации спорогенной ткани, а у видов
Lantana — микроспорипыльцевых зерен (Lantana chamaedrifolia).
Семяпочки с одним интегументом, тенуинунеллятные, у большинства видов
анатропные, ортотропные у A. officinalis и у видов рода Phryma; число их в
завязи варьирует от одной (Phryma) до 4 (Duranta, Tectona, Vitex) или 5 (Geunsia).
Интегумент массивный, 6—7-слойный у L. nodiflora и Tectona grandis, 10-слой-
ный у Vitex negundo, образует длинное прямое микропиле, за исключением
A. officinalis, у которой вследствие задержки роста интегумент не достигает
вершины нуцеллуса и микропиле не образуется. Внутренний эпидермис инте-
гумента уже на стадии формирования тетрады мегаспор дифференцируется в ин-
тегументальный тапетум, клетки которого наиболее активны в период роста и
созревания зародышевого мешка и дезорганизуются после оплодотворения.
У L. nodiflora, T. grandis и V. negundo интегументальный тапетум окружает
только среднюю часть зародышевого мешка. Нуцеллус однослойный, рано
разрушается. Единственная археспориальная клетка преобразуется в
мегаспороцит, не отчленяя париетальной клетки. Случаи 2-клеточного археспория
отмечены у L. nodiflora, Pityrodia bartlingii и Premna integrifolia. Тетрады
мегаспор линейные, у A. officinalis и Verbena officinalis встречаются Т-образные.
Чаще всего функционирующей становится халазальная мегаспора (L.
nodiflora, Lantana ihdica, Stachytrpaheta indica, Т. grandis, V. negundo). У Cithare-
xylum ilicifolium (Paterman, 1935) зародышевый мешок развивается из эпиха-
лазальной мегаспоры; у Bouchea incrassata, С. ilicifolium, L. camara, L> involu-
crata и Petrea volubilis имеется тенденция к развитию более чем одной мегаспоры.
У A. officinalis 3 нефункционирующие мегаспоры остаются жизнеспособными и
не дегенерируют вплоть до оплодотворения зародышевого мешка,
развивающегося из халазальной мегаспоры (Paterman, 1935; Padmanabhan, 1960).
Зародышевый мешок моноспорический, развивается по Polygonum-THiry,
8-ядерный, 7-клеточный, в разных родах несколько варьирует по форме: от
веретенообразного у L. nodiflora, длинного и узкого у видов Verbena и
расширенного в халазальной части у Clerodendron, а также по размеру: наиболее крупный
21»
Verbenaceae
1—3, 9—11, 14, 15, 19 — Caryopteris mongolica, 4—8, 12, 13 — Lantana camara, 16, 20, 23,
24, 34 — Avicennia officinalis, 17, 18, 21, 22, 33 — Lippia nodiflora, 25—32 — Verbena
officinalis.
1—8 — развитие стенки пыльника, микроспорогенез, образование плацентоидов (пл);
9—15 — фиброзный эндотеций в стенке пыльника, образование микроспор (14), 2- и 3-кле-
точных пыльцевых зерен (13—15), полный лизис плацентоидов (12) и разрушение
перегородок между гнездами (11);
из изученных видов у Т. grandis. У некоторых видов (P. volubilis, Congea,
A. officinalis) микропилярный его конец проходит через микропиле, вынося
яйцевой аппарат в полость завязи. Синергиды удлиненные, грушевидные,
■с крючками и клювовидными базальными концами, мелкими ядрами и крупной
апикальной вакуолью (L. nodiflora., С. wallichiana, Clerodendron flomidis);
у видов рода Phryma — с нитчатым аппаратом. У Т. grandis яйцевой аппарат
значительно крупнее, чем у других видов, и синергиды не имеют крючков, а
апикальные концы их сильно заострены. Полярные ядра сливаются до
оплодотворения {Clerodendron, Cornutia, L. nodiflora, Phryma) или во время его (Pityrodia,
Callicarpa). Однако Магешвари (Maheshwari, 1954) наблюдал слияние полярных
ядер у L. nodiflora только после вхождения пыльцевой трубки в зародышевый
мешок. 3 антиподы эфемерны, как у A. officinalis и С. wallichiana, и дегенерируют
-вскоре после образования, так что их нельзя обнаружить в зрелом зародышевом
222
м.г
23
Verbenaceae (продолжение)
22—24— развитие эндоспермальных гау-
сториев, многоядерный микропилярный
(м. г) и одноядерный халазальный (.г. в)
гаустории;
Verbenaceae (продолжение)
25—32 — отдельные стадии эмбриогенеза; 33, 34 — зрелое семя. (1—15, 19 — ориг.; 16,
20 — по Padmanabhan, 1960; 17, 18, 21, 22, 33 — по Maheshwari, 1954; 23, 24, 34 — по Pad-
manabhan, 1964; 25—32 — по SouegeSj 1942).
мешке (A. officinalis, T. grandis), или многократно делятся, образуя
антиподальние комплексы, насчитывающие у С. flomidis до 20 клеток. У видов Lantana
делятся только ядра антипод, образуя 3—6-ядерные клетки, которые в
дальнейшем разрастаются и функционируют как гаустории; ядра их вторично
сливаются. Особенно сильно разрастаются антиподы у L. сатага, занимая
почти половину зародышевого мешка. В то же время у ряда видов (L. nodiflora,
Duranta plumieri, Ph. leptostachya, Т. grandis ж др.) клетки антипод сохраняются
без изменений и дегенерируют уже после оплодотворения. Оплодотворение по-
рогамное. Пыльцевая трубка, входя в зародышевый мешок, разрушает одну из
синергид, вторая дегенерирует вскоре после оплодотворения (Т. grandis).
Перед оплодотворением вторичное ядро перемещается из центра зародышевого
мешка ближе к яйцевому аппарату, где и происходит двойное оплодотворение.
Эндосперм целлюлярный. Деление первичного ядра происходит раньше
деления зиготы и сопровождается заложением поперечной клеточной
перегородки и образованием крупной микропилярной и меньшей по размеру халазаль-
ной клеток эндосперма. Первая из них дает начало собственно эндосперму и
формирующемуся позднее микропилярному гаусторию, состоящему из 2
многоядерных клеток у Avicennia marina и A. officinalis, 4 одноядерных клеток,
у L. сатага, S. indica и S. dichotoma. Вторая функционирует непосредственно
как халазальный гаусторий, который остается одноклеточным и одноядерным
у A. marina и A. officinalis или одноклеточным, но 2—4-ядерным у L. nodiflora,
S. indica, T. grandis и Verbena hispida. У Callicarpa macrophylla, L. сатага и
Ph. leptostachya он состоит из 4 одноядерных клеток. Микропилярный
гаусторий у V. officinalis дегенерирует еще до деления зиготы, ayi. nodiflora, T.
grandis и V. negundo — с началом роста зародыша; халазальный функционирует
более продолжительное время — до стадии глобулярного зародыша у V.
officinalis. У A. officinalis на торпедовидной стадии развития зародыша
халазальный гаусторий сохраняется в виде небольшого отростка, в то время как микропи-
224
лярный гаусторий на этой стадии чрезвычайно агрессивен. В процессе развитии
дна из 2 его клеток становится 8—12-ядерной, образует трубкообразный вырост,
оторый вытягивается по направлению к халазе, пронизывает ее и дает 3 лато-
альные ветви в плаценту, приближаясь к прокабиальному тяжу. Другая (2—4-
*дерная) клеткамикропилярного гаустория не разрастается и остается в микро-
илярной части зародышевого мешка. В процессе роста обе клетки микропиляр-
ого гаустория образуют плазмодесмоподобные выросты, соединяющие его
соседними эндоспермальными клетками (Padmanabhan, 1964). Эндосперм в
семени отсутствует у большинства представителей семейства или скудный
(Avicennia, Lippia).
Эмбриогенез Onagrad-типа (Verbena) или Solanad-типа (Lippia, Phryma).
Зигота имеет длительный период покоя и делится только при наличии
значительного количества эндосперма, еще до деления глубоко проникая в его ткань.
В семени зародыш .крупный, дифференцированный, с короткими широкими
семядолями, с крахмалом в клетках, занимает 3Д или почти весь объем семени.
Лейко эмбриофиты.
Исследованные виды. Avicennia marina, A. officinalis, Bouchea
incrassata, Callicarpa macrophylla, Caryopteris mongholica, C. wallichiana, Citha-
rexylum ilicifolium, Clerodendron ( = Clerodendrum)fallax,C. flomidis, C. foetidum,
C. macrosiphon, C. phlomoides, C. thomsonaefl C. trichotomum, C. ugandense, C. ur-
ticifolium, Congea villosa, Duranta plumieri, Gmelina arborea, Hosta caerulea,
Lantana camara,L. chamaedrifolia, L. indica, L. involucrata, Lippia citriodora, L.
nodiflora, Petrea volubilis, Phryma latifolia, Ph. leptostachya, Ph. serratifolia, Pi-
tyrodia bartlingii, Premna foetida, P. integrifolia, P. japonica, Priva laevis,
Stachytarpheta dichotoma, S. indica, Tectona grandis, Verbena angustifolia, V.
hispida, V. officinalis, Vitex agnus-castus, V. negundo.
Литература. Hofmeister, 1858; Treub, 1883b; Karsten, 1891; Koor-
ders, 1896; Kanda, 1920; Dahlgren, 1923; Schnarf, 1923, 1925; Duffas, 1930;
Schwencke, 1931; Junnell, 1934; Paterman, 1935; Roever, 1935; Soueges, 1935a,
1935b; Misra, 1937, 1939; Tatachar, 1940; Cooper, 1941; Crete, 1941, 1942, 1951;
Erdtman, 1945; Pal, 1951; Rao, 1951; Maneshwari, 1954; Tandon, 1955; Moldenke,
1958; Padmanabhan, 1959, 1960, 1962a, 1964, 1967, 1970; Swamy, Padmanabhan,
1961a; Rhaleel, Nalini, 1972; Whipple, 1972; Perkins, James, Thorp, 1975; Ka-
jewska, 1977; Venkata Rao, Prakash Rao, 1983; Фрейберг (ориг. данные).
Семейство LAMIACEAE
Пыльник 4-гнездный, раскрывающийся продольной щелью. Гнезда в теках
перед вскрытием частично объединяются из-за разрушения верхней половины
перегородки между ними. Характерная особенность в строении пыльника
некоторых родов (Lavandula, Salvia и Stachys) — наличие плацентоида —
радиального выроста ткани связника или перегородки, вдающегося в каждое гнездо
пыльника. Стенка пыльника формируется центробежно и состоит из
эпидермиса, эндотеция, среднего слоя и тапетума. Тапетум клеточный секреторный,
однослойный, с 2—4 или многоядерными клетками, с орбикулами. У Salvia
mellifera, Nepeta hindostana и Stachys trinervis тапетум морфологически
неоднороден, клетки внутренней его части (у '^Stachys — расположенные на плацеи-
тоиде) значительно крупнее и более вытянуты радиально, чем клетки наружной
части. Средний слой эфемерный. В клетках эндотеция образуются фиброзиыо
утолщения. Последние не наблюдаются в эндотеции пыльников клейстогамтшх
цветков Lamium aplexicaule. У S. trinervis на эпидермисе образуются
многоклеточные желёзки, функционирующие на всем протяжении развития пыльники и
разрушающиеся к его созреванию. У видов Lavandula, Thymus и Ziziphora
в премейотический период развития пыльника в клетках эпидермиса, эидотоцшг
и связника наблюдаются хлоропласты. Максимум запасных питательных nii-
ществ в стенке пыльника и в связнике наблюдается в конце мейотичоокого и
в начале постмейотического периодов. В тапетуме это липиды с расторопными
в них каротиноидами; в остальных слоях стенки и в клетках связника — крпх-
15 Сравнительная эмбриология
22Г)
Lamiaceae
1-—8, 17—20, 35, 35a — Stachys trinervis, 9, 10, 13—16, 36 — Lavandula spica, 11,12 —
Salvia officinalis, 21 — Ajuga reptans, 22 ■— Anisomeles indica, 23 — Amethystea caerulea, 24 —
Anisomeles malabarica, 25, 26 — Prunella vulgaris, 27, 28 — Physostegia virginiana, 29, 30 —
Leonurus sibiricus, 31—34 — Ocimum adscendens, 37—46 — Mentha aquatica, 47 — Ajuga
chamaepitus, 48 ■— Physostegia parviflora, 49 — Scutellaria galericulata, 50 ■— Lavandula
officinalis.
1 — гнездо пыльника и его схема (2) со сформированной стенкой и микроспороцитами;.
3 — тетрады микроспор;
мал (Шоферистова, Резникова, 1977; Курбанов, Шоферистова, 1981; Курбанов,
1984). Стенка зрелого пыльника состоит из эпидермиса, покрытого тонким слоем
кутикулы, и фиброзного эндотеция. Их клетки не содержат запасных
питательных веществ. У S. trinervis 3—5 слоев связника, примыкающие к гнездам,
становятся фиброзными. Спорогенные клетки располагаются в один или несколько'
рядов. Мейоз в микроспороцитах у большинства исследованных видов
протекает без нарушений. Образование тетрад микроспор происходит по
симультанному типу, они тетраэдральные, реже — изобилатераль-ные, в каллозных
оболочках. Зрелые пыльцевые зерна 2-клеточные, с крупной генеративной клеткой,,
расположенной рядом с ядром вегетативной (виды родов Ajuga, Teucrium,.
Tinnea, Isanthus, Trichostema, Westringia, Prostanthera, Prasium, Phyllostegiar
Scutellaria, Thuspeinantha, Marrubium, Sideritis, Hypogomphia, Physostegia,
Melittis, Eremostachys, Phlomis, Leucas, Galeopsis, Lamium, Leonurus, MolucellaT
Otostegia, Ballota, Stachys, Anisomeles, Pogostemon и др.), или 3-клеточные,
с 2 веретеновидными спермиями и лопастным ядром вегетативной клетки (виды
родов Rosmarinus, Lavandula, Nepeta, Glechoma, Dracocephalum, Lallemantiar
226
Ziamiaceae (продолжение)
4 — фрагмент пыльника и его схема
(5) на стадии микроспор; 6 —
фрагмент пыльника и его схема (7)с2-
клеточными пыльцевыми зернами;.
8 — схема зрелого пыльника и его
фрагмент (8а) (ж — желёзка, пл —
плацентоид);
Lamiaсвае (продолжение) -
9 — одноклеточный археспорий в нуцеллусе; 10 — мегаспороцит; 11, 12 — тетрады
мегаспор; 13, 14 — 4- и 8-ядерный зародышевые мешки; IS — семяпочка;
Lamiaceae (продолжение)
16 — зрелый зародышевый мешок; 17 —
многоклеточный археспорий; 18—20 — одноядерный,
4-ядерный и зрелый зародышевые мешки; над
ними виден комплекс клеток с ослизняющимися
оболочками — производное многоклеточного
археспория (п. м. а);
Lamiaceae (продолжение)
21, 22, 25, 27 — семяпочки с зародышевым мешком; 31 — зрелый зародышевый мешок;
23, 24, 26, 28—30, 32—36 — отдельные стадии развития эндосперма по разным типам: 23,
24 — Scute laria-тип эндоспермогенеза, 26, 28—30 — Prunella-тип, 32—35 — Stachys-тип,
/ 35а — схема семяпочки со структурой эндосперма (35),
Lamiaceae (продолжение)
Prunella, Salvia, Ramona, Perovskia, Monarda, Horminum, Lepechinia, Ziziphora?
Melissa, Satureja, Hyssopus, Majorana, Origanum, Thymus, Bystropogon, Lycopus^
Mentha, Perilla, Elsholtzia, Hypiis, Plectranthus, Ocimum и др.) (Wunderlich, 1967).
В семействе широко распространено явление гинодиэции. У растений с
функционально-женскими цветками происходит стерилизация пыльников в результате
различных нарушений в мейозе (Dracocephalum, Ocimum, Origanum, Thymus
и др.) или из-за аномалий в развитии тапетума в постмейотический период,
приводящих к дегенерации микроспор {Lavandula, Salvia, Mentha и др.).
Семяпочка у большинства видов анатропная, базально прикрепленная, или
гемитропная (Ajuga, Amethystea, Prostanthera, Scutellaria), с одниминтегументом,
тенуинуцеллятная. Интегумент состоит из 6—9 слоев клеток. Внутренний
эпидермис интегумента дифференцируется в интегументальный тапетум, степень
развития которого различна. Уровень его со стороны халазы варьирует от
1/5 до 3/4 длины зародышевого мешка. У Lallemantia iberica, Salvia greggll,
S. leucantha, S. splendens и Physostegia virginiana интегументальный тапотум
не отмечен. У Prasium majus, родов Marrubium, Sideritis, Melittis, Brazoria,
у всех родов подтрибы Lamiinae, а также у родов Rostinicula, Comanthosphace,
Dysophylla, Colebrookia, у части видов Teucrium и Scutellaria на наружном они—
дермисе интегумента развиваются трихомы. У остальных родов семойстли ОНИ
не обнаружены. Трихомы различны по структуре. Дисковидные на пожко, мно-
т
гоклеточиыо — Scutellaria-типа и сидячие, 4-клеточные — Lamium-типа
{Schnnrf, 1917). Микропиле узкое, обычно длинное, слегка изогнутое по
направлению к фуникулусу. Нуцеллус развит слабо, быстро разрушается, начиная
дегенерировать у многих видов ко времени мейоза. У Anlsomeles Indlca и Leonurus
sibiricus 2 микропилярные клетки эпидермиса нуцеллуса делятся периклинально,
образуя 2-слойный колпачок. Гипостаза из 2—4 слоев клеток с плотной
цитоплазмой и утолщенными стенками располагается под халазальным концом
зародышевого мешка. У видов родов Mentha, Lycopus, Monarda, Oclmum,
Anlsomeles и у S. trlnervls установлено наличие фуникулярного обтуратора.
Проводящий пучок короткий, из фуникулуса он следует в халазу и подходит к
зародышевому мешку. Археспорий одноклеточный у большинства исследованных видов.
Археспориальная клетка становится непосредственно мегаспороцитом. Наличие
2-клеточного археспория отмечено в отдельных случаях у Galeopsls pubescens,
Lamium maculatum, L. slbtrtcus, Molucella laevis, Oclmum baslltcum, Salvia
officinalis, S. sclarea и Pogostemon patchouli. По нашим данньш, у S. trlnervls
археспорий многоклеточный (до 8 клеток) и все клетки одновременно вступают
в мейоз. Тетрада мегаспор линейная. У S. officinalis микропилярная клетка
диады иногда не делится и формируется триада клеток. В большинстве случаев
функционирующей мегаспорой становится халазальная, остальные
дегенерируют. У Lavandula spica, S. officinalis, S. sclarea и N. hlndostana отмечалось
дальнейшее развитие всех 4 мегаспор тетрады или только субмикропилярной; микро-
пилярной и халазальной; субмикропилярной и халазальной; эпихалазальной и
халазальной, Однако дополнительный зародышевый мешок дегенерирует на
2—4-ядерной стадии. У S. trlnervls образуются многочисленные тетрады
мегаспор и несколько зародышевых мешков, из которых только один достигает
зрелости.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
В зрелом зародышевом мешке, как правило, различаются узкая, трубковидная,
окруженная интегументальным тапетумом халазальная и расширенная в той
или иной степени микропилярная части. Отношение обеих частей зародышевого
мешка друг к другу варьирует. Микропилярная часть может быть длиннее,
равна или короче халазальной, она разрастается главным образом латерально,
внедряясь довольно глубоко в интегумент. Вследствие этого зародышевый
мешок приобретает булавовидную, обратногрушевидную или волчкообразную
форму. Яйцевой аппарат состоит из 3 типично поляризованных клеток
грушевидной формы. Синергиды с крючковидными выростами и хорошо выраженным
нитчатым аппаратом. Яйцеклетка чуть крупнее синергид. Полярные ядра
сливаются до или во время (О. baslltcum, A. Indlca) оплодотворения. В цитоплазме
центральной клетки отмечено наличие крахмала. 3 антиподы разнообразны
по форме, обычно эфемерны, реже — наблюдаются на первых стадиях эндоспер-
могенеза. У Ph. vtrgtntana число клеток антипод увеличивается до 6—7 (Sharp,.
1911).
Всем исследованным видам свойственны порогамия и двойное
оплодотворение, протекающее по премитотическому типу. После вхождения пыльцевой
трубки в зародышевый мешок одна или обе синергиды остаются
неповрежденными и сохраняются до первых делений эндосперма. Как правило, слияние ядра
спермия с центральным ядром зародышевого мешка происходит быстрее, чем
таковое с ядром яйцеклетки. Зигота перед делением значительно удлиняется,
погружаясь в формирующуюся эндоспермальную ткань.
Эндосперм целлюлярный, с терминальными гаусториями. Развитие основной
эндоспермальной ткани происходит в той части зародышевого мешка, которая
окружена интегументальным тапетумом. Деление первичного ядра эндосперма
сопровождается заложением поперечной Перегородки, при этом образуются
первичная микропилярная ж первичная халазальная клетки эндосперма. Со
второго деления наблюдаются различия в направлении делений и дифференциации,
что послужило основанием для выделения в семействе нескольких типов эндо-
спермогенеза (Schnarf, 1917; Полищук, Дзевалтовский, 1971).
1. Scutellaria-тип — продольная перегородка возникает как в первичной
микропилярной, так и в первичной халазальной клетках эндосперма (Amethy-
stea, Anlsomeles, Craniotomy, Scutellaria).
232
Lamiaceae (продолжение)
36 — Lavandula-тип (з — зародыш, эн — эндосперм, м. э. г — микропилярный и х. о. о
халазальный эндоспермальный гаустории);
2. Prunella (ВгипеИа)-тип — продольная перегородка образуется только
в первичной микропилярной клетке, первичная халазальная клетка эидосиорМИ
без дальнейшего деления становится халазальным гаусторией. Наиболоо
распространенный тип (Teucrlum, Lallemantla, Prunella, Leonurus, Ballotu, Salotil
и др.).
m
Lamiaceae (продолжение)
37—46 — эмбриогенез Onagrad-типа Mentha-вариации; 47—50 — зрелые зародыши: 47, 48 —
первого, 49 — второго, 50 — третьего типов. (1—8, 17—20, 35, 35а — рис. О. П. Камели-
ной; 11, 12, 16, 36 — рис. А. К. Дзевалтовского; 9, 10, 13—15 — по Полищук, Дзевалтов-
ский, 1971; 21, 25, 26, 49 — по Schnarf, 1917; 22, 24, 31—34 — по Murthi, 1946a, 1946b;
23 — по Crete, 1942; 27, 28 — по Sharp, 1911; 29, 30 — по Ganguly, 1948; 37—46 — по Jaitly,
Guignard, Mestre, 1968; 47, 48 — по Martin, 1946; 50 — по Crete, 1946) (21—34, 47—50 —
пит. по: Wunderlich, 1967)).ч
3. Galeopsis-тип, который, по Вундерлих (Wunderlich, 1967), является
формой Prune!la-типа; отличается от предыдущего незначительным развитием и
ранней дегенерацией халазального гаустория (Galeopsis).
4. Stachys-тип — первичная микропилярная клетка эндосперма делится
поперечно, первичная халазальная клетка становится гаусторией (Ajuga, Маг-
rubium, Sideritis, Nepeta, Phlomis, Stachys, Ocimum и др.).
5. Lavandula-тип (Полищук, Дзевалтовский, 1971) — первичная
микропилярная клетка эндосперма не делится, становится микропилярным гаусторием,
первичная халазальная клетка делится поперечно {Lavandula).
Эндоспермальные гаустории варьируют как по числу и величине клеток и
ядер в них, так и по форме, направлению роста и продолжительности
существования. Особенно вариабельны и сильно развиты микропилярные гаустории.
Они могут быть 2-клеточными (Elsholtzia), многоклеточными {Westringia, Pro-
stanthera, Scutellaria, Anisomeles, Pogostemori), но чаще всего одноклеточными,
с 2 ядрами {Nepeta, Prunella, Satureja, Phlomis), с 4—8 ядрами {Horminum,
Perilla, Lavandula и др.) или многоядерными (до 24 ядер у Prasium). Плоидность
ядер также различна. Микропилярный гаусторий у Galeopsis выходит за
пределы семяпочки (Schnarf, 1917). Халазальный гаусторий в большинстве случаев
состоит из одной 2-ядерной клетки. У Scutellaria и Anisomeles он 2-клеточный,
у Prostanthera и Amethystea — 4—8-клеточный. Крупные разветвленные хала-
зальные гаустории отмечены у Lallemantia, Horminum и Elsholtzia. В цитоплазме
гаусториев имеется крахмал. В зрелом семени у большинства родов и видов
семейства эндосперм отсутствует. Наличие эндосперма отмечено у представителей
234
подсем. Prostantheroideae. Скудный эндосперм из 2—5 слоев, окружающих ни"
родыш, наблюдается в родах подсем. Ajugoideae, Scutellarioideae и большом
чисти родов подсем. Lamioideae.
Эмбриогенез у большинства исследованных видов протекает в соответс/пши
с Onagiad-типом Mentha-вариации. У Lamium, Galeopsis^ Ballota зародыш
развивается по Asterad-типу Lamium-вариации (Johansen, 1950). Характерны,
длинные подвески. Базальнай клетка подвеска у многих видов значительно
разрастается и выполняет гаусториальную функцию. Зрелый зародыш у всех видов
прямой, за исключением видов рода Scutellaria и некоторых видов Teucrium,
у которых он изогнутый. В роде Catopheria зрелый зародыш со спирально
закрученным гипокотилем. Семядоли хорошо развиты и различны по форме
(продолговатые, округлые, округло-треугольные, овальные, со стреловидным,
сердцевидным или выемчатым основанием). В зависимости от формы различают 3 типа
зрелых зародышей (Martin, 1946).
1. Лопатовидный (spatulate) — зародыш прямой, с расширенными или
широкими семядолями (роды подсем. Ajugoideae и Lamioideae).
2. Изогнутый (bent) — зародыш согнут в форме складного ножа, семядоли
толстые {Scutellaria).
3. Инвентированный (investing) — зародыш прямой, с толстыми семядолями,,
основания которых облекают гипокотиль и корешок в той или иной степени
{Lavandula, Salvia, роды подсем. Saturejoideae, Ocimoideae).
Тип зародыша коррелирует, как правило, с наличием или отсутствием
эндосперма в зрелом семени, а именно: 1-й и 2-й типы — семя со скудным
эндоспермом, 3-й тип — семя без эндосперма. Основные запасные вещества в зародыше —
липиды и крахмал. Лейкоэмбриофиты.
Явление апомиксиса семейству не свойственно. У гинодиэцичных форм Salvia
tesquicola и Origanum vulgare возможно развитие апоспорических
нередуцированных зародышевых мешков (Зайцева, Звержанская, 1983). Развитие апомик-
тического эндосперма до нескольких клеток отмечено в опыте у О. basilicum.
(Кобахидзе, 1978, 1981), что нуждается в подтверждении.
Исследованные роды и виды. Ajuga (8), Amethystea caerulear
Anisomeles indica, A. malabarica, Ballota foetida, B. nigra, Betonica abchasica,
B. grandiflora, B. ossetica, Bystropogon origanifolius, Calamintha grandiflora,
Craniotome versicolor, Dracocephalum (5), Elsholtzia cristata, E. fruticosa,
Eremostachys napuligera, Galeopsis {7), Glechoma hederacea, Horminum py-
renaicum, Hyptis pectinata, H. suaveolens, Hyssopus ' officinalis,
Lallemantia iberica, L. peltata, Lamium (11), Lavandula (6), Leonurus cardiaca,
Lj. sibiricus, Lepechinia spicata, Leucas aspera, L. biflora, L. cephalotes, Lophanthus
chinensis, Lycopus europaeus, L. rubellus, Majorana hortensis, Marrubium pannoni-
cum, M. peregrinum, Melissa officinalis, Melittis melissophyllum, Mentha (9),
Molucella laevis, Monarda didyma, M. fistulosa, M. punctata, Moschosma polysta-
chyum, Nepeta cataria, N. hindostana, N. micrantha, Notochaete hamosa, Ocimum
(6), Origanum lanceolatum, 0. vulgare, Orthosiphon stamineus, Perilla arguta,
P. frutescens, Perovskia atriplicifolia, Phlomis (5), Physostegia virginiana, Pleciran-
thus oertendahlii, Pogostemon patchouli, P. plectranthoides, Prasium majus,
Prostanthera lasianthos, P. sieberi, P. violacea, Prunella vulgaris, Salvia (28), Satureja
acinos, S.- hortensis, S. vulgaris, Scutellaria (5), Sideritis hirsuta, S. hyssopifolia,
S. montana, S. scordioides, Stachys (11), Teucrium (11), Thymus (7), Westringia
rosmariniformis, Ziziphora biebersteiniana, Z. capitata, Z. tenuior.
Литература. Tulasne, 1849, 1855; Hofmeister, 1858, 1859; Warniiiig,
1873, 1878; Chatin, 1874; Vesque, 1878, 1879; Elfving, 1879; Jonsson, 1879—\880;
Strasburger, 1879, 1889, 1900; Fischer, 1880; Guignard, 1882, 1893; D'Huborl,,
1896; Balicka-Iwanowska, 1899; Rupert, 1902; Habermann, 1906; Tieghem villi,
1907; Billings, 1909; Sharp, 1911; Guerin, 1917, 1919; Schnarf, 1917, 1929, 1D.41,
1937; Soueges, 1921b, 1921c, 1921e; Schurhoff, 1926, 1927; Gorczvnski, :li)2();
Leitz, 1929; Wolf, 1929; Laws, 1930; Финн, 1930, 1939; Ruttle, 1931, 1932; Hit-
нютина-Мухина, 1933; Junell, 1934, 1937; Buslmell, 1936; Carlson, Stunrl, \W\\
Голубинский, 1936, 1947; Murthi, 1940, 1941, 1942, 1946a, 1946b, 1947; СгШ,
1942, 1946c, 1951, 1963; Leither, 1942; Ganguly, 1948; Johansen, 1950; Адмирпль-
2№
екая, 1960а, 19606; Резникова, 1960, 1961, 1962, 1970; Budell, 1964; Adval,
1965; Baqvinr, 1965; Jaitly, 1966, 1968; Mortier, Lebegue, 1966; Каракозова,
Логофмчшп, 1967; Wunderlich, 1967; Jaitly, Guignard, Mestre, 1968a, 1968b;
Шофористона, 1970, 1973, 1978; Буюкли, 1971; Канделаки, Кобахидзе, 1971,
1977; Коваленко, 1971; Курбанов, 1971, 1973, 1977, 1978, 1981а, 19816, 1984;
Пол щук, Дзевалтовський, 1971; Полшгук, 1972, 1973; Верещагина, 1973, 1976;
Яковлев, Жукова, 1973, 1980; Верещагина, Маланина, 1974; Дзевалтовський,
Полпщук, 1974; Кобахидзе, 1975, 1977а, 19776, 1978, 1984: Савченко, Резникова,
1975, 1982; Дзевалтовский, 1976; Dommee, 1976; Шоферистова, Резникова,
1977; Assouad, Dommee, 1978; Кобахидзе, Кобаснидзе, 1978; Ростовцева, 1978;
Верещагина, Бояршинова, 1979; Dwivedi, Joshi, 1980, 1981; Joshi, Dwivedi,
1980a; Савченко, 1980, 1982; Кобаснидзе, Кобахидзе, 1981; Курбанов,
Шоферистова, 1981; Татищева, 1982; Зайцева, Звержанская, 1983; Ахмед-Заде,
Гусейнова, 1984; Suarez-Cervera, Seoane-Camba, 1986; Камелина (ориг. данные по
Stackys trinervis*).
Семейство CALLITRICHACEAE
Пыльники 4-гнездные. Гнезда объединены в 2 теки и перед созреванием
сливаются в результате разрушения перегородок между ними. По нашим данным,
стенка гнезда пыльника у. Callitriche palustris развивается по центробежному
типу, состоит из эпидермиса, эндотеция, среднего слоя и тапетума. Эпидермис
представлен удлиненными, сильновакуолизированными клетками с тонкой
кутикулой на поверхности. В эндотеции развиваются фиброзные утолщения.
Фиброзный слой окружает гнездо с его внешней стороны, отсутствуя в перегородках
между гнездами и прерываясь в месте вскрытия гнезда группой специфических
клеток. Со стороны связника 3—4 слоя клеток также имеют фиброзные
утолщения. У С. autumnalis и у форм некоторых видов, полностью погруженных
в воду, фиброзный слой не дифференцируется (Jorgensen, 1925a). Средний слой
эфемерен, разрушается в процессе мейоза. Тапетум секреторный, местами 2-
слойный, 2- или многоядерный, лизис его происходит к стадии 2-клеточных
пыльцевых зерен. Стенка зрелого пыльника 2-слойная — эпидермис и эндотеции.
Спорогенная ткань состоит из 2 рядов клеток. Тетрады микроспор образуются
симультанно, тип тетрад не установлен. При гибридизации С. stagnalis с-другими
видами в естественных условиях наблюдаются нарушения в расхождении
хромосом при мейозе. Образующиеся при этом микроядра обособляются в клетки,
в результате чего вместо тетрад формируются октады и гексады микроспор
{Winge, 1917; Jorgensen, 1925a). Такие дополнительные микроспоры, как
правило, в дальнейшем дегенерируют. Генеративная клетка у С. palustris крупная,
овальной формы, с сильно хроматизированным ядром. Зрелые пыльцевые зерна
3-клеточные, содержат 2 заостренных с одного конца спермия и ядро
вегетативной клетки, часто неправильной формы. Цитоплазма заполнена запасными
веществами. Часто встречаются сложные пыльцевые зерна, состоящие из 2—4
пылинок.
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная. Интегу-
мент массивный, закладывается на стадии формирования археспориальной
клетки; в ходе развития его клетки приобретают утолщенные оболочки.
Дифференцируется интегументальный тапетум, который после разрушения нуцел-
луса прилегает непосредственно к зародышевому мешку. После оплодотворения
клетки интегумента постепенно разрушаются, за исключением микропилярной
ж халазальной областей семяпочки. В семяпочке развивается проводящий пучок,
который следует через фуникулус в халазальную часть семяпочки.
Единственная археспориальная клетка превращается непосредственно в мегаспороцит.
Тетрады мегаспор линейные (Jorgensen, 1925). Иногда микропилярная клетка
диады не делится, в результате чего образуется триада. Функционирующей
становится халазальная мегаспора, остальные мегаспоры сохраняются до стадии
4-ядерного 'зародышевого мешка, затем дегенерируют.
* Материал собран в Бадхызском гос. заповеднике в 1984 г.
236
^.y-.wrrwmw.^,
\^:^Ш^''^^''''0-УШШЩ№
Callitrichaceae (продолжение)
Callitrichaceae (продолжение)
11—16 — мегаспорогенез и развитие зародышевого мешка; 17 — процесс оплодотвороиин;
18—23 — развитие эндосперма; 24—31 — развитие зародыша; 32 — схема строения аролого
семени. (1—10 — ориг.; 11—17, 32 — по Jorgensen, 1925а; 18—31 — по Soueges, 1062).
Зародышевый мешок мбнбспо'ркческий, развивается по Poiygonuni-типу;
Зрелый зародышевый мешок удлиненной формы, расширенный в микропилярной
части. Он состоит из яйцевого аппарата, центральной клетки с 2 полярными
ядрами и 3 антипод. Яйцеклетка длиннее синергид, с крупной базальнон
вакуолью. Сииергиды грушевидной формы, имеют крупные вакуоли в апикальной
части. Полярные ядра, как правило, располагаются в центральной части зароды- '
шевого мешка, в пристенном слое цитоплазмы, и сливаются у большинства
видов перед оплодотворением, у С. autumnalis — в процессе оплодотворения.
Антиподы эфемерны. Оплодотворение порогамное. У С. autumnalis отмечены
вхождение пыльцевой трубки в зародышевый мешок и контакт одного из спермиев;
с яйцеклеткой. При этом разрушались обе синергиды (Jorgensen, 1925).
Эндосперм целлюлярный. Первая клеточная перегородка закладывается"
поперечно, вторая — продольно оси зародышевого мешка, в результате чегс
образуется 4-клеточный эндосперм. Халазальная пара клеток сильно
отличается от микропилярной более плотной цитоплазмой. Микропилярные клетки:
одновременно делятся поперечно — в результате образуются 3 ряда клеток по 2.
Халазальная и микропилярная пары клеток образуют халазальный и микропи-
лярный гаустории соответственно, средняя пара — собственно эндосперм.
У Callitriche оба гаустория эндосперма развиты очень слабо (Samuekson, 1913).
Микропилярный гаусторий состоит из З1—4 длинных изогнутых густоплазменных
клеток (Jorgensen, 1925; Soueges, 1952). Он проникает в микропиле, разрушая
при этом окружающие клетки интегумента, и достигает плаценты, где
контактирует с проводящим пучком фуникулуса. Халазальный гаусторий эндосперма,
имеет значительно меньшие размеры по сравнению с микропилярным и
подходит к проводящему пучку в халазальной части семяпочки. У С. autumnalis-
халазальный гаусторий иногда отсутствует. К созреванию семени халазальный
гаусторий разрушается полностью, тогда как остатки микропилярного часто
сохраняются. На поздних стадиях развития в клетках эндосперма и его гаусто-
риев откладывается крахмал.
Развитие зародыша соответствует Onagrad-типу (Jorgensen, 1925a, 1925b;:
Soueges, 1952). Перед делением зигота значительно увеличивается в размерах и
опускается глубоко в ткань эндосперма. Первое, деление происходит на стадии
многоклеточного эндосперма (более 12 клеток). Образующаяся при этом
клеточная перегородка делит зиготу поперечно на клетки са и сЪ, дериваты которых
принимают участие в образовании зародыша. 4-клеточный проэмбрио имеет
Т-образную форму. Клетка сЪ многократно делится поперечно, образуя длинный,
нитевидный суспензор, дегенерирующий на поздних стадиях развития зародыша.
Эмбриодерма закладывается на стадии октантов. Клетка т дает начало иници-
алям корня. В зрелом семени зародыш прямой, дифференцированный на
семядоли, почечку, зародышевый корень.
В сем. Callitrichaceae обнаружена полиэмбриония (Поддубная-Арнольди,
1982).
Исследованные виды. Callitriche autumnalis, С. hamulata, С. pa--
lustris, С. stagnalis, С. vernalis.
Литература. Baillon, 1858; Hegelmaier, 1864, 1867; Clarke, 1865;
Strasburger, 1884; Samuelsson, 1913; Winge, 1917; Schiirhoff, 1924, 1926;
Jorgensen, 1925a, 1925b; Netolitzky, 1926; Schnarf, 1931; Soueges, 1952; Maheshwari P.,..
1963; Davis, 1966; Corner, 1976; Поддубная-Арнольди, 1982; Колесова, Ваты—
гина (ориг. данные).
Порядок 68. SCROPHULARIALES
Семейство SOLANACEAE
Пыльник 4-гнездный. Развитие стенки гнезда пыльника происходит центро-
бежно. У Withania somnifera описан основной тип (Davis, 1966).
Сформированная стенка гнезда пыльника состоит из эпидермиса, эндотеция, 1—2 средних
слоев и тапетума. В эндотеции зрелых пыльников наблюдаются фиброзные
утолщения; исключение составляют пыльники, рассеивание пыльцы которых
осуществляется через поры. У Lycium europaeum в районе связника эндотеции
многослойный (Jain, 1956), а в отдельных участках пыльцевых гнезд Lycopersicon
esculentum 2-слойный. У Solarium nigrum фиброзные утолщения обнаружены,
только в верхней части пыльника (Saxena, Singh, 1966). Отмечена
вариабельность и в числе средних слоев: так, у L. esculentum описано 3—4 средних слоя.
Средние слои эфемерны. Тапетум секреторного типа. У Datura stramonium та-
петум 3 типов (Avery et al., 1959, цит. по: Mohan Ram, Kamini, 1964), но эти
данные требуют проверки. Клетки тапетума, как правило, 2-ядерные, однако
у некоторых пасленовых обнаружены и многоядерные (Острецова, Резникова,
1977). Ядра тапетума претерпевают эндомитотические деления. Все эндомито-
тические циклы прекращаются в позднем диакинезе (Орел, 1964). Плоидность
клеток в результате делений ядер тапетума может достигать у томатов 16а и
32n (Brown, 1949). У L. esculentum отмечен диморфизм тапетума (Орел, Жакова,
1976). Цитоплазма клеток тапетума насыщена рибосомами и ЭР (Horner, Rogers,
1974). Ко времени созревания пыльцы стенка пыльника состоит из эпидермиса
и эндо'теция. В тапетуме L. esculentum и Solanum tuberosum установлено
наличие спорополлениновой оболочки с орбикулами и экстратапетальной мембраны
(Огородникова, 1976; Москалева, Огородникова, 1977). Образование тетрад
микроспор симультанное. В оболочках микроспороцитов Nicotiana glauca
отмечена каллоза. Она наблюдается со стадии профазы и на всех последующих
фазах микроспорогенеза вплоть до распада тетрад на отдельные микроспоры
(Лунева, Поддубная-Арнольди, 1973). Тетрады микроспор тетраэдральные,,
изобилатеральные или крестообразные. Ультраструктурная характеристика
микроспорогенеза дана на примере Capsicum annuum (Horner, Rogers, 1974).
Зрелые пыльцевые зерна 2-клеточные; у Solanum phureja в пыльниках одного-
цветка описаны 2- и 3-клеточные пыльцевые зерна (Dnyansagar, Cooper, 1960).
Генеративная клетка и спермии-клетки малоплазменные. Данные по
ультраструктуре генеративной клетки противоречивы. У Petunia в составе органелл
ее цитоплазмы, по одним данным, наблюдаются пластиды, митохондрии, ЭР и
диктиосомы (Sassen, 1964), по другим — митохондрии, гранулярный ЭР, дик-
тиосомы, рибосомы и микротрубочки; пластиды не обнаружены (Ciampolini,
Cresti, 1977). Не обнаружено пластид и в генеративной клетке L. esculentum
(Hagemann, 1981). В генеративной клетке пыльцевого зерна Solanum chacoense
первоначально пластиды имеются. Позднее предполагается постепенная их
элиминация (Clauhs, G-run, 1973, 1977); механизм этого процесса, однако, не
ясен. Генетическими исследованиями установлена передача отцовских пластид,
при оплодотворении у Browallia speciosa и S. tuberosum (Sears, 1980).
Семяпочка анатропная (D. stramonium, Petunia nyctaginiflora, 9 видов
Nicotiana и др.), гемитропная (Brunfelsia americana, Datura fastuosa, Physalis minima,
Ph. peruviana, Salpiglossis sinuata, W. somnifera), кампилотропная (Cestrum diur-
num, C. nocturnum) или амфитропная (S. tuberosum), с одним интегументом, то-
нуинуцеллятная. В отношении семяпочки L. esculentum, S. nigrum, S.
tuberosum, S. phureja данные противоречивы. У N. rustica ко времени цветения што-
гумент 5—6-слойный, после опыления — 9—10-слойный (Sehgal, G-ifford, 197U);
у Lycopersicon — 20—30-слойный. Эпидермис интегумента снаружи покрыт
кутикулой. Дифференцируется интегументальный тапетум, который состоит ш>,
радиально удлиненных клеток с крупными ядрами. В семяпочках со лролым.
зародышевым мешком их гиалоплазма плотная, насыщена свободными риГммкн
мами. Гранулярный ЭР образует участки эргастоплазмы. Вакуом раанит ела По.
16 Сравнительная эмбриология
>А\-
Solanaceae
1—6 — Lycopersicon esculentum, 7, 8, 11,
12 — Solarium aviculare, 9, 10 — Lycium
europaeum, 13, 29 — Solarium phureja, 14—
18, 20 — S. torvum, 19 — Nicotiana taba-
cum, 21—27 — Solarium nigrum, 28 —
Nicotiana paniculata.
1—6 — фрагменты продольных и
поперечного (4) срезов гнезд пыльников: начало
дифференциации клеток внутреннего
тапетума (2), образование эндотеция и
средних слоев (3), полностью сформированная стенка пыльника (4), диформизм тапетума
особенно ярко выражен во время мейоза в микроспороцитах (5), тапетум в период
образования одноядерных микроспор (6); 7—13 — микроспорогенез и развитие пыльцевого зерна:
тетраэдральные (8), изобилатеральные (9) и крестообразные (10) тетрады; 2- и 3-клеточные
пыльцевые зерна (12, 13); 14—18 — мегаспорогенез и развитие зародышевого мешка; 19 —
двойное оплодотворение; 20 — первые деления в эндосперме; 21—27 — развитие зародыша;
28, 29 — зародыш зрелого семени. (1—6 — по Орёл, Жаковой, 1976; 7, 8, 11,12 — по Остре-
првой, Резниковой, 1977; 9, 10 — по Jain, 1956; 13, 29 — по Dnyansagar, Cooper, 1960;
14—18, 20 — по Mohan, Singh, 1969; 19 — по Даниелян, 1963; 21—27 — по Soueges, 1922;
28 — по Поддубной-Арнольди, Лодкиной, 1945).
Лейкопласты со скудной внутренней мембранной системой. Много липидных
капель. Плипмаломма извилиста (Ермаков, Горяева, 19826). У Petunia hybrida
в 3—4 слоях клеток интегумента вокруг зародышевого мешка приблизительно
черо;) 22 ч поело опыления отмечено отложение каллозы. Количество слоев,
содоржшцих каллозу, увеличивается по направлению к микропилярному концу
сомнпочки. Через 90 ч после опыления вся каллоза исчезает (Esser, 1963).
Ео отложение автор связывает с активностью интегументального тапетума.
Для инициации этого процесса необходимо опыление. Нуцеллус у пасленовых
обычно полностью дезинтегрирует в ходе развития зародышевого мешка. У Ly-
cium cestroides (Bernardello, 1983), Lycopersicon esculentum и S. nigrum описана
гипостаза. В ее клетках много свободных рибосом, мелких вакуолей и
гранулярного ЭР (главным образом близ протуберанцев клеточной оболочки и амило-
пластов — Ермаков, Горяева, 19826). У Datura metel имеется постамент.
Сосудистый пучок короткий, не достигающий халазы, или с несколькими короткими
постхалазальными ответвлениями [Datura). Археспорий одноклеточный. У
большинства исследованных видов, преимущественно культурных, выявлена
тенденция к образованию 2- и многоклеточного археспория (Young, 1922; Cooper,
1931; Bhaduri, 1935; Орел, 1958, 1963, 1964; Рыбченко, 1959; Глущенко, 1962;
Грабовская, 1968, и др.). Так, у L. esculentum в семяпочках диких томатов
закладывается, как правило, лишь одна археспориальная клетка, а у
крупноплодных томатов — от 2 до 6 дополнительных археспориальных клеток. У
Lycopersicon hirsutum закладывается обычно одна археспориальная клетка, а у L. реги-
vianum на 100 семяпочек с одной археспориальной клеткой приходится 50
семяпочек с дополнительными археспориальными клетками (Орел, 1964). У В. ате-
ricana, N. plumbaginifolia, 2 видов Physalis, нескольких видов Solanum и
W. somnifera отмечено формирование дополнительных зародышевых мешков.
Археспориальные клетки преобразуются в мегаспороциты. Тетрада
мегаспор линейная. Жизнеспособной является халазальная мегаспора.
Известны случаи функционирования 2 мегаспор (Орлова, 1965; Jos, Singh,
1968).
Зародышевый мешок моноспорический развивается по Polygonum-типу.
У S. tuberosum (Young, 1923) и S. muricatum описан Adoxa-тип, у Capsicum fru-
tescens, Cestrum elegans, Nicotiana ditagla и N. rustica — Allium-тип, ayff. gla-
uca — Endymion-тип развития (Davis, 1966). Яйцевой аппарат состоит из
яйцеклетки и 2 синергид, типично поляризованных. Халазальный полюс яйцеклетки
P. hybrida (Went van, 1970b, 1970c), N. tabacum (Mogensen, Suthar, 1979) и
L. escuhntum (Ермаков, Горяева, 1982в) ограничен лишь плазмалеммой или
имеет неполную клеточную оболочку. Яйцеклетка содержит амилопласты.
У L. esculentum в них много пластоглобул. У яйцеклетки P. hybrida
подчеркнуто слабое развитие ЭР и аппарата Гольджи, а также сильная вакуолизация
цитоплазмы в ходе созревания. У яйцеклетки N. tabacum отмечено обилие
свободных рибосом, слабое развитие ЭР; диктиосомы не обнаружены. Для L.
esculentum характерно слабое развитие аппарата Гольджи. Синергиды
грушевидные, с крючкообразными выростами и с вытянутыми заостренными микропиляр-
ными концами, вдающимися в микропиле. Для синергид N. tabacum (Mogensen,
Suthar, 1979) и P. hybrida (Went van, 1970a) характерно большое количество
митохондрий, диктиосом, ЭР. В синергидах N. tabacum дифференцируются
амилопласты, обильны свободные рибосомы. По результатам светооптических
исследований, наличие нитчатого аппарата отмечено у небольшого числа
пасленовых, например в синергидах L. esculentum (Cooper, 1931) шЬ. cestroides
(Bernardello, 1983). Электронная микроскопия позволила выявить эту структуру и
в синергидах P. hybrida и N. tabacum. У последнего отмечены многочисленные
протуберанцы клеточной оболочки центральной клетки в районе
крючкообразного выроста синергид. В пластидах центральной клетки P. hybrida (Went van,
1970b) и N. rustica (Sehgal, Gifford, 1979) отмечено накопление крахмала.
Антиподы пасленовых — 3 клетки, вариабельны по форме и размерам. У N. rotundi-
folia 2 антиподы подобны синергидам, а 3-я антипода напоминает яйцеклетку.
У других исследованных видов Nicotiana такого явления не обнаружено (Good-
speed, 1947). Антиподы, как правило, эфемерны; дегенерируют на следующий
день после опыления или во время оплодотворения. У D. metel, Atropa bella-
Ш
donna и S. phurefa, однако, они наблюдаются на ранних стадиях развития
эндосперма. У S. phureja отмечено их увеличение на 2-клеточной стадии эндоспермо-
генеза. У N. rustica за один день до распускания цветка цитоплазма антипод
богата рибосомами, пластидами с мелкими крахмальными зернами,
митохондриями, вакуолями. Ядра крупные, сильно хроматизованные, с одним, изредка
с 2 электронно-плотными ядрышками. ЭР и диктиосомы не обнаружены.
Клеточные оболочки, смежные с нуцеллусом, утолщены; толщина их неравномерна;
межантиподальные стенки относительно тонкие, с плазмодесмами. В
зародышевых мешках Cestrum, Nicotiana, Petunia и Solanum demissum отмечена
аккумуляция крахмальныхо зерен, что подтвердилось и
электронно-микроскопическими исследованиями (Went van, 1970c). Полярные ядра сливаются до
оплодотворения.
Порогамия. Вхождение пыльцевой трубки в зародышевый мешок P.
hybrida, N. tabacum и L. cestroides происходит через нитчатый аппарат одной из
синергид. Содержимое пыльцевой трубки изливается в воспринимающую си-
нергиду через терминальную пору. Описано двойное оплодотворение. Слияние
ядер спермин и яйцеклетки у видов Lycopersicon происходит через 35—50 ч
после опыления. Ядро второго спермин сливается с ядром центральной клетки
зародышевого мешка раньше. Полярные ядра ко времени вхождения
пыльцевой трубки в зародышевый мешок чаще бывают слитыми, хотя это не является
правилом (Орел, 1964). У N. rustica сингамия и тройное слияние происходят
•одновременно. Первичное ядро эндосперма, однако, делится раньше зиготы
(Sehgal, Gifford, 1979). В зиготе P. hybrida наблюдается увеличение количества
липидных капель. Пластиды концентрируются вокруг ядра зиготы. У L.
esculentum отмечено исчезновение крупной микропилярной вакуоли после
оплодотворения яйцеклетки (Kadej, Kadej, 1981); у N. tabacum — не только ис-
чезнование крупной микропилярной вакуоли, но и уменьшение размеров
зиготы по сравнению со зрелой яйцеклеткой (Mogensen, Suthar, 1979). У Scopolia
carniolica отмечено значительное увеличение размеров зиготы за период от
•оплодотворения до деления (Глущенко, 1962). Для сохраняющейся синергиды,
что показано на L. esculentum, характерно обилие рибосом и длинных
листерн ЭР.
Эндосперм целлюлярный (Datura, Nicotiana, Petunia, Solanum, S. carniolica,
L. cestroides ж д-р. — Schnarf, 1927; Рыбченко, 1959, 1965; Davis, 1966, и др.).
"У таких пасленовых, как Hyoscyamus orientalis, Salpiglossis picta, Schizanthus
pinnatus и Scopolia atropoides (Hofmeister, 1858; Samuelsson, 1913; Mohan Ram,
Kamini, 1964), эндосперм нуклеарный, а у Hyoscyamus niger (Svensson, 1926) —
гелобиальный. Ультраструктура первичной клетки эндосперма сильно
отличается от таковой центральной клетки зародышевого мешка. После
оплодотворения митохондрии становятся значительно более крупными и неправильными
■по форме, особенно близ воспринимающей синергиды; меняется их внутренняя
структура. Сильно возрастает количество липидов, число диктиосом, цистерн
гранулярного ЭР. Их ультраструктура также изменяется. Происходит сборка
рибосом в крупные полисомы (Went van, 1970c). У P. hybrida и N. tabacum
отмечено уменьшение количества крахмала в центральной клетке после ее
оплодотворения. Первое деление эндосперма у L. cestroides поперечное, второе
может варьировать от продольного до поперечного (Bernardello, 1983). У S.
phureja как первое, так и второе деления продольные, в результате образуются
4 крупные цилиндрические клетки одинаковых размеров. Третье и четвертое
деления эндосперма поперечные, что приводит к образованию 3 ярусов из 4 кло-
ток каждый (Dnyansagar, Cooper, 1960). По данным О. И. Рыбченко (1965),
порядок заложения первых клеточных перегородок в эндосперме пасленовых
вариабелен. У одних и тех же исследованных им видов (Datura stramonium,
Browallia viscosa, Capsicum ацпиит, виды Lycopersicon, Solanum и др.)
обнаружены различные подтипы эндоспермогенеза (по классификации — Sell mi rf,
1929). Ко времени деления зиготы эндосперм обычно состоит из 24—48 клеток
(Dnyansagar., Cooper, 1960). У многих видов обнаружены различия в рнимерих
-и в структуре клеток отдельных участков эндосперма, на основании чего «и»
подразделяют на ряд зон (Svensson, 1926; Rosen, 1947; Рыбченко, 1951), :МЖГ>;
Глущенко, 1962; Saxena, 1970 — цит. по: Sharma et al., 1984). Дискуссионным
•м
являотел пои рос о голезисо миогоядерных структур в халазальжш части семя
почки nncjioiiojiJiix. Так, у S.,phureja через 8 сут после опыления отмечено
удлиненно хплплмльлых клеток эндосперма. Последние названы авторами халазаль-
пым гаусторием (Dnyansagar, Cooper, 1960). Сходное образование отмечено и
у Л'. maloiigena (Magtang, 1936 — цит. по: Dnyansagar, Coopei, 1960). У Вго-
wallla domissa, Salpiglossis sinuata и Schizanthus pinnatus (представители Sal-
pi tflosm'deae) описана халазальная ткань, сходная по ряду структурных призна-
коп с гаусторием. Она рассматривается авторами как производная эндосперма
(Moyor et al., 1962). В одной из сводок сем. Solanaceae описано, как
характеризующееся наличием неагрессивного халазального гаустория (Davis, 19.66),
л другой — в семействе выделен род Schizanthus со слабовыраженным эндоспер-
мальным гаусторием (Поддубная-Арнольди, 1982). Однако, согласно О. И. Рыб-
ченко (1965), гаусториеподобное образование в халазальной части
оплодотворенной семяпочки характерно для многих пасленовых. Это разрастающаяся
часть нуцеллуса; отдельные ее клетки гипертрофированы или
трансформированы в своеобразные многоядерные синцитии. Таким образом, вопрос о
наличии эндоспермальных гаусториев у пасленовых нуждается в
дополнительных исследованиях. Семена с эндоспермом (несколько слоев клеток),
содержащим следы крахмала (или без крахмала), белки и липиды. У Brunfelsia —
семена с обильным эндоспермом.
Эмбриогенез Solanad-типа (Johansen, 1950). Семейство оказалось очень
трудным для определения типа эмбриогенеза его представителей. Джогансеном
выделено 6 вариаций указанного основного типа: Nicotiana, Physalis I, Hyos-
cyamus, Datura, Physalis II и Physolis III. У С. аппиит развитие зародыша
соответствует Onagrad-типу. (Davis, 1966). Электронно-микроскопическое
исследование зародыша Petunia на проэмбриональной стадии эмбриогенеза выявило
постепенную утилизацию запасенных зиготой липидных отложений и крахмала
в первую очередь в центральной зоне проэмбрио (ярус Г). Одновременно
происходит также уменьшение размеров вакуолей. В 8—10-клеточном проэмбрио
отмечены автофагические вакуоли. На всех исследованных фазах пластиды
проэмбрио Petunia представлены лейкопластами. Клетки проэмбрио бедны
гранулярным ЭР и диктиосомами и богаты рибосомами, плотность которых
прогрессивно возрастает (Vallade, 1980). Суспензор S. phureja максимального
развития достигает на 13-е сутки после опыления и состоит из 14 клеток. Ба-
зальные клетки суспензора делятся поперечно и образуют 10 одноклеточных
ярусов, в то время как 2 апикальные клетки делятся продольно, образуя два
2-клеточных яруса. Суспензор зародыша пасленовых содержит крахмал.
Полное разрушение суспензора наблюдается в семенах с зародышем на торпедовид-
ной стадии развития (Dnyansagar, Cooper, 1960). Зародыш зрелого семени
прямой (TV. glauca), изогнутый (L. esculentum, S. phureja, Lycium cestroides) или
закрученный {Withania sp.). По данным Нетолицкого (Netolitzky, 1926), прямой
зародыш у представителей Cestreae, Nicotianeae и Salpiglossideae, а изогнутый —
у Datureae, Nicandreae и Solaneae. Он дифференцирован на 2 уплощенные
семядоли с прокамбиальной системой, гипокотиль, зародышевый корень с
выраженными корневым апексом и корневым чехликом и эпикотиль с выраженным
стеблевым апексом. У Solanum melongena описаны случаи трикотилии (Sethumadha-
van, Gopakumar, 1973). Запасные вещества в виде липидов и белков. Лейко-
эмбриофиты.
Случаи полиэмбрионии установлены у L. esculentum, N. tabacum, видов
Capsicum, Solanum и у других пасленовых. Обнаружен апомиксис, а именно
редуцированный партеногенез, интегументальная полиэмбриония (Поддубная-
Арнольди, 1982) и нуцеллярная полиэмбриония (N. rustica — Biraghi, 1930 —
цит. по: Schnarf, 1931; S. carniolica — Глущенко, 1973).
Исследованные виды и роды. Atropa belladonna, Browallia
demissa В. speciosa, В. viscosa, Brunfelsia americana, Capsicum (6), Cestrum auran-
tiacum, C. diurnum, C. elegans, C. nocturnum, Cyphomandra betacea, Datura fa-
stuosa (= Datura laevis), D. metel, D. stramonium (=Datura tatula), Duboisia lei-
chhardtii, D. myoporoides, Hyoscyamus albus, H. niger, H. orientalis (—Physoch-
laina orientalis), Lycium barbarum, L. cestroides, L. europaeum, Lycopersicon es-
246
eulentum, L. hirsutum, L. peruvianum, L. pimpinellifolium, Nicandra physaloidc.x,
Nicotiana (18), Petunia hybridq, P. nyctaginiflora, Physalis alkekengi, P. ixocarpa,
P. minima, P. peruviana, Physochlaina orientalis (=Hyoscyamus orientalis),
Salpiglossis picta, S. sinuata ( = Salpiglossis variabilis), Saracha jaltomata, SchizanlJuis
pinnatus, S. wisetonensis, Scopolia carniolica ( = Scopolia atropoides), S. lurida,
Solanum (24), Withania somnifera, Withania sp.
Литература. Hofmeister, 1855a, 1855b, 1858; Chatin, 1870, 1874;
Hanstein, 1870; Vesque, 1878a, 1878b, 1879; Jonsson, 1879—1880, 1881; Guig-
nard, 1882, 1901, 1902; Clarke, 1885; Hegelmaier, 1886; Halsted, 1890; Molliard,
1896a, 1896b; Balicka-Iwanowska, 1899; Tognini, 1900; Lotschei, 1905; Nanetti,
1912; Palm, 1915, 1922, 1923; O'Neal, 1920; Soueges, 1920a, 1920b, 1922b, 1936a;
Haberlandt, 1922; Young, 1922, 1923; Dahlgren, 1923; Svensson, 1925, 1926;
Netolitzky, 1926; Yamaha, 1926; Schnarf, 1927, 1931; Timmerman, 1927; Gli-
sic, 1928; Cooper, 1931, 1943, 1946; Bhaduri, 1932, 1933, 1935, 1936, 1951; Banerji,
Bhaduri, 1933; Персидский, 1935; Персидский, Модилевский, 1934а, 19346;
Rees-Leonard, 1935; Бейлис, 1936, 1938; Mactang, 1936; Модилевский, 1936,
1937, 1938, 1939, 1946, 1953; Поддубная-Арнольди, 1936, 1976, 1982; Lamm,
1937; Модилевский, Дзюбенко, 1937, 1939; Cochran, 1938; Clarke A. E., 1940;
Arnason, 1943; Chiistensen, Bamford, 1943; Поддубная-Арнольди, Лодкина,
1945; Goodspeed, 1947; Rosen, 1947; Barnard, 1949; Brown, 1949; Morgan, Rap-
pleye, 1949, 1950, 1954; Johansen, 1950; Prakash, Chatterjee, 1953; Scarascia,
1953; Crete', 1954a, 1959a, 1960, 1961a, 1961b, 1961c, 1961d; Кахидзе, 1954; Riet-
sema et al., 1955; Walker, 1955; Jain, 1956; Орел, 1957а, 19576, 1957b, 1958,
1962, 1963, 1964; Pavari, 1957; Choudhury, 1958; Marschall, 1958; Цингер, 1958;
Рыбченко, 1959, 1963a, 19636, 1963в, 1963г, 1964, 1965; Dnyansagar, Cooper,
1960; Lengel, 1960; Татевосян, 1960; Глущенко, 1962, 1963a, 19636, 1967, 1968,
1973; Даниелян, 1962, 1963, 1965, 1973, 1974; Meyer et al., 1962; Батыгина и др.,
1963; Esser, 1963; Fagherazzi-Abgrall, Meyer, 1963; Иванова, Орел, 1963; Мол-
кова, 1963; Банникова, Остапенко, 1964; Ервандян, 1964а, 19646, 1965а, 19656,
1971; Махалова, 1964; Микаелян, 1964, 1966, 1967а, 19676; Mohan Ram, Kamini,
1964; Мутафян. 1964, 1965, 1971; Sassen, 1964; Vasil, 1964; Агаджанян, 1965;
Лудникова, 1965; Орлова, 1965; Роборовская, 1965; Романов, 1965, 1970;
Davis, 1966; Mohan, 1966, 1968; Plujim van der, Linskens, 1966; Saxena, Singh,
1966, 1969; Тахтаджян, 1966; 1980; Went van, Linskens, 1967; Ермаков, 1967;
Герасименко, Резникова, 1968; Грабовская, 1968; Jos, Singh, 1968; Оганесян,
1968, 1975; Резникова и др., 1968; Банникова, Хведынич, 1969, 1973, 1982;
Ciobanu, 1969a, 1969b, 1970a, 1970b, 1970-1971 (1972), 1971; Mohan, Singh,
1969; Молкова, Филева, 1969; Банникова, 1970а, 19706, 1975; Dryanovska,
1970; Husain, Khan, 1970; (Лунева и др.) Luneva et al., 1970 (1971); Vallade,
1970, 1973, 1980; Varghese, 1970; Went van, 1970a, 1970b, 1970c; Yoshida, 1970;
Hesemann, 1972; Лунева и др., 1972; Parveen et al., 1972; Банникова,
Овсянникова, 1973; Clauhs, Grun, 1973, 1977; Hausbrandt, Golinowski, 1973, 1975
(1976); Horner, Rogers, 1973, 1974; Лунева, Поддубная-Арнольди, 1973; Pal,
Barnabas, 1973; Sethumadhavan, Gopakumar, 1973; Варшанина, 1973, 1977,
1979; Vallade, Cornu, 1973; Яковлев, Жукова, 1973, 1980; Батикян и др., 1974;
Беляева, 1974; Острецова, 1974; Swamy, 1974; Vallade, Bugnon, 1974; Whelan,
1974; Whelan et al., 1974; Еналеева, Душаева, 1975; Селиванов, Тырнов, 1975;
Corner, 1976; Cresti, Went van, 1976; Cresti et al., 1976a, 1976b, 1984, 1985; Oro-
родникова, 1976; Орел, Жакова, 1976, 1977; Raghavan, 1976; Abreu, Santos,
1977; Ciampolini, Cresti, 1977; Георгиева, 1977; Malecka, 1977b; Москалева,
Огородникова, 1977; Острецова, Резникова, 1977; Pacini, 1977a; Singh, Malum,
1977; Chwilkowska, Zenkteler, 1978; Dharamadhaj, Prakash, 1978; Еналеева и др.,
1978; Kami, Tiwari, 1978; Кордюм, 1978; Pacini, Cresti, 1978; Prasad, SiuK'li,
1978; Сердюк и др., 1978; Vallade et al., 1978; Mogensen, Suthar, 1979;
Овсянникова, 1979; Ramanna, 1979; Sehgal, 1979,1980; Sehgal, Gifford, 1979; Варпншшш,
Орел, 1980; Mestre, Vannereau, 1980; Sears, 1980; Банникова и др., 1981; Горл
ева, 1981; Денисова, Васильченко, 1981; Hagemann, 1981, 1983; Хведынич и др.,
1981; Kadej, Kadej, 1981, 1983; Raghavan, 1981; Горяева, Ермакон, 1IIH2;
Ермаков, Горяева, 1982а, 19826, 1982в; Sangwan, Camefor, 1982; Шончолко, 1'1,и
•HI
манова, 1982; Moniai'delio, 1983; брел, Варшанина, 1983; Bouman, 1984;
Reynolds, ИМ; Sliarma ot al., 1984; Bellani et al., 1985; Erdelska, 1985; Kadej et al.,
1985; Поддубшш-Лрнольди, Даниелян, 1985; Rae et al., 1985; Тарасенко, 1985;
Zhou C.Iiiuik, 1985.
|Семейство DUCKEODENDRACEAE
Эмбриологически не исследовано.1
В зрелом семени U-образный зародыш и скудный эндосперм,[ содержащий
лиииды.
Литература. Тахта джян, 1966.
Семейство BUDDLEJAGEAE
Пыльник 4-гнездный, вскрывается у Buddleja davidi и Nicodemia diversifolim
продольными щелями. По нашим данным, стенка гнезда пыльника у В.
davidi, развивающаяся центробежно, состоит из эпидермиса, эндотеция, среднего-
слоя и тапетума. В процессе ее формирования происходит утолщение наружных
тангенциальных стенок клеток эпидермиса и радиальных стенок клеток
эндотеция. Клетки среднего слоя постепенно разрушаются. Тапетум клеточный
секреторный, с 2-ядерными клетками, ядра могут сливаться. Тапетум со стороны
связника нерегулярно 2-слойный, представлен крупными клетками.
Располагаясь весьма своеобразно в гнезде пыльника, эти клетки образуют подобие
выступа и веерообразно подходят к спорогенным клеткам. Со стадии вакуолизи-
рованных микроспор клеточные оболочки в тапетуме не выявляются, однако
протопласты четко отграничены друг от друга. Частично и на
непродолжительное время вторично возникшие оболочки клеток тапетума обнаруживаются на
стадии сформированных 2-клеточных пыльцевых зерен. В зрелом пыльнике
тапетум не сохраняется. Стенка зрелого пыльника представлена эпидермисом,-
на наружных стенках которого откладывается кутикула в виде небольших
шипиков, и фиброзным эндотецием. В клетках эпидермиса и эндотеция перед,
вскрыванием перегородок в теках обнаружен крахмал. Спорогенная ткань-
на поперечном срезе гнезда пыльника имеет в очертании подковообразную форму
и представлена 15—17 тяжами клеток. Образование тетрад микроспор
происходит по симультанному типу. Тетрады микроспор тетраэдральные, реже —
крестообразные. Зрелые пыльцевые зерна у В. davidi и N. diversifolia 2-клеточные^
с крахмалом. Удлиненно-яйцевидной формы спермин образуются в пыльцевой
трубке, растущей по столбику плодолистика.
Семяпочка гемитропная, с одним интегументом, тенуинуцеллятная. Нуцел-
лус представлен одним слоем клеток вокруг мегаспороцита и разрушается в
период мегаспорогенеза и на первых этапах развития зародышевого мешка. В
семяпочке дифференцируется гипостаза. Микропиле узкое. В клетках итегумента
в области микропиле с началом формирования зародышевого мешка
обнаруживается крахмал. После оплодотворения он появляется во всех клетках инте-
гумента. Внутренний эпидермис интегумента дифференцируется в интегумен-
тальный тапетум, который на стадии зрелого зародышевого мешка контактирует
лишь со средней его частью, заканчиваясь на границе яйцевого аппарата и
антипод. Внутренние тангенциальные стенки его клеток кутинизированы.
Археспорий одноклеточный, археспориальная клетка преобразуется в мегаспороцит
без отделения париетальной клетки. Тетрада мегаспор линейная.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. Синергиды грушевидные. Полярные ядра сливаются до оплодотворения.
3 антиподы небольшие, сохраняются на ранних стадиях развития эндосперма.
Порогамия. Оплодотворение двойное.
Эндосперм целлюлярный, характеризуется образованием микропилярного-
и халазального гаусториев, которые у В. curviflora представлены 4
одноядерными клетками каждый. Клетки микропилярного гаустория с многочисленными!
248
11
Buddlejaceae
1—10, 14, 15—18 — Buddleja
davidi, 19 — В. curviflora, 20—
26 — В. variabilis, 11—13 —
Nicodemia diversifolia.
i, '2 — формирование стопки
пыльника; образование споро-
генных клеток (1) и микроспо-
фопитов (2); 3 — фрагмент стенки гнезда пыльника на стадии тетрад микроспор; <1
-схема пыльника на этой же стадии развития; тапетум в гнезде пыльника зачернен; Л
•фрагмент|стенки гнезда пыльника на стадии микроспор; клеточные оболочки л тппотума
•не выявляются; 6 — фрагмент стенки гнезда пыльника перед вскрыванием на стадии .,-
клеточных пыльцевых зерен; видны вторично возникшие оболочки клеток тапетум»; f II •
■микроспорогенез; 12—14 — развитие пыльцевого зерна; 15 — пыльцевая трубки и столпнии
плодолистика; видны спермин и ядро вегетативной клетки;
Buddlejaceae (продолжение)
16 — семяпочка на стадии дифференциации археспорий; 17 — схема сформированной геми-
тропнои семяпочки; выделены интегументальный тапетум и гипостаза; 18 — зрелый
зародышевый мешок; 19 — стадия развития зародыша и эндосперма; видны микропилярный и
халазальныи гаустории эндосперма; 20—26 — развитие зародыша. (1—18 — о риг • 19 —
по Dop, 1913; 20—26 — по Soueges, 1940). '
выростами, внедряющимися в ткань интегумента. Эндосперм в зрелом семени
состоит из 2—3 слоев клеток, заполненных жирами и крахмалом. d
Зародыш у В. variabilis (Soueges, 1940; Johansen, 1950) развивается в
соответствии с Onagrad-типом Veronica-вариацией. Первое деление в зиготе
поперечное, затем в апикальной клетке продольное, в базальной — поперечное.
После стадии октантов проэмбрио представлен ярусами 1,Г,тж ci. В ходе
дальнейшего развития из верхнего этажа октанта (I) дифференцируются семядоли
и апекс побега, а из нижнего (I') — гипокотиль. Клетка т делится поперечно
на 2 клетки, из которых верхняя (d) становится гипофизарной и дает начало
инициалям коры корня и корневого чехлика, а нижняя (/) и производные
клетки ci образуют нитевидный подвесок. Зрелый зародыш небольшой, прямойг
дифференцирован на семядоли, апекс побега, гипокотиль и зародышевый
корень с чехликом.
Исследованные виды. Buddleja curviflora, В. davidi, В. lindler-
giana, В. variabilis, Nicodemia diversifolia.
250
Литература. Solereder, 1895; Dop, 1913, 1923; Dahlgren, 1922, 1923;
Soueges, 1940b; Crete, 1942, 1951; Johansen, 1950; Melchior, 1964; Bendre, 1975;
Шамров (ориг. данные).
Семейство RETZIACEAE
Эмбриологически не изучено.
Семяпочка, по-видимому, с одним интегументом, тенуинуцеллятная.
Эндосперм целлюлярный и, вероятно, имеет терминальный эндоспермальный
гаусторий.
Зародыш окружен эндоспермом, прямой, цилиндрический, крупный.
Исследованный вид. Refzia capensis.
Литература. Leeuwenberg, 1964.
Семейство SCROPHULARIACEAE
Пыльник у большинства исследованных видов 4-гнездный, из 2 тек,
раскрывающихся продольными щелями, или 2-гнездный, «почковидной» формы, со
слившимися гнездами в теке (Verbascum, Scrophularia). У некоторых таксонов
встречается разная степень стерилизации гнезд и редукции тек. Однотековыи
2-гнездный пыльник отмечен у Limosella aquatica, у некоторых видов родов
Striga и Harveya, а также у исследованных представителей трибы Selagineae.
Одногнездный пыльник характерен для Hyobanche sanguinea. Стенка гнезда
пыльника формируется центробежно и состоит из 4—6 слоев клеток. Эпидермис
сохраняется в зрелом пыльнике, представлен крупными клетками, наружные
его стенки часто утолщены. Эндотеций с фиброзными утолщениями, у некоторых
видов развитыми только в большей или меньшей части этого слоя, как например
у Melampyrum nemorosum и Bartsia alpina. У ряда видов фиброзные утолщения
развиваются также и в среднем слое, и в слоях клеток со стороны связника,
как у Verbascum thapsus и Digitalis grandiflora (Никитичева, 1968). У Chelone
glabra (Arekal, 1963) благодаря периклинальным делениям эндотеций становится
многослойным. Тапетум секреторного типа, гетерогенный по происхождению,
обычно однослойный, состоит из 2-ядерных (реже 3—4-ядерных) клеток. У,
некоторых видов гетерогенные части тапетума хорошо различаются
морфологически, особенно там, где связник образует плацентоид, вдающийся в каждое
гнездо. Клетки тапетума со стороны плацентоида более крупных размеров,
вытянуты радиально, имеют большую плоидность ядер, чем клетки наружной
части тапетума (М. nemorosum, В. alpina, Lathraea squamaria и др.).
Ультраструктурные изменения, происходящие в тапетуме во время мейоза и созревания
пыльцевых зерен, прослежены у Antirrhinum majus (Lombardo, Carraro, 1976).
Дезинтеграция тапетума происходит в период созревания пыльцевых зерен.
Археспорий имеет форму пластинки клеток на поперечном срезе. Спорогенная
ткань может быть однослойной (обычно у L. squamaria), 2-слойной (В. alpina)
и многослойной (М. nemorosum, D. grandiflora, V. thapsus). Характерен
симультанный тип образования тетрад микроспор. У L. squamaria наблюдался цито-
миксис во время мейоза (Gates, Latter, 1927). Тетрады микроспор
тетраэдральные, реже — изобилатеральные или крестообразные. Зрелые пыльцевые зерна
у большинства видов 2-клеточные, одиночные; 3-клеточная пыльца обнаруя^ена
у Е. tatarica, многих видов Veronica (Афанасьева, 1976), Globularia incanescem
{Corsi, Garbari, 1972) и некоторых других. Спермиогенез у большинства
норичниковых происходит в пыльцевой труб'ке (Руденко, 1929, 1930, 1933).
Семяпочка тенуинуцеллятная, с одним интегументом, чаще всего анатроп-
ного или гемитропного типа (иногда имеется промежуточное состояние — го-
мианатропное); встречаются также семяпочки кампилотропные (Orthocarpim
luteus, Pedicularissylvatica, Toreniaviolacea, Vandellia Crustacea, видыRhinanthutt)}
анакампилотропные (Rhynchocorys orientalis) и амфитропные (некоторые \щ\\А
Veronica). Однослойный нуцеллус разрушается в период 2—4-ядерной отндии
развития зародышевого мешка. Интегумент имеет в толщину от 3 до 8, родко ■--
уы
Scrophulariaceae
1—4, 6—9, 11—13, 15—17, 22—28, 30—42 — Bartsia alplna, 5, 19, 29 — Verbascum thapsus,.
10 — Digitalis grandiflora, 14 — Pedicularis kaufmanni, 18, 43 — Lathraea squamaria, 20 —
Rhinanthus minor, 21 — Melampyrum nemorosum.
1—4, 6—8 — фрагменты гнезда пыльника на разных стадиях развития: заложения и деления^
археспориапьного слоя (1, 2), дифференциации внутренней и наружной частей тапетума;
(3, 4), формирования пыльцевых зерен (6—8); 2а, 4а — схемы пыльников; 5 — мейоз II:
в мйкроспороцитах; 9, 10 — схемы строения зрелых пыльников;
Scrophulariaceae^ продолжение)
11—13 — ранние этапы формирования семяпочки в мегаспорогенез; 14 — 5 мегаспороднтпп
в нуцеллусе; 15—17 — стадии развития и строение зрелого (17) зародышевого метка, 17ч • •
схема гемитропной семяпочки; 18 — антиподальныи конец зародышевого мешка с иршич'пми
щими 2-ядерными клетками гипостазы;
Scrophulariaceae (продолжение)
19 — анатропная семяпочка; видны толстостенные клетки гипостазы; 20, 21 —
оплодотворение: контакт спермиев с ядром яйцеклетки и вторичным ядром (20) или микропилярныи
полярным ядром (21); 22—27 — этапы развития эндосперма; 28, 29 — схемы строения
эндосперма и его гаусториев в незрелом семени;
более, слоев клеток. У всех исследованных видов развит интегументальный
тапетум, окружающий зародышевый мешок по всей его длине (Rhinanthus) или
только его часть — халазальную (Gerardia pedicularia, Tozzia alpina), микро-
пилярную (виды Melampyrum) или среднюю (Linaria ramosissima, Mecardonia
procumbens, Mimulus ringens). У Melampyrum lineare, M. pratense и М. nemoro-
sum интегументальный тапетум формируется из гиподермального слоя, а эпи-
254
Scrophulariaceae (продолжение)
. 30—41 — ранний эмбриогенез; '42, 43 — схема строения зародыша и эндосперма (42) в
пролом семени (т — тапетум, н — нуцеллус, м. п. я, х. п. я — микропилярное и халазплЬИОв
полярные ядра, сп — спермий, м. г, х. г — микропилярныи и халазальныи гаустории ППДО»
сперма). (1—13, 15—19, 22—29, 42, 43 — ориг.; 14 — по Афанасьевой, Граханцепой, 107fl|
20 — по Афанасьевой, Окуловой, Граханцевой, Юсуповой, 1975; 21 — по Иоффо, 10701
30—41 — по Никитичевой, 1971).
.'дермпльпмй слой иптогумента вокруг зародышевого мешка разрушается во
время роста послодпого (Arekal, 1963; Raju, Arekal, 1977; Никитичева, 1979а).
У иродстапитолой подсем. Scrophularioideae — Verbascum и Celsla — интегу-
мснтпльпмй тапетум состоит из клеток, не равных по размерам; внутренняя тан-
гоптальиан стоика этих клеток значительно утолщается в процессе развития
■оомшги. Цитохимические исследования интегументального тапетума у Linaria
Ы/шгШа (Kallarackal, Bhatnagar, 1980, 1981) выявили показатели высокой
метаболической активности этой ткани по содержанию в ней белков, РНК и
нерастворимых полисахаридов. У большинства представителей семейства
разлита гипостаза, варьирующая по структуре: она может состоять из клеток с
утолщенными оболочками (V. thapsus) или тонкостенных 2-ядерных клеток (L.
squamaria). У A. majusB клетках гипостазы обнаружена каллоза (Rodkiewicz, 1967).
Женский археспорий обычно одноклеточный, у некоторых видов эпизодически
встречается 2-клеточный, у Pedicularis kaufmanni — многоклеточный
(Афанасьева, Граханцева, 1975). Археспорий преобразуется в мегаспороцит без
отделения кроющей клетки. Мейоз завершается образованием тетрады мегаспор
обычно линейного типа, но у М. ringens ж Bacopa hamlltoniana тетрада
Т-образная.
Зародышевый мешок у подавляющего большинства видов моноспорический,
развивается по Polygonum-типу из халазальной мегаспоры линейной тетрады,
у Penstemon secundiflorum, Pedicularis sylvatica и Striga orobanchoides может
развиваться из любой мегаспоры. У P. kaufmanni в одной семяпочке образуются
несколько зародышевых мешков из мегаспор одной или разных тетрад. У Ale-
ctra thomsoni (Vijayaraghavan, Ratnaparkhi, 1972) и Scrophularia himalensis
(Natesh, Bhandari, 1975) зародышевые мешки развиваются как по Polygonum-
типу, так иногда и по Allium-типу. Для L. ramosissima (Arekal, Raju, 1964)
характерен биспорический зародышевый мешок Allium-типа, а для видов Ме-
lampyrum (Arekal, 1963; Greilhuber, 1973; Raju, Arekal, 1977) — тетраспориче-
ский Drusa-типа. У большинства видов зародышевый мешок удлиненный, с
расширенной микропилярной и суженой халазальной частью. У Vandellia angusti-
folia, V. crustacea и Т. violacea микропилярный конец зародышевого мешка
выходит из микропиле (Krishna Iyengar, 1940, 1941; Guilford, Fisk, 1952; Yama-
zaki, 1955); у видов Melampyrum на микропилярном конце мешка развиваются
трубчатые выросты (Speta, 1975, и др.). У многих видов в зародышевом мешке
отмечен крахмал. Яйцевой аппарат 3-клеточный, синергиды с заостренным ба-
зальным концом, иногда крючковидные. Электронно-микроскопическое
исследование выявило нитчатый аппарат у Torenia fournieri (Pluijm van der, 1964).
Последний был обнаружен и у видов других родов (Melampyrum, Linaria,
Scrophularia). Антиподы из 3 клеток, у некоторых представителей иногда из
2 клеток, тогда одна клетка 2-ядерная (Rhinanthus (=Alectorolophus) hirsutus,
R. minor, Sopubia trifida, M. ringens, L. squamaria, Veronica agrestis и другие
виды рода Veronica). Антиподы обычно эфемерны, однако у Gratiola officinalis
(Gligic, 1933), М. ringens (Arekal, 1965) и О. luteus (Arekal, 1963) они длительно
сохраняются, а у последнего вида могут делиться! Полярные ядра сливаются,
как правило, до оплодотворения, образуя вторичное ядро центральной клетки.
Исключением являются виды Melampyrum, у которых слияния полярных ядер
не происходит.
Оплодотворение порогамное, двойное. Пыльцевая трубка разрушает одну
из синергид, другая обычно вскоре дегенерирует. Сингамия и тройное слияние
могут происходить одновременно (у Striga; Tiagi, 1956), чаще же слияние ядер
в центральной клетке завершается раньше, чем в зиготе; процесс происходит
по премитотическому типу. У видов Melampyrum второй спермий объединяется
только с верхним полярным ядром, давая начало диплоидному ядру эндосперма
(Arekal, 1963; Greilhuber, 1973; Speta, 1975; Иоффе, 1976).
Эндосперм целлюлярного типа, с развитыми микропилярным и халазальным
/гаусториями. Первая перегородка в первичной клетке эндосперма поперечная
(Brunella-тип эндосперма — по: Schnarf, 1929), она отделяет инициальную
клетку халазального гаустория и микропилярную клетку. Последняя делится
обычно продольной перегородкой, у некоторых видов (P. sylvatica, M. lineare,
Euphrasia arctica, G. pedicularia, Т. alpina) она может быть неполной. Обе до-
256
черние от микропилярной клетки разделяются поперечно на инициал и cofi
ственно эндосперма и микропилярного гаустория. Лишь у Отдельных иидоа
микропилярная клетка 2-клеточного эндосперма делится поперечной
перегородкой (Sopubia delfinifolia, S. trifida, Alonsoa sp., Anticharis linearis), что требует
проверки. Разработан ряд классификаций развития эндосперма в семейстно
(Glisic, 1936—1937; Krishna Iyengar, 1947; Crete, 1955; Yamazaki, 1957; Л«-
nerji, 1961, и др.), в основу которых положены направление и последовательность
его первых делений, а также особенности развития и строения эндосперма льны х
гаусториев, имеющих большое морфологическое разнообразие по числу,
размерам и форме клеток, по числу и плоидности ядер. Микропилярный гаусторий
может быть многоклеточным, разделенным поперечными перегородками
(Gratiola); 4-клеточным с продольными перегородками (Linaria, Verbascum, Zalu-
zianskya и др.); из двух 2-ядерных клеток (Alectra, Striga, некоторые виды
Veronica); одноклеточным 2-ядерным (некоторые виды Veronica) или 4-ядерным
(Rhinanthus, Lathraea, Tozzia и др.). Халазальный гаусторий может быть 4-
клеточным (Verbascum, Gratiola, Mimulus), 2-клеточным (Zaluzianskya,
некоторые виды Veronica и Gratiola) или одноклеточным 2-ядерным (Pedicularis,
Rhinanthus, Melampyrum). Многоклеточные эндоспермальные гаустории, как
правило, слабо разрастаются, одноклеточные же (характерные для всех
представителей трибы Rhinantheae) достигают гигантских размеров (до 500 мкм в длину),
а их ядра имеют высокую плоидность (256п — у Rhinanthus). Халазальный
гаусторий эндосперма достигает проводящего пучка в халазе. Микропилярный
гаусторий или развивается в пределах микропилярной части интегумента (в трибе
Verbasceae), или образует длинные выросты, достигающие проводящего пучка
в фуникулусе (большинство представителей трибы Rhinantheae). У Globularia
cordifolia и G. vulgaris отростки микропилярного и халазального гаусториев
выходят из семяпочки и достигают стенки завязи (Billings, 1901; Rosen, 1940),
что требует проверки. У G. nudicaulis, по нашим данным, гаустории эндосперма
находятся в пределах семяпочки. Только у единичных видов гаустории
эндосперма не обнаружены: у 2 видов Nemesia (Crete, 1950a, 1950) не развит
халазальный гаусторий, у Linaria genistifolia (Персидский, 1934) и Chaenorhinum
minus (Arekal, 1963a) — микропилярный.
У большинства видов между микропилярным гаусторием и запасающей
тканью эндосперма формируется особым образом специализированная ткань,
представленная в виде колонки и состоящая из мелких густоплазменных клеток
(«istimus», или «шейка» эндосперма). Подобная ткань у некоторых видов
хорошо развита и со стороны халазального гаустория (L. squamaria, B. alpina;
Никитичева, 19796). У A. thomsoni отмечено развитие вторичных гаусториев
в виде небольших одноядерных выростов из клеток «шейки» эндосперма
(Vijayaraghavan, Ratnaparkhi, 1972). У мирмекохорных видов (Pedicularis,
Melampyrum, Rhynchocorys) халазальный или микропилярный гаустории эндосперма
становятся вместилищем жировых веществ и в зрелом семени выполняют
функцию элайосомы (Berg, 1954; Tiagi, 1965; Никитичева, 19796; Терехин,
Серафимович, 1981). В семени эндосперм имеется и обычно хорошо развит. У
некоторых видов эндосперм руминирован (Verbascum, Celsia, Scrophularia) вследствие
неравномерного разрастания клеток интегумента (Verbascum — тип руминации
по: Periasamy, 1962). Запасные вещества эндосперма — крахмал, белковые
или жировые соединения. Клеточные оболочки эндосперма по своей структуре
варьируют и, вероятно, видоспецифичны (тонкостенные или более или менее
значительно утолщенные, с заметными порами).
Эмбриогенез происходит в соответствии с IV мегархитипом I периода серии
А классификации Суэжа или Ohagrad-типом Veronica- и Mentha-вариации но
классификации Джогансена. Исключением является эмбриогенез М. /.Inaai'ti
(Arekal, 1963), соответствующий III мегархитипу, и эмбриогенез Ellisiophj/UiiiU
pinnatum (Yamazaki, 1957), происходящий по Solanad-типу. Эмбриогошш
начинается на стадии многоклеточного эндосперма. Характерно сильноо
удлинение зиготы до ее поперечного деления, происходящего в апикальном конца
клетки, и образование 2 неравных по величине клеток. Клетка са проходит
в своем развитии через стадии квадрантов и октантов. Периклинальиыо далпиим
в последних приводят к отделению эмбриодермы. Суспензор хорошо раннит,
17 Сравнительная эмбриология У(1|
обычно нитенмдиый, из 3—25 клеток, расположенных линейно, редко — более
миогорядпый.
Зародыш л зрелом семени автотрофных представителей семейства обычно-
хорошо раапит, прямой, с 2 семядолями, апексом побега (иногда с зачатками
шфлых листьев) и корневым апексом. В гипокотиле и семядолях развит про-
паокулнриый тяж. У норичниковых, ведущих паразитный образ жизни,
зародышу свойственна более или менее значительная структурная редукция
органов и тканей (L. squamaria). Представители рода Striga позволяют составить
эволюционный ряд по степени органогенной и гистогенной редукции
зародыша, завершающийся редукцией семядолей и апекса побега у зародышей
наиболее высокоспециализированных паразитов — S. orobanchoides и S. hermonthica
(Терёхин, 1977). Крайним результатом такой редуции является глобулярный
зародыш Harveya coccinea (Никитичева, 1971, 19796). Большинство из
исследованных представителей семейства — лейкоэмбриофиты, но Collinsia heterophylla,
Limosella sp. (Netolitzki, 1926) и Penstemon humilis — хлороэмбриофиты
(Яковлев, Жукова, 1973).
Отмечены случаи образования 2 зародышей в семени: в одном зародышевом
мешке (A. linearis) или в разных зародышевых мешках одной семяпочки (P. kauf-
manni).
Исследованные виды. .Agathelpis dubia, Alectra parasitica var.
chitrakutensis, A. thomsoni, A. vogelii, Alonsoa caulialata, Alonsoa sp., Anticharis
linearis, Antirrhinum majus, Bacopa hamiltoniana, B. monnieri (=Herpestis mon-
nieri), Bartsia alpina, Bonnaya (=Vandellia) ruellioides (V. antipoda), B. tenuifo-
lia, B. verbenaefolia (=V. anagallis), Calceolaria mexicana, Capraria biflora, Cel-
sia coromandeliana, Centranthera hispida, Chaenorhinum minus, Chaenostoma
(=Sutera) foetidum, Chelone glabra, Collinsia bicolor, C. heterophylla, Deinostema,
Dermatobotrys saundersii, Digitalis grandiflora, D. purpurea, Dischisma arenarium,
D. capitatum, D. ciliatum, Ellisiophyllum pinnatum var. reptans, Erinus alpinus,
Euphrasia arctica, E. officinalis, E. rostkoviana, E. tatarica, E. tenuis, Gerardia
pedicularia, Globularia cordifolia, G. incanescens, G. nudicaulis, G. vulgaris, Gratiolcc
officinalis, Harveya coccinea, Hebenstretia comosa, H. dentata, H. integrifolia,
Hyobanche sanguinea, Ilysanihes (=Lindemia) dubia, I. hyssopioides, I. parviflora,
Isoplexis (=Digitalis) canariensis, Lagotis glauca, Lathraea clandestina, L.
squamaria, Limnophyla heterophylla, Limosella aquatica, Linaria (6), Lindernia
hyssopioides, L. pyxidaria, Lyperia (=Sutera) violacea, Mecardonia procumbens, Me-
lampyrum (7), Microcarpaea muscosa, Mimulus moschatus, M. ringens, M. tigrinus,
Nemesia floribunda, N. melissaefolia, N. strumosa, Orthocarpus luteus, Parentucel-
lia latifolia, Pedicularis (6), Penstemon secundiflorum, Rehmannia angulata,
Rhamphicarpa longiflora, Rhinanthus hirsutus, R. major, R. minor, R. serotinus,
Rhynchocorys orientalis, Scoparia dulcis, Scrophularia arguta, S. himalensis, S. ma-
rylandica, Sopubia delphinifolia, S. trifida, Stemodia viscosa, Striga euphrasioi-
des, S. lutea, S. gesnerioides (=S. orobanchoides), Sutera antirrhinoides, S. foetida,
Tetranema mexicanum, Torenia cordifolia, T. fournieri, T. hirsuta, T. violacea,
Tozzia alpina, Vandellia (=Lindernia) angustifolia, V. Crustacea, V. hirsuta,
V. scabra, Verbascum blattaria, V. phoeniceum, V. thapsus, Veronica (около 50
видов).
Литература. Tulasne, 1849; Hofmeister, 1858, 1859; Ghatin, 1874;
Warming, 1878; Jonsson, 1879—1880, 1881; Vesque, 1879; Bachmaim, 1880;
Beck-Mannagetta, 1890; Buscalioni, 1893a, 1893b, 1894; Wettstein, 1895; Meimier,
1897; Baliska-Iwanowska, 1899; Tischler, 1899; killings, 1901; Bernard, 1903;
Tieghem van, 1903; Schmid, 1906; Wurdinger, 1910; Dop, 1913, 1914; Magnus,
1913; Lundquist, 1915; Michel, 1915; Evans, 1919; Boeshore, 1920; Soueges, 1921a,
1935c; Cook, 1924; Gscheidle, 1924; Gates, 1925; Hakansson, 1926; Gates, Latter,
1927; Hauss, 1927; Svensson, 1928; Руденко, 1929, 1930, 1933; Schnarf, 1929,
1931; Glisid, 1932, 1933, 1936—1937; Персидский, 1934; Srinath, 1934, 1938—
1939; Krishna Iyengar, 1937, 1939a, 1939b, 1939c, 1940a, 1940b, 1941, 1942a,
1942b, 1942c, 1947; Rosen, 1940; Kumar, Abraham, 1941; Raghavan, Srinivasan,
1941a, 1941b; Crete, 1943, 1948b, 1949e, 1950a, 1950b, 1950c, 1950d,1952a, 1953a,
1954b, 1954c, 1958, 1964; Srinivasan, 1946; Desole, 1949; Safeeulla, Govindu,
258
4950; Guilford, Fisk, 1952; Yamasaki, 1953, 1954, 1955, 1957a, 1957b; Berg, 1954;
Tiagi, 1956, 1965b, 1966; Trapp, 1956; Hartl, 1959; Johri, Singh, 1959; Pal, 1959;
Banerji, 1961; Charma, 1962; Joshi, Vargese, 1962, 1963; Junell, 1962; Arekal,
1963a, 1963b, 1963c, 1964, 1965, 1966; Vargese, 1963; Arekal, Raju, 1964, 1967,
1971; Bhatnagar, Singh, 1964; Kapil, Masand, 1964; Pluijm, 1964; Erbrich, 1965;
Михайлова, 1966; Никитичева, 1966, 1968, 1971, 1979a, 19796; Rodkiewich,
1967; Schrock, Palzer, 1967; Jaitly, Guignard, Mestre, 1968; Окулова, 1968;
Tiagi, 1968; Tschermak-Woess, 1968; Mestre, Guignard, 1969; Taneia, 1969a,
1969b; Arekal, Girijamma, Swamy, 1970; Tiagi, Vargese, 1970; Arekal, Rajesh-
wary, Swamy, 1971; Афанасьева, 1971, 1975, 1976; Афанасьева, Окулова, 1971;
Vijayaraghavan, Ratnaparkhi, 1972, 1973; Батикян, Карагезян, 1973; Вакар,
Карлова, 1973; Карлова, 1973а, 19736, 1976, 1979; Greilhuber, 1973;
Никитичева, Терёхин, 1973; Raju, 1973, 1976; Афанасьева, Граханцева, 1975;
Афанасьева, Окулова, Граханцева, Юсупова, 1975; Hakki, 1975, 1977; Hesse,
Greilhuber, 1975; Kapoor, Parukelar, Vijayaraghavan, 1975; Kapoor, Vijayaraghavan,
1975; Natesh, Bhandari, 1975, 1984; Speta, 1975; Bhandari, Bouman, 1976; Иоффе,
1976; Lombardo, Carraro, 1976a; Терёхин, 1977; Raju, Arekal, 1977, 1978; Ko-
poor, Vijayaraghavan, Parukelar, 1978; Bhatnagar, Kallaraskal, 1979; Chandra,
Singh, Pandey, 1980; Kallaraskal, Bhatnagar, 1980, 1981; Mitroiu, Radubesku,
Moroianu, 1981; Терёхин, Никитичева, 1981; Терёхин, Серафимович, 1981;
Okonkwo, 1982; Tivari, 1982; Reddy, Prakasa Rao, 1983; Johri, Ambegaokar,
1984; Bhandari, Natesh, 1985; Никитичева (ориг. данные).
Семейство BIGNONIACEAE
Пыльник 4-гнездный, из 2 глубокорасщепленных тек; у Dolichandrone
и Parmentiera 2-гнездный. Слияния гнезд в теках перед созреванием
пыльников не происходит. Характерная особенность пыльников изученных видов —
развитие плацентоида — стерильного выроста паренхимы связника, глубоко
внедряющегося в полость каждого гнезда, что отчасти определяет
подковообразную форму спорогенной ткани и самих гнезд. Этот вырост сохраняется
в течение всего микроспорогенеза, и начало его дезорганизации наблюдается
на стадии зрелых тетрад (Pyrostegia ignea, Tecoma stans) или 2-клеточных
пыльцевых зерен (Paulownia fortunei, P. tomentosa). В зрелом пыльнике он
сохраняется в виде небольшого выступа из дегенерирующих клеток (Pyrostegia)
или почти полностью разрушен (Тесота). Стенка пыльника формируется цен-
тробежно. Кутинизированный эпидермис у Pyrostegia имеет устьица. Эндо-
теций однослойный, нерегулярно 2-слойный у P. ignea и 3-слойный у Огоху-
lum indicum. Фиброзные утолщения в нем образуются к моменту созревания
пыльцевых зерен и располагаются только в основании гнезд пыльника (P.
ignea, Т. stans). У P. fortunei * и P. tomentosa* на стадии 2-клеточных пыльцевых
зерен фиброзные утолщения в эндотеции нами не обнаружены. Средние слои
(2—3 у Pyrostegia и Тесота и 4 у Oroxylum) эфемерйы, и начало их
дезинтеграции наблюдается еще до мейоза. По нашим данным, средние слои сохраняются
более длительно — вплоть до образования тетрад микроспор (Campsis radicans)
и 2-клеточных пыльцевых зерен (P. fortunei, P. tomentosa). Тапетум
секреторный однослойный, у С. radicans со стороны связника может быть нерегулярно
2-слойным, одноядерный на ранних стадиях, позднее 2-ядерный у Pyrostegia
и Тесота, 2—4-ядерный у Oroxylum и Paulownia и многоядерный у С. radicans.
В отдельных клетках его происходит уменьшение числа ядер за счет их
слияния, что приводит к образованию крупных полиплоидных ядер. Тапетум
морфологически разнородный, что особенно отчетливо проявляется у видов
Paulownia, у которых клетки внутренней части тапетума, окаймляющие вырост
связника (плацентоид), радиально вытянуты, крупные, многоядерные, im-
пиллообразные, с сильно утолщенными оболочками в отличие от более
уплощенных тапетальных клеток стенки. Гистохимия развивающегося и зрелого
пыльника и, в частности, тапетума освещена в работах Гупта и Нанда (C.upUi,
Nanda, 1975, 1978, 1983). На внутренней поверхности стенки тапетума ofipn-
* Материал собран в}Батумском ботаническом саду. .
17* Ж
\ Bignoniaceae
1—4, 7,8 — Campsis radicans, 5, 6, 9, 11—14 — Paulownia tomentosa, 10,15, 16 — P. fortunei,-
17, 20, 23—25 — Parmentiera cerifera, 18 — Oroxylum indicum, 19, 21, 22 — Kigelia pinnata,
26 — Tecoma stans, 27 — Incarvillea compacta, 28—37 — Catalpa kaempferi.,
1—10 — развитие пыльника: 1 — спорогенная ткань; дифференциация тапетума, 2 —
поперечный срез через молодой пыльник; показаны выросты связника — плацентоиды
в гнездах и подковообразное расположение микроспороцитов (схема к 3), 3 — фрагмент
гнезда пыльника — профаза мейоза (синапсис) в микроспороцитах; многоядерный тапе-
тум, 4 — стенка пыльника на стадии тетрад микроспор; в отдельных клетках тапетума
полиплоидные ядра, 5 — поперечный срез через пыльник (схема к 6),
зуются орбикулы, строение и возможные функции которых у Rhigozym dicho-
tomum описаны Робертсоном (Robertson, 1984). Наличие в семействе
амебоидного тапетума (Davis, 1966; Поддубная-Арнольди, 1982) не подтвердилось ни:
анализом литературы, ни нашими данными (Ghatak, 1956; Gupta, Nanda,
1978; Nanda, Gupta, 1978). Стенка зрелого пыльника состоит из эпидермиса
(Pyrostegia), эпидермиса и эндотеция (Тесота); у О. indicum в ней сохраняется
260
Bignoniaceae (продолжение)
6 — многослойная стенка пыльника и дистальный конец выроста — плацентоида с тапе-
тальными папиллообразными клетками, 7 — типы тетрад, 8—10 — пыльцевые зерна;
до 8 слоев (Ghatak, 1956). Спорогенная ткань однослойная, из 10—14 клеток
у P. ignea и Т. stans и 2-слойная у О. indicum и С. radicans. Во время мейоза
вокруг микроспороцитов образуется каллозная оболочка. Образование
микроспор симультанное. Тетрады микроспор тетраэдральные, изредка
крестообразные (О. indicum); у С. radicans изобилатеральные и крестообразные; единично
встречаются Т-образные и линейные тетрады. У Kigelia pinnata изредка
наблюдается дегенерация отдельных микроспор в тетрадах. Зрелые пыльцевые зерни
у большинства родов одиночные, 2-клеточные; тетрадная пыльца отмечонп
j^Jatalpa duclouxii, Cuspidaria и Chilopsis saligna. Вегетативная клетка с
крупным округлым ядром, с крахмалом в цитоплазме (Niedzwedzkia semireLichaii'
skia, Paulownia). Генеративная клетка овальной формы, довольно крушит,
у Paulownia — с хорошо различимой цитоплазмой.
Семяпочки многочисленные, анатропные, в отдельных родах изредка
истончаются и гемитропные (Kigelia, Parmentiera, Oroxylum), с одним интегумонтнм,
на массивном фуникулусе, располагаются на 2—4 париетальных шмщомтмх
равномерно (Jacaranda) или 2 группами (Kigelia, Parmentiera, Тесопм), ти-
нуинуцеллятные. Интегумент массивный, многослойный (до 25 слоом у incur
1>М\
Bignoniaceae (продолжение)
11—18 — мегаспорогенез: 11 — одноклеточный археспорий; закладка интегумента, 12 —
3-клеточный археспорий, 13—16 — стадии развития мегаспороцита,
^5
villea). После дезорганизации нуцеллуса на стадии тетрад мегаспор (Kigelia)
или на стадии 2—8-ядерного зародышевого мешка у Parmentiera cerifera
я Т. starts внутренний слой интегумента дифференцируется в интогументальный
тапотум, особенно четко прослеживающийся в халазальной части
зародышевого мешка. Гипостаза хорошо выражена и состоит из упорядоченно
расположенных клеток с плотным содержимым и утолщенными лигнифицированными
стенками. Неразветвленный васкулярный пучок входит в семяпочку через
фуникулус и заканчивается в области халазы, ниже гипостазы. Нуцеллус
скудный, рано исчезает, дегенерация его начинается с микропилярной части.
Ко времени образования зрелого зародышевого мешка нуцеллус почти целиком
исчезает у Oroxylum, но может сохраняться в халазальной области семяпочки
вплоть до ранних стадий эндоспермогенеза у Bignonia megapotamica, P.
cerifera я Т. starts. Единственная археспориальная клетка преобразуется в мега-
спороцит. Париетальная ткань отсутствует. Случаи образования 2-клеточного
археспория отмечены у К. pinnata и Т. stans, 3—5-клеточного — у P. tomen-
tosa, но у последней, по нашим данным, в мейоз вступает только одна из клеток
археспория. В то же время у В. megapothamica и К. pinnata в отдельных
семяпочках встречаются двойные тетрады. Мейоз проходит без нарушений,
образующиеся тетрады мегаспор линейные, изредка Т-образные (К. pinnata); отмечен
единственный случай изобилатерального (Kigelia) и крестообразного (P.
cerifera) расположения мегаспор в тетраде. Халазальная мегаспора
функционирует, остальные 3 дегенерируют. У P. cerifera иногда развивается эпихала-
зальная мегаспора.
2<32
34- 35 ^36 31
Bignoniaceae (продолжение)
17, 18 — диада и тетрада мегаспор; 19—22 — стадии развития зародышевого мешка; 23—
27 — эндоспермогенез и развитие гаусториев: 23 — 2-клеточный эндосперм, 24—26 — 2-
и 4-клеточный халазальный гаусторий, 27 — Incarvillea-тип эндосперма; 28—37 —
эмбриогенез. (1—16 — ориг.; 17, 19—26 — по Govindu, 1950; 18 — по Ghatak, 1956; 27 — по Маи-
ritzon, 1935; 28—37 — по Soueges, 1940).
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Сформированный зародышевый мешок 8-ядерный, 7-клеточный, незначительно
варьирующий по форме в отдельных родах семейства, овально-удлиненный,
с более узким халазальныМ концом, проникающим в область халазы, что
особенно хорошо заметно у Parmentiera; при формировании зародышевого мешка
О. indicum отмечена разница в размере микропилярной и халазальной пары
ядер: первые значительно крупнее. Зрелый зародышевый мешок,
суживающийся на концах и максимально расширенный в средней части у Bignonia,
Тесота, Oroxylum и др., но узкий, вытянутый у Parmentiera и Phaedranihus.
Яйцеклетка у многих видов вытянутой формы; синергиды имеют слабо
выраженные крючки и крупные апикальные вакуоли; нитчатый аппарат в них по
обнаружен, хотя базальные концы синергид, плотно окрашивающиеся и
структурированные, дают возможность предполагать его наличие. Полярные ядра
располагаются в средней расширенной части зародышевого мешка, спили но
их происходит до оплодотворения; антиподы у ряда видов эфемерны, но у Jaca-
randa mimosaefolia, P. cerifera и Т. stans они сохраняются до ранних стмдий
эндоспермогенеза. Оплодотворение порогамное. Слияние яйцеклетки со спор-
20
мием происходит при наличии 10—12 клеток эндосперма {О. indicum). Опло-
дотш>|Ю1111!1>1 яйцеклетка не делится в течение длительного времени.
Эпдоспорм цоллюлярный. На основании особенностей его развития в се-
мойг/пю иыдолоиы 2 типа эндосперма: Catalpa-тип, характерный для
большинства наученных видов, и Incarvillea-тип, специфичный для видов родов
Incarvillea, ЛHiphicome и, возможно, для монотипного рода Niedzwedzkia (Райкова,
Лащоико, 1977). Первые фазы развития общие для обоих типов: первичное ядро
яидосперма перед делением спускается в халазальную область зародышевого
мешка, располагаясь над его суженным концом. Первая перегородка заклады-
иается поперечно и делит полость зародышевого мешка на 2 неравные части —
большую микропилярную и маленькую халазальную. У видов с эндоспермом
Gatalpa-типа в результате 2 последовательных вертикальных делений микро-
пилярной и халазальной камер образуется 8 клеток эндосперма,
расположенных в 2 яруса. Клетки нижнего яруса образуют 4-клеточный (Catalpa bigno-
nioidbs, С. kaempferi, Bignonia tveediana, Pithecoctenium clematideum и др.) или
2-клеточный (В. megapotamica, P. cerifera) активный халазальный гаусторий.
Эндосперм образуется из клеток верхнего яруса. У видов с эндоспермом Catal-
ра-типа микропилярный гаусторий не развивается, за исключением P.
cerifera и Т. stans, у которых он типично 2-клеточный. При развитии эндосперма
Incarvillea-типа после образования первой поперечной перегородки халазаль-
ная клетка 2-клеточного эндосперма больше не делится и развивается в
крупный одноядерный халазальный гаусторий. Производные микропилярной
клетки образуют собственно эндосперм и одноклеточный микропилярный
гаусторий. Оба гаустория сохраняются в зрелом семени (Incarvillea olgae, N. semi-
retschenskia). В зрелом семени эндосперм отсутствует или сохраняется в виде
тонкой пленки, состоящей из сплющенных, лишенных содержимого клеток
(Incarvillea, Niedzwedzkia, Paulownia).
Эмбриогенез Onagrad-типа. Зрелый зародыш дифференцированный,
прямой, с крупными обратносердцевидными семядолями. Зародыш Paulownia
содержит в семядолях глобулы белка и липидные капли. Лейкоэмбриофиты.
Исследованные виды. Amphicome arguta, Bignonia bungei,
В. capensis, В. megapotamica, В. tveediana, В. unguis-cati, В. venusta, Campsis
chinensis, С. radicans, Catalpa bignonioides, C. duclouxii, C. kaempferi, C. sy-
ringaefolia, Chilopsis saligna, Crescentia macrophylla, Dolichandrone rheedii,
Eccremocarpus scaber, Incarvillea compacta, I. delavayi, I. grandiflora, I. olgae,
Jacaranda mimosaefolia, Kigelia pinnata, Niedzwedzkia semiretschenskia, Oroxy-
lum indicum, Parmentiera cerifera, Paulownia fortunei, P. tomentosa, Phaedranthus
sp., Pithecoctenium clematideum, Pyrostegia ignea, P. venusta, Rhigozum dicho-
tomum, Tecoma sambucifolia, T. stans.^ '
Литература. Guignard, 1882; Duggar, 1899; Campbell, 1930; Maurit-
zon, 1935; Millsaps, 1936; Soueges, 1940a; Swamy, 1941; Venkatasubban, 1945;
Westfall, 1949; Govindu, 1950; Crete', 1952b; Ghatak, 1956; Sharma, 1967; Mitra,
1968; Rickson, 1968; Цибух, Горб, 1970; Горб, Цибух, 1971а, 19716, 1973, 1978;
Nanda, Gupta, 1971, 1978, 1983; Gupta, Nanda, 1972, 1975, 1978a, 1978b, 1983;
Муратгельдыев, 1972; Торб, 1973; Райкова, Пащенко, 1977; Buurman, 1978;
Goldblat, Gentry, 1979; Robertson, 1983, 1984; Yang Hongyuan, Zhou Chang,
1984; Фрейберг (ориг. данные).
••■ Семейство PEDALIACEAE
Пыльник 4-гнездный. Стенка гнезда пыльника развивается центробежно
и состоит из эпидермиса, эндотеция, в котором образуются фиброзные
утолщения, 2—3 средних слоев и тапетума. Тапетум секреторного типа, клетки его
на поздних стадиях развития многоядерны. У некоторых видов (Pedalium mu-
гех) наблюдается слияние ядер в клетках тапетума. Отмечено наличие орбикул.
Образование микроспор симультанное, расположение их в тетраде тетраэдраль-
264
Pedaliaceae
1—9, 18—24 — Sesamum indicum, 10—17 — Pedalium murex.
2—8 — развитие стенки пыльника и микроспорогенез; 9 — пыльцевое зерно;
ное, изобилатеральное, крестообразное, иногда Т-образное. Зрелые пыльцевые
зерна 3-клеточные.
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная.
Дифференцируются 1—3 археспориальные клетки. Отделения париетальной
клетки не происходит, и. археспоральная клетка преобразуется непосредственно
в мегаспороцит. После мейоза образуется линейная тетрада мегаспор.
Зародышевый мешок развивается из халазальной мегаспоры. У Sesamum indicum
отмечены интегументальный тапетум и гипостаза, клетки которой содержат
небольшое количество запасных белков.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Зрелый зародышевый мешок удлиненный, 7-клеточный. Полярные ядра в
центральной клетке обычно сливаются перед оплодотворением. Антиподальные
клетки довольно быстро дегенерируют. Оплодотворение порогамное.
Эндосперм целлюлярный. У ряда видов семейства в эндосперме отмечено
образование микропилярного и халазального гаусториев. В зрелом семени
эндосперм сохраняется.
Развитие зародыша происходит по Onagrad-типу. На ранних этапах
развития зародыш имеет длинный подвесок. В зрелом семени зародыш небольших
размеров, прямой.
У S. indicum была изучена динамика белков и липйдов в ходе развития
тканей семяпочки, эндосперма и зародыша. Значительные запасы белков
обнаружены в наружном слое интегумента семяпочки и в нуцеллусе и небольшое их
количество — в клетках гипостазы. Заметное увеличение запасных болиоп
наблюдается после заложения семядолей зародыша в клетках эндосперма.
Большое количество липйдов в эндосперме наблюдается в то время, когда
семядоли зародыша достигают приблизительно половины длины .зародыши НО ГО
мешка. На сердечковидной стадии развития зародыша наибольшая аккуму-
205
Pedaliaceae (продолжение)
10, 11 — мегаспорогенез; 12—14 — развитие зародышевого мешка; 15 — двойное
оплодотворение; 16, 17 — развитие гаустория в эндосперме; 18—24 — эмбриогенез. (1—9, 18—
124 — по Singh, 1960b; 10—17 — по Srinivasan, 1942),
ляция белков наблюдается в его апикальных тканях, меньшее их количество
содержится в клетках средней части зародыша. В созревающих семенах в
клетках эндосперма отмечено накопление липидов, в зародыше — уменьшение
количества запасных белков.
Исследованные виды. Pedalium murex, Sesamum indicum,
S. laeiniatum, S. orientale, S. prostratum, Trapella sinensis.
f Л и т е р а т у р a. Oliver, 1888; Balicka-Iwanowska, 1889; Schnarf, 1931;
Nohara, 1934; Gliick, 1940; Srinivasan, 1942; Raghavan, Krishnamurty, 1947;
Hanawa, 1953; Singh, 1960a, 1960b; Davis, 1966; Тахтаджян, 1966; Singh, 1967,
1970; Kulkarni, Pataskar, 1973—1974; Padmanabhan, 1976; Поддубная-Арноль-
ди, 1982; Yang Hongyuan, Zhou Chang, 1984.
266
Martyniaeeae
ц—15 — Martynia louisiana.
IS _ мегаспорогенез; 4, 5 — развитие зародышевого мешка; 6 — зрелый ннродыИНЧШЙ
мешок; 7 — оплодотворение; контакт ядер спермин и яйцеклетки; 8—10 — ртшитив НИДО-
сперма; удлинение антипод; 11—15 — развитие зародыша. (1—15 — по Апаогмоп, ИЩИ),
Семейство MARTYNIACEAE
Раз пит ио пыльника изучено недостаточно. Сформированная стенка гнезда
пыльника состоит из эпидермиса, эндотеция, среднего слоя и тапетума. Тапе-
тум сокроторпого типа, во время начала мейоза в микроспороцитах ядра клеток
та ноту ма долятся и клетки становятся 2-ядерными. В клетках зндотеция
разминаются фиброзные утолщения. Средний слой эфемерный. У Martynia
louisiana вокруг микроспороцитов отмечено образование каллозной оболочки,
а и цитоплазме содержится значительное количество липидов. Образование
тотрад микроспор симультанное. Тетрады тетраэдральные, изобилатеральные
и крестообразные. Зрелые пыльцевые зерна 2-клеточные (Martynia diandra)
или 3-клеточные (Proboscidea louisianica).
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная. У видов
Martynia и Proboscidea отмечен интегументальный тапетум. Наблюдается
дифференциация одной или 2—3 археспориальных клеток. В мегаспороцит, не
отделяя париетальной клетки, преобразуется только одна клетка. Формируется
линейная тетрада мегаспор, из которых функционирует халазальная.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Сформированный зародышевый мешок содержит яйцевой аппарат, 2 полярных
ядра и 3 антиподальные клетки. У М. Louisiana в некоторых случаях
наблюдается образование 4 хорошо развитых антипод. Синергиды имеют
грушевидную форму, в них хорошо выражен нитчатый аппарат. Исследование
ультраструктуры синергид P. louisianica показало, что в зрелом зародышевом мешке
до опыления обе синергиды содержат обычный набор органелл, в пластидах
наблюдаются крахмальные зерна, в клетках имеются липиды. Клеточная
оболочка окружает лишь микропипярную половину синергиды, в ней наблюдаются
многочисленные инвагинации, направленные к центральной клетке. После
опыления, но до попадания пыльцевой трубки в семяпочку одна из синергид
начинает изменяться: уменьшается объем клетки, расширяются цистерны эндо-
плазматического ретикулума и т. д. Полярные ядра в центральной клетке
у представителей семейства сливаются до оплодотворения, антиподы эфемерны
или существуют и после того, как зародышевый мешок заполнится
эндоспермом. В клетках антипод у М. Louisiana наблюдаются пластиды. Оплодотворение
порогамное. У P. louisianica показано, что пыльцевая трубка, проникая в одну
из синергид через нитчатый аппарат, изливает свое содержимое через
терминальную пору.
Эндосперм целлюлярный. Наблюдается развитие халазального и микро-
пилярного гаусториев. У некоторых видов (М. louisiana) в цитоплазме клеток
эндосперма отмечены пластиды. В зрелом семени содержится небольшое
количество эндосперма.
Развитие зародыша происходит по Onagrad-типу. У Martynia проэмбрио
с длинным узким подвеском, благодаря росту которого он продвигается в ха-
лазальный конец зародышевого мешка.
Исследованные виды. Martynia diandra, M. louisiana,,
Proboscidea louisianica, P. lutea.
Литература. Hofmeister, 1849; Schacht, 1850; Balicka-Iwanowska,
1899; Samuelsson, 1913; Anderson, 1922; Eseltine, 1929; Martini, 1939; Gaiser,
Sutherland, 1943; Davis, 1966; Тахтаджян, 1966; Mogensen, 1978a, 1978b, 1978c;
Поддубная-Арнольди, 1982.
Семейство OROBANCHACEAE
Пыльники 4-гнездные (Orobanche и большинство родов), гнезда объединены
попарно в 2 латеральные теки, или 2-гнездные (Aeginetia, Christisonia, Tien-
muia), когда одна из тек редуцирована. Стенка гнезда пыльника развивается
центробежно (Терёхин, 1966; Никитичева, 1968) и состоит из эпидермиса,
эндотеция, среднего слоя и тапетума (на отдельных участках стенка из 5—
6 слоев). У Aeginetia indica и Cistanche tubulosa формируются 2 средних слоя
208
0.01мм
Orobanchaceae
2-4 16-27 - Orobanche crenata, 5-8 - О. pallidiflora, 9-15 - О. cernua, 28-36 - О. Ш-
' mosa, 37 — Diphelypaea coccinea.
!-3 - последовательные стадии развития стенки гнезда пыльника; 4,5- сформпjiihi»иiiiiII
стенка гнезда пыльника; 6-8 - образование тетрад микроспор по суккцессивному типу,
д_12 _ образование тетрад микроспор по симультанному типу; 13, 14 — развитие
микроспор; 15 — зрелое пыльцевое зерно;
Orobanchaceae (продолжение)
16—20 — развитие семяпочки и зародышевого мешка; 21 — сформированная семяпочка;
(Tiagi, 1952a, 1952b). Наружная стенка клеток эпидермиса у Orobanche сетиа
и О. aegyptiaca сильно кутинизирована. У большинства изученных видов
фиброзные утолщения образуются либо только в эндотеции или в части этого слоя
(Orobanche), либо еще и в среднем слое (Boschniakia, Xylanche), либо в
эпидермисе, эндотеции и среднем слое (Aeginetia). В клетках эндотеция Diphelypaeat
Mannagettaea и Gleadovia формируются кольцевые или спиральные утолщения.
Тапетум секреторный, обычно однослойный из 2-ядерных клеток, реже — из-
2—4 (б)-ядерных клеток (Aeginetia, Christisonia); часто в клетках тапетума
со стороны связника наблюдаются полиплоидные ядра. Образование
микроспор симультанного типа, лишь у Orobanche pallidiflora (Никитичева, 1968)
описан сукцессивный тип образования микроспор. Тетрады микроспор изоби-
латеральные или тетраэдральные. Зрелые пыльцевые зерна одиночные, 2-
или 3-клеточные.
Семяпочки анатропные (Aeginetia, Orobanche) или гемитропные (Conopho-
lis, Mannagettaea, Phacellanthus), с одним интегументом, тенуинуцеллятные.
Интегумент у представителей разных родов существенно различается по числу
образующих его клеточных слоев: у Aeginetia, Christisonia и большинства
видов Orobanche он состоит из 2—4 слоев; у видов Cistanche, Boschniakia rossica,
Xylanche himalaica и Orobanche uniflora — из 4—6 слоев, у Kopsiopsis tube-
rosa — из 8 слоев, у Conopholis americana — из 9—12 слоев (Терёхин,
Никитичева, 1981, и др.). Для семяпочек заразиховых характерно образование
однослойного интегументального тапетума, однако у С. americana
формируется многослойный интегументальный тапетум (из 4—6 слоев). Прокамбиаль-
ный пучок в семяпочках заразиховых редуцирован обычно до 2—4-клеточных
тяжей. Археспорий одноклеточный, без отделения кроющей клетки
преобразуется в мегаспороцит. Тетрада мегаспор обычно линейная, реже —
Т-образная.
Зародышевый мешок моно'спорический, развивается из халазальной
мегаспоры по Polygonum-типу. У Kopsiopsis возможно образование биспорических
зародышевых мешков (Tiagi, 1963). Для большинства заразиховых характерна
особая «оробанхоидная» форма зародышевого мешка: с расширенной округлой
микропилярной частью и зауженным, изогнутым в направлении семяшва
халазальным концом. Полярные ядра у большинства изученных видов
сливаются до оплодотворения, только у Phacellanthus tubiflorus полярные ядра
и спермий сливаются одновременно (Терёхин, 1973). Поведение антипод ва-
270
Orobunchaceae (продолжение)
22—27 — развитие эндосперма; 28—36 — эмбриогсшш;
37— зрелое семя (продольный медианный сроа). (14,
16—36 — ориг.; 5—8 — по Никитичевой, 19GH; !) Ш
по Tiagi, 1951; 37 — рис. Т. И. Кращшюй).
риабельно: они офомориы у К. tuberosa, но долго сохраняются у остальных
изученных видом. Оплодотворение двойное (Гургенова, 1927, и др.).
Эндосиорм цоллюлярный. Развивается по Brunella-типу (Schnarf, 1929).
Первичная клетка эндосперма делится поперечно, отделяя халазальный
гаусторий. Норное деление в микропилярной клетке 2-клеточного эндосперма —
продольное Образовавшиеся при этом 2 удлиненные дочерние клетки делятся
поноро'иго, отделяя 2 клетки микропилярного гаустория и клетки зачатка
ооботионно эндосперма. В результате дальнейших делений дифференцируются
центральное «тело» эндосперма и его «шейка» (истмус), прилегающий к микро-
лилярному гаусторию. Халазальный гаусторий почти всегда
одноклеточный, с одним ядром у Aeginetia или 2 ядрами у остальных изученных видов.
У Cistanche иногда образуется 2 клетки халазального гаустория (Tiagi, 1952a;
Kadry, 1955). Микропилярный гаусторий всегда 2-клеточный, с одним или
2 ядрами в каждой клетке; у Cistanche в них образуется иногда до 4 ядер.
Клетки микропилярного гаустория у О. aegyptiaca иногда сливаются (Tiagi,
1951). У некоторых представителей семейства клетки микропилярного
гаустория образуют выросты в паренхиму интегумента (Aeginetia, Cistanche, Cono-
pholis, Diphelipaea, Mannagettaea, Orobanche, Xylanche). По нашим наблюдениям,
эти выросты особенно активно разрастаются со стороны, противоположной
семяшву. В зрелом семени эндосперм сохраняется, в клетках его
периферического слоя содержатся жировые вещества и белки (Cistanche, некоторые виды
Ordbanche). У видов Cistanche эндосперм богат запасным крахмалом.
Наружная оболочка периферических клеток эндосперма обычно более или менее
утолщена.
Эмбриогенез Onagrad-типа. Как показали наши исследования,
представление о Caryphyllad-типе эмбриогенеза у A. indica и Christisonia subacaulis
(Johansen, 1950; Tiagi, 1952) ошибочно. Зародыши всех изученных видов
следуют в своем развитии Onagrad-типу эмбриогенеза; естественная
вариабельность поведения тех или иных бластомеров в раннем эмбриогенезе — следствие
глубокой редукции основных структур зародыша — позволила выявить 8
вариаций этого типа эмбриогенеза (Терёхин, Никитичева, 1981). Развитие
зародыша у заразиховых завершается на глобулярной стадии, поэтому в зрелых
семенах всех изученных видов семейства зародыши представлены
редуцированным овальным слабодифференцированным телом, лишенным основных
органов: семядолей, почечки, гипокотиля и зародышевого корня. Степень
редукции зародышей различна у разных представителей семейства, что
обусловлено уровнем приспособления отдельных видов заразиховых к паразитному
существованию. Наиболее редуцированные зародыши обнаружены у
представителей рода Aeginetia.
Исследованные виды. Aeginetia indica, Boschniakia rossica,
Christisonia albida, С bicolor, С. neilgherrica, С subacaulis, Cistanche f lava, ■
C. salsa, C. tinctoria, C. tubulosa, Conopholis americana, Diphelypaea coccinea,
Epiphegus americanus, Kopsiopsis strobilacea, K. tuberosa, Mannagettaea humme'-
lii, Orobanche aegyptiaca, 0. alsatica, 0. bungeana, 0. caesia, O. cernua, O. colo-
rata, O. crenata, O. cumana, 0. pallidiflora, 0. purpurea, 0. ramosa, O. uniflora,
Phacellanthus tubiflorus, Tienmuia triandra, Xylanche himalaica.
Литература. Caspary, 1854; Koch, 1878, 1887; Wilson, 1889; Wors-
dell, 1895-1897; Cook, Shively, 1904; Гургенова, 1927; Carter, 1928; Glisic,
1929; Schnarf, 1929; Cassera, 1935; Juliano, 1935a; Hu, 1939a, 1939b; Srivas-
tava, 1939; Crete, 1942, 1955; Johansen, 1950; Маркова, 1950; Tiagi' 1951b
1952a, 1952b, 1963, 1965a, 1970; Kadry, 1952, 1953, 1955; Kadry, Tewfic 1956a'
1956b; Krenner, 1958; Rao, 1963; Tiagi, Sankla, 1963; Терёхин, 1966, 1968
1973, 1976, 1979; Никитичева, 1968, 1970, 1979a; Терёхин, Никитичева, 1968,
1981; Никитичева, Терёхин, 1976; Анисимова, 1978; Терёхин, Анисимова
1978.
272
Семейство GESNERIACEAE
Пыльник 4-гнездный. Стенка гнезда пыльника образуется по
центробежному типу и состоит' из эпидермиса, эндотеция, среднего слоя и тапетума.
Ко времени созревания пыльцы в эндотеции образуются фиброзные утолщении,
клетки среднего слоя сильно уплощаются. Тапетум клеточный секреторный.
Клетки тапетума первоначально одноядерные, к моменту профазы мейоза
в микроспороцитах они значительно увеличиваются в размерахг становятся
многоядерными. Так, у Didymocarpus tomentosa (Thathachar, 1942) они 2—5-
ядерные, у Klugia notoniana (Arekal, 1961) — 2—3-ядерные, у Epithema car-
nosum (Padmanabhan, 1961) и Platystemma violoides (Adatia et al., 1971) —
2-ядерные. В то же время в тапетальных клетках наблюдалось и слияние ядер.
Стенка зрелого пыльника представлена эпидермисом и эндотецием. Клетки
спорогенной ткани митотически делятся, увеличиваются в размерах и
преобразуются в микроспороциты. Тетрады микроспор образуются по
симультанному типу, обычно тетраэдральные, реже —крестообразные. Зрелая пыльца
2-клеточная. Согласно цитохимическим и электронно-микроскопическим
данным (Dexheimer, 1970), в пыльце Streptocarpus caulescens на начальных этапах
дифференциации генеративной и вегетативной клеток в цитоплазме
наблюдается образование крахмала, тогда как зрелая пыльца лишена крахмала и
содержит значительное количество липидных включений.
Семяпочка, как правило, анатропная, реже — ортотропная (Saintpaulia
ionantha), тенуинуцеллятная, с одним интегументом, который образует
микропиле и представлен 2—4 слоями клеток. Внутренний эпидермис интегумента
дифференцируется в интегументальный тапетум, клетки которого, по данным
Могенсена (Mogensen, 1981), в отличие от остальных клеток интегумента и
клеток зародышевого мешка содержат аденозинтрифосфатазу и участвуют в
активном транспорте веществ в зародышевый мешок. Нуцеллус развит слабо, на
стадии тетрад мегаспор он представлен одним слоем уплощенных клеток, плотно
прилегающих к тетраде. По мере развития зародышевого мешка нуцеллус
разрушается, и только отдельные его клетки сохраняются в халазальной части
семяпочки. В некоторых семяпочках встречаются сильно уплощенные клетки
нуцеллуса и на более поздних стадиях — во время образования эндосперма.
Гипостаза описана только у P. violoides (Adatia et al., 1971). Единственная
археспориальная клетка выделяется еще до начала заложения интегумента.
После значительного роста она преобразуется в мегаспороцит, который
делится, образуя линейную тетраду мегаспор. Деления в диаде клеток обычно
симультанные, хотя в некоторых случаях нижняя клетка диады делится
значительно раньше (Arekal, 1961). 3 верхние клетки тетрады дегенерируют, а ха-
лазальная мегаспора становится функционирующей. Как исключение, в
семяпочках К. notoniana наблюдались 2 мегаспороцита, которые развивались
асинхронно до стадии тетрад мегаспор; из их мегаспор образовывались два 2-ядер-
ных зародышевых мешка, но только один достигал зрелости. У Haberlea rho-
dopensis (Glisic, 1928) в одной семяпочке были описаны 2 зародышевых мешка.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Исключение представляет Rhytidophyllum crenulatum, где развитие
зародышевого мешка происходит по Adoxa-типу (Cook, 1907). У большинства
изученных эмбриологически видов — К. notoniana, К. zeylanica, Corytholoma cyclo-
phyllum, Monophyllaea horsfieldii, Roettlera, Alloplectus sanguineus, P.
violoides — зрелый зародышевый мешок сильно удлинен, заходит в микропилярную
область и сравнительно узкую халазальную часть семяпочки. В районе
микропиле зародышевый мешок расширен и окружен еще сохранившимися клетками
нуцеллуса. В остальной своей части зародышевый мешок ограничен интогу-
ментальным тапетумом. У Monophyllaea horsfieldii, Klugia zeylanica и Roelt-
lera отмечался выход из микропиле наружу верхней части зародышевого
мошка. Глишич (Glisi6, 1934) считает такие мешки нежизнеспособными. У St-ru/)-
tocarpus rexii зрелый зародышевый мешок сравнительно небольшой, лишь
слегка выступает в область микропиле, 7-клеточный, 7-ядерный. Яйцоиой
аппарат состоит из яйцеклетки, имеющей боковое прикрепление, и 2 оииор-
гид. В центральной клетке полярные ядра занимают серединное лоложопио,
18 Сравнительная эмбриология
т-
Gesneriaceae
1—12 — Klugla notoniana, 13—53 — Streptocarpus rexii.
1 — выделение археспория в гнезде пыльника; 2—5 — формирование стенки пыльника
и микроспорогенез; 6 — фиброзные утолщения в эндотеции; 7 — зрелое пыльцевое зерно;
8,9 — ранние стадий развития семяпочки; 10 — 2-ядерный зародышевый мешок и линейная
тетрада мегаспор; 11 — зрелый зародышевый мешок; 12 — семяпочка с зародышем и хорошо
развитым халазальным гаусторием эндосперма;
сливаются перед или во время оплодотворения. 3 антиподы могут иметь
Т-образное, реже — линейное расположение. У большинства изученных видов
антиподы эфемерны. Однако у S. rexii антиподы сохраняются и на ранних
этапах эмбриогенеза. У Saintpaulia ionantha, согласно
электронно-микроскопическим данным (Mogensen, 1981), синергиды имеют хорошо развитый
нитчатый аппарат; подобное разрастание клеточной оболочки в области халазы
отмечено и в клетках антипод.
Порогамия. Содержимое пыльцевой трубки изливается в одну из синергид,
вызывая ее разрушение. Вторая синергида сохраняется, у К. notoniana она была
отмечена даже в созревающем семени. Возможно вхождение и
дополнительной пыльцевой трубки, что приводит к разрушению второй синергиды. У S.
rexii наблюдается премитотический тип оплодотворения, поскольку слияние
половых ядер происходит до начала митоза ядра зиготы и первичного ядра
эндосперма. Объединение половых ядер в яйцеклетке осуществляется медленнее,
чем в центральной клетке. В то время, когда на ядре яйцеклетки еще виден
274
16 П
Gesneriaceae (продолжение)
13 — линейная тетрада мегаспор; 14 — 4-ядерный зародышевый мешок;"^5 — зрелый
зародышевый мешок; 16 ■— двойное оплодотворение; 17 — разрушенная синергида с остатками
пыльцевой трубки, зигота, клетки эндосперма; 18—26 — эндоспермогенез; 27 —
шаровидный зародыш, окруженный многоклеточным эндоспермом, микропилярный гаусторий;
28—49 — последовательные этапы эмбриогенеза; 50—53 — более поздние этапы развития
зародыша. (1—12 — по Arekal, 1961; 13—53 — по Алимовой, Яковлеву, 1982).
спермий, в ядре центральной клетки в зоне его растворения уже образовалось
ядрышко. Первичное ядро эндосперма значительно раньше зиготы приступает
к делению. Зигота значительно удлиняется, глубоко вдаваясь в
развивающийся эндосперм, и приобретает булавовидную форму. Ядро зиготы
перемещается в апикальную густоплазменную часть клетки.
Развитие эндосперма происходит по целлюлярному типу с образованием
халазального и микропилярного гаусториев. Роды семейства различаются
по направлению первых делений, времени заложения инициален гаусториоп
и их развитию. У К. zeylanica, Ramondia natkaliae и R. serbica первое и второе
деления в эндосперме проходят в поперечном направлении с образованном
линейного ряда клеток, крайние из которых дают начало халазальному и микро-
пилярному гаусториям. Другая направленность первых делений (перпоо
деление — поперечное, второе — вертикальное) с последующим заложенном
инициалей халазального и микропилярного гаусториев была описана у С. <що-
lophyllum, H. rhodopensis, Roettlera, Ch. lavandulaceae, A. sanguineus, K.
notoniana, E. carnosum, P. violoides, S. rexii. Халазальный гаусторий можот быть
18*
27Г.
Gesneviaceae (продолжение)
27
51 V У 52 V У 53
Gesneviaceae (продолжение)
предстаплои одной или несколькими клетками. У большинства изученных
родов он одноклеточный, одноядерный, реже — 2-ядерный. Сильно развитый
халазалышй гаусторий был описан у К. notoniana, где он представлен
одноядерной клеткой, которая простирается в субэпидермальный район интегу-
моита, разрушая клетки, лежащие между интегументальным тапетумом и
наружным эпидермисом. Слабо развит и недолговечен халазальный гаусторий
у S. rexii. По мере падения активности халазального гаустория возрастает
роль микропилярного гаустория, который чаще всего образован 2
одноядерными клетками, реже — одной 2-ядерной клеткой. 4-клеточный микропиляр-
ный гаусторий описан у R. nathaliae и R. serbica (GKsi6, 1924) и как редкое
явление был отмечен для Н. rhodopensis (GKsic, 1928). Наблюдается сильное
разрушение клеток эндосперма, прилегающих к зародышу. Эндосперм зрелого
семени богат жирами и белками, но лишен крахмала.
Эмбриогенез соответствует Onagrad-типу (Johansen, 1950), что
подтверждено на примере Chirita lavandulaceae (Crete, 1949), К. notoniana (Arekal, 1961),
P. violoides (Adatia et al., 1971), Streptocarpu$ rexii (Алимова, Яковлев, 1978,
1982, 1983). При формировании зародыша S. rexii наблюдалась разная доля
участия клеток верхнего и нижнего ярусов зародыша в закладке его тканей
и органов. В образовании плеромы и периблемы зародыша участвуют только
внутренние клетки нижнего яруса зародыша. Внутренние клетки верхнего
яруса образуют немногочисленные инициали эпифизиса. Выделение семядолей
происходит за счет роста и делений клеток периблемы, образовавшейся в
нижнем ярусе, и эмбриодермы обоих ярусов зародыша. Зрелый зародыш имеет
2 одинаково развитые семядоли и мощный гипокотиль. Центральный прокам-
биальный тяж из гипокотиля переходит в обе семядоли. Апекс побега, на
примере S. rexii, представлен небольшим очагом меристематических клеток.
Корневой апекс зародыша слабодифференцирован, лишен корневого чехлика.
Лейкоэмбриофиты.
Исследованные роды и виды. Aeschynanthus pulchra, Allo-
plectus sanguineus, Chirita lavandulacea, Corytholoma cyclophyllum, Didymo-
carpus tomentosa, Epithema carnosum, Gesneria elongata, Haberlea rhodopensis,
Klugia notoniana, K. zeylanica, Monophyllaea horsfieldii, Platystemma violoides,
Ramondia nathaliae, R. serbica, Rhynchoglossum obliguum, Rhytidophyllum cre-
nulatum, Roettlera, Saintpaulia ionantha, Streptocarpus caulescens, S. nobilis,
S„ rexii, S. wendlandii.
Литература. Hofmeister, 1847; Strasburger, 1877, 1884; Vesque,
1878; Hielscher, 1883; Balicka-Iwanowska, 1899; Cook, 1907; Schnarf, 1921b;
Laurent, 1923; Glisid, 1924, 1928, 1934; Dahlgren, 1927; Crete, 1942, 1949f, 1951,
1955a, 1955b; Thathachar, 1942, 1943; Johansen, 1950; Arekal, 1961; Padma-
nabhan, 1961a, 1966; Oehlkers, 1962; Anders Olaf, 1966; Dexheimer, 1970;
Adatia, Sharma, Vijayaraghavan, 1971; Weber Anton, 1971, 1976; Яковлев,
Жукова, 1973; Viemont, Astie, 1974; Pargney, Dexheimer, 1976; Viemont, 1976,
1979; Алимова, Яковлев, 1978, 1982, 1983; Mogensen, 1981; Георгиев, Tep-
зийска, 1983.
Семейство PLANTAGINACEAE
Пыльник 4-гнездный. При раскрывании пыльника перегородка,
разделяющая гнезда, разрушается и гнезда объединяются. У P. salsa стенка гнезда
пыльника формируется центробежно (Титова, ориг. данные) и в
сформированном состоянии 4-слойная. В клетках эндотеция на стадии 2-клеточной пыльцы
образуются фиброзные утолщения. Начало дегенерации среднего слоя
совпадает по времени с началом мейоза в микроспороцитах, а лизис — с началом
формирования 2-клеточной пыльцы. Тапетум секреторного типа. Клетки
тапетума становятся 2-ядерными во время пахинемы первой мейотической
профазы в микроспороцитах. Деление ядер осуществляется путем кариокинеза
или амитотически (Жадовский, 1923—1924). Ядра часто сливаются, образуя
одно крупное тетраплоидное ядро. У P. media в отдельных клетках тапетума
образуются 4 ядра, которые также могут сливаться, формируя октоплоидное
278
Г
i—7 — Plantago salsa, 8
Plantaginaceae
-10, 16 - P. media, 14 - P. major, 11-13, 15, 17-31 - P. /««-
ceolata.
!-i0 - мпкроспорогенез; развитие стенки гнезда пыльника и пыльцевого зори»;
Plantaginaceae (продолжение)
11~14 — мегаспорогенез; 15 — продольный срез семяпочки с зародышевым мешком: видны
остатки нуцеллуса; показано местоположение сосудистого пучка; 16, 17 — зародышевый
мешок перед объединением полярных ядер (16) и фрагмент (17) халазального полюса с 3
антиподами; is—г! — первые фазы эндоспермогенеза и основные этапы эмбриогенеза- 28—30 —
отдельные фазы формирования гаусториев в ходе эндоспермогенеза; 31 - продольный срез-
семени. (1-10 - Титова, ориг.;11-13 15 17, 28-31 - по Cooper, 1942; 14- по Misra,
1970; 16 - по Schnarf, 1917; 18-27 - по Soueges, 1923).
ядро. У P. salsa имеет место гетероморфность тапетума, проявляющаяся в
различии формы и размеров клеток внешней и внутренней частей тапетума. Но
время мейоза в микроспороцитах клетки тапетума сильно вакуолизируютсн,
лизис их начинается в период обособления, микроспор и заканчивается на
стадии 2-клеточной пыльцы. Стенка зрелого пыльника представлена
эпидермисом, наружная оболочка клеток которого имеет зубчатые утолщения, и
фиброзным эндотецием. Спорогенная ткань многослойная. У P. major и P. salsa
мейоз в микроспороцитах, как правило, проходит нормально. У других
представителей рода Plantago отмечены нарушения мейоза. У P. media
обнаружено запаздывание или полное отсутствие деления одного из гаплоидных ядер,
в результате чего образуются триады. Образование тетрад микроспор у P. major
происходит симультанно, изредка — сукцессивно (Ekstrand, 1918). У P. step-
posa этот процесс протекает только симультанно (Кордюм, 1978). Способ
образования тетрад у P. lanceolata определен как промежуточный (Koul, Du-
rani, 1969). Ранее он был описан у ряда цветковых растений как
«модифицированный симультанный» — по терминологии Шнарфа (Schnarf, 1929).
Тетрады, микроспор крестообразные или тетраэдральные. Зрелые пыльцевые зерна
одиночные, 2-клеточные. У P. salsa генеративная клетка овальной формы.
У P. media и P. salsa в зрелом пыльнике обнаружена карликовая пыльца с
неокрашивающейся или слабокрасящейся цитоплазмой (Ekstrand, 1918; Титова,
ориг. данные). У P. lagopus и P. major наблюдались гигантские пыльцевые
зерна (Misra, 1967).
Семяпочка анатропная или анакампилотропная, с одним интегументом,
тенуинуцеллятная. Дифференцируется интегументальный тапетум, который
сохраняется в семени в виде пигментного слоя (Bouman, 1984). 6 семяпочках
со зрелым зародышевым мешком форма его клеток палисадная —радиальные
клеточные стенки значительно длиннее тангентальных. У P. lanceolata
клеточные оболочки интегументального тапетума со стороны зародышевого мешка
в средней его части покрыты кутикулой (он окружает только среднюю часть
зародышевого мешка). Ядра клеток крупные. ЭР образует участки эргасто-
плазмы из 5—10 цистерн, которые ориентированы главным образом
параллельно длинной оси зародышевого мешка. Клетки интегументальной
паренхимы на уровне яйцевого аппарата в семяпочках со зрелым зародышевым
мешком очень богаты крахмалом (Vannereau, 1978; Vannereau, Mestre, 1980).
Клетки эпидермиса интегумента P. ouata в процессе развития семени
увеличиваются в 60—80 раз. Рост клеток начинается после опыления и
сопровождается первоначально увеличением размеров ядра и ядрышка, изменениями
в распределении рибосом, накоплением крахмала и утончением клеточных
оболочек. При созревании семени клетки заполняются слизистыми веществами
полисахаридной природы. Секрет выделяется протопластом этих клеток.
Процесс выделения секрета сопровождается активизацией аппарата Гольджи,
исчезновением крахмала и постепенной дегенерацией протопласта (Hyde, 1970).
Археспорий одноклеточный. Археспориальная клетка становится
непосредственно мегаспороцитом. Тетрада мегаспор линейная. Функционирует хала-
зальная мегаспора.
Зародышевый мешок развивается по Polygonum-типу. У Littorella uni-
flora он прямой, у P. lanceolata — слегка изогнутый; его халазальный конец
зауженный, трубкообразный. Яйцеклетка P. lanceolata грушевидной формы.
По данным электронной микроскопии, она сильно вакуолизирована. Наряду
с крупной центральной вакуолью, расположенной ближе к микропиле, в пой
наблюдается много мелких вакуолей, распределенных по всей цитоплазме.
Плотность свободных рибосом высокая. ЭР и аппарат Гольджи развиты слабо.
Пластиды крупные, многочисленные, представлены амилопластами,
содержащими наряду с крахмалом пластоглобулы. Отмечено обилие митохондрий
чашевидной формы; такие митохондрии не обнаружены в других клетках :пи
родышевого мешка. Клетки яйцевого аппарата в апикальной части на границ»
■с центральной клеткой имеют неполные клеточные оболочки. В синоргидах
хорошо развит нитчатый аппарат полисахаридной природы (Vannereau, 11)78;
Vannereau, Mestre, 1980). У P. media описаны крючкообразные выросты. Ядро
■синергид расположено в их медианной части,"крупная центральная пакуоль —
2Н1
И МНИКИЛЫЮЙ. Орпшоллы равномерно распределены по всей цитоплазме. В
отличии от лйцоклотки синергиды P. lanceolata содержат митохондрии округлой
формы, » I) их редких пластидах, имеющих слабовыраженную внутреннюю-
структуру, крахмал наблюдается лишь на отдельных срезах. Эти клетки за-
родышоного мешка богаты гранулярным ЭР, цистерны которого ориентиро-
ШШМ лдоль длинной оси синергид. Плотность свободных рибосом в синергидах
шпию, чем в других клетках зародышевого мешка. В их цитоплазме
наблюдаются также включения липидной природы и миелиновые образования. В микро-
ИИЛярном районе центральной клетки зародышевого мешка P. lanceolata, на
границе с интегументом и в месте контакта с синергидами, с их латеральной
частью, выявлены выросты клеточной оболочки полисахаридной природы.
Преобладающей органеллой центральной клетки является аппарат Гольджи.
Плотность рибосом также значительна. ЭР образует эргастоплазму, тяжи
которой параллельны длинной оси клетки. Пластиды представлены амилопла-
стами. Митохондрии концентрируются преимущественно вокруг ядра и близ
яйцевого аппарата. Полярные ядра сливаются до оплодотворения. Антиподы
(3 клетки) обычно сохраняются после оплодотворения; дегенерируют вскоре
после деления первичного ядра эндосперма. У L. uniflora они, как правило,
эфемерны. В редких случаях их наблюдали, однако, вплоть до второго
деления в эндосперме. Описаны порогамия и двойное оплодотворение.
Эндосперм целлюлярный. Первичное ядро эндосперма делится, находясь
около зиготы (виды Plantago) или в средней части зародышевого мешка (L.
uniflora). Первая клеточная оболочка формируется в поперечном направлении
и делит первичную клетку эндосперма на сравнительно небольшую микро-
пилярную и крупную халазальную клетки. Микропилярная клетка делится
затем 2 продольными стенками, расположенными во взаимно
перпендикулярных плоскостях, образуя 4-клеточную структуру. В результате деления всех
этих 4 клеток в поперечном направлении образуется 8-клеточная 2-ярусная
структура. Каждая из клеток верхнего яруса функционирует как одноядерный
микропилярный гаусторий. Микропилярные гаустории растут по направлению-
к плаценте. У P. coronopus, P. major, и P. pumila все гаусториальные клетки,
остаются неразветвленными, а. у P. amplexicaulis и P. ovata они ветвятся
(Misra, 1970). Данные Мисра о микропилярных гаусториях совпадают с
данными одних авторов (Schnarf, 1917; Soueges, 1923; Rosen, 1940) и не совпадают
с данными других авторов (Hofmeister, 1859; Balicka-Iwanowska, 1899; Жадов-
ский, 1924; Cooper, 1942), описавшими у Plantago 2-клеточные
микропилярные гаустории. В отличие от микропилярной клетки ядро халазальной клетки
2-клеточного эндосперма делится только один раз. Размеры халазального
2-ядерного гаустория у видов Plantago значительно увеличиваются. Как
и микропилярные гаустории, он также достигает плаценты. У P. coronopus,
P. media и P. major халазальный гаусторий обычно образует латеральный
вырост в направлении плаценты, куда и мигрируют оба ядра. У P. lagopus-
гаусторий приобретает бочонкообразную форму; его верхушка разбухает и
образует бульбу. Оба ядра перемещаются в эту бульбу, которая дает начала
2 одноядерным ответвлениям. Они продвигаются в верхнюю часть семяпочки,,
заключая в свое кольцо собственно эндосперм. Ядра халазального гаустория
увеличиваются и становятся гипертрофированными. Как микропилярные, так:
и халазальный гаустории наблюдаются вплоть до заключительных фаз
эмбриогенеза. В зрелом семени сохраняется обильный эндосперм.
Эмбриогенез Onagrad-типа. Согласно Джогансену (Johansen, 1950),
проанализировавшему развитие зародыша P. lanceolata по данным Суэжа
(Soueges, 1923), эмбриогенез Plantago соответствует Veronica-вариации Onagrad-
типа. Однако, по данным Мисра (Misra, 1970), развитие зародыша Plantago-
не соответствует Veronica-вариации и не согласуется ни с одной из вариаций
Onagrad-типа, упоминаемых в работе Джогансеца (Johansen, 1950).
Зародыш в семени дифференцированный, прямой, редко — согнутый (Bougueria),.
семядоли продолговатые или линейные, плоско-выпуклые. Лейкоэмбриофиты.
У P. lanceolata известны случаи полиэмбрионии (Soueges, 1926). У P.
coronopus обнаружен апомиксис (Paliwal, Hyde, 1959).
2S2
Исследованные виды. Bougueria, Littorella uniflora, Plantago
■agopus, P. amplexicaulis, P. arenaria, P. coronopus, P. hirtella, P. indica, P. la-
gopus, P. lanceolata, P. major, P. media, P. maritima, P. ovata, P. psyllium,
P. pumila, P. salsa, P. stepposa.
Литература. Hofmeister, 1858a, 1858b, 1859; Jonsson, 1879—1880,
1881; Vesque, 1879a, 1879b; Buscalioni, 1894; Навашин, 1895;
Balicka-Iwanowska, 1899; Rossler, 1917; Schnarf, 1917a, 1929, 1931; Ekstrand, 1918; Жа-
довский, 1923-1924; Soueges, 1923c, 1926b; Schurhoff, 1924; Netolitzky, 1926;
Rosen, 1940; Cooper, 1942; Johansen, 1950; Rahn, 1954; Paliwal, Hyde, 1959;
Misra, 1964a, 1964b, 1965, 1967, 1970; Singh, 1964; Czapska-Dziekanowska,
1965 (1966); Davis, 1966; Тахтаджян, 1966; Koul, Durani, 1969; Hyde, 1970;
Смирнова, Каден, 1971; Савченко, 1973; Яковлев, Жукова, 1973; Vannereau,
Mestre, 1975, 1980; Kapil, Tiwari, 1978; Кордюм, 1978; Vannereau, 1978; Под-
.дубная-Арнольди, 1982; Bouman, 1984; Титова (ориг. данные по P. media,
P. salsa).
Семейство LENTIBULARIACEAE
Пыльник 4-гнездный или 1—2-гнездный (Genlisea, Polypompholyx). Стенка
гнезда пыльника формируется центробежно и в сформированном состоянии
4-слойная. Средний слой эфемерен. В эндотеции образуются фиброзные
утолщения. Тапетум секреторного типа, состоит из 2—3-ядерных клеток. Спороген-
ная ткань, как правило, однослойная. Мейоз в микроспороцитах завершается
симультанным цитокинезом. Тетрады микроспор обычно тетраэдральные, но
встречаются изобилатеральные и крестообразные. У большинства видов
микроспоры становятся свободными, но у Utricularia punctata и у U. arcuata иногда
•остаются в тетрадах. Пыльцевые зерна рассеиваются на 3-клеточной стадии.
У многих видов Utricularia пыльца начинает прорастать в пыльнике in situ.
Семяпочка обычно анатропная или промежуточная между ана- и гемитроп-
ной (гемианатропная), у некоторых видов Utricularia (U. arcuata, U. scandens) —
анакампилотропная, с одним интегументом, тенуинуцеллятная. Интегумент
немногослойный, в дорсальной части семяпочки из 2—6 слоев. Микропилярный
канал семяпочки у видов рода Pinguicula формируется на стадии завершения
мегаспорогенеза, но у видов рода Utricularia края интегумента не смыкаются
и окружают выступающий из семяпочки зародышевый мешок, т. е. микропиле
в строгом смысле не образуется. Интегументальный тапетум обычно хорошо
дифференцирован, лишь у отдельных видов не обнаружен (U. striatula). Для
представителей семейства, кроме видов рода Pinguicula, характерно образование
специализированных групп клеток — «питательной ткани» в плаценте
(Utricularia), в фуникулусе (Polypompholyx) или в семяпочке — в микропилярной
(Genlisea) и в халазальной (Genlisea, Utricularia) ее частях. Проводящий пучок
•состоит из прокамбиальных элементов (Pinguicula), у многих видов Utricularia
сильно редуцирован. Нуцеллус разрушается на ранних стадиях развития
зародышевого мешка. Археспорий обычно одноклеточный, редко — 2—3-клеточ-
ный. Мегаспоры в тетрадах в большинстве'случаев расположены линейно, но
возможно и иное их положение (Т- и Ii-образное и изобилатеральное).
Зародышевый мешок моноспорический, развивается по Polygonum-типу,
имеет характерную удлиненную форму с расширенным микропилярный и
более узким халазальным концом, часто изогнутым. Яйцевой аппарат 3-клеточ-
ный, у многих видов Utricularia примыкает непосредственно к плаценте (U. сое-
rulea, U. scandens, U. striatula) или может быть смещен в латеральное
положение к фуникулярной стороне семяпочки (U. flexuosa; Khan, 1954). Синергиды
грушевидные, имеют крючковидные выросты (U. reticulata), нитчатый аппарат
не отмечен. Антиподы из 3 клеток, обычно довольно мелких. Данные о
разрастании одной из антипод у Pinguicula vulgaris (Kopczynska, 1964) не подтлорди-
лись. У этого вида, как и у других, нами обнаружены 3 мелкие, равные но nti-
.личине эфемерные клетки антипод. Изредка антиподальный аппарат состоит
из 2 клеток, тогда одна из них 2-ядерная (U. flexuosa). Полярные ядра в Ираном
зародышевом мешке сливаются полностью или частично. В яйцеклетке и
центральной клетке у видов Utricularia отмечены крахмальные зерна. Для ////'/>
2М.<1
1—13 — Utricularia coerulea, 14 — U. scandens, 15—22, 40—44 — Pinguicula vulgaris,, 23—
30 — U. coerulea var. filicaulis, 31—39 —• P. leptoceras.
1—3 — фрагменты гнезда пыльника на разных стадиях формирования его стенки: со споро-
генной тканью (1, 2) и микроспороцитами (3); 4 — второе деление мейоза; 5 — тетрада
микроспор; 6 — зрелое пыльцевое зерно; 7—9 — этапы мегаспорогенеза; 10, 11 — 2- и 4-ядерная
стадии развития зародышевого мешка; 12 — зрелый зародышевый мешок; микропилярная
его часть примыкает к «питательной ткани» плаценты; 13 — слияние спермия и полярных
ядер; 14, 15 — строение семяпочки и зародышевого мешка у разных родов;
м.г
т.г-
«.да
х.&
Lentibulariaceae (продолжение)
16—20 — начальные этапы развития зародыши iff
эндосперма; 21—23 — семя с глобулярным !Ш|)ОДЫ>
шем и эндоспермом: микропилярная часть (21), XII-
лазальная часть (21а), схемы строения (22, 211)'
(в эпидермисе интегумента — крахмал);
Lentibulariaceae (продолжение)
%i~f? ~~ эмбРП0Генез; Ж — строение зародыша в зрелом семенп; 31—42 — эмбриогенез-
43, 44 — схемы строения зародыша (ложнооднодольного) и эндосперма в созревающем (43)
ж зрелом (44) семени, (м. г — микропилярный и х. г — халазальный гаустории эндосперма
и. т - интегументальный тапетум). (1-13 - по Kausic, 1938; 14 - по Farooq, Bilquist^
1966; 15—22, 43, 44 - ориг.; 23—30 — по Siddiqui, 1975; 31—39
42 — по Haccius, Hartl-Baude, 1957).
по Crete, 1956; 40-
cularia и Polypompholyx характерными особенностями • являются разрастание
микропилярнои части зародышевого мешка за пределы семяпочки и ее контакт
с «питательной тканью» в плаценте. У видов Pinguicula и Genlisea зародышевый
мешок не выходит из микропиле. Отмечены разнообразные отклонения в
развитии зародышевых мешков уряда видов Utricularia, а также развитие в
некоторых семяпочках до 4 зародышевых мешков (U. flexuosa). Оплодотворение двойное,
у Pinguicula и Genlisea порогамное, у P. vulgaris происходит по постмитотиче-
скому типу. В тех случаях, когда зародышевый мешок выступает своим
микропилярный концом в полость завязи {Utricularia, Polypompholyx), пыльцевая
трубка входит в него экзогамно. Обычно под воздействием пыльцевой трубки
разрушается одна из синергид, иногда обе (U. uliginosa), но чаще интактная
синергида существует некоторое время после оплодотворения. Тройное слияние
обычно предшествует сингамии и происходит по одному из 3 вариантов: спер-
286
мий сливается с вторичным ядром или с одним из 2 неполностью слипшихся
полярных ядер или все 3 ядра сливаются одновременно (Kausic, 1938; Kuusic,
Raju, 1955).
Эндосперм целлюлярный, развивается по Scutellaria-типу (Schnarf, 1917),
у большинства видов — с микропилярный и халазальным гаусториями,
распитыми в разной степени. Первичная клетка эндосперма делится поперечной
перегородкой, затем каждая из 2 дочерних клеток делится продольно. На 8-кло-
точной стадии эндосперм представлен 4 этажами по 2 клетки в каждом. Иногда
терминальные клетки разделены неполными перегородками. Из 2 средних
этажей формируется собственно эндосперм, а из терминальных — гаустории.
У видов Utricularia наблюдались значительные вариации в направлении и
последовательности клеточных делений в процессе формирования эндосперма.
В некоторых клетках развивающегося эндосперма у U. coerulea var. filicaulis
(Siddiqui, 1975) обнаружены свободноядерные деления. Микропилярный и
халазальный гаустории обычно 2-клеточные и 2-ядерные. У некоторых видов
Utricularia микропилярный гаусторий, внедряющийся в питательную ткань
плаценты, разрушает оболочки ее клеток, а объединенное в общую массу
содержимое используется гаусторием во время развития семени. Данные о том,
что у U. flexuosa (Khan, 1954) ядра разрушенных соматических клеток входят
в гаусторий (их число может достигать 150) и там функционируют, вызывают
сомнение. Имеются сведения, что у Pinguicula alpina гаустории не развиты,
а у P. vulgaris отсутствует или слабо развит микропилярный гаусторий (Stolt,
1936; Crete, 1956b). По нашим данным, микропилярный гаусторий у P. vulgaris
состоит из двух 2-ядерных клеток, которые разрастаются незначительно.
Халазальный гаусторий также из 2 клеток: 2- или 4-ядерных на поздних стадиях
развития, обычно изогнут в направлении проводящего пучка.
Сформированный эндосперм у видов Pinguicula имеет веретеновидную, у видов Utricularia —
изогнутую, часто U-образную форму. В зрелом семени эндосперм скудный (из
одного или нескольких сжатых слоев клеток) или отсутствует.
Эмбриогенез представителей семейства причисляется к различным вариациям
Onagrad-, Asterad-, Solanad-, Chenopodiad-типов. Характерно значительное
удлинение зиготы и ее поперечное деление, сдвинутое в апикальный конец
клетки (иногда у U. flexuosa наблюдалось продольное деление зиготы). У P.
vulgaris и P. leptoceras зародыш развивается по Onagrad-типу, P. alpina — по As-
terad-типу. Апикальная часть зародыша у P. alpina и P. vulgaris формируется
по типу ложнооднодольных растений (Haccius, Hartle-Baude, 1956). У видов
Utricularia определить тип эмбриогенеза довольно трудно или невозможно из-за
больших вариаций в последовательности клеточных делений на ранних стадиях
и из-за отсутствия отчетливой дифференциации зародыша в зрелом семени.
Иногда даже у одного вида ход эмбриогенеза варьирует и соответствует
различным типам (U. striatula, U. coerulea var. filicaulis, U. uliginosa, U. stellaris
var. inflexa). Для многих видов Utricularia указана Т-образная тетрада клеток
проэмбрио, но наряду с ней часто встречается и линейная. Эмбриогенез у U.
bifida (Basheer, Prakasa Rao, 1984) идентифицирован с I периодом III мегархи-
типа серии С2 классификации Суэжа или с Chenopodiad-типом Chenopodiad-ва-
риацией системы Джогансена главным образом на основании строения
линейной тетрады бластомеров зародыша. Суспензор нитевидный, 3—4-клеточный,
дегенерирует на ранней стадии развития зародыша. У представителей
семейства зародыш в зрелом семени варьирует по размерам, форме и степени
органогенной и гистогенной (по терминологии Терёхина, 1977) редукции. У
большинства видов Pinguicula веретеновидный зародыш дифференцирован на корневой
апекс, гипокотиль с центральным цилиндром, апекс побега и 1 или 2 семядоли.
У P. lusitanica и P. caudata (Dickson, 1870) развиты 2 семядоли; у P. leptoceras
закладываются 2 семядоли, но развивается только одна; для P. alpina и P.
vulgaris (Haccius, Hartle-Baude, 1956) характерна одна семядоля (ложнооднодоль-
ные виды). Зародыш видов Genlisea имеет 2 семядоли, развитые в разной степени
(Kamenski, 1890; Merl, 1915): у Genlisea africana, G. reflexa, G. violacea и G. цг<т~
dulosissima они составляют около х/2 длины яйцеобразного зародыша, у G. //-
liformis, G. ornata, G. luteo-viridis они выглядят, как 2 маленьких бугорки.
Корневой апекс в зародыше исследованных видов Genlisea, Polypompholyx и Ulrl-
i!H7
cularia но дифференцирован, у представителей 2 последних родов отсутствуют
и семядоли. Л по кс побега у большинства видов Utricularia представлен
меристемой, у некоторых водных видов отмечена дифференциация листовых примор-
дион, накладывающихся по спирали (U. nelumbifolia, U. reniformis, U. stella-
ris, U. vulgaris) вокруг вогнутой верхушки. Форма зародыша вариабельна:
у сухопутных видов — более или менее веретеновидная, у водных видов —
чашевидная, блюдцевидная. Клетки периферического слоя зрелых зародышей
Utricularia имеют отложения кутина (Farooq, 1964). Зародыш у видов
Polypompholyx сходен с зародышами видов Utricularia: у Polypompholyx multifida он
шарообразный, с приплюснутой верхушкой и небольшими бугорками вокруг
нее; у P. laciniata зародыш со слабовыпуклой верхушкой (Каменский, 1890).
На структуру зародыша накладывает отпечаток чужеядный и водный образ
жизни этих растений. Зародыш содержит запасные вещества в виде крахмала,
масла или белковых соединений. У U. emarginata зародыш хлорофиллоносный
{Netolitzky, 1926).
Полиэмбриония отмечена у U. flexuosd и U. arcuata.
Исследованные виды. Genlisea filiformis, G. glandulosissima,
G. orndta, Pinguicula alpina, P. leptoceras, P. vulgaris, Polypompholyx multifida,
■Utricularia arcuata, U. bifida, U. coerulea, U. coerulea var. filicaulis, U. colorata,
U.' elephas, U. exoleta, U. flexuosa, U. globulariaefolia, U. graminifolia, U. in-
flexa, U. laterifolia, U. leptoceras, U. oligosperma, U. purpurea, U. reniformis,
U. reticulata, U. scandens, U.spicata, U.stellaris, U.stellarisv&r. inflexa, U. stria-
tula, U. stricticaulis, U. uliginosa, U. vulgaris, U. vulgaris var. americana, U. wal-
lichiana.
Литература. Caspary, 1867; Каменский, 1877, 1886, 1890; Merz,
1897a, 1897b; Billings, 1901; Lang, 1901; Merl, 1915; Schnarf, 1917b; Wylie,
Yocom, 1923; Netolitzky, 1926; Kausik, 1935a, 1938e; Stolt, 1936; Khan, 1953,
1954, 1963, 1970a; Kausic, Raju, 1955, 1956; Crete, 1956a, 1956b; Haccius,
Hartle-Baude, 1957; Farooq, 1958, 1960, 1964a, 1964b, 1965a, 1965b, 1966; Fa-
arooq, Si'ddiqui, 1964, 1966, 1967; Kopczynska, 1964; Shivaremiah, 1964a, 1964b,
1967; Begum, 1965, 1969; Siddiqui, 1965a, 1965b, 1975; Farooq, Bilquis, 1966a,
1966b; Терёхин, 1977; Basheer, Prakasa Rao, 1984; Никитичева (ориг. данные).
Семейство MYOPORACEAE
Развитие стенки пыльника не изучено. Тапетум секреторный, клетки его
содержат 1—2 ядра. Зрелое пыльцевое зерно 2-клеточное.
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная.
Археспорий одноклеточный. Археспориальная клетка, не отделяя париетальной,
преобразуется в мегаспороцит, который дает начало 4 мегаспорам.
Расположение мегаспор в тетраде линейное. Функционирует халазальная мегаспора.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Состоит из 7 клеток, содержащих 8 ядер. Синергиды имеют грушевидную форму.
Полярные ядра сливаются перед оплодотворением. Антиподальные клетки
могут сохраняться до ранних этапов развития эндосперма или дегенерируют
довольно быстро после их образования. Оплодотворение порогамное.
Эндосперм целлюлярный, с микропилярным и халазальным гаусториями.
Халазальный гаусторий небольших размеров, состоит из 4 клеток; микропиляр-
ный гаусторий у Eremophila duttoni, E. longifolia и Myoporum acuminatum
многоклеточный, у Oftia africana — из 4 больших клеток.
Зародыш развивается по Onagrad-типу, имеет удлиненную форму.
Исследованные виды. Eremophila duttoni, E. longifolia,
Myoporum acuminatum, M. humile, M. serratum, Oftia africana.
Литература. Billings, 1901; Schnarf, 1931; David, 1938; Maheshwari,
1946; Vos de, 1947; Davis, 1966; Тахтаджян, 1966; Поддубная-Арнольди, 1982.
:288
Myoporaceae
1,2 — Myoporum humile.
1 — 4-ядерный зародышевый мешок; 2 — сформированный зародышевый мешок. (1, 2 —
по David, 1938).
Семейство ACANTHACEAE
Пыльник 4-гнездный. Стенка гнезда пыльника развивается по
центробежному типу и состоит из эпидермиса, эндотеция, среднего слоя и секреторного
тапетума с 2—4-ядерными клетками. В роде Justicia тапетум диморфен, со
стороны связника его клетки сильно удлиняются. В эндотеции развиваются
фиброзные утолщения, кроме Elythraria acaulis (Johri, Singh, 1959), где они
появляются лишь в основании пыльника, и Ruellia tuberosa, Barleria priontis (Naraia-
nan, 1956) и Thunbergia alata (Wadhi, 1962), у которых они вообще не
обнаружены. У Nelsonia campestris (Mohan Ram, Masand, 1963) фиброзные утолщения
развиваются не только в эндотеции, но и в клетках среднего слоя. Тетрады
микроспор тетраэдральные, крестообразные, реже — изобилатеральные,.
формируются симультанно. Зрелые пыльцевые зерна 2-клеточные.
Семяпочка различных типов: анатропная (Justicia, Dipteracanthus), амфит-
ропная (Elythraria), кампилотропная (Nelsonia, Acanthus, Barleria, Blepharis),
тенуинуцеллятная. Единственный массивный интегумент образует узкое
микропиле. Фуникулярный обтуратор хорошо развит у представителей Acantho-
idea (за исключением 2 триб: Aphelandrae и Acanthea), слабо — у Nelsonioidea
и отсутствует у Thunbergioidea и Mendocioidea. Интегументальный тапетум
отмечен только у N. campestris vs. E. acaulis. У большинства видов нуцеллус
исчезает до завершения формирования зародышевого мешка. Археспорий одно-,
реже — 2-клеточный. Тетрады мегаспор линейные.
Зародышевый мешок развивается по Polygonum-типу из халазальной моги-
споры. Форма зрелого зародышевого мешка у представителей различных родом
19 Сравнительная эмбриология 281)
Acanthaceae
1—9, 14, 15 — Nelsonia campestris, 10—13, 16—18, 27—33 — Elytraria acaulis, 19—22 —
Andrographis serpyllifolia, 23—25 — Asistasia shimperi, 26 — Adhatoda vasica.
1—9 — микроспорогенез и развитие пыльцевого зерна: 1,2 — формирование стенки
пыльника, 2а — схема поперечного среза молодого пыльника, 3, 4 — метафаза и анафаза второго
деления мейоза в микроспороцитах; 5,6 — тетрады микроспор, 7 — фрагмент стенки
пыльника с микроспорами, 8 — фрагмент стенки зрелого пыльника и 8а — его схема (поперечный
срез), 9 — 2-клет.очное пыльцевое зерно;
разнообразна. Он может быть прямым и изогнутым. Иногда его микропилярный
конец сильно вытягивается и выходит верхушкой из микропиле, как у Justiciar
betonica (Bhatnagar, Puri, 1970), или внедряется в ткани фуникулуса и может
достигать плаценты, как у N. campestris (Mohan Ram, Masand, 1963). У Dipte-
racanthus patulus зародышевый мешок формирует выросты как на
микропилярном, так и на халазальном полюсах (Maheshvari, Negi, 1955). Яйцевой аппарат-
3-клеточный< Синергиды исчезают после оплодотворения, но в некоторых
случаях одна из них сохраняется вплоть до ранних стадий эмбриогенеза.
Полярные ядра сливаются до или во время оплодотворения. Антиподы в большинстве-
родов дегенерируют в период оплодотворения, но у Pseudoeranthemum, Dicli-
ptera, Barleria, Asistasia и Ecbolium сохраняются до первых делений зародыша..
У В. priontis (Phatak, Ambegaokar, 1956) они могут делиться, образуя группу
из 12—13 клеток, а у Е. acaulis (Johri, Singh, 1959) становятся 2-ядерными..
Семейству свойственна порогамия.
Эндосперм целлюлярный, с терминальными гаусториями — микропиляр-
ным и халазальным. У Т. alata (Mauritzon, 1934) и Blepharis maderaspatensis:
290
Г
Acanthaceae (продолжение)
10 — нуцеллус с археспориальной клеткой; 11, 12 — тетрады мегаспор; 13 — 4-клетотшый
зародышевый мешок; 14, 15 — образование выроста на микропилярном конце зародышопого
мешка; 16 — 8-ядерный зародышевый мешок; 17, 18 — зародышевый мешок сразу носло
оплодотворения;
19*
Acanthaceae (продолжение)
19—26 — различные стадии развития эндосперма: 19, 20 —
образование микропилярного и халазального гаусториев; начало
делений в центральной зоне, 21 — эндосперм на глобулярной
стадии развития зародыша; хорошо развиты микропилярный,
халазальный и вторичный гаустории; терминальные клетки
подвеска многоядёрные, 22 — вторичные гаустории, 23, 24, 26 —
свободноядерные деления в «центральной зоне» эндосперма,.
25 — образование свободноядерного «базального аппарата»
в центральной зоне эндосперма;
Acanthaceae (продолжение)
27—33 — эмбриогенез. (1—9, 14, 15 — по Mohan Ram, Masand, 1963; 10—13, 16—18, 27—
33 — по John, Singh, 1959; 19—22 — no Mohan Ram, 1960; 23—25 — no Karlstrom, 1972;
26 — no Mohan Ram, 1961).
(Phatak, Ambegaocar, 1963) халазальный гаусторий отсутствует. Развитие
эндосперма обычно происходит следующим образом. Первичное ядро эндосперма
мигрирует перед делением в халазальную часть зародышевого мешка. После его
деления закладывается поперечная перегородка, отделяющая маленькую
халазальную клетку от большой микропилярной. Микропилярная клетка делится
поперечно и образуется ряд из 3 клеток. Верхняя становится инициальной
клеткой микропилярного гаустория, нижняя — халазального, средняя является
исходной для собственно эндосперма. Микропилярный гаусторий хорошо
развит, функционально активен (исключая Jacobinia, Blechum, Dipteracanthuk),
одноклеточный, обычно 2-, реже — 4-ядерный. В редких случаях содержит
1, 3, 5 или 10 ядер. Как правило, выходит из микропиле и внедряется в фуни-
кулус, а иногда и в сосудистый пучок семяпочки. У большинства видов он
отмирает во время ранних стадий развития зародыша, но у Е. acaulis и Justicla
simplex (Mohan Ram, Sehgal, 1958) может сохраняться в зрелом семени.
Халазальный гаусторий одноклеточный, меньших размеров, 2-, 4-ядерный, обычно
существует до глобулярной стадии развития зародыша, после чего начинает
дегенерировать. В процессе развития эндосперма взаимное расположение
халазального гаустория относительно микропилярного меняется мало, но клетки
собственно эндосперма растут и делятся более интенсивно, в основном в напрни-
лении выпуклой части зародышевого мешка, образуя массу эндосперма лижо
гаусториев, которые в результате оказываются сближенными, причем
халазальный гаусторий лежит на латеральной стороне эндосперма. Собстноппо кн-
досперм, развивающийся из средней клетки 3-клеточной стадии его ран нити и,
может быть изначально клеточным (Peristrophe bicaliculata; Madhavim, 1!)HU),
но, как правило, в нем проходит некоторое число свободноядерных долоиий:
у Ruspolia (Karlstrom, 1972) их 4, у Dipteracanthus — 64 (Maheslivnrl, Notfl,
1955), у большинства видов Ruellia — около 256. Образование клеточных ил*
регородок в собственно эндосперме начинается со стороны ранни на мнщччм'н
зародыша и у многих видов, не достигнув противоположного полюса, При
Ж\
останавливается. Тогда в нижней его части остается свободноядерная область —
«базалышй аппарат» (Ruspolia, DicUptera, Justicia, Adhatoda, Nelsonia, Peri-
strophe, Phlebophyllum). У Andrographis, Ashtasia, Justicia и Elythraria
некоторые периферические клетки эндосперма, расположенные с его более выпуклой
стороны, сильно удлиняются, внедряются в ткани интегумента и разрушают
окружающие клетки. Эти одноядерные отростки рассматриваются как вторич-
нмо гаустории (Mohan Ram, Sehgal, 1958; Johri, Singh, 1959; Mohan Ram, 1960;
Mohan Ram, Masand, 1962; Mohan Ram, Wadhi, 1964). Они обычно
дегенерируют одновременно с халазальным гаусторием. В зрелом семени эндосперм
румииированный, чаще сохраняются 2—3 слоя его клеток.
Эмбриогенез Onagrad- или Solanad-типа. Подвесок варьирует от короткого
3-клеточного у Elythraria до длинного 60—70-клеточного у Ecbolium. У
Andrographis базальная клетка подвеска крупная, содержит от 4 до 15 ядер,
подвесок сохраняется в зрелом семени — редкое явление для Acanthaceae. Зрелый
зародыш прямой (у Elythraria изогнутый), двусемядольный,
дифференцированный, содержит жиры, иногда крахмал, алейроновые зерна и кристаллы окса-
лата кальция. Лейкоэмбриофиты.
В семействе обнаружена полиэмбриония [Dipteracanthus, Acanthus, Barle-
ria). Дополнительные зародыши (один, реже — 2) образуются из клеток
подвеска, в зрелом семени они обычно не сохраняются. У Ruellia hummilis (Baskin,
Baskin, 1971) в незначительном количестве исследованных семян содержалось
по 2 полноценных зародыша, их происхождение не выяснено.
Исследованные виды. Acanthus ilicifolius, A. mollis, Adhatoda
vasica, Andrographis echioides, A. paniculata, A. serpyHi folia, Asteracantha longi-
folia, Asystasia (4), Barleria (4), Blechum angustifolium, Blepharis maderaspaten-
sis, Chamaeranthemum beyrichii, Crabbea angustifolia, С nana, Crossandra nilotica,
DicUptera bupleuroides, D. roxburghiana, Diplanthera uninervis, Dipteracanthus
patulus, Dishoriste humilis, Ecbolium linneanum, Elythraria acaulis, Eranthemum
albomaculatum, E. leuconeuron, E. nervosum, Haplanthus tentaculatus, Jacobinia
pauciflora, Justicia betonica, J. simplex, Lankesteria barteri, L. brevior, Nelsonia
campestris, Peristrophe bicaliculata, Phlebophyllum kunthianum, Pseudoeranthe-
mum (4), Ruellia (5), Ruspolia hypocrateriformis, R. seticalyx, Sericocalyx scaber,
Thunbergia alata, T. misorensis, T. reticulata.
Литература. Hofmeister, 1858, 1859; Chatin, 1870; Vesque, 1878;
Strasburger, 1882; Karsten, 1891; Lindau, 1895; Tieghem, 1908a; Juel, 1915;
Hartman, 1923; Netolitzky, 1926; Shurhoff, 1926; Giganti, 1929; Schnarf, 1931;
Mauritzon, 1934; Bremecamp, 1938, 1942, 1944, 1953; Rangasami, 1941; Bhaduri,
1944; Crete, 1951; Rao, 1953; Maheshvari, Negi, 1955; Phatak, Ambegaokar,
1955,1956,1957, 1961, 1963; Johri, Singh, 1956, 1959; Mohan Ram, 1956, 1959a,
1959b, 1960a, 1960b, 1961, 1962; Narayanan, 1956; Mohan Ram, Seghal, 1958;
Raj, 1961; Mohan Ram, Masand, 1962, 1963; Wadhi, 1962, 1967, 1970; Engler,
1964; Mohan Ram, Wadhi, 1964, 1965; Wall, Long, 1965; Davis, 1966; Sahi, 1966;
Тахтаджян, 1966, 1970; Jaitly, 1969; Bhatnagar, Puri, 1970; Baskin, Baskin,
1971; Karlstrom, 1972, 1973, 1974a, 1974b; Bhathagar, Kallarackal, 1973;
Corner, 1976; Sell, 1977; Cosa, 1978; Sareen, Bhanwara, 1978; Shamsuddin, 1978;
Madhavan, Gupta, 1982; Поддубная-Арнольди, 1982.
Семейство HYDROSTACHYACEAE
Сформированная стенка пыльника состоит из эпидермиса, эндотеция, 2
средних слоев и секреторного тапетума. Клетки тапетума содержат по 2 ядра.
Средние слои разрушаются. Образование тетрад микроспор симультанное.
Пыльца в тетрадах. Зрелая пыльца 2-клеточная.
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная. Архе-
спориальная клетка одна, становится непосредственно мегаспороцитом. Тетрада
мегаспор линейная, редко — Т-образная.
294
Hydrostachyaceae
1—6 — Hydrostachys goudotiana.
1 — зрелый зародышевый мешок; 2—5 — развитие эндосперма
и зародыша; образование микропилярного эндоспермального
гаустория; 6 — незрелое семя; зародыш с семядолями и
зародышевым корешком. (1—6 — по Jager-Ziirn, 1965).
Зародышевый мешок развивается по Polygonum-типу из халазальной
мегаспоры. В зрелом зародышевом мешке есть крахмальные зерна. Для данного
семейства характерна порогамия и двойное оплодотворение.
Эндосперм целлюлярный. Считалось, что развитие эндосперма идет по
Anona-типу, а его гаусторий рассматривался как вытянутая и вздутая базальная
клетка суспензора (Palm, 1915). Новые исследования (Jager-Ziirn, 1965)
опровергают эти данные. У Hydrostachys goudotiana развитие эндосперма происходит
по Stachys-типу. Первое деление сопровождается образованием поперечной
стенки. Из микропилярной клетки образуется многоядерный микропилярный
гаусторий. Центральная клетка дает собственно эндосперм путем поперечных,
а затем — продольных делений.
Эмбриогенез соответствует Onagrad-типу.
Исследованные виды. Hydrostachys distichophylla, H. goudotiana,
Н. hildebrantii, H. imbricata, H. longifida, H. longipoda, H. stolonifera, H. ver-
ruculosa.
Литература. Warming, 1891; Palm, 1915; Dahlgren, 1927; Mauritzon,
1933, 1939; Subramanyam, 1962; Jager-Ziirn, 1965; Raugh, Jager-Ziirn, (1965)
1966.
Семейство HIPPURIDACEAE
Пыльник 4-гнездный. По нашим данным, сформированная стенка гнезда
пыльника у Hippuris vulgaris состоит из 4 слоев. Эпидермис сохраняется в
зрелом пыльнике, его клетки вблизи стомиума вытягиваются радиально. В эидото-
ции развиваются фиброзные утолщения. Средний слой эфемерен. Тапетум
секреторного типа, 2-ядерный. Пыльцевые зерна одиночные, генеративная
клетка перед делением из округлой становится веретеновидной (Juel, 1911).
Зрелые пыльцевые зерна 3-клеточные.
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная. Инто-
гумент 4—5-слойный, смыкаясь над нуцеллусом, образует длинный
микропилярный канал. Развит интегументальный тапетум, окружающий халаиальную
половину зародышевого мешка. Проводящий пучок семяпочки состоит ип про
камбиальных элементов, заканчивается в халазе. Однослойный пуцоллуи
разрушается на ранней стадии развития зародышевого мешка. Данные о ччш,
что микропилярная часть нуцеллуса сохраняется в виде колпачка над народы
шевым мешком в готовой к оплодотворению и в оплодотворенной спмнпО'НН*
I'.lld
(Juel, 1911; Soueges, 1922), в нашем исследовании не подтвердились: в
сформированной семяпочке Н. vulgaris никаких остатков нуцеллуса не обнаружено.
Археспорий одноклеточный, без деления преобразуется в мегаспороцит.
Тетрада мегаспор линейного типа.
Зародышевый мешок моноспорический, развивается из халазальной
мегаспоры по Polygonum-типу; в зрелом состоянии удлинен по оси семяпочки и
изогнут на халазальном конце в направлении проводящего пучка. Яйцевой
аппарат 3-клеточный. Синергиды с хорошо выраженным нитчатым аппаратом
(ориг. данные). Антиподы из 3 небольших клеток, сохраняются на первых
этапах эндоспермогенеза. Полярные ядра сливаются перед оплодотворением.
296
Sippuridaceae (продолжение)
8—10 — начальные этапы развития семяпочки; 11 — семяпочка, готовая к оплодотворешпо;
12 — зрелый зародышевый мешок; 13—15 — первые этапы развития^эндосперма;
В центральной клетке и яйцеклетке много крахмала. Оплодотворение порогам-
ное, двойное.
Эндосперм целлюлярный. Первичная клетка эндосперма делится попорочио
к ее длинной оси, обе образовавшиеся дочерние клетки делятся продольно, п :ш~
тем микропилярная пара — поперечно. На этой стадии клетки эндоспорма рио-
полагаются в 3 этажа; из клеток среднего этажа образуется соботпоип»
эндосперм, из терминальных — микропилярный и халазальный га устриц
Последние 4-клеточные, разрастаются незначительно. Халазальный гаусторий
;Ш7
Hippuridaceae (продолжение)
16—18 — семяпочка на стадии
глобулярного зародыша: 16 — схема
строения, 17 — микропилярная и
18 — халазальная части семяпочки;
19—27 — эмбриогенез; ' 28— 30 —
зародыш и эндосперм на разных
стадиях созревания семени (28, 29) и
в зрелом семени (30). (1—4, 11, 12,
15—18, 28—30 — ориг.; 5—10, 13,
14 — по Juel, 1911; 19—27 — по So-
ueges, 1922).
|
внедряется в халазу и контактирует слроводящим пучком семяпочки. В сформю
рованном эндосперме выделяется зона, прилегающая к халазальному гаусторию,
с более мелкими густоплазменными клетками. В зрелом семени эндосперм
скудный, представлен 2—4-клеточными слоями вокруг зародыша, содержит крахмал.
Эмбриогенез Onagrad-типа. Зигота перед делением удлиняется, врасти к
в эндосперм, первая перегородка в ней поперечная. Суспензор длинный,
нитевидный, из 5 или более клеток. Проэмбрио проходит в своем развитии стадии
квадрантов и октантов, в которых периклинальные стенки отделяют эмбрио-
дерму. 'Зародыш в зрелом семени прямой, занимает большую часть его объема,
дифференцирован на органы: имеет 2 развитые семядоли, выпуклый апекс
побега, удлиненный гипокотиль с прокамбиальным тяжом и зародышевый корень.
Исследованный вид. Hippuris vulgaris.
Литература. Unger, 1849; Fisher, 1880; Juel, 1910, 1911; Soueges,
1922a; Никитичева (ориг. данные).
Порядок 69. CAMPANULALES
Семейство CAMPANULACEAE
Пыльник 4-гнездный. Сформированная стенка гнезда пыльника,
развивающаяся центробежно, состоит из эпидермиса, эндотеция, в котором развиваются
фиброзные утолщения, одного эфемерного среднего слоя (2 — у Pentaphragma
horsfieldii) и секреторного тапетума с 2-ядерными клетками. По нашим данным,
у Campanula rapunculoides в клетках тапетума одного и того же гнезда пыльника
может быть 2, 4, 8 ядер, а также по 1—2 гипертрофированных ядра, возникших
возможно, путем эндомитоза или реституции при аномальном митозе. Тапеталь-
ные клетки у этого вида до конца сохраняют свое пристенное положение и
выделяют внутрь гнезда большое количество слизи полисахаридной природы,
обволакивающей микроспоры. Тетрады, образовавшиеся симультанно,
тетраэдральные или изобилатеральные. Крестообразные тетрады (наряду с изоби-
латеральными) обнаружены у P. horsfieldii. Зрелые пыльцевые зерна 2-клеточ-
ные у Pentaphragmoideae и у некоторых представителей Campanuloideae
(Campanula americana, С. rapunculoides, Wahlenbergia bicolor) и Lobelioideae (Lobelia
amoena). У Wahlenbergia gracilis (Campanuloideae), Isotoma longiflora и Lobelia
cardinalis (Lobelioideae) описаны 3-клеточные пыльцевые зерна. Однако у
последнего вида, растущего в условиях Ленинграда, пыльцевые зерна высыпаются
из пыльника в 2-клеточном состоянии (ориг. данные). У Sphenocleoideae зрелая
пыльца 3-клеточная. В пыльцевых зернах некоторых видов обнаружен
крахмал (Cephalostigma schimperi, Isotoma fluviatilis). С помощью электронного
микроскопа в вегетативной клетке пыльцевого зерна Lobelia erinus (Dexheimer,
1970) ко времени его созревания обнаружены амилопласты (на одном срезе
амилопласта можно видеть 10^-20 крахмальных зерен), ЭР, состоящий из
коротких, изредка длинных, образующих эргастоплазму, цистерн,
митохондрии с очень короткими кристами. Ко времени созревания пыльцевого зерна
сокращается число диктиосом и цистерн в каждой диктиосоме, уменьшается
образование крупных везикул с электронно-прозрачным содержимым и
увеличивается продуцирование мелких везикул. Липидные глобулы многочисленны
и располагаются в цитоплазме вегетативной клетки неравномерно. В
генеративной клетке (как и в образовавшихся из нее спермиях) число цитоплазматиче-
ских органелл невелико. Очень редки митохондрии с почти неразвитыми
кристами. Диктиосомы представлены небольшим числом укороченных цистерн.
ЭР в виде коротких цистерн. Лейкопласты со слаборазвитой мембранной
системой. Свободные рибосомы немногочисленны. У Lobelia erinus, L. syphilitica
и L. splendens в цитоплазме генеративной клетки вакуоли отсутствуют. У
Lobelia trialata (Kausik, Subramanyam, 1945) и L. pyramidalis (Subramanyam, 1949)
имеется тенденция к прорастанию пыльцевых зерен в пыльнике, причем
спермин могут мигрировать в пыльцевую трубку. У С. rapunculoides (ориг. данные)
генеративная клетка в некоторых случаях делится в пыльцевом зерне, правда,
уже попавшем на рыльце и иногда уже начавшем прорастать. В гиалиновой зоне
пыльцевой трубки L. erinus обнаружены большая активность диктиосом
(образование многочисленных везикул) и начало формирования вакуолей путем
расширения каналов ЭР (Dexheimer, 1970). Спермин, наблюдавшиеся в
пыльцевом зерне L. cardinalis (Cooper, 1942) и в пыльцевой трубке С. rapunculoides
(ориг. данные), богатоплазменны. По нашим наблюдениям, у L. cardinalis
Campanulaceae
1—4, 15—21, 23—35 — Campanula rapunculoides, 5—14 — Lobelia cardinalis, 22, 47 —
Lobelia amoena, 36—46 — Specularia speculum.
1—4 — фрагменты гнезда пыльника на разных стадиях развития; 5 — схема 2 соседних
пыльников; 6 — участок контакта 2 смежных гнезд соседних пыльников; (1—3, 5, 6 —
поперечные срезы, 4 — продольный срез);
300
ко времени созревания пыльника некоторые участки его эпидермиса покрыты
довольно толстой кутикулой. Она особенно хорошо выражена у гнезд пыльника,
обращенных кнаружи от центра цветка, а также, хотя и несколько слабее, на
соприкасающихся друг с другом участках «внутренних» гнезд одного и того же
пыльника. Есть основания полагать, что кутикула эпидермальных клеток
соприкасающихся друг с другом участков стенки «наружных» гнезд соседних
пыльников полимеризуется как единое целое. Вследствие этого пыльники
оказываются прочно связанными друг с другом, и после вскрывания гнезд и
высыпания пыльцы остается неразомкнутое кольцо из стенок «наружных» гнезд
и связников всех 6 пыльников. У С. rapunculoides подобной кутикулы не
образуется, и пыльники остаются свободными как до, так и после высыпания
пыльцы.
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная. Имеется
хорошо выраженный интегументальный тапетум, который у Sphenocleoideae
примыкает к боковым стенкам зародышевого мешка по всей его длине. У Реп-
taphragmoideae и Campanuloideae он окружает лишь 2 нижние трети
зародышевого мешка, примерно до уровня апекса яйцеклетки (С. rapunculoides, ориг.
данные); у Lobelia amoena, L. nicotianaefolia и L. trigona интегументальный та-
петун также охватывает только халазальную часть зародышевого мешка, что
считается характерным для Lobelioideae (Davis, 1966; Subramanyam, 1970;
Поддубная-Арнольди, 1982). Однако у L. excelsa (Billings, 1901) и L. cardinalis
(Cooper, 1942) он окружает весь зародышевый мешок. Единственная археспо-
риальная клетка функционирует как мегаспороцит. Тетрады мегаспор
преимущественно линейные, изредка Т-образные (W. gracilis), иногда с наклонной
перегородкой между 2 верхними мегаспорами. У Sphenocleoideae — только
линейные. Функционирует халазальная мегаспора.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
У P. horsfieldii микропилярная часть зародышевого мешка сильно разрастается
и ко времени 4-ядерной стадии выходит за пределы семяпочки. Синергиды
удлиненные, с крючкообразными выростами. Нитчатый аппарат обнаружен
у С. americana, L. cardinalis, L. pyramidalis и /. fluviatilis. У Jasione montana
не имеется обычного нитчатого аппарата, наблюдаются лишь впячивания в
протопласт синергиды выступов полисахаридной оболочки, одевающей микропиляр-
ную часть клеток яйцевого аппарата. С помощью электронного микроскопа
обнаружено впячивание в протопласт участка базальной части плазмаяеммы
синергиды и его последующее разрастание с образованием массы складок и
отростков в форме лабиринта, который авторы (Berger, Erdelska, 1973)
квалифицируют как нитчатый аппарат, правда, атипичный, функции которого
неизвестны. Этими же авторами обнаружено, что в отличие от других растений
у /. montana утолщенная клеточная стенка микропилярных концов синергид
кутинизирована. Причем сплошной слой кутина прерывается только у
заостренного конца одной из синергид. Такая структура оболочки чисто механически
предопределяет, в какую из синергид может войти пыльцевая трубка, даже если
эти синергиды идентичны по своей ультраструктуре. Центральная клетка также
покрыта двуслойной кутикулой (тонкий слой — остаток кутикулы клеток ну-
целлуса и более толстый — кутикула клеток интегументального тапетума,
окружающего зародышевый мешок). В зоне наибольшего расширения
центральной клетки — на уровне яйцеклетки и вторичного ядра — кутинизированная
оболочка представлена лишь отдельными маленькими пластинками. В этой же
зоне плазмалемма центральной клетки образует так называемый «лабиринт»,
т. е. становится глубокоскладчатой, морщинистой (на срезе выглядит как очень
извилистая линия). Такая структура, по мнению авторов, обеспечивает особую
интенсивность обменных процессов в этой зоне. Вокруг антипод кутина не
обнаружено. Полярные ядра сливаются ко времени.оплодотворения. У L.
nicotianaefolia и L. pyramidalis нижний конец центральной клетки вырастает за
антиподы, образуя тонкий гаусторий. У некоторых видов (W. bicolor и др.)
в центральной клетке обнаружены крахмальные зерна. Антиподы эфемерны и
обычно дегенерируют ко времени оплодотворения. Однако у L. nicotianaefolia,
Sphenoclea zeylanica и P. horsfieldii они сохраняются до ранних стадий развития
эндосперма. Семейству свойственна порогамия. Двойное оплодотворение отме-
302
Campanulaceae (продолжение)
22 — семяпочка с археспрриапьной клеткой; 23—26 — мегаспорогенез; 27—30 — развитие
зародышевого мешка;
чено у L. cardinalis и Downingia bacigalupii. По нашим данным, у С. rapunculoi-
des оно происходит по премитотическому типу.
Эндосперм целлюлярный, с терминальными гаусториями. Различаются 6
типов развития эндосперма (Rosen, 1932, 1949; Crete, 1951; Subramanyam, 1951,
1970; Kapil, Vijayaraghavan, 1962, 1965). Первичная клетка эндосперма
делится поперечной перегородкой с образованием 2 клеток — микропилярной
и халазальной. У 5 типов (Codonopsis, Scutellaria, Phyteuma, Isotoma и Sphe-
304
Campanulaceae (продолжение)
31 — сформированный зародышевый мешок; 32 — халазапьная часть зародышевого Мишин
с дегенерирующими антиподами; 33 — семяпочка со зрелым зародышевым мешком; 84, НП ►-
. дегенерирующими ,
двойное оплодотворение;
20 Сравнительная эмбриология
noclea) деления микропилярной клетки 2-клеточного эндосперма и ее
производных одинаковы вплоть до образования микропилярного гаустория (у Sphenoclea
происходит одно дополнительное деление). Перегородка в микропилярной
клетке закладывается продольно. Затем лежащие бок о бок клетки делятся
поперечными перегородками. Образуется комплекс из 4 клеток,
расположенных в два 2-клеточных яруса. Клетки верхнего яруса развиваются в 2-клеточ-
ный микропилярный гаусторий. Деление' халазальной клетки 2-клеточного
эндосперма и ее производных происходит по-разному.
1. Codonopsis-тйп. Халазальная клетка делится продольной перегородкой,
а ее производные — поперечными, образуя два 2-клеточных яруса. После того
как клетки этих ярусов еще 1 —2 раза поделятся поперечными перегородками,
2 клетки самого нижнего яруса начинают дифференцироваться в 2-клеточный
халазальный гаусторий. Этот тип свойствен в основном представителям Сат-
panuloideae (Codonopsis clematidea, видам рода Campanula, Symphyandra hof-
.manni, Cyananthus integer, Wahlenbergia, C. schimperi) и Downingia pulchella
(Lobelioideae).
2. Scutellaria-тип. По существу это упрощенная вариация Codonopsis-
типа, где вычленение халазального гаустория происходит уже на 8-клеточной
стадии. Тип характерен для Lobelioideae (Hypsela reniformis, Isotoma axillaris,
виды родов Lobelia и Pratia).
3. Sphenoclea-тип. Описан у S. zeylanica. Развитие первоначально идет,
жак при Scutellaria-типе, но все 8 клеток делятся вертикальными
перегородками так, что образуются четыре 4-клеточных яруса. Верхний и нижний ярусы
.дифференцируются в 4-клеточные микропилярный и халазальный гаустории.
4. Phyteuma-тип. Халазальная клетка 2-клеточного эндосперма делится
поперечной перегородкой. Верхняя из 2 образовавшихся клеток далее
делится продольной перегородкой, а нижняя — поперечной. После этого самая
нижняя клетка образует одноклеточный халазальный гаусторий (Campanuloi-
deae: Adenophora, Campanula carpatica, С. persicifolia, С. portenschlagiana, С. ro-
306
Carnpanulaceae (продолжение)
48 — схема типов развития эндосперма сем. Carnpanulaceae.' (1—21, 23—35, 48 — ориг.;
22, 47 — по Hewitt, 1939; 36—46 — no|Longevialle, 1968).
tundifolia, С. steveni, Musschia, Specularia^Lobelioideae: I. longiflora, Laurentia
tenella).
5. Isotoma-тип. Вариант Phyteuma-типа. Халазальная клетка
2-клеточного эндосперма делится поперечной перегородкой (как и при Phyteuma-типе).
Обе образовавшиеся клетки также делятся поперечными перегородками.
Самая нижняя клетка дает начало . одноклеточному халазальному гаусторию.
3 остальные клетки халазального комплекса делятся продольными
перегородками. Isotoma-тип встречается в 50 % семяпочек /. longiflora наряду с чистым
Phyteuma-типом.
У всех типов расположенные между гаусториями ярусы клеток образуют
собственно эндосперм.
6. Pentaphragma-тип. Описан у P. horsfieldii (Kapil, Vijayaraghavan, 1962,
1965). Микропилярная клетка 2-клеточного эндосперма не делясь
дифференцируется в одноклеточный микропилярный гаусторий. Халазальная клетка
долится продольно; так же делятся ее производные, образуя ярус из 4 клеток.
Их дальнейшие деления образуют собственно эндосперм. Халазальный
гаусторий отсутствует.
Для семейства характерен Solanad-тип эмбриогенеза. Однако у S. zeylanica
установлен Onagrad-тип (Swami, Padmanabhan, 1961). Зародыш в семени
дифференцированный, 2-семядольный, занимает от 1/i (L. атоепа) до х/з (W. blcolor)
длины семени. Лейкоэмбриофиты.
В подсемействах Campanuloideae и Lobelioideae описана полиэмбриоиин.
У С. schimperi, I. longiflora, W. gracilis, W. bicolor и L. syphilitica
дополнительные зародыши образуются из клеток подвеска.
?0*
1107
Исслодованные виды. Adenophora bulleyana, A. diplodonta,
A. Ullflora, Campanula (16), Cephalostigma schimperi, Codonopsis clematidea,
Cijananthus integer, Downingia bacigalupii, D. pulchella, Glosocomia sp., Hyp-
sela reniformis, Isotoma axillaris, I. fluviatilis, I. longiflora, I. petraea, Jasione mon-
iana, Laurentia michelii, L. tenella, Lobelia (21), Musschia aurea, M. wollastoni,
ParUaphragma horsfieldii, Phyteuma limonifolium, Pratia angulata, P. arenaria,
P. alliptica, Siphocampylus manettiaeflorus, Specularia castellana, S. falcata,
S. pentagonia, S. speculum, Sphenoclea zeylanica, Symphyandra hofmanni, S. por-
tenschlagiana, Trachelium cauruleum, Wahlenbergia bicolor, W. gracilis, W. he-
deracea, W. lobelioides, W. marginata, W. pendula, W. tasmania, W. vincifolia.
Литература. Radlkofer, 1856; Hofmeister, 1858, 1859; Vesque, 1878,
1879; Elfving, 1879; Jonsson, 1879—1880, 1881; Ward, 1880; Guignard, 1882;
Strasburger, 1884, 1889; Barns, 1885; Hegelmaier, 1886; Hubert, 1896; Schlotter-
beck, 1896; Balicka-Iwanowska, 1899; Billings, 1901; Habermann, 1906; Ohlen-
dorf, 1907; Armand, 1912, 1913, 1921; Samuelsson, 1913; Juel, 1915; Schnarf,
1918; ScMrhoff, 1926; Rosen, 1930, 1932, 1949; Зафийовская, 1934, 1935a, 19356;
Kausik, 1935b, 1938d; Soueges, 1936b, 1938a; Crete, 1938a, 1938b, 1948a, 1951,
1956e; Hewitt, 1939; Сукачев, 1940; Cooper, 1942; Maheshwari, 1944a, 1944b;
Kausik, Subramanyam, 1945a, 1945b, 1946a, 1946b, 1947; Martin, 1946; Subra-
manyam, 1947, 1948, 1949, 1950b, 1950c, 1951a, 1951b, 1951c, 1953a, 1970a,
1970b, 1970c; Erdtman, 1952; Mathew, 1960; Swamy, Padmanabhan, 1961b;
Kapil, Vijayaraghavan, 1962, 1965; Teleska, 1962; Want, 1963; Dexheimer, 1965a,
1965b, 1966, 1970; Longevialle, 1966, 1968a, 1968b, 1969; Erdelska, 1968, 1969a,
1969b, 1972, 1973, 1975, 1981; Kaplan, 1968, 1969a, 1969b; Beltran, 1970; Tora-
sian, 1971; Berger, Erdelska, 1973; Bielawska, 1973; Dunbar, 1973; Яковлев,
Жукова, 1973, 1980; Corner, 1976; Erdelska, Klasova, 1978; Коробова, Жин-
кина, 1986 и ориг. данные.
Семейство STYLIDIACEAE
Пыльник 4-гнездный. Стенка гнезда пыльника развивается центробежно
и состоит из эпидермиса, эндотеция, 1—2 средних слоев и секреторного 2-ядер-
ного тапетума. Средние слои эфемерные; в клетках эндотеция образуются
фиброзные утолщения. Стенка зрелого пыльника у Stylidium graminifolium
представлена эпидермисом, фиброзным эндотецием и дегенерирующими
остатками среднего слоя и тапетума (Subramanyam, 1951). Образование микроспор
симультанное, их расположение в тетрадах тетраэдральное. Зрелые пыльцевые
зерна одиночные, 3-клеточные, с крахмальными зернами. У Levenhookia и
Stylidium пыльца иногда прорастает in situ.
Семяпочки многочисленные, анатропные, с одним интегументом, тенуину-
целлятные. Интегумент начинает развиваться непосредственно после
дифференциации археспориальной клетки. На стадии зрелого зародышевого мешка
он 4—6-слойныё, формирует длинное и узкое микропиле. Внутренний
эпидермис интегумента дифференцируется в хорошо выраженный интегументальный
тапетум с радиально удлиненными клетками, плотной цитоплазмой и крупным
ядром. Интегументальный тапетум чаще окружает не весь зародышевый мешок,
а только его 2/3 со стороны халазы. Эпидермис семяпочки и клетки интегумен-
тального тапетума часто заполняются темноокрашенным содержимым.
Археспорий обычно одноклеточный, редко — 2-клеточный (Levenhookia, Stylidium).
В последнем случае могут развиваться оба мегаспороцита. Имеются данные
о формировании 2 диад и тетрад мегаспор в одной семяпочке (Subramanyam,
1951, 1970). Археспориальная клетка преобразуется в мегаспороцит. Тетрада
мегаспор линейная, редко — Т-образная; иногда стенка, сформированная после
деления микропилярной клетки диады, может быть наклонной (Forstera,
Levenhookia, Stylidium).
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. Зрелый зародышевый мешок удлиненной формы, суженный к обоим
концам. Яйцеклетка грушевидная, синергиды часто с крючковидными выростами
(S. graminifolium, S. tenellum) и с длинными базальными концами, проникаю-
308
Stylidiaceae
1—9, 11, 12, 15, 16, 19, 20, 22—38 — Stylidium graminifolium, 10, 13, 17, 18, 21 — Forntura
tenella, 14 — Stylidium tenellum.
1—3 — фрагменты развития пыльника; 4 — часть стенки зрелого пыльника; 5 — II долошн)
мейоза в микроспороците; 6—9 — стадии развития пыльцевого зерна; 10—15 — могмошцю-
генез; 16 — тетрада мегаспор и диада в одной семяпочке; 17—20 — развитие зародшпопош
мешка; 21, 22 — зрелые зародышевые мешки; 23 — двойное оплодотворошю;
Stylidiaceae (продолжение)
24—27 — отдельные стадии развития эндосперма и дифференциация микропилярного и ха-
пазапьного гаусториев; 28 — микропилярный и 29 — халазальный эндоспермальные
гаустории; 30—38 — отдельные стадии развития зародыша. (1—9, 11,12, 15, 16, 19, 20, 22—38 —
по Subramanyam, 1951; 10, 13, 17, 18, 21 — по W. Philipson, M. Philipson, 1973; 14
по Subramanyam, 1950).
щими в микропиле. У Stylidium adnatum синергиды достигают почти центра
зародышевого мешка (Rosen, 1935). У Forstera tenella и Levenhookia dubia в них
отмечается нитчатый аппарат. После оплодотворения синергиды начинают
дегенерировать. Полярные ядра сливаются перед оплодотворением. Ядро
центральной клетки крупное, располагается в центре зародышевого мешка вблизи
яйцевого аппарата или в нижней его трети (S. adnatum). В цитоплазме
центральной клетки у Stylidium содержится крахмал. Антиподы представлены 3
одноядерными клетками. Время существования их вариабельно: дегенерируют
до оплодотворения (F. tenella) или сохраняются на разных этапах развития
эндосперма (S. adnatum, S. caespitosum, S. graminifolium, S. tenellum).
Установлены порогамия и двойное оплодотворение. Пыльцевая трубка
у S. graminifolium входит в зародышевый мешок между стенкой интегумента
и одной из синергид или между синергидами. Сингамия и тройное слияние
осуществляются синхронно (Subramanyam, 1970).
Эндосперм целлюлярный. Имеются данные (Burns, 1908) о наличии нуклеар-
ного эндосперма у Stylidium squamellosum. Розен (Rosen, 1935), анализируя
310
рисунки Бэнса и сопоставляя их с соответствующими стадиями развития апдо-
сперма у исследованного им вида S. adnatum, указывает на полное сходотпо
в расположении эндоспермальных ядер. Он полагает, что отсутствие
перегородок у S. squamellosum. является артефактом, и выражает сомнение по поводу
нуклеарного эндосперма у данного вида. Вероятно, этот вопрос нуждается
в переисследовании. Первичное ядро эндосперма делится значительно раныгто
зиготы. Первое деление — поперечное, следующее — в микропилярной и хала-
зальной клетках — продольное. Каждая из возникших таким образом 4 клеток
делится поперечной перегородкой, что приводит к образованию 8-клеточного
4-ярусного эндосцерма. Последующие деления 2 средних ярусов формируют
собственно эндоспермальную ткань; 2 клетки верхнего и нижнего яруса дальше
не делятся и дифференцируются соответственно в микропилярный и
халазальный эндоспермальные гаустории. Оба гаустория до конца остаются 2-клеточ-
ными. Каждая гаусториальная клетка одноядерная, развивает неправильные
лопасти, которые внедряются в интегументальную ткань. Обычно
микропилярный гаусторий крупнее и физиологически более активен, чем халазальный.
У S. graminifolium отмечается высокая активность обоих терминальных
гаусториев (Subramanyam, 1951). В зрелом семени сохраняется обильный эндосперм.
Эмбриогенез соответствует Solanad-типу. Первое деление зиготы поперечное.
Терминальная и базальная клетки также делятся поперечными перегородками,
образуя 4-клеточный линейный проэмбрио. Формируется длинный одноядерный
суспензор. Зрелый зародыш маленький, прямой, его величина не превышает
1/i линейной длины семени.
Исследованные виды. Forstera tenella, Levenhookia dubia,
Stylidium adnatum, S. caespitosum, S. graminifolium, S. lineare, S. squamellosum,
S, -зпеПит.
Литература. Burns, 1900; Dahlgren, 1920; Schnarf, 1931; Rosen, 1935,
1949; Johansen, 1950; Subramanyam, 1950a, 1950b, 1951a, 1951d, 1953b, 1970;
Crete, 1951; Hutchinson, 1959; Engler, 1964; Davis, 1966; Тахтаджян, 1966;
Philipson W., Philipson M., 1973; Corner, 1976; Поддубная-Арнольди, 1982.
Семейство DONATIACEAE
Пыльники 4-гнездные. Развитие пыльника и пыльцевого зерна не
исследовано.
Семяпочки в завязи многочисленные, анатропные, с одним интегументом,
тенуинуцеллятные. Интегумент в начале своего развития 2-слойный, ко времени
созревания зародышевого мешка — многослойный. Наружный эпидермис
интегумента заполнен темноокрашенным веществом, за исключением небольшой
группы клеток в районе микропиле. Клетки внутреннего эпидермиса
интегумента радиально удлиняются и формируют хорошо выраженный интегумен-
тальный тапетум, который окружает около 2/з зародышевого мешка с халазаль-
ного конца. Формируется узкое длинное микропиле. У Donatia novae-zelandiae
отмечена гипостаза. В субэпидермисе нуцеллуса дифференцируется одна,
редко — 2 археспориальные клетки. Наблюдались семяпочки с 2 мегаспороци-
тами на стадии мейоза. Археспориальная клетка становится непосредственно
мегаспороцитом. Париетальные клетки отсутствуют. В результате мейоза
образуется линейная тетрада мегаспор, при этом стенка, формирующаяся после
деления микропилярной клетки диады, может быть наклонной.
Развитие зародышевого мешка не описано, но оно очень сходно с таковым
у Forstera (сем. Stylidiaceae) (Philipson, Philipson, 1973), т. е., очевидно,
осуществляется по Polygonum-типу. Зрелый зародышевый мешок у D. novae-
zelandiae веретеновидной формы. Яйцевой аппарат состоит из 2 синергид с
удлиненными концами и яйцеклетки, которая значительно глубже вдается u iiupo-
дышевый мешок, чем синергиды. Ядро центральной клетки, возникшее и ри-
зультате слияния 2 полярных ядер, располагается вблизи яйцеклетки п цоптро
расширенной части зародышевого мешка. Антиподы представлены 3 клоткпми.
ЛИ
6
Donatiaceae
1—8 ■— Donatio, novae-zelandiae.
1 — поперечный срез пыльника (схема); 2 — семяпочка с археспориапьной клеткой- 3 —
первое меиотическое деление в мегаспороците; 4 - нуцеллус с 2 мегаспороцитами,
вступающими в меиоз; 5 —семяпочка со зрелым зародышевым мешком; 6 — ранняя стадия развития
семени с 2 эндоспермальными гаусториями и проэмбрио; 7 — более поздняя стадия развития
семени с зародышем, окруженным обильным эндоспермом; 8 — проэмбрио (1 — по Carolin
1960, фрагмент; 2—8 — по W. Philipson. M. Philipson, 1973).
В зрелом зародышевом мешке наблюдаются крахмальные зерна,
сосредоточенные главным образом вокруг центрального ядра.
Эндоспермогенез не описан, но есть сведения, что развитие эндосперма и
микропилярного и халазального гаусториев очень сходно с Forstera (Philipson,
Philipson, 1973). Каждая гаусториальная клетка развивает неправильные
лопасти. Микропилярный гаусторий больше халазального и активно вторгается
между интегументальными клетками по обе стороны микропиле. В зрелом
семени сохраняется обильный эндосперм.
Последовательные стадии эмбриогенеза не исследованы. Отмечено, что форма
проэмбрио овальная. Ко времени первого вертикального деления
терминальной клетки, проэмбрио состоит из ряда клеток дисковидной формы (ширина
значительно больше высоты). На этой стадии зародыш располагается близко
к микропиле. Последующее удлинение суспензорных клеток ведет к тому, что
он глубоко опускается в эндосперм. Зрелый зародыш занимает сравнительно
небольшую часть семени.
Исследованный вид. Donatio, novae-zelandiae.
Литература. Mildbraed, 1908; Carolin, I960; Тахтаджян 1966-
Philipson W., Philipson M., 1973. ' '
312
Семейство GOODENIACEAE
Пыльники 4-гнездные. Стенка гнезда пыльника развивается по
центробежному типу и состоит из эпидермиса, эндотеция, одного (Dampiera stricta, Scaevola
lobelia) или 2 (Scaevola frutescens) средних слоев и секреторного тапетума.
Последний вначале одноядерный, в процессе развития становится многоядерным;
в дальнейшем в клетках тапетума наблюдается слияние ядер с образованием
одного полиплоидного ядра. Средние слои эфемерны; у S. frutescens они
дегенерируют на стадии микроспороцитов, находящихся в профазе (Vijayaraghavan,
Malik, 1972). В эндотеции развиваются фиброзные утолщения. У S. frutescens
они наблюдаются и в некоторых примыкающих к гнезду клетках связника.
В эндотеции у этого вида отмечается содержание кристаллообразных
идиобластов (Vijayaraghavan, Malik, 1972). В клетках эндотеция и средних слоев
присутствуют кристаллы оксалата кальция. Стенка зрелого пыльника представлена
эпидермисом и фиброзным эндотецием. Образование микроспор симультанное.
Тетрады микроспор тетраэдральные или изобилатеральные. Зрелые пыльцевые
зерна одиночные, 2-клеточные. У Leschenaultia они остаются в тетрадах, при этом
характерно ромбоидальное расположение пыльцевых зерен (Rosen, 1946;
Martin, Peacock, 1959; Knox, Friederich, 1974).
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная.
Интегумент у S. frutescens начинает развиваться вскоре после
дифференциации археспория. На стадии тетрад мегаспор интегумент состоит из 13—15 слоев
клеток, многие из которых содержат кристаллы оксалата кальция. Ко времени
созревания зародышевого мешка он достигает 18—20 слоев (Vijayaraghavan,
Malik, 1972). Внутренний эпидермис интегумента дифференцируется в хорошо
выраженный интегументальный тапетум, окружающий часто не весь
зародышевый мешок, а только центральную его часть. У S. frutescens на 2- или 4-ядерной
стадии зародышевого мешка формируется гипостаза. Археспорий обычно
одноклеточный, у Leschenaultia biloba — многоклеточный (Rosen, 1946). В последнем
случае все археспориальные клетки или только некоторые из них могут
формировать тетрады мегаспор. Археспориальная клетка преобразуется в мега-
спороцит. В результате мейоза образуется линейная тетрада мегаспор.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. Зрелый зародышевый мешок удлиненной формы. Яйцевой аппарат состоит
из 3 клеток (яйцеклетки и 2 удлиненных синергид). Полярные ядра сливаются
перед оплодотворением. 3 одноядерные антиподальные клетки обычно эфемерны.
Однако у D. stricta (Brough, 1927) и D. lavandulacea (Rosen, 1946) они
сохраняются после оплодотворения довольно долго. Отмечаются порогамия и двойное
оплодотворение.
Эндосперм целлюлярный. У D. stricta отмечался нуклеарный тип эндосперма
(Biough, 1927). Однако Розен (Rosen, 1946), который, анализируя рисунки
Брауха, исследовал ряд других видов Dampiera, подвергает его выводы
сомнению. Очевидно, сообщение о нуклеарном эндосперме у D. stricta нуждается
в подтверждении. Первичное ядро эндосперма делится с образованием
поперечной перегородки. У большинства исследованных видов последующими
поперечными делениями формируется линейный ряд не менее чем из 4 клеток (у Scaevola
procera до 9 клеток) перед появлением продольных стенок. У Velleya paradoxa
лервое деление в клетке эндосперма поперечное, а дочерние клетки делятся
продольно (Rosen, 1946). Зрелые семена обычно с обильным эндоспермом,
содержащим липиды, редко — без эндосперма (Brunonia).
Эмбриогенез соответствует Solanad-типу. Между оплодотворением и
делением зиготы проходит значительное время, в течение которого зигота
удлиняется. У S. frutescens ее деление осуществляется на 12-клеточной стадии
эндосперма (Vijayaraghavan, Malik, 1972). Первое деление зиготы поперечное. Оно
приводит к образованию маленькой апикальной клетки са и более крупной би-
зальной сб. Производные базальной клетки формируют многоклеточный подио-
сок. У Brunonia деление зиготы происходит раньше, чем первое деление и ипдо-
сперме (Rosen, 1946). Тип эмбриогенеза не установлен. Характерной
особенностью этого рода является формирование крупного многоядерного (до 8 идор)
суспензорного гаустория. Зрелый зародыш прямой, дифференцирошшпый
:ца
1-—26 —• Scaevola frutescens.
1 — поперечный срез пыльника (схема); 2—5 — отдельные стадии развития пыльника; 6 —
фрагмент стенки пыльника с эпидермисом и фиброзным эндотецием; 7, 8 — стадии мейоза
в микроспороцитах; 9 — тетраэдральная тетрада микроспор; 10,11 — стадии развития
пыльцевого зерна; 12 — продольный срез семяпочки с археспориальной клеткой; 13 — нуцеплус
с мегаспороцитом; 14 — линейная тетрада мегаспор; 15 — 2-ядерный зародышевый мешок;
16 — 4-ядерный зародышевый мешок; 17 — зрелый зародышевый мешок; 18 — зародышевый
мешок после оплодотворения; 19 — 2-клеточный эндосперм; 20 — многоклеточный
эндосперм:
*
23
Ooodeniaceae (продолжение)
21^-25 — отдельные стадии эмбриогенеза; 26 — эндосперм на стадии 2-семядольного
зародыша. (1—26 — по Vijayaraghavan, Malik, 1972).
на 2 семядоли и корень, обычно занимает от 1/i до 3/4 линейной длины семени
или все семя (Brunonia).
Исследованные виды.' Brunonia australis, Dampiera lanceolata,
D. lavandulacea, D. stricta, Goodenia cycloptera, G. geniculata, G. ovata, Leschenaul-
tia biloba, L. floribunda, L. formosa, L. linarioides, Scaevola attenuata, S.
frutescens, S. koenigii, S. lobelia, S. microcarpa, [S. procera, Selliera radicans, Velleya
paradoxa.
Литература. Fritzsche, 1837; Billings, 1901; Haviland, 1914; Brough,
1927; Schnarf, 1931; Rosen, 1937, 1946; Kausik, 1939b; Johansen, 1950;
Hutchinson, 1959; Martin, Peacock, 1959; Engler, 1964; Garolin, 1966; Davis, 1966; Tax-
таджян, 1966; Vijayaraghavan, Malik, 1972; Knox, Friederich, 1974; Corner,
1976; Поддубная-Арнольди, 1982.
Порядок 70. CALYCERALES
Семейство GALYGERAGEAE
II i.iji ышк 4-гнездный. Развитие стенки пыльника и микроспорогенез не
описан ы. У Acicarpha tribuloides тапетум секреторный. Стенка зрелого пыльника^
состоит из фиброзного эндотеция и остатков разрушенных клеток эпидермиса.
Зрелое пыльцевое зерно 2-клеточное; деление генеративной клетки происходит
в пыльцевой трубке.
Семяпочка анатропная, висячая, на довольно длинном фуникулусе, с одним
интегументом, тенуинуцеллятная. Микропиле узкое и длинное, прямое.
Внутренний эпидермис интегумента дифференцируется в интегументальный
тапетум, который после разрушения нуцеллуса примыкает к зародышевому мешку.
Разветвленный проводящий пучок из фуникулуса заходит в халазу.
Археспорий одноклеточный, без отделения париетальной клетки преобразуется в мега-
спороцит — крупную клетку с большим ядром. В результате мейоза образуется
диада, а затем — линейная тетрада мегаспор, халазальная из которых
становится материнской клеткой зародышевого мешка, а остальные постепенно
дегенерируют.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Основной рост его идет во время дифференциации элементов. Зрелый
зародышевый мешок овальный, с зауженными концами. Яйцеклетка крупная,
грушевидная, синергиды удлиненные, с вытянутыми концами. 3 клетки антипод
расположены в халазальном конце, подобно яйцевому аппарату, но значительно'
меньших размеров, начинают дегенерировать еще до оплодотворения.
Полярные ядра сливаются до оплодотворения, и центральное ядро зародышевого мешка
находится в тяжах густой цитоплазмы под яйцевым аппаратом.
Оплодотворение порогамное, двойное. Пыльцевая трубка проникает в зародышевый мешок,
разрушая одну из синергид. Остатки ее и второй синергиды, которая
разрушается несколько позже, наблюдаются и на ранних стадиях развития эндосперма.
Эндосперм целлюлярный. Первые деления его проходят с заложением
поперечных перегородок. В зрелом семени эндосперм сохраняется, окружая
зародыш.
Эмбриогенез изучен недостаточно. Первое деление зиготы поперечное,
клетки са и сЪ также делятся поперечно, образуется линейная тетрада
нитевидного проэмбрио. Зрелый зародыш прямой, дифференцированный, с массивным
гипокотилем и небольшими семядолями.
Исследованные виды. Acicarpha tribuloides, Calycera crenata
(фрагментарно).
Литература. Warming, 1913; Dahlgren, 1915, 1923; Juel, 1915; Dollr
1927.
Calyceraceae
1—13 — Acicarpha tribuloides.
1 — зрелое 2-клеточное пыльцевое зерно; 2 — пыльцевая трубка; 3 — семяпочка; 4—6 —
мегаопорогенез- 7, 8 — 8-ядерный и зрелый зародышевые мешки; 9—11 — развитие :>д|Д<>-
сперма; 12 — 4-клеточный проэмбрио, окруженный эндоспермом; 13 — зрелый ящшдыШ
в семени. (1—13 — по Dahlgren, 1915).
Порядок 72. ASTERALES
Семейство ASTERAGEAE
Нылыгак у большинства родов 4-гнездный; у некоторых видов встречается
2-Г1ю:щ1шй (Calotis hispidula, С. squamigera, Blumea membranacea, Cotula).
Стенка гнезда пыльника развивается центробежно и состоит из эпидермиса,
оидотеция, среднего слоя и тапетума. Средний слой эфемерный. В эндотеции
развиваются фиброзные утолщения. У Launaea pinnatifida и Emilia sonchifolia
фиброзных утолщений нет. У всех видов в начале развития пыльника тапетум
имеет клеточное строение. После стадии тетрад происходит частичное
растворение оболочек тапетальных клеток и протопласты проникают в полость гнезда
пыльника между пыльцевыми зернами, при этом, как правило, они не сливаются.
На клеточной стадии развития клетки тапетума сначала одноядерные, затем
в них проходят деления без закладки клеточных перегородок с образованием
в одной клетке от 4—8 (Rudbeckia, Echinacea, Helianthus) до 16 ядер (Taraxacum).
Во время делений происходят слияния ядер и часто образуются
реституционные полиплоидные ядра; тогда одно очень крупное ядро располагается в
каждой клетке (Taraxacum, Rudbeckia, Dissotis). Таким образом, тапетум у
большинства видов клеточный, многоядерный, в постмейотический период
реорганизуется в амебоидный, а у Arctotideae—Gudelinae (Ahlstrand, 1979), Heliantheae,
Vernonieae и Eupatorieae — в ложный периплазмодий. Секреторный тапетум
установлен у Ainsliaea aptera (Kapil, Sethi, 1962), Platycarpha carlinoides
(Ahlstrandi, 1979), Chrysothamnus (Snow, 1945; Anderson, 1970), Vernonia cinerea,
V. cinerascens (Tiagi, Taimni, 1963), Sonchus oleraceus, S. asper (Walter, Ruta,
1971), Hypochaeris radicata, Joungia japonica (Kaul, 1972, 1973). Однако эти
данные ставятся под сомнение (Pullaiach, Swarajya Lakshmi, 1984). В зрелом
пыльнике тапетум не сохраняется. У Helianthus annuus отмечена экстратапетальная
«порополлениновая мембрана. Ультраструктура этой мембраны показана
как в норме, так и с 'таметоцидной (индуцированной гиббереллином)
стерильностью (Орел, Вишнякова, Константинова, 1984). Стенка гнезда зрелого
пыльника состоит из эпидермиса, клетки которого сильно вытянуты в длину, и
■фиброзного эндотеция. Археспорий однорядный или многорядный. Микроспо-
роциты располагаются как в один ряд (Blumea malabarica), так и в несколько
рядов (Zaggera pterodontha, Anaphalis busua, H. annuus). Мейоз проходит
правильно, без нарушений. У Н. annuus исследованы археспориальные клетки,
микроспороциты, микроспоры, пыльцевые зерна и тапетум на
ультраструктурном уровне в норме и у линии с ЦМС (Симоненко, 1977, 1978, 1982, 1986).
Некоторые ультраструктурные признаки дифференциации микроспороцитов
в мейотической профазе (Dickinson, 1981) показаны у рода Cosmos. Образование
•тетрад микроспор происходит по симультанному типу. Тетрады микроспор
тетраэдральные, изобилатеральные, крестообразные. Зрелые пыльцевые зерна
одиночные, . 3-клеточные, обычно с очень длинными спермиями. Спермин бедно-
ллазменные (Поддубная-Арнольди, 1982). У Wedelia спермин диморфные, у Ро-
lymnia laevigata описаны даже 4 их типа (Davis, 1966). У апомиктичных видов
(Crepis, Taraxacum, некоторые Rudbeckia, Arnica, Hieracium и др.) часто
наблюдаются нарушения во время мейоза, в результате чего вместо тетрад возникают
диады (обычно диплоидные), полиады, монады и формируется неоднородная
пыльца с большим процентом стерильных пыльцевых зерен (Afcelius, 1936;
Gustafsson, 1937; Babckok, Stebbins, 1938; Fagerlind, 1939; Battaglia,. 1947,
и др.).
Семяпочка анатропная, с одним интегументом, тенуинуцеллятная.
Сосудистый пучок семяпочки обычно один (только у L. pinnatifida имеются 4
проводящих пучка). Он проходит через халазу и проникает в интегумент, почти
достигая микропиле у Tridax procumbens, Tagetes patula, Zinnia elegans, до х/2 длины
интегумента у Е. (=Senecio) sonchifolia и лишь до 1/3 длины у Cosmos bipinnatus
и Eupatorium cannabium (Venkateswarlu, 1941). В семяпочке иногда
формируется обтуратор. Микропиле у многих видов короткое, но у Echinops — очень
•318
\
cum officinale.
Ц~3 — развитие стенки гнезда пыльника и спорогенной ткани; 4, 5 — мейоз I и мейоз II
в пыльнике; 6 — момент распада тетрад микроспор и начало реорганизации тапетума;
длинное. У видов групп Cynareae, Carduinae, Centaurinae, Carlinae, Cichorieae
(Calendula, Rudbeckia, Taraxacum, Echinacea, Carduus, Jurinea, Arctium,
Helianthus и др.) внутренний эпидермис интегумента дифференцируется в интегу-
ментальный тапетум. Он бывает однорядным и многорядным, его клетки
одноядерные или многоядерные. У Echinopsidinea интегументального тапетума нет.
На начальных этапах развития зародышевого мешка Calendula officinalis и
Я. annuus клетки интегументального тапетума обладают ультраструктурными
признаками меристематических клеток (Плиско, 1971; Newcomb, 1973a). В
процессе развития клетки интегументального тапетума делятся; стенки со сторон \Л
нуцеллуса сильно утолщаются и покрываются кутикулой, к 4-ядерной стадии
' развития зародышевого мешка толщина ее увеличивается в 3 раза, что обоопо-
чивает выполнение этими клетками барьерной функции. Позднее кутикул»
становится прерывистой и к началу эмбриогенеза исчезает полностью (Басилi.oji,
Плиско, 1971; Плиско, 1974). Однорядный нуцеллус, окружающий аародыню-
811>
Asteraceae (продолжение)
7 — одноядерные пыльцевые зерна и ложный периплазмодий; 8,9 — формирование 2- и
■3-клеточных пыльцевых зерен; 10 — стенка зрелого пыльника с пыльцевым зерном; 11—
14 — мегаспорогенез в нуцеллусе семяпочки; 15 — разрастание одной из клеток тетрады;
вый мешок, быстро разрушается и к моменту созревания зародышевого мешка
исчезает. Париетальные клетки не формируются, и археспориальная клетка
преобразуется в мегаспороцит. Только у Ambrosia maritima отделяется несколько
париетальных клеток (Langlet, 1925). Археспорий обычно одноклеточный,
реже — 2-клеточный, а иногда многоклеточный. В роде Chrysanthemum у одних
видов — Ch. decaisneanuni, Ch. nipponicum (Tahara, 1915), Ch. boreale (Ерван-
дян, 1975) — дифференцируется одноклеточный археспорий, у других —
многоклеточный: у Ch. roseum — 5—10 клеток, у Ch. marschallii — 7—10, у Ch. co-
ronarium — 4—6, у Ch. arinatum — 7—3, у Ch. leucantemum и Ch. frutescens —
2—4 (Tahara, 1915, 1921). Многоклеточный археспорий обнаружен также
у Achillea, Anthemis, Erigeron, Aster, Pyrethrum. Мегаспороциты в период
пролазы мейоза исследованы на ультраструктурном уровне у Crepis tectorum (Go-
320
Celastraceae
1—6 — Euonymus macroptera.
1 — инициальные клетки и развивающиеся зародыши в ткани внутреннего ннтегумента,
эндосперм многоядерный; 2 — фрагмент семяпочки с 2 интегументальными зародышами,
эндоспермом и остатками пыльцевой трубки; 31— 2 разновозрастных интегументальпых
зародыша; 4 — интегументальные зародыши на более поздних стадиях развития;
i/4 I Зак. 1642
Celastraceae (продолжение)
5,6 — фрагменты инициальной клетки интегументального зародыша (5) я клетки
внутреннего интегумента, несколько удаленной от зародышевого мешка и не ставшей инициальной (б).
(1—6 — ориг.).
Loranthaceae (1, 2), Conrolrulaccac (3, 4)
1,2 — Loranthus eitropaeus.
1 — зародышевые мешки (з. .и) в завязи над гипостазои (_■); 2 — зародыш (з) с гупнчморим
в окружении эгщосперма (зн), видна гшшстаза (г) и ткапп завязи (ориг.).
3,4 — Convolvulus scammonii.
3,4 — разные фазы развития зародыша (ориг.).
I Зап. 1G42
Vitaceae
1—5 — Vitis vinifera.
1 — 2 гнезда пыльника, формирование стенки пылышка, ,спорогенная ткань, клетки
связника; 2 — спермин в пыльцевой трубке; 3 — семяпочка на стадии одноядерного
зародышевого мешка; 4 — зпгота; 5 — 2-клеточный проэмбрио. (1—5 — по Якимову, Литваку,
Балан, Малтабар, 1977).
1—4
Elaeagnaceae
1' 5—? — Elaeagnus multiflora, 2—4 —Е. umbellata, 8, 9 — Е. argentea.
пыльники на стадиях: 1 — микроспороцнтов, 2 — микроспор, 3 — 2-клоточмоИ
пыльцы, 4 — тека зрелого пыльника с разрушенной перегородкой между гнездами;
5 — i — мегаспороцпты;
Elaeagnaccae (продолжение)
семяпочка со зрелым зародышевым мешком п его микропиляр-
ная часть (9). (1—9 — орпг.)-
Asclepiadcccac
1—4 — Vincetoxicum o[]ir.inalr-.
1—3 — последовательные этапы развития пнтегумектальиых зародышей: 2 — многичислоп-
ные пнтегуыентальыие зародыши, располсженпые над нуклеарным эндоспермом; 4 - фриг-
мент пптогумента с пипцпальпыми клетками нитегументальиых заредытпеп. (1—4 — орпг.).
Caprifoliacene
1—10 — Lonicera turczaninowii, 11 — L. edulis.
1—11 — фрагменты пыльников на разных стадиях развития: 1 — стадия микроспороцитов,
2 — стадия тетрад микроспор, 3 — стадия одноядерных микроспор, 4 — вакуолизированные
микроспоры, 5 — 2-клеточпые пыльцевые зерна, 6 — гнездо пыльника перед вскрыванием,
Caprifoliaceae (продолжение)
7 — микроспороциты перед вступлением в мейоз; тапетальная клетка окружена нерпичий»
оболочкой, видно большое количество лейкопластов, Х8100, 8 — периплазмодии им стадии
микроспор (видно большое количество каротиноидных глобул), Х1700, 9 — лизис. iic|>iiiijiuii«
модия на стадии 2-клеточных пыльцевых зерен, Х3900, 10, 11 — участок экстрата riuihiHift
спорополлениновой мембраны, (г. к — генеративная клетка, к — каллоза, к. .■ карп'М-
ноидная глобула, к. т — клетка тапетума, л. к — липидная капля, лп — лейкопласт, ,« -->
микроспороцпт, п — периплазмодий, э — экзина, я — ядро). (1—11 — рис. JV1. Л. Пишнино-
вой).
Valerianaceae
1—6 — Valeriana phu, 7,8 — Patrinia intermedia, 9 — Centranthus ruler, 10 — Valeria-
nella sp., 11, 12 - С ealcitrapa, 13-27 — Valeriana officinalis.
Г отдельные стадии развития пыльника: 1,2 - мпкроспороциты, 3 - тетрады
микроспор, 4 7,8 — одноклеточная и 5, 9 — 2-клоточная пыльца, 6, 10 — гнезда зрелого
пыльника, 7 - начало реорганизации тапетума, 4, 5,8,9 - ложный периплазмодий в пыльниках-,
11 — стеолевей п 12 — корневой апексы зародыша;
гд
Vftlerianaeeac (продолжатс)
Valerianaeaae (продолжение)
13, 14 — фрагменты халазальной (13) и микропилярной (14) частей 2-ядерного зародышевого
мешка (см. схему 15) и интегументального тапетума (несколько клеток халазальной части
интегументального тапетума свободны ст кутикулы);
Yalerianaceae (продолжение)
16, 18 — фрагменты клеток интегументального тапетума на стадии 4-ядерного зародышевого
мешка (16, см. схему 17) и на торпедовидной фазе эмбриогенеза (18) (см. схему 19); крахмал
в интегументальном тапетуме не аккумулируется в отличие от пнтегументальной паренхимы
(16); на оболочках клеток интегументального тапетума, обращенных к зародышевому мошку,
кутикула (стрелка) еще наблюдается (18);
Valerianaceae (продолжение)
20, 21 — фрагменты сохраняющейся синоргпды. {20) и антипод (21, см. схему 22) в период
зпготогепеза (эндосперм 2-клеточный); в спнергпде — запасной крахмал; цитоплазма
антипод насыщена рибосомами;
Valerianaceae (продолжение)
23 24 — пластиды: пнтегу.мептальнои паренхимы на стадии зрелого зародышевого мсшк»
в латеральной части семяпочки (23) п в наружных слоях микропилярной части интегумснти;
25, 26 — пластида эндосперма па 2-клеточной стадии развития (25) и на торпедовпдиой финн
эмбриогенеза (2в); показано полное исчезновение крахмала, образованпе у пластид глубоких
инвагинаций (двойная стрелка); 27 — фрагмент эндосперма в период формирования ]) лом
2 клеток; вакуоли окружены тяжами гранулярного ЭР; типичная клеточная оболочка на
границе с сохраняющейся синергидой отсутствует, (ан — антипода, an — амилопласт, и --
вакуоль, г. э. р — гранулярный ЭР, д — диктиосома, з. м — зародышевый мешок, и., и ■ -
интегументальная паренхима, и. т — пнтегументальный тапетум, к — кутикула, к, и ■ ■
крахмальное зерно, к. о — клеточная оболочка, л. к — липидная капля, лп — лейкопласт,
ж __ ломасома, м — митохондрия, н — нуцеллус, п. а — нитчатый аппарат, п.: ■ • млаети-
глобула, пд — плазмодесма, п. к. о — протуберанец клеточной оболочки, с. с - ■ сохршшш-
тцаяся синергида, пл — плазмалемма, тп — тонопласт, э» — эндосперм, о. /> иидоилши
матический ретикулум, я — ядро, яд — ядрышко). (1, 3—5, 11, 12 — продольные, 2, (I •
20 — поперечные срезы; 13—27 — масштабная линейка 1 мкм). (1—6 — по IWiMWilflloll,
Малдыбековой, 1980; 7—12 — Камелина, ориг.; 13—27 — Жукова, орнг.).
Polemoniaceae
1—3 — Polemonlum caeruleum.
Ультраструктура клеток ннтегумента в период распускания цветка: 1 — фрагменты клеток
наружной эпидермы; форма клеток неправпльная; 2,3 — фрагменты клеток паренхимы инте-
гумента; хлоропласты с длинными эвагинациями перистромия (3 — один из снимков серии
срезов хлоропласта), (в — вакуоль, к — кутикула, к. о — клеточная оболочка, м —
митохондрия, хл — хлоропласт, я — ядро, яд —ядрышко). (Масштабная линейка — 1 мкм).
(1—3 — ориг.).
Solanaceae
1,2 — Lycopersicon esculentum, 3,4 — Solarium tuberosum.
Фрагменты спорополленпновой оболочки клеток тапетума после обработки зрелого
пыльника концентрированной серной кислотой: 1,3 — сетчатое переплетение тяжей и орбикулы;
в промежутках между тяжами видны участки экстратапетальной мембраны (вид с ноисрх-
ности); 2,4 — клетка тапетума окружена сетчатым переплетением, на котором со сто роим
гнезда пыльника-располагаются орбикулы, а со стороны среднего слоя — экстритаие'1'iuiii'
ная мембрана (поперечный срез пыльника); на 2, 4 виден участок экзины пыльцоного :ii'|inn,
(1 — Х16000, 2 — хИООО, 3 — Х15000, 4 — Х2700). (о — орбикула, с. ел — сетчмты»
слой, э — экзпна, э. м — экстратапетальная мембрана). (1, 2 — по Москалевой, Огородим ■
ковой, 1977; 3, 4 — по Огородниковой, 1976).
5 JbJ&k
Bignoniaceae
1 — Campsis rvdicans, 2 — Paulownia tomentosa, 3 — P. fortunea.
1 — гнездо пыльника с выростом связника (плацентопдом) на стадии микроспороцитов;
2 — фрагмент гнезда пыльника в районе плацентоида (стадия одноклеточных микроспор);
3 — незрелое семя с глобулярным зародышем на нитевидном подвеске и мнкрошшярным
эндоспермальным гаусторием. (1—3 — ориг.).
Gesneriaceae
1—5 — Streptocarpus rexii.
1 — микропилярная часть зародышевого мешка на стадии зиготы; 2 — шаровидный
зародыш, окруженный клеточным эндоспермом; 3,4 — шаровидный зародыш, деление гипофи-
зарной клетки; 5 — 2-семядольный зародыш, разрушение клеток эндосперма. (1—5 —
по Алимовой, Яковлеву, 1982).
Asteraceae
1—4 — Rudbeckia laciniata, 5,6 — Echineacea purpurea.
1—2 — гемигамия, автономные деления ядер спермия и яйцеклетки; 3 — яйцеклеточный
я антиподный (маленький) зародыши; 4 — яйцеклеточный и синергидный (маленький)
зародыши; 5 — 2 клетки ^антипод, верхняя с полиплоидным ядром; 6 — зародыш на
шаровидной стадии с длинным подвеском. (1—6 — ориг.).
16—18 — развитие зародышевого мешка; 19 — зрелый зародышевый мешок с 5 антиподами;
20, 21 — 6- и 7-клеточньгё антиподы, чаще всего 2-ядерные, реже — с реституционными
ядрами; 22 — двойное оплодотворение; 23—26 — объединение ядра спермия с ядром
яйцеклетки; премитотический тип оплодотворения;
dineau, 1968). В результате мейоза образуется тетрада мегаспор. Тетрады
обычно линейные (Antennaria plantaginifolia, Galinsoga ciliaris, Onopordon acan-
thium и др.), реже — Т-образные. Далее развивается чаще халазальная
мегаспора, у некоторых видов — микропилярная: Tussilago farfara, Solidago se-
rotina, Bellis perennis, Calendula, Anthemis, Chrysnthemum, Tanacetum и др.
У ряда видов деление мейоза II не сопровождается цитокинезом, и тогда
образуется диада 2-ядерных клеток, после чего начинается развитие биспорического
зародышевого мешка. У некоторых видов клеточные перегородки не образуются
при обоих делениях мейоза, и тогда возникает 4-ядерный ценоцит, дающий па-
21 Сравнительная эмбриология 321
Asteraceae (продолжение)
27 — зародышевый мешок в момент завершения деления первичного ядра эндосперма-
в ядре зиготы заканчивается растворение ядра спермия; 2 клетки антипод остаются
жизнеспособными; 28 — то же с развивающимся проэмбрио, многоклеточным эндоспермом и
3 антиподами; 29 — микропилярная часть зародышевого мешка; в результате нарушения,
деления ядра зиготы сформировалось реституционное ядро;
чало развитию тетраспорического зародышевого мешка. Мегаспоры С.
officinalis имеют неравномерно утолщенную оболочку, лишенную плазмодесм.
В микрогшлярной части клетки располагаются митохондрии (число их
небольшое), а пластиды концентрируются вокруг ядра (Плиско, 1971).
Зародышевый мешок чаще всего развивается по Polygonum-типу, но
встречаются и другие типы его развития. Allium-тип, биспорический, известен
у Chrysanthemum, Erigeron, Tridax trilobata и др. Особый тип биспорического-
зародышевого мешка обнаружен у АттоЫит alatum (Davis, 1962). Тетраспори-
ческие зародышевые мешки развиваются по типам: Adoxa, Fritillaria, Drusa,.
Peperomia. Adoxa-тип известен у Leontodon и Hispidus. У Rudbeckia hirta (Palm,.
1934) и R. laciniata (Rosen, 1944) также был определен Adoxa-тип развития
зародышевого мешка, но переисследование установило ошибочность этого
определения (Battaglia, 1945a, 1946). Drusa-тип с различными вариациями
установлен у Tanacetum vulgare, Pyrethrum parthenifolium (=Chrysanthemum parthe-
nium), Erigeron aurantiacum, Helichrysum bracteatum, Matricaria maritima, Mi-
nuria denticulata, Tripleurospermum maritimum, Moreades, Anthemis. Peperomia-
тип наблюдается у Erigeron eriocephalus, E. politus и Pyrethrum parthenifolium
var. aureum. Fritillaria-тип обнаружен у половых видов Rudbeckia (R. amplexi-
322
Asteraceae (продолжение)
30—39 — начальные стадии развития зародыша по Oxalis-вариации Asterad-типа; 40—47 —
ранний эмбриогенез и формирование длинного подвеска;
.caulis, R. bicolor, R. fulgida, R. hirta, R. pinnata, R. missouriensis), у Gaillardia
aristata, G. pulchella, Ratibida columnifera, R. tagetes и Leptachis columnaris.
У некоторых видов отмечены 2 типа развития зародышевого мешка: Polygonum
и Adoxa (Leontodon hispidus), Drusa и Allium (Erigeron frigidus), Polygonum и
Allium (Minuria cunninghami, Sanvitalia procumbens, T. trilobata). Среди апо-
миктических растений развитие зародышевого мешка происходит по Тагаха-
«ит-(биспорический), Ixeris-, Rudbeckia-, Antennaria- (тетраспорические) и
Шегасшт-(апоспорический) типам, согласно классификации Батталья
(Battaglia, 1963). Ixeris-тип, например, характерен для Ixeria dentata, апомиктичных
видов Rudbeckia, Erigeron annuus и Е. karvinskianus. У Е. karvinskianus
встречается ряд вариаций Ixeris-типа и зародышевые мешки могут быть 18-, 16-,
12-, 10- и 8-ядерными (Battaglia, 1949). Кроме того, встречаются такие
вторичные типы развития зародышевого мешка, как Rudbeckia I, Rudbeckia II,
Rudbeckia III и др. Зрелый зародышевый мешок обычного строения. Тонкая
структура компонентов зародышевого мешка исследована у Crepis (Godinoau,
1966, 1969; Гуляев, Герасимова-Навашина, 1968; Герасимова-Навашина,
Гуляев, 1973), Picris, Cichorium, Calendula (Godineau, 1969; Васильев, Плиоко,
1971а, 19716; Плиско, 1971, 1977а, 19776) и у Helianthus (Newcomb, Stoovofl,
1971; Newcomb, 1973a, 1973b). Яйцеклетки крупные; по ультраструктурной
организации они обнаруживают полярность. ЭР и аппарат Гольджи рнпниты
слабо, но свободные рибосомы, как митохондрии и пластиды, многочиолошш.
21*
\т
Astevaceae (продолжение)
48—51 — зародышевые мешки на начальных стадиях формирования гемигамных проэмбрио;
Амилопласты локализуются вокруг ядра. У Helianthus annuus в цитоплазме-
яйцеклетки обнаружены пластиды, содержащие крахмальные зерна.
Апикальная часть яйцеклетки не имеет клеточной оболочки, а ограничена только плазма-
леммой. Синергиды имеют крючковидные выросты; у некоторых видов {Blumea
malabarica, ряда видов Ursinia) их нет. У одних видов описан нитчатый аппарат
(Helianthus), у других он отсутствует (Calendula, Cichorium, Crepis, Picris).
У Ursinia, Cotula, Calendula, Ammobium и Elephantopus scaber после
оплодотворения формируется синергидный гаусторий. Ультраструктурные особенности
синергид изучены у Helianthus annuus, С. Uctorum, С. officinalis, Picris echioides
и Cichorium intybus. Синергиды имеют полисахаридную клеточную оболочку
в микропилярной части клеток и в местах контакта друг с другом. Апикальная
часть синергид ограничена лишь плазмалеммой. Синергиды всех изученных
видов имеют полярность по распределению пластид и вакуолярной системы.
Диктиосомы и гранулярный ЭР обильны в микропилярном районе и особенно
в средней части клетки. Многочисленные митохондрии, а также пластиды
располагаются в основном в середине клетки. Встречаются и липидные капли.
В микропилярной части синергид (Calendula, Helianthus) обнаруживаются
короткие и редкие протуберанцы оболочки. Клеточная оболочка между синерги-
дами вначале имеет многочисленные плазмодесмы, затем они исчезают.
Наружные стенки синергид не имеют плазмодесм. В синергидах на первом этапе их
развития сильно развита внутриклеточная мембранная система — ЭР, диктио-
324
Asteraceae (продолжение)
сомы, митохондрии и пластиды. По мере подготовки к оплодотворению проиохо ■
дят ультраструктурные изменения в синергидах: возрастает плотность гнило ■
плазмы, нуклеоплазмы и энхилемы, в диктиосомах накапливается осмиофиль
ное вещество, а также увеличивается число свободных рибосом. В центральной
клетке обнаружен гладкий ЭР, активные диктиосомы, митохондрии,^пластиды,
а также запасные липиды. На границе с яйцеклеткой полисахаридной оболочки
нет и клетка ограничена только плазмалеммой. Антиподы варьируют но числу
Asteraceae (продолжение)
52—54 — формирование диплоидного гаметофита в результате образования
реституционного ядра в меиозе I; 55 — тетрада мегаспор и апоспорический зародышевый мешок- 56 57 —
исчезновение клеточных стенок между мегаспорами и формирование 4-ядерного
зародышевого мешка; 58 — яйцеклеточный и синергидный зародыши. (1—10 — рис. К Н Тодерич-
11—26, 30—39 — по Герасимовой-Навашиной, 1954; 27—29, 40—51, 58 — ориг ■ 52—54 —
по Battaglia, 1950; 55—57 — по Bergman, 1935).
клеток, их расположению, форме и числу ядер в них. У большинства родов
имеются 2 антиподы; 3 антиподы характерны для Blumea, Centaurea, Cnicus,
trupina, Echmopsidinae, Laggera, Rudbeckia, Serratula, Taraxacum и др. У
некоторых родов встречаются и 2, и 3 антиподы {Echinacea, Taraxacum и др.). У
небольшого числа родов антипод-значительно больше: у Aster novae-angliae —
от 2 до 13 (но чаще 6—7), у В. membranacea — до 8, у Berkheya bergiana — 14,
j Belhs perennis — 21, у Cosmidium burridgeanum — 40, а у Podolepis arachnoidss
их число достигает 51. Антиподы обычно одноядерные, реже — 2-ядерные.
326
У видов с 2 антиподами та из них, которая соприкасается с центральной клеткой
зародышевого мешка, часто становится 2-ядерной или имеет полиплоидное ядро.
У Aster undulatus, A. novae-angliae и Cosmidium число ядер в одной клетке
достигает 19, у Cosmos — 7—25; иногда число ядер в антиподах доходит до (50.
Расположение клеток антипод Т-образное, линейное (в один или 2 ряда). У
некоторых родов антиподы по строению имитируют яйцевой аппарат (Rudbeckia):
одна крупная антипода похожа на яйцеклетку, располагается в центре, а 2
другие — по бокам от нее. У Vicoa auriculata, Laggera pterodonta и В. malabarica
клетки антипод тоже сходны с яйцевым аппаратом, но не так явно, как у
Rudbeckia. У одних видов антиподы долго сохраняются, у других они дегенерируют
до начала развития эндосперма (например, у Platycarpha carlinoides, В.
bergiana; Gelin, 1936). Иногда встречаются антиподальные халазальные гаустории
(Vernonia cinerascens, Podolepis jaceoides, Bidens); у Barkhausia foetida, Grindelia
sguarrosa, Andryala, Gutierrezia, Haplopappus — боковые гаустории.
В семействе установлена порогамия; 2 случая халазогамии у Blainuillea
rhomboidea (Doll, 1927) требуют переисследования. Оплодотворение двойное,
премитотического типа (Герасимова-Навашина, 1951). Тройное слияние обычно
следует за сингамией, но иногда оно происходит раньше сингамии или
одновременно с ней. У Calendula после оплодотворения одна из синергид превращается
в гаусторий; она сначала приобретает меристематический характер, а затем
врастает в микропиле. Рост клетки сопровождается интенсивным синтезом
цитоплазмы и формированием полисахаридной оболочки. Ультраструктурные
изменения указывают на приобретение клеткой гаусториальных функций —
возможен синтез гидролитических ферментов и активное поглощение
гаусторией продуктов распада (Плиско, 19776). У Н. annuus неповрежденная синер-
гида не становится гаусторией, но сохраняется до глобулярной стадии развития
зародыша и, возможно, тоже выполняет сходные функции (Newcomb, 1973b).
Эндосперм у большинства видов целлюлярный. Нуклеарный эндосперм
отмечен у Barkhausia, Bidens, Dahlia, Dimorphotheca, Galinsoga, Glossocardia,
Grindelia, Helianthus, Mutisia, Silphium, Ursinia, у видов трибы Cynareae {Arctium,
Carduus, Cirsium, Centaurea), а также у Antennaria alpina, A. porsildii,
Chrysanthemum indicum, Eupatorium glandulosum и Volutarella ramosa. Нуклеарная
стадия кратковременная, и тип эндосперма определяется часто лишь по 1—2
делениям. У разных видов одного рода может встречаться как нуклеарный,
так и целлюлярный тип эндосперма. Так, у всей трибы Пипеа, в том числе
и в роде Blumea, эндосперм целлюлярный, но у В. oxyodonta, B. eriantha и
В. malabarica — нуклеарный (Chennaveeriah, Patil, 1971; Pullaiah, 1979).
При целлюпярном типе эндосперма первая перегородка у одних видов (Chondrilla
juncea, Ageratum mexicanum, Lactuca muralis, T. farfara) закладывается
поперечно, у других (Artemisia maritima, B. rhomboidea, Gnaphalium undulatum, La-
gascea mollis, R. laciniata) — продольно. У некоторых родов, однако, заложение
первой клеточной стенки может варьировать: оно может быть поперечным,
продольным или наклонным (Eupatorium glandulosum, Hieracium aurantiacum,
Senecio и др.). Имеются данные по ультраструктуре клеток эндосперма у Н.
annuus {Newcomb, 1973b). В зрелом семени эндосперм не сохраняется, лишь
у В. malabarica, B. membranacea и Laggera pterodonta остаются один или 2 ряда
эндосперма (Pullaiah, 1979).
Эмбриогенез отнесен к Asterad-типу и нескольким вариациям этого типа.
Для семейства основной считается Senecio-вариация Asterad-типа (Johansen,
1950), характерная для S. vulgaris (Soueges, 1920a, 1920b), В. membranacea,
В. malabarica, Laggera pterodonta (Pullaiah., 1979), В. perennis, Calendula arven-
sis, H. annuus, C. intybus, а также Т. officinale (ориг. данные) и др. У Cardans
nutans из трибы Cynarees развитие зародыша происходит по Asterad-тмиу,
но отмечены иные конструктивные возможности исходных этажей (Mo8l.ru,
1957). У Eclipta erecta эмбриогенез соответствует Polygonum-вариации (John и
sen, 1950), а у Crepis capillaris ~ Oxalis-вариации (Герасимова-Навашипп,
1951). Подвесок зародыша обычно развит слабо, нитевидный, состоит w.\ 3-
8 клеток. Тонкая структура развивающегося зародыша описана у Bidens cernua
(Simola, 1971), а клеток подвеска — у Н. annuus (Newcomb, 1973).
Дифференцированный зародыш прямой, крупный, имеет 2 семядоли, гипокотиль, impu-
11-17
дышевый Kupuiib и почечку. Зародыш в зрелом семени занимает весь его объем.
Запасиыо нощоства в семядолях — жиры. Лейкоэмбриофиты.
Аномикоио истречается у представителей ряда родов: чаще
нередуцированный, но бмиаот и редуцированный. Партеногенез отмечается чаще, чем другие
типы апомиксиса (Поддубная-Арнольди, 1976). Апогаметия может быть синер-
ГИД110Й и цнтиподной. Диплоидная синергидная апогаметия обнаружена у Anten-
narla carpatica, Hieracium vulgatum, H. pilosella, H. ramosum, R. laciniata,
R. mlliuanti, R. triloba и Taraxacum officinale. Диплоидная антиподная
апогаметия истречается очень редко, она найдена у Hieracium flagellare, H. pilosella,
Н. laciniata и Taraxacum palustre. Антиподный зародыш, достигший зрелости,
обнаружен у R. laciniata (Солнцева, 1973). Гаплоидная синергидная апогаметия
установлена у Artemisia nitida, Carthamus tinctorium, С. capillaris, Elephanto-
pus scaber, H. ramosum, H. vulgatum, Parthenium argentatum, P. incanum и
Taraxacum kok-sagyz. Гемигамия характерна для 9 видов рода Rudbeckia
(Солнцева, 1974, 1976). Интегументальная эмбриония обнаружена у Melampodium
divaricatum и у С. tinctorius (Maheshwari Devi, Pullaiach, 1976a, 1977).
Адвентивные зародыши развиваются из клеток интегументального тапетума.
Апоспория установлена у представителей Alchemilla, Antennaria, Artemisia, Aster,
Calendula, Calotis, Carthamus, Cirsium, Coreopsis, Hieracium, Helianthus, Leon-
todon, Minuria, Parthenium, Tithonia и др.
Полиэмбриония отмечается у представителей родов Andryala, Erigeron,
Hieracium, Helianthus, Minuria, Taraxacum и др. В большинстве случаев
развиваются 2 зародыша: один из яйцеклетки, другой из синергиды. Реже возможна
ложная полиэмбриония (С. tinctorius): развиваются 2-зародыша из 2
зародышевых мешков одной семяпочки.
Исследованные роды и виды. Acanthospermum hispidum,
Achillea millefolium, Adenocaulon bicolor, Adenostemma lavenia, A. rugosum, Ade-
nostyles albifrons, Ageratum mexicanum, Ainsliaea aptera, Ambrosia artemisifolia,
A. maritima, Ammobium alatum, Anacyclus radiatus, Anaphalis busua, Andryala,
Antennaria (19), Anthemis (19), Arctium (4), Arctotheca calendula, Arctotis (5),
Arnica (4), Artemisia (4), Aster (5), Rarkhausia foetida, Rellidiastrum michelii,
Rellis (4), Rellium bellidioides, Rerkheya aldami, R. bergiana, Ridens cernua,
R. lainvillea, R. tripartita, Ridensis biternata (=Ridens pillosa), Rlainvillea rhom-
boidea, Rlumea (5), Rrachycome ciliaris, R. iberidifolia, Ruphthalmum salicifolium,
Caesulia axillaris, Calendula arvensis, C. officinalis, Calotis (4), Carduus
acanthoides, C. defloratus, C. nutans, Carlina acaulis, Carthamus lanatus, C.
tinctorius, Castalis (2), Centaurea (6), Chondrilla (11), Chrysanthemum (11), Chrysotham-
nus nauseosus speciosus, Chrysocoma coma-aurea, Cicerbita alpina, Cichorium inty-
bus, Cirsium (5), Cladanthus arabicus, Cnicus benedictus, Coreopsis laceolata, Cosmi-
dium burridgeanum, Cosmos bipinnatus, Cotula australis, Cousinia carduiformis,
C. pseudoarctium, C. umbrosa, Crepis (15), Crossocephalum crepioides, Crupina crupi-
nastrum, C. vulgaris, Cynara scolymus, Dahlia, Dicoma tomentosa, Dimorphotheca
oblongifolium, D. orientate, D. sinuata, Doronicum plantagineum, Echinacea
purpurea, Echinops (6), Eclipta alba, E. erecta, E. prostrata, Elephantopus scaber,
E. species, Emilia flammea, E. sonchifolia, Epaltes australis, Erechtites hieracifolia,
Erigeron (22), Eupatorium (4), Flaveria repanda, Funaria hygromertrica, Gaillardia
aristata, G. lorenziana, G. pulchella, Galinsoga (4), Gazania, Gerbera anandria,
G. hybrida, G. jamesoni, Gibbaria, Glossocardia bosvallia, Gnaphalium (5), Grindelia
squarrosa, Guizotia abyssinica, Gutierrezia, Haplocarpha lyrata, Haplopappus cilia-
tus, H. gracilis, Helianthemum vulgare, Helianthus annuus, H_ tuberosum, Helichry-
sum bracteatum, Heliopsis helianthoides, H. scabra, Hieracium (18), Homogyne
alpina, Hymenatherum tenuifolium, ' Hypochaeris aetnensis, H. maculata, H.
radicata, H. uniflora, Inula helenium, Ixeria dentata, Jungia japonica,
Jurinea, Lactuca muralis, L. sativa, Lagascea mollis, Laggera pterodonta, Lampsana
communis, Langsdorffia, Launaea nudicaulis, L. pinnatifida, Leontodon autumnalis,
L. hispidus, Leontopodium alpinum, L. nivale, Lepachis columnaris, Leucanthemum
vulgare, Liatris elegans, Ligularia kaempferi, Macraea laricifolia, Matricaria matri-
carioides, M. maritima, Melampodium divaricatum, Melitella pusilla, Minuria (5),
Mutisia candolleana, Myriactis wightii, Onopordon acanthium, Osteospermum (16),
328
Othonna carnosa, Parthenium argentatum, P. hysterophorus, P. incanum, t'clasHt'H
frigidus, Picris (5), Platycarpha carlinoides, Podolepis arachnoides, P. jacaoldrs,
Polymnia, Prionopsis ciliata, P. parthenifolium, Pterotheca falconeri, Pyrethmm
carneum, P. parthenifolium, P. roseum, Ratibida columnifera, R. tagetes, ИшШс-
ckia (12), Sanvitalia procumbens, Saussurea amara, Scorzonera tau-saghys, Sctic
do (9), Serratula cornata, S. radiata, Siegesbeckia orientalis, Silphium, Solidago (4),
Sonchus arvensis, S. asper, S. oleraceus, Spilanthes acmella, Synedrella nodiflora,
Syneilesis palmata, Tagetes patula, T. signata, Tanacetum vulgare,
Taraxacum (10), Tithonia rotundifolia, Tragopogon orientalis, Tridax procumbens,
T. trilobata, Tripleurospermum maritimum, Tripteris vaillantii, Tussilago farfara,
Urospermum picroides, Ursinia anthemoides, Vernonia chinensis, V. cinerascens,
V. cinerea, Vicoa auriculata, Vittadinia triloba, Yolutarella divaricata, V. ramosa,
Wedelia calendulacea, Xanthisma texanum, Xanthium spinosum, X. strumarium,
Xeranthemum annuum, X. cylindraceum, X. sqarrosum, Zaggera pterodontha, Zinnia
elegans, Z. grandiflora.
Литература. Hofmeister, 1849, 1858; Tulasne, 1849, 1855; Haenlein,
1874; Vesque, 1878, 1879; Warming, 1878; Elfing, 1879; Jonsson, 1879-1880;
Strasburger, 1879a, 1879b, 1882, 1884, 1889; Ward, 1880; Guignard, 1882;
Winkler, 1882; Wille, 1887; Hegelmaier, 1889; Westermaier, 1890; Martin, 1892; Nor-
ris, 1892; Mottier, 1893; Chamberlain, 1895; Hubert, 1896; Schwere, 1896; Vande-
velde, 1896; Goldfluss, 1898, 1899; Green, 1898; Juel, 1898, 1904, 1906, 1909;
Land, 1900; Merrell, 1900; Nawaschin, 1900, 1909; Billings, 1901; Portheim, 1901;
Bernard, 1903; Murheck, 1904; Oppermann, 1904; Gerdts, 1905; Leavitt, 1905;
Eichler, 1906; Rosenberg, 1906, 1907, 1909, 1912, 1917, 1927, 1930; Schiller, 1907;
Lundegardh, 1909; Ikeno, 1910; Osterwalder, 1910; Lavialle, 1911, 1912, 1921,
1922; Smith R., 1911; Schkorbatow, 1912; Carano, 1913a, 1913b, 1914, 1915a,
1915b, 1915c, 1919a, 1919b, 1920, 1921; Ernst, 1913, 1918; Osawa, 1913; Palm,
1914a, 1914b, 1915, 1923, 1925, 1931, 1934; Winge, 1914, 1923; Ayres, 1915;
Holmgren, 1915, 1916, 1919; Tahara, 1915a, 1915b, 1921; Farr, 1916; Tackholm,
1916; Sears, 1917, 1922; Schnarf, 1919, 1923, 1931; Dahlgren, 1920, 1924; Gates,
1920; Schiirhoff, 1920, 1925, 1927; Soueges, 1920a, 1920b; Stork, 1920; Gates,
Rees, 1921; Haberlandt, 1921, 1922, 1923, 1938; Afzelius, 1924, 1936; Langler,
1925; Meyer K., 1925; Chiarugi, 1926a, 1926b, 1927a, 1927b, 1927c, 1934;
Howe T. D., 1926, 1959, 1964, 1969, 1975; Поддубная-Арнольди, 1926, 1939a,
19396, 1940, 1947, 1958, 1964, 1976, 1980, 1982; Yamaha, 1926, 1927; Doll, 1927;
Donald, 1927; Jones, 1927; Poddubnaja-Arnoldi, 1927, 1931, 1933a, 1933b, 1934,
1935a, 1935b; Weindel-Lieban, 1928; Кокиева, 1929, 1932; Tateishi, 1929; Ro-
dolico, 1930, 1933; Bergman, 1932, 1935a, 1935b, 1935c, 1937, 1941, 1942, 1944,
1950, 1951; Gustafsson, 1932, 1933a, 1933b, 1933c, 1934a, 1934b, 1935a, 1935b,
1939, 1942a, 1942b, 1946, 1946-1947, 1948; Okabe, 1932; Stebbins, 1932a, 1932b;
Gerassimova, 1933; Gelin, 1934, 1936; Poddubnaja-Arnoldi, Dianova, 1934; Bhar-
gava, 1935; Dianova, Sosnovitz, Steshina, 1935; Harris, 1935; Cooper, 1936;
Negodi, 1936a, 1936b; Tongiorgi, 1936; Babcock, Stebbins, 1938; Diettert, 1938;
Dutta, 1938; Fagerlind, 1938a, 1938b, 1941, 1945c, 1946a, 1947b, 1947c, 1947d;
Popham, 1938; Martinoli, 1939, 1940, 1942, 1967; Stebbins, Babcock, 1939;
Stebbins, Jenkins, 1939; Banerji, 1940a, 1940b, 1940c, 1942, 1959; Battaglia, 1940,
1945, 1946a, 1946b, 1946c, 1946d, 1947a, 1947b, 1947c, 1947d, 1947e, 1947f, 1948a,
1948b, 1949, 1950, 1951a, 1951b, 1952a, 1952b, 1952c, 1955, 1956a, 1956b, 1963;
Christoff, 1940; Venkatesvarlu, 1941, 1959; Ruth, 1943; Smith F., 1943; Warmko,
1943; Esau, 1944, 1946; Maheshwari, Srinivasan, 1944; Rosen, 1944; Walkor,
1944; Annen, 1945; Powers, 1945; Руми, 1945, 1947; Snow, 1945; Gustafsson,
Nygren, 1946; Маркова, 1946; Babcock, 1947; Герасимова-Навашина, 1947а,
19476, 1947в, 1947г, 1947д, 1951, 1954a, 19546, 1956, 1957, 1959, 1960, 19(Ma,
19616, 1962, 1963, 1969, 1971, 1972, 1977, 1978, 1982; Desole, 1947, 1951; Milrn,
1947b; Avanzi, 1948; Maheshwari Devi, 1948, 1957, 1963; Anzalone, 1949; Cal,a-
lani, 1950—1951; Gerstel, Mishanes, 1950; Harling, 1950, 1951a, 1951b, МЫ,
1960; Johansen, 1950; Nygren, 1950, 1967; Augier, Rubar du Merac, 1951; HolU,
1951; Hjelmqvist, 1951, 1964; Петрова, 1951а, 19516; Устинова, 1951а, 19516.
1951b, 1954, 1955, 1957, 1962, 1964a, 19646, 1964b, 1966, 1970; Устииопа, 11o-
ilHIl
стерова, 1951; Wcislo, 1951; Бенецкая, 1952, 1954; Maheshwari, Roy, 1952;
Vemin, 1952; Моисосян, 1953, 1963, 1964, 1970, 1971, 1973, 1977, 1979, 1981;
Czapik, 1954; Pagini, 1954; Snoad, 1954; Szwarowicz, 1954; Бенецкая,
Мовсесян, (liiMO)inu, 1955; Crete, 1955; Martin, Smith, 1955; Venkateswarlu,
Maheshwari l)<ivl, 1955; Berger, Feeley, Witkus, 1956; Симонян, 1956, 1961; Urbanska,
1950; МояЬге, 1957a, 1957b, 1958, 1963—1964; Misra, 1957, 1964, 1965; Banerji,
Pal, 1959; Beaudry, 1959; Bianchi, Schwemmin, Wagner, 1959; Богомолова, 1959,
1900, Днюбенко, 1959, 1965; Sokolowska-Kulczycka, 1959; Wunderlich, 1959;
DoHlipnude, 1960a, 1960b, 1960c, 1961, 1962a, 1962b, 1962c, 1962d, 1964a, 1964b,
19(M«, 1967, 1970; Montgomery, Yang, 1960; Пжрев, 1960, 1963, 1965, 1966, 1968;
Tiagi, Taimni, 1960, 1963; Banchetti, 1961; Beruti, 1961; Davis, 1961a, 1961b,
190ic, 1961d, 1962a, 1962b, 1963a, 1963b, 1964a, 1964b, 1964c, 1964d, 1966, 1967,
1968a, 1968b; Ferri, 1961; Кострюкова, 1961; Malecka, 1961, 1964a, 1964b, 1965,
1907, 1971, 1982, 1984; Urbanska-Worythkiewicz, 1961, 1962a, 1962b, 1967a,
1967b, 1969; Vaidya, 1961; Ghosh, 1962, 1974; Hook, Davis, 1962; Kapil, Sethi,
1962; Кордюм, Бойко, 1962; Maugini, 1962, 1967; Padmanabhan, 1962b; Пай-
зиева, 1962; Руденко, 1962; Skawinska, 1962; Герасимова-Навашжна, Батыгина,
Коробова, 1963; Лазаров, 1963; Martinioli, Angiolini, 1963; Meyer J., 1963;
Renzoni-Cela, 1963; Bauer, 1964; Bijok, 1964; Kapil, Maheshwari, 1964; Richard,
1964; Касымова, 1965, 1966a, 19666, 1981; Мовсесян, Багдасарян, 1965, 1966;
Цингер, Поддубная-Арнопъди, Петровская, Полунина, 1965; Godineau, 1966,
1968, 1969, 1971; Pogliani, 1966; Sehgal, 1966; Venugopalan, 1966; Arnott, Smith,
1967; Said, 1967; Светозарова, 1967; Valentine, Richards, 1967; Герасимова-
Навашина, Капил, Коробова, Савина, 1968; Каневская, Свиридова, 1968;
Мовсесян, Оганесян, 1968; Nordenstam, 1968; Paulson, Srivastava, 1968; Rajan, 1968;
Солнцева, 1968,1971a, 19716, 1973a, 19736, 1973в, 1973г, 1974,1975, 1976, 1977a,
19776, 1978a, 19786, 1978в, 1979, 1982a, 19826, 1983; Srivastava, Paulson, 1968;
Хохлов, 1968; Бланковская, Мирончак, 1969; Chopra, 1969a, 1969b, 1970; Ge-
rassimova-Navashina, Kapil, Korobova, Savina, 1969; Heslop-Harrison, 1969;
Howe Т., 1969, 1975; Khan, Khatoon, 1969a, 1969b; Khidir, 1969; Kovacik, Sy-
korova, 1969; Narayan, Shukur, 1969; Obuchowska, 1969; Rogers, 1969; Anderson,
1970; Букина, 1970; Engell, 1970; Gillet, Elvera, 1970; Kirsten, 1970; Васильев,
Плиско, 1970, 1971; Видаяти, Поддубная-Арнольди, 1971; Глущенко, 1971;
Newcomb, Steeves, 1971; Плиско, 1971а, 19716, 1974а, 19746, 1977а, 19776,
1977в, 1982; Simola, 1971; Татинцева, 1971, 1975; Walter, Ruta, 1971; Eliasson
Uno, 1972; Kaul, 1972, 1973; Koyama, Maeda Fumiko, 1972; Литвиненко, Дзе-
валтовский, 1972; Мовсесян, Багдасарян, Каспарова, 1972; Singh, Kaul, 1972,,
1974; Skalinska, Kubien, 1972; Tanaka, Terasaka, 1972; Tanaka, Watanabe,
1972; Хведынич, 1972; Видаяти, 1973; Галукян, Мовсесян, 1973; Герасимова-
Навашина, Гуляев, 1973; Ключарева, 1973; Newcomb, 1973a, 1973b; Низамова,
1973; Попова, Колесников, 1973; Pandey, Singh, 1973, 1976, 1980, 1982;
Skalinska, 1973; Telezynska, Telezynski, 1973; Яковлев, Жукова, 1973, 1980; Bobek,
Kovacik, 1974; Cuthbertson, 1974; Мовсесян, Каспарова, 1974, 1976, 1977, 1978a,
19786; Sundara, 1974a, 1974b; Whelan, Haggis, Ford, 1974; Юрцев, Юрцева, 1974;
Yamazaki, 1974; Ервандян, 1975, 1978; Капинос, 1975; Kaul, Dathan, Singh,
1975; Мовсесян, Хачатрян, 1975, 1978; Беляева, 1976а, 19766, 1977; Галукян,
Арутюнян, 1976; Maheshwari Devi, Pullaiah, 1976; Мовсесян, Саркисян,
Абрамян, 1976; Pullaiah, 1976, 1978а, 1978b, 1978с, 1979а, 1979Ь, 1980, 1981а, 1981b,
1982, 1983а, 1983b; Bijok, Pawlak, Krenska, 1977; Engell, Petersen, 1977; Favre-
Duchartre, Louant, 1977—1978, 1979; Horner, 1977; Prithopalsingh, 1977;
Rowley, Dahl, 1977; Sharma, Mutry, 1977, 1978; Симоненко, 1977, 1978, 1982, 1986;
Татевосян, 1977; Zabinska, 1977; Ahlstrand, 1978, 1979a, 1979b, 1979c, 1979d,
1985; Ashton, 1978; Asplund, 1978; Гусейнова, Ахундова, 1978; Dakshini, Dad-
lani, 1978; Delannay, 1978; Орел, Огородникова, Голубева, 1978; Jurukova-
Gryncharova, 1978; Попова, 1978; Чубирко, 1978; Юрукова-Грънчарова, 1978,
1979, 1983а, 19836; Arvena, Gramuglio, 1979; Бойко, 1979; Leung, 1979; Pra-
kasa Rao, Sundari, Narayana, 1979; Rao, Sundari et al., 1979; Kaul, Singh, 1980,
1982; Kosconska, 1980; Pandey, 1980; Rajashekar, 1980, 1981; Smith, Johnson,
1980; Андрощук, 1981; Gill, 1981; Longly, Louant, 1981, 1982; Lott, 1981; Louant,
Longly, 1981a, 1981b; Новикова, 1981; Pillai, Goyal, 1981; Chichan, Palser,
330
1982; Chikkannaih, Heremath, 1982; Favre-Duchartre, 1982; Гусойнопй, 1U82t
Kaul, Singh, 1982; Ram Lalitha, 1982; Вечерко, 1983; Ермаков, ГусикоиоИНЯ,
1983; Gramuglio, Arena, Villari, Rossitto, 1983; Koscinska-Pajak, 1983; KyHMft»
нов, Юрукова-Грънчарова, 1983; Coleman Т., Coleman R., 1984; Johri, Amlm»
goakar, 1984; Lankosz-Mroz, 1984a, 1984b; Longly, 1984; Mesfin, 1984; Орел, Ниш •
някова, Константинова, 1984; Psaras, 1984; Pullaiah, Swarajya, 1984; Roomi,
Hilder, 1984; Schmitter, 1984; Ahlstrand, Lennart, 1985; Гусаковская, 1.985;
Kumar, 1985; Levieil, Hyughe, 1985; Longly, Raban, Louant, 1985; Maheshwad
Devi, Padma, 1985; Плющ, Банникова, Главацкая, 1986; Солнцева (ориг.
данные); Тодерич (ориг. данные по Н. annuus).
Содержание запасных питательных веществ в зрелом семени покрытосеменных растений
Приложение
Порядок
Cornales
Araliales
Celastrales
Santalales
Семейство
Nyssaceae
Cornaceae
Aacubaceae
Araliaceae
Apiaceae
Aqulfoliaceae
Celastraceae
Salvadoraceae
Corynocarpaceae
Olacaceae
Число
исследованных
видов
3
57
5
13
Анализированные
структуры
Семя + эндокарпий
(з + эн+ т) + эк
Семя
(з + эн + т)
Зародыш-}- эндосперм
Семя + перикарпий
(з + эн + т) + пк
Семя
(з + эн + т)
Семя
(з + эн + т)
Семя
(з+ эн+ т)
Семя
(з + эн + т)
Зародыш + эндосперм
Семя
(з+эн + т)
Зародыш + эндосперм
Семя
(з+ эн+т)
Семя
(з + эн+ т)
Зародыш + эндосперм
Содержание запасных веществ
(% на сухую массу)
белки
31—39
35
9
10-31
17-33
6—21
10—22
16-21
15-20
жиры
7-50
43
0.8
6-46
5—44
12—30
28—56
44—75
0.6-50
45—48 *
16—72
30—66 **
олиго-
сахара
крахмал
.6—9*
6—12
+
15
Литературный нсэткнгк
Earle, Jones, 1962
Eckey, 1954; Шарапов, 1959; Earle,
Jones, 1962; Hegnauer, 1964
Earle, J opes, 1962
Smith et al., 1959; Heguauer, 1964'
Wehmer, 1931; Tietz, 1953; Eckey,
1954; Шарапов, 1959; Earle, Jones,
1962; Hegnauer, 1964; Jones,
Earle, 1966
Earle, Jones, 1962; Hegnauer, 1964;
Jones', Earle, 1966
Wehmer, 1931; Шарапов, 1959; Smith
et al., 1959; Варасова, 1962;
Earle, Jones, 1962; Hegnauer, 1964
Шарапов, 1959; Hegnauer, 1973
Hegnauer, 1964
Eckey, 1954; Шарапов, 1959; Smith
et al., 1959; EarJe, Jones, 1962;
Corner, 1976
Приложение (продолжение)
Порядок
Santalales
Rhamnales
Elaeagnales
Proteales
Gentianales
Семейство
Santalaceae
Loranthaceae
Bhamnaceae
Vitaceae
Elaeagnaceae
Proteaceae
Loganiaceae
Rubiaceae
Число
исследованных
видов
1
17
16
Анализированные
структуры
Семя
(з + эн+т)
Зародыш + эндосперм
Семя
(з+ эн + т)
Семя
(з + эн + т)
Зародыш + эндосперм
Семя
(з + эн + т)
Зародыш + эндосперм
Семя
(з+эн+ т)
Семя
(з+эн + т)
Зародыш+ эндосперм
Зародыш
Семя
(з + эн + т)
Зародыш + эндосперм
Семя
(з + эн + т)
Зародыш + эндосперм
Содержание запасных веществ
(% на сухую массу)
белки
жиры
олиго-
сахара
крахмал
Литературный источник
10-15
11-39
25
5-20
28—42
5-10
9 *
11—19
И*
8-15
18
26—56
44—60 *
17
8-69
57
6—33
30*
9—26
68 ,
67—80 *
20
0.5—28
1-39
5-16*
3-10
1-7
+
0-10
0-16
Ескеу, 1954; Шарапов, 1959; Smith
et al., 1959; Jones, Earle, 1966;
Hegnauer, 1973
Шарапов, 1959
Eckey, 1954; Шарапов, 1959; Earle,
Jones, 1962; Jones, Earle, 1966;
Hegnauer, 1973
Wehmer, 1931; Eckey, 1954; Экстер,
1957; Шарапов, 1959; Smith et al.,
1959; Earle, Jones, 1962; Jones,
Earle, 1966; Matsushita, 1971;
Hegnauer, 1973; Grosbois, 1976
Wehmer, 1931; Earle, Jones, 1962;
Jones, Earle, 1966
McNair, 1930; Wehmer, 1931;
Melville, 1947; Eckey, 1954;
Шарапов, 1959; Smith et al., 1959;
Hegnauer, 1969; Staden et al., 1975
Wehmer, 1931; Earle, Jones, 1962;
Hegnauer, 1966
Wehmer, 1931; Eckey, 1954;
Шарапов, 1959; Smith et al., 1959;
Earle, Jones, 1962; Courtois et al.,
1963; Jones, Earle, 1966
Приложение (продолжение',
Порядок
Gentianales
Oleales
Dipsacales
Loasales
Polemoniales
• Семейство
Apocynaceae
Asclepiadaceae
Gentianacede
Oleaceae
Caprifoliaceae
Valerianaeeae
Dipsacaceae
Loasaceae
Convolvalaceae
Cuscutaceai
Число
исследованных
видов
23
14
1
12
14
4
2
14
Анализированные
структуры
Семя
(з + эн + т)
Зародыш + эндосперм
Семя
(з + эн + т)
Зародыш + эндосперм
Семя
(з + эн+т)
Семя
(з + эн + т)
Зародыш + эндосперм
Семя
(з + эн+ т)
Эндосперм
Семя
(з+эн + т)
Семя
(з+эн + т)
Семя
(з + эн+т)
Семя
(з + эн + т)
Семя
(8+SH+T)
Содержание запасных веществ
(% на сухую массу)
белки
0—33
1—20*
20—41
27
16
10-25
10-21
+
5-19
15—35
19—21
16—31
жиры
11—60
37—64*
11-38
47
27
10—33
14—65
11—42
34
34-39
21—29
34—42
5—21
2-14 2—16
олиго-
сахара
крахмал
24-53
4-5
0-3
+
0-5
+
3-8
Литературный источник
Wehmer, 1931; Eckey, 1954;
Шарапов, 1959; Earle, Jones, 1962;
Jones, Earle, 1966
Eckey, 1954; Шарапов, 1959; Smith
et al., 1959; Earle, Jones, 1962;
Hegnauer, 1964; Jones, Earle, 1966
Jones, Earle, 1966
Wehmer, 1931; Гершёнович и др
1953; Eckey, 1954; Варасова, 1956
Шарапов, 1959; Smith et al., 1959
Earle, Jones, 1962; Jones, Earle
1966
Wehmer, 1931; Eckey, 1954;
Шарапов, 1959; Earle, Jones, 1962; Heg-
nauer, 1964; Jones, Earle, 1966;
Fedec, Knowles, 1973
Eckey, 1954; Smith et al., 1959;
Earie, Jones, 1962; Jones, Earle
1966
Eckey, 1954; Шарапов, 1959; Smith
et al., 1959; Jones, Earle, 1966
Earle, Jones, 1962
Eckey, 1954; Шарапов, 1959; Earle,
Jones, 1962; Jones, Earle, 1966;
Matsushita, 1971
Шарапов, 1959; Earle, Jones, 1962;
Rahman, Krishnan, 1971;
Алфимова, 1977; Шацанова, 1977
Приложение (продолжение)
Порядок
Polemoniales
Lamiales
Scrophulariales
Семейство
Polemoniaceae
Hydrophyllaceae
Boraginaceae
V erbenaceae
Lamiaceae
Solanaceae
Buddlejaceae
Scrophulariaceae
Bignoniaceae
Число
исследованных
видов
42
10
99
38
1
.40
13
Анализированные
структуры
Семя
(з+эн + т)
Семя
(з + эн + т)
Семя
(з + эн + т)
Зародыш + эндосперм
Семя
(з + эн + т)
Зародыш + эндосперм
Семя
(з+эн+ т)
Семя
(з + эн + т)
Семя
(з + эн+т)
Семя
(з + эн + т)
Семя
(з + эн + т)
Зародыш + эндосперм
Содержание запасных веществ
(% на сухую массу)
белки
14—41
10-22
18
36*
11-25
12-32
5-30
19
10-31
17-41
20-62
жиры
18—31
3—16
1-46
45-65*
16-61
41*
7-51
11-46
28
8-48
20-34
18—36 *
олиго-
сахара
9—12**
3-6
0.3—4
крахмал
+
+
+
0-3
±
Литературный источник
Earle, Jones, 196?; Jones, Earle,
1966
Earle, Jones, 1962; Jones, Earle,
1966
Wehmer, 1931; Шарапов, 1959;
Earle, Jones, 1962; Jones, Earle, 1966
Wehmer, 1931; Eckey, 1954;
Шарапов, 1959; Earle, Jones, 1962;
Jones, Earle, 1966
Eckey, 1954; Шарапов, 1959; Smith
et al., 1959; Earle, Jones, 1962;
Hegnauer, 1966; Jones, Earle, 1966;
Рушковский, 1967; Овчаров, 1976
Wehmer, 1931; Eckey, 1954;
Шарапов, 1959; Smith et al., 1959;
Earle, Jones, 1962; Jones, Earle, 1966;
Matsushita, 1971; Овчаров, 1976;
Koiwai et al., 1982
Hegnauer, 1964
Wehmer, 1931; Eckey, 1954; Hattori,
Hatanaka, 1958; Шарапов, 1959;
Earle, Jones, 1962; Tanfel et al.,
1962; Jones, Earle, 1966; Corner,
1976
Wehmer, 1931; Eckey, 1954;
Шарапов, 1959; Smith et al., 1959;
Earle, Jones, 1962; Hegnauer, 1964;
Jones, Earle, 1966
се м
РЧ2
яИ
В л,-
ю^1
ел -
■_ се
«В ш
м
о .й
W.-S
.. а
^чЮ
СО
03 ДГ
ю
-аэ
Ьч ^тН
CD
В и
xi о
со С
ел
со
ел
со
3
се
й
Я нсо
Р.™ ел
я Н ч
ИСЛ <D
V2 «
ю щ
ел -
- се ct>
^ й
<Ч ш °
^ >-э
ОД
НЙм
й со
... П аз
.^Ю -^
го
2 сл~ со
Ю CD
-сл й
a CQ
Xi О щ
«аЛ
се н со
сь се со
сеН2
а
со
а
S5 -w
СЗД1-"
Bcsi со
, гп СЛ ^н
й
о
-4^ '
се со cd й
се
3CJ
о еъ
ВН
ft
се
47 ю _,
со ^
2 °> сп" ь<"
и -"-I о се
Ви" ьо
й
ад
S3
cd cd
н
*-* г
.и
CD
*£ СО
се со
Н2
И
ш и
а й
Л о
tco
К се Я
- &.Й --cot
... се coj^ со 1
«Я<|—I СО о;, -
юН сл S"
•-ел <*>,£>
>,Ю й
а>сл - 0
о се
н«"«•"
И.CD ь,
ZS ° rf се
-ga^-
_'-* СО со
4 2
° м •-
5 Э'Л •
Я осп-
со д ^н се
СП
вд
а>
pi
*-л
■+J
о
£
0)
и
о
LO !>.
СО СО
05 аэ
■рЧ
г!
>
■*Ч
и
О
с
a
аэ
-
Рч
О
?й
£
II
Г*1Я
°S
SB
К Я
В co
я»
° I
В I
a*
В
ft
отсу
сп
н
S
и
К X
к
ф
к
s
и
1
+
*
в
Pico-
и
о
о
U,
в
в
CDS'
и»
п
а
к
*
a-
tttt
as о
со
1
К
о
аз
о
к
со р*.
СТ1
я
SS
В >»
о
СТ1
К
S
о.
&*
н
1
И
W
о.
£
р.
со
В
о о
ИИ-
^^
м
ф -.
ИИ
со 0
и -
и 3
л р.
Я »■
2 ^
в t».
2d,
5 f
5 о
ю
I
о
+
+1
см
I
о
I
I
О
I
о
+
CS1 Ю
СО -еЧ
I I
ю о
+
со
I CD
О т
S
ft
CD
С
о
« + S
S И ?
CD ГО +
и + в
ее
о
ft
се
СО
S
ft
со
о
^&
а к ™
со го + — —
«я
о
ft
се
СО
« +
s и
CD ГО
* В &
к + Я ®
ф m 2 п f
° + «|°
S
ft
CD
И
-о
« + 5
CD го +
со Я
о
ft
се
со
ITS
, ft
И + ш
S И g
CD m §
И
-co
со
О.
Рн CJ
к+ и
Sg-H
J£. Я ■
tc
о
ft
и g
г»
о
Е
о
^.
&н В
перм
к.
семе
о ^>
и:-п.
як
го
1
И
л
в
оды
as
с*
С)
ах
сящ
|
m
к
о
щ
о
RJ
д в.
S
№
ф
%
ff
я
St!
А
й
^>
ф
о о
с
в
селе
s
и
2
и
§
ю
03
е
^
1
е
Si
1
СО
I
ЛИТЕРАТУРА
Агаджанян д. А. II Студ. учен. зап. Ереван,
1965. Т. 10, вып. 2, С. 29—34.
Адмиральская С. А. II Докл. АН СССР.
1960а. Т. 130, № 4, С. 919-921.
Адмиральская С. A. 11 C6. науч.-исслед.
работ по масличн. и эфиромасл. культурам.
М., 19606. С. 207-215.
Алимова Г. К., Яковлев М. С. II Ботан.
журн. 1982. Т. 67, № 4, С. 470—479.
(Алимова Г. К., Яковлев М. С.) Alimova G. К.,
Yakovlev M. S. II Fertilization and Em-
bryogenesis in Ovulated Plants. Bratislava,
1983. P. 291—293.
Алфимова Р. A. II Физиолого-биохимичес-
кие особенности сахарной свеклы в
условиях Киргизии. Фрунзе, 1977. С. 42—45.
Андронова Н. Я. II Ботан. журн. 1972.
Т. 57, № 7, С. 826—831.
Андронова Я. Я. II Ботан. журн. 1973.
Т. 58, № 9. С. 1371—1377.
Андронова Я. Я. II Бюл'. Моск. о-ва испыт.
•природы. Отд. биол. 1975. Т. 80, № 2,
С. 68—76.
Андронова Я. Я. I I Ботан. журн. 1977.
Т. 62, № 10. С. 1461—1469.
Андронова Я. Я. II Ботан. журн. 1978.
Т. 63, № 3. С. 404-410.
Андронова Я. Я. II Филогения высш. раст.
М., 1982. С. 11—12.
Андронова Я. Я. II Проблемы гаметогенеза,
оплодотворения и эмбриогенеза. Ташкент,
1983. С. 36.
Андронова Я. Я. II Ботан. журн. 1984.
Т. 69, № 1, С. 43-54.
Андрощук А. Ф. II Цитология и генетика.
1981. Т. 15, № 1. С. 54—61.
Анисимова Г. М. II Ботан. журн. 1983.
Т. 63, № 4. С. 473—482.
Артамонова Л. Я., Яванов М. А. //Изв.
Биол.-геогр. науч.-исслед. ин-та при Ир-
кут. гос. ун-те. 1969. Т. 23, № 3. С. 284—
292.
Афанасьева Н. Г. II Ботан. журн. 1971.
Т. 56, № 2. С. 215-229.
Афанасьева Я. Г. Эмбриология вероник
(p. Veronica L.). Казань, 1976.
Афанасьева Я. Г., Грахащева Л. Ш. II
Ботан. журн. 1975. Т. 60, № 6. С. 777—
787.
Афанасьева Я. Г. II Ботан. журн. 1971.
Т. 56, № 7. С. 1013-1019.
Афанасьева Я. Г., Окулова С. М., Грахан-
цева Л. Ш., Юсупова И. К. II Ботан.
журн. 1975. Т. 60, № 12. С. 1770—1776.
Ахмед-Заде Ф. А., Гусейнова Я. А. II Докл.
АН АзСССР. 1984. Т. 40, № 2. С. 62—64.
Багаев С. Я. II Докл. АН СССР. 1955.
Т. 103, № 3. С. 511—512.
Банникова В. П. II Цитология и генетика.
1970а. Т. 4. № 3. С. 260-267.
(Банникова В. Я.) Bannikova V. P. //Ann.
Univ. Reims. 19706. N 6-7. P. 73-77.
Банникова В. Я. Цитоэмбриология^
межвидовой несовместимости у растений. Киев,
1975.
Банникова В. Л., Овсянникова О. В. II Сб.
науч.-исслед. работ ВНИИ табака и
махорки. 1973. № 160-161. С. 112—120.
Банникова В. П., Остапенко О. К. II Укр.
ботан. журн. 1964. Т. 21, № 3. С. 20—26.
Банникова В. Л., Хведынич О. А.
//Цитология и генетика. 1969. Т. 3, № 3. С. 195—
201.
Банникова В. П., Хведынич О. А. II Укр.
ботан. журн. 1973. Т. 30, № 5. С. 668—670.
Банникова В. Л., Хведынич О. А. Основы
эмбриологии растений. Киев, 1982.
(Банникова В. П., Хведынич О. А.,
Сердюк Л. С.) Bannikova V. P., Khvedy-
nich О. A., Serdyuk L. S. II Acta Soc.
bot. pol. 1981. Vol. 50, N 1-2. P. 121-126.
Банникова В. П., Хведынич О. А.,
Шпилевая С. П. и др. Половые клетки и
оплодотворение у покрытосеменных и
водорослей. Киев, 1985.
(Баранов П. A.) Baranov Р. А. II Вег.
Dtsch. bot. Ges. 1927a. Bd 45. S. 97—114.
Баранов П. А. II Тр. Ак-Кавакской опытно-
оросительной станции. Ташкент, 19276.
Вып. 4. С. 119—187.
Баранов П. А. II Ампелография СССР. 1946.
Т. 1. С. 217—346.
Баранов Я., Иванова-Паройская ЛГ // Тр.
Ак-Кавакской опытно-оросительной
станции. Ташкент, 1927. Вып. 4. С. 79—94.
Баранов Л., Райкова И. II Тр. по прикл.
ботан., генет. и селекции. Л., 1930. Т. 24,
вып. 1. С. 283—300.
Батикян Т. Г., Карагезян А. С. II Биол.
' журн. Армении. 1973. Т. 26, № 8, С. 72-75.
Батикян Г. Г., Туманян д. Р., Дание-
лян А. X. //Биол. журн. Армении. 1974.
Т. 27, № 12. С. 22—27. '
Бейлис Р. А. II Журн. 1нст. ботан. АН
УРСР. 1936. № 10 (18). С. 99—144.
Бейлис Р. А. II Журн. 1нст. ботан. ЛИ
УРСР. 1938. № 17 (25). С. 113-120.
Беляев А. А. II Ботан. журн. 1984. Т. (И),
№ 5. С. 585—594.
Беляева М. А. II Сб. науч. тр. Ярослим.
гос. пед. ин-та. 1974. Вып. 125 (3). С. 1U—
31.
22 Сравнительная эмбриология
:ш
Беляева ГГ. С. II И ни. АН ТССР. Сер. биол.
наук. 107(54». .№ 1. С. 42—47.
Беляева П. С. II Изв. АН ТССР. Сер. биол.
паук. 107(56. № 2. С. 63—67.
Бешщкаи Г. К. II Ботан. журн. 1939. Т. 24,
.Nil \. С. 273—281.
Бешщкая, Г. К. II Изв. АН АрмССР. 1952.
Т. 5. С. 7-11.
Бешщкая Г. К. II Изв. АН АрмССР. 1954.
Т. 7, № 12. С. 7—17.
Платовская Т. Ф., Мирончак М. В. II Сб.
работ молодых ученых. Всесоюз. селекц.
гопот. ин-та. Одесса, 1969. С. 155—158.
Богданова В. М., Грушвицкий И. В. II Раст.
ресурсы. 1970. Т. 6, вып. 4. С. 523—527.
Богомолова Т. Д. II Докл. Тимирязев, с.-х.
акад. 1959. Вып. 46. С. 227—232.
Богомолова Т. Д. II Изв.' Тимирязев, с.-х.
акад. 1960. № 4. С. 196—199.
Бородин И. П. II Докл. АН УзССР. 1952.
№ 3. С. 38—43.
Бородин И. П. II Докл. АН УзССР. 1954.
№ 10. С. 59—63.
Букина Р. А. II Зап. Воронеж, с.-х. ин-та.
1970. № 45. С. 108—115.
Буюкли М. В. II Ботан. журн. 1971. Т. 56,
№ 10. С. 1496—1498.
Шакар В. А., Карлова А. А. //Проблемы
ботаники на Урале. Свердловск, 1973.
С. 158—163.
Валъцева О. В. II Бюл. Гл. ботан. сада
АН СССР. 1959а. Вып. 35. С. 61—66.
Валъцева О. В. II Науч. докл. высш. школы.
Биол. науки. 19596. № 1. С. 112—116.
Варасова Н. Н. II Тр. Ботан. ин-та АН
СССР. Сер. 4. 1956. № 11. С. 370—387.
Варасова Н. Н. II Сб. работ по лесному
хозяйству. М., 1962. Вып. 5. С. 243—252.
Варшанина Т. П. II Бюл. Всесоюз. ин-та
растениеводства. 1973. Вып. 33. С. 90—98.
Варшанина Т. П. II Тр. по прикл. ботан.,
генет. и селекции. 1977. Т. 60, вып. 2.
С. 128—133.
Варшанина Т. П., Орел Л. И. II Тр. по
. прикл. ботан., генет. и селекции. 1980.
Т. 67, вып. 3. С. 108—118.
Васильев А. Е.\ Плиско М. А. II Вотан.
журн. 1971. Т. 56, № 3. С. 335—346.
Верещагина В. А. II Ботан. журн. 1971.
Т. 56, № 8. С. 1006—1013.
Верещагина В. А. II Ботан. журн. 1973.
Т. 58, № 12. С. 1760—1764.
Верещагина В. А. II Ботан, журн. 1976.
Т. 61, № 115. С. 1582—1589.
Верещагина В. А. II Ботан. журн. 1978а.
Т. 63, № 2. С. 183—190.
Верещагина В. А. II Экология опыления.
Пермь, 19786. С. 98—105.
Верещагина В. А. II Ботан. журн. 1983.
Т. 68, № 8. С. 1107—1112.
Верещагина В. А., Вояршинова О. Н. II
Экология опыления. Пермь, 1979. № 4.
С. 13—21.
Верещагина В. А., Маланина Л. И. II Науч.
докл. высш. школы. Биол. науки. 1974.
№ 6. С. 51—57.
Видаяти О. Цитоэмбриология некоторых
декоративных сложноцветных: Автореф.
дис. . . . канд. биол. наук. М., 1973.
Видаяти О., Поддубная-Арнолъди, В. А. II
Морфология цветковых растений. М., 1971.
С. 75—84.
Вишнякова М. А. //Тр. по прикл. ботан.,
генет. и селекции. 1983. Т. 74. С. 79—87.
Вишнякова М. А. //Матер. VIII Всесоюз.
совещ. по эмбриол. растений. Ташкент,
1983. С. 45—47.
Вишнякова М. А., Лебский В. К. //Ботан.
журн., 1986. Т. 71, № 6. С. 754—759.
Волосовцев В. Д. Биология цветения и
цитоэмбриология бессемянных сортов
винограда. Автореф. дис. . . . канд. биол.
наук. Ташкент, 1967.
Гаврилова О. М. II С.-х. биология. 1967.
Т. 2, № 4. С. 559—562.
Галукян М. Г., Арутюнян Л'. Г. I/ Учен.
зап. Ереван. Гос.ун-та. 1976. №2. С. 88—92.
Георгиев Г., Терзийска Г. II Трета национал-
не конференция по Ботанике. София,
1983. С. 248—257.
Георгиева Й. II Генетика и селекция (НРБ).
1977. Т. 10, № 5. С. 359—366.
Герасименко И. И., Резникова С. А. II
Ботан. журн. 1968. Т. 53, № 4. С. 505—513.
{Герасимова Е. Н.) Gerassimova H. II Cellule.
1933. Vol. 42. P. 101—144.
Герасимоеа-Навашина Е. Н. II Докл. АН
СССР. 1947а. Т. 56, № 4. С. 415—418.
Герасимоеа-Навашина Е. Н. II Докл. АН
СССР. 19476. Т. 56, № 6. С. 643—646.
Герасимоеа-Навашина Е. Н. II Докл. АН
СССР. 1947в. Т. 57, № 3. С. 285—288.
Герасимоеа-Навашина Е. Н. II Тр. Ботан.
ин-та им. В. Л. Комарова АН СССР.
1951. Вып. 11. С. 294—355.
Герасимоеа-Навашина Е. Н. II Докл. АН
СССР. 1954а. Т. 95, № 4. С. 877—880.
Герасимоеа-Навашина Е. Н. II Ботан. журн.
19546. Т. 39, № 5. С. 655—680.
Герасимоеа-Навашина Е. Н. Двойное
оплодотворение покрытосеменных, его
природа и происхождение: Дис. . . . докт.
биол. наук. Л., 1954в.
Герасимоеа-Навашина Е. Н. II Проблемы
современной эмбриологии. М., 1956. С.
48—57.
Герасимоеа-Навашина Е. Н. II Ботан. журн.
1957а. Т. 42, № 11. С. 1654—1673.
(Герасимоеа-Навашина Е. Н.) Gerassimova-
Navashina H. II Phytomorphology. 19576.
Vol. 7, N 2. P. 150—167.
(Герасимоеа-Навашина E. H.) Gerassimova-
Navashina H. II The Nucleus. 1960. Vol. 3.
N 1. P. 111—120. •■
Герасимоеа-Навашина E. H. II Морфогенез
растений. М., 1961а. Т. 2. С. 431—436.
(Герасимоеа-Навашина Е. Н.) Gerassimova- .
Navashina, H. II Phytomorphology. 19616.
Vol. 11, N 1—2, P. 139—146.
Герасимоеа-Навашина Е. Н. II Тр. Ботан.
ин-та им. В. Л. Комарова АН СССР. 1962.
Сер. 7, вып. 5. С. 238—249.
(Герасимоеа-Навашина Е. Н.) Gerassimova-
Navashina H. II Rev. cytol. et biol. veget.
1969. T. 32, fasc 3—4. P. 301—308.
Герасимоеа-Навашина E. H. II Вестн. Моск.
ун-та. 1971. Сер. 6, биол., почвовед., № 3.
С. 93—94.
Герасимоеа-Навашина Е. Н. II Ботан. журн.
1972. Т. 57, № 4. С. 441—457.
Герасимоеа-Навашина Е. Н. II Докл. АН
СССР. 1977. Т. 236, № 4, С. 990—993.
Герасимоеа-Навашина Е. Н. II Докл. АН
СССР. 1978. Т. 243, № 1. С. 265—267.
(Герасимоеа-Навашина Е. Н.) Gerassimova-
Navashina H. II Phytomorphology. 1982.
Vol. 32, N 2—3. P. 222—233.
Герасимоеа-Навашина Е. Н., Гуляев В. А. II
Бюл. Гл. ботан. сада АН СССР. 1973.
№ 89. С. 14—20.
.338
Герасимоеа-Навашина Е. Н., Капил Р. Н.,
Коробова С. Н., Савина Г. И. II Ботан.
журн. 1968. Т. 53, № 5, С. 614—627.
(Герасимоеа-Навашина Е. Н., Капил Р. Н.,
Коробова С. Н., Савина Г. И.) Gerassimova-
Navashlna H. N., Kapil В. N., Koro-
bova S. N., Savina G. I. II
Phytomorphology. 1969. Vol. 19, N 1. P. 66—81.
Гершенович 3. С, Коваль Д. Д.,
Новикова И. II Учен. зап. Ростов на Дону ун-та.
1953. Т. 19, № 3, С. 179—184.
Гецадзе Г. Н. II Тр. Сухум. опытн.. станции
эфиромасл. культур. 1971. Вып. 10.
С 15—26.
Глущенко Г. И. II Ботан. журн. 1962. Т. 47,
№ 7, С. 1017—1025.
Глущенко Г. И. II Ботан. журн. 1963а.
Т. 48, № 11. С. 1680-1686.
Глущенко Г. И. II Изв. АН СССР. Сер.
биол. 19636. № 5. С. 724—734.
Глущенко Г. I. II Укр. ботан. журн. 1967.
Т. 24, № 3. С. 26—32.
Глущенко Г. I. II Укр. ботан. журн. 1968.
Т. 25, № 1. С. 82-91.
Глущенко Г. I. //Укр. ботан. журн. 1971.
Т. 28, № 5. С. 652—658.
Глущенко Г. И. II Проблемы апомиксиса
у растений и животных. Новосибирск,
1973. С. 144—150.
Голубинский И. Н. II Сов. ботан. 1936.
№ 3, С. 49—60.
Голубинский I. H. II Ботан. журн. АН
УРСР.. 1947. Т. 4, № 1—2. С. 24—34.
Горб Л. К., Цибух В. Г. II Вопросы
интродукции и акклиматизации растений. Киев,
1971. С. 12—13.
Горб Л. К., Цибух В. Г. II Охрана,
изучение и обогащение раст. мира. Киев, 1978.
Вып. 5. С. 97—105.
Грабовская С. Р. II Тр. по прикл. ботан.,
генет. и селекции. 1968. Т. 40, № 1.
С. 65—73.
Граханцева Л. Ш., Смирнов А. Г.
//Морфологическая эволюция высших растений.
М., 1981. С. 33—36.
Гревцова Н. А., Тихомиров В. Н.,
Троицкая Т. А. II Биол. науки. 1980. № И.
С. 61-65.
Гревцова Н. А., Троицкая Т. А. II Бюл.
Моск. о-ва испыт. природы. Отд. биол.
1981. Т. 86, № 2. С. 111—119.
Гревцова Н. А., Троицкая Т. А. II Проблемы
гаметогенеза, оплодотворения и
эмбриогенеза. Ташкент, 1982. С. 12—13.
Гуляев В. А., Герасимоеа-Навашина Е. Н. II
Матер. Всесоюз. симпоз. по эмбриологии
растений. Киев. 1968. С. 53.
Гургенова М. II Сборник им. С. Г. Нава-
шина. М., 1927. С. 157—164.
Гусаковская М. А. Закономерности роста
клеток в процессе макроспоро- и макро-
гаметофитогенеза у половых и апомикти-
ческих видов покрытосеменных растений:
Автореф. дис. . . . канд. биол. наук. М.,
1985.
Гусейнова Н. А. Исследование мужской
и женской генеративной сферы басмы
туркменской в условиях Апшерона. Баку,
1982.
Гусейнова С. О., Ахундова Е. С. II Тез. докл.
VII Всесоюз. симпоз. по эмбриологии
растений. Киев, 1978. Ч. 3. С. 22—23.
Дагигпе С. Ю., Моркунас А. В. //Тр. АН
ЛитССР. 1968. Сер. В. Т. 2. С. 69—75.
Даниелян А. X. //Изв. АН АрмССР. Биол.
науки. 1962. Т. 15, № 7. С. 67—0».
Даниелян А. X. //Изв. АН АрмССР. Биол.
науки. 1963. Т. 16, № 1. С. 87—90.
Даниелян А. X. II Учен. зап. Ереван, гон.
ун-та. 1965. Т. 97. С. 25—30.
Даниелян А. X. II Биол. журн. Армении.
1974. Т. 27, № 11. С. 64—71.
Даскалова Цвегпана II Фитология (НРБ).
1977. Т. 7. С. 59—74.
Денисова Г. А. II Докл. АН СССР. 1961.
Т. 139, № 4, С. 999—1000.
Дзевалтповский А. К. //Ботан. журн. 1976.
Т. 64, № 1. С. 100—111.
Дзюбенко Л. К. II Укр. ботан. журн. 1959.
Т. 16, № 3. С. 8—19.
Дзюбенко Л. К. II Укр. ботан. журн. 1965.
Т. 22, № 1. С. 43—53.
Дудукал Г. Д. II Отдаленная гибридизация
косточковых и ореха. Кишинев, 1973.
С. 121-126.
Дудукал Г. Д. II Интродукция и
акклиматизация растений на Украине и в Молдавии.
Киев, 1974. С. 51—52.
Дудукал Г. Д., Руденко И. С. //Изв. АН
МССР. 1.976. № 5. С. 10—14.
Дудукал Г. Д. II Изв. АН МССР. 1981.
№ 2. С. 24—30.
Елисеев И. Л. II Бюл. Гл. ботан. сада
АН СССР. 1984. № 133. С. 101—104.
Еналеева Н. X., Душаева Н. А. //Апомик-
сис и цитоэмбриология растений. Саратов,
1975. Вып. 3. С. 171—175.
Ерамян Е. Н. //Вотан, журн. 1967. Т. 52,
№ 9. С. 1287—1294.
Ервандян С. Г. II Изв. АН АрмССР. Сер.
биол. 1964. Т. 17, № 7. С. 79—84.
Ервандян С. Г. II Сб. статей Ереван, гос.
ун-та. Сер. естеств. 1965а. № 2. С. 87—98.
Ервандян С. Г. II Изв. АН АрмССР. Биол.,
науки. 19656. Т. 18, № 11. С. 76—81.
Ервандян С. Г. II Биол. журн. Армении.
1971. Т. 24, № 6. С. 69—74.
Ервандян С. Г. II Биол. журн. Армении.
1975. Т. 28, № 9. С. 98—102.
Ервандян С. Г. II Тез. докл. VII Всесоюз.
симпоз. по эмбриологии растений. Киев,
1978. Ч. 3. С. 24—26.
Ермаков И. П. II С.-х. биологии. 1967.
Т. 2, № 1. С. 51—59.
Ермаков И. П., Горяева О. В. Изменения
в структуре клеток семяпочки Lycopersicon
esculentum Mill., сопровождающие
активацию зародышевого мешка перед
оплодотворением. М., 1982а. 12 с. Деп. в
ВИНИТИ, 1982, № 1851—82 деп.
Ермаков И. П., Горяева О. В.
Ультраструктура клеток семяпочки у некоторых
представителей семейства пасленовых. М.,
19826. 30 с. Деп. в ВИНИТИ, 1982,
.№ 1858—82 деп.
Ермаков И. П., Горяева О. А. Изменения
в структуре клеток женского гаметофита
Lycopersicon esculentum Mill, в период
их активации перед оплодотворением. М.,
1982в. 27 с. Деп. в ВИНИТИ, 1982,
№ 2104—93 деп.
Ермаков И. П., Гусаковская М. II Вести,
Моск. гос. ун-та. М., 1983. С. 19.
Жданова Л. П., Иванова Г. В. II
Физиология растений. 1954. Т. 1, № 2. С. 123—ПК).
Зайцева М. И., Звержанская Л. С. II Лио-
миксис и цитоэмбриология растоний, (',»-
. ратов, 1983. С. 48—53.
Иванов М. А., Шаренкова Е. А. II Инн.
22*
:иш
Биол.-гоогр. науч.-иослсд. ин-та при
Ириут. гос.. ум-то. 1909. Т. 23, вып. 3.
С. 3.-18.
Ивапоаа И. Л. II Бюл. Гл. ботан. сада
Alt <!G<;L\ 1905. Вып. 59. С. 36—44.
Иоашша К. В., Орел Л. И. II Тр. по прикл.
ботик.. гочет. и селекции. 1963. Т. 35,
шли. 2. С. 146—150.
Иоффе М. Д. II Ботан. журн. 1976. Т. 61,
.Nil 11. С. 1515-1529.
Камелина О. П. II Актуальные вопросы
эмбриологии покрытосеменных растений.
Л., 1979а. С. 69—74.
Камелина О. П. II Актуальные вопросы
эмбриологии покрытосеменных растений.
Л., 19796. С. 82—89.
Камелина О. П. Сравнительная
эмбриология семейств Dipsacaceae и Morinaceae.
Л., 1980.
(Камелина О. П.) Kamelina О. Р. /I
Fertilization and Embryogenesis in Ovulated
Plants. Bratislava (Czechoslovakia), 1983.
P. 343—346.
Камелина О. П., Малдыбекова К. С. II
Ботан. журн. 1980. Т. 65, № 5. С. 640—646.
Камелина О. П., Проскурина О. Б. II Ботан.
журн. 1987. Т. 72, № 7. С. 909—917.
Камелина О. П., Яковлев М. С. II Ботан.
журн. 1974. Т. 59, № 11. С. 1609—1617.
Камелина О. П., Яковлев М. С. II Ботан.
журн. 1976. Т. 61, № 7. С. 932—945.
(Каменский К. В.) Kamensky К. W. II Angew.
Bot. 1928. Bd 10. S. 387—406.
(Каменский Ф. М.) Kamienski F. II Bot.
Ztg. 1877. Vol. 35. P. 761—776.
Каменский Ф. M. II Тр. СПб. о-ва естество-
испыт. 1886. С. 1—71.
Каменский Ф. М. II Зап. Новорос. о-ва
естествоиспыт. 1890. Т. 12, вып. 1.
С. 179—210.
Канделаки Г. В., КобахидзеЛ. А. II Сообщ.
АН ГССР. 1977. Т. 86, № 1. С. 176—180.
Каневская Г. С, Свиридова А. Д. II Охрана
природы Центр, черноземн. полосы.
Воронеж, .1968. Вып. 6. С. 231—234.
Капинос Г. Е. II Бюл. Гл. ботан. сада
АН СССР. 1975. Вып. 96. С. 38—46.
Карагвозова М. Д., Логофетова В. II Изв.
Ботан. ин-та Бълг. АН. 1967. Кн. 17.
С. 187—198.
Карлова А. А. II Проблемы ботаники на
Урале. Свердловск, 1973а. Вып. 6.
С. 163—166.
Карлова А. А. II Науч. докл. высш. школы.
Биол. науки. 19736. № 8. С. 55—58.
Карлова А. А. II Онтогенез травянистых
поликарпических растений. Свердловск,
1976. С. 14—19.
Карлова А. А. II Онтогенез травянистых
поликарпичвских растений. Свердловск,
1979. С. 121 125.
Касимова X. Н. II Докл. АН УзССР. 1965.
№ 5. С. 49-52.
Касымова X. Н. II Бюл. Гл. ботан. сада
АН СССР. 1966. Вып. 61. С 83—87.
Касымова X. Н. II Вопр. биол., экол. и
физиол. растений Таджикистана.-
Душанбе, 1981. С. 63—66.
Кахидзе Н. Т. //Изв. АН СССР. Сер. биол.
1954. № 1. С. 74—82.
Ключарева М. В. II Журн. общ. биологии.
1973. Т. 34, № 6. С. 907—915..
Кобаснидзе д. Я., Кобахидзе Л. А. II Изв.
АН ГССР. Сер. биол. 1981. Т. 7, № 4.
С. 327—332.
340
Кобахидзе Л. А. II Сообщ. АН ГССР. 1975.
Т. 80, № 1. С. 137—140.
Кобахидзе Л. А. //Изв. АН ГССР. Сер. биол.
1977а. Т. 3, № 5. С. 415—421.
Кобахидзе Л. А. II Сообщ. АН ГССР. 19776.
Т. 86, № 1. С. 137—140.
Кобахидзе,Л. А. II Апомиксис и
цитоэмбриология растений. Саратов, 1978. Вып. 4.
С. 56—58.
Кобахидзе Л. А. II Сообщ. АН ГССР. 1981.
Т. 104, № 2. С. 433—440.
Кобахидзе Л. А. II Сообщ. АН ГССР. 1984.
Т. 113, № 2. С. 377—380.
Коваленко В. А. II Матер. V Всесоюз. совещ.
по эмбриологии растений. Кишинев, 1971.
С. 78—79.
Кокиева Е. И. // Изв. Ассоциации н.-иссл.
ин-тов физ.-мат. факультетов 1-го Моск.
гос. ун-та. 1929. Т. 2, № 2.. С. 145—166.
Кокиева Е. И. II Ботан. журн. 1932. Т. 17,
№ 1, С. 72—99.
Кондорская В. Р. // Вестн. Моск. гос. ун-та.
Биол.-почвовед. 1967а. № 4. С. 45—53.
Кондорская В. Р. II Науч. докл. высш.
школы. Биол. науки. 19676. № 4 (40). С. 69—
75.
Кордюм Е. Л. II Укр. ботан. журн. 1961а.
Т. 18, № 3. С. 48—54.
Кордюм Е. Л. II Укр. ботан. журн. 19616.
Т. 18, № 5. С. 6-13.
Кордюм Е. Л. II Доповвд АН УРСР. 1962.
№ 8. С. 1109—1112.
Кордюм Е. Л. II Укр. ботан. журн. 1963.
Т. 20, № 1. С. 21—28,
Кордюм Е. Л. II Эмбриология
покрытосеменных растений. Кишинев, 1973. С. 24—33.
Кордюм Е. Л. II Укр. ботан. журн. 1964.
Т. 21, № 4. С. 49—52. .
Кордюм Е. Л. II Цитология и генетика.
Киев, 1965. Вып. 1. С. 140—144.
Кордюм Е. Л. II Цитология и генетика.
Киев, 1966. Вып. 2. С. 89—103.
Кордюм Е. Л. II Укр. ботан. журн. 1967а.
Т. 24, № 3. С. 33—40.
Кордюм Е. Л. II Укр. ботан. журн. 19676.
Т. 24, № 2. С. 24—32.
Кордюм Е. Л. II Цитология и генетика.
1967в. Т. 1, № 1. С. 67—75.
Кордюм Е. Л. Цитоэмбриология семейства
зонтичных. Киев, 1967г.
Кордюм Е. Л. II Морфология высших
растений. М., 1968. С. 27—36.
{Кордюм Е. Л.) Kordyum E. L. // Actes
2е Sympos. intern. Ombellif. (Perpignan,
1977). Paru, 1978. С. 269—279.
Кордюм Е. Л., Веледни^кая Д. Л. II Ботан.
журн. 1964. Т. 49, № 11. С. 1609—1615.
Кострюкова К. Ю. II Журн. общ. биологии.
1961. Т. 22, № 1. С. 58—65.
Кудрявцева В. М., Бибикова В. Ф. II Бюл.
Гл. ботан. сада АН СССР. 1969. Вып. 73.
С. 51—54.
Кузманов Б., Юрукова-Грънчарова П. Д. II
Фитология (НРБ). 1983. Кн. 23. С. 3—29.
Кулиева Н. А. II Изв. АН АзССР. Сер. биол.
наук. 1966. № 3. С. 12—18.
Кулиева Н. А. II Изв. АН АзССР. Сер.
биол. наук. 1969. № 3. С. 10—14.
Курбанов д. А. II Изв. АН АзССР. Сер.
биол. наук. 1977. № 4. С. 23—26.
Курбанов Э. А. II Изв. АН АзССР. Сер.
биол. наук. 1981а. № 4. С. 6—12.
Курбанов Э. А. Цитоэмбриология
представителей губоцветных (Thymus L., Zizi-
phora L.). M., 19816.106c. Деп. в ВИНИТИ,
1981, № 4932—81 деп.
Курбанов Э. А. II Бюл. Гл. ботан. сада
АН СССР. 1984. Вып. 134. С. 81—84.
Курбанов д. А., Шоферистова Е. Г. II
Бюл. Гл. ботан. сада АН СССР. 1981.
Вып. 121. С. 92—97.
Лазаревский М. II Тр. по прикл. ботан.,
генет. и селекции. Сер. 8. 1934. № 2.
С. 213—227.
Литвак А. И. О развитии мужского гамето-
фита некоторых покрытосеменных
растений по данным микрокиносъемки и
люминесцентной микроскопии: Автореф.
дис. . . . канд. биол. наук. Саратов, 1966.
Литвак А. И. Люминесцентная макро- и
микроскопия в исследованиях плодовых
культур и винограда. Кишинев, 1978.
Литвак А. И. II Научно-технический
прогресс в виноградарстве и виноделии.
Кишинев, 1980. С. 24—32.
Литвак А. И., Якимов Л. М. II Тр. Молд.
НИИ виногр. и виноделия. Кишинев,
1971. Т. 18. С. 68—83.
Литвиненко И. М., Дзевалтовский А. К. II
Укр. ботан. журн. 1972. Т. 29, № 5.
С. 614—618.
Литвиненко И. М., Жоголева В. Г. II 1нтро-
дукц. та акл1матиз. рослин на Украшь
1980. Вип. 16. С. 97—99.
Лодкина М. М. II Ботан. журн. 1966. Т. 51,
№ 5. С. 649-659.
Лудникова Л. А. II Изв. АН МССР. Сер.
биол. и хим. науки. 1965, № 6. С. 97—
104.
Лудникова Л. А. II Изв. АН МССР. Сер.
биол. и хим. науки. 1971. № 1. С. 7—12.
Лунева М. 3., Поддубная-Арнолъди В. А. II
Бюл. Гл. ботан. сада АН СССР. 1973.
Вып. 89. С. 36—45.
(Лунева М. 3., Поддубная-Арнолъди В. А.,
Бхандари Н. Н.) Lunyeva M. Z., Poddub-
naya- Arnoldi V. A., Bhandari N. N. II
Phytomorphology. 1970 (1971). Vol. 20,
N 3. P. 270—281.
Лунева M. 3., Поддубная-Арнолъди В. А.,
Бандари Н. П. II Генетика. 1972. Т. 8,
№ 9. С. 16—29.
Мантос А. М. II Докл. АН СССР. 1948.
Т. 61, № 4. С. 725—728.
Маркова Л. Г. II Докл. АН СССР. 1945.
Т. 49, № 2. С. 144—145.
Маркова Л. Г. И Ботан. журн. 1946. Т. 31,
№ 1. С. 19—26.
Маркова Л. Г. II Изв. Зап.-Сиб. фил.
АН СССР. Сер. биол. 1947. Вып. I, ботан.
С. 9—19.
Маркова Л. Г. II Бюл. Моск. о-ва испыт.
природы. Отд. биол. 1957. Т. 56, вып. 4.
С. 55—64.
Махалова М. Р. II Докл. ВАСХНИЛ. 1964.
№ 7. С. 18—22.
Мерзликина Т. И. II Бюл. Гл. ботан. сада
АН СССР. 1954. Вып. 19. С.. 135—138.
Микаелян С. Г. II Изв. АН АрмССР. Биол.
науки. 1964. Т. 17, № 8. С. 79—84..
Микаелян С. Г. II Биол. журн. Армении.
1966. Т. 19, № 10. С. 34—42.
Микаелян С. Г. II Биол. журн. Армении.
1967а. Т, 20, № 4. С. 53—60.
Микаелян С. Г. II Биол. журн. Армении.
19676. Т. 20, № 8. С. 95—100.
Минаева В. Г. II Комплекс, изучение полезн.
растений Сибири. Новосибирск, 1974.
С. 79—84.
Михайлова Е. И. II Сб. аспирантских работ
Казанск. ун-та. Естеств. науки: Биологин.
1966. Ч. I. С. 49—58.
Мовсесян С. Н. II Изв. АН АрмССР. Биол.
науки. 1953. Т. 6, № 7. С. 27—33.
Мовсесян С. Н. II Изв. АН АрмССР. Биол.
науки. 1963. Т. 16, № 5. С. 43—47.
Мовсесян С. Н. II Изв. АН АрмССР. Биол.
науки. 1964. Т. 17, № 2. С. 77—83.
Мовсесян С. Н. II Апомиксис и селекция.
М., 1970. С. 126—134.
Мовсесян С. Н. II Эмбриология
покрытосеменных растений. Кишинев, 1973.
С. 140—147.
Мовсесян С. Н. II Цитология и генетика.
Киев, 1977. Т. 11, № 3. С. 250-254.
Мовсесян С. Н. II Биология. 1979. Вып. 1.
С. 42—49.
Мовсесян С. Н. II Вопросы биологии
(Ереван). 1981. № 2. С. 27—33.
Мовсесян С. Н., Багдасарян А. М. II Изв.
АН АрмССР. Биол. науки. 1965. Т. 18,
№ 10. С. 29—34.
Мовсесян С. Н., Багдасарян А. М. II Биол.
журн. Армении. 1966. Т. 19, № 7. С. 47—
52.
Мовсесян С. Н., Багдасарян А. М.,
Каспарова И. П. II Биол. журн. Армении. 1972.
Т. 25, № 9. С. 64—72.
Мовсесян С. И., Каспарова И. П. II Учен,
зап. Ереван, гос. ун-та. Естеств. науки.
1974. № 1. С. 84—90.
Мовсесян С. Н., Каспарова И. П. II Ботан.
журн. 1977. Т. 62, № 3. С. 422—429.
Мовсесян С. Н., Каспарова И. П. II Учен.
зап. Ереван, гос. ун-та. Естеств. науки.
1978а. № 3. С. 76—81.
Мовсесян С. Н., Каспарова И. П. II Тез. докл.
VII Всесоюз. симпоз. по эмбриологии
растений. Киев, 19786. Ч. 3. С. 56—57.
Мовсесян С. Н., Оганесян P.A./I Биол. журн.
Армении. 1969. Т. 29, № 5. С. 56-66.
Мовсесян С. Н., Хачатрян Т. Л. II Учен.
зап. Ереван, гос. ун-та. Естеств. науки.
1975. № 2 (129). С. 110—117.
Мовсесян С. И., Хачатрян Т. Л. II
Апомиксис и цитоэмбриология растений. 1978.
№ 4. С. 79—80.
Модилевский Я. С. II Журн. Ин-та ботан.
АН УССР. 1936. № 10 (18). С. 43—52.
Модилевский Я. С. II Журн. Ин-та ботан.
АН УССР. 1937. № 13—14. С. 63—79.
Модилевский Я. С. II Журн. Ин-та ботан.
АН УССР. 1938. № 17 (25). С. 97-112.
Модилевский Я. С. II Журн. Ин-та ботан.
АН УССР. 1939. № 21—22 (29-30).
С. 201—216.
Модилевский С. Я. II Ботан. журн.
АН УССР. 1946. Т. 2, № 3-4. С. 3-18.
Модилевский С. Я., Дзюбенко Л. К. II
Журн. Ин-та ботан. АН УССР. 1937.
№ 13—14. С. 109—125.
Модилевский Я. С, Дзюбенко Л. К. II
Журн. Ин-та ботан. АН УССР. 1939.
№ 23 (31). С. 3—12.
Модилевский Я. С, Дзюбенко Л. К. II Укр.
ботан. журн. 1966. Т. 23. С. 31—40.
Модилевский Я. С, Дзюбенко Л. К. II
Укр. ботан. журн. 1967. Т. 24, № 2. С. 15 —
23.
Молхова Е. К. II Изв. на Ин-та по растонио-
въдство Бълг. АН. 1963. Т. 17. С. 49-50.
Молхова Е., Филева М. II Генетика и солок-
пия (НРБ). 1969. № 2. С. 77-85.
Москалева Г. И., Огородникова В. Ф. II
'М\
Тр. прикл. ботам., гонет. и селекции.
1977. Т. (SO, iii.ni. 2. С. 16—24.
Мохамег) А . Л ., Дмитриева И. И. II
Физиологи)! растений. 1977. Т. 24, вып. 6.
С. 1280—1294.
Муратов 3. М. II Бюл. Среднеаз. гос. ун-та.
Ш9. Вып. 28. С. 195—215.
Мутафян Е. М. •// Изв. АН АрмССР. Биол.
науки. 1964. Т. 17, № 1. С. 95—99.
Мутафян Е. М. II Изв. АН АрмССР. Биол.
пауки. 1965. Т. 18, № 1. С. 55—61.
Мутафян Е. Я. II Изв. с.-х. наук АрмССР.
1971. № 9. С. 113—116.
(Навашин С. Г.) Nawaschin S. II Osterr.
bot. Z. 1909. Bd 59. S. 457—467.
Навашин С. Г. Об оплодотворении у
сложноцветных и орхидных. // Избр. тр. М.;
Л., 1951. Т. 1. С. 225—229.
Наумова Т. Н. II Ботан. журн. 1970а.
Т. 55, № 5. С. 638—648.
Наумова Т. Н. II Ботан журн. 19706. Т. 55,
№ 9. С. 1270—1281.
Наумова Т. Н. II Тез. докл. Всесоюз. симпоз.
по применению электронной микроскопии
в ботан. исследованиях. Рига, 1978.
С. 180—182.
Наумова Т. Н. // Актуальные вопросы
эмбриологии покрытосеменных растений. Л.,
1979. С. 46—57.
Нгуен Данг Фонг. Анатомическое и
эмбриологическое изучение культурных и диких
форм моркови: Автореф. дис. . . . канд.
биол. наук. М., 1965.
Негрулъ А. М. II Тр. прикл. ботан., генет.
и селекции. Сер. 8. 1934. Вып. 2. С. 229—
268.
Низамова X. II Учен. зап. Душанб. гос.
пед. ин-та.' 1973. № 87. С. 90—93.
Никитичева 3. И. II Ботан. журн. 1966.
Т. 51, № 11. С. 1607-1617.
Никитичева 3. И. II Ботан. журн. 1968.
Т. 53, № 12. С. 1704—1715.
Никитичева 3. И. II Ботан. журн. 1971,
Т. 56, № 1. С. 93—105.
Никитичева 3. И. II Ботан. журн. 1979а.
Т. 64, № 11. С. 1567—1582.
Никитичева 3. И. II Актуальные вопросы
эмбриологии покрытосемянных растений.
Л., 19796. С. 130—157.
Никитичева 3. И., Терёхин Э. С. II Ботан.
журн. 1973. Т. 58, № 5. С. 680—690.
Никитичева 3. И., Терёхин Э. С. II Ботан.
журн. 1976. Т. 61, № 5. С. 690—700.
Николаева 3. В. II Ботан. журн. 1962. Т. 47,
№ 2. С. 1333—1338.
Николаева 3. В. II Ботан. журн. 1966.
Т. 51, № 2: С. 283—291.
Новикова В. М. II Тез. докл. VII Всесоюз.
симпоз. по эмбриологии растений. Киев,
1978. Ч. 3. С. 61—62.
Новикова В. М. II Бюл. Никит, ботан. сада.
1981. № 31/46. С. 91—96.
Оганесян М. Г. II Биол. журн. Армении.
1968. Т. 21, № 3. С. 52—58.
Оганесян М. Г. II Биол. журн. Армении.
1975. Т. 28, № 9. С. 103—107.
Огородникова В. Ф. II Тр. прикл. ботан.,
генет. и селекции. 1976. Т. 58, вып. 1.
С. 124—129.
Окулова С. М. II Сб. аспирант, работ Казан.
ун-та. Естеств. науки: Биология. 1968.
С 175—178.
Орел Л. И. Ц Докл. Всесоюз. акад. с.-х.
наук. 1957а. Вып. 1. С. 11—14.
Орел, Л. И. II Тр. прикл. ботан., генет. и
селекции. 19576. Т. 31, вып. 2. С. 145—
149.
Орел Л. И. II Вестн. с.-х. науки. 1957в. № 2'.
С. 132—135.
Орел Л. И. II Культурная флора СССР. М.;.
Л., 1958. Т. 20. С. 190—194.
Орел Л. И. II Докл. АН СССР. 1962. Т. 147,,
№ 6. С. 1495—1498.
Орел Л. И., Брежнев Д. Д. Томаты. Л.,.
1964. С. 149-168.
Орел Л. И., Варшашна Г. П. II Тр. прими
ботан., генет. и селекции. 1983. Т. 74.
С. 50—56.
Орел Л. И., Вишнякова М. А.,
Константинова Л. Н. II Цитология. 1984. Т. 26,.
№ 7. С. 767—772.
Орел Л. И., Жакова М. А. II Ботан. журн.
1976. Т. 61, №■ 12. С. 1720—1729.
Орел Л. И., Жакова М. А. //Ботан. жури.
1977. Т. 62, №12. С. 1720—1730.
Орел Л. И., Огородникова В. Ф., Голубееа
Е. А. //Тез. докл. VII Всесоюз. симпоз..
по эмбриологии растений. Киев, 1978.
Ч. 1. С. 62—63.
Орлова И. Н. II Тр. по прикл. ботан., генет.
и селекции. 1965. Т. 37, № 3. С. 143—152.
Острецова И. Н. Изучение полового
воспроизведения у видов рода Solanum L.
в связи с задачами селекции: Автореф.
дис. . . . канд. биол. наук. М., 1974.
Острецова И. Н., Резникова С. А. //Бюл.
Гл. ботан. сада АН СССР. 1977. Вып. 106.
С. 91—95.
Пайзиева С. А. II Вестн. Ленингр. гос. ун-та.
Биология. 1962. Т. 21, вып. 4. С. 148—153.
Панютина-Мухина В. Д. II Бюл. Моск. о-ва
испыт. природы. Отд. биол. 1933. Вып. 42.
С. 61—64.
Персидский Д. Я. II В1сник Кшвського
ботан. саду. 1934. Вип. 17. С. 11—18.
Персидсъкий Д. Я. II Журн. Ин-та ботан.
АН УССР. 1935. № 4 (12). С. 35-49.
Персидсъкий Д. Я-, Модилевсъкий Я. С. II
Журн. Ин-та ботан. АН УССР. 1934.
№ 3 (11). С. 33—50.
Петрова К. А. //Тр. Гл. ботан. сада
АН СССР. 1951а. Т. 11. С. 207—216.
Петрова К. А. II Бюл. Гл. ботан. сада
АН СССР. 1951в. Вып. 9. С. 39-Г-53.
Петровская-Баранова Т. П. II Тр. Гл. ботан.
сада АН СССР. 1959. Т. 6. С. 211—225.
Пирев М. Н. II Биология оплодотворения и
гетерозис культурных растений.
Кишинев, 1963. Вып. 2. С. 65—78.
Пирев М. Н. II Биология оплодотворения и
генерозис культурных растений.
Кишинев, 1965. Вып. 3. С. 115—125.
Пирев М. Н. II Изв. АН МССР. Сер. биол.
и хим. наук. 1966. № 11. С. 91—94.
Пирев М. Н. II Изв. АН МССР. Сер. биол.
и хим. наук. 1968. № 4. С. 62—71.
Плеханова М. Н., Вишнякова М. А. II Сб.
науч. тр. по прикл. ботан., генет. и
селекции. 1986. Т. 99. С. 111—115.
Плиско М. А. 11 Апомиксис и селекция.
М., 1970. С. 134-141.
Плиско М. А. II Ботан. журн. 1971а. Т. 56,
№ 5. С. 582—598.
Плиско М. .4.//Цитология. 19716. Т. 13,
№ 10. С. 1211-1217.
Плиско М. А. II Электронная микроскопия
в ботанических исследованиях.
Петрозаводск, 1974а. С. 88—90.
Плиско М. А. II Ботан. журн. 19746. Т. 59,
№ 2. С. 246-251.
342
Ллиско М. А. II Ботан. журн. 1977а. Т. 62,
№ 2. С. 161—172.
Плиско М. А. II Ботан. журн. 19776. Т. 62,
№ 11. С. 1612-1620.
Плющ Т. А., Банникова В. П., Главац-
кая О. М. II Укр. ботан. журн. 1986. Т. 43,
№ 6. С. 15—20.
ПоддубнаяВ. А. //Бюл. Моск. о-ва испыт.
природы. Отд! биол. 1926. Т. 35, вып. 3—4,
С. 291—313.
{Поддубная-Арнолъди В. A.) Poddubnaja-
Arnoldi V. А. II Planta. 1927. Bd 4, Н. 3.
S. 284—298.
{Поддубная-Арнолъди В. A.) Poddubnaja-
Arnoldi V. A./lBeih. bot. Ztbl. 1931.
Bd 48, Abt. 2, H. 2. S. 141—237.
{Поддубная-Арнолъди В. A.) Poddubnaja-
Arnoldi V. A. //Planta. 1933a. Vol. 19,
H. 1—2. P. 19—86.
{Поддубная-Арнолъди В. A.) Poddubnaja-
Arnoldi V. A. //Planta. 1933b. Vol. 19.
P. 299—304.
{Поддубная-Арнолъди В. A.) Poddubnaja-
Arnoldi V. A. II Planta. 1934. Bd 21, H. 3.
S. 381—386.
{Поддубная-Арнолъди В. A.) Poddubnaja-
Arnoldi V. A. //Planta. 1935. Bd 23, H.
1—2. P. 19—46.
{Поддубная-Арнолъди В. A.) Poddubnaja-
Arnoldi V. A./lBeih. bot. Ztbl. 1935.
Bd 53, Abt. A. S. 309—339.
{Поддубная-Арнолъди В. A.) Poddubnaja-
Arnoldi V. A. II Planta. 1936. Bd 25.
S. 502—529.
Поддубная-Арнолъди В. А. //Бюл. Моск. о-ва
испыт. природы. Отд. биол. 1939а. Т. 48,
№ 5—6. С. 186—198.
Поддубная-Арнолъди. В. А. II Докл.
АН СССР. 19396. Т. 24, № 4. С. 376—379.
Поддубная-Арнолъди В. А. //Ботан. журн.
1940. Т. 25, № 1. С. 75—91.
Поддубная-Арнолъди. В. А. II Бюл. Моск.
о-ва испыт. природы. Отд. биол. 1947.
Т. 52, № 1. С. 81—90.
Поддубная-Арнолъди В. А. II Проблемы
ботаники. М., 1958. Вып. 3. С. 196—247.
{Поддубная-Арнолъди В. A.) Poddubnaja-
Arnoldi V. А. II Wiadomosci botanoczne.
1980. Vol. 24, N 4. P. 241—248.
Поддубная-Арнолъди В. А., Даниелян A. X.I/
Бюл. Гл. ботан. сада АН СССР. 1985.
"Вып. 137. С. 95—102.
Поддубная-Арнолъди В. А., Лодкина М. М. II
Ботан. журн. 1945. Т. 30, № 5. С. 195—
216.
Полщук В. С. II Укр. ботан. журн. 1972.
Т. 29, № 1. С. 25-30.
Полщук В. С. II Изв. АН МССР. Сер. биол.
и хим. наук. 1973. № 1. С. 81—82.
Полщук В. С, Дзевалтовсъкий А. К. II
Укр. ботан. журн. 1971. Т. 28, № 6.
С. 778^781.
Попов П. С. II Биохимия и физиология
масличных растений. Майкоп, 1967. Вып. 2.
. С. 380-389.
Попова Л. К. II Апомиксис и цитоэмбриоло-
гия растений. М., 1978. № 4. С. 100—101. -
Попова Л. К., Колесников С. М. II Изв.
АН МССР. Сер. биол. и хим. наук. 1973.
№ 1. С. 80-81.
Райкова И. А., Пащенко 3. М. II Интро-
дукц. и акклиматиз. раст. Ташкент, 1977.
Вып. 14. С. 112—120.
Раси-Заде Г. М. II Докл. АН АзССР. 1967.
Т. 23, № 4. С. 62-65.
Резникова {Адмиральская) С. А. II
Полиплоидия у растений. М., 1962. С. 222—
229.
Резникова С. А., Ярыгина С. А., Зубко
Й. H./I Матер. Всесоюз. симпоз. по
эмбриологии растений. Киев, 1968. С. 183—186.
Роборовская В. Н. II Тр. по прикл. ботан.,
генет. и селекции. 1965. Т. 37, № 3.
С. 19-23.
Романов И. Д. II Тр. по прикл. ботан.,
генет. и селекции. 1965. Т. 37, № 3.
С. 132—142.
Романов И. Д. II Ботан. журн. 1970. Т. 55,
№ 11. С. 1563—1569.
Руденко X. Ю. II BicHHK Кшвського ботан.
саду. 1929. Вип. 9. С. 18—30.
Руденко Ф. Е. II BicHHK Кшвського ботан.
саду. 1930. Вип. 11. С. 41—55.
Руденко Ф. Е. II Науч. докл. высшей школы.
Биол. науки. 1962. № 1. С. 119—122.
Руденко X. Ю. II BicHHK Кигвського ботан.
саду. 1933. Т. 16. С. 3—16.
Руми В. А. II Бюл. АН УзССР. 1945. № 7.
С. 22—25.
Руми В. А. II Бюл. АН УзССР. 1947. № 2.
С. 20—23.
Рустамова Д. М., Ходжаева Г. А. II
Вопросы экологии растений и фитоценологии.
Ташкент, 1984. С. 64—68.
Рушковский С. В. II Биохимия и
физиология масличных растений. Майкоп, 1967.
Вып. 2. С. 15—28.
Рибченко О. I. II Укр. ботан. журн. 1959.
Т. 16, № 1. С. 44-56.
Рибченко О. I. II Укр. ботан. журн. 1963а.
Т. 20, № 2. С. 40—46.
Рибченко О. I. II Укр. ботан. журн. 19636.
Т. 20, № 3, С. 33—42.
Рибченко О. I. II Укр. ботан. журн. 1963в.
Т. 20, № 5. С. 33—43.
Рибченко О. I. II Укр. ботан. журн. 1963г.
Т. 20, № 6. С. 3—14.
Рибченко О. I. II Укр. ботан. журн. 1964.
Т. 21, № 2. С. 37—46.
Рибченко О. I. Цитоембр10ЛОг1я родини
пасльонових. Ки1в, 1965. 160 с.
Савченко Л. Ф. Изучение особенностей микро-
спорогенеза шалфея мускатного (Salvia
sclarea L.) в связи с селекцией и
семеноводством: Автореф. дис. ... канд. биол.
наук. Кишинев, 1980.
Савченко Л. Ф., Резникова С. А. //Тр. по
прикл. ботан., генет. и селекции. 1975.
Т. 33, № 2. С. 250—254.
Савченко Л. Ф., Резникова С. А. II Цито-
лого-эмбриологические и генетико-био-
химические основы опыления и
оплодотворения растений. Киев, 1982. С. 333—
335.
Самвелян Г. Е. Цитоэмбриологическое
исследование начальных и поздних стадий
эмбриогенеза некоторых сортов винограда
(Vitis vinifera), возделываемых в
условиях Армении: Автореф. дис. . . . канд.
биол. наук. Ереван, 1973.
Сапанкевич П. В. II Тр. Брянск, лесохоя.
- ин-та. 1951. Т. 5. С. 129—138.
Сапанкевич П. В. II Тр. Ин-та леса. 1953.
Т. 11. С. 168—178.
Светозарова В. В. II Бюл. Гл. ботан. сада
АН СССР. 1967. Вып. 67. С. 36-43.
Селиванов А. С, Тарное В. С. II Апомиксис
и цитоэмбриология растений. Сарато»,
1975. Вып. 3. С. 109—122.
Ж\
Сердюк Л. С, ХвеОшшч, О. А., Ванникова
B. П. //Докл. ЛИ СССР. 1978. Т. 241,
№ 3. С. 730---732.
Симоненко В. К, // Цитология и генетика.
1977. Т. 11, ,№ 5. С. 395—399.
Симоненко В. К. II Цитология и генетика.
1982, Т. 16, № 5. С. 34—41.
Симоненко В. К. II Ботан. журн. 1986.
Т. 71, № 9. С. 1222—1227.
Симонова О. Н. II Охрана и рациональное
использование флоры и фауны Нижнего
Приамурья и Сахалина. Хабаровск, 1979.
C. 18—25.
Симонян Е. Г. //Изв. АН АрмССР. Биол.
науки. 1956. Т. 9, № 10. С. 35—42.
Симонян Е. Г. II Изв. АН АрмССР. Биол.
науки. 1961. Т. 14, № 11. С. 39—44.
Симонян Е. Г., Самвелян Г. Е.ПЖгъ.
АН АрмССР. Биол. науки. 1965. Т. 18,
№ 9. С. 12—22.
Скокова А. А., Курлянчик И. А. //Вопр.
биологии, охраны и использования
растений в Рязанской обл. 1980. С. 50—64.
Скрябишевский В. Морфологические и
эмбриологические исследования чужеядного
растения Arcenthobium oxycedri D. С.
(Razoumowskia Hoffm.). Ялта, 1890.
Скупченко Л. А. //Экология опыления
растений. Пермь, 1984. № 8. С. 112—120.
Скупченко Л. А., Еоломийцева Т. Ф.,
Александрова М. И., Моисеев К. А. II
Экологические исследования природных
ресурсов Севера нечернозем, зоны. Сыктывкар,
1977. С. 51-59.
Скупченко Л. А., Моисеев К. А. II Тр. Коми
Фил. АН СССР. Сыктывкар, 1980. № 47.
С. 18-30.
Скупченко Л. А., Моисеев К. А.,
Скупченко В. Б. II Тр. по прикл. ботан., ге-
нет. и селекции. 1977. Т. 60, вып. 2.
С. 82—89.
Смирнов К. В., Перепелицина Е. П. II
Докл. Тимирязев, с.-х. академии. 1979.
Вып. 251. С. 29—33.
Смирнова Н. К. Структурные и
метаболические особенности формирования бессемян-
ности у винограда: Автореф. дис. . . .
канд. биол. наук. М., 1984.
Солнцева М, П. II Докл. АН СССР. 1971.
Т. 197, № 1. С. 234—237.
Солнцева М. Я. // Проблемы апомиксиса
у растений и животных. Новосибирск,
1973а. С. 161—169.
Солнцева М. П. II Ботан. журн. 19736.
Т. 58, № 9. С. 1261—1277.
Солнцева М. П. II Эмбриология
покрытосеменных растений. Кишинев, 1973в.
С. 47—57.
{Солнцева М. П.) Solntzeva M. P. 11
Fertilization in higher plants. Amsterdam, 1974.
P. 311—324.
Солнцева М. П. II Цитогенетические основы
селекции растений. Новосибирск, 1977.
С. 114—122.
Солнцева М. П. II Апомиксис и цитоэмбрио-
логия растений. Саратов, 1978а. С. 108—
110.
(Солнцева М. П.) Solntzeva М. Р. II Ргос.
Indian nath. Sci. Acad. B. 1978b. Vol. 44.
P. 78—90.
Солнцева М. П. II Актуальные вопросы
эмбриологии покрытосеменных. Л., 1979.
С. 39-46.
Солнцева М. П. II Матер. 6-го Моск. совещ.
по филогении растений. М., 1982. С. 134—
136.
Солнцева М. П. II Проблемы гаметогенеза,
оплодотворения и эмбриогенеза. Ташкент,.
1983. С. 127—128.
Солнцева М. П., Камелина О. П. //Ботав.
журн. 1976. Т. 61, № 2. С. 254—263.
Сукачев В. Н. II Ботан. журн. 1940. Т. 25,
№ 4—5. С. 297-303.
Тамамшян С. Г., Денисова Г. А. //Ботан.
журн. 1959. Т. 44, № 4. С. 433—446.
Тарасенко Л. В. II Укр. ботан. журн. 1985.
Т. 42, № 4. С. 71-75.
Татпевосян В. В. II Биол. журн. Армении.
1977. Т. 30, № 11. С. 102.
Татищева С. С. II Изв. АН ТССР. Сер.
биол. наук. 1971. № 1. С. 14—21.
Татищева С. С. //Ботан. журн. 1975.
Т. 60, № 12. С. 1707—1720.
Татищева С. С. II Цитолого-эмбриологиче-
ские и генетико-биохимические основы
опыления и оплодотворения растений.
Киев, 1982. С. 335—338.
Терёхин 9. С. II Ботан. журн. 1966. Т. 51,
№ И. С. 1601-1607.
Терёхин Э. С. II Ботан. журн. 1973. Т. 58,
№ 12. С. 1775—1888.
Терёхин 9. С. II Ботан. журн. 1979. Т. 65,
№ 10. С. 1390—1400.
Терёхин 9. С, Никитичева 3. И. II Бюл.
Моск. о-ва испыт. природы. Отд. биол.
1976. Т. 81, № 3. С. 74-88.
Терёхин Э. С, Никитичева 3. И. Семейство
Orobanchaceae: Онтогенез и филогенез.
Л., 1981.
Терёхин Э. С, Никитичева 3. И.,
Яковлев М. С. II Ботан. журн. 1975. Т. 60,
. № И. С. 1603-1613.
Терёхин Э. С, Серафимович Н. Б. II
Ботан. журн. 1984. Т. 69, № 6. С. 782—788.
Терёхин 9. С, Яковлев М. С. II Ботан.
журн. 1967. Т. 52, № 6. С. 745—758.
Терёхин 9. С, Яковлев М. С,
Никитичева 3. И. II Ботан. журн. 1975. Т. 60,
№ 2. С. 153—162.
Ткаченко Г. В. Биология цветения и
оплодотворения винограда в Закарпатье:
Автореф. дис. . . . докт. биол. наук. М., 1958а.
Ткаченко Г. В. II Науч. докл. высшей школы.
Биол. науки. 19586. № 4. С. 129—133.
Ткаченко Г. В. II Докл. и сообщения
Ужгород, гос. ун-та. Сер. биол. 1959. № 3.
С. 3-5.
Ткаченко Г. В. //Морфогенез растений. М.,
1961. Т. 2. С. 371—374.
Ткаченко Г. В. II Вестник Моск. гос. ун-та.
Сер. биол. 1969. № 3. С. 59—62.
Тучина Н. Г. II Тр. 7-й конф. мол. ученых
Ботан. ин-та АН СССР. Л., 1985. 7 с.
Деп. в ВИНИТИ, 1985, № 6591-85 деп.
Тучина Н. Г., Камелина О. П. //Проблемы
гаметогенеза, оплодотворения и
эмбриогенеза. Ташкент, 1983. С. 137—138.
Устинова Е. И. II Агробиология. 1951. № 3.
С. 104—113.
Устинова Е. И. II Изв. АН СССР. Сер. биол.
1954. № 5. С. 74—87. .
Устинова Е. И. II Докл. АН СССР. 1955.
Т. 100, № 6. С. 1163-1166.
Устинова Е. И. II Вестн. Моск. гос. ун-та.
Сер. биол. 1957. № 4. С. 25—37.
Устинова Е. И. II Вестн. Моск. гос. ун-та.
Сер. биол. 1962. № 1. С. 25—33.
Устинова Е. И. II Докл. ВАСХНИЛ. 1964а.
№ 4. С. 6—10.
344
Устинова Е. И. II Бюл. Моск. о-ва испыт.
природы. Отд. биол. 19646. Т. 69, вып. 4.
С. 111—117.
Устинова Е. И. II Проблемы современной
эмбриологии. М., 1964. С. 118—126.
Устинова Е. И. II Апомиксис и селекция.
М., 1970. С. 110—116.
Устинова Е. И., Нестерова Т. Г. II Докл.
ВАСХНИЛ. 1951. Вып. 11. С. 14—22.
{Федорчук В. Ф.) Fedortschuk W. F. II Planta.
1931. Bd 14, Hf. 1. S. 94—111.
{Федорчук В. Ф.) Fedortschuk W. F. II Planta.
1932. Bd 16. S. 554-574.
-Фтн В. В. II Укр. ботан. журн. 1921. Т. 1,
вып. 1—2. С. 82—83.
{Финн В. В.) Finn W. W. II Bot. Gaz. 1925.
Vol. 80, N 1. P. 1—25.
■Фтн В. В. II Зап. Кшв. шст. нар. oceiTH.
1926а. Т. 1. С. 129—132.
{Финн В. В.) Finn W. W. II Вег. Dtsch. bot.
Ges. 1926b. Bd 44. S. 133—137.
■{Финн В. В.) Finn W. W. II Ber. Dtsch.
bot. Ges. 1928. Bd 46. S. 235—246.
Фтн В. В. II Журн. 1н-ту ботан. АН УРСР.
1930. № 20. С. 77—96.
■Фтн В. В. II Журн. 1н-ту ботан. АН УРСР.
1937. № 12 (20). С. 83—89.
■Финн В. В. II Сов. ботан. 1939. № 2. С. 7—
19.
Харитонашвили Л. А. Цитоэмбриология
некоторых грузинских сортов винограда:
Автореф. дис. . . . канд. биол. наук.
Тбилиси, 1971а.
.Харитонашвили Л. А. II Матер. 5-го Все-
союз. совещ. по эмбриологии растений.
Кишинев, 19716. С. 189.
Харитонашвили Л. А. II Сообщения
АН ГССР. 1981. Т. 100, № 2. С. 413—415.
Харитонашвили Л. А., Микаберидзе Л. Е. II
Тез. докл. VII Всесоюз. симпоз. по
эмбриологии растений. Киев, 1978. Ч. '3.
С. 102—104.
Х^ачатрян Т. Л. II Биол. журн. Армении.
1975. Т. 28, № 1. С. 51—59.
-Хведынич О. А. Процесс оплодотворения
и ранние стадии развития зародыша и
эндосперма при отдаленной гибридизации:
Автореф. дис. . . . канд. биол. наук.
Киев, 1972.
Х^ведынич О. А., Банникова В. П.,
Сердюк Л. С. II Укр. ботан. журн. 1981.
Т. 38, № 6. С. 18—21.
Хохлов С. С. II Учен. зап. Ульянов, гос.
пед. ин-та. 1968. Вып. 23, № 3. С. 57—66..
Дибух В. Г., Горб Л. К. II Матер. V Конф.
молодых ученых ботанических садов
Украины и Молдавии. Киев, 1970. С. 144—
145.
Цингер Н. В., Поддубная-Арнольди В. А.,
Петровская Т. П., Полунина Н. Н. II
Тр. Моск. о-ва испыт. природы. 1965.
Т. 13. С. 201-237.
-Чапик Р. II Тр. Биол. ин-та Сиб. отд.
АН СССР. 1977. Вып. 32. С. 122—127.
-Чубирко М. М. II Тез. докл. VII Всесоюз.
симпоз. по эмбриологии растений. Киев,
1978. Ч. 2. С. 62—64.
Шамров И. И. II Ботан. журн. 1986. Т. 71,
№ 6. С. 733—739.
Шапанова Л. Г. II Физиолого-биохимические
особенности сахарной свеклы в условиях
Киргизии. Фрунзе, 1977. С. 34—41.
Шаренкова Е. А. Биология цветения,
опыления и цитоэмбриологичеокое
исследование некоторых видов сирени в условиях
Прибайкалья: Автореф. дис. . . . канд.
биол. наук. Иркутск, 1969.
Шаренкова Е. А., Иванов М. А. II Бюл. Гл.
ботан. сада АН СССР. 1970. Вып. 70.
, С. 41-51.
Шевченко С. В., Елманова Т. С. //Ботан.
журн. 1982. Т. 67, № 3. С. 330—333.
Шоферистова Е. Г. II Тр. Гос. Никит, ботан.
сада, 1970. Т. 46. С. 178—183.
Шоферистова Е. Г. Цитоэмбриологичеокое
исследование некоторых представителей
рода Lavandula L. в связи с задачами
селекции: Автореф. дис. . . . канд. биол.
наук. Кишинев, 1978.
Шоферистова Е. Г., Резникова С. А. II
Цитология и генетика. 1977. Т. 11, № 5.
С. 403-409.
Шугаева Е. В. II Генетика. 1972. Т. 8, № 7.
С. 37—46.
Шугаева Е. В. II Генетика. 1979. Т. 15, № 1.
С. 138-144.
Шугаева Е. В. II Биология, селекция и
семеноводство лекарственных культур. М.,
1982. С. 11—16.
Шугаева Е. В. II Проблемы гаметогенеза,
оплодотворения и эмбриогенеза. Ташкент,
1983. С. 156—157.
Шугаева Е. В. Цитоэмбриология некоторых
лекарственных видов рода Valeriana L.:
Автореф. дис. . . . канд. биол. наук. Л.,
1985.
Щепотъев Ф. Л. II Агротехника и селекция
бересклетов. Харьков, 1939. С. 109—149.
Экстер Я. 9. II Тр. Одесского с.-х. ин-та.
1957. Т. 8. С. 89—92.
Эрккенова Е. М. II Научи, тр. аспирантов
Ташкент, гос. ун-та. Биология,
почвоведение. 1970. Вып. 378. С. 29—35.
Эрккенова Е. М. II Научн. докл. высшей
школы. Биол. науки. 1971а. № 9. С. 51 —
55.
Эрккенова Е. М. II Научн. тр. аспирантов
Ташкентского гос. ун-та. Проблемы
биологии и географии. 19716. Вып. 400.
С. 58-67.
Эрккенова Е. М. II Изв. АН ТаджССР.
Отд. биол. наук. 1972а. № 1. С. 32—35.
Эрккенова Е. М. Развитие генеративной
сферы унаби и жестеров в связи с обиль-
. ным опадением цветков и низким
качеством семян унаби: Автореф. дис. . . .
канд. биол. наук. Ташкент, 19726.
Эрккенова Е. М. II Узб. биол. журн. 1973.
№ 3. С. 58—61.
Юр^ев В. Н., Юрцева Н. С. II Докл.
Тимирязев, с.-х. академии. 1974. Вып. 204.
С. 213—218.
Юрукова-Грънчарова П. Д. II Фитология
(НРБ). 1978. Кн. 9. С. 52—69.
Юрукова-Грънчарова П. Д. II Трета нацио-
нална конференция по ботаника. София,
1983а. Р. 258—264.
Юрукова-Грънчарова П. Д. II Трета нацио-
нална конференция по ботаника. София,
19836. Р. 265—270.
Якимов Л. М., Журавель М. С, Малта-
бар Т. В: II Половой процесс и
эмбриогенез растений. М., 1973. С. 287—288.
Якимов Л. М., Литвак А. И., Балан 10. /'.,
Малтабар Т. В. Атлас по эмбриологии ни-
нограда. Кишинев, 1977.
Якобсон Я- Я-, Литвинчик И. С, Лан-
генфелъд В. Т. II Бюл. Гл. ботан. сади
АН СССР. 1984. Вып. 131. С. 105-108.
:!'|Г)
Abreu I., Santos A. .11 J. Submicrosc. Cytol.
1977. Vol. 9, N 2-3. P. 239—246.
Adamkiewicz E. II Zesz. nauk, Wyzszej szkoly
roln Olszbynie. 1966. Vol. 22, N 2. P. 313—
328.
Adatia R. D., Gavde S. G. //Plant
embryology — A Symposium CSIR. New Delhi,
1962. P. 1—11.
Adatia R. D., Mulay B. H., Hingorani G. R. II
J. Univ. Bombay B. 1950. Vol. 19. P. 1—10.
Adatia R. D., Mulay B. N.f Hingorani
G. R. II J. Univ. Bombay B. 1953. Vol. 21.
P. 51—60.
Adatia R. D., Shah G. L. II J. Univ.
Bombay B. 1952. Vol. 20. P. 34—46.
Adatia R. D., Sharma Y. В., Vijayaragha-
van M. R. II Bot. notis. 1971. Vol. 124,
N 1. P. 25—38.
Adval P. II Proo. Combd. 52nd, 53rd Soi.
Congr. 1965. Part III. P. 334—335.
Afzelius K. II Acta hort. berg. 1924. Bd. 8.
g' 123- 219
Afzelius K. II Sv. bot. tidskr. 1936. Bd. 30.
S. 572—679.
Agarwal S. II Phytomorphology. 1961a.
Vol. 11, N 3. P. 269—272.
Agarwal S. II Naturo (Lond.). 1961b. Vol. 192,
, N 4809. P. 1313—1314.
Agarwal S. II Plant Embriology. — A
Symposium CSIR. New Dehli, 1962. P. 162—
169.
Agarwal S. II Phytomorphology. 1963a.
Vol. 13, N 2. P. 185—196.
Agarwal S. II Phytomorphology. 1963b.
Vol. 13, N 3. P. 348—356.
Agrawal Y. S. II Proo. 37th Indian Soi.
Congr. 1950. Vol. 3. P. 46—47.
Agrawal J. S. II Proc. 41 Indian Sci. Congr.
1954. Vol. 3. P. 137.
Ahlstrand L. II Bot. notis. 1978. Vol. 131,
N 4. P. 487—496.
Ahlstrand L. II Bot. notis. 1979a. Vol. 132,
N 1. P. 109—116.
Ahlstrand L. II Bot. notis. 1979b. Vol. 132,
N 3. P. 371—376.
Ahlstrand L. II Bot. notis. 1979c. Vol. 132,
N 3. P. 377—381.
Ahlstrand L. Arctotideae and Calenduleae
(Compositae): Diss. Goteborg. 1979d.
Ahmad B. II J. Indian Bot. Soc. 1978.
Vol. 57, N 1. P. 60—62.
Al-Attar Adnan A. A. Studies in the
systematic anatomy, embryology and
morphology of the Umbelliferae tribe Caucalideae:
Diss. Univ. of Reading, England. 1974.
Al-Attar Adnan A. A. II Proc. Indian Acad.
Sci. B. 1977. Vol. 85, N 5. P. 364—368.
Al-Attar Adnan A. A. II Proc. Indian Acad.
Sci. B. 1979. Vol. 88, part 2, N 6. P. 435—
443.
Altamura Betti M. M., Pasqua G., Mazzo-
lani G. II Ann. Bot. (Roma). 1982a.
Vol. 40. P. 111—117.
Altamura Betti M. M., Pasqua G., Mazzo-
lani G. II Ann. Bot. (Roma). 1982b.
Vol. 40. P. 141—152.
Anders Olaf. II Flora. 1966. Bd 156, N 4.
S. 446—451.
Anderson F. II Bull. Torrey Bot. Club. 1922.
Vol. 49. P. 141—157.
Anderson L. C. II Modrono. 1970. Vol. 20,
N 7. P. 337—342.
Andersson A. // Lunds univ. Arsskr. 1931.
Vol. 7 (2), N 27. P. 1—112.
Annen E. II Ber. Schweiz. bot. Ges. 1945,
Bd 55. S. 81.
Anzalone B. II Ann. Bot. (Roma). 1949,
Vol. 23. P. 31—41.
Arekal G. D. II Bot. Gaz. 1961a. Vol. 123,.
N 2. P. 144—150.
Arekal G. D. II Can. J. Bot. 1961b. Vol. 39,.
N 5. P. 1001—1006.
Arekal G. D. II Can. J. Bot. 1963a. Vol. 41,.
N 2. P. 267—302.
Arekal G. D. II Phytomorphology. 1963b.
Vol. 13, N 4. P. 376—388.
Arekal G. D. II Proc. Indian Acad. Sci. В..
1963c. Vol. 58, N 6. P. 375—385.
Arekal G. D. /П. Indian Bot. Soc. 1964,
Vol. 43, N 3. P. 409—424.
Arekal G. D. II Bot. Gaz. 1965. Vol. 126,.
N 1. P. 58—66.
Arekal G. D. II Proc. Indian Acad. Sci. В..
1966. Vol. 64, N 5. P. 241—258.
Arekal G. D., Girijamma S., Swamy S. N. R. II
Proc. Indian Acad. Sci. B. 1970. Vol. 72,.
N 5. P. 221—235,
Arekal G.D., Rajeshwari S., Swamy S. N. R. II
Bot. notis. 1971. Vol. 124. P. 237—248.
Arekal G. D., Raju D. //Curr. Sci. (India),
1964. Vol. 33, N 19. P. 591—592.
Arekal G. D., Raju D. //Curr. Sci. (India),
1967. Vol. 36, N 1. P. 22—23.
Arekal G. D., Raju D. II J. Mysore Univ,
1971. Vol. 24. P. 120—126.
Arekal G. D., Swamy S. N. R. //Curr. Sci,
(India). 1974. Vol. 43, N 3. P. 87-88,
Arena M., Gramuglio G. II Giorn. Bot. Ital,
1979. Vol. 113, N 3. P. 163—171.
Armand L. II С. г. Acad. sci. (Paris). 1912,
T. 155. P. 1534—1536.
Armand L. II C. r. Acad. sci. (Paris). 1913.
T. 156^ P. 1089—1090.
Armand L. II С. г. Acad. sci. (Paris). 1921,
T. 172. P. 762—764.
Arnason T. J. II Canad. J. Res. sec. С 1943,
Vol. 21, N 2. P. 41—56.
Arora N. II Phytomorphology. 1953. Vol. 3,
N 1—2. P. 88-98.
Arora K., Tiagi B. II Curr. Sci. (India),
1977. Vol. 46, N 15. P. 531.
Asplund E. II Kgl. sv. vet.-akad. handl.
1920. Bd 61, N 3. S. 3—66.
Avanzi H. G. II Caryologia. 1948. Vol. 1,
N 1. P. 83-91.
Ashton R. S. II Nature. 1978. Vol. 271,
P. 440-442.
Ayres J. A. II Bot. Gaz. 1915. Vol. 59,
S. 154-157.
Babcock E. В., Stebbins G. L. II Publ.
Carnegie Inst. Washington. 1938. Vol. 504.
P. 1—199.
Bacchi O. II Bragantia. 1941. Vol. 1, N 6,-
P. 483-490.
Bachmann E. Die Entwicklungsgeschichte-
und der Bau der Samensehalen der Scrophu-
larineen: Diss. Leipzig; Dresden, 1880.
Backs-Hiisemann D., Reinert J. II Proto-
plasma. 1970. Vol. 70, N 1. P. 49—53.
Bai V. Narmatha, Lakshmanan К. K. II
J. Indian Bot. Soc. 1984. Vol. 63, N 1,
P. 20—24. |
Bailey I. W., Swamy B. G. L. II Amer. J.
Bot. 1951. Vol. 38, N 5. P. 373—379.
Bailey I. W., Swamy B. G. L. II J. Arnold
Arboretum. 1953. Vol. 34, N 1. P. 77—85,
Baillon H. II Bull. mens. soc. Linn. Paris,
1882. T. 1, N 42. P. 336.
346
Balicka-Iwanowska G. P. II Flora. 1897.
Bd 83. S. 357—366.
Balicka-Iwanowska G. P. II Flora. 1899.
Bd 86. S. 47—71.
JBallantine A. J. //Ann. Bot. 1909. Vol. 23.
P. 161—162.
Banchetti Ch. II Caryologia. 1961. Vol. 14,
N 2. P. 303—311.
Banerji I. II Proc. Nat. Inst. Sci. India.
1940a. Vol. 6. P. 73-86.
Banerji I. II Proc. Indian Acad. Sci. B.
1940b. Vol. 1. P. 325-336.
Banerji I. II J. Bombay nat. hist. Soc.
1940c. Vol. 42. P. 89—99.
Banerji I. //J. Indian Bot. Soc. 1942. Vol. 21.
P. 295—307.
Banerji I. //J. Indian Bot. Soc. 1961.
Vol. 40, N 1. P. 1—11.
Banerji I., Bhaduri P. N. II Curr. Sci.
(India). 1933. Vol. 1, N 10. P. 310.
Banerji I., Pal S. II Bot. J. Linn. Soc.
1959. Vol. 55. P. 810-817.
Baquar S. R. II Pakistan J. Sci. Industr.
Res. 1965. Vol. 8, N 4. P. 226—229.
Barnard C. II Austral. J. sci. res. Ser. B.
1949. Vol. 2, N 3. P. 241-248.
Babcock E. В., Stebbins G. L. II Publ.
Carnegie Inst. Washington. 1938. Vol. 504.
P. 200.
Babcock E. B. The genus Crepis. // Univ.
Calif. Press, 1947.
Ahlstrand L. II Nord. J. Bot. 1985. Vol. 5,
N 1. P. 79—97.
Barnes С R. II Bot. Gaz. 1885. Vol. 10.
P. 349—354.
Barrit B. H. II Vitis. 1970. Bd 9, H. 1.
S. 7-14.
Basheer Md., Prakasa Rao P. S. //Curr. Sci.
(India). 1984. Vol. 53, N 9. P. 502—504.
Baskin I. M., Baskin С. С. II Bull. Torrey
Bot. Club. 1971. Vol. 98, N 2. P. 109—110.
Battaglia E. II N. G. bot. Ital. 1940. Vol. 47.
P. 271—276.
Battaglia E. II N. G. bot. Ital. 1945. Vol. 52.
P. 34-38.
Battaglia E. II N. G. bot. Ital. 1946a. Vol. 53.
P. 1—26.
Battaglia E. II N. G. bot. Ital. 1946b
Vol. 53. P. 27—69.
Battaglia E. II N. G. bot. Ital. 1946c. Vol. 53.
P. 437—482.
Battaglia E. II N. G. bot. Ital. 1946d. Vol. 53.
P. 483—511.
Battaglia E. II Atti Soc. Tosc. sci. Natur.
sert. B. 1947a. Vol. 54. P. 50—69.
' Battaglia E. II C. r. Accad. Lincei Roma.
1947b. Ser. 8, Vol. 2. P. 63—67.
Battaglia E. II N. G. bot. Ital. 1947c. Vol. 54.
P. 560—567.
Battaglia E. II N. G. bot. Ital. 1947d. Vol. 54.
p 53^ 559
Battaglia E. II N. G. bot. Ital. 1947e. Vol. 54.
P. 406—431.
Battaglia E. II N. G. bot. Ital. 1947L Vol. 54.
P. 377—405.
Battaglia E. II Caryologia. 1948a. Vol. 1.
P. 1-47.
Battaglia E. II Caryologia. 1948b. Vol. 1.
P. 248—268.
Battaglia E. II Caryologia. 1949. Vol. 1.
p 23 30.
Battaglia E. II Caryologia. 1950. Vol. 2, N 2.
P. 165—204.
Battaglia E. II Amer. J. Bot. 1951a. Vol. 38,
N 9. P. 718—724.
Battaglia E. II Bot. Gaz. 1951b, Vol. 112,
N 4. P. 490—494.
Battaglia E. II Atti Soc. Tosc. sci. Natur.
sect. B. 1952a. Vol. 59. P. 172—197.
Battaglia E. II Atti Soc. Tosc. sci. Natur.
sect. B. 1952b. Vol. 59. P. 205—209.
Battaglia E. //Atti Soc. Tosc. sci. nat.
Ser. B. 1952c. Vol. 59. P. 210—216.
Battaglia E. II Caryologia. 1955. Vol. 8.
P. 1—32.
Battaglia E. II Phytomorphology. 1956.
Vol. 6. P. 119—123.
Battaglia E., Breviglieri N. II Caryologia.
1955. Vol. 8, N 1. P. 45—68.
Bauer Z. II Acta Biol. crac. Ser. bot. 1964.
Vol. 7, P. 117—130.
Beandry J. R. II Proc. Genet. Soc. Canada.
1959. Vol. 3. P. 7—14.
Beer R. //Ann. Bot. 1911. Vol. 25. P. 199—
214.
Begum Magbool II Curr. Sci. (India). 1965.
Vol. 34, N 11. P. 355—356.
Begum Magbool II Curr. Sci. (India). 1969.
Vol. 38. P. 445—446.
Bellani L. M., Pacini E., Franchi G. G. И
Acta bot. neer. 1985. Vol. 34, N 1. P. 59—
64.
Bendre A. M.lll. Indian Bot. Soc. 1975.
Vol. 54, N 3-4. P. 272-279.
Berg R. Y. II Nytt. Mag. Bot. 1954. Vol. 2.
P. 1—60.
Berg R. Y. //Amer. J. Bot. 1985. Vol. 72,
N 11. P. 1775—1787.
Berger Ch., Erdelskd O. II Caryologia. 1973.
Vol. 25. P. 109-120.
Berger С A., Feeley E. J., Witkus E. R. II
Bull. Torrey Bot. Club. 1956. Vol. 83.
P. 428-434.
Bergman B. II Sv. bot. tidskr. 1932. Bd 26,
H. 3—4. S. 453-457.
Bergman B. II Sv. bot. tidskr. 1935a. Bd 29.
S. 155-301.
Bergman B. II Hereditas. 1935b. Bd 20, H. 1.
S. 47—64.
Bergman B. II Hereditas. 1935c. Bd 20, H. 2.
S. 214-226.
Bergman B. II Sv. bot. tidskr. 1937. Bd 31.
S. 391-394.
Bergman B. II Sv. bot. tidskr. 1941. Bd 35,
H. 1. S. 1-42.
Bergman B. // Sv. bot. tidskr. 1942. Bd 36,
H. 4. S. 429—443.
Bergman B. II Sv. bot. tidskr. 1944. Bd 38,
H. 3. S. 249—259.
Bergman B. II Hereditas. 1950. Vol. 36.
P. 297-320. .
Bergman B. //Hereditas. 1951. Bd 37, H. 4.
S. 501-518.
Berlese A. N. //'Malpighia. 1882. Vol. 6.
P. 293-324, 442—536.
Bernardello L. M. II Kurtziana. 1983. Vol. 16.
P. 33—70.
Bernardi L. II Cardollea. 1964. Vol. 19.
P. 199-205.
Beruti R. II Caryologia. 1961. Vol. 14, N 2.
P. 319—325.
Bhaduri P. N. II J. Indian Bot. Soc. 1932.
Vol. 11. P. 202—224.
Bhaduri P. N. II Curr. Sci. (India). 1933.
Vol. 2, N 3. P. 95.
Bhaduri P. N. 111. Indian Bot. Soc. 1935.
Vol. 14, N 2. P. 133—149.
Bhaduri P. N. II Bot. Gaz. 1936. Vol, i)H,
N 2. P. 283—295.
Bhaduri S. II J. Dop. Sci. Calcuta Univ.
1944. Vol. 1. P. 25—38.
Bhaduri P. N. II Indian J. Genet, a. plant
breeding, 1951. Vol. 11, N 1. P. 75—82.
Bhandari N. N., Bouman F., Natesh S. II
Bot, Jb. Syst. Pflanzengesch. und Pflan-
zongeogr. 1976. Bd 95, H. 4. S. 535—548.
Bhandari N. N., Indira K. II Bot. notis.
1969a. Vol. 122, N 2. P. 183—203.
Bhandari N. N., Nanda K. II Phytomorpho-
logy. 1968a. Vol. 18, N 4. P. 435—450.
Bhandari N. N., Nanda K. II Amer. J. Bot.
1968b. Vol. 55, N 9. P. 1028—1031.
Bhandari N. N., Natesh S. II Plant Syst.
and Evol. 1985. Vol. 148, N 3—4. P. 177—
184.
Bhargava H. R. II Proc. Indian Acad. Sci.
B. 1935b. Vol. 6. P. 325—339.
Bhargava Y. R. II Curr. Sci. (India). 1980.
Vol. 49, N 23. P. 911—912.
Bhargava Y. R. II Curr. Sci. (India). 1985.
Vol. 54, N 11. P. 523.
Bhatnagar S. P. II Phytomorphology. 1959.
Vol. 9, N 1. P. 87—91.
Bhatnagar S. P. II Phytomorphology. 1960.
Vol. 10, N 2. P. 198—207.
Bhatnagar S. P. II Bull. Nat. Bot. Gard.
Lucknow. 1965. N 112. P. 1—90.
Bhatnagar S. P. II Proc. Nat. Inst Sci.
India (B). 1966. Vol. 32, N 1—2. P. 47—52.
Bhatnagar S. P. II Bull. Indian Nat. Sci.
Acad. 1970. N 41. P. 15—18.
Bhatnagar S. P., Agarwal S. II
Phytomorphology. 1961. Vol. 11, N 3. P. 273—282.
Bhatnagar S. P., Chandra S. II Curr. Scb
(India). 1968. Vol. 37, N 24. P. 704—706.
Bhatnagar S. P., Gandhi V. II Bot. Jb. Syst.
Pflanzengesch. und Pflanzengeogr. 1979—
1980. Bd 101, N 4. S. 385—388.
Bhatnagar S. P., Garg R. II Plant Syst. a.
Evol. 1984. Vol. 146, N 3—4, P. 265—267.
Bhatnagar S. P., Joshi P. С II Proc. Nat.
Inst. Sci. India. 1965. Vol. 31, N 1—2.
P. 34—44.
Bhatnagar S. P., Kallarackal I. II
Phytomorphology. 1973. Vol. 23, N 3—4. P. 205—
211.
Bhatnagar S. P., Kallarackal J. II
Phytomorphology. 1979. Vol. 29, N 1. P. 1—6.
Bhatnagar S. P., Puri S. II Osterr. bot. Z.
1970. Bd 118, N 1—2. S. 55—71.
Bhatnagar S. P., Sabharwal G. II
Phytomorphology. 1966. Vol. 16, N 4. P. 588—591.
Bhatnagar S. P., Sabharwal G. II Beitr. Biol.
Pflanz. 1968 (1969). Vol. 45, N 3. P. 465—
479.
Bhatnagar S. P., Singh N. S. II Bull. Nat.
Bot. Gard. Lucknow. 1964. Vol. 92. P. 1—10.
Bhore D. P. II Sci. and Cult. 1968. Vol. 34,
N 11. P. 463.
Bianchi D. E., Schwemmin D. /., Wagner
W. H. II Bot. Gaz. 1959. Vol. 120, N 3-4.
P. 235—243.
Bielawska Halina II Acta Soc. bot. pol. 1973.
Vol. 42, N 2. P. 253—264.
Bijok K. II Acta biol. crac. Ser. bot. 1960.
Vol. 3. P. 15—24.
Bijok K. II Zesz. nauk. Wyzserej szkoly roln.
Olsztynie. 1964. Vol. 18, N 1. P. 121—140.
Biiok K., Pawlak Т., Krenska B. II Acta
Soc. bot. pol. 1977. Vol. 46, N 4. P. 647—657.
Billings F. H. II Kansas Univ. Sci. Bull.
1909. Vol. 5, N 5. P. 37—83.
Billings F. H. II Ann. Bot. 1932. Vol. 66,
N 184. P. 979—992.
Billings F. H. II Ann. Bot. 1933. Vol. 47,
N 186. P. 261—278.
Biswas I. S. II Curr. Sci. (India). 1955.
Vol. 24, N 6. P. 204—205.
Biswas I. S. II J. Indian Bot. Soc. 1957.
Vol. 36, N 2. P. 207—222.
Bobde P. L. II Bull. Soc. Coll. Sci. Nagpur.
1963. Vol. 4. P. 33—38.
Bobe K. J., Kovacik K. A. //Sci. Agr. bo-
hemosl. 1974. Vol. 6, N 1. P. 7—12.
Boeshore J. II Contrib. Bot. Lab. Univ.
Pennsylvania. 1920. Vol. 5, N 2. P. 139—177.
Bookman S. S. II Amer. J. Bot. 1983. Vol. 70,
N 6. P. 897—905.
Borgenstam F. II Ark. bot. 1922. Bd 17, N 15.
S. 1—27.
Borthwick H. A. //Bot. Gaz. 1931. Vol 92.
P. 23-44.
Bouman F. II Embryology of angiosperms.
Berlin etc., 1984. P. 123—157.
Bouquet A. II Vitis. 1980. Bd 19. S. 134—151.
Bradley M. V., Griggs W. H. II
Phytomorphology. 1963. Vol. 13, N 12. P. 141—156.
Bremekamp C. E. B. II Rec. trav. Bot. Neerl.
1938. Vol. 35. P. 130—174.
Bremekamp C. E. B. II Rec. trav. bot. Neerl.
1942. Vol. 39. P. 166—175.
Bremecamp C. E. B. II Rec. trav. bot. Neerl.
1944. Vol. 41. P. 1—306.
Bremecamp C. E. B. II Proc. Kon. ned. akad.
wetensch. С 1953. Vol. 56, N 5. P. 533—546.
Brenan I. P. M. II Kew Bull. 1953. N 4.
P. 507-511.
BrewbakerJ. L. II Amer. J. Bot. 1967. Vol. 54,
N 9. P. 1069—1083.
Brizicky G. K. II i. Arnold Arboretum. 1964.
Vol. 45, N 2. P. 251—259.
Brough P. II Proc. Linn. Soc. N. S. W. 1927.
Vol. 52. P. 471—498.
Brough P. II Proc. Linn. Soc. N. S. W. 1933.
Vol. 58. P. 33-73.
Brown S. W. //Amer. J. Bot. 1949. Vol. 36,
N 10. P. 703—716.
Burns G. P. II Flora. 1900. Bd 87. S. 313—354.
Buscalioni L. II Malpighia. 1894. Vol. 8..
P. 3—13.
Bushnell E. P. II Bor. Gaz. 1936. Vol. 98.
P. 190—197.
Buurman I. II Pollen et spores. 1977 (1978)..
Vol. 19, N 4. P. 447—519.
Cammerloher H. II Osterr. bot. Ztschr. 1910.
Bd 60, N 8—9. S. 289—300, 356—359.
Campbell D. H. II Bull. Torrey Bot. Club..
1930. Vol. 57, N 1. P. 47—50.
Carano E. II Ann. Bot. (Roma). 1913a. Vol. 11.
P. 313-315.
Carano E. II Ann. Bot. (Roma). 1913b. Vol. 11.
P. 435-439.
Carano E. II Rend. ace. Lincei Roma el
dis. mat. nat. 1914. Ser. 5, vol. 23. P. 514—
516.
Carano E. II Ann. Bot. (Roma). 1915a. Vol.
13. P. 251—301.
Carano E. II Rend. Accad. naz. Lincei Roma,
Classe sci. fisiche, matem., natur. 1915b.
Vol. 24, ser. 5. P. 1244—1248.
Carano E. II Rend. Accad. naz. Lincei Roma,
Classe sci. fisiche, matem., natur. 1919a.
Vol. 28, ser. 5. P. 94—96.
Carano E. II Rend. Accad. naz. Lincei Roma,
Classe sci. fisiche, matem., natur. 1919b.
Vol. 28, ser. 5. P. 412—415.
Carano E. II Rend. Accad. naz. Lincei Roma,
Classe sci. fisiche, matem., natur. 1920.
Vol. 29, ser. 5. P. 157—159.
348
Carano E. II Ann. Bot: (Roma). 1921. Vol. 15.
P. 97—196.
Carano E. II Rend. Accad. naz. Lincei Roma,
Classe sci. fisiche, matem., natur. 1924.
Vol. 32, .sem. 2. P. 150—155.
Carlson E. M., Stuart В. С //New Phytol.
1936. Vol. 35, N 1. P. 68—91.
Carniel K. II Osterr. bot. Ztschr. 1952. Bd 99,
N 2/3 S 318 362.
Carniel K. II Osterr. bot Ztschr. 1963. Bd 110,
N 5-6. S. 547—555.
Carolin R. С II Proc. Linn. Soc. N. S. W.
1966. Vol. 91, part 1. P. 58—83.
Carraro L., Lombardo G., Cargnello G., Ge-
rola F. II Vitis. 1979. Bd 18, H. 4. S. 285-
290.
Carraro L., Lombardo G., Cargnello G., Ge-
rola F. II Vitis. 1981. Bd 20, H. 3. S. 193-
201.
Carter К. М. II J. Roy Microscop. Soc. 1928.
Vol. 48. P. 389-403.
Caspary R. II Flora. 1854. Bd 37. S. 557-
588, 593-603.
Caspary R. II Schr. phys.-okon. ges. Konigs-
berg. 1867. Bd 18. S. 16
Cassera I. D. II Bull. Torrey Bot. Club. 1935.
Vol. 62. P. 455-461.
Catalani R. II Caryologia. 1950-1951.
Vol. 3, N 3. P. 327-335.
Cave M. S. //Lilloa. 1962. T. 31. P. 171 —
182.
Cerceau-Larrival M. Th., Roland-Heydacker F.jl
С. г. Acad. sci. (Paris). 1976. T. 283,
N 1. P. 29 32.
Chamberlain С J. II Bot. Gaz. 1895. Vol. 20.
p 205 212.
Chan S. С. К.; Hillson С. J. II Bot. Gaz.
1968. Vol. 129, N 2. P. 150—156.
Chan S. С. К., Hillson С. L. II Bot. Gaz.
1971. Vol. 132, N 3. P. 224—229.
Chandra S., Singh R. P., Pandey A. K. II
Flora. 1980. Bd 169, N 1. P. 111—120.
Chatin J. II Ann. sci. natur. Bot. 1874. Ser. 5,
vol. 19. P. 1—107.
Chauveaud G. L. II С. г. Acad. sci. (Paris).
1892a. T. 114, N 6. P. 313—315.
Chauveaud G. L. II С. г. Acad. sci. (Paris).
1892b. T. 114, N 9. P. 504—506.
Chauveaud G. L. Sur la fecondation dans les
cas de polyembryonie. Reproduction chez le
Dompte-venin (Vincetoxicum). Paris. 1892c.
Chenneveeraiah M. S., Patil R. M.
//Phytomorphology. 1971. Vol. 21, N 1. P. 71—76.
Chiarugi A. II N. G. bot. Ital. 1926a. Vol. 33.
P. 501—626.
Chiarugi A. IIС R. Accad. Lincei, Roma.
1926b. Vol. 3. P. 281—284.
Chiarugi A. //N. G. bot. Ital. N. S: 1927a.
Vol. 34, P. 5-133.
Chiarugi A. /IN. G. bot. Ital. N. S. 1927b.
Vol. 34. P. 717-777.
Chiarugi A. UN. G. bot. Ital. N. S. 1927c.
Vol. 34. P. 783-828.
Chiarugi A. II N. G. bot. Ital. N. S. 1930.
Vol. 37, N 5. P. 287—312.
Chichan M. A., Palser B. //Amer. J. Bot.
1982. Vol. 69, N 6. P. 885—895.
Chikkannaih P. S., Hiremath B. S. //Proc.
Indian Acad. Sci. Plant Sci. 1982. Vol. 91,
N 6. P. 519-527.
ChodatR., Bernard Ch. II J. Bot. 1900. T. 14.
P. 72—79.
Chopra S. II Plant Sci. 1969a. Vol. 1. P. 126—
129.
Chopra S. II Curr. Sci. (India). 1969b. Vol. У8,
N 16. P. 392—393.
Chopra R. N., Kaur H. II Phytomorphology.
1965. Vol. 15, N 4. P. 353—359.
ChoudhuryB. II Indian J. Hort. 1958. Vol. 15,
N 2. P. 72—75.
Christensen H. M., Bamford R. //J. Heredity.
1943. Vol. 34, N 4. P. 99-104.
Chwilkowska Z. M., Zenkteler M. II Acta>
agrobotanica. 1978. Vol. 31, N 1/2. P. 7—20.
Ciampolini F., Cresti M. //Caryologia. 1977.
Vol. 30, N 4. P. 487—488.
Ciobanu I. R. II Rev. roum. biol. Ser. bot.
1969a. T. 14, N 5. P. 269—273.
Ciobana J. R. II Rev. roum. biol. Ser. bot.
1969b. T. 14, N 6. P. 351—356.
Ciobanu I. R. II Ann. sci. natur. Ser. 12.
1970a. T. 1, N 2. P. 115—127.
Ciobanu I. R. II Rev. roum. biol. Ser. bot.
1970b. T. 15, N 3. P. 143—148.
Ciobanu I. R. I Rev. cytol. et biol. veget.
1971. T. 34, N 3—4. P. 383-395.
Clarke A. E. II Amer. Potato J. 1940. Vol. 17.
p 20 25.
Clauhs R. P., Grun P. II Amer. J. Bot. 1973.
Vol. 60, N 4. P. 5.
Clauhs R. P., Grun P. II Amer. J. Bot. 1977.
Vol. 64, N 4. P. 377—383.
Cochran H, L. II J. Agr. Res. 1938. Vol. 56,
N 6. P. 395—419.
Cocucci A. E., Venturelli M. II Kurtziana.
1984. T. 17. P. 9—24.
Cohen L. I. II Amer. J. Bot. 1963. Vol. 50,
N 4. P. 400—407.
Coleman J. R., Coleman M. A. II Rev. bras.
genet. 1984. T. 7, N 3. P. 549—567.
Cook M. T. II Bull. Torrey Bot. Club. 1907.
Vol. 34. P. 179—184.
Cook M. T. II Bot. Gaz. 1924. Vol. 77. P. 224—
227.
Cooke E., Shively A. F. II Contrib. Bot. Lab.
Univ. Pennsylv. 1904. Vol. 2, N 3. P. 352—
398.
Cooper D. С //Amer. J. Bot. 1931. Vol. 18,
N 9. P. 739—748.
Cooper D. С //Amer. J. Bot. 1941. Vol. 28,
N 9. P. 755—761.
Cooper D. С II Amer. J. Bot. 1943. Vol. 30,
N 6. P. 408—413.
Cooper D: С //Amer. J. Bot. 1946. Vol. 33,
N 1. P. 54-57.
Cooper D. С II Amer. Naturalist. 1952.
Vol. 86. P. 219—229.
Cooper D. C, Brink R. A. II Bot. Gaz. 1949.
Vol. Ill, N 2. P. 139-153.
Cooper G. O. II Bot. Gaz. 1936. Vol. 98, N 2.
P. 348—355.
Cooper G. O. II Bot. Gaz. 1942. Vol. 104,
N 1. P. 72—81.
Copeland H. F. II Madrono. 1960. Vol. 15,
N 6. P. 161—172.
Copeland. H. F. II Phytomorphology. 1963.
Vol. 13, N 4. P. 453—464.
Copeland H. F. II Phytomorphology. 1060.
Vol. 16, N 3. P. 326-333.
Cooper G. O. II Amer. J. Bot. 1942. Vol. 29,
N 7. P. 577—581.
Correa J. P. Morphological and embryologionl
studies in the Loranthaceae—Viscoiflouo:
Ph. D. Thesis. Univ. Delhi, 1958.
Corry T. H. II Trans. Linn. Bot. Soc. bin-
don (Bot.). 1883. Vol. 2, part 4. P. 75 -M.
Corry Т. Н. II Trans. Linn. Soc. London
(Bot.). 1884. Vol. 2, part 8. P. 173--207.
;mi>
Cosa M. II Bot. Acuil. Nac. Ci. Cordova.
1978. Vol, 52, I'. 253-266.
Coulter '/'. // Шт. Soo. Phys., Hist., Nat.
Giiiiovi). шм. Vol. 2. p. 13—60.
CourlnlH .1, /'-',, Percheron F., Glomaud J.-CI. //
(iitlYi, i'.iiciio, tb.6. 1963. T. 7. N 3. P. 231 —
2.'lll.
C-rvHll /I'/,, Clampolini F., Kapil R. N. II
.1, Siibmicros. Cytol. 1984. Vol. 16, N 2.
I', .417-320.
CvuM M., Clampolini F., Mulcahy D. L. M.,
Mulcahi/ G. //Amer. J. Bot. 1985. Vol. 72,
N Г). P. 719—727.
СгеШ М., Went J. L. van //Planta. 1976.
Vol. 133, N 1. P. 35—40.
Cresli M., Went J. L. van, Pacini E., Wil-
lemse M. Т. М. II Planta. 1976. Vol. 132,
N 3. P. 305—312.
Cresti M., Went J. L. van, Willemse M. Т. М.,
Pacini E. I Acta hot. neer. 1976. Vol. 25,
N 5. P. 381—383.
Crete P. II С. г. Acad. sci. (Paris). 1938a.
T. 207. P. 177—179.
Crete P. II Bull. Soc. bot. France. 1938b.
T. 85, N 7—8. P. 580—583.
Crete P. Recherches histologiques et physiolo-
giques sur l'embryologie des Labiatiflores.
Contribution a l'etude des formations haus-
toriales: These. Paris. 1942.
Crete P. II Bull. Soc. bot. France. 1943.
T. 90. P. 36-39.
Crete P. II С. г. Acad. sci. (Paris). 1946a.
T. 222, N 9. P. 509—511.
Crete P. /1С. r. Acad. sci. (Paris). 1946b.
T. 222, N 15. P. 920—921.
Crete P. II Bull. Soc. bot. France. 1946c.
T. 93. P. 210—213.
Crete P. II С. г. Acad. sci. (Paris). 1946d.
T. 223, N 12. P. 459—460.
Crete P. II С. г. Acad. sci. (Paris). 1947.
T. 224, N 10. P. 749—751.
Crete P. II С. г. Acad. sci. (Paris). 1948a.
T. 229, N 1. P. 1742—1744.
Crete P.. II Bull. Soc. bot. France. 1948b.
T. 95. P. 142—146.
Crete P. II С. г. Acad. sci. (Paris). 1949a.
T. 228, N 10. P. 768-770.
Crete P. II С. г. Acad. sci. (Paris). 1949b.
T. 228, N 18. P. 1448—1449.
Crete P. II Bull. Soc. bot. France. 1949c.
T. 96, N4—6. P. 113—115.
Crete P. II С. г. Acad. sci. (Paris). 1949d.
T. 230, N 12. P. 1198—1199.
Crete P. II Bull. Soc. bot. France. 1949e.
T. 96. P. 186—188.
Crete P. II Bull. Soc. bot. France. 1949f.
T. 96, N 7—9. P. 234—235.
Crete P. II Bull. Soc. bot. France. 1950a.
T. 97. P. 177—179.
Crete P. II Bull. Soc. bot. France. 1950b.
T. 97. P. 196—197.
Crete P. II Bull. Soc. bot. France. 1950c.
T. 97. P. 204—206.
Crete P. II С. г. Acad. sci. (Paris). 1950d.
T. 231. P. 711—713.
Crete P.l/C.v. Acad. sci. (Paris). 1950e.
T. 230, N 8. P. 772—773.
Crete P. II Bull. Soc. bot. France. 1952a.
T. 92. P. 266—268.
Crete P. II Bull. Soc. bot. France. 1952b.
T. 99, N 7—9. P. 315—318.
Crete P. II Phytomorphology. 1953a. Vol. 3,
N 3. P. 168—172.
■Crete P. II С. г. Acad. sci. (Paris). 1953b.
T. 237, N 22. P. 1432—1434.
Crete P. II С. г. Acad. sci. (Paris). 1954a.
T. 239, N 7. P. 552—554.
Crete P. II Phytomorphology. 1954b. Vol. 4,
N 3-4. P. 325.
Crete P. II Bull. Soc. bot. France. 1954c.
T. 101. P. 232—235.
Crete P.//C.T. Acad. sci. (Paris). 1954d.
T. 239, N 23. P. 1671—1673.
Crete P. II Bull. Soc. bot. France. 1954e.
T. 101. P. 130—133.
Crete P. II Bull. Soc. bot. France. 1955a.
T. 102, N 5-6. P. 205—208.
Crete P. //Phytomorphology. 1955b. Vol. 5,
N 4. P. 422—435.
Crete P. II С. г. Acad. sci. (Paris). 1955c.
T. 241, N 24. P. 1825—1828.
Crete P. II Bull. Soc. bot. France. 1955d.
T. 102. P. 293—296.
Crete P. II С. г. Acad. sci. (Paris). 1956a.
T. 242, N 8. P. 1063—1066.
Crete P. II С. г. Acad. sci. (Paris). 1956b.
T. 242, N 10. P. 1346—1349.
Crete P. II Ст. Acad., sci. (Paris). 1956c.
T. 242, N 26. P. 3110—3113.
Crete P. II С. г. Acad. sci. (Paris). 1956d.
T. 243, N 12. P. 861—863.
Crete P. II Bull. Soc. bot. France. 1956e.
T. 103, N 7-8. P. 446—454.
Crete P. II Phytomorphology. 1958. Vol. 8,
N 3—4. P. 302.
Crete P. II Phytomorphology. 1959a. Vol. 9,
N 2. P. 163-167.
Crete P. II Ст. Acad. sci. (Paris). 1959b.
T. 248, N 25. P. 3594—3596.
Crete P. II С. г. Acad. sci. (Paris). 1959c.
T. 249, N 20. P. 2095-2097.
Crete P. II С г. Acad. sci. (Paris). 1960.
T. 250, N 25. P. 4194—4196.
Crete P.IIC.t. Acad. sci.' (Paris). 1961a.
T. 252, N 14. P. 2128—2130.
Crete P.IIC.t. Acad. sci. (Paris). 1961b.
T. 252, N 19. P. 2921—2923.
Crete P. II С г. Acad. sci. (Paris). 1961c.
T. 252, N 20. P. 3104—3106.
Crete P. II С. г. Acad. sci. (Paris). 1961d.
. T. 253, N 25. P. 3032—3034.
Crete P. II Phytomorphology. 1963. Vol. 13,
N 4. P. 364—367.
Crete P. II Phytomorphology. 1964. Vol. 14,
N 3. P. 468—472.
Crete P. II С г. Acad. sci. (Paris). 1965.
T. 260, N 21. P. 5617—5619.
Cuthbertson E. G. II Austral. J. Bot. 1974.
Vol. 22, N 1. P. 13—18.
Czapik R. II Acta Soc. bot. pol. 1954. Vol. 23,
N 1. P. 175—194.
Czapik R. // Acta biol. crac. Ser. bot. 1976.
Vol. 19, N 1. P. 3—14.
Czapska—Dziekanowska D. II Acta biol. crac.
Ser. bot. 1965 (1966). Vol. 8, N 2. P. 101 —
112.
Dahlgren K. V. O. II Sv. bot. tidskr. 1915.
Bd9. S. 184-191.
Dahlgren K. V. O. II Ztschr. Bot. 1920.
Bdl2. S. 481-516.
Dahlgren K. V. O. II Sv. bot. tidskr. 1922.
Bd 16, N 1. S. 77—87.
Dahlgren K. V. O. II Sv. bot. tidskr. 1924.
Bd 18. S. 177-203. '
Dahlgren K. V. O. II Sv. bot. tidskr. 1938.
Bd 32, N 3. S. 221—237.
Dahlgren R., Nielsen B. J., Goldblatt P.,
Rourke J. P. II Ann. Missouri Bot. Gard.
1979. Vol. 66, N 3. P. 545—556.
350
Dahlgren R., Rao V. S. II Bot. notis. 1969.
Bd 122, N 2. S. 207—227.
Dakshini K., Dadlani N. P. II Bot. Mag.
(Tokyo). 1978. Vol. 91, N 1022. P. 131—135.
D'Amato F. II N. G. bot. Ital. 1946. Vol. 55.
P. 170—210.
Dan Dicko-Zafimanova L. II Adansonia. 1978.
T. 17, fas. 4. P. 455—463.
Davis G. L. II Austral. J. Sci. 1961a. Vol. 23,
N 12. P. 413—414.
Davis G. L. II Austral. J. Sci. 1961b. Vol. 24,
N 6. P. 296.
Davis G. L. II Phytomorphology. 1961c.
Vol. 11, N 1—2. P. 86—97.
Davis G. L. II Phytomorphology. 1961d.
Vol. 11, N 3. P. 206—219.
Davis G. L. II Austral. J. Bot. 1962a. Vol. 10,
N 1. P. 1—12.
Davis G. L. II Austral. J. Bot. 1962b. Vol. 10.
P. 65—75.
Davis G. L. II Proc. Linn. Soc, N. S. Wales.
1963a. Vol. 88, pt 1, N 401. P. 35—40.
Davis G. L. II Austral. J. Sci. 1963b. Vol. 26.
P. 90.
Davis G. L. II Nature. 1964a. Vol. 204,
N 4953. P. 94.
Davis G. L. II Phytomorphology. 1964b.
Vol. 14. P. 231-239.
Davis G. L. II Austral. J. Bot. 1964c. Vol. 12,
N 2. P. 142-151.
Davis G. L. If Austral. J. Bot. 1964d. Vol. 12,
N 2. P. 152-156.
Davis G. II Phytomorphology. 1967. Vol. 17,
N 1—4. P. 270—277.
Davis G. II Austral. J. Bot. 1968a. Vol. 16,
N 1. P. 1—17.
Davis G. L. //Proc. Linn. Soc, N. S. Wales.
1968b. Vol. 93, N416, pt. 1. P. 184-192.
Delannay X. II Bull. Soc. roy. bot. Belg.
1978. T. 111. P. 10—18.
Deshpande P. K. II Curr. Sci. (India). 1960a.
Vol. 29, N 1. P. 56-57.
Deshpande P. K. II J. biol. sci. 1960b. Vol. 3.
P. 26—29.
Deshpande P. K. II J. Indian Bot. Soc. 1960c.
Vol. 43, N 1. P. 141—148.
Deshpande P. K. //Bull. bot. Soc, Coll. Sci.
Nagpur. 1961. Vol. 2. P. 1-8.
Deshpande P. K. II J. Indian Bot. Soc. 1962a.
Vol. 41. P. 505—509.
Deshpande P. K. II J. Indian Bot. Soc. 1962b.
Vol. 41. P. 540—549.
Deshpande P. K. II Curr. Sci. (India). 1962c.
Vol. 31, N 3. P. 113—114.
Deshpande P. K. II Bull. Bot. Soc, Coll. Sci.
Nagpur. 1962d. T. 3. P. 84—91.
Deshpande P. K. II 1. Indian Bot. Soc 1964a.
Vol. 43. P. 141-148.
Deshpande P. K. II J. Indian Bot. Soc. 1964b.
Vol. 43, N 1. P. 149—157.
Deshpande P.' K. II Bull. Indian Nat. Sci.
Acad. 1970. N41. P. 325—333.
Desole L. II Bull. Inst. bot. Univ. Sassari.
1949. Vol. 3. P. 1—10.
Desole L. II N. G. bot. Ital. 1951. Vol. 58.
P. 162—168.
Dexheimer J. II С г. Acad. sci. (Paris). 1965a.
T. 260. P. 6963.
Dexheimer J. II С. г. Acad. sci. (Paris). 1965b.
T. 261. P. 507-508.
Dexheimer J. II C. r. Acad. sci. (Paris). 1966.
T. 262. P. 853-855.
Dexheimer J. II Rev. cytol. et biol. veg.
1970. T. 33, f. 2-3. P. 169—234.
Dhakre Y. S. II J. Indian Bot. Soo. 11ЮН,
Vol. 47, N 1—2. P. 13—22.
Dharamadhaj P., Prakash N. II Austral. J.
Bot. 1978. Vol. 26, N 3. P. 433—481».
Dianova V. /., Sosnovitz A. A., Steshlna
N. A. II Beih. bot. Zentr.-Bl. 1935. Bd 5УЛ.
S. 293-308.
Dickison W. G., Baas P. II Blumea. 1977.
Vol. 23, N 2. P. 417—438.
Dickinson H. G. II Acta Soc. bot. pol. 1981.
Vol. 50, N 1—2. P. 3—12.
Diettert R. ^.//Lloydia. 1938. Vol. 1.
P. 3—74.
Dixit S. N. II Phytomorphology. 1958.
(1959)a. Vol. 8, N 3—4. P. 346—364.
Dixit S. N. I/ Phytomorphology. 1958.
(1959)b. Vol. 8, N 3-4. P. 365-376.
Dixit S. N. II Phytomorphology. 1961. Vol.
11, N 4. P. 335—345.
Dnyansagar V. R., Cooper D. C. //Amer. J.
Bot. 1960. Vol. 47, N 3. P. 176—186.
Dnyansagar V. R., Momin A. R. II Mohan
Ram M. Y. et al. Form, structure and
function in plants. 1975.
Dolcher T. II Caryologia. 1951. Vol. 4, N 1—3.
P. 58—76.
Doll W. II Bot. Arch. 1927. Bd 17. S. 107—
146.
Dop P.l/C.v. Acad. sci. (Paris). 1902a.
T. 135, N 17. P. 710—712.
Dop P.IIC.t. Acad. sci. (Paris). 1902b.
T. 135, N 19. P. 800—803.
Dop P. Recherches sur la structure et le de-
veloppement de la fleur des Asclepiadeesr
These. Paris; Toulouse. 1903a. P. 119.
Dop P. II С. г. Acad. sci. (Paris). 1903b.
T. 136, N 4. P. 250—252.
Dop P. II Bull. Soc. bot. France. 1913a.
T. 60. P. 9-16, 45-50, 92—98.
Dop P. II С. т. Acad. sci. (Paris). 1913b.
T. 156. P. 1922—1924.
Dop P. II Rev. gen. bot. 1914. T. 25 (Fest.
Bonnier). P. 167—177.
Dop P. II Bull. Soc. bot. France. 1923. T. 70.
P. 136-139.
Dorsey M. J. II Univ. Minnesot. Agr. Exp.
Bull. 1914. Vol. 144. P. 1—60.
Dowding E. S. //Bot. Gaz. 1931. Vol. 91..
P. 42-54.
Drexler U., Hakki M. I. II Willdenowia.
1979. Bd 2, N 1. S. 131—147.
Dublin P. II Agron. trop. 1957. Vol. 12, N 5.
P. 576—594.
Dublin P. II Agron. trop. 1958. Vol. 13, N 6.
P. 704—731.
Dublin P. II Agron. trop. 1960. Vol. 15, N 2.
P. 189—212.
Ducamp L. II С. г. Acad. sci. (Paris). 1901a.
T. 133. P. 651—653.
Ducamp L. II С. г. Acad. sci. (Paris). 1901b.
T. 133. P. 753—756.
Ducamp L. II Ann. sci. nat. Bot. 1902. Ser. 8,.
t. 15. P. 311—402.
Dufau O. II Rev. gen. bot. 1961. Vol. 68,
N 801. P. 73—110.
Duffas F. II Bull. Soc. Hist. nat. Touluso.
1930. Vol. 59, N2. P. 177.
Duggar B. II Bull. Torrey Bot. Club. 181)1),
Vol. 26, N 3. P. 89-105.
Dumas A. II Ann. Univ. et ARERS. 1971,
T. 9, N 1. P. 51—57.
Dumas A. //Bull. Soc bot. Franco. 11I7H,
T. 125, N 1—2. P. 193—197.
Dunbar A. /I Bot. notis. 1973. Vol. 12(1, N 3.
P. 277—315.
Dutta S. II Curr. Sci. (India). 1939. Vol. 8.
P. 71-472.
Dwivedi N. K., Joshi В. М. II Curr. Soi.
(India). 1980. Vol. 49, N 7. P. 274—275.
Dwivedi N. K., Joshi В. М. II Curr. Soi.
(Indiu). 1981. Vol. 50, N 14. P. 647—649.
Eichler K. II S. B. Acad. wiss. Wien. 1906.
Vol, 115. S. 841—856.
Ekambaram Т., Panje R. R. II Proo. Indian
Acad. Soi. B. 1935. Vol. 1, N 9. P. 522—
543.
Elestrand H. II Sv. bot. tidskr.' 1918. Bd 12,
N 2. S. 202—206.
El-Gazzar A., Hamza M. K., Badawi A. A. II
Pollen et spores. 1974. Vol. 16, N 2. P. 227—
238.
Eliasson U. II Sv. bot. tidskr. 1972. Vol. 66,
N 1. P. 43—47.
Engell K. II Sv. bot. tidskr. 1970. Vol. 65,
N 3. P. 225—244.
Engell K., Petersen G. B. II Sv. bot. tidskr.
1977. Vol. 71, N 3—4. P. 237—244.
Erdelskd O. II Acta Soo. bot. pol. 1981.
Vol. 30, N 1—2. P. 269—272.
Erdelskd O. II Biologia (CSSR). 1985. Vol. 40,
N 1. P. 17-30.
Erdtman G. II Sv. bot. tidskr. 1945. Bd 39,
N 3 S 279 285
Ernst A. '// Flora. 1914. Bd 106, N 2. S. 129—
159.
Ernst A. Bastardierung als Ursache der Apo-
gamy in Pflanzenreich. // Jena, 1918.
Ernst A. II Vjschr. natur. Ges. Zurich. 1942.
Bd87. S. 269—300.
Esau K. II Proo. nat. Acad. Soi. (Wash.).
1944. Vol. 30, N 11. P. 352—355.
Esau K. II Hilgardia. 1946. Vol. 17, N 2.
P. 61—101.
Eseltine G. P. van II N. Y. St. Agr. Exper.
Sta. Tech. Bull. 1929. Vol. 149. P. 1—41.
Esser K. II Ztschr. Bot. 1963. Bd 51, N 1.
g 22 51
Eck'ey E. W. Vegetable Fats and Oil // N. Y.,
1954.
Eichinger A. //Mitt. Bayer, bot. Ges. Mtin-
ohen. 1907. Bd 2. S. 65—74, 81—93.
Evans A. T. //Bot. Gaz. 1919. Vol. 67.
P. 427—437.
Eyde R. H. //Amer. J. Bot. 1964. Vol. 51,
N 10. P. 1083—1092.
Eyde R. H. //J. Arnold Arboretum. 1968.
Vol. 49, N 2. P. 167—192.
Faber F. C. van II Ann. Jard. Bot. Buiten-
zorg. 1912. Ser. 2. Vol. 10. P. 59—160.
Fagerlind F. II Sv. bot. tidskr. 1936a. Bd 30,
N 1—4. S. 362—372.
Fagerlind F. II Bot. notis. 1936b. N 1—6.
P. 577—584.
Fagerlind F. II Acta horti berg. 1937. Bd 11,
N 9. S. 195-470.
Fagerlind F. II Sv. bot. tidskr. 1938a. Bd 32,
N 2. S.^ 139—159.
Fagerlind F. II Bot. notis. 1938b. P. 461 —
498.
Fagerlind F. 11 Sv. bot. tidskr. 1939. Bd 33,
N3. S. 303—309.
Fagerlind F. II Sv. bot. tidskr. 1941. Bd 35,
H. 2. S. 157-176.
Fagerlind F. II Sv. bot. tidskr. 1945a. Bd 39,
N 1. S. 65—82.
Fagerlind F. II Sv. bot. tidskr. 1945b. Bd 39,
N 1. S. 197—210.
Fagerlind F. II Bot. notis. 1945c. Vol. 39,
P. 330—350.
Fagerlind F. II Sv. bot. tidskr. 1945d. Bd 39,
N 4. S. 346—364.
Fagerlind F. II Acta horti berg. 1946a. Vol. 14,
N 3. P. 39 90.
Fagerlind F. II Sv.' bot. tidskr. 1946b. Bd 40,
N 1. S. 9—14.
Fagerlind F. II Bot. notis. 1947a. N 3. S. 207—
230.
Fagerlind F. II Sv. bot. tidskr. 1947b. Bd 41,
H. 2. S. 247—263.
Fagerlind F. II Sv. bot. tidskr. 1947c. Bd 41,
H. 3. S. 365—390.
Fagerlind F. II Acta horti berg. 1947d. Vol. 14,
N 6. P. 221—247.
Fagerlind F. II Sv. bot. tidskr. 1948. Bd 42,
N 3. S. 195-229.
Fagerlind F. jj Sv. bot. tidskr. 1959. Bd 53,
N 3. S. 257—282.
Fagherazzi-Abgrall M., Meyer J. II Phyto-
morphology. 1963. Vol. 13, N 1. P. 22—29.
Familler J. II Flora. 1896. Bd 82. S. 133—168.
Farooq M. II Curr. Sci. (India). 1952. Vol. 21,
N 9. P. 252 253
Farooq M. II Curr. Soi. (India). 1953. Vol. 22,
N 9. P. 280—282.
Farooq M. II Sci. and Cult. 1958a. Vol. 23,
N 9. P. 479—480.
Farooq M. //J. Indian Bot. Soc. 1958b.
Vol. 37, N 3. P. 358—364.
Farooq M. II J. Indian Bot. Soc. 1959.
Vol. 38, N 2. P. 280—287.
Farooq M. II J. Indian Bot. Soo. 1960a.
Vol. 39, N2. P. 171—175.
Farooq M. II Sci. and Cult. 1960b. Vol. 25.
P. 428-430.
Farooq M. II Proo. Nat. Inst. Sci. India, B.
1964. Vol. 30, N 5-6. P. 280—299.
Farooq M. II Phytomorphology. 1965a. Vol. 15,
N 2. P. 123 131.
Farooq M. II Indian Bot. Soo. 1965b. Vol. 44,
N 3. P. 326-346.
Farooq M. II J. Indian Bot. Soc. 1966. Vol. 45,
N 1—2. P. 1—13.
Farooq M. II Beitr. Biol. Pflanz. 1966a.
Bd 42. S. 127—131.
Farooq M. II Beitr. Biol. Pflanz. 1966b.
Bd 42. S. 363—371.
Farooq M., Inamuddin M. //J. Indian Bot.
Soo. 1969. Vol. 48, N 1—2. P. 166—173.
Farooq M., Siddiqui S. A. //Sci. and Cult.
1964. Vol. 30, N 8. P. 394—395.
Farooq M., Siddiqui S. A. II New Phytol.
1966. Vol. 65, N 1. P. 50—53.
Farooq M., Siddiqui S. A. //J. Indian Bot.
Soo. 1967. Vol. 46. P. 31—44.
Farr W. K. II Bull. Torrey Bot. Club. 1920.
Vol. 47, N 8. P. 325—338.
Fathima Т., Boraiah G. II Proc. Indian Acad.
Soi. B. 1973. Vol. 78, N 2. P. 157—171.
Faure G. //Ann. Bot. (Roma). 1911. Vol. 9,
F. 3. P. 323—325.
Favre-Duchartre M. II Bull. Soc. bot. France.
1982. T. 129, N 3. P. 217—222.
Favre-D uchartre M. II Ann. sci. Univ. Remis
et ARERS. 1977—1978. Vol. 15. P. 27—31.
F avre-D uchartre M. II С. г. Acad. Sci. Ser. 2.
T. 288, N 3. P. 331-334.
Fedec P., Knowles R. H. II Can. J. Bot. 1973.
Vol. 51, N 10. P. 1761—1764.
Feng Y.-A. II Botaniste. 1934. Ser. 26, fasc. 1.
P. 3—84.
Ferri S. II N. G. bot. Ital. 1961. Vol. 68.
P. 269-284.
Figdor W. //Ann. Jard. Bot. Buitenzorg.
1897. Bd. 14. S. 213—240.
352
Flemion F., Renrickson E. II Boyce
Thompson Inst. Contr. 1949. Vol. 15. P. 291—297.
iFrancini E. II N. G. bot. Ital. 1927a. Vol. 34,
N 19. P. 381—396.
iFrancini F. II N. G. bot. Ital. 1927b. Vol. 34,
N 19. P. 403—408.
Frey L. II Acta biol. crac. Ser. bot. 1976.
Vol. 19, N 2: P. 173—179.
Fritsche I. II Mem. Sav. Etrang. Acad. St.-
Petersb. 1837. T. 3. P. 649-770.
Frye Т. С II Bot. Gaz. 1901. Vol. 32, N 5.
p 325 331
Frye Т. С II Bot. Gaz. 1902. Vol. 34. P. 389—
413.
Frye T. C, Blodgett E. B. II Bot. Gaz. 1905.
Vol. 40. P. 49-53.
Fuchs A. II Osterr. bot. Ztschr. 1936. Bd 85.
S. 1—16.
Gager С St. II Ann. Bot. 1902. Vol. 16,
N 61. P. 123—148.
Gaiser L. O., Sutherland R. //Amer. J. Bot.
1943. Vol. 30, N 7. P. 543—551.
Galil J., Zeroni M. II Bot. Gaz. 1969. Vol. 130,
N 1. P. 1—4.
Ganapathy P. M. II J. Madras Univ. Sect. B.
1956a. Vol. 26. P. 263—275.
Ganapathy P. M. II J. Madras Univ. Sect. B.
1956b. Vol. 26. P. 589-592.
Ganguly J. K. II Proc. Nat. Inst. Sci. India.
B. 1948. Vol. 14, N 4. P. 181-212,
Garg S. II Nature. 1958. Vol. 182, N 4649.
P. 1615—1616.
Garside S. II J. Afr. Bot. 1946. Vol. 12.
P. 27—34.
Gates R. R. II Proc. Roy. Soo. London. B.
1920. Vol. 91. P. 216—223.
Gates R. R., Rees E. M. //Ann. Bot. 1921.
Vol. 35, N 139. P. 365—398.
Gates R. R. II Cellule. 1925. T. 35. P. 47-60.
Gelin О. Е. V. II Sv. bot. tidskr. 1936. Bd 30,
H. 3. S. 324—328.
Gelin О. Е. V. II Acta horti berg. 1934.
Vol. 11, N 6. P. 99—128.
George K., Geethamma S. II Curr. Soi. (India).
1985. Vol. 54, N 3. P. 148-149.
Gerstel D. U., Mishanec W. II Bot. Gaz.
1950. Vol. 112, N 1. P. 96—106.
Ghatak J. II Proc. Indian Acad. Sci. B. 1956.
Vol. 43, N 1. P. 72—83.
Ghosh M. II Curr. Soi. (India). 1955. Vol. 24,
N 8. P. 280—281.
Ghosh R. B. II J. Indian Bot. Soc. 1962.
Vol. 41. P. 197-206.
Ghosh R. B. II Britheria Cieno. natur. 1974.
Vol. 43, N 3-4. P. 103-117.
Giganti R. II N. G. bot. Ital. 1929. Vol. 36.
P. 1—33.
Giger E. II Beih. bot. Zentr.-Bl. 1913. Bd 30,
Abt 2. S. 1—78.
Gill B. S. II Curr. Sci. (India). 1981. Vol. 50,
N 17. P. 781—782.
Glisic L. M. Development of. the female
x-generation and embryo in Ramondia:
Diss. Belgrad, 1924.
Glisic L. M. II Bull. Inst. Jard. bot. Univ.
Beograd. 1928. T. 1, N 1. P. 1—13.
Glisii L. M. II Bull. Inst. Jard. bot. Univ.
Beograd. 1932. T. 2, N 1. P. 20-56.
Glisic L. M. II Bull. Inst. Jard. bot. Univ.
Beograd. 1933. T. 2. P. 129—152.
Glisic L. M. II Bull. Inst. Jard. bot. Univ.
Beograd. 1934. T. 3, N 1—2. P. 94-111.
Gluck Е./ПЪ. Wiss. Bot, 1940. Bd 71.
S. 267—336.
Godineau J. С II С. г. Acad. sci. (Paris).
Ser. D. 1966. T. 265, N 12. P. 852—855.
Godineau J. С. // С. г. Acad. sci. (Paris),
ser. D. 1968. T. 266, N 10. P. 1008—1010.
Godineau J. C. II Rev. oytol. et biol. veg.
1969. T. 32, N 3—4. P. 209—218.
Godineau J. C. II Ann. Univ. et ARERS.
1971. Vol. 9, N 1. P. 7—88.
Godineau M. II Rev. cytol. et biol. veg.
1963. Vol. 26, N 4. P. 363—404.
Goldblatt P., Gentry A. H. II Bot. notis.
1979. Vol. 132, iss. 4. P. 475—482.
Goldfluss M. II J. Bot. France. 1898. T. 12.
P. 374—384.
Goldfluss M. //J. Bot. France. 1899. T. 13.
P. 9—17, 49—59, 87—96.
Goodspeed Т. Н. II Madrono. 1947. Vol. 9,
N 4. P. 110—120.
Gopal V., Lakshmanan К. К. II Curr. Sci.
(India). 1977. Vol. 46, N 12. P. 423—424.
Gopinath D. M. II Curr: Sci. (India). 1943a.
Vol. 12. P. 58—59.
Gopinath D. M. II Curr. Sci. (India). 1943b.
Vol. 12. P. 329—330.
Gopinath D. M. II Proo. Indian Acad. Sci. B.
1944. Vol. 20, N 5. P. 175—186.
Gopinath D. M. II Proo. Indian Acad. Soi. B.
1945. Vol. 22, N 4. P. 225—231.
Gopinath P. M., Chennaveeraiah M. S. II
J. Karnatak Univ. Sience. 1961. Vol. 6.
P. 61—70.
Govil С. М. II Bull. Indian Nat. Sci. Acad.
1970a. N 41. P. 246—249.
Govil С. М. II Bull. Indian Nat. Sci. Acad.
1970b. N 41. P. 241—243.
Govil С. М., Lavania S. II Proe. Indian
Acad. Soi. 1980. Vol. 89, N 3. P. 219—228.
Govindu H. С II Proc. Indian Acad. Sci. B.
1950. Vol. 32, N 4. P. 164—178.
Graner E. A. 11 Arch. Inst. Biol. veg. (Bra-
sil). 1936. Vol. 1. P. 3—69.
Grebel H. II Flora. 1820. Bd 21. S. 321—336.
Greene E. S. II Plant World. 1898. Vol. 1.
P. 102—103.
Greilhuber J. II Osterr. bot. Ztschr. 1973.
Bd 121, N 1—2. S. 81—97.
Grewal S. S., Sukhija P. S., Bhatia I. S. II
Biochem. u. Physiol. Pflanz. 1978. Bd 173,
N 1. S. 11—16.
Griffith W. II Trans. Linn. Soc. London
(Bot.). 1841a. Vol. 18. P. 59—70.
Griffith W. II Trans. Linn. Soo. London
(Bot.). 1841b. Vol. 18. P. 71—91.
Griffith W. II Trans. Linn. Soc. London
(Bot.). 1945. Vol. 19. P. 171—214.
Grosbois M. II Physiol, plant. 1976. Vol. 36,
N 2. P. 145—149.
Grugg W. //Amer. J. Bot. 1962. Vol. 49,
N 10. P. 1027—1032.
Gscheidle A. //Flora. 1925. Bd 117. S. 144—
172.
Gue'rin P. II J. Bot. 1903. T. 17, N 3.
P. 101—108.
Gue'rin P. II J. Bot. 1904. T. 18, N 1—2.
P. 33—52, 83—88.
Guerin P. IIC. r. Acad. sci. (Paris). 1919.
T. 168. P. 182—185.
Guerin P. II С. г. Acad. sci. (Paris). 1924.
T. 179. P. 1620—1622.
Guerin P. II С. г. Acad. sci. (Paris). 1925.
T. 180. P. 852—854.
Guerin P. II Bull. Soo. bot. France. l()2(i.
T. 23, N 1. P. 5—18.
Guignard L. II Bull. Soo. bot. Franco. 1881,
T. 28. P. 197—201.
i/„ 23 Сравнительная эмбриология
!)Г)8
Guignard Л. //Ann^Sci. natur. Bot. Ser. 7.
1885. T. 2',,' P. 181—24)2,' 310—392.
Guignard L. //C. r. Acad! soi. (Paris). 1901.
T. 133, P. 1208-1272.
Guignard L./I'S. Bot. 1902. T. 16, N 5.
P. 145—1(57.
Guignard L. II G. r. Acad. soi. (Paris). 1903.
T. 137. P. 19-24.
Guignard L. II Mem. Acad. sci. Inst. France.
1017a. T. 55. P. 1-34.
Guignard L. II C. r. Acad. sci. (Paris). 1917b.
T. 165. P. 981—987.
Guignard L. II Mem. Acad. sci. Inst. France.
Ser. 2. 1922a. T. 57. P. 1—34.
Guignard L. II C. r. Acad. sci. (Paris). 1922b.
T. 175. P. 1015—1020.
Guilford V. В., Fisk E. L. II Bull. Torrey
Bot. Club. 1952. Vol. 79, N 1. P. 6-24.
Gulati N. Loganiaceae. // Seminar
Comparative Embryology of Angiosperms. New
Delhi, 1967a. P. 88.
Gulati N. Stackhousiaceae. // Seminar
Comparative Embryology of Angiosperms. New
Delhi, 1967b. P. 57.
Gulati N. Menyanthaceae. // Seminar
Comparative Embryology of Angiosperms. New
Delhi, 1967c. P. 90.
Gupta S. C. Morphological and embryologi-
cal studies of some Umbelliferous spices:
Thesis. Delhi, 1960.
Gupta S. C. //Curr.. Sci. 1962a. Vol. 31,
N 5. P. 203—205.
Gupta S. С II Plant Embryology: A
Symposium, С S. I. R., New Delhi, 1962b.
P. 188—191.
Gupta S. С II Phytomorphology. 1964.
• Vol. 14, N 4. P. 530-547.
Gupta S. С II Bull. Indian Nat. Sci. Acad.
1970. Vol. 41. P. 233—238.
Gupta S. С II Beitr. Biol. Pflanz. 1964a.
Bd 40, N 2. S. 301—323.
Gupta S. C, Gupta M. //Curr. Sci. (India).
1964b. Vol. 33, N 18. P. 563—564.
Gupta S. C, Nanda K. II Grana. 1972.
Vol. 12, N 2. P. 99—104.
Gupta S. C, Nanda iL //Amer. J. Bot.
1978. Vol. 65, N 4. P. 395—399.
Gupta S. C, Nanda K. II Beitr. Biol. Pflanz.
1983. Bd 58, N 2. S. 237—242.
Gustafsson A. II Hereditas. 1932. Vol. 16.
P. 41—62.
Gustafsson A. II Bot. Gaz. 1933a. Vol. 94,
N 4. P. 512—533.
Gustafsson A. II Bot. notis. 1933b. P. 531 —
534.
Gustafsson A. II Hereditas. 1934a. Bd 19,
H. 3. S. 259—283.
Gustafsson A. II Bot. notis. 1934b. S. 333—338.
Gustafsson A. II Hereditas. 1935a. Bd 20,
H. 1—3. S. 1—31.
Gustafsson A. II Hereditas. 1935b. Bd 21,
H. 1. S. 1—112.
Gustafsson A. II Hereditas. 1939. Bd 25. S.
289—322.
Gustafsson A. II Chromosoma. 1942. Bd 2,
H. 4. S. 367—387.
Gustafsson A. II Lunds univ. Arsskr. (2).
1946a. Bd 42, N 3. S. 1—66.
Gustafsson A. II Lunds univ. Arsskr. (2).
1947a. Bd 43, N 2. S. 71—178.
Gustafsson A. II Lunds univ. Arsskr. (2).
1947b. Bd 43, N 12. S. 183—370.
Gustafsson A., Nygren A. II Hereditas. 1946;
Vol. 32. P. 1—14.
Haber J. M. — Phytomorphology. 1959.
Vol. 9, N 3. P. 325—357.
Haber J. M. II Phytomorphology. 1966. Vol.
16, N 4. P. 490-527.
Haberlandt G. II S. B. Preuss. Akad. wiss.
Wien. 1921. Bd 51. S. 861—881.
Haberlandt G. II Biol. Zentr.-Bl. 1922. Bd 42,
N 4. S. 145-172.
Haberlandt G. IIS. B. Preuss. Akad. wiss.
Berlin. 1922. Bd 25. S. 386—406.
Haberlandt G. II S. B. Preuss. Akad. wiss.
Berlin. 1923. Bd 25. S. 283—294.
Haberlandt G. II S. B. Preuss. Akad. wiss.
Berlin. 1938. Bd 2. S. 24—31.
Haccius В., Hartl-Baude E. II Ostcrr. bot.
Ztschr. 1957. Bd 103, N 5. S. 567—587.
Hagemann R. II Acta Soc. bot. pol. 1981.
Vol. 50, N 1—2. P. 321—327.
Hagemann R. II Fert.. and Embryogenesis-
in Ovulated Plants. Bratislava, 1983.
P. 97—99.
Hakansson A. II Acta Univ. Lund. 1923i.
Avd. 2. Bd 18, N 7. S. 1—120.
Hakansson A. II Ber. Dtsch. bot. Ges. 1927.
Bd 45, H. 8. S. 654-664.
Hakansson A. II Hereditas. 1933. Bd 17..
S. 246-248.
Hakansson A. II Bot. notis. 1952. H. 105..
S. 33—45.
Hakki M. I. II Bot. Jb. Syst. Pflanzenhesch.
und Pflanzengeogr. 1975. Bd 96, H. 1—4-.
S. 125-153.
Hakki M. I. II Bot. Jb. Syst. Pflanzengesch.
und Pflanzengeogr. 1977. Bd 98, N 1.
О ПО jHQ
Hailok F. A. II Ann. Bot. 1930. Vol. 44.
P. 771—812.
Halperin W., Wetherell D. F. II Amer. J.
Bot. 1964. Vol. 51, N 3. P. 274-283.
Halperin W., Wetherell D. F. II Science.
1965. Vol. 147. N 3659. P. 756—758.
Halsted B. D. II Bot. Gaz. 1887. Vol. 12..
P. 285—288.
Halsted B. D. II Bot. Gaz. 1890. Vol. 15..
P. 103-106.
Hamilton A. G. II Proc. Linn. Soc. N. S. W.
1885. Vol. 10. P. 157—160.
Hamilton A. G. II Proc. Linn. Soc. N. S. W.
1894. Vol. 19. P. 201—212.
Hamilton A. G. II Proc. Linn. Soc. N. S. W„
1930. Vol. 55. P. 39.
Hanausek T. F. II Ber. Dtsch. bot. Ges.
1895. Bd 13. S. 73—78.
Hanawa J. II Bot. Mag. (Tokyo). 1953. Vol.
66. P. 98—102.
Hanstein J. II Bot. Abhandl., Bonn. 1870..
Bd 1, N 1. S. 1-112.
Harling G. II Acta horti berg. 1950. Bd 15-
S. 135-168.
Harling G. II Acta horti berg. 1951a. Vol. 16.
P. 1—56.
Harling G. II Acta horti berg. 1951b. Vol. 16.
P. 73—120.
Harling G. II Sv. bot. tidskr. 1954. Bd 48.
S. 489-496.
Harling G. II Sv. bot. tidskr. 1960. Vol. 45.
P. 571-590.
Harris С J. II Univ. Pittsb. Bull. 1935.
Vol. 32. P. 131-137.
Harry E., Mestre Y. C, Guignard Y. L. If
Bull. Soc. bot. France. 1977. T. 124, N 7—
8. P. 395—405.
354
Шаги D. II Beitr. Biol. Pflanz. 1959. Bd 35,
N 1. S. 95—110.
Hartman A. //Flora. 1923. Bd 116. S. 216—
258.
Harvey С F., Braggins J. E. II N. Z. J. Bot.
1985. Vol. 23, N 1. P. 151—156.
iHattori S., Hatanaka S. II Bot. Mag.
(Tokyo). 1958. Vol. 71, N 845—846. P. 417—
424.
Hausbrandt L., Golinowski W. II Acta agrobot.
1973. Vol. 26, N 2. P. 285—292.
Hausbrandt L., Golinowski W. II Acta agro-
bat. 1975 (1976). Vol. 28, N 7. P. 89—93.
Mausner G. II Beirt. Biol. Pflanz. 1976.
Bd 52, H. 1—3. S. 101-126.
iHauss H.-ll Bot. Archiv. 1927. Bd 20. S. 74.
Maviland F. II Proc. Linn. Soc. N. S. W.
1885. Vol. 10. P. 237—240.
Haviland F. E. II Proc. Linn. Soc. N. S. W.
1914. Vol. 39. P. 851—854.
Hegelmaier F. II Bot. Ztschr. 1875. T. 33,
H. 5, Abt. 1. S. 75—76.
Megelmaier F. II Bot. Ztschr. 1889. Bd 47.
S. 805-812, 821—826, 837—842.
Heitz E. Experementia. 1951. Bd 7. S. 456.
Helm F. //Assoc. Fr. Av. Sci. 24th
(Bordeaux). 1895. P. 638—640. .
Henfrey A. II Trans. Linn. Soc. London (Bot.).
1856. Vol. 22, pt 1. P. 69—79.
Herr J. M. 1П. Elisha Mittchell Sci. Soc.
1959a. Vol. 75, N 2. P. 107—128.
MerrJ.M. //Virginia J. Sci. 1959b. Vol. 10.
P. 259
Herr J.'m.I/J. Elisha Mitchell Sci. Soc.
1961. Vol. 77, N 1. P. 26—32.
Mesemann С U. II Biol. Zentr.-Bl. 1972.
Bd 91, N 6. S. 695-698.
Meslop-Harrisom J. II Can. J. Bot. 1969.
Vol. 47, N 4. P. 541—542.
Messe М., Greilhuber J. II Linzer biol. Beitr.
1975. Vol. 7, N 2. P. 257—276.
Hewitt W. С IIJ. Elisha Mitchell Sci. Soc.
1939. Vol. 55, N 1. P. 63—82.
Mielsoher T. II Beitr. Biol. Pflanz. 1883.
Bd 3. S. 1-24.
Hiroyuki Kato II Sci. Papers Coll. Gen. Educ.
Univ. Tokyo. 1968. Vol. 18, N 2. P. 191 —
197.
Hjelmqvist.H. II Bot. notis. 1951. S. 180—187.
Hjelmqvist H., Grazi F. II Bot. notis. 1965.
Vol. 118, fasc. 4. P. 329—360.
Hjelmqvist H., Holmberg U. II Bot. notis.
1961. Vol. 114, fasc. 3. P. 353—360.
Hefmeister W. II Flora. 1855a. Bd 17.
S. 257—266.
Mofmeister W. II Ann. sci. natur. Bot. 1855b.
Vol. 3. P. 209—219.
Holm Th. II Ann. Bot. 1897. Vol. 11, N 43.
P. 369—383.
Holmgren I. II Sv. bot. tidskr. 1915. Bd 9.
Holmgren I. /I Sv. bot. tidskr. 1916. Bd 10.
S, 263—269.
Holmgren I. II Kgl. sv. vet.-akad. handl.
1919. Bd 59. S. 1—118.
Hook F., Davis G. L. II Austral. J. Bot. 1962.
Vol. 10, N 1. P. 1—12.
Лвокег I. D. //Trans. Linn. Soc. 1855.
Vol. 22. P. 1-68.
Heme A. S. II Trans. Linn. Soc. London.
Ser. 2, Bot. 1909. Vol. 7. P. 303—326.
Horner H. T. II Amer. J. Bot. 1977. Vol. 64,
N 56. P. 745—759.
Horner H. 2"., Rogers М. А. Ц Can. J. Bot.
1974. Vol. 52, N 3. P. 435—441.
Houk W. G. II Sciences. 1936. Vol. 83.
P. 464—465.
Houk W. G. //Amer. J. Bot. 1938. Vol, 25,
N 1. P. 56-61.
Howe T. D.//Bot. Gaz. 1926. Vol. 81,
p 280 296
Howe T. D. //Amer. J. Bot. 1964. Vol. 51,
N 6, pt 2. P. 678.
Howe T. D. //Amer. J. Bot. 1969. Vol. 56,
N 6. P. 641-645.
Howe T. D. //Amer. J. Bot. 1975. Vol. 62,
N 3 P 273 279
Husain W., Khan A. H. II Sci. and Cult.
1970. Vol. 36, N 4. P. 217.
Hyde B. B. //Amer. J. Bot. 1970. Vol. 57,
N 10. P. 1197—1206.
Ikeno S. II Ber. Dtsch. bot. Ges. 1910. Bd 28,
H. 8. S. 394—397.
Ishii K. II Tokyo Nipon Univ. Col. Agr. Vet.
Med. Bull. 1964. Vol. 19. P. 17—27.
Ives S.A.I/ Bot. Gaz. 1923. Vol. 76. P. 60-77.
Iyengar G. S. II J. Indian Bot. Soc. 1937.
Vol. 16, N 4. P. 175-195.
Jacobsson-Palay R. II Bull. Soc. bot. Geneve.
Ser. 2. 1920. T. 12, N 2. P. 65—86.
Jager-Ziirn J. II Osterr. bot. Ztschr. 1965.
Bd 112, N 4. S. 621—639.
Jain Т. С //J. Indian Bot. Soc. 1956.
Vol. 35, N 2. P. 181—188.
Jaitly S. С II Phytomorphology. 1966.
' Vol. 16, N 4. P. 430-436.
Jaitly S. С II Symp. Morphology, Anatomy
and Embryology of Land Plants. 1969.
P. 62—63.
Jaitly S. C, Guignard J. L., Mestre J. C. II
Bull. Soc. bot. France. 1968a. T. 115.
P. 369—372.
Jaitly S. C, Guignard J. L., Mestre J. C. II
С r. Acad. sci. (Paris). 1968b. T. 267.
P. 1717—1719.
Jaitly S. C, Guignard J. £., Mestre J. C. II
С r. Acad. sci. (Paris). 1968c. T. 267,
N 2. P. 170-173.
Jalaja S., Namboodirik A. N. II Experientia.
1975. Vol. 31, fasc. 8. P. 915.
Johansen D. A. //Bot. Rev. 1945. Vol. 11,
N 2. P. 87—107.
Johnson T. II Ann. Bot. 1888. Vol. 2.
P. 137—160.
Johnson T. II Ann. Bot. (London). 1889—
1890. Vol. 3, N 10. P. 179-206.
Johow F. II Jb. Wiss. Bot. 1885. Bd 16, N 3.
S. 415—449.
Johow F. II Jb. Wiss. Bot. 1889. Bd 20, N 4.
S. 475—525.
Johri В. М. II Curr. Sci. (India). 1951. Vol. 20,
N 7. P. 189—191.
Johri В. М. II Plant embryology: A
Symposium CSIR. New Delhi; 1962. P. 192—198.
Johri В. М., Agarwal S. II Phytomorphology.
1965. Vol. 15, N 4. P. 360—372.
Johri B. M., Agrawal J. S. II Curr. Sci.
(India). 1954. Vol. 23, N 3. P. 96—98.
Johri B. M., Agrawal J. S., Garg S. II
Phytomorphology. 1957. Vol. 7, N 3—4. P. 336—
354.
Johri В. М., Ambegaekar К. В. II Proc.
Indian Acad. Sci. (Plant Sci.). 1984.
Vol. 93, N 3. P. 413—424.
Johri B. M., Bhatnagar S. P. II Proc. Nat.
Inst. Sci. India, B. 1960. Vol. 26,, N 4.
P. 199—220.
Johri B. M., Bhatnagar S. P. II Rov. cylol.
et biol. veg. 1969. T. 32, fasc. 3-4. P. 358-
369.
23*
1555
Johri В. М:, Jan К. К. //Cytologia. 1974.
Vol. 39, N 4. Р, 801-813,
Johri В. Ml, Nand S. II Ргоо. Indian Acad.
Sci., B. 1934, Vol.. 1, N 6. P. 283—289.
Johri B. M., Prakash S. II Phytomorphology.
1965. Vol. 15, N 2. P. 150—158.
Johri B. M., Raj B. II Osterr. bot. Ztschr.
1969. Bd 116, N 1-5. S. 475-485.
Johri В. M., Seghal C. B.I!Naturwissen-
schaften. 1963. ,H 2. S. 47—48.
Johri B. M., Seghal С. В. II
Phytomorphology. 1968. Vol. 16, N 3. P. 364—378.
Johri B. M., Singh H. //Bot. notis. 1959.
Vol. 112, N 2. P. 227—251.
Johri B. M., Tiagi B. II Phytomorphology.
1952. Vol. 2, N 2—3. P. 162—180.
Johri B. M., Vasil L. K. II Phytomorphology.
1956. Vol., 6. P. 134—143.
Jones H. A. //Calif. Agt. Expi. Sta. 1927.
Vol. 2. P.. 42^—442'.
Jones B. L., Gordon.C. C. //Amer. J. Bot.
1965. Vol. 52, N 2. P. 127—132.
Jonson G. W. //Amer. J. Bot. 1941. Vol. 28.
P. 306—319.
Jordaan P. G. II J. Sth. Afr. Bot. 1946. Vol. 12.
■ P. 15—26.
Jos J. S. II Agra Univ. J. Res.-Sci'. 1963.
-Vol. 12, pt 2. P. 247—260.
Jos J. S., Singh S. P: II J. Indian Bot. Soc.
1968. Vol. 47, N 1—2. P. 117—128.
Joshi P. C. II Phytomorphology. 1960. Vol. 10,
N 3.*i\ 239—248.
Joshi В. M.\ Dwivedi N. K. Studies in the La-
miaoeae. III. Embryology of Plectranthus
rugosus Wall. // J. Indian Bot. Soc.' 1980a:
Vol. 59, N 127.
Joshi B. M., Dwivedi, N. K. II Trans. Indian
Soc. Desert Technol. and Univ. Cent.
Desert Stud. 1980b. Vol. 5, N 2. P. 32—38.
Joshi M. C, Varghese. Т. М. II Sci. and Cult.
1962. Vol. .28. P. 489,'
Joshi M. C, Varghese Т. М. //Proc. Indian
Acad. Sci., B. 1963. Vol. 57, N 3. P. 164—
177.
Jost L. II Bot. Ztschr. 1888. Bd 46, N 23.
S. 357—368, 373—387.
Juel H. O. II Beih. bot. Zentr.-Bl. 1898.
Vol. 74. P. 369-372.
Juel H. O. II Jb. Wiss. Bot. 1900. Bd 35.
S. 626—659.
Juel H. O. II Beih. bot. Zentr.-Bl. 1903.
Bd 13. S. 194—202.
Juel H. O. II Ark. Bot. 1904. Vol. 2. P. 1—9.
Juel H. O. II Kgl. sv. vet.-akad. handl. 1906.
Vol. 39. P. 1—21.
Juel H. O. II Kgl. sv. vet.-akad. handl. 1909.
Vol. 33. P. 1—59.
Juel H. O. II Sv. bot. tidskr. 1910. Bd 4,
N 3. S. 151—159..
Juel H. O. II Nova acta soc. sci. Upsal. 1911.
Ser. 4. Bd 2, N 11. S. 1—26.
Juel H. O. II Kgl. sv. vet.-akad. handl. 1929.
Bd 7, N 3. S. 1—13.
Juliano J. B. //Philipp.. J. Sci. 1935a.
Vol. 56. P. 405—451.
Juliano J. B. II Philipp. Agr. 1935b. Vol: 23.
P. 833—858.
Junell S. II Symbol, bot. Upsalienses. 1934.
Vol. 4. S. 1-219.
Junell S. //Sv. bot. tidskr. 1937. ' Bd 31.
S. 67—110.
Junell S. II Acta horti Gotheb. 1962. Bd 25.
S. 91—101.
Jurica H. S. II Bot. Gaz. 1922. Vol. 74, N 3.
P. 292—307.
Jurukova-Gryncharova P. D. II Fitologia BGR.
1978. Vol. 9. P. 59-69.
Kadej P., Kadej A. //Acta Soc. bot. poll
1981. Vol. 50, N 1—2. P. 139—142.
Kadej A., Kadej F. //Fertilization and em-
bryogenesis in ovulated plants. June, 1982.
Bratislava, 1983. P. 249—253.
Kadej A., Wilms H. J:, Willemse M. Т. М: //'
Acta bot. neer. 1985. Vol. 34, N 1. P. 95—
103.
Kadry A. E. R. II Bot. notis. 1952. Vol. 105,.
fasc. 1. P. 46—47.
Kadry A. E. R. II Sv. bot. tidskr. 1953-
Bd 47, N 4. S. 488—508.
Kadry A. E. R. //Bot. notis. 1955. Vol. 108,
fasc 2 P 231' 243.
Kddry K., Tenfic H. II Bot. notis. 1956.
Vol 109, fasc. 4. P. З^б—399.
Kainradl E. II S. B. Acad. wiss. Wien. 1927.
Abt. 1, Bd 136, N 1—10. Й. 167—194.
Kajale L. B. II Curr. Sci. (India). 1944a.
Vol. 13. P. 49.
Kajale L. B. //Proc. Nat. Inst. Sci. Indian
1944b. Vol. 10: P. 387—391. ■
Kajewska E. II Actabiol. ;c'rac. S'er. bot. 1977;.
Vol. 20, N 1, P. 41-49, . •
Kallarackal J., Bhatriagar S. P. //Garyolo-
gia. 1981. Vol. 34, N 4. P. 447—455.
Kanda M. .11 Bot: Gaz. 1920. Vol. 69,: N 1.
P. 54—71. '
Kapil R. N. If Bull. bot. Surv. India: 1962.
Vol. 4. P. 57—66.
Kapil R. N., Masand P. II Proc. Nat. Inst.
Sci. India. 1964. Vol. 30, N 2. P. 99—113.
Kapil R. N., Mohana Rao P. R. II
Phytomorphology. 1966a. Vol. 16, N 4. P. 564—
578.
Kapil R. N., Mohana Rao P. R. II Proc:
Nat. Inst. Sci. India. 1966b (1967). Vol. 32,
N 5—6. P. 218—232.
Kapil R. N,, Rustagi P. N., Venkataraman. II
Phytomorphology. 1969. Vol. 18, N'3'.
P. 403-412.
Kapil R. N., Sethi S. B. II
Phytomorphology. 1962. Vol. 12. P. 235—239.
Kapil R. N., Tiwari S. С II Bot. Rev.
1978 (1979). Vol. 44, N 4. P. 457—490.
Kapil R. N., Vani R. S. II
Phytomorphology. 1966. Vol. 16. P. 533—563.
Kapil R. N'., Vtjayaraghavan M. R. II Curt.
Sci. (India). 1962. Vol. 31, N 7. P. 270—
272.
Kapil R. N., Viayaraghavan M. R. II
Phytomorphology. 1965. Vol. 15, N 1. P. 93—102.
Kaplan D. R. II Amer. J. Bot. 1968. Vol. 55„
N 8. P. 933—950.
Kaplan D. R. II Phytomorphology. 1969.
Vol. 19, N 3. P. 253—278.
Kaplan D. R. II Bull. Torrey Bot. Club..
1969. Vol. 96', N 4. P. -418—434.
Kapoor Т., Parulekar N. K., Vjiayaragha-
van M. R. II Bot. notis. 1975. Vol. 128,.
N 4. P. 438—449.
Kapoor Т., Vtjayaraghavan M. R. II Beitr.
Biol. Pflanz. 1975. Bd 51. S. 321—324..
Kapoor Т., Vtjayaraghavan M. R. II Phyten.
1978. Vol. 18, fasc. 3—4. P. 209—217.
Karlstrom P. O. II Sv. bot. tidskr. 1972..
Bd 66, N 4. S. 303—313.
Karlstrom P. 0. //Sv. .bot. tidskr. 1973.
Bd 67, N 3. S. 257—280.
Karlstrom P. O. II Sv. bot. tidskr. 1974a.
Bd 68, N 2. S. 121—135.
Karlstrom P. O. II Sv. bot. tidskr. 1974b..
Bd 68, N 3. S. 315—328.
356
Karuna Mohan Km. II Proc. Indian Acad.
Sci. B. 1966. Vol. 64, N 1. P. 26—31.
Kashyap G. II Agra. Univ. J. Res. (Sci.).
1955. Vol. 44. P. 777—783.
Kashyap G. II J. Indian Bot. Soc. 1958.
Vol. 37, N 2. P. 240—248.
Kaul V. II Proc. 60th Indian Sci. CoDgr.
1973. Apt. 3. P. 328.
Kaul V., Dathan A. S. R., Singh D. II J.
Indian Bot. Soc. 1975. Vol. 54, N 3—4.
P. 238—245.
Kaul V., Singh D. II N. G. bot. Hal. 1980.
Vol. 114, N 6. P. 277—294.
Kaul V., Singh D. II Cytologia. 1982. Vol.'47,
N 1. P. 125—135.
Kaul V., Singh D. //Acta Biol. crac. Ser.
bot. 1982. Vol. 24. P. 19—30.
Kaur H. II J. Indian Bot. Soc. 1969 (1970).
Vol. .48, N 3—4. P. 346—351.
Kaur H. II Bull. Indian Nat. Sci. Acad.
1970. N 41. P. 230—232.
Kaur И. //Curr. Sci. (India). 1981. Vol. 50,
N 20. P. 912 913.
Kaur H., Singh R. p' II J. Indian Bot. Soc.
1970. Vol. 49, N 1—4. P. 168—174.
Kausik S. B. II Curr. Sci. (India). 1935a.
Vol. 3. P. 357—359.
Kausik S. B. //Proc. Indian Acad. Sci. B.
1935b. Vol. 2. P. 410-418.
Kausik S. B. II Ann. Bot. 1938a. Vol. 2.
P. 899—910.
Kausik S. B. II Curr. Sci. (India). 1938b.
Vol. 6. P. 332—333.
Kausik S. B. II Proc. Indian Acad. Sci, B.
1938c. Vol. 8. P. 45—62.
Kausik S. B. II J. Indian Bot. Soc. 1938d.
Vol. 17, N 2—3. P. 161—168.
Kausik S. B. II Beih. bot. Zentr.-Bl. 1938e.
Bd 58, Abt. A. S. 365—378.
Kausik S. B. II Ann. Bot. 1939a. Vol. 3,
N 12. P. 815—824.
Kausik S. B. II Proc. Indian Acad. Sci.
1939b. Vol. 9. P. 39—48.
Kausik S. B. II Ann. Bot. 1940. Vol. 4,
N 13. P. 73—80.
Kausik S. B. II Proc. Indian Acad. Sci. B.
1941. Vol. 14. P. 137—140.
Kausik S. B. II Proc. Indian Acad. Sci.
1942. Vol. 16, N 5. P. 121—140.
Kausik S. В., Raju M. V. S. II Proc. Indian
Acad. Sci. B. 1955. Vol. 41, N 4. P. 155—
166.
Kausik S. В., Raju M. V. S. //Curr. Sci.
(India). 1956. Vol. 25, N 9. P. 296—297.
Kausik S. В., Subramanyam K. //J. Indian
Bot. Soc. 1945a. Vol. ,24. P. 175—181,
Kausik S. В., Subramanyam K. II Proc.
Indian Acad. Sci., B. 1945b. Vol. 21. P. 269—
278. ■ . _
Kausik S. В., Subramanyam K. II Curr. Sci.
(India). 1946a. Vol. 15, N 3. P. 78—79.
Kausik S. В., Subramanyam K. II Proc.
Indian Acad. Sci., B. 1946b. Vol. 23. P. 274—
280.
Kausik S. В., Subramanyam K. II Curr. Sci.
. (India). 1946c. Vol. 15. P. 257—258.
kausik S. В., Subramanyam K. II Proc.
Indian Acad. Sci., B. 1947a. Vol. 26, N 4.
P. 164—167.
Kausik S. В., Subramanyam K. II Bot. Gaz.
1947b. Vol. 109, N 1. P. 85—90.
Kenyan F. M. G. II Bull. Torrey Bot. Club.
1928. Vol. 55. P. 499—512.
Khaleel T. F. II Bot. notis. 1974. Vol. 127,
N 2. P. 193-210.
Khaleel T. F. II Bot. Gaz. 1975. Vol. 13».
P. 380—387.
Khaleel T. F. //Bot. notis. 1977. Vol. 130,
N 4. P. 441—452.
Khaleel T. F. //Plant. Syst. and Evol. 1978.
Vol. 129, N 1—2, P. 45—62.'
Khaleel T. F. II Plant Syst. and Evol. 1982.,
Vol. 139, N 3—4. P. 303—311.
Khaleel T. F., Nalini A. S. II Curr. Sci.
(India). 1972. Vol. 41, N 13. P. 491—494.
Khan R. //Curr: Sci. (India). 1953. Vol. 22,
N 6. P. 179—180.
Khan R. II Phytomorphology. 1954. "Vol. 4,
N 1—2. P. 80—117.
Khan R. II Proc. Nat. Acad. Sci. India. B.
1963. Vol. 33. P. 651—655. '
Khan R. II Bull. Indian Nat. Sci. Acad.
1970a. N 41. P. 290—297.
Khan P. S. II Proc. Nat. Acad. Sci. India, B.
1970b. Vol. 40. P. 21—24.
Khan R., Khatoon F. II Seminar on
morphology, anatomy and embryology of lands-
plants. Delhi, 1969. P, 67—68.
Khanna P. II J. Indian Bot. Soc. 1964a.
Vol. 43, N 2. P. 192—202.
Khanna P. II Bull. Torrey Bot. Club. 1964b.
Vol. 91, N 2. P. 105—114.
Khidir M. O. II Cytologia. 1969. Vol. 34„
N 3. P. 454—460.
Khoshoo T. N., Tandon S. R. II Caryologia.
1963. Vol. 16, N 2. P. 445—477.
King I. R. II Hilgardia. 1938. Vol. 11„
N 8—9. P. 437—458.
Kirsten E. II Sv. bot. tidskr. 1970. Vol. 65,.
N 3. P. 225—244.
Knox R. В., Friederich E. II New Phytol..
1974. Vol. 73, N 1. P. 251—258.
Koch L. II Jb. Wiss. Bot. 1878. Bd 11..
S. 218—261.
Koiwai A., Suzuki F., Matsuzaki T:, Ka~
washima N. II Phytochemistry. 1982..
Vol. 21, N 2. P. 305—308.
Koncalova M. N., Hfib J., Jicinska D. II
Fertilization and embryogenesis in
ovulated plants. Bratislava, 1983. P. 43^49.
Koorders II Bot. Jb. 1896. Bd 21. S. 458—498.
Kopczynska K. II Acta Soc. bot. pol. 1964..
Vol. 33, N 1. P. 141—156.
Koscinska M. II Acta biol. crac. Ser. bot..
1980. Vol. 22, N 1. P. 71—80.
Koscinska-Pajak M. II Fertilization and
Embryogenesis in Ovulated Plants. Bratislava,.
1983. P. 295—298.
Koul A. K., Durani P. K. //Curr. Sci.
(India). 1969. Vol. 38, N 21. P. 521—522.
Kovacik A., Sykorova O. II Sbornikuvtiz «Ge-
netika a. slechteni». 1969. rocn. 15, с 4.
P. 252—266.
Koyama H., Maeda Fumiko II Acta phyto-
taxon. et geobot. 1972. Vol. 25, N 2—3».
P. 92—96.
Kremer I. A. //Acta bot. Acad. sci. hung..
1958. Vol. 4, fasc. 1—2. P. 113-144.
Krishna Iyengar С V. //J. Indian Bot..
Soc. 1937. Vol. 16, N 2. P. 99—109. '
Krishna Iyengar С V. II Curr. Sci. (India)1..
1939a. Vol. 8. P. 261—263.
Krishna Iyengar С V. //J. Indian Bot.,
, Soc. 1939b. Vol. 18, N 1. P. 13-20. \
Krishna Iyengar С V. II I. Indian Bot. Soc
1939c. Vol. 18, N 1. P. 35—42.
Krishna Iyengar С V. II J. Indian IJtltl.
Soc. 1940a. Vol. 18, N 4. P. 17(1- W.
Krishna Iyengar C. V. II J. Indian Bol. H.OIV
1940b. Vol. 19, N 1. P. 5—17.
m
Krishna Iyengar С. V. II J. Indian Bot. Soo.
1940c. Vol. t(), N 5. P. 251—261.
Krishna Iyengar C. V. II Proc. Nat. Inst.
Soi., India. U. 1941. Vol. 7. P. 61—71.
Krishna Iyengar C. V. II Proc. Nat. Inst. Soi.,
India. J3. 1942a. Vol. 8. P. 249—261.
.Krishna Iyengar C. V. II J. Indian Bot. Soc.
1942b. Vol.. 21, N 1. P. 51—57.
.Krishna Iyengar C. V. II Proc. Nat. Inst.
Sci. India. 1942c. Vol. 8. P. 59—69.
.Krishna Iyengar С V. II J. Mysore Univ.
N. S. 1947. Vol. 7, N 2. P. 83—98.
.Krishna Gowda, Nagaraj M. II Proc. Indian
Acad. Sci. 1983. Vol. 92, N 1. P. 5—18.
Krug С A., Carvalho A. II Nature. 1939.
Vol. 144, N 3646. P. 515.
Kuijt J. II Bot. Rev. 1955. Vol. 21. P. 569—
' 626.
Kuijt J. II Univ. Calif. Pubis Bot. 1960.
Vol. 30.. P. 337—436. '
Kulkarni A. R., Pataskar P. G. II J. Biol.
,. Sci. 1973—1974. Vol. 16—17, N 1—2.
P. 86—91.
Jtulkarni H. D., Srimathi R. A. II Indian
Forest. 1981. Vol. 107, N 11. P."704—706.
Kumar L. S.. S., Abraham A. II Proc. Indian
Acad. Sci. B. 1941. Vol. 14. P. 509—516.
Kumar S., Jain D. K. //Curr. Sci. (India).
1977. Vol. 46, N 21. P. 749—750.
Kumar К. В., Pillai S. K., Pillai A. II
Beitr. Biol. Pflanz. 1983. Bd 58, N 1.
S. 47—52.
"Kumar Sood Sarvesh II Proc. Indian Acad.
Sci. Plant Sci. 1985. Vol. 94, N 4—6.
P. 553—559.
Kusano S. II Bull. Coll. Agr. Tokyo Imp.
Univ. 1908. Vol. 8. P. 51—57.
Kuwada Y. II Bot. Mag. (Tokyo). 1928.
Vol. 42. P. 117—129.
Laguna I. G., Cocucci A. E. II Kurtziana.
1971. T. 6. P. 53—62.
Lakshminarayana K., Maheshwari Devi H. II
Proc. Indian Acad. Sci. 1985. Vol. 95, N 3.
P. 213—219.
ILamba L. С II Curr. Sci. (India). 1976.
Vol. 45, N 10. P. 387—388.
Lamm R. // Sv. bot. tidskr. 1937. Bd 31,
N 3. S. 217-220.
Lament В., Perry M. //Search, Agriculture.
1976. Vol. 7, N 7. P. 316—318.
Land W. T. G. II Bot. Gaz. 1900. Vol. 30.
P. 252—260.
Lang F. X. II Flora. 1901. Bd 88. S. 149—
206.
Langlet O. II Sv. bot. tidskr. 1925. Bd 19.
S. 215—231.
Lankosz-Mroz M. II Acta biol. crac. Ser. bot.
1984a. Vol. 26. P. 19—32.
Lankosz-Mroz M. II Acta biol. crac. Ser. bot.
1984b. Vol. 26. P. 55—73.
Latoo С S. II Bot. Gaz. 1974. Vol. 135, N 3.
P. 173-180.
Laurent V. II Sv. bot. tidskr. 1923. Bd 17,
N 2. S. 165—174.
Lavialle P. II Bull. Soc. bot. France. 1911.
Vol. 58.
Lavialle P. // Ann. sci. natur. Bot. Ser.
bot. 1912. Vol. 9. P. 39—141.
Lavialle P. II Bull. Soc. bot. France. 1921.
T. 68. P. 414-417.
Lavialle P. II Bull. Soc. bot. France. 1922.
, T. 69. P. 75—79.
Lavialle P. 11 C. r. Acad. sci. (Paris). 1925a.
T. 180. P. 1127-1129.
Lavialle P. II C. r. Acad. sci. (Paris). 1925b.
T. 180. P. 1606—1608.
Lavialle P. II G. r. Acad. sci. (Paris). 1925c.
T. 180. P. 2055—2056.
Lavialle P. II C. r. Acad. sci. (Paris). 1926.
T. 182. P. 77—79.
Leavitt R. G., Spaltung L. J. Parthenpgene-
sis in Antennaria. // Rhodora, 1905.
Lebegue A. II C. r. Acad. sci. (Paris). 1962.
T. 254, N 19. P. 3413—3415.
Leeuwenberg A.J. M. II Acta bot. neer. 1964.
Vol. 13, N 3. P. 333—339.
Leinfellner W. II Osterr. bot. Ztschr. 1972.
Bd 120, N 3. S. 269-277.
Leinfellner W. II Osterr. bot. Ztschr. 1973.
Bd 121, N 1. S. 13—22.
Leitner J. II Osterr. bot. Ztschr. 1942. Bd 91.
S. 29—40. •
Lengel P. A. //Ohio J. Sci. 1960. Vol. 60,
N 1. P. 8—12.
Leung D. W. II Planta. 1979. Vol. 146, N 3.
P. 335-341.
Levieil C, Hyughe C. II C. r. Acad. sci.
(Paris), ser. 3. Vol. 301, N 7. P. 373—378.
Lindau G. II Ber. Dtsch. bot. Ges. 1891.
Bd. 9. S. 274—279.
Lloyd F. E. II Bull. Torrey Bot. Club. 1902.
Vol. 8. P. 1—112.
Lombardo G., Caxra.ro L. II Caryologia. 1976a.
Vol. 29, N 1. P. 113—125.
Lombardo G., Carraro L. II Caryologia. 1976b.
Vol. 29, N 3. P. 345—349.
Lengevialle M. II C. r. Acad. Sci. (Paris).
1966. T. D262. P. 1527—1529.
Lengevialle M. II C. r. Acad. sci. (Paris).
1968a. T. D267. P. 946—949.
Lengevialle M. II G. r. Acad. sci. (Paris).
1968b. T. D266. P. 461—464.
Longevialle M. II C. r. Acad. sci. (Paris).
1969. T. D269. P. 838—840.
Longly B. II Can. J. Bot. 1984. Vol. 62, N 4.
P. 635-646.
Longly В., Louant B.-P. //Acta Soc. bot. pol.
1981. Vol. 50, N 1—2. P. 205-212.
Lougly В., Louant B.-P. II Ann. Univ.
Arers. 1982. T. 18. P. 17—20.
Lougly В., Raban Т., Louant B. P. II Sexual
reproduction in seed plants, ferns and
mosses. Wageiiingen, 1985. P. 157—159.
Lotsy I. P. II Ann. Jard. Bot. Buitenzorg.
1899. Ser. 2, t. 16. P. 173—186.
Lotsy I.. P. II Ann. Jard. Bot. Buitenzorg.
1901. Ser. 2, t. 17, P. 73—101.
Lott J. N. A. //Nord. J. Bot. 1981. Vol. 1,
N 3. P. 421—432.
Louant B.-P., Lougly B. II Rev. cytol. et
biol. veg. Bot. 1981a. T. 4, fasc. 2. P. 173— .
186.
Louant B.-P., Lougly B. II Rev. cytol. et
biol. veg. Bot. 1981b. T. 4, fasc. 2. P. 187—
201.
Lundquist G. II Ztschr. Bot. 1915. Bd 7.
S. 545—559.
Lyshede O. B. //Nord. J. Bot. 1984. Vol. 4.
P. 669—674.
Ly ТЫ Ba II C. r. Acad. sci. (Paris). 1960.
T. 251, N 17. P. 1812—1814.
Ly Thi Ba II C. r. Acad. sci. (Paris). 1961.
T. 252, N 6. P. 927—929.
Macpherson G. E. II Bot. Gaz. 1921. Vol. 71.
P. 392—398.
Mactang M. V. II Philipp. Agr. 1936. Vol. 25.
P. 30—53.
Madhavan R:-{Nie V.^M\)t Gupta S. С II
Beitr. Biol. '■ Pflanz. 1982: Bd 57, N2.
S. 309—321.
Maheshwari J. K. II Phytomorphology. 1954.
Vol. 4, N 1-2. P. 217-230.
Maheshwari Devi H. II Proc. Indian Acad.
Sci. B. 1957. Vol. 46, N 1. P. 68—74.
Maheshwari Devi H. II Proc. 49th Indian
Sci. Congr. 1962a. Part 3. P. 268-269.
Maheshwari Devi H. II Proc. Indian Acad.
Sci. B. 1962b. Vol. 56, N 4. P. 195-216.
Maheshwari Devi H. II Proc. Indian Acad.
Sci. B. 1963. Vol. 58, N 5. P. 274-290.
Maheshwari Devi H. II Proc. Indian Acad.
Sci. B. 1964. Vol. 60, N 1. P. 52-65.
Maheshwari Devi H. II Morphology, anatomy
and embryology of land plants. Delhi,
1969. P. 72—73.
Maheshwari Devi H. II Curr. Sci. (India).
1970. Vol. 39. P. 376—377.
Maheshwari Devi H. II J. Indian Bot. Soc.
1972. Vol. 51. P. 56—62.
Maheshwari Devi H. II Acta bot. Indica. 1975.
Vol. 3, N 1. P. 52—61.
Maheshwari Devi H. II Proc. Indian Acad.
Sci., Plant Sci. 1980. Vol. 89, N 3. P. 213-
218.
Maheshwari Devi H. II J. Indian Bot. Soc.
1977. Vol. 56, N 2. P. 182—188.
Maheshwari Devi H., Padma K. II Curr. Sci.
(India). 1985. Vol. 54, N 11. P. 524-526.
Maheshwari Devi H., Pullaiah T.
//Phytomorphology. 1976. Vol. 26, N 1. P. 77—86.
Maheshwari Devi H., Satyanarayana P. II
Plant Sci. 1971. Vol. 3. P. 61—67.
Maheshwari P. II Curr. Sci. (India). 1944a.
Vol. 13, N 7. P. 186—187.
Maheshwari P. II I. Indian Bot. Soc. 1944b.
Vol. 23. P. 79—81.
Maheshwari P. II Lloydia. 1946. Vol. 9,
N 2. P. 73—113.
Maheshwari P., Hague A. //New Phytol.
1948. Vol. 48, N 2. P. 255—258.
Maheshwari P., Johri В. М. II Nature. 1950.
Vol. 165, N 4207. P. 978—979.
Maheshwari P., Johri В. М., Dixit S. N. II
J. Madras Univ. B. 1957. Vol. 27, N 1.
P. 121—136.
Maheshwari P., Negi V. II Phytomorphology.
1955. Vol. 5, N 4. P. 456-472.
Maheshwari P., Roy S. K.
//Phytomorphology. 1952. Vol. 2, N 4. P. 245-252.
Maheshwari P., Singh B. //Bot. Gaz. 1952.
Vol. 114, N 1. P. 20—32.
Maheshwari P., Srinivasan S. R. II New
Phytol. 1944. Vol. 44, N 2. P. 135-142.
Mahlberg P. G. II Phytomorphology. 1960.
Vol. 10. P. 118—131.
Mahlberg P.G. II Amer. J. Bot. 1961. Vol. 48.
p. 90 99.
Maicde К. Н. II Curr. Sci. (India). 1982.
Vol. 51, N 13. P. 661—662.
Maleska J. II Acta biol. crac. Ser. hot. 1.961.
Vol. 4, N 1. P. 25—42.
Malecka J. II Acta biol. crac. Ser. bot. 1964.
Vol. 7, N 00. P. 107—116.
Malecka J. II Acta biol. crac. Ser. bot. 1965.
Vol. 8, N 2. P. 223—235.
Malecka J. II Acta biol. crac. Ser. bot. 1967.
Vol. 10, N 2. P. 195-206.
Malecka J. //Acta biol. crac. Ser. bot. 1971.
Vol. 14, N 1. P. 1—10.
Malecka J. II Acta biol. crac. Ser. bot. 1975.
Vol. 18, N 1. P. 13-26.
Malecka J. II Acta b'ipl. orac. Ser. bot. 1977m...
Vol. 20, N 1^2.' P. 33-40./ ■
Malecka J. //Acta biol. crac. Ser. bot. 1977bi
Vol. 20, N 1—2. P. 89-99.
Malecka J. II Acta Soc. bot. pol. 1981. Vol. 50,.
N 1—2. P. 147—149.
Malecka J. II Acta biol. crac. Ser. bot. 1982..
Vol. 24. P. 153—157.
Magnus W. II Flora. 1913. Bd 195. S. 275—
336.
Magin N. II Ber. Dtsch. bot. Ges. 1977...
Bd 7, N 1—2. S. 53—56.
Marano Y. II N. G. bot. Ital. N. S. 1954a:.
Vol. 61, N 2—3. P. 201—213.
Marano Y. II N. G. bot. Ital. N. S. 19541k
Vol. 61, N 4. P. 720-721.
Marschall H. H. II Can. J. Plant Sci. 19581
Vol. 38, N 1. P. 67—72.
Martin G. W. II Bot. Gaz. 1892. Vol. 17„
P. 353-411.
Martin P. G., Peacock W. I. II Proc. Linn..
Soc. N. S. W. 1959. Vol. 84, part 2. P. 271 —
277.
Martin R. W., Smith F. H. II Bot. Gaz.
1955. Vol. 116, N 3. P. 243^-249.
Martini E. II N. G. bot. Ital. 1939. Vol. 46..
P. 197—226.
Martinoli G. II N. G. b6t. Ital. N. S. 1939..
Vol. 46, N 2. P. 259—298.
Martinoli G. II N. G. bot. Ital. 1940. Vol. 47,.
N 2. P. 287—322. ;' '
Martinoli G. II N. G. bot. Ital. 1942. Vol. 49,
N 2. P. 311—336.
Martinoli. G. O. //Phytomorphology. 1967.
Vol. 17, N 14. P. 207-210.
Martinoli G., Angiolini D. II N. G. hot. ItaL
1963. Vol. 70, N 3. P. 482—492.
Mathew С J. 11 B. 'V. J. Agr. Res. 1960i_
N 2. P. 49—50.
Mathewson С. А. II Bull. Torrey Bot. Club,.
1906. Vol. 33. P. 487-493.
Mathur K. L. II Curr. Sci. (India). 1934*.
Vol. 3. P. 160-161.
Matsushita A. II J. Agr. Chem. Soc. Japv
1971. Vol. 45, N 1. P. 43—48.
Maugini E. II N. G. bot. Ital. 1962. Vol. 69i.
N 1. P. 1—18.
Maugini E. II N. G. bot. Ital. 1967. Vol. 101„
N 3. P. 185—187.
Mauritzon J. II Bot. notis. 1933. N 1/3.-
S. 172—180.
Mauritzon J. II Lunds univ. Arsskr. 1934..
Bd 30, N 5. S. 1-41.
Mauritzon J. II Bot. notis. 1935. S. 60—77.
Mauritzon J. II Sv. bot. tidskr. 1936a. Bd 30^.
H. 3. S. 541—550.
Mauritzon J. II Ark. bot. 1936b. Bd 28B,
N 5. S. 1—6.
Mazzolani G. II Ann. Bot. (Roma). 1961.
Vol. 27, N 1. P. 110—119.
Mazzolani G. II Olivicoltura. 1963. N 1»
P. 12—13.
Mazzolani G. II Ann. Bot. (Roma). 1973..
Vol. 32. P. 127—128.
McCoy R. W. II Bull. Torrey Bot. Clubw.
1949. Vol. 76, N 6. P. 430-439.
McDonald С. С. II Bull. Torrey Bot. Club;
1927. Vol. 54. P. 479—497.
Medina D. M. II Bragantia. 1960. Vol, 11);.
P. 767—784.
Melville R. II Chemistry a. Industry, 1047.,
N 22. P. 304-306.
Mendes A. J. T. II Amer. J. Bol. I Ml'.
Vol. 28, N 9. P. 784-789.
3!>tt
Menies A. J, T. //Bragantia. 1944. Vol. 4,
N 12. P; 093-7,08.
Menies A. J. T. //Bragantia. 1950. Vol. 10,
N 3. P. 79—87.
Merl E. M. II Йога. 1915. Bd 108. S. 127—200.
Men-ell W. D. //Bot. Gaz.; 1900. Vol. 29.
p. 99—133
Men M. II Flora. 1897a. Bd 84, S. 69—87.
Merz M. Untersuchungen iiber Anatomie
uiid Sanaenentwickelung der Utricularien
uud Pinquicula: Diss. Univ. zu Bern,
Miinchen. 1897b.
Messeri A. //N.. G. hot. Ital. 1927. N 19.
P. 1037—1042.
Messeri A. //N. G. bot. Ital. 1950. Vol. 57,
N 1—2. P. 149—169.
Mestre J. С II С. г. Acad. sci. (Paris). 1957
T. 245, N 3. P. 355-358.
Mestre J. C. II Bull. Soc. hot. France. 1957.
T. 104, N 1—2. P. 37—40.
Mestre J. С IIG. r. Acad. sci. (Paris). 1958.
T. 247, N 3. P. 333—336.
Mestre J. C. II C. r. Acad. sci. (Paris). 1965.
T. 260, N 12. P. 3453—3456.
Mestre J. С II Rev. gen. bot. 1967. N 877.
P. 273—324.
Mestre J. C, Guignard J. L. II С r. Acad.
sci. (Paris), D. 1969. T. 268. P. 3170—3172.
Mestre J. C, Guignard J. L. II С r. Acad.
sci. (Paris), D. 1970. T. 271, N 16. P. 1358—
- 1360.
Mestre J. C, Guignard J. L. II С r. Acad.
'■ sci. (Paris). 1971. T. 272, N 10. P. 1383—
1386.
Mestre J. C, Vannereau A. II Bull. Soc.
hot. France. 1980. T. 127, N 3-4. P. 39—51.
Meunier A. //Cellule. 1897. T. 12. P. 297—
333.
Meyer S. II J. Dept. Sci. Cal. Univ. 1938.
Vol. 1. P. 131—158.
Meyer K. II Ber. Dtsch. bot. Ges. 1925.
Bd 43. S. 108—114.
Meyer /., Abgrall M., Hortin M. II С. г.
Acad. sci. (Paris). 1962. T. 254, N 14.
P. 2629—2631.
Mez С II Bot. Ver. Prov. Brandenburg.
' 1887. Bd 29, N 1. S. 30—36.
Michalik B. II Bull. Acad. pol. sci. Ser.
sci. biol. 1979. Vol. 27, N 3. P. 211—216.
Michell M. R. II Bot. Gaz. 1915. Vol. 59.
P. 124—135.
Miller H. A.., WetmoreR. H. II Amer. J. Bot.
1945. Vol. 32, N. 9. P. 588-599.
Millsaps V. Ij J. Elisha Mitchell Sci. Soc.
1936. Vol. 52. P. 56—75.
Misra К. С II Curr. Sci. (India). 1937. Vol. 6,
N 1. P. 98—99.
Misra К. С II Proc. Indian Acad. Sci., B.
1939. Vol. 9, N 1. P. 49—56.
Misra R. С II Bull. Nat. Bot. Gard. 1964a.
N 105. P. 1-14.
Misra R. С II Curr. Sci. (India). 1964b.
Vol. 33, N 14. P. 438—439.
Misra R. C: II Seminar comparative
embryology of angiosperms. New Delhi, 1967.
P. 105.
Misra R. C. //Bull. Indian Nat Sci. Acad.
1970. N 41. P. 298—305.
Misra S. II J. Indian Bot. Soc. 1957. Vol. 36,
N 4. P. 503-512.
Misra S, II Bot. Mag. (Tokyo). 1964. Vol. 77,
' N 914. P. 290—296.
Misra S. //Austral. J. Bot. 1965. Vol. 13,
' N 1. P. 1—10.
Mitra J. N.. //Curr. Sci. (India). 1945. Vol. 14
N. 8: p., 206.
Mitra J.vNr/n. Indian Bot: Soc. 1947a.
Vol. 26. P. 51—61.
Mitra J. N. II J. Indian Bot. Soc. 1947b.
Vol. 26. P. 105—123.
Mitra J. N., Datta R. M. //Sci. and Cult.
1947. Vol. 12. P. 451—452.
Mitra J. N., Datta R. M. II Bull. Bot. Soc.
Bengal. 1949. N 3. P. 11—15.
Mitroin-Radulescu N., Mordianu M. II Rev.
roum. biol. veg. 1981. T. 26, N 2. P. 117—
122.
Moar N. T. //NN. Z. J. Sci. 1960. Vol. 9,
N 1. P. 51-60.
Moens P. II Bull. Soc. roy. bot. Belg! 1965a.
Vol. 98, N 2. P. 319—320.
Moens P. II Cellule. 1965b. Vol. 65, N 2.
P. 127—147.
Mogensen H. L. II Phytomorphology. 1978a.
Vol. 28, N 1. P. 114—122.
Mogensen H. L. II Amer. J. Bot. 1978b.
Vol. 65, N 9. P. 953—964.
Mogensen H. L. II Bull. Soc. bot. France.
1978c. Vol. 125, N 1—2. P. 237—241.
Mogensen H. L. II Amer. J. Bot. 1981. Vol. 68,
N 2. P. 183-194.
Mogensen H. L., Suthar H. K. II Bot. Gaz.
1979. Vol. 140, N 2. P. 168—179.
Mohan K. II Proc. Nat. Inst. Sci. India.
B. 1968. Vol. 34, N 3. P. 142—148.
Mohan K., Singh B. II J. Indian Bot. Soc.
1969. Vol. 48, N 3—4. P. 338-345.
Mohan Ram H. Y. II Proc. 43rd Indian Sci.
Congr. 1956. Part 3. P. 235—236.
Mohan Ram H. Y. II Curr. Sci. (India).
1959a. Vol. 28, N 5. P. 169—170.
Mohan Ram H. Y. II Congr. Intern. Bot.,
9th. 1959b. P. 2—267.
Mohan Ram H. Y. II Lloydia. 1960a. Vol. 23,
N 1. P. 21-27.
Mohan Ram H. Y. II Amer. J. Bot. 1960b.
Vol. 47, N 3. P. 215—219.
Mohan Ram H. Y. II Can. J. Bot. 1961.
Vol. 39, N 1. P. 207-214.
Mohan Ram H. Y. II J. Indian Bot. Soc.
1962. Vol. 41, N 2. P. 288—296.
Mohan Ram H. Y., Kamini I.
//Phytomorphology. 1964. Vol. 14, N 4. P. 574—587.
Mohan Ram H. Y., Masand P. //Curr. Sci.
(India). 1962. Vol. 31, N 1. P. 7—8.
Mohan Ram H. Y., Masand P.
//Phytomorphology. 1963. Vol. 13, N 1. P. 82—91.
Mohan Ram H. Y., Sehgal P. P. II
Phytomorphology. 1958. Vol. 8, N 1—2. P. 124—136.
Mohan Ram H. Y., Wadhi M.
//Phytomorphology. 1964. Vol. 54, N 3. P. 388—413.
Mohan Ram H. Y., Wadhi M. II
Phytomorphology. 1965. Vol. 15, N 2. P. 201-205.
Mohana Rao P. R. II Curr. Sci. (India). 1963.
Vol. 32, N 10. P. 468-469.
Mohana Rao P. R. II Phytomorphology. 1972a.
Vol. 22, N 1. P. 8-21.
Mohana Rao P. R../I Phytomorphology.
1972b. Vol. 22, N 1. P. 75-87.
Mohrbutter С //Planta. 1937. Bd 26, N 1.
S. 64-80.
Moissl H. E. II Osterr. bot. Ztschr. 1941.
Bd 90, N 3. S. 153—212.
Molliard M. II Bull. Soc. bot. France. 1895.
Vol. 42. P.. 9—10.
Molliard M. I Rev. gen. bot. 1896a. Vol. 8.
P. 49—58.
Molliard M. M. Rev. gen. bot. 1896b.
Vol. 8. P. 273—283.
Momin A. R. H Sci. and Cult. 1975. Vol. 41,
N 7. P. 318—319.
Montgomery F. H., Yang S.-J. II Can. J. Bot.
1960. Vol. 38, N 3. P. 381—386.
Moore R. J. //Can. J. Res. 1946. Vol. 24,
N 4. P. 56—65.
Moore R. J. //Amer. J. Bot. 1948. Vol. 35,
N 7. P. 404-410.
Morgan D. Т., Rappleye R. D. II Amer.
J. Bot. 1949. Vol. 36, N 10. P. 800
Morgan D. Т., Rappleye R. D. II J. Hered.
Washington. 1950. Vol. 41, N 4. P. 91—94.
Morgan D. Т., Rappleye R. D. II Amer.
J. Bot. 1954. Vol. 41, N 7. P. 576—585.
Morse W. С II Ohio Natur. 1907. Vol. 8.
P. 197—204.
Mortier J., Lebegue A. II С. г. Acad. sci.
(Paris), D. 1966. T. 282, N 1. P. 76—79.
Mottier D. M. II Bot. Gaz. 1893. Vol. 18.
P. 245—253.
Mulay B. N., Deshpande B. D., Tolani U. II
J. Indian Bot. Soc. 1965. Vol. 44, N 1.
P. 95—104.
Mulay B. N., Nair N. C, Sastry M. S. R. K.
/I Proc. Rajasthan Acad. Sci. 1953. Vol. 4.
P. 17—28.
Murbeck S. II Bot. notis. 1904. S. 285—296.
Murthi S. N. II J. Mysore Univ. 1940B.
Vol. 1. P. 97—104.
Murthi S. N. II Curr. Sci. (India). 1941.
Vol. 10, N 5. P. 257—259.
Murthi S. N. II Curr. Sci. (India). 1942.
Vol. 11, N 7. P. 284—285.
Murthi S. N. II J. Univ. Bombay. 1946a.
Vol. 14, N 5. P. 37—46.
Murthi S. N. II J. Univ. Bombay. 1946b.
Vol. 15, N 20. P. 1—14.
Murthi S. N. II J. Indian Bot. Soc. 1947.
Vol. 26. P. 87—94.
Murty I. S., Chauhan T. S. II Agra Univ. J.
(Sci.). 1966. Vol. 15. P. 147—162.
Nagaraj M., Khaleel T. F. II Curr. Sci.
(India). 1968. Vol. 37, N 9. P. 265-267.
Nair N. С II Nature. 1965. Vol. 208. P. 402.
Nair N. С II Bull. Indian Nat. Sci. Acad.
1970a. Vol. 41. P. 168—173.
Nair N. С II Bull. Indian Nat. Sci. Acad.
1970b. N 41. P. 174—179.
Nair N. C, Bajaj G. P. S. III. Indian Bot.
Soc. 1966. Vol. 45, N 1—2.' P. 103—115.
Nair N. C, Mani K. V. II Phytomorphology.
1960. Vol. 10. P. 138-144.
Nair N. C, Nambisan II Bot. notis. 1957.
Vol. 110. P. 160-172.
Nair N. C, Parasuraman V. II Curr. Sci.
(India). 1954. Vol. 23, N 5. P. 163-164.
Nair N. C, Parasuraman V. II Phyton. B.
1962. Vol. 18, fasc. 2. P. 157—164.
Nair N. C, Suri P..L. II Sci. and Cult. 1957.
Vol. 22, N 7. P. 387—389.
Nanda K. Morphology and embryology of
Arcenthobium Bieb. — A parasitic
dicotyledon.: M. Sc. Thesis. Delhi, 1966.
Nanda K., Gupta S. C. II Curr. Sci. (India).
1971. Vol. 40, N 17. P. 470-471.
Nanda K., Gupta S. C. II Amer. J. Bot. 1978.
Vol. 65, N 4. P. 400-405.
Nanda K., Gupta S. С II Beitr. Biol. Pflanz.
1983. Bd 58, N 2. S. 243—251.
Nanetti A. II N. G. bot. Ital. N. S. 1912.
Vol. 19. P. 91—111.
Narang N. II Phytomorphology. 1953. Vol. 3,
N 4. P. 485-493.
Narayana L. L., Sundari К. Т. II Nat. Acad.
Sci. 1978. Vol. 1, N 12. P. 433-435.
Narayana R. II Curr. Sci. (India). 1954.
Vol. 23, N 1. P. 23-24.
Narayana R. II J. Mysore Univ. B. 195(1.
Vol. 16. P. 185—205.
Narayana R. IГ Phytomorphology. 1958
(1959)a. Vol. 8, N 1—2. P. 146-168.
Narayana R. II Phytomorphology. 1958
(1959)b. Vol. 8, N 3—4. P. 306—323.
Narayanan C. R. II J. Madras Univ. B. 1956.
Vol. 26. P. 189—207.
Natesh S., Bhandari N. N. II Ann. Bot. 1975.
Vol. 39, N 162. P. 729—732.
Natesh S., Bhandari N. N. II
Phytomorphology. 1984. Vol. 34, N 1—4. P. 208—221.
Negi S. S., Olmo H. P. II Vitis. 1971. Bd 9,
H. 4. S. 266-281.
Negodi G. II Boll. Soc. Adriatica, Sci. Nat.
1936a. Vol. 25.
Negodi G. II Atti Soc. Nat. Mat. Modena.
1936b. Vol. 15.
Newcomb W. II Can. J. Bot. 1973a. Vol. 51,
N 5. P. 863—878.
Newcomb W. II Can. J. Bot. 1973b. Vol. 51,
N 5. P. 879—890.
Newcomb W., Steeves T. A. II Bot. Gaz. 1971.
Bd 132, N 4. P. 367—371.
Nirula R. L. II Proc. Indian Acad. Sci.
B. 1945a. Vol. 21, N 3. P. 174-177.
Nirula R. L. II Proc. Indian Acad. Sci.
B. 1945b. Vol. 21, N 3. P. 181-185.
Nirula R. L., Richharia R. H. II Proc. Indian
Acad. Sci. B. 1945. Vol. 21, N 3. P. 178—
180.
Nohara S. II J. Coll. Agr. Tokyo Imp. Univ.
1934. Vol. 13. P. 9-25.
Nordenstam B. The genus Euryops: Aspects
of morphology and cytology. Lund, 1968.
Part 2.
Nordheim K. Entwicklungsgeschichtlich-zyto-
logische und microchemische
Untersuchungen an Conium maculatum L.: Diss.
Berlin, 1930.
Norris H. W: II Amer. Nat. 1892. Vol. 26,
N 307. P. 703—704.
Nyeren A. II Hereditas. 1950. Bd 36. P. 483—
486.
Obuchowska B. II Stud. Soc. sci. torun. D.
1969: Vol. 8, N 5—6. P. 1—18.
Oehler E. II Planta. 1927. Bd 3, N 4. S. 641 —
733.
Oehlkers F. II Ztschr. Bot. 1962. Vol. 50, N 3.
P. 217—236.
Ogawa K. Y. II Mem. Coll. Sci. Univ. Kyoto.
B. 1929. N 4. P. 309—311.
Ohlendorf O. Beitrage zur Anatomie und Bio-
logie der Frtichte und Samen einheimischer
Wasser- und Sumpfpflanzen.: Diss. Er-
langen. 1907.
Okabe S. II Bot. Mag. {Tokyo). 1932. Vol. 46.
P. 518—532.
Okonkwo N. С II Amer. J. Bot. 1982. Vol. 69,
N 10. P. 1636—1645.
Oliver F. W. II Ann. Bot. 1888. Vol. 2.
P. 75—115.
Omana P., Mathew P. M. II Can. J. Bot. 1975.
Vol. 53, N 18. P. 2032-2037.
O'Neal С E. II Bull. Torrey Bot. Club. 1920.
Vol. 47, N 6. P. 231—241.
Oppermann M. II Bot. Gaz. 1904. Vol. 37,
N 5. P. 353—362.
Orlido N. M., Capinpin J. M. II Phjlipp.
Agr. 1957. Vol. 41, N 1—2. P. 53--07.
Pacini E. II Caryologia. 1977a. Vol. 30, N '\.
P. 496—497.
24 Сравнительная эмбриология
301
Pacini E. II Giom. Bot. Ital. 1977b. Vol. 3,
N 6. P. 377.
Pacini E., Casadoro G. II Protoplasma. 1981.
Vol. 106. P. 289-296.
Pacini E., Cresti M. II Bull. Soc. bot. France.
1978. T. 125, N 1-2. P. 121—128.
Pacini E., Franchi D., Bellani U. II Pros.
8 Intern. Symp. Wageningen, 1985.
P. 25-27.
Pacini E., Juniper В. Е. II New Phytol.
1979a. Vol. 83. P. 157—163.
Pacini E., Juniper В. Е. II New Phytol.
1979b. Vol. 83. P. 165—174.
Padmanabhan D. II Proc. Indian Acad. Sci.
B. 1959. Vol. 49, N 6. P. 420—427.
Padmanabhan D. II Proc. Indian Acad. Sci.
B. 1960. Vol. 52, N 4. P. 131—145.
Padmanabhan D. II J. Madras Univ. 1961a.
Vol. 31, N 1. P. 37—46.
Padmanabhan D. A. II Proc. Nat. Inst. Sci.
India. B. 1961b. Vol. 27, N 6. P. 389—398.
Padmanabhan D. II J. Madras Univ. B. 1962a.
Vol. 32, N 1. P. 13—19.
Padmanabhan S. II Phytomorphology. 1962b.
Vol. 12. P. 256—361.
Padmanabhan D. II Phytopmorphology. 1964.
Vol. 14, N 1—2. P. 442—451.
Padmanabhan D. II Proc. Indian Acad. Sci.
B. 1966. Vol. 64, N 6. P. 283—292.
Padmanabhan D. II Bull. Indian Nat. Sci.
Acad. 1970. N 41. P. 250—254.
Padmanabhan D., Rajasekaran К. М. II
Phytomorphology. 1983. Vol.' 33, N 1—4.
P. 85-88.
Pagini P. II N. G. bot. Ital. N. S. 1954.
Vol. 61, N 1. P. 67—79.
Pal N. II J. Indian Bot. Soc. 1951. Vol. 30,
N 1. P. 59—74.
Pal N. //J. Asiatic Soc. 1959. Vol. 1.
P. 245—249.
Pal Y., Barnabas B. II Acta agron. Acad.
sci. hung. 1973. Vol. 22, N 1—2. P. 19—
25.
Paliwal R. L. II Curr. Sci. (India). 1951.
Vol. 20, N 1. P. 17.
Paliwal R. L. II Agra Univ. J. Res. Sci. 1956.
Vol. 5, N 1. P. 193—284.
Paliwal R. L., Hyde B. II Amer. J. Bot.
1959. Vol. 46, N 6. P. 460—466.
Palm B. II Acta horti berg. 1914a. Bd 5,
N 4. P. 1—18.
Palm B. II Sv. bot. tidskr. 1914b. H. 4.
S. 447—453.
Palm B. II Ann. Jard. Bot. Buitenzorg. 1923.
Vol. 32. P. 89-^95. '
Palm В. Т. II Ann. Jard. Bot. Buitenzorg.
1925. Vol. 34. P. 188-192.
Palm B. II Trans. Illinois St. Acad. Sci.
1931. Vol. 24. P. 143—147.
Palm B. II Bot. notis. 1934. P. 423—427.
Palm В., Rutgers A. A. II Rec. Trav. bot.
neer. 1917. Vol. 14. P. 119—126.
Pandey A. K. II Acta bot. Indica. 1980.
Vol. 8, N 1. P. 50-56.
Pandey A. K., Singh R. P. II Plant Sci.
1973. Vol. 5. P. 148—150.
Pandey A. K., Singh R. P. II Curr. Sci.
(India). 1976. Vol. 45, N 1. P. 29—30.
Pandey A. K., Singh R. P. II Flora. 1980.
Bd 169, N 5. P. 443—452.
Pandey A. K., Singh R. P. II Bot. Jb. Syst.
Pflanzengesch. und Pflanzengeogr. 1982.
Bd 103, N 3. S. 413—422.
Pannocchia-Lay F. II N. G. bot. Ital. 1938a.
Vol. 45, N 2. P. 122-130.
Pannocchia-Lay F. II N. G. bot. Ital. 1938b>.
Vol. 45, N 2. P. 157—187.
Pardi P. II N. G. bot. Ital. 1933. Vol. 40,.
N 4. P. 560-569.
Pargney J. C, Derheimer J. II Rev. gen. bot..
1976. Vol. 83, N 986—988. P. 201—229.
Parveen A., Naseeni I., Khan N. R. II
Pakistan J. Sci. and Ind. Res. 1972. Vol. 15j.
N 3. P. 196—198.
Paterman A. Beitrage zur Zytologie der Ver-
benaceen: Diss. Berlin, 1935.
Patwardhan U. II J. Univ. Poona. 1953.
N 4. P. 11-18.
Paulson R. E., Srivastava I. M. II Can. J.
Bot. 1968. Vol. 46, N 11. P. 1437—1445.
Pavari F. II Caryologia. 1957. Vol. 9, N 3.
P. 436—452.
Pearson H. M. II Proc. Amer. Soc. Hort.
Sci. 1932. Vol. 29. P. 169-175.
Periasamy K. II Proc. Indian Acad. Sci. B.
1962a. Vol. 56, N 1. P. 13—26.
Periasamy K. II Plant Embryology (A
Symposium CSIR). New Delhi, 1962b. P. 62—
74.
Periasamy K. II Proc. Indian Acad. Sci. В..
1963. Vol. 58, N 6. P. 325—332.
Periasamy K. II Proc. Indian Acad. Sci. В..
1964. Vol. 60, N 5. P. 351—360.
Periasamy K. II Proc. Indian Acad. Sci. В..
1966. Vol. 64, N 3. P. 127—134.
Periasamy K., Parameswaran N. II Curr. Sci-
(India). 1962. Vol. 31, N 7. P. 300—301.
Periasamy K., Parameswaran N.' II Beitr.
Biol. Pflanz. 1965. Bd 41, N 1. S. 123—138.
Perkins W., James R., Thorp R. II Bull.
Torrey Bot. Club. 1975. Vol. 102, N .4.
P. 194—198.
Peters K. Vergleichende Untersuchungen iiber
die Ausbildung der Sexuellen Reproduktions-
organe bei Convolvulus und Cuscuta: Diss.
Zurich, 1908.
Petria E. II Lucrarile grSdinii botanice.
Bucuresti, 1970—1971 (1972). P. 275—284.
Petria E. II Lucrarile gradinii botanice.
Bucuresti, 1972—1973 (1973). P. 285—352.
Pfeffer W. II Jb. Wiss. Bot. 1872. Bd 8.
S. 194—215.
Phatak V. G., Ambegaokar К. В. II J. Univ.
Baroda. 1955. Vol. 4. P. 87-97.
Phatak V. G., Ambegaokar К. В. //J. Univ.
Baroda. 1956. Vol. 5. P. 73-87.
Phatak V. G., Ambegaokar К. В. //J. Univ.
Baroda. 1957. Vol. 6. P. 1—10.
Phatak V. G., Ambegaokar К. В. II J. Indian
Bot. Soc. 1961a. Vol. 40, N 4. P. 525—534.
Phatak V. G., Ambegaokar К. В. II J. Univ..
Poona. 1961b. Vol. 22. P. 139—145.
Phatak V. G., Ambegaokar К. В. II Proc.
Indian Acad. Sci. B. 1963. Vol. 57, N 2..
P. 88-95.
Philipson W. R., Philipson M. N. II N. Z. J»
Bot. 1973. Vol. 11, N 3. P. 449—460.
Pienaar R. de V. II Trans. Roy. Soc. Sth.
Afr. 1952. Vol. 33, pt 2. P. 223—237.
Pigott E. M. II Trans, and Proc. New Zeal.
Inst. 1915. Vol. 47. P. 599—612.
Pigott E. M. II Trans, and Proc. New ZeaL
Inst. 1927. Vol. 58. P. 57-71.
Pisek A. II Jb. Wiss. Bot. 1923. Bd 62..
S. 1—19.
Pisek A. II S.-Ber. Akad. Wien. Math.-nat,.
Kl. 1924. Bd 133. S. 1—15.
Pitot A. It Bull. Soc. bot. France. 1938».
Vol. 85, N 9/10. P. 690—696.
362
Pluijm J. E. van der II Linskens H. F. Pollen
Physiology and fertilization. Amsterdam,
1964. P. 8—16.
Pluijm J., Linskens H. F. II Ziichter. 1966.
Bd 36, N 5. S. 220-224.
Pogliani M. II Ann. Bot. 1966. Vol. 28, N 3.
P. 725-729.
Ponzi R., Pizzolongo P. II J. Submicrosc.
Cytol. 1972. Vol. 4. P. 199—204.
Ponzi R., Pizzolongo P. II J. Submicrosc.
Cytol. 1973. Vol. 5. P. 257-263.
Ponzi R., Pizzolongo P. II Giorn. Bot. Ital.
1984. Vol. 118, N 3—4. P. 147—154.
Popham R. A. II Bot. Gaz. 1938. Vol. 99,
N 3. P. 543-555.
Portheim L. R. von II S.-Ber. dtsch. Nat.-
Med. Ver. Bohtmen «Lotos». 1901. Bd 21.
Powers I. II Genetics. 1945. Vol. 30. P. 323—
346.
Prakasa Rao P. S., Sundari К. Т., Naray-
ana L. L. II Curr. Sci. (India). 1979. Vol. 48,
N 3. P. 129 131.
Prakash S. II Phytomorphology. 1960. Vol. 10,
N 3. P. 224-234.
Prakash S. II Phytomorphology. 1961. Vol. 11,
N 4 P 325 -335
Prakash S. II Phytomorphology. 1963. Vol. 13,
N 1. P. 97—103.
Prakash R., Chatterjee B. II Curr. Sci.
(India). 1953. Vol. 22, N 3. P. 84-85.
Prasad Т., Singh D. II J. Indian Bot. Soc.
1978. Vol. 57, N 1. P. 76-83.
Pratt С II Amer. J. Enol. Vitic. 1971. Vol. 22.
P. 92-109.
Prithipalsingh D. K. II Bot. Mag. (Tokyo).
1977. Vol. 90, N 1020. P. 291—299.
Przywara L. II Acta biol. crac. Ser. bot.
1974. Vol. 17, N 2. P. 207—214.
Psaras G. II Ann. Bot. 1984. Vol. 54, N 2.
P. 187—195.
Pullaiah T. II Phytomorphology. 1978a. Vol.
28, N 4. P. 437—444.
Pullaiah T. II Bot. Mag. (Tokyo). 1978b.
Vol. 91, N 1023. P. 197—205.
Pullaiah T. II Amer. J. Bot. 1979a. Vol. 66,
N 10. P. 1119—1127.
Pullaiah T. II Bot. notis. 1979b. Vol. 132, '
N 1. P. 51—56.
Pullaiah T. II Plant Syst. and Evol. 1981a.
Vol. 137, N 3. P. 203—215.
Pullaiah T. II Curr. Sci. (India). 1981b.
Vol. 50, N 22. P. 992—994.
Pullaiah T. II Curr. Sci. (India). 1982. Vol.
51, N 14. P. 708—710.
Pullaiah T. II Plant Syst. and Evol. 1983a.
Vol. 142, N 1—2. P. 61—70.
Pullaiah T. II Curr. Sci. (India). 1983b.
Vol. 52, N 3. P. 137—138.
Pullaiah Т., Swarajya P. L. II Proc. Indian
Acad. Sci. (Plant Sci.). 1984. Vol. 93,
N 4. P. 437-443.
Radlkofer L. Die Befruchtung der Phanero-
gamen: Ein Beitrag zur Entscheidung des
daruber bestehenden Streites. Leipzig, 1856.
Rae A. L., Harris P. /., Bacic A., Clarke A. E.
II Planta. 1985. Vol. 166, N 1. P. 128—133.
Raghavan T. S., Krishnamurty K. V. II Proc.
Indian Acad. Sci. B. 1947. Vol. 26, N 5.
P. 236-275.
Raghavan T. S., Rangaswamy K. II J. Indian
Bot. Soc. 1941. Vol. 20, N 5, P. 341—356.
Raghavan T. S., Srinivasan A. R. II Proc.
Indian Acad. Sci. B. 1941. Vol. 14, N 4.
P. 412—426.
Raghavan T. S., Srinivasan V. K. II Proc.
Indian Acad. Sci. B. 1941a. Vol. 13, N 1.
P. 24—32.
Raghavan T. S., Srinivasan V. K. II Proc.
Indian Acad. Sci. B. 1941b. Vol. 13, N 4.
p 229 235
Raghavan V.'II Science. 1976. Vol. 11)1,
N 4225. P. 388-389.
Raghavan V. A. //Development. Biol. 1981.
Vol. 81, N 2. P. 342-348.
Rahman Q., Krishnan P. S. II
Photochemistry. 1971. Vol. 10, N 8. P. 1751-1757.
Raj B. II Grana Palynol. 1961. Vol. 3, N 1.
P. 3—108.
Raj B. //Curr. Sci. (India). 1964. Vol. 33,
N 11. P. 348—349.
Raj B. II Osterr. bot. Ztschr. 1970a. Bd 118,
N 5. S. 417-430.
Raj B. II Beitr. Biol. Pflanz. 1970b. Bd 46,
N 2. S. 193-207.
Raj B. II Osterr. bot. Ztschr. 1972. Bd 120,
N 1—2. S. 143-154.
Rajan S. S. II Curr. Sci. (India). 1968.
Vol. 37, N 1. P. 26—28.
Rajashekar G. II Curr. Sci. (India). 1980.
Vol. 49, N 4. P. 156—158.
Rajashekar G. II Indian Acad. Sci., Plant
Sci. 1981. Vol. 90, N 2. P. 177—182.
Raju D. //Phytomorphology. 1973. Vol. 23,
N 3-4. P. 194-205.
Raju Z).//Plant Syst. and Evol. 1976.
Vol. 126, N 2. P. 209-220.
Raju D., Arekal G. D. II Proc. Indian Acad.
Sci. B. 1977. Vol. 86, N 1. P. 23—31.
Raju D., Arekal G. D. II Phytomorphology.
1978. Vol. 28, N 1. P. 88-95.
Raju D., Chamaiah H. N. II Proc. Indian
Acad. Sci. B. 1972. Vol. 75, N 3. P. 129—
139.
Ram L. II Phytomorphology. 1982 (1983).
Vol. 32, N 213. P. 234-241.
Ram M. II Phytomorphology. 1957. Vol. 7,
N 1. P. 24—35.
Ram M. II Nature. 1959a. Vol. 184, N 4690.
P. 912—915.
Ram M. И Phytomorphology. 1959b. Vol. 9,
N 1. P. 4—19.
Ram M. II Phytomorphology. 1959c. Vol. 9,
N 1. P. 20—33.
Ram M. II Bull. Indian Nat. Sci. Acad.
1970a. N 41. P. 4—8.
Ram M. II Bull. Indian Nat. Sci. Acad.
1970b. N 41. P. 19—21.
Ramam S. S. //Agra Univ. J. Res.-Sci.
1954. Vol. 3, N 2. P. 343—348.
Ramanna M. S. II Euphytica. 1979. Vol. 28,
N 3. P. 537—561.
Ramirez О. С Comparative embryogenesis
of Erie, Concord and Golden Muscat grape
varieties as related to the germinability
of seeds: Diss. Rutgers, 1968.
Randhawa G. S., Negi S. S. II Indian J.
Hort. 1965. Vol. 22. P. 287-308.
Rangasamy K. II Proc. Indian Acad. Sci. B.
1941. Vol. 14, N 2. P. 149—165.
Rao K. V. R. II J. Indian Bot. Soc. 1940.
Vol. 19. P. 53-69.
Rao L. N. II Ann. Bot. 1942. Vol. 6, N 21- •
24. P. 151—175.
Rao P. S., Sundari К. Т. et al. //Curr. Sci.
(India). 1979. Vol. 48, N 3. P. 120- 1.TI,
Rao V. S. 1П. Indian Bot. Soc. 1944. Vol, 2IS.
P. 164—169.
Rao V. S. II J. Univ. Bombay. 1953. Vol, 21.
P. 7-34.
24* ana
Rao В. H., Prakasa R. P. S. II Curr. Sci.
(India). 1980. Vol. 49, N 2. P. 77—80.
Rao B. H., Prakasa R. P. S. II Curr. Sci.
(India). 1983. Vol. 52, N 1. P. 28—30.
Rao В. #., Prakasa R. P. S. II Proc. Indian
Acad. Sci. 1984. Vol. 93, N 1. Г. 57—65.
Rao K. S., Nagaraj M. //Can. J. Bot. 1982.
Vol. 60, N 2. P. 141—151.
Rassemeyer K. H., Staudt G. II Ber. Dtsch.
bot. Ges. 1982. Bd 95. S. 449—455.
Паи M. A. II J. Indian Bot. Soc. 1940.
Vol. 19. P. 33—44.
Rau M. A., Sharma V. K. II Bull. Indian
Nat. Sci. Acad. 1970. N 41. P. 185—187.
Rauch K. II Ber. Schweiz. bot. Ges. 1936.
Bd 45. S. 5—61.
Razi, B. A., Subramanyam K. II Proc. Indian
Acad. Sci. B. 1952. Vol. 36, N 6. P. 249—
257.
Reddy S., Prakasa Rao P. S. II Curr. Sci.
(India). 1983. Vol. 52, N 15. P. 726—728.
Rees-Leonard O. L. II Bot. Gaz. 1935. Vol. 96.
P. 734—750.
Reese H., Hilger H. II Beitr. Biol. Pflanz.
1984. Vol. 59, N 3. P. 425—439.
Renzoni-Cela G. II N. G. bot. Ital. 1963.
Vol. 70, N 5—6. P. 493—504.
Reynolds T. II Amer. J. Bot. 1984. Vol. 71,
N 4. P. 490—504.
Richard A. II Rev. cytol. et biol. veg. 1964.
T. 28, N 1. P. 1—37.
Richharia R. H. II Curr. Sci. (India). 1934.
Vol. 2, N 7. P. 340—342.
Rickson F. R. II Amer. J Bot. 1968. Vol. 55,
N 3. P. 280—290.
Rietsema /., Blondel В., Satina S., Blakes-
lee A. P. //Amer. J. Bot. 1955. Vol. 42,
N 5. P.. 449—455.
Risse K. II Ber. Dtsch. bot. Ges. 1926. Bd 44.
S. 296—297.
Risse K. II Bot. Arch. 1929. Bd 23, H. 1—2.
S. 266—288. *
Robertson B. L. II Ann. Bot. 1984. Vol. 53,
N 6. P. 803—809.
Rodkiewicz B. II Bull. Acad. pol. sci. Ser.
biol. 1967. Vol. 15, N 8. P. 493—495.
Rodolico A. II N. G. bot. Ital. 1930. Vol. 37.
P. 392—408.
Rodolico A. II N. G. bot. Ital. 1933. Vol. 40.
P. 421—425.
Rodriguez P. II Acta bot. Venez. 1976. Vol. 11,
N 1-4. P. 283-383.
Roever W. II Bull. Torrey Bot. Club. 1935.
Vol. 62. P. 345-358.
Rogers S. II Cytologia. 1969. Vol. 34, N 2.
P. 188—195.
Rosen W. II Acta horti Gotheb. 1932. Bd 7,
N 1. S. 31-42.
Rosen W. II Bot. notis. 1935. S. 273—278.
Rosen W. II Acta horti Gotheb. 1937. Bd 12.
S. 1—10.
Rosen W. II Bot. notis. 1940. N 3. S. 253—
261.
Rosen W. II Acta horti Gotheb. 1944. Bd 15.
S. 267—273.
Rosen W. II Acta horti Gotheb. 1946. Bd 16.
S. 235—249.
Rosen W. II Bot. notis. 1947. N 4. P. 372—
382.
Rosen W. II Bot. notis. 1949. H. 2. S. 137—
147.
Rosenberg O. II Ber. Dtsch. bot. Ges. 1906.
Bd 24. S. 157—161.
Rosenberg O. II Sv. bot. tidskr. 1907. Vol. 25.
P. 143—170.
364
Rosenberg O. II Sv. bot. tidskr. 1909. Bd 3..
H. 1. S. 64—77.
Rosenberg O. II Sv. bot. tidskr. 1912. Bd 6.
S. 914—919.
Rosenberg O. II Sv. bot. tidskr. 1917. Bd 11,.
H. 2, N 8. S. 145—206.
Rosenberg О II Hereditas. 1927. Vol. 6. P. 305—
338.
Rosenberg O. II Handb. L. Vererb. Wiss..
Lieferung. 1930. Bd 12; S. 1—66.
Rossler W. II Ber. Dtsch. bot. Ges. 1917.
Bd 35. S. 460—463.
Rowley J. R., Dahl A. //Pollen et spores..
1977. Vol. 19, N 2. P. 169—284.
Ruth С M. II U. S. Dept. Agr. Tech. Bull..
1943. Vol. 843. P. 1—24.
Rutishauser A. //Ber Schweiz. bot. Ges.
1935. Bd 44. S. 389-436.
Rutishauser A. //Mitt. • naturforsch. Ges.-
Schaffhausen. 1937a. Bd 13. S. 25-47.,
Rutishauser A. I/ Ber. Schweiz. bot. Ges..
1937b. Bd 47. S. 5—28.
Rutishauser A. II Protoplasmatologia. 1967..
Bd 6, fasc. 3. 245 S.
Ruttle M. L. II Gartenbauwissenschaft. 1931.
Bd 4. S. 428—468.
Ruttle M. L. II Gartenbauwissenschaft. 1932.
Bd 7. S. 154—177.
Sabet Y. S. II Ann. Bot, 1931. Vol. 45, N 179.
P. 513—518.
Safeeulla K. M., Govindu H. C. II Lloydia.
1950. Vol. 13, N 3. P. 179—182.
Safwat F. M. II Ann. Missouri. Bot. Gard.
1962. Vol. 49, N 1—2. P. 95—129.
Sahi B. G. II Curr. Sci. (India). 1966. Vol. 35,.
N 14. P. 368-369.
Said Ch. II Rev. gen. bot. 1967. T. 74, N 879.
P. 377-387.
Samuelsson G. II Sv. bot. tidskr. 1913. Bd 7,.
H. 2. S. 97—188.
Sangwan R. S., Camefor H. //Rev. cytol.
et biol. veg. 1982. T. 5., N 3—4. P. 265—
282.
Sankara Rao K. II Acta bot. Indica. 1975.
Vol. 3. P. 165-166.
Sankara Rao K. II Curr. Sci. (India). 1978.
Vol. 47, N 20. P. 786—788.
Sankara Rao K. Embryological studies in
Gentianaceae: Ph. D. thesis. Bangalore-
Univ., India, 1979.
Sankara Rao K. II Proc. Indian Acad. Sci.
1984. Vol. 93, N 1. P. 43—51.
Sankara Rao K., Chinnappa С. С II Can.
J. Bot. 1983. Vol. 61, N 1. P. 324—336.
Sankara Rao K., Shivaramiah G. II Proc.
Indian Acad. Sci. B. 1978. Vol. 87, N 2.
P. 23—27.
6areen T. S., Bhanwara R. R. //Bull. Bot.
Soc. Bengal. 1978. Vol. 32, N 1—2. P. 1-8.
Sassen M. M- A. II Acta bot. neer. 1964.
Vol. 13, N 2. P. 175—181.
Sartorius Q. II Angev. Bot. 1926. Bd 8.
S. 66—89.
Sato Y. II Sci Repts. Tohoku Univ. Ser. 4
(Biol.). 1971. Vol. 35, N 4. P. 201—206.
Sato Y. II Sci. Rep. Tohoku Univ. Ser. 4
(Biol.). 1976. Vol. 37, N 2. P. 117—130.
Saxena Т., Singh D. //J. Indian Bot. Soc.
1969. Vol. 48, N 1—2. P. 148—157.
Scarascia G. T. II Caryologia. 1953. Vol. 5,
N 1. P. 25—42.
Schacht H. II Jb. Wiss. Bot. 1865—1866. Bd 4.
S. 1—22.
Schaeppi H., Steindl F. II Ber. Schweiz. bot.
Ges. 1937. Bd 47. S. 369—392.
Schaeppi H., Steindl F. II Vischr. naturf.
Ges. Zurich. 1942. Bd 87. S. 301—372.
Schaeppi H., Steindl F. //Vischr. naturf.
Ges. Zurich. 1945. Bd 90. S. 1—46.
Schertz F. II Bot. Gaz. 1919. Bd. 68. S. 441—
450.
Schill R., Jakel U. II Abh. Akad. Wiss.
und Lit. Maht.-Naturwiss. Kl. Trop. und
Subtrop. Pflanzenwelt. 1978. N 22. S. 122. .
Schiller J. II Osterr. bot. Ztschr. 1907. Bd 57.
Schkorbatow L. II Trav. Soc. Nat. Univ.
Imp. Kharkow. 1912. Bd 45. S. 15—25.
Schleiden W. 3.11 Wiegmanns Arch. 1837.
Bd 3 S 289 320
Schleiden W. J. II Nova acta С L. С G. Nat.
Cur. 1839. Bd 19. S. 29—58.
SchmidE. //Beih. bot. Zentr.-Bl. 1906. Bd 20.
S. 175—299.
Schnarf K. II S.-Ber. Akad. Wiss. Wien.
Math.-naturwiss. Kl. 1917a. Bd 126, AM. 1.
N 10. S. 927—950.
Schnarf K. II Denkschr. Akad. Wiss. Wien.
1917b. Bd 94. S. 211—275.
Schnarf K. II S.-.Ber. Acad. Wiss. Wien (I).
1919. Bd 128, S. 1—17.
Schnarf K. II 6sterr. bot. Ztschr. 1921a.
Bd 70. S. 153—158.
Schnarf K. II Osterr. bot. Ztschr. 1921b.
Bd 70. S. 255—261.
Schanrf K. II S.-Ber. Akad. Wiss. Wien.
Math.-naturwiss. Kl. 1922. Bd 131, Abt. 1.
S. 199—208.
Schnarf K. II Osterr. bot. Ztschr. 1923. Bd 72,
N 1—5. S. 242—245.
Schnarf K. II Osterr. bot. Ztschr. 1925. Bd 74,
N 1—3. S. 40—50.
Schnarf K. II Planta. 1937. Bd 27, N 4.
S. 450-465.
Schnarf K. II Planta. 1938. Bd 27, N 4.
S. 450-465.
Schneider H. II Flora. 1914. Bd 106, N1.
S. 1—42.
Schrauwen J. A. M., Sondheimer E. II Ztschr.
Pflanzenphysiol. 1975. Bd75, N1. S 65—
77.
Schrock G. F., Palzer B. F. II Bot. Gaz. 1967.
Vol. 128, N 2. P. 83--104.
Schulle H. II Flora. 1933. Bd 27. S. 140—184.
Schurhoff P. N. II Ber. Dtsch. bot. Ges.
1920. Bd 38. S. 217—219.
Schurhoff P. N. II Ber. Dtsch. bot. Ges.
1921. Bd 39. S. 377—379.
Schurhoff P. N. II Ber. Dtsch. bot. Ges.
1924. Bd 42. S. 311—321.
Schurhoff P. N. II Bot. Jb. 1925. Bd 59.
S. 198—203.
Schurhoff P. N. II Ber. Dtsch. bot. Ges.
1927. Bd 44, H. 10. S. 665—673.
Schurhoff P. N. II Beitr. Biol. Pflanz. 1927.
Bd 15. S. 129—146.
Schurhoff P. /V., Muller H.I Cytologia.
1937. Bd 8, N 1. S. 407—415.
Schwencke E. H. Zytologische Untersuchun-
gen einiger Verbenaceen: Diss. Berlin, 1931.
Schwere S. II Flora. 1896. Vol. 82. P. 32—66.
Scrobischewsky W. II Bot. Zentr.-Bl. 1884.
Bd 18. S. 156—157.
Sears B. B. II Plasmid. 1980. Vol. 4, N 3.
p 233 255.
Sears P. B. //Ohio J. Sci. 1917. Vol. 17.
P. 97—100.
Sears P. B. II Bot. Gaz. 1922. Vol. 73.
P. 308—325.
Sediey M. II Austral. J. Bot. 1981. Vol. 29,
N 2. P. 185—193.
Seefeldner G. II S.-Ber. Acad. Wiss. Wien.
Math.-naturwiss. Kl. 1912. Bd 121, N 1.
S. 273—296.
Sehgal C. B. Morphological, embryologioall
and experimental studies in the Umbolli-
ferae: Ph. D. Thesis. Univ. Delhi, 1963.
Sehgal С. В. //Curr. Sci. (India). 1964.
Vol. 33, N 12. P. 373—375.
Sehgal С. В. II Bot. Univ. Delhi. 1965..
Vol. 31, B, N 5—6. P. 175—201.
Sehgal С. В. II Beitr. Biol. Pflanz. 1966.
Bd 42, N 2. S. 161—183.
Sehgal С. В. II Proc. Nat. Inst. Sci. India..
B. 1968. Vol. 34, N 1. P. 60—70.
Sehgal С. В. //J. Cytol. Genet. 1979. Vol. 14,.
N 2. P. 192—197.
Sehgal С. В. II Phytomorphology. 1980..
Vol. 30, N 1. P. 61—66. .
Sehgal С. В., Gifford E. M. II Bot. Gaz. 1979..
Vol. 140, N 2. P. 180—188.
Sell Y. II Ber. Dtsch. bot. Ges. 1977. Bd 90,.
N 1/2. S. 135—147. r r ■
Servettaz C. Monographie des Eleagnacees.
Paris, 1911.
Sethumadhavan P., Gopakumar K. //Agr.
Res. J. Kerala. 1973. Vol. 11, N 2. P. 181.
Shah G. L. II Curr. Sci. (India). 1953a..
Vol. 22, N 10. P. 311—312.
Shah G. L. 1/3. Univ. Bombay. 1953b.
Vol. 22. P. 41—46.
Shamanna S. II Proc. Indian Acad. Sci. В..
1954. Vol. 39, N 6. P. 249—256.
Shamanna S. II Curr. Sci. (India). 1955.
Vol. 24, N 5. P. 165—167.
Shamanna S. II Proc. Indian Acad. Sci. B.
1961. Vol. 54, N 1. P. 12—16.
Shamsuddin A. K. II Banglad J. Sci. industr.
Res. 1978. Vol. 13, N 1—4. P. 212—214.
Sharma V. K. II Curr. Sci. (India). 1962.
Vol. 31. P. 342—344.
Sharma V. K. II Curr. Sci. (India). 1966.
Vol. 35, N 7. P. 185—186.
Sharma V. K. Morphological and
embryological studies of some families and genera
of disputed systematic position: Ph. D.
Thesis. Univ. Agra, 1967.
Sharma H. P., Murty Y. S. II J. Indian
Bot. Soc. 1977. Vol. 56, N 4. P. 321—328.
Sharma H. P., Murty Y. S. II Proc. Indian
Acad. Sci. B. 1978. Vol. 87, N 5. P. 149—
156.
Sharma D. R., Upadhyay S. R. II Proc.
49th Indian Sci. Congr. 1962. Part 3.
P. 275.
Sharma R. C, Raghuvanshi R. K., SinghD. It
Curr. Sci. 1984. Vol. 53, N 16. P. 870—872.
Sharp L. W. II Bot. Gas. 1911. Bd 52.
S. 21.8—224.
Shivamurthy G. R.,\Arekal G. D., Swamy,
B. G. L. II Ann. Bot. 1981. Vol. 47, N 6.
P. 735—745.
Shivaramiah G. II Curr. Sci. (India). 1964a.
Vol. 33, N 16. P. 501-503.
Shivaramiah G. II Curr. Sci. (India). 1964bk
Vol. 33, N 21. P. 657—658.
Shivaramiah G. II Proc. Indian Acad. Sci. B.
1967. Vol. 65, N 1. P. 56—62.
Shivaramiah G. II Curr. Sci. (India). 1971.
Vol. 40, N 22. P. 606-607.
Shivaramiah G., DuttJR. C. II Curr. Sci.
(India). 1964. Vol. 33, N 9. P. 280 281.
Shivaramiah G., Ganapathy P. S. II Curr, Sol.
(India). 1961. Vol. 30, N 5. P. 190 191.
Shivaramiah G., Sankara Rao K. II Слит.
MB.
Sci. (India). 1977. Vol. 46, N 19. P. 662—
664.
■ Shivaramlah G., Sundara Rajan S. II Proc.
Indian Acad. Sci. B. 1973. Vol. 77, N 1.
P. 10-24.
Shivaramlah G., Sundara Rajan S. II Vignana
Bhimilhi. 1979. Vol. 5, N 1—2. P. 6—14.
Siddlqui S. A. II Labdev J. Sci. Tech. India.
1965a. Vol. 3. P. 116—118.
Siddlqui S. A. II Labdev J. Sci. Tech. India.
1965b. Vol. 3. P. 186—188.
Slsslqul S. A.WBoX. notis. 1975. Vol. 128,
N 4. P. 432-437.
Siddlqui S. A., Siddiqui S. R. II Beitr. Biol.
Pflanz. 1968a. Bd 44, N 3. S. 343—351.
Slddlqui S. A., Sissiqui S. B. //Beitr. Biol.
'Pflanz. 1968b. Bd 44, N 3. S. 353—360.
Siddlqui S. В., Slddlqui S. A. //Nat. Acad.
Sci. Lett. 1983. Vol. 6, N 6. P. 189—190.
Sieler T. II Ztschr. Bot. 1870. Bd 26. S. 360—
369, 377—382.
Simola L. K. II Physiol, plant. 1971. Vol. 25,
N 1. P. 98—105.
Sims R. P. A., McGregor W. G., Plessers A. G.,
Mes J. С //J. Amer. Oil Chemists Soc.
1961. Vol. 38, N 6. P. 273-276.
Singh B. II Bull. Nat. bot. Gardens, India.
1964. Vol. 89. P. 1—115.
Singh D. II Agra Univ. J. Res. 1954. Vol. 3,
part 2. P. 289—299.
Singh D., Gupta Y. S. II Sci. and Cult. 1956.
Vol. 22. P. 342—343.
Singh D., Kaul V. II Curr. Sci. (India).
1972. Vol. 41, N 15. P. 572-573.
Singh D., Kaul V. II Cytologia. 1974.
Vol. 40, N 1. P. 35-44.
Singh D., Mahna S. K. II J. Indian Bot. Soc.
1977. Vol. 56, N 4. P. 281—286.
Singh S. P. II Agra Univ. J. Res.-Sci. 1960a.
Vol. 9, part 2. P. 217—220.
Singh S. P. II Phytomorphology. 1960b.
Vol. 10, N 1. P. 65-82..
Singh S. P. //Agra Univ. J. Res.-Sci. 1963.
Vol. 12. P. 143-166.
Singh S. P. II Symposium on Comparative
Embryology of Angiosperms. New Delhi,
1970. N 41. P. 273—277.
Singh Т. С N. II J. Indian Bot. Sci. 1931.
Vol. 10. P. 38—42.
Skalinska M. II Acta biol. crac. Ser. bot.
1958. Vol. 1, N 1. P. 18—22.
Skalinska M. II Acta biol. crac. Ser. bot.
1973. Vol. 16, N 1. P. 121—133.
Skalinska M., Kubien E. //Acta biol. crac.
Ser. bot. 1972. Vol. 15, N A. P. 39—50.
Skawinska R. II Acta biol. crac. Ser. bot.
1962. Vol. 5, N 2. P. 89-96.
Skottsberg С II Kgl. sv. vet.-akad. handl.
1913. Bd 51, N 4. S. 3-34.
Smart С II Trans, proc. Roy. Soc. N. Z.
1952. Vol. 79, pt. 3—4. P. 459—466.
Smith A. C. II Contrib. Bot. Lab. Univ. Penn-
sylv. 1901. Vol. 2, N 2. P. 111—121.
Smith B. B. //Amer. J. Bot. 1973. Vol. 60,
N 4. P. 322—338.
Smith B. B. II Amer. J. Bot. 1975. Vol. 62,
N 4. P. 393—394.
Smith В. В., Johnson L. K. II Amer. J. Bot.
1980. N 5. P. 612—618.
Smith В. Е. //J. Elisha Mitchell Sci. Soc.
1934. Vol. 50. P. 283—302.
Smith F. H. II Bot. Gaz. 1943. Vol. 105.
P. 263-267.
Smith R. W. II Bot. Gaz. 1911. Vol. 52.
P. 209—217.
366
Snoad B. II Ann. Bot. N. S. 1954. Vol. 18,
N 69. P. 1—6.
Snow E. II Bot. Gaz. 1945. Vol. 106. P. 451—
463.
Sokolowska-Kulczycka A. II Acta biol. crac.
Ser. bot. 1959. Vol. 2. P. 51—63.
Soleder H. 11 Angler A., Prantl K. Die na-
ttirlichen Pflanzenfamilien. Berlin, 1895.
Teil 4, Abt. 2. S. 19—50.
Soueges R. /1С. r. Acad. sci. (Paris). 1920a.
T. 170, N 19. P. 1125—1127.
Soueges R. /1С. r. Acad. sci. (Paris). 1920b.
T. 170, N 21. P. 1279—1281.
Soueges R. /1С. r. Acad. sci. (Paris). 1920c.
T. 171. P. 254—256.
Soueges R. /1С. r. Acad. sci. (Paris). 1920d.
T. 171. P. 356-357.
Soueges R. II С. г. Acad. sci. (Paris). 1921a.
T. 172. P. 703-705.
Soueges R. II С. г. Acad. Sci. (Paris). 1921b.
T. 172. P. 1057-1058.
Soueges R. II С. г. Acad. sci. (Paris). 1921c.
T. 173, N 1. P. 48—50.
Soueges R. II С. г. Acad. sci. (Paris). 1921d.
T. 173. P. 724-848.
Soueges R. II Bull. Soc. bot. France. 1921e.
T. 68. P. 441—464.
Soueges R. /1С. r. Acad. sci. (Paris). 1922a.
T. 175, N 14. P. 529—532.
Soueges R. //Bull. Soc. bot. France. 1922b.
T. 69, N 10. P. 163-178, 236—241, 352—
365, 555—585.
Soueges R. II Bull. Soc. bot. France. 1923a.
T. 70. P. 385—401.
Soueges R. /1С. r. Acad. sci. (Paris). 1923b.
T. 176. P. 1081—1083.
Soueges R. II С. г. Acad. sci. (Paris). 1923c.
T. 177, N 20. P. 964—967.
Soueges R. IIC. r. Acad. sci. (Paris). 1924.
T. 178, N 23. P. 1919—1921.
Soueges R. II Bull. Soc. bot. France. 1925.
T. 72, N 36. P. 546-564.
Soueges R. 11С. r. Acad. sci. (Paris). 1926a.
T. 182. P. 339-341.
Soueges R. II Bull. Soc. bot. France. 1926b.
T. 73, N 9—10. P. 955—957.
Soueges R. II Bull. Soc. bot. France. 1930.
T. 77. P. 494—511.
Soueges R. /1С. r. Acad. sci. (Paris). 1935a.
T. 201. P. 234-236.
Soueges R. II С. г. Acad. sci. (Paris). 1935b.
T. 201. P. 529—531.
Soueges R. //Bull. Soc. bot. France. 1935c.
T. 82. P. 328—334.
Soueges R. II Bull. Soc. bot. France. 1936a.
T. 83. P. 570—577.
Soueges R. /1С. r. Acad. sci. (Paris). 1936b.
T. 202, N 24. P. 2009—2011.
Soueges R. II С. г. Acad. sci. (Paris). 1937a.
T. 204. P. 292—294.
Soueges R. /1С. r. Acad. sci. (Paris). 1937b.
T. 205, N 18. P. 813—815.
Soueges R. /1С. r. Acad. sci. (Paris). 1938a.
Т.-206. P. 278^280.
Soueges R. II С. г. Acad. sci. (Paris). 1938b.
T. 207. P. 640.
Soueges R. II С. г. Acad. sci. (Paris). 1938c.
T. 207, N 6. P. 245—249.
Soueges R. II С г. Acad. sci. (Paris). 1939a.
T. 208, N 17. P. 1338—1340.
Soueges R. II С. г. Acad. sci. (Paris). 1939b.
T. 208, N 21. P. 1673—1675.
Soueges R. /1С. r. Acad. sci. (Paris). 1940a.
T. 210. P. 116-118.
Soueges R. /1С. r. Acad. sci. (Paris).. 1940b.
T. 211, N 8. P. 139—140.
Soueges R. /1С. r. Acad. sci. (Paris). 1941a.
T. 212. P. 245-246.
Soueges R. II C. r. Acad. sci. (Paris). 1941b.
T. 212, N 17. P. 718-720.
Soueges R. II С. г. Acad. sci. (Paris). 1941c.
T. 213. P. 39-41.
Soueges R. II С. г. Acad. sci. (Paris). 1942a,
T. 215, N 16. P. 328—330.
Soueges R. II С. г. Acad. sci. (Paris). 1942b.
T. 215, N 23. P. 543—545.
Soueges R. II C. r. Acad. sci. (Paris). 1943a.
T. 217. P. 488—490.
Soueges R. II C. r. Acad. sci. (Paris). 1943b.
T. 217. P. 551—553.
Soueges R. II С. г. Acad. sci. (Paris). 1945a.
T. 220. P. 128—131.
Soueges R. /1С. r. Acad. sci. (Paris). 1945b.
T. 220, N 26. P. 897—900.
Soueges R. /1С. r. Acad. sci. (Paris). 1945c.
T. 221, N 18. P. 480—482.
Soueges R. II С. г. Acad. sci. (Paris). 1948*
. T. 227, N 21. P. 1066—1068.
Soueges R. II С. г. Acad. sci. (Paris). 1950a.
T. 230, N 25. P. 2142—2145.
Soueges R. II С. г. Acad. sci. (Paris). 1950b.
T. 231, N 3. P. 200—202.
Soueges R. II С. г. Acad. sci. (Paris). 1951a.
Т.. 232, N 24. P. 2164—2167.
Soueges R. II С. г. Acad. sci. (Paris). 1951b.
T. 233, N 1. P. 5—8.
Soueges R. II С. г. Acad. sci. (Paris). 1952a.
T. 235, N 3. P. 217—219.
Soueges R. /1С. r. Acad. sci. (Paris). 1952b.
T. 235, N 14. P. 674—677.
Soueges R. /1С. r. Acad. sci. (Paris). 1954a.
T. 238, N 20. P. 1948—1951.
Soueges R. /1С. r. Acad. sci. (Paris). 1954b.
T. 239, N 21. P. 1327—1330.
Soueges R. IIC. r. Acad. sci. (Paris). 1954c.
T. 239, N 2. P. 141—144.
Soueges R. II С. г. Acad. sci. (Paris). 1954d.
T. 239, N 5. P. 377—379.
Soueges R. II С. г. Acad. sci. (Paris). 1954e.
T. 239, N 18.. P. 1104—1106.
Soueges R. 11 С. г. Acad. sci. (Paris). 1955a.
T. 240, N 11. P. 1169—1171.
Soueges R. II С. г. Acad. sci. (Paris). 1955b.
T. 240, N 12. P. 1596—1598.
Soueges R. II С. г. Acad. sci. (Paris). 1955c.
T. 214, N 3. P. 265—268.
Soueges R. II С. г. Acad. sci. (Paris). 1956.
T. 243, N 19. P. 1376—1380.
Soueges R. II С. г. Acad. sci. (Paris). 1957a.
T. 244, N 20. P. 2446—2450.
Soueges R. II С. г. Acad. sci. (Paris). 1957b.
T. 245, N 5. P. 465—468.
Soueges R. II С. г. Acad. sci. (Paris). 1958a.
T. 247, N 3. P. 249—253.
Soueges R. II С. г. Acad. sci. (Paris). 1958b.
T. 247, N 17. P. 1274—1279.
Soueges R. II С. г. Acad. sci. (Paris). 1959.
T. 248, N 8. P. 1073—1078.
Soueges R. II С. г. Acad. sci. (Paris). 1963a.
T. 256, N 1. P. 45—48.
Soueges R. II С. г. Acad. sci. (Paris). 1963b.
T. 256, N 6. P. 1190—1194.
Soueges R. II С. г. Acad. sci. (Paris). 1963c.
T. 256, N 11. P. 2268—2273.
Speta F. II Zinz. biol. Beitr. 1975. Jg 7,
N 3. v. 393—402.
Spitzer E., Lott Y. N. A. //Can. J. Bot.
1982a. Vol. 60, N 8. P. 1392—1398.
Spitzer E., Lott Y. N. A. II Can. J. Hot.
1982b. Vol. 60, N 8. P. 1399—1403.
Sreedevi P., Namboodiri A. N. //CyloloRin.
1979. Vol. 44, N 2. P. 377—384.
Sreedevi P., Namboodiri A. N. II Can. ,1. Bot.
1982. Vol. 60, N 2. P. 166-172.
Srinath K. V. II Curr. Sci. (India). 1934.
Vol. 3. P. 257—25§.
Srinath K. V. II Proc. Linn. Soc. London.
(Bot.). 1938—1939. Vol. 151. P. 136.
Srinivasachar D. M. Sc. II Proc. Indian Acad..
Sci. B. 1940. Vol. 11, N 2. P. 107-116.
Srinivasan A. R. //Proc. Indian Acad. Sci.
B. 1941. Vol. 14, N 6. P. 529—542.
Srinivasan A. R. //Proc. Indian Acad. Sci.
1942. Vol. 16B, N 5. P. 155—164.
Srinivasan A. R. II Proc. Indian Acad.
Sci. B. 1946. Vol. 24, N 1. P. 21-33.
Sripleng A., Smith F. H. //Amer. J. Bot.
1960. Vol. 47, N 5. P. 386—392.
Srlvastava I. D. II Proc. Nat. Acad. Sci.
India. B. 1939. Vol. 9. P. 58—63.
Srlvastava J. M., Paulson R. E. //Can. J.
Bot. 1968. Vol. 46, N 11. P. 1447—1453.
Srlvastava J. N., Chauhan S. V. II Curr. Sci.
(India). 1980. Vol. 49, N 23. P. 909—
911.
Staden J. van, Gllliland M. G., Drewes S. T.y
Davey Y. E. IIZ. Pflanzenphysiol. 1975.
Vol. 76, N 4. P. 369—377.
Stebblns G. L. II Bot. Gaz. 1932a. Vol. 94,.
N 1. P. 134—151.
Stebblns G. L. II Bot. Gaz. 1932b. Vol. 94,.
N 2. P. 322—344.
Stebbins G. I., Babcock E. B. II Heredity.
1939. Vol. 30, N 12. P. 519—530.
Stebbins G. L., Jenkins J. A. II Genetica.
1939. deel 21. P. 191—224.
Steenis С G. G. J. van II Sv. bot. tidskr.
1955. Bd 49, N 1-2. S. 19-23.
Steffen K. II Planta. 1956. Bd 47, H. 6..
S. 625—652.
Steinbauer G. P. II Bot. Gaz. 1943. Vol. 105,.
N 2. P.. 285.
Stetndl F. II Ber. Schweiz. bot. Ges. 1935.
Bd 44. S. 343—388.
Stephens E. L. II New Phytol. 1909. Vol. 8,.
N 9—10. P. 345—348.
Stevens W. С II Kansas Univ. Quart. A.
1898. Vol. 7. P. 77—85.
Stolt К. А. Н. //Kgl. sv. vet.-akad. handl..
1921. Bd 61, N 14. S. 1—56.
Stolt К. А.Н. II Bot. notis. 1927. S. 225-242.
Stolt K. A. H. II Sv. bot. tidskr. 1936. Bd 30r
N 3. S. 690—696.
Stork H. E. II Bull. Torrey Bot. Club. 1920.
Vol. 47, N 5. P. 199—210.
Stover E II Bot. Gaz. 1932. Vol. 93, N 4.
P. 474—483.
Strasburger E. Uber den Bau und das Wachstum,
vegetabilisher Zellhaute: Histolog. Beitr.
Jena, 1882.
Strasburger E. II Ber. Dtsch. bot. Ges. 1885.
Bd 3. S. 105—113.
Strasburger E. II Ber. Dtsch. bot. Res. 1901.
Bd 19. S. 450—461.
Suarez-Cervera M., Seoane-Camba J. A. It
Pollen et spores. 1986. Vol. 28, N 1. P. 5 -28.
Subramanyam K. //Curr. Sci. (India). 1M7.
Vol. 16, P. 350.
Subramanyam K. II Proc. Nat. Inst. Sci.
India. B. 1948. Vol. 14. P. 359 3(10.
Subramanyam K. II New Phytol. 1949. Vol, 84,
N 3. P. 365—373.
МП
Subramanyam К. II Сшт. Sci. (India). 1950a.
Vol. 10. P. 294.
Subramanyam K. II Proc. Nat. Inst. Sci.
India. 1950b. Vol. 16. P. 245—253.
Subramanyam K. II Proc. Indian Acad. Sci.
B. li)50o. Vol. 31. P. 60-65.
Subramanyam K. II J. Mysore Univ. B. 1951a.
Vol. 12. P. 5-13.
Subramanyam K. II Bot. Gaz. 1951b. Vol.
112, N 3. P. 319—322.
Subramanyam K. II Proc. Nat. Inst. Sci.
India. B. 1951c. Vol. 17, N 4. P. 275—285.
Subramanyam K. II Lloydia. 1951d. Vol. 14,
N 2. P. 65-81.
Subramanyam K. II J. Mysore Univ. B. 1951e.
Vol. 12. P. 331—339.
Subramanyam K. 111. Mysore Univ. B.
1953a. Vol 13. P. 1—4.
Subramanyam K. //J. Mysore Univ. B.
1953b. Vol. 13. P. 355—358.
Subramanyam K. //Plant Embryology: A
Symposium, GSIR. New Delhi, 1962. P. 94—
112.
Subramanyam K. II Bull. Indian Nat. Sci.
Acad. 1970. N 41. P. 306—312, 313—316,
317—320, 321—324.
Sud К. С //Proc. Indian Acad. Sci., Plant
'. Sci. 1984. Vol. 93, N 4. P 495—501.
Sundar Rao Y. II Proc. Nat. Inst. Sci.
India. 1940. Vol. 6, N 4. P. 695—704.
Sundara Rajan S. II Proc. Indian Acad.
Sci. B. 1974a. Vol. 79; N 6. P 260—282.
Sundara Rajan S. II Curr. Sci. (India). 1974b.
Vol. 43, N 2. P. 56-57.
Sundara Rajan S., Shivaramaiah G., Sathya-
nanda N. II Curr. Sci. (India). 1975. Vol.
44, N 4. P. 132.
Sundara Rajan S., Shivaramaih G., Sathya-
nanda N. II Proc. Indian Acad. Sci. B.
1976. Vol. 84, N 5. P. 180—184.
Sunesson S. II Bot. notis. 1933. S. 181—194.
Svedelius N.l/Kgi. sv. vet.-akad. handl.
1902. Bd 28, Teil 3, N 4. S. 1—16.
Svensson H. G. II Sv. bot. tidskr. 1922. Bd
16. S. 137—138.
Svensson H. G II Sv. bot. tidskr. 1923a.
Bd 17. S. 388—389.
Svensson H. G. II Sv. bot. tidskr. 1923b.
Bd 17. S. 390
Svensson H. G. II Uppsala Univ. Arsskr.
1925. Bd 2. S. 1—176.
Svensson H. G. II Sv. bot. tidskr. 1926. Bd
20, N 3. S. 420—434.
Svensson H. G. II Sv. bot. tidskr. 1928. Bd 22,
N 3. S. 462—476.
Swamy B. G. L. II J. Indian Bot. Soc. 1941.
Vol. 20, N 4. P. 299—305.
Swamy B. G. L. II Phytomorphology. 1960.
Vol. 10, N 4. P. 397-409
Swamy B. G. L. II Phytomorphology. 1974.
Vol. 24, N 1-2.
Swamy B. G. L., Ganapathy P. M. II
Phytomorphology. 1957. Vol. 7, N 3, 4. P 331—336.
Swamy В., Padmanabhan D. II Curr. Sci.
(India). 1961a. Vol. 30, N 11. P 424—425.
Swamy B. G. L., Padmanabhan D. II Proc.
Indian Acad. Sci. B. 1961b. Vol. 54. P. 169—
197.
Swamy B. G. L., Rao J. D. II
Phytomorphology. 1963. Vol. 13, N 4. P. 423—428.
Szabo Z. II Amer. J. Bot. 1923. Vol. 37.
P. 325—334.
Szujko-Lacza J. II Acta bot. Acad. sci. hung.
1971. Vol. 17. P. 189—215.
Szujko-Lacza J. II Acta biol. Acad. sci. hung.
1976. Vol. 27, N 1. P. 65—70.
Szujk6-Lacza J. II Acta Biol. Acad. sci.
hung. 1978. Vol. 29, N 3. P. 255—271.
Szwabowicz A. //Acta Soc. bot. pol. 1954
Vol. 23. P. 243—257.
Tdckholm G. II Sv. hot. tidskr. 1916. Bd 10,
H. 3. S. 423-437.
Tahara M. II Bot. Mag. (Tokyo). 1915. Vol.
29. P. 92—103, 245-254.
Tahara M. II J. Coll. Sci. Imp. Univ. Tokyo.
1921. Vol. 43, Art 7. P. 1—53.
Tanaka R., Terasaka O. //Chromosoma. 1972.
Vol. 37, N 1. P. 95—100.
Tanaka R., Watanabe K. II J. Sci. Hiroshima
Univ. B, div. 2. 1972. Vol. 14, N 2. P. 75—
84.
Tandon S. L., Bali P. N. II Indian J. Hort.
1955. Vol. 12, N 1. P. 1—15.
Tandon Sh. R., Hen J. M. //Can. J. Bot.
1971. Vol. 49, N 4. P. 505—514.
Taneja S. II Curr. Sci. (India). 1969. Vol. 38,
N 21. P. 522.
Taneja S. //J. Indian Bot. Soc. 1969. Vol. 48,
N 3—4. P. 300—310.
Tarnavschi I., Petra E. //An. Univ. Bucu-
resti, Ser. stunt, natur. Biol. 1968a. an. 17.
P. 177—198.
Tarnavschi I., PetriiaE. II LucrSrile Gradinii
botanice. Bucuresti, 1968b (1970). P. 57—
79.
Tateishi S. II Jap. J. Bot. 1929. Vol. 4. P 317—
326.
Taufel K., Tdufel A., Ruttlofj,H. //Planta.
1962. Bd 58, N 2. S. 127—135.
Telesca M. R. II N. G. bot. Ital. 1962. Vol. 69.
P. 372—378.
Telezynska /., Telezyncki H. II Acta Soc.
bot. pol. 1973. Vol. 42, N 2. P. 323—
343.
Thathachar Т./П. Indian Bot. Soc. 1940.
Vol. 19, N 1. P. 45—52.
Thathachar T. II J. Indian Bot. Soc. 1942.
Vol. 21. P. 185—194.
Thathachar T. 111. Indian Bot. Soc. 1943.
Vol. 22. P. 51—57.
Thoday D., Johnson E. T. II Ann. Bot. 1930.
Vol. 44, N 176. P. 813—824.
Tiagi B. II Phytomorphology. 1951a. Vol. 1,
N 1—2. P. 9—21.
Tiagi B. II Phytomorphology. 1951b. Vol. 1,
N 3-4. P. 158—169.
Tiagi B. II Lloydia. 1952a. Vol. 15, N 3.
P. 129—148.
Tiagi B. II Bull. Torrey Bot. Club. 1952b.
Vol. 79, N 1. P. 63—78.
Tiagi B. //Bull Torrey Bot. Club. 1956.
Vol. 83. P. 154—170.
Tiagi B. II Bot. notis. 1963. Vol. 116, fasc. 1.
P. 81—93.
Tiagi B. II Acta bot. Acad. sci. hung. 1965a.
T. 11 N 1 2. P. 253 263
Tiagi в'II Can. j'. Bot. 1965b. Vol. 43, N 12.
P. 1511-1521.
Tiagi B. II Curr. Sci. (India). 1965c. Vol. 34,
N 23. P. 671—672.
Tiagi B. II Amer. J. Bot. 1966. Vol. 53, N 7.
P. 645—652.
Tiagi B. II Bull. Indian Nat. Sci. Acad. 1970.
N 41. P. 283—289.
Tiagi В., Gupta P. K. II Proc. Rajasthan
Acad. Sci. 1963. Vol. 10. P 51—58.
Tiagi В., Sankla H. II Bot. Mag. (Tokyo).
1963. Vol. 76. P 81—88.
368
Tiagi В., Taimni S. II Curr. Sci. (India). 1960.
Vol. 29, N 10. P. 406.
TiagiB., Taimni S. II Agra Univ. J. Res. 1963.
Vol. 12. P. 123—137.
Tiagi В., Varghese Т. М. II Bull. Indian Nat.
Sci. Acad. 1970. N 41. P. 259—266.
Tiagi Y. D. II Acta bot. Acad. sci. hung.
1968. T. 14, fasc 1—2. P. 197—217.
Tieghem Ph. van II Ann. Sci. natur. Bot.
Ser. 8. 1903. Vol. 17. P. 363—371.
Tieghem Ph. van II Ann. Sci. natur. Bot.
1907. Vol. 15. P 321—350.
Tieghem Ph. van II J. Bot. 1908a. T. 1. P. 5—
11.
Tieghem Ph. van II Ann. sci. natur. Bot. Ser.
9. 1908b. vol. 7. P. 128—129.
Tieghem Ph. van II Ann. sci. natur. Bot. N.
Ser. 1908c. Vol. 8. P. 176.
Timmerman H. II Pharm. J. 1927. Vol. 118.
P. 742—746.
Tischler G. II Schrift. physik-okon. Ges. K6-
nigsberg. 1899. Bd 40. S. 1—18.
Tischler G. II Jb. Wiss. Bot. 1913. Bd 52.
S. 1—84.
Tiwari N. #., Rao V. S. //Proc. 23rd
Indian ' Sci. Congr. (Indore), 1936. Pt 3.
P. 299.
Tiwari S. C. //Protoplasma. 1982. Vol. 110,
N 1. P. 1—4.
Tognini F. II Atti. Inst. Bot. Pavia Ser. 2.
1900. Vol. 6. P. 109—122.
Toks E. II Acta biol. crac. Ser. bot. 1976.
Vol. 19. P. 47-59.
Tongiorgi E. II N. G. bot. Ital. N. S. 1936.
Vol. 43, N 2. P. 425—439.
Tongiorgi E. II N. G. bot. Ital. N. S. 1937a. .
Vol. 44, N. 3. P. 381-384.
Tongiorgi E. II N. G. bot. Ital. N. S. 1937b.
Vol. 44, N 1. P. 179—181.
Torosian CD. II Amer. J. Bot. 1971. Vol. 58,
N 5. P. 456—457.
Trapp A. II Beitr. Biol. Pflanz. 1956. Bd 32,
N 2. S. 279—312.
Treub M. II Ann. Jard. bot. Buitenzorg.
1881 (1885). T. 2, part 1. P. 54-76. \
Treub M. II Ann. Sci. nat. bot. Ser. 6. 1882a.
T. 13. P. 250—282.
Treub M. II Ann. Jard. bot. Buitenzorg.
1882b (1883). T. 3, part 1. P. 184—190.
Treub M. II Ann. Jard. bot. Buitenzorg.
1883a. T. 3. P. 1—12.
Treub M. II Ann. Jard. bot. Buitzenzorg.
1883b. T. 3. P. 77—87.
Treub M. II Ann. Jard. bot. Buitenzorg.
1898. T. 15. P. 1—39.
Treviranus L. С II Flora. 1839. Bd 22. S. 289.
Tulasne L. R. II Ann. sci. natur. Bot. Ser. 3.
1849. T 12. P. 121—137.
Tulasne L. R. II Ann. sci. natur. Bot. Ser. 4.
1855. T. 3. P. 65—74.
Unger D. F. //Bot. Ztschr. 1849. Bd 7.
S. 329—339.
Urbanska K. II Acta Soc. bot. pol. 1956.
Vol. 25, N 4. P. 733-751.
Urbanska-Worytkiewicz K. II Acta biol. crac.
Ser. bot. 1961 (1962). Vol. 4, N 1. P. 49—
64.
Urbanska-W'orytkiewicz K. II Acta biol. crac.
Ser. bot. 1962a. Vol. 5, N 2. P. 97—102.
Urbanska-Worytkiewicz K. II Acta biol. crac.
Ser. bot. 1962b. Vol. 5, N 2. P. 103—115.
Urbanska Worytkiewicz K. II Acta biol. crac.
Ser. bot. 1967a. Vol. 10, N 1, p. 85—98.
Urbanska-Worytkiewicz K. II Genet, pol. 1967b.
Vol. 8, N 3—4. P. 181—183.
Urbanska-Worytkiewicz K. II Acta biol. ci'mo.
Ser. bot. 1969. Vol. 12, N 1-2. P. 21-.'(Я.
Vaidya P. B. //J. Biol. Sci. Bombay. 19(4.
Vol. 4. P. 11—15.
Valentine D. H, Richards A. J. II NaUiro.
1967. Vol. 214, N 5083. P. 114.
Vallade J. II С. г. Acad. sci. (Paris), D. 1970.
T. 270, N 15. P. 1893—1896.
Vallade J. II Bull. Soc. bot. France, Memoi-
res. 1973. Coll. Morphologie, part 3.
P. 355—365.
Vallade J. II Bull. Soc. bot. France. 1980.
T. 127, N 3/4. P. 19-37.
Vallade /., Bugnon Fr.llC. r. Acad. sci.
(Paris). D. 1974. T. 278, N 6. P. 747-750.
Vallade J., Cornu A. /1С. r. Acad. sci.
(Paris). D. 1973. T. 276, N 20. P. 2793—2796.
Vallade J., Cornu A., Essad S., AlabouvetteJ./t
Bull. Soc. bot. France. 1978. T. 125, N 1/2.
P. 253—258.
Vannereau A. II Bull. Soc. bot. France. 1978.
T. 125, N 1—2. P. 201—205.
Vannereau A., Mestre J. С II С. г. Acad.
sci. (Paris). 1975. T. 281, N 11. P. 699—
702.
Vannereau A., Mestre J. С II Rev. cytol. et.
biol. veg. 1980. T. 3, N 4. P. 355-370.
Varghese Т. М. II Proc. Indian Acad. Sci.
B. 1963. Vol. 58. P. 333—347.
Varghese Т. М. II Bull. Indian Nat. ScL
Acad. 1970. N 41. P. 255-258.
Vasil J. II Bull. Torrey Bot. Club. 1964.
Vol. 91, N 5. P. 370—377.
Venkata Rao C. II Proc. Nat. Inst. Sci. India.
B. 1960. Vol. 26, N 5. P. 300-336.
Venkata Rao С II Proc. Nat. Inst. Sci.
India. B. 1961. Vol. 27, N 3. P. 126-151.
Venkata Rao С II Plant Embryology: A
symposium CSIR. New Delhi, 1962. P. 261 —
273
Venkata Rao С. И Proc. Net. Inst. Sci.
India, B. 1963. Vol. 29, N 5. P. 489-510.
Venkata Rao С II Curr. Sci. (India). 1964.
Vol. 33, N 23. P. 722—724.
Venkata-Rao C. II J. Palynol. 1965. Vol. 1,
N 23. P. 1—9.
Venkata Rao С II Proc. Nat. Inst. Sci.
India. 1967a. Vol. 33, N 3, 4. P. 162-199.
Venkata Rao С II New Phytol. 1967b. Vol. 66f
N.4. P. 755—768.
Venkata Rao С II Seminar Comparative
Embryology of Angiosperms. New' Delhi,
1967c. P. 3.
Venkata Rao С II Proc. Indian Acad. Sci. B.
1968. Vol. 68. N 1. P. 11—24.
Venkata Rao C. II J. Indian Bot. Soc. 1969.
Vol. 48, N 3—4. P. 310—321.
Venkata Rao C. II Rao S. R. //J. Indian Bot.
Soc. 1954. Vol. 33, N 4. P. 453-472.
Venkata Rao R., Rao P. II Curr. Sci. (India).
1982. Vol. 52, N 22. P. 1059—1061.
Venkatasubban K. R. II Proc. Indian Acad.
Sci. B. 1945. Vol. 21, N 2. P. 77—92.
Venkateswarlu J. II Curr. Sci. (India). 1941.
Vol. 10. P. 367—368.
Venkateswarlu J. II Curr. Sci. (India). 1.951).
Vol. 28. O. 556-557.
Venkateswarlu /., Atchutaramamurti II. II
J. Indian Bot. Soc. 1955. Vol. 34, N !».
P. 235-247.
Venkateswarlu /., Maheswari Devi 11, II
Proc. Indian Acad. Sci. B. 1955. Vol. 41,
N 1. P. 38—46.
Venkateswarlu /., Rao Rajeswara II i. Indian
Bot. Soc. 1958. Vol. 37, N 4. P. 442- -454.
Ж
VentarelUl M. II Kurt/Лапа. 1981. Т. 14.
P. 73—100.
VenUirellU M. II Kurtziana. 1983. Т. 16.
].'. 71-00.
VenlurMU M. II Kev. bras. bot. 1984. Vol. 7,
N 2. P. 107-119.
Venugopalan Si II Univ. Kansas Sci. Bull.
1900. Vol. 46, N 14. P. 487—493.
Vevnln J. Etat de la guestion sur le develop-
poment du sac embryonnaire, de l'albumen
ol de l'embryon chez les Composees: Diss.
Paris, 1952.
Viemont J. D. II Bull. Soc. bot. France.
1976. T. 123, N 9. P. 491—502.
Viemont J. D. Streptocarpus rexii: biologie,
ontogenese et morphologie experimentale:
Diss. Angers, 1979.
Viemont J. D., Astie M. II Bull. Soc. not.
France. 1974. Vol. 121, N 1. P. 11—22.
Viiaya V., Lakshmanan К. К. III. Madras
Univ. 1979. Vol. 42. P. 26—34.
Vijayaraghavan M. R., Malik Urmila II Bot.
notis. 1972. Vol. 125, N 3. P. 241—254.
Viiayaraghavan M. R., Padmanabhan N. II
Beitr. Biol. Pflanz. 1969. Bd 46, N 1.
S. 15—37.
Vijayaraghavan M. R., Ratnaparkhi S. II
Phytomorphology. 1972. Vol. 22, N 1.
P. 1—8.
Vijayaraghavan M. R., Ratnaparkhi S. II
Ann. Bot. 1973. Vol. 37, N 150. P. 355—
359.
Vijayaraghavan M. R., Sarveshwari G. S. II
Bot. notis. 1968. Vol. 121, fasc. 3. P. 383—
402.
Vishveshwara S., Chinnappa С. С II Turrialba.
1965. Vol. 15, N 4. P. 307—316.
Volk О. Н. II Ber. Dtsch. bot. Ges. 1950.
Bd 62, N 3. S. 68—72.
Vos M. P. de II Sth. Afr. J. Sci. 1947. Vol. 43.
P. 171—187.
Wadhi M. Morphology and embryology of
Thunbergia alata Boj. ex Sims.: Diss.
Univ. Delhi, 1962.
Wadhi M. II Seminar Comparative
Embryology of Angiosperms. New Delhi, 1967.
P. 100.
Wadhi M. II Symposium on Comparative
Embryology of Angiosperm. New Delhi,
1970. Vol. 41. P. 267—272.
Walker R. I. II Bull. Torrey Bot. Club.
1944. Vol. 71, N 5. P. 529—535.
Walker R. I. II Bull. Torrey Bot. Club. 1955.
Vol. 82, N 2. P. 87—101.
Wall W. F., Long R. W. II Bull. Torrey
Bot. Club. 1965. Vol. 92, N 5. P. 373—
377.
Walter R., Kuta E. //Acta biol. crac. Ser.
bot. 1971. Vol. 14. P. 103-109.
Want G. //Austral J. Bot. 1963. Vol. 11,
N 2. P. 152—167.
Warmke H. E. II Bull. Torrey Bot. Club.
1943. Vol. 70, N 2. P. 164—173.
Watanabe S. //Yamagata Daigaku Klyo,
Nogaky. 1963. N 4. P. 155—167.
Waterkeyn L., Bienfait A. /1С r. Acad.
sci. (Paris). D. 1968. T. 267, N 1. P. 56—
58.
Waterkeyn L., Bienfait A. II Grana. 1970.
Vol. 10, N 1. P. 13-20.
Woislo H. II Bull. Int. Cad. sci. polon. B.
1951. T. 1. P. 147-166.
Weber A. II Osterr. bot. Ztschr. 1971. Bd 119,
N 1—3. S. 234—305.
Weber A. II Bot. Jb. Syst. Pflanzengesch.
und Pflanzengeogr. 1976. Bd 97, N 4.
S. 435—454.
Weberling F., Hildenbrand M. II Beitr.
Biol. Pflanz. 1986. Bd 61, N 1. S. 3—20.
Weddel H. II Arch. Museum d'histoire na-
turelle. Paris, 1858—1861. T 10. P. 269—
308.
Wefelscheid G. (Jber die Entwicklung der ge-
nerativen Zelle im Pollenkorn der dikoty-
len Angiospermen: Diss. Bonn, 1911.
Weinedel-Lieban F. II Jb. Wiss. Bot. 1928.
Bd 69. S. 636—686.
Wehmer C. Die Pflanzenstoffe. Jena, 1931.
Bd 2.
Weiss G. II Flora. 1932. Bd 126. S. 418—464.
Went J. L. van II Acta bot. neer. 1970a.
Vol. 19, N2. P. 121—132.
Went J. L. van II Acta bot. neer. 1970b.
Vol. 19, N 3. P. 313—322.
Went J. L. van II Acta bot. neer. 1970c.
Vol. 19, N4. P. 468—480.
Went J. L. van, Linskens H. F. II Gen.
Breeding Res. 1967. Bd 37, N 12. S. 51—56.
Westfall S. S. II Amer. J. Bot. 1949. Vol. 36,
N 10. P. 805.
Whelan E. D. P. II Can. J. Bot. 1974. Vol. 52,
N 6. P. 1219—1224.
Whelan E. D., Haggis G. H., Ford E. II Can.
J. Bot. 1974. Vol. 52, N 6. P. 1215—1218.
Wilkinson A. M. II Bull. Torrey Bot. Club.
1944. Vol. 71, N3. P. 276—301.
Winge O. II Bot. tidskr. 1914. Vol. 33.
Winge O. II С. г. trav. Lab. Carlsberg. 1923.
Vol. 15. P. 26.
Winkler H. tjber Parthenogenesis und Apo-
gamie in Pflanzenreich. Jena, 1908. Bd 2.
S. 347.
Wolf P. II Beitr. Biol. Pflanz. 1929. Bd 17.
S. 351—392.
Woodcock E. F. II Papers Michigan Acad.
Sci., Arts and Letters. 1929. Vol. 11.
P. 341—347.
Woodcock E. F. II Papers Michigan Acad.
Sci., Arts and Letters. 1943. Vol. 28.
P. 209—212.
Wormer Т. М. II Turrialba. 1963. Vol. 13,
N4. P. 237—238.
Worsdell W. G. 111. Linn. Soc. London.
1895-1897. Vol. 31. P. 576—584.
Wdycicki Z. II Acta Soc. bot. pol. 1932a.
Vol. 9, N 1—2. P. 7—30.
Woycicki Z. II Acta Soc. bot. pol. 1932b.
Vol. 9, N3-4. P. 457—472.
Wdycicki Z. II Acta Soc. bot. pol. 1933.
Vol. 10, N 1. P. 1—24.
Woycicki Z. II Acta Soc. bot. pol. 1935.
Vol. 12, N 3. P. 207—226.
Wulff H. D., Raghavan T. S. II Planta.
1938. Bd 27, N 4. S. 466—473.
Wunderlich R. II Osterr. bot. Ztschr; 1967.
Bd 114, N 4—5. S. 383—483.
Wunderlich R. II Osterr. bot. Ztschr. 1971-
Bd 119, N 4—5. S. 329—394.
Wurdinger M. II Denkschr. Akad. Wiss.
Wien. 1910. Bd 85. S. 511—530.
Wyatt R. II Amer. J. Bot. 1976. Vol. 63, N 6.
P. 845—851.
Wylie R. В., Yocom A. E. II Stud. nat. Hist.
Iowa Univ. 1923. Vol. 10. P. 3—18.
Yamazaki T. II Bot. Mag. (Tokyo). 1953.
Vol. 66. P. 141-149.
Yamazaki T. II Bot. Mag. (Tokyo). 1957a.
Vol. 70. P. 162—168.
370
Yamazaki T. 111. Fac. Sci. Univ. Tokyo.
Sec. 3. 1957b. Vol. 7. P. 91-162.
Yamazaki T.lll. Fac. Sci. Univ. Tokyo.
Sec. 3. 1974. Vol. 11, N 8-9. P. 263-281.
Yamazaki Т.1П. Jap. Bot. 1975. Vol. 50,
N 9 P. 281—284.
York H. H. II Bot. Gaz. 1913. Vol. 56, N 2.
P. 89—111, 200—216. тт
Young W. J. //Amer. J. Bot. 1922. Vol. 9,
N5. P. 213-214. , лп
Young W. J. II Amer. J. Bot. 1923. Vol. 10,
N 6. P. 325—335.
Yoyal S. Floral morphology and embryology
of Cissus quadrangularis: Diss. Univ. Uu-
jasthan, 1959.
ZaUnska D. II Acta biol. crac. Ser. bot. 1977.
Vol. 20, N1-2. P. 133-146
Zenkteler M. //Amer. J. Bot. 1962. Vol. 49,
N4. P. 341—348. n n
Zhou Chang II Acta Bot. Sin. 1985. Vol. 27,.
N 3. P. 252-262.
Zweifel R. II Viert. Naturforsch. Ges. Zurich,
1939. Bd 84. S. 245—306.
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ РАСТЕНИЙ
Abelia 159, 165, 167, 168
— grandifiora 159, 160, 168
Aoanthaceae 289—293
Acanthopanax sessiliflorum 35
— spinosum 35
Acanthospermum hispidum 328
Acanthus 289, 294
— ilicifolius 294
— mollis 294
Acerates 132
— longifolia 136
— viridiflora 136
Achillea 320
— millefolium 328
Acicarpha tribuloides 316, 317
Acokanthera spectabilis 129, 132
Actinotus 41
— sp. 43
Adelocaryum 211
— coelestinum 216
— malabaricum 212, 216
Adenocaulon bicolor 328
Adenophora 306
— bulleyana 308
— diplodonta 308
— liliflora 308
Adenostemma lavenia 328
— rugosum 328
Adenostyles albifrons 328
Adhatoda 294
— vasica 290, 294
Adina cordifolia 124
— sp. 124
Adoxa moschatellina 169—171
Adoxaceae 169—171
Aeginetia 268, 270, 272
— indica 268, 272
Aegopodium. podagraria 41, 43
Aeschynanthus puTchra 278
Aethusa cynapium 43
Agastachys 113
Agathelpis dubia 258
Ageratum mexicanum 327, 328
Agonandra silvatica 65, 66
Ainsliaea aptera 318, 328
Ajuga 226, 234, 235
— reptans 227
Alangiaceae 15—17
Alangium 15—18
— chinense (=begoniael'olium) 16—18
— handelii 18
— havilandii 15, 18
— javanicum 15, 18
— lamarckii 18
— longiflorum 15, 18 '
— platanifolium 15—18
— ridleyi 15, 18
372
— rotuhdifolium 18
— salviifolium 18
— villosum 18
Alchemilla 328
Alectra 257 •
— parasitica var. chitrakutensis 258
— thomsoni 256—258
— vogelii 258
Alkanna 213, 216
Allamanda cathartica 132
— neriifolia 129
Alloplectus sanguineus 273, 275, 278
Alonsoa caulialata 258
— sp. 257, 258
Ambrosia artemisifolia 328
— maritima 320, 328
Amethystea 226, 232, 234
— caerulea 227, 235
Ammi 43
— majus 43
Ammobium 324
— alatum 322, 328
Ampelocissus latifolia 101
— tomentosa 101
Ampelopsis hederacea 101
Amphicome 264
— arguta 264
Amsinckia 212, 216
Amsonia tabernaemontana 129 132
Amyema 74, 78, 81
— congener 81
— gravis 81
— miquelii 74, 81
— pendula 81
—. preissii 74, 81
Amylotheca 81
— dictyophleba 74, 76, 81
Anacolosa frutescens 62, 63
Anacyclus radiatus 328
Anaphalis busua 318, 328
Anchusa 211—213, 216
— officinalis 216
Andrographis 294
— echioides 294
— paniculata 294
— serpyllifolia 290, 294
Andryala 318, 328
Anethum graveolens 35, 42, 43
Angelica 43
— archangelica 43
— gmelinii 42, 43
— palustris 43
— sylvestris 43
Anisomeles 226, 232, 234
— indica 226, 232, 235
— malabarica 227, 235
Anisum vulgare 41, 43
Anotis lancifolia 124
— wightiana 124
Antennaria 328
— alpina 327
— carpatica 328
— plantaginifolia 321
— porsildii 327
Anthemis 320—322, 328
Anthriscus 43
— cerefolium 43
— sylvestris 42, 43
Anticharis linearis 257, 258
Antirrhinum majus 251, 256
Apiaceae 35—40
Apium graveolens 43
— inundatum 43
Apocynaceae 128—131
Apocynum androsaemifolium 128, 132
— cannabinum 132
Apodytes dimidiata 45
Aquifoliaceae 47, 48
Aralia 30
— cachemirica 34, 35
— continentalis 30, 35
— cordata 34, 35
— edulis 35
— mandschurica 30, 34, 35
■— pentaphylla 35
— racemosa 34, 35
— sclimidtii 30, 35
— spinosa 35
Araliaceae 30—34
Araliales 30
Araujia albens 136
Arceuthobium 82, 83, 85, 86
— americanum 82, 86
— dougiasii 82, 86
— minutissimum 82, 83, 85, 86
— oxycedri 82, 83, 85, 86
— pusillum 83, 86
Arctium 319, 327, 328
Arctotheca calendula 328
Arctotis 328
Argyreia 200
— speciosa 201
Arnica 318, 328
Artemisia 328
— maritima 327
— nitida 328
Asclepiadaceae 132—135
Asclepias 132, 135, 136
— cornuti 136
— curassavica 136
— dougiasii 136
— incarnata 136
— mexicana 136
— phytolaccoides 136
— speciosa 136
— syriaca 136
— tuberosa 136
— verticillata 136
Asperugo 212, 216
Asperula 121, 124
— humifusa 116, 117, 119
— montana 120
— odorata 116, 117, 119
Aster 320, 328
— novae-angliae 326, 327
— undulatus 327
Asteracantha longifolia (=Hydrophila
spinosa) 294
Asteraceae 318—326
Asterales 318
Astrantia 35
— major 41—43
Astro daucus orientalis 42, 43
Asystasia 290, 294
— shimperi 290
Atkinsonia 81
— ligustrina 76, 81
Atropa belladonna 244, 246
Aucuba 21, 24
— himalaica 21, 22, 24
— japonica 21, 22, 24
Aucubaceae 21—24
Avicennia 225
— marina 224, 225
— officinalis 219, 220, 222, 224, 225
Azima sarmentosa 58
— tetracantha 58
Azorella trifurcata 41, 43
Bacopa hamiltoniana 256, 258
— monnieri (=Herpestis monnieri) 258
Balanophora 89, 91—93
— abbreviata 91—93
— dioica 91, 93
— elongata 90—93
— fungosa ssp. indica var. indica (—B.
indica, =B. thwaitesii) 90—93
— fungosa ssp. indica var. globosa (=B. glo-
bosa) 90—93
— japonica 92, 93
— laxiflora 90, 93
— poliandra 90, 93
Balanophoraceae 89—91
Balanophorales 87
Ballota 226, 233
— foetida 235
— nigra 235
Barathranthus 74, 76, 81
— axanthus 81
Barkhausia 327
— foetida 327, 328
Barleria 290, 294
— prionitis 289, 294
Bartonia 145
— virginica 145
Bartsia alpina 251, 252, 257, 258
Bellendena 113
Belli diastrum michelii 328
Bellis 328
— perennis 321, 326, 327
Belli urn belli dioides 328
Berchemia polyphylla 94, 98
Berkheya aldami 328
— bergiana 326—328
Betonica abchasica 235
— grandifiora 235
— ossetica 235
Biasolettia 43
Bidens 327
— cernua 327, 328
— lainvillea 328
— tripartita 328
Bidensis biternata (=Bidens pillosa) 328
Bifora radians 35, 43
Bignonia 263
— bungei 264
— capensis 264
— megapotamica 262, 264
— tveediana 264
— unguis-cati 264
— venusta 264
Bignoniaceae 259—263
Bilacunaria caspia (=Hippomarallii'iiiu сак
pium) 43
Blackstonia perfoliata (=Chlora pm'I'ollaUi)
145
a?:i
Blainvillon rlmmlioidea 327, 328
Blechum 293
— anguslil'oliuiti 294
Bleplmris 289
— mudcraspatensis 290, 294
Bhimoa 326—328
— oriantha 327
— malabarica 318, 324, 327
— membranaeea 318, 326, 327
— oxyodonta 327
Blumenbachia 193
— hieronymi 193, 195
Bonnaya (=Vandellia) mellioides (=V.
tipoda) 258
— tenuifolia 258
— verbenaefolia (=V. anagallis) 258
Boraginaceae 211—216
Borago 212, 216
Borreria hebecarpa 117, 124
— hispida 124
— pusilla (=B. stricta) 116, 124
— verticillata 117, 124
Boschniakia 270
— rossica 270, 272
Bouchea incrassata 219, 225
Bougueria 282, 283
Bouvardia coccinea 124
— humboldti 124
— leiantha 124
— sp. 124
Bowlesia tenera 41, 43
Bracbycome ciliaris 328
— iberidifolia 328
Brassaia actinophylla 30, 33, 35
Brazoria 226
Browallia demissa 246
— speciosa 241, 246
— viscosa 245, 246
Brunfelsia 246
— americana 241, 244, 246
Brunonia 313
— australis 315
Buckleya 68, 69, 71
— lanceolata 66
Buddleja curviflora 248—250
— davidi 248—250
— lindlergiana 250
— variabilis 249, 250
Buddlejaceae 248—250
Bunium 43
— chaerophylloides 43
— ferulaceum 41, 43
— paucifolium 36, 41—43
— setaceum 43
Buphtlialmum salicifolium 328
Bupleurum 43
— aureum 41
— dianthifolium 41
— rotundifolium 36, 41, 42
— spinosum 41
— terme 41, 42
Bystropogon 231
— origanifolius 240
Caohrys odontalgica 41, 43
Caesulia axillaris 328
Caiophora 193
— lateritia 193, 195
— silvestris 195
Calamintha grandiflora 235
Calceolaria mexicana 258
Calendula 319, 321, 323, 327, 328
— arvensis 327, 328
— nutans 328
— officinalis 319, 322, 324, 328
Calestania palustris 41
Callicarpa 219, 222
— macrophylla 224, 225
Callipeltis cucullaria 124
Callitrichaceae 236—239
Callitriche 240
— autumnalis 236, 237, 240
— hamulata 240
— palustris 236, 240
— stagnalis 236, 237, 240
— vernalis 237, 240
an- Calotis 328
— hispidula 318
— squamigera 318
Calotropis 132, 136
— gigantea 136
— procera 136
Calycera crenata 316
Calyceraceae 316, 317
Calycerales 316
Calystegia sylvestris 196, 201
Campanula 306, 308 '
— americana 300, 302
— carpatica 306
— persicifolia 306
— portenschlagiana 306
— rapunculoides 300, 302, 304
-^ rotundifolia 306
— steveni 307
Campanulaceae 300, 302—306,
Campanulales 300
Campsis chinensis 264
— radicans 259—261, 264
Canscora 140
— decurrens 145
— decussata 141, 145
— diffusa 145
— pauciflora 145
Cansjera 65 v
— rheedii 64, 66
Canthium sp. 124
Capraria biflora 258
Caprifoliaceae 159
Capsicum 246
— annuum 241, 245, 246
— frutescens 244
Caralluma 132
— attenuata 133, 136
— fimbriata 136
Cardiopteris lobata 49
— moluccana 49
Cardiopterygaceae 49
Carduus 319, 327
— nutans 327
Carissa carandas 132
— grandiflora 129, 132
Carlina acaulis 328
Caropodium 43
— platycarpum 43
Carthamus 328
— lanatus 328
— tinctorius 328
Carum 42
— carvi 41, 43
Caryopteris mongholica 219, 220, 225
— wallichiana 219, 222, 225
Castalis 328
Catalpa bignonioides 264
— duclouxii 261, 264
— kaempferi 260, 264
— syringaefolia 264
Catharanthus pusillus 131, 132
— roseus 128—130, 132
Catopheria 235
374
'Caucalis platycarpos 42, 43
Cayratia carnosa 101
— pedata 101
Ceanothus 95
— azureus 98
-Gelastraceae 49, 50, 52
•Celastrales 45
•Celastrus 50, 53
— orbiculata 50, 53, 54
— paniculata 49, 50, 52—54
— scandens 50, 53, 54
■Celsia 256, 257
— coromandelina 258
■Cenarrhenes 113
— nitida 111, 113
Cenolophium denudatum 43
■Centaurea 326—328
Centaurium erythraea (=Erythraea
centaurium) 145
— ramosissimum 142, 145
— roxburghii (=Erythraea roxburghii) 145
■Centranthera hispida 258
■Centranthus 171, 173
— calcitrapa 172, 176, 177
— macrosiphon 173, 176, 177
— ruber 172, 177
■Cephalanthus sp. 124
Gephalaria 190
— alpina 192
— ambrosioides 192
— brevipalea 185, 192
— gigantea 185, 192
— leucantha 192
— syriaca 192
— tatarica 1.92
Cephalostigma schimperi 300, 306—308
■Cerbera odollam 132
•Cerinthe minor 216
•Ceropegia 135, 136
— candelabrum 136
— debilis 136
— elegans 136
— juncea 136
— sandersoni 136
— stapeliaeformis 136
■Cestrum 245
— aurantiacum 246
— diurnum 241,, 246
— elegans 244, 246
— nocturnum 246
'Chaenorhinum minus 257, 258
Chaenostoma (=Sutera) foatidum 258
■Chaerophyllum 43
— aromaticum 35, 41
— aureum 41
— roseum 41
'Chamaeranthemum beyrichii 294
Chaunochiton kappleri 63
■Chelone glabra 251, 258
€hilopsis saligna 261, 264
•Chiococca sp. 124
Chirita lavandulacea 275, 278
•Chlora 141
— perfoliata 140, 142, 145
■Chondrilla 328
— juncea 327
■Choretrum 71
— lateriflorum 71
Christisonia 268, 270
— albida 272
— bieolor 272
— neilgherrica 272
— subacaulis 272
Chrysanthemum 320, 322, 328
— arinatum 320
— boreale 320
— coronarium 320
— decaisneanum 320
— frutescens 320
— indicum 327
— leucantemum 320
— marschallii 320
— nipponicum 320
— roseum 320
Chrysocoma coma-aurea 328
Chrysothamnus 318
— nauseosus speciosus 328
Cicendia 137
— filiformis 145
Cicerbita alpina 328
Cichorium 323, 324
— intybus 324, 327, 328
Cicuta virosa 41, 43
Cirsium 327, 328
Cissus 99
— pallida (=Vitis pallida) 99, 101
— quadrangularis 100, 101
— trilobata 101
— vitiginea 99, 101
Cistanche 270, 272
— flava 272
— salsa 272
— tinctoria 272
— tubulosa 268, 272
Citharexylum ilicifolium 219, 225
Cladanthus arabicus 328
Clerodendron (=Clerodendrum) 219, 222
— fallax 225
— flomidis 219, 222, 225
— foetidum 225
— macrosiphon 225
— phlomoides 225
— thomsonae 225
— trichotomum 225
— ugandense 225
— urticifolium 225
Cnicus 326
— benedictus 328
Cnidium dubium 43
Cobaea 209
— scandens 206, 207, 209
Codonopsis clematidea 306, 308
Coffea 121, 124
— arabica 116, 120
— canephora 121
— dewevrei 116
— excelsa 116
Coldenia 211—213
— procumbens 211, 212, 216
Colebrookia 226
Colletia 94
— ferox 94, 98
— spinosissima 95, 98
Collinsia bieolor 258
— heterophylla 258
Collomia coccinea 209
— grandiflora 209
Comandra 68, 69, 71
— umbellata 71
Comastoma tenellum (=Gentiana tenella) 145
Comanthosphace 226
Congea 222
— villosa 225
Conium 35
— maculatum 43
Conopholis 272
— americana 270—272
Conospermum 113
— brownii 113
— coeruleum 113
375
— densii'loi'uin 113
— distichum 113
— ollipticum 113
— oricit'olium 113
— Iloxuosum 113
— glumaceum 113
— huogelii 113
— incurvum 113
— longifolium 113
— stoechadis 113
— taxifolium 113
— tenuifolium 113
— triplinervium 113
Convolvulaceae 196—200
Convolvulus 196
— arvensis 196—198, 200, 201
— scammonia 196—198, 201
— sepium 201
Cordia 212
— sebestena 216
Coreopsis 328
— laceolata 328
Coriandrum sativum 35, 36, 41, 43
Gornaceae 18—20
Comales 7
Cornus 18—21
— alba 21
— alternifolia 21
— amomum 18, 20, 21
— asperifolia 21
— controversa 18, 19, 21
— florida 18, 20, 21
— macrophylla 21
— mas 18—21
— oblonga 18, 20, 21
— sanguinea 21
— stolonifera 21
— stricta 21
— suecica 18
Cornutia 222
Corynaea 90
— sphaerica 91, 93
■Corynocarpaceae 58
Corynocarpus laevigata 58
Corytholoma cyclophyllum 273, 275, 278
Cosmidium 327
— burridgeanum 326, 328
Cosmos 318, 327
— bipinnatus 318, 328
Cotula 318, 323
— australis 328
Cotylanthera 137, 144, 145
— tenuis 137, 141, 144, 145
Coula edulis 62, 63
Cousinia carduiformis 328
— pseudoarctium 328
— umbrosa 328 .
Crabbea angustifolia 294
— nana 294
Craniotome 232
— versicolor 235
Crepis 318, 323, 324, 328
— capillaris 319, 327, 328
— tectorum 319, 320, 324
Crescentia macrophylla 264
Crithmum maritimum 41, 43
Crossandra nilotica 294
Crossocephalum crepioides 328
Crucianella 119, 124
Cruciata laevipes 117, 124
Crupina 326
— crupinastrum 328
— vulgaris 328
Cryptolepis 135
— buchanani 136
Cryptostegia grandiflora 133, 136, 137
Cuminum cyminum 35, 42, 43
Cuscuta 201, 203
— calycina 201, 202, 204, 206
— campestris 204
— epithymum 201, 202, 204, 206
— europaea 201, 202, 204, 206
— gronovii 204, 206
— hyalina 201, 202, 204, 206
— japonica 201—204,. 206
— lupuliformis 202, 204, 206
— mOBOgyna 201—204, 206
— planiflora 201, 202, 204, 206
— reflexa 201, 202, 204, 206
— rostrata 204
Cuscutaceae 201—205
Cuspidaria 261
Cyananthus integer 306, 308
Cynanchum 135, 136
— acutum 136, 137
— calliajata 136, 137
— fuscatum 137
— laeve 137
— medium 137
— nigrum 136, 137
— speciosum 137
— vincetoxicum 136, 137
Cynara scolymus 333
Cynoglossum 216—218, 221
— amabile 217, 221
Cynomoriaceae 87, 88
Cynomorium 89
— coccineum 89
— songaricum 87, 89
Cynoxylon florida 19
Cyphomandra betacea 246
Cyphostemma 99
— setosum 99, 101
Dactylanthus 92
— teylori 90, 92, 93
Daemia 132
— extensa 136, 137
Dahlia 327, 328
Dampiera 313
— ianceolata 315
— lavandulacea 313, 315
— stricta 313, 315
Datura 250
— fastuosa (= Datura laevis)T246, 251
— metel 244, 246
— stramonium (=Datura tatula)^241, 245,
Daucus 43
— carota 41—43
— muricatus 43
— sativus 43
Davidia involucrata 7, 8, 12
Davidiaceae 7—11
Deinostema 258
Delarbrea lauterbachii 30, 31, 35
Dendropemon (=Phthirusa) 74, 78, 81
Dendrophthoe 81
— falcata 81
— pentandra 81
Dendrophthora 82, 83, 85
— gracilis 86
— opuntioides 86
Dentella repens 124
— serpyllifolia 121, 124
Dermatobotrys saundersii 258
Desmostachys preussii 45
Dialypetalanthaceae 153
Dialypetalanthus fuscescens 153
376
Dicliptera 290
— bupleuroides 294
— roxburghiana 294
Dicoma tomentosa 328
Dictyanthus ceratopetala 137
Didiscus 41
— pilosus 43
Didymocarpus tomentosa 273, 278
Diervilla 159, 165
— japonica 168
Digitalis grandiflora 251, 252, 258
— purpurea 258
Dimorphotheca 327
— oblongifolium 328
— orientale 328
— sinuata 328
Diodia dasycephala 124
— teres 124
— virginiana 120, 124
Diphelypaea 270. 272
— coccinea 269, 272
Diplanthera uninervis 294
Dipsacaceae 184—191
Dipsacales 159
Dipsacus 190
— dipsacoides 185, 192
— laciniatus 185, 192
— leschenaultii 192
— sylvestris 192
Dipteracanthus 289, 293, 294
— patulus 290, 294
Dischisma arenarium 258
— capitatum 258
— ciliatum 258
Dischoriste humilis 294
Dissotis 318
Ditepalanthus 91
— afzelii 93
Dolichandrone 259
— rheedii 264
Donatia novae-zelandiae 311, 312
Donatiaceae 311
Doronicum plantagineum 328
Downingia bacigalupii 304, 308
— pulchella 306, 308 ,
Dracocephalum 226, 235
Dregea volubilis 137
Drusa 41
— oppositifolia 41, 43
Duboisia leichhardtii 246
— myoporoides 246
Duckeodendraceae 248
Duranta 219
— plumieri 224, 225
Dyshoriste humilis 294
Dysophylla 226
Ecbolium 290, 294
— linneanum 294
Eccremocarpus scaber 264
Echinacea 318, 319, 326
— purpurea 319, 326
Echinops 318, 328
Echium 211, 213
— amoenum 212, 216
— plantagineum 212, 213, 216
— russicum 212, 216
— vulgare 212, 213, 216
Eclipta alba 328
— erecta 327, 328
— prostrata 328
Ehretia 212
— laevis 216
— microphylla 216
— ovalifolia 216
Elaeagnaceae 105—107, 109, 110
Elaeagnales 105
Elaeagnus 105—107, 109, 110
— angustifolia 110
— argentea 106, 109, 110
— conferta 109, 110
— multiflora 110
— songarica 110
— umbellata 105, 106, 110
Elaeodendron 50
— glaucum 50, 54
Elaeoselinum sp. 43
Elaeosticta allioideS' 36, 41—43
— lutea 41—43
Elephantopus' scaber^324, 328
— species 328
Eleutherococcus senticosus 30, 31,
Ellisia 211
— nyctelea 210, 211
Ellisiophyllum pinnatum 257
— pinnatum var. reptans^258
Elsholtzia 226, 234
— cristata 235
— fruticosa 235
Elythranthe 82
Elythraria 289, 294
— acauiis 289, 290, 293, 294
Emilia flammea 328
— sonchifoiia 318, 328
Enicostema 137
— hyssopifolium 145
— littorale 137, 140, 144, 145
— verticillatum 145
Epaltes australis 328
Epiphegus americanus 272
Epithema carnosum 273, 275, 278
Epvatamia heyneana 132
Eranthemum albomaculatum 294
— leuconeuron 294
— nervosum 294
Erechtites hieracifolia 328
Eremophila duttoni 288
— longifolia 288
Eremostachys napuligera 235
Erigeron 320, 322, 328
— annus 323
— aurantiacum 322
— eriocephalus 322
— frigidus 323
— karvinskianus 323
— politus 322
Erinus alpinus 258
Ervatamia heyneana 132
Eryngium 35, 43
— amethystinum 42, 43
— juccifolium 41, 43
— maritimum 41, 43
— planum 36, 41—43
Erythraea 144
— centaurium 142, 144, 145
Erythropalum 63
— scandens 62, 63
Eubrachion 82, 85
— ambiguum 82, 83, 85, 86
Euonymus 53, 54
— alata 54
— alata var. angustifolia 54
— alata var. apretus 54
— americana 54
— bungeana 54
— dielsiana 54
— ■europaea 53, 54
— fimbriata 54
— hamiltoniana 54
25 Сравнительная эмбриология
— japonica 49, 53, 54
— koopmani 54
— latii'olia 50, 54
— macroptora 49, 50, 53, 54
— maximowicziana 54
— miniala 54
— oxyphylla 54
— planipes 49, 53, 54
— sachalinensis 54
— vagans 54
— verrucosa 49, 54
— verrucosoides 54
Eupatorium 328
— cannabium 318
— glandulosum 327
.Euphrasia arctica 256, 258
— officinalis 258
— rostkoviana 258
— tatarica 251, 258
— tenuis 258
Eustoma exaltatum (=Gentiana exaltatum)
145
Evolvulus 196
— alsinoides 196, 200, 201
Exacum 137, 140
— affine 142, 145
— bicolor 145
— pedunculatum 145
— petiolare 141, 145
— pumilum 145
— saulieri 145
Exocarpus 66, 68—71
— bidwillii 71
— cupressiforum 69, 71
— gaudichaudii 71
— latifolius 71
— menziesii 71
— sparteus 71
— strictus 71
Fadogia cienkowskii 117, 119, 120, 124
Fagraea fragrans 114, 116
— Janceolata 114, 116
— litoralis 114, 116
Falcaria vulgaris 43
Fatsia japonica 34, 35
Fedia 173
— cornucopiae 177
Ferula 43
Ferulago campestris 43
Flaveria ropanda 328
Foeniculum vulgare 35, 36, 41—43
Forstora 308, 311, 312
— tenella 309—311
Fraxinus 154, 155
— americana 155, 158
— excelsior 158
— glabra 158
— Janceolata 154, 158
— nigra 156, 1.58
— ornus 158
— oxycarpa 158
— paflisao 158
— pensylvanica 158
— pubescens 158
— quadrangulata 158
— syriaca 158
— toumeyi 158
— velutina 154—156
— viridis 158
Funaria hygromertrica 328
Gaillardia aristata 322, 323, 328
— lorenziana 328
— pulchella 322, 323, 328
Galeopsis 226, 235
— pubescens 232
Galinsoga 327, 328
— ciliaris 321
Galium 120, 121, 124
— boreale 117
— lucidum 120
— verum 116
Gardenia sp. 124
Garrya douglas 27
— fiavescens 26, 27
— fiavescens var. pallida 26
— elliptica 25—27
— veatchii 25—27
— wrightii 26, 27
Garryaceae 25, 26
Gastonia lyrata 35
Gazania 328
Geissoloma marginatum 56, 57
Geissolomataceae 56, 57
Gelsemium nitidum (=G. semprevirens) 116
Geniostoma moluccanum 116
Genlisea 283, 286, 287'
— africana 287
— filiformis 287, 288
— glandulosissima 287, 288
— luteo-viridis 287
— ornata 287, 288
— reflexa 287
— violacea 287
Gentiana acaulis 137, 145
— angustifolia 13.7, 145
— asclepiadea 141, 145
— crinita 145
— cruciata 137, 138, 140, 144, 145
— fetisowi 137, 145
— germanica 145
— lutea 137, 138, 140, 142, 144, 145
— pedicellata 145
— pneumonanthe 145
— prostrata 142, 144, 145
— punctata 145
— quadrifaria 145
— septemfida 140, 145
— straminea 145
— tenella 141, 144, 145
— tibetica 141, 145
— walujewi 145
Gentianaceae 137—140, 142—144
Gentianales 114
Gentianella amarella (=Gentiana amarelia)
144, 145
— campestris (=Gentiana campestris) 141,
145
— carpathica (= Gentiana carpathica) 144,
145
— lingulata 138, 140, 141, 144, 145
— livonica (=Gentiana livonica) 144, 145
— uliginosa (=Gentiana uliginosa) 144, 145
Gentianopsis barbata (=Gentiana barbata)
138, 140, 144, 145
— ciliata (=Gentiana ciliata) 141, 145
Gerardia pedicularia 254, 256, 258
Gerbera anandria 328
— hybrida 328
— jamesoni 328
Gesneria elongata 278
Gesneriaceae 273—276
Geunsia 219
Gibbaria 328
Gilia 206, 209
— capitata 206—209
— millefoliata (=G. multicaulis) 209
— tricolor 209
378
Ginalloa 83, 85
— linearis 86
Gleadovia 270
Glechoma 226
— hederacea 235
Globularia cordifolia 257, 258
— incanescens 251, 258
— nudicaulis 257, 258
— vulgaris 257, 258
Glosocomia sp. 308
Glossocardia 327
— bosvallia 328
Gmelina arborea 225
Gnaphalium 328
— undulatum 327
Gomphandra javanica 45
— polymorphs 45, 46
Gomphocarpus 135
— fruticosus 137
Gonocaryum pyriforme 45, 46
Goodenia cycloptera 315
— geniculate 315
— ovata 315
Goodeniaceae 313—315
Gouania tiliaefolia 98
Goupiaceae 56
Govenia 94
— microcarpa 98
Gratiola 257
— officinalis 256, 258
Grevillea 111
— australis 113
— banksii 111—113
— buxifolia 113
— crithmifolia 111, 113
— endlicheriana 111—113
— ilicifolia 111, 113
— leucopteris 111, 113
— macrostachya 113
— obtusifolia 113
— oleoides 113
— robusta 113
— rosmarinifolia 113
— rubiginosa 111, 113
— trifida 113
— vestita 113
— vieillardi 111, 113
Grindelia 327
— squamosa 327, 328
Griselinia littoralis 27, 28
— lucida 28
Griseliniaceae 27
Gronovia scandens 195
Guettarda speciosa 124
Guizotia abyssinica 328
Gutierrezia 327, 328
Gymnosporia rothiana 49, 50, 53, 54
— spinosa 50, 53, 54
Haberlea rhodopensis 273, 275, 278
Hachettea 92
— austro-caledonica 89, 91, 93
Hakea saligna 111
Halenia elliptica 142, 145
Hamelia patens 124
Haplanthus tentaculatus 294
Haplocarpha lyrata 328
Haplopappus 327
— ciliatus 328
— gracilis 328
Harveya 251
— coccinea 258
Hebenstretia comosa 258
— dentata 258
— integrifolia 258
Hedera australiana 30, 33—35
— helix 30, 34, 35
— nepalensis 30, 35
— rhombea 35
Heisteria cyanocarpa 62, 63
Helianthemum vulgare 328
Helianthus 318, 319, 323, 324, 327, 328-
— annuus 318, 319, 323, 324, 327, 328
— tuberosus 328
Helicanthes 81
— elastica 82
Helichrysum bracteatum 322, 328
Helinus lanceolatus 98
Heliopsis helianthoides 328
— scabra 328
Heliotropium 211—213
— curassavicum 213, 216
— europaeum 212, 216
— indicum 213, 216
— ovalifolium 213, 216
— peruvianum 213, 216
— scabrum 213, 216
— strigosum 213, 216
— supinum 216
Helixanthera 74
^~ ligustrina 74, 82
Helosis 92
— cayennensis 90, 91, 93
Helwingia japonica 29
Helwingiaceae 29
Hemidesmus 135
— indicus 133, 137
Heptapleurum venulosum 30, 33, 35
Heracfeum 43
— sosnowskyi 35
— sphondylium 42
Heteropanax fragrans 35
Hieracium 318, 328
— aurantiacum 327
— flagellare 328
— pilosella 328
— ramosum 328
— vulgatum 328
Hippophae 105, 110
— rhamnoides 105—107, 109, 110
Hippuridaceae 295—298
Hippuris vulgaris 295, 296, 299
Hispidus 322
Hoffmannia ghiesbreghtii 124
— refulgens 124
— sp. 124
Holarrhena antidysenterica 128, 129, 131, 132
Holostemma rheedei 137
Homogyne alpina 328
Hoplestigma 218
Hoplestigmataceae 218
Hoppea dichotoma 140, 144, 145
— fastigiata 145
Horminum 226, 234
— pyrenaicum 235
Hosta caerulea 225
Houstonia 119, 121
— coccinea 124
— coerulea 121, 124
— longifolia 124
— sp. 124
Hoya carnosa 137
Huernia kirkii 137
Hydrocotyle 41
— ranunculoides 43
— vulgaris 43
Hydrolea 209
— spinosa 210, 211
— zeylanica 209, 211
25*
:i7i)
Hydrophylax maritima 116, 124
Hydrophyllaceae 209, 210
Hydrophyllum 211
— canadense 211
— fendleri 211
— occidental 211
— virginicum 209, 211
Hydrostachyaceae 294, 295
Uydrostachys distichophylla 295
— goudotiana 295
— hildebrantii 295
— imbricata 295
— longifida 295
— longipoda 295
— stolonifera 295
— verruculosa 295
Hymenatherum tenuifolium 328
Hyobanche sanguinea 251, 258 j
Hyoscyamus albus 246
— niger 245, 246
— ori en talis 245, 246
Hyphear 74
Hypochaeris aetnensis 328
— maculata 328
— radicata 318, 328
— uniflora 328
Hypogomphia 226
Hypsela reniformis 311, 313
Hyptis 226
— pectinata 235
— suaveolens 235
Hyssopus 226
— officinalis 235
Icacinaceae 45, 46
Idenburgia 47
— sp. 47
Ilex aquifolium 47, 48
— cornuta 47, 48
— crenata 48
— decidua 48
— opaca 48
— verticillata 48
— vomitoria 48
Ilysanthes (=Lindernia) dubia^258
— hyssopioides 258 *~
— parviflora 258
Incarvillea 261, 264
— compacta 260, 264
— delavayi 264
— grandiflora 264
— olgae 264
Inula helenium 328
Iodina 68, 69, 71
— rhombifolia 66, 71
Ipomoea 196, 200, 201
— aquatica 196, 201
— batatas 196, 201
— biloba 201
— carnea 200, 201
— hederacea 201
— hispida 201
— horsfalliae 201
— leari 201
— obscura 196, 197, 200, 201
— pes-tigridis 201
— pulchella 196, 201
— purpurea 198, 200, 201
— reptans 196, 201
— sepiaria 201
— sinuata 200, 201
— staphylina 196, 201
— trifida 201
Isanthus 226
380
Isoplexis (= Digitalis) canariensis 263
Isotoma axillaris 306, 308
— fluviatilis 300, 302, 308
— longiflora 300, 307, 308
— petraea 308
Ixeria dentata 323, 328
Ixora 124
— radiata 117
Jacaranda 261
— mimosaefolia 263, 264
Jacobinia 293
— pauciflora 294
Jacquemontia violacea 196, 201
Jasione montana 302, 308
Jasminum 154—156
— angustifolium 154, 156, 158
— grandiflorum 158
— nudiflorum 158
— pubescens 158
— sambac 156, 158
Jungia japonica 318, 328
Jurinea 319, 328
Justicia 289, 294
— betonica 290
— simplex 293
Kigelia 261, 262
— pinnata 260—262, 264
Klugia notoniana 273—275, 278
— zeylanica 273, 275, 278
Knautia 190, 192
— arvensis 185, 192
— drymeja 192
— macedonica 192
— montana 185, 192
— neglecta 192
— sylvatica 192
Knightia 113
— excelsa 113
Knoxia corymbosa 119, 124
Kopsia longifolia 132
Kopsiopsis 270
— strobilacea 272
— tuberosa 270, 272
Korthalsella 82, 83, 85
— dacrydii 86
— opuntia 82, 86
Lactuca muralis 327, 328
— sativa 328
Lagascea mollis 327, 328
Laggera 326
— pterodonta 327, 328
Lagoecia cuminoides 43
Lagotis glauca 258
Lallemantia 226, 234
— iberica 226, 235
— peltata 235
Lambertia formosa 113
— inermis 113
— multiflora 113
— uniflora 113
Lamiaceae 225, 227, 234
Lamiales 219
Lamium 226, 235
— amplexicaule 225
— maculatum 232
Lampsana communis 328
Langsdorffia (Aster.) 328
Langsdorffia (Balan.) 92, 93
— hypogaea 90—93
Lankesteria barteri 294
— brevior 294
Lantana 219, 224
— camara 219, 220, 224, 225
— chamaedrifolia 219, 225
— indica (=Lantana trifolia) 219, 225
— involucrata (=Lantana stricta) 219,
Lappula 212, 216
Laser trilobum 41, 43
Laserpitium hispidum 35, 41, 43
— siler 43
Lasianthera apicalis 45
Lathraea 257
— clandestina 258
— squamaria 251, 252, 256—258
Lathrophytum 91, 93
Launaea nudicaulis 328
— pinnatifida 318, 328
Laurentia michelii 308
— tenella 307, 308
Lavandula 225, 226, 234, 235
— officinalis 227
— spica 227, 232
Leea edgeworthii 104
— indica 104
— robusta 102, 104
— sambucina 102, 104
Leeaceae 101—103
Leiphaimos 137, 144, 145
— aurantiacus 145
— spectabilis 144, 145
Lennoa 218
— caerulea 217, 218 .
— madreporoides 217, 218
Lennoaceae 217
Lentibulariaceae 283—286
Leontodon 322, 328
— autumnalis 328
— hispidus 319, 325, 328
Leontopodium alpinum 328
— nivale 328
Leonurus 226, 233
— cardiaca 235
— sibiricus 227, 232, 235
Lepachis columnaris 328
Lepechinia 226
— spicata 235
Lepeostegeres 74, 82
— gemmiflorus 74, 76, 81
Leptachis columnaris 323
Leptadenia 132, 135
— pyrotechnica 137
— reticulata 137
Leptaulus daphnoides 45
Leptodermis lanceolata 124
— sp. 124
Leptomeria 66, 68—71
— acida 68, 69, 71
— billardieri 71
— cunninghamii 68, 69, 71
Leptosiphon androsaceus (=Gilia androsacea)
207—209
Leschenaultia 313
— biloba 313, 315
— floribunda 315
— formosa 315
— linarioides 315
Leucanthemum yulgare 328
Leucas 226
— aspera 235
— biflora 235
— cephalotes 235
Levenhookia 308
— dubia 310, 311
jLevisticum officinale 42, 43
Leycesteria 159, 165, 167, 168
— formosa 160, 167, 168
Liatris elegans 328
Ligularia kaempferi 328
Ligusticum meum 43
Ligustrum ovalifolium 155, 156, 158
Limnanthemum (=Nymphoides) 145, 14(1
— cristatum (=Nymphoides cristatum) 145,
146, 153
— indicum (=Nymphoides indicum) 145,
146, 153
— nymphoides (=Nymphoides peltatum) 145,
146, 151, 153
Limnophyla heterophylla 258
Limosella aquatica 251, 258
— sp. 258
Linaria 256—258
— bipartita 256
— ramosissima 254, 256
Lindelofia 211, 216
Lindernia hyssopioides 258
— pyxidaria 258
Linnaea 159, 168
— borealis 168
Lippia 219, 225
— citriodora 219, 225
— nodiflora (=Lippia canescens) 219, 220,
222, 224, 225
Liriosma acuta 62, 63
Littorella uniflora 281—283
Loasa 193
— bergii 193, 195
— hispida 195
— lateritia 193, 195
— tricolor 195
— vulcanica 193, 195
Loasaceae 193, 194
Loasales 193
Lobelia 311, 313
— amoena 305, 307, 312
— cardinalis 305, 307, 309
— erinus 305
— excelsa 307
— nicotianaefolia 307
— pyramidalis 305, 307
— splendens 305
— syphilitica 305, 312
— trialata 305
— trigona 307
Lochnera pusilla 132
— rosea 128, 132
Loganiaceae 114, 115
Lomatia 113
— dentana 113
— ferruginea 113
— hirsuta 113
— longifolia 111
— polymorpha 113
— salaifolia 113
— tinctoria 111
Lonicera 159, 165, 166, 168
— alpigena 166, 168
— caerulea 168
— saprifolium 159, 168
— edulis 159, 168
— involucrata 168
— kamtschatica 154, 168
— ledebourii 168
— myrtilloides 168
— pileata 168
— pyrenaica 168
— standishii 168
— tatarica 159
— turczaninowii 159, 168
Lophanthus chinensis 235
Ml
Lophophytum 89, 91
— mirabile 90, 91, 93
Lophopyxidaceae 59
Lophopyxis maingayi 59
Loranthaceae 74, 76—80, 86
Loranthus 76
— bicolor 81
— europaeus 74, 81
— globosus 81
— pentandrus (=Dendrophthoe pentandra)
81
— rubromarginatus 81
Lycium barbarum 246
— cestroides 244—246
— europaeum 241, 243, 246
Lycopersicon 241, 245
— esculentum 241—246
— hirsutum 244, 247
— peruvianum 244, 247
— pimpinellifolium 247
Lycopsis 211—213
— orientalis 216
Lycopus 226
— europaeus 235
— rubellus 235
Lyperia (=Sutera) violacea 255
Lysiana 81
— exocarpi 76, 81
Macadamia integrifolia 113
— ternifolia 113
Macraea laricifolia 328
Macrosolen 74, 76, 81
— cochinchinensis (=Loranthus sphaerocar-
pus) 74, 76, 81
— forropsus 81
— pseudoperfoliatus 81
Macrosphyra longistyla 116, 117, 124
Macrotheca elaeocarpa 62, 63
Majorana 226
— hortensis 235
Malabaila graveolens 41, 43
Manettia bicolor 116, 124
— inflata 124
— sp. 124
Mannagettaea 270, 272
— hummelii 272
Marrubium 226, 234
— pannonicum 235
— peregrinum 235
Marsdenia 135
— erecta 137
— volubilis 137
Martynia diandra 268
— louisiana 268
Martyniaceae 267, 268
Matricaria maritiraa 322, 328
— matricarioides 328
Maythenus boaria 54
— ilicifolia 54
Mecardonia procumbens 254, 258
Medusandraceae 49
Melampodium divaricatum 328
Melampyrum 254, 256—258
— lineare 254, 256, 257
— nemorosum 251, 252, 254
— pratense 254
Melanophyllaceae 27
Melissa 226
— officinalis 235
Melitella pusilla 328
Melittis 226
— melissophyllum 235
Mentha 226, 235
382
— aquatica 227
Mentzelia 193 ■
— albescens 193, 195
— aurea 193, 195
— gonsatti 193, 195
— laevicaulus 193, 195
Menyanthaceae 145, 152
Menyanthes 145
— trifoliata 145, 146, 151, 153.
Mericarpaea sp. 124
— vaillantioides 124
Mertensia 211, 212
— paniculata 211, 212, 216
— platyphylla 211, 212,' 216
Meryta macrophylla 35
Microcarpaea muscosa 258
Mida 68, 69, 71
— salicifolia 71
Mimulus 257
— moschatus 258
— ringens 254, 256, 258
— tigrinus 258
Minquartia guianensis 62, 63^
Minuria 328
— cunninghami 323
— denticulata 322
Misodendraceae 73
Misodendrum 71—73
— brachystachyum 73, 74
— linearifolium 73, 74
— punctulatum 73, 74
— quadriflorum 73, 74
— recurvum 73, 74
Molucella 226
— laevis 232, 235
Monarda 226
— didyma 235
— fistulosa 235
— punctata 235
Monophyllaea horsfieldii 273, 278:
Moreades 322
Moquiniella rubra 74, 81
Morina kokanica 178, 184
— lehmanniana 178, 184
— longifolia 184
— persica 178, 184
Morinaceae 177—183
Morinda citrifolia 116, 124
Moschosma polystachyum 235-
Mussaenda erythroneura 124
— frondosa 117, 119, 124
— sp. 124
Musschia 307
— aurea 308
— wollastoni 308
Mutisia 327
— candolleana 328
Myoporaceae 288
Myoporum acuminatum 288
— humile 288
— serratum 288
Myosotis 212, 213, 216
Myriactis wightii 328
Myrmecodia echinata 124
— sp. 124
Myrrhis odorata 43
Nauclea orientalis 124
Navarretia squarrosa (=Gilia squarrosa) 209>
Nelsonia 289, 294
— campestris 289, 290, 294
Nemesia 257
— floribunda 258
— melissaefolia 258
— strumosa 258
iNemophila 210, 211
— aurita (=Pholistoma auritum) 210, 211
— insignis 209—211
— maculata 209, 211
.TMepeta 226, 234
— cataria 235
— hindostana 225, 232, 235
— micrantha 235
Nephrophyllidium crista-galli 153
Nerium indicum 132
— oleander 129, 132
Nicandra physaloides 247
Nicodemia diversifolia 248—250
Nicotiana 241, 242, 245, 247
— ditagla 244
— glauca 244
— paniculata 243
— plumbaginifolia 244
— rotundifolia 244
— rustica 241, 244, 245
— tabacum 242, 244, 245, 246
INiedzwedzkia 264
— semiretschenskia 261, 264
JMoltea africana 94, 98
Nothapodytes foetida 45, 46
TMothopanax arboreum 30, 34, 35
TMotochaete hamosa 235
JMouhuysia 47
— arfakensis 47
JMuytsia 78, 81
— floribunda 74, 76, 81
JMyctanthes 154,. 155 '
— arbortristis 155, 158
JMymphoides humboldtianum 145, 146, 153
— peltatum 145, 146, 151, 153
-Nyssa aquatica 14
—' biflora 13, 14
— sylvatica 12—14
.Nyssaceae 12—14
Obolaria virginica 145
Ochanostachys amentacea 62, 63
Ocimum 226, 234
— adscendens 227
— basilicum 232, 235
Octodon setosum 117, 120, 124
Odontadenia speciosa 132
Oedibasis apiculata 41—43
— platycarpa 43
— tamerlani 43
•Oenanthe aquatica 42, 43
Oftia africana 288
Olacaceae 60—63
■Olax 60, 62, 63
— andronensis 62, 63
— imbricata 62, 63
— scandens 62, 63
— stricta 60,, .62, 63
— wiglitiana 60., 62, 63
■Oldenlandia 120, 124
— dichotoma 121
— nudicaulis 119
•Olea europaea 155, 158
Oleaceae 154—158
Oleales 154
■Ombrophytum 91, 93
Omphalodes 213, 216
Onopordon acanthium 321, 328
■Onosma 212, 213, 216
■Operculina turpethum 201
Ophiorrhiza harrisiana 119, 124
— mungos .1,1 a, 121, 124
Opilia 65
— afzelii 66
— amentacea 64, 66
— celtidifolia 66
— tomentella 66
Opiliaceae 64, 65
Oplopanax elatum 30, 35
Oreopanax capitatum 35
— fulvum 34, 35
— mexicanum 35
Origanum 226
— lanceolatum 235
— vulgare 235
Orites 113
— acicularis 113
— diversifolia 113
— lancifolia 113
— milligani 113
— myrtoides 113
— revoluta 113
Orlaya grandiflora 43
Orobanchaceae 268—271
Orobanche 268, 270, 272
— aegyptiaca 270, 272
— alsatica 272
—, bungeana 272
— caesia 272
— cernua 269, 272
— colorata 272
— crenata 269, 272
— cumana 272
— pallidiflora 269, 272
— purpurea 272
— ramosa 269, 272
— uniflora 270, 272
Oroxylum 259, 261—263
— indicum 259—261, 263, 264
Orthocarpus luteus 251, 256, 258
Orthosiphon stamineus. 235
Osmorhiza aristata 41—43
Osteospermum 328
Osyris 66, 68, 69, 71
— alba 71
— arborea 67, 71
— nepalensis 71
— wightiana 71
Othonna carnosa 329
Otostegia 226
Oxyanthus sp. 124
Oxypetalum coeruleum 137
Paederia sp. 124
Pagamea sp. 124
Palimbia rediviva 43
Paliurus 94
— spina christi 94, 95, 98
Panax fruticosum 30, 33—35
— ginseng 30, 31, 33—35
— murrayi 35
— sessiliflorum 35
Paracryphia sp. 49
Paracryphiaceae 49
Parentucellia latifolia 258
Parmentiera 259, 261, 263
— cerifera 260, 262—264
Parthenium 328
— argentatum 328, 329
— hysterophorus 329
— incanum 328, 329
Parthenocissus semicordata 101
Pastinaca sativa 41, 43
Patrinia 171
— intermedia 171, 172, 177
— rupestris 177
Paulownia 259, 261, 264
•№
— fortunei 259, 260, 264
— tomentosa 259, 260, 262, 264
Pavetta sp. 124
Pedaliaceae 264 . "
Pedalium murex 265
Podicularis 257, 258
— kaul'manni 252, 256, 258
— sylvatica 251, 256
Penstemon humilis 257
— secundiflorum 256, 258
Pentaphiagma horsfieidii 305, 307, 312, 313
Pentas carnea 124
— rubra 124
— sp. 124
Pentatropis 132
— spiralis 137
Peraxilla 81
— tetrapetala 76, 81
Pergularia 132
— daemia 137
— pallida 137
Perilla 226
— arguta 235
— frutescens 235
Periploca 135
— graeca 137
Peristrophe 294
— bicalyculata 293, 294
Perovskia 226
— atriplicifolia 235
Persoonia
Petasites frigidus 329
Petrea volubilis (=Petrea subserrata, P. ar-
borea) 219, 222, 225
Petroselinum 43
— crispum 41, 43
Petunia 246, 250, 251
— hybrida 244, 245, 247
— nyctaginiflora 246, 252
Peucedanum 43
— alsaticum 36, 42
— baicalense 35
— cervarii folium 36, 42
— officinale 35, 36
Phacelia 210
— congesta 209—211
— malvaefolia 210—211
— parryi 210—211
— tanacetifolia 209—211
— viscida 210, 211
— whitlavia 209, 211
Phacellanthus 270
— tubiflorus 270, 272
Phaedranthus 263
— sp. 264
Phellinaceae 49
Phelline comosa 49
Phlebophyllum 294
— kunthianum 294
Phlojodicarpus sibiricus 35, 36, 43
Phlomis 226, 234, 235
Phlox 209
— bifida 209
— drummondii 207, 209
— paniculata 206, 209
Pholisma arenarium 218
Pholistoma 209—211
— auritum (=Nemophila aurita) 211
— membranaceum 209, 211
— racemosum 211
Phoradendron 82, 83, 86
— californicum 86
— flavescens 82, 86
— villosum 82, 86
Phrygilanthus aphyllus
Phryma 219, 222, 225
— latil'olia 225
— leptostachya 219, 224, 225
— serratifolia 225
Phthirusa 81
— adunca 81
— pyrifolia 81
Phuopsis stylosa 117, 124
Phyllis nobla 120, 124
Phyllostegia 226
Physalis 242
— alkelcengi 247
— ixocarpa 247
— minima 241, 247
— peruviana 241, 247 '
Physocaulis nodosus 41Д43
Physochlaina orientalis (=Hyoscyamus
entalis) 247
Physospermum cornubiense 43-
Physostegia 226
— parviflora 227
■ — virginiana 232, 235
Phyteuma limonifolium 308
Phytocrene dasycarpa 45, 46.
— macrophylla 45
Picris 323, 324, 329
,— echioides 324
Pimpinella 42
— adscendens 43
— anisum 42, 43
— diversifolia 43
— saxifraga 35, 41—43
Pinguicula 283, 286, 287
— alpina 287, 288
— leptoceras 287, 288
— vulgaris 283, 284, 286—288
Pithecoctenium clematideum 264.
Pityrodia 222
— bartlingii 219, 225
Placospermum 111, 113
— coriaceum 111, 113
Plantaginaceae 278—280
Plantago 281, 282
— agopus 283
— amplexicaulis ,282, 283
— arenaria 283
— coronopus 282, 283
— hirtella 283
— indica 283
— lagopus 281—283
— lanceolata 279, 281—283
— major 279, 281—283
— maritima 283
— media 278, 279, 281-283
— ovata 281, 283
— psyllium 283
— pumila 282, 283
— salsa 278, 279, 281, 283
— stepposa 281, 283
Platycarpha carlinoides 318, 327, 32S
Platystemma violoides 273, 278
Plectranthus 226
— oertendahlii 235 •
Plumeria bicolor 132
Podolepis arachnoides 326, 329
— jaceoides 327, 329
Pogostemon 226, 234
— patchouli 232, 235
— plectranthoides 235
Polemoniaceae 206, 207
Polemoniales 208
Polemonium 206—209
— caeruleum 206—209-
— flavum 209
— lacteum 209
384
— pauciflorum 208, 209
— pulcherrimum 206, 207, 209
!Polymnia 329
— laevigata 328
iPolypompholyx 283, 286—288
— laciniata 288
— multifida 288
sPolypremum 114
— procumbens 114, 116
Polyscias pinnata 30, 33, 35
Pomaderris 94
— hamiltonii 98
— kumeraho 98
— phylicaefolia var. cricifolia 98
— phylicaefolia var. polifolia 98
Portlandia sp. 124
Prangos pabularia 36, 41—43
Prasium 226, 234
— majus 226, 235
Pratia 306
— angulata 308
— arenaria 308
— elliptica 308
IPremna foetida 225
— integrifolia (=Premna divaricata) 219,
225
— japonica 225
— latifolia 219
— serratifolia 219
Prionopsis ciliata 329
— parthenifolium 329
Priva laevis 225
Proboscidea louisianica 268
— lutea 268
.Prostanthera 226, 234
— lasianthos 235
— sieberi 235
— violacea 235
Protea 113
— lepidocarpon 113
Proteaceae 111
Proteales 111
.Prunella (=Brunella) 233, 234
— vulgaris 227, 235
Psammogeton biternatum 42, 43
-Pseudoeranthemum 290, 294
Pseudorlaya pumila 42, 43
Psittacanthus 76, 81
— cuneifolius 74 81
Psychotria calva 124
— emetica 124
— leucocephala 124
— sp. 124
Pterocephalus 190
— afghanicus 185, 192
— broussonetii 192
— plumosus 192
Pterotheca falconeri 329
Ptychopetalum olacoides 62, 63
— petiolatum 62, 63
Pulmonaria 211, 213
— mollissima 212, 216
— obscura 212, 216
Putoria calabrica 120, 124
Putterlickia pyracantha 54
Pyrethrum 320
— carneum 329
— parthenifolium 322, 329
— parthenifolium var. aureum 322
— roseum 329
Pyrostegia 259, 260
— ignea 259, 261, 264
— venusta 264
Pyrularia 71
Quinchamalium 68—71
— chilense 66, 67, 71
Ramona 226
Ramondia nathaliae 275, 278
— serbica 275, 278
Randia malabarica 121, 124
— sp. 124
Ratibida columnifera 323, 329
— tagetes 323, 329
Rauwolfia 128
— canescens 128, 132
— serpentina 129, 131, 132
— tetraphylla 128, 130—132
Rehmannia angulata 258
Retzia capensis 251
Retziaceae 251
Rhamnales 94
Rhamnaceae 94—98
Rhamnus 94, 95
— alaternus 94, 95, 98
— cathartica 98
— frangula 98
— wightii 95, 98
Rhamphicarpa longiflora 258
Rhaphiostylis ferruginea 45
Rhazya orientalis 129, 132
Rhigozym dichotomum 260, 264
Rhinanthus 251, 254, 257
— hirsutus 256, 258
— major 258
— minor 252, 256, 258 .
— serotinus 258
Rhopalocnemis 91, 92
— phalloides 89—91, 93
Rhopalopilia 65
— umbellulata 66
Rhynchocorys 257
— orientalis 251, 258
Rhynchoglossum obliguum 278
Rhytidophyllum crenulatum 273, 278
Richardia scabra 119, 121, 124
Richardsonia pilosa (=R. brasiliensis) 124
— sp. 124
Roettlera (=Didymocarpus) 273, 275,
278
Romanzoffia 211
— sitchensis 210, 211
Rondeletia 124
— odorata 119
Rosmarinus 226
Rostinicula 226
Rubia cordifolia 124
— olivierii 119, 124
— tinctorum 124
Rubiaceae 116—123
Rudbeckia 318, 319, 322, 323, 326—
329
— amplexicaulis 322
— bicolor 323
— fulgida 323
— hirta 322, 328
— laciniata 319, 322, 327, 328
— missouriensis 323
— pinnata 323
— sullivanti 328
— triloba 328
Ruellia 293, 294
— humilis 294
— tuberosa 289, 294
Rumia crithmifolia 43
Ruspolia 293, 294
— hypocrateriformis 294
— seticalyx 294
ЗНГ)
Saintpaulia ionantha 273, 274, 278
Salpiglossis picta 245, 247
— sinuata 241, 240, 247
— variabiliH 247
Salvadoru porsica 58
Salvudoi'ucoao 57
Salviu 225, 226, 233, 235
— groggii 226
— loucantha 226
— mollilora 225
— officinalis 232
~- sclaroa 232
— splendens 226
— tesquicola 235
Sambucus 159, 165—168
— coreana 159, 168
— ebulus 159, 168
— nigra 159, 160, 168
— pubens 159
— racemosa 159, 168
— sieboldiana 159
— tigranii 159
Sanicula europaea 41—43
Santalaceae 66—70
Santalales 60, 92
Santalum 68—71
— acuminatum 71
— album 66—68, 71
— freycinetianum 71
— obtusifolium 71
— pyrularium 71
— yasi 71
Sanvitalia procumbens 323, 329
Saracha jaltomata 247
Sarcophyte sanguinea 91 —93
Sarcostemma brevistigma 135, 137
Satureja 226
— acinos 235
— hortensis 235
— vulgaris 235
Saussurea amara 329
Scabiosa 190, 192
— africana 192
— bipinnata 185, 192
— calcarea 185
— caucasica 192
— columbaria 192
— hladnikiana 192
— holosericea 192
— imeretica 192
— lucida 192
— ochroleuca 192
— olgae 192
— olivieri 185, 192
— prolifera 192
— purpurea 192
— rhodantha 185, 192
— rotata 185, 192
— sicula 192
— songarica 185, 192
— sosnowskyi 192
Scaevola attenuata 315
— frutescens 313—315
— koenigii 315
— lobelia 313, 315
— microcarpa 315
— procera 313, 315
Scandix iberica 42, 43
— pecten-veneris 41—43
Schizanthus 246
— pinnatus 245—247
— wise tone nsis 247
Schoepfia brasiliensis 62, 63
— fragrans 62, 63
Schrenkia involucrata 43
Scleropyrum 71
Scoparia dulcis 258
Scopolia atropoides 245
— carniolica (=Scopolia atropoides) 245—
247
— lurida 247
Scorzonera tau-saghys 329
Scrophularia 251, 256, 257
— arguta 258
— himalensis 256, 258
— marylandica 258
Scrophulariaceae 251—255
Scrophulariales 241
Scurrula 74, 76, 81
— atropurpurea 74, 78, 81
— pulverulenta 74, 81
Scutellaria 226, 232, 234, 235
— galericulata 227
Scutia myrtina 94, 95, 98
Scyphiphora hydrophyllacea 119, 124
Secamone 132, 135
— frutescens 137
Selinum carvifolia 43
Selliera radicans 315
Senecio 327, 329
— vulgaris 327
Sericocalyx scaber 294
Serissa foetida 124
Serratula 326
— cornata 329
— radiata 329
Sesamum indicum 265, 266
— laciniatum 266
— orientale 266
— prostratum 266
Seseli 43
— gracile 41
— gummiferum 42
— rigidum 35, 41, 42
Shepherdia 105, 110
— canadensis 105, 106, 110>
Sherardia arvensis 124
Sideritis 226, 234
— hirsuta 235
— hyssopifolia 235
— montana 235
— scordioides 235
Siegesbeckia orientalis 329-
Siella erecta 43
Silaum silaus 43
Silphium 327, 329
Siphocampylus manettiaeflorus 308"
Siphonodontaceae 56
Sium cicutaefolium 43
— sisaroideum 43
Solanaceae 241, 243, 244, 246
Solanum 242, 245—247
— aviculare 243
— chacoense 241
— demissum (=Solanum tuberosum) 245-
— melongena 246
— muricatum 244
— nigrum 241—247
— phureja 241, 242, 244—246
— torvum 243
— tuberosum 241, 244
Solenanthus 212, 216 .
Soli dago 329
— serotina 321
Sonchus arvensis 329
— asper 318, 319
— oleraceus 318, 319
Sopubia delphinifolia 257, 258
— trifida 256—258'
Soyauxia floribunda 49
386
Specularia 307
— castellana 308
— falcata 308
— pentagonia 308
— speculum 302, 308
;Spermacoce hispida 116
— longifolia 124
— tenuior 117
— sp. 124
.Sphenoclea 306
— zeylanica'302, 306—308
.Sphenostemon 47
— pachycladum 47
— papuanum 47
;Sphenostemonaceae 47
.Spigelia splendens 114, 116
„Spilanthes acmella 329
Stachys 225, 226, 234, 235
— trinervis 225—227-
.Stachytarpheta dichotoma 219, 224,
— indica 219, 224, 225
:Stackhousia brunonis 56
— linariifolia 54, 55
— monogyna 56
— pubescens 56
— viminea 56
:Stackhousiaceae 54
.Stapelia 135
— asterias 137
— munbyana 137
— planiflora 137
— semota 137
— variegata 137
:Stemodia viscosa 258
-Stemonurus secundiflorus 45
-Stenocarpus sinuatus 113
Stephegyne parviflora 124
.Stirlingia 113
.Streptocarpus caulescens 273, 278
— nobilis 278
— rexii 273-275
— -wendlandii 278
:Striga 251, 256—258
— euphrasioides 258
— gesnerioides (=S. orobanchoides) 256,
— hermonthica 258
— lutea 258
.Strombosia 60, 63
— ceylanica 60, 62, 63
— javanica 62, 63
.Struthanthus 81
— flexicaulis 81
— vulgaris 74, 78, 81
Strychnos laurina 114, 116
— sansibariensis 114, 116
.Stylidiaceae 308—311
.Stylidium 308, 310
— adnatum 310, 311
— caespitosum 310, 311
•— graminifolium 308—311
— lineare 311
— squamellosum 310, 311
— tenellum 308—311
Succisa 190
— pratensis 185, 190, 192
Succisella inflexa 192
.Sutera antirrhinoides 258
— foetida 258
■Swertia carolinensis 144, 145
— corymbosa 145
— lawii 145
— longifolia 142, 145
— minor 140, 141, 145
— perennis 145
' .Symphoricarpos 159, 167, 168
— occidentalis 168
— racemosus 168
Symphyandra hofmanni 306, 308
— portenschlagiana 308
Symphytum 213
— officina le 216
Synaphea 113
— acutiloba 113
— favosa 113
— polymorphs 113
— reticulata 113
Synedrella nodiflora 334
Syneilesis palmata 334
Syringa 154, 155
— amurensis 155, 158
— chinensis 154—156, 158
— josikaea 154, 155, 158
— persica 158
— reflexa 154, 158
— villosa 154, 155, 158
— vulgaris 154—156, 158
Tagetes patula 318, 329
— signata 329
Tanacetum 321
— vulgare 322, 329
Tapinostemma acaciae 81
Taraxacum 318, 319, 326, 328, 329
— kok-sagyz 328
— officinale 319, 327, 328
— palustre 328
Tarenna asiatica 116, 121, 124
Tecoma 259—261, 263
— sambucifolia 264
— stans 259
Tectona 219
— grandis 219, 222, 224, 225
Tetranema mexicanum 258
Tetrastigma lancedarium 101
Tetrastylidium janeirense 62, 63
Teucrium 226, 233, 235
Theligoniaceae 124, 126, 127
Theligonum cynocrambe 125, 127, 128
Thesium 66, 68, 69, 71
— alpinum 71
— arvense 66, 67, 71
— divaricatum 71
— humifusum 67, 71
— intermedium 69, 71
— linophyllum 71
— montanum 69, 71
— rostratum 71
— wightianum 71
Thevetia nereifolia 132
Thonningia 92, 93
Thunbergia alata 289, 290, 294
Thuspeinantha 226
Thymus 225, 226, 235
Tieghemopanax sambucifolius 30, 31, 35
Tienmuia 268
— triandra 272
Tinnea 226
Tithonia 328
— rotundifolia 329
Tolypanthus 78
— involucratus 81
— lageniferus 81
Tordylium 43
— maximum 42, 43
Torenia cordifolia 258
— fournieri 256, 258
— hirsuta 258
— violacea 251, 256, 258
Torilis japonica 43
.487
— nodosa 42, 43
Torricelliacoao 28
Tournel'ortia 211, 216
Tozzia 257
— alpinn 254, 256, 258
Tracholium caoruleum 308
Tracholospormum fragrans 132
Trachyspermum ammi 35, 36, 41—43
Tragopogon orientalis 329
Trapeila sinensis 266
Tricalysia reticulata 116, 117, 124
Trichodesma 211—213
— indicum 211, 216
— zeylanicum 211, 212, 216
Trichostema 226
Tridax procumbens 318, 329
— trilobata 322, 323, 329
Trinia multicaulis 42, 43
Triosteum 159
Tripleurospermum maritimum 322, 329
Tripteris vaillantii 329
Tripterygium -wilfordii 50, 54
Tupeia antarctica 76, 82
Turgenia latifolia 41, 43
Tussilago farfara 321, 327, 329
Tylophora 132, 135
— asthmatica 137
— cordifolia 136, 137
— indica 137
Urospermum picroides 329
Ursinia 324, 327
— anthemoides 329
Utricularia 283, 286—288
— arcuata 283, 288
— bifida 287, 288
— coerulea 283, 284, 288
— coerulea var. filicaulis 284, 287, 288
— colorata 288
— elephas 288
— emarginata 288
— exoleta 288
— flexuosa 283,286—288
— globulariaefolia 288
— graminifolia 288
— inflexa 288
— laterifolia 288
— leptoceras 284, 288
— nelumbifolia 288
— oligosperma 288
— punctata 283
— purpurea 288
— reniformis 288
— reticulata 283, 288
— scandens- 283, 284, 288
— spicata 288
— stellaris 288
— stellaris var. inflexa 287, 288
— striatula 283, 287, 288
— stricticaulis 288
— uliginosa 286—288
— vulgaris 288
— vulgaris var. americana 288
— wallichiana 288
Vaillantia hispida 124
Valeriana 171, 173, 174, 176
— alliariefolia 177
— collina 177
— dioica 177
— fauriei 177
— montana 173, 177
— nitida 177
— officinalis 171, 173, 174, 176, 177/ ■)
— phu 171-173, 177
— sambucifolia 177
— supina 177
— wolgensis 177
Valerianaceae 171—175, 177
Valerianella 171
— coronata 177
— eriocarpa 177
— olitoria 177
— pumila 177
— rimosa 177
— sp. 172, 177
Vallaris heynii 132
Vandellia (=Lindernia) angustifolia 256, 258-
— Crustacea 251, 256, 258
— hirsuta 258
■— scabra 258
Velleja paradoxa 315
Ventilago bombaiensis 98
— calyculata 98
Verbascum. 251, 256, 257
— blattaria 258
— phoeniceum 258
— thapsus 251, 252, 259, 263
Verbena 219, 225
— angustifolia 219, 225
— hispida 224, 225
— officinalis 219, 220, 224, 225
Verbenaceae 219, 221—224
Vernonia chinensis 329
— cinerascens 318, 327, 329
— cinerea 318, 329
Veronica 251, 256—258
— agrestis 256
Viburnum 159, 166, 168
— acerifolium 167, 168
— dentatum 160, 168
— foetens 168
— Ian tana 167, 168
— lentago 168
— mongolicum 168
— opulus 160, 168
— tinus 168
Vicoa auriculata 327, 329
Villaresia mucronata 45
— paniculata 45
Villarsia reniformis 146, 153
Vinca 128
— herbacea 128, 132
— major 128—132
— minor 128—132
Vincetoxicum 132, 136
— medium 137
— nigrum 137
— officinale 132, 133, 135—137
Viscaceae 82—86
Viscum 82, 85, 86
— album 82, 83, 85, 86
— articulatum 83, 86
Visnaga daucoides 43
Vitaceae 98, 100
Vitex 219
— agnus-castus 225
— negundo 219, 224, 225
Vitis amurerisis 101
— himalayana 98, 101
— latifolia 98, 99
— pallida 99, 101
— pedata 99, 101
— rotundifolia 101
— silvestris 101
— trifolia (=Cissus trifolia, =Cayratia
trifolia) 98, 99, 101
— vinifera 100, 101
388
Vittadinia triloba 329
Voacanga footida 128, 129/131, 132
— grandifolia 132
Volutarella divaricata 329
— ramosa 327, 329
Voyria 137, 141, 145
— coerulea 144, 145
— mexicana 145
— obconica 145
— tenella 145
— trinitatis 145
— uniflora 145
Voyriella 144
— parviflora 144, 145
Wahlenbergia 306
— bicolor 300, 302/ 307, 308
— gracilis 300, 302, 307, 308
— hederacea 308
— lobelioides 308
— marginata 308
— pendula 308
— tasmania 308
— vincifolia 308
Warburgina factorovskyi 124
Wedelia 318
— calendulacea 329
Weigela 159, 165
Westringia 226, 234
— rosmariniformis 235
Withania somnifera 241, 244, 247
— sp. 247
Xanthisma texanum 329
Xanthium spinosum 329 $
— strumarium 329 щ. p
Xeranthemum annuum 329
— cylindraceum 329
— sqarrosum 329
Ximenia americana 60, 62, 63
Xylanche 270, 272
— bimalaica 270, 272
Zaggera pterodonthaX318, 329
Zaluzianskya 257
Zinnia elegans 318, 329
— grandiflora 329
Ziziphora 225, 226
— biebersteiniana 235
— capitata 235
— tenuior 235
Zizyphus 94, 95, 98
— cenoplia 94, 95, 98
— glabrata 94, 95, 98
— jujuba 94, 95, 98
— mauritiana 94, 98
— nummularia 94, 96/>98<
— rotundifolia 94, 95,_9&
— sativa 94, 98
СОДЕРЖАНИЕ
Стр.
Предисловие 5
{Порядок 54. Cornales 7
Семейство Davidiaceae (С. В. Шевченко, О. П. Камелина) 7
Семейство Nyssaceae (С. Н. Коробова) 12
Семейство Alangiaceae (Г. К. Алимова) 15
Семейство Согпасеае (Г. К. Алимова) 18
Семейство Aucubaceae (Г. К. Алимова, Н. А. Жинкина) 21
Семейство Garryaceae (Г. И. Савина) 26
Семейство Melanophyllaceae (С. И. Коробова) 27
Семейство Griseliniaceae (Г. К. Алимова) 27
Семейство Toricelliaceae (С. Н. Коробова) 29
Семейство Helwingiaceae (С. Н. Коробова) 29
Шорядок 55. Araliales 30
Семейство Araliaceae (Г. М. Анисимова) 30
Семейство Apiaceae (Н. А. Гревцова) 35
Порядок 56. Celastrales 45
Семейство Icacinaceae (Т. Б. Соколовская) 45
Семейство Sphenostemonaceae (М. П. Солнцева) 47
Семейство Aquifoliaceae (Т. И. Наумова) 47
Семейство Phellinaceae (M. П. Солнцева) 49
Семейство Paracrypbiaceae (Т. Е. Фрейберг) 49
Семейство Cardiopterygaceae (Т.Е. Фрейберг) 49
Семейство Medusandraceae (Т. Н. Наумова) 49
Семейство Celastraceae (Т. Н. Наумова) 49
Семейство Stackhousiaceae (Г. И. Савина) 54
Семейство Siphonodontaceae (Г. К. Алимова) 56
Семейство Goupiaceae (И. И. Щамров) 56
Семейство Geissolomataceae (Й. И. Шамров) 56
Семейство Salvadoraceae (Г. И. Савина) 57
Семейство Corynocarpaceae (Т. Н. Наумова) . . 58
Семейство Lophopyxidaceae (Г. М. Анисимова) . 59
Порядок 57. Santalales 60
Семейство Olacaceae (Г. М. Анисимова) 60
Семейство Opiliaceae (Г. М Анисимова) 64
Семейство Santalaceae (Э. С. Терёхин, Г. М. Анисимова) 66
Семейство Misodendraceae (3. И. Никитичева) 73
Семейство Loranthaceae (3. И. Никитичева, Г. М. Анисимова) ... 74
Семейство Viscaceae (Э. С. Терёхин) 82
Порядок 58. Balanophorales 87
Семейство Cynomoriaceae (Э. С. Терёхин) 87
Семейство Balanophoraceae (Э. С. Терёхин) 89
Порядок 59. Rhamnales 94
Семейство Rhamnaceae (Т. Б. Батыгина, Г. Е. Колесова, Е. В. Драгу-
нова) 94
Семейство Vitaceae (А. И. Литвак, Г. К. Алимова, Л. М. Якимов) 98
Семейство Leeaceae (Т. Б. Батыгина) 101
Порядок 60. Elaeagnales 105
Семейство Elaeagnaceae (О. П. Камелина, О. Б. Проскурина) . . . 105
Порядок 61. Proteales Ill
Семейство Proteaceae (Г. И. Савина) 111
390
Стр.
Порядок 62. Gentianales Ш
Семейство Loganiaceae (Т. Б. Соколовская) 114
Семейство Rubiaceae {Е. Н. Андронова) . . . 116
Семейство Theligonaceae (M. П. Солнцева) 124
Семейство Аросупасеае (С. В. Шевченко) 128
Семейство Asclepiadaceae (Т. Н. Наумова) 132
Семейство Gentianaceae (И. И. Шамров) 137
Семейство Menyanthaceae (Т. Б. Батыгина, Г. Е. Колесова) .... 145
Семейство Dialypetalanthaceae {И. И. Шамров) 153
Порядок 63. Oleales 154
Семейство Oleaceae (Я. М. Литвиненко) 154
Порядок 64. Dipsacales 159
Семейство Caprifoliaceae (О. П. Камелина, Н. Г. Тучина М. А.
Вишнякова) 1°9
Семейство Adoxaceae (О. П. Камелина) 168
Семейство Valerianaceae (О. П, Камелина, Г. Я. Жукова) 171
Семейство Morinaceae (О. П. Камелина) 177
Семейство DipsacaGeae (О. П. Камелина) 184
Порядок 65. Loasales 193
Семейство Loasaceae (Т. Б. Соколовская) 193
Порядок 66. Polemoniales 196
Семейство Convolvulaceae (3. И. Никитичева, О. Б. Проскурина) 196
Семейство Cuscutaceae (3. И. Никитичева, Э. С. Терёхин) 201
Семейство Polemoniaceae (Г. Я. Жукова) 206
Семейство Hydrophyllaceae (Г. Я. Жукова) 209
Семейство Boraginaceae (В. А. Верещагина) 211
Семейство Lennoaceae (Э. С. Терёхин) 217
Семейство Hoplestigmataceae (Г. Я. Жукова) 218
Порядок 67. Lamiales 219
Семейство Verbenaceae (Т. Е. Фрейберг) 219
Семейство Lamiaceae (О. П. Камелина, А. К. Дзевалтовский) .... 225
Семейство Callitrichaceae (Т. Б. Батыгина, Г. Е. Колесова) .... 236
Порядок 68. Scrophulariales 241
Семейство Solanaceae (Г. Я. Жукова, В. А. Поддубная-Арнольди) 241
Семейство Duckeodendraceae (Т. Б. Соколовская) 248
Семейство Buddlejaceae [И. И. Шамров) 248
Семейство Retziaceae (Т. Б. Соколовская) 251
Семейство Scrophulariaceae (3. И. Никитичева) 251
Семейство Bignoniaceae (Т. Е. Фрейберг) 259'
Семейство Pedaliaceae. (Г. И. Савина) 264
Семейство Martyniaceae (Г. И. Савина) 268
Семейство Orobanchaceae (Э. С. Терёхин) 268
Семейство Gesneriaceae (Г. К. Алимова) 273
Семейство Plantaginaceae (Г. Я. Жукова, А. А. Титова) 278
Семейство Lentibulariaceae (3. И. Никитичева) 283
Семейство Муорогасеае (Г. И. Савина) 288
Семейство Acanthaceae (Л. Г. Красников) . . : 289
Семейство Hydrostachyaceae (Т. Б. Соколовская) 294
Семейство Hippuridaceae (3. И. Никитичева) : . . 295
Порядок 69. Campanulales 300
Семейство Campanulaceae (С. Н. Коробова, Н. А. Жинкина) .... 300
Семейство Stylidiaceae (Т. Б. Маметъева) '. . 308
Семейство Donatiaceae (Т. Б. Маметъева) 311
Семейство Goodeniaceae (Т. Б. Маметъева) 313-
Порядок 70. Calycerales 316
Семейство Calyceraceae (О. П. Камелина) 316-
Порядок 72. Asterales 318
Семейство Asteraceae (M. П. Солнцева) 318-
Приложение (В. Е. Васильева) 332
Литература 337
Указатель латинских названий растений 372:
СРАВНИТЕЛЬНАЯ ЭМБРИОЛОГИЯ
ЦВЕТКОВЫХ РАСТЕНИЙ
DAVIDIACEAE—ASTERACEAE
Утверждено к печати
Ботаническим институтом им. В. Л. Комарова
Академии наук СССР
Редактор издательства Л. В. Шоренкова
Технический редактор Б. В. Траскевич
(Корректоры Г. Д. Адейкина, М. В. Едемская и В. В. Крайнева
ИБ № 33039
Сдано в набор 11.06.87. Подписано к печати 23.11.87. М-17334.
Формат 70xl08Vie- Бумага книжно-журнальная. Гарнитура
•обыкновенная. Печать высокая. Усл. печ. л. 36.05. Усл.
«tp.-от. 36.32. Уч.-изд. л. 39.44. Тираж 1000. Тин. зак. № 1642.
Цена 5 р. 90 к.
Ордена Трудового Красного Знамени
издательство «Наука». Ленинградское отделение.
199034, Ленинград, В-34, Менделеевская лин., 1.
Ордена Трудового Красного Знамени
Первая типография издательства «Наука».
199034, Ленинград, В-34, 9 линия, 12.