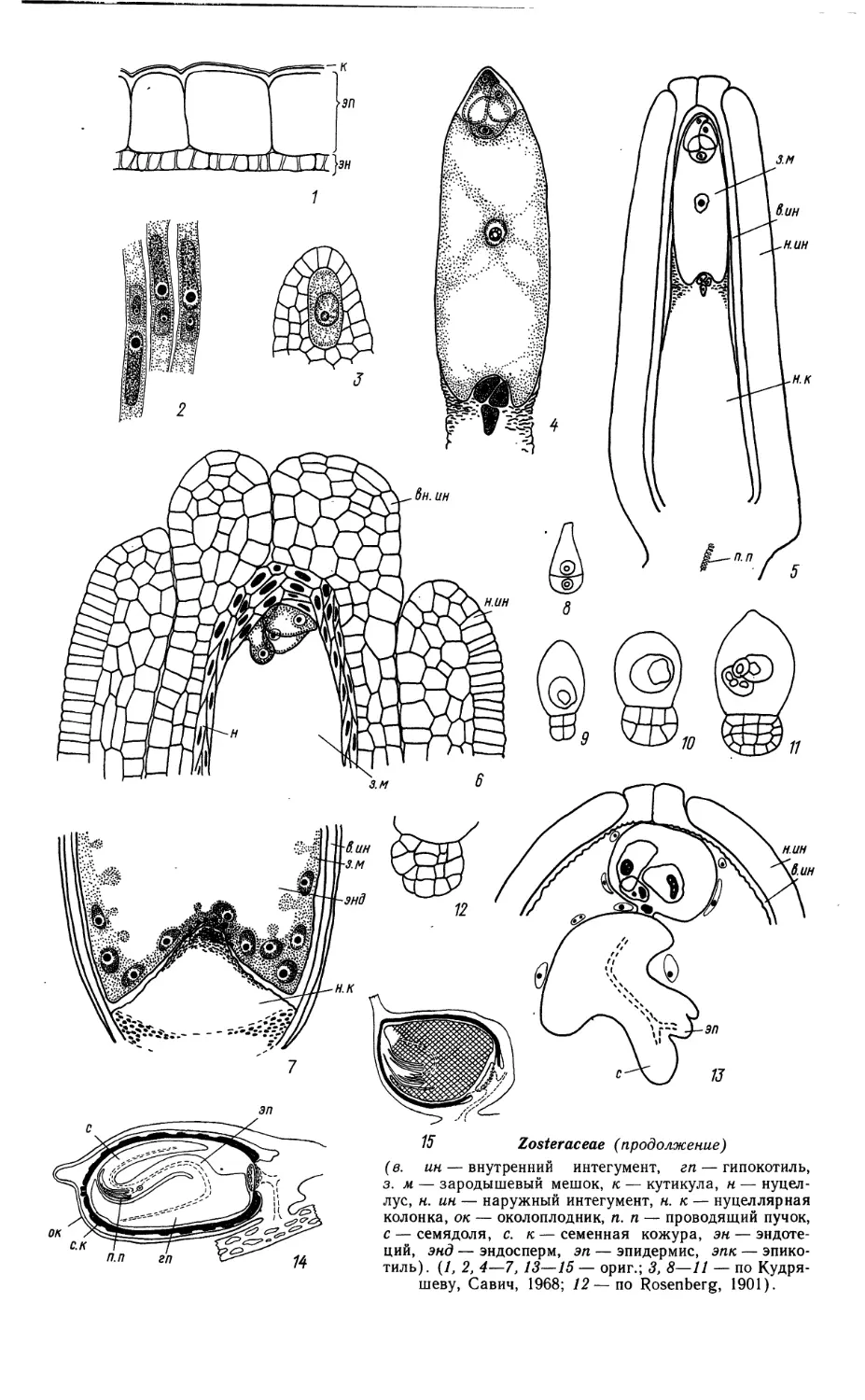
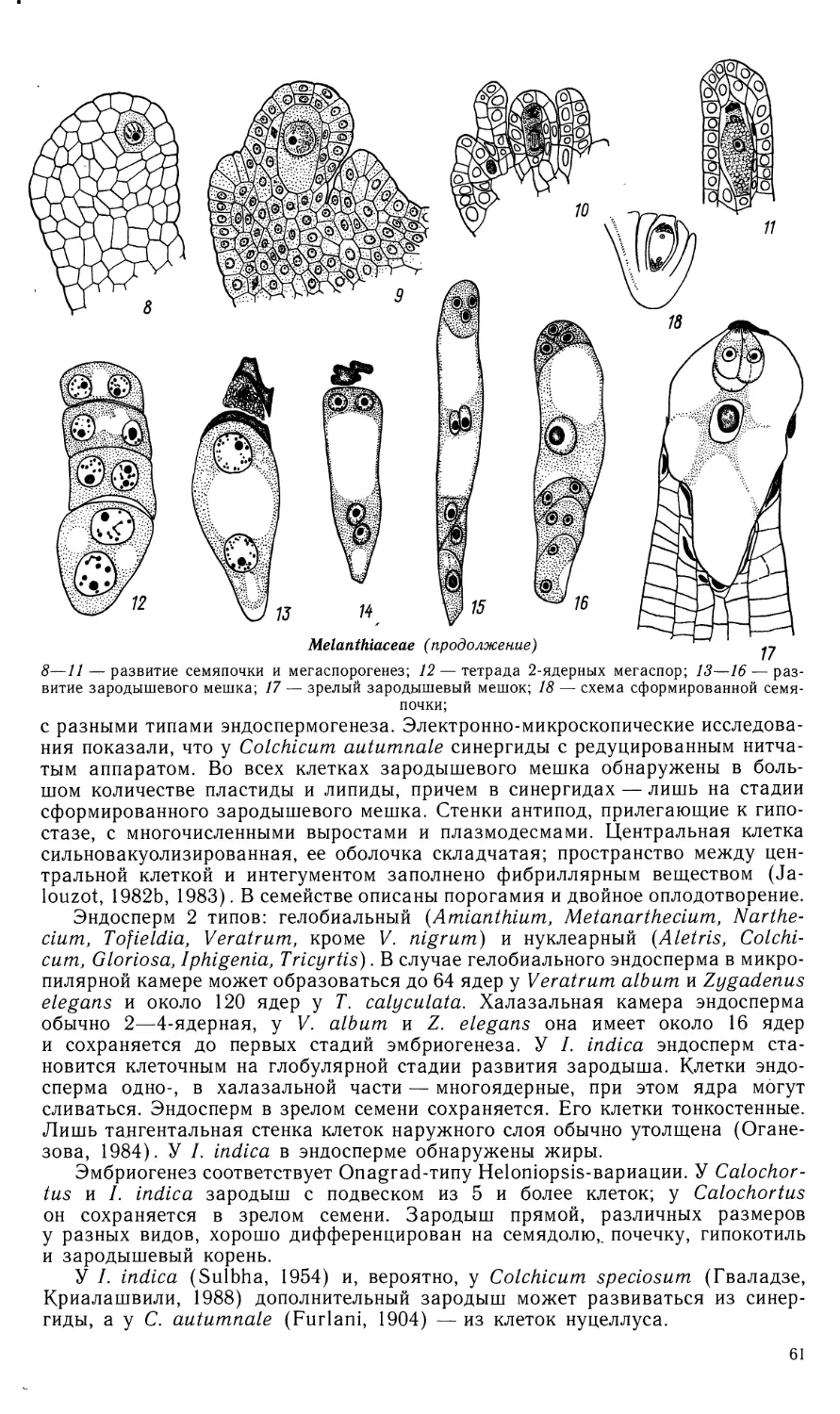
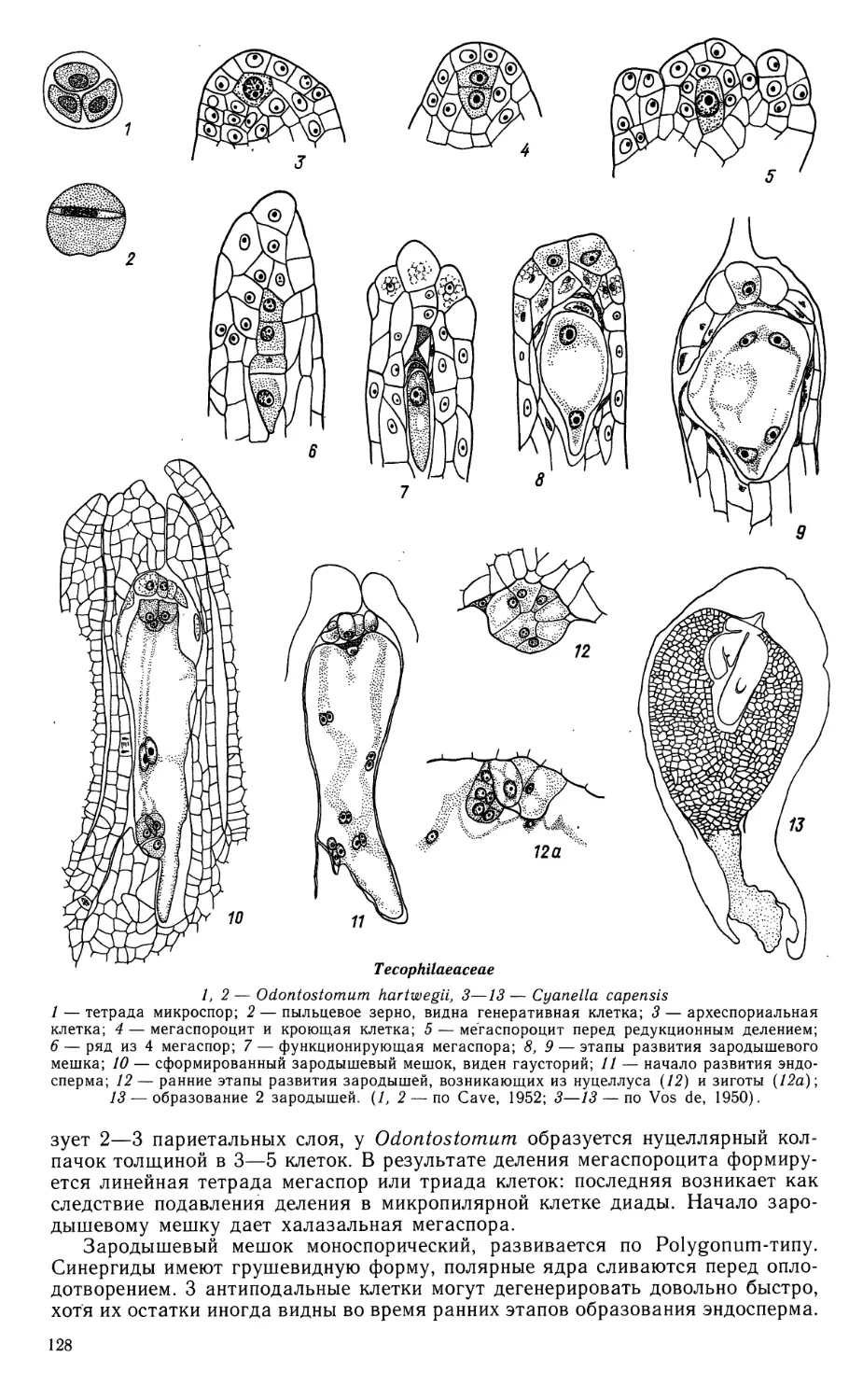
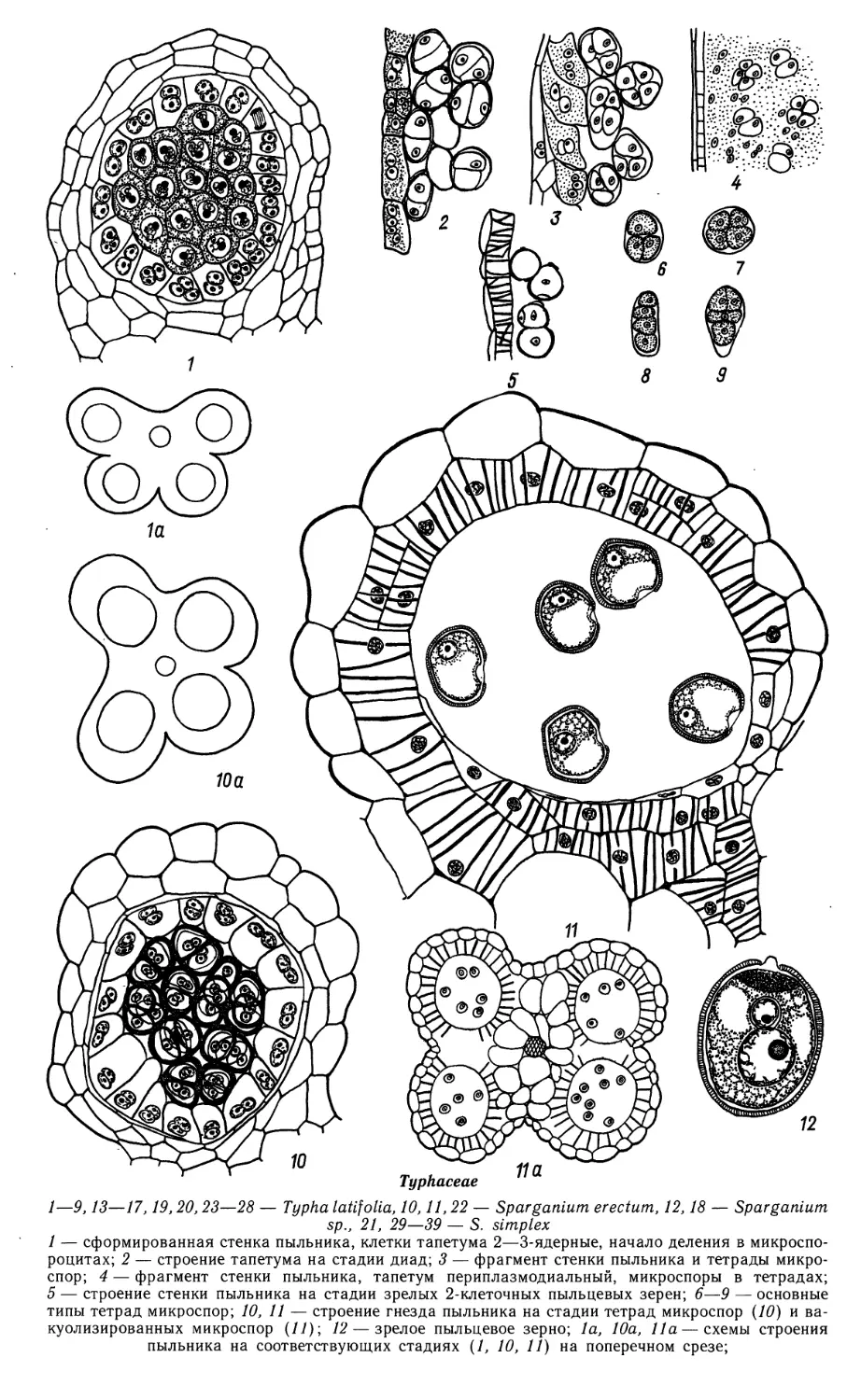
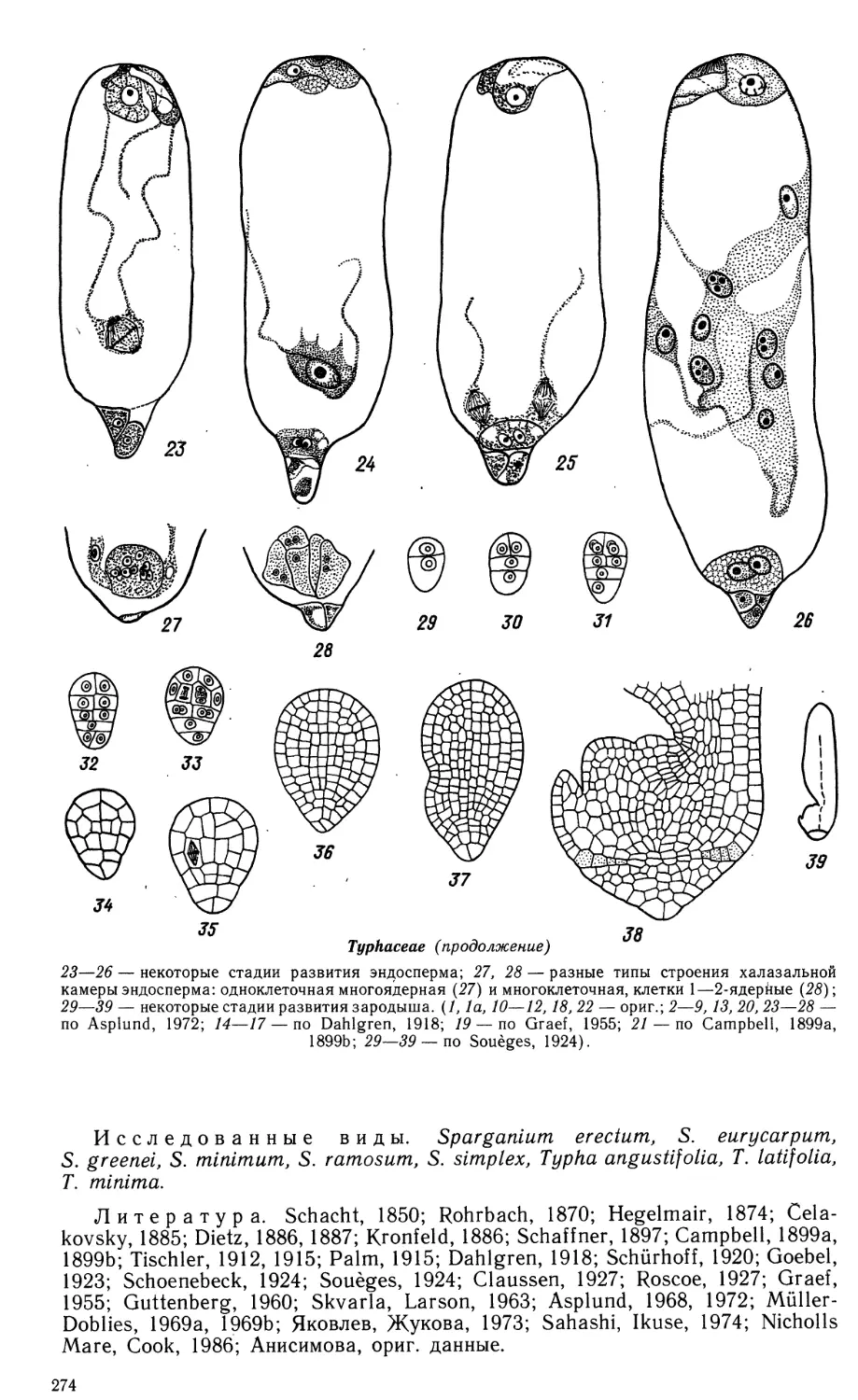
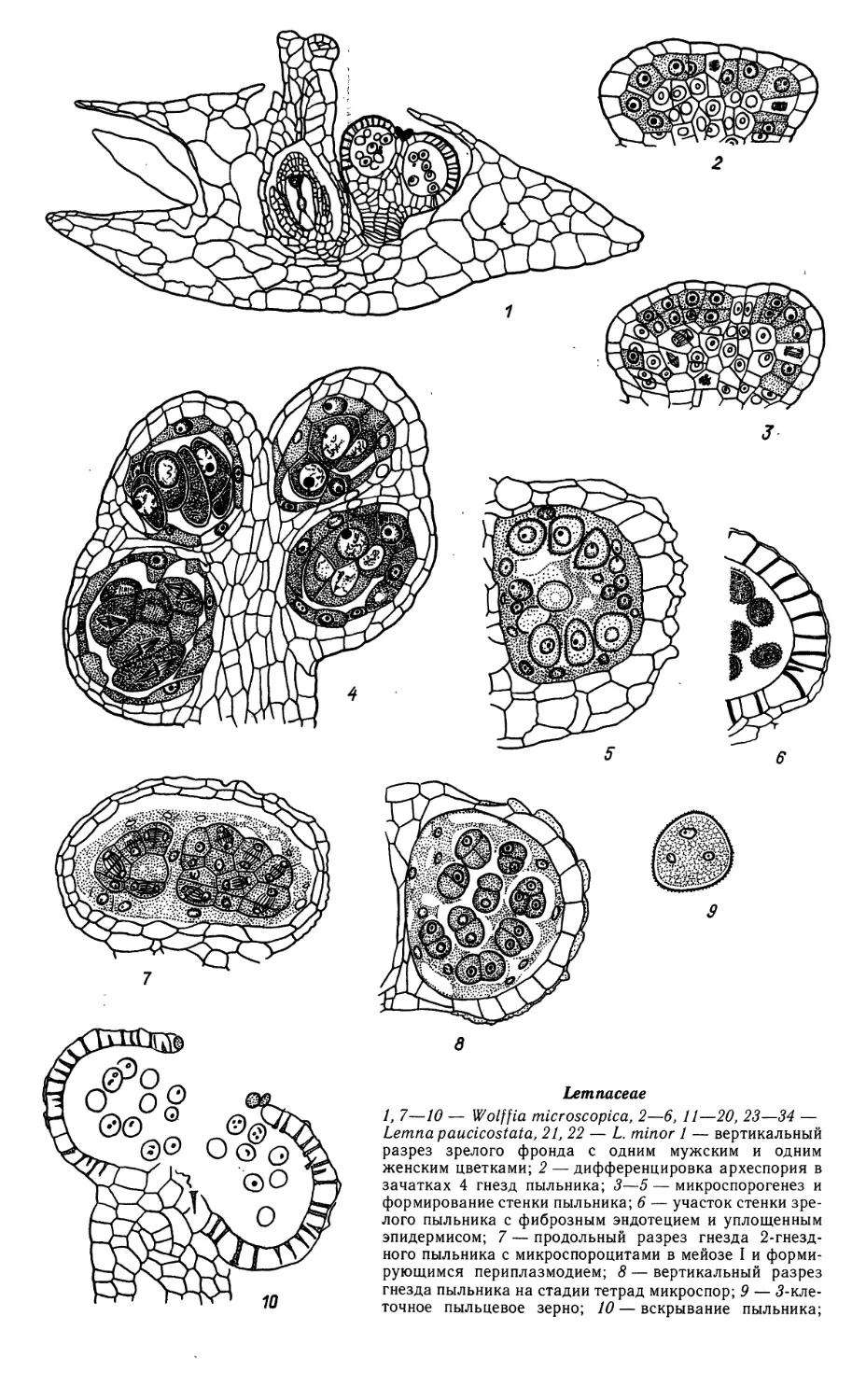
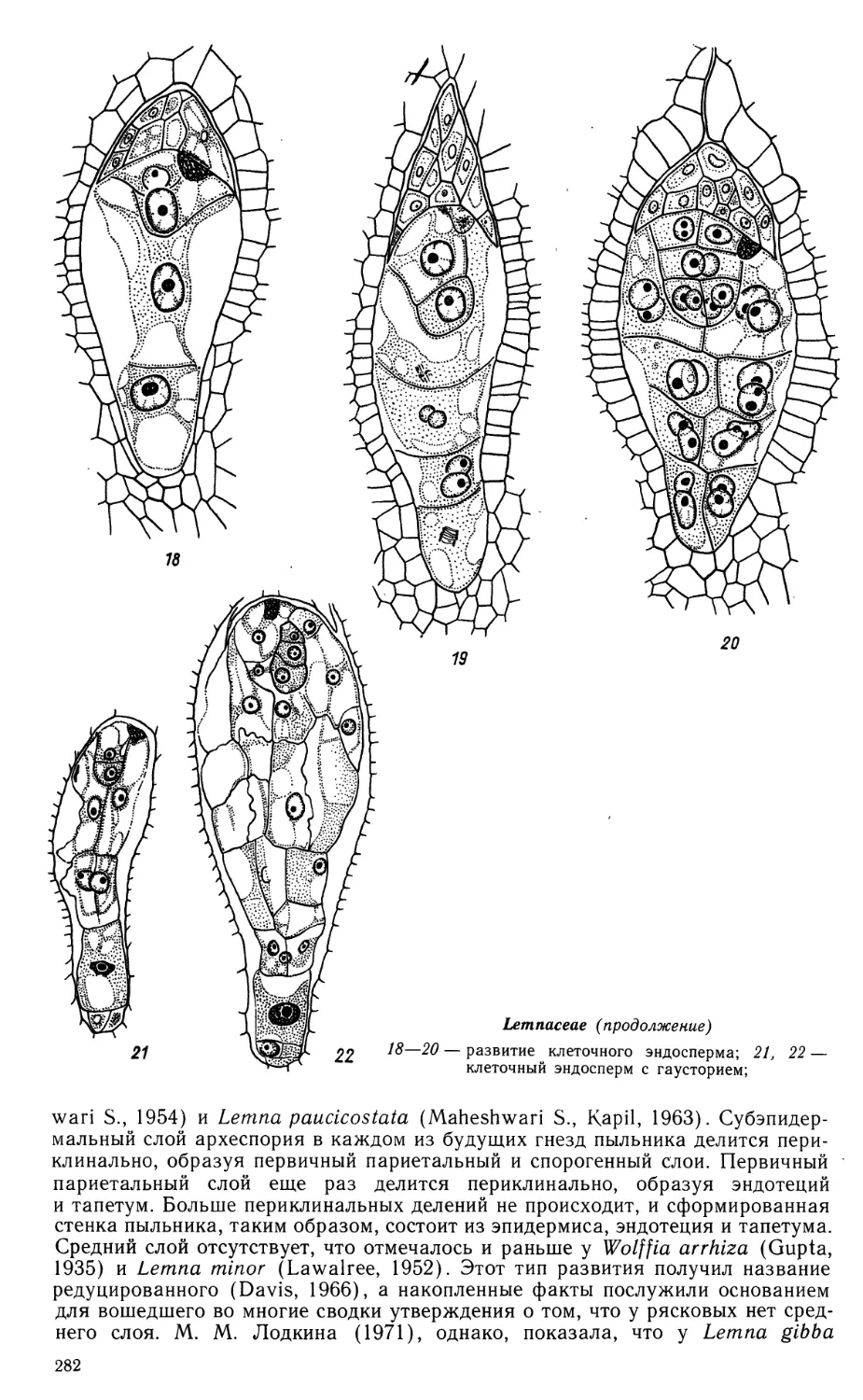
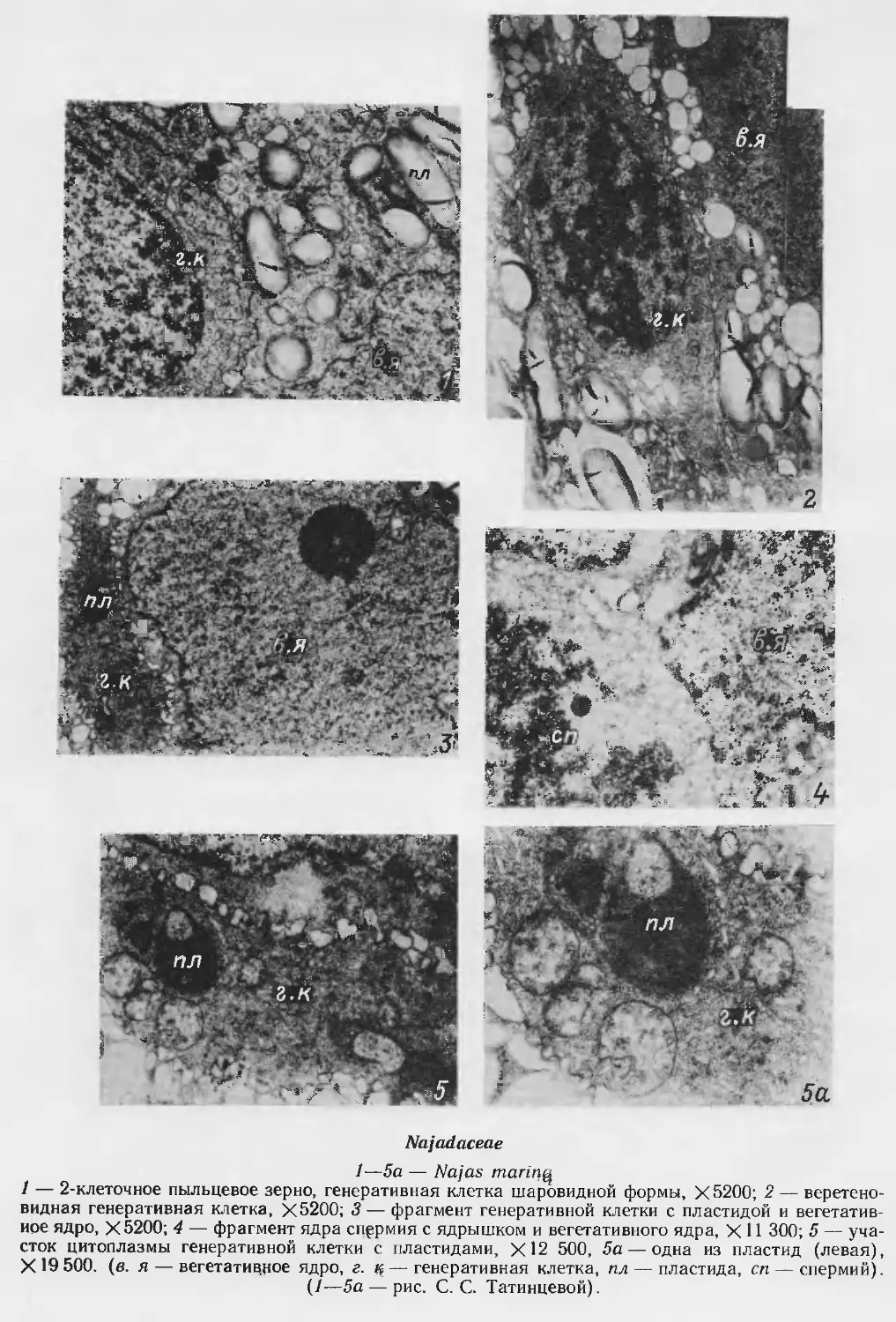
Автор: Яковлев М.С.
Теги: эмбриология растений семенные растения в целом (embryophyta siphonogamа spermatophyta) иллюстрации эмбриологические признаки характеристики
ISBN: 5-02-026635-3
Год: 1990
Текст
АКАДЕМИЯ НАУК СССР
БОТАНИЧЕСКИЙ ИНСТИТУТ ИМ. В. Л. КОМАРОВА
ACADEMY OF SCIENCES OF THE USSR
KOMAROV BOTANICAL INSTITUTE
COMPARATIVE
EMBRYOLOGY
OF FLOWERING
PLANTS
MONOCOTYLEDONES
« *
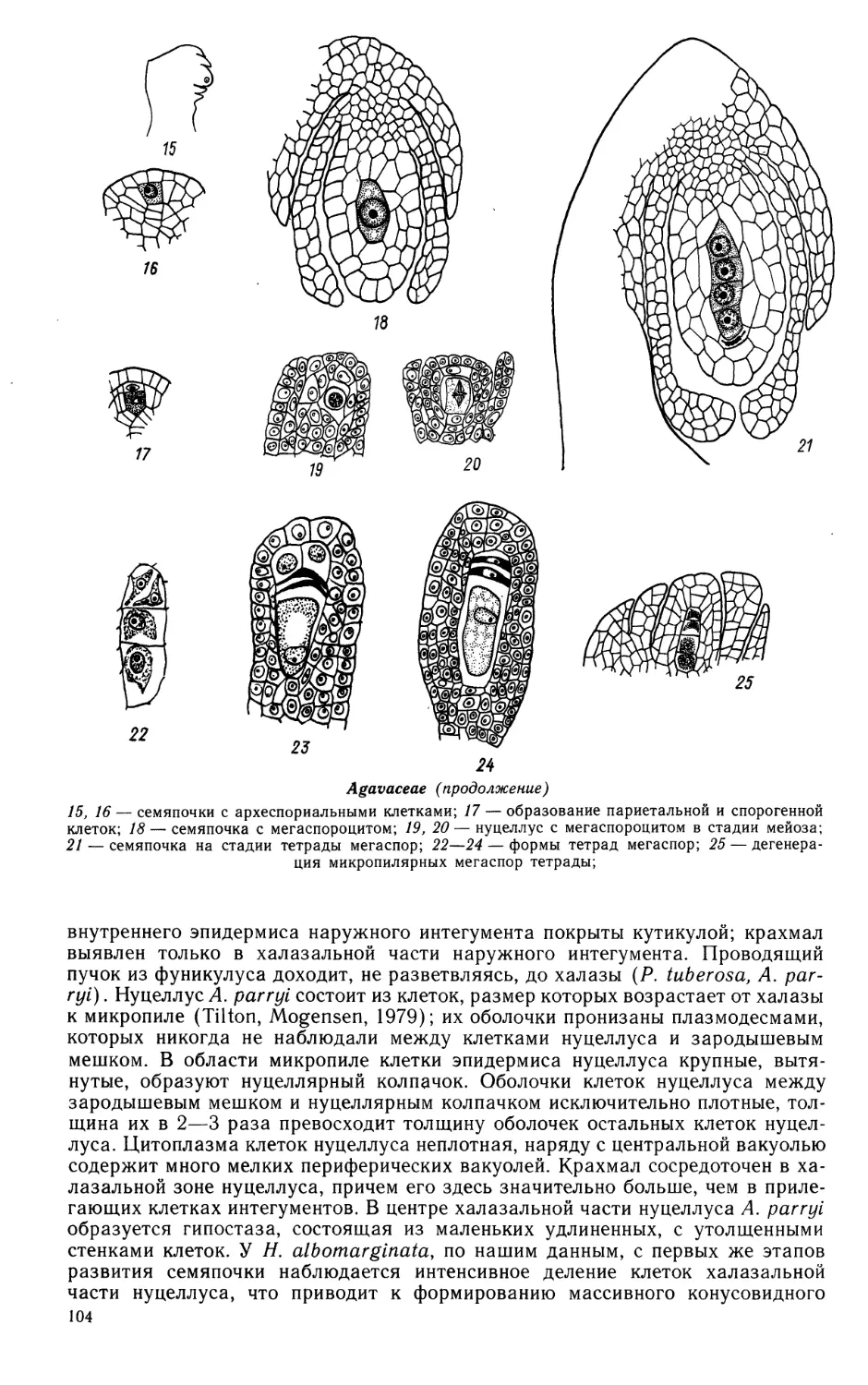
BUTOMACEAE- LEMNACEAE
6
LENINGRAD
«NAUK A»
LENINGRAD BRANCH
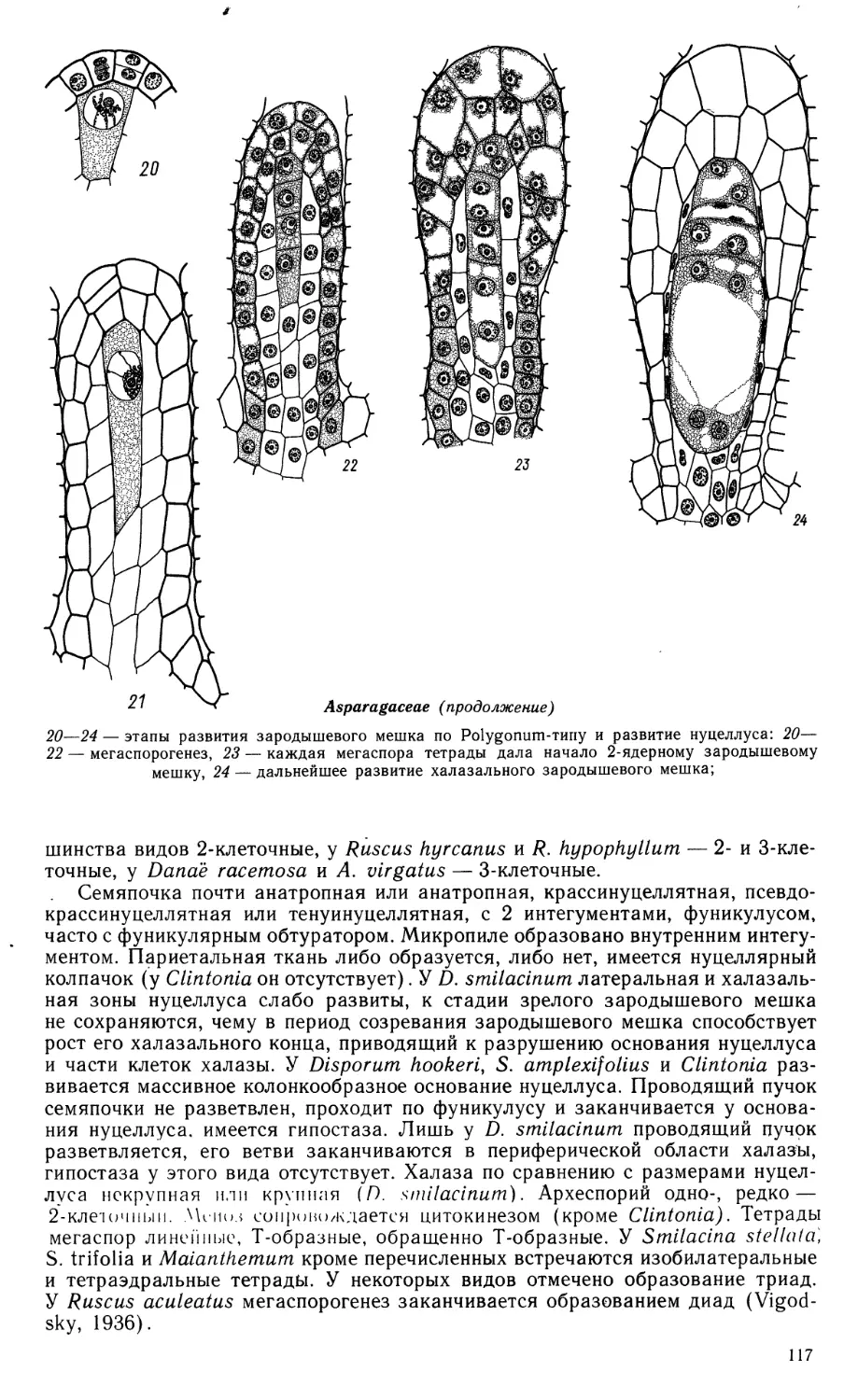
I 990
СРАВНИТЕЛЬНАЯ
ЭМБРИОЛОГИЯ
ЦВЕТКОВЫХ
РАСТЕНИЙ
ОДНОДОЛЬНЫЕ
BUTOMACEAE- LEMNACEAE
е
ЛЕНИНГРАД
«НАУКА»
ЛЕНИНГРАДСКОЕ ОТДЕЛЕНИЕ
1990
УДК 581.3+582.4/9
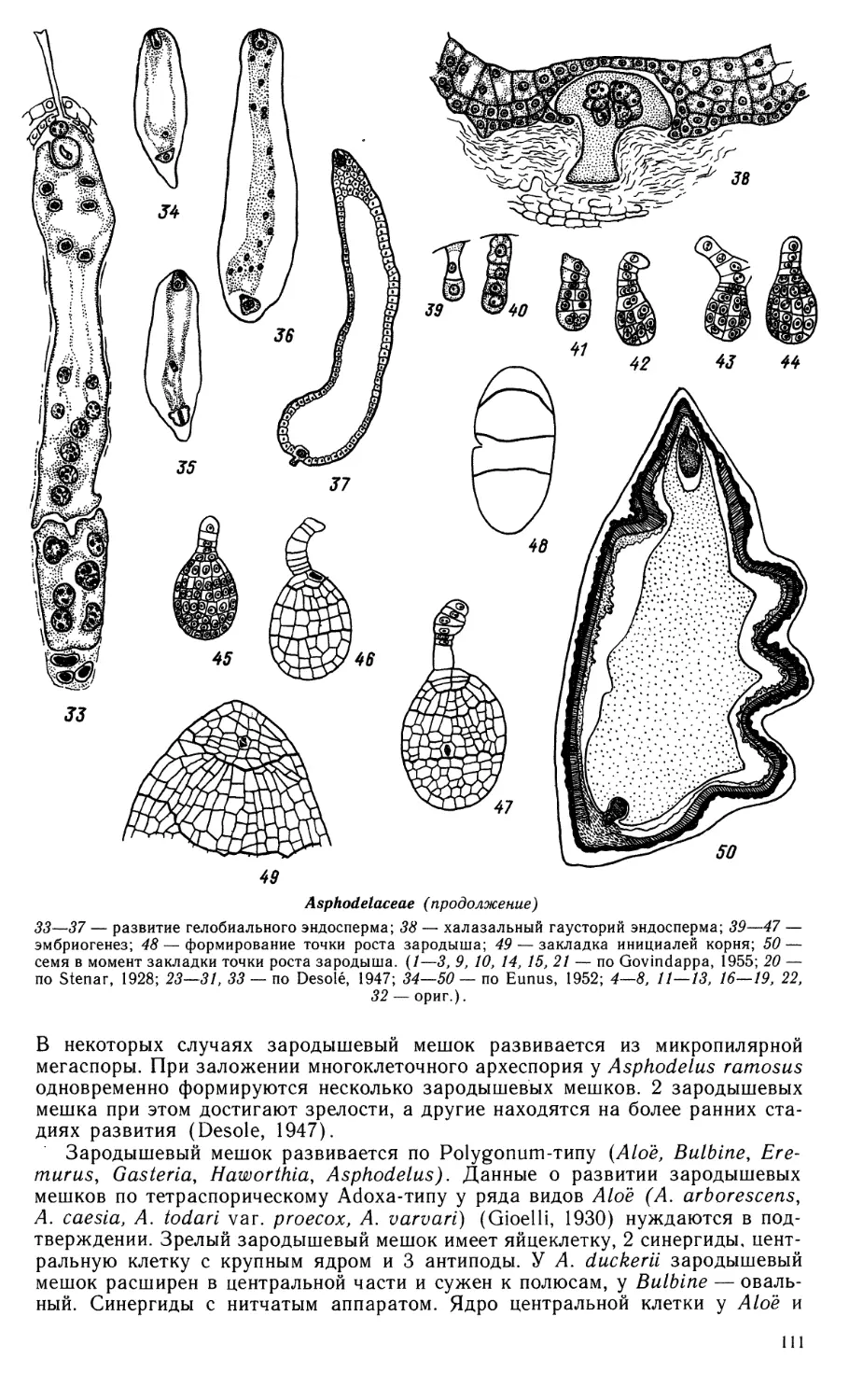
Сравнительная эмбриология цветковых растений. Однодольные. Butomaceae — Lemnaceae / Отв.
ред. Т. Б. Батыгина, М. С. Яковлев.— Л.: Наука, 1990. — 332
В книге, которая является пятым томом многотомного издания по сравнительной эмбриологии
цветковых растений, даны эмбриологические характеристики 78 семейств покрытосеменных,
составленные на основании имеющихся литературных сведений и в ряде семейств дополненные
оригинальными данными, иллюстрированные рисунками и микрофотографиями на световом и
электронном уровнях. Библиогр. 2011 назв. Ил. 72 (62 рис. + Ю табл.-вкл.). Табл. 1.
Авторы:
Г. К. АЛИМОВА, Г. М. АНИСИМОВА, Т. Б. БАТЫГИНА, В. Е. ВАСИЛЬЕВА,
Л. И. ВОРСОБИНА, Н. А. ЖИНКИНА, Г. Я. ЖУКОВА, Г. М. ИЛЬИНА,
О. П. КАМЕЛИНА, С. Н. КОРОБОВА, Л. Г. КРАСНИКОВ, Т. Н. НАУМОВА,
3. И. НИКИТИЧЕВА, В. А. ПОДДУБНАЯ-АРНОЛЬДИ, О. Б. ПРОСКУРИНА, Г. И. САВИНА,
Т. Н. САТАРОВА, Т. Б. СОКОЛОВСКАЯ, М. П. СОЛНЦЕВА,
Э. С. ТЕРЁХИН, Н. Г. ТУЧИНА, Т. Е. ФРЕЙБЕРГ, М. М. ЧУБИРКО,
И. И. ШАМРОВ, С. В. ШЕВЧЕНКО, Б. Е. ШПИЛЕВОЙ, М. С. ЯКОВЛЕВ
Редакционная коллегия:
Т. Б. БАТЫГИНА, М. С. ЯКОВЛЕВ (ответственные редакторы), Г. Я- ЖУКОВА,
О. П. КАМЕЛИНА (ответственный секретарь), А. Л. ТАХТАДЖЯН
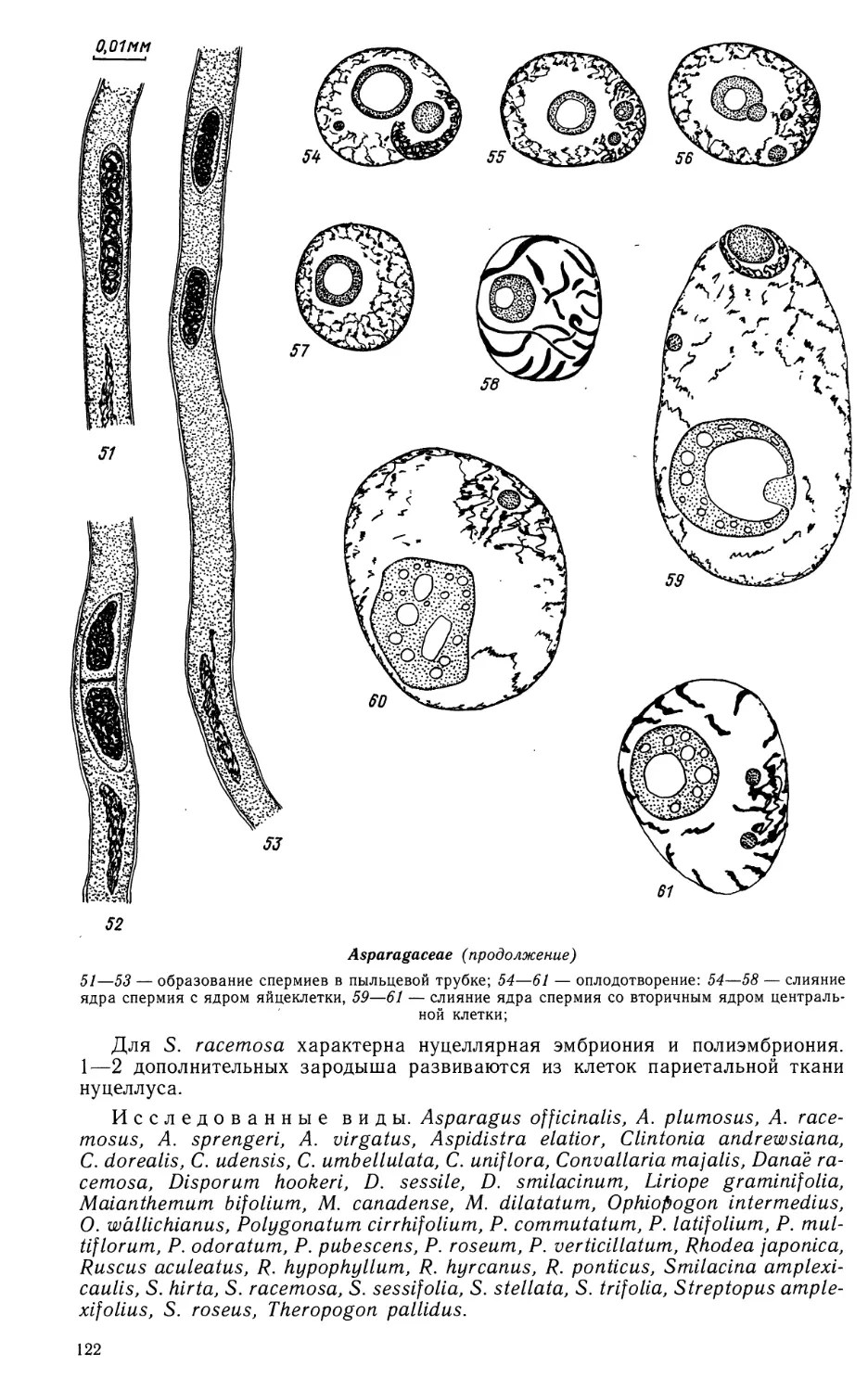
Рецензенты:
Н. Н. ЦВЕЛЕВ, Г. Е. ГВАЛАДЗЕ
A u I h о г ^:
G. К. ALIMOVA, G. M. ANISIMOVA, Т. В. BATYGINA, M. M. CHUBIRKO,
Т. Е. FREIBERG, G. M. ILYINA, О. P. KAMELINA, S. N. KOROBOVA,
L. G. KRASNIKOV, Т. N. NAUMOVA, Z. I. NIKITICHEVA, V. A. PODDUBNAYA-ARNOLDI,
О. В. PROSKURINA, G. I. SAVINA, Т. N. SATAROVA, I. I. SHAMROV,
S. V. SHEVCHENKO, В. Е. SHPILEVOY, Т. В. SOKOLOVSKAYA, M. P. SOLNTSEVA,
Е. S. TERYOKHIN, N. G. TOUTCHINA, V. Е. VASILYEVA, L. I. VORSOBINA,
М. S. YAKOVLEV, N. A. ZHINKINA, G. Ya. ZHUKOVA
Editorial board:
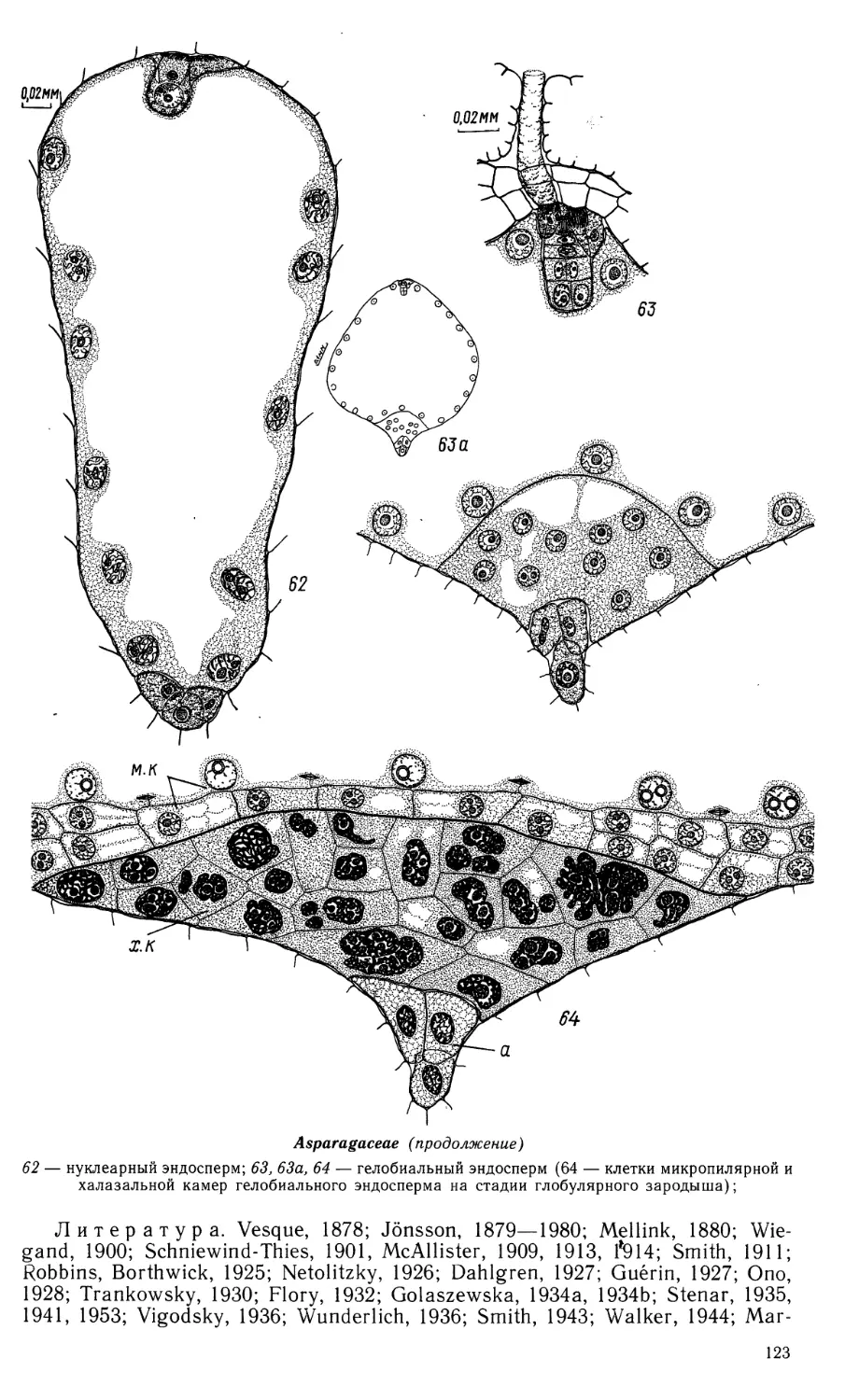
Т. В. BATYGINA (EDITOR), О. P. KAMELINA (SECRETARY),
A. L. TAKHTAJAN, M. S. YAKOVLEV (EDITOR), G. YA. ZHUKOVA.
R e v i e w г s:
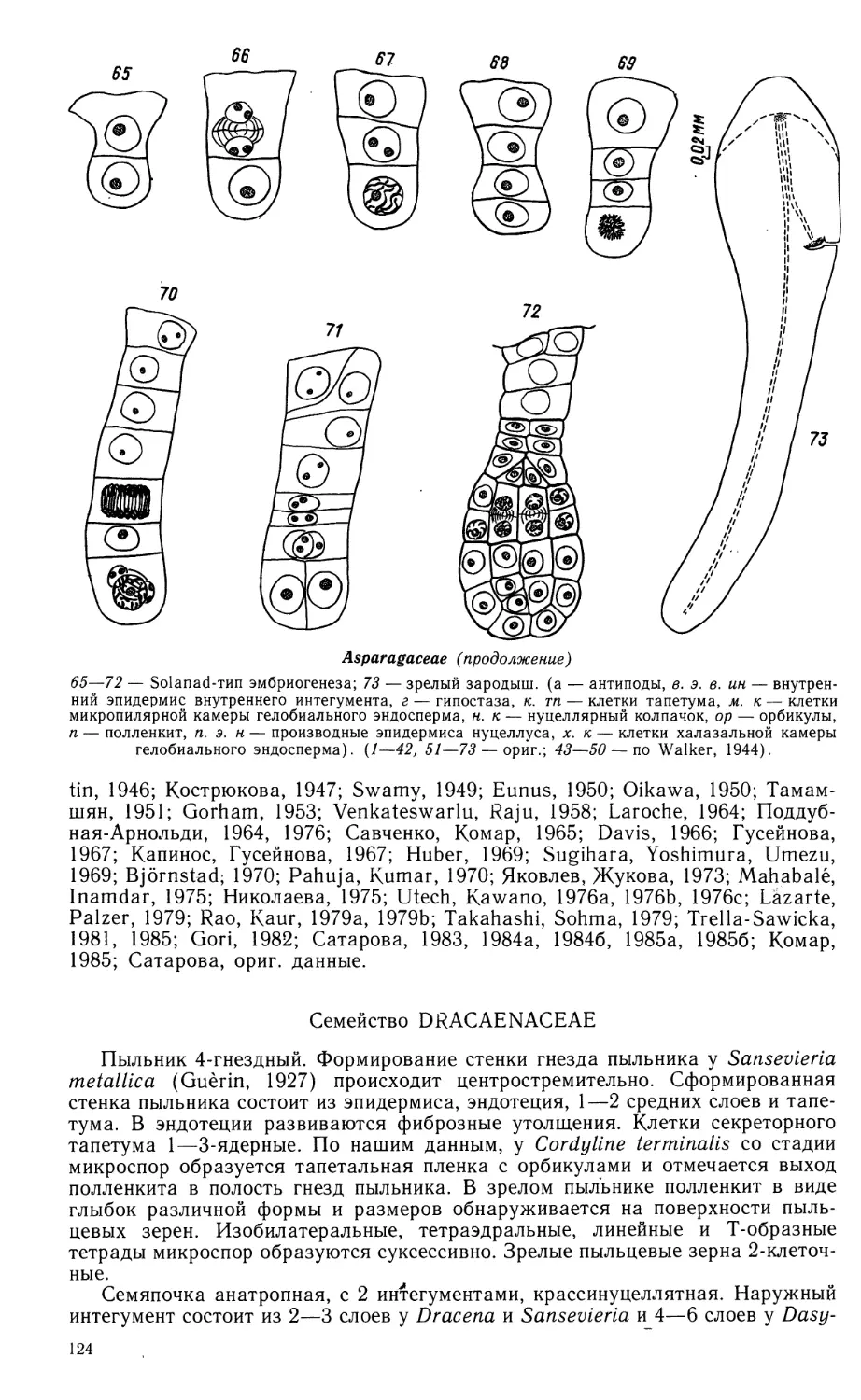
N. N. TSVELEV, G. E. GVALADZE
„ 1906000000-599 cco n„ TI
C 042(02)-90 552"9°' П П0ЛуГ°ДИе
ISBN 5-02-026635-3 © Коллектив авторов, 1990
ПРЕДИСЛОВИЕ
В пятый и последний том «Сравнительной эмбриологии цветковых растений»
включены семейства класса однодольных от Butomaceae до Lemnaceae из
подклассов Alismatidae (порядки Alismatales и Najadales), Liliidae (порядки
Triurldales—Zingiberales) и Arecidae (порядки Arecales—Arales) (в
соответствии с системой А. Л. Тахтаджяна, 1980). По эмбриологическим признакам
класс однодольных отличается от двудольных не только наличием одной
семядоли в зародыше, но и довольно часто встречающимся периплазмодиаль-
ным типом тапетума в пыльнике, не свойственного двудольным, причем в
порядках, стоящих и в основании системы однодольных (Alismatales, Najadales),
и на более высоких ее уровнях (Commelinales, Pandanales, Arales). Интересно
отметить, что для однодольных характерны семяпочки с 2 интегументами,
в большинстве случаев крассинуцеллятные, практически отсутствующий целлю-
лярный, но с равной частотой встречающийся с нуклеарным гелобиальный
эндосперм, и другие признаки, нашедшие свое отражение в характеристиках
семейств.
Эмблемой пятого тома послужила ортотропная семяпочка Zannichellia
pedunculata (Zannichelliaceae) с развивающимися зародышем и гелобиальным
эндоспермом.
В пятый том вошли эмбриологические характеристики 78 семейств из 21
порядка. Принцип составления эмбриологической характеристики семейства
тот же, что и в предыдущих томах. Так же составлены иллюстрации и их
описания. Здесь, как и раньше, в некоторых крупных, хорошо изученных
семействах приведены списки не только исследованных видов, но также общее их
количество (помещенное в скобках после названия рода). Список литературы
составлен по примеру третьего и четвертого томов этого издания. В конце
эмбриологической характеристики каждого семейства приводится по
возможности полный перечень литературных источников (автор, год),
расположенных в хронологической последовательности. В общий список библиографии
пятого тома вошли основные эмбриологические работы по каждому семейству.
В связи с ограниченным объемом тома в него не включены работы, упомянутые
в первом—четвертом томах, статьи с фрагментарными сведениями, тезисы
докладов совещаний, названия диссертаций и авторефератов, труды и сводки
по ботанике, из которых были почерпнуты некоторые сведения по отдельным
признакам для эмбриологически не изученных семейств.
В составлении пятого тома кроме сотрудников Лаборатории эмбриологии
БИН АН СССР принимали участие эмбриологи из других учреждений:
Л. И. Ворсобина (Саранск, Пединститут), Г. М. Ильина (Москва, МГУ),
Т. Н. Сатарова (Днепропетровск, ВНИИ кукурузы), М. М. Чубирко (Ужгород,
университет), С. В. Шевченко (Ялта, Никитский ботан. сад), Б. Е. Шпилевой
(Киев, ЦРБС).
В конце тома приведена сводная таблица (см. Приложение, с. 00) с данными
по запасным питательным веществам зародыша и эндосперма для семейств
этого тома (автор В. Е. Васильева). Завершает том указатель латинских
названий растений, составленный О. Б. Проскуриной. Копии рисунков из
опубликованных работ выполнены художницей Р. А. Лейкиной, оригинальные рисунки —
авторами. В характеристики многих семейств вошли материалы исследований
авторов, что, как и в предыдущих томах, отмечено в каждом случае («ориг.
данные» — под характеристикой и «ориг.» — в подписях к рисункам). Ориги-
5
нальные микрофотографии в сем. Najadaceae и 2 таблицы в Роасеае
представлены С. С. Татинцевой.
Материал для исследования собирался в Батумском, Сухумском, Никитском
ботанических садах, в оранжереях и в саду БИН АН СССР, в природных
условиях Крыма, Кавказа, Средней Азии, Ленинградской и Псковской областей.
Авторы и редколлегия искренне благодарны за помощь в приготовлении
препаратов и техническую работу при составлении и оформлении данного
тома О. Б. Проскуриной, Н. А. Жинкиной, Н. Г. Тучиной, Г. Е. Титовой,
С. И. Исаковой.
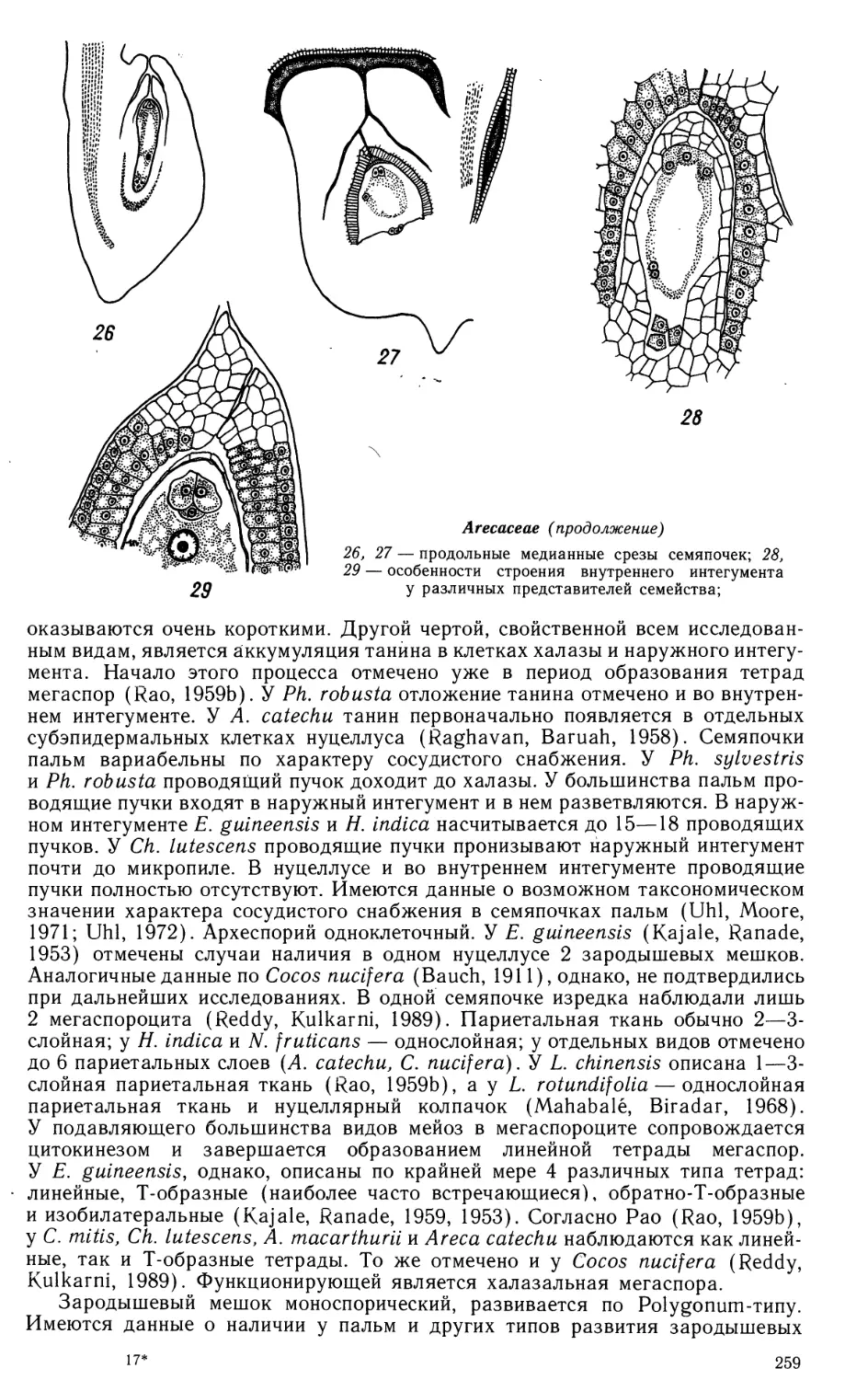
Порядок 1. ALISMATALES
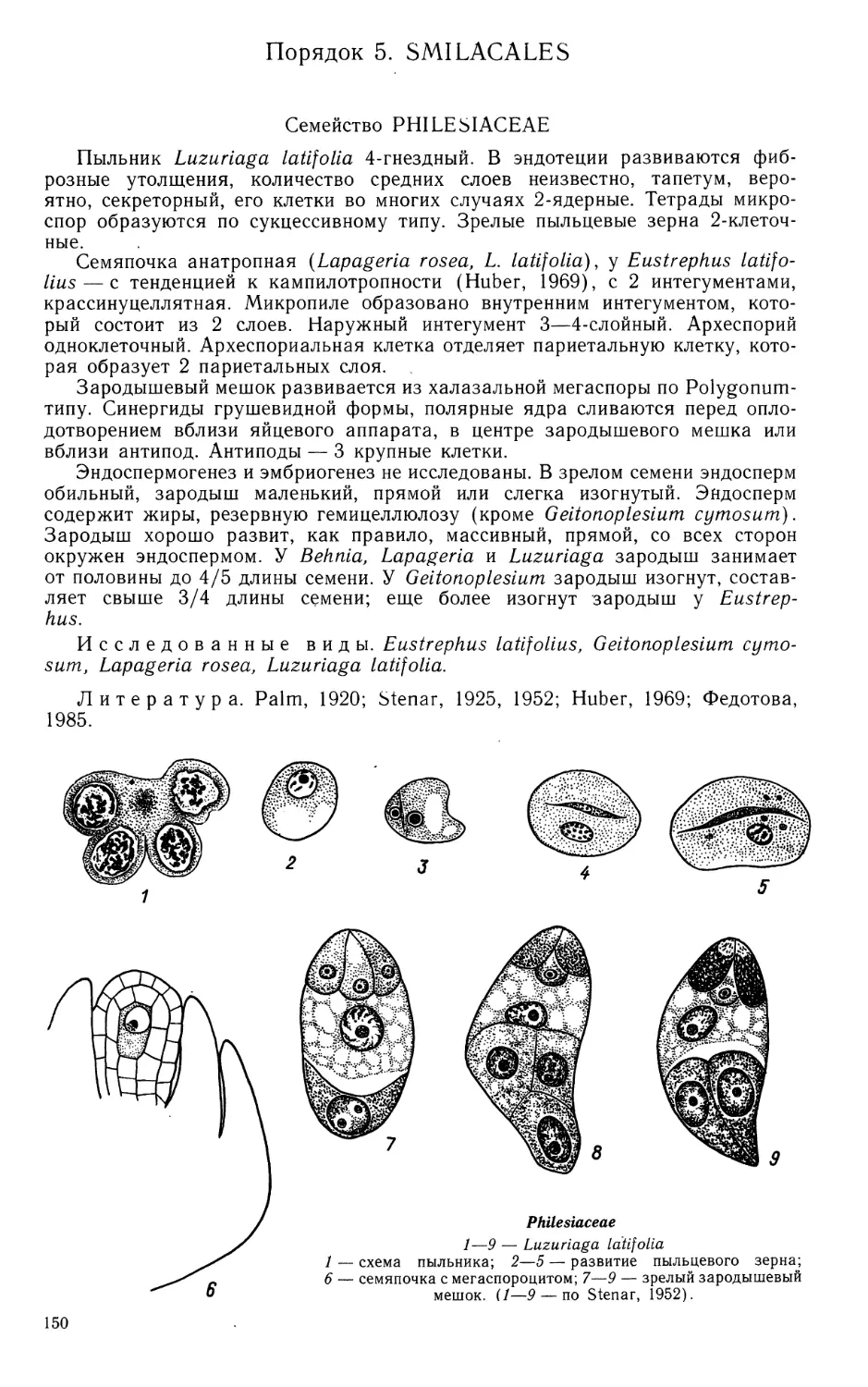
Семейство BUTOMACEAE
Пыльник 4-гнездный. Стенка гнезда пыльника развивается по
центробежному типу и состоит из эпидермиса, эндотеция, 2—3 средних слоев и тапетума.
В эндотеции и отдельных клетках среднего слоя формируются фиброзные
утолщения. Тапетум периплазмодиального типа. Растворение его клеточных
оболочек происходит во время профазы I в микроспороцитах, лизис — на стадии
2-клеточных пыльцевых зерен. Иногда наблюдается задержка растворения
оболочек, и клетки тапетума в этом случае становятся гипертрофированными.
Нормальные тетрады микроспор при этом не образуются. Тип образования
тетрад микроспор — сукцессивный, иногда в нижней части пыльников —
симультанный. В последнем случае резко возрастает число аномальных тетрад.
Тетрады микроспор тетраэдральные, изобилатеральные, крестообразные,
Т-образные, содержание каллозы в их оболочке минимальное. Зрелые
пыльцевые зерна 3-клеточные. Деление генеративной клетки происходит перед
вскрытием пыльника. Спермин крупные, с большим количеством цитоплазмы.
Вегетативная клетка содержит крахмал.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Микропиле
образовано внутренним интегументом. Каждый интегумент состоит из 2 слоев
уплощенных клеток. В микропилярной части отмечено их небольшое локальное
разрастание. Ко времени оплодотворения в наружном интегументе
накапливается крахмал, позднее, по мере развития зародыша, замещающийся
танинами. Внутренний интегумент значительно тоньше наружного. На обращенных
к нуцеллусу стенках клеток внутреннего слоя формируется складчатая кутикула.
При созревании семени внешний слой его клеток лизируется. Сосудистый
пучок заканчивается в халазе. Нуцеллус на ранних стадиях развития состоит
из эпидермиса и единственного париетального слоя. Наши исследования не
подтвердили данных Ропера (Roper, 1952) об отсутствии в некоторых случаях
париетального слоя. Окончательная дифференциация нуцеллуса происходит
после оплодотворения. Сформированный нуцеллус можно разделить на 3 зоны:
микропилярную, латеральную и халазальную. Микропилярная зона
дифференцируется раньше других и состоит из 1—2 слоев небольших, относительно
слабо дифференцированных клеток, сохраняющихся почти до полного
созревания семени. Эти клетки находятся в контакте с гигантской базальной клеткой
подвеска. Латеральная зона составляет основную массу нуцеллуса. Ее клетки
растут и дифференцируются только после оплодотворения. Халазальная зона
формируется в период развития зародышевого мешка. Она состоит из 2—3-ряд-
ного тяжа вытянутых клеток с крупными ядрами и утолщенными оболочками
(гипостазы), соединяющего проводящий пучок семяпочки с халазальным
концом зародышевого мешка, и веером расходящихся от него сильно удлиненных
клеток. С началом интенсивного роста эндосперма часть радиальных клеток
этой зоны разрушается быстрее клеток гипостазы — в результате образуется
постамент. Окончательный лизис нуцеллуса происходит по достижении
зародышем 3/4 конечного объема. Единственная (иногда 2—3 — Holmgren, 1913;
Красников, ориг.) археспориальная клетка делится периклинально, образуя
париетальную и спорогенную клетки. Тетрады мегаспор линейные или
Т-образные.
Зародышевый мешок моноспорический, развивается по Polygonum-типу
(Holmgren, 1913; Roper, 1952; Красников, 1986, 19886), иногда биспорический,
развивающийся по Allium-типу. В этом случае после I деления мейоза в
материнской клетке мегаспор образуется диада клеток. Ядро микропилярной клетки
диады начинает дегенерировать еще в интерфазе, до начала II деления мейоза
в халазальной клетке, после которого образуется 2-ядерный
зародышевый мешок. В этот момент развитие семяпочки соответствует семяпочке
на стадии тетрад мегаспор при Polygonum-типе развития. В начальный период
характер роста биспорического зародышевого мешка отличается от моноспо-
7
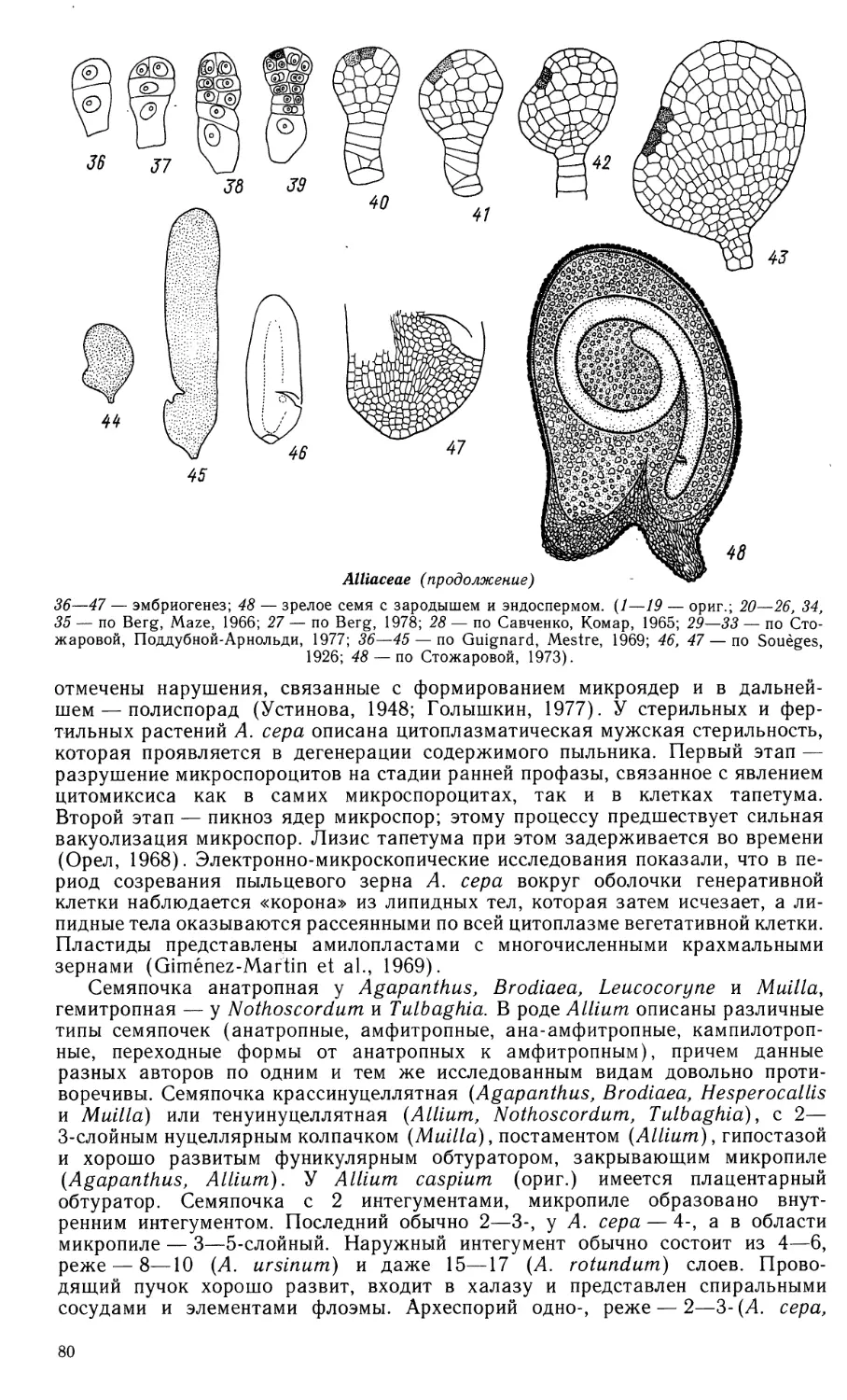
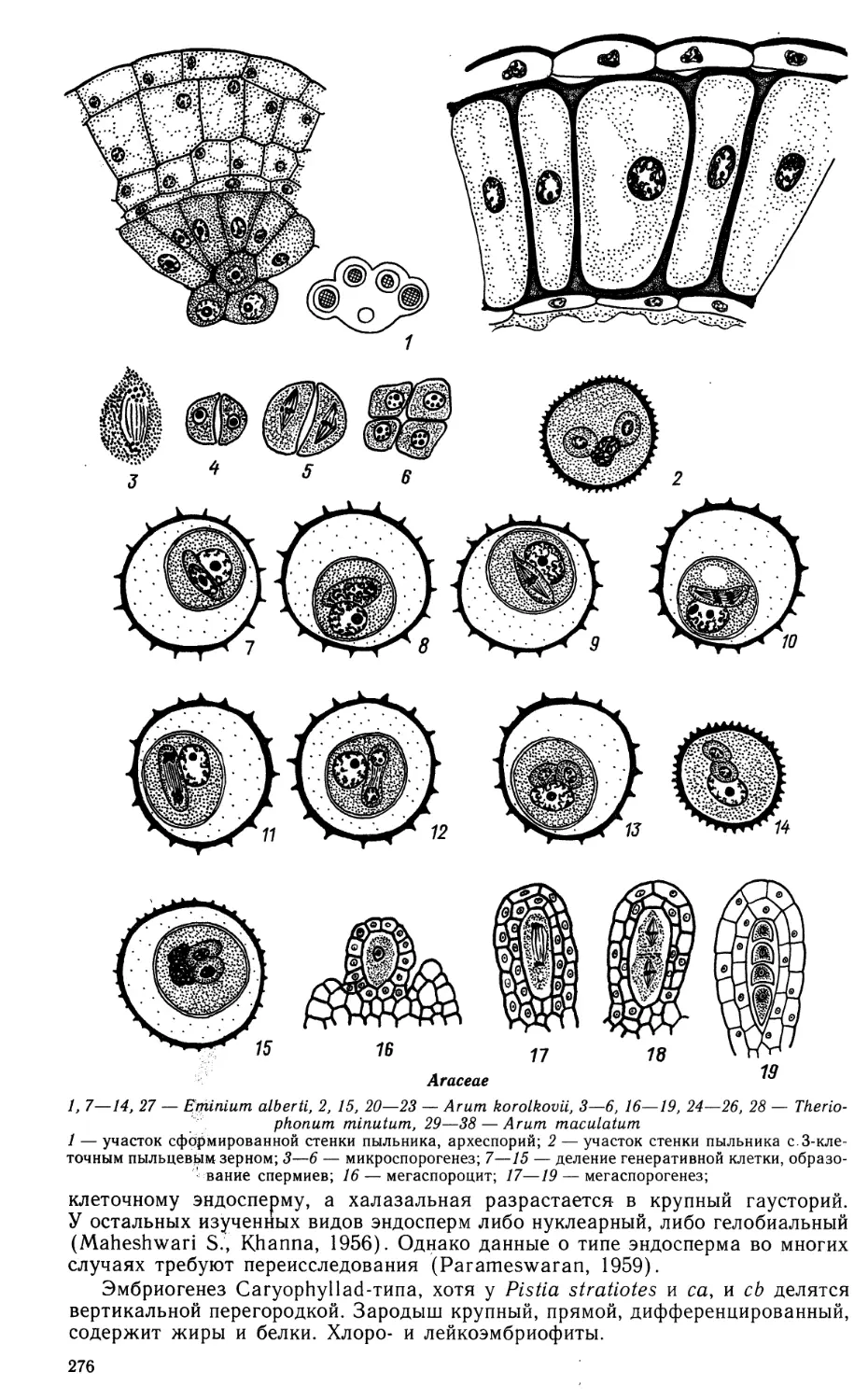
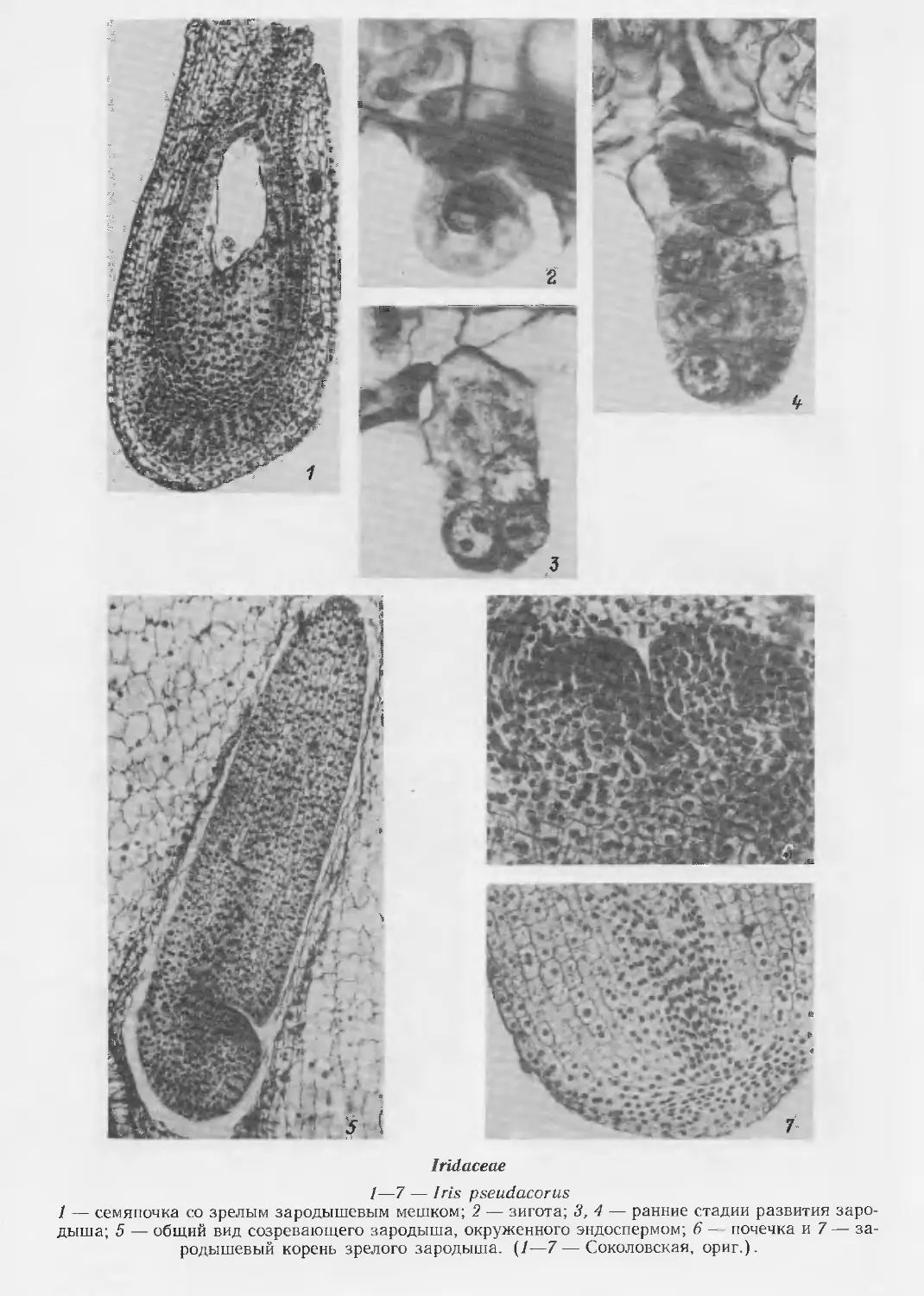
Butomaceae
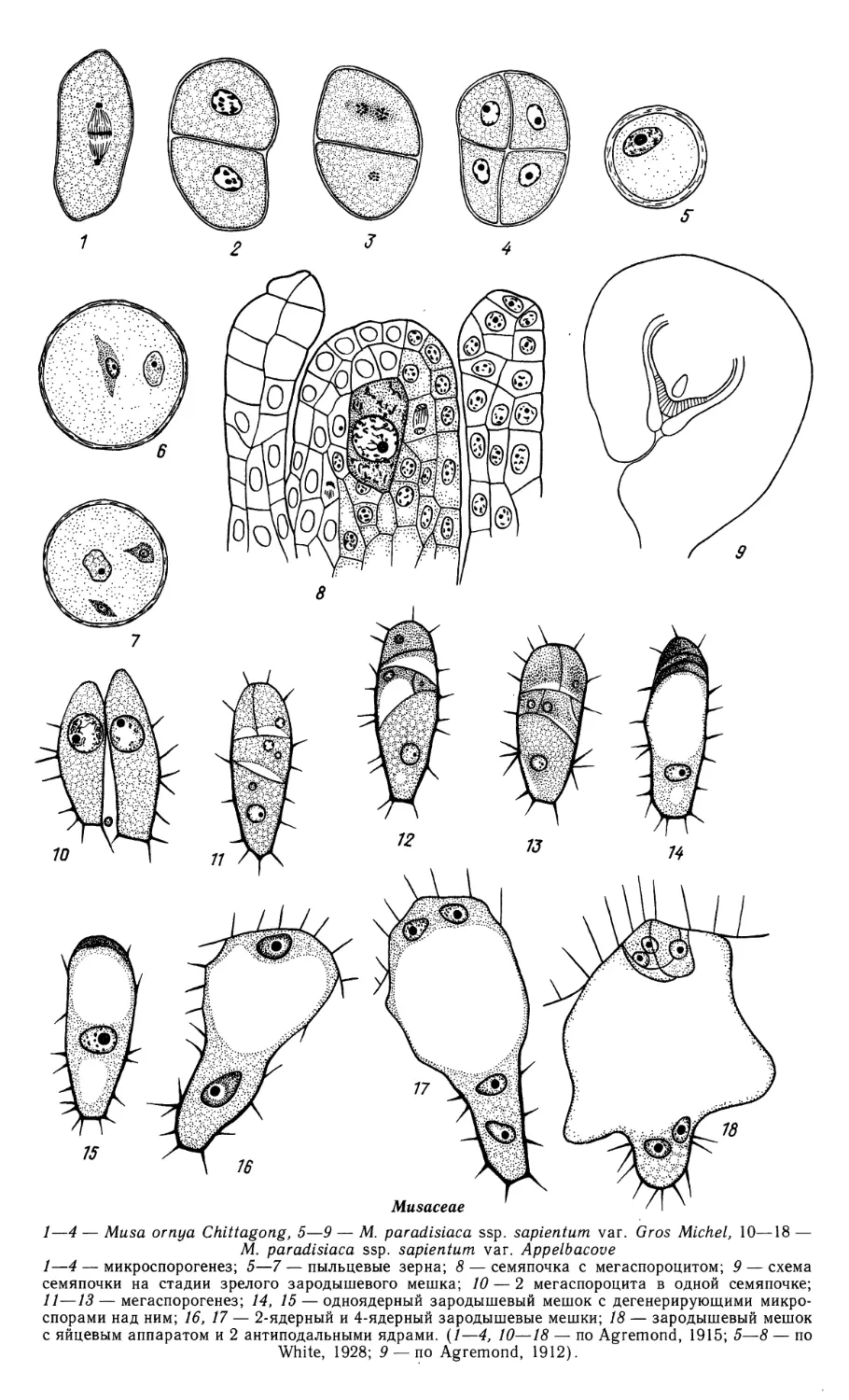
1—55 — Butomus umbellatus
1—3 — формирование стенки гнезда пыльника и спорогенной ткани; 4—5 — метафаза I в микро-
спороцитах, растворение клеточных стенок тапетума; 6—14 — формирование тетрад микроспор;
15 — фрагмент гнезда пыльника с микроспорами в периплазмодии;
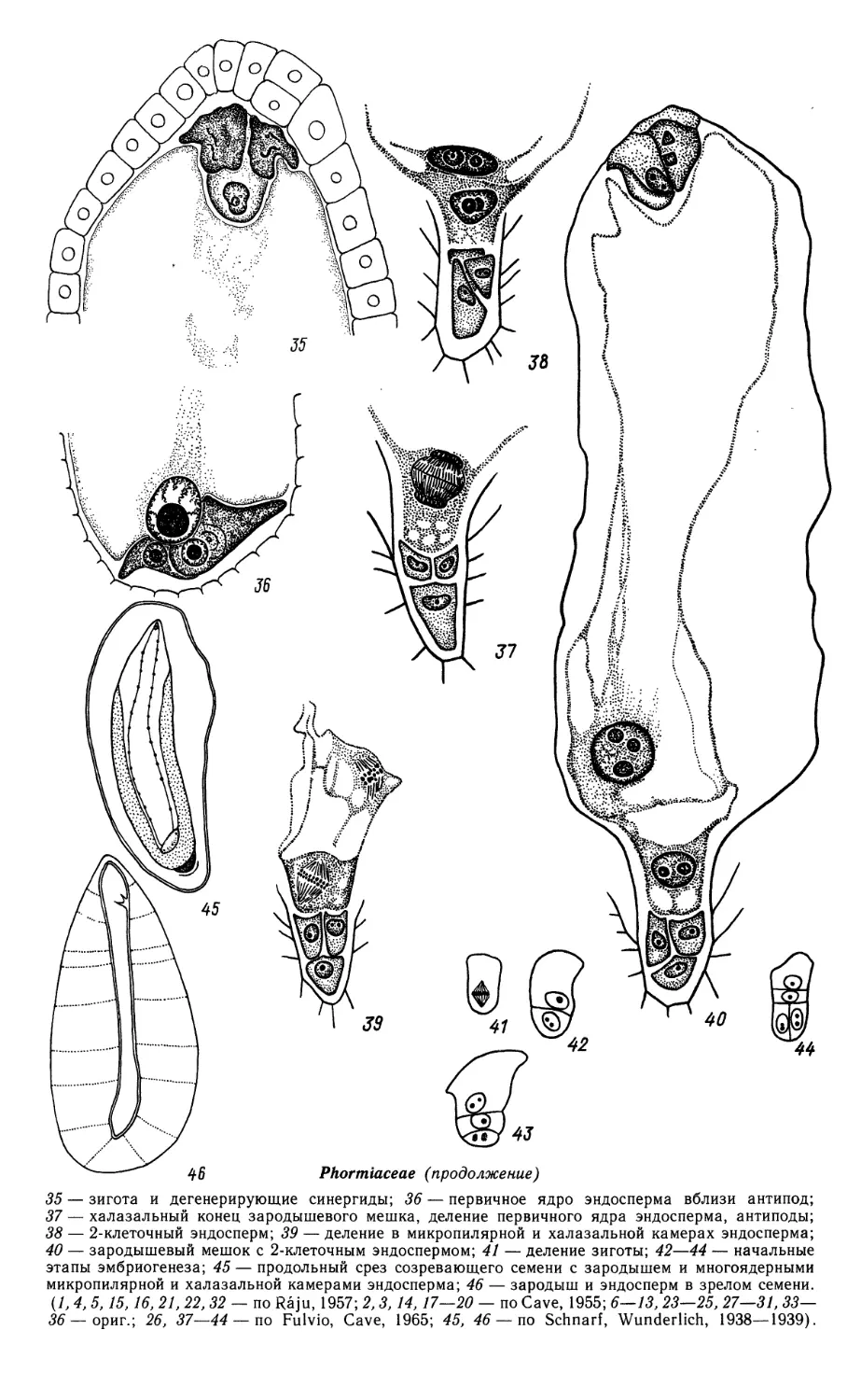
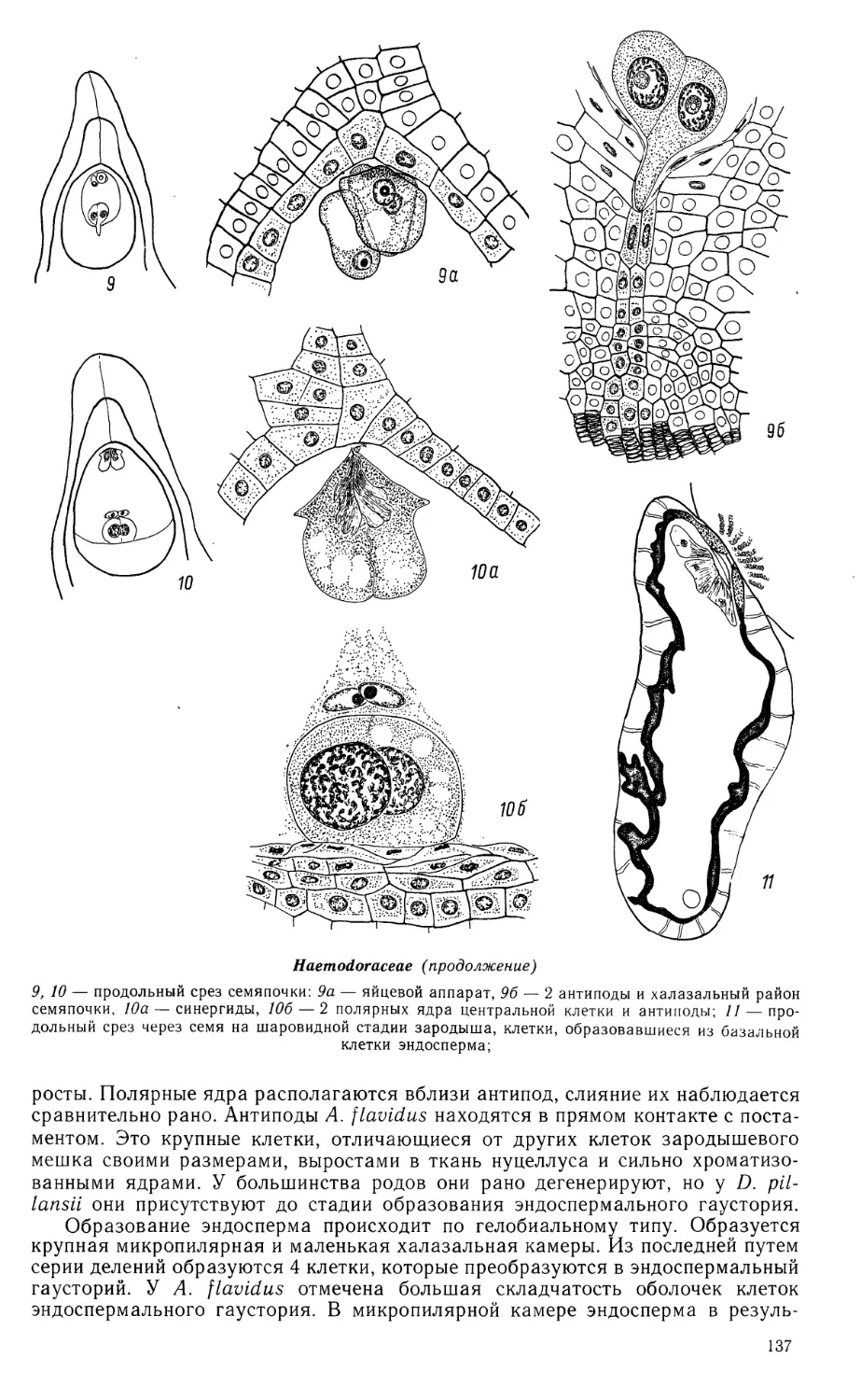
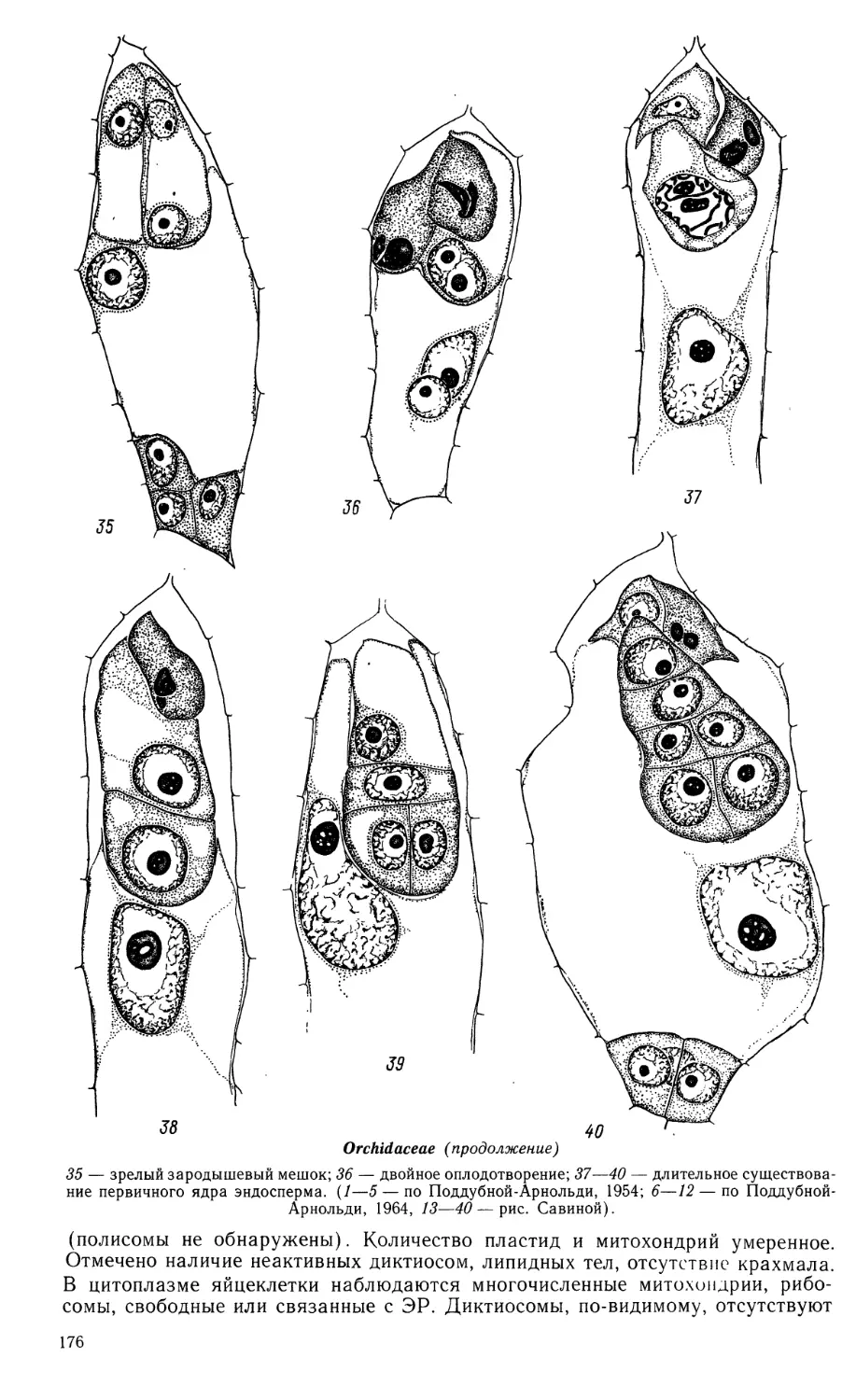
Butomaceae (продолжение)
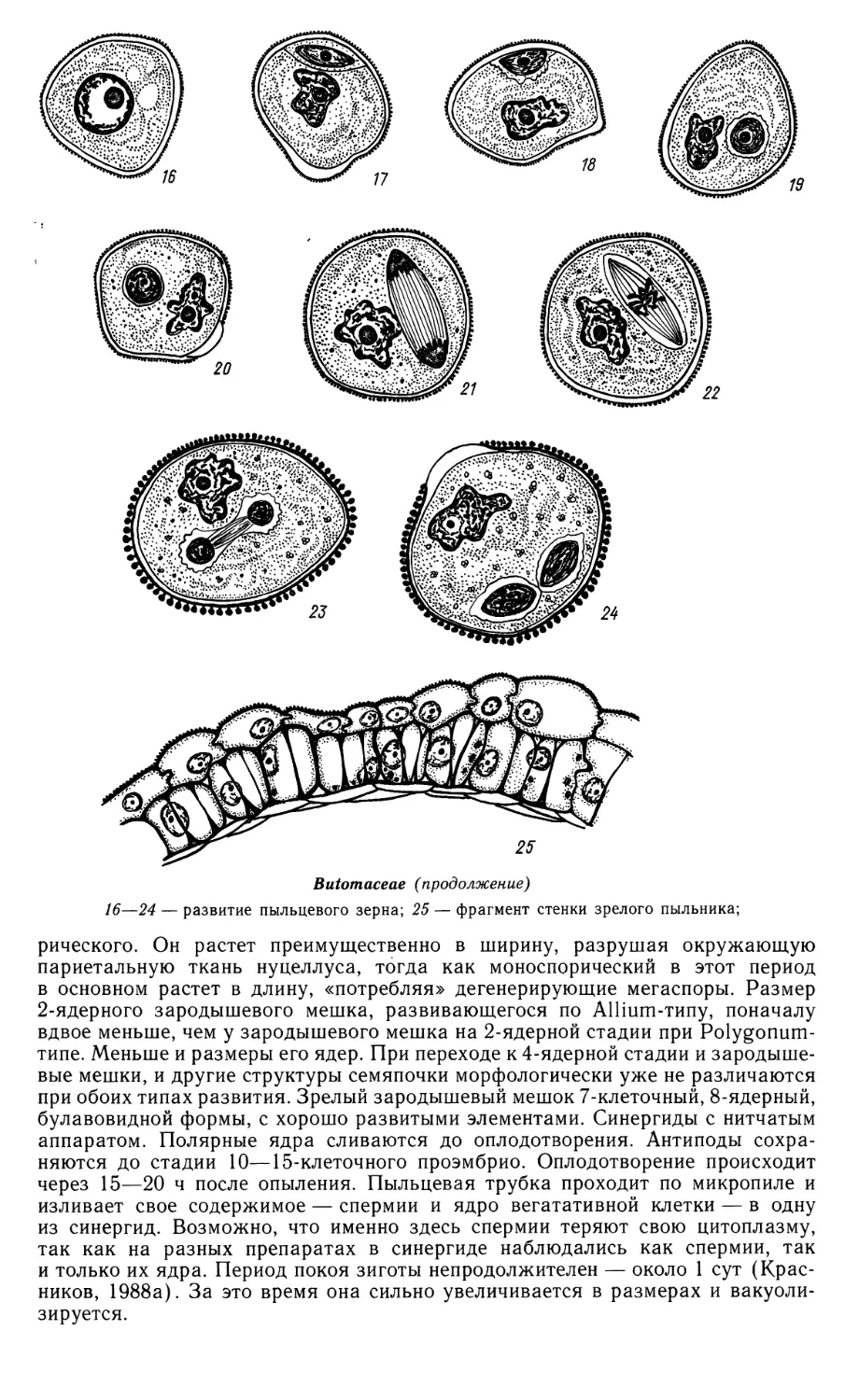
16—24 — развитие пыльцевого зерна; 25 — фрагмент стенки зрелого пыльника;
рического. Он растет преимущественно в ширину, разрушая окружающую
париетальную ткань нуцеллуса, тогда как моноспорический в этот период
в основном растет в длину, «потребляя» дегенерирующие мегаспоры. Размер
2-ядерного зародышевого мешка, развивающегося по Allium-типу, поначалу
вдвое меньше, чем у зародышевого мешка на 2-ядерной стадии при Polygonum-
типе. Меньше и размеры его ядер. При переходе к 4-ядерной стадии и
зародышевые мешки, и другие структуры семяпочки морфологически уже не различаются
при обоих типах развития. Зрелый зародышевый мешок 7-клеточный, 8-ядерный,
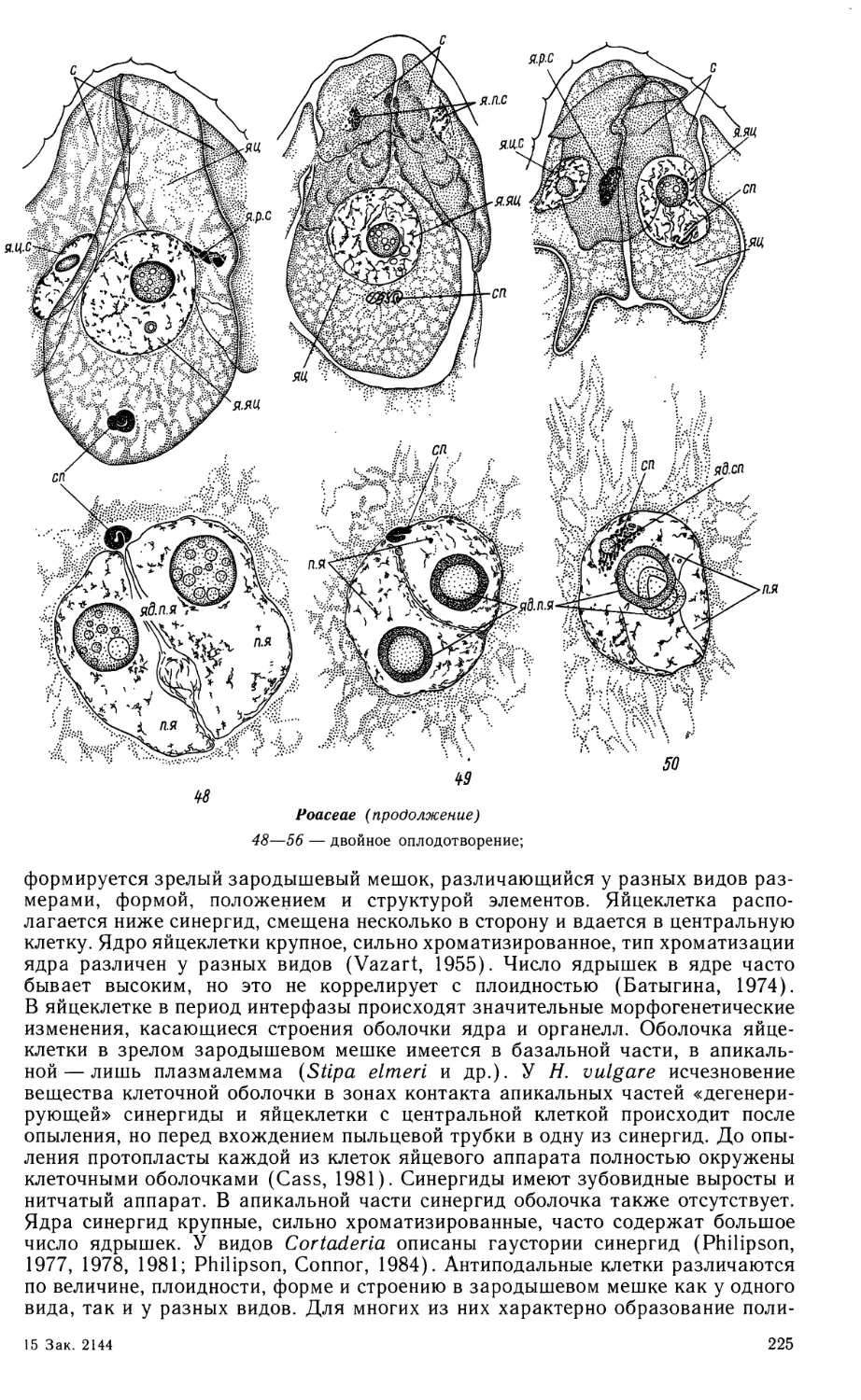
булавовидной формы, с хорошо развитыми элементами. Синергиды с нитчатым
аппаратом. Полярные ядра сливаются до оплодотворения. Антиподы
сохраняются до стадии 10—15-клеточного проэмбрио. Оплодотворение происходит
через 15—20 ч после опыления. Пыльцевая трубка проходит по микропиле и
изливает свое содержимое — спермин и ядро вегатативной клетки — в одну
из синергид. Возможно, что именно здесь спермии теряют свою цитоплазму,
так как на разных препаратах в синергиде наблюдались как спермии, так
и только их ядра. Период покоя зиготы непродолжителен — около 1 сут
(Красников, 1988а). За это время она сильно увеличивается в размерах и вакуоли-
зируется.
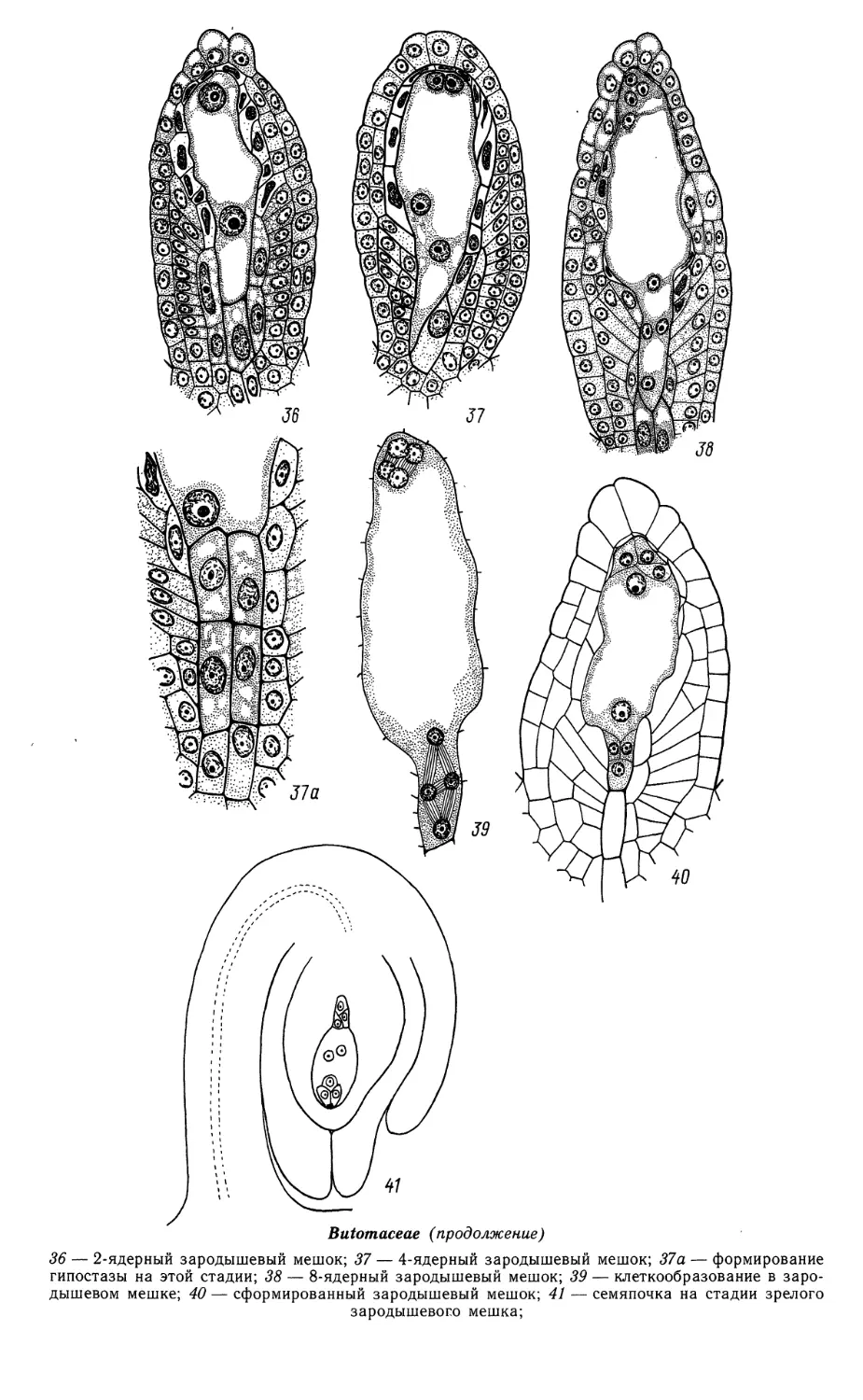
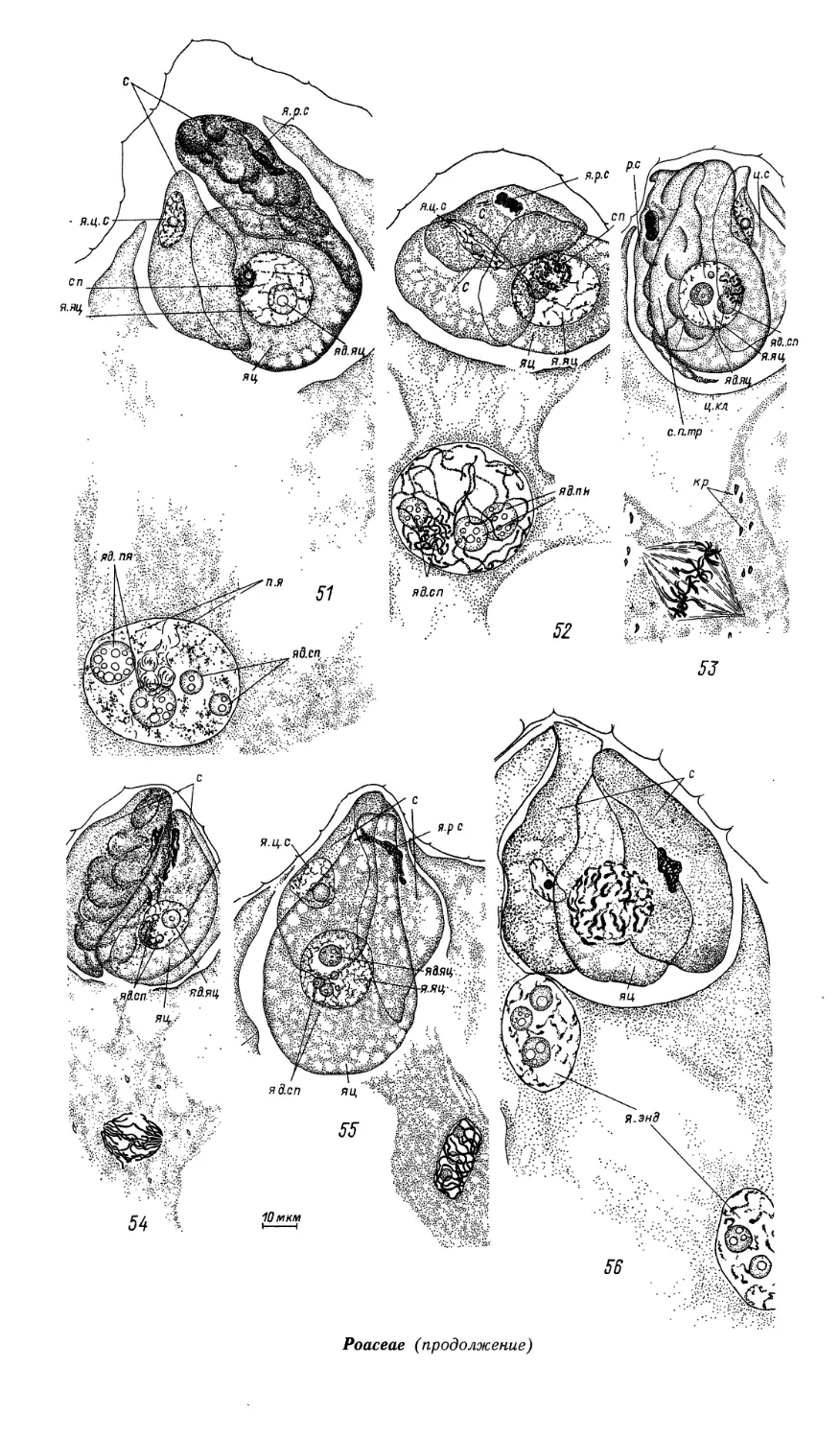
Эндосперм гелобиальный. Первичное ядро эндосперма делится почти
одновременно с зиготой. Образовавшаяся в результате первого деления поперечная
перегородка отделяет халазальную клетку-камеру, которая обычно остается
одноядерной (реже становится 2-ядерной) и сохраняется до конечных стадий
созревания зародыша. Ее ядро примерно в 6 раз увеличивается в объеме,
становится лопастным и, вероятно, полиплоидным. В микропилярной камере
эндосперма идут свободноядерные деления. Перед клеткообразованием ядра
Butomaceae (продолжение)
36 — 2-ядерный зародышевый мешок; 37 — 4-ядерный зародышевый мешок; 37а — формирование
гипостазы на этой стадии; 38 — 8-ядерный зародышевый мешок; 39 — клеткообразование в
зародышевом мешке; 40 — сформированный зародышевый мешок; 41 — семяпочка на стадии зрелого
зародышевого мешка;
Butomaceae (продолжение)
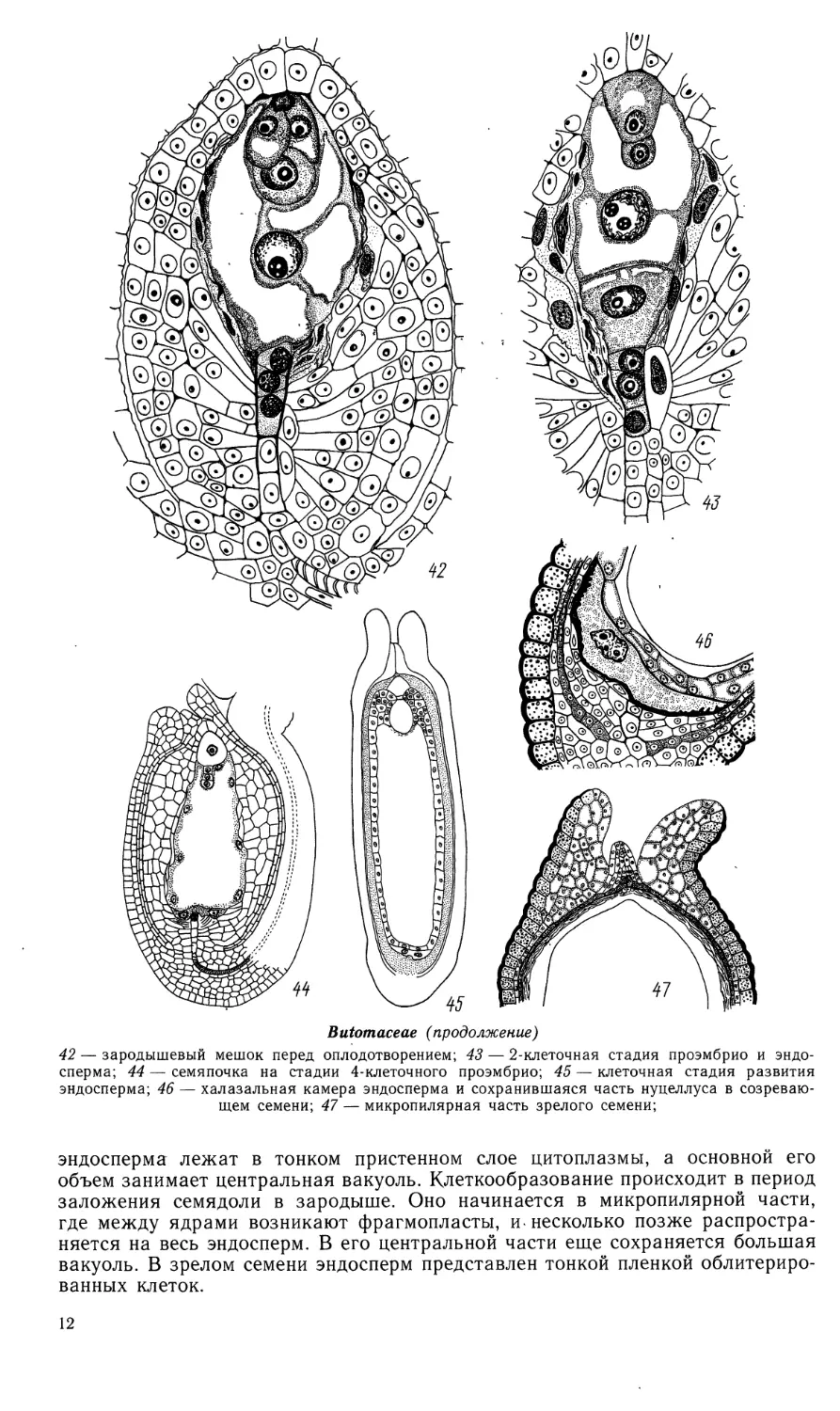
42 — зародышевый мешок перед оплодотворением; 43 — 2-клеточная стадия проэмбрио и
эндосперма; 44 — семяпочка на стадии 4-клеточного проэмбрио; 45 — клеточная стадия развития
эндосперма; 46 — халазальная камера эндосперма и сохранившаяся часть нуцеллуса в
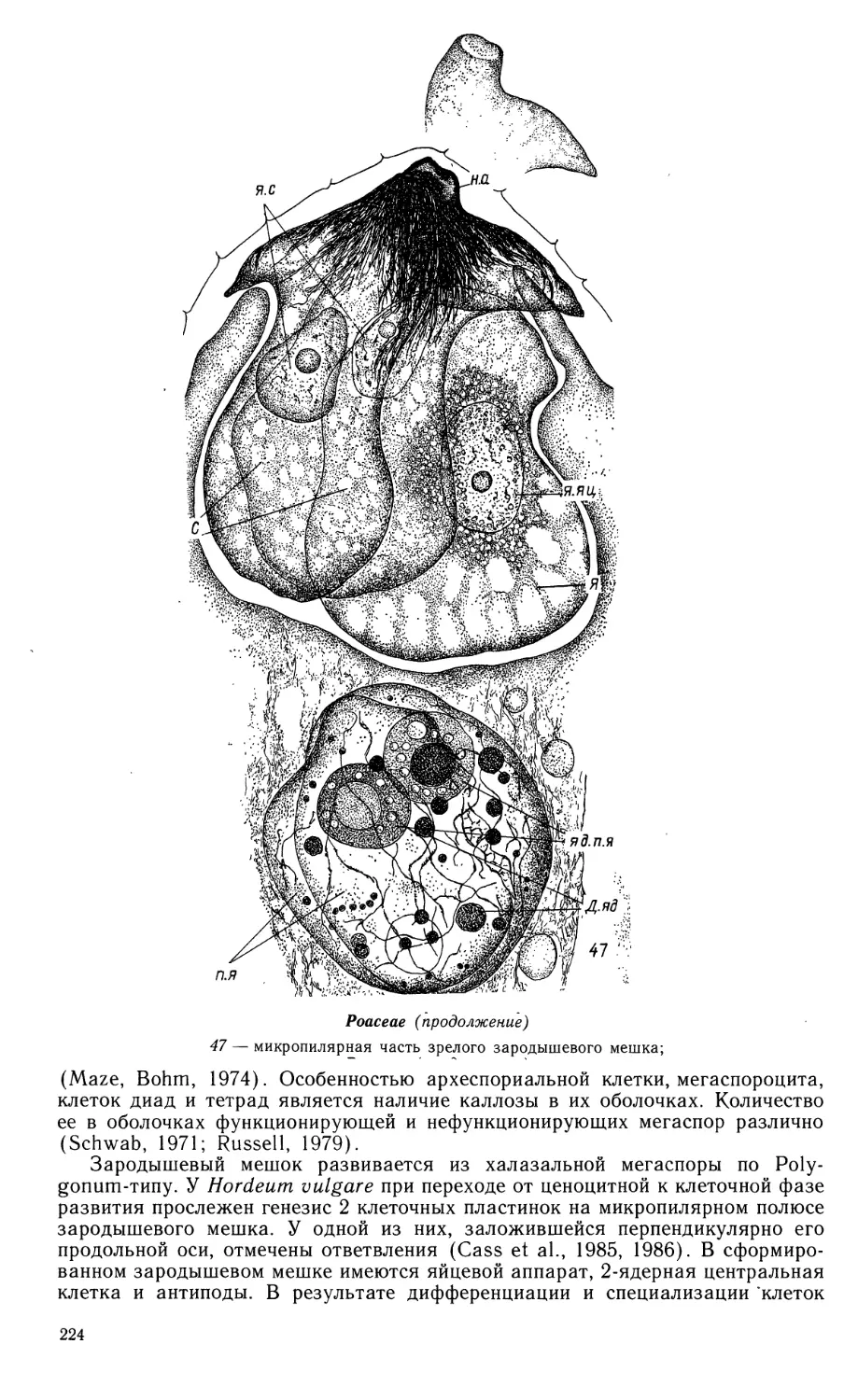
созревающем семени; 47 — микропилярная часть зрелого семени;
эндосперма лежат в тонком пристенном слое цитоплазмы, а основной его
объем занимает центральная вакуоль. Клеткообразование происходит в период
заложения семядоли в зародыше. Оно начинается в микропилярной части,
где между ядрами возникают фрагмопласты, и* несколько позже
распространяется на весь эндосперм. В его центральной части еще сохраняется большая
вакуоль. В зрелом семени эндосперм представлен тонкой пленкой облитериро-
ванных клеток.
12
Butomaceae (продолжение)
48—54— ранние стадии эмбриогенеза; 55— динамика развития зародыша. {1—55 — ориг.).
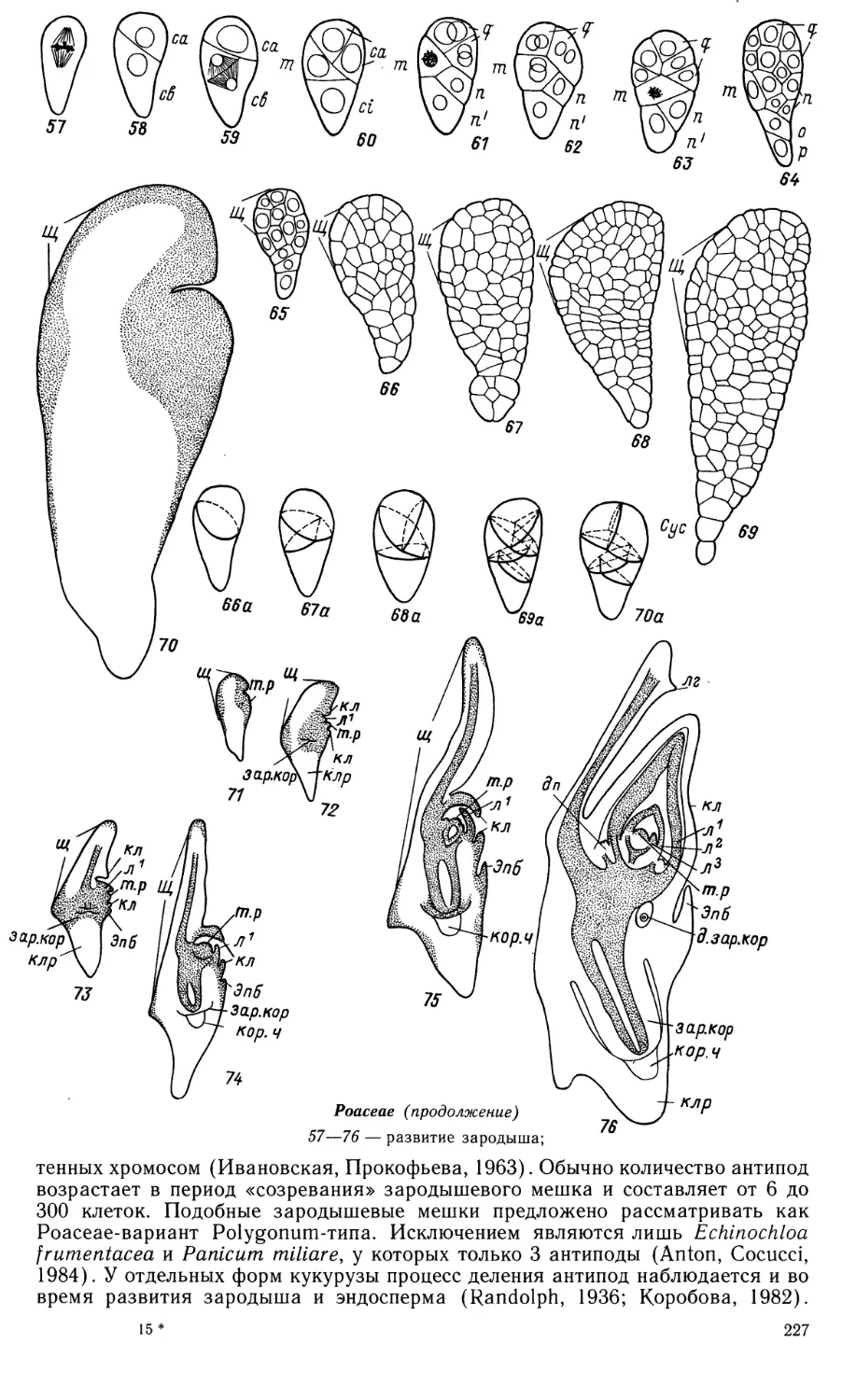
Первые этапы развития зародыша соответствуют Caryophyllad-типу.
Образовавшаяся после деления зиготы базальная клетка больше не делится и сильно
гипертрофируется. Ее ядро становится лопастным, в цитоплазме появляются *
несколько крупных вакуолей, клеточная оболочка в зоне контакта с клетками
нуцеллуса сильно утолщается. После серии делений в апикальной клетке
образуется линейный проэмбрио от 4 до 10 клеток длиной. Антиклинальные
деления обычно начинаются в терминальной клетке в случае короткого
зародыша либо в субтерминальной — в случае длинного. Скорость делений в терми-
13
нальном сегменте на первых этапах ниже, чем в субтерминальном. Этап
гистогенной дифференциации зародыша характеризуется «дроблением» клеток,
объем зародыша в этот период не изменяется. Семядоля закладывается
валиком. Инициали апикальной меристемы первоначально занимают терминальное
положение. В дальнейшем вследствие быстрого разрастания семядоли точка
роста смещается на боковую поверхность зародыша. Заложение примор-
дия первого листа происходит несколько позже семядоли. Прокамбиальный
тяж возникает одновременно как в семядоле, так и в зачатке первого листа.
Зрелый зародыш прямой, дифференцированный, занимает весь объем зрелого
семени. В клетках его содержится крахмал. Лейкоэмбриофит.
Исследованный вид. Butomus umbellatus.
Литература. Buchenau, 1857, 1882; Vesque, 1878, 1879; Elfving, 1879;
Ward, 1880; Holmgren, 1913; Glausen, 1927; Герасимова-Навашина, 1951;
Roper, 1952; Davis, 1960; Тахтаджян, 1966; Johri, 1970; Яковлев, Жукова, 1973,
1980; Ly Thi Ba, 1981; Поддубная-Арнольди, 1982; Красников, 1986, 1988a,
19886 и ориг. данные.
Семейство LIMNOCHARITACEAE
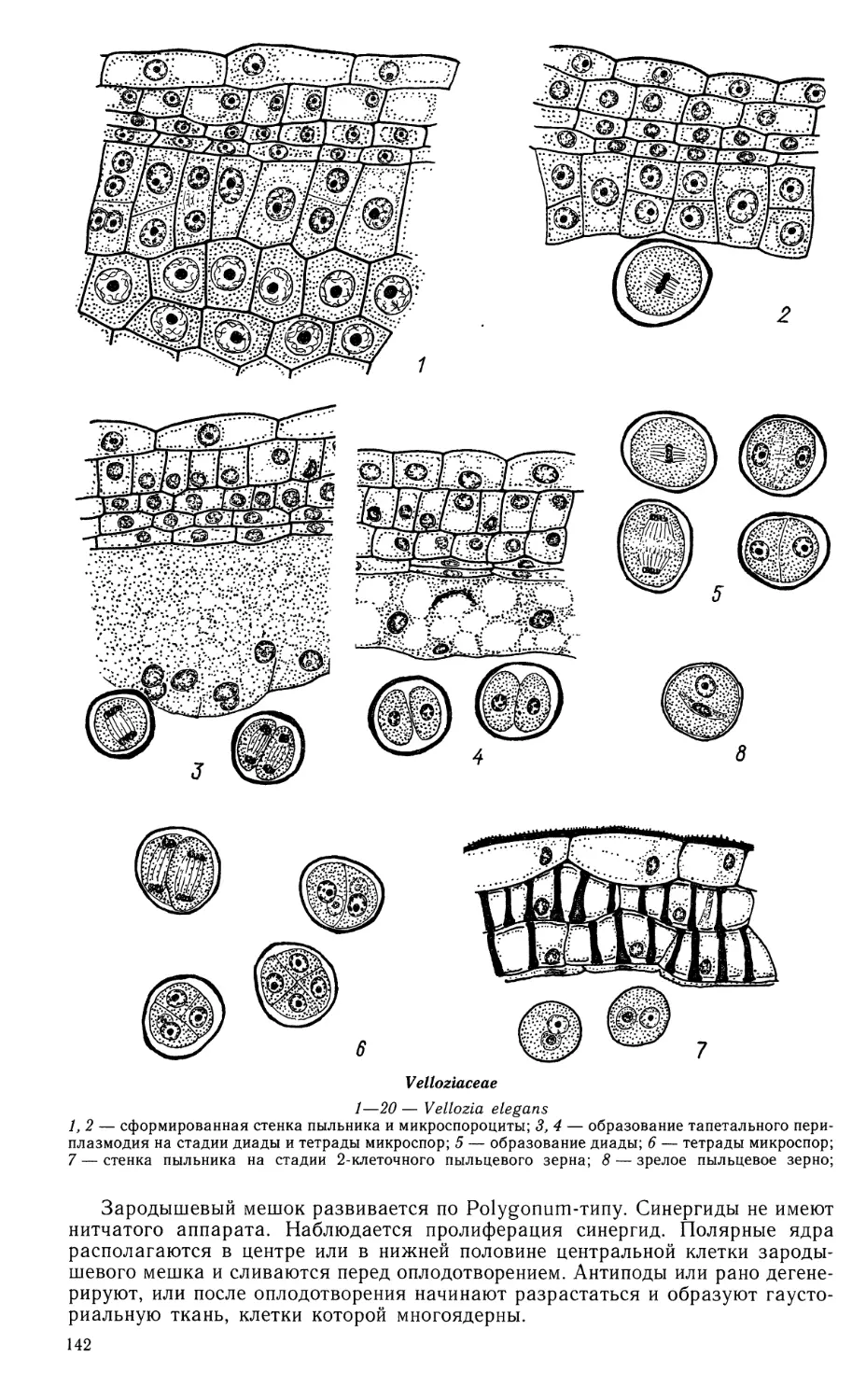
Пыльник 4-гнездный. Развитие стенки гнезда пыльника детально не
прослежено. Сформированная стенка у Butomopsls lanceolata 4-слойная.
Единственный средний слой эфемерен, эпидермис и эндотеций сохраняются в зрелом
пыльнике. Тапетум периплазмодиальный. Первоначально тапетум состоит
из одноядерных клеток. После растворения их оболочек протопласты
внедряются в пыльцевое гнездо и сливаются в единую массу, образуя
периплазмодий. На стадии выделения микроспор из тетрады ядра тапетума занимают
периферическое положение, а в процессе развития микроспор перемещаются
внутрь гнезда, равномерно распределяясь между ними. Тапетум расходуется
в процессе созревания пыльцевых зерен. Спорогенная ткань многослойная.
Мейоз в микроспороцитах происходит по сукцессивному типу, тетрады
микроспор обычно тетраэдральные и изобилатеральные, иногда Т-образные и
линейные. Зрелые пыльцевые зерна шаровидные, 3-клеточные, с веретеновидными
спермиями.
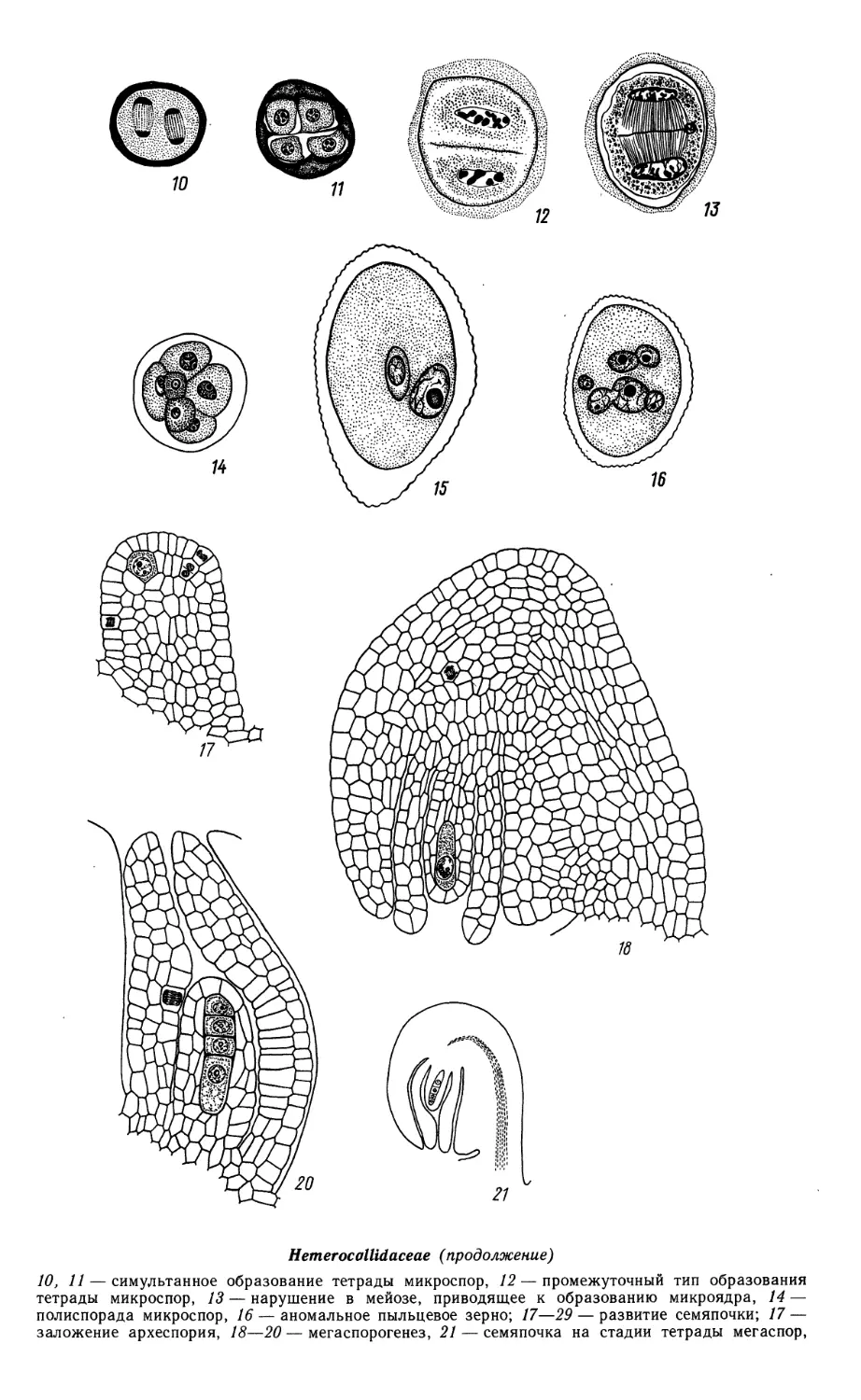
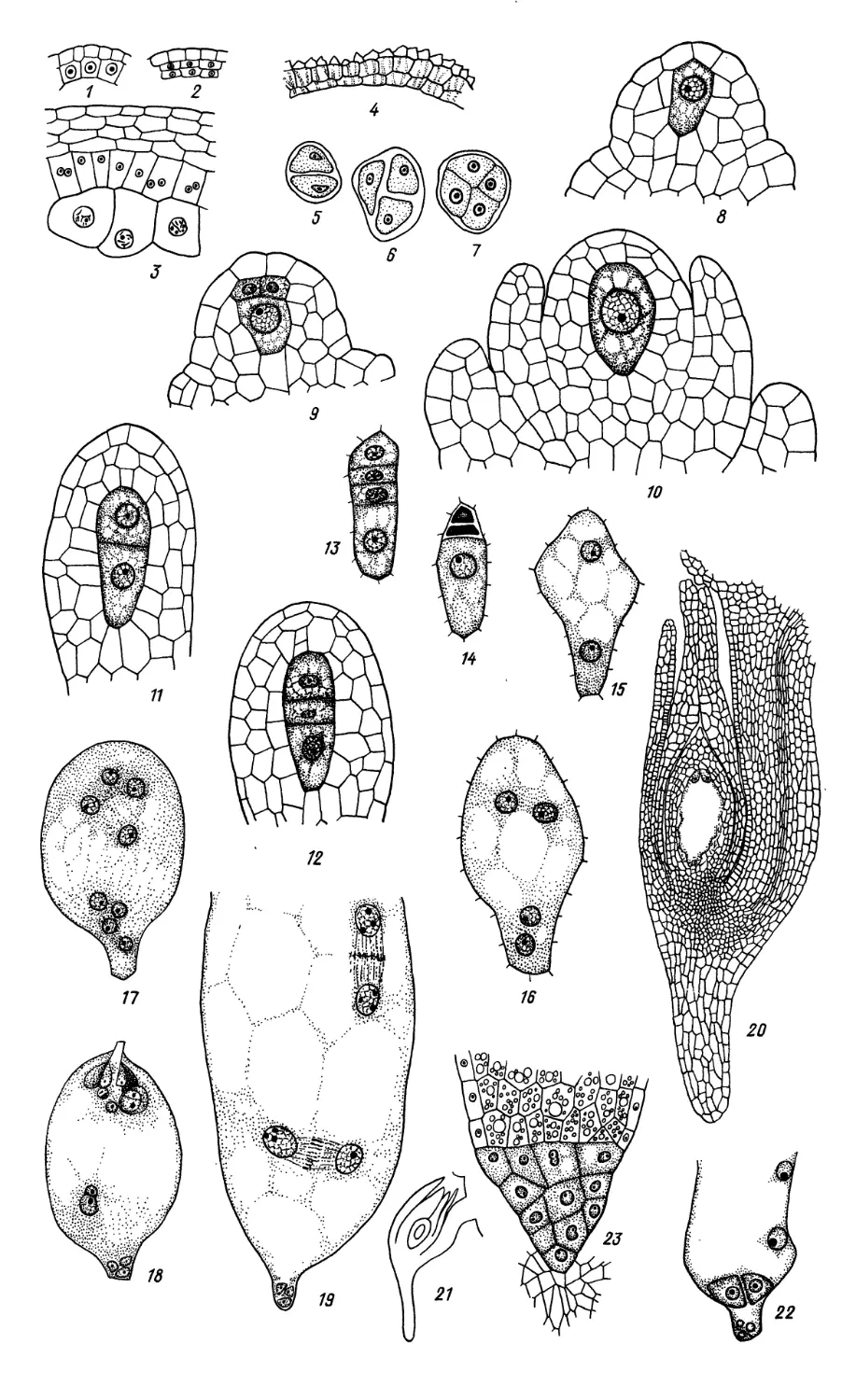
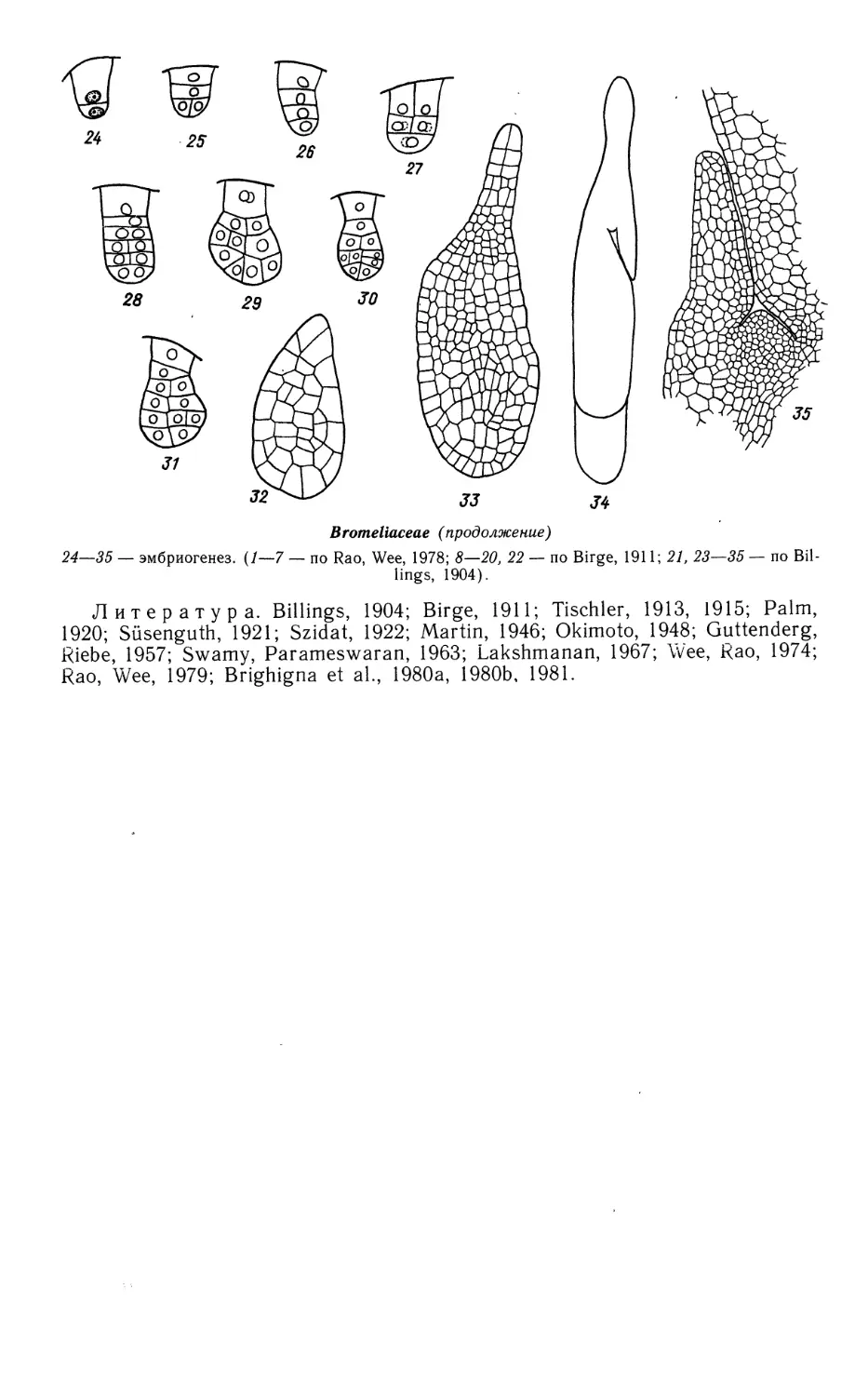
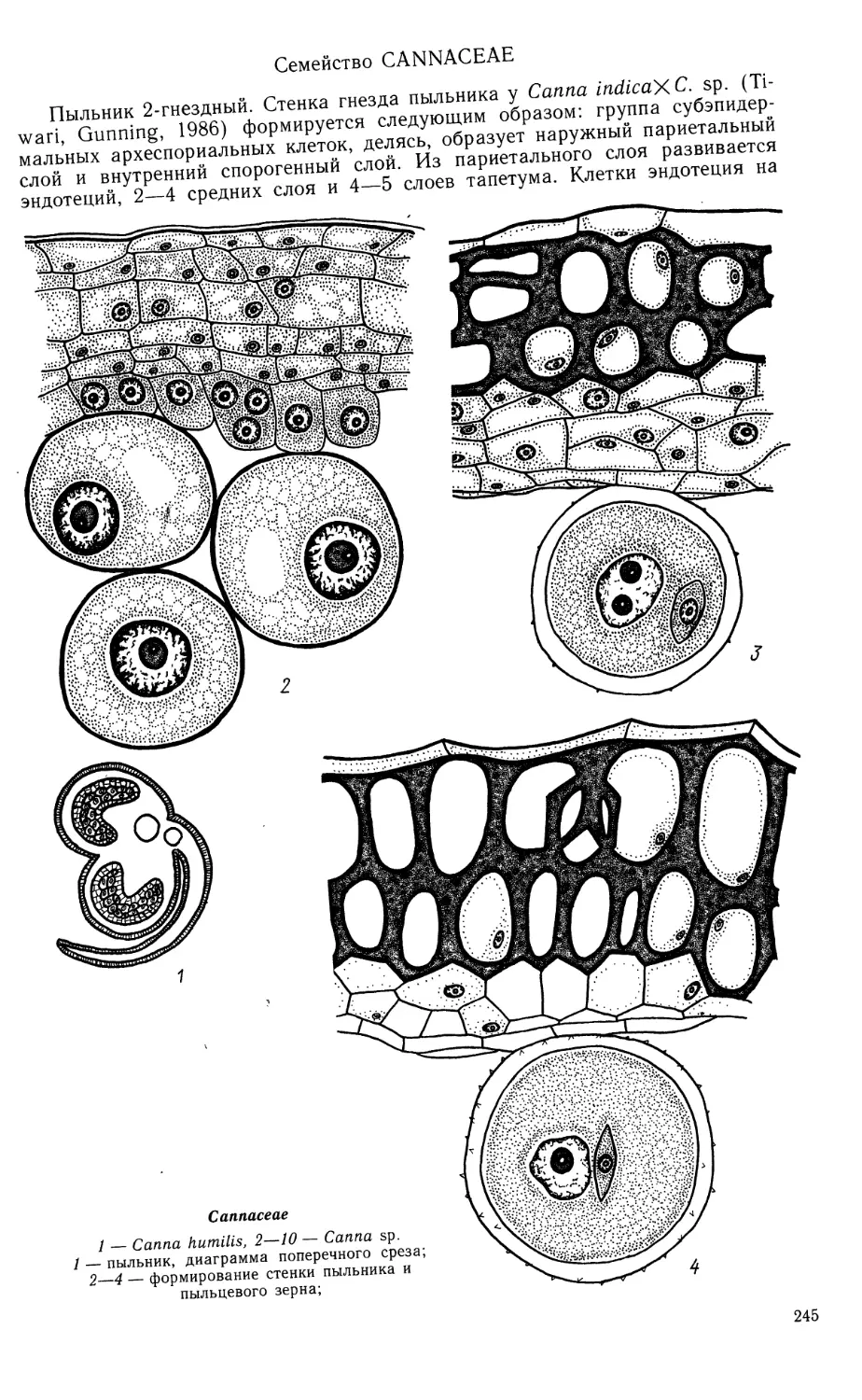
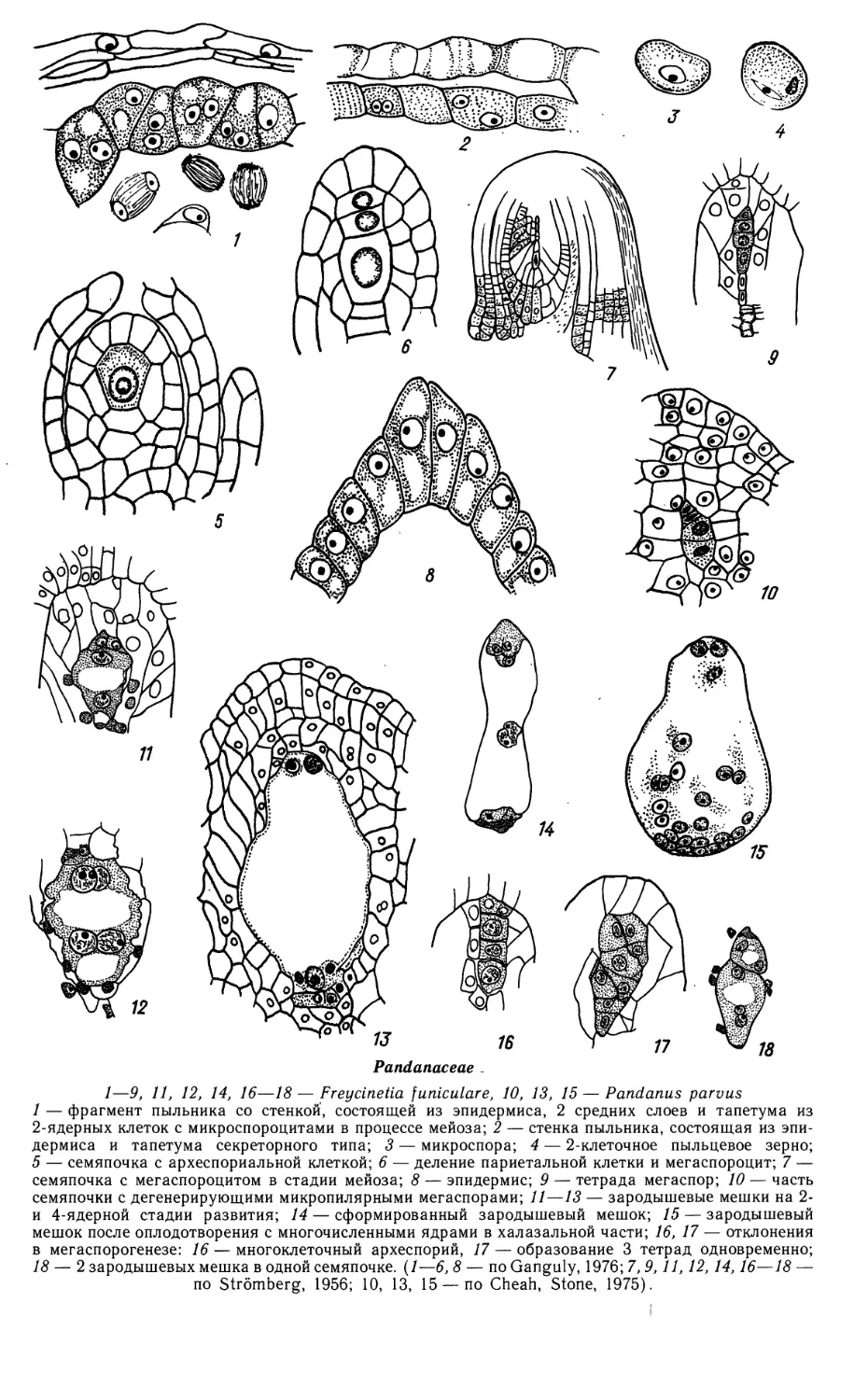
Limnocharitaceae
1—9, 15, 16, 19, 21, 22 — Butomopsis lanceolata, 10—14, 17, 18, 20 — Limnocharis emarginata
1—4 — фрагменты гнезда пыльника на разных стадиях его развития; 5—9 — микроспорогенез
(5—7) и развитие пыльцевого зерна (8, 9);
14
Limnocharitaceae (продолжение)
10—15 — мегаспорогенез и ранние стадии развития семяпочки; 16, 17 — 4-ядерная стадия
зародышевого мешка; 18, 19 — сформированный {18) и оплодотворенный (19) зародышевые мешки;
20 — строение семяпочки, готовой к оплодотворению; 21 — проэмбрио и 2-клеточный эндосперм
гелобиального типа; 22 — зародыш в период органообразования. (/—9,15, 16, 19, 21, 22 — no Johri,
1936; 10—14, 17, 18, 20 — по Johri, 1938).
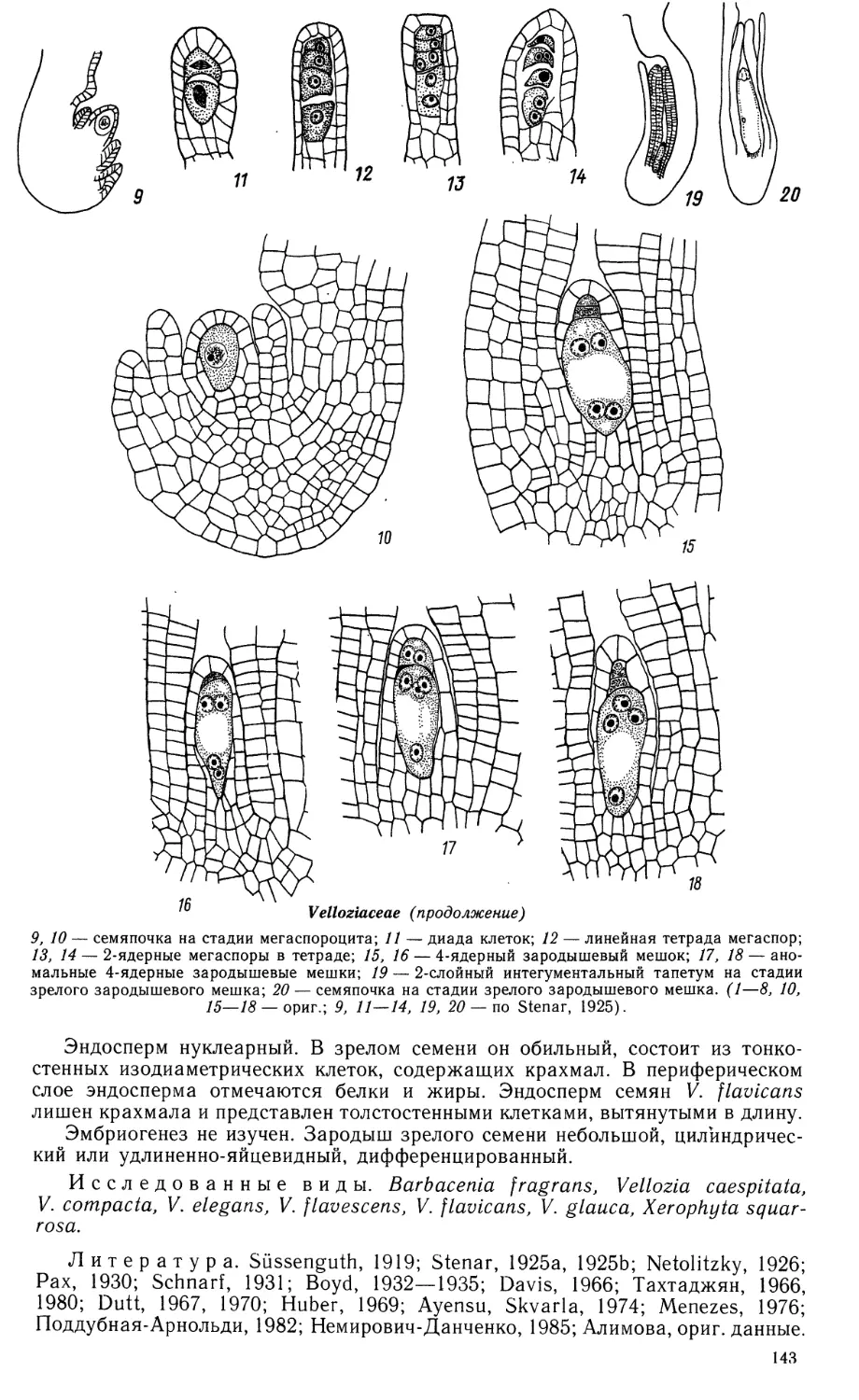
Семяпочка анатропная, с 2 интегументами, тенуинуцеллятная. Интегу-
менты тонкие, состоят из 2 слоев клеток. Микропиле формируется только
внутренним интегументом. Нуцеллус большей частью 2-слойный за счет деления
клеток эпидермиса. По мере созревания семени нуцеллус превращается в слой
облитерированных клеток. Археспорий одноклеточный, не отделяет кроющей
клетки, а дифференцируется непосредственно в мегаспороцит.
Зародышевый мешок биспорический, развивается по редуцированному
Allium-типу из халазальной клетки диады у В. lanceolata, Hydrocleis nymphoides
и Limnocharis emarginata (Johri,e 1936, 1938a, 1938b). Для этих видов наиболее
характерны 5-ядерные зародышевые мешки с одной антиподальной клеткой и
одним (микропилярным) полярным ядром. Их образование обусловлено
депрессией халазального ядра на 2-ядерной стадии развития зародышевого мешка.
Однако наряду с 5-ядерными встречаются и 6-, 7- и 8-ядерные зародышевые
мешки в зависимости от степени активности халазального ядра. Яйцевой
аппарат всегда 3-клеточный. Центральная клетка с одним или 2 полярными ядрами,
антиподальный аппарат в большинстве случаев редуцирован до одной клетки.
Оплодотворение порогамное, двойное. Пыльцевая трубка входит в
зародышевый мешок через одну из синергид.
Эндосперм гелобиального типа. Первая поперечная перегородка разделяет
эндосперм на 2 клетки-камеры. Небольшая халазальная остается одноядерной,
в микропилярной камере происходят свободноядерные деления. В зрелом семени
эндосперм отсутствует.
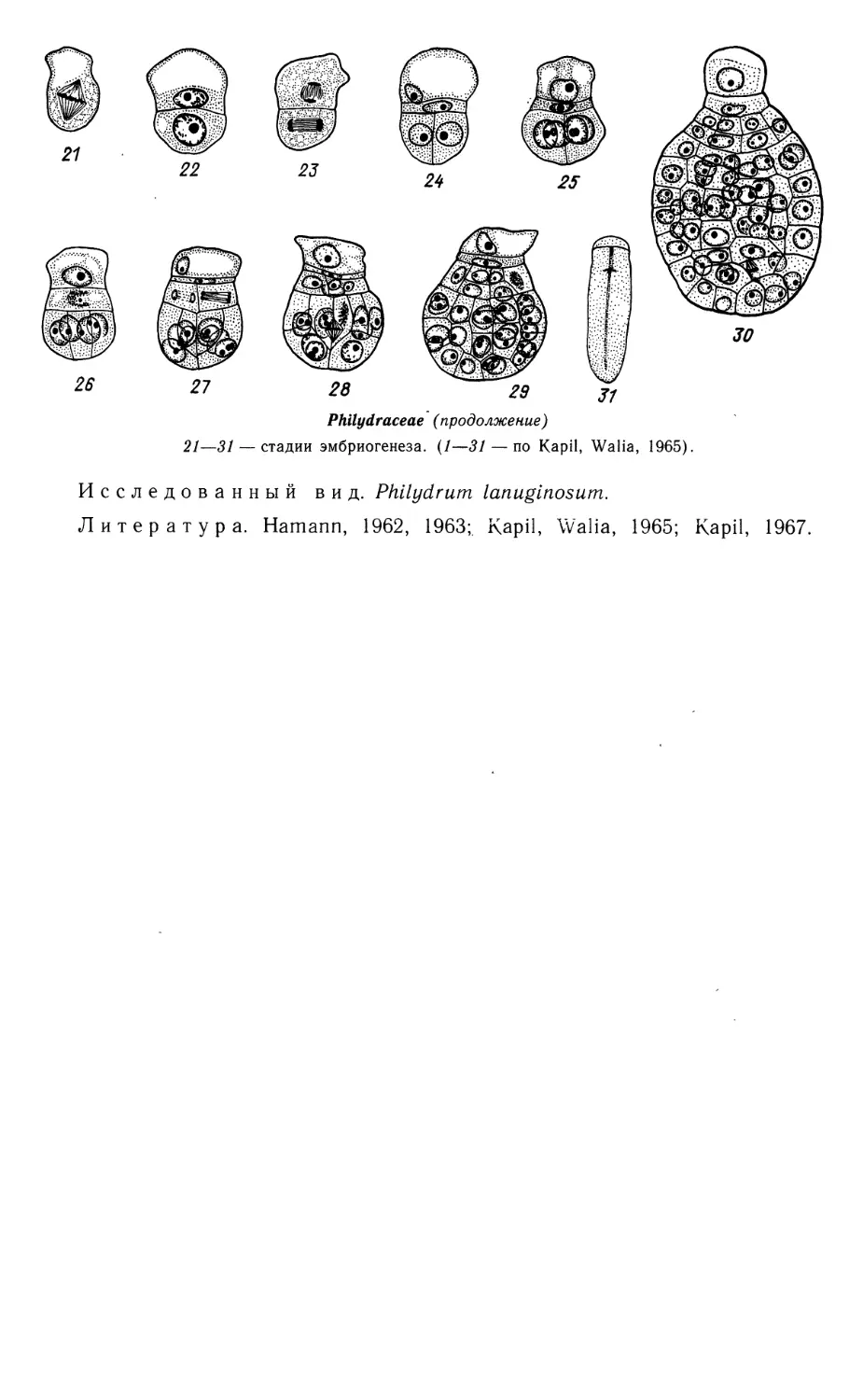
Эмбриогенез происходит в соответствии с Caryophyllad-типом развития.
Характерна крупная везикулярная клетка суспензора. Зародыш в зрелом
семени хорошо развит, подковообразно изогнут, расчленен на длинную
семядолю, апекс побега, короткий гипокотиль и зародышевый корень.
Полиэмбриония отмечена у L. emarginata.
Исследованные виды. Butomopsis (=Tenagocharis) lanceolata,
Hydrocleis nymphoides, Limnocharis emarginata.
Литература. Hall, 1902; Nitzschke, 1914; Sussenguth, 1921; Tischler,
1915; Herrig, 1919; Palm, 1920; Clausen, 1927; Johri, 1936, 1938a, 1938b; Ma-
heshwari, 1943; Johri, Bhatnagar, 1957; Вышенская, 1985.
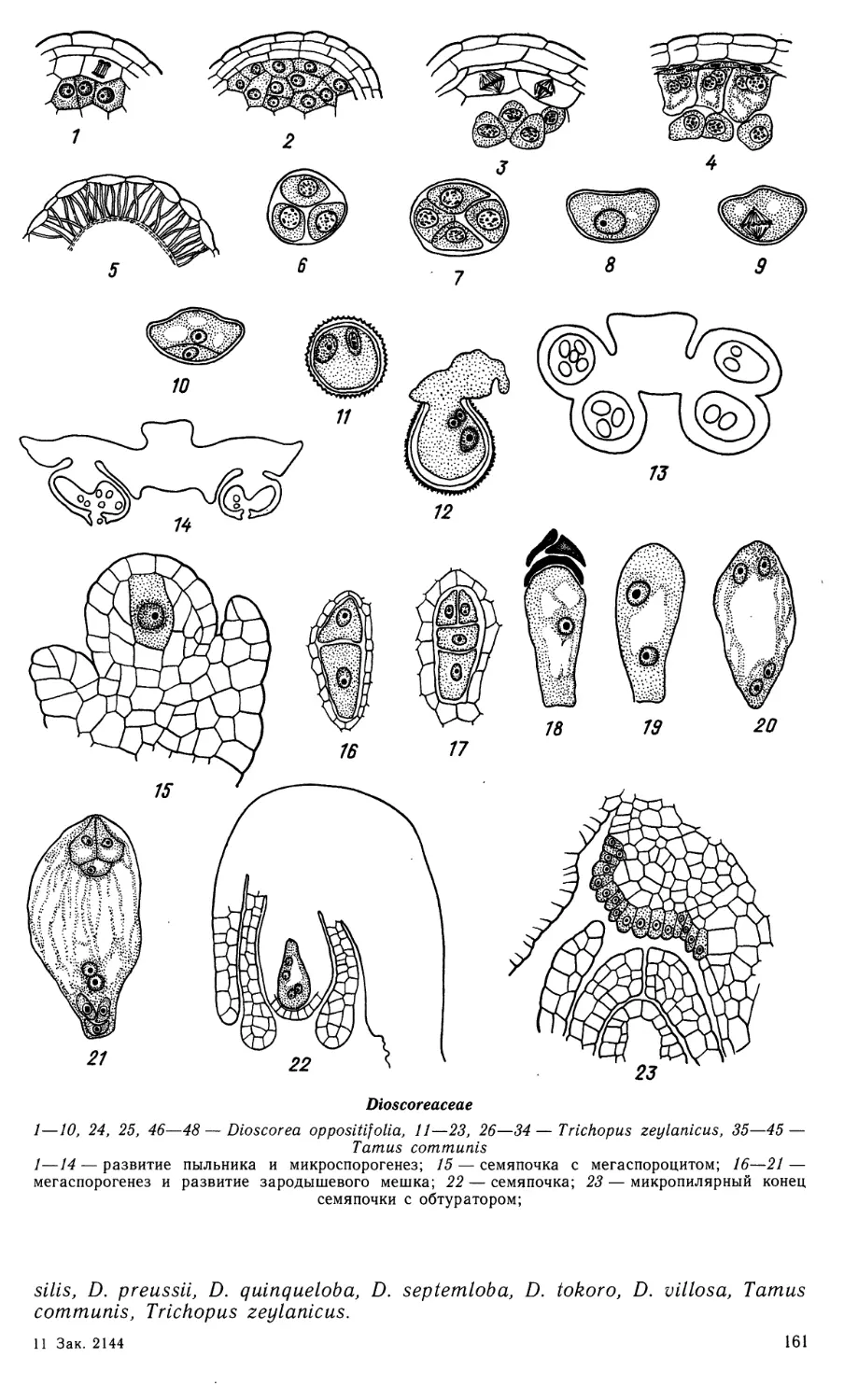
Семейство ALISMATACEAE
Пыльник 4-гнездный. Стенка гнезда пыльника развивается в
центростремительном направлении (по типу однодольных), в сформированном состоянии
она обычно состоит из эпидермиса, эндотеция, одного среднего слоя и тапетума.
Средний слой эфемерен. Тапетум периплазмодиальный, одноядерные клетки
тапетума на стадии метафазы в микроспороцитах теряют свои целлюлозные
оболочки, а позднее их протопласты внедряются внутрь гнезда, а затем
сливаются на стадии обособившихся из тетрады микроспор. Между последними
равномерно распределяются ядра тапетума. На стадии вакуолизации микроспор
в цитоплазме периплазмодия появляются гранулы полленкита. Лизис тапетума
происходит во время созревания пыльцевых зерен. Спорогенная ткань
многослойная. Микроспороциты делятся сукцессивно, тетрады микроспор чаще всего
изобилатеральные, но встречаются крестообразные, линейные и Т-образные
тетрады. Характерна толстая каллозная оболочка, окружающая микроспороциты
во время прохождения мейоза. Она разрушается во время распада
образовавшихся тетрад микроспор. В зрелом пыльнике пыльцевые зерна 3-клеточные,
у Alisma plantago-aquatica они могут прорастать в гнезде пыльника (Кудряшов,
Савич, 1963). Спермии округлые или, чаще, веретеновидные.
Семяпочка анатропная или амфитропная, с 2 интегументами,
тенуинуцеллятная. Интегументы 2-слойные. Микропиле сформировано внутренним
интегументом, края которого, состоящие из 3—4 слоев, плотно смыкаются. У видов
Alisma, Echinodorus, Sagittaria сосудистый пучок семяпочки заканчивается
в халазе. Нуцеллус развит слабо, в микропилярной зоне представлен слоем
эпидермиса или 2 его производными, в латеральной обычно 2-слойный. У A.
plantago-aquatica нуцеллус разрушается на ранней стадии развития эндосперма,
16
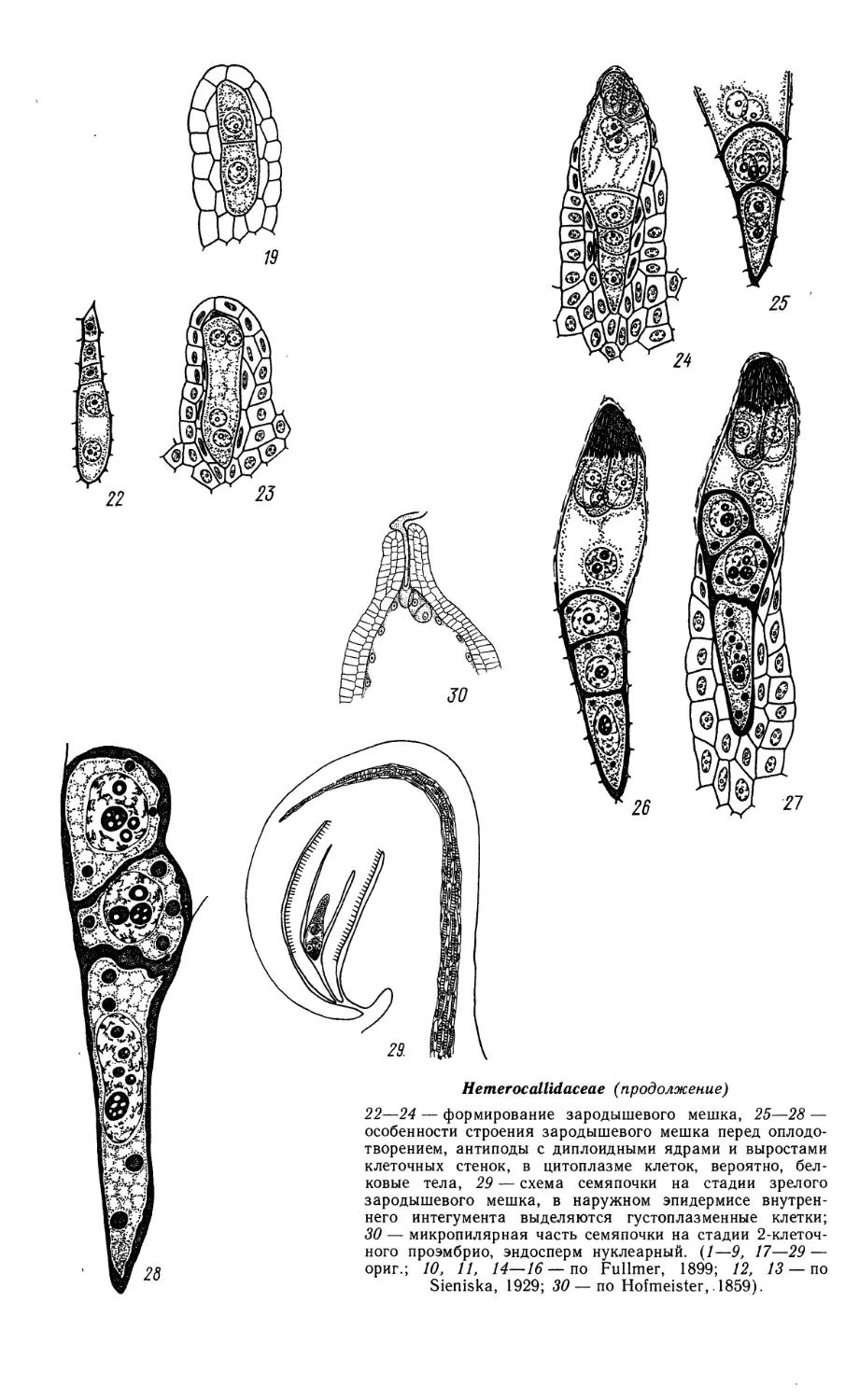
Alismataceae
1—9, 11, 12, 17 — Alisma plantago-aquatlca; 10, 13, 15 — Echinodorus macrophyllus; 18—24, 27 —
Sagittaria guayanensis; 14, 16, 25, 26 — S. sagittifolia.
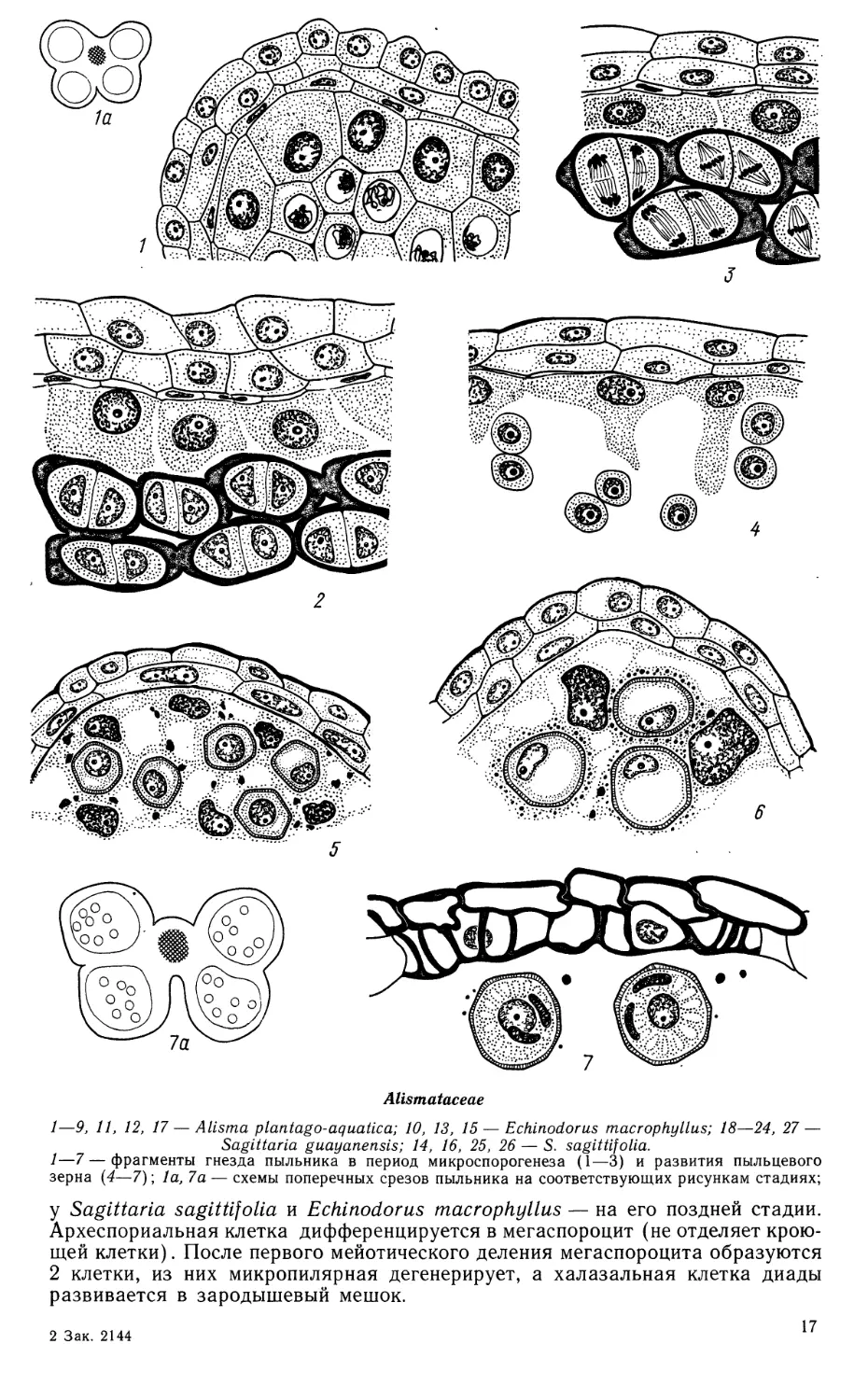
1—7—фрагменты гнезда пыльника в период микроспорогенеза (1—3) и развития пыльцевого
зерна (4—7); 1а, 7а — схемы поперечных срезов пыльника на соответствующих рисункам стадиях;
у Sagittaria sagittifolia и Echinodorus macrophyllus — на его поздней стадии.
Археспориальная клетка дифференцируется в мегаспороцит (не отделяет
кроющей клетки). После первого мейотического деления мегаспороцита образуются
2 клетки, из них микропилярная дегенерирует, а халазальная клетка диады
развивается в зародышевый мешок.
2 Зак. 2144
17
Atismataceae (продолжение)
8—13 — мегаспорогенез и развитие зародышевого
мешка; 14 — семяпочка со зрелым зародышевым
мешком; 15 — 2-клеточный проэмбрио и гелобиаль-
ный эндосперм с микропилярнои и халазальнои
«камерами»; 16 — семяпочка на стадии 2-клеточного
проэмбрио и 2-ядерной микропилярнои камеры
эндосперма;
ХЛ$
Alismataceae (продолжение)
17 — семяпочка, содержащая проэмбрио и нуклеарный эндосперм (схема); 17а — фрагмент
микропилярной части семяпочки: виден проэмбрио с крупной базальной клеткой суспензора,
окруженный ядерным эндорпермом; 176 — фрагмент халазальной части семяпочки с небольшим
постаментом нуцеллуса и эндоспермом в свободноядерном состоянии; 18—26 — развитие
зародыша; 27 — зрелый зародыш, (вн. ин — внутренний интегумент, н. ин — наружный интегумент,
н — нуцеллус, м. к. э — микропилярная и х. к. э — халазальная камеры эндосперма). (/—7, 14, 16,
17, 17а, 176 — ориг.; 8, 9, 11, 12 — по Johri, 1936; 10, 13, 15 — по Dahlgren, 1934; 18—24, 27 — по
Johri, 1935; 25, 26 — по Swamy, 1980).
Зародышевый мешок биспорический, Allium-типа, обычно с редуцированным
числом ядер: до 5 у Echinodorus ranunculoides (Dahlgren, 1928) или до 6 у
представителей родов Alisma, Sagittaria, Limnophyton вследствие отсутствия
деления одного или обоих халазальных ядер 4-ядерного зародышевого мешка
(Dahlgren, 1934; Johri, 1935a, 1935b, 1935c, 1936). У этих же видов могут
встречаться 7- и 8-ядерные зародышевые мешки. Существует мнение, что типичными
являются 8-ядерные зародышевые мешки (Schaffner, 1896; Murthy, 1935).
Яйцевой аппарат 3-клеточный. Синергиды с заостренными микропилярными
концами имеют нитчатый аппарат (Sagittaria guayanensis — Johri, 1935;
S. sagittifolia — ориг.). Полярные ядра сливаются до оплодотворения.
Антиподы варьируют по числу клеток, могут быть представлены 3, 2 или одной
клеткой или 1—2 ядрами. В процессе созревания зародышевый мешок значительно
удлиняется и начинает изгибаться.
2*
19
Эндосперм развивается по гелобиальному или нуклеарному типам.
Характерна U-образная форма эндосперма, приобретаемая им на стадии
глобулярного зародыша. У видов с гелобиальным эндоспермом (Sagittaria latifolia,
S. sagittifolia, S. graminae, E. macrophyllus) при первом делении образуются
2 клетки-камеры: небольшая халазальная и более крупная микропилярная.
Халазальная камера 1—2-ядерная, функционирует, вероятно, как гаусторий.
В микропилярной камере происходят свободноядерные деления; ядра
распределяются в постепенном слое цитоплазмы. У некоторых видов отмечен нуклеарный
тип эндосперма (Alisma plantago, Damasonium stellatum, Elisma natans).
В халазальной части эндосперма у A. plantago-aquatica (ориг.) наблюдается
скопление цитоплазмы и ядер, варьирующих по размерам и форме. Клетко-
образование начинается с халазального полюса эндосперма. Зародыш во время
своего развития, как правило, окружен ядерным эндоспермом. В зрелом семени
эндосперм отсутствует.
Эмбриогенез Caryophyllad-типа. Зигота делится поперечно на клетки са и cb.
Базальная клетка cb далее не делится и становится крупной пузыревидной
клеткой суспензора. Для нее характерны полиплоидизация ядра (Nagl, 1962;
Bohdanowicz, 1987) и образование складчатых утолщений оболочки в базальной
части (Bohdanowicz, 1987; ориг.). Проведено гистохимическое исследование
эмбриогенеза у Limnophyton obtusifolium (Shah, Pandey, 1978). Зародыш
в зрелом семени U-образно изогнут, дифференцирован на семядолю, гипокотиль,
апе^с побега и зародышевый корень. У Alisma, Echinodorus, Sagittaria зародыш
бесцветный (Яковлев, Жукова*, 1973).
Отмечены случаи полиэмбрионии синергидного происхождения у Sagittaria
graminea (Johri, 1936).
Исследованные виды. Alisma lanceolatum, A. plantago, A. plantago-
aquatica, Damasonium alisma, D. stellatum, Echinodorus macrophyllus, E. ra-
nunculoides, Elisma natans, Limnophyton obtusifolium, Machaerocarpus califor-
nicus, Sagittaria graminea, S. guayanensis, S. lancifolia, S. latifolia, S. sagittifo-
lia, S. variabilis.
Литература. Hofmeister, 1859, 1861; Hanstein, 1870;. Фаминцин, 1879;
Fischer, 1880; Schaffner, 1896, 1897; Lotscher, 1905; Cook, 1907; Sykes, 1909;
Nitzschke, 1914; Soueges, 1917a, 1917b, 1931; Stenar, 1925; Clausen, 1927;
Dahlgren, 1928, 1934; Lemesle, 1929; Johri В. М., 1933, 1934a, 1934b, 1935a,
1935b, 1935c, 1936; Murthy S. K. N., 1933a, 1933b, 1935; Maheshwary, Singh,
1943; Maheshwari, 1955; Nagl, 1962; Кудряшов, Савич, 1963; Кудряшов, 1964;
Pogan, 1965; Fray, 1966; Савич, 1967, 1968; Bohdanowicz, 1973, 1987; Serba-
nescu, 1973; Яковлев, Жукова, 1973, 1980; Ly Thi Ba, Guignard, 1976; Shah,
Pandey, 1978; Swamy B. G. L., 1980; Ly Thi Ba, 1981; Padmanabhan, 1987;
Никитичева, ориг. данные.
Семейство HYDROCHARITACEAE
Пыльник 4-гнездный, реже — 2-гнездный (Elodea canadensis, Philotria).
Стенка гнезда пыльника развивается по центростремительному типу и состоит
из эпидермиса, эндотеция, 1—2 средних слоев и тапетума. Тапетум периплазмо-
диальный. В эндотеции фиброзные утолщения не образуются, кроме Ottelia.
Образование тетрад микроспор сукцессивное. ^етрады микроспор линейные,
изобилатеральные, крестообразные. Зрелые пыльцевые зерна 3-клеточные, за
исключением Ottelia и Blyxa octandra, у которых они 2-клеточные.
Семяпочка анатропная (Blyxa, Halophila, Ottelia, Stratiotes), ортотропная
(Lagar о siphon, Nechamandra, Vallisneria), гемитропная (Hydrilla verticcillata),
с 2 интегументами, крассинуцеллятная. Микропиле образовано внутренним
интегументом. У Blyxa oryzetorum в его формировании участвуют оба интегу-
мента. Первичная париетальная клетка образует 2—4 париетальных слоя,
за исключением Ottelia (Narasimhamurthy, 1935) и Stratiotes (Baude, 1956),
у которых париетальная клетка не отделяется. Археспориальная клетка одна,
реже — 2. Тетрады мегаспор линейные, Т-образные или тетраэдральные.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
20
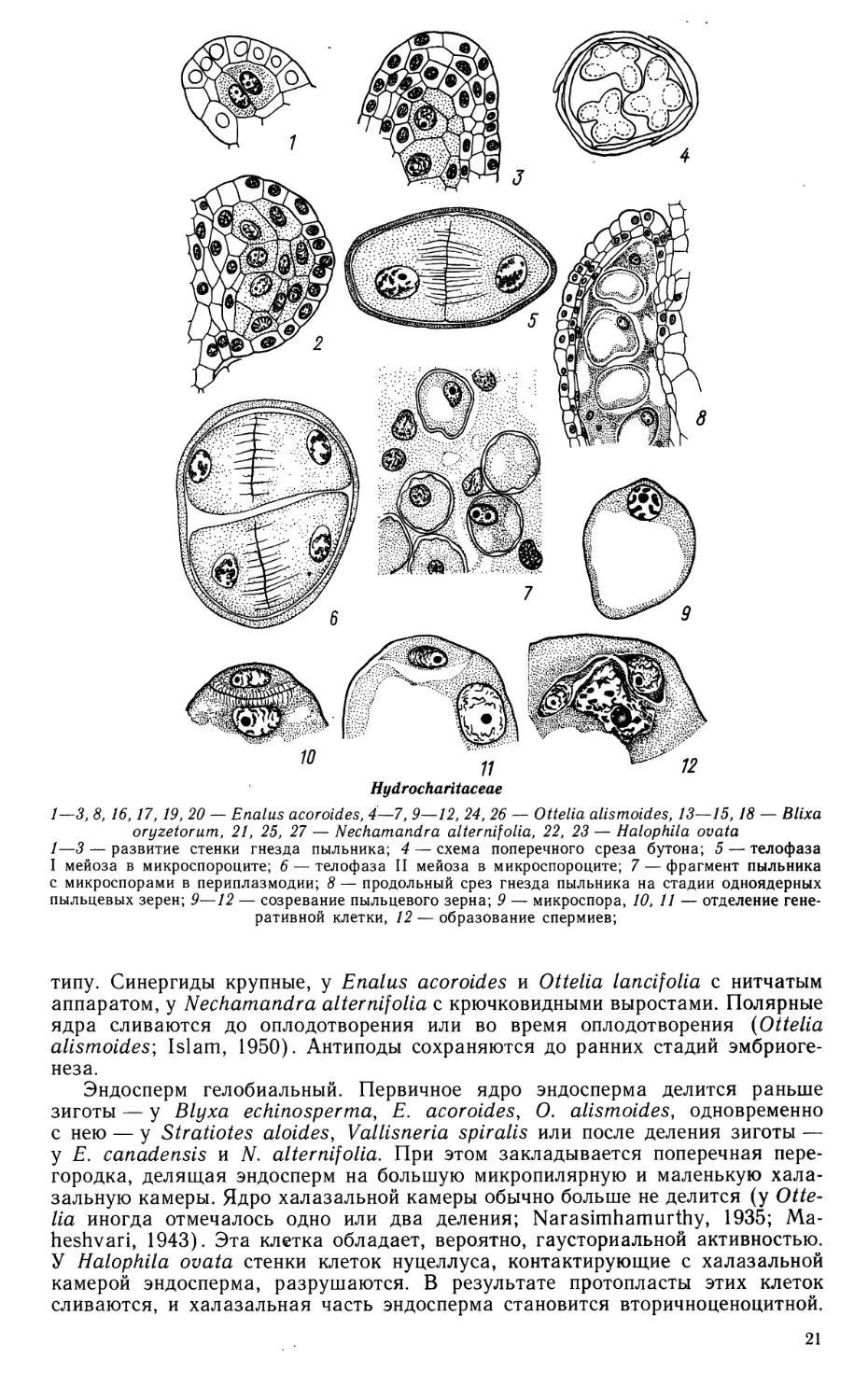
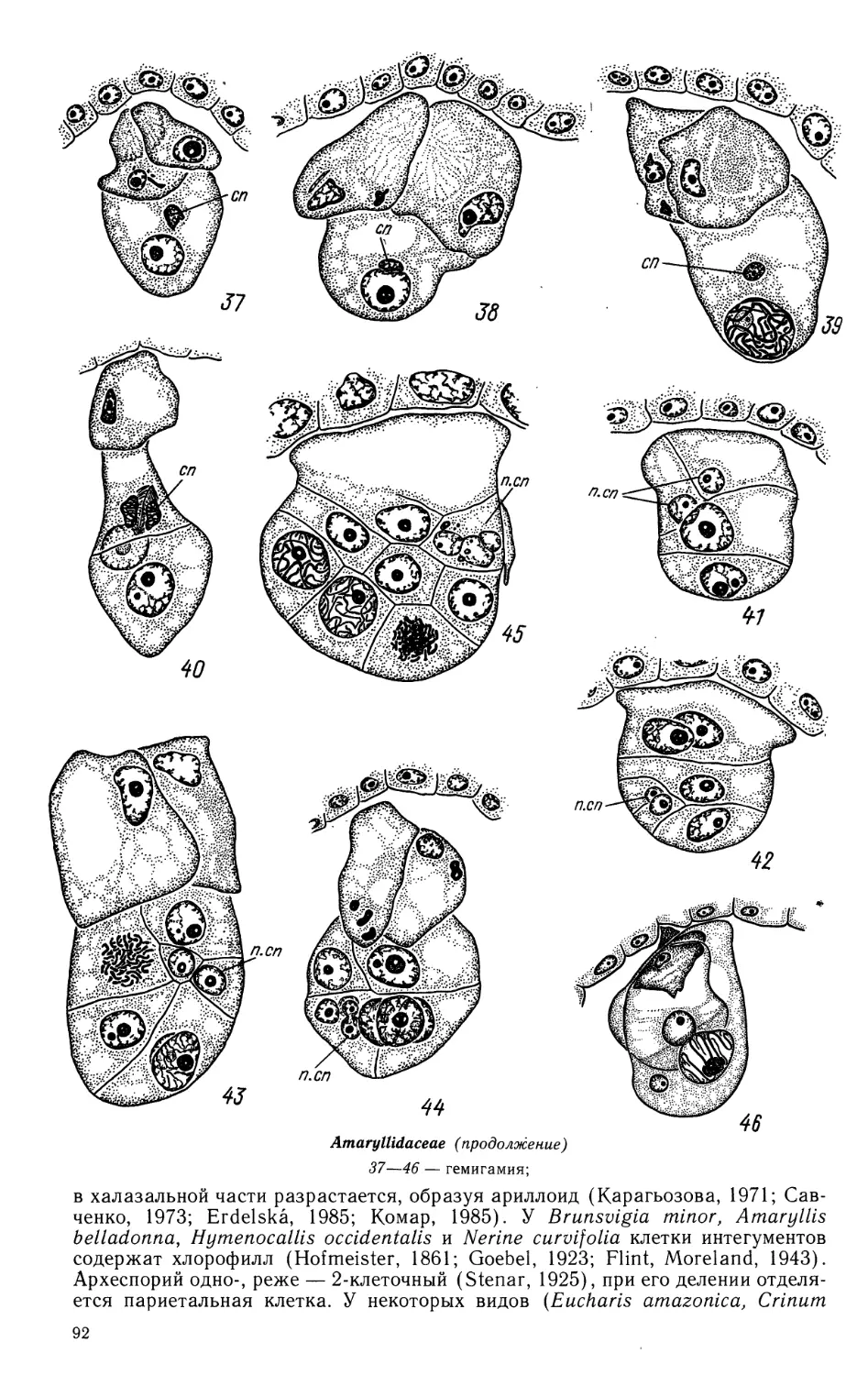
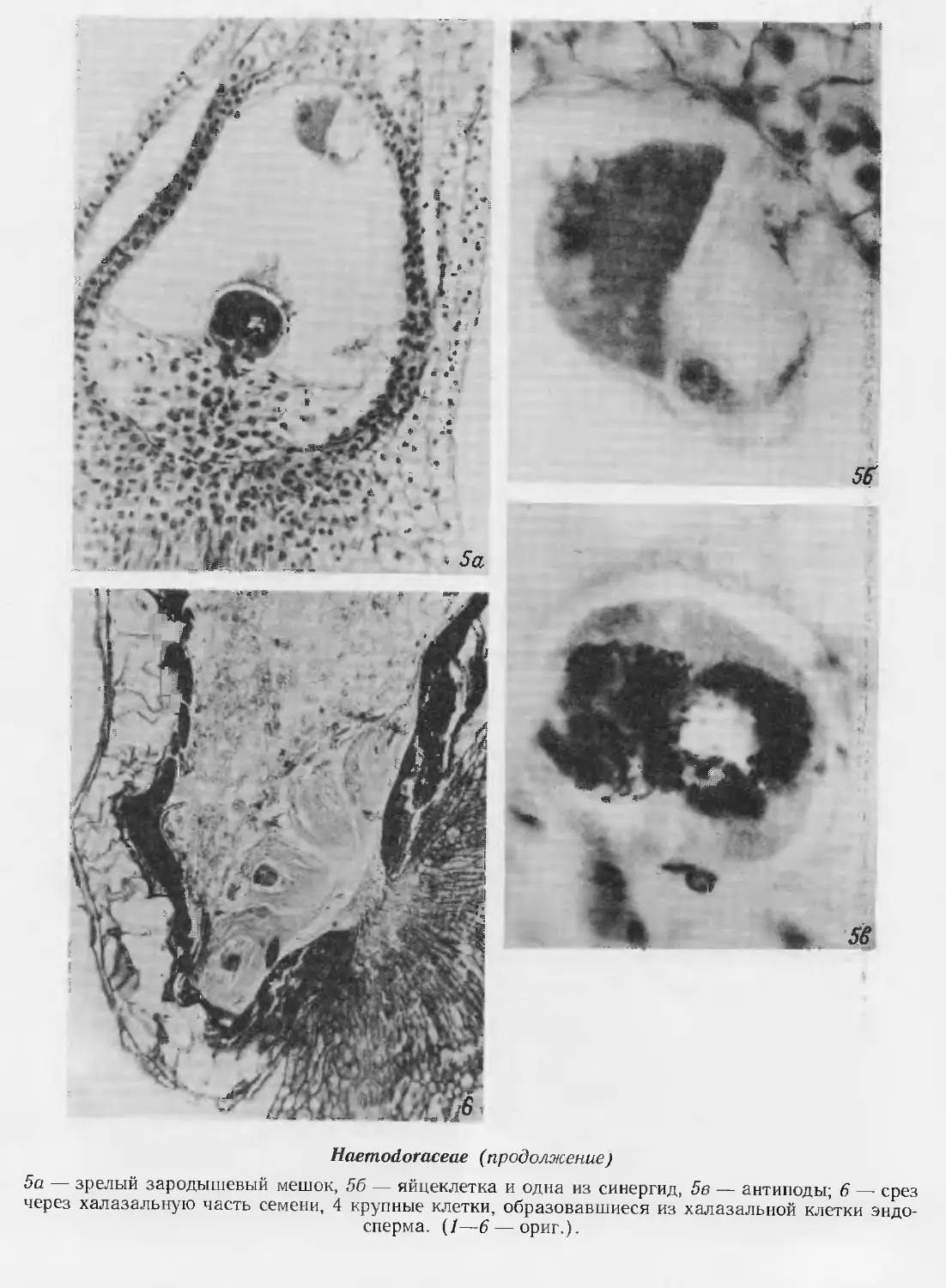
1—3, 8, 16,17, 19, 20 — Enalus acoroides, 4—7, 9—12, 24, 26 — Ottelia alismoides, 13—15,18 — Blixa
oryzetorum, 21, 25, 27 — Nechamandra alternifolia, 22, 23 — Halophila ovata
1—3 — развитие стенки гнезда пыльника; 4 — схема поперечного среза бутона; 5 — телофаза
I мейоза в микроспороците; 6 — телофаза II мейоза в микроспороците; 7 — фрагмент пыльника
с микроспорами в периплазмодии; 8 — продольный срез гнезда пыльника на стадии одноядерных
пыльцевых зерен; 9—12 — созревание пыльцевого зерна; 9 — микроспора, 10, 11 — отделение
генеративной клетки, 12 — образование спермиев;
типу. Синергиды крупные, у Enalus acoroides и Ottelia lancifolia с нитчатым
аппаратом, у Nechamandra alternifolia с крючковидными выростами. Полярные
ядра сливаются до оплодотворения или во время оплодотворения (Ottelia
alismoides; Islam, 1950). Антиподы сохраняются до ранних стадий
эмбриогенеза.
Эндосперм гелобиальный. Первичное ядро эндосперма делится раньше
зиготы — у Blyxa echinosperma, E. acoroides, О. alismoides, одновременно
с нею — у Stratiotes aloides, Vallisneria spiralis или после деления зиготы —
у Е. canadensis и N. alternifolia. При этом закладывается поперечная
перегородка, делящая эндосперм на большую микропилярную и маленькую хала-
зальную камеры. Ядро халазальнои камеры обычно больше не делится (у
Ottelia иногда отмечалось одно или два деления; Narasimhamurthy, 1935; Ма-
heshvari, 1943). Эта клетка обладает, вероятно, гаусториальной активностью.
У Halophila ovata стенки клеток нуцеллуса, контактирующие с халазальнои
камерой эндосперма, разрушаются. В результате протопласты этих клеток
сливаются, и халазальная часть эндосперма становится вторичноценоцитной.
21
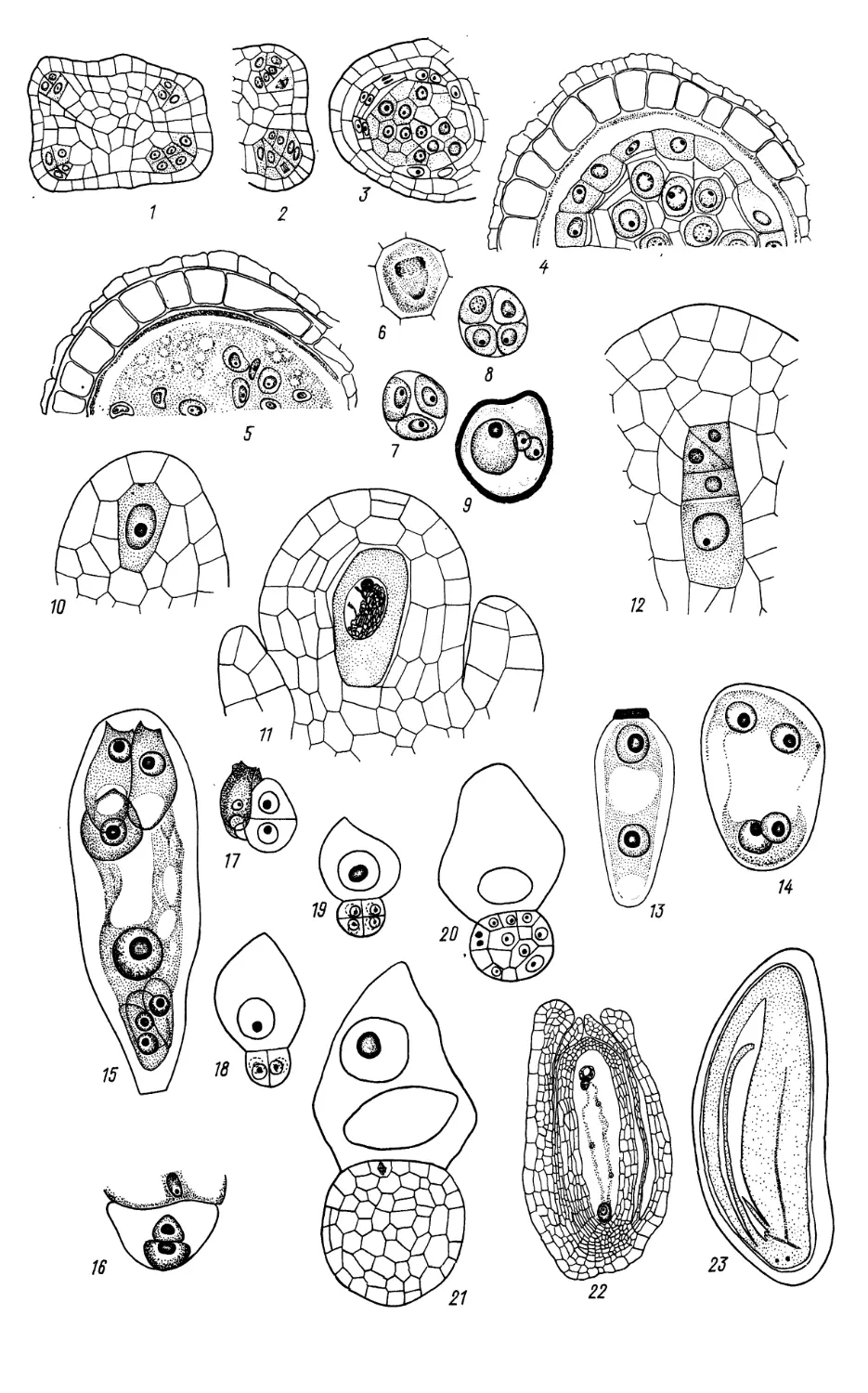
Hydrocharitaceae (продолжение)
13 — семяпочка с париетальной и спо-
рогенной клетками; 14 — мегаспороцит;
15 — тетрада мегаспор; 16 —
функционирующая мегаспора; 17 — зрелый
зародышевый мешок; 18 — семяпочка на
стадии зрелого зародышевого мешка;
19 — микропилярная часть
зародышевого мешка вскоре после
оплодотворения; 20 — халазальная камера
эндосперма; 21, 22 — ценоцитная стадия
развития эндосперма; 23 — клеточная
стадия развития эндосперма; 24 —
ранние стадии эмбриогенеза; 25 —
дифференцирующийся зародыш; 26 —
созревающее семя; 27 — одновременное
развитие 2 зародышей в семени. (/—3,
8 —по Kausik, 1941; 16, 17, 19, 20 —
по Kausik, 1940; 4—7, 9—12, 24, 26 —
по Islam, 1950; 13—15, 18— по Govin-
dappa, Naidu, 1956; 21, 25, 27 — по
Lakshmanan, 1963b; 22, 23 — no Laksh-
manan, 1963a).
Образовавшийся «базальный аппарат» может включать различное число
нуцеллярных ядер в дополнение к собственному ядру халазальной камеры
эндосперма (Lakshmanan, 1963a). В микропилярной камере эндосперма
проходит ряд свободноядерных делений. У Blyxa octandra халазальная часть
микропилярной камеры эндосперма во время свободноядерной стадии
внедряется в ткани семяпочки по направлению к халазе, активно разрушая
окружающие клетки. В результате халазальная камера эндосперма
оказывается смещенной на боковую сторону (Lakshmanan, 1961). У В. echinosperma
(Rangaswamy, 1941) и О. alismoides (Islam, 1950) ядра эндосперма
дегенерируют до начала клеткообразования, но у других видов на последующих стадиях
развития в эндосперме происходит клеткообразование. В зрелом семени
эндосперм не сохраняется.
Эмбриогенез Caryophyllad-типа Saggittaria-вариации. Короткий подвесок
заканчивается крупной базальной клеткой. Зародыш прямой, хорошо
дифференцированный, занимает весь объем зрелого семени. Содержит жиры или
крахмал. Лейкоэмбриофиты.
Полиэмбриония отмечена у N. alterniphollia (Lakshmanan, 1963b).
Исследованные виды. Blyxa echinosperma, В. octandra, В. oryzeto-
rum, Elodea canadensis, Enalus acoroides, Halophila ovata, H. stipulacea, Hyd-
rilla verticillata, Hydrocharis morsus-ranae, Lagarosiphon roxburghii, Necha-
mandra alternifolia, Ottelia alismoides, O. lancifolia, Stratoites aloides, Thalassia
hemprichii, Vallisneria spiralis.
Литература. Caspary, 1860; Elfving, 1879; Tassi, 1900; Burr, 1903;
Svedelius, 1904; Wylie, 1904, 1923, 1941; Raddle, 1905; Shurhoff, 1926; Clausen,
1927; Wager, 1928; Tuschnjakova, 1929; Troll, 1931; Maheshvari, 1933b, 1934a,
1943a; Rangasamy, 1934; Narasimhamurthy, 1935; Kausik, 1939b, 1940a, 1941a;
Kausik, Rao, 1942; Ernst-Schwarzenbach, 1945a, 1945b, 1956; Islam, 1950;
Maheshvari, Johri, 1950b; Haccius, 1952; Baude, 1956; Govindappa, Naidu,
1956; Soueges, 1959; Padhye, Rao, 1960, 1963; Lakshmanan, 1961, 1963a, 1963b,
1965, 1970; Padhye, 1962a; Swamy, Lakshmanan, 1962; Swamy, 1963; Davis,
1966; Тахтаджян, 1966; Robert, 1969, 1970; Ly Thi Ba, 1981; Pettit, 1981; Под-
дубная-Арнольди, 1982; Indra, Krichnamurthy, 1984, 1985; Czapik, 1988.
Порядок 2. NAJADALES
Семейство APONOGETONACEAE
Пыльник 4-гнездный. Стенка гнезда пыльника формируется по
центростремительному типу, представлена 4 слоями клеток. В зрелом пыльнике
сохраняется эндотеций с фиброзными утолщениями и эпидермис, средний слой
эфемерен. Тапетум периплазмодиального типа. Клетки тапетума одноядерные
до слияния. Образование тетрад микроспор происходит 2 способами: сукцес-
сивным (Aponogeton abyssinicus) или симультанным (Л. crispus, Л.
monostachyon), а у Л. distachys встречаются оба типа одновременно. Тетрады
микроспор тетраэдральные или крестообразные. Пыльцевые зерна 3-клеточ-
ные.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Внутренний
интегумент 2-слойный, наружный — 3-слойный. Микропиле формируется
внутренним интегументом. У отдельных видов интегументы срастаются в базальной
части (Л. crispus, Л. quadrangular is). Нуцеллус состоит из нескольких слоев
клеток; в микропилярной части 2—3 слоя париетального и несколько слоев
эпидермального происхождения. Археспорий одноклеточный, отделяет
париетальную клетку. Тетрада мегаспор линейного типа. У некоторых видов иногда
формируется триада (верхняя клетка диады не делится).
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Синергиды грушевидные, полярные ядра сливаются до оплодотворения,
вторичное ядро мигрирует в халазальный конец зародышевого мешка. Антиподы
представлены 3 клетками, сохраняющимися во время раннего эмбриогенеза.
Оплодотворение порогамное, двойное.
Эндосперм формируется по гелобиальному типу. Первая перегородка
эндосперма поперечная, разделяет маленькую халазальную камеру и более крупную
микропилярную. Ядро халазальной клетки обычно не делится (или делится
один раз). Микропилярная камера разрастается, становится ценоцитной,
формируя свободноядерный эндосперм. Весь эндосперм поглощается во время
развития зародыша.
Эмбриогенез проходит по Caryophyllad-типу Sagittaria-вариации.
Характерна крупная пузыревидная клетка суспензора. В зрелом семени зародыш
прямой, хорошо дифференцирован, расчленен на апекс побега, крупную
семядолю, небольшой гипокотиль и зародышевый корень, несколько смещенный
в латеральное положение. У некоторых видов апекс побега формирует листовые
примордии: у Л. monostachyon — один, у Л. crispus — 3—4 (Sane, 1939). Хлоро-
эмбриофиты (Netolitzky, 1926).
Исследованные виды. Aponogeton abyssinicus, A. crispus, A.
distachys, Л. guillotii, Л. madagascariensis, Л. monostachyon, A. natans, A. quadran-
gularis, Л. ulvaceus, A. violaceus.
Литература. Hofmeister, 1858; Engler, 1887; Sergeeff, 1907; Palm, 1915;
Tischler, 1915; Sussenguth, 1919, 1921; Afzelius, 1920; Stenar, 1925; Netolitzky,
1926; Clausen, 1927; Sane, 1939; Shan, 1970; Yamashita, 1970.
Aponogetonaceae
1—21, 23 — Aponogeton monostachyon, 22 — A. violaceus
1 — строение пыльника на стадии деления археспория; 2—5 — фрагменты гнезда пыльника на
разных стадиях его развития: видна стенка пыльника в сформированном (3) и зрелом (5) состоянии и
преобразование тапетума в периплазмодий (4, 5); 6—8 — микроспорогенез; 9 — зрелое пыльцевое
зерно; 10—12 — фрагменты семяпочки и мегаспорогенез; 13—15 — зародышевый мешок на 2- и
4-ядерной стадии развития (13, 14) и в сформированном состоянии; 16 — халазальная часть гело-
биального эндосперма с 2-ядерной халазальной камерой; 17—21 — различные стадии развития
зародыша; 22 — семяпочка с 2-клеточным гелобиальным эндоспермом и проэмбрио; 23 — зародыш
в зрелом семени. (1—21, 23 — по Sane, 1939; 22 — по Afzelius, 1920).
24
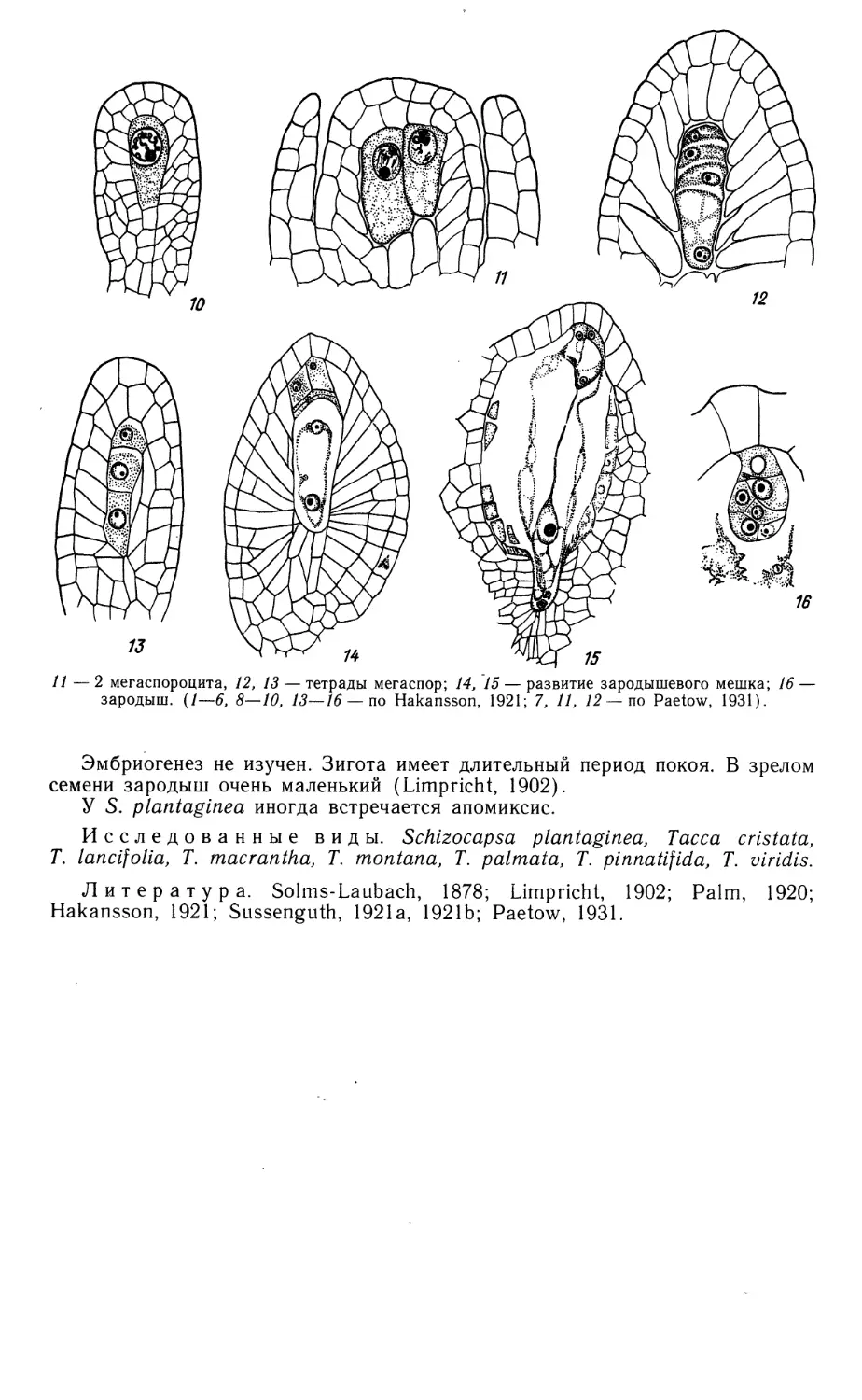
Семейство SCHEUCHZERIACEAE
Пыльник у Scheuchzeria palustris 4-гнездный. В созревшем пыльнике гнезда
в теках попарно сливаются вследствие разрушения перегородки между ними,
и пыльник вскрывается 2 продольными щелями. Развитие стенки гнезда
пыльника не прослежено. Сформированная стенка состоит из эпидермиса,
эндотеция, 1—2 средних слоев и тапетума. Средний слой эфемерен. Тапетум пери-
плазмодиального типа. После разрушения клеточных оболочек и слияния
протопластов ядра тапетума в периплазмодии располагаются между
микроспорами; они обычно крупнее последних. Периплазмодий разрушается ко
времени созревания пыльцевых зерен. Фиброзные утолщения формируются в
клетках эндотеция и в 1—2 слоях клеток со стороны связника, окружая оба гнезда
одной теки. Микроспороциты делятся по сукцессивному типу. Зрелые пыльце-
Scheuchzeriaceae
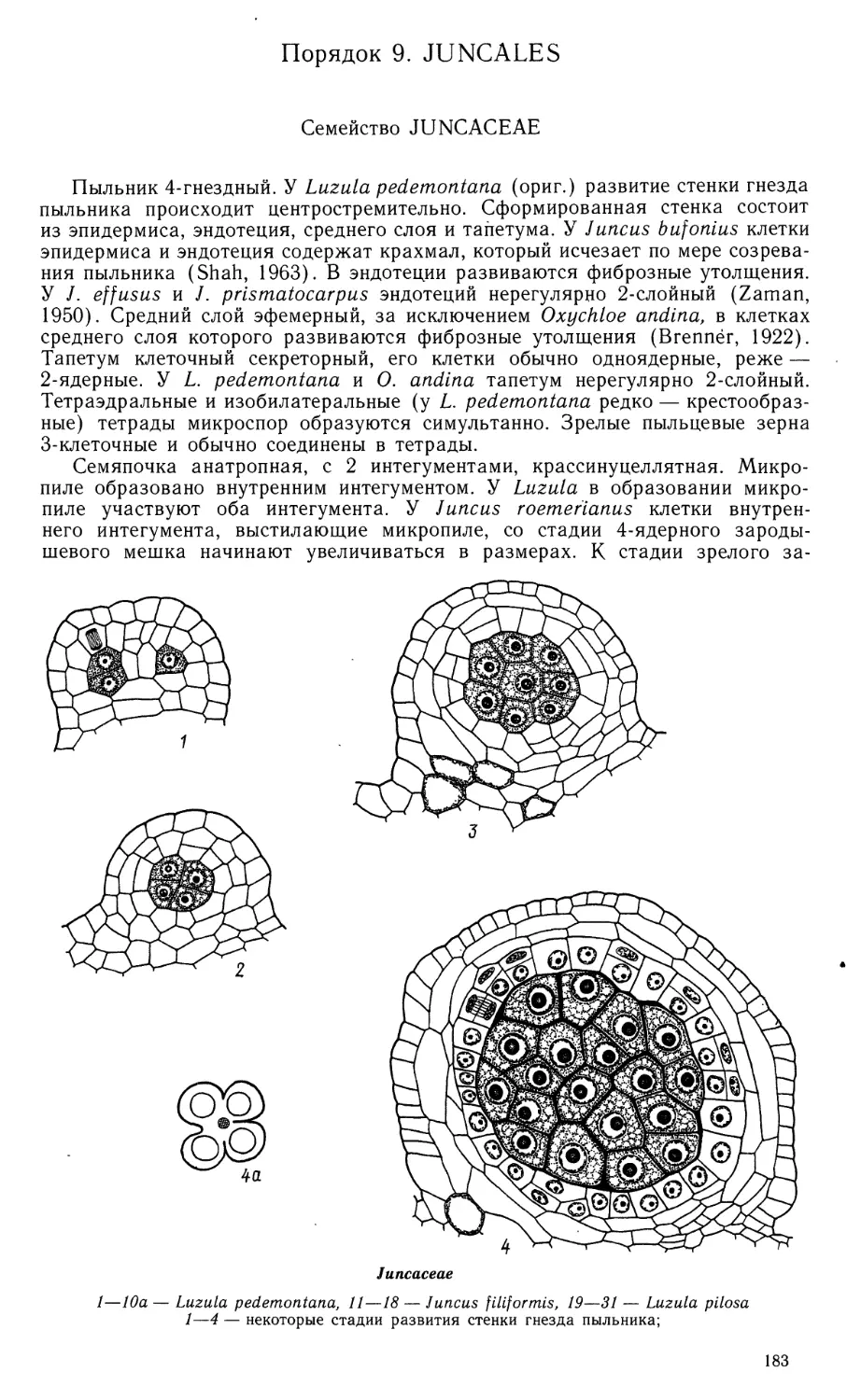
1—15 — Scheuchzeria palustris
1 — лопасть формирующегося пыльника: в центре 2 спорогенные клетки, окруженные тапетальным
слоем; 2 — гнездо пыльника с одноядерными микроспорами; 3 — фрагмент стенки зрелого гнезда
пыльника с 2- и 3-клеточными пыльцевыми зернами; 2а, За — схемы строения пыльника (поперечные
срезы); 4 — тетрада мегаспор; 5 — схема семяпочки на стадии формирования интегументов; 6—8 —
зародышевые мешки на 2- и 4-ядерной стадии и в зрелом состоянии;
26
Scheuchzeriaceae (продолжение)
9 — нуцеллус с оплодотворенным зародышевым мешком; 10, 11 — зародышевые мешки с 2-клеточ-
ным эндоспермом и зиготой (10) или 3-клеточным проэмбрио (//);■ 12, 13 — микропилярная часть
зародышевого мешка с ядерным эндоспермом и проэмбрио; 14 — микропилярная часть незрелого
семени; видны толстый наружный и тонкий внутренний интегументы, нуцеллус, эндосперм в
клеточном состоянии и зародыш; 9а, 12а, 14а — схемы строения семяпочки и развивающегося семени;
15 — схема зрелого семени, (вн. ин — внутренний интегумент, з — зигота, зародыш, н — нуцеллус,
н. ин — наружный интегумент, с — суспензор, х. к. энд — халазальная камера эндосперма, энд —
эндосперм. (/—3, 8—15—Никитичева, ориг.; 4—7—по Stenar, 1935).
вые зерна 3-клеточные (Lakshmanan, 1970), наряду с ними встречаются и
2-клеточные (ориг.); они часто соединены в пары (диады).
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. По нашим
данным, внутренний интегумент 3—4-слойный, наружный — значительно
массивнее. Микропиле образовано внутренним интегументом. В микропилярной
части внутреннего интегумента созревающего семени концентрируются эрга-
стические вещества, в остальной его части, окружающей нуцеллус, клеточные
слои сильно спрессовываются и в виде тонкой 2-слойной пленки сохраняются
в зрелом семени. Сосудистый пучок проходит по фуникулусу, сросшемуся
с вентральной частью наружного интегумента, халазе и дорсальной стороне
наружного интегумента. Нуцеллус 4—5-слойный в зрелой семяпочке,
сохраняется в период эмбриогенеза, постепенно дегенерируя во время созревания
семени. Единственная археспориальная клетка делится на париетальную и
спорогенную. Тетрада мегаспор линейного типа.
Зародышевый мешок моноспорический, развивается по Polygonum-типу,
8-ядерный, в зрелом состоянии широкоовальный на продольном срезе. Яйцевой
аппарат состоит из 3 небольших клеток, синергиды с нитчатым аппаратом
(ориг.). Центральная клетка содержит большую вакуоль. Полярные ядра
сливаются, образуя вторичное ядро. Нами установлено наличие 3 клеток антипод
в зрелом зародышевом мешке, сохраняющихся в период формирования
эндосперма. Ранее антиподы обнаружены не были (Hofmeister, 1861; Stenar, 1935).
Оплодотворение двойное, порогамное. Пыльцевая трубка входит в одну из
синергид, разрушая при Этом ее цитоплазму. Остатки пыльцевой трубки
длительно сохраняются над яйцевым аппаратом (ориг.).
Эндосперм развивается по гелобиальному типу. Первичное ядро эндосперма
располагается в нижней трети клетки. Инициальная клетка эндосперма
делится поперечно на 2 клетки-камеры. В сильно разрастающейся микропилярной
камере в первый период ядра делятся без цитокинеза. Затем на стадии
глобулярного зародыша происходит клеткообразование, начинаясь с микропилярного
конца ценоцита. Халазальная камера увеличивается и вакуолизируется,
содержит 1—2 крупных ядра (Stenar, 1935; ориг.). В зрелом семени эндосперм
представлен пленкой, образованной спрессованными клеточными слоями,
которая окружает зародыш.
Эмбриогенез детально не изучен, но имеющиеся фрагментарные данные
Стенара (Stenar, 1935), дополненные оригинальным материалом, позволяют
присоединиться к мнению Дэвис (Davis, 1966) о развитии зародыша по Сагу-
ophyllad-типу. Зигота делится поперечной перегородкой. Базальная клетка cb
2-клеточного проэмбрио не принимает участия в построении зародыша,
становится гаусториальной клеткой суспензора. Она характеризуется крупными
размерами, широким основанием, контактирующим с нуцеллусом, плотной
цитоплазмой и крупным полиплоидным ядром. Часто (а возможно, как правило)
базальная клетка делится наклонной перегородкой на 2 сходные по строению
клетки. Апикальная клетка са 2-клеточного проэмбрио делится поперечно;
из ее производных формируется часть суспензора и все органы зародыша.
Зрелый зародыш прямой. Ось зародыша проходит через крупную удлиненную
семядолю, заполненную запасными питательными веществами. Гипокотиль
короткий, эпикотиль с зачатками первого листа, инициали зародышевого корня
сформированы. Зародыш содержит хлорофилл^(Netolitzky, 1926; ориг.).
Исследованный вид. Scheuchzeria palustris.
Литература. Hofmeister, 1858, 1861; Palm, 1915; Netolitzky, 1926;
Stenar, 1935; Davis, 1966; Lakshmanan, 1970; Ly Thi Ba, 1981; Плиско, 1985;
Никитичева, ориг. данные.
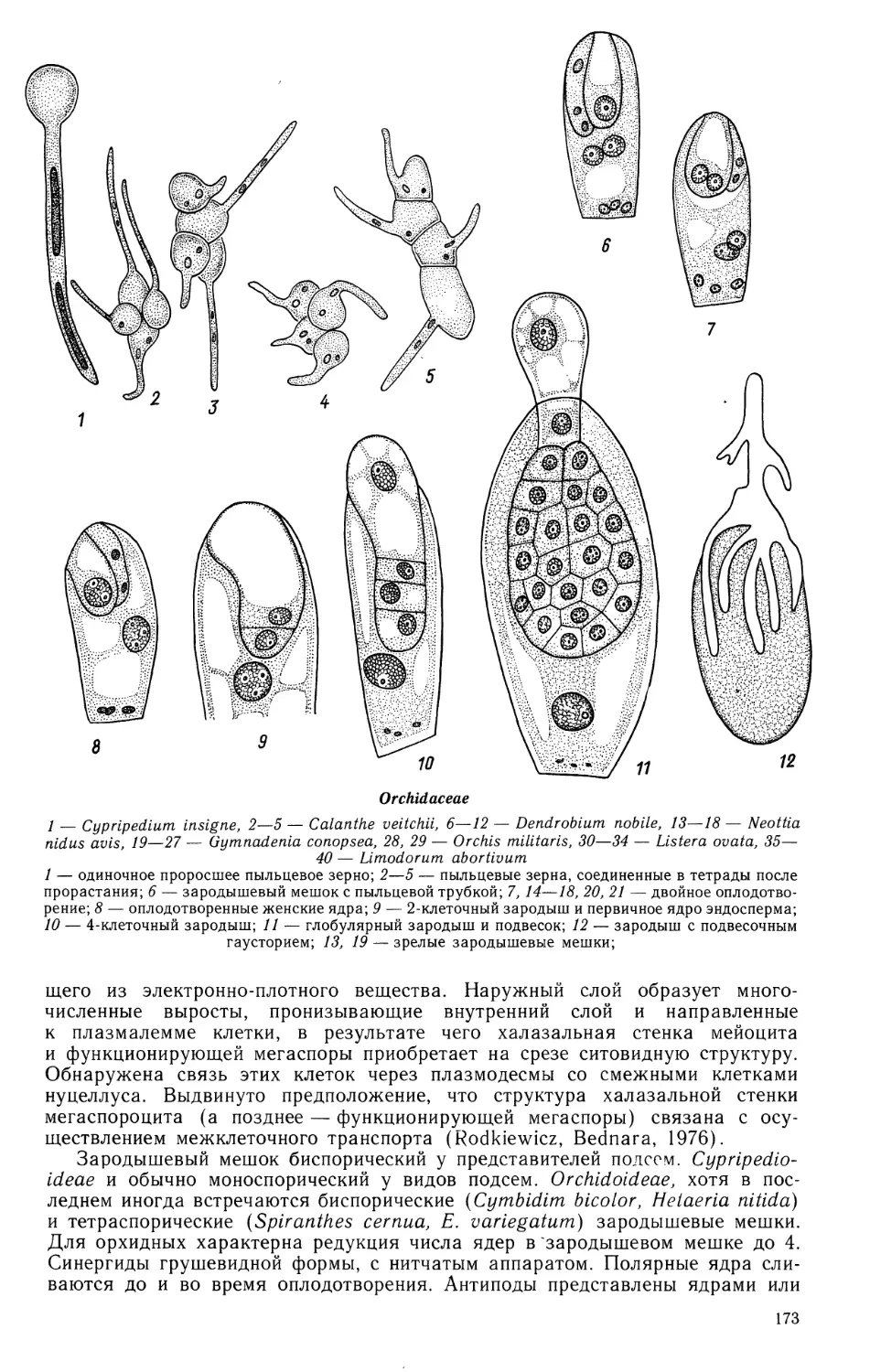
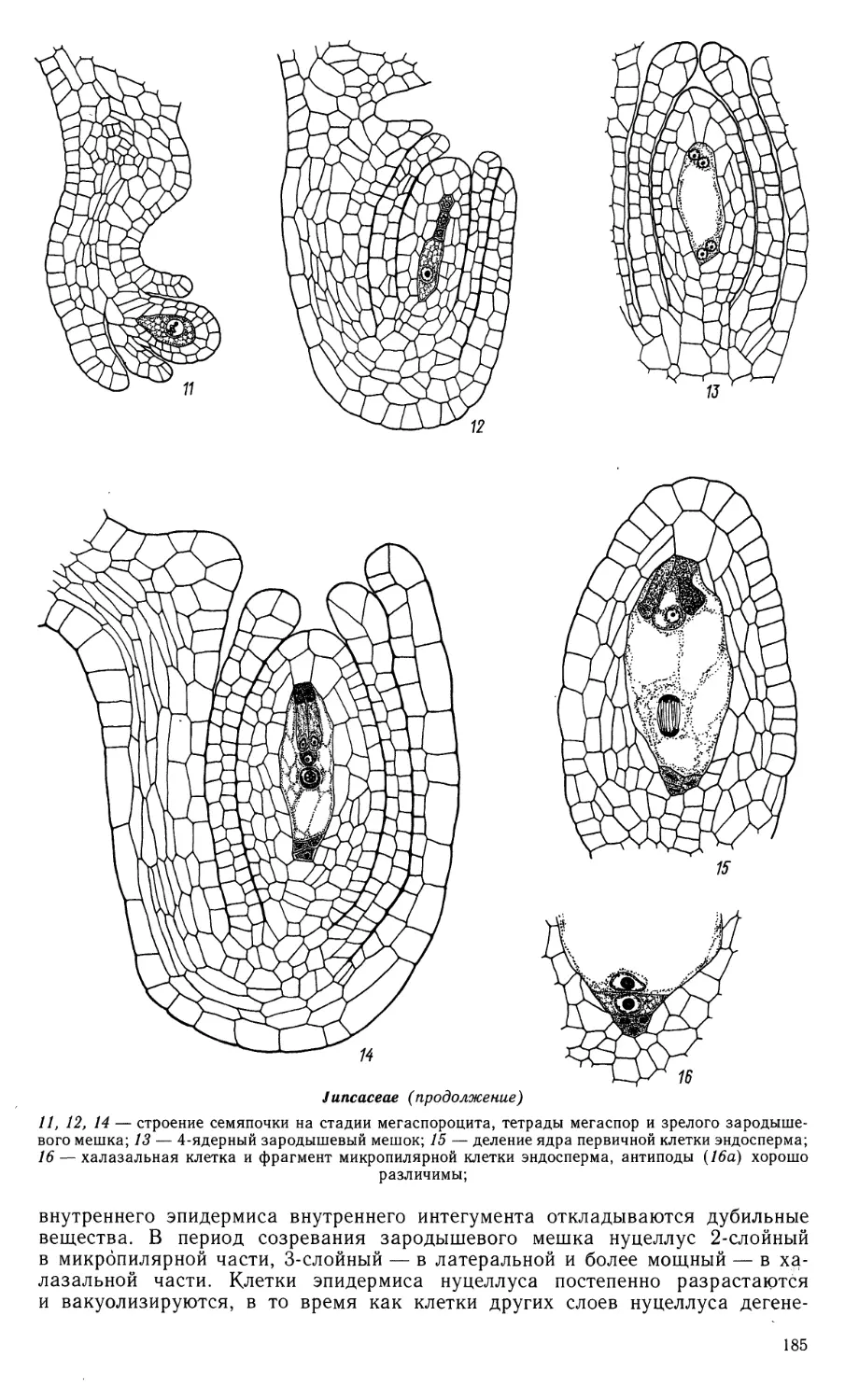
Семейство JUNCAGINACEAE
Пыльник 4-гнездный; гнезда объединены в 2 теки, в процессе созревания
пыльника перегородка между гнездами каждой теки разрушается и они
объединяются. У Triglochin palustre (ориг.) и Lilaea subulata (Agrawal, 1952)
сформированная стенка гнезда пыльника состоит из эпидермиса, эндотеция, 2—3 сред-
28
них слоев и тапетума. При сравнении продольного и поперечного срезов
пыльника выявлено, что клетки эпидермиса вытянуты вдоль продольной оси
пыльника, клетки эндотеция — перпендикулярно ей. Средние слои сохраняются
долго, лизируя ко времени созревания пыльцевых зерен. Тапетум периплазмо-
диального типа. Оболочки клеток тапетума начинают растворяться во время
поздней профазы мейоза I. К моменту образования тетрад микроспор
цитоплазма клеток тапетума сливается, проникая внутрь гнезда, однако их ядра еще
находятся на периферии. После разобщения микроспор из тетрад ядра
тапетума распределяются равномерно в цитоплазме периплазмодия и
увеличиваются в размере. Стенка зрелого пыльника состоит из эпидермиса и
фиброзного эндотеция. Спорогенная ткань многослойная. Микроспорогенез проходит
синхронно по всей длине пыльника. Образование тетрад микроспор сукцес-
сивное. Тетрады изобилатерального и тетраэдрального типов, у Шаеа
встречаются также линейные и Т-образные. Зрелые пыльцевые зерна 2-клеточные,
генеративная клетка имеет веретеновидную форму.
Семяпочка анатропная у видов Triglochin и Шаеа, ортотропная у Maundia
(Engler, 1903), с 2 интегументами, крассинуцеллятная. Оба интегумента тонкие,
из 2—3 слоев клеток. Микропиле сформировано внутренним интегументом.
В зрелом семени сохраняется наружный эпидермис наружного интегумента и
внутренний эпидермис внутреннего интегумента. Эти 2 слоя, составляющие
семенную кожуру, представлены уплощенными клетками. Нуцеллус
характеризуется интенсивным развитием в период спорогенеза и образования
зародышевого мешка. У Т. palustre, по нашим данным, в готовой к оплодотворению
семяпочке нуцеллус состоит из нескольких слоев клеток: в латеральной части
под эпидермисом имеются 3—4 слоя, а в микропилярном районе можно
различить нуцеллярный колпачок и 3—5-слойную париетальную ткань. В халазальной
части нуцеллуса образуется тяж удлиненных клеток между антиподами и
халазой, к которой подходит проводящий пучок фуникулуса. У Шаеа 2—3
наружных слоя нуцеллуса сохраняются в зрелом семени, а внутренние
дегенерируют в период развития зародыша (Agrawal, 1952). Археспорий
одноклеточный (Triglochin) или многоклеточный (Шаеа): при этом только одна споро-
генная клетка, образующаяся после отделения археспорием париетальной
клетки, преобразуется в мегаспороцит. Мегаспорогенез завершается
образованием тетрады мегаспор линейного типа.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Он имеет удлиненно-овальную форму, с заостренным антиподальным концом.
Синергиды значительно меньше яйцеклетки. Центральная клетка крупная,
с большой вакуолью; полярные ядра у L. subulata сливаются до оплодотворения,
а у видов Triglochin приходят в контакт и располагаются вблизи яйцевого
аппарата не сливаясь. Антиподальный аппарат развит хорошо; у Шаеа он состоит
из 3 клеток, причем самая верхняя из них может сильно вдавливаться в полость
зародышевого мешка, а ядро клетки увеличивается и иногда может делиться
(Campbell, 1898; Lakshmanan, 1970). У Triglochin 3 первоначальные антиподы
обычно делятся, и число клеток может увеличиваться до 14 (Hill, 1900; ориг.).
Эндосперм, по имеющимся в литературе описаниям, нуклеарного типа
(Davis, 1966; Lakshmanan, 1970). У Шаеа первичное ядро эндосперма делится
в микропилярной части зародышевого мешка, а у Triglochin maritimum —
в центральной его части. В дальнейшем ядра эндосперма распределяются
в слое цитоплазмы по периферии клетки эндосперма. В халазальной части
эндосперма у Т. maritimum и Т. palustre образуется более толстый слой
цитоплазмы, содержащий крупные ядра, часто неправильной формы (Schnarf,
1925; ориг.). Клеточные стенки в эндосперме не образуются ни у Triglochin
(Hill, 1900), ни у Шаеа (Campbell, 1898), или образуются у Шаеа в небольшом
числе только в микропилярном районе, вокруг базальнои клетки зародыша
(Agrawal, 1952; Lakshmanan, 1970). У Т. palustre в нескольких случаях нами
обнаружена 2-ядерная халазальная клетка эндосперма, примыкающая к
антиподам, но значительно отличающаяся от них по размеру и строению. Это
свидетельствует о возможности образования эндосперма гелобиального типа.
В зрелом семени эндосперм отсутствует.
29
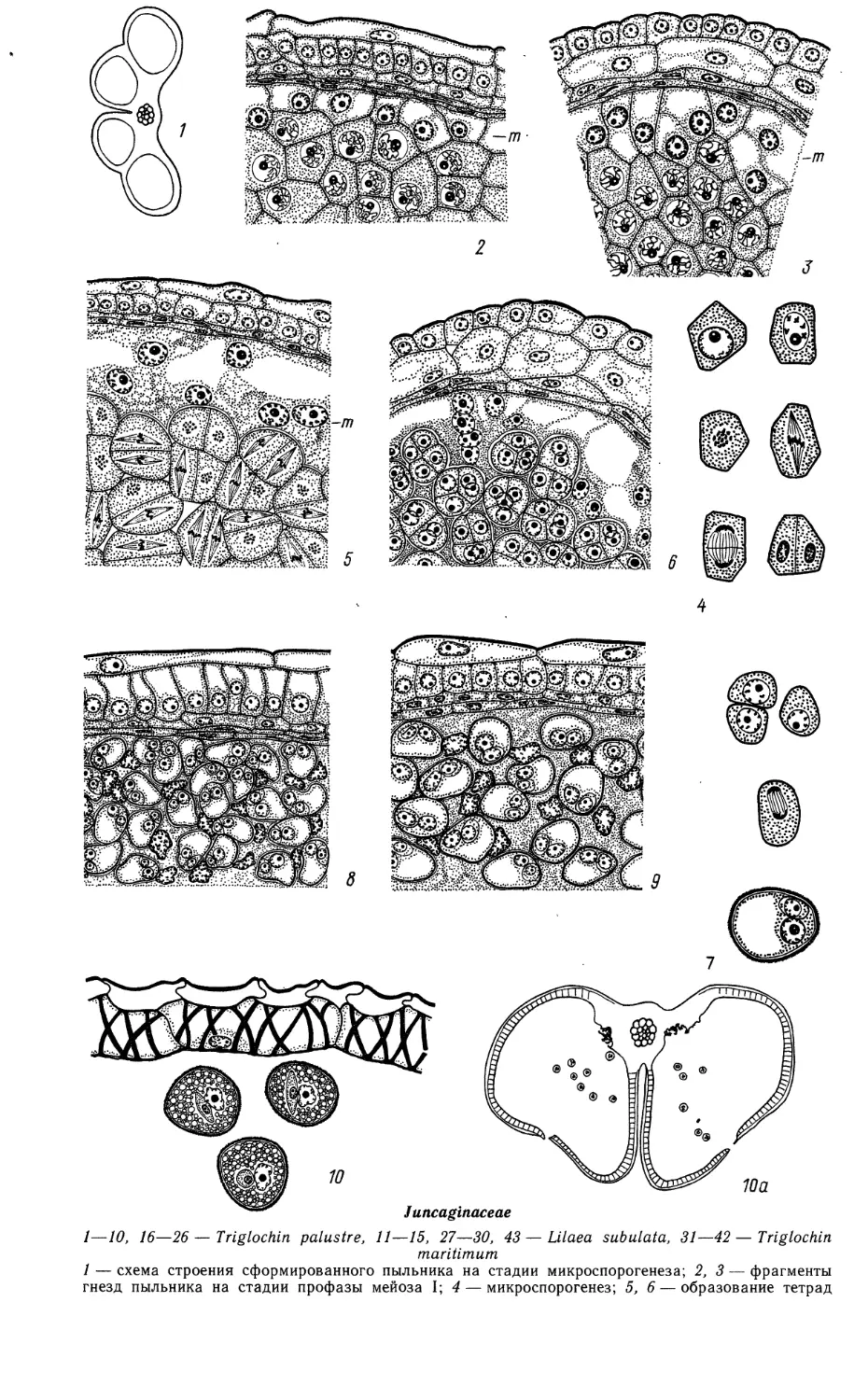
Juncaginaceae
1—10, 16—26—Triglochin palustre, 11—15, 27—30, 43 — Lilaea subulata, 31—42—Triglochin
maritimum
1 — схема строения сформированного пыльника на стадии микроспорогенеза; 2,3 — фрагменты
гнезд пыльника на стадии профазы мейоза I; 4 — микроспорогенез; 5, 6—образование тетрад
Juncaginaceae (продолжение)
11—15 — мегаспорогенез (//, 12) и развитие зародышевого мешка (13, 14), 15 — расположение
семяпочки в завязи; 16, 16а, 17 — семяпочка с мегаспороцитом; 18, 19 — фрагмент нуцеллуса
с одно- и 2-ядерным зародышевым мешком;
* микроспор и периплазмодия; 7 — развитие пыльцевого зерна; 8,9 — преобразование периплазмодия
на стадии 2-клеточных пыльцевых зерен; 10, 10а — зрелый пыльник: схема строения (10а) и зрелые
пыльцевые зерна с фрагментом стенки пыльцевого гнезда (2, 5, 8, 9 — продольные и 1, 3, 6, 10 —
поперечные срезы пыльника);
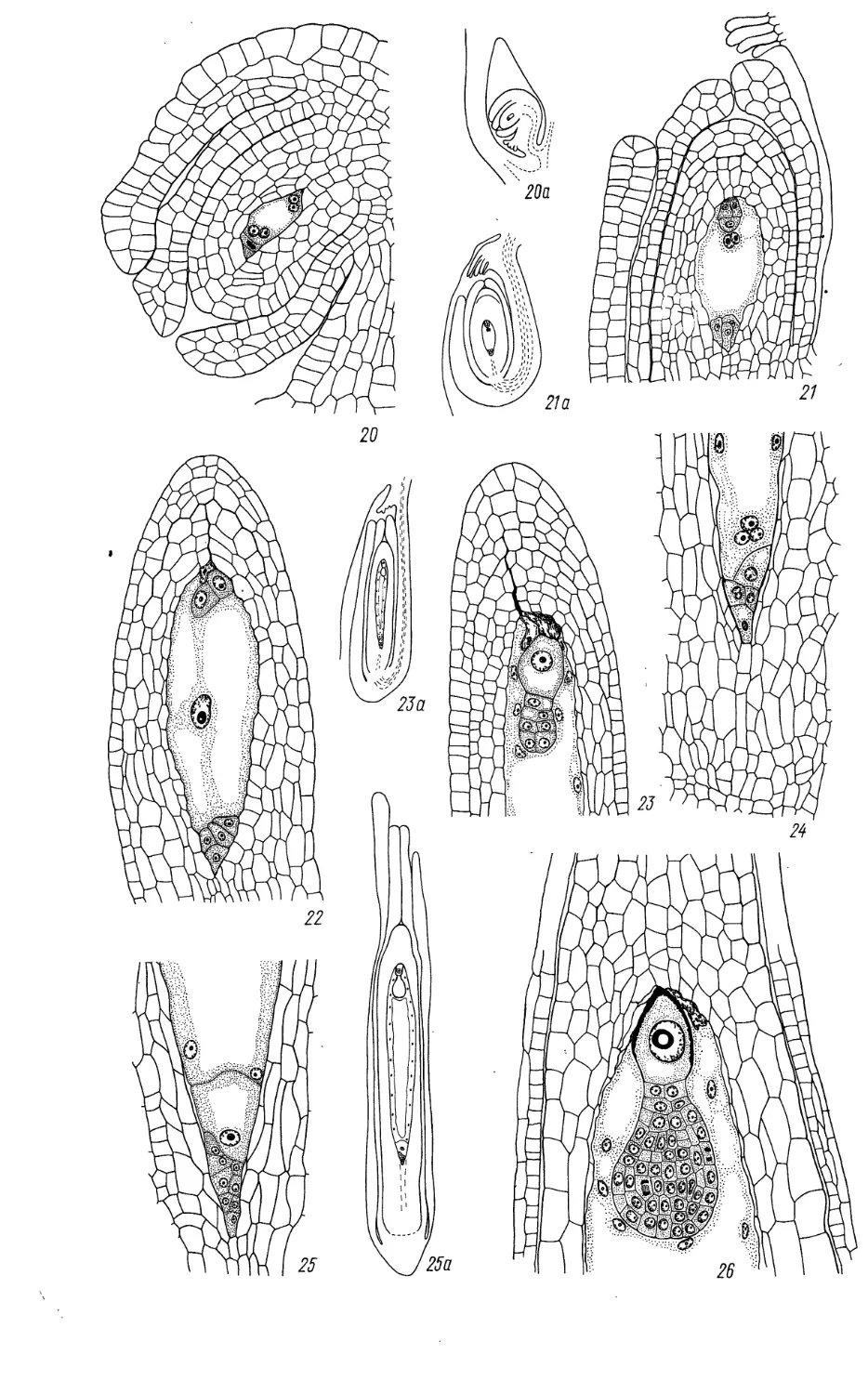
Juncaginaceae (продолжение)
27—42 — стадии эмбриогенеза у представителей 2 родов; 43 — схема строения зародыша, близкого
к зрелости. (/—10, 16—26— Никитичева, Проскурина, ориг.; //—15, 27—30, 43 — по Campbell,
1898; 31—42 —по Soueges, 1943).
Эмбриогенез исследован у Т. maritimum (Schnarf, 1925; Soueges, 1943) и
L. subulata (Campbell, 1898; Agrawal, 1952; Yamashita, 1970) и отнесен к Са-
ryophyllad-типу Sagittaria-вариации (Johansen, 1950). Зигота делится
поперечной перегородкой на базальную (cb) и апикальную (са) клетки. Первая сильно
увеличивается в размерах и становится гаусториальной клеткой суспензора.
Апикальная клетка са делится поперечно, тетрада клеток проэмбрио линейная.
В процессе эмбриогенеза отмечены стадии квадрантов, октантов, выделения
эмбриодермы. Зародыш в зрелом семени прямой, дифференцирован на органы:
крупная вытянутая семядоля в основании образует влагалище, окружающее
почечку с апексом побега и листовыми примордиями; гипокотиль короткий.
Зародышевый корень у Lilaea и Triglochin дифференцируется терминально под
суспензором (Agrawal, 1952; Петрова, 1985); однако существует также мнение,
что у Lilaea корень формируется латерально по отношению к оси зародыша
(Campbell, 1898; Yamashita, 1970).
Полиэмбриония отмечена у Т. palustre (Buchet, Gatin, 1908).
Исследованные виды. Lilaea subulata, Triglochin maritimum, Т. pa-
lustre.
Juncaginaceae (продолжение)
20, 21 — семяпочка с 4-ядерным (20) и сформированным зародышевым мешком (21); 22 —
зародышевый мешок с 2-клеточным проэмбрио, первичным ядром эндосперма и антиподами, окружен нуцел-
лусом; 23, 24 — фрагменты микропилярной (23) и халазальной (24) части нуцеллуса; видны
проэмбрио, эндосперм в ядерном состоянии и группа антипод; 25 — случай образования гелобиального
эндосперма с хорошо выраженной халазальной камерой; 26 — глобулярный проэмбрио с гигантской
клеткой суспензора; виден эндосперм в ядерной фазе, а также фрагмент нуцеллуса и 2-слойного
внутреннего интегумента; 16а, 20а, 21а, 23а, 25а — схемы строения семяпочки на соответствующих
рисункам стадиях;
3 Зак. 2144
33
Литература. Hofmeister, 1858, 1961; Vesque, 1879; Ficher, 1880;
Campbell, 1898; Hill, 1900; Engler, 1903; Buchet, Gatin, 1908; Tackholm, Soderberg,
1918; Schnarf, 1925; Clausen, 1927; Wulff, 1939; Soueges, 1943; Johansen, 1950;
Agrawal, 1952; Guttenberg, 1960; Тахтаджян, 1966; Lakhsmanan, 1970;
Yamashita, 1970; Delay, 1972; Li Thi Ba, 1981; Петрова, 1985; Никитичева,
Проскурина, ориг. данные.
Семейство POSIDONIACEAE
Эмбриологически не изучено.
Семейство POt!\MOGETONACEAE
Пыльник 4-гнездный, состоит из 2 тек; гнезда в теках перед вскрытием
объединяются из-за разрушения перегородки между ними. Теки вскрываются
продольной щелью. Сформированная по центростремительному типу (Wiegand,
1899) стенка гнезда пыльника состоит из эпидермиса, эндотеция, среднего
слоя и тапетума. Тапетум периплазмодиального типа. По поводу происхождения
тапетума в роде Potamogeton существуют разные точки зрения. Впервые
исследовавший развитие пыльника у P. foliosus Виганд (Wiegand, 1899) показал,
что тапетум дифференцируется из слоя стенки пыльника, т. е. он париетального
происхождения. Однако Гупта (Gupta, 1934), изучая пыльник у P. crispus,
но не располагая материалом с ранними стадиями развития, предположил
археспориальное происхождение тапетума за счет стерилизации спорогенной
ткани. Этой же точки зрения придерживается Е. И. Савич (1969). Детальное
исследование ранних стадий развития пыльника у нескольких видов
Potamogeton, проведенное нами, не позволяет согласиться с мнением последних авторов
и подтверждает данные Виганда. Тапетум у видов Potamogeton, как и у всех
цветковых, в стенке пыльника париетального происхождения. В процессе
формирования стенки пыльника по центростремительному типу тапетум
образуется последним из вторичного париетального слоя, когда спорогенная ткань
уже многослойная. Клетки его в премейотический период делятся и
антиклинально, и периклинально, в результате чего тапетум становится нерегулярно
2-слойным. Клетки тапетума одноядерные (Wiegand, 1899; Davis, 1966; ориг.).
Периплазмодий образуется в мейотический период, занимая вначале
пристенное положение (Clausen, 1927), затем его цитоплазма проникает между
тетрадами микроспор, а ядра еще некоторое время остаются в пристенном слое.
После разобщения тетрад микроспор цитоплазма периплазмодия и его ядра
равномерно распределяются по всему гнезду пыльника. Ядра в периплазмодии
очень Крупные, часто неправильной формы (ориг.). Лизис тапетума проходит
довольно быстро, к моменту образования 2-клеточной пыльцы даже остатков
периплазмодия уже не наблюдается. Средний слой эфемерный. Почти на всем
протяжении развития пыльника в клетках эпидермиса и эндотеция присутствует
большое количество крахмала. Стенка зрелого пыльника состоит из эпидермиса,
наружная оболочка клеток которого покрыта толстым слоем кутикулы, и
эндотеция, в крупных клетках которого хорошо заметна густая сеть фиброзных
утолщений. Спорогенная ткань многослойная. Образование тетрад микроспор
происходит по сукцессивному типу, тетрады в очень тонких каллозных
оболочках, изобилатеральные и крестообразные, изредка линейные. Зрелые пыльцевые
зерна 3-клеточные. Спермии довольно крупные, с хорошо различимой
цитоплазмой, располагаются рядом с ядром вегетативной клетки, цитоплазма
которой заполнена крахмалом.
Семяпочка до оплодотворения ортотропная (Davis, 1966; Терёхин, 1985)
или орто-кампилотропная (Takaso, Bouman, 1984; ориг.) и амфитропная после
оплодотворения, с 2 интегументами, крассинуцеллятная. Интегументы
2—3-слойные, внутренний утолщается в микропилярной части до 5 слоев. В
наружном интегументе имеется крахмал. Микропиле образовано внутренним
интегументом. Нуцеллус массивный, с 2-слойным нуцеллярным колпачком,
5—7 слоями париетальной ткани, многослойными латеральной и халазальнои
частями. У P. perfoliatus (ориг.) клетки эпидермиса нуцеллуса в микропилярной
34
Potamogetonaceae
1,3,4 — Potamogeton foliosus, 2* 30—44 — P. lucens, 5—7a, 11, 13—14a, 24 — P. perfoliatus, 8—
10, 12, 22, 23, 25—28 — P. pectinatus* 15—21 — P. pusillus *
1 — начало формирования и 2 — сформированная стенка гнезда пыльника; 3, 4 — мейоз I; 5 —
мейоз II в микроспороцитах; 6,7 — фрагменты пыльников и схема (7а) с тетрадами и микроспорами,
окруженными периплазмодием; 8, 9 — фрагменты пыльников и схема (9а) с 2-клеточными
пыльцевыми зернами;
* Рисунки выполнены по препаратам Э. С. Терёхина.
3*
Potamogetonaceae (продолжение)
10—12 — спермиогенез; 13 — зрелое пыльцевое зерно; 14 — участок стенки вскрывшегося
пыльника и его схема (14а);
части заметно увеличиваются. Париетальная ткань дифференцируется в эпи-
стазу, клетки ее с утолщенными оболочками. Под зародышевым мешком
выделяется тяж из удлиненных клеток, идущий к гипостазе, расположенной в
основании нуцеллуса. После оплодотворения нуцеллус значительно разрастается
и очень медленно поглощается развивающимися эндоспермом и зародышем.
Проводящий пучок подходит к гипостазе. Археспорий одноклеточный. Архе-
спориальная клетка делится на спорогенную и париетальную клетки, последняя
формирует многослойную париетальную ткань. Мегаспорогенез завершается
образованием линейной и Т-образной тетрады мегаспор. Иногда в верхней
клетке диады деление не происходит, и тогда образуется триада. Функционирует
халазальная мегаспора.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Сведения о развитии у P. foliosus биспорического Allium-типа зародышевого
мешка (Wiegand, 1900), очевидно, нуждаются в подтверждении. Зрелый
зародышевый мешок 7-клеточный, 7-ядерный, овальный, с дифференцированными
элементами. Яйцеклетка крупная, синергиды с широким основанием, с нитчатым
аппаратом. Полярные ядра сливаются до оплодотворения. Ядро центральной
клетки располагается в плотной цитоплазме в халазальной части
зародышевого мешка, у антипод. Центральная клетка пронизана тонкими тяжами
цитоплазмы. 3 небольшие клетки антипод разрушаются на ранних стадиях развития
эндосперма. Оплодотворение порогамное, двойное.
Эндосперм гелобиальный. Данные о нуклеарном типе эндосперма у P. natans
(Holferty, 1901) в более поздних исследованиях не подтвердились (Cook, 1908;
Tokaso, Bouman, 1984; ориг.). Первичное ядро эндосперма делится в
халазальной части зародышевого мешка. Образуется 2 камеры: маленькая халазальная
и большая микропилярная, в которой проходят свободноядерные деления,
и ядра располагаются в пристенном слое цитоплазмы. Со стадии образования
семядоли в зародыше в микропилярной ценоцитной камере проходит клетко-
образование, но клетки эндосперма в центральной части зародышевого мешка
часто остаются многоядерными. В халазальной камере ядро не делится и
увеличивается в объеме. У P. densus вследствие эндомитотического деления
ядро халазальной камеры становится 192-плоидным и в 30—40 раз превышает
объем остальных трирлоидных ядер эндосперма (Hasitschka-Jenschke, 1959).
Эта клетка выполняет гаусториальную функцию. В зрелом семени эндосперм
отсутствует.
Эмбриогенез соответствует Caryophyllad-типу Sagittaria-вариации (Johan-
sen, 1950). Зигота делится поперечно на клетки са и cb. Последняя более не
делится и превращается в крупную пузыревидную с полиплоидным ядром
клетку суспензора. Весь зародыш и 3 остальных слоя суспензора образуются
36
Potamogetonaceae (продолжение)
15—17 — мегаспорогенез; 18—21 — развитие зародышевого мешка; 22 — зрелый зародышевый
мешок; 23 — семяпочка; 24—29 — развитие гелобиального эндосперма в семени:
из производных клетки са. Дискуссионным является вопрос о происхождении
семядоли и апекса побега у Potamogeton. Ряд авторов считают, что семядоля
терминального, а апекс побега — латерального происхождения (Wiegand,
1900; Cook, 1908; Soueges, 1954). Однако Хациус (Haccius, 1952), а также
поддержавшие ее Свами и Парамесваран (Swamy, Parameswaran, 1962),
Ли Ти Ба iree соавторы (Ly Thi Ba et al., 1976, 1978; Ly Thi Ba, 1981) пришли
к заключению, что и семядоля, и апекс побега происходят из терминального
яруса, хотя топографически они занимают разное положение. Это также
подтверждается, как считают авторы, исследованием развития зародыша
P. lucens с помощью сканирующего электронного микроскопа (Ly Thi Ba et al.,
1978). Зрелый зародыш изогнутый, занимает всю полость семени,
дифференцирован. Крупная семядоля изогнута, почечка с 1—2 примордиями листьев,
гипокотиль массивный, зародышевый корень с выраженной апикальной
меристемой и небольшим чехликом. Прокамбиальныи тяж проходит по гипокотилю
37
Potamogetonaceae (продолжение)
24 — образование халазальнои и микропилярной клеток-камер эндосперма; в наружном интегументе
крахмал, эпистаза в нуцеллусе, 25—27 — ядерная стадия в микропилярной камере эндосперма,
халазальная становится гаусторием, 28 — клеткообразование в микропилярной камере эндосперма
на стадии образования семядоли; 29 — созревающее семя, клетки эндосперма, окружающие
крупный зародыш, не содержат запасных веществ;
J9 43 44
к почечке и ответвляется в семядолю. В тканях зародыша накапливаются
запасные вещества в виде крупных крахмальных зерен и липидных тел. Лейко-
эмбриофиты.
Исследованные виды. Potamogeton crispus, D. densus, P. foliosus,
P. indlcus, P. lucens, P. natans, P. pectinatus, P. perfoliatus, P. pusillus, P. versus.
Литература. Schacht, 1850; Hofmeister, 1861; Wiegand, 1898, 1899,
1900; Holferty, 1901; Cook, 1908; Tischler, 1915; Schurhoff, 1926; Clausen, 1927;
Dahlgren, 1927; Wisniewska, 1931; Gupta, 1934; Soueges, 1940, 1954; Hasitschka-
Jenschke, 1959; Swamy, Parameswaran, 1962; Schwanitz, 1967b; Савич, 1969;
Lakshmanan, 1970; Яковлев, Жукова, 1973; Ly Thl Ba et al., 1976; 1978; Ly Thi
Ba, 1981; Takaso, Bouman, 1984; Терёхин, 1985; Камелина, ориг. данные.
Семейство RUPPIACEAE
Пыльник 4-гнездный; гнезда объединены попарно в 2 далеко отстоящие
теки. Стенка гнезда пыльника формируется по центростремительному типу и
состоит из эпидермиса, эндотеция, 1—3 средних слоев и тапетума. Тапетум
периплазмодиальный. Ранее высказанное положение об археспориальном
происхождении тапетума у Ruppia (Graves, 1908; Савич, 1968) не подтверждается
нашими данными. Тапетум гетерогенный. В стенке гнезда пыльника он
формируется из вторичного париетального слоя, со стороны связника — из слоя
активной меристемы, прилегающей к спорогенной ткани. Образование
периплазмодия происходит в конце премейотического и в начале мейотического периодов.
Оболочки клеток тапетума растворяются вскоре после их образования. Митоз
ядер проходит в протопластах тапетума, находящихся в пристенном слое,
после чего они проникают в полость гнезда между микроспороцитами. В пери-
плазмодиальной массе ядра еще раз могут митотически делиться. Лизис
периплазмодия происходит постепенно. Со стадии 2-клеточных пыльцевых зерен,
когда генеративная клетка находится около ядрз$е|етативной, периплазмодий
уже отсутствует; с этой же стадии в эндотеции ндбйюдаются фиброзные
утолщения. Во всех слоях стенки пыльника, в том числе и в тапетуме, на ранних стадиях
развития обнаружены хлоропласты с зернами крахмала (Schwanitz, 1967a).
На более поздних стадиях в периплазмодии отмечены липидные глобулы.
Средние слои дезинтегрируют. Стенка зрелого пыльника представлена
эпидермисом, клетки которого содержат танины и покрыты кутикулой, и фиброзным
эндотецием. Спорогенная ткань многослойная. Спорогенные клетки
увеличиваются, превращаясь в микроспороциты. Образование тетрад происходит
по сукцессивному типу. Каллозные оболочки микроспороцитов и клеток тетрад
очень тонкие, в цитоплазме их много крахмала. Тетрады микроспор изобилате-
ральные. Зрелые пыльцевые зерна одиночные, 3-клеточные. Спермин овальные,
находятся рядом с ядром вегетативной клетки, в цитоплазме которой имеются
крахмальные зерна и липидные глобулы.
Семяпочка ортотропная, с 2 интегументами, крассинуцеллятная. Внутренний
интегумент 2-слойный, наружный — 2—3-слойный. Микропиле образовано
обоими интегументами. В основании нуцеллуса хорошо выражена гипостаза.
Проводящий пучок из плодолистика подходит к гипостазе. Нуцеллус в микро-
пилярной части представлен эпидермисом или 2-слойным нуцеллярным
колпачком и 1—4 слоями париетальной ткани, латеральная и халазальная части
нуцеллуса 4—6-слойные. Дезинтеграция нуцеллуса после оплодотворения
проходит постепенно. Семяпочка во время развития семени становится кампило-
тропной. Археспорий одноклеточный, иногда 2-клеточный (Савич, 1969). Архе-
спориальная клетка делится на париетальную клетку и спорогенную, которая
преобразуется в мегаспороцит. В результате мейоза образуется Т-образная
или линейная тетрада мегаспор. Халазальная мегаспора функционирует,
остальные дегенерируют.
Potamogetonaceae (продолжение)
30—43 — эмбриогенез; 44 — зрелый зародыш. (1, 3, 4 —по Wiegand; 1899; 2, 5—14а, 22—29 —
ориг.; 15—21 — по Gupta, 1934; 30—44 — по Ly Thi Ba, 1981).
39
1—20 — Ruppia brachypus, 21—47 — R. maritima
1,2 — формирование спорогенной ткани и стенки гнезда пыльника; 3,4 — образование периплазмо-
диального тапетума на стадии профазы мейоза в микроспороцитах; 5 — микроспороцит; 6 —
фрагмент пыльника с диадами в периплазмодии; 7— мейоз II; 8—11 — тетрады микроспор;
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Элементы яйцевого аппарата крупные. Синергиды с хорошо выраженным
нитчатым аппаратом. Полярные ядра сливаются до оплодотворения в
центральной или халазальной части зародышевого мешка. 3 клетки антипод
сохраняются некоторое время после оплодотворения. Порогамия и двойное
оплодотворение.
40
Ruppiaceae (продолжение)
12, 13 — фрагменты пыльников во время образования 2-клеточных пыльцевых зерен (12) и с 2-кле-
точными пыльцевыми зернами (13); 12а, 13а — схемы пыльника (12а) и теки (13а) на
соответствующих стадиях; 14 — зрелое 3-клеточное пыльцевое зерно;
Эндосперм развивается по гелобиальному типу. Деление первичного ядра
эндосперма происходит в халазальной части зародышевого мешка, образуются
2 неравные клетки-камеры; меньшая — халазальная и большая — микропиляр-
ная. Ядро халазальной клетки обычно не делится, становится очень крупным,
цитоплазма в клетке плотная. В большой микропилярной камере проходят
свободноядерные деления. Клеткообразования в эндосперме не наблюдалось.
В зрелом семени эндосперм отсутствует.
Эмбриогенез Caryophyllad-типа Ruppia-вариации. Базальная клетка cb
2-клеточного проэмбрио не делится и развивается в крупный пузыревидный,
длительно функционирующий суспензор. Апикальная клетка са делится
поперечно, а ее производные ее и cd — продольно. На следующих стадиях
эмбриогенеза производные этажа се формируют квадранты q и октанты / и /'; cd и ее
производные делятся поперечно и продольно, формируя серию этажей,
состоящую из 2—4 тяжей бластомеров. Последующие деления в клетках проэмбрио
имеют различную ориентацию, образуется глобулярный зародыш с
дифференцированной эмбриодермой. Несколько позже зародыш приобретает удлиненно-
овальную форму, в это время происходит инициация семядоли и адвентивного
корня.
О морфологической природе зародышевого корня Ruppia ведется длительная
дискуссия. По мнению одних исследователей, зародышевый корень у Ruppia
элиминирован в процессе эволюции, а развивающийся при прорастании апекс
корня, расположенный _у основания почечки, является адвентивным
образованием (Wille, 1882; Murbeck, 1902; Graves, 1908; Терёхин, 1985). Согласно
другой точке зрения, функционирующий при прорастании зародыша Ruppia
корень является гомологом зародышевого корня, закладка которого смещена
в латеральное положение (Asherson, 1889; Yamashita, 1972; Ly Thi Ba et al.,
1973). Последней точке зрения противоречит, однако, не только положение
апекса корня, но и его происхождение. Известно, что апекс зародышевого
41
корня всегда дифференцируется непосредственно в районе микропиле, под
суспензором. Вероятно, изменение характера прорастания у Ruppia привело
в процессе эволюции к редукции, а затем и к полной элиминации зародышевого
корня и замещению его функций адвентивным корнем. Замещение функций
зародышевого корня адвентивными стуктурами — явление, известное у
покрытосеменных растений. Такое замещение может происходить на разных
стадиях онтогенеза. У Ruppia это замещение происходит уже в эмбриогенезе,
что свидетельствует о высокой специализации зародышевых структур этого
растения. Зрелый зародыш занимает всю полость семени, дифференцирован,
состоит из почечки с 2—3 примордиями листьев, одной семядоли, адвентивного
корня и массивного гипокотиля, в котором аккумулируются зерна крахмала.
Исследованные виды. Ruppia brachypus, R. maritima (=R. rostel-
lata), R. spiralis.
Ruppiaceae (продолжение)
21—47 — эмбриогенез, (в. п. — вторичный париетальный слой, мсц — микроспороциты, сп — споро-
генная ткань, ср. с — средний слой, т — тапетум, эн — эндотеций, эп — эпидермис). (1—20 —
рис. О. П. Камелиной; 21—47—по Yamashita, 1972).
Литература. Hofmeister, 1861; Wille, 1882; Asherson, 1889; Murbeck,
1902; Graves, 1908; Schwanitz, 1967a, 1967b, 1968a, 1968b, 1969; Yamashita,
1972; Ly Thi Ba, Mestre, Guignard, 1973; Ly Thi Ba, 1981; Терёхин, 1985 и ориг.
данные; Камелина, ориг. данные по RuppiaKbrachypus *.
Семейство ZANNICHELLIACEAE
Пыльник 4-гнездный, у Zannichellia — иногда 8-гнездный, у Althenia —
2-гнездный (Miceli, Renzoni, 1978). Гнезда расположены попарно в
симметричных теках; перед вскрыванием пыльника перегородка между гнездами
разрушается. Пыльник с надсвязником, клетки которого расположены рыхло, с
большими воздухоносными полостями. Вскрывается пыльник продольными щелями.
У Zannichellia pedunculata стенка гнезда пыльника формируется и по
редуцированному, и по центростремительному типу и состоит из эпидермиса, эндотеция,
из одного или только отдельных клеток среднего слоя (иногда средний слой
вообще не образуется) и тапетума. Тапетум периплазмодиальный. В начале
мейотического периода оболочки слабо дифференцированных клеток тапетума
растворяются и протопласты, в каждом из которых в это время по 1—2 ядра,
сливаются, оставаясь в пристенном положении. После распада тетрад
цитоплазма периплазмодия проникает в пыльцевое гнездо, заполняя все
пространство между микроспорами. В процессе развития микроспор и пыльцевого
зерна происходит постепенный лизис периплазмодия, и со стадии 2-клеточного
пыльцевого зерна, когда генеративная клетка находится около ядра
вегетативной клетки, периплазмодий в пыльнике не наблюдается. Средний слой, или
отдельные клетки этого слоя, дегенерируют. Клетки эндотеция незначительно
увеличиваются, имеют изогнутые оболочки без фиброзных утолщений. У
Althenia filiformis в эндотеции образуются фиброзные утолщения. Клетки эпидермиса
увеличиваются. Оболочки их также изогнутые. Стенка зрелого пыльника
состоит из эпидермиса и эндотеция, в клетках которых имеются каротиноиды.
Спорогенная ткань многослойная — до 5 слоев. Мейоциты расположены так,
что их длинная ось параллельна длинной оси пыльника, в их оболочках почти не
откладывается каллоза. Образование тетрад микроспор происходит по сукцес-
сивному типу. У Z. pedunculata заметны нарушения в мейозе I — цитомиксис,
разброс хромосом в метафазе. Тетрады микроспор разнообразны по форме:
линейные, Т-образные, изобилатеральные, крестообразные, в очень тонких кал-
лозных оболочках. Разобщенные из тетрады микроспоры округлые. Деление
ядра в микроспоре происходит у ее стенки, до появления крупной вакуоли.
Образуется линзовидная генеративная клетка, которая перемещается затем
внутрь вегетативной клетки. Зрелые пыльцевые зерна у Althenia и Zannichellia
3-клеточные, с шаровидными спермиями, расположенными рядом с лопастным
ядром вегетативной клетки, цитоплазма которой заполнена липидными
глобулами.
Семяпочка ортотропная, крассинуцеллятная, с 2 интегументами. Нуцеллус
хорошо развит, состоит из 2-слойного нуцеллярного колпачка, 4 слоев
париетальной ткани, 4-слойной латеральной и 10-слойной халазальной частей.
В процессе развития семени нуцеллус разрушается очень медленно. В основании
нуцеллуса дифференцируется гипостаза, клетки ее заполнены таниноподобными
веществами. Оба интегумента 2-слойные, внутренний интегумент в районе
микропиле 4-слойный. Микропиле образуется внутренним интегументом.
Проводящий пучок из плодолистика подходит к халазе. Археспорий одноклеточный.
Археспориальная клетка делится на первичную париетальную и спорогенную
клетки, последняя развивается в мегаспороцит. Мегаспорогенез у Althenia
завершается образованием тетрады мегаспор, в которой функционирующей
становится халазальная клетка, а остальные постепенно дегенерируют. У
Zannichellia в результате мейоза образуется диада 2-ядерных клеток, халазальная
клетка остается жизнеспособной, микропилярная — отмирает.
Зародышевый мешок у Althenia моноспорический, развивается по
Polygonum-типу. У Z. pedunculata зародышевый мешок биспорический, развивается
по Allium-типу. Имеются также сведения о наличии моноспорического зароды-
* Материал собран в Туркмении в 1984 г.
44
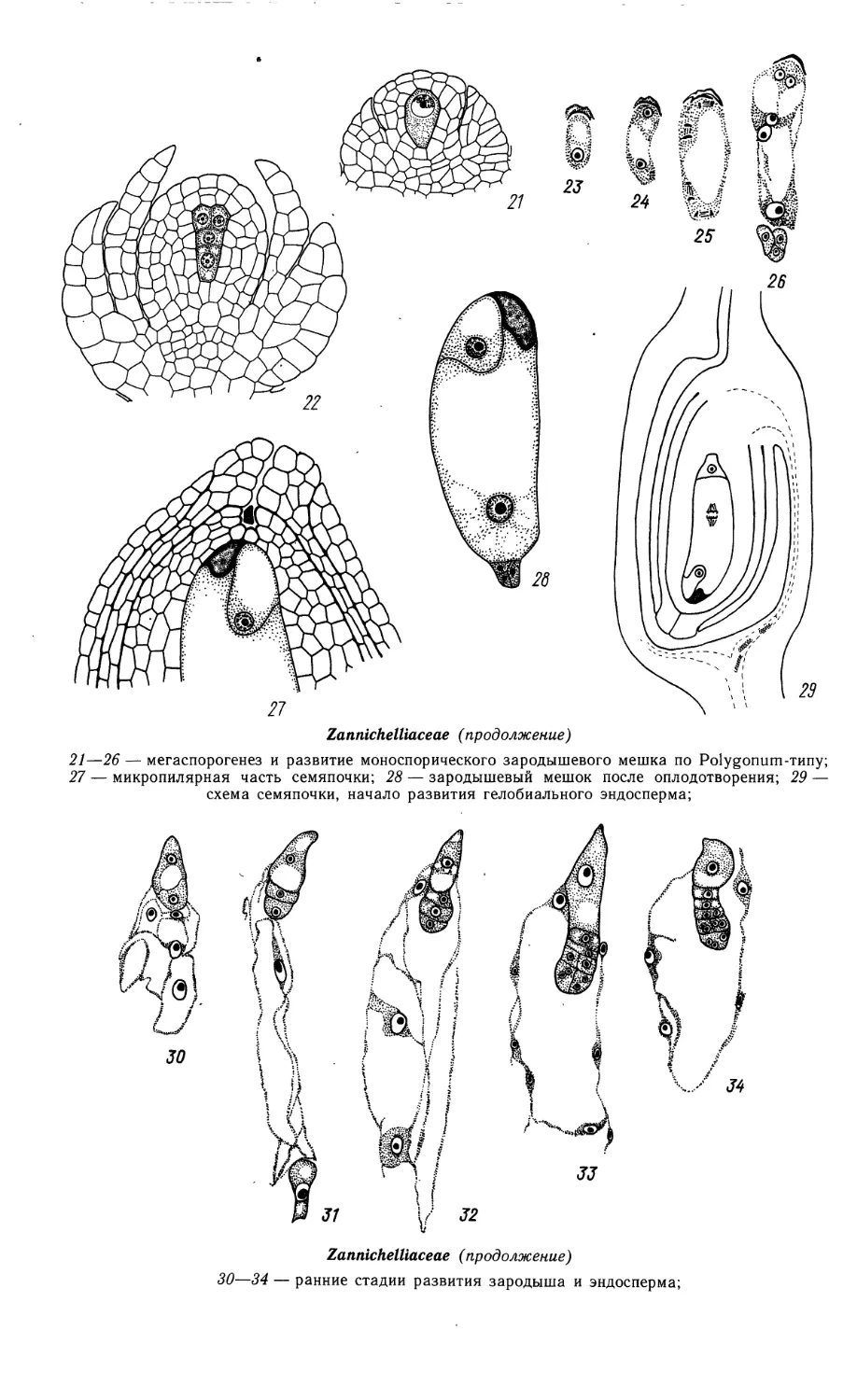
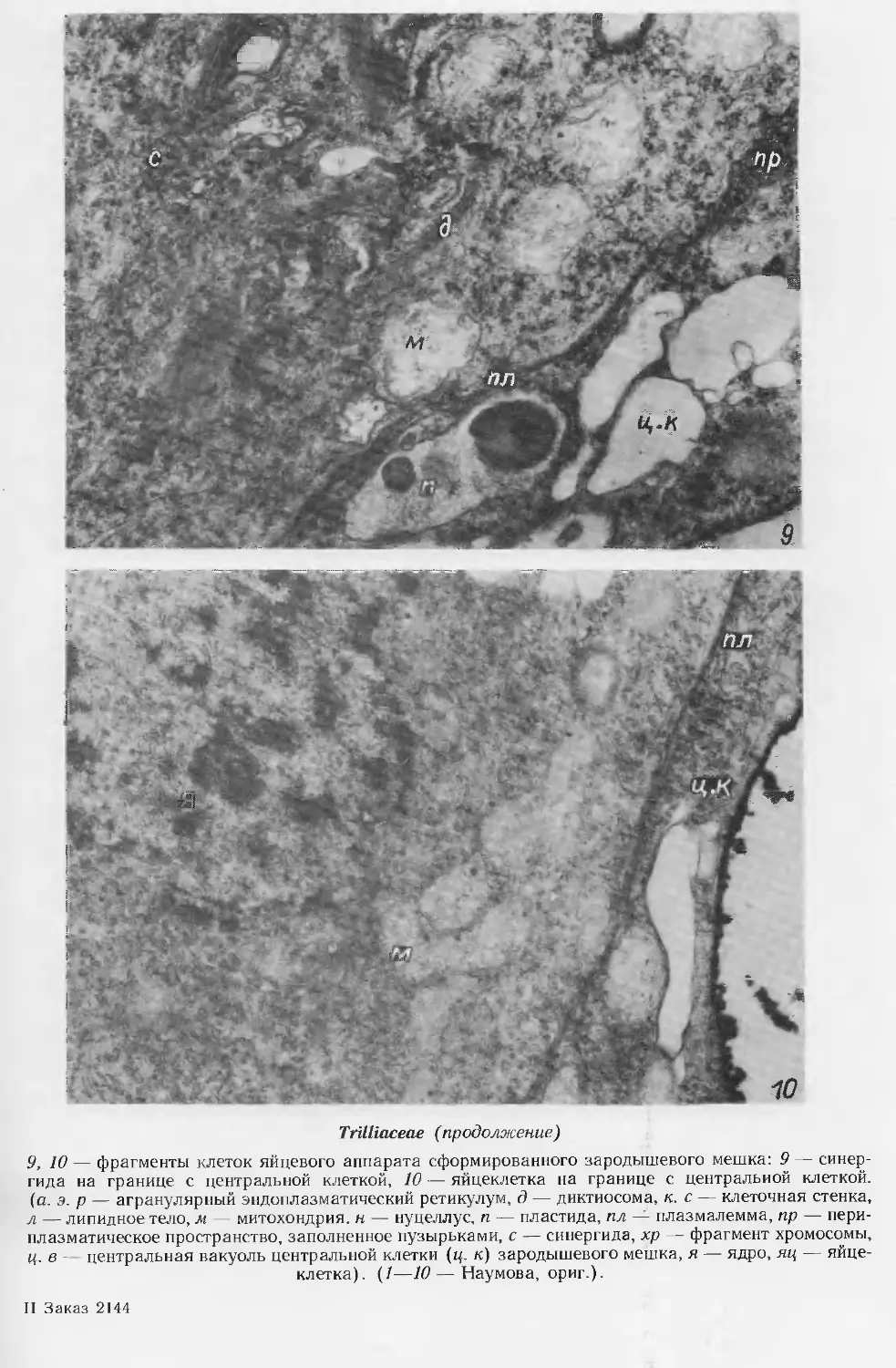
Zannichelliaceae
1—14a, 16—20a, 35—42— Zannichellia peduncutata; 15, 15a, 21—34 — Althenia filiformis
1 — гнездо пыльника со сформированной спорогенной тканью и формирующейся стенкой; 2—4 —
мейоз в микроспороцитах, диады {3) и тетрады (4) микроспор, образование периплазмодия;
За — схема пыльника на стадии диад; 5 — фрагмент пыльника с микроспорами;
шевого мешка у Z. palustris (Савич, 1969; Lakshmanan, 1970). Зрелый
зародышевый мешок овальный, с узким халазальным концом. Яйцевой аппарат
представлен крупными яйцеклеткой и 2 синергидами, нормально поляризованными.
Центральная клетка с большой вакуолью, цитоплазма локализована в хала-
зальной части зародышевого мешка, где располагается и ядро,
образовавшееся после слияния 2 полярных ядер, что происходит до оплодотворения.
Антиподы — 3 небольшие клетки — существуют довольно продолжительное
время, вплоть до стадии октантов проэмбрио. Синергиды эфемерны.
Оплодотворение порогамное, двойное.
Эндосперм развивается по гелобиальному типу. У Z. pedunculata деление
первичного ядра эндосперма происходит в халазальной части зародышевого
мешка. Образуются 2 камеры: небольшая — халазальная, с плотной
цитоплазмой, и крупная, с большой вакуолью и пристенным слоем цитоплазмы —
микропилярная. Ядро в халазальной клетке-камере больше не делится,
становится лопастным, с крупным ядрышком. В микропилярной камере проходят
свободноядерные деления; ядра располагаются в тонком слое цитоплазмы
вдоль стенок зародышевого мешка и вокруг развивающегося зародыша. Клетко-
45
Zannichelliaceae (продолжение)
6 — схема 8-гнездного пыльника; 7—12 — развитие пыльцевого зерна; 13, 14 — фрагменты
пыльников с 2- и 3-клеточными пыльцевыми зернами; 13а, 14а — схемы пыльников на этих стадиях;
15, 15а — фрагмент стенки и схема вскрывшегося пыльника; (/, 3, За, 5, 6, 13—15а — поперечные,
2, 4 — продольные срезы);
Zannichelliaceae (продолжение)
16—19 — мегаспорогенез и развитие биспорического зародышевого мешка по Allium-типу; 20 —
зрелый зародышевый мешок в нуцеллусе; 16а, 19а, 20а — семяпочка в плодолистике с мегаспо-
роцитом, с 4-ядерным и зрелым зародышевым мешком;
образования не происходит. У Z. palustris (Lakshmanan, 1965) отмечалось
формирование клеток во всем эндосперме. В зрелом семени эндосперм
отсутствует.
Эмбриогенез соответствует Caryophyllad-типу Zannichellia-вариации.
Деление зиготы происходит одновременно с делением первичного ядра эндосперма.
Базальная клетка cb 2-клеточного проэмбрио далее не делится и становится
крупной пузыревидной, с большим ядром, плотной цитоплазмой и утолщенной -
оболочкой базальной клеткой суспензора. Собственно зародыш и остальная
часть подвеска, состоящая из 2—3 клеток, формируются из производных
клетки са. Суспензор сохраняется продолжительное время. Зрелый зародыш
занимает весь объем семени, хорошо дифференцирован, с удлиненным гипо-
котилем, апексом зародышевого корня и развитой почечкой, в которой
различаются 3—4 листовых примордия. Семядоля выше почечки резко изогнута и
прилегает к гипокотилю. Лейкоэмбриофиты.
Исследованные виды. Althenia filiformis, Lepilaena, Zannichellia
palustris, Z. pedunculata.
Литература. Hofmeister, 1858, 1861; Warming, 1873; Jonsson, 1881;
Wille, 1882; Campbell, 1897; Palm, 1915, 1920; Venkatesh, 1952; Soueges, 1954;
47
Zannichelliaceae (продолжение)
21—26 — мегаспорогенез и развитие моноспорического зародышевого мешка по Polygonum-типу;
27 — микропилярная часть семяпочки; 28 — зародышевый мешок после оплодотворения; 29 —
схема семяпочки, начало развития гелобиального эндосперма;
Zannichelliaceae (продолжение)
30—34 — ранние стадии развития зародыша и эндосперма;
Zannichelliaceae (продолжение)
35—41 — сопряженное развитие эндосперма и зародыша (38а, 40а — схема
семяпочки на соответствующей стадии); 42 — схема зрелого зародыша. (1—
22, 35—42— рис. О. П. Камелиной; 27—29— рис. Э. С. Терёхина; 23—26,
30— 34 — по Miceli, Renzoni, 1978).
40а х$
4 Зак. 2144
Lakshmanan, 1965, 1970; Schwanitz, 1967b, 1968, 1969; Яковлев, Жукова,
1973; Vijayaraghavan, Kumari, 1974; Miceli, Renzoni, 1978; Ly Thi Ba, 1981;
McConchie et al., 1982; Терёхин, 1985 и ориг. данные по Althenia *; Камелина,
ориг. данные по Z. pedunculated **.
Семейство CYMODOCEACEAE
Пыльник 4-гнездный, у Halodule иногда 8-гнездный (Yamashita, 1976);
гнезда расположены попарно в теках. Вскрываются пыльники продольными
щелями. Сформированная стенка гнезда пыльника состоит из 4 (Halodule)
или 8—10 (Amphibolis) слоев: эпидермиса, эндотеция, 1—2 (Halodule) или
4—6 средних слоев (Amphibolis, Thalassodendron) и однослойного (Halodule)
или 4-слойного (Amphibolis) тапетума. Тапетум периплазмодиальный. В конце
премейотического или в начале мейотического периода оболочки клеток
тапетума растворяются, цитоплазма смешивается и ее однородная масса с
крупными ядрами заполняет все пространство гнезда пыльника, окружая микро-
спороциты, а затем тетрады микроспор, микроспоры и пыльцевые зерна. В
процессе созревания пыльника периплазмодий постепенно лизирует. Средние слои
по мере развития пыльника дегенерируют. В эндотеции фиброзные утолщения
не образуются и в зрелом пыльнике он не сохраняется. У Amphibolis в клетках
эпидермиса и эндотеция отмечались полифенольные вакуоли (Ducker et al.,
1978). Стенка зрелого пыльника состоит из увеличенных клеток эпидермиса.
Спорогенная ткань 4—6-слойная. Микроспороциты эллиптические, без
специфической каллозной оболочки. Образование тетрад микроспор происходит1 по
сукцессивному типу, причем заложение перегородок происходит продольно в
направлении длинной оси микроспороцита, в результате чего микроспоры в изо-
билатеральной тетраде располагаются параллельно друг другу. Тетрады
микроспор с очень тонким слоем каллозы, который у Amphibolis и Thalassodendron
отмечается только между микроспорами (Ducker et al., 1978; Pettitt, 1981).
После разобщения тетрад микроспор у Amphibolis, Thalassodendron и Halodule
еще до вакуолизации микроспоры происходит первый митоз. Генеративная
клетка занимает терминальное положение в удлиненном пыльцевом зерне,
затем перемещается к его центру, одновременно с этим в цитоплазме
вегетативной клетки появляются вакуоли и накапливается крахмал. В генеративной
клетке крахмал отмечается в незначительном количестве. Зрелые пыльцевые
зерна 3-клеточные, нитевидные, суженные на концах, иногда раздвоенные
( Amphibolis), длиной от 1000 мкм у Halodule до 5000 мкм у Amphibolis. Спермии
овальные или с одним вытянутым концом. Цитоплазма вегетативной клетки
зрелых пыльцевых зерен Amphibolis antarctica содержит митохондрии, амилоп-
ласты диктиосомы, сферосомы, ЭР и многочисленные везикулы (Ducker et al.,
1978). Характерным для видов Amphibolis и Thalassodendron является
отсутствие экзины в оболочке пыльцы (Pettitt, 1981; Knox, 1984).
Семяпочка ортотропная, висячая, с 2 интегументами, крассинуцеллятная.
Археспорий одноклеточный. Археспориальная клетка, делясь периклинально,
образует первичную париетальную и спорогенную клетки. Первичная
париетальная клетка формирует париетальную ткань. Мегаспорогенез не прослежен.
Зародышевый мешок 8-ядерный, развивается по Polygonum-типу.
Эндосперм нуклеарный (Lakshmanan, 1970). Ядра эндосперма различной
величины и формы, собраны в группы по всей периферии зародышевого мешка.
У Cymodocea isoetifolia и Halodule uninervis в эндосперме проходит клетко-
образование. В зрелом семени эндосперм не сохраняется.
Развитие зародыша происходит по Caryophyllad-типу. Базальная cb клетка
2-клеточного проэмбрио не делится, становится пузыревидной, выполняя гаусто-
риальную функцию подвеска. Собственно зародыш и многослойный суспензор
формируются из дериватов апикальной клетки (са). Зрелый зародыш занимает
всю полость семени, дифференцированный, с хорошо развитой почечкой
(Lakshmanan, 1968).
* Материал собран в окрестностях г. Семипалатинска в 1986 г.
** Материал собран в долине р. Мургаб в Туркмении в 1984 г.
50
Cymodoceaceae
1—8, 10—13— Halodule (—Diplanthera) uninervis, 9 — Amphibolis antarctica
1—6 — схематическое изображение развития пыльника: / — спорогенная ткань и однослойный
тапетум, 2— мейоз I в микроспороцитах, окруженных периплазмодием; 3— мейоз II в диадах,
4 — митоз в микроспорах, 5 — 2-клеточные пыльцевые зерна, 6 — 3-клеточные пыльцевые зерна;
7 — фрагмент пыльника с 2-клеточными пыльцевыми зернами; 8, 9 — фрагменты зрелого
пыльцевого зерна; 10—13 — отдельные стадии развития зародыша. (/—6 — по Yamashita, 1976; 7, 8, 10—
13 — по Lakshmanan, 1968; 9 — по Knox, 1984).
Исследованные виды. Amphibolis antarctica, A. griffithii, Cymodo-
сеа ciliata, С. isoetifolia, С. nodosa, Halodule (= Diplanthera) pinifolia, H. uni-
nervis, Thalassodendron ciliatum.
Литература. Bornet, 1864; Dudley, 1893; Lakshmanan, 1968, 1970;
Yamashita, 1974, 1976; Ducker, Knox, 1976; Pettitt, 1976, 1981; Ducker, Pettitt,
Knox, 1978; McConchie, Knox, Ducker, Pettitt, 1982; Knox, 1984.
4*
51
Семейство ZOSTERACEAE
Пыльники 4-гнездные (Zostera). Развитие стенки гнезда пыльника не
изучено. Сформированная стенка состоит из эпидермиса, среднего слоя и 1—2-слой-
ного тапетума, клетки которого содержат по одному ядру. Тапетум периплазмо-
диального типа. Тетрады микроспор формируются по сукцессивному типу.
Редукционное деление у Phyllospadix torreyi происходит в уже удлиненных
микроспороцитах. Зрелые пыльцевые зерна у Zostera marina 2-клеточные,
у Ph. torreyi — 3-клеточные. У Z. mdrina нитевидные пыльцевые зерна длиной
от 1 до 2 мм.
Семяпочки ортотропные, с 2 интегументами, тенуинуцеллятные (Dahlgren,
1935; Кудряшов, Савич, 1968). По нашим наблюдениям, в нуцеллусе Z. marina
и Z. japonica из клеток эпидермиса нуцеллуса формируется 2—3-слойный
нуцеллярный колпачок. Нуцеллус Zostera под зародышевым мешком
разрастается в колонковидный подиум (нуцеллярную колонку), который состоит
из запасающей ткани и постепенно потребляется эндоспермом в течение его
развития. Остатки колонки сохраняются и в зрелом семени. Данные о
зональности нуцеллярной колонки (Кудряшов, Савич, 1968) в нашем исследовании
не подтвердились. Микропиле в семяпочках Zostera формируется внутренним
интегументом. Согласно литературным данным (Jensen, 1890; Taylor, 1957;
Кудряшов, Савич, 1968; Lakshmanan, 1970), внутренний интегумент Zostera
состоит из 2 слоев, за исключением микропилярной зоны, где число его слоев
увеличивается. По нашим наблюдениям, внутренний интегумент Zostera (на
большем своем протяжении) состоит из 3 слоев, перед микропиле — из 2 слоев,
в зоне микропиле — из 5—6 слоев. Промежуточный третий слой резорбируется
еще до оплодотворения. Сведения о числе слоев наружного интегумента
семяпочки существенно различаются (Jensen, 1830; Кудряшев, Савич, 1968;
Lakshmanan, 1970). По нашим данным, у Z. marina и Z. japonica наружный
интегумент полностью развивается уже после оплодотворения. В это время он состоит
из 7—8 слоев довольно однородных клеток. Археспорий одноклеточный,
образуется в субэпидермальном слое на вершине нуцеллуса и функционирует как
мегаспороцит, без отделения кроющей клетки (Dahlgren, 1935; Кудряшев,
Савич, 1968). Тетрада мегаспор линейная. Функционирует халазальная
мегаспора.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Сформированный зародышевый мешок удлиненно-овальной формы. Халазаль-
ный конец зародышевого мешка выгибается вокруг вершины нуцеллярной
колонки, так что антиподы оказываются расположенными в его вогнутом
пространстве.
Эндосперм нуклеарный. Свободноядерное состояние эндосперма
сохраняется до его полного потребления разивающимся зародышем. Халазальный
конец эндосперма содержит плотную цитоплазму и более крупные ядра и,
очевидно, выполняет гаусториальную функцию, потребляя содержимое
нуцеллярной колонки. В зрелом семени эндосперм отсутствует.
Эмбриогенез Caryophyllad-типа. Базальная клетка cb 2-клеточного проэм-
брио разрастается в длительно функционирующий пузыревидный суспензор,
1—3-ядерный. Апикальная клетка са делится продольно, а ее производные ее и
cd — поперечно (Dahlgren, 1939; Hofmeister, 1952; Кудряшев, Савич, 1968;
Ly Thi Ba, 1981). Последующие деления в дочерних клетках проходят вдоль оси
проэмбрио. На стадии октантов проэмбрио содержит по 4 клетки в каждом
из 2 этажей. Непосредственно вслед за этим происходит дифференциация
эмбриодермы и образование глобулярного зародыша. В ходе дальнейшего раз-
Zosteraceae
1, 3, 4, 5, 8—12, 14 — Zostera marina, 2, 6, 7 — Z. japonica, 13 — Z. nana, 15 — Phyllospadix iwatensis
1 — стенка гнезда пыльника (продольный срез); 2 — фрагменты 2-клеточных пыльцевых зерен; 3 — археспо-
риальная клетка в субэпидермисе нуцеллуса; 4 — зрелый зародышевый мешок; 5 — схема семяпочки со
зрелым зародышевым мешком и нуцеллярной колонкой; 6 — микропилярная часть семяпочки с яйцевым
аппаратом зародышевого мешка; 7 — халазальная часть ядерного эндосперма и остаток нуцеллярной колонки; 8—
12 — ранние стадии эмбриогенеза; 13 — микропилярная часть семяпочки на стадии формирования эпикотиля
зародыша; 14 — зародыш в зрелом семени Z. marina; 15 — зародыш в зрелом семени Ph. iwatensis.
52
15 Zosteraceae (продолжение)
(в. ин — внутренний интегумент, гп — гипокотиль,
з. м — зародышевый мешок, к — кутикула, н — нуцел-
лус, н. ин — наружный интегумент, н. к — нуцеллярная
колонка, ок — околоплодник, п. п — проводящий пучок,
с — семядоля, с. к — семенная кожура, эн — эндоте-
ций, энд — эндосперм, эп — эпидермис, эпк — эпико-
тиль). (1, 2, 4—7, 13—15 — ориг.; 3, 8—11 — по Кудря-
шеву, Савич, 1968; 12— по Rosenberg, 1901).
вития зародыш приобретает характерное асимметричное строение вследствие
одностороннего разрастания зачатка гипокотиля. Развитие зародыша Phyllo-
spadix протекает на первых этапах развития сходно с таковым Zostera (Dudley,
1893, цит. по: Lakshmanan, 1970). Зародыш в зрелом семени всех изученных
видов (Z. marina, Z. japonica и Phyllospadix iwatensis) имеет в основном
сходное строение. По отношению к оси соцветия зародыш этих родов занимает,
однакб, противоположное положение: у Zostera гипокотиль расположен абак-
сиально, а у Phyllospadix — адаксиально.
О морфологической природе органов зародыша Zostera ведется длительная
дискуссия. По мнению Гофмейстера (Hofmeister, 1858), щитковидная
структура зародыша Zostera является осью первого порядка, тогда как ось второго
порядка, образующаяся, по его мнению, латерально, производит стеблевой
апекс с листовыми примордиями. Согласно точке зрения других
исследователей, щитковидная структура зародыша Zostera представляет собой семядолю,
а остальная часть зародыша является выростом из ее вогнутой центральной
зоны (Gronland, 1851; Tutin, 1938). По мнению Л. В. Кудряшева и Е. И. Савич
(1968), разросшаяся часть зародыша Z. marina включает гипокотиль и 2
семядоли, тогда как его радиальная структура представлена только гипокотилем.
В соответствии с наиболее распространенным взглядом щитковидная структура
зародыша Zostera представляет собой разросшуюся базальную часть
гипокотиля, а из его верхней радиальной части образуются семядоля, почечка и
адвентивный корень. Зародышевый корень полностью редуцирован (Jensen,
1890; Rosenberg, 1901a; Arber, 1920; Goebel, 1933; Dahlgren, 1939; Taylor, 1957;
Терёхин, 1985).
Исследованные виды. Phyllospadix iwatensis, Ph. torreyi, Zostera
japonica, Z. marina.
Литература. Gronland, 1851; Hofmeister, 1852; Jensen, 1890; Dudley,
1893 (цит. по: Lakshmanan, 1970); Rosenberg, 1901a, 1901b; Arber, 1920; Qobel,
1933; Dahlgren, 1939; Soueges, 1954; Harada, 1956; Taylor, 1957; Tutin, 1957;
Schwanitz, 1967; Кудряшев, Савич, 1968; Stewart, Rudenberg, 1980; Терёхин,
1985 и ориг. данные.
Семейство NAJADACEAE
Пыльники 4-гнездные у Najas graminea и N. guadalupensis, одно-, редко —
2-гнездные у N. flexilis и постоянно одногнездные у N. marina (Campbell,
1897; Singh, 1965; Лодкина, 1976). Сформированная стенка гнезда
пыльника состоит из эпидермиса, эндотеция (без фиброзных утолщений в зрелом
пыльнике) и тапетума из одноядерных клеток. Тапетум периплазмодиального
типа. Тетрады микроспор образуются сукцессивно. Форма тетрад изобилате-
ральная, тетраэдральная, реже — линейная или Т-образная. У N. marina
в оболочке мейоцитов и тетрад микроспор каллоза не обнаружена (Jain,
Shan, 1985). У N. palustris образование генеративной клетки происходит
в микроспорах, еще находящихся в тетрадах. Зрелые пыльцевые зерна
3-клеточные.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Микропиле
образовано внутренним интегументом. Внутренний интегумент во время
оплодотворения состоит из 2 слоев, наружный — из 3. Археспориальная клетка
преобразуется в мегаспороцит после отделения париетальной клетки,
образующей 1—2 слоя париетальной ткани. Тетрада мегаспор линейного типа.
Функционирует халазальная мегаспора.
Зародышевый мешок моноспорический, Polygonum-типа. У некоторых видов
Najas, в частности у N. flexilis, описаны биспорические зародышевые мешки
(Maheshwari P., 1937; Maheshwari S. С, 1955).
Эндосперм нуклеарный (Swamy, Lakshmanan, 1962; ориг.). После первого
деления ядра эндосперма мигрируют к противоположным полюсам
зародышевого мешка, где образуют первичные зоны скопления ядер. В дальнейшем
ядра распределяются вдоль оболочки зародышевого мешка. Деления ядер
эндосперма на протяжении 5 генераций происходят синхронно. В халазальнои
54
/ — Najas graminea, 2—20 — N. lacerata, 21—23 — N. foveolata, 24 — N. marina, 25 — N. major
1—3 — формирование стенки пыльцевого гнезда и спорогенной ткани; 4 — строение семяпочки до
оплодотворения и ее положение в завязи; 5,6 — мегаспорогенез; 7 — 2-ядерный зародышевый
мешок; 8 — зародышевый мешок до оплодотворения; 9 — зародышевый мешок после
оплодотворения; 10 — деление зиготы и первые деления ядер эндосперма; //—20 — эмбриогенез;
зоне зародышевого мешка ядра эндосперма увеличиваются в размерах,
вероятно, в результате эндомитозов, а цитоплазма становится более плотной.
Это указывает на гаусториальную функцию халазальной области эндосперма.
На более поздних стадиях развития в микропилярной зоне эндосперма
начинается клеткообразование. Данные о начале клеткообразования в халазальной
зоне эндосперма (Шпаков, 1974) нуждаются в подтверждении.
55
Najadaceae (продолжение)
21 — зародыш с суспензором на стадии дифференциации эмбриодермы; 22 — семяпочка во время
заложения семядоли и дифференциация халазальной зоны ядерного эндосперма; 23 — то же, микро-
пилярная зона; 24 — зародыш в период дифференциации первого листа почечки с пузыревидным
суспензором, состоящим из 2 клеток; 25 — сформированный зародыш, (в. ин — внутренний инте-
гумент, гип — гипокотиль, г. с — гаусторий суспензора, зар — зародыш, з. м — зародышевый
мешок, л — первый лист, н — нуцеллус, н. ин — наружный интегумент, р — радикула, с — семядоля,
ф. о — фуникулярный обтуратор, ш. с — шейка суспензора, эп — эпикотиль). (/—20 — по Swamy,
Lakshmanan, 1962; 21—25 — ориг.).
Эмбриогенез Caryophyllad-типа (Hofmeister, 1861; Campbell, 1897; Swamy,
Lakshmanan, 1962). Зигота делится поперечно. Базальная клетка 2-клеточного
проэмбрио сЬ развивается в долго сохраняющийся пузыревидный одноядерный
суспензор. Апикальная клетка са также делится поперечно. Дальнейшая
судьба ее производных различна. Из апикальной клетки се формируются
октанты, а затем глобулярный проэмбрио, в котором дифференцируется эмбрио-
дерма. Клетка cd делится поперечно, формируя тяж уплощенных клеток,
представляющих собой переходную зону от зародыша к пузыревидной клетке
суспензора. Зародыш в зрелых семенах дифференцирован на массивный
гипокотиль, семядолю, почечку с 2—3-листовыми зачатками и апекс зародышевого
корня.
Исследованные виды. Najas flexilis, N. graminea, N. guadalupen-
sis, N. lacerata, N. major, N. minor, N. palustris.
Литература. Hofmeister, 1858, 1861; Campbell, 1897; Guignard, 1899a,
1899b; Maheshwari P., 1937; Maheshwari S. C, 1955; Venkatesh, 1956; Swamy,
Lakshmanan, 1962; Singh, 1965; Шпаков, Колесников, 1969; Lakshmanan,
1970; Шпаков, 1974;. Лодкина, 1976; Ly Thi Ba, 1981; Jain, Shan, 1985;
Vijayaraghavan, Kapoor, Tripat, 1985; Терёхин, ориг. данные.
56
Порядок 3. TRIURIDALES
Семейство TRIURIDACEAE
Пыльник 4-гнездный (Sciaphila), вскрывается экстрорзно. Тип
формирования стенки гнезда пыльника не установлен. Сформированная стенка гнезда
пыльника состоит из эпидермиса, эндотеция, среднего слоя и тапетума. Тапетум
секреторный. В эндотеции развиваются фиброзные утолщения.Тетраэдральные
и изобилатеральные тетрады микроспор формируются сукцессивно. Зрелые
пыльцевые зерна 3-клеточные.
Семяпочка анатропная, с 2 интегументами, тенуинуцеллятная. Микропиле
образовано внутренним интегументом. Археспорий одноклеточный,
преобразуется в мегаспороцит без отделения кроющей клетки. Тетрада мегаспор
линейная.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. Синергиды грушевидные. Клеткообразование при формировании антипод,
по-видимому, не происходит. Ядра антипод у Sciaphila sp. сохраняются до
ранних стадий развития эндосперма. Полярные ядра сливаются до оплодотворения.
Эндосперм формируется по нуклеарному типу. В зрелом семени имеется
обильный клеточный эндосперм, клетки которого содержат белки и жиры.
Эмбриогенез не изучен. Зигота делится поперечной перегородкой на 2 более
или менее равные по величине клетки. Зародыш в зрелом семени представлен
сравнительно малоклеточной стадией глобулярного проэмбрио, не
дифференцирован на основные органы, имеет короткий 2-клеточный подвесок.
/, 2, 7—9, 12 — Sciaphila sp., 3—6, 10, 11 — S. japonica, 13—15 — S. caudata, 16 — S. maculata
1 — сформированная стенка гнезда пыльника; 2 — стенка пыльника перед вскрыванием; 3 — диада
и тетрады (4—5) микроспор; 6 — зрелое 3-клеточное пыльцевое зерно; 7,8 — строение семяпочки
на стадии мегаспороцита (7) и тетрады мегаспор (8); 9—// — стадии развития зародышевого
мешка; 12 — халазальная часть семяпочки с эндоспермом и ядрами антипод (12а); 13 — зигота;
14, 15 — ранние стадии развития зародыша; 16 — зрелое семя. (/, 2, 7—9, 12 — по Wirz, 1910; 3—
6, 10, И — по Ohga, Sinoto, 1932; 13—15 — по Poulsen, 1884—86; 16 — по Терёхину, 1977).
57
Triuridaceae (продолжение)
Исследованные виды. Sciaphila caudata, S. japonica, S. maculata,
S. nana, S. schwackeana, Sciaphila sp.
Литература. Poulsen, 1884—1886, 1906; Johow, 1889; Wirz, 1910; Ohga,
Sinoto, 1924, 1932; Терёхин, 1977.
Порядок 4. LILIALES
Семейство MELANTHIACEAE
Пыльник 4-гнездный. Стенка гнезда пыльника у Iphigenia indica развивается
центростремительно и состоит из эпидермиса, эндотеция, 2—3 средних слоев
и тапетума (Sulbha, 1954). Клетки эпидермиса постепенно становятся сосочко-
видными. Средние слои разрушаются, однако у Amianthium muscaetoxicum
и Л indica наружный средний слой сохраняется в зрелом пыльнике. В эндотеции,
сохраняющемся среднем слое, а у Veratrum tobelianum (ориг.) и в клетках
связника вокруг проводящего пучка образуются фиброзные утолщения. Тапетум
секреторный, без реорганизации в дальнейшем. Обычно он представлен
одноядерными, у V. lobelianum (ориг.) и V. nigrum (Sokolowska-Kulczycka,
1977) — 2—4-ядерными клетками с мелкими орбикулами. У A. muscaetoxicum
клетки тапетума всегда 2-ядерные (Eunus, 1951). Крестообразные и изобилате-
ральные тетрады микроспор формируются по сукцессивному, а у Tofieldia
calyculata (Seelieb, 1924; Sokolowska-Kulczycka, 1980) и, возможно, у Uvularia
sessilifolia (Alden, 1912) — по симультанному типу. У Tricyrtis hirta и Т. affinis
(=Т. macropoda) в профазе первого деления мейоза в микроспороцитах
отмечено явление кариомиксиса (Nawa, 1928). Зрелые пыльцевые зерна 2-
клеточные, у /. indica с крахмалом.
Семяпочка анатропная, тенуинуцеллятная (A. muscaetoxicum, Calochortus,
I. indica, U. sessilifolia) или крассинуцеллятная (Aletris, Gloriosa, Narthecium,
Zygadenus). Для представителей родов Veratrum, Tofieldia и Tricyrtis данные
о степени развития нуцеллуса противоречивы. Возможно, это связано с
отсутствием подробных данных по развитию семяпочки. Кроме того, не все
исследователи достаточно четко различают париетальную ткань и нуцеллярный колпачок.
Так, у Calochortus (Cave, 1941) и /. indica (Sulbha, 1954) говорится о нуцел-
лярном колпачке над мегаспороцитом, а судя по рисункам это образование
можно рассматривать и как париетальную ткань. Соответственно семяпочку
определяют либо как тенуинуцеллятную, либо как крассинуцеллятную. У Aletris
aurea (Browne, 1961) и /. indica (Sulbha, 1954) семяпочки с фуникулярным
обтуратором; у /. indica имеется гипостаза, представленная тонкостенными
клетками. С началом развития зародышевого мешка отмечается разрушение
нуцеллуса в микропилярной и латеральных частях семяпочки. В семяпочке
перед оплодотворением нуцеллус имеется лишь в области халазы. В
дальнейшем он полностью исчезает, однако у Calochortus amabilis он сохраняется и
в зрелом семени (Berg, 1960). Семяпочка с 2 интегументами, микропиле
образовано внутренним интегументом. Последний обычно 2-слойный (у A.
muscaetoxicum образуется оперкулум), а наружный интегумент состоит из 3—
4 слоев клеток. У С. amabilis и /. indica формируется интегументальный тапетум.
Проводящий пучок оканчивается в халазе. Археспорий одноклеточный, реже —
клеток более 2 (/. indica, U. sessilifolia). В случае отделения париетальной
клетки париетальная ткань, как правило, однослойная. У большинства видов
тетрада мегаспор линейная или Т-образная.
Зародышевый мешок моноспорический, развивается из халазальной
мегаспоры по Polygonum-типу. У Gloriosa virescens во всех клетках линейной
тетрады мегаспор происходят деления ядер без цитокинеза. В дальнейшем
зародышевый мешок чаще всего формируется из халазальной клетки, иногда —
из эпихалазальной. В последнем случае халазальная мегаспора долго
сохраняется (Afzelius, 1918). У Т. calyculata, V. lobelianum и V. nigrum
зародышевый мешок может быть как моноспорическим и развиваться в
соответствии с Polygonum-типом, так и биспорическим и развиваться по 2
различным типам. Во всех случаях диада мегаспор образуется как обычно.
Затем в одних семяпочках деление происходит только в халазальной клетке,
причем без образования перегородки, а микропилярная клетка дегенерирует;
зародышевый мешок биспорический, Allium-типа. В других семяпочках
микропилярная клетка делится раньше халазальной и, таким образом, формируется
59
с фиброзными утолщениями;
триада мегаспор. Далее деление идет в халазальной клетке, при этом оно
может сопровождаться заложением перегородки (формируется моноспориче-
ский зародышевый мешок Polygonum-типа) или перегородка не возникает
(зародышевый мешок биспорический, формируется в соответствии с Veratrum
lobelianiim-типом — название типа впервые; см.: Sokolowska-Kulczycka, 1973).
У исследованных видов количественное соотношение зародышевых мешков
с разными типами развития примерно одинаково. У Т. calyculata доля моно-
спорических зародышевых мешков при неблагоприятных условиях уменьшается,
а биспорических — увеличивается (Sokolowska-Kulczycka, 1973, 1977, 1980,
1985). Зрелый зародышевый мешок различной формы, чаще всего —
вытянутый. У A. muscaetoxicum, С. amabilis, V. lobelianum, V. nigrum и U. sessilifolia
синергиды с нитчатым аппаратом. Обычно имеются 3 одноядерные антиподы.
У Amianthium, Gloriosa, Heloniopsis, Iphigenia, Veratrum и Zygadenus они 2-,
иногда многоядерные, а клетки могут быть в числе 4—5 (Л. muscaetoxicum)
и даже 10—11 (/. indica, V. nigrum). Антиподы эфемерные, дегенерируют
сразу же после оплодотворения, у С. amabilis — еще в период созревания
зародышевого мешка. Напротив, у Tricyrtis антиподы увеличиваются в
размерах, занимая 1/3 объема зародышевого мешка в его халазальной части,
и сохраняются до начала эмбриогенеза. Полярные ядра сливаются до
оплодотворения вблизи яйцевого аппарата или антипод, что связано в дальнейшем
60
8—// — развитие семяпочки и мегаспорогенез; 12— тетрада 2-ядерных мегаспор; 13—16 —
развитие зародышевого мешка; 17 — зрелый зародышевый мешок; 18 — схема сформированной
семяпочки;
с разными типами эндоспермогенеза. Электронно-микроскопические
исследования показали, что у Colchicum autumnale синергиды с редуцированным
нитчатым аппаратом. Во всех клетках зародышевого мешка обнаружены в
большом количестве пластиды и липиды, причем в синергидах — лишь на стадии
сформированного зародышевого мешка. Стенки антипод, прилегающие к
гипостазе, с многочисленными выростами и плазмодесмами. Центральная клетка
сильновакуолизированная, ее оболочка складчатая; пространство между
центральной клеткой и интегументом заполнено фибриллярным веществом (Ja-
louzot, 1982b, 1983). В семействе описаны порогамия и двойное оплодотворение.
Эндосперм 2 типов: гелобиальный (Amianthium, Metanarthecium, Narthe-
cium, Tofieldia, Veratrum, кроме V. nigrum) и нуклеарный (Aletris,
Colchicum, Gloriosa, Iphigenia, Tricyrtis). В случае гелобиального эндосперма в микро-
пилярной камере может образоваться до 64 ядер у Veratrum album и Zygadenus
elegans и около 120 ядер у Т. calyculata. Халазальная камера эндосперма
обычно 2—4-ядерная, у V. album и Z. elegans она имеет около 16 ядер
и сохраняется до первых стадий эмбриогенеза. У /. indica эндосперм
становится клеточным на глобулярной стадии развития зародыша. Клетки
эндосперма одно-, в халазальной части — многоядерные, при этом ядра могут
сливаться. Эндосперм в зрелом семени сохраняется. Его клетки тонкостенные.
Лишь тангентальная стенка клеток наружного слоя обычно утолщена (Огане-
зова, 1984). У /. indica в эндосперме обнаружены жиры.
Эмбриогенез соответствует Onagrad-типу Heloniopsis-вариации. У Calochor-
tus и /. indica зародыш с подвеском из 5 и более клеток; у Calochortus
он сохраняется в зрелом семени. Зародыш прямой, различных размеров
у разных видов, хорошо дифференцирован на семядолю,, почечку, гипокотиль
и зародышевый корень.
У /. indica (Sulbha, 1954) и, вероятно, у Colchicum speciosum (Гваладзе,
Криалашвили, 1988) дополнительный зародыш может развиваться из
синергиды, а у С. autumnale (Furlani, 1904) — из клеток нуцеллуса.
61
Melanthiaceae (продолжение)
19, 20 — стадии развития нуклеарного эндосперма; 21, 30 — семя на стадии глобулярного
зародыша; 22, 23 — стадии развития гелобиального эндосперма; 24—29 — эмбриогенез; 31 — зрелое
семя с зародышем и эндоспермом. (1—7 — ориг.; 8, 9, 18—21, 24—29, 31 — по Sulbha, 1954;
10, 11 — по Cave, 1941; 12, 13 — по Afzelius, 1918; 14—16 — по Stenar, 1928; 17 — по Berg, 1960,
22, 23 —по Опо, 1929; 30 — по Guerin, 1937).
Исследованные роды и виды. Aletris aurea, A. farinosa, A. fo-
liata, Amianthium muscaetoxicum, Calochortus (12), Colchicum autumnale,
C. speciosum, Gloriosa rothschildiana, G. superba, G. virescens, Heloniopsis
breviscapa, Iphigenia indica, Metanarthecium luteo-virde, Narthecium asiaticum,
N. ossifragum, N. scardicum, Pleea tenuifolia, Tofieldia calyculata, T. japonica,
T. racemosa, Tricyrtis af finis (=7\ macropoda), T. hirta, T. latifolia, Uvularia
grandiflora, U. sessilifolia, Veratrum album, V. lobelianum, V. maackii, V.
nigrum, V. viride, Zygadenus elegans.
Литература. Hofmeister, 1859; Ikeda, 1902; Furlani, 1904; Berghs,
1905; Lotscher, 1905; Alden, 1912; Afzelius, 1918; Heiman-Winawer, 1919;
Seelieb, 1924; Ono, 1926, 1928, 1929; Nawa, 1928; Stenar, 1928, 1931; Buxbaum,
1937; Guerin, 1937; Beal, §939; Joshi, 1939; Varitchak, 1940; Cave, 1941,
62
1967; Silva, 1945; Martin, 1946; Eunus, 1949, 1951; Sulbha, 1954; Berg,
1960; Browne, 1961; Ogura, 1964; Савченко, Комар, 1965; Sokolowska-Kul-
czycka, 1973, 1977, 1980, 1985; Jalouzot, 1982a, 1982b, 1983; Jalouzot, Gianordoli,
Favre-Duchartre, 1983; Оганезова, 1984; Гваладзе, Криалашвили, 1988, 1989;
Шамров, ориг. данные.
Семейство HERRERIACEAE
Эмбриологически не изучено.
Эндосперм представлен тонкостенными клетками без пор (Herreria salsa-
parilha) либо толстостенными клетками с порами (Я. montevidensis). Запасные
питательные вещества накапливаются в виде белков и жиров
(Немирович-Данченко, 1985).
Зародыш цилиндрической формы, почти прямой, занимает 1/2—1/3 часть
семени (Huber, 1969); у Н. stellata с семядолью и зародышевым корнем
(Немирович-Данченко, 1985).
Литература. Engler, 1889; Krause, 1930; Huber, 1969; Немирович-
Данченко, 1985.
Семейство LILIACEAE
Пыльник 4-гнездный. Формирование стенки гнезда пыльника происходит
центростремительно. Сформированная стенка состоит из эпидермиса, эндотеция,
обычно 2 (у Dipcadi montanum— 1, у Lilium candidum 3—5) средних слоев
и тапетума. В эндотеции, а у D. montanum (Mahabale, Chennaveeraiah, 1961)
и в смежных с ним клетках со стороны связника, развиваются фиброзные
утолщения. Средние слои эфемерные. Тапетум клеточный секреторный. У Belle-
valia lipskyi и Muscari racemosum он секретирует липофильные вещества;
ЭР хорошо развит (Кордюм и др., 1974). Реорганизация в нем в дальнейшем
не происходит. Клетки тапетума 2-, реже — 2—3-(Camassia quamash, Hyacin-
thus romanus) и 3—4-ядерные (D. montanum). У L. candidum до стадии
диплотены они 2-ядерные, затем в некоторых из них происходит еще одно
деление ядер. В результате этого клетки тапетума могут содержать от одного
до 4 ядер, различающихся по плоидности и величине. С наружной,
примыкающей к среднему слою стороны клеток тапетума формируется перита-
петальная пленка и тапетальная пленка с орбикулами — со стороны,
обращенной внутрь гнезда пыльника (Резникова, 1984). Первые признаки
деградации тапетума проявляются на стадии вакуолизированных микроспор. Этот
процесс у разных видов может идти различными путями. У Lilium davidii
и L. henryi происходит постепенная деструкция ядер. Они становятся
лопастными, затем разрушаются их оболочки и в них появляются светлые
вакуолеподобные структуры, выходящие в цитоплазму. Пластиды заполняются
пластоглобулами, оболочки их в конечном счете дезинтегрируют. Деградация
клеток тапетума сопровождается вакуолизацией цитоплазмы. У L. martagon,
напротив, вакуоли в цитоплазме не образуются, цитоплазма заполняется
темноокрашенными запасными веществами. Ядра остаются до конца
компактными и нелопастными (Herich, Lux, 1985). Во время мейоза в оболочках
микроспороцитов откладывается каллоза, наибольшее количество которой
наблюдается в тетрадах микроспор. Образование тетраэдральных, изобилате-
ральных, реже — крестообразных тетрад микроспор происходит сукцессивно.
У С. quamash в одном пыльнике тетрады могут образовываться как по сук-
цесссивному, так и по симультанному типу (Leffingwell, 1930). В ходе микро-
спорогенеза у L. henryi (Dickinson, 1981) и L. longiflorum (Dickinson, Heslop-
Harrison, 1970) отмечены глубокие изменения в ультра структуре цитоплазмы
клеток. Пластиды и митохондрии подвергаются дедифференциации и редиф-
ференциации. Зрелые пыльцевые зерна обычно 2-клеточные; генеративная
клетка серповидной формы. У Ornithogalum narbonense встречаются и 3-кле-
точные пыльцевые зерна (Рустамова, 1982). Гистохимическое исследование
пыльника L. candidum и L. hybridum показало, что в микроспоре перед
митозом наблюдается накопление крахмала и липидов, причем процесс
аккумуляции последних первоначально замедлен. После завершения деления ве-
63
гетативная клетка пыльцевого зерна полностью заполняется крахмалом, а
количество липидов достигает максимума. К моменту вскрывания пыльников
крахмал, накопленный ранее в пыльцевых зернах, гидролизуется (Reznikova,
1978; Резникова, Виллемсе, 1981; Резникова, 1984). У Scilla nonscripta (Gi-
menez-Martin et al., 1969), B. lipskyi и М. racemosum (Кордюм и др.,
1975) вокруг оболочки генеративной клетки имеются скопления липидных
глобул, причем у 5. nonscipta — в виде «короны». В процессе созревания
пыльцевого зерна «корона» исчезает и у всех видов липидные тела
оказываются рассеянными в цитоплазме вегетативной клетки. Пластиды
представлены амилопластами. На ряде видов показана неоднотипность поведения
пластид в ходе формирования и созревания пыльцевого зерна (Schroder,
Hagemann, 1985). В период отхождения генеративной клетки от спородермы
ее оболочка у L. longiflorum формируется за счет пузырьков, производных
аппарата Гольджи, гранулярного ЭР и полисахаридных частиц, возникающих
при гидролизе липидных тел цитоплазмы вегетативной клетки. В зрелом
пыльцевом зерне оболочка генеративной клетки извилистая, с неравномерными
утолщениями. Она окружена большим числом липидных тел цитоплазмы
вегетативной клетки. В ее собственной цитоплазме довольно много электрон-
нопрозрачных пузырьков, продуктов распада липидных тел, а также редкие
липидные тела, митохондрии и диктиосомы (Nakamura, Miki-Hirosige, 1985).
У Hyacinthus orientalis (Stow, 1930, 1934; Naithani, 1937) и у Ornithogalum
nutans (Qeitler, 1941) описаны аномальные гигантские пыльцевые зерна. Перво-
64
Liliaceae (продолжение)
10—17—микроспорогенез и развитие пыльцевого зерна; 18—21 — аномалии при формировании
пыльцевого зерна, приводящие к возникновению зародышеподобных структур;
начально в них образуется до 8 ядер; после клеткообразования они
приобретают вид зародышевых мешков. Такое нарушение в развитии пыльцевых
зерен наблюдается после специальной обработки растений высокой
температурой во время мейоза. У Я. orientalis и L. candidum способность к
образованию ценоцитных и многоклеточных структур в условиях in vivo
представляет интерес в плане возможного получения эмбриоидов в культуре in vitro
(Шевченко, 1986).
Семяпочка анатропная, с 2 интегументами, тенуинуцеллятная (подсем.
Lllloldeae, кроме Medeola virginiana) или крассинуцеллятная (подсем. Sclllo-
ideae). Микропиле образовано внутренним интегументом, клетки которого у
О. caudatum секреторные (Tilton, Lersten, 1981a). Внутренний интегумент
обычно 2-слойный, в районе микропиле — 3—4-(Lilium kesselrlnglanum) или
4—6-слойный (Sctlla sibirica). Наружный интегумент обычно 4-слойный, у Ga-
gea stipitata (наши данные) состоит из 2, у Я. romanus — из 5, у S. sibirica —
из 4—б, у Tulipa kaufmanniana — из 11 —12 слоев клеток. У
представителей родов Lilium, Fritillaria, Tulipa в эпидермисе наружного интегумента
имеются устьица (Петрова, 1977). У Albuca transvaalensis и О. caudatum
образуется нуцеллярный колпачок. У последнего вида клетки нуцеллярного
колпачка похожи на клетки секреторного типа. У Gagea fascicularls (=G. luted)
и 5. sibirica эпидермис нуцеллуса также в виде секреторных клеток с крупными
ядрами и плотной цитоплазмой (Савченко, Комар, 1965). Гипостаза отмечена
у Bowlea volubilis, О. caudatum и О. nutans. У О. caudatum она начинает
дифференцироваться после завершения мейоза и в сформированной семяпочке
представлена 2—3 рядами клеток. В халазальной части семяпочки у этого
вида накапливается большое количество крахмала; немного крахмала есть
и в клетках гипостазы. Однако в 1—3 ее клетках, примыкающих к антиподам,
обнаруживается значительное количество углеводов, но не в форме крахмала
5 Зак. 2144
65
(Tilton, 1980). У Л. transvaalensis, В. volubitis, D. montanum и О. caudatum
имеется обтуратор фуникулярного происхождения. Мощный проводящий пучок,
выходя из фуникулуса, заканчивается в халазе. У О. caudatum он отделен
от гипостазы лишь несколькими клетками и состоит из многочисленных тра-
хеид и тонкостенных клеток флоэмы. У Lilium neilgherrense в клетках
фуникулуса вокруг проводящего пучка содержится крахмал. Археспорий
одноклеточный, реже — 2—3-клеточный (Л. transvaalensis, Gagea minima, О. umbella-
tum). У большинства видов семейства при делении археспориальной клетки
отделяется кроющая клетка. Обычно образуется один париетальный слой,
однако у Л. transvaalensis, Camassia leichtlinii и Chlorogalum pomeridianum
их 2, у D. montanum — 2—3, у Eucomis punctata — 4 париетальных слоя.
У видов родов Erythronium, Gagea и Lilium археспориальная клетка
преобразуется в мегаспороцит без отделения кроющей клетки. У значительного
66
Liliaceae (продолжение)
32 — зрелый зародышевый мешок; 33—35 — двойное оплодотворение по постмитотическому типу;
36—39 — двойное оплодотворение по премитотическому типу: 36—38 — объединение спермия с
ядром яйцеклетки, 39 — с полярными ядрами;
числа представителей семейства каждое меиотическое деление в мегаспороците
сопровождается заложением перегородок и возникновением линейных, реже —
Т-образных и неправильной формы тетрад мегаспор. У некоторых видов
после второго (вероятно, Scilla) или при обоих мейотических делениях (Егу-
thronium, Tulipa, Lilium и др.) перегородки не возникают, что в дальнейшем
приводит к развитию би- и тетраспорических зародышевых мешков. У Lilium
tigrinum выявлены нарушения в мейозе, выражающиеся в элиминации и
расщеплении отдельных хромосом, в образовании хромосомных мостов и в
неполном расхождении хромосом, что приводит к формированию в зародышевом
мешке дополнительных микроядер (Westfall, 1940). У L. longiflorum в мега-
спорогенезе, как и во время микроспорогенеза, обнаружены значительные
изменения ультраструктуры клеток (Dickinson, Potter, 1978).
Зародышевый мешок у видов Albuca, Bowiea, Camassia, Drimiopsis и
Ornithogalum моноспорический, развивается из халазальной мегаспоры по
Polygonum-типу. У Я. romanus он формируется из микропилярной мегаспоры
(Гамбарова, 1972). Относительно типа развития зародышевого мешка в роде
Scilla данные противоречивы. У 5. sibirica, согласно ряду авторов (Schniewind-
Thies, 1901; Устинова, 1949; Герасимова-Навашина, Батыгина, 1964),
зародышевый мешок биспорический, формируется по Allium-типу из нижней клетки
5*
67
Liliaceae (продолжение)
40—43 — двойное оплодотворение: процесс сингамии происходит по постмитотическому, а тройное
слияние — по премитотическому типу; 44—46 — формирование гелобиального эндосперма,
антиподы долго сохраняются;
диады. Согласно Г. Е. Капинос (1980), зародышевый мешок у этого вида моно-
спорический и развивается по Polygonum-типу. Остается дискуссионным
также вопрос о типе развития зародышевого мешка у Scilla hispanica: одни
авторы (Treub, Mellink, 1880; Guignard, 1882; McKenney, 1898) определяют
его как биспорический, развивающийся из верхццй клетки диады по Endymion-
типу, другие (Sulbha, 1954) — как моноспорический Polygonum-типа. Переис-
Liliaceae (продолжение)
47—55 — развитие зародыша по Asterad-типу, Muscari-вариации; 56—61 — развитие зародыша
по Caryophyllad-типу; 62 — зрелое семя; 63—67 — некоторые стадии образования дополнительных
зародышей в случае расщепленной полиэмбрионии; 68 — 2-клеточный синергидный проэмбрио,
около ядра яйцеклетки находится спермий; 69 — синергидный и зиготический проэмбрио; 70 —
проэмбрио из антиподы; 71 — проэмбрио разного происхождения: из антиподы, синергиды и зиготы
в одном зародышевом мешке. (/—4, 10, 11, 56—61 — по Mahabale, Chennaveeraiah, 1961; 7—9,
22—24, 26—31, 40—43 — ориг.; 5, 6, 12—17 — по Резниковой, 1984; 18—21 — по Naithani, 1937;
25 — по Еутё, 1965; 32, 36—39 — по Герасимовой-Навашиной, Батыгиной, 1964; 33—35 — по
Ментковськой, 1983; 44—46 — по Wunderlich, 1937; 47—55 — по Crete, 1952; 62 — по Govindappa,
1956; 63—66 — по Jeffrey, 1895; 67 — по Guerin, 1937; 68—71 — по Смирнову, Граханцевой, 1982).
68
следование этого вида показало, что зародышевый мешок биспорический,
Endymion-типа (Battaglia, 1958). У 5. indica, 5. autumnalis и 5. obtusifo-
lia зародышевый мешок Polygonum-типа. В семействе описаны различные
типы развития тетраспорических зародышевых мешков. Чаще других
встречается Fritillaria-тип, характерный для представителей родов Gagea, Fritil-
laria, Rhinopetalum, Cardiocrinum, Medeola, а также для большинства видов
Erythronium и Lilium и некоторых видов Tulipa (Г. gesneriana, T. greigi,
Т. kaufmanniana, Т. lehmanniana, Т. vvedenskyi и др.); У Erythronium albidum
и Е. americanum (Cooper, 1939; Романов, 1971) —Adoxa-тип, а у £ dens-
canis (Hruby, 1938), вероятно, Drusa-тип развития зародышевого мешка.
В роде Tulipa кроме Fritillaria-типа описаны еще 4 типа развития зародышевого
мешка: Eriostemones-тип (Tulipa turkestanica), Adoxa-тип (Т. kolpacovskiana,
Т. ostrowskiana), Drusa-тип (Т. korolkovii, Т. rosea, T. wilsoniana), Tulipa
tetraphylla-тип (Романов, 1957, 1959, 1965, 1971). Особенностям развития
зародышевого мешка по Fritillaria-типу у лилейных посвящена обширная
литература. Обычно после завершения мейоза образуется так называемый
первичный 4-ядерный зародышевый мешок, в котором одно ядро находится в микро-
пилярной, а 3 — в халазальной части. Затем во время деления происходит
объединение 3 ядер халазального полюса с образованием одного триплоидного
ядра. Однако у G. stipitata (ориг.) объединяются веретена делений лишь
2 ядер, а 3-е отходит от них вниз и в дальнейшем не делится. Зрелый
зародышевый мешок у этого вида б-клеточный и 7-ядерный (ядра клеток яйцевого
аппарата, нижней антиподы и верхнее полярное ядро — гаплоидные, а ядро верхней
антиподы и нижнее полярное ядро — диплоидные). Подобное распределение
ядер и.объединение 2 средних ядер в первичном 4-ядерном зародышевом мешке
было описано у Chrysanthemum cinerariaefolium (Martinoli, 1939), при этом
нижнее полярное ядро также оказывалось диплоидным. В дальнейшем, однако,
образуется 12 ядер и формируется 7 антипод (3 — диплоидные и 4 —
гаплоидные). Для классического Fritillaria-типа характерны аномальные митозы,
которые чаще всего происходят на стадии вторичного 4-ядерного зародышевого
мешка (2 гаплоидных ядра в микропилярной и 2 триплоидных ядра в
халазальной части). Аномальные митозы характеризуются выпадением профазы и
переходом из ранней профазы или интерфазы в метафазу с агглютинацией
хроматина. По мнению И. Д. Романова (1963, 1965), это явление обусловлено особым
цитоплазматическим градиентом и так называемой депрессией халазального
конца зародышевого мешка. Последняя может захватывать чаще всего нижнее
{Cardiocrinum, Erythronium, Gagea, Fritillaria, Rhinopetalum, большинство
видов Lilium, а также Tulipa anadroma и Т. urumoffii), но иногда и оба ядра
(Т. lehmanniana, Т. greigi и др.). В результате этого в 2, редко — в 3 антиподах
ядра находятся в сильно хроматизованном состоянии и клетки дегенерируют до
оплодотворения. У Lilium regale на ранних стадиях развития различия между
концами зародышевого мешка, а также процессы локального автолиза в его
халазальной части не выявляются (Плющ, 1987). Однако в зрелом
зародышевом мешке в халазальной части центральной клетки больше цитоплазмы, а в
антиподах она характеризуется более плотным распределением органелл.
У L. regale отмечены аномалии, проявляющиеся в незавершенности митоза
одного из микропилярных ядер и дегенерации его в дальнейшем. Это приводит
к тому, что синергиды в зрелом зародышевом мешке не образуются, а яйцевой
аппарат представлен только яйцеклеткой (Крушева, Белчева, 1976).
Электронно-микроскопические исследования показали, что во время мейоза постепенно
уменьшается число диктиосом, причем они располагаются по периферии
мегаспороцита. В том месте, где должно происходить формирование клеточной
перегородки, обнаруживаются лишь редкие аномальные диктиосомы и система
цистерн ЭР (эргастоплазма) в виде кольцевых образований у L. regale или
параллельно расположенных цистерн у Lilium candidum, Tulipa oculus-solis и Т. silve-
stris (Mikulska, Rodkiewicz, 1964, 1967a, 1967b; Eyme, 1965, 1966; Rodkiewicz,
Mikulska, 1966; Marciniak, 1975; De Boer-De-Jeu, 1978). Такого своеобразия
ультраструктуры мегаспороцита, обусловливающего в последующем развитие
тетраспорического зародышевого мешка любого типа, не обнаружено при мега-
спорогенезе, сопровождающемся заложением клеточных перегородок. У L. сап-
70
didum система цистерн эргастоплазмы возникает и вокруг делящихся микро-
пилярных ядер вторичного 4-ядерного зародышевого мешка (Rodkiewicz, Mi-
kulska, 1966). Зрелый зародышевый мешок обычно вытянут, расширен в микро-
пилярной и сужен в халазальной частях (Dipcadi, Fritillaria, Lilium, Tulipa
и др.)- У Scilla он яйцевидный, расширен в халазальной части. У S. sibirica
(Герасимова-Навашина, Батыгина, 1958), L. regale (Кордюм и др., 1980;
Плющ, 1987), G. stipitata (ориг.) и у некоторых других видов клетки яйцевого
аппарата морфологически наразличймы. Синергиды в семействе вариабельны
по своей структуре: крючковидные у D. montanum и L. henryi, крючковидные
с нитчатым аппаратом у С. quamash, С. pomeridianum и Drimiopsis maculata.
У видов Scilla, Galltonia candicans, H. romanus, Urginea indica синергиды
без крючковидных выростов, с нитчатым аппаратом. У В. vdlubllis и О. gussonli
синергиды не имеют крючковидных выростов и нитчатый аппарат в них не
обнаружен. У Л. transvaalensis синергиды дифференцированы по типу яйцеклетки
(Eunus, 1950). Антиподы, как правило, в числе 3 клеток, однако у S. sibirica
их 6—8, реже — 10 (Герасимова-Навашина, Батыгина, 1958). У S. campanulata,
S. nutans и S. nonscripta при формировании антипод клетки обычно не
образуются, если же это происходит, то они рано дегенерируют (Guignard, I882;
McKenney, 1898). При развитии зародышевого мешка по Fritillaria-типу 2—
3 антиподы разрушаются до оплодотворения, в случае Polygonum-типа развития
они часто сохраняются до первых стадий эндоспермогенеза. У О. gussonii
антиподы 2-ядерные, обнаруживаются до начала эмбриогенеза (Zabinska,
1972). УЛ. transvaalensis (Eunus, 1950) и D. montanum (Mahabale, Chennavee-
raiah, 1961) антиподы различаются по величине, при этом более крупная
находится в самой нижней части зародышевого мешка. Часто они похожи
на синергиды и у S. sibirica в них иногда выявляется структура,
напоминающая нитчатый аппарат (Герасимова-Навашина, Батыгина, 1958). Полярные
ядра сливаются до оплодотворения вблизи яйцевого аппарата, у Ornithogalum
gussonii, О. nutans, Scilla hohenackeri и S. sibirica — вблизи антипод. У D. топ-
tanum слияние полярных ядер начинается в микропилярной, а заканчивается
в халазальной части зародышевого мешка. По данным гистохимии клеток
зародышевого мешка О. caudatum (Tilton, 1981a) и S. sibirica (Bhandari,
Sachdeva, 1983), синергиды имеют непрерывную клеточную оболочку.
Электронно-микроскопические исследования синергид L. regale до оплодотворения
не внесли полной ясности в вопрос о строении их клеточной оболочки. Одни
авторы (Кордюм и др., 1980) считают, что клеточная оболочка в синергидах
и вообще в клетках яйцевого аппарата присутствует только в базальной
части клеток, тогда как их апикальные части окружены лишь плазмалеммой.
Другие (Плющ, 1987) полагают, что клетки яйцевого аппарата имеют полные
полисахаридные оболочки. В синергидах S. sibirica пластиды и ЭР находятся
только в халазальной части клеток, в то время как митохондрии — по всей
клетке. Хорошо развитый нитчатый аппарат в синергидах образован сетью
многочисленных пальцеобразных выростов клеточной оболочки. У О. caudatum
в нем наряду с углеводами выявлены белки и РНК. Особенности строения
синергид позволяют рассматривать их как передаточные клетки. Кроме того,
нитчатый аппарат, вероятно, причастен к секреции хемотропных веществ
для осуществления направленного роста пыльцевых трубок в синергиду (Tilton,
1981а; Bhandari, Sachdeva, 1983, и др.). У О. caudatum на проксимальных
концах клеток нуцеллярного колпачка имеются многочисленные пузырьки,
которые, по-видимому, транспортируют вещества из синергид в нуцеллярный
колпачок. У S. sibirica стенки клеток эпидермиса нуцеллуса, контактирующие с
зародышевым мешком, также имеют выросты клеточных оболочек. Яйцеклетка
у этого вида с крахмальными зернами и значительным количеством белка.
Полисахаридная клеточная оболочка центральной клетки, присутствующая
лишь в области контакта с клетками нуцеллуса, имеет небольшие выросты.
В центральной клетке выявляются белки и крахмал. Антиподы с полной
полисахаридной оболочкой и выростами 2 типов — в виде пучка из
разветвленных пальцеобразных структур и небольших отдельных бугорков, что
характеризует их наряду с синергидами как передаточные клетки. В цитоплазме
антипод обнаружено большое количество белка и крахмальных зерен (Bhandari,
71
Sachdeva, 1983). Порогамия. Оплодотворение двойное, у большинства видов
проходит по постмитотическому, а у Fritillaria pudica (Sax, 1916), S. sibirica
(Герасимова-Навашина, Батыгина, 1958; Korobova, 1978) и S. hohenackeri
(Капинос, 1980) — по премитотическому типу. Пыльцевая трубка входит в
зародышевый мешок через одну из синергид спустя 18 ч (С. leichtlinii — Smith,
1942), 72—84 (Т. vvedenskyi — Печеницын, 1965) или 84—96 ч (L. henryi —
Ментковська, 1982) после опыления. Объединение ядер спермиев с ядрами
яйцеклетки и центральной клетки происходит у Т. vvedenskyi в течение
40—60 ч; ядро первичной клетки эндосперма приступает к делению через
120—130 ч после опыления. У S. sibirica (Герасимова-Навашина, Батыгина,
1958) при обильном опылении в искусственных условиях спустя 10 ч
происходило образование спермиев в пыльцевой трубке, а через 18—25 ч
пыльцевая трубка входила в зародышевый мешок, и наблюдалось слияние гамет,
тогда как у S. hohenackeri (Капинос, 1980) оплодотворение осуществлялось
значительно позже. У некоторых видов с Fritillaria-типом развития
зародышевого мешка (Gagea parva, Г. greigi, Т. kaufmanniana, T. vvedenskyi) нижнее
триплоидное полярное ядро в оплодотворении не участвует, хотя у Т. vvedenskyi
оно может вступать в контакт с верхним гаплоидным полярным ядром и ядром
спермия. G. stipitata (ориг.) характеризуется некоторыми особенностями
двойного оплодотворения: процесс сингамии завершается по постмитотическому,
а тройного слияния — по премитотическому типу. Еще задолго до полного
объединения ядер яйцеклетки и спермия происходит деление первичного ядра
эндосперма.
Эндосперм 2 типов: гелобиальный (Albuca, Chlorogalum, Dipcadi, Eucomis,
Galtonia, Ornithogalum, Muscari, Puschkinia, S. indica, Veltheimia) и нукле-
арный (Camassia, Cardiocrinum, Erythronium, Gagea, Fritillaria, Hyacinthus,
Korolkowia, Medeola, Scilla cernua, S. japonica, S. sibirica, Tulipa). При ге-
лобиальном типе развития эндосперма небольшая халазальная камера, обычно
эфемерная, имеет 2—4 ядра. В микропилярной камере происходит большое
число делений ядер, после чего наступает клеткообразование. В случае развития
по нуклеарному типу эндосперм проходит сначала стадию ценоцита (у
Cardiocrinum giganteum — 300 ядер, у Erythronium sibiricum — около 4000; Петрова,
1977), а затем — клеточную. В зрелом семени эндосперм сохраняется, в нем
обнаруживаются запасные вещества в виде крахмала, белков и жиров.
Эмбриогенез у видов Cardiocrinum, Fritillaria, Lilium соответствует Onag-
rad-типу Lilium-вариации. У Muscari comosum, M. racemosum, а также у
S. autumnalis зародыш развивается по Asterad-типу Muscari-вариации, у
Dipcadi и Gagea — по Caryophyllad-типу. Виды Tulipa и Erythronium, развитие
зародыша которых не укладывается в существующие типы, отнесены к видам
с поздно дифференцирующимся зародышем (Haccius, Hausner, 1972; Петрова,
1977). Зародыш с подвеском разного строения, что связано с различными
типами эмбриогенеза. В зрелом семени он сравнительно небольшой, прямой или
слегка изогнутый, занимает от 1/12 до 1/5 длины семени у разных видов.
Зародыш, как правило, дифференцирован на небольшую семядолю, почечку и
короткий зародышевый корень. У Fritillaria семя с зародышем, не
дифференцированным на органы; доразвитие происходит после опадения семян до их прорастания
(Двораковская, 1971). Лейкоэмбриофиты (Яковлев, Жукова, 1973).
Описаны различные типы апомиксиса. У видов Erythronium обнаружена
расщепленная полиэмбриония (Guerin, 1937; Jeffrey, 1895). Для О. umbellatum
(Desole, 1947; Czapik, 1966) и О. gussonii (Zabinska, 1972) характерна
нередуцированная апоспория, прослежено развитие зародышевых мешков из
пограничных с халазой клеток нуцеллуса до 4-ядерной стадии. У L. kessel-
ringianum основной зародышевый мешок может иногда не развиваться, в таком
случае дополнительные зародышевые мешки возникают из клеток интегумента
на уровне халазального конца зародышевого мешка (Кобахидзе, 1970). У
многих видов семейства дополнительные зародыши возникают путем
редуцированной апогаметии, чаще всего из синергид, у Fritillaria meleagroides (Смирнов,
Граханцева, 1982) и Gagea chomutovae (Петрова, 1977) — из синергид и
антипод. У Т. gesneriana наряду с редуцированной апогаметией обнаружен
автономный и индуцированный гиногенез (Романова и др., 1983).
72
Исследованные роды и виды. Albuca transvaalensls, Bellevalia
lipskyi, Bowiea volubilis, Camassia leichtlinii, C. quamash, Cardlocrinum corda-
tum, С giganteum, Chionodoxa luciliae, Chlorogalum pomeridianum, Dipcadi
montanum, D. serotinum, Drimiopsis barteri, D. kirki, D. maculata, Erythronium
(15), Eucomis punctata, Fritillaria (12), Gagea (12), Galtonia candicans,
Hyacinthus amethystinus, H. orientalis, H. romanus, Korolkowia sewerzowii,
Lachenalia pendula, Lilium (19), Lloydia serotina, Medeola virginiana, Muscari
(6), Notholirion thomsonianum, Ornithogalum (12), Puschkinia scilloides,
Rhinopetalum arianum, R. bucharicum, Scilla (15), Tulipa (35), Urginea indica,
U. maritima, Veltheimia viridiflora, V. viridifolia.
Литература. Hofmeister, 1859; Treub, Mellink, 1880; Guignard, 1882,
1900a, 1900b; Dixon, 1895, 1946; Jeffrey, 1895; Sargant, 1896a, 1896b, 1897;
Chamberlain, 1897; Coulter, 1897; Schaffner, 1897, 1901; Bouin M., Bouin P.,
1898; McKenney, 1898; Mottier, 1898; Навашин, 1898а, 18986; Nawaschin,
1899, 1910; Bernard, 1900; Ernst, 1901; Schniewind-Thies, 1901; Ferguson,
1907; Schneider, 1908; Lechmere, 1910; Smith R., 1911; Nemec, 1912, 1931;
Blackman, Welsford, 1913; Welsford, 1914; Sax, 1916; Nothnagel, 1918; Weniger,
1918; Schowalter, 1921; Herrig, 1922; Baranov, 1926; Soueges, 1926, 1932;
Bambacioni, 1927, 1928a, 1928b, 1928c; Lenoir, 1927; Stenar, 1927, 1932,
'1937, 1949, 1950, 1951; Heimans, 1928; Krupko, 1928; Nawa, 1928; Ono,
1928; Schnarf, 1928, 1929; Bambacioni, Qiombini, 1930; Guerin, 1930, 1931,
1937; Leffingwell, 1930; Stow, 1930, 1934; Bambacioni-Mezzetti, 1931, 1947;
Finn, 1931; Messeri, 1931; Maheshwari, 1932, 1946, 1947; Schnarf, Wunderlich,
1933; Smith R, 1933, 1942, 1943, 1955; Cooper, 1934, 1935, 1936, 1939, 1943;
Hoare, 1934; Hruby, 1934, 1938; Romanov, 1936, 1959; Westergard, 1936;
Бочанцева, 1937; Buxbaum, 1937; Capoor, 1937a, 1937b; Chandler, Porterfield,
Stout, 1937; Naithani, 1937; Oikawa, 1937, 1940, 1953; Santos, 1937; Simoni,
1937; Wunderlich, 1937; Романов, 1938, 1939, 1944, 1945, 1954, 1957, 1960,
1961, 1963, 1965, 1971; Кострюкова, 1939, 1960, 1961; Martinoli, 1939; Joshi,
1940; Mezzetti-Mambacioni, 1940, 1943; Sundar Rao, 1940; Westfall, 1940;
Bellows, Bamford, 1941; Fagerling, 1941; Geitler, 1941; Cave, 1942, 1974;
Conant, Haquist, 1944; Walker, 1944; Bianchi, 1946; Капинос, 1946, 1955,
1972, 1980; Martin, 1946; Rosenberg, 1946; Wilkie, 1946; Desole, 1947; Buchner,
1948; Erickson, 1948; D'Amato, 1949; Eunus, 1949, 1950, 1951; Fourcroy,
1949; Subramanyan, Govindu, 1949; Устинова, 1949; Agrawal, 1950; Govindappa,
Sheriff, 1951; Haque, 1951; Morgan, Rappleye, 1951; Crete, 1952; Sulbha,
1954; Brock, 1955; Chiappini, 1955, 1962; Govindappa, 1956; Vazart, 1956;
Батыгина, Герасимова-Навашина, 1957; Guttenberg, Jakuszeit, 1957; Hubac,
1957; Лодкина, 1957; Battaglia, 1958a, 1958b, 1958c, 1959; Flint, Johansen,
1958; Герасимова-Навашина, Батыгина, 1958, 1964; Linskens, 1958; Battaglia,
Feeley, 1959; Герасимова-Навашина, Коробова, 1959; Самородова-Бианки,
1959; Mahabale, Chennaveeraiah, 1961; Rodkiewicz, 1961; Berg, 1962; Chenna-
veeraiah, Mahabale, 1962; Герасимова-Навашина, 1962; Emsweller, Uhring,
1962; Johri, 1962; Фурст, 1962; Печеницын, 1963, 1965a, 1965b, 1972a, 1972b; Tan-
don, Kapoor, 1963; Mikulska, Rodkiewicz, 1964, 1967a, 1967b; Rodkiewicz,
Mikulska, 1964, 1965a, 1965b, 1966a, 1966b, 1967; Волховских, 1965, 1968;
Eyme, 1965, 1966; Каракозова, 1965; Кохабидзе, 1965, 1966a, 19666, 1966в,
1967, 1968, 1970; Савченко, Комар, 1965; Sokolowska-Kulczycka, 1965;
Гусейнова, 1967; Петрова, 1967, 1968а, 19686, 1977; Гамбарова, 1969, 1972, 1978;
Gimenez-Martin, Risueno, Lopez-Saez, 1969; Koul, Wafai, Khan, 1969; Kuran,
Marciniak, 1969; Dickinson, Heslop-Harrison, 1970, 1977; Pahuja, Kumar,
1970; Двораковская, 1971; Dickinson, 1971, 1981; Коробова-Семенченко, Шипов-
ская, Колокольникова, 1971; Reznickova, 1971; Резникова, 1971, 1973а, 19736,
1975, 1984; Stack, 1971; Czapik, 1972; Гусейнова, Капинос, 1972, 1980; Haccius,
Hausner, 1972; Карагьозова, Фан Ван Ханх, 1972; Reznickova, Bogdanov,
1972; Tellini-Battaglia, Di Cristo-Maggini, 1972; Zabinska, 1972; Беляева,
1973, 1975, 1977; Гваладзе, 1973, 1974, 1976, 1978; Williams, Heslop-Harrison,
Dickinson, 1973; Яковлев, Жукова, 1973; Canto, Bandel, Sandra, 1974; Кордюм,
Глущенко, Попова, 1974, 1975; Кордюм, Попова, 1974; Резникова, Теплицкая,
73
Миляева, 1974; Dutt, Prakasa Rao, 1975; Marciniak, 1975; Koul, Wafai, Wakhlu,
1976; Крушева, Белчева, 1976, 1977; Syamasundar, Panchaksharappa, 1976;
Dickinson, Andrews, 1977; Krusheva, 1977; Ротов, Петрова, 1977; Шпильовий,
1977; Wafai, 1977; De Boer-De-Jeu, 1978a, 1978b; Dickinson, Potter, 1978; Koro-
bova, 1978; Rodriguez-Garcia, 1978; Rodriguez-Garcia M., Garcia A., 1978;
Смирнов, 1978, 1982; Шпилевой, Ященко, Литвиненко, 1978; Utech, 1978; Gva-
ladze, 1979; Tanaka, Taguchi, Ito, 1979; Кордюм, Недуха, Сидоренко, 1980;
Ментковська, 1980, 1982; Reznickova, Willemse, 1980, 1981; Резникова, Виллем-
се, 1981а, 19816; Tilton, 1980a, 1980b, 1981a, 1981b; Tilton, Horner, 1980;
Willemse, Reznickova, 1980; Koul, Wafai, 1981; Svoma, 1981; Tilton, Lersten, 1981a,
1981b; Ghosh, Shivanna, 1982; Оганезова, 1982; Резникова, Погорельская,
Попов, 1982; Рустамова, 1982; Смирнов, Граханцева, 1982; Wafai, Koul, 1982,
1985; Bhandari, Sachdeva, 1983; Dickinson, Willson, 1983; Hisako, Sumio, 1983;
Комар, 1983; Романова, Кольцова, Мосолкова, 1983; Соколов, 1983; Хведынич,
Банникова, Сердюк, 1983; Bednarska, 1984; Naidu, 1984; Oyewole, 1984; Татин-
цева, 1984; Банникова, Хведынич, Шпилевая, Остапенко, Сидорова, Плющ,
1985; Herich, Lux, 1985; Крушева, 1985; Nakamura, Miki-Hirosige, 1985;
Schroder, Hagemann, 1985; Капинос, Гусейнова, Ахундова, 1986; Мезев, 1986; Narain,
1986; Шевченко, 1986; Кравец, 1987; Плющ, 1987; Юнусова, Рустамова, 1987;
Шамров, ориг. данные.
Семейство ALSTROEMERIACEAE
Пыльник 4-гнездный. Сформированная стенка гнезда пыльника состоит
из эпидермиса, эндотеция, 1—3 средних слоев и тапетума. Тапетум клеточный
секреторный, с 1—2-ядерными, реже — 4-ядерными клетками. На стадии
одноядерных микроспор наблюдается пикноз ядер клеток тапетума. Стенка зрелого
пыльника в месте вскрывания представлена эпидермисом и фиброзным эндо-
тецием, а по мере удаления от него число слоев в стенке увеличивается до 3—4
за счет сохранившихся клеток средних слоев, которые также имеют фиброзные
утолщения. Образование тетрад микроспор происходит по сукцессивному типу.
Зрелые пыльцевые зерна 2-клеточные. Генеративная клетка имеет вытянутую
форму.
Семяпочка анатропная, с 2 интегументами, тенуинуцеллятная. Внутренний
интегумент 2-слойный, наружный — многослойный. Микропиле образовано
внутренним интегументом. Семяпочка с фуникулярным обтуратором. Начиная
со стадии 4-ядерного зародышевого мешка отмечается дифференциация интегу-
ментальноготапетума. Описана гипостаза (Schlimbach, 1924). Периклинальные
деления в эпидермальных клетках нуцеллуса редки. Археспориальная клетка
дифференцируется в мегаспороцит без отделения париетальной клетки. В
результате мейоза образуется линейная или Т-образная тетрада мегаспор.
Функционирует халазальная мегаспора.
Зародышевый мешок развивается по Polygonum-типу. Синергиды заострены
в базальной части и расширены в апикальной, без нитчатого аппарата.
Яйцеклетка бедноплазменная. Полярные ядра сливаются до оплодотворения,
и ядро центральной клетки лежит над антиподами. Антиподы по своим
размерам и хроматизации ядер первоначально сходны с клетками яйцевого
аппарата; на более поздних стадиях, ко времени созревания зародышевого
мешка, наблюдается усиление хроматизации их ядер. У Alstroemeria антиподы
чаще расположены на боковой стороне зародышевого мешка и контактируют
с ослизненными сжатыми клетками нуцеллуса. На ранних стадиях развития
зародышевого мешка (2—4-ядерной) в цитоплазме его отмечен крахмал.
Эндосперм нуклеарный. В зрелом семени клеточный, содержит белки и жиры.
Эмбриогенез не исследован. Зародыш в семени прямой, занимает 1/3 или
2/5 длины семени.
Исследованные виды. Alstroemeria aurantiaca, A. pelegrina,
A. pulchella (=Л. psittacina), Bomarea caldasii.
Литература. Guignard, 1884, 1889; Schlimbach, 1924; Stenar, 1925, 1951;
Schnarf, 1931; Dellert, 1933; Cave, 1966; Davis, 1966; Тахтаджян, 1966;
Huber, 1969; Немирович-Данченко, 1985; Алимова, ориг. данные.
74
Alstroemeriaceae
1—3, 6—// — Bomarea caldasii, 4, 5, 12—15 —
Alstromerla aurantiaca, 16 — A. pulchella
1 — митоз в клетке тапетума; 2,3 — 2-ядерные
клетки тапетума; 4 — стенка пыльника и
микроспоры; 5 — стенка зрелого пыльника и
2-клеточное пыльцевое зерно; 6 — продольный
срез семяпочки, профаза мейоза в мегаспо-
роците; 7 — диада клеток; 8, 9 — тетрады
мегаспор; 10 — одноядерный зародышевый
мешок; // — семяпочка с 2-ядерным
зародышевым мешком;
Alstroemeriaceae (продолжение)
12 — 2-ядерный зародышевый мешок; 13 — 4-ядерный зародышевый мешок; 14 — яйцевой аппарат;
15 — антиподы; 16 — продольный срез семяпочки, 7-клеточный зародышевый мешок с антиподами,
сдвинутыми на его боковую сторону. (/—9 — по Stenar, 1925; 10—16 — ориг.).
Семейство ALLIACEAE
Пыльник 4-гнездный. У Allium caspium (ориг.) и A. textile (Khaleel,
Mitchell, 1982) стенка гнезда пыльника формируется центростремительно и
состоит из эпидермиса, эндотеция, одного (A. caspium) или 2 (A. textile)
средних слоев и тапетума. В эндотеции, а у Л. caspium также и в 2—3 слоях
со стороны связника, развиваются фиброзные утолщения. Средние слои
эфемерны. Тапетум секреторный, без реорганизации в дальнейшем, с мелкими
> АШасеае
1—19 — Allium caspium, 20—26, 34, 35 — Muilla maritima, 27 — Brodiaea coronaria, 28 — Allium
victorialis, 29—33 — A. nutans, 36—45 — Agapanthus umbellatus, 46, 47 — Allium ursinum
1—15 — развитие пыльника: / — деление археспориальной клетки, 2,3 — образование клеток спо-
рогенной ткани и париетальных слоев, 4 — схема пыльника на стадии 4 тяжей спорогенной ткани,
5, 6 — формирование среднего слоя и тапетума, 7 — фрагмент стенки пыльника на стадии профазы
мейоза I, 8, 9 — образование тетрады микроспор, 10 — фрагмент стенки пыльника на стадии тетрад
микроспор, начало дегенерации среднего слоя, //, 12 — тетрады микроспор, 13, 14 — фрагменты
стенки пыльника на стадии вакуолизированных микроспор и 2-клеточных пыльцевых зерен, тапе-
тальная пленка с орбикулами, 15 — схема пыльника перед вскрыванием, видны слои клеток
с фиброзными утолщениями;
76
77
Alliaceae (продолжение)
16—28 — развитие семяпочки: 16 — семяпочка на стадии мейоза, 17 — диада мегаспор, 18 —
2-ядерный биспорический зародышевый мешок, развивающийся в дальнейшем по Allium-типу,
19 — семяпочка на этой же стадии, имеется плацентарный обтуратор, 20—26 — образование
париетальной ткани, мегаспорогенез и развитие монрспорического зародышевого мешка по Polygonum-
типу, 27, 28 — семяпочки на стадии зрелого зародышевого мешка;
орбикулами. Клетки тапетума одноядерные, у A. aflatunense они иногда
2-ядерные. У А. сера в них обнаружены липофильные вещества, количество
которых к стадии тетрад микроспор постепенно уменьшается, а в дальнейшем
увеличивается на стадии формирующихся микроспор (Глущенко, 1964). Изо-
билатеральные и крестообразные тетрады микроспор образуются по сукцессив-
ному типу. Зрелые пыльцевые зерна 2-клеточные, у A. textile — 3-клеточные.
Генеративная клетка овальной формы, почти таких же размеров, как и ядро
вегетативной клетки. У А. сера в вегетативной клетке зрелого пыльцевого
зерна обнаружены пероксидаза, каталаза, жиры и белки (Глущенко, 1956).
У вивипарных луков (A. fistulosum, A. oleraceum, A. senescens и др.) в мейозе
78
АШасеае (продолжение)
29 — зрелый зародышевый мешок, одна из синергид имеет крупные размеры; 30, 31 — двойное
оплодотворение и деление первичного ядра эндосперма, образование протуберанцев в гигантской
синергиде; 32 — состояние гигантской синергиды в период образования 2-клеточного проэмбрио
и нуклеарного эндосперма; 33 — глобулярный зародыш и эндосперм на клеточной стадии развития;
видны остатки гигантской синергиды; 34, 35 — стадии развития гелобиального эндосперма;
36—47 — эмбриогенез; 48 — зрелое семя с зародышем и эндоспермом. (/—19 — ориг.; 20—26, 34,
35 — по Berg, Maze, 1966; 27 — по Berg, 1978; 28 — по Савченко, Комар, 1965; 29—33 — по Сто-
жаровой, Поддубной-Арнольди, 1977; 36—45 — по Guignard, Mestre, 1969; 46, 47 — по Soueges,
1926; 48 — по Стожаровой, 1973).
отмечены нарушения, связанные с формированием микроядер и в
дальнейшем— полиспорад (Устинова, 1948; Голышкин, 1977). У стерильных и фер-
тильных растений А. сера описана цитоплазматическая мужская стерильность,
которая проявляется в дегенерации содержимого пыльника. Первый этап —
разрушение микроспороцитов на стадии ранней профазы, связанное с явлением
цитомиксиса как в самих микроспороцитах, так и в клетках тапетума.
Второй этап — пикноз ядер микроспор; этому процессу предшествует сильная
вакуолизация микроспор. Лизис тапетума при этом задерживается во времени
(Орел, 1968). Электронно-микроскопические исследования показали, что в
период созревания пыльцевого зерна А. сера вокруг оболочки генеративной
клетки наблюдается «корона» из липидных тел, которая затем исчезает, а ли-
пидные тела оказываются рассеянными по всей цитоплазме вегетативной клетки.
Пластиды представлены амилопластами с многочисленными крахмальными
зернами (Gimenez-Martin et al., 1969).
Семяпочка анатропная у Agapanthus, Brodiaea, Leucocoryne и Muilla,
гемитропная — у Nothoscordum и Tulbaghia. В роде Allium описаны различные
типы семяпочек (анатропные, амфитропные, ана-амфитропные, кампилотроп-
ные, переходные формы от анатропных к амфитропным), причем данные
разных авторов по одним и тем же исследованным видам довольно
противоречивы. Семяпочка крассинуцеллятная (Agapanthus, Brodiaea, Hesperocallis
и Muilla) или тенуинуцеллятная (Allium, Nothoscordum, Tulbaghia), с 2—
3-слойным нуцеллярным колпачком (Muilla), постаментом (Allium), гипостазой
и хорошо развитым фуникулярным обтуратором, закрывающим микропиле
(Agapanthus, Allium). У Allium caspium (ориг.) имеется плацентарный
обтуратор. Семяпочка с 2 интегументами, микропиле образовано
внутренним интегументом. Последний обычно 2—3-, у А. сера — 4-, а в области
микропиле — 3—5-слойный. Наружный интегумент обычно состоит из 4—6,
реже — 8—10 (A. ursinum) и даже 15—17 (A. rotundum) слоев.
Проводящий пучок хорошо развит, входит в халазу и представлен спиральными
сосудами и элементами флоэмы. Археспорий одно-, реже — 2—3-(Л. сера,
80
A. textile, Brodiaea) клеточный. В крассинуцеллятных семяпочках
преобразование археспориальной клетки в мегаспороцит идет с отделением
париетальной клетки. Париетальная ткань обычно однослойная, у Muilla — 3—4-слойная.
У Brodiaea, Hesperocallis и Muilla каждое мейотическое деление в мега-
спороците сопровождается заложением перегородок и возникновением
линейной, реже — Т-образной и неправильной формы тетрад мегаспор. У
большинства видов Allium, Leucocoryne ixioides, Nothoscordum fragrans, Tulbaghia
violacea после стадии диады микропилярная клетка дегенерирует, а деление
происходит в халазальной клетке без образования перегородки. У Allium
neapolitanum и A. triquetrum микропилярная клетка диады делится, однако
в дальнейшем возникшие клетки также дегенерируют (Messeri, 1931). Как
показали электронно-микроскопические исследования, прямой контакт мегаспо-
роцита А. сера с клетками нуцеллуса имеется только в районе халазы,
где обнаружены плазмодесмы. Мегаспороцит поляризован — митохондрии
распределены преимущественно в микропилярной, а пластиды — в халазальной
части. Вследствие этого при первом неравном делении, приводящем к
образованию диады мегаспор, больше митохондрий оказывается в микропилярной,
а пластид — в халазальной клетке. Микропилярная клетка диады изолируется
от окружающих клеток каллозой. Она содержит большое количество диктио-
сом, необходимых для образования литических ферментов, и в дальнейшем
постепенно разрушается (De Boer-De-Jeu, 1978).
Зародышевый мешок моноспорический, развивается из халазальной
мегаспоры тетрады по Polygonum-типу (Agapanthus umbellatus, Brodiaea coronaria,
B. elegans, Hesperocallis undulata, Nothoscordum bivalve, N. striatum), или би-
спорический, развивается из халазальной клетки диады по Allium-типу (виды
Allium, N. fragrans, T. violacea). Зрелый зародышевый мешок обычно
яйцевидной формы. У большинства видов синергиды с нитчатым аппаратом;
у Allium govanianum отмечены лишь крючковидные выросты. У некоторых
представителей рода Allium (А. сера, A. nutans, A. rotundum, A. schoenoprasum,
A. unifolium и др.) и у N. fragrans синергиды разной величины и различного
строения. Нитчатый аппарат имеется в обеих синергидах, но больше развит
в крупной клетке. У A. ursinum после завершения клеткообразования в
зародышевом мешке в синергидах происходят эндомитозы. В небольшой синер-
гиде, которая сразу же дегенерирует после оплодотворения, ядро имеет 4п
набор хромосом, а в крупной— 16n (Hasitschka-Jenschke, 1957). У A. nutans
эндомитозы с образованием политенных хромосом и с наличием
гипертрофированного ядра характерны только для крупной синергиды. Такая синергида
сохраняется до стадии многоклеточного зародыша. После оплодотворения в ее
оболочке появляются поры, через которые цитоплазма клетки выходит в виде
«протуберанцев» в центральную клетку. Возможно, что особая структура
крупной синергиды способствует выполнению ею трофической функции на
ранних стадиях развития .зародыша и эндосперма (Стожарова, 1971, 1973, 1974;
Стожарова, Поддубная-Арнольди, 1977). Гистохимическое исследование
яйцевого аппарата у этого вида показало, что по сравнению с яйцеклеткой
в цитоплазме гипертрофированной синергиды находятся в большем
количестве полисахариды, белки, рибосомальная РНК, а ядро, имеющее очень
большое ядрышко, дает более интенсивную реакцию на ДНК и РНК. На ранних
стадиях развития эндосперма и с началом деления зиготы в гипертрофированной
синергиде постепенно исчезают полисахариды, белки и РНК и позже
накапливаются в растущем зародыше (Syamasundar, Panchaksharappa, 1975). УЛ. сера
в синергидах обнаружены жиры (Глущенко, 1964). Антиподы 3, одноядерные,
эфемерные и дегенерируют все до оплодотворения (А. сера, A. neapolitanum,
A. sativum, A. schoenoprasum, A. textile, A. triquetrum, Т. violacea) или
сначала разрушаются только 2, а 3-я еще обнаруживается на первых стадиях
развития эндосперма. У A. ursinum сохраняющаяся антипода имеет 16п
набор хромосом (Hasitschka-Jenschke, 1957). У Muilla maritima антиподы
крупные, дегенерируют сразу после оплодотворения (Berg, Maze, 1966). У A. odorum
(Третьяков, 1895; Модилевский, 1925), A. govanianum (Sundar Rao, 1940)
и N. fragrans (Stenar, 1932) они морфологически похожи на клетки яйцевого
аппарата, при этом 2 из них, как и синергиды, могут иметь нитчатый аппарат.
6 Зак. 2144
81
Полярные ядра у большинства видов сливаются до оплодотворения в хала-
зальной части центральной клетки. Однако у Allium полярные ядра перед
оплодотворением располагаются около яйцевого аппарата, причем у многих
видов этого рода (кроме A. aflatunense, A. decipiens, A. govanianum, A. nigrum,
Л. textile), а также у N. striatum они находятся лишь в контакте. Порогамия.
Процесс двойного оплодотворения подробно изучен у некоторых представителей
рода Allium. У Л. aflatunense и Л. nutans он происходит по премитотическому,
а у Л. schubertii — по постмитотическому типу (Миркамилов, 1977а; Стожарова,
Поддубная-Арнольди, 1977). Пыльцевая трубка входит в зародышевый мешок
через 16—18 ч, а слияние ядер спермиев с полярными ядрами и ядром
яйцеклетки начинается через, 18—22 ч после опыления. У Л. nutans и Л. fetisovii
ядро одного из спермиев объединяется сначала с верхним, а затем — с нижним
полярными ядрами. У Л. nutans погружение и деспирализация ядра спермия
в ядре центральной клетки длятся 8, в ядре яйцеклетки — 26—29 ч.
Состояние покоя в центральной клетке продолжается 33—34, в зиготе — 52—
55 ч.
Эндосперм у Allium и Brodiaea нуклеарный, у Muilla и N. striatum — гело-
биальный. У N. fragrans данные о типе развития эндосперма противоречивы.
При нуклеарном эндосперме ядра делятся в постенном слое цитоплазмы.
Сначала деления синхронные, но после 5—6 циклов наступает асинхронность
(Соколов, 19686, 1973; Миркамилов, 1978). Клеткообразование идет в
направлении халаза—микропиле. В эндосперме ядра различаются по величине,
форме и плоидности. Более крупные, часто неправильной формы ядра находятся
в его халазальной части. Здесь обнаруживаются эндомитозы, слияние ядер
в одно, образование реституционных ядер. Небольшие одноядерные клетки
присущи микропилярной части эндосперма (Гвзладзе, 1966, 1969, 1979).
В случае гелобиального эндосперма при первом делении возникают большая
микропилярная и маленькая халазальная камеры. Затем в обеих клетках-
камерах идут свободноядерные деления. У N. striatum халазальная камера
имеет лишь 4 ядра, которые крупнее ядер микропилярной камеры, в то время
как у М. maritima их 8. В микропилярной камере образуется 128 ядер.
Халазальная камера дегенерирует, и весь эндосперм формируется из
микропилярной. Эндосперм в зрелом семени сохраняется и состоит из крупных
клеток большей частью с утолщенными пористыми оболочками; в клетках
содержится крахмал (Allium), а также белки и жиры.
Эмбриогенез соответствует Onagrad-типу. Зародыш с 2—4-клеточным
подвеском. Зрелый зародыш прямой (Agapanthus, Tulbaghia), часто изогнутый
или винтообразно закрученный (Allium, Muilla), почти равен по длине
эндосперму или составляет половину его длины. У Agapanthus umbellatus апекс
стебля дифференцируется на верхушке зародыша. Затем семядоля, зачаток
которой появляется сбоку, смещает апекс стебля в окончательное латеральное
положение (Guignard, Mestre, 1969). УЛ. сера 1/10 часть зародыша составляет
гипокотиль и зародышевый корень, остальная часть приходится на семядолю.
Зародыш с почечкой, в которой можно различить зачатки 2 листьев.
Единственный прокамбиальный тяж идет от корневого чехлика к почечке и в семядолю,
иногда в нем обнаруживаются спиральные сосуды (Hoffman, 1933). Лейкоэмб-
риофиты (Яковлев, Жукова, 1973, 1980).
Описаны различные типы апомиксиса. У Л. odorum дополнительные
зародыши способны возникать из всех 3 антипод, но чаще только из одной,
яйцеклеткоподобной, а также из синергид, яйцеклетки (при этом ядра клеток
могут быть как гаплоидными, так и диплоидными), из клеток нуцеллуса
и интегументов (Третьяков, 1895; Schurhoff, 1922; Haberlandt, 1923; Модилев-
ский, 1925, 1930, 1931). Нормально развивается лишь зиготический зародыш.
Возможность осуществления партеногенеза у Л. odorum в дальнейшем была
доказана цитологически. Было установлено, что A. odorum является дипло-
спорическим апомиктом (Hakansson, Levan, 1957). У Л. nutans (Hakansson,
1951) обнаружены нередуцированный партеногенез и антиподальная апогаме-
тия, а у Л. sativum и Л. schoenoprasum (Гваладзе, 1963, 1965, 1969, 1970а,
19706) — синергидная апогаметия и апоспория (последнюю удалось наблюдать
при изучении нарушений нормального полового воспроизведения). N. fragrans
82
присуща нуцеллярная эмбриония. Адвентивные зародыши развиваются из
клеток нуцеллуса в области халазы и микропиле (Stenar, 1932).
Исследованные роды и виды. Agapanthus umbellatus, Allium
(42), Androcymbium, Brodiaea coronaria, B. elegans, B. peduncular is, Hespero-
callis undulata, Leucocoryne ixioides, Muilla maritima, Nothoscordum bivalve,
N. fragrans, N. striatum, Tulbaghia acutifolia, T. leucantha, T. pulchella,
T. violacea.
Литература. Tulasne, 1855; Hofmeister, 1859, 1861; Strasburger, 1878,
1879; Vesque, 1878; Fischer, 1880; Третьяков, 1895; Hegelmaier, 1897; Ishikawa,
1897; Elmore, 1898; Schniewind-Thies, 1901; Bally, 1916; Ernst, 1918; Haberlandt,
1922, 1923, 1925; Schurhoff, 1922; Модилевский, 1925, 1928, 1930, 1931; Stenar,
1925, 1932, 1933, 1949; Soueges, 1926, 1931; Dahlgren, 1927; Ono, 1928;
Schnarf, 1929; Weber, 1929; Messeri, 1931; Beal, 1932; Hoffman, 1933; Geitler,
1935; Jones, Emsweller, 1936; Porter, 1936; Maheshwari, 1937; Cave, 1939,
1948; Sundar Rao, 1940; Трофимец, 1940; Brumfield, 1941; Eckles, 1941;
Устинова, 1942, 1948, 1950; Martin, 1946; Murphy, 1946; Hakansson, 1951,
1953; Guttenberg, Heydel, Pankow, 1954; Глущенко, 1956, 1957, 1958, 1964;
Hakansson, Levan, 1957; Hasitschka-Jenschke, 1957, 1958; Kato, 1957; Гваладзе,
1960a, 19606, 1961, 1962, 1963, 1965, 1966, 1969a, 19696, 1970a, 19706, 1973,
1976, 1979; Седова, 1961; Tandon, Kapoor, 1963; Савченко, Комар, 1965;
Berg, Maze, 1966; Канделаки, Гваладзе, 1966; Транковский, Троицкая, 1967;
Орел, 1968, 1972; Соколов, 1968а, 19686, 1968в, 1969, 1971, 1973; Bose,
1969; Gimenez-Martin, Risuefio, Lopez-Saez, 1969; Guignard, Mestre, 1969;
Миркамилов, 1969, 1970, 1971, 1972, 1975, 1977a, 19776, 1977b, 1978; Стожарова,
1971, 1973, 1974; Novak, 1972; Vosa, 1972; Варшанина, 1973; Konvicka, 1973;
Kuruta, 1973; Яковлев, Жукова, 1973, 1980; Nanda, Gupta, 1974; Голышкин,
1975, 1976, 1977; Syamasundar, Panchaksharappa, 1975; Орел, Голышкин, 1976;
Стожарова, Поддубная-Арнольди, 1977; Берг, 1978; De Boer-De-Jeu, 1978;
Rogriguez-Garcia, Risuefio, 1978; Gohil, Ranjana, 1980; Bhandari, Bhargava,
Geier, 1981; Gori, 1982; Khaleel, Mitchell, 1982; Комар, 1983; Талиева, Юрьева,
1985; Жамеран, Хоролсурен, 1987; Шамров, ориг. данные.
Семейство HEMEROCALLIDACEAE
Пыльник 4-гнездный. Стенка гнезда пыльника у Hemerocallis fulva (Fullmer,
1899), Н. citrina и Н. hybrida (ориг.) формируется центростремительно и состоит
из эпидермиса, эндотеция, 2 средних слоев и тапетума. По нашим данным,
у Hemerocallis эпидермис в зрелом пыльнике представлен сосочковидными
клетками, наружные тангентальные стенки которых покрыты кутикулой в виде
шипиков разных размеров. Фиброзные утолщения формируются не только
в эндотеции, но и в 3—5 слоях клеток гнезда пыльника со стороны связника.
Средние слои разрушаются в процессе развития. Тапетум однослойный и лишь
со стороны связника 2-слойный, секреторный, без реорганизации. Клетки
тапетума сначала 2-ядерные, затем в некоторых клетках ядра могут сливаться.
После стадии тетрад микроспор образуется тапетальная пленка сорбикулами,
которая сохраняется и в зрелом пыльнике, и отмечается выход полленкита
в полость гнезд пыльника. Обнаружена стерилизация некоторых микроспоро-
цитов в центральной части гнезд пыльника, а иногда и целых гнезд пыльника.
Тетрады микроспор изобилатеральные и крестообразные. Данные относительно
типа формирования тетрад микроспор противоречивы. Одни авторы (Fullmer,
1899; Narain, 1979) считают, что тетрады образуются по симультанному,
другие (Juel, 1897; Jamaha, 1926; Sienicka, 1929) —по промежуточному и,
наконец, третьи (Schnarf, 1929) — по сукцессивному типу. В процессе мейоза
у различных видов Hemerocallis отмечены нарушения, приводящие к появлению
микроядер и образованию вместо тетрад полиспорад микроспор. Обнаружены
также случаи цитомиксиса на стадии телофазы II (Narain, 1979). Зрелые
пыльцевые зерна у Н. fulva 2-клеточные (Fullmer, 1899). По нашим данным,
у Н. hybrida зрелые пыльцевые зерна также 2-клеточные. Однако во вскрытом
пыльнике ядро генеративной клетки находится в состоянии профазы; у Н. citrina
происходит его деление с образованием 2 спермиев. У Н. fulva описаны
6*
83
Hemerocallidaceae
1—4, 6, 7', 9, 17—24 — Hemerocallis citrina, 5, 8, 25—
29 — H. hybrida, 10—16, 30 — H. fulva
1—16 — развитие пыльника: /—3 — формирование стенки
гнезда пыльника и микроспороцитов, 4 — схема пыльника
на стадии мейоза, 5—7 — фрагменты стенки пыльника на
стадии тетрады микроспор, вакуолизированных микроспор,
2- и 3-клеточных (зрелых) пыльцевых зерен, 8, 15 — зрелые
пыльцевые зерна, 9 — схема пыльника перед вскрыванием,
зачернены слои клеток с фиброзными утолщениями,
аномальные 5—6-ядерные пыльцевые зерна, ядра в которых могут сливаться
(Fullmer, 1899).
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная у Leucocri-
пит montanum (Cave, 1948) и тенуинуцеллятная у Н. citrina и Н. hybrida
(ориг.). По нашим данным, у Hemerocallis микропиле образовано обоими
интегументами. Наружный интегумент состоит из 10—12 слоев, внутренний —
4—5-слойный. Клетки эпидермиса внутреннего интегумента до верхней границы
зародышевого мешка очень крупные, таблитчатой формы, с плотной цито-
84
Hemerocollidaceae (продолжение)
10, 11 — симультанное образование тетрады микроспор, 12 — промежуточный тип образования
тетрады микроспор, 13 — нарушение в мейозе, приводящее к образованию микроядра, 14 —
полиспорада микроспор, 16 — аномальное пыльцевое зерно; 17—29 — развитие семяпочки; 17 —
заложение археспория, 18—20 — мегаспорогенез, 21 — семяпочка на стадии тетрады мегаспор,
\
Hemerocallidaceae (продолжение)
22—24 — формирование зародышевого мешка, 25—28 —
особенности строения зародышевого мешка перед
оплодотворением, антиподы с диплоидными ядрами и выростами
клеточных стенок, в цитоплазме клеток, вероятно,
белковые тела, 29 — схема семяпочки на стадии зрелого
зародышевого мешка, в наружном эпидермисе
внутреннего интегумента выделяются густоплазменные клетки;
30 — микропилярная часть семяпочки на стадии 2-клеточ-
ного проэмбрио, эндосперм нуклеарный. (/—9, 17—29 —
ориг.; 10, 11, 14—16— по Fullmer, 1899; 12, 13 — по
Sieniska, 1929; 30— по Hofmeister, .1859).
плазмой. У L. montanum имеется хорошо выраженная гипостаза и нуцеллярный
колпачок. У Hemerocallis со стадии 4-ядерного зародышевого мешка начинается
дегенерация клеток нуцеллуса и в семяпочке перед оплодотворением нуцеллус
сохраняется лишь в ее халазальной части вокруг антипод. Мощный проводящий
пучок у Hemerocallis, образованный многочисленными трахеидами со
спиральными утолщениями и клетками флоэмы, входит в халазу и заканчивается
в медианной части наружного интегумента (Савченко, Комар, 1965; ориг.).
У L. montanum археспориальная клетка преобразуется в мегаспороцит с
отделением париетальной клетки. У этого вида после стадии диады делится только
халазальная клетка, в результате чего возникает триада мегаспор. Для
Hemerocallis характерна линейная тетрада мегаспор.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. У Н. middendorffii начиная с 2-ядерной стадии в зародышевом мешке
выявляется крахмал (Sato Shin-lchi, 1985). Зрелый зародышевый мешок
у Hemerocallis удлиненный, у Leucocrinum — яйцевидный, у Н. hybrida и Н.
middendorffii синергиды с нитчатым аппаратом; в яйцеклетке Н. middendorffii
обнаружен крахмал. По нашим данным, антиподы у Н. citrina одноядерные,
у Я. hibrida, так же как и у L. montanum, они сначала 2-ядерные, а перед
оплодотворением ядра в них сливаются, что совпадает по времени с
объединением полярных ядер. В антиподах у Я. hybrida отмечено образование выростов
клеточных стенок и наличие запасных веществ, вероятно, белковой природы.
Полярные ядра сливаются до оплодотворения, кроме Я. citrina, у которого
они находятся лишь в контакте.
Эндосперм у Hemerocallis развивается по нуклеарному, у Leucocrinum —
по гелобиальному типу. В зрелом семени он представлен радиально
вытянутыми клетками, в которых у Hemerocallis накапливаются липиды (Huber,
1969).
Эмбриогенез не изучен. Зародыш Hemerocallis небольшой, в то время как
у Leucocrinum он сравнительно крупный, занимает от 1/3 до 2/3 объема
семени, прямой, цилиндрический, слабо дифференцирован (Martin, 1946).
Доразвитие зародыша у Hemerocallis происходит после опадения семян к
моменту их прорастания (Попцов и др., 1981). Лейкоэмбриофиты.
Исследованные виды. Hemerocallis aurantiaca, Я. citrina, Я. elmu-
sae, Я. flava, Я. fulva, Я. hybrida, Я. lutea, Я. middendorffii, Я. vermusae,
Leucocrinum montanum.
Литература. Hofmeister, 1859; Strasburger, 1882; Tangl, 1882; Baroni,
1892; Brourge, 1892; Juel, 1897; Fullmer, 1899; McAllister, 1914; Jamaha,
1926; Ono, 1928; Timm, 1928; Sienicka, 1929; Takenaka, 1929; Krause, 1930;
Dark, 1932; Chandler, 1940; Martin, 1946; Cave, 1948; Савченко, Комар,
1965; Huber, 1969; Яковлев, Жукова, 1973; Narain, 1979; Попцов и др.,
1981; Комар, 1983, 1985; Sato Shin-ichi, 1985, 1986; Шамров, ориг. данные.
Семейство AMARYLLIDACEAE
Пыльник 4-гнездный. Тип развития стенки пыльника не определен. Число
слоев сформированной стенки гнезда пыльника варьирует; она состоит из
эпидермиса, эндотеция, средних слоев и тапетума. В эндотеции развиваются
фиброзные утолшения. Средних слоев обычно несколько (2—4), у Crinum as-
iaticum и С. deii am в наружном слое формируются фиброзные утолщения
(Dutt, 1970). Та* тум клеточный секреторный, с орбикулами. Клетки тапетума
2-ядерные (Galanthus nivalis), реже — 4-ядерные (G. woronowii, Haemanthus,
Clivia) или многоядерные (G. imperati, Nerine filifolia). У видов Galanthus
по всей вероятности тапетум периплазмодиальный (Pankow, 1958; ориг.). Спо-
рогенная ткань многоклеточная, микроспороциты расположены в несколько
слоев. Мёйоз протекает без нарушений, хотя у G. woronowii иногда в тетрадах
встречаются микроядра. Образование тетрад микроспор сукцессивного типа,
за исключением рода Ixiolirion, у которого описан симультанный тип (Stenar,
1925; Dutt, 1970). Тетрады микроспор тетраэдральные или изобилатеральные.
Пыльцевые зерна к моменту рассеивания пыльцы 2-клеточные. Генеративная
87
/, 6—8, 57, 58 — Pancratium maritimum, 2—4 — Galanthus woronovii, 5 — Hlppeastrum hybridum,
9, 29—35, 47—56, 60 — Argyropsis Candida, 10—12 — Galanthus nivalis, 13, 15, 16, 19—28, 36—45 —
Zephyranthes macrosiphon, 14, 17, 18 — Sternbergia lutea, 46 — Habranthus andersoni var. texanus,
59 — Sternbergia fisheriana.
1 — сформированное гнездо пыльника; 2 — диады и клетки тапетума; 3 — тетрады микроспор;
4 — микроспоры; 5 — стенка зрелого пыльника; 6—8 — мегаспорогенез; 9 — семяпочка;
клетка богата цитоплазмой. В вегетативной клетке Haemanthus katherinae
пластиды (лейкопласты) с обкладкой из элементов ЭР, в ряде случаев отмечены
крахмальные зерна. Деление генеративной клетки происходит в пыльцевой
трубке. Спермии удлиненно-овальные или овально-округлые, с тонким слоем
цитоплазмы.
Семяпочка анатропная, иногда гемианатропная (Davis, 1966), гемитропная
(Dutt, 1959), с 2, редко — с одним (Nerlne) интегументом, у большинства
видов крассинуцеллятная, реже — тенуинуцеллятная {Crinum, Narcissus,
Zephyranthes). У Crinum семяпочка голая (Hofmeister, 1861; Stenar, 1925; Merry,
88
AmarylUdaceae (продолжение)
10, 11 — 2-й 4-ядерный зародышевые мешки; 12—14 — зрелые зародышевые мешки; 15, 17 —
зрелые и 16, 18 — прорастающие пыльцевые зерна; 19—21 — спермиогенез в пыльцевой трубке;
1937; Dutt, 1957, 1959; Савченко, Комар, 1965; Huber, 1969; Савченко, 1973;
Комар, 1985). Внутренний интегумент состоит из 2 слоев клеток, в районе
микропиле разрастается и становится 3—4-слойным, наружный интегумент
4—5-слойный. Микропиле узкое, прямое, образовано чаще внутренним интегу-
ментом, реже — обоими; в последнем случае оно несколько изогнутое.
Проводящий пучок заканчивается вблизи халазы. Гипостаза состоит из крупных
клеток с утолщенными оболочками. У Clivia и Galanthus ткань семяпочки
90
Amaryllidaceae (продолжение)
29—36— формирование гелобиального эндосперма;
Amaryllidaceae (продолжение)
37—46 — гемигамия;
в халазальной части разрастается, образуя ариллоид (Карагьозова, 1971;
Савченко, 1973; Erdelska, 1985; Комар, 1985). У Brunsvigia minor, Amaryllis
belladonna, Hymenocallis occidentalis и Nerine curvifolia клетки интегументов
содержат хлорофилл (Hofmeister, 1861; Goebel, 1923; Flint, Moreland, 1943).
Археспорий одно-, реже — 2-клеточный (Stenar, 1925), при его делении
отделяется париетальная клетка. У некоторых видов (Eucharis amazonica, Crinum
92
Amaryllidaceae (продолжение)
47—54, 57— стадии развития зародыша; 55, 58 —
зародыши на стадии органогенеза; 56 — зародыш из
развитого семени; 59 — апогаметия, 2-ядерные си-
нергиды, к ним прилегает ядро центральной клетки;
60 — апогаметия, 4-ядерный синергидный и 4-клеточ-
ный зиготный зародыши. (1, 6—8 — по Dutt, 1970;
2—4, 5, 9, 13—56, 59, 60 — ориг.; 10—12 — по
Остапенко, Хведынич, 1987; 57, 58 — по Soueges, 1952).
latifolium; Stenar, 1925; Dutt, 1953) париетальная клетка не образуется. В
результате мейоза формируется обычно тетрада мегаспор, но у С. asiaticum,
Pancratium maritimum, Zephyranthes citrina и Z. rosea верхняя клетка диады не
93
делится и образуется триада. Тетрада мегаспор линейная или Т-образная.
Функционирует халазальная мегаспора, но имеются указания о наличии в
семяпочке G. nivalis 2 функционирующих мегаспор, которые формируют 2
зародышевых мешка, один из которых погибает (Erdelska, 1975). 2 зародышевых
мешка описаны в семяпочках N. filifolia (Stenar, 1925).
Зародышевый мешок развивается в основном по Polygonum-типу. Указания
о развитии биспорических зародышевых мешков у Narcissus tazetta (Cuignard.,
1882) не подтвердились; и у этого вида установлен Polygonum-тип развития
зародышевого мешка (Stenar, 1925). УЛ. belladonna, Buphane disticha, N. си-
rvifolia, Cooperia drummondii и Cyrtanthus sanguineus формируются тетраспо-
рические зародышевые мешки по Adoxa-типу (Church, 1916; SchHmbach, 1924;
Stifler, 1925; Schnarf, 1929). У Habranthus andersoni описан Antennaria-тип
развития зародышевого мешка в случае апомиксиса (Brown, 1951). Для
G. nivalis наряду с формированием гаплоидных зародышевых мешков
Polygonum-типа отмечено образование диплоидных гаметофитов (Карагьозова,
1971). У этого же вида исследована продолжительность периодов интерфазы
ядер на разных стадиях развития зародышевого мешка (Остапенко, Хведынич,
1987). Зрелый зародышевый мешок крупный, удлиненно-овальной формы, часто
сужен к халазальному концу. Яйцевой аппарат хорошо дифференцирован.
Яйцеклетка крупнее синергид, имеет большое ядро, смещенное в апикальную
часть. Синергиды расположены выше яйцеклетки, с крючковидными
выростами, снабжены нитчатым аппаратом, имеют густую цитоплазму почти без
вакуолей и ядро, находящееся в средней или апикальной части клетки.
Полярные ядра чаще всего перед оплодотворением сливаются, ядро центральной
клетки располагается возле антипод. Метаболическая активность ядер зрелого
зародышевого мешка различна; наиболее высока она в центральной клетке
(Остапенко, Хведынич, 1987). У Zephyranthes macrosiphon полярные ядра,
находясь в контакте в халазальной части зародышевого мешка, не сливаются.
Антипод обычно 3, иногда — у P. maritimum — их 4 (Shadowsky, 1925).
У С. drummondii и Hypoxis decumbens антиподы мелкие, рано дегенерируют
(Church, 1916; Stenar, 1925), но у большинства изученных видов (Crinum,
Haemanthus, Zephyranthes, Ixiolirion montanum, Valota purpurea и др.)
антиподы крупные, иногда с гипертрофированными ядрами, сохраняются вплоть
до раннего эмбриогенеза. Самые крупные антиподы в семействе, занимающие
почти 1/3 зародышевого мешка, описаны у видов Nerine (Stenar, 1925). У Argy-
ropsis Candida гипертрофированные ядра антипод иногда принимают
улиткообразную форму или антиподы становятся многоядерными (Ворсобина, 1973;
Ворсобина, Солнцева, 1979а). У С. asiaticum в некоторых случаях наблюдаются
аномалии в развитии зародышевого мешка — яйцевой аппарат развивается
на халазальном полюсе, а у микропилярного конца формируются антиподы
(Swamy, 1946). Яйцевой аппарат в области антипод иногда наблюдался у
G. nivalis (Карагьозова, 1971). У Н. andersoni var. texana при апомиксисе
яйцевой аппарат иногда располагался на боковой стенке зародышевого мешка.
Встречалось и несколько яйцеклеток в одном яйцевом аппарате (2 яйцеклетки
и 2 синергиды), иногда отмечалось более одного яйцевого аппарата (Расе,
1913). Порогамия. Пыльцевые трубки проникают в зародышевый мешок через
синергиду. У G. nivalis мужские гаметы входят в зародышевый мешок в виде
клеток (Erdelska, 1985). Одна клетка спермия вскоре сливается с яйцеклеткой.
Ядро второй клетки спермия движется к ядру центральной клетки,
находящемуся возле антипод. Контакт ядер длится примерно 2 ч. Ядро спермия
постепенно увеличивается, и, когда оно достигнет 1/5 размера ядрышка ядра
центральной клетки, ядра сливаются. Слияние ядер длится от нескольких минут
до 1 ч, в зависимости от температурных условий. Двойное оплодотворение у
Zephyranthes, Sternbergia, Argyropsis, Habranthus, Galanthus следует премито-
тическому типу. Слияние ядер яйцеклетки и спермия протекает замедленно.
У Z. macrosiphon объединение полярных ядер и ядра спермия происходит
по постмитотическому типу (Карагьозова, 1971; Ворсобина, Солнцева, 1979а).
Эндосперм большинства триб гелобиальный. Нуклеарный эндосперм
установлен у всех родов триб Galantheae и Narcisseae. У представителей триб
Crineae и Eucharideae отмечается и нуклеарный, и гелобиальный эндосперм
94
(Stenar, 1925, 1951; Swamy, 1946; Swamy, Parameswaran, 1963; Dutt, 1970;
Swamy, Krishnamurthy, 1973; Солнцева, Ворсобина, 1979; Ворсобина,
Солнцева, 19796). Микропилярная камера гелобиального эндосперма крупная,
многоядерная, халазальная — маленькая, число ядер в ней от 2 до 32. После
образования 2 или 4 ядер у Zephyranthes grandiflora происходит их дегенерация,
а затем и всей халазальной камеры. У Z. macrosiphon, A. Candida и Sternbergia
lutea процессы дегенерации начинаются на 16-ядерной стадии. У Z. grandiflora
развитие эндосперма относится к группе С, а у Z. macrosiphon, A. Candida и
S. lutea — к группе D классификации этого типа эндосперма, основанной на
максимальном числе ядер в халазальной камере (Swamy, Parameswaran,
1963). Довольно часто у Я. andersoni происходит слияние ядер в этой клетке
(Swamy, 1946). У Z. macrosiphon в обеих камерах гелобиального эндосперма
наблюдаются нарушения ядерных делений и образование реституционных
гантелевидных полиплоидных ядер с большим числом ядрышек и микроядер.
Данные о нуклеарном типе эндосперма у Clivia nobilis, С. miniata, Я. katherinae,
Л. Candida и Z. citrina (Schlimbach, 1924) были опровергнуты более поздними
исследованиями (Stenar, 1925; Johry, Maheshwary, 1966; Ворсобина, Солнцева,
1979). Развитие нуклеарного эндосперма у G. nivalis прослежено при
прижизненном наблюдении семяпочек (Erdelska, 1983, 1985). Первичное ядро
эндосперма делится раньше зитоты. Первичное ядро эндосперма делится в
центральной зоне зародышевого мешка; позднее ядра группируются в постенном слое
цитоплазмы. Когда число ядер достигает нескольких сотен, в эндосперме
начинается процесс клеткообразования. У зефирантесов клеткообразование
начинается в халазальной части микропилярной камеры и идет от периферии
к центру. Лишь у Я. katherinae, развитие эндосперма у которого относится
к группе Е, клеткообразование происходит в обеих камерах гелобиального
эндосперма; при этом в халазальной камере — путем свободного роста
клеточных стенок (Newcomb, 1978). У С. defixum описаны эндоспермальные
гаустории, внедряющиеся в клетки нуцеллуса, а затем интегумента и даже стенок
завязи. Периферические клетки эндосперма становятся похожими на пробковый
камбий и продуцируют несколько слоев покровной ткани, в смежных с ней
клетках эндосперма обнаружен хлорофилл (Stenar, 1925; Dutt, 1970). В зрелом
семени массивный эндосперм занимает около 2/3 его объема, содержит много
крахмала и липидов.
Зародыш у зефирантес и штернбергии начинает развиваться через 2 сут
после опыления, когда в микропилярной клетке эндосперма уже много ядер
(Ворсобина, 1973). У G. nivalis к моменту деления зиготы в эндосперме
насчитывается от 3 до 64 ядер (Erdelska, 1985). Эмбриогенез у Z. citrina, С. defixum,
Crinum pratense, Pancratium longiflorum, P. maritimum, A. Candida, S. lutea
следует Asterad-типу Muscary-вариации. У С. drummondii эмбриогенез идет по
Asterad-типу Lilium-вариации. У Cyrtanthus parviflorus, Hippeastrum aulicum,
Habranthus chilensis, Crinum capense — no Onagrad-типу Anthericum-вариа-
ции (Johansen, 1950). Точка роста закладывается латерально, семядоля имеет
апикальное происхождение (Soueges, 1952). Зародыш в зрелом семени
составляет от 1/3 до 4/5 его объема. Он прямой или несколько согнутый, с хорошо
выраженной семядолей и почечкой, расположенной сбоку. У A. Candida в только
что созревшем семени семядоля имеет светло-зеленую окраску, тогда как в
воздушно-сухих семенах она бесцветна (Ворсобина, 1973). Зеленая окраска
зародыша обнаружена также у Я. katherinae (Ryczkowsky, Szewczyk, 1972, 1973)
и у Я. albiflos (Яковлев, Жукова, 1973, 1980). Остальные исследованные виды
лейкоэмбриофиты.
Апомиксис в форме гемигамии установлен у Я. andersoni var. texana,
Zephyr anthes pulchella, Z. «Valles yellow», Z. citrina, Z. clintiae, Z. macrosiphon,
С drummondii, C. pedunculata, C. smallii, A. Candida, Habranthus robustus
(Сое, 1953; Солнцева, Ворсобина, 1972; Solntzeva, 1974; Crane, 1978). Синер-
гидная апогаметия описана у Л. Candida и Sternbergia fischeriana; она, вероятно,
в гаплоидной форме (Ворсобина, Солнцева, 1979). УЛ. belladonna, С. asiaticum,
С. broussoneti, Calostemma cunninghami, С. purpureum, Hymenocallis caribaea,
Я chiapasiana, Я glauca, Я ovata, Я howardii, Я mexicana, Я maximilliani,
Я sonorensis описано явление полиэмбрионии (Braun, 1860; Goebel, 1889;
95
Ernst, 1918; Newton, 1985). Адвентивная эмбриония отмечена у Calostemma sp.
(Baillon, 1873) и у С. purpureum (Schlimbach, 1924), предположительно — ну-
целлярная (Наумова, Яковлев, 1972). У Hymenocallis mexicana и С. asiaticum
полиэмбриония, вероятно, связана с формированием 2 зародышевых мешков
в одной семяпочке (Stenar, 1925).
Исследованные роды и виды. Amaryllis belladonna, A. longifo-
lia, A. vittata, Argyropsis Candida, Brunswigia minor, Buphane disticha,
Calostemma cunninghami, С purpureum, Clivia gardeni, С miniata, С nobilis,
Cooperia drummondii, C. pedunculata, С smallii, Crinum asiaticum, С brousso-
neti, С capense, С curvifolia, C. defixum, С latifolium, С pratense, Cyrtanthus
parviflorus, С sanguineus, Eucharis amazonica, Eustephia, Fourcroya depaupe-
rata, Galanthus caspius, G. caucasicus, G. imperati, G. nivalis, G. woronowii,
Habranthus andersoni var texanus, H. chilensis, H. chillopsis, H. robustus,
Haemanthus albiflos, H. katherinae, H. tigrinus, Hippeastrum aulicum,
Hymenocallis caribaea, H. chiapasiana, H. glauca, H. howardii, H. maximilliani, H.
mexicana, H. occidentalis, H. ovata, H. rutilum, H. sonorensis, Ixiolirion montanum,
I. pallasii, I. tataricum, Leucojum aestivum, L. vernum, Lycoris, Narcissus angus-
tifolius, N. biflorus, N. poeticus, N. pseudonarcissus, N. tazetta, N. triandrus,
Nerine curvifolia, N. filifolia, N. undulata, Pancratium illyricum, P. longiflorum,
P. maritimum, P. sternbergia, P. tenuifolium, Paramongaia, Phaedranassa,
Spivelia, Sternbergia colchiciflora, S. fischeriana, S. lutea, Ungernia sewerzovii,
U. trisphaera, Valota purpurea, V. speciosa, Zephyranthes atamasco, Z. citrina,
Z. clintiae, Z. grandiflora (=Z. carinata), Z. lancasteri, Z. macrosiphon, Z. pulche-
lla, Z. rosea, Z. tubispatha, Z. «Valles yellow».
Литература. Richard 1808; Tulasne, 1855; Hofmeister, 1858; 1861;
Braun, 1860; Strasburger, 1877, 1878, 1879a, 1879b, 1882; Elfing, 1879; Vesque,
1879a, 1879b; Ficher, 1880; Goebel, 1880; Treub, Mellink, 1880; Mellink, 1881;
Guignard, 1882, 1900; Solwedol, 1882; Preda, 1897; Schniewind-Thies, 1901;
Pace, 1913; Farrell, 1914; Dahlgren, 1915; Church, 1916; Ernst, 1918; Palm, 1920;
Kranzlin, Herzog, 1921; Taylor, 1921; Haberlandt, 1922, 1923; Schlimbach, 1924;
Stenar, 1924, 1925, 1951a, 1951b; Баранов, Поддубная, 1925; Жадовский, 1925;
Shadowsky, 1925; Stifler, 1925; Schurhoff, 1926; Woycicki, 1926, 1929, 1931,
1936; Kosmath, 1927; Nakajima, 1928; Troll, 1928; Trankowsky, 1930; Cappel-
letti, 1931; Schnarf, 1931; Tomita, 1931; Wunderlich, 1936; Merry, 1937; Suita,
1937, 1938; Кострюкова, 1939, 1945; Кострюкова, Бенецкая, 1939; Whitehead,
Brown, 1940; Johston, 1941; Flint, Moreland, 1943; Weaver, 1943; Gustafsson,
1946; Swamy, 1946a, 1946b; Johansen, 1950; Nrown, 1951; Soueges, 1952; Cave,
1953; Сое, 1953, 1954; Steffen, 1953; Mendosa, 1954; Dutt, 1957a, 1957b, 1958,
1959, 1964, 1969, 1970a, 1970b; Капинос, 1957, 1959, 1960a, 19606, 1961, 1964,
1965; Pankow, 1958; Полунина, Свешников, 1959; Ambrose, Bajer, 1960;
Капинос, Германова, 1961; Капинос, Каграманова, 1961; Tandon, Kapoor, 1961,
1962a, 1962b; Kapoor, Tandon, 1963, 1964a, 1964b; Навашин, Макушенко,
Волховских, 1963; Schildknecht, 1963; Swamy, Parameswaran, 1963; Савченко,
Комар, 1965; Toilliez-Genoud, 1965; Johri, Maheshwari, 1966; Guignard, Mestre,
1969; Huber, 1969; Karagiosowa, 1970; Карагьозова, 1971; Ryczkowski, Szew-
czyk, 1971, 1972, 1973; Sanger, Jackson, 1971a, 1971b, 1971c; Солнцева, Жид-
кина, 1971, Ворсобина, 1972, 1973, 1978, 1983; Erdelska, 1972, 1975, 1976, 1983,
1985; Erdelska, Ryczkowski, 1972; Капинос, Кулиева, 1972; Radulescu, 1972;
Ryczkowski, Szewczyk, 1972, 1973; Солнцева, Ворсобина, 1972, 1979; Swamy,
Krishnamurthy, 1973; Яковлев, Жукова, 1973, 1980; Кордюм, 1974; Кордюм,
Попова, 1974а, 19746; Solntzeva, 1974, 1978; Петрович, 1976; Chen, Ueda, 1977;
Crane, 1978; Newcomb, 1978; Ryczkowski, 1978; Tarkowska, 1978; Amico,
Stefanzzi, 1979; Ворсобина, Солнцева, 1979а, 19796; Гусейнова, 1981; Jackson,
Doyle, 1982; Gvaladze (Гваладзе), 1983, Knox, 1984; Комар, 1985; Newton,
1985; Остапенко, Хведынич, 1987; Артюшенко, Николаева, 1989.
96
Семейство PHORMIACEAE
Пыльник 4-гнездный. Стенка гнезда пыльника состоит из эпидермиса,
1—2 слоев эндотеция, 1—2 средних слоев и тапетума. Тапетум клеточный
секреторный. Стенка зрелого пыльника представлена эпидермисом и 1—2 слоями
фиброзного эндотеция, к внутренней поверхности которого примыкает тапеталь-
ная пленка с орбикулами. Фиброзные утолщения наблюдаются и в клетках
связника. Тип образования тетрад микроспор симультанный. Тетрады
микроспор, как правило, тетраэдральные, но встречаются и крестообразные. Зрелые
пыльцевые зерна 2-клеточные. Генеративная клетка имеет вытянутую
серповидную форму. У Dianella tasmanica 2 конца генеративной клетки четко
различаются: один из них вытянут в длину и притуплён, другой короткий и
заостренный.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная или тенуи-
нуцеллятная. Наружный интегумент 4—6-слойный, внутренний — 2-слойный, но
в районе микропиле число слоев значительно больше. Микропиле образовано
внутренним интегументом. Нуцеллус представлен небольшим числом клеток.
Нуцеллярный колпачок 2—3-слойный. Париетальная ткань у Blandfordia nobilis
представлена одним слоем клеток и исчезает на стадии 2-ядерного
зародышевого мешка. У Dianella и Phormium отделения париетальной клетки не
наблюдается. У Blandfordia отмечается четко выраженная гипостаза,
представленная клетками с утолщенными стенками. Проводящий пучок подходит к клеткам
гипостазы. У Phormium гипостаза не обнаружена. Археспорий, как правило,
одноклеточный. У Dianella возможно образование 2 микроспороцитов в одном
нуцеллусе. В результате мейоза образуется линейная, реже — Т-образная
тетрада мегаспор. У Blandfordia после первого мейотического деления образуется
диада, состоящая из неравных клеток: маленькой микропилярной и крупной
халазальной. Микропилярная клетка часто не делится, и в результате мейоза
II формируется триада.
Зародышевый мешок разивается из халазальной мегаспоры по Polygonum-
типу. Зародышевый мешок 8-ядерный, 7-клеточный; у Dianella и Phormium он
яйцевидной формы, у Blandfordia — вытянут и заужен в халазальной части.
Яйцевой аппарат представлен крупной яйцеклеткой и 2 синергидами. В синер-
гидах четко выражен нитчатый аппарат. Синергиды у Blandfordia и Dianella
имеют клювовидные выросты. У Phormium встречаются яйцеклеткоподобные
синергиды. Полярные ядра чаще сливаются вблизи антипод. Антиподы
представлены 3 клетками. У Blandfordia и Dianella они сохраняются и после
оплодотворения и наблюдаются на ранних стадиях эндоспермогенеза.
Оплодотворение порогамное. Описаны случаи вхождения в зародышевый мешок
дополнительных пыльцевых трубок.
Эндосперм гелобиальный. Деление первичного ядра эндосперма
происходит в халазальной части зародышевого мешка, в результате чего образуется
большая микропилярная и маленькая халазальная клетки-камеры. Второе
деление может быть синхронным в обеих клетках, но позднее деления идут чаще
в большой клетке, где ядра располагаются в пристенном слое цитоплазмы.
На стадии 4-клеточного проэмбрио в микропилярной камере эндосперма
насчитывается 128, а в халазальной — 32 ядра. Эндосперм зрелого семени
представлен тонкостенными клетками, содержащими белки и липиды.
Развитие зародыша было прослежено у Blandfordia только на ранних
стадиях. Деление зиготы поперечное, при втором делении апикальная клетка
делится продольно, а базальная поперечно. В зрелом семени Dianella зародыш
прямой, с очень длинной семядолей, конец которой часто загнут; он
дифференцирован и занимает почти все семя. Маленький зародыш у Blandfordia. Лей-
коэмбриофиты.
Исследованные виды. Blandfordia nobilis, Dianella nemorosa,
D. tasmanica, Phormium tenax.
7 3ак. 2144
97
Phormiaceae
1, 4, 5, 15, 16, 21, 22, 32 — Dianella nemorosa, 2, 3, 7, 8, 10—14, 17—20, 25—31 — Phormium tenax,
6, 9, 23, 24, 33—36 — Dianella sp., 37—44 — Blandfordia nobilis, 45, 46 — Dianella tasmanica
Phormiaceae (продолжение)
1 — продольный срез пыльника, микроспороциты и клетки тапетума; 2,3 — деления мейоза в микро-
спороците; 4,5 — образование тетрады микроспор; 6 — продольный срез пыльника на стадии тетрад
микроспор; 7,8 — 2-клеточное пыльцевое зерно; 9 — продольный срез пыльника на стадии зрелой
пыльцы; 10 — зрелая пыльца; // — схема поперечного среза вскрывшегося пыльника; 12 — место
вскрытия гнезда пыльника; 13 — клетки на месте вскрытия гнезда пыльника;
14 — профаза мейоза в мегаспороците, периклинальное деление в эпидермальной клетке нуцел-
луса; 15, 16 — деления мейоза в мегаспороцитах; 17 — образование диады клеток; 18, 19 — типы
тетрад мегаспор; 20 — одноядерный зародышевый мешок; 21, 23 — 2-ядерные зародышевые мешки;
22, 24, 25 — 4-ядерные зародышевые мешки;
7*
Phormiaceae (продолжение)
26, 32 — продольные срезы семяпочек на стадии зрелого зародышевого мешка; 27, 28 —
зародышевые мешки с яйцеклеткоподобными синергидами, положение полярных ядер в центральной клетке;
29 — 7-клеточный зародышевый мешок; 30 — зигота; 31 — 2-клеточный проэмбрио, дополнительная
пыльцевая трубка; 33 — зрелый зародышевый мешок; 34 — зародышевый мешок с
дегенерирующими антиподами;
35 — зигота и дегенерирующие синергиды; 36 — первичное ядро эндосперма вблизи антипод;
37 — халазальный конец зародышевого мешка, деление первичного ядра эндосперма, антиподы;
38 — 2-клеточный эндосперм; 39 — деление в микропилярной и халазальной камерах эндосперма;
40 — зародышевый мешок с 2-клеточным эндоспермом; 41 — деление зиготы; 42—44 — начальные
этапы эмбриогенеза; 45 — продольный срез созревающего семени с зародышем и многоядерными
микропилярной и халазальной камерами эндосперма; 46 — зародыш и эндосперм в зрелом семени.
(1, 4,5,15,16, 21,22,32 — по Raju, 1957; 2,3,14,17—20 — по Cave, 1955; 6—13,23—25, 27—31, 33—
36— ориг.; 26, 37—44 —по Fulvio, Cave, 1965; 45, 46 — по Schnarf, Wunderlich, 1938—1939).
Литература. Palm, 1920; Krause, 1930; Cave, 1933, 1955, 1975; Sch-
narf, Wunderlich, 1938—1939; Raju, 1957; Schlittler, 1957; Fulvio, Cave, 1965;
Яковлев, Жукова, 1973; 1980; Немирович-Данченко, 1985; Алимова, Жинкина,
ориг. данные.
Семейство AGAVACEAE
Пыльник 4-гнездный; гнезда пыльника объединены попарно в 2 теки.
Развитие стенки гнезда пыльника происходит центростремительно, по типу
однодольных. Сформированная стенка гнезда пыльника у Polianthes tuberosa 6-слой-
ная, у видов рода Agave— 10—12-слойная. Клетки первичного париетального
слоя P. tuberosa образуют эндотеций и вторичный париетальный слой (Joshi,
Pantulu, 1941). Клетки последнего делятся дважды, в результате чего
образуются 4 слоя клеток: наружный слой дифференцируется в эндотеций, 2
последующих слоя становятся средними и быстро исчезают, а внутренний слой дает
начало тапетуму. Таким образом, стенка гнезда пыльника этого вида содержит
2-слойный эндотеций. У видов рода Agave отмечен многослойный эндотеций,
но не прослежен путь формирования стенки гнезда пыльника. У Hosta ко
времени обособления микроспор стенка гнезда пыльника состоит из 2 слоев —
эпидермиса и эндотеция. При развитии пыльцевых зерен происходят
увеличение размеров клеток эпидермиса и интенсивное деление клеток эндотеция, что
приводит к образованию 4—5 слоев. Стенка гнезда зрелого пыльника агавовых
состоит из 2 или нескольких слоев клеток эндотеция и более или менее
сохранившихся клеток эпидермиса. Тапетум однослойный, клеточный секреторный.
У Agave lechugullla (Grove, 1941) и у Hosta albomarginata (ориг.) тапетум
периплазмодиальный, заполняющий всю полость гнезда пыльника однородной
цитоплазматической массой. Клетки тапетума P. tuberosa во время микроспо-
рогенеза становятся 4-ядерными. В дальнейшем отмечены как попарное слияние
ядер с образованием тетраплоидных, так и слияние 3 ядер и образование гек-
саплоидных ядер (Joshi, Pantulu, 1941). Археспориальные клетки в каждом
гнезде пыльника закладываются в 2—3 продольных ряда. После отделения
первичных париетальных клеток количество спорогенных клеток значительно
возрастает. Увеличиваясь, они становятся микроспороцитами, которые
отличаются не только размерами, но и крупным ядром с ядрышком. Микроспороге-
нез протекает нормально. Тетрады микроспор образуются по сукцессивному
типу; их расположение в тетрадах зависит от формы микроспороцитов:
сферические изодиаметрические микроспороциты дают начало тетраэдральным и
изобилатеральным тетрадам, цилиндрические — линейным и Т-образным (Joshi,
Pantulu, 1941). Пыльцевые зерна округлой или овальной формы, 2-клеточные.
Генеративная клетка округло-веретеновидная, располагается рядом с ядром
вегетативной клетки в центре пыльцевого зерна. Спермиогенез протекает в
пыльцевой трубке.
Семяпочка анатропная, с 2 интегументами, на коротком, очень массивном
фуникулусе, крассинуцеллятная. Внутренний интегумент в прилегающей к ну-
целлусу части 2-слойный, в области микропиле он более массивный; у P.
tuberosa, например, количество слоев возрастает до 5. У Furcraea andina (Nevins,
1927) и Н. albomarginata, по нашим данным, внутренний интегумент во время
развития зародышевого мешка образует над вершиной нуцеллуса многослойный
массивный оперкулум. Микропиле у всех изученных видов образовано
внутренним интегументом. Электронная микроскопия семяпочки Agave parryi на стадии
7-клеточного зародышевого мешка (Tilton, Mogensen, 1979) показала, что
внутренний интегумент состоит из мелких плоских клеток и покрыт тонким слоем
кутикулы, которую никогда не пересекают плазмодесмы. Крахмал обнаружен
преимущественно в халазальной части внутреннего интегумента. Наружный
интегумент у всех изученных видов значительно короче и массивнее, чем
внутренний, у A. parryi он 4—7-слойный (Mogensen, 1970), у P. tuberosa — 2—
5-слойный (Joshi, Pantulu, 1941), причем в области халазы количество слоев
клеток на 1—2 больше, чем в микропилярной части. Массивный у основания
наружный интегумент Н. albomarginata суживается к вершине, становясь
1—2-слойным. Во время развития зародышевого мешка он отстает от внутрен-
102
1—6, 9—14, 16, 17, 22, 25, 33, 34 — Poli-
anthes tuberosa, 7, 8, 15, 18, 21, 26, 28,
29, 32, 35, 37 — Hosta albo-marginata,
19, 20, 23, 24, 27, 30, 31 — Yucca aloifo-
lia, 36 — Agave virginica
1—5 — последовательные стадии
развития стенки пыльника и спорогенных
клеток; 6 — пыльник, содержащий
микроспоры; 7 — фрагмент пыльника с 2-
клеточными пыльцевыми зернами; 8 —
стенка зрелого пыльника; 9 — микро-
спорогенез и 10—12 — тетрады
микроспор; 13, 14 — развитие пыльцевых
зерен;
него, в дальнейшем вытягивается, становясь тонким, 2-слойным, и почти
смыкается над внутренним интегументом. Наружный интегумент A. parryi состоит
из сильно вакуолизирован^ых клеток с оболочками, .пронизанными плазмодес-
мами, количество которых возрастает от халазы к микропиле (Tilton, Mogensen,
1979). Эти клетки — наиболее крупные во всей семяпочке. Тангентальные стенки
юз
Agavaceae (продолжение)
15, 16 — семяпочки с археспориальными клетками; 17 — образование париетальной и спорогенной
клеток; 18 — семяпочка с мегаспороцитом; 19, 20— нуцеллус с мегаспороцитом в стадии мейоза;
21 — семяпочка на стадии тетрады мегаспор; 22—24 — формы тетрад мегаспор; 25 —
дегенерация микропилярных мегаспор тетрады;
внутреннего эпидермиса наружного интегумента покрыты кутикулой; крахмал
выявлен только в халазальной части наружного интегумента. Проводящий
пучок из фуникулуса доходит, не разветвляясь, до халазы (P. tuberosa, A.
parryi) . Нуцеллус A. parryi состоит из клеток, размер которых возрастает от халазы
к микропиле (Tilton, Mogensen, 1979); их оболочки пронизаны плазмодесмами,
которых никогда не наблюдали между клетками нуцеллуса и зародышевым
мешком. В области микропиле клетки эпидермиса нуцеллуса крупные,
вытянутые, образуют нуцеллярный колпачок. Оболочки клеток нуцеллуса между
зародышевым мешком и нуцеллярным колпачком исключительно плотные,
толщина их в 2—3 раза превосходит толщину оболочек остальных клеток
нуцеллуса. Цитоплазма клеток нуцеллуса неплотная, наряду с центральной вакуолью
содержит много мелких периферических вакуолей. Крахмал сосредоточен в
халазальной зоне нуцеллуса, причем его здесь значительно больше, чем в
прилегающих клетках интегументов. В центре халазальной части нуцеллуса A. parryi
образуется гипостаза, состоящая из маленьких удлиненных, с утолщенными
стенками клеток. У Н. albomarginata, по нашим данным, с первых же этапов
развития семяпочки наблюдается интенсивное деление клеток халазальной
части нуцеллуса, что приводит к формированию массивного конусовидного
104
Agavaceae (продолжение)
26 — семяпочка, содержащая одноядерный зародышевый мешок; 27—30 — 2-й 4-ядерные стадии
развития зародышевого мешка; 31—33 — зрелые зародышевые мешки; 34, 35 — семяпочки на
стадии зрелого зародышевого мешка; 36 — ядра эндосперма в полости зародышевого мешка до
деления ядра зиготы; 37 — семяпочка на ранней стадии эмбриогенеза. (/—6, 9—14, 16, 17, 22, 25, 33,
34 — по Joshi, Pantulu, 1941; 7, 8, 15, 18, 21, 26, 28, 29, 32, 35, 37 — ориг.; 19, 20, 23, 24, 27, 30, 31 —
по Wolf, 1940; 36 — по Regen, 1941).
образования — перисперма. Последний отмечен и у видов рода Yucca.
Изображение семяпочек P. tuberosa также свидетельствует о формировании
перисперма, хотя авторы исследования (Joshi, Pantulu, 1941) не упоминают о нем.
Археспорий одноклеточный. Археспориальная клетка делится, образуя
первичную париетальную и спорогенную клетки. Первичная париетальная клетка
формирует преимущественно 2-слойную ткань, но эта ткань может оставаться и
однослойной (F. andina). Спорогенная клетка, не делясь, становится мегаспоро-
цитом. К мейозу он приступает после значительного увеличения в размере,
превосходя в длину окружающие нуцеллярные клетки у A. parryi, например,
в 3—4 раза (Mogensen, 1970). Мейоз проходит без отклонений, сопровождаясь
цитокинезом, с образованием 4 мегаспор, в редких случаях образуются лишь
3 мегаспоры в результате подавления мейоза II в микропилярной клетке диады
(Yucca gloriosa — Guignard, 1882; F. andina — Nevins, 1927). у A. lechuguilla
отмечен случай образования только диады вследствие отсутствия цитокинеза
после мейоза II (Grove, 1941), что, однако, подверглось критике (Mogensen,
1970). Тетрады мегаспор линейные (Yucca filamentosa, Y. rupicola, F. andina,
A. parryi, H. albomarglnata), линейные и Т-образные (P. tuberosa, Agave slsa-
lana, A. virglnlca). Преобладание Т-образных тетрад отмечено у Yucca glauca
(Folson, 1916) и у Yucca alolfolla (Wolf, 1940). Функционирующей становится
преимущественно халазальная мегаспора. Отмечены случаи образования
зародышевого мешка и из эпихалазальной мегаспоры (Y. gloriosa — Guignard,
1882; Y. filamentosa — Reed, 1903). У F. andina функционирующей является
микропилярная мегаспора (Nevins, 1927). У Y. glauca образование
зародышевого мешка возможно из любой мегаспоры тетрады (Folson, 1916).
Зародышевый мешок моноспорический, разивается по Polygonum-типу, что
отмечено почти всеми исследователями. Определение зародышевого мешка
A. lechuguilla как биспорического (Grove, 1941) вызывает сомнение и требует
проверки. После первого деления ядра функционирующей мегаспоры
происходит вакуолизация клетки. Последующие деления ядер зародышевого мешка
на полюсах проходят преимущественно синхронно (P. tuberosa, Y. alolfolla, F.
andina, H. albomarglnata)', иногда эта синхронность нарушается (A. parryi),
ядра микропилярного конца делятся быстрее, но может быть, и наоборот
(Mogensen, 1970). Ко времени завершения деления ядер зародышевого мешка
париетальные клетки у всех видов разрушаются и зародышевый мешок
оказывается непосредственно под эпидермисом нуцеллуса. Форма зародышевого
мешка на этой стадии довольно типична: микропилярный конец, ограниченный
эпидермисом нуцеллуса, расширен, а халазальный — заужен и вытянут в виде
трубки. Вдаваясь в нуцеллус, он выполняет, возможно, гаусториальную
функцию, что отмечено у Y. alolfolla (Wolf, 1940). У P. tuberosa зародышевый мешок
овально-веретеновидный, наиболее широкий в средней части. Дифференцировка
клеток зародышевого мешка типична. Синергиды грушевидные, с ядром в базаль-
ной и вакуолью в апикальной частях каждой клетки. Небольшой крючковид-
ный вырост отмечен у P. tuberosa и A. parryi. Нитчатый аппарат выявлен у видов
Yucca; у A. parryi — только при изучении с помощью электронного микроскопа
(Tilton, Mogensen, 1979). Цитоплазма синергид этого же вида очень плотная,
многочисленные органеллы расположены преимущественно по периферии
клетки; пластиды и митохондрии более многочисленны в апикальной, а диктиосомы
в состоянии гиперсекреции и ЭР чаще наблюдаются в базальной части клетки.
Рибосомы многочисленные, распределены в цитоплазме равномерно, сообщая ей
гомогенность и плотность. Пластид в синергидах больше, чем в любой другой
клетке зародышевого мешка. Ядра синергид лопастные. Часть клеточной стенки
синергид, примыкающая к нуцеллярному колпачку, отличается значительной
толщиной. Синергиды дегенерируют до оплодотворения, одновременно или
последовательно. Яйцеклетка располагается под синергидами. Ядро яйцеклетки
A. parryi крупное, занимает большую часть объема клетки (Tilton, Mogensen,
1979). В базальной части яйцеклетки расположена большая вакуоль, а вокруг
ядра — многочисленные мелкие вакуоли. Цитоплазма яйцеклетки плотная;
рибосомы свободные, но иногда объединены в полисомы. Пластиды очень крупные,
содержат пластоглобулы; размещение пластид преимущественно перинуклеар-
ное. Митохондрий мало, ЭР развит слабо, диктиосомы распределены и ориен-
106
тированы беспорядочно. Крахмал не выявлен ни в яйцеклетке, ни в синергидах.
В центральной клетке обнаружены крупные пластиды, но крахмал
наблюдается только в некоторых из них. Оболочка центральной клетки тонкая на всем
протяжении; в зоне, прилегающей к яйцеклетке, отсутствует, наблюдается лишь
плазмалемма. Диктиосомы обнаружены в прилегающей к яйцевому аппарату
части центральной клетки. ЭР развит слабо. Плазмодесмы густо пронизывают
оболочки клеток между синергидами, между синергидами и яйцеклеткой,
яйцевым аппаратом и центральной клеткой, но совершенно отсутствуют между
центральной клеткой и окружающими ее клетками нуцеллуса (Tilton, Mogensen,
1979). Полярные ядра сливаются до оплодотворения. Как редкий случай у
Л. virginica (Regen, 1941) отмечено слияние полярных ядер после, а у Л. lechu-
guilla (Grove, 1941) —во время оплодотворения. Первичное ядро эндосперма
мигрирует в халазальный конец зародышевого мешка и располагается над
антиподами. Это явление расценивается Шнарфом и Вундерлих (Schnarf,
Wunderlich, 1939) как признак развития гелобиального эндосперма. Антиподы
одноядерные, но у P. tuberosa отмечен случай образования 2-ядерных антипод.
Антиподы, находящиеся в узкой части зародышевого мешка, дегенерируют
вскоре после его созревания. Данные о процессе оплодотворения в литературе
отсутствуют. У A. virginica изображена зигота, окруженная ядрами эндосперма
(Regen, 1941). Это позволяет предположить, что тройное слияние опережает
сингамию.
Сведения по эндосперму противоречивы: Шнарф (Schnarf, 1931) у Furcraea
cubensis, Шлимбах (Schlimbach, 1924) у Agave chloracantha и A. atienuata и
Риген (Regen, 1941) у Л. virginica отмечают наличие свободных ядер на ранних
стадиях развития, тогда как другие исследователи, изучавшие этот процесс
(Wunderlich, 1950 — Agave dasylirioides, A. virginica; Joshi, Pantulu, 1941 —
P. tuberosa), считают более вероятным гелобиальный тип эндосперма.
Зародыш у К. glauca развивается по Caryophyllad-типу (Folson, 1916).
Лейкоэмбриофиты (Яковлев, Жукова, 1973, 1980).
Исследованные виды. Agave attenuata, A. chloracantha, Л.
dasylirioides, A. lechuguilla, Л. parryi, Л. sisalana, A. virginica, A. zapupe, Beschor-
neria decosteriana, Furcraea andina, F. cubensis, Hosta (=Funkia) albomar-
ginata, Polianthes tuberosa, Yucca aloifolia, Y. filamentosa, Y. glauca, Y. gloriosa,
Y. recurva, Y. rupicola.
Литература. Vesque, 1879; Guignard, 1882; Herail, 1889; Koernicke,
1901; Reed, 1903; Lary de Latour, 1908; Wojcicki, 1911; Folson, 1916; Palm, 1920;
Schlimbach, 1924; Cappelletti, 1927; Nevins, 1927; Catalano, 1928, 1929a, 1929b,
1930, 1931; McKelvey, Sax, 1933; Vignoli, 1936, 1937; Watkins, 1936, 1937;
Wunderlich, 1936, 1938, 1950; Schnarf, Wunderlich, 1939; Wolf, 1940; Grove,
1941; Joshi, Pantulu, 1941; Regen, 1941; Webler, 1953; Arnott, 1959, 1961, 1962;
Guzowska, 1960; Mogensen, 1970; Яковлев, Жукова, 1973, 1980; Tilton,
Mogensen, 1979.
Семейство DORYANTHACEAE
Пыльник не исследован.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Наружный
интегумент состоит из 7 и более слоев, внутренний — 2-слойный.
Зародышевый мешок не исследован.
Эндоспермогенез не исследован. В эндосперме зрелого семени содержатся
белки и жиры.
Зрелый зародыш крупный, прямой. У Daryanthes excelsa его длина равна
приблизительно 2 мм, что составляет 1/3 (иногда чуть более половины) длины
эндосперма. У D. palmari зародыш длиной 7 мм и почти равен длине семени
(Huber, 1969). Он имеет большую треугольно-вееровидную семядолю с хорошо
развитой проводящей системой.
Исследованные виды. Doryanthes excelsa, D. palmeri.
Литература. Newman, 1929a, 1929b, Pax, 1930; Cave, 1955; Huber, 1969;
Немирович-Данченко, 1985.
107
Семейство ASPHODELACEAE
Пыльник 4-гнездный, 2-тековый, перед раскрыванием гнёзда каждой теки
сливаются. Тип формирования стенки гнезда пыльника не определен.
Сформированная стенка гнезда пыльника состоит из эпидермиса, эндотеция, среднего
слоя и тапетума (Govindappa, 1955). У Asphodelus fistulosus средних слоев
может быть 2 (Гусейнова, 1967). Однослойный тапетум сначала состоит из
одноядерных, а затем из 2-ядерных клеток. У A. fistulosus стенки некоторых
клеток тапетума разрушаются и образуется «нетипичный» периплазмодий
(Гусейнова, 1967). У Aloe duckerii (ориг.) во время мейоза тапетум в основном
сохраняет клеточное строение. На стадии тетрад микроспор или после распада
тетрад некоторые клетки тапетума увеличиваются в размерах, их оболочки
растворяются, а протопласты проникают внутрь гнезда пыльника, ядра
удлиняются, становятся лентовидными или приобретают неправильную форму и
располагаются между микроспорами. Следует отметить, что хотя в
периплазмодий превращается большая часть клеток тапетума, в некоторых частях
пыльника тапетум так и остается клеточным. Очевидно, тапетум, который мы
наблюдали у A. duckerii, можно отнести к переходному типу. Пока трудно считать,
однако, данный тип тапетума характерным для семейства, поскольку он
обнаружен только у Asphodelus и Aloe, причем в последнем случае — у
оранжерейных экземпляров, что может быть связано со стерильностью растений. В эндоте-
ции формируются фиброзные утолщения (Govindappa, 1955). Стенка зрелого
пыльника состоит из эпидермиса и эндотеция. Мейоз проходит без отклонений.
Asphodelaceae
1—3, 9, 10, 14, 15, 21 — Aloe ciliaris, 4—8, 11—13, 16—19, 22, 32 — A. duckerii, 20 — Eremurus hima-
laicus, 23—31, 33 — Asphodelus ramosus, 34—50 — A. tenuifolius
1—3 — формирование стенки пыльника; 4 — поперечный разрез пыльника на стадии формирования
тетрад; 5—10 — мейоз при микроспорогенезе; 11, 12 — тетрады микроспор; 13 — микроспора после
выхода из тетрад; 14 — 2-клеточное пыльцевое зерно; 15 — стенка зрелого пыльника;
108
Тетрады микроспор формируются симультанно. Микроспоры в тетрадах
располагаются тетраэдрально, у A. duckerii иногда крестообразно. Пыльцевые зерна
в момент рассеивания 2-клеточные.
Семяпочки в семействе разных типов. Наиболее часто встречается анатроп-
ная (Комар, 1982). Этот тип известен у Asphodeiine taurica, Laxmannia, So-
werbeae, Anthericum, Arthropodium, Chlorophytum, Alectorurus, Lomatophyl-
lum, Echeandia. Гемитропные семяпочки обнаружены у ряда видов триб
Asphodeleae (Asphodeiine lutea, Bulbine alooides, Eremurus), у Aloeae (Gas-
teria carinata, G. decipiens, Aloe de Wetii, A. grandidentata, A. commuiata,
A. macrocarpa) и Kniphotiae (Knipliofia uvaria). У Aloe ciliaris семяпочка
гемианатропная (Qovindappa, 1955), у A. vera и A. africana — ортотропная,
но у последнего вида она становится кампилотропной (Joshi, 1937; Naughton,
Robertson, 1977). Семяпочки с 2 интегументами, крассинуцеллятные.
Микропиле образовано внутренним интегументом, который обычно 2-слойный,
состоит из тонкостенных клеток; в районе микропиле он может быть 3-слойным.
Наружный интегумент 3—7-слойный. Семяпочки имеют ариллус, который у As-
phodelus tenuifolius после оплодотворения полностью покрывает семяпочку.
Ариллусы известны у разных видов Asphodelus (Desole, 1947; Eunus, 1952;
Гусейнова, 1968), Aloe, Asphodeiine (Schnarf, Wunderlich, 1939), Bulbine,
Eremurus (Stenar, 1928). У ряда видов исследованных родов имеется обтуратор
(Aloe, Asphodeiine, Bulbine, Eremurus, Gasteria, Kniphofia). Гипостаза и
подиум отмечены в родах Asphodeiine, Bulbine, Eremurus, Kniphofia (Комар,
1982, 1985). Археспорий одноклеточный (A. ciliaris, A. fistulosus) или много-
109
jf|/ 20, 21 — семяпочки на стадии зрелого зародышевого мешка; 22 — нуцеллус
: |/ семяпочки с увеличившимся мегаспороцитом и кроющей клеткой; 23 — много-
|| клеточный археспорий в нуцеллусе; 24 — мегаспороцит во время мейоза;
\':3\ 25 — мейоз в 2 мегаспороцитах; 26 — тетрада мегаспор; 27 — одноядерный
•}|! зародышевый мешок; 28—31 — развитие нескольких зародышевых мешков
$] в одной семяпочке; 32— микропилярная часть зародышевого мешка в момент
../ J0 контакта спермия с ядром яйцеклетки;
клеточный {Asphodelus ramosus). Археспориальная клетка становится
мегаспороцитом после отделения {Aloe ciliaris, A. duckerii, Asphodelus fistulosus)
или без отделения париетальной клетки {Aloe africana). В случае отделения
париетальная клетка 1—2 раза делится, формируя париетальную ткань. Обычно
единственный мегаспороцит делится мейотически и образует линейную, реже —
Т-образную тетраду мегаспор. Иногда в микропилярной клетке диады
клеточной стенки не возникает (Л. ciliaris). Функционирует халазальная мегаспора.
НО
Asphodelaceae (продолжение)
33—37 — развитие гелобиального эндосперма; 38 — халазальный гаусторий эндосперма; 39—47 —
эмбриогенез; 48 — формирование точки роста зародыша; 49 — закладка инициалей корня; 50 —
семя в момент закладки точки роста зародыша. (/—3, 9, 10, 14, 15, 21 — по Govindappa, 1955; 20 —
по Stenar, 1928; 23—31, 33 — по Desole, 1947; 34—50 — по Eunus, 1952; 4—8, 11—13, 16—19, 22,
32 — ориг.).
В некоторых случаях зародышевый мешок развивается из микропилярной
мегаспоры. При заложении многоклеточного археспория у Asphodelus ramosus
одновременно формируются несколько зародышевых мешков. 2 зародышевых
мешка при этом достигают зрелости, а другие находятся на более ранних
стадиях развития (Desole, 1947).
Зародышевый мешок развивается по Polygonum-типу {Aloe, Bulbine, Ere-
murus, Gasteria, Haworthia, Asphodelus). Данные о развитии зародышевых
мешков по тетраспорическому Adoxa-типу у ряда видов Aloe (A. arborescens,
A. caesia, A. todari var. proecox, A. varvari) (Qioelli, 1930) нуждаются в
подтверждении. Зрелый зародышевый мешок имеет яйцеклетку, 2 синергиды,
центральную клетку с крупным ядром и 3 антиподы. У A. duckerii зародышевый
мешок расширен в центральной части и сужен к полюсам, у Bulbine —
овальный. Синергиды с нитчатым аппаратом. Ядро центральной клетки у Aloe и
ill
Bulbine annua располагается вблизи яйцевого аппарата, в расширенной части
зародышевого мешка, а у Asphodelus и A. duckeril — около антипод. Антиподы
одноядерные, расположены Т-образно или линейно в халазальной части
зародышевого мешка. Порогамия. Пыльцевая трубка проникает в зародышевый
мешок, разрушая одну из синергид, вскоре дегенерирует и вторая синергида.
Оплодотворение двойное, тип объединения ядер гамет, вероятно, премитотиче-
ский.
Эндосперм гелобиального типа. Первичное ядро эндосперма делится в
халазальной области, образуются 2 неравной величины клетки-камеры (халазаль-
ная — очень маленькая). У A. tenuifolius следующее деление в обеих камерах
протекает синхронно. Позднее в халазальной камере формируются только 4
ядра, которые, вероятно, могут сливаться в 2 полиплоидных ядра. В микропи-
лярной камере ядра располагаются по периферии клетки, где в дальнейшем
происходит клеткообразование. Халазальная камера образует клиновидный
вырост в сторону халазы, который выполняет гаусториальную функцию. Эта
клетка долго сохраняется, почти до стадии созревания семени (Eunus, 1952).
У A. fistulosus и A. tenuifolius халазальная камера гелобиального эндосперма
4-ядерная, у В. annua — 2-ядерная, у Eremurus himalaicus в ней
насчитывается до 30—32 ядер (Stenar, 1928). Зрелые семена с эндоспермом.
Тип эмбриогенеза не определен. У A. tenuifolius описан нитевидный проэм-
брио (4—5-ярусный). В дальнейшем деления чаще идут в ярусах / и /', что
приводит к формированию глобулярного зародыша с 7—8-клеточным
подвеском. Впоследствии ряд / дает семядолю, Г — апекс стебля, т — гипокотиль,
п — апекс корня, п' — подвесок. Точка роста, по данным Эунуса (Eunus,
1952), закладывается латерально. В зародыше уже на ранних стадиях развития
(на стадии 2-клеточного проэмбрио) обнаруживаются крахмальные зерна.
Зрелый зародыш занимает 1/3 часть семени. Лейкоэмбриофиты.
Исследованные виды и роды. Alectorurus, Aloe africana, A. ar-
borescens, A. brownii, A. caesia, A. ciliaris, A. commutata, A. de Wetii, A. duckerii,
A. grandidentata, A. humilis, A. macrocarpa, A. todari var. proecox, A. variegata,
A. varvari, A. vera, Anthericum, Arthropodium, Asphodeline lutea, A. taurica,
\sphodelus albus, A. fistulosus, A. tenuifolius, Bulbine alooides, B. annua,
H. frutescens, Chlorophytum, Echeandia, Eremurus Hhnalaicus, E. robustus,
E. tauricus, Gasteria carinata, G. decipiens, G. verrucosa, Haworthia, Kniphofia
proecox, K. uvaria, Laxmannia, Lomatophyllum, Sowerbaea.
Литература. Bergen, 1853; Mellink, 1880; Treumann, 1880; Habermann,
1906; Suessenguth, 1921; Stiffler, 1925; Ono, 1926, 1929; Guerin, 1927; Stenar,
1928; Schnarf, 1929a, 1929b; Gioelli, 1930; Soueges, 1931, 1932; Maheshwari,
Singh, 1933; Schnarf, Wunderlich, 1939; Johansen. 1945; Desole, 1947; Eunus,
1952; Govindappa, 1955; Sun, 1964; Davis, 1966; Капинос, Гусейнова, 1966;
Гусейнова, 1967, 1968; Vig, 1968; Яковлев, Жукова, 1973, 1980; Naughton,
Robertson, 1974; Комар, 1982, 1985; Schroder, 1985; Willemse, Franssen-Verhei-
jen, 1986, 1988a, 1988b; Солнцева, ориг. данные.
Семейство XANTHORRHOEACEAE
Развитие и строение стенки гнезда пыльника и пыльцевого зерна не
исследованы.
Семяпочка, как правило, анатропная, у Lomandra rigida — кампилотроп-
ная, крассинуцеллятная, с 2 интегументами. Микропиле образовано внутренним
интегументом. Эпидермальные клетки нуцеллуса делятся периклинально и
антиклинально, формируя нуцеллярный колпачок, состоящий из 2 слоев клеток.
Сильно развита халазальная часть нуцеллуса, в которой среди крупных бед-
ноплазменных клеток выделяется тяж из мелких богатоплазменных, идущий
от халазы к основанию зародышевого мешка. Археспориальная клетка делясь
образует париетальную и спорогенную клетки. Париетальная клетка дает
начало париетальной ткани, состоящей из 3 слоев. Спорогенная клетка диф-
112
Xan thorrhoeaceae
1—4 — Lomandra rigida
1 — продольный срез через нуцеллус с 4 мегаспорами; 2 — зародышевый мешок; 3, За — 2
последующих среза: синергиды с нитчатым аппаратом и яйцеклетка; 4 — семяпочка со зрелым
зародышевым мешком. (1—4 — по Schnarf, Wunderlich, 1938—1939).
ференцируется в мегаспороцит, который делится и образует линейную тетраду
мегаспор. Из халазальной мегаспоры образуется зародышевый мешок.
Развитие зародышевого мешка происходит по Polygonum-типу.
Зародышевый мешок небольшой, округлый. В нем выделяются большие грушевидные
синергиды, которые значительно крупнее яйцеклетки. В синергидах
отсутствуют вакуоли, ядра их лежат в апикальной части клеток и заметно крупнее
остальных ядер зародышевого мешка; сильно развит нитчатый аппарат.
Антиподы — крупные богатоплазменные клетки. Ядро центральной клетки
яйцевидное, лежит в коротком тяже цитоплазмы между клетками яйцевого аппарата
и антиподами.
Эндосперм нуклеарного типа (Lomandra, Xanthorrhoea), в зрелом семени
сохраняется, содержит белки и жиры.
Эмбриогенез не изучен. Зародыш в зрелом семени прямой или изогнутый,
занимает 1/2 длины семени или превышает ее.
Исследованные роды и виды. Lomandra dura, L. micrantha,
L. rigida, Xanthorrhoea.
Литература. Schnarf, Wunderlich, 1938—1939; Stenar, 1951; Davis,
1966; Тахтаджян, 1966, 1980; Поддубная-Арнольди, 1982;
Немирович-Данченко, 1985.
Семейство APHYLLANTHACEAE
Эмбриологически почти не исследовано.
Семяпочка анатропная, крассинуцеллятная. Имеется париетальный слой.
Зародышевый мешок развивается по Polygonum-типу.
Эндосперм гелобиальный.
Зародыш хорошо развит, прямой, иногда слабозакрученный, более или менее
цилиндрический, занимает 3/4 объема зрелого семени.
Исследованный вид. Aphyllanthes monspeliensis.
Литература. Krause, 1930; Schnarf, Wunderlich, 1938—1939; Stenar,
1951; Тахтаджян, 1966; Huber, 1969; Комар, 1985.
Семейство HANGUANACEAE
Эмбриологически не исследовано.
Семяпочка ортотропная, с 2 интегументами.
В семени эндосперм обильный, представлен тонкостенными клетками,
заполненными крахмалом.
8 Зак. 2144
113
Зародыш маленький, округлый.
Исследованный вид. Hanguana malayana.
Литература. Maury, 1888; Тахтаджян, 1966, 1980;
Немирович-Данченко, 1985.
Семейство ASPARAGACEAE
Пыльник 4-гнездный, гнезда каждой из 2 тек перед вскрытием пыльника
либо сливаются попарно, либо остаются изолированными (Disporum smilaci-
пит). Развитие стенки гнезда пыльника соответствует центростремительному
типу. Сформированная стенка состоит из эпидермиса, эндотеция, 1—2 средних
слоев (у D. smilacinum и Streptopus amplexifolius 2—3 средних слоя) и тапе-
тума. Клетки средних слоев, за исключением прилежащего к эндотецию
среднего слоя в пыльниках D. smilacinum и S. amplexifolius, рано уплощаются.
Тапетум клеточный секреторный, с 2-, редко — 4-ядерными, у D. smilacinum
одно-, редко — 2-ядерными клетками. Отмечено образование тапетальной плен-
Asparagaceae
1, 15, 19, 19а, 25—32 — Polygonatum pubescens, 2—14, 17, 17а, 20—24 — Disporum smilacinum, 16,
33—42, 51—53 — Smilacina stellata, 18—18a, 54—62, 65—73 — Streptopus amplexifolius, 63, 63a,
64 — Polygonatum roseum, 43, 44, 46—49 — Clintonia umbellulata, 45, 50 — C. uniflora
1— центростремительное формирование стенки пыльника; 2—16—развитие пыльника; 2, 15 —
участки пыльников на стадии микроспороцитов; 3—7 — микроспорогенез; 8 — стадия тетрад;
9, 16 — участки пыльников на этапе распада тетрад, полисахаридная оболочка на радиальной и
обращенной в полость пыльцевого гнезда поверхностях тапетальных клеток отсутствует;
114
Asparagaceae (продолжение)
10 — фрагмент пыльника с вакуолизирован-
ными микроспорами, видна тапетальная
пленка с орбикулами, в цитоплазме клеток тапе-
тума множество включений; //—13 —
выделение тапетумом глобул полленкита и их
растворение на поверхности пыльцевых зерен;
14 — участок зрелого пыльника; 15, 16 —
fc клетки тапетума 2-ядерные;
8*
Asparagaceae (продолжение)
17—19 — основные типы строения семяпочек в семействе: 17, 18, 19 — билатеральные и 17а, 18а,
19а — дорсовентральные срезы;
ки с орбикулами. Клетки тапетума выделяют в полость гнезда пыльника пол-
ленкит, адсорбирующийся на поверхности пыльцевых зерен. Стенка зрелого
пыльника состоит из кутинизированного эпидермиса и фиброзного эндотеция,
к которому примыкает тапетальная пленка с орбикулами. У видов подсем.
Ruscoideae к у Asparagus virgatus эпидермис в зрелом пыльнике не сохраняется.
Спорогенная ткань 3—4-слойная. Тетрады микроспор тетраэдральные и изоби-
латеральные, формируются по сукцессивному типу. Пыльцевые зерна у боль-
116
20—24 — этапы развития зародышевого мешка по Polygonum-типу и развитие нуцеллуса: 20—
22 — мегаспорогенез, 23 — каждая мегаспора тетрады дала начало 2-ядерному зародышевому
мешку, 24 — дальнейшее развитие халазального зародышевого мешка;
шинства видов 2-клеточные, у Ruscus hyrcanus и R. hypophyllum — 2-й 3-кле-
точные, у Danae racemosa и A. virgatus — 3-клеточные.
Семяпочка почти анатропная или анатропная, крассинуцеллятная, псевдо-
крассинуцеллятная или тенуинуцеллятная, с 2 интегументами, фуникулусом,
часто с фуникулярным обтуратором. Микропиле образовано внутренним интегу-
ментом. Париетальная ткань либо образуется, либо нет, имеется нуцеллярный
колпачок (у Clintonia он отсутствует). У D. smilacinum латеральная и халазаль-
ная зоны нуцеллуса слабо развиты, к стадии зрелого зародышевого мешка
не сохраняются, чему в период созревания зародышевого мешка способствует
рост его халазального конца, приводящий к разрушению основания нуцеллуса
и части клеток халазы. У Disporum hookeri, S. amplexifolius и Clintonia
развивается массивное колонкообразное основание нуцеллуса. Проводящий пучок
семяпочки не разветвлен, проходит по фуникулусу и заканчивается у
основания нуцеллуса, имеется гипостаза. Лишь у D. smilacinum проводящий пучок
разветвляется, его ветви заканчиваются в периферической области халазы,
гипостаза у этого вида отсутствует. Халаза по сравнению с размерами
нуцеллуса некрупная или крупная (D. smilacinum). Археспорий одно-, редко —
2-кле'ючныи. Мним сопровождается цитокинезом (кроме Clintonia). Тетрады
мегаспор линейные, Т-образные, обращенно Т-образные. У Smilacina stellala,
S. trifolia и Maianthemum кроме перечисленных встречаются изобилатеральные
и тетраэдральные тетрады. У некоторых видов отмечено образование триад.
У Ruscus aculeatus мегаспорогенез заканчивается образованием диад (Vigod-
sky, 1936).
117
ОМ мм
Asparagaceae (продолжение)
33—42 — Drusa-тип развития зародышевого мешка, развитие нуцеллуса: 33, 34 — мегаспорогенез,
35 — тетрада мегаспор, 36, 37 — исчезновение клеточных перегородок I и II делений мейоза между
мегаспорами тетрады, формирование тетраспорического ценоцита, 37, 38 — рост и вакуолизация
тетраспорического ценоцита (4-ядерного зародышевого мешка), 39 — поляризация ядер в 4-ядер-
ном зародышевом мешке;
Зародышевый мешок развивается по Polygonum-, Allium-, Drusa-типам
и Clintonia-подтипу Drusa-типа. При Polygonum-типе функционирующими
являются халазальная (Ophiopogon intermedins, D. hookerl, S. amplexlfoltus,
Polygonatum roseum, P. clrrhlfollum, P. vertlclllatum, Theropogon pallidas,
R. hypophyllum, R. hyrcanus, R. pontlcus, Asparagus), халазальная или эпиха-
лазальная (Danae) или микропилярная (Aspidistra elatior, Smilacina hirta)
мегаспоры. У D. smilacinum и D. sessile все 4 мегаспоры достигают 2-ядерной
стадии, но далее развивается халазальная или эпихалазальная. При Allium-
Asparagaceae (продолжение)
25—32 — Allium-тип развития зародышевого мешка, развитие нуцеллуса: 25 — мегаспороцит,
26 — тетрада мегаспор, 27—29 — растворение клеточной перегородки между халазальной и эпи-
халазальной мегаспорами, формирование халазального биспорического ценоцита (2-ядерного
зародышевого мешка), 30 — 4-ядерный, 31 — сформированный, 32 — зрелый зародышевый мешок,
утолщение клеточных оболочек в базальной зоне антипод;
119
Asparagaceae (продолжение)
40 — 8-ядерный и 41—15-клеточный 16-ядерный зародышевый мешок, сближение полярных ядер,
42 — зрелый зародышевый мешок;
типе развития зародышевый мешок возникает из халазальнои клетки диады
(R. aculeatus), халазального биспорического ценоцита, образующегося после
растворения клеточной перегородки между халазальнои и эпихалазальной
мегаспорами тетрады (Polygonatum pubescens, P. latifolium, P. odoratum, Conval-
laria majalis), или микропилярного биспорического ценоцита, который
формируется в результате исчезновения перегородки между микропилярной и субмик-
ропилярной мегаспорами (Endymion-форма Allium-типа, Smilaclna racemosa,
S. amplexicaulis). У S. stellata, S. trifolia и видов Maianthemum в тетраде
мегаспор лизируются все клеточные перегородки, образовавшийся тетраспори-
ческий 4-ядерный ценоцит развивается далее по Drusa-типу. У Polygonatum
multiflorum обнаружены Polygonum-, Allium- и Drusa-типы (Bjornstad, 1970).
По Clintonia-подтипу Drusa-типа проходит формирование зародышевого мешка
у видов рода Clintonia. В результате мегаспорогенеза, проходящего без
цитокинеза, у видов этого рода образуется клетка с 4 ядрами, жизнеспособным
микропилярным и 3 дегенерирующими халазальными ядрами. Микропилярное
ядро дважды делится, образуя 4 ядра, которые после клеткообразования в
зародышевом мешке становятся ядрами клеток яйцевого аппарата и
единственным полярным ядром центральной клетки. В халазальном конце
сформированного зародышевого мешка Clintonia остаются 3, часто слившихся
дегенерирующих мегаспориальных ядра. Сформированный зародышевый мешок в
семействе 7-клеточный 8-ядерный; 15-клеточный 16-ядерный или 4-клеточный
120
Asparagaceae (продолжение)
43—50 — развитие зародышевого мешка по Clintonia-подтипу Drusa-типа: 43 — семяпочка с мега-
спороцитом, 44, 45 — образование в ходе мегаспорогенеза 4-ядерного зародышевого мешка, при
этом 3 халазальных мегаспориальных ядра дегенерируют, 46—49 — дальнейшее развитие
зародышевого мешка, халазальный его конец' депрессирован, 50 — зрелый зародышевый мешок;
4-ядерный, что обусловлено типом его развития. Яйцевой аппарат 3-клеточный,
синергиды с нитчатым аппаратом. Полярные ядра до оплодотворения либо
остаются в контакте, либо полностью сливаются, располагаясь у яйцевого
аппарата, в средней части центральной клетки или у антипод. В центральной
клетке Aspidistra elatior обнаружены рафиды (Golaszewska, 1934a). Антипо-
диальный аппарат 3-клеточный или изначально И-клеточный (при Drusa-
типе), или отсутствует вовсе (Clintonia). У Asparagus plumosus число антипод
увеличивается. У Polygonatum pubescens наблюдается утолщение базальных
клеточных оболочек антипод, напоминающих по своей структуре нитчатый
аппарат синергид. Антиподы начинают рано дегенерировать или длительное
время остаются жизнеспособными клетками. Порогамия. Пыльцевая трубка,
входя в зародышевый мешок, разрушает одну из синергид, вторая синергида
сохраняется в течение первых делений зародыша. Оплодотворение двойное,
у S. amplexifolius проходящее по премитотическому типу.
Эндосперм нуклеарный или гелобиальный. Последний обнаружен у О.
intermedin, у некоторых Polygonatum, Ruscus и Danae. У P. roseum и P. pubescens
клеткообразование отмечено как в микропилярной, так и в халазальной камерах
гелобиального эндосперма. В зрелом семени эндосперм обильный, у S.
amplexifolius и S. roseus он руминирован (настоящая руминация — по классификации
Тамамшян, 1951).
Эмбриогенез у R. ponticus и S. amplexifolius соответствует Solanad-типу,
у последнего вида — его Nicotiana-вариации. У О. intermedius развитие
зародыша проходит по Onagrad-типу (Rao, Kaur, 1979a). Зрелый зародыш прямой,
дифференцирован на зародышевый корень, состоящий из апикальной меристемы
и чехлика, короткий гипокотиль, апекс побега и семядолю. Точка роста побега
замкнута разросшимся основанием семядоли. Подвесок короткий, его клетки
рано становятся бедноплазменными. У D. smilacinum в зрелом семени
сохраняется несколько дегенерирующих клеток подвеска, у остальных изученных
видов он полностью разрушается и его место заполняется тканью эндосперма.
Лейкэмбриофиты.
121
Asparagaceae (продолжение)
51—53 — образование спермиев в пыльцевой трубке; 54—61 — оплодотворение: 54—58 — слияние
ядра спермия с ядром яйцеклетки, 59—61 — слияние ядра спермия со вторичным ядром
центральной клетки;
Для S. racemosa характерна нуцеллярная эмбриония и полиэмбриония.
1—2 дополнительных зародыша развиваются из клеток париетальной ткани
нуцеллуса.
Исследованные виды. Asparagus officinalis, A. plumosus, A. гасе-
mosus, A. sprengeri, A. virgatus, Aspidistra elatior, Clintonia andrewsiana,
С. dorealis, С. udensis, С. umbellulata, С. uniflora, Convallaria majalis, Danae
racemosa, Disporum hookeri, D. sessile, D. smilacinum, Liriope graminifolia,
Maianthemum bifolium, M. canadense, M. dilatatum, Ophiopogon intermedius,
O. wallichianus, Polygonatum cirrhifolium, P. commutatum, P. latifolium, P. mul-
tiflorum, P. odoratum, P. pubescens, P. roseum, P. verticillatum, Rhodea japonica,
Ruscus aculeatus, R. hypophyllum, R. hyrcanus, R. ponticus, Smilacina amplexi-
caulis, S. hirta, S. racemosa, S. sessifolia, S. stellata, S. trifolia, Streptopus ample-
xifolius, S. roseus, Theropogon pallidus.
122
Asparagaceae (продолжение)
62 — нуклеарный эндосперм; 63, 63а, 64 — гелобиальный эндосперм (64 — клетки микропилярнои и
халазальной камер гелобиального эндосперма на стадии глобулярного зародыша);
Литература. Vesque, 1878; Jonsson, 1879—1980; Mellink, 1880; Wie-
gand, 1900; Schniewind-Thies, 1901, McAllister, 1909, 1913, ft 14; Smith, 1911;
Robbins, Borthwick, 1925; Netolitzky, 1926; Dahlgren, 1927; Guerin, 1927; Ono,
1928; Trankowsky, 1930; Flory, 1932; Golaszewska, 1934a, 1934b; Stenar, 1935,
1941, 1953; Vigodsky, 1936; Wunderlich, 1936; Smith, 1943; Walker, 1944; Mar-
123
Asparagaceae (продолжение)
65—72 — Solanad-тип эмбриогенеза; 73 — зрелый зародыш, (а — антиподы, в. э. в. ин —
внутренний эпидермис внутреннего интегумента, г — гипостаза, к. тп — клетки тапетума, м. к — клетки
микропилярной камеры гелобиального эндосперма, н. к — нуцеллярный колпачок, ор — орбикулы,
п — полленкит, п. э. н — производные эпидермиса нуцеллуса, х. к — клетки халазальной камеры
гелобиального эндосперма). (1—42, 51—73 — ориг.; 43—50 — по Walker, 1944).
tin, 1946; Кострюкова, 1947; Swamy, 1949; Eunus, 1950; Oikawa, 1950; Тамам-
шян, 1951; Gorham, 1953; Venkateswarlu, Raju, 1958; Laroche, 1964; Поддуб-
ная-Арнольди, 1964, 1976; Савченко, Комар, 1965; Davis, 1966; Гусейнова,
1967; Капинос, Гусейнова, 1967; Huber, 1969; Sugihara, Yoshimura, Umezu,
1969; Bjornstad; 1970; Pahuja, Kumar, 1970; Яковлев, Жукова, 1973; Mahabale,
Inamdar, 1975; Николаева, 1975; Utech, Kawano, 1976a, 1976b, 1976c; Llzarte,
Palzer, 1979; Rao, Kaur, 1979a, 1979b; Takahashi, Sohma, 1979; Trella-Sawicka,
1981, 1985; Gori, 1982; Сатарова, 1983, 1984a, 19846, 1985a, 19856; Комар,
1985; Сатарова, ориг. данные.
Семейство DRACAENACEAE
Пыльник 4-гнездный. Формирование стенки гнезда пыльника у Sansevieria
metallica (Guerin, 1927) происходит центростремительно. Сформированная
стенка пыльника состоит из эпидермиса, эндотеция, 1—2 средних слоев и
тапетума. В эндотеции развиваются фиброзные утолщения. Клетки секреторного
тапетума 1—3-ядерные. По нашим данным, у Cordyline terminalis со стадии
микроспор образуется тапетальная пленка с орбикулами и отмечается выход
полленкита в полость гнезд пыльника. В зрелом пыльнике полленкит в виде
глыбок различной формы и размеров обнаруживается на поверхности
пыльцевых зерен. Изобилатеральные, тетраэдральные, линейные и Т-образные
тетрады микроспор образуются суксессивно. Зрелые пыльцевые зерна 2-клеточ-
ные.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Наружный
интегумент состоит из 2—3 слоев у Dracena и Sansevieria и_4—6 слоев у Dasy-
124
Dracaenaceae
1—3 — Sansevieria metallica, 4 — S. ehrenbergii, 5 — S. trifas-
ciata; 6—8a — Cordyline terminalis, 9—12 — Sansevieria zeyla-
nica, 13 — S. suffruticosa, 14—17 — Dracena surculosa, 18 —
Dasylirion glaucophyllum, 19 — Cordyline australis
1—5 — развитие стенки пыльника; 6 — сформированная стенка
гнезда пыльника и начало мейоза в микроспороцитах; 7—8 —
строение стенки гнезда пыльника на стадии тетрад микроспор
(7) и зрелых пыльцевых зерен (8); 6а, 8а — схемы строения
пыльника на поперечном срезе; 9 — изобилатеральная тетрада
микроспор;
Dracaenaceae (продолжение)
10—12 — мегаспорогенез; 13 — фрагмент семяпочки с 2-ядерным зародышевым мешком; 14 —
строение семяпочки на стадии 4-ядерного зародышевого мешка; 15 — схема строения семяпочки
на стадии зрелого зародышевого мешка;
lirion. Внутренний интегумент 2-слойный, но у Dasylirion, Dracena и Sansevie-
ria в микропилярной части он 4—6-слойный. Микропиле образовано внутренним
интегументом. У большинства видов имеется гипостаза. Археспорий
одноклеточный, у Dasylirion, Dracena, Nolina и Sansevieria (Stenar, 1942; Wunderlich,
1950; Lakshmi, 1979) функционирует как мегаспороцит без отделения
париетальной клетки. Однако у S. suffruticosa (ориг.) над зародышевым мешком
на 2-ядерной стадии развития имеются 3—4 слоя париетальной ткани, которая
уже к 4-ядерной стадии развития зародышевого мешка почти полностью
разрушается. Тетрады мегаспор линейные и Т-образные.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу, однако у Nolina (Gioelli, 1933) отмечен Adoxa-тип. Строение яйцевого
аппарата типичное. Синергиды с нитчатым аппаратом. Антиподы — 3 клетки,
у Cordyline rubra довольно крупные. Полярные ядра сливаются до
оплодотворения. У Dasylirion glaucophyllum центральная клетка зародышевого мешка
формирует латеральный гаусторий (Wunderlich, 1950).
\
Dracaenaceae (продолжение)
16 — микропилярная часть семяпочки с яйцевым аппаратом; 17 — халазальная часть семяпочки
с антиподами и гипостазой; 18 — зародышевый мешок с латеральным гаусториальным выростом
центральной клетки; 19 — зародыш в зрелом семени. (/—5—по Guerin, 1927; 6—8а, 13—17 —
ориг.; 9—12 — по Lakshmi, 1979; 18, 19 — по Wunderlich, 1950).
Тип развития эндосперма не установлен. В зрелом семени эндосперм
обильный.
Тип развития зародыша не установлен. В зрелом семени зародыш
цилиндрический (Dasylirion), прямой (Astelia), изогнутый (Cordyline) или закрученный
(Nolina), дифференцирован на крупную семядолю, почечку и зародышевый
корень.
У Dasylirion acrotrichum отмечен случай апогаметии (Went, Blaauw, 1906).
Исследованные виды. Cordyline australis, С. rubra, С. stricta,
С. terminalis, Dasylirion acrotrichim, D. glaucophyllum, D. quandrangulatum,
Dracena fragrans, D. grandis, D. hookeriana, D. surculosa, Nolina longifolia,
Sansevieria cylindrica, S. ehrenbergii, S. guineensis, S. metallica, S. suffruticosa,
S. trifasciata, S. zeylanica.
Литература. Went, Blaauw, 1906; Tischler, 1912; Palm, 1920; Guerin,
1927; Gioelli, 1933; Stenar, 1942; Wunderlich, 1950; Cave, 1955; Guedes, 1973;
Lakshmi, 1979; Анисимова, ориг. данные.
Семейство TECOPHILAEACEAE
Развитие пыльника изучено неполно. Тапетум секреторного типа. На ранних
стадиях развития у Odontostomum клетки тапетума одноядерные. Во время
мейоза микроспороцитов клетки становятся 2-ядерными; начало дегенерации
клеток тапетума наблюдается ко времени образования пыльцевых зерен.
Образование тетрад микроспор проходит по симультанному типу. Тетрады микроспор
тетраэдральные. Зрелые пыльцевые зерна 2-клеточные.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Микропиле
образовано обоими интегументами у Odontostomum, у Cyanella — только
внутренним интегументом. У Odontostomum развивается фуникулярный
обтуратор. Археспориальная клетка отделяет париетальную, которая, делясь, обра-
127
10
11
Tecophilaeaceae
1,2 — Odontostomum hartwegii, 3—13 — Cyanella capensis
1 — тетрада микроспор; 2— пыльцевое зерно, видна генеративная клетка; 3—археспориальная
клетка; 4 — мегаспороцит и кроющая клетка; 5 — мегаспороцит перед редукционным делением;
6 — ряд из 4 мегаспор; 7 — функционирующая мегаспора; 8, 9 — этапы развития зародышевого
мешка; 10 — сформированный зародышевый мешок, виден гаусторий; // — начало развития
эндосперма; 12 — ранние этапы развития зародышей, возникающих из нуцеллуса (12) и зиготы (12а);
/3 — образование 2 зародышей. (1, 2 — по Cave, 1952; 3—13 — по Vos de, 1950).
зует 2—3 париетальных слоя, у Odontostomum образуется нуцеллярный
колпачок толщиной в 3—5 клеток. В результате деления мегаспороцита
формируется линейная тетрада мегаспор или триада клеток: последняя возникает как
следствие подавления деления в микропилярной клетке диады. Начало
зародышевому мешку дает халазальная мегаспора.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Синергиды имеют грушевидную форму, полярные ядра сливаются перед
оплодотворением. 3 антиподальные клетки могут дегенерировать довольно быстро,
хотя их остатки иногда видны во время ранних этапов образования эндосперма.
128
У некоторых видов (Cyanella capensis и др.) зародышевый мешок образует
трубчатый халазальный гаусторий.
Оплодотворение не исследовано.
Эндосперм нуклеарный, с халазальным гаусторием, содержащим свободные
ядра. Клеткообразование в нем начинается после образования большого числа
ядер. У С. capensis эндосперм в зрелом семени содержит жиры и белки.
Развитие зародыша не изучено.
У отдельных представителей семейства (С. capensis) отмечены случаи
адвентивной эмбрионии. Дополнительные зародыши развиваются из клеток нуцел-
луса. Обычно наблюдается 3 зародыша, один из которых по величине превышает
другие. Этот крупный зародыш дает начало новому растению, остальные
постепенно дегенерируют. Оплодотворенная яйцеклетка часто начинает развитие,
но довольно быстро разрушается и ее место занимают нуцеллярные зародыши.
Исследованные виды. Cyanella capensis, Odontostomum hartwegii.
Литература. Fries, 1919; Nietsch, 1941; Vos, 1950; Cave, 1952; Davis,
1966.
Семейство CYANASTRACEAE
Пыльник не исследован.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная, с мощной
халазой и фуникулярным обтуратором. Наружный интегумент 4-слойный,
внутренний — 2—3-слойный и только у микропиле становится многослойным.
Сосудистый пучок следует по фуникулусу, разветвляется при входе в халазу и
глубоко проникает в наружный интегумент.
Развитие зародышевого мешка и эндосперма не исследовано. На ранних
стадиях развития зародыша эндосперм полностью абсорбируется.
Эмбриогенез не исследован. В зрелом семени зародыш состоит из семядоли,
зародышевого корня и почечки. В семядоле содержится запасной крахмал.
Исследованные виды. Cyanastrum cordifolium, С. johnstoni.
Литература. Fries, 1919; Huber, 1969; Немирович-Данченко, 1985.
Семейство IRIDACEAE
Пыльник 4-гнездный. Стенка гнезда пыльника развивается
центростремительно по типу однодольных (Belamcanda chinensis). Сформированная стенка
у Sisyrinchium californicum и S. striatum состоит из эпидермиса, эндотеция,
1—2 средних слоев и тапетума. Клетки секреторного тапетума обычно
одноядерные, иногда 2-ядерные. У Gladiolus X hybridus клетки тапетума 2-
ядерные, иногда 4-ядерные, с орбикулами. Средние слои эфемерные. В
эндотеции образуются фиброзные утолщения. Стенка зрелого пыльника Gladiolus
X hybridus имеет 3 слоя клеток с фиброзными утолщениями. Многослойный
эндотеции в области связника отмечен у В. chinensis. Образование микроспор
происходит по симультанному типу. У В. chinensis, Eleutherine plicata и
Gladiolus X hybridus цитокинез при микроспорогенезе сукцессивный. Татрады
тетраэдральные, крестообразные, Т-образные и изобилатеральные. Зрелые
пыльцевые зерна у большинства представителей семейства 2-клеточные и только
у немногих родов 3-клеточные. У Iris japonica всего 63 % пыльцевых зерен
жизнеспособны (Jasui, Sawada, 1940).
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. У Iris
pseudacorus и Crocus sieberi наружный интегумент 4—6-слойный,
внутренний — 2-слойный, утолщающийся в микропилярном конце до 4—6 слоев.
Микропиле образовано только внутренним интегументом. У /. pseudacorus
хорошо развит интегументальный тапетум, состоящий из 2 слоев. Клетки его
при развитии зародышевого мешка сильно увеличиваются (в 2—2.5 раза)
и вакуолизируются. Цитоплазма в слое, прилегающем к зародышевому мешку,
значительно плотнее. Дегенерация интегументального тапетума начинается
на стадии глобулярного зародыша. Имеются фуникулярный обтуратор и ги-
9 Зак. 2144
129
n
Iridaceae
1—12, 15—27 — Gladiolus hybridus, 13, 14 — Iris versicolor, 28—31 — Romulea marattii, 32 — Iris
pseudacorus
1—3 — формирование стенки пыльника; 4 — клетки тапетума; 5—9 — микроспорогенез; /—14 — развитие
пыльцевого зерна;
постаза у /. pseudacorus, видов Crocus и Romulea. Археспорий одноклеточный.
Археспориальная клетка отделяет париетальную клетку, которая образует
один или несколько париетальных слоев. Тетрада мегаспор линейная.
Зародышевый мешок образуется из халазальной мегаспоры по Polygonum-
типу. У /. pseudacorus и /. tenax синергиды имеют нитчатый аппарат, их микро-
пилярный конец заужен, глубоко вдается в канал микропиле (Rudall et al.,
1984). У /. japonica, S. calif or nicum и 5. striatum синергиды изогнуты в виде
крючка. Полярные ядра /. pseudacorus и С. sieberi сливаются перед
оплодотворением в халазальном конце зародышевого мешка. Антиподы у /. pseudacorus
и С. sieberi крупные и сохраняются на ранних стадиях эмбриогенеза. У видов
Crocus обычно 3 антиподы, но довольно часто встречается увеличение их числа
и размеров: так, в нескольких случаях обнаружено до 8 очень крупных антипод.
У Iris chamaeiris после оплодотворения также наблюдается увеличение
количества антипод. У Sisyrinchium anceps антиподы отсутствуют (Haeckel, 1930).
У Iris fulva и /. hexagona var. giganticoerulea синергиды и антиподы начинают
дегенерировать до оплодотворения, у Crocus speciosus — после оплодотворения.
У /. pseudacorus установлена определенная зависимость фаз развития заро-
9*
131
Iridaceae (продолжение)
20—26—развитие зародышевого мешка;
дыша от времени с начала цветения. Цветок /. pseudacorusw цветет 3 сут, на 4-е
происходит его увядание, и в это время в семяпочке наблюдаются зрелые
зародышевые мешки. Оплодотворение порогамное. Зигота образуется на 5-е сутки
132
Iridaceae (продолжение)
27— зрелый зародышевый мешок; 28—30— развитие зародышевого мешка; 31— антиподы;
32 — зрелый зародыш. {1—12, 15—27 — по Шпилевому, 1980, 1985; 13, 14 — по Sawyer, 1917; 28—
31 — по Ferraris, 1902; 32 — по Guignard, 1962).
от начала цветения, деление ее происходит на 8-е сутки. Первая перегородка
закладывается перпендикулярно ее оси. Синергиды в это время деформируются
и постепенно разрушаются.
Эндосперм нуклеарный. У /. tenax деление первичного ядра эндосперма
происходит примерно через 70 ч после оплодотворения. У /. pseudacorus на 6-е
сутки от начала цветения наблюдаются 2—4 ядра эндосперма, на 8-е — 20—
24 ядра. Ядра эндосперма делятся синхронно. Самые крупные ядра находятся
в районе гипостазы. Клеткообразование у /. pseudacorus начинается от
микропиле на 25-е сутки от начала цветения на стадии глобулярного зародыша.
Клеткообразование происходит в волне делений в поздней телофазе митоза.
После клеткообразования большинство клеток оказываются одноядерными.
Иногда образуются многоядерные клетки; это результат того, что между
некоторыми несестринскими ядрами не закладываются клеточные пластинки.
У /. pseudacorus и Iris pumila на стадии интерфазы обнаружены случаи, когда
в одном и том же эндосперме имеются свободноядерные и клеточные зоны.
При переходе от свободноядерной к клеточной стадии развития в эндосперме
/. pseudacorus отмечены некоторые особенности механизма клеткообразования
133
в его халазальной и субхалазальной зонах (Olszewska, Gabara, 1966). В
зрелом семени в стенках клеток эндосперма /. germanica, I. pallida и /. pseudacorus
обнаружена гем и целлюлоз а. Во время развития зародыша у /. pseudacorus
эндосперм дифференцируется на 2 полюса: микропилярный и халазальный.
На халазальном полюсе в начале развития эндосперма белков в 2 раза больше,
чем на микропилярном, при последующем развитии эндосперма увеличивается
количество белков на микропилярном полюсе. Наличие большого количества
РНК в микропилярной части связано, вероятно, с формированием зародыша.
Эмбриогенез у /. pseudacorus соответствует Asterad-типу Muscari-вариации
(Guignard, 1962), у Crocus vernus — Caryophyllad-типу Sagittaria-вариации
(Johansen, 1950). На ранних стадиях развития зародыша у /. pseudacorus
в месте его прикрепления обнаружена каллоза, в клетках зародыша очень
много крахмала, на более поздних стадиях каллоза исчезает, не наблюдается
и крахмал. Появление каллозы и крахмала и последующее их исчезновение
тесно связаны, возможно, с регуляцией питания зародыша (Соколовская,
Яковлев, 1973; Яковлев, Соколовская, 1978). У I.pseudacorus на 10-е сутки от
начала цветения зародыш 2-клеточный, на 15-е — 4-клеточный, на 25-е —
глобулярный зародыш с четко выраженной эмбриодермой, на 32-е — намечается
место заложения почечки, на 60-е — зародыш зрелый и состоит из
зародышевого корня, семядоли и почечки. Лейкоэмбриофиты, Tritonia crocosmifolia —
хлороэмбриофит (Яковлев, Жукова, 1973, 1980).
Одна из синергид у /. pseudacorus и /. sibirica иногда функционирует как
вторая яйцеклетка и тогда образуются 2 зародыша (Dodel, 1891;
Каракозова, 1963).
Исследованные виды. Belamcanda chinesis, Crocus sativus, С. sie-
beri, С. speciosus, С. vernus, Eleutherine plicata, Gladiolus X hybridus,
Iridodictyum reticulatum, Iris chamaeiris, I. fulva, I. germanica, I. hexagona var.
giganticoerulea, I. japonica, I. munzii, I. primula, I. pseudacorus, I. pumila,
I. sambucina, I. sibirica, I. versicolor, Romulea bulbocodium, R. columnae, R. rosea
var. reflexa, Sisyrinchium anceps, S. californium, S. striatum, Tritonia
crocosmifolia.
Литература. Hofmeister, 1849, 1858a, 1858b, 1861; Schacht, 1858;
Fleischer, 1874; Vesque, 1878, 1879a, 1879b; Elfving, 1879; Jonsson, 1879—1880;
Strasburgea, 1879, 1884; Guignard, 1882, 1915a, 1915b; Soltwedel, 1882; Herail,
1889; Westmaier, 1890,1897; Dodel, 1891; Hubert, 1896; Berg, 1898; Koerniche
(Kornicke), 1901a, 1901b; Ferraris, 1902; Lotscher, 1905; Habermann, 1906; Juel,
1915; Sawyer, 1917; Farr, 1922; Himmelbaur, 1926; Haeckel, 1930; Jungers, 1931;
Schnarf, 1931; Simonet, 1932, 1934; Jasui, Sawada, 1940; Riley, 1942; Johansen,
1950; Родионенко, 1956; Lenz, 1956; Wunderlich, 1959; Guignard, 1962;
Каракозова, 1963; Кордюм, 1963; Olszewska, Gabara, 1966; Gorska-Brylass, 1967;
Mikulska, Gabara, Olszewska, 1967; Rodkiewicz, 1968a, 1968b; Lakshmanan,
Philip, 1971; Konopska, 1972; Бурова, 1973; Gupta, Nanda, 1973; Соколовская,
Яковлев, 1973; Steyn, 1973a, 1973b; Яковлев, Жукова, 1973, 1980; Kapil, 1974;
Simoncioli, 1974; Соколов, Гераськова, 1974;; Соколов, Петров, Крамаренко, 1974;
Nanda, Gupta, 1975; Соколов, Бондаренко, 1975; Соколов, 1976, 1977, 1982, 1983;
Яковлев, Соколовская, 1978; Соколов, Романов, Аминов, 1980; Venkateswarlu
1980; Шпильовий, 1980, 1985; Pande, Singh, 1981; Гамбарова, 1984; Rudalf,
Owens, Kenton, 1984; Шпилевой, Литвиненко,1984; Соколовская, 1985, ориг.
данные.
Семейство HAEMODORACEAE
Пыльник 4-гнездный. Сформированная по типу однодольных стенка гнезда
пыльника состоит из эпидермиса, эндотеция, 2—3 средних слоев и 1—2 слоев
тапетума. Тапетум периплазмодиального типа. Первоначально он клеточный,
клетки его 1—2-ядерные, начиная со стадии профазы мейоза происходит
заметное разрастание клеток тапетума, усиление вакуолизации их цитоплазмы,
затем лизис их оболочек. На стадии тетрад микроспор слившиеся протопласты
клеток тапетума образуют выросты в полость гнезд пыльника, заполняя
134
Haemodoraceae
1—11 — Anigozanthos flavidus, 12—17 — Dilatris pillansii
1 — продольный срез пыльника на стадии профазы микроспороцитов; 2,3 — стенка пыльника, пери-
плазмодиальный тапетум, молодые микроспоры; 4 — стенка пыльника, микроспора;
все свободное пространство. На стадии одноядерных микроспор цитоплазма
периплазмодиального тапетума приобретает рыхлый вид, в ней хаотично
разбросаны ядра, а на более поздних стадиях от периплазмодиального
тапетума не остается следов. Такое развитие тапетумаа было прослежено у
Anigozanthos flavidus, Dilatris pillansii, Wachendorfia paniculata, Lachnanthes
caroliniana и Xiphidium. Эндотеций имеет фиброзные утолщения и может быть
2-слойным. Фиброзные утолщения могут наблюдаться и в наружном среднем
слое. Эпидермальные клетки имеют утолщенную наружную кутикулу. Тип
образования тетрад микроспор сукцессивный. Тетрады микроспор
тетраэдральные или изобилатеральные. Зрелые пыльцевые зерна 2-клеточные.
Семяпочка ортотропная (Conostylis, Dilatris, Xiphidium), анатропная
(Lachnanthes) или гемитропная (Anigozanthos, Haemodorum, Wachendorfia),
крассинуцеллятная, с 2 интегументами. Оба интегумента 2-слойные. В области
микропиле внутренний интегумент многослойный. Микропиле, как правило,
образовано внутренним интегументом, у A. flavidus — обоими интегументами.
Отмечается наличие интегументального тапетума. У A. flavidus в образовании
интегументального тапетума участвуют оба слоя клеток внутреннего
интегумента. Нуцеллус в микропилярной части развит слабее по сравнению с более
массивной халазальной частью. У большинства изученных родов отмечается
присутствие нуцеллярного колпачка, который состоит из 2 или большего числа
клеток, но у A. flavidus он отсутствует. У D. pillansii описано увеличение
135
Haemodoraceae (продолжение)
5 — тетрада мегаспор, формирование из халазальной мегаспоры 2-ядерного зародышевого мешка;
6 — 2-ядерный зародышевый мешок; 7 — 4-ядерный зародышевый мешок; 8 — 7-клеточный
зародышевый мешок;
эпидермальных клеток нуцеллуса в его основании, где они приобретают
«палисадный вид». У A. flavidus сильно развита ткань нуцеллуса в районе
халазы, образующая постамент. У L. caroliniana боковые эпидермальные клетки
нуцеллуса радиально удлиняются, а в основании нуцеллуса образуется
гипостаза. Широкий сосудистый пучок, состоящий из большого числа
лестничных трахеид, проходит в халазу, где сильно разветвляется, но не дает
ответвлений в интегументы. Археспорий одноклеточный. У A. flavidus в единичных
случаях наблюдается 2-клеточный археспорий. При делении археспориальнои
клетки образуются первичная париетальная и спорогенная клетки. Из первичной
париетальной клетки путем периклинальных и антиклинальных делений
формируется париетальная ткань, состоящая из 2—5 слоев клеток. В результате
мейоза в мегаспороците образуется линейная или Т-образная тетрада
мегаспор. Функционирующей становится халазальная мегаспора. У A. flavidus
и W. paniculata деления ядер наблюдаются и в других клетках тетрады, но
перевес в развитии получает халазальная мегаспора.
Зародышевый мешок формируется по Polygonum-типу. В сформированном
зародышевом мешке синергиды имеют нитчатый аппарат и зубовидные вы-
136
Haemodoraceae (продолжение)
9, 10 — продольный срез семяпочки: 9а — яйцевой аппарат, 96 — 2 антиподы и халазальный район
семяпочки, 10а — синергиды, 106 — 2 полярных ядра центральной клетки и антиподы; // —
продольный срез через семя на шаровидной стадии зародыша, клетки, образовавшиеся из базальной
клетки эндосперма;
росты. Полярные ядра располагаются вблизи антипод, слияние их наблюдается
сравнительно рано. Антиподы A. flavidus находятся в прямом контакте с
постаментом. Это крупные клетки, отличающиеся от других клеток зародышевого
мешка своими размерами, выростами в ткань нуцеллуса и сильно хроматизо-
ванными ядрами. У большинства родов они рано дегенерируют, но у D. pil-
lansii они присутствуют до стадии образования эндоспермального гаустория.
Образование эндосперма происходит по гелобиальному типу. Образуется
крупная микропилярная и маленькая халазальная камеры. Из последней путем
серии делений образуются 4 клетки, которые преобразуются в эндоспермальный
гаусторий. У A. flavidus отмечена большая складчатость оболочек клеток
эндоспермального гаустория. В микропилярной камере эндосперма в резуль-
137
тате многочисленных делений образуется большое количество ядер. Цитокинез
происходит позднее и распространяется от основания зародышевого мешка
к его вершине. В зрелом семени эндосперм обильный, руминированный,
богат жирами, белком и крахмалом.
Эмбриогенез Asterad- или Onagrad-типа. У D. pillansii деление зиготы
поперечное, за ним следует продольное деление в апикальной клетке и поперечное
деление в базальной клетке. Клетки, производные срединной клетки 4-клеточного
проэмбрио, также участвуют в образовании зародыша. Суспензор, производное
базальной клетки, короткий, 3—4-клеточный. У W. paniculata суспензор состоит
из 1—2 рядов клеток, более раннее развитие не прослежено. В зрелом семени
у D. pillansii зародыш не дифференцирован на органы, тогда как у W.
paniculata он дифференцирован на терминальную семядолю, точку роста и
сохраняющийся прямой короткий суспензор. У D. pillansii суспензор изогнут.
Исследованные роды и виды. Anigozanthos flavidus* Conostylis
dealbata, Dilatris pillansii, Haemodorum, Lachnanthes caroliniana, Wachendor-
fia paniculata, Xiphidium.
Литература. Schnizlein, 1860; Schulze, 1893; Sussenguth, 1921; Stenar,
1925, 1927, 1938; Pax, 1930; Dellert, 1933; De Vos, 1956, 1961, 1963; Green, 1960;
Dutt, 1970; Немирович-Данченко, 1983; Zavada, et al., 1983; Simpson, 1988;
Алимова, ориг. данные.
Семейство HYPOXIDACEAE
Пыльник 4-гнездный. Сформированная стенка гнезда пыльника состоит из
эпидермиса, эндотеция, в котором развиваются фиброзные утолщения, 2—4
средних слоев и тапетума. У Curculigo фиброзные утолщения наблюдаются
в наружном среднем слое зрелого пыльника. Во время мейоза микроспороцитов
в клетках тапетума у Сатрупета, Curculigo и Hypoxis наблюдается много
ядер, позднее, когда образуются тетрады микроспор, выявляется
периплазмодий. Он наиболее хорошо выражен на стадии отделившихся друг от друга
микроспор и исчезает к моменту заполнения пыльцевых зерен запасными пита-
* Материал собран в оранжерее БИН АН СССР (Ленинград).
138
Hypoxidaceae Hfl
1—10 — Campynema lineare, 11—14 — Curculigo recurvata, 15—25 — Pauridia minuta
1 — фрагмент гнезда пыльника с микроспороцитами; 2, 3 — изобилатеральная и тетраэдральная
тетрады; 4 — 2-клеточное пыльцевое зерно; 5 — часть зрелого пыльника, видны эпидермис и эндо-
теций; 6 — семяпочка, содержащая мегаспороцит и первичную париетальную клетку; 7 — клетки
диады, мейоз II; 8 — Т-образная тетрада мегаспор; 9 — зрелый зародышевый мешок; 10 —
семяпочка на этой стадии, микропиле образовано только внутренним интегументом; // — фрагмент
гнезда зрелого пыльника с 2-клеточной пыльцой; 12 — семяпочка с 2 мегаспороцитами; 13 — 4-ядер-
ный зародышевый мешок; 14 — микропилярная часть зрелого зародышевого мешка, в синергидах
хорошо виден нитчатый аппарат и крючковидные выросты, 14а — халазальная часть зрелого
зародышевого мешка, видны антиподы и расположенное рядом с ними ядро центральной клетки;
Hypoxidaceae (продолжение)
15— мегаспороцит; 16— увеличенная халазальная мегаспора; 17—19 — этапы развития
зародышевого мешка; 20—25 — эмбриогенез. (/—10 — по Dutt, 1970; 11—14 — ориг.; 15—25 — по Vos de,
1949).
тельными веществами. У Сатрупета описан тапетум секреторного типа.
Образование микроспор сукцессивное. Тетрады — изобилатеральные или
тетраэдральные. Пыльцевые зерна 2-клеточные.
Семяпочка анатропная (Hypoxis, Curculigo), гемитропная (у некоторых
Pauridia, Forbesia) или кампилотропная (Forbesia), с 2 интегументами, красси-
нуцеллятная (Hypoxis aurea, Сатрупета) или тенуинуцеллятная (Curculigo
recurvata, Hypoxis decumbens). Микропиле образовано обоими интегументами,
имеет слабозигзагообразную форму. Архе'спориальная клетка у большинства
видов дифференцируется непосредственно в мегаспороцит, но у отдельных
представителей (Сатрупета) она отделяет париетальную клетку, которая
в свою очередь делится антиклинально: производные париетальной клетки
иногда могут делиться периклинально. У lanthe aquatica отмечено образование
2-слойного нуцеллярного колпачка. У этого вида наблюдается образование
в семяпочке 2 мегаспороцитов. Аналогичные данные получены нами при
изучении С. recurvata. В результате деления мегаспороцита образуются Т-образная
или линейная тетрады мегаспор. В зародышевый мешок развивается
халазальная мегаспора.
Зародышевый мешок обычно моноспорический, развивается по Polygonum-
типу. У Forbesia описан биспорический Allium-тип зародышевого мешка. Зрелый
зародышевый мешок состоит из яйцеклетки, 2 синергид, 3 антиподальных
клеток и центральной клетки с полярными ядрами или ее вторичным ядром.
У Pauridia minuta во всех клетках зародышевого мешка кроме яйцеклетки
наблюдается наличие крахмальных зерен. В синергидах у Н. decumbens
отсутствует нитчатый аппарат, у С. recurvata нитчатый аппарат в синергидах
хорошо выражен, у них наблюдаются также крючковидные выросты. Клетки
антипод дегенерируют до оплодотворения или могут существовать в течение
некоторого времени после оплодотворения. У /. aquatica поведение
антиподальных клеток изменчиво: в большинстве случаев они существуют в течение
некоторого времени после оплодотворения; иногда наблюдаются до тех пор, пока
эндосперм не заполнит центральную клетку; в некоторых случаях они
дегенерируют вскоре после оплодотворения. Наблюдалось большое число
зародышевых мешков, в которых антиподы делились. Оплодотворение порогамное.
140
Эндосперм нуклеарный (ряд видов lanthe, Pauridia) или гелобиальный
(Curculigo, Hypoxis, lanthe schlechteri). Халазальная клетка гелобиального
эндосперма проявляет признаки гаустория. У видов lanthe после деления
первичного ядра эндосперма образуется большое число (до 200—300) ядер эндосперма,
расположенных в тяже цитоплазмы вдоль стенки зародышевого мешка,
центральную часть которого занимает большая вакуоль. Во многих семяпочках
встречаются гипертрофированные и лопастные ядра эндосперма. У видов
lanthe клеткообразование в эндосперме начинается, когда в зародыше
насчитывается до 32 ядер. У P. minuta образование клеток в эндосперме
происходит по достижении в нем 130—150 ядер; в клетках наблюдается большое
количество белков и жиров. Ход развития гелобиального эндосперма у видов
Curculigo и Hypoxis различен: у представителей рода Curculigo после
образования крупной микропилярной и небольшой халазальной камер более быстрые
темпы деления ядер наблюдаются в микропилярной камере, и в ней же раньше
начинается клеткообразование, которое позднее осуществляется и в
халазальной камере. У представителей Hypoxis ценоцитная халазальная камера
эндосперма в конечном итоге, не переходя к образованию клеток, дегенерирует.
Развитие зародыша происходит по Asterad-типу. Деление зиготы
поперечное, далее базальная клетка делится поперечной, а апикальная — продольной
перегородками. На более поздних стадиях образуется короткий подвесок.
Зародыш в зрелом семени не дифференцирован на органы.
Исследованные виды. Сатрупета lineare, Curculigo crassifolia,
С. recurvata, Forbesia plicata, Hypoxis aurea, H. decumbens, H. villosa, lanthe
alba, I. aquatica, I. minuta, I. schlechteri, Pauridia minuta.
Литература. Palm, 1920; Stenar, 1924,, 1925; Schnarf, 1931; Dellert,
1933; Vos, 1948, 1949, 1956, 1961; Johansen, 1950; Davis, 1966; Тахтаджян, 1966;
Arekal, 1967; Dutt, 1970; Поддубная-Арнольди, 1982; Dahlgren, An-ming Lu,
1985; Савина, Жинкина, ориг. данные.
Семейство VELLOZIACEAE
Пыльник 4-гнездный; гнезда объединены в 2 теки. Сформированная стенка
гнезда пыльника состоит из эпидермиса, 1—2 слоев эндотеция, 2—3 средних
слоев и тапетума. Средние слои эфемерны. По данным Стенара (Stenar, 1925),
тапетум клеточный, одноядерный и не образует периплазмодия. По нашим
данным, в пыльниках Vellozia elegans на стадии профазы мейоза I в клетках
тапетума наблюдаются деления ядер, которые могут сопровождаться цитокинезом,
что приводит к образованию нерегулярно 2-слойного тапетума. На стадии диады
происходит нарушение целостности клеток тапетума, растворение их клеточных
оболочек и сильная вакуолизация цитоплазмы, в результате чего образуется
тапетальный периплазмодий, внедряющийся в полость гнезда пыльника. Таким
образом, у V. elegans тапетум периплазмодиального типа. Стенка зрелого
пыльника представлена эпидермисом и 1—2 слоями фиброзного эндотеция.
Фиброзные утолщения наблюдаются и в клетках связника. Тетрады микроспор
образуются по сукцессивному типу. Тетрады микроспор тетраэдральные, изобилате-
ральные и крестообразные. Зрелое пыльцевое зерно 2-клеточное.
Генеративная клетка имеет вытянутую форму. У V. compacta пыльца объединена
в тетрады.
Семяпочка анатропная, с 2 интегументами, тенуинуцеллятная. Наружный
интегумент 2—3-слойный, внутренний — 2-слойный. По типу интегументального
тапетума дифференцируются оба слоя внутреннего интегумента. Микропиле
образовано внутренним интегументом. Отмечается наличие фуникулярного
обтуратора. Археспорий одноклеточный. Археспориальная клетка
дифференцируется в мегаспороцит без отделения париетальной клетки. Мегаспороцит,
делясь, образует линейную или Т-образную тетраду мегаспор.
Функционирующей, как правило, становится халазальная мегаспора, хотя возможно деление
ядер и в других мегаспорах тетрады. У V. elegans на 4-ядерной стадии
встречались аномальные зародышевые мешки, в цитоплазме микропилярного конца
которых располагались 3 ядра, а на халазальном конце — одно ядро.
141
Velloziaceae
1—20 — Vellozia elegans
1,2 — сформированная стенка пыльника и микроспороциты; 3,4 — образование тапетального
периплазмодия на стадии диады и тетрады микроспор; 5 — образование диады; 6 — тетрады микроспор;
7 — стенка пыльника на стадии 2-клеточного пыльцевого зерна; 8 — зрелое пыльцевое зерно;
Зародышевый мешок развивается по Polygonum-типу. Синергиды не имеют
нитчатого аппарата. Наблюдается пролиферация синергид. Полярные ядра
располагаются в центре или в нижней половине центральной клетки
зародышевого мешка и сливаются перед оплодотворением. Антиподы или рано
дегенерируют, или после оплодотворения начинают разрастаться и образуют гаусто-
риальную ткань, клетки которой многоядерны.
142
Velloziaceae (продолжение)
9, 10 — семяпочка на стадии мегаспороцита; // — диада клеток; 12 — линейная тетрада мегаспор;
13, 14 — 2-ядерные мегаспоры в тетраде; 15, 16 — 4-ядерный зародышевый мешок; 17, 18 —
аномальные 4-ядерные зародышевые мешки; 19 — 2-слойный интегументальный тапетум на стадии
зрелого зародышевого мешка; 20 — семяпочка на стадии зрелого зародышевого мешка. (1—8, 10,
15—18 — ориг.; 9, 11—14, 19, 20 — по Stenar, 1925).
Эндосперм нуклеарный. В зрелом семени он обильный, состоит из
тонкостенных изодиаметрических клеток, содержащих крахмал. В периферическом
слое эндосперма отмечаются белки и жиры. Эндосперм семян V. flavlcans
лишен крахмала и представлен толстостенными клетками, вытянутыми в длину.
Эмбриогенез не изучен. Зародыш зрелого семени небольшой,
цилиндрический или удлиненно-яйцевидный, дифференцированный.
Исследованные виды. Barbacenla fragrans, Vellozla caespltata,
V. compacta, V. elegans, V. flavescens, V. flavlcans, V. glauca, Xerophyta squar-
rosa.
Литература. Sussenguth, 1919; Stenar, 1925a, 1925b; Netolitzky, 1926;
Pax, 1930; Schnarf, 1931; Boyd, 1932—1935; Davis, 1966; Тахтаджян, 1966,
1980; Dutt, 1967, 1970; Huber, 1969; Ayensu, Skvarla, 1974; Menezes, 1976;
Поддубная-Арнольди, 1982; Немирович-Данченко, 1985; Алимова, ориг. данные.
143
Семейство PONTEDERIACEAE
Пыльник 4-гнездный. Формирование стенки гнезда пыльника не прослежено.
У Eichhornia crassipes сформированная стенка гнезда пыльника состоит из
эпидермиса, эндотеция, 3 средних слоев и тапетума (Smith, 1898). Средние слои
эфемерны, их дегенерация начинается со слоя, примыкающего к тапетуму.
В эндотеции развиваются фиброзные утолщения. У Monochoria hastaefolia
клетки тапетума становятся 2-ядерными к профазе мейоза в микроспороцитах
(Banerji, Haldar, 1942). В дальнейшем, в мейозе, оболочки между клетками
тапетума исчезают и их содержимое заполняет пыльцевое гнездо, что
свидетельствует о формировании периплазмодиального тапетума. У Pontederia cordata
(ориг.) стенка пыльника перед вскрыванием представлена эпидермисом, эндоте-
цием с фиброзными утолщениями и остатками средних слоев. Тетраэдральные,
изобилатеральные, редко — крестообразные тетрады микроспор формируются
сукцессивно. Зрелые пыльцевые зерна 2-клеточные. У М. hastaefolia
генеративная клетка имеет серповидную форму.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная.
Микропиле образовано обоими интегументами. У Е. crassipes и М.
hastaefolia оба интегумента 2-слойные, но в микропилярной части они более мощные.
Археспорий одноклеточный, отделяет париетальную клетку, из которой
в дальнейшем формируется единственный париетальный слой, разрушающийся
во время развития зародышевого мешка. У P. cordata (Smith, 1898) отмечены
случаи значительного разрастания париетальных клеток и эпидермиса нуцел-
луса в длину. У Monochoria (Ono, 1928) клетки нуцеллуса в основании
зародышевого мешка заполняются запасными веществами. Тетрада мегаспор
линейная, у Heteranthera limosa иногда Т-образная, а у Е. crassipes перегородка
в микропилярной клетке диады может закладываться наклонно.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. Яйцевой аппарат типичного строения. Яйцеклетка небольших размеров.
Синергиды грушевидные, с отчетливо выраженным нитчатым аппаратом.
Антиподы у большинства видов — 3 небольшие одноядерные клетки, однако
у М. hastaefolia образования клеточных перегородок при формировании
антипод-не происходит. Дезорганизация антипод начинается либо после слияния
полярных ядер (Eichhornia), либо после первого деления в эндосперме
(Heteranthera, Monochoria, Pontederia). Остатки антипод в виде темноокра-
шенных сгустков различаются на разных стадиях развития эндосперма.
Зрелый зародышевый мешок расширен в микропилярной части и
постепенно сужается к халазе. У М. hastaefolia он достигает 30.4 мкм в длину.
Слияние полярных ядер происходит до оплодотворения. Двойное оплодотворение
наблюдали у Monochoria (Ono, 1928).
Эндосперм развивается по гелобиальному типу. В результате первого
деления образуются 2 клетки-камеры: крупная микропилярная и небольшая
халазальная. В дальнейшем в этих клетках происходит ряд свободноядерных
делений. У Heteranthera и Pontederia в халазальной камере вслед за свободно-
ядерными делениями обычно следует клеткообразование. У Heteranthera клетки,
возникшие в халазальной камере, одноядерные, а у Pontederia они изначально
многоядерные, причем ядра в дальнейшем могут сливаться. У Monochoria
в халазальной камере образование перегородок между ядрами не происходит
и халазальный ценоцит содержит от 4 до 8 ядер. В микропилярной камере
клеткообразование, как правило, происходит раньше, чем в халазальной, оно
начинается с микропилярного и постепенно распространяется к халазальному
Pontederiaceae
1 4—8, 18 — Eichhornia crassipes, 2, 9—14, 16, 17, 19, 20, 25, 26, 31, 32 — Monochoria hastaefolia,
St 3a, 24 — Pontederia cordata, 15, 21—23, 27, 28, 33—35 — Monochoria korsakowii, 29, 30 — M.
vaginalis.
I _ фрагмент сформированной стенки гнезда пыльника, микроспороциты вступают в мейоз
(поперечный срез); 2 — периплазмодиальный тапетум и тетрады микроспор (продольный срез);
3 фрагмента стенки гнезда пыльника перед вскрыванием; За — схема строения пыльника на
поперечном срезе; 4—6 — некоторые стадии микроспорогенеза; 7,8 — тетрады микроспор; 9 — зрелое
пыльцевое зерно; 10—13 — фрагмент пыльцевой трубки и некоторые стадии образования спермиев; 14—
/7 — мегаспорогенез; 18, 19 — 2-ядерный (18) и 4-ядерный (19) зародышевые мешки; 20, 21 —
зрелые зародышевые мешки; 22 — микропилярная часть семяпочки и зрелый зародышевый мешок;
144
10 Зак. 2144
145
23 — оплодотворение; 24 — схема строения семяпочки на стадии оплодотворения; 25—30 —
некоторые стадии развития эндосперма; 31—33 — некоторые стадии развития зародыша; 34, 35 —
схемы строения зародыша и эндосперма на завершающих стадиях развития. (/, 4—8, 18, 24 — по
Smith, 1898; 2, 9—14, 16,17, 19, 20, 25, 26, 31, 32 — по Banerji, Haldar, 1942; 15, 21—23, 27—30, 33—
35 — по Опо, 1928; 3, За — ориг.).
полюсу. Клетки халазальной камеры густоплазменные, у Pontederia они имеют
более толстые стенки, чем клетки микропилярной камеры (Coker, 1907).
У Monochoria на свободноядерной стадии развития эндосперма из
микропилярной камеры формируются 2 латеральных гаусториальных выроста, которые
растут в направлении халазы, разрушая при этом окружающие клетки нуцел-
луса. В терминальной части гаусториев в плотной цитоплазме находятся ядра.
146
Перед делением зиготы гаустории достигают верхней границы халазальной
камеры. В дальнейшем латеральные гаустории, а также халазальная камера
эндосперма дегенерируют и в зрелом семени эндосперм состоит из производных
центральной зоны микропилярной камеры. В зрелом семени эндосперм
обильный, с хорошо выраженным алейроновым слоем. Крупные клетки эндосперма
заполнены крахмалом.
Эмбриогенез изучен слабо, у Pontederia и Monochoria в соответствии
с ранними стадиями он отнесен к Asterad-типу (Johansen, 1950). У Pontederia
подвесок более развит, чем у Monochoria. Зародыш в зрелом семени прямой,
цилиндрический, у Е. crassipes — с хорошо развитой семядолей и меристемой
эпикотиля.
Исследованные виды. Eichhornia crassipes, Heteranthera dubia,
H. graminea, H. limosa, H. reniformis, Monochoria hastaefolia, M. korsakowii,
M. vaginalis, Pontederia cor data.
Литература. Hofmeister, 1858, 1859; Arcangeli, 1897; Smith, 1898,
1908; Coker, 1907; Wylie, 1917; Palm, 1920; Schurhoff, 1922; Ono, 1928; Juliano,
1931; Banerji, Gangulee, 1937; Banerji, Haldar, 1942; Анисимова, ориг. данные.
Семейство PHILYDRACEAE
Пыльник 4-гнездный. Тип развития стенки гнезда пыльника не установлен.
Сформированная стенка состоит из эпидермиса, эндотеция, 2—3—4 средних
слоев и тапетума. В эндотеции развиваются фиброзные утолщения. Средние
слои эфемерны. Тапетум секреторный, нерегулярно 2-слойный, перед мейозом
его клетки становятся 2-ядерными. Впоследствии протопласты клеток тапетума
дегенерируют, что сопровождается выделением из них продуктов дегенерации,
которые полностью окружают микроспоры (Kapil, Walia, 1965). Образование
тетраэдральных, изобилатеральных, реже — крестообразных тетрад микроспор
происходит сукцессивно. У Philydrum lanuginosum иногда 1—3 микроспоры
в тетраде дегенерируют и функционирующей остается лишь одна. Зрелые
пыльцевые зерна 2-клеточные, у P. lanuginosum они объединены в тетрады.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Оба инте-
гумента 2-слойные, микропиле образовано внутренним интегументом. Имеется
гипостаза. В фуникулусе образуется схизогенная полость. Проводящий пучок
хорошо развит и доходит до халазы, не входя в нее. Археспорий одно-, редко —
2-клеточный; преобразование в мегаспороцит происходит с отделением
париетальной клетки, из которой в дальнейшем формируется париетальная ткань.
Тетрады мегаспор линейные, Т-образные, иногда перегородка в микропилярной
клетке диады закладывается наклонно.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. Синергиды с крючковидными выростами. 3 одноядерные антиподы
дегенерируют вскоре после деления ядра первичной клетки эндосперма. Полярные
ядра сливаются до оплодотворения вблизи антипод. У P. lanuginosum
наблюдали порогамию и двойное оплодотворение.
Эндосперм развивается по гелобиальному типу. Халазальная клетка либо
одноядерная, либо в ней образуется 2—6 ядер, между которыми позднее
закладываются перегородки. Активность клеток халазальной части эндосперма
постепенно снижается и они дегенерируют. В микропилярной клетке сначала
идут свободноядерные деления, а затем происходит формирование клеток,
причем клеткообразование начинается с халазального конца микропилярного
ценоцита. Эндосперм становится полностью клеточным, когда зародыш
достигает глобулярной стадии развития. Клетки эндосперма содержат в зрелом
семени крахмал и жиры.
Эмбриогенез Onagrad-типа либо Philydrum-, либо Juncus-вариации (Kapil,
Walia, 1965). Суспензор 2-клеточный. Зародыш в зрелом семени
дифференцирован на семядолю, апекс побега, зародышевый корень с чехликом. Клетки
зрелого зародыша содержат жиры.
10* 147
/—31 — Philydrum lanuginosum
1 — поперечный срез гнезда пыльника: сформированная стенка пыльника, клетки тапетума 1 —
2-ядерные, микроспороциты; 2 — общий вид тычинки со спирально закрученным пыльником;
2а — тычинка с абаксиальной стороны, пыльник вскрылся; 3 — стенка зрелого пыльника; За —
схема поперечного среза пыльника на стадии вскрывания; 4—8 — микроспорогенез; 9 — зрелые
2-клеточные пыльцевые зерна в тетрадах; 10—13 — мегаспорогенез; 14—16 — развитие
зародышевого мешка; 16а — схема строения семяпочки на стадии зрелого зародышевого мешка; 17—20 —
некоторые стадии развития эндосперма;
28 29
Philydraceae (продолжение)
21—31 — стадии эмбриогенеза. (/—31 — по Kapil, Walia, 1965).
Исследованный вид. Philydrum lanuginosum.
Литература. Hamann, 1962, 1963;. Kapil, Walia, 1965; Kapil, 1967.
Порядок 5. SMI LAC ALES
Семейство PHILESIACEAE
Пыльник Luzuriaga latifolia 4-гнездный. В эндотеции развиваются
фиброзные утолщения, количество средних слоев неизвестно, тапетум,
вероятно, секреторный, его клетки во многих случаях 2-ядерные. Тетрады
микроспор образуются по сукцессивному типу. Зрелые пыльцевые зерна 2-клеточ-
ные.
Семяпочка анатропная (Lapageria rosea, L. latifolia), y Eustrephus latifo-
lius — с тенденцией к кампилотропности (Huber, 1969), с 2 интегументами,
крассинуцеллятная. Микропиле образовано внутренним интегументом,
который состоит из 2 слоев. Наружный интегумент 3—4-слойный. Археспорий
одноклеточный. Археспориальная клетка отделяет париетальную клетку,
которая образует 2 париетальных слоя. ч
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. Синергиды грушевидной формы, полярные ядра сливаются перед
оплодотворением вблизи яйцевого аппарата, в центре зародышевого мешка или
вблизи антипод. Антиподы — 3 крупные клетки.
Эндоспермогенез и эмбриогенез не исследованы. В зрелом семени эндосперм
обильный, зародыш маленький, прямой или слегка изогнутый. Эндосперм
содержит жиры, резервную гемицеллюлозу (кроме Geitonoplesium cymosum).
Зародыш хорошо развит, как правило, массивный, прямой, со всех сторон
окружен эндоспермом. У Behnia, Lapageria и Luzuriaga зародыш занимает
от половины до 4/5 длины семени. У Geitonoplesium зародыш изогнут,
составляет свыше 3/4 длины семени; еще более изогнут зародыш у
Eustrephus.
Исследованные виды. Eustrephus latifolius, Geitonoplesium
cymosum, Lapageria rosea, Luzuriaga latifolia.
Литература. Palm, 1920; Stenar, 1925, 1952; Huber, 1969; Федотова,
1985.
150
Семейство STEMONACEAE
Пыльник не исследован.
Семяпочка анатропная или ортотропная, у рода Croomia гемитропная,
с 2 интегументами, крассинуцеллятная. Наружный интегумент состоит из 2—3
и большего числа слоев; внутренний интегумент — из 2 слоев. Число слоев
может увеличиваться по направлению к микропиле и к халазе.
Развитие зародышевого мешка и эндосперма не исследовано. В зрелом
семени эндосперм обильный. Запасные вещества: белки, жиры и в небольшом
количестве крахмал. В эндосперме С. pausiflora много крахмала; он
наблюдается почти во всех слоях, кроме наружного.
Эмбриогенез не исследован. В зрелом семени зародыш обычно маленький,
прямой. У Croomia и Stemona он длиной около 0.5 мм, а у S. tuberosa занимает
3/4 объема семени.
Исследованные виды. Croomia pausiflora, Stemona tuberosa.
Литература. Gray, 1859; Федотова, 1985.
Семейство TRILLIACEAE
Пыльники 4-гнездные. Сформированная стенка гнезда пыльника 4—5-слой-
ная. Эндотеций с фиброзными утолщениями. Тапетум секреторный, к началу
мейоза в микроспороцитах его клетки становятся 2-ядерными. Средний слой
(слои) эфемерный. Образование тетрад микроспор происходит по сукцессив-
ному типу. Микроспорогенез без отклонений от нормы. Зрелые пыльцевые
зерна 2-клеточные. Генеративная клетка удлиненная, бедноплазменная. В
пыльцевой трубке и вегетативное ядро, и генеративная клетка становятся вере-
теновидными. Вегетативное ядро в отличие от генеративного имеет слабую
хроматизацию. Спермиогенез проходит в пыльцевой трубке, спермии также
бедноплазменные. Своеобразное строение гинецея (Trillium), выраженное
в наличии свободных плодолистиков в верхней части столбика, срастающихся
в основании, позволяет пыльцевым зернам проникать непосредственно в завязь
либо задерживаться на выступах канала столбика. Отклонений при
прорастании пыльцевых зерен не обнаружено.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная.
Внутренний интегумент 2-слойный у основания и 4—6-слойный в области микропиле.
Наружный интегумент 2—4-слойный. Микропиле образовано внутренним
интегументом. Париетальная ткань и нуцеллярный колпачок формируются
у представителей всех исследованных родов семейства: Trillium, Paris, Daiswa.
Наиболее развита париетальная ткань в родах Trillium и Daiswa. Разрушение
ее начинается со стадии 4-ядерного зародышевого мешка, на стадии
сформированного зародышевого мешка число ее слоев значительно уменьшается.
Многослойный нуцеллярный колпачок обнаружен у Daiswa hainanensis.
В латеральной зоне на стадии сформированного зародышевого мешка нуцеллус
2—3-слойный, у основания — 4—6-слойный. В зоне халазы остатки нуцеллуса
сохраняются и в зрелом семени (Trillium). В отдельных клетках нуцеллуса
и наружного интегумента после оплодотворения наблюдаются рафиды.
Археспорий одноклеточный. Мегаспороцит вступает в мейоз осенью либо ранней
весной. В результате мейоза I образуется диада, мейоз II обычно не
сопровождается клеткообразованием и обе клетки диады остаются 2-ядерными;
изредка в микропилярной клетке возможно образование клеточной стенки.
Зародышевый мешок биспорический, развивается по Allium-типу. В 2—4-
ядерном зародышевом мешке центральная вакуоль крупная, цитоплазма
концентрируется по полюсам. Ультраструктурные исследования Trillium cam-
schatcense не выявляют существенных различий в организации протопласта
микропилярного и халазального полюсов зародышевого мешка. Пластиды
многочисленные, довольно крупные, гантелевидные или чашевидные, часто
с несколькими крахмальными зернами. Митохондрии мелкие, овальные, с
единичными кристами. Диктиосомы из 3—5 цистерн, единичные и слобоактивные.
Цистерны АЭР с локальными расширениями, некоторые из которых достигают
151
Trilliaceae
1, 3, 15—18 — Paris quadrifolia, 2, 5—14, 19—22, 36—53 — Trillium camschatcense, 4, 23—27 —
Daiswa hainanensis, 28—33 — Trillium chloropetalum, 34 — T. ovatum, 35 — Paris lancifolia
1 — фрагмент стенки пыльника на стадии микроспор; 2—4 — зрелые пыльцевые зерна; 5—7 —
прорастающие пыльцевые трубки;
значительных размеров и содержат включения. Менее развит ГЭР. Свободные
рибосомы, многие из которых в полисомах, многочисленны. Липидные тела
образуют скопление. В цитоплазме латеральной части клетки в отличие
от полюсов пластиды единичные, митохондрий также значительно меньше.
Клеточная оболочка 2—4-ядерного зародышевого мешка неравномерно
утолщенная, плазмодесмы в ней отсутствуют, лишь на халазальном полюсе они
еще частично сохраняются. В сформированном зародышевом мешке клетки
яйцевого аппарата слабо дифференцированы: яйцеклетка и синергиды близких
размеров, уплощенной формы и располагаются у самой вершины зародышевого
мешка, крупная центральная вакуоль в них отсутствует, ядро находится
в центре клетки. У представителей родов Daiswa и Trillium синергиды от
яйцеклетки отличаются лишь наличием нитчатого аппарата. В роде Paris
синергиды лишены нитчатого аппарата. При ультраструктурном исследовании
клеток яйцевого аппарата сформированного зародышевого мешка Т.
camschatcense в строении яйцеклетки и синергид выявлены как сходство, так и различия.
Для обеих клеток характерно крупное, слегка лопастное ядро, ядерная оболочка
с многочисленными порами. В ядрышке преобладает гранулярный компонент.
Клеточные органеллы довольно равномерно распределены по гиалоплазме,
которая имеет высокую плотность; особенно обильны полисомы. Митохондрии
многочисленные, некрупные, овальные, кристы немногочисленны. Пластид
в клетках меньше, чем митохондрий, но они крупнее последних, по форме
овальные, гантелевидные, чашевидные. Некоторые пластиды содержат крахмал
и пластоглобулы. Встречаются ломасомы, а также липидные тела. Вакуоли
некрупные, некоторые с включениями. Клеточная оболочка и у яйцеклетки,
и у синергид сформирована лишь вдоль границы этих клеток с нуцеллусом,
плазмодесмы отсутствуют. Вдоль зоны контакта с центральной клеткой она
неоднородная, имеются участки, представленные лишь плазмалеммой. У синер-
152
Trilliaceae (продолжение)
8, 15 — семяпочки с диадами, из которых микропилярная дегенерирует, а халазальная дает начало
зародышевому мешку; 9—11 — 2-й 4-ядерные зародышевые мешки; 12, 14, 16, 18, 27, 34 —
семяпочки со сформированными зародышевыми мешками; 13 — сформированный зародышевый мешок;
гид в периплазматическом пространстве наблюдаются локальные скопления
пузырьков: подобное обнаружено и в нитчатом аппарате. Различия между
яйцеклеткой и синергидами проявляются в числе клеточных органелл на
единицу площади. В яйцеклетке значительно больше митохондрий и лишь
единичные диктиосомы, в ней большая плотность полисом и значительно меньшее
число вакуолей. В синергидах же очень обильны диктиосомы, они состоят
из 4—5 цистерн, но функционально слабоактивны. В этих клетках довольно
хорошо развит АЭР, цистерны его с локальными расширениями. Полярные
ядра перед оплодотворением находятся вблизи клеток яйцевого аппарата.
Антиподы эфемерны. У Trillium undulatum обнаружены крупные яйцеклеткопо-
.добные антиподы (Swamy, 1948). 7-клеточные, 8-ядерные зародышевые мешки
у всех исследованных представителей семейства образуются исключительно
153
Trilliaceae (продолжение)
редко. Это связано с наличием отклонений в развитии зародышевых мешков
на ценоцитной стадии. Такие явления обнаружены у Paris quadrlfolia (Ernst,
1902), а также нами у Т. camschatcense, P. quadrlfolia и D. halnanensls.
Нарушения полярности в распределении ядер, асинхронность или прекращение
делений некоторых из них, а также непостоянство в образовании клеток антипод
и отчетливо проявляющаяся депрессия халазального конца зародышевого
мешка являются основными причинами несбалансированности в развитии
зародышевого мешка Allium-типа у представителей данного семейства.
Указанные процессы могут наблюдаться с разных стадий развития зародышевого
мешка: 2-ядерной, 4-ядерной или 8-ядерной. Нарушения, имеющие место на
первых 2 стадиях, приводят к образованию нежизнеспособных зародышевых
мешков. При этом образуются 3—4-клеточные зародышевые мешки с 4—6
ядрами. Они могут иметь 2-клеточный или 3-клеточный яйцевой аппарат
и центральную клетку с единственным полярным ядром и 1—2 ядрами несфор-
мировавшихся клеток антипод. В случае образования 2-клеточного яйцевого
аппарата, представленного синергидами, присутствует также ядро,
предназначенное для образования яйцеклетки, но не сформировавшее ее. Вследствие
того что не происходит оплодотворения одного полярного ядра, эндосперм
не образуется, и такие зародышевые мешки остаются нежизнеспособными.
Отклонения, наблюдаемые с 8-ядерной стадии развития зародышевого мешка,
могут приводить к образованию также 3—4-клеточных зародышевых
мешков, но с большим числом ядер. При этом возможно формирование
зародышевых мешков с 2-клеточным и 3-клеточным яйцевым аппаратом и
центральной клеткой, имеющей 2 полярных ядра, а также ядра несформировавшихся
клеток антипод и депрессированное ядро несформировавшейся яйцеклетки.
Последнее возможно при 2-клеточном яйцевом аппарате, состоящем,
154
17 — клетки яйцевого аппарата; 19—22 — отклонения в развитии зародышевых мешков на ценоцит-
ной стадии; 23 — микропилярная часть семяпочки с зародышевым мешком, имеющим 2-клеточный
"яйцевой аппарат; 24, 38 — сформированный зародышевый мешок с 2-клеточным яйцевым
аппаратом; 25, 26, 36 — 2-клеточные яйцевые аппараты, состоящие из синергид, под ними расположено
ядро несформировавшейся третьей клетки.
Trilliaceae (продолжение)
28—32 — последовательные этапы развития зародышевого мешка; 33 — клетки яйцевого аппарата;
35 — семяпочка с 2-ядерным зародышевым мешком; 37 — оплодотворение при 2-клеточном
яйцевом аппарате, один из спермиев находится в пространстве между клетками яйцевого аппарата и
центральной клеткой, другой — над полярными ядрами;
40
39
Trilliaceae (продолжение)
39—44 — фрагменты зародышевого мешка после оплодотворения: 39 — одна из синергид
разрушается, другая, гаплоидная, делится (п=5), зигота по размерам не превышает делящуюся синер-
гиду, первичное ядро эндосперма крупное, с несколькими ядрышками, 40—42 —
последовательные стадии зиготогенеза, 43, 44 — стадии развития зиготических и синергидных зародышей;
как правило, из синергид. Образование 2-клеточного яйцевого аппарата
было описано ранее для Trillium grandiflorum (Ernst, 1902). Сведения о
формировании зародышевых мешков по Polygonum- и Oenothera-типам не
подтвердились. Зародышевые мешки Allium-типа развития, а также те,
157
Trilliaceae (продолжение)
45—49 — последовательные этапы развития зиготических зародышей; 50 — схема зародышевого
мешка перед началом эндоспермогенеза, первичное ядро эндосперма смещается в халазальную
часть центральной клетки; 51 — зигота и начало формирования гелобиального эндосперма;
52 — 2-клеточный зародыш и развивающийся гелобиальный эндосперм; 53 — схема зрелого семени
(1—27, 36—53 — ориг.; 28—35 — по Berg, 1962).
у которых отклонения наблюдаются лишь с 8-ядерной стадии, могут быть
жизнеспособными при условии двойного оплодотворения.
При наличии 3-клеточного яйцевого аппарата двойное оплодотворение
осуществляется без отклонений от нормы. Сингамия предшествует тройному
слиянию. При наличии 2-клеточного яйцевого аппарата двойное оплодотворение
также возможно. Оно наблюдалось нами у Т. camschatcense. Пыльцевая
трубка при этом входит в одну из синергид. Спермии, как обычно, проникают
в пространство между клетками яйцевого аппарата и центральной клеткой.
Далее возможно продвижение одного из спермиев к полярным ядрам, а
другого — к сохранившейся синергиде. Обнаружены делящиеся синергиды в стадии
метафазы с диплоидным набором хромосом, равным 10, в то время как неопло-
дотворенные синергиды гаплоидны (п=5).
Эндосперм гелобиального (Trillium) либо нуклеарного (Paris) типа. При
гелобиальном эндосперме у Т. camschatcense микропилярная камера
значительно больше халазальной. Клеткообразование в халазальной камере
начинается раньше, чем в микропилярной. Структура клеток микропилярной
и халазальной камер эндосперма различна: клетки халазальной мелкие,
с плотной цитоплазмой. Ядра этих клеток различаются между собой по величине,
но значительно меньше микропилярных. Халазальная камера существует
непродолжительное время, вскоре после завершения клеткообразования в ней
158
начинают наблюдаться процессы деструкции. Микропилярная камера
эндосперма интенсивно развивается, массивный эндосперм сохраняется в зрелом
семени (Наумова, Яковлев, 19756). Близкие данные были получены по Т. tscho-
noskii (Liping, Zheng Xuejing, 1986).
Зародыш у Т. camschatcense развивается по Solanad-типу. Зигота от
момента образования до начала эмбриогенеза претерпевает значительные
изменения: увеличиваются ее размеры, формируется крупная базальная вакуоль,
ядро смещается в терминальный конец клетки, отчетливо выявляется
полярность, происходит накопление крахмала, который концентрируется главным
образом вокруг ядра. Деление зиготы поперечное, неравное. Базальная клетка 2-
клеточного зародыша крупнее терминальной. Зрелое семя имеет маленький сла-
бодифференцированный зародыш, у которого лишь начинают формироваться
семядольные бугорки и проводящая система. На данной стадии развития у этого
однодольного растения довольно отчетливо выявляются 2 бугорка будущих
семядолей. Чтобы прорасти, семя нуждается в длительном покое, в течение
которого происходит доразвитие зародыша. Перед прорастанием зародыш
Trillium, согласно данным Имс (1964), имеет 2 хорошо развитые семядоли,
которые располагаются супротивно. По своему строению зародыш рода
Trillium считается отклоняющимся от типичного зародыша однодольных. Зрелый
зародыш Paris sp. бесцветный (Яковлев, Жукова, 1973); бесхлорофилльный
зародыш и у Г. camschatcense.
У Т. camschatcense обнаружено образование синергидных зародышей
(Наумова, Яковлев, 19756). Большинство из них развивается без
оплодотворения и имеет гаплоидный набор хромосом. На начальных этапах развития
синергидные зародыши по размерам незначительно отличаются от зиготических;
формироваться они начинают часто раньше последних. Синергидные зародыши
обычно достигают стадии 8—10 клеток, после чего начинают дегенерировать.
Характер развития диплоидных синергидных зародышей не изучен.
У Т. erectum и Т. grandiflorum описано формирование апомиктического
диплоидного эндосперма и диплоидных зародышей, возникающих из эндосперма
(Jeffrey, Haertl, 1939a, 1939b). Эти данные, однако, не нашли подтверждения
в последующих исследованиях. Для Т. undulatum описано формирование
дополнительных зародышей из клеток нуцеллуса. Указано, что такие зародыши
возникают в 19 % семяпочек.
Исследованные виды. Daiswa hainanensis, D. lancifolia (= Paris
lancifolia), D. polyphylla (=Paris polyphylla), Daiswa sp., Paris axialis,
P. incompleta, P. quadrifolia, Trillium camschatcense. T. cernuum, T. chlorope-
talum, T. erectum, T. govanianum, T. grandiflorum, T. ovatum, T. recurvatum,
T. sessile, T. smalii, T. tschonoskii, T. undulatum.
Литература. Smith, 1896; Chamberlain, 1898; Atkinson, 1899; Ernst,
1902; Coulter, Chamberlain, 1903; McAllister, 1914; Brandt, 1916; Heatley, 1916;
Nothnagel, 1918; Spangler, 1925; Ono, 1928; Jeffrey, Haertl, 1939a, 1939b;
Howe, 1940; Swamy, 1948; Johri, Eunus, 1950; Stenar, 1951; Sparrow, Pond,
Koyan, 1955; Johri, Bhatnagar, 1957; Berg, 1958, 1962; Dyer, 1963; Имс, 1964;
Johri, 1966; Sakai, 1969; Наумова, Яковлев, 1975а, 19756; Наумова, 1978;
Naumova, 1978; Joshika et al., 1981; Takahashi Masamichi, 1982, 1984, 1987;
Liang Hanxing, Zhang Xianglan, 1984, 1985; Liping, Zheng Xuejing, 1986;
Наумова, ориг. данные.
Семейство SMILACACEAE
Эмбриологически не исследовано. Пыльники одногнездные. У Smilax herba-
сеа мейоз в микроспороцитах сопровождается цитокинезом. Тетрады микроспор
изобилатеральные.
Семяпочка у S. zeylanica ортотропная, у Rhipogonum scandens — гемит-
ропная, с 2 интегументами.
Развитие зародышевого мешка, эндосперма и зародыша не исследовано.
Эндосперм содержит крахмал и жиры. У 5. zeylanica — резервная
целлюлоза, белки и жиры; крахмала нет. Резервная целлюлоза характерна также
для представителей рода Rhipogonum.
159
Зрелое семя с эндоспермом и маленьким зародышем, который у 5. zeylanica
занимает 1/15 или 1/16 часть объема семени (Huber, 1969).
Исследованные виды. Rhipogonum scandens, Smilax herbacea,
S. zeylanica.
Литература. Martin, 1946; Huber, 1969; Комар, 1985.
Семейство DIOSCOREACEAE
Пыльник у Trichopus zeylanicus 4-гнездный. Сформированная стенка гнезда
пыльника у Dioscorea oppositlfolia и Т. zeylanicus состоит из эпидермиса,
эндотеция, среднего слоя и тапетума. В эндотеции образуются фиброзные
утолщения. Клетки секреторного тапетума 2-ядерные. Тетрады микроспор
у Т. zeylanicus тетраэдральные, изобилатеральные, крестообразные или
линейные; у D. oppositlfolia они тетраэдральные, изредка встречаются
изобилатеральные. Зрелые пыльцевые зерна 2-клеточные. У Т. zeylanicus некоторые
пыльцевые зерна прорастают in situ.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. У D.
oppositlfolia внутренний интегумент 2-слойный, наружный — 4—5-слойный. У
Т. zeylanicus и внутренний, и наружный интегументы 2-слойные.
Микропиле образовано обоими интегументами. Имеется гипостаза. У D. oppositlfolia
археспориальная клетка отделяет париетальную, которая в свою очередь
делится, образуя массивную париетальную ткань. У Dioscorea nipponica
и D. tokoro имеется один или 2 слоя париетальных клеток. У Т. zeylanicus
археспориальная клетка становится непосредственно мегаспороцитом. Тетрада
мегаспор линейная или Т-образная.
Зародышевый мешок у большинства представителей семейства Polygonum-
типа, развивается из халазальной мегаспоры. У 2 японских видов — Dioscorea
izuensis и D. septemloba встречается тетраспорический 16-ядерный зародышевый
мешок Drusa-типа с 11 антиподами. Одна из синергид и антиподы наблюдаются
до стадии 2-клеточного проэмбрио. У D. oppositlfolia и Т. zeylanicus синергиды
крючкообразные. Полярные ядра у D. oppositlfolia сливаются в центре
зародышевого мешка, а у Г. zeylanicus — в халазальном районе, вблизи антипод.
Антипод 3, они эфемерны, дегенерируют вскоре после оплодотворения.
Зародышевый мешок в это время сильно увеличивается в размерах; у Т. zeylanicus
халазальный его конец вытягивается и вступает в контакт с гипостазой.
Эндосперм нуклеарный. Клеткообразование начинается от микропилярного
конца. У Т. zeylanicus клетки эндосперма крупные, с большим ядром, плотной
цитоплазмой и множеством липидных тел. В зрелом семени наружные стенки
клеток эндосперма утолщены, богаты гемицеллюлозой. У D. oppositlfolia
эндосперм сохраняется также в зрелом семени.
Эмбриогенез соответствует Asterad-типу. Деление зиготы у Tamus
communis, D. oppositlfolia и Т. zeylanicus обычно поперечное. У Dioscorea villosa
при делении зиготы перегородка закладывается наклонно, вертикально или
поперечно. У D. caucasica в месте прикрепления зародыша обнаружена каллоза.
У Т. communis эмбриогенез нерегулярен. Семядоля образуется из апикальной
клетки 2-клеточного проэмбрио; точка роста, инициали зародышевого корня
и суспензор — из базальной клетки. Суспензор у Т. communis широкий и
многоклеточный. Зрелый зародыш вытянутый, с терминальной семядолей,
латерально расположенной точкой роста и зародышевым корнем с корневым
чехликом. Некоторые авторы предполагают, что у Dioscorea bulblfera, D. prae-
hensllls, D. odoratissima, D. hirtiflora и D. preussii имеются 2 семядоли, одна из
которых остается в семени как абсорбирующий орган, другая развивается позже
и выполняет функции листа (Lawton, Lawton 1967).
Известен единственный случай полиэмбрионии у Т. zeylanicus. Автор
(Rao, 1954) предполагает, что один из 2 зародышей нуцеллярного
происхождения.
Исследованные виды. Dioscorea bulblfera, D. caucasica, D.
hirtiflora, D. izuensis, D. nipponica, D. odoratissima, D. oppositlfolia, D. praehen-
160
Dioscoreaceae
1—10, 24, 25, 46—48 — Dioscorea oppositifolia, 11—23, 26—34—Trichopus zeylanicus, 35—45 —
Tamus communis
1—14 — развитие пыльника и микроспорогенез; 15 — семяпочка с мегаспороцитом; 16—21 —
мегаспорогенез и развитие зародышевого мешка; 22 — семяпочка; 23 — микропилярныи конец
семяпочки с обтуратором;
sills, D. preussil, D. qulnqueloba, D. septemloba, D. tokoro, D. vlllosa, Tamus
communis, Trichopus zeylanicus.
11 Зак. 2144 161
Dioscoreaceae (продолжение)
24, 25 — ранние стадии эндоспермогенеза; 26—32 — отдельные стадии развития зародыша; 33 —
полиэмбриония: половой и нуцеллярные зародыши; 34 — зрелый зародыш, неправильный рост
семяпочки и эндоспермальной ткани; 35—45 — отдельные стадии развития зародыша; 46—48 —
зрелый зародыш в разных плоскостях. (1—10, 24, 25, 46—48 — по Nagaraja Rao, 1953; 11—23, 26—
32, 34— по Nagaraja Rao, 1955; 33 — по Nagaraja Rao, 1954; 35—45 — no Guignard, 1963).
Литература. Beccari, 1870; Tischler, 1915; Smith, 1916; Tackholm,
1918; Rao, 1951, 1953, 1954, 1955; Guignard, 1963; Lawton J., Lawton I., 1967;
Takeuchi Yasuyoshi, Kimura Chugai, 1968; Takeuchi Yasuyoshi, 1971;
Соколовская, 1986.
162
Семейство ТАССАСЕАЕ
Пыльник 4-гнездный; гнезда объединены в 2 теки, вскрывающиеся
продольно. Сформированная стенка гнезда пыльника состоит из эпидермиса,
эндотеция, 2 средних слоев и тапетума, клетки которого становятся 2-ядерными.
У Schizocapsa plantaginea тапетум периплазмодиальный. Образование тетрад
микроспор идет по симультанному, изредка — по сукцессивному типам. Тетрады
микроспор тетраэдральные. Зрелые пыльцевые зерна 2-клеточные.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная, с микропиле,
образованным внутренним интегументом. У S. plantaginea и Тасса cristata
часть семяпочек дегенерирует. Наружный и внутренний интегументы 2-слойные.
Они различаются по своей структуре: у наружного интегумента клетки мелкие,
с плотной цитоплазмой, у внутреннего — крупные, сильно вакуолизированные.
Археспорий одноклеточный, иногда 2-клеточный. Археспориальная клетка
отделяет первичную париетальную клетку, которая образует единственный
париетальный слой. Тетрады мегаспор Т-образные, реже — линейные, иногда
крестообразные.
Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
типу. Синергиды грушевидной формы. Положение полярных ядер различно
у разных видов: у Тасса palmata они располагаются непосредственно под
яйцевым аппаратом, у Т. macrantha и Т. lanclfolla оба полярных ядра
передвигаются в халазальную часть зародышевого мешка, у Т. vlrtdts
располагаются в центре. Полярные ядра сливаются до оплодотворения. 3 антиподальные
клетки эфемерны. У S. plantaginea они очень маленькие и лежат на постаменте,
образованном клетками с утолщенными стенками. Оплодотворение порогамное.
Содержимое пыльцевой трубки у Т. macrantha изливается в одну из синергид;
у Т. palmata синергиды дегенерируют до оплодотворения и пыльцевая трубка
изливает свое содержимое непосредственно в зародышевый мешок.
Эндосперм нуклеарный. В зрелом семени клетки эндосперма содержат
белки и жиры. 4—5 халазальных слоев эндосперма не содержат запасных
веществ. Халазальная часть эндосперма рассматривается как гаусторий (Рае-
tow, 1931).
Тассасеае
1—6, 8—10, 13—16 — Schizocapsa plantaginea, 7 — Тасса palmata; 11 — Т. viridis, 12 — Т.
macrantha
1—5—развитие пыльника и пыльцы; в семяпочка; 7—нуцеллус с археспориальной клеткой;
8—13—мегаспорогенез: 9— образование париетальной и спорогенной клеток,
11* 163
// — 2 мегаспороцита, 12, 13 — тетрады мегаспор; 14, 15 — развитие зародышевого мешка; 16 —
зародыш. (1—6, 8—10, 13—16 — по Hakansson, 1921; 7, 11, 12 — по Paetow, 1931).
Эмбриогенез не изучен. Зигота имеет длительный период покоя. В зрелом
семени зародыш очень маленький (Limpricht, 1902).
У S. plantaginea иногда встречается апомиксис.
Исследованные виды. Schizocapsa plantaginea, Tacca cristata,
Т. lancifolia, Т. macrantha, Г. montana, Т. palmata, 7\ pinnatifida, T. viridis.
Литература. Solms-Laubach, 1878; Limpricht, 1902; Palm, 1920;
Hakansson, 1921; Sussenguth, 1921a, 1921b; Paetow, 1931.
Порядок 6. BURMANNIALES
Семейство BURMANNIACEAE
/ — Gymnosiphon guainensis, 2,3 — Burmannia grandiflora, 4, 20 — B. bicolor, 5, 6, 16, 37—42 —
B. dasyantha, 7, 17 — Gymnosiphon suaveolens, 8, 52 — Miersiella umbellata, 9—14, 47—50 — Ap-
teria aphylla (—A. setacea), 15, 21, 23—30 — Burmannia oblonga, 18 — Campylosiphon purpuras-
cens, 19 — Burmannia densiflora, 22, 55 — Thismia panamensis, 31—36 — Burmannia tenella, 43—46,
53 — B. disticha, 51 — Marthella trinitatis, 54 — Gumnosiphon divaricatus
1 — поперечный срез цветка на уровне пыльников в период их созревания; 2—4 — развитие 3-
слойной стенки пыльцевого гнезда (в стенке зрелого пыльника эндотеций отсутствует): 2 —
фрагмент поперечного среза пыльцевого гнезда на стадии микроспороцитов, 3 — то же, во время
формирования тетрад микроспор, 4 — то же, во время дегенерации субэпидермального слоя стенки
пыльцевого гнезда; 5—8 — развитие 4-слойной стенки пыльцевого гнезда (в стенке зрелого пыльцевого
гнезда эндотеций присутствует): 5 — фрагмент поперечного среза пыльцевого гнезда в период
заложения археспориальной ткани, 6 — то же, на стадии 2—3-слойной стенки пыльцевого гнезда, 7 —
то же, на стадии 4-слойной стенки пыльцевого гнезда, во время развития микроспороцитов, 8 —
то же, на стадии отдельных микроспор; 9—13 — образование 3-клеточных пыльцевых зерен,
объединенных в тетрады; 14 — прорастающее пыльцевое зерно;
165
Burmanniaceae (продолжение)
15, 16— семяпочка на стадии археспория и мегаспороцита; 17— тетрада мегаспор; 18—20—
развитие зародышевого мешка; 21 — сформированный зародышевый мешок; 22 — зародышевый
мешок с депрессией антипод; 23 — семяпочка после деления центральной клетки;
из эпидермиса, эндотеция, 1—2 средних слоев и тапетума. (Rubsamen, 1986).
Число слоев в стенке пыльника может варьировать даже в пределах одного
рода. Так, у Burmannia tenella она состоит из 4 слоев, у В. championii — из
5. В зрелом пыльнике эндотеций обычно с фиброзными утолщениями. У видов
Burmannia эндотеций часто замещает эпидермис, при этом фиброзные
утолщения не образуются (Rubsamen, 1986). Тапетум секреторный, его клетки
содержат одно или 2 ядра. У Thismia americana на стенках клеток тапетума
обнаружены орбикулы (Preiffer, 1918). Образование тетрад микроспор происходит
по сукцессивному типу. У Burmannia coelestis отмечены митотические деления
микроспороцитов (Ernst, Bernard, 1912b); однако у этого вида обнаружена
и редукция числа хромосом в мейозе (Schoch, 1920, цит. по: Rubsamen, 1986).
Тетрады микроспор обычно тетраэдральные. Многие изученные виды имеют
3-клеточную зрелую пыльцу {Burmannia grandiflora, В. bicolor и др.). У других
166
Burmanniaceae (продолжение)
24—30—образование халазальной «камеры» гелобиального эндосперма и первое деление ядра
в микропилярнои камере эндосперма; 31—38 — свободноядерная стадия эндосперма; 39—41 —
халазальныи гаусторий эндосперма; 42 — созревающее семя;
Burmanniaceae (продолжение)
43—50 — эмбриогенез; 51—55 — строение зрелых семян. (/—14, 16—20, 22, 31—42, 51, 52, 54, 55 —
по Rubsamen, 1986; 15, 21, 23—30 — ориг.; 43—50 — по Терёхину, 1977; 53 — по Терёхину, 1985).
видов зрелая пыльца остается 2-клеточной (Burmannia Candida, В. densiflora,
В. chamrionii и др.). У отдельных видов зрелая пыльца 2—3-клеточная
(Burmannia disticha, В. coelestis). Зрелая пыльца одиночная.
Семяпочка анатропная, с 2 интегументами, тенуинуцеллятная, на
выраженном фуникулусе. Оба интегумента 2-слойные. Образование внутреннего инте-
гумента происходит вскоре после дифференциации археспория, наружного —
несколько позже. Микропиле формируется внутренним интегументом. Имеется
гипостаза (Rubsamen, 1986). Археспорий одноклеточный, преобразуется в ме-
гаспороцит без отделения париетальной клетки. Тетрада мегаспор линейная
или Т-образная, иногда образуется триада мегаспор, когда не делится микро-
пилярная клетка диады (Ernst, Bernard, 1912a).
Зародышевый мешок, как правило, моноспорический, развивается по
Polygonum-типу из халазальной клетки тетрады мегаспор. У В. Candida (Ernst,
Bernard, 1912a) и у ряда видов Thismia (T. luetzelburgii, T. panamensis;
Rubsamen, 1986) описан Allium-тип развития зародышевого мешка. В зрелом
зародышевом мешке синергиды без нитчатого аппарата (Rubsamen, 1986).
Полярные ядра сливаются до оплодотворения. Антиподы очень мелкие (за
исключением Gymnosiphon niveus) и часто неотчетливо отграничены друг от
друга клеточными перегородками, например у Marthella trinitatis (Johow,
168
1885), Hexapterella gentianoides, В. grandiflora (Rubsamen, 1986). У Т. ате-
ricana антиподы представлены З свободными ядрами (Pfeiffer, 1918). Отмечены
отклонения от нормального хода развития зародышевого мешка: вследствие
сильной редукции халазальнои части семяпочки у Т. luetzelburgii
зародышевый мешок содержит только 5 ядер; антиподы отсутствуют (Rubsamen, 1970).
Оплодотворение двойное, описано у В. championli (Ernst, Bernard, 1912a)
и A. aphylla (Rubsamen, 1986). Во время оплодотворения обе синергиды
разрушаются. Сингамия и тройное слияние проходят синхронно.
Эндосперм гелобиальный; у Т. luetzelburgii и Т. panamensis — целлюляр-
ного типа. Число ядер в халазальнои камере гелобиального эндосперма
и число образующихся в ней клеток варьируют. Одноядерная халазальная
камера отмечена у Gymnosiphon divaricatus; 2-ядерная — у М. trinitatis,
В. grandiflora, Cymbocarpa saccata, Dictyostega orobanchoides, Gymnosiphon
breviflorus и ряда других видов; 3-ядерная — у A. aphylla; 4-ядерная —у В. Ы-
color; 4—5-ядерная — у Gymnosiphon guianensis; 8-ядерная — у Вигтап-
nia dasyantha. 2-клеточная халазальная камера обнаружена у В. longifolia
и D. orobanchoides, многоклеточные — Н. gentianoides и G. divaricatus. Оболочки
клеток халазальнои камеры в зоне контакта их с окружающими клетками
образуют протуберанцы. В микропилярной камере вскоре после ее
формирования начинается процесс клеткообразования. Иногда клеткообразование в
халазальнои камере гелобиального эндосперма происходит раньше, чем в
микропилярной (Apteria, Campylosiphon). Запасными веществами эндосперма
являются гемицеллюлоза утолщенных оболочек, белки и жиры. Крахмал
в эндосперме эфемерен, он полностью используется в процессе развития
семени.
Зигота, а затем и базальная клетка (cb) 2-клеточного проэмбрио делятся
обычно поперечно, клетка са — продольно, формируя Т-образную тетраду. Ход
эмбриогенеза у Thismia не вполне ясен. Зародыш зрелого семени крайне
редуцирован и представлен ранним проэмбрио или глобулярной стадией
у представителей трибы Thismieae. В роде Burmannia зародыш развивается
обычно до стадии квадрантов, в роде Thismia — до стадии дифференциации
эмбриодермы. У крайне редуцированных зародышей A. aphilla обнаружены
отдельные периклинальные деления, что связано, вероятно, с нарушением хода
эмбриогенеза (Терёхин, 1977). У Gymnosiphon suaveolens зрелый зародыш
может состоять всего из 2—3 клеток. Распределение зародышей сем. Burmannia-
сеае на 2 группы, в основном совпадающее с границами триб (Терёхин, 1977),
подтверждено в более позднем исследовании (Rubsamen, 1986).
У В. coelestis описаны диплоспория и полиэмбриония (Ramaswamy, 1970).
Исследованные виды. Apteria aphylla (==А. setacea), Burmannia
bicolor, В. championii, В. coelestis, В. dasyantha, В. disticha, В. grandiflora,
В. longifolia, В. vanpesana, Campylosiphon, Cymbocarpa saccata, Dictyostega
orobanchioides, Gymnosiphon breviflorus, G. divaricatus, G. guianensis, G.
suaveolens, Hexapterella gentianoides, Marthella trinitatis (=Burmannia capitata,
= Gymnosiphon trinitatis), Thismia americana, T. luetzelburgii, T. panamensis.
Литература. Treub, 1881 — 1982, 1883; Johow, 1885, 1889; Ernst, 1909;
Meyer, 1909, 1925; Ernst, Bernartr, 1910, 1911, 1912a, 1912b, 1914; Pfeiffer, 1914,
1918; Goebel, Suessenguth, 1924; Ramaswamy, 1970; Arecal, Ramaswamy, 1979;
Spitman, 1975 (no: Rubsamen, 1986); Терёхин, 1977, 1985; Rubsamen, 1986.
Семейство CORSIACEAE
Пыльник 4-гнездный. Стенка сформированного гнезда пыльника состоит
из эпидермиса, эндотеция, среднего слоя и тапетума (Rubsamen, 1986).
Тапетум секреторный. Дегенерация среднего слоя и тапетума завершается
ко времени образования 2-клеточных пыльцевых зерен. У Arachnites uniflora
на внутренней поверхности тапетума обнаружены многочисленные орбикулы.
В эндотеции образуются фиброзные утолщения. Зрелая пыльца 2-клеточная.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Оба инте-
гумента 2-слойные. Археспориальная клетка дифференцируется еще до изги-
169
Corsiaceae
1, 10, 11 — Arachnites uniflora, 2, 3, 5,7, 8 — Corsia cf lamellata, 4, 6, 12 — Corsia sp.,9 — C. ungui-
cи lata
1 — поперечный срез зрелого пыльника; 2 — фрагмент поперечного среза стенки пыльцевого
гнезда; 3 — зрелое пыльцевое зерно; 4 — строение и расположение семяпочек в завязи; 5 —
семяпочка на стадии мегаспороцита; 6 — 4-ядерный зародышевый мешок; 7 — яйцевой аппарат
зародышевого мешка на поперечном срезе; 8 — поперечный срез халазальной части семяпочки во время
оплодотворения; 9 — строение клеточных оболочек эндосперма в зрелом семени; 10 — полиэмбрио-
ния; // — строение зрелого семени на продольном медианном срезе; 12 — фрагмент продольного
среза зародыша и микропилярной области эндосперма зрелого семени. (/—// — по Rubsamen,
1986; 12 — по Терёхину, 1985).
бания семяпочки. Она превращается в мегаспороцит после отделения
париетальной клетки (Rubsamen, 1986).
Зародышевый мешок, вероятно, тетраспорический, 7-клеточный, 7-ядерный,
с 3-клеточным,яйцевым аппаратом. Одна из синергид разрушается в процессе
оплодотворения.
Развитие эндосперма и зародыша не изучено.
У A. uniflora зародыш в семени, по-видимому, 2—4-клеточный; эндосперм
из нескольких клеток с утолщенными оболочками (Rubsamen, 1986). У Cor sua sp.
и С. unguiculata зародыш не дифференцирован на органы, состоит примерно
из 30—50 клеток, со слабодифференцированнои эмбриодермои и коротким
суспензором (Терёхин, 1985; Rubsamen, 1986).
У С. unguiculata обнаружена полиэмбриония.
Исследованные виды Arachnites uniflora, Corsla sp., С. unguiculata.
Литература. Терёхин, 1985; Rubsamen, 1986.
Порядок 7. ORCHIDALES
Семейство ORCHIDACEAE
Пыльник 4-гнездный. Развитие стенки гнезда пыльника проходит
центростремительно, по типу однодольных. Сформированная стенка гнезда пыльника
состоит из эпидермиса, эндотеция, в котором образуются фиброзные утолщения,
1—2 эфемерных средних слоев и секреторного тапетума. У Spathoglottis
фиброзные утолщения имеет не только эндотеций, но и другие слои пыльника.
Клетки тапетума одно- или 2-ядерные. У некоторых видов (Zeuxine longilabris)
клетки эпидермиса становятся многоядерными, ядра сливаются, образуя
полиплоидные структуры. Предполагается, что эпидермис здесь выполняет функцию
питания. Образование тетрад микроспор происходит по симультанному типу.
Встречаются изобилатеральные, линейные и Т-образные тетрады. Зрелые
пыльцевые зерна 2-клеточные. У представителей подсем. Cypripedioldeae пыльцевые
зерна одиночные, у представителей подсем. Orchidoideae они обычно соединены
в тетрады, массулы и поллинии, но у Vanilla planifolia наблюдаются одиночные
пыльцевые зерна. Изучение ультраструктуры поллиниев показало, что в
пыльцевом зерне генеративная клетка отделена от окружающей ее вегетативной
клеточной оболочкой, в которой имеются плазмодесмы. В цитоплазме
генеративной клетки наблюдаются пузырьки, ограниченные одинарной мембраной,
диктиосомы, липидные тела. По всей цитоплазме клетки распределены
рибосомы. Ядро неправильной формы, имеет инвагинации. Наличие липидных тел
отмечено и в спермиях. Цитоплазма вегетативной клетки орхидных отличается
от таковой других цветковых растений бедностью ГЭР, отсутствием крахмала,
наличием пластид с упрощенной внутренней структурой. В поллинии
обнаружены заметные различия в структуре спородермы внутренних и наружных
тетрад, у последних она большей толщины и сложности со спорополленином
на поверхности наружных тангентальных стенок.
Семяпочка анатропная, обычно развиваются 2 интегумента, реже — один,
тенуинуцеллятная. Микропиле образовано только внутренним интегументом.
У большинства орхидных внутренний интегумент состоит из 2 или 3 слоев
клеток, а наружный из одного слоя, реже — из 2. У V. planifolia описан
внутренний 4-слойный и наружный 4—5-слойный интегументы. В процессе развития
в халазальной части семяпочки между наружным и внутренним интегументами
образуется большая воздушная полость. Археспориальная клетка обычно
одна, в редких случаях (Habenaria densa и др.) их 2; не отделяя
париетальной клетки, она дифференцируется в мегаспороцит. Мегаспорогенез у
различных видов орхидных осуществляется по-разному. У представителей подсем.
Cypripedioldeae образуется диада клеток, верхняя из которых дегенерирует,
а нижняя дает начало зародышевому мешку. У представителей подсем.
Orchidoideae мегаспорогенез чаще всего завершается образованием 3 клеток
(V. planifolia, Galeola septentrionalis, Spiranthes australis и др.). У ряда
таксонов образуется тетрада мегаспор (Gymnadenia, Platanthera и др.),
которые располагаются линейно или Т-образно. Функционирующей обычно
является халазальная мегаспора. У Epidendrum variegatum исходной клеткой
зародышевого мешка является мегаспороцит. У ряда видов орхидных (Cypri-
pedium insigne, Orchis latifolia, О. mascula, О. militaris, Epipactis palustris)
прослежена динамика распределения крахмала во время мегаспорогенеза.
Установлено, что крахмальные зерна появляются в археспориальной клетке
перед мейозом; во время профазы мейоза они концентрируются вокруг ядра,
а позднее обнаруживаются в клетках диад и тетрад. Крахмальные зерна
исчезают из дегенерирующих мегаспор, но наблюдаются в функционирующей
мегаспоре, дающей начало зародышевому мешку. На примере Orchis, Cepha-
lanthera и Epipactis показано, что у орхидных клетки мейоцита, диад и тетрад
в своих оболочках содержат каллозу. Установлено, что халазальная часть
оболочки мейоцита и функционирующей мегаспоры состоит из 2 слоев:
внутреннего, электронно-прозрачного, содержащего каллозу, и наружного, состоя-
172
; _ Cypripedium insigne, 2—5 — Calanthe veitchii, 6—12 — Dendrobium nobile, 13—18 — Neottia
nidus avis, 19—27 — Gymnadenia conopsea, 28, 29 — Orchis militaris, 30—34 — Listera ovata, 35—
40 — Limodorum abortivum
1 — одиночное проросшее пыльцевое зерно; 2—5 — пыльцевые зерна, соединенные в тетрады после
прорастания; 6 — зародышевый мешок с пыльцевой трубкой; 7, 14—18, 20, 21 — двойное
оплодотворение; 8 — оплодотворенные женские ядра; 9 — 2-клеточный зародыш и первичное ядро эндосперма;
10 — 4-клеточный зародыш; // — глобулярный зародыш и подвесок; 12 — зародыш с подвесочным
гаусторием; 13, 19 — зрелые зародышевые мешки;
щего из электронно-плотного вещества. Наружный слой образует
многочисленные выросты, пронизывающие внутренний слой и направленные
к плазмалемме клетки, в результате чего халазальная стенка мейоцита
и функционирующей мегаспоры приобретает на срезе ситовидную структуру.
Обнаружена связь этих клеток через плазмодесмы со смежными клетками
нуцеллуса. Выдвинуто предположение, что структура халазальной стенки
мегаспороцита (а позднее — функционирующей мегаспоры) связана с
осуществлением межклеточного транспорта (Rodkiewicz, Bednara, 1976).
Зародышевый мешок биспорический у представителей подсем. Cypripedio-
ideae и обычно моноспорический у видов подсем. Orchidoideae, хотя в
последнем иногда встречаются биспорические (Cymbidim bicolor, Hetaeria nitida)
и тетраспорические (Spiranthes cernua, E. variegation) зародышевые мешки.
Для орхидных характерна редукция числа ядер в зародышевом мешке до 4.
Синергиды грушевидной формы, с нитчатым аппаратом. Полярные ядра
сливаются до и во время оплодотворения. Антиподы представлены ядрами или
173
Orchidaceae (продолжение)
Orchidaceae (продолжение)
22—26 — различные этапы эмбриогенеза; 27—29 — полиэмбриония; 30—34 — последовательные
этапы слияния спермия с ядром яйцеклетки;
клетками. В 8-ядерных зародышевых мешках чаще встречаются 3 клетки
антипод, хотя иногда и наблюдаются антиподальные ядра (Epipogium, Spathoglot-
tis); в 5—6-ядерных зародышевых мешках в халазальном конце наблюдаются
одно или 2 ядра: перед оплодотворением они приближаются к полярному
ядру или ядрам и, входя с ними в контакт, образуют полярно-антиподальный
комплекс ядер. У многих видов отмечена ранняя дегенерация антипод. Си-
нергиды у Epidendrum scutella (Cocucci, Jensen, 1969) и Epipactis atrorubens
(Savina, Zhukova, 1984) до оплодотворения богаты свободными рибосомами
175
Orchidaceae (продолжение)
35 — зрелый зародышевый мешок; 36 — двойное оплодотворение; 37—40 — длительное
существование первичного ядра эндосперма. (/—5 — по Поддубной-Арнольди, 1954; 6—12— по Поддубной-
Арнольди, 1964, 13—40 — рис. Савиной).
(полисомы не обнаружены). Количество пластид и митохондрий умеренное.
Отмечено наличие неактивных диктиосом, липидных тел, отсутствие крахмала.
В цитоплазме яйцеклетки наблюдаются многочисленные митохондрии,
рибосомы, свободные или связанные с ЭР. Диктиосомы, по-видимому, отсутствуют
176
или представлены в небольшом числе. У Е. atrorubens на ранних этапах
клеточной фазы развития зародышевого мешка, когда полярность клеток
яйцевого аппарата еще слабо выражена, у яйцеклетки и синергид
наблюдается полная клеточная оболочка. Для цитоплазмы центральной клетки
характерно обилие рибосом, наличие крупных пластид с небольшим запасом
крахмала и гладкого ЭР. Клетки антипод содержат свободные и связанные
с ЭР рибосомы и пластиды с мелкими крахмальными зернами. У всех клеток
зрелого зародышевого мешка Е. scutella отмечено наличие самостоятельных
оболочек, которые прерываются в определенных зонах центральной клетки
и яйцеклетки, на границе с дегенерирующей синергидой. В ходе развития
зародышевого мешка Е. atrorubens отмечено изменение толщины и структуры
клеточных оболочек яйцевого аппарата. Они утончаются по направлению
к апикальной части клеток. В местах контакта яйцеклетки с синергидами и
центральной клеткой наблюдается прерывистость клеточных стенок, на
отдельных участках отмечено расхождение плазмалемм смежных клеток.
Оплодотворение порогамное. Промежуток между опылением и
оплодотворением у орхидных может быть от нескольких дней до 2 мес и более. Обычно
двойное оплодотворение осуществляется нормально, но в ряде случаев
наблюдаются нарушения во 2-м звене процесса — объединении ядра спермия
с ядром или ядрами центральной клетки. Кульминационным моментом такого
нарушения является отсутствие слияния ядра спермия с ядром центральной
клетки (Oreorchis patens, Calanthe aristulifera, Listera nipponica).
Существуют различные точки зрения относительно причин нарушения
двойного оплодотворения у орхидных. Хагеруп (Hagerup, 1944) считает, что
причиной отсутствия объединения ядра спермия с полярными ядрами
исследованного им Orchis maculata является то, что к моменту
оплодотворения эти ядра мертвы. Герасимова-Навашина (1954) и Поддубная-
Арнольди (1958) полагают, что нарушение двойного оплодотворения
у орхидных связано с редукцией зародышевого мешка в процессе их
исторического развития. Сравнительный анализ 3 видов орхидных (С. 1п-
signe, Dendrobium nobile, Calanthe veitchii) с разной степенью редукции
зародышевого мешка показал, что у вида с наиболее редуцированным мешком
двойное оплодотворение осуществляется нерегулярно и образования
эндосперма не происходит. Слияние половых ядер происходит обычно по постми-
тотическому типу, у некоторых видов (Listera ovata) — по премитотическому.
У Е. atrorubens при постмитотическом типе объединения половых ядер в
большинстве исследованных зародышевых мешков наблюдался один случай пре-
митотического объединения. После оплодотворения в сохраняющейся синер-
гиде Е. scutella, E. atrorubens рибосомы большей частью собраны в полисомы.
В зиготе рибосомы также собраны в полисомы. Диктиосомы у Е. scutella
не были обнаружены, но отмечены у Е. atrorubens. В центральной клетке
наблюдается значительное число полисом, имеются запасные липиды.
Ультраструктура антипод сходна с ультраструктурой центральной клетки.
Образование эндосперма у большинства представителей орхидных
подавлено, первичное ядро эндосперма чаще всего, не делясь, довольно быстро
дегенерирует. У некоторых орхидных (Limodorum и др.) оно сохраняется
в течение длительного времени, увеличиваясь в объеме; однако деления его
не происходит и в конечном итоге оно дегенерирует. Там, где деление первичного
ядра эндосперма происходит, эндосперм развивается по нуклеарному типу.
Число ядер эндосперма от 2 (Cypripedium spectabile, С. parviflorum и др.)
до 16 (G. septentrionalis).
Эмбриогенез у орхидных, как правило, осуществляется по Onagrad- и
Asterad-типам. У Pogonia japonica отмечен Piperad-тип. Зародыш в зрелом
семени обычно не дифференцирован на органы, и лишь у некоторых видов
(Bletilla striata, Platyclinis sp., Sobralia macrantha, Dendrochilum sp., Thunia
marchalliana и др.) описано развитие семядоли. Однако вопрос о наличии
семядоли у некоторых видов орхидных остается дискуссионным (Батыгина,
Андронова, 1988). Вместе с тем уже на ранних этапах развития клетки
зародыша орхидных в зависимости от их расположения различаются
размерами, составом запасных питательных веществ и др. У Doritis pulcherrima
12 Зак. 2144
177
отмечена разница в содержании РНК между терминальной и базальной
клетками 2-клеточного проэмбрио. Изучение зародыша орхидных с помощью
сканирующего микроскопа показало, что среди его клеток можно выделить
3 типа клеточной организации. У Е. atrorubens (Жукова, Савина, 1978) в
ранний период эмбриогенеза выявлены различия в ультраструктурной организации
клеток базальной и апикальной частей зародыша на всех исследованных фазах
развития, отмечены различия в ультраструктуре клеточных оболочек, плазма-
леммы, в плотности и агрегации рибосом, а также по ряду других показателей.
Таким образом, несмотря на кажущуюся однородность клеток зародыша
орхидных, установлено, что в них имеются некоторые структурные различия,
т. е. выявляется определенная степень его дифференциации. Дифференциация
органов зародыша у орхидных происходит во время прорастания семени,
на начальных этапах которого образуется своеобразная структура «прото-
корм». Существуют различные трактовки природы листовых органов,
возникающих в процессе развития протокорма (Veyret, 1965, 1974; Терёхин, 1977;
Батыгина, Васильева, 1981; Батыгина, Андронова, 1988). Зародыш у орхидных
округлой или овальной формы, у многих видов обладает подвеском
различной структуры и сложности. По данным гистохимии, запасные вещества
в клетках зародыша представлены липидами, бурым полисахаридом неиз-.
вестной природы и белками, не дающими биуретовой реакции. Лейкоэмбрио-
фиты. Наличие хлороэмбриофитов нуждается в подтверждении.
В семействе широко распространены случаи полиэмбрионии.
Дополнительные зародыши образуются из синергид (О. militaris, Cephalanthera damasonium
и др.), нуцеллуса (Zeuxine sulcata, Z. strateumatica) и интегументов (Z. stra-
teumatica). Монозиготная полиэмбриония описана у С. bicolor, Spathoglottis
plicata и др., ложная полиэмбриония встречается у В. striata и Lecanorchis
japonica. Отмечены случаи факультативного партеногенеза (Epipactis latifo-
lia).
Исследованные роды и виды. Ла achalensis, Bletilla shepherdii,
B. striata, Broughtonia sanguinea, Calanthe aristulifera, С discolor, C. torifera,
C. veitchii, Calopogon pulchellus, Calypso bulbosa, Cephalanthera
damasonium, C. erecta, C. longifolia, C. rubra, Chamorchis alpina, Coeloglossum viride,
Corallorhiza maculata, Cremastra appendiculata, Cymbidium bicolor, Cypri-
pedium (9), Dendrobium anosmum, D. farmeri, D. macrostachyum, D. nobile,
Doritis pulcherrima, Eleorchis japonica, Ephippianthus schmidtii, Epidendrum
nocturnum, E. prismatocarpum, E. scutella, Epipactis latifolia, E. palustris,
E. pubescens, E. rubra, Epipogium aphyllum, Eulophia epidendraea, Eulophidium
sandersianum, Garcanthus pallidus, Gastrodia elata, Goodyera repens, Gym-
nadenia albida, G. camtchatica, G. conopsea, Habenaria (9), Hetaeria nitida,
H. shikokiana, Himantoglossum hircinum, Laccolabium pubescens,
Lecanorchis japonica, Limodorum abortivum, Listera nipponica, L. ovata, Myrmechis
japonica, Neottia nidus-avis, Nigritella nigra, Oncidium altissimum, 0. prae-
textum, Ophrys arachites, 0. arifera, 0. my odes, Orchis (15), Oreorchis patens,
Paphiopedilum (7), Phajus grandifolius, Ph. minor, Platanthera chlorantha,
P. obtusata, P. sachalinensis, P. tipuloides var. nipponica, Pogonia japonica,
P. macrophylla, Polystachya flavescens, Saccolabium matsuran, Serapias lingua,
S. pseudocordigera, Spiranthes alliance, S. cernua, Thunia marchalliana, Vanilla
plahifdlia, Zeuxine longilabris, Z. strateumatica, Z. sulcata.
Литература. Brongniart, 1831; Brown R., 1931; Braun, 1860; Hildebrand,
1863; Strasburger, 1878a, 1878b; Vesque, 1978; Monteverde, 1880; Ward, 1880;
Guignard, 1886; Rohrbach, 1886; Leavitt, 1900, 1901; Навашин, 1900; Hall, 1902;
Pace, 1907a, 1907b; Brown W., 1909; Dumee, 1910; Brown W. H., Sharp,
1911; Sharp, 1912; Chodat, 1913; Chamberlain, 1914; Баранов, 1915, 1917, 1924,
1925; Dahlgren, 1915; Dathrie, 1915; Heusser, 1915; Kusano, 1915; Afzelius,
1916, 1928, 1954; Модилевский, 1918; Palm, 1920; Rutgers, 1923; Сенянинова,
1924; Fuchs, Ziegenspech, 1924; Hoffman, 1926; Yahama, 1926; Tuschnjakova,
1929; Prosina, 1930; Francini, 1931; Pastrana, Santos, 1931; Seshgiriah, 1932a,
1932b, 1941; Pardi, 1937; Stenar, 1937—1948; Carlson, 1940, 1945; Barder,
1942; Hagerup, 1944, 1945, 1947; Swamy, 1944, 1945, 1946a, 1946b, 1947, 1948,
1949; Johansen, 1950; Maheshwari, Narayanaswami, 1952; Поддубная-Арнольди,
178
1952, 1954, 1956,- 1958, 1959, 1960a, 19606, 1965, 1976, 1982; Krupko, 1954;
Geitler, 1956; Veyret, 1956, 1957, 1965, 1981; Поддубная-Арнольди, Селезнева,
1957; Цингер, Поддубная-Арнольди, 1957; Gilliland, 1958; Withner, 1959;
Niimoto, Sagawa, 1961, 1962; Полунина, 1961; Sagawa, Niimoto, 1961; Israel,
1963; Cocucci, 1964, 1969; Israel, Sagawa, 1964; Rao, 1964, 1967; Савина, 1964,
1965, 1971, 1972a, 19726, 1974, 1978, 1979; Цингер, Поддубная-Арнольди,
Петровская-Баранова, 1964; Jeynayaghy, Rao, 1966; Тахтаджян, 1966, 1970;
Abe, 1967, 1968a, 1968b, 1972a, 1972b, 1976, 1977; Rodkiewicz, G6rska-Bry-
lass, 1967; Kimura, 1968a, 1968b; Терёхин, Никитичева, 1968; Tohda, 1968,
1971a, 1971b, 1974a, 1974b; Cocucci, Jensen, 1969a, 1969b, 1971; Терёхин, Камели-
на, 1969, 1972; Rajan, 1971; Rodkiewicz, Kadej, 1971; Prakash, Lee-Lee, 1973;
Яковлев, Жукова, 1973, 1980; Поддубная-Арнольди, Цингер, Петровская, 1974,
1976; Rodkiewicz, 1975; Schulz, 1975; Rodkiewicz, Bednara, 1976; Ansari, 1977;
Ekanthappa, Arekal, 1977a, 1977b; Bednara, 1978; Жукова, Савина, 1978;
Rodkiewicz, Stoliecka, 1978; Mohana Rao P. R., Sood, 1979; Bednara* Kuras,
Rodkiewicz, 1981; Karanth, Swamy, Arekal, 1981; Liang Hanxing, 1983, 1984;
Sood, 1983, 1984, 1985; Yasugi, 1983; Rao P. R., Rao M. К. М., 1984; Savina,
Zhukova, 1984; Батыгина, Шевцова, 1985; Stort, Dos Santes, 1985; Андронова,
1986; Sawesh K. S., 1986; Sawesh K. S., Rao P. R. M., 1986; Шевцова, 1986;
Philip, Nainar, 1987; Ren Ling, Wan Fuxiong (Wan Fuhsiung), 1987; Vij,
Sharma, 1987, Батыгина, Андронова, 1988.
12*
Порядок 8. BROMELIALES
Семейство BROMELIACEAE
Пыльник у Ananas comosus 2-гнездный. Сформированная стенка гнезда
пыльника состоит из эпидермиса, эндотеция, 2 средних слоев и тапетума.
При созревании один средний слой дегенерирует, во втором, как и в эндоте-
ции, развиваются фиброзные утолщения. Тапетум с 2-ядерными клетками,
клеточный секреторный. Тетрады микроспор изобилатеральные,
тетраэдральные или линейные. Зрелые пыльцевые зерна 2-клеточные. У Tillandsia caput-
medusae в вегетативной клетке пыльцевого зерна откладывается крахмал.
Перед вскрытием пыльника в вегетативной клетке образуется крупная
вакуоль. В синтезе ее содержимого принимают участие пластиды, транспортируя
в вакуоль концентрические мембранные образования. По мере их формирования
в пластидах отмечается постепенное исчезновение крахмала. При
ультраструктурном исследовании развития пыльцевого зерна Т. caput-medusae авторы
выделили 3 стадии, которые согласуются с основными стадиями развития,
описанными для цветковых растений. На 3-й стадии в протопласте
генеративной клетки выявляется полярность, наблюдаются фрагментарное
исчезновение клеточной оболочки и активизация процесса биогенеза микротрубочек.
Отмечается тесная связь ядра вегетативной клетки с генеративной клеткой.
В цитоплазме последней на первой стадии развития наблюдали пластиду
(Brighigna et al., 1980, 1981).
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная или тену-
инуцеллятная. У A. comosus большинство семяпочек анатропные 3—9 % —
ортотропные, с одним интегументом. Наружный интегумент 4-слойный,
внутренний — 2-слойный; у Lindmania penduliflora наружный и внутренний интегу-
менты 2-слойные. Микропиле образовано внутренним интегументом. У A.
comosus развивается гипостаза. Археспорий одноклеточный. Археспориальная
клетка отделяет париетальную, которая образует 1—2 слоя париетальной
ткани. У Tillandsia usneoides париетальная клетка не образуется. Тетрада
мегаспор линейная.
Зародышевый мешок развивается из халазальной мегаспоры по
Polygonum-типу. Синергиды грушевидные. Полярные ядра обычно сливаются до
оплодотворения в халазальном конце зародышевого мешка. У A. comosus
полярные ядра сливаются в халазальном, микропилярном конце или в центре
зародышевого мешка. У Т. usneoides полярные ядра сливаются до
оплодотворения, во время оплодотворения или после него. 3 антиподы маленькие,
эфемерные. У A. comosus они дегенерируют через 12—24 ч, иногда
наблюдается и через 5 сут после цветения.
Эндосперм гелобиальный. У Tillandsia recurvata — нуклеарный (Birge,
1911), однако высказано мнение (Swamy, Parameswaran, 1963) о
необходимости переисследования эндосперма у Т. usneoides и Т. recurvata.
Эмбриогенез Asterad-типа Muscari-вариации. Зигота у A. comosus находится
в состоянии покоя в течение 10 сут. Максимального размера она достигает
через 50 сут после цветения. Зрелые семена с обильным эндоспермом и чаще
с маленьким, но иногда и с довольно крупным зародышем. Зародыш A.
comosus содержит белки, жиры и в небольшом количестве крахмал.
Исследованные виды. Ananas comosus, A. sativa var. microcep-
hala, Cryptanthus acaulis, С bivittatus, Lindmania penduliflora, Pitcairnia
paniculata, Tillandsia caput-medusae, T. recurvata, T. usneoides.
Bromeliaceae
1—7 — Ananas comosus, 8—20, 22 — Tillandsia recurvata, 21, 23—35 — T. usneoides
1—4 — развитие стенки пыльника; 5 — диада; 6,7 — тетрада микроспор; 8 — семяпочка с археспо-
риальной клеткой; 9 — семяпочка с мегаспороцитом и кроющими клетками; 10 — развитие интегу-
ментов; //—14 — мегаспорогенез; 15—18 — развитие зародышевого мешка; 19 — первое и второе
деления эндоспермальных ядер; 20, 21 — семяпочки; 22 — халазальный конец зародышевого мешка;
23 — эндоспермальная ткань в халазальном конце зародышевого мешка;
180
Bromeliaceae (продолжение)
24—35 — эмбриогенез. {1—7 — по Rao, Wee, 1978; 8—20, 22 — по Birge, 1911; 21, 23—35 — по
Billings, 1904).
Литература. Billings, 1904; Birge, 1911; Tischler, 1913, 1915; Palm,
1920; Susenguth, 1921; Szidat, 1922; Martin, 1946; Okimoto, 1948; Guttenderg,
Riebe, 1957; Swamy, Parameswaran, 1963; Lakshmanan, 1967; Wee, Rao, 1974;
Rao, Wee, 1979; Brighigna et al., 1980a, 1980b, 1981.
Порядок 9. JUNCALES
Семейство JUNCACEAE
Пыльник 4-гнездный. У Luzula pedemontana (ориг.) развитие стенки гнезда
пыльника происходит центростремительно. Сформированная стенка состоит
из эпидермиса, эндотеция, среднего слоя и тапетума. У ]uncus bufonius клетки
эпидермиса и эндотеция содержат крахмал, который исчезает по мере
созревания пыльника (Shah, 1963). В эндотеции развиваются фиброзные утолщения.
У /. effusus и /. prismatocarpus эндотеции нерегулярно 2-слойный (Zaman,
1950). Средний слой эфемерный, за исключением Oxychloe andina, в клетках
среднего слоя которого развиваются фиброзные утолщения (Brenner, 1922).
Тапетум клеточный секреторный, его клетки обычно одноядерные, реже —
2-ядерные. У L. pedemontana и О. andina тапетум нерегулярно 2-слойный.
Тетраэдральные и изобилатеральные (у L. pedemontana редко —
крестообразные) тетрады микроспор образуются симультанно. Зрелые пыльцевые зерна
3-клеточные и обычно соединены в тетрады.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная.
Микропиле образовано внутренним интегументом. У Luzula в образовании
микропиле участвуют оба интегумента. У /uncus roemerianus клетки
внутреннего интегумента, выстилающие микропиле, со стадии 4-ядерного
зародышевого мешка начинают увеличиваться в размерах. К стадии зрелого за-
/—10а — Luzula pedemontana, 11—18 — Juncus filiformis, 19—31 — Luzula pilosa
1—4 — некоторые стадии развития стенки гнезда пыльника;
183
Juncaceae (продолжение)
5—8 — формирование тетрад микроспор; 9, 10 — фрагменты стенки пыльника на стадии 2-клеточ-
ных пыльцевых зерен (9) и зрелых пыльцевых зерен (10); 4а, 10а — схемы строения пыльника на
поперечном срезе;
родышевого мешка их размеры в 2—3 раза превышают первоначальные
параметры (Eleuterius, 1984). Наружный интегумент в средней, не сросшейся
с фуникулусом части у Juncus состоит из 2, а у Luzula — из 4 слоев клеток.
Внутренний интегумент 2-слойный. У большинства видов Juncus в клетках
184
Juncaceae (продолжение)
11, 12, 14 — строение семяпочки на стадии мегаспороцита, тетрады мегаспор и зрелого
зародышевого мешка; 13 — 4-ядерный зародышевый мешок; 15 — деление ядра первичной клетки эндосперма;
16 — халазальная клетка и фрагмент микропилярной клетки эндосперма, антиподы (16а) хорошо
различимы;
внутреннего эпидермиса внутреннего интегумента откладываются дубильные
вещества. В период созревания зародышевого мешка нуцеллус 2-слойный
в микропилярной части, 3-слойный — в латеральной и более мощный — в ха-
лазальной части. Клетки эпидермиса нуцеллуса постепенно разрастаются
и вакуолизируются, в то время как клетки других слоев нуцеллуса дегене-
185
Juncaceae (продолжение)
17,18 — микропилярная (17) и халазальная (18) части семяпочки перед делением зиготы; 19—31 —
некоторые стадии развития зародыша. (/—18 — ориг.; 19—31 — по Juguet, 1969).
рируют. Археспорий одноклеточный, однако у /. effusus и /. prismatocarpus
иногда закладываются 2—3 археспориальные клетки, но в дальнейшем
функционирует лишь одна. Преобразование археспориальной клетки в мегаспо-
роцит происходит с отделением париетальной клетки (за исключением /. гоете-
rianus), которая в дальнейшем формирует 1—2 париетальных слоя. Тетрада
мегаспор линейная, у /. bufonius — иногда Т-образная.
1 -Зародышевый мешок развивается из халазальной мегаспоры по Polygonum-
тйпу.^Зрелый зародышевый мешок удлиненно-овальной формы, у /. гоете-
186
rianus он сужается к халазальному концу. У /. filiformis синергиды крупные
(ориг.), с нитчатым аппаратом. У большинства видов 3 небольшие антиподы
сохраняются на ранних стадиях эмбриогенеза, однако у /. bufonius они
эфемерны. Полярные ядра сливаются до оплодотворения вблизи яйцевого аппарата.
Эндосперм развивается по гелобиальному типу. Первичное ядро эндосперма
делится вблизи антипод, в результате чего формируется крупная микропи-
лярная клетка и небольшая халазальная. Деления ядер в микропилярной
клетке происходят сначала без цитокинеза, но в дальнейшем наблюдается
заложение клеточных перегородок. У /. bufonius халазальная клетка
одноядерная, у /. filiformis — 1—2-ядерная; у /. effusus число ядер в халазальной
клетке может достигать 8, после чего начинается клеткообразование. В
процессе развития зародыша клетки халазальной части эндосперма дегенерируют.
У /. bufonius клетки периферического слоя эндосперма содержат липиды,
а клетки центральной части заполнены крахмалом. У /. effusus и /. prisma-
tocarpus крахмал отмечен и в клетках периферического слоя.
Эмбриогенез соответствует Onagrad-типу Juncus-вариации. У /. bufonius
зигота делится после того, как в микропилярной клетке эндосперма образуется
16 ядер. Подвесок короткий, у /uncus — из 2, а у Luzula — из 3 клеток.
Зародыш в сформированном семени дифференцирован на семядолю, почечку
и зародышевый корень с корневым чехликом. Большую часть зародыша
составляет терминальная семядоля, почечка занимает латеральное положение.
Лейкоэмбриофиты (Яковлев, Жукова, 1973, 1980).
Исследованные виды. Distichia muscoides, i uncus bufonius,
J. compressus, J. conglomerate, J. effusus, J. filiformis, J. glaucus, J. lampo-
carpus, J. prismatocarpus, J. roemerianus, J. squarrosus, /. subnodulosus,
J. tenuis, Luzula campestris, L. forsteri, L. maxima, L. multiflora, L. pedemon-
tana, L. pilosa, L. purpurea, Oxychloe andina.
Литература. Elfling, 1879, 1880; Fischer, 1880; Wille, 1882 (1883);
Strasburger, 1884; Laurent, 1903a, 1903b, 1904; Tackholm, Soderberg, 1918;
Brenner, 1922; Soueges, 1923, 1933; Wulff, 1939; Almeida, Sampayo, 1950;
Zaman, 1950; Shah, 1959, 1963; Bartkowia, Brukaczyk, 1965; Juguet, 1969, 1973;
Яковлев, Жукова, 1973, 1980; Eleuterius, 1984; Анисимова, ориг. данные.
Семейство THURNIACEAE
Эмбриологически не изучено.
Семяпочка анатропная, с 2 интегументами.
У Thurnia sphaerocephala зародыш в зрелом семени
овально-цилиндрический, вероятно, малодифференцированный, занимает менее половины объема
семени (Немирович-Данченко, 1985). Эндосперм обильный, содержит
крахмал.
Исследованный вид. Thurnia sphaerocephala.
Литература. Engler, 1964; Немирович-Данченко, 1985.
Порядок 10. CYPERALES
Семейство CYPERACEAE
Пыльник 4-гнездный. Сформированная стенка гнезда пыльника 4-слойная,
развивается центростремительно и состоит из эпидермиса, эндотеция, среднего
слоя и тапетума. Эндотеций со спиральными утолщениями. Сведения о
наличии фиброзных утолщений подвергаются сомнению (Makde, 1981). Тапетум
секреторного типа, его клетки постоянно остаются одноядерными, редко —
единичные клетки могут быть 2-ядерными. Стенка зрелого пыльника состоит
из эпидермиса и эндотеция. Некоторые клетки эпидермиса увеличиваются
в размерах и в них накапливаются танины. Характер микроспорогенеза в сем.
Сурегасеае отличается от других цветковых. В результате 2 делений мейоза
образуется как обычно 4 равных по величине ядра. Цитокинез симультанного
типа. Однако в дальнейшем лишь одно из ядер остается жизнеспособным,
3 остальных постепенно уменьшаются в размерах и дегенерируют, поэтому
правильных тетрад микроспор не формируется. Образования с одним
функционирующим ядром и 3 дегенерирующими имеют грушевидную форму, их
принято называть «криптомонадами», или «псевдомонадами». Дегенерирующие
микроспоры располагаются обычно в терминальной зоне псевдомонад и лишь
у Rhyncospora japonlca они находятся в базальной зоне. В последнем случае
псевдомонады имеют обратногрушевидную форму. Как считают некоторые
авторы, клеточные оболочки между ядрами псевдомонады образуются не всегда.
На этом основании сложилось не совсем обоснованное представление об их
отсутствии у части видов семейства или об образовании септ — очень тонких
клеточных оболочек. Часто переисследования приводят к их обнаружению.
Дегенерирующие ядра микроспор в редких случаях обладают слабой
способностью к делениям, но и при наличии последних все дочерние ядра
объединяются и дегенерируют. Дегенерация нефункционирующих микроспор
происходит у разных видов на разных этапах: у одних остатки дегенерирующих
ядер сохраняются при наличии в псевдомонаде 2-клеточных или даже 3-клеточ-
ных пыльцевых зерен (Cyperus tegetum, С. alternifolius); у многих других
видов дегенерация происходит более быстрыми темпами. Отмечено
образование из одной псевдомонады 2 жизнеспособных пыльцевых зерен. Возможны
также случаи возникновения аномальных 5—4-ядерных пыльцевых зерен
(Bulbostylis barbata, Cyperus articulatus). У некоторых видов все 4 микроспоры
псевдомонады могут быть нефункционирующими (Eleocharls geniculate,, С.
articulatus, В. barbata, Kyllinga brevifolia, Cyperus iria). Причины
функционирования только одной из 4 микроспор псевдомонады долгое время
оставались неясными, так как аномалий в мейозе обнаружено не было. Лишь в самое
последнее время на примере Carex ciliato-marginata было показано, что в
нефункционирующих микроспорах не происходит репликации ДНК (Hoshino,
Takuju, 1986). Зрелые пыльцевые зерна 3-клеточные, содержат крахмал.
В спермиях Heleocharis palustris пластиды не обнаружены (Carniel, 1972).
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Микропиле
образуется внутренним интегументом. Оба интегумента 2-слойные. В области
фуникулиса, вблизи от проводящего пучка имеется воздухоносная камера,
которая рассматривается как приспособление к водным условиям обитания.
Характерно наличие обтуратора и гипостазы. Обтуратор образуется у осно-
Сурегасеае
1—3 — Cyperus tegetum, 4—13,29 — Kyllinga melanospora, 14—27 — Diploctrum caricinum, 28,30—
33,44,45 — Scleria foliosa, 34—43 — Eleocharls plantaginea, 46—48 — Kobresia bellardii, 49 —
Cyperus articulatus
1—3 — формирование микроспороцитов и стенки пыльника; 4, 5 — развитие стенки пыльника и
микроспороцитов до стадии тетрады микроспор; 6—10 — мейоз в микроспороцитах и образование
тетрад микроспор, только одна, наиболее крупная из микроспор, остается функционирующей;
11, 12 — одно- и 2-клеточные пыльцевые зерна; 13, 14 — зрелые 3-клеточные пыльцевые зерна;
15—22 — аномалии в развитии пыльцевых зерен; 23, 24 — семяпочки с мегаспороцитом (23) и
тетрадой мегаспор (24); 25, 26 — последовательные стадии развития зародышевого мешка Polygonum-
типа; 27—29 — зрелые зародышевые мешки;
26
Cyperaceae (продолжение)
30—32 — развитие гаусторий эндосперма; 33 — развивающееся семя с зародышем и эндоспермом;
34—43 — эмбриогенез; 44 — зародыш, семядоля которого имеет палиллообразные выросты; 45 —
зрелое семя; 46—48 — 2 зародышевых мешка в одной семяпочке, в каждом из которых развивается
зародыш; 49 — 2 зародыша, образовавшихся из клеток яйцевого аппарата одного зародышевого
мешка. (1—3 — по Padhye, Moharir, 1958; 4—13, 29 — по Khanna, 1965; 14—27 — по Nijalingappa,
Devaki, 1978; 28,30—33,44,45 — по Nijalingappa, 1986; 34—43 — по Shah, 1971; 46—48 — по Juguet,
1967; 49 — по Shah, 1965).
вания фуникулуса на стадии зрелого зародышевого мешка. Формирующие
его клетки секреторные. Сохраняется обтуратор до стадии глобулярного
зародыша. Гипостаза становится отчетливо различимой после оплодотворения.
Клетки ее сначала богатоплазменные, но постепенно количество цитоплазмы
в них уменьшается, клеточные оболочки утолщаются, накапливаются танины.
Гипостаза сохраняется в зрелом семени, но клетки ее к этому времени уже
лишены и цитоплазмы, и ядер. Проводящий пучок доходит до гипостазы
у большинства представителей семейства, но у некоторых он заканчивается
у основания фуникулуса (С. alternifolius). Археспорий одноклеточный, очень
редко 2-клеточный, но функционирует в дальнейшем, как правило, лишь одна
клетка. При делении археспориальной клетки образуются мегаспороцит и
париетальная клетка. В результате, делений последней формируется париетальная
ткань, состоящая из 2—8 слоев клеток в зависимости от вида. Мейоз
завершается образованием линейной, редко — Т-образной тетрады мегаспор.
Функционирующей является халазальная мегаспора.
Зародышевый мешок развивается по Polygonum-типу. В зрелом
зародышевом мешке яйцеклетка крупная, овальная, с большой базальной вакуолью.
Синергиды грушевидные, с нитчатым аппаратом и крючковидными выростами,
имеют характерную для них поляризацию. Антиподы располагаются линейно или
Т-образно в зауженном халазальном конце зародышевого мешка. Они
дегенерируют вскоре после оплодотворения. Полярные ядра сливаются до
оплодотворения или в течение его (С у per us) и находятся в это время вблизи клеток
яйцевого аппарата. Оплодотворение порогамное.
Эндосперм нуклеарный. Триплоидное ядро эндосперма делится раньше
зиготы. До образования 100—120 ядер деления осуществляются синхронно.
Клеткообразование в эндосперме у разных таксонов начинается на различных
стадиях развития зародыша: при 2-клеточном зародыше (Scleria stocksiana, S.
lithosperma), при 4-клеточном (Pycreus pumilis, С. alternifolius и др.) либо
еще позже. Направленность клеткообразования в эндосперме может быть
разной: от микропиле к халазе у К bievifolia и С. iria\ от периферии
зародышевого мешка к центру — у Fimbristylis tetragona, Fuirena trilobites, Kyllinga
triceps, Pycreus sanguinolehtus и Carex alopecuroides. Хорошо развитые эндо-
спермальные гаустории описаны у Scleria foliosa и Rhynchospora corymbosa.
Менее развитые халазальные гаусториальные выросты эндосперма характерны
для S. stocksiana и С. iria. Микропилярный эндоспермальный гаусторий,
в котором рано дегенерирует ядро и количество цитоплазмы незначительно,
развит только у S. foliosa. Халазальные гаустории многоядерные,
клеткообразование в них начинается значительно позже, чем в собственно эндосперме,
часто при наличии глобулярного зародыша. В зрелом семени гаусторий не
сохраняется. Клетки эндосперма при созревании семени становятся
многоядерными, возможна полиплоидизация ядер. Эндосперм богат запасными
питательными веществами, крахмалом, белком, жирами, он сохраняется в зрелом
семени. Сведения о наличии у представителей семейства руминированного
эндосперма подвергаются сомнению (Khanna, 1965).
Зародыш на ранних этапах у всех представителей семейства развивается
сходно и соответствует Onagrad-типу Juncus-вариации. Сообщение о
наличии у Scirpus mucronatus Asterad-типа эмбриогенеза (Khanna, 1965) не
подтвердилось более поздними исследованиями (Nijalingappa, Tejavathi, 1977).
Взаиморасположение органов в зрелом зародыше у представителей семейства
неоднотипно. Почечка и зародышевый корень могут занимать латеральное,
базальное или переходное между ними положения.- На этом основании
выделено несколько типов зрелых зародышей: Сагех-тип, Cyperus-тип, Bulbostylis-
тип и Schoenus-тип (Schneider, 1932; Shah, 1965; Veken, 1965). Семядоля
зрелого семени S. foliosa и С. alternifolius имеет папилловидные выросты.
В зрелом семени зародыш занимает 1/5 часть его объема. Лейкоэмбриофиты.
Наличие 2 проростков, происхождение которых осталось неизвестным,
обнаружено у Eleocharis prolifera, E. vivipara, Isolepis prolifera, I. thouarsii,
Dichronema pubera, Scirpus atrovirens (Braun, I860). Возможность развития
2 зародышевых мешков в одной семяпочке и образование в каждом из них
зародыша описано для Carex pendula (Shah, Neelakandan, 1971).
191
Исследованные виды. Bulbostylis barbata, Carex (14), Cyperus
(16), Dichronema pub era, Diplacrum caricinum, D. radicans, Eleocharis (=He~
leocharis) geniculata, E. palustris, E. prolifera, E. vivipara, Eriophorum angus-
tifolium, Fimbristylis dichotoma, F. diphylla, F. monostachya, F. quinquangularis,
F. tetragona, Fuinera trilobites, Hypolytrum latifolium, I solepis prolifera, I. thouar-
sii, Kobresia bellardi, Kullinga brevifolia, К melanospora, К monocephala,
К triceps, Pycreus globolus var. miligiricus, P. pumilis, P. sanguinolentus,
Rhynchospora corymbosa, R. japonica, Scirpus (9), Scleriafoliosa, S. lithosperma,
S. stocksiana.
Литература. Pointeau, 1809; Braun, 1860; Vesque, 1878; Elfving, 1879;
Wille, 1882, 1886; Tieghem van der, 1897; Juel, 1900; Stout, 1913; Suessenguth,
1921; Pieck, 1924a, 1924b, 1928a, 1928b; Кострюкова, 1930; Schnarf, 1931;
Schneider, 1932; Tanaka, 1939a, 1939b, 1940, 1941, 1950; Wulff, 1939; Dnyansagar,
Tiwary, 1956a, 1956b; Khanna, 1956,1963,1965; Guttenberg, Semlow, 1957; Gupta,
1958,1959,1962; Padhye,Moharir, 1958; Padhye, 1959,1960,1968,1969,1971; Guig-
nard, 1961, 1962; Koyama, 1961; Carniel, 1962a, 1962b, 1971, 1972; Shah, 1962,
1964, 1965; Veken van der, 1965; Juguet, 1966a, 1966b, 1967a, 1967b, 1969,
1970a, 1970b, 1972; Juguet, Lebegue, 1966; Murty, Kumar, 1967; Nagaraj,
Nijalingappa, 1968, 1972, 1973; Kamdar, 1969a, 1969b, 1969c; Padhye, Chaube,
1969; Padhye, Jyer, 1969; Padhye, Geen, Kaur, 1969; Jarar, Mukhevjee, 1969;
Tiwari, 1969a, 1969b; Untawale, Padhye, 1969a, 1969b; Padhye, Chaube, Jyer,
1970; Padhye, Kasture, 1970; Shah, Neelakandan, 1971; Untawale, Makde, 1971,
1984; Яковлев, Жукова, 1973, 1980; Nijalingappa, 1977, 1986; Nijalingappa,
Tejavathi, 1977, 1983; Nijalingappa, Devaki, 1978, 1979; Тодераш, Чеботарь,
1978; Nagaraj, 1980; Tejavathi, 1980, 1987; Тодераш, 1980; Makde, 1981a, 1981b,
1982a, 1982b; Nijalingappa, Arekal, 1983; Vallade, 1983; Makde, Bhuskute,
1984, 1987; Utawale, Makde, 1984; Hoshino Takuji, 1986.
Порядок И. COMMELINALES
Семейство RAPATEACEAE
Пыльник 4-гнездный, 2-тековый, вскрывается субэпидермальной короткой
продольной щелью или настоящей апикальной порой (Spathanthus bicolor).
У Mashalocephalus dinklagei перед созреванием пыльника перегородка между
гнездами в теках разрушается и гнезда объединяются попарно, чего,
по-видимому, не происходит у Saxofridericia regalis. Стенка гнезда пыльника
формируется центростремительно по типу однодольных и состоит из эпидермиса,
Rapateaceae
1,15,16,18,19, 22—24, 27—33 — Spathanthus bicolor, 2,11,13, 14, 26 — Maschalocephalus, 3, 5, 21 —
Saxofridericia regalis, 4, 6—9,17 — Rapatea paludosa, 10,12 — R. rugulosa, 20 — Spathanthus unila-
teralis, 25 — Stegolepis guianensis
1—14 — развитие пыльника: 1 — гнездо молодого пыльника с микроспороцитами, 2 — гнездо
пыльника на стадии тетрад, разделенное перегородкой из тапетальных клеток, 3 — поперечный срез
зрелого пыльника (схема, штриховкой показан фиброзный слой), 4, 5 — фрагменты стенки гнезда
зрелого пыльника, танин и крахмальные зерна в эпидермисе, фиброзные утолщения в эндотеции,
6—8 — отдельные стадии мейоза, симультанный тип образования тетрад микроспор, 9, 10 —
тетрады микроспор, //, 13, 14 — зрелое пыльцевое зерно (продольный и поперечные срезы),
13 Зак. 2144
193
Rapateaceae (продолжение)
12 — генеративная клетка у стенки пыльцевого зерна; 15—27 — мегаспорогенез и развитие
зародышевого мешка: 15 — субэпидермальное заложение археспориальной клетки, 16 — мегаспоро-
цит и 2 париетальные клетки над ним, инициали интегументов, 17 — мегаспороцит в каллозной
оболочке, 18, 19 — образование тетрады мегаспор, 20 — семяпочка с эндостомом, 21 — то же,
с эндостомом и экзсостомом, 22—24 — 1—2 и 4-ядерный зародышевые мешки, 25, 26 — семяпочка
со зрелым зародышевым мешком (схема), 27 — зрелый зародышевый мешок; 28—33 — отдельные
стадии эмбриогенеза, зрелый зародыш (33) слабо дифференцирован. (/—33 — по Tiemann, 1985).
эндотеция, 1—4 средних слоев и тапетума. Клетки эпидермиса в зрелом
пыльнике Rapatea paludosa и S. regalis заполнены танином и незначительным
количеством крахмальных зерен (S. regalis), наружная поверхность их
покрыта сильно структурированной кутикулой. Клетки радиально вытянуты
у R. paludosa и тангентально — у остальных изученных видов (Cephalostemon
angustatus и др.) и имеют утолщенные оболочки. Фиброзные утолщения
в эндотеции развиваются вокруг каждого гнезда пыльника, за исключением
области связника. У С. angustatus и М. dinklagei они имеются и в части клеток
связника. Средние слои эфемерны (S. regalis, С. angustatus) или же сохраняются
и в зрелом пыльнике (R. paludosa), оболочки их сильно утолщены. Тапетум
секреторный, с 2-ядерными клетками. У М. dinklagei в гнездах пыльника из
тапетальных клеток образуются временные перегородки, не сохраняющиеся
в зрелом пыльнике. Стенка зрелого пыльника 2-слойная (эпидермис и
фиброзный эндотеции) у S. regalis или многослойная за счет сохраняющихся
средних слоев у R. paludosa. Тетрады микроспор тетраэдральные или
крестообразные, образуются по симультанному типу. Зрелые пыльцевые зерна 2-клеточные.
Генеративная клетка округлой или веретенообразной формы.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная, с заметно
развитым фуникулярным обтуратором и микропиле, образованным обоими
интегументами. Внутренний из них 2-слойный, содержит танины, наружный
состоит из 1—3 слоев, варьируя в отдельных родах. У ряда видов клетки
эпидермиса нуцеллуса радиально вытягиваются и часть из них делится перикли-
нально. Единственная археспориальная клетка делится, образуя спорогенную
и париетальную клетки, последняя в свою очередь формирует 1—2
париетальных слоя посредством нескольких антиклинальных или периклинальных
делений. В результате мейоза образуется линейная тетрада мегаспор. Халазальная
мегаспора развивается, остальные дегенерируют.
Зародышевый мешок моноспорический, Polygonum-типа. У Maschalocepha-
lus и Potarophytum образуется несколько мелких антиподальных клеток, у других
исследованных родов — только 3 клетки, которые во всех случаях дегенерируют
довольно рано. Оплодотворение порогамное.
Эндосперм нуклеарный, причем его ядра сосредоточиваются в халазальном
конце зародышевого мешка, и клеточные перегородки образуются очень поздно.
В зрелом семени эндосперм сохраняется, содержит запасной крахмал и белки.
Эмбриогенез Asterad-типа Репаеа-вариации. Клетка cb 2-клеточного проэмб-
рио делится продольно, суспензор отсутствует. Зрелый зародыш чечевице-
образный, недифференцированный.
Исследованные виды. Cephalostemon angustatus, Maschalocepha-
lus dinklagei, Potarophytum riparium, Rapatea friderici-augusti, R. paludosa,
R. rugulosa, R. xiphoides, Saxofridericia aculeata, S. regalis, Spathanthus
bicolor, S. unilateralis, Stegolepis guianensis.
Литература. Tiemann, 1985.
/
Семейство XYRIDACEAE
Пыльник 4-гнездный, гнезда объединены в 2 теки. Развитие стенки
пыльника происходит центростремительно. Сформированная стенка гнезда пыльника
состоит из эпидермиса, эндотеция, среднего слоя и тапетума. Фиброзные
утолщения в эндотеции развиваются только у Abolboda grandis. Единственный
средний слой у всех исследованных видов эфемерный. Тапетум секреторный,
без реорганизации у видов Xyris, с 2-ядерными клетками (Xyris indica) или
только с частью 2-ядерных клеток (X. pauciflora). У A. grandis клеточный
тапетум реорганизуется в ложный периплазмодий после разобщения
микроспор из тетрад. Спорогенная ткань многорядная (виды Xyris), но
однорядная у A. grandis. Изобилатеральные, изредка крестообразные тетрады
микроспор образуются по сукцессивному типу. У X. indica веретенообразная
генеративная клетка отделяется у внутренней стороны микроспор, находящихся
в тетраде (Weinzieher, 1914). Зрелые пыльцевые зерна одиночные, 2-клеточ-
13*
195
Xyridaceae
1—5, 8—26 — Xyris pauciflora, 6,7 — Abolboda grandis
1—5 — развитие пыльника: / — фрагмент гнезда молодого
пыльника со спорогенной тканью, 2 — стенка пыльника
с дегенерирующим ^средним слоем, 2-ядерный тапетум,
3, За — образование тетрад микроспор по сукцессивному
типу, 4 — отчленение генеративной клетки с внутренней
стороны микроспор в тетраде, 5 — фрагмент гнезда зрелого
пыльника, фиброзные утолщения в эндотеции отсутствуют;
6—14 — мегаспорогенез и развитие зародышевого мешка:
6,7 — семяпочка (схема) и линейная тетрада мегаспор,
8—14 — последовательные стадии развития биспорического
зародышевого мешка Allium-типа; 15, 16 — эндоспермоге-
нез: 15 — нуклеарный эндосперм, агрегация ядер в хала-
зальном конце зародышевого мешка, 16 — клеточная стадия
эндосперма, одно- и многоядерные клетки, в халазальном
конце сохраняются свободные ядра;
Xyridaceae (продолжение)
17—26— эмбриогенез (26— отсутствие дифференциации в зрелом зародыше). (/—5, 8—26 —
по Govindappa, 1955; 6—7—по Tiemann, 1985).
ные (X. pauciflora, A. grandis) или 3-клеточные у X. indica. Для A. grandis
характерны очень крупная богатоплазменная с ясно видимой вакуолизацией
цитоплазмы генеративная клетка и дегенерирующее вегетативное ядро.
Семяпочка (несколько или множество) — ортотропная у видов Xyris или
близкая к кампилотропной (X. nigromucronata), слабокампилотропная (Огес-
tanthe), анатропная (A. grandis и Achlyphila), тенуинуцеллятная (X. раи-
ciflora и X. schoenoides) или слабокрассинуцеллятная {A. grandis) с 2 обычно
2-слойными интегументами. Микропиле образовано обоими интегументами,
которые также принимают участие в формировании семенной кожуры. В
процессе развития семени клетки обоих слоев внутреннего интегумента
заполняются флабофенами (A. americana, Orectanthe sceptrum), оболочки их в мик-
ропилярной части семяпочки могут сильно утолщаться (A. americana). У видов
Xyris происходит одревеснение и опробковение оболочек клеток внутреннего
интегумента. В зрелом семени халаза массивная, клетки ее также заполнены
флабофенами. Нуцеллус дегенерирует очень рано и на поздних стадиях
развития семени только в микропилярной части можно обнаружить
маленький нуцеллярный колпачок-эпистазу и остатки нуцеллуса в виде тонкой пленки,
отделяющей эндосперм от внутреннего интегумента. Закладывающаяся субэпи-
дермально единственная археспориальная клетка развивается в мегаспороцит
без отчленения париетальной клетки. У видов рода Xyris в процессе мегаспо-
рогенеза микропилярная клетка диады, образовавшаяся в результате мейоза I,
дегенерирует, в то время как ядро халазальной клетки диады делится^-возни-
кающая при этом клеточная пластинка быстро исчезает, и образовавшийся
2-ядерный ценоцит дает начало зародышевому мешку. В роде Abolboda в
результате мейоза формируется линейная тетрада мегаспор, халазальная из
которых становится функционирующей, остальные 3 дегенерируют. Тем самым
определяются 2 типа зародышевого мешка, встречающиеся в семействе.
Зародышевый мешок у изученных видов рода Xyris биспорический, 8-ядер-
ный, Allium-типа. Этот тип, по-видимому, может считаться основным в роде
197
Xyris (Ramaswamy, Raju, 1982). Развитие зародышевого мешка по Polygonum-
типу у X. indica (Weinzieher, 1914) требует уточнения, так как и у этого вида
автор наблюдал в процессе мегаспорогенеза случаи дегенерации микропилярной
клетки диады с одновременным развитием халазальной. Но вместе с тем он же
наблюдал образование триады, при этом халазальная мегаспора становилась
функционирующей, определяя, тем самым, по мнению автора, развитие
зародышевого мешка по Polygonum-типу. У A. grandis развивается типичный
моноспорический 8-ядерный зародышевый мешок Polygonum-типа. Зрелый
зародышевый мешок с крупной яйцеклеткой и сравнительно маленькими си-
нергидами, имеющими нитчатый аппарат и крючкообразные выросты.
Полярные ядра сливаются до оплодотворения. Ядра антипод дегенерируют вскоре
после образования, не формируя клеток (X. pauciflora и X. schoenoides).
У A. grandis и X. indica антиподы представлены клетками, но также эфемерны.
Всем исследованным видам свойственна порогамия и двойное оплодотворение.
Эндосперм нуклеарный (X. indica) и гелобиальный (A. grandis), с
преимущественной аккумуляцией ядер и цитоплазмы в халазальной части
зародышевого мешка. Образование клеточных перегородок начинается с микропи-
лярного полюса. Позднее в халазальной части эндосперма возникают клетки
с несколькими ядрами, иногда отмечается вторичное их слияние (X. pauciflora).
В зрелом семени сохраняется хорошо развитый эндосперм, содержащий
крахмал, белки и капли жира.
Эмбриогенез Asterad-типа Репаеа-вариации. Зрелый зародыш прямой,
широкий, линзовидный, без подвеска, слабодифференцированный (отсутствует
почечка и апикальная меристема корня). Широкая семядоля с гаусториаль-
ными выростами своей плоской поверхностью примыкает к эндосперму.
Зародыш занимает не более 1/4 длины семени.
Исследованные виды и роды. Abolboda americana, A.
grandis, Achlyphila, Orectanthe (фрагментарно), Xyris capensis, X. indica, X. nigro-
mucronata, X. pauciflora, X. schoenoides.
Литература. Weinzieher, 1914; Govindappa, 1953, 1955; Kircher, 1977;
Ramaswamy, Raju, 1982; Вышенская, 1985; Tiemann, 1985.
Семейство СОММЕ LI NACEAE
Пыльник 4-гнездный, гнезда объединены в 2 теки, разделенные широким
уплощенным связником. Размер и форма тек и расположение их относительно
связника значительно варьируют в отдельных родах (Pyrrheima fuscata, Rhoeo
discolor, Setcreasia purpurea, Tripogandra amplexicaulis) * По нашим данным,
у Aneilema beniniense, P. fuscata и R. discolor перегородка между гнездами
не разрушается до самого вскрывания пыльника. Характерный признак
семейства — наличие хазмогамных и клейстогамных форм в отдельных родах
(Commelina, Commelinantia, Tradescantia). Строение стенки пыльника изучено
только у хазмогамных цветков, причем у них, как и у клейстогамных форм,
наблюдается диморфизм тычинок и пыльников (Commelina benghalensis,
С. forscalaei, Rhoeo spathacea, Tripogandra grandiflora). Развитие стенки
пыльника происходит центростремительно. Сформированная стенка гнезда пыльника
состоит из эпидермиса, эндотеция, одного среднего слоя и тапетума. У Gibasis
venustula стенка пыльника, по-видимому, развивается по редуцированному
типу и средний слой в ней отсутствует (Stevenson, Owens, 1978). По мере
развития пыльника клетки эпидермиса многократно делятся антиклинально,
сильно уплощаются и в зрелом пыльнике имеют скудную цитоплазму и
дегенерирующие ядра. Эндотеций с крупными удлиненными клетками; у P. fuscata
и R. discolor фиброзные утолщения в нем полностью сформированы уже на
стадии вакуолизированных микроспор; то же отмечено у Cyanotis axillaris (Chik-
kannaiah, 1962), тогда как у A. beniniense (ориг.) и Commelina subulata (Chik-
kannaiah, 1963) они появляются только после образования генеративной клетки,
достигая полного развития уже в зрелом пыльнике. Утолщения имеются во
* Материал собран в оранжереях БИН АН СССР (Ленинград).
198
/—//, 19, 20, 28, 29 — Rhoeo discolor, 12, 21, 22, 30 — Pyrrheima fuscata, 13 — Aneilema beniniense,
14—18, 23, 24, 26, 31—33 — Commelina subulata, 25 — Floscopa scandens, 27 — Tinantia fugax, 34—
39 — Commelina communis
1—13 — микроспорогенез и развитие пыльцевого зерна: / — поперечный срез пыльника, 2 —
фрагмент его гнезда на стадии спорогенной ткани, 3 — микроспороциты в профазе мейоза,
формирование периплазмодиального тапетума, 4 — тетрады микроспор, дегенерация ядра в отдельных из них,
5 — поперечный срез пыльника, 6 — его стенка на стадии вакуолизированных микроспор, 7,8 —
сукцессивный способ образования тетрад микроспор, 9—13 — формирование пыльцевого зерна;
Commelinaceae (продолжение)
14—30 — мегаспорогенез, развитие зародышевого мешка: 14, 15 — археспорий и отделение
париетальной клетки, 16 — линейная тетрада мегаспор, 17—19—1—2-ядерный зародышевый мешок,
20—22 — отдельные стадии развития биспорического зародышевого мешка, 23, 24, 29, 30 —
сформированный и зрелый зародышевые мешки, крахмал в цитоплазме центральной клетки, 19а, 25—28 —
Commelinaceae (продолжение)
особенности строения семяпочек; 31—33 — начальные стадии развития эндосперма; 34—39 —
эмбриогенез. (1—13, 19, 19а, 21, 22, 28—30 — ориг.; 14—18, 23, 24, 31—33 — по Chikkannaiah, 1963;
20— по Tschermak-Woess, 1947; 25—27 — по Chikkannaiah, 1962; 34—39 — по Soueges, 1958).
всех клетках стенки пыльника и части клеток связника, за исключением
перегородок между гнездами в теках и области растрескивания пыльника.
Средний слой, по литературным данным, описан как эфемерный, но у R. discolor
мы наблюдали остатки среднего слоя в виде тонкого тяжа цитоплазмы и
отдельных ядер на стадии вакуолизированных микроспор, а у P. fuscata —
еще позже. Тапетум периплазмодиального типа. В сформированной стенке
пыльника тапетум однослойный, с одноядерными клетками, которые позднее
у ряда видов становятся 2-ядерными и содержат рафиды (Nanda, Gupta,
1978). Эти же авторы отмечают необычно тонкие стенки тапетальных клеток
у R. spathacea по сравнению с клетками секреторного тапетума. Начиная со
стадии синапсиса в мейоцитах стенки тапетальных клеток растворяются и
протопласты, сливаясь, образуют периплазмодий. Вначале он окружает
развивающиеся мейоциты и по мере их изоляции проникает между ними, а позднее
окружает тетрады и молодые микроспоры. На этой стадии в периплазмодии
увеличивается число рафид (R. spathacea), отмечается полиплоидизация ядер
за счет их слияния и эндомитоза. У G. venustula при переходе тапетума от
201
клеточного состояния к периплазмодиальному гистологический анализ выявляет
увеличение РНК и белков; то же наблюдается и в спорогенной ткани
(Stevenson, Owens, 1978). Полный лизис периплазмодия наступает ко времени
созревания пыльцевых зерен. Стенка гнезда зрелого пыльника представлена
эпидермисом и фиброзным эндотецием. Спорогенная ткань многоклеточная.
Микроспороциты в процессе мейоза округляются, изолируются друг от друга,
приобретая каллозные оболочки. Тетрады микроспор чаще изобилатеральные,
значительно реже — тетраэдральные (Aneilema spiratum, С. axillaris, R.
discolor и др.), формируются по сукцессивному типу, у R. discolor в тетрадах
наблюдается дегенерация ядер отдельных микроспор. После растворения кал-
лозных оболочек микроспоры высвобождаются из тетрад. Деление микроспоры
происходит типичным способом с образованием центральной вакуоли,
оттесняющей ядро к стенке. Генеративная клетка у P. fuscata и R. discolor, округлая
или овально-округлая при внедрении ее в цитоплазму вегетативной клетки, при
созревании пыльцевого зерна приобретает удлиненносерповйдную форму.
Вегетативное ядро у этих видов округлой или слаболопастной формы, окрашивается
интенсивно и остается жизнеспособным в процессе всего генезиса пыльцевого
зерна. У других видов генеративная клетка варьирует от овально-округлой
у A. spiratum до веретенообразной у Murdania simplex и спиралевидной
у Commelina forskalaei, какой она бывает при выходе в пыльцевую трубку.
Вегетативное ядро дегенерирует у ряда видов еще в пыльцевом зерне (A.
spiratum, Tradescantia paludosa и др.)- Структура и развитие генеративной клетки
у Gibasis karwinskyana, G. venustula и Tradescantia blossfeldiana изучены
на ультраструктурном уровне (Owens, Westmuckett, 1983). Зрелые пыльцевые
зерна одиночные, 2-клеточные, содержат крахмал. 3-клеточная пыльца
обнаружена только у Floscopa scandens (Chikkannaiah, 1962) и R. spathacea
(Nanda, Gupta, 1977). У обоих изученных видов Rhoeo встречаются стерильные
пыльцевые зерна, у R. discolor, по нашим данным, они могут составлять до
30 %; встречаются и полностью стерильные пыльники. У форм с 2-клеточ-
ной пыльцой деление генеративной клетки происходит в пыльцевой трубке.
Спермии удлиненной (С. forskalaei) или линзовидной (Cyanotis cristata)
формы. У клейстогамных форм пыльцевые зерна прорастают внутри
пыльника.
Семяпочка одна или несколько (до 6); у A. spiratum и Murdania versicolor
количество их значительно больше; инициируются посредством периклиналь-
ных делений в осевых плацентах, варьируют по типу от ортотропной (М.
versicolor, С. cristata, G. venustula, F. scandens), ортокампилотропной и кампи-
лотропной (Pollia sorzogonensis, Commelinantia pringlei) до гемитропной
(Commelina benghalensis, С. forskalaei, Stanfieldiella imperforata=Buforrestia
imperforata, R. discolor) и анатропной у Cartonema spicatum, с 2 интегументами,
крассинуцеллятная у большинства изученных видов; тенуинуцеллятная
у Aneilema paniculatum, Amischophacelus cucullata и Cyanotis tuberosa.
Микропиле прямое (зигзагообразное у Coleotrype natalensis), образовано
обоими интегументами (С. axillaris, P. sorzogonensis) или только внутренним
(С. benghalensis, С. forskalaei, R. discolor, Tinantia fugax). Внутренний
интегумент 2-слойный, наружный — 4-слойный у P. sorzogonensis, 7—10-слой-
ный у Commelina и др., причем число слоев может быть различным на
разных участках интегумента. У М. simplex и С. subulata микропиле не
образуется вследствие задержки роста интегументов. Но в этом случае радиально
вытягиваются апикальные клетки нуцеллуса, играя роль проводниковой ткани.
У этих видов интегументы значительно вырастают и смыкаются над нуцел-
лусом только после оплодотворения. Сосудистый пучок заканчивается в области
халазы. Нуцеллус массивный, особенно его базальная часть. Апикальные клетки
эпидермиса нуцеллуса, делясь периклинально, образуют 2—3-слойный
колпачок, становящийся эпистазой (разрушается в зрелом семени); в халазальной
области нуцеллуса развивается гипостаза, наиболее ярко выраженная у
Amischophacelus axillaris. В зрелом семени нуцеллус представлен несколькими
слоями дегенерирующих клеток. На поздних стадиях развития зародышевого
мешка ниже микропилярной области интегументы образуют складки-выросты,
обращенные в полость семяпочки, что происходит главным образом за счет
202
увеличения числа слоев наружного интегумент#, а также интенсивных
антиклинальных делений в эпидермисе внутреннего интегумента. Тем самым
семяпочка как бы разделяется на куполовидную меньшую микропилярную часть,
в которой располагается зародышевый мешок, и нижнюю большую часть,
содержащую основную массу нуцеллуса. Такое строение семяпочки
прослеживается у большинства изученных видов (Aneilema beniniense, A. panicula-
tum, Amischophacelus axillaris, Commelina angustifolia, Commelinantia pring-
lei, Cyanotis cristata, P. sorzogonensis, R. discolor, T. fugax). Археспориальная
клетка одна (у С. forskalaei, С. subulata, Cyanotis axillaris встречаются
2), функционирует непосредственно как мегаспороцит без отчленения
париетальной клетки (A. paniculatum, С. axillaris, С. cucullata) или же отделяет
париетальную клетку, которая либо делится антиклинально, образуя несколько
клеток париетальной ткани (С. subulata, R. discolor), либо у большинства
видов дегенерирует вскоре после образования (A. spiratum, виды Commelina,
М. versicolor, P. sorzogonensis, R. discolor и др.)- Тетрады мегаспор линейные
(С. benghalensis, С. subulata, F. scandens, P. sorzogonensis и др.),
Т-образные (A. spiratum, С. cucullata), у М. versicolor встречаются оба типа;
промежуточный тип между линейной и Т-образной тетрадой отмечен у С.
forskalaei. Частое явление в семействе — образование триад вследствие задержки
или отсутствия деления микропилярной клетки диады (С. forskalaei, P.
sorzogonensis, Zebrina pendula).
Зародышевый мешок варьирует по типу образования: у большинства
изученных видов из халазальной мегаспоры линейной или Т-образной тетрады
(часто триады) развивается моноспорический 8-ядерный зародышевый мешок
Polygonum-типа (A. spiratum, С. benghalensis, С. forskalaei, С. crystata,
Tradescantia albiflora, Т. virginica и др.); моноспорический 4-ядерный
Oenothera-типа описан у Commelinantia anomala (Tharp, 1922) и С. pringlei
(Parks, 1935). В этом случае после мейоза II 3 верхние клетки тетрады
дегенерируют, а из халазальной посредством 2 делений образуется 4-ядерный
зародышевый мешок с гетероморфными ядрами. Биспорический зародышевый
мешок Allium-типа отмечен у Commelina stricta, R. discolor и Т. paludosa.
Можно полагать, что и у P. fuscata зародышевый мешок развивается из
халазальной клетки диады, т. е. относится к этому же типу развития. Тетраспо-
рический зародышевый мешок Adoxa-типа обнаружен у Commelina
angustifolia (McCollum, 1939) и G. venustula (Stevenson, Owens, 1978).
Сформированный зародышевый мешок (Polygonum-, Allium- и Adoxa-типов)
8-ядерный, 7-клеточный, почти округлой формы у P. fuscata, овально-удлиненный
у R. discolor и видов Commelina. Размеры и форма зародышевого мешка
до оплодотворения определяются его расположением в ограниченной
микропилярной части семяпочки. Яйцевой аппарат состоит из крупной грушевидной
или слегка уплощенной яйцеклетки с апикально или центрально расположенным
ядром и 2 клиновидных синергид с крючками и развитым нитчатым
аппаратом (P. fuscata, R. discolor, Z. pendula). Нитчатый аппарат не обнаружен
у G. venustula, но сами синергиды увеличиваются в размере и интенсивно
красятся на основные белки и РНК. Полярные ядра крупнее остальных
ядер зародышевого мешка (С. cristata, виды Commelinantia, R. discolor),
сливаются до оплодотворения (С. axillaris, M. simplex, Т. fugax и др.) или во
время его, что мы наблюдали у P. fuscata. В цитоплазме центральной клетки
до оплодотворения накапливается крахмал (R. discolor). Антиподы клеточные,
эфемерные, дегенерируют ко времени слияния полярных ядер (М. simplex);
у P. fuscata и R. discolor, по-видимому, еще раньше; у С. cristata вообще
трудно обнаруживаются. В зрелом зародышевом мешке антиподы уже
отсутствуют (С. axillaris, С. cucullata, P. fuscata, R. discolor). Оплодотворение по-
рогамное, пыльцевая трубка при вхождении в зародышевый мешок изливает
содержимое в одну из синергид, разрушая ее (P. fuscata, R. discolor). Тройное
слияние происходит раньше сингамии (A. paniculatum, С. subulata, R. discolor
и др.). Дегенерация зародышевых мешков наблюдается и до оплодотворения
(у R. discolor уже на 2-ядерной стадии дегенерирует до 50 % зародышевых
мешков), и после него (С. forskalaei), при этом рост семяпочек продолжается
еще некоторое время за счет роста нуцеллуса.
203
Эндосперм нуклеарный. После нескольких синхронных делений (у С. forska-
laei до стадии 64 ядер) ядра эндосперма занимают периферийное положение.
Клеткообразование в нем начинается с микропилярного конца (у С. forskalael
не ранее накопления 500—600 ядер) и распространяется центрипетально;
полностью клеточным эндосперм становится на стадии глобулярного зародыша.
Два наружных слоя его составляют вытянутые одноядерные клетки с плотной
цитоплазмой; клетки внутренних слоев крупные, сильно вакуолизированные,
многоядерные (у A. axillaris до 11 ядер), наблюдается слияние ядер, число
ядрышек колеблется от нескольких до 12. Халазальный эндоспермальный гаусторий
формируется у С. axillaris и A. axillaris, у которого в зрелом семени он
сохраняется в виде массы дегенерирующих ядер и цитоплазмы, окруженных ну-
целлярной тканью. У Т. fugax, M. simplex и С. forskalaei наблюдается только
агрегация ядер и цитоплазмы на халазальном полюсе эндосперма, что
позволяет предполагать его гаусториальную активность. Микропилярный
эндоспермальный гаусторий описан у С. tuberosa (Chikkannaiah, Hemaraddi, 1979).
В зрелом семени обильный мучнистый эндосперм заполняет широкую базаль-
ную область семени, в апикальной части он полностью абсорбирован. Клетки
эндосперма заполнены сложными крахмальными зернами, за исключением
клеток наружного слоя; в небольшом количестве имеются белки.
Эмбриогенез соответствует Asterad-типу Commelina-вариации (Soueges,
1958; Chikkannaiah, 1963, 1964, 1965а, 1965b, 1971). Сегментация клетки cb и ее
дериватов сходна у всех изученных видов семейства, в то же время отделение
инициалей эмбриодермы из дериватов клетки са вариабельно и происходит
на стадии квадрантов у видов Commelina, F. scandens, R. discolor и на стадии
октантов у М. simplex и A. axillaris, после чего деления становятся
нерегулярными и зародыш принимает субсферическую форму вследствие более частых
делений в его базальной части. Терминальная семядоля развивается из
дериватов клеток яруса q, остальные части зародыша — из дериватов клетки cb.
В зрелом семени массивный дифференцированный зародыш имеет семядолю
с трубчатым семядольным влагалищем, почечку с 2 примордиями листьев,
короткий гипокотиль и зачаток корня. В отличие от других видов у С. spicatum
зародыш мал и слабо дифференцирован. У Л. paniculatum обнаружен
единственный случай полиэмбрионии.
Исследованные виды. Amischophacelus axillaris, A. cucullata,
Aneilema beniniense, A. paniculatum, A. spiratum, Cartonema spicatum, Coleo-
trype natalensis, Commelina angustifolia, C. benghalensis, C. forscalaei, C. stricta,
C. subulata, Commelinantia anomala, C. pringlei, Cyanotis axillaris, С cristata,
C. cucullata, С tuberosa, Floscopa scandens, Gibasis karwinskyana, G. venus-
tula, Murdania simplex, M. versicolor, Pollia sorzogonensis, Pyrrheima fuscata,
Rhoeo discolor, R. spathacea, Setcreasia purpurea, Stanfieldiella imperforata—
= Bufforestia imperforata), Tinantia fugax, Tradescantia albiflora, T. blossfel-
diana, T. bracteata, T. paludosa, T. virginica, Tripogandra amplexicaulis, T. gran-
diflora.
Литература. Hance, 1915; Tischler, 1915; Tackholm, Soderberg, 1918;
Palm, 1920; Mascre, 1925a, 1925b; Kato, 1930a, 1930b; Rau, 1930; Sax, Edmonds,
1933; Maheshwari P., Singh, 1934; Murthy, 1934, 1938; Parks, 1935; Bates,
1939; McCollum, 1939; Yasui, 1939; Painter, 1943; Tschermak-Woess, 1947;
Beatty J., A. Beatty, 1953; Bishop, McGowan, 1953, Magaraj, 1954a, 1954b;
Dolezal, Tschermak-Woess, 1955; Maheshwari P., Maheshwari J., 1955;
Maheshwari, Baldev S., 1958; Sharma, Sharma, 1958; Soueges, 1958a, 1958b;
Делоне, 1959"; Rowley, 1959; Carniel, 1960; Chikkannaiah, 1961, 1962, 1963,
1964, 1965a, 1965b, 1971, 1973; Lee, 1961; Raghavan, Rao, 1961; Lakshmanan,
1962, 1977; Albertini, 1963, 1965, 1967a, 1967b, 1971a, 1971b; Maruyama, 1965,
1968; Mepham, Lane, 1968, 1969a, 1969b, 1970; Kulkarni, Patil, 1969; Mepham,
1970; Souvre, 1971; Nanda, 1972; Nanda, Gupta, 1977; Souvre, Albertini, 1978,
1981, 1982, 1983; Stevenson, Owens, 1978; Chikkannaiah, Hemaraddi, 1979;
Grootjen, Bouman, 1981; Owens, Westmuckett, 1982, 1983; Grootjen, 1983;
Owens, Dickinson, 1983; Вышенская, 1985; Фрейберг, ориг. данные.
204
Семейство MAYACACEAE
Эмбриологически не исследовано.
Пыльник 4-гнездный, раскрывается апикальной порой.
Семяпочка ортотропная, с 2 2-слойными интегументами, близкая к тенуину-
целлятной. Нуцеллус рано дегенерирует; остатки его клеток сильно сжаты и
составляют едва различимый слой под семенной кожурой.
Эндосперм с четко выделяющимся алейроновым слоем сохраняется в зрелом
семени; его клетки увеличиваются в размере от периферии к центру,
содержат сложные крахмальные зерна и белки.
Зародыш линзовидный или округлый, с конусообразным корневым полюсом,
вдающимся в микропиле, недифференцированный.
Исследованный род. Мауаса (фрагментарно).
Литература. Pilger, 1930; Smith, 1937; Castellanos, 1945; Lourteig,
1963, 1968; Thieret, 1975; Stevenson, 1983; Вышенская, 1985.
205
Порядок 12. ERIOCAULALES
Семейство ERIOCAULACEAE
Пыльник 2-тековый, 4-гнездный; перед созреванием пыльника перегородка
между соседними гнездами в теках разрушается и гнезда сливаются попарно.
Развитие стенки гнезда пыльника происходит по центростремительному
(однодольному) типу у всех изученных видов. Данные о развитии стенки пыльника
по двудольному типу у Eriocaulon cinereum (Patel, Patel, 1964) нуждаются
в уточнении, так как приведенные авторами рисунки, по-видимому, не дают
оснований для такого вывода (Arecal, Ramaswamy, 1980). Стенка
сформированного пыльника состоит из эпидермиса, эндотеция, одного среднего слоя
и тапетума. Клетки эпидермиса в процессе развития пыльника значительно
увеличиваются в размере, особенно крупными они становятся в области вскры-
вания пыльника, за исключением 2—3 мелких замыкающих клеток. Эндотеций
хорошо выражен, фиброзные утолщения в нем развиваются перед созреванием
пыльника. Средний слой присутствует довольно длительно, на стадии мейоза
в микроспороцитах его уплощенные клетки еще не проявляют признаков
дегенерации (Е. hookerianum, E. xeranthemum). Тапетум клеточный секреторный,
с одноядерными клетками. Наличие 2-ядерных клеток в тапетуме у Е. quinquan-
gulare (Begum, 1968) не подтвердилось при переисследовании (Ramaswamy,
1975). В процессе мейоза клетки тапетума вакуолизируются, он длительно
сохраняется. В созревающем пыльнике с 3-клеточной пыльцой еще сохраняются
его остатки в виде гранулированного тяжа цитоплазмы с фрагментами ядер
(Е. hookerianum, E. xeranthemum). Стенка зрелого пыльника 2-слойная,
представлена эпидермисом и фиброзным эндотецием. Спорогенная ткань
однорядная. Наличия каллозы при образовании микроспороцитов не отмечено.
Образование тетрад микроспор происходит по сукцессивному типу; расположение
микроспор в тетрадах изобилатеральное. Сведения о симультанном способе
образования тетрад микроспор, приведенные в сводке Дэвис (Davis, 1966),
опровергаются всеми известными исследованиями. Деление ядра микроспоры
происходит типичным способом с образованием центральной вакуоли,
оттесняющей ядро к стенке. Отчленившаяся маленькая густоплазменная
генеративная клетка отделяется от стенки пыльцевого зерна и внедряется в цитоплазму
вегетативной клетки, где образует 2 спермия (Е. hookerianum, E. robustobrow-
nianum и др.). У Е. truncatum центральная вакуоль, по-видимому, не образуется
(Ramaswamy, Arekal, 1981), но тем не менее и в этом случае отделение
генеративной клетки происходит у стенки микроспоры. Зрелое пыльцевое зерно
3-клеточное у всех исследованных видов, за исключением Е. quinquangulare,
у которого оно 2-клеточное (Begum, 1968).
Семяпочка (1—3)-ортотропная, с 2 интегументами, тенуинуцеллятная,
с микропиле, образованным только внутренним интегументом. Археспориаль-
ная клетка становится мегаспороцитом, не отчленяя париетальной. Халазаль-
ная мегаспора линейной или Т-образной тетрады становится функционирующей,
остальные, как правило, дегенерируют. Изредка обнаруживает признаки
дальнейшего развития эпихалазальная мегаспора.
Зародышевый мешок развивается по Polygonum-типу. Интегументальный
тапетум отчетливо определяется на стадии 2—4-ядерного зародышевого мешка;
достигает наибольшего развития на стадии зрелого зародышевого мешка;
после оплодотворения секреторная роль его незначительна. Синергиды
грушевидные. Полярные ядра сливаются до оплодотворения, во время слияния
располагаются в нижней трети зародышевого мешка. 3 клетки антипод
значительно крупнее клеток яйцевого аппарата. Еще до слияния полярных ядер
оболочки клеток антипод разрушаются, протопласты их сливаются, образуя
антиподальный «пузырь» с крупным лопастным триплоидным ядром.
Разрастаясь в направлении яйцевого аппарата, он может занимать до 2/3
зародышевого мешка, уменьшая, таким образом, объем центральной клетки. После
слияния полярных ядер происходит обратный процесс разрастания центральной
206
Eriocaulaceae
1—11, 18—21 — Eriocaulon hookerianum, 12—17 — E. xeranthemum, 22—30 — E. robusto-brownia-
num
1—5 — формирование стенки гнезда пыльника и микроспорогенез; 6 — фрагмент теки пыльника
перед созреванием, в стенке фиброзный эндотеций, 3-клеточные пыльцевые зерна; 7—9 — сукцес-
сивный тип образования тетрад микроспор; 10, 11 — вакуолизированная микроспора и зрелое 3-кле-
точное пыльцевое зерно;
клетки по направлению к халазальному концу зародышевого мешка, а анти-
подальный «пузырь» постепенно дегенерирует. Для семейства характерна по-
рогамия.
Эндосперм нуклеарный. Первичное ядро эндосперма локализуется в хала-
зальном конце зародышевого мешка и делится значительно раньше зиготы.
Только несколько первых делений ядер происходят симультанно, причем быстрее
идет образование ядер в халазальном конце; имеется центральная вакуоль.
Клеткообразование в эндосперме начинается также с халазального конца
зародышевого мешка и распространяется по направлению к микропилярному,
постепенно заполняя всю полость центральной клетки. В зрелом семени
эндосперм обильный, содержит крахмал.
Эмбриогенез Asterad-типа. Зрелый зародыш маленький, слабодифференци-
рованный, с единственной семядолей, выполняющей гаусториальную функцию.
У £. septangulare обнаружена полиэмбриония.
207
Исследованные виды. Eriocaulon cinereum, E. hookerianum, E. quia-
quangulare, E. robusto-brownianum, E. septangulare, E. setaceum, E. sexangu-
lare, E. truncatum, E. xeranthemum, Paepalanthus bifidus, Syngonanthus nitens.
Литература. Smith, 1910; Palm, 1920; Patel, Patel, 1964; Sharma, 1965;
Thanilaimoni, 1965; Begum, 1966, 1968; Brewbaker, 1967; Swamy, Krishna-
murthy, 1970; Bouman, 1974; Ramaswamy, 1975; Monteiro-Scanavacca, 1978;
Arekal, Ramaswamy, 1980; Ramaswamy, Swamy, Arekal, 1980; Hohendorff,
1981; Ramaswamy, Arekal, 1981a, 1981b, 1982a, 1982b.
Eriocaulaceae (продолжение)
12—21 — мегаспорогенез и развитие зародышевого мешка: 12 — мегаспороцит, 13 — линейная
тетрада мегаспор, 14—17 — стадии формирования зародышевого мешка, 18—20 — лизис оболочек
антипод и образование антиподальной цисты в сформированном зародышевом мешке,^2/ —
оплодотворенный зародышевый мешок, зигота в покое, свободные ядра эндосперма в халазальной части;
22—30 — эмбриогенез. {1—11, 18—21 — по Arekal, Ramaswamy, 1980; 12—17 — по Ramaswamy,
Arekal, 1982a; 22—30 — по Ramaswamy et al., 1980).
14 Зак. 2144
Порядок 13. RESTIONALES
Семейство FLAGELLARIACEAE
Эмбриологически не изучено.
Микроспороциты у Flagellaria indica небольшие, прямоугольные. Мейоз
в микроспороцитах сопровождается сукцессивным цитокинезом. Тетрады
микроспор линейные или изобилатеральные.
Исследованный вид. Flagellaria indica.
Литература. Palm, 1920; Chanda, Sunirmal, 1966; Chanda et al.,
1967.
Семейство JOINVILLEACEAE
Эмбриологически не изучено.
Семейство RESTIONACEAE
Пыльники 2-гнездные. Сформированная стенка гнезда пыльника состоит
из эпидермиса, эндотеция, среднего слоя и тапетума, клетки которого могут
быть 2-ядерными в период мейоза в микроспороцитах. Признаки разрушения
в тапетуме начинают проявляться со стадии диад или тетрад микроспор.
В эндотеции образуются фиброзные утолщения. Тетрады микроспор
формируются по сукцессивному типу. Отклонения в ходе мейоза не обнаружены.
Зрелые пыльцевые зерна 3-клеточные у Elegia racemosa и Hypodiscus aristatus,
но у последнего вида они могут быть и 2-клеточными. У Chondropetalum
hookerianum зрелые пыльцевые зерна чаще всего 2-клеточные, но иногда встречаются
3-клеточные.
Семяпочка ортотропная, с 2 интегументами, тенуинуцеллятная. У Restio
dodii, E. racemosa, Ch. hookerianum семяпочка отнесена к ортотропному типу
(Krupko, 1963; Mlodzianowski, 1964). Ранее для семейства в целом также указан
ортотропный тип семяпочки (Netolitzky, 1926). Однако при изучении Н.
aristatus один из авторов пришел к выводу, что семяпочка у этого вида начинает
развиваться как анатропная, а впоследствии становится ортотропной (Krupko,
1962). Исследованиями, проведенными на примере многих родов и видов Restio-
naceae (Kircher, 1986), показано, что семяпочки у представителей этого
семейства действительно являются ортотропными, висячими. Оба интегумента
состоят из 2 слоев, но наружный интегумент в области микропиле может
быть многослойным. Во внутреннем слое внутреннего интегумента
накапливаются танины со стадии сформированного зародышевого мешка. На более
поздних стадиях развития танинсодержащие клетки присутствуют и в ха-
лазе. Клетки эпидермиса верхушки нуцеллуса радиально удлиняются. У Lep-
tocarpus similis формируется оперкулум. Микропиле может быть образовано
одним или обоими интегументами. Гипостаза формируется у Ch. hookerianum.
Одиночная археспориальная клетка закладывается субэпидермально. В
дальнейшем она становится непосредственно мегаспороцитом. Имеются сведения
о наличии субэпидермального слоя у #ч aristatus (Krupko, 1962). Тетрада
мегаспор линейная, функционирующей является халазальная мегаспора, 3
другие дегенерируют.
Restio пас еае
1,2 — Restio triticeus, 3 — Leptocarpus similis, 4—6 — Chondropetalum hookerianum, 7 — Thamno-
chortus fruticosus, 8 — Elegia capensis
1 —2-гнездный пыльник с микроспороцитами и сформированной стенкой; 2,3 — 2-клеточное и
зрелое 3-клеточное пыльцевые зерна; 4,5 — семяпочки с 2 интегументами: с субэпидермально
расположенным мегаспороцитом (4), с линейной тетрадой мегаспор (5); 6 — фрагмент семяпочки с 2-ядер-
ным зародышевым мешком; 7 — зрелый зародышевый мешок и прилегающие к нему клетки
нуцеллуса; 8 — семяпочка с зародышевым мешком перед оплодотворением. (/—3, 8 — по Kircher, 1986;
4—6—по Krupko, 1963; 7 — по Mlodzianowski, 1964).
210
14*
Зародышевый мешок развивается по Polygonum-типу. Расположение ядер
в 4-ядерном зародышевом мешке может быть Т-образным вследствие
расширенной его микропилярной и суженной халазальной части. У R. dodii
обнаружены 3-ядерные зародышевые мешки, которые возникают в результате
асинхронных делений ядер 2-ядерных зародышевых мешков. Зрелые зародышевые
мешки 8-ядерные, 7-клеточные у Я. aristatus и Ch. hookerianum. Яйцеклетка
имеет сферическую форму. Синергиды, морфологически сходные с яйцеклеткой,
наблюдаются у Thamnochortus fruticosus и Е. racemosa. Грушевидные
синергиды с крючковидными выростами и нитчатым аппаратом формируются
у Я. aristatus и Ch. hookerianum. Полярные ядра смещаются к яйцевому
аппарату. Сливаются они перед оплодотворением. Большое число ядер и клеток
в зародышевых мешках обнаружено у R. dodii, R. triticeus, E. racemosa и Т.
fruticosus. У этих видов имеет место образование многочисленных клеток антипод,
число которых может достигать 15. В случае образования 3 клеток антипод
они эфемерны и дегенерируют после образования. Многоклеточные антиподы
(некоторые из них могут быть 2-ядерными) сохраняются более длительное
время, до ранних стадий эндоспермогенеза. Ядра антипод мелкие, гораздо
мельче ядер клеток яйцевого аппарата. Имеются сведения о необычном
характере клеткообразования в зародышевом мешке Ch. hookerianum (Krupko,
1963). Двойное оплодотворение у Т. fruticosus и Я. aristatus характеризуется
задержкой процесса сингамии по сравнению с тройным слиянием.
Формирование зиготы завершается при многоядерном эндосперме. Однако у R. dodii
отмечено оплодотворение яйцеклетки до завершения оплодотворения в
центральной клетке и деление зиготы до начала развития эндосперма.
Оплодотворение у Я. aristatus происходит редко. У Ch. hookerianum отмечается
дегенерация зародышевых мешков до оплодотворения, при этом полярные ядра
имеют неправильную форму. Дегенерация одной или обеих синергид до
оплодотворения имеет место у R. dodii.
Эндосперм нуклеарный; в зрелом семени сохраняется.
Зародыш маленький, слабодифференцированный.
Исследованные виды. Anarthria laevis, Cannomois virgata, Chond-
ropetalum hookerianum, Ch. mucronatum, Ch. nudum, Elegia asperiflora var,
lacerata, E. capensis, E. parviflora, E. persistens, E. racemosa, E. stipularis,
E. vaginulata, Hypodiscus argenteus, H. aristatus, Я digitata, Я latariflora,
Leptocarpus paniculatus, L. similis, Restio callistachyus, R. cuspidatus, R. dodii,
R. egregius, R. sieberi, R. similis, R. subverticillatus, R. triticeus, Thamnoshor-
tus dichotomus, Th. fruticosus, Th. muirii, Th. obtusus, Willdenowia lucaeana.
Литература. Netolitzky, 1926; Borwein et al., 1949; Krupko, 1956—1957,
1962, 1963, 1966; Mlodzianowski, 1964; Chanda, Sunirmal, 1966, 1967; Kircher,
1986.
Семейство ECDEIOCOLEACEAE
Эмбриологически не изучено.
Семейство CENTROLEPIDACEAE
Пыльник 2-гнездный. Сформированная стенка гнезда пыльника 4-слойная,
образование ее происходит центростремительна (по типу однодольных). Тапе-
тум секреторного типа, клетки его могут быть 2-ядерными. Эндотеций с
фиброзными утолщениями. Деление микроспороцитов сукцессивное. Тетрады
микроспор Т-образные, изобилатеральные, реже — линейные. Зрелые пыльцевые
зерна 3-клеточные, возможно их прорастание внутри пыльника. Пыльцевые
зерна в качестве запасных питательных веществ содержат белки.
Семяпочка ортотропная, тенуинуцеллятная, с 2 интегументами. Каждый
из интегументов 2-слойный, оба принимают участие в формировании микропиле.
Клетки эпидермиса нуцеллуса, расположенные над вершиной зародышевого
мешка, радиально удлиняются, оболочки их постепенно утолщаются.
Археспорий одноклеточный. Археспориальная клетка становится непосредственно ме-
гаспороцитом. Тетрада мегаспор линейная или Т-образная. Возможно обра-
212
Centrolepidaceae
1—20, 22—25 — Centrolepis arlstata, 21 — C. glabra, 26 — С winiata, 27, 28 — Gaimardia setacea,
29 — Centrolepis polygyna
1 — гнезда пыльника с микроспороцитами; 2 — фрагмент пыльника с клетками тапетума и микро-
спороцитами; 3—6 — формирование тетрады микроспор; 7—9 — тетрады микроспор; 10—12 —
микроспора, 2- и 3-клеточные пыльцевые зерна; 13 — семяпочка с мегаспороцитом; 14, 15 —
семяпочки с диадой клеток (14) и тетрадой (15) мегаспор; 16—18 — семяпочки с 2- и 8-ядерным
зародышевым мешком; 19 — схема семяпочки со сформированным зародышевым мешком; 20 —
зародышевый мешок с зиготой и нуклеарным эндоспермом; 21 — зародышевый мешок с нуклеарным
эндоспермом и окружающим его нуцеллусом; 22—28 — эмбриогенез; 29 — схема зрелого семени.
(1—20 — по Hamann, 1962; 21—29 —по Hamann, 1975).
зование триад из-за отсутствия деления микропилярной клетки диады (Сеп-
trolepis tenuior). Функционирует халазальная мегаспора.
Зародышевый мешок развивается по Polygonum-типу. Клетки яйцевого
аппарата дифференцированы. Обнаружено деление ядер каждой из 3 антипод
и образование 2-ядерных клеток или клеток антипод с крупными, очевидно,
полиплоидными ядрами. Дегенерация антипод наблюдается при
развивающемся эндосперме. Полярные ядра сливаются до оплодотворения. Зрелый
зародышевый мешок содержит крахмальные зерна, особенно богата ими
центральная клетка. Пыльцевая трубка проникает в зародышевый мешок
через микропиле, разрушая одну из синергид.
Эндосперм нуклеарный, сохраняется при созревании семени, клетки его
богаты крахмалом. Деление зиготы происходит при 16-ядерном эндосперме
(С. tenuior). Эмбриогенез С. aristata и С. miniata соответствует Onagrad-типу
Luzula (Juncus) -вариации.
' Образование 2 зародышевых мешков в одной семяпочке наблюдали у С.
aristata. Происхождение дополнительных зародышевых мешков неизвестно.
Исследованные виды. Aphelia cyperoides, Centrolepis aristata,
С. ciliata, С. fascicularis, С. glabra, С. miniata, С. paleida, С. polygyпа, С. stri-
gosa, С. tenuior, Gaimardia setacea.
Литература. Jonsson, 1879—1880; Hamann, 1962, 1975; Chanda Sunir-
mal, 1966; Prakash, 1969.
Порядок 14. HYDATELLALES
Семейство HYDATELLACEAE
Эмбриологически исследовано недостаточно.
Пыльник 4-гнездный. Пыльцевые зерна 2-клеточные, что требует
подтверждения.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Микропиле
образуется обоими интегументами. Клетки эпидермиса нуцеллуса, в его
апикальной части, делятся периклинально, образуя нуцеллярный колпачок.
По одним данным, он постепенно разрушается, по другим — сохраняется в
зрелом семени. В ходе развития семени отмечены различия в структурных
преобразованиях клеток наружного эпидермиса наружного интегумента у разных
таксонов. У Hydatella inconspicua они разрастаются, накапливают дубильные
вещества, выделяют толстый слой кутикулы на поверхность наружных клеток,
утолщаются за счет отложения целлюлозы. У Trithuria submersa, напротив,
клетки хотя и увеличиваются, но дубильных веществ не накапливают,
поверхностный слой кутикулы очень тонкий, утолщаются не наружные, а боковые и
внутренние клеточные оболочки. У обоих родов внутренний слой внутреннего
интегумента формирует оперкулум.
Hydatellaceae
1 — Hydatella australis, 2—8 — Н. inconspicua
1 — пыльцевое зерно; 2 — продольный срез пестика с висячей семяпочкой; 3 — продольный срез
микропилярной части семяпочки на стадии 2-ядерного зародышевого мешка; 4 — одна из ранних фаз
эндоспермогенеза; 5—7—последовательные фазы эмбриогенеза; 8— семя (продольный срез).
(1—8 — по Hamann, 1975).
215
Эндосперм (предположительно) целлюлярный, из нескольких клеток, без
крахмала. Семена с обильным периспермом, запасающим крахмал. ^
Зародыш маленький, периферический, линзовидный, очень слабодифферён-
цированный.
Исследованные виды. Hydatella austraiis, H. inconspicua (=Trithu-
ria inconspicua), Trithuria submersa (=Juncella tasmanica).
Литература. Hamann, 1975, 1976; Hamann, Kaplan, 1979; Вышенская,
1985.
Порядок 15. POALES
Семейство POACEAE
Пыльники 4-гнездные; гнезда объединены попарно в 2 латеральные теки.
Теки соединены между собой связником. Тип формирования стенки гнезда
пыльника центростремительный, тапетум является производным париетального
слоя. Сформированная стенка гнезда пыльника состоит из эпидермиса, эндоте-
ция, среднего слоя и тапетума (Модилевский и др., 1958). В эндотеции
образуются фиброзные утолщения. Средний слой относительно эфемерен, признаки его
дегенерации обычно отмечаются во время деления микроспор. Тапетум
однослойный, клеточный секреторный; в процессе развития клетки тапетума
становятся обычно 2-ядерными, иногда ядра сливаются, образуя одно большое
полиплоидное ядро. Ядра тапетума многоядрышковые. Особенность развития
тапетума у Triticum aestivum, Avena sativa и Secale cereale — образование споро-
поллениновой пленки (оболочки), формирующейся вокруг каждой клетки
после деструкции первичной целлюлозной оболочки (Огородникова, 1976,
19866). Виды злаков различаются по величине и числу орбикул, приходящихся
на единицу поверхности тапетальной клетки, что является хорошим
диагностическим признаком (Огородникова, 19866). Стенка гнезда зрелого
пыльника состоит из эпидермиса, эндотеция и спорополлениновой пленки с орби-
кулами. Иногда обнаруживаются отдельные дегенерирующие клетки
среднего слоя. Особенность строения стенки зрелого пыльника — взаимно
перпендикулярное расположение сильно вытянутых клеток эндотеция и
эпидермиса, а также наличие в отдельных случаях фиброзных утолщений в
некоторых клетках эпидермиса у пшеницы (Батыгина, 1974). Для всех злаков
характерно своеобразное однослойное расположение микроспороцитов, тетрад,
микроспор и пыльцевых зерен в пыльнике (Schnarf, 1931; Dragowzal, 1936;
Батыгина и др., 1963; Романов, 1966, 1970). В начальный период развития
микроспороциты у всех злаков имеют характерную клиновидную форму,
изменяющуюся в процессе формирования пыльника. Количество и форма
микроспороцитов варьируют у различных злаков. У пшеницы спорогенный комплекс
на поперечном срезе обычно состоит из 4—6 микроспороцитов, у кукурузы —
4—5, у ржи— 11 —12 (Романов, 1970). Полость гнезда пыльника образуется
за счет расхождения внутренних концов микроспороцитов в период от ранней
до средней профазы мейоза I (Романов, 1970). Характерная форма
микроспороцитов (близкая к эллипсоиду) определяет тангентальную ориентировку
веретен при обоих делениях. Изобилатеральная тетрада микроспор
образуется по сукцессивному типу. Тангентальная (параллельно стенке гнезда)
ориентировка веретен при образовании тетрад микроспор определяет то, что все
4 клетки тетрады находятся в одной плоскости и все прилегают к тапетуму.
Пыльцевые зерна, производные одной тетрады, располагаются рядом.
В процессе микроспорогенеза у исследованных злаков образуются утолщенные
каллозные оболочки в микроспороцитах, клетках диад и тетрад микроспор.
Своеобразие этого явления, присущего только злакам, заключается в
основном в формировании каллозных гребней, направленных внутрь гнезда пыльника
(Романов, 1970). Их форма и величина у разных видов может варьировать.
У пшеницы они обычно низкие и клиновидные, у ржи — высокие. Важнейшая
морфологическая особенность пыльцы злаков — наличие одной поры,
обращенной в сторону тапетума (Dragowzal, 1936; Carniel, 1961), и движение клеток
(генеративной и вегетативной) и их ядер по отношению к поре (Kichara, Hori,
1937, 1966; Батыгина, 1962а, 1974, 1987; Романов, 1970). Зрелое пыльцевое
зерно 3-клеточное, имеет 2 вытянутых в длину спермия, у пшеницы — с ясно
различимыми концами: одним тупым, другим — заостренным (Батыгина,
1962а), что нашло подтверждение при электронно-микроскопических
исследованиях (Chu, Ни, 1981). Форма спермиев с момента их образования в пыльцевом
зерне до попадания в пыльцевую трубку значительно изменяется (Батыгина,
217
Poaceae
1—18, 24—45, 47—79 — Triticum (47 — Т. aestivum var. diamant, 48, 50—52, 57—76 — T. aestivum,
49 — T. dicoccum, 53—56, 77, 78 — T. monococcum), 19—23 — Secale, 46 — Zea mays
1—18 — развитие стенки пыльника и пыльцевого зерна;
1974). Имеются некоторые данные о диморфизме спёрмиев у злаков (Batygina,
1974; Mogensen, Rusche, 1985). Спермии различных злаков содержат пластиды.
Так, у Aegilops обнаружены 2 пластиды (Татинцева, ориг.). Цитоплазма
вегетативной клетки заполнена запасными веществами: крахмалом, белками,
жирами и др. Состав жирных кислот и каротиноидов в пыльцевом зерне ячменя
меняется в процессе развития (Кириченко, 1985).
Семяпочка злаков характеризуется рядом особенностей: отсутствием фуни-
кулуса (Harrington, Crocker, 1923), образованием плацентохалазы
(Александров, 1943), дорсовентральностью с самого начала развития (Батыгина,
1974). Среди исследователей нет единого мнения о типе семяпочки злаков.
Гебель (Goebel, 1933) определяет семяпочку всех злаков как анатропную. Одни
исследователи присоединяются к этой точке зрения (Яковлев, 1950; Моди-
левский и др., 1958; Коробова, 19616), другие определяют ее как кампилотроп-
ную (Miller, 1919; Паламарчук, 1958; Чеботарь, 1960), амфитропную (Cooper,
1937), гемитропную (Цвелев, 1976), гемианатропную (Maze, Bohm, 1973; Shoda,
Bhanwaru, 1980), анакампилотропную (Bocquet, 1959; Савченко, Петрова,
1963). При этом даже семяпочку одного вида различные исследователи относят
218
/
Роасеае (продолжение)
к разным типам. Чандра и Саксена (Chandra, 1962, 1963; Chandra, Saxena,
1964), исследовавшие строение завязи и семяпочек различных триб злаков,
отмечают большое разнообразие строения семяпочек. Исследование генезиса
завязи и семяпочки разных видов пшеницы позволило выявить ряд
особенностей их формирования (Батыгина, 1974, 1987). Изменение положения
семяпочки в завязи является результатом неравномерного разрастания как одной
из /сторон завязи, так и самой семяпочки, тогда как изменение ее формы и
219
Роасеае (продолжение)
строения обусловлено в основном неравномерным ростом нуцеллуса и интегу-
ментов. Общий поворот семяпочки в целом (разворот направления микропиле)
происходит на 80—90 °, а не на 130—140 °, как указывалось ранее.
Морфологический тип семяпочки пшеницы может быть определен так: по положению в
завязи она сидячая, апотропная; по строению она приближается к анакампило-
тропной. У большинства злаков семяпочки с 2 интегументами, исключением
является Melocanna bambusoides, у которой, по последним данным, обнаружен
один интегумент (Петрова и др., 1985). Отмечается взаимно
перпендикулярное расположение клеточных слоев в интегументах (Percival, 1921; Алявдина,
1938). Микропиле обычно образовано одним интегументом, редко — обоими
(Miller, 1919; Narayanaswamy, 1955; Паламарчук, 1958; Петрова и др., 1985).
У некоторых видов Zea обнаружен интегументальный обтуратор (Weatherwax,
1930), у Zizania aquatica и Z. latifolla — разрастание наружного интегумента
в верхней части семяпочки (Петрова, Банникова, 1982). У большинства злаков
семяпочка крассинуцеллятная, однако для ячменя отмечен промежуточный
между красси- и тенуинуцеллятным типами семяпочки. У некоторых видов
220
Роасеае (продолжение)
19—22 — образование каллозных гребней и оболочек в микроспороцитах; 23 — однослойное
расположение микроспор на стенке пыльцевого гнезда; 24—26 — схема поворота семяпочки в ходе ее
развития: семяпочка на стадии меристематического бугорка (24), археспориальной клетки (25),
зрелого зародышевого мешка (26: 1—/ — основание завязи, 2—2 — основание семяпочки,
3—3 — продольная ось нуцеллуса);
Роасеае (продолжение)
27—46 — мегаспорогенез и развитие зародышевого мешка;
(пшеница, мятлик, кукуруза и др.) на раннем этапе развития под спорогенной
клеткой выявлен ряд «таблитчатых» клеток — своеобразная гипостаза (Баты-
гина, 1974; Батыгина, Фрейберг, 1979). Клетки нуцеллуса, смежные с
таблитчатыми, также приобретают со временем более или менее уплощенную форму.
Они имеют упорядоченную ориентацию по отношению к плацентохалазе и
непосредственно контактируют с ней. На стадии зрелого зародышевого мешка
таблитчатые клетки дегенерируют и замещаются растущим зародышевым
мешком, достигающим плацентохалазы. В этот период у ячменя нуцеллус
представлен эпидермисом и дифференцированными клетками его паренхимы
(Norstog, 1974). У кукурузы клетки эпидермиса делятся, образуя многослойный
нуцеллярный колпачок (Коробова, 1982). В клетках нуцеллуса, примыкающих к
зародышевому мешку, на отдельных участках наблюдаются цитомиксис и
образование цитоплазматических каналов (Шмараев, ориг. данные — см.:
Батыгина, 1987). Проводящая система завязи представлена 4 пучками, 2 из
которых (латеральные) идут в рыльце, образованное краями плодолистика,
а 2 других (дорсальный и вентральный) заканчиваются в завязи. Вентральный
пучок, снабжающий семяпочку, состоит из 2 слившихся пучков и
заканчивается в плацентохалазе. Археспорий одноклеточный. Археспориальная клетка
обычно дифференцируется непосредственно в мегаспороцит. Он значительно
увеличивается в размерах и принимает характерную цилиндрическую форму.
В мегаспороците отчетливо выявляется полярность (Батыгина, 1974; Russel,
222
Роасеае (продолжение)
1979; Коробова, 1982). В результате мейоза I образуется диада, в которой
халазальная клетка крупнее апикальной, в результате мейоза II, также
неравного — тетрада мегаспор. Тетрады обычно линейные, но встречаются
Т-образные, с наклонной перегородкой между апикальными клетками или без нее
223
Роасеае (продолжение)
47 — микропилярная часть зрелого зародышевого мешка;
(Maze, Bohm, 1974). Особенностью археспориальной клетки, мегаспороцита,
клеток диад и тетрад является наличие каллозы в их оболочках. Количество
ее в оболочках функционирующей и нефункционирующих мегаспор различно
(Schwab, 1971; Russell, 1979).
Зародышевый мешок развивается из халазальной мегаспоры по
Polygonum-типу. У Hordeum vulgare при переходе от ценоцитной к клеточной фазе
развития прослежен генезис 2 клеточных пластинок на микропилярном полюсе
зародышевого мешка. У одной из них, заложившеися перпендикулярно его
продольной оси, отмечены ответвления (Cass et al., 1985, 1986). В
сформированном зародышевом мешке имеются яйцевой аппарат, 2-ядерная центральная
клетка и антиподы. В результате дифференциации и специализации 'клеток
224
Роасеае (продолжение)
48—56 — двойное оплодотворение;
формируется зрелый зародышевый мешок, различающийся у разных видов
размерами, формой, положением и структурой элементов. Яйцеклетка
располагается ниже синергид, смещена несколько в сторону и вдается в центральную
клетку. Ядро яйцеклетки крупное, сильно хроматизированное, тип хроматизации
ядра различен у разных видов (Vazart, 1955). Число ядрышек в ядре часто
бывает высоким, но это не коррелирует с плоидностью (Батыгина, 1974).
В яйцеклетке в период интерфазы происходят значительные морфогенетические
изменения, касающиеся строения оболочки ядра и органелл. Оболочка
яйцеклетки в зрелом зародышевом мешке имеется в базальной части, в
апикальной— лишь плазмалемма (Stipa elmeri и др.). У Я. vulgare исчезновение
вещества клеточной оболочки в зонах контакта апикальных частей
«дегенерирующей» синергиды и яйцеклетки с центральной клеткой происходит после
опыления, но перед вхождением пыльцевой трубки в одну из синергид. До
опыления протопласты каждой из клеток яйцевого аппарата полностью окружены
клеточными оболочками (Cass, 1981). Синергиды имеют зубовидные выросты и
нитчатый аппарат. В апикальной части синергид оболочка также отсутствует.
Ядра синергид крупные, сильно хроматизированные, часто содержат большое
число ядрышек. У видов Cortaderia описаны гаустории синергид (Philipson,
1977, 1978, 1981; Philipson, Connor, 1984). Антиподальные клетки различаются
по величине, плоидности, форме и строению в зародышевом мешке как у одного
вида, так и у разных видов. Для многих из них характерно образование поли-
15 Зак. 2144
225
яд сп
54 К
Юм км
/<
SB
Poaceae (продолжение)
тенных хромосом (Ивановская, Прокофьева, 1963). Обычно количество антипод
возрастает в период «созревания» зародышевого мешка и составляет от 6 до
300 клеток. Подобные зародышевые мешки предложено рассматривать как
Роасеае-вариант Polygonum-типа. Исключением являются лишь Echinochloa
frumentacea и Panicum miliare, у которых только 3 антиподы (Anton, Cocucci,
1984). У отдельных форм кукурузы процесс деления антипод наблюдается и во
время развития зародыша и эндосперма (Randolph, 1936; Коробова, 1982).
15*
227
Роасеае (продолжение)
771 78 — развитие эндосперма; 79 — схема процесса клеткообразования в эндосперме, (а
—археспорий, ант — антиподы, в — вакуоль, в. о. з. м — выросты оболочки зародышевого мешка, в. ел —
внутренний слой, г — гипостаза, д. зар. кор — дополнительный зародышевый корень, д. м —
дегенерирующая мегаспора, д. п — дополнительная почечка, д. яд — дополнительные ядрышки, з — завязь,
зар — зародыш, зар. кор — зародышевый корень, к — каллоза, кл — колеоптиль, клр — колеориза,
Кр _ крахмал, кор. ч — корневой чехлик, л1 — первый листочек почечки, лг — лигула, н.а—
нитчатый аппарат, н. ел — наружный слой, н. к— нуцеллярный колпачок, о з. м — оболочка
зародышевого мешка, п. ел — париетальный слой, п. я — полярное ядро, р. с — разрушенная синергида,
с — синергида, сп — спермий, с. п. тр — содержимое пыльцевой трубки, сп. тк — спорогенная
ткань, ср. ел — средний слой, тп — тапетум, т р — точка роста, т. ц. в — тонопласт центральной
вакуоли, ф. к. с — формирующаяся клеточная стенка, ф. м — функционирующая мегаспора, ц. в —
центральная вакуоль, ц. кл — центральная клетка, ц. с — целая синергида, щ — щиток, эн — эндо-
теций, энд — эндосперм, эп — эпидерма (экзотеций), эпб — эпибласт, я — ядро, я. энд — ядро
эндосперма, яд. п. я — ядрышки полярных ядер, яд. сп — ядрышко спермия, я р. с — ядро
разрушенной синергиды, яц — яйцеклетка, я. ц. с — ядро целой синергиды, я. яц — ядро яйцеклетки,
яд. яц — ядрышко яйцеклетки. (1—18, 24—45, 47—78 — по Батыгиной, 1974, 19—23 — по
Романову, 1970; 46 — по Коробовой, 1982; 79 — по Шмараеву, 1983).
В этих случаях число антипод может достигать 100 и более.
Продолжительность их функционирования варьирует у разных §рдов и составляет в среднем от
5 до 25 сут после опыления. Отмечены случаи сохранения антипод до стадии
зрелой зерновки (Randolph, 1936; Коробова, 1982); они образуют ткань, клетки
которой содержат крахмал и мало отличаются от смежных клеток эндосперма.
Длительность существования этой ткани в зерновке кукурузы зависит от уровня
плоидности ее клеток: при отсутствии нарушений в ходе митозов клетки
антиподальной ткани остаются гаплоидными и сохраняются дольше, и напротив,
при нарушениях в ходе митозов образуются антиподы с полиплоидными ядрами,
время существования которых значительно сокращается (Randolph, 1936).
Антиподы сохраняются после оплодотворения и у Agrostis interrupta (Maze,
Bohm, 1974) и S. elmeri (Maze, Lin, 1975). Они исключительно богаты
рибосомами и гранулярным ЭР. Строение оболочки антипод различно как у разных
228
Роасеае (продолжение)
видов, так и в пределах одного антиподального комплекса. У ячменя в клетках,
граничащих с нуцеллусом, образуются выросты клеточной оболочки, а в меж-
антиподальных стенках имеются поры (Norstog, 1974). У антипод пшеницы
клеточные оболочки также имеют извилистые очертания (Шмараев, 1988).
Полярные ядра не сливаются до оплодотворения, за исключением некоторых
форм кукурузы, у которых отмечены случаи их раннего слияния (Коробова,
1982). Оболочка центральной клетки зародышевого мешка также образует
многочисленные выросты, которые достигают максимума в своем развитии
после оплодотворения к моменту формирования первых слоев клеток
эндосперма. Позднее они не обнаруживаются (Шмараев, ориг. данные — см.:
Батыгина, 1987; Орел, Шмараев, 1988). Центральная клетка зародышевого
мешка, таким образом, также организована по типу передаточных клеток.
Различные аспекты процесса оплодотворения у злаков рассмотрены в ряде
работ (Sax, 1918; Львова, 1950; Morrison, 1955; Оксиюк, Худяк, 1955; Модилев-
229
ский и др., 1958). Выявлены (на пшенице, кукурузе, ячмене) специфические
изменения поведения мужских гамет в процессе двойного оплодотворения (Ге-
расимова-Навашина, Батыгина, 1959; Батыгина, 1961а, 19616, 1962, 1974, 1987;
Коробова, 19616, 1982; Хведынич, 1969; Mogensen, 1982) и уточнен ряд
дискуссионных моментов, касающихся структуры спермиев и их объединения
с женскими ядрами (на ячмене) (Mogensen, 1982). Темп и характер
прорастания пыльцы и роста пыльцевых трубок видоспецифичны. Пыльцевые трубки
растут в проводниковой ткани пестика, раздвигая при этом плотно сомкнутые
его клетки, что часто приводит к их деформации и даже разрушению (Батыгина
и др., 1961). Обычно через 15—20 мин пыльцевые трубки достигают
микропиле. Спермин в пыльцевых трубках различных видов пшеницы претерпевают
значительные изменения по форме и структуре. Пыльцевая трубка (иногда
несколько) входит в зародышевый мешок либо через одну из синергид, либо
между ними. Обнаружена дегенерация 2 синергид еще до оплодотворения (You,
Jensen, 1985). Процесс двойного оплодотворения может быть охарактеризован
как идущий по премитотическому типу. Объединение ядра спермия с полярными
ядрами происходит до митоза (что соответствует, скорее, критериям
промежуточного типа), но полное объединение мужского и женского хроматина
происходит лишь в метафазе. После короткой интерфазы спермий в полярных ядрах
вступает в профазу раньше и раздельно от них (Батыгина, 1961а, 19616, 19626;
Коробова, 19616; Герасимова-Навашина, Батыгина, 1969). Явление
асинхронного преобразования хроматина мужских и женских гамет во время
оплодотворения, вероятно, можно объяснить разными для каждого спермия темпами
прохождения всех процессов и разными условиями, в которые попадает спермий
одной пары (Батыгина, 1959, 1961а, 19616, 19626, 1974). Имеется
определенная детерминированная сопряженность прохождения процессов син-
гамии и тройного слияния, а также развития зародыша и эндосперма. Нарушение
гомеостаза может приводить к аномалиям в развитии зародыша и эндосперма,
а часто и к полной гибели обеих структур. При этом отмечены обратимые и
необратимые нарушения (Батыгина, 1966).
Эндосперм нуклеарного типа. При развитии эндосперма наблюдаются волны
делений, которые идут от микропиле к халазе (Петрова, 1970). Ядерная
стадия развития характеризуется образованием ценоцитной структуры с
различной плотностью ядер в разных частях и их полиморфизмом. Плазмалемма
эндоспермального ценоцита пшеницы и ячменя извилиста (Morrison, O'Brien,
1976; Шмараев, ориг. данные — см.: Батыгина, 1987). Вопрос о механизме
клеткообразования в эндосперме остается дискуссионным (Батыгина, 1974;
Morrison, O'Brien, 1976; Шмараев, 1983; Fineran et al., 1982, и др.). Процесс
клеткообразования и исчезновения центральной вакуоли в эндосперме хлебных
злаков заканчивается через 3—7 сут после опыления. Особенностью клеточной
стадии развития эндосперма являются цитомиксис, наличие полиплоидных ядер,
выросты оболочки некоторых клеток, граничащих с плацентохалазой (Shel et al.,
1984). Своеобразная черта эндоспермогенеза у злаков — формирование
алейронового слоя, клетки которого приобретают характерный тип вакуолизации
(Иоффе, 1957). Алейроновый слой в зрелой зерновке пшеницы состоит из
3 зон, отличающихся по морфологии клеток (Ивановская, 1965). Строение
клеток алейронового слоя различно у представителей разных триб (Вигоров,
1960; Bechtel, Pomeranz, 1977; Холодова, Болякина, Бузулукова, 1980; Петрова
и др., 1985). Некоторые клетки алейронового слоя (обычно у основания
зерновки) , так же как и клетки эндоусперма, имеют выросты оболочек (Lee, O'Brien,
1970, 1971; Wada, Maeda, 1981). У некоторых видов, однако, они отсутствуют
(Post, Lersten, 1970; Петрова и др., 1985). Для многих злаков характерно
наличие субалейронового слоя, который по характеру вакуолизации и
включений напоминает алейроновый. Число алейроновых слоев у разных видов может
варьировать: у Arrhenatherum elatius их 2, у Sasa palmata и Pleioblastus di-
stichus 3—4 (Петрова, 1985). В эндосперме различных злаков описаны сложные
и простые крахмальные зерна (Александров, Александрова, 1936; Randolph,
1936; Яковлев, 1938, 1950). В эндосперме пшеницы крахмальные зерна
представлены различными типами (А, Б), которые различаются между собой
230
размерами. Эндосперм различается как по форме, так и по строению
крахмальных зерен (4 типа — Tateoka, 1962). Основные запасные вещества в
эндосперме — углеводы, белки, жиры; их количество и соотношение видоспеци-
фичны. Соотношение различных типов крахмала, белка и липидов определяет
структуру зрелой зерновки (стекловидность, мучнистость). У большинства
злаков большая часть эндосперма сохраняется в зрелой зерновке, у М. Ьат-
busoides он представлен лишь пленкой, заключенной между семенной кожурой
и щитком (Петрова, Яковлев, 1968).
Эмбриогенез злаков долгое время вызывал дискуссию. Его относили к
Onagrad- (Яковлев, 1946) или Asterad-типу (Поддубная-Арнольди, 1976),
к мегархитипу I (Soueges, 1939) или к мегархитипу II (Guignard, 1961a).
Гиньяр (Guignard, 1961a) показал несостоятельность положений Суэжа
(Soueges, 1924) о том, что точка роста у злаков образуется из базальной клетки
2-клеточного проэмбрио, и предложил новую схему строения зародыша злаков.
Магешвари (Mahehswari, 1950) считал, что эмбриогенез злаков не
укладывается ни в один из типов имеющихся классификаций, аргументируя это тем, что
в зародыше злаков нет определенного порядка в направлении клеточных
делений. Установлено, что развитие зародыша злаков протекает по
своеобразному Graminad-типу (Poad=Poaceae) (Батыгина, 1968а, 19686, 1974, 1987;
Batygina, 1969). Graminad-тип характеризуется своеобразием развития и
строения раннего проэмбрио, процессов органогенеза и строения зрелого зародыша.
Проэмбрио злаков присуще специфическое дорсовентральное строение,
являющееся в основном результатом определенной ориентации делений зиготы и
первых ее дериватов (наклонное положение перегородок по отношению к
продольной оси зародыша и одной перегородки к другой), в результате чего
образуется оригинальная тетрада бластомеров. Специфической особенностью
зародыша является его дорсовентральное строение начиная со стадии органогенеза,
сохраняющееся в процессе всего развития. Во многом это обусловлено дорсовен-
тральностью строения структур (зародышевый мешок, семяпочка, завязь),
в которых он развивается. Установлено, что латеральное положение апекса
побега и терминальное положение семядоли в развитом зародыше вторично как в
онтогенетическом, так и в историческом плане (Batygina, 1969; Батыгина, 1974).
Для большинства зрелых зародышей характерна совокупность специфических
органов: щиток, эпибласт, колеоптиль, мезокотиль, колеориза, почечка,
состоящая из нескольких примордиев листьев. Ридер (Reeder, 1957) на основании
совокупности ряда признаков зародыша (величина и форма щитка, наличие или
отсутствие эпибласта, щели между нижней частью щитка, характер ветвления
проводящей системы) выделил 6 его типов: Panicoid, Festucoid, Bambusoid,
Chlorid-Eragrostoid, Arundinoid-Danthoid, Orizoid-Olyroid.
Гаметофитный апомиксис и нуцеллярная эмбриония чаще всего встречаются
в роде Роа (Nischimura, 1922; Andersen, 1927; Akerberg, 1939; Hakansson,
1943, 1944; Nygren, 1950; Солнцева и др., 1977; Батыгина, Маметьева, 1979).
Выявлено, что у Роа pratensis нуцеллярные зародыши могут образовываться
2 способами: из одной клетки, подобно половому зародышу, и через
эмбриональный клеточный комплекс (Батыгина, Фрейберг, 1979). Интересной
особенностью является также образование зародышеподобных структур из антипод
в зародышевом мешке Stipa (Яковлев, Солнцева, 1965).
Исследованные роды и виды. Aegilops squarrosa, Agropyron
cristatum, A. repens, Agrostis interrupta, A. pilosula, A. vulgaris, Alopecurus
pratensis, A. ventricosus, Ammophila arenaria, A. baltica, Andropogon ischae-
mum, Arrhenatherum elatius, Arundinaria, Arundinella raddi, Arundo, Avena
fatua, A. sativa, A. strigosa, Bambusa arundinacea, Bothriochloa ischaemum,
B. odorata, Bouteloua hirsuta, B. pectinata, Brachiaria ruziziensis, Briza minor,
Bromus inermis, Calamagrostis obtusata, С purpurea, Capillipedium huegelii,
Cenchrus grancus, C. madulics, Ceratochloa, Chloris gayana, Coix aquatica,
C. lacryma-jobi, Cortaderia (14), Cymbopogon citriodorus, Cynodon dactylon,
Dactylis glomerata, Dactyloctenium aegyptium, Desmostachya bipinnata, Diar-
rhena, Dichanthium (== Andropogon) annulatum, D. aristatum, D. intermedium,
231
Dlgitaria polevansi, Echinochloa crus — galli, E. frumentacea, E. stagnina, Eleu-
sine africana, E. compressa, E. coracana, E. indica, Elymus arenarins, E. gigan-
teus, E. virginicus, Elytrophorus spicatus, Eragrostis cilianensis, E. curvula,
E. unioloides, Eremopogon foveolatus, Eustachys glauca, E. petraeus, Festuca
microstachys, F. pratensis, Hierochloe alpina, H. australis, H. monticola, H. odo-
rata, Hordeum (5), Jansenella griffithiana, Lolium multiflorum, Melocanna
bambusoides, Mibora minima, Oryza coarctata, O. sativa, Oryzopsis hendersoni,
O. miliacea, Panicum antidotale, P. maximum, P. miliaceum, P. miliare, Pappopho-
rum, Paspalum (7), Pennisetum (10), Phalaroides arundinacea, Phleum pra-
tense, Phragmites, Phyllostachys bambusoides, Pleioblastus distichus, Poa (8),
Pseudosasa japonica, Rhynchoryza subulata, Sasa palmata, Schizachyrium,
Secale cereale, S. segatale, Setaria italica, S. lutescens, S. verticillata, Sorghum
bicolor, S. caffrorum, S. vulgare, Spinifex litoreus, Sporobolus coromandelianus,
Stipa elmeri, S. leucotricha, S. tortilis, Themeda triandra, Tripsacum dactyloides,
Triticale, Triticum (7) и культурные формы, Urochloa mosambicensis, Zea mays,
Zizania aquatica, Z. latifolia, Z. texana.
Литература. Petit-Thouars, 1810; Cassini, 1828; Tieghem van, 1872;
Norner, 1881; Bruns, 1892; Hubert, 1896; Celakovsky, 1897; Cannon, 1900;
Guignard L., 1901; Karsten, 1904; Stapf, 1904; Kuwada, 1910, 1911; Brenchley,
1912; Bohutinsky, 1914; Sax, 1918; Miller, 1919; Weatherwax, 1919, 1926, 1930,
1955; Palm, 1920; Percival, 1921; Komuro, 1922; Nishimura, 1922; Harrington,
Croker, 1923; Stratton, 1923; Dietrich, 1924; Soueges, 1924, 1939, 1954; Kiessel-
bach, 1926; Rodrigo, 1926; Andersen, 1927; Watkins, 1927; Ferada, 1928; Reeves,
1928; Mowery, 1929; Noguchi, 1929; Percival et al., 1929; Avery, 1930; Ayyangar,
Krishnaswamy, 1930; Krishnaswamy, Ayyanagar, 1930, 1937; Lampe, 1931;
Яковлев, Николаенко, 1931; Beck, Horton, 1932; Kihara, Nishiyama, 1932; Ste-
nar, 1932; Yamaura, 1933; Alicja, Marja, 1934; Wakakuwa, 1934; Ayyangar,
Rao, 1935; Ramiah, Parthasarathy, Ramanujam, 1935; Александров,
Александрова, 1936; Drahowzal, 1936; Randolph, 1936; Armstrong, 1937; Boyes,
Thompson, 1937; Kichara, Hori, 1937, 1966; Kiellander, 1937, 1941; Pope,
1937, 1943a, 1943b, 1946; Рожевиц, 1937; Stover, 1937; Алявдина, 1938;
Яковлев, 1938, 1946, 1948, 1949, 1950; Akerberg, 1939, 1943; Александров, 1939, 1943;
Rahdolph, Ficsher, 1939; Kostoff, 1940; Narayanaswamy, 1940, 1952, 1955a,
1955b; Merry, 1941; Hakansson, 1943, 1944, 1948; Hansen, Abbe, 1943; Bennet,
1944; Brink, Cooper, 1944; Swamy, 1944; Ивановская, 1946, 1958, 1959, 1961,
1963, 1965, 1968, 1970, 1973, 1983; Nielsen, 1947a, 1947b; Artswager, MacGuire,
1949; Brown W. V., 1949, 1955, 1960, 1965; Львова, 1950; Nygren, 1950; Paul,
Datta, 1950, 1953; Beaudry, 1951; Skalinska, 1952, 1959; Johnston, 1953; Abbe,
Stein, 1954; Banerjee, 1954, 1967; Bell, 1954; Guttenberg, Heydel, Pankow, 1954;
Warmke, 1954; Morrison, 1955; Оксиюк, Худяк, 1955; Roth, 1955, 1957, 1959,
1961; Vazart, 1955; Celarier, Harlan, 1957; Иоффе, 1957; Merwe van der, 1957;
Reeder, 1957, 1962; Bashaw, Hoit, 1958; MacLeod, MacCorquodale, 1958;
Модилевский и др., 1958; Паламарчук, 1958; 1962; Петрова К. А., 1958; Баты-
гина, 1959, 1961а, 19616, 1962а, 19626, 1966, 1968а, 19686, 1969, 1974, 1978а,
19786, 1987; Герасимова-Навашина, Батыгина, 1959; Hoshikawa, 1959, 1960,
1967а, 1967b, 1967c, 1967d, 1967e, 1967f, 1967g, 1967h; Ключарева, 1959, 1973,
1983, 1985, 1986; Pankow, Guttenberg, 1959; Устинова, 1959, 1960; Вигоров,
1960; Kamra, 1960; Kumari, 1960; Чеботарь, 1960, 1969, 1970a, 19706, 1971,
1972, 1978, 1981; Батыгина, Долгова, Коробова, 1961; Carniel, 1961, 1962;
Guignard J. L., 1961a, 1961b, 1963, 1970, 1984; Коробова, 1961а, 19616, 1962,
1974, 1982; Rowley, 1961, 1963; Чолахян, Согомонян, 1961; Xy Хань, 1961;
Zhebrak, 1961; Афанасьева, 1962; Bashaw, 1962; Chandra, Tateoka, 1982; Гав-
рилова, 1962; Поддубная-Арнольди, Пащенко, 1962; Skwarla, Heslop-Harrison,
1962; Банникова В. П., 1963; Батыгина, Терехин и др., 1963; Белицер, 1963,
1965; Bremner, Eckersall, Scott, 1963; Buttrose, 1963a, 1963b; Ивановская,
Прокофьева, 1963а, 19636; Norstog, 1963, 1972, 1974; Palk, Jennings, Morton,
Palk, 1963; Савченко, Петрова, 1963; Yoshida, 1963; Бланковская, 1964;
Brown С. М., 1964; Chandra, Saxena, 1964; Engler, 1964; Фурсов, 1964; Venka-
teswarlu, Devi, 1964; Яковлев, Солнцева, 1964, 1965; Соколовская, 1965, 1967;
Батыгина, Троицкая, Алимова, 1966; Diboll, Larson, 1966; Erdelska, 1966; Lar-
232
son, 1966; Романов, 1966, 1970a, 19706; Luxova, 1967, 1968; Орел, 1967, 1969,
1970, 1972; Симонова, 1967, 1974; Солнцева, 1967, 1968; Татинцева, 1967,
1968а, 19686, 1972, 1975; Venkateswarlu, Rao, 1967, 1975, 1976; Weimarck,
1967а, 1967b, 1970; Cruz, Reddy, 1968; Diboll, 1968a, 1968b; Desai, 1968; Donini,
Hussain, 1968; Зотова, Филатова, 1968; Kubien, 1968, 1970a, 1970b; Лиманская,
1968; Литвиненко, 1968; Малышева, 1968; Маханец, 1968, 1971; Петрова Л. Р.,
Яковлев, 1968; Powell, Burton, 1968; Rao, Narayana, 1968; Руми, Шукуров,
1968; Салимова, 1968; Tilton, 1968; Христов, Крушева, 1968; Carlbom, 1969;
Chatterji, Timothy, 1969a, 1969b; Guignard, Mestre, 1969, 1970, 1971; Jones, 1969;
Канделаки, 1969; Lindgren, Eriksson, Ekberg, 1969; Paulson, 1969; Попова,
Николов, 1969; Reddy et al., 1969; Ross, Wilson, 1969; Saran Sunil, De Wet, 1969;
Shambulingappa, 1969; Sisodia, 1969; Тажин, 1969, 1971; Untawale, Deshpande,
Sharma, 1969; Фрумкина, Колесников, 1969; Хведынич, 1969; Vijendra, 1969;
Батыгина, Троицкая, 1970; Cass, Jensen, 1970; Dakshini, Fandon, 1970; Дарку-
лов, 1970; Evers, 1970; Жиров, 1970; Hanna, Schertz, Bashaw, 1970; Khoo,
Wolf, 1970; Кордюм, 1970; Лайкова, 1970; La Cour, Wells, 1970; Maze, Bohm,
Mehlenbacher, 1970; Mehlenbacher, 1970; Мовсесян, 1970; Москова, Мандилова,
1970; Петрова Т. Ф., 1970; Post, Lersten, 1970; Pritchard, 1970; Sapre, 1970; Tai,
1970; Хазова, 1970, 1971, 1972; Хведынич, Банникова В. П., 1970; Хохлов,
Малышева, 1970; Чеботарь, Челак, Суружиу, 1970; Zee O'Brien, 1970, 1971; Zeven,
Heemert van, 1970; Bennett, Chapman, Riley, 1971; Грати, 1971; Ильина, 1971;
Красноок, Ерыгин, 1971; Rost, 1971; Фрумкина, 1971; Хохлов, 1971; Цветаева,
1971; Шишкинская, Горюнова, 1971; Schwab, 1971; Lakshmanan, 1972;
Мануйлова, 1972; Philip, 1972; Rao, Murty, 1972; Христов, Москова, 1972; Voigt,
Bashaw, 1972; Bennett, Rao, Smith, Bayliss, 1973; Cass, 1973, 1981; Габедава,
1973, 1985; Данилова, Соколовская, 1973; Kurup, 1973; Maze, Bohm, 1973, 1974,
1977; Mlada, 1973, 1974, 1975; Москова, 1973; Stephen, 1973; Терзийски, Христов,
1973; Яковлев, Камелина, 1973; Chandra, Bhatnagar, 1974; Chennaveeraiah,
Kanmani, 1974; Christensen, Horner, 1974; Chuan-Ying, 1974, 1980; Главацкая,
Кабыш, 1974, 1975; Зуева, 1974, 1976a, 19766, 1977, 1980, 1981; Киршин,
1974; Лодкина, 1974; Pi Paihsi, Chuan Ying, 1974; Tanaka, 1974; Баева, 1975;
Банникова В. П., Хведынич, 1975, 1982; Johri, Ambegaokar, 1975; Кириллова,
Бущухина, 1975; Лодкина, Данилова, 1975; Mares, Norstog, Stone, 1975; Maze,
Lin Shuchang, 1975; Sadie, Okereke, 1975; Шишкинская, 1975, 1982, 1983; Mit-
roiu-Radulescu et al., 1975—1976, 1979—1980; Банникова В. А., 1976, 1979;
Bhatnagar, Chandra, 1976; Bhatt, Shah, 1976; Верещагина, 1976; Chikkannaiah,
Mahalingappa, 1975, 1976; Главацкая, Хохлова, 1976; Главацкая, Фомченкова,
1976; Deshpande, 1976; Harcharan, Dhaliwal, Lennart, 1976; Karas, Cass, 1976;
Morrison, O'Brien, 1976; Мошкович, Чеботарь, 1976; Muniyamma, 1976, 1978;
Muszynski, Kokon, 1976; Огородникова, 1976, 1977, 1980, 1983, 1986a, 19866;
Петрович,'1976; Philip, Haccius, 1976; Скачкова, 1976; Sladky, 1976; Цвелев,
1976; Шпильова, 1976; Bechtel, Pomeranz, 1977, 1978a, 1978b; Васильев,
Москова, 1977; Choda, Bhanwra, 1977, 1980; Giraldez, 1977; Главацкая, 1977,
1985; Hu Shiyi, Wang Moshar, Hsu Liyun, 1977; Зуева, Шатерников, Севидова,
1977; Jensen, 1977; Кирилова, 1977а, 19776; Kyle, Styles, 1977; Lin'Boryaw,
1977; Mahalingappa, 1977, 1978; Mares, Stone et al., 1977; Meyers, Stone,
Jeffry, Norstog, 1977; Philipson, 1977, 1978a, 1978b, 1981, 1985; Pohler, 1977;
Shanthamma, Narayan, 1977; Скворцов, 1977; Солнцева, Левковский, Кишечни-
кова, 1977; Steer, 1977; Vijendra, Rangaswamy, 1977; Яшвили, 1977, 1979;
Блюденов, Конарев, 1978; Дзевалтовский, Шпилевая, 1978; Grober, Matzk,
Zacharias, 1§78; Кириченко А. Б., Кириченко Е. Б., Чеботарь, 1978а, 19786;
Kocon, Muszynski, Sawa, 1978a, 1978b; Kocon, Muszynski, Dybowska et al., 1978;
Лазарева, 1978; Miodzianowski, Jdzikowska, 1978; Мошкович, 1978; Murty,
Mohan Rao, Rao N. G. P., 1978; Nagato, 1978, 1981; Narayana, Narsa, 1978; Nasinec,
1978; Nishiyama, Yabuno, 1978, 1979; Орел, Огородникова, 1978; Поддубная-
Арнольди, 1978; Rao, Narayana, Reddy, 1978; Shanthamma, 1978, 1979, 1982;
Цицин, 1978; Шулындин, Островская, 1978; Vazard, 1978; Vijendra, Sree, 1978;
Батыгина, Маметьева, 1979; Батыгина, Фрейберг, 1979; Cebrat, 1979, 1983;
Costas-Lippman, 1979; Главацкий, Ржанова, 1979; Deshpande, Raju, 1979;
Emery, Guy, 1979; Heslop-Harrison, 1979; Hu, Zhu, Xu, Li, Zhen, 1979; Зуева,
233
Егорова, 1979, 1980; Levings, Pring, 1979; Левковский, Солнцева, 1979;
Мирошниченко, 1979, 1982; Петрова Л. Р., 1979; Reddy, Narayana, Rao N. G.,
1979; Russell, 1979; Sau Hingyu, Chuang Yingchao, 1979; Sunderland, Roberts,
Evans, Wildon, 1979; Христов, 1979; Христов, Терзийски, 1979; Шакарян, Авакян,
Амирбекян, 1979; Young, Schulz-Schaeffer, Caroll, 1979; Young, Sherwood,
Bashaw, 1979; Bhanwra, Kumar, Choda, 1980; Birari, 1980; Cartier, Lengir, 1980;
Cheng, Shiyi, Liyun, Xinzu, Jiacheng, 1980; Cochrane, Duffus, 1980; Focke, 1980;
Govindappa, Arecal, 1980; Hanten, Ahlgren, Carlson, 1980; Hara, Hondo, Funa-
cuma, 1980; Kosina, 1980; Lakshmanan, Jayalakshmi, 1980; Палилова, Орлов,
1980; Rao A. N., Sindhe, Govindappa, Arekal, 1980; Рочева, Таскаева, 1980;
Rudramaniyappa, Panchaksharappa, 1980, 1982; Shah, Sreekumaris, 1980; Shoda,
Bhanwaru, 1980; Симоненко, 1980; Tang Xihua, Shen Ruijuan, Cao Meisheng,
1980; Фурсова, 1980; Холодова, Болякина, Бузулукова, 1980; Walter, 1980;
Whallon, 1980; Zhu Zhiping, Shen Ruijuan, Tang Xihua, 1980; Basappa, Mu-
niyamma, 1981; Bhanwra, 1981, 1985; Bhanwra, Choda, 1981, 1986; Bhanwra,
Choda, Deori, 1981; Campbell et al., 1981; Chu, Hu, 1981; Colhoun, Steer, 1981;
Hsu, Sunyuan, Peterson, 1981; Hu, Zhu, Xu, 1981; Joachimiak, 1981; Kolhe, Bhat,
1981; Lammeren van, 1981, 1986a, 1986b, 1987; Мудрова, Поддубная-Арнольди,
1981; Parker, 1981; Saini, Aspinall, 1981; Wada, Maeda, 1981; Barkworth,
1982; Bechtel, Gaines, Pomeranz, 1982; Bhandari, Khosla, 1982; Bhanwra,
Choda, Kumar, 1982; Carman, Hatch, 1982; Choda, Harsch, Bhanwra, 1982;
Deshpande, Gomkale, 1982; Fineran, Wild, Ingerfeld, 1982; Gobbe, Longly, Lou-
rant, 1982; Жгенти, 1982; Hill, 1982; Jacques-Felix, 1982; Лукьянюк, 1982;
Мелия, 1982, 1983; Mogensen, 1982; Mol, Zenkteler, 1982; Петрова Л. Р.,
Банникова В. А., 1982; Steven, 1982; Шишкинская, Ларина, 1982; Шмараев, 1982,
1983а, 19836; Zeleznak, Varriano-Marston, 1982; Авалкина, 1983; Батыгина,
Васильева, 1983; Бияшев, Хайленко, 1983; Bourdu, 1983; Заиров, Ережепов,
Валиханова, 1983; Звержанская, 1983; Hernandez, 1983; Lammeren van, Kieft
van, 1983; Lammeren van, Marti, 1983; Lammeren van, Shel van, 1983; Орлова,
Авалкина, 1983, 1985; Петров, Батыгина, 1983, 1986а, 19866; Rogers, Quatrano,
1983; Satyamurty, Seshavatharam, 1983; Schrober, 1983; Smart, O'Brien et al.,
1983; Wang Yaozhi, Cheng Kuochang, 1983; Xiang Yuanxi, De Caicui, 1983; Xu S.
X., Xu X. В., Han, 1983; Zhang Tingbi, 1983; Anton, Cocucci, 1984; Aulbach-Smith,
Her, 1984; Богданова, 1984; Cass, Peteya, Robertson, 1984, 1985, 1986; Chen Zhu,
Chen, Cao, 1984; Hagemann, Schroden, 1984; Kukkarni, Dnyan, 1984; Lu, Kuo,
1984; Murty, Kirti, Sridhar, Bharati, 1984; Negbi, 1984; Philipson, Connor,
1984; Протасевич, 1984; Schel, Kieft, Lammeren van, 1984; Shah, 1984; Симинел,
Кильчевская, 1984; Stefaniak, 1984; Xi, Demason, 1984; Yang, Li, 1984; Hari Go-
pal, Mohan Ram, 1985; Heslop-Harisson J., Heslop-Harisson Y., Reger, 1985;
Jayalakshmi, Pantulu, 1985; Карамшук, Поляков, 1985; Кириченко, 1985;
Круглова, 1985, 1987; Longly, Rabau, Louant, 1985; Mogensen, Rusche, 1985;
Mu Xijin, Wang Fuxiong, 1985; Петрова, Федотова, Николаевская, 1985;
Satyamurty, 1985; Хайленко, Бияшев, 1985; You, Jensen, 1985; Bhuskute, Macde,
1986; El-Ghazaly, Jensen, 1986, 1987; Ge Xiulin, Qian Nanfer, Wang Fuxiong,
1986; Kvaale, Olsen, 1986; Shobha, Sindne, Nagabhushana Rao, 1986; Тарасенко,
Банникова, 1986; Тихенко, 1986; Федорова, 1986; Хведынич, Петрик, 1986;
Хведынич, Середюк, 1986; Baum, Grant Bailey, 1987; Crane, Carman, 1987;
Lersten, 1987; McConchie, Hough, Knox, 1987; Орел, Шмараев, 1987а, 19876,
1988. Шишкинская, Бородько, 1987; Cass, Fabi, 1988; Heslop-Harisson J.,
Heslop-Harisson Y., 1988; Raghavan, 1988; Raju Manjarabad V. S., Walter, Quick,
1988; Тарасенко, 1988; Тарасенко, Банникова, Сытник, 1988.
234
Порядок 16. ZINGIBERALES
Семейство STRELITZIACEAE
Пыльник 4-гнездный. Сформированная стенка гнезда пыльника состоит из
эпидермиса, эндотеция, в котором образуются фиброзные утолщения, 3—6
эфемерных средних слоев и тапетума, клетки которого содержат 2—3 ядра.
Тапетум секреторного типа, у Strelitzia reginae отмечены 2—3 слоя тапетальных
клеток. Образование микроспор происходит по сукцессивному типу.
Расположение их в тетраде Т-образное, изобилатеральное или линейное. Иногда в
результате нарушений мейоза в микроспорогенезе образуются аномальные структуры,
состоящие из 5—8 клеток. Пыльцевые зерна, которые развиваются из них,
оказываются нежизнеспособными. Вегетативные ядра таких пыльцевых зерен
эфемерны и быстро дегенерируют. Зрелые пыльцевые зерна 2-клеточные.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Микропиле
образовано обоими интегументами, имеются ариллоид и нуцеллярный колпачок.
Археспорий одноклеточный. Археспориальная клетка отделяет париетальную.
Тетрады мегаспор расположены линейно или Т-образно. Начало зародышевому
мешку дает халазальная мегаспора.
Зародышевый мешок развивается по Polygonum-типу. Синергиды имеют
грушевидную форму. 3 небольшие клетки антипод дегенерируют вскоре после
образования. Полярные ядра сливаются перед оплодотворением.
Оплодотворение не изучено.
Эндосперм нуклеарного типа, в зрелом семени сохраняется. Перисперм
отсутствует или сохраняется (Плиско, 1985).
Развитие зародыша не изучено. В зрелом семени он небольшой, прямой,
с одной массивной семядолей, верхушка которой функционирует как гаусторий.
Исследованный вид. Strelitzia reginae.
Литература. Humphrey, 1896; Brown, Sharp, 1911; Schnarf, 1931;
Mauritzon, 1936; Davis, 1966; Тахтаджян, 1966, 1970; Venter van de, 1976;
Поддубная-Арнольди, 1982; Плиско, 1985.
Семейство MUSACEAE
Развитие стенки гнезда пыльника и ее строение не изучены. Тапетум
секреторного типа, клетки его 2-ядерные. Микроспороциты многочисленные,
вступают в мейоз неодновременно. Мейоз сопровождается сукцессивным
цитокинезом. Тетрады микроспор изобилатеральные. Зрелые пыльцевые зерна 3-кле-
точные, содержат крахмал. Обычным является прорастание пыльцевых зерен
внутри пыльников.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Внутренний
интегумент 2-слойный. Микропиле образуется обоими интегументами.
Париетальная ткань представлена несколькими клетками, которые в процессе
развития семяпочки разрушаются. Эпидермальные клетки вершины нуцеллуса у
многих видов радиально удлиняются, образуя клювовидный вырост в область
микропиле. После оплодотворения клеточные оболочки их утолщаются. У Musa
coccinea формируется постамент. Археспориальная клетка (редко их может /
быть 2) делится на париетальную клетку и мегаспороцит. Далее париетальная
клетка претерпевает 1—2 деления. Из мегаспороцита в результате мейоза
образуется тетрада мегаспор: Т-образная, обратно-Т-образная или линейная.
Иногда микропилярная клетка диады в отличие от халазальной не делится
и в этих случаях формируется триада мегаспор. Функционирующей остается
халазальная мегаспора, остальные дегенерируют.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Синергиды грушевидные, яйцеклетка по размерам несколько меньше синергид,
3 клетки антипод эфемерны. В некоторых случаях клеткообразование в хала-
зальном конце не происходит, и антиподальные ядра находятся в центральной
235
/—4 — Musa ornya Chittagong, 5—9 — M. paradisiaca ssp. sapientum var. Gros Michel, 10—18 —
M. paradisiaca ssp. sapientum var. Appelbacove
1—4 — микроспорогенез; 5—7 — пыльцевые зерна; 8 — семяпочка с мегаспороцитом; 9 — схема
семяпочки на стадии зрелого зародышевого мешка; 10 — 2 мегаспороцита в одной семяпочке;
11—13 — мегаспорогенез; 14, 15 — одноядерный зародышевый мешок с дегенерирующими
микроспорами над ним; 16, 17 — 2-ядерный и 4-ядерный зародышевые мешки; 18 — зародышевый мешок
с яйцевым аппаратом и 2 антиподальными ядрами. (/—4, 10—18 — по Agremond, 1915; 5—8 — по
White, 1928; 9 — по Agremond, 1912).
клетке. Полярные ядра перед тройным слиянием смещаются в сторону антипод.
Зрелый зародышевый мешок имеет зауженные микропилярный и халазальный
концы и очень широкую центральную часть. Пыльцевые трубки дорастают до
зародышевого мешка через 3—4 недели после опыления. Яйцеклетка может
оставаться неоплодотворенной в течение 6 недель.
Эндосперм нуклеарный. Клеткообразование начинается в нем при большом
числе ядер. У М. acuminata ssp. burmaniaca это происходит через 55 сут после
оплодотворения, у других видов этот период может быть еще более
продолжительным. Ядра эндосперма могут различаться по р-азмерам, деления их
происходят асинхронно. Эндосперм массивный, имеет алейроновый слой. Остатки
эндосперма, а также перисперм сохраняются в зрелом семени.
Эмбриогенез изучен слабо. Первое деление зиготы поперечное или
наклонное. 15—20-клеточные зародыши имеют глобулярную форму, подвесок
представлен 1—2 клетками. Развитие зародыша происходит медленно, и через 2 мес
после начала развития он имеет эллипсовидную форму без признаков
органогенеза. Зрелые зародыши характеризуются высокой степенью дифференциации:
имеют зародышевый корень с зачатками нескольких адвентивных корней,
почечку с 1—2 примордиальными листьями, массивную семядолю, хорошо
развитый прокамбий. Ось почечки не продолжает оси зародышевого корня, угол
между ними составляет 90—120°.
Большинство гибридных, полиплоидных форм и сортов съедобных бананов
не является абсолютно стерильным. У них наблюдается, хотя и очень редко,
формирование жизнеспособных пыльцевых зерен, зародышевых мешков и
зародышей. Возможны различные аномалии в развитии этих структур.
Аномальный мейоз в микроспороцитах может приводить к неправильному распределению
генетического материала между микроспорами. Из одного микроспороцита
может формироваться различное число клеток микроспор (от 2 до 6). Некоторые
из таких микроспор оказываются способными к дальнейшему развитию
вплоть до образования сформированных пыльцевых зерен, однако плоидность
таких пыльцевых зерен может быть различной — от п до 2п, включая анеу-
плоиды. Для М. paradisiaca ssp. sapientum var. Gros Michel наряду с
секреторным типом тапетума отмечается образование амебоидного тапетума. Мейоз
в мегаспороцитах также может проходить с отклонениями, сходными с таковыми
в мейозе микроспороцитов. Мегаспоры в результате образования
реституционных ядер и анеуплоидии могут различаться по плоидности. В случае
жизнеспособности таких мегаспор из них формируются диплоспорические
зародышевые мешки.
У многих представителей рода Musa возможен апомиксис. У М. paradisiaca
ssp. sapientum var. Gros Michel отмечено развитие зародыша при наличии
2 неповрежденных синергид, что свидетельствует о возможности
партеногенеза. Формирование жизнеспособных пыльцевых зерен и зародышевых
мешков с нередуцированным числом хромосом является, вероятно, основной
причиной образования высокополиплоидных форм культурных сортов бананов.
У М. seminifera и ее гибридов обнаружена полиэмбриония.
Дополнительные зародыши формируются в результате «почкования» зиготического
зародыша. При этом первые 8—10 делений в нем происходят, как у других
видов, однако далее деления становятся все менее и менее регулярными,
на многоклеточном половом зародыше образуются выступы и протуберанцы,
что приводит в дальнейшем к образованию 2—4 отделенных друг от друга
зародышей. Каждый из этих зародышей может нормально
дифференцироваться, достигать зрелости и, прорастая, давать отдельные растения (White,
1928).
Исследованные виды. Musa acuminata (формы), М. acuminata
ssp. burmaniaca, M. arnoldiana, M. bakeri, M. balbisiana (формы), М. basjoo,
М. cavendishii, M. coccinea, M. ensete, M. errans var. botoan, M. ornata ssp.
sapientum (var. Gros Michel, var. Appelbacove), M. religiosa, M. rosea, M.
seminifera.
Литература. Humphrey, 1986; Gatin, 1905, 1908; Tishler, 1910, 1912;
Agremont, 1912, 1915; White, 1928; Juliano, Alcala, 1933; Dodds, 1943, 1945;
237
Shepherd, 1954, 1960; Wakabayashi, 1959; Gahan, 1961; Simmonds, 1961;
Bouharmont, 1963; Nur, 1976.
Семейство HELICONIACEAE
Эмбриологически почти не исследовано.
Образование тетрад микроспор сукцессивное.
Развитие зародышевого мешка происходит по Polygonum-типу.
Эндосперм нуклеарный.
Исследованный вид. Heliconia bihai.
Литература. Humphrey, 1986; Palm, 1920; Kracauer, 1930; Schnarf,
1931; Тахтаджян, 1966, 1970; Поддубная-Арнольди, 1982.
Семейство LOWIACEAE
Эмбриологически не исследовано.
Семейство ZINGIBERACEAE
Пыльник 4-гнездный. Сформированная стенка гнезда пыльника состоит из
эпидермиса, эндотеция, 4—5 средних слоев и тапетума. Фиброзные утолщения
развиваются не только в эндотеции. У Атотит, Elettaria, Hitchenia и Zingiber
они наблюдаются также и в эпидермисе. Из 4—5 средних слоев эфемерны самые
внутренние, а один или 2 наружных слоя сохраняются, в них также могут
развиваться фиброзные утолщения. Последние распространяются и на
клеточные слои со стороны связника. В зрелом пыльнике стенка гнезда наряду с эндо-
тецием может сохранять не только эпидермис, но и 1—2 средних слоя,
снабженных фиброзными утолщениями. Тапетум клеточный секреторный, нерегулярно
2- или 3-слойный. У Атотит dealbatum и Nicolaia atropurpurea (Boehm von,
1931; Sachar, Arora, 1963) отмечено своеобразие в развитии тапетума.
Образование тетрад микроспор сукцессивное. У Alpinia calcarata (Raghavan, Venka-
tasubban, 1941), Elettaria cardamomum и Zingiber macrostachyum (Pan-
chaksharappa, 1966) тетрады микроспор изобилатеральные, как и у видов,
исследованных Панхаксхараппа (Panchaksharappa, 1959 — цит. по: Sachar,
Arora, 1963). У Hitchenia caulina наряду с изобилатеральными тетрадами
обнаружены и Т-образные (там же). Положение микроспор в тетрадах N.
atropurpurea нестабильно: описаны изобилатеральные, линейные, тетраэдральные
и Т-образные тетрады (Boehm von, 1931). У Curcuma colorata отмечены
случаи образования от 4 до 7 микроспор из одного микроспороцита (Palm,
1920). Пыльцевые зерна 2-клеточные. У Е. cardamomum, H. caulina и Z.
macrostachyum в них отмечен крахмал (Panchaksharappa, 1962, 1966).
Семяпочка анатропная, изредка ортотропная (Я.
caulina—Panchaksharappa, 1966; Hedychium acuminatum—Sachar, Arora, 1963), с 2 интегу-
ментами, крассинуцеллятная. Эпидермис нуцеллуса претерпевает ряд перикли-
нальных делений, становясь многослойным в латеральной зоне. Клетки микро-
пилярного полюса эпидермиса остаются, однако, неподелившимися. Они сильно
вытягиваются в радиальном направлении. Такой генезис эпидермиса
нуцеллуса описан у исследованных Мауритзоном (Mauritzon, 1936) видов, у
Hedychium coronarium (Harling, 1949), Н. acuminatum, A. dealbatum (Sachar,
Zingiberaceae
1,7,9 — Hitchenia caulina, 2—6 — Elettaria cardamomum, 8, 22—25 — Hedychium coronarium, 10—
15, 21 — Paracautleya bhatii, 16—20, 26—40 — Hedychium acuminatum
1—6 — развитие стенки гнезда пыльника и отдельные фазы микроспорогенеза и развития
пыльцевого зерна; 7 — продольный срез семяпочки на стадии зрелого зародышевого мешка; 8,9 —
продольные медианные срезы нуцеллуса с 4-ядерным (8) и зрелым зародышевым мешком (9), видны пери-
клинальные деления в латеральных зонах эпидермиса (8, 9, 21) и нуцеллярный колпачок (9);
10—21 — заложение археспориальной клетки, образование париетального слоя, мегаспорогенез и
развитие зародышевого мешка; отмечены триады мегаспор (15) и развитие 2. зародышевых мешков
из мегаспор одной тетрады (17); синергиды с крючковидными выростами (20) или конической формы
(21);
238
36 37 \-Уз9 *°
Zingiberшеае (продолжение)
22—29 — варианты генезиса халазальной клетки эндосперма гелобиального типа развития (=ба-
зального аппарата); 30—40 — последовательные фазы эмбриогенеза. (/—7, 9 — по
Panchaksharappa, 1966; 8, 22—25 —по Harling, 1949; 10—15, 21 — по Gurudeva, Somashekar, 1985; 16—20,
26—40— по Sachar, Агога, 1963).
Arora, 1963) и Е. cardamomum (Panchaksharappa, 1966). Большинством
авторов такой многослойный эпидермис нуцеллуса определяется как нуцел-
лярный колпачок. Согласно Мауритзону, он характерен для всех
представителей семейства. У Я. caulina и Z. macrostachyum описан, однако, типичный ну-
целлярный колпачок — разросшаяся апикальная зона нуцеллуса в результате
периклинальных делений клеток эпидермиса (Panchaksharappa, 1962, 1966).
После оплодотворения из разрастающихся в радиальном направлении
апикальных клеток эпидермиса нуцеллуса и нуцеллярного колпачка образуется
эпистаза. Утолщения приурочены к тангентальным клеточным стенкам.
Эпистаза отсутствует у A. calcarata (Raghavan, Venkatasubban, 1941) и
Е. cardamomum (Panchaksharappa, 1966). В халазальной части семяпочки
клетки нуцеллуса образуют гипостазу. Гипостаза и эпистаза сохраняются
до созревания семени. В зрелых семяпочках и в семенах формируется постамент
(Boehm von, 1931; Harling, 1949; Panchaksharappa, 1966). Образование
постамента, согласно Дальгрену (Dahlgren, 1940 — цит. по: Harling, 1949),
характерно для всех представителей Zingiberaceae. В зрелом семени многих
представителей семейства нуцеллус сохраняется в качестве перисперма. Его клетки
заполнены крахмалом. Микропиле образуется внутренним интегументом. На-
240
ружный интегумент обычно многослойный (Hedychium — 5—7 слоев, Ато-
тит — 6—7, Aframomum — 8—13 слоев), внутренний — всегда 2-слойный,
только при переходе к эндостому становится 3-слойным. У Е. cardamomum
внутренний эпидермис наружного интегумента формирует каменистый слой
(Humphrey, 1896; Panchaksharappa, 1959). Описаны карункула и ариллус.
У Donacodes elongata (=Amomum)} Elettaria sp. и Alpinia mutica ариллус
не обнаружен (Humphrey, 1896). Археспорий одноклеточный. Первичная
париетальная клетка делится, формируя один слой париетальных клеток. Споро-
генная клетка увеличивается и функционирует как мегаспороцит. Тетрады
мегаспор линейные и Т-образные (A. dealbatum — Sachar, Arora, 1963). У Я. сого-
narium (Harling, 1949), как и у Kaempfera baueri (Mauritzon, 1936 — цит. по:
Harling, 1949), во всех исследованных случаях тетрады мегаспор Т-образные.
У Я. acuminatum, однако, тетрады мегаспор только линейные (Sachar, Arora,
1963), как и у N. atropurpurea (Boehm von, 1931). Изредка наблюдали также
изобилатеральные тетрады, а у Curcuma aromatica, Я. caulina, Z. macro-
stachyum (Panchaksharappa, 1959) и Paracautleya bhatil (Gurudeva, Somashe-
kar, 1985) наряду с тетрадами наблюдали также и триады. Функционирует
халазальная мегаспора.
Зародышевый мешок развивается по Polygonum-типу. Зрелый зародышевый
мешок грушевидный. У Я. acuminatum синергиды с крючкообразными
выростами (Sachar, Arora, 1963), у P. bhatii синергиды конические (Gurudeva,
Somashekar, 1985). У Z. macrostachyum синергиды дегенерируют до
оплодотворения. Яйцеклетка крупнее синергид. Антиподы (3 клетки) эфемерны;
у Я coronarium (Harling, 1949), как и у N. atropurpurea (Boehm von, 1931), —
иногда сохраняющиеся в ходе эндоспермогенеза. Полярные ядра сливаются до
оплодотворения, центральное ядро зародышевого мешка находится в его
зауженной халазальнои части. Характерной для семейства является миграция
ядер нуцеллуса в зародышевый мешок (Boehm von, 1931; Madge, 1934;
Harling, 1949; Panchaksharappa, 1959). Порогамия. Двойное оплодотворение.
Сингамия и тройное слияние происходят синхронно.
Эндосперм гелобиальный. Обе клетки эндосперма у Hedychium разделены
целлюлозной оболочкой, у других видов — плазматической мембраной
(Panchaksharappa, 1962, 1966). В крупной микропилярной клетке в ранний период
эмбриогенеза происходят свободноядерные деления. В ходе этого процесса ядра
распределяются по периферии клетки. Переход к клеткообразованию в ней
наблюдается на глобулярной стадии развития зародыша. При этом завершается
дезинтеграция окружающих клеток нуцеллуса. Небольшая халазальная клетка
остается обычно 2-ядерной, но у Я. caulina в ней насчитывается до 24 ядер.
Чаще всего халазальная клетка эндосперма дегенерирует на одно- или 2-
ядерной стадии. Поведение халазальнои клетки у Я. acuminatum вариабельно.
Установлено 3 основных варианта ее генезиса: в отдельных семяпочках
халазальная клетка увеличивается в размерах, но остается одноядерной, в других
она становится 2-ядерной и в третьих — 2-клеточной. В последнем случае
формируется базальный аппарат гаусториального типа. Его верхняя клетка
становится ценоцитной с гипертрофированными ядрами; нижняя при этом остается
одноядерной (Sachar, Arora, 1963). Отмечена большая вариабельность в
степени развития базального аппарата у различных представителей семейства.
У Hitchenia, Elettaria и Zingiber, например, он 2-ядерный (Panchaksharappa,
1959), как и у Я. coronarium (Harling, 1949). Базальный аппарат дегенерирует
в проэмбриональный период эмбриогенеза. В зрелых семенах эндосперм
содержит крахмал. У Elettaria в дополнение к крахмалу наблюдаются кристаллы
оксалата кальция (Berger, 1958). На микропилярном конце зародышевого
мешка сохраняется алейроновый слой толщиной в один или 2 ряда клеток,
который лишен каких-либо запасных веществ (Panchaksharappa, 1962a, 1962b,
1966). Согласно Харлингу (Harling, 1949), у Я. coronarium возможно
автономное развитие эндосперма.
Эмбриогенез протекает по Asterad-типу. Зародыш в семени прямой,
цилиндрический или конический, дифференцированный, с одной семядолей. У Alpinia
nutans зародыш 2-дольчатый (Tschirch, 1891 —цит. по: Плиско, 1985).
Подвесок не образуется. Семя с хорошо развитым периспермом и остатками
эндосперма.
16 Зак. 2144 241
Известны случаи полиэмбрионии. У Z. macrostachyum и Hitchenia
добавочные зародыши нуцеллярные по происхождению (Panchaksharappa, 1962,
1966); у Я. acuminatum добавочные зародыши образуются из синергид (Sachar,
Arora, 1963). У A. dealbatum теми же авторами отмечен случай наличия
в семяпочке близнецовых нуцеллусов.
Исследованные роды и виды. Aframomum melegueta, Alpinia
alata, A. calcarata, A. mutica, A. nutans, Amomum daniellii, A. dealbatum,
A. elongatum (=Donacodes elongata), Brachychilum horsfieldii, Burbidgea,
Curcuma aromatica, C. colorata, Elettaria cardamomum, Globba bracteata,
G. bulbifera, Hedychium acuminatum, H. coronarium, H. gardnerianum, H. spica-
tum, Hitchenia caulina, Kaempfera baueri, Nicolaia atropurpurea, Paracautleya
bhatii, Roscoea, Zingiber macrostachyum.
Литература. Elfving, 1879; Humphrey, 1896; Lotscher, 1905; Gaiin,
1912; Ролл, Ильев, 1912; Palm, 1915, 1920; Sussenguth, 1921; Schachner, 1924;
Netolitzky, 1926; Loesener, 1930; Boehm von, 1931; Schnarf, 1931; Madge, 1934,
1936; Gregory, 1936; Mauritzon, 1936; Dahlgren K. V. O., 1940; Raghavan,
Venkatasubban, 1941; Harling, 1949; Berger, 1958; Panchaksharappa, 1959,
1961, 1962a, 1962b, 1966, 1970; Sachar, Arora, 1963; Singh, 1964; Davis, 1966;
Тахтаджян, 1966, 1970, 1980; Philip, 1968; Поддубная-Арнольди, 1982; Guru-
deva, Somashekar, 1985; Плиско, 1985.
Семейство COSTACEAE
Пыльник 4-гнездный. Сформированная стенка гнезда пыльника состоит из
эпидермиса, эндотеция, 4—5 средних слоев и тапетума. Эндотеций имеет
фиброзные утолщения. Тапетум клеточный секреторный; его клетки 2-ядерные
(Costus speciosus — Banerji, 1940; Panchaksharappa, 1962). У С. cylindricus и
С. speciosus описан многослойный тапетум. Образование тетрад микроспор
сукцессивное. Тетрады микроспор изобилатеральные. Пыльцевые зерна 2-кле-
точные. Генеративная клетка небольшая, линзовидная. Цитоплазма
вегетативной клетки богата крахмалом.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Эпидермис
нуцеллуса в микропилярной зоне представлен радиально удлиненными
клетками (периклинальных делений в эпидермисе нуцеллуса не отмечено ни
в микропилярной, ни в латеральной частях). Внутренние тангентальные
стенки этих палисадоподобных клеток утолщаются. Эту ткань рассматривают
как эпистазу. В халазальной области нуцеллуса дифференцируется гипостаза.
Нуцеллус сохраняется в семени в качестве перисперма с запасным
крахмалом. Микропиле образуется внутренним интегументом. Наружный интегумент
5—6-слойный, внутренний — 2-слойный. У С. speciosus внутренний эпидермис
наружного интегумента формирует каменистый слой (Humphrey, 1896;
Panchaksharappa, 1959). Описаны также ариллус и оперкулум. Археспорий
одноклеточный. Отделяется один слой париетальных клеток. У С. speciosus, по одним
данным, тетрады мегаспор линейные (Panchaksharappa, 1962), по другим —
во всех исследованных случаях тетрады мегаспор Т-образные (Banerji, Ven-
kateswarlu, 1936 — цит. по: Harling, 1949). Функционирует халазальная
мегаспора. Известны случаи наличия двух зародышевых мешков в одном
нуцеллусе (С. speciosus — Panchaksharappa, 1962); образуются они благодаря
функционированию 2 смежных мегаспор одной тетрады.
Зародышевый мешок развивается по Polygonum-типу, что характерно для
С. cylindricus (Boehm von, 1931) и С. speciosus (Panchaksharappa, 1962).
Однако у Costus sp. (Humphrey, 1896) и С. igneus (Mauritzon, 1936) был
описан Adoxa-тип развития зародышевого мешка. Синергиды с
крючкообразными выростами. Антиподы эфемерные, очень мелкие и дегенерируют, как и
обе синергиды, еще до оплодотворения. Полярные ядра сливаются также до
оплодотворения. Вторичное ядро центральной клетки зародышевого мешка
находится в его халазальной части. В зародышевом мешке С. speciosus
отмечено наличие добавочных — «блуждающих» — ядер (по терминологии
Мэджа — Madge, 1934). Это ядра окружающих дезинтегрирующих клеток
242
/—7, 9—26 — Costus speciosus, 8 — С. cuspidatus
1—7 — развитие стенки гнезда пыльника и отдельные фазы микроспорогенеза и развития
пыльцевого зерна; 8 — продольный медианный срез зрелой семяпочки; 9—14 — заложение археспориаль-
ной клетки, образование париетального слоя, мегаспорогенез и развитие зародышевого мешка;
16*
нуцеллуса. Оплодотворение порогамное. Сингамия и тройное слияние
происходят почти одновременно (Banerji, 1940). Пыльцевая трубка сохраняется даже
в процессе формирования эндосперма.
Эндосперм гелобиальный. У Costus первые клетки разделены целлюлозной
оболочкой (Panchaksharappa, 1966). У С. speciosus в микропилярной клетке
ценоцитная фаза эндоспермогенеза продолжается до глобулярной стадии
развития зародыша, после чего начинается клеткообразование. Клетки
заполняются липидными телами. Халазальная клетка также становится ценоцитной.
Она увеличивается, ее цитоплазма становится оптически плотной, ядра
гипертрофированными. В базальном аппарате С. speciosus клеткообразования не
отмечено. Признаки дезинтеграции в нем проявляются ко времени
дифференциации зародыша. В семени сохраняется один слой клеток эндосперма,
именуемый алейроновым слоем, на микропилярном полюсе и от 5 до 7 слоев клеток
в латеральной части. Крахмал в эндосперме не наблюдается.
Эмбриогенез протекает по Caryophyllad-типу Sagittaria-вариации. Подвесок
не образуется. Зародыш прямой, почти цилиндрический, дифференцированный,
с одной семядолей; почечка с 2 или более листовыми примордиями; наряду
с главным наблюдаются и добавочные зародышевые корни.
Исследованные виды. Costus cuspidatus (=Costus igneus),
С. cylindricus, С. igneus, С. malortieanus, С. speciosus.
Литература. Humphrey, 1896; Lotscher, 1905; Palm, 1920; Boyd, 1930;
Boehm von, 1931; Schnarf, 1931; Banerji, Venkateswarlu, 1935; Madge, 1936;
Mauritzon, 1936; Fagerlind, 1939; Banerji, 1940; Ranchaksharappa, 1959, 1962;
Mangaly, Sworrupanandan, 1977; Тахтаджян, 1980; Grootjen, Bouman, 1981;
Плиско, 1985.
244
Семейство CANNACEAE
Пыльник 2-гнездный. Стенка гнезда пыльника у Carina indicaXC. sp. (Ti-
wari, Gunning, 1986) формируется следующим образом: группа субэпидер-
мальных археспориальных клеток, делясь, образует наружный париетальный
слой и внутренний спорогенный слой. Из париетального слоя развивается
эндотеций, 2—4 средних слоя и 4—5 слоев тапетума. Клетки эндотеция на
Саппасеае
1 — Carina humilis, 2—10 — Carina sp.
1 — пыльник, диаграмма поперечного среза
2—4 — формирование стенки пыльника и
пыльцевого зерна;
245
Саппасеае (продолжение)
5 — схема семяпочки на стадии зрелого зародышевого мешка;
6,7 — ранние стадии развития семяпочки и мегаспороцит; 8 —
двойное оплодотворение; 9 — зигота и ядерный эндосперм; 10 —
многоклеточный зародыш. (/ — по Offerijns, 1936; 2—10 — ориг.)
ранних стадиях претерпевают 1—2 периклинальных деления, формируя
многослойный эндотеций. Ко времени первого митоза в микроспорах в эндотеции
образуются характерные фиброзные утолщения. Средние слои сохраняются
долго — до 2-клеточной стадии развития пыльцевых зерен. Клетки тапетума к
началу мейоза становятся 2—6-ядерными. Как показали Тивери и Ганнинг
(Timari, Ganning, 1986), у С. indicaXC. sp. в период профазы мейоза оболочки
клеток тапетума растворяются, протопласты обособляются и могут проникать в
полость гнезда. При этом протопласты разных клеток не сливаются друг с
другом и периплазмодий не формируется. На более поздних стадиях
протопласты удлиняются, приобретая амебоидную форму, и в созревающем пыльнике
их фрагменты можно наблюдать в контакте с пыльцевыми зернами, где они
участвуют в образовании трифинового покрытия пыльцевых зерен. Тапетум
Саппа авторы называют инвазивным, рассматривая его как промежуточный
между секреторным и периплазмодиальным типами. Стенка зрелого пыльника
состоит из сплющенных клеток эпидермиса, 2—3 слоев фиброзного эндотеция
и остатков средних слоев. Спорогенная ткань 2—3-слойная. Тетрады
микроспор образуются сукцессивно. Микроспорогенез исследован на
ультраструктурном уровне (Scheer, Franke, 1972). Зрелые пыльцевые зерна у большинства
видов Саппа 2-клеточные. Однако встречаются виды и с 3-клеточными
пыльцевыми зернами, например С. polymorpha (Никифоров, Феофилова, 1982), С.
indicaXC. sp. (Tiwari, Gunning, 1986).
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Микропиле
сформировано внутренним интегументом, состоящим из 2 слоев клеток.
Наружный интегумент многослойный. Проводящий пучок доходит почти до халазы.
Ко времени оплодотворения формируется гипостаза. Археспорий
одноклеточный, делясь, образует париетальную и спорогенную клетки. Париетальная
клетка путем периклинальных и антиклинальных делений формирует 2 слоя
клеток. Спорогенная клетка преобразуется в мегаспороцит. В результате
мейоза образуется линейная тетрада мегаспор.
Зародышевый мешок формируется по Polygonum-типу, вытянутый, с хорошо
дифференцированным яйцевым аппаратом. Синергиды грушевидной формы.
3 антиподы эфемерны. Полярные ядра сливаются перед оплодотворением.
Оплодотворение порогамное, двойное.
Эндосперм нуклеарный. В зрелом семени хорошо развит перисперм;
эндосперм сохраняется в виде тонкого слоя.
Эмбриогенез не изучен. Зародыш прямой, маленький, односемядольный,
содержит крахмал. Подвесок слабо развит.
Исследованные виды. Саппа discolor, С. generalis, С. glauca,
С. humilis. С. indica, С. lutea, С. polymorpha, Саппа sp.
Литература. Guignard, 1882; Wiegand, 1900; Gatin, 1909; Schnarf,
1931; Offerijns, 1936; Erdtman, 1954; Davis, 1966; Тахтаджян, 1966, 1970;
Scheer, 1972; Franke, 1973; Шевченко, Феофилова, 1981; Никифоров,
Феофилова, 1982; Tiwari, Gunning, 1986; Шевченко, ориг. данные.
Семейство MARANTACEAE
Пыльник 2-гнездный, однотековый, вскрывается продольно. Перегородка
между гнездами разрушается перед созреванием пыльника. По нашим данным,
в пыльниках Calathea louisae, Maranta leuconeura и Ctenanthe lubbersiana *
в постмейотический период образуются плацентоиды — выросты стерильной
ткани со стороны связника внутрь гнезда. Стенка гнезда пыльника
формируется по центробежному типу и состоит из эпидермиса, эндотеция (у
Maranta— 2-слойного), 5—7 средних слоев и неравномерно-многослойного
тапетума, некрупные клетки которого становятся 2-ядерными у Maranta и Ctenanthe
и 2—4-ядерными у Calathea. Клетки тапетума интенсивно делятся и врастают
между микроспороцитами, иногда образуя перегородки. Во время мейоза
оболочки клеток тапетума растворяются, происходит интенсивное выделение пол-
Материал собран в оранжереях БИН АН СССР (Ленинград).
247
Marantaceae
l—g> nt na> 13, 13a, 15—32 — Calathea louisae, 10, 10a, 12, 12a — Ctenanthe lubbersiana, 14, 14a —
Maranta leuconeura, 33 — Calathea picturata
1—14a — последовательные стадии развития пыльника: 1,2 — гнездо пыльника и его схема (2а) с
формирующейся стенкой, 3,4 — фрагменты пыльника с микроспороцитами в профазе (3) и мета-
фазе I (4), 5 — мейоз II в диадах, в тапетуме начало растворения оболочек и выделение гранул
полленкита, 5а — схема пыльника с диадами, 6 — тетрады микроспор и схема пыльника на этой
Marantaceae (продолжение).
стадии (6а), 7 — разобщение микроспор из тетрады, 8— фрагмент пыльника с микроспорами,
пространство между которыми заполнено гранулами полленкита и слизью, 9—11 — фрагменты
пыльника с 2-клеточными пыльцевыми зернами и схемы (10а, 11а) пыльников, в которых
перегородка между гнездами еще не разрушена, вокруг пыльцевых зерен остатки полленкита (9, 10)
Marantaceae (продолжение)
15—21 — динамика развития семяпочки от спорогенной клетки до зрелого зародышевого мешка;
ленкита, который в виде тяжей и гранул окружает и протопласты тапетума, и
тетрады микроспор, микроспоры, а затем и пыльцевые зерна. Протопласты
клеток тапетума дегенерируют, практически оставаясь в своем изначальном
положении. Таким образом, реорганизации тапетума не происходит, и тапетум,
очевидно, можно классифицировать как клеточный секреторный, тем более что
вокруг протопластов наблюдалась тонкая вторичная оболочка. Обрикулы не
различимы из-за обилия гранул полленкита. К моменту деления ядра вакуо-
лизированной микроспоры тапетум полностью лизирует. Средние слои у Са-
lathea постепенно разрушаются, выделяя небольшое количество слизи, которая
Marantaceae (продолжение)
и слизи (//), тапетум полностью лизирован, изменения в средних слоях, 12 — фрагмент пыльника
и его схема (12а) с 2-клеточным пыльцевым зерном, интенсивное выделение слизи средними слоями,
которая заполняет пространство гнезда, 13 — стенка и зрелое пыльцевое зерно во вскрывающемся
пыльнике и его схема (13а), 14 — схема пыльника и его фрагмент (14а) со зрелым пыльцевым
зерном;
251
исчезает по мере созревания пыльцевого зерна. Для Maranta и Ctenanthe
характерно наличие слизи полисахаридной природы вплоть до вскрытия
пыльника, что обусловлено спецификой поведения средних слоев. После
исчезновения тапетума ранее уплощенные, с плотной цитоплазмой клетки внутреннего
среднего слоя, к нему примыкавшие, заметно изменяются. Они увеличиваются,
вакуолизируются, некоторые из них становятся пузыревидными или вдаются
в полость гнезда и интенсивно выделяют слизь. Клетки остальных средних
слоев также увеличиваются и ослизняются. Разрушение средних слоев
происходит медленно, и часто даже к моменту вскрытия пыльников отдельные
клетки одного или 2 слоев сохраняются. В эндотеции и в 2—3 слоях связника,
прилегающих к гнезду, образуются фиброзные утолщения. Стенка зрелого
пыльника представлена сжатым эпидермисом (кутикула не обнаружена),
у Calathea и Ctenanthe однослойным, у Maranta 2-слойным фиброзным эндоте-
цием и 1—2 средними слоями или гомогенной массой из остатков оболочек
средних слоев (Calathea). Спорогенная ткань одно-, 2-слойная. Микроспоро-
циты очень крупные, каллоза в их оболочках почти не откладывается. Тетрады
микроспор образуются по сукцессивному типу, они изобилатеральные,
Т-образные, линейные, иногда тетраэдральные. Зрелые пыльцевые зерна 2-клеточные.
У Calathea генеративная клетка длинная, лентовидная, спирально скрученная,
с большим количеством гомогенной цитоплазмы и округлым ядром,
расположенным в центре клетки. Ядро вегетативной клетки округлое, цитоплазма
заполнена гранулами запасных веществ. У Maranta и Ctenanthe пыльцевые зерна
очень крупные, генеративная клетка веретеновидная, как правило,
соприкасается с ядром вегетативной клетки, образуя единый комплекс.
Семяпочка ана-кампилотропная, с 2 интегументами, крассинуцеллятная.
Микропиле образовано внутренним интегументом, за исключением рода Phry-
nium, у представителей которого оно образовано обоими интегументами.
Внутренний интегумент состоит из 2 слоев клеток, в микропилярной части
разрастается до 4—5 слоев. Наружный интегумент 5-слойный, расширяющийся
в микропилярной части до 12—14 слоев. К моменту оплодотворения в этой
части интегумента выделяются зоны активных делений клеток, идущих в разных
направлениях и формирующих специфические образования: ариллоид, опер-
кулум и микропилярный воротничок (Mauritzon, 1936; Grootjen, 1983; Плиско,
252
1985). Нуцеллус массивный, со слаборазвитой микропилярной зоной, в которой
различается нуцеллярный колпачок, состоящий из радиально удлиненных
папилловидных клеток эпидермиса, у Thalia dealbata врастающих в микропиле
(Schachner, 1924), и 5—7 слоев у Calathea или 3—4 слоев у Maranta
значительно более мелких клеток латеральной части, формирующих своеобразный
валик. Радиально удлиненные клетки эпидермиса апикальной части нуцеллуса
с утолщенными оболочками рассматриваются как эпистаза, клетки которой
заполняются танинами. Халазальная зона нуцеллуса массивная, многослойная,
в ее клетках накапливается крахмал. Гипостаза представлена клетками с
утолщенными пектиновыми оболочками, окружающими халазальный конец
зародышевого мешка. Фуникулус широкий, с обтуратором, по фуникулусу к основанию
нуцеллуса проходит массивный проводящий пучок, у Thalia, Maranta и Stro-
manthe — разветвленный. Далее по нуцеллусу к гипостазе следует тяж из
тонкостенных вытянутых клеток. После оплодотворения со стороны фуникулуса
формируется халазальный вырост с проводящим пучком, врастающий в
нуцеллус и образующий в семени периспермальный канал (Grootjen, 1983),
разветвленный у Thalia, Maranta и Stromanthe на 2 рукава. Археспорий
одноклеточный, отделяет париетальную клетку, которая образует один слой
париетальной ткани, полностью разрушающейся в процессе развития зародышевого
мешка. Мегаспорогенез завершается образованием линейной тетрады мегаспор.
Функционирующей становится халазальная мегаспора.
253
Marantaceae (продолжение)
30—32 — вариабельность строения антипод, гипостаза четко выделяется утолщенными оболочками
клеток (25—32); 33 — почти зрелое семя, (а — ариллоид, в. п — васкулярный пучок, з — зародыш,
on — одревесневшая часть оперкулюма, п — перисперм). (1—32 — ориг.; 33 — по Grootjen, 1983).
Зародышевый мешок моноспориче'ёкий, развивается по Polygonum-типу.
Зрелый зародышевый мешок овальный, с крупными элементами. Синергиды
с ядрами в центре клетки, вакуолью в апикальной части, с нитчатым
аппаратом. Яйцеклетка с ядром в апикальной и вакуолью в центральной части клетки.
У С. louisae встречались зародышевые мешки, в которых все 3 клетки яйцевого
аппарата дифференцированы по типу синергид. Полярные ядра сливаются до
или во время (Calathea) оплодотворения. 3 антиподы у Thalia эфемерные
клетки, у Maranta, Phrynium и Stromanthe присутствуют после оплодотворения,
а у Calathea они вариабельны и по форме, и по числу; могут быть одноядерными,
с неравномерно утолщенными оболочками, или образуют 5—6-клеточный
комплекс. Крупные 2—5-ядерные антиподы наблюдались у Maranta arundina-
сеа и М. veitchii. В родах Calathea и Maranta отмечались случаи развития
2 зародышевых мешков в одной семяпочке (Ролл, Ильев, 1912). Порогамия,
двойное оплодотворение.
Эндосперм нуклеарный. В зрелом семени не сохраняется. Запасающей
тканью является перисперм с клетками, заполненными крахмалом.
Эмбриогенез предположительно отнесен к Chenopodiad-типу (Johansen,
1950). Зрелый зародыш изогнутый, дифференцированный, с крупной семя-
долью, бесхлорофилльный.
Ис следованные виды. Calathea louisae, С. picturata, Ctenanthe
lubbersiana, Maranta arundinacea, M. leuconeura, M. veitchii, Phrynium capi-
tatum, Pleiostachya pruinosa, Stromanthe lutea, Thalia dealbata, T. genicu-
lata.
Литература. Hofmeister, 1861; Jonsson, 1881; Humphrey, 1896; Ролл,
Ильев, 1912; Schachner, 1924; Mauritzon, 1936; Venkateswarlu, 1937; Johansen,
1950; Davis, 1966; Поддубная-Арнольди, 1982; Grootjen, 1983; Плиско, 1985;
Камелина, 1990 и ориг. данные по Calathea louisae, Ctenanthe lubbersiana,
Maranta leuconeura.
254
ИОрЯДОК 1/. AKCV-^iLHO
Семейство ARECACEAE
Пыльник 4-гнездный. Стенка гнезда пыльника формируется
центростремительно и состоит из эпидермиса, эндотеция, 1—5 средних слоев и тапетума.
Тапетум секреторного типа. Он может становиться 2-слойным (Hyphaene
indica — Mahabale, Chennaveeraiah, 1957; Borassus flabellifer, Licuala sp.,
Livistona sp., Pritchardia sp. — Rao, 1955, 1956) и даже 2—4-слойным (Cocos
nucifera — Juliano, Quisumbing, 1931). Клетки тапетума, как правило, 2-ядер-
ные, однако у Cocos plumosa (Rao, 1959b) и Phoenix sylvestris (Mahabale,
Biradar, 1968) обнаружены и многоядерные клетки; у Caryota urens клетки
тапетума первоначально имеют радиально удлиненную форму; в них
наблюдается запасной крахмал (Rao, 1959b). В пыльниках С. nucifera обнаружен
настоящий периплазмодий, образование которого начинается на стадии микроспоро-
цитов (Juliano, Quisumbing, 1931). Число средних слоев вариабельно:
у Н. indica — их 2—3, у С. nucifera — 3--5, у большинства исследованных
видов, однако, описаны 1—2 средних слоя. Они, как правило, эфемерны.
Отмечены случаи сохранения этих слоев и в зрелом пыльнике (С. nucifera). Эндоте-
ций с фиброзными утолщениями. У Livistona chinensis (Kulkarni, Mahabale,
1974) и Ph. sylvestris он нерегулярно 2-слойный. В зрелом пыльнике стенка
состоит из эпидермиса и фиброзного эндотеция. У Ph. sylvestris (Mahabale,
Biradar, 1968), Chrysalidocarpus lutescens (Rao, 1959b) и Ch. lucubensis (наши
данные) наружная поверхность эпидермиса покрыта кутикулой. По нашим
данным, в отдельных клетках эндотеция зрелого пыльника Chrysalidocarpus
lucubensis накапливаются танины. Образование тетрад микроспор происходит
симультанно. Исключение составляют Nypa fruticans (Radermacher, 1925 —
цит. по: Mahabale, Chennaveeraiah, 1957), Ph. sylvestris и Pinanga disticha
(Davis, 1966), у которых описан сукцессивный тип образования тетрад
микроспор. Способ образования тетрад микроспор у Н. indica своеобразный
(Mahabale, Chennaveeraiah, 1957). Тетрады микроспор тетраэдральные, изобилате-
ральные. У Н. indica наблюдаются также Т-образные и линейные тетрады.
У Areca catechu и Ch. lutescens наряду с тетраэдральными иногда встречаются
изобилатеральные и крестообразные тетрады (Rao, 1959b). У С. nucifera
(Juliano, Quisumbing, 1931) к Areca triandra (Rao, 1959b) отмечена
стерилизация отдельных микроспор в тетрадах. Зрелые пыльцевые зерна 2-клеточные.
У Phoenix robusta встречаются и 3-клеточные пыльцевые зерна (Biradar,
Mahabale, 1968 — см. ил.). Генеративная клетка С. nucifera, Ph. sylvestris
и Ph. robusta чечевицеобразной формы. У Chamaerops описаны веретеновидные
генеративные клетки (Schnarf, 1938). Генеративные клетки Ch. lutescens (Rao,
1959b) и Ch. lucubensis (наши данные) имеют форму полумесяца.
Семяпочка анатропная, гемианатропная, реже — кампилотропная и орто-
тропная, с 2 интегументами, крассинуцеллятная. У большинства исследованных
видов микропиле образуется обоими интегументами. Оно может быть прямым
(С/г. lutescens, H. indica, виды Phoenix, Ch. lucubensis — наши данные) или
зигзагообразным (С. plumosa, Licuala grandis, L. peltata, L. spinosa, Livistona
chinensis, Pritchardia pacifica, Trachycarpus sp.). У A. catechu и A. triandra
экзостом короткий, но у A. concinna, Actinophloeus macarthurii, Caryota mitis,
C. urens, Cocos plumosa, С schizophylla, Howea belmoreana, L. grandis и L.
peltata он сильно удлинен. Livistona rotundifolia характеризуется очень коротким
как экзо-, так и эндостомом. У Sabal blackburniana (=Sabal palmetto),
S. adansoni и Washingtonia sp. микропиле прямое и формируется внутренним
интегументом, экзостом образуется только после оплодотворения (S. palmetto).
Интегументы различаются по толщине. Наружный интегумент, как правило,
4—5-слойный, а внутренний — 2—3-слойный. У Ph. robusta наружный
интегумент 5—7-слойный, а внутренний — 3—4-слойный. Н. indica характеризуется
12—14-слойным наружным интегументом и 3—4-слойным внутренним.
Массивный наружный интегумент описан у Elaeis guineensis, его внутренний интегумент
255
также толще, чем у других пальм — 5—7-слойный (Kajale, Ranade, 1953).
Почти у всех исследованных видов дифференцируется интегументальный тапе-
тум. Известны, однако, и исключения: у L. chinensis эта ткань хорошо выражена
(Kulkarni, Mahabale, 1974), однако у другого вида рода Livistona — L.
rotundifolla — в зрелых семяпочках она не обнаружена. Отмечено лишь радиальное
удлинение клеток внутреннего интегумента после оплодотворения (Rao, 1959a).
Клетки внутреннего эпидермиса внутреннего интегумента зрелых семяпочек
S. adansonl радиально удлинены, но не выделяются структурой своего
протопласта. У L. grandls и L. splnosa 2-слойный интегументальный тапетум. То же
самое обнаружено нами и у Coccothrlnax crlnlta-, при этом во внутреннем,1
'обращенном к зародышевому мешку, слое с вытянутыми в радиальном
направлении клетками на стадии 4-ярусного проэмбрио отмечена вакуолизация протог
пластов. Интегументальный тапетум L. grandls аккумулирует крахмал, что
отмечено в семяпочках еще с 2-ядерным зародышевым мешком. У P. paclflca также
(описано накопление крахмала в клетках интегументального тапетума, но после
оплодотворения (Rao, 1959a). У L. rotundifolla зрелый зародышевый мешок
окружен 3—4 слоями клеток нуцеллуса, часть которых сохраняется и на ранних
фазах развития семени. У S. blackburnlana (=S. palmetto) и S. adansonl (Rao,
1959a), а также у 2 видов Areca, Caryota, Chrysalldocarpus, Howea, Actlno-
phloeus и Cocos (Rao, 1959b) только 1—2 слоя клеток нуцеллуса окружают
зрелый зародышевый мешок. У Е. gulneensls на стадии зрелого зародышевого
мешка наблюдается только эпидермис нуцеллуса. У видов с интегументальным
тапетумом нуцеллус полностью разрушается ко времени созревания
зародышевого мешка. Для большинства исследованных видов характерен постамент.
Наличие постамента установлено у видов Areca, Llcuala, Ch. lutescens, H. belmo-
reana, A. macarthurll и Waschlngtonla sp. (Rao, 1955b, 1959a, 1959b). Клетки
нуцеллуса вокруг постамента дезинтегрируют, а постамент сохраняется,
вдаваясь в полость мешка либо с противоположной микропиле стороны,
либо с одной из латеральных сторон. У A. catechu клетки апикальной части
постамента богаче цитоплазмой, чем клетки его базальной части. Антиподы
Nephrosperma и Verschaffeltla благодаря наличию постамента далеко вдаются
в зародышевый мешок (Bauch, 1911). Постамент сохраняется до 3—4-клеточной
стадии развития проэмбрио. У Н. belmoreana и A. trlandra он вытесняется
в период развития руминаций эндосперма и постепенно дезинтегрирует.
У S. adansonl клетки нуцеллуса вокруг антиподального конца зародышевого
мешка тонкостенны, вакуолизированы и выполняют, по-видимому, функции
тапетума (Rao, 1959а). У L. rotundifolla, L. chinensis, S. blackburnlanum
(=S. palmetto) и S. adansonl толстостенных клеток нуцеллуса вокруг
зародышевого мешка не обнаружено; вследствие этого контур зародышевого мешка
ровный. У P. paclflca и Trachycarpus sp. клетки нуцеллуса вокруг халазального
полюса зародышевого мешка характеризуются утолщенными оболочками, хотя
и не формируют постамента (Rao, 1959a). Не формируется постамент и у Bactrls
major (Rao, 1959b). Семяпочка пальм варьирует также и по степени развития
и структуре фуникулярных обтураторов (подробнее об этом см.: Rao, 1959a).
Наиболее ярко выражен обтуратор у видов Sabal. У S. palmetto клетки
эпидермиса фуникулуса образуют пальцеобразные одноклеточные волоски типа
секреторных клеток, а у других видов — железистую ткань (Rao, 1959a). Обтуратор
видов Sabal и L. rotundifolla сохраняется до начальных фаз развития семени.
У исследованного нами С. crlnlta фуникулярный обтуратор отмечен в проэмбрио-
нальный период развития зародыша. Характерной особенностью всех
исследованных родов является сильное развитие халазы семяпочки. Благодаря росту
семяпочки главным образом за счет халазального района интегументы часто
Агесасеае
1, 2, 46, 47, 49, 50 — Actlnophloeus macarthurli, 3,4 — Caryota urens, 5—7, 11—13, 26 — Phoenix syl-
vestris, 8, 9, 24 — Cocos nucifera, 10,^25, 55 — Chrysalldocarpus lucubensis, 14, 15, 23, 43, 45 — Ch.
lutescens, 16—22, 38—42 — Hyphaene indica, 27 — Cocos plumosa, 28 — Washingtonia sp., 29 —
Llcuala grandls, 30—33, 44 — Areca catechu, 34—37 — Livistona chinensis, 48, 53, 54 — Coccothrlnax
crlnlta, 51 —Areca trlandra, 52 — Howea belmoreana, 56—66 — Chamaerops humllls
1—10— фрагменты продольного (1) и поперечных срезов гнезд пыльников: на 10 сохраняющийся
эпидермис с утолщенными клеточными стенками, покрыт кутикулой с сосочковидными выростами;
отдельные клетки эндотеция заполнены танином; л„„
17 Зак. 2144 257
Arecaceae (продолжение)
11—25 — микроспорогенез и развитие пыльцевого зерна: тетраэдральные (13—15), изобилатераль-
ные (19), линейные (20) и Т-образные тетрады микроспор (21); на 22 представлена октада;
срезы пыльцевых зерен (25) даны в разных плоскостях;
23 У различных представителей семейства;
оказываются очень короткими. Другой чертой, свойственной всем
исследованным видам, является аккумуляция танина в клетках халазы и наружного интегу-
мента. Начало этого процесса отмечено уже в период образования тетрад
мегаспор (Rao, 1959b). У Ph. robusta отложение танина отмечено и во
внутреннем интегументе. У A. catechu танин первоначально появляется в отдельных
субэпидермальных клетках нуцеллуса (Raghavan, Baruah, 1958). Семяпочки
пальм вариабельны по характеру сосудистого снабжения. У Ph. sylvestris
и Ph. robusta проводящий пучок доходит до халазы. У большинства пальм
проводящие пучки входят в наружный интегумент и в нем разветвляются. В
наружном интегументе Е. guineensis и Н. indica насчитывается до 15—18 проводящих
пучков. У Ch. lutescens проводящие пучки пронизывают наружный интегумент
почти до микропиле. В нуцеллусе и во внутреннем интегументе проводящие
пучки полностью отсутствуют. Имеются данные о возможном таксономическом
значении характера сосудистого снабжения в семяпочках пальм (Uhl, Moore,
1971; Uhl, 1972). Археспорий одноклеточный. У Е. guineensis (Kajale, Ranade,
1953) отмечены случаи наличия в одном нуцеллусе 2 зародышевых мешков.
Аналогичные данные по Cocos nucifera (Bauch, 1911), однако, не подтвердились
при дальнейших исследованиях. В одной семяпочке изредка наблюдали лишь
2 мегаспороцита (Reddy, Kulkarni, 1989). Париетальная ткань обычно 2—3-
слойная; у Н. indica и N. fruticans — однослойная; у отдельных видов отмечено
до 6 париетальных слоев (A. catechu, С. nucifera). У L. chinensis описана 1—3-
слойная париетальная ткань (Rao, 1959b), а у L. rotundifolia — однослойная
париетальная ткань и нуцеллярный колпачок (Mahabale, Biradar, 1968).
У подавляющего большинства видов мейоз в мегаспороците сопровождается
цитокинезом и завершается образованием линейной тетрады мегаспор.
У Е. guineensis, однако, описаны по крайней мере 4 различных типа тетрад:
линейные, Т-образные (наиболее часто встречающиеся), обратно-Т-образные
и изобилатеральные (Kajale, Ranade, 1959, 1953). Согласно Pao (Rao, 1959b),
у С. mitis, Ch. lutescens, A. macarthurii и Areca catechu наблюдаются как
линейные, так и Т-образные тетрады. То же отмечено и у Cocos nucifera (Reddy,
Kulkarni, 1989). Функционирующей является халазальная мегаспора.
Зародышевый мешок моноспорический, развивается по Polygonum-типу.
Имеются данные о наличии у пальм и других типов развития зародышевых
17*
259
Arecaceae (продолжение)
30—42 — мегаспорогенез и развитие зародышевого мешка;
мешков, но они противоречивы. Так, зародышевый мешок Chamaedorea latifolia
(Jonsson, 1879—1880 — по Mahabale, Chennaveeraiah, 1957) и N. fruticans
(Radermacher, 1925) определен как биспорический. Дальнейшими
исследованиями, однако, это не подтвердилось (Maheshwari S. С., 1955). Наличие Allium-
типа развития у Н. indica (Mahabale, Chennaveeraiah, 1957) представляется
260
Arecaceae (продолжение)
43—46 — особенности строения антипод у различных представителей семейства; 47 — вхождение
пыльцевой трубки в зародышевый мешок; 48 — микропилярная часть семяпочки после
оплодотворения: видны проэмбрио, эндосперм в свободноядерном состоянии, сохраняющаяся синергида,
остатки клеток нуцеллуса; оба слоя внутреннего интегумента функционируют как интегументаль-
ный тапетум; показано место отложения танинов в этом районе семяпочки;
Arecaceae (продолжение)
49, 50 — 2 последовательные начальные фазы клеткообразования в эндосперме; 51—54 —
формирование руминированного эндосперма; на схеме 53 показано относительное расположение
проводящих пучков и руминаций на поперечном срезе развивающегося семени (фаза проэмбрио) —
руминации образуются за счет локальных разрастаний наружного интегумента в направлении
зародышевого мешка (54); 55 — одна из заключительных фаз клеткообразования в эндосперме;
клетки наружного интегумента заполнены танином (внутренний интегумент дегенерирует);
достоверным, судя по иллюстративному материалу. Зародышевый мешок
С. nucifera, согласно одним данным, развивается по Adoxa-типу (Quisumbing,
Juliano, 1927), согласно другим — по Polygonum-типу (Bauch, 1911; Kulkarni,
Mahabale, 1974). Не подтверждаются данные о наличии Adoxa-типа развития
зародышевого мешка у Е. guineensis (Poerck de, 1950). У этого вида описаны
4 типа тетрад мегаспор и моноспорический зародышевый мешок,
развивающийся по Polygonum-типу (Kajale, Ranade, 1953). Форма зародышевого мешка
у пальм вариабельна. На 8-ядерной стадии развития зародышевый мешок либо
правильной цилиндрической формы (Ch. lutescens), либо с широким микро-
пилярным и зауженным халазальным полюсами (Cocos, Caryota, Licuala,
A. catechu). У последних зародышевый мешок растет симметрично, значительно
расширяясь главным образом на микропилярном полюсе; у Ch. lutescens,
262
Arecaceae (продолжение)
56—66 — последовательные фазы развития зародыша. (/—4,14,15, 23, 27, 30—33,43—47,49—52 —
по Rao, 1959b; 5—7, 11—13, 26 — по Mahabaie, Biradar, 1968; 8, 9, 24 — по Juliano, Quisumbing,
1931; 10, 25, 48, 53—55 — ориг.; 16—22, 38—42 — no Mahabaie, Chennaveeraiah, 1957; 28, 29 — по
Rao, 1959a, 34—37 — no Kulkarni, Mahabaie,, 1974; 56—66 — no Guignard, 1961).
A. macarthuril, H. belmoreana, однако, он разрастается асимметрично, формируя
гаусторий зародышевого мешка. Встречаются зародышевые мешки
эллипсоидальной формы (L. rotundifolia и виды Sabal), а также с зауженным микро-
пилярным и расширенным халазальным полюсами (L. chinensis). У Е. guineensis
яйцеклетка намного меньше синергид. Клетки яйцевого аппарата поляризованы
типично. Синергиды с крючкообразными выростами (Rao, 1959a, 1959b).
У отдельных видов в процессе дифференциации синергиды значительно
увеличиваются в размере, их цитоплазма начинает сильнее окрашиваться, у них
развиваются множественные крючковидные выросты и гаустории; они сохраняются
после оплодотворения (Kajale, Ranade, 1953). Антиподы — 3 клетки, часто
эфемерны (виды Phoenix, Chamaedorea concolor, Е. guineensis, L. chinensis).
Описаны и сохраняющиеся антиподы. При этом они могут оставаться
маленькими (В. major, виды Cocos) и одноядерными (S. adansoni, L. grandis) либо
значительно увеличиваться в размерах при созревании зародышевого мешка
(виды Areca, Actinophloeus macarhurii, Н. belmoreana) и становиться
многоядерными (Loxococcus rupicola, Pinanga sp., Calyptrocalyx sp., Ch. lutescens).
У Ch. lutescens при этом клеточные оболочки утончаются. В антиподах P.
pacified при созревании зародышевого мешка отмечено не только увеличение
размеров клеток, но и накопление крахмала. Антиподы сохраняются до начальных фаз
эмбриогенеза {Calyptrocalyx, Nephrosperma, Verschaffeltia) или до стадии
3—4-клеточного проэмбрио (Я. belmoreana). Полярные ядра сливаются
до оплодотворения. Судя по имеющимся в литературе описаниям, положение
вторичного ядра центральной клетки вариабельно у Ch. lutescens (Rap, 1955b)
и S. blackburnianum (=S. palmetto) (Rao, 1959a), вторичное ядро расположено
близ яйцевого аппарата. В зародышевом мешке Е. guineensis это ядро
сравнительно крупное и встречается в его микропилярной половине (Kajale, Ranade,
1953). Такое же положение вторичного ядра описано и у видов Phoenix (Biradar,
1968). По данным Рао, в зародышевом мешке L. rotundifolia вторичное ядро
находится в средней части его центральной клетки, а у L. chinensis оно
располагается ближе к антиподам (Rao, 1959a). Положение вторичного ядра
центральной клетки Ph. sylvestris рассматривается авторами как нестабильное: оно
наблюдается близ яйцеклетки, либо в центральной зоне, либо около антипод
(Mahabaie, Biradar, 1968). Такое разнообразие в местоположении вторичного
ядра может быть связано не с видовыми особенностями перечисленных пальм,
263
а с различной степенью зрелости исследованных зародышевых мешков.
Оплодотворение порогамное. Пыльцевая трубка входит в зародышевый мешок через
синергиду. Вторая синергида сохраняется. После оплодотворения в
зародышевом мешке отмечено увеличение количества запасного крахмала.
Эндосперм нуклеарный. У Ph. sylvestris формирование клеточных оболочек
начинается на глобулярной стадии развития зародыша в направлении от
периферии зародышевого мешка к центру (Mahabale, Biradar, 1968). В эндосперме
Ph. pusilla начало этого процесса отмечено на стадии 4—5-клеточного про-
эмбрио, a Ph. acaulis и Ph. reclinata — 8—10-клеточного (Biradar, 1968).
Согласно Рао, у A. macarthurii формирование клеточных оболочек также
начинается на стадии 8—10-клеточного проэмбрио. Оно наблюдается сначала
в микропилярном районе и продолжается в направлении к халазе, как и у других
исследованных представителей Arecoideae, Cocosoideae и Caryotoideae. Первый,
самый периферический слой клеток образуется своеобразно при помощи
вакуолизации цитоплазмы вокруг смежных ядер эндосперма и последующего
перемещения вакуолей в места образования клеточных перегородок. Позднее в
районах их расположения рядами в перпендикулярном к оболочке зародышевого
мешка направлении появляются клеточные перегородки. Они первоначально
волнисты. Дальнейший процесс клеткообразования идет путем заложения
типичных клеточных пластинок в ходе последующих делений ядер эндосперма.
Клетки эндосперма оказываются выстроенными правильными рядами (Rao,
1959b). Эндосперм Ch. lutescens отличается от эндосперма других
представителей семейства формированием массивного халазального гаустория с
протуберанцами. Он достигает проводящих пучков плаценты, вступая с ними в контакт
(Rao, 1955b, 1959b). Халазальный гаусторий эндосперма обнаружен и у
исследованного нами Ch. lucubensis. У С. nucifera клетки наружного слоя
эндосперма делятся и функционируют наподобие камбия. В зрелом семени эндосперм
обильный. Он чаще всего гомогенный, но может быть и руминированным,
складчатым, даже в пределах одного и того же рода (Moore, Uhl, 1982). У ряда
родов (например, Cocos) эндосперм внутри полый. У представителей Coryphoi-
deae и Phoenicoideae эндосперм инвагинирован семенной кожурой. У отдельных
представителей он рассечен на части (L. rotundifolia, Coccothrinax, Zombia)
или перфорирован (Thrinax). Степень руминированности эндосперма различна.
У Ph. pusilla, Ph. acaulis и Ph. reclinata руминация приурочена только к району
плаценты. Инвагинации семенной кожуры не разветвлены и не
распространяются глубоко в эндосперм. Слаборуминированный эндосперм отмечен у Licuala
rumphii, Chrysalidocarpus propinquus, Neodypsys tsaratananensis, Linospadix
petrickiana, Coleospadix oninensis и др. (Reddy, Kulkarni, 1985). Сильно
складчатый эндосперм описан у многих видов пальм (Periasamy, 1962; Данилова,
Савченко, 1985). Складчатость эндосперма происходит за счет внедрения в него
рафе или за счет локального разрастания частей наружного интегумента.
Иногда выступы в эндосперм развивает и халаза (Netolitzky, 1926; Rao, 1959a).
У Н. belmoreana, видов Агеса, видов Caryota руминированность также обильна.
Она развивается за счет халазы и наружного интегумента. Начало этого
процесса отмечено уже в зрелой семяпочке, но особенно заметным ор становится
после оплодотворения. Выросты интегумента в эндосперм обычно развиваются
в районе местонахождения проводящих пучков. При этом их ответвления даже
простираются в эти выросты (A. catechu, Actinophloeus ambiguus, Chamaerops
humilis, Caryota furfuracea, Nenga wendlandlana и др.). У С. crinita на ранних
фазах эмбриогенеза ответвлений проводящих пучков в выросты не обнаружено.
Никаких признаков руминации не обнаружено у 5. palmetto. Оболочки клеток
эндосперма, как правило, утолщены благодаря отложению гемицеллюлозы как
основного запасного вещества эндосперма (Ch. lutescens, A. macarthurii,
Phoenix dactylifera, Roystonea regia, Verschaffeltia splendida, Hyophorbe lageni-
caulis, Trachycarpus fortunei). Рисунок утолщений клеточных оболочек и
распределения пор в них, по-видимому, может иметь таксономическое значение
(Данилова, Савченко, 1985). Эндосперм с тонкими клеточными оболочками
обнаружен лишь у отдельных видов (Salacca edulis, Cocos sp., Jubaea spectabi-
lis). По данным электронной микроскопии, клетки эндосперма Ph. dactylifera
содержат, кроме того, запасные жиры и белки; первые в виде мелких липидных
264
капель, вторые — белковых тел различной величины. Крахмал в пластидах
отсутствует (De Mason et al., 1983; De Mason, 1986). У отдельных видов пальм,
однако, крахмал в эндосперме обнаружен. В клеточных оболочках эндосперма
зрелого семени A. macarthurii выявлены плазмодесмы.
Эмбриогенез Actinophloeus macarthurii и Areca catechu соответствует
Onagrad-типу, A. catechu — Onagrad-типу Trifolium-вариации. Зародыш
Ch. humilis и L. chinensis развивается по Asterad-типу. У 4 видов Phoenix
эмбриогенез следует Asterad-типу Geum-вариации, однако у Ph. robusta наряду
с Geum-вариацией встречается и Polygonum-вариация Asterad-типа. Суспензор
массивный, короткий. Лейкопласты семядоли Ph. dactylifera содержат пласто-
глобулы и кристаллические тела. Пластоглобулы мелкие, собраны группами,
обильны (De Mason, Thomson, 1981). Зародыш зрелого семени маленький,
цилиндрический (С. nucifera, Е. guineensis) или конический (A. catechu);
у P. pacifica зародыш в своей базальной части имеет цилиндрическую форму,
а в апикальной — коническую. Положение зародыша в семени апикальное,
латеральное или базальное. Зародыш дифференцирован. Его единственная
семядоля полностью окружает почечку, оставляя щель, через которую при
прорастании выносятся части проростка. Дистальная часть семядоли
функционирует как гаусторий. Почечка зародыша у пальм дифференцирована по-разному.
У Ph. pusilla она представлена стеблевым апексом и кроющим листом (Biradar,
1968); у С. nucifera стеблевой апекс окружен зачатками чешуи и листьев,
которые в свою очередь заключены в колеоптиле (Selvaratnam, 1952). Базальная
(корневая) часть зародыша у пальм дифференцируется только после
прорастания. В семени инициали кончика корня зародыша не прослеживаются (Gatin,
1906). В покоящемся зародыше Е. guineensis, однако, выделяется прокамбиаль-
ный тяж, направляющийся к слабодифференцированному корневому полюсу
от семядольного узла (Vallade, 1966b). В структуре зародыша Nypa отмечены
своеобразные черты (Murray, 1971 — цит. по: Moore, Uhl, 1982). Лейкоэмбрио-
фиты (Яковлев, Жукова, 1973, 1980).
У Phoenix canariensis и Pinanga patula отмечена полиэмбриония. У Ph.
dactylifera установлены метаксении.
Исследованные роды и виды. Actinophloeus (=Drymophloeus)
ambiguus, A. macarthurii (=Ptychosperma macarthurii), Aiphanes caryotifolia,
A. erosa (=Martinezia erosa), Archontophoenix cunninghamiana, Areca catechu,
A. concinna, A. triandra, Arecastrum romanzoffiana, Arenga pinnata, Aricuryroba
schizophylla, Astrocaryum rostratum, Attalea speciosa, Bactris major, Borassus
flabellifer, Calamus, Calyptrocalyx spicatus, Calyptronoma dulcis (=Geonoma
dulcis), Caryota furfuracea, С mitis, С urens, Chamaedorea arenbergiana,
Ch. concolor, Ch. corallina, Ch. glaucophylla (=Ch. glaucifolia), Ch. karwin-
skyana, Ch. latifolia, Ch. oblongata, Ch. sartorii, Chamaerops humilis, Chrysalido-
carpus lucubensis, Ch. lutescens (=Areca lutescens), Ch. propinguus, Coccothri-
nax crinita (—Thrinax crinita), Cocos nucifera, C. plumosa, C. schizophylla,
Coleospadix oninensis, Dypsis madagascariensis, Elaeis guineensis, Euterpe,
Heterospathe elata, Howea belmoreana (=Kentia belmoreana), Hyophorbe lage-
nicaulis, Hyphaene indica, H. ventricosa, Jubaea spectabilis,\Jubaeopsis caffra,
Latania loddigesii, Licuala grandis, L. peltata, L. rumphii, L. spinosa, Linospadix
petrickiana, Livistona chinensis, L. olivaeformis, L. rotundifolia, Loxococcus
rupicola, Mischophloeus paniculata, Nenga wendlandiana, Neodypsis tsaratana-
nensis, Nephrosperma vanhoutteanum, Nypa fruticans, Phoenix acaulis, Ph.
canariensis, Ph. dactylifera, Ph. pusilla (=Ph. zeylanica), Ph. reclinata, Ph. robusta,
Ph. roebelenii, Ph. sylvestris, Rhytelephas macrocarpa, Pinanga disticha,
P. moluccana, P. patula, Pritchardia pacifica, Pterygospermum sp., Ptychococcus
paradoxus, Roystonea regia, Sabal adansoni, S. blackburnianum (=S. palmetto),
Salakka edulis (=Zalacca edulis), Socratea durissima, Syagrus coronata, Thrinax
radiata, Trachycarpus excelsus, T. fortunei, Veitchia joannis, Verschaffeltia
splendida, Washingtonia filifera, Zombia.
Литература. Drude, 1877; Jonsson, 1879—1880; Voigt, 1888; Karsten
1891; Osenbrug, 1894; Tischler, 1900; Gatin, 1905, 1906; Lotscher, 1905; Lloyd,
1910; Bauch, 1911; Soderberg, 1919; Sussenguth, 1919, 1921; Palm, 1920; Rader-
265
macher, 1924; Netolitzky, 1926; Schurhoff, 1926; Quisumbing, Juliano, 1927;
Santos, 1928; Swingle, 1928; Gioelli, 1930; Juliano, Quisumbing, 1931; Schnarf, 1931,
1938; Gassner, 1941; Swamy, 1942; Long, 1943; Bosch, 1947; Guerin, 1949;
Poerck, 1950; Kajale, Ranade, 1952, 1953; Selvaratnam, 1952; Dutt, 1953, 1955;
Cutter, Freeman, 1954; Махешвари, 1954; Cutter, Wilson, Freeman, 1955;
Maheshwari, 1955; Rao, 1955a, 1955b, 1955c, 1956, 1959a, 1959b; Henry, 1956;
Raghavan, Baruah, 1956; Mahabale, Chennaveeraiah, 1957; Pankov, Guttenberg,
1957; Raghavan, Baruah, 1958; Knapp, 1959; Васильченко, 1960; Nambiar,
Swaminathan, 1960; Guevara, 1961; Guignard J.-L., 1961, 1962, 1984; Peryasamy,
1962; Abraham, Mathew, 1963; Menon, 1963; Corner, 1966; Davis, 1966;
Maheshwari, Kapil, 1966; Тахтаджян, 1966; Vallade, 1966a, 1966b, 1969; Biradar,
1968; Biradar, Mahabale, 1968; Mahabale, Biradar, 1968; Murray, 1971; Uhl,
Moore, 1971; Яковлев, Жукова, 1973, 1980; Kulkarni, Mahabale, 1974; Robertson,
1976a, 1976b, 1976c; De Mason, Thomson, .1981; Имханицкая, 1982, 1985; Moore,
Uhl, 1982; Поддубная-Арнольди, 1982; De Mason, Sexton, Reid, 1983; Natesh,
Rau, 1984; Данилова, Савченко, 1985; De Mason, 1985, 1986; Reddy, Kulkarni,
1985, 1989; De Mason, Stillman, 1986; Chandra Sekhar, De Mason, 1988; Жукова,
Тучина — ориг. данные по Chrysalidocarpus lucubensis*, Coccothrinax crinita*.
* Материал собран Г. И. Савиной в 1985 г. на Кубе.
Порядок 18. CYCLANTHALES
Семейство CYCLANTHACEAE
Пыльник 4-гнездный. Сформированная стенка гнезда пыльника состоит
из эпидермиса, эндотеция, одного среднего слоя и тапетума. Тапетум
секреторного типа. Клетки тапетума 2—г4-ядерные, с орбикулами. Реорганизации в
ложный периплазмодий не отмечено (Harling, 1946). Лизис тапетума проходит
довольно быстро и на стадии 2-клеточной пыльцы наблюдаются лишь остатки
его клеток. Средний слой эфемерный. В эндотеции наблюдается образование
фиброзных утолщений. Эпидермис сохраняется в зрелом пыльнике (Carludovica,
Cyclanthus, Dicranopygium). Образование тетрад микроспор происходит
сукцессивно. Тетрады микроспор изобилатеральные, крестообразные.
Пыльцевые зерна 2-клеточные.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Микропиле
образуется обоими интегументами, зигзагообразное. В месте перехода фунику-
луса в халазу отмечено наличие рафид. Клетки субэпидермиса нуцеллуса
претерпевают существенные структурные преобразования. Они увеличиваются при
этом в размерах, сжимая зародышевый мешок, в особенности с латеральных
сторон (последний приобретает форму песочных часов); ядра этих клеток
становятся крупнее ядер клеток зародышевого мешка (Harling, 1946). Семена
Ludouia с крупным ариллоидом. Археспорий одноклеточный. Археспориальная
клетка отчленяет кнаружи первичную париетальную клетку, которая образует
2-слойную париетальную ткань. У исследованных видов (за исключением видов
Cyclanthus) отмечены также периклинальные деления апикальных клеток
эпидермиса нуцеллуса, что ведет к образованию нуцеллярного колпачка (в 2—
3 слоя клеток). Тетрады мегаспор линейные.
Зародышевый мешок образуется по Polygonum-типу из халазальной
мегаспоры. Синергиды грушевидные. Антиподы (3 одноядерные клетки)
различаются у исследованных видов продолжительностью своей функциональной
активности. Полярные ядра сливаются перед оплодотворением. Относительно
процесса оплодотворения данных не имеется.
Эндосперм гелобиальный. Семена с обильным эндоспермом, богатым жирами
и белками, редко — крахмалом.
Тип эмбриогенеза не определен. Зародыш в семени маленький, прямой,
дифференцированный, с одной семядолей. В зародыше часто встречаются
рафиды; в эндосперме не обнаружены (Harling, 1946).
Исследованные роды и виды. Carludovica latifolia, С. macro-
poda, С. rivularis, Cyclanthus cristatus, Dicranopygium, Evodianthus (=
Carludovica), Ludovia.
Литература. Drude, 1877; Suessenguth, 1919; Palm, 1920; Harling,
1946, 1958; Davis, 1966; Тахтаджян, 1966, 1970;/Имханицкая, 1982; Поддубная-
Арнольди, 1982.
Cyclanthaceae
1—5 — Carludovica latifolia, 6 — С. rivularis
1—6 — мегаспорогенез и развитие зародышевого мешка. (/—6 — по Harling, 1946).
267
Порядок 19. PANDANALES
Семейство PANDANACEAE
Пыльник 4-гнездный; гнезда попарно сближены в 2 теки. У Pandanus parvus
(Cheah, Stone, 1975) полости смежных пыльцевых гнезд 2-текового пыльника
перед раскрытием сливаются. Сформированная стенка гнезда пыльника P.
parvus состоит из эпидермиса, эндотеция, 1—2 средних слоев и тапетума. Средние
слои исчезают во время микроспорогенеза; в эндотеции образуются фиброзные
утолщения;,эпидермис, состоящий из маленьких, неправильной формы клеток,
сохраняется и в зрелом пыльнике. У Freycinetia funicularis стенка гнезда
пыльника состоит из эпидермиса, 2 средних слоев и тапетума. Средние слои
дегенерируют, а клетки эпидермиса вытягиваются в радиальном направлении; стенки
клеток приобретают фиброзные утолщения. Эндотеции у этого вида отсутствует,
его роль выполняет видоизмененный эпидермис, что требует уточнения
(Ganguly, 1976). Тапетум однослойный, клетки его одноядерные (P. parvus) или
2-ядерные (F. funicularis). У последнего вида тапетум секреторного типа. Что
касается P. parvus, то здесь после профазы мейоза I наблюдаются
вакуолизация, а затем разрушение оболочек клеток тапетума и проникновение
протопластов в полость гнезда пыльника. Авторы исследования (Cheah, Stone, 1975)
справедливо замечают, что в отличие от утверждения Дэвис (Davis, 1966)
о наличии у Pandanaceae секреторного тапетума такое развитие тапетума
соответствует периплазмодиальному типу. Спорогенные клетки образуют ткань,
состоящую из нескольких слоев. Перед мейозом микроспороциты содержат
плотную цитоплазму и крупное ядро. Мейоз протекает синхронно и без отклонений.
Изобилатеральные тетрады микроспор образуются по сукцессивному типу,
заключены в каллозную оболочку. Зрелые пыльцевые зерна 2-клеточные, причем
округлое ядро вегетативной клетки находится в центре, а удлиненная
генеративная клетка — в периферической части пыльцевого зерна (P. parvus) либо
в непосредственной близости к ядру в центре пыльцевого зерна (F. funicularis).
Проращивание пыльцевых зерен на искусственной питательной среде дало
положительные результаты лишь у Pandanus odoratisimus (Cheah, Stone, 1975),
однако деления генеративной клетки авторы не наблюдали.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Микропиле
образовано внутренним (F. funicularis, P. parvus) или обоими интегументами
{Freycinetia javanica). Интегументы 2-слойные, однако в микропилярной части
количество слоев интегументов возрастает до 3 (F. funicularis) и даже 4—5
(P. parvus). Исследованные виды рода Pandanus имеют ярко выраженный
фуникулярный, плацентарный и плодолистиковый обтураторы (Cheah, Stone,
1975). Археспорий одноклеточный. Археспориальная клетка делится, образуя
париетальную и спорогенную клетки. Париетальная клетка, как правило,
делится периклинально и образует 1—4 париетальных слоя либо не делится
(F. funicularis — Gangly, 1976). Париетальные клетки дегенерируют довольно
скоро. Эпидермис нуцеллуса, делясь периклинально, формирует нуцеллярный
колпачок, который у P. parvus состоит из 2—3 слоев клеток. У F. funicularis
эпидермис нуцеллуса состоит из одного слоя сильно вытянутых радиально,
с утолщенными оболочками клеток. Спорогенная клетка преобразуется в мега-
спороцит. У F. funicularis обнаружена семяпочка с 3 спорогенными клетками
(Stromberg, 1956). В результате мейоза формируется линейная или Т-образная
тетрада мегаспор.
Зародышевый мешок у F. funicularis развивается по Polygonum-типу. После
первого деления между ядрами зародышевого мешка появляется крупная
центральная вакуоль: в дальнейшем вакуолизации подвергается халазальная
и микропилярная части зародышевого мешка. Зрелый зародышевый мешок
имеет типичное строение: яйцевой аппарат, образованный синергидами и
яйцеклеткой, центральная клетка с 2 тесно контактирующими полярными ядрами
и 3 маленькие антиподы в халазальной части зародышевого мешка. Последние
разрушаются довольно рано, до слияния полярных ядер. Зародышевый мешок
268
1—9, 11, 12, 14, 16—18 — Freycinetia funiculare, 10, 13, 15 — Pandanus parvus
1 — фрагмент пыльника со стенкой, состоящей из эпидермиса, 2 средних слоев и тапетума из
2-ядерных клеток с микроспороцитами в процессе мейоза; 2 — стенка пыльника, состоящая из
эпидермиса и тапетума секреторного типа; 3 — микроспора; 4 — 2-клеточное пыльцевое зерно;
5 — семяпочка с археспориальной клеткой; 6 — деление париетальной клетки и мегаспороцит; 7 —
семяпочка с мегаспороцитом в стадии мейоза; 8 — эпидермис; 9 — тетрада мегаспор; 10 — часть
семяпочки с дегенерирующими микропилярными мегаспорами; 11—13 — зародышевые мешки на 2-
и 4-ядерной стадии развития; 14 — сформированный зародышевый мешок; 15 — зародышевый
мешок после оплодотворения с многочисленными ядрами в халазальной части; 16, 17 — отклонения
в мегаспорогенезе: 16 — многоклеточный археспорий, 17 — образование 3 тетрад одновременно;
18 — 2 зародышевых мешка в одной семяпочке. (1—6, 8 — по Ganguly, 1976; 7, 9,11,12, 14,16—18 —
по Stromberg, 1956; 10, 13, 15 —по Cheah, Stone, 1975).
широкий, окружен дегенерирующими клетками нуцеллуса. Под халазальным
концом его находится группа клеток, напоминающих гипостазу (Ganguly, 1976).
Что касается видов рода Pandanus, то здесь о развитии зародышевого мешка
нет единого мнения. Кэмпбелл (Campbell, 1908—1911), обнаружив большое
количество ядер в халазальной части зрелого зародышевого мешка Pandanus
atrocarpus, высказал предположение о близости типа развития зародышевого
мешка этого вида к Peperomia- и G-unnera-типам. Это, однако, противоречит
исследованиям самого автора, который описал мейоз I в мегаспороците и
развитие зародышевого мешка из халазальной клетки диады, что соответствует
биспорическому типу. Очевидно, на основании этого описания Дэвис (Davis,
1966) отмечает, что у рода Pandanus образование клеточной стенки после
мейоза II подавлено и имеет место Allium-тип развития зародышевого мешка.
Все последующие исследователи видов рода Pandanus (Cheah, Stone, 1975;
Fagerlind, 1976) отмечают нормальное течение мейоза при мегаспорогенезе
и образование тетрад мегаспор с последующим развитием зародышевого мешка
из халазальной мегаспоры. Таким образом, зародышевый мешок у видов рода
Pandanus развивается по Polygonum-типу. Источник противоречий при
определении типа развития зародышевого мешка — весьма своеобразное явление,
отмеченное всеми исследователями видов рода Pandanus и требующее
дальнейших исследований: у P. dubius на 4-ядерной стадии (Fagerlind, 1940), у P. atro-
carpus (Campbell, 1909), P. parvus (Cheah, Stone, 1975) —несколько позже
наблюдается значительное увеличение количества ядер в халазальной части
зародышевого мешка. Это явление, которое впервые наблюдал и описал
у Pandanaceae Кэмпбелл (Campbell, 1908—1911), было интерпретировано им
как деление ядер халазальной части зародышевого мешка и увеличение, таким
образом, количества «антипод». Фагерлинд (Fagerlind, 1940) объясняет это
явление проникновением в зародышевый мешок ядер окружающих его клеток
нуцеллуса. Более детальное изучение этого процесса у P. parvus (Cheah, Stone,
1975) показало, что миграция ядер клеток нуцеллуса происходит после
завершения формирования элементов зародышевого мешка. Нуцеллярные клетки под
халазальным концом зародышевого мешка деформируются, оболочки их
разрушаются и ядра мигрируют вглубь зародышевого мешка. При это отмечается
большое сходство их с ядрами зародышевого мешка. Зрелый зародышевый
мешок оказывается заполненным значительным количеством ядер,
происхождение которых, за исключением яйцевого аппарата, не вполне ясно. В отличие
от ядер зародышевого мешка мигрирующие ядра всегда диплоидны, фигуры
митотического деления обнаружены только в этих ядрах. Дальнейшая судьба
их не изучена. На этой стадии развития полость зародышевого мешка
значительно увеличивается за счет роста в двух направлениях — в сторону
микропиле и халазы, под которой обнаруживается сильно смятая ткань нуцеллуса.
Разрушение клеток нуцеллуса ограничивается мелкими утолщенными клетками
гипостазы.
Эндосперм нуклеарный, образование клеточных перегородок между ядрами
происходит в центрипетальном направлении.
Эмбриогенез не изучен. Семена видов рода Pandanus содержат маленькие
недифференцированные зародыши.
Прямых наблюдений и исследований апомиксиса у Pandanus нет, но наличие
диплоидных ядер в зародышевом мешке позволяет предположить возможность
этого явления. Кроме того, наличие семян и плодов на женских экземплярах
Pandanus при отсутствии мужских говорит о существовании каких-то форм
апомиксиса.
Исследованные виды. Freycinetia funicularis, F. \avanica,
Pandanus atrocarpus, P. coronatus, P. dubius, P. helicopus, P. yvdnii, P. militaris var.
^malayanus, P. odoratissimus, P. parvus, P. polycephalus, P. recurvatus, P. saint-
johnii, P. spurius, P. utilis.
Литература. Solms-Laubach, 1878; Strasburger, 1884; Campbell, 1908,
1909, 1910, 1911; Fagerlind, 1940; Sternberg, 1956; Ganguly, 1959, 1976; Stone^
1969; Cheah, Stone, 1973, 1976; Huynh Kim Lang, 1983.
270
Порядок 20. TYPHALES
Семейство TYPHACEAE
Пыльник 4-гнездный. Тип формирования стенки гнезда пыльника не
установлен. Сформированная стенка состоит из эпидермиса, эндотеция, 1—2 средних
слоев и 1—2-слойного тапетума. В эндотеции развиваются фиброзные
утолщения. Средние слои эфемерны. Клетки тапетума 2—8-, чаще 4-ядерные. Тапетум
клеточный секреторный у Sparganium ramosum (Tischler, 1915) или пери-
плазмодиальный у S. simplex (Clausen, 1927), Typha angustifolia и Т. latifolia
(Asplund, 1972). Тетрады микроспор формируются сукцессивно. Отмечена
значительная вариабельность типов тетрад микроспор в пределах одного гнезда
пыльника. Обнаружены изобилатеральные (у Typha до 80 %), тетраэдральные,
крестообразные, линейные, Т-образные, ромбовидные тетрады микроспор,
а также целый ряд переходных форм (Sahashi, Ikuse, 1974). Зрелые пыльцевые
зерна 2-клеточные, одиночные или соединены в тетрады. Ультраструктурные
исследования показали, что у Т. latifolia сцепление пыльцевых зерен в тетрадах
происходит благодаря наличию общего экзинового слоя в местах их
соприкосновения (Skvarla, Larsson, 1963). Запасные вещества вегетативной клетки —
крахмал.
Семяпочка анатропная, с 2 интегументами, крассинуцеллятная. Оба инте-
гумента 2-слойные, у Sparganium в микропилярной части — многослойные.
В формировании микропиле участвуют оба интегумента. Фуникулус с одним
проводящим пучком, заканчивающимся в халазе. Имеется фуникулярный
обтуратор. Клетки эпидермиса нуцеллуса делятся периклинально, формируя
2-слойный нуцеллярный колпачок. Археспорий одноклеточный (у Typha иногда
2-клеточный), отделяет париетальную клетку, из которой в дальнейшем
образуется 2—3-слойная париетальная ткань. Тетрада мегаспор линейная, у Typha
иногда Т-образная.
Зародышевый мешок у Typha развивается из халазальной мегаспоры
по Polygonum-типу. Яйцеклетка несколько крупнее синергид. Последние
грушевидные, с нитчатым аппаратом. Антиподы — 3 небольшие клетки, у Т.
angustifolia они формируются несколько раньше, чем яйцевой аппарат (Graef, 1955).
У S. simplex (Campbell, 1899a, 1899b), S. minimum (Schurhoff, 1920) и Typha
minima (Schoenebeck, 1924) после оплодотворения антиподы делятся, формируя
многоклеточный комплекс. У S. simplex он насчитывает до 150 клеток (Campbell,
1899а, 1899b), которые, однако, в дальнейшем рассматриваются как
производные базальной клетки эндосперма (Tischler, 1912; Palm, 1915). Полярные ядра
сливаются до оплодотворения, как правило, вблизи антипод. Оплодотворение
двойное, одна из синергид разрушается пыльцевой трубкой.
Эндосперм гелобиального типа. В результате первого деления эндосперма
образуются 2 неравные по размерам клетки-камеры: крупная микропилярная
и маленькая халазальная. У Typha деления в халазальной камере начинаются
раньше, чем в микропилярной, и, как правило, не сопровождаются цитокинезом,
что приводит к образованию ценоцитной структуры, содержащей 10—20 ядер.
Иногда клетообразование в халазальной камере осуществляется, причем уже
на 2-ядерной^стадии развития. В дальнейшем формируется многоклеточная
ткань, представленная сначала одноядерными, позднее — многоядерными
клетками. В микропилярной камере сначала происходят свободноядерные деления,
после чего начинается клеткообразование. Эндосперм в зрелом семени
обильный, окружен периспермом.
Эмбриогенез у Typha соответствует Asterad-типу, а у Sparganium —
Onagrad-типу. Зародыш в зрелом семени занимает центральное положение
и по длине почти равен эндосперму. Он дифференцирован на крупную семядолю,
почечку и широкий тупой корешок. Клетки зародыша содержат белки, жиры
и крахмал. Лейкоэмбриофиты (Яковлев, Жукова, 1973, 1980).
271
1—9,13—17,19,20,23—28 — Typha latifolia, 10,11,22 — Sparganium erectum, 12,18 — Sparganium
sp., 21, 29—39 — S. simplex
1 — сформированная стенка пыльника, клетки тапетума 2—3-ядерные, начало деления в микроспо-
роцитах; 2 — строение тапетума на стадии диад; 3 — фрагмент стенки пыльника и тетрады
микроспор; 4 — фрагмент стенки пыльника, тапетум периплазмодиальный, микроспоры в тетрадах;
5 — строение стенки пыльника на стадии зрелых 2-клеточных пыльцевых зерен; 6—9 — основные
типы тетрад микроспор; 10, 11 — строение гнезда пыльника на стадии тетрад микроспор (10) и ва-
куолизированных микроспор (11); 12 — зрелое пыльцевое зерно; 1а, 10а, Па—схемы строения
пыльника на соответствующих стадиях (/, 10, 11) на поперечном срезе;
Typhaceae (продолжение)
13—15 — мегаспорогенез; 16—20 — развитие зародышевого мешка; 18 — схема продольного среза
семяпочки на стадии 4-ядерного зародышевого мешка; 21 — фрагмент микропилярнои части
семяпочки, яйцевой аппарат и вторичное ядро; 22 — халазальная часть семяпочки и 3
антиподы (22а);
18 Зак. 2144 v '
Typhaceae (продолжение)
23—26 — некоторые стадии развития эндосперма; 27, 28 — разные типы строения халазальной
камеры эндосперма: одноклеточная многоядерная (27) и многоклеточная, клетки 1—2-ядерные (28);
29—39 — некоторые стадии развития зародыша. (1,1а, 10—12,18, 22 — ориг.; 2—9, 13, 20, 23—28 —
по Asplund, 1972; 14—17 — по Dahlgren, 1918; 19 — по Graef, 1955; 21 — по Campbell, 1899a,
1899b; 29—39 — по Soueges, 1924).
Исследованные виды. Sparganium erectum, S. eurycarpum,
S. greenei, S. minimum, S. ramosum, S. simplex, Typha angustifolia, T. latifolia,
T. minima.
Литература. Schacht, 1850; Rohrbach, 1870; Hegelmair, 1874; Cela-
kovsky, 1885; Dietz, 1886, 1887; Kronfeld, 1886; Schaffner, 1897; Campbell, 1899a,
1899b; Tischler, 1912, 1915; Palm, 1915; Dahlgren, 1918; Schurhoff, 1920; Goebel,
1923; Schoenebeck, 1924; Soueges, 1924; Claussen, 1927; Roscoe, 1927; Graef,
1955; Guttenberg, 1960; Skvarla, Larson, 1963; Asplund, 1968, 1972; Muller-
Doblies, 1969a, 1969b; Яковлев, Жукова, 1973; Sahashi, Ikuse, 1974; Nicholls
Mare, Cook, 1986; Анисимова, ориг. данные.
274
Порядок 21. ARALES
Семейство ARACEAE
Пыльник 2-гнездный (Arisaema, Dieffenbachia) или 4-гнездный (Arum,
Calla, Eminium, Peltandra, Spathyema). Сформированная стенка гнезда
пыльника состоит из эпидермиса, эндотеция, одного (Theriophonum), 2 или более
средних слоев (Arisaema, Acorus calamus, Eminium alberti, Peltandra) и 1 —
2- или 4-слойного тапетума. Тапетум периплазмодиального типа; его развитие
прослежено на ультраструктурном уровне у Arum italicum (Pacini, Juniper,
1983). Средние слои эфемерны. В эндотеции формируются фиброзные
утолщения. Стенка зрелого пыльника состоит из эпидермиса и фиброзного эндотеция.
Образование тетрад микроспор сукцессивное. Тетрады изобилатеральные,
крестообразные, тетраэдральные. Зрелые пыльцевые зерна 2-клеточные
(Arisaema, Dieffenbachia, Spathyema, Symplocarpus) или 3-клеточные (Aglao-
пета, Arum, Eminium, Peltandra, Zantedeschia). Оба типа встречаются у Calla
и Pothos. У Theriophonum minutum пыльцевые зерна в пыльнике 2-клеточные,
а деление генеративной клетки происходит в пыльцевом зерне, попавшем в
столбик, но еще не проросшем. У Е. alberti и Arum korolkovii обнаруживается
значительное утолщение наружного слоя интины (гиалины) пыльцевого зерна
в период деления генеративной клетки. При этом в тех же пыльцевых гнездах
встречается небольшое число пыльцевых зерен (как правило, уже 3-клеточных)
с неутолщенной гиалиной.
Семяпочка анатропная (Arisaema wallichianum), ортотропная (Acorus
calamus, Lagenandra ovata) или гемитропная, с 2 интегументами, тенуину-
целлятная или псевдокрассинуцеллятная (по Davis, 1966). Микропиле
образуется внутренним (Т. minutum) или обоими интегументами (A. korolkovii,
Dieffenbachia seguine, E. alberti). Имеется интегументальный тапетум,
гипостаза, у A. calamus — постамент. Ко времени мегаспорогенеза эпидермис
нуцеллуса, делясь периклинально, образует вокруг мегаспороцита 2-слойную
ткань (A. calamus, Т. minutum). УЛ. calamus (Buell, 1938) внутренний слой
сильно разрастается в радиальном направлении, особенно в халазальной
части. Ко времени оплодотворения несколько клеток этого слоя (около
микропиле) резорбируются, а остальные в трансформированном виде сохраняются
и в зрелом семени. У других видов ко времени 4—8-клеточного зародышевого
мешка нуцеллярные клетки сохраняются лишь под его халазальным концом
и над его микропилярным концом — в виде 2-слойного (Т. minutum) или
многослойного (A. korolkovii, E. alberti) нуцеллярного колпачка. Археспорий
одно-, редко — многоклеточный. Археспориальная клетка дифференцируется
непосредственно в мегаспороцит. Мегаспорогенез завершается образованием
линейной тетрады мегаспор.
Зародышевый мешок моноспорический, развивается их халазальной
мегаспоры по Polygonum-типу (A. korolkovii, Lagenandra ovata, T. minutum).
В ряде ранних работ описывался биспорический тип зародышевого мешка,
однако эти данные ошибочны или сомнительны (Maheshwari S., 1955;
Maheswari S., Khanna, 1956). Яйцевой аппарат дифференцирован. Синергиды
грушевидной формы, с крючкообразными выростами (A. korolkovii). Полярные
ядра сливаются до оплодотворения (A. korolkovii, E. alberti, L. ovata, T.
minutum) . Антиподы эфемерны и резорбируют вскоре после оплодотворения. У A.
calamus антиподы претерпевают 1—2 деления. У некоторых видов антиподы
после оплодотворения активизируются: увеличиваются в размере
(Symplocarpus foetidus) и в числе (L. ovata). Оплодотворение двойное, слияние гамет
происходит по премитотическому типу (A. korolkovii, E. alberti).
Эндосперм целлюлярный, описан примерно у половины (14—15)
исследованных видов. У A. wallichianum (Maheshwari S., Khanna, 1956), E. alberti,
Peltandra virginica (Goldberg, 1941), T. minutum (Parameswaran, 1959) и Typho-
nium trilobatum (Banerji, 1947) после деления первичной клетки эндосперма
образуются 2 клетки, микропилярная — более крупная — дает начало много-
18*
275
1, 7—14, 27 — Etfdmum alberti, 2, 15, 20—23 — Arum korolkovii, 3—6, 16—19, 24—26, 28 — Therio-
phonum minutum, 29—38 — Arum maculatum
1 — участок сформированной стенки пыльника, археспорий; 2 — участок стенки пыльника с.З-кле-
точным пыльцевым зерном; 3—6 — микроспорогенез; 7—15 — деление генеративной клетки, образо-
"' вание спермиев; 16 — мегаспороцит; 17—19 — мегаспорогенез;
клеточному эндосперму, а халазальная разрастается в крупный гаусторий.
У остальных изученных видов эндосперм либо нуклеарный, либо гелобиальный
(Maheshwari S., Khanna, 1956). Однако данные о типе эндосперма во многих
случаях требуют переисследования (Parameswaran, 1959).
Эмбриогенез Caryophyllad-типа, хотя у Pistia stratlotes и ш, и cb делятся
вертикальной перегородкой. Зародыш крупный, прямой, дифференцированный,
содержит жиры и белки. Хлоро- и лейкоэмбриофиты.
276
Полиэмбриония обнаружена у Spathiphyllum floribundum и S. patinii.
Исследованные виды. Acorus calamus, Aglaonema sp., A.
versicolor, Anthurium violaceum, Arisaema sp., A. dracontium, A. triphyllum, A. walli-
chianum, Arisarum vulgare, Arum korolkovii, A. maculatum, Atherurus terna-
tus (=Pinellia ternqta), Calla palustris, Colocasia antiquorum, Dieffenbachia
seguine, Eminium alberti, Lagenandra ovata, Lysichiton sp., Peltandra undulata,
277
Araceae (продолжение)
24—28 — развитие эндосперма и формирование халазального гаустория;
P. virginica, Pistia stratiotes, Pothos sp., Spathicarpa sp., Spathiphyllum floribun-
dum, S. patinii, Spathyema foetida, Symplocarpus foetidus, Theriophonum minu-
tum, Typhonium trilobatum, Typhonodorum lindleyanum.
Литература. Tulasne, 1855; Hofmeister, 1858a, 1858b, 1861; Hanstein,
1870; Hegelmaier, 1874; Engler, 1877, 1884; Kubin, 1878; Elfwing, 1879; Jonsson,
1879—1880; Strasburger, 1879, 1882, 1884; Vesque, 1879; Mellink, 1880; Mottier,
1892; Campbell, 1899, 1900, 1903, 1905, 1912; Rosendahl, 1906, 1909; Gow, 1907,
1908a, 1908b, 1913; Tieghem, 1907; Muck, 1908; Svedelius, 1910; Pickett, 1913,
1915, 1916; Juel, 1915; Jacobson-Paley, 1920a, 1920b; Palm, 1920; Dahlgren, 1923;
278
Araceae (продолжение)
29—38 — развитие зародыша. {1—2, 7—15, 20—23, 27—ориг.; 3—6, 16—19, 24—26, 28 — по Рага-
meswaran, 1959; 29—38 — по Guttenberg, 1960).
Schurhoff, Jussen, 1925; Mascre, 1928; Schnarf, 1931; Shadowsky, 1931; Meada,
1932; Banerji, 1934, 1937, 1947; Edwards, 1934; Buell, 1935, 1938; Dudley, 1937;
Goldberg, 1941; Maheshwari S., 1955; Maheshwari S., Khanna, 1956; Parameswa-
ran, 1959; Guttenberg, 1960; Guignard, 1963; Panicker, 1965; Kapil, 1967; Pacini,
Juniper, 1983; Коробова, Жинкина, ориг. данные.
Семейство LEMNACEAE
Пыльник 4-гнездный (Lemna, Spirodela) или 2-гнездный {Wolffid). Ко
времени созревания пыльцы гнезда в теках пыльника сливаются вследствие
разрушения перегородки между ними, и тека вскрывается общей продольной
щелью. Развитие стенки гнезда прослежено у Wolffia microscopica (Mahesh-
279
Lent пасеае
1, 7—10 — Wolffia microscopica, 2—6, 11—20, 23—34 —
Lemna paucicostata, 21, 22 — L. minor 1 — вертикальный
разрез зрелого фронда с одним мужским и одним
женским цветками; 2 — дифференцировка археспория в
зачатках 4 гнезд пыльника; 3—5—микроспорогенез и
формирование стенки пыльника; 6 — участок стенки
зрелого пыльника с фиброзным эндотецием и уплощенным
эпидермисом; 7 — продольный разрез гнезда 2-гнезд-
ного пыльника с микроспороцитами в мейозе I и
формирующимся периплазмодием; 8 — вертикальный разрез
гнезда пыльника на стадии тетрад микроспор; 9 — <?-кле-
точное пыльцевое зерно; 10 — вскрывание пыльника;
Lemnaceae (продолжение)
11—15 — мегаспорогенез и развитие биспорического зародышевого мешка Allium -типа;
16 — зрелый зародышевый мешок; 17 — зародышевый мешок после оплодотворения (зигота и
первичное ядро эндосперма);
281
wari S., 1954) и Lemna paucicostata (Maheshwari S., Kapil, 1963). Субэпидер-
мальный слой археспория в каждом из будущих гнезд пыльника делится
периклинально, образуя первичный париетальный и спорогенный слои. Первичный
париетальный слой еще раз делится периклинально, образуя эндотеций
и тапетум. Больше периклинальных делений не происходит, и сформированная
стенка пыльника, таким образом, состоит из эпидермиса, эндотеция и тапетума.
Средний слой отсутствует, что отмечалось и раньше у Wolffia arrhiza (Gupta,
1935) и Lemna minor (Lawalree, 1952). Этот тип развития получил название
редуцированного (Davis, 1966), а накопленные факты послужили основанием
для вошедшего во многие сводки утверждения о том, что у рясковых нет
среднего слоя. М. М. Лодкина (1971), однако, показала, что у Lemna gibba
282
и L. trisulca, как и у других покрытосеменных, формируется средний слой,
и стенка пыльника, таким образом, становится 4-слойной. Тапетум периплазмо-
диальный. Оболочки одноядерных клеток тапетума еще до завершения мейоза
II лизируются, протопласты мигрируют внутрь гнезда пыльника и сливаются,
образуя периплазмодий, в который погружены формирующиеся тетрады
микроспор. Периплазмодий потребляется при созревании пыльцевых зерен. Стенка
зрелого пыльника состоит из эпидермиса и эндотеция. Клетки эпидермиса
283
сильно вытягиваются тангентально и становятся уплощенными, клетки эндоте-
ция увеличиваются в размерах, в них развиваются хорошо заметные
фиброзные утолщения. Спорогенная ткань в каждом гнезде пыльника состоит из
нескольких слоев клеток. Мейоз в разных гнездах одного пыльника протекает
не синхронно: в одном могут быть сформированные тетрады или
обосабливающиеся из тетрад микроспоры, тогда как в другом — еще не завершенный мейоз
II. Довольно часто имеет место полная дегенерация одного из гнезд.
Формирование тетрад микроспор сукцессивное. Тетрады изобилатеральные и
крестообразные у видов Lemna и тетраэдральные и изобилатеральные у видов Wolffia.
Обосабливающиеся микроспоры имеют интенсивно окрашивающееся,
центрально расположенное ядро. Деление ядра при первом митозе происходит около
оболочки развивающегося пыльцевого зерна; в результате цитокинеза
образуется линзовидная генеративная клетка, контактирующая с оболочкой
пыльцевого зерна. Позднее генеративная клетка мигрирует в центральную часть
вегетативной клетки, где и делится, образуя 2 спермия. Зрелые пыльцевые
зерна одиночные, 3-клеточные, обильно заполнены зернами крахмала. У видов
Lemna, имеющих 2 мужских цветка, развитие в обеих тычинках происходит
неодновременно: в то время как в одной пыльник содержит зрелую пыльцу,
в другой развитие пыльцы только начинается.
У большинства рясковых в основании завязи закладывается и развивается
только одна семяпочка, у Spirodela polyrrhiza — 2 семяпочки, очень редко —
3—4. Семяпочка анатропная (Spirodela), гемианатропная (Lemna) или орто-
тропная (Wolffia), крассинуцеллятная, с 2 интегументами. Внутренний интегу-
мент появляется довольно рано в онтогенезе семяпочки (на стадии мегаспоро-
цита), тогда как наружный дифференцируется значительно позже (на 2-ядерной
стадии зародышевого мешка), остается коротким и у Wolffia не принимает
участия в формировании микропиле, которое образовано только внутренним
интегументом. У Spirodela наружный интегумент, хотя и закладывается позднее
внутреннего, растет довольно быстро и полностью окружает внутренний, так что
микропиле формируется обоими покровами, при этом экзостом и эндостом
расположены в разных плоскостях. Виды Lemna занимают в этом отношении
промежуточное положение: наружный интегумент отстает в своем развитии от
внутреннего и до оплодотворения экзостом не выражен, он формируется только
по мере развития семени. Внутренний интегумент обычно 2-слойный (у
Spirodela — 2—3-слойный), однако в районе микропиле толщина интегументов
возрастает до 4—7 слоев за счет делений и последующего разрастания клеток.
При формировании семени эти разросшиеся апикальные части обоих
интегументов у Spirodela и Lemna и только внутреннего — у Wolffia образуют оперкулум.
Наличие его — характерный признак рясковых, отмеченный еще Гегельмайером
(Hegelmaier, 1868). У Wolffia стенки клеток оперкулума лигнифицированы.
Нуцеллус, за исключением его микропилярной зоны, дегенерирует довольно
быстро — на стадии зрелого зародышевого мешка (Spirodela), к началу его
формирования (Lemna) или до мейоза в мегаспороците (Wolffia). Микропиляр-
ная зона нуцеллуса представлена эпидермисом, париетальной тканью,
дезорганизованные остатки которой, покрытые сверху оперкулумом, сохраняются
и в зрелом семени. Халазальная зона нуцеллуса дифференцируется в гипостазу,
толстостенные клетки которой приобретают темно-бурую окраску вследствие
накопления в содержимом их таниноподобного материала. Археспорий
одноклеточный. Археспориальная клетка отчленяет париетальную, дающую начало
2—3-слойной париетальной ткани, и спорогенную, которая в дальнейшем
становится мегаспороцитом. Первое деление мейоза в мегаспороците всегда
сопровождается цитокинезом, при этом микропилярная клетка диады меньше
по величине, чем халазальная, и дегенерирует, не приступая к мейозу II или
вскоре после него.
Зародышевый мешок развивается по 2 типам. У видов Lemna и Wolffia
в халазальной клетке диады в результате мейоза II образуются 2 ядра,
располагающихся у противоположных полюсов клетки и разделенных большой
центральной вакуолью. После 2 митотических делений формируются
последовательно 4- и 8-ядерные зародышевые мешки, что соответствует биспорическому
Allium-типу развития зародышевого мешка. У Spirodela из халазальной клетки
284
диады в результате мейоза II образуются 2 клетки-мегаспоры, из которых
верхняя меньше по величине и вскоре дегенерирует. Функционирующая хала-
зальная мегаспора трижды делится митотически, образуя последовательно 2-,
4- и 8-ядерные зародышевые мешки. Следовательно, у Spirodela развитие
зародышевого мешка происходит по моноспорическому Polygonum-типу.
Зрелый зародышевый мешок у всех видов овальный и состоит из более широкой
микропилярной и суженной халазальной частей. Синергиды грушевидной
формы, полярные ядра сливаются до оплодотворения. Антиподы эфемерны
и дегенерируют ко времени оплодотворения.
Эндосперм целлюлярный. Сообщения о гелобиальном эндосперме у
некоторых рясковых (Cardwell, 1899; Lawalree, 1952) не подтвердились
последующими исследованиями. Первое деление первичного ядра эндосперма всегда
сопровождается заложением поперечной стенки, разделяющей центральную
клетку на 2 неравные клетки эндосперма: большую микропилярную и меньшую
халазальную. Микропилярная клетка увеличивается в размерах, в ней
происходит последовательный ряд делений, каждое из которых всегда
сопровождается заложением клеточных стенок, как поперечных, так и продольных,
и, следовательно, развитие с самого начала клеточное. Никаких свободноядер-
ных делений не происходит. Именно за счет первичной микропилярной клетки
и формируется большая часть ткани эндосперма. Халазальная клетка
развивается в гаусториальный вырост, проникающий глубоко в халазу семяпочки.
У Spirodela халазальная клетка не делится, но разрастается и становится
высокоактивной, о чем свидетельствует плотная цитоплазма,
гипертрофированные ядро и ядрышко, добавочные ядрышки. У L. paucicostata и W. microscopica
первичная халазальная клетка делится, становится 4- или 8-клеточной и
принимает вид узкого пальцевидного отростка с плотной цитоплазмой и сильно
хроматизованными ядрами. У L. minor наблюдается промежуточное состояние
халазальной клетки: она обычно не делится, но может и разделиться. В зрелом
семени большая часть эндосперма поглощается развивающимся зародышем,
особенно в халазальной зоне, так что вокруг него остаются только 2—3 слоя
(Spirodela, Lemna) или один слой (Wolffia). Клетки эндосперма заполнены
зернами крахмала и каплями жира.
Эмбриогенез, согласно Джогансену (Johansen, 1950), соответствует
Onagrad-типу Lilium-вариации. Джогансен обосновывает свое мнение,
анализируя рисунки других авторов по Lemna minor (Cardwell, 1899) и L. perpusilla
(Blodgett, 1923). Суэж (Soueges, 1959), однако, переисследовал эмбриогенез
L minor и пришел к выводу, что он относится к Asterad-типу. К такому же
выводу пришли индийские исследователи, изучая развитие зародыша у W.
microscopica (Maheshwari S., 1954), L. paucicostata (Maheshwari S., Kapil, 1963)
и S. polyrrhiza (Maheshwari S., Maheshwari N., 1963). У всех исследованных
видов зигота делится поперечно, образуя клетки саисЬ. Клетка яруса cb делится
на т и ciy а в апикальном ярусе са происходят 2 последовательных деления под
прямым углом друг к другу, образуя квадрант q. Поперечные деления в 4
клетках квадранта q дают октанты с ярусами / и Г. Они делятся периклинально
и антиклинально, а дериваты cb — продольно, так что ярусы т и ci становятся
4-клеточными. Позднее ярусы т и ci делятся поперечно, увеличиваясь в длину.
Последующий рост имеет место почти исключительно в дочерних клетках ярусов
т, I и V. Из яруса т в результате интенсивных делений одной или 2 субэпидер-
мальных клеток его нижнего слоя образуется меристематический бугорок —
примордий материнского фронда. Последующие деления происходят таким
образом, что молодой фронд, занимающий латеральное положение, смещается
к основанию проэмбрио и в зрелом зародыше становится полностью
вертикальным. Деления клеток в / и V дают единственную булавовидную семядолю. Пери-
клинальные деления нескольких эпидермальных клеток под примордием фронда
дают начало формированию влагалища семядоли, окружающего вскоре фронд
снизу. С основным телом зародыша фронд связан короткой ножкой (pedicel)
и по достижении им 20 клеток в диаметре на соединении ножки и пластинчатой
части фронда образуется меристематический бугорок — дочерний фронд,
развивающийся, как и материнский. Для эмбриогенеза в целом характерно, что
в отличие от многих цветковых растений развивающийся проэмбрио после
285
глобулярной стадии лишен гистогенной дифференцировки на дерматоген,
периблему и плерому. Нет также четкой границы между гипокотилем и районом
подвеска, поскольку практически нет отличия в интенсивности окраски клеток,
составляющих подвесок и собственно зародыш. Эта узкая удлиненная часть
зародыша называется «подвесок-гипокотиль» (Maheshwari S., Kapil, 1963).
При дифференцировке зародыша вместо почечки, колеоптиле или листового
примордия образуется примордий фронда.. Таким образом, у рясковых
производные клетки са образуют единственную семядолю; производные сЬ дают: т —
материнский и дочерние фронды и часть гипокотиля, ci — остальную часть гипо-
котиля и подвесок. Следовательно, не только терминальная, но и базальная
клетки 2-клеточного проэмбрио формируют собственно зародыш. В зрелом
семени зародыш хорошо дифференцирован и занимает большую часть его
объема, а по длине почти равен продольной оси семени. Он состоит из короткого
«подвеска-гипокотиля», длинной массивной терминальной семядоли и
материнского, дочернего, а иногда (Wolffid) и внучатого фрондов, которые полностью
окружены семядольным влагалищем и гипокотилем, за исключением
небольшого отверстия около гипокотиля.
Клетки фрондов мелкие, с плотной цитоплазмой, тогда как остальная часть
зародыша состоит из крупных, сильно вакуолизированных клеток. Главный
зародышевый корень не образуется. У Spirodela и L. minor зародыш имеет
хорошо развитый примордий придаточного корня, латерально расположенный
дочерний фронд и довольно заметный прокамбиальный тяж в материнском
фронде, тогда как L. paucicostata и Wolffia примордий корня и
прокамбиальный тяж отсутствуют, а у Wolffia дочерний фронд закладывается симметрично
(на медианной линии) (Maheshwari S., Kapil, 1963). Терминальное положение
семядоли у рясковых в отличие от латерального у однодольных, по мнению
Хациус (Haccius, Lakshwari, 1966), является производным состоянием,
связанным с резко выраженной акселерацией семядоли в ходе эмбриогенеза.
Исследованные виды. Lemna minor, L. paucicostata, L. perpusilla,
L. trisulca, Spirodela polyrrhiza, Wolffia arrhiza, W. microscopica.
Литература. Hofmeister, 1858; Hegelmaier, 1868, 1871; Jonsson, 1879—
1880; Cardwell, 1899; Ростовцев, 1905; Goebel, 1921; Blodgett, 1923; Schurhoff,
1926; Schnarf, 1931; Gupta, 1935; Brooks, 1940; Lawalree, 1945, 1952; Johansen,
1950; Maheshwari S. C, 1954, 1956a, 1956b, 1958, 1959; Soueges, 1959;
De Sloover, 1961; Maheshwari S. C, Kapil, 1963a, 1963b, 1964; Maheshwari S. C,
Maheshwari N., 1963; Singh, 1964; Смирнова, 1964; Davis, 1966; Lakshmanan,
1966; Kapil, 1967; Лодкина, 1971, 1976, 1985; Brunaud, 1974; Поддубная-
Арнольди, 1982.
Содержание запасных питательных веществ в зрелом семени покрытосеменных
растений
Приложение
Порядок
Семейство
Кол-во
исследованных
видов
Анализированные
структуры
Содержание запасных веществ
(% на сухую массу)
белки
жиры
олигосахара
крахмал
Литературный
источник
Alismatales
Liliales
Smilacales
Orchidales
to
00
•^1
A lis mat ас еае
Melanthiaceae
Liliaceae
Alliaceae
Hemerocallidaceae
Amaryllidaceae
Agavaceae
Asphodelaceae
Asparagaceae
Dracaenaceae
Iridaceae
Smilacaceae
Orchidaceae
1
3
3
6
1
2
16
3
5
6
7
4
4
Семя
(з+эн+т)
Семя
(з-Ьэн+т)
Семя
(з+эн-Ьт)
Семя
(з-Ьэн+т)
Зародыш-{-эндосперм
Семя
(з+эн+т)
Семя
(з±эн±пс+т)
Семя
(з+эн+т)
Семя
(з+эн+т)
Семя
(з+эн+т)
Семя
(з+эн+т)
Эндосперм
Семя
(з-Ьэн+т)
Плод
Семя
(з+т)
19
14—18
19—28
39
5—15
8—33
11—20
11—50
10—17
20
10—11
11 *
23
4—35
6—10
14—29
27
9—10
0.8—36
19—21
0.4—16
22—48
4—17
7—11
8—11
37
4—13**
0.5 :
1(2*)
+ Earle, Jones, 1962
zfc Eckey, 1954; Шарапов, 1959;
Hegnauer, 1963; Jones, Earle,
1966
zh Earle, Jones, 1962; Jones,
Earle, 1966
zh Eckey, 1954; Шарапов, 1959;
Earle, Jones, 1962; Jones,
Earle, 1966;" Овчаров, 1976; Гру-
JHri-Инэац и др., 1983
— Earle, Jones, 1962
± Earle, Jones, 1962; Johri, Ma-
heshwari, 1966
— Earle, Jones, 1962; Jones, Earle,
1966
+ Шарапов, 1959; Hegnauer, 1963
zh Golaszewska, 1934; Шарапов,
1959; Earle, Jones, 1962;
Hegnauer, 1963; Jones, Earle, 1966
— Earle, Jones, 1962; Jones, Earle,
1966
zh Ларин и др., 1950; Earle, Jones,
zh 1962; Hegnauer, 1963; Jones,
Earle, 1966; Konopska, 1972
zh Earle, Jones, 1962; Hegnauer,
1963
Шарапов, 1959; Arditti, 1967;
_,_ Васильева, Андронова, ориг.
~~~ данные
Продолжение приложения
Порядок
Семейство
Кол-во
исследованных
видов
Анализированные
структуры
Содержание запасных веществ
(% на сухую массу)
белки
жиры
олигосахара
крахмал
Литературный
источник
Bromeliales
Juncales
Cyperales
Poales
Bromeliaceae
Juncaceae
Cyperaceae
Poaceae
1
1
39
245
Семя
(з+эн+т)
Семя
(з+эн+т)
Семя
(з+эн+т)
Семя
(з+эн+т)
Зародыш+
эндосперм
Зародыш
Эндосперм
13
4—15
0.8—33
11—20
5—41
8—14
2
5
2—32
0.8—18
8—60
0.5—12
0.4—9
1—2
3—25
0.4—4
+
+
0—51
0—90
58—90
0—7
20—84
Ескеу, 1954
Jones, Earle, 1966
Melville, 1947; Рожановский,
1960; Earle, Jones, 1962; Jones,
Earle, 1966; Morice, 1977
Ларин и др., 1950; Eckey, 1954;
Дарканбаев, Каптюшина,
1955; Колобкова, 1958;
MacLeod, McCorquodale, 1958;
Nordin, 1959; Шарапов, 1959;
Smith et al., 1959; Pintea et al.,
1960; Морозов; 1962; Цуркан,
1962; Earle, Jones, 1962; Heg-
nauer, 1963; Jennings, Morton,
1963; Maslowski, Skorko, 1963;
Соколова, 1964; Агинян, Ми-
насян, 1965; Lambertsen et al.,
1966; Creech, 1968; Vaughan,
1970; Жуковский, 1971; Kpac-
ноок и др., 1971; Briggs, 1972;
Cock, Yoshida, 1972; Петиб-
ская, Красноок, 1972; Плеш-
ков, 1975; Воробьев, 1976;
Овчаров, 1976; Gupta et al., 1977;
Jenner, Rathjen, 1977; Singh,
Juliano, 1977; Вечер и др.,
1978; Lodha et al., 1978; Илли
и др., 1979а, 19796; Gentinetta
et al., 1979; Poey et al., 1979;
Порядок
Семейство
Кол-во
исследованных
видов
Анализированные
структуры
Содержание запасных веществ
(% на сухую массу)
белки жиры олигосахара крахмал
1 1 1
Продолжение приложения
Литературный
Zingiberales
Arecales
Pandanales
Typhales
A rales
Musaceae
Zingiberaceae
Costaceae
Arecaceae
Pandanaceae
Typhaceae
Araceae
2
2
1
1
1
3
7
Семя
(з-т-эн-т-пс-f-T)
Семя
(з-т-эн-т-пс+т)
Семя
(з-|-эн-|-пс-|-т)
Семя
(з-|-эн-|-т)
Зародыш-|-эндо-
сперм
Эндосперм
Семя
(з+эн-|-т)
Семя
(з-f эн-f пс-у-т)
Семя
(з+эн±псН-т)
2
3—25
6—19
8
19
20
15
0.8—1.5
4—14
6
1—65
0.4—75
0.4—75
47
18—20
3
0.5 :
Shewry et aL, 1979; Vaidyan
et al., 1979; Wankhede et al.,
1979; Bhatia et al., 1980; Wiec-
zorek et al., 1980; Boyer, Liu,
1983; Dickinson et al., 1983;
Osagie, Kates, 1984; Merrier,
1985; Dhaliwal, Sharma, 1986
7 Eckey, 1954; Hegnauer, 1963
+ Шарапов, 1959; Hegnauer, 1963
Suri et al., 1986
0—85 Melville, 1947; Eckey, 1954;
Crombie, 1956: Smith et al.,
1959; Шарапов, 1959; Earle,
Jones, 1962; Hegnauer, 1963;
Jones, Earle, 1966; Vaughan,
1970; Жуковский, 1971; Bala-
subramaniam et al., 1973; Oo,
Stumpf, 1979
— Hegnauer, 1963
+ Eckey, 1954; Smith et al., 1959;
Шарапов, 1959
+ Earle, Jones, 1962
to
00
CD
Примечание, з — зародыш, эн — эндосперм, т — теста (семенная кожура),
пс — перисперм; ± — наличие или отсутствие вещества или структуры; * —
содержание веществ (% на сырую массу); ** — суммарное содержание растворимых углеводов
и крахмала; *** — глюкозный эквивалент (мг/семя); **** — содержание глюкозы
(% на сухую массу).
ЛИТЕРАТУРА
Абалкина Н. А. // Тр. по прикл. ботан., генет.
и селекции. Л., 1983. Т. 74. С. 21—27.
АгинянА. А.,Минасян С. М. // Изв. АНАрмССР.
Сер. биол. наук. 1965. Т. 18, № 1. С. 35—40.
Александров В. Г. // Ботан. журн. 1939. Т. 24,
№ 1. С. 58—63.
Александров В. Г. // Сов. ботан. 1943. № 4.
С. 24—25.
Александров В. Г., Александрова О. Г. // Тр.
по прикл. ботан., генет. и селекции. Сер. VII.
1936. № 2. С. 25—42.
Алявдина А. А. 11 Бюл. Моск. о-ва испыт.
природы. Отд. биол. 1975. Т. 80, № 2. С. 68—76.
Андронова О. В. // Укр. ботан. журн. 1986. Т. 43,
№ 6. С. 79—81.
Афанасьева Н. Г. // Науч. докл. высш. школы.
Биол. науки. 1962. № 4. С. 107—112.
Банникова В. А. // Ботан. журн. 1976. Т. 61,
№ 7. С. 990—993.
Банникова В. А. // Экология опыления. Пермь,
1979. № 4. С. 21—26.
Баранов Я. А. // Бюл. Моск. о-ва естествоис-
пыт. 1915. Т. 29. С. 74—92.
Баранов Я. А. // Журн. рус. ботан. о-ва при
Акад. наук. 1917. № 2. С. 1—2, 20—29.
Баранов Я. А. // Журн. рус. ботан. о-ва при
Акад. наук. 1924. № 9. С. 5—9.
Баранов Я. А. // Бюл. Среднеаз. гос. ун-та. 1925.
Вып. 10. С. 181 — 195.
(Баранов Я. A.) Baranov Р. А. // Ztschr. Zell-
forsch. und Micros. Anat. 1926. Bd 3, H. 2.
S. 131 — 148.
Баранов П., Поддубная В. // Бюл. Среднеаз.
гос. ун-та. 1925в. № И. С. 1 — 14.
Батыгина Т. Б. // Докл. АН СССР. 1961. Т. 137,
№ 1. С. 220—223.
Батыгина Т. Б. // Морфогенез растений. М.,
1961. Т. 2. С. 334—340.
Батыгина Т. Б. // Докл. АН СССР. 1962а.
Т. 142, № 5. С. 1205—1208.
Батыгина Т. Б. // Тр. Ботан. ин-та им. В. Л.
Комарова АН СССР. Сер. 7. 1962в. Вып. 5.
С. 260—293.
Батыгина Т. Б. // Ботан. журн. 1966. Т. 51,
№ 10. С. 1461 — 1479.
Батыгина Т. Б. // Ботан. журн. 1968. Т. 53,
№ 4. С. 480—490.
Батыгина Т. Б. // Докл. АН СССР. 1968.
Т. 181, № 6. С. 1499—1502.
(Батыгина Т. Б.) Batygina Т. В. // Rev. cytol.
et biol. veg. 1969. Т. 32, N 3—4. P. 335—341.
Батыгина Т. Б. Эмбриология пшеницы. Л., 1974.
(Батыгина Т. Б.) Batygina Т. В. // Ргос. Indian
Acad. Sci. В. 1978а. Vol. 44, N 1. P. 13—29.
(Батыгина Т. Б.) Batygina Т. В. // Ргос. Indian
Acad. Sci. В. 1978b. Vol. 44, N 1. P. 30—43.
Батыгина Т. Б. Хлебное зерно. Л., 1987.
Батыгина Т. Б., Андронова Е. В. // Докл. АН
СССР. 1988. Т. 302, № 4. С. 1017—1019.
Батыгина Т. Б., Васильева В. Е. // Онтогенез.
1983. Т. 14, № 3. С. 304—312.
Батыгина Т. Б., Долгова О. А., Коробова С. Н. //
Докл. АН СССР. 1961. Т. 136, № 6. С. 1482—
1485.
Батыгина Т. Б., Маметьева Т. Б. // Актуальные
вопросы эмбриологии покрытосеменных
растений. Л., 1979. С. 89—95.
Батыгина Т. Б., Терёхин Э. С. // Ботан. журн.
1963. Т. 48, № 8. С. 1108—1120.
Батыгина Т. Б., Троицкая Е. А, // Тр. Ботан.
ин-та им. В. Л. Комарова АН СССР. Сер. 4.
1970. Вып. 20. С. 22—38.
Батыгина Т. Б., Троицкая Е. А., Алимова Г. К- II
Ботан. журн. 1966. Т. 51, № 12. С. 1751 — 1754.
Батыгина Т. Б., Фрейберг Т. Е. // Ботан. журн.
1979. Т. 64, № 6. С. 793—804.
Батыгина Т. Б., Шевцова Г. Г. // Ботан. журн.
1985. Т. 70, № 12. С. 1614—1621.
Белицер Н. В. // Укр. ботан. журн. 1963. Т. 20,
№ 4. С. 7—15.
Белщер Н. В. // Укр. ботан. журн. 1965. Т. 22,
№ 5. С. 51—58.
Беляева Н. С. // Изв. АН ТССР. Сер. биол.
наук. 1975. № 3. С. 3—8.
Беляева Н. С. Развитие зародышевого мешка и
оплодотворение у покрытосеменных: Дис. . . .
докт. биол. наук. Л., 1977.
Бияшев Г. 3., Хайленко Н. А. // Изв. АН
КазССР. Сер. биол. 1983. № 1. С. 19—24.
Бланковская Т. Ф. // Докл. ВАСХНИЛ. 1964.
№ 1. С. 19—28.
Блюденов М. А., Конарев В. Г. // Цитология и
генетика. 1978. Т. 12, № 3. С. 200—207.
Волховских 3. В. II Цитология. 1965. Т. 7, № 6.
С. 745—748.
Бочанцева 3. Я. // Бюл. Среднеаз. гос. ун-та.
1937. Вып. 22, № 38. С. 329—338.
Бурова Э. А. II Половой процесс и эмбриогенез
растений. М., 1973. С. 29—30.
Варшанина Т. Я. // Бюл. Всесоюз. ин-та
растениеводства. 1973. Вып. 33. С. 90—98.
Васильев А. Е., Москова Р. Д. // Тр. Биол. ин-та
Сиб. отд. АН СССР. 1977. Вып. 32. С. 107—
114.
Васильченко И. Т. Всходы деревьев и
кустарников. (Определитель). М.; Л., 1960.
Верещагина В. А. // Экология опыления. Пермь,
1976. Вып. 2. С. 82—89.
Вечер А. С, Василъкевич О. К., Ненадович Р. А.}
Решетников В. Н. // Физиол.-биохим. условия
повышения продуктивности с.-х. раст.'Минск,
1978. С. 3—9.
Воробьев Н. В. II Бюл. н.-т. информации ВНИИ
риса. 1976. Вып. 18. С. 19—24.
Ворсобина Л. И. II Апомиксис и цитоэмбриоло-
гия растений. М., 1978. С. 20—21.
Ворсобина Л. И. II Тез. докл. 7-го Делегат.
съезда Всесоюз. ботан. о-ва. Донецк, 11 —
14 V 1983. Л., 1983. С. 253.
Ворсобина Л. И., Солнцева М. Я. // Актуальные
вопросы эмбриологии покрытосеменных
растений. Л., 1979а. С. 28—37.
290
^
ВорсобинаЛ. И., СолнцеваМ. П. // Актуальные
вопросы эмбриологии покрытосеменных
растений. Л., 19796. С. 75—81.
Вышенская Т. Д. // Сравнительная анатомия
семян. Л., 1985. Т. 1. С. 190—191.
Вышенская Т. Д. // Сравнительная анатомия
семян. Л., 1985. Т. 1. С. 177.
Габедава Л. Ш. // Изв. АН ГССР. Сер. биол.
1985. Т. И, № 6. С. 375—378.
Гаврилова О. М. // Тр. Ин-та генетики АН
СССР. 1962. Т. 29. С. 231—237.
Гамбарова Р. К. Исследование женской сферы
цветка придодиктиона сетчатого: Морфо-
функциональные аспекты развития женских
генеративных структур семенных растений.
Телави, 1984. С. 12.
Гамбарова Р. К. // Докл. АН АзССР. 1969.
Т. 25, № 4. С. 82—85.
Гамбарова Р. К. / / Цитоэмбриологические
исследования растений флоры Азербайджана.
Баку, 1972. С. 112—120.
Гваладзе Г. Е. // Сб. работ аспирантов и науч.
работы. Тбилиси, 1960а. С. 25—32.
Гваладзе Г. Е. // Сообщ. АН ГССР. 19606.
Т. 25, № 3. С. 327—334.
Гваладзе Г. Е. // Сообщ. АН ГССР. 1961.
Т. 26, № 2. С. 193—200.
Гваладзе Г. Е. // Сообщ. АН ГССР. 1963.
Т. 31, № 2. С. 393—398.
Гваладзе Г. Е. // Сообщ. АН ГССР. 1965.
Т. 40, № 2. С. 421—427.
Гваладзе Г. Е. // Вестн. Груз, ботан. о-ва. 1966.
№> 3. С. 3—8. ,
Гваладзе Г. Е. // Сообщ. АН ГССР. 1969а.
Т. 53, № 3. С. 681—684.
Гваладзе Г. Е. // Тр. Ин-та ботаники АН ГССР.
Сер. «культурная флора». 19696. Т. 26, № 3.
С. 34—43.
Гваладзе Г. Е. // Сообщ. АН ГССР. 1970а.
Т. 58, № 1. С. 185—188.
Гваладзе Г. Е. // Апомиксис и селекция. М.,
19706. С. 155—159.
Гваладзе Г. Е. // Сообщ. АН ГССР. 1973.
Т. 71, № 2. С. 485—488.
Гваладзе Г. Е. // Сообщ. АН ГССР. 1974. Т. 74,
№ 2. С. 421—423.
Гваладзе Г. Е. Халазальное полярное ядро
центральной клетки зародышевого мешка
покрытосеменных. Тбилиси, 1976.
Гваладзе Г. Е. / / Вестн. Груз, ботан. о-ва. 1978.
№ 7. С. 127—146.
(Гваладзе Г. Е.) Gvaladze О: Б. // Ргос. Indian
Nat. Acad. Sci. В. 1979. Vol. 45, N 6. P. 596—
604.
(Гваладзе Г. E.) Gvaladze G. E. // Fertilization
and embryogenesis in ovulated plants. Veda,
Bratislava, 1983. P. 203—204.
Гваладзе Г. Е., Криалашвили Л. Г. // Сообщ.
АН ГССР. 1988. Т. 132, № 1. С. 117—119.
Гваладзе Г. Е., Криалашвили Л. Г. // Изв. АН
ГССР. Сер. биол. 1989. Т. 15, № 2. С. 110—
114.
Георгиева Й. Д. // Генетика и селекция. София,
1971а. Т. 4, № 2. С. 150—154.
Георгиева Й. Д. // Генетика и селекция. София,
19716. Т. 4, № 3. С. 199—206.
Георгиева Й. Д. // Генетика и селекция. София,
1980. Т. 13, № 2. С. 89—96.
(Георгиева Й. Д.) Georgieva I. D. // С. г. Acad.
sci. Bulg. 1965. Т. 18. P. 477—480.
(Георгиева Я. Д.) Georgieva I. D. // Phyto-
morphology. 1982. Vol. 32, N 4. P. 381—385.
Герасимова-Навашина Е. Н. // Тр. Ботан. ин-та
им. В. Л. Комарова АН СССР. Сер. 7. 1962.
Вып. 5. С. 238—249.
Герасимова-Навашина Е. Н., Батыгина Т. Б..//
Докл. АН СССР. 1959. Т. 124, № 1. С. 223—226.
Герасимова-Навашина Е. Н., Батыгина Т. Б. //
Проблемы современной эмбриологии. М.,
1964. С. 86—99.
Герасимова-Навашина Е. Н., Батыгина Т. Б. //
Ботан. журн. 1958. Т. 43, № 7. С. 959—988.
Герасимова-Навашина Е. Н., Коробова С. Н. / /
Бюл. Моск. о-ва испыт. природы. Отд. биол.
1959. Т. 64, № 3. С. 69—76.
Главацкая Т. П. // Онтогенез травянистых по-
ликарпических растений. Свердловск, 1977.
С. 86—91.
Главацкая Т. Я. // Ботан. исслед. на Урале.
Свердловск, 1985. С. 18.
Главацкая Т. П., Кабыш Н. А. // Индукция
цветения и морфогенез монокарпических
побегов травянистых поликарпических растений.
Свердловск, 1975. С. 82—86.
Главацкая Т. П., Фомченкова М. Ф. //
Онтогенез травянистых поликарпических растений.
Свердловск, 1976. С. 96—102.
Главацкая Т. П., Хохлова Л. А. // Матер, по
экологии и физиологии растений Уральской
флоры. Свердловск, 1976. С. 58—63.
Главацкий А. М., Ржанова Е. // Онтогенез
травянистых поликарпических растений.
Свердловск, 1979. С. 111 — 120.
Глущенко Г. И. // Журн. общ. биологии. 1956.
Т. 17, № 1. С. 40—45.
Глущенко Г. И. // Изв. АН СССР. Сер. биол.
1957. № 2. С. 220—233.
Глущенко Г. И. // Проблемы современной
эмбриологии. М., 1964. С. 127—130.
Голышкин Л. В. I/ Бюл. Всесоюз. ин-та
растениеводства. 1975. Вып. 47. С. 55—57.
Голышкин Л. В. I/ Бюл. Всесоюз. ин-та
растениеводства. 1976. Вып. 60. С. 61—64.
Голышкин Л. В. I/ Тр. по прикл. ботан.,
генет. и селекции. Л., 1977. Т. 60, вып. 2.
С. 39—81.
Грати В' Г. II Цитокариологическое
исследование злаковых Молдавии. Кишинев, 1971.
С. 15—25.
rpyjuh-Инац Б., КапетановиЪ, Р., Стефано-
euh Б., Ла\шш\ С. II Гласник. Српска АН и
уметн. Од. природ.-мат. наука. 1983. Т. 335,
№ 49. С. 27—38.
Гусейнова Н. А. // Докл. АН АзССР. 1981.
Т. 37, № 7. С. 79—82.
Гусейнова С. О. Цитоэмбриологическое
исследование некоторых древних и редких
кавказских видов семейства лилейных: Автореф. дис.
. . . канд. биол. наук. Баку, 1967.
Гусейнова С. О. // Изв. АН АзССР. Сер. биол.
1968. № 1. С. 25—29.
Данилова М. Ф.} Соколовская Т. Б. // Ботан.
журн. 1973. Т. 58, № 3. С. 337—349.
Дарканбаев Т. Б.} Каптюшина Г. А. // Изв.
КазССР. Сер. биол. 1955. № 10. С. 87—
93.
Даркулов Н Д. // Вестн. с.-х. науки. 1970. № 9.
С. 34—37.
Двораковская В. М. // Морфология цветковых
растений. М., 1971. С. 170—180.
Делоне Н. Л. // Ботан. журн. 1959. Т. 44,
№ 1. С. 61—64.
Дзевалтовский А. К., Шпилевая С. // Бюл. Гл.
ботан. сада АН СССР. 1978. Вып. 109.
С. 60—65.
Жадовский А. Е. // Бюл. по прикл. ботан., генет.
и селекции. Л., 1925. Т. 14. С. 133—142.
Жамсран Ц., Хоролсурен Ш. // Ботан.: Хурэ-
элэнгийн эрдэм шинжилгээний бутээл. БН
МАУ шинжлэх ухааны акад. 1987. № 10.
С. 100—104. На монг. яз.
19*
291
Жгенти Л. И. // Изв. АН ГССР. Сер. биол.
1982. Т. 7. С. 219—425.
Жиров Е. Г. II Апомиксис и селекция. М., 1970.
С. 149—155.
Жукова Г. Я., Савина Г. И. // Ботан. журн.
1978. Т. 63, № 9. С. 1241 — 1246.
Звержанская Л. С. // Апомиксис и цитоэмбрио-
логия растений. Саратов, 1983. С. 104—ПО.
Зотова Г. С, Филатова И. А. // Апомиксис и
цитоэмбриология растений. Саратов, 1968.
С. 116—129.
Зуева Г. В. // Биол. основы семеноведения и
семеноводства интродуцентов. Свердловск,
1974. С. 44—45.
Зуева Г. В. // Онтогенез травянистых поликар-
пических растений. Свердловск, 1976а.
С. 120—127.
Зуева Г. В. // Матер, по экологии и физиологии
Уральской флоры. Свердловск, 19766. С. 64—
71.
Зуева Г. В. 11 Онтогенез травянистых поликар-
пических растений. Свердловск, 1977. С. 99—
102.
Зуева Г. В. // Онтогенез травянистых поликар-
пических растений. Свердловск, 1980. С. 58—
61.
Зуева Г. В. // Вопросы биологии семенного
размножения. Ульяновск, 1981. С. 21—28.
Зуева Г. В., Егорова Н. Н. // Онтогенез
травянистых поликарпических растений.
Свердловск, 1979. С. 81—87.
Зуева Г. В., Егорова Н. Н. // Онтогенез
травянистых поликарпических растений.
Свердловск, 1980. С. 53—57.
Зуева Г. В., Шатерников Т. П., Севидова А. И. //
Онтогенез травянистых поликарпических
растений. Свердловск, 1977. С. 79—86.
Ивановская Е. В. // Докл. АН СССР. 1946.
Т. 54, № 5. С. 449—452.
Ивановская Е. В. // Отдаленная гибридизация
растений в семействе злаковых. М., 1958.
С. 130—143.
Ивановская Е. В. // Ботан. журн. 1959. Т. 44,
№ 1. С. 19—34.
Ивановская Е. В. // Изв. АН СССР. Сер. биол.
1965. № 6. С. 848—858.
Ивановская Е. В. // Бюл. Гл. ботан. сада АН
СССР. 1968. Вып. 70. С. 34—43.
Ивановская Е. В. // Цитология. 1973. Т. 15,
№ 12. С. 1445—1452.
Ивановская Е. В. Цитоэмбриологическое
исследование дифференцировки клеток растений.
М., 1983. '
Ивановская Е. В., Прокофьева 3. Д. // Докл.
АН СССР. 1963. Вып. 152, № 2. С. 446—449.
Ивановская Е. В., Прокофьева 3. Д. //
Цитология и генетика. 1970. Т. 4, № 5. С. 392—396.
Илли И. Э., Орехова Г. В., Лысак Л. Н. //
Биохим. и физиол. исследования семян.
Иркутск, 1979. С. 42—57.
Илли И. Э., Щербатюк Н. В., Орехова Г. В.,
Кузнецова С. В., Реймерс Ф. Э. // Физиология
растений. 1979. Т. 26, № 3. С. 656—661.
Ильина Г. К II Науч. тр. Омск. с.-х. ин-та. 1971.
Т. 88. С. 106—110.
Имханицкая Н. Н. Пальмы. Л., 1985.
Иоффе М. Д. II Тр. Ботан. ин-та им. В. Л.
Комарова АН СССР. Сер. 7. 1957. Вып. 4.
С. 211—269.
Канделаки Г. В. Отдаленная гибридизация и ее
закономерности. Тбилиси, 1969.
Канделаки Г. В., Гваладзе Г. Е. // Вестн. Груз,
ботан. о-ва. 1966. № 3. С. 9—19.
Капинос Г. Е. // Тр. Ин-та ботан. АН АзССР.
1957. Т. 20. С. 190—201.
292
Капинос Г. Е. // Докл. АН СССР. 1959. Т. 129
№ 1. С. 220—223.
Капинос Г. Е. // Тр. Ин-та ботан. АН АзССР.
1960а. Т. 22. С. 5—16.
Капинос Г. Е. // Ботан. журн. 19606. Т. 45, № 7
С. 1044—1055.
Капинос Г. Е. // Проблемы современной
эмбриологии. М., 1964. С. 137—143.
Капинос Г. Е. Биологические закономерности
развития луковичных и клубнелуковичных
растений на Апшероне. Баку, 1965.
Капинос Г. Е. // Бюл. Гл. ботан. сада АН СССР.
1980. Вып. 115. С. 98—105.
Капинос Г., Германова Ф. // Изв. АН АзССР.
Сер. биол. и мед. наук. 1961. № 2. С. 3—
12.
Капинос Г. Е., Гусейнова С. О. // Изв. АН
АзССР. Сер. биол. наук. 1966. № 4. С. 20—25.
Капинос Г. Е., Гусейнова С. О. // Докл. АН
АзССР. 1967. Т. 23, № 7. С. 76—80.
Капинос Г. Е., Гусейнова С. О. // Бюл. Гл.
ботан. сада АН СССР. 1980. Вып. 118. С. 94—
98.
Капинос Г. Е., Каграманова Ф. В. // Изв. АН
АзССР. Сер. биол. и мед. наук. 1961. № 2.
С. 3—12.
Капинос Г. Е., Кулиева Н. А. // Цитоэмбрио-
логические исследования растений флоры
Азербайджана. Баку, 1972. С. 121 — 130.
Карагьозова М. // Изв. Ботан. ин-та Бълг. АН.
1963. Кн. 11. С. 111 — 123.
Карагьозова М. Д. // Изв. Ботан. ин-та Бълг.
АН. 1965. Кн. 15. С. 215—231.
Карагьозова М. Д. // Годишн. Софийск. ун-т.
Биол. фак. (1969—1970). 1972. Т. 64, № 2.
С. 1 — 18.
Karagiosowa M. D. // Comptes rendus Acad,
bulgare des Sci. 1970. T. 23, N 6.
Карагьозова М. Д. // Годишн. Софийск. ун-т.
Биол. фак. 1971. Т. 63, кн. 2.
Карамшук 3. П., Полякова Н. Я. // Изв. АН
КазССР. Сер. биол. 1985. № 4. С. 13—19.
Кириллова Г. И. I/ Онтогенез травянистых
поликарпических растений. Свердловск, 1977а.
С. 79—86.
Кириллова Г. И. 11 Актуальные вопросы
современной ботаники. Киев, 19776. С. 97—99.
Кириллова Г. И., Бущухина Н. А. // Индукция
цветения и морфогенез монокарпических
побегов травянистых поликарпических растений.
Свердловск, 1975. С. 125—132.
Кириченко А. Б., Кириченко Е. Б.,
Чеботарь А. А. //Цитология. 1978а. Т. 20, № 4.
С. 380—383.
Кириченко А. Б., Кириченко Е. Б.,
Чеботарь А. А. II Физиология растений. 19786.
Т. 35, вып. 1. С. 113—117.
Ключарева М. В. // Наследственность и
изменчивость растений, животных и
микроорганизмов. 1959. Т. 2. С. 358—361.
Ключарева М. В. // Журн. общ. биологии. 1973.
Т. 34, % 2. С. 275—283.
Ключарева М. В. // Докл. АН СССР. 1983.
Т. 269, № 2. С. 509—512.
Ключарева М. В. // Бюл. Гл. ботан. сада АН
СССР. 1985. Вып. 136. С. 91—95.
Ключарева М. В. // Бюл. Гл. ботан. сада АН
СССР. 1986. Вып. 142. С. 75—81.
Кобахидзе Л. А. // Сообщ. АН ГССР. 1965.
Т. 37, № 3. С. 661—667.
Кобахидзе Л. А. // Апомиксис и селекция. М.,
1970. С. 160—164.
Колобкова Е. В. // Докл. АН СССР. 1958.
Т. 120, № 4. С. 907—910.
Комар Г. А. II Ботан. журн. 1965. Т. 50, № 5.
С. 715—724.
Комар Г. А. I/ Ботан. журн. 1982. Т. 67, № 7.
С. 800—805.
Комар Г. А. И Ботан. журн. 1983. Т. 68, № 4.
С. 417—427.
Комар Г. А. II Сравнительная анатомия семян.
Л., 1985. Т. 1. С. 82—85, 93—96, 99—103,
132—133.
Кордюм Е. Л. И Укр. ботан. журн. 1963. Т. 20,
№ 1. С. 21.
Кордюм Е. Л. II Апомиксис и селекция. М., 1970.
С. 141 — 149.
Кордюм Е. Л., Глущенко Г. И., Попова А. Ф. //
Докл. АН УРСР. Сер. Б. 1974. № 8. С. 755—
758.
Кордюм Е. Л., Попова А. Ф. // Ботан. журн.
1974. Т. 59, № 8. С. 1171 — 1176.
Корюм Е. Л., Глущенко Г. И., Попова А. Ф. //
Науч. докл. высш. школы. Биол. науки. 1975.
№ 7. С. 56—61.
Кордюм Е. Л., Недуха Е. М., Сидоренко П. Г.
Структурно-функциональная характеристика
растительной клетки в процессах дифферен-
цировки. Киев, 1980.
Коробова С. Я.//Докл. АН СССР. 1961а.
Т. 136, № 1. С. 223—226.
Коробова С. Н. II Морфогенез растений. М.,
19616. Т. 1. С. 514—523.
Коробова С. Н. II Тр. Ботан. ин-та им. В. Л.
Комарова АН СССР. Сер. 7. 1962. Вып. 5.
С. 294—314.
(Коробова С. Н.) Korobova S. N. //
Fertilization in higher plants. Amsterdam, 1974.
P. 261—272.
(Коробова С. H.) Korobova S. N. // Bull. Soc.
bot. France. 1978. T. 125, N 1—2. P. 233—236.
Коробова С. Н. II Культурная флора СССР. М.,
1982. С. 151 — 176.
Коробова-Семенченко Л. В., Шиповская Е. И.,
Колокольникова В. И. // Вестн. Моск. ун-та.
Биол., почвовед. 1971. № 6.С. 113—115.
Кострюкова О. Ю. // Вюник Кшв. ботан. саду.
1930. Вип. 11. С. 10—17.
Кострюкова К. Ц Журн. 1нст. ботан. АН УРСР.
1939а. Т. 21/22. С. 157—164.
Кострюкова К. Ю. // Докл. АН СССР. 19396.
Т. 22, № 7. С. 444—447.
Кострюкова К. Ю. // Сов. ботан. 1945. Т. 13,
№ 1. С. 33—48.
Кострюкова К. Ю. // Сов. ботан. 1947. Т. 15,
№ 6. С. 329—336.
Кострюкова К. Ю. // Вопросы ботаники. Л.,
1960. Вып. 3. С. 12—13.
Кострюкова К. Ю. // Изв. АН АрмССР. Биол.
науки. 1961. Т. 14, вып. 1. С. 3—16.
Кострюкова К., Бенецкая Г. // Ботан. журн.
1939. Т. 24, № 2. С. 209—220.
Красников Л. Г. II Тр. 2-й молодежной конф.
ботаников г. Ленинграда. Л., 1988. Ч. 3.
С. 22—26. Деп. в ВИНИТИ, 1988, № 5684-В
88 деп.
Красноок Н. П., Ерыгин И. С, Петибская В. С,
Вишнякова И. А. // С.-х. биология. 1971. Т. 6,
№ 6. С. 836—843.
Круглова Н. Н. Эмбриология двукисточника
тростникового Phalaroides arundinaceae (L.)
Rausch.: Автореф. дис. . . . канд. биол. наук.
Л., 1985.
Круглова Н. Н. // Экология опыления цветков.
Пермь, 1987. С. 56—63.
Крушева Р. М. II Годишн. Софийск. ун-т. Биол.
фак. (1981 — 1982). 1985. Т. 75, № 2. С. 65—73.
Крушева Р., Белчева Р. // Годишн. Софийск.
ун-т. Биол. фак. 1977. Т. 68, № 2. С. 81—88.
Крушева Р. М., Белчева Р. Г. // Цитология и
генетика. 1976. Т. 10, № 1. С. 45—48.
(Крушева P.) Krusheva R. // Ann. Fac. Biol.
Univ. Sofia. 1977. Vol. 68, N 2. P. 81—88.
Кудряшов Л. В. II Ботан. журн. 1964. Т. 49,
№ 4. С. 473—486.
Кудряшов Л. В., Савич Е. И. // Бюл. Моск.
о-ва испыт. природы. Отд. биол. 1963. Т. 68,
№ 4. С. 50—63.
Кудряшов Л. В., Савич Е. И. // Морфология
высших растений. М., 1968. С. 3—17.
Кулакова Е. В., Вайнерман Е. С, Садкова Н. П.,
Рогожин С. В. II Прикл. биохимия и
микробиология. 1978. Т. 14, № 1. С. 103—109.
Лайкова Л. И. // Апомиксис и селекция. М.,
1970. С. 106—110.
Ларин И. В., Агабабян Ш. М., Работное Т. А.,
Любская А. Ф. II Кормовые растения
сенокосов и пастбищ СССР. М.; Л., 1950. Т. 1.
С. 688.
Левковский В. П., Солнцева М. П. // Экология
опыления. Пермь, 1979. С. 32—50.
Лиманская А. П. // Апомиксис и цитоэмбриоло-
гия растений. Саратов, 1968. С. 96—106.
Литвиненко СП. // Цитология и генетика. 1968.
Т. 2, № 4. С. 376—378.
Лодкина М. М. // Тр. Ботан. ин-та им. В. Л.
Комарова АН СССР. Сер. 7. 1957. Вып. 4.
С. 323—377.
Лодкина М. М. // Ботан. журн. 1976. Т. 61,
№ 11. С. 1536—1545.
Лодкина М. М. // Сравнительная анатомия
семян. Л., 1985. Т. 1. С. 275—280.
Лодкина М. М.} Данилова М. Ф. // Ботан. журн.
1975. Т. 60, № 1. С. 47—52.
Лукьяненко Э. X. // Тр. по прикл. ботан., генет.
и селекции. Л., 1979. Т. 65, № 3. С. 60—64.
Львова И. Н. II Селекция и семеноводство.
М., 1950. № 9. С. 11—23.
Мадреимов А. // Ф из иол. и биохим. культур.
раст. 1976. Т. 8, № 2. С. 178—181.
Малышева Н. А. // Апомиксис и цитоэмбриоло-
гия растений. Саратов, 1968. С. 90—95.
Мануйлова О. Н. // Изв. АН ТаджССР. Отд-ние
биол. наук. 1972. № 1. С. 76—78.
Маханец И. А. // Укр. ботан. журн. 1968. Т. 25,
№ 2. С. 79—90.
Маханец I. А. // Укр. ботан. журн. 1971. Т. 28,
№ 5. С. 640—643.
Мезев Г. М. // Укр. ботан. журн. 1986. Т. 43,
№ 6. С. 20—23.
Мейер К- II Бюл. Моск. о-ва испыт. природы.
Нов. сер. 1909. Т. 23. С. 1 — 18.
Мелия Н. С. // Изв. АН ГССР. Сер. биол. 1982.
Т. 8, № 6. С. 378—386.
Ментковська О. А. // Укр. ботан. журн. 1980.
Т. 37, № 3. С. 44—47.
Ментковська О. А. // Укр. ботан. журн. 1982.
Т. 39, № 5. С. 83—87.
Миркамилов М. А. // Узб. биол. журн. 1969.
Вып. 6. С. 33—36.
Миркамилов М. А. // Научн. тр. аспирантов
Ташкент, гос. ун-та. Биол., почвовед. 1970.
Вып. 378. С. 224—229.
Миркамилов М. А. //Докл. АН УзССР. 1972.
Т. 6, № 1. С. 48—49.
Миркамилов М. А. 11 Узб. биол. журн. 1975.
№ 1. С. 75—76.
Миркамилов М. А. 11 Вопросы ботанических
исследований в Узбекистане. Ташкент, 1977а.
С. 83—85.
Миркамилов М. А. // Вопросы ботанических
исследований в Узбекистане. Ташкент, 19776.
С. 81—83.
Миркамилов М. А. Цитоэмбриология видов рода
Allium L. (секция Molium Don). Ташкент,
1977в.
293
Миркамилов М. А. II Узб. биол. журн. 1978.
№ 5. С. 62—63.
Мирошниченко Е. Я- // Проблемы ботаники.
1979. Т. 14, вып. 2. С. 148—152.
Мирошниченко Е. Я- // Отдаленная
гибридизация и апомиксис. Новосибирск, 1982. С. 119—
140.
Мовсесян С. Н. II Биол. журн. Армении. 1970.
Т. 23, № 6. С. 21—29.
Модилевский Я. С. // Зап. Киев, о-ва естество-
исп. 1918. Т. 26. С. 1—55.
(Модилевский Я. С.) Modilewski J. S. // Вег.
Dtsch. Bot. Ges. 1930. Bd 48, H. 7. S. 285—294.
(Модилевский Я. С.) Modilewski J. // Вюник
Кшв. ботан. саду. 1931. Вып. 12—13.
С. 27—48.
Модилевский Я. С, Оксиюк П. Ф., Худяк М. И.
и др. Цитоэмбриология основных хлебных
злаков. Киев, 1958.
Морозов А. С: II Тр. Всесоюз. с.-х. ин-та
заочного образования. 1962. Вып. 9. С. 43—48.
Москова Р. II Генетика и селекция. 1973. Т. 6,
№ 5. С. 367—372.
Москова Р. II Фитология. 1976. Кн. 4. С. 34—46.
Москова Р., Мандилова С. // Генетика и
селекция НРБ. 1970. Т. 3, № 6. С. 485—491.
Мошкович А. М. II Изв. АН МССР. Сер. биол.
и хим. наук. 1978. № 3. С. 42—46.
Мошкович А. М.} Чеботарь А. А. Рожь.
Кишинев, 1976.
Мудрова Н. Л., Поддубная-Арнольди В. А. //
Бюл. Гл. ботан. сада АН СССР. 1981. Вып. 120.
С. 60—65.
Навашин С. Г. // Дневник X съезда рус. есте-
ствоисп. и врачей. Киев, 1898а. Т. 6. С. 16—21.
(Модилевский Я. С.) Modilewski J. // Вкник
Кшв. ботан. саду^. 1925. Вып. 2. С. 9—19.
(Модилевский Я. С.) Modilewski J. // Вкник
Кшв. ботан. саду. 1928. Вып. 7—8. С. 57—64.
Навашин С. Г. // Бюл. имп. Акад. наук. СПб.
Сер. 5. 19896. Т. 9. С. 377—382.
(Навашин С. Г.) Nawaschin S. G. // Bot. Zentr.-
Bl. 1899. Bd 77, N 1. S. 62.
(Навашин С. Г.) // Nawaschin S. G. // Ann.
Jard. bot. Buitenzorg. 1910. Vol. 8 (23),
Suppl. 3, part 2. P. 871—904.
(Наумова Т. H.) Naumova Т. N. // Bull. Soc.
bot. France. 1978a. T. 125, N 1—5, P. 183—186.
Наумова Т. Н. // Апомиксис и
цитоэмбриология растений. Саратов, 19786. Вып. 4. С. 84—
85.
Наумова Т. П., Яковлев М. С. // Ботан. журн.
1972. Т. 57, № 8. С. 1006—1021.
Наумова Т. Н., Яковлев М. С. // Ботан. журн.
1975а. Т. 60, № 3. С. 342—350.
Наумова Т. Н., Яковлев М. С. // Ботан. журн.
19756. Т. 60, № 5. С. 627—635.
Немирович-Данченко Е. Н. // Сравнительная
анатомия семян. Л., 1985. Т. 1. С. 69—71,
86—87, 92—93, 96, 107—108, 161 — 162.
Никифоров Ю. Л., Феофилова Г. Ф. // Ботан.
журн. 1982. Т. 67, № 2. С. 166—176.
Новикова Н. Г., Нечаев А. П., Еременко Т. В.,
Байков В. Г. II Физиология растений. 1973.
Т. 20, № 5. С. 896—899.
Оганезова Г. Г. // Ботан. журн. 1982. Т. 67, № 6.
С. 729—742.
Оганезова Г. Г. // Ботан. журн. 1984. Т. 69, № 6.
С. 772—782.
Огородникова В. Ф. // Тр. по прикл. ботан.,
генет. и селекции. Л., 1977. Т. 60, вып. 2.
С. 99—104.
Огородникова В. Ф. // Тр. по прикл. ботан.,
генет. и селекции. Л., 1980. Т. 67, вып. 3.
С. 150—157.
Огородникова В. Ф. // Тр. по прикл. ботан.,
генет. и селекции., Л., 1983. Т. 74, вып. 2.
С. 27—36.
Огородникова В. Ф. // Тр. по прикл. ботан.,
генет. и селекции. Л., 1986а. Т. 99. С. 65—68.
Огородникова В. Ф. // Ботан. журн. 19866.
Т. 71, № 10. С. 1366—1371.
Оксиюк П. Ф., Худяк М. И. // Докл. АН СССР.
1955. Т. 105, № 4. С. 835—837.
Орел Л. И. И Генетика. 1967. № 12. С. 3—11.
Орел Л. И. II Тр. по прикл. ботан., генет. и
селекции. Л., 1968. Т. 40, № 1. С. 163—176.
(Орел Л. И.) Oryol L. // Rev. cytol. et biol.
veg. 1969. T. 32, N 1—2. P. 37—40.
Орел Л. И. II Бюл. Всесоюз. ин-та
растениеводства. 1970. Вып. 15. С. 47—53.
Орел Л. И. Цитология мужской цитоплазмати-
ческой стерильности кукурузы и других
культурных растений. Л., 1972.
Орел Л. И., Голышкин Л. В. // Тр. по прикл.
ботан., генет. и селекции. Л., 1976. Т. 55,
№ 2. С. 29—40.
Орел Л. И., Огородникова В. Ф. // Бюл.
Всесоюз. ин-та растениеводства. 1978. Вып. 83.
С. 72—81.
Орел Л. И., Шмараев И. Г. // Ботан. журн.
1987. Т. 72, № 6. С. 753—757.
Орел Л. И., Шмараев И. Г. // Ботан. журн. 1987.
Т. 72, № 10. С. 1331 — 1337.
Орлова И. Н, Абалкина Н. А. // Тр. по прикл.
ботан., генет. и селекции. 1983. Т. 74. С. 6—15.
Остапенко Е. К., Хведынич О. А. / / Ботан. журн.
1987. Т. 72, № 3. С. 291—298.
(Паламарчук И. A.) Palamarchuk I. А. // The
Morphology of Corn. Moscow, 1962. P. 121 —
139.
Паламарчук И. А. // Науч. докл. высшей
школы. Биол. науки. 1958. № 4. С. 118—123.
Палилова А. Н., Орлов П. А. // Весщ АН БССР.
Сер. б1ял. наук. 1980. № 6. С. 62—67.
Петибская В. С., Красноок Н. П. // Науч. со-
общ. Дагест. отд-ния Всесоюз. ботан. о-ва.
1972. Вып. 3. С. 139—145.
Петров Г. Я., Батыгина Т. Б. // Приемы
повышения урожайности и качества семян
зерновых культур. Пермь, 1983. С. 95—104.
Петров Г. Я., Батыгина Т. Б. //
Совершенствование агротехники зерновых и кормовых
культур. Пермь, 1986а. С. 69—80.
Петрова К. А. // Отдаленная гибридизация
в семействе злаковых. М., 1958. С. 115—128.
Петрова Л. Р. // Экол. опыления. Пермь, 1979.
№ 4. С. 108—112.
Петрова Л. Р., Банникова В. А. // Ботан. журн.
1982. Т. 67, № 1. С. 26—32.
Петрова Л. Р., Федотова Т. А.,
Николаевская Т. С. II Сравнительная анатомия семян.
Л., 1985. Т. 1. С. 192—205.
Петрова Л. Р., Яковлев М. С. // Ботан. журн.
1968. Т. 53, № 12. С. 1688—1703.
Петрова Т. Ф. // Ботан. журн. 1967. Т. 52, № 8.
С. 1187—1193.
Петрова Т. Ф. // Ботан. журн. 1970. Т. 55, №11.
С. 1662—1665.
Петрова Т. Ф. Цитоэмбриология лилейных.
Подсемейство Lilioideae. M., 1977.
Петрович И. В. Мужской гаметофит
амариллисовых, бобовых и злаковых растений.
Кишинев, 1976.
Печеницын В. П. // Вопросы биологии и краевой
медицины. Ташкент, 1963. Вып. 4. С. 239—243.
Печеницын В. П. // Узб. биол. журн. 1965а. № 2.
С. 53—57.
Печеницын В. П. // Ботан. журн. 1972а. Т. 57,
№ 2. С. 221—229.
294
Печеницын В. П. // Ботан. журн. 19726. Т. 57,
№ 5. С. 465—469.
Плиско М. А. II Сравнительная анатомия
семян. Л., 1985. Т. 1. С. 217—227.
Плющ Т. А. II Ботан. журн. 1987. Т. 72, № 5.
С. 651—657.
Поддубная-Арнольди В. А. // Бюл. Гл. ботан.
сада АН СССР. 1952. Вып. 14. С. 3—12.
Поддубная-Арнольди В. А. // Бюл. Гл. ботан.
сада АН СССР. 1954. Вып. 18. С. 81—91.
Поддубная-Арнольди В. А. // Ботан. журн. 1958.
Т. 43, № 2. С. 178—193.
Поддубная-Арнольди В. А. // Тр. Гл. ботан.
сада АН СССР. 1959. Т. 6. С. 47—89.
Поддубная-Арнольди В. А. // Бюл. Гл. ботан.
сада АН СССР. 1960а. Вып. 37. С. 47—52.
Поддубная-Арнольди В. А. // Бюл. Гл. ботан.
сада АН СССР. 19606. Вып. 36. С. 56—61.
Поддубная-Арнольди В. А. // Бюл. Гл. ботан.
сада АН СССР. 1960в. Вып. 39. С. 54—61.
Поддубная-Арнольди В. А. // Бюл. Гл. ботан.
сада АН СССР. 1964а. Вып. 54. С. 51—62.
Поддубная-Арнольди В. А. // Проблемы
современной эмбриологии. М., 19646. С. 25—32.
Поддубная-Арнольди В. А. // Докл. АН СССР.
1965. Т. 162, № 3. С. 705—708.
Поддубная-Арнольди В. А. Характеристика
семейств покрытосеменных растений по цито-
эмбриологическим признакам. М., 1982.
Поддубная-Арнольди В. А., Пащенко 3. М. //
Морфология кукурузы. М., 1962. С. 162—170.
Поддубная-Арнольди В. А., Селезнева В. А.
Орхидеи и их культура. М., 1957.
Поддубная-Арнольди В. А., Цингер Н. В.,
Петровская Т. П., Полунина Н. Н. // Тр. Гл.
ботан. сада АН СССР. 1961. Т. 8. С. 162—194.
Полунина Н. Н. // Морфогенез растений. М.,
1961. Т. 2. С. 192—194.
Полунина Н. П., Свешников А. И. // Докл.
АН СССР. 1959. Т. 127, №> 1. С. 217—219.
Попова М., Николов Хр. // Генетика и селекция
(НРБ). 1969. № 5. С. 363—369.
Попцов А. В., Некрасов В. И., Иванова И. А.
Очерки по семеноведению. М., 1981.
Резникова С. А. // Онтогенез. 1973. Т. 4, № 1.
С. 69—79.
Резникова С. А. Закономерности клеточной
дифференциации при макроспоро- и гаметогенезе
(на примере Lilium candidum): Автореф. дис.
. . . докт. биол. наук. М., 1975.
Резникова С. А. Цитология и физиология
развивающегося пыльника. М., 1984.
(Резникова С. А., Богданов Ю. Ф.) Reznl-
kova S. A., Bogdanov Yu. F. // Biol. Zentr.-
Bl. 1972. Bd 91, H. 4. S. 469—428.
Резникова С. А., Виллемсе М. Т. М. // Ботан.
журн. 1981а. Т. 66, № 8. С. 1155—1165.
Резникова С. А., Виллемсе М. Т. // Физиология
растений. 19816. Т. 28, № 6. С. 1181 — 1189.
(Резникова С. А., Виллемсе М. Т. М.) Rezni-
kova S. A., Willemse М. Т. М. // Acta bot.
neer. 1980. Vol. 29, N 2—3. P. 141 — 156.
(Резникова С. А., Виллемсе М. Т. М.) Rezni-
kova S. A., Willemse М. Т. М. // Acta Soc. bot.
polon. 1981. Vol. 50, N 1—2. P. 83—87.
Резникова С. А., ■ Погорельская А. Н.,
Попов П. С. II Физиология растений. 1982. Т. 29,
вып. 6. С. 1155—1163.
Романовский С. Ю. // Узб. биол. журн. 1960.
№ 1. С. 27—34.
Ролл #., Ильев Д. // Протоколы О-ва испыт.
природы при Харьков, ун-те. 1912. Вып. 1.
С. 5—12.
(Романов И. Д.) Romanov I. D. // Planta. 1936.
Vol. 25. P. 438—458.
Романов Я. Д. // Докл. АН СССР. 1938. Т. 19,
№ 1. С. 113—115.
Романов Я. Д. // Докл. АН СССР. 1939. Т. 22,
№ 3. С. 140—142.
Романов Я. Д. // Бюл. Среднеаз. гос. ун-та.
1945. Вып. 23. С. 118—119.
Романов Я. Д. // Бюл. Моск. о-ва испыт.
природы. Отд. биол. 1954. Т. 59, вып. 6. С. 61—70.
Романов Я. Д. // Докл. АН СССР. 1957. Т. 115,
№ 5. С. 1025—1027.
Романов Я. Д. // Докл. АН СССР. 1961. Т. 141,
№ 4. С. 984—986.
Романов И. Д. // Цитология. 1963. Т. 5,
№ 6. С. 623—629.
Романов Я. Д. // Цитология. 1965а. Т. 7, № 1.
С. 23—32.
Романов Я. Д. // Ботан. журн. 19656. Т. 50, № 9.
С. 1276—1287.
Романов Я. Д. // Докл. АН СССР. 1966. Т. 169,
№ 2. С. 456.
Романов И. Д. // Генетика. 1970а. Т. 6, № 10.
С. 11—25.
Романов Я. Д. // Бюл. Всесоюз. ин-та
растениеводства. 1970в. Вып. 15. С. 38—47.
Романова Г. С, Кольцова А. С, Мосол-
кова И. М. II Цитогенетические и
эмбриологические исследования многолетних растений.
Ялта, 1983. Т. 91. С. 102—113.
Ростовцев С. Я. Биолого-морфологический
очерк рясок. М., 1905.
Ротов Р. А., Петрова Т. Ф. // Бюл. Гл. ботан.
сада АН СССР. 1977. Вып. 106. С. 96—100.
Рочева Г. П., Таскаева Н. Н. Цитоэмбриологи-
ческое исследование канареечника тростнико-
видного. Некоторые особенности роста и
развития растений в условиях Европейского
Северо-Востока. Сыктывкар, 1980.
Рустамова Д. М. // Узб. биол. журн. 1982.
№ 6. С. 37—39.
Руми В. А., Шукуров Т. II Узб. биол. журн. 1968.
№ 5. С. 61—62.
Савина Г. Я. // Ботан. журн. 1964. Т. 49, № 9.
С. 1317—1322.
Савина Г. Я. // Ботан. журн. 1965. Т. 50, № 1.
С. 96—102.
Савина Г. Я. // Ботан. журн. 1972а. Т. 57,
№ 1. С. 118—123.
Савина Г. Я. // Ботан. журн. 19726. Т. 57, № 3.
С. 382—392.
Савина Г. И. // Актуальные вопросы
эмбриологии покрытосеменных. Л., 1979. С. 19—28.
(Савина Г. И., Жукова Г. Я-) Savina G., Zhu-
kova G. II Ргос. VII Int. Cytoembr. Symp.
(High Tatra, 1983). 1984. P. 207—210.
Савич E. Я. // Морфология растений. М., 1967.
С. 45—61.
Савич Е. Я. // Ботан. журн. 1968. Т. 53, № 4.
С. 514—523.
Савич Е. Я. Эмбриологическое исследование Не-
lobiae: Автореф. дис. . . . канд. биол. наук.
М., 1969.
Савченко М. И., Комар Г. А. // Морфология
цветка и репродуктивный процесс у
покрытосеменных растений. М.; Л., 1965. С. 74—
ИЗ.
Савченко М. Я., Петрова Л. Р. // Ботан. журн.
1963. Т. 48, № И. С. 1623—1638.
Салимова М. Ш. // Тр. аспирантов и молодых
науч. сотр. Всесоюз. ин-та растениеводства.
1968. Т. 9, № 13. С. 160—163.
Самородова-Бианки Г. Б. // Физиология
растений. 1959. Т. 6, № 1. С. 99—102.
Сатарова Т. Н. // Тр. 7-й конф. молодых ученых
Ботан. ин-та АН СССР. Л., 1984. С. 110—114.
Деп. в ВИНИТИ, 1985, № 6591-85 деп.
295
Сатарова Т. Я. // Ботан. журн. 1985. Т. 70, № 3.
С. 373—378.
Сатарова Т. Я. // Ботан. журн. 1984а. Т. 69,
№ 4. С. 481—491.
Сатарова Т. Я. Эмбриология представителей
семейства Asparagaceae: Автореф. дис. . . .
канд. биол. наук. Л., 1985.
Седова Т. В. // Тр. по прикл. ботан., генет. и
селекции. Л., 1961. Т. 34, № 2. С. 50—54.
Сенянинова М. В. // Журн. Рус. ботан. о-ва при
АН. 1924. Т. 9. С. 10—14.
Симинел В. Д., Кильчевская О. С. Особенности
биологии цветения, опыления и
оплодотворения тритикале. Кишинев, 1984.
Симоненко В. /С // Цитология и генетика. 1980.
Т. 14, № 5. С. 35—42.
Симонова О. Я. // Вопросы биологии.
Хабаровск, 1974. С. 54—65.
Скачкова В. Я // Тр. по прикл. ботан., генет. и
селекции. Л., 1976. Т. 58, № 1. С. 139—145.
Скворцов А. К. II Бюл. Моск. о-ва испыт.
природы. Отд. биол. 1977. Т. 82, вып. 5. С. 96—
111.
Смирнов А. Г. Женский гаметофит
покрытосеменных и его эволюция. Казань, 1982.
Смирнов А. Г., Граханцева Л. Ш. // Ботан.
журн. 1982. Т. 67, № 4. С. 491—499.
Смирнова Е. С. II Бюл. Гл. ботан. сада АН
СССР. 1964. Вып. 55. С. 71—81.
Соколов И. Д. // Изв. АН ТССР. Сер. биол.
наук. 1968а. № 1. С. 87—89.
Соколов И. Д. // Изв. АН ТССР. Сер. биол.
наук. 19686. № 4. С. 21—27.
Соколов И. Д. // Ботан. журн. 1969. Т. 54, № 2.
С. 202—207.
Соколов И. Д. // Цитология и генетика. 1971.
Т. 5, № 6. С. 555—556.
Соколов И. Д. // Цитология и генетика. 1973.
Т. 7, № 1. С. 73—76.
Соколов И. Д. // Укр. ботан. журн. 1976. Т. 33,
№ 3. С. 265—267.
Соколов I. Д. // У1зЧзд Украшського боташч-
ного товариства. Кшв, 1977. С. 158.
Соколов И. Д. // Ботан. журн. 1983. Т. 68, № 10.
С. 1333—1340.
Соколов И. Д., Бондаренко А. М. // Цитология.
1975. Т. 16, № 12. С. 1470—1474.
Соколов И. Д., Петров А. П., Крамарен-
ко Ю. Я. // Ботан. журн. 1974. Т. 59, № 11.
С. 1576—1582.
Соколова С. М. II Бюл. Гл. ботан. сада АН
СССР. 1961. Вып. 44. С. 58—62.
Соколова С. М. II Эвол. биохимия растений. М.,
1964. С. 60—69.
Соколовская Т. Б. // Ботан. журн. 1965. Т. 50,
№ 12. С. 1686—1693.
Соколовская Т. Б. // Ботан. журн. 1967. Т. 52,
№ 12. С. 1773—1784.
Солнцева М. П. // Ботан. журн. 1967. Т. 52,
№ 12. С. 1757—1772.
Солнцева М. П. // Учен. зап. Ульянов, гос. пед.
ин-та. 1968. Вып. 23, № 3. С. 29—40.
Солнцева М. П., Ворсобина Л. И. // Докл. АН
СССР. 1972. Т. 206, № 4. С. 1005—1009.
Солнцева М. П., Ворсобина Л. И. // Докл. АН
СССР. 1979. Т. 245, № 2. С. 509—512.
Солнцева М. П., Левковский В., Кишечни-
кова Г. Я. // Докл. АН СССР. 1977. Т. 237,
№ 1. С. 238—241.
Стожарова И. А. // Сб. статей молодых ученых
и аспирантов НИИ овощн. хоз-ва. 1971.
Вып. 4. С. 204—206.
Стожарова И. А. // Докл. сов. ученых к XIX
Междунар. конф. по садоводству в Варшаве.
М., 1974. С. 493—498.
Стожарова И. А., Поддубная-Арнольди В. А. //
Бюл. Гл. ботан. сада АН СССР. 1977. Вып. 105.
С. 70—78.
Тажин О. Г. И Изв. АН КазССР. Сер. биол.
1969. № 6. С. 82—83.
Тажин О. Г. II Биол. науки. Алма-Ата, 1971.
Вып. 1. С. 77—80.
Талиева М. П., Юрьева Я. А. // Бюл. Гл. ботан.
сада АН СССР. 1985. Вып. 137. С. 102—
108.
Тамамшян С. Г. // Ботан. журн. 1951. Т. 36,
№ 5. С. 497—514.
Тарасенко Л. В. // Укр. ботан. журн. 1988.
Т. 45, № 4. С. 45—50.
Тарасенко Л. В., Банникова В. П. // Укр. ботан.
журн. 1986. Т. 43, № 1. С. 71—73.
Тарасенко Л. В., Банникова В. П.,
Ситник К. М. II Докл. АН УССР. 1988. Сер. Б.
№ 3. С. 81—84.
Татинцева С. С. // Ботан. журн. 1967. Т. 52,
№ 5. С. 690—695.
Татинцева С. С. // Изв. АН ТССР. Сер. биол.
наук. 1968. № 3. С. 26—31.
Татинцева С. С. // Ботан. журн. 1972. Т. 57, № 8.
С. 916—921.
Татинцева С. С. // Ботан. журн. 1975. Т. 60,
№ 12. С. 1707—1720.
Татинцева С. С. // Изв. АН ТССР. Сер. биол.
наук. 1984. № 3. С. 49—52.
Терёхин Э. С. /I Анатомия семян. Л., 1985.
Т. 1. С. 51—57, 138—141.
Терёхин Э. С, Камелина О. П. // Ботан. журн.
1972. Т. 57, № 11. С. 1373—1383.
Терёхин Э. С, Никитичева 3. И. // Ботан. журн.
1968. Т. 53, № 1. С. 39—57.
Терзийски Д., Христов М. // Генетика и
селекция. 1973. Т. 6, № 1. С. 45—57.
Тихенко Я. Д. // Тр. по прикл. ботан., генет. и
селекции. 1986. Т. 99. С. 79—82.
Транковский Д. А. // Бюл. Моск. о-ва испыт.
природы. Отд. биол. 1938 (1939). Т. 48, № 5—
6. С. 124—128.
Транковский Д. А., Троицкая Т. А. // Вестн.
Моск. ун-та. 1967. Биол., почвовед. № 1.
С. 55—58.
(Третьяков С.) Tretjakow S. // Ber. Dtsch. bot.
Ges. 1895. Bd 13, H. 1. S. 13—17.
Трофимец В. К. II Вестн. соц. растениеводства.
1940. № 5. С. 76—86.
Устинова Е. И. // Ботан. журн. 1948. Т. 29,
№ 5. С. 232—239.
Устинова Е. И. // Докл. ВАСХНИЛ. 1950.
Вып. 10. С. 16—24.
Устинова Е. И. // Докл. АН СССР. 1959. Т. 127,
№ 3. С. 689—692.
Устинова Е. И. // Ботан. журн. 1960. Т. 45,
№ 5. С. 764—767.
Федорова Т. Я.//С.-х. биология. 1986. № И.
С. 40—46.
Федотова Т. А. // Сравнительная анатомия
семян. Л., 1985. Т. 1. С. 126—130.
Феофилова Г. Ф. Некоторые биологические
особенности канны садовой в условиях Крыма:
Автореф. дис. . . . канд. биол. наук. Л., 1973.
(Финн В. В.) Finn W. W.,// Ber. Dtsch. bot. Ges.
1931. Bd 49, H. 3. S. 153—157.
Фрумкина А. П. 11 Экспериментальная цито-
эмбриология растений. Кишинев, 1971.
С. 118—133.
Фрумкина А. П. II Изв. АН МССР. Сер. биол.
и хим. наук. 1969. № 5. С. 72—73.
Фурсов В. И. II Биология нуклеинового обмена
у растений. М., 1964. С. 100—105,
Фурст Г. Г. II Тр. Ин-та генетики АН СССР.
1962. № 26. С. 128—133.
296
Хазова И. И. // Ботан. журн. 1970. Т. 55,
№ 1—6. С. 93—102.
Хазова И. И. // Узб. биол. журн. 1972. № 5.
С. 52—54.
Хведынич О. А. // Укр. ботан. журн. 1969. Т. 26,
№ 5. С. 120—123.
Хведынич О. А., Банникова В. Я. // Цитология и
генетика. 1970. Т. 4, № 5. С. 387—391.
Хвединич О. О., Банникова В. П.,
Сердюк Л. С. Ц Укр. ботан. журн. 1983. Т. 40,
№ 2. С. 57—59.
Хведынич О. А., Петрик С. А. // Ботан. журн.
1986. Т. 71, № 1. С. 47—52.
Хведынич О. А., Сердюк Л. С. / / Ботан. журн.
1986. Т. 71, № 5. С. 617—622.
Хохлов С. С. 11 Апомиксис и цитоэмбриология
растений. Саратов, 1971. Вып. 2. С. 3—24.
Хохлов С. С, Малышева Н. А. // Апомиксис и
селекция. М., 1970. С. 47—55.
Христов М. А. И Фитология. 1979. № 11. С. 3—
14.
Христов М. А., Крушева Р. // Генетика и
селекция (НРБ). 1968. Т. 1, № 3. С. 233—250.
Христов М. А., Москова Р. // Генетика и
селекция (НРБ). 1972. Т. 5, № 1. С. 71—86.
Христов М. А., Терзийски Д. Я. / / Фитология
(НРБ). 1979. №> 11. С. 3—14.
Ху Хань И Цитология. 1961. Т. 3, № 2. С. 189—
195.
Цветаева М. И. // Апомиксис и
цитоэмбриология растений. Саратов, 1971. Вып. 2. С. 94—
103.
Цингер Н. В., Поддубная-Арнольди В. А. //
Докл. АН СССР. 1957. Т. 118, № 3. С. 607—
610.
Цингер Н. В., Поддубная-Арнольди В. А.,
Петровская-Баранова Т. П. II Бюл. Гл. ботан.
сада АН СССР. 1964. Вып. 55. С. 81—90.
Цуркан П. А. Сравнительное биохимическое
изучение азотистых веществ семян и
вегетативной массы кукурузы и сорго: Автореф.
дис. . . . канд. биол. наук. Кишинев, 1962.
Чеботарь А. А. // Хлоропласта и митохондрии.
М., 1969. С. 122—145.
Чеботарь А. А. // Изв. АН МССР. Сер. биол.
и хим. наук. 1970а. № 2. С. 29—36.
Чеботарь А. А. // Апомиксис и селекция. М.,
19706. С. 100—106.
Чеботарь А. А. // Цито-кариол. исслед.
злаковых Молдавии. Кишинев, 1971. С. 5—15.
Чеботарь А. А. Эмбриология кукурузы.
Кишинев, 1972.
(Чеботарь Л. A.) Chebotaru А. А. // Bull. Soc.
bot. France. 1978. Т. 125, N 1/2. P. 155—163.
Чеботарь А. А. // Изв. АН МССР. Сер. биол.
и хим. наук. 1981. № 3. С. 34—39.
Чеботарь А. А., Челак В. Р., Суружиу А. И.
Цитолого-кариологическое исследование
хлебных злаков. Кишинев, 1970.
Чолахян Д. П., Согомонян С. А. // Изв. АН
АрмССР. Сер. биол. 1961. Т. 14, № 7. С. 15—24.
Шакарян Ж. О., Авакян В. А., Амирбе-
кян В. А. II Биол. журн. Армении. 1979.
Т. 32, № 10, С. 948—958.
Шевченко С. В. // Ботан. журн. 1986. Т. 71,
№ И. С. 1512—1516.
Шевченко С. В., Феофилова Г. Ф. // Бюл.
Никит, ботан. сада. 1981. Вып. 3 (46). С. 94—98.
Шевцова Г. Г. // Укр. ботан. журн. 1986. Т. 43,
№ 6. С. 81—83.
Шишкинская Н. А. // Апомиксис и
цитоэмбриология растений. Вып. 3. Саратов, 1975.
С. 153—159.
Шишкинская Н. А. // Филогения высш. раст.
М., 1982. С. 160—162.
Шишкинская Н. А., Бородько Н. А. // Науч.
докл. высшей школы. Биол. науки. 1987.
№ 1. С. 84—89.
Шишкинская Н. А., Горюнова Н. В. //
Апомиксис и цитоэмбриология растений. Саратов,
1971. Вып. 2. С. 109—113.
Шишкинская И. А., Ларина Т. В. // Науч. докл.
высшей школы. Биол. науки. 1982. № 9.
С. 95—98.
Шмараев И. Г. // Бюл. Всесоюз. ин-та
растениеводства. 1982. № 118. С. 24—25.
Шмараев И. Г. // Тр. по прикл. ботан., генет.
и селекции. 1983а. Т. 74. С. 15—21.
Шмараев И. Г. // Бюл. Всесоюз. ин-та
растениеводства. 19836. Вып. 134. С. 19—21.
Шпаков А. М., Колесников С. М. // Изв. АН
МССР. Сер. биол. и хим. наук. 1969. № 5.
С. 73—74.
Шпаков А. М. II Изв. АН МССР. Сер. биол, и
хим. наук. 1974. № 6. С. 86—87.
Шпильова С. Я. // Укр. ботан. журн. 1976. Т. 33,
№ 3. С. 284—287.
Шпильовий Б. Ю. II Интродукция та аюпмати-
зация рослин на Украш. Кшв, 1977. С. 106—
108.
Шпильовий Б. Ю. II II Укр. ботан. журн. 1980.
Т. 37, № 5. С. 48—54.
Шпильовий Б. Ю. II Укр. ботан. журн. 1985.
Т. 42, № 3. С. 65—68.
Юнусова М. И., Рустамова Д. М. //
Интродукция и акклиматизация растений. Ташкент,
1987. № 21. С. 109—113.
Яковлев М. С. Строение эндосперма основных
селекционных сортов пшениц СССР. М.; Л.,
1938.
Яковлев М. С. // Сов. ботан. 1946. Т. 14, № 6.
С. 351—363.
Яковлев М. С. /I Докл. АН АрмССР. 1948. Т. 8,
№ 3. С. 127—134.
Яковлев М. С. II Тр. Ин-та физиологии
растений им. К. А. Тимирязева. 1949. Т. 6, вып. 2.
С. 296—302.
Яковлев М. 'С. II Тр. Ботан. ин-та им. В. Л.
Комарова АН СССР. 1950. Вып. 1. С. 121—218.
Яковлев М. С, Камелина О. П. // Ботан. журн.
1973. Т. 58, № 3. С. 248—263.
Яковлев М. С, Николаенко Е. И. Число
сосудисто-волокнистых пучков в Coleoptile пшениц
как систематический признак. Л., 1931.
Яковлев М. С, Солнцева М. Я. // Ботан. журн.
1964. Т. 49, № 5. С. 625—633.
Яковлев М. С, Солнцева М. Я. // Морфология
цветка и репродуктивный процесс у
покрытосеменных растений. М.; Л., 1965. С. 61—73.
Яшвили М. Н. И Сообщ. АН ГССР. 1977. Т. 85,
№ 1. С. 153—156.
Яшвили М. Н. И Сообщ. АН ГССР. 1979. Т. 93,
№ 2. С. 433 437.
Abe'К. // Sci. Repts Tohoku Univ. Ser. 4. 1967.
Vol. 33. P. 79—82.
Abe K. II Sci. Repts Tohoku Univ. Ser. 4. 1968a.
Vol. 34, N 1. P. 56—65.
Abe К. И Sci. Repts Tohoku Univ. Ser. 4. 1968b.
Vol. 34. P. 119—123.
Abe К. И Sci. Repts Tohoku Univ. Ser. 4. 1972a.
Vol. 36, N 3. P. 135—178.
Abe К. И Sci. Repts Tohoku Univ. Ser. 4. 1972b.
Vol. 36, N 3. P. 179—201.
Abe K. II Ann. Bot. 1976. Vol. 40, N 165. P. 99—
102.
Abe K. II Ann. Bot. 1977. Vol. 44. P. 897—899.
Abbe E. C, Stein O. L. //Amer. J. Bot. 1954.
Vol. 41, N 4. P. 285—293.
Abraham A.} Mathew P. M. // Ann. Bot. 1963.
Vol. 27, N 107. P. 505—512.
297
Afzellus К. II Sv. bot. tidskr. 1916. Bd 10, H. 2.
S. 183—227.
Afzellus K. //Acta horti berg. 1918. Bd 6, N 3.
5 з 12.
Afzellus K. II Sv. boUtidskr. 1920. Bd 14, H. 2—
3. S. 168—175.
Afzellus K. II Sv. bot. tidskr. 1922. Bd 16, H. 3—
4. S. 370—382.
Afzellus K. II Sv. bot. tidskr. 1928. Bd 22, H. 1 —
2 § 82 91
Afzellus K. II Sv. bot. tidskr. 1954. Bd 48, H. 2.
5. 513—520.
Agrawal J. S. // Phytomorphology. 1952. Vol. 2,
N 1. P. 15—29.
Akerberg E. // Hereditas. 1939. Vol. 25. P. 359—
370.
Akerberg E. // Hereditas. 1943. Vol. 29. P. 199—
201.
Albertini L. И С r. Acad. sci. D. 1963. T. 256,
N 16. P. 3490—3491.
Albertini L. И С r. Acad. sci. D. 1965. T. 260,
N 2. P. 651—653.
Albertini L. // С r. Acad. sci. D. 1967a. T. 265,
N 8. P. 598—601.
Albertini L. I/ C. r. Acad. sci. D. 1967b. T. 264,
N 24. P. 1773—1776.
Albertini L. // Rev. cytol. et biol. veg. 1971a.
T. 34, fasc. 1—2. P. 49—92.
Albertini L. // Rev. cytol. et biol. veg. 1971b.
T. 34, f. 3—4. P. 309—326.
Alden I. // Bull. Torrey Bot. Club. 1912. Vol. 39,
N 9. P. 439—446.
Almeida J. L. F., Sampayo Т. M. // Bol. Soc.
broter. 1950. Vol. 24, ser. 2. P. 323—334.
Anderson A. M.//J. Agr. Res. 1927. Vol. 34,
N 11. P. 1001 — 1018.
Angremont A. de//Ber. Dt. bot. Ges. 1912.
Bd. 30, S. 686—691.
Angremont A. de // Flora. 1915. Bd 107. P. 57—
110.
Ansarl R.//Curr. Sci. (India). 1977. Vol. 46,
N 17. P. 607.
Anton A. M., Cocuccl A. E. // Plant Syst. and
Evol. 1984. Vol. 146, N 1—2. P. 117—121.
Ardlttl J. И Bot. Rev. 1967. Vol. 33, N 1. P. 1—97.
Arekal G. D. // J. Indian Bot. Soc. 1967. Vol. 46,
N 2—4. P. 193—198.
Arekal G. D.} Ramaswamy S. N. // Beitr. Biol.
Pflanz. 1973. Bd 49. S. 35—46.
Arekal G. D., Ramaswamy S. N. // Bot. notis.
1980. Vol. 133. P. 295—-309.
Arnott H. J. I/ Congr. Intern. Bot. 9th. 1959.
Vol. 2. P. 9—10.
Arnott H. J. И Univ. Calif. Pubis. Bot. 1962.
Vol. 35. P. 1 — 144.
Asplund I. И Sv. bot. tidskr. 1968. Bd 62, H. 2.
S. 410—412.
Asplund I. И Sv. bot. tidskr. 1972. Bd 66, H. 1.
S. 1 — 17.
Atkinson G. F. И Bot. Gaz. 1899. Vol. 28, N 1.
P. 1—28. '
Aulbach-Smith С A., Herr J. M. // Amer. J. Bot.
1984. Vol. 71. P. 427—438.
Avery G. S. //Bot. Gaz. 1930. Vol. 89, N 1.
P. 1—39.
Ayensu E. S., Skvarla J. J. // Bull. Torrey Bot.
Club. 1974. T. 101, N 5. P. 250—266.
Ayyangar G. N. R., Krlshnaswamy N. // Madras
Agr. J. 1930. Vol. 18, P. 393—395.
Bajer A. S., Mole-Bajer J., Jnoue S. // J. Cell
Biol. 1985. Vol. 101, N 5. pt 2. P. 146.
Balasubramanlam K., Atukorala T. M. S., Wije-
sundera S., Hoover A. A., DeSllva M. A. T. //
Ann. Bot. 1973. Vol. 37, N 151. P. 439—
445.
Bally W. И Verh. Schweiz. natur. Ges. Basel.
1916. Bd 98, T. 2. S. 169—170.
Bambaclonl V.I 1С. r. Acad. Lincei (Roma).
1928. Ser. 6, T. 6, fasc. 5. P. 544—546.
Bambaclonl V.//C. r. Acad. Lincei (Roma).
1928. Ser. 6, T. 8, fasc. 6. P. 612—618.
Bambaclonl V. //Ann. Bot. (Roma). 1928. T. 18,
fasc. 1. P. 7—37.
Bambaclonl V., GlomblnlA. // Ann. Bot. (Roma).
1930. Vol. 18, fasc. 3. P. 373—386.
Bambaclonl-Mezzettl V. // Ann. Bot. (Roma).
1931. Vol. 19, fasc. 2. P. 145—155.
Bambacioni-Mezzetti V. // Ann. Bot. (Roma).
1947. Vol. 23, fasc. 1. P. 1—23.
Banerjee U. С // Grana palynol. 1967. Vol. 7,
N 2/3. P. 365—377.
Banerji /.//J. Indian Bot. Soc. 1937. Vol. 16,
N 3. P. 159—164.
Banerji J. И У Indian Bot. Soc. 1940. Vol. 19,
N 3—4. P. 181 — 196.
Banerji J. // Proc. Nat. Inst. Sci. India B. 1947.
Vol. 13, N 3. P. 207—230.
Banerji J., Haldar S. // Proc. Indian Acad. Sci.
B. 1942. Vol. 16, N 4. P. 91 — 106.
Banerji J., Venkateswarlu V. // Curr. Sci.
(India). 1935. Vol. 4. P. 414.
Banerji J., Gangulee H. C. // J. Indian Bot. Soc.
1937. Vol. 16. P. 289.
Barber H. N. // J. Genet. 1942. Vol. 43, N 1—2.
P. 97—103.
Barkworth M. E. //Taxon. 1982. Vol. 31, N 2.
P. 233—243.
Baronl E. И Bull. Soc. Bot. Ital. 1892. P. 61—65.
Bartkowla E., Brukarczyk K. // Bull. Soc. amis
Sci. et lett. Pozn. D. 1965. Vol. 6. P. 79—97.
Basappa G. P., Muniyamma M. // Proc. Indian
Acad. Sci. Plant. Sci. 1981. Vol. 90, N 5.
P. 477—483.
Bashaw E. С // Crop Sci. 1962. Vol. 2. P. 412—
415.
Bashaw E. C.} Holt E. С // Agron. J. (USA).
1958. Vol. 50, N 102. P. 753—756.
Battaglla E. // N. G. bot. Ital. 1958a. Vol. 65,
N 1—2. P. 397—398.
Battaglla E. // Caryologia. 1958b. Vol. 11, N 2.
P. 247—252.
Battaglla E. // Caryologia. 1958c. Vol. 11, N 2.
P. 253—258.
Battaglla E.} Feeley E. // Caryologia. 1959.
Vol. 11, N 3. 'P. 407—414.
Batygina Т. В. // Fertilization process in
higher plants (Linskens H. F. ed.). Amsterdam,
1974. P. 205—220.
Baude E. // Planta. 1956. Vol. 46, N 6. P. 649—
671.
Beat J. M. И Bot. Gaz. 1932. Vol. 93, N 3.
p 278 295.
Beatty S. W.} Beatty A. V. // Amer. J. Bot. 1953.
Vol. 40, N 8. P. 593—596.
Beccarl O. 11 N. G. bot. Ital. 1870. Vol. 2. P. 149—
155.
Bechtel D. В., Gaines R. L., Pomeranz Y. A. //
Ann. bot. 1982. Vol. 50, N 4. P. 507—518.
Bechtel D. В., Pomeranz Y. A. // Amer. J. Bot.
1977. Vol. 64, N 8. P. 966—973.
Bechtel D. В., Pomeranz Y. A. // Amer. J. Bot.
1978a. Vol. 65, N 1. P. 75—85.
Bechtel D. В., Pomeranz Y. A. // Amer. J. Bot.
1978b. Vol. 65, N 6. P. 684—691.
Beck P., Horton J. S. И Bot. Gaz. 1932. Vol. 93,
N 1. P. 42—54.
Bednarska E. // Acta Soc. bot. pol. 1984. Vol. 53,
N 2. P. 145—158.
Begum M. И Proc. Indian Acad. Sci. B. 1968.
Vol. 67. P. 148—156.
298
Bell M. E. И Iowa State Coll. J. Sci. 1954.
Vol. 29. P. 133—139.
Bellows J. M., Bamford R. 11 Bot. Gaz. 1941.
Vol. 102, N 4. P. 699—711.
Bennef M. D., Rao M. /0, Smith G. В., Вау-
liss M. W. И Trans. Roy. Soc. London. 1973.
Ser. B. Vol. 266. P. 39—81.
Bennet H. W. 11 Bot. Gaz. 1944. Vol. 106, N 1—4.
P. 40—45.
Bennett M. D., Chapman V., Riley R. // Proc.
Roy. Soc. London. 1971. Ser. B. Vol. 178,
N 1052. P. 259—275.
Berg R. Y. II Nytt. mag. bot. 1960. Vol. 8.
P. 189—206.
Berg. R. J. Contribution to the comparative
embryology of the Liliaceae: Scoliopus,
Trillium, Paris and Medeola. Oslo, 1962.
Berg R. Y. II Norw. J. Bot. 1978. Vol. 25, N 1.
P. 1—7.
Berg R. Y., Maze J. R. 11 Madrono. 1966. Vol. 18,
N 5. P. 143—151.
Berger F. // Sci. pharm. 1958. Bd 26, N 4.
5 224 258.
Berghs /.//Cellule. 1905. Vol. 22, N 1—2.
P. 141 — 160.
Bhandari N. N., Bhargava M., Geier T. / / Ann.
Bot. 1981. Vol. 48, N 4. P. 425—431.
Bhandari N. N., Khosla Reeta //
Phytomorphology. 1982. Vol. 32, N 1. P. 18—27.
Bhandari N. N., Sachdeva A. // Protoplasma.
1983. Vol. 116, N 2—3. P. 170—178.
Bhanwra R. К. Ц Curr. Sci. (India). 1985.
Vol. 55, N 20. P. 1033—1034.
Bhanwra R. /(., Choda S. P. 11 Nord J. Bot.
1981. Vol. 1, N 1. P. 97—101.
Bhanwra R. K., Choda S. P. // Proc. Indian
Acad. Sci. Plant. Sci. 1986. Vol. 96, N 1.
P. 71—78.
Bhanwra R. K., Choda S. P. // Proc. Indian
Nat. Sci. Acad. 1981. Vol. 47, N 3. P. 408—
418.
Bhanwra R. K., Kumar S., Choda S. // Curr.
Sci. (India). 1980. Vol. 49, N 13. P. 524.
Bhanwra R. /(., Choda S. P., Kumar S. // Proc.
Indian Nat. Sci. Acad. 1982. Vol. 48, N 1.
P. 152—162.
Bhatia I. S., Gumber S. C, Singh R. // Physiol.
plant. 1980. Vol. 49, N 2. P. 248—254.
Bhatnagar S. P., Chandra Sudhir // Phyto-
morphology. 1976. Vol. 26, N 2. P. 139—
143.
Bhuskute S. M., Makde К. H. // Curr. Sci.
(India). 1986. Vol. 55, N 7. P. 364—367.
Bianchi R. // Ber. Schweiz. bot. Ges. 1946. Bd 56,
H. 5. S. 523—582.
Billings F. H. I/ Bot. Gaz. 1904. Vol. 38, N 2.
P. 99—119.
Biradar N. V. // Proc. Indian Acad. Sci. B. 1968.
Vol. 67, N 4. P. 165—173.
Biradar N. V., Mahabale T. S. 11 Proc.
Indian Acad. Sci. B. 1968. Vol. 68, N 1.
P. 1—8.
Birari S. P. // Genetica. 1980. Vol. 54, N 2.
p j33 i39
Birge W. I. //Bull. Univ. Texas. 1911. Vol. 194,
ser. 20. P. 5—24.
Bishop J. В., McGowan L. J. // Amer. J. Bot.
1953. Vol. 40, N 9. P. 658—659.
Bjornstad I. II Nytt. mag. bot. 1970. Vol. 17,
N 3—4. P. 169—207.
Blackman V. П., Welsford E. J. 11 Ann. Bot. 1913.
Vol. 27, N 105. P. 111 — 114.
Blodgett F. H. II Amer. J. Bot. 1923. Vol. 10, N 2.
P. 336—342.
Boehm K. von 11 Planta. 1931. Bd 14, N 2.
S. 411—440.
Bohdanowicz J. // Acta biol. Crac. Ser. bot. 1973.
Vol. 16. P. 235—246.
Bohdanowicz J. // Protoplasma. 1987. Vol. 137,
N 2—3. P. 71—83.
Borwein В., Coetsee M. L., Krupko S. // J. Sth.
Afr. Bot. 1949. Vol. 15. P. 1 — 11.
Bosch E. I/ Ber. Schweiz. bot. Ges. 1947. Bd 57.
S. 37—100.
Bouharmont J. // Cellule. 1963. Vol. 63. P. 259—
279.
Bouin M., Bouin P. // Arch. anat. microsc. 1898.
T. 2, fasc. 4. P. 419—454.
Bouman F. // Naarden (Drukkerij Los). 1974.
P. 76—85.
Boyd L. //Trans. Bot. Soc. Edinburgh. 1930.
Vol. 30. P. 218—229.
Boyd L. II Trans. Proc. Bot. Soc. Edinburgh.
1932—1935. Vol. 31, pt 1. P. 1—224.
Boyer C. D.t Liu Kang-chien // Phytochemistry.
1983. Vol. 22, N 11. P. 2513—2515.
Brandt R. P. //Univ. Calif. Pubis. Bot. 1916.
Vol. 7, N 3. P. 39—68.
Brenchley W. E. // Ann. Bot. 1912. Vol. 26.
P. 903—928.
Brenner W. // Acta Soc. sci. fenn. 1922. T. 50,
N 4. S. 1—37.
Briggs D. E. II Biosynthesis and its control in
plants. Proc. Phytochem. Soc. Symp. Sitting-
bourne, London; New York, 1972. P. 219—
277.
Brighigna K., Cecchi A. Fiordi, Palandri M. R. //
Caryologia. 1980a. Vol. 33, N 2. P. 227—232.
Brighigna K., A. Cecchi Fiordi, Palandri M. R. //
Amer. J. Bot. 1980b. Vol. 67, N 10. P. 1493—
1494.
Brighigna K., Cecchi Fiordi A., Palandri M. R. //
Amer. J. Bot. 1981.'Vol. 68, N8. P. 1033—1041.
Brock R. D. И Heredity. 1955. Vol. 9, N2. P. 199—
222.
Brown С M. II Crop Sci. 1964. Vol. 4. P. 475—
477.
Brown R. //Trans. Linn. Soc. 1833. Vol. 16.
P. 683—746.
Brown W. H. //Bot. Gaz. 1909. Vol. 48, N 4.
P. 241—250.
Brown W. H., Sharp L. W.//Bol Gaz. 1911.
Vol. 52, N 6. P. 439—452.
Brown W. V. II Madrono. 1949. Vol. 10. P. 97—
107.
Brown W. V. //Amer. J. Bot. 1951. Vol. 38,
N 9. P. 697—702.
Brown W. V. И Phytomorphology. 1960. Vol. 10,
N 3. P 215 223
Brown W. V. И Phytomorphology. 1965. Vol. 15,
N 3. P. 274—284.
Browne E. T. II Amer. J. Bot. 1961. Vol. 48, N 2.
P. 143—147.
Brunaud A. 11 C. r. Acad. sci. D. 1974. T. 278,
N 16.
Bruns E. II Flora. 1892. Bd 76. S. 1—33.
Buchet S., Gatin C. L. 11 Bull. Soc. bot. France.
1908. T. 55. P. 164—169.
Buchner L. //Osterr. bot. Ztschr. 1948. Bd 95,
H. 4. S. 428—450.
Buell M. F. II Bot. Gaz. 1935. Vol. 96, P. 758—
765.
Buell M. F. И Bot. Gaz. 1938. Vol. 99, N 3.
P. 556—568.
Burr H. G. И Ohio Natur. 1903. Vol. 3. P. 439—
443.
Buttrose M. S. //Austral. J. Biol. Sci. 1963a.
Vol. 16, N 2. P. 305—317.
299
Buttrose M. S. //Austral. J. Biol. Sci. 1963b.
Vol. 16, N 4. P. 768—774.
Caldwell 0. W. // Bot. Gaz. 1899. Vol. 27, N 1.
P. 37—66.
Campbell D. H. // Proc. Calif. Acad. Sci. 1897.
Bot. Vol. 1, N 3. P. 1—71.
Campbell D. H. // Ann. Bot. 1898. Vol. 12. P. 1 —
28.
Campbell D. H. // Proc. Calif. Acad. Sci. 1899a.
Vol. 1, N 9. P. 293—328.
Campbell D. H. // Bot. Gaz. 1899b. Vol. 27, N 3.
P. 153—166.
Campbell D. H. // Ann. Bot. 1900. Vol. 14.
P. 1—25.
Campbell D. H. // Ann. Bot. 1903. Vol. 17.
P. 665—687.
Campbell D. H. // Ann. Bot. 1905. Vol. 19.
p 329 349.
Campbell D. H. // Ann. Bot. 1908. Vol. 22.
P. 330.
Campbell D. H. // Bull. Torrey Bot. Club. 1909.
Vol. 36. P. 205—220.
Campbell D. H. // Bull. Torrey Bot. Club. 1910.
Vol 37 P 293 295
CampbellD. H. // Ann. Bot. 1911. Vol. 25. P. 773—
789.
Campbell D. H. // Scot. Bot. Rev. 1912. Vol. 1.
P. 100—115.
Campbell E. O. // Trans. Roy. Soc. N. Z. Bot.
1968. Vol. 3 (14). P. 209—219.
Campbell W. P., Lee J. W. et al. // Austral.
J. Plaflt Physiol. 1981. Vol. 8, N 1. P. 5—21.
Cannon W. A. II Proc. Calif. Acad. Sci. 1900.
Vol. 1, N 3. P. 329—356.
Canto F. Т., Bandel G. A., Sandra M. 11 Solo.
1974! T. 66, N 2. P. 17—22.
Capoor S. P. И Beih. bot. Zentr.-Bl. 1937a.
Bd 56A. S. 156—170.
Cappelletti C. // N. G. bot. Ital. 1927. Vol. 34.
P. 409—490.
Cappelletti C. // Ann. Bot. (Roma). 1931. Vol. 19.
P. 1—62.
Carlbom С//Hereditas. 1969. Vol. 61, N 3.
P. 421—423.
Carman J. G. // Crop Sci. 1982. Vol. 22, N 6.
p 1252 1256
Carniel K. 11 Osterr. bot. Ztschr. 1960. Bd 107,
H. 2. S. 241 244.
Carniel K. // Osterr. bot. Ztschr. 1961. Bd 108,
N 1. S. 89—96.
Carniel K. // Osterr. bot. Ztschr. 1962a. Bd 109,
H. 1/2. S. 81—95.
Carniel К // Osterr. bot. Ztschr. 1962b. Bd 109,
H. 1/2. S. 168—173.
Carniel /(.//Osterr. bot. Ztschr. 1971. Bd 119,
N 4—5. S. 496—502.
Carniel /(.//Osterr. bot. Ztschr. 1972. Bd 120,
N 3. S. 223—234.
Cave M. S. 11 Phytomorphology. 1975. Vol. 25,
N 1. P. 95—99.
Cartier D., Lenoir A. 11 Rev. gen. bot. 1980.
Vol. 87, N 1037—1039. P. 289—295.
Cass D. D. II Can. J. Bot. 1973. Vol. 51, N 3.
P. 601—605.
Cass D. D. II Acta Soc. bot. pol. 1981. Vol. 50,
N 1/2. P. 177—180.
Cass D. D., Fabi C. // Can. J. Bot. 1988. Vol. 66,
N 5. P. 819—825.
Cass D. D., Jensen W. A. 11 Amer. J. Bot. 1970.
Vol. 57, N 1. P. 62—70.
Cass D. D., Peteya D. /., Robertson B. L. //
Can. J. Bot. 1985. Vol. 63, N 12. P. 2164—2172.
Cassini A. H. // J. physiol. (France). 1828. T. 91.
P. 321—420.
Catalano G. 11 Bull. Soc. sci. natur. Econ.
Palermo. 1928. Vol. 10. P. 31—40.
Catalano G. // N. G. bot. Ital. 1929a. Vol. 36.
P. 317—324.
Catalano G. // G. Sci. Nat. Econ. Palermo. 1929b.
Vol. 35. P. 137—175.
Catalano G. 11 Lav. R. Inst. Bot. Palermo. 1930.
Vol. 1. P. 1—60.
Catalano G. 11 Lav. R. Inst. Bot. Palermo. 1931.
Vol. 2. P. 22—45.
Cave M. S. // Cytologia. 1939. Vol. 9, N 4.
P. 407—411.
Cave M. S. // Amer. J. Bot. 1941. Vol. 28, N 5.
p 390 394.
Cave M. S. /'/ Madrono. 1942. Vol. 6, N 6.
P. 177—181.
Cave M. S. 11 Amer. J. Bot. 1948. Vol. 35, N 6.
P. 343—349.
Cave M. S. 11 Phytomorphology. 1952. Vol. 2, N 2.
P. 210—214.
Cave M. S. //Chronica Botanica. 1953. Vol. 14.
P. 140—153.
Cave M. S. // Phytomorphology. 1955. Vol. 5,
N 2—3. P. 247—253.
Cave M. S. // Guayana Bot. 1966. N 15. P. 25—
31.
Cave M. S. // Phytomorphology. 1967. Vol. 17,
N 1—4. P. 233—239.
Cave M. S. // Phytomorphology. 1974. Vol. 24,
N 1—2. P. 56—60.
Cave M. S. 11 Phytomorphology. 1975. Vol. 25,
N 1. P. 95—99.
CebratJ. II Hadowla Rosl. Aklim. Nasienn. 1979.
Vol. 23, N 5. P. 293—310.
Cebrat J. II Zesz. nauk. AR Wroclaw Rozpr.
1983. N 30. P. 53.
Celakovsky L. // Bot. Ztschr. 1897. Bd 55.
S. 141 — 174.
Celarier R. P., Harlan J. R. // Phytomorphology.
1957. Vol. 7, N 2. P. 93—102.
Chamberlain C. /.//Bot. Gaz. 1897. Vol. 23,
N 6. P. 423—430.
Chamberlain C. /. // Bot. Gaz. 1898. Vol. 25.
P. 124—128.
Chamberlain C. /. // Bot. Gaz. 1914. Vol. 57.
P. 443.
Chanda S. // Grana Palynol. 1966. Vol. 6, N 3.
P. 355—415.
Chanda S., Rowley J. 11 Grana Palynol. 1967.
Vol. 7, N 1. P. 16—36.
Chandler С // Bull. Torrey bot. Club. 1940.
Vol. 67, N 7. P. 649—672.
Chandler C, Porterfield W. M., Stout A. B. 11
Cytologia. 1937. Fujii Jub. P. 1025—1035.
Chandra N. // Curr. Sci. (India). 1963a. Vol. 32.
P. 277—279.
Chandra N. // Proc. Indian Acad. Sci. 1963b.
Vol. 58, N 3. P. 117—127.
Chandra S. // Agra Univ. J. Res.-Sci. 1962.
Vol. 11. P. 91—92.
Chandra S.} Bhatnagar S. P. //
Phytomorphology. 1974. Vol. 24, P. 211—217.
Chandra S. K. N., DeMason D. A. // Amer. J.
Bot. 1988. Vol. 75, N 3. P. 323—329.
Chatterji A. /(., Timothey D. H. // Crop Sci.
1969a. Vol. 9, N 2. P. 219—222.
Chatterji A. K., Timothy D. H. // Crop Sci. 1969b.
Vol. 9, N 6. P. 796—799.
Cheah С H., Stone В. С 11 Bot. Jb. Syst. 1973.
Bd 93. S. 498—529.
Cheah С. П., Stone В. С. // Phytomorphology.
1975. Vol. 25, N 2. P. 228—238.
Chen S.t Veda R. 11 Bot. Mag. Tokyo. 1977.
Vol. 90. P. 277—290.
300
Cheng Z.} Shiyi H., Liyun X., Xinzu L., Jiacheng 11
Sci. sinica. 1980. Vol. 23, N 4. P. 371—379.
Chennaveeraiah M. S., Mahabale T. S. // Plant
embryology. New Delhi. 1962. P. 12—22.
Chen-Zhu X. Z., Chen Y. Т., Gao X. Z. // Acta
bot. sinica. 1984. Vol. 26. P. 235—240.
Chiappini M. 11 N. G. bot. Ital. 1955. Vol. 62,
N 3—4. P. 437—447.
Chiappini M. // N. G. bot. Ital. 1962. Vol. 69,
N 1—3. P. 91—92.
Chikkannaiah P. S. 11 J. Karnatak Univ. Sci.
1961. Vol. 6, N 1., P. 57—60.
Chikkannaiah P. S. // Plant embryology. New
Delhi, 1962. P. 23—35.
Chikkannaiah P. S. // Phytomorphology. 1963.
Vol. 13, N 2. P. 174—184.
Chikkannaiah P. S. //J. Indian Bot. Soc. 1964.
Vol. 43, N 2. P. 238—248.
Chikkannaiah P. S. // J. Karnatak Univ. Sci.
1965. Vol. 9, N 1. P. 2—16, 3—15.
Chikkannaiah P. S. // Proc. Indian Acad. Sci.
B. 1971. Vol. 73, N 2. P. 96—104.
Chikkannaiah P. S. // Proc. Indian Acad. Sci.
B. 1973. Vol. 77, N 4. P. 166—175.
Chikkannaiah P. S. // Curr. Sci. (India). 1979.
Vol. 48, N 8. P. 363.
Choda S. P., Bhanwra R. K. // Proc. Indian Nat.
Sci. Acad. 1977. Vol. 43, N 5. P. 175—183.
Choda S. P., Bhanwra R. K. // Proc. Indian Nat.
Sci. Acad. 1980. Vol. 46, N 4. P. 572—578.
Choda S. P., Mitter Harsch, Bhanwra R. K. //
Proc. Indian Acad. Sci. Plant Sci. 1982. Vol. 91,
N 1. P. 55—60.
Christensen J. E., Homer H. T. // Amer. J. Bot.
1974. Vol. 61, N 6. P. 604—623.
Chuan Ying Chao//Bot. notis. 1974. Vol. 127,
N 2. P. 267—275.
Chuan Ying Chao //Bot. notis. 1980. Vol. 133,
N 2. P. 215 222.
Church M. B. //Bull. Torrey Bot. Club. 1916.
Vol. 43. P. 397—405.
Claussen P. // Bot. Arch. 1927. Bd 18, N 1. S. 1 —
27.
Coc G. E. //Amer. J. Bot. 1953. Vol. 40, N 5.
P. 335—343.
Cock J. H., Yoshida S. // Proc. Crop Sci. Soc. Jap.
1972. Vol. 41, N 2. P. 226—234.
CocucciA. E. I/ Phytomorphology. 1964. Vol. 14,
N 4. P. 588—597.
Cocucci A. E. I/ Kurtziana. 1968. T. 5. P. 7—21.
Cocucci A. E., Jensen W. A. // Kurtziana. 1969a.
T 5 P 23 28
Cocucci A., Jensen W. A. // Planta. 1969b. Vol. 64.
P. 215—229.
Cocucci A., Jensen W. A. // Amer. J. Bot. 1969c.
Vol. 56, N 6. P. 629—640.
Cocucci A. E., Jensen W. A. // Kurtziana. 1971.
Vol. 6. P. 25—39.
Сое А. С //Bot. Gaz. 1954. Vol. 115. P. 342—
346.
Coker W. С. И Bot. Gaz. 1907. Vol. 44.
p 293 301
Colhoun C. W., Steer M. W. // Ann. Bot. 1981.
Vol. 48, N 4. P. 417—424.
Conran J. G. II Nord. J. Bot. 1988. Vol. 8, N 1.
P. 13—17.
Cook M. T. II Ohio Nat. 1907. Vol. 7. P. 97—101.
Cook M. T. //Bull. Torrey Bot. Club. 1908.
Vol. 35. P. 209—218.
Cooper D. С II Proc. Nat. Acad. Sci.
(Washington). 1934. Vol. 20, N 2. P. 358—364.
Cooper D. С//Bot. Gaz. 1935. Vol. 97, N 1.
P. 346—355.
Cooper D. С //Bot. Gaz. 1936. Vol. 98, N 1.
P. 169—171.
Cooper D. С. И Bot. Gaz. 1939. Vol. 100, N 4.
P. 862—867.
Costas-Lippman M. 11 Bot. Gaz. 1979. Vol. 140,
N 4. P. 393—397.
Coulter J. M. II Bot. Gaz. 1897. Vol. 23, N 6.
P. 412—422.
La Cour L. F., Wells B. // Chromosoma. 1970.
Vol. 29, N'4. P. 419—427.
Crane Ch. F. 11 Ph. D. Univ. of Texas at Austine.
1978. Vol. 39, N 4. P. 1605—1608.
Crane Ch. F., Carman J. Y. 11 Amer. J. Bot. 1987.
Vol. 74, N 4. P. 477—496.
Creech R. G. 11 Adv. Agron. 1968. Vol. 20.
P. 275—322.
Crete P. /I С. г. Acad. sci. (Paris). 1952. T. 235,
N 4. P. 313—316.
Crombie W. M. 11 J. Exp. Bot. 1956. Vol. 7, N 20.
P. 181 — 193.
Cruz R., Reddy P. S. // Sci. and Cult. 1968.
Vol. 34, N 6. P. 255—257.
Cutter V. M.} Freeman B. // Nature. 1954.
Vol. 173, N 4409. P. 827—828.
Cutter V. M., Wilson K- S., Freeman B. 11
Amer. J. Bot. 1955. Vol. 42, N'2. P. 109—115.
Czapik R. //Acta biol. crac. Ser. bot. 1972.
Vol. 15, N 2. P. 165—176.
Czapik R. //Ann. Bot. 1988. N 23. P. 138—139.
Dahlgren K. V. O. // Sv. bot. tidskr. 1928. Bd 22,
H. 1. S. 1 — 17.
Dahlgren K. V. O. 11 Planta. 1933—1934. Bd 21,
H. 4. S. 602—612.
Dahlgren K. V. O. //Bot. notis. 1939. P. 607—
615.
Dahlgren R., An-ming Lu 11 Nord. J. Bot. 1985.
Vol. 5, N 4. P. 321—330.
D'Amato F. // Caryologia. 1949. Vol. 2, N 1.
p. 60—70.
Dark S. O. S. I/ New Phytol. 1932. Vol. 31, N 5.
P. 310—320.
Dathrie A. V. 11 Trans. Roy. Soc. Sth. Afr. 1915.
Vol. 5. P. 593—598.
De Boer-De-Jen M. J. // Bull. Soc. bot. France.
1978. T. 125, N 1—2. P. 176—182.
Delay J. II J. Microsc. (France). 1972. Vol. 14,
N 2. P. 34—35.
De Mason D. A. 11 Protoplasma. 1985. Vol. 126,
N 3. P. 168—177.
De Mason D. A., Sexton R., Reid /. S. G. //
Ann. Bot. 1983. Vol. 52, N 1. P. 71—80.
De Mason D. A., Stillman J. I. 11 Planta. 1986.
Vol. 163, N 3. P. 321—329.
De Mason D. A., Thomson W. W. //Bot. Gaz.
1981. Vol. 142, N 3. P. 320—328.
Deshpande P. K. //Plant Syst. and Evol. 1976.
Vol. 125, N 4. P. 253—259.
Deshpande P. K., Gomkale /C. D. // J. Indian
Bot. Soc. 1982. Vol. 61. P. 39—46.
Deshpande P. K., Raju P. S. G. 11
Phytomorphology. 1979. Vol. 29, N 2. P. 100—111.
De Sloover J. L. // Pollen et spores. 1961. T. 3.
P. 5—11.
Desole L. // Bull. Inst. bot. Univ. Sassari. 1947.
Vol. 3. P. 1 — 11.
Desole L. И Atti Soc. tosc. sci. natur. 1947. T. 55,
N 1. P. 1—8.
DhaliwalA. S., Sharma H. L. 11 Austral. J. Plant
Physiol. 1986. Vol. 13, N 2. P. 249—255.
Diboll A. J. II Amer. J. Bot. 1968a. Vol. 55, N 7.
P. 787—806.
Diboll A. J. II Caryologia. 1968b. Vol. 21. P. 91 —
95
Diboll A. J., Larson D. A. // Amer. J. Bot. 1966.
Vol. 53, N 4. P. 391—402.
Dickinson H. G. //Grana. 1971. Vol. 11, N 2.
P. 117—127.
301
Dickinson H. G.//J. Cell Sci. 1981. Vol. 52.
P. 223—241.
Dickinson H. G., Andrews L. // Planta. 1977.
Bd 134, H. 1. S. 229—240.
Dickinson D. В., Boyer С D., Velu J. G. // Phyto-
chemistry. 1983. Vol. 22, N 6. P. 1371 — 1373.
Dickinson H. G.} Heslop-Harrison /. // Cytobios.
1970. N 6. P. 103—118.
Dickinson H. G., Heslop-Harrison J. / / Phil.
Trans Roy. Soc. London B. 1977. Vol. 277.
p 327 342.
Dickinson H. G., Potter U. //J. Cell Sci. 1978.
Vol. 29, N 1. P. 147—169.
Dickinson H. G., Willson C. // Ann. Bot. 1983.
Vol. 52, N 6. P. 803—810.
Dietrich K- 11 Flora. 1924. Vol. 17. P. 379—417.
Dietz S. И Bot. Zentr.-Bl. 1886. Jb. 28, N 4.
S. 26—30, 56—60.
Dietz S.//Biblioth. bot. 1887. H. 5. S. 1—55.
Dixon H. H. II Proc. Roy. Irish Acad. С 1895.
Т. 3, N 4. P. 721—725.
Dixon H. H. //Proc. Roy. Soc. Dublin. 1946.
Vol. 24, N 12—17. P. 119—124.
Dnyansagar V. R., Tiwary D. K. // Curr. Sci.
(India). 1956a. Vol. 25, N 1. P. 16.
Dnyansagar V. R., Tiwary D. /C. // Bull. bot. Soc.
Univ. Saugar. 1956b. Vol. 8. P. 3—6.
Dodds K. S. //J. Genet. 1943. Vol. 45, N 2.
p i iо jqo
Dodds K. S. //J. Genet. 1945. Vol. 46, N 2—3.
P. 161 — 179.
Dolezal R., Tschermak-Woess E. //Osterr. bot.
Ztschr. 1955. Bd 102, N 3. S. 158—185.
Donini В., Hussain S. // Radiat. Bot. 1968.
Vol. 8, N 4. P. 289—295.
Drennan D. S. H. // New Phytol. 1962. Vol. 61,
N 3. P. 261—265.
Ducker S. C.} PettittJ. M., Knox B. R. 11 Austral.
J. Bot. 1978. Vol. 26, N 3. P. 265—285.
Dudley M. G.//Bot. Gaz. 1937. Vol. 98,
P. 556—571.
Dumee P. // Bull. Soc. bot. France. 1910. T. 57.
P. 83—87.
Dutt B. S. M. //Curr. Sci. (India). 1957a.
Vol. 26. P. 22—24.
Dutt B. S. M. И Sci. and Cult. 1957b. Vol. 22.
P. 688—690.
Dutt B. S. M. II Curr. Sci. (India). 1958. Vol. 27,
N 12. P. 501—502.
Dutt B. S. M. //Curr. Sci. (India). 1959.
Vol. 28, N 7. P. 293—294.
DuttB. S. M. И Curr. Sci. (India). 1964. Vol. 33,
N 5. P. 150—151.
Dutt B. S. M. II Seminar comparative
embryology of angiosperms. New Delhi, 1967. N 3.
P. 123.
DuttB. S. M. И Curr. Sci. (India). 1969. Vol. 33,
N 5. P. 150—151.
Dutt B. S. M. И Bull. Indian Nat. Sci. Acad.
1970a. N 41. P. 362—377.
DuttB. S. M. И Phytomorphology. 1970b. Vol. 20,
N 1. P. 1—5.
DuttB. S. M. И Curr. Sci. (India). 1975. Vol. 44,
N 3. P. 91—92.
Dutt M. II Nature. 1953. Vol. 171, N 4357.'
P. 799—800.
Dutt M. II Trans. Bose Res. Inst. Culcutta. 1955.
Vol. 19. P. 117—125.
Dyer A. F. II Chromosoma. 1963. Vol. 14, N 6.
P. 549—567.
Eckles M. L. II Bot. Gaz. 1941. Vol. 102, N 4.
P. 806—809.
Edwards T. J. // Amer. Natur. 1934. Vol. 68.
P. 283—286.
Ekanthappa K. G.y Arekal G. D. // Proc. Indian
Acad. Sci. B. 1977a. Vol. 86, N 4. P. 211—216.
Ekanthappa K. G., Arekal G. // Curr. Sci.
(India). 1977b. Vol. 46, N 19. P. 484—686.
Eleuterius L. N. // Bull. Torrey Bot. Club. 1984.
Vol. Ill, N 4. P. 445—450.
El-Ghazaly Gamal, Jensen W. 11 Can. J. Bot.
1986. Vol. 64, N 2. P. 3141—3154.
El-Ghazaly Gamal, Jensen W. A. // Amer. J. Bot.
1987. Vol. 74, N 9. P. 1396—1418.
Elmore C. J. 11 Bot. Gaz. 1898. Vol. 26, N 4.
P. 277—278.
Emery W. П., Guy M. N. // Bull. Torrey Bot.
Club. 1979. Vol. 106, N 1. P. 29—31.
Emsweller S. L., Uhring J. // Amer. J. Bot. 1962.
Vol. 49, N 9. P. 978—984.
Erdelska O.//Biologia (CSSR). 1966. Vol. 21,
N 12. P. 857—864.
Erdelska O. // Biologia plantarum. Praha, 1975.
T. 17, N 4. P. ЗП—31'5.
Erdelska O. // Fert. and embryogenesis in
ovulated plants. Bratislava, 1983. P. 49—54.
Erdelska O., Ryczkowski M. // Biologia (CSSR).
1972. Roc 27, N 4. С 241—248.
Erickson R. O. I/ Amer. J. Bot. 1948. Vol. 35,
N 10. P. 729—739.
Ernst A. II Flora. 1901. Bd 88, N 1. S. 37—77.
Ernst A. H Flora. 1902. Bd 91. S. 1—46.
Ernst А. И Ber. Dtsch. bot. Ges. 1909. Bd 27,
S. 157—168.
Ernst A., Bernard Ch. // Ann. Jard. bot. Buiten-
zorg. 1910. Ser. 2. Vol. 8, N 23. P. 48—61.
Ernst A., Bernard Ch. // Ann. Jard. bot. Buiten-
zorg. 1911. Ser. 2. Vol. 9, N 24. P. 61—69.
Ernst A., Bernard Ch. // Ann. Jard. bot. Buiten-
zorg. 1912a. Ser. 2. Vol. 10, N 25. P. 161 — 188.
Ernst A., Bernard Ch. // Ann. Jard. bot. Buiten-
zorg. 1912b. Ser. 2. Vol. 11, N 26. P. 234—257.
Ernst A., Bernard Ch. 11 Ann. Jard. bot. Buiten-
zorg. 1914. Ser. 2. Vol. 13, N 28. P. 121 — 124.
Ernst-Schwarzenbach M. // Arch. Julius Klaus-
Stift. f. Vererb. 1945a. Bd 20. S. 22—41.
Ernst-Schwarzenbach M. // Ber. Schweiz. bot.
Ges. 1945b. Bd 55, H. 1. S. 33—69.
Ernst-Schwarzenbach M. 11 Phytomorphology.
1956. Vol. 6, N 3. P. 296—311.
Eunus A. M. II J. Indian Bot. Soc. 1950. Vol. 29,
N 1. P. 68—78.
Eunus A. M. II Pakistan J. Sci. Res. 1951. Vol. 3,
N 1. P. 106—113.
Eunus A. M. И Lloydia. 1952. Vol. 15, N 3.
P. 149—155.
Eunus A. M. II New Phytol. 1950. Vol. 49, N 2.
P. 269—273.
Eunus A. M. II Phytomorphology. 1951.
Vol. 1, N 1—2. P. 73—79.
Evers A. D. //Ann. Bot. 1970. Vol. 34, N 136.
P. 547—555.
Eyme /.//Botanist. 1965. T. 48, fasc. 1—6.
P. 99—105.
Eyme /.//Botanist. 1966. T. 49, fasc. 1—6.
P. 109—155.
Fackholm G.t Soderberg E. // Sv. bot. tidskr.
1918. Bd 12, H. 2. S. 189—201.
Fagerlind F. // Ann. Jard. bot. Buitenzorg. 1940.
Vol. 49. P. 55—78.
Fagerlind F. // Sv. bot. tidskr. 1941. Bd 35, H. 3.
S. 258—260.
Farr С. Н. И Bull. Torrey Bot. Club. 1922.
Vol. 49. P. 51—61.
Farrell M. E. // Bot. Gaz. 1914. Vol. 57. P. 428—
436.
Ferguson M. С // Bot. Gaz. 1907. Vol. 43.
P. 418—419.
Ferraris Т./ / Ann. bot. (Roma). 1902. Vol. 9.
P. 221—241.
302
Fineran В. A., Wild D. J. C, Ingerfeld M. //
Can. J. Bot. 1982. Vol. 60, N 9. P. 1776—1795.
Fleischer £.'// Flora. 1874. Bd 57. S. 369—375,
• 384—394,401—411,417—448.
Flint F. F., Johansen D. A. // Amer. J. Bot.
195S. Vol. 45, N 6. P. 464—473.
Flory W. H Genetics. 1932. Vol. 17. P. 432—467.
Focke A. I/ Beitr. Biol. Pflanz. 1980. Bd 54, N 3.
5 353 374
Focke R. //Der Zuchter. 1956. Bd 26, H. 1/2.
' S. 40—41.
Folson D. //Minn. Bot. Stud. 1916. Vol. 4.
' p. 427—435.
FourcroyM. II Bull. Soc. bot. France. 1949. T. 96,
N 1—3. P. 54—56.
Fray L. II Acta biol. crac. Ser. bot. 1966. Vol. 9,
N 2. P. 125—136.
Fries Т. C. E. I/ Sv. bot. tidskr. 1919. Vol. 13,
H. 3—4. S. 195—304.
Fuchs A., Ziegenspech H. 11 Bot. Arch. Mez. 1924.
N 5. S. 457—470.
Fullmer E. L. //Bot. Gaz. 1899. Vol. 28, N 2.
' P. 81—88.
Fulvio P. E. di, Cave M. S. // Phytomorphology.
' 1965. Vol. 14, N 4. P. 487—499.
Furlani J. И Osterr. bot. Ztschr. 1904. Bd 54, N 9,
10. S. 318—324, 373—379.
Ganguly В. И Curr. Sci. (India). 1959. Vol. 28.
P. 82.
Ganguly B. II Sci. and Cult. 1976. Vol. 42, N 5.
P. 270—272.
Gassner G. G. // Beih. bot. Zentr.-Bl. 1941.
Bd 61A, H. 2. S. 237—276.
Gatin C. L. И Rev. gen. bot. 1905a. T. 17. P. 60—
66.
Gatin C. L. И Bull. Soc. bot. France. 1905b. T. 52.
P. 638—640.
Gatin C. L. // Ann. Sci. natur. Bot. 1906. Ser. 9,
T. 3. P. 191—315.
Gatin C. L. И Ann. Sci. natur. Bot. 1908. T. 8.
P. L13—146.
Gatin C. L. H Ann. Sci. natur. Bot. 1909. Ser. 9,
T. 8. P. 117—146.
Gatin C. L.//C. r. Acad. sci. (Paris). 1912.
T. 154. P. 35—37.
Geitler L.//Ber. Dtsch. bot. Ges. 1941. Bd 59,
H. 9. S. 419—423.
Geitler L. // Osterr. bot. Ztschr. 1956. Bd 103.
S. 312—335.
Gentinetta E., Zambello M.t Salamini F. //
Cereal Chemistry. 1979. Vol. 56, N 2. P. 81 —
83.
Ghadimi R. // Ztschr. Acker- u. Pflanzenbau.
1974. Bd 139, N 2. S. 111 — 122.
Ghosh S., Shivanna K. R. // Phytomorphology.
1982. Vol. 32, N 4. P. 385—395.
Gilliland H. B. // Proc. Cent, and Bicent. Congr.
Biol. Singapore, 1958. P. 277—279.
Gimenez-Martin G., Risueno M. C, Lopez-
Saez J. F. 11 Protoplasma. 1969. Vol. 67, N 2—
3. P. 223—235.
Gioelli F. // Lavori del R. Inst. Bot. Palermo.
1930. Vol. 1. P. 61—84.
Gioelli F. // Lavori del R. Inst. Bot. Palermo.
1933. Vol. 4. P. 17.
Giraldez R. // Genetica iberica. 1977. Vol. 29,
fasc. 1—2. P. 35—39.
Gobbe J., Longly В., Louant B. P. 11 Can. J. Bot.
1982. Vol. 60, N 10. P. 2032—2071.
Goebel K. II Flora, oder allgemeine botanische
Zeitung. 1921. Bd 114, H. 2. S. 278—305.
Goebel K-, Suessenguth K. // Flora. 1924. Bd 117,
H. 1. S. 55—90.
Golaszewska Z.//Acta Soc. bot. pol. 1934a
Vol. 11, N 3. P. 399—407.
Golaszewska Z. /'/ Acta Soc. bot. pol. 1934b.
Vol. 11, N 1. P. 85—102.
Gohil R. N., Ranjana K. // Caryologia. 1980.
Vol. 33, N 2. P. 295—297.
Goldberg B. II Bot. Gaz. 1941. Vol. 102.
P. 641—662.
Gorham A. // Phytomorphology. 1953. Vol. 3,
N 1. P. 44—50.
Gori P. S. И Phytomorphology. 1982. Vol. 32,
N 2—3. P. 277—284.
Gori P. И J. Ultrastruct. Res. 1982. Vol. 81, N 2.
P. 158—162.
Gorska-Brylass A. // Acta Soc. bot. pol. 1967.
Vol. 36, N 2. P. 419—422.
Govindappa B. // J. Indian Bot. Soc. 1955.
Vol. 34, N 2. P. 146—150.
Govindappa D. A., Sheriff A. // J. Mysore Univ.
B. 1951. Vol. 12, N 1. P. 15—21.
Govindappa D. A. // Curr. Sci. (India). 1953.
Vol. 22, N 12. P. 386.
Govindappa D. A. // Proc. Indian Acad. Sci.
B. 1955. Vol. 42, N 2. P. 47—57.
Govindappa D. A. // Curr. Sci. (India). 1956.
Vol. 25, N 6. P. 198—199.
Govindappa D. A. et al. // Curr. Sci. (India).
1980. Vol. 49, N 23. P. 914—915.
Govindappa D. A., Naidu T. R. // J. Indian Bot.
Soc. 1956. Vol. 35, N 4. P. 417—422.
Gow J. E. И Bot. Gaz. 1907. Vol. 43. P. 131 — 136.
Gow J. E. И Bot. Gaz. 1908a. Vol. 45. P. 38—44.
Gow J. E. И Bot. Gaz. 1908b. Vol. 46. P. 35—42.
Gow /. E. И Bot. Gaz. 1913. Vol. 56. P. 217—142.
Graef P. E. //Amer. J. Bot. 1955. Vol. 42, N 9.
P. 806—809.
Graves A. H. // Trans. Conn. Acad. Arts and Sci.
1908. Vol. 14. P. 59—170.
Gray A. II Gray A. Botanical memoirs. Boston,
Cambridge, 1859. P. 453—457.
Green /. W. // Proc. Linn. Soc. N. S. W. 1960.
Vol. 85, part 3. P. 334—374.
Gregory P. J. //J. Linn. Soc. Bot. London, 1936.
Vol. 50, N 334. P. 363—391.
Gronland J. И Bot. Zeit. 1851. Bd 9. S. 185—192.
Grootsen C. S., Bouman F. // Acta bot. neer.
1981. Vol. 30, N 4. P. 265—275.
Grootjen C. J. //Austral. J. Bot. 1983a. Vol. 31.
p 297 305
Grootjen C. /."//Acta bot. neer. 1983b. Vol. 32,
N 1/2. P. 69—86.
Grootjen С J., Bouman F. // Bot. J. Linn. Soc.
1981. Vol. 83, N 1. P.'27—39.
Grove Л. R. И Bot. Gaz. 1941. Vol. 103. P. 354—
365.
Guedes M. M. 11 C. r. Acad. sci. D. 1973. T. 276,
N 6. P. 953—956.
Guerin H.-P. I/ Ann. sci. natur. Bot. 1949.
Ser. 2. T. 10, fasc. 1. P. 21—69.
Guerin P. //Bull. Soc. bot. France. 1927. T. 74.
P. 102—107.
Guerin P. I/C. r. Acad. sci. 1930. T. 191.
P. 1369—1372.
Guerin P. И Botaniste. 1931. Vol. 23. P. 185—
195
Guerin P. //Ann. sci. natur. Bot. 1937. Ser. 10.
T 19 P 255 265.
Guevara V. F. // Philipp. Agr. 1961. Vol. 44,
N 10. P. 520—522.
Guignard J.-L. // С. г. Acad. sci. 1961a. T. 252,
N 14. P. 2125—2127.
Guignard J.-L. // С. г. Acad. sci. 1961b. T. 253,
N 17. P. 1834—1836.
Guignard J.-L. // Ann. sci. natur. Bot. 1961c.
T. 2. P. 491—610.
Guignard J.-L. // Bull. Soc. bot. France. 1961d.
T. 108. P. 212—217.
303
Gulgnard J.-L. // С. г. Acad. sci. 1962. Т. 255,
N 17. P. 2161—2163.
Guignard J.-L. // Bull. Soc. bot. France. 1963.
T. 110. P. 193—194.
Guignard J.-L. // С r. Acad. sci. 1963a. T. 256,
N 14. P. 3172—3175.
Guignard J.-L. // C. r. Acad. sci. 1963b. T. 257.
P. 1139—1142.
Guignard J.-L. // Bull. Mus. nat. hist, natur.
1984. Ser. В. Т. 6, N 1. P. 19—27.
Guignard J.-L., Mestre J.-Ch. // С. г. Acad. sci.
D. 1969. T. 268, N 25. P. 3068—3070.
Guignard J.-L., Mestre J. С // Bull. Soc. bot.
France. 1969. T. 116. P. 207—214.
Guignard J.-L., Mestre J. C. // Phytomorphology.
1971. Vol. 20, N 2. P. 190—197.
Guignard L. // Ann. sci. natur. Bot. 1884.
Ser. 6. T. 17. P. 5—59.
Guignard L. // Ann. sci. natur. Bot. 1886. Ser. 7.
T. 4. P. 202—240.
Guignard L. // Bull. Soc. bot. France. 1889.
T. 36. P. 100—146.
Guignard L.//C. r. Acad. sci. 1899. N 128.
P. 202—207.
Guignard L. // Ann. sci. natur. Bot. 1900. Ser. 8.
T. 11. P. 365—387.
Guignard L.//J. Bot. (Paris). 1901a. Vol. 15,
N 2. P. 37—50.
Guignard L. // J. Bot. (Paris). 1901b. Vol. 15.
P. 205—213.
Guignard L.//C. r. Acad. sci. 1915a. T. 160.
P. 428—433.
Guignard L. // С. г. Acad. sci. 1915b. T. 161.
P. 623—625.
Gupta B. L. И J. Indian Bot. Soc. 1934. Vol. 13.
P. 51—65.
Gupta B. L. //Curr. Sci. (India). 1935. Vol. 4.
P. 104.
Gupta M. N. II Agra Univ. J. Res.-Sci. 1962.
Vol. 11, part 1. P. 59—67.
Gupta D. N., Lodha M. L., Mehta S. L. //
Indian J. Exp. Biol. 1977. Vol. 15, N 2. P. 91 —
93.
Gurudeva M. R.//Curr. Sci. (India). 1985.
Vol. 54, N 19. P. 1009—1010.
Gustafsson A. // Lunds univ. arsskr. 1946.
Vol. 42. P. 1—66.
Guttenberg H. von. // Flora. 1916. Bd 149. H. 2.
S. 243—281.
Guttenberg H. von, Heydel H., Pankow H. //
Flora. 1954a. Bd 141. S. 298—311.
GuttenbergH. von, HeydelH., Pankow H. // Flora.
1954b. Bd 141, H. 3. S. 476—500.
Guttenberg H. von, Jakuszeit C. // Bot. Stud.
1957. Bd 7, H. 1. S. 91 — 126.
Guttenberg H. von, Riebe J. // Bot. Stud. 1957.
H. 7. S. 142—157.
Guttenberg H. von, Semlow A. // Bot. Stud. 1957.
H. 7. S. 127—141.
Guzowska I. II Przy Komis Biol. Prace. B. 1960.
Vol. 22. P. 25—35.
Haberlandt G. // S. B. Preuss. Akad. wiss.
Berlin. 1922. Bd 25. S. 386—406.
Haberlandt G. // S. B. Preuss. Akad. wiss.
Berlin. 1923a. Bd 25. S. 293—294.
Haberlandt G. // Ber. Dtsch. bot. Ges. 1923b.
Bd 41, H. 2—3. S. 174—179.
Haberlandt G. // Ber. Dtsch. bot. Ges. 1925.
Bd 43, H. 10. S. 559—564.
Habermann A. // Beih. bot. Zentr.-Bl. 1906.
Bd 20. S. 300—317.
Haccius В. И Planta. 1952. Vol. 40, N 6. P. 443—
460.
Haccius В., Hausner G. // Beitr. Biol. Pflanz.
1972. Bd 48, N 2. S. 207—228.
Haccius В., Lakshmann K. K. // Beitr. Biol.
Pflanz. 1966. Bd 42, H. 3. S. 425—443.
Haeckel I. //Flora. 1930. Bd 125. S. 1—82.
Hagerup O. // Dan. bot. Ark. 1944. Bd 11, N 5.
P. 1—26..
Hagerup O. // Det. K- G. L. Danske vid. selskab.
biol. middel. 1945. Bd 19, N 11. P. 1 — 13.
Hagerup O. // Det. K- G. L. Danske vid.
selskab. biol. middel. 1947. Bd 20, N 9. P. 1—22.
Hakansson A. // Hereditas. 1943. Vol. 29. P. 25—
61.
Hakansson A. // Bot. notis. 1944. H. 1—4.
p 299 311.
Hakansson A. //Hereditas. 1948. Vol. 34, H. 3.
P. 233—247.
Hakansson A. // Bot. notis. 1951. H. 2. S. 143—
179.
Hakansson A. // Bot. notis. 1953. H. 1. S. 129—
J 39.
Hakansson A., Levan A. // Hereditas. 1957.
Bd 43, N 2. S. 179—200.
Hall J. G. И Bot. Gaz. 1902. Vol. 33. P. 214—
219.
Hamann U. // Ber. Dtsch. bot. Ges. 1962a. Bd 75,
H. 5. S. 153—171.
Hamann U.//Jb. wiss. Bot. 1962b.' Bd 81.
S. 397—404.
Hamann U. 11 Ber. Dtsch. bot. Ges. 1963.
Bd 76, H. 6. S. 203—208.
Hamann U. // Bot. Jb. Syst. 1975. Bd 96, N 1—4.
§ 154 i9i
Hamann U. /j N. Z. J. Bot. 1976. Vol. 14, N 2.
P. 193—196.
Hamann U., Kaplan K., Rubsamen T. // Bot.
Jb. Syst. 1979. Bd 100, N 4. S. 555—563.
Hance R. T. // Bull. Torrey Bot. Club. 1915.
Vol. 42, N 1. P. 63—70.
Hanna W. W., Schertz K. F., Bashaw E. С //
Science. 1970. Vol. 170, N 3955. P. 338—
339
Hansiein J. // Bot. Abhandl. 1870. Bd 1. S. 1 —
112.
Hanten H. В., Ahlgren G. E., Carlson J. B. //
Can. J. Bot. 1980. Vol. 58, N 21. P. 2269—2273.
Haque A. // Bot. Gaz. 1951. Vol. 112, N 4.
P. 495—500.
Harcharan S. D., Johnson B. L. // Amer. J. Bot.
1976. Vol. 63, N 3. P. 363—369.
Hari Gopal В., Mohan Ram H. Y. // Plant Syst.
and Evol. 1985. Vol. 148, N 3—4. P. 239—
246.
Hading G. И Sv. bot. tidskr. 1946. Bd 40, N 3.
S. 257—272.
Hading G. I/ Sv. bot. tidskr. 1949. Bd 43, N 2—3.
S. 357—364.
Hading G. // Acta horti berg. 1958. Bd 18, N 1.
S. 482.
Hasitschka-J enschke G. // Osterr. bot. Ztschr.
1957. Bd 104, H. 1/2. S. 1—24.
Hasitschka-J enschke G. // Osterr. bot. Ztschr.
1958. Bd 105, H. 1/3. S. 71—82.
Hasitschka-J enschke G. / / Osterr. bot. Ztschr.
1959. Bd 106. S. 301—314.
Heatley M. // Bot. Gaz. 1916. Vol. 61, 'N 5.
P. 425—424
Hegelmaier F. Die Lemnaceen, eine mono-
graphische Untersuchung. Leipzig, 1868.
Hegelmaier F. // Bot. Ztg. 1871. Bd 29, N 38—39.
S. 621—666.
Hegelmaier F. // Bot. Z'g. 187-. В 32. N 39—44.
S. 631—639, 648—671 673—6^, 6 8—700,
705—719.
Hegelmaier F. // Bot. Ztg. 1897. Bd 55. S. 133—
140.
Hegnauer R. // Chemotaxonomie der Pflanzen.
304
1\
•3! I
Ruppiaceae
1—4 — Ruppia brachypus
Развитие пыльника с периплазмодиальным тапетумом: / — гнезда пыльника на стадии микро-
спороцитов, 2 — стадия диад, 3 — стадия тетрад микроспор, 4 — фрагмент пыльника с
микроспорами. (1—4 — рис. О. П. Камелиной).
721 Зак. 2144
■.•("* * *i'ff
<Ч
яя^Л**.
''%Л
'« л. ■-,»
Г
* 7? Л"
&к
~ffl4 •
«ч^
•л
пл
•4.. Ч?'
.•*fc.'~»'.«ae*'jri8
I
1
~ч#-.
ИЛ
!З.К
&я
ч*г.к'
*Vi
iV.
X
г«
■■-л ??'
9ЙМ
„jT
А чГ
•«С
.".■* 'i*""
«Г Л
(V
/7Л
Najadaceae
50L
1—5а — Najas тагьщ
1 — 2-клеточное пыльцевое зерно, генеративная клетка шаровидной формы, Х5200; 2 — веретено-
видная генеративная клетка, Х5200; 3— фрагмент генеративной клетки с пластидой и
вегетативное ядро, Х5200; 4 — фрагмент ядра сп^рмия с ядрышком и вегетативного ядра, X 11 300; 5 —
участок цитоплазмы генеративной клетки с пластидами, X12 500, 5а— одна из пластид (левая),
X 19 500. (е. я — вегетативное ядро, г. щ—генеративная клетка, пл— пластида, сп— спермий).
(1—5а — рис. С. С. Татинцевой).
I
*Щ0 $
i
i
4,
< ь. з
%
■-it Yl
< *
r
s
'40*-- К
Amaryllidaceae
1—6, 10, 11— Zephyranthes macrosiphon, 7—9 — Argyropsis Candida
1,2 — спермин в яйцеклетке; 3 — профаза деления ядра яйцеклетки и интерфаза ядра спермия;
4 — 2-клеточный зародыш и телофаза деления ядра спермия; 5,6 — 2-клеточный зародыш, профаза
деления крупных ядер материнского происхождения и 2 мелких ядер, производных ядра спермия;
7 — 4-клеточный зародыш; 8 — зрелое семя с зародышем; 9 — зрелый зародыш; 10 — халазальная
клетка гелобиального эндосперма; 11 — начало дегенерации халазальнои клетки гелобиального
эндосперма. (1—// — ориг.).
Iridaceae
1—7 — Iris pseudacorus
1 — семяпочка со зрелым зародышевым мешком; 2 — зигота; 3,4 — ранние стадии развития
зародыша; 5 — общий вид созревающего зародыша, окруженного эндоспермом; 6 - почечка и 7—
зародышевый корень зрелого зародыша. (1—7 — Соколовская, ориг.).
Haemodoraceae
1—6 — Anigozanthus flavidus
1 — тетрада мегаспор, из халазальной мегаспоры образовался 2-ядерный зародышевый мешок;
2 — 2-ядерный зародышевый мешок; 3,4 — срез через семяпочку;
7.1*
/•
с
I
I "*
т.
rfH
* *
9 «Ж
• 5й
У;-
4
^
1 J '
1 I ■#
^ ~' *"
'lew ***
Haemodoraceae (продолжение)
5а — зрелый зародышевый мешок, 56 — яйцеклетка и одна из синергид, 5в — антиподы; 6 — срез
через халазальную часть семени, 4 крупные клетки, образовавшиеся из халазальной клетки
эндосперма. (/—6 — ориг.).
*t
ч
1*
%»~>~^
* ! ^ч
л • ■"**
', *у
*■ *'7 -. -• <
Trilliaceae
1—10 — Trillium camschatcense
1,2 — деление ядер синергид, стадия метафазы (/ — гаплоидная, п=5, 2 — диплоидная, 2п=10);
3,4 — зигота и 2-клеточные синергидные зародыши; 5 — фрагмент зрелого семени с зародышем и
окружающим его эндоспермом;
3r
%0
Л
/V,
ш
в
ш- с-
17
Д4
■м
х> ... :^. ^fe. «._ ______ А-
Trilliaceae (продолжение)
6—8 — фрагменты микропилярной (6) зоны 2 -4-ядериого зародышевого мешка (ядра в делении):
7 — латеральной зоны и 8 — халазальнои зоны этого же зародышевого мешка;
OP
■Э'
пл
ц.к
пл
10
Trilliaceae (продолжение)
9, 10 — фрагменты клеток яйцевого аппарата сформированного зародышевого мешка: 9 —
синергида на границе с центральной клеткой, 10 — яйцеклетка на границе с центральной клеткой.
(а. э. р — агранулярный эндоплазматический ретикулум, д — диктиосома, к. с — клеточная стенка,
л — липидное тело, м — митохондрия, и — нуцеллус, п — пластида, пл — плазмалемма, пр — пери-
плазматическое пространство, заполненное пузырьками, с — синергида, хр — фрагмент хромосомы,
ц. в - центральная вакуоль центральной клетки (ц. к) зародышевого мешка, я — ядро, яц —
яйцеклетка). (1—10 — Наумова, ориг.).
II Заказ 2144
г
А !
Л !
* ё
г •
м
f
■ 1
Dioscoreaceae
- Dioscorea caucasica
1—4 — отдельные последовательные стадии развития зародыша. (/—4 — ориг.).
ф
"СО
tl»
r*\
«»
''Hi/.
Роасеае
1—3, 19—33 — Triticum, 4—9 — Aegilops squarrosa, 10—13 — Zea mays, 14—18 — Hordeum vul
gare.
1,2 — фрагменты клеток тапетума на стадии микроспоры (/)
ЯГ
t
rM
.§£
&?p
Ш'
КЗ
- Л
£P
►
-w чК9 л J * ___ _.. *j2j
Роасеае (продолжение)
и микроспоры в районе поры (X 7000) (2);
6
jf*^- .i- % ry
1 4
ct
W.
/
s
«8j
/
■n>
Hi"
i/4
k
■ *$щ,&
£
■\-ft
vn
Poaceae (продолжение)
П
m
Ш
3—8— пыльцевое зерно с лежащей у оболочки генеративной клеткой (X 2700) (3), генеративная
клетка после отделения ее от оболочки пыльцевого зерна (X 7000) (4), поперечный срез одного из
спермиев — общий вид (X 12 5000) (5), фрагмент этого же спермия, видна пластида (35 000) (6),
спермий из другого пыльцевого зерна — общий вид (X 10 5000) (7), фрагмент этого же спермия,
видна пластида (X 35 000) {8);
A*
*Фм*
ФМ
*«-9W
•1
10
-па
ФМ
11
.ь
Роасеае (продолжение)
9, 10 — триада мегаспор до увеличения функционирующей мегаспоры (X 720) (9) и после
(X 575) (10); 11 — флуоресценция каллозы в клеточной стенке нефункционирующих мегаспор;
12 — функционирующая мегаспора и дегенерирующие мегаспоры (X 3150). видны плазмодесмы
в стенке халазальной части функционирующей мегаспоры (отмечены стрелками);
ЯСп
Ж
f я
ПТр
(HJ
Г" чей л i * ^
Роасеае (продолжение)
13 — один из удлиненных спермиев в зрелом 3-клеточном пыльцевом зерне; большое эллиптическое
ядро спермия занимает «головку», в то время как мелкие вакуоли, митохондрии, микротрубочки,
крахмальные зерна и фибриллярные структуры сосредоточены в цитоплазме зауженной части
спермия; пространство между плазмалеммами спермия и вегетативной клетки имеет характерный
пузырьковый вид; 14—17 двойное оплодотворение: пыльцевая трубка в районе микропиле между
стенкой завязи и внутренним интегументом через 2—2 ч 45 мин после опыления, видна
дегенерировавшая цитоплазма пыльцевой трубки (14),
9
дс
у* 9
J. ^.*
ВСп
т ;а
Сп
i •"--■■ -
ВСП
'ЦКл,
> 15
Роасеае (продолжение)
продольный срез семяпочки через 1 ч 45 мин после опыления, клетка спермия в межклеточном
пространстве между яйцеклеткой и центральной клеткой, видна плазматическая мембрана (стрелка)
(15); та же семяпочка, хорошо виден контакт плазматических мембран яйцеклетки и спермия
(стрелки) (16), ядро спермия, сливающееся с полярным ядром через 2—2 ч 45 мин после опыления
(17); 18 — зигота (52X70 мкм), окруженная цитоплазмой центральной клетки и непосредственно
граничащая с нуцеллусом (Х3300);
■м.
м
Щ
N.
' Ш^Щ-г
•:- 4
, >*
Роасеае (продолжение)
яд 14
к--
Ш
ЦКп
\7
Роасеае (продолжение)
\
-&7
10Г
Poaceae (продолжение)
Щ
ш
л
щ
21
- ^
22
h
ЧКЙ:
Л*-
/
Ж
20
Роасеае (продолжение)
23
19—23 — зерновка и строение зародыша: зерновка (19), зародыш (20), отдельные фрагменты
зародышей при большом увеличении (21—23);
Z7
28
ш.
'Кл.
TP ^
Кл-*
Ч.-
25
Нлр
*.2Я
м
- Щ
■ $
)
. . . . -М
Роасеае (продолжение)
У
ЗарКор
30
24—30 — развитие зародыша от начальных стадий дифференциации органов до их
полной дифференциации: общий вид зародыша, вычлененного из незрелой (24, 25) и зрелой
зерновки (26), положение зародыша в зерновке — вид спереди (27) и сбоку (28), продольный срез
зародыша из незрелой (29) и зрелой (30) зерновки;
►
"0
В
1 I f
, I ■ *p8
1 '
.—' iMKM
.31 _ • 1 12
x,
r
i •*■.! t
КрЗ КрЗ
к
>'
ВТ '" .- Г^!^--■ ' .33
Poaceae (продолжение)
31—33 — алейроновый и субалейроновый слои эндосперма: периферический район эндосперма
к концу 3-й недели после опыления (сестринские клетки алейронового и субалейронового слоев
отличаются от клеток слоев, расположенных глубже) (3/), цитоплазма клеток алейронового
слоя (32), фрагмент клеток алейронового и субалейронового слоев эндосперма на 20-е сутки после
опыления (стрелками отмечены формирующиеся кристаллоиды) (33). (а. с—алейроновый слой,
б.т — белковое тело, е — вакуоль, е. сп — вакуоль спермия, е. э. р — вакуолеобразное расширение
эндоплазматического ретикулума, г — глобоид, г. к — генеративная клетка, д — диктиосома,
дд. кл — «диадная» клетка, д. м — дегенерирующая мегаспора, д. с — дегенерирующая синергида,
зар — зародыш, зар. пор — зародышевый корень, кл. о — клеточная оболочка, клр — колеориза,
кл — колеоптиль, кор. ч — корневой чехлик, кр. з — крахмальное зерно, к. э — канал экзины,
л1—л3 — 1—3-й листья почечки, лг — лигула, л. к — липидная капля, м — митохондрия, к - нуцел-
лус, нэ — нэкзина, о — орбикула, о. г - осмиефильная глобула, on — оперкулум, о. м — осмиофиль-
ный материал, п — пластида, п. г — пузырек Гольджи, пз — пыльцевое зерно, пл — плазмалемма,
пр. с — проводящая система, пр — пропластида, п. т — промежуточное тело, п. тр — пыльцевая
трубка,
I
■г
i ЗОмкм,
^.^
Strelitziaceae
1—4 — Strelitzia reginae
1—3 — различное расположение микроспор в тетраде: / — изобилатеральное, 2 — линейное,
3 — Т-образное; 4—аномальная группа из 5 микроспор. (/—4 — по Venter van de, 1976).
п. я — полярное ядро, са. с — субалейроновый слой, сп — спермий, сус — суспензор, тп — тапетум,
т. р — точка роста, тк — тектум, ф. м — функционирующая мегаспора, ц. кл — центральная клетка,
щ — щиток, э — экзина, энд — эндосперм, эпб — эпибласт, а. р — эндоплазматический ретикулум,
я — ядро, яд — ядрышко, я. п — ядерная пора, яд. п. я - ядрышко полярного ядра, я. сп — ядро
спермия). (/ — по Огородниковой, 1980; 2- Огородникова, ориг. данные; 3 — по Chu, Ни, 1981;
4—9—Татинцева, ориг. данные; 10—13 — по Russel, 1979, с изм.; 14—17 — по Mogensen. 1982,
с изм.; 18 — по Norstog, 1972; 19—23—по Батыгиной, 1974; 24—30—Рытова, ориг. данные;
31—33—Шмараев, ориг. данные).
Marantaceae
*•— e f^—Же
/ — Maranta leuconeura, 2 — Calathea louisae
1 — поперечный срез зрелого пыльника; 2 — семяпочка со зрелым зародышевым мешком.
(/, 2—ориг.).
Monocotyledoneae. Basel u. Stuttgart. 1963.
Bd 2. 540 S.
Heiman-Winawer T. Beitrage zur Embryologie
von Colchicum autumnale L.: Diss. Freiburg,
1919
Heimans J. // Rec. trav. bot. neer. 1928. Vol.
Jubl. 25a. P. 138—167.
Henry M. P. И С r. Acad. sci. 1956. T. 243, N 4.
P. 401—404.
Herail J. Organes reproducteurs et formation
de l'oeuf chez les Phanerogames. Paris, 1889.
Herring F. I/ Beitr. allg. Bot. 1922. Bd 2, H. 4.
S. 403—411.
Heslop-HarrisonJ. // Ann. Bot. (USA). Suppl. 1.
1979. Vol. 44. P. 3—47.
Heslop-Harrison J., Heslop-Harrison Y. // Ann.
Bot. (USA). 1988. Vol. 61, N 2. P. 249—254.
Heslop-Harrison J., Heslop-Harrison Y.,
Reger B. J. // Acta bot. neer. 1985. Vol. 34, N 2.
p 193 211
Heusser K. //Beih. bot. Zentr.-Bl. 1915. Bd 32,
Abt. 1. S. 218—277.
Hildebrand F. //Bot. Ztg. 1863. Bd 44.
Hill T. G. // Ann. Bot. 1900. Vol. 14, N 53. P. 83—
107.
Himmelbaur W. // Testschrift fur Alexander
Tschirch. Leipzig, 1926. S. 335—350.
Hisako M.-H., Sumio N. // Pollen biol. and
implic. plant breed. Proc. Symp. Lake Garda
(1982). New York, 1983. P. 141 — 147.
Hoare G. //Cellule. 1934. T. 42, fasc. 1—2.
P. 269—292.
Hoffman C. A. 11 Bot. Gaz. 1933. Vol. 95, N 2.
p 279 299.
Hoffman K. // Ber. Dtsch. bot. Ges. 1929 Bd 47
S. 321—326.
Hoffman K. // Planta. 1930. Bd 10. S. 523—595.
Hofmeister W. // Bot. Ztg. 1852. Bd 10. S. 121 —
131, 137—149, 157—158.
Hofmeister W. // Jb. wiss. Bot. 1858. Vol. 1.
P. 82—189.
Hohendorff U. Embryologische Untersuchungen
an Eriocaulaceen. Unveroffentlichte Staats-
examensarbeit. Bochum, 1981.
Holferty G. M. //Bot. Gaz. 1901. Vol. 31.
P. 339—346.
Hoshikawa /C. // Proc. Crop Sci. Soc. Japan,
1959. Vol. 34. P. 142—144.
Hoshikawa /(.//Bot. Mag. (Tokyo). 1960.
Vol. 73, N 861. P. 107—112.
Hoshikawa K. // Proc. Crop Sci. Soc. Japan.
1967a. Vol. 36, N 2. P 151 — 161.
Hoshikawa /(. // Proc. Crop Sci. Soc. Japan.
1967b. Vol. 36, N 3. P. 203—209, 210—215,
216—220, 221—227.
Hoshikawa K. // Proc. Crop Sci. Soc. Japan.
1967c. Vol. 36, N 4. P. 389—394, 395—402,
403—407.
Hoshino Takuji// Bot. Mag. (Tokyo). 1986.
Vol. 99, N 1054. P. 185—190.
Howe T D. И Amer. J. Bot. 1940. Vol. 27
(suppl.). P. 11.
Hruby С. И Bull. Int. Acad. Sci. Boheme. 1934.
Vol. 35, N 2. P 124—132.
Hruby С//Chronica Bot 1938. Vol. 4, N 1.
P. 20—21.
Hsu Sun-yuan, Peterson P. A. // Iowa State
J. Res. 1981. Vol. 55, N 4. P. 351—373.
Ни S. Y., Zhu C, Xu L. Y. // Acta bot. sinica.
1981 Vol. 23. P 85—91
Ни S., Zhu S., Xu L., Li X., Shen I. // Acta
Bot. sinica. 1979. Vol. 21. P. 208—214.
Ни Shi-yi, Wang Mo-shan, Hsu Li-yun //
Acta bot. sinica. 1977. Vol. 19, N 3. P. 169—171.
Huber H. II Mitt. Bot. Staatssamml. Munchen.
1969. Bd 8, H. 2 S. 219—538.
Hubert E. de//Ann. sci. natur. Bot. 1896.
Ser. 8. Vol. 2. P. 37—128.
Humphrey J. E. // Ann. Bot. 1896. Vol. 10, N 37.
P. 1—40.
Huynh Kim-lang // Webbia. 1983. Vol. 37, N 1.
P. 141 — 148.
Islam A. S. // J. Indian Bot. Soc. 1950. Vol. 29,
N 1. P. 79—91.
Israel H. W. // Amer. J. Bot. 1963. Vol. 50. P. 615.
Israel H. W., Sagawa Y. // Caryologia. 1964.
Vol. 17. P. 301.
Ikeda Т. И Bull. Coll. Agr. Tokyo Imp. Univ.
1902. Vol. 5. P. 41—72.
Indra R., Krishnamurthy K. V. // Curr. Sci.
(India). 1984. Vol. 53, N 8. P. 442—443.
Indra R., Krishnamurthy K. V. // Phyton. 1985.
Vol. 45, N 1. P. 41—44.
Ishikawa C. // J. Coll. Sci. Tokyo Imp. Univ.
1897. Vol. 10, N 2. P. 119—238
Jackson W. Т., Doyle B. G. // J. Cell. Biol. 1982.
Vol. 94, N 3. P. 637—643.
Jacob son-Paley R. // Bull. Soc. bot. Geneve.
Ser 2. 1920. Vol. 12. P 55—64.
Jacob son-Paley R. // Bull. Soc. bot Geneve.
Ser. 2. 1920. Vol. 12. P. 87—92.
Jacgues-Felex H // Bull. Mus. nat. hist, natur.
Adansonia. 1982. N 4 (1—2). P. 3—40.
Jalouzot M.-F. II Ann. Sci. Univ. Reims. 1982a.
Vol. 18. P. 21—24.
Jalouzot M.-F. //Phytomorphology 1982b.
Vol. 32, N 4'. P. 396—399.
Jalouzot M -F. II Proc. 7th Intern. Cytoembr.
Symp. Bratislava, 1983. P. 183—187.
Jalouzot M.-F., Gianordoli M., Favre-Du-
chartre M // С. г. Acad. sci. Paris. 1983. T.
296, N. 5. P. 235—237.
Je Xiulin, Qian Nanfen, Wang Fuxiong // Acta
bot. Yunnanica. 1986. Vol. 8, N 2. P. 125—131
Jeffrey E. С //Ann. Bot. 1895. Vol. 9, N 36.
P. 537—541.
Jeffrey E. C, Haertl E. J. // Science. 1939a.
Vol. 90, N 2326. P. 81—82.
Jeffrey E. C, Haertl E. J. // Cellule. 1939b.
Vol. 48. P. 79—88.
Jenner C. F., Rathjen A. J. // Austral. J. Plant
Physiol. 1977. Vol. 4, N 5. P. 691—701
Jennings A. C, Morton R. K. // Austral. J. Biol.
Sci. 1963. Vol. 16, N 2. P. 318—331.
Jensen /(.//Bot. tidsskr. 1890. Bd 17, H. 4.
S. 162—167.
Jeyanayaghy S., Rao A. N. // Bull. Torrey Bot.
Club. 1966. Vol. 93, N 2. P. 97—103.
Joachimiak A. //Acta biol. crac. Ser. bot. 1981
Vol. 23. P. 25—35.
Johansen D. A. // Bot. Rev. 1945. Vol. 11. P. 87—
107.
Johnston G. W. И Phytomorphology. 1953. Vol. 3.
p 3J3 3J5
John B. M. //Curr. Sci. (India). 1933. Vol. 2,
N 1. P. 12—13.
Johri B. M. H Curr. Sci. (India). 1934a. Vol. 2.
P. 428—429.
Johri В. М. //Curr. Sci. (India). 1934b. Vol. 3.
P. 17—18.
Johri В. М. H Proc. Indian Acad. Sci. B. 1935a.
Vol. 1, N 7. P. 340—348.
Johri В М. И Proc. Indian Acad. Sci. B. 1935b.
Vol. 2, N 1. P. 33—48.
Johri В. М. И J. Indian Bot. Soc. 1935c. Vol. 14,
N 1. P. 49—66.
Johri В. М. И Proc. Indian Acad. Sci. B. 1936.
Vol. 4. P. 122—138.
20 Зак 2144
305
Johri В. M. И Beih. bot. Zentr.-Bl. 1938a. Bd 38.
S. 165—172.
Johri В M. И New Phytol. 1938b. Vol. 37, N 3.
P. 279—285.
Johri B. M., Ambegaokar К В. //
Phytomorphology. 1975. Vol. 25, N 1. P. 112—117.
Johri B. M., Bhatnagar S. P. // Phytomorpho-
logy. 1957. Vol. 7, N 3—4. P. 292—296.
Johri B. M., Eunus A. M. // Proc. 37th Indian
Sci. Congr. 1950. Vol. 3. P. 44.
Johri M. M. И Curr. Sci. (India). 1962. Vol. 31,
N 6. P. 255—256.
Johri M. M. H Phytomorphology. 1966. Vol. 16,
N 1. P. 92—109.
Johri M. M., Maheswari S. C. // Plant a. Cell
Physiol. 1966. Vol. 7, N 3. P. 385—393.
Johston G. W.//Amer. J. Bot. 1941. Vol. 28.
P. 306—319.
Jones H. A., Emsweller S. L. // Hilgardia. 1936.
Vol. 10, N 11. P. 415—428.
Jones P L. // Planta. 1969. Vol. 85, N 4. P. 359—
375.
Jonsson В. И Lunds Univ. Arsskr. 1879—1880.
Vol. 16. P. 1—86.
Joshi А. С. И J. Indian Bot. Soc. 1937. Vol. 26.
P. 297—300.
Joshi А. С. И Proc. Nat. Inst. Sci. India. 1939.
Vol. 5, N 3. P. 289—305.
Joshi А. С. И Bull. Torrey Bot. Club. 1940.
Vol. 67, N 2. P. 155—158.
Joshi A. C., Pantulu J. V. // J. Indian Bot. Soc.
1941. Vol. 20. P. 37—71.
Juel H. О. И Jb. wiss. Bot. 1897. Bd 30. S. 205—
226.
Juguet M. И С r. Acad. sci. D. 1966. T. 263, N 22.
P. 1710—1713.
Juguet M. И Bull. Soc. bot. France. 1967a. T. 113,
N 9. P. 448—452.
Juguet M. И Bull. Soc. bot. France. 1967b. T. 114,
N 7—8. P. 277—279.
JuguetM. H Bull. Soc. bot. France. 1969a. T. 116,
N 3—4. P. 137—143.
Juguet M. И С r. Acad. sci. D. 1969b. T. 268.
N 25. P. 3036—3039.
Juguet M. II С r. Acad. sci. D. 1970a. T. 271, N 6.
P. 580—583.
Juguet M. H Adansonia. 1970b. Vol. 10, N 2.
P. 271—288.
Juguet M. II C. r. 93e Congr. nat. Soc. savantes,
Tours, 1968, Sec. Sci. 3. Paris, 1972. P. 547—
572.
Juguet M. И Bull. Soc. bot. France. 1973. T.
mem. P. 337—353.
Juguet M., Lebegue A. // С. г. Acad. sci. D. 1966.
T. 262, N 17. P. 1844—1847.
Juliano J. В. И Philipp. Agr. 1931. Vol. 20.
P. 177—186.
Juliano J. B.} Alcala P. £. // Philipp. Agr. 1933.
Vol. 22 P. 91 — 126.
Juliano J. В., Quisumbing E. // Philipp. J. Sci.
1931. Vol. 45, N 3. P. 449—458.
Jungers V. //Cellule. 1931. T. 40. P. 293—354.
Kajale L. В., Ranade S. G. // Curr. Sci. (India).
1952. Vol. 21, N 6. P. 170.
Kajale L. В., Ranade S. G. // J. Indian Bot. Soc.
1953. Vol. 32, N 3. P. 101 — 107.
Kamdar H. M. // Proc. 56th Indian Sci. Congr.
Bombay. 1969. N 3. P. 369.
Kamra O. P // Hereditas. 1960. Vol. 46, N 3—4.
P. 536—542.
Kapil R. N. I/ Seminar Comparative Embryology
of Angiosperms. New Delhi, 1967. S. 125—127.
Kapil R. N. //Acta Bot. Indica. 1974. Vol. 2.
P. 79—106.
Kapil R. N.t Walia K. 11 Beitr. Biol. Pflanz.
1965. Bd 41, H. 3. S. 381—404.
Kapoor B. M., Tandon S. L. // Genetica. 1963.
Vol. 34. P. 102—112.
Kapoor B. M.} Tandon S. L. // Phyton. 1964a.
Vol. 21, N 1. P. 37—43.
Kapoor B. M., Tandon S. L. // Sci. and Cult.
1964b. Vol. 30, N 3. P. 146—147.
Karanth K. A., Swamy B. G. L., Arekal G. D. //
Proc. Indian Acad. Sci. Plant Sci. 1981. Vol. 90,
N 1. P. 1—7.
Karas I., Cass D. D. // Phytomorphology. 1976.
Vol. 26. P. 36—45.
Kato K. //Ebenda. 1930a. Vol. 5. P. 139.
Kato K. II Mem. Coll. Sci. Univ. Kyoto. B. 1930b.
Vol. 5, N 2. P. 229.
Kausik S. В. И Amer. J. Bot. 1939. Vol. 26, N 2.
P. 83—99.
Kausik S. В. И Proc. Indian Acad. Sci. 1940.
Vol. 11, N 2. P. 83—99.
Kausik S. B.I /Proc. Indian Acad. Sci. 1941.
Vol. 14, N 1. P. 1 — 16.
Kausik. S. В., Rao P. V. K. // J. Mysore Univ.
1942. Vol. 3, N 1. P. 41—49.
Khaleel T. F., Mitchell B. // Amer. J. Bot. 1982.
Vol. 69, N 6. P. 950—956.
Khanna P. // Proc. 43rd Indian Sci. Congr. 1956.
Vol. 3. P. 236—237.
Khanna P. // Curr. Sci. (India). 1963. Vol. 32.
p 133 134
Khanna P. //Can. J. Bot. 1965. Vol. 43, N 12.
P. 1539—1547.
Khoo V., Wolf M. /.//Amer. J. Bot. 1970.
Vol. 57, N 9. P. 1042—1050.
Kiellander С L. // Sv. bot. tidskr. 1937. Bd 31.
P. 425—429.
Kiellander С L. // Sv. bot. tidskr. 1941. Вd 35.
p 32i 332
Kiesselbach T.'A. //Amer. J. Bot. 1926. Vol. 13.
p 33 34
Kihara H., 'Hori T. // Zuchter. 1966. Vol. 36.
P. 145.
Kimura Chugai // Sci. Repts Tohoku Univ. Ser. 3.
1968. Vol. 34, N 1. P. 67—74.
Kircher E. Embryologische Untersuchungen an
Xyris capensis Thunb. Unveroffentlichte
Staatsexamensarbeit Bochum, 1977.
Kircher P. Untersuchungen zur Bltiten- und
Infloreszenzmorphologie, Embryologie und
Systematik der Restionaceen in Vergleich mit
Gramineen und Verwandten Familie: Diss.
Berlin, Stuttgart, 1986.
Knapp D. И Principes J. Palm Soc 1959.
Vol. 3. P. 13—18.
Knox R. B. 11 Johri B. (ed.). Embryology of
Angiosperms. 1984. P. 197—271.
Kocon J., Muszynski S., Dybowska A. et al. //
Bull. Acad, pol sci. Ser. sci. biol. 1978a.
Vol. 26, N 6. P. 359—360.
Kocon J., Muszynski S., Soma W. // Bull. Acad.
pol. sci. Ser. sci. biol. 1978b. Vol. 26, N 12.
P. 839—841.
Koerniche M. (Kornicke M.) // S. B. Nied. Ges.
Nat. Heilk. Bonn, 1901. S. 25—34.
Komuro H. И Bot. Mag. (Tokyo). 1922. Vol. 36.
P. 23—24.
Konopska L. I/ Acta Soc. bot. pol. 1972. Vol. 41
N 3. P. 369—383.
Kovnicka P. II Biol, plant. Acad. sci. bohemosl.
1973. Vol. 15, N 2. P. 144—149.
KosinaR. И Wiad. bot. 1980. Vol. 24, N 1. P. 41 —
56.
Kosmath L. // Osterr. bot. Ztschr. 1927. Bd 76.
S. 235—241.
306
Koul A. K., Wafai В. А. // Phytomorphology.
1981. Vol. 31, N 1—2. P. 11 — 17.
Koul A. K., Wafai B. A., Khan A. U. // Kash.
Sci. 1969. Vol. 6. P. 23—32.
Koul A. K., Wafai B. A., Wakhlu A. K. //
Phytomorphology. 1976. Vol. 26, N 3—4.
P. 255—263.
Koyana T.//J. Fac. Sci. Univ. Tokyo. 1961.
Vol. 8. P. 148.
Kracauer P. Die Haploigeneration von Canna
indica: Diss. Berlin, 1930.
Krichnaswamy N., Ayyangar G. N. R. // Beih.
bot Zentr.-Bl. 1937. Vol. 57. P. 297—318.
Kronfeld M.//S. B. Kais. Akad. wiss. 1886.
Bd 16. S. 78—109.
Krupko S. И J. Sth. Afr. Bot. 1962. Vol. 28, N 1.
P. 21—44.
Krupko S. //Acta Soc. bot. pol. 1963. Vol. 32,
N I. P. 171 — 190.
Krupko S. II Bull. Soc. amis sci. et lett. Pozn.
D (7). 1966. P. 59—67.
Krupko S., Israelstam G. F., Martinovic B. //
Sth. Afr. J. Sci. 1954. Vol. 51, N4. P. 115—117.
Kubien E. II Acta biol. crac. Ser. bot. 1968.
Vol. 11, N 1. P. 21—29.
Kubien E. II Acta biol. crac. Ser. bot. 1970a.
Sect. B, N 2. P. 99—110.
Kubien E. И Acta biol. crac. Ser. bot. 1970b.
> Vol. 13, N 1. P. 1 — 10.
Kulkarni A. R., Dnyan // J. Indian Bot. Soc.
1984. Vol. 63, N 2. P. 206—213.
Kulkarni K. M., Mahabale T. S. // Proc. Indian
Acad. Sci. 1974. Vol. 80, N 1. P. 1 — 17.
Kulkarni A. R.t Patil V. D //Curr. Sci. (India).
1969. Vol. 38, N 9. P. 220—221.
Kumari K. Sh. // Curr. Sci. (India). 1960.
Vol. 29, N 5. P. 191.
Kuran H., Marciniak K. // Acta Soc. bot. pol.
1969. Vol. 38, N 1. P. 83—92.
Kusano Sh. I/ J. Coll. Agr. Imp. Univ. Tokyo.
1915. Vol. 6, N 1. P. 7—120.
Kuwada Y. // Bot. Mag. (Tokyo). 1910. Vol. 23.
p ззз 342
Kuwada Y. //Bot. Mag. (Tokyo). 1911. Vol. 25.
P 163—181.
Kvaale A., Olsen O. A. // Ann. Bot. (USA).
1986. Vol. 57, N 6. P. 829—833.
Lakshmanan К /С.//J. Madras Univ 1961.
Vol. 1, N 2. P. 133—141.
Lakshmanan К. К. // Curr. Sci. (India). 1962.
Vol. 31, N 5. P. 208.
Lakshmanan К. К. //J. Indian Bot. Soc. 1963a.
Vol. 42, N 1. P. 15—18.
Lakshmanan К. К // Phyton. 1963b. Vol. 20, N 1.
P. 49—58.
Lakshmanan K. K. // Phyton. 1965a. Vol. 22, N 1.
P. 13—14.
Lakshmanan K. K. 11 Phyton. 1965b. Vol. 22, N 1.
P. 45—50.
Lakshmanan K. K. 11 Proc. Indian Acad. Sci.
B. 1967. Vol. 65, N 2. P. 49—55.
Lakshmanan К. К. // Curr. Sci. (India). 1968.
Vol. 37. P. 534—535.
Lakshmanan К. К. // Bull. Indian Nat. Sci. Acad.
1970. N 41. P. 336—357.
Lakshmanan K. /(.//Vistas Plant Sci. 1972.
Vol. 11. P. 61 — 110.
Lakshmanan K. K. 11 Proc. Indian Acad. Sci. B.
1977. Vol. 86, N 3. P. 167—174.
Lakshmanan K. K., Jayalakshmi R. // Curr. Sci.
(India). 1980. Vol. 49, N 8. P. 325—326.
Lakshmanan K. K., Philip V. G. // Proc. Indian
Acad. Sci. B. 1971. Vol. 73, N 3. P. 110—116.
Lakshmi N. A. // Curr. Sci. (India). 1979.
Vol. 48, N 9. P. 410—412.
Lambertsen G., Andresen /., Braekkan O. R. //
Acta agr. scand. 1966. Vol. 16, N 3—4. P. 213—
216.
Lammeren A. A. van // Acta Soc. bot. pol. 1981.
Vol. 50, N 1—2. P. 289—290.
Lammeren A. A. M. van // Acta bot. neer. 1986.
Vol. 35. P. 169—188.
Lammeren A. A. M. van // Embryogenesis in Zea
mays L. A structural approach to maize caryop-
sis development in vivo and in vitro. Wagenin-
gen, 1987. 132 p
Lammeren A. A. M. van // Acta bot. neer. 1983.
Vol. 32. P. 355.
Laroche M. // Rev. Gen. bot. 1964. T. 71, N 845.
P. 385—395.
Lary de Latour E. // С. г. Acad. sci. Paris. 1908.
T. 146. P. 833—836.
Laurent M. // С r. Acad. sci. Paris. 1903a. T. 137.
p. 499—500.
Laurent M. // С r. Acad. sci. Paris. 1903b. T. 137.
P. 532—533.
Laurent M. //Ann. sci. natur. Bot. 1904. Ser. 19,
T. 19. P. 97—194.
Lawalree A. // Bull. Soc. roy. bot. Belg. 2 ser.
1945. T. 27, fasc. 1—2. P. 27—38.
Lawalree A. // Cellule. 1952. T. 54, fasc. 3.
P. 305—326.
Lawton J. R, Lawton I. R. // Proc. Linn. Soc.
1967. Vol. 178, part 2.
Lazarte J., Palzer B. // Amer. J. Bot. 1979.
Vol. 66, N 7. P. 753—764
Leavitt R. G. // Rhodora. 1900. Vol. 2. P. 227—
228
Leavitt R. L. // Rhodora. 1901. Vol. 3, N 25.
P. 61—63.
Lechmere A. E. // New Phytol. 1910. Vol. 9, N 2.
p 257 259
LeeR. E. // Baileya. 1961. Vol. 9, N 2. P. 53—56.
Leffingwell A. M. // Res. Stud. State Coll.
Washington, 1930. Vol. 2, N 2. P. 80—89.
Lemesle R. // Bull. Soc. bot. France. 1929. T. 76.
P. 74—78.
Lenoir M. И С. г. Acad. sci. Paris. 1927. T. 184.
P 1132—1134.
Lenz K. W. //Aliso. 1956. Vol. 3. P. 329—343.
Lersten N. L. // Wheat and wheat improvement.
2nd edition. USA, 1987. P. 33—75.
Liang Han-xing // Acta bot. sinica. 1983. Vol. 25,
N 1. P. 29—33.
Liang Han-xing // Acta bot sinica. 1984. Vol. 26,
N 5. P 466—472.
Liang Han-xing // Acta bot. sinica. 1985. Vol. 27,
N 5 P. 465—468.
Liang Han-xing, Zhan Xian-glan // Acta bot.
Yunnanica. 1984. Vol. 64. P. 435—440.
Lindgren Dag, Eriksson G., Ekberg I. // Heredi-
tas. 1969. Vol. 63, N 1—2. P. 205—212.
Linskens H. F. // Acta bot. neer. 1958. Bd 7, N 1.
S. 61—68.'
Liping, Zheng Xuejing // Bull. Bot. Res. 1986.
Vol. 6, N 4. P. 113—118.
Lloyd F. E. //Ann. Missouri Bot. Gard. 1910.
Rep. 21. P. 103—164.
Lodha M. L., Srivastava K. N., Ram P. C.,
Mehra S. L. // Biochem. und Physiol. Pflanz.
1978. Bd 173, H. 2. S. 123—128.
Longly В., Raban Т., Louant B. // Can. J. Bot.
1985. Vol. 63, N 11. P. 1900—1907.
Lu W. L., Кио С //Acta bot. sinica. 1984.
Vol. 26. P. 28—33.
Luxova M. И Biologia, PI. 1967. Vol. 9, N 4.
P. 301—307.
Luxova M. И Biol, plant. Acad. sci. bohemosl.
1968. Vol. 10, N 1. P. 10—14.
20*
307
Ly Thi Ba // Rev. gen. bot. 1981 T. 88, N 1046—
1048. P. 201—252
Ly Thi Ba, Cave G., Henry M., Guignard J.-L. //
С. г. Acad. sci. D. 1978. T. 286, N 19. P. 1351 —
1353.
Ly Thi Ba, Guignard J.-L. // С r. Acad sci D.
1976a. T. 282, N 6. P. 549—552.
Ly Thi Ba, Guignard J.-L. // C. r. Acad. sci. D.
1976b. T. 283, N 2. P. 151 — 153.
Ly Thi Ba, Mestre J. Ch., Guignard J.-L. //
С r. Acad. sci. D. 1973. T. 276, N 5. P. 737—
740.
Madge M. // Proc. Linn. Soc. Bot. (London).
1934. Vol. 146. P. 108—109.
Madge M. // Cellule. 1936. T. 45. P. 171 — 176.
Mahabale T. S., Biradar N. V. // Proc. Indian
Acad. Sci. B. 1968. Vol. 67, N 2. P. 77—96.
Mahabale T. S., Chennaveeraiah M. S. //
Phytomorphology. 1957. Vol. 7, N 2. P. 184—
194.
Mahabale T. S., Chennaveeraiah M. S. //
Proc. Nat. Inst. Sci. India B. 1961. Vol. 27,
N 4. P. 153—171.
Mahabale Т., Inamdar A. // Proc. Indian Acad.
Sci. B. 1975.'Vol. 81, N 4. P. 162—169
Mahalingappa Mr S. // Phytomorphology. 1977.
Vol. 27, N 3. P. 231—239.
Maheshwari P. // Curr. Sci. (India). 1933. Vol. 2,
N 1. P. 13—14
Maheshwari P. // New Phytol. 1937. Vol. 36,
N 5. P. 359—417.
Maheshwari P. // Proc. Nat. Acad. Sci. India
1943. Vol. 13, N 2. P. 260—263.
Maheshwari P. // J. Indian Bot. Soc. 1946.
M. O. P. Iyengar. Commen. P. 101 — 119.
Maheshwari P. // Lloydia. 1947. Vol. 10, N 1.
R 1 — 18.
Maheshwari P., Johri B. M. // J. Indian Bot.
Soc. 1950. Vol. 29, N 1. P. 47—51.
Maheshwari P., Kapil R. N. // Phytomorphology.
1966. Vol. 16, N 3. P. 239—291.
Maheshwari P., Maheshwari S. //
Phytomorphology. 1955. Vol. 5, N 4. P. 413—422.
Maheshwari P., Narayanaswami S. // J. Linn.
Soc. Bot. (London). 1952. Vol. 53. P. 474—486.
Maheshwari P., Singh B. // J. Indian Bot. Soc.
1930. Vol. 9. P. 31—39
Maheshwari P., Singh B. // Curr Sci. (India).
1934. Vol. 3, N 3. P. 158—160.
Maheshwari P., Singh B. // Proc. Nat. Inst. Sci.
India. B. 1943. Vol. 9. P 311—322.
Maheshwari S. C. // Phytomorphology. 1954.
Vol. 4, N 3—4 P. 355—365.
Maheshwari S. С // Phytomorphology. 1955.
Vol. 5, N 1. P. 67—69.
Maheshwari S. С // Nature. 1956a. Vol. 178,
N 4539. P. 925—926.
Maheshwari S. С // Phytomorphology. 1956b.
Vol. 6, N 1. P. 51—55.
Maheshwari S. С // Nature. 1958. Vol. 181,
N 4625. P. 1745—1746.
Maheshwari S. C, Baldev B. //
Phytomorphology. 1958. Vol. 8, N 3. P. 277—298. .
Maheshwari S. C, Kapil R. N. // Amer. J. Bot.
1963a. Vol. 50, N 7. P. 677—686.
Maheshwari S. C., Kapil R. N. // Amer. J. Bot.
1963b. Vol. 50, N 9. P. 907—914.
Maheshwari S. C., Kapil R. N. // J. Indian Bot.
Soc. 1964. Vol. 43, N 2. P. 270—277.
Maheshwari S. C, Khanna P. P. //
Phytomorphology. 1956. Vol. 6, N 3—4. P. 379—388.
Maheshwari S. C, Maheshwari N. // Beitr. Biol.
Pflanz. 1963. Bd 39, H. 2. S. 179—188.
MakdeK. H. //Curr. Sci (India). 1981a. Vol. 50,
N 9. P. 421—422.
MakdeK. H. // Curr. Sci. (India). 1981b. Vol. 50,
N 2. P. 98—99
MakdeK. H. // Curr. Sci. (India). 1982a. Vol. 51,
N 10. P. 525—527
Makde K. H. // J. Indian Bot. Soc. 1982b. Vol. 61,
N 2—3. P. 242—249.
Makde K. H., Bhuskute S. M. // Curr. Sci.
(India). 1984. Vol. 53, N 9. P. 504—506.
Makde K. H., Bhuskute S. M. // Plant Syst. and
Evol. 1987 Vol. 156, N 3—4. P. 143—150.
Mangaly J. К, Sworrupanandan K. // Proc.
Indian Acad. Sci. B. 1977. Vol. 86, N 3. P 175—
179.
Marciniak K. // Acta Soc. bot. pol. 1975. Vol. 44,
N 3. P. 335—347.
Mares D. J., Norstog K., Stone B. A. // Austral.
J. Bot. 1975. Vol. 23, N 2. P. 311—326.
Mares D. J., Stone B. A. et al. // Austral. J. Bot.
1977. Vol. 25, N 6. P. 599—613.
Maruyama К // Cytologia, Jap. 1965 Vol. 30.
P. 354—374.
Maruyama K. 11 Cytologia, Jap. 1968. Vol. 33,
N 3—4. P. 482—497.
Mascre M.//C r. Acad. sci. 1925a. T. 181.
P. 1165—1166.
Mascre M. И Bull. Soc. bot France. 1925b. T. 72
P. 1060—1066
Mascre M. 11 С. г. Acad. sci. 1928. T. 186.
P. 1642.
Masiowski P, Skorko R.I /Hod rosl., aklim.
i nasienn. 1963. T. 7, N 2. С 133—141.
Mauritzon J. //Acta Univ lund. 1936. Bd 31,
N 9. S. 1—31.
Maze J., Bohm L. R. // Can. J. Bot. 1973.
Vol. 51. P. 235—247.
Maze J., Bohm L. R. // Can J. Bot. 1974. Vol. 52.
p 3g5 379
Maze J , Bohm L. R. // Can. J Bot. 1977 Vol.55.
P. 1768—1782
Maze J., Bohm L. R, Mehlenbachen L E. //
Can. J. Bot 1970. Vol 48, N 1. P 27—41.
Maze J , Lin Shu-chang // Can J. Bot 1975
Vol 53, N 24. P 2958—2977.
McAllister F. // Bot. Gaz. 1909 Vol. 48, N 3.
P. 200—215.
McAllister F. // Trans. Wise Acad. Sci., Arts and
Letters. 1913. Vol. 17, pt 1, N 5. P. 599—660.
McAllister F. //Bot. Gaz 1914. Vol 58, N 2.
P 137—153.
McCollum R. И Bull. Torrey Bot. Club
Burlington. 1939. Vol. 66, N 8. P. 539—548.
McConchie С A., Hough T, Knox R B. // Proto-
plasma. 1987. Vol. 139, N 1. P. 9—19.
McConchie С A , Knox R. В., Ducker S. С //
Micron 1982. Vol. 13, N 3. P. 339—340.
McConchie С A., Knox R В., Ducker S. C,
Pettitt J. M. //Ann. Bot. 1982. Vol. 50.
p 729 732
McGahan M. W. //Amer. J. Bot 1961. Vol. 48,
N 3. P. 230—238.
МсКеппщ R. E. B. // Contrib. Bot. Lab. Univ.
Pennsylv. 1898. Vol. 2, N 1 P. 80—85.
McLeod A. M., McCorquodale H. // J. Inst Brew.
1958. Vol. 64. P. 162—170.
McLeod A. M., McCorquodale H. // New Phytol.
1958. Vol. 57, N 2. P. 168—182.
McNaughton J. E., Robertson B. // J Sth. Afr.
Bot. 1974. Vol. 40, pt 1. P. 75—79
Mehlenbacher L. E. // Can. J. Bot. 1970. Vol. 48,
N 10. P. 1741 — 1758.
Mendoza D. R. // Philipp. J. Sci. 1954. Vol 83,
N 3. P. 219—238.
Menezes N. L // Bol. bot. Inst, biocienc. 1976.
N 4. P. 41—59.
308
Mepham R. H., Lane G. R. // Nature. 1968.
Vol. 219, N 5157. P. 961—962.
Mepham R. H., Lane G R. // Nature. 1969a.
Vol. 221, N 3. P. 282—284.
Mepham R. H., Lane G. R. // Protoplasma
1969b. Vol. 68, N 2. P. 175—192.
Mepham R. H., Lane G. R. // Protoplasma. 1970.
Vol. 70, N 1. P. 1—20
Mercier С // Physiol, veget. 1985. Vol. 23, N 2.
p 231 242.
Merry J. И Bull. Torrey Bot. Club. 1941. Vol. 68.
P. 585—598.
Merwe R B. van der // J Sth. Afr Bot. 1957.
Vol. 23. P. 139—149.
Messeri A. // N. G. bot. Ital. 1931 T. 38, N 3.
P. 409—441
Meyer K. J 11 Ber. Dtsch. bot. Ges. 1925. Bd 43.
S. 193—197.
Meyers D. G.t Stone В H, Jeffrey S., Nors-
tog K. //Austral. J. Bot 1977. Vol. 26, N 6
P. 57—67.
Mezzetti-Bambacioni V. // N. G. bot. Ital. 1940.
Vol. 47, N 3. P. 421—423.
Mezzetti-Bambacioni V. // Ann. Bot (Roma).
1943. Vol. 22, fasc. 2. P. 153—172.
Miceli P., Renzoni G. C. // Atti Soc. tosc. sci.
natur 1978. Vol. 85 P. 233—249.
Mikulska E., Gabara В., Olszewska M. // Acta
Soc bot. pol. 1967. Vol 36, N 4. P. 699—711.
Mikulska E., Rodkiewicz B. // Acta Soc. bot. pol.
1964. Vol. 33, N 3. P. 619—630
Mikulska E., Rodkiewicz B. // Flora. Abt. A.
1967a. Bd 157, H. 5. S. 365—372.
Mikulska E., Rodkiewicz B. // Acta Soc. bot. pol.
1967b. Vol 36, N 3. P. 555—566.
Miller E. E. //J. Agr. Res. 1919. Vol. 18, N 5.
P. 225—286.
Miodzianowski F., Idzikowska /C. // Acta Soc.
bot. pol. 1978. Vol. 47, N 3. P. 219—325
Mitroiu-Radulescu N et al. // Lucr. grand, bot.
Bucuresti. 1975—1976 P 95—106.
Mitroiu-Radulescu N. et al. // Acta bot hort.
bucurestiens. 1979—1980. P 35—43
Mlada I. H Acta Univ. carol. Biol. 1974. N 2—3.
P. 51 — 156.
Mlodzianawski F. // Bull. Soc. amis sci. et lett.
Pozn. D. 1964. Liv 4. P. 3—11.
Mogensen H. L. // Phytomorphology. 1970.
Vol. 2, N 1. P. 16—22.
Mogensen H. L. // Carlsbery Res Commun.
1982. Vol. 47. P. 313—354.
Mogensen H. L., Maxine Losoff Rusche //
Protoplasma. 1985. Vol. 128. P. 1 — 13.
Mol R., Zenkteler M. // Ztschr. Pflanzenzucht.
1982. Bd 89, N 1. S. 31—38.
Monteiro-Scanavacca W. R., Mazzoni S. С //
Rev. brasil. bot. 1978. Vol. 1. P. 59—64.
Monteverde M. // Bull. Acad. St. Petersb. 1880.
Vol. 26. P. 326—335.
Morgan D. T. J., Rappleye R. D. // J. Hered.
1951. Vol. 42, N 2. P. 90—93.
Morice I. M. II Phytochemistry. 1977. Vol. 16,
N 5. P. 571—574.
Morrison J W. И Can. J. Bot. 1955. Vol. 33, N 2.
P. 168—176.
Morrison J. W.} O'Brien T P. // Planta. 1976.
Vol. 130, N 1. P. 57—67.
Mottier D. M. И Bot Gaz. 1892. Vol. 17. P. 258—
260.
Mottier D. M. И Proc. Indian Acad. Sci. 1898.
Vol. 8, N 1—2. P. 168—169.
Mowery M. И Bull. Torrey Bot. Club. 1929.
Vol. 56. P. 319—324.
Mu Xi-jin, Wang Fu-xiong (Wang Fu-hsiung) //
Acta bot. sinica. 1985. Vol. 27, N 1. P. 7—12.
Mucke M. //Bot. Ztg. 1908. Vol. 66. P. 1—23.
Muller-Doblies 17.//Bot. Jb. 1969. Bd 89.
S. 359—450; 451—562.
Muniyamma M. // Can. J. Bot. 1976. Vol. 54,
N 21. P. 2490—2496.
Muniyamma M. // Bot. Gaz. 1978. Vol. 139, N 1.
P. 87—94.
Murbeck S II Kgl. sv. vetenskaps akad. handl.
1902. Vol. 36, N 5. P. 1—28.
Murphy J В //Bot. Gaz. 1946. Vol. 108, N 1.
P. 129—136
Murthy K. L И J. Indian Bot. Soc. 1938. Vol. 17,
N 2. P. 101 — 116.
Murthy S. K. N. //Curr. Sci. (India). 1933a.
Vol. 1. P. 53—54.
Murthy S. K. N.//3. Mysore Univ. 1933b.
Vol. 7. P. 1—32.
Murthy S. K. N //J. Indian Bot. Soc. 1935.
Vol. 14, N 4. P. 351.
Murty U. R., Mohan Rao V. /., Rao N. G. P. //
Indian J. Genet, and Plant Breed. 1978. Vol. 38,
N 2. P. 216—219.
Muszynski S., Kocon J., Darlewska M., Gro-
madka M. // Bull. Acad. pol. sci. Ser. sci. biol.
1976. T. 24, N 8. P. 449—450.
Murty Y. S, Kumar V. // Proc. Indian Acad. Sci.
B. 1967. Vol. 65, N 5. P. 185—191.
Nagaraj M. // Proc. Indian Acad. Sci. B. 1954a.
Vol. 40, N 4 P. 110—115.
Nagaraj M. // Curr. Sci. 1954b. Vol. 23, N 9.
P. 300
Nagaraj M. // Curr. Trends in Botanical
Research — New Delhi. Kalyani, 1980. P. 51 —
58.
Nagaraj M., Nijalingappa В. Н. // Curr. Sci.
(India). 1968. Vol. 37, N 11. P. 324—
325.
Nagaraj M., Nijalingappa В. Н. // Curr. Sci.
(India). 1972. Vol. 41, N 7. P. 260—261.
Nagaraj M., Nijalingappa B. H. M. // Proc.
Indian Acad. Sci. B. 1973. Vol. 77, N 6. P. 252—
263.
Nagato Y. // Jap. J. Breedg. 1978. Vol. 28, N 2.
P. 97—105.
Nagato Y. //Bot. Gaz. 1981. Vol. 142, N 2.
P. 274—278.
Naidu T. R. B. //Curr. Sci. (India). 1984.
Vol. 53, N 9. P. 500—502.
Naithani S P. //Ann. Bot. N. S. 1937. Vol. 1,
N 3. P 369—377.
Nakajima Y. // Sci. Repts Tohoku Univ. Ser. 4.
1928. Vol. 3. P. 431—442.
Nakamura S., Miki-Hirosige H. // Amer. J. Bot.
1985. Vol. 72, N 3. P. 365—375.
Nambiar M. C, Swaminathan M. S. // Indian
J. Genet, and Plant Breed. 1960 Vol. 20.
P. 200—211.
Nanda K., Gupta S. С 11 Beitr. Biol. Pflanz.
1974 Bd 50, N 3. S. 465—472.
Nanda К, Gupta S. С // Phytomorphology.
1977 (1978). Vol. 27, N 3. P. 308—314.
Narain P. // Curr. Sci. (India). 1979. Vol. 48,
N 22. P. 996—998.
Narasimkamurthy S. K. 11 Proc. Indian Acad.
Sci. B. 1935. Vol. 2, N 1. P. 59—66.
Narayana L. L., Narsa R. // Caryologia. 1978.
Vol. 31, N 4. P. 427—433.
Narayanaswamy S // Indian J. Agr. 1940.
Vol. 10. P. 534—551.
Narayanaswamy S. // Curr. Sci. (India). 1952.
Vol. 21. P. 19—21.
Narayanaswamy S. // Phytomorphology. 1955a.'
Vol. 18, N 2. P. 61—73.
Narayanaswamy S. // Phytomorphology. 1955b.
Vol. 18, N 5. P. 161 — 181.
309 -
Natesh S., Rau M. A. // Embryol. Angiosperms.
Berlin etc., 1984. P. 377—443.
Nemec B. // Bui. Internat. Acad Sci. Boheme.
1912. Vol. 17, N 1. P. 1 — 17.
Nemec B. // Preslia. 1931. Vol. 10. P. 104—110.
Nevins В. И Amer. J. Bot. 1927. Vol. 14. P. 370—
378
Newcomb W. // Can. J. Bot. 1978. Vol. 56, N 5.
Newton G. И Herbertia. 1985. Vol. 41. P. 83—85.
Nicholls M. S., Cook C. D. K. 11 Ueroff. Geobot.
Inst. ETH, Stiffung Rubel. Zurich, 1986. N 87.
S 112 119.
Nielsen E L. // Bot. Gaz. 1947a. Vol 108, N 4.
P 531—534
Nielsen E. L. // Amer. J. Bot. 1947b. Vol. 34,
N 8. P. 431—433.
Niimoto D. H., Sagawa Y. // Amer. Orchid. Soc.
Bull. 1961. P. 813—819.
Niimoto D. #., Sagawa Y. // Caryologia 1962.
Vol. 15. P. 89—97.
Nijalingappa B. H. M. // Proc. Indian Acad. Sci.
B. 1977. Vol. 85, N 6. P. 391—398
Nijalingappa B. H. M. // Plant Syst. and Evol.
1986. Vol. 156, N 3/4. P. 219—231.
Nijalingappa B. H. M., Arekal G. D. // Curr.
Sci. (India). 1983. Vol. 52, N 17. P. 816—817.
Nijalingappa B. H. M., Devaki N. // Beitr. Biol.
Pflanz. 1978. Bd 54, H. 2. S. 215—225.
Nijalingappa B. H. M., Devaki N. // Curr. Sci.
(India) 1978. Vol. 48, N 10. P. 451—452.
Nijalingappa B. H., Tejavathi D. H. // Curr. Sci.
(India). 1977. Vol. 46, N 3. P. 84—85.
Nijalingappa B. H. M., Tejavathi D. H. // Curr.
Sci. (India). 1983. Vol. 52, N 6. P. 262—263.
Nishimura M. // Bot. Mag. (Tokyo). 1922
Vol. 36. P. 47—54.
Nishiyama I., Yabuno T. /// Cytologia. 1978.
Vol. 49, N 2. P. 453—466.
Nishiyama /., Yabuno T. // Euphytica. 1979.
Vol. 28, N 1. P. 57—65.
Noguchi Y. //Jap. J. Bot. 1929. Vol. 4. P. 385—
403.
Nordin Ph. II Trans. Kansas Acad. Sci. 1959.
Vol. 62, N 3. P. 212—215.
Norner C. //Flora. 1881. Bd 16. S. 241—251;
257—266; 273—281
Norstog K. //Amer. J. Bot. 1963. Vol 50, N 8.
P. 815—821.
Norstog K. //Amer. J. Bot. 1972. Vol 59, N 2.
p 123 132.
Norstog /C.//Bot. Gaz. 1974. Vol. 139, N 2.
P. 97—103.
Nothnagel M. // Bot. Gaz. 1918. Vol. 66, N 2.
P. 143—161.
Nur N. И Ann. Bot. 1976. Vol. 40, N 166. P. 166—
177.
Ogura H. II Sci. Repts Tohoku Univ. Ser. 4.
1964. Vol. 30, N 3—4. P. 219—222.
Ohga I., Sinoto Y. // Bot. Mag. (Tokyo). 1932.
Vol. 46, N 544. P. 311—315.
Oikawa K. // Sci. Repts Tohoku Univ. Ser. 4.
1937. Vol. 11. P. 303—306.
Oikawa К. И Bot. Mag. (Tokyo). 1940. Vol. 54.
P. 366—369.
Oikawa К // Bull. Liberal Arts Dept., Mil. Univ.
1950. Vol. 4. P. 37—43
Oikawa K. // Bull. Liberal Arts Dept., Mil. Univ.
1953. Vol. 10. P. 23—31.
Okimoto M. С. И Bot. Gaz. 1948. Vol. 110. P. 217.
Olszewska M., Gabara B. // Acta Soc. bot. pol.
1966. Vol. 35, N 4. P. 557—573.
Ono Т. И Sci. Repts T6hoku Univ. Ser. 4. 1926.
Vol. 2. P. 93—104.
Ono T. II Sci. Repts Tohoku Univ. Ser. 4.
1928a. Vol. 3. P. 407—415.
310
Ono T. //Bot. Mag. (Tokyo). 1928b. Vol. 42,
N 501. P. 445—448.
Ono Т. И Sci. Repts Tohoku Univ. Ser. 4. 1929.
Vol. 4, N 2. P. 381—393.
Oo K. C, Stumpf P. К. И Lipids. 1979. Vol. 14,
N 2. P. 132—143.
Osagie A. V.t Kates M. // Lipids. 1984. Vol. 19,
N 12. P. 958—965.
Owens S. S., Dickinson H. G. // Ann. Bot. 1983.
Vol. 51, N 1. P. 1 — 16.
Oyewole S. O. // Cytologia. 1984. Vol. 49, N 1.
P. 87—93.
Pace L. II Bot. Gaz. 1907a. Vol. 44, N 5. P. 353—
374.
Pace L. И Bot. Gaz. 1907b. Vol. 48, N 2. P. 126—
135.
Pace L. //Bot. Gaz. 1913. Vol. 56. P. 376—
394.
Pacini E.} Juniper В. Е. // Protoplasma. 1983
Vol. 117, N 1. P. 116—129.
Padhye M. D. // J. Biol. Sci. 1959. Vol. 2.
P. 116—117.
Padhye M. D // Bull. Bot. Soc. Coll. Sci. Nagpur.
1960. Vol. 1. P. 1 — 15.
Padhye M. D. // Bull. Bot. Soc. Coll. Sci. Nagpur.
1962. Vol. 3. P. 92—100.
Padhye M. D. // Proc. Indian Acad. Sci. B. 1968.
Vol. 67, N 2. P. 54—60.
Padhye M D. //Bot. Gaz. 1971. Vol. 132, N 3.
P. 172—179
Padhye M. D., Chaube 5. N. /I Proc. 56th
Indian Sci. Congr. Bombay. 1969. Vol. 3.
P. 362—363.
Padhye M. D., Chaube S. N., Iyer A. V. //
J. Indian Bot. Soc. 1970. Vol. 49, N 1—4.
P. 86—92.
Padhye M. D., Geed L. N., Kaur B. R. // Proc.
56th Indian Sci. Congr. Bombay. 1969. Vol. 3.
P. 363—364.
Padhye M. D., Kasture S. W. // J. Biol. Sci. 1970.
Vol. 13, N 2. P. 37—42.
Padhye M. D., Moharir S. K. // Proc. Indian
Acad. Sci. B. 1958. Vol. 48, N 2 P. 89—95.
Padhye M. D., Rao H. // Bull. Bot. Soc. Coll. Sci.
Nagpur. 1963. Vol. 4, N 1. P. 39—44.
Padmanabhan D. // Phytomorphology. 1987.
Vol. 37, N 2—3. P. 187—190.
Pahuja A. N., Kumar V. // Phytomorphology.
1970. Vol. 20, N 2. P. 97—102
Painter T. S. //Bot Gaz. 1943. Vol. 105, N 1.
P. 58—68.
Palk B. A., Jennings A. C, Morton R. К 11
Austral. J. Biol. Sci. 1963. Vol. 16, N 2.
P. 366—374.
Palm В. И Sv. bot. tidskr. 1920. Vol. 14 P. 261 —
266.
Panchaksharappa M. G. // J. Karnatak Univ. Sci.
1961. Vol. 6. P. 49—56.
Panchaksharappa M. G. // Plant embryology.
A Symposium. GSIR New Delhi, 1962. P. 224—
238.
Panchaksharappa M. G. // Phytomorphology.
1962. Vol. 12, N 4. P. 418—430.
Panchaksharappa M. G. // Phytomorphology.
1966. Vol. 16, N 4. P. 412—417.
Panchaksharappa M. G. // Bull. Indian Nat. Sci.
Acad. 1970. N 41. P. 380—385.
Pande P. C, Singh V. // J. Indian Bot. Soc.
1981. Vol. 60, N 2. P. 160—167.
Panicker Т. К. В. // Curr. Sci. (India). 1965.
Vol. 34, N 21. P. 614—615.
Pankow H. И Flora. 1958. Bd 146 A. S. 240—253.
Pankow #., Guttenberg H. von // Troll W.,
Guttenberg H von Botanishes Studien. Iena,
1957. N 7. S. 1—39.
Pankow H., Guttenberg H. von // Planta. 1959.
Bd 52, N 6. S. 629—643.
Parameswaran N. // Proc. Indian Acad. Sci. B.
1959. Vol. 50, N 1. P. 15—25.
Pardi L.//N. g. bot. Ital. 1937. Vol. 44, N 1.
P. 324—329.
Parker M. L.//Ann. Bot. 1981. Vol. 47, N 2.
P. 181 — 186.
Parks M. И Bull. Torrey Bot. Club. 1935.
Vol. 62. P. 91 — 104.
Pastrana M. D., Santos J. K. 11 Nat. and appl.
Sci. Bull. Philippines Univ. 1931. Vol. 1.
P. 133—144.
Patel C. M., Patel D. S. // J. Guiarat Univ. 1964.
Vol. 7, N 1. P. 58—70.
Paul A. K., Datta R. M. // Philipp. J. Sci. 1953.
Vol. 82. P. 15—18.
Paulson W. И Crop Sci. 1969. Vol. 9, N 1. P. 97—
102.
Pettitt I. M. //Micron. 1976. Vol. 7. P. 21—32.
Pettitt I. M. //Ann. Bot. 1981. Vol. 48. P. 609—
622.
Pfeiffer N. E. // Bot. Gaz. 1914. Vol. 57, N 1.
p 122 135.
Pfeiffer N. E. // Bot. Gaz. 1918. Bd 66. S. 354—
363.
Philip V. /.//Austral. J. Bot. 1968. Vol. 16.
P. 427—431.
Philip V. /. //Curr. Sci. (India). 1972. Vol. 41,
N 4. P. 153.
Philip V. J., Haccius В. Ц Beitr. Biol. Pflanz.
1976. Bd 52, N 1—3. S. 83—100.
Philip V. /., Nainar S. A. Z. // Beitr. Biol.
Pflanz. 1987. Bd 62, N 3. P. 429—440.
Philipson M. N. И N. Z. J. Bot. 1977. Vol. 15, N 4.
P. 777—779.
Philipson M. N. И N. Z. J. Bot. 1978a. Vol. 16,
N 1. P. 45—59.
Philipson M. N. II Protoplasma. 1978b. Vol. 95,
N 4. P. 361—369.
Philipson M. N. II Acta Soc. bot. pol. 1981.
Vol. 50, N 1—2. P. 151 — 160.
Philipson M. N.f Connor H. E // Bot. Gaz. 1984.
Vol. 145, N 1. P. 78—82.
Pi Pai-hsi, Chao Chuan-ying 11 Cytologia. 1974.
Vol 39, N 3. P. 453—465.
Pickett F. L. //Bull. Torrey Bot. Club. 1913.
Vol. 40. P. 229—235.
Pickett F. L. //Mem. Torrey Bot. Club. 1915.
Vol. 16. P. 1—55.
Pickett F. L. И Amer. J. Bot. 1916. Vol. 3, N 8.
P. 461—469.
Piech К II Bull. Acad. pol. sci. B. 1924. S. 113—
123; 605—621.
Piech K. //Bull. Acad. pol. sci. B. 1928a. S. 1 —
43
Piech K. II Planta. 1928b. Bd 6. H. 1. S. 96—117.
Poerck R. A de // Oleagineux. 1950. Vol. 5.
P. 623—628.
Pogan E. II Acta bioi. crac. Ser. bot. 1965. Vol. 8,
N 1. P. 11 — 19.
Pohler W. И Biol. Zentr.-Bl. 1977. Bd 96, N 5.
P. 579—597.
Pointeau A. // Ann. Mussouri hist. nat. Paris.
1809. T. 13. P. 381—400.
Pope M. N. //J. Agr. Res. 1937. Vol. 54, N 7.
p 525 529
Pope M. N. //J. Agr. Res 1943. Vol. 66, N 11.
P. 389—402.
Pope M. N. И J. Amer. Soc. Agron. 1946. Vol. 38,
N 5. P. 432—440.
Porter T. R. И Bot. Gaz. 1936. Vol 98, N 2.
P. 317—327
Posluszny V., Charlton W. A., Jain D. K. //
Bot. J. Linn. Soc. 1986. Vol. 92, N 4. P. 323—
342.
Poulsen V. A. II Vid. medd. naturhist. foren.
Kjobenhavn. 1906. S. 161 — 176.
Powell J. В., Burton G. W. // Crop Sci. 1968.
Vol. 8, N 6. P. 771—773.
Prakash N. // Phytomorphology. 1969. Vol. 19,
N 3. P. 285—291.
Prakash N., Lee-Lee A. // Phytomorphology.
1973. Vol. 23, N 1—2. P. 9—17.
Preda A. // Bull. herb. Boissier. 1897. T. 5, N 1.
P. 948—952
Pritchard A. /.//Austral. J. Agr. Res. 1970.
Vol. 21, N 5. P. 640—652.
Prosina M. N. //Planta. 1930. Bd 12, H. 3.
S. 532—544.
Quisumbing E., Juliano /. B. // Bot. Gaz. 1927.
Vol. 84, N 3. P. 279—293.
Rabau Т., Longly В., Louant B.-P. // Can. J. Bot.
1986. Vol. 64, N 8. P. 1778—1785.
Radermacher A. // Ann. Jard. bot. Buitenzorg.
1925. Vol. 35. P. 1—54.
Raghavan R. S., Rao R. S. // Curr. Sci. (India).
1961. Vol. 30, N 8. P. 310—311.
Raghavan V. // Amer. J. Bot. 1988. Vol. 75, N 2.
P. 183—196.
Raghavan V., Baruah H. K. // J. Indian Bot. Soc.
1956. Vol. 35, N 2. P. 139—151.
Raghavan T S., Venkatasubban K. R. // Proc.
Indian Acad. Sci. B. 1941. Vol. 13, N 4. P. 325—
344.
Radulescu D. // Licrerile gradinii botanice.
Bucuresti, 1972. P. 245—273.
Raju M. V. S. И J. Indian Bot. Soc. 1957.
Vol. 36, N 2. P. 223—226.
Raju M. V. S., Walther A., Quick W. A. // Bot.
Mag. (Tokyo). 1988. Vol 100, N 1061. P. 9—23.
Ramaswamy S. N. // Bull. Indian Nat. Sci. Acad.
1970. Vol. 41. P. 375—379.
Ramaswamy S. N., Swamy B. G. L., Arekal G. D.
II Beitr. Biol. Pflanz. 1980. Bd 55. S. 179—188.
Ramaswamy S. N., Arekal G. D. /./ Plant Syst.
and Evol. 1981a. Vol. 138. P. 175—188.
Ramaswamy S. N., Arekal G. D. // Caryologia.
1981b. Vol. 32, N 2. P. 187—196.
Ramaswamy S. N.t Arekal G. D. // Proc. Indian
Nat. Sci. Acad. 1981c. Vol 47, N 5. P. 682—693.
Ramaswamy S. N., Arekal G. D. // Acta bot.
neer. 1982a. Vol. 31, N 1—2. P. 41—54.
Ramaswamy S. N., Arekal G. D. // Ann. Bot.
1982b. Vol. 49. P. 99—102.
Ramaswamy S. N., Raju M. V. S. // Bull. Torrey
Bot. Club. 1982. Vol. 109, N 3. P. 325—329.
Ramiah K., Parthasarathy N., Ramanujam S. //
Indian J. Agr. Sci. 1935. Vol. 5, N 2. P. 119—
124.
Randolph L. F. // J. Agr. Res. 1936. Vol. 53, N 12.
P. 881—916.
Rangasamy K. // J. Indian Bot. Soc. 1934.
Vol. 13, N 1. P. 129—148.
Rao A. N.l/Стт. Sci. (India). 1951. Vol. 20,
N 6. P. 162—163.
Rao A. N. И Phytomorphology. 1953. Vol. 3, N 1,
2. P. 121 — 126.
Rao A. N. H Sci. and Cult. 1954. Vol. 20, N 3.
P. 143—144.
Rao A. N.//J. Indian Bot. Soc. 1955. Vol. 34,
N 3 P 213 221
Rao A. N. II Experimentia. 1964. Bd 20. S. 388.
Rao А. ЛЛ//Phytomorphology. 1967. Vol. 17.
P. 291—300.
Rao A. N., Sindhe (Late), Arekal G. D. //
Curr. Sci. (India). 1980. Vol. 49, N 23. P. 914—
915
Rao A. N., Wee Y. С // New Phytol. 1979. Vol. 83,
N 2. P. 485—497.
311
Rao С. V. //Nature. 1955. Vol. 175, N 4453.
P. 432—433.
Rao С V.//Curr. Sci. (India). 1955. Vol. 24,
N 11. P. 381—382.
Rao C. V. II Proc. Nat. Inst. Sci. India. B.
1959a. Vol. 25, N 3. P. 143—168.
Rao С V. И J. Indian Bot. Soc. 1959b. Vol. 38,
N 1. P. 46—75.
Rao N. G., Murty U. R. // Indian J. Genet.
1972. Vol. 32, N 3. P. 379—383.
Rao N. G., Narayana L. L., Reddy R. N. //
Caryologia. 1978. Vol. 31, N 4 P. 427—433.
Rao P., Kaur A. // Proc. Indian Nat. Sci. Acad.
B. 1979a. Vol. 45, N 2. P. 175—187.
Rao P., Kaur A. // Phytomorphology. 1979b.
Vol. 29, N 2. P. 93—97.
Rao P. R., Mohana Rao К. M. //
Phytomorphology. 1984. Vol. 34, N 1—4. P. 237—242
Rau N. S. H J. Indian Bot. Soc. 1930. Vol. 9, N 1.
P. 79—113.
Reddy G. ЛЛ, Kulkarni A. R. // Proc. Indian
Acad. Sci. 1985. Vol. 95, N 3. P. 153—166
Reddy G. N., Kulkarni A. R. // Curr. Sci.
(India). 1989. Vol. 58, N 3. P. 156—157.
Reddy P. S. et ai // Bot. Gaz. 1969. Vol. 130, N 3
P. 162—165.
Reed H. S. // Bot. Gaz. 1903. Vol. 35. P. 215—
222.
Reeder J. R. // Amer. J. Bot. 1957. Vol. 44, N 9.
P. 756—768.
Reeder J. R. // Amer. J. Bot. 1962. Vol. 49, N 6,
pt 1. P. 639—641.
Reeves R. G. // Amer. J. Bot. 1928. Vol. 15.
P. 114—122.
Reddy N. R., Narayana L. L., Rao N. G. // Proc.
Indian Acad. Sci. B. 1979. Vol. 88, N 6, pt 6.
P. 455—461.
Regen L. // Bull. Torrey Bot. Club. 1941. Vol. 68.
P. 229—236.
Ren Ling, Wan Fu-xiong (Wan Fu-hsiung) //
Acta phytotaxon. sinica. 1987. Vol. 29, N 1.
P. 14—21
Riddle L. C. // Ohio Natur. 1905. Vol. 5. P. 304—
305.
Riley H. P. И Trans. Amer. Micros. Soc. 1942.
Vol. 61. P. 328—335.
Robbins W., Borthwick H. // Bot. Gaz. 1925
Vol. 80. P. 426—438.
Robert R. В. И Amer. J. Bot. 1969. Vol. 56, N 8.
p ggj g^g
Robert R. B. II Amer. J. Bot. 1970. Vol. 57, N 6,
pt 1. P. 708—715.
Robertson B. L. // J. Sth. Afr. Bot. 1976a. Vol. 42,
N 2. P. 97—108.
Robertson B. L. // J. Sth. Afr. Bot. 1976b. Vol. 42,
N 3. P. 173—184.
Robertson B. L. // J. Sth. Afr. Bot. 1976c. Vol. 42,
N 4. P. 285—299.
Rodkiewicz B. // Acta Soc. bot. pol. 1961. Vol. 30,
N 3—4. P. 749—754.
Rodkiewicz B. // Bull. Soc. sci. et lett. £odz.
1968a. Vol. 19. P. 1 — 10.
Rodkiewicz B. // Bull. Acad. pol. sci. Ser. sci.
biol. 1968b. Vol. 16, N 10. P. 663—665.
Rodkiewicz B. // Bull. Acad. pol. sci. Ser. sci.
biol. 1975. Vol. 23a. P. 707—711.
Rodkiewicz В., Bednara J. // Phytomorphology.
1976. Vol. 26, N 3. P. 276—281.
Rodkiewicz В., Gorska-Brylass A. // Natur-
wissenschaften. 1967. H. 18. S. 499—500
Rodkiewicz В., Kadej F. // Bull. Acad. pol. sci.
Ser. sci. biol. 1971. Vol. 19, N 9. P. 601—604
Rodkiewicz В., Mikulska E. // Flora. 1964. Bd
154, Abt. A, H. 2. S. 383—387.
Rodkiewicz В., Mikulska E. // Flora 1965a
Bd 155, Abt. A, H. 3. S. 341—346
Rodkiewicz В., Mikulska E. // Planta. 1965b.
Bd 67, H. 3. S. 297—304.
Rodkiewicz В , Mikulska E. / / Flora. 1966a
Bd 156, Abt. A, H. 5. S. 510—520.
Rodkiewicz В., Mikulska E. // Bull. Soc. sci.
et lett. todz. 1966b. Vol. 17, N 3. P. 1 — 12.
Rodkiewicz В., Mikulska E. // Flora. 1967.
Bd 158, Abt. A, H. 2. S. 181 — 188.
Rodkiewicz В., Stobiecka H. // Bull. Acad. pol.
sci. Ser. sci. biol 1978. Vol. 26, N 2. P. 107—
110.
Rodrigo P. И Philipp. Agr. 1926 Vol. 14. P. 629—
630.
Rodriguez-Garcia M. I. // Pollen et spores. 1978.
Vol. 20, N 4. P. 467—484.
Rodriguez-Garcia M. I, Garcia A. // Biol. Cell.
1978. Vol. 33, N 1. P. 63—70.
Rohnbach P. // Bot. Ztg. 1870. Jahrg. 28, N 29
S. 479—480.
Roscoe M. V. И Bot. Gaz. 1927. Vol. 84. P. 392—
406.
Rosenberg O. 11 Medd. Stockholms Hogsk. Bot.
Inst. 1901a. P. 1—21.
Rosenberg O. // Kgl. sv. vetenskaps akad. handl
1901b. Bd 27. P. 1—26.
Rosenberg O. // Hereditas 1946. Vol. 32, N 1.
P. 65—92.
Rosendahl С. О. // Minn Bot. Stud. 1909.
Vol. 4. P. 1—9.
Ross W. M, Wilson J. A. //Crop Sci. 1969.
Vol. 9, N 6. P. 842—843.
Rost Th. L. И Protoplasma 1971. Vol. 73, N 3—
4. P. 475—479.
Roth I. И Flora. 1955. Vol. 42. P. 564—600.
Roth I. И Flora. 1957. Bd 144, N 2. S. 163—212.
Roth I. II Recent advances in botany. Montreal,
1961. P. 96—99.
Rowley J. R. И Grana palynol. 1959. Vol. 2, N 1.
P. 3—31.
Rowley J. R //Grana palynol. 1963. Vol. 4.
P. 25—36.
Rubsamen T. // Dissertationes Botanicae. 1986.
Bd 92. S. 1—310.
Rudall P. G., Owens S. G.t Kenton A. Y. //
Plant Syst. and Evol. 1984. Vol. 148, N 1—2.
P. 119—134.
Rudramaniyappa С. К., Panchaksharappa M. G.
II J. Sth. Afr. Bot. Newslands, 1980. Vol. 46,
N 1. P. 33—43.
Rudramuniyappa С. К-, Panchaksharappa M. G.
//Beitr. Biol. Pflanz. 1982. Bd 57, N 2.
5 193 203.
Russell S. P. I /Can J. Bot. 1979. Vol. 57,
N 10. P. 1093—1110.
Ryczkowski M. И Bull. Soc. bot. France. 1978.
T. 125, N 1/2. P. 285—288.
Ryczkowski M., Szewczyk E. // Bull. Acad. pol.
sci. Ser. sci. biol. 1972. Vol. 20, N 1. P 49—53.
Ryczkowski M., Szewczyk E // Bull. Acad. pol.
sci. Ser. sci. biol. 1973. CI. V. Vol. 21, N 10.
Sabiro Yasugi // Amer. J. Bot. 1983. Vol. 70, N 4.
P. 555—560.
Sachar R. C., Arora V. // Bot. Gaz 1963.
Vol. 124, N 5. P. 353—360.
Sadie S., Okereke О U.//Ann. Bot. 1975.
Vol. 39, N 161. P. 597—604.
Sahashi N., Ikuse M.//S. Jap. Bot. 1974.
Vol. 49, N 2. P. 54—62.
Saini H. S., Aspinall D. // Ann. Bot. 1981.
Vol. 48, N 5. P. 623—633.
Sakai A. // Cytologia. 1969. Vol 34, N 4.
P. 593—604.
312
Sane Y. К. //J. Indian Bot. Soc. 1939. Vol 18,
N 2. P. 79—92.
Sanger J. M„ Jackson W. T. //J. Cell Sci. 1971.
Vol. 8, N 2. P. 289—301, 303—315, 317—329.
Santos J. K. II Philipp. J. Sci. 1928. Vol. 37,
N 4. P. 417—437.
Santos J K. II Cytologia. 1937 Fujii Jubl.
P 822—835.
Sapre A. B. // Sci. and Cult. 1970. Vol. 36, N 4.
p 225 226.
Saran Sunil, De Wet J. M // Can. J. Bot. 1969.
Vol. 47, N 7. P. 1205—1206.
Sargant E. //Ann. Bot 1896. Vol. 10. P. 107—
108; 445—477
Sargant E. //Ann Bot. 1897. Vol. 11. P. 187—
224.
Sato Shin-ichi // Jap. J. Genet. 1985. Vol. 60, N 1.
P. 53—61.
Sato Shin-ichi // Jap. J Genet. 1986. Vol. 61,
N 1. P. 83—87.
Satyamurthy T V Ch // Phytomorphology.
1985. Vol. 35, N 1—2. P. 11 — 15.
Satyamurty T. V. Ch., Seshavatharam V. //
Curr. Sci. (India). 1983 Vol. 52, N 22.
P. 1072—1073.
Savina G. I (Савина Г. И.) // Ann Univ. et
ARERS. 1971 Vol. 9. P. 62—66.
Savina G I. (Савина Г. И.) // Proc Indian Nat.
Sci. Acad. 1978 Vol 44B P 141 — 145.
Sawesh Kumar Sood // Proc. Indian Acad. Sci.
1986. Vol 96, N 6. P. 487—494.
Sawyer M. K. II Bot. Gaz 1917. Vol. 64. P. 159—
164.
Sax K. //Bull. Torrey Bot. Club 1916 Vol. 43,
N 10. P. 505—522.
Sax /C., Edmonds H. №.//Bot. Gaz. 1933.
Vol. 95, N 1. P. 156—163
Schachner J //Flora. 1924. N. F. 17. Bd 117.
S. 16—40.
Schaffner J. //.//Bot. Gaz. 1896. Vol. 21.
p 123 132
Schaffner J. H // Bot Gaz. 1897. Vol. 23.
p 252 273* 430 452.
Schaffner J H //Bot. Gaz. 1897 Vol. 24, N 1.
p 93 Ю2.
Schaffner J. //. // Bot. Gaz. 1901. Vol. 31, N 5
P. 369—387
Schel J H /V., Kieft H , Van Lammeren A A M.
II Can. J. Bot 1984. Vol. 62, N 12. P. 2842—
2853.
Schlimbach H. // Flora. 1924. Bd 117. S. 41—54.
Shadowsky A E. // Ber. Dtsch. bot. Ges 1925.
Bd 43. S. 361—365.
Schlimbach H. // Flora. 1924. Bd 117. S. 41—54.
Schlatter /.//Vierteljahresschr. Naturforsch.
Ges. Zurich. 1957. Jahrg. 102, N 1. S 38.
Schmid E. // Naturwissenschaften. 1917. Bd 5,
H. 39 S 605—610.
Schmidhauser T. // Ber. Schweiz. bot. Ges 1955.
Bd 65. S. 302—342.
Schnarf К. И Osterr. bot. Ztschr. 1928. Bd 77.
S. 173—177.
Schnarf К. И S. B. Acad. Wiss. Wien. 1929.
Bd 138. S. 69—92.
Schnarf K., Wunderlich R. // Flora. 1939. Bd 33.
g 297 327.
Schneider H. // Beih. bot. Zentr -Bl. 1932. Bd 49.
S. 649—674.
Schnirlein A. // Flora. 1860. Bd 43. S. 529—532.
Schoenebeck B. // Ber. Dtsch. bot. Ges. 1924.
Bd 42 H. 7. S. 296 299.
Schowalter A. M. // Torreya. 1921. Vol. 21, N 4.
P. 62—63.
Schrober M. B. // Fertilization and embryo-
genesis in ovulated plants. Bratislava, 1983.
P. 101 — 104.
Schroder M. В., Hagemann R. // Proc. 8th
Intern. Symp. Wageningen, 1985. P. 52.
Schurhoff P. N II Ber. Dtsch. bot Ges. 1920.
Bd 38. S. 346—349
Schurhoff P. N. И Ber. Dtsch. bot. Ges. 1922a.
Bd 40, H. 2. S. 60—63.
Schurhoff P. N. И Ber. Dtsch. bot. Ges. 1922b.
Bd 40, H. 10. S. 374—381.
Schurhoff P. N.} Jtissen J. // Ber. Dtsch. bot.
Ges. 1925. Bd 43 S 454—456.
Schwab Ch. A //Can. J. Bot 1971. Vol 49, N 8.
P. 1523—1524.
Schwanitz G. // Pollen et spores. 1967a Vol. 9,
N 1 P. 9—48.
Schwanitz G // Pollen et spores 1967b. Vol 9,
N 2 P 183—209
Seelieb W //Bot. notis. 1924. S 172—178.
Selvaratnam E. M. // Nature. 1952. Vol. 169,
N 4304 P. 714—715.
Serbanescu-Yitarin Gabriela // An. Univ. Bu-
curesti. Biol, veg 1973. N 22. P. 17—24.
Seshagiriah K. N. 11 Curr. Sci. (India). 1932a.
N 1. P. 102.
Seshagiriah К N //Curr. Sci. (India). 1932b.
N 3. P. 205—206.
Seshagiriah K. N.//J Indian Bot. Soc. 1941.
Vol. 20. P. 357—365.
Shadowsky A. E. //Ber Dtsch. bot. Ges 1931.
Bd 49. S. 350—356.
Shah С. /С. // Plant Embryology. A Symposium.
GSIR. New Delhi, 1962 P. 81—93.
Shah С. К II J. Indian Bot. Soc. 1963. Vol. 42,
N 2 P 238 251
Shah C. K. II Nat. Can. 1964. Vol. 35. P. 41—49.
Shah С К. И Phytomorphology. 1965. Vol. 15,
N 1. P. 1—9
Shah С /(., Neelakandan N. // Beitr. Biol.
Pflanz. 1971. Bd 17, H 2. S. 215—227.
Shah С К., Sreekumari S. В // Curr. Sci.
(India). 1980. Vol. 49 P. 284—285.
Shambulingappa К G. 11 J. Agr. Univ. P. R.
1969. Vol. 53, N 2. P 106—112.
Shan С. /С., Pandey S. N. // Phytomorphology.
1978. Vol. 28, N 1. P. 31—42.
Shanthamma С // Bull. Torrey Bot. Club. 1979
Vol. 106, N 2. P. 73—78.
Shanthamma С // Proc. Indian Acad. Sci. Plant
Sci. 1982 Vol. 91, N 1. P. 25—35
Shanthamma C, Narayan К N // Ann. Bot.
1977. Vol. 41, N 172. P. 469—470.
Sharma A. K-, Sharma A //J. Genet. 1958.
Vol. 56, N 1. P. 63—84.
Sharma M. // Palyn. Bull 1965. Vol. 1. P. 45—
48.
Sharp L W И Bot. Gaz. 1912. Vol. 54. P. 372—
385
Shepherd К //J. Hort. Sci. 1954. Vol. 29, N 1.
P. 1 — 11.
Shepherd К //J. Hort. Sci 1960. Vol 35, N 1.
P. 6—20.
Shewry P. R., Pratt H. M., Leggatt M. M.,
Miflin B. Y. H Creal Chemistry. 1979. Vol. 56,
N 2. P. 110—117.
Shnarf R.t Wunderlich R. // Flora. 1939 Vol. 33.
P. 297—327.
Shobha P., Sindne A., Nagabhushana Rao//
Curr. Sci. (India). 1986. Vol. 55, N 12. P. 573—
574.
Shoda S. P., Bhanwra K. // Proc. Indian Nat
Sci. Acad. 1980. Vol. 46B, N 4. P. 572—578.
Sienicka A. //Acta Soc. bot. pol. 1929. Vol. 6
N 3. P. 296—334.
313
SilvaB. L. И Ceylon J. Sci. Ser. A. 1945. Vol. 12,
N 2. P. 155—159.
Sllva Stort M. N.t Dos Santos Pavanelli E. A //
Ann. Bot. 1985. Vol. 55, N 3. P. 331 Ш
Slmmonds N. W. // J. Genet. 1961. Vol. 57, N 2-
3. P. 269—278
Simoncioli C. //Giorn. Bot. Ital. 1974. Vol. 108,
N 3—4. P. 175—189.
Simonet M. // Bull. biol. France et Belg. 1932.
T. 66. P. 255—444.
Simonet M. // Ann. sci. natur. Bot. et biol.
veget. 1934. Ser. 10. T. 16. P. 231—383.
Slmonl D. II Lav. Inst. bot. Gen. Univ. Zurigo.
1937. T. 22, fasc. 1. P. 1—72.
Simpson M. G. II Amer. J. Bot. 1988. Vol. 75,
N 9. P. 1394—1408.
Singh В. И Bull. Nat. Bot. Gard. Lucknow.
1964. N 89. P. 1 — 115.
Singh R., Jullano Blenvenldo // Plant Physiol.
1977. Vol. 59, N 3. P. 417—421.
Slsodla К. Р. И Sci. and Cult. 1969. Vol. 35, N 12.
P. 684—685.
Skallnska M. // Acta biol. crac. Ser. bot. 1959.
Vol. 2. P. 91 — 112.
Skvarla J. /., Larson D. A. // Science. 1963.
Vol. 140, N 3563. P. 173—175.
Sladky L. H. II Biologia Plantarum Praha. 1976.
T. 18, N 6. P. 469—472.
Smart M. G., O'Brien T. P. et al. // Protoplasma.
1983. Vol. 114, N 1—2. P. 1 — 13.
Smith А. И Bot. Gaz. 1896. Vol. 22. P. 402—403.
Smith F. H. И Amer. J. Bot. 1933. Vol. 20, N 5.
P. 341—347.
Smith F. H. И Amer. J. Bot. 1942. Vol. 29, N 8.
P. 657—663.
Smith F. H. //Amer. J. Bot. 1955. Vol. 42, N 3.
p 213 222.
Smith P. M. )l Bull. Torrey Bot. Club. 1916.
Vol. 43, N 11. P. 545—558.
Smith R. W. И Bot. Gaz. 1898. Vol. 25. P. 324—
337.
Smith R. W. И Bot. Gaz. 1908. Vol. 45. P. 338—
339.
Smith R. W. И Bot. Gaz. 1910. Vol. 49. P. 281 —
289.
Soderberg E. // Sv. bot.tidskr. 1919. Bd 13, N 2.
P. 204—211.
Sokotowska-Kulczycka A. // Acta biol. crac. Ser.
bot. 1965. Vol. 8, N 1. P. 63—81.
Sokotowska-Kulczycka A. // Acta biol. crac. Ser.
bot. 1973. Vol. 16, N 1. P. 85—98.
Sokotowska-Kulczycka A. // Acta biol. crac. Ser.
bot. 1977. Vol. 20, N 1—2. P. 11—24.
Sokotowska-Kulczycka A. 11 Acta biol. crac. Ser.
bot. 1980. Vol. 22, N 1. P. 113—130.
Sokotowska-Kulczycka A. // Acta biol. crac. Ser.
bot. 1985. Vol. 25, N 1. P. 1—7.
Solms-Laubach H. G. // Bot. Ztschr. 1878. Jahrg.
36, Abt 1. S. 65—74; 81—83.
Soltwedel F. // Jen. Ztschr. f. Nat. 1882. Vol. 15.
P. 341—380.
Sood S. К. И J. Plant. Anat. Morphol. 1984.
Vol. 1. P. 69—75.
Sood S. К. И Indian Bot. Contr. 1985. Vol. 2.
P. 65—66.
Sood S. /C.//Curr. Sci. (India). 1983. Vol. 52.
P. 890—891.
Sood S. K., Rao Pladugu R. M. // Bot. Mag.
(Tokyo). 1986. Vol. 99, N 1056. P. 351—359.
Soueges R.I I С г. Acad. sci. (Paris). 1917.
T. 165, N 21. P. 715—717; 1014—1017.
Soueges R. И С. г. Acad. sci. 1923. T. 177.
P. 705—708.
Soueges R. 11 С. г. Acad. sci. 1924a. T. 178.
P. 409—412.
Soueges R. // C. r. Acad. sci. 1924b. T. 179.
P. 198—200.
Soueges R. IIC. r. Acad. sci. 1926a. T. 182.
P. 1344—1346.
Soueges R. II С. г. Acad. sci. 1926b. T. 183.
P. 233—235.
Soueges R. II Bull. Soc. bot. France. 1931a.
T. 78, N9—10. P. 662—681.
Soueges R. 11 Ann. sci. natur. Bot. 1931b. Ser. 10.
T. 13, N 1, 2. P. 353—402.
Soueges R. 11 Bull. Soc. bot. France. 1932.
T. 79, N 1. P. 11—23.
Soueges R. // Bull. Soc. bot. France. 1933. T. 80.
P. 51—69.
Soueges R.I 1С. r. Acad. sci. 1940. T. 211.
P. 232—233.
Soueges R. II С r. Acad. sci. 1943. T. 216, N 22.
P. 746—748.
Soueges R. И С. г. Acad. sci. 1952. T. 234.
P. 1300.
Soueges R. //Ann. sci. natur. Bot. 1954. Ser. 2.
T. 15. P. 1—20.
Soueges R. 11 C. r. Acad. sci. 1958. T. 246, N 14.
P. 2082—2086; N 17. P. 2436—2440.
Soueges R. 11 C. r. Acad. sci. 1959a. T. 248, N 1.
P. 45—49.
Soueges R. 11 С. г. Acad. sci. 1959b. T. 248.
P. 1896—1900.
Souvre A., Albertini L. // Bull. Soc. bot. France.
1978. N 1—2. P. 33—37.
Souvre A., Albertini L. // Rev. cytol. et biol.
veg. 1982. T. 5. P. 151 — 169.
Souvre A., Albertini L. // Fertilization and
embryogenesis in ovulated plant. VEDA.
Bratislava, Tcheslovaquie, 1983. P. 69—75.
Souvre A., Albertini L., Grenet-Auberger H. //
Acta Soc. bot. pol. 1981. Vol. 50. P. 89—97.
Spangler R. С // Bot. Gaz. 1925. Vol. 79.
P. 217—221.
Sparrow A. H., Pond V., Kojan S. // Amer. J.
Bot! 1955. Vol. 42, N 4. P. 384—394.
Stack S. И Bull. Torrey Bot. Club. 1971. Vol. 98,
N 4. P. 207—214.
Stapf O. II Trans. Linn. Soc. London (Bot).
1904. Vol. 6. P. 401.
Steer M. W. // J. Cell Sci. 1977. Vol. 25. P. 125—
138.
Stefanlak B. // Acta Soc. bot. pol. 1984. Vol. 53.
P. 11 — 16.
Steffen /(.//Flora. 1953. Bd 140. S. 140—174.
Stenar H. // Sv. bot. tidskr. 1924. Bd 18.
P. 524; 526—527.
Stenar H. Embryologische Studien. I u. II: I. Zur
Embryologie einiger Columniferen. II. Die
Embryologie der Amaryllideen : Diss. Uppsala,
1925
Stenar H. // Sv. bot. tidskr. 1927a. Bd 21, H. 3.
S. 344—360.
Stenar H.I / Bot. notis. 1927b. Bd 16, H. 1.
S. 104—114.
Stenar H. // Sv. bot. tidskr. 1928a. Bd 22, H. 1 —
2. S. 145—159.
Stenar H. // Bot. notis. 1928b. S. 357—378.
Stenar H. // Bot. notis. 1931. S. 51—54.
Stenar H. //Ark. bot. 1932a. Bd 25A. S. 1—8.
Stenar H. // Sv. bot. tidskr. 1932b. Bd 26, H. 1 —
2 s 25 44
Stenar H. // Bot. notis. 1933. S. 520—530.
Stenar H. // Bot. notis. 1935a. H. 1—2. S. 78—86.
Stenar H. // Ark. bot. 1935b. Bd 26A, N 08. S. 1 —
20.
Stenar H. // Heimbyg. tidskr. Jamten. 1937—
1938. S. 177—221.
Stenar H. // Sv. bot. tidskr. 1938. Bd 32, H. 3.
S. 274—282.
314
Stenar H. //Bot. notis. 1941. H. 1. S. 123—128.
Stenar H. // Heimbyg. tidskr. Fornv. 1942. Bd 8.
S. 183—195.
Stenar H. // Heimbyg. tidskr. Jamten. 1948.
S. 184—189.
Stenar H. //Acta horti berg. 1949. Bd 15, N 3.
S. 45—63.
Stenar H. // Acta horti berg. 1950. Bd 15, N 8.
S. 169—184.
Stenar H. //Acta horti berg. 1951a. Bd 16, N 2.
С CO 70
Stenar H. // Bot. notis. 1951b. H. 3. S. 209—228.
Stenar H. //Acta horti berg. 1952. Bd 16.
S. 219—232.
Stenar H. // Phytomorphology. 1953. Vol. 3, N 3.
p 325 338.
Stephen J. // Sci. and Cult. 1973. Vol. 39, N 7.
p 323 324
Stevenson D. W. M. // Amer. J. Bot. 1983.
Vol. 70, N 5. P. 32.
Stevenson D. W., Owens S. S. // Bot. J. Linn.
Soc. 1978. Vol. 77, N 3. P. 157—175.
Stewart J. G., Rudenberg L. // Amer. J. Bot.
1980. Vol. 67, N 6. P. 949—954.
Steyn E. //J. Sth. Afr. Bot. 1973. Bd 39, H. 2.
S. 113—121; H. 3. S. 235—243.
Stiffler E G. // Bot. Gaz. 1925. Vol. 79. P. 207—
216.
Stoddart J. L. //J. Agr. Sci. 1964. Vol. 62, N 1.
P. 67—72.
Stoddart J. L. //J. Agr. Sci. 1965. Vol. 65, N 3.
P. 365—370.
Stone В. С II Webbia Raccolta S. Bot. 1969.
Vol. 23, N 2. P. 597—607.
Stout A. B. //Arch. f. Zellf. 1913. Bd 9, H. 1.
P 114—140.
Stort S. M. N., Dos Santes Pavanelli E. A. //
Ann. Bot. 1985. Vol. 55, N 3. P. 331—336.
Stover E. С. И Ohio J. Sci. 1937. Vol. 37. P. 172—
184.
Stow I. И Cytologia. 1930. Vol. 1, N 4. P. 417—
439.
Stow I. И Cytologia. 1934. Vol. 5, N 1. P. 88—
108.
Strasburger E. // Arch. mikr. Anat. 1882. Bd 21.
S. 497—611.
Stromberg B. // Sv. bot. tidskr. 1956. Bd 50,
H. 1. S. 129—134
Subramanyam K., Govindu H. C. // J. Indian
Bot. Soc. 1949. Vol. 28, N 1. P. 36—41.
Siiessenguth К Beitrage zur Frage des systema-
tischen Anschlusses des Monocotylen: Diss.
Munchen, 1919; Beih bot. Zentr.-Bl. 1921.
Bd 38, Abt. II, N 1. S 1—79.
Suessenguth К I/ Flora. 1921. Bd 119. S. 313—
328.
Suita N. II Cytologia. 1937. Fujii Jubl. P. 920—
933.
Suita N. //'Cytologia. 1938. Vol. 8. P. 532—541.
Sunderland N., Roberts M., Evans L. J.,
Wildon D. С//J. Exp. Bot. 1979. Vol. 30,
N 119. P. 1133—1144.
Sugihara Y., Yoshimura H., Ymesu N. //
Phytomorphology. 1969. Vol. 19, N 2. P. 112—114.
Sulbha /(.//Phytomorphology. 1954a. Vol. 4,
N 1, 2. P. 180—191.
Sulbha K. //Curr Sci. (India). 1954b. Vol. 23,
N 3. P. 98—99.
Sundar Rao Y.//J. Indian Bot. Soc. 1940.
Vol. 19, N 5—6. P. 273—282.
Sundara R.//Curr. Sci. (India). 1971. N 20.
P. 554—555.
Suri R. K., Jain P. P., Sharma В. /С. // Indian
Forest. 1986. Vol. 112, N 2. P. 135—138.
Svedelius N. // Ann. Roy. Bot. Gdns. Peradeniya,
1904. Vol. 2. P. 267—297.
Svedelius N. // Sv. bot. tidskr. 1910. Bd 4.
5 225 252.
Svoma E. // Linz. biol. Beitr. 1981. Bd 13, N 1.
S. 81.
Swamy B. G. L. // Curr. Sci. (India). 1942.
Vol. 11. P. 109.
Swamy В G. L. // Curr. Sci. (India). 1944.
Vol. 13. P. 103—104.
Swamy B. G. L.//J. Indian Bot. Soc. 1944.
Vol. 23. P. 66—70.
Swamy B. G. L. // Bot. Gaz. 1945. Vol 107, N 2.
P. 291—295.
Swamy B. G. L. // Ann. Bot. 1946a. Vol. 9.
P. 171 — 183.
Swamy B. G. L. // Proc. Nat. Inst. Sci. India B.
1946b. Vol. 12. P. 187—190.
Swamy B. G. L. // New Phytol. 1946c. Vol. 45,
N 1. P. 132—136.
Swamy B. G. L. // Proc. Nat. Inst. Sci. India
B. 1946d. Vol. 12. P. 413—426.
Swamy B. G. L. // Bot. Gaz. 1947. Vol. 108.
P. 449—456.
Swamy B. G. L. // Lloydia. 1948a. Vol. 11, N 3.
P. 149—162.
Swamy B. G. L. // Cellule. 1948b. T. 52, fasc. 1.
P. 7—14.
Swamy B. G. L. // Amer. Midland Natur. 1949a.
Vol. 41. P. 184—232.
Swamy B. G. L. // Bull. Torrey Bot. Club. 1949b.
Vol 76, N 1. P. 17—23.
Swamy B. G. L. // Beitr. Biol, pflanz. 1963.
Bd 39, H. 1. S. 1 — 16.
Swamy B. G. L. // Phytomorphology. 1980.
Vol 30, N 2—3. P. 204—212.
Swamy B. G. L., Krishnamurthy K. V. 11
Phytomorphology. 1973. Vol. 23, N 1, 2. P. 74—
79.
Swamy B. G. L., Lakshmanan К. К. // Ann. Bot.
1962a. Vol. 26, N 102. P. 243—249.
Swamy B. G. L., Lakshmanan K. K- // J. Indian
Bot. Soc. 1962b. Vol. 41, N 2. P. 247—267.
Swamy B. G., Parameswaran N. // Osterr. bot.
Ztsch. 1962. Bd 109, H. 3. P. 344—349.
Swamy В., Parameswaran N. // Biol. Rew. 1963.
Vol. 38, N 1. P. 1—50.
Swingle W Т. И J. Heredity. 1928. Vol. 19, N 6.
P. 257—268.
Syamasundar J., Panchaksharappa M. G. //
Cytologia. 1975. Vol. 40, N 2. P. 371—376.
Syamasundar J., Panchaksharappa M. G. //
Cytologia. 1976. Vol. 41, N 1. P. 123—130.
Szidat L. // Bot. Arch. 1922. Bd 1, N 1. S. 29—46.
Tackholm G., Soderberg E. // Sv. bot. tidskr.
1918. Bd 12, H. 2. S. 189—201.
Tai W. //Amer. J. Bot. 1970. Vol. 57, N 10.
P. 1160—1169.
Takahashi M. // Amer. J. Bot. 1982. Vol. 69, N 7.
P. 1185—1195.
Takahashi M. // Bot. Mag. (Tokyo). 1984.
Vol. 97, N 1046. P. 233—245.
Takahashi M. // Amer. J. Bot. 1987. Vol. 74, N 12.
P. 1842—1852.
Takahashi M., Sohma K. // Sci. Repts Tohoku
Univ. Ser. 4. 1979. Vol. 37, N 4. P. 273—281.
Takaso Т., Bouman F. // Acta bot. neer. 1984.
Vol. 33, N 4. P. 519—533.
Takeuchi Y., Kimura Ch. // Sci. Repts Tohoku
Univ. Ser. 4. 1968. Vol. 34, N 2—4. P. 137—
140.
Tanaka L, Taguchi Т., Ito M. // Bot. Mag.
(Tokyo). 1979. Vol. 92, N 1028. P. 291—298.
Tanaka N.//Jap. J. Genet. 1939a. Vol. 15.
P. 153—157.
315
Tanaka N. // Bot Mag. (Tokyo). 1939b. Vol. 53.
P. 480—487.
Tanaka N. // Cytologia. 1940. Vol. 10, N 3.
P. 348—362.
Tanaka N. //Bot. Mag. (Tokyo). 1941. Vol. 55.
P. 55—65.
Tandon S., Kapoor В. М. // Curr. Sci. (India)
1961. Vol. 30, N 2. P. 72—73.
Tandon S. L., Kapoor B. M. // Sci. and Cult.
1962a. Vol. 28. P. 189—190.
Tandon S. L., Kapoor B. M. // Caryologia.
1962b. Vol. 15. P. 21—41.
Tandon S. L., Kapoor В. M. // Caryologia. 1963.
Vol. 16, N 2. P. 377—395.
Tang Xi-hua, Shen Rui-juan, Cao Mei-sheng //
Acta phytophysiol. 1980. Vol. 6, N 1. P 57—66.
Tangl E. I/ Denkschr. Kais Akad. Wiss. 1882
Bd 45 S. 73—94.
Tarkowska J. A. //Acta Soc. bot pol. 1976
Vol. 45, N 3. P. 211—283.
Tarkowska J. A // Bull. Soc. bot France. 1978
T. 125, N 1—2. P. 289—293.
Taylor W. Д.//Amer. J. Bot 1921. Vol. 8.
P. 502—506.
Taylor A. R. A. //Can. J. Bot. 1957. Vol. 35.
P. 477—499.
Tejavathi D. H. // Beitr. Biol. Pflanz. 1987.
Bd 62, N 1. S. 43—55.
Tellini-Bataglia G., Di Cristo-Maggini V //
Ann. Bot. 1972. Vol. 31. P. 125—131.
Terada S. // J. Coll. Agr. Hokkaido. Imp. Univ.
Sapporo. Japan. 1928. Vol. 19. P. 245—260.
Tieghem P. van// Ann sci. natur. Bot. 1872.
T 15. P. 237—276.
Tieghem P. van // Ann. sci. natur. Bot. 1897.
Vol. 8, N 3. P. 259—309.
Tiemann A. Untersuchungen zur Embryologie,
Blutenmorphologie und Systematic der Rapa-
teaceen und der Xyridaceen — Gattung Abol-
boda (Monocotyledoneae). Diss. Bot. 1985.
Bd 82.
Tilton V. R. /I Amer. J. Bot 1968. Vol. 68, N 7.
p ggQ 9Q3
Tilton V. R. //Can J. Bot 1980a Vol. 58, N 17.
P. 1872—1884.
Tilton V R. И Can. J. Bot. 1980b. Vol 58, N 19.
P. 2059—2066.
Tilton V. R. И New Phytol. 1981 Vol. 88, N 3.
P. 459—476; 505—531
Tilton V. R., Horner H. T. // Amer. J. Bot. 1980.
Vol. 67, N 7. P. 1113—1131.
Tilton V. R., Lersten N R. // New Phytol. 1981.
Vol. 88, N 3. P. 439—457; 477—504.
Tilton V. R., Mogensen H. L. // Phytomorpho-
logy 1979. Vol. 29, N 2—3. P. 338—350.
Timm H. // Planta. 1928. Bd 5. S. 784—
810.
Tischler G. // Verh. Nat.-Med. Ver Heidelberg.
1900. Bd 6. S. 351—380.
Tischler G. //Arch f. Zellf. 1910. Bd 5, H. 4.
S. 622—670.
Tischler G. // Jb. wiss. Bot. 1913. Bd 52, H. 1.
S. 1—84.
Tischler G. // Jb. wiss. Bot. 1915. Bd 55, H 1.
S. 52—90.
Tiwari D. K.//J. Indian Bot. Soc. 1969a.
Vol. 47, N 3—4. P. 264—271.
Tiwari D. K. //J Biol. Sci. 1969b. Vol. 12, N 2.
P. 21—30.
Tiwari S. C, Gunning В. Е. S //Ann. Bot.
(USA). 1986. Vol. 57, N 4. P 557—563.
Tohda H. II Sci. Repts Tohoku Univ Ser. 4.
1971a. Vol. 35, N 4. P. 239—243.
Tohda H. II Sci. Repts Tohoku Univ. Ser. 4.
1971b. Vol. 35. P. 245—251.
Tohda H. I/ Sci. Repts Tohoku Univ Ser. 4.
1974a. Vol. 37. P. 71—77.
Tohda H I/ Sci. Repts Tohoku Univ. Ser. 4.
1974b. Vol. 37. P. 79—87
Toilliez-Genoud J. // Adansonia. 1965. Vol 5,
N 4. P. 525—530.
Tomita K. // Sci. Repts Tohoku Univ Ser. 4.
1931. Vol. 6. P. 163—169.
Trankowsky D. // Planta. 1930. Vol. 12, N 145
P. 1 — 18.
Trella-Sawicka Z. 11 Acta biol. crac Ser. bot.
1981. Vol. 23. P. 15—23.
Trella-Sawicka Z. 11 Acta biol. crac. Ser. bot.
1985. Col. 27. P. 75—81.
Treub M. //Ann. Jard. bot. Buitenzorg. 1883.
Bd 3. S. 120—122.
Treub M , Mellink J. // Arch. neer. Sci exact.
et natur. 1880. T. 5. P. 452—457.
Troll W. //Flora. 1928. Bd 23 S. 321—343.
Troll W. И Flora. 1931. Bd 25, N 3. S. 427—456.
Tschermak-Woess E:// Osterr. bot Ztschr. 1947.
Bd 94, H. 1—2. S 128—135.
Tulasne L. R. // Ann. sci. natur. Bot. 1855.
Ser. 4. Vol. 3. P 65—74
Tuschnjakova M. // Planta. 1929. Bd 7, H. 1.
5 29 44.
Tut'in T. G.//New Phytol. 1938. Vol. 37, N 1.
P. 50—71.
Untawale A. G., Deshpande Т., Sharma К. В //
J. Indian Bot. Soc. 1969. Vol. 48, N 3—4.
P. 386—392.
Untawale A. G., Makde K. H. // Curr. Sci.
(India) 1971. Vol. 40, N 12 P. 327—328.
Untawale A G., Makde К H. // J. Indian Bot.
Soc 1984. Vol. 63, N 3. P. 298—305.
Vallade J. M. // С. г. Acad. sci. 1966. Ser. D.
T. 262, N 8. P. 856—859, N 9. P. 989—992.
Vallade J // Rev. cytol. et biol veg. 1969. T. 32,
N 3—4. P. 343—352.
Varitcjak B. // Bull. Acad Sci. mathem et
natur B. Sci. natur. Belgrade 1940. N 6.
P 97—105.
Vazard B. // Bull. Soc. bot. France. 1978. T. 125,
N 1—2. P. 39—43.
Vazart B. // Rev. cytol. et biol. veg. 1955 T. 16,
N 3—4. P. 209—406.
Vazart B. // Rev. gen. bot. 1956. T. 63. P. 1 — 11.
Veken P."van der//Bull. Jard bot. Elat Brux.
1965 Vol 25. P. 143—147.
Venkatesh С S. // Curr Sci. (India). 1952.
Vol. 21, N 8. P. 225—226.
Venkatesh С S. // Bot. notis 1956. N 2. P. 75—
82.
Venkateswarlu J. // J. Indian Bot. Soc. 1937.
Vol. 16. P. 95—98.
Venkateswarlu J, Devi P. I. // Curr. Sci.
(India). 1964. Vol. 33 P 104—106.
Venkateswarlu S , Devi P. S, Nirmala A //
Proc Indian Acad. Sci В 1980 Vol 89, N 5.
P. 361—367.
Venkateswarlu J., Raju C. // J. Indian Bot. Soc.
1958. Vol. 37, N 2. P. 290—299.
Venkateswarlu J., Rao P N //Ann. Bot 1975.
Vol. 39. P. 1131 — 1160.
Venkateswarlu J., Rao N. P. // The nucleus.
1976. Vol. 19, N 3. P. 150—152.
Venter H A van de // J. Sth. Air. Bot. 1976
Vol. 42, N 1 P. 25—31.
Veyret Y. // Bull Soc bot. France 1956. T. 103,
N 3—4 P. 120—126.
Veyret Y // C. r. Acad. sci. 1957. T. 244, N 7.
P. 930—933.
Veyret Y. Embryogenie comparee et blastogenie
chez les Orchidaceae — Monandrae. Paris,
1965.
316
Veyret Y // С. г. Acad. sci. 1974. Ser. D. T. 280,
N 24. P. 2761—2763.
Veyret Y. // Bull Soc bot France. 1976. T. 123
P. 137—144
Veyret Y. // Bull. Mus. natur hist natur Ser. 4.
1981. Sect. B. Adansonia N 2. P. 179—184.
Vijayaraghavan M. R., Kapoor-Tripat // Aquat.
Bot. 1985. Vol. 22, N 1. P. 45—60.
Vijayaraghavan M R, Kumari A. V. //
J. Indian Bot. Soc. 1974. Vol. 53. P. 292—302.
VigodskyA. /I N G bot Ital. 1936. N S. Vol 43,
N 3. P. 707—734.
Vij S. P., Sharma Madhu // Phytomorphology.
1987. Vol. 37, N 1 P. 81—86.
Vijayaraghavan M R., Kumari A V. // J Indian
Bot Soc. 1974. Vol. 53. P. 292—302.
Vijendra D. L. D // Curr. Sci. (India) 1969.
Vol. 38, N 10. P. 248—249.
Vijendra L. D., Rangaswamy S. R. // N. Z J. Bot.
1977. Vol. 15. P 61
Vijendra D.f Sree R //Acta bot. neer. 1978.
Vol. 27, N 1. P. 61—68.
Voigt P. W., Bashaw E. С // Crop Sci. 1972.
Vol. 12, N 6. P. 843—847.
Vos M. P. de И У Sth. Afr. Bot 1948. Vol 14.
P. 159—169
Vos M. P. de // 3. Sth Afr Bot. 1949. Vol. 15.
p 13 22
Vos M. P. de II J. Sth. Afr. Bot. 1950. Vol. 46,
N 7. P. 220—226.
Vos M. P. de И J. Sth. Afr Bot 1956. Vol. 22.
P 41—63.
Vos M. P. de II Recent Advances in Botany
Toronto, 1961. P. 694—698.
Vos M. P. de И J. Sth. Afr. Bot. 1963. Vol. 29,
pt 1—4. P. 79—90.
Vosa С G. И Caryologia. 1972. Vol 25, N 3.
P 277—281.
Wada Т., Maeda E A. //Jap J. Crop Sci. 1981.
Vol. 50, N 2. P. 199—209.
Wafai B. A. Cytoembryology of some species of
the genera Tulipa and Fritillaria: Diss
Srinagar, 1977.
Wafai B. A., Koul А. К // Phytomorphology.
1982. Vol. 32, N 4. P. 289—301.
Wafai B. A., Koul A. /(.//Phytomorphology.
1986. Vol. 34, N 1. P. 64—49.
Wager A. V. // Trans. Roy. Soc. Sth. Afr. 1928
Vol. 16. P. 191—204.
Wakabayashi F. 11 J Jap. Bot. 1959. Vol. 34, N 5.
p 153 157
Wakakuwa S. /I Jap. J. Bot. 1934. Vol. 7.
P. 151 — 186.
Walker R I. // Bull. Torrey Bot Club. 1944.
Vol. 71, N 5. P. 529—535
Walter R. //Acta biol. crac. Ser. bot. 1980.
Vol. 22, N 1 P. 7—20
Wang Yao-zhi, Cheng Kuo-chang // Chih Wu
Hsueh Pao. 1983. Vol. 25, N 2 P 115—119.
Wankhede D. В., Shehnaj A., Raghavendra Rao
M. R И Qual. plant. 1979. Vol 28, N 4.
p 293 303
Ward H. M. II Quart J. Micr Sci. 1880. Vol. 20.
P. 1 — 18
Warmke H. E. // Amer. J. Bot 1954 Vol. 41,
N 1. P. 5—11.
Watkind G M. // Amer. J. Bot. 1937 Vol. 24
P. 481—484.
Weatherwax P. // Bull. Torrey Bot. Club. 1919.
Vol. 46. P 73—90.
Weatherwax P. 11 Bull. Torrey Bot. Club. 1926.
Vol. 53. P. 381—384.
Weatherwax P. // Amer J. Bot. 1930. Vol. 17.
P. 371—380.
Weatherwax P. // Corn and corn improvement,
Sprague, Y. F., Ed. Acad. Press. Inc.
Publisgers, New York. 1955. P. 89—121.
Weaver N. // Tex. A and M Coll. 1943.
Weber E. //Bot. Arch. 1929. Bd 25, H. 1—2.
S. 1—44
Wee Y. C, Rao A. N.//Curr. Sci. (India).
1974. Vol 43, N 6 P 171 — 173.
Weimarck G. // Bot notis. 1967. Vol. 120, N 2.
P. 209—235; N 4. P. 448—455
Weimarck G. // Bot. notis. 1970. Vol. 123, N 4.
P. 495—504.
Weinzieher S Ц Flora. 1914. Bd 106. N. F. 6.
g 393 432.
Welsford E. J 'И Ann. Bot. 1914. Vol. 28, N 110.
P. 265—270.
Weniger W. // Bot Gaz. 1918 Vol. 66. P. 259—
268.
Went F A. F. C, Blaauw A. H. // Rec. trav.
bot. neer. 1906. Vol. 2. P. 223—234.
Westergard M // С. г trav. Lab. Carlsberg.
Ser. Physiol. 1936 T. 21, N 18. P. 437—451
Westfall /. /. //Bot. Gaz. 1940. Vol. 101, N 3.
P. 550—581.
Whallon J. H. Microsporogenesis in Hordeum
compressum: microspore and tapetum from the
tetrad stage to pollen mitosis: Diss Abstr
intern. B. Ann. Arbot. 1980. Vol 40, N 12, pt 1.
P. 5523
White P R. //Ztschr. Zellforsch. 1928. Bd 7,
H. 5. S. 673—733.
Whitehead M. R., Brown С A // Amer. J. Bot.
1940. Vol. 27. P. 199—203.
Wieczorek E., Bijak A , Morawiecka B. //
Acta Soc. bot. pol. 1980 Vol. 49, N 1—2.
P. 85—90.
Wiegand K. M. 11 Bot. Gaz. 1898. Vol. 25.
P. 116—117.
Wiegand K. M. // Bot. Gaz. 1899. Vol. 28.
p 32g 359
Wiegand К // Bot. Gaz. 1900. Vol. 30 P. 25—
47.
Wille N. И Forh. Vodensk.-Selsk. Christ. 1882
(1883). N 16 S. 1—4.
Wille N. //Vid. medd. naturhist. foren. Kj0ben-
havn. 1882—1886. S. 1—4.
Willemse M.T.M, Franssen-Verheijen M. A. W.
II Acta Bot. Neerl. 1986. Vol. 35, N 3. P. 297—
309
Willemse M. T M., Franssen-Verheijen M. A. W.
I/ Ann. Sci. Univ. Reims. 1988a. N 23. P 119—
123.
Willemse M. T. M., Franssen-Verheijen M A. W.
II Sexual reproduction in higher plants
Berlin etc., 1988b. P. 357—362.
Willemse M. T. M., Reznickova S. A 11 Acta
bot. neerl. 1980. Vol. 29, N 2—3. P. 127—140.
Willeams E, Heslop-Harrison J'.,
Dickinson H G. I/ Protoplasma. 1973. Vol. 77, N 1.
p 79 93
Wirz H. //Flora 1910. Bd 101 (N. F. Bd 1).
S. 395—446.
Wi'sniewska E.I /Acta Soc. bot pol. 1931
Vol. 8. P. 157—174.
Wolf F. T. I/ Bull. Torrey Bot. Club 1940.
Vol. 67. P. 755—761.
Woycicki Z.I I C R. Soc Sci. Varsovia. 1911.
Vol. 4. P. 17—23.
Woycicki Z. И Bull. int. Acad. Polon. 1926. Sci.
B. P. 177—188, 535—557.
Woycicki Z. //Acta Soc. bot. pol. 1929. Vol. 6.
P. 195—202.
Woycicki Z. //Acta Soc. bot. pol 1931 Vol. 8.
P. 85—108
Wulff H. D //Jb. wiss. Bot. 1939. Bd 87, H. 4.
S. 533—536.
317
Wulff H D. //Jb. wiss. Bot. 1939. Bd 88, H. 1.
S. 141 — 168.
Wunderlich R. // Osterr. Bot. Ztschr. 1936.
Bd 85. S. 30—55.
Wunderlich R. // Flora. 1937. Bd 132. S. 48—90.
Wunderlich R. // Osterr. bot. Ztschr. 1938. Bd 87.
S. 109—113.
Wunderlich R. // Osterr. Bot. Ztschr. 1950.
Bd 97, H. 1—5. S. 437—502.
Wunderlich R. // Osterr. Bot. Ztschr. 1959.
Bd 101. S. 1—63.
Wylie R. B. //Bot. Gaz. 1904. Vol. 37, N 1.
P. 1—22.
Wylie R. В. И Bull. Lab. Nat. Hist. Univ. Iowa.
1917. Vol. 7. P. 48—58.
Wylie R. B. //Bot. Gaz. 1923. Vol. 75, N 2.
P. 191—202.
Wylie R. B. //Amer. J. Bot. 1941. Vol. 28, N 2.
P. 169—172.
Xi Xiang-yuan // Acta bot. sinica. 1987. N 5.
P. 459—464.
Xi Xiang-yuan, Demason D. A / Amer. J. Bot.
1984. Vol. 71. P. 1067—1079.
Xi Xiang-yuan, De Cai-cui // Bot. Gaz. 1983.
Vol. 144, N 2. P. 191—200.
Xu S. X., Xu X. В., Han H. H. // Sci. sinica.
1983. Ser. B. Vol. 26. P. 255—261.
Yamashita T. // J. Fac. Sci. Univ. Tokyo. 1970
Sect. 3. Vol. 10. P. 181—205.
Yamashita T. // Beitr. Biol. Pflanz. 1972. Bd 48,
H. 2. S. 157—170.
Yamashita T. // Proc. Jap. Soc. Plant Taxo-
nomists. 1974. Vol. 3. S. 20—22.
Yamashita T. // Beitr. Biol. Pflanz. 1976a. Bd 52,
N 1—3. S. 217—226.
Yamashita T. //J. Fac. Sci. Univ. Tokyo. 1976b.
Vol. 3, N 12. P. 37—64
Yamaura A. // Bot. Mag. (Tokyo). 1933. Bd 47.
g 55j 555
Yasui K., Suita N.//Bot. Mag. (Tokyo). 1939.
Vol 54, N 6. P. 521—524.
Yasui K., Sawada N. // Bot. Mag. (Tokyo). 1940.
Vol. 54. P 96—102.
Yasuyoshi T. // Sci. Rpts Tohoku Univ. Ser. 4.
1977. Vol. 35. P. 225—229.
Yoshioka M., Maeda Masuo, Ito Michio // Bot.
Mag. (Tokyo). 1981. Vol. 94, N 1036. P. 371 —
378.
Young B. A., Schulz-Schaeffer, Carroll T W. //
Can. J. Bot. 1979. Vol. 57, N 6. P. 602—619.
Young B. A., Sherwood R. Т., Bashaw E. С //
Can. J. Bot. 1979. Vol. 57, N 15. P. 1668—1672.
Zabihska D. // Acta biol. crac. Ser. bot. 1972.
Vol. 15, N 2. P. 177—190.
Zaman B. // Proc. Indian Acad. Sci. B. 1950.
Vol. 31, N 4. P. 223—234.
Zavada M., Xue Lin Xu, Edwards J. M. //
Rhodora. 1983. Vol. 85, N 842. P. 73—81.
Zeid F A. // Z. Pflanzenernahr. und Bodenk.
1973. Bd 135, N 3. S. 208—219.
Zeleznak K., Varriano-Marston E. // Amer. J.
Bot. 1982. Vol. 69, N 8 P. 1306—1313.
Zeven A. C, Heemert С van // Euphytica. 1970.
Vol. 19. P. 175—179.
Zhang Ting-bi//Chlh Wu Hsueh Pao. 1983.
Vol. 25, N 2. P. 187—191.
Zhu Zhi-ping, Shen Rui-juan, Tanh Xi-hua //
Chih Wu Hsueh Pao. 1980. Vol. 22, N 2.
P. 122—126.
УКАЗАТЕЛЬ ЛАТИНСКИХ
НАЗВАНИЙ РАСТЕНИЙ
Аа achalensis 178
Abolboda 195, 197
— americana 197, 198
— grandis 195, 197, 198
Achlyphila 197, 198
Acorus calamus 275, 277
Actinophloeus (=Drymophloeus) 257, 265
— ambiguus 265
— macarthurii (=Ptychosperma macarthurii)
255, 257, 259, 263—265
Aegilops 218
— squarrosa 231
Aframomum 241
— melegueta 242
Agapanthus 80, 82
— umbellatus 76, 81—83
Agavaceae 102—105
Agave 102
— attenuata 107
— chloracantha 107
— dasylirioides 107
— lechuguilla 102, 106, 107
— parryi 102—104, 106, 107
— sisalana 106, 107
— virginica 103, 106, 107
— zapupe 107
Aglaonema 275
— versicolor 277
— sp. 277
Agropyron cristatum 231
— repens 231
Agrostis interrupta 228, 231
— pilosula 231
— vulgaris 231
Aiphanes caryotifolia 265
— erosa (=Martinezia erosa) 265
Albuca 67, 72
— transvaalensis 65, 66, 73
Alectorurus 109, 112
Aletris 59, 61, 62
— aurea 59, 62
— farinosa 62
— foliata 62
Alisma 16, 19, 20
— lanceolatum 20
— plantago 20
— plantago-aquatica 16, 17, 20
Alismataceae 16—19
Alismatales 5
Alliaceae 76, 78—80
Allium 80—83
— aflatunense 78, 82, 83
— caspium 76
— сера 78, 80—83
— decipiens 82, 83
— fetisovii 82, 83
— fistulosum 78, 83
— govanianum 81—83
— neapolitanum 81, 83
— nigrum 82, 83
— nutans 76, 81—83
— odorum 81—83
— oleraceum 78, 83
— rotundum 80, 81, 83
— sativum 81—83
— schoenoprasum 81—83
— schubertii 82, 83
— senescens 78, 83
— textile 76, 78, 81—83
— triquetrum 81, 83
— unifolium 81, 83
— ursinum 76, 80, 81, 83
— victorialis 76, 83
Aloe 108, 109, 111
— africana 109, 110, 112
— arborescens 111, 112
— brownii 112
— caesia 111, 112
— ciliaris 108—110, 112
— commutata 109, 112
— de Wetii 109, 112
— duckerii 108—112
— grandidentata 109, 112
— humilis 112
— macrocarpa 109, 112
— todari var. proecox 111, 112
— variegata 112
— varvari 111, 112
— vera 109, 112
Alopecurus pratensis 231
— vertricosus 231
Alpinia alata 242
— calcarata 238, 240, 242
— mutica 241, 242
— nutans 241, 242
Alstroemeria 74
— aurantiaca 74
— pelegrina 74
— pulchella (=A. psittacina) 74
Alstroemeriaceae 74
Althenia 44, 50
— filiformis 44, 45, 47
Amaryllidaceae 87—93
Amaryllis belladonna 92, 94
— longifolia 96
— vittata 96
Amianthium 61
— muscaetoxicum 59, 60, 62
Amischophacelus axillaris 202—204
— cucullata 202, 204
Ammophila arenaria 231
— baltica 231
Amomum 238, 241
— daniellii 242
— dealbatum 238, 242
— elongatum ( = Donacodes elongata) 242
Amphibolis 50
— antarctica 50, 51
— griffithii 51
Ananas comosus 180
319
— sativa var. microcephala 180
Anarthria laevis 212
Androcymbium 83
Andropogon ischaemum 231
Aneilema beninense 198, 199, 203, 204
— paniculatum 202—204
— spiratum 202—204
Anigozanthos 135
— flavidus 135—138
Anthericum 109, 112
Anthurium violaceum 277
Aphyllanthaceae 113
Aphyllanthes monspeliensis 113
Aponogeton abyssinicus 24
— crispus 24
— distachys 24
— guillotii 24
— madagascariensis 24
— monostachyon 24
— quadrangularis 24
— ulvaceus 24
— violaceus 24
Aponogetonaceae 24
Apteria 169
— aphylla (=A. setacea) 165, 169
Araceae 275—279
Arachnites uniflora 169—171
Arales 275
Archontophoenix cunninghamiana 265
Areca 257, 263, 264
— catechu 255, 257, 259, 262, 265
— concinna 255, 265
— triandra 255, 257, 265
Arecaceae 255, 257—263
Arecales 255
Arecastrum romanzoffiana 265
Arenga pinnata 265
Argyropsis 94
— Candida 88, 94—96
Aricuryroba schizophylla 265
Arisaema 275
— dracontium 277
— sp. 277
— triphyllum 277
— wallichianum 275, 277
Arisarum vulgare 277
Arrhenatherum elatius 230, 231
Arthropodium 109, 112
Arum 275, 277
— italicum 275
— korolkovii 275—277
— maculatum 276, 277
Arundinaria 231
Arundinella raddi 231
Arundo 231
Asparagaceae 114—124
Asparagus 119
— officinalis 122
— plumosus 121, 122
— racemosus 122
— sprengeri 122
— virgatus 116, 117, 122
Asphodelaceae 108—111
Asphodeline 109
— lutea 109, 112
— taurica 109, 112
Asphodelus 108, 109, 111, 112
— albus 112
— fistulosus 108—110, 112
— ramosus 108—110
— tenuifolius 108, 109, 112
Aspidistra elatior 119, 121, 122
Astrocaryum rostratum 265
Atherurus ternatus (=Pinellia ternata) 277
Attalea speciosa 265
320
Avena fatua 231
— sativa 217
— strigosa 231
Bactris major 257, 263, 265
Bambusa arundinacea 231
Barbacenia fragrans 143
Belamcanda chinensis 129, 134
Bellevalia lipskyi 63, 64, 73
Behnia 150
Beschorneria decosteriana 107
Blandfordia 97
— nobilis 97, 98
Bletilla shepherdii 178
— striata 177, 178
Blyxa 20
— echinosperma 21, 23
— octandra 20, 23
— oryzetorum 20, 23
Bomarea caldasii 74
Borassus flabellifer 255, 265
Bothriochloa ischaemum 231
— odorata 231
Bouteloua hirsuta 231
— pectinata 231
Bowiea 67
— volubilis 65, 71, 73
Brachiaria ruziziensis 231
Brachychilum horsfieldii 242
Briza minor 231
Brodiaea 80—83
— coronaria 76, 81, 83
— elegans 81, 83
— peduncularis 83
Bromeliaceae 180, 182
Bromeliales 180
Bromus inermis 231
Broughtonia sanguinea 178
Brunswigia minor 92, 96
Bulbine 109, 111
— alooides 109, 112
— annua 112
— frutescens 112
Bulbostylis barbata 188, 192
Buphane disticha 94, 96
Burbidgea 242
Burmannia 165, 169
— bicolor 165, 166, 169
— Candida 168
— championii 166, 168, 169 i
— coelestis 166, 168, 169
— dasyantha 165, 169
— densiflora 165, 168
— disticha 165, 168, 169
— grandiflora 165, 166, 168, 169
— longifolia 169
— oblonga 165
— tenella 165, 166
— vanpesana 169
Burmanniaceae 165—169
Burmanniales 165
Butomaceae 5, 7
Butomopsis ( = Tenagocharis) lanceolata 14, 16
Butomus umbellatus 14
Calamagrostis obtusata 231
— purpurea 231
Calamus 265
Calanthe aristulifera 177, 178
— discolor 178
— torifera 178
—veitchii 173, 177, 178
Calathea 247, 248, 251—254
— louisae 247, 254
— picturata 248, 254
Calla 275
— palastris 277
Calochortus 59, 61
— amobilis 59, 60, 62
amoenus 60, 62
— plummerae 60, 62
— umbellatus 60, 62
Calopodon pulchellus 178
Calostemma cunninghamii 95, 96
— purpureum 95, 96
— sp. 96
Calypso bulbosa 178
Calyptrocalyx spicatus 265
— sp. 263
Calyptronoma dulcis (=Geonoma dulcis)
Camassia 67, 72
— leichtlinii 66, 73
— quamash 63, 71, 73
Campylosiphon 169
— purpurascens 165
Campynema 138, 140
— lineare 139, 141
Cannaceae 245, 246
Canna 247
— discolor 247
— generalis 247
— glauca 247
— humilis 245, 247
— indica 247
— indica x C. sp. 245, 247
— lutea 247
— polymorpha 247
— sp. 245, 247
Cannomois virgata 212
Capillipedium huegelii 231
Cardiocrinum 70, 72
— cordatum 73
— giganteum 73
Carex 192
— alopecuroides 191
— ciliato-marginata 188
— pendula 191
Carludovica 267
— latifolia 267
— macropoda 267
— rivularis 267
Cartonema spicatum 202, 204
Caryota 259, 262
— furfuracea 265
— mitis 255, 259, 265
— urens 255, 257, 265
Cenchrus grancus 231
— madulics 231
Centrolepidaceae 212, 213
Centrolepis aristata 213, 214
— ciliata 214
— fascicularis 214
— glabra 213, 214
— miniata 213, 214
— paleida 214
— polygyna 213, 214
— strigosa 214
— tenuior 212, 214
Cephalanthera 172
— damasonium 178
— erecta 178
— longifolia 178
— rubra 178
Cephalostemon angustatus 195
Ceratochloa 231
Chamaedorea arenbergiana 265
— concolor 263, 265
— corallina 265
— glaucophylla (=Ch. glaucifolia) 265
— karwinskyana 265
— latifolia 260, 265
— oblongata 265
— sartorii 265
Chamaerops 255
— humilis 257, 265
Chamorchis alpina 178
Chionodoxa luciliae 73
Chloris gayana 231
Chlorogalum 72
— pomeridianum 66, 73
Chlorophytum 109, 112
Chondropetalum hookerianum 210, 212
— mucronatum 212
— nudum 212
Chrysalidocarpus 257
— lucubensis 255, 257, 264, 265
— lutescens (=Areca lutescens) 255, 257, 259,
262—265
— propinquus 265
Clintonia 117, 120, 121
— andrewsiana 122
— dorealis 122
— udensis 122
— umbellulata 114, 122
— uniflora 114, 122
Clivia 87, 90
— gardeni 96
— miniata 95, 96
— nobilis 95, 96
Coccothrinax crinita (=Thrinax crinita) 257, 265
Cocos 257, 262—264
— nucifera 255, 257, 259, 260, 264, 265
— plumosa 255, 257, 265
— schizophylla 255, 265
Coeloglossum viride 178
Coix aquatica 231
— lacryma-jobi 231
Colchicum 61
— autumnale 61, 62
— speciosum 61, 62
Coleospadix oninensis 265
Coleotrype natalensis 202, 204
Colocasia antiquorum 277
Commelina 198, 202—204
— angustifolia 203, 204
— benghalensis 198, 202—204
— forscalaei 198, 202—204
— stricta 203, 204
— subulata 198, 199, 202—204
Commelinaceae 198—200
Commelinales 193
Commelinantia 198, 203
— anomala 203, 204
— pringlei 202—204
Conostylis 135
— dealbata 138
Convallaria majalis 120, 122
Cooperia drummondii 94—96
— pedunculata 95, 96
— smallii 95 06
Corallorhiza maculata 178
Cordyline 127
— australis 125, 127
— rubra 126, 127
— stricta 127
— terminalis 124, 125, 127
Corsiaceae 169, 170
Corsia cf. lamellata 170, 171
— sp. 170, 171
— unguiculata 170, 171
Cortaderia 225, 231
Costaceae 242—244
21 Зак. 2144
321
Costus 244
— cuspidatus (=Costus igneus) 243, 244
— cylindricus 242, 244
— igneus 242, 244
— malortieanus 244
— speciosus 242—244
— sp. 242
Cremastra appendiculata 178
Crinum 94
— asiaticum 94—96
— broussoneti 95, 96
— capense 95, 96
— curvifolia 96
— defixum 87, 95, 96
— latifolium, 92, 96
— pratense 95, 96
Crocus 131
— sativus 134
— sieberi 129, 131, 134
— speciosus 134
— vernus 131, 134
Croomia 151
— pauciflora 151
Cryptanthus acaulis 180
— bivittatus 180
Ctenanthe 247, 252
— lubbersiana 247, 248, 254
Curculigo 138, 140, 141
— crassifolia 141
— recurvata 139, 140
Curcuma aromatica 241, 242
— colorata 238, 242
Cyanastraceae 129
Cyanastrum cordifolium 129
— johnstoni 129
Cyanella 127
— capensis 128, 129
Cyanotis axillaris 198, 202—204
— cristata 202—204
— cucullata 203, 204
— tuberosa 202, 204
Cyclanthaceae 267
Cyclanthales 267
Cyclanthus 267
— cristatus 267
Cymbidium 173
— bicolor 173, 178
Cymbocarpa saccata 169
Cymbopogon citriodorus 231
Cymodocea ciliata 51
— isoetifolia 50, 51
— nodosa 51
Cymodoceaceae 50, 51
Cynodon dactylon 231
Cyperaceae 188
Cyperales 188
Cyperus 191, 192
— alternifolius 188, 191
— articulatus 188
— iria 188, 191 г
— tegetum 188
Cypripedium 172, 178
— insigne 172, 173, 177, 178
— parviflorum 177, 178
— spectabile 177, 178
Cyrtanthus parviflorus 95, 96
— sanguineus 94, 96
Dactylis glomerata 231
Dactyloctenium aegyptium 231
Daiswa, 151, 152
— hainanensis 151, 154, 159
— lancifolia (=Paris lancifoiia) 156, 159
— polyphylla (=Paris polyphylla) 159
322
— sp. 159
Damasonium alisma 20
— stellatum 20
Danae 119, 121
— racemosa 117, 122
Dasylirion 124, 125, 127
— acrotrichum 127
— glaucophyllum 125—127
— quadrangulatum 127
Dendrobium anosmum 178
— farmed 178
— macrostachyum 178
— nobile 173, 177
Dendrochilum sp. 177
Desmostachya bipinnata 231
Dianella 97, 98
— nemorosa 97
— sp. 98
— tasmanica 97, 98
Diarrhena 231
Dichanthium (=Andropogon)
— annulatum 231
— aristatum 231
— intermedium 231
Dichronema pubera 191, 192
Dicranopygium 267
Dictyostega orobanchioides 169
Dieffenbachia 275
— seguine 275, 277
Digitaria polevansi 232
Dilatris 135
— pillansii 135, 137, 138
Dioscoreaceae 160
Dioscorea bulbifera 160
— caucasica 160
— hirtiflora 160
— izuensis 160
— nipponica 160
— odoratissima 160
— oppositifolia 160
— praehensilis 160
— preussii 160, 161
— quinqueloba 161
— septemloba 160, 161
— tokoro 160, 161
— villosa 160, 161
Dipcadi 72
— montanum 63, 64, 66, 71, 73
— serotinum 73
Diplacrum caricinum 188, 192
— radicans 192
Disporum hooked 117, 119, 122
sessile 119 122
— smilacinuni 114, 117, 119, 121, 122
Distichia muscoides 187
Donacodes elongata 241
Doritis pulcherrima 177, 178
Doryanthaceae 107
Doryanthes excelsa 107
— palmeri 107
Dracaena 124, 126, 127
— fragrans 127
— grandis 127
— hookeriana 127
— surculosa 125, 127
Dracaenaceae 124—126
Drfrniopsis 67
— barteri 73
— kirki 73
— maculata 71, 73
Dypsis madagascariensis 265
Echeandia 109, 112
Echinochloa crus-galli 232
— frumentacea 232
— stagnina 232
Echinodorus 16
— macrophyllus 17, 20
— ranunculoides 16, 20
Eichhornia 144
— crassipes 144, 147
Elaeis guineensis 255, 259, 262, 263, 265
Elegia asperiflora var. lacerata 212
— capensis 210, 212
— parviflora 212
— persistens 212
— racemosa 210, 212
— stipularis 212
— vaginulata 212
Eleocharis (=Heleocharis) geniculata 11
— palustris 192
— plantaginea 188, 192
— prolifera 191, 192
— vivipara 191, 192
Eleorchis japonica 178
Elettaria 238, 241
— cardamomum 238, 240—242
— sp. 241
Eleusine africana 232
— compressa 232
— coracana 232
— indica 232
Eleutherine plicata 129, 134
Elisma natans 20
Elodea canadensis 20, 23
Elymus arenarius 232
— giganteus 232
— virginicus 232
Elytrophorus spicatus 232
Eminium 275
— alberti 275—277
Enalus acoroides 21, 23
Ephippianthus schmidtii 178
Epidendrum nocturnum 178
— prismatocarpum 178
— scufella 175, 177, 178
— variegatum 172, 173
Epipactis 172
— atrorubens 175, 177, 178
— latifolia 178
— palustris 172, 178
— pubescens 178
— rubra 178
Epipogium 175
— aphyllum 178
Eragrostis cilianensis 232
— curvula 232
— unioloides 232
Eremopogon foveolatus 232
Eremurus 109, 111
— himalaicus 108, 112
— robustus 112
— tauricus 112
Eriocaulaceae 206, 207, 209
Eriocaulales 206
Eriocaulon cinereum 206, 209
— hookerianum 206, 207, 209
— quinquangulare 206, 209
— robusto-brownianum 206, 207, 209
— septangulare 207, 209
— setaceum 209
— sexangulare 209
— truncatum 206, 209
— xeranthemum 206, 207, 209
Eriophorum angustifolium 192
Erythronium 67, 70, 72, 73
— albidum 70
— americanum 64, 70
— dens-canis 70
— revolutum 64, 73
— sibiricum 72
Eucharis amazonica 92, 96
Eucomis 72, 73
— punctata 66
Eulophia epidendraea 178
Eulophidium sandersianum 178
Eustachys glauca 232
— petraeus 232
Eustephia 96
Eustrephus 150
— latifolius 150
Euterpe 265
Evodianthus (=Carludovica) 267
1, 192 Festuca microstachys 232
— pratensis 232
Fimbristylis dichotoma 192
— diphylla 192
— monostachya 192
— quinquangularis 192
— tetragona 191, 192
Flagellaria indica 210
Flagellariaceae 210
Floscopa scandens 199, 202—204
Forbesia 140
— plicata 141
Fourcroya depauperata 96
Freycinetia funicularis 268—270
— javanica 268, 270
Fritillaria 70—72
— meleagroides 64, 72
— pudica 72
Fuirena trilobites 191, 192
Furcraea andina 102, 106, 107
— cubensis 107
Gagea 66, 70, 72
— chomutovae 72
— fascicularis (=G. lutea) 65
— minima 66
— parva 72
— stipitata 64, 70, 72
Gaimardia setacea 213, 214
Galanthus 87, 90, 94
— caspius 96
— caucasicus 96
— imperati 87, 96
— nivalis 87, 88, 94, 96
— woronowii 87, 88, 96
Galeola septentrionalis 172, 177
Galtonia 72
— candicans 71, 73
Garcanthus pallidus 178
Gasteria 109, 111
— carinata 109, 112
— decipiens 109, 112
— verrucosa 112
Gastrodia elata 178
Geitonoplesium 150
— cymosum 150
Gibasis karwinskyana 202, 204
— venustula 198, 201—204
Gladiolus x hybridus 129, 130, 134
Globba bracteata 242
— bulbifera 242
Gloriosa 59—61
— rothschildiana 62
— superba 62
— virescens 59, 60, 62
Goodyera repens 178
Gymnadenia 172, 178
— camtschatica 178
323
21*
— conopsea 173, 178
Gymnosiphon breviflorus 169
— divaricatus 165, 169
— guianensis 165, 169
— niveus 168
— suaveolens 165, 169
Habenaria densa 172, 178
Habranthus 94
— andersoni 94
— andersoni var. texanus 88, 94—96
— chilensis 95, 96
— chillopsis 96
— robustus 95, 96
Haemanthus 87, 94
— albiflos 95, 96
— katherinae 88, 95, 96
— tigrinus 96
Haemodoraceae 134—138
Haemodorum 138
Halodule (=Diplanthera) 50, 51
— pinifolia 51
— uninervis 50, 51
Halophila 20
— ovata 21, 23
— stipulacea 23
Hanguana malayana 114
Hanguanaceae 113
Haworthia 111, 112
Hedychium 241
— acuminatum 238, 241, 242
— coronarium 238, 241, 242
— gardnerianum 242
— spicatum 242
Heliconia bihai 238
Heliconiaceae 238
Heloniopsis 60, 62
— breviscapa 62
Hemerocallidaceae 83—85
Hemerocallis 83, 84, 87
— aurantiaca 87
— citrina 83, 84, 87
— elmusae 87
— flava 87
— fulva 83, 84, 87
— hybrida 83, 84, 87
— lutea 87
— middendorffii 87
— vermusae 87
Herreria montevidensis 63
— salsaparilha 63
— stellata 63
Herreriaceae 63
Hesperocallis 80, 81, 83
— undulata 81, 83
Hetaeria nitida 173, 178
— shikokiana 178
Heteranthera 144
— dubia 147
— graminea 147
— limosa 144, 147
— reniformis 147
Heterospathe elata 265
Hexapterella gentianoides 169
Hierochloe alpina 232
— australis 232
— monticola 232
— odorata 232
Himantoglossum hircinum 178
Hippeastrum aulicum 95, 96
— hybridum 88
Hitchenia 238, 241, 242
— caulina 238, 240—242
Hordeum 232
— vulgare 224, 225
Hosta (=Funkia) 102
— albomarginata 102—104, 106, 107
Howea 257
— belmoreana ( = Kentia belmoreana) 255, 257,
263, 265
Hyacinthus 72
— amethystinus 73
— orientalis 64, 65, 73
— romanus 65, 71, 73
Hydatella australis 215, 216
— inconspicua (=Trithuria inconspicua) 215,
216
Hydatellaceae 215
Hydatellales 215
Hydrilla verticillata 20, 23
Hydrocharis morsus-ranae 23
Hydrocharitaceae 20—22
Hydrocleis nymphoides 16
Hymenocallis caribaea 95, 96
— chiapasiana 95, 96
— glauca 95, 96
— howardii 95, 96
— maximilliani 95, 96
— mexicana 95, 96
— occidentalis 92, 96
— ovata 95, 96
— rutilum 96
— sono'rensis 95, 96
Hyophorbe lagenicaulis 265
Hyphaene indica 255, 257, 259, 260, 265
— ventricosa 265
Hypodiscus argenteus 212
— aristatus 210, 212
— digitata 212
— latariflora 212
Hypolytrum latifolium 192
Hypoxidaceae 138—140
Hypoxis 138, 140
— aurea 140, 141
— decumbens 140, 141 ^
— villosa 141
lanthe 140, 141
— alba 141
— aquatica 140, 141
— minuta 141
— schlechteri 141
Iphigenia 60, 61
— indica 59—62
Iridaceae 129—133
Iridodictyum reticulatum 134
Iris chamaeiris 131, 134
— fulva 131, 134
— germanica 134
— hexagona var. giganticoerulea 131, 134
— japonica 129, 131, 134
— munzji 134
— pallida 134
— primula 134
— pseudacorus 129—134
— pumila 133, 134
— sambucina 134
— sibirica 134
— tenax 131, 133
— versicolor 130, 134
Isolepis prolifera 191, 192
— thouarsii 191, 192
Ixiolirion 87
— montanum 94, 96
— pallasii 96
— tataricum 96
324
Jansenella griffithiana 232
Joinvilleaceae 210
Jubaea spectabilis 265
Jubaeopsis caffra 265
Juncaceae 183—186
Juncaginaceae 28, 30, 31, 33
Juncales 183
Juncus 183, 184, 187
— bufonius 183, 186, 187
— compressus 187
— conglomeratus 187
— effusus 183, 186, 187
— filiformis 183, 187
— glaucus 187
— lampocarpus 187
— prismatocarpus 183, 186, 187
— roemerianus 183, 186, 187
— squarrosus 187
— subnodulosus 187
— tenuis 187
Kaempfera baueri 241, 242
Kniphofia 109
— proecox 112
— uvaria 109, 112
Kobresia bellardi 188, 192
Korolkowia 72
— sewerzowii 73
Kyllinga brevifolia 188, 191, 192
— melanospora 188, 192
— triceps 191, 192
Laccolabium pubescens 178
Lachenalia pendula 73
Lachnanthes caroliniana 135, 136, 138
Lagarosiphon 23
— roxburghii 23
Lagenandra ovata 275, 277
Lapageria 150
— latifolia 150
— rosea 150
Latania loddigesii 265
Laxmannia 109, 112
Lecanorchis japonica 178
Lemna 279, 283, 284
— gibba 282
— minor 280, 282, 284, 285
— paucicostata 280, 282, 284, 285
— perpusilla 284, 285
— trisulca 283, 285
Lemnaceae 279—283
Lepilaena 47
Leptocarpus paniculatus 212
— similis 210, 212
Leucocoryne 81
— ixioides 81, 83
Leucocrinum montanum 84, 87
Leucojum aestivum 96
— vernum 96
Licuala 255, 257, 262
— grandis 255, 257, 263, 265
— peltata 255, 265
— rumphii 265
— spinosa 255, 257, 265
Lilaea 29
— subulata 28, 30, 33
Liliaceae 59, 64—68
Liliales 59
Lilium 65—67, 70, 72, 73
— candidum 63—65, 70
— davidii 63
— henryi 63, 64, 71, 72
— hybridum 63
— kesselringianum 65, 72
— longiflorum 63, 64, 67
— martagon 63
— neilgherrense 66
— regale 70, 71
— tigrinum 67
Limnocharis emarginata 16
Limnocharitaceae 14, 15
Limnophyton 19
— obtusifolium 20
Limodorum 177
— abortivum 173
Lindmania penduliflora 180
Linospadix petrickiana 265
Liriope graminifolia 122
Listera nipponica 177, 178
— ovata 173, 177, 178
Livistona chinensis 255, 257, 259, 263, 265
— olivaeformis 265
— rotundifolia 255, 257, 259, 263, 265
— sp. 255
Lloydia serotina 73
Lolium multiflorum 232
Lomandra 112, 113
— dura 113
— micrantha 113
— rigida 112, 113
Lomatophyllum 109, 112
Lowiaceae 238
Loxococcus rupicola 263, 265
Ludovia 267
Luzula 183, 184, 187
— campestris 187
— forsteri 187
— maxima 187
— multiflora 187
— pedemontana 183, 187
— pilosa 183, 187
— purpurea 187
Luzuriaga 150
— latifolia 150
Lycoris 96
Lysichiton sp. 277
Machaerocarpus californicus 20
Maianthemum 117, 120
— bifolium 122
— canadense 122
— dilatatum 122
Maranta 247, 252—254
— arundinacea 254
— leuconeura 247, 248, 254
— veitchii 254
Marantaceae 247—254
Marthella 165
— trinitatis (=Burmannia capitata, — Gymno-
siphon trinitatis) 165, 168, 169
Maschalocephalus 193, 195
— dinklagei 193, 195
Maundia 29
Mayaca 205
Mayacaceae 205
Medeola 70, 72
— virginiana 65, 73
Melanthiaceae 59—62
Melocanna bambusoides 220, 231
Metanarthecium 61
— luteo-virde 62
Mibora minima 232
Miersiella umbellata 165
Mischophloeus paniculata 265
Monochoria 144, 146, 147
— hastaefolia 144, 147
— korsakowii 144, 147
325
— vaginalis 144, 147
Muilla 80—82
— maritima 76, 81, 83
Murdannia simplex 202—204
— versicolor 202—204
Musa acuminata (формы) 237
— acuminata ssp. burmaniaca 237
— arnoldiana 237
— bakeri 237
— balbisiana (формы) 237
— basjoo 237
— cavendishii 237
— coccinea 235, 237
— ensete 237
— errans var. botoan 237
— ornata ssp. sapientum (var. Gros
var. Appelbacove) 236, 237
— patadisiaca ssp. sapientum var. Gro
236, 237
— religiosa 237
— rosea 237
— seminifera 237
Musaceae 135
Muscari 72
— comosum 72, 73
— racemosum 63, 64, 72, 73
Myrmechis japonica 178
Najadaceae 54—56
Najadales 24
Najas 54
— flexilis 54, 56
— graminea 54—56
— guadalupensis 54, 56
— lacerata 55, 56
— major 55, 56
— marina 54, 55
— minor 56
— palustris 54, 56
Narcissus 88
— angustifolius 96
— biflorus 96
— poeticus 96
— pseudonarcissus 96
— tazetta 94, 96
— triandrus 96
Narthecium 59, 61
— asiaticum 62
— ossifragum 62
— scardicum 62
Nechamandra 20
— alternifolia 21, 23
Nenga wendlandiana 265
Neodypsis tsaratananensis 265
Neottia nidus-avis 173, 178
Nephrosperma 257, 263
— vanhoutteanum 265
Nerine 88, 94
— curvifolia 92, 94, 96
— filifolia 87, 94, 96
— undulata 96
Nicolaia atropurpurea 238, 241, 242
Nigritella nigra 178
Nolina 126, 127
— longifolia 127
Notholirion thomsonianum 73
Nothoscordum 80, 83
— bivalve 81, 83
— fragrans 81—83
— striatum 81—83
Nypa 265
— fruticans 255, 259, 260, 265
Odontostomum 127', 128
— hartwegii 128, 129
Oncidium altissimum 178
— praetextum 178
Ophiopogon intermedius 119, 121, 122
— wallichianus 122
Ophrys arachnites 178
— arifera 178
— myodes 178
Orchidaceae 172, 173, 175, 176
Orchidales 172 "
Orchis 172, 178
— latifolia 172, 178
— maculata 177
— mascula 172, 177, 178
Michel, — militaris 172, 173, 178
Orectanthe 197, 198
— sceptrum 197
Oreorchis 177, 178
— patens 177, 178
Ornithogalum 67, 72, 73
— caudatum 65, 66, 71
— gussonii 71
— narbonense 63
— nutans 64, 65, 71
— umbellatum 72
Oryza coarctata 232
— sativa 232
Oryzopsis hendersoni 232
— miliacea 232
Ottelia 20, 21
— alismoides 21, 23
— laucifolia 21, 23
Oxychloe andina 183, 187
Paepalanthus bifidus 209
Pancratium illyricurn 96
— longiflorum 96
— longifolium 95
— maritimum 88, 93—96
— sternbergia 96
— tenuifolium 96
Pandanaceae 268—270
Pandanales 268
Pandanus 270
— atrocarpus 270
— coronatus 270
— dubius 270
— helicopus 270
— militaris var. malayanus 270
— odoratissimus 268, 270
— parvus 268—270
— polycephalus 270
— recurvatus 270
— saint-johnii 270
— spurius 270
— utilis 270
— yvanii 270
Panicum antidotale 232
— maximum 232
— miliaceum 232
— miliare 227, 232
Paphiopedilum 178
— barbatum 178
Pappophorum 232
Paracautleya bhatii 238, 241, 242
Paramongaia 96
Paris 151, 152, 158, 159
— axiallis 159
— incompleta 159
— quadrifolia 153, 154, 159
— sp. 159
Paspalum 232
326
Pauridia 140, 141
— minuta 139—141
Peltandra 275
— undulata 277
— virginica 278
Pennisetum 232
Phaedranassa 96
Phajus grandifolius 178
— minor 178
Phalaroides arundinacea 232
Philesiaceae 150
Philotria 20
Philydraceae 147—149
Philydrum lanuginosum 147—149
Phleum pratense 232
Phoenix 255, 263, 265
— acaulis 264, 265
— canariensis 265
— dactylifera 265
— pusilla (=Ph. zeylanica) 264, 265
— reclinata 264, 265
— robusta 255, 259, 265
— roebelenii 265
— sylvestris 255, 257, 259, 263—265
Phormiaceae 97—101
Phormium 97
— tenax 97, 98
Phragmites 232
Phrynium 252, 254
— capitatum 254
Phyllospadix 52, 54
— iwatensis 52, 54
— torreyi 52, 54
Phyllostachys bambusoides 232
Phytelephas macrocarpa 265
Pinanga disticha 255, 265
— moluccana 265
— patula 265
— sp. 263
Pistia stratiotes 276, 278
Pitcairnia paniculata 180
Platanthera 172
— chlorantha 178
— obtusata 178
— sachalinensis 178
— tipuloides var. nipponica 178
Platyclinis sp. 177
Pleea tenuifolia 62
Pleioblastus distichus 230
Pleiostachya pruinosa 254
Poa 231
— pratensis 231
Poaceae 217, 218, 221, 222, 224, 225, 227, 228
Poales 217
Pogonia japonica 177, 178
— macrophylla 178
Polianthes luberosa 102—104, 106, 107
Pollia sorzogonensis 202—204
Polygonatum 121
— cirrhifolium 119, 122
— commutatum 122
— latifolium 120, 122
— multiflorum 120, 122
— odoratum 120, 122
— pubescens 114, 120—122
— roseum 114, 119, 121, 122
— verticillatum 119, 122
Polystachya flavescens 178
Pontederia 144, 146, 147
— cordata 144, 147
Pontederiaceae 144, 146
Posidoniaceae 34
Potamogeton 34, 37
— crispus 34, 35, 39
— densus 36, 39
— foliosus 34, 35, 39
— indicus 39
— lucens 35, 37, 39
— natans 36, 39
— pectinatus 35, 39
— perfoliatus 34, 35, 39
— pusillus 35, 39
— versus 39
Potamogetonaceae 34—39,
Potarophytum 195
— riparium 195
Pothos 275
— sp. 275
Pritchardia pacifica 255, 257, 265
— sp. 255
Pseudosasa japonica 232
Pterygospermum sp. 265
Ptychococcus paradoxus 265
Puschkinia 72
— scilloides 73
Pycreus globolus var. miligiricus 192
— pumilus 191, 192
— sanguinolentus 191, 192
Pyrrheima fuscata 198, 199, 201—204
Rapateaceae 193, 196
Rapatea friderici-augusti 195
— paludosa 193, 195
— rugulosa 193, 195
— xiphoides 195
Restio callistachyus 212
— cuspidatus 212
— dodii 210, 212
— egregius 212
— sieberi 212
— similis 212
— subverticillatus 212
— triticeus 210, 212
Restionaceae 210
Restionales 210
Rhinopetalum 70
— arianum 73
— bucharicum 73
Rhipogonum scandens 160
Phodea japonica 122
Rhoeo discolor 198, 199, 201—204
— spathacea 198, 201, 202, 204
Rhynchoryza subulata 232
Rhynchospora corymbosa 191, 192
— japonica 192
Romulea 130
— bulbocodium 134
— columnae 134
— maratti 130
— rosea var. reflexa 134
Roscoea 242
Roystonea regia 265
Ruppia 39, 41, 42
— brachypus 40, 42, 44
— maritima (=R. rostellata) 40, 42
— spiralis 42
Ruppiaceae 39—43
Ruscus 121
— aculeatus 117, 120, 122
— hypophyllum 117, 119, 122
— hyrcanus 117, 119, 122
— ponticus 119, 121, 122
Sabal 257, 263
— adansoni 255, 257, 263, 265
— blackburnianum (=S. palmetto) 255, 257,
263, 265
327
— palmetto 255, 257, 263, 265
Saccolabium matsuran 178
Sagittaria 16, 19
— graminea 20
— guayanensis 17, 19, 20
— lancifolia 20
— latifolia 20
— sagittifolia 17, 19, 20
— variabilis 20
Salakka (=Zalacca) edulis (=Zalacca edulis)
265
Sansevieria 124, 126, 127
— cylindrica 127
— ehrenbergii 125, 127
— guineensis 127
— metallica 124, 125, 127
— suffruticosa 125—127
— trifasciata 125, 127
— zeylanica 125, 127
Sasa palmata 230, 232
Saxofridericia aculeata 195
— regalis 193, 195
Scheuchzeria palustris 26, 28
Scheuchzeriaceae 26
Schizachyrium 232
Schizocapsa plantaginea 163, 164
Sciaphila 57
— caudata 57, 58
— japonica 57, 58
— maculata 57, 58
— nana 58
— schwackeana 58
— sp. 57, 58
Scilla 67, 71, 73
— autumnalis 64, 70
— campanulata 71
— cernua 72
— hispanica 68
— hohenackeri 71, 72
— indica 64, 70, 72
— japonica 72
— nonscripta 64, 71
— nutans 71
— obtusifolia 70
— sibirica 64, 65, 67, 71, 72
Scirpus 192
— atrovirens 191
— mucronatus 191
Scleria foliosa 188, 191, 192
— lithosperma 191, 192
— stocksiana 191, 192
Secale 218
— cereale 217, 232
Serapias lingua 178
— pseudocordigera 178
Setaria italica 232
— lutescens 232
— verticillata 232
Setcreasea purpurea 198, 204
Sisyrinchium anceps 131, 134
— californicum 129, 131, 134
— striatum 129, 131, 134
Smilacaceae 159
Smilacales 150
Smilacina amplexicaulis 120, 122
— hirta 119, 122
— racemosa 120, 122
— sessilifolia 122
— stellata 114, 117, 119, 122
— trifolia 117, 119, 122
Smilax herbacea 159, 160
— zeylanica 159, 160
Sobralia macrantha 177
Socratea durissima 265
Sorghum bicolor 232
— caffrorum 232
— vulgare 232
Sowerbaea 109, 112
Sparganium 271
— erectum 272, 274
— eurycarpum 274
— greenei 274
— minimum 271, 274
— ramosum 271, 274
— simplex 271, 272, 274
— sp. 272
Spathanthus bicolor 193, 195
— unilateral 193, 195
Spathicarpa sp. 278
Spathiphyllum floribundum 276, 278
— patinii 276, 278
Spathoglottis 172, 175
— plicata 178
Spathyema 275
— foetida 278
Spinifex litoreus 232
Spiranthes alliance 178
— australis 172
— cernua 173, 178
Spirodela 279, 283
— polyrrhiza 283—285
Spivelia 96
Sporobolus coromandelianus 232
Stanfieldiella imperforata (=Buforrestia
imperforata) 202, 204
Stegolepis guianensis 193, 195
Stemona 151
— tuberosa 151
Stemonaceae 151
Sternbergia 94
— colchiciflora 96
— fischeriana 88, 95, 96
— lutea 88, 95, 96
Stipa 231
— elmeri 225, 228, 232
— leucotricha 232
— tortilis 232
Stratiotes 20
— aloides 21, 23
Strelitzia reginae 235
Strelitziaceae 235
Streptopus amplexifolius 114, 117, 119, 121, 122
— roseus 121, 122
Stromanthe 253, 254
— lutea 254
Syagrus coronata 265
Symplocarpus 275
— foetidus 275
Syngonanthus nitens 209
Tacca cristata 163, 164
— lancifolia 163, 164
— macrantha 163, 164
— montana 1§4
— palmata 163, 164
— pinnatifida 164
— viridis 163, 164
Taccaceae 163
Tamus communis 160, 161
Tecophilaeceae 127, 128
Thalassia hemprichii 23
Thalassodendron 50
— ciliatum 51
Thalia 253, 254
— dealbata 253, 254
— geniculate 254
Thamnochortus dichotomus 212
— fruticosus 210, 212
— muirii 212
328
— obtusus 212
Themeda triandra 232
Theriophonum 275
— minutum 275, 276, 278
Theropogon pallidus 119, 122
Thismia 168, 169
— americana 166, 169
— luetzelburgii 168, 169
— panamensis 165, 168, 169
Thrinax radiata 265
Thunia marchalliana 177, 178
Thurnia sphaerocephala 187
Thurniaceae 187
Tillandsia caput-medusae 180
— recurvata 180
— usneoides 180
Tinantia fugax 199, 202—204
Tofieldia 59, 61, 62
— calyculata 59, 61, 62
— japonica 60, 62
— racemosa 62
Trachycarpus excelsus 265
— fortunei 265
— sp. 255, 257
Tradescantia 198
— albiflora 203, 204
— blossfeldiana 202
— bracteata 204
— paludosa 202—204
— virginica 203, 204
Trichopus zeylanicus 160, 161
Tricyrtis 59—62
— affinis (=T. macropoda) 59, 62
— hirta 59, 62
— latifolia 62
Triglochin 29, 33
— maritimum 29, 30, 33
— palustre 28—30
Trilliaceae 151, 152
Trillium 151, 152, 158, 159
— camschatcense 151 —154, 158, 159
— cernuum 159
— chloropetalum 156, 159
— erectum 159
— govanianum 159
— grandiflorum 157, 159
— ovatum 153, 159
— recurvatum 159
— sessile 159
— smallii 159
— tschonoskii 159
— undulatum 153, 159
Tripogandra amplexicaulis 198, 204
— grandiflora 198, 204
Tripsacum dactyloides 232
Trithuria submersa (=Juncella tasmanii
216
Triticale 232
Triticum 218
— aestivum 217
— aestivum var. diamant 218
— dicoccum 218
— monococcum 218
Tritonia crocosmiiflora 134
Triuridaceae 57
Triuridales 57
Tulbaghia 80, 82
— acutifolia 83
— leucantha 83
— pulchella 83
— violacea 81, 83
Tulipa 67, 70—73
— anadroma 70
— gesneriana 70
— greigi 70, 72
— kaufmanniana 65, 70, 72
— kolpacowskiana 70
— korolkowii 70
— lehmanniana 70
— oculis-solis 70
— ostrowskiana 70
— rosea 70
— silvestris 70
— turkestanica 70
— urumoffii 70
— vvedenskyi 70, 72
— wilsoniana 70
Typha 271
— angustifolia 271, 274
— latifolia 271, 272, 274
— minima 271, 274
Typhaceae 271—274
Typhales 271
Typhonium trilobatum 275, 278
Typhonodorum lindleyanum 278
Ungernia sewerzovii 96
— trisphaera 96
Urginea indica 71, 73
— maritima 73
Urochloa mosambicensis 232
Uvularia grandiflora 62
— sessilifolia 59, 62
Vallisneria 20
— spiralis 21, 23
Valota purpurea 94, 96
— speciosa 96
Vanilla planifolia 172, 178
Veitchia joannis 265
Vellozia caespitata 143
— compacta 141, 143
— elegans 141 —143
— flavescens 143
— flavicans 143
— glauca 143
Velloziaceae 141 —143
Veltheimia 72, 73
— viridiflora 73
— viridifolia 73
Veratrum 59—62
— album 61—62
— lobelianum 59, 60, 62
— maackii 62
— nigrum 59—62
— viride 62
Verschaffeltia 257, 263
215 — splendida 265
Wachendorfia 135
— paniculata 135, 136, 138
Washingtonia filifera 265
— sp. 255, 257
Willdenowia lucaeana 212
Wolffia 279, 283—285
— arrhiza 282, 285
— microscopica 279, 280, 284, 285
Xanthorrhoea 113
Xanthorrhoeaceae 112, 113
Xerophyta squarrosa 143
Xiphidium 135, 138
Xyridaceae 195—197
Xyris 195, 197, 198
— capensis 198
— indica 195, 197, 198
— nigromucronata 197, 198
— pauciflora 195, 197, 198
— schoenoides 197, 198
Yucca 106
— aloifolia 103Л06> 107
— filamentosa 1ШГ 107
— glauca 106, 107
— gloriosa 1.06, 107
— recurva 107
— rupicola 106, 107
Zannichellia 44
— palustris 45, 47
— pedunculata 5, 44, 45, 47, 50
Zannichelliaceae 5, 44—49
Zantedeschia 275
Zea 220
— mays 218, 232
Zebrina pendula 203
Zephyranthes 88, 94
— atamasco 96
— citrina 93, 95, 96
— clintiae 95, 96
— grandiflora (—Z. carinata) 95, 96
— lancasteri 96
— macrosiphon 88, 94—96
— pulchella 95, 96
— rosea 96
— tubispatha 96
— «Valles yellow» 95, 96
Zeuxine longilabris 172, 178
— strateumatica 178
— sulcata 178
Zingiber 238, 241
— macrostachyum 238, 240—242
Zingiberaceae 238, 240
Zingiberales 235
Zizania aquatica 220, 232
— latifolia 220, 232
— texana 232
Zombia 265
Zostera 52, 54
— japonica 52, 54
— marina 52, 54
— nana 52
Zosteraceae 52
Zygadenus 59, 60
— elegans 60, 61
СОДЕРЖАНИЕ
Предисловие 5
Порядок I. Alismatales 7
Семейство Butomaceae (77. Г. Красников) 7
Семейство Limnocharitaceae (3. И. Никитичева) 14
Семейство Alismataceae (3. И. Никитичева) 16
Семейство Hydrocharitaceae (Л. Г. Красников) 20
Порядок 2. Najadales 24
Семейство Aponogetonaceae (3. И. Никитичева) 24
Семейство Scheuzeriaceae (3. И. Никитичева) 26
Семейство Juncaginaceae (3. И. Никитичева, О. Б. Проскурина) 28
Семейство Posidoniaceae (О. П. Камелина) 34
Семейство Potamogetonaceae (О. П. Камелина) 34
Семейство Ruppiaceae (О. П. Камелина, Э. С. Терёхин) 39
Семейство Zannichelliaceae (О. П. Камелина, Э. С. Терёхин) 44
Семейство Cymodoceaceae (О. П. Камелина) 50
Семейство Zosteraceae (Э. С. Терёхин) 52
Семейство Najadaceae (Э. С. Терёхин) 54
Порядок 3. Triuridales 57
Семейство Triuridaceae (Г. М. Анисимова) 57
Порядок 4. Liliales 59
Семейство Melanthiaceae (И. И. Шамров) 59
Семейство Herreriaceae (И. И. Шамров) 63
Семейство Liliaceae (И. И. Шамров) 63
Семейство Alstroemeriaceae (Г. К Алимова) . 74
Семейство Alliaceae (И. И. Шамров) 76
Семейство Hemerocallidaceae (И. И. Шамров) 83
Семейство Amaryllidaceae (Л. И. Ворсобина, М. П. Солнцева) 87
Семейство Phormiaceae (Г. К. Алимова, Н. А. Жинкина) 97
Семейство Agavaceae (М. М. Чубирко) 102
Семейство Doryanthaceae (Т. Б. Соколовская) 107
Семейство Asphodelaceae (M. П. Солнцева) 108
Семейство Xanthorrhoeaceae (Г К- Алимова) 112
Семейство Aphyllanthaceae (Г. К Алимова) 113
Семейство Hanguanaceae (Г. /С Алимова) 113
Семейство Asparagaceae (Т. Н Сатарова) 114
Семейство Dracaenaceae (Г. М. Анисимова) 124
Семейство Tecophilaeaceae (Г. И. Савина) 127
Семейство Cyanastraceae (Т. Б. Соколовская) 129
Семейство Iridaceae (Т. Б. Соколовская, Б. Е. Шпилевой) 129
Семейство Haemodoraceae (Г. К Алимова) 134
Семейство Hypoxydaceae (Г. И. Савина, Н А. Жинкина) 138
Семейство Velloziaceae (Г. К. Алимова) 141
Семейство Pontederiaceae (Г. М. Анисимова) 144
Семейство Philydraceae (Г. М. Анисимова) 147
Порядок 5. Smilacales 150
Семейство Philesiaceae (Т. Б. Соколовская) 150
Семейство Stemonaceae (Т. Б. Соколовская) 151
Семейство Trilliaceae (Т. Н. Наумова) 151
Семейство Smilacaceae (T Б. Соколовская) 159
Семейство Dioscoreaceae (Т. Б. Соколовская) 160
Семейство Тассасеае (Т. Б. Соколовская) 163
Порядок 6. Burmanniales ^
Семейство Burmanniaceae (Э. С. Терёхин) 165
Семейство Corsiaceae (Э. С. Терёхин) 169
331
Порядок 7. Orchidales 172
Семейство Orchidaceae (Г. И. Савина, В. А. Поддубная-Арнольды) 172
Порядок 8. Bromeliales 180
Семейство Bromeliaceae (Т. Б. Соколовская) 180
Порядок 9. Juncales 183
Семейство Juncaceae (Г. М. Анисимова) 183
Семейство Thurniaceae (Г. М. Анисимова) 187
Порядок 10. Cyperales 188
Семейство Сурегасеае (Т. Н. Наумова) 188
Порядок 11. Commelinales 193
Семейство Rapateaceae (Т. Е. Фрейберг) 193
Семейство Xyridaceae (Т. Е. Фрейберг) 195
Семейство Commelinaceae (Т. Е. Фрейберг) 198
Семейство Мауасасеае (Т. Е. Фрейберг) 205
Порядок 12. Eriocaulales 206
Семейство Eriocaulaceae (Т. Е. Фрейберг) 206
Порядок 13. Restionales 210
Семейство Flagellariaceae (Т. Н. Наумова) 210
Семейство Joinvilleaceae (Т. Н. Наумова) 210
Семейство Restionaceae (Т. Н. Наумова) 210
Семейство Ecdeiocoleaceae (Т. Н. Наумова) 212
Семейство Centrolepidaceae (Т. Н. Наумова) 212
Порядок 14. Hydatellales 215
Семейство Hydatellaceae (Г Я. Жукова) 215
Порядок 15. Poales • 217
Семейство Роасеае (Т. Б. Батыгина, М. С. Яковлев) 217
Порядок 16. Zingiberales 235
Семейство Strelitziaceae (Г. И. Савина) 235
Семейство Musaceae (Т. Н. Наумова) 235
Семейство Heliconiaceae (Г. И. Савина) 238
Семейство Lowiaceae (Г. Я. Жукова) ... 238
Семейство Zingiberaceae (Г. Я. Жукова) 238
Семейство Costaceae (Г. Я. Жукова) 242
Семейство Саппасеае (С. В. Шевченко) 245
Семейство Marantaceae (О. П Камелина) 247
Порядок 17. Arecales 255
Семейство Агесасеае (Г. Я. Жукова, Н. Г. Тучина) 255
Порядок 18. Cyclanthales . . 267
Семейство Cyclanthaceae (Г. Я. Жукова) 267
Порядок 19. Pandanales 268
Семейство Pandanaceae (М. М. Чубирко) 268
Порядок 20. Typhales 271
Семейство Typhaceae (Г. М. Анисимова) 271
Порядок 21. Arales 275
Семейство Агасеае (С. Н. Коробова, Н. А Жинкина) 275
Семейство Lemnaceae (Г. М. Ильина) 279
Приложение (В. Е. Васильева) 287
Литература • • • •, 290
Указатель латинских названий растений 319
Научное издание
СРАВНИТЕЛЬНАЯ ЭМБРИОЛОГИЯ
ЦВЕТКОВЫХ РАСТЕНИЙ
Однодольные
Butomaceae— Lemnaceae
Утверждено к печати
Ботаническим институтом им В Л Комарова
Академии наук СССР
Редактор издательства Л В Шоренкова
Технический редактор М. Э Карлайтис
Корректоры В В Крайнева иС И Семиглазова
ИБ № 44379
Сдано в набор 24 11 89 Подписано к печати 5 Об 90
М-34094. Формат 70ХЮ8 Vie Бумага № 1 офсетная
Гарнитура литературная Печать офсетная Фотонабор
Уел печ.л 29 40+2 10вкл Уел кр-от. 31 77 Уч-изд л 37 97
Тираж 650 Тип зак № 2144. Цена 5 р 90 к
Ордена Трудового Красного Знамени
издательство «Наука» Ленинградское отделение
199034, Ленинград, В-34, Менделеевская линия , 1
Ордена Трудового Красного Знамени
Первая типография издательства «Наука»
199034, Ленинград, В-34, 9 линия, 12.
ИЗДАТЕЛЬСТВО «НАУКА»
готовит к выпуску во II полугодии 1991 года книгу
Дарвин Чарлз. Происхождение видов.
Объем 47 л. Ориентировочная цена 10 р.
В книге представлен полный текст перевода с шестого английского издания,
заново сверенный с оригиналом. Внесено много изменений в соответствии
с современными требованиями, предъявляемыми к научным переводам.
Восстановлены многие термины Дарвина, вошедшие в международную научную
терминологию и современный русский язык. Текст снабжен комментарием,
отражающим основные дополнения и изменения, которые вносил Дарвин,
в результате чего в одной книге читатель может получить представление
о всех шести английских изданиях. Сопроводительные статьи посвящены
истории и современному состоянию эволюционной теории и снабжены
обширными библиографиями.
Для биологов, историков науки, философов, эволюционистов и всех
специалистов в области естественных наук.
ИЗДАТЕЛЬСТВО «НАУКА»
готовит к выпуску во II полугодии 1991 года книгу
Е л и н а Г. А. Аптека на болоте:
путешествие в неизведанный мир.
Объем 20 л. Ориентировочная цена 5 р.
В книге в научно-популярной форме рассказано о малоизвестных сторонах
жизни болот и мелководных водоемов Советского Союза, которые в лесной
и степной зонах, субтропиках и тундрах отличаются не только внешним обликом,
но и растительным покровом. Описано около 100 видов, применяемых в научной
медицине или перспективных, показаны их биология и экология, полезные
и вредные свойства, способы применения, правила сбора и заготовки.
Рассмотрен вопрос об охране местообитаний с обилием воды и их растений.
Для специалистов-ботаников, биологов других специальностей, экологов,
любителей природы и широкого круга читателей.
Заказы принимаются в магазинах конторы «Академкнига».
Для получения книг почтой
заказы просим направлять по адресу:
197345, Ленинград, Петрозаводская ул. 7.
КНИГИ ИЗДАТЕЛЬСТВА «НАУКА»
МОЖНО ПРЕДВАРИТЕЛЬНО ЗАКАЗАТЬ
В МАГАЗИНАХ КОНТОРЫ «АКАДЕМКНИГА»,
В МЕСТНЫХ МАГАЗИНАХ КНИГОТОРГОВ
ИЛИ ПОТРЕБИТЕЛЬСКОЙ КООПЕРАЦИИ
ДЛЯ ПОЛУЧЕНИЯ КНИГ ПОЧТОЙ
ЗАКАЗЫ ПРОСИМ НАПРАВЛЯТЬ ПО АДРЕСУ:
117192 Москва, Мичуринский пр., 12. Магазин «Книга — почтой»
Центральной контрры «Академкнига»;
197345 Ленинград, Петрозаводская ул., 7. Магазин «Книга-почтой»
Северо-Западной конторы «Академкнига»
или в ближайший магазин «Академкнига»,
имеющий отдел «Книга — почтой»:
480091 Алма-Ата, ул. Фурманова, 91/97 («Книга — почтой»);
370005 Баку, Коммунистическая ул., 51 («Книга — почтой»);
232600 Вильнюс, ул. Университето, 4;
690088 Владивосток, Океанский пр., 140 («Книга — почтой»);
320093 Днепропетровск, пр. Гагарина, 24 («Книга — почтой»),
734001 Душанбе, пр. Ленина, 95 («Книга — почтой»);
375002 Ереван, ул. Туманяна, 31;
664033 Иркутск, ул. Лермонтова, 289 («Книга — почтой»);
420043 Казань, ул. Достоевского, 53 («Книга — почтой»);
252030 Киев, ул. Ленина, 42;
252142 Киев, пр. Вернадского, 79;
252030 Киев, ул. Пирогова, 2;
252030 Киев, ул. Пирогова, 4 («Книга — почтой»);
277012 Кишинев, пр. Ленина, 148 («Книга — почтой»);
343900 Краматорск, Донецкой обл., ул. Марата, 1 («Книга —
почтой»);
660049 Красноярск, пр. Мира, 84;
443002 Куйбышев, пр. Ленина, 2 («Книга — почтой»);
191104 Ленинград, Литейный пр., 57;
199034 Ленинград, Таможенный пер., 2;
194064 Ленинград, Тихорецкий пр., 4;
220012 Минск, Ленинский пр., 72 («Книга — почтой»);
103009 Москва, ул. Горького, 19а;
117312 Москва, ул. Вавилова, 55/7;
630076 Новосибирск, Красный пр., 51;
630090 Новосибирск, Морской пр., 22 («Книга — почтой»);
142284 Протвино, Московской обл., ул. Победы, 8;
142292 Пущино, Московской обл., MP «В», 1;
620161 Свердловск, ул. Мамина-Сибиряка, 137 («Книга —
почтой»);
700000 Ташкент, ул. Ю. Фучика, 1;
700029 Ташкент, ул. Ленина, 73;
700070 Ташкент, ул. Шота Руставели, 43;
700185 Ташкент, ул. Дружбы народов, 6 («Книга — почтой»);
634050 Томск, наб. реки Ушайки, 18;
634050 Томск, Академический пр., 5;
450059 Уфа, ул. Р. Зорге, 10 («Книга — почтой»);
450025 Уфа, Коммунистическая ул., 49;
720000 Фрунзе, бульв. Дзержинского, 42(«Книга — почтой»);
310078 Харьков, ул. Чернышевского, 87 («Книга — почтой»).